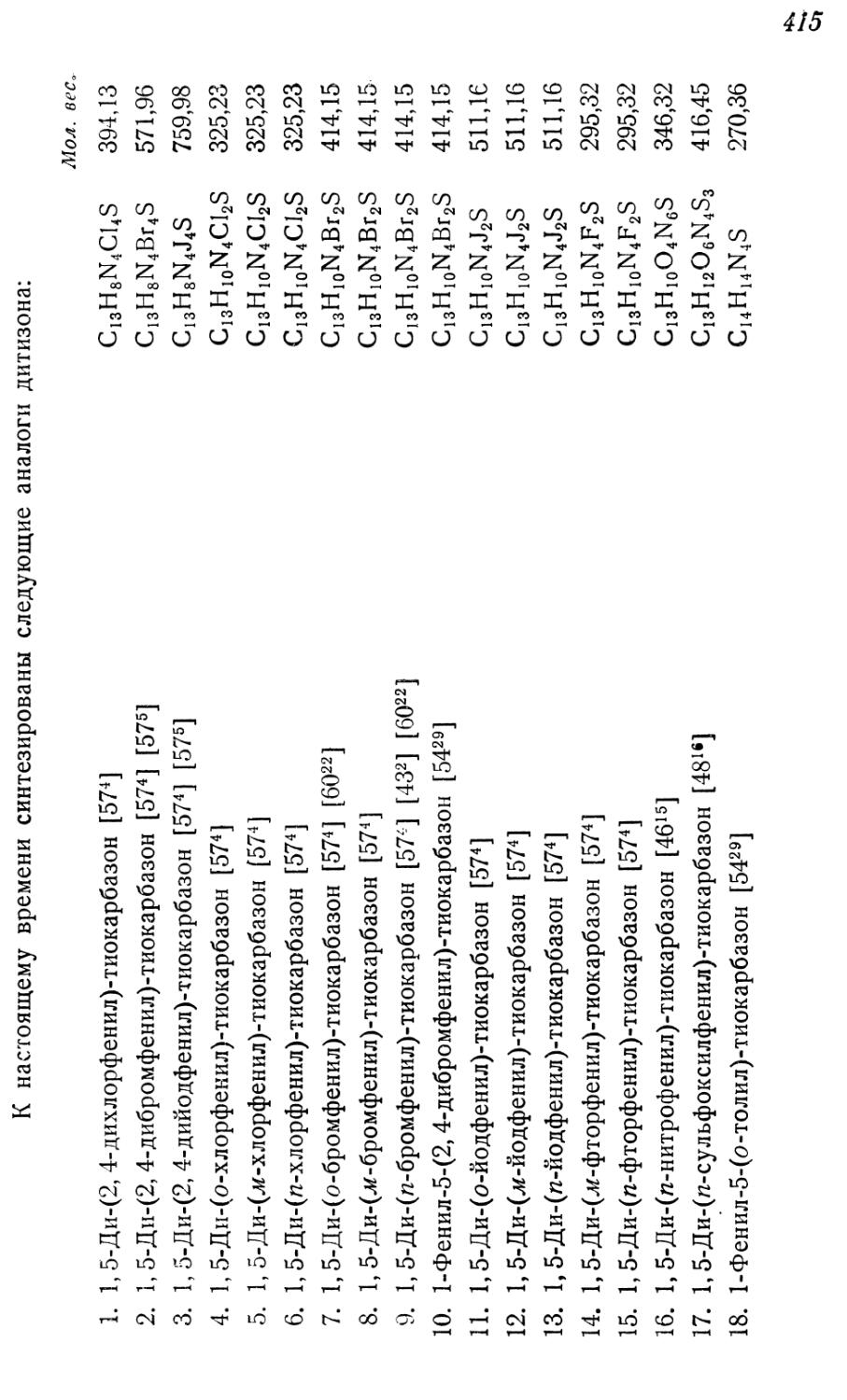
Текст
DAS DITHIZON
UND SEINE ANWENDUNG IN DER MIKRO- UND SPURENANALYSE
VON
DR. GEORG IWANTSCHEFF
Leiter der anorganisch-chemischen Abteilung im Forschungslaboratorium
der Siemens-Schuckertwerke AG., Erlangen
Mit einem Geleitwort von prof. dr. HELLMUTH FISCHER Leiter des Werkstoff-Hauptlaboratoriums der Siemens & Halske AG., Karlsruhe
VERLAG CHEMIE • GMBH • WEINHEIM/BERGSTR.
1958
Больше химической литературы и прочих полезных материалов для химиков на https://vk.com/chemzone
More chemistry books and other useful resources for chemists are available on https://vk.com/chemzone
СНВйПИЕ
vk.com/chemzone
Г. ИВАНЧЕВ
итизон
И ЕГО ПРИМЕНЕНИЕ
Перевод с немецкого канд. техн, наук Ю. И. ВАЙНШТЕЙН и Ф. Б. РАБИНОВИЧ
Под редакцией канд. хим. наук И. Б. СУПРУНОВИЧА
ИЗДАТЕЛЬСТВО ИНОСТРАННОЙ ЛИТЕРАТУРЫ
Москва • 1961
В книге изложены свойства дитизона и его приме
нение в качественном и количественном анализе для
определения следов металлов и некоторых анионов.
Книга является практическим руководством для химиков, работающих в области аналитического кон
троля металлургических производств, в частности про
изводства чистых и сверхчистых металлов и сплавов, полупроводников, материалов для ядерной энергетики, авиационных материалов, чистых реактивов, фармацев
тических препаратов, минерального сырья, пищевых и биологических продуктов.
В отдельных случаях книга может служить и учебным пособием для студентов химических и других факультетов университетов и химико-технологических
институтов.
Редакция литературы по химии
ПРЕДИСЛОВИЕ
В области применения органических реактивов в неорганическом анализе, открытой русскими химиками М. А. Ильинским и Л. А. Чугаевым, дитизон является одним из наиболее известных и распространенных реактивов на тяжелые металлы.
В книге Г. Иванчева впервые в литературе дана наиболее полная сводка исследований и применения дитизона в аналитической химии. Наряду с описанием большого числа проверенных автором и его сотрудниками методов определения следов металлов и некоторых анионов в книге подробно описаны свойства дитизона, техника работы с ним, применение его в качестве индикатора в объемном анализе, в эмиссионном спектральном анализе, полярографии и хроматографии.
Эта книга является ценным практическим руководством и справочником для химиков-аналитиков многих производств и научно-исследовательских учреждений, а также для других специалистов, интересующихся определением следов элементов. В отдельных случаях она может служить и учебным пособием для студентов химических и других факультетов университетов и химикотехнологических институтов.
Следует отметить, что Г. Фишер и Г. Иванчев недооценивают значения аналогов дитизона в развитии дитизонового метода. Синтез и изучение аналитических свойств аналогов дитизона имеют не только теоретический, но. как это уже показано рядом химиков, и практический интерес.
Несмотря на то что дитизон, как указывает автор в предисловии данной книги, «уже достаточно всесторонне и основательно обследован», дитизоновый метод
6
Предисловие
все же таит в себе еще немало неиспользованных возможностей и особенно в связи с применением аналогов дитизона. О неослабевающем интересе к дитизону и его аналогам можно судить по числу ежегодно публикуемых работ в этой области.
Нами сделаны дополнения по советским работам, большая часть которых, к сожалению, не имела своего отражения в книге Иванчева, и по работам, опубликованным в последующие годы после выхода книги (1957— 1959 гг. и частично 1960 г.).
Кроме этого, нами написано дополнение в виде отдельной главы «Аналоги дитизона».
Главы 1 и 2, а также часть главы 3 (разделы «Серебро» и «Ртуть») переведены Ф. Б. Рабинович. Остальная часть главы 3 и главы 4 и 5 переведены Ю. И. Вайнштейн.
В работе по переводу оказал помощь В. П. Жмуро; пользуюсь случаем выразить ему свою благодарность.
И. Супрунович
ПРЕДИСЛОВИЕ ПРОФЕССОРА Г. ФИШЕРА
При чтении этой книги я испытал то же чувство, какое должен испытывать отец, вновь встретившийся со своим сыном после десятка лет разлуки. Когда-то он отпустил в свет полного надежд юношу; теперь перед ним муж в расцвете сил, приобретший друзей во многих странах: химиков, металлургов, геологов, медиков, биологов, ботаников, фармакологов и представителей многих других специальностей.
Когда в 1925 г. я опубликовал свою первую работу о применении дифенилтиокарбазона, не кто иной, как Фриц Файгль благословил меня, 23-летнего юношу, на дальнейшие исследования. Таким образом, я разработал качественные реакции с применением дитизона. Последующие 12 лет работы были посвящены количественным определениям следов элементов. Однако мне никогда не удалось бы провести такую большую работу, если бы не активная помощь, оказываемая мне с 1931 г. в лаборатории фирмы «Сименс и Хальске» в лице верной сотрудницы Греты Леопольди. Химия дитизона очень многим обязана неутомимой и добросовестной работе Греты Леопольди. Разработанные ею методы анализа были экспериментально проверены и одобрены автором настоящей книги Г. Иванчевым и его сотрудниками.
В первые годы развития методов анализа с помощью дитизона еще не было потребности в определении следов элементов. Мой начальник, правда, предоставил мне рабочее место в лаборатории промышленного предприятия, в котором я служил, но дитизоном я мог заниматься только в вечернее время, после окончания работы. Теперь, через 30 лет, все лаборатории нашего большого предприятия применяют дитизон, например для
8
Предисловие профессора Г. Фишерй
серийных определений чистоты полупроводников и металлов, для испытания изоляционных масел, для анализа воды и воздуха, а также в других санитарных исследованиях.
Уже начиная с 1931 г. распространение дитизона нашло отчетливое отражение в специальной литературе. До начала второй мировой войны дальнейшей разработкой методов с применением дитизона в равной степени занимались немецкие и англосаксонские исследователи. Как было установлено статистикой, между 1936 и 1939 гг. каждый месяц появлялись две статьи по дитизону. Во время войны исследования были, естественно, приостановлены, но после 1949 г. поток публикуемых работ превысил число публикаций довоенного времени. В это время перевес находился на стороне исследователй англосаксонских стран. Число немецких работ после окончания войны и до 1949 г. было очень невелико. За последние годы число немецких работ, точно так же как и французских, советских, японских и итальянских, все увеличивается. Во всяком случае, остается только удивляться, каким обширным источником исследований все еще является дитизон. Более 500 публикаций (не говоря уже о неопубликованных работах) свидетельствуют о том интересе, который представлял этот препарат для аналитической химии.
Постепенно были изучены основные параметры реакций. Более точно определены константы равновесия реакций дитизона, коэффициенты распределения дитизонатов в двухфазной системе, устойчивость комплексных соединений. Получены гомологи дитизона; их реакционная способность сравнена с реакционной способностью дитизона, однако эти соединения не обладают какими-либо существенными преимуществами перед дитизоном *.
Как было установлено впоследствии, дитизон может быть также использован для количественного определения палладия, таллия, индия и полония. Были также
* В некоторых частных случаях гомологи (аналоги) дитизона все же представляют практический интерес и обладают не малыми преимуществами в сравнении с дитизоном (см. дополнение, стр. 414). — Прим. ред.
Предисловие профессора Г. Фишера 9
разработаны косвенные способы количественного определения галогенидов, цианидов и сульфидов.
Развитие аналитических методов с дитизоном имело общее значение для развития техники анализа. Впервые использованная для этого реактива двухфазная система теперь широко применяется и в других реакциях, при проведении которых приходится экстрагировать образовавшееся внутрикомплексное соединение. Косвенным следствием применения дитизона явилось повышение требований к степени чистоты применяемых для анализов реактивов и препаратов.
Методы анализа с дитизоном заняли свое место наряду со спектральными и полярографическими методами анализа. Годы «сосуществования» показали, что все эти методы могут прекрасно дополнять друг друга; нередко хорошие результаты получались при комбинировании их с методами анализа с дитизоном.
Те, кто уже работал с дитизоном, знают, что овладение техникой анализа не обошлось без трудностей. Определение следов металлов требует от аналитика умения, которое приобретается опытом и тренировкой. Предлагаемая монография должна поэтому стать «рабочей книгой» аналитика.
Г. Иванчев является большим знатоком техники работы с дитизоном. Приведенные в его книге методы, заимствованные из литературы, проверены им в исследовательской лаборатории фирмы «Сименс Шуккерт» (Эрланген). Таким образом, в книгу вошли только действительно проверенные способы. Автор обращает также внимание на присутствие посторонних примесей, которые могут ввести в заблуждение начинающих исследователей.
Я уверен, что эта заслуживающая хорошей оценки книга станет незаменимым советником для химиков, работающих с дитизоном. Несомненно, она будет способствовать увеличению круга лиц, работающих с дитизоном, и поможет еще больше расширить его применение.
Желаю этой книге большого распространения.
Карлсруэ, июнь 1956 г.
Гельмут Фишер
ПРЕДИСЛОВИЕ АВТОРА
С тех пор как в 1925 г. Гельмут Фишер рекомендовал определение металлов дитизоном и впоследствии детально разработал этот способ, появилось очень много работ в этой области, главным образом в иностранной литературе, которая не всегда доступна. Таким образом, у нас возникла мысль обобщить все полученные результаты, проверить некоторые литературные данные, сравнить их с собственными данными и опубликовать весь материал в виде книги.
Такой реактив, как дитизон, с помощью которого можно селективно определить более двенадцати металлов в микроколичествах и в виде следов, естественно, уже достаточно всесторонне и основательно обследован. Результаты исследований физических и химических свойств дитизона описаны в гл. 1 книги и являются основой для глубокого понимания возможностей использования этого реагента.
Эта область аналитической химии, охватывающая множество высокочувствительных реакций, нуждалась, с нашей точки зрения, в подробном изложении техники работы, что и осуществлено нами в гл. 2. Описанные нами детально анализы и способы отделения примесей должны помочь начинающим освоить методы работы с помощью дитизона. Обобщенное изложение основных методов анализа и методов разделения ионов дополняет представление об этом реагенте. Это дало возможность более скупо описывать методы анализа в гл. 3. Колориметрические методы сведены к визуальной колориметрии или колориметрии с применением монохроматора, что помогло придать методу большую универсальность и разобраться в большом числе вариантов.
Предисловие автора
В 18 разделах гл. 3 приведена самая важная область применения дитизона, а именно методы количественного определения отдельных металлов. Для каждого металла после описания механизма реакции приводятся основные методы определения, кратко описана большая часть областей применения и, наконец, некоторые практические примеры. В основном мы выбирали более сложные проверенные методы определения следов металлов главным образом в продуктах металлургической промышленности. Во избежание повторений в этой части имеется много ссылок на соответствующие места текста и принято единообразное изложение.
В гл. 4 книги описаны качественные реакции и применение дитизона как группового реагента. В гл. 5, посвященной особым случаям применения дитизона в качестве вспомогательного реактива, показано его значение для других областей аналитической химии: при титровании по методу осаждения, в спектральном анализе, полярографии, хроматографии и т. д.
В приложении дан обзор методов получения дитизона и его аналогов, которые хотя и не обладают преимуществами по сравнению с дитизоном, но представляют несомненный научный интерес *.
Выражаю благодарность профессору Г. Фишеру за доверие, оказанное мне, взявшему на себя смелость обобщить работы по дитизону, а также всем моим сотрудникам за помощь в проведении экспериментальных работ.
Г. Иванчев
* См. примечание редактора на стр. 8. — Ред.
Глава 1
ДИТИЗОН И ОБРАЗУЕМЫЕ ИМ ВНУТРИКОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
ДИТИЗОН
1. ОБЩИЕ СВЕДЕНИЯ
Дифенилтиокарбазон* CeH5N = NCSNHNHC6H5, или C6H5N = NC(SH) = NNHC6H5, сокращенно названный Г. Фишером [29]'дитизон (брутто-формула C13H12N4S [78], мол. вес 256,337), в последующем изложении будет нами обозначаться формулой H2Dz, где Dz соответствует остатку C13H10N4S.
Дитизон образует фиолетово-черные тонкие плоские иглы (см. рис. 1) с металлическим блеском, которые в тонком слое имеют фиолетово-красную окраску. Плотность дитизона 1,1, темпералура разложения ~169°. При медленном нагревании дитизон испаряется при более низкой температуре [521].
2. ОТНОШЕНИЕ К НЕОРГАНИЧЕСКИМ РАСТВОРИТЕЛЯМ
Дитизон представляет собой слабую кислоту, не растворимую в воде при pH < 7 (табл. 1). При pH > 7 с увеличением щелочности раствора дитизон растворяется и находится в растворе в виде полностью диссоциированной соли щелочного металла; при этом анион HDz- придает раствору желтую до желто-оранжевой окраску (см. рис. 2, а также табл. 1). При нейтрализации или подкислении этого раствора H2Dz количественно выпадает в виде сине-черных хлопьев.
* Может быть также назван: фенилгидразид бензолазотиому-равышой кислоты; МЖ-дифенил-С-меркаптоформазан; Ы,Ы'-дифе-нилформазилмеркаптан (см. Beilstein, Syst. № 2092). (Это соединение называют также 1,5-дифенилтиокарбазоном [5130].—Прим, ped.'j
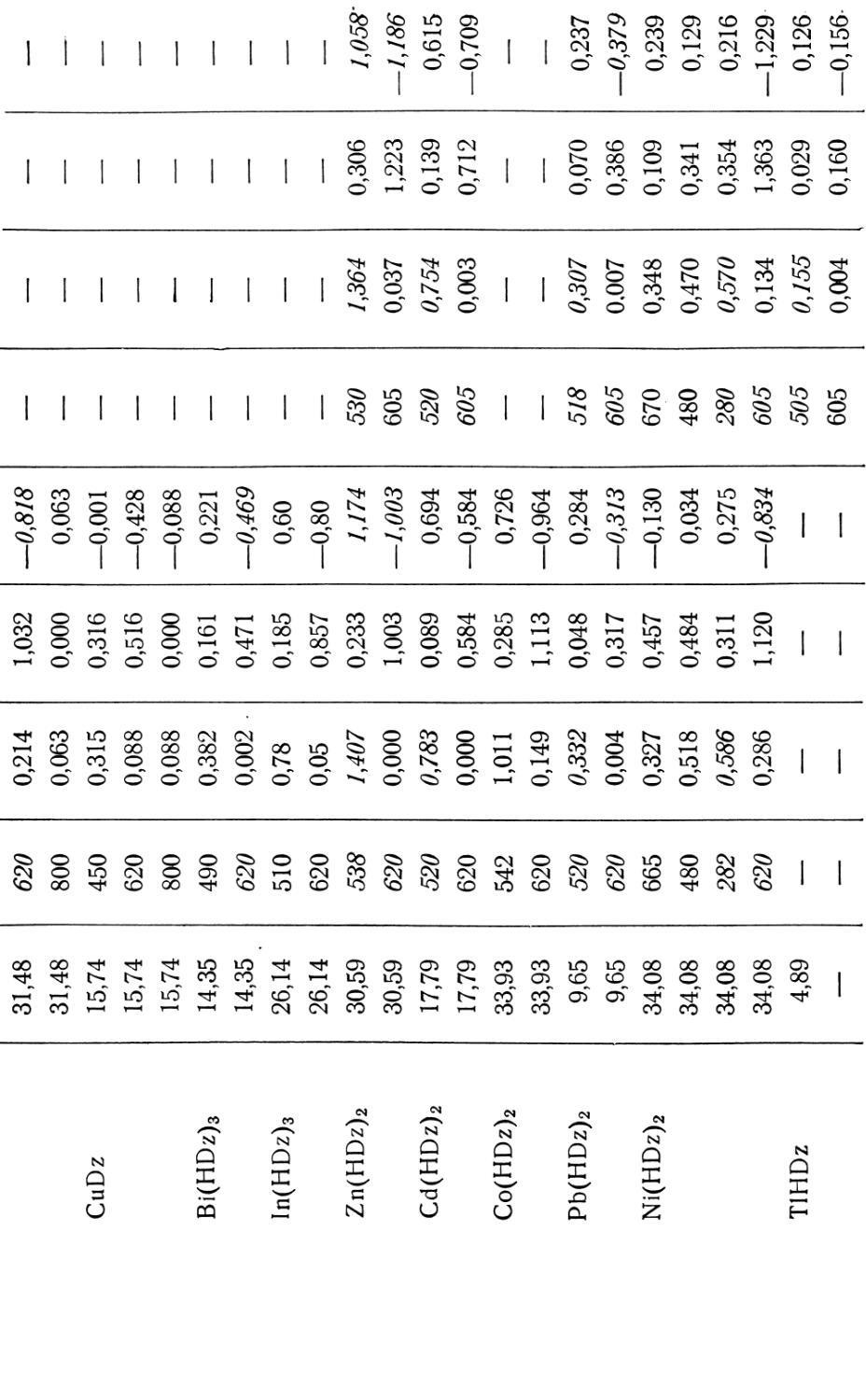
ДАННЫЕ О РАСТВОРИМОСТИ ДИТИЗОНА П ОПТИЧЕСКИЕ И ОРГАНИЧЕСКИХ
Растворитель Растворимость дитизона а, г/л Экстремальные значения длин ВОЛН, X, М[). 6
Ч макс. Ч макс. Ч мин.
Вода 5-10“5 ' 11
Водный раствор щелочи >20 470 — 1
Пиридин 1,7 500 —
Пиридин (80%-ный) 510 - -
Четыреххлористый углерод 0,64 620 450 515
Хлороформ 17,8 605 445 505
Хлористый метил 610 445 505
Бензол 1,64 620 450 510
Толуол — 625 455 515
Хлорбензол 620 455 530
Нитробензол ——. 620 450 525
н-Гексан — 600 435 —
н-Гептан 0,04 625 450 515
Этиловый спирт 0,3 (0,2) 600 445 520
Этиловый спирт (50%-ный) 0,007 — — • —
Изоамиловый спирт — — 580 460 —
Ацетонитрил 1,0 605 440 505
Ацетон 615 450 510
Метилэтилкетон 615 445 510
Этиловый эфир 0,4 620 450 510
Диоксан — - 615 445 510
Сероуглерод "— 640 460 530
Нафталин (100°) — 1 620 450
а Приведена растворимость при комнатной температуре.
6 В таблице приведены максимумы и минимумы поглощения, наблюдаемые только
Соответствующие экстремальным величинам длины волн X и величины е приве в Наблюдались окраски 25 икМ растворов дитизона 6.41 • 10 3 г/л) при толщи
Таблица 1
ХАРАКТЕРИСТИКИ ДИТИЗОНА В ВОДНЫХ РАСТВОРАХ ЩЕЛОЧЕЙ РАСТВОРИТЕЛЯХ
Молярный коэффициент поглощения, e-10_J, л!мо.1Ь‘СМ Окраска в Ссылка на литературу
е1 макс. £2 макс. £1 мин.
— — — [503]
22 — — Оранжево-желтая
30,4 — —— Оранжево-красная
34,0 — »
32,8 20,0 4,4 Изумрудно-зеленая [5Щ
40,0 16,0 6,0 Сине-зеленая [516, 542]
41,0 17,7 5,5 »
38,8 20,8 5,2 Темно-зеленая
32,4 18,4 4,4 »
24,0 16,6 6,4 Зеленая
30,0 14,6 4,0 »
— — Бледно-зеленая [526]
23,2 20,6 4,0 »
13,0 9,2 4,8 » [5328]
— ——. —— [5328]
14,5 6,2 — Бледно-зеленая [526]
32,6 16,2 4,6 Зеленая
20,6 13,6 6,6 »
25,6 16,4 4,8 »
18,4 13,2 2,8 »
26,6 17,2 3,8 »
29,6 19,2 4,0 Темно-зеленая
— ' [55']
в видимой части спектра.
дены в порядке от более длинных волн к более коротким, не слоя 1 см.
Рис. 1. Кристаллы дитизона, полученные при медленном выпаривании хлороформного раствора (40 X).
Модуль поглощения
Рис. 2. Спектры поглощения HDz- в водных щелочных растворах.
——— водный 25 мкМ раствор HDz-; ---------25 мкМ раствор H_>Dz в четырех-
хлористом углероде.
Дитизон
17
Дитизон немного растворим в концентрированных минеральных кислотах (H2SO4, НО, Н3РО4 и др.) с образованием фиолетово-красного раствора, а в ледяной уксусной кислоте — с образованием синего раствора. Растворы в кислотах, особенно в концентрированной серной кислоте, мало устойчивы [78] и обычно быстро разлагаются.
Спектры поглощения растворов дитизона в кислотах несколько напоминают спектры поглощения его растворов в индифферентных органических растворителях (см. рис. 3). Первые две полосы поглощения различны по высоте, но смещены в сторону более коротких длин волн.
3. ОТНОШЕНИЕ К ОРГАНИЧЕСКИМ РАСТВОРИТЕЛЯМ
В органических растворителях дитизон растворяется относительно хорошо. Хуже всего он растворяется в насыщенных углеводородах, спиртах и кетонах, лучше — в галогенозамещенных углеводородах, из них особенно хорошо в хлороформе. Дитизон удерживается в растворе даже в водусодержащих органических растворителях. Все растворы дитизона в органических растворителях в основном окрашены в зеленый тон, если только не произошло разложения дитизона. Ассоциации молекул H2Dz и соответственно отклонение поведения раствора дитизона от закона Беера не наблюдалось.
Растворы дитизона в органических растворителях окрашены в очень интенсивный зеленый цвет. Так, раствор дитизона в хлороформе, разбавленный до 1 : Ю7, при толщине слоя 1 см обладает еще отчетливой окраской. Растворы дитизона во всех органических растворителях имеют в видимой области спектра два четко выраженных максимума потлощения и один минимум, лежащий в интервале длин волн 505—530 мц (табл. 1).
В ультрафиолетовой области наряду с менее четко выраженными полосами поглощения четкий максимум поглощения наблюдается в интервале длин волн 235— 320 мц, а минимум поглощения — в интервале 360 — 380 лф (см. рис. 3). Наиболее четкими являются ультра
18 Дитизон и образуемые им внутрикомпяексные соединения
фиолетовые спектры поглощения растворов дитизона в ацетонитриле, диэтиловом эфире, диоксане.
Р и с. 3. Спектры поглощения растворов H2Dz в четыреххлористом углероде и хлороформе.
------25 мкМ раствор H2Dz в четыреххлористом углероде; ----- 25 мкМ. раствор H2Dz в хлороформе;----------------------------------- 250 мкМ раствор H2Dz в четыреххлористом
углероде;------- 250 мкМ раствор H2Dz в хлороформе.
В зависимости от природы органического растворителя растворы дитизона обладают более или менее четко выраженным дихроизмом, т. е. на прямом свету они окрашены в зеленый цвет, а в проходящем — в красный. В данном случае дихроизм, являющийся результатом расширения обоих максимумов поглощения в сторону расположенного между ними минимума поглощения (см. рис. 3), вследствие справедливости закона Беера прямо пропорционален концентрации дитизона и толщине слоя. В растворах дитизона в хлороформе дихроизм проявляется примерно в 2,5 раза сильнее, чем в растворах в четыреххлористом углероде [366]; особенно сильный дихроизм наблюдается для растворов дитизона в этиловом спирте. Относительно малое поглощение спиртовых растворов дитизона по сравнению с поглощением хлороформных растворов дитизона является, по мнению Р. Е. Черницкой [526], свидетельством образования молекулярного соединения из спирта и дитизона, в особенности из изоамилового спирта и дитизона.
Как это следует из рис. 3, харатер спектра поглощения растворов дитизона зависит от природы растворителя.
Дитизон
19
В случае растворов дитизона в смешанных растворителях по1 лощение при определенной длине волны зависит от состояния обоих растворителей. Как видно из рис. 4, эта зависимость не является линейной. Из наклона кривых следует, что добавки небольших количеств
Рис. 4. Изменение поглощения 25 мкМ растворов дитизона в зависимости от соотношения растворителей (четыреххлористый углерод — хлороформ).
хлороформа к четыреххлористому углероду оказывают заметное влияние на поглощение, в то время как присутствие небольших количеств четыреххлористого углерода в хлороформе мало влияет на поглощение в обычном интервале длин волн.
4. РАВНОВЕСИЯ В ОДНО- И ДВУХФАЗНЫХ СИСТЕМАХ
В водных растворах дитизон ведет себя как очень слабая одноосновная кислота:
Н2^^волн Ч—— HDzBoah. + Нводн.*
(1)
Константа равновесия D этой системы равна Т~\ _________________ [HDz ]водн. 1водп.
[H2Dz]B(Uh.
Дитизон
2/
дятся ионы HDz-. Распределение дитизона рассчитывают с помощью уравнений (2) и (5) по величинам D и V:
________[H2Pz]opr>_________ 1водн, Zg\
[H2Dz]boah. + [HDz ]водп. £> + [Н+]водп.
При увеличении щелочности раствора концентрация [H2Dz]bm„. и [Н+]водн. соответственно уменьшается, так что при суммировании этими членами можно пренебречь. В результате получается упрощенное выражение [503]:
[Н2Рг]Орг, Р IH + 1 1 1Н + 1 /7^
[HDz"]B(Uh. Род»-— дЛ11 Ьодн.- J
Отсюда
TS__ [HDz ]водн. ’ [ВЫВОДИ. _ /Q\
Л — [H2Pz]opr. — V ’ W
где К — константа равновесия реакции диссоциации дитизона в двухфазной системе *:
HoD Zgpp. Ч— Н D z ВОДН. Ч- НВОДН.«
(9)
Значения К для систем четыреххлористый углерод — вода и хлороформ — вода неоднократно определялись также в присутствии различных электролитов. Для систем бензол — вода и изоамиловый спирт — вода значение К равно соответственно 2,9 • 10~10 и 0,1 • 10~10 [526] **. Соотношение [H2Dz]Opr./[HDz~]B(UH. (7) служит мерой экстракции дитизона данным органическим растворителем из водного щелочного раствора при определенном pH. На рис. 5 приведены кривые распределения дитизона в двух наиболее часто применяющихся в анализе двухфазных системах растворителей. Переход дитизона
* Бабко А. К. и Пилипенко А. Т. [467] константу этого равновесия обозначают /\h_.Dz и считают, что она характеризует энергию химической связи в водном растворе между анионом HDz- и водородным ионом; образовавшиеся молекулы дитизона переходят в органический растворитель. В случае применения четыреххлористого углерода ими было найдено /\н Dz = 2 • 10-9. — Прим, ред.
**Для систем хлороформ — вода, дихлорэтан — вода эта же константа соответственно равна 1,76 • 10-11 и 0,76 • 10-10 [571].— Прим. ред.
22 Дитизон и образуемые им внутрикомплексные соединения
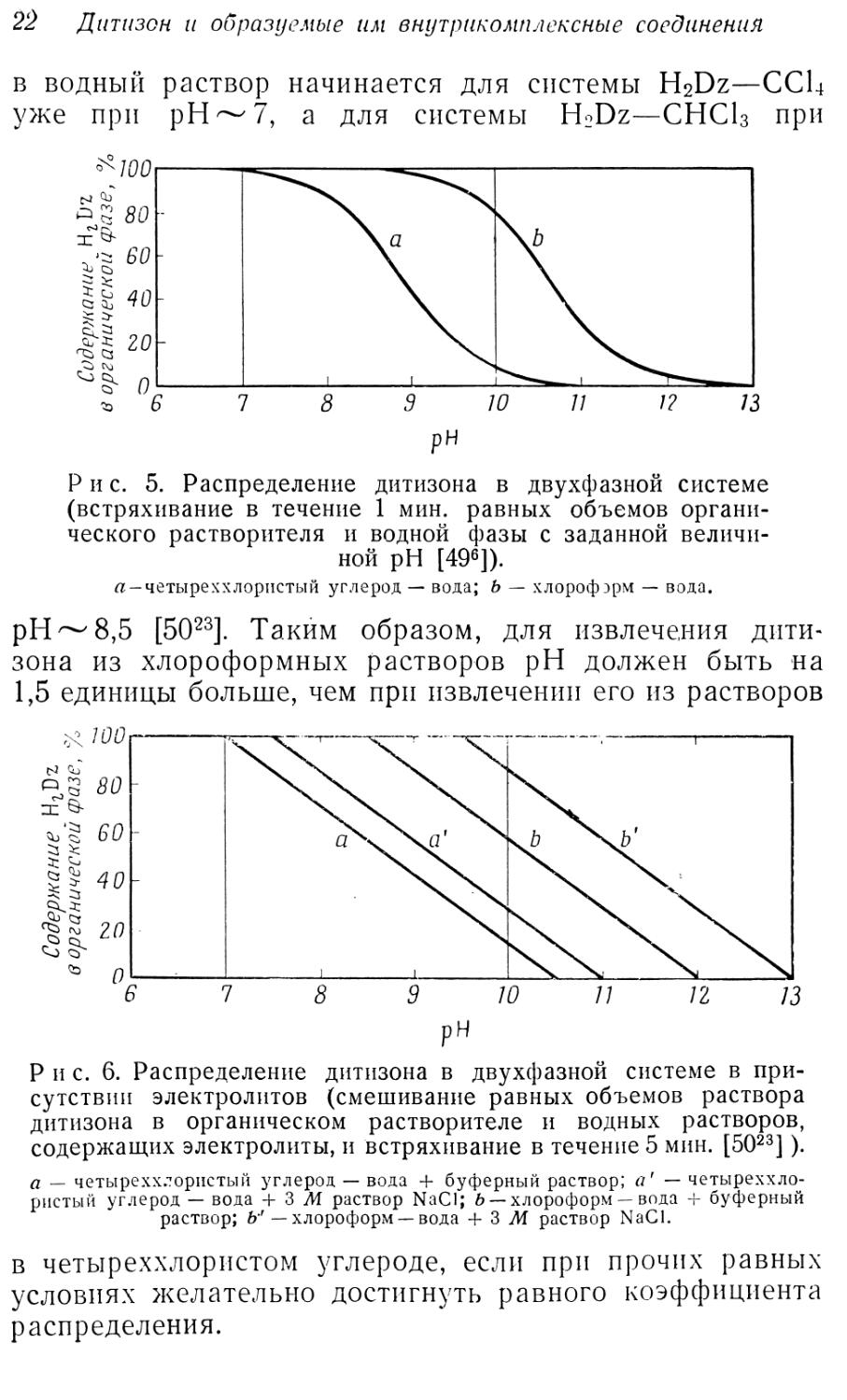
в водный раствор начинается для системы H2DZ—ССЦ уже при рН~7, а для системы H2Dz—CHCI3 при
Р и с. 5. Распределение дитизона в двухфазной системе (встряхивание в течение 1 мин. равных объемов органического растворителя и водной фазы с заданной величиной pH [496]).
« — четыреххлористый углерод — вода; Ь — хлорофэрм — вода.
pH ~ 8,5 [5023]. Таким образом, для извлечения дитизона из хлороформных растворов pH должен быть на 1,5 единицы больше, чем при извлечении его из растворов
pH
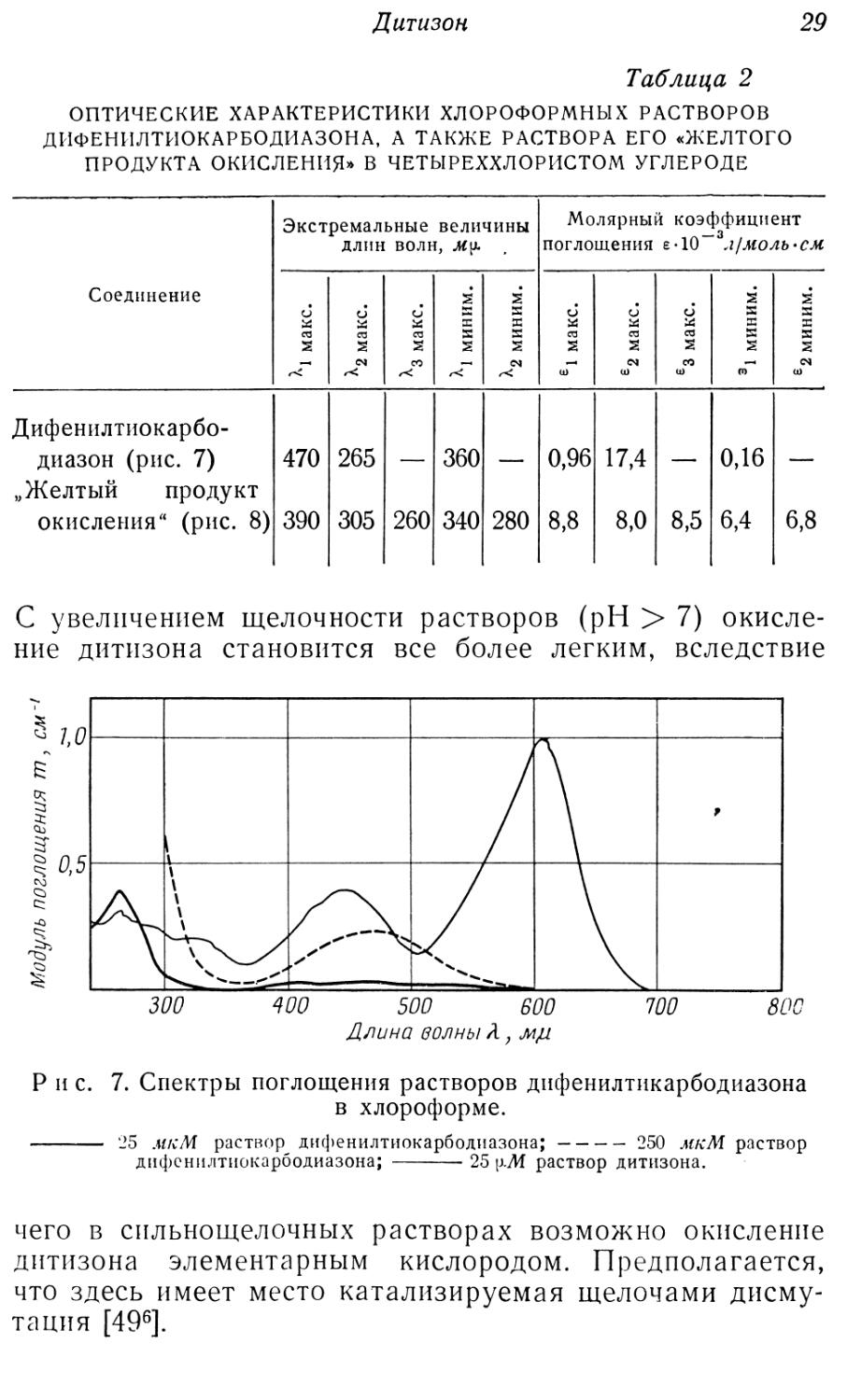
Р и с. 6. Распределение дитизона в двухфазной системе в присутствии электролитов (смешивание равных объемов раствора дитизона в органическом растворителе и водных растворов, содержащих электролиты, и встряхивание в течение 5 мин. [5023]). а _ четыреххлористый углерод — вода + буферный раствор; а' — четыреххлористый углерод — вода + 3 М раствор NaCl; Ь — хлороформ — вода ч- буферный раствор; Ь’’ —хлороформ — вода + 3 М раствор NaCl.
в четыреххлористом углероде, если при прочих равных условиях желательно достигнуть равного коэффициента распределения.
Дитизон
23
В присутствии большого количества электролитов переход дитизона в водную фазу может быть затруднен, и для извлечения из органической фазы приходится создавать более высокий pH (рис. 6) [3516].
Целесообразно коэффициент распределения, выведенный в формулах (6) и (7), вследствие его сходства с коэффициентом распределения Нернста, считать коэффициентом экстракции и обозначить символом Е.
В данном случае содержание вещества S в обеих фазах относят не к определенному молекулярному состоянию, а к брутто-концентрации:
[$]ОрГ.
[^]водн.
(10)
Для дитизона распределение его записывается следующим образом:
Г7 _ _______[HgDzBpr,_______,_[H2Dz]Opr. ____ 1 Гт_т +1
23 ~ [H2Dz]B0AHt ф-[HDz“]BOjH. ~[HDz"]B(mi. ~К[ГЛ
(11)
Так как К зависит от температуры и от характера и количества электролитов, то и Е зависит от этих величин.
Выход экстракции А, достигаемый при однократном извлечении равными объемами органического растворителя УОрг. и водной фазы УрОдН. (иначе говоря, при V0Pr. = Цзодн.), можно рассчитать при помощи следующей формулы:
А = —100%. (12)
Zi -f- 1
Выход экстракции А при заданной величине Е можно изменять: а) при простом встряхивании — изменяя соотношение объемов ЦОрг./^БОднл Ь) при фракционной экс-стракции — применением нескольких (п) повторных встряхиваний со свежими порциями растворителя. Для п экстракций выход А можно рассчитать по следующей формуле:
(13)
24 Дитизон и образуемые им внутрикомплексные соединения
Для -vv°pi' £"$>1 (около 10) можно пользоваться прибли-•'водн.
женной формулой:
/I/ \п
I горг. М I Т Г I
А = юо у— / = 100 —— . (14)
I V Орг. M il рП /V ВОДИ.
\ V П I ~l L П —- у I
\ v води. / \ v орг. /
5. СТРУКТУРНЫЕ ФОРМУЛЫ ДИТИЗОНА
Для дитизона были предложены следующие структурные формулы:
N=-_N-C6H5 s^cz
^NH—NH-C6H5 Кето-форма
N-N—C6H5
N—NH • C6H5
Енольная форма
/СбН5
ZN=N( HS—cz 'ti
^N—N(
C6H6
Циклическая форма
Чтобы объяснить отношение дитизона к ионам металлов (см. стр. 34—35), Г. Фишер [343] выдвинул предположение о существовании таутомерии между кето- и енольной формой, по которому в кислых растворах преобладает кето-форма, а в щелочных — енольная. Ирвинг и сотрудники [49б] допускают существование внутреннего водородного мостика для енольной формы и таким образом приходят к циклической форме *. Кислотные свойства дитизона обусловлены водородом сульфгидрильной группы (см. стр. 19). В образовании двузамещенных внутрикомплексных солей должен принимать участие водород имидной группы (см. стр. 36).
* Существование внутреннего водородного мостика (Н-цикла, водородной связи) в молекулах исходных аналитических реагентов, образующих внутрикомплексные соли, впервые было отчетливо показано Кульбергом Л. М. [4311, 4614, 5031].— Прим. ред.
Дитизон 25
Корвин и Джексон [499] сделали вывод о дифенилтио-карбазидном строении дитизона, установив правильное местоположение фенильных групп, и подтвердили, что он соответствует формуле, которую принял для дитизона Е. Фишер [78], исходя из его синтеза. Кето- и енольную таутомерию дитизона пытались объяснить путем сравнения кривых поглощения дитизона (в интервале 250— 700 жр) с кривыми поглощения аналогичных соединений [522б] *
6. ПРОИЗВОДНЫЕ ДИТИЗОНА
При взаимодействии водного щелочного раствора дитизона с диметилсульфатом образуется S-метилдитизон (со-метилмеркаптодифенилформазан или метиловый тиоэфир дитизона) [5214]:
ZN—N-—СбН5 /N=N—C6H5
NaS—(У ..(CH3O),so2^ CH3S—CZ
^N—NH • C6H5 ^N—NH • C6H5
представляющий собой черное вещество с бронзовым металлическим блеском (т. пл. 118—120°). Вследствие блокирования сульфгидрильной группы это соединение
* Пелькис П. С. с сотрудниками (Пупко Л. С. и Дубенко Р. Г.) ' [5130, 5336, 5628, 5629, 572, 573, 574, 575], рассматривая дитизон и его аналоги с точки зрения тион-тиольной таутомерии, считают, что коротковолновый максимум на кривой спектра поглощения этих соединений (в частности, для дитизона в четыреххлористом углероде 450 jwp-) принадлежит тиольной форме, а длинноволновый максимум поглощения (для дитизона в СС1< 620 лф) — тионной форме. Кислые свойства дитизона связаны с тиольной (енольной) формой. Для количественного соотношения тиольной и тионной (кето) форм в таутомерной смеси имеют значение растворитель, природа заместителей, температура и другие факторы. Отношением оптических плотностей в области длинноволнового и коротковолнового максимумов Пелькис П. С. с сотрудниками характеризуют состояние тион-тиольного равновесия в данном растворителе. Пелькис П. С. и Дубенко Р. Г. [575], изучая влияние растворителя на таутомерное равновесие дитизона и его аналогов, показали, что константа этого равновесия для арилтиокарбазонов приближенно равна отношению оптической плотности в области длинноволнового максимума d\ макс, к оптической плотности при коротковолновом максимуме d\ макс., •
Дубенко Р. Г., Пелькис П. С. и Шека И. А. [601] измерили дипольный момент дитизона и нашли его равным 3,50£>, что находится в пределах, характерных для группы уС = S. — Прим, ped.
26 Дитизон и образуемые им внутрикомплексные соединения
в отличие от дитизона не растворяется в водных щелочах и не образует при взаимодействии с ионами металлов внутрикомплексных соединений. В растворах наблюдалась термическая изомеризация, которую объясняют возможной цис-транс- и с^н-ант-изомерией [5619] *.
* S-Метильное производное дитизона получил также Пель-кис П. С. [5336] при взаимодействии равномолекулярных количеств дитизона и йодистого метила в щелочной среде на холоду в виде кристаллов коричневого цвета с металлическим блеском и т. пл. 122—123°. Полученный им продукт растворяется в большинстве органических растворителей с фиолетово-розовым окрашиванием. Этот продукт был им хроматографически разделен на два одинаковых по составу, но различных по окраске и температуре плавления: продукт красного цвета с т. пл. 127—128° и максимумом поглощения бензольного раствора (желтого) при 430 мр; продукт темно-коричневого цвета с т. пл. 124° и максимумом поглощения бензольного раствора (фиолетового) при 545 лца
Дальнейшими работами Пелькис П. С. и Дубенко Р. Г. [5628, 577, 578] установили, что желтый продукт метилирования дитизона является цис-цислхзомеуом, а фиолетовый — транс-транс-изомером. Для проверки правильности этого вывода Дубенко Р. Г., Пелькис П. С. и Шека И. А. [60* 1 * * *] определили дипольные моменты этих продуктов. (Для ряда веществ показано, что если вообще транс-изомеры имеют постоянный дипольный момент, то он значительно меньший, чем у час-изомеров.) Для желтого продукта дипольный момент оказался равным 4,802), а для фиолетового — 2,242). В связи с тем, что установленное различие в величинах дипольных моментов согласуется с литературными данными для других веществ, авторы считают, что полученные ими результаты служат подтверждением их предположения, что желтый продукт метилирования представляет собой /{Hc-zjac-изомер (а), а фиолетовый—транс-транс-изомер (б):
С6Н5
I
/N=N-C6H5 zN=N
CH3SCZ CH3SCZ
^N—NH • C6H6
I
NH • CeH5
(a) (6)
Кроме этого, Пелькис П. С. и Дубенко Р. Г. [57s] синтезировали бензильные производные дитизона
/N=N • СбН5 c6h5ch2sc/
NH • СбН5
1,5-ди- (о-толил) - и 1,5-ди- (о-феноксифенил) -тиокарбазонов и изучили их изомерные превращения. — Прим. ред.
Дитизон
27
S-Метилдитпзон образуется также при действии на хлороформный раствор однозамещенного дитизоната серебра (AgHDz) йодистого метила CH3J, а также при обработке спиртового раствора со-хлордифенилформазана метилмеркаптидом натрия NaSCH3 [5214]:
СбН5 С6Н5
I I
ZN—N4 zN=N
Г1 г/ NaSCH3 у ГН Q
CI—С п---------> Сп3э—С
%N—n/ ^N—NH
I I
C6H5 C6H6
Под влиянием фосгена, который может присутствовать в виде примеси в четыреххлористом углероде или хлороформе, образуется дифенилтиобиазолон [91]:
HS—С
/N=N—С6Н5
^N—NH • С6Н5
COClo ------>
S___С—N=N—С6Н5
ОС N
I
С6н5
При восстановлении дитизона цинковой пылью в щелочном растворе образуется дифенилтиокарбазид C13H14N4S [82] *. Он образуется так же, как промежуточное соединение при обычном способе получения дитизона, и превращается в дитизон при дисмутации в спиртовом растворе щелочи:
/N=n-c6h5 s=cz
XNH—NH • СбН5
,NH—NH • C6H5
+ 2H S=CZ
XNH—NH • C6H5
Чистый дифенилтиокарбазид кристаллизируется в виде бесцветных призм, т. разл. 140°.
В отличие от поведения дитизона в щелочных растворах его нейтральные и кислые растворы не окисляются кислородом. С ионами Ag+ и Hg2+ дитизон образует внутрикомплексные соединения, причем эти ионы не
* По некоторым данным [26], дифенилтиокарбазид образуется также при восстановлении карбазона сульфидом аммония, что, однако, не подтвердилось при проверке.
28 Дитизон и образуемые им внутрикомплексные соединения
восстанавливаются. Свободный йод заметно не окисляет дитизон; ионы Fe3+ окисляют его медленно, а ионы [Fe(CN)6]3-— быстрее.
При сливании хлороформных растворов дитизона и йода окраска раствора становится фиолетовой и выпадает йодид дитизона C13H12N4SJ2 в виде блестящих бронзово-зеленых призм, плавящихся при 135° [26]. Если к раствору йодида дитизона в смеси ацетона и ледяной уксусной кислоты прилить раствор тиосульфата натрия, то количественно выделяется свободный дитизон.
В более жестких условиях окисления (бром, хлор, пергидроль, амилнитрит [26] и др.) дитизон может быть легко окислен и в кислых растворах. С переходом через промежуточный продукт при этом образуется дифенилтиокарбодиазон C13H10N4S:
/N=N—С6Н5 N=N—СбН5
S- C + О —> S—С или
XNH—NH • СбН5 XN=N—С6Н5
Дифенилтиокарбодиазон кристаллизуется в виде оранжево-красных игл, разлагающихся при 180°. Растворы двуххлористого олова и другие восстановители (кроме водорода в момент выделения) не восстанавливают дифенилтиокарбодпазон вновь в дитизон. Вещество растворимо в хлороформе, ацетоне и этиловом спирте с образованием желтых растворов и едва растворимо в четыреххлористом углероде, диэтиловом эфире и бензоле. Дифенилтиокарбодпазон не образует внутрикомплексных соединений и не растворяется в водных щелочах. В концентрированной серной кислоте он растворяется с образованием синего раствора, который при разбавлении водой становится красным. Раствор дифенилтиокарбодиазона в хлороформе проявляет слабое поглощение в видимой области спектра; напротив, в ультрафиолетовой области возникают четкие полосы поглощения (см. рис. 7 и табл. 2).
Дитизон
29
Таблица 2
ОПТИЧЕСКИЕ ХАРАКТЕРИСТИКИ ХЛОРОФОРМНЫХ РАСТВОРОВ ДИФЕНИЛТИОКАРБОДИАЗОНА, А ТАКЖЕ РАСТВОРА ЕГО «ЖЕЛТОГО ПРОДУКТА ОКИСЛЕНИЯ» В ЧЕТЫРЕХХЛОРИСТОМ УГЛЕРОДЕ
Соединение Экстремальные величины длин волн, жр Молярный коэффициент — 3 поглощения е -10 л/моль-см
\ макс. ^2 макс. макс. \ миним. ^2 МИНИМ. е1 макс. е2 макс. £ з макс. 1 3, 1 миним. £ 2 МИНИМ.
Дифенилтиокарбодиазон (рис. 7) „Желтый продукт окисления" (рис. 8) 470 390 265 305 260 360 340 280 0,96 8,8 17,4 8,0 8,5 0,16 6,4 6,8
С увеличением щелочности растворов (pH > 7) окисление дитизона становится все более легким, вследствие
Р и с. 7. Спектры поглощения растворов дифенилтикарбодиазона в хлороформе.
------ 25 мкМ раствору дифенилтиокарбодиазона;---- 250 мкМ раствор дифенилтиокарбодиазона; --------------------------25 рТИ раствор дитизона.
чего в сильнощелочных растворах возможно окисление дитизона элементарным кислородом. Предполагается, что здесь имеет место катализируемая щелочами дисму-тация [496].
30 Дитизон и образуемые им внутрикомплексные соединения
В результате легкого окисления дитизона всегда образуется дифенилтиокарбодиазон, однако этот процесс сопровождается образованием ряда промежуточных продуктов, растворяющихся с желтой окраской в хлороформе и четыреххлористом углероде. Эти продукты могут присутствовать в виде примесей в дитизоне или образуются при хранении растворов дитизона. Аналогично дифенилтиокарбодиазону промежуточные продукты окисления не растворимы в водных щелочах, вследствие чего их легко отделить от дитизона. Они не способны также к образованию внутрпкомплексных соединений.
Рис. 8. Спектр поглощения „желтого продукта окисления", образовавшегося в 25 мкМ растворе дитизона в четыреххлористом углероде.
------„желтый продукт окисления" в четыреххлористом углероде; ------ 25 мкМ. раствор дитизона в четыреххлористом углероде.
При длительном хранении изумрудно-зеленого раствора дитизона в четыреххлористом углероде в зависимости от чистоты растворителя, интенсивности освещения и температуры последний через некоторое время (от нескольких дней до нескольких месяцев) желтеет. Одновременно выпадают желтые хлопья дифенилтиокарбодиазона. Раствор остается желтым вследствие присутствия промежуточных продуктов. Вследствие хорошей растворимости дифенилтиокарбодиазона в хлороформе он не выпадает из хлороформных растворов дитизона. С течением времени промежуточные продукты
Внутрикомплексные соединения 31
окисления постепенно превращаются в дифенилтиокарбодиазон. Частично эти соединения могут быть восстановлены двухлористым оловом вновь до дитизона. При действии солнечных лучей на раствор дитизона в четыреххлористом углероде быстро образуются продукты окисления, еще быстрее они образуются при действии рентгеновских лучей. При дальнейшей обработке перекисью водорода в щелочном растворе образуется дифенилтиокарбодиазон. Согласно данным Карлтона и сотрудников [551], разложение дитизона в нафталине является реакцией первого порядка и при 100° энергия активации равна 18 ккал)моль.
Спектры поглощения промежуточных продуктов окисления, названных «желтый продукт окисления», изучались в видимой области спектра Г. Фишером [35 Ч и другими исследователями [37 7]. Так как состав этого «желтого продукта» меняется в зависимости от происхождения, то для него не было получено определенного спектра поглощения. Несомненно лишь то, что поглощение в видимой области спектра сильнее, чем у дифенилтиокарбодиазона, но все же значительно слабее, чем у дитизона. В ультрафиолетовой области спектра всегда наблюдаются три характерные полосы поглощения (рис. 8).
В жестких условиях окисления (KMnO4, Н2О2, горячая концентрированная H2SO4, НС1О4 и др.) дитизон быстро разлагается.
П. ВНУТРИКОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
1. ОБЩИЕ СВЕДЕНИЯ
В водных растворах щелочей дитизон H2Dz образует легко растворимые и полностью диссоциированные соли щелочных и щелочноземельных металлов (см. стр. 13); с 18 различными ионами тяжелых металлов в определенном интервале pH образуются соответствующие внутрикомплексные соли. В периодической системе эти элементы расположены очень близко один от другого
Таблица 3
РАСПОЛОЖЕНИЕ ЭЛЕМЕНТОВ ГРУППЫ ДИТИЗОНА В ПЕРИОДИЧЕСКОЙ СИСТЕМЕ ЭЛЕМЕНТОВ (В ГРУППЕ ДИТИЗОНА РИМСКИМИ ЦИФРАМИ ОБОЗНАЧЕНА ПОЛОЖИТЕЛЬНАЯ ВАЛЕНТНОСТЬ ИОНОВ МЕТАЛЛОВ ВО ВНУТРИКОМПЛЕКСНЫХ СОЕДИНЕНИЯХ)
1а Па II lb IVb Vb VIb Vllb VIHb lb lib Illa IVa Va Via Vila 0
1 2
н He
3 4 5 6 7 8 9 10
Li Be В c N 0 F Ne
11 12 13 14 15 16 17 18
Na Mg Al Si P s Cl Ar
25 26 27 28 29 30
19 20 21 22 23 24 II II II II П, I II 31 32 33 34 35 36
К Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga Ge As Se Br fcr
46 47 48 49 50
37 38 39 40 41 42 43 44 45 II I II III II 51 52 53 54
Rb Sr Y Zr Nb Mo Tc Ru Rh Pd Ag Cd In Sn Sb Те J Xe
78 79 80 81 82 83 84 85 86
55 56 57 72 73 74 75 76 77 II III, I II, I I II III
Cs Ba La Hf Ta W Re Os Ir Pt Au Hg Tl Pb Bi Po At Rn
87 88 89 99 91 92
Fr Ra Ac 1 Th Pa . U
Внутрикомплексные соединения
33
и обычно называются элементами «группы дитизона». К этой группе относятся только те элементы, ионы которых образуют в водных растворах труднорастворимые сульфиды. В табл. 3 группа дитизона заключена в рамку.
При теоретическом исследовании свойств дитизона-тов и их устойчивости были установлены некоторые закономерности. Имеется определенная зависимость между числом внешних электронов, их распределением и ионными радиусами катионов, реагирующих с дитизоном с образованием внутрикомплексных соединений [343, 375, 406, 422]. Параллельно проводилось сравнение дитизонатов с комплексными соединениями, образуемыми дифенилкарбазоном, а-нитрозо-р-нафтолом, g-нит-розо-а-нафтолом и другими комплексообразователями [406, 422, 4813, 525]. Так называемое «правило Вих-мана» [395], согласно которому дитизонат данного элемента способен существовать в тем более кислой среде, чем более благороден этот элемент, не всегда оправдывается.
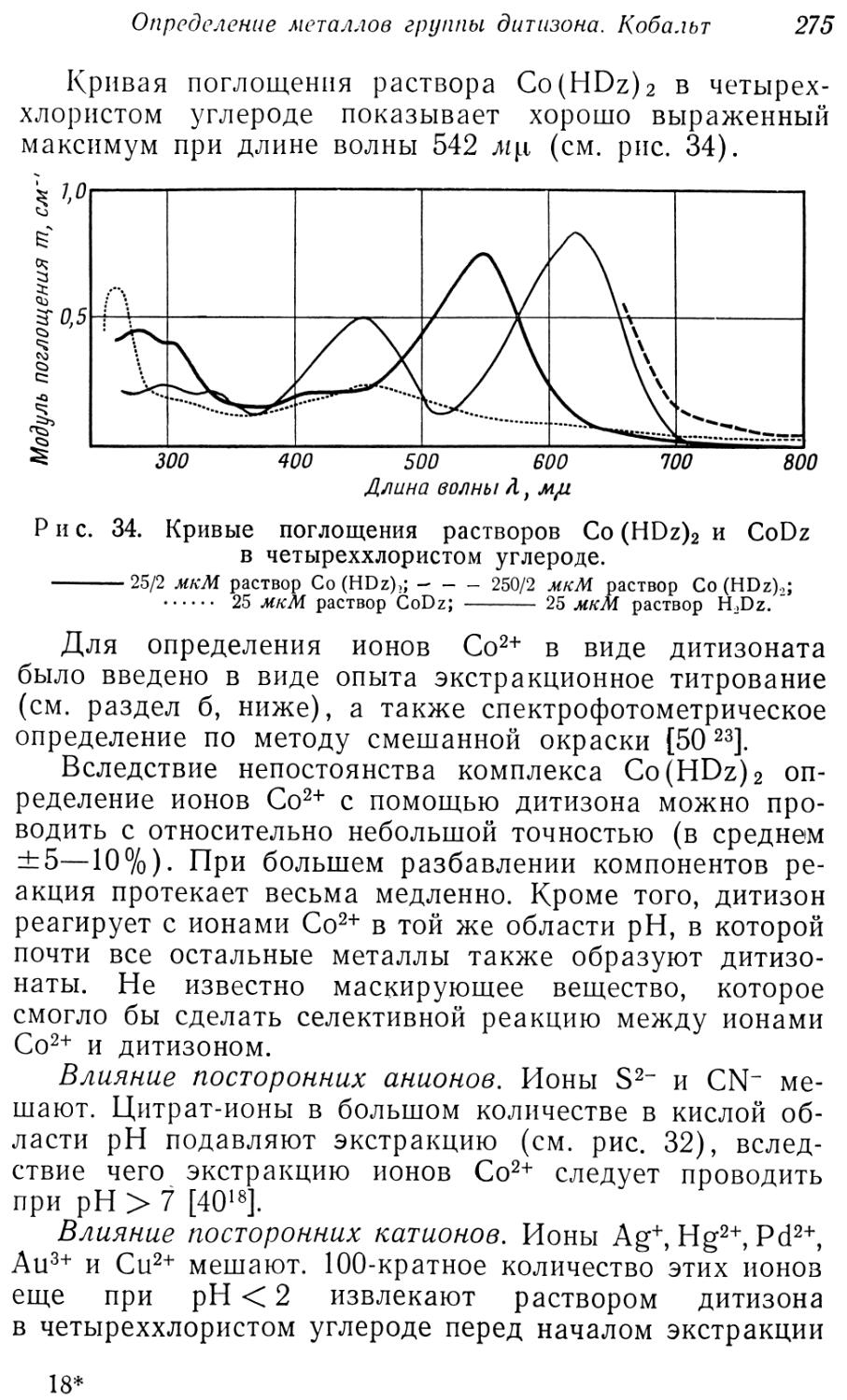
Утверждение, что из группы платиновых металлов главным образом Ru3+ образует фиолетовый дитизонат [52 15], не было нами подтверждено даже для препаратов, не содержащих 2п2+-ионов.
Карлтон и Бредбери [546, 551] наблюдали красное окрашивание при взаимодействии ионов Sb3+ с растворами дитизона в бензоле, в плавленом нафталине и др. Эти же авторы описывают цветные реакции растворов дитизона в расплавленном нафталине с ионами Fe3+, Sn4+, Се4+ и Mg2+.
Красные и оранжевые соединенеия Sb3+ и As3+ с дитизоном можно извлекать органическими растворителями из кислых растворов: Sb3+ из 1,2—1,5 н. солянокислых растворов, As3+ из 3—7 н. солянокислых растворов. Поведение этих соединений, а также их строение отличаются от других дитизонатов, так что сурьму и мышьяк едва ли можно причислить к элементам группы дитизона. Цветные реакции дитизона были использованы в хроматографии (стр. 371).
Тарбелл и Беннет [47s] провели подробные исследо-
3 Зак. 2157.
34 Дитизон и образуемые им внутрикомплексные соединений вания взаимодействия соединений мышьяка с аналогом дитизона с ди-/г-бифенилтиокарбазоном *.
Образуемые дитизоном внутрикомплексные соединения называют дитизонатами. В зависимости от того, замещается ли в дитизоне один или оба водорода, различают одно- и двузамещенные дитнзонаты [5225].
Существование однозамещенных дитизойатов состава M!HDz, М (HDz)2 и Min(HDz)3 установлено для всех элементов группы дитизона (см. рис. 13, стр. 132), кроме Аи+ и Ро ?, дитнзонаты которых не выделены в чистом виде и пока еще детально не исследованы.
Двузамещенные дитнзонаты состава MoDz или М11 Dz были точно установлены для ионов Cu2+, Си+ Ag+, Hg2+ и Hg+. Имеются доказательства существования двузамещенных дитизонатов Pd2+, Pt2+, Au‘3+, Au+ и Co2+ (см. стр. 181, 186, 189, 190 и 271).
Для ионов, способных образовывать одно- и двузамещенные дитнзонаты, можно направлять реакцию по желаемому пути созданием соответствующего pH (или введением избытка реагента). Одно- и двузамещенные дитнзонаты находятся между собой в подвижном равновесии.
Брутто-фор'мула большинства исследованных дитизонатов достаточно точно установлена, однако имеется еще много неясностей в вопросах, касающихся их строения. Особенно большие затруднения йстречаются при объяснении структуры двузамещенных дитизонатов.
Г. Фишер считает [343], что в основу строения однозамещенных дитизонатов должна быть положена кетоформа дитизона, а в основу двузамещенных — енольная форма (см. стр. 24). Поэтому начиная с 1934 г. в литературе однозамещенные дитнзонаты называют «кето-
* Пилипенко А. Т. [5627] сопоставил прочность комплексов металлов с реагентами, содержащими тионную и тиольную группу (в том числе и дитизонатов), с прочностью соответствующих сульфидов в зависимости от положения металла в периодической системе Д. И. Менделеева и показал, что наибольшей прочностью обладают сульфиды и комплексы металлов радонового периода и наименьшей—металлов криптонового периода, т. е. прочность связи растет в группах с увеличением порядкового номера (менделеевского числа). — Прим. ред.
Внутрикомплексные соединения
солями», а двузамещенные — «енольными солями». Хотя кето- и енольная формы берут начало от двух таутомеров дитизона, полученные соли не являются изомерами, так как они отличаются между собой различным молярным соотношением дитизона и эквивалента металла в соответствии с тем, что одна из них является однозамещенной, а другая — двузамещенной.
Далее Г. Фишер [343] предполагает, что при образовании однозамещенного дитизоната («кето-соли») водород имидной группы, находящейся в непосредственном соседстве с фенильным остатком, замещается соответствующим эквивалентом металла; одновременно происходит замыкание шестичленного цикла за счет побочной валентности иона металла и азота из азогруппы (формула I). Ирвинг и сотрудники [496] исходили из циклической формулы дитизона (см. стр. 24). Они считали, что при образовании однозамещенных дитизона-тов водород сульфгидрильной группы замещается эквивалентом металла (формула II). Гейгер [52 25] считает, что в данном случае образуется клешневидное соединение, в котором ион металла связан главной валентностью с атомом серы, а побочной валентностью — с атомом азота (формула III).
Ниже приводятся структурные формулы однозамещенных дитизонатов (/г — валентность иона металла):
с6н5 I
ZN=N\
s=c/
XNH—Ny I C6H5
C—N=N—C6H5
'-NH—
I
. c6H6
1.1
n
3*
36 Дитизон и образуемые им внутрикомплексные соединения
Экспериментально доказано, что в молекуле дитизона атом водорода замещается эквивалентным количеством иона металла. Подтверждением справедливости формулы (II) пли (Ш) служит то обстоятельство, что при замещении сульфгидрильной группы группой метил меркаптида образующийся S-метилдитизон (см. стр. 25) не способен давать металлические соли *.
При объяснении структуры двузамещенного дитизо-ната («енольного дитизоната») Г. Фишер [343] допускает, что при енольном строении эквивалентным количеством иона металла замещается как водород имидной, так и сульфгидрильной групп, при этом не обязательно замыкание цикла через азот стоящей на конце азогруппы (формулы IV и V представляют собой структурные формулы двузамещенных дитизонатов):
СбН5
Из соображений напряженности формула IV не пригодна для изображения солей многовалентных металлов [496, 5225]. Исходя из этого, строение двузамещенного дитизоната серебра (Ag2Dz, формула IVa) должно отличаться от структуры двузамещенного дитизоната
* Кузнецов В. И. [4717, 579], рассматривая действие органических реагентов, применяемых в неорганическом анализе, по аналогии с действием неорганических считает также, что в дитизо-патах металл связан с серой. — Прим. ред.
Внутрикомплексные соединения
37
меди (CuDz, формула Va):
/ S
Ag—S—С—N =N—Сб Н5
II
Ag—N—N I
С6н5
I Va
5
С6н5
Va
Двузамещенный дитизонат меди CuDz растворим в органических растворителях, а двузамещенный дитизонат серебра Ag2Dz практически не растворим. Однако различие в растворимости в /г10 раз не является причиной для допущения различного строения. Лишь немногие металлы из элементов группы дитизона образуют двузамещенные дитнзонаты, и то главным образом в щелочной среде. Это обстоятельство было использовано Г. Фишером при обосновании своей кето-енольной теории строения дитизонатов. Существование двузамещенных дитизонатов щелочных металлов пока еще не установлено *.
2. ТВЕРДЫЕ ДИТНЗОНАТЫ
Чистые дитнзонаты представляют собой интенсивно окрашенные кристаллические вещества призматической или игольчатой формы, имеющие определенный стехиометрический состав. При нагревании они заметно разлагаются уже примерно при 80°, при более высоких температурах они улетучиваются [521]. В водных растворах (в определенном интервале pH) они заметно не раство-
* Терентьев А. П. и Рухадзе Е. Г. [5029], отмечая малую вероятность формулы IV из соображений большого перенапряжения связей, предлагают рассматривать соли дитизона, образующиеся в щелочной среде, как внутриионные, т. е. имеющие пространственно не фиксированную связь:
— Прим, ред
Таблица 4 РАСТВОРИМОСТЬ ДИТИЗОНА II НЕКОТОРЫХ ДИТИЗОНАТОВ В ВОДЕ3, ЧЕТЫРЕХХЛОРИСТОМ УГЛЕРОДЕ II ХЛОРОФОРМЕ
Вещество Состав Растворимость д, моль/л Ссылки
вода CClt СНС13 вона СС1, СНС13
Дитизон H,Dz 2-Ю-7 2,1 -10~ 3 > 10“2 [50Д [50Д [50=]
2,5-10“7 * 2,5-Ю-3 7-10“2 [5213]
0,9-10“7 1,0-10“3 > 10“2 [5225] [5223] [50=1
Первичные AgHDz — > 2-10“3 4-10“2
дитнзонаты Hg (HDz). — 6,6-10-5 2,8-10“4
Pd (HDz), — 4,5-10“ 4 —
Au (HDz)3 — 1 -10“5 —
Cu (HDz), 8Д0“9 * * > 1,2-10“3г > 1.5-10“3 [5324]
Bi (HDz)3 — 1,3-10“ 5 1.2-10“5
In (HDz)3 — 7,8 -10“ 4 1,1-10“3
Zn (HDz), _ в > 2,8«10-3 > 1,6-10“3
Cd (HDz), — 1,3-10“ 5 1,3-10“4
Co (HDz), _ в 1,6-ю-4 1,4-10“ 3
Pb (HDz), 2,5 • 10“ 5 4,3-10“ 4
Ni (HDz), _ в 1,2-10“3 . 1,6-10“3
TlHDz — * > 1-10“ 5
Вторичные AgoDz — < 10“ 6 < 10“6
дитнзонаты HgDz — 1,3.10“3 2,8 • 10“ 3
PdDz 6 ——• < 10“ 6 < 10“6
PtDz 6 ’ < 10“ 6 < 10“6
CuDz 6-10 —8 2,1-10“3г 3-10“3 [5328]
CoDz — > 2,5-10“ 5 —
3 Под словом «вода» подразумевается водный раствор, pH которого установлен
для каждого дитизоната так, чтобы не происходило разложения комплексной соли.
б Состав этих дитизонатов достаточно не установлен.
в В строго определенных условиях pH эти соли способны давать при-
мерно 10“4 Л1 растворы в воде (стр. 246, 271, 278). Эти растворы в основном имеют
коллоидный характер.
г Растворимость Cu(HDz), и CuDz установлена (исходя из твердых солей)
равной 5,5’10 —4 или < 1 -10 — 3 молъ!л [5328].
д Приведена растворимость при комнатной температуре.
внутрикомплексные соединения
39
ряются и не разлагаются. Величина растворимости достигает 10-8—10~9 моль!л, т. е. значительно меньше растворимости дитизона (табл. 4). Некоторые дитизо-наты весьма устойчивы в сильнокислой, а другие — в сильнощелочной средах (стр. 132). Только дитизонат таллия TIHDz всегда разлагается в водных растворах; при pH ~ 14 он заметно разлагается, а при pH < 7 полностью.
Для получения твердых дитизонатов к водному раствору соли металла с определенным pH приливают раствор дитизона в водной щелочи или в смеси водной щелочи и смешивающегося с ней органического растворителя (метиловый спирт, этиловый спирт, ацетон и др.), при этом выпадает объемистый осадок мелкокристаллического дитизоната [26, ЗЗ2, 349, 518, 521, 78, 82]. Дити-зонаты можно также получать путем встряхивания водного раствора соли металла с определенным pH с раствором дитизона в хлороформе. Образующийся дитизонат растворяется при этом в хлороформе. Путем упаривания раствора или добавления четыреххлюристогО углерода, петролейного эфира или других растворителей можно выделить кристаллический дитизонат [26, 521, 5225 , 5328].
3. РАСТВОРЫ ДИТИЗОНАТОВ В ОРГАНИЧЕСКИХ РАСТВОРИТЕЛЯХ
За небольшим исключением, однозамещенные и многие двузамещенные дитизонаты образуют окрашенные растворы в органических растворителях, которые можно фотометрировать. Для этой цели пригодны растворы с концентрацией дитизоната 10“5 моль/л.
Растворимость дитизона, а также дитизонатов в четыреххлористом углероде в 104 или в 105 раз больше, чем в воде. Из большинства дитизонатов можно приготовить 10-3—10-4Л4 растворы; несколько менее растворимы Cd(HDz)2, Pb(HDz)2 и Au(HDz)3. Некоторые двузамещенные дитизонаты практически не растворимы в четыреххлористом углероде.
Лучшим растворителем для дитизона и дитизонатов является хлороформ. Растворимость в хлороформе
Таблица 5
ОПТИЧЕСКИЕ ХАРАКТЕРИСТИКИ РАСТВОРОВ ДИТИЗОНА И ДИТИЗОНАТОВ В ЧЕТЫРЕХХЛОРИСТОМ УГЛЕРОДЕ И ХЛОРОФОРМЕ а
Вещество Г б Состав Экстремальные значения длин волн в, мо. Молярный коэффициент поглощения г с-10-3, Л/МОЛЬ-СМ Окраска 1
А1 макс. ^2 макс. Аз M l КС. S А2 МИН. S1 макс. с 2макс. 1 ез макс. I £ 1 мин. £2 мин.
Дити- H2Dz 620 450 300 510 365 32,8 20,0 9,2 4,4 4,4 Изумрудно-зеленая
зон (605) (445) (265) (505) (365) (40,0) (16,0) (12,4) (6,0) (4,0) (Сине-зеленая) а
Одно- AgHDz 462 273 —— 365 - 30,5 17,0 — 2,8 — Золотисто-желтая^
заме- Hg(HDz)2 485 265 — 375 — 71,2 38,4 5,2 — — Оранжево-желтая
щен- Pd(HDz)2 640 450 280 500 370 28,8 34,4 38,4 18,8 8,0 Бледно-зеленая
ные Pt(HDz)2 710 490 260 570 370 30,0 31,6 29,6 5,6 7,6 Коричнево-желтая
дитизо- Au(HDz)3 (-450) (-275) " (-345) — (-24) (-36) — - (-6) — Золотисто-желтая
наты Cu (HDz)2 550 280 350 - 45,2 24,8 —— 15,2 — Красно-фиолетовая
Bi (HDz)3 490 275 380 — 80,0 60,0 14,4 — Красно-оранжевая
ln(HDz)3 510 275 385 87 36 12 —- Малиново-красная
Sn(HDz)2 520 265 —— 395 54 38 — 8 — Красная
Zn(HDz)2 538 280 — 420 — 92,0 31,2 5,6 • (Пурпурно-красная)2
Zn(HDz)2 (530) (280) (420) - (88,0) (33,6) • (5,2) — (Пурпурно-красная)
Cd (HDz)2 520 280 ——— 410 88,0 34,3 —— 4,8 - Розово-красная
Cd(HDz)2 (520) (280) — (405) — (85,6) (34,8) — (4,8) — (Розово-красная) 2
Co(HDz)2 542 277 370 — — 59,2 36,0 — — 11,2 — — Красно-фиолетовая
Pb (HDz)2 520 270 - 405 68,8 35,2 — 8,0 —11 " Карминово-красная-
Pb(HDz)2 Ni (HDz)2 (518) 665 (275) 480 282 (405) 630 385 (63,6) 19,2 (37,2) 30,4 34,8 (8,0) 16,4 14,4 (Карминово-крас-\ a ная) Коричнево-фиолето-
вая
Ni (HDz)2 (670) (480) (280) (620) (385) (20,0) (27,6) (33,6) (16,8) (П.2) (Коричнево-фиолетовая) а
TIHDz (505) (255) 1 — (400) ——— (33,2) (21,2) (2,8) — (Малиново-красная)3
Двуза- HgDz 515 270 — 380 — 23,6 20,0 — 3,4 Фиолетовая
мещен- CuDz 450 - 340 — 20,0 8,0 — Желто-коричневая
ные дитизонаты CoDz 465 1 258 1 360 — -— 9,2 24,8 1 4,8 » 1
а Величины, взятые в скобки, относятся к хлороформным растворам.
6 Одно- и двузамещенные дитизонаты расположены в том порядке, в каком они экстрагируются при увеличении pH (стр. 132, рис. 13).
в Длины волн, а также соответствующие им значения е приведены в порядке от более длинных к более коротким волнам. Приведенные значения максимальных и минимальных длин волн (в jfp.) почти все без исключения соответствуют величинам, установленным Фишером и Вейлем [351] для видимой области спектра. Даже данные для относительно плавных экстремальных величин мало отличаются от других данных, приведенных в литературе.
г Для определения коэффициента поглощения пользовались 25 мкМ. растворами дитизона в органических растворителях, концентрация которых устанавливалась по соответствующему водному раствору соли серебра. Для получения растворов дитизонатов к определенному объему 25 мкМ раствора дитизона прибавляли 2—5-кратный избыток водного раствора соли металла. При встряхивании весь дитизон переходил в соль*и полученный раствор дитизоната фотометрировали на фоне чистых растворителей на спектрофотометре Цейса, модель М4 или M4Q. Приведенные в литературе величины коэффициентов поглощения зачастую несколько отличаются друг от друга. Очевидно, это зависит от чистоты испытуемых растворов, возможного их разложения, разности температур, возможного испарения, конструкции оптических измерительных приборов и др. За небольшим исключением [к таким относятся малоустойчивые растворы дитизонатов In(HDz)3, Co(HDz),, Au(HDz)3 и др.], сходимость величин коэффициента поглощения колеблется в интервале ± 1% [516, 542] *.
л Наблюдали окраску 25 л.'л'ТИ растворов при толщине слоя 1 см.
* Вебер и Воук [60llJ] сделали попытку определить более точные значения молярных коэффициентов экстинкции специально очищенных дитизона и дитизоната свинца. Данные многократных оптических измерений обрабатывались статистически. Авторы считают наиболее важными для расчета концентраций по спектрофотометрическим данным следующие значения: eH.Dz при 620 ml 35.4-10 ; sj-i.Dz ПРИ 520 лго. 5.8-10; ерь (HDz), ПРИ 620 лщ. 3,9-Ю3; ерь (HDz), ПРИ 520 лгр. 72,9-10;. — Прим. ред.
42 Дитизон и образуемые им внутрикомплексные соединения
в 10 раз больше, чем в четыреххлористом углероде. Однако некоторые двузамещенные дитнзонаты очень слабо растворяются в хлороформе.
Растворы дитизонатов в органических растворителях интенсивно окрашены, причем их окраска всегда отличается от окраски растворов дитизона в этих растворителях. Преобладают красные, желтые и фиолетовые тона (табл. 5). Цвет и интенсивность окраски эквимолекулярных растворов в первую очередь зависят от характера и валентности иона металла, относительного содержания дитизона (одно- или двузамещенный дитизонат) и характера растворителя. Температура оказывает различное, но не очень значительное влияние [442].
В видимой области спектра наблюдают четкую полосу поглощения, а для дитизонатов Pt (HDz) 2, Pd(HDz)2 и Ni(HDz)2— даже две полосы В ультрафиолетовой области спектра обычно имеется более или менее четкая полоса поглощения наряду с несколькими более слабыми полосами (см. спектры поглощения дитизонатов в соответствующих разделах гл. 3).
Спектральное поглощение, выраженное с помощью максимального молярного коэффициента поглощения е (л/молъ • см), измеренного при максимальной длине волны, колеблется для различных однозамещенных дитизонатов от 30 000 до 92 000, а для двузамещенных дитизонатов от 20 000 до 25 000 (см. табл. 5).
Стойкость растворов отдельных дитизонатов в органических растворителях во времени и под действием освещения очень различна. Однако даже наименее стойкие растворы все же настолько устойчивы, что их удобно фотометрировать при затемненном дневном свете. С повышением температуры разложение растворов протекает более легко.
Растворы Zn(HDz)2 в четыреххлористом углероде или хлороформе заметно не разлагаются как при хранении в темноте, так и при многодневном стоянии на солнечном свету (стр. 235). Растворы Hg(HDz)2 относительно устойчивы в темноте, но быстро изменяются на свету; с помощью, уксусной кислоты их можно сделать менее чувствительными к свету (ср. стр. 165). Скорость
Ьнутрикомплексные соединения
43
разложения растворов различных дитизонатов в значительной степени зависит от чистоты растворителей (см. примечание на стр. 85).
4. РАВНОВЕСИЕ В ОДНО- И ДВУХФАЗНЫХ СИСТЕМАХ
При встряхивании водного раствора соли металла (Мводн.) с раствором дитизона в органическом растворителе, не смешивающемся с водой, на границе раздела фаз протекает химическое преобразование. Образуется дитизонат, который почти не растворим в воде (см. табл. 4) и поэтому количественно переходит в фазу органического растворителя. Этот процесс, при котором химическая реакция протекает одновременно с экстракцией продуктов реакции, был назван реакцией извлечения [343 , 5 120].
Равновесная реакция образования однозамещенного дитизоната описывается уравнением
МВ0Дн. Ч-/tH2DzOpr M(HDz)nopr. + ^HBoAH., (15)
где п — валентность нона металла.
Константа равновесия К этой реакции, протекающей в двухфазной гетерогенной системе, без учета активностей [Мп+]водн. и [Н+]водн. может быть рассчитана по формуле
[M(HDz)/z]opr.-[H Зводн. [M" + ]boah.-[H2Dz]''pi,
Коэффициент Е рассчитывается по формуле
_ [M(HDz)„]opr. _ [H2Dz]«pr
“ ’[M-W. [нХди.
(16)
(17)
(см. уравнение 10, стр. 23).
При взаимодействии с ионом двухвалентного металла М2+ получается двузамещенный дитизонат. По анало-
44 Дитизон и образуемые им внутрикомплексные соединения
гии для такой системы справедливы уравнения: Мводн.-|-H2DzOpr> MDZopr. + 2НВОдп., [MDz]opr,jH+]"CUH.
[М2 Н]водн. ’ [H2Dz]opr.
[MDz]opr [H2Dz]opr>
. = Л [нП10ДН. •
(15а)
(16а)
(17а)
Если ион двухвалентного металла образует при взаимодействии с дитизоном однозамещенный и двузамещенный дитизонаты, то в органической фазе обе соли находятся в равновесии:
M(HDz)2opr MDzopr. + H2Dzopr.. (18)
Для этой системы константа диссоциации D равна
[MDz]opr..[H2Dz]opr. [М (HDz)2]opr. ‘
Условия равновесия очень усложняются, если при этом принять во внимание распределение дитизона и дитизонатов между обеими фазами и их диссоциацию в водной фазе.
Определение константы равновесия, константы диссоциации и константы распределения между двумя фазами практически весьма затруднено вследствие очень малой растворимости дитизона и дитизонатов в водных растворах с определенными pH. Для этих целей часто приходится пользоваться косвенными методами определения или рассчитывать искомую величину с помощью более легко определяемых величин. В связи с тем что система гетерогенная (водный раствор — органический растворитель), а также в связи с постепенным разложением дитизона и его растворов экспериментальное определение некоторых констант осложняется еще и кинетическими процессами. Для ускорения реакции приходится очень сильно встряхивать смесь, однако процесс встряхивания очень трудно точно воспроизводится. Кроме того, при продолжительном встряхивании, еще до достижения равновесия основной исследуемой реакции, возникают помехи от начавшейся побочной реакции
Внутрикомплексные соединения
45
(например, от разложения дитизона). Эти причины, а также многие другие привели к тому, что до настоящего времени удалось точно определить лишь немногие константы.
'* Сендэл и Гейгер [5225, 5328] подробно изучили равновесия, устанавливающиеся при извлечении иона Си2+ раствором дитизона в органическом растворителе, исходя из предположения, что все коэффициенты активности равны, единице. Эти исследователи экспериментально определили или рассчитали ряд констант равновесия (в качестве растворителя применялся четыреххлористый углерод).
Образование однозамещенного дитизоната меди описывается следующей равновесной реакцией:
Си2воДН. + 2H2Dzopr. Cu(HDz) 2 орг.
= [Сч(НРг)2]орГ| • [Н+]д0Д„ I [Си2 ' ]воап. ’ [Н2О2]ор1.
водя. ’
(I)
Эту равновесную систему можно расчленить на ряд равновесий.
Диссоциация в водных растворах дитизона, являющегося одноосновной кислотой
2*-'^волн. —• FIL/Zb
7~) [HDz ]ВОдн
ZJla =
волн.,
(1а)
ВОЛН.
[H2Dz]
волн.
Равновесное распределение дитизона между водой и четыреххлористым углеродом
IH2Dz]
води. <- — [H2Dz]Opr>, (lb)
[H2Dz]Opr.
V |1J " [H2Dz]bo;i„. •
Диссоциация однозамещенного дитизоната водных растворах
Cu(HDz)2 воды. —J— СЦводн.»
г-\__[HDz ]водн [Cu2+]B0IH.
1с"" [Cu(HDz)2]B01II. *
меди в
(1с)
46 Дитизон и образуемые им внутрикомплексные соединения
Равновесное распределение однозамещенного дитнзо-ната меди между водой и четыреххлористым углеродом
Си (HDz)2bwh. ^=± Си (HDz), ор, , (Id)
[Cu(HDz)2]opr.
v 'd^ [Cu(HDz)2]BOjH. •
Константы Ki, Ць и были определены экспериментально прямыми методами, а константы DIa и £>1с — косвенными методами.
Комбинируя все эти величины, получают
1 Д1с • ‘
Коэффициент экстракции Е, представляющий интерес в аналитической химии, согласно его определению, является мерой распределения определяемого аналитически элемента между фазой органического растворителя и водной фазой и не зависит от того, в каком виде существует этот элемент в обеих фазах. Для описываемой реакции меди с дитизоном коэффициент экстракции равен
_ [Си] орг. [Cu(HDz)2]opr.
Lle = 2 [Си]ВОдн. [Си2+]водн>[Си (НОг)2]водн. •
Как экспериментально и расчетным путем доказали Гейгер и Сендэл [5225 , 5328], во всех встречающихся на практике случаях Си2+ всегда количественно экстрагируется раньше, чем концентрация [Си (HDz) 2] достигает величины одного порядка с [Си2+]водн. • Поэтому на практике можно рассчитывать коэффициент экстракции с помощью упрощенной формулы
_ [Cu(HDz)2]opr. _ [H2Dz]2opr.
[Си2+]водн. [Н-]2одн. •
В присутствии анионов X’, образующих с Си+2труд-нодиссоциируемые соли (маскирующие соединения, а также другие ионы), приведенные уравнения не могут быть непосредственно использованы. При этом в водной фазе связывается дополнительное количество меди и
Внутрикомплексные соединения
47
поэтому следует пользоваться следующим общим урав
нением:
[Cu(HP2)2]„pr. [H2Dz];rp
Ig 2[Си]вод„. 1 [н+];0ДН.
в котором Кг зависит от молярной концентрации аниона и ионной силы раствора.
Для образования двузамещенного дитизоната меди справедлива следующая равновесная реакция:
орг. <— ± CuDzopr.4-2H водн.»
[CuDz]opr [Н + 1'одн
(II)
води
ряд еще
M1 [Си2+]водн. • [H2Dz]opr. • равновесную систему можно также расчленить на равновесий. Кроме равновесий 1а и lb, возможны следующие.
Диссоциация иона HDz- в водном растворе
Н02водн. <--- DZgoflH. +
Зводн. • 1Н 1водн. [HDz ]водн.
-Она =
водн.»
(Па)
Диссоциация двузамещенного дитизоната меди в водном растворе
CuDzboah. Dz водн. + Си водн. , (Пс)
Г\ ___ ЗвОДН. • [Си2~*~]водн.
[CuDz]B0AH.
Равновесное распределение двузамещенного дитизоната меди между водой и четыреххлористым углеродом
CuDzB0AH. -<— CuDzopr., (Ud)
ж, [CuDz]opr<
IId = [CuDz]B0,H. ’
Константы Kia и Vib обсуждались уже при рассмотрении однозамещенного дитизоната меди. Константу Уна оказалось возможным определить экспериментально, константы DUa и Z)IIc были рассчитаны. Очень важную константу Ки нельзя непосредственно определить, так как в условиях образования CuDz всегда образуются заметные количества Си(HDz)2. Однако эту константу можно рассчитать, как это показано ниже.
48 Дитизон и образуемые им внутрикомплексные соединения
Путем комбинирования выражений для V[b, -Она И Viid получают
ГЛ__^Hd ' £>Ia ’
VIb-Dnc
Величина упрощенного коэффициента экстракции Ещ равна
[CuDz]opr. [H2Dz]opr.
h’1 f - [Си2+]„ол— == 1 • [H+]2 •
В то время как Ей является функцией [H2Dz]opr., величина Ещ линейно зависит от [H2Dz]opr.-
Между одно- и двузамещенными дитизонатами меди также устанавливается равновесие.
Так, при взаимодействии однозамещенного дитизоната меди с Си 2+ образуется двузамещенный дитизонат
Сиводн. + Си (HDz)2opr. ^=± 2CuDzopr. 4- 2НтодН.» (Ш) [CuDz]“pr [Н+]цОдн.
[Си (HDz)2]opr. • [Си2+] ВОДИ.
A”in можно легко определить спектрофотометрическим способом. Комбинируя Еь К\\ и /<ш, получают соотношение, по которому можно рассчитать К\\
К\\ = VAjii *
В чистой водной фазе протекает следующая равновесная реакция диссоциации:
СиЦн. + Си (HDz)2b0№ 2CuDzBOIH. + 2НВ+Одн.- (П1с)
2 г 412 /z __ [CuDz] водн.• |H 1 водн.
Ашс = [Си(НО4]вод„.-[Си2+]води. •
Величину константы /<Шс можно рассчитать с помощью выражения, полученного комбинацией выражений для Via, Vnd, Алп и Лдпс*.
№пс = ~-/Сп1.
Mid
В чисто органической фазе устанавливается следующее диссоциационное равновесие:
Си (HDz)2 орг. ^=± CuDzopr. 4- H2Dzopr., (Шо) [CuDz]upr • [H2Dz]opr.
= [Си (HDz)2]opr: *
Внитрикомплексные соеоинения
49
Константу диссоциации Дц0 можно еще иначе выразить следующей формулой:
В чисто водной фазе формально устанавливается равновесие диссоциации
Си (HDz)2 водн< ч—- CuDzboah.4-H2Dzboah., (IIIw)
[CuDz]B04II. •
[H2Dz]
ВОЛН.
[Cu(HDz)2]BOaH#
J
Коэффициент экстракции Впи, относящийся к смеси обоих дитизонатов в органическом растворителе, можно определять с помощью следующей формулы:
[CuDz]opr> [Си (HDz)2]opr>
В пи ГСи2+1 ~
]водн.
[H2Dz]opr> ।
— [|_i+1 1^41 Н" * {I^DzJoprJ.
1*1 1водн.
В результате проведенных исследований и расчетов получены следующие значения коэффициентов (в качестве растворителя применялся четыреххлористып углерод):
К\ = 3,0 • 10В * 10 1,0 • 1010
АФ = 2 • 102 ^ш-2- IO"6
Ум = 7 • 104
У1Ы = 2 • 104
при 0,1 н. NaC104
при 1 М NaCl
при ионной силе раствора 0,1
при ионной силе раствора 0,1
при рН~ 1
при рН~6
^1110= 1 • 10~а
•^niw = 4-10 12
4 Зак. 2157.
КОНСТАНТЫ РАВНОВЕСИЯ ДИТИЗОНА И ДИТИЗОНАТОВ
Таблица 6
Пон Равновесная реакция Состав водного раствора Константа равновесия К Ссылка
растворитель СС14 растворитель СНС13
H2Dzopr <—- HDzBOflH< + Ацетат аммония 1,2 -10“9 2,4 -10““ [5023]
“Ь ^ВОДН. 1 М раствор КС1 0,84- 109 ' [5023]
1 М раствор NaCl 0,84- 10~9 2,0 • 10““ [5023]
2 М раствор NaCl 0,50 - 10э 1,0 • 10“" [SO23]
3 М раствор NaCl 0,26-10“9 0,21 10““ [5023]
0,1 М раствор KCN 0,95 • 10“9 2,3 -10““ [5023]
0,5 М раствор лимоннокис- 0,62 • 10“9 1,2 • 10““ [5023]
лого натрия
0,5 М раствор виннокислого 0,64- 10“9 1,1 -10"“ [5023]
калия-натрия
0,5 М раствор лимоннокис- 0,35 10“9 0,39-10““ [5023]
лого натрия 4- 0,1 М рас- 1,58 • 10“9 0,33- 10“9 [453]
твор KCN 2,0 10“9 — [467]
— 1,76- 10““ [57]а
Ag + А^водн. ^2^^орг. < 6 н. раствор H2SO4 1,5 -107 1,0 • 106 [5023]
AgHDzopr. + HB+MH. ионная сила 0,1 (18°) 4- 107 ' ' — [54s]
Ag+
* Hg2+
Ag^H. + AgHDzopr.
^=± Ag2Dz ф + Н + дн
HgL™. + 2H2Dzopr. ^=>
^=> Hg (HDz)2 opr. + 2Н+одн.
Hg2BoIH. + Hg (HDz)2 opr.
7=i 2HgDzopr. + 2Нв+одн.
Cu2+
Cu;+ + 2H2Dzopr.
Cu(HDz)2opr.+ 2Н+дн
BP +
Сиводн. "b ^2^zopr. < >-
CuDzopi.. + 2HB+o№ CC. + Cu (HDz)2 opr ^2CuDzopr +2Н+одн. Bi3+ + 3H2Dzopr ^=> 5=± Bi(HDz)3Opr. + 3H + №
ионная сила 0,1 (18°) 5 • 105 -
— 5,7 • 1026 -
NaC104—HC1O4 7,1 • 1026 —
ионная сила 0,5 1(Г3 —
(NaCIO4—НСЮ4)
0,1 уИ раствор NaC104 3,0- 10“> —
~0,1 н. раствор H2SO4 3,4- 10’» 3,2 • 106
0,1 М раствор NaCl 1,0 • 10'» —
0,5 М раствор КВг 3,4-10'° —
0,5 М раствор KJ 3,4-10'о —
ионная сила 0,1 2,5-1О'о —
ионная сила 0,1 2- 102 —
ионная сила 0,1 2 - 10 е
ионная сила 0,1 1 10~6 -
Ацетат аммония 5,6 -10» 2,3-10»
0,1 М раствор KCN 3,5-10» 1,6- 10»
Морская вода (12°/00 С1~) 5,2 • 108 8,5 • 103
0,1 М раствор NaCl 8,3 • 104 3,4 • 102
0,1 М раствор лимонно- 3,9-10“6 2,7-10“"
кислого натрия
[54s]
[53'3]a
[56"]
[56"]
[5225, 5328]
[5023]
[5328]
[54s] [5328]
[5225 , 5328] [54s]
[SO23] [5023] [SO23]
[5023]
[SO23]
Продолжение табл. 6
Ион Равновесная реакция Состав водного раствора Константа равновесия К Ссылка
растворитель СС14 растворитель СНС13
Bi3 + ВСдн. + 3H2Dzop, 0,1 М раствор виннокислого 2,5 10“6 8,3 - 10—12 [5023]
^Bi(HDz)3opr. + 3H+aH. калия-натрия
In3+ 1пводн. Н~ ^^2^zopr. < Ацетат аммония 6,9 • 104 — [50й]а
In (HDz)3 орг + ЗН*одн
Sn2+ 5"во+дн. + 2H2Dzopr. - — 9 -10”3? — [5313]а
Z^Sn(HDz)2opr +2Н-дн.
Zn2+ ZnX. + 2H2Dzopr. Ацетат аммония 2,0 -102 4,4 [5023]
Zn (HDz)2 opr + 2Н + дн.
- “ 1,96-102 3,2; 4,5 [413, 444].
Морская вода (12°/00 С1 —) 1,8 • 102 4.2 [5023]
0,1 М раствор NaCl 1,0 102 2,0 [5023]
0,1 М раствор KCN 2,2 • 102 4,4 [5023]
0,1 М раствор Na2S2O3 0,2 • 102 1,2 [5023]
0,05 М раствор винноки- " 5,4 • 10—5 [5614]
слого аммония
5 % (молярных) карбамата 2,4 -10“2 4,1 • 10~4 [5023]
ионная сила 0 1,3 -102 10 [522] 6
Cd2+ сСди. + 2H2Dzopr Ацетат аммония 38,5 3,4 [5023]
Cd (HDz)2 opr. + 2Н;одн.
С°2водН. + 2H2Dzopr
Co(HDz)2opr +2НХД1,
рЬ2во+дн. + 2H2Dzopr
Pb(HDz)2opr +2Н + дн.
Морская вода (120/00С1 —) 15 1,2 [5023]
1 М раствор NaCl 0,27 2,6 -10"2 [5023]
0,2 М раствор лимоннокислого натрия 1,2 -10"2 1,4 • КГ3’ [5023]
0,2 М раствор виннокислого калия-натрия 0,38 3,0 10"2 [5023]
Ацетат аммония 39 3,2 • 10~2 [5023]
Морская вода (12°/00 С1~) 33 2,5 КГ2 [5023]
1 М раствор NaCl 12 7,9 -10"3 [5023]
0,2 М раствор лимоннокислого натрия 4,6 • 10 4 3,0 • 10"7 [5023]
0,05 М раствор виннокислого аммония — 3,07- 10"7 [56 ч]
Ацетат аммония 2,4 0,13 [5023]
Морская вода (12°/00С1-) 0,89 6,4 10"2 [5023]
1 Л1 раствор NaCl 0,12 9,6 • 10"3 [5023]
0,1 М раствор KCN 4,5 0,88 [5023]
0,2 М раствор виннокислого калия-натрия 2,0- 10"3 2,3 -10"4 [5023]
0,2 М раствор лимоннокислого натрия 5,4- 10" 6,6 10"6 [5023], 1
Продолжение табл. 6
11он Равновесная реакция Состав водного раствора Константа равновесия К Ссылка
растворитель СС1, растворитель снсь
РЬ2+ рьводн. + 2H2Dzopr Pb(HDz)2opr. + 2H^H. 0,2 Л4 раствор лимоннокислого натрия 0,1 М раствор KCN 4,5 -10—5 5,0 -10“s [5023]
То же 2,6- 10“2 - ' — [453]
Ni2 + №‘0+дн. + 2H2Dzopr. Ni(HDz)2opr +2Нв+одн. Ацетат аммония 0,05 М раствор виннокислого аммония 6,4- 10“2 1,2 10~3 1,06-10“8 [5023] [5614]
Ti + Т1в+одн. + H2Dzopr. TlHDzopr. + Н + Дн. 4,6- 10“4 [50й]а
а Приведенные константы равновесия образования дитизонатов ртути, олова, индия и таллия вычислены по экспериментальным данным Пилипенко А. Т. [5011, 5313]. — Прим. ред.
0 Коренман И. М. и Шеянова Ф. Р. [591] исследовали экстрагирование дитизоната цинка с использованием радиоактивного изотопа Zn65 при разной ионной силе раствора и показали незначительное влияние ионной силы на экстрагирование. — Прим, ред»
Внутрикомплексные соединения
55
В табл. 6 приведены все известные значения констант равновесия для реакции диссоциации дитизона и для реакций образования дитизонатов в двухфазной системе четыреххлористый углерод (или хлороформ) — водный раствор с различным содержанием электролитов.
Зная величину константы равновесия К для данной двухфазной системы, можно рассчитать коэффициент экстракции Е (см. стр. 43, уравнение 17), а затем и выход экстракции А при однократном и многократном извлечении (стр. 23—24, уравнения 12—14).
Ирвинг и Вилльямс [49 13] для своих дальнейших исследований придали уравнению (17) логарифмическую форму
lg Е = 1g К+п (.pH + 1g [ H2Dz ]opr.).
Поддерживая постоянными величины К, п (п — валентность иона металла) и [H2DzoprJ (молярная концентрация раствора дитизона в органическом растворителе после достижения равновесия), можно получить выражение, в котором Е зависит от pH водного раствора. Из значения Е определяют выход экстракции А
л 100£
При нанесении на график зависимости А от значения pH получают S-образные равновесные кривые экстракции (рис. 9).
Эти кривые симметрично изгибаются и асимптотически приближаются к осям при выходе экстракции 0 и 100%. Чем больше валентность выделяемого катиона, тем круче подъем равновесной кривой. При изменении pH водного раствора на единицу или при изменении содержания избыточного дитизона на один порядок величины в зависимости от валентности катиона (zz= 1, 2 или 3) коэффициент экстракции изменяется в 10, 100 или 1000 раз. При извлечении Zn2+ найденные экспериментально результаты в большом интервале совпадают с приведенными здесь теоретическими соображениями [41Т
56 Дитизон и образуемые им внутрикомплексные соединения
При увеличении концентрации избыточного дитизона на один порядок величины равновесные кривые смещаются параллельно, причем это смещение соответствует уменьшению концентрации водородных ионов на одну единицу pH. При уменьшении концентрации дитизона наблюдается обратное явление. С уменьшением значений К, что часто обусловлено присутствием электролитов, происходит более или менее сильное смещение равновесных кривых в сторону более высоких значений pH. Если вместо четыреххлористого углерода в качестве растворителя применяют хлороформ, то в зависимости от характера катиона, образующего дитизонат [5023], наблюдается смещение кривых на 0,5—1,5 pH.
Р и с. 9. Равновесные кривые экстракции в зависимости от pH и валентности (/?) катиона. К=2; [H2Dz]Opr< — 1 • 10 ~7М.
Для « — величина п равна 1; для Ь — величина п равна 2; для « — величина п равна 3.
При данном избыточном содержании дитизона коэффициент экстракции увеличивается с увеличением pH водного раствора. Однако произвольный выбор pH ограничен, так как в зависимости от характера органического растворителя и дитизоната при более высоких pH может произойти разложение дитизоната. Кроме того, приходится выбирать такую величину pH, при которой не захватываются дитизонаты других металлов.
Если два катиона, способные реагировать с дитизоном, присутствуют в равных концентрациях, то достаточно различия в константе равновесия в 10" раз (где п — малое число), чтобы можно было подобрать соответствующие условия pH для их разделения, т. е. такие
Внутрикомнлексные соединения
57
области pH, при которых равновесные кривые экстракции очень мало перекрывают или почти не перекрывают одна другую. Если же катион, константа равновесия которого меньше, находится в избыточном количестве, то его равновесная кривая экстракции смещается в соответствии с избыточным количеством катиона в сторону меньших значений pH, причем одновременно изменяется форма кривой. Несмотря на различие в величинах pH, обе кривые могут полностью перекрыть одна другую и разделение обоих катионов только путем установления требуемого pH становится невозможным *.
Таким образом, константы равновесия служат отправной точкой для выбора условий (pH водных растворов, количество избыточного дитизона), при которых можно выделить экстракцией один катион группы дитизона в присутствии умеренных количеств другого катиона этой группы. Если же в растворе присутствуют также анионы, образующие с ионами металлов более или менее прочные комплексные соединения, то нужно также учитывать константу реакции образования комплексных соединений в данных условиях. Условия равновесия очень сильно усложняются, если протекает ряд
* Коренман II. М. и Шеянова Ф. Р. [591] предложили понятие «области экстрагирования», соответствующее условиям перехода 1—99% общего количества экстрагируемого металла в неводный растворитель. Ими рассмотрены условия экстрагирования соединений MR, являющихся солями слабой кислоты HR, и выведены формулы, позволяющие рассчитать pH области экстрагирования в зависимости от концентрации избытка реактива, константы равновесия
HRopr. —Мводн. <--- MRopr. “Н Нводн.
и соотношения объемов водной и неводной фаз. Зависимость степени экстрагирования (в %) от указанных условий показана в виде графиков. Теоретические выводы зависимости извлечения металла от концентрации реактива подтверждены экспериментально экстрагированием дитизоната кадмия при различном избытке дитизона с использованием радиоактивного изотопа Cd115.
Интервалы кислотности, при которой извлекаются эквивалентным количеством раствор;! дитизона в четырххлористом углероде 1% металла и 99% металла, для ртути, серебра, меди, висмута, цинка, кадмия, индия, свинца, кобальта, никеля, олова и таллия были рассчитаны, исходя из величин констант нестойкости дитизонатов этих металлов, также Пилипенко А. .Т. [5626, 5627]. — Прим. ред.
Таблица 7
КОНСТАНТЫ НЕСТОЙКОСТИ (/) ДИТИЗОНА И ДИТИЗОНАТОВ а> 6
Равновесие Константы нестойкости Ссылки для
CC1, (Л) изоамиловый спирт (Л-) т />
^2^zopr. 4 ^водн. ^^2водн. 2 10° 1 • IO-”" [464 [524
AgHDzopr А&водн. 1 Н^гводн. 2,3 -10 18 0,15-Ю"9 [5313] [524
Hg(HDz)2opr HgX. + 2HDzbmh. 0,7 10~44 0,39- IO”18 [5313] [524
Cu(HDz),opr CU2+ н. + 2HDz-„ 1,1 -10-27 0,71 • IO"20 [53‘3] [524.
Bi(HDz).Jopr Bi’+н. + 3HDz-MH. 1,1 -10“37 — [5313]
ln(HDz)3opr 1п '+ „. + ЗНО2в;лн 1,16- 10”31 — [50"] — -
Sn(HDz).2opr Sn2+„ +2HDz-OT 4,5 -IO-16? ——~ [5313] ' —
Zn(HDz)2opr Zn;+H +2HDz-„. 0,8 • 10“2° 0,49 • 10"22 [474 [524
Cd (HDz)2 opr. CdX. + 2HDZbwih 2,9 1O“20 0,38 • 10“22 [474 [524,
Co(HDz)2opr Co2+h.+2HDZ-
Pb(HDz)3opr Pb;+H. + 2HDz"
Ni(HDz).2opr Ni2B+H. + 2HDz-„
TlHDzopr Т1 + ди. + HDz-„_
5-10~18 2,2 • 10”19 0,38 10 21 [5313] [47* 4 *] [52']
1,7 • 1(Г'7 * * * • [5313] ——
4,35- 106 — [5011 *]
К. и Пилипенко A. T. считают, что эти константы характеризуют энергию связи в водном растворе и анионом дитизона с образованием из них раствора дитизонатного комплекса в органическом рас-константы нестойкости дитизонатов (/) были определены Бабко А. К. и Пилипенко А. Т. [474], Пили-
Приведенные в таблице величины 1 вычислены, исходя из величин К, рассчитанных для растворов, содержащих некоторое
(точно не указанное) количество уксуснокислого аммония. Эти константы значительно отличаются от констант, приведенных
в табл. 6.
6 Характеризовать дитизонаты их константами нестойкости предложили Бабко А. К. и Пилипенко А. Т. [47*]. Обозначая
их ^M(HDz)n ’ Бабко А-между катионом металла творителе.
Указанные в табл. 7
пенко А. Т. [50п, S313] и Черницкой Р. Е. [527] экспериментальным изучением равновесных концентраций [мп + ]водн< ] ОрГ
и [Н2Ог]орГ при различных pH и рассчитаны по уравнению 11
^M(HDz) —
IV
1м"+1В0ДН. - [h2dz] - (л1;Рг)п [M(HDz)„]o₽r • [Н+]"одн
Константы нестойкости дитизонатов можно вычислить, исходя из констант равновесия образования дитизонатов
М"одн. b«H2Dzopr M(HDz)„opr+„H+M
(HDz) —
II/
[5536]. — Прим. ред.
равновесия
60 Диигзон и образуемые им внутрикомплексные соединения
равновесных реакций, перекрывающих одна другую. Такие условия часто возникают при определении следов металла группы дитизона в присутствии других металлов этой группы. При этом редко удается заранее расчетным путем подобрать оптимальные условия экстракции и ход процесса разделения элементов. При таких обстоятельствах условия определения следов элементов разрабатываются экспериментальным путем.
До настоящего времени константы равновесия К определены для относительно немногих простых растворов (табл. 6). Они представляют большой практический интерес, являясь отправными вехами. Однако все же их использование несколько ограничено, так как на практике количество примесей в анализируемом объекте никогда настолько точно не установлено, чтобы было целесообразно пользоваться точными значениями констант равновесия, приведенными в тдбл. 6. Кроме того, константы равновесия известны только для кислотной области pH и не распространяются на весь ход кривой экстракции, имеющей также «щелочную ветвь» (стр. 132, рис. 13).
«Щелочная ветвь» кривой экстракции ограничивает экстракцию дитизоната данного металла при более высоких значениях pH (стр. 147, рис- 15; стр. 234, рис. 28). Эта кривая имеет форму перевернутой буквы S, ее можно сместить в сторону более высоких pH, увеличив избыточное количество иона металла или заменив растворитель четыреххлористый углерод на хлороформ.
Из величин констант равновесия К можно рассчитать константы нестойкости I дитизонатов, которые являются мерилом прочности дитизонатов (табл. 7).
Константа нестойкости дитизона /h_,dz идентична константе равновесия дитизона Kh.dz •
Константа нестойкости первичного дитизоната катиона M/z+ определяется соотношением
/ M(HDz) =
/ 4
[М«+]|10Д11. [HDz-]",,,,,.
[М(НОг)„]„рг.
Если концентрацию дитизоната в фазе органического растворителя поддерживают постоянной, то и произве
Внутрикомплексные соединения
61
дение ионов, входящих в числитель, остается постоянным. Это произведение ионов было сопоставлено с произведением растворимости сульфидов металлов, что дало возможность также теоретически объяснить установленный экспериментально факт, заключающийся в том, что с помощью сероводорода однозамещенный дитизонат кадмия Cd (HDz)2 в растворе четыреххлористого углерода разлагается легче, нежели однозамещенный дитизонат цинка Zn(HDz)2 в растворе хлороформа [474].
Константа нестойкости I связана с коэффициентом распределения Vm(hdz) константой диссоциации дитизоната Dm(hdz) а также константами равновесия дитизоната К M(HDz)n и дитизона Kh2Dz
__ OM(HDz)zi __ ^2Dz
1 M(HDz) I/ rz •
n kM(HDz)^ *'M(HDz)
Так как дитнзонаты металлов почти не растворимы в водных растворах с определенным pH, а растворимость их в органических растворителях (за редкими исключениями) больше в 104—107 раз (см. стр. 38, табл. 4), то и величины коэффициентов экстракции Е, а также соответствующие выходы экстракции А очень велики. С помощью небольшого объема раствора дитизона в органическом растворителе можно извлечь очень малые количества ионов металлов группы дитизона из большого объема водного раствора. Этот способ был назван Г. Фишером [34 3] «экстракционным концентрированием». В некоторых случаях концентрация извлеченного дитизоната увеличивается в 103 — 104 раз, особенно если применяют избыточное количество дитизона.
Особенно хорошие результаты получаются, если «экстракционное концентрирование» проводят, применяя каждый раз небольшие порции свежего раствора дитизона и отделяя каждую порцию экстракта. Вследствие непрерывного смещения равновесной реакции в сторону образования дитизоната этим способом удается практически полностью перевести металл в виде дитизоната в органическую фазу. Последняя порция дитизона ввиду отсутствия иона металла не претерпевает никакого изменения. Этот весьма эффективный способ извлечения
62 Дитизон и образуемые им внутрикомплексные соединения
иона металла назван полным или исчерпывающим извлечением или исчерпывающей экстракцией.
Если в водном растворе с определенным pH присутствует ряд ионов металлов группы дитизона, то дитизон селективно реагирует с этими металлами. При прочих равных физических и химических условиях сродство дитизона к различным элементам отличается в сотни, тысячи, а иногда и больше раз. В результате металлы, обладающие меньшим сродством к дитизону, вытесняются из дитизонатов ионами металлов, обладающих большим сродством, т. е. протекает реакция обмена, как, например,
Си (HDz)o oPr. + 2AgB+oaH. ; -> 2AgHDzopr. + Cu^H.-
Г. Фишер [375] разместил металлы группы дитизона в ряд по их сродству к дитизону в растворах с определенным pH. При изменении pH сродство некоторых металлов к дитизону очень сильно изменяется и нарушается последовательность в данном ряду. Сродство ионов металлов к дитизону зависит не только от pH раствора, но и от характера и концентрации присутствующих в растворе анионов.
Для обычно применяемой в анализе исходной концентрации реагентов — 25 мкМ скорость реакции образования дитизонатов очень велика. Скорость реакции зависит от органического растворителя и главным образом от pH водного раствора. При хорошем перемешивании фаз (энергичном встряхивании) для растворов с pH > 7 равновесие устанавливается в течение нескольких секунд. В присутствии анионов, способных связывать металл в комплексное соединение (винная и лимонная кислоты и др.), реакция образования дитизонатов замедляется, что приводит и к уменьшению скорости экстракции. В области pH < 4 скорость образования дитизонатов ионов металлов, способных еще к этой реак ции в этих условиях (Ag+, Hg2+, Pd2+, Pt2+, Au3+, Cu2+, а также Bi3+), очень различна. Равновесие для каждого данного иона устанавливается тем медленнее, чем меньше pH водного раствора.
Так, скорость экстракции Си2+ при pH < 1 особенно мала, По имеющимся данным [5225], реакция образова
Ёнутрикомплексные соединения
63
ния дитизоната меди является реакцией третьего порядка. Исключение представляет дитизонат серебра AgHDz, который образуется почти мгновенно даже при pH <0.
При извлечении скорость экстракции слагается из скорости реакции образования дитизоната и из той скорости, с которой дитизонат проходит границу раздела фаз водный раствор — органический растворитель. Определяющей является скорость наиболее медленного процесса — реакции образования дитизоната. В общем можно сказать, что экстракция хлороформом протекает медленнее, чем экстракция четыреххлористым углеродом.
Бьеррум и Поулсен [525] исследовали скорость образования некоторых дитизонатов, с тем чтобы сравнить энергию активации в этиловом и метиловом спиртах при —75 и —100°.
Реакция обмена между 65Zn2+ и Zn(HDz)2 при 25° в растворе пиридина полностью завершается в течение 0,5 мин. [52 4].
Реакции образования дитизонатов (стр. 50, табл. 6) приводят к равновесным состояниям, которые полностью обратимы без торможения. Поэтому можно разложить какой-либо дитизонат в органическом растворителе путем встряхивания его с водным раствором, характеризующимся определенным pH.
При кислотном разложении дитизоната выделяется свободный дитизон, остающийся в фазе органического растворителя, а ион металла переходит в водную фазу. Большое значение для аналитической химии имеет то, что различные дитизонаты можно очень избирательно разлагать при различных значениях pH:
M(HDz) -\-пН+ zzH9Dz +М"+ .
\ 'п. ОрГ. 1 водн. 2 орг. 1 воды.
Не все превращения дитизона обратимы во всех областях pH. Так, в водных растворах, pH которых меньше значения pH, требующегося для образования однозамещенных дитизонатов кобальта и никеля, последние очень долго не разлагаются.
При щелочном разложении дитизоната в водную фазу переходит и остаток дитизоната в виде иона HDz
64 Дитизон и образуемые им внутрикомплексные соединения
и ион металла. В этом процессе различные дитнзонаты также ведут себя по-разному, вследствие чего становится возможным избирательное разложение:
орг. ОН ВОЛН. ~~ “I- (ОН)явОДН.»
Однозамещенные и двузамещенные дитнзонаты Ag* Hg2+, Pd2+, Pt2+, Au3+ и Cu2+ могут взаимно превращаться один в другой при обработке их водным раствором с определенным pH.
При кислотном превращении двузамещенного дитизоната в однозамещенный последний связывает весь дитизон и остается в фазе органического растворителя, а половина присутствующего металла в виде иона переходит в водную фазу:
2CuDzopr. + 2Н^дН. 4 Си (HDz)_> орг.’4” Спводн.•
При щелочном превращении однозамещенного дитизоната в двузамещенный последний остается в фазе органического растворителя, а половина дитизона в виде иона HDz~ переходит в щелочной водный раствор
Cll (HDz)2 орг. “4~ ОН волн. <-* CuDzOpr. —j— HDZboah. Н- Н2О.
Взаимное превращение дитизонатов, особенно однозамещенных в двузамещенные, вообще очень заторможено. Поэтому однозамещенные дитнзонаты довольно долго не изменяются в щелочных растворах.
Дитнзонаты можно разлагать не только обработкой растворами с определенным pH, но и введением анионов, образующих с металлом дитизоната комплексные соединения. Если при этом пользуются водным раствором с pH < 7 (для четыреххлористого углерода) или pH < 8,5 (для хлороформа), то остаток дитизоната остается в фазе органического растворителя в виде свободного дитизона, а металл переходит в водную фазу в виде растворимой или нерастворимой комплексной соли:
Hg(HDzk г + 4HJ 2H2Dznnr +H2HgJ4 \ /J орг. 1 водн. * орг. 1 * сэ 4води.»
AgHDzOpr. I НВгводн> <— H2Dzopr<-|-AgBr
Внутрикомплексные соединения
65
Разложение дитизонатов комплексообразователями, связывающими металл, во многих случаях удается проводить весьма избирательно. Если при этом получается не растворимое в водной фазе комплексное соединение, то оно либо образует в водной фазе суспензию, либо коагулирует и собирается на границе двух фаз.
5. РАЗЛОЖЕНИЕ И РАЗРУШЕНИЕ ДИТИЗОНАТОВ
В то время как обратимую реакцию разложения или образования дитизонатов чаще всего проводят намеренно в нужном направлении, более или менее сильное необратимое разрушение дитизонаты претерпевают при хранении (стр. 42). С помощью реагентов, разлагающих дитизон или остаток дитизонатов (стр. 27—28),, можно легко необратимо разрушить даже наиболее устойчивые к действию щелочей и кислот дитизонаты.. При этом металл переходит из органической в водную фазу, а продукты разложения дитизоната остаются в фазе органического растворителя.
Ь Зак 21Б^
Глава 2
ОБЩИЕ СВЕДЕНИЯ О МЕТОДАХ ОПРЕДЕЛЕНИЯ ЭЛЕМЕНТОВ С ПОМОЩЬЮ ДИТИЗОНА
I. ОБОРУДОВАНИЕ
В связи с высокой чувствительностью реакций дитизона с различными элементами при проведении анализов приходится принимать особые меры для предохранения рабочего места, посуды или реактивов от попадания следов примесей.
1. РАБОЧЕЕ МЕСТО
Чтобы легче было поддерживать чистоту рабочего места, для защиты столов можно рекомендовать покрытия из пластмасс. Свинцовые покрытия для работы с дитизоном непригодны [5413]. Воздух в помещении по возможности не должен содержать пыли и паров. Физиологически не ощущаемые следы сероводорода разлагают большую часть дитизонатов. Следует принимать также во внимание ядовитость паров четыреххлористого углерода и хлороформа (стр. 79).
2. ПРИБОРЫ
При применении дитизона для объемных и колориметрических определений никаких дорогостоящих приборов не требуется.
Лаборатория, в которой проводятся анализы с помощью дитизона, должна быть обеспечена ассортиментом посуды и аппаратов, применяемых только для этой цели, так как первичная очистка их от следов мешаю-
Оборудование
67
щих элементов отнимает очень много времени. Рекомендуется пользоваться посудой из термостойкого стекла. В редких случаях требуется кварц. Для хранения щелочных растворов, а также воды можно применять также склянки из полиэтилена, полистирола или полиакрилатов.
Совершенно исключается применение таких материалов, как поливинилхлорид, поливинилацетат, а также пластмассы с наполнителями и различные сорта резины. Поливинилхлорид разлагает растворы дитизона. Не рекомендуется также хранить водные растворы в склянках из оранжевого стекла. Для хранения запаса раствора дитизона лучше всего пользоваться склянками из термостойкого стекла, покрытыми сверху черным лаком или обернутыми в черную бумагу.
а. Посуда
Для хранения растворов и в качестве приемников пользуются узкогорлыми колбами с пробками, колбами Эрленмейера и пробирками.
Для измерения объемов требуются различные бюретки с оттянутыми узкими кончиками (емкостью 50 мл с делениями 0,1 мл; емкостью 10 мл с делениями 0,02 мл), несколько различных градуированных пипеток (емкостью 10 мл с делениями 0,5 мл; емкостью 2 мл с делениями 0,02 мл), несколько обычных пипеток (емкостью 25, 20, 10, 5 и 2 мл), а также мерные колбы (емкостью 1000, 500, 250, 100, 50, 25 и 10 мл).
Растворы цианида калия и концентрированные растворы аммиака добавляют из бюреток, установленных в вытяжном шкафу. Запрещается пользоваться пипетками, градуированными эмалью, содержащей свинец.
В качестве рабочих сосудов применяют грушевидные делительные воронки (рис. 10, а), конические делительные воронки (рис. 10, б), цилиндрические делительные воронки (рис. 10, в), смесительные цилиндры (рис. 10, а), пробирки для колориметрирования (рис. 10, д) и разделительные пробирки (рис. 10, е).
Для очистки реактивов пользуются большими толстостенными делительными воронками емкостью 500 мл, 5*
68 Общие сведения о методах определения элементов с Dz
1 л и 2 л. Для экстрагирования пользуются легкими тонкостенными делительными воронками (емкостью 25, 50, 75, 100 и 250 мл) с хорошо пришлифованными кранами и пробками. Можно пользоваться коническими делительными воронками Скибба (рис. 10,6), однако более удобны грушевидные суженные возле крана делительные воронки (рис. 10, а).
Р и с. 10. Посуда для проведения извлечения и колориметрирования.
« — сужающаяся книзу грушевидная делительная воронка; коническая делительная воронка Скибба; в —цилиндрическая делительная воронка; г— смесительный цилиндр; д — пробирка для колориметрирования; « — пробирка для разделения фаз.
В —водная фаза; О —органическая фаза.
В такой воронке легче определять окраску растворов, а также удобнее разделять фазы. Суженная часть этой воронки не должна быть настолько узкой, чтобы это мешало перемешиванию раствора, находящегося в этой части воронки, или выравниванию давления через кран. Пробки воронок следует делать пустотелыми, но закрытыми снизу с плоскими головками. Пробку такой формы легко прижимать, удобно вынимать и класть на стол так, чтобы ее рабочая часть не прикасалась к рукам или другим предметам. Сточная часть трубки воронки также не должна быть очень узкой, ее срезают под углом, оставляя ниже крана отросток 10—15 мм. Краны по краям слегка смазывают вазелином, специальной смазкой для кранов, глицерином или водой. Неко
Оборудование
69
торые исследователи рекомендуют в качестве смазки графит [36 4], силиконовую смазку и др. *
Для серийных анализов требуется несколько одинаковых по объему (50 или 100 мл) делительных воронок, так как часто в этих воронках проводят и колориметрическое определение. Смесительные цилиндры служат для собирания экстрактов, получаемых при извлечении дитизонатов органическим растворителем, а также для проведения реакции извлечения и визуального наблюдения оттенка окраски. Для колориметрирования применяют пробирки с пришлифованными пробками. Для анализа следует подобрать 5—10 пробирок одинакового диаметра. Пробирки для разделения фаз представляют собой пробирки, к которым припаяны краны с узкими отверстиями. Их можно использовать в качестве дополнительных делительных воронок, когда приходится повторно встряхивать водный раствор с органическим растворителем.
Очистка и уход за стекляннойпосудой
Обычный способ мойки посуды, применяемый в количественном макроанализе, недостаточен, если нужно определять мпкрограммовые количества вещества. На 1 см2 поверхности стенки сосудов обычно удерживаются адсорбированные, абсорбированные или связанные химически мпкрограммовые количества элементов группы дитизона (преимущественно цинк, свинец и медь), которые обязательно следует удалять со стенок сосудов, а также кювет, особенно если последние прежде применялись для макроопределений.
Если сосуд впервые применяется для определения следов элементов, то после тщательной мойки его обрабатывают теплой азотной кислотой (1 : 1), промывают водой и затем 0,01 н. раствором аммиака. Затем сосуд заполняют концентрированным раствором дитизона в хлороформе, оставляют на несколько часов,
* Поддубная Л. В. и Поддубный Б. Н. [59 й] сконструировали простой прибор для серийного экстрагирования органическим растворителем в делительной воронке, который может быть использован и при экстрагировании дитизонатов. — Прим. ред.
70 Общие сведения о методах определения элементов с Dz
опоражнивают, прополаскивают небольшим количеством хлороформа и затем водой, обработанной дитизоном (стр. 75).
Для проверки чистоты в очищенный сосуд помещают 20 мл воды, обработанной дитизоном (стр. 75), добавлением 1—2 капель 1 н. раствора чистого аммиака доводят среду до pH 9,5 и вводят 0,5 мл 25 мкМ раствора дитизона в хлороформе (стр. 92). Сосуд закрывают пришлифованной пробкой и энергично встряхивают в течение 1 мин. Если фаза органического растворителя не становится бесцветной, то приходится еще раз повторить очистку сосуда.
Возможность наглядно убедиться в чистоте посуды является большим преимуществом дитизона по сравнению с другими реагентами.
Если посуда недостаточно чистая, то при встряхивании воды с раствором дитизона меняется оттенок изумрудно-зеленой окраски этого раствора. В присутствии нескольких микрограммов металлов группы дитизона окраска раствора заметно изменяется и переходит в фиолетовую или красную. Особенно сильно удерживаются на шероховатых поверхностях тяжелые металлы (шлифы!). В случае, если поверхность стеклянного сосуда сильно загрязнена тяжелыми металлами, рекомендуется сосуд предварительно обработать 10%-ным раствором плавиковой кислоты [381]. После спуска плавиковой кислоты сосуд тщательно прополаскивают водой. Нельзя прикасаться руками (особенно руками, смазанными кремом, так как кремы всегда содержат цинк!), к краям вымытых сосудов и к внутренним поверхностям. Кварцевая посуда поддается очистке легче, чем стеклянная. Хорошие результаты получаются уже после нескольких часов пропаривания кварца, в то время как для стекла на это приходится затрачивать несколько дней (стр. 72).
Сосуды, уже применявшиеся для определений элементов группы дитизона, достаточно очищать кратковременным встряхиванием с раствором дитизона в органическом растворителе и последующим полосканием чистым хлороформом или четыреххлорпстым углеродом, а также обработанной дитизоном водой.
Оборудование
71
Нередко целесообразно особенно тщательно мыть посуду. Например, посуду, применяемую для определения РЬ2+, обрабатывают 1%-ным раствором дитизона в хлороформе вместе с 1%-ным раствором KCN [403].
б. Аппараты
Чтобы приготовить запас воды, обработанной дитизоном (стр. 75), требующейся для определения следов элементов, которые часто являются п загрязняющими примесями (цинк, свинец, медь), нужен аппарат для получения дважды дистиллированной воды. Для этой цели можно применять хорошо зарекомендовавший себя аппарат, показанный на рис. 11.
Рис. 11. Аппарат для получения дважды дистиллированной воды (масштаб 1 : 15).
Весь аппарат сделан из термостойкого стекла, и для его питания пользуются дистиллированной или обессоленной с помощью ионообменников водой *. Производи
* Обессоленная вода часто содержит значительные количества углерода, о чем свидетельствуют черные включения, п-?авляющисёя на попергчности погружных кипятильников.
72 Общие сведения о методах определения элементов с t)z
тельность такого аппарата ~1 л дважды дистиллированной воды в час.
Из впервые включенного аппарата, промытого предварительно 8 н. раствором азотной кислоты и дистиллированной водой, можно только через 20—50 час. его работы отбирать дважды дистиллированную воду, пригодную для использования в анализе. Такая очистка аппарата производится также после какого-либо ремонта его и гарантирует полное удаление следов металлов с внутренних поверхностей холодильников. Если аппарат сделан из кварца, то воду можно отбирать уже через 10—20 час.
Аппарат для фракционированной перегонки требуется для очистки пли регенерации использованных органических растворителей. Такой аппарат должен быть полностью собран на шлифах и приспособлен для перегонок в вакууме.
При проведении серийных анализов и осуществлении более медленных реакций, требующих продолжительного встряхивания (более 0,5 мин.), например при определении Cu2+, Pd2+ и др., пользуются механическими встряхивателями. Хорошо иметь несколько отличающихся по ритму встряхивателей *. Механический встряхиватель должен быть снабжен соответствующими держателями для закрепления делительных воронок, смесительных цилиндров и колб различных размеров (держатели могут быть изготовлены в механической мастерской) .
После встряхивания воронки помещают для отстаивания в кольца, закрепленные в штативах на таком уровне, чтобы можно было свободно подставить приемник и оставалось место для манипулирования краном.
Удобно для этой цели применять железные кольца
* При встряхивании растворов, представляющих собой гетерогенные системы органический растворитель—водный раствор — воздух, поверхность соприкосновения обеих жидких фаз должна становиться как можно больше. В связи с тем что колебательный процесс является очень сложным явлением, зависящим от многих факторов, качество извлечения нельзя определять только с помощью числа колебаний в минуту, амплитуды колебаний (cat) и времени встряхивания, как это обычно принято.
Оборудование 73
с. муфтами, покрытые лаком, имеющие впереди прорезь в несколько сантиметров. Для серийных анализов были рекомендованы многоярусные плоские [351и] и круглые [393] стопки.
Для фотометрпрования удобно пользоваться фотометром с монохроматором, в котором выгодно используются четко выраженные полосы поглощения растворов дитизона и дитизонатов, увеличена чувствительность определения и в некоторых случаях имеется возможность одновременно определять несколько компонентов. Удобно пользоваться также фильтрофото-метром. Максимальные длины волн, при которых измеряют поглощение дитизонатов, лежат в интервале 460—550 ДЦ1 (в основном 520 Лф), а для растворов дитизона— в интервале 605—620 лф, для чего приходится пользоваться соответствующими светофильтрами *.
3. РЕАКТИВЫ
К чистоте реактивов предъявляются очень высокие требования. В основном должны отсутствовать примеси, реагирующие с дитизоном и изменяющие таким образом его свойства (стр. 27—28). В отдельных случаях важно принять меры для удаления таких часто встречающихся примесей, как ионы Zn2+, Pb2+, Си2+.
Чем меньшие количества РЬ2+ предстоит определить в данном испытуемом объекте, тем меньше их должно содержаться в применяемых для анализа реагентах. Совершенно ясно, что проверка чистоты реактивов проводится также с помощью дитизона. Если есть возможность установить требуемый pH, то мешающие примеси могут быть удалены раствором дитизона методом исчерпывающего извлечения.
* Наиболее распространенными в СССР приборами с монохроматором являются спектрофотометры СФ-2 и СФ-4. Наряду с ними широко применяются приборы, снабженные светофильтрами,— фотометры ФМ-56 и ФМС-56 и фотоэлектроколориметры ФЭК-М и ФЭК-Н-54. Описание этих приборов см. в дополнениях редактора к книге Г. В. Ю и н г, Инструментальные методы химического анализа, Госхимиздат, 1960. — Прим, ред.
74 Общие сведения о методах онреОелсния элементов Dz
Ниже будут рассмотрены требовании, предъявляемые к чистоте наиболее часто применяемых основных и вспомогательных реактивов, соответствующие методы испытания, методы очистки и регенерации, а также условия хранения и данные о стойкости реактивов.
а. Основные реактивы
1, Вода
Вода употребляется в большшх количествах как растворитель, для разбавления растворов, а также для промывок, вследствие чего к ее селективной чистоте * предъявляются особенно строгие требования.
Обычная дистиллированная вода, даже после перегонки ее в стеклянном или кварцевом аппарате, содержит в 1 л до нескольких микрограммов Zn2+, Pb2+ и Си2+; в некоторых случаях присутствуют и другие металлы группы дитизона или окислители. Все эти мешающие примеси удается удалить только в результате многократной перегонки. Поэтому для анализов с помощью дитизона следует готовить очень чистую воду.
Для проведения анализов с дитизоном некоторые исследователи [502, 5521] рекомендовали также обессоленную воду, т. е. воду, очищенную с помощью ионообмен-ников. Однако такая вода не всегда применима, так как частично растворенные в ней ионообменные смолы при последующих реакциях с ионами металлов часто служат для них комплексообразователямп либо, наоборот, вместе со смолой в воду вводятся мешающие катионы**.
* Требования, предъявляемые к чистоте воды, зависят от того, для чего эта вода предназначена. Для анализов, проводимых с помощью дитизона, требуется вода, преимущественно не содержащая тех ионов или компонентов, которые способны вступать в реакцию с дитизоном или с определяемыми ионами. Не является обязательным удаление щелочных и щелочноземельных элементов, СОо, небольших количеств кремневой кислоты и т. и.
•};* Если воду, которая при проверке ее с дитизоном не содержала ионов металлов, пропустить через ионообменную колонку,
затем выпарить, прокалить полученный остаток и растворить его в небольшом количестве кислоты, то после нейтрализации можно пробой с дитизоном обнаружить значительные количества ионов Zn2+,
Оборудование
75
В специальных случаях можно пользоваться даже водопроводной водой, очищенной от металлов группы дитизона встряхиванием с раствором дитизона в органическом растворителе [3722, 5013, 5515].
В отдельных случаях для очистки воды в нее вводили коллекторы, например для очистки воды от свинца вводили фосфат кальция [428].
Предъявляемые требования
1) Допускается содержание металлов группы дитизона в пересчете на РЬ не более 1 мкг!л.
2) Содержание окислителя в пересчете на О — не более 1 мкг! л.
Методы испытания. Реактивы. Аммиак, 2 н. раствор (см. стр. 76).
Дитизон, 50 мкМ раствор в четыреххлористом углероде (см. стр. 92). 1 мл раствора соответствует ~5,2 мкг РЬ+2 или ~1,6 мкг Zn2+? Cu2+ или окислителя (последний в пересчете на кислород).
Испытание на присутствие металлов группы дитизона. В делительную воронку емкостью 500 мл помещают 250 мл воды и с помощью нескольких капель раствора аммиака доводят среду до pH 9,5, добавляют 2 мл раствора дитизона и примерно в течение 2 мин. энергично встряхивают. После расслоения фаз органическая фаза должна оставаться бесцветной.
Возникновение розовой, серой или бледно-коричневой окраски свидетельствует о присутствии Zn2+, Pb2+, Си24’ или других металлов группы дитизона. Возникновение бледно-желтой окраски свидетельствует о присутствии окислителей. Избыточное количество дитизона извлекается водной фазой в виде HDz” и обнаруживается по возникновению желтой окраски.
Испытание на окислители в отсутствие металлов группы дитизона [5225]. К 250 мл воды (pH 5—5,5) в делительной воронке прибавляют 0,1 мл раствора ди
Pb2+, Си-'+ и др. Следует отметить, что низкая электропроводность обессоленной воды в основном свидетельствует о ее нейтральности, т. е. о концентрации Н+- и ОН~-ионов, но не является критерием полного отсутствия тяжелых металлов.
76 Общие сведения о методах определения элементов с Dz
тизона, 0,4 мл чистого четыреххлористого углерода и в течение 2 мин. энергично встряхивают. После расслоения фаз зеленая окраска органической фазы должна оставаться неизменной (стр. 140).
О приготовлении воды, очищенной дитизоном, см. стр. 75.
X р а н е н и е и сто й кость. Очищенную воду предохраняют от попадания пыли и вредных паров (H2S, NOo) путем хранения ее в закрытых сосудах из термостойкого стекла или полиэтилена. Поглощенная двуокись углерода или щелочные металлы не являются вредными примесями.
2. Расшзор аммиака
При определении металлов группы дитизона применяются растворы аммиака различных концентраций. Для очистки растворов дитизона, так же как и для одноцветных спектрофотометрических определений, пользуются 0,01—0,03 и. растворами аммиака. Для нейтрализации и для приготовления буферных растворов применяют 15 н. раствор аммиака.
Продажный аммиак почти всегда содержит значительные количества металлов группы дитизона, особенно Zn2+, РЬ2+ и Си2+.
Предъявляемые т р е б о в а н и я. В 15 н. растворе аммиака допускается содержание металлов группы дитизона не более 10 мкг)л (в пересчете на РЬ).
Методы испытания. Помещают в кварцевый сосуд 25 мл примерно 15 н. раствора аммиака и испаряют на водяной бане * до 7з первоначального объема. Оставшийся в сосуде практически нейтральный раствор испытывают так, как это описывалось при испытании воды.
Приготовление раствора аммиака. Промытый газообразный аммиак (получаемый из баллона или в результате взаимодействия окиси кальция и хлорида аммония) медленно пропускают в охлаждаемую склянку из термостойкого стекла, полиэтилена или
* Не следует применять медные бани или бани с медными кольцами.
Оборудование
77
кварца, наполненную на 2/з своего объема водой, обработанной дитизоном. Аммиак пропускают по кварцевой трубке, присоединенной с помощью полиэтиленовой трубки. Для очистки аммиака совсем не обязательно прибегать к изотермической перегонке [387, 5023, 5225] или к изотермическому диффузионному способу очистки [5120].
Хранение и стойкость раствора. Раствор аммиака, аналогично воде, можно неограниченное время сохранять в склянках из термостойкого стекла, а еще лучше из полиэтилена или кварца. Ввиду высокого давления пара 15 н. раствора аммиака хранению подлежат растворы, разбавленные в 2 раза водой.
5. Типовые растворы
Типовыми растворами называют водные растворы солей металлов группы дитизона определенной концентрации. Обычно готовят растворы 25 мкМ, 25/2 мкМ, 25/3 мкМ (1 мкМ = 10 6 М) в зависимости от валентности металла и взаимодействия его с дитизоном (образование однозамещенных или двузамещенных дитизонатов). Эти растворы применяют вместо неизвестных испытуемых растворов для калибровки; при приготовлении шкалы сравнения ими пользуются для титрования. Для установки титра раствора дитизона пользуются титрованным 25 мкМ раствором нитрата серебра.
Предъявляемые требования. Для приготовления типовых растворов можно пользоваться солями металлов квалификации ч.д.а., так как присутствующие в них незначительные количества примесей отделяются при разбавлении их водой, обработанной дитизоном.
Приготовление растворов. Исходный 0,1 н. или 0,01 н. раствор разбавляют водой до нужной концентрации. Для повышения устойчивости растворов их делают 0,1 н. или 1 н. по кислоте.
Хранение и стойкость растворов. Разбавленные типовые растворы не следует хранить более
78 Общие сведения о методах определения элементов с Dz
одного дня [3912], так как их концентрация меняется вследствие сорбции вещества на стенках сосудов *.
4. Органические растворители
К органическим растворителям, применяемым для приготовления растворов дитизона, используемых для аналитических целей, предъявляют ряд требований.
1. Растворимость дитизона или дитизонатов в растворителе при комнатной температуре должна быть не менее 1
2. При комнатной температуре растворитель практически не должен смешиваться с водной фазой и должен быстро расслаиваться в широком интервале pH.
Растворители, хорошо смешивающиеся с водой, имеют лишь ограниченное применение.
Для растворителей, не смешивающихся с водой, быстрое и полное разделение фаз зависит частично от разности плотностей органического растворителя и водного раствора. Растворители с большей плотностью (d > 1,4) отделяются быстрее более легких растворителей (d<l,0), поэтому им оказывают предпочтение.
Из органических растворителей с меньшей плотностью имеются данные о применении бензола [5030, 592, 593], толуола [451, 5421, 556, 565]**, ксилола [5326] и изоамилового спирта [526, 527], а также уайт-спирита [5644, 5910, 5911]. Бромзамещенные (бромбензол [3522]) и йодза-мещенные углеводороды, несмотря на их высокую плотность, оказались малопригодными в качестве растворителей вследствие легкости гидролиза.
В качестве растворителей испытывались для экстракции при повышенных температурах органические соединения, представляющие собой при комнатной
* Еременко В. Я. [5932], изучая с помощью радиоактивных Со и Fe адсорбцию стенками бутылок микроэлементов из проб природных вод при их хранении, показал, что стенки белых и зеленых бутылок адсорбируют не более 3,5% находящихся в растворе микроэлементов. Для устранения адсорбции он рекомендует перед взятием пробы воды дважды сполоснуть бутылку тон же водой. Эту операцию целесообразно, вероятно, применять и для очень разбавленных стандартных растворов. — Прим. ред.
** См. также [5030, 592, 593]. — Прим. ред.
Оборудование
79
температуре твердые вещества, например бензофенон [5621].
3. Давление пара растворителя должно быть низким и при температурах выше комнатной.
4. Растворитель должен оставаться инертным по отношению к дитизону даже в присутствии самых различных реагентов. Иначе говоря, ни сам растворитель (или присутствующие в нем неотделимые примеси), ни его продукты распада не должны взаимодействовать с дитизоном с образованием замещенных дитизона (стр. 27—28).
Обычно для анализов пользуются 25 мкМ растворами дитизона. В таких разбавленных растворах даже побочные реакции, обусловленные взаимодействием следов примесей, очень сильно сказываются на изменении титра раствора. Так, 10 мкМ. раствор дитизона в специально очищенном нитробензоле заметно окисляется в течение нескольких часов. Большинсто растворителей квалификации ч. д. а. содержат следы примесей, которые со временем вызывают заметное изменение дитизона.
5. Растворитель не должен оказывать неблагоприятное влияние на положение и четкость полос поглощения растворов дитизона и дитизонатов (см. стр. 14, табл. 1).
6. Растворитель должен быть физиологически относительно безвредным.
Необходимо обратить внимание на возможность острых хронических отравлений парами четыреххлористого углерода и хлороформа [4922]. Ввиду их невоспламеняемости обычно не обращают внимания на близость зажженных горелок, в результате чего увеличивается опасность возможных отравлений (образование фосгена!). Для удаления вредных паров лаборатория должна быть оснащена мощной вытяжной системой.
Если растворитель удовлетворяет шести перечисленным требованиям, его пригодность для аналитических целей рассматривают еще с точки зрения ряда других факторов. Такими факторами являются: величина коэффициента распределения при различных значениях pH (см. стр. 22), скорость экстракции, превращение и раз-
Таблица 8
НЕКОТОРЫЕ СВОЙСТВА, ХАРАКТЕРИЗУЮЩИЕ ЦЕННОСТЬ ЧЕТЫРЕХХЛОРИСТОГО УГЛЕРОДА И ХЛОРОФОРМА КАК РАСТВОРИТЕЛЕЙ ДИТИЗОНА
Свойства СС1, СНС1;( Преимущества а
СС14 СНС13
Растворимость в воде при 20 0,50 5,5 —Р"
мл)л
Растворимость воды при 20 ', 0,62 4,8 —1 -
мл) л
Растворимость дитизона, г/л 0,64 17,8 —
(см. табл. 1, стр. 14) •
Растворимость некоторых Умерен- Удовле- —1—
дитизонатов, например ная твори-
Cd(HDz)2 и Pb(HDz)2 (см. тельная
табл. 4, стр. 38)
Плотность, ZfCM3 1,59 1,49 +
Способность расслаиваться Очень Хорошая ’"1 *
хорошая
Давление пара при 20° 91 160 !_
То же при 30° 142 248 + 4- -4-
Инертность к дитизону Удовле- Хорошая 1 г
твори-
тельная
Оптическая характеристика
растворов дитизона:
макс.’ 620 605 —н*
£1 макс., л!МОЛЬ'СМ (СМ. 32 800 40 000 —Ь
табл. 4)
Величина pH, при котором 8,8 10,6 — —[—
коэффициент распределения
НгОгорр/НгОгзоди. = 1 В зависимости от
(см. рис. 5, стр. 22) использования
(см. табл. 9)
Максимально допустимая кон- 0,487 0,315 и
центрация в воздухе рабо-
чего помещения [4922], мг[л
а Превосходящие преимущества 4-; значительно превосходящие + + .
0 Практически СС14 менее вреден вследствие более низкого давления пара.
Оборудование
81
ложение дитизонатов, горючесть, возможность регенерации, экономические факторы и др.
Таблица 9
ПРЕИМУЩЕСТВА ЧЕТЫРЕХХЛОРИСТОГО УГЛЕРОДА И ХЛОРОФОРМА В ЗАВИСИМОСТИ ОТ ОБЛАСТИ ИХ ПРИМЕНЕНИЯ [374]
Область применения Рекомендуемый растворитель Преимущества
Качественный анализ СС14 Более четкие и более легко различимые окраски
Очистка растворов дитизона СС14 Более легкий перевод H2Dz в водную фазу в виде HDz-
Экстракционное титрование Ag+, Hg2+,Pd2+, СС14 Более быстрое разделение фаз
Pt2+, Cu2+, Bi3+, Zn2+
Экстракционное титрование Au3+, In3+, Cd2+, Pb2+ (Co2+), T1+ СНС13 Лучшая растворимость, более высокий выход экстракции
Спектрофотометрия одноцветного раствора СС14 Более легко отмывается избыток H2Dz
To же при определении Т1+, Cd2+ CHCL о Более высокий выход экстракции, лучшая растворимость
Разделение металлов СС14 Более четкое разделение
в щелочном растворе, например Cd и Zn
Отделение более значи- СНС13 Большая растворимость
тельных количеств металлов
В качестве растворителей дитизона пока общепризнанными являются четыреххлористый углерод и хлороформ. Сравнительные характеристики этих растворителей и некоторые их свойства приведены в табл. 8.
Наибольший интерес для аналитической практики представляют различия в растворимости дитизонатов
6 Зак. 2157
82 Общие сведения о методах определения элементов с Dz
некоторых ‘Металлов в этих двух растворителях, а также в их коэффициентах распределения. Какой из растворителей следует избрать, зависит от определяемого катиона и выбранного метода определения (табл. 9).
Четыреххлористый углерод
Этот растворитель чаще всего применяется для приготовления растворов дитизона.
Даже самый чистый четыреххлористый углерод ведет себя не совсем индифферентно по отношению к дитизону. В воде он медленно гидролизуется уже при комнатной температуре, причем этот процесс очень сильно ускоряется в присутствии железа, меди, кислот и оснований, особенно при повышении температуры или под действием света. С переходом через промежуточные продукты (COCK, НОС1, СК), действующие агрессивно на дитизон, образуются двуокись углерода и хлористый водород. Таким образом, даже чистые продажные сорта четыреххлористого углерода содержат большие или меньшие количества примесей, которые не поддаются определению при помощи существующих методов испытания [3924, 5026, 5512]. Поэтому препараты квалификации ч. д. а. различных поставок ведут себя совершенно по-разному по отношению к дитизону [5532].
В то время как хлорзамещенные углеводороды (хлороформ, гексахлорэтан, тетрахлорэтилен и трихлорэтилен), а также сероуглерод изменяют спектр поглощения раствора дитизона, другие примеси при концентрации 1 мкМ вызывают его заметное разложение. При комнатной температуре разложение протекает весьма медленно, поэтому Клиффорд [3811] считал, что раствор дитизона перестает изменяться только через две недели после его изготовления.
Сендэл [502] и Гейгер [5225] наблюдали для различных партий четыреххлористого углерода различия в скорости и полноте извлечения Си (HDz) 2 из кислых растворов с определенным pH. Они предположили, что это явление может быть объяснено присутствием органически?; соединений серы, очевидно меркаптанов, действующих как ингибиторы и окисляющихся бромом, хлором
Оборудование
83
илы перманганатом калия [5328], в результате чего образуются растворимые в воде соединения.
Кислоты (особенно соляная кислота) не влияют на качество четыреххлористого углерода как растворителя, так как их легко можно извлечь промывкой водой. Однако нарастающее образование хлористого водорода в четыреххлористом углероде свидетельствует о протекании ускоренного катализаторами гидролиза, промежуточные продукты которого оказывают вредное действие, вступая в реакцию с дитизоном.
Чем ниже концентрация раствора дитизона, тем сильнее проявляется действие реакционноспособных примесей четыреххлористого углерода. Вот почему для более концентрированных исходных растворов дитизона в четыреххлористом углероде изменение титра за одно и то же время относительно меньше.
В очень редких случаях некоторые сорта четыреххлористого углерода содержат химически инертные примеси, обладающие поверхностной активностью и оказывающие вредное влияние на расслоение фаз, т. е. способствующие образованию эмульсий.
Предъявляемые требования. Четыреххлористый углерод считается пригодным для аналитических целей, если в приготовленном из него 2,5 мкМ растворе дитизона (640 мкг дитизона на 1 л четыреххлористого углерода) после его хранения при 20° в темноте в течение 24 час. разложение составляет не более 64 мкг дитизона (0,25 мкМ дитизона). Иными словами, для 2,5 мкМ. раствора разложение за сутки не должно превышать 10%. Так как на практике в основном пользуются 25 мкМ растворами, то в результате разложения их концентрация меняется примерно на 1% в сутки.
С повышением температуры и освещения разложение раствора дитизона увеличивается. В какой-то мере влияет и концентрация дитизона, так как с увеличением количества агрессивных примесей растет и скорость превращения дитизона. Сначала скорость разложения несколько больше, но со временем она уменьшается и, наконец, достигает постоянной величины, обусловленной постоянной скоростью образования агрессивных
6*
84 Общие сведения о методах определения элементов с Dz
продуктов распада самого четыреххлористого углерода. Разложение раствора дитизона, обусловленное продуктами разложения четыреххлористого углерода, при нормальных условиях хранения раствора примерно4 в 10 раз меньше 64 мкг)л в сутки.
Методы испытания
а) Спектрофотометрическое определение. В смесительный цилиндр емкостью 50 мл помещают 2,5 мл 50 мкМ раствора дитизона в хлороформе и доводят объем до 50 мл подлежащим испытанию четыреххлористым углеродом. Полученный 2,5 мкМ раствор дитизона хранят в течение 24 час. в темноте при 20°. Измеряют оптическую плотность слоя раствора толщиной 5 см при 620 Mfi в начале (Ео) и в конце хранения (Е\). Разложение (X) рассчитывают по формуле
Х=640
fo —
мкг л • сутки
В этих условиях Ео равно — 0,4. Положение максимума поглощения вследствие присутствия в растворе хлороформа несколько смещено в сторону более коротких длин волн (см. стр. 19, рис. 4 и стр. 18, рис. 3).
б) Объемное определение. Смешивают в делительной воронке емкостью 200 мл точно 5 мл титрованного 50 мкМ раствора дитизона в хлороформе и 95 мл испытуемого четыреххлористого углерода и оставляют смесь на 24 часа. После этого вводят пипеткой 20 мл титрованного 25 мкМ раствора AgNCb в 0,1 н. азотной кислоте (26,97 мгк Ag) и примерно 20 мл воды. Энергично встряхивают смесь в течение 1 мин. и отделяют окрасившуюся в желтый цвет органическую фазу. В водном растворе определяют количество оставшегося Ag+ путем экстракционного титрования 2,5 мкМ раствором дитизона в растворе хлороформа (см. стр. 153) и записывают число миллилитров (а) израсходованного на титрование раствора дитизона. Разложение (X) рассчитывают по формуле
А мкг = 64# —-----
л • сутки
Оборудование
85
в) Визуальное колориметрическое определение. Раствор готовят как в пункте (а), оставляют на 24 часа и затем сравнивают с аналогично приготовленным свежим раствором. При визуальной оценке обеих проб не должно наблюдаться никакого различия в окраске растворов *.
Очистка и регенерация четыреххлористого углерода. Из четыреххлористого углерода плохого качества или из отходов его после проведения определений с дитизоном можно путем очистки получать препарат, пригодный для приготовления растворов дитизона. Так как разложение четыреххлористого углерода ускоряется при повышении температуры, а кислоты являются катализаторами этого процесса и так как основными агрессивными примесями являются вещества, действующие как окислители, четыреххлористый углерод следует сначала нейтрализовать, затем подвергнуть перегонке при возможно более низкой температуре в присутствии соответствующих восстановителей. Специфически чистый четыреххлористый углерод получается, если перед перегонкой его обрабатывают некоторым количеством дитизона. Отходы четыреххлористого углерода, содержащие большие количества S2- пли CN", следует обрабатывать отдельно или просто выливать [387].
Проведение очистки. Отработанный четыреххлористый углерод отделяют от водной фазы. Если жидкость остается мутной, то ее дополнительно фильтруют через бумажный фильтр. Для разрушения дитизонатов металлов и удаления непрореагировавшего дитизона встряхивают четыреххлористый углерод в течение 5 мин. дважды порциями (по 150 мл) 5 н. раствора едкого натра 1 и разделяют слои в делительной воронке. Далее его отмывают от щелочи 2—3 порциями дистиллированной
* В США качество четыреххлористого углерода испытывают следующим способом. Препарат считается удовлетворительным, если розово-красная окраска свежеприготовленного примерно раствора Cd (HDz)2 в четыреххлористом углероде заметно не бледнеет после 10 мин. встряхивания с 1,25 н. раствором NaOH. Гейгер [5225], Сендэл и другие исследователи рекомендуют наряду с проверкой изменения коэффициента поглощения раствора дитизона в четыреххлористом углероде при 620, 510 и 450 определять замедление экстракции дитизоната меди Cu(HDz)2 из 0,1 н. раствора НС1.
86 Общие сведения о методах определения элементов с Dz
воды (по 150 мл каждая) и пропускают через двойной складчатый фильтр для отделения последних капель воды 2. После такой предварительной очистки 3 к отработанному четыреххлористому углероду добавляют 0,5 г/л твердого дитизона 4 и выдерживают в течение 1 часа на водяной бане при 35°. Отгонку ведут в стеклянном перегонном аппарате5 с фракционной колонкой! при разрежении 40—50 мм рт. ст. и температуре водяной бани примерно 35°. Холодильник и приемник охлаждают ледяной водой или измельченным льдом. После того как в колбе останется V20 часть начального объема, перегонку прекращают, а оставшуюся жидкость вместе с осадком6 отсасывают и отбрасывают. Дистиллят7 вновь переносят в колбу и перегоняют в вакууме уже без добавления дитизона.
Примечания
1 Если в отработанном четыреххлористом углероде содержится большое количество дитизонатов, плохо разлагающихся щелочью, рекомендуется провести предварительную обработку 15 н. серной кислотой.
2 Вследствие присутствия «желтых продуктов окисления» жидкость обычно окрашена в желтый цвет.
3 Чистый продажный четыреххлористый углерод, не содержащий органических серосодержащих соединений, можно не подвергать такой предварительной обработке. Соединения серы удаляют окислением.
4 Для этого не требуется очень чистый дитизон.
5 Шлифы совсем не смазывают или смачивают только водой.
6 Не следует стараться полностью удалять осадок. Достаточно 2 раза ополоснуть колбу 20 мл дистиллята. Если перегонная колба имеет боковой отвод для воздушного капилляра, то аппарат можно не разнимать.
7 Часто дистиллят окрашен в светло-зеленый цвет увлеченным дитизоном, который почти полностью удаляется после второй перегонки.
Другие способы очистки. К предварительно очищенному отработанному четыреххлористому углероду добавляют 10 н. раствор гидразина (10 мл) и нагревают в течение 3—4 час. с вертикальным холодильником. После охлаждения основную массу гидразина нейтрализуют 2 н. серной кислотой.
Перегонкуч лучше всего вести также в вакуумеJ. Часть гидразина увлекается парами и переходит в ди
Оборудование
87
стиллят. После отгонки его грубо отделяют в делительной воронке. Остатки гидразина2 удаляют фильтрованием дистиллята через сухой бумажный фильтр.
П р и м е ч а н и я
1 Четыреххлористый углерод, отогнанный при нормальном давлении, тоже вполне пригоден.
2 Присутствие раствора гидразина обусловливает помутнение ч ет ы р ех х л о р 11 ст о го у гл ер од а.
При фракционированной перегонке недоброкачественного продажного четыреххлористого углерода лишь небольшое количество вредных примесей накапливается в остатке [5 17 , 5532].
Гейгер и Сендэл [5328], очищая четыреххлористый углерод, всегда старались удалить предполагаемые примеси серосодержащих соединений, мешающие извлечению дитизоната меди Си (HDz) 2. Для этого к четыреххлористому углероду добавляли бром (несколько капель на 1 л) и оставляли на 2 недели. После этого четыреххлористый углерод в течение 4 часов нагревали с 2,5 н. раствором щелочи с вертикальным холодильником. Щелочь отмывали водой, встряхивали растворитель в течение 5 мин. с раствором солянокислого гпдроксиламина, перегоняли и высушивали над хлористым кальцием. Хогль и Сульзер [517] энергично встряхивали 2 л четыреххлористого углерода в течение 3 мин. со смесью 100 мл 5 н. раствора едкого натра и 0,8 г солянокислого гидроксиламина. Обработку повторяли дважды или в случае надобности до тех пор, пока щелочь не становилась бесцветной (при обработке загрязненного четыреххлористого углерода щелочь окрашивалась в желтый цвет). После отделения четыреххлористый углерод перегоняли над хлористым кальцием.
Были предложены и другие способы очистки [5115].
Хранение и у с т о й ч и в о с т ь. Обработанный дитизоном четыреххлористый углерод, предохраняемый от действия света (склянка из оранжевого стекла или лучше покрытая черным лаком склянка с указателем уровня жидкости) и тепла, пригоден для употребления в течение нескольких недель и даже месяцев
88 Общие сведения о методах определения элементов с Dz
Хлороформ
Несмотря на более высокое давление пара, хлороформ предпочитают четыреххлористому углероду в качестве растворителя в щелочной среде в тех случаях, когда лучшая растворимость и лучшая способность хлороформа удерживать дитизон и дитизонаты в растворе способствуют более легкому извлечению последних.
Имеющийся в продаже хлороформ квалификации ч.д. а. может быть использован без всякой очистки. Предлагаемые методы очистки относятся главным образом к регенерации отработанного растворителя. Несомненно, хлороформ часто употребляют вместо четыреххлористого углерода и вследствие отсутствия чистого четыреххлористого углерода.
Хлороформ более устойчив, чем четыреххлористый углерод. Однако и его рекомендуется защищать от излишне длительного воздействия кислот, щелочей, света и тепла [4712].
Предъявляемые требования и методы испытания. Такие же, как для четыреххлористого углерода (см. стр. 83).
Регенерация хлороформа. Хлороформ, применявшийся в качестве растворителя дитизона, можно регенерировать такими же способами, как и четыреххлористый углерод [5515]. Чаще достаточно воспользоваться самыми простыми способами, например перегонкой над прокаленной окисью кальция [362, 3811], предварительно очистив раствор встряхиванием с 36 н. раствором серной кислоты [394]. Очень грязный хлороформ следует попросту выливать [4212].
Очень загрязненный хлороформ очищали [557] перегонкой его над слоем водного сульфита (10%-ный раствор). Дистиллят можно еще обработать водным раствором солянокислого гидроксиламина до полного обесцвечивания водного слоя. Дополнительно можно провести перегонку над окисью кальция или древесным углем. В приемник добавляют небольшое количество этилового спирта из расчета содержания 1 % (объемн. )спирта в хлороформе. Описана [37б, 4712] также перегонка хлороформа над тиосульфатом натрия (при температуре не выше 57°).
Оборудование
Этиловый спирт служит консервирующим средством и предотвращает, например, образование фосгена.
Хранение и устойчивость. Если хлороформ хранить в таких же условиях, как и четыреххлористый углерод, он сохраняется практически бесконечно долго даже без добавления этилового спирта.
5. Дитизон (дифенилтиокарбазон)
Твердый дитизон может быть получен в виде 100%-ного вещества (см. примечания на стр. 379). Однако растворы дитизона в четыреххлористом углероде легко поддаются очистке (стр. 91 сл.); таким образом, применение менее чистого дитизона также не вызывает особых затруднений1. Все же применяемые препараты дитизона квалификации ч. д. а. не должны содержать более 2% примесей2.
Предъявляемые требования
1. При объемном определении3 по серебру содержание дитизона должно равняться не менее 98%.
2. Модуль поглощения 12,5 мкМ раствора дитизона в хлороформе4 (соответствует раствору 3,205 мг препарата в 1 л хлороформа) при 605 жц и 20° должен равняться5 0,485 ± 0,015 см~\
Примечания
1 Очень вредной является примесь сульфидов, так как последние образуют очень прочные соединения с тяжелыми металлами, которые в дальнейшем уже не могут быть обнаружены дитизоном.
2 Обычно в дитизоне содержатся следующие примеси: дифенил-тиокарбодиазон, «желтые продукты окисления», небольшие количества фенилтиокарбазида, анилина и следы тяжелых металлов. Иногда присутствуют небольшие количества серы [5023]. Фирма «Мерк» выпускает дитизон для анализа с гарантированным 98%-ным содержанием, так называемый «дитизон для анализа № 3092».
3 Описанные ранее методы определения [3924, 5026, 5512] не пригодны.
90 Общие сведения о методах определения элементов с Dz
4 Растворы в хлороформе (вместо четыреххлористого углерода) более устойчивы; кроме того, в хлороформе в течение 10 мин. полностью растворяется даже крупнокристаллический дитизон. Добавление к хлороформу других растворителей, например четыреххлористого углерода, снижает модуль поглощения при 605 М[т (см. стр. 19).
5 Дополнительное измерение абсолютной величины поглощения дает возможность судить о присутствии других анионов, связывающих Ag+-HOH, или других дитизонатов, также образующихся при титровании дитизоном (на ни.х также расходуется дитизон). Однако для определения поглощения при 605 мр такое измерение ничего существенного не дает. В качестве критерия чистоты растворов дитизона рекомендуется также определять коэффициент поглощения по первому и второму максимуму поглощения [516, 5620], что является очень чувствительным способом выявления ионов металллов и продуктов окисления.
Методы испытания
1. Взвешивают примерно 25 мг дитизона в предварительно тарированной с точностью до 0,5 мг чашечке (навеска а), переводят навеску в мерную колбу емкостью 200 мл и приливают 150 мл хлороформа. Частое встряхивание ускоряет растворение дитизона. Через 10 мин. доводят хлороформом раствор до метки. Отбирают пипеткой 10 мл раствора, помещают его в мерную колбу емкостью 100 мл и доводят хлороформом до метки. Полученный таким образом раствор примерно 50 мкМ по дитизону. В делительную воронку на 100 мл помещают точно 25 мл свежеприготовленного 50 мкМ раствора AgNO3 (1 мл = 5,394 мкг Ag+ = 12,81б85 лгкг H2Dz), примерно 0,1 н. по азотной кислоте, и титруют с точностью до 0,05 мл разбавленным раствором дитизона из бюретки на 50 мл (цена деления 0,1 мл) методом экстракционного титрования (см. стр. 96). Отмечают объем израсходованного дитизона (б) и рассчитывают содержание дитизона по формуле
Содержание дитизона (°0H2Dz)=^
64084 а • б
2. Точно 25 мл разбавленного раствора дитизона (см. пункт 1) разбавляют хлороформом до 100 мл и опреде
Оборудование
91
ляют модуль поглощения т в кювете длиной 1 см при 605 л/р (см. стр. 99). После умножения полученной вели-
чины на коэффициент получается
//z = 0,485 ± 0,015 слг\
Получение и очистка дитизона см. стр. 375 и сл.
Хранение и устойчивость. Крупнокристаллический дитизон можно хранить неограниченно долгое время при условии предохранения его от действия света и тепла. Препарат в виде мелкого порошка обладает тем преимуществом, что он быстрее растворяется. Однако имеются сведения, что в течение месяцев его активность снижается.
6. Растворы дитизона
Дитизон обычно растворяют в четыреххлористом углероде пли хлороформе. После соответствующей очистки из них готовят исходные растворы, растворы для экстракций и титрованные растворы. Растворы дитизона в других органических растворителях представляют меньший' интерес (см. стр. 78 и примечание на стр. 106).
Очень часто приходится иметь дело с водными щелочными растворами дитизонатов щелочных металлов (см. стр. 13). Как реагенты их применяют редко [498, 5610], но довольно часто их используют в качестве «промежуточных растворов» для вымывания избыточного дитизона или при очистке растворов дитизона.
Растворы щелочных дитизонатов устойчивы в течение очень ограниченного времени. Так, 50 мкМ раствор дитизона в 1,5 н. аммиаке при хранении в темноте при 20° разлагается ежечасно на 10%. Разложение несколько ускоряется в присутствии кислорода воздуха и с переходом через «желтые продукты окисления» приводит к образованию дифенилтиокарбодиазона (см. стр. 28 и сл.). Очень медленно разлагается раствор дитизона в 0,15 н. аммиаке при отсутствии катализаторов.
92 Общие сведения о методах определения элементов с Dz
Приготовлен неочищенного исходного раствора
Посуду следует мыть, как указано на стр. 69, а вспомогательные реактивы очищать от металлов группы дитизона, как описано на стр. 74 и сл.
Посуда
Делительные воронки емкостью 200 и 500 мл.
Колбы Эрленмейера емкостью 200 и 500 мл.
Мерные цилиндры емкостью 250 мл.
Воронки диаметром 6 см.
Склянки емкостью 250 мл (со шлифами, покрытые черным лаком).
Реактивы
Дитизон, 0,1 г.
Четыреххлористый углерод, 1 л.
Аммиак ~0,75 н., 600 мл.
Серная кислота ~1 н., 50 мл.
Вода, 1 л.
Приготовление раствора. Встряхивают энергично в течение 10 мин. в сухой делительной воронке емкостью 200 мл примерно 0,1 г дитизона со 150 мл четыреххлористого углерода *. Для отделения нерастворимого осадка2 темно-зеленый раствор фильтруют через плотный фильтр в делительную воронку емкостью 500 мл, добавляют 100 мл аммиака и в течение 1 мин. энергично встряхивают3.
После расслоения фаз органическую (нижнюю) фазу сливают в колбу Эрленмейера 4 емкостью 200 мл, а водную собирают в колбу емкостью 500 мл. Органическую фазу вновь переносят в делительную воронку емкостью 500 мл, встряхивают 2—3 раза с аммиаком, как описано выше, и после отделения водных фаз сливают в специальную склянку5 или выливают.
Объединенные водные вытяжки переносят в делительную воронку емкостью 500 мл, предварительно промытую небольшим количеством воды, и 2—3 раза обрабатывают примерно 2 мл чистого четыреххлористого
Оборудование
93
углерода 6. После этого добавляют 200 мл четыреххлористого углерода, подкисляют 10 мл серной кислоты и энергично встряхивают7 примерно в течение 1 мин. Через несколько минут фазы расслаиваются, органическую фазу спускают в колбу Эрленмейера емкостью 200 мл, а водную фазу отбрасывают8.
Дитизон переводят из раствора в четыреххлористом углероде в аммиачный раствор и обратно столько раз, пока после встряхивания с аммиаком не получится практически бесцветная органическая фаза9. К тщательно отделенному водному раствору дитизоната в аммиаке приливают 100—200 мл желаемого органического растворителя 10, подкисляют 15 мл серной кислоты, примерно в течение 1 мин. энергично встряхивают и спускают11 в ополоснутую колбу Эрленмейера емкостью 200 мл. Очищенный таким образом исходный раствор переносят в делительную воронку емкостью 500 мл и встряхивают в течение 1 мин. со 100 мл воды, спускают в склянку для хранения и наверх наливают 10 мл воды и 1 мл серной кислоты 12.
Примечания
1 Только крупнокристаллические препараты приходится встряхивать более длительное время.
2 Высококачественный дитизон почти не содержит нерастворимого остатка.
3 Из дитизона образуется растворимый в щелочах диссоциированный дитизонат
H2Dzopr. + ИН4ОНводн. NH4HDzBCW1. + H2O, который при высоком pH среды в своей значительной части переходит в водную фазу (см. стр. 22) и окрашивает ее в оранжевокрасный цвет. В органической фазе остается часть зеленого дитизона, а также примеси, не способные образовывать соли.
4 При разделении фаз следует обращать внимание на то, чтобы в водную фазу попадало как можно меньше органической фазы, так как в ней концентрируются примеси. Если органическая фаза остается зеленой, то ее вновь обрабатывают аммиаком.
5 Органическую фазу собирают, чтобы регенерировать четыреххлористый углерод. .Обычно она более иди менее окрашена в желтый цвет, обусловленный большой концентрацией примесей, извлеченных из дитизона. Если дитизон содержал большие количества металлов группы дитизона (они попали в эту фазу из стекла, воды или аммиака), то жидкость может быть окрашена, например в присутствии Pb(HDz)2,B красный цвет. При наличии благородных
94 Общие сведения о методах определения элементов с Dz
металлов, образующих желтые дитнзонаты, получается желтая окраска. Дитнзонаты благородных металлов можно обнаружить путем встряхивания органического экстракта с 1%-ным раствором цианистого калия. Вследствие разложения дитизонатов в зависимости от pH водного раствора органическая жидкость становится зеленой или обесцвечивается [352].
6 В результате последующей промывки все примеси в значительной степени удаляются и лишь в редких случаях приходится прибегать к повторной или трехразовой очистке.
7 При подкислении выделяется не растворимый в воде при pH < 7 дитизон и переходит в органическую фазу, окрашивая ее в зеленый цвет.
NH4HDzB(WbHSO4 ВГ)Д1Ь H2Dzopr. + NH4HSO 4 ВОЛИ.»
8 Следует стремиться как можно более полно отделять органическую фазу от водной. Последняя может быть окрашена коллоидными частицами дитизона в зеленоватый или даже фиолетовый цвет.
9 Это обычно наступает после повторения операции 1—2 раза. Если органическая фаза бесцветна, то в водной фазе содержится только чистый дитизонат аммония.
10 Если в качестве растворителя выбран хлороформ, то, чтобы чистый исходный раствор дитизона освободить от четыреххлористого углерода, водный раствор предварительно встряхивают с несколькими миллилитрами хлороформа.
11 Колбу Эрленмейера предварительно ополаскивают выбранным растворителем и небольшим количеством воды.
12 Налитый поверх слой воды предупреждает испарение, кислота предохраняет от местного выщелачивания из стекла щелочи [404].
Хранение и устойчивость. При хранении на холоду и в затемненном месте устойчивость исходного раствора зависит от выбранного растворителя и его чистоты.
Подкисленные растворы дитизона не чувствительны к действию кислорода. Изменение титра 0,001 М раствора дитизона в хлороформе, даже в отсутствие этилового спирта [5026], после года хранения составляет менее 0,2%; 0,001 М растворы дитизона в обработанном дитизоном растворе четыреххлористого углерода при хранении их при 20° в затемненном месте изменяют титр в течение месяца на 1—2%. При температуре выше 50~ скорость разложения быстро растет. Иа основании нашего опыта можно сказать, что предохранение растворов дитизона в четыреххлористом углероде от разложения слоем водного раствора сернистой кислоты [ЗЗ2,
Оборудование
95
3811, 421] и солянокислого гидроксиламина не дает желаемых результатов [404, 421]. Наблюдаемое усиление интенсивности окраски при покрытии слоем более концентрированной сернистой кислоты [3811], возможно, является следствием влияния растворителя.
Из исходного раствора путем разбавления готовят растворы для экстрагирования и для количественных определений. В хранившихся долгое время исходных растворах дитизона в четыреххлористом углероде с течением времени образуются продукты разложения. Не говоря уже об изменении концентрации раствора, эти продукты могут мешать при фотометрических определениях, так как они также немного поглощают в области между 600 и 220 м\к (см. рис. 7 и 8, стр. 29 и 30), таким образом, их полное удаление весьма полезно.
Можно применять и неочищенные растворы дитизона, так как, хотя продукты разложения и окрашены, они не реакционноспособны. Однако в их присутствии создается окрашенный фон, что снижает чувствительность и точность определения.
Обычно очистке подвергают не весь приготовленный исходный раствор, а только часть его, нужную для приготовления раствора реактива *.
Приготовление раствора для экстрагирования
Растворы дитизона в четыреххлористом углероде или хлороформе применяются для отделения или концентрирования какого-либо катиона. Концентрация раствора (от 25 мкМ до 2,5 мкМ) зависит, кроме всего прочего, еще от того, предстоит ли экстрагировать катион, присутствующий в большом количестве, или желательно извлечь катион из разбавленного раствора, чтобы получить более концентрированный его раствор. Растворы дитизона для экстрагирования готовят из исходного раствора. Очень точная установка концентрации раствора, как и особая его чистота, также не требуется.
* Маркова А. И. [583] для очистки дитизона от продуктов его окисления и непрореагировавшего дифенилтиокарбазида использовала аскорбиновую кислоту. — Прим. ред.
§6 Общие сведения о методах определения элементов с Dz
Приготовление и установка титра раствора дитизона
Дитизон в качестве реактива чаще всего применяют в растворе четыреххлористого углерода, реже — в растворе хлороформа и еще более редко — в других органических растворителях. Обычно готовят растворы 25 ж/сМ, иногда 50 мкМ или еще более разбавленные. Их готовят разбавлением части исходного раствора незадолго до употребления. Существует несколько методов установки титра [5023], что зависит от определенных конкретных условий. Чаще всего пользуются следующими методами.
1. Объемный метод. Метод заключается в непосредственном экстракционном титровании с помощью титрованного раствора соли металла группы дитизона. В этом случае применяемый растворитель не имеет значения, так как смешанные растворители не оказывают влияния. Стараются титровать растворы соли того же катиона, который предполагают впоследствии определять. Очень точные результаты дает титрование раствором соли серебра (±0,2%). Обычные примеси дитизона при этом не оттитровываются и мало влияют на процесс титрования.
2. Спектрофотометрический метод. Применение метода связано с видом органического растворителя, так как последний влияет на спектры поглощения (см. табл. 1, стр. 14; рис. 3, стр. 18; рис. 4, стр. 20).
/. Установка титра раствора дитизона прямым экстракционным титрованием раствором соли серебра [352]
Посуда
Пипетка емкостью 10 мл.
Бюретки (две) емкостью по 50 мл (цена деления 0,1 мл).
Делительная воронка емкостью 150 мл.
Мерные колбы емкостью по 250 мл.
Колбы Эрленмейера емкостью по 50 мл.
Оборудование
97
Реактивы
Исходный раствор дитизона в четыреххлористом углероде, примерно 0,001 М (~ 250 мг/л).
Титрованный 50 мкМ раствор соли серебра (AgNO3), 0,1 н. по HNO3. 1 мл содержит 5,394 мкг Ag+ (= 12,81 мкг дитизона).
Серная кислота, 0,1 н.
Четыреххлористый углерод1.
Вода.
Выполнение. В мерную колбу емкостью 250 мл помещают 10 мл исходного раствора дитизона2, доводят объем до метки четыреххлористым углеродом и переливают в бюретку. Из другой бюретки в делительную воронку спускают 25,0 мл (а) титрованного раствора соли серебра, добавляют 25 мл воды и титруют методом экстракционного титрования3 разбавленным раствором дитизона до тех пор, пока последняя капля при встряхивании больше не окрашивается в чисто желтый цвет4. Органические экстракты собирают в колбу Эрленмейера.
Отмечают количество израсходованного раствора дитизона (б) с точностью до 0,05 мл и рассчитывают его концентрацию в мкМ [50 а/б]. Путем дальнейшего определенного количества исходного раствора можно довести раствор дитизона до нужной концентрации5. На время хранения раствор дитизона заливают слоем серной кислоты толщиной 0,5 см6.
Примечания
1 Вместо четыреххлористого углерода’ можно применять хлороформ.
2 Если исходный раствор уже немного разложился, то берут большее его количество и очищают, как описано на стр. 92. Из чистого раствора дитизона последний полностью извлекается после нескольких экстракций 0,15 н. раствором аммиака, причем органическая фаза становится бесцветной.
3 Растворенный в органическом растворителе с зеленой окраской дитизон при встряхивании быстро и количественно взаимодействует с эквимолекулярным количеством ионов серебра, находящихся в водной фазе, с образованием дитизоната серебра, растворяюще-
7 Зак. 2157.
98 Общие сведения о методах определения элементов с Ьг
гося в органическом растворителе с золотисто-желтой окраской:
а8в+одн. + H2Dzopr AgHD Zopr. ~Ь НВОдн.’
Зеленый Золотисто-желтый
Титрование можно вести и обычным способом, добавлением отдельных порций разбавленного раствора дитизона к водному раствору соли серебра. После каждой порции дитизона раствор несколько секунд энергично встряхивают, поворотом крана выравнивают давление в делительной воронке, оставляют на несколько секунд для расслаивания и наблюдают изменение окраски органической фазы. По достижении стехиометрической точки эквивалентности избыточный зеленый дитизон распределяется в относительно большохМ объеме золотисто-желтого раствора AgHDzopr. в органическом растворителе и придает ему зеленый оттенок. При таком способе титрования воспроизводимость результатов составляет около ±5%.
Согласно рекомендуемому способу экстракционного титрования, после добавления каждой порции титрующего раствора дитизона смесь несколько секунд энергично встряхивают, 20—30 сек. отстаивают, наблюдают окраску органического слоя и спускают его в колбу Эрленмейера. Постукиванием о стенки сосуда принуждают опуститься вниз более крупные капли органического экстракта, плавающие на поверхности водной фазы. Раствор дитизона прибавляют в несколько меньшем количестве, чем это требуется для достижения точки эквивалентности. Переход окраски вызывают добавлением очень незначительного избытка титрующего раствора по сравнению с общим объемом израсходованного раствора дитизона.
Обычно раствор дитизона добавляют следующими порциями: 1) 7г—2/з всего предполагаемого количества; 2) 7г—2/з оставшегося количества и т. д., пока почти весь раствор не будет добавлен, затем добавляют избыток 0,05 мл. Так как при титровании 1 мкг Ag+ в 50 мл водного раствора 5 мкМ раствором дитизона теоретическая погрешность равна ±5%, то при содержании 100 мкг Ag+ эта погрешность должна равняться ±0,05% от этой величины. Обычно к этой погрешности еще прибавляются ошибки, возможные при отсчете объема, потери и др., так что практически точность определения составляет ± 0,2%.
При разделении фаз следует обращать внимание на то, чтобы в начале титрования вместе с органической фазой не удалить и водную, так как последняя еще содержит большие количества Ag+-HOHOB. Под конец титрования органическую фазу отделяют возможно полнее, хотя и на этом этапе потери водной фазы, почти не содержащей серебра, уже не имеют значения, но она может влиять на оттенок окраски органической фазы. Чтобы облегчить отделение (т. е. перемешивание) небольших объемов органической фазы, добавляют 7г—1 мл чистого растворителя, выполняя тем самым нечто вроде промывки.
4 В конце титрования содержание Ag+-noHOB в водном растворе очень мало, около 1 • 10-8 М. При добавлении чистого раствори
Оборудование
99
теля для облегчения встряхивания и промывки концентрация дитизона в растворе также уменьшается (до 1 • 10~6 Л4). При таком сильном разбавлении компонентов реакции образование AgHDz происходит, естественно, медленнее, чем в начале реакции, поэтому для достижения равновесия приходится энергичнее и дольше встряхивать (примерно 1 мин.). Замедление реакции является также признаком приближающегося конца титрования.
Если из интенсивного позеленения следует, что раствор пе-ретитрован, то можно добавить небольшое количество титрованного раствора соли серебра и вновь титровать раствором дитизона до правильного перехода окраски. Добавленное количество миллилитров раствора серебра учитывают при расчете.
5 Чтобы приготовить точный титрованный раствор дитизона, не требующий коэффициентов пересчета, смешивают рассчитанные количества титрованного разбавленного раствора дитизона или исходного раствора дитизона с некоторым количеством чистого растворителя и еще раз устанавливают титр.
6 Титр 25 мкМ раствора дитизона, приготовленного на обработанном дитизоном четыреххлористом углероде, снижается в течение рабочего дня (8 час.) примерно на Уз %. Растворы дитизона в хлороформе более устойчивы.
2. Спектрофотометрический метод установки * титра раствора дитизона путем измерения максимального поглощения
После соответствующей очистки1 и разбавления2 аликвотной части исходного раствора измеряют модуль поглощения m для первого максимума3. Из молярного коэффициента поглощения е рассчитывают молярную концентрацию с разбавленного раствора дитизона
с = т]г л!моль.
Точность метода определяется точностью фотометрического измерения4.
Примечания
1 См. примечание 2 на стр. 97.
2 Раствор разбавляют так, чтобы при применении кюветы с толщиной слоя 1 или 0,5 см была достигнута чувствительная область спектрофотометра. При длине волны 620 мр 25 мкМ раствор дитизона в четыреххлористом углероде имеет модуль поглощения т ~ 0,82 см~1\ 25 мкМ раствор дитизона в хлороформе при 605 му. имеет модуль поглощения т ~ 1,0 слг1.
3 Ср. табл. 1, стр. 14. Измеряют 'по отношению к чистому растворителю.
4 Можно достигнуть воспроизводимости ±0,5%.
7*
100 Общие сведения о методах определения элементов с Dz
б. Вспомогательные реактивы
/. Кислоты и щелочи
Кислоты и щелочи расходуют в относительно больших количествах. Обычно концентрацию кислот выражают в единицах нормальности. Приводим таблицу, с помощью которой можно по плотности или соответствующему процентному содержанию кислоты и щелочи находить единицы нормальности (табл. 10).
Таблица 10
ПЛОТНОСТЬ, ВЕСОВЫЕ ПРОЦЕНТЫ II НОРМАЛЬНОСТЬ НЕКОТОРЫХ КИСЛОТ И ЩЕЛОЧЕЙ
Название Формула d (15°) Содержание вещества г/100 г раствора (приблизительно) Нормальность, н. (приблизительно)
Азотная кислота HNO3 1,40 67 15
Соляная кислота НС1 1,19 37 12
Серная кислота H2SO4 1,84 96 36
Хлорная кислота НС1О4 1,60 65 10
Аммиак NH3 0,90 26 14
Едкий натр NaOH 1,43 40 14
Так как при упаривании очищенных кислот происходят потери и увеличивается содержание тяжелых металлов, то кислоты приходится испытывать на содержание тяжелых металлов пробой с дитизоном, для чего их нейтрализуют обработанным дитизоном аммиаком; едкий натр нейтрализуют очищенной соляной кислотой.
Азотная кислота HNO3 (0,04—15 н.). Удовлетворительной очистки кислоты достигают ее перегонкой [403, 5413]. Окислы азота и хлориды должны отсутствовать. Не следует подвергать кислоту излишнему действию света.
Соляная кислота НС1 (0,2—12н.). В соляной кислоте обычно содержатся значительные количества
Оборудование
101
Zn2+, Hg2+ [5020, 5427], Pb2+, Cl2 и др. Хорошей очистки достигают с помощью фракционированной перегонки [5427]. Более эффективна очистка методом изотермической диффузии [5023, 5120]. Кислоту хорошего качества получают поглощением чистой водой промытого газообразного НС1 из баллона или полученного при взаимодействии хлористого аммония и серной кислоты [517].
Серная кислота H2SO4 (0,02 — 36 н.). Эта кислота загрязнена значительными количествами Pb2+, Zn2+, Cu2+, Hg2+ и др. Очистка кислоты перегонкой дает средний эффект [403, 5413]. После разбавления кислоты до 5 н. ртуть можно удалить экстрагированием раствором дитизона в четыреххлористом углероде [3819].
Хлорная кислота НС1О4 (10 н.). Содержит чаще всего РЬ2+ и Zn2+. Перегонка в вакууме приводит лишь к частичной очистке.
Бромистоводородная кислота НВг (—'7н., 41%-ная). Содержит Pb2+, Zn2+ и другие примеси.
Аммиак NH4OH — см. стр. 76.
Едкий натр NaOH (0,5 — 6н.). Обычно содержит значительные количества различных примесей.
2, Индикаторы для установки pH
При работе с дитизоном всегда очень важно строго контролировать pH среды. При ориентировочных испытаниях и отдельных определениях пользуются капельными пробами на индикаторной бумаге. При серийных анализах удобнее применять растворы индикаторов. Для этой цели пригодны индикаторы, растворимые в воде, но не растворимые в органическом веществе, являющемся растворителем для дитизона. В табл. 11 приведены некоторые наиболее широко употребляемые индикаторы, отвечающие предъявляемым требованиям.
3. Буферные и маскирующие растворы
Буферные растворы служат для поддержания определенного интервала pH при фракционном разложении дитизонатов, а также при вымывании избыточного
102 Общие сведения о методах определения элементов с Dz
свободного дитизона при колориметрических определениях одноцветных экстрактов.
Таблица 11
ИНДИКАТОРЫ, ПРИМЕНЯЕМЫЕ для УСТАНОВКИ pH
Наименование Интервал рн Переход окраски Приготовление индикатора а
навеска, мг объем 0,02 н. NaOH, мл
Метакрезоловый пур- 0,5—2,5 Красная — желтая 10 13,6
пурный
Тимоловый голубой 1,2—2,8 » 10 10,75
Бромфеноловый голу- 3,0-4,6 Желтая —голубая 10 7,45
бой
Конго красный 3,0—5,2 Синяя — красная 25 0,0
Метиловый оранже- 3,0—4,4 Красная — желтая 10 0,0
вый
Бромкрезоловый зе- 3,8—5,4 Желтая —голубая 10 7,15
леный
Метиловый красный 4,2—6,2 Красная — желтая 10 18,6
Бромкрезоловый пур- 5,2—6,8 Желтая—пурпур- 10 9,25
пурный ная
Бромфеноловый крас- 5,2—7,0 Желтая — красная 10 9,25
ный
Бромтимоловый голу- 6,0—7,6 Желтая —голубая 10 8,0
бой
Феноловый красный 6,8—8,4 Желтая— красная 10 14,2
Крезоловый красный 7,2—8,8 » 10 13,1
Метакрезоловый 7,4—9,0 Желтая — пурпур- 10 13,1
пурпурный ная
Тимоловый голубой 8,0—9,6 Желтая — голубая 10 10,75
а Тщательно растирают порошок индикатора с указанным количеством щелочи и водой, не содержащей СО2, доводят объем до 250 мл.з
Маскирующими веществами обычно являются соединения, анионы которых связывают некоторые катионы в комплексные соединения и таким образом предупреждают их осаждение или взаимодействие с дитизоном.
Оборудование
ЮЗ
Часто применяют комбинации буферных и маскирующих растворов. Следует помнить, что в этих растворах всегда присутствуют примеси Zn2+, Pb2+ и Си2+. Их отделяют обычно методом исчерпывающей экстракции раствором дитизона в четыреххлористом углероде при том же значении pH, при котором они должны быть использованы. Непрореагировавший дитизон извлекают чистым растворителем. При pH > 9 для отделения примесей следует предпочитать раствор дитизона в хлороформе.
Уксусная кислота СНзСООН (0,05 — 6н.). В этой кислоте обычно содержатся ионы Си2+ и РЬ2+. С помощью перегонки достигается лишь частичная очистка.
Уксуснокислый аммоний CH3COONH4 (10— 20%-ный раствор). Подвергают очистке дитизоном.
Уксуснокислый натрий CH3COONa • ЗН2О (10—20%-ный раствор). Подвергают очистке дитизоном.
Винная кислота С4Н60б (10—50%-ный раствор). Всегда содержит примеси Pb2+, Zn2+ и Си2+.
Натрий-калий виннокислый (сегнетова соль) NaKC4H4O6• 4Н2О (10—20%-ный раствор). Предупреждает осаждение многих солей; подвергают очистке дитизоном.
Лимонная кислота СбНзОу’НгО (10—50%-ный раствор). Всегда содержит ионы Pb2+, Zn2+ и Си2+.
Двузамещенный лимоннокислый аммоний (НН4)2НСбН5О7 (10—50%-ный раствор). Содержит в растворе ионы Al3+, Ga3+, Fe*3+, а также фосфаты щелочноземельных металлов; подвергается очистке дитизоном.
Трехзамещенный лимоннокислый аммоний (НН4)зСбН5О7 (10—50%-ный раствор). Подлежит очистке дитизоном [5413].
Трехзамещенный лимоннокислый натрий ЫазСбНбС^ • 5Н2О (10—50%-ный раствор). Подлежит очистке дитизоном [485].
Тиосульфат натрия Na2S2O3*5H2O (10—50%-ный раствор). Применяется при селективном определении Zn2+ дитизоном; подлежит очистке дитизоном.
Цианистый калий I\CN (0,5—50%-ный раствор). Имеет большое значение при определении малых количеств РЬ2+. При pH > 7 маскирует все металлы группы
104 Общие сведения о методах определения элементов с Dz
дитизона, кроме Pb2+, Bi3+, In3+, Sn2+ и Т1+. Очень важно, чтобы препарат совершенно не содержал ионов S2" [4919, 5316] и почти не содержал ионов РО4" [3714, 5316, 5535], так как эти ионы могут связывать Pb2+, Bi3+, In3+ и Т1+. Содержание РЬ2+ не должно превышать 1 • 10-6% [5413], однако обычно он присутствует в значительно больших количествах [3714, 3924, 404, 5316, 5512].
Если присутствует [Ее(СМ)б]3", то его следует восстановить (например, с помощью NH2OH) до [Fe(CN)6]4-. Путем перекристаллизации достигается лишь частичная очистка KCN [3714]. Удаление Pb2+, Bi3+ и частично Т1+ производят из 50%-ного раствора цианистого калия [5026, 5413].
Для этой цели раствор 50 г цианистого калия в 100 мл воды исчерпывающе экстрагируют небольшими порциями (1—2 мл) примерно 10 мкМ раствора дитизона в хлороформе до тех пор, пока последний органический экстракт не приобретет зеленоватой окраски. Перешедший в водную фазу HDz- -ион извлекают многократной экстракцией (порциями по 5—10 мл) чистым хлороформом. Освобожденный от ионов РЬ2+ и Bi3+ раствор разбавляют водой до нужной концентрации. Растворенный хлороформ выдувают током теплого фильтрованного воздуха.
Не рекомендуется удалять ионы РЬ2+ из разбавленных растворов цианистого калия обработкой растворами дитизона в хлороформе или даже в четыреххлористом углероде, так как после этого очень трудно удалять HDz “-ионы.
pH среды раствора цианистого калия определенной концентрации зависит от соотношения KCN : КОН : К2СО3 в данном препарате. Это обстоятельство следует учитывать при применении разбавленного раствора цианистого калия в качестве промывной жидкости для удаления избыточного дитизона.
Растворы цианистого калия очень быстро разлагаются, поэтому их следует готовить ежедневно или хотя бы раз в неделю.
Применяют также аммиачные растворы цианистого калия: к 2 г цианистого калия добавляют 15 мл 14 н. раствора аммиака и доводят раствор водой до 100 мл.
Основные методы определения металлов с Dz 105
В присутствии 50% лимоннокислого аммония этот раствор сохраняется более 6 мес. Растворы цианистого аммония особой чистоты можно приготовить пропусканием цианистого водорода (из цианистого калия и серной кислоты) в раствор аммиака.
Для регулирования pH применяются также следующие буферные смеси: Н3ВО3 — Na4B4O7 • ЮН2О; Н3РО4 — Na2HPO4 • 2Н2О; Na2CO3 — Na2HPO4 • 2Н2О; Na2CO3 — Na4B4O7 • ЮН2О; Na2CO3 — Na4P2O7 • ЮН2О [3515] и др. Все они подлежат предварительной очистке дитизоном.
В качестве маскирующих агентов, например при селективном разложении дитизонатов, применяют: NH4CNS (50%-ный раствор); KCNS (2%-ный раствор); NaCl (10%-ный раствор); КВг (20%-ный раствор); KJ (2%-ный раствор); Na2S’9Н2О (0,05%-ный раствор) и др.
4. Восстановители
Гидроксиламин солянокислый NH2OH • НС1 (5—20%-ный раствор). Соответствующие pH раствора устанавливают с помощью 14 н. раствора аммиака и очищают раствор дитизоном.
Рекомендуется также [5535] удаление следов тяжелых металлов экстракцией диэтилдитиокарбаматом при pH 8.
Гидразин N2H4 (Юн. водный раствор).
II. ОСНОВНЫЕ МЕТОДЫ ОПРЕДЕЛЕНИЯ МЕТАЛЛОВ С ПОМОЩЬЮ ДИТИЗОНА
ОБЩИЕ СВЕДЕНИЯ
Методы определения металлов основаны на использовании следующих свойств:
1) легкой экстрагируемое™ дитизонатов металлов, представляющих собой комплексные соединения (см. стр. 43); 2) отчетливом различии между спектрами поглощения этих дитизонатов и дитизона (табл. 5, стр. 40); 3) способности дитизона экстрагироваться водными растворами щелочей (стр. 13).
106 Общие сведения о методах определения элементов с Dz
Все эти наблюдения дали возможность разработать несколько основных методов определения ионов металлов дитизоном, а также ряда вариантов этих методов.
Характерным для всех методов определения является работа с гетерогенной системой и особенно с системой двух жидких фаз вода — четыреххлористый углерод или вода — хлороформ *.
Путем экстрагирования (стр. 43) почти всегда удается за одну операцию выделить из смеси и определить соответствующий катион. С помощью экстракционного концентрирования или исчерпывающей экстракции (стр. 61—62) значительно повышается и без того большая чувствительность реакций, благодаря чему эти приемы пригодны для определения очень малых количеств металлов— в пределах 0,1 —100 мкг.
КЛАССИФИКАЦИЯ И ВЫБОР ОСНОВНЫХ МЕТОДОВ АНАЛИЗА
Хотя и нет возможности четко разграничить отдельные методы, нам кажется целесообразной следующая классификация основных методов:
1. Объемные методы
а) Прямое экстракционное титрование.
* Определение можно проводить и в гомогенной системе, например в таких смешивающихся с водой растворителях, как этиловый спирт [391, 5624], ацетон [518, 5124, 5326], монометиловый эфир этиленгликоля [547] и др., однако чувствительность метода от этого сильно снижается.
При эмульсионной технике проведения анализа растворенный в аммиаке или ацетоне раствор дитизона или какой-либо эмульгатор (например, лаурилсульфонат натрия — ксилол) облегчают хорошее перемешивание реактива с испытуемым раствором. Такой метод дает возможность провести быстрое полуколичественное определение тяжелых металлов Cu2+, Zn2+ и РЬ2+, что полезно при поисковых работах [4815, 498, 5013, 51Ц 5326]. Суспензионная техника определения не нашла широкого распространения [355].
Поначалу малая растворимость дитизонатов в воде была использована для разработки весовых методов определения некоторых катионов [ЗЗ2, 349]. При добавлении растворов дитизона в аммиаке, метиловом или этиловом спиртах или ацетоне к водному раствору соли металла образуются мелкокристаллические объемистые осадки, легко захватывающие некоторое количество реактива, которые можно высушивать при температуре не выше 68° [5117].
Основные методы определения металлов с Dz 107
б) Косвенное экстракционное титрование.
С помощью объемных методов часто удается достигнуть такой же точности, особенно при определении больших количеств определяемого иона (> 100 мкг), какая достижима классическими методами титрования. Увеличенный расход времени не выходит за пределы допустимого. При прямом экстракционном титровании часто удается легко установить наличие побочных реакций, вернее наличие примесей.
2. Колориметрические методы
а) По одноцветному экстракту: визуальный колориметрический, спектрофотометрический.
При этом методе заметны изменения в окраске, обусловленные примесями. Путем подготовки соответствующих стандартов сравнения метод удобен как для отдельных, так и для серийных определений.
б) По экстракту смешанной окраски: визуальный колориметрический, спектрофотометрический.
При работе по методу смешанной окраски требуется подготовка стандартных (типовых) растворов и зачастую выдерживание постоянных условий, однако для серийных определений этот метод очень удобен и приводит к значительной экономии времени. Визуальная колориметрия экстрактов смешанной окраски дает возможность определять очень малые количества ионов металлов (например, < 1 мкг).
При выборе метода следует принимать во внимание не только чувствительность, надежность и удобство выполнения анализа, но и условия образования и свойства отделяемого дитизоната металла. Не всякий металл группы дитизона удобно определять из любого раствора каждым из перечисленных методов. В табл. 12 приведены условия и ошибки определения каждого из ионов указанными методами; этой таблицей можно пользоваться для выбора метода.
В дальнейшем мы рассмотрим более подробно основные методы определения и некоторые их варианты. Частные случаи определения каждого катиона описываются в гл. 3.
Таблица 12
ТОЧНОСТЬ ОПРЕДЕЛЕНИЯ МАЛЫХ КОЛИЧЕСТВ МЕТАЛЛОВ ГРУППЫ ДИТИЗОНА С ПОМОЩЬЮ ОСНОВНЫХ МЕТОДОВ а
co X О s H co > раствора, Ошибка определения, ± %
экстракционное титрование одноцветная колориметрия колориметрия по смешанной окраске
Катион cd о X 1 о « 1 о R
s И ) Н со О к Н сП О чз
CO о CQ О ’Т' cd X л *Q* cj СО • X •©*
я Сц 2 QJ cd о Ни Я <и ►3 cd Е- X со н S
Ф О A \O 2 к СП о гЪ СП X Оч CD Н гЪ СП а а, ф Н Л1
о о Um С о СП к 2: о S X СП о S
Ag+ 0,5 6 — - 5 - -
5 15 —— —— 2 -1
25 10 —— 4 3 - 2
50 50 0,5 —
100 100 0,2 — — —
Hg2 + 5 5 —- — — 3 —
15 25 — ' — — 2
50 50 — 0,5 ' - 3 1 ”
200 20 1 — — — —-
Pd2+ 25 20 " 2 — — 3
pt2+ 25 25 10 - 1 ——
Au3+ 35 50 3 — — ' —
70 50 - — 11 5 ——
Cu2+ 5 15 —— —• — 2 —
10 15 3 3
200 25 2 " — — ——• — ' —- —
Bi3+ 20 15 — - " 3 3
35 15 2 ——— —
In3 + 10 15 — 1 2
40 25 4 —- — —' ~~ — - — —
Zn2+ 5 10 - ' —— — 2 2
10 20 3 — 3 2 —
100 25 1 — — —-•
Cd2+ 15 20 - — 2 3 2 —— ———
Co2+ 20 40 10 ' — 1 ' —
Ni2 + 15 15 5 - — 3 ——— 5
Основные методы определения металлов с Dz
109
Продолжение табл. 12
Катион Содержание катиона, мкг Объем водного раствора, М.1 Ошибка определения, ± %
экстракционное титрование одноцветная колориметрия колориметрия по смешанной окраске
прямое косвенное визуальная спектрофотометрическая визуальная спектрофотометрическая
РЬ2 + 15 15 2 2
50 30 - 2 3 2 - —
100 25 1 —— - - — —
Т1+ 50 40 11 10 3 - ' * 1 —
а Все приведенные методы подробно описаны в гл. 3. Приведенные ошибки являются максимальными отклонениями отдельных величин. Средняя ошибка по нескольким определениям, как правило, равна V2 —*/з максимальной ошибки отдельного определения, так что чаще всего точность определения меньше ±1%.
1. ОБЪЕМНЫЕ МЕТОДЫ
Для применения прямого экстракционного титрования должны существовать следующие предпосылки:
I. Равновесная реакция взаимодействия катиона с дитизоном должна быть сильно сдвинута в сторону образования дитизоната, т. е. коэффициент экстракции
[M(HDz)Jopr.
[М^]ВОдн.
должен быть равен довольно большой величине.
II. При приближении к стехиометрической точке эквивалентности должен наблюдаться довольно четкий переход окраски.
III. При стехиометрических соотношениях компонентов реакция между ними должна протекать быстро и количественно даже в условиях, когда концентрация одного
110 Общие сведения о Методах определения элементов с
из компонентов более чем в 100 раз меньше начальной концентрации отдельных компонентов.
Условия I и II при соответствующих pH водных растворов осуществимы практически для всех реакций дитизона. Условие III лучше всего выполняется при реак-.ции серебра с дитизоном; вот почему эту реакцию используют для точной установки титра растворов дитизона (см. стр. 96).
В основном все катионы группы дитизона можно титровать с допустимой воспроизводимостью при соответствующей им концентрации.
а. Прямое экстракционное титрование
Водный раствор1, содержащий катион, встряхивают2 со все уменьшающимися количествами3 раствора дитизона 4. Дитизон является одновременно и титрующим раствором и индикатором.
Примечания (см. также стр. 97).
1 В находящемся в делительной воронке водном растворе устанавливают соответствующий pH. Величина pH зависит от определяемого катиона, присутствующих примесей и применяемого органического растворителя.
2 При анализе совершенно неизвестного раствора зачастую приходится затрачивать много времени, чтобы оттитровать раствор сразу точно до точки эквивалентности. Рекомендуется сначала провести грубое, ориентировочное титрование или в случае перетитро-вания раствора оттитровывать избыточный дитизон титрованным раствором соли металла. Часто путем подкисления объединенного органического экстракта можно вновь перевести металл в ионное состояние и повторить титрование.
На точное титрование расходуется 5 мин. Достигаемая воспроизводимость и точность различны для каждого катиона. Независимо от количества определяемого иона воспроизводимость и точность определения зависят от четкости и быстроты установления точки эквивалентности.
3 Объем первой добавляемой порции раствора дитизона зависит от общего предполагаемого расхода раствора дитизона. Под конец добавляют избыток в 0,05 мл раствора дитизона. Следует учитывать возможность образования одно- и двузамещенных дитизонатов. Если желательно образование только одиозамещенного дитизоната, pH раствора не должен быть очень высоким; следует сразу добавлять значительное количество дитизона (см. рис. 15,
Основные методы определения металлов с Dz
111
стр. 147). После каждой добавленной порции дитизона раствор встряхивают до достижения равновесия, после чего отделяют органическую фазу. Добавление раствора дитизона и отделение органической фазы повторяют до тех пор, пока последняя порция раствора дитизона не приобретет смешанной окраски, обусловленной присутствием дитизоната и избытка дитизона. Погрешность, обусловленная избыточным количеством дитизона, играющего роль индикатора, в экстракционном титровании очень мала.
4 Предварительно устанавливают титр раствора дитизона в органическом растворителе по известному типовому раствору, который должен по своему составу, концентрации катиона, pH и концентрации примесей по возможности мало отличаться от испытуемого раствора.
Вариант. Обменное титрование. Часто различие в сродстве отдельных катионов к дитизону так велико, что можно для прямого экстракционного титрования пользоваться титрованным раствором дитизоната металла. Такое обменное или вытеснительное титрование основано на вытеснении из дитизоната одного катиона другим (стр. 62). В отдельных случаях при таком титровании наблюдаются более четкие переходы окраски (стр. 154).
б. Косвенное экстракционное титрование
При реакциях дитизона с некоторыми катионами, например Hg2+ и Pd2+, недостаточно выполняется условие III (стр. 109), т. е. при большом стехиометрическом разбавлении эти ионы реагируют с дитизоном значительно медленнее, вследствие чего под конец титрования переход окраски затягивается. В присутствии избытка дитизона реакция протекает быстро и количественно. Так как эти ионы очень прочно связываются с дитизоном, то однажды образовавшийся дитизонат уже заметно не изменяется в присутствии небольших количеств Ag+. Исходя из этого был разработан следующий метод титрования.
Катион исчерпывающе экстрагируют отдельными порциями раствора дитизона, добавляя небольшой избыток, по сравнению с требующимся для достижения точки эквивалентности, чтобы последний отделяемый органический экстракт был окрашен в зеленый цвет,
112 Общие сведения о методах, определения элементов с Dz
К объединенному органическому экстракту добавляют раствор соли серебра в количестве, превышающем количество избыточного дитизона ]. После отделения органической фазы 2 оставшийся в водном растворе избыток А§*+-ионов непосредственно оттитровывают раствором дитизона.
Содержание металла X (мкг) рассчитывают по формуле
Х= [(а + с) Са — ЬСЬ] d,
где а + с — количество израсходованного раствора дитизона, мл\ b — количество добавленного водного раствора соли серебра, мл*, Са—концентрация раствора дитизона, мкМ\ Сь — концентрация раствора соли серебра, мкМ\ d—10-3 г-экв определяемого металла.
Примечания
1 Избыток добавляемых Ag+-nonoB обязателен, но он не должен быть очень значительным. В этом случае ионы Ag+ почти не вытесняют других металлов из их дитизонатов. Нужное количество раствора приближенно устанавливают по ориентировочному экстракционному титрованию.
2 В органической фазе определяемый катион находится в виде дитизоната, а избыточный дитизон — в виде AgHDz.
Вариант 1. Определение неблагородных металлов группы дитизона. Если из экстракта смешанной окраски можно удалить избыточный дитизон и константа образования дитизонатов этих металлов значительно меньше константы образования AgHDz, то все определение можно свести к титрованию раствором соли серебра. Таким методом можно титровать дитизо-наты всех неблагородных металлов.
Полученные после исчерпывающей экстракции экстракты смешанной окраски объединяют и отмывают щелочным водным раствором от избыточного дитизона L Чистый раствор дитизоната определяемого металла обрабатывают 0,1 — 1 н. кислотой2 и добавляют определенное избыточное количество титрованного раствора соли серебра. В органической фазе образуется AgHDz, который отделяют, а присутствующие в водном растворе Ag+-iioHbi оттитровывают титрованным раствором дитизона3.
Основные методы определения металлов с Dz
113
Содержание металла X (мкг) рассчитывают по следующей формуле:
X=(bCb-aCa)d,
где а — количество израсходованного раствора дитизона, мл; b — количество добавленного раствора соли серебра, мл; Са—концентрация раствора дитизона, мкМ; Сь — концентрация раствора соли серебра, мкМ; d—\$~3г1экв. определяемого металла.
Примечания
1 Хорошо воспроизводимые результаты получаются только при тщательной промывке (см. стр. 118).
2 Путем подкисления создают pH, нужный для титрования А^+-ионов. Одновременно дитизонат делается малоустойчивым и разлагается на ион металла и свободный дитизон.
3 Присутствие умеренных количеств неразлагающихся или не способных к реакции обмена дитизонатов не мешает определению.
Вариант 2. Броматометрическое титрован и е. Существуют броматометрические методы определения дитизонатов металлов [373, 384].
2. КОЛОРИМЕТРИЧЕСКИЕ МЕТОДЫ
В колориметрических методах концентрацию иона в растворе определяют по интенсивности окраски, развивающейся в результате цветной реакции, причем принципиально безразлично, определяют ли интенсивность окраски простым сравнением окрасок или проводят измерения в определенном интервале длин волн *.
Для дитизона и всех дитизонатов закон Беера полностью справедлив во всех областях концентрации, с которыми приходится встречаться в анализе.
Отчетливые спектры поглощения дитизона и почти всех дитизонатов наблюдаются в видимой области спек
* Основы колориметрии изложены во многих учебниках. Особенно можно рекомендовать книгу Kortiim G., Kolorimetrie, Pho-tometrie tind Spektrophotometric, Springer Verlag, Berlin, 1955.
[См. также Бабко А. К. и Пилипенко A. T., Колориметрический анализ, M.—Л., Гос. Науч. Техн. изд. хим. литер., 1951; Бабко А. К., Спектрофотометрический анализ, Хим. наука и про-мыш., том 4, № 2, 164—171 (1959).—Прим, ред.]
8 Зак. 215‘
114 Общие сведения о методах определения элементов с Dz
тра (см. табл. 1, стр. 14 и табл. 5, стр. 40); таким образом, колориметрическое определение содержания дитизонатов возможно без применения оптических приборов, т. е. оно осуществимо визуально. Однако лучше всего пользоваться спектрофотометром. Все данные и методики, приведенные в этой книге, относятся в основном к колориметрическим определениям либо чисто визуальным, либо спектрофотометрическим.
Если в экстракте присутствует только чистый дити-зонат какого-либо металла, то окраска экстракта обусловлена только окраской этого дитизоната. В этих случаях говорят об одноцветной окраске, такие экстракты принято называть одноцветными.
При наличии в экстракте наряду с дитизонатом свободного дитизона окраска экстракта зависит от соотношения обоих окрашенных компонентов в смеси, и тогда говорят о смешанной окраске или об экстракте смешанной окраски.
В визуальной колориметрии глубина окраски одноцветного экстракта зависит только от концентрации дитизоната металла. Метод смешанной окраски выгодно отличается тем, что максимумы поглощения многих дитизонатов расположены вблизи минимума поглощения свободного дитизона. Так, при соответствующем соотношении окрашенных компонентов в смеси вследствие «полного поглощения» возникает серый тон, появление которого очень четко различимо. Чувствительность визуальной колориметрии, выраженная в виде коэффициента изменения окраски (изменение соотношения ди-тизонат металла — избыточный дитизон) для области «чувствительной смешанной окраски», различна для различных металлов.
В спектрофотометрическом методе фотометрическая чувствительность одноцветного экстракта, выраженная с помощью модуля поглощения m (см~х) раствора, содержащего 1 мкг металла в 1 мл, зависит только от молекулярного коэффициента поглощения дитизоната металла при благоприятной длине волны % (лф.). Фотометрическая чувствительность экстракта смешанной окраски при данной длине волны X (лщ) зависит как от модуля поглощения дитизоната металла так
Основные методы определения металлов с Dz
115
и от модуля поглощения свободного избыточного дитизона (слг1). При благоприятной длине волны % (л!ц) абсолютная величина разности Am = т\—mQ должна быть максимальной.
В табл. 13 приведены длины волн и соответствующие нм модули поглощения mi для одноцветного экстракта и дополнительно т0 или Ат для экстракта смешанной окраски. Эти данные весьма полезны; часто употребляемые величины напечатаны в таблице курсивом; остальные данные полезны для контрольных измерений.
О воспроизводимости величин m можно сказать то же, что и о величинах коэффициента поглощения е (табл. 5, стр. 40). Для особенно точных анализов рекомендуется вновь определять эту величину на собственном спектрофотометре, применяя ту методику, которой пользуются в анализе, как это обычно принято в аппаратах со светофильтрами. Определяют также изменение поглощения для смешанных растворителей (рис. 4, стр. 19).
а. Метод одноцветной колориметрии
Так как большинство дитизонатов металлов устойчивы в щелочах, промывая органическую фазу щелочным водным раствором, можно отделить свободный дитизон, заметно не разрушая дитизонат металла.
Получение одноцветного экстракта
В делительной воронке исчерпывающе экстрагируют катион отдельными порциями 1 раствора дитизона в органическом растворителе2 до тех пор, пока последний экстракт останется неизменным3. Объединенные органические экстракты разбавляют определенным образом растворителем и путем промывки4 щелочным водным раствором5 освобождают6 их от свободного дитизона*.
* Для получения одноцветного экстракта пользуются также тем, что разбавленная азотистая кислота разрушает в результате окисления преимущественно свободный дитизон [5326].
При применении титрованного раствора дитизона свободный дитизон, отмытый из экстракта смешанной окраски щелочной промывкой, можно количественно определять несколькими способами в водном растворе, окрашенном в желтый цвет, что, несомненно, представляет интерес для изучения реакции.
8*
Таблица 13
МОДУЛИ ПОГЛОЩЕНИЯ, ПРИМЕНЯЕМЫЕ ПРИ СПЕКТРОФОТОМЕТРИЧЕСКИХ ОПРЕДЕЛЕНИЯХ (ДЛЯ 1 мкг МЕТАЛЛА В 1 мл ОРГАНИЧЕСКОГО РАСТВОРИТЕЛЯ)
Соединение h2d, mkM Четыреххлористый углерод Хлороформ
x, M[J. CM~ 1 m0, CM~ 1 Д/72, CM~ 1 X, см~х mQ, cm~x Д/л, CM~ 1
AgHDz2 9,27 462 0,282 0,169 0,113 465 0,297 0,124 0,173
9,27 620 0,001 0,304 —0,303 605 0,001 0,371 —0,370
Hg(HDz)2 9,97 485 0,355 0,124 0,231 - 1 " —• ——
9,97 620 0,000 0,328 0,328 — —— -——
HgDz 4,985 515 0,118 0,024 0,094 — - 1 1 —
4,985 620 0,005 0,164 —0,159 —— — ——•
Pd(HDz)2 18,74 640 0,270 0,525 —0,255 —— " 1 - •
18,74 280 0,360 0,169 0,191 —— -—-- —
18,74 620 0,240 0,615 —0,375 - 1 " ' -•
Pt(HDz)2 10,24 710 0,152 0,008 0,144 —— — ' —
10,24 620 0,055 0,336 —0,281 ’ " 1 —
10,24 490 0,162 0,115 0,045 — — — - —
Au(HDz)3 15,23 ' " —— —" 450 0,12 0,238 —0,12
—- —— - — 275 0,18 0,171 0,01
Cu(HDz)2 31,48 510 0,567 0,149 0,418 - 1 — ' — —
31,48 550 0,712 0,327 0,385 — —-
31,48 620 0,214 1,032 —0,818 11 — ** ——
31,48 800 0,063 0,000 0,063 — -
CuDz 15,74 450 0,315 0,316 —0,001 - —
15,74 620 0,088 0,516 —0,428 — - - ’
15,74 800 0,088 0,000 —0,088 — —
Bi(HDz)3 14,35 490 0,382 0,161 0,221 — — -
14,35 620 0,002 0,471 —0,469 — - — ———
In(HDz)3 26,14 510 0,78 0,185 0,60 — ——
26,14 620 0,05 0,857 —0,80 — — -—— ——
Zn(HDz)2 30,59 538 1,407 0,233 1,174 530 1,364 0,306 1,058'
30,59 620 0,000 1,003 —1,003 605 0,037 1,223 —1,186
Cd(HDz)2 17,79 520 0,783 0,089 0,694 520 0,754 0,139 0,615
17,79 620 0,000 0,584 —0,584 605 0,003 0,712 —0,709
Co(HDz)2 33,93 542 1,011 0,285 0,726 —'1 - — — —
33,93 620 0,149 1,113 —0,964 —— - -——
Pb(HDz)2 9,65 520 0,332 0,048 0,284 518 0,307 0,070 0,237
9,65 620 0,004 0,317 —0,313 605 0,007 0,386 —0,379
Ni(HDz)2 34,08 665 0,327 0,457 —0,130 670 0,348 0,109 0,239
34,08 480 0,518 0,484 0,034 480 0,470 0,341 0,129
34,08 282 0,586 0,311 0,275 280 0,570 0,354 0,216
34,08 620 0,286 1,120 —0,834 605 0,134 1,363 —1,229
TIHDz 4,89 505 0,155 0,029 0,126
— — ——- — 605 0,004 0,160 -0,156-
118 Общие сведения о методах определения элементов с bz
Примечания
1 Обходятся немногими порциями среднего размера. Следует избегать большого избытка дитизона. При серийных анализах экстрагирование проводят одной достаточно большой порцией дитизона.
2 Раствор дитизона должен быть по возможности чистым; состав его может быть только приблизительно известен.
3 Окраска последней порции экстракта зависит от pH обрабатываемого раствора. Экстрагирование Т1+, Cd2+ и РЬ2+ можно проводить при столь высоком pH, что практически весь свободный дитизон переходит в водную фазу [4712]. В этом случае последний органический экстракт бесцветен и поэтому объединенный органический экстракт получается одноцветным.
4 При промывке объединенный экстракт энергично встряхивают с небольшими порциями щелочного водного раствора. Так как при этом всегда приходится удалять верхнюю фазу, целесообразно промывку вести в делительной воронке и делительной пробирке или в двух делительных воронках.
5 Для промывки применяют водные растворы аммиака или цианистого калия, буферные растворы с определенным pH и др. При применении более сильных щелочей нужно следить за тем, чтобы не произошло разложения дитизона, в противном случае в органический экстракт могут попасть посторонние окрашенные компоненты.
6 Экстракт смешанной окраски считается отмытым от свободного дитизона, когда промывная вода остается бесцветной, т. е. не содержит больше желтого HDz--nona.
7 . Визуальная колориметрия одноцветного экстракта
Прямой метод. В пробирках для колориметрирования сравнивают интенсивность окраски определенного объема чистого одноцветного экстракта с окраской шкалы сравнения из типовых растворов, приготовленных так же, как испытуемый раствор.
Шкала сравнения состоит из ряда проб типового раствора с постепенно увеличивающимся содержанием металла, обработанных в тех же условиях, что и испытуемый раствор. В основном должны быть выдержаны условия, аналогичные условиям испытуемого раствора: содержание электролитов, pH, продолжительность встряхивания и т. д. Последовательное изменение содержания искомого иона в шкале должно возможно лучше соответствовать предполагаемому интервалу концентраций испытуемого раствора. Шкалу сравнения
Основные методы определения металлов с Dz
119
можно хранить только в течение ограниченного времени. Метод довольно длительный, однако с его помощью можно установить ошибки, обусловленные извлечением в экстракт посторонних ионов, изменяющих оттенок окраски.
Если шкалу сравнения готовят разбавлением более концентрированного типового раствора, получается более плохая компенсация ошибок, а значит, и плохая воспроизводимость. То же относится к погружной колориметрии.
Для ускорения анализов в некоторых случаях рекомендуют применять искусственную шкалу сравнения, например из цветных стекол [3621] или окрашенных растворов (раствор метилового оранжевого [3911] и азотнокислого кобальта (II) [471] при определениях Pb(HDz)2 ОрГ.» раствор амаранта 107 при определении Zn(HDz)2opr [373]).
Вариант. Колориметрия по измененной одноцветной окраске. Присутствующий в одноцветном экстракте дитизонат металла разлагают встряхиванием с кислотой [361] или с другими реагентами (сероводород, йодистый калий [353]). При этом выделяется дитизон в количестве, эквивалентном содержанию иона металла, и органическая фаза окрашивается в зеленый цвет. Интенсивность окраски раствора определяют по шкале сравнения.
Иногда такие зеленые растворы более устойчивы, а их яркая зеленая окраска легче улавливается при визуальном определении.
2. Спектрофотометрия по одноцветной окраске
Прямой метод. Измеряют поглощение в опре.-деленном объеме одноцветного экстракта 1 при соответствующей оптимальной длине волны2 по сравнению с поглощением чистого растворителя или контрольной пробы3. Содержание металла рассчитывают из установленного модуля поглощения или определяют его по калибровочной кривой, построенной по данным,
полученным в аналогичных условиях4.
120 Общие сведения о методах определения элементов с Dz
Примечания
1 Путем дополнительных измерений поглощения при различных критических длинах волн можно установить присутствие примесей. Так, при 620 мр (для СС14) и при 605 (для СНС13) можно обнаружить полосы поглощения свободного дитизона и учесть его при расчете результатов анализа.
2 Если обнаружено несколько максимумов поглощения, то, пренебрегая максимальной величиной, выбирают такой максимум, при котором наблюдается минимальное поглощение для свободного дитизона. Таким путем уменьшается ошибка, обусловленная свободным дитизоном, остающимся в экстракте в результате неполного удаления избыточного дитизона. Оптимальные длины волн можно выбрать по табл. 13, стр. 116.
3 Перед измерением нужно убедиться в том, что растворы в кюветах прозрачны. Растворы, помутневшие вследствие присутствия капелек воды, становятся прозрачными после 10—15 мин. стояния в прикрытой кювете.
От присутствия воды можно освобождаться также фильтрованием через воронку с бумажным фильтром или через бумажный или ватный ролик, помещенный в устье воронки. В последнем случае раствор испаряется значительно меньше. Ни бумага, ни вата не должны быть кислыми (разложение) или содержать реакционноспособные ионы (обменная реакция с дитизонатом и разложение), что, однако, редко выполнимо. Промывка фильтра кислотами с последующим высушиванием при 100° редко дает положительные результаты.
4 В качестве приближенной величины модуля поглощения можно пользоваться данными для величины т\ из табл. 13. При работе с монохроматическим светом кривая поглощения представляет собой прямую линию. На оси абсцисс откладывают содержание металла (мкг/мл органического раствора), а на оси ординат—модуль поглощения (слН). Масштаб делений по осям выбран так, чтобы градуировочная кривая имела наклон 45°.
Вариант. Фотометрия по измененной одноцветной окраске. Разлагают дитизонат металла, присутствующий в одноцветном экстракте так, как это описано на стр. 119.
Зеленый раствор фотометрируют при 620 жц (СС14) или при 605 жц (СНС1з) по отношению к чистому растворителю или к контрольной пробе. Иногда при этом усиливается поглощение. Оставшийся в одноцветном экстракте свободный дитизон при таком способе работы влияет на результаты анализа.
Можно присутствующий в одноцветном экстракте дитизонат данного металла перевести с помощью более чувствительного к реакции с дитизоном катиона в дити-
Основные методы определения металлов с Dz
121
зонат другого металла и таким образом повысить фотометрическую чувствительность. Однако каждая новая реакция обмена является возможным источником ошибок.
б. Методы смешанной окраски
Приготовление экстракта смешанной окраски
Экстракты смешанной окраски можно приготовить из всех металлов группы дитизона, за исключением Т1+, при условии, что в водном испытуемом растворе будет pH < 11,5 для ССк или pH < 13 для CHCI3 (ср. рис. 5, стр. 22).
Их готовят незадолго до непосредственного определения содержания металла.
7. Визуальная колориметрия экстракта смешанной окраски
Визуальная колориметрия экстракта смешанной окраски пригодна для определения даже очень малых количеств металла.
К водному раствору в смесительном цилиндре 1 прибавляют при встряхивании постепенно такое количество раствора реактива, пока не будет достигнута соответствующая смешанная окраска2. Отмечают количество израсходованного реактива3. Сравнивают полученную смешанную окраску с аналогичным образом приготовленной шкалой сравнения 4 или проводят сравнительное титрование 5.
Примечания
1 При работе с малыми количествами вещества можно вместо смесительных цилиндров пользоваться пробирками для колориметрирования. Применяется также исчерпывающее экстрагирование в делительной воронке с собиранием экстракта в пробирку для колориметрирования.
2 Оптимальный оттенок окраски в зависимости от свойств данного дитизоната соответствует 20—80%-ному избытку дитизона. Наиболее точно удается определить переходы оттенков серого цвета.
3 Раствор реактива примерно известной концентрации может быть не очень чистым.
122 Общие сведения о методах определения элементов с Dz
4 Приготовлению шкалы сравнения предшествует ориентировочное определение содержания металла в испытуемом растворе путем проведения частичной экстракции. В ряд одинаковых по размеру смесительных цилиндров помещают такое количество раствора реактива, какое израсходовано в опытном определении, добавляют водный раствор с последовательно изменяющимся содержанием металла и встряхивают до установления равновесия. Далее поступают так, как описано на стр. 118. Для этой цели было предложено [3622] также применение искусственной шкалы сравнения (растворы Ni2+, Со2+, Си2+).
5 Под сравнительным титрованием (известным также под названиями «титрование до чувствительной смешанной окраски» [383] или «метод серой окраски» [517]) подразумевают колориметрическое титрование с обратным порядком добавления реактивов.
В смесительный цилиндр помещают нужное для достижения смешанной окраски количество раствора дитизона в органическом растворителе и титруют типовым раствором соли металла при периодическом встряхивании до тех пор, пока окраска органической фазы не сравняется с окраской, достигнутой при пробном титровании. Отмечают количество израсходованного типового раствора, по которому рассчитывают содержание металла. Величины pH испытуемого и типового раствора должны быть по возможности близки одна к другой. Почти трехкратная разница в концентрации электролитов не оказывает влияния на точность титрования.
Сравнительное титрование более удобно, чем применение шкалы сравнения. Учитывая обратимость реакций, этот метод почти всегда применим. Для нестрого обратимых реакций, например при определениях 1п3+, Со2+ и Ni2+, наблюдаются значительные отклонения. При мало отчетливых переходах окрасок рекомендуется пользоваться шкалой сравнения.
2. Спектрофотометрия экстракта сметанной окраски
Фотометрирование экстракта смешанной окраски особенно удобно для серийных анализов.
В делительной воронке1 экстрагируют испытуемый раствор избыточным количеством раствора дитизона2. Измеренный объем3 смешанного экстракта фотометри-руют (см. ниже).
Примечания
1 Из делительной воронки очень удобно спускать в кювету нужное количество экстракта смешанной окраски. Далее поступают так, как описано на стр. 120, примечание 3.
С помощью фракционной экстракции, проводимой в делительной воронке, ориентировочно определяют содержание металла. В серийных анализах пробы содержат приблизительно одинаковое количество металла, поэтому можно сразу добавить все требуемое количество раствора реактива.
Основные методы определения металлов с Dz 123
2 Избыток реактива, отнесенный к :го доле в смешанном экстракте, должен составлять 5—100%. Если экстрагируют щелочные растворы, то в соответствии с коэффициентом распределения дитизона между двумя фазами прибавляют большее количество раствора реактива.
3 Измерение объема требуется для расчета содержания металла по величине концентрации, установленной фотометрически. Общий объем органической фазы лучше определять по объемам отдельных порций раствора реактива, добавляемых из бюретки, плюс количество добавленного органического растворителя (для промывки и разбавления раствора) без учета потерь на испарение и потери жидкости. ЛАенее точные результаты дает измерение объема спущенной органической фазы.
Фотометрирование экстракта смешанной окраски
При длине волны, соответствующей максимальному поглощению дитизоната металла (~500 Лф), поглощение свободного дитизона минимально, а при длине волны, соответствующей максимальному поглощению свободного дитизона (~600 Лф), поглощение дитизоната металла обычно составляет незначительную величину (ср. кривые поглощения в гл. 3, а также величины в табл. 13, стр. 116). Пользуясь этим обстоятельством, можно, зная величину поглощения чистых растворов, относительно точно спектрофотометрически определить содержание в смеси того или другого окрашенного компонента.
Фотометрическое определение концентрации дитизоната металла в экстракте смешанной окраски возможно тремя следующими методами: 1) измерение смешанного экстракта по отношению к раствору реагента; 2) измерение смешанного экстракта по отношению к раствору, в котором произведено разложение дитизоната металла; 3) измерение смешанного экстракта при двух длинах волн по отношению к чистому растворителю *.
* В литературе часто описывается метод, заключающийся в фо-тометрировании смешанного экстракта при одной длине волны по отношению к чистому растворителю. В этом случае для каждой серии анализов приходится строить специальную калибровочную кривую. Кроме того, вследствие большого влияния pH и содержания электролитов на распределение дитизона (см. стр. 22) приходится очень строго соблюдать условия определения.
124 Общие сведения о методах определения элементов с Dz
Наиболее удобными оказались методы 1 и 2, в которых проводят измерения только при одной длине волны.
1. Фотометрирование смешанного экстракта по отношению к раствору реагента
При применении метода исходят из допущения, что в смешанном экстракте находится весь добавленный дитизон (в виде дитизоната металла и свободного дитизона), что соответствует действительности при экстрагировании при pH < 7 (для СС14) или pH < 8,5 (для СНС13).
Теоретическое обоснование метода
Исходную концентрацию са применяемого раствора реагента можно распределить на часть с, расходуемую на связывание катиона в соответствующий дитизонат, и на часть с0, соответствующую количеству свободного дитизона, оставшегося после образования дитизоната:
са = с4~с0. (20)
Если эти концентрации выразить в фотометрических величинах в виде соответствующих модулей поглощения при длине волны X, получается
£ОХ^а = £оХ^ Ч- £0Х^0 = ^аХ? (21)
где е0> —коэффициент поглощения раствора дитизона.
В процессе превращения фотометрически исчезает часть дитизона, вместо него возникает модуль поглощения г^с дитизоната металла
<ьс + <^со = тл, (22)
где — коэффициент поглощения раствора дитизоната металла.
В качестве разности А//?х измеряемых модулей поглощения для —добавленного раствора реагента и тех ~~ образовавшегося смешанного экстракта получают
Д//гх - /яаХ — /гаеХ = с (soX — ех). (23)
Основные методы определения металлов с Dz 125
Искомую концентрацию с дитизоната металла рассчитывают по формуле *
с = Д/7/х • 1 . (24)
£0Х — £Х
Величина концентрации дитизоната металла зависит только от величины разности модулей поглощения Д/тгх; она не зависит от исходной концентрации раствора реактива и от его избытка в смешанном экстракте. Концентрация дитизоната не зависит также от содержания окрашенных примесей в растворе реактива при условии, что они не реагируют с дитизоном, иными словами, изменение поглощения должно быть вызвано исключительно взаимодействием иона металла с дитизоном **.
Выполнение. Для фотометрического определения А/7?х измеряют т7?аХ прибавленного раствора дитизона и mеХ смешанного экстракта по отношению к чистому растворителю и вычитают эти величины одну из другой либо один раствор помещают во вторую кювету в качестве раствора сравнения и при измерении непосредственно получают величину Дтх [442] ***. В качестве величин Д//?х могут служить значения Дтх, приведенные в табл. 13, стр. 116.
При использовании табличных данных при построении градуировочных кривых на оси абсцисс откладывают содержание металла в микрограммах иона металла в 1 мл органического растворителя, а на оси ординат — абсолютные значения модуля поглощения (ДтА).
* При применении монохроматора и длинах волн, соответствующих максимальному поглощению дитизона, коэффициенты поглощения ех дитизонатов многих металлов так малы, что ими можно пренебречь, и формула (24) принимает следующий упрощенный вид:
С =- ^т-к . (25)
£о).
** Для достижения максимально возможной точности данного метода требуется, чтобы было минимальным избыточное количество дитизона и всех окрашенных примесей, поглощающих при той же длине волны, при которой проводят измерение.
*** Надо обращать внимание на то, чтобы оба раствора имели одинаковое разбавление.
126 Общие сведения о методах определения элементов с Dz
На рис. 12 приведена калибровочная кривая для смешанного экстракта Hg(HDz)2 + H2Dz в четыреххлористом углероде при 620 Л1ц и другая контрольная кривая при 485 жц.
Концентрация мкг Ндг+/'мл СС14
Рис. 12. Калибровочные кривые для смешанного экстракта Hg(HDz)2 и H2Dz в четыреххлористом углероде.
2. Фотометрирование смешанного экстракта по отношению к раствору, в котором произведено разложение дитизоната металла
В этом методе исходят из допущения, что дитизонат металла, содержащийся в смешанном экстракте, может быть разложен, причем выделяется количество дитизона, эквивалентное содержанию металла. Теоретпче ское обоснование этого метода аналогично описанному для предыдущего метода.
Основные методы определения металлов с Dz 127
Выполнение. Измеряют модуль поглощения смешанного экстракта тс\. Разлагают дитизонат металла во всем растворе или в аликвотной части. При этом выделяется эквивалентное количество свободного дитизона. Измеряют новый модуль поглощения тах. Концентрацию дитизоната металла с рассчитывают по формуле
Д/?гх = т'Л — тсХ = с (еоХ — гх),
с = Дтх
1
£ох-£х
(23а)
(24а)
(ср. с уравнениями 23 и 24).
По этому «обратимому» методу, предложенному Ирвингом и сотр. [483, 495, 497, 5321], можно определить концентрацию дитизоната металла в щелочных смешанных экстрактах, не зная количества и исходной концентрации раствора дитизона, а также распределения дитизона между двумя фазами. Изменение поглощения при длине волны %, или абсолютная «обратимая величина» (Д/гг'). для дитизоната металла, численно равно величине Д/пх из первого метода. Поэтому и в данном случае можно пользоваться величинами, приведенными в табл. 13, стр. 116. Описанный метод до определенной степени не зависит от окрашенных примесей, если только они остаются неизменными в смешанном экстракте и в растворе после разложения дитизонатов. Чаще всего это достигается путем избирательного разложения (с помощью буферных растворов и маскирующих веществ).
3. Фотометрирование смешанного экстракта при двух длинах волн
по отношению к чистому растворителю
Метод не связан ни с исходной концентрацией раствора реактива, ни с разложением дитизонатов.
Теоретическое обоснование метода
Чтобы определить концентрацию дитизоната металла с наряду с также неизвестной концентрацией дитизона Cq,
128 Общие сведения о методах определения элементов с Dz
выбирают две оптимальные длины волны X и Xi, при которых коэффициенты поглощения дитизона еох и гох1 намного меньше или намного больше соответствующих коэффициентов поглощения дитизонатов металлов ех и еЛ1.
Измеряют тх и тпХ1 смешанного экстракта по отношению к чистому растворителю и получают
+ £0Х^0’
,ПХ, "Т SOXx^O’
zVox1 —"Vox eX£OXj ““ еох£х1
(26)
(27)
(28)
В этом выводе исходят из допущения, что поглощения обоих окрашенных компонентов при всех длинах волн накладываются одно на другое. При этом совершенно безразлично, действительно ли имеет место наложение или оно обусловлено строгой монохромазией.
При пользовании монохроматическими приборами коэффициент поглощения еХ1 дитизонатов многих металлов при длине волны М (соответствует максимуму поглощения дитизона) имеет исчезающе малую величину, таким образом, для этих дитизонатов уравнение (28) может быть упрощено:
тхг'ОЪ — "Vox £Х£ОХ!
(29)
Метод измерения при двух длинах волн был использован для получения численных результатов при филь-трофотометрии смешанного экстракта системы Hg(HDz)2 + H2DZ [459] и для получения графических результатов (построение номограмм) в анализе Pb(HDz)2 + H2Dz, а также Си (HDz) 2 + H2Dz [464, 473].
Приведенный вывод справедлив также для многочисленных анализов двухкомпонентных экстрактов, состоящих из Pb(HDz)2 + Bi (HDz) 3, а также AgHDz + + Pd(HDz)2.
Значения е измеряют для чистых титрованных растворов дитизона и дитизонатов металлов и используют их при расчетах.
Разделение металлов
129
Рекомендуется применять растворы дитизона высокой чистоты, так как иначе для того, чтобы учесть окрашенные примеси, придется каждый раз строить калибровочную кривую.
III. РАЗДЕЛЕНИЕ МЕТАЛЛОВ
По имеющимся в настоящее время данным, дитизон образует экстрагируемые дитнзонаты металлов с 21 катионом (см. табл. 3, стр. 32). Такими катионами являются: Ag+, Hg\ Hg2+, Pb2+, Pt2+, Au+, Au+3, Po?, Cu+, Cu2+, Bi3+, In3+, Sn2+, Zn2+, Cd2+, Co2+,
Pb2+, Ni2+, Fe2+, Mn2+ и Tl+.
Просто как групповой реактив для такого множества ионов дитизон никогда бы не приобрел того большого значения в микроанализе и для определения следов элементов, если бы не удалось достигнуть селективного образования дитизонатов.
В настоящем разделе рассмотрены различные возможности ограничения реакционноспособности дитизона, а также методы устранения различного вида помех. В гл. 3 детально рассмотрены способы отделения эазличных катионов.
1. ИЗМЕНЕНИЕ ВАЛЕНТНОСТИ ИОНА
Одновалентные ионы Hg+, Au+ и Cu+ путем окисле-шя очень легко перевести в Hg2+, Au3+ и Cu2+, для того тобы они реагировали только в своей высшей степени кисления. После перевода Pt2+ и Sn2+ в высшую степень кисления Pt4+ и Sn4+ последние не образуют дитизо-атов.
Окисление Mn2+, Fe2+, Со2+ и Т1+ не целесообразно, ак как образующиеся Mn4+, Fe3+, Со3+ и Т13+, хотя и не бразуют дитизонатов, окисляют дитизон (особенно по-аедние два иона) и, таким образом, могут очень сильно ешать определению остальных катионов.
2. РАЗЛИЧИЕ В СРОДСТВЕ
Ярко выраженное различие в сродстве катионов дитизону (см. стр. 62) часто дает возможность в опре-
9 Зак. 2157.
130 Общие сведения о методах определения элементов с Dz
деленных границах проводить ступенчатую экстракцию, что имеет особое значение для выделения и разделения ионов благородных металлов и Си2+ (табл. 14). Изменение сродства наблюдается только при переходе от pH 4 до pH > 7. Последовательное изменение сродства для растворов в едком натре можно записать в виде следующего ряда: Ag+, Hg2+, Cu2+, Au3+, что представляет значительный интерес для качественного анализа.
Таблица 14
ИОНЫ БЛАГОРОДНЫХ МЕТАЛЛОВ И Cu2h, РАСПОЛОЖЕННЫЕ ПО ВЕЛИЧИНЕ ИХ СРОДСТВА К ДИТИЗОНУ ПРИ pH < 4 а (ДАННЫЕ Г. ФИШЕРА [375])
Катионы Окраска слоя CC14 Предельная концентрация
АцЗ-1 Hg2 г Ag + 1 Си2’1"
Pd2+ Бледно-зеленая 1 : 1 1: 103 1 : Ю3 1: 103
Au3+ Желтая — 1: 10 1 : 102 1 : 103
Hg2+ Оранжево-желтая — —— 1: 103 1: 103
Ag+ Золотисто-желтая — — — 1 :103
Cu2+ Красно-фиолетовая — — —
а Кроме иона Ац^’1-, способность которого экстрагироваться начиная с pH 2 так же снижается, как и для ионов Си2+ (ср. рис. 13, стр. 132), приведенная последовательность сохраняется и в концентрированных сернокислых растворах.
Особое значение имеет очень малое сродство Fe2+ и Мп2+ к дитизону даже в области оптимального pH, вследствие чего эти ионы почти не мешают при определении других катионов.
Четкость разделения двух катионов (например, Hg2+ и Си2+) иногда удается увеличить путем введения третьего катиона, обладающего промежуточным по величине сродством к дитизону (ср. стр. 178).
Разделение металлов
131
3. ЭКСТРАГИРОВАНИЕ В ОПРЕДЕЛЕННОЙ ОБЛАСТИ pH
Области pH экстрагирования отдельных дитизонатов очень различны как по величине, так и по интервалу, что ясно видно из рис. 13*.
Путем установления определенного интервала pH удается очень селективно провести экстрагирование катиона. Имеются следующие возможности разделения металлов группы дитизона.
а) Если экстрагирование отдельного катиона при данном pH не совпадает с экстрагированием сопутствующих катионов, то этот катион можно отделить путем экстракции от присутствующих в любом количестве других катионов при условии, что интервал pH достаточно велик.
Так, при pH ионы, находящиеся на рис. 13 ниже Bi3+, не мешают экстракции 1000-кратных количеств ионов, расположенных выше Bi3+. Из 1,5 н. раствора едкого натра можно экстрагировать только ионы Hg2+, Cu2+, Cd2+, Со2+ и Т1+.
б) Если при определенном значении pH экстрагирование посторонних мешающих ионов не совпадает с pH экстрагирования определяемого катиона, то можно, наоборот, сначала экстрагировать мешающие ионы, а в оставшемся водном растворе вновь установить pH и без помех экстрагировать определяемый ион.
Такая предварительная экстракция удобна вообще в том случае, если количество посторонних ионов превышает количество определяемого катиона не более чем в 100 раз. Она ограничена малой растворимостью дитизонатов в органическом растворителе (см. табл. 4, стр. 38).
4. РАЗЛОЖЕНИЕ ДИТИЗОНАТОВ ПРИ ОПРЕДЕЛЕННОМ pH
Селективное разложение дитизонатов металлов, перешедших при экстрагировании в органическую фазу, можно осуществить (см. стр. 63—64) встряхиванием этого экстракта с водным раствором определенного pH
* О разделении металлов дитизоном см. также Пилипенко А. Т. [5626], [5627]. — Прим. ред.
9*
№г
Соединение
рНэ
-7 О 1 2 3 4 5 6 7 8 9 10 II 12 13 /? 15
Цвет е
о
1
2
3
4
5
6
7
д
9
10
11
12
13
М
15
16
77
18
HDz HzDz
V Ндг* Pd1’ Pt1’ Au3* Ро? Си2* Bi3* It?* Sn1' Zn1* Cd1* Co1* AgHDz AgzD% Hg(HDz)2 HgDz Pd(HDz), PdDzJ Pt(HDz)2 PtDz^ Au(HDz)3 AujDzf Po(HDz), Cu(HDz)2 CuDz BilHDzJj ln(HDz)3 Sn(HDz)2 ZnlHDz)2 Cdf HDx)2 Co(HDz)2 CoDz Nil HDz)2 Pb(HDz)2 Fe(HDz)j Mn(HDz);, TIHDz
ишииШиг ШИШ"
illllHIIllllll iiiiiillHIIIIIHilf ж
Ni1’ Pb1* Fe2* Mn!* Tt*
Из у мру дно -зеленый
Оранжево-желтый м
Золотисто -желтый
| Фиолетовый
Оранжево-желтый
Фиолетовый
Бледно-зеленый
I /Гори чнево - фиолетовый
Кори чнево желтый
1 Коричневый
Золотисто -желтый Красно-коричневый
Красно-фиолетовый Желто-коричневый
Красно - ори нжевый
Малиново -красный
Красный
Пурпурно - красный
Розово-красный
Красно - фиолетовый Желто-коричневый
Кори чнево - фиолетовый
Карм и ново -красный Фиолетово - красный | Коричневый и
Малиново красный
х I 100°/о-ная экстракция однозамещенного дитизоната 411111/ I 100°/о-ная экстракция двузамещенного дитизоната Xet-tZ t 1007о-ная экстракция HzDz в виде HDz~e водном растворе
• Двизаменный дитизонат не растворим в СС14
т Данные о цвете относятся к водной суспензии
Р и с. 13. Схематическое3 изображение областей pH извлечения6 дитизонатов8 четыреххлористьш углеродом.
Разделение металлов
133
а Обычный S-образный ход «кислотной» и «щелочной» ветви кривой экстракции схематически изображен в виде граничных прямых линий (ср. рис. 9, стр. 56 и рис. 5, стр. 22).
б Кривые экстракции получены для 25 мкМ растворов дитизона в четыреххлористом углероде и водных растворов солей металлов соответствующей концентрации, к которым добавлен в качестве электролита уксуснокислый аммоний. При изменении концентрации компонентов реакции наблюдаются смещения в соответствии с законом действия масс (ср. рис. 14, стр. 146 и рис. 15, стр. 147). Для 50%-ного избытка дитизона смещение области экстракции влево отвечает примерно 0,3 единицам pH [5023]. Даже для области, в которой экстракция достигает < 100% (наклонная часть кривой экстракции), можно многократным повторением операции добиться исчерпывающего извлечения (см. стр. 61—62).
Смещение pH экстракции вследствие присутствия других электролитов, кроме уксуснокислого аммония, а также применение для экстракции хлороформа показаны на графиках, приведенных в главе 3 книги. При извлечении хлороформом область экстракции смещается обычно вправо на 1—2 единицы pH.
в Дитнзонаты Hg+, Au+ и Cu+ не представляют интереса для аналитической практики, поэтому они исключены из схемы рис. 13.
г Порядок перечисления ионов, за исключением поставленного первым Ag+, выбран по увеличению экстракции с увеличением pH. Подобные последовательные ряды составили Вихман [395], Г. Фишер [422], а также Королев [5023].
д Для создания областей pH < 2 и pH > 12 применяли серную кислоту и соответственно едкий натр; за основу формальных величин pH брали нормальность кислоты или щелочи без учета активностей
е За исключением AU2DZ3 и Cd (HDz)2, умеренно растворимых в четырххлористом углероде, приводимая окраска относится к растворам, эквивалентным 25 мкМ. растворам дитизона в четыреххлористом углероде при рассмотрении слоя толщиной в 1 см.
ж Приведена окраска водного раствора.
3 Приведен предполагаемый состав дитизоната.
И Мп (HDz) 2 растворим в хлороформе с образованием фиолетового раствора.
(с кислотой, щелочью или буферным раствором). В общих чертах селективное разложение является как бы обратно повернутой селективной экстракцией.
Нормально экстракция дитизонатов приводит к действительному равновесию, вследствие чего для кислотного разложения дитизонатов в большинстве случаев можно пользоваться данными, приведенными на рис. 13. Только однозамещенные дитнзонаты никеля и кобальта отличаются ненормальной устойчивостью к действию кислот (ср. рис. 35, стр. 278 и рис. 33, стр. 274), что опять-
134 Общие сведения о методах определения элементов с Dz
таки используется для отделения этих дитизонатов. С аномальным установлением равновесия во времени чаще всего сталкиваются при обработке дитизонатов щелочными растворами, что используют в одноцветном методе (ср., например, рис. 16, стр. 148 и рис. 28, стр. 234).
Чаще всего предшествующую разложению экстракцию проводят селективно; таким образом, последующее разложение предпринимается главным образом для вымывания увлеченных при экстракции примесей. В результате разложения определяемый ион либо находится в водном растворе определенного pH, либо переходит один в органическую фазу, а все сопутствующие ионы находятся в другой фазе.
5. ЭКСТРАКЦИЯ И РАЗЛОЖЕНИЕ В ПРИСУТСТВИИ МАСКИРУЮЩИХ ВЕЩЕСТВ
Очень полезными и удобными для разделения металлов оказались маскирующие вещества, которые образуют с определенными катионами труднодиссоциируе-мые соли или комплексные соединения. Их можно применять в большом избытке, вследствие чего даже относительно слабые маскирующие вещества дают хороший эффект.
Активность маскирующего вещества и требуемое его количество зависят от свойств подлежащего маскированию катиона, его концентрации и pH водного раствора. С увеличением количества избыточного дитизона в растворе убывает активность маскирующего вещества. В табл. 15 приведены все применявшиеся до настоящего времени маскирующие вещества для различных ионов, области pH и достигаемый при этом эффект.
Маскирующие вещества можно вводить различными способами:
а) Маскирующее вещество добавляют к испытываемому раствору, предупреждая тем самым экстрагирование нежелательных сопутствующих ионов. При применении достаточно активных маскирующих веществ удается отделить определяемый металл от практически любых количеств посторонних ионов.
Разделение металлов
135
Таблица 15
МАСКИРОВАНИЕ МЕТАЛЛОВ ГРУППЫ ДИТИЗОНА
pH Маскирующие вещества а Маскируемые : катионы 6
tjQ < ci X __l_ Cl ’O < _L ci a o co CQ + co a _i_ Cl c N Cl U Cl О О _L z “i“ Cl X) (X
< 1 СГ, Br~,SCN~ * () ♦
< 1 * —
~ 1 CN“ +SCN~ ❖ () •s —
-5 S О2- в d2U3 () () () () * —
-5 CN“ B’r () ф ——-
> 9 CN" r * * — * *
> 6 Н4УД * :i: ❖ * •4’ *
Соответствующий ион маскируется. Подробные сведения о концентрации маскирующего вещества и значениях' pH приводятся при описании определений отдельных металлов (стр. 145) в разделах о посторонних ионах, областях применения и в примерах. Особенно полезные данные приведены в табл. 17, стр. 239.
— Соответствующий ион не реагирует с дитизоном при данном pH.
( ) Ион маскируется слабо.
а В таблицу не вошли применяемые от случая к случаю маскирующие вещества: диметилглиоксим —для Со2 + или Ni^+ [494, 522;], сульфид, диэтилдитиокарбамат. Лимоннокислые и виннокислые соли с увеличением их концентрации в большей , или меньшей степени тормозят экстракцию ионов, не будучи способны в то же время связать эти ионы количественно при нужных pH, так что их нельзя применять для селективного разделения металлов группы дитизона.
б Из катионов не перечислены: Hg", Au '", Си"’", Pt"*" и Sn-"’", легко отделяемые окислением (стр. 129), а также Ро, Fe^ + , Мп2"*", не мешающие отделению других ионов (стр. 129—145).
в См. табл. 17, стр. 239.
г Ионы Sn^+ также не маскируются.
д HtY — этилендиаминтетрауксусная кислота. Нитрилотриуксусная кислота еще не испытывалась для маскирования металлов группы дитизона; очевидно, она должна себя вести так же, как H|Y.
б) Маскируют определяемый ион, после чего экстрагируют сопутствующие ионы. Находящееся в водном растворе комплексное соединение разлагают и экстрагируют определяемый ион. Этим способом удается легко отделить 100-кратные количества посторонних ионов.
Для разложения комплекса часто бывает достаточно изменить pH раствора. Ионы CN~ можно устранить кипячением с кислотами или с формальдегидом. В последнем случае образуется нитрил гликолевой кислоты.
13b Общие сведения о методах определения элементов с Dz
в) Органический экстракт, содержащий определяемый ион и посторонние ионы, встряхивают с водным раствором определенного pH, к которому добавлено маскирующее вещество, связывающее либо посторонние ионы, либо определяемый ион и удерживающее их в водной фазе. Этим способом удается разделить поны при соотношении их 1 : 100. Часто при селективной экстракции промывка экстракта раствором маскирующего вещества помогает отмыть экстракт от незначительных количеств увлеченных посторонних ионов.
Путем комбинирования экстрагирования и разложения в определенном интервале pH при одновременном применении маскирующих веществ, а также повторением этих операций удается очень полно отделять ионы с помощью только дитизона. Предельные концентрации ионов, которые удается отделить, приведены в табл. 16.
В качестве примера анализа, проведенного только с помощью дитизона, приводим несколько методов разделения ионов Cu2+, Zn2+, Pb2+.
1. При pH 8,5 экстрагируют все три иона вместе в виде дитизонатов, чтобы освободиться от посторонних ионов. Органический экстракт отделяют, встряхивают с 0,1 н. соляной кислотой, при этом в органической фазе остается только Си (HDz) 2. Из одной части полученной водной фазы при pH 4,5—5 в присутствии 320з~ экстрагируют Zn(HDz)2; из второй части при pH 9—10 в присутствии CN- извлекают Pb(HDz)2 [372].
2. При pH ~2 экстрагируют только Си (HDz) 2. Полученную водную фазу подщелачивают до pH 9—10, добавляют С NT и извлекают Pb(HDz)2. Для удаления СЬС водный раствор обрабатывают соляной кислотой, испаряют, остаток растворяют в воде, устанавливают pH 4,5—5 и извлекают Zn(HDz)2 [371, 3817].
3. Поступают так, как во втором методе, но вместо того, чтобы удалять цианистый водород выпариванием с соляной кислотой, добавляют к водному раствору формальдегид [451].
Только в очень редких случаях, особенно для определения следов элементов, приходится концентрировать ионы не с помощью дитизона, а другими реактивами.
Таблица 16
ПРЕДЕЛЬНЫЕ КОНЦЕНТРАЦИИ а ИОНОВ МЕТАЛЛОВ ГРУППЫ ДИТИЗОНА6, КОТОРЫЕ УДАЕТСЯ ОТДЕЛИТЬ
Определяемый ион В присутствии 10-кратных количеств ионов в
Ag ‘ Hg2+ Pd- * * Ац3 + Си2 + Bi3 In3 Zn2 г Cd2 L ~ 9-1- Со“^ Ni2’1 РЬ2г Т1
Ag+ • 1 0 0 4 т * ф * * Л-
Hg2+ 9 • 0 3 Д: * •ь * *
Pd2+ 2 1 • — 4 * * * * * *
Au3 + 3 0 — • 3 л *
Cu2 + 3 3 2 2 • 1 * * ❖ 4’ •S- * *
Bi3 + * л- * • 3 * ❖ Ф * 3 3
In3 + 9 2 9 2 2 2 3 3 3 3 9
Zn2 + 4 3 2 2 3 3 3 • 0 * Ф 4 4
Cd2+ 2 2 2 2 2 * ❖ * • 3 2 PC
Co2+ 2 9 2 2 2 1 1 2 2 • — 9 2
Ni2+ 9 9 9 2 2 9 1 1 1 — • 1 1
Pb2+ •ь ф * •р * 2 3 4: е 3
тГ * 4: 2 4 * 4 2 1 •
— Определению мешает присутствие даже самых малых количеств посторонних ионов.
О, 1. 2. 3 ... предельные концентрации 1 : 10°, 1 : Ю1, 1 : 10-, 1 : 10' ...
* Предельная концентрация 1 : 103 и меньше.
а При указании предельной концентрации имеется в виду, что определяемый ион может быть определен в присутствии посторонних ионов с точностью не ниже ±10?о.
6 Поны других металлов не мешают при условии, что они не окисляют дитизон. В их присутствии не изменяются также предельные концентрации обнаруживаемых ионов при условии, что полученные растворы прозрачны (см. раздел «Различного вида помехи», стр. 139).
в См. примечание 2 к табл. 15.
138 Общие сведения о методах определения элементов с Dz
Из таких способов чаще всего применяют: отделение Ni2+ дпметилглиоксимом и эфиром; осаждение Ag+ в виде галогенида; восстановление благородных металлов; отгонку ртути, кадмия и цинка; отделение ионов Zn2+ и Cd2+ с помощью ионообменников,
6. РАЗРУШЕНИЕ ДИТИЗОНАТОВ
Иногда в ходе анализа возникает необходимость перевести из органической в водную фазу металл, находящийся в виде дитизоната, трудно разлагающегося кислотами. Это достигается обычно разрушением дитизона: встряхиванием органической фазы с окислителем; выпариванием или прокаливанием полученного твердого остатка.
а) Разрушение дитизоната металла встряхиванием с окислителем
1. Перманганат калия в кислом растворе. К органическому экстракту в делительной воронке добавляют 5 мл 2 н. раствора H2SOi и по каплям 0,1 н. раствор КМпО4. Энергично встряхивают и продолжают добавлять раствор КМпО4 до тех пор, пока водный слой не приобретет стойкую окраску перманганата. При этом органический экстракт становится бесцветным или окрашивается в бледно-желтый цвет.
Для разрушения избыточного перманганата раствор обрабатывают NH2OH-HC1, N2H4 • H2SO4, H2SO3, Н2С2О4 или другими восстановителями до тех пор, пока не растворятся даже хлопья МпО2 • /гН2О.
3 кислом растворе ионы Мп2+ не влияют на экстракцию металлов; в щелочной среде помехой является выпадающая двуокись марганца.
2. Б р о м или хлор в кислой среде. Дитизон переводят в карбодиазон, в результате чего освобождается металл в виде иона. Можно пользоваться соляной или азотной кислотами. Избыточный хлор или бром можно удалить каким-либо восстановителем.
Разделение металлов
139
3. Пергидроль в щелочной среде. Дитизон окисляют до карбодиазона (см. пункт 2).
б) Разрушение дитизонатов металлов обработкой твердого остатка, остающегося после испарения органического растворителя (способ не пригоден для летучих металлов)
1. О б р а б о т к а серной и хлорной кислотами [3514, 502]. Сухой остаток нагревают до 200— 250° с 0,25 мл концентрированной серной кислоты и 0,25—0,50 мл концентрированной хлорной кислоты до обесцвечивания раствора Выпаривают HoSOl, а остаток растворяют в 0,5 мл разбавленной кислоты.
2. Обработка серной и азотной кислотами [5210]. Сухой остаток увлажняют 0,2 мл концентрированной серной кислоты и 0,2 мл концентрированной азотной кислоты и нагревают до начала обугливания. Смачивают каплей концентрированной азотной кислоты, опять нагревают и так до тех пор, пока не будет получен бесцветный раствор. После разбавления 5 мл воды нагревают до выделения белых паров и остаток растворяют в воде.
3. Обработка серной кислотой и пергидролем [347 * *, 3512, 35гз]. К сухому остатку добавляют 0,5 мл концентрированной серной кислоты, нагревают и по каплям добавляют пергидрол, пока раствор не станет прозрачным. Остаток растворяют в воде.
4. Разрушение дитизонатов прокаливанием сухого остатка. Сухой остаток увлажняют 8 н. раствором азотной кислоты и умеренно сильно прокаливают. Остаток растворяют в разбавленной кислоте. При таком методе возможны потери вследствие разбрызгивания, улетучивания или сплавления образовавшихся окислов с материалом тигля.
7. РАЗЛИЧНОГО ВИДА ПОМЕХИ
Не говоря уже об анионах, действующих как маски-
рующие вещества, или о веществах, присоединяющихся
к молекуле дитизона и изменяющих таким образом его
140 Общие сведения и методах определения, элементов с Dz
свойства, экстрагированию дитизонатов мешают сильные, а иногда даже мягкие окислители, а также некоторые химически индифферентные осадки.
Действие сильных окислителе й. Сильные окислители, такие, как СЬ, Вг2, NOCI, NOj", Н2О2, О3, МпОГ, Cr2O?”, CrOi", [Fe(CN)6]3- и др., быстро разрушают дитизон, вследствие чего их нужно устранить еще до экстракции обработкой раствора сернистой кислотой, гидроксиламином, гидразином, аскорбиновой кислотой и другими восстановителями. Для разрушения NOF достаточно кипячения с мочевиной или сульфаминовой кислотой.
Чтобы установить присутствие окислителей в подкисленном испытуемом растворе, делают пробу с KJ. Однако не все вещества, способные вытеснять йод из раствора йодистого калия, способны окислять дитизон (например, Си2+, незначительные количества Fe3+). Лучше всего испытывать раствор на присутствие окислителя путем встряхивания испытуемого раствора в делительной воронке с 0,5 мл раствора дитизона в четыреххлористом углероде. После отделения органического слоя последний промывают 1 н. раствором серной кислоты и водой и встряхивают с 5%-ным раствором цианистого калия. Устойчивая желтая окраска органической фазы свидетельствует о наличии окислителя; окраска, возникшая вследствие образования AgHDz и Hg(HDz)2, быстро исчезает.
Действие мягких окислителей. В присутствии значительных количеств таких мягких окислителей, как Fe3+, БеОз” и др., может происходить медленное окисление дитизона. В этом случае полезно для экстракции применять значительный избыток дитизона. Полученный экстракт разлагают, отделяют водную фазу и извлекают из нее определяемый ион повторной экстракцией.
Большие количества Fe3+ можно легко устранить либо восстановлением его до Fe2+, либо извлечением в виде хлорида или купфероната.
При pH > 7 ион Мп2+ инициирует окисление дитизона (путем активирования кислорода воздуха), что можно предупредить добавлением гидразина [3813]
Разделение металлов
141
Затруднения, о бу с л ов л ен н ы е о с а д к а м и. В основном только прозрачные растворы удается экстрагировать без помех. Сами по себе химически индифферентные осадки, как, например, гели SnO2-aq., Fe2O3«aq., Al2O3-aq., Cr2O3-aq., NiO-aq., MnO-aq. и фосфаты щелочноземельных элементов, препятствуют количественному извлечению следов металлов.
Образование осадков вследствие гидролиза можно предупредить добавлением винной, лимонной или других кислот. Если и это не помогает, как, например, в присутствии больших количеств Sn4+, приходится прибегать к другим способам. Такими, например, являются многократное испарение с бромом и бромистоводородной кислотой (см. стр. 256).
Глава 3
ПРИМЕНЕНИЕ ДИТИЗОНА
В КОЛИЧЕСТВЕННОМ АНАЛИЗЕ
ПРЕДВАРИТЕЛЬНЫЕ ЗАМЕЧАНИЯ
За исключением серебра, описываемого первым, все остальные металлы группы дитизона расположены в приведенных 18 разделах в соответствии с возрастающим pH полного извлечения их дитизонатов (см. рис. 13, стр. 132). В основном в описание каждого металла входят следующие разделы:
а) Общие сведения
б) Основные методы определения
в) Применение г) Примеры
В раздел «Общие сведения» входит рассмотрение уравнения реакции, специфических условий экстракции, скорости экстракции, описание обменных реакций дитизонатов, данные о растворимости, окраске, устойчивости, а также о помехах, возникающих при экстракции в присутствии некоторых анионов и посторонних катионов.
Зависимости экстракции от pH и содержания электролитов в водном растворе, а также от применяемого органического растворителя приведены в виде графиков. Для упрощения кривые экстракции изображены в виде прямых вместо обычной S-образной формы кривой. При получении данных для построения кривых, если нет специальных указаний, всегда встряхивали одинаковый объем ~25 мкМ раствора дитизона (25 X Ю"6 Л1) с водным раствором соли металла соответствующей концентрации до установления равновесия. В некоторых аномальных случаях наряду со схематизированным графическим изображением про-
Предварительные замечания 143
цесса образования дитизоната приведен процесс его разложения.
Для дитизонатов почти всех металлов приведены спектры поглощения. В некоторых случаях приведены спектры поглощения 25 мкМ. растворов дитизона и дитизоната в одном и том же растворителе. Значения X и е для максимального и минимального поглощения приведены в табл. 5, стр. 40.
О помехах, обусловленных веществами, вызывающими функциональные изменения дитизона, см. стр. 25 и сл. и 139. О значении других помех см. стр. 139.
Такой простой случай, как устранение помех, обусловленных ионами Pt2+, Sn2+, Fe2+ и Мп2+, будет в дальнейшем рассматриваться лишь кратко. Подробно об этом см. стр. 129 и 141. Способы устранения остальных двенадцати катионов группы дитизона (исключая полоний и определяемый катион), рассматриваются, наоборот, весьма подробно. К сожалению, не всегда удавалось выражать количество мешающего иона в величинах, кратных 10. При грубой оценке допустимых количеств примесей пользовались следующими определениями (по отношению к содержанию определяемого иона):
«Незначительное количество» означает примерно концентрацию определяемого иона
«Малые количества» означает 10-кратное количество
«Среднее количество» означает 100-кратное количество
«Большее количество» означает 1000-кратное количество
«Большое количество» означает 10 000-кратное количество
«Любое количество» означает количество, более чем 104 раз превышающее содержание определяемого иона
В разделе «Основные методы определения» описываются методы, особенно рекомендуемые для определения данного иона. В методах, рассчитанных на применение спектрофотометра, последний легко может
144
Применение дитизона в количественном анализе
быть заменен фотометром пли колориметром с применением светофильтров при условии, что и калибровочные кривые будут построены с применением этих приборов.
Пример экстракционного титрования подробно описан на стр. 96 и сл.
Каждой прописи анализа предшествует перечень нужных реактивов. Концентрация титрованных реактивов дается в единицах молярности или нормальности (см. табл. 10, стр. 100). К ним относятся: растворы дитизона; растворы, применяемые для титрования и приготовления шкалы сравнения; кислоты; щелочи и т. д. Если концентрация приведена в процентах, то это можно понимать или как весовые проценты, или как содержание вещества в граммах в 100 мл раствора. Все приведенные концентрации надо рассматривать как примерные. Для растворов дитизона и титрованных растворов, кроме концентрации в микромолях (мкМ), приводятся также практически наглядные величины в микрограммах на миллилитр (лпсг/лы), причем числа даются с точностью до третьего знака. Титрованные растворы применяют для установки титра раствора дитизона, для обратных титрований. Их можно использовать при освоении методик вместо «испытуемых растворов». Основные величины модулей поглощения, необходимые при фотометрических определениях, приведены в табл. 13 (стр. 116). Различные способы фотометрирования приведены на стр. 119 и 122 и сл.
Точность определения ±х% от установленной величины обозначает максимальное отклонение отд^дных анализов в данных условиях определения. В табл. 12 приведены ошибки, возможные при определении элементов группы дитизона различными методами.
Следуя основным способам анализа, можно проводить микроопределения (например, определение металлов группы дитизона в обычной воде, содержащей очень мало посторонних ионов), причем выбор того или другого метода зависит от конкретных условий. Для определения следов металлов требуются некоторые дополнительные операции, вернее, анализу должно предшествовать концентрирование искомого элемента. Ряд
Определение металлов группы оитизона. Серебро 145
указаний, помогающих учитывать частные обстоятельства, можно найти в разделе «Влияние посторонних ионов» и при описании примеров.
Краткие рефераты и литературные ссылки в разделе «Применение» приводятся примерно в следующем порядке: определения в воде, воздухе, почве, силикатах, руде, металлах и неметаллических материалах, химических реагентах, биологических материалах.
По значимости выбора метода определения все ионы можно распределить на следующие группы: для определения ионов Pb2+, Zn2+, Hg2+ и Ag+ выбор метода имеет очень большое значение; для определения ионов Cd2+, Cti2+, Bi3+ и Tl+ — большое значение; для ионов Pd2+, Au3+, In3+, Pt2+ и Ni2+ — некоторое значение.
Ионы Sn2+, Fe2+ и Мп2+ с помощью дитизона определять нельзя; Со2+ можно определять в специальных условиях; Ро вовсе нельзя определить, однако дитизон полезен для концентрирования этих ионов.
Чтобы в какой-то степени предостеречь себя от ошибок, напоминаем о пользе контрольных проб (без металла и с добавлением металла) и контрольных анализов.
ОПРЕДЕЛЕНИЕ МЕТАЛЛОВ ГРУППЫ ДИТИЗОНА
СЕРЕБРО
а) ОБЩИЕ СВЕДЕНИЯ
Ион Ag+ образует с дитизоном золотисто-желтый однозамещенный дитизонат AgHDz и фиолетово-красный двузамещенный дитизонат Ag?Dz:
Ag^oAH. “I- AgHDz орг. <-— Ag2Dz ; Ч-Нвддн.>
(I) (П)
2Ag^n. + H2Dzopr. <— Ag2Dz -Ь2Нводн.. (Ш)
Состав этих солей [351, 5313], так же как и константы равновесия [5023, 548], был неоднократно определен (см. табл. 6, стр. 50).
10 Зак. 2157.
146
Применение дитизона в количественном анализе
Однозамещенный дитизонат AgHDz в воде не растворим, но относительно хорошо растворим в обычных органических растворителях (см. табл. 4, стр. 38). Для образования AgHDz требуется кислая среда и избыток дитизона. Если для работы пользуются 25 мкМ водным раствором соли серебра и 25 мкМ раствором дитизона в ССЦ, то полная экстракция в раствор четыреххлористого углерода достигается в интервале кислотности от нейтральной до 4 н. пр серной кислоте.
При одномолярном избытке раствора дитизона извлечение протекает количественно в 8 н. серной кислоте (см. рис. 14).
Р и с. 14. Влияние концентрации серной кислоты и избытка дитизона на экстракцию четыреххлористым углеродом ионов серебра в виде AgHDz.
« — эквимолекулярные количества 25 мкМ растворов соли серебра в воде и дитизона в четыреххлористом углероде; 6 —молярный избыток раствора дитизона в четыреххлэристом углероде.
Даже в очень разбавленных растворах (< 1 мкМ) по реакции (I) образование AgHDz завершается в течение нескольких секунд. Благодаря этому методом экстракционного титрования достигается такая же точность, как и классическими объемными макрометодами.
Двузамещенный дитизонат Ag2Dz не растворим ни в воде, ни в обычных органических растворителях. Возникающие при растворении Ag2Dz в хлороформе или ацетонитриле гранатово- или фиолетово-красные окраски следует, очевидно, приписать образованию коллоидных растворов. Для образования Ag2Dz требуется
Определение металлов группы дитизона. Серебро 147 избыточное количество Ag+; положительное влияние оказывает также повышение pH (см. рис. 15). Эта реакция используется для обнаружения Ag+.
Если pH выбран слишком высоким, то в начале экстракционного титрования Ag+ (раздел б, 1) вследствие большого избытка ионов Ag+ на границе двух фаз иногда образуется темно-красная пленка, обусловленная образованием Ag2Dz.
Р и с. 15. Образование Ag2Dz в растворе дитизона в четыреххлористом углероде; зависимость от избытка Ag+-noHOB и величины pH (схематическое изображение):
-------эквимолекулярные количества 25 мкМ растворов дитизона в четыреххлористом углероде и соли серебра в воде;-----1-, 10-, 100- и 1000-крат-
ный избыток Ag+.
Алексеев [3818] пользовался при определении серебра двузамещенным дитизонатом. Согласно этому способу, дитизон растворяют в 0,1 н. растворе пирофосфата натрия (pH ~10). Так как пирофосфат натрия со многими двух- и трехвалентными ионами металлов образует устойчивые, растворимые в воде комплексные соединения, реакция иона дитизона HDz~ с ионом Ag+ (Hg2+ реагирует аналогично) проходит относительно избирательно. В желтом растворе дитизоната образуется розово-красная суспензия, интенсивность окраски которой и измеряют.
При повышении кислотности среды или при добавлении раствора дитизона в органическом растворителе Ag2Dz быстро превращается в AgHDz:
Ag2Dz j +H2Dzopr. 2AgHDzopr, (IV)
10*
148 Применение дитизона в количественном анализе
Образовавшийся AgHDz относительно устойчив к действию разбавленных щелочей, т. е. очень вяло протекает реакция
2AgHDzopr. + ОНВОдн. Ag.2Dz | + HDzB(WI. + H2O. (V)
Таким образом, раствор AgHDz орг. + H2Dzopr. можно освободить от избыточного дитизона встряхиванием с разбавленным аммиаком, причем AgHDz в основном остается без изменения (см. рис. 16). Благодаря этому становится возможным определение серебра по одноцветному методу (разделы б, 2 и б, 3).
Р и с. 16. Разложение AgHDz в растворе четыреххлористого углерода водным раствором аммиака.
При встряхивании уже освобожденного от избытка свободного дитизона 25 мкМ раствора AgHDz в четыреххлористом углероде с 0,0015 н. раствором аммиака теряется примерно 4% AgHDz. Такого рода ошибки компенсируются при определениях со шкалой сравнения.
Прл pH < 0 сродство дитизона к ионам Ag+ в 103 раз сильнее, чем к ионам Сп2+. Поэтому можно титровать водные растворы соли серебра дитизонатом меди
Определение металлов группы дитизона. Серебро
149
Си(HDz)2 в растворе четыреххлористого углерода (раздел б, 1, варианты):
2Ag^H. Cu(HDz)2 орг. '<• — 2AgHDzopr.+ СиВОдн.. (VI)
При исследовании спектров поглощения раствора AgHDz в четыреххлористом углероде (см. рис. 17) обнаружен максимум поглощения при 462 лц, который используют при фотометрировании одноцветного экстракта (раздел б, 3). При тех длинах волн, при которых наблюдается максимум поглощения дитизона в растворе четыреххлористого углерода, дитизонат серебра AgHDz (в том же растворителе) почти вовсе не поглощает, что с выгодой используется при определении избытка дитизона в методе смешанной окраски (раздел б, 5).
Р и с. 17. Спектр поглощения AgHDz в растворе четыреххлористого углерода:
25 мкМ раствор AgHDz;----------- 250 мкМ раствор AgHDz;
-------25 мкМ раствор H_,Dz.
В смеси золотисто-желтого раствора AgHDz и зеленого раствора H2Dz удается визуальным способом легко различать переходы цветов, что делает возможным визуальную колориметрию экстракта смешанной окраски (раздел б, 4).
Раствор AgHDz в четыреххлористом углероде почти не чувствителен к рассеянному свету. Заметное изменение окраски наступает только через несколько часов, особенно при относительно сильном освещении.
П рименение дитизона в количественном анализе
150
Раствор сохраняется без изменения в течение нескольких дней в темноте под слоем 0,1 н. раствора серной кислоты *.
Для количественного определения Ag+ пользуются образованием AgHDz в растворе четыреххлористого углерода или хлороформа **.
Влияние посторонних анионов. Ионы S2-, S2O3 и J' мешают определению (не говоря уже о явлениях адсорбции), если они содержатся в строго стехиометрическом количестве по отношению к ионам Ag+.
Ионы Вг~, CN- и SCN- не мешают извлечению Ag+ при содержании их в стехиометрических количествах в виде 5 мкМ растворов при условии, что экстракцию проводят быстро. Вследствие относительно хорошей растворимости солей серебра, образуемых этими анионами, можно избытком раствора дитизона извлечь Ag+ в органическую фазу даже из осадка.
Ионы С1" не мешают экстракции серебра из 20 мкМ раствора (0,1 н. по азотной кислоте) даже при удвоенной молярной концентрации при условии, что время контакта не превышает 5 мин. Пользуясь избыточным количеством дитизона в органическом растворителе, можно количественно извлечь серебро из осадка хлористого серебра. При pH 3—3,5 можно количественно извлекать Ag+ из 1%-ного, а при pH 5 — из 20%-ного раствора хлорида аммония. Более высокий pH не рекомендуется, так как при этом начинается образование Ag2Dz ***.
Для определения серебра в присутствии больших количеств мешающих анионов следует осадить серебро в виде хлорида, бромида, йодида или сульфида, отде-
* Судзуки [595], изучая устойчивость дитизоната серебра в четыреххлористом углероде с применением радиоактивного изотопа Ag110, установил, что ~ 10~5 М раствор его, содержащий избыток дитизона, устойчив в течение длительного времени. Стабильность раствора понижается при понижении концентрации до Ю-6 молъ[л и на свету. — Прим. ред.
** Судзуки [594] описал количественное определение серебра методом изотопного обмена при помощи радиоактивного дитизоната серебра. — Прим. ред.
*** Швейцер и Дайер [606] изучали экстракцию дитизоната серебра с помощью радиоактивного изотопа Ag в присутствии различных маскирующих веществ. В результате они охарактеризовали
Определение металлов группы дитизона. Серебро 151 лить осадок, восстановить серебро до металла и растворить металл в азотной кислоте (раздел г, 4). В качестве коллекторов можно пользоваться сульфидами свинца или ртути. В дальнейшем сульфид ртути можно удалить слабым прокаливанием.
Влияние посторонних катионов. Ионы Hg2+, Pd2+ и Au3+ в кислом растворе реагируют с дитизоном раньше иона Ag+. Так как трудно судить о ходе реакции по не очень четкому переходу окраски, удобнее проводить совместное экстрагирование этих ионов.
В общем случае серебро можно отделить от этих благородных металлов в виде хлорида или бромида и после отделения осадка восстановить серебро до металла и растворить в азотной кислоте (раздел г, 4). Возможны и другие способы отделения.
Так, Hg2+ (до 10-кратных количеств по отношению к Ag+) можно экстрагировать вместе с AgHDz в виде Hg(HDz)2. Далее полученный экстракт встряхивают с 1%-ным раствором тиоцианата калия в 0,1 н. растворе серной кислоты, что вызывает разложение только дитизоната серебра. По увеличению поглощения органического экстракта при 620 л/ц до и после разложения дитизоната определяют количество Ag+, эквивалентное количеству освободившегося дитизона.
Можно разрушить также перешедший в водный слой комплексный тиоцианат серебра и определить с помощью дитизона освободившиеся ионы серебра [352] (см. раздел г, 1).
Значительные количества Hg2+ можно осадить в виде сульфида и удалить последующим прокаливанием. Строго регулируя температуру, следят за тем, чтобы потери серебра вследствие улетучивания или сплавления с массой тигля были минимальными.
HoH.Pd2+ (до 10-кратных количеств) экстрагируют совместно с Ag+ и измеряют поглощение этого экстракта при двух различных длинах волн. При 640 игр наблю-
влияние на экстракцию серебра С1~, Вг~, J-, CNS- и S2O3 и не обнаружили маскирующего действия уксусной, винной, лимонной, этилендиаминтетрауксусной и нитрилтриуксусной кислот, а также глицина.— Прим. ред.
152
Применение дитизона в количественном анализе
дается только поглощение раствором Pd(HDz)2 в четыреххлористом углероде. Из этого измерения устанавливают содержание Pd2+, рассчитывают его влияние на поглощение при 462 ntpi (максимум поглощения дитизоната серебра в растворе четыреххлористого углерода) и вычитают эту величину из величины поглощения, измеренной при 462 жр.
Большие количества Pd2+ целесообразно предварительно отделять экстракцией с диметилглиоксимом в растворе хлороформа.
Ион Аи3+ восстанавливают вместе с Ag+ до металла, затем металлы разделяют классическими методами таким образом, чтобы в конце концов получился чистый раствор соли серебра. Ион Си2+ экстрагируют из слабокислого раствора вместе с Ag+.
Путем увеличения кислотности до 5н. по серной кислоте можно понизить сродство дитизона к Си2+ в 1000 раз, после чего можно экстракционным титрованием определять 100 мкг Ag+ в 100 мл раствора в присутствии 10-кратного количества Си2+ с точностью, превышающей 1%. При 100-кратном содержании Си2+ менее четкий красно-бурый переход окраски наблюдается при определении 95% Ag+ в расчете на теоретическое.
Если соотношение Ag: Си = 1 : 10 000, то, чтобы сконцентрировать серебро, его специально извлекают путем встряхивания органического экстракта с сернокислым раствором тиоцианата калия, при этом преимущественно разлагался AgHDz и образующееся комплексное соединение серебра с тиоцианатом переходит в водную фазу. Его разлагают выпариванием с серной кислотой (раздел б, 1) и определяют обычными способами
Ион Bi3+ в 1 н. азотнокислом растворе не мешает определению серебра при соотношении Bi: Ag = 105: 1.
Ионы In3+, Zn2+, Cd2+, Co2+, Ni2+, а также Tl+ в 2— 5 н. сернокислых растворах не мешают экстракции Ag+ даже при соотношении 1 : 105 или 1 : Г0б по сравнению с Ag+.
Ионы РЬ2+ в 1 н. азотнокислом растворе не мешают при содержании их 1 : 107 по отношению к Ag+ (раздел б, 2).
Определение металлов группы дитизона. Серебро 163
б) ОСНОВНЫЕ МЕТОДЫ ОПРЕДЕЛЕНИЯ
Для определения Ag+ в виде AgHDz можно пользоваться несколькими методами. Наиболее целесообразными являются: прямое экстракционное титрование (раздел б, 1) или спектрофотометрическое определение по методу смешанной окраски (разделы б, 3 и б, 5).
За исключением ионов Hg2+, Pd2+ и Au3+, в кислом растворе ион Ag+ реагирует с дитизоном активнее других металлов группы дитизона. Таким образом, определению Ag+ не мешают примеси, содержащиеся обычно в реактивах и воде. Небольшие количества ионов Cl-также не мешают до момента выпадения осадка хлористого серебра. Лучше всего работать с 0,1 — 1 н. сернокислыми или азотнокислыми растворами. Только в присутствии очень значительных количеств ионов неблагородных металлов группы дитизона, особенно ионов Си2+, нужно подкислять раствор сильнее.
1. Прямое экстракционное титрование
Этот способ применим и для установки титра дитизона и особенно подробно рассматривался на стр. 96—97. Он положен также в основу косвенного экстракционного титрования серебра и находит очень широкое применение.
Реактивы
Серная кислота, 2 н. раствор.
Дитизон, 25 мкМ раствор в четыреххлористом углероде. 1 мл раствора 2,7 мкг Ag+.
Нитрат серебра, 25 мкМ раствор 0,1 н. по азотной кислоте. 1 мл раствора содержит 2,7 мкг Ag+.
Ход определения. Помещают 20 мл испытуемого раствора 0,1 — 1н. по серной кислоте1 в делительную воронку и разбавляют водой до 50 мл. Добавляя раствор дитизона, проводят экстракционное титрование до тех пор, пока от последней порции реактива после 30 сек. встряхивания вместо золотисто-желтой окраски 'AgHDz не появится зеленоватая 2. Точность определения ±0,5% 3.
154
П рименение дитизона в количественном анализе
Примечания
1 Раствор можно подкислить до 5 н. по серной кислоте, главным образом если присутствуют другие металлы группы дитизона, особенно большие количества Си2+ (ионы Hg2+, Рс12+ и Аи3+ всегда мешают определению).
2 В присутствии Си2+ в стехиометрической точке эквивалентности вместо зеленой окраски появляется переходный красно-бурый оттенок, так как после связывания всего серебра избыточный дитизон реагирует с Си2+ с образованием красно-фиолетового Cu(HDz)2.
3 Основной ошибкой определения является незначительная индикаторная ошибка. При определении 100 мкг Ag+ точность определения составляет ±0,2%. При работе с микробюреткой можно в 100 мл раствора определить 1 мкг Ag+ с точностью ± 10%.
Вариант. Если присутствуют большие количества Си2+, то для титрования вместо раствора дитизона можно применять раствор Си (HDz)2 в четыреххлористом углероде. Испытуемый раствор можно сделать менее кислым, чтобы проходило быстрей превращение дитизонатов. Неблагородные металлы группы дитизона вытесняют медь из дитизоната меди, если только их содержание велико.
Раствор Си (HDz) 2 в четыреххлористом углероде готовят путем встряхивания в течение 2 мин. в делительной воронке 100 мл 25 мкМ раствора дитизона в четыреххлористом углероде с 50 мл 50 мкМ раствора сульфата меди в 0,01 н. серной кислоте. Органическую фазу спускают в другую делительную воронку и отмывают от увлеченных Си2+-ионов двумя порциями 0,01 н. серной кислотой по 30 мл каждая. Концентрация приготовленного таким образом раствора Си (HDz) 2 равна ~25/2 мкМ.
2. Визуальная колориметрия одноцветного экстракта Реактивы
Те же, что в разделе б, 1.
Аммиак, 0,015 н. раствор.
Ход определения. Помещают в делительную воронку 10 мл испытуемого раствора и добавляют серную кислоту до концентрации 0,1 — 1 н. Титруют смесь раствором дитизона до исчерпывающей экстракции серебра, т. е. до тех пор, пока от прибавления последней
Определение металлов группы дитизона. Серебро 155 порции реактива экстракт после 30 сек. встряхивания сохранит зеленую окраску.
Органические экстракты собирают в другой делительной воронке, разбавляют определенным количеством четыреххлористого углерода 1 и отмывают аммиаком2 от избыточного дитизона 3. Золотисто-желтый экстракт спускают в пробирку для колориметрирования и сравнивают его окраску с аналогично приготовленной стандартной шкалой растворов. Точность определения ±4%.
Примечания
1 Из бюретки приливают такое количество четыреххлористого углерода, чтобы общий объем равнялся целому числу миллилитров, например 10, 15 или 20. Объем органической фазы суммируется из числа миллилитров израсходованного раствора дитизона, количества чистого четыреххлористого углерода, использованного для ополаскивания при отделении органического экстракта, и количества четыреххлористого углерода, добавленного для получения определенного объема.
2 Если в испытуемом растворе, кроме Ag+, имеются еще другие ионы металлов группы дитизона, которые при обработке аммиаком могут реагировать с избыточным дитизоном, то, чтобы освободиться от них, органический экстракт промывают сперва несколькими порциями 0,5 н. серной кислоты (по 15 мл каждая), а затем водой. Чтобы избежать потерь AgHDz, возможных при разделении слоев, после каждого разделения промывают определенным объемом четыреххлористого углерода и учитывают этот объем при последующем разбавлении экстракта.
3 Обычно достаточно двухразовой промывки порциями аммиака по 10 мл, что подтверждается отсутствием окрашивания после добавления второй порции аммиака.
Вариант. Можно встряхивать золотисто-желтый экстракт с подкисленными растворами NaCl, КВг, KJ или H2S. При этом AgHDz разлагается, выделяется эквивалентное количество дитизона, окрашивающее раствор в зеленый цвет, интенсивность которого определяют колориметрически.
3. Спектрофотометрическое определение по методу одноцветной окраски
Реактивы те же, что и в разделе 6,2.
X Ov определения. Определение проводят, как описано в разделе б, 2. Золотисто-желтый экстракт фо-тометрируют при 462 лгц. Точность определения ±3%.
156
Применение дитизона в количественном анализе
4. Визуальная колориметрия экстракта смешанной окраски
Метод особенно удобен для определения менее 1 мкг Ag+.
Реактивы
Серная кислота, 2 н. раствор.
Дитизон, 10 мкМ раствор в четыреххлористом углероде. 1 мл 1,08 мкг Ag+.
Нитрат серебра, 2,5 мкМ раствор 0,1 н. по азотной кислоте. 1 мл содержит 0,27 мкг Ag+.
Ход определения. К 2 мл испытуемого раствора в пробирке для колориметрирования добавляют 2 мл серной кислоты и 2 мл воды. Растворы добавляют по каплям из микробюретки, периодически энергично встряхивая пробирку. Раствор дитизона приливают до возникновения отчетливой зеленовато-желтой окраски и отмечают израсходованное количество реактива.
В другую пробирку одинакового размера вливают такое количество раствора дитизона, какое было израсходовано на титрование, и титруют его 2,5 мкМ раствором AgNO3 до появления такой же зеленовато-желтой окраски1. Точность определения ±5% 2.
Примечания
1 Вместо такого сравнительного титрования можно интенсивность окраски определять по шкале сравнения. Такой способ дает более надежные результаты.
2 При определении относительно больших количеств серебра точность определения достигает ±2%.
Вариант [352]. Вместо раствора дитизона в четыреххлористом углероде можно для титрования пользоваться красно-фиолетовым 10 мкМ раствором Си (HDz) 2 в этом растворителе. При этом получается раствор, окрашенный в желто-оранжевые и оранжево-фиолетовые тона. -Этим методом пользуются, если в испытуемом растворе содержатся значительные количества Си2+ (ср. с разделом б, 1, вариант).
Определение металлов группы дитизона. Серебро
157
5. Спектрофотометрическое определение по методу смешанной окраски
Реактивы те же, что в разделе б, 1.
Ход определения. Помещают в делительную воронку 10 мл испытуемого раствора и добавляют серную кислоту до 0,1 — 1 н. концентрации. Приливают определенное избыточное количество раствора дитизона и встряхивают в течение 30 сек. Полученный экстракт смешанной окраски фотометрируют при 620 жц. По величине поглощения определяют количество избыточного раствора дитизона, после чего рассчитывают содержание1 Ag+. Точность определения ±2%.
Примечания
1 Из поглощения, измеренного при 620 лг|л, можно определить поглощение свободного дитизона в растворе четыреххлористого углерода при 462 лф и вычесть эту величину из величины поглощения смешанного экстракта при этой длине волны, что дает величину поглощения чистого AgHDz в растворе четыреххлористого углерода *.
в) ПРИМЕНЕНИЕ
Очень удобные методы определения Ag+-Hona с помощью дитизона используются не только для определения микроколичеств элементов, но и для установления титра раствора дитизона в четыреххлористом углероде (стр. 96—97), для косвенного экстракционного титрования других металлов группы дитизона (Hg, Pd, Cd и Pb), для косвенного определения анионов (раздел г, 4), а также для определения веществ, восстанавливающих Ag+ (раздел г, 3).
Фишер и сотрудники [352] определяли содержание Ag+ в олигодинамически действующей воде; Курода [4214] пользовался дитизоном для определения Ag+ в минеральных водах, содержащих железо; Парьо и Арши-нар [5227] определяли этим методом растворимость серебра в чистейшей воде, из которой удалены растворенные газы.
* Возможно спектрофотометрическое определение серебра с применением в качестве реактива дитизоната меди по смешанной окраске дитизонатов серебра и меди [581]. Хара [5827] предложил фотометрический метод определения серебра с использованием спиртового раствора дитизона. — Прим. ред.
158
Применение дитизона в количественном анализе
Метод с дитизоном применялся в качестве скоростного микрометода для определения серебра и благородных металлов. Так, Шима [5335] определял серебро и золото в рудах, Эрдей и Флепс [5419, 5422] — серебро, палладий, платину, золото и медь, Фридеберг [553] — серебро наряду с ртутью и медью.
Следы серебра определяли в ряде металлов и их сплавов: Фишер и Леопольди [352] определили в меди 10~2% серебра (раздел г, 1), в висмуте, цинке и его сплавах [3826] (раздел г, 2), в кадмии, свинце, мышьяке и сурьме было найдено от 10-4 до 10~5% серебра с относительной точностью в несколько процентов. Эрдей, Ради и Флепс [5422] определили 10-3% серебра в присутствии меди, цинка и свинца. Определение проводили при pH 4—5 и применении комплексообразователя — этплендиамин-тетрауксусной кислоты *.
В гомеопатических средствах следы серебра определяли Блейер, Нагаль и Швайболд [3912], а также Райт и ван Дик [4010].
Иванчев [507] разработал косвенные методы определения цинка в окиси цинка (раздел г, 3) и С1" в селене (раздел г, 4). Кирстен [5522] определял малые количества С1_, В г", J~ и S2~ с помощью обменных реакций с раствором AgHDz в этилацетате и последующим фотометрическим определением выделившегося эквивалентного свободного дитизона при 598 лф **.
* Влияние этилендиампнтетрауксусной кислоты (комплексон III, трилон Б) на повышение специфичности дитизонового метода определения серебра экстракционным титрованием изучали также Горюшина В. Г. и Гайлис Е. Я. [5630]. Синякова С. И. и Цветкова Л. А. [603] предложили метод определения DIO-3 — 2- 10~5% серебра в металлическом висмуте.
Лю-Бик-У [597] описал метод определения серебра в висмуте и его соединениях, основанный на экстрагировании дитизоната серебра при pH 3—3,5 в присутствии комплексона III. Метод позволяет определять 1—40 мкг серебра в присутствии 105-кратных количеств Си. Bi и РЬ.
Чернихов Ю. А. и Добкина Б. М. [5633] определяли серебро (а также кадмий) в цирконии. Макарьянц А. 14. и Заглодина Т. В. [5646] определяли 10~3—10~4% серебра (а также меди) в свинце методом экстракционного титрования. — Прим. ред.
** Миллер А. Д. и Аранович М. II. [604] определяли малые концентрации цианидов в сточных водах с помощью дитизоната се
Определение металлов группы дитизона. Серебро
159
г) ПРИМЕРЫ
1. Определение серебра в меди [352]
В 0,5 г меди можно определить 1 • 10-2% Ag с точностью ±5%.
Реактивы
Азотная кислота, 8 н. раствор.
Азотная кислота, 2 н. раствор.
Мочевина.
Дитизон, 25 мкМ раствор в четыреххлористом углероде. 1 мл =s 2,7 мкг Ag+.
Серная кислота, 0,2 н. раствор.
Тиоцианат калия, 2%-ный раствор.
Ход определения. Растворяют 1 г меди в 8 н. растворе азотной кислоты, упаривают раствор до густого сиропа, разбавляют 100 мл воды и кипятят до удаления окислов азота; добавляют немного мочевины и еще кипятят в течение 2 мин. Раствор охлаждают, добавляют 8 н. азотной кислоты, чтобы раствор стал 2 н. по азотной кислоте, и разбавляют водой до 200 мл. В делительной воронке встряхивают 100 мл этого раствора с отдельными порциями дитизона до тех пор, пока последний экстракт не приобретет чисто фиолетовую окраску, присущую Си (HDz) 2, т. е. не должен проявляться буроватый оттенок смешанной окраски, обусловленный смесью AgHDz + Си (HDz) 2.
Органические экстракты собирают в другой делительной воронке и промывают 50 мл 2 н. раствора азотной кислоты, после чего три раза разлагают дитизонат смесью 5 мл раствора тиоцианата калия и 1 мл 2 н. азотной кислоты.
Водные растворы после разложения дитизоната, собранные в третьей делительной воронке, промывают 10 мл четыреххлористого углерода и выпаривают досуха
ребра. Сутер и Хадори [5823] разработали микрометод определения хлоридов в чистом селене, подобный методу Иванчева, согласно которому хлориды осаждают в виде AgCl, осадок фильтруют, серебро в нем восстанавливают до металлического, растворяют в HNO.3 и определяют экстракционным титрованием. — Прим. ред.
160
Применение дитизона в количественном анализё
в фарфоровой чашке. Остаток обрабатывают 2—3 мА серной кислоты и снова выпаривают. Остаток растворяют в 2—3 мл 2 н. раствора азотной кислоты и разбавляют водой до объема 20 мл. В полученном растворе содержание Ag+ определяют методом экстракционного титрования.
2. Определение серебра в цинке [352, 3826]
В 2 а цинка можно определить 1 • 10~3 4% Ag с точностью ±10%. . t
Реактивы
Дитизонат меди, 25 мкМ раствор в четыреххлористом углероде. 1 мл =з 2,7 мкг Ag+.
Раствор готовят, как описано в разделе б, 1, вариант (стр. 154).
Ход определения. Цинк растворяют, как описано в разделе г, 4 (стр. 213), и устанавливают в растворе pH 1—2.
Аликвотную часть раствора, содержащую примерно 10 мкг Ag+, помещают в смесительный цилиндр, добавляют отдельные порции раствора дитизоната меди и каждый раз 30 сек. встряхивают. Добавление реактива и встряхивание продолжают до возникновения отчетливой смешанной окраски между желто-оранжевой и оранжево-фиолетовой. Интенсивность окраски определяют по аналогично приготовленной шкале сравнения или сравнительным титрованием.
3. Косвенное определение металлического цинка наряду с окисью цинка
10 мкг цинка можно определить с точностью 1-2%.
Реактивы
Ацетат серебра.
Уксусная кислота, 0,05 н. раствор.
Уксусная кислота, 1 н. раствор.
Азотная кислота, 2 н. раствор.
Ход определения. Пробу испытуемого раствора, содержащую несколько микрограммов цинка, помещают
Определение металлов группы дитизона. Серебро
161
в центрифужную пробирку, добавляют 1 г ацетата серебра, 5 мл разбавленной уксусной кислоты и оставляют при комнатной температуре до утра Г После этого раствор доводят до кипения, центрифугируют, отсасывают жидкость и промывают осадок достаточным 2 количеством 1 н. раствора уксусной кислоты. Металлическое серебро растворяют в азотной кислоте и разбавляют раствор водой. Серебро определяют экстракционным титрованием.
Примечания
1 При микроанализе цинковой пыли определенного состава удается, подбирая мягкие условия для растворения цинка и поддерживая низкую кислотность, осуществить с 98—99% выходом осаждение
Zn | + 2Ag+MH —> 2Ag | + Zn2B+н,-
2 Промывку свежими порциями уксусной кислоты ведут до отсутствия А£+-ионов в последней промывной воде. Обычно это достигается после 3—5-кратной промывки порциями уксусной кислоты по 10 мл.
4. Косвенное определение хлоридов в селене [507]
В 0,2 г селена можно определить 2- 10-2% С1“ с точностью ± 5% Ч
Реактивы
Нитрат серебра, 30%-ный раствор.
Азотная кислота, 15 н. раствор.
Едкий натр, 20 н. раствор.
Гидразинсульфат, 0,5 н. раствор.
Ход определения. В центрифужную пробирку емкостью 15 мл помещают 200 мг селена, добавляют каплю раствора нитрата серебра2 и 2 мл азотной кислоты 3 и, установив колбу наклонно 4 на песочной бане, нагревают5 до полного растворения селена. При этом выделяются хлопья хлорида серебра 6.
Добавляют при встряхивании осадка 8—10 мл горячей дистиллированной воды и центрифугируют в течение 1—2 мин. С помощью капиллярной пипетки, стараясь не задеть осадка, отсасывают жидкость так, чтобы в пробирке оставалось ее не более 0,2 мл. Такую промывку повторяют 3 раза. После добавления 4 капель раствора
Ц Зак. 2157.
162
Применение дитизона в количественном анализе
едкого натра и 0,5 мл раствора гидразина умеренно нагревают пробирку на песочной бане до тех пор, пока хлорид серебра не восстановится до металлического серебра. Темно-серый губчатый осадок серебра промывают при перемешивании, как описано выше, 4 порциями горячей дистиллированной воды по 8 мл каждая. Растворяют серебро в 5 каплях азотной кислоты. Раствор с помощью 10—20 мл воды переводят в делительную воронку и определяют содержание Ag+ методом экстракционного титрования.
Примечания
1 Аналогично могут быть определены Вг~-ионы. При определении J--hohob следует учитывать легкость их окисления до JO^~.
2 При введении большого избытка ионов Ag+ снижается растворимость хлорида серебра и предотвращается улетучивание С1_-ионов.
3 Азотная кислота не должна содержать С1~-ионов. При необходимости следы хлоридов можно удалить путем перегонки кислоты над нитратом серебра. Применение дымящей азотной кислоты сокращает продолжительность растворения.
4 Не следует нагревать верхнюю половину центрифужной пробирки, так как она выполняет роль конденсатора.
5 До тех пор, пока присутствует еще не растворенный селен, раствор кипит без задержек с одновременным выделением окис-лов азота; 0,2 г селена растворяются примерно в течение 20 мин.
6 Вследствие большой концентрации электролитов и нагревания хлорид серебра коагулирует и выпадает в виде крупных хлопьев, которые из-за большого содержания азотной кислоты остаются белыми даже на свету; включения в виде темных точек свидетельствуют о присутствии нерастворенного селена. Полученный раствор следует быстро подвергнуть дальнейшей обработке до того, как начнут выпадать кристаллы селенистой кислоты и солей серебра.
РТУТЬ
а) ОБЩИЕ СВЕДЕНИЯ
Ион Hg2+ при действии дитизона может образовывать как однозамещенный оранжево-желтый дитизонат Hg(HDz)2, так и двузамещенный фиолетово-красный дитизонат HgDz:
HgBoAH. “h 2H2Dzopr. Hg (HDz)2 орг. H- 2Нводн. > (I)
НСдн. + Н&(НО2)2орг. 2Н§°2орг.+2Нв+одн., (П)
HgBoAH. 4“ H2DzOpr. 4 HgDZopr. 4"2Нводн.. (Ill)
Определение металлов группы дитизона. Ртуть
163
Оба комплексных соединения не растворимы в воде, но растворяются в органических растворителях, образуя растворы указанных выше окрасок.
Образование Hg(HDz)2 сначала идет быстрее, но с уменьшением концентрации обоих компонентов процесс замедляется. Он идет медленнее, чем образование AgHDz, и для его осуществления требуется кислая среда. Избыток дитизона ускоряет реакцию. При выполнении этого последнего условия реакция протекает количественно по уравнению (I) даже в разбавленных растворах солей ртути. Эти обстоятельства использованы Г. Фишером [353] при разработке определения Hg2+ методом косвенного экстракционного титрования (раздел 6,1).
При действии дитизона на ртутьорганические соединения типа RHgCl (где R — органический радикал) также образуются интенсивно окрашенные соединения, экстрагирующиеся хлороформом:
CH3C6H4HgCl + H2Dz ^=± CH3C6H4HgHDz Д- НС1. (IV)
Эта реакция тоже была использована для определения Hg2+-HonoB [5129, 5426, 559].
Для образования HgDz требуется нейтральная или щелочная среда. В присутствии избыточного количества Hg2+-HonoB этот дитизонат может образоваться и в слабокислой среде [353, 5023]. При понижении pH и особенно при добавлении дитизона HgDz мгновенно превращается в Hg(HDz)2.
HgDzopr. + H2Dzopr. —> Hg(HDz)2opr.. (V)
При встряхивании раствора Hg(HDz)2 в четыреххлористом углероде с водным раствором едкого натра временно возникает фиолетовая окраска, обусловленная HgDz. При расслоении фаз вновь возникает желтый Hg(HDz), [422].
Реакцию образования HgDz используют в качественном анализе для обнаружения ионов Hg2+ [ЗЗ4, 3 723]; эту же реакцию использовали для количественного определения ртути в присутствии ионов других металлов после маскирования последних с помощью пирофосфата.
Ион [Hg2]2+ также реагирует с дитизоном [353, 5023], причем в кислой среде образуется оранжево-желтый
11*
164
Применение дитизона в количественном анализе
дитизонат Hg2(HDz)2, а в щелочной среде или при избытке ионов [Hg2]2+ образуется фиолетовый Hg2Dz. Первый дитизонат хорошо растворим в органических растворителях, второй — едва растворим; в воде оба дитизоната не растворяются. Эти соединения не нашли широкого применения в анализе.
Наибольшее значение для анализов имеет однозамещенный дитизонат ртути. В растворе чегыреххлористого углерода Hg(HDz)2 образуется количественно в среде 10 н. серной кислоты и заметно не разлагается даже при обработке еще более концентрированной серной кислотой. В 1 н. растворе соляной кислоты он мало устойчив и полностью разлагается при увеличении концентрации кислоты. Образовавшийся Hg(HDz)2 очень устойчив в разбавленных щелочах, вследствие чего даже в 2 н. растворе едкого натра реакция
Hg(HDz)2opr. + ОНвоцн. <- — HgD Zopr.’-j— HDzBq£H> —|- H2O (VI) протекает очень медленно. Это дает возможность освободиться от свободного дитизона путем встряхивания с разбавленным аммиаком раствора Hg(HDz)2 + H2Dz в четыреххлористом углероде; Hg(HDz)2 при. этом практически не разлагается. Это обстоятельство положено в основу метода определения Hg2+ в одноцветном экстракте (раздел 6,4).
На рис. 18 приведен спектр поглощения Hg(HDz)2 в растворе четыреххлористого углерода. Максимум поглощения соответствует 485 Л1ц, при 620 мр, поглощение практически отсутствует, что делает возможным определение Hg2+ в экстракте смешанной окраски (оазделы 6,2, 6,3) *.
Раствор Hg(HDz)2 в четыреххлористом углероде очень чувствителен к действию света. При облучении раствор, окрашенный в оранжево-желтый цвет, быстро буреет, затем становится серым и, наконец, грязноватозеленым. При хранении в затемненном месте оранжево
* Более удобно определять ртуть по методу смешанной окраски с помощью нафтильного аналога дитизона — ди- р -нафтилтиокарбазона в связи с красной окраской ди-р-нафтилтиокарба-зоната ртути [388, 402, 463]; см. приложение «Аналоги дитизона», стр. 380, и дополнение редактора, стр. 414. — Прим. ред.
Определение металлов группы дитизона. Ртуть 165
желтая окраска медленно возвращается. При встряхивании с разбавленной кислотой изменение окраски в оранжево-желтую происходит мгновенно. Рейт и Гарри-тема [459] установили, что в присутствии примерно 2 н. раствора уксусной кислоты раствор остается устойчивым даже на солнечном свету.
Длина волны Л , m/j.
Рис. 18. Спектры поглощения Hg(HDz)2 и HgDz в растворе четыреххлористого углерода.
------25/2 мкМ. раствор Hg(HDz)>;- 250/2 мкМ раствор Hg(HDz)2; ------25 мкМ раствор HgDz; -------25 мкМ. раствор H2Dz.
Чувствительность к облучению уменьшают и другие кислоты, растворяющиеся в тех же растворителях, что и дитизон, причем действие этих кислот пропорционально их растворимости в четыреххлористом углероде или хлороформе. Так, разложение растворов дитизонатов на солнечном свету исключается в 2 н. уксусной, 1 н. пропионовой, 0,1 н. монохлоруксусной кислотах и даже в 0,03 н. трихлоруксусной кислоте. Более разбавленные растворы этих кислот предохраняют раствор от разложения под действием менее активного облучения.
Уменьшение чувствительности к свету имеет большое значение для одноцветного метода определения ртути (раздел 6,4). Следует всегда стремиться к уменьшению чувствительности раствора, поэтому, особенно в летнее время, рекомендуется работать в сильно затемненном помещении.
Раствор HgDz в четыреххлористом углероде также чувствителен к свету, особенно в присутствии щелочи. Происходит медленное превращение HgDz в Hg(HDz)2.
166 Применение дитизона в количественном анализе
Влияние посторонних анионов. Ионы С1" до 0,2 н. концентрации не мешают определению Hg2+ при условии, что по содержанию свободной серной кислоты концентрация раствора не превышает 1 н. Если хотят извлечь Hg2+ из раствора в виде Hg(HDz)2 четыреххлористым углеродом при более высоком содержании С1~-ионов, то необходимо понизить концентрацию кислоты [5023]. При pH 1—2 ртуть можно количественно экстрагировать еще при предельном соотношении Hg2+ : Cl" = 1 : 105. После предварительного экстрагирования ртути с помощью значительного избытка раствора дитизона в четыреххлористом углероде можно определять еще меньшие количества ртути *.
Ионы В г", CN~ и SCN- связывают Hg2+ в более прочное комплексное соединение, чем ионы С Г", поэтому, если их содержание достигает 0,01 н. концентрации, извлечение Hg2+ раствором дитизона в четыреххлористом углероде затрудняется, особенно при низких значениях pH.
Любые количества ионов J“ и S2~ мешают .извлечению ртути.
В растворах с pH < 5 даже малые количества ионов S2O3~ мешают извлечению ртути.
Влияние посторонних катионов. Ионы Ag+ мешают при любом их содержании, так как из кислого раствора они экстрагируются вместе с Hg(HDz)2. По своей окраске дитизонат AgHDz визуально и спектрофотометрически мало отличается от Hg(HDz)2, вследствие чего большее сродство ртути к дитизону не может быть использовано для определения конца титрования. Кроме того, при большом разбавлении наблюдается кажущееся уменьшение сродства. При одновременном присутствии ионов Cl", SCN~ и Вг_ ртуть может быть определена с удовлетворительной точностью наряду со 100-кратным
* Като, Такэи и Окагами [5648], изучая возможность определения малых количеств ртути в присутствии больших количеств С1“-ионов, пришли к заключению, что при pH ~2 присутствие СЕ-ионов не влияет на экстрагирование Hg2+ раствором дитизона в четыреххлористом углероде. Ими же изучено равновесие образования ртутного комплекса с «енолизированным» дитизоном и установлено, что это комплексное соединение устойчиво при pH 5—7. — Прим,, ред.
Определение металлов группы дитизона. Ртуть
16?
количеством Ag+ только в определенном интервале концентрации. Смешанный экстракт, содержащий Hg(HDz)2 и AgHDz, можно обработать таким количеством С1“, SCN-, или Вг~, чтобы вызвать разложение только AgHDz (раздел г, 1). Можно отделить 104-кратные количества Ag+ осаждением их в виде хлорида или бромида и последующим фильтрованием или центрифугированием. При совместном осаждении, электролизе или восстановлении Ag+ и Hg2+ металлическую ртуть можно отделить перегонкой.
Любые количества Pd2+ экстрагируются совместно со ртутью. Если в испытуемом растворе содержатся соизмеримые количества ртути и палладия, то в смешанном экстракте, содержащем Hg(HDz)2 и Pd(HDz)2, после отделения свободного дитизона можно спектрофотометрически определять один ион в присутствии другого. Максимальное поглощение Pd(HDz)2 в четыреххлористом углероде соответствует 640 жц, а максимальное поглощение Hg(HDz)2 — только 485 мц, причем поглощение дитизоната ртути в 3,5 раза сильнее, чем поглощение дитизоната палладия. При большем содержании палладия его можно отделить встряхиванием с хлороформным раствором диметилглиоксима.
Любые количества иона Аи3+ мешают определению, и поэтому золото следует отделить либо селективным восстановлением, либо совместным восстановлением с Hg2+, после чего ртуть селективно переводят в раствор с помощью азотной или серной кислоты.
В кислых растворах сродство Сп2+ к дитизону значительно слабее сродства Hg2+. Поэтому медь реагирует с дитизоном намного позже ртути. Эта реакция заметно протекает лишь в 1 н. растворе серной кислоты, когда содержание меди в растворе в 1000 раз превышает содержание ртути. С увеличением кислотности раствора это соотношение становится более благоприятным. После предварительной экстракции можно определять ртуть при ее соотношении с медью 1 : 105 (см. раздел г, 2).
По данным Барнеса [455, 466, 4710], ионы Си2+ связываются в прочное комплексное соединение раствором Кз[Со(СМ)б], причем избыточное количество реактива не мешает экстрагированию Hg2+. Согласно Фриде-
168 Применение дитизона в количественном анализе бергу [553], этилендиаминтетрауксусная кислота в кислой среде является слабым комплексообразователем для ионов Си2+.
Лауг и Нелсон [429] извлекают совместно Hg2+ и Си2+ и переводят Hg2+в водную фазу в виде K2HgBr4 встряхиванием экстракта с подкисленным раствором бромида калия. Доводят водный раствор до рН~6 и экстрагируют ртуть раствором дитизона. Способ применим только в узких пределах концентраций. Винклер [3819, 4510], а также Клайн [5236] извлекали из экстракта, содержащего дитизонаты ртути и меди, в водную фазу только ртуть в виде комплексного соединения путем встряхивания с 1,5%-ным сернокислым раствором Na2S20s; далее комплекс разлагали раствором КМпО4 и H2SO4. Козелка [4716] обрабатывал 9 н. раствором NH4OH смесь Си (HDz) 2 и Hg(HDz)2; при этом разлагался только дитизонат меди *.
При pH < 0 ионы Bi3+, In3+, Zn2+, Cd2+, Co2b, Ni2+, Pb2+ и Tl+ не мешают экстрагированию Hg2+. Для отделения ртути или для ее концентрирования можно использовать летучесть металлической ртути (в токе водорода) или летучесть HgCl2 [4716, 561, 5620].
б) ОСНОВНЫЕ МЕТОДЫ ОПРЕДЕЛЕНИЯ
L Косвенное экстракционное титрование [353]
Реактивы
Дитизон, 25 мкМ раствор в четыреххлористом углероде. 1 мл = 2,51 мкг Hg2+.
Уксусная кислота, 2 н. раствор.
Нитрат серебра, 25 мкМ раствор 0,1 н. по азотной кислоте.
Серная кислота, 2 н. раствор.
Титрованный раствор соли ртути (И), 25/2 мкМ раствор HgCl2. 1 н. по серной кислоте. 1 мл содержит 2,51 мкг Hg2+.
* Айзекс, Морис и Стакки [5723] отделяли дитизонат ртути от дитизонатов меди и цинка хроматографированием смеси их в колонке с окисью алюминия. — Прим. ред.
Определение металлов группы дитизона. Ртуть 169
Ход определения. Помещают 20 мл испытуемого раствора в делительную воронку, разбавляют 20— 30 мл воды и добавляют 5 мл уксусной кислоты. Из бюретки приливают отдельные порции раствора дитизона, каждый раз встряхивая, до тех пор пока от прибавления последней порции после 20 сек. встряхивания раствор не сохранит чистую зеленую окраску. Записывают количество израсходованного раствора дитизона. Водную фазу промывают несколькими каплями раствора четыреххлористого углерода.
К объединенным органическим экстрактам в другой делительной воронке добавляют 10 мл раствора нитрата серебра, 2 мл серной кислоты, 25 мл воды и в течение 5 сек. энергично встряхивают. Органическую фазу полностью отделяют, промывая водную фазу некоторым количеством четыреххлористого углерода, и отбрасывают ее. В оставшемся водном растворе определяют избыточное количество Ag+-HOHOB прямым экстракционным титрованием раствором дитизона.
Расчет приведен на стр. 112. Точность определения ±0,5%.
Концентрированные растворы солей ртути (II), содержащие, например, 10—15 мкг/мл Hg2+, можно также быстро определить прямым экстракционным титрованием 50—10 мкМ раствором дитизона в четыреххлористом углероде. Способ дает возможность ^определять ртуть с точностью, превышающей ± 1 % от общего содержания ртути. Определению не мешают 10-кратные по сравнению с Hg2+ количества Си2+. Переход окраски — от красной к фиолетовой.
2. Визуальное колориметрическое определение по смешанной окраске [353]
Реактивы
Дитизон, как в разделе б, 1.
Серная кислота, как в разделе б, 1.
Уксусная кислота, 6 н. раствор.
Раствор соли ртути, как в разделе б, 1.
170 Применение дитизона в количественном анализе
Ход определения. Помещают 2 мл испытуемого раствора в пробирку для колориметрирования, подкисляют пробу серной кислотой, чтобы она стала 0,5 н. по кислоте, и прибавляют равное количество уксусной кислоты. Раствор дитизона прибавляют из бюретки по каплям и каждый раз энергично встряхивают. Органическая фаза все время окрашивается в оранжево-желтый цвет, присущий Hg(HDz)2, пока избыток дитизона не придаст ей зеленую окраску. Титрование заканчивают, когда раствор приобретает четкую переходную окраску от оранжево-желтой к зеленой. Записывают количество израсходованного раствора дитизона.
В другую пробирку для колориметрирования помещают такое же количество дитизона и титруют титрованным раствором соли ртути до той же окраски, которая была достигнута при титровании испытуемого раствора. Точность определения ±3%.
Вместо такого сравнительного титрования можно пользоваться шкалой сравнения, что дает более надежные результаты.
Способ особенно применим для определения следов ртути (менее 1 мкг). При исследовании очень разбавленных растворов для их концентрирования применяют фракционированную экстракцию. Объединенные экстракты помещают в пробирку и колориметрируют. Таким способом можно определять 1 мкг Hg2+ в 100 мл раствора с точностью, превышающей ±10% *.
3. Спектрофотометрическое определение по методу смешанной окраски
Реактивы, как в разделе б, 2.
Ход определения. Помещают 5 мл испытуемого раствора в делительную воронку и доводят объем жидкости до ~20 мл, добавляя воду и серную кислоту в таком количестве, чтобы раствор стал 0,5 н. по серной кислоте. После этого добавляют 5 мл уксусной кислоты, 10 мл раствора дитизона и в течение 10—20 сек. энергично встряхивают. Добавляют к раствору 10 мл четыреххлористого углерода и вновь встряхивают. После раз-
* См. примечания редактора на стр. 164 и 174.
Определение металлов группы дитизона. Ртуть
171
деления фаз органический слой спускают в кювету. Фотометрируют при 620 л/р, сравнивая с чистым растворителем. Для контроля можно провести измерение еще при 485 мр, сравнивая с чистым раствором реактива, разбавленным, как и в первом случае, четыреххлористым углеродом. Точность определения ±2%.
Вариант [497]. В качестве реактива пользуются раствором дитизона в хлороформе, экстрагируют, как описано выше, и разбавляют жидкость определенным количеством хлороформа. Часть экстракта смешанной окраски непосредственно колориметрируют при 605 л/р. К другой части экстракта добавляют раствор йодида с рН~4 (10,2 г однозамещенного фталата калия + 30 г йодида калия разбавляют водой до объема 500 мл), встряхивают и фотометрируют отделенный органический слой при 605 л/р. По увеличению поглощения, обусловленному разложением Hg(HDz)2 ( см. раздел б, 4, вариант), определяют содержание Hg2+.
Разложение Hg(HDz)2 в хлороформном растворе при добавлении раствора йодида протекает селективно еще в присутствии 20-кратного количества Си2+.
4. Спектрофотометрическое определение по методу одноцветной окраски [353]
Реактивы, см. раздел б, 2.
Аммиак, 0,015 н. раствор.
Уксусная кислота, 2 н. раствор.
Ход определения. В делительную воронку помещают 20 мл исследуемого раствора и добавляют серную кислоту, чтобы раствор стал 0,5 н. по кислоте; титруют при встряхивании раствором дитизона до появления в последнем экстракте устойчивой зеленой окраски. Объединенные экстракты собирают в другую делительную воронку, разбавляют1 определенным количеством четыреххлорнстого углерода и промывкой аммиаком2 освобождают его от избыточного свободного дитизона 3. Добавляют 10 мл уксусной кислоты4, короткое время встряхивают и отделенную органическую фазУ фотометрируют при 485 л/р. Точность определения ±3%.
172 Применение дитизона в количественном анализе
Примечания
1 Ср. с примечанием 1 на стр. 155.
2 Ср. с примечанием 2 на стр. 155, применив все соответственно к Hg2+ (вместо Ag+).
3 Ср. с примечанием 3 на стр. 155.
4 Встряхивание с уксусной кислотой делает раствор Hg(HDz)2 в четыреххлористом углероде менее чувствительным к действию света.
Вариант. Стабилизированный уксусной кислотой оранжево-желтый раствор Hg(HDz)2 в четыреххлористом углероде разлагают сернокислым раствором йодида калия:
Hg(HDz)2opr. + 2HJ водн. HgJ2 водн. —2H2Dzopr,.
При этом органическая фаза окрашивается в зеленый цвет. Промывкой разбавленной сернистой кислотой ее освобождают от йода и фотометрируют при 620 л/ц. На этот способ затрачивается больше времени, чем на предыдущий *.
в) ПРИМЕНЕНИЕ
Определение ртути в виде Hg(HDz)2 является очень чувствительным методом, с помощью которого получаются воспроизводимые результаты. Для проведения определения требуется меньше навыков, чем при использовании старого классического способа Штока. Способ дает возможность определять ртуть наряду с любыми количествами селена и теллура. Следует иметь в виду, что следы ртути часто имеются в реактивах (НС1, КМ11О4 и др.).
Королев [5023] и Уаттенберг [4310] описали определение Hg2+ в морской воде, т. е. в присутствии больших количеств хлорида натрия и некоторого количества Си2+.
* В период возникновения дитизонового метода Вассерман Е. С. и Супрунович И. Б. [349] определяли ртуть (а также свинец и цинк) следующим образом: в делительную воронку помещали 5—10 мл водного слабощелочного насыщенного раствора дитизона (очищенного от следов тяжелых металлов, образующих ди-тизонаты), прибавляли 15 мл четыреххлористого углерода, встряхивали («холостой» опыт) и затем прибавляли анализируемый раствор. После встряхивания слой четыреххлорпстого углерода отделяли и колориметрировали с помощью колориметра погружения. — Прим, ред.
Определение металлов группы дитизона. Ртуть
173
Определение Hg2+ в присутствии антигнилостных препаратов (вещества, применяемые для защиты древесины от гниения) описали Барнес [465, 466, 4710] и Гофман [5025]. Рейт и ван Дик [4010] определяли Hg2+ в гомеопатических препаратах.
Кузятина [3914] для определения ртути в воздухе поглощала пары ртути раствором 0,1 н. КМпО4 + + 2 н. H2SO4. Чувствительность метода составляет 0,05 мкг Hg2+. Этот способ был успешно использован Пьянковым [4911] и Чолаком и Хаббардом [463] *.
Фишер и Леопольди [4110] подробно исследовали способы определения ртути в металлах, например в серебре (раздел г, 1), палладии, меди (раздел г,2), висмуте, цинке (раздел г, 3), кадмии и свинце. Определение следов ртути в присутствии олова связано с определенными трудностями [4110]. Фридеберг [53]3 определял Hg2+ в смеси с серебром и медью. Энсслин, Дрейер и Лессман [561], а также Дрейер и Лессман [5520] занимались определением ртути в рудах и продуктах металлургических заводов, главным образом в цинковой обманке и производственной пыли**.
При анализе всех биологических материалов приходится считаться с присутствием Си2+. В анализах мочи (раздел г, 4) органические вещества разрушают кипячением со смесью H2SO4 + КМпО4 [3919, 463, 472, 5533]. Ролф, Рэс-сел и Вилкинсон [555] разлагали мочу под давлением смесью HNO3 + КМпО4. Рейт и ван Дик [4014] пользовались для разложения смесью НС1 + КСЮ3 и осаждали Hg2+ в виде сульфида ***. В работе Вайнера и
* Кимура и Миллер [605] применили дитизон для раздельного определения ртути в парах метил- или этплртутп в присутствии паров металлической ртути. Дру и Кинг [5729] описали усовершенствованный метод определения ртути в воздухе. — Прим. ред.
** Кроужек Е. и Повондра П. предложили определять небольшие количества ртути в ископаемом сырье и для точного контроля хода обжига бедных ртутных руд [582].
Рот [5724] определял ртуть в чесноке, Аббот и Джонсон [5725] определяли ртуть в яблоках, Дейк и Слотхаувер [5741] — в биологических материалах и пищевых продуктах. — Прим. ред.
*** Миллер и Суонберг [5720] к пробе мочи добавляют катализатор (6 н. НС1, содержащая в 100 мл раствора 1 г ЕеС1з* 6Н2О и 2 г KCr(SO4)2 • 12Н2О при разрушении органических веществ кипячением с Н2О2 — Прим. ред.
174
Применение дитизона в количественном анализе
Мюллера [5532] имеются указания об устранении мешающих примесей, когда в моче одновременно присутствуют соединения, содержащие сульфгидрильную группу (например, салиргановая кислота и цистеин) *.
Твердые органические соединения Чолак и Хаббард [463], Клайн [5236] и Симонсен [532] минерализовали путем кипячения с обратным холодильником со смесью H2SO4 + HNO3. После отделения жиров фильтрованием дальнейшее разложение осуществляли с помощью KM.nO4 [3511, 463, 567]. Козелка [4716] и Вайнер и Мюллер [5532] концентрировали Hg2+ путем отгонки в виде HgCl2 из концентрированного сернокислого раствора (NH4)2SO4, через который пропускали газообразный хлор.
Критическую оценку методов определения Hg2+ сделал в своей работе Клайн [5016]. Более старый обзор методов определения Hg2+ принадлежит Уичмэну [3617\ Полли и Миллер [559] определяли в биологических материалах и почвах ртуть, вносимую туда с фунгицидами. Они разрушали пробы смесью H2SO4 + Н2О2 и затем КМпО4; образовавшийся HgCl2 при pH 3—4 переводили с помощью (CH3C6H4)2Hg в СН3С6Н4Н^С1, извлекали последний хлороформом и добавлением дитизона получали дитизонат (см. стр. 163, уравнение IV). Избыток дитизона определяли фотометрически при 620 жц. Определяли также содержание ртути в яблочной шелухе [5123], в галоидозамещенных ртутьорганических соединениях [407].
* Лучшие результаты при определении ртути в биологических материалах (моче, крови), в воздухе и других объектах анализа получаются при применении нафтильного аналога дитизона — ди-р -нафтилтиокарбазона вследствие большей стабильности диф-на-фтилтиокарбазоната ртути в сравнении с дитизонатом, большей чувствительности реакции и других качеств как реактива, так и продукта реакции [402, 463, 5411].
Наряду с этим, по другим соображениям, некоторыми преимуществами при определении ртути в сравнении с дитизоном обладает также и другой аналог дитизона — о-дитолилтиокарбазон, предложенный в качестве реактива на тяжелые металлы Супрунови-чем И. Б. и Шамшиным Д. Л. [4611].
Такэи [5710], отмечая большую избирательность о-дитолилтио-карбазона к ртути и меди сравнительно с дитизоном, разработал методы их количественного определения с помощью этого аналога. Ртуть определяется в пределах 0—30 мкг с точностью ±1%. См. в приложении «Аналоги дитизона», стр. 380, и дополнение редактора, стр. 414.—Прим. ред.
Определение металлов группы, дитизона. Ртуть 175
По другому способу ртутьорганические соединения разлагали путем восстановления порошкообразным алюминием в щелочной среде [4312].
Штельгенс [5329] определял косвенным способом частицы креатинина в моче и крови, используя тот факт, что креатинин восстанавливает какую-то часть добавленной окиси ртути до металлической ртути. Оставшуюся окись ртути растворяют в разбавленной серной кислоте и определяют Hg2+ дитизоном.
Для отделения Hg2+ от больших количеств мешающих примесей пользуются обычно предварительной экстракцией раствором дитизона в четыреххлористом углероде или хлороформе. Полученный экстракт разлагают окислением или другим каким-либо способом *. В полученном водном растворе ртуть определяется просто (раздел г, 2), без каких-либо помех.
Если ртуть отделяют или концентрируют путем выпаривания или другими термическими способами, то следует помнить о летучести хлорида и металлической ртути. Сконцентрировать ртуть можно осаждением ее в виде сульфида (раздел г, 2). В качестве коллекторов следов ртути применяют CdS, CuS, As2S3 и др. Применяется также отгонка металлической ртути. Винклер [3919, 4019] осаждал Hg2+ из солянокислых биологических экстрактов вытеснением ее металлическим цинком.
г) ПРИМЕРЫ
1. Определение ртути в серебре [4110]
0,2% (5 мкг) ртути можно определять с точностью 10%.
Реактивы
Дитизон, 25 мкМ раствор в четыреххлористом углероде 1 мл = 2,5 мкг Hg2+.
Азотная кислота, 1 н. раствор.
Соляная кислота, 0,5 н. раствор.
* Если разложение производят с помощью бромистого водорода или бромида калия [496, 567], то ртуть переходит в водную фазу в виде K2HgBr4, откуда ее вновь извлекают при pH ^6 раствором дитизона.
176
Применение дитизона в количественном анализе
Ход определения. В делительную воронку помещают 20 мл испытуемого раствора, подкисляют азотной кислотой и, добавляя небольшие порции 1 раствора дитизона, проводят фракционную экстракцию. Органические экстракты спускают в другую делительную воронку, в которую предварительно влили 3 мл соляной кислоты. После добавления каждой порции экстракта раствор тщательно перемешивают. Экстракция считается законченной, когда выделяющийся из совместно увлеченного AgHDz свободный зеленый дитизон образует смешанную окраску2 с оранжево-красным Hg(HDz)2. Разбавляют экстракт определенным количеством органического растворителя и определяют колориметрически содержание Hg2+.
Примечания
1 Рекомендуется ориентировочное предварительное определение Hg2, чтобы знать примерные количества требующихся реактивов. Если с самого начала добавить больше дитизона, чем это соответствует количеству Hg2+, то реакция обмена между образовавшимся AgHDz и Hg2+ будет весьма затруднена. При малых концентрациях Hg2+ рекомендуется после каждой порции реактива энергично в течение 20 сек. встряхивать раствор.
2 При значительном содержании Hg2+ конец извлечения ионов Hg2+ и начало извлечения ионов Ag+ определяется по изменению тона окраски раствора (переход от оранжево-желтого в желтый). Чтобы точнее определить конец экстракции, можно каждый экстракт спускать в чистую пробирку и встряхивать с небольшим количеством соляной кислоты. Экстракты Hg(HDz)2 следует оберегать от сильного и длительного воздействия света. Для их десенсибилизации можно прибавлять уксусную кислоту (ср. раздел 6,4, стр. 171).
2. Определение ртути в меди [4110]
В 1 г меди можно определить 10-3% ртути.
Ионы Hg2+ в приблизительно 1 н. растворе азотной или серной кислоты реагируют с дитизоном раньше ионов Си2+. Если в подлежащем экстракции растворе соотношение Hg2+:Cu2+ больше 1 : 103, то ионы Си2+ все в большем количестве экстрагируются вместе с ртутью. Поэтому концентрацию Hg2+ в испытуемом растворе повышают предварительной экстракцией, после чего экстракт разлагают КМпО4 [4014]. В полученном таким образом водном растворе имеются значительные количе-
Определение металлов группы дитизона. Ртуть 177 ства Hg2+ наряду с относительно малым количеством Сн2+-понов, и поэтому ртуть можно без помех определять одним из ранее описанных способов.
Реактивы
Дитизон, 25 мкМ раствор в четыреххлористом углероде. 1 мл =5 2,51 мкг Hg2+.
Серная кислота, 1 н. раствор.
Перманганат калия, 1%-ный раствор.
Солянокислый гидроксиламин, 20%-ный раствор.
Ход определения. Подвергают фракционированному экстрагированию 20 мл испытуемого раствора, содержащего не более 100 мг Си2+ на 1 мкг Hg2+ и подкисленного до 0,5—1 н. концентрации по кислоте, до появления чисто фиолетовой окраски, обусловленной Си (HDz) 2, что свидетельствует об отсутствии Hg(HDz)2. Водный слой отбрасывают. Органические экстракты объединяют в другой делительной воронке, промывают 20 мл воды, добавляют 15 мл раствора серной кислоты и 1 мл раствора перманганата калия и примерно в течение 2 мин. встряхивают. При этом органическая фаза обесцвечивается, ртуть переходит в фиолетовый водный раствор, который обесцвечивают каплей раствора гидроксиламина. После разделения фаз органическую фазу подвергают аналогичной обработке, после чего ее отбрасывают. В объединенных водных экстрактах Hg2+ определяют одним из основных описанных методов.
Вариант 1 [553]. Вместо одновременного разрушения дитизонатов Hg(HDz)2 и Си (HDz) 2 кислым раствором перманганата их можно разрушить 6 н. раствором соляной кислоты, причем ионы Hg2+ и Си2+ переходят в водную фазу. После установления pH 2 можно экстрагировать дитизоном только Hg2+.
Вариант 2. По Барнесу [465, 466, 4710], можно непосредственно определять по методу смешанной окраски Hg2+ в присутствии 10—20-кратных количеств Си2+ (раздел 6,2 или 6,3), если маскировать ионы меди Кз[Со(СМ)б]. Для этой цели к 100 мл испытуемого раствора приливают примерно 5 мл свежеприготовленного 10%-ного раствора K3[Co(CN)6] и оставляют смесь на
12 Зак. 2157.
178 Применение дитизона в количественном анализе несколько минут. Слабое помутнение водной фазы не мешает определению.
Вариант 3. Миллер и Вахтер [505] растворяли медь и медные сплавы в смеси H2SO4 и Н2О2, восстанавливали ртуть до металла SnSCU и отгоняли ртуть. Затем ее растворяли в сернокислом растворе перманганата и избыток ионов МпОГ устраняли с помощью H2SO3. Количество Hg2+ определяли визуальной колориметрией экстракта смешанной окраски.
В 5 а металла можно определить 5 мкг ртути (1 • 10"4% Hg) с точностью до ±10%. Обычно получают пониженные результаты.
3. Определение ртути в цинке [4110]
Проба цинка, содержащая не менее 1 • 10~4% Hg, может включать до 0,01 % серебра и до 0,1% меди. Если меди в пробе содержится больше, то нужно пользоваться способом, приведенным в разделе г, 2.
При проведении фракционированного экстрагирования Hg2+-HOHOB раствором дитизона в кислой среде последовательность взаимодействия разных ионов с этим реактивом такова: Hg2+, Ag2+, Cu2+, Zn2+ и др. Поэтому экстрагирование продолжают почти до возникновения фиолетовой окраски, обусловленной Си (HDz) 2. Из объединенных экстрактов, содержащих весь Hg(HDz)2 и AgHDz, последний отделяют встряхиванием раствора с соляной кислотой:
AgHDzopr. + HCl
водн. AgCl водн. +H2Dzopr>.
Органическая фаза представляет собой смешанный экстракт, содержащий Hg(HDz)2 и H2Dz.
Если в цинке содержится мало серебра, то его добавляют, чтобы интервал между экстрагированием ртути и меди был достаточно велик.
Р е а к т и в ы
Дитизон, 25 мкМ раствор в четыреххлористом углероде. 1 лы==2,51 мкг Hg2+.
Азотная кислота, 5 н. раствор.
Аммиак, 5 н. раствор.
Определение металлов группы дитизона. Ртуть 179
Нитрат серебра 10 мкМ раствор, 0,1 н. по азотной кислоте. 1 мл содержит 10,8 мкг Ago
Соляная кислота, 0,5 и. раствор.
Ход определения. Растворяют 5 г металлического цинка примерно в 50 мл азотной кислоты. После упаривания раствора до половинного объема его разбавляют горячей водой до 50 мл, для разрушения HNO2 вносят 1 г мочевины, быстро доводят до кипения, охлаждают и после переливания в мерную колбу доводят объем до 100 мл.
В делительную воронку помещают 10 мл этого раствора, нейтрализуют его аммиаком до начала образования осадка, подкисляют азотной кислотой до посинения бумаги конго и дополнительно приливают еще 1 мл азотной кислоты. После добавления 5 мл раствора нитрата серебра доводят конечный объем раствора до 50—60 мл.
Добавляя отмеренные количества раствора дитизона и каждый раз энергично встряхивая в течение 30—60 сек., экстрагируют ртуть. Все экстракты, в том числе и еще имеющие чисто желтую окраску (AgHDz), собирают в другой делительной воронке и встряхивают с 3 мл соляной кислоты. В полученном смешанном экстракте ртуть определяют одним из основных колориметрических способов.
Г. Фишер и сотрудники [4110] определили аналогичным способом 3-1О~4О/о ртути в кадмии, свинце и висмуте.
4, Определение ртути в моче
В 1 л мочи можно определить 100 мкг Hg с относительной отрицательной ошибкой 5%.
Р е а к т и в ы
Дитизон, 25 мкМ раствор в четыреххлористом углероде. 1 мл = 2,51 мкг Hg2+.
Серная кислота, разбавленная, ~1 н. раствор.
Серная кислота, разбавленная, ~1 н. раствор.
Перманганат калия, кристаллический.
12*
180 Применение дитизона в количественном анализе
Перманганат калия, насыщенный раствор.
Солянокислый гидроксиламин, 20%-ный раствор.
Ход определения. В круглодонную колбу с вертикальным холодильником помещают 100 мл мочи1, 10 мл концентрированной серной кислоты, 15 г перманганата калия, несколько кипятильных камешков и кипятят смесь в течение 1—2 час. Если окраска перманганата исчезает, то добавляют шпателем еще перманганата калия до тех пор, пока фиолетовая окраска не сохранится после 10 мин. кипячения2.
После охлаждения к смеси приливают раствор гидроксиламина, чтобы избыток составлял не менее 1 мл, доводят до кипения и охлаждают до комнатной температуры. Помещают в делительную воронку 2—3 мл полученного раствора и исчерпывающе экстрагируют его 10 мл раствора дитизона в течение 1—2 мин., энергично встряхивая после добавления каждой новой порции.
Объединенные органические экстракты встряхивают в течение 2 мин. в делительной воронке с 15 мл разбавленной азотной кислоты и 1 мл раствора перманганата калия; при этом органическая фаза должна обесцветиться. Ртуть переходит в фиолетовую водную фазу, которую обесцвечивают добавлением нескольких капель раствора гидроксиламина. После разделения фаз слой четыреххлористого углерода еще раз обрабатывают аналогичным образом и отбрасывают.
В объединенном водном экстракте Hg2+ определяют одним из приведенных основных методов, причем надо учитывать присутствие Си2+ (ср. раздел г, 3), а также количество увеличенной ртути3.
Примечания*
1 На анализ берут часть суточной мочи.
2 В общем расходуют около 30 г перманганата калия.
3 Содержание Hg2+ в реактивах (КМпОД) определяют точно так же, но вместо мочи берут воду.
* При определении ртути в моче с помощью ди-р-нафтилтио карбазина в количествах, превышающих 50 мкг Hg2+, погрешность составляет ±2%. Для 5 мкг или менее ртути была достигнута точность ±0,2 мкг [402]. См. примечание редактора стр. 174.— Прим. ред.
Определение металлов группы дитизона. Палладий
181
ПАЛЛАДИЙ
а) ОБЩИЕ СВЕДЕНИЯ
Ион Pd2+ образует в кислой среде с раствором дитизона в органическом растворителе однозамещенный дитизонат палладия Pd(HDz)2 [уравнение (I)] грязного коричнево-зеленого цвета, который при растворении в органических растворителях дает раствор бледно-зеленой окраски. В щелочной среде получается двузамещенная соль палладия PdDz [уравнение (II)] в виде 6ypoj фиолетовых хлопьев, не растворимых во всех обычных растворителях. При недостатке дитизона комплекс PdDz образуется также и в кислой среде, но при избытке дитизона быстро превращается в Pd(HDz)2, согласно уравнению (Ш):
Р deoflH. + 2H2Dz0Pr. <
Pd(HDz)2opr. + 2НВОДн.»
PdB0+AH. + H2Dz0pr> PdDz; +2Нв+одн.,
PdDz; +H2Dzopr. Pd(HDz)2opr
(I) (П) (HI)
Для количественного определения ионов Pd2+ представляет интерес только соединение Pd(HDz) 2. Еще более медленно, чем при реакции со ртутью, протекает солеобразование в разбавленных растворах, вследствие чего требуются более концентрированные растворы и более продолжительное время реакции. При этом следует очень энергично и долго встряхивать. При некотором избытке дитизона реакция протекает по уравнению (I), при большом разбавлении медленно, но количественно. Используя эту особенность, Леопольди [512] разработала метод косвенного экстракционного титрования ионов Pd2+ (раздел 6,1).
Образовавшийся комплекс Pd(HDz)2 весьма стоек: он не разлагается даже при действии 12 н. раствора H2SO4 и устойчив к промыванию 2н. раствором NaOH. Разбавленный раствор сероводорода только очень медленно разрушает комплекс.
Кривая поглощения комплекса Pd(HDz)2 в четыреххлористом углероде состоит из трех почти одинаково хорошо выраженных максимумов адсорбции с длиной
182
Применение дитизона в количественном анализе
волн 640, 450 и 280 л/р, (см. рис. 19). В видимой области поглощение комплекса незначительно отличается от поглощения раствора дитизона соответствующей концентрации, вследствие чего колориметрическое определение по методу смешанной окраски мало чувствительно.
P и с. 19. Кривые поглощения растворов Pd (HDz)2 в четыреххлористом углероде.
-----------25/2 мкМ раствор Pd (HDz).,;- 250/2 мкМ раствор Pd (HDz)2; ---------------------------------------- 25 мкМ раствор H2Dz;- 250 .и/ъМ раствор H2Dz.
Для спектрофотометрических определений по методу смешанной окраски представляет интерес различие в поглощении между Pd(HDz)2 и раствором дитизона в четыреххлористом углероде при длине волн 620 л/р, или 280 л/р, (раздел 6,2). Спектрофотометрические определения по методу одноцветной окраски можно успешно проводить в присутствии AgHDz и Hg(HDz)2, превышающих количество палладия (раздел 6,3).
Раствор Pd(HDz)2 в четыреххлористом углероде очень чувствителен к свету, но менее, чем раствор Hg(HDz)2 в том же растворителе. Протекающая при этом реакция, по-видимому, обратима. Рекомендуется работать при сильно затемненном свете. Органические кислоты (уксусная и хлоруксусная) оказывают заметное влияние, но не достаточно десенсибилизирующее. Раствор Pd(HDz)2 в четыреххлористом углероде, покрытый раствором аммиака, почти светоустойчив.
Определение металлов группы дитизона. Палладии
183
Влияние посторонних анионов. Ионы J" и в особенности ионы S2- мешают определению ионов Pd2+, если присутствуют даже в незначительном количестве.
Влияние посторонних катионов. Ионы Ag+ экстрагируются вместе с ионами Pd2+. При спектрофотометрическом определении одноцветного раствора ионы Ag+, присутствующие в растворе в количестве, превышающем количество палладия, не мешают фотометрированию при длине волны 640 лгц.
В экстракте, содержащем Pd(HDz)2 и AgHDz, последний можно разрушить встряхиванием с 0,5 н. раствором соляной кислоты [512]. В полученном растворе, состоящем из Pd(HDz)2 и дитизона, содержание ионов Pd2+ можно определить по одному из основных методов (раздел б, 1—3). Так, например, можно определить ионы Pd2+ в присутствии 100-кратного избытка ионов Ag+.
При большом содержании ионов серебра ионы Pd2+ в виде Pd (глиоксим) 2 экстрагируют хлороформом и затем комплекс разрушают царской водкой.
Ионы Hg2+ экстрагируются совместно с ионами Pd2+. Присутствие Hg(HDz)2 также не мешает спектрофотометрическому определению Pd(HDz)2 при длине волны 640 жц. Большие количества ртути следует удалить в виде металла отгонкой.
Ионы Аи3+ мешают в любом количестве. Палладий можно отделить классическим методом.
Ионы Си2+ в кислом растворе проявляют значительно меньшее сродство к дитизону, чем ионы Pd2+, т. е. равновесие реакции сдвинуто в сторону образования дитизоната палладия Pd(HDz)2. Ионы P,d2+ еще можно определить в присутствии 104-кратного количества ионов Си2+. При большом избытке ионов Си2+ вначале появляется окраска, принадлежащая Си(HDz) 2, и лишь при длительном встряхивании происходит вытеснение меди. Поэтому экстрагирование проводят до тех пор, пока появляющаяся фиолетовая окраска комплекса Си (HDz) 2 при дальнейшем встряхивании остается без изменения. Затем ионы Си2+ вытесняются из Cu(HDz)2 ионами Ag-и Pd(HDz)2 фотометрируют при длине волны 640 жц.
Ионы Bi3+, In3+, Zn2+, Cd2+, Со2+, Ni2+, Pb2+, а также Т1+ при pH < 0 не мешают.
i 84
Применение дитизона в количественном анализе
б) ОСНОВНЫЕ МЕТОДЫ ОПРЕДЕЛЕНИЯ
1. Косвенное экстракционное титрование [512] Принцип метода см. б, стр. 168.
Реактивы
Дитизон, 25 мкМ раствор в четыреххлористом углероде. 1 мл ==1,33 мкг Pd2+.
Нитрат серебра, 25 мкМ раствор.
Серная кислота, приблизительно 2н. раствор.
Эталонный раствор соли палладия, 25/2 мкМ раствор PdCl2 в 0,5 н. растворе серной кислоты. 1 мл содержит 1,33 мкг Pd2+.
Ход определения. Вносят 20 мл испытуемого раствора в делительную воронку, туда же из бюретки порциями отмеряют раствор дитизона и энергично встряхивают до тех пор, пока последняя порция экстракта после 5 мин. встряхивания не будет оставаться изумрудно-зеленой. Объединенные органические экстракты обрабатывают 10 мл раствора нитрата серебра, 2 мл раствора серной кислоты и приблизительно 25 мл воды и сильно встряхивают в течение 10 сек. Нижний слой отбрасывают. В остающемся верхнем водном слое определяют избыточное количество ионов Ag+ прямым экстракционным титрованием.
Вычисление результатов см. стр. 112.
Точность определения ±2%.
Юнг [5111] определяет Pd2+ путем прямого экстракционного титрования с точностью ±10% (объемн.) в растворе примерно 10%-ном по соляной кислоте, в 20 мл которого содержится 10—20 мгк палладия и к которому в качестве восстановителя (стр. 188) прибавлен раствор двухлористого олова в соляной кислоте.
Конечную точку титрования определяют по переходу бледно-зеленой окраски раствора Pd(HDz)2 в изумрудно-зеленую, отвечающую окраске дитизона в четыреххлористом углероде. Раствор дитизона в четыреххлористом углероде устанавливают по эталонному раствору Pd2+ в условиях, аналогичных условиям проведения анализа испытуемого раствора.
Определение металлов группы дитизона. Палладий 185
2. Спектрофотометрическое определение по методу смешанной окраски
Реактивы
Дитизон, 50 мкМ раствор в четыреххлористом углероде, 1 мл = 2,67 мкг Pd2+.
Эталонный раствор Pd2+, аналогичный указанному в разделе б, 1.
Ход определения. Вносят 20 мл испытуемого раствора в делительную воронку, добавляют избыточное количество раствора дитизона и сильно встряхивают в течение 10 мин. Выделенный экстракт оставляют в кювете в абсолютной темноте на 5 мин. и фотометри-руют при длине волны 620 и 280 мр,. Точность определения ±3%.
3. Спектрофотометрическое определение по методу одноцветной окраски
Реактивы те же, что и в разделе б, 2, и кроме того: Аммиак, 0,03 н. раствор.
Серная кислота, приблизительно 0,5 н. раствор.
Ход определения. 20 мл испытуемого раствора экстрагируют в делительной воронке, постепенно добавляя отдельными порциями раствор дитизона до тех пор, пока изумрудно-зеленая окраска последней порции дитизона не останется без изменения после встряхивания в течение 10 мин.
Удаляют избыток дитизона из известного объема объединенной смеси органических экстрактов с помощью раствора аммиака 1 и фотометрируют 2 при длине волны 640 и 280 мр,. Точность определения ±3%.
Примечания
1 Если испытуемый раствор содержит, кроме ионов Pd2+, еще неблагородные металлы, реагирующие с дитизоном, как, например, ионы Cu2+, Bi3+, In3+, Zn2+, Cd2+ и т. п., то объединенный экстракт следует предварительно 2—3 раза промыть приблизительно 10—20 лм серной кислоты и, наконец, водой, чтобы удалить из него указанные ионы.
2 Присутствующие в испытуемом растворе ионы Ag+ и Hg2+ экстрагируются вместе с ионами Pd2+ и остаются в одноцветном экстракте. При фотометрировании при длине волны 640 мр определяется только Pd(HDz)2.
186 Применение дитизона в количественном анализе
в) ПРИМЕНЕНИЕ
Определение палладия дитизоном разработано только в последнее время, и имеются лишь недостаточно всесторонне испытанные примеры применения метода.
Леопольди [51 2] определяет палладии в сплавах, состоящих из серебра и меди. Юнг [51н] определяет палладий в присутствии серебра, золота, платины и тяжелых металлов.
ПЛАТИНА
а) ОБЩИЕ СВЕДЕНИЯ
Платина реагирует с дитизоном только в виде двухвалентного иона (Pt2+). В кислом растворе в органических растворителях она образует растворимую однозамещенную комплексную соль Pt(HDz) 2, окрашенную в коричнево-желтый цвет:
PteOAH ♦ + 2H2Dzopr. Pt(HDz)2opr. + 2Нв+оцн..
Эта реакция протекает достаточно быстро в 1,5 до 3 н. растворе соляной кислоты. Платина в растворе удерживается в виде двухвалентных ионов Pt2+ с помощью двухлористого олова в соляной кислоте.
Раствор дитизоната платины в четыреххлористом углероде образует три резко выраженных максимума поглощения при длине волн 710, 490 и 260 жц (см. рис. 20). При максимуме с длиной волны 710 жц свободный дитизон в четыреххлористом углероде поглощает незначительно, а при максимуме 620 жц, отвечающем поглощению дитизона в четыреххлористом углероде, Pt (HDz) 2 в четыреххлористом углероде поглощает в малой степени. Это теоретически благоприятно для спектрофотометрических определений по методу смешанной окраски. Однако возникающая вуаль * мешает фотометрирова-нию.
Наблюдения показали на возможность образования в органическом растворителе труднорастворимого двузамещенного дитизоната платины PtDz.
Определение металлов группы дитизона. Платина
187
Дитизонат платины весьма стоек к действию сильно концентрированных минеральных кислот, а также и щелочей.
Влияние посторонних анионов. Ионы S2~ мешают определению.
Влияние посторонних катионов. Ионы Ag+ и Hg2+ в присутствии большого количества соляной кислоты только в малой степени экстрагируются вместе с ионами Pt2+.
Р и с. 20. Кривые поглощения растворов Pt (HDz)2 в четыреххлористом углероде.
------- 25/2 лгагЖ раствор Pt (HDz)2; -25 мкМ раствор H2Dz;- 250 мкМ раствор H2Dz.
Ионы Pd2+ мешают, и их следует предварительно отделить.
Ионы Аи3+ мешают, и их также следует предварительно удалить. Их можно селективно выделить с помощью SO2 или щавелевой кислоты или сначала экстрагировать непосредственно раствором дитизона в четыреххлористом углероде в присутствии ионов Pt4+.
Ионы Си2+ не мешают экстракции ионов Pt?+ в сильнокислых растворах, даже если присутствуют в большой концентрации.
Остальные металлы, реагирующие с дитизоном и присутствующие в большой концентрации, также не мешают определению.
188
П рименение дитизона в количественном анализе
б) ОСНОВНЫЕ МЕТОДЫ ОПРЕДЕЛЕНИЯ
Прямое экстракционное титрование [5111]
Реактивы
Дитизон, 75 мкМ раствор в четыреххлористом углероде. 1 мл = 7,32 мкг Pt2+.
Соляная кислота, 2 н. раствор.
Раствор восстановителя SnCl2 в НС1; 8 г SnCl2 • 2Н2О растворяют в 18 мл теплого 12 н. раствора НС1, доводят до 30 мл и добавляют гранулированный цинк.
Эталонный раствор Pt4+ H2PtCle в 0,1 н. растворе НО, 1 мл содержит —5 мкг Pt4+.
Ход определения. К 5 мл испытуемого раствора в делительной воронке прибавляют 15—20 мл соляной кислоты, 0,3—0,5 мл раствора восстановителя, встряхивают и оставляют на несколько минут. Затем проводят экстракционное титрование раствором дитизона 1 до тех пор, пока коричнево-желтая окраска дитизоната платины в четыреххлористом углероде не перейдет в изумрудно-зеленую, соответствующую дитизону в четыреххлористом углероде. Точность определения ±10%.
Примечание
1 Раствор дитизона устанавливают по эталонному раствору.
в) ПРИМЕНЕНИЕ
Определение с помощью дитизона ионов Pt2+ является еще мало апробированным методом.
Юнг [51и] определяет 10—20 мкг платины в пробе при купелировании прямым экстракционным титрованием с точностью ±10% *.
* Горюшина В. Г. и Гайлис Е. Я. [5428] описали условия определения малых количеств платины в присутствии Cu2+, Hg2+, Au3+ и Ag+ методом экстракционного титрования. — Прим. ред.
Определение металлов группы, дитизона. Золото
189
ЗОЛОТО
а) ОБЩИЕ СВЕДЕНИЯ
Ионы Аи3+ реагируют с дитизоном как с образованием золотисто-желтой однозамещенной комплексной соли Au (HDz)з [5218, 343], так и двузамещенной комплексной соли [343] Au2Dz3 красно-коричневого цвета:
AUboah. -4-3H2Dzopr. < -- Au (HDz)sopr. ЗН^дн., 2АиВ0ДН. + 3H2Dzopr. -<— Au2Dz3Opr. “Н6НВОдН>.
(I)
(И)
О кинетике и характере равновесия этих реакций известно очень мало. Реакция по уравнению (I), по-видимому, протекает медленнее, чем реакция по уравнению (II). Образовавшийся дитизонат золота сравнительно устойчив в разбавленных щелочных растворах: на этом свойстве основано разработанное Эрдэем и Ради [52 18] фотометрическое определение одноцветного раствора, содержащего ионы Аи3+ (раздел 6,2).
В щелочном растворе преимущественно образуется красно-коричневый комплекс Au2Dz3, не растворимый в воде и трудно растворимый в четыреххлористом углероде [35 !]. Из растворов минеральных кислот с помощью раствора дитизона в четыреххлористом углероде выделяется экстракт красновато-желтого цвета с серо-коричневатыми хлопьями, сконцентрированными на границе четыреххлористый углерод — вода. С помощью дитизона в хлороформе получают прозрачный красновато-желтый экстракт. На основании израсходованного количества дитизона установлено, что эти экстракты представляют собой смесь, состоящую из Au (HDz) 3 + + Au2Dz3. В экстракте четыреххлористого углерода содержится преимущественно комплекс Au(HDz) 3, в хлороформном экстракте — преимущественно комплекс Au2Dz3. Состав экстракта меняется в зависимости от взятой концентрации исходного компонента и значения pH. В определенных значениях pH и определенных пределах концентраций органические экстракты в данном органическом растворителе имеют довольно идентичный состав, что позволяет использовать для многих целей
190
Применение дитизона в количественном анализе
прямое экстракционное титрование малых количеств ионов Аи3+Л в достаточной степени воспроизводимое [51й, 5218] (раздел б, 1).
Сродство ионов Аи3+ к дитизону в растворах минеральных кислот больше, чем сродство ионов Ag+. Поэтому можно определить малое количество ионов Аи3+ при титровании их раствором дитизоната серебра в четыреххлористом углероде [34 3]. Признаком взаимодействия является посветление окрашенного в интенсивно желтый цвет раствора дитизоната серебра в четыреххлористом углероде при переходе его в дитизонат золота светло-желтого цвета.
Поглощение растворов дитизоната золота сильно зависит от условий проведения опыта [35 !]. В видимом свете поглощение качественно напоминает поглощение обычных продуктов разложения дитизона, но для дитизоната золота оно больше [52 18]. При длине волн от 250 до 400 спектральная характеристика поглощения дитизоната золота заметно отличается. Максимум поглощения его лежит примерно при длине волны 450 жц (четыреххлористый углерод или хлороформ в качестве растворителя).
Растворы дитизоната золота чувствительны к свету. При хранении их на свету через 1—2 часа появляется зеленоватая окраска, позже снова переходящая в желтый цвет. Также при хранении дитизоната золота в темноте быстро появляются заметные изменения. Возможно, при этом происходит окисление дитизона. Под действием 0,5 н. раствора соляной кислоты из раствора дитизоната золота выделяется свободный дитизон.
Фишер [34 4, 40 6, 42 2] полагает, что ионы Аи+ также способны образовывать комплексные дитнзонаты.
Влияние посторонних анионов. Ионы S2~ и S2O3 мешают, если присутствуют в любом количестве.
Ионы CN~ мешают, присутствуя уже в малой концентрации.
Ионы СИ, Вт- и J“ не мешают *.
* По данным Горюшиной В. Г. и Гайлис Е. Я. [5338], наличие в растворе йодидов, бромидов и роданидов в некоторой мере препятствует извлечению золота дитизоном и при большой кон-
Определение металлов группы дитизона. Золото
191
Влияние посторонних катионов. Ионы Ag+ незначительно мешают в присутствии ионов С1" и особенно Вгд если их содержание не превышает 103-кратного количества. Большие количества ионов Ag+ следует выделить в виде галогенида *.
Ионы Hg2+ мешают в любом количестве. Небольшое содержание ионов Hg2+ можно замаскировать с помощью ионов J".
Ионы Pd2+ мешают в любом количестве.
Ионы Си2+ мешают начиная с 103-кратного избытка.
Ионы Bi3+, In3+, Zn2+, Cd2+, Co2+, Ni2+, Pb2+, а также Tl+ не мешают, если pH испытуемого раствора меньше 4.
В щелочном растворе ионы Аи3+ вытесняются из ди-тизонатного комплекса большим количеством ионов Zn2+.
Ионы Fe3+ можно связать фосфорной кислотой в комплекс, вследствие чего они не мешают, если их содержание не превышает 100-кратного количества.
б) ОСНОВНЫЕ МЕТОДЫ ОПРЕДЕЛЕНИЯ
1. Прямое экстракционное титрование [51ll, 5218]
Реактивы
Дитизон, 25 мкМ раствор дитизона в четыреххлористом углероде.
Серная кислота, приблизительно 2 н. раствор.
Эталонный раствор Аи3+, —100/3 мкМ раствор НАиС14 в 0,2 н. растворе НС1, 1 мл содержит ~6,5 мкг Аи3+.
центрации этих веществ может полностью предотвратить экстракцию. По их же наблюдениям, не полностью экстрагируется золото и в присутствии больших количеств хлорида натрия. — Прим. ред.
* Горюшина В. Г. и Гайлис Е. Я. [5338] показали, что дитизонат золота в отличие от дитизоната серебра не разлагается 10%-ным раствором хлорида натрия. Это различие они предлагают использовать для отделения золота от серебра путем обработки раствора дитизонатов этих металлов в СС14 раствором NaCl; дитизонат серебра при этом полностью разрушается и серебро переходит в водную фазу. — Прим. ред.
192 Применение дитизона в количественном анализе
Ход определения. К 5 мл испытуемого раствора 1 в делительной воронке прибавляют 2—3 мл серной кислоты и около 40 мл воды и проводят экстракционное титрование раствором дитизона2 до первой остающейся зеленоватой окраски3, не обращая внимания на появление буро-коричневатой вуали4!. Точность метода ±3%.
Примечания
1 100-кратное количество ионов Fe3+ можно еще замаскировать фосфорной кислотой Н3РО4. В присутствии бромида натрия также исчерпывающе маскируются ионы Ag+
2 Раствор дитизона устанавливают по стандартному раствору Аи3+ в условиях, аналогичных условиям проведения анализа испытуемого раствора.
3 При применении хлороформного раствора дитизона вместо раствора дитизона в четыреххлористом углероде получают прозрачный экстракт. Титрование протекает аналогичным образом. Уменьшается расход дитизона на титрование ионов Аи3+.
4 В присутствии ионов Си2+ в точке перехода появляется красно-фиолетовая окраска *.
2. Спектрофотометрическое определение пр методу одноцветной окраски [5218]
Реактивы
Дитизон, 50 мкМ раствор в хлороформе, 1 мл^ ~4 мкг Аи3+ (теоретически 1 мл Au(HDz)3s £=3,28 мкг Аи3+).
Серная кислота, приблизительно 2 н. раствор Аммиак, '0,015 н. раствор.
Эталонный раствор Аи3+, ~ 100/3 мкМ раствор HA11CI4 в 0,2 н. растворе НС1, 1 мл содержит ~6,5 мкг Аи3+.
Ход определения. К 10 мл испытуемого раствора в делительной воронке прибавляют 2—3 мл серной кислоты, приблизительно 40 мл воды и исчерпывающе экстрагируют избытком раствора дитизона. В последней операции извлечения встряхивание проводят около 2 мин. Соединенные органические экстракты
* Об определении золота путем экстракционного титрования см. также [5338] и [603]. — Прим. ред.
Определение металлов группы дитизона. Золото 193
оставляют на 10 мин. на затененном дневном свету и избавляются от избытка дитизона двукратным встряхиванием с раствором аммиака порциями по 10 мл. Известный объем желто-золотистого органического экстракта фотометрируют по отношению к четыреххлористому углероду при длине волны 450 дщ. 1 мкМ Аи3+ в 1 мл хлороформа соответствует модулю поглощения в среднем 0,12 см~\
Точность определения ±5%.
Определению мешает присутствие других металлов, образующих комплексы с дитизоном, вследствие чего требуется предварительное тщательное отделение ионов Аи3+.
в) ПРИМЕНЕНИЕ
Определение малых количеств золота с помощью дитизона проводится очень просто и быстро, причем достигается точность определения, достаточная для многих практических целей.
Эрдэй и Ради [5218] применяют экстракционное титрование (раздел б, 1) при быстром определении содержания золота в электролитическом шламе, в отходах производства, пирите, силикатных породах и в пробах чертой на золотых поделках (пример, раздел г, 1). Юнг [5111] определяет содержание золота в корольке после купелирования и сообщает об отделении или маскировании благородных металлов: палладия, платины и серебра. Фишер [343, 374] определяет с помощью раствора AgHDz в четыреххлористом углероде содержание золота в очень маленьких пробах из королька после купелирования способом по смешанной окраске. Шима [5335] определяет содержание золота, а также и серебра в рудах, после того как предварительно было выделено с помощью эфира золото в виде АнНВг4 *.
* Синякова С. II. и Цветкова Л. А. [603] разработали метод определения золота в висмуте с помощью экстракционного титрования раствором дитизона в четыреххлористом углероде в присутствии I н. соляной кислоты. Ими показано, что присутствие серебра несколько понижает результаты по золоту. При 10-кратном содержании серебра ошибка доходит до 13%. Для более четкого перехода
13 Зак. 2157.
194 Применение дитизона в количественном анализе
г) ПРИМЕРЫ
1. Определение общего содержания золота в золотых изделиях [5218]
Р е а к т и в ы
Соляная кислота, 12 н. раствор.
Азотная кислота, 15 н. раствор.
Дитизон, 25 мкМ раствор дитизона в четыреххлористом углероде.
Ход определения. Отбирают пробу чертой испытуемого материала в 200—300 мкг на неглазурован-ном и взвешенном фарфоровом черепке. Растворяют в царской водке, споласкивают черепок, многократно выпаривают раствор на водяной бане (в отсутствие пыли) с несколькими каплями соляной кислоты и переносят сиропообразный остаток с помощью 1 мл воды в центрифужную пробирку. При растворении в воде выпадает хлорид серебра, который и отцентрифугируют. Отбирают раствор, содержащий ионы Аи3+, и титруют (раздел 6,1) раствором дитизона.
Точность определения ±5%, что при определении общего содержания металла вполне достаточно.
ПОЛОНИЙ
Ионы полония Ро?+ можно экстрагировать из очень разбавленных растворов избытком дитизона в органическом растворителе в виде сложного дитизоната. Состав и цвет дитизонатов полония неизвестны * *.
Из слабокислых (0,4 н. НЫОз) или слабоаммиачных растворов, содержащих 10~8 мкг полония в миллилитре,
желтой окраски в конце титрования авторы предлагают вводить как индикатор медь 100 мкг), в присутствии которой после связывания всего золота дитизоном образуется дитизонат меди, окрашивающий последнюю порцию титрованного раствора в розовато-фиолетовый цвет (смесь дитизонатов серебра и меди) вместо зеленовато-желтого (в отсутствие меди). При этом следует учитывать только половину последней добавленной порции дитизона. — Прим. ред.
* По Бэгналлу [5749], дитизонат полония существует в виде соединения PoO(HDz)2, где полоний четырехвалентен. При 120° и давлении 1 атм это соединение возгоняется. — Прим. ред.
Определение металлов группы дитизона. Полоний 195
экстракция раствором дитизона в четыреххлористом углероде протекает практически количественно после 2—3 встряхиваний [5012, 554]. Раствором дитизона в хлороформе с содержанием в среднем 400 мкМ вещества и при pH от 0 до 5 можно проэкстрагировать около 95% полония, содержащего 10~4 мкг полония в миллилитре [509]. Содержание полония после отделения и упаривания органической фазы определяют радиометрически, т. е. получение дитизоната полония служит только для отделения и обогащения полония.
Ишимори и Сакагучи [5012] выделяют полоний из урановой смоляной руды. Последнюю они растворяют в 8 н. растворе HNO3, осаждают сульфиды, которые затем растворяют в царской водке, нейтрализуют, слабо подкисляют, цементируют полоний на никелевой жести, с которой и сублимируют его при температуре красного каления в токе СО или СО2. Сублимированный полоний растворяют в азотной кислоте и многократно встряхивают с раствором дитизона в четыреххлористом углероде. В другой работе [5617] Ишимори и Хатас определяют Po218(Ra-A) и Po2I0(Ra-F) в источниках радиоактивного излучения.
Буссьер и Феррадини [509] разделяют и очищают смесь, состоящую из Ra-D, Ra-E и Ra-F, т. е. Pb210, Bi210 и Ро210, встряхивая ее с 400 мкМ раствором дитизона в хлороформе при различных значениях pH. Для отделения полония от висмута они пользуются свойствами ионов Bi3+ образовывать комплекс с ионами С1“, причем образовавшийся комплекс Bi(HDz)3 разлагают с помощью 0,3—0,5 н. раствора соляной кислоты, в то время как дитизонат полония остается в органическом растворе.
Исследования Кимура и Маручи [554] позволяют предполагать, что дитизонат полония сублимируется при температуре выше 120° при атмосферном давлении *.
* Мабути [5647] показал, что с дитизоном взаимодействует также и теллур. Теллур количественно извлекается из солянокислых растворов в широком интервале концентраций НС1 избытком дитизона в четыреххлористом углероде. Зеленая окраска фазы СС14 изменяется при этом в желто-зеленую (зеленый оттенок
13*
196
Применение дитизона в количественном анализе
МЕДЬ
а) ОБЩИЕ СВЕДЕНИЯ
Ионы Си2+ образуют с дитизоном однозамещенную комплексную соль красно-фиолетового цвета [уравнение (I)] и двузамещенную соль [уравнения (II) и
желто-коричневую комплексную
'<>иводн. “I — 1 i2i>^opr.
Сиводн. Ч- Си (HDz)o орг.
водн
орг.
t Cu(HDz)2opr.+ 2НводН.?
- 2CuDzOpr. + 2Hj,4H.,
— CuDzopr.+2НВодН,.
(П)
(Па)
Обе комплексные соли растворяются в органических растворителях, образуя растворы с вышеупомянутыми окрасками, и не растворяются в воде.
По Фишеру [ЗЗ2, 374], аналогичным образом реагируют с дитизоном также ионы Си+ с образованием соответствующих одно- и двузамещенных комплексных солей. Последние не имеют аналитического применения. По Королеву [5023], комплекс CuHDz растворяется в четыреххлористом углероде с коричневой окраской, а комплексная соль Cu2Dz, напротив, трудно растворима в четыреххлористом углероде и придает фиолетовый цвет раствору, т. е. существует аналогия с комплексами AgHDz и Ag2Dz. По Фишеру [422], раствор CuHDz в четыреххлористом углероде устойчив в области от 3 н. раствора серной кислоты до pH 10.
Образованию комплекса Си (HDz) 2 благоприятствует кислая среда и избыток дитизона; комплекс CuDz получается предпочтительно в щелочном растворе и при недостатке дитизона. Поэтому в почти нейтральном растворе протекают одновременно и параллельно реакции по уравнению (I) и (II), а также (Па). При изменении pH среды и соотношений концентраций компонентов обе I соли очень медленно, но обратимо переходят одна I в другую. При соответствующем большом избытке ионов
вызван избытком дитизона). Максимум светопоглощения раствора комплекса теллура с дитизоном в четыреххлористом углероде лежит при 430 л/р.. Дитизонат теллура возгоняется при 12O'J и похож по свойствам на дитизонат полония. — Прим. ред.
Определение металлов группы дитизона. Медь
197
Си2+ и одновременно высокой их концентрации еще при pH 2 можно получить исключительно комплексную соль CuDz [521]. В органической фазе существует равновесие:
Си (HDz)2орг. CuDzopr. + H2Dzopr>. (Ill)
Сендэл и Гейгер [5225, 5328] установили, что приблизительно 10 мкМ раствор Си (HDz)2 в четыреххлористом углероде диссоциирован на 3% на комплекс CuDzopr H2Dzpr< (свободный дитизон) *. Реакция по уравнению (I) при большом разбавлении компонентов в растворе протекает весьма вяло. Она представляет собой, согласно Гейгеру [5225], реакцию третьего порядка, и ее скорость прямо пропорциональна концентрации ионов Си2+ и пропорциональна квадрату концентрации дитизона. С увеличением кислотности раствора равновесие устанавливается только в течение довольно продолжительного времени встряхивания [466, 5023].
Скорость реакции возрастает в 3—4 раза при изменении нормальности соляной кислоты от 1 н. до 0,01 н. [5328]. Поэтому работают с растворами по возможности с пониженной кислотностью (pH 2—4) и заботятся об избытке дитизона. Большей частью требуется интенсивное, механически осуществляемое встряхивание в течение достаточно длительного времени. При недостаточно известном составе испытуемого раствора приходится считаться с возможным присутствием в нем больших количеств ионов Bi3+, Со2+, Ni2+ и Zn2+, которые реагируют с дитизоном при pH 2—4, если присутствуют в больших концентрациях. Поэтому предварительно следует выделить основную массу ионов Си2+. Для этого сначала проводят фракционированную экстракцию весьма концентрированным раствором дитизона при более низком pH, при котором вышеперечисленные ионы металлов не реагируют с дитизоном и к концу экстракции используют большой избыток этого раствора
* Упомянутые авторы обстоятельно исследовали равновесия реакции дитизонатов меди (см. стр. 45 сл.) и пришли к следующему выводу: чтобы подавить диссоциацию по уравнению (III) на 1%, достаточно присутствия избыточного количества 1 мкМ. раствора ди-тизона в четыреххлористом углероде.
198
Применение дитизона в количественном анализе
дитизона. В полученном органическом экстракте комплексную соль Си (HDz)о разрушают, после чего в водном растворе определяют обычным образом ионы Си2+ с помощью раствора дитизона при pH 2—4.
Если ионы Си2+ находятся в 1 н. растворе соляной кислоты, то, чтобы проэкстрагировать - 99,9% ионов меди, следует пользоваться 300 мкМ раствором дитизона в четыреххлористом углероде. Если водный раствор 0,1 н. по соляной кислоте, то для достижения аналогичного эффекта экстракцией достаточно применить 30 мкМ раствор дитизона в четыреххлористом углероде; с помощью 10 мкМ раствора дитизона в четыреххлористом углероде достигают уже 99% экстракции ионов Сп2+. Сендэл и Гейгер [5328] рассчитывали с помощью известной константы равновесия в уравнении (I) (7<~1010) необходимую концентрацию раствора дитизона для достижения желаемой степени извлечения ионов Си2+ по уравнению
1НП1 -IH-M -_ / [Си (HDz)2]opr. 1 [ri2iJZ|Opr< [ ГТ ]ВОдн. I [Си2 + ]водп К ’
Комплекс Си(HDz)2 в четыреххлористом углероде разлагается 7 н. раствором серной кислоты [5028], а также 6 н. раствором соляной кислоты [4115]. При подкислении бурого раствора CuDz в органическом растворителе образуются красно-фиолетовый комплекс Си (HDz)2 в органическом слое и ионы Си2+ в водном растворе [уравнение (II)].
Благодаря не очень большой устойчивости в щелочном растворе комплекса Си (HDz) 2, полученного в кислом растворе, т. е. благодаря малому противодействию сильной щелочи к переходу Си (HDz)2 в CuDz и вследствие сдвига диссоциации по уравнению (III) опыты определения по методу одноцветной окраски на основе Си(HDz)2 требуют ограниченных узкой областью условий работы. Необходима исключительная тщательность при отмывании избытка дитизона; в то время как при pH 10,5 Си (HDz) 2 при 30-минутном встряхивании не обнаруживает заметных изменений, уже при pH 11,5 наступает быстрое превращение его в CuDz [374, 5023]. Фишер и Леопольди [ЗЗ2, 342], а также другие исследо-
Определение металлов группы дитизона. Медь 199 ватели [3515, 3916, 4013] применили с хорошим результатом метод одноцветной окраски для определения Си (HDz)2 (раздел 6,4)- Использованию метода одноцветной окраски для определения CuDz препятствуют неблагоприятные условия поглощения, а также многочисленные помехи в щелочной области, хотя скорость образования комплекса CuDz больше, чем скорость образования комплекса Си (HDz) 2.
Для количественного определения ионов Си2+ пригодно лишь получение их в виде Си (HDz) 2 по уравнению (I). Так как реакция при обычных исходных концентрациях (дитизона в четыреххлористом углероде в среднем 25 мкМ, ионов Си2+ в воде в среднем 25 мкМ при pH около 0—4) протекает к концу очень вяло и изменение окраски очень нечеткое, то раствор следует интенсивно и долго встряхивать [3515]. Следовательно, прямое экстракционное титрование ионов Си2+ в указанных условиях является совершенно неудовлетворительным. Состав экстрактов [Си(HDz)2 + CuDz] зависит от среды и концентрации компонентов реакции, а также от последовательности и размеров добавляемых порций экстрагента при титровании. Поэтому раствор дитизона следует устанавливать по эталонному раствору. При выборе более высокой исходной концентрации дитизона и по возможности низком pH (3—4) раствора экстракционное титрование ионов Си2+ в отдельных определениях протекает удовлетворительно и надежно (раздел б, 1).
Было также исследовано титрование ионов Си2+ в гомогенных ацетоновых растворах раствором дитизона в ацетоне по смешанной серо-голубой окраске [518].
Избыток дитизона ускоряет реакцию по уравнению (I), благоприятствует диссоциации комплекса Си(HDz)2 в обратном направлении по уравнению (III) и, следовательно, способствует проведению определений по методу смешанной окраски.
На рис. 21 приведены спектры поглощения растворов Си (HDz) 2 и CuDz в четыреххлористом углероде. Для фотометрии по методу смешанной окраски (раздел 6,3) пригоден максимум поглощения комплекса Си (HDz) 2 в четыреххлорпстом углероде с длиной волны 550 л/ц, близкий к минимуму поглощения дитизона, а также сам
200 Применение дитизона в количественном анализе
этот минимум [377] или максимум поглощения дитизона в четыреххлористом углероде при длине волны 620 мр,, где раствор комплекса Си (HDz)2 поглощает сравнительно мало. Для более концентрированных растворов из дитизоната меди и дитизона в четыреххлористом углероде Фишер [374] предложил проводить фотометрирова-ние в области длин волн 750—800 Лф, в которой раствор дитизона в четыреххлористом углероде и большинство других дитизонатов практически не поглощают. Однако это преимущество теряется вследствие 10-кратного уменьшения чувствительности.
Рис. 21. Кривые поглощения растворов Си (HDz)2 и CuDz в четыреххлористом углероде.
------25/2 мкМ раствор Си (HDz)2;----- 250/2 мкМ раствор Cu(HDz)2;
..... 25 мкМ раствор CuDz; ----25 мкМ раствор H2Dz;----- 250 мкМ раствор HoDz.
Для визуального колориметрирования по методу смешанной окраски (раздел 6,2) при определении ионоЬ Си2+ особенно благоприятен тот факт, что при наложении кривых поглощения дитизоната меди в четыреххлористом углероде (красно-фиолетовая) и дитизона в четыреххлористом углероде (изумрудно-зеленая), в особенности при 40—50%-ном избытке дитизона, результирующая кривая поглощения слабо волниста и почти горизонтальна в более далекой области видимого света. Такая смесь Си (HDz)2 и дитизона в четыреххлористом углероде или хлороформе обладает серой окраской, оттенки которой не утомляют зрения и очень легко могут
Определение металлов группы дитизона. Медь
201
быть различимы. Грубич и Синигой [383] обстоятельно исследовали точность метода определения содержания меди в области «чувствительности смешанной окраски». Бехт [531] смог определить в узких стеклянных трубках 0,1 мкг Си2+ с ошибкой ±20% и 0,04 мкг с ошибкой ±100%.
Раствор дитизоната меди в четыреххлористом углероде заметно чувствителен к свету и времени стояния, но довольно устойчив в течение часа при проведении колориметрических или фотометрических определений.
Влияние посторонних анионов. Ионы S2- и S2O2- мешают в любом количестве.
Ионы [Fe(CN) ]4- мешают в любом количестве.
Ионы J" в концентрации до 0,1 н. не оказывают влияния. В значительно большей концентрации, особенно если выделяется много йода, ионы йода мешают.
Ионы Вг~ в 0,5 н. концентрации не оказывают никакого влияния [5023].
Ионы SCN“ образуют ионы Си+, которые также реагируют с дитизоном [368].
Тартрат и цитрат слегка подавляют экстракцию ионов Си2+ раствором дитизона в четыреххлористом углероде [519].
Влияние посторонних катионов. Ионы Ag+ мешают, однако их можно замаскировать с помощью ионов Вг“ или J-. Можно также из объединенного экстракта, содержащего комплексы Си(HDz) о и AgHDz, последние отмыть разбавленным раствором галоидоводородной кислоты, например 0,5 н. раствором НС1, после того как предварительно будет извлечено основное количество ионов Ag+ [3824, 421].
Ионы Hg2+ мешают, однако, если их содержание мало, они могут быть замаскированы с помощью ионов Вг~ или J". При добавлении ионов J~ к испытуемому раствору можно определить содержание ионов Си2+ в присутствии больше чем 103-кратного количества ионов Hg2+ [ЗЗ2, 342, 429, 461]. Также приводит к положительной цели отмывание объединенного экстракта 0,2 н. солянокислым раствором бромида калия или йодида калия. В объединенном экстракте, полученном при извлечении
202
Применение дитизона в количественном анализе
раствором дитизона в четыреххлористом углероде, можно дитизонат меди селективно разрушить 6 н. раствором соляной кислоты.
Ионы Рс12+ и Аи3+ мешают. Ионы Bi3+ мешают тем больше, чем ниже pH раствора и чем выше избыток дитизона. Ионы Си2+ экстрагируются раньше ионов Bi3+. С помощью ионов Вг~ или еще лучше ионов J- можно удовлетворительно замаскировать небольшие количества ионов Bi3+ при pH 3 [461]. При промывании объединенного экстракта 2%-ным раствором йодида калия в 0,01 н. соляной кислоте удается обнаружить ионы Си2+ в присутствии 20-кратного избытка ионов Bi3+ [4211, 458] При pH 0,2 и 6,5-кратном избытке дитизона можно извлечь ионы Си2+ в присутствии 10-кратного количества ионов Bi3+, минуя образование комплекса Bi (HDz)3 [4115].
Ионы Zn2+ экстрагируются после ионов Си2+. При низком pH испытуемого раствора (pH ~1) удается подавить экстракцию ионов Zn2+. Дополнительное промывание экстракта, содержащего незначительное количество комплекса Zn(HDz)?, 0,1 н. раствором соляной кислоты позволяет удовлетворительно определить содержание ионов Си2+ в присутствии 105-кратного количества ионов Zn2+ (раздел г, 4).
Ионы Fe3+ не мешают, если их содержание не превышает 103-кратного избытка. Вредное влияние большего количества ионов Fe3+ вследствие их окислительного действия можно подавить с помощью фосфорной кислоты. В случае очень большого содержания ионов Fe3+ следует сначала обогатить раствор ионами Си2+ путем экстракции (раздел г, 3) или . выделить в виде HFeCh встряхиванием с эфиром [ЗЗ2, 342]. Также оказалось пригодным переведение ионов Fe3+ в Fe2+ с помощью растворов (NH3OH)C1, (N2H6)SO4 [3610], TiCl3 [4011, 4821] и других [421] (см. (раздел г, 3).
Ионы Sn2+ окисляются в Sn4+. Очень большое содержание олова образует слизистую оловянную кислоту, вызывающую затруднения при экстракции. Олово удаляют кипячением со смесью брома и бромистого водорода (1:7) [ЗЗ2, 342].
Поны Ni2+ и Со2+, присутствующие в высокой концентрации, могут экстрагироваться вместе с ионами Си2+,
Определение металлов группы витизона. МеОь
203
если испытуемый раствор недостаточно подкислен (*~0,5 н. НС1) [374]. При pH < 2 не мешает КР-кратное количество эти?; ионов.
Поны 1п3+, Сс12+, РЬ2+ и Т1+ в общем не мешают определению ионов Сп2+, если не превышают соотношения 1 : 105 [ЗЗ2, 342].
В металлическом кадмии можно еще определить 4*1О~5О/о меди, если частично выделить кадмий в виде сульфида, последний растворить в кислоте и дальнейшее концентрирование ионов Сп2+ провести с помощью амберлита JR-120 [55б].
б) ОСНОВНЫЕ МЕТОДЫ ОПРЕДЕЛЕНИЯ
1. Прямое экстракционное титрование
Реактив ы
Дитизон, 300 мкМ раствор в четыреххлористом углероде. 1 мл = 9,53 мкг Си2+.
Аммиак, 2 н. раствор.
Серная кислота, 2 н. раствор.
Эталонный раствор соли меди, 300/2 мкМ раствор CuSOi в 0,01 н. растворе H2SOi. 1 мл содержит 9,53 мкг Сп2+.
Ход определения. 20 мл испытуемого раствора в делительной воронке доводят раствором аммиака или серной кислоты до pH 3—4 и проводят экстракционное титрование раствором дитизона 1 из бюретки, периодически взбалтывая его в течение —1 мин. Титрование продолжают до тех пор, пока последняя порция экстракта вместо чисто фиолетового приобретает незначительный сине-стальной оттенок2. Точность определения ±2% 3.
Примечания
1 Раствор дитизона устанавливают по аналогично полученному эталонному раствору. Более целесообразно прибавить к экстрагируемому раствору аналогичное количество ионов Си2+ и таким же способом повторить экстракционное титрование, так как титр раствора несколько меняется с изменением концентрации и pH раствора. Вблизи нейтральной точки образуется почти исключи
204
Применение дитизона в количественном анализе
тельно дитизонат меди — CuDz [уравнение (II)], вследствие чего расход дитизона может уменьшиться приблизительно вдвое.
2 Ионы Ni2+ и Со2+ не мешают. Ионы Bi3+ реагируют после ионов Си2+. В присутствии последних окраска раствора переходит из красно-фиолетовой в коричневатую.
3 Сендэл [372] проводит экстракционное титрование более разбавленных растворов солей меди (II) приблизительно 25 мкМ. раствором дитизона в четыреххлористом углероде с точностью ± 0,5 мкг Си2+ по соответствующей калибровочной кривой. При pH 3 он перетитровывает раствор до сине-зеленого цвета и вычитает «ошибку индикатора».
2. Визуальное колориметрическое определение по методу сметанной окраски [342] *
Реактивы
Дитизон, 25 мкМ раствор в четыреххлорисгом углероде. 1 мл 0,794 мкг Си2+.
Аммиак, 2 н. раствор.
Соляная кислота, 0,5 н. раствор.
Эталонный раствор соли меди, 25/2 мкМ раствор CuSO4 в 0,01 н. растворе H2SO4. 1 мл содержит 0,794 мкг Си2+.
Ход определения. 5 мл испытуемого раствора в делительной воронке доводят раствором аммиака или соляной кислоты до pH 3—4 и разбавляют приблизительно до 15 мл водой. Проводят экстракционное титрование раствором дитизона из бюретки, каждый раз интенсивно встряхивая в течение 1—2 мин. Каждую порцию экстракта промывают в другой делительной воронке приблизительно 1 мл соляной кислоты и после 10—20 сек. встряхивания собирают в цилиндре с притертой пробкой. Фиолетовая или голубоватая окраска полученных экстрактов указывает на присутствие ионов Си2+ в испытуемом растворе. Экстракцию прекращают после того, как предпоследняя порция экстракта окрасится в чисто зеленый цвет.
Объединенные экстракты промывают и, если требуется, смешивают с определенным объемом раствора дитизона до появления требуемого для визуальных колориметрических определений серо-фиолетового оттенка.
Для получения сравнительного раствора вносят во
* Метод колориметрического титрования. — Прим. ред.
Определение металлов группы дитизона. Медь
205
второй цилиндр с притертой пробкой предварительно освобожденный от ионов Си2+ водный испытуемый раствор и сразу прибавляют к нему общее количество израсходованного выше раствора дитизона. Затем прибавляют из бюретки порциями эталонный раствор соли меди (II), сильно взбалтывают в течение V2—1 мин. и сравнивают окраску экстракта с окраской экстракта, находящегося в первом цилиндре. Чтобы сузить границы ошибки, проводят еще два сравнения окрасок, различие которых еще можно установить визуально с более высоким и более низким содержанием ионов Си2+ *.
Точность определения ±2%.
С помощью этого метода можно с достаточной точностью определить в растворе пробы менее 1 мкг Си2+.
3. Спектрофотометрическое определение по методу смешанной окраски
Реактивы аналогичны указанным в разделе б, 2.
Ход определения. 10 мл испытуемого раствора в делительной воронке доводят аммиаком или соляной кислотой до pH 2—3 и добавляют из бюретки раствор дитизона до заметного его избытка. Для этой цели пригодно грубое предварительное титрование (согласно разделу 6,1 или 6,2) или же встряхивание после каждой прибавленной порции раствора дитизона в течение около 2 мин. Конечная окраска раствора должна заметно отличаться от чисто красно-фиолетовой окраски комплекса Си(HDz)2 в четыреххлористом углероде.
В заключение полученный раствор встряхивают в течение 2 мин. и после прояснения вносят в измерительную кювету н фотометрируют при соответствующей длине волны (см. табл. 13, стр. 116). Точность метода ±3%.
* Или поступают следующим образом: прибавление эталонного раствора меди ведут до тех пор, пока окраски в обоих цилиндрах не сравняются (при этом лучше недотитровать, чем перетитровать). Записывают израсходованный объем эталонного раствора и продолжают прибавлять его до начала изменения окраски. Отмечают израсходованный при этом объем раствора, отбросив последнюю порцию. Среднее арифметическое между двумя зафиксированными величинами и будет тем объемом, который принимается в расчет содержания меди в исследуемом растворе. — Прим. ред.
206
Применение дитизона в количественном анализе
4. Спектрофотометрическое определение по методу одноцветной окраски
Р е а к т и в ы аналогичны указанным в разделе б, 2 и дополнительно:
Раствор для промывания ~0,08 н. раствор NH4OH
Серная кислота, приблизительно 0,1 н. раствор.
Ход определения. 10 мл испытуемого раствора в делительной воронке доводят раствором аммиака или соляной кислоты до pH 1—2, добавляют порциями из бюретки раствор дитизона и в течение 4—5 мин. встряхивают. Раствор* дитизона прибавляют до тех пор, пока изумрудно-зеленая окраска последней порции экстракта перестанет изменяться.
Собранные в стеклянном цилиндре органические экстракты вновь' переносят в делительную воронку и встряхивают 1—2 раза с 5 мл раствора для промывания в течение 10 сек. для удаления избытка дитизона. В заключение промывают раствор дитизоната меди чистого красно-фиолетового цвета 5 мл серной кислоты и фотометрируют1. Точность определения ±3%.
Примечание
1 Соответствующие измерительные сосуды и исходную точку для модуля поглощения можно подобрать по табл. 13, стр. 116*.
в) ПРИМЕНЕНИЕ
Этот метод пригоден для определения следов и микроколичеств благодаря высокой чувствительности и весьма селективной реакции между ионами Си2+ и дитизоном в кислом растворе.
Следы меди (а также цинка и свинца) в питьевой и хозяйственной воде Хёгль и Сульсер [517] многократно определяли методом по смешанной окраске. Рейт и Ван
* Хейм [5711] провел сравнительное изучение фотометрических методов определения меди, основанных на реакциях меди с дитизоном, салициловой кислотой, диэтилдитиокарбампнатом натрия, бензидином, сероводородом в щелочной среде, NH4OH и K4Fe(CN)6. — Прим. ред.
Определение металлов группы дитизона. Медь
207
Дик [408, 409, 4010] определяли медь в питьевой воде и гомеопатических средствах; Строхеккер с сотр. [371, 3817] проводили определения в воде и продуктах питания. Абрагамчпк [387] сначала извлекал одновременно медь, цинк и свинец раствором дитизона в четыреххлористом углероде, а затем отделял отдельные дитизонаты с помощью 1 н. раствора НС1 и ионов CN- и S2-. Аналогичные определения проводил Швайбольд [427] с сотр., [3912].
Парьо и Аршинар [5227] определяли следы ионов Си2+, переходящих в раствор при соприкосновении металлической меди с чистой водой, из которой удалены растворенные газы. Стаут и Арнон [3926] определяли этим методом очень малое содержание ионов Си2+ в чистой воде, используемой при опытах по питанию растений.
Уоррен, Делаво и Ириш [511] применяли эмульсионную технику для быстрого полуколичественного определения очень малых следов меди, цинка и свинца в качестве полевых тестов в поверхностных водах для геологических разведывательных работ.
Уэб и Милльмэн [5013] определяли визуально содержание ионов Сп2+ в водах методом одноцветного раствора или по смешанной окраске.
Хоролев [5023] подробно исследовал в озерной воде содержание следов меди и почти всех других металлов, реагирующих с дитизоном. Далее Бух [441], Уотенберг [431 °], а также Гофман [5025] определяли медь в озерной воде *.
Сендэл [372] (г, Г) ** исследовал силикатные породы. Хибэрд [384], Шарер [4821]***, а также Шарер и Кюн
* См. также Лодочникова Н. В. [5645]. — Прим. ред.
** Миллер А. Д. и Либина Р. И. [584] определяли микроколичества меди (а также свинца и цинка) в природных водах и вытяжках из почв. — Прим. ред.
*** Едваб Г5632]. Пейве Я. В. и Рннькнс Г. Я. [599]. Корен-ман II. М. и Шеянова Ф. Р. [585] описали варианты одновременного определения двух (Си и Zn) и трех (Hg, Си, Zn; Ag, Си, Cd) катионов путем радиометрического экстракционного титрования с использованием непзотопных индикаторов и применили для определения меди и цинка в латуни и других сплавах.
Холман [5641] проводил определения с применением уайт-спирита в качестве растворителя для дитизона. Данный метод позво-
208 Применение дитизона в количественном анализе [4011] определяли в почвенном экстракте следы меди и других металлов, реагирующих с дитизоном. Хаф [514], а также Кимура и Фуивара [5112] пользовались дптпзо-новым методом в качестве полуколичественного полевого метода для определения меди, цинка, свинца при разведывательных работах на поверхности земли (почва).
Фишер определял следы меди в алюминии особой чистоты [374] (раздел г, 2), железе и стали [421] (раздел г, 3), а также в цинке [3824] и цинковых сплавах [3826] (раздел г, 4). Сендэл [502] также выяснил содержание следов меди в железе и стали (раздел г, 3) *. Мюллер и Сивертс [401] определяли примеси меди, кадмия, свинца и цинка для установления эталонных растворов для эмиссионного спектрального анализа. Йокосука [5531] смог еще обнаружить 2-10-4% меди в металлическом никеле**. Браун [464], а также Кнап [449] определяли небольшое содержание ионов Си2+ в гальванических никелевых ваннах, причем при pH 1—3 с помощью избытка раствора дитизона в четыреххлористом углероде они извлекали еще 1 • 10-3% ионов Си2+.
Асаф и Холибог [405], а также Эванс и Дэвенпорт [3715] определяли следы меди в минеральных маслах.
Следует предостеречь, что при работе с биологическим материалом при сухом его озолении медь образует летучие соединения с продуктами разложения биологического материала [4713], вжигаегся в стенки тигля или вместе со шлаком образует труднорастворимый силикат. При мокром сожжении органического вещества можно внести с химическими реактивами много меди. Следы меди были определены в молочных продуктах [3710, 461],
ляет проводить 100—150 анализов за 8 час. Автор отмечает преимущество использования уайт-спирита как растворителя в поле-вых условиях. — Прим. ред.
* Супрунович И. Б. и Коновалова А. Б. [4826] определяли медь в легированных сталях методом колориметрического титрования. — Прим. ред.
** Пендер [587] предложил метод спектрофотометрического определения меди в титане и титановых сплавах, с помощью которого можно определять Си в пределах 0,0001 — 1% с ошибкой 1—2%. хМакарьянц А. II. и Заглодина Т. В. [564’] определяли медь в свинце. — - Прим. ред.
Определение металлов группы дитизона. Медь
209
яйцах [461] * крови [461], твороге [3610], золе растений [4011, 4821], сахарном сиропе, а также в напитках [5212] и т. д. **.
г) ПРИМЕРЫ
1. Определение меди в силикатных породах [372, 502]
По этому методу одновременно определяются медь, цинк и свинец и поэтому проводится предварительное экстрагирование дитизоном в щелочной среде.
Реактивы
Хлорная кислота, 10 н. раствор.
Плавиковая кислота, 20%-ный раствор.
Соляная кислота, 2 н. раствор.
Соляная кислота разбавленная, 0,02 н. раствор.
Цитрат натрия NaaCeHsO? • 5Н2О, 10%-ный раствор.
Аммиак, 14 н. раствор.
Сода.
Дитизон, приблизительно 300 мкМ раствор в четыреххлористом углероде.
Перманганат калия, 0,1 н. раствор.
Серная кислота, 2 н. раствор.
Гидроксиламин солянокислый, 20%-ный раствор. Азотная кислота, 5 н. раствор.
Соляная кислота, концентрированная, 12 н. раствор.
Ход определения. К 0,25 г тонкорастертой пробы в платиновой чашке прибавляют 0,5 мл хлорной кислоты,
* В консервах [4020], пищевых продуктах [5741]. — Прим. ред.
** Смит и Хене [596] описали определение меди и кобальта в растительных материалах с предварительным экстрагированием диэтилдитиокарбаминатов меди и кобальта, их хроматографическим разделением и последующим фотометрированием дитизонатов.
Такэи [5710] установил возможность количественного определения меди в речной воде и других образцах при помощи о-дитолил-тиокарбазона (аналога дитизона) с использованием только регулирования pH без добавления каких-либо маскирующих агентов. Этот способ он считает более удобным по сравнению с дитизоно вым методом. — Прим. ред.
14 Зак. 2157.
210
Применение дитизона в количественном анализе
3 мл воды и 2—3 мл плавиковой кислоты и многократно выпаривают. После последнего выпаривания остаток извлекают при нагревании 7 мл соляной кислоты. Добавляют 5 мл. раствора цитрата натрия, дают охладиться, нейтрализуют аммиаком, прибавляют еще 0,25 мл избытка аммиака, оставляют на 10 мин. для осаждения и получения прозрачного фильтрата.
Осадок вместе с фильтром осторожно озоляют, золу сплавляют с 0,15 г соды, плав извлекают 2—3 мл воды, к полученному фильтрату прибавляют 0,5 мл раствора цитрата натрия и доводят до pH 9 разбавленной соляной кислотой.
Вновь полученный осадок озоляют вместе с фильтром, золу многократно выпаривают с плавиковой и хлорной кислотами. Полученный после выпаривания остаток извлекают с помощью соляной кислоты и обрабатывают таким же способом, как описано выше, до полного растворения пробы. Отдельные фильтраты в делительной воронке исчерпывающе экстрагируют большим избытком раствора дитизона в четыреххлористом углероде, объединяют полученные прозрачные органические экстракты, промывают приблизительно 3 мл слабоаммиачной воды * и взбалтывают в течение 1—2 мин. с двумя порциями по 10 мл разбавленной соляной кислоты в делительной воронке. Если было взято достаточное количество дитизона, экстракт не должен быть окрашен в красно-фиолетовый цвет, характерный для комплекса Си (HDz) 2**. Ионы Zn2b и РЬ2+ переходят в водный раствор после выделения из своих комплексов с дитизоном. Их можно определить в этом водном растворе. Оставшийся органический экстракт содержит наряду со свободным дитизоном медь, связанную в виде Си (HDz) 2.
* К 3 мл воды добавляют каплю аммиака. — Прим. ред.
** Если же четыреххлористый углерод после взбалтывания с первой порцией соляной кислоты остается красно-фиолетовым и не становится зеленоватым или пурпурным, добавляют еще некоторое количество раствора дитизона, чтобы придать ему пурпурный оттенок, и снова взбалтывают в течение 1 мни. Затем сливают четырех-хлористый углерод в другую делительную воронку и взбалтывают со второй порцией соляной кислоты. — Прим. ред.
Определение .металлов гриппы дитшюна. Медь
211
Органический экстракт выпаривают, остаток смачивают азотной кислотой и слабо прокаливают. Окись меди растворяют в приблизительно 0,5ль? концентрированной соляной кислоты и разбавляют водой до определенного объема. В аликвотной части полученного водного раствора определяют содержание ионов Си2+ по одному из основных методов (например, 6,2)*.
Об определении ионов Zn2+ или РЬ2+ см. стр. 254 и соответственно стр. 310.
2. Определение меди в очищенном алюминии [374]
Реактивы
Соляная кислота, 6 н. раствор.
Сулема, 5%-ный раствор.
Азотная кислота, 15 н. раствор.
Гидроксиламин солянокислый, 20%-ный раствор, йодид калия, 1 %-ный раствор.
Ход определения. Алюминиевые стружки в количестве 5 г растворяют в соляной кислоте при добавлении 5 мл 5%-ного раствора сулемы 1 и упаривают до момента образования кристаллов. Кристаллическую массу извлекают водой и переносят в мерную колбу емкостью 250 мл. Оставшиеся шарики ртути растворяют в горячей азотной кислоте и раствор выпаривают. При нагревании окись ртути удаляется. Небольшой остаток растворяют в малом количестве соляной кислоты, добавляют к содержимому в мерной колбе и объем раствора в последней доводят до метки водой.
Отбирают из мерной колбы аликвотную часть, переносят в делительную воронку, прибавляют туда 0,5 мл раствора гидроксиламина и доводят с помощью соляной кислоты до pH 3—4. После добавления 2 мл 1%-ного раствора йодида калия (для маскирования следов ионов Hg2+) определяют содержание ионов Сп2+ одним из основных методов.
* Более подробное описание этого же хода определения меди в силикатных породах см. в книге: Сендэл, Колориметрическое определение следов металлов, Госхимиздат, М. — Л., 1949,
стр. 318—320. — Прим. ред.
14*
212 Применение Опт неона в количественном анализе
П р и м е ч а и и е
1 Если алюминий более сильно загрязнен (чистый алюминий и алюминиевые сплавы), он легко растворяется в соляной кислоте. Тогда не следует добавлять сулему и операция удаления ртути отпадает.
3. Определение меди в железе и стали [421]
Медь в количестве 1 • 10-2% определяется с точностью ±3%. Время, необходимое для проведения одного определения, составляет около 1 часа.
Так как при высоком содержании ионов Fe3+ дитизон медленно (в зависимости от pH раствора) окисляется, перед экстракцией ионов Си2+ ионы Fe3+ следует перевести в Fe2+ *. Определению не мешают никель, кобальт, молибден, ванадий, титан и алюминий. Присутствующие Сг2ОГ и МпОГ восстанавливаются ионами Fe2+, SiOs и МоОз удаляются при выпаривании с соляной кислотой и после выделения или фильтрования аликвотной части не попадают в подготовленный к экстракции раствор.
Реактивы
Соляная кислота, 10 н. раствор.
Азотная кислота, 10 и. раствор. Хлорноватокислый калий.
Соляная кислота, разбавленная, 2 н. раствор.
Аммиак, 8 н. раствор.
Гидроксил а мин солянокислый, 10%-ный раствор.
Ход определения. 0,5 г железных или стальных стружек1 растворяют в соляной кислоте и окисляют хлорноватокислым калием. Раствор выпаривают, извлекают остаток разбавленной соляной кислотой и полу-
* Сендэл [502] обходит операцию восстановления ионов Fe3+ в Fe2+, предварительно экстрагируя ионы Си2+ приблизительно 300 мкМ, раствором дитизона в четыреххлористом углероде. Частично окисленный экстракт не пригоден для фотометрирования. Его разрушают выпариванием досуха, добавляют 1 мл смеси серной и хлорной кислот (3:1) и нагревают приблизительно при 250° до обесцвечивания. Разбавляют водой, доводят pH раствора до 3—4 и определяют содержание меди фотометрированием по методу смешанной окраски.
Определение металлов группы дитизона. Медь 213 ченный раствор переносят, не фильтруя, в мерную колбу емкостью 100 мл.
Аликвотную часть этого раствора доводят до pH 3—4 раствором аммиака, нагревают почти до кипения и добавляют по каплям раствор гидроксиламина до полного восстановления ионов Fe3+ в Fe2+.
Затем разбавляют вдвое водой и вновь доводят pH раствора до 3—4. Для определения ионов Си2+ служит один из основных методов (см. раздел 6,2 или 6,3).
Примечание
1 Легированные стали растворяют в царской водке. Также пригодны и другие растворители, например серная кислота.
4. Определение меди в очищенном цинке [3824]
Медь в количестве 1 • 10~4% можно определить с точностью ±5%. В очищенном цинке присутствуют медь, свинец и кадмий в количестве 10-2 до 10-4%. Определение в присутствии серебра см. стр. 214.
Реактивы
Азотная кислота, 5 н. раствор.
Мочевина.
Серная кислота, 2 н. раствор.
Серная кислота, разбавленная, 0,1 н. раствор.
Аммиак, 8 н. раствор.
Соляная кислота, 0,5 н. раствор.
Дитизон, 50 мкМ раствор в четыреххлористом углероде. 1 то = 1,59 мкг Си2+.
Ход определения. Растворяют 10 г цинка1 в 100—125 мл азотной кислоты. Раствор выпаривают при добавлении нескольких капель азотной кислоты до сиропообразного состояния, извлекают водой, кипятят в течение нескольких минут с 0,5—1 г мочевины для разрушения остатков азотной кислоты, охлаждают и доводят до метки в мерной колбе емкостью 100 мл. Аликвотную часть полученного раствора разбавляют в делительной воронке двойным объемом воды и доводят аммиаком до pH 1—2. Исчерпывающе экстрагируют медь при добавлении соответствующих порций раствора дитизона
214 Применение Литизона в количественном анализе
и при встряхивании в течение 5—ГО мин. до тех пор, пока последняя порция дитизона не будет изменять своей окраски 2.
Органические экстракты (непрореагировавший раствор дитизона + промывной четыреххлористый углерод) собирают в цилиндре. Во втором цилиндре такого же объема проводят сравнительное титрование эталонным раствором меди (раздел 6,2).
Примечания
1 При анализе цинковых сплавов, содержащих медь [3826], исходят из соответственно меньших навесок. Чтобы определить, например, 3% меди методом смешанной окраски, требуется около 1 мг цинкового сплава.
2 Лишь при слишком высоком значении pH последняя порция дитизонового экстракта имеет сине-зеленый цвет, который может вызываться присутствием следов одновременно извлеченного комплекса Zn(HDz)2. Эту фракцию промывают отдельно в делительной воронке 1 мл соляной кислоты, причем, если отсутствует комплекс Си (HDz) 2, раствор должен окраситься в изумрудно-зеленый цвет вследствие разложения комплекса Zn(HDz)2. В противном случае экстракцию продолжают.
Вариант метода в при сутств и и серебра [3824]. Если в исследуемом цинке доказано присутствие небольших количеств серебра, то основную его массу выделяют постепенной предварительной экстракцией раствором дитизона и отбрасывают экстракты до тех пор, пока еще появляется желтая окраска комплекса AgHDz при встряхивании в течение 2—3 сек.
Затем, не обращая внимания на наличие оставшихся ионов Ag+, проводят экстракцию ионов Си2+. Собранные в стеклянном цилиндре органические экстракты встряхивают с 3—5 мл соляной кислоты (0,5 н.) для удаления остатков серебра; при этом разлагаются AgHDz, а также и случайно извлеченный Zn(HDz)2-
ВИСМУТ
а) ОБЩИЕ СВЕДЕНИЯ
Ионы Bi3+ образуют в области pH от 3 до 10 краснооранжевый однозамещенный дитизонат висмута [351]:
BiX. + 3H2Dzopr. ^=± Bi(HDz)3npr. + 3HB+oan..
Определение металлов группы дитизона. Висмут
215
Растворимость дитизоната висмута как в четыреххлористом углероде, так и в хлороформе ограничивается приблизительно 15 мкг Bi(HDz)3 в миллилитре (см. табл. 4, стр. 38). Выпавший дитизонат висмута может быть снова быстро растворен только в хлороформе. Королев [5023] исследовал условия равновесия (также в присутствии различных анионов) и определил константы равновесия (стр. 51—52). На рис. 22 схематически показано извлечение ионов Bi3+ приблизительно 25 мкМ раствором дитизона, влияние pH раствора, влияние некоторых анионов, а также типа органического растворителя.
Рис. 22. Извлечение ионов Bi3+ в зависимости от pH раствора, различных компонентов, присутствующих в растворе, и природы органического растворителя.
а или а’ — в отсутствие или в присутствии 0,1 Л1 раствора цианида калия; Ь или Ь’ — в присутствии 1 Л1 раствора хлорида натрия; с или с' — в присутствии 0,1 М раствора цитрата натрия или тартрата натрия-калия (схематическое изображение по данным Королева [502j]).
Если вместо четыреххлористого углерода в качестве растворителя взять хлороформ, то соответствующие границы извлечения сдвинутся приблизительно на 1,5 единицы в сторону более высоких значений pH.
Поскольку ноны CN- практически не влияют на экстракцию ионов Bi3+, можно реакцию дитизона с ионами Bj3+ сделать селективной. В щелочных растворах, содержащих ионы CN", с дитизоном, кроме ионов Bi3+, реагируют только ионы Sn2+, Ti+ и Pb2+.
При отделении ионов Си2+ от ионов Bi3+ пользуются тормозящим влиянием галоидов (С1~, Вг~ и J") на экстракцию ионов Bi3+ в кислом растворе (ср. стр. 202).
216
Применение дитизона в количественном анализе
С сильно тормозящим извлечение действием цитрат-и тартрат-ионов встречаются при проведении экстракции ионов Bi3+ раствором дитизона в четыреххлористом углероде при pH 9—9,5 и раствором дитизона в хлороформе при pH 10,5—11, при этом заботятся о соответствующем избытке дитизона.
Экстракция ионов Bi3+ раствором дитизона в четыреххлористом углероде протекает очень быстро при pH 6. В более кислых растворах для установления равновесия следует проводить встряхивание тем дольше, чем ниже значение pH и чем более разбавлены растворы реагирующих веществ. Прямое экстракционное титрование ионов Bi3+ раствором дитизона в четыреххлористом углероде проводят при pH по возможности ниже 4 (раздел б, 1) или раствором дитизона в хлороформе при pH ниже 5, чтобы воспрепятствовать одновременному протеканию реакции дитизона с небольшими количествами ионов РЬ2+ и Т1+. Раствор дитизоната висмута в четыреххлористом улгероде разлагается при действии 0,15 н. раствора минеральной кислоты. Для разложения дитизоната висмута в хлороформе достаточен 0,05 н. раствор минеральной кислоты.
Раствор дитизоната висмута в четыреххлористом углероде при pH 9,5 еще довольно стоек, тогда как в хлороформе он устойчив еще при pH 11.
Спектр поглощения дитизоната висмута в четыреххлористом углероде (см. рис. 23) характеризуется двумя резко выраженными максимумами при длине волн 490 жц и 275 дщ.
В точке максимума поглощения дитизона в четыреххлористом углероде при длине волны 620 жц дитизонат висмута в том же растворителе не поглощает; это используется при спектрофотометрических определениях по методу смешанной окраски (раздел 6,3). Для измерений можно воспользоваться волной минимума поглощения дитизона в четыреххлористом углероде при длине волны 510 дф. При визуальных колориметрических определениях по смешанной окраске (раздел 6,2) из переходной окраски красно-оранжево-коричнево-зеленой выбирают наиболее подходящую коричневую окраску, оттенок которой можно легко определить.
Определение металлов группы дитизона. Висмут 217
Растворы дитизоната висмута довольно стойки к свету.
Рис. 23. Кривые поглощения растворов Bi (HDz)3 в четыреххлористом углероде.
------25/3 мкМ раствор Bi (HDz)j------- 250/3 мкМ раствор Bi (HDz):,; --------------------------25 мкМ раствор H2Dz.
Влияние посторонних анионов. Ионы S2" мешают; ионы С1" также мешают, если только присутствуют в большом количестве. Мешающее влияние растет с уменьшением pH раствора. В щелочной области (pH > 9) ионы С1“ не мешают.
Ионы Вг~ мешают сильнее ионов С1~, ионы J~ мешают сильнее ионов Вг~; ионы CN~ не мешают в щелочном растворе. Они служат для маскирования всех металлов, образующих дитизонаты, за исключением Sn2+ Т1+ и РЬ2+. Цитрат и тартрат мешают, если присутствуют в большом количестве, особенно в кислом растворе (рис. 22) и меньше мешают при pH выше 9,5. Ацетат подавляет экстракцию из кислых растворов.
Влияние посторонних катионов. Ионы Ag+, Hg2+, Pd2+, Au3+ и Cu2+ мешают. В содержащих ионы CN- щелочных растворах они полностью маскируются. Эти ионы можно предварительно удалить с помощью дитизона при pH < 0, если их содержание не превосходит 100-кратного избытка.
Ионы 1п3+ мешают в пределах pH от 3 до 8. При pH > 8, даже при 103-кратном количестве, ионы 1п3+ совместно с висмутом не экстрагируются.
218 Применение дитизона в количественном анализе
Ионы Zn2+, Ni2+, Со2+ и Сс12+ в щелочных растворах, содержащих ионы CN", не мешают экстракции висмута.
Ионы ТР мешают при pH > 6. Можно отделить ионы Bi3+ в присутствии 10-кратного количества таллия с помощью дитизона в четыреххлорпстом углероде при pH < 5. При большем содержании таллия требуются pH 2,5 и избыток дитизона в органическом растворителе [502]. При встряхивании экстракта из Bi(HDz)3 + Tl(HDz) в четыреххлористом углероде с водой (рН~7) дитизонат таллия разлагается. При встряхивании хлороформных экстрактов с буферным раствором с pH 3,4 дитизонат висмута еще не разлагается [489 * * * * *, 425]. Большие количества хлорида или бромида таллия можно извлечь этиловым или изопропиловым эфиром [5517].
Ионы РЬ2+ мешают при pH > 3,5. Для их отделения можно воспользоваться приведенным выше способом (при отделении таллия) фракционированной экстракции, или фракционированного разложения общего экстракта при pH 2,3—2,5 [4216] (ср. стр. 225, примечание 3). Большие количества ионов РЬ2+ можно отделить в виде сульфата свинца. Затем при pH 2,5 в 20%-ном растворе уксусной кислоты экстрагируются только ионы Bi3+ [49:7]. При этом необходимо применить большой избыток раствора дитизона в хлороформе (раздел г, 3).
б) ОСНОВНЫЕ МЕТОДЫ ОПРЕДЕЛЕНИЯ
1. Прямое экстракционное титрование [398, 456 *]
Реактивы
Дитизон, 25 мкМ раствор в четыреххлорпстом
углероде, 1 мл = 1,74 мкг Bi3\
Азотная кислота, 1 н. и 0,1 н. растворы.
Аммиак, 2 н. раствор.
Эталонный раствор соли висмута, 50/3 мкМ рас-
твор Bi(NO3)3 в 0,5 н. растворе HNO3. 1 мл
содержит 3,48 мкг Bi3+.
Ход определения. 10 мл испытуемого раствора1
в делительной воронке доводят аммиаком или азотной кислотой до pH 3,5 и проводят экстракционное титрова-
Определение металлов группы, дитизона. Висмут
219
ние раствором дитизона. В качестве точки перехода выбирают коричневую окраску. В конце титрования раствор следует встряхивать в течение 1 мин.
Раствор дитизона устанавливают по эталонному раствору способом, аналогичным проведению самого определения. Отдельные порции дитизона должны соответствовать объему и порядку их прибавления, принятому при титровании испытуемого раствора.
Точность определения ±2%.
Примечание
1 Ионы Сп2+ и благородных металлов мешают. Не мешают ионы Pb2+, Т1+, Zn2+ п др., если даже присутствуют в 10-кратном избытке.
2. Визуальное колориметрическое определение по методу смешанной окраски *
Реактивы
Азотная кислота, 0,5 н. раствор.
Цианид калия, 10%-ный раствор.
Аммиак, 2 н. раствор.
Дитизон, 25 мкМ раствор в четыреххлористом углероде. 1 лы = 1,74 мкг Bi3+.
Эталонный раствор соли висмута, 25/3 мкМ раствор ВЦМОз)з в 0,5 н. растворе HNO3. 1 мл содержит 1,74 мкг Bi3+.
Ход определения. К 10 мл испытуемого раствора 1 в цилиндре для смешивания прибавляют 2,5 мл аммиака и 2,5 мл раствора цианида. При этом pH раствора устанавливается около 9—9,5. Титруют при сильном встряхивании, прибавляя порциями раствор дитизона до появления соответствующей коричневой окраски раствора.
Во второй цилиндр для смешивания вносят 10 мл азотной кислоты, 2,5 мл аммиака, 2,5 мл раствора цианида и столько раствора дитизона, сколько пошло на первое титрование, и титруют эталонным раствором до появления аналогичной окраски.
* Колориметрическое титрование. — Прим. ред.
220
Применение дитизона в количественном анализе
Точность определения ±3%.
Примечание
1 Ионы РЬ2+ и Т1+ мешают. Не мешают ионы благородных металлов, Cu2+, Zn2+ и др.
3. Спектрофотометрическое определение по методу смешанной окраски [5023]
Реактивы
Дитизон, 25 мкМ раствор в четыреххлористом углероде. 1 мл = 1,74 мкг Bi3+.
Аммиак, 2 н. раствор.
Уксусная кислота, 2 н. раствор.
Эталонный раствор соли висмута, 25/3 мкМ раствор Bi(NO3).3 в 0,5 н. растворе HNO3. 1 мл содержит 1,74 мкг Bi3+.
Ход определения. 10 мл испытуемого раствора 1 в делительной воронке доводят аммиаком или уксусной кислотой до pH 6, прибавляют в избытке раствор дитизона и встряхивают в течение 1 мин. Фотометрируют при длине волны 490 лф или 620 мц2.
Точность определения ±2%.
Примечания
1 Ионы Pb2+, Т1+, Cu2+, Zn2+ и др. мешают.
2 Лог [4917] фотометрирует экстракт, полученный как описано в разделе б, 2. Хэбард [489] доводит раствор висмута (0—50 мкг висмута в 50 мл) аммиаком и раствором цианида до pH 11,5, прибавляет 15 мл раствора дитизона в хлороформе (200 мкМ, 1 мл = = 13,9 мкг ВР+), встряхивает в течение 1 мин. и фотометрирует при длине волны 505 мр. Для вычислений служит калибровочная кривая. Мешают ионы РЬ2+ и Т1+. Ввиду сильнощелочных свойств раствора большая часть дитизона переходит в водную фазу в виде иона HDz~, вследствие чего делают определение по методу одноцветной окраски.
Клучески, Лонгли и Козелка [4216] доводят испытуемый раствор растворами цитрата, цианида, а также аммиака до pH 8,5, прибавляют в избытке раствор дитизона и фотометрируют по методу смешанной окраски при длине волны 490 (520) лдс и 620 (660) лф, Содержание висмута определяют по номограмме. Мешают ионы РЬ2+ и Т1+.
Определение металлов группы дитизона. Висмут
221
в) ПРИМЕНЕНИЕ
Работы, посвященные определению висмута в виде дитизоната, немногочисленны. С одной стороны, висмут не слишком распространенный элемент, а с другой — отделение сопутствующего ему свинца — очень трудоемкий процесс.
Следы висмута были определены в цинковых сплавах (раздел г, 1), в меди (раздел г, 2) и в биологическом материале (раздел г, 3).
Некоторые исследователи пользуются для отделения висмута его дитизоновым комплексом, затем разрушают последний и определяют ионы Bi3+ колориметрически в виде KBiJ4. Таким способом было определено 10~3% висмута в меди [3512], а также в серебре, ртути, олове, железе, сурьме и в биологическом материале [347] *.
г) ПРИМЕРЫ
1. Определение висмута в цинковых сплавах Реактивы
Азотная кислота, 8 н. раствор.
Тартрат натрия-калия КПаС4Н40б • 4Н2О, 10%-ный раствор.
Аммиак, 8 н. раствор.
Цианид калия, 10%-ный раствор.
Дитизон, приблизительно 200 мкМ. раствор в четыреххлористом углероде. 1 жл^13,9 мкг Bi3+.
Азотная кислота, разбавленная, 0,5 н. раствор.
Ход определения. Пробу растворяют в 8 н. растворе азотной кислоты, кипятят и разбавляют до
* Руденко Н. П. [5639] разработал быстрый экстракционный метод разделения Th-B (Pb212) и Th-C (Bi212), по которому Th-C (Bi212) экстрагируется 0.01%-ным раствором дитизона при pH ~ 3,0. Метод позволяет получать препараты этих радиоактивных изотопов в радиохимически чистом состоянии как без носителя, так и с носителем.
Дейк и Слотхаувер [5741] описали метод определения висмута (а также Pb, Си, Zn, Cd. Hg и Au) в биологических материалах и пищевых продуктах путем экстракционного титрования хлороформным раствором дитизона. — Прим. ред.
222
Применение дитизона в количественном анализе
определенного объема. Аликвотную часть раствора, содержащую около 20 мкг висмута, доводят до 25 мл. добавляют 1 мл раствора тартрата на каждые 20 мг вещества и слабо подщелачивают аммиаком. После добавления 5 мл раствора цианида pH раствора становится около 9—10.
В делительной воронке полученный раствор исчерпывающе экстрагируют раствором дитизона (встряхивая каждый раз в течение 20 сек.) до исчезновения оранжево-коричневого цвета и получения устойчивой окраски раствора дитизона.
Объединенные органические экстракты встряхивают с 10 мл разбавленной азотной кислоты в течение около 20 сек. Ионы Bi3+ (а также РЬ2+ и Т1+) переходят в водную фазу.
В отсутствие ионов РЬ2+ и Т1+ содержание висмута можно определить по методам, приведенным в разделе 6,2 или 6,3; в присутствии незначительны?; количеств упомянутых элементов содержание висмута можно определить по методу, рассмотренному в разделе б, 1, или же пригоден один из описанных на стр. 218 способов.
2. Определение висмута в меди [45б]
Возможно определение 2-10~4% висмута.
Сначала ионы Bi3+ выделяют из основной массы меди осаждением на двуокиси марганца (метод концентрирования) . После растворения двуокиси марганца висмут вместе с сопутствующими свинцом и таллием отделяют экстракцией раствором дитизона в щелочной среде. Дитизонаты разлагают в кислом растворе и ионы Bi3+ определяют при pH 3 прямым экстракционным титрованием раствором дитизона в четыреххлористом углероде.
Реактивы
Азотная кислота, 8 и. раствор.
Аммиак, 8 н. раствор.
Бромид калия, 20%-ный раствор.
Перманганат калия, 3%-ный раствор
Серная кислота, 8 н. раствор.
Сульфит натрия, 20%-ный раствор.
Определение металлов группы дитизона. Висмут
223
Лимонная кислота C^HsO; • Н2О, 50%-ный раствор. Цианид калия, 50%-ный раствор.
Дитизон, 200 ж/М4 раствор дитизона в четыреххлористом углероде. 1 мл = 13,9 мкг Bi+3.
Азотная кислота, разбавленная, 0,75 н. раствор.
Ход определения. Растворяют в азотной кислоте 15 г медных стружек. После удаления окислов азота выпариванием и охлаждения доводят аммиаком pH раствора до 4 и, наконец, прибавляют столько азотной кислоты, чтобы ее концентрация в растворе соответствовала 0,02 н. Нагревают до кипения, прибавляют 5 мл- раствора бромида калия и 3 мл раствора перманганата калия, снова кипятят до исчезновения фиолетовой окраски, отфильтровывают выпавшую двуокись марганца через тигель для фильтрования и промывают осадок 2 раза водой по 5 мл. Этот прием повторяют с объединенным фильтратом. Осадки объединяют.
Осадок двуокиси марганца растворяют в 5 мл смеси из серной кислоты и раствора сульфита (1:1), добавляют 4 мл лимонной кислоты, подщелачивают аммиаком и добавляют 4 мл раствора цианида калия. Полученный раствор в делительной воронке исчерпывающе экстрагируют порциями дитизона по 5 мл до тех пор, пока зеленая окраска последней порции не останется без изменения в течение 1 мин. Объединенные органические экстракты промывают 5 мл воды.
Полученные дитизонаты разлагают 2-кратным сильным встряхиванием с разбавленной азотной кислотой порциями по 5 мл и спускают раствор четыреххлористого углерода. Объединенные водные вытяжки доводят аммиаком до pH 3 и дважды промывают небольшим количеством четыреххлористого углерода.
Содержание висмута определяют прямым экстракционным титрованием (ср. раздел б, 1).
3. Определение висмута в биологическом материале [4917]
Ионы Bi3h отделяют от ионов РЬ2+ и других сопутствующих элементов из 20%-ного раствора уксусной кислоты при pH 2,5 обработкой избытком 400 мкМ
224
Применение дитизона в количественном анализе
раствора дитизона в четыреххлористом углероде. Фосфаты не мешают. Присутствующие в растворе ионы Си2+ полностью, а ионы Zn2+ частично экстрагируются вместе с ионами Вг3+. Полученный дитизонат висмута разлагают разбавленной азотной кислотой, содержащей бромид калия. Из водного раствора после доведения его до pH 9,5 и маскирования ионов Си2+ и Zn2+ раствором цианида калия экстрагируют ионы Bi3+ 25 мкМ раствором дитизона в хлороформе и фотометрируют.
Реактивы
Азотная кислота, 10 н. раствор.
Уксусная кислота, ледяная.
Едкий натр, 2 н. раствор.
Дитизон, приблизительно 400 мкМ раствор дитизона в четыреххлорпстом углероде. 1 мл 2 g 27,9 мкг Bi3+.
Азотная кислота, разбавленная, 0,04 н. раствор. Бромид калия, 40%-ный раствор, подщелоченный несколькими каплями NH4OH.
Ход определения. Органическое вещество подвергают озолению сухим путем при 500°!, остаток растворяют в малом количестве азотной кислоты и разбавляют водой до 30 мл. К раствору в делительной воронке, содержащему не больше 10 мкг висмута, прибавляют 10 мл ледяной уксусной кислоты и с помощью едкого натра при охлаждении устанавливают pH раствора до 2,5. Затем прибавляют раствор дитизона порциями по 10 мл и тщательно встряхивают2.
Объединенные органические экстракты встряхивают в течение 1 мин. с 50 мл разбавленной азотной кислоты и отделяют водную фазу. Затем опять органический экстракт обрабатывают 50 мл разбавленной азотной кислоты и 5 мл раствора бромида калия, в течение 1 мин., встряхивают и отделяют. В отделенном водном растворе определяют висмут по методу, описанному в разделе б, 23.
Примечания
1 Следует обратить внимание на возможность улетучивания висмута при озолении сухим путем органического материала [347].
2 В присутствии большого количества ионов Fe3+, Са2+ и РО^-для получения прозрачного щелочного раствора требуются большие
Определение металлов группы дитизона. Индий
226
количества подавляющего экстракцию цитрата, поэтому Хэбард [394, 489] рекомендует сначала отделять висмут в виде сульфида.
3 Хэбард [489] определяет от 0 до 10 мкг висмута с точностью ± 0,1 мкг; из щелочных растворов, содержащих растворы цитрата и цианида, висмут вместе со свинцом и таллием отделяют с помощью избытка 200 Л1кА4 раствора дитизона в хлороформе. Буферным раствором с pH 3,4 разлагают дитизонаты свинца и таллия. Затем разлагают дитизонат висмута 0,15 н. раствором азотной кислоты и в водном растворе определяют содержание висмута по методу, приведенному в разделе 6.2.
Клучески, Лонгли и Козелка [4216] минерализовали органическое вещество серной, азотной п хлорной кислотами мокрым путем. После прибавления цитрата, цианида и аммиака висмут вместе со свинцом и таллием экстрагировали из раствора с pH 8,5 раствором дитизона в четыреххлористом углероде. Затем встряхивали органический экстракт с азотной кислотой (pH 2,3—2,5), причем дитизонаты свинца и таллия разлагались и оставшийся смешанный экстракт, состоящий из дитизоната висмута и дитизона, фотометрировали при двух длинах волн и вычисляли содержание висмута по номограмме.
ИНДИЙ
а) ОБЩИЕ СВЕДЕНИЯ
Ионы 1п3+ образуют с дитизоном в органических растворителях в узком интервале pH растворимый однозамещенный дитизонат малиново-красного цвета [375, 492]:
InX. + 3H2Dzopr. 7=* In (HDz)30pr. + ЗНв+одн..
Реакция протекает вяло и сильно зависит от pH, концентрации и избытка дитизона. В ацетатном растворе ионы 1п3+ реагируют с раствором дитизона в че-реххлористом углероде быстрее всего при pH ~ 5,5 и с раствором дитизона в хлороформе при pH ~ 9 [4812]. На рис. 24 приведены области pH, в которых экстрагируется индий в четыреххлористом углероде и в хлороформе в качестве растворителей.
Раствор дитизоната индия в четыреххлористом углероде быстро разлагается при действии 0,01 и. раствора аммиака [375]. Пилипенко [5011] определил константу нестойкости дитизоната индия в четыреххлористом углероде (см. табл. 7, стр. 58). Раствор дитизоната индия
15 Зак 2157.
226 Применение дитизона в количественном анализе в четыреххлористом углероде немного, а в хлороформе незначительно чувствителен к свету [4812].
Прямое экстракционное титрование (раздел б, 1) ионов 1п3+ протекает удовлетворительно при соответствующем оптимальном значении pH, которое зависит от характера и количества присутствующих компонентов в растворе *.
рн
Рис. 24. Извлечение ионов 1п3+ в зависимости от pH раствора и природы органического растворителя (схематическое изображение по данным Мэя и Гофмана [4812]).
Спектр поглощения дитизоната индия в четыреххлористом углероде (рис. 25) показывает резко выраженный максимум при длине волны 510 лщ, точно совпадающий с минимумом поглощения раствора дитизона в четыреххлористом углероде.
Мэй и Гофман [4812] определили спектрофотометрически индий в виде дитизоната в хлороформе.
* Клейнер К. Е. и Маркова Л. В. [5315], изучая влияние концентрации водородных ионов на образование дитизоната индия при экстракционном титровании треххлористого индия раствором дитизона в четыреххлористом углероде, нашли, что максимальное извлечение дитизоната индия из растворов в присутствии ацетатных буферных смесей (CH3COONa 4-НС1 или СН3СООН 4-NH4OH) наблюдается при pH 4—4,3, без буферных смесей — при pH 3,5.
Коренман Н. М., Шеянова Ф. Р., Митрохина Т. Н. и Трапезникова Т. Н. [5927] изучали экстрагирование дитизоната индия хлороформом в зависимости от pH раствора и показали, что дитизонат индия полностью экстрагируется при pH ~5. Ими же разработан метод радиометрического титрования 100—10 мкг индия с помощью хлороформного раствора дитизона. — Прим. ред.
Определение металлов группы дитизона. Индий
227
При визуальных колориметрических определениях по методу смешанной окраски (раздел 6,2) выбирают серо-фиолетовой оттенок из малиново-красной — серофиолетовой — серо-зеленой — изумрудно-зеленой переходной окраски.
Влияние посторонних анионов. Ионы CN~ не мешают, если присутствуют в умеренном количестве [4812]. При pH 8,5 и хлороформном растворе дитизона подавляющее экстракцию влияние 1%-ного раствора цианида калия еще ничтожно мало.
Модуль поглощения т, см
Р и с. 25. Кривые поглощения раствора In(HDz)3 в четыреххлористом углероде.
------25/3 мкМ раствор In(HDz)3; ----25 мкМ. раствор H2Dz.
Цитрат- и тартрат-ионы с увеличением концентрации соответственно подавляют экстракцию ионов 1п3+. В щелочной области при применении хлороформного раствора дитизона подавляющее действие меньшее, чем при использовании раствора дитизона в четыреххлористом углероде.
Ионы РО'Г” мешают, присутствуя уже в малой концентрации [5315].
Влияние посторонних катионов. Ионы Ag+, Hg2+, Pd2+, Au3+, а также Cu2+ мешают. Умеренные количества этих ионов можно удалить при pH < 2 предварительной экстракцией дитизоном.
Ионы Bi3+, Zn2* Ni2+, Со2* Tl+, Pb2+ и Cd2* мешают. Их можно выделить при pH > 7,5 предварительной
15*
228 При менение дитизона в количественном анализе
экстракцией раствором дитизона в четыреххлористом углероде, если их содержание не превышает 10-кратного избытка [5315]. Ионы Zn2+, Сс12+, Со2+ и Ni2+ можно замаскировать с помощью ионов CN~. Ионы Т1+ при pH < 7 могут незначительно мешать.
б) ОСНОВНЫЕ МЕТОДЫ ОПРЕДЕЛЕНИЯ
1. Прямое эстракционное титрование
Реактивы
Дитизон, 50 мкМ раствор в четыреххлористом углероде. 1 мл == 1,91 мкг 1п3+.
Аммиак, 0,1 н. раствор.
Соляная кислота, 0,1 н. раствор.
Эталонный раствор соли индия, 50/3 мкМ раствор 1пС1з, 0,5 н. по НС1. 1 мл содержит 1,91 мкг 1п3+.
Ход о п р е д е л е н и я. 20 мл испытуемого раствора в делительной воронке доводят аммиаком пли соляной кислотой до pH 5,5 и проводят экстракционное титрование раствором дитизона. После каждой добавленной порции дитизона раствор встряхивают в течение 2 мин. В точке перехода раствор окрашивается в серо-фиолетовый цвет. Расход дитизона приблизительно на 5% выше стехиометрического значения.
Точность определения ±4%.
2. Визуальное колориметрическое определение по методу сметанной окраски
Реактивы. Аналогичные указанным в разделе б, 1.
Ход определения. Кислотность 5 мл испытуемого вещества доводят 1 с помощью аммиака пли соляной кислоты до pH 5,5. Раствор разбавляют водой до 15 мл и проводят извлечение раствором дитизона, прибавляя его определенными порциями, каждый раз встряхивая, до получения серо-фиолетовой окраски. Этого достигают при прибавлении избытка дитизона
Определение металлов группы дитизона. Индии
229
в количестве около 60%. Сравнивают по методу стандартных серий.
Точность определения ±2%.
Примечание
1 В присутствии металлов, маскируемых ионами CN~, определение проводят в щелочном растворе (см. следующий вариант).
Вариант определения в щелочной области pH.
Реактивы
Дитизон, 25 мкМ раствор в хлороформе. 1 мл = = 0,956 мкг 1п3+.
Аммиак, 2 и. раствор.
Цианид калия, 10%-ный раствор.
Эталонный раствор соли индия см. в разделе б, 1.
Ход определения [4812]. 5 мл испытуемого раствора слабо подщелачивают аммиаком в цилиндре для смешивания. Прибавляют 1 мл раствора цианида калия и доводят аммиаком pH до 9, после чего разбавляют водой до 15 мл. Добавляют порциями раствор дитизона, каждый раз взбалтывая до появления сине-фиолетовой смешанной окраски, которая возникает при приблизительно 40%-ном избытке дитизона.
Проводят сравнение с серией эталонных растворов.
Точность определения ±2%..
в) ПРИМЕНЕНИЕ
По определению ионов 1п3+ раствором дитизона имеется мало опубликованных работ.
Мэй и Гофман [4812] определяли 10 мкг индия в присутствии ряда других металлов, а также 10-кратного количества ионов Zn2+. В 1%-ном растворе KCN и при pH ~8,5 можно полностью отделить ионы 1п3+ от ионов Zn2+ экстракцией дитизоном в хлороформе. Если присутствуют еще и другие металлы, ионы 1п3+ обогащают путем экстракции их раствором оксина в хлороформе.
230 Применение дитизона в количественном анализе
Последующего концентрирования ионов 1п3+ достигают экстракцией содержащим купферрон раствором дитизона в хлороформе *.
ОЛОВО
а) ОБЩИЕ СВЕДЕНИЯ
Ионы Sn2+ реагируют с дитизоном в области pH от 5 до 9 с образованием однозамещенных дитизонатов, растворяющихся в органических растворителях с красным окрашиванием [351]:
Sn2BXlH. + 2H2Dzc,nr. Sn (HDzbopr. + 2НЕ+одн,.
Пилипенко [5313] определил константу нестойкости дитизоната олова в четыреххлорпстом углероде (табл.7, стр. 58).
Р и с. 26. Кривые поглощения раствора Sn(HDz)2 в четыреххлористом углероде.
------25/2 мкМ раствор Sn(HDz)j ---25 мкМ раствор H2Dz.
10% раствора дитизоната олова в четыреххлорпстом углероде разлагаются в течение 1 часа в темноте и свыше 50%—при нормальном’ дневном освещении. Разложение протекает еще быстрее под влиянием элементарного кислорода, окисляющего ионы Sn2+ в Sn4+
* При определении следов индия в германии и двуокиси германия [5634], в минеральных водах [5337] и биологических материалах [4315] применяют дитизон для предварительного извлечения индия из анализируемых проб. Подробное описание хода этих определений см. [588]. — Прим ред.
(Jnpcde iCHiie металлов группы дитизона. Цинк 231
с образованием при этом свободного дитизона. Это явление, несмотря на хорошо выраженное поглощение (рис. 26), делает непригодным дитизон для аналитического определения * ионов Sn2+ **.
Влияние посторонних ионов. Поны CN" не мешают образованию дитизоната олова. При. pH > 7 в присутствии ионов CN~ маскируются остальные металлы, образующие дитизонаты, кроме ионов Bi3+, Pb2+ и Т1+ (или 1п3+).
Йоны Sn2+ благодаря легкой окисляемости не мешают отделению и определению других металлов, образующих дитизонаты, легко окисляясь из Sn2+ в Sn4+. Последние не реагируют с дитизоном. Большие количества коллоидной метаоловянной кислоты подавляют экстракцию. Во многих случаях олово можно выпарить в виде бромида олова (IV) (ср. стр. 141, 256 и 317), однако следует иметь в виду, что оно захватывает сопутствующие элементы.
цинк
а) ОБЩИЕ СВЕДЕНИЯ
Ионы Zn2+ в нейтральном растворе образуют с дитизоном однозамещенный дитизонат цинка, растворимый в органических растворителях с образованием пурпурно-
* Олридж и Кример [5717] установили образование комплексов дитизона с оловоорганическими соединениями. При взбалтывании хлороформного раствора дитизона с раствором диэтил-олова в присутствии трихлоруксусной кислоты образуется комплекс с максимумом поглощения при 510 лщ. Трпэтилолово в этих условиях не реагирует. В боратном буферном растворе (pH 8,4) образуют комплексы как диэтил-, так и трпэтилолово с максимумами поглощения соответственно при 485 и 440 лгд. Коэффициенты распределения между боратным буферным раствором и хлороформом для комплексов диэтил- и триэтилолова соответственно равны 50 и 0,13. Олридж и Кример разработали метод спектрофотометрического определения диэтил- и триэтилолова в их смесях, основанный на различной экстрагируемости их хлороформом и образовании комплексов с дитизоном. Введением комплексона III устраняют помехи, вызываемые присутствием других металлов, образующих да тизонаты. — Прим. ред.
** Только Пкеда [55;?,"j сообщает <>б экстракции дитизоната олова с целью конценгрированпя конов Sn-+ в воде горячих источников (ср. стр. 368).
232
Применение дитизона в количественном анализе
красной окраски [/8, 82]:
2Пводн. 2H-jDZopr. <—- Zn (HDz)-j Орг.2НВодп.« (1)
Константа равновесия этого уравнения была повторно определена в четыреххлористом углероде [444, 5023, 522] и в хлороформе [413, 502\ 522] (ср. стр. 52). Реакция обычно протекает при оптимальном pH раствора относительно быстро, причем в четыреххлористом углероде несколько быстрее, чем в хлороформе [373, 384, 5023]. На рис. 27 приведены данные, характеризующие извлечение ионов Zn2+, причем встряхивание с четыреххлористым углеродом протекало 5 мин., а с хлороформом в качестве растворителя в течение одного часа до достижения равновесия в сильнокислом растворе.
Рис. 27. Извлечение ионов Zn2 ь в зависимости от рИ раствора, сопутствующих компонентов в растворе и природы органического растворителя.
а или с;г — в присутствии 1 Ж раствора ацетата или хлорида натрия; Ь пли Ь' — в присутствии 0,1 М раствора Na_,S.O3; с или с' —в присутствии 5-10“Ч. раствора карбамината (схематическое изображение по данным Королева [50 • ] ).
При использовании четыреххлористого углерода можно количественно извлечь ионы цинка из уксуснокислого водного раствора при pH 6,5—7,5 при встряхивании в течение полминуты. В присутствии тиосульфата натрия встряхивание следует проводить дольше, а в присутствии карбамината pH испытуемого раствора доводят до 8,5*.
* Огава [56 s] исследовал влияние pH раствора в присутствии других электролитов при образовании и разложении дитизоната цинка в четырех хлористом углероде.
Определение металлов группы дитизона. Цинк
233
При использовании хлороформа экстракцию ионов цинка проводят в растворах с pH на единицу выше, чем при применении для топ же цели четыреххлористого углерода.
Повышая концентрацию одного из компонентов реакции, можно расширить пределы pH, при которых протекает извлечение. Так, например, при двойном избытке дитизона (в хлороформе) при pH 3,97 извлекается больше 60% ионов Zn2+. Если избыток дитизона составляет 8,5-кратное количество, то при pH 3,97 достигают 9&%-ного извлечения и при pH 3,05 около 35% цинка переходит в органический экстракт [413]. При 10-кратном избытке цинка, pH около 2 и встряхивании в течение 10 мин. с раствором дитизона в четыреххлорпстом углероде можно извлечь около 5% цинка. При фракционированном встряхивании можно значительно увеличить эффективность экстракции.
На рис. 28 приводится ход образования и разложения 25/2 мкМ раствора дитизоната цинка в четыреххлорпстом углероде в зависимости от pH и времени встряхивания *.
Процессы образования и разложения дитизоната цинка при встряхивании в течение 10 мин. не являются зеркально симметричными, поскольку в граничных областях pH в указанное время реакция не достигает равновесия (I).
Дитизонат цинка в четыреххлорпстом углероде при встряхивании водного раствора с pH 10,5 в течение 10 мин. не претерпевает заметного разложения.
* Многократно исследовалась экстракция дитизоната цинка хлороформом в зависимости от pH и в присутствии различных электролитов [413, 435, 50-3, 522, 56\ 5614, 5621]- Влияние большого избытка дитизона, а также ход экстракции при применении бензофенона в качестве растворителя при экстракции изучались радиометрически (ZnG;) Коренманом II. М. и Шеяновой Ф. Р. [5621]. [Ко-ренман II. М., Шеянова Ф. Р. и Савельева М. II. [59я], кроме этого, изучали зависимость экстрагирования дитизоната цинка (а также дитизоната кобальта с использованием Со60) салолом и /z-дибром-бензолом от pH раствора, нагревания и перемешивания. При этом они установили, что характер закономерностей экстрагирования дитизонатов твердыми экстрагентами в зависимости от pH такой же, как и для жидких экстрагентов. —Прим. ред.
234
I'рам<. пение дитизона и количественном анализе
Разработан метод определения ионов Zn2+ в щелочной области по методу одноцветной окраски (ср. раздел 6,2, а также раздел 6.3). Ионы Zn2+ экстрагируют при оптимальном pH 6,5—7,5 небольшим избытком раствора дитизона в четыреххлорпстом углероде и удаляют послед-н 11 й и р омыванием с л а б о щ ел о и и ы м р а ст вором. Если
Р н с. 28. Ход образования и разложения Zn(HDz)2 в четыреххлористом углероде в зависимости от pH раствора и времени встряхивания (схематическое изображение).
-------образование или разложение после встряхивания в течение полминуты; ------ образование или разложение после
встряхивания в течение 10 мин. Для выяснения хода образования встряхивали равные объемы 25 мкМ. раствора H.Dz в четыреххлористом углерода и 25/2 ж/гЛТ раствора соли цинка в ваде с известным pH. Для выяснения хода разложения встряхивали равные объемы 25/2 мкМ раствора Zn(HDz). в четырехх.ъ ри-стом углероде и водного ацетатного буферного раствора с известным pH.'
в щелочном растворе присутствует умеренное количество ионов S2~, то одновременно соэкстрагпрованные дитизонаты серебра, ртути, меди, свинца, кадмия и др. разлагаются, превращаясь в сульфиды *, в то время как дитизонат цинка в четыреххлористом углероде остается практически без изменения.
* Например, Hg (HDz)2 орг, у S/OilH. HgSBMIL + 2HDzB0.n —.
Прим. ред.
Определение металлов группы дитизона. Цинк
235
Водные растворы с pH > 13 быстро разлагают дитизонат цинка в четыреххлористом углероде (уравнение II)
Zn(HDz)2opr. + 2OH3"^. Zn(OH)2BosH.4-2HDzB-AH.. (И)
Дитизонат цинка в четыреххлористом углероде можно количественно разложить в течение 10 мин. водным раствором с pH 4, с помощью же 0,01 н. раствора соляной кислоты — уже в течение 1 мин., чем и пользуются при отделении ионов Zn2+ из дитизонового экстракта, содержащего кислотостойкие дитизонаты, как, например, Cu(HDz)2, Co(HDz)2 и аналогичные.
В оптимальных границах pH 6,5—7,5 образование дитизоната цинка протекает исключительно быстро, вследствие чего можно проводить прямое экстракционное титрование ионов Zn2+ раствором дитизона в органическом растворителе (раздел 6,1).
Растворы дитизоната цинка в хлороформе устойчивы в течение нескольких недель. Растворы дитизоната цинка в четыреххлористом углероде, приготовленные с вычисленным количеством четыреххлористого углерода и хранящиеся в темноте, не показывают заметного уменьшения экстинкции. Повышенная температура и, особенно, яркое освещение обусловливают медленное разложение. В аналогичных условиях (качество четыреххлористого углерода, температура, освещение и т. п.) стойкость во времени дитизоната цинка в четыреххлористом углероде выше, чем дитизона в том же растворителе.
Кривая поглощения раствора дитизоната цинка в четыреххлористом углероде (см. рис. 29) характеризуется хорошо выраженным максимумом с длиной волны 538 лць В этой точке (538 л/р) раствор дитизона в аналогичном растворителе соответствующей концентрации поглощает относительно слабо, поэтому избыток дитизона в четыреххлористом углероде в количестве 1 % повышает поглощение дитизоната цинка в четыреххлористом углероде только на 0,17%. Следовательно, полное удаление избытка дитизона не является необходимым при определениях по спектрофотометрическому методу одноцветной окраски (см. раздел 6,3). Следует больше
236 Применение дитизона в количественном анализе
обращать внимание на то, чтобы экономным промыванием по возможности слабощелочным раствором не допустить разложения дитизоната цинка. Избыточное количество дитизона в четыреххлорпстом углероде можно определить при длине волны 620 зщ, поскольку при этой длине волны дитизонат цинка в четыреххлорпстом углероде практически не поглощает. Эта способность благоприятствует фотометрии по смешанной окраске (раздел 6,5). При визуальной колориметрии по методу смешанной окраски (раздел. 6,4) из ряда оттенков — от пурпурно-красного [Zn(HDz)2 в четыреххлорпстом углероде] через красно-фиолетовый, фиолетовый, пурпурнофиолетовый, синий, сине-серый, сине-зеленый до изумрудно-зеленого (H2Dz в четыреххлорпстом углероде) — следует выбрать сине-серый, как наиболее чувствительный.
Рис. 29. Кривые поглощения растворов Zn(HDz)2 в четыреххлористом углероде.
25/2 мкМ раствор Zn(HDzL; — — — 2о0/2 раствор ----------------- 25 мкМ раствор H_,Dz.
Zn(HDz),.;
Влияние посторонних анионов. Ионы S2- слегка мешают, если присутствуют в 100-кратном количестве. Ионы S2O5~, присутствуя в больших количествах, подавляют экстракцию (ср. рис. 27, стр. 232), и в тем большей степени, чем ниже pH раствора. С другой стороны, ионы S20j маскируют в кислых растворах мешающие ионы (см. табл. 17, стр. 239). При pH<4 следует учитывать заметное разложение серноватистой кислоты.
Определение металлов группы дитизона. Цинк
237
Ионы С1" подавляют экстракцию, если присутствуют в большом количестве, образуя [ZnClJ2-. Ионы CN-, присутствующие в большой концентрации, слабо влияют при pH<6 на экстракцию и маскируют ионы Со2+ и Ni2+. При рН>7 они также маскируют ионы Zn2+. Очень большое содержание ионов CN“ уже при pH 4,5 подавляет экстракцию ионов Zn2+. Ионы РОГ в большой концентрации подавляют экстракцию, особенно при pH около 7 [552]. Тартрат и цитрат в больших концентрациях затрудняют экстракцию, в особенности при pH <7.
Диэтилдитиокарбаминат также реагирует с ионами Zn2+ при pH 8,5; в органическом экстракте наряду с ди-тизонатом цинка присутствует и /п(карбаминат)2 (см. рис. 27). Диэтилдитиокарбаминат - способен замаскировать умеренные количества ионов Hg2+, Cu2+, Со2+, Ni2+ и Pb2+, а также небольшие количества ионов Cd2+ [392, 414, 452, 482]. При рН>9 с помощью раствора диэтил-дитиокарбамината в четыреххлористом углероде можно извлечь и удалить ионы Си2+ [392\
Аналогично дпэтилдитиокарбампнату при pH 7,5— 8,5 ведет себя диэтила ммонийдпэтилдитиокарбаминат (СоНбДЫ • CS • S • NH2 • (C2Hs)2. Из цитратного раствора можно с помощью дпэтиламмоннйдиэтилди-тиокарбамината в хлороформе количественно извлечь ионы Hg2+? Cu2+, Bi3A Zn2+, Cd2+, Co2A Ni2+ и Pb2+ [485].
При встряхивании хлороформного экстракта с сильнощелочным цитратным раствором происходит разложение карбамината цинка, вследствие чего меняется содержание ионов Zn2+ в водной фазе. В присутствии половинного количества ионов Bi3+ и 2,5-кратного количества ионов Cd2+ количество карбамината, необходимого для их маскирования, настолько невелико, что оно не мешает определению ионов цинка дитизоном в четыреххлористом углероде [485]. Ионы Ag+, Hg2+, Cu2+ и Bi3+ при 100-кратном содержании можно удалить из 6 н. раствора серной кислоты при встряхивании с раствором карбамината в хлороформе, причем не происходит одновременной экстракции ионов Zn2+ [485].
Дпэтанолдитпокарбаминат [бис- (оксиэтил) -днтпокар-бампнат] совместно с раствором дитизона в четыреххло
238
Применение дитизона в количественном анализе
ристом углероде экстрагирует из тартратного раствора с pH 8,8 5 мкг цинка в присутствии 1 мг кадмия и 100 мг никеля [475, 4711]. При pH 5,5—6,0 с помощью этого же реагента можно замаскировать ионы Bi3+ и Cd2+, а также ионы Си2+, РЬ2+ и Ni2+, присутствующие в умеренном количестве [5028, 53'].
Влияние посторонних катионов. Поскольку ионы Zn2+ реагируют с дитизоном в области pH, в которой большинство других металлов образуют дитнзонаты большей частью раньше, чем цинк, то можно селективно провести реакцию с ионами Zn2+, используя маскирующие вещества, как это видно из табл. 17. Ниже описываются другие способы маскировки или устранения мешающих ионов.
Ионы Ag+, Hg2+, Pd2+, Au3+ и Cu2+ реагируют раньше ионов Zn2+. Можно предварительно извлечь еще 10-кратное количество этих ионов из раствора с рН<2 и попутно захваченное незначительное количество дитизоната цинка в четыреххлористом углероде разложить 0,01 и. раствором серной кислоты. Впрочем, эти ионы можно выделить или с помощью сероводорода, или электролитически, или восстановлением фосфорновати-стой кислотой [364-
Ионы Ag+ можно замаскировать ионами J-, Вг~, CN~, SCN" или С1" или же с помощью последних можно разложить дитизонат серебра, полученный в экстракте из четыреххлористого углерода.
Ионы Си2+ (а также ионы Fe3+) можно извлечь из кислого раствора путем экстракции купфероном в хлороформе.
Ионы 1п3+ неколичественно реагируют при pH 8,5— 9,5 с дитизоном, вследствие чего в этой области pH можно еще определить до 1 % цинка в индии. К аналогичным результатам приводит щелочное разложение объединенного экстракта при pH 9,5. При определениях одноцветных растворов (раздел б, 2) или при их спектрофотометрических определениях (раздел б, 3) мешают уже 100-кратные количества дитизоната индия.
Ионы Cd2+ экстрагируются совместно с ионами Zn2+ в области pH от 4 до 12. Малые количества (до 20-кратного) дитизоната кадмия можно разложить в экстракте из четыреххлористого углерода промыванием его щелоч-
Определение металлов группы дитпгона. Цинк 239
Таблица 17
ДОПУСТИМЫЕ КОЛИЧЕСТВА ЭЛЕМЕНТОВ, ОБРАЗУЮЩИХ ДИТИЗОНАТЫ И НЕ МЕШАЮЩИХ ЭКСТРАКЦИИ ИОНОВ Zn2 + [361] (возможно определять 1 мкг пинка в 2 мл раствора с pH 4,5 — 5.0)
Катион Допусти м ы с к о личества Дополнительные данные к IV колонке
в отсутствие маскирующего вещества в присутствии маскирующего вещества при однократной экстракции, мкг маскирующее вещество, формула количество, мг
при однократной экстракции, мкг при двукратно:’! экстракции, мкг
Ag+ 0 102 Ю4 Na2S2O3 • 5Н2О 500
Hg2+ 0 102 103 Na2S2O3 • 5Н2О 700
Pd2+ 0 102 —Н* Na2S2O3 • 5Н2О
1 - KCN
Au3 + 0 102 —1—• Na2S2O3 • 5Н2О
KCN
Cu2+ 0 102 103 Na2S2O3 • 5Н2О 500
Bi3 + 0 102 103 Na2S2O3 • 5Н2О 300
ln3 + 102 1Q3 а
Cd2+ < 1 > 1а 10 Na2S2O3 • 5Н2О 500
Co2+ 10 103 104 KCN 600
Pb2+ 10 102 104 Na2S2O3 • оН2О 350
Ni2+ 10 103 104 KCN 600
Ti + 102 104
+ Способность к маскированию, установленная качественно.
а После первой (однократной) экстракции полученный экстракт в четыреххлористом углероде разлагают щелочью в противоположность обычному кислотному разложению.
ным раствором, содержащим S2~ ионы (ср. раздел б, 2, вариант 3), не разрушая дитизоната цинка. Можно также сначала определить спектрофотометрически общее содержание дитизонатов в экстракте, затем разложить оба дитизоната и в полученном растворе определить содержание кадмия, которое и учесть при вычислении содержания цинка [451]. Сильная щелочь разлагает преимущественно дитизонат цинка. Можно отделить избыток кадмия не более чем в 10-кратном количестве в 0,5 н.
240 Применение дитизона в количественном анализе
растворе едкого натра экстракцией дитизоном в четыреххлористом углероде. Большие количества ионов Сс12+ можно выделить в виде [CdJJ2’ с помощью ионообменной колонки. Методом концентрирования можно определить еще 5‘10~3% цинка в металлическом кадмии [552]. Было проведено также разделение в виде солянокислых комплексов с помощью смолы дауэкс 1 [564]. После предварительного отделения кадмия с помощью амберлита JR-120 можно еще определить 2- 1СН% цинка [556J *.
Была показана возможность выделения следов цинка возгонкой в токе водорода [5521, 5525].
б) ОСНОВНЫЕ МЕТОДЫ ОПРЕДЕЛЕНИЯ
Поскольку цинк имеет широкое распространение, необходимо проводить испытание всех применяемых реактивов на содержание в них цинка и соответствующим образом от него освобождаться, попутно проводя «холостой» опыт.
1. Прямое экстракционное титрование [361] Реактивы
Дитизон, 25 мкМ раствор в четыреххлорпстом углероде. 1 мл = 0,817 мкг Zn2+.
Ацетат натрия КтаС2НзО2 • ЗН2О, 10%-ный раствор.
Аммиак, 2 н. раствор.
Эталонный раствор соли цинка, 25/2 мкМ раствор
ZnSO.i, 0,01 н. по HoSOi. 1 мл содержит 0,817 мкг Zn2+.
* Бабко А. К. и Клибус Г. X [591 ] предложили метод разделения равных количеств цинка и кадмия, основанный на различной скорости разложения их дитизонатов в растворе хлороформа комплексоном III. При pH 8, соотношении объемов водной и хлороформной фаз 9 : 1 и концентрации комплексона 0,01 моль)л кадмий переходит в водную фазу практически полностью за 35 сек., а заметный переход цинка наблюдается через 90 сек.
Катино и Оддоне [589] описали разделение цинка и кадмия в форме дитизонатов методом противоточного распределения. — Прим. ред.
Определение металлов группы дитизона- Цинк
241
Ход определения. К 10 мл испытуемого раствора в делительной воронке прибавляют 5 мл раствора ацетата натрия, доводят аммиаком до pH 6,5—7,51 и проводят экстракционное титрование раствором дитизона до появления синеватого оттенка (вместо чисто красного) после добавления последней небольшой порции при встряхивании в течение 1 мин.
Точность'определения ±3% 2.
П р и м е ч а н и я
1 С увеличением кислотности раствора (pH < 6.5) расход дитизона уменьшается по сравнению со стехиометрическим значением, в особенности если при этом не увеличивать времени встряхивания для компенсации уменьшения скорости реакции.
С увеличением щелочности (pH > 7,5) растет расход дитизона по сравнению со стехиометрическим, так как часть дитизона в водной фазе переходит в HDz~, в особенности вблизи конечной точки, т. е. когда концентрация ионов Zn2+ уменьшается.
2 Присутствующие в растворе и реагирующие с дитизоном катионы Cu2+, Bi3+, Pb2+, Со2+ и прочие можно замаскировать с помощью 820з- или CN~, одновременно увеличивая кислотность раствора в зависимости от количества взятого маскирующего вещества. При этом прямое экстракционное титрование ионов Zn2+ протекает недостаточно удовлетворительно и понижается точность определения.
Вариант [485]. pH испытуемого раствора доводят до значения 8,7—9,3 и проводят экстракционное титрование хлороформным раствором дитизона, как описано выше.
2. Визуальное колориметрическое определение по методу одноцветной окраски
Разработано несколько вариантов определения в зависимости от характера и количества маскируемых ионов.
Универсальный основной способ. Способ )азработан на распространенных по составу чистых ис-[ытуемых растворах (искусственных смесях).
Ввиду перенесения условий экстракции ионов Zn2+ из птимальной области pH (6,5—7,5) к более низким зна-ениям pH определению не мешает небольшое содержание ионов Т1+ и малые количества ионов Со2+, РЬ2+, Ц2 + , |П3+ И + e
16 ’Зак. 2157.
242
Применение <)ui изона в количественном анализе
Можно воспрепятствовать одновременной экстракции больших количеств ионов. Ag+, Hg2+, Pd2+, Au3+, Cu2+ и Bi3\ если в исследуемый раствор добавить соответствующее количество тиосульфата натрия (см. табл. 17, стр. 239).
Реактивы идентичны применяемым в разделе 6,1 и дополнительно аммиак 0,01 н. раствор.
Ход определения. 1\ 10 мл испытуемого раствора в делительной воронке прибавляют 5 мл раствора ацетата натрия, доводят аммиаком до pH 4,5—5,0 и исчерпывающе экстрагируют раствором дитизона, добавляя его порциями до получения стойкой изумрудно-зеленой окраски раствора после добавления последней порции дитизона и встряхивания в течение 1 мин. Объединенные органические экстракты собирают во второй делительной воронке, разбавляют четыреххлористым углеродом до определенного объема и три раза промывают разбавленным раствором аммиака порциями по 10 мл, сильно встряхивая в течение полминуты *. При этом последний промывной экстракт не должен иметь желтого оттенка.
Экстракт четыреххлористого углерода пурпурнокрасного цвета сравнивают с серией эталонных растворов. Последние можно сохранять в темноте и пользоваться ими в течение нескольких дней.
Точность определения ±3%.
Примечание
1 При легко протекающей в щелочном растворе обратной реакции (уравнение I, стр. 232) (см. рис. 28) отмывание избытка дитизона является тонкой операцией.
Щелочные промывные растворы сначала захватывают свободный дитизон в виде ионов HDz~. Затем, в зависимости от pH и объема промывного раствора, извлекается дитизонат цинка (уравнение II, стр. 235). Были испытаны буферные растворы с высокой буферностью в щелочной области (pH 10,5), поскольку в этих условиях и строго по аналогичной прописи обрабатывались серия эталонных растворов и испытуемый раствор.
В качестве промывных растворов был предложен ряд буферных растворов. Они все могут быть использованы при соблюдении соответствующей прописи способа промывки, в особенности при сравнении в работе с эталонной серией.
Для экономии времени можно пользоваться агрессивными, т. е. более концентрированными щелочными растворами и при этом уда
Определение металлов группы дитизона. Цинк
243
лять избыток дитизона однократной .промывкой. В этом случае следует строго придерживаться ограниченного избытка дитизона, а также одинакового времени встряхивания отдельных проб (ср. раздел б, 3).
Чтобы выделить с помощью отмывки небольшие количества одновременно захваченных дитизоном примесей металлов, Фишер [361] предложил щелочной сульфидный раствор (ср. вариант 3, стр. 244).
Вариант 1 [361]. Применяется для устранения совместного извлечения больших количеств ионов Ag+, Hg2+, Cu2+, Bi3+ и Pb2+. Содержание ионов Cd2+ не должно превышать содержание ионов Zn2+.
Реактивы аналогичны указанным в разделе 6,2 и дополнительно:
Тиосульфат натрия Na2S2O3 • 5Н2О, 50%-ный раствор.
Смесь тиосульфата натрия с ацетатом натрия, 200 мл раствора ацетата натрия сливают с 10 мл раствора тиосульфата и 300 мл 0,25 н. раствора HNO3.
Ход определения. К 10 мл испытуемого раствора в делительной воронке прибавляют 5 мл раствора ацетата натрия и pH раствора доводят аммиаком до 4,5— 5,0. Прибавляют 0,5 мл (в крайнем случае больше) раствора тиосульфата и исчерпывающе экстрагируют раствором дитизона, прибавляя его отдельными порциями до тех пор, пока изумрудно-зеленая окраска последнего экстракта после встряхивания в течение 2 мин. не останется без изменения. Органические экстракты, объединенные во второй делительной воронке, разбавляют до определенного объема четыреххлористым углеродом и промывают 2 раза по 5 мл раствора смеси тиосульфата и ацетата натрия, один раз 10 мл воды и, наконец, разбавленным раствором аммиака (3 раза по 10 мл), каждый раз сильно встряхивая в течение полминуты. Последующая обработка проводится согласно разделу б, 2, (стр. 242).
Точность определения ±3%.
Вариант 2 [361]. Применяется для устранения совместной экстракции больших количеств металлов, реагирующих с дитизоном, кроме кадмия.
16*
244 Применение дитизона в количественном анализе
Для одновременного маскирования больших количеств ионов Ag+, Hg2+, Cu2+, Bi3+, Pb2+, Co2+ и Ni2+ следует наряду c S2O,+ прибавить соответствующее количество ионов CN- (ср. раздел г, 6, стр. 257).
Фишер [433] провел реакцию между нонами Zn2+ и дитизоном практически специфически, применив маскирующую смесь, составленную по нижеприведенному описанию.
Маскирующая с м е с ь. 10 мл NH4OH (2 н.) сливают с 3 мл (NH4)2C2O4-5H2O (5%-ный) +
+ 30 мл KCN (5%-ный) + 70 мл НС1 (1 н.) +
+ 90 мл NaC2H3O2 • ЗН2О (10%-ный) +
+ 240 мл Na2S2O3-5H2O (50%-ный) +
+ 150 мл NaC2H3O2• ЗН2О (10%-ный) + 400 мл воды.
Маскирующая смесь маскирует «исчерпывающе», и ее можно очистить исчерпывающим встряхиванием с дитизоном в четыреххлористом углероде и последующим промыванием четыреххлористым углеродом. Слабая опалесценция от выпавшей серы не мешает.
Реактивы аналогичны указанным в разделе б, 1 и дополнительно маскирующая смесь, приведенная выше, и смесь тиосульфата натрия с ацетатом натрия, аналогичная указанной в разделе б, 2, вариант I.
Ход определения. В делительной воронке 10 мл испытуемого раствора доводят аммиаком до pH 4,5, прибавляют 20 мл маскирующей смеси, доводят до pH 4,5— 5,0 и исчерпывающе экстрагируют, добавляя порциями раствор дитизона до тех пор, пока последняя порция экстракта после 5-минутного встряхивания не будет сохранять свою изумрудно-зеленую окраску. С объединенными органическими экстрактами поступают согласно разделу б, 2, вариант 1.
Точность определения ±3%.
Вариант 3 [361]. Метод позволяет выделить в виде сульфидов совместно с цинком извлеченные дитизоном металлы, именно ионы Ag+, Hg2+, Cu2+, Bi3+ и Pb2+. Метод особенно пригоден для определения ионов Zu2+ в присутствии 10-кратного избытка ионов Cd2+.
Определение металлов группы дитизона. Цинн 245
Реактивы аналогичны указанным в разделе 6,2, вариант 2, и дополнительно промывной раствор — 0,05%-ный раствор Na2S-9H2O. Готовят ежедневно разбавлением 1%-ного раствора Na2S-9H2O, который в качестве основного раствора должен быть свежим. После декантации раствор не должен содержать свободных ионов металлов, реагирующих с дитизоном.
Ход определения. 10 мл испытуемого раствора в делительной воронке доводят аммиаком до pH 4,5, прибавляют 200 мл маскирующей смеси, вновь устанавливают pH 4,5—5,0 и исчерпывающе экстрагируют порциями раствора дитизона до тех пор, пока изумрудно-зеленая окраска последней порции экстракта не останется без изменения после 5-минутного встряхивания.
Объединенные органические экстракты, собранные во второй делительной воронке, доводят до определенного объема с помощью четыреххлористого углерода, промывают два раза по 5 мл раствора смеси тиосульфата с ацетатом натрия, один раз 10 мл воды и, наконец, 3 раза по 5 мл промывным раствором, каждый раз сильно встряхивая в течение полминуты Г Последующая обработка аналогична описанной на стр. 241, раздел 6,2.
Точность определения ±4%.
Примечание
1 В зависимости от длительности промывания, частой смены промывных вод и их pH захватывается соответственное количество дитизоната цинка [442]. Поэтому Багот и Уилкокс [552] предложили сильно забуференный раствор с pH около 11,0 в качестве промывного раствора (см. раздел б, 3).
В предложенном последнем методе определения проводили с «исчерпывающе» маскирующей смесью. Так как большое количество реактивов для анализа, с одной стороны, захватывает извне ионы цинка, а с другой — временно подавляет экстракцию, не следует превышать количества маскирующей смеси по сравнению с требуемым (см. табл. 17). Избыточное количество кислоты следует удалить выпариванием. Использование
246
Применение дитизона в количественном анализе
кварцевой или полиэтиленовой аппаратуры или посуды уменьшает количество «холостых» опытов.
В период возникновения дитизонового метода [355] дитизонат цинка колориметрировали в водных щелочных растворах: 0,1 н. раствор едкого натра насыщают дитизоном, раствор густого оранжевого цвета в 100 раз разбавляют водой, после чего концентрация едкого натра в нем соответствует 1 • 10-4 н. Затем прибавляют нейтральный водный раствор соли цинка от 1 до 3 мкг в 100 мл; это вызывает появление вишнево-красной окраски раствора, в котором с точностью до ±10% можно определить указанное выше содержание цинка методом стандартных серий. Содержание ионов Zn2+ выше 10 мкг в 100 мл вызывает выпадение не растворимого в воде дитизоната цинка *.
В качестве реагента применялись также растворы дитизона в этиловом спирте [391, 56 24].
3. Спектрофотометрическое определение по методу одноцветной окраски
Реактивы аналогичны указанным в разделе 6,2 или в одном из вариантов.
Ход определения аналогичен описанному в разделе б, 2 или в одном из вариантов. После соответствующего разбавления фотометрируют при длине волны 538 лщ.
Точность определения ±2%.
Так как дитизонат цинка в четыреххлорпстом углероде сильно поглощает при длине волны 538 л/р, в то время как в этих условиях раствор дитизона в том же растворителе показывает слабое поглощение (см. рис. 29, стр. 236), то целесообразно проводить не слишком длительную отмывку избытка дитизона, чтобы попутно не разлагать некоторого количества дитизоната цинка.
При быстром серийном спектрофотометрическом определении ионов Zn2+ в присутствии не более 20-крат-
* Вассерман Е. С. и Супрунович II. Б. [34± 3623] из полученных таким образом щелочных водных растворов дитизоната цинка экстрагировали его затем четыреххлористым углеродом и колориметрировали с помощью колориметра погружения. — Прим. ред.
Определение металлов группы дитизона. Цинп
247
ного избытка ионов Cd2+ Багот и Уилкокс [552] заменили многократное фракционированное извлечение иона Zn2+ однократным и полученный экстракт промывали только один раз раствором фосфата с pH 11,0, содержащим ноны S2-. Поскольку эти авторы при переменном содержании ионов Zn2+, как и при спектрофотомет-рировании по методу смешанной окраски (раздел 6,5, стр. 249), всегда пользовались одинаковым количеством дитизона, то возможное разложение дитизоната цинка, согласно уравнению (II) (стр. 235), по абсолютной величине будет меньшим в случае малого содержания дитизоната цинка.
Вариант [552]. Этот вариант служит для ускоренного определения ионов Zn2+ в присутствии ионов Cd2+ в соотношении, не превышающем Zn : Cd = 1 : 20.
Реактивы
Дитизон, 50 мкМ раствор в четыреххлористом углероде. 1 мл = 1,63 мкг Zn2+ или 2,81 мкг Cd2+.
Ацетат натрия, см. раздел б, 1.
Тиосульфат натрия, см. раздел 6,2, вариант 1.
Смесь фосфата и сульфида натрия, 6%-ный раствор Na2HPO4 • 12Н2О доводят 5 н. раствором NaOH до pH 11,0. К 100 мл полученного раствора добавляют 10 мл 0,25 н. раствора Na2S. Последний, всегда свежеприготовленный, получают пропусканием газообразного H2S в 0,25 н. раствор NaOH до достижения pH раствора 8,0.
Эталонный раствор соли цинка, см. раздел б, 1.
Ход определения. К 20 мл испытуемого раствора, содержащего 5—25 мкг цинка и не более 80 мкг кадмия в делительной воронке и доведенного ацетатным раствором до pH 5, прибавляют 2 мл раствора тиосульфата и 50 мл раствора дитизона. Сильно встряхивают в течение 2 мин.
Большую часть органического экстракта спускают во вторую делительную воронку, прибавляют 10 мл смеси фосфата и сульфида натрия, 15 мл воды и сильно встряхивают в течение полминуты. Скатывают кусочек
248
Применение дитизона в количественном анализе
фильтровальной бумаги в виде ролика, протирают им кончик делительной воронки, спускают немного органического экстракта, затем наполняют экстрактом кювету и фотометрируют при длине волны 538 л/р. Содержание цинка вычисляют по калибровочной кривой.
4. Визуальное колориметрическое определение по методу смешанной окраски [36Ч
Реактивы аналогичны указанным в разделе 6,1 и дополнительно:
Тиосульфат натрия, см. раздел 6,2, вариант 1.
Уксусная кислота, 2 н. раствор.
Ход определения. 1\ 5 мл испытуемого раствора в цилиндре для смешивания прибавляют 2 мл раствора ацетата натрия и 0,25 мл раствора тиосульфата натрия !. С помощью аммиака или уксусной кислоты доводят pH раствора до значения 5,0 и из бюретки добавляют порциями раствор дитизона, встряхивая каждый раз в течение полминуты. Дают раствору проясниться, снова добавляют раствор дитизона, все время наблюдая за окраской раствора до тех пор, пока окраска от пурпурно-красной через фиолетовую не перейдет в сине-зеленую, что соответствует 400 %-ному избытку дитизона. Сравнивают с серией эталонных растворов или проводят сравнительное титрование.
Точность определения ±2%2.
Пр и меча ни я
1 При прибавлении тиосульфата натрия маскируются еще небольшие количества ионов Ag+, Hg2+, Cu2+, Bi3+ и Pb2+; ионы Ni2+ и Co2+ должны присутствовать только в очень малых количествах. Повышение количества тиосульфата затрудняет экстракцию цинка. Поэтому при малом содержании последнего следует проводить продолжительное встряхивание. В присутствии большого количества ионов Со2+ и Ni2+ требуется прибавить соответствующее количество цианида калия (под тягой!) для их маскирования. В случае надобности можно прибавить маскирующую смесь для «исчерпывающего» маскирования и экстрагировать аналогично тому, как это указано в разделе б, 2, вариант 2.
2 С точностью ± Ю'/и можно определить при pH 6,5—7,5 в отсутствие тиосульфата еще 1 мкг цинка в 100 мл чистой воды.
Определение металлов группы дитизона. Цинк
249
5. Спектрофотометрическое определение по методу смешанной окраски
Реактивы аналогичны указанным в разделе 6,4.
Ход определения. К 5 мл испытуемого раствора в делительной воронке прибавляют 2 мл раствора ацетата натрия и 0,25 мл раствора тиосульфата натрия после чего pH доводят аммиаком или уксусной кислотой до 5,0. Добавляют 10 мл раствора дитизона и встряхивают в течение 1 мин. Органический смешанный экстракт фотометрируют при длине волны 538 лщ или 620 Лф. Ввиду высокой экстинкции измеряют ее при толщине слоя 0,5 см. Целесообразнее измерять по отношению к раствору дитизона (стр. 124 сл.) •*.
Точность определения ±2%.
Примечание
1 В случае необходимости можно проводить экстракцию при прибавлении маскирующей смеси для так называемого «исчерпывающего» маскирования по разделу б, 2, вариант 2.
в) ПРИМЕНЕНИЕ
На основе работы Фишера и Леопольди [361] были разработаны колориметрические методы определения следов цинка исключительно на основе реакции с дитизоном. Эту весьма чувствительную реакцию можно за малым исключением провести совершенно селективно; определение довольно простое, и полученные результаты показывают хорошую воспроизводимость.
Поскольку цинк часто и в больших концентрациях находится во многих веществах, то при применении высокочувствительных методов при анализе следов цинка следует из используемой аппаратуры и реактивов полностью удалить следы цинка. «Холостые» опыты предохраняют от ошибочных заключений.
* Майоров Н. Ф. [5537, 5915] разработал метод капельного определения цинка (а также свинца) с помощью дитизона. По этому методу каплю исследуемого раствора наносят на фильтровальную бумагу, обрабатывают парами аммиака и определяют цинк с помощью дитизона методом гашения реакционного пятна. Цинк, при содержании его > 5- 10-5%, находят по калибровочному графику. Чувствительность реакции 10~4%. Метод очень прост и по точности не уступает химическому и спектральному методам. — Прим. ред.
250 Применение дитизона в количественном анализе
В различных водах цинк присутствует вместе с малыми количествами меди и свинца. Зачастую все три указанных элемента определяются при их совместном присутствии (ср. гл. 2, стр. 136). Если требуется определить только цинк, то достаточно добавить к испытуемому раствору небольшое количество Б20з , с помощью которого при pH около 5 маскируются как медь, так и свинец.
В питьевой и хозяйственной воде Хэгль и Сульсер [517] определяли цинк методом смешанной окраски. По методу одноцветного раствора проводили определения Штрогекер, Рифарт и Габершток [371, 3817], Мурака, Гарднер и Серфас [549], Бутс, Галер и Мелон [5028], а также Швайбольд, Блейер и Нагель [38l, 3912] *. Манита [5624] проводил определение цинка при pH 11 в гомогенном растворе с помощью дитизона в этаноле. Ионы Си2+, мешающие определению, он предварительно осаждал в виде Cu2(SCN)2. Уорен, Делаво и Ириш [51 ’], Уэб и Мильман [5013], Гуф [4815] и другие авторы при постановке разведывательных исследований пользуются эмульсионным методом в качестве полуколичественного быстрого метода. Абрагамчик [387] перед определением проводит концентрирование ионов Zn2+ (и других тяжелых металлов) на ионообменных смолах. Коррозию металлического цинка при его соприкосновении с водой изучали Парьо и Аршинар [5227] и Грубич [386]. Стаут и Арнон [3926] определяли весьма малое содержание следов цинка в воде, используемой в опытах по питанию растений.
Определением цинка в морской воде занимались Королев [5023], Бух [444], Уотенберг [4310] и Ц. Гофман [5025].
* Миллер А. Д. и Либина Р. И. [584] разработали метод раздельного определения цинка, меди и свинца в природных водах и вытяжках из почв. Цинк, медь и свинец по этому методу сначала экстрагируют в виде диэтилдитиокарбаминатов с помощью четыреххлористого углерода, затем реэкстрагируют цинк 0,1 н. раствором НС1 (а свинец — 3 н. раствором НС1). В полученных реэкстрактах цинк и свинец титруют раствором дитизона.
Резников A. A. [383G], определяя цинк (а также медь.) в природных водах полярографическим методом, предварительно экстрагировал эти металлы дитизоном при малом содержании их. — Прим. ред.
Определение металлов группы дитизона. Цинк
251
В силикатных породах Сендэл [372] (ср. раздел г, 1) определял цинк в присутствии целого ряда других металлов, образующих дитизонаты. Московии и Бурке [3816] определяли цинк в дыме и пыли. Определением цинка в почве занимались Холмс [452], Шерман и Макхарг [426]. Гибард [384], а также Барон [5529], Шеу и Дин [5220] экстрагировали твердую пробу почвы раствором дитизона в четыреххлористом углероде. Гейльман и Нэб [5525] сначала выделяли цинк возгонкой в токе водорода.
Гейльман и Нэб [5524] определяли содержание цинка в бокситах и глиноземе, Лаплас [52 28] — в железной руде *.
В высокосортной стали с содержанием 18—25% хрома и 8—20% никеля по Брикеру, Вейнбергу и Проктору [454] было определено 5* 10-3% цинка с точностью до ±20 вес.%. Хром и, возможно, присутствующее олово улетучиваются в виде хромилхлорида и соответственно тетрахлорида олова в токе сухого хлористого водорода. Ионы Zn2+ из цитратного раствора с pH 8—8,5 вместе с присутствующими в незначительных количествах ионами Си2+, Со2+, РЬ2+ и частично Ni2+ экстрагируют концентрированным раствором дитизона в хлороформе. Экстракт разлагают кислотой, причем ионы Zn2+ и РЬ2+ переходят в водную фазу и могут быть определены с помощью дитизона в четыреххлористом углероде **.
В легированных алюминиевых сплавах Фишер и Леопольди [433] (ср. раздел г, 3, стр. 255), а также Жан [5224] определяли цинк ускоренным методом. Фалер [5416], Гейльман и Нэб [5524] определяли цинк в алюминии,
* Стрельникова Н. П. [5746] определяла цинк в рудах и металлах с высоким содержанием железа. — Прим. ред.
** Ота [593] модифицировал и упростил этот метод определения цинка в сталях и чугуне. Он предложил экстрагировать цинк (а также свинец) бензольным раствором дитизона, считая это более удобным в данных условиях, чем экстрагирование раствором дитизона в СНС1з и ССр. Предложенный нм метод применен для определения 2 • 10~4 — 4* 10-1% цинка в чугуне и углеродистой стали.
Судо и Хирокава [5912j применяли дитизоновую экстракцию при определении цинка в сталях, никеле и свинце. — Прим. ред.
252 Применение дитизона в количественном анализе
Колодуб — в белом металле [4012] (ср. раздел г, 5, стр. 256) *. Цинк в металлической сурьме определял Геберли [56181. в металлическом кобальте — Юнг [476] (ср. раздел г, 6, стр. 257), в металлическом никеле — Филиппова и Лурье [504] (ср. раздел г, 7, стр. 259, примечания), в ваннах для никелирования цинк определяли Серфас и Левин [47 s, 4711] (ср. стр. 259), в металлическом кадмии— Багот и Уилкокс [552]. Упомянутые авторы определяли еще 5’1О-зо/о цинка с точностью ±4%; они пропускали растворы вода и сульфата, содержащие ионы Cd2+ и Zn2+, через ионообменную смолу — анионит (деацидит FF в ОН-форме), на которой прочно удерживались ионы СсЦЦ, а ионы Zn2+ проходили в элюат. Цинк определяли по методу одноцветного раствора, причем еще 20-кратное количество ионов Сс12+ (так же как и других металлов, образующих дитнзонаты) можно было замаскировать или выделить из щелочного, содержащего ионы S2", буферного раствора с pH 11 однократным промыванием избытком дитизона (ср. раздел б, 3, стр. 246) **.
* Никитина Е. И. [4825] предложила метод микрохимического определения малых количеств цинка дитизоном в алюминиевых сплавах колориметрическим титрованием. Разработанный ею метод дает возможность определять сотые доли процента цинка непосредственно в щелочном растворе алюминиевого сплава.
Мухина 3. С. [4828] при полярографическом определении цинка в алюминиевых сплавах применяет экстрагирование цинка дитизоном для отделения его от больших количеств железа, алюминия и щелочноземельных металлов. Об определении цинка в алюминиевых сплавах см. также [5738]. — Прим. ред.
** Бабко А. К. и Марченко П. В. [59!6] разработали метод определения микропримеси цинка в цирконии с предварительным осаждением цинка раствором метиленового голубого в присутствии роданида аммония.
Назаренко В. А., Фуга Н. А., Флянтикова В. Г. и Эстерис К. А. [607] определяли микропримеси цинка в чистых индии и таллии с предварительной экстракцией пиридин-роданидного комплекса цинка хлороформом.
Аврунина А. М. [5237] с помощью дитизона определяла цинк в бронзах.
Мухина 3. С. и Сударчикова Т. II. [Ь238] провели сравнительное изучение колориметрического (с помощью дитизона) и полярографического методов определения цинка в сплавах на хромоникелевой основе с содержанием Zn 10~3—10~4% и рекомендуют первый для арбитражных, второй — для рядовых анализов. — Прим. ред.
Определение металлов группы дитизона. Цини
253
Определением содержания цинка в биологическом материале занимался ряд исследователей [485]: Гейнен и Бенне [5221, 5319], Ширли, Уолдрон, Джонс и Бенне [482], Патерат и Хёгль '[4814], Ловеринг и Соколов [4817], Рейхен и Лакэн [4920], Коулинг и Миллер [414], Швай-болд [381, 3912, 427], ван Дурен [4013], Боланд и Ричи [392], Гогэй, Боланд и Ричи [3821], Биббард [373] и Барон [5421] *. В крови цинк определяли Бэнкс, Топер и Уормэл [5010], Бош и Вэлли [4916], Фогеленцанг [3913], Вольф [491], в органических соединениях — Страфорд, Ует и Кершоу [451] **.
Нередко встречаются опыты, связанные с концентрированием цинка с помощью экстракции дитизоном и последующим определением ионов Zn2+ другими химическими методами. Работы*** Сильвестера и Хюджеса ’36й], Перльмана и Меншинга [3712], Алпорта и Муна 3921] относятся к начальному периоду возникновения дитизонового метода.
Дитизон легко связывает цинк, находящийся в островках Лангерганса поджелудочной железы и вследствие этого вызывающий диабет.
Поэтому ряд исследователей, как, например, Вольф с сотрудниками [523, 541], Карота [5019], Бэнкс, Топер и Уормэл [5010], Бамбаси и Карнпмео [5232], Алкалде, Ко-лас, Бранде и Пег [5233], Кампана и Дотта [5119] **** и другие пользовались дитизоном при физиологических и гистологических исследованиях *****.
* См. также Вардьер, Стейн и Ив [57зу].— Прим. ред.
** В различных методах количественного определения цинка (и других металлов наряду с ним) в почвах, материалах растительного и животного происхождения применяли дитизон Бергман Г. Г. [5032], Бёниг и Хейгенер [5636, 5637], Шарер и Мунк [5638], Юань и Фискелл [5811], Пейве Я. В. и Ринькис Г. Я. [59у], Жуй и Лекагиё [5917], Кампен и Дюмулен [5918], Логинов Н. Я. [5340], Франсис и Пилгрим [5722], Рекер [6014]. — Прим. ред.
*** См. также работу Вассермана Е. С. и Супруновича И. Б. [349]. — Прим. ред.
См. также Науменко Е. В. [5715]. — Прим. ред.
***** С большим успехом в сравнении с дитизоном определялся цинк в биологических материалах [435, 53у] с помощью ди-IB -нафтилтиокарбазона (аналога дитизона) и в алюминии [5835, 6023]. См. приложение « Аналоги дитизона» и дополнение редактора, стр. 414.
Маркова Л. В. и Клейнер К. Е. [5913] разработали метод косвенного определения натрия, основанный на осаждении натрия
254 Прим енение дитизона в количественном анализе
г) ПРИМЕРЫ
!. Определение цинка в силикатных породах [372]
Реактивы аналогичны указанным в разделе г, 1 (стр. 209).
Ход определения. Согласно разделу г, 1 (стр. 209), водные растворы, освобожденные от ионов Си2+, подвергаются обработке по основным методам, описанным в разделах б, 2, 3, 4 или 5 (стр. 241 сл.).
2. Определение цинка в галлии
1 • 10~3% цинка можно определить с точностью ±5<У0.
Поскольку ионы Ga3+ не образуют химического соединения с дитизоном, следует только строго придерживаться pH 5—6, при котором галлий в достаточном количестве винной кислоты переходит в раствор.
Реактивы
Соляная кислота, 12 н. раствор.
Тартрат натрия-калия NaKC4H40e • 4Н2О, 20%-ный раствор.
Тиосульфат натрия Na2S2O3 • 5Н2О, 50%-ный раствор.
Ацетат натрия NaC2H3O2 • ЗН2О, 10%-ный раствор.
Аммиак, 2 н. раствор.
Дитизон, ~ 100 мкМ раствор дитизона в четыреххлористом углероде, 1 мл^З,27 мкг Zn2+.
Ход определения. Растворяют 3 г металлического галлия в 30 мл соляной кислоты; избыток кислоты удаляют выпариванием. Раствор переносят в мерную колбу и водой доводят до 100 мл.
в виде цинкнатрийуранилацетата и последующем экстракционном титровании цинка в осадке раствором дитизона в четыреххлористом углероде.
Хилл [Ь91П] применил уйат-спирит в качестве растворителя для дитизона при определении цинка (а также свинца).
Степанюк О. М. [5815] с помощью дитизона определяла произведение растворимости диэтилдикарбамата цинка. — Прим. ред.
Определение металлов группы дитизона. Цинк
255
10 мл полученного раствора (1—3 мкг цинка) переносят в делительную воронку, куда добавляют 6 мл раствора тартрата, 3 мл раствора ацетата, и доводят аммиаком до pH 5—6 (по универсальному индикатору), добавляют 1 мл раствора тиосульфата и порциями по 1—2 мл раствора дитизона исчерпывающе экстрагируют. После добавления последней порции дитизона и встряхивания в течение 2 мин. окраска раствора не должна измениться.
Во второй делительной воронке объединенные органические экстракты далее обрабатывают как описано в разделе 6,2, вариант 1.
3. Определение цинка в легированном алюминии [433]
Определяют 10-2% цинка с точностью ±3%.
Возможно присутствие только незначительных количеств никеля, кобальта и кадмия. На определение по этому ускоренному методу требуется 30 мин.
Реактивы
Соляная кислота, 6 н. раствор.
Хлорат калия.
Аммиак, 7 н. раствор.
Маскирующая смесь, см. раздел б, 2, вариант 2. Дитизон, 25 мкМ раствор в четыреххлористом углероде. 1 мл== 0,817 мкг Zn2+.
Промывной раствор, см. раздел 6,2, вариант 2.
Ход определения. Растворяют 0,5 г сплава в виде стружек в 25 мл соляной кислоты и в конце растворения прибавляют 0,2 г хлората калия. Кипятят в течение 5 мин., охлаждают, переносят в мерную колбу емкостью 250 мл и доводят водой до метки. К 1—5 мл отфильтрованного раствора добавляют 30 мл маскирующей смеси и сильно встряхивают с порциями дитизона по 10; 5 мл и т. д. в течение 5 мин. Экстракцию прекращают после того, как последняя добавленная порция в 1 мл дитизона не сохранит после встряхивания в течение 1 мин. свой зеленый цвет в растворе.
Объединенные органические экстракты, собранные в цилиндре для смешивания, покрывают 5 мл
256
Применение дитизона в количественном анализе
промывного раствора, доводят до 25 мл четыреххлористым углеродом п несколько раз встряхивают. Отделяют органический слой с помощью делительной воронки, промывают еще 3—4 раза промывным раствором порциями по 5 мл и затем фотометрируют.
4. Определение цинка в олове [342]
Возможно определение 10~3% цинка.
Реактивы
Смесь бром — бромистоводородная кислота, раствор 20 мл Вг2 + 80 мл НВг ~7 н.
Соляная кислота, 12 н. раствор.
Азотная кислота, 15 н. раствор.
Ход определения. На водяной бане выпаривают 1 г олова в 10 мл смеси брома с бромистоводородной кислотой. Полученный остаток извлекают 4 мл соляной кислоты, 2 мл азотной кислоты и 10 мл воды. Выпаривают на песчаной бане досуха, растворяют в 1 мл азотной кислоты и 10 мл воды, переносят в мерную колбу и доводят водой до метки.
В аликвотной части раствора определяют содержание ионов Zn2+, а также Cu2+, Cd2+, Pb2+ и других металлов.
5. Определение цинка в оловянистых баббитах [4012]
Возможно еще определить 2-1О~зо/о цинка в олове или свинцовом баббите.
Реактивы
Соляная кислота, 12 и. раствор.
Азотная кислота, 15 н. раствор.
Тартрат натрия-калия ХаКС4Н40б • 4Н2О, 10%-ный раствор.
Ацетат натрия NaC2H3O2 • ЗН2О, 20%-ный раствор. Тиосульфат натрия, см. раздел б, вариант 1.
Смесь ацетата натрия и тиосульфата натрия, см. раздел 6,2, вариант 1.
Промывной раствор, см. раздел 6,2, вариант 2.
Определение металлов группы дитизона. Цинк 257
Серная кислота, 0,02 н. раствор.
Дитизон для экстракции, приблизительно 250 мкМ раствор в четыреххлористом углероде. 1 мл ~ 2 8,17 мкг Zn2+.
Ход определения. Растворяют при слабом нагревании в 2 мл царской водки 0,1 г баббита, и раствор выпаривают досуха на водяной бане. Полученный остаток полностью растворяют в 0,2 мл соляной кислоты и 5 мл тартратного раствора при умеренном нагревании. Переносят раствор в делительную воронку с помощью 6—7 мл ацетатного раствора, добавляют 8 мл раствора тиосульфата и исчерпывающе экстрагируют раствором дитизона.
Каждую порцию тщательно выделенного органического экстракта промывают три раза по 5 мл раствором тиосульфат-ацетатной смеси, один раз 10 мл воды, 2— 3 раза по 5 мл промывного раствора и, наконец, 2 раза по 10 мл воды, встряхивая в течение !/4—V2 мин.
Промытый экстракт встряхивают в течение 1 мин. с 10 мл серной кислоты; при этом цинк переходит в водную фазу. Последнюю тщательно отделяют и разбавляют определенным объемом серной кислоты. Аликвотные части раствора служат для определения содержания цинка по одному из основных методов *.
6. Определение цинка в кобальте [476]
1 -10-3% цинка определяют с точностью ±5%.
При содержании меньше 0,1% цинка в металлическом кобальте цинк предварительно концентрируют экстракцией раствором дитизона в четыреххлористом углероде. Полученный дитизонат цинка разлагают кислотой и наконец в полученном водном растворе проводят определение ионов Zn2+ с помощью раствора дитизона в четыреххлористом углероде.
* Более подробное описание этого хода определения см. Бабко А. К. и Пилипенко А. Т., Колориметрический анализ, Госхим-издат, М. — Л., 1951 г., стр. 339.—Прим ред.
17 Зак. 2157.
258
Применение дитизона в количественном анализе
Реактивы
Азотная кислота, 15 н. раствор.
Соляная кислота, 2 н. раствор.
Соляная кислота, разбавленная, 0,2 н. раствор. Цианид калия, 5%-ный раствор.
Гидроксиламин солянокислый, 20%-ный раствор. Ацетат натрия NaC2H3O2 • ЗН2О, 10%-ный раствор. Тиосульфат натрия Na2S2O3 • 5Н2О, 50%-ный раствор.
Дитизон для экстракции, ~100 мкМ раствор в четыреххлористом углероде. 1 мл ~ 3,27 мкг Zn2+.
Ход определения. (При содержании цинка 10~2%.) После растворения 0,3 г металлического кобальта 1 в 1,5 мл азотной кислоты прибавляют 10 мл воды, выпаривают при кипячении окислы азота и доводят до метки водой в мерной колбе емкостью 100 мл. К 10 мл полученного слабокислого раствора с содержанием 5—15 мкг цинка в делительной воронке добавляют (в вытяжном шкафу) раствор цианида калия до тех пор, пока выпавший осадок снова не растворится. Прибавляют 1 мл раствора гидроксиламина и раствором ацетата натрия или соляной кислоты доводят до pH 5, после чего добавляют 1,5 мл раствора тиосульфата натрия. В полученной смеси исчерпывающе экстрагируют цинк раствором дитизона порциями в 1—2 мл до тех пор, пока от добавления предпоследней порции дитизона после 2-минутного встряхивания не будет наблюдаться заметного изменения окраски испытуемого раствора.
Находящиеся во второй делительной воронке объединенные экстракты промывают дважды в течение 30 сек. по 10 мл разбавленной соляной кислоты, а затем объединенные водные экстракты промывают четыреххлористым углеродом. К кислому водному реэкстракту ионов Zn2+ добавляют 1 мл раствора гидроксиламина, несколько капель раствора цианида калия (в вытяжном шкафу), доводят раствором ацетата натрия до pH 5 и прибавляют 1 мл раствора тиосульфата. В полученном растворе определяют содержание цинка по одному из основных методов.
Определение металлов группы, дитизона. Кадмий 259
Примечание
1 При содержании цинка в количестве 1 . 10—3% навеску металлического кобальта увеличивают до 3 г. При этом требуется большее количество цианида калия для маскирования, увеличивают избыток раствора дитизона и удлиняют время экстракции.
7. Определение цинка в никеле
При содержании цинка в металлическом никеле менее 10“зо/о определение проводят аналогично определению малых количеств цинка в металлическом кобальте (ср. с описанием в разделе 61).
Примечание
1 О возможности маскирования ионов Ni2+, а также Cd2+ ди-этанолдитиокарбаминатом см. стр. 237. Рекомендованное концентрирование ионов Zn2+ в виде цинкакридинроданидного комплекса с ионами Со2+ или Fe3+ в качестве коллекторов [504] в некоторых опытах протекало неудовлетворительно.
КАДМИЙ
а) ОБЩИЕ СВЕДЕНИЯ
В нейтральном, и вплоть до сильнощелочного, растворе ионы Cd2+ образуют с дитизоном однозамещенный дитизонат, растворяющийся с розово-красной окраской в органических растворителях:
Сбводн. -I- 2H2Dzopr. <• — Cd (HDz)2 орг. + 2Нводн.. (I)
Дитизонат кадмия умеренно растворяется в четыреххлористом углероде, так что уже в 25 мкМ. растворах выделяются желто-красные хлопья дитизоната кадмия. Напротив, в хлороформе растворимость его значительно выше (см. табл. 4, стр. 38). Благодаря лучшей возможности отделения кадмия от ионов цинка в четыреххлористом углероде последний в качестве растворителя предпочитают хлороформу [374].
Образование дитизоната по уравнению (I) в области pH > 7 протекает быстро и количественно. Поэтому при pH 7—8 возможно прямое экстракционное
17*
260
Применение дитизона в количественном анализе
титрование ионов Cd2+, как и определение их по методу смешанной окраски [5023]. Однако при этом pH взаимодействие ионов Cd2+ с дитизоном малоселективно, вследствие чего применение обоих методов сильно ограничено. Хорошая извлекаемость и стойкость дитизоната кадмия в 1—2 н. растворе едкого натра имеет большое значение для селективного определения ионов Cd2+.
рн
Рис. 30. Извлечение ионов Cd2+ в зависимости от pH раствора, различных компонентов в растворе и природы органического растворителя.
а или а’— в присутствии ацетатного раствора; били Ъг — в присутствии 0,2 АГ тартратного раствора или содержащего 1 М раствора хлорида; с или с' —в присутствии 0,2 Л1 цитратного раствора (схематическое изображение согласно данным Королева [5023]).
В таком сильнощелочном растворе избыток дитизона переходит в виде ионов HDz~ в водный раствор, что способствует развитию методов одноцветной окраски (см. раздел 6,2, а также 6,3). Так как испытуемый раствор обладает сильнощелочной реакцией, то органические растворители (главным образом четыреххлористый углерод) должны быть высокого качества и не должны длительное время соприкасаться со щелочью [535].
Извлечение ионов Cd2+ наглядно представлено на рис. 30 *.
Дитизонат кадмия в четыреххлористом углероде представляет собой однозамещенное соединение, стойкое к щелочи, что облегчает его отделение от других ме
* О влиянии других буферных растворов, как, например, би-фталатного, цитратного, фосфатного, на экстракцию дитизоната кадмия хлороформом имеются сведения, полученные радиометрическими (Cd115) опытами [5621].
Определение металлов группы дитизона. Кадмий
261
таллов, образующих дитизонаты малоустойчивые и щелочные, как, например, висмута, индия, цинка, свинца и таллия. Дитизонат кадмия в четыреххлористом углероде разлагается под влиянием кислот (pH < 3) и таким образом может быть отделен от таких стойких к кислотам дитизонатов, как дитизонаты серебра, ртути (II), палладия (II), золота, меди (II), кобальта и никеля.
Устойчивость и чувствительность к свету раствора дитизоната кадмия в четыреххлористом углероде в большей или меньшей степени зависит от качества ССЦ. При использовании пригодных сортов четыреххлористого углерода не наблюдается заметного изменения оптической плотности в течение получаса. Раствор дитизоната кадмия в хлороформе более устойчив, чем в четыреххлористом углероде. Он сохраняется в течение нескольких дней без заметного изменения.
Рис. 31. Кривые поглощения растворов Cd (HDz)2 в четыреххлористом углероде.
------25/2 мкМ раствор Cd (HDz)2;-- 250/2 мкМ раствор Cd (HDz)2; —--------- 25 мкМ раствор H2Dz; --- 250 мкМ раствор H2Dz.
Поглощение раствора дитизоната кадмия в четыреххлористом углероде при длине волны 520 жц характеризуется резко выраженной полосой поглощения (рис. 31), аналогичной для дитизоната цинка в четыреххлористом углероде. Поглощение раствора дитизона в четыреххлористом углероде при той же длине волны равно приблизительно 11% от поглощения дитизоната кадмия в том
262 Применение дитизона в количественном анализе же растворителе, вследствие чего при фотометрировании небольшой избыток дитизона мало заметен.
Влияние посторонних анионов. Ионы S2- мешают. Ионы CN~ мешают, если присутствуют в большой концентрации. Мешающее влияние пропорционально концентрации ионов CN~, но не зависит от pH раствора. После сливания равных объемов 25 мкМ раствора дитизона в хлороформе и 25/2 мкМ раствора соли кадмия в воде проводили экстракцию полученного дитизоната кадмия, при этом из 0,01%-ного раствора KCN было извлечено около 97% ионов Cd2+, из 0,1 %-кого раствора KCN — около 85% Cd2+ и из 1%-ного раствора KCN извлекли около 30% ионов Cd2+. Равновесие реакции достигается уже после полминутного встряхивания.
Соответствующим количеством цианида можно с успехом замаскировать другие металлы, реагирующие с дитизоном, в то время как ионы Cd2+ еще экстрагируются некоторым избытком дитизона [535].
Тартрат и цитрат в большом количестве подавляют экстракцию только в нейтральной области pH (см. рис. 30) *.
Влияние посторонних катионов. Ионы Ag+, а также и Pd2+ не экстрагируются при pH > 7, так как образуют нерастворимые двузамещенные соли.
Ионы Hg2+, Au3+ и Cu2+ при pH > 7 экстрагируются одновременно с ионами Cd2+. 10—100-кратное количество этих ионов, так же как и вышеупомянутых ионов благородных металлов, можно проэкстрагировать при pH < 3 и предварительно отделить от ионов Cd2+ [3711]. Из полученных при pH 8—9 объединенных органических экстрактов при встряхивании с водным раствором с pH < 2 разлагается только дитизонат кадмия [455] (ср. г, 2).
Небольшое количество ионов Cd2+ (вместе с ионами Cu2\ Zn2+, Со2+, Ni2+ и РЬ2+) можно извлечь хлороформом в виде пиридинроданидного комплекса и таким способом отделить от больших количеств ионов Ag+,
* Швейцер и Дайер [606] изучали влияние хлоридов, бромидов и йодидов на экстракцию кадмия с помощью его радиоактивного изотопа. — Прим, ред,
Определение металлов группы дитизона. Кадмий 263
Hg2+ и Cu+ [3711]. Ионы Си2+ и Fe3+ экстрагируют в виде солей с купфероном [5028].
Ионы Bi3+, In3+, Zn2+, Pb2+ и Tl+ при pH > 14 в 103-кратном количестве, превышающем содержание ионов Cd2+, с трудом извлекаются дитизоном в четыреххлористом углероде. Одновременно извлеченные дитизонаты упомянутых ионов разлагаются при промывании водой, содержащей 0,5 н. раствор едкого натра [3711]. Дитизонат таллия при промывании водой (pH ~7) претерпевает гидролиз. Удается отделить ионы Cd2+ от ионов Zn2+ с помощью йодистого бруцина [5028] *.
Ионы Со2+, присутствуя даже в малых количествах, мешают определенно. При pH 7 можно отделить ионы Cd2+ экстракцией от ионов Со2+. Диметилглиоксим маскирует умеренное количество ионов Со2+ [494, 558]. Многократным фракционированным разложением разбавленной соляной кислотой дитизонатов кобальта и кадмия достигают того, что в органическом экстракте остается только дитизонат кобальта [455] (ср. раздел г, 2). Затем концентрируют ионы Cd2+ фракционированным осаждением в виде сульфида [502].
Ионы Ni2+ также мешают при pH > 14, так как выпадающая в осадок NiOB0AH. захватывает дитизонат кадмия, и препятствуют экстракции. При pH 8—9 ионы Ni2+ экстрагируются вместе с ионами Cd2+.
При обработке объединенных экстрактов 0,01 н. раствором кислоты дитизонат кадмия разлагается полностью, в то время как дитизонат никеля почти количественно остается в органическом экстракте. При повторении экстрагирования и разложения можно еще выделить 100-кратное количество ионов Ni2+. Наиболее целесообразно отделить никель при pH 8—9 встряхиванием с ди-метилглиоксимом в хлороформе [494] (ср. раздел г, 2, вариант 1). Затем ионы Cd2+ отделяют и концентрируют путем дробного осаждения в виде сульфида [502, 5622]. Согласно Серфассу с сотр. [4820], ионы Cd2+ следует извлекать хлороформом из аммиачного раствора в виде соли 2-меркаптобензтиазола. Отделенный
* О разделении кадмия и цинка см. примечание редактора на стр. 240. — Прим. ред.
264
Применение дитизона в количественном анализе
экстракт при обработке 6 н. раствором соляной кислоты выделяет в свободном виде ионы Cd2+.
Ионы Fe3+ мешают мало. Можно еще 1*10~3% кадмия определить при pH > 14 с точностью ±10% [37й].
Ионы Мп2+ в больших количествах мешают при pH > 14 вследствие индуцированного окислительного действия на дитизон. Это мешающее влияние можно значительно уменьшить добавлением гидроксиламина [396].
Будет показана возможность отделения кадмия перегонкой в виде металла.
б) ОСНОВНЫЕ МЕТОДЫ ОПРЕДЕЛЕНИЯ
1. Косвенное экстракционное титрование [3711] Реактивы
Дитизон, 25 мкМ раствор в четыреххлористом углероде. 1 мл == 1,405 мкг Cd2+.
Тартрат натрия-калия NaKC4H40e • 4Н2О, 20%-ный раствор.
Едкий натр, 2,5 н. раствор.
Промывной раствор, 0,5 н. раствор NaOH.
Серная кислота, 1 н. раствор.
Эталонный раствор Cd2+, 25/2 мкМ раствор CdSO4 в 0,01 н. растворе H2SO4. 1 мл содержит 1,405 мкг Cd2+.
Эталонный раствор соли серебра, 25 мкМ раствор AgNOa в 0,1 н. растворе HNO3. 1 мл содержит 2,697 мкг Ag+.
Ход определения. К 10 мл испытуемого раствора в делительной воронке прибавляют достаточное количество раствора тартрата 1 и нейтрализуют. Полученный объем раствора удваивают добавлением едкого натра, исчерпывающе экстрагируют раствором дитизона до тех пор, пока последняя порция добавленного раствора дитизона после полуминутного встряхивания вместо красной не станет бесцветной.
Объединенные органические экстракты во второй делительной воронке разбавляют четыреххлористым углеродом до определенного объема 2, дважды промывают порциями по 5 мл промывным раствором и наконец
Определение металлов группы дитизона. Кадмий
265
10 мл воды, каждый раз встряхивая в течение 20 сек. К органическому раствору красного цвета в делительной воронке прибавляют 10 мл серной кислоты и встряхивают в течение 20 сек.; за это время дитизонат кадмия разлагается и выделяется эквивалентное количество дитизона зеленого цвета. К зеленому раствору дитизона в четыреххлористом углероде добавляют определенный объем избытка эталонного раствора Ag4*, встряхивают в течение 20 сек. и спускают образовавшийся желтый раствор AgHDz в четыреххлористом углероде. Оставшийся в водном растворе избыток ионов Ag+ подвергают экстракционному титрованию раствором дитизона (см. стр. НО).
Точность определения ±2%.
Примечания
1 Должно быть отмерено такое количество раствора тартрата, чтобы при подщелачивании испытуемого раствора не выпадали гидроокиси металлов.
2 Препятствуя образованию пересыщенных растворов дитизоната кадмия, все же следует избегать сильного разбавления.
Вариант. В случае присутствия небольших количеств ионов Zn2+ можно пользоваться раствором дитизона в хлороформе в качестве реагента.
2. Визуальное колориметрическое определение по методу одноцветной окраски [3711]
Реактивы аналогичны указанным в разделе б, 1.
Ход определения. Полученный как описано в разделе б, 1 раствор зеленого цвета довольно стоек и сравнивается с рядом эталонных растворов.
Точность определения ±2%.
Вариант. Розово-красный раствор дитизоната кадмия можно колориметрировать с несколько меньшей точностью.
3. Спектрофотометрическое определение по методу одноцветной окраски [455, 552]
Реактивы аналогичны указанным в разделе 6,1.
Ход определения. К 10 мл испытуемого раствора в делительной воронке добавляют достаточное
266
Применение дитизона в количественном анализе
количество раствора тартрата и нейтрализуют. Полученный объем удваивают с помощью раствора едкого натра. Исчерпывающе1 экстрагируют раствором дитизона до тех пор, пока последняя порция экстрагента после встряхивания в течение полминуты не станет вместо красной бесцветной.
Объединенные органические экстракты во второй делительной воронке разбавляют до определенного объема четыреххлористым углеродом, прибавляют 20 мл промывного раствора, встряхивают в течение 1 мин. и тотчас, после того как раствор станет прозрачным, фото-метрируют при длине волны 520 жц.
Точность определения ±2%.
Примечание
1 При серийных анализах экстрагируют только один раз определенным объемом большого избытка дитизона и соответствующим образом проводят сравнение с эталонным раствором.
в) ПРИМЕНЕНИЕ
Определение следов кадмия дитизоном несколько длительно, однако метод весьма чувствительный. В сточных водах Серфас, Мурека и Гарднер [5318], а также Боте, Галер и Мелон [5028] определяли содержание ионов Cd2+ в присутствии других металлов, реагирующих с дитизоном.
В силикатных породах Сендэл [396, 502] определял 0,02 мкг или 2-10-5% кадмия.
В цинке Фишер и Леопольди [3711, 3826], а также Иошино и Койима [556] определяли менее 1 • 10-3% кадмия (ср. раздел г, 1). В сурьме, мышьяке, висмуте, олове, свинце, железе и других металлах можно определить 1 • 10-3% кадмия с точностью ±5% [3711]*. Сильверман и Трего [5211] сначала концентрировали ионы Cd2+ при анализе свинца или свинцовых сплавов экстрагированием раствором дитизона в четыреххлористом углероде, затем разлагали органический экстракт кислотой и опреде-
* Родричес-Паскес с сотр. [5640] определял небольшие количества кадмия в уране. — Прим. ред.
Определение металлов группы дитизона. Кадмий 267 ляли содержание ионов Cd2+ в полученном водном растворе с помощью раствора дитизона в хлороформе. При содержании 1 • 10-2% кадмия они рекомендуют проводить предварительное осаждение PbSCU или электролиз кислого раствора пробы, с помощью которого выделяются основные количества ионов Pb2+, Cu2+, Bi3+, Sb3+ и Sn4+. Щербов и Шевцова [5534] занимались определением кадмия в рудах. Мюллер и Сивертс [40* 1 *] пользовались определением кадмия в цинке при контроле эталонных электродов для спектрального анализа. В меди Иошино и Койима [556] определяли 1 • 10-3% кадмия после предварительного концентрирования с помощью амберлита JR-120 (в Н-форме). Мухина, Тихонова и Жемчужная [5622] определяли 1 • 10~3% кадмия в никелевых сплавах после обогащения пробы в виде CdS *.
Биологический материал, в котором определяют кадмий, вследствие летучести последнего обрабатывают мокрым путем; при соответствующей предосторожности можно также проводить минерализацию сухим путем [535]. Клейн [455, 478 * * * *, 5018] и Вихман [4915] подробно исследовали возможность определения следов кадмия (ср. раздел г, 2). Ширли, Бенне и Миллер [494] особенно учитывали присутствие умеренных количеств ионов Со2+ и Ni2+. Чорч [477] работал с растворами дитизона в хлороформе. Зальтцман [535] принимал во внимание при
* Кадмий, как микропримесь в цирконии, определяли: Бабко А. К. и Марченко П. В. [5916] с предварительным осаждением кадмия кристаллическим фиолетовым в присутствии йодида калия, Чернихов Ю. А. и Добкина Б. М. [5633] с предварительным экстрагированием кадмия в виде диэтилкарбамата, с чувствительностью
1 • 1О-5О/о. Предварительно экстрагируя в виде пиридинроданидного
комплекса, Назаренко В. А. и Флянтикова Г. В. [5813] определяли
кадмий в индии и таллии.
Для определения кадмия, а также свинца в ванадии и ниобии
Назаренко В. А. и Бирюк Е. А. [5919] предложили отделение этих
примесей (совместно с висмутом) экстракцией в виде диэтнлтио-
карбаминатов. Синякова С. И. и Цветкова Л. А. [603] разработали
метод определения кадмия в висмуте, позволяющий определять до
10-5% Cd.
Мухина 3. С., Тихонова А. А. и Жемчужная И. А. [6017]
определяли кадмий (а также свинец) в металлическом хроме и его
сплавах. — Прим. ред.
268
Применение дитизона в количественном анализе
этом большое содержание почти всех металлов, реагирующих с дитизоном. Смит, 1\енч и Лэйн [5526] занимались определением кадмия в моче. Холек и Гоббард [443] выделяли ионы Cd2+ раствором дитизона в хлороформе и проводили колориметрическое определение с помощью ди-р-нафтилтиокарбазона (см. стр. 380) или полярографически, а также спектроскопически *.
Штейн [5115] определял следы кадмия в искусственных красителях, получаемых из каменноугольной смолы.
г) ПРИМЕРЫ
/. Определение кадмия в очищенном цинке [3711, 3826]**
Можно определить 1-1О"зо/о кадмия с погрешностью ±5%.
Реактивы
Азотная кислота, 7 н. раствор.
Аммиак, 7 н. раствор.
Сульфид натрия Na2S-9H2O, 0,05 %-ный раствор.
Дитизон, раствор, аналогичный указанному в разделе б, 1.
Ход определения. Растворяют в азотной кислоте 25 г очищенного цинка1 и полученный раствор нейтрализуют аммиаком. Вносят небольшие порции раствора сульфида и при сильном перемешивании осаждают сульфид кадмия. Продолжают прибавление раствора сульфида до выделения сульфида цинка чистого белого цвета. Осадок оставляют на 1 час в тепле, собирают на фильтре (не промывают) и растворяют в азотной кислоте. Раствор выпаривают до небольшого объема и, наконец, разбавляют водой до определенного объема.
* Холек и Гоббард отмечают при этом преимущества диф-нафтилтиокарбазона в сравнении с дитизоном в связи с меньшей растворимостью нафтильного аналога и его комплексов в водных щелочных растворах. — Прим. ред.
** Иошино и Койима [556] определяли еще 2 • 10~4% кадмия в цинке, предварительно проводя обогащение пробы на амберлите JR-120 (Н-форма). Малоэффективным оказалось концентрирование кадмия в виде его хлорокомплексов на ионите дауэкс I.
Определение металлов группы дитизона. Кадмий 269
Доводят pH раствора до 2 и исчерпывающе экстрагируют из аликвотной части ионы Ag+ и Си2+. В этом растворе ионы Cd2+ определяют по одному из основных методов.
Примечание
1 В технических сортах цинка, а также в его сплавах анализируют пробу весом 0,1 г. При этом определение кадмия проводят прямым путем, т. е. минуя операцию концентрирования в виде сульфида кадмия.
2 . Определение кадмия в биологическом материале
Можно определить 25 мкг кадмия с погрешностью ±2 мкг.
Присутствие незначительных количеств ртути, меди, висмута, кобальта, никеля и свинца, а также несколько больших количеств цинка не мешает.
Реактивы
Аммиак, 14 н. раствор.
Цитрат аммония, 20%-ный раствор.
Дитизон (для экстракции), приблизительно
2,5- 10~3 М раствор в хлороформе.
Соляная кислота, 0,2 н. раствор.
Едкий натр, 6 н. раствор.
Дитизон, приблизительно 75 мкМ раствор в хлороформе.
Оксалат аммония.
Ход определения. Испытуемый органический материал разлагают при выпаривании с азотной и серной кислотами. Добавляют 15 мл воды и немного оксалата аммония и еще раз выпаривают. Полученный остаток извлекают водой. К 25 мл кислого раствора после разложения прибавляют в делительной воронке 5 мл раствора цитрата, доводят до pH 8—8,5, разбавляют водой до 75 мл и присутствующие в качестве примесей металлы, образующие дитизонаты, экстрагируют раствором дитизона порциями по 10 мл.
Объединенные органические экстракты во второй делительной воронке встряхивают в течение 1 мин. с 25 мл соляной кислоты \
270
Применение дитизона в количественном анализе
В хорошо отделенном и промытом хлороформом водном растворе в третьей делительной воронке с помощью 5 мл воды и 20 мл едкого натра доводят концентрацию последнего до 2,5 н. и исчерпывающе экстрагируют дитизоном порциями по 15 мл при встряхивании в течение 1 мин. до обесцвечивания последней порции экстракта 2.
Объединенные органические экстракты в четвертой делительной воронке встряхивают в течение 1 мин. с 25 мл соляной кислоты. Отбрасывают органический раствор, содержащий остатки Со2+ и Ni2+ в виде дитизонатов. После тщательного отделения в водном слое определяют содержание кадмия по одному из основных методов.
Примечания
1 В органическом растворе полностью остаются дитизонаты ртути, меди и большей части никеля и кобальта. Этот раствор отбрасывают.
2 Только в присутствии большого количества цинка последняя порция экстракта сохраняет розовый цвет. Доказательством присутствия дитизоната цинка служит обесцвечивание окрашенного экстракта при встряхивании с 0,5 н. раствором едкого натра.
Вариант [494]. Испытуемый кислый, подвергшийся разложению раствор в делительной воронке доводят до рН~2, исчерпывающе извлекают раствором дитизона для экстракции присутствующие ионы Hg2+ и Си2+ и сливают полученный органический раствор. Водный раствор полностью отмывают от остатков дитизона многократным промыванием хлороформом, прибавляют 5 мл раствора цитрата и доводят с помощью аммиака до pH 8,5—9,0. Прибавляют 5 мл раствора диметил-глиоксима (0,2%-ный раствор в 0,1 н. растворе NH4OH) и полученный диметилглиоксимат никеля дважды встряхивают в течение 1 мин. с хлороформом порциями по 15 мл. Хлороформ вытесняют промыванием раствора четыреххлористым углеродом L
В водном растворе определяют содержание кадмия по одному из основных методов.
Примечание
1 Оставшийся в водном растворе диметилглиоксим служит для маскирования небольших, а также умеренных количеств ионов Со2+.
Определение металлов группы дитизона. Кобальт
271
КОБАЛЬТ
а) ОБЩИЕ СВЕДЕНИЯ
Ионы кобальта образуют в нейтральном растворе с дитизоном однозамещенный дитизонат [351] [уравнение (I)], растворимый в органических растворителях с красно-фиолетовой окраской:
СоВодП. + 2H2Dzopr. < — Со (HDz)2opr. "4“2Нводн.« (I)
Наряду с указанной реакцией, протекающей в области pH 5,5—8,5, при более высоком pH наблюдались другие явления, частично связанные с окислением ионов Со2+ в Со3+, уже не образующих дитизонатов.
При pH 9,8 и применении раствора дитизона в четыреххлористом углероде водный слой сначала окрашивается в красноватый цвет, а после длительного встряхивания обесцвечивается, тогда как слой, содержащий четыреххлористый углерод, сильно окрашивается в красно-фиолетовый цвет, и образуется легкая вуаль.
При pH 11,5 органический слой с четыреххлористым углеродом сначала переходит в фиолетовый цвет, затем после продолжительного встряхивания становится желтоватым до бесцветного, тогда как водный слой, напротив, приобретает красно-фиолетовую окраску. При дальнейшем встряхивании в течение 3—5 мин. водный слой обесцвечивается, а слой четыреххлористого углерода становится коричневато-желтым. Это происходит, по-видимому, вследствие образования двузамещенного дитизоната кобальта CoDz [уравнение (II)], очень стойкого к 2 н. раствору едкого натра и только медленно подвергающегося воздействию 2 н. раствора соляной кислоты.
С О ВОдн. { H2DzOpr. <- CoDzopr.2Нводн.« (II)
Комплекс CoDz образуется в хлороформе с трудом. Так, в присутствии 0,1 и. раствора едкого натра и встряхивании в течение 1 часа водный раствор приобретает красно-фиолетовую окраску, тогда как хлороформный становится слабо красновато-желтым.
272 Применение дитизона в количественном анализе
Красно-фиолетовая окраска водного раствора, полученная при сливании аммиачного раствора, содержащего ионы Со2+, с раствором дитизона в четыреххлористом углероде, служит для открытия 0,1% кобальта в никеле [374]. Эта красно-фиолетовая окраска появляется тем скорее, чем больше содержание в нем ионов Со2+.
Королев [5023] исследовал равновесие реакции по уравнению (I) в зависимости от содержания ионов С1“ и лимонной кислоты в качестве компонентов раствора и получил значения констант равновесия как в четыреххлористом углероде, так и в хлороформе в качестве растворителей (см. стр. 50) *. На рис. 32 показан ход экстракции комплекса Со(HDz) 2 четыреххлористым углеродом и хлороформом.
Рис. 32. Извлечение ионов Со2+ в зависимости от pH раствора, различных компонентов в растворе и природы органического растворителя.
а или а' —в присутствии ацетата; 6 или Ь' — в присутствии 0,2 М раствора цитрата (схематическое изображение по данным Королева [5023]). а, Ь — растворитель СС1(; а', Ъг — растворитель СНС13. Время встряхиг ния —90 мин., чтобы достигнуть по возможности установления равновесия.
С помощью четыреххлористого углерода в качестве растворителя можно количественно извлечь ионы Со2+ из ацетатного буферного раствора с pH 6—8 в течение полминуты. Следует ожидать быстрого количественного
* Изучением влияния тартрата на извлечение ионов Со2+ дитизоном в хлороформе занимались Эве и Штрасгейм [5614].
Определение металлов группы дитизона. Кобальт 273 извлечения ионов Со2+ при pH > 7,9 в хлороформе в качестве растворителя *.
С увеличением кислотности раствора (pH < 6 в присутствии четыреххлористого углерода) сильно уменьшается скорость реакции по уравнению (I). Путем повышения концентрации дитизона в четыреххлористом углероде, а также при применении избытка дитизона, с одной стороны, увеличивается область pH, при которой протекает экстрагирование, а с другой — повышается скорость экстракции при данном значении pH, что имеет значение для концентрирования ионов Со2+. Повышение температуры заметно увеличивает скорость реакции.
На рис. 33 изображены ход образования и разложения 25/2 мкМ раствора однозамещенного дитизоната кобальта в четыреххлористом углероде в зависимости от значения pH и времени встряхивания.
Следует отметить, что разложение кислотой комплекса Со (HDz) 2 в четыреххлористом углероде зависит от предшествующей продолжительности хранения после его получения. Так, например, при встряхивании в течение 10 мин. кривая хода разложения свежеприготовленного раствора Со (HDz)2 в четыреххлористом углероде показывает почти зеркальное изображение кривой хода образования дитизоната кобальта. Если оставить на продолжительное время раствор дитизоната кобальта в четыреххлористом углероде, то оптическая плотность раствора сначала уменьшается вследствие «саморазложения», но оставшийся Со (HDz) 2 теперь уже очень устойчив к кислотам, растворам, содержащим ионы CN" и S2" [361]. Быстрый распад протекает только под действием 6 н. раствора соляной кислоты [374].
«Саморазложение» дитизоната кобальта в четыреххлористом углероде, которое становится заметным по изменению оптической плотности со временем, может обусловливаться частичным окислением ионов * 18
* Экстракцию Со (HDz) 2 хлороформом в зависимости от избытка дитизона и от значения pH радиометрически (Со60) исследовали Коренман и Шеянова и нашли, что при 200-кратном избытке дитизона экстракция ионов Со2+ почти количественно протекает при pH 5 [5621].
18 Зак. 2157.
274 Применение дитизона в количественном анализе
Со2+ в Со3+. Поэтому полезно раствор, содержащий ионы Со2+, непосредственно перед экстрагированием подщелочить и сразу же после встряхивания измерить оптическую плотность. С помощью восстановителя
Рис. 33. Ход образования и разложения Со (HDz)2 в четыреххлористом углероде в зависимости от pH раствора и времени встряхивания (схематическое изображение).
----— образование после встряхивания в течение полминуты; ---- образование или разложение после встряхивания в течение 10 мин.; ....... разложение после встряхивания в течение
30 мин. и двухчасового стояния. Для определения хода образования встряхивали равные объемы 25 мкМ раствора H2Dz в четыреххлористом углероде и 25/2 мкМ водного раствора ионов Со2+ с известным значением pH. Для определения хода разложения встряхивали равные объемы 25/2 мкМ раствора Со (HDz)2 в четыреххлористом углероде и водного раствора с известным значением pH. Пунктирная кривая относится к 25/2 мкМ. раствору Со (HDz)3 в четыреххлористом углероде, простоявшему 2 часа и при этом потерявшему около 30% оптической плотности.
(например, гидразина) можно воспрепятствовать окислению ионов Со2+ в Со3+ в щелочном растворе*.
* Термин «саморазложение» в данном случае, по нашему мнению, применен не совсем удачно. Лучше было бы, пожалуй, говорить о «старении» Со (HDz) 2, в связи с которым изменяется устойчивость дитизоната кобальта к кислотам, растворам, содержащим CN~- и S2- ионы, и т. п. Такое поведение дитизонатов кобальта и никеля подобно поведению сульфидов этих металлов. Возможно, в связи с этим же с течением времени изменяется и оптическая плотность раствора дитизоната кобальта.
О применении затвердевающих экстрагентов см. примечание редактора на стр. 233. — Прим. ред.
Определение металлов группы дитизона. Кобальт
275
Кривая поглощения раствора Со(HDz)2 в четыреххлористом углероде показывает хорошо выраженный
P и с. 34. Кривые поглощения растворов Со (HDz)2 и CoDz в четыреххлористом углероде.
------25/2 мкМ раствор Со (HDz)}; — — — 250/2 мкМ раствор Со (HDz)2; ............. 25 мкМ раствор CoDz; ---- 25 мкМ раствор H2Dz.
Для определения ионов Со2+ в виде дитизоната было введено в виде опыта экстракционное титрование (см. раздел б, ниже), а также спектрофотометрическое определение по методу смешанной окраски [50 23].
Вследствие непостоянства комплекса Со (HDz) 2 определение ионов Со2+ с помощью дитизона можно проводить с относительно небольшой точностью (в среднем ±5—10%). При большем разбавлении компонентов реакция протекает весьма медленно. Кроме того, дитизон реагирует с ионами Со2+ в той же области pH, в которой почти все остальные металлы также образуют дитизо-наты. Не известно маскирующее вещество, которое смогло бы сделать селективной реакцию между ионами Со2+ и дитизоном.
Влияние посторонних анионов. Ионы S2~ и CN~ мешают. Цитрат-ионы в большом количестве в кислой области pH подавляют экстракцию (см. рис. 32), вследствие чего экстракцию ионов Со2+ следует проводить при pH > 7 [4018].
Влияние посторонних катионов. Ионы Ag+, Hg2+, Pd2+, Au3+ и Cu2+ мешают. 100-кратное количество этих ионов еще при pH < 2 извлекают раствором дитизона в четыреххлористом углероде перед началом экстракции
18*
276 Применение дитизона в количественном анализе
ионов Со2+. В присутствии цитрат-ионов можно извлечь ионы Си2+ 0,2%-ным раствором дитизона в хлороформе при pH 3—4, не увлекая в экстракт ионы Со2+[4018]. Ионы Bi3+ мешают. Ионы 1п3+ не мешают при pH > 9. Ионы Zn2+ мешают. 100-кратный их избыток при pH 8—9 извлекается вместе с ионами Со2+. Экстракт дитизонатов через определенное время обрабатывают 0,01 н. раствором соляной кислоты. При этом разлагается почти исключительно дитизонат цинка в хлороформе, тогда как Со (HDz)2 остается без изменения [5023]. Эта совместная экстракция и последующее разложение многократно повторяется [384].
Ионы Ni2+ мешают. Их можно выделить экстракцией раствором диметилглиоксима в хлороформе из аммиачного раствора, содержащего цитрат-ионы [3920].
Ионы Cd2+, Pb2+ и Т1+ мешают. Можно обработкой 0,01 н. раствором соляной кислоты добиться того, чтобы из одновременно извлеченных дитизонатов только дитизонат кобальта остался в органическом растворе.
б) ОСНОВНЫЕ МЕТОДЫ ОПРЕДЕЛЕНИЯ
Прямое экстракционное титрование Реактивы
Дитизон, 25 мкМ раствор в хлороформе. 1 мл = = 0,737 мкг Со2Л
Эталонный раствор соли кобальта, 25/2 мкМ раствор CoSO4, 0,1 н. по H2SO4. 1 мл содержит 0,737 мкг Со2+.
Ход определения. 30 мл испытуемого раствора доводят до pH 6,5—7,5 в делительной воронке и проводят экстракционное титрование раствором дитизона до тех пор, пока последняя порция дитизона не приобретет сине-фиолетовую окраску.
Точность определения ±10%.
в) ПРИМЕНЕНИЕ
Экстракцию ионов Со2+ в виде дитизоната применяют не для прямого определения, ио исключительно для обогащения или отделения малых количеств ионов Со2+ от ионов Fe3+, Сг3+, Са2+, Mg2+ и других.
Определение металлов группы дитизона. Никель 277
После предварительной подготовки к анализу к солянокислому раствору испытуемой пробы прибавляют столько твердого цитрата аммония, чтобы не происходило выпадения осадка в щелочной области pH. Раствор доводят аммиаком до pH 8—9 и тотчас исчерпывающе экстрагируют приблизительно 250 мк,М раствором дитизона в четыреххлористом углероде порциями по 5 мл. Встряхивают в течение около полминуты. Дитизоновые экстракты выпаривают и после выпаривания разрушают раствором смеси НСЮ4 и H2SO4 (стр. 139). Полученный после выпаривания осадок извлекают соляной кислотой и содержание ионов Со2+ определяют колориметрированием с помощью нитрозо-Р-соли, нитрозокрезола или роданида калия [502] *.
Эти опыты являются почти селективными, и их проведению не мешают ионы, одновременно извлеченные дитизоном. Сендэл и Перлих определили 1О~4О/о кобальта в силикатных породах [3920, 502]. Холмс [452] и Ги-бард [384], а также Шаррер и Таубел [5528] определили следы кобальта в почве. Мэрстон и Дью [4018] и другие [4512, 5010, 5217, 5317, 5424, 5528] ** определяли кобальт в биологическом материале.
НИКЕЛЬ
а) ОБЩИЕ СВЕДЕНИЯ
Ионы Ni2+ в нейтральных растворах образуют с раствором дитизона в четыреххлористом углероде однозамещенный дитизонат [351], растворимый в органических растворителях с коричнево-фиолетовой окраской:
ЬНводн. 2H2Dzopr. '<—- Ni(HDz)2opr. 4“2Н^)дн.. (I)
Фишер [374] сделал наблюдение, что в сильнощелочных растворах, и в особенности при избытке ионов
* Монье с сотр. [5920] предлагает экстрагировать кобальт раствором дитизона в диэтиловом эфире. При pH 7—10 в результате однократного экстрагирования при этом удается количественно извлечь 0,0002—3,25 мкг кобальта. — Прим. ред.
** См. также [596]. — Прим. ред.
278 Применение дитизона в количественном анализе
Ni2+, при встряхивании с раствором дитизона в четыреххлористом углероде водный слой окрашивается в зеленоватый, а органический — в серый цвет.
Реакция дитизона в четыреххлористом углероде протекает направо по уравнению (I) и в области pH > 6 и <8 — быстро. Экстракцию хлороформом проводят при pH, сдвинутом приблизительно на две единицы к высшим значениям [5023]. Скорость, с какой протекает извлечение, позволяет проводить прямое экстракционное титрование ионов Ni2+ (раздел б, 1).
Рис. 35. Ход образования и разложения раствора Ni (HDz)2 в четыреххлористом углероде в зависимости от pH раствора и времени встряхивания (схематическое изображение).
------образование или разложение после встряхивания в течение полминуты; —=-----образование или разложение после
встряхивания в течение 30 мин. Для определения хода образования встряхивали равные объемы 25 мкМ раствора H2Dz в четыреххлористом углероде и 25/2 мкМ. раствора NP+ (водный раствор с известным pH). Для определения хода разложения встряхивали равные объемы 25/2 мкМ раствора Ni (HDz)., в четыреххлористом углероде и водного раствора с известным pH.
Дитизонат никеля в четыреххлористом углероде к водным растворам с pH около 10 довольно стоек. Поэтому из смеси дитизоната никеля и дитизона в четыреххлористом углероде можно с помощью разбавленного раствора аммиака отмыть дитизон, что имеет значение при проведении опытов с одноцветным раствором (раздел 6,2). Раствор дитизоната никеля в четыреххлористом
Определение металлов группы, дитизона. Никель 279 углероде поразительно устойчив к действию кислот. Ход реакции образования и обратной ей реакции разложения дитизоната никеля в четыреххлористом углероде * после 30-минутного встряхивания сильно отклоняется от зеркально симметричного изображения (см. рис. 35). Это явление может быть использовано для “отделения дитизоната никеля от дитизонатов металлов, мало устойчивых к кислотам (ср. стр. 280).
Р и с. 36. Кривые поглощения растворов Ni (HDz)2 в четыреххлористом углероде.
25/2 мкМ раствор Ni (HDz)_>;----------- 250/2 мкМ раствор Ni (HDz)2;
------25 мкМ раствор H2Dz; ............. 250 мкМ раствор H2Dz.
Кривая поглощения раствора дитизоната никеля в четыреххлористом углероде (см. рис. 36) похожа на кривую поглощения дитизоната палладия в том же растворе (ср. рис. 19, стр. 182). Из трех максимумов поглощения наиболее резко выражен максимум при длине волны 285 жц. Поглощение раствора дитизоната никеля в четыреххлористом углероде при длине волны 620 мц составляет почти V4 от величины поглощения раствора дитизона в четыреххлористом углероде. Это благоприятствует спектрофотометрическим опытам по методу смешанной окраски (раздел 6,3).
* Эве и Штрасгейм [5614] занимались извлечением ионов Ni2+ раствором дитизона в хлороформе из виннокислого раствора.
280 Применение дитизона в количественном анализе
Влияние посторонних анионов. Ионы S2“ и CN- мешают.
Влияние посторонних катионов. Все металлы, реагирующие с дитизоном, мешают. Поэтому отделяют ионы Ni2+ с помощью диметилглиоксима в виде диметилгли-оксимата*никеля, либо в виде осадка, либо экстракцией хлороформом [4610, 5513]. Диметилглиоксимат палладия можно отделить в кислом растворе от днметилглиок-симата никеля.
Ионы Ag+, Hg2+, Pd2+, Au3+, Cu2+ и Bi3+, присутствующие в 100-кратном избытке, можно отделить от ионов Ni2+ экстракцией раствором дитизона в четыреххлористом углероде при pH < 4. Извлечение этих ионов предшествует экстракции ионов никеля.
Ионы 1п3+ в 10-кратном избытке не извлекаются вместе с ионами Ni2+ раствором дитизона в четыреххлористом углероде при pH около 8.
Ионы Zn2+, Cd2+, Pb2+ и Т1+ экстрагируются раствором дитизона в четыреххлористом углероде вместе с ионами Ni2+. При встряхивании объединенных органических экстрактов с водным раствором с pH < 4 в слое четыреххлористого углерода остается только неразло-жившийся дитизонат никеля. Таким образом удается устранить десятикратный избыток этих мешающих ионов.
Ионы Со2+ мешают всегда.
б) ОСНОВНЫЕ МЕТОДЫ ОПРЕДЕЛЕНИЯ
1. Прямое экстракционное титрование
Реактивы
Дитизон, 50 мкМ раствор в четыреххлористом углероде. 1 ли = 1,47 мкг Ni2+.
Эталонный раствор соли никеля, 50/2 мкМ раствор NiSO4 0,01 н. по H2SO4. 1 мл содержит 1,47 мкг Ni2+.
Ход определения. В делительной воронке 10мл испытуемого раствора доводят до pH 7—7,5 и проводят экстракционное титрование раствором дитизона до тех пор, пока последняя добавленная порция раствора
Определение металлов группы дитизона. Никель
281
дитизона не получит слабую желтовато-красноватую окраску или обесцветится Ч
Точность определения ±5%.
Примечание
1 При 10-кратном увеличении концентрации обоих компонентов реакции конечную точку можно установить по появлению желтой окраски водного раствора (HDz-).
Вариант [4610] Реактивы
Дитизон, 250 мкМ раствор в хлороформе. 1 мл = 7,34 мкг Ni2+.
Аммиак, 2 н. раствор.
Роданид, NH4SON + ЫаООССНз • ЗН2О. 3 части насыщенного раствора NH4SCN смешивают с 1 частью насыщенного раствора ацетата натрия. Эталонный раствор соли никеля, 250/2 мкМ рас-
твор NiSO4 0,1 по H2SO4. 1 мл содержит 7,34 мкг Ni2+.
Ход определения. К 5 мл испытуемого раствора в делительной воронке прибавляют 4 мл раствора роданида, доводят аммиаком до pH 8 и проводят экстракционное титрование раствором дитизона.
2. Спектрофотометрическое определение по методу одноцветной окраски
Реактивы
Дитизон, раствор, аналогичный указанному в разделе б, 2.
Эталонный раствор соли никеля, раствор, аналогичный указанному в разделе б, 2.
Аммиак, 0,015 н. раствор.
X о д о и р е д е л е н и я. 10 мл испытуемого раствора в делительной воронке доводят до pH 7—7,5 и исчерпывающе экстрагируют раствором дитизона до тех пор, пока зеленая окраска последней порции дитизона не останется без изменения. Объединенные органические экстракты доводят с помощью четыреххлористого углерода до определенного объема и фракционированно промывают аммиаком до обесцвечивания последней порции
282
Применение дитизона в количественном анализе
промывного раствора. Промытый органический экстракт фотометрируют при длине волны 665, 480 или 285 жц.
Точность определения ±3%.
Вариант [5513] Реактивы
Дитизон, раствор, аналогичный указанному в разделе б, 1, вариант.
Аммиак, раствор, аналогичный указанному в разделе б, 1, вариант.
Эталонный раствор соли никеля, раствор, аналогичный указанному в разделе б, 1, вариант.
Промывной раствор, 0,5 н. раствор NH4OH.
Ход определения. Нейтрализуют аммиаком в делительной воронке 5 мл испытуемого раствора и добавляют еще столько аммиака, чтобы его концентрация в растворе достигла 0,3 н. Исчерпывающе встряхивают с раствором дитизона. Объединенные органические экстракты разбавляют хлороформом до определенного объема и встряхивают с порциями промывного раствора по 3 мл до обесцвечивания последней вытяжки. Органический экстракт фотометрируют при длине волны 665 мрс.
3. Спектрофотометрическое определение по методу смешанной окраски [5023]
Реактивы
Дитизон, раствор, аналогичный указанному в разделе б, 1.
Эталонный раствор соли никеля, раствор, аналогичный указанному в разделе б, 1.
Ход определения. Доводят 10 мл испытуемого раствора в делительной воронке приблизительно до pH 8, прибавляют избыточное количество раствора дитизона и встряхивают в течение полминуты. Удваивают объем органического раствора добавлением чистого четыреххлористого углерода, устанавливают pH 6 и встряхивают в течение полминуты. Органический раствор фотометрируют при длине волны 620 жц.
Определение металлов группы дитизона. Свинец 283
Точность определения ±5%.
Вариант. Встряхивание можно проводить сначала при pH 6—7.
в) ПРИМЕНЕНИЕ
Взаимодействие ионов Ni2+ с дитизоном протекает почти избирательно, вследствие чего можно иногда отказаться от предварительного выделения ионов Ni2+, которое целесообразно проводить с помощью диметилгли-оксима. С другой стороны, поглощение дитизоната никеля в четыреххлористом углероде (285 жц) почти в 3 раза большее, чем поглощение окисленного диметил-глиоксимата никеля в водном растворе (450 жц), что также является преимуществом метода в отношении чувствительности.
Определение ионов Ni2+ в виде дитизоната до настоящего времени было рекомендовано в двух случаях: Юнг, Стрикленд и Лейбович [4610] определяли содержание 1СГ4% никеля в металлах (цинке, меди, ванадии и др.), Шервуд и Чепмэн [5513] применили дитизоновый метод для определения следов никеля в катализаторах для нефти и нефтяных остатках.
СВИНЕЦ
а) ОБЩИЕ СВЕДЕНИЯ
Ионы РЬ2+ в нейтральных и щелочных растворах образуют с дитизоном однозамещенный дитизонат *, растворимый в органических растворителях с карминовокрасным окрашиванием:
Pb2BO+M.+2H2Dzopr. 5=± Pb(HDz)20pr.+ 2НводН.-
Так как растворимость дитизоната свинца в органических растворителях (см. табл. 4, стр. 38) сильно ограничена, то при работе в нейтральном растворе
* Состав дитизоната свинца был повторно проверен [29, 438, 474, 495> 528, 5310].
284
Применение дитизона в количественном анализе
целесообразно пользоваться максимально 50 мкМ. раствором дитизона в четыреххлористом углероде. В хлороформе растворимость дитизоната свинца в 17 раз выше. Поэтому для операций отделения большей частью предпочитают хлороформ четыреххлористому углероду в качестве растворителя.
Ионы РЬ2+ еще реагируют с дитизоном в слабокислом растворе, однако в зависимости от растворителя, а также характера и количества присутствующих анионов только при pH > 7 извлечение протекает полностью (см. рис. 37) [4212, 5023]. Благодаря сильному сродству ионов РЬ2+ к дитизону можно с помощью избыточного количества последнего разрушить даже сульфид свинца [ЗЗ10].
Р и с. 37. Извлечение ионов РЬ2+ в зависимости от pH раствора, различных компонентов в растворе и природы органического растворителя.
а или а'—в присутствии 0,1 М раствора ацетата; Ь или Ь'— в присутствии 1 М раствора хлорида; с или с' — в присутствии 0,2 М раствора тартрата; d или d'— в присутствии 0,2 М раствора цитрата (схематическое изображение по данным Королева [502г]). В * * * * * * * *
В присутствии ионов CN~ при pH > 8, кроме ионов
РЬ2+, реагируют с дитизоном еще ионы Bi34’ и Т1+, од-
нако преимущественно протекает реакция с ионами
РЬ2+. Взаимодействие свинца с дитизоном в органиче-
ском растворителе протекает быстро при pH 7—9, бла-
годаря чему возможно прямое экстракционное титрова-
ние (раздел б,1).
Раствор дитизоната свинца в четыреххлористом уг-
лероде разлагается при pH < 3,5, а в хлороформе —
Определение металлов группы дитизона. Свинец 285 при pH < 4,5. Такой легкий распад делает возможным, с одной стороны, полное отделение ионов РЬ2+ (ср. стр. 296), а с другой — косвенное экстракционное титрование, а также косвенное колориметрическое определение свободного дитизона после распада дитизоната свинца (ср. раздел б, 2; раздел б, 3, вариант, а также раздел 6,6, примечание 4). По отношению к щелочным растворам дитизонат свинца еще довольно устойчив до pH 10,5. Это позволяет отмывать избыток дитизона и таким образом проводить определение по методу одно* цветной окраски (разделы б, 3; б, 4).
Отмывка избытка дитизона проводится на практике ради экономии времени водными растворами с pH > > 10,5. При этом могут быть разрушены заметные количества дитизоната свинца. Чтобы достигнуть хорошо сходимых данных по свинцу, следует заботиться о том, чтобы избыточное количество дитизона в смеси органических экстрактов не превышало определенных границ концентрации, чтобы по возможности его избыток был незначительным, и, кроме того, следует строго контролировать отмывку дитизона по количеству и pH промывного раствора, а также продолжительность встряхивания [374, 3828, '5516].
При высоком значении pH и одновременном выборе соответственно высокой концентрации дитизона в органическом растворителе можно достигнуть того, чтобы дитизонат свинца оставался в органическом слое, тогда как весь дитизон в виде иона HDz- переходил бы в водный раствор (раздел 6,6, вариант 1). Сравнительно хорошая устойчивость дитизоната свинца в щелочных растворах позволяет выделить небольшие количества дитизоната висмута из растворов дитизоната свинца в органическом растворителе (ср. стр. 289).
Растворы дитизоната свинца в четыреххлористом углероде пли хлороформе сохраняют в темноте и на холоду; в зависимости от характера растворителей они устойчивы в течение нескольких часов и даже дней. При освещении, в особенности на солнечном свету, быстро наступает заметное их разложение.
Благодаря указанной способности дитизоната свинца разлагаться были предложены для построения
286
Применение дитизона в количественном анализе
сравнительной шкалы при визуальной колориметрии цветные стекла [3621] или определенные жидкости — .метиловый оранжевый [39й] или водный раствор нитрата кобальта (II) [471] для дитизоната свинца в органических растворителях и (Ni2+ + Cu2+ + Со2+) [3622] для смеси дитизоната свинца и дитизона в органическом растворителе.
Кривая поглощения раствора дитизоната свинца в четыреххлористом углероде при длине волны 520 мц дает хорошо выраженный максимум, используемый при спектрофотометрических определениях по методу одноцветной окраски (раздел 6,4) (см. рис. 38). При этой длине волны раствор дитизона в четыреххлористом углероде соответствующей концентрации поглощает только в количестве 14%, вследствие чего не требуется полного отмывания избытка дитизона, во время которого может иметь место незначительное разложение дитизоната свинца.
Рис. 38. Кривые поглощения растворов Pb (HDz)2 в четыреххлористом углероде.
------2Ъ/2мкМ раствор Pb(HDz)j------250/2 мкМ раствор Pb(HDz):;----- 25 мкМ раствор H2Dz.
Полоса поглощения дитизоната свинца в органическом растворителе расположена между двумя почти одинаковой интенсивности полосами поглощения дитизона в органическом растворителе, что благоприятствует проведению визуальных определений по методу смешанной окраски (раздел 6,5).
Определение металлов группы дитизона. Свинец
287
При максимуме поглощения раствора дитизона в четыреххлористом углероде (длина волны 620 жц) или в хлороформе (длина волны 605 жц) раствор дитизоната свинца в органическом растворителе поглощает в незначительной степени, вследствие чего можно определить при этих длинах волн содержание свободного дитизона в присутствии дитизоната свинца. Можно также определить при длине волны 470 жр дитизон в водном растворе в виде HDz“ [3923].
Влияние посторонних анионов. Ионы S2- мешают. Ионы GN“ не мешают. Они служат для маскирования остальных реагирующих с дитизоном металлов, за исключением ионов Bi3+, 1пЗ+ и Т1+ [ЗЗ8, 438] и особенно Sn2+.
Ионы [Ре(СЫ)б]3" и одновременно присутствующие ионы Fe3+ и CN- в зависимости от концентрации и значения pH влияют на дитизон окисляющим образом [367]. В присутствии цитрата уменьшается скорость окисления [3813]. При прибавлении таких восстановителей, как NH2OH [3521, 354, 3814], N2H5OH, Na2SO3 [5521], Na2S2O4 [3719] и другие, ионы [Fe(CN)6]3“ переходят в ионы [Fe(CN)6]4~. В этом случае при быстрой работе еще можно определить 10 мкг свинца в присутствии 1 мг Fe3+.
Ионы РО4~ в большой концентрации незначительно уменьшают экстракцию, но это влияние можно вполне скомпенсировать путем соответствующего повышения pH и добавления цитрата [3823, 4811]. Большие количества ионов РО4~ можно выделить в виде фосфата магния-аммония MgNH4PO4 • 6Н2О [3813], но образующийся осадок, по-видимому, захватывает заметные количества ионов РЬ2+. В этом случае целесообразнее проводить выделение ионов РЬ2+ в виде сульфида на сульфиде меди в качестве коллектора [5535]. Цитрат и тартрат в больших количествах подавляют экстракцию (ср. рис. 37).
Ионы SO4” не мешают. Осадок сульфата свинца можно в данном случае перевести в раствор с помощью ацетата аммония. SiO2 • /гН2О в виде коллоида затрудняет экстракцию ионов РЬ2+. Следует встряхивать с более концентрированным раствором дитизона в органическом растворителе чаще и дольше обычного. Эта
288 Применение дитизона в количественном анализе
операция более целесообразна, чем отфильтровывание кремневой кислоты или выпаривание с плавиковой кислотой [5535].
Влияние посторонних катионов. Ионы Ag+, Hg2+, Pd2+, Au3+, Cu2+, Zn2+, Cd2+, Co2+ и Ni2+ не мешают экстракции ионов Pb2+ дитизоном в органическом растворителе в присутствии достаточного количества ионов CN-. Первые пять элементов в количестве до 1 мг также экстрагируются дитизоном в органнческОлМ растворителе при pH < 0 *.
Ионы Bi3+, In3+ и Т1+ не маскируются ионами CN". Если не созданы особые условия, то они экстрагируются вместе с ионами РЬ2+ в области pH (см. рис. 39), обычно принятой для экстракции последних.
Фигуры на рис. 39 характеризуют реакцию обмена 25 мкМ раствора дитизона в органическом растворителе с равным объемом водного раствора соли металла соответствующей концентрации. Путем изменения концентрации одного из компонентов реакции можно сузить или расширить область pH, в которой протекает экстракция в соответствии с законом действия масс. В общем случае анионы сдвигают экстракцию к более высоким значениям pH.
Поскольку реакция обмена исследуемых ионов как в кислой, так и в щелочной области практически обратима, то показанные на рис. 39 фигуры, изображающие
* В связи с ядовитостью цианида калия и тем, что он вызывает понижение результатов для свинца, были предложены способы разделения и последующего определения Си, РЬ и Zn без применения KCN. Лурье Ю. Ю. и Николаева 3. В. [5716] разработали метод, по которому при pH 2 предварительно экстрагируется и определяется медь, затем pH раствора доводят до 6,8—7,0 и связывают цинк гексацианоферратом (II) калия в комплексное соединение K2Zn3[Fe(CN)e]2, из которого дитизон цинка не извлекает. После добавления гидроксиламина и цитрата (или тартрата) доводят pH раствором щелочи до 8—8,5 и экстрагируют свинец дитизоном. Миллер А. Д. и Либина Р. И. [584] разработали два способа разделения и последующего определения Си, РЬ и Zn без применения KCN. В первом способе после обычного отделения меди реэкстра-гируют свинец из смеси дитизонатов цинка и свинца обработкой тиосульфатом при pH ~ 5,5—6,0, не затрагивая при этом дитизоната свинца. Реэкстрагированный свинец определяют с помощью дитизона экстракционным титрованием при pH ~ 8,5. О втором способе см. примечание редактора на стр. 250. — Прим. ред.
Определение металлов группы дитизона Свинец
289
экстракцию, характеризуют также и распад указанных дитизонатов.
Ионы Bi3+ являются главными мешающими ионами при определении ионов РЬ2+. Многие исследователи занимались определением ионов РЬ2+ в присутствии ионов Bi3+. Наиболее часто они пользовались узким интервалом pH, в пределах которого извлечение или разложение обоих дитизонатов совершенно не накладывается друг на друга или накладывается в очень малой степени * (рис. 39).
рн
Р и с. 39. Области pH, в которых протекает извлечение или разложение дитизонатов Bi3+, In3+, Pb2+ и Т1+ с применением четыреххлористого углерода (----) или хлороформа
(_ —) в качестве растворителей.
1. После совместной экстракции ионощ РЬ2+ и Bi3+ раствором дитизона в органическом растворителе при pH > 7 экстракт многократно промывают щелочным раствором (большей частью 0,5—1 % раствором KCN, pH >11), причем преимущественно разлагается дитизонат висмута [342, 356, 3516, 395]. Этим путем можно
* Лишь при большом количестве ионов Bi3+ целесообразно их удалить в виде BiBr3, чтобы выделить перед определением свинца [5535]. После прибавления смеси брома с бромистоводородной кислотой препарат, содержащий висмут, выпаривают досуха на водяной бане. Наконец, сухой остаток постепенно прокаливают в электрической печи при 300° в течение 5 мин. Прокаленный остаток растворяют в азотной кислоте.
19 Зак. 2157.
290
Применение дитизона в количественном анализе
определить ионы РЬ24' в присутствии 2—3-кратного избытка ионов Bi3+.
2. После совместной экстракции ионов РЬ2+ и Bi3+ дитизоном в органическом растворителе при pH > 7 органический экстракт четыреххлористого углерода встряхивают с кислым раствором HNO3 с pH 2,3—2,5 [4113, 4216, 5321] или хлороформный экстракт встряхивают с буферным раствором с pH 3,4 [425, 438, 4915, 5510, 5535] (ср. примечание 6, стр. 297), причем преимущественно разлагается дитизонат свинца. Этим способом можно отделить 5—10-кратное количество ионов Bi3+.
3. Подкисляют водный раствор, содержащий ионы РЬ2+ и Bi3+ (рН~2[3519, 366, 376, 393, 4015, 5516, 5625], pH 3,'О—3,5 [3717] или pH 4,0 [3925]) и полностью экстрагируют ионы Bi3+ избыточным количеством раствора дитизона в органическом растворителе. Так как реакция между висмутом и дитизоном протекает при низких pH очень медленно, раствор следует долго встряхивать и вблизи конца экстракции слегка увеличивать его pH. При этом способе можно извлечь до 1 мг висмута в присутствии 25 мкг свинца одновременно, не захватывая большого количества свинца (ср. пример г, 3, стр. 223).
4. Подщелачивают водный раствор, содержащий ионы РЬ2+ и Bi3+, (рН~12) и фракционированно экстрагируют ионы РЬ2+ раствором дитизона.
5. Комбинируют опыты, описанные в пунктах 1—4 Так, Фишеру [403] (см. ниже) удалось с помощью предварительной экстракции ионов Bi3+ дитизоном в четыреххлористом углероде при pH 2,8 и последующей щелочной промывки органического экстракта свинца определить с точностью ±10% содержание свинца в присутствии 100-кратного избытка висмута.
6. В присутствии 500-кратного избытка ионов Bi3+ можно определить ионы РЬ2+, используя способность раствора дитизона в органическом растворителе в первую очередь реагировать со свинцом при pH 8—9 [403]. Экстракцию проводят малыми порциями раствора дитизона до тех пор, пока последняя фракция примет красно-оранжевую окраску дитизоната висмута. Полученный экстракт, который, кроме дитизоната свинца, содержит еще некоторую часть дитизоната висмута, раз-
Определение металлов группы дитизона. Свинец
291
лагают кислотой по методу, указанному в пункте 2. Затем определяют содержание ионов РЬ2+ по одному из основных методов (см. ниже).
7. Так как дитизонаты свинца и висмута образуют при длинах волн 360 Л1ц и 530 Л1ц (в СС14) различные полосы поглощения (см. рис. 23 и 38), то Клиффорду [438] в присутствии умеренных и примерно равных концентраций дитизонатов свинца и висмута удалось фото-метрированием по разности обеих длин волн определить с помощью номограммы еще 5% дитизоната висмута в присутствии дитизоната свинца
Указанное фракционированное извлечение или фракционированное разложение дитизонатов требует строгого соблюдения узких границ pH растворов с одновременным учетом сопутствующих солей, способных сдвинуть область экстракции в неблагоприятную сторону. Разделения тогда протекают недостаточно четко, и достигнутая точность определений сводится к более или менее удачной компенсации ошибок.
Мешающее влияние ионов Bi3+ на экстракцию ионов РЬ2+ дитизоном можно обнаружить по получающейся необычной окраске органических экстрактов по сравнению с контрольными при 520 и 620 лщ или по окраске при встряхивании части раствора дитизоната свинца со смесью из 10%-ных растворов серной кислоты и тиомочевины [5610]. При протекании последней реакции в присутствии ионов Bi3+ наступает желтое окрашивание раствора [5412]. Если установить pH водного раствора нитрата свинца в отсутствие цианид-ионов равным 4,0 и встряхивать с раствором дитизона в хлороформе, то по изменению окраски в фиолетово-красную до красной можно определить 2 мкг висмута в присутствии 500 мкг свинца [3925].
Рекомендуемые предварительные отделения ионов РЬ2+ с помощью других веществ, как, например, осаждение в виде сульфата свинца с сульфатом стронция в качестве коллектора [4215], осаждение ионов Bi3+ из 2 н. раствора соляной кислоты в виде сульфида с помощью сульфида меди в качестве коллектора [5623], экстракция диэтиламмонпйдпэтилдитиокарбамината свинца в присутствии 5 н. раствора НО или ионов J" хлоро-
19*
292 Применение дитизона в количественном анализе формом [5413], экстракция карбамината висмута (в присутствии ионов Cu2+, Hg2+ и благородных металлов) в присутствии 2 н. раствора НС1 [451, 5128] или при pH 7,5—8,0 в присутствии цианида калия [5610], как и роданида висмута метилизопропилкетоном [5235], еще недостаточно апробированы *.
Отделение ионов РЬ2+ от ионов Bi3+ [3519, 403].
Реактивы
Тартрат натрия-калия NaKC-tH-tOe • 4НоО, 10%-ный раствор.
Аммиак, 7 н. раствор.
Азотная кислота, 2 н. раствор.
Дитизон, раствор для экстракции, 50 мкМ раствор в хлороформе, 1 мл ==3,48 мкг Bi34’.
Цианид калия, 10%-ный раствор.
Дитизон, 25 мкМ раствор в четыреххлористом углероде. 1 мл = 2,59 мкг РЬ2+.
Промывной раствор, 0,5%-ный раствор KCN.
Ход определения. 5 мл испытуемого раствора (содержащего около 20 мкг свинца в присутствии до 500 мкг висмута) в делительной воронке доводят аммиаком или азотной кислотой до pH 2,5!. Исчерпывающе экстрагируют раствор, содержащий висмут с раствором дитизона для экстракции, до тех пор пока чисто зеленая окраска последней порции экстракта после встряхивания в течение 5 мин. не останется без изменения. К водному раствору, промытому четыреххлористым углеродом, прибавляют 1 мл раствора тартрата и доводят аммиаком pH раствора до 9,5. После добавления 10 мл раствора цианида исчерпывающе экстрагируют ионы свинца раствором дитизона. Объединенные органические экстракты разбавляют четыреххлористым углеродом до определенного объема для удаления остающихся следов дитизоната висмута, дважды промывают промывным раствором порциями по 10 мл и 1 раз 10 мл воды 2 и колориметрируют.
* Катино и Малетто [5736] описали способ быстрого разделения свинца, таллия и висмута путем противоточного распределения. При этом возможно количественное отделение Т1 от Bi и РЬ и Bi от РЬ с точностью 1 %. — Прим. ред.
Определение металлов группы дитизона. Свинец
293
Точность определения ± 10%.
Примечания
1 Добавление раствора тартрата или цитрата следует проводить экономно, чтобы не затруднить экстракцию дитизоната висмута (см. рис. 22, стр. 215). По этой же причине следует воздерживаться от прибавления галогенидов, в особенности ионов J-.
2 Вместо промывания органического экстракта щелочным цианидным раствором экстракт встряхивают с 25 мл азотной кислоты с pH 2,5 (^0,005 н. HNO3) в течение 1 мин.; при этом ионы РЬ2+ переходят в водный раствор. Из последнего ионы РЬ2+ определяются по одному из основных методов.
Ионы 1п3+ не мешают, если присутствуют в 100-кратном избытке (возможно, даже и больше), если экстракция ионов РЬ2+ проводится при pH > 10 раствором дитизона в органическом растворителе. Большие количества хлорида или бромида трехвалентного индия следует отделить экстракцией эфиром или другими органическими растворителями.
Ионы Т1+ в 100-кратном избытке не мешают, если экстракция ионов РЬ2+ проводится раствором дитизона в четыреххлористом углероде при pH 6,0—6,4 [438] или раствором дитизона в хлороформе при pH около 7,5 [3925]. Если содержание ионов Т1+ такого же порядка, что и содержание ионов РЬ2+, то при обычных операциях выделения и определения свинца раствором дитизона в четыреххлористом углероде они не принимают участия в реакции. При применении хлороформного раствора дитизона ионы таллия легче экстрагируются совместно с ионами РЬ2+, однако большую часть их можно отмыть 0,5%-ным раствором KCN [3516, 403] или выгоднее и легче удалять их промыванием водой (pH около 7). Можно также фракционирование экстрагировать ионы РЬ2+ раствором дитизона в четыреххлорпстом углероде [403], так как при pH 8—10 ионы РЬ2+ реагируют с дитизоном раньше ионов Т1+.
Так как переход от карминово-красной окраски дитизоната свинца к малиново-красной дитизоната таллия едва заметен, то каждую органическую фракцию испытывают отдельно на присутствие дитизоната свинца красного цвета, встряхивая с промывным раствором (0,5%-ный раствор KCN). Если последняя фракция ор
294
Применение дитизона в количественном анализе
ганического экстракта содержит только чистый дитизонат таллия, то последний разлагают промыванием и ранее окрашенный раствор обесцвечивается. Объединенные органические экстракты содержат, кроме основной массы дитизоната свинца, еще немного дитизоната таллия. Последний удаляют промыванием 0,5%-ным раствором KCN и раствор колориметрируют. Таким способом можно еще определить 10 мкг свинца в присутствии 500 мкг таллия.
1000-Кратное количество таллия можно выделить при извлечении эфиром в виде хлорида таллия (III).
Ионы Fe3+ мало мешают, присутствуя в умеренных количествах в растворе, содержащем цианид и тартрат. При большом содержании ионов Fe3+ целесообразно обогатить раствор ионами РЬ2+ встряхиванием с избытком концентрированного раствора дитизона в органическом растворителе [354, 3814] (ср. раздел г, 4). В этом случае невозможно замаскировать многие металлы, реагирующие с дитизоном, и они экстрагируются совместно со свинцом (о помехах, вызываемых ионами [Ре(СЫ)б]3", см. стр. 140, а также стр. 287).
Можно удалить большое количество Fe3+ извлечением в виде купферата [399] хлороформом при pH > 4 или в виде HFeCl4 [3820, 4613] извлечением эфиром (ср. раздел г, 3).
В щелочном растворе и в присутствии цитрата, пирофосфата и цианида можно отделить ионы РЬ2+ от ионов Fe3+ и Cu2+ извлечением раствором диэтилдитио-карбамината в эфире [3922, 35б].
б) ОСНОВНЫЕ МЕТОДЫ ОПРЕДЕЛЕНИЯ
При определении следов свинца в испытуемой пробе, благодаря огромному распространению этого элемента, следует предварительно уменьшить (в зависимости от определяемого количества свинца) его содержание в применяемых реактивах и пользоваться достаточно чистой посудой.
До того как пипетки будут погружены в растворы реактивов, требуется удалить с наружной их стороны следы свинца (содержащиеся в эмали, использованной
Определение металлов группы дитизона. Свинец
295
для градуировки [5425]). Ранее очищенная посуда и реактивы уже при хранении могут набрать из воздуха заметные количества свинца. Поэтому параллельно с проводимыми определениями необходимо ставить «холостые» опыты.
В присутствии большого количества сопутствующих солей, как, например, фосфатов щелочноземельных металлов, солей железа, алюминия и т. п., для получения совпадающих результатов полезно перед собственно определением провести предварительную экстракцию ионов РЬ2+ раствором дитизона в органическом растворителе. Извлеченный в органическом растворителе дитизонат свинца затем разрушают разбавленным раствором соляной кислоты, при этом ионы РЬ2+ переходят в водный слой. Лишь в исключительных случаях такому отделению свинца дитизоном предшествует еще обогащение пробы с помощью других веществ, например получение сульфида свинца (ср. разделы г, 5 и г, 3).
При наличии ионов Т1+ и Bi3+, также реагирующих с дитизоном в щелочном растворе в присутствии ионов CN~ и в том случае, если их содержание не превышает содержания свинца, их можно удалить в процессе выделения ионов свинца. Если же ионы Т1+ или Bi3+ присутствуют в больших количествах, то последние следует отделить с помощью специальных способов (ср. стр. 289 и сл.).
Так как ионы РЬ2+ удобнее всего извлекать из щелочных растворов, не содержащих мешающих примесей, при pH > 7 четыреххлористым углеродом или при pH > 8,5 хлороформом, т. е. в условиях, при которых происходит заметный переход дитизона из органического слоя в водный, следует строго контролировать распределение дитизона между обеими фазами, особенно если проводятся определения свинца по методу смешанной окраски. Для этого необходимо сохранять постоянными объем и pH водного раствора, содержащего ионы свинца. Предварительное экстрагирование ионов свинца в органическом растворителе в виде дитизоната и разложение полученного соединения кислотой определенного объема и концентрации создают наряду с отделением от компонентов раствора требуемые подле-
296 Применение дитизона в количественном анализе жащие контролю условия для ионов РЬ2+ в водном растворе. Из последнего можно затем удовлетворительно определить несколько микрограммов свинца по методу смешанной окраски.
Выделение свинца [36б, 403]
Реактивы
Аммиак, 14 н. раствор.
Тартрат натрия-калия NaKC4H4O6 • 4Н2О, 10%-ный раствор.
Цианид калия, 10%-ный раствор.
Гидроксиламин солянокислый, 10%-ный раствор. Дитизон, 25 мкМ раствор в хлороформе. 1 мл = = 2,59 мкг РЬ2+.
Азотная кислота, 0,15 н. раствор.
Ход определения. Испытуемый раствор в делительной воронке нейтрализуют достаточными количествами растворов тартрата 1 и аммиака 4. Затем прибавляют достаточное количество раствора цианида2. После добавления 1 мл солянокислого раствора гидроксиламина 3 испытуемый раствор доводят аммиаком до pH 8,5—10,0. После этого проводят исчерпывающую экстракцию раствором дитизона 5 до тех пор, пока последняя порция реагента после встряхивания в течение полминуты больше не дает красной окраски. К объединенным органическим экстрактам во второй делительной воронке прибавляют разбавленный раствор азотной кислоты, встряхивают в течение полминуты, промывают водный слой органическим растворителем и тщательно разделяют оба слоя. Водный раствор содержит почти чистый свинец в 0,15 н. растворе азотной кислоты и служит в качестве исходного раствора для окончательного определения содержания ионов РЬ2+ по одному из основных методов 6.
Примечания
1 См. примечание на стр. 300. Вместо раствора тартрата можно пользоваться раствором цитрата [20%-ный раствор (NH^HCeHsO?]. В присутствии больших количеств фосфатов щелочноземельных металлов предпочитают применять цитратный раствор. Большие количества ортофосфатов можно, по Джонсону и Полхиллу [5519], удерживать в растворенном состоянии с помощью гексаметафосфата натрия.
Определение металлов группы дитизона. Свинец
297
2 В зависимости от природы и содержания маскируемых ионов прибавляют соответствующее количество раствора цианида калия (ср. примечание 2, стр. 300).
3 См. примечание 3, стр. 300.
4 В присутствии больших количеств фосфатов щелочноземельных металлов рекомендуется повысить pH испытуемого раствора до 11,5 или же добавить гексаметафосфат натрия [5519], чтобы достигнуть количественного извлечения ионов РЬ2+. При этом целесообразнее экстрагировать более концентрированным раствором (например, 250 мкМ) дитизона в хлороформе [ЗЗ6, 4819].
5 Количество раствора дитизона применяют в соответствии с предполагаемым содержанием ионов РЬ2+. По израсходованному раствору дитизона (мл) на получение фиолетовой смешанной окраски можно приблизительно судить о содержании ионов РЬ2+. Если экстракция затрудняется большим содержанием солей в испытуемом растворе, то рекомендуется экстрагировать более концентрированным хлороформным раствором дитизона (например, 250 мкМ) и добавлять его в большем избытке.
6 Для устранения помех, вызываемых ионами Т1+, следует объединенные органические экстракты во второй делительной воронке 1—2 раза промыть водой порциями по 25 мл (pH около 7) при встряхивании в течение полминуты. При этом происходит гидролиз дитизоната таллия (TIHDz).
Для устранения мешающего влияния ионов Bi3+ следует промытый водой экстракт встряхивать в течение 1 .мин. с 25 мл кислого буферного раствора * с pH 3,4 [425]. В результате этой операции дитизонат свинца разлагается, в то время как дитизонат висмута остается в органическом слое неизмененным и сливается. (В отсутствие дитизоната висмута красный органический слой приобретает чисто зеленую окраску дитизона.)
Полученный таким способом раствор, содержащий ионы РЬ2+, в котором отсутствуют ионы Т1+ и Bi3+, вторично обрабатывают описанным выше способом (с самого начала). Таким образом, можно из раствора ионов свинца удалить 100-кратный избыток ионов Т1+ и 50-кратный избыток ионов Bi3+. Относительно выделения еще больших количеств таллия (I) и висмута см. стр. 291—293.
* Приготовление кислого буферного раствора [425]: 9,1 мл азотной кислоты (15 н.) разбавляют водой приблизительно до 500 мл, доводят аммиаком (7 н.) до pH 3,4, прибавляют 25 мл раствора кислого фталата калия (0,2 М, 5,0 мл 0,2 н. соляной кислоты и доводят водой до объема 1 л.
298
Применение дитизона в количественном анализе
1. Прямое экстракционное титрование [3218, 33й, 3518, 36б, 437]
Реактивы
Аммиак, 2 н. раствор.
Цианид калия, 10%-ный раствор.
Азотная кислота, 2 н. раствор.
Дитизон, 50 мкМ раствор в хлороформе. 1 мл == = 5,18 мкг РЬ2+.
Эталонный раствор соли свинца, 25 мкМ раствор Pb(NO3)2, 0,15 н. по HNO3. 1 мл содержит 5,18 мкг РЬ2+.
Ход определения. Нейтрализуют аммиаком 20 мл испытуемого раствора1 в делительной воронке, прибавляют 2 мл раствора цианида и доводят до pH около 7,5 с помощью азотной кислоты2. Проводят экстракционное титрование раствором дитизона до тех пор, пока зеленая окраска последней порции дитизона не останется без изменения после встряхивания в течение полминуты3.
Точность определения ±1%.
Примечания
1 Целесообразно пользоваться более чистыми растворами, содержащими свинец, получаемыми после предварительного отделения ионов РЬ2+ в виде дитизоната свинца и разложения дитизоната кислотой (ср. стр. 296). В таком случае наблюдается четкий переход окраски.
2 Можно также работать с растворами с более высоким pH, например до pH 9, однако следует раствор дитизона устанавливать по эталонному раствору РЬ2+ с тем же pH. В этом случае последняя добавляемая порция раствора приобретает светло-зеленую окраску или обесцвечивается.
3 Если раствор перетитровывают, то можно объединенные органические экстракты в делительной воронке разложить с помощью 20 мл 0,15 н. раствора азотной кислоты, полученный водный раствор установить до соответствующего pH и вновь оттитровать раствором дитизона. В стехиометрической эквивалентной точке окраска последней порции экстракта становится темно-фиолетовой. Продолжают титрование до тех пор, пока последняя добавленная порция раствора дитизона не будет сохранять сине-зеленую окраску хлороформного раствора дитизона. Перерасход дитизона соответствует примерно +2%.
Определение металлов группы дитизона. Свинец
299
2. Косвенное экстракционное титрование [ЗЗ2, 342, 359, 403]
Реактивы
Реактивы по возможности не должны содержать ионов Pb2+, Bi3+, а также TH.
Дитизон, 50 мкМ раствор в четыреххлорпстом углероде. 1 мл = 5,18 мкг РЬ2+.
Аммиак, 7 н. раствор.
Цианид калия, 10 %-ный раствор.
Гидроксиламин солянокислый, 10%-ный раствор. Промывной раствор, 0,5%-ный раствор KCN.
Эталонный раствор, 25/2 мкМ раствор Pb(NO3)2, 0,15 н. по HNO3. 1 мл содержит 2,59 мкг РЬ2+.
Азотная кислота, 1 н. раствор.
Раствор соли серебра, 25 мкМ раствор AgNO3, 0,1 н. по HNO3, 1 мл содержит 2,697 мкг Ag+.
Ход определения. Нейтрализуют аммиаком в делительной воронке 20 мл испытуемого раствора (до pH около 7) 1 и добавляют 5 мл раствора цианида калия 2 и 1 мл раствора гидроксиламина 3. Исчерпывающе экстрагируют4 все уменьшающимися по объему порциями раствора дитизона до тех пор, пока окраска последней порции органического экстракта вместо красной не станет зеленой или бесцветной 5.
Объединенные органические экстракты два раза промывают во второй делительной воронке промывным раствором порциями по 5 мл, в течение 20 сек. встряхивают и таким способом освобождают от избыточного количества дитизона 6.
Красный органический слой содержит чистый дитизонат свинца и промывается дважды водой 7 по 10 мл. К нему добавляют 5 мл азотной кислоты, отмеренный объем взятого в избытке раствора соли серебра, около 25 мл воды и встряхивают в течение 1 мин. Тщательно отделяют полученный золотисто-желтого цвета дитизонат серебра в четыреххлористом углероде и сливают. В оставшемся водном слое определяют избыточное
300
Применение дитизона в количественном анализе
количество ионов Ag+ экстракционным титрованием раствором дитизона (ср. стр. 111 и сл. и 153).
Точность определения ±2%.
Примечал и я
1 Если присутствуют ионы А13+, Ве2+, фосфаты щелочноземельных металлов и другие вещества, также дающие осадки с аммиаком в присутствии ионов CN~, следует предварительно прибавить в соответствующем количестве раствор тартрата или цитрата. Достаточно прибавить, например, 5 мл раствора тартрата (10%-ный раствор NaKCiH-jOe • 4Н2О), чтобы удержать в растворе 100 мг алюминия.
2 Этого количества раствора цианида калия достаточно для маскирования умеренных количеств ионов Hg2+, Cu2+, Zn2+ и др. Если эти ионы присутствуют в больших количествах, то следует соответственно увеличить объем раствора цианида калия (см. вариант, стр. 313).
3 Гидроксиламин прибавляют для восстановления окислителей и поддержания буферности раствора. В присутствии ионов Fe3+ или Си2+ раствор после прибавления гидроксиламина короткое время кипятят (ср. раздел г, 4, стр. 314, а также вариант, стр. 313).
4 Можно также сразу проэкстрагировать испытуемый раствор избыточным количеством раствора дитизона, однако следует знать приблизительное содержание свинца и дольше встряхивать. Экстракция дитизоната свинца протекает количественно только при большом избытке дитизона (см. рис. 37, стр. 284). Концентрация раствора дитизона в четыреххлористом углероде должна быть выше 50 мкМ только при высоких значениях pH водного раствора.
5 Окраска органического слоя, а именно зеленая, светло-зеленая или бесцветная, зависит от pH водного слоя.
6 Первая порция промывного раствора имеет желтоватую окраску, обязанную ионам HDz-, вторая порция должна быть бесцветной. В противном случае следует еще раз провести извлечение 5 мл промывного раствора (ср. также стр. 285).
7 В растворе не должны содержаться ионы CN-, чтобы не произошло связывания ионов Ag+.
Вариант [3717, 3816]. Экстракцию ионов РЬ2+ проводят 25 мкМ хлороформным раствором дитизона, как описано в приведенном выше методе (см. абзацы 1 и 2), согласно описанию, а затем продолжают определение как описано ниже.
Полученный экстракт красного цвета встряхивают с 0,15 н. раствором соляной кислоты, разлагая при этом дитизонат свинца. Отбрасывают водный слой, зеленый слой раствора дитизона в хлороформе обрабатывают 0,5%-ным раствором цианида калия. При этом боль
Определение метил юв группы дитизона. Свинец
301
шая часть дитизона в виде HDz~ переходит в водный раствор. Затем титруют дитизон, распределенный по обеим фазам, прибавляя порции эталонного раствора РЬ2+ и чистого хлороформа до тех пор, пока не прекратится образование дитизоната свинца, заметное по появлению красной окраски раствора.
3. Визуальное колориметрическое определение
по методу одноцветной окраски [ЗЗ2, 342, 403]
Реактивы идентичны указанным в разделе б, 2 (кроме раствора соли серебра).
Ход определения. Полученный аналогично описанному в разделе 6,2 (абзац 2) органический раствор красного цвета разбавляют четыреххлористым углеродом до определенного объема и проводят определение методом стандартных серий.
Точность определения ±4%.
Вариант [374, 375]. К органическому раствору красного цвета 1 прибавляют 5 мл азотной кислоты, встряхивают в течение полминуты, разбавляют до определенного объема четыреххлористым углеродом и сравнивают полученный раствор дитизона в четыреххлористом углероде по методу стандартных серий.
Точность определения ±2%.
Примечание
1 Раствор дитизоната свинца красного цвета дает в видимой области спектра хотя и интенсивную, но узкую полосу поглощения. Последняя весьма пригодна для спектрофотометрических измерений, и при этом не мешают малые количества присутствующего в испытуемом растворе дитизона. Визуально эту окраску труднее сравнивать, чем окраску свободного дитизона, имеющего более широкую зону поглощения (2 полосы).
4. Спектрофотометрическое определение по методу одноцветной окраски [403]
Реактивы аналогичны указанным в разделе б, 3.
Ход определения. Полученный согласно разделу 6,2 органический раствор красного цвета разбавляют до определенного объема четыреххлористым
302
Применение дитизона в количественном анализе
углеродом 11 фотометрируют при длине волны 520 Лф (ср. примечание 1, раздел 6,3).
Точность определения ±2%.
5. Визуальное колориметрическое определение по методу смешанной окраски [366, 372, 403]
Исходят из раствора соли свинца с известным объемом и содержанием кислоты, полученного по описанию на стр. 296.
Реактивы
Азотная кислота, 0,15 н. раствор.
Буферный раствор, pH 11,5. Приготовление: к 100 мл 10%-ного раствора KCN прибавляют 75 мл 14 н. раствора NH4OH и доводят объем до 1 л.
Дитизон, 25 мкМ раствор в хлороформе. 1 мл == = 2,59 мкг РЬ2+.
Эталонный раствор соли свинца, РЬ(МОз)2 в буферном растворе. 1 мл содержит 2,59 мкг РЬ2+.
Титрованный раствор, РЬ(ЫОз)2 в буферном растворе. 1 мл содержит 1,295 мкг РЬ2+. Приготовление: к 100 мл эталонного раствора соли свинца сначала прибавляют 10 мл раствора тартрата (ср. стр. 296), затем 20 мл буферного эаствора и водой доводят объем до 200 мл. Ежедневно приготовляют свежий раствор.
Ход определения. Вносят 5 мл испытуемого раствора в цилиндр для перемешивания, добавляют до 10 мл разбавленной азотной кислоты и 2 мл буферного раствора L Титруют раствором дитизона, встряхивая в течение полминуты до получения хорошо определяющейся фиолетовой смешанной окраски2*. Полученную смешанную окраску сравнивают методом стандартных серий3 или же определяют содержание свинца сравнительным титрованием4.
Точность определения ±2%.
Примечания
1 При прибавлении отмеренного объема буферного раствора можно всегда установить определенный pH (между 9,0 и 10,0) раствора. В вышеописанном случае pH соответствует 9,6.
2 Из ряда оттенков: карминово-красного (чистый дитизонат свинца), красно-фиолетового, фиолетового, сине-фиолетового, темно-
Определение металлов группы, дитизона. Свинец 303
фиолетового, зелено-синего и сиза-лелвяого (чистый дитизон) оттенки красно-фиолетовый (околев ^^) избытка дитизона) и темно-фиолетовый (выше 100% и^вддау|мявляются наиболее чувствительными при опреде^^фь^оет' •/ МК G.
3 При составлении шкадмт^О^^ф^ОН’^СйЗ^убывающие объемы
эталонного раствора в идай^^^ИОвИШвЖнйСаКэРДИнакового размера. Затем с помошыепразбавленйой гаэотнргй^Э^лойыководят объем раствора в цилиндре#^ olQ4{#bitoZK^^
раствора и соотве^тй^^9дащ^Ш^^^МпТШЙ«^(>Рибав’ ляют израсходов^м^йрхвй р -дитизона. Каждый #й@нтз3«йй. OIdT>
4 Для o*b,ott+bpoii ци-
раствора туемого. встряхни
чвдй иараододрваныому 5₽$>вание испы-, «рответствующем Установленным раство-не приобретет такую же испытуемого веще-
ства. Титрова4^^О1ра(г1йед1Г^и^а911дйд^н содержать тартрат, чтобы воспрепят13|®^ф£!а|м^^ соединений свинца,
особенно если растифвадаимлх’аи адффМШт ионы РО^’в качестве примесей [37^]. -яаэаиннк^дат&ат
чш ЙБгинегоавд
туя иш
6. Спектрофотометрическое определение по методу смешанной окраски [366]
Реактивы идентичны указанным в разделе б,51, но без титрованного раствора соли свинца.
Ход определения. 5 мл испытуемого раствора2 в делительной воронке доводят до 10 мл разбавленной азотной кислотой и прибавляют 2 мл буферного раствора. После добавления 10 мл раствора дитизона3 встряхивают в течение 1 мин., причем устанавливается смешанная окраска, промежуточная между карминовокрасной дитизоната свинца и сине-зеленой, характерной для дитизона. Органический слой фотометрируют при длине волны 520 мц и устанавливают содержание ионов РЬ2+ по калибровочной кривой 4.
Точность определения ±2%.
Примечания
1 Вместо хлороформного раствора дитизона можно пользоваться раствором дитизона в четыреххлористом углероде. Однако в последнем случае pH водного раствора следует снизить на 1,5— 2 единицы.
304
Применение дитизона в количественном анализе
2 Целесообразно пользМйй$><Я1* раствором соли свинца в кислоте определенной концентр ац1ИМч(4)РДдЭ96, примечание 1), который получен после отделения (^эдадкдашв^Жчюнов РЬ2+.
3 Указанных 10 мл растБораН^ЧйШзона вполне достаточно для реакции с 10 ШОч^^Ьб^ТИФбя небольшой избыток. Если
требуется опраде#й#Йй<1&Ий^ свинца, следует приме-
нять бол^1Й^Е^^^1Т{^^ йо|^с^т‘С|^^^^нтрированнь1Й раствор дитизон^ раствором дити-
зона .»(о1^Й?Йгё#№ТруйЬАИЙЙв1Ш^’,|^ьоДййт^<.Чцентрации). При-близит®4йЙ&<5оДш4<аМй^бйо1Фввв>^^гнв растворе большей частно .ИМ^стн©нй§р^одит^§укйдаэ© Если же это
не известно,о$о трШДОВДйТ до получе-
ния смешаШбй' | (Й^^10ЙС1Йв»г1Й₽ (дамшййч Зг#ей Йъ 'тупают со-гласно прим®р|Ийюв* р10®вддмодо)(;р|в1ч£н ; рь^рнпрмда., ь .
4 ПосколВйу МЦ <5В8аШз«Й?И " длине
волны 605 мр. ическп
не поглощает, методу
смешанной окраскиф^Ж@р^гЙй^ЭДШФТ^дйтйй0Н1ОРО<УЙ1панном экстракте и вычесть при длине
волны 520 жц. В таком"от точного соблюдения pH водного расзвдт^^ц.^^ин&сдар^ао'нцентрацпи дитизона.
Можно также встряхивать ^органищйкйе смешанные экстракты с приблизительно 15 мл раз&авУ1е#нЬйГ кислоты в течение 1 мин. и измерять увеличение поглощения гфй Хлине волны 605 тир. (в СНС1з) или 620 мр (в ССЕ), т. е. опро^дять количество дитизона, выделившееся после разложения дитизоната свинца.
Если проводить указанный «контроль» (ср. стр. 127) с помощью 0,005 н. раствора HNO3 или буферного раствора с pH 2,4, то присутствующий дитизонат висмута не разлагается и, следовательно, не приводит к увеличению абсорбции при упомянутых длинах волн [532Ч.
Вариант 1 [4712, 4819]. При повышении pH водного раствора до 11,5 и увеличении избытка дитизона достигают того, что дитизонат свинца остается в органическом слое, в то время как дитизон полностью-переходит в водный слой в виде HDz~. Поэтому меньше придерживаются строгого соблюдения определенного объема и концентрации как испытуемого раствора, так и раствора дитизона. Таким способом удается без изменения условий опыта определить содержание свинца в широком интервале концентраций.
Реактивы
Азотная кислота, как в разделе б,5.
Буферный раствор, pH около 11,5. Получение: к 500 мл NH4OH (7 н.) прибавляют 100 мл
Определение металлов группы дитизона. Свинец 305
NaoSOs (1%-ный раствор) и 20 мл KCN (10 % - н ы й раствор).
Раствор дитизона 250 мкМ раствор в хлороформе. I j/л 25,9 мкг РЬ2+.
Эталонный раствор соли свинца, как в разделе б, 1.
Ход определения. Вносят в делительную воронку 10 мл испытуемого раствора2, прибавляют 20 мл разбавленной азотной кислоты, 30 мл буферного раствора и 10 мл раствора дитизона и встряхивают в течение 1 мин. Тотчас фотометрируют полученный карминово-красный раствор дитизоната свинца в органическом растворителе при длине волны 520 лф.
Точность определения ±2%.
Примечания
1 Вместо хлороформного раствора дитизона можно пользоваться раствором дитизона в четыреххлорпстом углероде [5518]. В этом случае практически получается одноцветный раствор, так как дитизон переходит в водный слой в виде ионов HDz-.
2 Целесообразно пользоваться раствором с небольшим содержанием ионов РЬ2+, полученным после предварительного выделения свинца, хотя на определение оказывают относительно небольшое влияние сопутствующие соли (кроме ионов Bi3+ и Т1+) *.
в) ПРИМЕНЕНИЕ
Высокая чувствительность, как и способность к селективному проведению реакции свинца с дитизоном, привела к тому, что колориметрическое определение свинца в виде дитизоната получило широкое распространение **.
Хёгль и Сульсер [517] определили методом смешанной окраски еще около 0,2 мкг свинца в 100 мл воды. Штрохекер с сотрудниками также определили ионы РЬ2+ прямым путем. Томпсет [3616] предварительно выпаривал воду, разрушал органические вещества
* Дайапер и Куксис [5737] предложили фотометрический метод определения свинца в однофазной водно-ацетоновой системе. — Прим. ред.
** В дополнение к колориметрическому методу часто пользуются конкурирующими методами: радиометрическим, эмиссионным спектральным [401] и полярографическим.
20 Зак. 2157.
3U6 Применение дитизона в количественном анализе серной и хлорной кислотами и в остатке определял свинец. Абрагамчик [387] предварительно проводил обогащение тяжелых металлов на ионообменниках *. Бате, Галер и Мелон [5028] определяли содержание свинца в сточных водах. Парно и Аршинар [5227] определяли растворимость свинца в чистой воде, из которой предварительно удаляли растворенные газы. Крейг и Винас [3915] исследовали растворимость сульфида свинца в растворе серной кислоты различной концентрации.
Определению содержания свинца в воздухе (пыли, дыме и парах) посвящен целый ряд статей: Вебера [3720], Гарольда, Мика и Холдена [3614, 3814], Московича и Бурке [3816], Прихня [3918], Фэрхола [3815], а также Шнайдера, Барнеса и Токоса [4824]. Следует отметить обзор, сделанный Американской ассоциацией народного здравоохранения **.
Хуайт [3619] определял свинец в сухом остатке после опрыскивания плодов, причем применял смесь из хлороформного раствора дитизона и водного раствора цианида калия, одновременно используемых в качестве растворителей. Холмс [452] определял в почве ионы РЬ2+ наряду с ионами Cu2+, Zn2+ и Со2+. В почве, а также золе растений определял свинец Вестергоф [3813]. Геологические поисковые работы проводили Уэб и Мильмэн [5013], Милки [528, 5229], а также Ловеринг, Соколов и Моррис [4817]. Последние предложили полевой метод определения ионов РЬ2+***.
В силикатных породах Сендэл [372] (ср. раздел г, 1) определил менее 10-3% свинца в присутствии меди и цинка. Лаплас [5228] определял свинец в железной руде, Шульц и Гольдберг [439] — в неорганических исходных
* Алесковский В. Б., Либина Р. И. и Миллер А. Д. [586] предварительно концентрировали свинец (а также медь) посредством ионообменной колонки с катионитом СБС. — Прим. ред.
** Мечерли, Лилли и Уитман [5730] с целью ускорения и повышения точности определения свинца в воздухе, крови и моче применили специально изготовленные аппараты для подготовки проб и экстрагирования дитизоната свинца и заменили визуальное колориметрирование фотометрированием. — Прим. ред.
*** Хилл [5910] для дитизоновой колориметрии в полевых условиях предложил применять уайт-спирит в качестве растворителя. — Прим. ред.
Определение металлов группы дитизона. Свинец 307 веществах для косметических препаратов. Уэпль п Рэдоу [359] определили свинцовую присадку к глазури *.
Целый ряд исследователей занимался определением свинца в металлургическом производстве. Фишер и Лео-польАи [ЗЗ2, 3824] определяли менее 10-3% свинца в серебре, ртути, меди, цинке (ср. раздел г, 2), кадмии, олове (ср. раздел г, 6), мышьяке, сурьме, алюминии и бериллии. В меди малые количества свинца определяли Юнг и Лейбович [4613]** и Сильвермэн [486] (ср. раздел г, 3). Брикер и Проктор [4513] определяли содержание свинца в хромоникелевой стали (ср. раздел г, 5)., Йокосука [5531] — в никеле, содержащем 2* 10~4% свинца, Иошнморп и Хирано [5417] определяли свинец в стали, Мильнер и Тоуненд [5112]— в сплавах, не содержащих железа (в медных, цинковых и оловянных сплавах), Мюллер и Сивертс [401] — в цинковых электродах, служащих в качестве эталонов в спектральном анализе***.
* Стрельникова Н. П. и Павлова В. Н. [6011] предложили способ определения малых количеств свинца в рудах с большим содержанием железа (порядка 30—40%). Железо при этом экстрагируется амилацетатом, свинец предварительно осаждается с коллектором Са3(РО4)2- Отделение свинца можно проводить также с помощью анионита ЭДЭ-10 П.
Баскова 3. А. [5921] провела сравнительное экспериментальное изучение различных методов концентрирования свинца (в том числе эстрагированием дитизоната свинца хлороформом) при определении малых количеств этого металла в горных породах.
Сравнивая результаты двух методов конечного определения свинца — фотометрического (дитизонового) и полярографического, она отмечает ценность и пригодность обоих методов. Выбор метода выделения и определения свинца в каждом частном случае следует производить с учетом особенностей состава анализируемого материала и его количества.
Мейнс и Мак-Брайд [5732] определяли следовые количества свинца в минералах вулканического происхождения, Пауэлл и Кинсер [5818] — в монацитах.
Майоров Н. Ф. [5915] описал методику определения свинца и цинка в геологических материалах из одной навески методом капельного анализа. — Прим. ред.
** См. также Йокосука [5538].— Прим. ред.
*** Ота и Мори [5811, 59-] разработали методику спектрофотометрического определения свинца в чугуне и свинцовистой стали с высокими режущими свойствами, согласно которой производят предварительное восстановление Fe3+ посредством NH2OH • НС1 при pH 2,5—3,0, а затем прибавляют KNaC-jHjOe и KCN. В качестве экстрагента вместо хлороформа или четыреххлористого угле-
20*
308
Применение дитизона в количественном анализе
С начала 1933 г. появилось более 100 публикаций, посвященных определению свинца в биологическом материале, для которого он является ядом. В них описывается открытие, принципы определения, освобождение от мешающих примесей и применение к анализу различных органических материалов, как, например, моча, кровь, кости, продукты питания различного характера.
Биологический материал можно минерализовать мокрым путем без давления [3515, 3518, 4017, 5413] или по методу Кариуса [3820], причем особенно при применении серной кислоты следует обращать внимание на содержание в ней свинца. Органический материал не всегда следует полностью подвергать разложению. Часто достаточно частично окислить его, например азотной кислотой, чтобы выделить свинец [395].
При сухой минерализации [3510, 3515, 366, 5413] не следует перегревать образец выше 500°, чтобы избежать потери свинца при улетучивании или при вжигачии в стенки тигля. Потери при выжигании имеют место особенно в пробах, бедных минеральными солями. В качестве веществ, способствующих озолению [3510, 366, 5412, 5413], оказались пригодными растворы следующих солей:
рода они используют бензол, однократное экстрагирование которым обеспечивает хорошие результаты. Разработанная методика пригодна для определения 3 • 10-4— 4‘10~2% РЬ.
Обзор методов определения свинца в стали дает Хепфнер [5922], а в чугуне Руни [6013].
Свинец определяли: Назаренко В. А. и Бирюк Е. А. [5919] в ванадии и ниобии, Мухина 3. С., Тихонова А. А. и Жемчужная И. А. [5622] в никелевых сплавах, Волкова А. И. и Захарова Н. Н. [5714] в индии, Судо и Хирокава [5912] в меди, оловянных сплавах, сталях, марганце и др., Гото и Хирокава [5735, 5816] в электролитическом марганце и ферромарганце. Об определении свинца в алюминии и его сплавах см. также [5817], в металлическом цирконии см. [5926].
Азрельян О. П., Рабовская С. М. и Андреев А. С. [5341] определяли малые количества свинца в железо-кадмиевых массах. После предварительного отделения его совместно с сульфатом стронция свинец определялся колориметрически по методу смешанной окраски сравнением с серией стандартных растворов.
Вил и Вуд [6015] определяли свинец спектрофотометрически при содержании его 1 • 10-5% в теллуровой кислоте.
Мухина 3. С., Тихонова А. А. и Жемчужная И. А. [6017] определяли свинец (а также кадмий) в металлическом хроме и его сплавах. — Прим. ред.
Определение металлов группы дитизона. Свинец 309
Ca(NO3)2-5H2O, Mg'(NO3)2’6Н2О или A1(NO3)3-9H2O. К удовлетворительному результату приводит также сжигание сухого органического вещества в токе кислорода или двуокиси азота [5518] пли в кислородной бомбе [5414].
Если в золе содержится много фосфатов щелочноземельных металлов, то рекомендуется концентрировать свинец в виде сульфида, причем в качестве коллектора можно воспользоваться, например, сульфидом меди (II) [366]. Более того, почти всегда свинец концентрируют в органическом растворителе в виде дитизоната; отделенный раствор дитизоната свинца в органическом растворителе разрушают разбавленной кислотой и только в таком водном растворе определяют содержание ионов РЬ2+. Проводят также обогащение с помощью экстракции йодида свинца метилизопропилкетоном [5235, 5510].
Экстракцией диэтилдиокарбаминатом, а также диэтил аммонийдиэтилдитиокарбаминатом в органическом растворителе при pH около 7 удается отделить ионы Fe3+, а также фосфаты щелочноземельных металлов [366, 3616, 5412, 5517]. При исследовании мочи особенно часто концентрируют ионы РЬ2+ на коллекторах, таких, как оксалат кальция [ЗЗ12, 357, 3717, 3830, 5316], фосфат кальция [ЗЗ10, 4112, 478, 4811], сульфат кальция [346, 3612] и сульфат стронция [4215]. При этом не всегда весь свинец собирается на коллекторе. К обогащению пробы ионами РЬ2+ привлекают также электролиз [416].
Большая часть работ, относящихся к определению свинца в биологическом материале, методически близка одна другой. Следует отметить обзор, составленный по этому вопросу Американской ассоциацией народного здравоохранения [5535] *.
Бамбах [4015] определял в лекарствах сумму свинца и таллия, присутствующих в качестве ядов. Кайзер и
* Вестерберг и Сёхолм [5132], сравнивая определения свинца в биологических материалах (моче, крови и др.) с помощью дитизона и его анолога ди-Р-нафтилтиокарбазона, отмечают, что последний более чувствителен и дает более точные результаты. Ди-р-наф-тилтиокарбазон, по их мнению, имеет преимущества особенно в методе смешанной окраски. — Прим. ред.
310
Применение дитизона в количественном анализе
Ветцель [3517], а также Рейт и Ван Дик [4010] определяли содержание ионов РЬ2+ в сильно разбавленных лекарствах, Страффорд, Уйетт и Кэршоу [451] также определяли содержание свинца в лекарствах, а кроме того, и в органических соединениях. Штейгер [3716] определял содержание свинца в бензине и масле и Эванс и Давенпорт [3715] в минеральном масле*.
В красителях содержание свинца было определено Олпортом и Скримшайром [321]. Холстэн [363] применил дитизон в судебной химии для определения следов свинца в поле обстрела **.
г) ПРИМЕРЫ
1. Определение свинца в силикатах [372]
В некоторых пробах, содержащих 10-3% свинца, его определяли с погрешностью ±5%.
Ход определения. В водном испытуемом растворе, освобожденном от примеси меди, аналогично описанному в разделе г, 1 (стр. 209), содержание свинца определяют по одному из основных методов, лучше всего визуально по методу смешанной окраски.
2. Определение свинца в очищенном цинке [3824]
10-3% свинца определяют с погрешностью ±4%. Реактивы
Азотная кислота, 7 н. раствор.
Мочевина.
Аммиак, 7 н. раствор.
Цианид калия, 10%-ный раствор.
* Гриферинг с сотр. [5718] разработали два варианта быстрого определения свинца в бензинах и лигроинах.
Руденко Н. П. [5639] применял дитизон для разделения Th-B (РЬ212) и Th-C (Bi212), Зыков С. И. и Ступникова Н. И. [5747]— при определении изотопного состава свинца.—Прим. ред.
** Немировская А. Ф. и Петрашень В. И. [5928] на основании критического разбора работ за 1936—1957 гг. по фотометрическому определению свинца сделали вывод, что наиболее точным и чувствительным методом является определение при помощи дитизона (применение диф-нафтилтиокарбазона ими не рассматривалось).— Прим. ред.
Определение металлов группы дитизона. Свинец
311
Гидроксиламин солянокислый, 25%-ный раствор. Дитизон, 100 мкМ раствор в четыреххлористом углероде. 1 мл s 10,36 мкг РЬ2+.
Промывной раствор, 0,5%-ный раствор KCN.
Ход определения. 5 г металлического цинка растворяют в 50—60 мл азотной кислоты. Раствор выпаривают почти до густоты сиропа, прибавляют 10 мл воды и 0,2 г мочевины, в течение нескольких минут кипятят, переносят в мерную колбу емкостью 25 мл и доводят объем до метки. К 5 мл раствора ( = 1 г Zn) в делительной воронке прибавляют аммиак1 до растворения выпадающей сначала гидроокиси цинка. После прибавления 50—60 мл раствора цианида2 и 1 мл раствора гидроксиламина3 исчерпывающе экстрагируют раствором дитизона до тех пор, пока последняя порция органического экстракта не приобретет вместо красной зеленую окраску или обесцветится4. Объединенные экстракты во второй делительной воронке снова обрабатывают по одному из основных методов.
Примечания
1 Если испытуемый раствор содержит ионы А13+, следует прибавить достаточное количество тартратного раствора, чтобы воспрепятствовать выпадению гидроокиси алюминия.
2 Количество цианидного раствора добавляют сообразно с маскируемым количеством ионов Zn2+. Раствор цианида, а также навеску испытуемого образца берут в зависимости от ожидаемого содержания свинца.
3 Раствор гидроксиламина предохраняет от окисления и бу-ферирует щелочной цианидный раствор. Поэтому его количество должно соразмеряться с количеством цианидного раствора, чтобы сохранился требуемый pH раствора, необходимый при экстракции ионов РЬ2+.
4 Зеленая, светло-зеленая или бесцветная окраска последней порции экстракта зависит от pH испытуемого раствора (ср. рис. 6-стр. 22).
3. Определение свинца и меди [4613]
1- 10-4% свинца определяются с погрешностью ±20%.
Ионы РЬ2+ выделяют на гидроокиси железа (III) в качестве коллектора, осадок растворяют в соляной кислоте и полученную HFeCl4 отделяют экстракцией
312 Применение дитизона в количественном анализе эфиром. Из водного раствора сперва выделяют ионы РЬ2+ с помощью дитизона в органическом растворителе, разлагают полученный дитизонат свинца кислотой и, наконец, определяют содержание свинца раствором дитизона в органическом растворителе.
Реактивы
Азотная кислота, 8 н. раствор.
Нитрат железа (III) Ре(МОз)з • 9Н2О, 5%-ный раствор.
Аммиак, 14 н. раствор.
Аммиак, 1,4 н. раствор.
Соляная кислота, 7 н. раствор. Эфир.
Лимонная кислота СбН8О7 • Н2О, 50%-ный раствор. Цианид калия, 50%-ный раствор.
Дитизон, 25 мкМ раствор в четыреххлористом углероде. 1 мл = 2,59 мкг РЬ2+.
Ход определения. Растворяют в азотной кислоте 10 г меди !. К раствору прибавляют 5 мл раствора нитрата железа (III) 2, осторожно подщелачивают аммиаком и добавляют еще 10 мл в избытке3. Кипятят, собирают осадок4 на гладкий фильтр, слегка промывают разбавленным раствором аммиака и, наконец, горячей водой. Осадок переносят в стакан, растворяют в азотной кислоте и после разбавления водой снова осаждают аммиаком, отфильтровывают и промывают, как описано выше.
Осадок растворяют в горячем растворе соляной кислоты, переносят в делительную воронку, хорошо охлаждают и HFeCl4 извлекают эфиром5. Для испарения остатков эфира водный раствор нагревают в стакане. Полученный раствор переносят в делительную воронку, добавляют 1 мл лимонной кислоты, доводят аммиаком до pH 8, добавляют 5 мл раствора цианида и исчерпывающе экстрагируют раствором дитизона б. Объединенные во второй делительной воронке органические экстракты разлагают разбавленной азотной кислотой согласно описанию на стр. 296 или 133 и определяют в водном слое содержние ионов РЬ2+ по одному из основных методов7.
Определение металлов группы дитизона. Свинец
313
При ме ча и и я
1 Величину навески сообразуют с ожидаемым содержанием свинца, которое варьирует между 10 и 100 мкг РЬ.
2 Следует взять такой объем раствора нитрата железа (III), чтобы количество ионов Fe3+ превышало в 30—50 раз сумму всех сопутствующих свинец элементов, т. е. висмута, мышьяка, сурьмы, селена и теллура.
3 Метод пригоден для определения свинца в никеле и кобальте. Только в этом случае следует повысить количество применяемого раствора аммиака, чтобы по возможности уменьшить соосаждение этих элементов.
4 Осадок, кроме свинца, может содержать еще висмут, мышьяк, сурьму, селен, теллур, фосфор, а также таллий и немного меди.
5 В присутствии ионов Т13+ экстракцию эфиром следует проводить таким образом, чтобы присутствующий Т1С1з также извлекался (ср. стр. 293).
6 Экстракт, кроме дитизоната свинца, содержит также весь висмут (обычно присутствующий в меди) в виде дитизоната висмута.
7 Если присутствуют ионы Bi3+, следует их предварительно отделить (ср. стр. 291). В этом случае можно количественно определить содержание висмута (ср. раздел г, 3, стр. 223).
Вариант [486]. Определяют 1 • 10~2% свинца с погрешностью ±5%.
Реактивы
Азотная кислота, 15 н. раствор.
Дитизон, 25 мкМ раствор в четыреххлористом углероде. 1 мл = 2,59 мкг РЬ2+.
Винная кислота1 С4НбО6 • Н2О, 50%-ный раствор.
Аммиак, 14 н. раствор.
Цианид натрия2, 10%-ный раствор.
Гидроксиламин солянокислый, 10%-ный раствор.
Промывной раствор, pH около 10. Приготовление: 10 г NaCN растворяют в 200 мл воды, прибавляют 75 мл аммиака (конц.) и доводят объем раствора до 500 мл. К 25 мл 0Д5 н. раствора HNO3 прибавляют полученный выше раствор до достижения pH раствора около 10.
Ход определения. К 5г медных стружек прибавляют 25 мл воды, 30 мл азотной кислоты и кипятят в течение 2—3 мин. По охлаждении объем раствора доводят водой до 250 мл.
314
Применение Оитизона в количественном анализе
К 25 мл испытуемого раствора (=0,5 г меди) прибавляют 5 мл раствора винной кислоты и аммиак до появления яркой синей окраски. По охлаждении и прибавлении 25 мл раствора цианида образуется желтоватый раствор. Последний кипятят3 с 2 мл раствора гидроксиламина, охлаждают, переносят в делительную воронку и исчерпывающе экстрагируют раствором дитизона, встряхивая в течение полминуты до тех пор, пока последняя порция экстракта вместо красной остается зеленой или бесцветной. Объединенные органические экстракты во второй делительной воронке разбавляют определенным объемом четыреххлористого углерода и встряхивают с 25 мл промывного раствора в течение полминуты. Промытый экстракт фотометрируют при длине волны 520 мц.
Примечания
1 Вместо винной кислоты можно воспользоваться сегнетовой солью, из которой легче выделить примесь свинца.
2 Вместо цианида натрия можно взять цианид калия.
3 Следует добавлять гидроксиламин, чтобы воспрепятствовать окислению присутствующими в растворе ионами Fe3+ или другими окислителями.
4. Определение свинца в железе
Возможно определение 1 • 10-2% свинца с погрешностью ±3%.
Общее содержание металлов, реагирующих с дитизоном, как, например, Cu2+, Zn2+, Cd2+ и Ni2+, не должно превышать 10-кратного избытка по сравнению с содержанием свинца.
Так как большие количества [Ре(СЫ)б]3“сильно окисляют дитизон, то сначала пробу обогащают ионами РЬ2+ путем экстракции раствором дитизона в четыреххлорп-стом углероде без добавления ионов CN".
Реактивы
Соляная кислота, 6 н. раствор.
Тартрат натрия-калия NaKCiH-iOe • 4Н2О, 20%-ный раствор.
Гидроксил амин солянокислый, 20%-ный раствор.
Аммиак, 7 н. раствор.
Определение металлов группы дитизона. Свинец
315
Дитизон, 250 мкМ раствор в четыреххлористом углероде (для экстракции), 1 мл = 25,9 мкг РЬ2+.
Соляная кислота, 0,2 н. раствор.
Цианид калия, 10%-ный раствор.
Дитизон (реагент), 25 мкМ раствор в четыреххлористом углероде. 1 мл = 2,59 мкг РЬ2+.
Ход определения. Растворяют 1 г металлического железа в 20 мл соляной кислоты и объем раствора доводят водой до 100 мл. 5 мл полученного раствора переносят в стакан, прибавляют 5 мл раствора тартрата, 5 мл солянокислого гидроксиламина, устанавливают аммиаком pH равным 9 и доводят до кипения. По охлаждении раствор переносят в делительную воронку и исчерпывающе извлекают ионы РЬ2+ при встряхивании.
Объединенные органические экстракты во второй делительной воронке промывают 10 мл воды, дважды встряхивают с разбавленной кислотой по 10 мл и сливают. Объединенные водные растворы во второй делительной воронке промывают 5 мл четыреххлористого углерода, прибавляют по 1 мл растворов тартрата и солянокислого гидроксиламина и устанавливают аммиаком pH 9—10. Экстрагируют ионы РЬ2+ с помощью 1—2 мл раствора дитизона (реагента) после прибавления 5 мл раствора цианида и проводят определение по одному из основных методов.
5. Определение свинца в хромоникелевой стали [455 * * * * * * * 13]
Можно определить 1 • 10~2% свинца с погрешностью
±10%.
Концентрируют ионы РЬ2+ в кислом растворе сна-
чала в виде сульфида, а затем в виде дитизоната
свинца в хлороформе.
Реактивы
Соляная кислота, 12 н. раствор.
Азотная кислота, 15 н. раствор.
316
Применение дитизона в количественном анализе
Хлорная кислота, 10 н. раствор Фтористоводородная кислота, 21 н. раствор. Аммиак, 7 н. раствор.
Сероводород.
Аммиак, 1,5 н. раствор.
Лимонная кислота СбН8О7 • Н2О, 50%-ный раствор. Цианид калия, 10 %-ный раствор.
Дитизон, 100 мкМ. раствор в хлороформе. 1 мл = 10,36 мкг РЬ2+.
Азотная кислота, 0,15 н. раствор.
Ход определения. К 1 г стальной стружки в конической колбе емкостью 300 мл прибавляют 12,5 мл соляной кислоты, 12,5 мл азотной кислоты, 25 мл хлорной кислоты и несколько капель фтористоводородной кислоты. Нагревают до выделения паров хлорной кислоты; при этом весь хром окисляется до Сг2О? • Доводят объем раствора водой приблизительно до 150 мл, прибавляют ровно столько аммиака, сколько необходимо, чтобы ионы Fe3+ оставались в растворе. В этот раствор до насыщения пропускают сероводород, прибавляют 10 капель разбавленного раствора аммиака и продолжают пропускать сероводород еще в течение 3 мин. Тотчас отфильтровывают осадок и прокаливают его в фарфоровом тигле. Остаток после прокаливания извлекают 10 мл горячего 8 н. раствора азотной кислоты в течение 5 мин. и отделяют прозрачный раствор.
Прибавляют к охлажденному фильтрату в делительной воронке 5 мл лимонной кислоты и нейтрализуют аммиаком. Прибавляют 10 мл раствора цианида и доводят pH раствора аммиаком до 9,0—9,6. Исчерпывающе экстрагируют ионы РЬ2+ раствором дитизона до тех пор, пока окраска последней порции экстракта не будет зеленой или' бесцветной.
К объединенным органическим экстрактам во второй делительной воронке прибавляют 25 мл разбавленной азотной кислоты и встряхивают в течение полминуты. Органический слой спускают; водный слой промывают органическим растворителем и определяют в нем содержание ионов РЬ2+ по одному из основных методов.
Определение металлов группы дитизона. Свинец
317
6. Определение свинца в олове [ЗЗ2]
Возможно определение 10"3% свинца с погрешностью ±5%.
Реактивы
Бром.
Бромистоводородная кислота, приблизительно 7 н. раствор (d = 1,38).
Смесь брома с бромистоводородной кислотой (70 мл Bt2 + 500 мл НВг).
Соляная кислота, 12 н. раствор.
Азотная кислота, 15 н. раствор.
Тартрат натрия-калия NaKC4H4O6 • 4Н2О, 10%-ный раствор.
Ход определения. К 1 г металлического олова 1 в фарфоровой чашке прибавляют 10—20 мл смеси из брома и бромистоводородной кислоты и нагревают на водяной бане до улетучивания SnBr4. После извлечения осадка 5 мл соляной и 2 мл азотной кислоты полученный раствор выпаривают досуха, осадок растворяют в 1 мл азотной кислоты и 5 мл раствора тартрата и раствор смывают водой в делительную воронку2. Выделяют ионы РЬ2+ в виде дитизоната (см. стр. 296) и в заключение их определяют по одному из основных методов.
Примечания
1 Если присутствует не растворимый в кислоте оловянный камень (ЗпОг), как, например, в золе биологического материала, его разлагают при восстановлении. Согласно Уигмэну и Клифорду [3510], сначала прибавляют 20 мл бромистоводородной кислоты и 0,5—1,0 г чистейшего металлического олова в виде порошка, оставляют до появления прозрачного раствора, прибавляют 15 мл хлорной кислоты (10 н.) и немного брома и выпаривают часть хлорной кислоты при температуре не свыше 150°. После прибавления порциями смеси из брома и бромистоводородной кислоты и выпаривания последней проводят определение по вышеописанному методу.
2 В этом растворе наряду с ионами РЬ2+ содержатся ионы Си2+, Bi3+, Zn3+, Cd2+, Fe3+ и другие элементы, сопутствующие олову, которые также могут быть определены,
318
Применение дитизона в количественном анализе
7. Определение свинца в моче [4210]
Определяют «общее содержание» свинца.
Реактивы
Соляная кислота, 6 н. раствор.
Хлорат калия.
Гидроксиламин солянокислый, 5%-ный раствор. Цитрат натрия ХазСбН5О7 * 5,5Н2О, 30%-ный раствор.
Цианид калия, 10%-ный раствор.
Аммиак, 14 н. раствор.
Дитизон, 100 мкМ раствор в хлороформе, 1 мл = = 10,36 мкг РЬЧ
Азотная кислота, 0,15 н. раствор.
Ход определения. К 100 мл мочи в круглодонной колбе емкостью 300 мл прибавляют 1 г хлората калия и 20 мл соляной кислоты, покрывают часовым стеклом и выдерживают при 90° в течение 2 час. 1 Отфильтровывают, переносят прозрачный фильтрат2 в делительную воронку, охлаждают, прибавляют 2,5 мл раствора гидроксиламина и 20 мл раствора цитрата, доводят аммиаком pH раствора до 8,5 и исчерпывающе экстрагируют ноны РЬ2+ раствором дитизона 3, пока последняя порция экстракта не останется зеленой. Объединенные органические экстракты во второй делительной воронке разлагают при встряхивании 10 мл разбавленной соляной кислоты4. Определяют перешедшие в водный слой ионы РЬ2+ по одному из основных методов.
Примечания
1 Сначала моча темнеет и затем через полчаса становится желто-зеленой до бесцветной. Если через последующие полтора часа раствор не потемнеет, разложение можно считать оконченным. В противном случае прибавляют еще немного хлората и нагревают.
2 Муть в фильтрате может окклюдировать ионы РЬ2+.
3 Появившаяся после экстракции муть не имеет значения.
4 Если предполагают присутствие в испытуемом растворе ионов Bi3+ или Т1+, то следует предварительно выделить их (см. стр. 292—293).
В а р и а нт [366]. Органическое вещество подвергают сухой минерализации. Метод пригоден также для определений свинца в твердых биологических материалах.
Определение металлов группы дитизона. Железо
319
Реактивы
Средство для озоления. Раствор 20 г Ca(NO3)2 • 5Н2О и 40 г A1(NO3)3 *9Н2О доводят до 100 мл водой.
Азотная кислота, 15 н. раствор.
Лимонная кислота СбНвО? • Н2О, 50 %-ный раствор, доведенный до pH 3,5—4,0 с помощью 14 н. раствора NH4OH.
Аммиак, аналогично описанию на стр. 318.
Цианид калия, аналогично описанию на стр. 318. Дитизон, аналогично описанию на стр. 318.
Ход определения. Выпаривают в чашке на водяной бане досуха 100 мл мочи и прокаливают до получения золы в печи при 500°. Затем смачивают сухое вещество 2—3 мл средства для озоления и прокаливают еще в течение 30 мин. до получения белой золы1.
Золу дважды выпаривают с азотной кислотой досуха порциями по 10 мл. Остаток извлекают водой, переводят в делительную воронку и разбавляют водой до 100 мл. После прибавления 10 мл раствора лимонной кислоты доводят аммиаком до pH 8,5. Охлаждают, прибавляют 5 мл раствора цианида и исчерпывающе экстрагируют ионы РЬ2+ раствором дитизона. Полученный органический экстракт затем подвергают операции, описанной на стр. 318 (раздел г, 7).
Примечание
1 Если зола получается недостаточно белой, следует добавить несколько миллилитров азотной кислоты и продолжить прокаливание.
в орга-
ЖЕЛЕЗО
Ионы Fe2+ реагируют с раствором дитизона ническом растворителе в пределах pH 7—9 с образованием однозамещенного дитизоната [5313]:
Ре1„д„. + 2H2Dzopr. Fe (HDz)2opr, + 2Нв+одн..
Дитизонат железа растворяется в четыреххлорпстом углероде и хлороформе с фиолетово-красной окраской [374]. Раствор быстро разлагается на воздухе, причем в щелочном растворе ионы Fe2+ под действием
320
Применение дитизона в количественном анализе
кислорода воздуха окисляются до Fe2+. Дитизонат железа стоек к 0,015 н. раствору аммиака, 10%-ному раствору тиосульфата натрия и 0,5 %-ному раствору цианида калия. Ионы Fe3+ не образуют дитизоната.
Максимум поглощения органического раствора дитизоната железа лежит приблизительно при длине волны 520 жц. Определение ионов Fe2+ в виде дитизоната не имеет аналитического значения.
Благодаря узким пределам pH, в которых протекает реакция между ионами Fe2+ и дитизоном, и малой устойчивости полученного дитизоната ионы Fe2+ мало мешают определению остальных металлов, реагирующих с дитизоном.
Большие количества ионов Fe3+ окисляют дитизон в зависимости от pH раствора более или менее быстро (см. стр. 141). Выпадающая в щелочном растворе гидроокись железа (III) окклюдирует или поглощает ионы других металлов, реагирующих с дитизоном. Поэтому следует удерживать ионы Fe3+ в растворе в виде тартратного, цитратного и других комплексов. Ионы [Fe(CN)6]3~ сильнее окисляют дитизон, чем ионы Fe3+.
Даусон [484] сообщает о желтом продукте неопределенного состава, образующемся при взаимодействии ионов Fe2+, а также Fe3+ с органическим раствором дитизона.
МАРГАНЕЦ
Ионы Мп2+ реагируют с раствором дитизона в хлороформе только в узких пределах [351, 422] pH около 10 с образованием однозамещенного дитизоната [5313]:
Мпводн. 2H2Dzopr. < — Мп (HDz)20pr. Ч-2НХдн.«
Дитизонат марганца растворяется в хлороформе с фиолетовой окраской раствора [374, 543] и на воздухе быстро разлагается вследствие окисления иона Мп2+.
Получение дитизоната марганца не имеет аналитического применения. Он почти не влияет на определение дитизонатов других металлов (см. стр. 141). Однако выпадающие гидроокиси марганца могут окклюдировать и адсорбировать ионы других металлов.
Определение металлов группы дитизона. Таллий
321
ТАЛЛИЙ
а) ОБЩИЕ СВЕДЕНИЯ
Ионы Т1+ образуют в щелочной среде с раствором дитизона в органическом растворителе однозамещенный дитизонат таллия [351], растворяющийся в органических растворителях с малиново-красной окраской раствора:
Т1водн. -j-H2DzOpr> <—- TlHDzOpr.Н^одн.* (I)
Предположение, что при pH 3—4 ионы Т13+ также образуют дитизонат [374, 5023], не было подтверждено. Так, в водном растворе нестойкие ионы Т13+ сначала окисляют дитизон. Образующаяся неустойчивая желтокрасная окраска вызывается смесью, состоящей из TIHDz и продуктов окисления дитизона.
рч
Рис. 40. Извлечение Т1+ в зависимости от pH раствора и природы органического растворителя (схематическое изображение).
При применении раствора дитизона в четыреххлористом углероде ионы Т1+ в водном растворе соответствующей концентрации образуют дитизонат в оптимальных условиях pH (5 н. раствор NaOH) только на 50% (см. рис. 40). Лишь после многократных встряхиваний с избытком раствора дитизона в четыреххлористом углероде наступает полное извлечение таллия.
При использовании хлороформного раствора дитизона можно извлечь при pH 11 —14,5 из водного
21 Зак. 2157.
322
Применение дитизона в количественном анализе
раствора соли таллия (I) соответствующей концентрации около 80% ионов Т1+ (рис. 40). Здесь также достигается количественное извлечение при применении избытка хлороформного раствора дитизона и многократного встряхивания.
Равновесие по уравнению (I) устанавливается очень быстро. Достаточно провести встряхивание в течение полминуты, чтобы в сильнощелочном растворе закончить полностью экстракцию TIHDz до того, как дитизон заметно разложится.
Реакция, протекающая по уравнению (I), не подавляется в обратном направлении, и поэтому раствор дитизоната одновалентного таллия в хлороформе можно разложить путем встряхивания с водным раствором. Это разложение сильно увеличивается с уменьшением pH (от pH < 11). Так, например, при встряхивании в течение нескольких минут с дистиллированной водой (pH около 6—7) наступает практически полное разложение TIHDz на ионы Т1+ в водном и дитизон в органическом слое. Разложение раствора дитизоната таллия в хлороформе проходит незначительно, если его встряхивать с водным раствором с pH > 11 и более высокой концентрацией дитизона.
Для извлечения и определения ионов Т1+ лучше всего служит раствор дитизона в хлороформе. В результате работы в щелочном растворе (pH > 11) избыточное количество дитизона почти количественно переходит в водную фазу и анализ сводится к определению по методу одноцветной окраски (ср. раздел б, 1, а также раздел 6,2, стр. 325). Для колориметрического или фотометрического определения пользуются или малиновокрасным раствором TIHDz в хлороформе, или образующимся при разложении последнего кислотой сине-зеленым раствором дитизона в хлороформе, или, наконец, водным раствором, содержащим избыточное количество дитизона, окрашенным в желтый цвет, свойственный ионам HDz".
При применении для экстракции ионов Т1+ большого избытка хлороформного раствора дитизона в испытуемом растворе с pH И —12 незначительное количество дитизона остается в органической фазе. Этот избыток
Определение металлов группы дитизона. Таллий 323 дитизона можно удалить, если органический слой промыть сильно подщелоченной водой или провести фото-метрирование при длине волны 605 жц. Таким образом анализ выливается в определение по методу смешанной окраски.
Кривая поглощения раствора дитизоната таллия в хлороформе (см. рис. 41) характеризуется максимумом поглощения при длине волны 505 жц. При длине волны 605 жц — максимуме поглощения раствора дитизона в хлороформе — поглощение дитизоната таллия не имеет значения для анализа.
Рис. 41. Кривые поглощения растворов TIHDz в хлороформе.
------25 мкМ раствор TIHDz;----- 250 мкМ раствор TIHDz; --------------------25 мкМ раствор H2Dz.
Раствор дитизоната таллия в хлороформе на затемненном дневном свету заметно не изменяется при хранении в течение получаса. При стоянии в темноте в течение 10 час. наблюдается едва заметное изменение раствора.
Влияние посторонних анионов. Ионы S2~ мешают. Ионы CN~ не мешают, если присутствуют даже в большой концентрации.
Цитрат незначительно подавляет экстракцию ионов Т1+ раствором дитизона в хлороформе, если присутствует в большой концентрации. Рекомендуется многократно экстрагировать таллий при pH 11 хлороформным раствором дитизона [4015].
21*
324
Применение дитизона в количественном анализе
Влияние посторонних катионов. Ионы Ag+, Hg2+ Pd2+, Au3+, Cu2+, Zn2+, Cd2+, Co2+ и Ni2+ не мешают определению в щелочной среде в присутствии достаточного количества ионов CN~ [374]. В присутствии больших количеств ионов Cd2+ таллий следует экстрагировать при очень высоком содержании ионов CN-и полученный хлороформный экстракт дитизоната таллия промыть щелочным раствором цианида. При этом происходит разложение одновременно образовавшегося дитизоната кадмия. При таком способе можно еще открыть 1 • 10-2% таллия в металлическом кадмии с погрешностью ±5% от его количества [4926].
Ионы Bi3+ мешают. Можно отделить еще 100-кратное количество висмута встряхиванием при pH < 7 с раствором дитизона или из общего экстракта дитизонатов таллия и висмута [TIHDz + Bi (HDz) з] промыванием буферным раствором с pH 3,4 и разложить только один дитизонат таллия [445]. В 10-кратном избытке ионы Bi3+ не реагируют с хлороформным раствором дитизона при pH > 12 (ср. рис. 39, стр. 289).
Ионы 1п3+ не мешают при pH > 11.
Ионы РЬ2+ мешают, так как одновременно с ионами Т1+ извлекаются из раствора, содержащего ионы CN". При работе в сильнощелочном растворе (pH > 14) 10-кратный избыток ионов РЬ2+ не мешает. В общем случае рекомендуется перед экстракцией раствором дитизона в хлороформе предварительно разделить ионы Т1+ и РЬ2+. Хорошее отделение ионов РЬ2+ достигается при извлечении хлорида (III) или бромида (III) таллия эфиром. Далее, возможно достаточное отделение ионов РЬ2+ в виде сульфата свинца при прибавлении этилового спирта [445].
Ионы Fe3+ особенно мешают в присутствии ионов CN". При большом содержании ионов Fe3+ испытуемый раствор доводят до pH >11 с помощью цитрата или тартрата, гидразина или гидроксиламина и сначала проводят грубую экстракцию ионов Т1+ 250 мкМ. хлороформным раствором дитизона. Выделенный в органическом слое дитизонат таллия разлагают кислотой и в полученном водном растворе определяют содержание таллия,
Определение металлов группы дитизона. Таллий
325
б) ОСНОВНЫЕ МЕТОДЫ ОПРЕДЕЛЕНИЯ
1. Визуальное колориметрическое определение по методу одноцветной окраски [4926]
Реактивы
Дитизон, 100 мкМ раствор в хлороформе, 1 мл =s 20,44 мкг Т1+.
Едкий натр, 2,5 н. раствор.
Тартрат натрия-калия NaKC4H40e • 4Н2О, 20%-ный раствор.
Цианид калия, 10%-ный раствор.
Эталонный раствор соли таллия, 25 мкМ раствор T1NO3, 0,1 н. по HNO3. 1 мл содержит 5,11 мкг Т1+.
Ход определения. К 10 мл испытуемого раствора в делительной воронке прибавляют 5 мл раствора тартрата, нейтрализуют едким натром и наконец прибавляют еще 10 мл последнего. После добавления 5 мл раствора цианида встряхивают с известным избыточным количеством раствора дитизона в течение 1 мин. Полученный органический экстракт красного цвета определяют ио методу стандартных серий.
Точность определения ±10%.
Вариант [4912]. Малиново-красный раствор дитизоната таллия в хлороформе встряхивают с 10 мл 2 н. раствора соляной кислоты; при этом дитизон выделяется в свободном состоянии. Колориметрируют по зеленой окраске хлороформного раствора дитизона.
2. Спектрофотометрическое определение по методу одноцветной окраски [5023]
Реактивы аналогичны описанным в разделе б, 1.
Ход определения аналогичен описанному в разделе б, 1.
Фотометрируют красный хлороформный раствор дитизоната таллия при длине волны 505 л/ц.
Точность определения ±3%.
Красный органический экстракт содержит большей частью малые количества свободного дитизона, показы
326
Применение дитизона в количественном анализе
вающие незначительное поглощение при длине волны 505 лф. Количественно это поглощение определяют фото-метрированием при длине волны 605 лф и вычитают из общего содержания.
в) ПРИМЕНЕНИЕ
До настоящего времени отсутствуют точные описания методов определения таллия в виде дитизоната. Однако эти почти селективные и простые способы определения оказываются пригодными во многих случаях.
Об определении ионов Т1+ в биологическом материале (внутренние органы) были сделаны указания Камерма-ном [445].
Бамбах [4015] определяет полуколичественно сумму ионов РЬ2+ и Т1+ в качестве недопустимых ядов в лекарствах.
Была показана возможность отделения ионов Т1+ в виде дитизоната от ряда других катионов, в особенности от ионов Fe3+ и Си2+: разлагают извлеченный дитизонат таллия, окисляют в полученном растворе ионы Т1+ до Т13+, осаждают последние йодидом калия и определяют выделившийся свободный йод. Йодометрическому определению не мешает присутствие малых количеств ионов РЬ2+ и Bi3+. Так, например, Хэддок [3513] определяет ионы Т1+ в присутствии большого числа других ионов металлов; при этом он выделяет их из щелочного раствора, содержащего цианид и цитрат (pH около 9,6), экстракцией избыточным количеством 0,005 М раствора дитизона в хлороформе. Аналогично Сил и Петерсон [4919] полуколичественно выделяют 10~3% таллия из руд и пыли в воздухе *.
* Кларк и Куттитта [5830] разработали метод фотометрического определения таллия, основанный на экстрагировании дитизоната его хлороформом, позволяющий определить от 1 до 100 мкг Т1. — Прим. ред.
Глава 4
ПРИМЕНЕНИЕ ДИТИЗОНА
В КАЧЕСТВЕННОМ АНАЛИЗЕ* [ЗЗ4, 34]
Цветные реакции и реакции с выделением хлопьевидных осадков дитизонатов благодаря своей исключительной чувствительности служат для открытия весьма незначительных количеств ионов металлов. Это открытие осуществляется почти селективно в большинстве практических случаев путем соответствующего проведения реакции. При этом в качестве экстрагента служит дитизон как при идентификации микроколичеств, так и при определении следов.
Методы открытия большей частью идентичны применяемым при количественных определениях (ср. гл. 3). Лишь в некоторых случаях привлекают методы получения двузамещенных солей и реакции с выделением хлопьевидных осадков, если они обладают лучшей способностью к разделению. Предложен микрокристалло-скопический метод открытия серебра, ртути (II) и свинца пиридиновым раствором дитизона [448].
При применении дитизона в качестве реактива для микроопределений в большинстве реакций открываемый минимум металлов, реагирующих с дитизоном, колеблется в пределах 0,1—0,01 мкг, а предельное разбавление составляет от 1 : 5 • 105 до 1:6* 106. Пользуясь методом обогащения с помощью экстракции (стр. 61), можно предельное разбавление раствора снизить до 1 :5-107.
* Поскольку в предшествующей главе описан количественный анализ, в этой главе оказалось возможным дать краткое изложение качественного анализа, ограничившись описанием типовых методов.
328
Применение дитизона в качественном анализе
При регулировании pH раствора (стр. 131), применении маскирующих веществ (стр. 134), а также использовании различий в сродстве металлов к дитизону (стр. 129) можно сильно ограничить многозначимость реакционной способности дитизона. Часто достигается большее предельное отношение, чем 1 : 105. В этом случае следует считаться с определенным уменьшением чувствительности реакции, что находит свое отражение в открываемом минимуме и предельном разбавлении.
В качестве реагента целесообразно пользоваться 50— 100 мкМ раствором дитизона в четыреххлористом углероде. Чтобы не затруднить расшифровку окрашенных растворов, следует применять раствор дитизона, свободный от продуктов окисления и всегда приблизительно одинаковой концентрации. Испытуемый раствор не должен содержать окислителей.
При наличии окислителей возможно образование желтого продукта окисления дитизона, что ошибочно можно принять как признак присутствия в растворе ионов серебра или ртути. Действие окислителей предварительно устраняют с помощью соответствующих восстановителей и выпаривания испытуемого раствора на водяной бане. Пробу на присутствие окислителей проводят согласно описанию на стр. 140. Если дитизон присутствует в недостатке, то получаемые оттенки зависят от концентрации раствора дитизона и толщины его слоя. При избытке дитизона и pH < 8 получается смешанная окраска вследствие наложения окраски свободного дитизона.
Открытие можно проводить с помощью экстракции тсследуемого раствора объемом 0,5 мл в пробирке, в трубочке для колориметрирования или в маленькой дели-‘ельной воронке. Для отделения органического экстракта [ последующей его обработки для дополнительного ис-[ытания особенно удобна делительная воронка.
При работах с микроколичествами наиболее чув-твительной является капельная проба в маленькой робирке [311, ЗЗ4]. Открываемый минимум отдельных лементов, если нет других указаний, отвечает капель-ой пробе.
Применение дитизона в качественном анализе
329
Пробирка для пробы представляет собой реакционный сосуд внутренним диаметром около 5 мм и длиной около 50 мм с пришлифованной пробкой. В эту пробирку вносят одну или несколько капель (около 0,05 мл) испытуемого раствора, прибавляют необходимые буферный и маскирующий растворы, вносят одну или несколько капель (около 0,05 мл) раствора дитизона и сильно встряхивают в течение около 2 мин. Изменение окраски органического слоя или выпадение хлопьевидного осадка и его окраска указывают на присутствие или отсутствие искомого катиона. Удобно проводить наблюдения с помощью лупы.
Менее чувствительно проведение капельного анализа на капельной пластинке из фарфора или стекла [379]. Для лучшего перемешивания фаз пользуются стеклянными палочками. Испаряющийся органический растворитель прибавляют по каплям.
При нанесении пятен на фильтровальную бумагу вследствие меньшей чувствительности определения пользуются более концентрированными (около 250 мкМ) растворами дитизона [31Ч (ср. также с хроматографическим адсорбционным анализом, стр. 371).
Карлтон и Брэдбери [546] проводят с большой чувствительностью открытие элементов в нафталиновом сплаве: они растворяют 16 мг дитизона в 75 мл хлороформа, вносят 66 г нафталина и выпаривают растворитель. Выпаривают каплю солянокислого испытуемого раствора на капельной пластинке, прибавляют несколько зернышек реагента, выдерживают при 90° и наблюдают за 'изменением окраски.
Так называемые «реакции на поверхности» [ЗЗ5, 343] с дитизоном позволяют во многих случаях проводить «без разложения» химические испытания твердых веществ. С этой целью твердое вещество оставляют с раствором дитизона на некоторое время или встряхивают. При селективном проведении реакции можно добавить небольшое количество маскирующего вещества или обрабатывать экстракт водным маскирующим раствором для дополнительной идентификации.
Если при анализах сохранять сколько-нибудь постоянными концентрации и объемы реагентов, а также технику
330
Применение дитизона в качественном анализе
определения, можно определить количество искомого металла или по крайней мере порядок величины *.
Ниже описывается применение дитизона для открытия отдельных металлов, а также и при групповых реакциях, при которых приводится ход анализа.
ОТКРЫТИЕ ОТДЕЛЬНЫХ КАТИОНОВ
Серебро
Метод открытия ионов Ag+ состоит в получении AgHDz [ЗЗ4] золотисто-желтого цвета при встряхивании кислого испытуемого раствора или в образовании фиолетово-красных хлопьев Ag2Dz [25, 29, 302, 311, 379] в щелочной среде.
Открытию в виде AgHDz при pH около 4 в присутствии ионов CN" мешают только ионы Hg2+.
Посторонние катионы —— Hg2 + a Си2 + б Bi3 i- Zn2 _l Cd2 + Со2 + Ni2 + Pb2 +
Открываемый минимум, мкг в 0,04 0,6 0,6 0,1 0,1 0,1 0,08 0,1
Предельные отношения 1: — —- 1000 5750 74 000 53 000 45 000 50 000 62 000
Примечания
а Отделение дитизоната серебра от Hg (HDz)2, извлеченного совместно с ионами Ag+, возможно при встряхивании органических экстрактов с соляной кислотой (0,5 н.). Если присутствует AgHDz, он разлагается и выделяется эквивалентное количество дитизона зеленого цвета; экстракт меняет свою окраску.
& При обогащении путем экстракции удается открыть 0,6 мкг серебра в присутствии 50 мг меди (II) и в отсутствие ионов С№. После 1—2 минутного встря хивания 25 мл испытуемого раствора СС1 t-слой приобретает красновато-коричневую смешанную окраску вместо желтой. Коричневый оттенок предполагается как следствие наличия AgHDz. О наличии AgHDz судят по изменению окраски отделенного слоя четыреххлористого углерода при промывании его соляной кислотой (0,5 н.). Коричневый оттенок окраски слоя исчезает, и появляется фиолетовая окраска, характерная для Си (HDz)?.
в Открываемый минимум составляет 0,02 мкг в нафталине [54е].
* Майоров Н. Ф. [5537] предложил полуколичественный метод капельного анализа на цинк проб при поисковых геологических работах в полевых условиях. Дифференциация определяемых содержаний цинка основана на гашении реакционного пятна раство-
Открытие отдельных катионов
331
В растворе едкого натра (1,25 н.) образуются фиолетово-красные хлопья Ag2Dz. Только лишь при очень большом избытке дитизона может в щелочном растворе получаться также AgHDz желтого цвета *.
Посторонние катионы —— Hg2 + Pd2 + Cu2 +
Открываемый минимум, мкг 0,3 1 1 0,9
Предельное отношение 1: 1000 1200 3300
Формой открытия ионов Hg2+ является оранжевожелтый Hg(HDz)s, извлекаемый из кислого раствора (pH < 0) [ЗЗ4, ЗЗ5, 343], или фиолетово-красный HgDz, извлекаемый из щелочного раствора (pH > 7) [25, 29]. Реакция одновалентного иона Hg+ не представляет интереса.
Открытию иона Hg2+ в виде Hg(HDz)2 при pH < 0 мешают ионы Pd2+ и Аи3+ в том случае, если ионы Ag+
ром дитизона различной концентрации. На листок фильтровальной бумаги наносится капля кислотной вытяжки пробы. После обработки аммиаком на каплю вытяжки наносится капля раствора дитизона определенной концентрации. Появление малинового пятна указывает на присутствие в пробе цинка. Затем через каждые 15— 20 сек. на реакционное пятно наносятся следующие капли дитизона той же концентрации до тех пор, пока малиновый цвет пятна не перейдет в зеленый или темно-зеленый. Если при данной концентрации гашения пятна не происходит, проводят анализ с раствором дитизона большей концентрации. Число капель реактива служит показателем количества цинка в вытяжке. Содержание цинка определяют по эталонным графикам. — Прим. ред.
* Гёке [5831] описал метод открытия серебра экстрагированием раствором дитизоната меди в четыреххлористом углероде. В присутствии Ag+ фиолетовая окраска переходит в желтую (при малых количествах Ag+— в оранжево-фиолетовую). Метод позволяет открывать Ag+ при его содержании > 10~5%. Катионы, образующие более прочные дитизонаты, чем дитизонат меди, мешают обнаружению серебра. — Прим. ред.
332
Применение дитизона в качественном анализе
маскируются ионами С1~ При pH около 4 в присутствии ионов CN~ и SCN~ мешают лишь большие количества ионов Си2+.
Открываемый минимум: 0,25 мкг; предельное отношение в присутствии ионов Си2н равно 1 :20 000.
Согласно Карлтону и Брэдбери [546], открываемый минимум в нафталине составляет 0,01 мкг.
Ваночи [481] находит специфическим и удобным метод открытия ионов Hg2\ заключающийся в предварительной перегонке ртути из жидкой смеси из НС1 + НВг для отделения от балластных материалов.
Уэст и Дафф [5523] вначале экстрагируют ионы Hg2+ из раствора трихлоруксусной кислоты /Y-бутилацетатом а затем объединяют органические экстракты с хлороформным раствором дитизона на капельной пластинке.
Штейгер [378] идентифицирует ионы Hg2+ в дифенил-ртути путем растирания с твердым дитизоном, в окиси ртути и даже сульфиде ртути — при встряхивании твердого вещества с раствором дитизона в органическом растворителе.
Открытие в виде HgDz проводится преимущественно в растворах, содержащих едкий натр. Открываемый минимум — около 5 мкг.
Штейгман [4311] описал специфический капельный метод открытия 0,2 мкг ртути на тонкой мембране из ацетилцеллюлозы.
Установлено, что очень малые количества ионов Hg2+ в присутствии избытка дитизона реагируют в щелочном растворе с образованием Hg(HDz)2, причем появляется смешанная окраска (оранжево-желтая + фиолетовая).
Палладий
Формой открытия ионов Pd2+ является экстрагируемый четыреххлористым углеродом из кислого раствора (pH около 4) дитизонат палладия (бледно-зеленый) и в случае высокой концентрации частично хлопьевидный дитизонат палладия (коричнево-фиолетовый), представляющий, по-видимому, смесь из Pd(HDz)2 и PdDz.
В хлороформе дитизонат палладия растворяется
Открытие отдельных катионов
333
лучше. Реакция протекает довольно вяло, и поэтому следует проводить экстракцию в течение 1—2 мин.
Открытию ионов Pd2+ при pH около 4 мешают только ионы Аи3+. Реакция прекращается в присутствии ионов CN", а также SsOj”. В щелочном растворе появляется фиолетовая окраска, частично переходящая в водный слой.
Посторонние катионы — Ag+ Hg2+ Au3 + Cu2+
Открываемый минимум, мкг 0,4 2 2 — 0,8
Предельное отношение 1 : ——• 3000 3500 "" 5000
Золото
Метод открытия ионов Аи3+ состоит в экстрагировании их из кислого раствора (pH около 4) в виде дитизоната золота четыреххлористым углеродом (золотисто-желтого) и частично в виде хлопьев (желто-коричневых) в случае высокой концентрации, по-видимому, состоящих из смеси Au (HDz)з и Au2Dzs. Открытию мешают ионы Pd2+.
Коричневые хлопья растворяются в хлороформе. Ионы Аи3+ маскируются ионами CN- в 0,5 н. растворе H2SO4. Напротив, в более концентрированном растворе кислоты ионы Аи3+ не маскируются. Ионы J- маскируют ионы Ag+ и Hg2+.
Посторонние катионы - Ag+ Hg2 + Pd2 + Cu2+
Открываемый минимум, мкг 0,05 1 1 0,2
Предельное отношение 1 : 1200 2000 —— 2000
Медь
Методы открытия ионов Си2+ состоят в экстракции их из кислого раствора (pH около 4) в виде Си (HDz) 2 красно-фиолетового цвета [ЗЗ4] или из щелочного раствора— в виде желто-коричневого CuDz [25,29, 302, 311].
334
Применение дитизона в качественном анализе
Открытие в виде Си (HDz)2 проводят при pH около 4, и поэтому реакция протекает довольно медленно, вследствие чего раствор приходится встряхивать в течение 1 мин. Присутствующие ионы Ag+, как и Hg2+, маскируются ионами J".
Посторонние катионы — Ag+ а б > Hg2 + б Pd2 + В Au3 + В
Открываемый минимум, мкг 0,008 0,2 0,06 0,4 0,4
Предельное отношение 1: —— 25 000 60 000 100 10 000
Посторонние катионы Bi3 + Zn2 + Со2 + Ni2 + Fe3 +
Открываемый минимум, мкг 0,08 0,015 0,015 0,015 0,04
Предельное отношение Г. 21000 370 000 250 000 250 000 12 000
Примечания
а Ионы Ag4- можно также замаскировать ионами SC№, причем ионы Си24* реагируют с образованием соединения коричневого цвета. К одной капле испытуемого раствора прибавляют несколько капель серной кислоты (1 н.) и роданида калия (10%-ного) до растворения образовавшегося осадка и затем встряхивают с 2—3 каплями раствора дитизона в четыреххлористом углероде.
К 1 капле испытуемого раствора (pH около 4) прибавляют 0.2 мл раствора йодида калия (10%-ного) и встряхивают с 1—2 каплями раствора дитизона.
в При открытии ионов Cu2 -i- в виде Си (HDz)2 в присутствии ионов Au3 % Ag-1" и Pd2 + к одной капле испытуемого раствора прибавляют 0,3 мл цианида или роданида калия (5%-ного), нейтрализуют аммиаком, затем слабо подкисляют серной кислотой (1 н.) и встряхивают с 2—3 каплями раствора дитизона.
При открытии в щелочном растворе (pH около 9) каждую каплю испытуемого раствора обрабатывают в присутствии 0,2 мл раствора тартрата (50%-ного).
Висмут
Открытие ионов Bi3+ основано на извлечении их из раствора с pH 4—10 в виде Bi (HDz)3 красно-оранжевого цвета [343]
При pH 7—9 в присутствии ионов CN~ и после окисления ионов Sn2+ в Sn4+ мешают, кроме ионов РЬ2+, еще ионы Т1+, если они находятся в большом количестве. Из
Открытие отдельных катионов 335
влеченный TIHDz совместно с дитизонатом висмута разлагают промыванием водным раствором с pH около 7. Совместно извлеченный Pb(HDz)2 разлагают затем при встряхивании с буферным раствором pH 3—5.
Посторонние катионы Zn2 + Cd2 + Ni2 + Pb2 +
Открываемый минимум, мкг 0,02 0,07 0,05 0,1 0,05
Предельное отношение 1: —- 28 000 140 000 40 000 240 000
Посторонние катионы — Ag + Cu2 + Zn2 + Pb2 + T1 +
Открываемый минимум, мкг 0,3 0,3 0,4 0,3 — 0,3
Предельное отношение 1: ' — 10 000 2 500 1 800 —— 100
Карлтон и Брэдбери [546] сообщают об открытии 0,004 мкг висмута в сплаве дитизона с нафталином: каплю, содержащую ионы Bi3+, выпаривают на стеклянной пластинке при 90°, к сухому остатку прибавляют кристаллик сплава дитизона с нафталином (10~3 Л4) и выдерживают при 100°. Ионы Bi3+ дают отличную красную окраску. Исследовалось мешающее влияние прежде всего ионов Ag+, Hg2+, Sn4+(?), Cd2+, а также Zn2+, Coi2+, Pb2+, Sb3+, Mn2+, Fe3+, Ce4+ и Mg2+ (?).
Индий
В качестве метода открытия ионов 1п3+ может служить экстракция их из раствора с pH 5—6 в виде In(HDz)з малиново-красного цвета.
Этот метод открытия мало исследован. Так как ионы CN- не препятствуют экстракции дитизоната индия, то во многих случаях можно достигнуть требуемой селективности определения.
336 Применение дитизона в качественном анализе
Олово
Ионы Sn2+ можно извлечь при pH 5—9 в виде Sn(HDz)2 красного цвета, однако это соединение легко окисляется на воздухе. Поскольку экстракции ионов Sn2+ в присутствии ионов CN- мешают только ионы Bi3+, In3+ и Pb2+ и в больших количествах Т1+, этот метод не пригоден для открытия следов.
Согласно Карлтону и Брэдбери [546], в сплаве с нафталином могут реагировать с дитизоном также ионы Sn4+ (?). Приведенный ими открываемый минимум составляет 0,004 мкг Sn.iv.
Цинк
Метод открытия ионов Zn2+ состоит в извлечении их из нейтрального раствора в виде пурпурно-красного Zn(HDz)2 [25, 29 , 302, 311, 341, 361]. При pH 4,5—5 в присутствии ионов CN-, а также 520з- можно практически селективно открывать ионы Zn2+.
Посторонние катионы — Ag+ Hg+ Pd2+ Au3 +
Открываемый минимум, мкг 0,025 а 1 1 2 2
Предельное отношение 1: — 15 000 7000 5000 5000
Продолжение
Посторонние катионы Си2 + В13 + Cd2+ Со2 + Ni2 + РЬ2+
Открываемый минимум, мкг 1 2 1 2 2 1
Предельное отношение 1: 5000 4000 6000 10000 10 000 12 000
Примечание
а Открываемый минимум в капилляре равен 0,001 мкг [31-],, в пробирке—0,5 мкг [341].
Открытие отдельных катионов
337
При обогащении экстракцией предельное разбавление составляет около 1:5*107. Следует учитывать высокую распространенность цинка.
Ринеккер и Шиф [ЗЗ1], Деккерт [355], а также Год и Науман [391] пользуются раствором с pH > 11; при этом дитизонат цинка красного цвета находится в водном растворе в виде тонкой суспензии. Этот способ мало чувствителен и не имеет практического применения [374,375]. По Ваночи [4217] можно открыть еще 0,02 мкг цинка после добавления дитизона по красной окраске органического и водного слоев в присутствии аммиака, сульфида натрия и четыреххлорнстого углерода.
При обычном способе работы к 0,1—0,5 мл испытуемого раствора в делительной воронке добавляют 20%-ный раствор ацетата натрия до тех пор, пока pH раствора не будет равен 4—5, после чего добавляют 0,3 мл раствора тиосульфата натрия (50%-ного) и 0,3 мл раствора цианида калия (10%-кого). В случае надобности вновь устанавливают pH испытуемого раствора с помощью кислоты, затем прибавляют 0,5—1 мл раствора дитизона и встряхивают.
Если в растворе присутствует большое количество ионов Cd2+, то в органический экстракт переходит некоторое их количество в виде розово-красного Cd (HDz)2. Последний встряхивают с сероводородной водой или с 0,05 н. раствором сульфида натрия, и Cd (HDz)2 быстро разлагается, в то время как Zn(HDz)2 в течение довольно продолжительного времени не изменяется.
В обычном классическом способе разделения катионов—после отделения выпавших сульфидов из раствора, подкисленного минеральной кислотой, — открытие ионов Zn2+ с помощью дитизона является специфическим *. Доббинс и Норман [508] вместо капельного метода или открытия цинка в пробирке с помощью органического
* Орлова Л. М. (В. Н. Алексеев, Курс качественного химического полумикроанализа, М., Госхимиздат, 1958, стр. 316) разработала следующий метод дробного открытия цинка: 3 капли исследуемого раствора обрабатывают в микротигле перекисью натрия, затем каплю полученного раствора вместе с осадком наносят на фильтровальную бумагу. Водянистую зону обводят по периферии капилляром с раствором дитизона. По появлению малиново-красного кольца судят о наличии цинка. — Прим. ред.
22 Зак. 2157.
338
Применение дитизона в качественном анализе
раствора дитизона рекомендуют наносить на бумагу, пропитанную дитизоном, каплю слабо подщелоченного (pH 8—10) испытуемого раствора. Еще 20 мкг цинка в 1 мл можно обнаружить по красной окраске, появляющейся через 1 мин. Позже появляется оранжевая окраска, характерная для продукта окисления дитизона. «Дитизоновую бумагу» получают погружением фильтровальной бумаги в раствор дитизона в ацетоне и последующим высушиванием. Она сохраняется в течение более восьми месяцев.
Фишер [343] встряхивал твердые сульфат, сульфид, окись и карбонат цинка с раствором дитизона и получал Zn(HDz)2. Штейгер [378] идентифицировал окись цинка по получающейся розово-красной окраске, появляющейся при растирании твердого вещества с твердым дитизоном в ступке. Кутцельниг [506] растирал металл или твердую соль металла с твердым дитизоном или спрессовывал бумагу, пропитанную дитизоном, с высушенной на бумаге солью металла и нагревал в течение 10 мин. при приблизительно 120°. В другой работе [513] рекомендуется для быстрого разделения металлических цинка и кадмия предварительно смочить органическим растворителем бумагу, пропитанную дитизоном. Красная окраска указывает на присутствие цинка, оранжевая — на кадмий.
Кадмий
Способ открытия ионов Cd2+ состоит в получении Cd(HDz)2 при встряхивании с приблизительно 1,2 н. раствором по едкому натру [ЗЗ4, 343]. Открытие кадмия можно проводить в ряде случаев довольно селективно.
Посторонние катионы —— Ag+ а Hg2+ а Pd2+ а Аи3+ а Си2+ 6
Открываемый минимум, мкг 0,01 д 0,05 0,04 0,4 0,4 0,3
Предельное отношение Г. *— 60 000 I 90 000 1 5000 5000 25 000
Открытие отдельных катионов
339
Продолжение
Посторонние катионы Bi3 + Zn2+ “ Со2 + г Ni2'*- г РЬ2 +
Открываемый минимум, мкг 0,03 0,8 0,4 0,2 0,04
Предельное отношение 1: 110 000 23 000 5000 5000 130 000
Примечания
а Открытие проводят в присутствии 0,25 мл раствора солянокислого гидроксиламина (50%-ного); при этом после прибавления "щелочи выпадают благородные металлы.
6 Испытуемый раствор выпаривают на песчаной бане с несколькими каплями фосфорноватистой кислоты (50 %-ой) до появления пламени от горящего фосфористого водорода. Раствор разбавляют водой, фильтруют, сильно подщелачивают едким натром и проверяют раствором дитизона присутствие ионов Cd2 + . При восстановлении одновременно выпадают в осадок упомянутые в примечании «а» благородные металлы.
в Открытие проводят с 5—6 мл испытуемого раствора в цилиндре для смешивания. После прибавления 3—4 мл едкого натра (2,5 н.) и 0,5 мл раствора тартрата (20%-ного) встряхивают с 2 мл раствора дитизона. Красная окраска слоя четыреххлористого углерода указывает на присутствие Cd (HDz)?.
г На одну каплю испытуемого раствора должно приходиться 0,2 мл раствора тартрата (50%-ного), 0,3 мл раствора хлорида олова (II) (10%-ного) и 1 мл раствора едкого натра (2,5 н.).
д Открываемый минимум в нафталине составляет 0,02 мкг [54г>].
Кобальт
Способы открытия ионов Со2+ состоят в получении красно-фиолетового Со (HDz)2 при встряхивании в растворе с pH 5—9 [343] или CoDz при встряхивании в растворе с pH > 12.
При pH 5—6 (открываемый минимум в пробирке 0,25 мкг) и в присутствии ионов 320з” мешают ионы Zn2+ а также присутствующие в умеренном количестве ионы Pd2+ и Ni2+. Окраску Со(HDz)2 можно отличить от окраски Zn(HDz)2 по большей стойкости первой к раствору сернистого аммония [361]. Образовавшийся Co(HDz)2 в течение длительного времени поразительно стоек в 6 н. растворе НС1, а также в растворе цианида калия.
Открытие кобальта в виде CoDz проводят в присутствии хлорида олова. Мешают благородные металлы, ионы Cu2+, Cd2+ и Т1+.
22*
340
Применение дитизона в качественном анализе
Кроме указанных выше способов, возможно открытие кобальта в водно-щелочном растворе [28] по фиолетовой окраске, переходящей в серую. Открываемый минимум равен 0,4 мкг. Мешают ионы Ag+, Hg2+, Pd2+, Au3+ и Cu2+ [ЗЗ1]. Предельное отношение в присутствии ионов Ni2+ составляет 1 : 103, в присутствии ионов Zn2+— 1 : 105.
Никель
При реакции извлечения ионов Ni2+ органическим раствором дитизона при pH 5—10 получается Ni(HDz)2 коричнево-фиолетового цвета. Эта реакция не имеет практического применения.
Свинец
Открытие ионов РЬ2+ состоит в извлечении их из раствора с pH 8—11 в виде Pb(HDz)2 карминово-красного цвета [25, 29, 302, 311, ЗЗ4].
Открытию при pH раствора 8—11 в присутствии ионов CN- (ионы Sn2+ предварительно следует перевести в ионы Sn4+) мешают только ионы Bi3+ и Т1+. Следует принимать во внимание высокую распространенность свинца.
Посторонние катионы — Ag+ Au3 + Cu2+ Bi3+ a Zn2 + Cd2 + Ni2 + T1+6
Открываемый минимум, мкг 0,1 0,2 0,1 0,1 2,5 0,1 0,1 0,1 1
Предельное отношение 1: —- 58 000 36 000 18 000 400 11 700 16 000 16 000 4000
Примечания
а Совместной экстракции с ионами Bi3+ можно помешать, если проводить реакцию в растворе с pH 11 — 12.
0 Также вряд ли будут соэкстрагироваться большие количества ионов Т14’ при pH раствора 6—7. При промывании экстракта четыреххлористого углерода содержащего дитизонаты свинца и таллия, водным растворохм с pH около 7 разлагается только дитизонат таллия.
Открытие отдельных катионов
341
При соприкосновении металлического свинца с раствором дитизона в четыреххлорпстом углероде появляется красная окраска, не исчезающая при промывании экстракта четыреххлористого углерода раствором цианида калия (5%-ным).
При погружении образца латуни (с содержанием свинца от 0,01 до 1%) на 20 мин. в раствор дитизона в четыреххлористом углероде можно по оттенкам красного цвета определить относительное содержание свинца. Аналогично реагирует свинец в оловянном припое, свинцовистой бронзе, алюминии (0,3% РЬ), а также почти во всех твердых солях свинца [343].
Штейгер [378] наносит на фильтровальную бумагу каплю бензола, содержащего тетрафенил- или тетраэтилсвинец, быстро облучает ультрафиолетовым светом, прибавляет каплю раствора цианида калия (1%-ного) и, наконец, каплю раствора дитизона в четыреххлористом углероде. Красная окраска пятна указывает на присутствие Pb(HDz)2. В виде варианта применяется капельная проба на поверхности воды.
Таллий
Метод открытия ионов Т1+ состоит в получении экстракцией при pH раствора > 14 малиново-красного TIHDz. Этот способ открытия до сих пор мало изучен. Открываемый минимум около 0,1 мкг.
В 5 н. растворе едкого натра, содержащем ионы CN”, мешают только большие количества ионов РЬ2+. При промывании органического экстракта, содержащего дитизо-наты таллия и свинца, раствором смеси цианида калия и едкого натра (pH > 14) разлагается преимущественно дитизонат свинца. В качестве растворителя предпочитают хлороформ вместо четыреххлористого углерода. Следует пользоваться хлороформным раствором дитизона с концентрацией, превышающей 100 мкМ*.
* Браун и Керк [5643] применяли дитизон для идентификации тяжелых металлов при качественном анализе небольших количеств металлов и сплавов электрорастворением и электрофорезом. — Прим. ред.
342
Применение дитизона в качественном анализе
ХОД КАЧЕСТВЕННОГО АНАЛИЗА С ПОМОЩЬЮ ГРУППОВЫХ РЕАКЦИЙ
Ввиду многообразной реакционной способности дитизона представляется возможным попользовать последний в качестве группового реагента.* Это рекомендуется главным образом в микроанализе, например при таких разбавлениях, при которых обычно применяемые аналитические реагенты дают ненадежные результаты. Однако и в микроопределениях можно упростить ход анализа с помощью дитизона. Так, например, возможно с помощью одной или небольшого числа реакций высказать суждение о присутствии или отсутствии целых групп металлов и таким образом быстро получить представление о составе или наличии примесей в производственной пробе или в соединении.
В практике оказались пригодными четыре главные группы специфических реакций [343, 404, 462]:
I группа. Реакции в присутствии минеральных кислот (Pd2+, Au3+, Hg2+, Ag+, Cu2+).
II группа. Реакции в присутствии уксусной кислоты (Pd2+, Zn2+, Со2+, Ni2+, [Cd2+, Sn2+]).
Ill группа. Реакции в присутствии щелочей (Ag+, Hg2+, Pd2+, Au3+, Cu2+, Co2+, Ni2+, Cd2+ [Zn2+, Tl+]).
IV группа. Реакции в присутствии цианида (Pb2+, Bi3+, Tl+, Sn2+ [In3+]).
Кроме анализа, предложенного Фишером и Леопольди и в значительной степени принятого Меснардом [441], рекомендуются еще частично отличающиеся пути разделения.
Лардера и Мори [5515] предлагают ход разделения большого числа металлов, определяемых после минерализации синтетических волокон и смол. При этом открываются 10 металлов, реагирующих с дитизоном: серебро, ртуть, медь, висмут, цинк, кадмий, кобальт, никель, свинец и таллий. Их выделяют дитизоном и идентифицируют с помощью других веществ.
Камерман [4511] анализировал органические экстракты ряда ядов: он разделял или идентифицировал ионы Bi3+, Sn2+, Zn2+, Pb2+ и Tl+ с помощью дитизона.
Для проведения групповых реакций вносят несколько
Ход качественного анализа с помощью групповых реакций 343
миллилитров испытуемого раствора в делительную воронку, соответствующим образом обрабатывают (установка определенного pH, маскирующие вещества) и затем встряхивают с раствором дитизона.
Отрицательный результат данной групповой реакции большей частью сразу показывает отсутствие принадлежащих к этой группе металлов. Если групповая реакция дает положительную реакцию по изменению окраски раствора дитизона, то большей частью можно судить о присутствии определенных металлов по окраске экстракта или выпадению хлопьевидного осадка. Последующую расшифровку можно сделать при помощи дополнительных реакций с полученными органическими экстрактами или водными фазами.
Присутствие или отсутствие ионов Ag+, Hg2+, Zn2+, Pb2+, а затем Cu2+ в отсутствие ионов Pd2+ можно установить с помощью одного дитизона. О присутствии или отсутствии ионов Pd2+, Au3+, Bi3+, (In3+),Sn2+, Cd2+, Co2+, Ni2+ и Tl+ можно сделать с достаточной осторожностью заключение большей частью в зависимости от условий определения.
Металлы, присутствующие в выделенных групповых экстрактах, можно удовлетворительно идентифицировать дополнительными способами (например, микрокристал-лоскопические реакции [544]) после разложения или разрушения дитизона.
Чтобы приблизительно определить концентрацию искомых металлов, рекомендуется проводить групповые реакции с испытуемыми растворами с различной степенью разбавления. Для «макроанализа» испытуемый раствор сильно разбавляют рассчитанным по дитизону количеством воды или одновременно обрабатывают более концентрированным раствором дитизона.
Испытуемый раствор не должен содержать веществ, окисляющих дитизон (ср. стр. 328).
ГРУППА I. РЕАКЦИИ В ПРИСУТСТВИИ МИНЕРАЛЬНЫХ КИСЛОТ
Реакционноспособные ионы расположены в порядке их сродства к дитизону (см. табл. 14, стр. 130): Pd2+, Au3+,
344
Применение дитизона в качественном анализе
Hg2+, Ag+ и Cu2+. Присутствующие в растворе ионы Pt2+ следует предварительно перевести в Pt4+.
Открываемый минимум в микрограммах на 1 мл раствора дитизона: Pd : 25; Ан3+ : 3; Hg2+ : 15; Ag+ : 3; Cu2+ : 3.
Реактивы
Дитизон, 100 мкМ раствор в четыреххлористом углероде.
Серная кислота, 1 н. раствор.
Аммиак, 2 н. раствор.
Соляная кислота, 0,5 н. раствор.
Индикаторная бумага, лакмусовая или аналогичная ей.
Ход определения. К 5 мл испытуемого раствора после нейтрализации прибавляют 2 мл серной кислоты, переносят в делительную воронку и прибавляют 5 мл раствора дитизона. Сильно встряхивают несколько раз и после разделения слоев наблюдают характерную окраску слоя четыреххлористого углерода. В табл. 18 приведены получающиеся окраски и их расшифровка. Если по окраскам невозможно судить о наличии тех или иных элементов, то следует (согласно разделу «Дополнительные испытания») отделить в делительной воронке органический экстракт и снова обрабатывать его или водный слой. В отдельных случаях дополнительно или вместо расшифровки окраски слоя четыреххлористого углерода пользуются окраской хлопьевидного осадка на границе фаз для установления присутствующих элементов.
Дальнейшие испытания
а) Слой четыреххлористого углерода тщательно отделяют и водный раствор подготавливают для испытаний по группе II.
б) Последующее открытие ионов Си2+ еще раз проводят по группе III, 3 (см. табл 22, стр. 351).
в) В исследуемом растворе можно дополнительно проводить отдельное открытие ионов Си2+ (стр. 333).
В присутствии ионов Ag+ и Hg2+ к подготовленному для анализа по группе I испытуемому раствору при
Таблица 18
I ГРУППА. РЕАКЦИИ В ПРИСУТСТВИИ МИНЕРАЛЬНЫХ КИСЛОТ
№ Окраска слоя четыреххлористого углерода Окраска хлопьевидного осадка Присутствие Отсутствуют безусловно Отсутствие доказательств относительно Дальнейшие испытания
безусловное возможное
1 Зеленая без изменения Pd2+ Au3+ Hg2+ б Ag+ а, б Cu2+ Труп-па II а)
2 Зеленоватая смешанная окраска Незначительные следы металлов I группы Труп-па II а)
3 Фиолетовая Си2+ Pd2+ Au3+ Hg2+ 6 Ag+ a> * 6 Группа II б) в)
4 Желтая Hg2+ Г Ag+ в Окислители д Pd2+ Au3+ Cu2+ г) В) д)
5 Светло-желтая Светло-коричневая Аи3+ Pd2+ Hg2 + Ag+ Cu2+ е)
6 Черно-коричневая до коричневофиолетовой Темная Pd2+ Au3+ Hg2 + Ag+ Cu2+ е)
а За исключением случаев, когда присутствуют ионы С1~ или Вг — .
6 За исключением случаев, когда присутствуют ионы J".
в Более сильный золотисто-желтый оттенок.
г Более сильный красноватый оттенок.
д Может также появляться желтая окраска за счет действия на дитизон окис лителей. Относительно выделения или распознавания см. стр. 140—141.
346
Применение дитизона в качественном анализе
встряхивании прибавляют твердый йодид калия до исчезновения получающегося осадка и вновь повторяют реакцию. Если слой четыреххлористого углерода остается зеленым, то это указывает на отсутствие ионов Си2+; появление фиолетовой окраски показывает на присутствие Си2+; если окраска органического слоя снова желтеет, то это свидетельствует о недостатке йодида калия.
г) Отделенный экстракт желтого цвета встряхивают в делительной воронке с 5 л-u соляной кислоты.
В табл. 19 приведены возможные реакции и их оценка.
Таблица 19
ОТКРЫТИЕ ИОНОВ Ag+ и Hg2 +
№ Окраска слоя СС1, Присутствуют безусловно Отсутствуют безусловно
1 Желтая без изменения Hg2 + Ag+
2 Зеленая Ag+ Au3+ Hg2+
д) Дополнительное открытие ионов Ag+ и Hg2+ описано в группе III.
е) Экстракт отделяют и встряхивание повторяют до тех пор, пока не прекратится выделение хлопьевидного осадка. Если появляется другая окраска экстракта, то ее расшифровывают по табл. 18.
ГРУППА II. РЕАКЦИИ В ПРИСУТСТВИИ УКСУСНОЙ кислоты
Реакционноспособные ионы: Pd2+, Zn2+, Со2+, Ni2+, а также ионы Cd2+ и Sn2+ в относительно высокой концентрации. Присутствующие ионы Sn2+ предварительно переводят в Sn4+, вследствие чего они не принимают участия в реакции с дитизоном.
Открываемый минимум в микрограммах на 1 мл раствора дитизона: Pd2+ : 25; Zn2+ : 5; Со2+ : 5; Ni2+ : 25.
Ход качественного анализа с помощью групповых реакций 347
Таблица 20
ГРУППА II. РЕАКЦИИ В ПРИСУТСТВИИ УКСУСНОЙ кислоты
№ Окраска слоя СС1.4 Присутствие возможное Отсутствие безусловное Отсутствие доказательств относительно Дальнейшие испытания
1 Зеленая без изменения Pd2+ Zn2+ Со2+ Ni2+ Cd2+ Sn2+ Группа III
2 Зеленоватая смешанная окраска Незначительные следы металлов группы II Группа III
3 Фиолетовая до пурпурной Zn2+ Со2+ Cd2+ Sn2+ Pd2+ Ni2+ a)
4 Коричневатая до коричневофиолетовой Pd2+ (при наличии осадка металлов группы I) Ni2 + Zn2+ Co2+ Cd2+ Sn2+ a) 1
Реактивы
Дитизон, тот же раствор, что и в группе I.
Аммиак, как указано в группе I.
Соляная кислота, как в группе I.
Ацетат натрия, 5%-ный раствор.
Тиосульфат натрия NaC2H3O2 • ЗН2О, 50%-ный раствор.
Тартрат натрия-калия ЫаКС4Н.10б • 4Н2О, 20%-ный раствор.
Цианид калия, 5%-ный раствор.
Сульфид натрия Na2S-9H2O, 0,04%-ный свеже-полученный раствор.
Индикатор, конго, лакмус или аналогичный.
348
Применение дитизона в качественном анализе
Таблица 21
СПЕЦИАЛЬНОЕ ИСПЫТАНИЕ НА СОДЕРЖАНИЕ ИОНОВ Zn2 + (ИЛИ БОЛЬШИХ КОЛИЧЕСТВ ИОНОВ Cd2+)
№ Окраска слоя СС14 Присутствие возможное Отсутствие безусловное Никаких доказательств относительно Дальнейшие испытания
1 Зеленая (Pd2+) Со2+ Ni2+ Zn2+ Cd2+ Sn2+ Группа III
2 Зеленоватая смешанная окраска Pd2+ Со2+ Ni2+ rZn2+Tl Cd2+ . Sn2+ _ Группа III
3 Фиолетовая до пурпурной Zn2+ Cd2+ Sn2+ i Co2+ Ni2+ 1 б)
а Могут быть открыты незначительные следы этих ионов.
Ход определения. (Для случая отрицательных реакций по группе I, № 3—5, табл. 18, в противном случае проводят испытания по группе II, б.)
В делительную воронку вносят 5 мл испытуемого раствора и добавляют раствор ацетата для достижения pH около 4. Прибавляют 5 мл раствора тиосульфата, еще 10 мл раствора ацетата и 5 мл раствора дитизона и сильно встряхивают. В табл. 20 содержатся возможные объяснения возникающих изменений в окраске испытуемого раствора.
Ход качественного анализа с помощью групповых реакций 349
Дальнейшие испытания
а) При специальных испытаниях на ионы Zn2+ (или больших количеств ионов Cd2+) * испытуемый раствор (в случае необходимости после прибавления тартрата) в делительной воронке слабо подщелачивают аммиаком и прибавляют раствор цианида (под тягой) до растворения выпадающих в незначительном количестве цианидов металлов. Слабо подкисляют соляной кислотой, с помощью раствора ацетата доводят pH раствора до 4, добавляют раствор тиосульфата и, наконец, прибавляют раствор ацетата в половинном количестве от общего объема. Встряхивают с 5 мл раствора дитизона. В табл. 21 приводятся возможные реакции и их объяснение.
б) Для отделения ионов Zn2+ от ионов Cd2+ или Sn2+ встряхивают выделенный органический экстракт с раствором сульфида; не исчезающая красная окраска указывает на присутствие ионов Zn2+, тогда как обесцвечивание раствора указывает на возможное присутствие ионов Cd2+ или Sn2+. Другие испытания на ионы Cd2+ см. в группе III.
ГРУППА III. РЕАКЦИИ В ПРИСУТСТВИИ ЩЕЛОЧИ
Реакционноспособные ионы ** ***: Ag+, Hg2+, Pd2+, Au3+, Cu2+, Co2+, Ni2+, Cd2+, (Zn2+ и Tl+)
Открываемый минимум в микрограммах на 1 мл дитизона: Ag+: 20; Hg2+: 20; Pd2+:>20; Au3+:20; Cu2+: : 3; Co2+:>20; Ni2+:>20; Cd2+ (Zn2+ и Tl+) : 3.
* Ионы металлов I группы, как, например, Bi3+, Со2+, Ni2+ и Pb2+, не мешают, т. е. реакция практически специфична (ср. стр. 239).
** После прибавления нескольких капель раствора гидрата гидразина (10 н.) и кипячения щелочного раствора благородные металлы Ag+, Hg2+, Pd2+ и Au3+ восстанавливаются и отделяются. Фосфорноватистая кислота также восстанавливает ионы Си2+ до металла (ср. стр. 339, примечание б). Если присутствует незначительное количество металлов I группы, то последние при pH около 4 исчерпывающе извлекаются дитизоном и больше не мешают.
*** Большие количества ионов Zn2+ и Т1+ могут частично реагировать с дитизоном.
350
Применение дитизона в качественном анализе
Реактивы
Дитизон, раствор, идентичный с указанным в группе I.
Тартрат натрия-калия, раствор, идентичный с указанным в группе* I.
Цианид калия, 10%-ный раствор.
Едкий натр, 2,5 н. и 1,25 н. растворы.
Формалин, 35%-ный раствор. Гидроксиламин солянокислый.
Ход определения. В делительной воронке разбавляют 5 мл слабокислого испытуемого раствора равным объемом едкого натра (2,5 н.). Если при этом выпадают в незначительном количестве нерастворимые гидроокиси металлов, следует предварительно прибавить достаточное количество раствора тартрата. После прибавления 5 мл раствора дитизона сильно встряхивают. В табл. 22 приводится расшифровка различных окрасок раствора.
Дальнейшие испытания
а) Для отличия ионов Cd2+ от Zn2+ отделенный экстракт красного цвета встряхивают с равным объемом 1,25 н. раствора едкого натра: остающаяся красная окраска указывает на присутствие ионов Cd2+. При обесцвечивании раствора, безусловно, отсутствуют ионы Cd2+ и, возможно, присутствуют ионы Zn2+ (ср. также группу II, 3 и II, а, см. табл. 20, стр. 347 и стр. 349).
б) Для открытия ионов Cd2+ (а также большого количества ионов Zn2+) в присутствии ионов Ag+, Pd2+, Au3+, Cu2+, Со2+ и Ni2+ к испытуемому раствору в делительной воронке прибавляют раствор щелочи (см. «Реактивы») и в достаточном количестве раствор тартрата. Сюда же прибавляют 10 мл раствора цианида, несколько кристаллов солянокислого гидроксиламина и 5 мл раствора формалина. Затем после прибавления 5 мл раствора дитизона делительную воронку встряхивают.
В табл. 23 помещены возможные реакции.
Таблица 22
III ГРУППА. РЕАКЦИИ В ПРИСУТСТВИИ ЩЕЛОЧИ
№ Окраска Присутствие Отсутствуют безусловно Никаких доказа-тельств относительно Дальнейшие испытания
слоя СС1( хлопьевидного осадка ВОДНОГО раствора а безусловное возможное
1 Бесцветная до желтоватой Желтая Ag+ Hg2+ Pd2 + Au3 + Cu2+ Zn2+ Cd2+ Co2+ Ni2+
2 Красная Жел- б тая Бесцветная в присутствии Cd2+ Красноватая в присутст-<7 2 -р В вии Zn Cd2+ Zn2+r Ag+ Hg2 + Pd2+ Au3+ Cu2+ Co2+ Ni2+ a)
3 Оливково-коричневая до грязно-коричневой Бесцветная в присутствии Си2+ Зеленоватая в присутствии Ni2+ Фиолетовая в присутствии Со2+ г и (Pd2+) Cu2+ л pd2+ е Со2 + ж №2+е гои + + Au3 + Zn2+ Cd24- 6)
4 Фиолетовая Бесцветная Hg2+3 Ag+ Pd2+ Au3+ Cu2+ и Zn2+ Cd2+ Co2+ Ni2+ 6)
Продолжение табл. 22
№ Окраска Присутствие Отсутствуют безусловно Никаких доказательств относительно Дальнейшие испытания
слоя СС1| хлопьевидного осадка водного раствора а безусловное возможное
5 Фиолетовая Бесцветная Ag+ ’< pjg2+ л Pd2+ Au3H Cu2+ и Zn2+ Cd2+ Co2+ Ni2+ б)
6 Желтоватая Коричневатая до красноватой Бесцветная Аи3+ м Ag+ Hg2 + Cu2+ Pd2+ Zn2+ Cd2+ Co2+ Ni2+ б)
7 Желтая Бесцветная Ag+ н Hg2+ н Pd2+ Au3+ Cu2+ Zn2+ Cd2+ Co2+ Ni2+ б)
а Поскольку собственная окраска водного раствора не перекрывается и^не меняется.
6 Если присутствует много Сс12+*
в Если присутствует много Zn2+ по сравнению с содержанием Cd2 + .
г Окраска весьма непрочная.
д В случае положительной реакции по группе I, 3 (табл. 18).
е Также в случае положительной реакции по группе II, 4 (табл. 20).
ж Также в случае положительной реакции по группе II, 3 (табл. 20).
3 В случае положительной реакции по группе 1,4 и I, г, 1 (табл. 18).
и Ср. данные по группе I, 3, а также I, в (табл. 18).
к Ср. данные по группе I, 4 (табл. 18), а также I, г (табл. 18, примечание 0).
л Ср. данные по группе I, 2, (табл. 18, примечание а).
м В случае положительной реакции по группе I, 5 (табл. 18).
и При весьма малых количествах этих ионов и избытке дитизона могут получаться однозамещенные соли вместо двузамещенных. Следует заботиться об отсутствии окислителей.
открытие ионов со24
Таблица 23
№ Окраска слоя СОЦ П| псугст-вие возможно Отсутствуют безусловно Никаких доказательств относительно Дал ьнеи-шие испытан ня
1 Обесцвечивается до желтоватой Hg2 + Cd2 + Ag+ Pd2 + Au3 + Cu2+ Zn2+ Co2+ Ni2+
2 Красная Zns+ а Cd2 + Hg2 + Ag+ Pd2+ Au3 + Cu2+ Co2-Ni2 + а)
3 Желтая Ag+ 6 Hg2+ 1 Pd2+ Au3+ Cu2+ Zn2 + Cd2+ Co2+ Ni2 + б)
‘2 Окраска появляется только в присутствии больших количеств.
Желтая окраска раствора появляется только в присутствии больших количеств.
V
23 Зак. 2157.
354
Применение дитизона в качественном анализе
а) Органический экстракт отделяют и испытывают по группе III.
б) Органический экстракт отделяют и испытывают по группе I, г.
Дальнейшие испытания
ГРУППА IV. РЕАКЦИИ В ПРИСУТСТВИИ ЦИАНИДА
Реакционноспособные ионы расположены в порядке сродства к дитизону: ионы Pb2+, В13+, Т1+ и Sn2+. При pH < 9 могут также извлекаться присутствующие в растворе ионы 1п3+. Путем предварительного окисления ионов Sn2+ до Sn4+ их исключают из реакции с дитизоном.
Открываемый минимум (мг/мл раствора дитизона): РЬ2+ : 5; Bi3+ : 15; Т1+ : > 20; Sn2+ : > 20.
Реактивы
Дитизон, раствор, указанный в группе I.
Аммиак, 2 и. и 7 н. растворы.
Тартрат натрия-калия, указанный в группе II.
Цианид калия, 10%-ный и 1%-ный растворы (удаляет свинец, см. стр. 103).
Индикаторная бумага, лакмусовая или аналогичная.
Гидроксиламин солянокислый.
Ход определения. 5 мл испытуемого раствора нейтрализуют раствором аммиака (7 н.) в конической колбе (50 мл). В случае выпадения в осадок гидроокисей металлов следует предварительно прибавить к раствору столько раствора тартрата, чтобы предотвратить их выпадение. Прибавляют 10 мл 10%-ного раствора цианида (под тягой), несколько кристалликов солянокислого гидроксиламина и кипятят в течение короткого времени. Охлаждают током воды, переносят раствор в делительную воронку, прибавляют 5 мл. раствора дитизона и сильно встряхивают. В табл. 24 приведены возможные реакции и дается их объяснение.
Ход качественного анализа с помощью групповых реакций 355
Дальнейшие испытания
а) Экстракт красного цвета 2—3 раза промывают равным объемом 1%-ного раствора цианида. Остающаяся красная окраска указывает на присутствие ионов РЬ2+. Обесцвечивание доказывает наличие ионов Т1+ или Sn2\
б) Для открытия ионов РЬ2+ в присутствии ионов Bi3+ и Sn2+ реакции IV группы проводят несколько измененным способом, а именно повторяют в присутствии более концентрированного раствора аммиака.
Таблица 24
ЦИАНИД .МЕТАЛЛА IV ГРУППЫ
№ Окраска слоя СС14 Присутствие Отсутствуют безусловно Никаких доказательств относительно Дальнейшие испытания
безусловное возможное
1 1 Бесцветная до желтоватой а РЬ2 + в;з+ б т,+ Sn2+6
2 Оранжевая В1зн РЬ2+В Sn2+ 6 Т1 +
3 Красная РЬ2+ Т1 + Sn2+ Bi3 + а) 6)
а Водный раствор окрашен в желтый цвет.
° Во всяком случае, не присутствует в виде следов.
в Pb23 может присутствовать, по-видимому, в количестве менее 0,1%' от содержания Bi3 г.
После нейтрализации испытуемого раствора 7 н. раствором аммиака прибавляют еще 2 мл его и проводят опыт аналогично описанию на стр. 354. В этих условиях не реагируют ни ионы Bi3+, ни Sn2+. Слабая красная окраска может быть обусловлена только ионами РЬ2+ или Т1+.
23*
Глава 5
ОСОБЫЕ СЛУЧАИ ПРИМЕНЕНИЯ ДИТИЗОНА
Дитизон нашел также применение в качестве индикатора при объемных анализах, а также вспомогательного вещества (коллектора) для выделения или концентрирования следов металлов, последующее определение которых можно проводить методом эмиссионной спектроскопии, полярографическим или другими способами. Иногда дитизон применяют в хроматографическом адсорбционном анализе.
Легкая окисляемость дитизона позволила использовать его для открытия окислителей. Амбергеру [423], а также Бергнеру К. и Бергнеру И. [431] принадлежит разработка методов открытия бромида или свободного брома раствором дитизона в четыреххлористом углероде. Эбле и Пфейфер [345] разработали метод открытия пероксидазы в молоке [3618] с помощью раствора дитизона в ацетоне.
Сильная комплексообразующая способность дитизона была использована при алкалиметрическом титровании кобальта и никеля. Брэммет и Голвег [5612] выпаривали на водяной бане досуха раствор, содержащий 100 мг СоСЬ пли NiCb, извлекали остаток безводной смесью из метанола и бензола (1:4) и добавляли к ней в избытке дитизон. Выделившиеся ионы Н+ титровали 0,1 н. раствором едкого натра в метанол-бензольной смеси. Кривую титрования регистрировали потенциометрически. Был получен большой и крутой скачок потенциала, соответствующий нейтрализации двух эквивалентов водорода (однозамещенный дитизонат),
Дитизон ci качестве индикатора
357
аналогичный получаемому при титровании сильной кислоты сильным основанием. Скачок потенциала, отвечающий четырем эквивалентам водорода, выражен менее отчетливо.
Получило развитие применение косвенных методов определения с использованием дитизона. Некоторые из этих методов приведены на стр. 160 и 175 этой книги.
Использование дитизона для очистки веществ от следов металлов, путем встряхивания с раствором дитизона имеет большое значение для получения исключительно чистых веществ.
Ниже приводятся некоторые отдельные методы применения, имеющие наибольшее практическое значение.
дитизон в качестве индикатора ПРИ ОБЪЕМНЫХ ОПРЕДЕЛЕНИЯХ
Ввиду чувствительности реакции с дитизоном, плохой растворимости дитизона и образования комплексных соединений дитизонатов в воде, а также хорошей растворимости последних в не смешивающихся с водой органических растворителях дитизон и дитизонаты металлов применяют при объемных определениях преимущественно в качестве экстракционных индикаторов. Большой коэффициент распределения в органической фазе вызывает еще при очень малых количествах индикатора высокий цветовой контраст, более высокий, чем в случае такого же количества индикатора, распределенного в гомогенном растворе. В противоположность капельным индикаторам дитизон имеет преимущество в экономии времени и в удобстве. Компоненты реакции состоят из металлов, реагирующих с дитизоном, а также из осадителей и комплексообразующих веществ. Появление или исчезновение малы?; количеств ионов металлов в водном испытуемом растворе индикатор регистрирует путем образования или разложения дитизонатов металлов в органическом растворе. Поскольку образование и распад дитизонатов металлов в выбранной области pH большей частью протекает обратимо, порядок титрования в этих случаях не имеет значения.
358 Особые применения дитизона
В то время как при экстракционном титровании, титровании по методу смешанной окраски, колориметрических или фотометрических методах определяют микро-граммовые количества веществ и поэтому удовлетворяются иногда несколько большей, чем обычная, погрешностью определения, в данном объемном методе определяют миллиграммовые количества испытуемых веществ, и ошибки определения находятся в пределах погрешностей обычных для классических объемных методов.
К раствору испытуемого вещества прибавляют индикатор в виде раствора дитизона или дитизоната металла (в четыреххлористом углероде, хлороформе, бензоле, толуоле и других растворителях пли в водной щелочи). Применяют 50—200 мкМ раствор индикатора, объем которого составляет Vio или даже меньшую часть от объема испытуемого раствора. Титруют периодически, причем после каждой новой добавленной порции титрующего раствора встряхивают сосуд, в котором титруют, и наблюдают за окраской органической фазы. Приближение к конечной точке титрования делается заметным по замедлению скорости реакции, и поэтому следует более продолжительно встряхивать. Показателем конечной точки служит первое отчетливое изменение окраски индикатора, устойчивой после 30 сек. встряхивания. Индикаторная ошибка по большей части очень незначительна. Следует учитывать разрушающее влияние на дитизон повышенной температуры некоторых окислителей и прямых солнечных лучей.
Дитизонат металла MHDz в органической фазе находится в равновесии со своими ионами в водной фазе:
MHDzopr <—- АЛводн. Н HDz води (М+ — одновалентный ион металла).
В зависимости от вида дитизонатов металлов и характера среды дитизоната металла в водном растворе существует определенное значение для показателя иона металла:
рМ = —1gcM = a.
Дитизон в качестве индикатора
359
Этот ион металла М+ количественно титруется анионом А~, если для реакции М+ + А'^-^МА, протекающей в аналогичной среде, выполняются следующие условия:
1. Реакция должна достаточно быстро (например, в течение 1 сек.) и количественно протекать в направлении слева направо в разбавленном на несколько порядков растворе.
2. Одновременно в стехиометрической точке эквивалентности должно соблюдаться значение рМ, отвечающее b > а.
В этом случае наблюдается отчетливая точка перехода индикатора, можно пользоваться соответствующими сильно разбавленными растворами и порядок титрования не оказывает влияния на результаты титрования.
Принципиально можно также до некоторой степени удовлетворительно титровать ион металла М+ анионом А-, если в стехиометрической эквивалентной точке преобладает значение рМ, отвечающее b < а. С помощью соответственно подобранного избытка аниона А" значение рМ соответственно увеличивается и при этом отвечает Ь > а. В этом случае точка перехода индикатора менее отчетливо выражена, лежит более или менее вблизи стехиометрической эквивалентной точки и часто зависит от последовательности проведения титрования. Бовалини и Касини [5217] исследовали эти соотношения на примере титрования ионов РЬ2+ ионами SO^-, С2ОГ и [Fe(CN)6]4-. Были получены следующие значения рМ:
Для
Pb(HDz)2 в СС14 5=± I Ц.... • 2110/.. ... рРЬ~6,2
PbSO4 ^*Pb2+ + SOi" pPb — 3,7
PbC2O4 I Ir : С_(г. pPb~5,3
Pb2[Fe(CN)6] 2! b' + [Fe(CNj6]4- pPb > 6
360 Особые применения дитизона
Зависимость между образованием или распадом дитизонатов, например дитизоната свинца, от pH и «точкой перехода» при pH около 4 была использована при ацидиметрическом титровании темноокрашенных растворов [4810, 5024]. В этих условиях можно титровать сильную кислоту сильным основанием. При этом окрашенная составная часть испытуемого раствора не должна растворяться в растворителе, принятом для растворения дитизона. До сих пор эти опыты не получили практического применения для определения pH [4923] *.
ПРИМЕНЕНИЕ
Карабаш [5314] определял ионы Ag+ титрованием ионами J- или SCN- (ср. ниже). Ионы J“, Вг~ или SCN' (ср. стр. 362), а также СМ" он определял с помощью ионов Ag+ (ср. стр. 364). Далее ионы Hg2+ можно титровать ионами J- в 5—8 н. растворе серной кислоты. Тяжелые металлы, например Pb2+, Cd2+, Bi3+, Ag* а также и Hg2+, титруются сульфидом натрия, а ионы Аи3+ — ионами 520з~-
Арчер [566] рекомендует для определения микро-граммовых количеств сероводорода (получаемых при восстановлении SO4) извлекать последний в ацетоновом растворе щелочи, содержащем немного дитизона в качестве индикатора, и титровать установленным 10”3 н. раствором Hg2+ (или раствором соли кадмия).
Мелиг и Гуилл [5113] титровали ионы Zn2+ в цинковой обманке ионами [Fe(CN)6]4~ (ср. стр. 365), тогда как
* Супрунович И. Б. и Дубовик Н. Е. (неопубликованные данные) установили возможность титрования уксусной кислоты в силь-ноокрашенных растворах едким натром в присутствии о-дитолил-тиокарбазона в четыреххлористом углероде как индикатора и соли свинца в водной фазе. Перемена зеленой окраски слоя ССЦ в чисто красную вследствие образования о-дитолилтиокарбазоната свинца происходит при рН~9, что соответствует точке титрования фенолфталеина.
Различные другие аналоги дитизона в комбинации с солями различных комплексообразующих металлов представляют широкие возможности подбора их в качестве индикаторов при титровании других слабых кислот и определении pH в сильноокрашенных водных растворах. — Прим. ред.
Дитизон в качестве индикатора 361
Бовалини и Касини [534] аналогичным образом определяли ионы Сс12+. Авторы, упомянутые последними, определяли содержание ионов РЬ2+ и Cd2+ титрованием раствором двунатриевой соли этилендиаминтетрауксусной кислоты. Викбольд [5613] для определения содержания ионов РЬ2+ пользовался раствором диэтилдитиокарбамата в качестве титрующего раствора *.
* Коста [5833] применил дитизон в качестве индикатора для прямого титрования различных металлов комплексоном III в гомогенной системе. Анализируемый раствор при этом разбавляется органическим растворителем. Оптимальные результаты получаются при использовании смеси пиридина с водой с соотношением компонентов 1 :4. Цинк можно титровать в смеси этанола и ацетона с водой с соотношением компонентов 1:1, а также в водно-мета-нольном растворе. В качестве индикатора применяют ацетоновый раствор предварительно растертой смеси дитизона и хлорида аммония. При титровании свинца в присутствии пиридина ионы С1" не мешают. Описанный метод не пригоден для определения Fe2+, Aln2+ Sn2+, Cu2+, Hg2+ и Ag+.
Котрлый [5733] титровал микроколичества свинца раствором комплексона III в присутствии дитизона в водно-спиртовой (40— 60% С2Н5ОН) или в водно-ацетоновой (50% ацетона) среде при pH 4,7—5,4 до перехода красной окраски в сине-зеленую.
Готшальк [6016] определял алюминий с помощью комплексона III. Из-за замедленного комплексообразования он применил метод обратного титрования. Лучшие результаты получаются при обратном титровании с цинком и дитизоном в качестве индикатора в ацетатном буферном растворе (pH ^5) в 50%-ном этаноле. Таким путем можно определить от 0,5 мкМ до 0,9 ммоля А! микро-, полумикро- или макрометодом.
Минами и Сато [5539] титровали малые количества свинца раствором комплексона III в присутствии дитизона как экстракционного индикатора.
Ванча и Волушнюк [5925] исследовали возможность применения дитизона в качестве экстракционного индикатора при определении Bi3+, Pb2+ и др. металлов, образующих осадки с РО^-, AsO^" и СгО^-, и показали, что ошибка 0,17%. Ими также разработан метод прямого титрометрического определения арсенатов в виде арсената висмута.
Больсан [5926] предложил для более точного определения конечной точки титрование с применением экстракционного индикатора в более тяжелом органическом растворителе, чем вода, проводить в обычной мерной колбе емкостью в 50 или 100 мл и наблюдать изменение окраски индикатора в тонком слое, создаваемом путем перевертывания колбы. — Прим. ред.
362
Особые применения дитизона
ПРИМЕРЫ
а) Титрование ионов Ац-+ ионами J~ (Вг~ и.ш SCN-) [53й] *
Принцип метода. Ионы Ag+ титруют ионами J~ при этом тотчас образуется труднорастворнмый йодид серебра (уравнение I). После оттитровыванпя всех ионов Ag+ полученный вначале дитизонат серебра разлагается и выделяется свободный дитизон зеленого цвета (уравнение II):
Ag+ + J- 5=± AgJ ; (PAg ~ 7.9), (I)
AgHDz + AgJ ; + H2Dzopr (II)
Желтый Зеленый
* Клейнер К- Е. и Маркова Л. В. [5240] определяли хлориды меркурпметрическим методом в водно-спиртовом (50% С2Н.5ОН) кислом (0,1—0,5 н.) растворе в присутствии дитизона как индикатора (насыщенный спиртовый раствор). Этот метод был применен ими для определения хлоридов в водопроводной воде, снеге, различных солях и др. В случае наличия следов металлов, реагирующих с дитизоном в этих условиях, производится предварительное экстрагирование их с помощью дитизона в четыреххлористом углероде. Метод позволяет определять хлориды в широком диапазоне концентраций при минимальном содержании 0,02 мг в пробе.
Арчер [5810] усовершенствовал аргентометрическое определение галоген- и циан-понов по методу Карабаша А. Г. [5314] путем проведения титрования в водно-ацетоновом и водно-этанольном растворах. Для титрования хлоридов при низком содержании воды в титруемой смеси (<3%) он использовал в качестве титранта раствор AgNCb в этаноле пли пропаноле. Метод применен для определения галогенов в органических соединениях (поливинилхлорид, поливинилиденхлорид и его сополимеры и др.) после их сожжения.
Сульфат-ионы методом прямого титрования раствором нитрата свинца в присутствии дитизона в качестве индикатора определяли Ничипоренко Г. Н. [5826] в природных водах с добавлением ацетона и Пюшель, Ласнер и Рейзер [5930] с добавлением пзопропанола для понижения растворимости РЬБСЦ и предварительным удалением металлов, реагирующих с дитизоном, катионообменным или другим методом.
Кункел. Бакли и Горик [5931] определяли алифатические меркаптаны в углеводородах титрованием раствором нитрата серебра в присутствии дитизона в аммиачно-спиртовой среде с точностью г'“0,2%. — Прим. ред.
Дитизон в качестве индикатора
363
Выбором соответствующего pH раствора задерживают мешающее влияние большинства других металлов и выпадение дитизоната серебра (см. рис. 15, стр. 147).
Вместо ионов J~ можно использовать также ионы Br (pAg—6,2) или SCN~ (pAg~6,l) в качестве титрующего раствора.
Реактивы
Нитрат серебра, 0,01 н. раствор ( 1 мл содержит 1,0788 мг Ag+).
Серная кислота, приблизительно 15 н. раствор. Дитизон, приблизительно 80 мкМ раствор дитизона в четыреххлорпстом углероде.
йодид калия, 0,02 н. раствор (1 Л1Л = 2,1576 мг Ag+).
Ход определения для 10 мг Ag+. Вносят в колбу 10 мл испытуемого раствора, с помощью серной кислоты подкисляют раствор до 4—5 н. и охлаждают до комнатной температуры. После прибавления 1—2 мл раствора дитизона и образования при встряхивании дитизоната серебра желтого цвета прибавляют порциями по 1 мл раствор йодида калия и в течение короткого времени встряхивают.
Вблизи конечной точки титрования индикатор приобретает промежуточный зеленоватый оттенок, весьма медленно переходящий в желтый. При достижении эквивалентной точки индикатор золотисто-желтого цвета приобретает грязно-зеленый отблеск и мутнеет от выпадения коагулированного осадка йодида серебра. Избыток йодида можно удалить прибавлением титрованного раствора серебра. Продолжительность титрования 5—10 мин.
Точность определения при анализе 10 мг серебра ±0,2 вес. %.
В качестве титрующих растворов применяется 1 — 9 н. раствор йодида калия, 2—9 н. раствор бромида калия и 3,5—6,5 н. раствор роданида калия.
В качестве растворителей для индикатора дитизона применяются хлороформ, толуол и другие. По чувствительности дитизон превосходит эозин (адсорбционный индикатор по Фаянсу).
364
Особые применения дитизона
б) Титрование ионов J", Вг~ или SCN- ионами Ag+ [5314]
Поступают способом, обратным описанному в предыдущем параграфе. Титруют раствором серебра до появления первого заметного перехода изумрудно-зеленого цвета индикатора в желтоватый, обязанный образовавшемуся дитизонату серебра желтого цвета.
в) Титрование ионов CN~ ионами Ag+ [5314]
Ионы CN- титруются ионами Ag+ в слабощелочном растворе с образованием комплексного иона [Ag(CN)2]~ (уравнение I). В качестве индикатора предложен карминово-красный и стойкий к щелочам раствор дитизоната свинца в хлороформе. Последний образуется, если после прибавления раствора дитизона в испытуемый раствор внести 1 каплю раствора соли свинца и встряхнуть (уравнение II). По окончании реакции связывания свободных ионов CN" избыточные ионы Ag+ взаимодействуют с карминово-красным днтизонатом свинца с образованием желтого дитизоната серебра в органической фазе (уравнение III) вследствие значительно большего сродства ионов серебра к дитизону:
2CN’+Ag-[Ag(CN2)]- (pAg~6,9)
2H2DzOpr> —РЬВодн. <—— Pb (HDz)2 ОрГе —|— 2Нводн.
Pb(HDz)2op, + 2AgB^H. 2А§НПгор, + РЬ2водн.
Карминово-красный Желтый
(I) (И) (III)
Р е а к т и в ы
Нитрат серебра, 0,025 н. раствор (1 мл содержит 2,697 мг Ag+).
Аммиак, 2 н. раствор.
Дитизон, приблизительно 400 мкМ раствор в хлороформе.
Цианид калия, приблизительно 0,025 н. раствор (1 мл~ 1,35 мг Ag+).
Нитрат свинца, приблизительно 25*10-3 М раствор.
Дитизон в качестве индикатора
365
Ход определен и я для 10 мг CN“ В колбу вносят 10 мл испытуемого раствора и столько аммиака, чтобы его концентрация стала 0,3—0,6 н. После прибавления 1—2 мл раствора дитизона и 1—2 капель раствора соли свинца и встряхивания зеленый цвет дитизона переходит в карминово-красный цвет дитизоната свинца. Затем титруют, периодически прибавляя раствор серебра аналогично методу, описанному в разделе а. Выпадающий сначала белый осадок цианида серебра при встряхивании переходит в раствор в виде комплексного иона [Ag(CN)2K- Область перехода относительно велика. Стехиометрическая точка перехода достигается как раз при появлении чистой золотисто-желтой окраски дитизоната серебра (AgHDz).
Вместо аммиачной реакционная среда может быть и щелочной (0,1—0,2 и. по NaOH). Не мешает присутствие K4[Fe(CN)6]. Небольшие количества ионов Zn2+ (ZnSO4: KCN =1:5) не оказывают заметного влияния на реакцию.
г) Титрование ионов Zn2+ ионами [Fe(CN)6]4- [5113]
Поступают по одному из вариантов титрования ионов Zn2+ по Галети (1865 г.).
Принцип метода. Раствор [Fe(CN)6]4' титруют раствором соли цинка, причем выпадает коллоидный осадок (уравнение I). Стехиометрический состав осадка зависит от условий осаждения, поэтому раствор ферроцианида устанавливают по возможности в аналогичных условиях по раствору цинка. Избыток ионов Zn2+ извлекается зеленым раствором дитизона с образованием дитизоната цинка красного цвета (уравнение II), который находится в обменном равновесии с ферроцианидом (уравнение III).
2К4 IFe (СN)6] + 3Zn2+ ~ Zn3K2 [Fe (CN)6]21 + 6К+ (I)
ZHboah. + 2H2DzOpr. Zn(HDz)2opr. + 2HBoaH. (II)
Зеленый Красный
2К4 [Fe (СЫ)6|ВОДН. + 3Zn (HDz)2 opr. + 6Н+
Красный
5=> 6H2Dz + Zn3K2[Fe(CN)6]2| + 6IC (Ш)
Зеленый
366
Особые применения дитизона
Реактивы
Фталат калия1, 10%-ный раствор (pH = 4).
Дитизон2, приблизительно 250 мкМ раствор в че-тыреххлористом углероде. 1 капля индикатора в 50 мл воды с 1 каплей раствора цинка должна окраситься в красный цвет менее чем за 30 сек.
Ферроцианид калия Ki[Fe(CN)6] • ЗН2О, приблизительно 0,17%-ный раствор 1 мл 0,4 мг Zn2+. Раствор очищают с помощью дитизона и устанавливают по раствору соли цинка.
Хлорид цинка, 0,002 н. раствор делают буферным с помощью раствора фталатного буфера с pH 4. 1 мл содержит 65,38 мкг Zn2+.
Ход определения для 5 мг Zn2+. Грубое предварительное титрование: к 20 мл вышеуказанного раствора ферроцианида3 прибавляют 1 каплю раствора дитизона и титруют забуференным раствором хлорида цинка4 при равномерном встряхивании до перехода окраски дитизона в розово-красную, отмечают расход раствора хлорида цинка в миллилитрах.
Точное титрование: к 20 мл вышеуказанного раствора ферроцианида цинка прибавляют сразу около 95% от израсходованного выше на титрование забуференного раствора хлорида цинка. Затем добавляют 1 каплю раствора дитизона и дотптровывают по каплям (как выше) 5.
Примечания
1 Вместо раствора фталата можно создать буферность раствором ацетата.
2 Если вместо дитизона в четыреххлористом углероде взять в качестве индикатора дитизон в хлороформе, то соответственно расход раствора соли цинка на 8% выше.
3 Обратный ход титрования нецелесообразен, так как разложение дитизоната цинка достаточно быстро протекает только при большом избытке ионов [Ее(СМ)б]4~ (уравнение III).
4 Все катионы, образующие при pH 4 труднорастворимые ферроцианиды, как, например, Cu2+, Fe3+, Со2+ и другие, следует предварительно удалить.
5 Мелпг и Гуплл [5113] получили очень хорошо воспроизводимые результаты при определении цинка в цинковой обманке.
Эмиссионный спектральный анализ
367
ЭМИССИОННЫЙ СПЕКТРАЛЬНЫЙ АНАЛИЗ
Неоднократно использовалась возможность спектро-аналитического определения малых количеств металлов после предварительного их концентрирования с помощью дитизона; этот метод получил значительное применение. В данном спектрохимическом методе дитизон является весьма пригодным экстрактивным групповым реактивом на большое число катионов, за исключением железа, вследствие малой дисперсии и наложения линий.
Хотя опыты и показывают большей частью недостаточную воспроизводимость результатов по сравнению с колориметрическим методом, использующим дитизон, однако спектральный метод является для ряда исследований весьма экономным по времени и удобным.
Ронер [382] проводил фракционированную и исчерпывающую экстракцию с помощью приблизительно установленного раствора дитизона в четыреххлористом углероде таким способом, что получал приблизительно равные по концентрации органические экстракты. Растворы дитизонатов непрерывно подводились к нижнему медному или платиновому электродам. Он работал с конденсированной искрой. Так были определены в пирите с погрешностью ±5% ЮО—200 мкг ртути в 1 г навески.
Холак и Хаббард [443] встряхивали подготовленный для определений раствор биологического материала, содержащий ионы Сс12+, с раствором дитизона в хлороформе в присутствии 1,25 н. раствора едкого натра. Экстракт разрушали кислотой, и водный раствор выпаривали досуха. Сухой остаток извлекали буферным раствором (фосфат, хлорид и молибдат натрия; молибден является элементом сравнения), вносили раствор в углубление нижнего угольного электрода, выпаривали и анализировали в дуге постоянного тока. Воспроизводимость была хорошей при содержании от 5 до 200 мкг ионов СсГ2+ в 1 мл буферного раствора. В специальном случае можно определить еще 0,4 мкг кадмия.
Уорк [543] сплавлял пробы почвы и золу растений с карбонатом натрия, растворял, добавлял цитрат, доводил pH раствора до 8,3 и исчерпывающе экстрагировал раствором дитизона в хлороформе. Дитизоновый
368
Особые применения дитизона
экстракт он смешивал с графитовой пылью, выпаривал, слабо прокаливал и проводил определения в искре.
Этим путем можно было определить:
0,3—100 мкг Си с погрешностью ±10% 10—100 мкг Zn с погрешностью ±9%
0,1 —100 мкг Со с погрешностью ±5%
Икеда [5530] экстрагировал из 1—20 мл воды горячих источников 0,5—100 мкг Sn2+ раствором дитизона в четыреххлористом углероде при pH 5—6 в присутствии тартрата. После разрушения органического экстракта полученный остаток он анализировал в дуге постоянного тока.
Поль [5333] спектрохимически анализировал воду, которую с этой целью последовательно экстрагировал при соответствующих pH различными органическими реагентами (диэтилдитиокарбаминатом, оксином и дитизоном). После выпаривания объединенных хлороформных экстрактов разрушают полученные комплексы хлорной или азотной кислотой, растворяют остаток в соляной кислоте, сбрызгивают полученный раствор на угольный электрод и снимают спектр в высокочастотной искре по Фейснеру. В качестве сравнительного электрода служит бериллий. Можно одновременно определить большое число элементов. Точность определений составляла 10—20%. Так как испытуемая вода содержала много железа, то последнее предварительно удаляли экстракцией эфиром из солянокислого раствора или комбинировали с экстракцией эфиром роданида. После удаления кремневой кислоты выпариванием с плавиковой и серной кислотами и выделения железа можно аналогичным образом определить около 20 элементов в золе растений [5334] *.
При анализе почв и горных пород [545] после выделения кремневой кислоты и железа сначала проводят экстракцию при pH 3,5—4 с помощью раствора смеси аммонийпиролидина и дитиокарбамината в хлороформе
* Назаревич Е. С. [5339] применял дитизон для предварительного концентрирования серебра, свинца, меди, никеля и кобальта при качественном спектрально-химическом определении микроколичеств этих металлов в природных водах. — Прим. ред.
Полярографический анализ
369
и затем при pH 8—9 раствором дитизона в хлороформе. Благодаря этому объединенные хлороформные экстракты дополнительно содержат, кроме ряда металлов, реагирующих с дитизоном, еще хром, молибден, ванадий, марганец и олово.
Горбах и Поль [515, 5126] рекомендуют для определения наибольшего числа примесей металлов сначала выделить железо в виде бензоата с последующей экстракцией эфиром и затем последовательно многократно экстрагировать раствором дитизона в хлороформе, а также раствором оксина в хлороформе.
По предложению Ива и Страсгейма [5614], медь, цинк, кобальт и никель одновременно экстрагируют раствором дитизона в хлороформе из 0,05 М тартратного, раствора при pH 9,5. После разложения выпаренных досуха органических экстрактов соляной и хлорной кислотами и извлечения полученного остатка 1 н. раствором соляной кислоты вышеупомянутые элементы были определены методом фотометрии пламени *.
Дунабин, Мэзон, Съюфанг и Вудмэн [4 925] поглощают извлеченный раствором дитизона в четыреххлористом углероде дитизонат кадмия на колонке из активной окиси алюминия и снимают спектрограмму последней в дуге постоянного тока **.
ПОЛЯРОГРАФИЧЕСКИЙ АНАЛИЗ
С успехом может быть использовано применение дитизона для выделения и обогащения следов металлов с последующим полярографическим их определением.
* Масси [5719] предложил определение меди в растительных тканях по фотометрии пламени. Медь при этом экстрагируют при помощи раствора дитизона в смеси хлороформа с керосином (1:1) и определяют спектрохимпчески непосредственно в органической фазе. — Прим. ред.
** После предварительного обогащения с помощью дитизона следы элементов спектральным методом определяли Бабко А. К., Пилипенко А. Т. и Дубовенко Л. И. [5131], Надь и Пойик [57,2] в природных водах, Кох [5821, 5824] в алюминии, титане, цирконии и их соединениях, Лоунамаа [5740] в силикатных породах, Кох и Додик [5744] в золе синтетического волокна. — Прим. ред.
24 Зак. 2157.
370
Особые применения дитизона
Геллер, Кула и Мачек [3722] одновременно экстрагировали дитизоном ионы Cu2+, Zn2+, Ni2+, Pb2+ и другие катионы из минеральной воды, разрушали экстракт встряхиванием с концентрированной соляной кислотой и определяли ионы металлов полярографическп в водном растворе *.
Джонс [5223] извлекал ионы Си2+ и Zn2+ из почвенных и растительных экстрактов дитизоном в хлороформе при pH 9,8—10 и при выпаривании разрушал дитизоновый экстракт. Так как присутствующие ионы Со2+ мешают полярографическому определению Zn2+, то перед экстракцией дитизоном их предварительно маскировали диметилглиоксимом [494]. Ионы Fe3+ также удаляли заранее экстракцией амилацетатом **.
Холак и Хаббард [443] подщелачивали раствор биологического материала для полярографирования едким натром таким образом, чтобы концентрация последнего равнялась 1,25 н., и отделяли кадмий от цинка, свинца и других мешающих ионов экстракцией дитизоном в хлороформе. Экстракт ионов кадмия разрушали кислотой, водный раствор выпаривали досуха и остаток растворяли в 3 мл смеси из 0,1 н. растворов КС1 и НС1. От 2 до 500 мкг кадмия в 3 мл раствора дают отчетливые полярограммы.
Холак и Бамбах [415] концентрировали ионы РЬ2+ дитизоном в четыреххлорпстом углероде из биологического материала и разлагали полученный экстракт азотной кислотой. При содержании ионов РЬ2+ менее чем 40 мкг следует их перед полярографированием сконцентрировать с помощью электролиза.
Согласно Майеру и Шведа [5516], для очень точных полярографических определений (~0,1 мкг свинца) служит сочетание обогащения при помощи исчерпывающей экстракции дитизоном в четыреххлористОхМ углероде,
* Таким же образом Резников А. А. [3836] определял Zn2+ и Си2+ в природных водах.'—Прим. ред.
** В растениях и почвах после предварительного извлечения дитизоном полярографически определяли Синякова С. И. [451G, 4517] свинец, Дука и Стэнеску [5743]—медь и никель, Вардьер Стейн и Ив [5739] — цинк, Рекер [G011]— цинк и медь (в биологических материалах).— Прим. ред.
Хроматографический адсорбционный анализ 371
кислотного разложения и полярографии полученных водных растворов.
Лаплас [5228] снимает полярограммы ионов Zn2+, Сс12+ и РЬ2+ в дитизоновых экстрактах железных руд.
Анастаси, Мекарелли и Новачич [5527] определяли содержание ионов Cu2+, Zn2+ и РЬ2+ порядка 10~5% в стекле; после удаления кремневой кислоты выпариванием с плавиковой и хлорной кислотами остаток извлекали соляной кислотой и с помощью растворов цитрата и аммиака устанавливали pH раствора приблизительно равным 8, Исчерпывающе экстрагировали раствором дитизона в четыреххлорпстом углероде. Органический экстракт с извлеченными ионами Cu2+, Zn2+ и РЬ2+ и не содержащий ионов Fe3+ упаривали в кварцевом тигле и выпаривали с азотной кислотой. Полученный остаток растворяли в соляной кислоте и снимали полярограммы ионов Pb2+, Си2+ и Zn2+ *.
ХРОМАТОГРАФИЧЕСКИЙ АДСОРБЦИОННЫЙ АНАЛИЗ
Ряд работ посвящен адсорбционному разделению ди-тизонатов металлов в неводных растворителях; в других работах сообщается о чувствительной окраске ионов с дитизоном, разделенных хроматографическим способом.
Эрёметсэ [434] принадлежат первые опыты по адсорбции растворов дитизонатов металлов в четыреххлористом углероде пли хлороформе на различных сортах окиси алюминия и на кварцевой муке. Им был получен следующий порядок поглощения элементов: Ni (Sn, Мп) — Си — Cd — Со — Zn — Hg.
Бах [5027] исследовал способность к разделению ди-тизонатов серебра, ртути и меди, а также ртути, меди, висмута и кадмия в четыреххлористом углероде на
* После предварительного извлечения дитизоном полярографически определяли: Мухина 3. С. [482ь] цинк и никель в алюминиевых сплавах, Мижон [5828] цинк в железе и его сплавах, Колодзен-Чакувна [5649] цинк в сульфате никеля, Сучихара и Сайто [5829] свинец, медь и цинк в химически чистом хлориде натрия. — Прим, ред.
24*
372
О сопью применения дитизона
активной окиси алюминия с использованием в качестве промывной жидкости четыреххлористого углерода, хлороформа и ацетона. Ал-Махди и Вильсон [5125] указали на трудности, связанные с разделением дитизонатов ртути, меди, висмута и кадмия на окиси алюминия *.
Вентурелло и Ге [5410] исследовали хроматографическое поведение дитизонатов серебра, ртути, меди, висмута, цинка, кадмия и свинца в хлороформе на бумаге, пропитанной буферными растворами [pH 1 —10]. В качестве подвижной фазы они применяли различные одноатомные спирты. С метанолом при pH 7 они получили следующий ряд поглощения: Си—Ag—Hg—Pb— — Zn — Cd.
Эрдей и Ради [5218] отделили однозамещенный дитизонат золота от дитизона и его продуктов окисления на колонке, наполненной сульфатом натрия.
Левандовский и Кильчевский [5418] определяли несколько микрограммов цинка на бумаге, пропитанной дитизоном, с точностью ±2%. Танака, Ашизава и Шп-бата [4927] сообщили о хроматографическом определении 0,001 мкг кобальта, никеля и цинка и 0,05 мкг меди на колонке, наполненной окисью алюминия.
Барстсэл и сотр. [5020] после хроматографического разделения ионов Cu2+, Pb2+, Bi3+, Cd2+ и Hg2+, а также As3+, Sb3+ и Sn2+ на бумаге окрашивали места распределения ионов разбрызгиванием раствора дитизона в хлороформе. Аналогичным образом Арден с сотр. [4823] окрашивали ионы In3+, Zn2+ и Hg2+. Также Тевари [5420] окрашивал выделенные ионы РЬ2+ раствором дитизона в хлороформе. Пфейфер и Дилер [562] использовали в качестве проявителя для ионов Cu2+, As3+, Zn2+, Sn2+, Cd2+, Hg2+, Tl+ и Sb3+ раствор дитизона в четыреххлористом углероде.
Лакур и Хейндрикс [5615] ** сообщают о высокой воспроизводимости опытов при фотометрических измерениях поглощения окраски дитизоната цинка, проявленного на бумаге.
* Франсис и Пилгрим [5722] на колонке с окисью алюминия отделяли дитизонат ртути от дитизонатов меди и цинка, вымывая его хлороформом. — Прим. ред.
** См. также [5639].— Прим. ред.
Определения с помощью различных других способов 373
Харасава и Сакамото [5616] разделяли ионы Zn2+, Ве2+ и А13+ хроматографией на бумаге и с помощью дитизона в четыреххлорпстом углероде доказали присутствие ионов Zn2+. Следует упомянуть аналогичную работу Танака с сотр. [4 927] *.
ОПРЕДЕЛЕНИЯ С ПОМОЩЬЮ РАЗЛИЧНЫХ ДРУГИХ СПОСОБОВ
Ряд исследователей использовали возможность самостоятельного применения экстрагированного дитизоната металла в качестве удовлетворительного способа обогащения пробы с последующим определением исследуемых элементов другими (кроме упомянутых в разделах «Эмиссионный спектральный анализ», «Полярографический анализ» и «Хроматографический адсорбционный анализ») методами. В одних случаях рекомендованные комбинированию методы оказались пригодными, в других — большей частью относящихся к более старым литературным данным — малопригодными или совершенно непригодными.
Так, целесообразно определять экстрагированный полоний радиометрически** (ср. стр. 195), выделенный кобальт — колориметрически с помощью нитрозо-Р-соли [4018, 452, 4512, 5017, 5210, 5317, 5424] или с помощью роданида [3920]. Также окончательное колориметрическое определение никеля из обогащенной пробы более селективно проводится с помощью диметилглиоксима.
С другой стороны, колориметрическое определение малых количеств меди в виде диэтилдитиокарбамината
* Наган [5933] произвел полное разделение Cu2+, Cd2+, Hg2+, Pb2+ и Bi3+ на бумаге, импрегнированной дитизоном
О разделении Со2+, Ni2+, Cu2+ и Zn2+ методом хроматографии на бумаге с применением дитизона см. также [5825] и [6012].— Прим. ред.
** Коренман И. Т. и Шеянова Ф. Р. [5621] [ [585], а также совместно с ними Митрохина Т. М. и Трапезникова [5927], Дунка и Томас [5731] — Прим, ред.] показали, что можно с успехом определять радиохимически ряд других катионов 65Zn2+, 115Cd2+, 60Со2+ и др. после встряхивания их с большим избытком дитизона независимо от интенсивности окраски экстракта.
374 Особые применения дитизона
[4211,45s] является менее чувствительным, чем колориметрическое определение с дитизоном. Колориметрическое определение висмута в виде йодида [347, 3512] показало определенную специфичность в присутствии свинца, однако оно оказалось мало чувствительным. Вследствие небольшой чувствительности можно определять йодометрически только большие количества таллия. Нецелесообразно определять малые количества цинка йодометрически с применением ферроцианида [3611, 3712] так же, как и весовым путем или колориметрически с помощью хинальдиновой кислоты [3921], а также определять свинец нефелометрически в виде сульфида [32\ ЗЗ6, 346] или йодометрически через хромат [344, 4112].
ПРИЛОЖЕНИЕ
ПОЛУЧЕНИЕ ДИТИЗОНА
Дифенилтиокарбазон впервые был получен Е. Фишером [78, 82] синтезом из сероуглерода и фенилгидра-зина в три стадии:
H2NHNC6H5 /HNHNCoHj
S=C=S+ —> S-=C7
H2NHNC6H5 XSHH2NHNC6H5|
Соль фенплгидразина
p-фенилдитиокарбазиновой кислоты
zhnhnc6h5 zhnhnc6h5
8=С7 ——S=CZ +H2St
xsh-h2nhnc6h5 xhnhnc6h5
Дифенилтпокарбазид
2S=C
/HNHNQHs ^HNHNCgHs
KOH спиртовый Дисмутация
(la)
(Ila)
/N=NC6H5 zNH2
> S=CZ -: S-- c7 +H2NC6H5 (Illa)
HNiI\C0Hs XHNHNC6HS
Дифенилтиокарбазон Фенилтпокарбазид Анилин (дитизон)
Бамбергер и сотр. [26] получили дитизон из нитрометана и фенилдиазотата натрия следующим путем:
376
П риложение
(—R—арильный остаток, в данном случае — CeHs)
O2NCH3 + 2NaON2R Ni'°H -> сочетание
с (N2R)2
(IB)
Ди-Р-иитрокарбодиазон (ди-Р-нитроформазил)
С (N2R)2 + H2S + 8Н----------------
восстановление и замещение
> S=C (HNHNR)2 + NH3 + 2Н2О Ди-Р-тиокарбазид
(ди-Р-дигидрофор-мацилмеркаптан)
(Пв)
2S=C(HNHNR)2 zN=NR
КОН спиртовой Дпсмутация /NH2
-> S=CZ +H2NR + S=CZ
^HNHNR XHNHNR
Ди-Р-тиокарбазон R-амин R-тиокарбазид
(ди-Р-формазил-
меркаптан)
(IIlB)
Ирвинг и Бил [5214] рекомендовали другой способ получения дитизона, позволяющий весьма выгодно вводить в молекулу радиоактивную серу.
R
I
/СООН /N==N4
Cl— Cf-H 4-2N=N—R p Z 7— -> Cl—CZ 'H (Ic)
^N—N/
I
R со-Хлордифенил-формазан
XCOOH I Cl
Хлормалоновая Бензолдиазокислота нийхлорид
R I I
/N-Ms Ns,
Cl —CZ T1 + H—S—Na —> H—S— C/N~ 'H (He)
^N—n/ z
। XN—
R N
Дитизон
Получение дитизона
Указанный выше метод Фишера более подробно исследовали Грэммит и Стпкл [424], а также Бпллмэн и Клилэнд [436], которые улучшили выход дитизона. Ниже описывается способ получения, переработанный авторами, упомянутыми последними.
1, Соль фенилгидразина fi-фенилтиокарбазиновой кислоты (1а)
В трехгорлую колбу емкостью 1 л, снабженную пришлифованными мешалкой, капельной воронкой и обратным холодильником, вносят 128 мл чистого свежеперег-нанного фенилгидразина (уд. в. 1,097) и 600 мл этилового эфира. При сильном перемешивании добавляют то каплям в течение около получаса 52 мл сероуглерода (уд. в. 1,26), что соответствует приблизительно двум каплям в секунду. Как только реакционная смесь начитает закипать, следует охлаждать колбу ледяной водой.
После добавления всей порции сероуглерода реакционную смесь перемешивают еще в течение получаса. По-тученный осадок отсасывают, промывают 50 мл этило-юго эфира и раскладывают на фильтровальную бумагу ia 15—20 мин. для испарения эфира. Выход около 180 г.
2. Дифенилтиокарбазид (Па)
Полученную выше соль переносят в толстостенный :такан емкостью 1л и на водяной бане при погружении {агревают до 96—98° *. С помощью толстой загнутой шизу или с плоским концом стеклянной палочки непре-)ывно перемешивают от руки порошкообразное вещество. Через 10—15 мин. соединение расплавляется, желает, пенится и начинает выделяться сероводород. Че-юз 20—30 мин. происходит выделение аммиака. После юявления запаха аммиака вынимают из водяной бани стакан2, устанавливают на 1 мин. в чашку с холодной юдой и, наконец, с битым льдом3. Прибавляют 150 мл [бсолютного спирта, слабо нагревают для разрыхления 1ассы, после чего перемешивают до перехода блестя-цего продукта в кристаллический белый осадок. Смесь ютавляют на 1 час., выпавший осадок собирают на
378
Приложение
воронке Бюхнера и промывают 50 мл абсолютного этилового спирта. Выход 100—125 г сырого дифенилтиокарбазида 4.
Около 50 г сырого дифенилтиокарбазида растворяют в 900 мл этилового спирта при кипячении5 в течение короткого времени, раствор отфильтровывают горячим и охлаждают до 10—0°. Перекристаллизованное вещество отсасывают и промывают три раза по 20 мл бензола. Выход: 2—2,5-кратный около 35 г белого продукта, т. е. 40—50%-ный выход, отнесенный к однозамещенному фенилгидразину. Плавится при 145—150° с разложением.
Примечания
1 Следует обратить особое внимание на то, чтобы не перегревать выше 98°.
2 При отрегулированной температуре нагревания масса окрашена в оливково-зеленый или коричневый цвет. По охлаждении приобретает светло-коричневую окраску.
3 Если вещество, нагретое до 98°, сразу же не охлаждают после удаления из водяной бани, то наступает энергичное разложение его.
4 Сырой дифенилкарбазид желтого цвета и содержит, согласно Корвину и Джексону [499], значительное количество побочного продукта неизвестного до сих пор строения и легко растворимого в бензоле в противоположность карбазиду.
5 При длительном кипячении наступает разложение продукта [424].
3. Дифенилтиокарбазон (II 1а)
Чистый карбазид (около 90 а) вносят в круглодонную колбу емкостью 1 л, содержащую раствор, состоящий из 60 г едкого кали в 600 мл метилового спирта, нагревают с обратным холодильником на водяной бане и кипятят в течение 5 мин.1 Раствор быстро охлаждают и при помешивании2 доводят до pH 3—44, добавляя охлажденный льдом 1 н. раствор серной кислоты 3. Выпавший карбазон сине-черного цвета отсасывают и промывают водой.
Для переосаждения собранные порции карбазона растворяют в 500 мл 5%-ного раствора едкого натра, отсасывают, фильтрат подкисляют (pH 3—4) 1 н. раствором серной кислоты, фильтруют через нутч и хорошо промывают водой.
Получение дитизона
379
Отжатый осадок переносят в сосуд емкостью 2 л, прибавляют 1,5—2 л дистиллированной воды, основательно перемешивают и фильтруют. Эту операцию повторяют до тех пор, пока последняя порция промывных вод не покажет отрицательную реакцию на сульфат5. Через собранный на воронке Бюхнера сырой карбазон просасывают воздух в течение 20—30 мин. и затем высушивают при 40°.
Для очистки 5—10 г сырого карбазона помещают в экстракционный аппарат Сокстлета, покрывают этиловым эфиром, не содержащим перекисей, оставляют на один час и затем экстрагируют в течение 3 часов 6. Карбазон переносят в стакан, промывают 50 мл этилового эфира, по возможности сильно отжимают и сушат досуха между листами фильтровальной бумаги. Выход около 35 г дифенилтиокарбазона, что составляет около 40% от теории7.
Содержание действующего начала полученного дитизона превышает 98%, и он вполне чист для обычных аналитических целей 8. Требования к препаратам дитизона и их испытания приводятся на стр. 89.
Примечания
1 При продолжительном кипячении падает выход. Щелочной раствор также чувствителен к действию кислорода воздуха.
2 Раствор содержит соль щелочного металла дитизона и окрашен в темно-красный цвет.
3 Требуется от 900 до 1100 мл.
4 Раствор над осадком бесцветен.
5 В большинстве случаев требуется 4—5 промывок.
6 В присутствии примесей растворяется около 0,4 г дитизона в 1 л эфира.
7 Бильмэн и Клплэнд получили выход от 52 до 66% от теории. В атмосфере азота дпсмутация карбазида протекает до 96%, что можно установить по действующему началу карбазона.
8 Растворяют 18 г препарата с содержанием выше 94% в 1 л хлороформа при 30°, пропускают через складчатый фильтр и вносят при помешивании 3—4-кратное количество петролейного эфира, после чего дитизон выпадает в виде темных сине-черных спутанных игл. При 75 %-ном выходе полученный продукт практически 100%-ный.
При медленном выпаривании хлороформного раствора чистый дитизон получается в виде длинных, в несколько миллиметров, игл (см. рис. 1, стр. 16), которые вследствие небольшой поверхности весьма медленно растворяются в четыреххлорпстом углероде.
380
П риложение
АНАЛОГИ ДИТИЗОНА
Исключительное значение дитизона в качестве аналитического реагента побудило многих исследователей синтезировать родственные аналоги дитизона и аналитически их испытать, надеясь найти среди них соединения с улучшенными свойствами.
До настоящего времени большей частью по методам Фишера (см. стр. 375 сл.) или Бамбергера (см. стр. 376) были синтезированы следующие симметричные аналоги дитизона:
Мол.
вес.
1. Ди-/г-толилтиокарбазон [91]
2. Ди-о-толилтиокарбазон [91, 4611]
3. Ди-2,4-диметилфенилтиокарба-зон [4816]
4. Ди-а-нафтилтиокарбазон |432]
5. Ди-р-нафтилтиокарбазон [388, 432, 5411, 91]
6. Ди-^-дифенилтиокарбазон [432]
C15H16N4S 284,38
CI5H16N4S 284,38
c17h20n4s
C21HI6N4S
C2iH16N4S
c25h20n4s
312,40
356,44
356,44
408,51
Были запатентованы синтезы ди-л-карбоксифенил-пюкарбазона (Ci5H12O2N4S) и ди-/г-сульфанплфеиил-тиокарбазона (С13Н12ОбМ45з) [4846]. Благодаря рас-
творимости в водных средах эти соединения связывают тяжелые металлы, присутствующие в жидкостях в организме, и поэтому действуют в качестве противоядий (ср. также стр. 353).
По сравнению с дитизоном эти его аналоги и другие соединения с повышенным молекулярным весом характеризуются более высоким молярным коэффициентом экстинкции (вплоть до фактора 3), а также повышенным сродством к тяжелым металлам. К сожалению, их растворимость в водном растворе аммиака сильно падает, вследствие чего затруднена их очистка через соль щелочного металла [4910], и испытания по методу одноцветной окраски практически невозможны. Также воз
Аналоги дитизона
381
можно уменьшение селективности реакций в зависимости от pH растворов *.
Из аналогов дитизона до сих пор используются только для количественных определений ди-р-нафтил-тиокарбазон, именно для определения следов Zn2+ [435, 539], Cd2+ [443] и Hg2+ [402, 463] в биологическом материале. Реакция открытия тяжелых металлов с помощью этого соединения в 2—2,5 раза чувствительнее, чем с дитизоном [388, 5411]. См. дополнение редактора стр. 414 и сл.
* В некоторых же случаях, наоборот, селективность реакций повышается, например для ди-о-толилтиокарбазона [4611, 5710]. См. дополнение редактора на стр. 414 и сл. — Прим. ред.
ЛИТЕРАТУРА
Литературные ссылки приведены в хронологическом порядке, причем при перечислении их значимость работ не принималась во внимание. Две первые цифры каждой ссылки относятся к году опубликования работы, следующие цифры обозначают произвольный порядок внутри соответствующего года издания.
Сокращенные обозначения журналов даны в соответствии с принятыми в Periodica Chemica (Akademic-Verlag Gmb H., Berlin, а также Verlag Chemie, Weinheim BergstraBe, 2 Aufl., 1952).
Если в дополнение к ссылке на оригинальную работу цитируется ее реферат, то это означает, что автор пользовался последним.
[78] Fischer Emil, Uber die Hydrazinverbindungen (1. Abh.), Liebigs Ann. Chem., 190, 67—183 (1878).
[82] Fischer Emil, Be st horn E., Uber die Hydrazinverbindungen (3. Abh.), Liebigs Ann. Chem., 212, 316—333 (1882).
(91] Preu nd AL. Zur Kenntnis der Biazolone. Ber. dtsch. chem. Ges., 24, 4178—4204 (1891).
[25] Fischer Hellmuth, Die Aletallverbindungen des Diphenyl-thiocarbazons und ihre Verwendbarkeit fur die chemische Analyse. Wiss. Veroff. Siemens-Werken, 4, 158—170 (1925).
[26] Bamberger E., Padova R., Ormerod E., Uber Nitround Aminoformazyl. Liebigs Ann. Chem., 446, 260—307 (1926).
[28] Fischer H e 11 m u t h. Neuer empfindlicher Nachweis des Ko-baits mittels Diphenvlthiocarbazon. Wiss. Veroff. Siemens-Werken, 6, 147—149 (1928).
[29] Fischer Hellmuth, Uber den Nachweis von Schwermetallen mit Hilfe von Dithizon (Diphenyl-thiocarbazon). Angew. Chem., 42, 1025—1027 (1929).
[302] Fischer Hellmuth, Mikrochemischer Nachweis einiger Schwermetalle durch Tropfenreaktionen mit Dithizon (Diphenyl-Thiocarbazon). Mikrochemie, 8, 319—329 (1930).
[31’] Fischer Hellmuth, Die Erfassungsgrenzen fur den Nachweis einiger Schwermetalle durch Tropfenreaktion mit Dithizon. Wiss. Veroff. Siemens-Werken, 10, 99—107 (1931).
[312] В r e n n e i s H. J., Uber qualitative Afikroelektrolysen mittels kleiner Elektroden. Mikrochemie, 9, 385—394 (1931).
[321] Allport N. L., S k r i m s h i r e G. H., A New Method for the Determination of Lead in Organic Material, with Special Reference to Dyestuffs. Analyst, 57, 440—449 (1932).
Литература
383
[ЗЗ1] Rien acker G., Schiff W., Qualitative Analyse kleiner Mi-neralmengen. ('2. Mitt.), Uber den Nachweis kleiner Zinkmen-gen mit Dithizon. Z. anal\t. Chem., 94, 409—415 (1933).
[332] Fischer H e 1 1 m u t h, L e о p о 1 d i G r e t e, Die quantitative mikrochemische Bestimmung von Schwermetallen mit Dithizon (Diphenylthiocarbazon). I. Die Bestimmung des Bleis. II. Die Bestimmung des Kupfers. Wiss. Veroff. Siemens-Werken, 12, 44—60 (1933).
[334] Fischer Hellmuth, Dithizon als Hilfsmittel zum Nachweis von Schwermetallspuren. Angew. Chem., 46, 442—446
(1933).
[335] W б 1 b 1 i n g H., Steiger B., Zur Kenntnis der Dithizon-Reaktionen. Angew. Chem., 46, 279—281 (1933).
[336] Kent-Jones D. W., Herd C. W., The Determination of Lead in Acid Calcium Phosphate. Analyst, 58, 152—153 (1933).
[338] Fischer Hellmuth, Zur Kenntnis der Dithizon-Reaktionen. Angew. Chem., 46, 517 (1933).
[339] Kisser J., L e 11 m а у r K., LTntersuchungen fiber die Verwend-barkeit von Tiipfelreaktionen fur quantitative Zwecke. Mikro-chemie, 12, 235—256 (1933).
[331 °] Ross J. R., Lucas С. C., A New Method for the Detection and Estimation of Minute Amounts of Lead in Biological Materials. Canad. med. Assoc. J., 29, 649—650 (1933).
[ЗЗ11] В о h n e n к a m p H., L i n n e w e h W., Uber Bleivergiftung und Bleinachweis. Dtsch. Arch. klin. Med., 175, 157—169 (1933).
[3312] S eelkop f K., Taeger H., Quantitative Bestimmung kleiner Bleimengen. Z. ges. exp. Med., 91, 539—548 (1933).
[341] Fischer Hellmuth, Leopoldi G r e t e, Nachweis kleiner Zinkmengen mit Dithizon. Z. analyt. Chem., 97, 385—395 (1934).
[342J Fischer Hellmuth, Leopoldi Grete, Colorimetrische Bestimmung von Blei und Kupfer mit Dithizon. Angew. Chem., 47, 90—92 (1934).
[343] Fischer Hellmuth, Dithizon als Reagens in der qualitativen und quantitativen Mikroanalyse. Angew. Chem., 47, 685—692 (1934).
[344] Wichmann H. J., Murray C. W., Harris M., Clifford P. A., Loughrey J. FL, Vorhes jr. F. A., Methods for Determination of Lead in Foods. J. Assoc, off. agric. Chemists, 17, 108—135 (1934).
[345] E b 1 e K., Pfeiffer FL, Dithizonprobe zum Nachweis hocherhitzter Milch. Z. Unters. Lebensmittel, 68, 307—310 (1934).
[346] Lynch G R., Slate r R. H., О s 1 e r T. G., The Determination of Traces of Lead in Biological Materials, with Special Reference to Bone. Analyst, 59, 787—806 (1934).
[347] Haddock L. A., The Determination of Traces of Bismuth in Presence of Other Metals. Analyst, 59, 163—168 (1934).
[349j Вассерман II. С., С у п p у н о в и ч II. Б., Применение ди-фенилтпокарбазона (дитизона) для количественного определения металлов. Укр. хим. ж., 9, 330—340 (1934); Chem. Zbl., 106, II, 3268 (1935).
384
Литература
[34й] Sulkowitch Н. W., A Rapid Microchemical Method for the Detection of Lead in Biological and Other Organic Material with N, N'-Diphenylformazyl Mercaptan and N, N'-Diphenyldi-hydroformazyl Mercaptan. J. biol. Chemistry, 105, 88 (1934).
[3412] К a Sahara M., Kasahara T., Direkter Bleinachweis mit Diphenylthiocarbazon (Nachtrag zu dcr Arbeit: Zur Diagnose der Bleikrankheit bei Kindern). Klin, Wschr., 13, 1857—1858 (1934)
[35 4 Fischer H e 1 1 m u t h, W e у 1 W„ D ie Absorptionsspektren der Metallkomplexe des Dithizons und ihre analytische Bedeutung. Wiss. Veroff. Siemens-Werken, 14, 41—53 (1935).
[352] Fischer Hell mu th, Leopoldi Grete, Uslar H., Quantitative Bestimmung kleiner Silbermengen mit Dithizon. Z. analyt. Chem., 101, 1—23 .(1935).
[353] Fischer Hellmuth, Leopoldi Grete, Quantitative Bestimmung kleiner Quecksilbermengen mit Dithizon. Z. analyt. Chem., 103, 241-^257 (1935).
[354] Fischer Hellmuth, Leopoldi Grete, Zur Mikrobestim-mung des Bleis mit Dithizon. Z. ges. exp. Med., 97, 819—822 (1935)
[355] D e с к e r t W., Colorimetrische Zinkbestimmung mit Dithizon. Z. analyt. Chem., 100, 385—390 (1935).
[35 е] T о m p s e 11 S. L., A n d e r s о n A. B., The Lead Content of Human Tissues and Excreta. Biochem. J., 29, 1851—1864 (1935).
[357] R о s s J. R., L u c a s С. C., A New Method for the Determination of Minute Amounts of Lead in Urine. J. biol. Chemistry, 111, 285—297 (1935).
[358] G a r r a 11 D. C., Extraction of Lead by Means of Diphenylthiocarbazone. Analyst, 60, 817 (1935).
[359] Weyl W., Rudow H., Uber eine neue analytische Bestimmung der Bleiabgabe von Steingutglasuren mittels Dithizon. Ber. dtsch. keram. Ges., 16, 281—286 (1935).
[3510] Wichmann H. J., Clifford P. A., Determination of Lead, Particularly in Canned Foods. J. Assoc, off. agric. Chemists, 18, 315—327 (1935).
[3511] W i n к 1 e r W. O., Determination of Small Quantities of Mercury in Leafy Vegetables by Means of Diphenylthiocarbazone (Dithizone). J. Assoc, off. agric. Chemists, 18, 638—644 (1935).
[3512] Anonym. Determination of Bismuth in Copper. Analyst, 60, 554________55g (1935).
[3513] Haddock L. A., The Determination of Traces of Thallium in Presence of Other Metals. Analyst, 60, 393—399 (1935).
[3514] Sylvester N. D., Lampitt L. H., The Determination of Copper in Foods with Special Reference to Milk. Analyst, 60, 376—382 (1935).
[3515] Mehurin R. M., Report on Copper. J. Assoc, off. agric. Chemists IS 1Q9_________1Q4 (1Q45)
[3516] Winter О. B., Robinson, Helen M., Lamb, Frances W., Miller E. J., Determination of Lead. A. Modification of the Fischer-Leopoldi Method. Ind. Engng. Chem., analyt. Edit., 7, 265—271 (1935).
Литература
385
[3517] Kaiser Н., Wetzel Е., Moderne Hilfsmittel zu Untersuch-ungen von Arzneistoffen in hohen Verdiinnungen, Siiddtsch. Apotheker.-Ztg., 75, 148—151 (1935).
[3518] Wilkins E. S., jr., W i 1 1 о u g h b v С. E., Kraemer E. O., Smith F. L., Determination of Minute Amounts of Lead in Biological Materials. A Titrimetric-Extraction Method. Ind. Engng. Chem., analyt. Edit., 7, 33—36 (1935).
f3519] Wiloughby С. E., Wilkins E. S., jr., Kraemer E. O., Determination of Lead. Removal of Bismuth Interference in the Dithizone Method. Ind. Engng. Chem., analyt. Edit., 7, 285—‘286 (1935).
[3521] В e h r e n s B., Taeger H., Quantitative Bestimmung der Bleiausscheidung im Harn Gesunder und Bleikranker mit Dip-henylthiocarbazon. Z. ges. exp. Med., 96, 282—303 (1935).
[3522] Kraus J., Zyr Mikrobestimmung des Bleis. Z. ges. exp. Med., 95, 434—440 (1935).
[3523] Berg P., S ch me ch el S., Schnellverfahren zur Bestimmung von Arsen und Blei (Schadlingsbekampfungsmitteln) in Leben-smitteln. Z. Unters. Lebensmittel. 70, 52—60 (1935).
[361] Fischer Hellmuth, Leopoldi Grete, Nachweis und Bestimmung kleiner Zinkmengen mit Dithizon. Z. analyt. Chem., 107, 241—269 (1936).
[362] Biddle D. A., Recovering Chloroform from Used Dithizone Solutions. Ind. Engng. Chem., analyt. Edit., 8, 99 (1936).
[363] H о 1 s t e n K„ Technik und Bedeutung des Bleinachweises im SchuBbild. Angew. Chem., 49, 771 (1936).
[364] Fischer Philipp, Straller H., Uber den Nachweis des Bleis im Harn und im Stuhl. Dtsch. Apotheker-Ztg., 51, 1718 (1936).
[355] Strafford N., Colorimetric Analysis by the Photo-electric Cell. Analyst, 61, 170—177 (1936).
[366] Clifford P. A., W i c h m a n n H. J., Dithizone Methods for the Determination of Lead. J. Assoc, off. agric. Chemists, 19, 130—156 (1936).
[367] Cheftel H., Pigeaud Marie-Louise, Dosage de peti-tes quantites de plomb dans les matieres biologiques. Ann. Fal-sificat. Fraudes, 326, 76—92 (1936).
[368] S t о 1 z e E., Uber die Bestimmung kleinster Mengen Kupfer vornehmlich in Pflanzen. Bodenkunde u. Pflanzenernahr., 1, 115—132 (1936).
[369] Morton F., The Application of Diphenyl-Thiocarbazone (Dithizone) of the Estimation of Lead in Urine. Analyst, 61, 465—471 (1936).
[36,c] Schwarz G., Fischer Otto, Stotz H., Die Bestimmung von Metallen in Milcherzeugnissen. I. Mitt.; Die Bestimmung von Kupfer in Quark. Milchwirtsch. Forschg., 17, 314—325 (1936).
[3611] Sylvester N. D., Hughes E. B., The Determination of Zinc in Foods. Analyst, 61, 734—742 (1936).
[3612] Gangl J., Liedl E., Die Bestimmung kleiner Bleirnengen in Milch. Mikrochemie (Molisch-Festschrift), 1936, 147—153.
25 Зак. 2157.
Литература
386
[3613] R u s р i n i A., Einffihrung in die qualitative Mikroanalyse, 2. Teil (Span.), Chemia, 9, 286—296 (1936); Chem. Zbl., 1937, I, 135.
[3614] Harrold G. C, Meek S. F, Holden F. R., A Practical Method for the Rapid Determination of Lead when Found in the Atmosphere. J. ind. Hyg. Toxicol., 18, 724—732 (1936).
[3615] Ellis L., The Extraction of Lead by Means of Diphenylthiocarbazone. Analyst, 61, 178—179 (1936).
[3616] T о m p s e 11 S. L., The Determination of Lead in Potable Waters. Analyst, 61, 591—597 (1936).
[3617] W i c h m a n n H. J., Report on Metals in Foods. J. Assoc, off. agric. Chemists, 19, 210—219 (1936).
[3618] White W. E., Dithizone as an Analytical Reagent. J. chem. Educat., 13, 369—373 (1936).
[3619] White W. E., Dithizone as a Reagent for Dissolving and Determining Spray Residue Lead. Ind. Engng. Chem., analyt. Edit., 8, 231 (1936).
[3621] Евланова А. В., Колориметрическое определение свинца в растворах малых концентраций по схеме X. Фишера с применением цветных стеклянных скал, Ж. Прикл. Химии, сер. Б, 9, 1690—1696 (1936).
[3622] Lederer Е., Die Bleigefahrdung der Schriftsetzer. Arch. Ge-werbepathol. Gewerbehyg., 7, 331—377 (1936).
[371] Strohecker R., Rifiart H., Haberstock J., Die stu-fenphotometrische Bestimmung von В lei, Kupfer und Zink mit-tels Dithizon in Wassern und Lebensmitteln. Z. Unters. Leben-smittel, 74, 155—169 (1937).
[372] Sandell E. B., Determination of Copper, Zinc, and Lead in Silicate Rocks. Ind. Engng. Chem., analyt. Edit., 9, 464—469 (1937).
{373] Hibbard P. L., A Dithizone Method for Measurement of Small Amounts of Zinc. Ind. Engng. Chem., analyt. Edit, 9, 127—131 (1937).
[374] Fischer Hellmuth, Dithizonverfahren in der chemischen Analyse. Uberblick uber die Entwicklung der letzten Jahre. Angew. Chem., 50, 919—932 (1937).
[375] Fischer Hellmuth, Dithizonverfahren in der chemischen Analyse. Uberblick fiber die Entwicklung der letzten Jahre. Habintationsschrift, 1937, Technische Hochshule Berlin.
[376] Hubbard D. M., Determination of Lead. A Photometric Dithizone Method as Applied to Certain Biological Material. Ind. Engng. Chem., analyt. Edit., 9, 493—495 (1937).
[377] L i e b h a f s k у H. A., Winslow E. FL, Diphenylthiocarbazone (Dithizone) as an Analytical Reagent. J. Amer. chem. Soc., 59, 1966—1971 (1937).
[378] Steiger B., Ein Beitrag zur Kenntnis der Oberflachenreak-tionen, sowie fiber einige Umsetzungen in organischen Losungs-mitteln Mikrochemie, 22, 216—227 (1937).
[379] Schafer H., Qualitative Analysen und kolorimetrische Schat-zungen mit Hilfe der Jenaer Glastfipfelplatte. Mikrochim. Acta (Wien), 1, 144—153 (1937).
Литература
387
[3710] Schwarz G., Fischer Otto, Die Bestimmung von Metal-len in Milch und Milcherzeugnissen. II. Mitteilung. Die Bestimmung von Kupfer in Milch, Kondensmilch, Milchpulver, Rahm. Butter und Milchzucker. Milchwirtsch. Forsch., 18, 196—204 (1937).
[3711] F i s c h e r Hellmuth, Leopoldi Grete, Quantitative Bestimmung kleiner Mengen Cadmium mit Dithizon. Microchim. Acta (Wien), 1, 30—42 (1937).
[37!2] Perlman J. L., M e n s c h i n g J. E., Occurrence and Determination of Zinc in Maple Products. J. Assoc, off. agric. Chemists, 20, 627—631 (1937).
[3713] Miller C. F., Dithizone an Excellent Reagent for Lead. Chemist-Analyst, 26, 55 (1937).
[3714] Clifford P. A., Report on Lead. J. Assoc, off. agric. Chemists, 20, 191 — 194 (1937).
[3715] Evans R. N., D a v e n p о r t J. E., Small Chemical Changes in an Insulating Oil Associated with Oxidation. Ind. Engng. Chem., analyt. Edit, 9, 321—323 (1937).
[3716] Steiger B., Nachweis und Bestimmung metallorganischer Verbindungen, im besonderen von Bleitetraathyl und Nickelcarbonyl. Petroleum, 33, Nr. 27, 3—6 (1937).
[3717] Horwitt M. I\., Cowgill G. R., A Titrimetric Method for the Quantitative Estimation of Lead in Biological Materials. J. biol. Chemistry, 119, 553—564 (1937).
[371S] Perlman J. L., Determination of Lead in Maple Products. J. Assoc, off. agric. Chemists, 20, 622—627 (1937).
[3719] Kraft-Strom H., Wiilfert K., Sydnes O., Bleibestim-mungen im Gesamtblut. Biochem. Z., 290, 382—393 (1937).
[3720] Weber H., Zur Frage der Bleigefahrdung bei der Herstellung von, Lagerschalen aus Bleibronze. Reichsarbeitsblatt, 1937, TI. 3, Nr. 12, 294—295, Arbeitsschutz, Berlin.
[3721] CholakJ., Hubbard D. M., M c N а г у R. R., S t о г у R. V., Determination of Lead in Biological. Materials. Ind. Engng. Chem., analyt. Edit., 9, 488—490 (1937).
[3722] Heller K„, Kuhl a G., Ma ch e к F., Methode zur Bestimmung von Schwermetallsuuren in Mineralwassern. Mikrochemie, 23, 78—115 (1937).
[3723] Алексеев P. И., Определение ртути посредством дифенилтиокарбазона в присутствии других металлов, Зав. лаб., 6, 955—959 (1937).
[3724] Taeger Н., Schmitt Frida, Quantitative Bestimmung des Bleigehaltes von Blut und Kot bei Gesunden und Bleikranken mit Diphenylthiocarbazon. Z. ges. exp. iMed., 100, 717—735 (1937).
[381] S c h w a i b о 1 d J., В ley er B., Nagel G., Die Bestimmung kleiner Mengen Kupfer, Blei und Zink mit Dithizon, mit beson-derer Hinsicht auf ihre Bestimmung in biochemischen Materia-lien (I). Biochem. Z., 297, 324—331 (1938).
[382] Rohner F., Dithizon als Hilfsmittel in der Emissions-spektral-analyse. Llelv. chim. Acta, 21, 23—32 (1938).
[383] Grubitsch H., Sinigoj J., Uber die Genauigkeit der Dithi-zon-Mischfarbentitration. Z. analyt. Chem., 114, 30—38 (1938),
25*
388
Литература
[384] Hibbard Р. L., Estimation of Copper, Zine and Cobalt (with Nickel) in Soil Extracts. Ind. Engng. Chem., analyt. Edit., 10, 615—618 (1938).
[385] Hibbard P. L., The Symbol Dz to Signily Dithizon. Ind. Engng. Chem., analyt. Edit., 10, 179 (1938).
[386] Grubitsch H., Schnellkorrosionsprufung mittels Dithizon: Die Heifiwasserkorrosion von Zink. Angew. Chem., 51, 836 (1938).
[387J Abr ahamczik E., Zur Bestimmung geringer Mengen von Schwermetallen in Wassern. Mikrochemie, 25, 228—241 (1938).
[388] Супрунов и ч II. Б., Синтез динафтилтиокарбазона и образование внутрикомплексных солей его с тяжелыми металлами, Ж. общей химии, сер. А, 8, 839—843 (1938).
[389] Perlman J. L., Rapid Colorimetric Determination of Lead in Maple Sirup. Ind. Engng. Chem., analyt. Edit., 10, 134—135 (1938)).
[3810] S h i e 1 s D. O., A Rapid Simple Method for the Determination of Lead in Small Quantities of Urine. J. ind. Hyg. Toxicol., 20, 581—588 (1938).
[38й] Clifford P. A., Some Notes on the Stability of Dithizone Solutions. J. Assoc off. agric. Chemists, 21, 695—703 (1938).
[3812] Parri W., Lelli G. F., Micheli F., Die Bestimmung des Bleis in Organflussigkeiten. (Vorschlag zur Abanderung der Methode von Taeger). (Ital.). Rass. Med. appl. Lavoro ind., 9, 167—186 (1938); Chem. ZbL, 1939, II, 3320.
[3813] W e s t e r h о f f H., Die colorimetrische Bestimmung kleiner Blei- und Zinkmengen mit Dithizon. (Unter besonderer Beriick-sichtigung der Frage ihrer Anwendbarkeit fur die Untersuchung von Boden und Pflanzenaschen.) Bodenkunde u. Pflanzener-nahr., 7, 370—384 (1938).
[3814] Harrold G. C., Meek S. F., Holden F. R., Note on ’A Practical Method for the Rapid Determination of Lead when Found in the Atmosphere’. J. ind. Hyg. Toxicol., 20, 589 (1938).
[3815] Fairhall L. T., Precision Methods in the Determination of the Heavy Metals. Amer. J. publ. Health Nation’s Health, 28, 825—831 (1938).
[3816] Moskowitz S., Burke W. J., Method for the Analysis of Dust and Fumes for Lead and Zinc. J. ind. Hyg. Toxicol., 20, 457—464 (1938).
[3817] Strohecker R., Riffart H., Die stufenphotometrische Bestimmung von Blei, Kupfer und Zink mittels Dithizon in Wassern und Lebensmitteln (Nachtrag), • Z. Unters. Lebensmittel, 75, 43—44 (1938).
[381*] Алексеев P. И., Определение ртути и серебра посредством дитизона в присутствии других металлов, Зав. лаб., 7, 415— 417 (1938).
[3819] Winkler W. О., Report on Mercury, J. Assoc, off. agric. Chemists, 21, 220—228 (1938).
[3820] Schmitt Frida, Basse W., Quantitative Bleibestimmung in biologischem Material: Modifizierte Dithizon-Methode. Nau-nyn-Schmiedebergs Arch. exp. Pathol. PharmakoL, 189,, 169—171 (1938).
Литература
389
[3821] С a u g h е у R. A., Holland Е. В., Ritchie W. S„ Report on Zinc. J. Assoc, off. agric. Chemists, 21, 204—207 (1938).
[3822] Clifford P. A., Report on Lead. J. Assoc, off. agric. Chemists, 21, 212—218 (1938).
[3823] L a u g E. P., Application of the Dithizone Method to the Determination of Lead in Biological Materials. J. Assoc, off. agric. Chemists, 21, 481—487 (1938).
Г3824] Fischer Hellmuth, Leopoldi Grete, Reinheitsuntersu-chungen mit dem Dithizon-Verfahren. I. Bestimmung von Ve-runreinigungen in Zink und Zinklegierungen. Metall u. Erz, 35, 86—88 (1938).
[3825] Willoughby С. E., Wilkins E. S.. jr., The Lead Content of Human Blood. J. biol. Chemistry, 124, 639—657 (1938).
[3826] Fischer, Hellmuth, Leopoldi Grete, Reinheitsunter-suchungen mit dem Dithizon-Verfahren. I. Bestimmung von Verunreinigungen in Zink und Zinklegierungen. Metall u. Erz, 35, 119—121 (1938).
[3827] Reith J. F., Van Dijk С. P., Die Mikro-Bleibestimmung in Urin (Holl.). Chem. WeekbL, 35, 671—677 (1938).
[3828] M u 1 1 e r H., Neue Untersuchungen fiber die Mikro-Verfahren zur Bleibestimmung mittels Elektrolyse und Dithizon. Z. analyt. Chem., 113, 161—182 (1938).
[3830] T a e g e г H. X., Ober die Bewertung des Bleigehaltes von Blut, Stuhl und Urin bei der Diagnose oder Bleivergiftung und bei der Begutachtung Bleikranker. Ergebnisse der inneren Medizin und Kinderheilkunde, 54, 459—526 (1938).
[3831] Gant V. A., Lead Poisoning.-Section I. Exposures to Lead; Its Absorption, Transportation, Distribution, and Deposition in the Tissues; the Photometric Dithizone Method as an Accurate Means of Determination; “Normal” Lead in Tissues and Urine; “Normal” Value in Blood. Ind. Medicine, 7, 608—622 (1938).
[3834] Lichtenegger F., Einzelheiten beim Ablauf der Dithizon-reaktion mit Blei. Dissertation, 1938, Medizin. Fakultat der Universitat Miinchen.
[391] G a d G., Naumann Kate, Der Nachweis und die colorime-trische Bestimmung von Zink in Wasser mit Dithizon. Gas-und Wasserfach, 82, 168—169 (1939).
[392] Holland E. B., Ritchie W. S., Report on Zinc. J. Assoc, off agric. Chemists, 22, 333—338 (1939).
[393] В a mb a ch K., Determination of Lead by Dithizone. Modifications and Improvements of the Hubbard-Clifford-Wichmann Method as Applied to Biological Material. Ind. Engng. Chem., analyt. Edit., 11, 400—403 (1939).
[394] Hubbard D. M., Determination of Bismuth in Biological Material. A Photometric Dithizone Method Ind. Engng. Chem., analyt. Edit., 11, 343—345 (1939).
[395] Wichmann H. J., Isolation and Determination of Traces of Metals. The Dithizone System. Ind. Engng. Chem., analyt. Edit, 11, 66—72 (1939).
[396] San dell E. B., Determination of Cadmium in Silicate Rocks Ind. Engng. Chem., analyt. Edit., 11, 364—365 (1939),
390
Литература
[397] Ashley S. Е. Q., Spectrophotometric Methods in Modern Analytical Chemistry. Ind. Engng. Chem., analyt. Edit., 11, 72—79 (1939).
[39s] Reith J. F., Van D i j к С. P., Die Titration von Wismut mit Dithizon (Holl.). Chem. Weekbl., 36, 343—344 (1939).
[399] Panouse-Pigeaud, Marie-L., Cheftel H., Elimination du fer a 1’aide de cupferron dans le dosage colorimetrique du plomb par la dithizone. Ann. Falsificat Fraudes, 32, 296— 301 (1939).
[3910] Hurst W. W., Dithizone Method for the Determination of Lead. Commonwealth Australia, Council sci. ind. Res. Pamphl. Nr. 2, 108—119 (1939).
[3911] Murray R. E., Stephens I. F., A Method for the Estimation of Lead in Biological Materials. Commonwealth Australia, Council sci. ind. Res. Pamphl. Nr. 2, 95—107 (1939).
[3912] В ley er B., Nagel G., Schwaibold J., Die Untersuchun-gen homdopathischer Zubereitungen mit Dithizon. Scientia pharmac., 10, 121 — 124 (1939).
[3913] Vogelenzang F. H., Das Vorkommen von Zink in Men-schenblut (Holl.). Pharmac. Weekbl., 76, 89—99 (1939).
[3914] Куз я th на H. С., Метод количественного определения ртути в воздухе дитизоном, Зав. лаб., 8, 174—177 (1939).
[3915] Craig D. N., Vinal G. W., Solubility of Lead Sulfate in Solutions of Sulfuric Acid, Determined by Dithizone with a Photronic Cell. J. Res. nat. Bur. Standards, 22, 55—70 (1939).
[3916] Numata L, Matsukawa D., Uber die colorimetrische Mikrobestimmung des Kupfers. J. Biochemistry [Tokyo], 30, 395—399 (1939).
[3917] Reith J. F., Van Dijk С. P., Der Bleigehalt von Urin und seine Bedeutung fiir die klinische Diagnose bei Bleivergiftung (Holl.). Nederl. Tijdschr. Geneeskunde, 83, 1584—1591
(1939)
[3918] П p и x н я В. M., Количественное определение свинца в воздухе при помощи дитизона, Зав. лаб., 8. 283—286 (1939).
[3919] Llacer A. J., Mikrobestimmung von Quecksilber in organi-schen Fliissigkeiten und Geweben. I. Bestimmung im Urin (Span.) An. Asoc. quim. argent., 27, 49—63 (1939); Chem. Zbl., 1939, II, 3730—3731.
[3920] Sandell E. B., Perl i ch R. W., Determination of Nickel and Cobalt in Silicate Rocks. Ind. Engng. Chem., analyt. Edit., 11, 309—311 (1939).
[3921] Allport N. L., Moon C. D. B., The Determination of Traces of Zinc in Biological Materials and Natural Waters. Analyst, 64, 395—402 (1939).
[3922] T 0 m p s e 11 S. L., CL. The Determination of Lead in Biolo^ gical Materials. Biochem. J., 33, 1231 — 1236 (1939).
[3923] Guettel Ch. L., A Photelometric Study of the Lead-Dithizone Svstem at 610 Millimicron. Ind. Engng. Chem., analyt. Edit., 11. 639—640 (1939),
Литература
391
[3924] Merck Е., Priifung der chemischen Reagenzien auf Reinheit. 5. Aufl.,. E. Merck, Darmstadt 1939.
[3925] Reith J. F., Van Dijk С. P., Uber die Spezifitat der Blei-bestimmung mit Dithizon, insbesondere neben Thallium und Wismut (Holl.). Chem. Weekbl., 36, 341—343 (1939).
[3926] Stout P. R., Ar non D. I., Experimental Methods for the Study of the Role of Copper, Manganese, and Zinc in the Nutrition of Higher Plants. Amer. J. Botany, 26, 144—149 (1939).
[3927] Barnes E. C., Possibilities of Control of Lead Exposure by Examining Less than 24-Hour Urine Samples. J. ind. Hyg. Toxicol., 21, 464—468 (1939).
[401] Muller W., Sieverts A., Gewichtsanalytische, colorimet-rische und spektralanalytische Verfahren zur Bestimmung von Cadmium, Kupfer, Eisen und Blei in Zinc. Spectrochim. Acta [Berlin], 1, 332—351 (1940).
[402] Hubbard D. M., Determination of Mercury in Urine. A Photometric Method Using a New Reagent, Di-beta-Naphtyl-thiocarbazone. Ind. Engng. Chem., analyt. Edit., 12, 768—771 (1940).
[403] Fischer Hellmuth, Leopoldi Grete, Zur Bestimmung kleiner Bleimengen mit Dithizon. Z. analyt. Chem., 119k, 161— 188 (1940).
[404] Fisc ke r Hellmuth, Leopoldi Grete, Rasche Vorpru-fungen auf Schwermetalle mit Dithizon in der qualitativen Analyse. Chemiker-Ztg., 49/50, 231—233 (1940).
[405] Assaf A. G., Hollibaugh W. C., Determination of Copper in Mineral Oils. Titrimetric Extraction. Using Dithizone. Ind. Engng. Chem., analyt. Edit., 12, 695—697 (1940).
[406] Fischer Hillmuth, Studien uber den Reaktionsbereich organischer Reagenzien in der Metallanalyse. Wiss. Veroff. Siemens-Werken, Werkstoff-Sonderheft, 217—229.
[407] S t о n e s t r e e t G. O., Wright G. F., Microchemical Technique. IV. The Microdetermination of Mercury and Halogen in Organomercuric Halides, Canad. J. Res., Sect. B, 18, 246—251 (1940).
[408] Reith J. F., Van Dijk С. P., Das Dithizon und seine An-wendung. I. Allgemeine Eigenschaften (Holl.). Pharmac. Weekbl., 77, 813—818 (1940).
[409] Van Dijk С. P., Das Dithizon und seine Anwendung. II. Die Bestimmung von Kupfer, Zink und Blei in Trinkwasser (Holl.). Pharmac. Weekbl., 77, 842—850 (1940).
[4010] Reith J. F., Van Dijk С. P., Das Dithizon und seine Anwendung. III. Untersuchung von homoopathischen Heilmitteln (Holl.). Pharmac. Weekbl., 77, 865—868 (1940).
[4011] Scharrer K., Kuhn H., Die Dithizon-Mischfarbenmethode und ihre Anwendung bei der Bestimmung kleinster Mengen Kupfer in Boden und biochemischen Substanzen. Bodenkunde u. Pflanzenernahr., 21/22, 344—364 (1940).
[4012] Кол оду б П. А., Определение цинка в оловянпстых баббитах дитизоновым методом, Зав. лаб., 9, 514—518 (1940).
392
Литература
[4013] V a n Duuren A. J., Mischfarben-Colorimetrie mit Dithizon (Holl.). Chem. Weekbl., 37, 269 (1940).
[IO14] Reith J. F., Van Dijk С. P., Die Mikrobestimmung von Quecksilber in biologischen Material bei chronischen Vergif-tungen (Hol!.). Chem. Weekbl., 37, 186 bis 193 (1940).
[4015] Bambach K., Estimation of Traces of Lead and Thallium in Pharmaceutical* Chemicals. A Simple Dithizone Limit Test. Ind. Engng. Chem., analyt. Edit., 12, 63—66 (1940).
[4017] Ken ch J. E., The Determination of Minute Amounts of Lead in Urine. Biochem. J., 34, 1245—1247 (1940).
[4018] Marston H. R., Dewey D. W., The Estimation of Cobalt in Plant and Animal Tissues. Austral. J. exp Biol. med. Sci., 18, 343—352 (1940).
[4019] Winkler W. O., Report on Alercury. J. Assoc, off. agric. Chemists, 23, 310—313 (1940).
[41 '] S m i t h F. L, 2nd., Rathmell T. K., Williams T. L., The Determination of Lead in Biological Materials. Amer. J clin. Pathol., IL 653—668 (1941).
[412] Kozel ka F. L., Kluchesky E. F., Photoelectric Colorimetric Technique for the Dithizone System. Ind. Engng. Chem., analyt. Edit., 13, 484—487 (1941).
[413] Kolthoff I. M., San de 11 E. B., A Quantitative Expression for the Extractability of Metals in the Form of Dithizona-tes from Aqueous Solutions. The Equilibrium Constant in Zinc Dithizonate. Preliminary Paper. J. Amer. chem. Soc., 63, 1906-1908 (1941).
[414] С о w 1 i n g H., M i 1 1 e r E. J., Determination of Small Amounts of Zinc in Plant Materials. A Photometric Dithizone Method. Ind. Engng. Chem., analyt. Edit., 13, 145—149 (1941).
[415] Choi a к J., Bambach K., Determination of Lead in Biolo-
gical Aiaterial. A Polarographic Method. Ind. Engng. Chem., analyt. Edit., 13, 583—586 (1941).
Bambach К., C h о 1 a к J., Electrolytic Deposition of Lead from Biological Material. Ind. Engng. Chem., analyt. Edit., 13, 504—505 (1941).
[416]
[419]
[41ln]
[41"]
Van Gils H. W. G., H a g e t h о r n N. E. M., Untersuchung uber die Metallaufnahme durch Isolierole wahrend der Oxyda-
tion und der EinfluB hiervon auf die elektrischen Eigenschai-
ten (Holl.). (1941).
Ingenieur [’s-Gravenhage], 56, Nr. 19, E 61—66
Fischer Hellmuth, L e o*p о 1 d i Grete, Reinheitsunter-suchungen mit dem Dithizon-Verfahren. II. Bestimmung von Quecksilber in Zink, Blei, Kadmium, Wismut, Silber und Kup-fer. Metall u. Erz, 38, 154—157 (1941).
Van Zwet W. L. C., Duran J. C., Die Bestimmung von kleinen Mengen Quecksilber (Holl.). Chem. Weekbl., 38, 186— 193 (1941).
[4112] Fairhall L. T., Keenan R. G., A Rapid Method for the Microanalysis of Lead., J. Amer chem. Soc., 63, 3076—3079 (1941).
Литература
393
[4113] Kozel к a F. L., Kluchesky Е. F., Determination of Lead in Biological Material. A Mixed Color Dithizone Method, Ind Engng. Chem., analyt. Edit., 13, 492—494 (1941).
[4115] Greenleaf C. A., Report on Copper, J. Assoc, off. agric. Chemists, 24, 337—348 (1941).
[421] Fischer, Hellmuth, Passer M., Leopoldi, Grete, Sammelreferat. Dithizon-Verfahren in der mikrochemischen Analyse. Uberblick uber die Entwicklung der vier letzten Jahre. Mikrochemie, 30, 307—328 (1942).
Г422] Fischer Hellmuth, Studien uber den Reaktionsbe-reich organischer Reagentien in der Metallanalyse. Mikrochemie, 30, 38—56 (1942).
[423] Amberger K., Ein qualitativer Nachweis von Brom mittcis Dithizon. Chemiker-Ztg., 66, 410 (1942).
[424] G rummitt O., Stickle R., Preparation of Diphenylthiocarbazide and Diphenylthiocarbazone (Dithizone). Ind. Engng. Chem., analyt. Edit., 14, 953—954 (1942).
[425] В a mb a ch K., Burkey R. E., Microdetermination of Lead by Dithizone. With an Improved Lead-Bismuth Separation. Ind. Engng. Chem., analyt. Edit., 14, 904—907 (1942).
[426] Sherman G. D., McH argue J. S., Methods for Determination of Copper and Zinc in Soil. J. Assoc, off. agric. Chemists, 25, 510—515 (1942).
[427] Schwaibold J., Die Bestimmung kleiner Mengen Kupfer, Blei und Zink mit Dithizon, mit besonderer Hinsicht auf ihre Bestimmung in biochemischen Materialien. Forschungsdienst Sonder-H., 16, 745—746 (1942).
[428] Gray, Th os D., Determination of Lead in Sugars and Sugar Products. An Adaptation of the Diphenylthiocarbazone Reaction. Ind. Engng. Chem., analyt. Edit., 14, 110 bis 114 (1942).
[429] L a u g E. P., Nelson K. W., Report on Mercury. J. Assoc, off. agric. Chemists, 25, 399—402 (1942).
[4210] V a n Dijk С. P., Der gesamte Bleigehalt von Urin (Holl.). Nederl Tijdschr. Geneeskunde, 86, 3141—3146 (1942).
[4211] Greenleaf C. A., Report on Copper. J. Assoc, off. agric Chemists. 25, 385—392 (1942).
[4212] Biefeld L. P., Patrick T. M., Extraction of Metals from Aqueous Solutions with Dithizone. Ind. Engng. Chem., analyt. Edit., 14, 275—278 (1942).
[4213] Braadlie O., Bergh H., Colorimetrische Bestimmung von Blei, Kupfer, Zink, Mangan und Eisen in Boden, Pflanzenteilen. Nahrungsmitteln usw. (Norweg.). Tidskr. Kjemy Bergv., Metallurg. 2, 88—89 (1942); Chem. ZbL 1943, II, 345.
[4214] Kuroda K-, Determination of the Minute Quantities of Silver in Mineral Waters by the Dithizone Method Bull. chem. Soc. Japan, 17, 419—423 (1942).
[4215] Rosenquist I. Th., Determination of Lead in Silicate Rocks. Amer. J. Sci., 240, 356—362 (1942).
[4216] Kluchesky E. F., Longley B. J., Kozel к a F. L., A Mixed Color Dithizone Method for the Determination of Bis-
394
Литература
ninth in Biological Material. J. Pharmacol, exp. Therapeut., 74, 395-400 (1942).
[4217] V a п о s s i R.. Die Charakferisierung des Zink-Ions mit Dithizon. (Span.). An. Soc. Cient. Argent. 134, 73—85 (1942); Chem. Abstr., 37, 579 (1943).
[4218] Marriott W. R. V., A Comparison of the Methods of Analysis for Lead in Urine. Amer. J. din. Pathol., 12, 488'—492
(1942).
[43']
[438]
[№]
[43']
[43=]
[43=]
[43']
[43«]
[43=]
Bergner K. G., Bergner J., Vorschlage zum Nachweis von Arzneistoffen in homoopathischen Zubereitungen. IV. Mit-teilung: Nachweis von Brom und Bromid in Verdiinnungen. Dtsch. Apoth.-Ztg., 58, 266—267 (1943).
Hubbard D. M., Scott E. W., Synthesis of Di-beta-naphthyl-thiocarbazone and Some of its Analog. J. Amer. chem. Soc., 65, 2390—2393 (1943).
Fischer, Hellmuth, Leopoldi, Grete, Colorimetrische Schnellmethode fur die Zink-Bestimmung in Aluminium-Umsch-melzlegierungen nach dem Dithizon-Verfahren. Aluminium, 25, 356—357 (1943).
Erametsa O., Die Chromatographie der Metalle als Diphe-nvlthiocarbazonkomplexe. Suomen Kemistilehti, 16B, 13—14 (1943).
Cholak J., Hubbard D. M., Burkey R. E., Determination of Zinc in Biological Material, Photometric and Polaro-graphic Methods Following Extraction with Di-beta-naphthyl-thiocarbazone. Ind. Engng. Chem., analyt. Edit., 15, 754—759 (1943).
Billman J. H., Cleland, Elizabeth S., An Improved Method for the Preparation of Dithizone (Diphenylthiocarbazone). J. Amer. chem. Soc., 65, 1300—1301 (1943).
Kaye S., A Rapid Microanalytical Method for Lead in Urine. J. Lab. clin. Med., 28, 1171—1174 (1943).
Clifford P. A., Report on Lead. Dithizone Method and Its Interferences. J. Assoc, off. agric. Chemists, 26, 26—53 (1943).
Schultz J., Goldberg M. A., Photometric Routine Estimation of Traces of Lead , by Dithizone. Application to Materials Used in the Manufacture of Cosmetics. Ind. Engng. Chem.,
analyt. Edit., 15, 155—158 (1943)
[43ю] Wattenberg H., Zur Chemie d es Meerwassers. Uber die in Spuren vorkommenden Elemente. Z. anorg. allg. Chem., 251» 86—91 (1943).
[4311] Steigmann A., Specific Tests for Mercury with Dithizone Membrane Papers. J. Soc. Chem. Ind., 62, 43—44 (1943).
[4312] Eckert H. W., Microdetermination of /Mercury in Organic Compounds. Ind. Engng. Chem., analyt. Edit., 15, 406—407 (1943).
[4313] M а г e n T. H., A Simple and Accurate Method for the Determination of Mercury in Biologic Material. J. Lab. clin. Med., 28, 1511—1514 (1943).
[441] Mesnard P., Emploi de la dithizone en analyse qualitative et en analyse quantitative. Application a la pharmacie et а Да
Литература
395
toxicologie. Bull. Trav. Soc. Pharmac. Bordeaux, 82, 90—102 (1944).
[442] Kartiim G., Finckh B., Uber die Zink-Bestimmung mit Dithizon. Eine photometrische Mischfarbenmethode. Angew. Chem., 57, 73—74 (1944).
[443] Cholak J., Hubbard D. M., Determination of Cadmium in Biological Material. Spectrographic, Polarographic, and Colorimetric Methods. Ind. Engng. Chem., analyt. Edit., 16, 333—336 (1944).
[444] Buch K., Dithizon-Methoden zur Bestimmung von Zink und Kupfer in natiirlichen Wassern (Schwed.). Finska Kemistsam-fundets Medd., 53, Nr. 1—2, 25—37 (1944); Chem. Abstr., 41, 3891 (1947).
[445] Kamerm an P. A. E., The Toxicological Determination of Thallium. J. South African chem. Inst., 27, Nr. 2, 22—24 (1944).
[446] Beaumont F. T., Dithizon as a Microchemical Reagent. Me-tallurgia [Manchester], 29, 217—220 (1944).
[447] S h i r a e f f D. A., Determination of Mercury in Textiles Mel-dew-Proofed with Organo-Mercuric Compounds. Amer. Dyestuff Reporter, 33, 310 u. 315 (1944).
[448] LI ace r A. J., Nachweis von Silber, Blei und Quecksilber. Cha-rakteristische Mikrokristallreaktionen mit Diphenylthiocarbazon (Dithizon) und Pyridin (Span.). An. Asoc. Quim. Argent, 32, 18—30 (1944).
[449] Knapp В. B., A Rapid Determination of Copper in Nickel Plating Baths. Proc. Amer. Electroplaters Soc., 1944, 109—112.
[4410] Steinmetz, Celesta A., Green M. W., The Estimation of Small Amounts of Lead in National Formulary Preparations by the Dithizone Method. J. Amer, pharmac. Assoc., sci. Edit., 33, 213—217 (1944).
[451] Strafford N., Wyatt P. F., Kershaw F. G., A Scheme for the Photometric Determination of Minute Amounts of Arsenic, Copper, Lead, Zinc and Iron (with Certain Other Metals) in Organic Compounds, e. g., Medicinals, Analyst, 70, 232—246 (1945).
[452] Holmes R. S., Determination of Total Copper, Zinc, Cobalt, and Lead in Soils and Soil Solutions. Soil Sci., 59, 77—84 (1945).
[453] Buch K., Koroleff F., Gleichgewichtsstudien an Blei- und Alkalidithizonaten (Schwed.). Finska Kemistsamfundets Medd., 54, 98—110 (1945); Chem. Abstr., 44, 8750 (1950).
[454] Bricker L. G., Weinberg S., Proctor K. L., Application of Colorimetry to the Analysis of Corrosion-Resistant Steels. Determination of Zinc. Ind. Engng. Chem., analyt. Edit., 17, 661—663 (1945).
[455] Klein A. K., Wichmann H. J., Report on Cadmium. J. Assoc. off. agric. Chemists, 28, 257—269 (1945).
[456] Y a о Y., Determining Traces of Bismuth in Copper by Means of Dithizone. Ind. Engng. Chem., analyt. Edit., 17, 114—115 (1945).
306
Литература
[457] Beaumont F. Т., The Detection and Determination of Small Quantities of Mercury. Metallurgia [Manchester], 31, 151 — 154 (1945).
[458] Greenleaf C. A., Report on Copper. J. Assoc, off. agric. Chemists, 28, 269—271 (1945).
[459] Reith J. F., G e r r i t s m a K. W., Photometric Determination of Microquantities of Mercury as Mercury Dithizonate. Recueil Trav. chim. Pays-Bas, 64, 41—46 (1945).
[4510] Winkler W. O., aus: Association of Official Agricultural Chemists, 6, Edit. Washington 1945, S. 29, 45.
[4511] Kamerm an P. A. E., Metallic Poisons; a System of Analysis. South African J. Sci., 41, 165—171 (1945).
[4512] Ellis G. H., Thompson J. F., Determination of Cobalt in Biological Materials with Nitrosocresol. Ind. Engng. Chem., analyt. Edit., 17, 254—257 (1945).
[4513] Bricker L. G., Proctor K. L., Application of Colorimetry to the Analysis of Corrosion-Resistant Steels. Determination of Lead. Ind. Engng., analyt. Edit., 17, 511—512 (1945).
[4514] Savoy J., Dosage du mercure au moyen de a dithizone. Ind. chimique, 32, 146—147 (1945).
[4515] Levine L., Fahy J. P., Evaluation of Urinary Determinations. I. The Significance of the Specific Gravity. J. ind. Hyg. Toxicol., 27, 217—223 (1945).
[46!] Morrison S. L., Paige H. L., Modified All-Dithizone Method for Determination of Traces of Copper. Ind. Engng. Chem., analyt. Edit., 18, 211—213 (1946).
[462] Fischer, Hellmuth, Leopoldi, Grete, Qualitative Analysengange und Gruppenreaktionen mit Dithizon. Siemens & Halske A. G., Abt. f. Elektrochemie, Berlin — Siemensstadt, Sept. 1946 (частное сообщение).
[463] C h о 1 a к J., Hubbard D. M., Microdetermination of Mercury in Biological Material. Ind. Engng Chem., analyt. Edit., 18, 149—151 (1946).
[464] Brown E. A., Nomographic Procedure for a Two-Component Colores System. Copper in a Nickel Plating Bath. Ind. Engng. Chem., analyt. Edit., 18, 493—495 (1946).
[465] Barnes H., The Determination of Mercury and Copper in Anti-fouling Compositions: Potassium Cobalticyanide as Complex-forming Agent in Dithizone Technique, Analyst, 71(, 578— 583 (1946).
[466] Barnes H., The Estimation in Sea-Water Solutions of MicroQuantities of Mercury in the Presence of Copper by Means of Dithizone. J. Marine biol. Assoc. United Kingdom, 26, 303—311 (1944—1947).
[467] Бабко А. К- и Пилипенко A. T., О применении дифенилтиокарбазона (дитизона) в анализе, Ж. анал. химии, 1, 275—281 (1946).
[468] Smith G. F., Destruction of Organic Matter in Blood Fibrin and Chromacized Medical Catgut by Wet Oxidation. Determination of Iron in Blood and of Chromium in Sutures. Ind. Engng. Chem., analyt. Edit., 18, 257—259 (1946).
Литерач ура
397
[46‘3] Heertjes Р. М., Eine spektrographische Methode zur quan-titativen Bestimmung geldster, in Salzform vorliegender kleiner Mengen Kupfer und Blei (Holl.). Chem. Weekbl., 42, 91—95 (1946).
[46k0] Young R. S., Strickland E. H., Leibowitz A., The Rapid Determination of Small Quantities of Nickel with Dithizone. Analyst, 71, 474—476 (1946).
[4611] Супрунов и ч И. Б. и Шамшин Д. Л., Синтез о-дито-лилтиокарбазона и исследование его аналитических свойств., Ж. анал. химии, 1, 198—205 (1946).
[4613] Y о u n g R. S., Leibowitz A., The Determination of Lead in Copper, Nickel and Cobalt by Dithizone. Analyst, 71, 477— 479 (1946).
[47!] Silverman L., Aqueous Lead Dithizone Color Standards. Analytic. Chem., 19, 698 (1947).
[47й] M i 11 о n R. F., Hoskins J. L., The Estimation of Traces of Mercury in Urine. Analyst, 72;, 6—10 (1947).
[473] Greenleaf C. A., Determination of Copper in Foods by a Two-Color Dithizone-Method. J. Assoc, off. agric. Chemists, 30, 144—152 (1947).
[474] Бабко A. К., Пилипенко A. T., К применению дифенилтиокарбазона (дитизона) в анализе. II. Константы нестойкости дитизонатов цинка, кадмия и свинца, Ж. анал. химии, 2, 33—42 (1947).
[475] Serfass Е. J., Levine W. S., Analytical Application of Sodium Bis (2-hydroxyethyl) -dithiocarbamate. Chemist-Analyst, 36, 55—57 (1947)
[476] Young R. S., The Determination of Zinc in Metallic Cobalt by Dithizone. Metallurgia (Manchester), 36, 347—348
(1947).
[477] Church F. W., A Mixed Color Method for the Determination of Cadmium in Air and Biological Samples by the Use of Dithizone. J. ind. Hyg. Toxicol., 29, 34—40 (1947).
[478] KI ein A. K-, Report on Cadmium. J. Assoc, off. agric. Che-mists, 30, 455—456 (1947).
[479] Tar bell D. S., В unnet J. F., The Reaction between Arsenicals and Di-(p-biphenyl)-thiocarbazone. J. Amer. chem. Soc., 69, 263—265 (1947).
[4710] Barnes H., The Determination of Mercury by Means of Dithizone. Analyst, 72, 469—472 (1947).
[4711] Serfass E. J., Levine W. S., Extraction Methods Applied to the Analysis of Electroplating Baths and Determination of Zinc and Other Impurities in Nickel Solutions, Monthly Rev. Amer. Electro-Platers’ Soc., 34, 1046 (1947).
[4712] Snyder L. J., Improved Dithizone Method for Determination of Lead. Mixed Color Micromethod at High pH- Analytic. Chem., 19, 684—687 (1947).
[4713] Maltbv J. G., A Volatile Compound of Copper. Nature [London], 160, 468 (1947).
[4714] Wei ch er F. J., Organic Analytical Reagents. Vol. III. D. Van Nostrand Comp., Inc., 1947, 2. Printing.
, 398
Литература
[4716] Kozel к a F. L., Determination of Mercury in Biological Material. Analytic. Chem., 19, 494—496 (1947).
[481] Vanossi R., Der Nachweis von Quecksilber (Span.). An. Asoc. quim. argent., 36, 93—119 (1948); Chem. Abstr., 44, 10592 (1950).
[482] Shirley R. L., Waldron, Dorothy R., Jones, E 1 v a D., Benne E. J., Report on Zinc in Plants. J. Assoc, oil agric. Chemists, 31, 285—293 1948).
[483] Irving H., Andrew G., Risdon E. J., Reversion: A New Procedure in Absorptiometry. Nature [London], 161, 805—806 (1918).
[484] Dawson E. C., New Reactions between Iron and Dithizone. Analyst, 73, 618-619 (1948).
[485] Analytical Methods Committee. Metallic Impurities in Foodstuffs Sub-Committee. Report № 4. The Determination of Zinc in Foodstuffs. Analyst. 73, 304—308 (1948).
[486] Silverman L., Precision Determination of Lead in High Grade Copper. Dithizone Color and Electrodeposition Gravimetric Methods. Analytic. Chem., 20, 906—909 (1948).
[487] Vallee B. L., Gibson J. G., An Improved Dithizone Method for the Determination of Smail Quantities of Zinc in Blood and Tissue Samples. J. biol. Chemistry, 176, 435—443 (1948).
[48s] Wells J. E., Hunter D. P., Amyl Acetate: A Solvent for the Separation of Iron in Metallurgical Analysis, Analyst 73, 671—673 (1948).
[48J] Hubbard D. M., Microdetermination of Bismuth in Biological Material. An Improved Photometric Dithizone Method. Analytic. Chem., 20, 363—364 (1948).
[4810] Hirsch W., The Acidimetric Titration of Dark Coloured Solutions. Analyst, 73, 160 (1948).
[4811] C h о 1 a к J., Hubbard D. M., Burkey R. E., The Determination of Lead in Freshly Voided Urine. A Rapid Screening Test. J. ind. Hyg. Toxicol., 30, 59—62 (1948).
[4812] May L, Hoffman J. L, A Study of Dithizone as a Reagent for Indium. J. Washington Acad. Sci., 38, 329—336 (1948).
[4813] Irving H., Williams R. J. P., Order of Stability of Metal Complexes. Nature (London), 162, 746—747 (1948).
[4814] Potterat I. M., Hogl O., Bestimmung von Zink in Na-hrungsmitteln und Gebrauchsartikeln. Mitt. Gebiete Lebens-mitteiunters. Hyg. (Bern), 39, 372—386 (1948); Chem. Abstr., 43, 1683—1684 (1949).
[4815] Huff L. C., A Sensitive Field Test for Heavy Metals in Water. Econ. GeoL, 43, 675—684 (1948); Chem. Abstr., 45, 290 (1951).
[4816] Oesper R. E., KI in gen berg J. J., The Synthesis and Properties of Di-2,4-dimethyl-phenylthiocarbazone. J. org. Chemistry, 13, 309—312 (1948).
[4817] L о v e r i n g T. S., S о к о 1 о f f V. P., Morris FI. T., Heavy Metals in Altered Rock over Blind Ore Bodies, East Tintic District, Utah. Econ. GeoL, 43, 384—399 (1948); Chem. Abstr., 43, 8989—8990 (1949).
Литература
399
[4818] Corwin А. Н., Jackson G. R., Webb J. L. A.. Antidote for Heavy Meta! Poisoning. AP. 2441396 vom 11. Mai 1948.
f-1819] Cholak J., Hubbard D. M., Burkey R. E., Microdeter-mination of Lead in Biological Material. With Dithizone Extraction at High pH-Analylic. Chem., 20, 671 bis 672 (1948).
[4 820] Serfass E. J., Levine W. S., Determination of Impurities in Electroplating Solutions. VII. Traces of Cadmium in Nickel Plating Baths. Plating, 35, 456—462 (1948).
[4821] Scharrer K., Beitrage zur Ermittlung kleinster Mengen von Bor und Kupfer. Z. analyt. Chem., 128, 435—422 (1948).
[4822] S t г о h e с к e r R., S i e r p E., Ober die Fluchtigkeit von Me-tallen im Wasserdampfstrom. Z. analyt. Chem., 128, 392—397 (1948)
[4823] Arden T. V., В u г s t a 11 F. H., D a v i e s G. R„ L e w i s I. A., L i n s t e a d R. P., A New Method for the Separation, Detection and Estimation of Inorganic Compounds. Nature (London), 162, 691—692 (1948).
[4824] Snyder L. J., Barnes W. R., Tokos J. V., Determination of Lead in Air. Rapid Micromethod for Field Use. Analytic Chem., 20, 772—776 (1948).
[491] Wolff H., Die spektraphotometrische Bestimmung des Serum-zinks. Klin. Wschr., 27, 348 (1949).
[49s] Uem ига T., M i у a к a w a S., Etudes spectroscopiques des complexes metalliaues du diphenylthiocarbazone. I. Bull. chem. Soc. Japan, 22, 115—120 (1949).
[493] Sutherland E. W., Activation of Phosphoglucomutase by Metalbinding Agents. J. biol. Chemistry, 180, 1279—1284 (1949).
[494] Shirley R. L., Benne E. J., Miller E. J., Cadmium in Biological Materials and Foods, Dithizone Method for Evaluating Minute Quantities. Analytic. Chem. 21, 300—303 (1949).
[495] Irving H., Risdon E. J., Andrew G., The Absorptiomet-ric Determination of Traces of Metals. Reversion: A New Procedure. J. Chem. Soc. (London), 1949, 537—541.
[496] Irving H„ Cooke S. J. H., Wood ger S. C., Williams R. J. P., Studies with Dithizone. Part. II. Dithizone as a Monobasic Acid. H. chem. Soc. (London), 1949, 1847—1855.
[497] Irving H., Andrew G., Risdon E. J., Studies with Dithizone. Part. I. The Determination of Traces of Mercury. J. chem. Soc. (London), 1949, 561—547.
[49 s] D e 1 a v a u 11 R. E., Irish Ruth, Emploi de la dithizone en solution, aqueuse ammoniacale. C. R. hebd. Seances Acad. Sci., 229, 1079—1081 (1949).
[499] Corwin A. H., Jackson G. R., The Structure of Dipheny-thiocarbazone (Dithizone). J. Amer. chem. Soc., 71, 3698—3701 (1949).
[4910] Cooper S. S., Kofron V. K-, Purification of Di-beta-na-phylthiocarbazone. Molecular Extinction Coefficient in Chloroform at 650 Millimicron. Analytic, Chem., 21, 1135—1139 (1949).
[49й] Пьянков В. А., О кинетике реакций паров ртути с озоном. Ж. Общей, химии, сер. А, 19, 224—229 (1949).
400
Литература
[4912] Snell F. D., Snell Cornelia T., Colorimetric Methods of Analysis. Vol. II, Inorganic. D. Van Nostrand Comp., Inc. New York, 1949, 3. Edit.
[4913] Irving H., Williams R. J. P., Metal Complexes and Partition Equilibria. J. chem. Soc. (London), 1949, 1841—1847.
[49*14 ] Klein A. K-, Report on Cadmium. J. Assoc, off. agric. Chemists, 32, 349—350 (1949).
[4915] Wichmann H. J., Report on Metals, Other Elements and Residues in Foods. J. Assoc, off. agric. Chemists, 32, 343—348 (1949).
[4910] Hoch F. L., Vallee B. L., Precipitation by Trichloroacetic Acid as a Simplification in the Determination of Zink in Blood and its Components. J. biol. Chemistry, 181, 295—306 (1949).
[4917] L a u g E. P., Determination of Bismuth in Biological Material. Analytic. Chem., 21, 188—189 (1949).
[4918]Feigl F., Chemistry of Specific, Selective and Sensitive Reactions. Academic Press. Inc., Publ. New York, 1949.
[4919] Sill C. W., Peterson H. E., Iodometric Semimicrodetermination of Thallium in Ores and Flue Dusts. Analytic. Chem., 21, 1268—1273 (1949).
[4920] Reichen Laura E., Lakin H. W., Field Method for the Determination of Zinc in Plants. U. S. Dep. Interior geol. Surv., Bull., 41, 4 (1949); Chem. Abstr., 43, 2890 (1949).
[4921] Warren H. V., D e 1 a v a u 11 R. E., Further Studies in Biogeochemistry. Bull. geol. Soc. America, 60, 531—560 (1949); Chem. Abstr., 43, 3321 (1949).
[4922] Jacobs M. B., The Analytical Chemistry of Industrial Poisons, Hazards, and Solvents, Interscience Publ., Inc. New. York, 1949 2. Edit.
[4923] К о It h о f f J. M., Indicators. Analytic. Chem., 21, 101—103 (1949).
[4924] Klein A. K., Report on Mercury. J. Assoc, off. agric. Chemists, 32, 351—353 (1949).
[4925] Dunabin J. E., Mason H., Seyfang A. P., Woodman F. J., Spectrographic Examination of Chromatographic Columns. Nature (London), 164, 916 (1949).
[4923] Leopoldi Grete, Colorimetrische Bestimmung von kleiner Mengen Thallium mit Dithizon. Siemens & Halske A. G., Abt. f. Elektrochemie, Berlin-Siemensstadt, 6. 4. 1949 (Privatmit-teilung).
[4927] Tanaka M., A s h i z a w a T., S h i b a t a M., Chromatography for Inorganic Compounds. Chem. Researches (Japan), Inorg. and Anal. (Japan), 5, 35—52 (1949); Chem. Abstr., 43, 8945 (1949).
[50i] Webb J. L. A., В h a t i а Г. S., С о г w i n A. H., S h a r p A. G, Reactions with Heavy Metals and their Bearing on Poisoning and Antidote Action. J. Amer. chem. Soc., 72, 91—95 (1950).
[502] Sandell E. B., Colorimetric Determination of Traces of Metals. 2. Edit., Interscience, New York, 1950.
[503] S a n d e 1 1 E. B., The Primary Dissociation Constant of Diphenylthiocarbazone. J. Amer. chem. Soc., 72, 4660—4661 (1950).
Литература
401
[504] Филиппова Н. А., Лурье Ю. Ю., Определение малых количеств цинка в чистом никеле. Зав. лаб., 16, 912—917 (1950).
[505] Miller W. L., Wachter L. Е., Determination of Traces of Mercury in Copper Alloys. Titration with Dithizone. Analytic. Chem., 22, 1312—1314 (1950).
[SO6] Kutzelnigg A., Uber die Reaktionsfahigkeit organischer Me-tallreagentien unter ungewohnlichen Bedingungen, Chemiker-Ztg., 74, 733 (1950).
[507] Iwantscheff G., Bestimmung kleiner Chlorid-Gehalte durch Extraktionstitration des im AgCl gebundenen Silbers. Angew. Chem., 62, 361—362 (1950).
[50s] Dobbins J. T., Norman J. H., An Improved Qualitative Test for the Zinc Ion. J. Chem. Educat., 27, 604—605 (1950).
[509] Bouissieres G., Ferradini Christiane, Emploi de la dithizone pour separer et purifier le Radium D, le Radium E et le Polonium. Analytica chim. Acta (Amsterdam) 4, 610— 614 (1950).
[5010] Banks T. E., T u p p e n R. L. F., W о r m a 11 A., The Fate of Some Intravenously Injected Zinc Compounds. 1. The Determination of 65Zn in Tissues. 2. The Fate of Injected Zinc Carbonate and Phosphate and a Zinc Dithizon Complex. Biochem. J., 47, 466—472 (1950).
[5011] Пилипенко A. T., К применению дифенилтиокарбазона (дитизона) в анализе. III. Константы нестойкости дитизонатов таллия, индия и о дитизонате галлия, Ж- анал. химии, 5, 14—20 (1950).
[5012] Ishimori Т., Sakaguchi Н., “Salzartige Dithizon-Verbin-dungen des Poloniums” (Japan). J. Chem. Soc. Japan. 71, 327—328 (1950); Chem. Abstr., 45, 7037 (1951).
[5013] Webb J. S., Millman A. P., Heavy Metals in Natural Waters as a Guide to Ore. A Preliminary Investigation in West Africa. Bull. Instn. Mining Metallurgy, 1950, Nr. 518, 3—16.
[5014] Buczowska Zofia, “Colorimetrische Methode zur Bestimmung des Bleis in Trinkwasser” (Poln.). Gaz, Woda Techn. sanit., 24, 99—102 (1950); Chem. Abstr., 44, 8570 (1950).
[5015] Stammer W. C., Report on Copper in Foods. J. Assoc, off. agric. Chemists, 33, 607—608 (1950).
[5016] Klein A. K., Report on Mercury. J. Assoc, off. agric. Chemists, 33, 594—597 (1950).
[5017] Beeson К. C., Gregory R. L., Report on Copper and Cobalt in Plants. J. Assoc, off. agric. Chemists, 33, 819—827 (1950).
[5018] Klein A. K., Report on Cadmium. J. Assoc, off. agric. Chemists, 33, 592—593 (1950).
[5019] К a d о t a I., Studies on Experimental Diabetes Mellitus as Produced by Organic Reagents. Oxine Diabetes and Dithizone Diabetes. J. Lab. clin. Med., 35, 568—591 (1950).
[5020] В u г s t a 11 F. H., Davies G. R., L i n s t e a d R. P., Wells R. A., Inorganic Chromatography on Cellulose. Part. II. The Separation of Metals and Acid Radicals on Strips of Absorbent Paper, J. chem. Soc., 1950, 516—528. 26
26 Зак. 2157.
402
Л итература
[5021] F е i g 1 F., Die Rolle von organischen Reagenzien in der Chemie der spezifischen, selektiven und empfindlichen Reak-tionen. Osterr. Chemiker-Ztg. 51, 118—141 (1950).
[5022] Assoc, off. agric. Chemists, Washington 4, D. C., 1950, 7. Edit. Official Methods of Analysis of the Association of Official Agricultural Chemists.
[5023] Korol eff F., Determination of Traces of Heavy Metals in Sea Water by Means of Dithizone. I. Metal-Dithizon Equilibria. Me-rentutkimuslaitoksen Julkaisu Havsforskningsinstitutets Skrift, Helsinki, Nr. 145, 7—69 (1950).
[5024] N u 11 e n A. J., Some New Indicators in Various Titrimetric Processes. Metallurgia (Manchester), 42, 216—219 (1950).
[5025] Hoffmann C., Beitrage zur Kenntnis der Wirkung von Gif-ten auf marine Organismen. Sonderdruck aus Kieler Meeres-forsch. des Instituts f. Meereskunde an der Univ. Kiel, 7, 38—52 (1950); Chem. Abstr. 45j, 2618 (1951).
[5026] Americ. Chem. Soc., Washington, 1950, Reagent Chemicals, Specifications.
[5027] Bach R. O., Neue Versuche zur anorganischen Chromatographie (Span.). Ind. у Quimica, 12, 283—286, 301 (1950); Chem. Zbl., 1953, 8941.
[5028J Butts P. G., G a h 1 e r A. R. with Mellon M. G., Colorimetric Determination of Metals in Sewage and Industrial Wastes. Sewages and Industr. Wastes, 22, 1543—1562 (1950).
[511] Warren H. V., Delavault R. E., Irish Ruth, Improved Dithizone Field Test for Heavy Metals in Water. Bull. geol. Soc. America, 62, 609—617 (1951).
[512] Leopoldi Grete, Quantitative Bestimmung kleiner Palla-diummengen mit Dithizon durch titrimetrische Extraktion. Siemens & Halske A. G., Werkstoff-Hauptlaboratorium, Berlin-Siemensstadt, 18. 10, 1951 (Privatmitteilung).
[513] Kutzelnigg A., Neue Reagenzpapiere zur Porenpriifung und zum Nachweis von Metallen. Metalloberflache, Ausg, B-3, 5, 113—115 (1951).
[514] H u f f L. C., A Sensitive Field Test for Detecting Heavy Metals in Soil or Sediment. Econ. Geol., 46, 524—540 (1951).
[515] Gorbach G., Pohl F., Die Anreicherung und spectranalyti-sche Bestimmung der Spurenmetalle. I. Die Extraktion mit organischen Reagenzien. Mikrocheme, 38, 258—267
(1951).
[516] Cooper S. S., Sullivan Mary Louise, Spectrophotometric Studies of Dithizone and Some Dithizonates. Molecular Extinction Coefficient of Dithizone in Carbon Tetrachloride. Analytic. Chem., 23, 613—618 (1951).
[517] Hogl O., Sulser H., Blei, Kupler und Zink in Trink- und Brauchwassen. Mitt. Gebiete Lebensmittelunters. Hyg. (Bern), 42/43, 286—311 (1951/1952).
[518] Delavault E. R., Irish Ruth, Dosage du cuivre par la dithizone ensolution acetonique homogene. C. R. (Doklady) Acad. Sci. URSS 232, 2318—2320 (1951).
[515] Uzumasa Y., Miyashita L, Dithizon-Reagens (Japan.).
Литература
403
J. Chem. Soc. Japan, 72, 38—41 (1951); Chem. Abstr., 46, 6607 (1952).
[5110] Barnes H., The Determination of Zinc by Dithizone. Analyst, 76, 220—223 (1951).
[5111] Young R. S., The Determination of Gold, Palladium and Platinum by Dithizone. Analyst, 76, 49—52 (1951).
[5112] Kimura K-, Fujiwara S., Geochemische Prospektierung von Metallerzlagerstatten (Japan.). J. geog. Soc. Japan, 60, 9—19 (1951); Chem. Abstr., 46, 6046 (1952).
[5113] Mehlig J. P., Guill A. P., Dithizone as an Indicator in Titrimetric Determination of Zink with Ferrocyanide Analytic. Chem., 23, 1876—1877 (1951).
[5114] Vasak V., Sedivec V., Anwendung des Komplexons bei der Colorimetrie. II. Bestimmung von Quecksilber mittels Dithizon (Tschech.). Chem. Listy, 45, 10—12, 177, 437 (1951).
[5115] Stein Ch., Report on Heavy Metals in Coal-Tar Colors-Cadmium. J. Assoc, off. agric. Chemists. 34, 417—421 (1951).
[5116] C h r i s t i a n s e n E., Der Einflufi von vulkanisiertem Gummi auf die Qualitat von destilliertem Wasser (Schwed.). Medd. norks. farmac. Selsk., 13, 135—153 (1951); Chem. Abstr., 46, 4169 (1952).
[5117] Clerq Monique de, Duval C., Sur la thermogravimetrie des precipites analytiques. II. Dosage du zinc. Analytica chim. Acta (Amsterdam), 5, 282—292 (1951).
[5118] M i у a к a w a S., Uemura T., Etudes spectroscopiques des complexes metalliques du diphenylthiocarbazone. II. Bull. chem. Soc. Japan, 24, 25—27 (1951); Chem. Abstr., 47, 9772 (1953).
[5119] C a m p a n a C., D о 11 a F., Voruntersuchungen fiber den expe-rimentellen Pankreasdiabetes, verursacht durch organische Rea-gentien fiir Zink (Ital.). Boll. Soc. ital. Biol, sperim., 27, 1489—1491 (1951); Chem. Abstr., 47, 8225 (1953).
[5120] A b r a h a m c z i к E., Anwendung organischer Komplexbildner zur Trennung und Bestimmung von Metallen mit Hilfe von Ausschiittelungsreaktionen. Mikrochemie, 36/37, 104—112 (1951).
[5121] Milner G. W. C., Townend J., The Determination of Small Amounts of Lead in Non-Ferrous Alloys. Analytica chim. acta (Amsterdam) 5, 584—598 (1951).
[5122] V a n о s s i R., “Der Nachweis von Silber und Blei nach Ex-traktion ihrer Jodie (allgemeine Analyse der Gruppe der Jodide von Pt, Pd, Те, Ag, Pb, In, Bj, Cu, Cd)” (Span.) An. Asoc. quim. argent., 151, 173—201 (1951); Chem. Zbl., 1952,5791 bis 5792.
[5123] Arthinston W., Hui me A. C., The Estimation of Mercury on the Peel of Apples. Analyst, 76, 211—215 (1951).
[5124] De la vault R. E., Irish Ruth, Dosage du cuivre par la dithizone en solution acetonique homogene. C. R. hebd. Seances Acad. Sci., 223„ 1614—1615 (1951).
[5125] A 1 - M a h d i A. K., Wilson C. L., Chromatography of Organo-Metallic Complexes. Mikrochemie, 36/37, 218—223 (1951).
[5126] Gorbach G., Pohl F., Beitrag zu den mikrochemischen Anreicherungsverfahren in der Spektranalyse. Mikrochemie, 36/37, 486—494 (1951).
26*
404
Литература
[5128] Hart Н. V., The Lead Content of Wheaten Flour and its Determination. Analyst, 76, 692—69'6 (1951).
[5129] Miller V. L., Polley Dorothy, Gould C. J., Phenyl Mercuric or Ethyl Mercuric Compounds. Direct Determination of Several Compounds in Dilute Aqueous Solution. Analytic. Chem., 23, 1286—1288 (1951).
[521] Pariaud J.-Ch., Archinard P., Preparation et analyse thermogravimetrique des dithizonates d’argent, de plomb, de zinc et de cuivre. Recueil Trav. chim. Pays-Bas, 71, 634—638 (1952).
[522] Irving H., Bell C. F., Williams R. J. P., Studies with Dithizone. Part III. The Extraction Constant of Zink Dithizo-nate. J. chem. Soc. (London) 1952, 356—369.
[523] Baumgarten F., Wolff H., Maske FL, St amp fl B., Die Schutzwirkung von Cystein gegeniiber Dithizondiabetes. Klin. Wschr., 30, 90—91 (1952).
[524] Atkins D. C., Garner C. S., Isotopic Exchange Reactions of Zinc Chelate Complexes, J. Amer. chem. Soc., 74, 3527— 3529 (1952).
[525] В j e г r u m J., Poulsen K. G., Reactions. Velocities and Activation Energies of some “Instantaneous” Complex Ion Reactions. Nature (London), 169, 463—464 (1952).
[526] Ч e p н и ц к а я P. E., Спектры поглощения и константы диссоциации дифенилтпокарбазона (дитизона) и его внутриком-плексных солей. I. Спектры поглощения дифенилтпокарбазона (дитизона) и равновесное распределение его в системе двух фаз. Ж. общей химии, сер. А, 22, 403—408 (1952).
[527] Ч е р н и ц к а я Р. Е., Спектры поглощения и константы диссоциации дифенилтиокарбазона (дитизона) и его внутриком-плексных солей. II. Спектры поглощения и константы нестойкости внутрикомплексных солей дитизона в растворе изоамилового спирта. Ж. общей химии, сер. А, 22,408—414 (1952).
[528] М i 1 к е у R. G., Absorption Characteristics of the Dithizone Mixed Color System. A Theoretical Treatment. Analytic. Chem., 24, 1675—1676 (1952).
[529] The Merck Index of Chemicals and Drugs. 6. Edit., Merck & Co., Inc., Rahway, N. Y., 1952.
[5210] Gallego R., D e i j s W. B., F e 1 d m e i j e r J. H., Sur le dosage de traces de cobalt. Recueil Trav. chim. Pays-Bas, 71, 987—998 (1952).
[5211] S i 1 v e r m a n L., Trego Katherine, Determination of Small Amounts of Cadmium in Lead by a One-Colour Dithizone Method. Analyst, 77, 143—148 (1952}.
[5212] Kratz Ph. D., Lewis J. L, Feldman A., Determination of Copper in Sugar Sirups and Beverages. Modified Dithizone Method. Anal. Chem., 24, 524—526 (1952).
[5213] Dyrssen D., Hok Brit a, The Primary Dissociation Constant of Diphenylthiocarbazone. Svensk. kem. Tidskr., 64, 80— 85 (1952).
[5214] Irving H., Bell C. F., S. Methyl Dithizone and the Structure of Metal Dithizonates. Nature (London), 169, 756 (1952).
Литература
405
[5215] Y a f f е Ruth P., Voigt A. F., Spectrophotometric Investigations of Some Complexes of Ruthenium. IV. Ruthenium Reactions with Thiosemicarbazide, 4. Phenylthiosemicarbazide and Diphenylthiocarbazide. J. Amer. chem. Soc., 74, 5043—5046 (1952).
[52IG] Irving H., Bell C. F, Studies with Dithizone. Part IV. The Dissociation Constant of Dithizone. J. chem. Soc. (London), 1952, 1216—1220.
[5217] Bovalini E., Casini Adriana, “Dithizon als Indikator bei volumetrischen Fallungstitrationen: Bestimmung von Blei” (Ital.). Ann. Chimica, 42, 610—618 (1952); Chem. Abstr., 47, 3172 (1953); Chem. ZbL, 126, 4420 (1955).
[5218] E г d e у L., Rady G., Mikrobestimmung des Goldes. Z. analyt. Chem., 135, 1—10 (1952).
[5219] Brandon A. L., Report on Copper in Foods. Determination by Means of Dithizone. J. Assoc, off. agric. Chemists, 35, 542—543 (1952).
[5220] Shaw E., Dean L. A., Use of Dithizone as an Extractant to Estimate the Zinc Nutrient Status of Soils. Soil Sci., 73, 341— 347 (1952).
[5221] Heinen E. J., Benne E. J., Report on Zinc in Plants. J. Assoc. off. agric. Chemists, 35, 397—398 (1952).
[5223] Jones G. B., The Polarographic Determination of Copper and Zinc in Plants and Soils. Analytica chim. Acta (Amsterdam), 7, 578—584 (1952).
[5224] J e a n M., Analyse des alliages legers a base d’aluminium par les methodes spectrophotometriques. I. Analytica chim. Acta (Amsterdam), 7, 338—348 (1952).
[5225] Geiger R. W., The Carbon Tetrachloride Extraction of Copper (II) Dithizonate. Dissertation Abstracts, 12, 249—250 (1952), Publicat. No. 3407, Dissertation 1951.
[5226] Grammaticakis P., Structure du diphenylcarbazide et de ses produits d’oxydation ainsi que leurs derives soufres isolo-gues d’apres leur absorption dans 1’ultraviolet moyen et le visible. C. R. hebd. Seances Acad. Sci., 234, 528—530 (1952).
[5227] Pariaud J. Ch., Archinard P., Sur la solubilite des me-taux dans 1’eau. Bull. Soc. chim. France, Mem. 5. Ser. 19, 454— 456 (1952).
[5228] Laplace G., Dosage de quelques elements rares dans les minerals de fer de Lorraine. Publication de 1’Institut Recher-ches de la Siderurgie, Ser. A, Nr. 41 (1952) Mai, Centre de documentation siderurgique, Paris.
[5229] Mil key R. G., Methods of Analysis Used in the Treatment of Colorado Plateau Carnolite for Age Studies. U. S. Dep. Interior geol. Surv., Bull. Trace Elements Investigation, TEI-245 (1952).
[5232] Gambassi G., Carnimeo N., “Einflufi des Dithizons auf die Hamoglycolyse in vitro” (Ital.). Boll. Soc. ital. Biol sperim, 28, 1794—1795 (1952); Chem. Abstr., 47, 8243 (1953).
[5233] Alcalde V., Colas A., Grande F., Peg V., Unwirksam-keit des Dithizons als Diabetogenes Agens beim Hund (Span.).
406
Литература
Rev. espan, fisioL, 8, 175—185 (1952); Chem. Abstr., 47, 8912— 8913 (1953).
[52351 West P. W., Carlton J. K-, The Extraction of Lead Iodide by Methyl iso-Propyl Ketone, Analytica chim. Acta (Amsterdam), 6, 406—411 (1952).
[5236] Klein A. K-, Report on Mercury. J. Assoc, off. agric. Chemists, 35, 537—542 (1952).
[531] Becht К. H., Uber die Verfeinerung des Dithizon-Bestim-mungsverfahrens fur sehr kleine Kupfermengen. Siemens & Halske A. G., Werkstoff-Hauptlaboratorium, Karlsruhe, 21. 3. 1953 (Privatmitteilung).
[532] Simonsen D G., Determination of Mercury in Biological Materials. Amer. J. clin. Pathol., 23, 789—797 (1953).
[533] Kato T., Takei S., Bestimmung von Spuren von Substanzen. VI. Colorimetrische Bestimmung von Zink nach der Dithizon-methode. Technol. Rep. Tohoku Imp. Univ. Sendai, Japan, 17, 170—175 (1953); Chem. Abstr., 47, 10396 (1953).
[534] Bovalini E., Casini Adriana, Dithizon als Indikator bei fallungs- und komplexometrischen Titrationen. Bestimmung von Blei und Cadmium (Ital.). Ann. Chimica, 43, 287—292 (1953).
[535] Saltz a man В. E., Colorimetric Microdetermination of Cadmium with Dithizone. With Improved Separation of Interfering Metals, Analytic. Chem., 25, 493—496 (1953).
[536] Am dur Mary O., Rapid Determination of Lead in Old Urine Samples. Arch. ind. Hyg. occiipat. Med., 7, 277—281 (1953).
[537] Kato T., Takei S., Colorimetrische Bestimmung von Zink mit Dithizon. Maskierung von storenden lonen mit Bis (hydroxyathyl) dithiocarbamat. Japan Analyst, 2, 208—210 (1953); Chem. Abstr., 47, 12117—12118 (1953).
[538] Koji ma AL, Bestimmung einer kleinen Blei-Menge in Zink-sulfat-Losung und in Cadmiumsulfat-Losung. Sci. Papers Coll. Gen. Educ. Univ. Tokyo, 3, 25—37 (1953); Chem. Abstr., 48, 5721 (1954).
[539] Martin A. E., Determination of Zinc with Special Reference to Separation from Cobalt and Copper. Analytic. Chem., 25, 1853—1858 (1953).
[5310] Copper S. S., Hibbits J. O., Analysis of Lead Dithizonate by the Method of Continuous Variations. J. Amer. chem. Soc., 75, 5084—5086 (1952).
[5311] Ringbom A., Oesterholm K-, Differential Method for Precision Colorimetric Analysis. Analytic. Chem., 25, 1798— 1803 (1953).
[5312] Elkins H. B., Ruotolo В. P. W., Notes on Determination of Lead by Dithizone Method. II. Interference from Bismuth and Tin. Amer. ind. Hyg. Assoc. Quart., 14, 111—112 (1953).
'[5313] Пилипенко A. T., К применению дифенилтиокарбазона (дитизона) в анализе. IV. Константы нестойкости дитизонатов никеля, кобальта, олова (И), висмута, меди (II), се-
Литература
407
ребра и ртути (II) и дитизонаты марганца и железа. Ж-анал. химии, 8, 286—292 (1953).
[5314] Кар а баш А. Г., Применение дитизона в качестве экстракционного индикатора. Ж- анал. химии, 8, 140—151 (1953).
[5315] Клейнер К. К., Маркова Л. В., Влияние концентрации водородных ионов на образование дитизоната индия. ЖАХ, 8, 279—285 (1953).
[5316] Elkins Н. В., Notes on Determination of Lead by Dithizone Method. I. Effects of Impurities in Cyanide. Amer. ind. Hyg. Assoc. Quart., 14, 109—111 (1953).
[5317] Beeson К. C., Report on Copper and Cobaltin in Plants. J. Assoc, off. agric. Chemists, 36, 405—411 (1953).
[5218] Serfass E. J., Mur аса R. F., Gardnen D. G., Colorimetric Determination of Cadmium Effluents. Plating, 40, 148—150, 154 (1953).
[5319] Heinen E. J., Benne E. J., Report on Zinc in Plants. J. Assoc, off. agric. Chemists, 36, 397—400 (1953).
[5320] Woessner W. W., C h о 1 a k J., Improvements in the Rapid Screening Method for Lead in Urine. Arch. ind. Hyg. occupat. Med., 7, 249—254 (1953).
[5321] Irving H. M., Butler E. J., A Reversion Method for the Absorptiometrie Determination of Traces of Lead with Dithizone. Analyst, 78, 571—580 (1953).
[5325] W у a 11 P. F., Diethylammonium Diethyldithiocarbamate for the Separation and Determination of Small Amounts of Metals. Part I. The Successive Determination of Small Amounts of Copper, Manganese and Iron in Organic Compoundes. Analyst, 78, 566—661 (1953).
[5326] Warren H. V., D e 1 a v a u 11 R. E., Irish Ruth L, Acetonic Dithizone in Geochemistry. Econ. GeoL, 48, 306—311 (1953).
[5328] Geiger R. W., Sandell E. B., Copper (ID-Dithizone Equilibria in Water-Carbon Tetrachloride. Analytica chim. Acta (Amsterdam), 8, 197—208 (1953).
[5329] S tel gens P., Uber die Kreatinkorperbestimmung mit Kali-umquecksilberrhodanid und Dithizon. Biochem. Z. 323, 480-^* 487 (1953).
[5331] Сушинская Л. Я-, Устойчивость свинца в воде, Гигиена и санитария, 1953, № 8, 49.
[5333] Pohl F. A., Methoden zur spectrochemischen Spurenanalyse. I. Zur Spurenanalyse von Wassern. Z. analyt. Chem., 139. 241—249 (1953).
[533}] Pohl F. A., Methoden zur spektrochemischen Spurenanalyse. II. Zur Spurenanalyse von pflanzlichen Materialen. Z. analvt Chem., 139, 423—429 (1953).
[5335] Shi ma M., Schnellbestimmung von Gold und Silber in Erzen (an Ort und Stelle). Japan Analvst, 2, 96—98 (1953); Analytic. Abstr., 2, 1460 (1955).
[541] Wolff H., Ringleb D., Histochemische Untersuchungen fiber das Inselzink. I. Natu'rwissenschaften, 41, 260—261 (1954).
[542] Landry A. S., Redondo S. F., Molar Absorptivity of Dithizone in Chloroform. Analytic. Chem.. 26. ,Z32—733 (1954).
408
Литература
[544 Wark W. J., Spectrographic Analysis of Minor Elements Extracted from Plants and Soils as Dithizonates. Analytic. Chem., 26, 203—205 (1954).
[544] G e i 1 m a n n W., Bilder zur qualitativen Mikroanalyse anor-ganischer Stoffe. Verlag Chemie GmbH., Weinheim/Bergstr., 1954.
[54*]
[544
[544
[544
Pohl F. A., Methoden zur spektrochemisthen Spurenanalyse. III. Zur Spurenanalyse von Gesteinen und Bodenpioben. Z. analyt. Chem., 141, 81—86 (1954).
Carlton J. К., Bradbury W. C., Detection of Bismuth by Dithizone in Molten Naphthalene. Analyt. Chem., 26, 1226— 1227 (1954).
Vallee B. L., Determination of Zinc by Dithizone in a Mo-
nophase Water-Glycol (1954).
System. Analytic.
Tremillon B., Extraction de 1’argent dithizone. I. Proprietes des dithizonates
cuivre. II. Proprietes des dithizonates cuivre et applications. Bull. Soc. chim.
1156—1163.
Chem., 26, 914—917
et du cuivre par la cetos d’argent et de enols d’argent et de
France, Mem., 1954,
[549] Mur аса R. F., Gardner D. G., Serfass E. J., The Colorimetric Determination of Zinc in Effluents. Plating, 41, 155— 156, 161—163 (1954).
[5410] Venturello G., Ghe A. M., Paper Chromatography of Organometallic Complexes: Dithizonates. Analytica chim. Acta (Amsterdam), 10, 335—345 (1954).
[54й] Гржегоржевскпй А. С., О некоторых аналитических свойствах ди- Р-нафтилтиокарбазона и о его синтезе. Ж. анал. химии, 9, Г09—111 (1954).
[5412] Lock wood Н С., Determination of Lead in Foodstuffs. Analyst, 79, 143—146 (1954).
[54’4 Analytical AAethods Committee, Report of the Lead Panel of the Metallic Impurities in Foodstuffs Sub-Committee. The Determination of Lead in Foodstuffs. Analyst, 79, 397—402 (1954).
[5414] E 1 v i d g e D. A., G a г г a 11 D. C., A Note on a Bomb Technique for Preparing Samples for Determination of Lead in Foodstuffes. Analyst, 79, 146—149 (1954).
[54’4 Feigl F., Spot Tests, Vol. I, Inorganic Applications. Elsevier Publ. Comp., 1954, 4. Edit.
[54‘4 Faller F. E., Die Analyse des Reinstaluminiums unter beson-derer Beriicksichtigung der Anforderungen aus der Praxis. Z. Erzbergbau Metallhiittenwes., 7, 473—479 (1954).
[5417] Yoshimori T., Hirano S., Bestimmung von Blei in Stahl mit Dithizon. Japan Analyst, 3, 470—474 (1954); Analytic. Abstr., 3, 675 (1956).
[54'4 Lewandowski A., Kielczewski W., Quantitative Bestimmung von kleinen Zinkmengen Roczniki Chem. (Ann. Soc. chim. Polonorum), 28, 285—290 (1954); Chem Abstr., 48, 13531—13532 (1954).
[54'4 Erdey L., Rady G., Fleps V., Colorinietrische Bestimmung kleiner Silbermengen mit Dithizon (Ungar.). Magyar Kemiai
Литература
409
Folyoirat (Ung. Z. Chem.), 60, 193—196 (1954); Z. analyt. Chem., 145, 43—44 (1955).
[5420] T e w a г i S. N., Analyse von anorganischen Verbindungen durch Papierchromatographie. II. Trennung und Nachweis von Quecksilber, Silber und Blei. Z. anal. Chem., 141, 401—404 (1954).
[5421] Baron H., Die kolorimetrische Bestimmung der Mikronahr-stoffe Kobalt, Molybdan, Eisen, Zink, Mangan und Kupfer ne-beneinander im Rauhfutter, Landwirtsch. Forschg., 6, 13—20 (1954).
[5422] E r d e у L., Rady G., F 1 e p s V., Colorimetrische Bestimmung von Silber mit Dithizon. Acta chim. Acad. Sci. hung., 5, 133—141 (1954); Analytic. Abstr. 2, 1458 (1955).
[5423] Kinnunen J., Wenner st г a n d B., Determination of Bismuth in Metallurgica Products. Chemists-Analyst, 43f 88—89 (1954); Analytic. Abstr., 2, 1194 (1955).
[5424] Pohl F. A., D e m m e 1 H., Die mikrophotometrische Bestimmung von Kobalt im Blusterum und anderen biologischen Sub-stanzen. Analytica chim. Acta (Amsterdam), 10, 554—561 (1954).
[5425] Maltby J. G., A Possible Source of Error in the Determination of Trace Metals, Particulary Lead. Analyst, 79, 786—787 (1954).
[5426] Polley, Dorothy, Miller V. L., Specific Microprocedure for Mercury in the Presence of -Many Metallic Ions. Analytic. Chem., 26, 1247 (1954) (Report from che Northwest Regional Meeting).
[5427] Bielfeldt K., G a n s^s 1 e A., Uber den Quecksilber-Genalt von Salzsauren des Handels. Angew. Chem., 66, 563 (1954).
[551] Carlton J. K., Bradbury W. C., Kruh R., Reactions of Metal Ions with Dithizone in Molten Naphthalene. Analytica chim. Acta (Amsterdam), 12, 101—106 (1955).
[552] В a g g о 11 E. R., W i 1 1 с о c«k s R. G. W., The Separation of Zinc from Cadmium. With Special Reference to the Determination of Zinc in Cadmium Metal. Analyst 80, 53—64 (1955).
[553] Friedeberg H., Separation and Determination of Microgram Quantities of Silver, Mercury and Copper with Dithizone. Analyt. Chem., 27, 305—306 (1955).
[554] Kimura K., Mabuchi H., Low-temperature Sublimation of Polonium Dithizonate. Bull. chem. Soc. Japan, 28, 535 (1955).
[555] Rolfe A. C., Russell F. R., W i 1 к i n s о n N. T., The Absorptiometric Determination of Mercury in Urine. Analyst, 80, 523—530 (1955).
[556] Y о s h i n о Y., Koji ma M., Analyse der Metalle bei Ver-wendung von lonenaustauscherharzen. I. Bestimmung von Cadmium in Kupfer und Zink sowie Zink und Kupfer in Cadmium. Japan Analyst, 4, 311—315 (1955); Analytic. Abstr., 3, 600 (1956).
[557] Mullin J. B., Riley J. P., Recovery of Chloroform Used in Dithizone Extraction. Analyst, 80, 316—317 (1955).
[55s] Petzold A., Lange, Ingeborg, Die Bestimmung von
410
Литература
Cadmium mit Dithizon in Gegenwart geringer Mengen von Nickel und Kobalt., Z. analyt. Chem., 146, 1—4 (1955).
[559] Polley, Dorothy, M i 11 e г V. L., Rapid Microprocedure for Determination of Mercury in Biological and Mineral. Materials Analytic. Chem., 27, 1162—1164 (1955).
[6510] M с С о r d W. M., Zemp J. W., Determination of Lead in Urine. Analytic. Chem., 27, 1171—1172 (1955).
[5511] Kenigsberg M., Stone I., Determination of Traces of Nickel in Malt Beverages. Analytic Chem., 27, 1339—1340 (1955).
[5512] Rosin J., Reagent Chemicals and Standards with Methods of Testing and Assaying. D. Van Nostrand Comp., Inc., New York, 1955, 3. Edit.
[5513] Sherwood R. M., Chapman, jr., F. W., New Techniques for Analyzing Mixtures of Trace Metals. Analytic. Chem. 27, 88—93 (1955).
[5514] Bonnier, Jane-M arie, Gaudemaris G. de, Simplifications apportees a 1’analyse spectrophotometrique d’un melange de deux constituants. Bull. Soc. chim. France, Mem., 4, 267—269 (1955).
[5515] Larder a, Rosa, Mori A., Systematische qualitative Analyse der Schwermetalle durch colorimetrische Mikroverfahren (Ital). Ann. Chimica, 45, 869—886 (1955).
[5516] Mayer F. X., Schwed a P., Studien zur quantitativen Bestimmung von Mikrogrammengen Blei. Mikrochim. Acta (Wien), 1956, 485—511.
[5517] L о u n a m a a K-, Die Bestimmung kleiner Mengen Thtallium in Blei. Extraktion des Thallium (III)-chlorids mit Isopropy-lather. Z. analyt. Chem., 147, 196—198 (1955).
[5518] Gage J. C., The Determination of Lead in Organic Material. Analyst, 80, 789—796 (1955).
[5519] Johnson E. L, Pol hi II R. D. A., The Use of Sodium Hexametaphosphate in the Determination of Traces of Lead in Food. Analyst, 80, 364—367 (1955).
[5520] Dreyer H., Lessmann O., Methoden zur Quecksilberbes-timmung in Erzen und Nattenprodukten. Z. Erzbergbau Metall-hiittenwes. 8, 236—240 (1955).
[5521] Bessman S. P., Layne E. C., jr., A Rapid Procedure for the Determination of Lead in Blood or Urine in the Presence
of Organic Chelating Agents. J. Lab. clin. Med., 45, 159—166
(1955).
[5522] Kirsten W. J., Ultramicrocolorimetric Argentimetry (Preliminary Report). Mikrochim. Acta (Wien), 43, 1086—1087 (1955).
[5523] West P. W., Duff M. A., Extraction of Mercury (I) and (II) and Subssequent Spot Test Detection with Dithizine. Mikrochim. Acta (Wien), 43, 987— 991 (1955).
[5524] G e i 1 m a n n W., N e eb R., Abtrennung geringer Zink-Mengen durch Verdampfung im Wasserstoff-Strom. Angew. Chem., 67, 26—31 (1955).
[5525] Geilmann W., Neeb R., Ein einfaches Verfahren zur Be-
stimmung des Zink Gehaltes in Boden. Z. Pflanzenernahr., Diing., Bodenkunde, 67, 38—47 (1955).
Литература
411
[5526] Smith J. С., Ken ch J. E., Lane R. E., Determination of Cadmium in Urine and Observations on Urinary Cadmium and Protein Excretion in Men Exposed to Cadmium Oxide Dust. Biochem. J., 61, 698—701 (1955).
[5527] A n a s t a s i, Ada, Mecarelli E., Nov a ci c L., Polaro-graphische Bestimmung von Spuren von Kupfer, Blei, Zink und Eisen in Glasern fur pharmazeutischen Gebrauch (Ital.). Ann. Chimica, 45, 88—98 (1955).
[5528] Scharrer K., Taubel N., Zur Bestimmung kleinster Men-gen Kobalt in biochemischen Substanzen und Boden. Land-wirtsch. Forsch., 7, 105—112 (1955).
[5529] Baron H., Gemeinsame Extraktion und chemische Bestimmung des loslichen Anteils der Mikronahrstoffe Bor., Eisen, Kobalt, Kupfer, Mangan, Molybdan und Zink im Boden. Land-wirtsch. Forsch., 7, 82—89 (1955).
[5530] Ikeda N., Halbquantitative Bestimmung von Mikromengen an Zinn in Heibwasser-Quellen. J. Chem. Soc. Japan, pure Chem. Sect., 76, 1011—1013 (1955); Analytic. Abstr., 3, 1665 (1956).
[5531] Yokosuka S., Studies on Analysis of AAetallic Nickel. I. Determination of Lead. II. Determination of Copper. Japan Analyst, 4, 99—105 (1955).
[5532] Weinen I. M., Muller О. H.. Intergerence of Sulfhydril Groups in Analysis of LTrinary Mercury and Its Elimination. Analytic. Chem., 27, 149—150 (1955).
[5533] Johansson A., Uhrnell H., Bestimmung von Quecksilber im Harn (danisch). Acta chem. scand., 9, 583—586 (1955); Z. anal. Chem., 153, 78 (1956).
[5534] Щ e p б о в Д. П., Шевцова Н. К-, Фотоколориметрическое определение кадмия в полиметаллических рудах при помощи дитизона. Изв. АН Казах. ССР. Серия химич., 8, 105—113 (1955).
[5535] American Public Health Association, Inc., Methods for Determining Lead in Air and in Biological Materials, 1790 Broadway, New York, 19, N. Y. 1955.
[561] Ensslin F., Dreyer H., Lessmann O., Methoden zur Quecksilberbestimmung in Erzen und Hiittenprodukten. Z. analyt. Chem., 149, 25—29 (1956).
[562] Pfeiffer H., Diller H., Erfahrungen in der toxikologischen Analyse, insbesondere mit dem Verfahren von Feldstein und Klendshoj. Z. analyt. Chem., 149, 264—269 (1956).
[563] Becht K.—H., Walter, Edith, Uber Versuche, die Bleis-puren-Bestimmung in Blut nach der Dithizon-Methode zu pra-zisieren. Siemens & Halske A. G. Werkstoff-Hauptlaboratorium, Karlsruhe, 5.1.1956 (частное сообщение).
[564] Kallmann S., Steele C. G., Chu N, Y., Determination of Cadmium and Zinc. Separation from Other Element and Each Other by Anion Exchange. Analytic. Chem., 28, 230—233 (1956).
[565] ABCM — SAC Committee, Methods for the Determination of Iron, Mercury and Nickel. Analyst, 81, 176—180 (1956).
412
Литература
[566] Archer Е. Е., The Determination of Small Amounts of Sulphate by Reduction to Hydrogen Sulphide and Titration with Mercurie or Cadmium Salts with Dithizone as Indicator. Analyst, 81, 181—182 (1956).
[567] Barrett F. R., Micro-Determination of Mercury in Biological Materials. Analyst, 81, 294—298 (1956).
[568] Ogawa K-, Methoden der chemischen Analyse von Spuren-elementen im lebenden Korper. Teil 7. Der EinfluB des pH so-wie von Salzen auf die Extraktion von Schwermetallspuren (I). Extraktionskurven des Dithizon-CCL-Zn-Systems. J. chem. Soc. Japan, pure Chem. Sect., 77, 144—147 (1956); Analytic. Abstr., 3, 2656 (1956).
[5610] T о m p s e 11 S. L., The Determination and Distribution of Lead in Human Tissues and Excreta. Analyst, 81, 330—339 (1956).
[5611] Breant Mylene, Etude des dithizonates des mercure mer-curique. Bull. Soc. Chem. France, Mem., 1956, 948—951.
[5612] В rum met B. D., Holl we g R. M., Chelating Agents in Nonaqueous Titrimetry. Analytic. Chem., 28, 448—450 (1956).
[5613] W i с к b о 1 d R., Visuelle Titrationen unter Verwendung von Diathyldithiocarbaminat 111. Mitteilung. Die Bestimmung des Bleis. Z. anal. Chem., 152, 266—270 (1956).
[56’4] E v e D. J., S t r a s h e i m A., The Influence of pH on the Extraction of Zinc, Cobalt, Nickel and Copper from Tartrate Solutions Using Dithizone. J. South African, chem. Inst., 9, 5—11 (1956).
[5615] L а с о u r t Al. A.. Heyndryckx P., Ultramicro-Determination of Zinc. Chem. Age, 74, 1225—1226 (1956).
[5616] Harasawa S., Sakamoto T., Anorganische Papierchro-matographie. XXV. Trennung und Nachweis von Zink, Beryllium und Aluminium, sowie die Anwendung in der systemati-schen Analyse. J. Chem. Soc. Japan, pure Chem. Sect., 77, 168—171 (1956); Analytic. Abstr., 3, 2660 (1956).
[5617] I s h i m о r i T., H a t a e I., Die Bestimmung von Radium-A und Radium-F in radioaktiven Quellen. J. Chem. Soc. Japan, pure Chem Sect., 77, 122—124 (1956); Analytic. Abstr., 3, 2668 (1956).
[5618] H a b e r 1 i E., The Application of the Dithizone Method to the Estimation of Metal Impurities in the 10~6 Percent Range in Highly Purified Antimony. Mitteilung auf dem XV. KongreB der IVRAC (Lissabon).
[5619] I r v i n g H., В e 11 F. C., F e r g u s о n I., The Structure of Dithizone and Metal-Complexes. Mitteilung auf dem XV. KongreB der IVRAC (Lissabon).
[5620] Weber O. A., Vouk V. B., Uber den molekularen Extinktions-koeffizient von Dithizon und Bleidithizonat in ССЦ. Mitteilung auf dem XV. KongreB der IVRAC (Lissabon).
[5621] К о p e н м а н И. M., Шея но в а Ф. Р., Исследование экстрагирования некоторых внутрикомплексных соединений методом радиоактивных индикаторов. Ж- неорг. химии, 1, 852—862 (1956).
Литература
413
[5622] Мухина 3. С., Тихонова А. А., Жемчужная И. А., Определение следов металлов свинца, висмута, олова и кадмия в сплавах на никелевой основе. Зав. лаб., 22, 535—537 (1956).
[5623] Moore V. J., The Separation and Determination of Traces of Lead in the Presence of Small Amounts of Bismuth. Analyst, 81, 553—554 (1956).
[5624] Ma нита M. Д., Применение дитизона для колориметрического определения цинка в питьевой воде. АН СССР, Труды комиссии по аналитической химии, 7, 194—200 (1956).
[5625] ABCM-SAC Committee, Methods for the Determination of Chromium, Lead and Selenium, Analyst, 81, 607—614 (1956).
АНАЛОГИ ДИТИЗОНА*
Супрунович И. Б.
Изучение влияния заместителей на аналитические свойства органических реактивов, применяемых в неорганическом анализе, является частью общей важной задачи изучения взаимного влияния атомов в молекулах. Эта задача была поставлена Бутлеровым и Марковни-ковым и связана с проблемой исследования реакционной способности органических соединений.
В процессе накопления материала, характеризующего влияние заместителей на аналитические свойства органических реактивов, встречаются органические соединения, имеющие превосходящую аналитическую ценность в сравнении с уже применяемыми в аналитической практике реактивами. Это имеет место и при изучении аналогов дитизона.
Введение заместителей в молекулу дитизона изменяет кислотные свойства его, влияет на кето-енольное равновесие и способность к образованию кето-енольных форм металлических комплексов. При этом наблюдается изменение прочности связи ионов металлов с кислотным остатком аналогов дитизона в их соединениях и окраски их. Изменяются также устойчивость реактивов и металлических комплексов к окислителям, свету, растворимость в воде и органических растворителях и некоторые другие их свойства. В результате этого улучшаются такие аналитические показатели, как специфичность и чувствительность реакций.
Применение аналогов дитизона в аналитической практике наряду с дитизоном расширяет возможности
К настоящему времени синтезированы следующие аналоги дитизона:
Мол. вес.
1. 1, 5-Ди-(2, 4-дихлорфенил)-тиокарбазон [574]
2. 1,5-Ди-(2,4-дибромфенил)-тиокарбазон [574] [575]
3. 1, 5-Ди-(2, 4-дийодфенил)-тиокарбазон [574] [575]
4. 1,5-Дн-(о-хлорфенил)-тиокарбазон [574]
5. 1, 5-Ди-(ж-хлорфенил)-тиокарбазон [574]
6. 1,5-Ди-(и-хлорфенил)-тиокарбазон [574]
7. 1,5-Ди-(о-бромфенил)-тиокарбазон [574] [6022]
8. 1, 5-Ди-(л£-бромфенил)-тиокарбазон [574]
9. 1, 5-Ди-(п-бромфенил)-тиокарбазон [57 ] [432] [6022]
10. 1-Фенил-5-(2,4-дибромфенил)-тиокарбазон [5429]
11. 1,5-Ди-(о-йодфенил)-тиокарбазон [574]
12. 1,5-Ди-(лг-йодфенил)-тиокарбазон [574]
13. 1,5-Ди-(и-йодфенил)-тиокарбазон [574]
14. 1,5-Ди-(ж-фторфенил)-тиокарбазон [574]
15. 1,5-Ди-(п-фторфенил)-тиокарбазон [574]
16. 1, 5-Ди-(п-нитрофенил)-тиокарбазон [4615]
17. 1,5-Ди-(/?-сульфоксилфенил)-тиокарбазон [481в]
18. 1-Фенил-5-(о-толил)-тиокарбазон [5429]
C13H8N4C14S C13H8N4Br4S c13h8n4j4s
С i з Н 1ON4C12S С is Н1 oN4C 12S С13Н iqN4C 12S Ci3H10N4Br2S CI3H10N4Br2S Ci3H10N4Br2S Ci3H10N4Br2S C13HI0N4J2S Ci3HioN4J2S c13h10n4j2s Ci3HioN4F 2S
13^ j qN4 F 2S Ci3Hio04N6S Ci3Hi2O8N4S3 Cj4H14N4S
394,13
571,96
759,98
325,23
325,23
325,23
414,15
414,15
414,15
414,15
511,16
511,16
511,16
295,32
295,32
346,32
416,45
270,36
Продолжение
Мол. вес.
19. 1-Фенил-5-(лг-толил)-тиокарбазон [5429] C14H14N4S 270,36
20. 1-Фенил-5-(/г-толил)-тиокарбазон [5429] c14hI4n4s 270,36
21. 1-Фенил-5-(о-анизил)“Тиокарбазон [5429] cI4h14on4s 286,36
99 Ля* Ля* « 1-Фенил-5-(/г-анизил)-тиокарбазон [5429] c14hI4on4s 286,36
23. 1, 5-Ди-(п-трифторметилмеркаптофенил)-тиокарбазон [573] [575] Ci5H10N4F 6S3 456,46
24. 1, 5-Ди-(ж-карбоксифенил)-тиокарбазон [4816] C15H12O4N4S 320,33
25. 1, 5-Ди-(2-метил-4-бромфенил)-тиокарбазон [574] Ci5Hi4N4Br2S 442,20
26. 1, 5-Ди-(/г-толил)-тиокарбазон [911] [4827] [513] [53зе] [572] [573] [5631] [602] 15H15N4S 284,38
27. 1,5-Ди-(о-толил)-тиокарбазон [911] [4611] [513] [5336] [572] [575] [576] [5710] c15h16n4s 284,38
[602]
28. 1,5-Ди-(ж-толил)-тиокарбазон [513] [5336] [576] C15HI6N4S 284,38
29. 1,5-Ди-(о-анизил)-тиокарбазон [4829] [573] [575] [576] 15H16O2N4S 316,38
30. 1, 5-Ди-(ж-анизил)-тиокарбазон [573] ^15^16^2^4^ 316,38
31. 1, 5-Ди-(я-анизил)-тиокарбазон [573] C15H16O2N4S 316,38
32. 1,5-Ди-(о-метилмеркаптофенил)-тиокарбазон [4829] [573] [575] C15H16N4S3 348,51
33. 1,5-Ди-(п-метилмеркаптофенил)-тиокарбазон [573] [576] C15H16N4S3 348,51
34. 1, 5-Ди-(2, 5-диметил-З,6-дибромфенил)-тиокарбазон [574] CiyH^N^B^S 628,07
35. 1, 5-Ди-(2, 3-ксилил)-тиокарбазон [572] C17H20N4S 312,44
27 Зак. 2157
36. 1,5-Ди-(2,4-ксилил)-тиокарбазон [4816] [572] [576]
37. 1,5-Ди-(2, 5-ксилил)-тиокарбазон [572] [57б]
38. 1,5-Ди-(3,4-ксилил)-тиокарбазон [572]
39. 1,5-Ди-(о-этилфенил)-тиокарбазон [572] [575] [576]
40. 1,5-Ди-(/г-этилфенил)-тиокарбазон [572] [576]
41. 1,5-Ди-(л/-этилфенил)-тиокарбазон [572]
42. 1,5-Ди-(о-фенетил)-тиокарбазон [4829] [573] [576]
43. 1, 5-Ди-(ж-фенетил)-тиокарбазон [573]
44. 1, 5-Ди-(п-фенетил)-тиокарбазон [573] [57б[
45. 1-Фенил-5-(о-феноксифенил)-тиокарбазон [5429]
46. 1,5-Ди-(я-изопропилфенил)-тиокарбазон [572]
47. 1, 5-Ди-(<э-изопропилоксифен11л)-тиокарбазон [573]
48. 1,5-Ди-(1,6-дибром-2-нафтил)-тиокарбазон [5629]
49. 1,5-Ди-(4-хлор-1-нафтил)-тпокарбазон [5629]
50. 1, 5-Дп-(1-хлор-2-нафтил)-тиокарбазон [5629]
51. 1,5-Ди-(4-бром-1-нафтил)-тиокарбазон [5629]
52. 1,5-Дп-(5-бром-1-нафтил)-тиокарбазон [5629] [576]
53. 1,5-Ди-(1-бром-2-нафтил)-тиокарбазон [5629]
54. 1,5-Дп-(а-нафтил)-тнокарбазон [432] [5336] [5629] [601Э]
Продолжение
Mo.i. вес.
C17H20N4S 312,44
C,7H20N4S 312,44
C17H20N4S 312,44
C,7H20N4S 312,44
C17H20N4S 312,44
CI7H20N4S 312,44
C17H20O2N4S 344,44
C,7H20O2N4S 344,44
CI7H20O2N4S 344,44
C19H,6ON4S 348,43
C19H24N4S 340,48
C19H24O2N4S 372,48
C21H12N4Br4S 672,08
C2IH,4N4CI2S 425,35
C21H14N4C12S 425,35
C21H14N4Br2S 514,27
C21H14N4Br2S 514,27
C2,H14N4Br2S 514,27
C2iH16N4S 356,45
Продолжение
418
/Ио. 1. вес
55. 1,5-Ди-([3-нафтил)-тиокарбазон [388] * [402] [432] [4910] [5411] [5641] C2iH16N4S 356,45
56. 1,5-Ди-(р-тетралил)-тиокарбазон [572] C21H24N4S 364,52
57. 1, 5-Ди-(/г-я-бутилфенил)-тиокарбазон [572] [576] C21H28N4S 368,55
58. 1,5-Ди-(/7-772/?£т-бутилфенил)-тиокарбазон [572] С21H28N4S 368,55
59. 1, 5-Ди-[2, 5-(метилизопропил)-фенил]-тиокарбазон [572] C21H28N4S 368,55
60. 1,5-Ди-(о-н-бутоксифенил)-тиокарбазон [573] С21H28O2N4S 400,55
61. 1,5-Ди-(<9-изоамилоксифенил)-тиокарбазон [573] C23H32O2N4S 428,60
62. 1,5-Ди-(о-бифенил)-тиокарбазон [4829] [6022] C25H20N4S 408,53
63. 1,5-Ди-(ж-бифенил)-тиокарбазон [4829] C25H20N4S 408,53
64. 1,5-Ди-(п-бифенил)-тиокарбазон [432] [479] C25I420N4S 408,53
65. 1,5-Ди-(о-феноксифенил)-тиокарбазон [4829] [573] [575], [576] C25H20O2N4S 440,53
66. 1, 5-Ди-(и-феноксифенил)-тиокарбазон [4829] C25H20O2N4S 440,53
67. 1,5-Ди-(о-фенилмеркаптофенил)-тиокарбазон [4829] C25H20N4S3 504,71
68. 1,5-Ди-[2-(/г-метоксифеноксил)-фенил]-тиокарбазон [4829] C27H24O4N4S 500,58
69. 1,5-Ди-[/1-(5-метилбензтиазолил-2)-фенил]-тиокарбазон [572] ^29^22^6^3 582,78
70. 1,5-Ди-(2-фенокси-4-бифенил)-тиокарбазон [4829] ^37^28^2^4^ 624,73
71. 1, 5-Ди-(2-фенилмеркапто-4-бифенил)-тиокарбазон [4829] C37H28N4S3 656,85
* В литературе по вопросу синтеза ди-3-нафтилтиокарбазона иногда встречается ссылка на работу Прейнда Прейнд синтезировал ди-^-нафтилтиокарбазид, но ди-3-нафтилтиокарбазон им получен не был. Ди-З-нафтилтиокарбазон впервые был синтезирован и предложен как аналитический реактив в 1938 г. [38я].
Аналоги дитизона
419
дитизонового метода. В некоторых же частных случаях целесообразна замена дитизона превосходящим его по аналитическим качествам аналогом.
Среди полученных к настоящему времени аналогов дитизона имеются:
1) замещенные дитизона, в фенильные группы которого введены различные электродонорные и электроноакцепторные заместители в различных положениях (алкил-, арил-, алкокси-, арилокси-, галоидо-, нитрозаме-щенные и др.),
2) нафтиловые аналоги и их галоидозамещенные,
3) различные несимметричные производные тиокарбазона
yN=N—R S=C
4 N—NH • Rz
H
Аналоги дитизона представляют собой кристаллические вещества большей частью черные, реже коричневого, темно-зеленого или темно-красного цвета. Растворяются они в органических растворителях, окрашивая их в зеленый цвет с различными оттенками от желтого до синего.
Максимумы поглощения растворов аналогов дитизона, как правило, смещены в длинноволновую область в сравнении с дитизоном.
Нафтильные аналоги в коротковолновой области максимумов поглощения вовсе не имеют [5336] [572] [6019].
Максимумы поглощения несимметричных тиокарбазонов лежат большей частью посредине, между максимумами соответствующих симметричных тиокарбазонов [5429].
В табл. 1 приведены, как примеры, максимумы поглощения некоторых тиокарбазонов, их молярные коэффициенты экстинкции (sMaKC1 и еМаксо) и значения а= —, 12 с2
характеризующие, по Пелькису, состояние тион-тиольно-го равновесия в данном растворителе.
27*
Таблица 1
ОПТИЧЕСКИЕ ХАРАКТЕРИСТИКИ РАСТВОРОВ НЕКОТОРЫХ АНАЛОГОВ ДИТИЗОНА В ОРГАНИЧЕСКИХ РАСТВОРИТЕЛЯХ [БЕНЗОЛЕ, ЧЕТЫРЕХХЛОРИСТОМ УГЛЕРОДЕ (ЖИРНЫЙ ШРИФТ) И ХЛОРОФОРМЕ (В СКОБКАХ)]
Аналоги дитизона Длина волны, .ио. Молярный коэфнцпент поглощения е-10-4 £1 а = — Литература
макс ^2 макс g 1 макс £ 2 макс
Дитизон 620 450 3,88 2,08 Ср. стр. 14 и 15
7,9 4,6 1,72 [57*]
620 450 3,28 2,0 Ср. стр. 14 и 15
3,61 [6010]
(605) (445) (4,00) 1,6 Ср. с гр. 14 и 15
1,5-Ди-(о-толнл)“Тиокарбазон 633 472 [5130]
632 472 12,3 4,8 2,56 [57*]
628 460 3,80 |57'°]
1,5-Ди-(Ж“ТОлпл)“Тпокарбазон 635 464 [5Р“]
635 465 11,4 5,5 2,07 [57*]
1,5-Ди-(/?-толил)-тиокарбазон 631 465 [5Р°]
630 465 14,5 6,4 2,27 [57*]
628 458 4,64 [5631]
1,5-Ди-(о«этилфенил)«тиокарбазон 635 455 8,8 4,08 2,15 [57*]
1,5-Дн-(/ьэтилфенил)-тиокарбазон 635 445 10,2 6.8 1,5 [57*]
1,5-Ди-(/г-бифенил)-тиокарбазон 655 480 10 5,2 1,92 [57*]
1, 5-Д|1-(о-ан11зил)-тиокарбазон 659 486 15,30 6,50 2,35 [57*]
28 Зак. 2157
Аналоги дитизона Длина волны, лги.
\ макс ^2 макс
1. 5-Ди-(.и-анизил)-тиокарбазон 634 465
1,5-Ди-(и-анизил)-тиокарбазон 646 476
1, 5-Ди-(п-феноксифенил)-тиокарба- 650 480
зон 1,5-Ди-(п-метилмеркаптофенил)- 675 530
тиокарбазон 1, 5-Ди-(о-хлорфенил)-тиокарбазон 645 465
1.5-Ди-(лг-хлорфенил)-тиокарбазон 631 460
1, 5-Ди-(п-хлорфенил)-тиокарбазон 626 452
1.5-(о-бромфенил)-тиокарбазон 640 475
1, 5-Ди-(о-йодфенил)-тиокарбазон 655 475
1,5-Ди-(ж-фторфенил)-тиокарбазон 625 420
1, 5-Ди-(2,4-дихлорфенил)-тиокарба- 665 455
зон 1,5-Ди-(а-нафтил)-тиокарбазон 683
1,5-Ди-(р~нафтил)-тиокарбазон 662
1-Фенил-5-о-толилтиокарбазон 626 460
1-Фенил-5-о-феноксифенилтиокар- 635 460
базон
Продолжение табл. I
Молярный коэфициент поглощения е-10~4 Литература
е. 1 макс £ 2 макс
11,03 5,56 1,98 [573]
18,10 6,11 2,96 [573]
8,40 3,60 2,33 [573]
16,44 9,14 1,8 [573]
3,68 3,26 1,12 [574
2,38 2,3 1,03 [574
2,9 2,9 1,00 [574
2,2 2,0 1,10 [574
4,3 4,2 1,02 [574
2,22 2,64 0,8 [574
3,2 4,0 0,8 ]574
11,5 ' —— [574
10,3 - - — —— [574
7,5 — [5424
11,7 ' — [5429]
422
А налоги дитизона
Пелькис, Пупко и Дубенко [57!] на основании спектрофотометрических исследовании считают, что электронодонорные заместители при введении их в фенильные группы дитизона смещают тион-тиольное равновесие в неполярных растворителях в сторону образования тионной формы, а электроноакцепторные — в сторону тиольной формы. С введением электроноакцепторных заместителей в несколько раз уменьшается молярный коэффициент экстинкции и, наоборот, электронодонорные заместители (особенно у /шра-замещенных, где имеет место удлинение цепи сопряжения) в несколько раз повышают его в сравнении с дитизоном.
3 связи с различным состоянием тион-тиольного равновесия находится склонность к образованию одно- и двузамещенных соединений с металлами. Понижение склонности к образованию енольных форм металлических комплексов повышает однозначность процессов образования металлических соединений [4611] [6019].
Ряд аналогов дитизона проявляют большую устойчивость к окислителям в сравнении с дитизоном [4611] [4827] [576]. Это повышает устойчивость их растворов при хранении и возможность определения металлов в присутствии некоторых окислителей.
Пелькис, Дубенко и Пупко [576] исследовали дитизон и 20 его аналогов на устойчивость их к окислению кислородом воздуха и нашли, что 19 из них более устойчивы, чем дитизон.
Состояние равновесий аналогов дитизона:
^2^орг ----
Н2Своди <--
H2Dopr < [>-
21-7 води >
водн
води?
(1)
(2)
(3)
где H2D — аналог дитизона находится в зависимости от растворимости соединений в органическом растворителе и воде и от прочности связи водорода с кислотным остатком. Эти свойства аналогов изменяются в результате проявления поляризующего влияния заместителей и эффекта утяжеления. В некоторых случаях заместитель может повышать растворимость, если он обладает способностью сольватироваться.
Аналоги дитизона
423
Известно, что электронодонорные заместители повышают прочность связи кислотного водорода, в результате чего понижаются кислотные свойства замещенного. Электроноакцепторные заместители действуют в противоположном направлении.
Эффект утяжеления ведет в большинстве случаев к уменьшению растворимости замещенного (если сам заместитель не проявляет способности сольватироваться) и его кислотных свойств. Следовательно, эффект утяжеления дополняет поляризующее влияние электронодонорных заместителей и элиминирует, в той пли иной мере, влияние электроноакцепторных заместителей.
Поляризующее влияние электроноакцепторных заместителей может быть и превзойдено противоположным влиянием эффекта утяжеления.
О прочности связи водорода с кислотными остатками различных аналогов дитизона целесообразно было бы судить по константам равновесия [2]. Однако вследствие очень малой растворимости этих соединений в воде экспериментальное определение указанных констант очень затруднительно.
Согласно Бабко и Пилипенко [467]. по аналогии с дитизоном, константа равновесия (3) должна характеризовать энергию связи ионов Н+ и HD“ в волной фазе с образованием раствора HqD в неводной фазе.
Эти константы позволяют судить о растворимости аналогов дитизона в водных щелочных растворах при извлечении их из растворов в органических растворителях и вычислять концентрации HD~-iiohob в водной фазе в зависимости от pH ее и концентрации реактива в органическом растворителе.
В табл. 2 приведены константы равновесия H2Dopr
НХдн + НПГодн, Лш.р для дитизона и некоторых его аналогов.
Как видно из табл. 2, константы приведенных аналогов дитизона имеют пониженные значения в сравнении с константой дитизона. Растворимость этих аналогов в водных щелочных растворах ниже растворимости дитизона. Некоторые авторы считают это недостатком аналогов дитизона, затрудняющим иногда удаление избытка
28*
424
Аналоги дитизона
Таблица 2
Соединение /(H2d Литература
Дитизон 2- ИГ9 [464
Ди-^-нафтилтиокарбазон 2,1 ИГ13 [56-”]
5- 10”13
Ди-а-нафтилтиокарбазон 1 • иг"
Ди-о-толилтиокарбазон 4 10—12
Ди-/?-толилтиокарбазон 8-10~12
Ди-(2, 4-ксилил)-тиокарбазон .... 2-10“13 I
реактива в одноцветном колориметрическом методе. Но это не имеет значения для метода смешанной окраски. Более того, некоторые аналоги создают более благоприятную тональность смешанной окраски их с комплексными соединениями, чем дитизон. Ценным качеством плохорастворимых в щелочах аналогов дитизона является возможность их применения для очистки растворов различных реактивов, имеющих щелочную реакцию от следов металлов, реагирующих с дитизоном.
Однако некоторые электроноакцепторные заместители, как галогены, например, повышают растворимость замещенных в водных щелочах. Галоидозамещенные дитизона лучше растворяются в водных щелочных растворах, чем алкил- и алкоксизамещенные [574]. Повышение растворимости в водных щелочах наблюдается также и у галоидозамещенных ди-а и ди-р-нафтилтиокарбазонов в сравнении с исходными соединениями [5629].
Состояние равновесия
Мводн + 2H2Dopr ^=± М(НО)2орг + 2Нв+Одн
для различных аналогов дитизона находится в зависимости от прочности связи ионов Н+ с HD“ в H2D и М2+ с HD" в образующемся M(HD)2, а также от растворимости H2D и M(HD)2 в органическом растворителе и воде.
Повышение молекулярного веса, как известно, часто сопровождается уменьшением растворимости и упроче
Аналоги дитизона
425
нием связи металлов в их соединениях. Поляризующее же влияние заместителей на прочность связи металла с кислотным остатком в его солях выяснено еще в недостаточной мере. Оно не всегда имеет одинаковый характер в сравнении с изменением прочности связи водорода, замещающегося металлом. Установление этой зависимости в случае введения в молекулу электроноакцепторных заместителей затрудняется элиминированием поляризующего влияния эффектом утяжеления.
На прочность связи ионов металлов с кислотным остатком аналогов дитизона в их внутрикомплексных солях в ряде случаев оказывают влияние пространственные затруднения в зависимости от положения заместителя и размеров его и иона металла. Поэтому наблюда’ лись случаи, когда влияние заместителей имело различный характер на прочность связи кислотного водорода в реактиве и иона металла в образующейся соли [4611] Например, замещение атомов водорода в фенильных радикалах дитизона метильными группами в орто-положении приводит к повышению прочности связи водорода, замещающегося металлом, тогда как прочность связи атомов металла в комплексных соединениях этого аналога, в сравнении с дитизонатом, уменьшается [4611] [5650].
В результате разнообразного влияния заместителей интервалы pH, в пределах которых происходит количественное извлечение металла из водной фазы аналогами дитизона, различны по своей величине и занимают различные положения в шкале pH, смещаясь в кислую или щелочную область. Это увеличивает в частных случаях избирательность реакций аналогов с металлами [46й] [5710] [6019]. Увеличению специфичности способствуют новые возможности подбора маскирующих средств.
Представляет интерес комбинированное применение дитизона и его аналогов при определении нескольких металлов из одного раствора анализируемой пробы без изменения pH раствора и содержания в нем тех или иных маскирующих средств.
Различное положение интервалов извлечения металлов аналогами дитизона в шкале pH расширяет воз-
426
Аналоги дитизона
можности применения их в качестве экстракционных индикаторов в объемном анализе при определении кислот и щелочей, а также pH в окрашенных водных растворах (см. прим. ред. на стр. 360) и титрометрическом определении металлов по методу Карабаша [53н].
Благодаря большей прочности связи ионов металла с кислотными остатками аналогов дитизона достигается более полное экстрагирование этих ионов из водной фазы и большая чувствительность реакций.
Окраска внутрикомплексных солей аналогов дитизона несколько отлична от окраски дитизонатов.
В рядах комплексных соединений Ag+, Hg+, Bi3+, Cd2+, Pb2+, Zn2+ и Cu2+ с аналогами дитизона, так же как в их дитизонатах, наблюдается последовательное углубление окраски от серебряных соединений к медным. Максимумы поглощения их растворов в органических растворителях последовательно смещаются в длинноволновую область.
В табл. 3 приведены значения длин волн (в лф.) максимумов светопоглощения некоторых дитизонатов и их аналогов в четыреххлористом углероде.
При сравнении светопоглощения растворов комплексов различных аналогов какого-либо одного металла с его дитизонатом чаще наблюдается смещение максимума поглощения аналогов в область длинных волн (углубление окраски). При введении заместителя в фенильные группы дитизона в орто-положение имеет место противоположное смещение — в коротковолновую область (повышение окраски). В этом случае наблюдается также понижение реакционной способности этих аналогов к ионам металлов по сравнению с дитизоном. Такне изменения наблюдались у ди-(о-толил)-тиокарбазона [46й] [5710] и у ди-(о-бромфенил)-тиокарбазона [6022].
Максимумы поглощения ди- (лг-толил) -тиокарбазона-тов очень близки или одинаковы в сравнении с соответствующими дитизонатами.
Молярные коэффициенты поглощения металлических соединений аналогов дитизона определены лишь для незначительного числа их. В табл. 4 приведены их величины для растворов в четыреххлористом углероде.
Таблица 3
ДЛИНЫ ВОЛН В лгр. МАКСИМУМОВ СВЕТОПОГЛ ОШЕНИД НЕКОТОРЫХ ДИТИЗОНАТОВ И ИХ АНАЛОГОВ В ЧЕТЫРЕХХЛОРПСТОМ УГЛЕРОДЕ
Реактив Комплексообразующие ионы Литература
Ag + Hg2 + Bi3 + Cd2+ ! Pb2 + Zn2 + Cu2 +
Дитизон 462 485 490 520 520 538 550 Ср. стр. 40 и 41
460 490 505 520 525 535 548 [5710]
Ди-а-нафтилтиокарбазон 525 535 552 568 1 570 1 [6019
Ди-р-нафтилтиокарбазон 512 555 560 560 [6019
Ди-/г-толилтиокарбазон 474 500 530 530 546 554 [5631] [5710]
Ди-ж-толилтиокарбазон 460 465 520 535 [5130]
Ди-о-толилтиокарбазои 456 486 476 515 500 525 538 [5710i
Таблица 4
Реактив Молярные коэффициенты поглощения металлических комплексов при Хмакс, г-Ю—3 Литература
Hg2 + Cu2 + Zn24~ Cd2 + Pb2 +
Дитизон 71,2 45,2 92,0 88,0 68,8 см. стр. 40 и 41
» 70,0 92,6 84,3 68,6 [5631]
Ди-(/2-толил)-тиокарбазон 80,3 98,4 99,3 69,7 5631'
Ди-(о-толил)-тиокарбазон 50,7 5710
Ди-(р-нафтил)-тиокарбазон 140,0 170,0 150,0 60s]
Ди-(а-нафтил)-тиокарбазон 51,5 6019
Ди-(о-бнфенил)-тиокарбазон .... 48,6 66,3 75.0 6022
428
Аналоги дитизона
К сожалению, очень мало работ посвящено изучению равновесия взаимодействия аналогов дитизона с металл-ионами. Количественное же рассмотрение экстракционных равновесий с применением аналогов дитизона играет большую роль в их аналитической характеристике. В табл. 5 приведены константы равновесий
Мводн + 2H2DCci4 M(HD)orr, +2Н +
Таблица 5
Ион металла Константы равновесия *
дитизон ди-р-нафтилтиокар-базон
Zn2+ 2 • 102 3,4 104
Cd2+ 38,5 44,1
Ni2 + 6,4- 10“2 1,9
для дитизона и ди^-нафтилтиокарбазона в реакциях их с металл-ионами в водном растворе в присутствии ацетатного буфера.
Из всех известных в настоящее время аналогов дитизона аналитические свойства изучены, в той или иной мере, лишь для небольшого числа.
Наибольшее число работ посвящено исследованию аналитических свойств ди-р-нафтилтиокарбазона [388]. Гржегоржевский [54й] [5641] [5812] [608] исследовал ряд свойств р-нафтилового аналога и комплексных соединений его с цинком, кадмием, ртутью, висмутом и никелем, а также разработал метод фотоколориметрического определения малых количеств цинка в алюминии [5835] [6023] с помощью этого аналога.
Ди-р-нафтилтиокарбазон имеет преимущества в сравнении с дитизоном при определении ртути [402] [463],
* Эти константы вычислены нами, исходя из величин Km(HD)2 , найденных Гржегоржевским [5641, 608].
Аналоги дитизона
429
цинка [435] [539], свинца [5132] и кадмия [443]. (См. примечание редактора, стр. 174, 180, 253, 268 и 309.)
Такэи [6019], изучая аналитические свойства ди-а-на-фтилтиокарбазона, установил, что он является более чувствительным и специфичным реактивом, чем дитизон для ртути и меди. По сравнению с ди-(о-толил)-тиокарбазоном а-нафтиловый аналог несколько менее специфичен, но более удобен вследствие трудности образования енольной формы.
Аналитические свойства ди- (о-толил) -тиокарбазона изучали Супрунович и Шамшин [4611]. Они установили реакционную способность о-метилового аналога по отношению к Cu2+, Ag2+, Au3+, Zn2+, Cd2+, Hg2+, Pb2+, Co2+ и Ni2+ и чувствительность реакции его к Hg2+, Pb2+ и Zn2+. При этом было показано, что аналитическим преимуществом данного аналога в сравнении с дитизоном является большая устойчивость к окислителям и более широкие возможности в повышении специфичности аналитических реакций его с металл-ионами. Такэи [5710] подтвердил большую избирательность ди-(о-толил)-тиокарбазона к ртути и меди и разработал методику количественного определения их с помощью этого аналога (см. примечание редактора, стр. 174 и 209).
Комплексообразующие свойства ди- (и-толил) -тиокарбазона с Ag+, Hg2+, Pb2+, Zn2+, Cd2+ и Cu2+ изучали Полтавец и Супрунович [4827]. При этом они установили, что /?-метилзамещенный аналог является более чувствительным реактивом, чем дитизон в реакциях с Hg2+, Pb2+ и Zn2+, и более устойчив к окислителям, что было подтверждено позже работами Пелькиса, Пупко и Дубенко [5130] [576], а также Такэи и Сибуя [5631].
Возможность применения в аналитической химии ди-(о-бромфенил) -тиокарбазона, ди- (n-бромфенил) -тиокарбазона и ди-(/7-бифенил)-тиокарбазона исследовал Такэи [6022]. Он установил, что максимумы поглощения растворов ди- (о-бромфенил) -тиокарбазона и ди- (/г-бифе-нил)-тиокарбазона, а также их комплексов с металлами смещены в коротковолновую область, а для ди-(/г-бром-фенил)-тиокарбазона и его комплексов с металлами — в длинноволновую область. Реакционная способность
430
Аналоги дитизона
ди- (о-бромфенил) -тиокарбазона и ди- (n-бифенил) -тиокарбазона к ионам металлов ниже, чем у дитизона. Ди- (n-бифенил) -тиокарбазоном количественно экстрагируются только Ag+, Hg2+, Cu2+ и Сс12+, тогда как Zn2+, РЬ2-1' и Bi3+ экстрагируются неполностью.
Скотт и Спелл [4615] изучали чувствительность реакций ди- (п-нитрофенил) -тиокарбазона к солям ртути, меди и свинца.
Остальные аналоги дитизона еще не исследованы.
дополнительный список литературы
[36‘23] Вассерман Е. С., Супрунович II. Б., Застосування дГ фенилтюкарбазону для юлькдсного визначення метал!в. Bicri-шституту ф1зично1 хемп АН УРСР, 6, 221—235 (1936).
[3725] Б е л е н ь к и и М, С., П р и х н я В. М., К у з я т и н а И. С., Шапиро Я. Л., Попова О. К., Дитизон его изготовление и применение для определения малых количеств тяжелых металлов. Сб. под ред. Н. К. Шифрина, Изд. Баксовета, Баку, 1937.
[3835] Евланов Г. А., Микроколичественный дитизоноколориметрический метод определения свинца. Научные записки института народного хозяйства им. Плеханова, вып. I, 131 —135 (1938).
[383G] Резников А. А., Полярографическое определение меди и цинка в природных водах. Материалы ЦНИГРИ, Геохимия, Сб. 3, 36—45 (1938).
[40-’] Немец С. М., Дитизоновый метод определения меди в консервах. Консервная и плодоовощная промышленность, № 3, 28—30 (1940).
[4116] Коз л я ев а Т. Н., Определение свинца с помощью фотоэлемента (в виде сульфида и дитизоната). Труды хим. лаборатории (НИИ охраны труда), кн. 3, 77—87 (1941).
рЗ14] Кульберг Л. М., Теоретические основы применения органических реактивов в анализе неорганических соединений (диссертация), Киев, 1943.
[4315] X э р р о л ь д и сотрудники (Harrold G., Meek S., Whitman N. k Cord C.). J. Ind. Hyg. Toxicol., 25, № 6, 233—237 (1943); цитир. no [58s].
[451G] Синякова С. И., О содержании свинца в растениях. Рефераты научно-исследовательских работ, отд. хим. наук АН СССР, Л.—М., 1945, стр. 174.
Г-1517] Синякова С. И., О распространенности свинца в почвах, ДАН СССР, 48, № 9, 677—679 (1915).
[4614] Кульберг Л. М„ Некоторые вопросы теории применения органических реактивов в анализе неорганических соединений. Успехи химии, 15, 605—623 (1946).
* Предисловие, данное к основному списку литературы (стр. 382 и сл.), относится и к дополнительному списку. Перевод заглавий дан
в кавычках.
432
Дополнительный список литературы
[4615] Скотт, Спелл (Scott A. W., Spell С. R.), «Синтез некоторых динитродифенилтиокарбазидов и динитродифенилтиокарбазона». J. Am. Chem., Soc., 68, 328—330 (1946).
[4717] Кузнецов В. И., Основы действия органических реагентов, применяемых в неорганическом анализе. Ж. анал. хим., 2, 67—84 (1947).
[4718] К у л ь б е р г Л. М., Синтезы органических реактивов. М.—Л., Госхимиздат, 1947.
[4825] Никитина Е. И., Микрохимическое определение малых количеств цинка дитизоном в алюминиевых сплавах. Зав. лаб., 14, 272—275 (1948); Труды ВИАМ, 2, 34—35 (1949).
[4826] Супрун ович И. Б., Коновалова А. Б., Количественное определение меди в сталях с помощью дитизона методом колориметрического титрования. Зав. лаб., 14, 1061—1063 (1948).
[4827] П о л т а в е ц Л. Е., Супрун ович И. Б., Комплексообразующие свойства n-дитолилтиокарбазона. Научные записки Днепропетровского университета, 33, 201—207 (1948).
[4828] Мухина 3. С., Полярографическое определение цинка и никеля в алюминиевых сплавах. Зав. лаб., 15, № 5, 522—527 (1948).
[4829] Тарбелл, Тодд, Полсон, Линдстром, Уистреч (Tarbell D. С., Todd С. W., Paulson М. С., Lindstrom Е. G , Wystrach V. Р.). «Синтез некоторых аналогов тиоларбазона»), J. Am. Chem. Soc., 70, 1381—1385 (1948).
[4928] Старчевская А. Д., Применение дитизона при судебнохимических исследованиях (открытие Си, Zn, Pb, Hg и Ag в биологических объектах после разрушения органических веществ). Криминалистика и научно-судебная экспертиза. Сб. 3, Киев, 161 — 169 (1949).
[4929] Ч е р н и х о в Ю. А., Добкина Б. М., Метод определения малых количеств кадмия (с применением извлечения его карбаматом, а затем дитизоном). Зав. лаб., 15, № 8, 906—909 (1949).
[5029] Терентьев А. П., Рухадзе Е. Г., К теории внутри-комплексных соединений как аналитических форм. Ученые записки МГУ, вып. 132, органическая химия, 197—215 (1950).
[503’] Петров А. М., Специфичность методов определения малых количеств свинца. Научные труды химической лаборатории Горьковского НИИ гигиены труда и профзаболеваний. Сб. 4, 93—97 (1950).
[5031] Кульберг Л. М., Органические реактивы в аналитической химии. М.—Л., Госхимиздат, 1950.
[5032] Бергман Г. Г. Определение малых количеств цинка в почвах, растительных и животных организмах. Сб. «Методы определения микроэлементов», изд. АН СССР, М.—Л., 49—68 (1950).
[513?] Пелькис П. С., Пупко Л. С., Исследования в области замещенных тиокарбазона (I. Дитолилтиокарбазоны). Укр. хим. ж., 17, 93—102 (1951).
[5131] Бабко А. К., Пилипенко А. Т., Дубовенко Л. И.,
Дополнительный список литературь!
433
Подготовка концентратов для спектрального анализа путем экстрагирования комплексных соединений дитизоном. Зав. лаб., 17, № 4, 443—445 (1951).
[5132] Вестерберг, Сёхолм (Vesterberg R., Sjoholm О.), «Микроопределение свинца в биологических материалах». Mikrochemie, 38, № 1—2, 81—91 (1951).
[5237] А в р у н и н а А. М., Определение цинка в бронзах с помощью дитизона, Зав. лаб., 18, № 2, 164—166 (1952).
[5238] Мухина 3. С., С у д а р ч и к о в а Т. И., Определение малых количеств цинка в сплавах на хромоникелевой основе (колориметрическим и полярографическим методами). Сб. «Новые методы химического анализа сталей и сплавов», М., Оборонив, 1952, 42—46.
[5239] Гнесин Ю. Д., Строение солей дифенилкарбазида, дифенил-карбазона, дитизона и некоторых их производных. Ученые записки Пятигорского фармацевтического института, 1, 155— 170 (1952).
[524П] Клейнер К. Е., Маркова Л. В., Меркуриметрическое определение хлоридов с применением дитизона как индикатора. Зав. лаб., 18, № 11, 1313—1315 (1952).
[5336] Пелькис П. С., Таутомерия 1,5-дифенилтиокарбазона (дитизона). ДАН СССР, 88, 999—1002 (1953).
[5337] И кед a (Ikeda N.), J. Chem. Soc. Japan, Pure Chem. Sect., 74, 91—93 (1953); C. A., 8294 (1953). Цитировано no [588].
[5333] Г о p ю ш и н а В. Г., Г а й л и с Е. Я., Применение дитизона для определения малых количеств золота. Зав. лаб., 19, № 7 785—788 (1953).
[5339] Н а з а р е в и ч Е. С., Качественный спектрально-химический метод определения микроколичеств некоторых тяжелых металлов в природных водах. Укр, хим., ж. 19, № 5, 544—547 (1953).
[5340] Логинов Н. Я., Фотоколориметрический метод определения цинка в биологическом материале, Ученые записки Моск. гос. пед. института, кафедра общей и аналитической химии, 76, № 5, 73—91 (1953).
[5341] Азрельян О. П., Рабовская С. М., Андреев А. С., Определение малых количеств свинца. Зав. лаб., 19, № 3, 274—276 (1953).
[5428] Г о р ю ш и н а В. Г., Г а й л и с Е. Я., Определение малых количеств платины дитизоном. Зав. лаб., 20, № 1, 14—18 (1954).
[54‘29] Пу пк о Л. С., Пелькис П. С., Исследование в области замещенных тиокарбазона. Синтез и изучение свойств несимметричных производных тиокарбазона. ЖОХ, 24, 1640—1645 (1954).
|5536] Бабко А. К., Физико-химический анализ комплексных соединений в растворах (оптический метод). Изд. АН УССР, Киев, . 1955.
[5537] М а й о р о в Н. Ф., Полуколичественный метод капельного анализа на цинк. Ученые записки Ленинградского Горного института, 30, № 2, 192—202 (1955).
434
Дополнительный список литературы
[553s] Йокосука. «Количественное определение малых количеств свинца в металлической меди. «Нихон киндзоку гаккайси, J. Japan Inst. Metals, 19, № 12, 693—696 (1955); РЖХ, 1956, 68692.
(5539] Минами, Сато, «Титрование малых количеств свинца эти-лендиаминтетрауксусной кислотой в присутствии дитизонового экстракционного индикатора», Бунсэки кагаку, Japan Analyst 4, № 9, 579—581 (1955); РЖХ, 19^7, 47-17.
.[551''] П о с и к а в а, М о р и и а к а, «Определение свинца в осадительной ванне дитизоновым методом», Тоё рэён кадусики кайся сюхо, Sclent. Repts Toyo Rayen Co., 10, № 4, 145—448 (1955); РЖХ, 1957, 23422.
[5626] Пилипенко A. T., Розд1лення метал!в дитизоном. Науков! записки Кшв. университета, х1мичний зб!рник, № 7, 267—281 (1956).
|5627] Пилипенко А. Т., Аналитические реагенты, содержащие тиольную и тионную группы. Успехи химии, 25, 1402—1428 (1956).
[5628] Пелькис П. С., Ду бен ко Р. Г., Строение метилированных форм дитизона и его замещенных. ДАН СССР, ПО, 798—801 (1956).
[5629] Д у б е н к о Р. Г., Пелькис П. С., Исследование в области замещенных арилтиокарбазонов. Синтез и изучение свойств производных 1,5-динафтилтиокарбазонов. Укр. хим. ж., 22, 633—638 (1956).
[5630] Горю ши на В. Г., Г ай лис Е. Я, Повышение специфичности дитизонового метода определения серебра с помощью комплексона III. Зав. лаб., 22, № 8, 905—907 (1956).
[5631] Такэи, Сибуя (Takei S., Shibuya К.), «Синтез производных дитизона и их применение в аналитической химии», I. п, /Г-Дп-метилдитизон», Бунсэки кагаку, Japan Analyst, 5, № 12, 695—701 (1956); РЖХ, 1956, 48 246.
[5632] Едваб (ledwab I.), «Быстрое определение тяжелых металлов в почвах». Bull, intorm. Univ, libre. Bruxelles, Centre geol-chim. appl., № 4, 1—3 (1956); РЖХ, 1957, 8542.
,[5633] Чернихов Ю. Л., Добкина Б. M., Методы определения примесей в цирконии. Зав. лаб., 22, № 9, 1019—1024 (1956).
J5634] Льюк, Кампбелл (Luke С. L., Campbell М. Е.), «Определение следов галлия и индия в германии и двуокиси германия». Anal. Chem., 28, № 8, 1340—1342 (1956); РЖХ, 1957, 4738.
[5635] Лакур, Хейн др икс (Lacourt М. A., Heyndryckx Р.), «Новые ультрамикрометоды прямого определения цинка на бумаге». Microchim. acta, № 11, 1685—1704 (1956); РЖХ, 1957, 19 543.
[563G] Б ё н и г, Хей ген ер (Bonig G., Heigener Н.), «Серийное определение усваиваемых микроэлементов почвы — меди, цинка, кобальта и никеля — методом хроматографии на бумаге». Landwirtsch. Forsch., 9,№2,89—96 (1956); РЖХ, 195/, 23 362.
Дополнительный список литературы
435
[5637] Бёниг (Bonig G.), «Определение микроэлементов почвы-— меди, кобальта, цинка, никеля и молибдена — в растительном материале методом хроматографии на бумаге». Landwirtsch. Forsch., № 2, 97—100 (1956); РЖХ, 1957, 23 363.
[5638] Ш а р р е р, Мунк (Scharrer К., Munk Н.), «Количественное определение небольших количеств цинка в почве, веществах растительного и животного происхождения и удобрениях». Z. Pfanzenerahr, Diing, Bodenkunde, 74, № 1, 24—42 (1956); РЖХ, 1957, 44 850.
[5639] Руденко Н. П., Методы выделения радиоактивных изотопов без носителя. Получение радиохимически чистых ThB и ThC. Ж. анал. хим. 11, 371—375 (1956).
[5640] Родригес-Паск е с, Посс и дон и де Альбинати (Radriguez-Pasques R. Н., Possidoni de Aebinati I. T.), «Определение небольших количеств кадмия в уране». An. Asoc. quim. argent., 44, № 2, 90—103 (1956); РЖХ, 1957, 19 547.
[5641 ] Г р ж е г о р ж е в с к и й А. С., О некоторых свойствах ди-Р-нафтилтиокарбазона и его висмутового и никелевого комплексов. Ж. анал. хим., 11, № 6, 689—693 (1956).
[5642] Гёке (Goke G.), «Определение тяжелых металлов при помощи дитизона». Lab. Praxis, 8, № 2, 13—15 (1956).
[5643] Браун, Керк (Braun С. L., Kirk Р. L.), «Анализ небольших количеств металлов и сплавов электрорастворением и электрофорезом». Mikrochim. acta, № 11, 1593—1599 (1956); РЖХ, 1957, 23 365.
[5644] Холман (Holman Р. Н. С.), «Метод определения легко-растворимой меди в почвах и аллювиях с применением уайт-спирита в качестве растворителя для дитизона». Bull. Inst. Mining and Metallurgy, № 599. 7—16 (1956); РЖХ, 1957, 23 399.
[5645] Л о д о ч н и к о в а Н. В., К вопросу об определении малых количеств кобальта, никеля и меди в горных породах. Информационный сборник ВНИИ геологии, № 3, 116—128 (1956).
[5646] М а к а р ь я н ц А. И., 3 а г л о д и и а Т. В., Ш у в а л о в а Е. Д., Определение малых количеств меди, серебра и висмута в свинце. Сборник научных трудов Гос. НИИ цветных металлов, № 12, 130—137 (1956).
[5647] М а бучи (Mabuchi Н.), «Экстрагирование теллура с применением дитизона». Bull. Chem. Soc. Japan. 2Q, № 7, 842—843 (1956); РЖХ, 1957, 44 405.
[564-] Като, T а к э и, О к а г а м и, Определение малых количеств ртути в присутствии больших количеств Cl-ионов. Равновесие образования комплексного соединения двухвалентной ртути с «энолизированным» дитизоном. Бунсэки кагаку, Japan Analyst, 5, №? 12, 689—695 (1956); РЖХ, 1957, 48 284i
[56!9] К о л о д з е й - Ч а к у в н a (Kolodzieje-Zakowna М.), «Полярографическое определение следовых количеств цинка в сульфате никеля». Chem. anal.. 1, № 2—3, 169—179 (1956): РЖХ, 1958. 7577
436 Дополнительный список литературы
[5650] Супрунов ич И. Б., Аналитические свойства аналогов дитизона. Тезисы докладов на I Всес. совещании по применению органических реагентов в аналитической химии, М., изд. АН СССР, 1956, стр. 39—40.
[571] Пилипенко А. Т., Др око в а И. Г., Спектры поглощения и константы диссоциации дифенилтиокарбазона (дитизона). Ученые записки Киевского университета, 16, вып. 15, Хим. сб. № 8, 113—116 (1957).
[572] Пелькис П. С., Пупко Л. С., Дубенко Р. Г., Исследования в области замещенных 1,5-дифенилтиокарбазона. IV. Синтез алкил- и арилзамещенных 1, 5-дифенилтиокарбазопа. ЖОХ, 27, 1849—1853 (1957).
[573] Пелькис П. С., Дубенко Р. Г., П у п к о Л. С. Исследования в области замещенных 1,5-дифенилтиокарбазона V. Синтез алкокси- и арилоксизамещенных; 1,5-дифенилтиокарбазона, ЖОХ, 27, 1854—1857 (1957).
[574] Пелькис П. С., Дубенко Р. Г., П у п к о Л. С., Исследования в области замещенных 1,5-дифенилтиокарбазона. VI. Синтез и изучение свойств моно- и дигалоидозамещенных 1, 5-дифенилтиокарбазона. ЖОХ, 27, 2134—2138 (1957).
[575J Пелькис П. С., Дубенко Р. Г., Исследования в области замещенных арилтиокарбазонов. Влияние растворителя на таутомерное равновесие в ряду арилтиокарбазонов. Укр. хим. ж., 23, 748—753 (1957).
[576] Пелькис П. С., Дубенко Р. Г., Пупко Л. С., Исследования в области замещенных арилтиокарбазонов. Устойчивость 1,5-дифенилтиокарбазона и его замещенных к окислению, Укр. хим. ж., 23, 754—756 (1957).
[577] Пелькис П. С., Дубенко Р. Г., Фотохимическая изомеризация метилированных производных дитизона и его замещенных. Укр. хим. ж., 23, 64—68 (1957).
[578] Пелькис П. С., Дубенко Р. Г., Изомерные превращения бензильных производных дитизона и его замещенных. Укр. хим. ж., 23, 69—71 (1957).
[579] Кузнецов В. И., Органические реагенты, Ж. анал. хим., 12, 606—617 (1957).
[5710] Такэи (Takei S.), «Синтез производных дитизона и их применение в аналитической химии. И. о, о-Диметилдитизон и его применение для определения ртути и меди». Бунсэки кагаку. Japan Analyst. 6, № 10, 630—637 (1957); РЖХ, 1958, 28 386.
[5711] X е й м, «Фотометрическое определение меди». Pubis Inst, in-vectig. microquim., 23, 112—128 (1957); РЖХ, 1960, 61 028.
[5712] Амер, Абдель Монем Измаил (Amer М. М., Abdel Монет Ismail), «Новый дитизоновый метод титрометрического микро-определения меди с использованием стандартного раствора свинца». Egypt Pharmac. Bull. Pharmac. Soc. Egypt Syndic. Pharmac., 39, № 12, 29—40 (1957); РЖХ, 1960, 38 386.
[5713] Амер, Абдель Монем Измаил (Amer М. М., Abdel Монет Ismail), «Новый дитизоновый метод титрометрического микроопределения серебра с использованием стандартного раствора свинца». Egypt. Pharmac. Bull. Pharmac. Soc.
Дополнительный список литературы
437
Egypt Syndic. Pharmac., 39, № 12, 41—52 (1957); РЖХ, 1960 38 393.
[5714] Волкова А. II., Захарова Н. II., Определение микроколичеств свинца в металлическом индии. Укр. хим. ж., 23, № 4, 530—533 (1957).
[5715] Н а у м е н к о Е. В., Экспериментальный дитизоновый диабет. Патологическая физиология и экспериментальная терапия, № 4, 26—32 < 1957).
[5716] Лурье Ю. Ю., Николаева 3. В., Определение малых количеств свинца. Зав. лаб., 23, № 6. 652—655 (1957).
[5717] О д д р и д ж, Кример (Aldridge W. N., Cremer I. Е.), «Комплексы дитизона с оловоорганическими соединениями. Фотометрическое определение соединений диэтилолова и триэтил-олова». Analyst, 82, № 970, 37—43 (1957); РЖХ, 1957, 54 647.
[5713] Гриффин г, Розе к, Снейдер, Ген дерсо н, «Определение следовых количеств свинца в газолинах и лигроинах», РЖХ, 1957, 63 786.
[5719] Масси (Massey Н. F.), Пламеннофотометрическое определение меди в растительных тканях». Anal. Chem., 29, № 3, 365—366 (1957); РЖХ, 1957, 66 386.
[5720] Миллер, С у о н б е р г (Miller V. L., Swanberg F. I.), «Определение ртути в моче». Anal. Chem., 29, № 3, 391—393 (1957); РЖХ, 1957, 66 396.
[5721] Б он а стр (Bonastre I.), «Колориметрическое определение свинца в пищевых продуктах». Chim. anal., 39, № 3, 104—105 (1957); РЖХ, 1957, 66 402.
[5722] Франсис, Пилгрим (Francies А. С,. Pilgrim А. I.), «Определение следов цинка в пищевых продуктах». Analyst, 82, № 973, 289—292 (1957); РЖХ, 1957, 69 136.
[5723] А й з а к с, Морис, Стакки (Isaacs М. D. I., Morries Р., Stuckey R. Е.), «Применение колонки с окисью алюминия при определении ртути в форме дитизоната», Analyst, 82, № 972, 203—206 (1957); РЖХ, 1957, 69 137.
[5724] Рот (Roth F. I.), «Определение субмикрограммовых количеств ртути». J. Assoc. Offic. Agric. Chem., 40, № 1, 302—305 (1957); РЖХ, 1957, 69 138.
[5725] Абботт, Джонсон (Abbott D. C,. Jonnson E. I.), «Определение следовых количеств ртути в яблоках». Analyst, 82, № 972, 206—208 (1957); РЖХ,'1957, 69 139.
[572fi] Нейман (Neumann F.), «Определение следов свинца в органических веществах (визуальный дитизоновый метод смешанных окрасок)», Z. anal. Chem., 155, № 5, 340—349 (1957); РЖХ, 1957, 71 928.
[5727] Абсон, Л и пеком, (Abson D., Lipscomb G.), «Определение свинца и меди в органических материалах (пищевые продукты) при разложении образцов методом сухого сжигания». Analyst, 82, № 972, 152—160 (1957); РЖХ, 1957, 74 676.
[5728] Иванчев (Iwantscheff G.), «Дитизоновые методы в химическом анализе. Обзор работ за последние 15 лет». Angp'v, Chem., 69, № 13—14, 472—477 (1957).
29 Зак. 2157
438
Дополнительный список, литературы
[5729] Д р у, Кинг (Druw R. G., King Е.), «Усовершенствованный метод определения ртути в воздухе поглощением раствором перманганата». Analyst, 82, № 976, 461—467 (1957); РЖХ, 1958, 7584.
[5730] М е ч е р л и, Лилли. Уитман (Mechcrly Р. L., Lilly А., Whitman N. Е.), «Определение свинца в воздухе и биологических жидкостях». Amer. Industr. Hvd. Assoc. Quart., 8, № 2, 161 — 161 (1957); РЖХ, 1958, 7594.
[5731] Дункан, Томас (Duncan F., Thomas F. G.), «Радиометрическое титрование 10-7—10~5 г переходных металлов». J. Inorg. NucL Chem., 4, № 5—6, 376—379 (1957); РЖХ, 1958, 14 135.
[5732] M e й н с, M а к - Б p а и д (Maynes A. D., Mc-Bryde W. A. E.), «Определение следовых количеств свинца в минералах вулканического происхождения», Anal. Chem. 29, № 9, 1259—1263 (1957); РЖХ, 1958, 14 170.
[5733] Котрлый (Kotrly S.), «Комплексометрическое титрование (хелатометрия). XXVIII. Микроопределение свинца с применением дитизона в качестве индикатора». Chem. listy, 51, № 4, 730—734 (1957); Сборник чехословацких химических работ, 22, № 6, 1765—1770 (1957); РЖХ, 1958, 24 773.
[5734] Корен ман II. М., Шеянова Ф. Р., Экстрагирование как метод физико-химического анализа. Ж. анал. хим., 12, № 3, 285—295 (1957).
[5735] Гото, Хирокава (Goto Н., Hirokawa К.), «Определение примесей в ферросплавах. I. Определение малых количеств свинца в электролитическом марганце и ферромарганце»: Нихон киндзоку гаккайси, J. Japan Inst. Metals, 21, № 1, 65—68 (1957); РЖХ, 1957, 77 350.
[5736] Катино, М а лет то (Catino A., Maletto М.), «Выделение свинца, таллия и висмута методом противоточного распределения». Rassegna chim.. 9, № 5, 3—10 (1957); РЖХ, 1958, 46 371.
[5737] Д а й а п е р, Куксис (Diaper D. G. М., Kuksis А.), «Определение свинца при помощи дитизона в однофазной водиоацето-иовой системе», Canad. J. Chem., 35, № 11, 1278—1284 (1957); РЖХ, 1958, 77 246.
[573S] В е н т у р е л л о, Ге (Venturello G., Ghe А. М.), «Систематический анализ алюминиевых сплавов с применением метода хроматографии на колонке с целлюлозой. Сообщение И. Количественный анализ». Ann. chimica, 47, № 7—8, 919—928 (1957); РЖХ. 1958, 28 504.
[5739] В а р д ь е, Стейн, II в (Verdier Е. Г, Steyn W. I. А. Eve D. I.), «Определение и пика в растениях и почвах». J Agric. a. Food Chem., 5, № 5. 354—360 (1957); РЖХ, 1958,35 894.
[57411] Лоунамаа (Lounamaa К.), «Химическое обогащение и спектральное определение следовых количеств некоторых элементов в силикатных породах», Suomen Кет., 30, № 12, 13 232— 13 240 (1957); РЖХ, 1958, 39 393.
[5741] Дейк, Слот хау вер (Dyk С. Р., van Sioth-mwer Г. М.), «Определение мпкроколичеств некоторы.х металлов при помощи аптизона (Ph, Bi, Си. Zn, Cd, Hg и Au в биологических
Дополнительный список литературы
439
материалах и пищевых продуктах)». Chem. wtekbi., 53, № 52, 704—708 (1957); РЖХ, 1958, 39 404.
[574-] Надь, Попик (Nadi Z., Poeyik Е.), «Спектральное определение следовых количеств элементов в природных водах» Magyar kern, folyoirat, 63, Ab 11, 207—302 (1957); РЖХ, 1958, 39 407.
[57n] Д у к а, Стэнеску (Duca A., Stanescu D.), «Определение некоторых микроэлементов почвы (Си, Pb. Ni, Со, Мп) полярографическим и фотометрическим методами». Studii si cercetari Chim. Acad. RPR Eil. Cluj, 8, № 1—2, 75—83 (1957); РЖХ, 1958, 46 434.
[5 744] Кох, Дедик (Koch O. G., Dedik G. А.), «Спектральные определения следовых количеств элементов в золе синтетического волокна после их экстрагирования в форме комплексов с пирролидиндитиокарбаматом и дитизоном». Chem. Analyst, 46, № 4, 88, 90—91 (1957); РЖХ, 1958, 70 612.
[5745] Марченко (Marczenko Z.), «Дитизон — основной органический реактив при анализе следов металлов». Chem. anal., 2, № 5, 393—414 (1957); РЖХ, 1958, 81 271.
[5746] Стрельникова Н. П., Определение малых количеств цинка в рудах и металлах с высоким содержанием железа. Зав. лаб., 23, № 3, 277—278 (1957).
[5747] Зыков С. 11., Ступникова Н. И., Об определении изотопного состава свинца. Ж. анал. хим., 12, № 4, 356—358 (1957).
[574S] А л и м а р и н II. П., Полянский В. Н., Применение экстракции в аналитической химии. Сборник трудов iMockob-ского вечернего металлургического института, вып. 2, 187—252 (1957).
[5749] Бегнал, Робертсон (Bagnall К. W., Robertson D. С.).. «Изучение экстракции полония из растворов». J. Chem. Soc., 100, 509—512 (1957).
[581] М и н ч е в с к и й, Малешевская (Minczewski I., Males-zewska Н.), «Попытки применения дитизонатов одних металлов для определения других металлов». Chem. anal., 3, № 3— 4, 655—658 (1958); РЖХ, 1960, 85 972.
[582] Кроужек, Повондра (Krouzek Е., Povondra Р). «Определение небольших количеств ртути в ископаемом сырье». Chem. listy, 52, № 9, 1825—1827 (1958); Collect, czechosl. chem., commun., 24, № 1, 280—282 (1959); РЖХ, 1959, 67 649.
[583] Маркова A. 11., Очистка дитизона при определении микроколичеств металла. Зав. лаб., 24, № 9, 1069 (1958).
[58Мил лер А. Д., Л и б и н а Р. II., К вопросу об определении микроколичеств меди, свинца и цинка в природных водах и вытяжках из почв. Ж. анал. хим., 13, № 6, 664—667 (1958).
[583] К о р е н м а н И. М., Ш е я н о в а Ф. Р., Неизотопные индикаторы в радиометрическом титровании. Труды комиссии по аналитической химии АН СССР, 9 (12), 205—212 (1958).
[58G] Алек со в ск ий В. Б., Л и б и и а Р. II., Миллер А. Д.. Определение микроколичеств свинца и меди в растворах при предварительном концентрировании посредством ионообмен-
29*
440
Дополнительный список литературы
ной колонки. Труды Ленинградского технологического института им. Ленсовета, вып. 48, 5—11 (1958).
[587] Пендер (Pender Н. W.), «Спектрофотометрическое определение меди в титановых сплавах с применением метода экстрагирования с дитизоном». Anal. Chem., 30, № 12, 1915—1917 (1958); РЖХ, 1959, 34 591.
[58s] Бу се в А. И. Аналитическая химия индия. М, Изд. АН СССР, 1958.
[58!)] Катино, Оддоне (Catino A., Oddone А.), «Разделение и определение металлов в форме их дитизонатов методом противоточного распределения». Ressegna chim., 10, № 4, 13—21 (1958); РЖХ, 1959, 53 093.
[5810] Арчер (Archer Е. Е.), «Аргентометрическое титрование галоген- и циан-ионов с использованием дитизона в качестве индикатора». Analyst, 83, № 991, 577—579 (1958); РЖХ, 1959, 27 101.
[5811] Юань, Фиске л л (Yuan Т. L., Fishel I. G. А.), «Применение дитизонового и цирконового методов для определения цинка в растительных материалах. Отделение мешающих элементов с помощью ионообменных смол». J. Assoc. Offic. Agric. Chem., 41, № 2, 424—428 (1958), РЖХ, 1959, 26 994.
[5812] Г р ж е г о р ж е в с к и й А. С., О некоторых свойствах цинкового комплекса ди-^-нафтилтиокарбазона. Научные доклады высшей школы. Химия и хим. техн., № 3, 479—481 (1958).
[5813] Назаренко В. А., Флянтикова Г. В., Анализ чистых металлов. Определение примеси кадмия в индии и таллии. Зав. лаб, 24, № 7, 801—802 (1958).
[5814] Ота, Мори (Ota К, Mori S.), «Быстрое спектрофотометрическое определение свинца в свинцовистой стали с высокими режущими свойствами при помощи дитизона». Нихон киндзоку гаккайси, Nippon kinzoku gakkai-si, J. Japan Inst. Metals 22, № 6, 290—292 (1958); РЖХ, 1959, 38 311.
[5815J Степанюк О. M, Определение растворимости диэтилдитиокарбамата цинка. Сборник научных трудов Днепропетровского медицинского института, 6, 447—449 (1958).
[5816] Гото, Хирокава (Goto Н, Hirokawa К-), «Быстрое определение малых количеств свинца в электролитическом марганце и ферромарганце». Sci. Repts Res. Inst. Tohoku Univ, A10, № 1, 11—19 (1958).
[5817] «Методы химического анализа, применяемые для текущего контроля металлургического производства. (Сплавы меди. Алюминий и его сплавы)». Methodes d’analyses chimiques de-stinees au controle courant en fonderic, Paris, 1953—1957; РЖХ, 1958, 67 325C—67 327C.
[5818] Пауэлл, Кинсер (Powell R. A, Kinser С. А.), «Дитизоновый метод определения свинца в монацитах». Anal. Chem, 30, № 6, 1139—1140 (1958); РЖХ, 1958, 77 247.
[5819] Доусон, Мей джи (Dawson I, Magee R. J.), «Определение сурьмы, олова и свинца». Mikrochim. acta, 3, 330—336 (1958); РЖХ, 1958, 77 195.
Дополнительный список литературы 441
[58'2°] «Фотометрическое определение свинца в моче». (The absorp-tiometric determination of lead in urine. Rept. Atomic Energy Res. Establ., 1958, № 100, AM/W-169); РЖХ, 1959, 23 047.
[5821] К ox (Koch O. G.), «Определение следов элементов. I. Определение следов элементов в алюминии и его соединениях. II. Определение следов элементов в титане и его соединениях», Mikrochim. acta, № 1, 92—103, 151—158 (1958)- РЖХ, 1958, 43 067.
[5822] Хебер л и (Haberli Е.), «Определение примесей металлов в сверхчистой сурьме дитизоновым методом». Z. anal. Chem., 160, № 1, 15—20 (1958); РЖХ, 1958, 57 219.
[5823] Зутер, Хардорн (Suter Н., Hardorn Н.), «Микроопределение хлоридов (в селене)». Z. anal. Chem., 160, № 5, 335—343 (1958); РЖХ, 1958, 64 229.
[5824] Кох (Koch О. G.), «Определение следов элементов. III. Определение следов элементов в цирконии и его соединениях. IV. Определение следов элементов в селене высокой чистоты». Mikrochim. acta, № 3, 347—352, 402—405 (1958); РЖХ, 1958, 70 609.
[5825] Фрайрсон, Ририк, Ио (Frierson W., Rearick D., Yoc J.), «Разделение следовых количеств кобальта, никеля, меди и цинка методом хроматографии на бумаге и их спектрографическое определение». Anal. Chem., 30, № 4, Part I, 468—471 (1958); РЖХ, 1958, 77 167.
[5826] Ничипоренко Г. И., Определение сульфатных ионов методом прямого титрования азотнокислым свинцом с дитизоном в качестве индикатора. Изв. АН СССР, Отд. хим. наук, № 3, 359—361 (1958).
[5827] Хара (Hara S.), «Фотометрическое определение серебра с помощью дитизона». Бунсэки кагаку, Japan Analyst, 7, № 3, 142—147 (1958); РЖХ, 1958, 81 290.
[5828] Ми ж он (Migeon J.), «Определение следовых количеств цинка в железе и его сплавах». Chim. anal., 40, № 8, 287—292 (1958); РЖХ, 1958, 81 298.
[5829] Сугихара, Сайто (Sugihara К., Saito Т.), «Полярографическое определение тяжелых металлов в химически чистом хлориде натрия. I. Определение свинца. II. Определение меди и цинка». Бунсэки кагаку, Japan Analyst, 4, № 1, 57—30 (1955); 7, № 3, 139—142 (1958); РЖХ, 1958, 81 361.
[5830] Кларк, Куттитта (Clarke R. S., Cuttitta F.), «Определение таллия методом смешанной окраски с дитизоном». Anal, chim. acta, 19, № 6, 555—562 (1958); РЖХ, 1959, 27 028.
[583!] Гёке (Goke G.), «Микрохимический анализ неорганических веществ. I и II». Lab.-Praxis, 10, № 11, 164—165, № 12, 183 (1958); РЖХ, 1959, 34 579.
[5832] Стантон, Куп (Stanton R. Е., Сооре I. А.), «Модифицированный полевой метод определения малых количеств никеля в почвах и породах». Bull. Inst. Mining and Metallurgy, № 623, Transaction, 1958—1959, 68, № 1, 9—14 (1958); РЖХ, 1959, 27 065.
442
Дополниiельныи список литературы
[583;] Коста (Costa А. С.), «Дитизон как индикатор для прямого титрования металлов комплексоном III». Chemist-Analyst, 47, № 2, 39—40 (1958); РЖХ, 1959, 81 912.
[5831] Пупко Л. С., Пелькис П. С., Восстановительное расщепление несимметричных производных 1,5-дифеиилтиокарба-зона. Укр. хим. ж., 24, № 4, 477—480 (1958).
[583’] Г р ж е г о р ж е в с к и й А. С., Фотоколориметрическое определение малых количеств цинка в алюминии посредством ди-3-иафтплтиокарбазоиа. Тезисы докладов совещания по химическому контролю в металлургической и металлообрабатывающей промышленности, Днепропетровск, 1958, 19.
[591] Корен ман II. М., Шеянова Ф. Р., Некоторые вопросы теории экстрагирования. Пзв. высших учебных заведений. Химия и хим. техн., 2, № 2, 151—156 (1959).
[592] Ота, Мори (Ota К., Mori S.), «Спектрофотометрическое определение малых количеств свинца в чугуне». Нихон кпн-дзоку гаккайси, J. Japan Inst. Metals, 23, № 1, 42—44 (1959); РЖХ, 1959, 4636.
[593] Ота (Ota К.), «Определение малых количеств специальных добавок в чугуне. Сообщение II. Спектрофотометрическое определение малых количеств цинка в чугуне». Нихон кин-дзоку гаккайси, J. Chem. Soc. Japan Pure Chem. Soc., 23, №3, 160—164 (1959); РЖХ, 1959, 26 237.
[594] Судзуки (Suzuki N.), «Количественный анализ методом изотопного обмена. Определение серебра при помощи радиоактивного дитизоната серебра». Нихон кагаку дзасси, J. Chem. Soc. Japan, Pure Chem. Soc. 80, № 4, 373—375. A 29 (1959); РЖХ, 1960, 42 370.
[595] Судзуки (Suzuki N.), «Изучение устойчивости растворов дитизона и дитизоната серебра в четырёххлористом углероде с применением радиоактивного изотопа серебра». Бунсэки кагаку, Japan Analist, 8, № 6, 349—353 (1959); РЖХ, 1960, 42 328.
[59б] Смит, Хейс (Smit D. М., Hayes I. R.), «Определение следовых количеств меди и кобальта методами комплексообразовательной хроматографии и дитизоновой фотометрии». Anal. Chem., 31, № 5, 898—902 (1959); РЖЖ, 1959, 78 284.
[597] Лю Б и к - у, «Определение микроколичеств серебра в висмуте и его соединениях». Хуасюе шицзе, Huazue Shijie, 14, Ab 12, 601—602 (1959); РЖХ, 1960. 69 143.
[59 s] К о р е н м а н И. М., Ш е я н о в а Ф. Р., Савельева М. И., Некоторые вопросы применения затвердевающих экстрагентов. Труды по химии и хим. техн., вып. I, 66—69 (1959).
[599] П е й в е Я. В., Р и н ь к и с Г. Я., Методы быстрого определения доступных растениям микроэлементов (Си, Zn, Ain, Со, Мо и В) в почва ?\. Почвоведение, № 9, 65—72 (1959).
[5910] Хилл (Hill V. G.), «Применение уайт-спирита в дитизоновой колориметрии в полевы.х условиях». Econ. Geol., 54, № 2, 310—312 (1959); РЖЖ, 1959, 71 206.
[5911] Стантон (Stanton R. Е.), «Дискуссия по статье: Хилл, Применение уайт-спирита в дитизоновой колориметрии в полевых условиях». Econ. Geol., 54, № 8, 1577—1578 (1959).
Дополнительный список литературы
443
[5912] С у д о, Хирокава (Sudo Е., Hirokava К.), «Жидкостная дитизоновая экстракция». Бунсэки кагаку, Japan Analyst, 8, № 2, 138—141 (1959); РЖХ, 1960, 42 353. ‘
[5913] Маркова Л. В., Клейнер К. Е., Определение натрия по цинку экстракционным титрованием. Зав. лаб., 25, № 2, 144—145 (1959).
[5914] Бабко А. К., К л и б у с Г. X., Разделение цинка и кадмия -яри помощи дитизона и комплексона III. Допов1д1 АН УРСР, № 9, 991—994 (1959).
[5915] Майоров Н. Ф., Методика определения цинка и свинца из одной навески методом капельного анализа. Записки Ленинградского горного института, 36, № 2, 104—107 (1959).
[5916] Бабко А. К., М а р ч е н к о П. В., Определение микропримесей с применением основных красителей. Зав. лаб., 25, № 9, 1047—1050 (1959).
[5917] Луи, Лекашё (Luis Е., Lecacheux М. Fh.) «Практический метод определения олиго-элементов Си, Zn и Мп в растениях и почвах, пригодный для применения в агрохимических лабораториях». Ann. Inst. nat. rech. agron., A10, № 3, 349—365 (1959); РЖЖ, I960, 61 136.
[5918] К а м п e н, Дюмулен (Campen W. A., Dumoulin H.), «Метод озоления органических материалов, исключающий возможность улетучивания цинка и определение его при помощи дитизона». Chem. weekbl., 55, № 45, 632—633 (1959); РЖХ, 1960, 47 183.
[5919] Назаренко В. А., Бирюк Е. А., Определение висмута, свинца и кадмия в ванадии и ниобии. Зав. лаб., 25, N? 1, 28—30 (1959).
[5920] М о н ь е, X е р д и, Фогель, Венгер (Monnier D., Haerdi W., Vogel I., Wenger P. E.), «Макро- и микроопределение следовых количеств кобальта. II. Отделение кобальта методом дитизоновой экстракции». Helv. chim. acta, 42, № 6, 1846—1854 (1959); РЖХ, I960, 26 300.
[5921] Баскова 3. А., К, вопросу определения малых количеств свинца в горных породах. Ж. анал. хим., 14, № 1, 75—80 (1959).
[5922] Хепфнер (Hopfner G.), «Значение определения свинца в высокорежущих сталях». Lab.-Praxis. 11, № 2, 17—20, № 3, 35—37, № 4, 53—55 (1959).
[5923] «Метод определения меди в урановых материалах». (Analytical method for the determination of copper in uranic materials Product Group U. K. Atomic Energy Author. 1959, № 14); РЖХ, 1960, 73 044.
A9-4] «Определение свинца (в органических материалах)». (The determination of lead). Analyst, 84, ЛЪ 996, 127—134 (1959)-РЖХ, 1959, 64 202.
5925] Ванча, Волушнюк (Vancea M., Volusniuc M.), «К применению дитизона в качестве внутреннего индикатора в осадительной титрометрии. I. Прямое пирометрическое определение висмута в виде фосфата висмута. II. Прямое определение свинца в виде фосфата свинца. П. Прямое титрометрическое
444
Дополнительный список литературы
определение висмута в виде арсената висмута. IV. Прямое титрометрическое определение висмута в виде оксалата висмута. V. Прямое титрометрическое определение арсенатов в виде арсенатов висмута». Studii si cercetari Chim. Acad. RPR Fil. Cluj, 10, № 2, 269—273, 275—278, 279—281, 287—290, 291—293 (1959); РЖХ, 1960, 77 013.
[5926] «Метод фотометрического определения свинца в металлическом цирконии». (Analytical method for the absorptiometric determination of lead in zirconium metal. Product. Croup. U. K. Atomic Energy Author, 1959, № 19, (S), 6 pp.) РЖХ, 1960, 77 047.
[5927] К о p e н м а н И. M., Ш e я н о в а Ф. Р., Митрохина Т. Н., Трапезникова Т. Н., Экстрагирование и радиометрическое определение индия. Труды по химии и хим. техн., вып. 2, 414—420 (1959).
[5928] Немировская А. Ф., Петрашень В. И., Органические реактивы в аналитической химии свинца. I. Определение малых количеств свинца. Труды Новочеркасского политехнического института, 97, 193—203 (1959).
[5929] Больсон (Bolzan J. Е.), «Улучшение визуального наблюдения конечной точки в титрометрии». Chemist-Analyst, 48, Кд 1.
18—19 (1959); РЖХ, 1960, 65 011.
[5930] П ю ш е л ь, Л а с н е р, Рейзер (Piischel R., Lassner Е., Reiser Р. L.), «Применение металлоспецифических индикаторов при титровании по методу осаждения. IV. Быстрое определение сульфата титрованием раствором свинца». Z. anal. Chem., 166, № 6, 401—406 (1959); РЖЖ, 1959, 71 250.
[5931] Кункел, Бакли, Горик (Kunkel R. К., Buckley J. Е., Go-ric G.), «Определение алифатических меркаптанов в углеводородах титрованием азотнокислым серебром в присутствии дитизона», Anal. Chem., 31, № 6, 1098—1099 (1959); РЖХ, 1960, 2538.
[5932] Еременко В. Я-, К вопросу об определении микроэлементов в природных водах. Гидрохимические материалы, 29, 242—247 (1959).
[5933] Нага и (Nagai Н.), «Хроматография неорганических катионов на бумаге с использованием дитизона». Нихон кагаку дзаси, Nippon kagaku zasshi, J. Chem. Soc. Japan Pure Chem. Sect., 80, № 6, 617—619 (1959); РЖХ, 1960, 26 206.
[5934] Поддубная Л. В., Поддубный Б. Н., Прибор для серийного экстрагирования органическим растворителем в делительной воронке. Сб. научных трудов Ростовского медицинского института, кн. 10, 187—188 (1959).
[5935] Амада Кадзуо, «Быстрый анализ свинца в свинцовистой автоматной стали». Тоёта гидзюцу, Toyota Eng., 11, № 1, 57—66 (1959); РЖХ, 1960, 92 091.
[601] Дубенко Р. Г., Пелькис П. С., Шека И. А., Дипольные моменты некоторых S-метильных производных арилтиокарбазонов. Укр. хим. ж., 26, 48—52 (1960).
Г60'2] С у п р у н о в и ч И. Б., Идентификация дитизона и его о- и ц-метилзамещенных, Ж. анал. хим., 15, 218—221 (1960),
Дополнительный список литературы 445
[603] Синякова С. И., Цветкова Л. А., Определение примесей кадмия, серебра и золота в металлическом висмуте при помощи дитизона. Труды комиссии по аналитической химии АН СССР, 12, Методы определения примесей в чистых металлах, 191—205, 1960.
[604] Миллер А. Д., Аранович М. И., Дитизоновый метод определения малых концентраций цианидов. Зав. лаб., 26, 426—429 (1960).
[605] Кимура, Миллер (Kimura, Miller V. L.), «Разделение соединений метил- или этилртути и металлической ртути в паровой фазе». Anal. Chem., 32, № 3, 440—424 (1960); РЖХ, 1960, 62 297
[606] Швейцер, Дайер (Schweitzer G. К., Dyer F. F.), «Изучение экстракции дитизонатов кадмия и серебра». Anal. chim. acta, 22, № 2, 172—180 (1960); РЖХ, 1960, 60 989.
[607] Н а з а р е н к о В. А., Фуга Н. А., Флянтикова Г. В., Эстер л ис К. А., Анализ чистых металлов. Определение примесей свинца и цинка в индии и таллии. Зав. лаб., 26, № 2, 131—134 (1960).
[608] Гржегоржевский А. С., Исследование некоторых свойств цинкового, кадмиевого, ртутного, висмутового и никелевого комплексов ди-р-нафтилтиокарбазона. Труды комиссии по аналитической химии, II. Органические реагенты в аналитической химии, 165—171 (1960).
[609] Воук, Вебер (Vouk V. В., Weber О. А.), «Константа экстрагирования дитизоната свинца». Analyst, 85, № 1006, 46—51 (1960); РЖХ, 1960, 60 990.
[6010] Вебер, Воук (Weber О. В., Vouk V. В.), «Молярный коэффициент светопоглощения дитизона и дитизоната свинца в четыреххлористом углероде». Analyst, 85, № 1006, 40—45 (1960); РЖХ I960, 60 991.
[6011] Стрельникова Н. П., Павлова В. Н., Краткое сообще-ние об определении малых количеств свинца в рудах с большим содержанием железа. Зав. лаб., 26, № 1, 63 (1960).
[6012] Д е й в и с, Луна (Davies R. I., Luna С.), «Количественная хроматография на бумаге неорганических ионов из почвы и растений». Analyst, 85, № 1008, 203—207 (I960); РЖХ, 1960, 73 012.
[6013] Руни (Rooney R. С.), «Обзор методов определения свинца в чугуне». В. С. I. R. A. Journal, 8, № 3, 360—376 (1960); РЖХ, 1960, 73 070.
[6014] Рекер (Raker К- О.), «Определение цинка и меди в биологических материалах». Z. anal. Chem., 173, № 1, 57—58 (1960); РЖХ, 1960, 73 150.
[6015] Вил, Вуд (Veale С. R., Wood R. G.), «Определение следовых количеств свинца в теллуровой кислоте». Analyst, 85, № 1010, 371—374 (1960); РЖХ, 1960, 80 780
[6016] Готшальк (Gottschalk G.), «Комплексометрическое определение алюминия с дитизоном в качестве индикатора». Z. anal Chem., 172, № 3, 192-197 (I960); РЖХ, 1960, 65 084.
446 Дополнительный список литературы
[6017] М у х и н а 3. С., Т и х о н о в а А. Л., Ж е м ч у ж н а я И. А., Определение следов свинца, олова, висмута и кадмия в металлическом хроме и его сплавах. Труды комиссии по аналитической химии АН СССР, 12, Методы определения примесей в чистых металлах, 298—310 (1960).
[6018] Марченко П. В., Определение малых количеств цинка в металлическом кадмии. Зав. лаб. 26, № 5, 532—535 (1960).
[60i9] Такэи (Takei S.), «Синтез производных дитизона и их применение в аналитической химии. III. Ди(а-нафтил)-тиокарбазон. IV. Применение ди-(а-нафтил)-тиокарбазона как аналитического реактива для двухвалентной ртути и меди», Бунсэки Кагаку, Japan Analist/9, № 4, 288—294, 294—298 (1960); РЖХ, 1960, 84 391.
[GO20] С у г и х а р a (Sugihara Т.), «Определение следов серебра в горячен ключевой воде». Нихон кагаку дзасси, Nippon ka-gaku zassni, J. Chem. Soc., Japan, Pure Chem. Sect., 81, № 1, 77—80, A5 (1960); РЖХ, 1960, 84 410.
[60?1] M а э к а в а, П о н э я м а, Фудз и м ори (Maekawa S., Yo-neyama Y., Fugimori E.), «Определение следовых количеств элементов в железе и сталях. I. Определение цинка в железе и углеродистых сталях экстракционно-полярографическим методом с использованием дитизона». Бунсэки кагаку, Japan Analyst 9, Nj 3, 244—247 (1960); РЖХ, 1960, 84 420.
[6022] Такэи (Takei S.), «Синтез производных дитизона и их применение в аналитической химии. V. Ди-(п-бромфенил)-тиокарбазон и ди-(о-бромфенил)-тиокарбазон. VI. Ди-(о-дифе-нил) -тиокарбазон». Бунсэки кагаку, Japan Analyst, 9, № 5. 369—409, 409—415 (1960); РЖХ, 1960, 96 110.
[6023] Г р ж е г о р ж е в с к и й А. С., Фотоколориметрическое определение малых количеств цинка в алюминии посредством ди-₽-нафтилтиокарбазона. Сб. Химический контроль производства в металлургической и металлообрабатывающей промышленности, 1960, Днепропетровск, стр. 125—127.
содержание
Предисловие............................................... 5
Предисловие профессора Г. Фишера ......................... 7
Предисловие автора........................................ 11
Глава 1. Дитизон и образуемые им внутрикомплексные соединения ........................................ 13
I. Дитизон........................................ 13
1. Общие сведения................................. 13
2. Отношение к неорганическим растворителям ... 13
3. Отношение к органическим растворителям .... 17
4. Равновесие в одно- и двухфазных системах .... 19
5. Структурные формулы дитизона .................. 24
6. Производные дитизона........................... 25
II. Внутрикомплексные соединения.................... 31
1. Общие сведения................................. 31
2. Твердые дитизонаты............................. 37
3. Растворы дитизонатов в органических растворителях 39
4. Равновесие в одно- и двухфазных системах .... 43
5. Разложение и разрушение дитизонатов............ 65
Г лава 2. Общие сведения о методах определения элементов с помощью дитизона................................... 66
I. Оборудование.................................... 66
1. Рабочее место.................................. 66
2. Приборы........................................ 66
а. Посуда...................................... 67
б. Аппараты.................................... 71
3. Реактивы....................................... 73
а. Основные реактивы..........................• 74
б. Вспомогательные реактивы.................. 100
II. Основные методы определения металлов с помощью дитизона ..... ................................ 105
448
Содержание
Общие сведения....................................105
Классификация и выбор основных методов анализа 106
1. Объемные методы................................109
а. Прямое экстракционное титрование..............ПО
б. Косвенное экстракционное титрование ........ 111
2. Колориметрические методы.......................113
а. Метод одноцветной колориметрии...............115
б. Методы смешанной окраски.....................121
III. Разделение металлов............................129
1. Изменение валентности иона.....................129
2. Различие в сродстве............................129
3. Экстрагирование в определенной области pH ... 131
4. Разложение дитизонатов при определенном pH . . . 133
5. Экстракция и разложение в присутствии маскирующих веществ....................................134
6. Разрушение дитизонатов.........................138
7. Различного вида помехи .............139
Глава 3. Применение дитизона в количественном анализе 142
Предварительные замечания ............ 142
Определение металлов группы дитизона • ..... 145
Серебро.............................................145
а) Общие сведения.................................145
б) Основные методы определения..................153
в) Применение ....................................157
г) Примеры........................................159
Ртуть...............................................162
а) Общие сведения.................................162
б) Основные методы определения..................168
в) Применение ....................................172
г) Примеры........................................175
Палладий............................................181
а) Общие сведения.................................181
б) Основные методы определения..................184
в) Применение ....................................186
Платина.............................................186
а) Общие сведения.................................186
б) Основные методы определения..................188
в) Применение....................................188
Золото..............................................189
а) Общие сведения............................... 189
Содержание
449
б) Основные методы определения...................191
в) Применение ...................................193
г) Примеры............................ .........194
Полоний...........................................194
Медь..............................................196
а) Общие сведения................................196
б) Основные методы определения.................203
в) Применение....................................206
г) Примеры.......................................209
Висмут............................................214
а) Общие сведения................................214
б) Основные методы определения.................218
в) Применение ...................................221
г) Примеры.......................................221
Индий.............................................225
а) Общие сведения................................225
б) Основные методы определения.................228
в) Применение....................................229
Олово.............................................230
а) Общие сведения................................230
Цинк..............................................231
а) Общие сведения................................231
б) Основные методы определения.................240
в) Применение....................................249
г) Примеры.......................................254
Кадмий..............................•.............259
а) Общие сведения................................259
б) Основные методы определения.................264
в) Применение ...................................266
г) Примеры . •...................................268
Кобальт...........................................271
а) Общие сведения................................271
б) Основные методы определения.................276
В) Пр вменение...................................276
Никель............................................277
а) Общие сведения................................ 277
б) Основные мею ы определения.......... 280
в) Применение .......................... , . , . 283
450
Содержание
Свинец...............................................283
а) Общие сведения ....................................283
б) Основные методы определения.........................294
в) Применение .........................................305
г) Примеры........................................... 310
Железо...............................................319
Марганец.............................................320
Таллий...............................................321
а) Общие сведения............................ 321
б) Основные методы определения .......... 325
в) Применение ........... .......... 326
I л а в а 4. Применение дитизона в качественном анализе . . . 327
Открытие отдельных катионов .............................330
Ход качественного анализа с помощью групповых реакции .......................................... 342
Группа I. Реакции в присутствии минеральных кислот 343
Группа И. Реакции в присутствии уксусной кислоты 346
Группа III. Реакции в присутствии щелочи ...... 349
Группа IV. Реакции в присутствии цианида.....354
Глава 5. Особые случаи применения дитизона........356
Дитизон в качестве индикатора при объемных определениях ..................................... 357
Примеры.......................... . .... 362
Эмиссионный спектральный анализ..........................367
Полярографический анализ.................................369
Хроматографический адсорбционный анализ..................371
Определения с по'мощыо различных других способов . . 373
Приложение....................................................375
Получение дитизона ..................................... 375
Аналоги дитизона ....................................... 380
Литература 382
Аналоги дитизона (дополнение) ............................... 414
Дополнительный список литературы............................ 431
Г. II в а и ч е в
ДИТИЗОН И ЕГО ПРИМЕНЕНИЕ
Редакторы В. А. Захарьевски'и и Л. В. Феигель
Художник М. Ровенский Технический редактор Л. Харьковская Корректор Е. А. Жеребцова
Сдано в производство 17/1 1961 г.
Подписано к печати 3/VII 1961 г.
Бумага <84хЮ8|/3.=7.1 бум. л., 23,2 псч. л.
Уч.-изд. л. 23,6. Изд. №3/5480.
Цена 1 р. 85 к. Зак. 2157
ИЗДАТЕЛЬСТВО
ИНОСТРАННОЙ ЛИТЕРАТУР Ы Москва. 1-й Рижский пер., 2
Типография № 2 им. Евг. Соколовой
УПП Ленсовнархоза
Ленинград, Измайловский пр., 29
Замеченные опечатки
Стр. Строка Напечатано Следует читать
34 8 сверху М (HDz)2 Мп (HDz)2
156 8 » 1 мл 1,08 1 лл = 1,08
180 11 снизу увеличенной увлеченной
204 16 сверху 1 мл 0,794 1 мле 0,794
247 15 снизу 0,25 н. 0,25 М
281 17 сверху 0,1 0,1 н.
292 18—17 снизу висмут с раствором висмут, раствором
320 1 сверху Fe2 + Fe3+
347 8 снизу NaC2H3O2 • ЗН2О Na2S2O3 • 5Н2О
R
376 2 » ZN=N. H-S-C< >Н X'N— / N zN=N4 Н—S—с< >н
R
379 20 » металла дитизона металла и дитизона
Верхняя таблица на стр. 335 относится к разделу «хМедь».
Зак. 2157.