Автор: Дриц М.Е. Будберг П.Б Бурханов Г.С. Дриц А.М. Пановко В.М.
Теги: химия физика строение атома
Год: 1985
Текст
СВОЙСТВА
ЭЛЕМЕНТОВ
Под общей редакцией
заслуженного деятеля науки
и техники РСФСР,
докт. техн. наук. проф. М. Е. ДРИЦА
Согласовано
с Государственной службой
стандартных справочных данных
МОСКВА «МЕТАЛЛУРГИЯ» 1985
УДК 541 136 004 12@3)
Авторы: М. Е. ДРИЦ, П. Б. БУДБЕРГ, Г. С. БУРХАНОВ,
А. М. ДРИЦ, В. М. ПАНОВКО
Рецензенты: чл.-кор. АН СССР Ч. В. Копецкий,
канд. техн. наук Е. С. Шпичинецкий
УДК 541 136:004.12@3)
Свойства элементов: Справ. изд./Под ред. Дрица М Е. М.:
Металлургия, 1985, 672 с.
В справочнике систематизированы сведения об атомном строении,
физических, химических, механических и технологических свойствах
элементов Периодической системы в широком интервале температур,
а также приведены основные данные об истории открытия элемен-
элементов, их распространенности, объеме производства н техническом ис-
использовании.
Для инженерно-технических и научных работников, занятых в
области металлургии, машино- и приборостроения, неорганической
химии, а также работников министерств, плановых и снабженческих
органов. Ил. 11. Табл. 537. Библиогр. список: 333 назв.
2605000000-010
040@1)—85 ~~
© Издательство «Металлургия», 1985
СОДЕРЖАНИЕ
Стр.
Предисловие ..... 5
МЕТАЛЛЫ И НЕМЕТАЛ-
НЕМЕТАЛЛЫ, ИХ РОЛЬ В ТЕХНИ-
КГ. 9
1. ЭЛРМЕНТЫ ПЕРВОЙ
ГРУППЫ . , 29
1.1. Литий 29
1.2. Натрий 36
1.3. Калий ...... 42
1.4. Рубидий 49
1.5. Цезий ...... 54
1.6. Франций 60
1.7. Медь 61
1.8. Серебро 71
1.9. Золото 79
2. ЭЛЕМЕНТЫ
ВТОРОЙ ГРУППЫ ... 86
2.1. Бериллий . , . , 86
2.2. Магний 95
2.3. Кальций 105
2.4. Стронций , . . . ПО
2.5. Барий 114
2.6. Радий 120
2.7. Цинк 122
2.8. Кадмий 131
2.9. Ртуть 138
3. ЭЛЕМЕНТЫ
ТРЕТЬЕЙ ГРУППЫ . . 147
3.1. Бор 147
3.2. Алюминий .... 155
3.3. Галлий 169
3.4. Индий 175
3.5. Таллий 182
3.6. Скандий 187
3.7. Иттрий 191
4. ЭЛЕМЕНТЫ
ЧЕТВЕРТОЙ ГРУППЫ . 196
4.1. Углерод 196
4.2. Кремний 203
4.3. Германий . . . , 213
Стр,
4.4. Олово , 223
4.5. Свинец 232
4.6. Титан ...... 240
4.7. Цирконий .... 250
4.8. Гафний 260
4.9. Курчатовнй . . . 266
5. ЭЛЕМЕНТЫ
ПЯТОЙ ГРУППЫ ... 268
5.1. Азот 268
5.2. Фосфор 271
5.3. Мышьяк 278
5.4. Сурьма ..... 283
5.5. Висмут 292
5.6. Ванадий .... 303
5.7. Ниобий 313
5.8. Тантал 325
5.9. Элемент № 105
(нильсборий) ..... 337
6. ЭЛЕМЕНТЫ
ШЕСТОЙ ГРУППЫ ... 337
6.1. Кислород 337
6.2. Сера 340
6.3. Селен 349
6.4. Теллур 359
6.5. Полоний 366
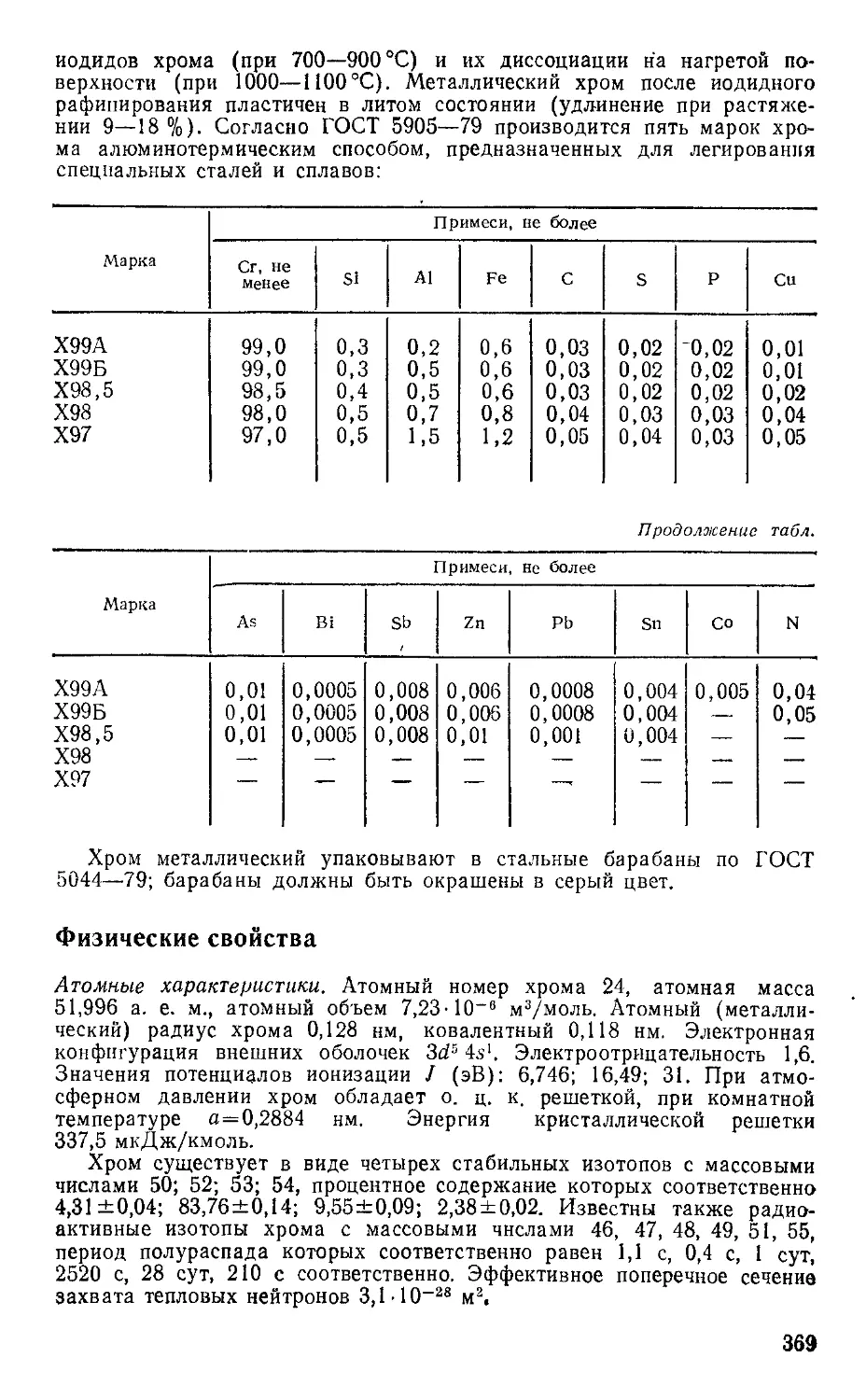
6.6. Хром 368
6.7. Молибден .... 376
6.8. Вольфрам .... 396
6.9. Элемент № 106 . . 412
7. ЭЛЕМЕНТЫ
СЕДЬМОЙ ГРУППЫ , . 413
7.1. Водород . . , , . 413
7.2. Фтор 420
7.3. Хлор 424
7.4. Бром 430
7.5. Иод 435
7.6. Астат 440
7.7. Марганец .... 442
7.8. Технеций .... 447
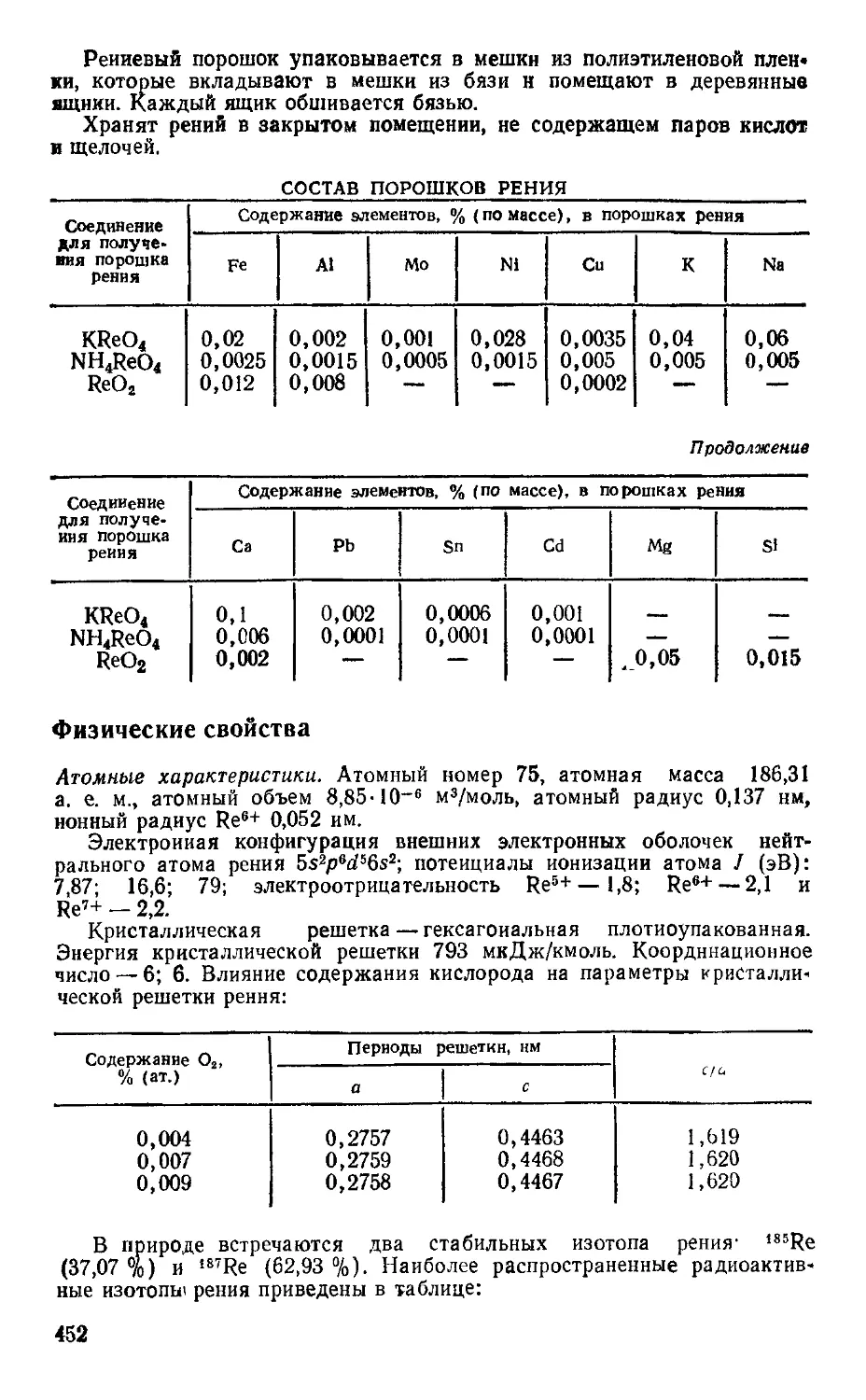
7.9. Рений 450
7.10. Элемент № 107 . , 460
3
8. ЭЛЕМЕНТЫ
ВОСЬМОЙ ГРУППЫ
Стр.
460
8.1. Железо 460
8.2. Кобальт 472
8.3. Никель 481
8.4. Рутений 492
8.5. Родий 497
8.6. Палладий .... 503
8.7. Осмий 509
8.8. Иридий 513
8.9. Платина 518
9. ИНЕРТНЫЕ ГАЗЫ
9.1. Гелий
9.2. Неои ....
9.3. Аргон ....
9.4. Криптон . . .
9.5. Ксенон ....
9.6. Радон ....
10. ЛАНТАН И ЛАНТА-
ЛАНТАНОИДЫ
10.1. Лантаи .
10.2. Церий . .
10.3. Празеодим
10.4. Неодим .
10.5. Прометий
10.6. Самарий ,
10.7. Европий .
527
527
532
535
540
543
547
549
550
554
559
562
565
567
570
10.8. Гадолиний . . ,
10.9. Тербий .....
10.10. Диспрозий . . .
10.11. Гольмий ....
10.12. Эрбий
10.13. Тулий
10.14. Иттербий ....
10.15. Лютеций ....
11. АКТИНИЙ И АКТИНО-
АКТИНОИДЫ
11.1 Актиний
11.2. Торий ....
11.3. Протактиний
11.4. Уран ....
11.5. Нептуний . . .
11.6. Плутоний . . .
11.7. Америций .
11.8. Кюрий ....
11.9. Берклий . . .
11.10. Калифорний
11.11. Эйнштейний .
11.12. Фермий . . .
11.13. Менделевий . .
11.14. Элемент №102 (но-
(нобелий)
11.15. Элемент №103 (лоу-
реисий)
Стр.
572
576
579
582
585
588
590
593
595
595
596
604
606
622
623
631
633
634
635
635
636
637
637
637
Библиографический список 638
Приложение ,,,,.. 6§0
ПРЕДИСЛОВИЕ
Решениями XXVI съезда КПСС и последующих Пленумов поставлена
задача о повышении роли науки и ее влияния на все отрасли производ-
производства. Не составляет исключения и производство химических элементов (ме-
(металлов и неметаллов), потребность в которых непрерывно увеличивает-
увеличивается. Удовлетворение этой потребности во все возрастающих- масштабах
ведет к истощению природных ресурсов, а следовательно, необходимо
более эффективное их использование, возможное лишь при создании ма-
материалов, отличающихся принципиально новыми свойствами. Одним из
путей повышения и изменения свойств является получение химических
элементов в состоянии высокой и ультравысокой чистоты, а также в мо-
нокрнсталлическом состоянии. Кроме того, в настоящее время развива-
развиваются работы в направлении синтеза сверхтяжелых элементов (суперак.
тцноидов). Прогнозируется, что некоторые из них должны отличаться
высокой стабильностью. Не исключено, что эти элементы будут играть
важную роль в современной технике.
Одновременно расширяется круг исследуемых свойств химических
элементов, увеличиваются диапазоны температур и давлений, в кото-
которых изучаются их свойства, а также свойства сплавов и соединений, что
в значительной степени связано с расширением областей их применения.
Исследуется влияние внешних воздействий (различного рода полей, об-
облучения, термоциклирования, разных сред и т. д.) на изменение струк-
структуры и свойств. В результате происходит непрерывное изменение харак-
характера производства химических элементов, увеличение масштаба этого
производства и их технического применения. Такая тенденция вызывает
необходимость периодической систематизации данных и обновления со-
соответствующей справочной литературы.
В настоящем справочнике систематизированы данные о различных
свойствах химических элементов, приведены краткие сведения об исто-
истории их открытия, распространенности и основных направлениях приме-
применения.
Справочные издания подобиого рода имеют свою-историю.
Тридцать лет назад был опубликован фундаментальный труд
М. П. Славинского «Физико-химические свойства элементов», который
стал настольной книгой для инженерно-технических и научных работ-
работников, конструкторов, специалистов металлургической и машинострои-
машиностроительной промышленности.
В 1965 г. издательством «Наукова Думка» был выпущен справочник
«Физико-химические свойства элементов» под редакцией чл.-кор. АН
УССР Г. В. Самсонова. Спустя одиннадцать лет, в 1976 г., этот спра-
справочник, дополненный в двух частях, вышел в издательстве «Металлур-
«Металлургия» под названием «Свойства элементов». В 1963 г. был опубликован
справочник «Свойства редких элементов» (авторы А. М. Филянд и
Е. И. Семенова). В 1965 г. издательство «Мир» выпустило в переводе с
английского «Справочник по редким металлам» (под ред. проф. В. F..
Плющева). В 1973 г. в издательстве «Металлургия» под ред. М. Ф. Ьа-
женова вышел справочник «Цветные металлы». В 1974 г. издательством
«Металлургия» опубликован справочник «Промышленные цветные ме-
металлы и сплавы» (авторы А. П. Смирягин, Н. А. Смирягина и А. В. Бе-
Белова). В 1976 г. Атомиздат выпустил справочник «Таблицы физичес-
физических величин», составленный коллективом авторов под ред. академика
И. К. Кикоина. Это фундаментальный справочник, содержащий обшир-
обширные данные по термодинамическим, молекулярно-кинетическим, элек-
электрическим, магнитным, оптическим и другим физическим свойствам. Из-.
дательство «Высшая школа» в 1976 г. выпустило учебное пособие «Хи-
«Химия и технология редких и рассеянных элементов» в трех частях под
ред чл -кор АН СССР К А Большакова В 1977 г издательство «На-
«Наука» выпустило «Популярную библиотеку химических элементов», где в
доступной и увлекательной форме изложены сведения об истории от-
открытий элементов, их роли в технике, сельском хозяйстве и медицине
В 1980 г издательство «Металлургия» опубликовало в переводе с анг-
английского справочник К Дж Смитлза «Металлы» под ред проф С Г.
Глазунова В том же году издательство «Металлургия» издало справоч
ник «Механические и технологические свойства металлов» А В Бобыле-
Бобылева Однако, несмотря на значительное количество изданий по свойствам
элементов, в настоящее время, по мнению авторов, назрела необходи-
необходимость в новом справочнике, в котором рассматривались бы не отдель-
отдельные свойства или отдельные группы элементов, а по возможности весь
спектр свойств всех элементов При этом в справочнике принята следу-
следующая схема описания элемента общие сведения, история открытия, на-
начало промышленного применения, сырье, способы получения В случае
необходимости сообщаются сведения по технике безопасности и oxpai e
труда Данные, характеризующие свойства, приводятся в следующей
последовательности
1) физические свойства (атомные характеристики, плотность, элек-
электрические и магнитные свойства, тепловые и термодинамические, опти-
оптические и др ),
2) механические свойства (характеристики прочности, пластичности,
упругости и т д ),
3) химические свойства (взаимодействие с другими химическими
элементами, коррозионная стойкость, электрохимические свойства и др ),
4) технологические свойства (литейные характеристики, обрабаты-
обрабатываемость давлением, резанием, свариваемость и др ),
5) области применения элемента и его важнейших соединений
При описании физических, механических, химических и технологи-
технологических свойств приводятся данные о влиянии вакуума, повышенных да-
давлений, высоких и низких температур, состояния материала и т д
Физические, химические, механические и технологические свойства
элементов зависят от содержания примесей, структурного состояния
(размера зереи, их ориентации, присутствия дефектов строения), состоя-
состояния поверхности, предшествующей обработки (термической, термомеха-
термомеханической, механической), технологии получения образцов и условий ис-
испытания (схемы напряженного состояния, скорости деформации, тем-
температуры и т д) Во многих случаях эти условия не оговариваются
Вследствие этого наблюдается большой разброс между опубликованны-
опубликованными данными, а иногда они носят противоречивый характер Авторы на-
настоящего справочника при отборе данных принимали во внимание их
повторяемость в различных источниках, время публикации, уровень ис-
использованной экспериментальной техники, авторитет исследователя и
т д Сведения о марках, химическом составе и свойствах элементов при-
приводятся, где это возможно, со ссылками иа действующие государствен-
государственные стандарты
Естественно, что объем разных разделов справочника неодинаков,
так как в литературе приведено неодинаковое количество данных для
отдельных элементов, связанное со степенью их изученности и при-
применения '
Элементы описаны в порядке их расположения в группах Периоди-
Периодической системы Д И Менделеева
Приведенные в справочнике данные в соответствии с ГОСТ 8 310—
78 относятся к категории информационных
1 Более подробная информация об элементах содержится в специ-
специальной литературе — см ссылки в начале каждого раздела
Раздел «Металлы и неметаллы, их роль в технике» напчсач Г С.
Бурхановым совместно с М Е Дрицем, разделы 1 1, 1 7 2 1—2 5, 2 7;
2 8, 4 7, 81и83 —М Е Дрицем, разделы 12—1,6, 18, 19, 4 1, i r->, 4 6;
4 8, 51, 61, 66—П Б Будбергом, разделы 4 2, 4 3, 4 9, 5 3, 5 9, 6 4;
6 5, 6 7—6 9, 7 7—7 10, 10 1—10 15 —Г С Бурхановым, разделы 3 2—
3 7, 4 4, 5 2, 5 4—5 8, 6 2, 6 3, 7 1—7 6 —А М Дрицем, разделы 2 6,
2 9, 3 1, 8 2, 8 4—9 6, 11 1—11 15 —В М Пановко
Авторы полагают, что, несмотря на неизбежные недостатки, спра-
справочник будет полезен широкому кругу читателей
Авторы выражают благодарность чл -кор АН СССР Ч В Копец-
кому и канд техн наук Е С Шпичинецкому за полезные замечания,
высказанные ими при рецензировании справочника, а также Н М Вла-
дсвой за помвщь при оформлении рукописи
Принятые обозначения
J — потенциал ионизации, эВ,
а, Ь, с —периоды кристаллической решетки, нм;
ф — работа выхода электронбв, эВ;
р — плотность, Мг/м3,
р — удельное электрическое сопротивление, мкОм м
(Ом м),
а —удельная элеьтрическая проводимость, Мсм/м (См/м),
* — температурный коэффициент электрического сопротив-
сопротивления, К~',
Тс — температура перехода в сверхпроводящее состояние,
К,
Е — т э д с, мВ,
е — абсолютный коэффициент т э д с, мкВ/К,
et — абсолютный коэффициент т э д с, вычисленный по от-
отношению к другому металлу, мкВ/К.
S — коэффициент Томсоиа, мкВ/К,
П— коэффициент Пельтье, мДж/К,
е — диэлектрическая постоянная,
R — постоянная Холла, м3/Кл,
ата* — коэффициент вторичной электронной эмиссии,
АЕ —ширина запрещенной зоны, эВ,
тп — эффективная масса электрона,
тр — эффективная масса дырок,
Mri —подвижность электронов, м2/(В с);
\ip —подвижность дырок, м2/(В с),
пп — концентрация электронов, м~3,
пр — концентрация дырок, м~3,
ОС — магнитная восприимчивость;
В —магнитная индукция, Тл;
Тк —температура Кюри, К,
Tn — температура Нееля, К;
5 —коэффициент Риги — Ледюка, м2/Ш-с),
Р— коэффициент Этингсгаузена, К М3/(В А с)
Q — коэффициент Этингсгаузена — Нернста, м2/(К-с),
dR/R — продольный (поперечный) четный гальваномагнитный
эффект,
И — напряженность магнитного поля, А/м,
/ — намагниченность, Тл,
0"s —удельная намагниченность насыщения, Тл-м3/кг;
ks — магнитострикция насыщения,
^пл (Ткпп) —температура плавления, °С(К);
7
'кии G"„ип) —температура кипения, °С(К);
'кревр (ГПррВр) —температура превращения, °С(К);
9d —характеристическая температура Дебая, К;
■ к АН ПЛ> I удельные теплоты плавления, испарения, сублимации
ДЯ.оп, АИс,«л и превращения, кДж/кг;
ЛЯпревр I
ДЯобр — теплота образования вещества, кДж/моль;
ср —удельная теплоемкость, Дж/(кг-К);
СрЛ — удельная электронная теплоемкость, Дж/(моль-К);
Y — коэффициент удельной электронной теплоемкости,
Дж/(моль-К2);
s" —молярная энтропия, Дж/(моль-К);
Фт — приведенный термодинамический потенциал, Дж/
/(моль-К);
р — давление пара вещества, Па;
X —теплопроводность, Вт/(м-К);
а —температуропроводность, м2/с;
а, C — температурный коэффициент линейного и объемного
расширения, К;
v — поверхностная энергия, мДж/м2;
а —поверхностное натяжение, мН/м;
т) —динамическая вязкость, мПа-с;
v — кинетическая вязкость, м2/с;
Е —энергия активации диффузии (самодиффузии), кДж/
/моль;
D —коэффициент диффузии (самодиффузии), м2/с;
Do — предэкспоненциальяый множитель, м2/с;
е^ —спектральный коэффициент излучения;
8т —интегральный коэффициент излучения;
по —коэффициент отражения, %;
п — показатель отражения;
X —показатель поглощения;
а —коэффициент поглощения, м;
Св, сгв, он — временное сопротивление разрыву и сжатию, МПа;
Он — предел выносливости, МПа;
<*о,2 — предел текучести, МПа;
а£/т —предел ползучести, МПа;
8 —скорость установившейся ползучести, %/с;
а'х — предел длительной прочности, МПа;
Тер —сопротивление срезу, МПа;
б, ф — относительное удлинение и сужение, %;
Е — модуль нормальной упругости, ГПа;
G —модуль сдвига, ГПа;
К — модуль объемного сжатия, ГПа;
v — коэффициент Пуассона;
KCU —ударная вязкость образцов с надрезом Шарпи, кДж/
/м2;
ИВ, HV, HR —твердость по Бринеллю, Виккерсу, Роквеллу;
f]^ —микротвердость, МПа;
и —сжимаемость, Па~';
Фо —нормальный электродный потенциал, В.
МЕТАЛЛЫ И НЕМЕТАЛЛЫ,
ИХ РОЛЬ В ТЕХНИКЕ
[1—35, 43, 57]
Периодический закон
Фундаментом современной науки и материи является единая система
элементов, созданная великим русским химиком Д. И. Менделеевым.
Первый вариант Периодической системы был опубликован в 1869 г. в
виде краткой таблицы. В том же году им были сформулированы основ-
основные положения Периодического закона, который гласил: «Свойства про-
простых тел, а также формы и свойства соединений элементов находятся в
периодической зависимости от величины атомных весов элементов1.
Последующее развитие атомной физики вскрыло природу периодич-
периодичности свойств элементов, заключающуюся в периодичности строения их
атомов, наблюдаемой при возрастании атомной массы или точнее поряд-
порядкового номера. Фундаментальность закона, открытого Д. И. Менделее-
Менделеевым, стала особенно понятной после создания Бором теории формирова-
формирования электронных конфигураций атомов, а также в результате работ Моз-
ли, Томсона, Резерфорда, Зоммерфельда, Паули, Шредингера и других
выдающихся ученых.
В современной форме Периодический закон устанавливает, что свой-
свойства химических элементов зависят от электронного строения данного
атома и закономерно изменяются с изменением атомного номера, кото-
который оказался важнейшей константой элемента, выражающей положи-
положительный заряд его атома. Поэтому Периодический закон Д. И. Менделе-
Менделеева в настоящее время формулируется следующим образом: «Свойства
элементов и образуемых ими простых и сложных веществ находятся в
периодической зависимости от заряда ядра атомов элементов».
В Периодической системе Д. И. Менделеева элементы располагаются
в порядке возрастания величины положительного заряда атомных ядер.
Имеется определенная закономерность в заполнении электронных уров-
уровней или оболочек, объясняющая открытую Д. И. Менделеевым перио-
периодичность в изменении свойств элементов (табл. 1).
В первом приближении все химические элементы можно разделить на
металлы и неметаллы. Некоторая условность такого деления связана с
1йногообразием типов химической связи (Ван-дер-Ваальсова, ковалент-
ная, металлическая), которые могут в разной степени одновременно про-
проявляться в химически чистом элементе.
Металлическая связь наиболее отчетливо проявляется у щелочных
и благородных металлов. Металлам свойственны высокие электрическаи
проводимость и теплопроводность электронного типа, пластичность, «ме-
«металлический» блеск. Металлами является подавляющее большинство из-
известных элементов (свыше 80). Неметаллы — это инертные газы (Не,
Ne, Ar, Кг, Хе, Rn), галогены F, Cl, Br, I, At, а также Н, В, С, N, О, Р,
S, Se, Те, Si, Ge.
Металлы и неметаллы в условиях химического взаимодействия стре-
стремятся приобрести электронную конфигурацию инертного элемента, при
этом неметаллы стремятся присоединить недостающие для заполнения
электронных уровней электроны, а металлы — отдать внешние, наименее
связанные с ядром. Инертные элементы занимают промежуточное поло-
положение между металлами и неметаллами.
1 Теперь относительная атомная масса.
01
aoccooaccocoooaocccoccooaooococccoooooacccoocccococooooococccccococcQo
CDCDOOOOCOCOIXCDCDCOCDCDOOOOOOOOOOOOOOCOOOOOCDCDCOOOOOOOCDCDODCOCOCDOO
tcto^-ot&ao~4criu*^b
toooсоooooooootooo coxoocoooюoooooo —
OOCOCOCCCOCOOOOoOOOOCOOOOOCOOOOOOOOOOOQOOOOOOOOOOOQOOOOOQOOOOOOOOO
оооооооосооооодадаоооооодадамЙдао^дадададададамдададаооооаосооо
Z
о
ТАБЛИЦА 2
ВНЕШНИЕ ЭЛЕКТРОННЫЕ КОНФИГУРАЦИИ АТОМОВ ЭЛЕМЕНТОВ
ПЕРИОДИЧЕСКОЙ СИСТЕМЫ Д И. МЕНДЕЛЕЕВА
1.
2.
3
4
5.
6
7.
8.
9.
10.
11.
12.
13.
14.
15.
16.
17.
18.
19.
20.
21.
22.
23.
24.
25.
26.
27.
28.
29.
30.
31.
32.
33.
34.
35.
36.
37.
38.
39.
40.
41.
42.
43.
44.
'to.
46.
47.
Элемент
Водород
Гелий
Литий
Бериллий
Бор
Углерод
Азот
Кислород
Фтор
Неон
Натрий
Магний
Алюминий
Кремний
Фосфор
Сера
Хлор
Аргои
Калий
Кальций
Скандий
Титан
Ванадий
Хром
Марганец
Железо
Кобальт
Никель
Медь
Цинк
Галлий
Германий
Мышьяк
Селен
Бром
Криптой
Рубидий
Стронций
Иттрий
Цирконий
Ниобий
Молибден
Техиеций
Рутений
Родий
Палладий
Серебро
Электронная
конфигурация
Is1
Is2
ls^s1
2s2
2s22pl
2s22p?
2б22р3
2s22p4
2s22p5
2s=2p«
2sa2p»3s'
3,2 H
3s23p*
3s4P*
3s=3p3
3s23p4
3s23p»
3s23p«
3s23pe4s*
4S2
3#4s2
3d24s!S
3d34s2
3dB46*
3^54s2
3de4s2
3d'4s2
3d84s2
3rfio4si
3d104s2
3dlo4s24p1!
3dlo4s24p?
3dlo4s24p»
3dlo4s24p*
3^1O4s24p6
3d1»4«24p»
3dlo4s24pe5^
5S2
4<P5s?
4d25s2
4d*5si
4d55s!
4<i65s2
4d75si
4/J8Kcl
4d10
4d1»5s1
Элемент
48. Кадмий
49. Индий
50. Олово
51. Сурьма
52. Теллур
53. Иод
54. Ксенои
55. Цезий
56. Барий
57. Лантан
58. Церий
59. Празеодим
60. Неодим
61. Прометий
62. Самарий
63. Европий
64. Гадолиний
65. Тербий
66. Диспрозий
67. Гольмий
68. Эрбий
69. Тулий
70. Иттербий
71. Лютеций
72. Гафний
73. Тантал
74. Вольфрам
75. Реиий
76. Осьмий
77. Иридий
78. Платина
79. Золото
80. Ртуть
81. Таллий
82. Свинец
83. Висмут
84. Полоний
85. Астат
86. Радон
87. Франций
88. Радий
89. Актиний
90. Торий
91. Протакти-
Протактиний
92. Уран
93. Нептуний
94. Плутоний
Электронная
конфигурация
4ds2
4dlo5s25p*
4dI05s25p?-
4dlo5s25p3
4dlo5s25p*
4dlo5s25p5
4dlo5s25pe
4d1»5s25p«6s*
6s2
5rf!6s2
4f6s2
4/36s?
4/«6s2
4f»6s?
4fe6s2
4/'6s2
4/'5d'6s?
4/96s?
4fi°6s2.
4/s2
4fi«6sa.
4n36s2
4/«6s2
4/id16s?
4f*5d26s2
4/«5d36s2
4/i*5d*6s?
4/i45d»6s2
4f45rfe6s2
4/1*5(f6s2
4/145d«6sl
5/W6S1
6S2
6526p!
6S26p2
6s26p3
6S26p<
6s26p6
6s26pe
6s26pe7s*
7s*
6rfi7s?
6d27s2
5/26d'7s2
5/36d'7s?
5/46d'7s2
5/'7sS
11
Продолжение
Элемент
95. Америций
96. Кюрий
97. Берклий
98. Калифор-
Калифорний
99. Эйнштей-
Эйнштейний
Электронная
конфигурация*
5/77s2
5/76rf'7s2
5/86rf'7s?
5/107s?
5/u7s?
Элемент
100. Фермий
101. Менделе-
Менделевий
102. Нобелий
103. Лоурен-
сий
Электронная
конфигурация*
5/47S?
5/«7s?
5/i*7s2
5p*6dl7sz
В Периодической системе Д. И. Менделеева (см. таблицу на форза-
форзаце) металлические и неметаллические свойства закономерно изменяются
при переходе от одного элемента к другому как в группах, так и в пе-
периодах. В пределах каждой группы с возрастанием атомного номера ме-
металлические свойства усиливается, а неметаллические ослабевают.
В пределах каждого периода с увеличением атомного номера на-
наблюдается закономерное ослабление металлических свойств и усиление
неметаллических.
Первые две группы Периодической системы содержат только ме-
металлы. Первый неметалл — бор — появляется в III группе; в IV группе
их уже два (углерод и кремний); в V группе три (азот, фосфор, мышь-
мышьяк); в VI — четыре (кислород, сера, селен, теллур); в VII — пять (фтор,
хлор, бром, иод, астат).
В соответствии с этой тенденцией самый типичный неметалл — фтор,
который во всех химических реакциях является окислителем.
В табл. 2 приведены внешние электронные конфигурации атомов
элементов Периодической системы Д. И. Менделеева.
Четырнадцать лантаноидов (№ 58—71) располагаются в таблице
Д. И. Менделеева в отдельной строке. У этих элементов происходит до-
достройка 4/-подоболочки (iV-оболочка). В отдельную строку выделены
и 14 актиноидов с атомными номерами 90—103, у которых происходит
достройка б/^-подоболочки (О-оболочка). Одиннадцать элементов из се-
семейства актиноидов (№ 93—103) являются трансурановыми. Всего в
Периодической системе на сегодня содержится 107 элементов. Элементы
с атомными номерами 104—107 находятся вне семейства актиноидов..
Эти элементы занимают «основные» места в седьмом периоде и соответ-
соответственно в четвертой, пятой, шестой и седьмой группах. У них происхо-
происходит заполнение 6й-подоболочки (Р-оболочка).
В табл. 3 представлены электронные конфигурация элементов с
№ 104—121 по Г. Т. Сиборгу.
Элемент № 104 (Курчатовий) является гомологом гафния. Пред-
Предполагается, что элемент № 105 (Нильсборий) — гомолог тантала, № 106—
гомолог вольфрама, № 107—гомолог рения и так далее до не открытого
еще элемента 118, который должен быть гомологом благородного газа—
радона
Предложено около 1000 вариантов графического изображения
системы Д. И. Менделеева. Наибольшее распространение получили раз-
развернутая (рис. 1) и пирамидальная (рис. 2) формы.
Американский ученый Г. Т. Сиборг предложил Периодическую сис-
систему с химическими элементами до номера 168 (рис. 3). Он ввел еще
одну группу переходных металлов о порядковыми номерами от 122 и
12
I
д
3
u
6,939
11
Na
22,9898
19
К
39,102
37
Rb
85,47
55
cs
132,905
87
Fr
Г223]
I
A
4
Be
9,0122
12
Mg
24,305
20
Ca
40,08
3£
Sr
67,62
56
Ba
137,34
88
Ra
[226]
Ж
Z1
Sc
44,956
39
Y
88,905
A
La
138,91
89
AC
1227]
ВТ
22
Ti
47,90
40
Zr
91,22
72
Hf
178,49
104
Ku
1264]
Лантаноиды
Актиноиды
T
23
V
50,942
41
Nb
92,906
73
Та
180,948
Ш
24
Cr
51,996
42
Mo
95,94
74
W
183,85
Ш
25
Mn
54,9380
43
TC
[99]
75
Re
186,207
26
Fe
55,847
i 44
Ru
101,07
76
OS
190,2
1
H
1,00797
ID
a
27
CO
58,933Z
45
Rh
102,905
77
IP
192,2
58
Се
140,12
90
Th
232,038
59
Pr
140,907
91
Pa
[231]
60
Nd
144,24
92
U
238,03
61
Pm
[1473
93
NP
И37]
62
Sm
150,35
94
Pu
Г244]
28
Ni
58,70
46
Pd
106,4
78
Pt
195,09
63
EU
151,96
95
Am
£243]
J
В
29
CU
63,546
47
Ag
107,868
79
Au
196,967
В
в
30
Zn
63,37
48
Cd
112,40
80
Hg
200,59
m
в
5
В
10,811
13
Al
26,9815
31
6a
ae,72
49
In
114,82
81
Tl
204,37
Iff
В
6
с
12,01115
14
Si
Z8,086
32
Ge
72,53
SO
Sn
118,69
82
Pb
207,19
64
Gd
157,25
96
Cm
[247]
65
Tb
158,924
97
BK
[2473
66
Iy
162,50
98
Cf
[252]
67
Ho
164,930
99
Es
[254]
У
в
7
N
14,0067
15
P
30,9738
33
As
74,9216
Sf
Sb
121,75
83
Si
208,980
в
в
8
0
15,9994
16
s
32,064
34
Se
78,96
52
Те
127,60
84
Po
[210]
в
9
F
18,9984
17
Cl
35,453
35
Br
79,904
53
I
126,9044
85
At
[210]
68
Er
167,26
100
Fm
C253]
69
Tm
168,934
101
Md
[257]
70
Yb
173,04
102
(No)
[255]
Инертные
газы
г
г
8
г
8
S
S
18
S
г
»
18
18
8
2
8
18
JZ
18
S
2
Не
4,0026
10
Ne
20,179
18
Аг
33,948
36
Кг
83,80
54
хе
131,30
86
Rn
[222]
71
Lu
174,97
103
Lr
[256]
|— Рис. 1. Развернутая форма Периодической системы элементов
14
ТАПЛИЦЛ 3
ВЫЧИСЛЕННЫЕ ОСНОВНЫЕ ЭЛЕКТРОННЫЕ СОСТОЯНИЯ
ГАЗООБРАЗНЫХ ТРАНСАКТИНОИДНЫХ ЭЛЕМЕНТОВ 104—121
Порядковый
номер
104 (Курчато-
Illli'l)
105 (Нильсбо-
рий)
106
107
108
109
Электронная
структура
6d27s?
6d37s2
6d'7s?
Порядко-
Порядковый номер
ПО
111
112
113
114
115
Электронная
структура
6d^7s2
6d^7s2
7s27p2
7s27p3
Порядко-
Порядковый номер
116
117
118
119
120
121
Электронная
структура
7*27р*
7s27p5
7s27pe
7s27pe8s1
7s27p»8s2
7s27p»7d18si5
g
<U
c:
1
з
4
5
a
7
8
IA
H
1
Li
3
Na
и
К
19
Rb
37
Cs
55
Fr
87
119
ЛА
Be
4
Mq
12
Ca
20
Sr
38
Ba
56
Ra
88
120
ШВ
Sc
21
Y
39
57-71
ss-ra
121-
ЖВ
Ti
22
Zr
40
Hf
72
KU
104
YB
V
23
Nd
41
Та
73
Ns
№
Cr
24
MO
42
W
74
106
ТШВ
Mn
25
TC
43
Re
75
107
Г f
Fe
26
Ru
44
OS
76
108
> V
ШЕ
Co
27
Rh
45
lr
77
109
П Л
Ni
28
Pd
46
Pt
78
110
a
IB
Cu
29
Aq
47
Au
79
111
IB
In
30
Cd
48
Hq
80
112
ША
В
s
Al
13
Ga
si
In
49
Tl
61
113
HA
С
e
Si
M
Ge
32
Sn
50
Pd
82
114
VA
N
7
P
15
As
33
Sb
51
Bi
83
115
ИА
0
8
S
16
se
34
те
si
Po
84
116
Ш
F
9
Cl
17
Br-
JS
I
At
85
W
ИПА
He
2
Ne
ip
Ar1
18 -
Kr
36
Xe
54
Rn
86
118
Супер-
Суперактиноиды
121 122 123 124 125 126
Лантанииды
Актиноиды
La
57
Се
38
Рг
59
Nd
60
Pm
61
Sm
62
EU
63
6d
64
Tb
65
Ho
67
Er
68
Tm
69
Yb
70
Lu
71
Ac
89
Th
90
Pa
91
U
92
Np
93
Pu
94
Am
95
Cm
96
Bk
97
Cf
98
Es
99
Fm
100
Md
101
Jl
102;
Rf
103
Рис. З. Современная Периодическая система химических элементов
10 15 20 25
Атомный номер
30
Рис. 4. Величины первых ионизационных потенциалов для атомов химических
элементов
до 153, назвав ее «суперактиноидами» (рис. 3). Элементы с номеров 154
до 168, следующие за суперактиноидами, по мнению Сиборга, должны
быть гомологами элементов 104—118, причем элемент 168 должен быть
благородным газом или «благородной жидкостью».
Академик Г. Н. Флеров и Г. Т. Сиборг обращают внимание на уве-
увеличение стабильности изотопов элементов в заурановой области. Пред-
Предполагается очень стабильным ядро с числом протонов 114 и числом ней-
нейтронов 184.
Как отмечает Г. Н. Флеров, ядра с массовыми числами более 300
должны характеризоваться настолько медленным распадом, что время их
жизни окажется сравнимым с возрастом Земли. Если эти сверхядра де-
делятся спонтанно с периодом полураспада 2-10s лет, то в Земле их дол-
должно сохраниться со времени синтеза элементов солнечной системы не
более одной миллионной доли процента.
В настоящее время ученые наряду с изучением возможностей синте-
синтеза этих элементов ведут их поиск в естественных условиях. По мненяго-
Г. Н. Флерова, перспективен поиск в веществе мантийного происхожде-
происхождения, в водах подземных соленых источников, насыщенных тяжелыми эле-
элементами, а также в веществах, выброшенных в пространство в резуль-
результате космических ядерных превращений и частично достигающих нашей
планеты.
Периодичность изменения свойств, установленная Д. И. Менделеевым,
особенно отчетливо проявляется у первого ионизационного потенциала
1\ (рис. 4), который увеличивается с возрастанием атомного номера и
достигает максимального значения для благородного газа; при переходе
к следующему элементу значение 1\ падает примерно на 25 % и вновь
увеличивается с возрастанием Z.
Периодически изменяются и другие свойства — электроотрицатель-
электроотрицательность, характеризующая способность атома в молекуле к притяжению
валентных электронов (в подгруппах А электроотрицательность умень-
уменьшается при переходе сверху вниз, в пределах одного периода возраста-
16
ТАБЛИЦА 4
Группа Пе-
Периодической
системы
III
IV
V
VI
VII
Металл
Li
Na
К
Rb
Cs
Be
Mg
Ca
Sr
Ba
Al
Y
La
Ti
Zr
Hf
V
Nb
Та
Cr
Mo
W
Mn
Re
ПЛОТНОСТЬ p
p при 18 °Ci
Мг/ма
0,53
0,97
0,86
1,51
4,81
1,85
1,74
1,54
2,63
3,59
2,70
4,472
6,16
4,50
6,53
13,09
6,1
8,57
16,5
7,19
10,2
19,23
7,24
21,01
МЕТАЛЛОВ
Группа Пе-
Периодической
системы
VIII
I
II
III
IV
V
Металл
Fe
Ru
Os
Co
Rh
Ir
Ni
Pd
Pt
Cu
Ag
Au
Zn
Cd
Hg
Ga
In
Tl
Ge
Sn
Pb
As
Sb
Bi
p при 18 °C,
Мг/м»
7,87
12,06
22,48
8,9
12,44
22,42
8,90
12,16
21,37
8,96
10,49
19,29
7,13
8,65
13,55
5,90
7,31
11,85
5,32
7,29
11,34
5,73
6,69
9,84
етс увеличением порядкового номера), модуль упругости, температурный
коэффициент линейного расширения, температура плавления, плотность
и др.
В табл. 4 представлено нзменение плотности металлов, а на рис. 5—
7 — изменение плотности, температуры плавления и модуля нормаль-
нормальной упругости элементов в зависимости от их атомного номера.
Изменение некоторых физических свойств переходных металлов в за-
висимости от числа электронов в rf-подоболочке, а также коэффициента
вторичной электронной эмиссии в зависимости от атомного номера ил-
иллюстрируется рис. 8.
17
го
is
12
8
0
-
-
/ &
/
А
\ 1 \
\/
I
\f
7
е
f
L.T.I, . 1
1
/
I
Г
nil
\
•
ч
i
1
1
1
в
.11,1.
/ 5 10 15 20 25 30 35 40 tS 50 55 60 65 70 75 80 85 90
Атомный номер
I I Ж I Ш I Ж \ 7 I Ш \ Ш
Период
Рис. 5 Изменение плотности элементов в зависимости от атом-
атомного номера
tnjl, "С
3500
3000 -
2500
1ЩЙ1 п| "*■'■'"'"■■''■■■'■■■■'■■■■'■'"'.'"'"" li...l,...l...,lni.r*i,lii
5 10 15 20 25 30 35 40 45 50 55 60 65 70 75 80 85 90
Атпмньш нпмрп
/I Л | Ш \
30 35 W 45 50 55
Атомный номер
Период
Ш
I ж
Рис. 6. Изменение температуры плавления элементов в зависи-
зависимости от атомного номера
18
10 20 JO
40 50 Cs 60 70 80 90 100.
Атомный номер
Рис. 7. Изменение модуля упругости элементов в зависимости от атом-
атомного номера
Коррозионные свойства металлов также определяются их положени-
положением в Периодической системе (рис. 9).
Следует подчеркнуть зависимость свойств элементов от их атомно-
кристаллического строения, которое в конечном итоге определяется осо-
особенностями межатомной связи и энергетического состояния электронов,
осуществляющих эту связь. Температура, давление могут оказать су-
существенное влияние на энергетическое состояние электронов и выз-
вызвать изменение атомно-кристаллического строения. Отличие в кристал-
кристаллической структуре модификаций полиморфных' металлов обусловлива-
обусловливает различие физико-механических свойств одного и того же металла.
Ряд свойств элементов определяется не только положением в Пе-
Периодической системе и атомно-кристаллическим строением, но и дефекта-
дефектами кристаллического строения. В связи с этим принято все свойства де-
делить на структурно-чувствительные и структурно-нечувствительные:
A. Ci руктурно-нечувствительные
Механические — модуль упругости
Термические — тепловое расширение, температура плавления, тепло-
теплопроводность, удельная теплоемкость
Оптические — отражательная способность
Ядерные — поглощение излучений
Б. Структурно-чувствительные
Механические — сопротивление разрушению, пластичность
Электрические — удельное электросопротивление
Магнитные — ферромагнитные (в частности, коэрцитивная сила и маг-
нитострикция).
IA ША FA НАША IB ШВ FB
Группа
c5b| IA MA FA MAMA IB MB FB*
Группа
Рис. 8. Изменение некоторых физичес-
физических свойств переходных металлов в -
зависимости от числа электронов и
изменение коэффициента вторичной
эмиссии в зависимости от атомного
номера элементов
Щ. 8 -
IAMAF/ГШАША 1ВМВГВ
груша
20 40 60 80
Атомныйномер
•
2
3
э
D
7
Группа элементов
I
T 3~ ]
! |_j
[ 5,940 \
'f~~\\~~\
:: Na i
;l22,997j
19 }
к i
■139,096]
¥ 29 о
1 Cu *
Г 37~ ]
i Rb >
185,48:
| 47 g
| Aq •
! 55 ]
i Cs ;
■132,91],
_
I Au S
ючлллДлл
87
Fr
B23)
П
4 •
Be
9,02
12
Mg
24,32
20
Ca
40,08
30
Zn
65,38
38
Sr
87,65
48
Cd
«Mb
56
Ba
137,36
H> •
i. Hq S
86
Ra
228,05
Ш
5
В
10,82
? Al
21
Sc
49,10
31
6a
69,72
39
Y
88,92
in g
114,7б|
57
La
138,92
81
П
204,39
89
As
B27)
Iff
6
С
12,010
14 *
Si
28,06
22 •
Ti «,
47,90§
32
Ge
72,60
40 S
zr*
91,22|
50 о
118,70e
72
Hf
178,6
82 о
РЬ„
207,21
■90
Th
232,12
V
7
N
14,008
15
P
30,98
Vii"
', V •
\ 50,95
33
AS
74,91
»,. 41 ?
* Nb»
51
Sb
121,76
* 73?
^ Та ©
;j80,88e
83
Bi •
209,00,
91
Pa
231
Ж
8
0
16,000
16
s
32,06
i 24*
'< cr „
> 52,01§
34
Se
76,96
Г4Т0
■ Mo»
IS»
52
Те
127,61
* w S
^183,92,
84
Po
B10)
92
U
238,07
W
1
H
1,008
9
F
19,00
17
Cl
35,457
25
Mn
54,93
35
Br
79,916
43
Tc
(99)
53
1-1
126,92
75
Re
188,31
85
At
B11)
93
Np
B37)
УПТ
^ 26 0
^ Fe a
£ 55,85
i 44 0
| On •
} nil Q
Щв
i 76 0
1 0s*
|t90j2|
94
Pu
B39)
'', 27
У CO 9
Iw94»
Г45 °
\ Rh§
П7 8
irS
95
Am
B41)
Ws/ssm
\ 28 0
5 Ni „
' 46
e Pd a
i 106,7®
F78 s
pt 1
96
Cm
B42)
Условные обозначения:
mm® благородные металлы
шт. Легко пассивирующиеся
гг~---"й Очень неустойчивые
в Устойчив в азотной кислота
о Устойчив веерной кислоте
в Устойчив в соляной кислоте
в Устойчив в органических кислотах
в Устойчив в щелочах
в Устойчив в аэрированном
растворе NaCl
Рис. 9 Коррозионная стойкость металлов в зависимости от их расположения
в Периодической системе
21
Распространенность химических элементов
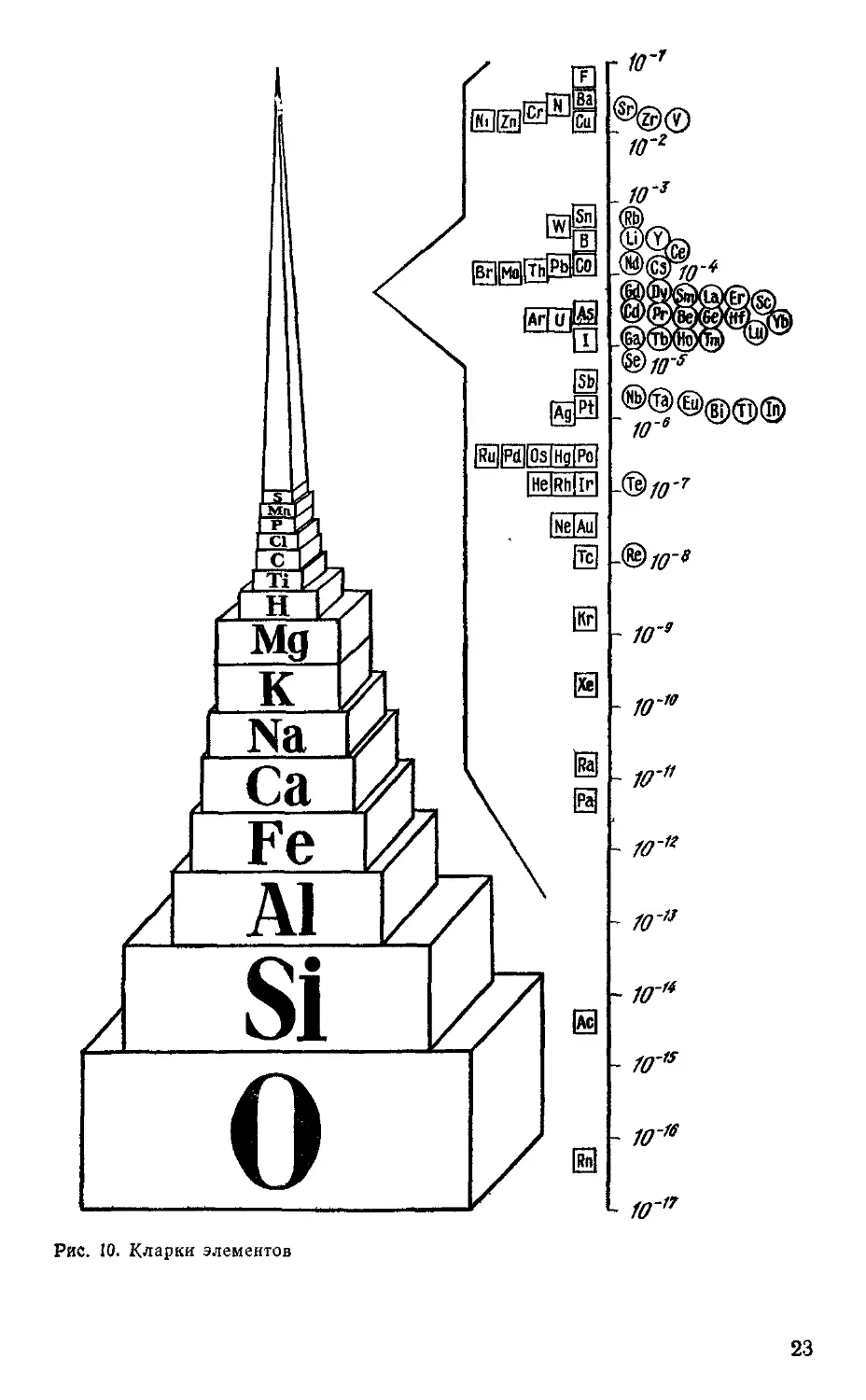
Химические элементы сильно различаются по степени распространения в
природе (рис. 10).
В земных условиях их содержание изменяется от 27,6 атомных клар-
ков для кремния до 8,5-10~9 дли рения и Ю-17 атомных кларков для
плутония. В качестве границы между распространенными и малораспро-
малораспространенными элементами акад. И, В. Тананаев предлагает принять вели-
величину атомного кларка 0,01, характерную, например, для стронция. К
числу распространенных могут быть отнесены Н, Li, Na, К, Mg, Ca, Ba,
Ti, Мп, Fe, С, N, О, F, Al, Si, P, S, C1.
Суммарное содержание этих элементов в литосфере характеризует-
характеризуется атомным кларком 99,95. Остальные 88 известных элементов мало рас-
распространены в природе. Причем технеций и заурановые элементы поле-
полечены искусственным путем. Время жизии некоторых из них исчисляется
долями секунды.
Элементы, мало распространенные в природе, принято называть ред-
редкими. И. В. Тананаев предлагает следующую классификацию редких
элементов:
1. «Малые» элементы A6): В, V, Cr, Co, Ni, Cu, Zn, As, Br, Cd, Hg,
Sn, Sb, I, Pb, Bi. Все эти элементы характеризуются малым атомным
кларком, при широком их практическом использовании, уровень которо-
которого определяется масштабами производства соответствующего элемента.
2. Радиоактивные элементы B3): Тс, Ро, At, Rn, Fr, Ra, Ac, Ku, Pra,
Th, Pa, U, Np, Pu, Am, Cm, Bk, Cf, Es, Fm, Md, No, Lr. К этой группе
можно отнести еще три трансурановых элемента: № 105 (нильсборий),
№ 106 и 107. Радиоактивные элементы получают и используют в срав-
сравнительно небольших количествах. Исключение составляют уран и торий.
Их добыча определяется потребностями атомной энергетики.
3. Благородные газы: Не, Ne, Аг, Кг, Хе. До последнего времени они
находили преимущественное применение в светотехнике, а также в хи-
химико-металлургических процессах для создания инертной атмосферы.
4. Благородные металлы (8): Ru, Rh, Pd, Ag, Os, Ir, Pt, Аи. Наряду
с валютным значением эти элементы приобретают все более широкое
техническое применение: химическая аппаратура и посуда, катализато-
катализаторы, электротехнические материалы.
5 Остальные элементы: Rb, Cs, Be, Sr, Sc, Y, La и лантаноиды A4 эле-
элементов), Zr, Hf, Nb, Та, Mo, W, Re, Ga, In, Tl, Ge, Se, Те. Эти эле-
элементы характеризуются малой распространенностью в природе, а неко-
некоторые из них недостаточно изучены и объем их производства невелик,
В то же время такие уже достаточно хорошо изученные элементы, как
Zr, Hf, Та, Nb и особенно W, Mo, Re, используются в больших масшта-
масштабах.
К настоящему времени накоплен большой объем знаний о физических
и химических свойствах этих элементов, особенностях их поведения в
тех или иных условиях.
Германий, кремний, селен, теллур, индий, галлий являются матери-
лами полупроводниковой техники. Расширяются масштабы производства
и применения редкоземельных металлов.
Акад. А. П. Виноградов отмечает определенную связь между поло-
положением элементов в Периодической системе Д. И. Менделеева и их рас-
распространенностью. На Земле наиболее распространены химические эле-
элементы 1-, 2- и 3-го периодов системы Д. И. Менделеева, в частности О,
Si, S, Fe, Mg и др., а на Солнце Н и Не. Проявляется общая тенденция
к понижению кларков с увеличением порядкового номера элементов
(рис. 11). Наименее распространены химические элементы с большим
П
1O'r
to
-г
V ю-"
h w"
I- /»-*
- /p^
r Iff''4
j
- /o-'s
- ^-*
Рис. 10. Кларки элементов
23
ТАБЛИЦА В
РАСПРОСТРАНЕННОСТЬ ЭЛЕМЕНТОВ В ЗЕМНОЙ КОРЕ ПО ДАННЫМ
А. П. ВИНОГРАДОВА (МОЩНОСТЬ 16 км, БЕЗ ОКЕАНА И АТМОСФЕРЫ)
И МЕЙСОНА
Atomhi
номер
1
2
3
4
5
6
7
8
9
11
12
13
14
15
16
17
18
19
20
21
22
23
24
25
26
27
28
29
30
31
32
33
34
35
37
38
39
40
41
s
Н
Не
Li
Be
В
С
N
О
F
Na
Mg
Al
Si
P
S
Cl
Ar
К
Ca
Sc
Ti
V
Cr
Mn
Fe
Co
Ni
Cu
Zn
Ga
Ge
As
Se
Br
Rb
Sr
Y
Zr
Nb
Содерж
% (по массе)
0,15
5,24-10-?*
6,5-Ю-з
6-10-*
3-10-*
0,14
0,01
47,3
6,25-10-5
2,50
2,10
8,80
27,6
0,08
0,1
1,7-10-1
2,60
3,60
6-10-*
0,60
0,015
0,035
0,09
5-10
1,8-10—8
8 10—3
0,010
0,02
1,5-10—3
7-10-4
5-10-*
6-10-6
1,6-10-*
1,5-10—3
0,04
2,8-10—3
0,020
Ы0-3
зние
г/т
1400
0,003
65
6
3
320
46
466 000
600
25 400
20 900
81 300
277 200
1180
1040
157
0,04
25 000
36 300
5
4400
150
300
1000
50 000
14
200
70
550
15
7
5
0,09
1,6
16
300
28
220
24
Атомнь
номер
42
44
45
46
47
48
49
50
51
52
53
55
56
57
58
59
60
62
63
64
65
66
67
68
69
70
71
72
73
74
75
76
77
78
79
80
81
82
83
Элемев
Мо
Ru
Rh
Pd
Ag
Cd
In
Sn
Sb
Те
I
Cs
Ba
La
Ce
Pr
Nd
Sm
Eu
Gd
Tb
Dy
Ho
Er
Tm
Yd
Lu
Hf
Та
W
Re
Os
Ir
Pt
Au
Hg
Те
Pb
Bi
Содерж
% (по массе)
3-10-*
E-10-')
ыо-7
Ы0-6
(Ы0-6)
E-Ю-')
A,4-Ю--5)
4-Ю-3
E-10-6)
ыо-6
D-Ю-6)
3,7-Ю-4
0,05
1,8-10—3
4.5-10-3
710—*
2,5-Ю-3
710—*
1,2-10-*
ыо-3
1,5-10-*
4,5-10-*
1,3-10—*
1,2-10-*
8-10—в
3-10-*
ыо-4
3,3-10-*
2-10-*
ыо-4
ыо-7***
5 10—е
ыо--'
5-10-'
5-10-'
7-10—*
3-10—*
1,6-Ю-3
B-10-6)
ание
г/т
15
@,001)
0,001
0,01
0,1
0,15
0,14
40
(О
0,002
0,4
4
250
18
46
5,5
24
6,5
1,1
6,4
0,9
4,5
1,2
1,1
0,2
2,7
0,8
4,5
69
0,001
0,01
0,001
0,005
0,005
0,5
0,6
16
0,2
24
Продолжение
я
а д,
Atoi
номе
84
86
88
89
«и
Эле>
Ро
Rn
Ra
Ac
Содержание
% (по массе)
B-10-")
7-10-16
Ы0-'
F.10-Я»)
Г/Т
.—
0,001
—
«я
2
90
91
92
94
1НЭР
Эле«
Th
Ра
и
Ри
Содержание
% (по массе)
8-Ю-*
ЬЮ-"
з-ю-4
ыо-«
г/т
12
—
4
—
* По данным А. П. Виноградова.
** По данным Мейсона содержание Ne, Кг, Хе, Ra н короткоживущих радио-
радиоактивных элементов составляет менее 0,001 г/т.
*** По данным С. М. Баситовой содержание Re на одни порядок выше по
сравнению с указанной величиной.
8 W 24
10 46 56 64 72 80 88
Атомный номер
Рис. 11. Логарифмы кларков элементов (no A. E. Ферсману)
массовым числом и избыточным числом нейтронов в ядрах, расположен-
расположенные в конце 7-го периода.
Распространенность химических элементов подгрупп IA, ПА, IVA и
VIII убывает сверху вниз.
Периодический закон действителен по отношению ко всему космосу.
Можно с уверенностью сказать, что в пределах атомных номеров от 1-го
до 107-го не могут быть открыты или синтезированы новые элементы,
исключая изотопы.
Количественные соотношения между отдельными элементами различ-
различны в зависимости от «возраста» космического объекта. Например, по
современным оценкам в космосе илн «горячих» звездах содержание ге-
гелия в 3000 раз больше, чем кремния. В то же время в земных условиях
содержание кремния в 60000 раз больше, чем гелия. В будущем ие-
плбежны изменения элементного состава земной коры, особенно ее глу-
глубинных слоев.
25
ТАБЛИЦА 6
РАСПРОСТРАНЕННОСТЬ ЭЛЕМЕНТОВ В КОСМОСЕ
Атомный
номер
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
19
20
21
22
23
24
25
26
27
28
29
30
31
32
33
34
35
36
37
38
39
40
Элемент
н
Не
Li
Be
В
С
N
О
F
Ne
Na
Mg
Al
Si
P
s
Cl
Ar
К
Ca
Sc
Ti
V
Cr
Mn
Fe
Co
Ni
Cu
Zn
Qa
Ge
As
Se
Br
Kr
Rb
Sr
Y
Zr
Концентра-
Концентрация, мг/л
11
10,7
9,62
2,0
1,3
1,25
6,6
6,85
7,45
3,25
6,95
4,65
6,0
5,0
6,1
4,05
5,7
3,95
5,2
3,45
4,65
0,4
3,5
2,3
3,9
3,7
5,8
3,25
4,5
2,25
2,7
1,1
1,75
0,60
1,85
1,15
1,4
0,75
1,3
0,90
1,8
Атомный
номер
41
42
44
45
4S
47
48
49
50
51
52
53
54
55
5S
57
58
59
60
62
63
64
65
SS
67
68
69
70
71
72
73
74
75
76
77
78
79
80
81
82
83
Элемент
Nb
Mo
Ru
Rn
Pd
Ag
Cd
In
Sn
Sb
Те
I
Xe
Cs
Ba
La
Ce
Pr
Nd
Sm
Eu
Gd
Tb
Dy
Ho
Er
Tm
Yb
Lu
Hf
Та
W
Re
Os
Ir
Pt
Au
Hg
Tl
Pb
Bi
Концентра-
Концентрация, мг/л
0
0,45
0,3
0,7
0,15
0,5
0
0,9
0,3
0,55
0,75
0,05
0,67
0,35
0,70
0,35
0,40
0,35
0,25
0,15
0,7
0,2
1,0
0,25
0,9
0,5
1,5
0,6
1.3
0,35
1,2
0,3
0,75
0,1
0
0,3
0,7
0,5
0,9
0,3
0,7
* Данные отнесены к содержанию атомов кремния (С=10"
графику).
26
и рассчитаны по
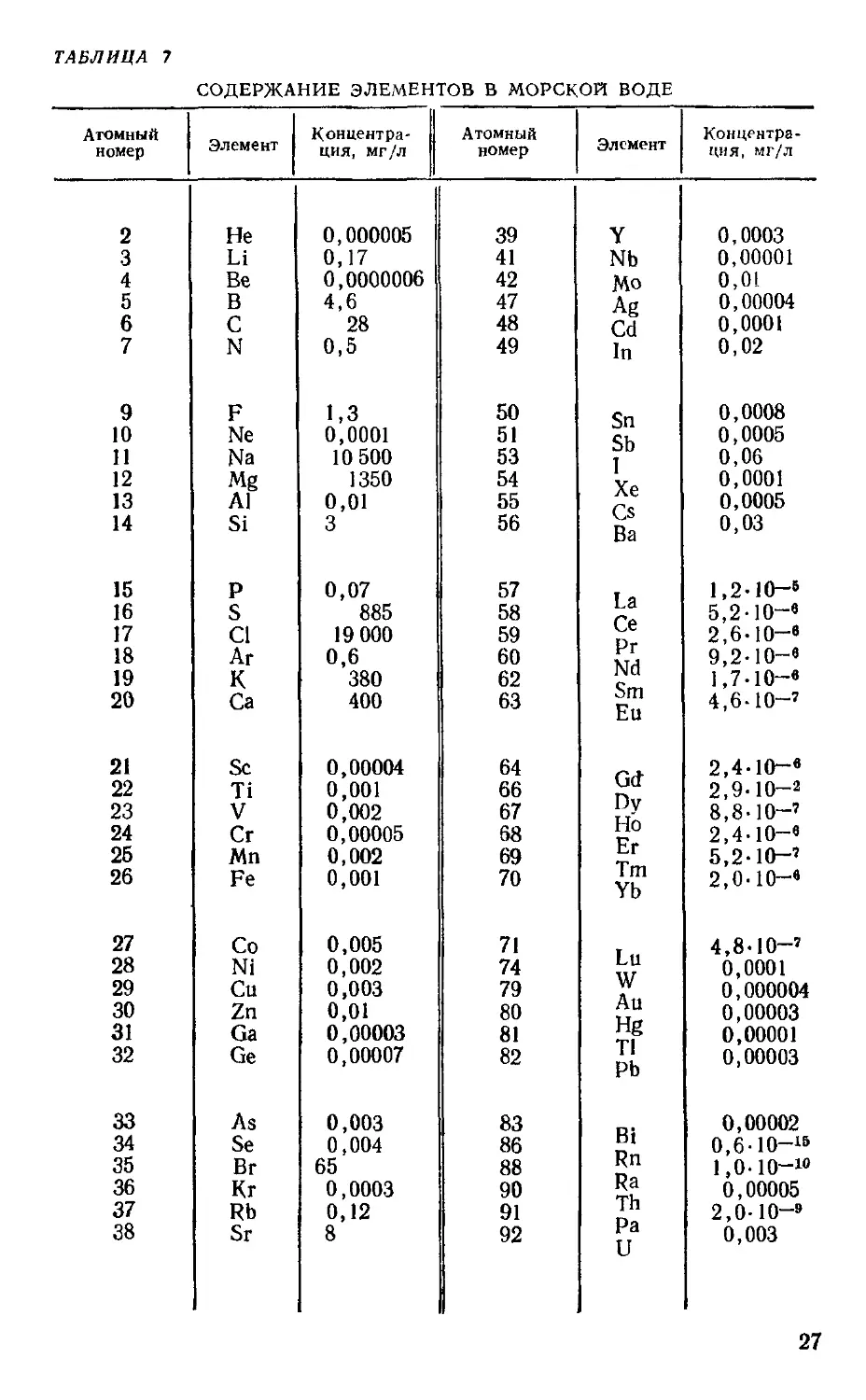
ТАБЛИЦА 7
СОДЕРЖАНИЕ ЭЛЕМЕНТОВ В МОРСКОЙ ВОДЕ
Атомный
номер
2
3
4
5
6
7
9
10
11
12
13
14
15
16
17
18
19
20
21
22
23
24
26
26
27
28
29
30
31
32
33
34
35
36
37
38
Элемент
Не
Li
Be
В
С
N
F
Ne
Na
Mg
Al
Si
P
S
Cl
Ar
К
Ca
Sc
Ti
V
Cr
Mn
Fe
Co
Ni
Cu
Zn
Ga
Ge
As
Se
Br
Kr
Rb
Sr
Концентра-
Концентрация, мг/л
0,000005
0,17
0,0000006
4,6
28
0,5
1,3
0,0001
10 500
1350
0,01
3
0,07
885
19 000
0,6
380
400
0,00004
0,001
0,002
0,00005
0,002
0,001
0,005
0,002
0,003
0,01
0,00003
0,00007
0,003
0,004
65
0,0003
0,12
8
Атомный
номер
39
41
42
47
48
49
50
51
53
54
55
56
57
58
59
60
62
63
64
66
67
68
69
70
71
74
79
80
81
82
83
86
88
90
91
92
Элемент
Y
Nb
Mo
Ag
Cd
In
Sn
ou
T
1
Vo
Ac
Ba
La
Ce
J\u
о
Sm
Eu
Oa
Dy
Ho
Er
Tm
Yb
■
Lu
W
д
Au
Hg
Tl
Pb
Bi
Rn
Ra
Th
Pa
U
Концентра-
Концентрация, мг/л
0,0003
0,00001
0,01
0,00004
0,0001
0,02
0,0008
0,0005
0,06
0,0001
0,0005
0,03
1,2-10—8
5,2-10—e
2,6-10-»
9,2-10—«
1,7-10-*
4,6-10-'
2,4-10-«
2.9-10-2
8,8-10-'
2,4-10—«
5,2-10-'
2,0-10—«
4,8-10-'
0,0001
0,000004
0,00003
0,00001
0,00003
0,00002
0,6-10—Х6
1,0- Ю-10
0,00005
2,0-Ю-9
0,003
27
Содержание элементов во Вселенной (приближ6нн0). 75 % Нг, 24 %
Не; остальные элементы 1 %.
Данные о содержании химических элементов в земной коре и в кос-
космосе приведены в табл. 5 и 6.
В связи с истощением природных ресурсов в земной коре все боль-
большее значение приобретает проблема освоения ресурСОв дна океанов и
морей, а также и самих вод Мирового океана (тавл 7). В прибрежных
песчаных осадках содержатся соединения железа, титана, хрома, цир-
циркония, олова, ниобия, тантала, благородных мета^лов (золота, серебра,
платины и др.). Современные технические средству позволяют'добывать
полезные ископаемые из прибрежных месторождений на глубину до
100 — 200 м.
ТАБЛИЦА 8
СОСТАВ ВОЗДУХА (БЕЗ ВЛАГИ И ПыЛИ)
Газы
N2
ог
Аг
сог
Не
Содержание, %
по объему
78,08
20,95
0,9325
о,о;о
0,0005
по массе
75,60
23,10
1,285
0,046
0,00007
Газ
Ne
Кг
Хе
О3
Rn
н2
Содержание, %
п0 объему
0.0018
°,С00Ю8
0,000008
°,000001
6. Ю-18
0,00005
по массе
0,0012
0,0003
0,00004
В табл. 8 и 9 приведены соответственно составЬ1 воздуха и гидро-
гидросферы.
ТАБЛИЦА 9
СОСТАВ ГИДРОСФЕРЫ (ПО А. Е. ФЕВСМДНУ)
Элемент
о2
н2
си
Na
N2
Mg
Содержание. %
85,45
10,63
2,05
1,14
0,37
0,14
Элемент
S
Са
К
Вг
С
Всего
Содержание, %
0,08
0,05
0,04
0,015
0,0025
99,95
Развитие производства химических элементов
Практически все химические элементы находят применение. Металлы
широко используются благодаря спектру физичес^ИХ) химических, меха-
механических, технологических и специальных экспл^атационных свойств.
Области их применения — от ядерной энергетику ракетно-космической
техники, электроники, светотехники до различных областей машиностро-
машиностроения и производства предметов быта. В качестве конструкционных ма-
материалов металлы применяют в основном в виде сплавов; в чистом ви-
28
де их используют реже. Особенно'важное значение имеют такие свойства
металлических материалов, как прочность, износостойкость, коррозион-
коррозионная стойкость, технологическая пластичность.
О динамике производства металлов можно судить также по следу-
следующим данным: если в 1800 г. производили 1 млн, т. металлов в год, то
в 1950 г. эта цифра достигла —400 млн. т. На душу населения плане-
планеты в 1900 г. приходилось около 10 кг металла в год, а в настоящее
время это количество превышает 400 кг.
Одновременно с производством металлов развивается и производ-
производство неметаллов; особенно значительный прогресс его начался во второй
половине XX в. Именно в это время возросли потребности современ-
современной техники в неметаллах и повысились требования к их чистоте.
Прежде всего это относится к полупроводниковым элементам (Si, Ge As,
Те, Se, P).
Важное значение в технологии различных производств, а также в
приборостроении приобретают галогены, инертные газы, водород, кисло-
кислород, азот.
Широкое техническое использование получили углерод и бор — от ле-
легирующих присадок в черной и цветной металлургии до конструкцион-
конструкционных материалов и арматурных составляющих композиционных матери-
материалов.
Крупными потребителями неметаллов являются медицина и сельское
хозяйство. Фосфор и азот, в частности, представляют собой основные
компоненты удобрений. Неметаллы наряду с металлами являются ком-
компонентами лекарственных препаратов.
Из всех неметаллических элементов в наибольшем количестве полу-
получают углерод, что связано с добычей и потреблением каменного угля;
значительно развито производство графита, алмазов и бриллиантов. Из
металлов наиболее высоким уровнем производства характеризуется же-
железо. Его годовое производство более чем в 50 раз превышает произ-
производство алюминия, занимающего второе место. Далее следует медь,
цинк, свинец, никель, магний. В незначительных количествах произво-
производятся теллур, гафний, платина, индий, галлий, характеризующиеся низ-
низким содержанием в земной коре. Однако эти металлы имеют важное
техническое значение и потребность в них возрастает.
1. ЭЛЕМЕНТЫ
ПЕРВОЙ ГРУППЫ
1.1. ЛИТИЙ [1-35, 58-60, 62, 63]
Общие сведения и методы получения
Литнй (Li)—щелочной металл. В компактном состоянии серебристо-
белого цвета. Получил название от греческого lithos (камень). Открыт
шведским химиком А. Арфведсоном в 1817 г. в минерале петалите
(алюмосиликата лития).
Металлический литий впервые выделен английским ученым Дэви в
1818 г. электролизом оксида лнтия. В 1885 г. в значительных количест-
количествах металлический литий получен независимо друг от друга Бунзеном
(Германия) и Матиссеном (Англия) путем электролиза (электролитом
служил хлорид лития).
Содержание лития в земной коре 0,0065 % (по массе). В свободном
состоянии литий ие встречается из-за большой химической активности.
29
Основные минералы, содержащие литнй н имеющие промышленное зна-
значение: сподумен F—7% Li2O); петалит C,5—4,9% Li2O); амблиго-
иит (8—10 % ЫгО). Кроме того, к литийсодержащим минералам отно-
относятся литиевые слюды — цинвальдит C,0—3,5 % Li2O) и лепидолит
D—6 % УгО). Литий содержится также в воде минеральных источни-
источников, морской и озерной воде, в каменных углях, в живых организмах н
растениях.
В промышленности металлический литий получают путем электроли-
электролиза расплавленного хлорида лития или смеси расплавленных хлорида
лития и хлорида калия с применением графитированного анода и сталь-
стального катода. Литий высокой чистоты (99,95%), почти свободный от
примесей щелочных и щелочноземельных металлов, получают электро-
электролизом насыщенного раствора LiCl в пиридине, разложением соединения
NH3Li в вакууме при 50—60 °С и восстановлением окиси лития алюми-
алюминием в вакууме (-10-1 Па) при 950—1000°С.
В зависимости от содержания примесей литий поставляют трех ма-
марок: ЛЭ-1, ЛЭ-2 и ЛЭ-3.
Химический
3
СО
£
ЛЭ-1
ЛЭ-2
ЛЭ-3
О)
К
3
99
98
98
О>
X
,5
,0
,0
0
0
0
состав
Na
,06
,1
,8
0,
0,
0,
лития
К
005
01
2
(по ГОСТ
Са
0,
0,
0,
03
03
1
8774—75):
Примеси, %,
Mg
0,02
0,05
0,3
Мп
0,001
0,005
0,02
не более
Fe
0,005
0,01
0,03
0
0
0
А1
,003
,005
,03
SiO2
0
0
0
.01
,05
,2
-хии хс
5
0
0
0
>я
3
в
о.
,05
,05
,2
Литий поставляют партиями массой не более 500 кг. Масса одной
чушки не должна превышать 2,5 кг. Чушки лития упаковывают в бан-
банки из белой жести или стальные барабаны и заливают смесью расплав-
расплавленного парафина и осушенного трансформаторного масла в отноше-
отношении 1:1. Прн транспортировке лития тару следует предохранять от ме-
механических повреждений и попадания влаги, так как литий
воспламеняется от воды. На складах литий следует хранить при темпе-
температуре не выше 240 °С и относительной влажности не более 85%.
В складских помещениях должны быть средства пожаротушения и от-
отсутствовать водяные и паровые коммуникации. Для тушения горящего
лития применяют порошкообразный технический хлористый калий
(влажность порошка не более 1 %), сухой графитовый порошок, инерт-
инертный газ (аргои).
Работникам, имеющим дело с литием, необходимо соблюдать прави-
правила техники безопасности, принятые в химической промышленности для
работы со щелочными металлами. Работа с литием в атмосфере возду-
воздуха относится к категории взрыво-, пожароопасных. При горении лития
образуется густой дым его конденсатов и соединений. Температура са-
самовоспламенения лития на воздухе 640 °С. Температура горения 1300 "С.
Литий не летуч и не дает ингаляционного поражения. Продукты
сгорания лития относятся к классу чрезвычайно опасных соединений
A-й класс опасности). Они обладают резким раздражающим действи-
действием, вызывая поражения слизистых оболочек глаз и дыхательных путей,
а также общетоксическим действием. Допустимая концентрация про-
продуктов сгорания лития не должна превышать 0,02 мг/м3. Необходимо
30
также принимать меры по защите окружающей среды (очистка сточ-
сточных вод и газовых выбросов от загрязнения литием).
При работе с расплавленным литием следует пользоваться маской
С-40; для защиты органов дыхания в атмосфере аэрозолей лития и его
соединений необходимо пользоваться респиратором типа «лепесток»,
органов зрения — герметичными защитными очками. В случае попада-
попадания расплавленного литня на кожу его удаляют сухим тампоном или
тампоном, смоченным рыбьим жнром, а затем обильно обмывают пора-
пораженное место водой и нейтрализуют 2—3 %-ным раствором борной
кислоты, после чего накладывают сухую повязку. При попадании в гла-
глаза литий немедленно удаляют ватным тампоном или хлопчатобумажной
тканью, смоченной рыбьим жиром, а затем промывают глаза струей
1—2 %-иого раствора борной кислоты или чистой водой.
Физические свойства
Атомные характеристики. Атомный номер 3, атомная масса 6,941 а. е. м.,
атомный объем 13,1 • 10~6 м3/моль. Потенциалы ионизации атомов
J (эВ): 5,39; 75,61; 122,42. Электроотрицательиость 0,97.
Из щелочных металлов Li обладает наименьшим атомным радиусом
@,157 нм), а следовательно, наибольшим ионизационным потенциалом
У, = 5,39 эВ, поэтому литий химически менее активен по сравнению с
другими щелочными металлами. Ионный радиус Li+ равен 0,068 нм.
Благодаря малому атомному радиусу литий обладает наиболее проч-
прочной кристаллической решеткой по сравнению с остальными щелочными
металлами. Это обусловливает наиболее высокие температуры плавле-
плавления и кипения лития по сравнению с его аналогами. При нормальной
температуре литий имеет о.ц. к. решетку, период решетки 0,35023 им,
координационное число 8, межатомное расстояние 0,30331 нм. Ниже
—195 °С литий кристаллизуется в г. п. у. решетке с а = 0,3111 нм и
е=0,5093 им. Энергия кристаллической решетки 155,2 мкДж/'кмоль.
Природный литий (эффективное поперечное сечение захвата тепло-
тепловых нейтронов 67±2-10~28 м2) состоит из двух стабильных изотопов
6Li G,42 %) и 7Li (92,58 %)• Тяжелый изотоп 7Li прозрачен для ней-
нейтронов, имеет эффективное поперечное сечение захвата тепловых ней-
нейтронов 0,033-10~28 м2; 6Li активно поглощает тепловые нейтроны; эф-
эффективное поперечное сечение захвата тепловых нейтронов 912-10~28м2.
Получены искусственные радиоактивные изотопы 8Li и 9Li. Период по-
полураспада их соответственно 0,841 и 0,168 с.
Работа выхода электронов <р=2,38 эВ.
Плотность в зависимости от температуры:
Г, К 293 473 673 873 1073 1273
р,Мг/м3 . . . 0,536 0,509 0,490 0,474 0,457 0,441
Электрические и магнитные. Удельная электрическая проводимость
лития при 293 К а= 10,7-10е МСм/м.
Удельное электрическое сопротивление р лития в зависимости от
температуры:
Т,К • . . 86 194,7 273 294,8 335,5 372,3 503
р, мкОм-м. 0,0134 0,054 0,0855 0,0943 0,1117 0,127 0,4525
Температурный коэффициент электрического сопротивления при
273—373 К а=4,50- Ю-3 К. Абсолютный коэффициент т. э. д. с. при
298 К г= + 12,2 мкВ/К. Постоянная Холла при комнатной температуре
# = —2- Ю-10 м3/Кл. Удельная магнитная восприимчивость при 298 К
Х=-т-2,04-10-9.
31
Литий парамагнитен, соединения его диамагнитны. Наибольшее зна.
чение коэффициента вторичной электронной эмиссии атах=0,5 при ус-
ускоряющем напряжении первичных электронов 0,085 кэВ.
Тепловые и термодинамические. Температура плавления <™ =
= 180,5 °С, температура кипения tm,= 1327-М351 °С, характеристичес-
характеристическая температура 0D = 370 К. Удельная теплота плавления ДЯ„Л =
=416 кДж/кг, удельная теплота испарения АН„С„ при температуре ки-
кипения 21290 кДж/кг. Удельная теплота сублимации при 298 К ДЯсубл =
= 23280 кДж/кг. При низких температурах происходят полиморфные
превращения лития, которые носят мартенситный характер.
Удельная теплоемкость ср в зависимости от температуры:
Т, К 273 323 373 459 573 1083
ср, Дж/(кг-К). 3282,0 3529,6 3768,1 4228,6 4270,5 4144,9
Удельная электронная теплоемкость cjf=[l,8 мДж/(моль-К2)] -Т.
Теплопроводность К в зависимости от температуры:
Г, К ....... 273 489 812
X, Вт/(мК) . . . 71,17 45,63 30,56
Температурный k коэффициент линейного расширения а при 293 К
56- Ю-6 К"-
Энтальпия / при 298 К равна 849,920 кДж/кг. Молярная энтропия
s° при 298 К составляет 28,26 Дж/(моль-К).
Давление пара р в зависимости от температуры:
т, к
1005
1101
1163
1,
6,
1,
р.
33
65
33
Па
•102
• 102
-103
1208
1241
1308
2
3
7
р, Па
,26-103
,72-10»
,58-10»
Г, К
1505
1609
5
1
р.
,32
.01
Па
-10*
• 10*
Давление пара при температуре плавления 1,66-10~7 Па.
Поверхностное натяжение при 200—500 °С: о = 400 мН/м.
Поверхностная энергия v=435 мДж/м2.
Сжимаемость лития х = 9,1-101 Па~'.
Энергия активации самодиффузии в интервале температур 308-
450 К -Б = 53,8 кДж/моль.
Параметры взаимной диффузии некоторых элементов в литии:
Диффундирую-
Диффундирующий элемент
Na
Си
Zn
Ag
In
Sn
Sb
Аи
Pb
Bi
T, К
323—449
324—394
330—446
340—433
348—443
381—447
414—449
318—423
402—442
413—450
0,41-10-*
0,47-Ю-4
0,57-10-*
0,37-10-*
0,39-10-*
0,62-10-*
1,69-10»
0,21-10-*
1,6-10-2
5,3-10»
В, кДж/моль
52,8
38,6
54,5
53,7
66,4
62,7
173,8
46
105,5
198
32
Механические свойства
Литий чистотой 99,7 %:
t,°C —269
ов, МПа ... 50
б, % 54
—253
43
29
—193
13
27
—7,8
5
38
+20
1
52
Литий чистотой 99,3 %:
t, °C —271
ав, МПа ... 44,0
а0 2, МПа. . . 15,7
6,'% Ю4
«|>, % 56
-268
59
22
100
57
,0
,6
—195
15
5,0
' 88
88
—123
8
3,0
51
96
+27
5
2,0
96
99
Твердость по Моосу 0,6, твердость по Бринеллю НВ 5 МПа, модуль
нормальной упругости £ = 5 ГПа.
Химические свойства
Нормальный электродный потенциал реакции Li—e=F±Li+, фо=3,2 В.
В соединениях проивляет степень окисления +1.
По способности соединяться с другими металлами и по участию в
химических реакциях литий ближе к магнию, чем к щелочным ме-
металлам.
Соединения лития с элементами периодической системы:
IA NLi КLi PbLi CLi
Ir,
р
—Na—Li, К—Li, Pb—Li, Cs—Li;
—Li—Be, Mg2Li, MgsLi2, Ca2Li, CaLi, Sr3Li, Sr7Li,
Sr3Li2> Sr6Li23,-BaLi;
—Li—Sc, Li—Y, Li—La;
— Li—Ti, Li—Zr, Li—Hf;
— Li—V, Li—Nb, Li—Та;
— Li—Cr, Li—Mo, Li—W;
— Li—Mn, Li—Tc, Li—Re;
— Li—Fe, Li—Ru, Li—Os, Li—Co?, Li—Rh, Li
Li-Ni?, Li-Pd, LiPt5;
— LiCu?, LiioAg3> LieAg^ LiAg, LiAu, Li3Au, is;
— Li6Zn?, Li3Zn?, Li2Zn3, LiCd, Li6Hg, Li3Hg, Li2Hg,
LiHg, LiHg2, LiHg3;
— LiB6, Li^l, Li2Al3, LiGa, Liln, Li4Tl; Li3Tl, Li5TI2,
Li2Tl, LiTl;
— LiC, Li4Si, Li2Si, LiSi2, Li4Ge, Li3Ge, Li4Sn, Li7Sn2,
Li5Sn2) Li2Sn, LiSn, LiSn2, Li4Pb, Lii0Pb3, Li3Pb,
Li3Pb2, LiPb;
— Li3N, Li3P, Li3As, LiAs5, Li3Sb, Li3Bi, LiBi;
— Li2O, Li2S, Li2Se, Li2Te, Li—Po?;
ру — LiF, LiCl, LiBr, Lil, LiAt?
Металлические соединения лития отличаются достаточно высокой
твердостью н хрупкостью, а также высокой температурой плавления:
подгруппа IA
подгруппа IIA
подгруппа IIIA
подгруппа 1VA .
подгруппа VA
подгруппа VIA
подгруппа VIIA
группа VIII
подгруппа IB
подгруппа ИВ
подгруппа IIIB
подгруппа IVB
подгруппа VB
подгруппа VIВ
подгруппа VIIB
М
33
Металлические соединения
»-
я
1
Mg
Al
Zn
Cd
Hg
Tl
Соединение
Li2Mg5
Li2Al3
LiZn
Li2Zn3
LiZn2
Li3Cd
LiCd
LiCd3
Li3Hg
LiHg
LiHg2
LiHg3
Li4Tl
Li.,Tl
'max
сущест-
существования
—
—
—
93
272
—
370
379
—
232
42
381
—
лития
ПЛ"
°c
590
598
—
520
—
—
549
—
—
600,5
—
—
—
447
448
I
4
Pb
Bi
Ag
Sn
Соединение
Li2Tl
LiTl
Li4Pb
Li,Pb2
Li3Pb
Li3Bi
LiBi
Li3Ag
LiAg
Li4Sn
Li7Sn2
Li6Sn2
Li2Sn
LiSn2
'max
сущест-
существования
381
648
—
658
415
—,
,
720
502
——
\?
°c
508
, „
726
—
1145
.
450
955
765
783
485
Растворимость металлов в литии в зависимости от температуры:
Металл
Армко- Fe
Ni
Ti
Mo
т, к
1173
1273
1473
973
1023
1123
1223
1173
1273
1473
Раствори-
Растворимость, %
(по массе)
0,01
0,02-0,1
0,35
0,15
0,5
1,36
3,2
0,014
10-*
0,03—0,1
Металл
Nb
Be
Zr
и
т, к
1273
1273
1173
1273
1473
1073
1173
1273
Раствори-
Растворимость, %
(по массе)
10-*
0,25
0,02
0,05
6,3
0,01
0,03
0,05
Литий взаимодействует со многими органическими соединениями
и их галоидными производными. Ои бурно реагирует с разбавленными
минеральными кислотами, а также с соляной и азотной; с концентриро-
концентрированной азотной кислотой он реагирует медленно. Лнтий легко сплав-
сплавляется почти со всеми металлами, за исключением железа. При повы-
повышенных температурах литий энергично вступает во взаимодействие
с хлором, бромом, нодом, углеродом и др. Литий горит с образова-
образованием оксида. В сухом воздухе не загорается. При низкой температу-
температуре на воздухе корродирует (тускнеет-, в отдельных местах покрывается
темно-коричневым налетом). Продукты коррозии лития могут вос-
воспламеняться при 200°С, поэтому хранить литий следует только в гер-
герметично закрытых сосудах или в инертной среде. Литнй быстро окис-
34
ляется в атмосфере влажного воздуха. Если влажность воздуха не
превышает 80 %, то литий медленно реагирует с азотом, образуя нит-
нитрид LiN. В более влажном воздухе образуется гидроксид LiOH.
Кроме L1N, известны также нитрид лития Li3N, имид лития LiNH3>
амнд лития LiNH2, азид лития УЫз, нитрид лития LiNO2, нитрат ли-
лития L1NO3. Взаимодействие лития с водой происходит без плавления
и самовозгорания с образованием гидроксида LiOH я выделением во-
водорода. При непосредственном взаимодействии расплавленного лития
с водородом образуется гидрид LiH. С кислородом литий образует
оксид Li2O и пероксид Li2O2. С сухнм кислородом при низкой темпе-
температуре не реагирует. При соединении лития с углеродом образуется
карбид лития U2C2, который представляет собой бесцветное хрупкое
кристаллическое вещество плотностью 1,65 Мг/м3. Другое соединение
лития с углеродом — карбонат лития Li2CO3.
При взаимодействии лития с хлором образуются соединения: хло-
хлорид лития LiCl, гипохлорид лития LiCIO, хлорит лития LiC102, перхло-
перхлорат лития LiClO4 и хлорат лития LiC103.
Непосредственное соединение брома и лития дает бромистый литий
LiBr, который выделяется в виде белых кристаллов правильной фор-
формы с различным содержанием кристаллизационной воды. Другие со-
соединения лития с бромом — гнпобромит лития LiBrO и бромит лития
ЦВгО2 — образуются при добавке брома к раствору гидроксида лития.
Литий с фтором образует фторид лития LiF, который кристалли-
кристаллизуется в виде белых мелких кристаллов правильной формы.
Известны три соединения лития с иодом — йодистый литий Lil,
иодат лития LiIO3 и периодит лития LilCv
Соединения лития с серой — сульфат лития U2SO4 и сульфид ли-
лития L12S. Безводный сульфат лития представляет собой мелкие белые
призматические кристаллы, сульфид лития—кристаллы зеленовато.
желтого цвета.
Известны соединения лития с кремнием в виде силикатов и силици-
силицидов лития. Силикаты лития кристаллизуются в трех соединениях: орто-
силикат лития U4SO4, метасиликат лития Li2SO3 и дисиликат лития
l^S^Os- Силициды лития: тетралитийсилицид Li4Si, трилитийсилицид
LieSi, дилитийсилицид Li2Si.
Сплавы системы литий — кремний представляют практический инте-
интерес как активные раскислнтели.
Соединения лития с фосфором: фосфид лития переменного состава
LuPy, гипофосфит лития LiH2PO2, ортофосфат лития Li3PO4, моно-
гидрофосфат лития Li2HPO4, дигидрофосфат лития LiH2PO4, пирофос-
фат лития Li4P2O7, метафосфат лития LiPO3, гипофосфат лития
Li4P2O6, двузамещенный LiHPO3 и однозамещенный ПН2РО3 фосфиты
литня.
Соединения с селеном и теллуром: селенид Li2Se, представляющий
собой красно-коричневое кристаллическое вещество, теллурид Ll2Te —
бесцветное кристаллическое вещество.
Имеются два соединения с мышьяком: трилитийарсенид Li3As — ве-
вещество коричневого цвета и монолитийарсенид LiAs.
Технологические свойства
Литий обладает очень высокой пластичностью и может легко дефор-
деформироваться при комнатной температуре прессованием, прокаткой и
волочением. При этом не происходит упрочнения, так как температура
рекристаллизации лития лежит ниже 20 °С. В холодном состоянии ли-
литии легко режется ножом. Приращение объема при плавлении 1,5 %•
Давление истечения (при 15—20 °С) равно 17 МПа,
35
Области применения
Важнейшей областью применения лития и его соединений является
ядерная энергетика (получение трития при бомбардировке изотопа 6Li
нейтронами).
Дейтерид лития используется в качестве твердого горючего в во-
водородных бомбах, жидкий 7Li — в качестве теплоносителя в ядерных
реакторах. Ряд соединений лития применяют в военной технике, а
также как топливо для ракет космических кораблей, управляемых
снарядов подводных лодок, сверхскоростной авиации и т. д.
Широко применяются соединения лития прн получении керамики,
эмали, специальных стекол, при сварке алюминиевых и магниевых спла-
сплавов, в химической промышленности, в холодильной технике, в радио-
радиоэлектронике и т. д.
В металлургии литий, его соединения и литийсодержащие сплавы
используют для раскисления, дегазации и десульфурации расплавов
различных металлов и сплавов. Для этой цели обычно применяют
2 %-ные лигатуры с теми металлами, которые подвергаются раскисле-
иию. Литиевые лигатуры (кремний — литий, алюминий — литий, маг-
иий — литий, кальций — литий, железо — кремний — литий и др.) слу-
служат присадками к углеродистым и специальным сталям, оказывая
раскисляющее действие, повышая жидкотекучесть, механические и кор-
коррозионные свойства сплавов.
Литий используют для повышения прочности и пластичности спла-
сплавов, снижения их плотности, повышения коррозноиной стойкости. До-
Добавки лития к магнию позволяют получать сверхлегкие сплавы, плот-
плотность которых на 15—25 % ниже плотности стандартных магниевых
сплавов. Легирование алюминия литием снижает плотность алюминие-
алюминиевых сплавов иа 10—12 %.
Литий улучшает антифрикционные и механические свойства подшип-
подшипниковых сплавов, в частности в евннцовокальциевые баббиты вводят
для этой цели 0,04 % Li. Литий улучшает литейные свойства чугуна.
Некоторые соединения лития в последние годы находят применение в
медицине.
1.2 НАТРИЙ [1—35, 64—66]
Общие сведения и методы получения
Натрий (Na) —серебристо-белый щелочной металл, быстро тускнеющий
на воздухе при обычных условиях. Содержание в земной коре 2,5 %
(по массе). В водах мирового океана средняя его концентрация 1,035 %.
В живых организмах содержится до 0,02 % (по массе) натрия, содер-
содержание его в растениях несколько ниже.
Известно более 220 минералов, в состав которых входит натрий.
Наиболее распространены, хлорид натрия, или поваренная соль, NaCl,
галит NaCl, или каменная соль, чилийская селитра NaNO3, тенардит
Na2SO4, мираболит (глауберова соль) Na2SCvl0H2O, трона
Na,H(CO3J-2H2O и др.
Натрий присутствует также в ряде более сложных минералов, со-
содержащих алюминий, кремний, серу и другие элементы. Например, в
иафелине Na[A]SiO4], лазурите (ультрамарин) Na3[Al3Si30i2] • Na2[SO4],
жадеите NaCl[Si2Oe] и др.
Ряд соединепий натрия, в первую очередь поваренная соль и сода
Na2CO3 • 10Н2О, известны человеку с глубокой древности.
В древнем Египте было известно моющее вещество (сода), коюрое
называли neter. У Аристотеля оно носит название vixpon, а у Плутарха
(Древний Рим) — nitrum. В рукописях арабских алхимиков соде отве-
отвечает термин natron, от которого постепенно в XVII—XVIII вв. обра-
36
зуется термин «натра», т. е. основание, из которого можно получить
поваренную соль. От «натра» произошло современное название элемен-
элемента. Надо отметить, что в ряде стран Западной Европы (Великобрита-
(Великобритания, Франция, Италия), а также США натрий носит название sodium.
Металлический натрий впервые был получен в 1807 г. английским
химиком Деви в результате электролиза (щелочной способ). Из-за
большой энергоемкости щелочной способ получил промышленное рас-
распространение лишь в конце XIX в. До этого металлический натрий по-
получали химическим восстановлением его соединений углеродом или рас-
расплавленным чугуном при высокой температуре. С первой четверти те-
текущего века щелочной способ постепенно вытесняется солевым, т. е.
электролизом непосредственно расплава хлористого натрия, минуя ста-
стадию получения щелочи. Электролиз расплавленной соли ведут при
850—860 К. Для снижения температуры плавления NaCI используют до-
добавки ряда солей, в частности NaF, KCI, СаСЬ и др. При электролизе
хлористого натрия получают также еще один ценный продукт — газооб-
газообразный хлор. Поэтому в настоящее время солевой способ получения
натрия практически вытеснил щелочной, не говоря уже о химических
способах. Производство натрия металлического технической чистоты в
нашей стране регламентируется ГОСТ 3273—75, согласно которому в
готовом продукте содержание натрия должно быть не менее 99,7 %, ка-
калия— не более 0,1 %, железа — не более 0,001 % и кальция — не бо-
более 0,15 %. В этом же ГОСТе содержатся правила транспортировки,
хранения и требования по технике безопасности при работе с натрием.
Физические свойства
Атомные характеристики. Атомный номер 11, атомная масса
22,98977 а. е. м., атомный объем 23,08- 10~в м3/моль. Атомный радиус
(металлический) 0,192 нм, ионный радиус Na+ 0,098 нм, ковалентный
0,157 нм. Конфигурация внешних электронных оболочек атома 2p63s'.
Натрий обладает единственным стабильным изотопом 23Na; известно
пять радиоактивных изотопов с массовыми числами от 20 до 25; период
полураспада изотопов изменяетси от тысячных долей секунды B0Na)
до 2,6 года у 22Na. При комнатной температуре натрий имеет о. ц. к.
решетку с периодом а=0,42905 нм; энергия кристаллической решетки
108,8 мкДж/кмоль. При низких температурах существует модификация
натрия с г. п. у. структурой, периоды которой при 5К: а=0,3767 нм,
с=0,6154 нм. Потенциалы ионизации атома натрия J (эВ) 5,138, 47,20,
71,8, электроотрицательность 0,9. Работа выхода электронов фо=
=2,35 эВ. Работа выхода электронов для различных граней монокри-
монокристалла ф=2,75эВ для {100}, <р=3,10эВ для {ПО}, ф=2,65эВ для {111}.
Плотность. При комнатной температуре плотность натрия рентге-
рентгеновская р=0,966 Мг/м3, пикнометрическая р=0,971 Мг/м3.
Плотность натрия в зависимости от температуры:
г. к
273,15
300
350
371,00(т)
371,00(ж)
400
450
р, Мг/м3
0,973
0,967
0,956
0,952
0,928
0,921
0,909
Г. К
500
550
600
650
700
750
800
■ |
р, Мг/м» Т, К
II
0,897
0,885
0,873
0,861
0,849
0,837
0,826
850
900
950
1000
1050
1100
1150
р, Мг/м3
0,814
0,802
0,790
0,778
0,768
0,754
0,742
37
При плавлении плотность натрия снижается на 2,5 %.
Электрические и магнитные. Удельная электрическая проводимость
натрия а в зависимости от температуры:
К 113 273 373 573
а,МСм/м. . ..100 21,1 10,4 6,0
Удельное электрическое сопротивление р натрия в зависимости от
температуры:
г, к
113
273
300
р, мкОм
0,010
0,0429
0,0485
Г, К
350
371 (тв)
371 (ж)
400
р, мкОм
0,0603
0,0658
0,0980
0,1060
т к
450
500
550
600
р, мкОм
0,1212
0,1380
0,1565
0,1767
При плавлении удельное электрическое сопротивление натрия воз-
возрастает в 1,451 раза. Температурный коэффициент электрического со-
сопротивления натрия при 273 К а=4,34-10-3 К.
В термопаре натрий — платина прн температуре горячего спая
173,16 К развивается т. э. д. с. £=0,29 мВ, а при температуре 373,16 К
Е——0,25 мВ. Абсолютный коэффициент т. э. д. с. е=— 4,4 мкВ/К. По-
Постоянная Холла при комнатной температуре /? = 2,3-10—10 м3/Кл и
/?=— 2,2-Ю-10 м3/Кл при 371—383 К.
Магнитная восприимчивость натрия х= +0,70- 10~в при 293 К.
Тепловые и терчодинамические. Температура плавления натрия /Пл =
=98 °С, температура кипения ?кип=878°С, характеристическая темпе-
температура 6в = 160К, удельная теплота плавления Д//пл = 117 кДж/кг.
Удельная теплота сублимации при 298 К ДЯсубл = 4717 кДж/кг, удель-
удельная теплота испарения Д#Исп = 3869 кДж/кг. Теплота испарения натрия
при нормальном давлении ДЯцСп = 3869 кДж/кг. При плавлении проис-
происходит увеличение объема на ДУ—27,82-10~6 м3/кг или ДУ/Уо=0,0265.
При повышении давления возрастает температура плавления металла,
достигая 515 К при 3 ГПа и 608 при 8 ГПа. Начальное значение уг-
углового коэффициента dT/dP = S5 К/ГПа, при 7 ГПа 33 К/ГПа. Фазовых
превращений в натрии до давления 8,5 ГПа не обнаружено.
Удельная теплоемкость натрия в интервале 273—7"Пл Ср=
= 1226 Дж/(кг-К).
Изменение удельной теплоемкости в зависимости от температуры:
Г. К
273,15
298,15
300
350
<■„ Дж/
/««■•К)
1201
1224
1228
1314
Г, К
371,0 (тв)
371,0(ж)
400
450
ср, Дж/
Дкр К)
1390
1385
1370
1348
т, к
500
550
600
■у Дж/
Л«г К)
1328
1310
1295
Электронная теплоемкость с^1 =[1,4 мДж/(моль-К2)]-7\ Зависимость
теплопроводности Я натрия от температуры;
38
г, к
17
40
60—100
273
>,,Вт/(м-К)
10,0
54,0
55,0
150,0
Г, К
323
371,9
393
473
V Вт/(м.К)
149,65
99,75
99,5
81,25
Г, к
673
873
1073
X, Вт/(м ■ К)
71,2
62,8
57,15
Температурный коэффициент линейного расширения а в интервале
температур 273—268 К а=72- Ю-6 К.
Молярная энтропия иатрия в зависимости от температуры:
7\ К 298 500 1000 1500 2000
s°, Дж/(моль-К) • 51,1 73,9 94,3 187,3 193,3
Приведенный термодинамический потенциал натрия Фх в зависимо-
зависимости от температуры:
Т,К 298 500 1000 1500 2000
Фг, Дж/(моль-К) 51,1 56,3 70,9 98,4 121,3
Давление пара натрия
т. к
400
500
600
Р. Па
17,65-10-'
8,47«10-2
4,56
в зависимости от температуры:
г, к
700
800
900
Р. Па
96,8
8,52-102
45,1-103
Г. К
1000
1100
Р Па
17,2-Ю3
50.2-103
Давление пара иатрия пря температуре его плавления C71,0 К)
14,32 мкПа.
Поверхностное натяжение с в зависимости от температуры:
т. к
371,0 (ж)
400
450
500
550
о, мН/м
195,0
192,1
187,1
182,1
177,1
Г, К
еоо
650
700
750
<т. мН/м
172,1
167,1
162,1
157,1
т.к.
800
850
900
950
1000
о. мН/м
152,1
147,1
142,1
137,1
132,1
Поверхностная энергия кристаллического натрия для грани A00) v=
= 171МДж/мг.
Динамическая вязкость ц натрия в зависимости от температуры:
39
г, к
371,0
400
450
500
Г), мПа-с
6,96
6,08
4,99
4,24
Г, К
550
600
650
700
Г), мПа.с |
3,69
3,28
2,95
2,69
Г, К
750
800
850
900
Г], мПа • с
2,48
2,30
2,15
2,02
Кинематическая вязкость натрия
г, к
371,0
400
450
500
V.108, м*/с
96,85
66,03
54,93
47,28
Т, К
550
600
650
700
v в зависимости от температуры:
V.108, мг/о
41,71
37,52
34,26
31,37
г, к
750
800
850
900
v. I08, мг/с
29,56
27,83
26,40
25,17
Оптические свойства. Отражательная способность натрия (коэффици-
(коэффициент отражения) в зависимости от длины волны:
X, мкм
X, мкм
X, мкм
0,33
0,42
0,56
91
93
96
0,66
1,18
98
99
1,53
2,28
99
99
Показатель преломления п в зависимости от длины волны Я:
К, мкм
0,042
©,080
0,950
0,105
я
1,020
0,942
0,910
0,884
я,
0,
0,
0,
мкм
1277
1436
1635
0
0
0
п
,817
,764
,679
Я
0,
0,
0,
, мкм
1739
1900
2000
0
0
0
п
,616
,485
,390
Механические свойства
Твердость натрия по Бринеллю ЯВ = 0,7 МПа. Модуль нормальной уп-
упругости при растяжении при комнатной температуре £=5,3 ГПа. Сжи-
Сжимаемость натрия а—15,99- 10~u Па-1.
Химические свойства
В химических соединениях, включая гидриды, проявляет степень окис-
окисления + 1.
40
Натрий относится к числу наиболее реакционноспособных металлов,
поэтому в чистом виде в природе не встречается. Натрий — один из
наиболее электроположительных металлов; интенсивно взаимодействует
с кислородом воздуха, поэтому его обычно хранят под слоем керосина.
Нормальный электродный потенциал реакции Na—e^=»=Na+, q>0 =
= —2,714 В. В ряду напряжений натрий стоит далеко впереди водорода
и вытесняет его из воды, образуя при этом гидрокснд NaOH.
При пропускании сухого водорода над слегка нагретым натрием об-
образуется гидрид натрия NaH, представляющий собой нонное соединение,
в которое натрнн входит в виде катноиа, а водород — в виде аниона.
Теплота образования NaH Д#Обр=50,19 кДж/моль.
Важнейшее соединение натрия с кислородом—оксид натрия Na2O и
пероксид натрия Na2O2.
Оксид натрия образуется при горении натрия в недостаточном коли-
количестве кислорода, бурно реагирует с водой с образованием гидроксида,
имеет кристаллическую решетку типа плавикового шпата.
Пероксид натрия образуется прн сжигании натрия на воздухе или
в кислороде, представляет собой бледно-желтый порошок, который пла-
плавится без разложения; очень сильный окислитель. Многие органические
вещества при соприкосновении с ним воспламеняются. При взаимодей-
взаимодействии Na2O2 с углекислым газом выделяется кислород. Эту реакцию
используют в дыхательных аппаратах, применяемых пожарными и во-
водолазами, а также для регенерации воздуха в закрытых помещениях,
например на подводных лодках.
Гидроксид натрня NaOH образуется в виде белых очень гигроско-
гигроскопических кристаллов, плавящихся прн 318,3 °С; плотность 2,13 Мг/м3.
Известно соединение натрия с углеродом Na2C2, которое можно рас-
рассматривать как соль ацетилена. Поэтому оно получило название аце-
тнлида натрня. Теплота его образования Д#Обр= 17,14 кДж/моль.
С азотом, возбужденным электрическим тлеющим разрядом, натрий
реагирует с образованием нитрида Na3N или азнда NaN3-
Нитрид натрия устойчив в сухом воздухе, но моментально разлага-
разлагается водой илн спиртом с образованием аммиака.
Сульфид натрия Na2S получают путем восстановления сульфата нат-
натрия углеродом. В чистом виде Na2S бесцветен, обладает кристалличе-
кристаллической решеткой типа CaF2. Очень распространенное соединение натрия
с серой и кислородом — так называемая глауберова соль Na2SO4-10Н2О.
Натрий наряду с обычными химическими соединениями, подчиняю-
подчиняющимися правилу валентности, образует также металлические соеди-
соединения. В сплавах системы Na — К образуется фаза Лавеса состава
KNa2, имеющая сложную о. ц. к. кристаллическую решетку типа
MgCu2 (C15). Аналогичное металлическое соединение наблюдается при
взаимодействии натрия с цезием. Ряд металлических соединений обра-
образуется при взаимодействии натрия с металлами I и VII В групп —се-
—серебром, золотом, цинком, кадмием, ртутью, галлием, оловом, свинцом
и другими элементами. Имеются, конечно, и исключения. Так, алюми-
алюминий, элемент ШВ подгруппы, не взаимодействует с натрием ни в жид-
жидком, нн в твердом состояниях. Элементы III—VIIIA подгрупп Перио-
Периодической системы практически с натрием не взаимодействуют из-за
большого различия как размерного фактора, так и температур плав-
плавления.
Технологические свойства
Натрий очень мягок и пластичен, легко деформируется на холоду. Дав-
Давление истечения натрия, по данным Н. С. Курнакова и С. Ф. Жемчуж-
Жемчужного, находится в пределах 2,74—3,72 МПа в зависимости от диаметра
выходного отверстия,
41
Области применения
Натрий достаточно широко применяется в различных областях техники.
Высокая реакционная способность этого элемента предопределила его
использование в металлургии в качестве восстановителя для получе-
получения натрийтермическим способом таких металлов, как титан, цирконий,
гафний, ниобий и др. При производстве некоторых сортов литейных
алюминиевых сплавов натрий и его соли используют в качестве моди-
модификаторов. В химической промышленности натрий применяют при Про-
Производстве цианистых солен, синтетического каучука и синтетических
моющих средств (детергенидов), фармацевтических препаратов, а так-
также тетраэтила свинца — антидетонатора прн получении высокооктано-
высокооктанового топлива для двигателей. В последние годы расширяется использо-
использование чистого натрия и его сплавов с калием в атомной энергетике в
качестве теплоносителей.
Широко применяются в народном хозяйстве его химические соеди-
соединения. Это прежде всего гндроксид натрия NaOH (каустическая сода),
который используют в мыловаренной промышленности, при производ-
производстве красок, в целлюлозно-бумажной и нефтяной промышленности, при
производстве искусственного волокна и др. Сода — карбонат натрия
Na2CO3 — применяется в стекольной, целлюлозно-бумажной, пищевой,
текстильной, нефтяной и других отраслях промышленности. В сельском
хозяйстве в качестве удобрения широко используется натриевая соль
азотной кислоты NaNO3, известная под названием чилийской селитры.
1.3. КАЛИЙ [1—35, 64—66]
Общие сведения и методы получения
Калий (К) — серебристо-белый металл, быстро тускнеющий на воздухе
при обычных условиях. Относится к щелочным металлам. Его блнжай-
шие аналоги ■— литий, натрий, рубидий, цезий. Содержание в земной ко-
коре —2,6% (по массе).
Наиболее распространенные минералы, содержащие калий: сильвин
КС1, арканит K2SO4, калийная селитра KNO3, калиевый полевой шпат
(ортоклаз) K[AlSi3O8), калиевая слюда KAl2fAlSi3Oio]-[OH-F]2, карнал-
карналлит KCl-MgCl2-6H2O и др
В соединениях известен с глубокой древности. Металлический калий
получен в 1807 г. английским химиком Деви электролизом влажного
едкого калн, который назвал его потассием, В 1809 г. Гильберт предло-
предложил называть потассий калием (от арабского аль-кали-поташ). Это
название было принято в России в 1840 г.
Масштабы производства и потребления калия значительно ниже,
чем натрня. По химическим свойствам калий близок натрию, но имеет
более высокую реакционную способность. По этой причине получение
калия более затруднительно, и в тех случаях, когда применение калия
или натрия сравнительно равноценно, предпочитают натрий. В про-
промышленности калий получают по обменным реакциям между металли-
металлическим натрием н КОН или КС1: KOH-f-Na->NaOH + K; KCI + Na-*-
-*-NaCl + K. В перзом случае реакция идет между расплавленным гид-
роксндом КОН и жидким натрием — противотоком в тарельчатой ре-
реакционной колонне прн 380—440 °С, во втором —через расплавленную
соль КС1 пропускают пары натрия при 760—800 °С; выделяющиеся
пары калия ьонденсируют. Электролиз расплавленных КОН и КС1 при-
применяют мало, вследствие низкого выхода по току н большой химиче-
химической активности калия, ГОСТ 10588—75 регламентирует производство
42
калня в нашей стране. Согласно этому ГОСТу металлический калий
выпускают двух марок А и Б:
А В
Внешний вид Слитки серебристо-белого цвета
К, %, не менее 98 97
Na, %, не более 1,5 2,0
Тяжелые металлы, %, не более,
в переводе на свинец .... Не нормируется 0,8
Металлический калий упаковывают в чистые, сухие, герметичные
стальные контейнеры вместимостью 25—100 л илн стальные банки
вместимостью 2—10 л согласно ГОСТ 6128—81.
Физические свойства
Атомные характеристики. Атомный номер 19, атомная масса
39,098 а. е. м., атомный объем 43,50-10-" м3/моль. Атомный радиус (ме-
(металлический) 0,236 нм, ионный радиус К+ 0,133, ковалентный 0,203 им.
Конфигурация внешних электронных оболочек атома калия 3p64s'. Ка-
Калий имеет два стабильных изотопа 39К (93,08 %) и 41К F,91 %) и один
слабо радиоактивный изотоп 40К @,0119%) с периодом полураспада
1,32 -10е лет. Известно несколько искусственных радиоактивных изото-
изотопов калия, среди которых практическое применение нашел изотоп "К с
периодом полураспада 0,52 сут. Калий прн комнатной температуре об-
обладает о. ц. к. решеткой с периодом а = 0,5247 им Энергия кристалли-
кристаллической решетки 90,2 мкДж/кмоль. Потенциалы ионизации атома калия
/(эВ): 4,339, 31,81, 45,9 Работа выхода электронов q>=2,22 эВ. Электро-
Электроотрицательность 0,8. Работа выхода электронов для различных граней
монокристалла калия: q>=2,4 эВ для грани A00), ф = 2,75 эВ для гра-
грани (ПО), ф = 2,35 эВ для грани A11).
Плотность. Плотность калия в зависимости от температуры:
Г, К
273,15
293
300
336,66 (тв)
336,66 (ж)
350
400
450
500
550
р, Мг/м»
0,8629
0,8621
0,8574
0,8500
0,8285
0,8253
0,8137
0,8020
0,7904
0,7787
Г, К
600
650
700
750
800
850
900
950
1000
р, Мг/м3
0,7669
0,7552
0,7433
0,7315
0,7196
0,7076
0,6957
0,6936
0,6716
Г, К
1050
1100
1150
1200
1250
1300
1350
1400
1450
р, Мг/м'
0,6595
0,6473
0,6351
0,6229
0,6167
0,5984
0,5860
0,5736
0,5612
Г, К
1500
1550
1600
1650
1700
1750
1800
р, Мг/м»
0,5488
0,5363
0,5237
0,5111
0,4985
0,4859
0,4732
При плавлении плотность калия снижается на 2,42 %.
Электрические и магнитные. Удельная электрическая проводимость
калия а при разных температурах:
Г, К 80 293 373 773
а, МСм/м ... 54 15 6,47 3,55
Удельное электрическое сопротивление р калия в зависимости от
температуры:
43
273
300
336
336
350
т,
,15
,66
,66
К
(ТВ)
(ж)
р, мкОм • м
0,0623
0,07267
0,08672
0,1257
0,1338
Г, К
400
450
500
550
600
650
р, мкОм-м
0,1637
0,1945
0,2264
0,2598
0,2950
0,3336
т, к
700
750
800
900
1000
р, мкОм ■ м
0,3720
0,4145
0,4601
0,5616
0,6791
При плавлении электрическое сопротивление калия возрастает в
1,45 раза. Температурный коэффициент электрического сопротивления
калия при 273 К а=5,81 • 10~3 К~1. С увеличением давления удельное
электрическое сопротивление твердого калия значительно уменьшается.
При 298 К и давлении 1177 МПа удельное электрическое сопротивление
калия составляет 27,5 % от того значения, которое наблюдается при
0,098 МПа. В термопаре калий — платина при температуре горячего
спая 173,16 К развивается т э д. с. £= + 0,780 мВ, а при температуре
горячего спая 373,16 £=—0,83 мВ. Абсолютный коэффициент т. э. д. с.
е=—15,6 мкВ/К. Максимальное значение коэффициента вторичной
электронной эмиссии атах = 0,75 и соответствует ускоряющему напря-
напряжению первичных электронов £р=0,2 кэВ. Постоянная Холла калня
при комнатной температуре равна Я=—4,2-100 м3/Кл. Магнитная
восприимчивость калия %=+0,53-10~9 при 293 К.
Тепловые и термодинамические. Температура плавления £Пл=63,5°С,
температура кипения йшп=759°С, характеристическая температура
вв=90К. Удельная теплота плавления Д#пл = 59,46 кДж/кг. Удельная
теплота сублимации, отнесенная к 298 К, Д#субл=2299 кДж/кг. Удель-
Удельная теплота испарения при температуре плавления Д//исп=2213кДж/кг,
при температуре кипения Д#„сп=2082 кДж/кг. При плавлении проис-
происходит увеличение объема на ДК=30-106 м3/кг, или ДК/У=0,0254 Уве-
Увеличение давления приводит к возрастанию температуры плавления ка-
калия, при 3 ГПа металл плавится при 516 К, а при 8 ГПа —при 553 К.
Начальное значение dTjdP близко к 160 К/ГПа, при увеличении давле-
давления dT/dP стремится к 0. Удельная теплоемкость калия в интервале
температур 298—Гпл ср=768 Дж/(кг-К). В интервале Гпл—бОО К ве-
величина ср=839 Дж/(кг-К).
Удельная теплоемкость в зависимости от температуры:
Г, К
273,15
298,15
300
336,66(тв)
336,66(ж)
ср, Дж/
/(кг-К)
739 '
765
766
820
824
Г, К
350
400
450
500
550
ср. Дж/
/(кг.К)
820
807
796
786
779
Г, к
600
650
700
760
800
ср. Дж/
/(кг-К)
772
767
764
763
763
Электронная теплоемкость с рЛ =[2,11 мДж/(моль-К2I-7'.
Теплопроводность К в зависимости от температуры:
44
г, к
3
5
6
Я, Вт/(м.К)
170,0
408,0
300,0
Г. К
8
35
40—100
\, Вт/(м-К)
260,0
100,0
95,0
г, к
293
673
973
\, Вт/(м-К)
97,15
39,0
35,0
Температурный коэффициент линейного расширения в интервале
273—333 К а=84-Ю-6 К.
Температурный коэффициент объемного расширения в интервале
347—373 К Р = 2,498-10-4 К.
Молярная энтропия s° калия в зависнмости от температуры:
Г, К 298 500 1000 1500 2000
s°, Дж/(моль-К) . 64,42 87,57 108,42 193,89 199,92
Приведенный термодинамический потенциап Фт в зависимости от
температуры:
Г, К 298 500 1000 1500 2000
Фг,Дж/(моль-К)-64,42 70,28 84,76 117,46 137,38
Давление пара р в зависимости от температуры:
300
366
400
T
,6
. К
(пл)
22
10
15
р,
,0-
,6-
.1-
Па
ю-7
Ю-6
10-з
Г, К
500
600
700
р,
2
79
8,88
Па
65
85
•10?
800
900
1000
52
21
62
Р, Па
,87-104
,Ы03
,09-103
Поверхностное натяжение жидкого калия при температуре плавле-
плавления C36,66 К) <т= 114,1 мН/м.
Изменение поверхностного натяжения в зависимости от температуры:
г, к
350
400
450
500
550
600
о, мН/м
113,2
110,2
107,2
104,2
101,2
98,2
г, К
650
700
750
800
850
900
о, мН/м
95,2
92,2
89,2
86,2
83,2
80,2
г, к
950
1000
1050
1100
1150
1200
о, мН/м
77,2
74,2
71,2
68,2
65,2
62,2
Поверхностная энергия кристаллического калия грани (ПО) v =
=91 мДж/м2.
Динамическая вязкость г\ в зависимости от температуры:
45
г, к
336,66
350
400
450
500
550
г],мПа-с
5,44
5,096
4,13
3,47
3,00
2,65
Т, К
600
650
700
750
800
850
Г), мПа.с
2,37
2,16
1,98
1,83
1,707
1,60
Г, К
900
950
1000
1050
1100
г], мПа.с
1,507
1,425
1,35
1,29
1,23
Кинематическая вязкость v в зависимости от температуры:
Г, К
336,66
350
400
450
500
Л.-108, м2/с
65,70
61,75
50,76
42,33
38,02
Г, К
550
600
650
700
750
800
Х-1№, м2/с
34,06
31,01
28,59
26,65
25,04
23,72
Г, к
850
900
950
1000
1050
1100
АЛО», м!/с
22,61
21,66
20,85
20,16
19,56
19,05
Оптические свойства. Отражательная способность калия (коэффици-
(коэффициент отражения nD); материал — пленка непрозрачная:
Я,,
0
0
0
мкм
,33
,42
,56
72
91
94
X, мкм
0,66
0,84
nD,%
95
98
X,
1
2
мкм
,19
,28
nD , %
99
99
Показатель преломления п в зависимости от длины волны %:
X, мкм
0,128
0,140
0,150
0,161
0,175
0,180
0,190
п
0,964
0,972
0,976
0,959
0,929
0,924
0,890
X, мкм
0,200
0,210
0,220
0,230
0,253
0,265
0,313
п
0,876
0,845
0,823
0,793
0,717
0,645
0,331
X, МКМ
0,366
0,406
0,436
0,492
0,546
0,620
п
0,053
0,046*
0,046
0,039
0,032
0,022
* Данные получены на пленке при 195 К.
Показатель поглощения % в зависимости от длины волны %*:
46
Я,, мкм
0,265
0,343
0
0
,0486
,0956
Я..
0,
0,
мкм
366
406
0
0
,551
,806
X.
0,
0,
мкм
436
492
0
1
,967
,232
К
0
0
мкм
546
620
1
1
X
,467
,769
• Данные получены на пленке при 195 К.
Механические свойства
Твердость калия по Бринеллю при комнатной температуре НВ 0,4 МПа.
Давление истечения калия по Н. С. Курнакову и А. И. Никитинскому
0,9 МПа прн диаметре матрицы 15,25 мм и выходном отверстии 2,86 мм
B95,15 К). Модуль нормальной упругости Е при растяжении при 83 К
равен 3,5 ГПа. Значения модуля Е, полученные на монокристалличе-
монокристаллических образцах, в большой степени зависят от их ориентировки. Так,
при 80 К значение Е вдоль направления < 111 > составляет 6,5 ГПа
и снижается до 1,30 ГПа вдоль направления <100>.
Калий обладает большой сжимаемостью при приложении внешнего
давления: x=32,4-J0-" Па-1.
Химические свойства
Калий — щелочной металл, является более активным элементом, чем
натрий. По химическим свойствам калий более близок к рубидию и це-
цезию, чем к натрню н литию. Во всех химических соединениях, в том
числе гидридах, проявляет степень окисления+1.
На воздухе калий очень быстро покрывается рыхлой пленкой окси-
оксидов, поэтому его хранят в керосине или парафиновом масле. При не-
незначительном нагреве на воздухе калий возгорается.
Калий — един из наиболее электроположительных элементов. Нор-
Нормальный электродный потенциал реакции К—еч*К+ Фо=—2,924 В.
В ряду напряжений калий стоит далеко впереди водорода и вытесняет
его из воды, образуя при этом сильное основание КОН.
При пропускании сухого водорода над слегка нагретым калием об-
образуется гидрид калия КН, теплота его образования Д#О6р=
=57,90 кДж/моль.
При сгорании калия в токе воздуха образуется супероксид калия
КО2 Теплота образования КО2 Д//Обр=284 кДж/моль.
Соединение устойчиво при атмосферном давлении и нагреве до
400 °С, а затем начинает распадаться с образованием оксида калия
КгО. Этот окенд имеет кристаллическую решетку типа CaF2 с периодом
0 = 0,644 нм, рентгеновская плотность 2,33 Мг/м3.
Гндроксид калия КОН представляет собой твердую, белую, хруп-
хрупкую массу плотностью 2,04 Мг/м3, плавящуюсч при 360,34 °С. Водный
раствор гидроксида калия носит название калиевого щелока. КОН хо-
хорошо растворяется в метиловом и этиловом спиртах, эти растворы на-
называют спиртовым калиевым щелоком. Теплота образования КОН
ДЯобР = 102,3 кДж/моль, плотность соединения 2,1 Мг/м3, температура
плавления 678 К D05 °С). КОН хорошо растворим в воде.
С хлором калнй образует хлорид КС1, который начинает заметно
улетучиваться при температурах более низких, чем температура его
плавления (/пл = 708оС). Кристаллическая решетка КС1 — типа NaCl с
периодом а=0,6277 нм.
Карбид калия КгС2 получается при взаимодействии калия с ацети-
ацетиленом при 50 °С, характеризуется исключительно высокой химической
активностью, самовоспламеняется даже в атмосфере БЮг и СОг', при
взаимодействии с водой взрывается.
Калий взаимодействует с азотом, возбужденным электрическим
тлеющим разрядом, прн этом в зависимости от условий образуется
нитрид калия KeN или азид KN3, т. е. соль азотистоводородной кисло-
кислоты HN3 Азид калия легко растворим в воде. Ннтрнд калия при ком-
комнатной температуре устойчив в сухом воздухе, но легко разлагается
водой или спиртом с образованием аммиака. Непосредственно с азо-
азотом калий не взаимодействует даже при высоком нагреве и давлении.
Калиевая соль азотной кислоты KNO3 известна под названием ка-
калийной селитры. Это бесцветная соль, кристаллизующаяся в двух раз-
различных формах (ромбоэдрической и ромбической). Калийная селитра
корошо растворима в воде: при 20 °С в 1 л воды растворяется 0,315 кг
селитры; при 100 °С растворимость возрастает до 2,46 кг.
Сульфид калия KjS получают насыщением раствора гидроксида се-
сероводородом Он бесцветен, кристаллизуется из раствора в-виде крис-
кристаллогидрата K2S-5H2O, имеет кристаллическую решетку типа CaF^ с
периодом а=0,739 нм.
Калий образует большое число химических соединений с электроот-
электроотрицательными элементами, прежде всего с элементами III—VIB под-
подгрупп, например галлием, таллием, оловом, висмутом, свинцом, теллу-
теллуром. В этих соединениях, как правило, превалирует ионный или инно-
ковалентиый тип связи. С натрием, одним из своих ближайших соседей
по группе, калнй образует фазу Лавееа KNa2 типа MgCu2 (C15). Ха-
Характерная черта этого соединения — металлическая природа связи меж-
между атомами ьалия и натрия. Непрерывных твердых растворов в систе-
системах с участием калия при обычных условиях не наблюдается.
Технологические свойства
Калий — очень мягкий и пластичный металл, легко поддающийся пла-
пластической деформации на холоду.
Области применения
Калий получил значительно более узкое промышленное применение по
сравнению с натрием, что вызвано его более высокой химической ак-
активностью и повышенной стоимостью. Калий используют для производ-
производства пероксида КгО, служащего для регенерации кислорода. Сплавы
натрия с 40—90 % К, сохраняющие жидкое состояние при комнатной
температуре, незаменимы в качестве теплоносителей для реакторов на
быстрых нейтронах, так как наряду с благоприятными ядерно-физиче-
ядерно-физическими свойствами обладают теплопроводностью, на несколько поряд-
порядков превосходящей теплопроводность обычных жидкостей.
Пары калия его сплавов с натрием могут быть использованы как
рабочие тела для транспортных энергетических установок, так как эти
материалы отличаются низкими температурами плавления и кипения, а
также высокими критическими параметрами этих металлов и большими
значениями теплот парообразования.
Низкий потенциал ионизации атомов калия, как и других щелочных
металлов, определяет его использование в газоразрядных приборах.
Широкое применение в народном хозяйстве получила калийная се-
селитра — одно из самых ценных минеральных удобрений. Ее также ис-
используют при производстве пороха, так как в отличие от натриевой
селитры она практически не гигроскопична. Большое промышленное
значение имеет гидроксид калия. В технике его получают в основном
электролизом раствора КС1. Большую часть гидрокенда калия транс-
транспортируют в виде концентрированных растворов (примерно 50 %-ных).
Выпариванием раствора получают твердый КОН. Калиевый щелок
48
применяют главным образом при производстве мыла как поглотитель
диоксида углерода. В мыловаренном и стекольном производствах, а
также при крашении, отбелке и отмывке шерстяных изделий широко
используют карбонат калия КгСОз.
1.4. РУБИДИЙ [1—35, 61, 64, 67]
Общие сведения и методы получения
Рубидий (Rb) — серебрнсто-белый металл. Относится к группе щелоч-
щелочных; его ближайшие аналоги — цезий, калий, натрий. Распространен-
Распространенность в земной коре 1,5- Ю-2 % (по массе). Элемент получил название
от латинского rubidus по пвету спектральных линий (красный, темно-
красный), обнаруженных в 1861 г. Бунзеном и Киргофом при исследо-
исследовании щелочных металлов.
Рубидий не образует собственных минералов и является типичным
рассеянным элементом. Как изоморфная примесь входит в минералы
калия и цезия (сильвинит, карналлит, микроклнн, биотит, пусковит
и др.). Концентрация рубидия в указанных минералах 0,02—0,09 %.
Во многих горных породах отношение К : Rb равно ~90. Соли рубидия
растворены в морской воде и в воде минеральных источников. Извлече-
Извлечение рубидия ит различных минералов и руд представляет значительные
трудности. Соли рубидия получают как побочные продукты при про-
производстве солей лития, магния и калия.
В промышленности металлический рубидий получают в основном
вакуумно-термическнм восстановлением, воздействуя, например, на
RbCl кальцием или магнием при 600—700 °С в вакууме. Можно также
получать металлический рубидий и электрохимическим способом, под-
подвергая электролизу его расплавленные галогенидные соединения. При
этом на жидком свинцовом катоде получают свинцоворубидиевый
сплав, из которого металлический рубидий выделяют диссоциацией в
вакууме. Небольшое количество рубидия высокой чистоты можно полу-
получить путем термического разложения азида при нагреве до 390—
395 °С в вакууме.
В нашей стране рубидий в ампулах производят в соответствии с
ТУ 48-05-25—70, содержание основного элемента не ниже 99,9 %, а со-
содержание примесей остальных щелочных металлов в сумме ие должно
быть более 0,1 °/о. Известны трн марки металлического рубидия повы-
повышенной чистоты
А
Б
В
Rb. %, не
менее
99,99
99,99
99,0
Na+K
0,08
Примеси
Cs
0,9
, %, не более
Na+K+Cs
0,009
0,08
Fe
0,00005
0,015
0,015
Физические свойства
Атомные характеристики. Атомный номер 37, атомная масса 85,47 а. е. м.,
атомный объем 55,48-10-* м3/моль. Атомный радиус (металлический)
0,253 нм, нонный радиус Rb+ 0,149 им, ковалентный 0,216 нм. Конфи-
Конфигурация внешних электронных оболочек атома 4pe5sK Элемент состоит
из стабильного изотопа 8SRb G2,15 %) и слабо радиоактивного изотопа
49
*'Rb B7,86 °/o). испускающего электроны с периодом полураепада
Б-1010 лет. Кроме того, искусственным путем получено свыше 20 мало-
малоустойчивых изотопов рубидия с атомной массой от 81 до 92. Изотопы
с атомной массой менее 85 испускают позитроны (Р+-лучи). Так, пе-
период полураспада изотопа 81Rb, 82Rb, 83Rb соответственно равен 4,7;
6,3 ч и 83 дням. Изотоп с атомной массой выше 85 испускают электро-
электроны (р--лучи), период полураспада этих изотопов составляет несколько
минут и даже секунд.
Рубидий кристаллизуется в о. ц. к. структуру, при комнатной темпе-
температуре период решетки а = 0,570 нм. Энергия кристаллической решетки
86 мкДж/к моль. Потенциалы ионизации атома рубидия / (эВ): 4,176;
27,56; 40 эВ. Радиус иона Rb+ 0,149 нм. Электроотрицательность 0,8.
Работа вылода электронов <р=2,16 эВ.
Плотность. При комнатной температуре плотность рубидия р равна
1,532 Мг/м3.
Изменение плотности рубидия р в зависимости от температуры'
300
31Й
312
350
г, к
,65 (тв)
,65 (ж)
р, мг/м3
1,5137
1,5087
1,4718
1,4547
т, к
400
450
500
550
р, мг/м3
1,417
1,4087
1,3857
1,3627
Т, к
600
650
700
750
Р.
1
1
1
1
мг/м»
,3397
,3167
,2937
,2707
При плавлении плотность рубидия снижается на 2,5 %.
Электрические и магнитные Удельная электрическая проводимость
о рубидия в зависимости от температуры:
Г, К 113 273 298
а,МСм/м ... 40 8,65 7,9
Удельное электрическое сопротивление рубндня р в зависимости от
температуры:
г, к
273,15
300
312,65 (тв)
312,65 (ж)
р, мкОм-м Т, К
0,1125
0,1281
0,1351
0,2153
350
400
450
р, мкОм* м
0,2476
0,2906
0,3345
т, к
500
550
600
р, мкОм.ы
0,3796
0,4261
0,4762
Температурный коэффициент электрического сопротивления рубидия
В интервале температур 273—293 К а=4,7-10~3 Кг1. Прн плавлении
электросопротивления рубидия возрастает в 1,6 раза.
В термопаре рубнднй — платина рубидий проявляет отрицательную
валентность по отношению к платине при температуре горячего спая
173,16 К. В этом случае £=+0,460 мВ. Абсолютный коэффициент
т. э.'д с. е=— 8,26 мкВ/К.
Максимальное значение коэффициента вторичной электронной эмис-
эмиссии рубидия о-тах=0,9 при ускоряющем напряжении первичных элект-
электронов 0,35 кэВ,
60
Постоянная Холла при комнатной температуре R = — 5,9-10~10 м3/Кл.
Рубидий — парамагнитный металл, его магнитная восприимчивость
Х=+0,198-Ю-9 в интервале 303—373 К.
Тепловые и термодинамические. Температура плавления ^Пл = 39,490С,
температура кипения tmu=686,04 °С, характеристическая температура
0D=55K. Удельная теплота плавления ДЯПП=27,42 кДж/кг, удельная
теплота сублимации, отнесенная к 298 К, ЛЯсубл = 930 кДж/кг. При
плавлении происходит увеличение объема иа AV=22,58- 10~e м3/кг, или
Д1/= Vo=0,0274. При повышении давления возрастает температура плав-
плавления рубидия, достигая 284 "С при 8 ГПа; dT/dP изменяется в функции
давления. При приложении давления 3,5 ГПа dT/dP равно 210 К/ГГТа,
а затем резко снижается и при 8 ГПа составляет всего 1 К/ГПа.
Удельная теплоемкость ср рубидия для интервала температур
298 — 7"пл в среднем ср = 367,3 Дж/(кг-К). Зависимость удельной теп-
теплоемкости рубидия от температуры:
Г, К
273,15
298,15
300
Ср. ДЖ/
/(кг.К)
345,3
363,9
365,4
Т. к
312,65 (тв)
312,65 (ж)
350
Ср. Д«/
/(кг-К)
379,1
379,1
377,6
г. к
400
450
500
550
с . Дж/
/(кг-К)
374,6
371,8
368,8
365,4
Электронная теплоемкость рубидия сэр" = [2,52 МДж/(моль-К2)] -7".
Теплопроводность рубидия % в зависимости от температуры:
Г, К 7,5 20 293 323 493
А.,Вт/(м-К)- . 400 150 35,6 31,41 34,35
Температурный коэффициент линейного расширения а у рубидия в
интервале температур 273—303 равен 90-10—6 Кг'.
Молярная энтропия s° рубидия в зависимости от температуры изме-
изменяется следующим образом:
Г, К 298 500 1000 1500 2000
8°,Дж/(моль-К) • 76,3 100,0 195,2 203,7 209,7
Приведенный термодинамический потенциал Фт рубидия в зависи-
зависимости от температуры:
Г, К 298 500 1000 1500 2000
Фг, Дж/(моль.К)- 76,3 82,7 98,6 132,4 150,9
Изменение давления пара р упругости рубидия в зависимости от
температуры-
Т, К . . 400 600 800 1000 1300
р,Па. . 16,38-10-? 3,55-10? 15,3-Ю3 14,2-10* 11,05-105
Давление пара рубидия при температуре плавления C12,65 К) рав-
равно 15,7-Ю-6 Па
Поверхностное натяжение а жидкого рубидия в зависимости от тем-
температуры;
51
г. к
313
350
400
450
0, мН/м
92,63
90,4
87,5
84,5
Г, К
500.
550
600
650
<т, мН/м
81,6
78,6
75,7
72,7
г. К
700
750
800
850
900
<т, мН/м
69,8
66,8
63,9
60,9
58,0
Поверхностная энергия кристаллического рубидия для грани A10)
v=75 мДж/м2.
Динамическая вязкость г\ рубидия в зависимости от температуры:
Г, К
312,65
350
400
450
г\, мПа.с
6,43
5,35
4,37
3,70
т, к
500
550
600
650
Г), мПа-с
3,23
2,87
2,58
2,36
г, к
700
750
800
850
900
Г), мПа-с
2,18
2,02
1,89
1,78
1,69
Кинематическая вязкость v рубидия в зависимости от температуры:
312
350
400
450
г, к
,65
V- 10е,
43
36
30
26
,68
,75
,51
,29
г, к
500
550
600
650
v-108, мг/с
23,28
21,02
19,27
17,93
т. к
700
750
800
850
900
V-103, м"/с
16,83
15,93
15,18
14,56
1,69
Сжимаемость рубидия >с= 40,5 • 10~т1 Па~'.
Оптические. Отражательная способность (коэффициент отражения
«в) рубидия в зависимости от длины волны У.
К, мкм
0,313
0,366
0,435
0,600
0,
0,
0,
0,
, %
067
240
724
879
К, мкм
0,70
0,80
0,90
1,00
0,928
0,942
0,955
0,962
1
2
2
WKM
,50
,00
,40
nD
0
0
0
. %
979
983
983
Показатель преломления п в зависимости от длины волны
52
X, мкм
0,1165
0,1280
0,1462
0,16 6
0,1875
0,2214
п
1,041
1,02
0,997
0,980
0,962
0,928
X, мкм
0,2750
0,3434
0,3800
0,435
0,60
0,70
п
0,790
0,465
0,216
0,114
0,096
0,081
X, мкм
0,80
0,90
1,00
1,5
2,0
2,4
п
0,087
0,086
0,091
0,111
0,157
0,224
Показатель поглощения % в зависимости от длины волны Я:
X, мкм
0,1165
0,1280
0,1462
0,1636
0,1875
0,2214
■ 1
0,027
0,035
0,050
0,065
0,081
0,073
X, мкм
0,2750
0,3434
0,3800
0,435
0,60
0,70
X
0,075
0,136
0,346
0,646
1,404
1,818
X, мкм
0,80
0,90
1,00
1,5
2,0
2,4
X
2,195
2,548
2,886
4,503
6,034
7,232
Химические свойства
Нормальный электродный потенциал реакции Rb—ет±ИЬ+ при 298 К
B5°С), фо=—2,925 В. Рубидий, как и остальные щелочные металлы,
во всех соединениях проявляет степень окисления +1 и является одним
из наиболее электроположительных элементов.
Рубидий Отличается более высокой реакционной способностью, чем
литий, натрий и калий: иа воздухе металл мгновенно окисляется с вос-
воспламенением.
В ряду напряжений рубидий стоят далеко впереди водорода и вы-
вытесняет его из воды, образуя при этом сильное основание RbOK.
При пропускании сухого водорода над слегка нагретым рубидием
образуется гидрид рубидия RbH с кристаллической решеткой типа NaCl,
имеющий период а=0,6037 нм; рентгеновская плотность р=2,59 Мг/м3;
теплота образования этого соединения ЛЯобр=54,98 кДж/моль.
При сгорании рубидия в токе воздуха образуется соединение RbOj —
супероксид рубидия; теплота образования ДЯОбр=28,47 кДж/моль, Кри-
Кристаллическая .решетка типа СаС2.
Оксид рубидия Rb2O может быть получен прн термическом распаде
супероксида по схеме RbO2-»-Rb2O2-»-Rb2O, который начинается при на-
нагреве RbO2 до температур, превышающих 397 "С. Rb2O имеет кристалли-
кристаллическую решетку типа CaF2, период а=0,674 нм, рентгеновская плотность
4,05 Мг/м3.
Гидроксид рубидия RbOH можно получить при взаимодействии
Rb2O с Н2 при слабом нагревании, он хорошо растворим в воде и
спирте. Плавится при 574 К C01 °С), кристаллизуется в решетку типа
NaCI с периодом а=0,697 нм. Теплота образования RbOH Д#ОбР =
— 105,85 кДж/моль, плотность 3,2 Мг/м3.
53
Хлорид рубидия RbCl получают взаимодействием карбонатов с со-
соляной кислотой, хорошо растворим в воде.
Карбид рубидия Rb2C2 может быть получен при взаимодействии
рубидия с ацетиленом по реакции 2Rb+2H2C2-*-2RbHC2-fH2. Кислый
ацетилид рубидия при слабом нагреве распадается на карбид и ацети-
ацетилен. Карбид рубидия обладает высокой химической активностью, са-
самовоспламеняется в среде СО2 и SO2. При взаимодействии карбида
рубидия с водой происходит взрыв, причем металл сгорает, а углерод
выделяется в виде угля.
Нитрид рубидия RbaN может быть получен при взаимодействии
паров рубидия с азотом. Это соединение крайне неустойчиво и от ма-
малейшего сотрясения может взорваться. Азид рубидия RbN3 можно по-
получить по схеме: Rb2CO3+2HN3-*-2RbN3+CO2+H2O. Азид рубидия
хорошо растворяется в воде.
Известен сульфид рубидия Rb2S, теплота образования которого со-
составляет Л#обр=600,38 кДж/моль. Rb2S имеет кристаллическую решетку
типа CaF2 с периодом а=0,765 нм.
С переходными и тугоплавкими металлами рубидий не взаимодейст-
взаимодействует и металлических соединений не образует. Со своими аналогами, в
частности калием, рубидий образует непрерывные твердые растворы, а с
натрием и цезием — эвтектические смеси. Металлические соединения
рубидия обнаружены в системах Cd—Rb, Hg—Rb, Au—Ru и др. (на-
(например, RbCdI3, Rb3Hg4l RbHg2, RbHg9). Соединение Au2Rb (аурид ру-
рубидия), можно синтезировать в токе аргона при 200—225 °С.
Области применения
Металлический рубидий применяют в гидридных топливных элементах.
Он входит в состав металлических теплоносителей для ядерных реакто-
реакторов, используется для изготовления высокоэффективных фотоэлектрон-
фотоэлектронных умножителей, в вакуумных радиолампах — в качестве геттера и для
создания положительных ионов на нитях иакала. Рубидий входит в сос-
состав смазочных материалов, применяемых в реактивной и космической
технике. Смесь хлоридов рубидия н меди используют при изготовлении
термометров для измерения высоких температур C80—390 °С). Лампы
низкого давления с парами рубидия служат источниками резонансного
излучения; пары рубидия также используют в лазерах в чувствительных
магнитометрах, необходимых при космических и геофизических иссле-
исследованиях.
1.5. ЦЕЗИЙ [1—35, 61, 64, 68]
Общие сведения и методы получения
Цезий (Cs) — золотисто-желтый металл, наиболее тяжелый и наиболее
электроположительный из всех щелочных металлов, не считая франция.
Относится к группе редких элементов. Открыт в 1860 г. Р. Бунзеном и
Г. Кирхгофером при изучении спектра осадка, оставшегося после упа-
упаривания минеральных вод Дюркгеимского источника. Были обнаружены
спектральные линии, особенно яркие в синей области. По цвету этих ли-
линий (от латинского caesius — голубой) элемент получил свое название.
Содержание цезия в земной коре 3,7-10"' %. Из-за большой хими-
химической активности в свободном виде в природе не встречается, присутст-
присутствует в качестве незначительных примесей в горных породах. В сотых и
тысячных долях процента цезий обнаружен в базальтах, гранитах, дна*
базах, нифелинах, полевых шпатах, известняках, глинистых сланцах,
54
Известны два минерала, в которых превалирует цезий. Это поллуцит
и авогадрит. Первый имеет промышленное значение. В среднем в пол-
луците содержится от 29 до 37 % Cs2O; по своей природе этот минерал
относится к алюмосиликату цезия.
Авогадрит, получивший свое название по имени итальянского физика
Авогадро — очень редкий минерал. Представляет собой борофторид ка-
калия (К, Cs) [BF4], в котором калий частично изоморфно замещен цези-
цезием. Состав минерала непостоянен. Содержание CsBF4 в отдельных слу-
случаях может достигать 20 %, но обычно составляет 9—10 %.
Получение металлического цезия связано с рядом трудностей, обус-
обусловленных прежде всего высокой химической активностью элемента.
Поэтому, в частности, металлургические процессы приходится проводить
либо в вакууме, либо в среде аргона, так как из-за присутствия влаги
или газообразных примесей (кислород, азот или диоксид углерода) сни-
снижается выход металла, создается опасность самовозгорания, а также
ухудшается качество металла. Большие трудности возникают и при вы-
выборе коррозионностойких материалов для аппаратурного оформления
процесса получения чистого цезия. Применяют следующие методы про-
производства цезия: электрохимический, вакуумтермическое восстановление,
вакуумтермическое разложение солей.
Электрохимический метод в настоящее время используют мало из-
за высоких значений потенциалов разложения галогеиидов (потенциал
разложения CsCl при 700 "С составляет 3,68 В). Кроме того, опреде-
определенные ограничения в развитие этого метода вносит низкая темпера-
температура кипения цезия и его высокая растворимость в солевом расплаве.
Так, при 650 °С в расплаве CsCl растворяется до 7,2 % Cs. Это сильно
снижает выход по току, а следовательно, способствует удорожанию
всего процесса в целом.
Основной метод получения металлического цезия — вакуумтермиче-
вакуумтермическое восстановление. Следует отметить прямой способ получения цезня
путем нагрева в вакууме при 900 °С смеси измельченного природного
поллуцита с кальцием или алюминием прн соотношении компонентов
1 :3. При этом методе из сырья удается извлечь до 85 % Cs.
Метод вакуумтермического разложения солей имеет ограниченное
применение и его используют только для получения особо чистого ме-
металла в небольших количествах.
В нашей стране цезий производят трех марок А, Б, В:
Марка
А
Б
В
Cs, %, не
менее
99,99
99,9
99,0
Na+K,
%, не более
0,08
Rb, »/„, не
более
од>
Na+K+Rb,
%, не более
0,009
0,08
Fe, %, не
более
0,00005
0,0M
0,015
Цезий в ампулах производится согласно ТУ 48-05-26—70 с массой
от 1 до 3-10~е кг или от 3 до 200-10~6 кг, допустимое отклонение в
массе металла не более ± 10 % от номинала.
Физические свойства
Атомные характеристики. Атомный номер 55, атомная масса 132,905
а. е. м., атомный объем 67,84-10~8 м3/моль. Атомный радиус (ме-
(металлический) 0,274 нм, ионный радиус Cs+ 0,165 нм, ковалентный
55
0,235 нм. Конфигурация внешних электронных оболочек атома цезия
5p66s'. Цезий состоит целиком из стабильного изотопа 133Cs. Получено
более 20 радиоактивных изотопов с массовыми числами от 123 до 144,
из этих изотопов наиболее устойчив 13SCs, имеющий период полураспада
3,0-10е года.
Цезий при комнатной температуре обладает о. ц. к. структурой с пе-
периодом а=0,6141 нм; энергия кристаллической решетки 79 мкДж/кмоль.
Потенциалы ионизации атома цезия J (эВ): 3,893; 25,1; 34,6. Электро-
Электроотрицательность 0,7. Работа выхода электронов ф== 1,81 эВ. Работа вы-
выхода электронов для различных граней монокристалла цезия: ф= 1,9 эВ
для грани A00), ф = 2,25 эВ для грани A10), ф=1,80 эВ для грани
Плотность. Плотность цезия в зависимости от температуры:
Г, К
4
293
300
301,55
301,55
350
400
450
р, Мг/м3
2,13
1,9039
1,888
1,887 (тв)
1,836 (ж)
1,809
1,780
1,752
г, к
500
550
600
650
700
750
800
р, Мг/щз
1,723
1,694
1,666
1,637
1,609
1,580
1,552
1»
850
900
950
1000
1050
1100
1150
р, Мг/ма
1,523
1,495
1,466
1,438
1,409
1,377
1,344
Г, к
1200
1250
1300
1350
1400
1450
1500
р, Мг/м»
1,311
1,277
1,243
1,209
1,174
1,138
1,102
При плавлении плотность цезия снижается иа 2,6 %.
Электрические и магнитные. Удельная электрическая проводимость
цезия а в зависимости от температуры:
Г, К 80 273 293
а, МСм/м .... 21,8 5,52 4,81
Удельное электрическое сопротивление р цезия в зависимости от
температуры:
Г, К
80
273,15
300
301,66 (тв)
301,55 ж)
350
р, мкОм.м
0,046
0,1830
0,2125
0,2142
0,3568
0,4169
Г, К
400
450
500
550
600
650
р, мкОм • м
476,6
534,8
592,6
650,9
710,7
793,2
г, к
700
750
800
850
900
р, мкОм-м
838,7
908,9
984,6
1067
1056
При плавлении электросопротивление цезия возрастает в 1,66 раза.
Температурный коэффициент электрического сопротивления цезия в
интервале температур 273—291 К равен а—6,0-10—3 К.
В термопаре цезий — платина при температуре горячего спая 373,16
К развивается т. э. д. с. £=1,5 мВ. Абсолютный коэффициент т. э. д. с.
е=+0,2 мкВ/К. Максимальное значение коэффициента вторичной элек-
электронной эмиссии цезия отах равно 0,72 при ускоряющем напряжении
первичных электронов 0,4 кэВ.
Постоянная Холла цезия при 268 К равна R = — 7,8- Ю0 м3/Кл.
Магнитная восприимчивость цезия % равна 4-0,22-10—9 для твердого
состояния н +0,2-10-9 для жидкого.
Тепловые и термодинамические. Температура плавления ^Пл = 28,39°С,
температура кипения <„Ип = б70°С, характеристическая температура
8D=39,2 К, удельная теплота плавления Л//пл= 16,05 кДж/кг. Удель-
Удельная теплота сублимации, отнесенная к 298 К, ДЯсубл = 589,2 кДж/кг.
Удельная теплота испарения цезия при нормальном давлении ЛЯИсп =
= 494 кДж/кг. При плавлении происходит увеличение объема на АК=
= 12,71 ■ Ю-6 м3/кг, или Д^/^«=0,026.
Удельная теплоемкость цезия интервале 273 — 7"Пл -00 = 236
Дж/(кг-К).
Зависимость теплопроводности а цезия от температуры:
г, К
К Вт/(мК)
Г. К
К Вт/(м-К)
г, к
Я. Bt/(m-K)
298
373
473
19,0
19,3
20,2
573
673
773
20,8
21,05
20,7
873
973
20,5
18,95
Температурный коэффициент линейного расширения цезия при 273 К
Малярная энтропия цезия s° в зависимости от температуры:
Т, К 298 500 1000 1500 2000 2500
s°, Дж/(моль-К) • . 84,4 120,5 200,8 209,2 215,2 220,1
Приведенный термодинамический потенциал цезия Фг в зависимости
от температуры:
Г, К 298 500 1000 1500 2000 2500
Фг, Дж/(моль-К) ■ 84,4 90,8 108 140,4 158,4 170,3
Давление пара цезия р в зависимости от температуры:
Г, К. 400 600 800 1000 1200 1400
р,Па- 36,98-Ю-2 5,46-10? 1,99-10* 16,38-Ю4 67,3-10* 18,3-10*
Давление пара цезия при температуре плавления 301,55 К равно
2,5-10-еПа.
Поверхностное натяжение а жидкого цезия при температуре плавле-
плавления C01,55 К) равно 60,0 мН/м, а в зависимости от температуры изме-
изменяется следующим образом:
Г, К
350
400
450
500
О, мН/м
69,2
66,7
64,3
61,9
Г, К
550
600
650
700
с, мН/м
59,5
57,1
54,7
52,3
Г, К
750
800
850
900
о, мН/м
49,9
47,5
45,1
42,7
Поверхностная энергия кристаллического цезия для грани {110}
г=68мДж/м2,
67
Динамическая вязкость г\ цезия в зависимости от температуры:
г, к
301,55
350
400
450
г\, мПа-с
6,76
5,27
4,30
3,65
г, к
500
550
600
650
I), мПа.с
3,18
2,83
2,56
2,34
Г, К
700
750
800
850
П, мПа-о
2,16
2,02
1,89
1,78
301
350
400
450
Кииемати'
Г, К
,55
(еская
v • 10»,
36
29
24
20
вязкость
мг/с
,8
,13
,16
,83
v цезня
Г, К
500
550
600
650
в зависимости
vlO8, м!/«
18,46
16,70
15,35
14,29
от температуры:
Г, К
700
750
800
850
v.io»
13
12,
12
11
44
75
17
70
Оптические. Отражательная способность цезия (коэффициент отра-
отражения nD) в зависимости от длины волны К:
%, мкм
0,302
0,365
0..100
0,513
V
1
9
21
53
%
,8
,0
,1
,5
0
0
1
1
мкм
,610
,885
,345
,52
V %
64,3
78,5
89,4
92,0
X., мкм
1,77
2,04
2,17
2,42
94,5
96,1
96,5
97,1
Показатель
X, мкм
0,297
0,313
0,365
0,435
0,546
преломления
п
0,833
0,755
0,584
0,489
0,308
п
К
0,
о,
о,
0,
в зависимости от длины
мкм
550
650
750
90
0
0
0
0
п
,331
,281
,271
,269
X,
1
1
2
2
волны
мкм
,10
,50
,00
,50
X:
0
0
0
0
п
,288
,197
,095
,132
Показатель поглощения % в зависимости от длины волны X:
/., мкм
0,297
0,313
0,365
0,435
0,546
X
0,176
0,210
0,267
0,400
0,875
0
0
0
0
мкм
,550
,650
,750
,90
X
0,861
1,16
1,55
2,00
К, мкм
1,10
1,50
2,00
2,50
X
2,41
3,28
4,50
5,43
58
Механические свойства
Цезий обладает крайне низкими механическими характеристиками. Мо-
Модуль нормальной упругости Е при комнатной температуре равен 1,7 ГПа.
Химические свойства
Нормальный электродный потенциал реакции Cs—e*±Cs+cp0=—2,923 В.
В соединениях проявляет степень окисления +1.
Цезий — один из наиболее электроположительных металлов. Химиче-
Химически очень активен, что обусловлено малым сродством к электрону, лег-
легкостью отдачи валентного электрона. В ряду напряжений цезий распо-
расположен далеко впереди водорода и вытесняет его из воды, образуя при
этом сильное основание CsOH. Цезий самовоспламеняется на воздухе.
При иагреве цезня в струе водорода образуется гидрид цезия CsH,
имеющий кристаллическую решетку типа NaCl с периодом а=0,6376 нм,
рентгеновская плотность 3,41 Мг/м3. Гидрид цезия — солеобразующее
соединение, содержащее анион Н~. Теплота образования CsH при 298 К
К25ОС) Д//Обр= 56,24 кДж/моль. Гидрид цезия — чрезвычайно химически
активное вещество, воспламеняется на воздухе, содержащем следы вла-
влаги, а также в среде хлора и фтора, при нагревании диссоциирует с об-
образованием водорода и цезия. Давление паров диссоциации достигает
атмосферного при 304 "С.
При сгорании цезия в токе воздуха образуется соединение CsO2—
супероксид цезия. Теплота его образования Л#обр=243,1 кДж/моль,
кристаллическая решетка типа СаСг. Оксид цезия CsO получается при
термическом распаде супероксида по схеме Cs02->-Cs2O2->-Cs20 выше
400—4Ю°С. СвОг имеет кубическую кристаллическую решетку типа
CaF2 с плотностью 4,15 Мг/м3. Гидроксид цезия CsOH можно получить
при взаимодействии Cs2O с водородом при слабом нагреве.
Соединение CsCI устойчиво, плавится без разложения при 645 °С.
Кристаллическая решетка — кубическая типа Csl с периодом а=
=0,411 им.
Соединения цезия с углеродом можно разделить иа две группы: аце-
тилид цезия CS2C2 — продукт замещения атомов водорода цезием в
ацетилене и соединение цезия, имеющее формулу CnCs.
Нитрид цезия CS3N представляет собой малоустойчивый, серовато-
зеленый или синий порошок; очень гигроскопичен, воспламеняется на
воздухе, при нагревании взрывается с выделением азота.
Азид цезия CsN3 — желтовато-белые и бесцветные кристаллы с тем-
температурой плавления в глубоком вакууме 326 °С E99 К). Нагрев CsN3
в глубоком вакууме выше температуры плавления — до 387 °С — приво-
приводит к его разложению на металл и азот.
Сульфид цезия обычно представляет собой кристаллогидрат Cs2S-
•4Н2О. Безводный моиосульфид цезия — темно-красный порошок с кри-
кристаллической решеткой типа CaF2.
Моносилицид кремния CsSi — компактная масса желтого цвета с
плотностью при комнатной температуре 3,48 Мг/м3. CsSi самопроизволь-
самопроизвольно воспламеняется на воздухе, а при взаимодействии с водой взрыва-
взрывается.
При взаимодействии с металлами, в том числе и щелочными, цезии
образует сплавы н металлические соединения. С рубидием и калием це-
цезий дает непрерывные твердые растворы, с натрием — эвтектические
смеси, а при взаимодействии с литнем наблюдается несмешиваемость в
жидком и твердом состояниях.
Известно соединение цезия с кадмием CsCdi3, имеющее кубическую
структуру и обладающее сверхпроводящими характеристиками. Соеди-
69
нения СэзВ! и Cs3Sb характеризуются высокой фотоэлектрической чув-
чувствительностью; на диаграммах состав — свойство эти соединения име-
имеют сингулярные точки. Известно соединение AuCs, характеризующееся
полупроводниковыми свойствами.
С остальными металлами, особенно тугоплавкими, цезий не взаимо-
взаимодействует ни в твердом, ни в жидком состоянии.
Области применения
Цезиевые фотоэлементы пригодны к эксплуатации в широком интерва-
интервале спектра и отличаются большой чувствительностью. По сравнению с
селеновыми они обладают рядом преимуществ и прежде всего отсутст-
отсутствием инерции. Цезиевые фотоэлементы и фотоумножители применяются
в телевидении, радиолокации, звуковом киио, в приборах для автома-
автоматического контроля различных процессов, радиотехнике. Светочувстви-
Светочувствительность цезия предопределила еще одну область его применения—ч
в люминесцентных трубках и экранах различного типа и назначения.
Ряд соединений цезия используется в инфракрасной спектроскопии, в
оптических приспособлениях для приборов иочиого видения и др. Цезий
имеет исключительно важное значение для развития совремеиной элект-
электроники, оптики, радиохимии и других областей техники. Общий расход
этого металла, однако, невелик и измеряется обычно несколькими сот-
сотнями килограммов в год, так как расход цезия иа изготовление одного
фотоэлемента 0,1—0,01 г.
1.6. ФРАНЦИЙ [1—35, 91]
Общие сведения и методы получения
Франций (Fr) —самый тяжелый из щелочных металлов. Существование
его в природе было предсказано еще в 1869—1870 гг. Д. И. Менделее-
Менделеевым, который оставил вакантное место для этого элемента в IA под-
подгруппе в 7-м периоде системы. Экспериментально это было подтверж-
подтверждено спустя 70 лет.
В 1939 г. М. Перей при изучении продуктов распада 23SU обнаружи-
обнаружила короткоживущнй E-активный изотоп с периодом полураспада
21,8 мин. Было показано, что указанный изотоп является искомым ще-
щелочным металлом. В 1946 г. он получил название франций в честь ро-
родины его первооткрывательницы.
Физические свойства
Атомные характеристики. Атомный номер франция 87, атомная мас-
масса 223 а е. м., атомный объем 95,49-10~6 м3/моль. Атомный радиус (ме-
(металлический) 0,280 им, ионный радиус Fr+ 0,186 нм.
Конфигурация внешних электронных оболочек атома 6p67s1. Стабиль-
Стабильного изотопа франций не имеет. В настоящее время известно более 20
радиоактивных изотопов франция с атомной массой от 203 до 229 и
периодами полураспада от тысячных долей секунды до 21,8 мин. Наи-
Наибольшим периодом полураспада обладает изотоп 223Fr. Франций, как и
его ближайший аналог цезий, кристаллизуется в о. ц. к. структуру. По-
Потенциалы ионизации атома франция J (эВ): 3,98; 22,5; 33,5. Электроот-
рнцательность 0,7. Работа выхода электронов ф=1,8 эВ.
Плотность. При комнатной температуре плотность франция
2,44 Мг/м3.
Электрические. Удельное электрическое сопротивление р франция при
291 К равно 0,450 мкОм-м.
60
Тепловые и термодинамические. Температура плавления /Пл=26,84сС,
температура кипения гкип = 677°С, удельная теплота плавления ДЯВЛ =
= 9,385 кДж/кг, удельная теплота сублимации, отнесенная к 298 К,
д# вл = 309,7 кДж/кг. Удельная теплоемкость франция при 298 К сР =
= 136,53 Дж/(кг-К).
Молярная энтропия s° франция в зависимости от температуры:
Г, К 298 500 1000 1500 2000 2500
«°,Дж/(моль-К). . . 94,2 117,6 207,2 215,6 221,7 226,8
Приведенный термодинамический потенциал Фг в зависимости от
температуры:
Т, К 298 500 1000 1500 2000 2500
Фг, Дж/(моль-К) . . 94,2 100,6 119,6 150,4 167,5 178,9
Давление пара р франция в зависимости от температуры:
Г, К ••• 218 248 289 346 434
р, Па ... 12,95-Ю-8 12,95-10—• 12,95-10-* 12,95-10-? 12,95
Давление паров франция при температуре его плавления 300 К рав-
равно 2,933 кПа.
Химические свойства
Франций не имеет долгоживущих изотопов, поэтому он не может быть
синтезирован в достаточном количестве и химические свойства его изу-
изучены только на индикаторных образцах. По химическим свойствам
франций весьма близок к рубидию и цезию. Гидроксид, фторид, хло-
хлорид, нитрид, сульфат и сульфид франция хорошо растворяются в воде.
Сам металл растворим в соляной, серной, азотной, уксусной, плавиковой
и щавелевой кислотах.
Области применения
Учитывая исключительно малую распространенность франция в приро-
природе, трудно указать конкретные области его применения. Имеются све-
сведения, что франций используется в радиохимических определениях ак-
актиния, а также в медицине при диагностике некоторых заболеваний.
1.7. МЕДЬ [1-35, 69, 70—741
Общие сведения и методы получения
Медь (Си) — металл, имеющий в компактном виде в зависимости от
способа изготовления и примесей красно-коричневый и светло-розовый
цвет, в диспергированном состоянии (порошок) — кирпично-красный
цвет.
Один из первых металлов, которые человек стал применять для тех-
технических целей. Найденные в Египте древнейшие изделия из самород-
самородной медн относятся к пятому тысячелетию до н. э. Латинское название
меди cuprum связано с островом Кипр, где уже в III в. до нашей эры
были медные рудники и выплавлялась медь.
Содержание меди в земной коре 0,01 % (по массе). Чаще, чем дру-
1ие металлы, встречается самородная медь, однако такие руды срав-
61
to
ХИМИЧЕСКИЙ СОСТАВ МЕДИ, % (ГОСТ 859-78)
Способ из-
изготовления
Меди
Марка
меди
Cu+Ag
не ме-
менее
Bi
Sb
As
Fe
Ni
Pb
Sn
S
O.
Zn
Катоды
Катодная
МВЧк
МООк
МОк
МОку
М1к
99,993
99,99
99,95
99,97
99,90
0,0002
0,0005
0,001
0,0005
0,001
0,0005
0,001
0,002
0,001
0,002
0,0005
0,001
0,002
0,001
0,002
0,0005
0,001
0,004
0,001
0,005
0,0005
0,001
0,002
0,031
0,002
0,0006
0,001
0,003
0,002
0,005
0,0005
0,001
0,002
0,001
0,002
0,0005
0,002
0,004
0,002
0,004
0,002
0,015
0,05
0,0007
0,001
0,003
0,001
0,004
Слитки и полуфабрикаты
Бескислород-
Бескислородная
Катодная
переплавлен-
переплавленная
Раскислен-
Раскисленная
Огневого
рафинирова-
рафинирования
М006
М06
М1б
М1у
Ml
Mlp
М1ф
М2р
МЗр
М2
МЗ
99,99
99,97
99,95
99,90
99,90
99,90
99,9
99,7
99,5
99,7
99,5
0,0005
0,001
0,001
0,0005
0,001
0,001
0,001
0,002
0,003
0,002
0,003
0,001
0,002
0,002
0,002
0,002
0,002
0,002
0,005
0,05
0,005
0,05
0,001
0,002
0,002
0,001
0,002
0,002
0,002
0,101
0,05
0,01
0,01
0,001
0,004
0,004
0,005
0,005
0,005
0,005
0,05
0,05
0,05
0,05
0,001
0,002
0,002
0,002
0,002
0,002
0,002
0,2
0,2
0,2
0,2
0,001
0,003
0,004
0,004
0,005
0,005
0,005
0,1
0,03
0,01
0,05
0,001
0,002
0,002
0,001
0,002
0,002
0,002
0,05
0,05
0,05
0,05
0,002
0,003
0,004
0,004
0,004
0,005
0,005
0,01
0,01
0,01
0,01
0,001
0,001
0,003
—
—
0,01
—
0,01
0,01
0,07
0,08
0,001
0,003
0,003
0,004
0,004
0,005
0,005
—
—
—
0,0005
0,001
0,002
0,001
0,005
0,002
0,002
>0,002—0,012
>0,03—0,16
>0,005—0,06
>0,005—0,06
Примечания' 1. Содержание отдельных примесей, не указанных в таблице, в меди марок МВЧк, МООк и М006, а также со-
содержание газов в меди марки М006 устанавливается по соглашению изготовителя и потребителя.
2. Массовая доля серебра в меди марок МОк, М1к, М06, М1у и Ml ие должна превышать 0,003%, а в меди марки МОку — 0,О0<! /о.
По требованию потребителя медь марок М06, М1у и Ml изготозляют с массовой долей серебра ие более 0,0025 %.
Pi6££cf l> ° ^ иительио редки и в настоящее время из них
g'oe'gg S. * 2 в добывают не более 5% Си. Самородная
•>■§•§ g < » "я медь, обычно очень чистая, содержит лишь
&4?gSS 8 * небольшие прнмеси серебра н железа, следы
eeS eg^ в go свинца, еще реже следы ртути и золота.
g'gSg.S51 м ящ Кроме того, очень часто в самородной ме-
B4ga§g *оЯ ди присутствуют включения оксида (I)
"%х 15 х g Si, меди.
§.* I в в 8. ° я" Медь входит в состав более чем 200 ми-
Bjs gg U „j^ о.к иералов, однако лишь немногие из них
1^1 -*£ л »S s § (приблизительно 40) имеют промышленное
osk"s<j 2 «°- gK значение. Важнейшие минералы, входящие
gSog^S g° « g в состав медных руд,— халькозин, илн мед-
8.8 "л §.~j «S я S ный блеск; халькопирит, или медный колче-
в S uj | s 2^ ц я дан; малахит.
1що?5*о «в I:» Медные руды — комплексное сырье, по-
i!"»« I Зи «з мимо меди, содержащее цинк, никель, мо-
*нз^1<°. Ео ^я либден, кобальт н, кроме того, серу, селен,
ojo S S ^& s g, теллур, индий, германий, свинец, гадолиний,
ояёдЙ$ |5 8,д а также серебро и золото. В настоящее
»мМ;а^| * § ся время перерабатываются руды, содержащие
■ |" ?S 8ч |* ° S от °>7 Д° 3 % меДи-
gi^ggisge^g ys Производство меди основано на перера-
?н«гсод1"с< I* ботке сульфидных и окисленных медных
руд. Более 80 °/о меди получают пирометал-
лургическим методом, остальные 20 % —
«o«<*i'*SSe &"S-S методом гидрометаллургии. При пирометал-
Sg§S5a§Se.s iSa?! лургическом методе руды предварительно
«g.5 §к§§о° Sз ag, обогащают, а затем концентрат подвергают
5,ё« gS jjSkS soo« собственно пирометаллургическому переде-
''SS "! o°l^-*°S" лу> состоящему из обжига, плавки и кон-
4sg о* go IS1? ч*| S вертирования. Получаемую черновую медь
"s« |« g | g-|n S g a g подвергают огневому илн электролитическо-
S-j0 §Й S.SoS§^a|§. му рафинированию.
вдч "s oiog^ggg13 Гидрометаллургическая переработка со-
oO ^ ««■ go |g* в g g-S стоит в выщелачивании руды для перевода
igjb а £•§■ g о «; g"? | g-ч в меди в раствор с последующим осаждением
o^i «^* -4feSB»s3 ее нз раствора. Гидрометаллургическим
§П*| m§ 4>§c!s~kS'"o методом перерабатывают главным образом
^S S § я § ч 5uJ g |°" бедные окисленные руды и самородную
од§ |,к 'J^ЧЙО ^с(ю н медь. Выщелачиванию подвергают руду в
"^~ " я а i2 S мелкораздробленном состоянии. Реагентами
« §
^" 2й * « § g ofiS
* а а ° u gg11* §
о
дение меди из ее сернокислых растворов,
« § g fiS S рр
я а „ а ° u gg11* Om § процесса служат обычно раствор серной
go-" % ^1 |"§i,BS и о кислоты или аммиачные растворы. Осаж-
sSSiS2|0'
3 ,g|s5og д д р рр,
I'i =- * L- ^ " I ^s ° I * * полученных в результате выщелачивания,
&S «о" S ^o.gg- «^ I'g производится электролитическим способом
-i°.oS' ч S ^| и'е^ s " Е н (электролиз с нерастворимыми анодами)
SgSSg ^Й§я-§о = Ятв или цементацией (осаждение железом).
* %о а "" § * °-к Эд "'S о.и « При выщелачивании аммиачными рас-
;g"J* ч*°§й|яю"йг| творами после разложения их острым паром
g,&4>Bg4i2gKgegD.sg« медь выделяется в виде СиО. Цементаци-
g S g a s ^J Bgg.^s^lgg онная медь н медь, полученная разложени-
el^s s« oiSjc'cS^ ем аммиачных растворов, поступает на ра-
.«иЗош S5 S.S_ -S -ам • финирование или переработку на специаль-
"g^g S^ Bgn*|ieS|<D ныезаводы.
S «5 E8SS § 2я Химический состав медн, выпускаемой
63
нашей промышленностью в виде катодов, слитков (в том числе вайер-
барсов), полуфабрикатов — см. табл. на с. 62.
Удельное электрическое сопротивление проволоки из меди марок
МООк, МОКу и М1К, применяемой для электротехнических целей при
20 °С, не должно превышать 0,01724 мкОм-м (удельная электрическая
проводимость не менее 58,0 МСм/м).
Физические свойства
Атомные характеристики. Атомный номер 29, атомная масса
63,54 а. е. м., атомный объем 7,21 -10~6 м3/моль, атомный радиус
0,128 нм, ионный радиус 0,098 нм. Конфигурация внешних электронных
оболочек атома 3dl04s'. Потенциалы ионизации атомов / (эв): 7,73; 20;
29, медь имеет г. ц. к. решетку с периодом а=0,36148 нм. Энергия кри-
кристаллической решетки 342 мкДж/кмоль. Координационное число 12,
межатомное расстояние 0,255 нм. Электроотрнцательность 1,9.
Природная медъ состоит из смесн двух стабильных изотопов с мас-
массовыми числами 63 F9,1%) и 65 'C0,9%). Получены радиоактивные
изотопы 58Cu, 59Cu, e0Cu, 61Cu, 62Cu, MCu, 6eCu, 67Cu, 68Cu с периодами
полураспада от 0,18 с до 58,5 ч. Из искусственных радиоактивных изо-
изотопов в качестве меченых атомов используют 61Си (период полураспада
3,3 ч) и 64Си (период полураспада 12,8 ч). Эффективное поперечное се-
сечение захвата тепловых нейтронов атомов меди 3,59-10~28 м2. Работа
выхода электронов <р=4,40 эВ, а для расплавленной меди ф=5,5 эВ.
Плотность. Плотность меди р зависит от ее чистоты и способа про-
производства. Плотность технически чистой меди 8,9—8,94 Мг/м3, а особо
чистой (более 99,99 % Си) — 8,96 Мг/м3. Плотность жидкой меди
8,03 Мг/м3. Изменение плотности чистой меди с увеличением темпера-
температуры (в интервале температур 293—1356 К) можно подсчитать по фор-
формуле pYG-)=po—Rp(T—То), где ро=8,96 Мг/м3; Яр= @,0005644-0,000574)
Мг/(м3-К); 7=293 К. Плотность жидкой меди в интервале температур
1356—2860 К можно подсчитать по формуле: р(Г) = (9,077+8,06) • 10-47"
Мг/м3. Изменение плотности при плавлении 4,1 %.
Электрические и магнитные. Удельная электрическая проводимость
меди чистотой 99,99 % при 293 К а=58,8 МСм/м, а при 73 К а=200
МСм/м. Электрическая проводимость меди заметно не изменяется под
влиянием висмута, свинца, серы, селена и теллура, сильно снижается
под влиянием незначительных количеств мышьяка, а также сурьмы.
Электросопротивление в зависимости от температуры:
Г, К 273 293 1356 1773 (ж)
р, мкОмм. . . . 0,0155 0,0168 0,210 0,2462
Изменение удельного электрического сопротивления прн плавлении
р>к/ртв= 2,1 4-2,2. Температурный коэффициент удельного электросопро-
электросопротивления при 298—398 К а=4,33-10~3 К~'. Абсолютный коэффициент
т. э. д. с. при 298 К составляет е=1,7 мкВ/К, в жидкой фазе при 1356 К
е= + 15 мкВ/К. Постоянная Холла при комнатной температуре R =
=—0,52-10-'° м3/Кл, а при 800 К #=— 0,58-10-'° м3/Кл.
Магнитная восприимчивость при 296 К х=—0,0860- 10~э, а жидкой
(чистота 99,9 % Си) х=0,097-10"9.
Наибольшее значение коэффициента вторичной электронной эмиссии
Отах=1,14, при ускоряющем напряжении первичных электронов 0,60 кэВ.
Тепловые и термодинамические. Температура плавления ^л =
= 1083 °С, температура кипения *кш, = 2573 "С, характеристическая тем-
температура Qd 345 К, удельная теплота плавления ДЯпл 239 кДж/кг,
удельная теплота испарения Д#исп = 4790 кДж/кг. Удельная теплоем-
теплоемкость меди при 293 К при постоянном давлении ср=384,2 Дж/(кгК),
64
а жндкой (при температуре плавления) 495 Дж/(кг-К). Удельная элект-
электронная теплоемкость сэрл = [0,688 мДж/(моль-К2)] -Т. Теплопроводность
К при 293 К равна 397 Вт/(м-К), при температуре 1356 К 165,6
Вт/(м-К).
Зависимость теплопроводности X от температуры (чистота 99,999 %):
т, к
2
5
20
50
К Вт/(м-К) Т. К
523,5
1487,0
25!8,0
1189,5
100
150
200
250
к, Вт/(м К)
481,3
428,4
413
406,0
т, к
300
350
400
Я, Вт/(м-К>
401,2
397,2
393,7
Теплопроводность меди заметно не изменяется под влиянием висму-
висмута, свинца, серы, селена, сильно понижается под влиянием незначитель-
незначительных количеств мышьяка, алюминия, снижается под влиянием сурьмы.
Температурный коэффициент линейного расширения при 293 К а=
= 16,7-10 6К-'.
Изменение а в зависимости от температуры (чистота 99,999%):
г, к
5
7
10
13
15
«■10я К
0,0024
0,01062
0,0294
0,06322
0,9634
т, к
20
40
60
100
200 '
а-106К~!
0,23
2,28
5,40
10,33
15,18
т. к
400
600
800
1000
1200
1300
а.10вК~*
17,58
18,92
20,09
22,1
24,5
27,0
Температурный коэффициент объемного расширения при 293 К Р=
= 49,2.10-6К-1, в диапазоне 293—1356 К: р= D5,0+0,016 TJ-IO^K,
где Р — коэффициент объемного расширения, К; Т — температура, К.
Молярная энтропия s° в зависимости от температуры.
Т, К 298 500 1000 1500 2000 2500 3000
5°,Дж/(моль-К) • 33,39 44,8 65,28 87,19 96,20 103,24 215,53
Поверхностное натяжение при 1083 °С 0=1351 мН/м.
Поверхностная энергия v=1115 мДж/м2, для грани A00) v=1060,
а для A11) v = 926 мДж/м3. Энергия дефекта упаковки 67 МДж/м2.
Давление пара р в зависимости от температуры:
т, к
ggg
Р, Па
31,066-10—15
38,514-Ю-!2
97,804 10-1»
г, к
1000
1100
Р. Па
82,22-Ю-8
30,968-Ю-6
Давление пара при температуре плавления р=50,47 мПа.
Энергия активации самодиффузии в интервале 1135—1330
= 205 КДж/моль.
К Е=
65
Параметры взаимной диффузии (предэкспоненциальный множитель
Do и энергия активации £) некоторых элементов в меди:
Диффунди-
Диффундирующий
элемент
н
Be
Si
S
S
Mn
Fe
Co
N1
Zn
Ge
As
Rh
Pd
Ag
Cd
In
Sn
Sb
Au
Tl
т к
_
—.
—
1403—1673
1073—1273
973—1348
973—1343
973—1348
973—1348
878—1323
952-1288
1083—1328
1023—1328
1080—1328
973—1173
998—1223
1023—1343
973—1189
873—1273
1058—1269
Образующаяся фаза
Твердый раствор
То же
»
Жидкая фаза
Твердый раствор
То же
»
»
»
»
»
»
»
»
»
»
»
»
»
»
»
О„. м2/с
5,6-10-8
2,32-Ю-8
3,7-Ю-6
3,44-10-'
8,24-Ю-5
5-Ю-5
1,4-10-*
1,93-10-*
2,7-10-*
3,4-Ю-6
3,97-Ю-5
2-Ю-5
3,3-10-*
1,71-10-*
1,3-10—в
9,35-Ю-5
1,3-10-4
1,0-10-*
3,4-Ю-6
МО-6
7,1-Ю-5
В, кДж/моль
38,52
117,23
167,47
28,85
196,78
192,59
216,88
226,51
236,55
190,92
187,5
176,6
242,5
227
161,6
191,34
193
190,5
175,85
187,99
181,29
Оптические свойства Спектральный коэффициент излучения глад-
гладкой поверхности при 773—1373 К 6^=0,12, длина волны Я=0,65 нм;
для жидкой неокисленной меди коэффициент излучения ех=0,15, а дли-
длина волиы Я=0,65 нм
Отражательная способность (коэффициент отражения Пс) в зависи-
зависимости от длины волны X для полированной меди (угол падения ~0):
X, мкм
0,251
0,305
0,326
0,385
25,9
25,3
24,9
28,6
Я, мкм
0,420
0,450
0,500
0,550
32,7
37,0
43,7
47,7
Я, мкм
0,600
0,650
0,700
0,800
1,00
71,8
80,0
83,1
86,6
90,1
Показатель преломления л в зависимости от длины волны (пленка
толщиной 0,025—0,050 мкм):
X, мкм
0,188
0,249
0,301
0,397
п
0,94
1,37
1,40
1,32
X. мкм
0,4
0,496
0,6
0,821
п
1,08
1,22
0,35
0,26
%, мкм
1,087
1,215
1,610
1,937
2,4
п
0,36
0,48
0,76
1,09
66
Механические свойства
Временное сопротивление ав, МПа
Предел текучести ао,2. МПа . .
Относительное удлинение б, %
Относительное сужение ф, % . .
Сопротивление срезу тСр, МПа .
Твердость НВ, МПа
Временное сопротивление литой меди при сжатии
Микротвердость электролитической
Н^ =760 МПа, а при 300 °С — 535—545 МПа.
Механические свойства меди (99,95 % Си) при низких температурах:
Си
мягкая
220—240
70
50
75
150
450
фи сжатии о
ни (99,95%
Си
твердая
400
340
8
35
210
1100
г£ж =1540 МПа.
Си) при 20 °С
Медь
Электролитическая холоднока-
холоднокатаная
То же, горячекатаная
То же, закаленная
То же, отожженная (отжиг
при 700 °С, 30 мин)
МО, отожженная
М2, отожженная
М2, холоднотянутая (наклеп
93%)
М2, холоднотянутая (наклеп,
73%)
Медь техническая, отожженная
и закаленная с 800 °С в воде
', °С
20
—78
— 183
20
—20
—60
—77
20
—253
20
-78
— 183
20
— 10
—40
—80
— 120
—180
18
0
-30
-80
20
0
—20
—30
—60
20
0
-20
—30
-60
— 17
— 196
—253
ств. МПа
410
423
455
212
236
255
263
271
310
240
291
365
220
224
236
270
288
408
230
236
237
263
468
486
487
493
506
411
419
429
435
449
240
380
460
°ох МПа
375
408
420
50
50
54
50
175
214
38
100
87
60
62
64
70
75
80
51
51
54
61
—
—
б. %
8,4
12
11,2
55
56,2
57,3
57,2
37,5
60
50,5
50
50,5
48
40
47
47
45
58
52
52
48
47
1,1
1,8
1,2
19
2,0
2,0
2,1
2,0
3,0
4,0
29
41
48
Ч>. %
51,5
56,6
61,2
70
70
67
68
77
75
71,4
73,6
83,3
76
78
77
74
70
77
70
69
69
67
57
56
56
54
58
57
57
57
57
57
70
72
74
67
Механические свойства полуфабрикатов (не менее):
Вид полуфабриката
ГОСТ
Листы:
холоднокатаные Мягкие 200 30 ГОСТ 495—70
Твердые 300 3 ГОСТ 495—70
горячекатаные — 200 30 ГОСТ 495—70
Лента толщиной 0,35 мм Мягкая 200 30 ГОСТ 1173—70
Трубы прессованные из Мягкие 210 35 ГОСТ 617—64
меди Ml диаметром ЗОХ ТУ 48-21-78—72
Х17 мм
Прутки тянутые диа- Мягкие 200 38 ГОСТ 1535—71
метром 5—40 мм Твердые 270 6 ГОСТ 1535—71
Прутки катаные — 250 8 ГОСТ 1535—71
35x100 мм
Прутки прессованные — 200 30 ГОСТ 1535—71
14X120 мм
Скорость звуковых волн, м/с: продольных с;=4730; поперечных с< =
= 2300. Удельное акустическое сопротивление Zs, МПа-с/м.
Ударная вязкость меди KCU—1570—1765 кДж/м2.
Модуль нормальной упругости Е в зависимости от температуры:
f,°C —180 0 100 200 300 600 800 900
£, ГПа .... 138 132 128 124 118 96 78 70
Модуль сдвига 0 = 42,400 ГПа.
Предел ползучести в зависимости от температуры:
t, CC 20 200 400
о-пл,МПа. . . 70 50 1,4
Предел выносливости 0"л при 108 циклов для мягкой меди равен
70 МПа, а для твердой 120 МПа.
Установлено, что долговечность меди в вакууме возрастает, причем
понижение давления до 1,33 -10~2 Па приводит к увеличению долговеч-
долговечности на порядок; при дальнейшем увеличении вакуума до 1,33- 10~в Па
долговечность практически не изменяется.
Типичные механические свойства меди (99,95 % Си) при комнатной
температуре (прутки прессованные):
Состояние
Мягкие
(отжнг
700 °С,
30 мин)
Твердые
(наклеп
25 %)
«3
с
bi
ПО
120
СТ0,2
<
МПа
240
400
80
350
60
е,о
%
50
6
75
35
„еж
тср
нв
**
°«
МПа
1500
150
200
450
959
80
100
й
160—
180
; Сопротивление разрушению при растяжении.
Предел выносливости ((Тр ) определялся на базе 108 циклов.
68
Химические свойства
Нормальный электродный потенциал реакции Си—2е*=еСи2+ cpo=O,34 В
а реакции Cu^*Cu2+ фо=О,52 В. В соединениях проявляет степени
окисления +1, +2, +3 (реже).
Медь обладает удовлетворительной коррозионной стойкостью в ат-
атмосферных условиях при комнатной температуре. Коррозионная стой-
стойкость меди, как правило, тем выше, чем чище медь. Наиболее вредные
примеси — кислород, сера, висмут, свинец и железо. Сухой воздух и вла-
влага при комнатной температуре порознь не действуют на медь, но во
влажном воздухе, содержащем ССЬ, на поверхности медн образуется
зеленая пленка основного карбоната. При нагреве на воздухе выше
185°С медь покрывается слоем оксида (I) меди Си2О, который прн
1025 °С переходит в оксид (II) меди СиО.
При нагревании медь растворяется в серной и азотной кислотах, а
также в аммиаке.
Влажный хлор взаимодействует с медью при обычной температуре,
образуя СиС12, хорошо растворимую в воде. Медь легко соединяется с
другими галогенами. Особое сродство проявляет медь к сере и селену.
С водородом, азотом и углеродом медь не реагирует даже при высоких
температурах.
Примеси, присутствующие в меди и попадающие в нее при плавке,
сильно влияют на физические и технологические свойства.
Алюминий повышает коррозионную стойкость и резко снижает окис-
ляемость меди при комнатной и повышенной температурах.
Висмут в твердом состоянии практически в меди нерастворим.
Свинец практически ие растворяется в меди в твердом состоянии.
Сурьма растворима в меди в твердом состоянии; при температуре эвтек-
эвтектики 645 °С растворяется до 9,5 % Sb. С понижением температуры раст-
растворимость ее резко уменьшается.
Кислород мало растворим в меди в твердом состоянии. При кристал-
кристаллизации кислород выделяется в виде эвтектики медь — окснд (I) меди,
располагающейся по границам зерен, что служит причиной хрупкости и
хладноломкости меди при холодной деформации. При повышении содер-
содержания кислорода заметно снижаются пластичность и коррозионные свой-
свойства меди, а также затрудняются процессы пайки, сваркн, лужения и
плакирования. При содержании более 0,1 % О2 медь легко разрушается
при горячей обработке давлением.
Водород значительно растворим в твердой н жидкой меди; с пони-
понижением температуры растворимость снижается.
Железо растворяется в меди в твердом состоянии незначительно.
Мышьяк растворим в меди в твердом состоянии до 7,5 %.
Сера хорошо растворяется в жидкой меди; в твердой меди раствори-
растворимость снижается до нуля.
Фосфор ограниченно растворим в меди в твердом состоянии. При
700°С растворимость достигает 1,3 %, а при 200"С снижается до 0,4 %.
Селен в твердом состоянии в меди растворяется менее 0,1 %. При за-
затвердевании селен выделяется в виде Cu2Se.
Теллур незначительно растворим в меди в твердом состоянии (око-
(около 0,01 %). Электрохимический эквивалент 0,32938 мг/Кл.
Технологические свойства
Температура литья 1150—1230"С. Линейная усадка при литье в кокиль
2,1 %, жидкотекучесть (литье в песок) 35 см.
Медь высокопластична в отожженном состоянии, при обработке дав-
69
лением выдерживает без промежуточных отжигов обжатие до 85—95%.
Вакуумная плавка улучшает пластичность меди.
Температура прессования 800—950 °С, температура горячей прокатки
820—860 °С. Температура полного отжига 500—700 °С, а отжига для
уменьшения остаточных напряжений 180—230 °С. В качестве травителя
полуфабрикатов после отжига применяют 10 %-ный водный раствор
H2SO4. Атмосферой для светлого отжига бескислородной меди служат
водород, инертный газ, пары воды, смесь углекислого газа и оксида угле-
углерода, смесь азота с 2—3 % Нг. Для светлого отжига технической меди,
содержащей 0,02—0,03% О2, используют пары воды при отсутствии ве-
веществ, вызывающих ее диссоциацию, смесь азота с 2—3 % водорода.
Качество меди можно улучшить применением вакуума при горячен де-
деформации.
Температура рекристаллизации в зависимости от чистоты меди состав-
составляет 257—377 °С. Медь лучше обрабатывается резанием в деформиро-
деформированном состоянии. Хорошо поддается сварке и пайке. Коэффициент тре-
трения меди в паре со сталью со смазкой (веретенное масло № 2) состав-
составляет 0,011, а без смазки 0,43.
Небольшие количества висмута @,005%) вызывают разрушение медн
при горячей обработке давлением. При повышенном содержании висму-
висмута медь становится хрупкой и в холодном состоянии. Присутствие свин-
свинца вызывает разрушение меди при горячей обработке давлением, сера
заметно снижает пластичность при горячей и холодной обработке дав-
давлением, фосфор повышает жидкотекучесть и оказывает положительное
влияние при сварке, селен и теллур улучшают обрабатываемость реза-
иием.
Области применения
Широкое применение медн в промышленности обусловлено ее высокой
электрической проводимостью, пластичностью, хорошей коррозионной
устойчивостью, теплопроводностью, хорошими литейными качествами
и др. Из цветных металлов медь уступает по уровню потребления только
алюминию. Основные потребители меди и ее соединений в развитых стра-
странах:
а) электротехника и электроника (обмоткн в электромашинах, прово-
провода, кабели, в частности, кабели для подземных линий высокого напряже-
напряжения, шины, детали в телеграфных, телефонных и радио-телевизионных ап-
аппаратах, печатные схемы);
б) машиностроение (теплообменники, криогенные установки, опрес-
опреснительные установки);
в) транспорт (детали и узлы вагонов, тепловозов, судов, самолетов,
сигнальных устройств);
г) бытовая техника (стиральные машины, конденсаторы, часы и др.);
д) строительные материалы (фитинговая арматура, декоративные
украшения);
е) химическая промышленность (катализаторы, краски и др.);
ж) сельское хозяйство (ядохимикаты).
Широкое техническое применение получили сплавы меди с цинком
(латуни), оловом, алюминием, кремнием, свинцом, бериллием (оловян-
(оловянные и специальные бронзы), никелем (мельхиор, константан, нейзильбер,
монельметалл), марганцем (манганины) и другие более сложные спла-
сплавы.
Значительно также применение меди в качестве легирующей добав-
добавки в сплавы иа алюминиевой основе (дуралюмин и др.). Использу-
Используется медь н в качестве легирующей прнсадки железным сплавам
70
для улучшения их свойств. Присадка меди к конструкционным сталям
повышает их предел текучести, коррозионную стойкость и увеличивает
закаливаемость.
1.8. СЕРЕБРО [1—35, 75, 76, 198]
Общие сведения и методы получения
Серебро (Ag) — благородный металл с красивым блеском. Известно с
глубокой древности. Наряду с золотом и медью является одним из пер-
первых металлов, которые познал человек.
Латинское название argentum (блеск, блестящий)серебро получило
примерно во II—III в. до н. э.
Содержание серебра в земной коре 10~5% (по массе). Наряду со
своими аналогами по подгруппе медью и золотом серебро встречается в
самородном состоянии. Самородное серебро чаще всего содержит при-
примеси золота и ртути, реже примеси сурьмы, висмута, меди, мышьяка,
платины. Из минералов самородного серебра можно указать кюстелит
(до 10 % Аи), кончсбергит (до 5 % Hg), бордозит (до 30 % Hg), аними-
кит (до 11 % Sb), чиленит (до 5 % Bi) и др. Основные минералы, в
которых серебро присутствует в связанном состоянии: аргенит (сереб-
(серебряный блеск) Ag2S, кераргирит (роговое серебро) AgCl, полибазит (Ag,
Cu^S, пираргирит Ag3SbS3, прустит AgaAsSa, стефанит AgsSiS^ бро-
мирит AgBr.
Однако большого промышленного значения серебряные руды не име-
имеют. Основную массу серебра (до 80 %) получают при комплексной пе-
переработке свинцовоцинковых, а также медных руд.
Из свинцовых руд серебро получают двумя способами. По первому
способу из расплава свинец — серебро выделяется свинец, а оставший-
оставшийся сплав эвтектического состава, содержащий ~2% Ag, подверга-
подвергают окислительной плавке, в процессе которой свинец удаляется в ви-
виде глета.
По второму способу расплав свинца с серебром обрабатывают цин-
цинком, который обладает большим сродством к серебру. Продукты взаимо-
взаимодействия цинка с серебром в виде пены всплывают на поверхность; при
понижении температуры эта пена затвердевает и легко отделяется от
расплава. Затем из пены сначала отгоняют цинк и отделяют серебро от
оставшегося свинца окислительной плавкой (купелированием).
В случае медных руд серебро извлекают из анодного шлама при
электролитическом рафинировании черновой меди. Из бедных серебром
руд, не используемых для получения свинца или меди, в настоящее вре-
время почти всюду серебро извлекают методом цианидного выщелачива-
выщелачивания. При этом методе соединения серебра обрабатывают цианидами ще-
щелочных металлов, в результате чего образуются комплексные цианиды
и серебро переходит в раствор. Из этого раствора серебро выделяется
введением цинка. Полученное рассмотренными выше методами серебро
всегда содержит немного золота, а также медь.
Рафинирование серебра проводят или методом аффинажа или элект-
электролитическим методом. При первом методе неочищенное серебро раст-
растворяют в кипящей серной кислоте. Серебро переходит в раствор в виде
сульфата, а золото в виде порошка осаждается иа дно ванны. Серебро
восстанавливают из раствора медью или железом.
В настоящее время более широко используется метод электролити-
электролитического рафинирования в слабом растворе азотной кислоты или нитрата
серебра. Из неочищенного серебрянного анода можно получить кристал-
кристаллическое серебро чистотой 99,95 %.
Основная продукция из серебра и его сплавов стандартизирована
71
(марки, сортамент, технические требования, методы анализа, химичес-
химический состав):
ГОСТ 6836—72. Серебро и серебряные сплавы; ГОСТ 9724—61. По-
Порошок серебряный; ГОСТ 13638—68 Серебро. Методы спектрального
анализа; ГОСТ 5.1214—72. Аноды серебряные; ГОСТ 19.738—74. Припои
серебряные Марки.
Состав серебра по ГОСТ 6836—72:
Марк
Ср999
Ср999
1
,9
Ag, %,
не менее
99,99
99,1
0
0
РЬ
,003
,003
0
0
Примеси,
Fe
,004
,04
0
0
% не <
Sb
,001
,002
5олее
0
0
Bi
002
002
всего
0,01
0,1
По ОСТ 48-78—75 изготовляют серебро в слитках марок СрА-1
(>'99,99 % Ag) и СрА-2 (>99,98 % Ag). Символ СрА означает сереб-
серебро аффинированное, а цифра при символе — степень его чистоты, напри-
например О — особую чистоту, 1—высокую, 2 и 3 — повышенную. Марки се-
серебряных порошков по ГОСТ 9724—61 обозначают символом П — по-
порошок, С — серебро и цифрой, характеризующей граиу точен- пеский
состав.
Физические свойства
Атомные характеристики Атомньш номер 47, атомная масса 107,869
а е. м., атомный объем 10,27-10~в м3/моль. Атомный (металлический)
радиус 0,1442 им, ионный радиус Ag+ 0,133 нм, ковалентный 0,141 им.
Электронная конфигурация внешней электронной оболочки атома 4d10
5s1. Электроотрицательность 1,9.
Значения потенциалов ионизации / (эВ) : 7,574; 21,8; 36,10. При атмос-
атмосферном давлении серебро обладает г. ц к. решеткой, при комнатной тем-
температуре а —0,40862 нм Энергия кристаллической решетки 290 мкДж/
/кмоль. Радиус междоузлий октаэдрических 0,106 нм, тетраэдрических
0,032 нм. Природное серебро состоит из двух стабильных изотопов 107Ag
и 1Пд Ag, процентное содержание которых соответственно равно 31, 35 и
48,65. Известно более 20 искусственных радиоактивных изотопов с атом-
атомной массой от 102 до 115 и периодами полураспада от нескольких де-
десятков до сотен тысяч секунд. Из этой группы изотопов наибольшие пе-
периоды полураспада имеют изотопы 110Ag и los Ag, соответственно рав-
равные 270 и 40 дням. Эффективное поперечное сечение захвата тепловых
нейтронов 63- 10-2е м2.
Плотность р чистого серебра, деформированного и подвергнутого
полному отжигу, равна 10,49 Мг/м3. В результате холодной обработки
давлением плотность уменьшается и составляет для холоднотянутой
проволоки 10,434 Мг/м3. При нагревании до 973, 1073 и 1173 К плотность
соответственно составляет 9,89, 9,8 и 9,72 Мг/м3.
Плотность жидкого серебра при различных температурах:
Г, К 1273 1323 1373 1423 1473 1523
р, Мг/м3 9,25 9,2 9,17 9,15 9,1 9,0
Плотность серебра при температуре плавления составляет
9,346 Мг/м3, при температуре кипения 8,244 Мг/м3.
Электрические и магнитные. Удельная электрическая проводимость
а серебра в зависимости от температуры:
72
Т, К 53 273 473 773
сг, МСм/м 200 62,0 35,1 21,1
Удельное электрическое сопротивление р серебра в зависимости от
температуры:
Г, К 53 273 473 773
р.мкОмм . . 0,005 0,0162 0,0285 0,0475
В более широком интервале температур наблюдаются следующие со-
соотношения:
т, к
1,3
20,4
81
90
РГ/Р273
0,0068
0,0100
0,207
0,226
Г, К
195
373
473
573
РГ/Р273
0,684
1,4098
1,8293
2,2626
Г, К
673
773
1073
1173
Р7-/Р273
2,710
3,168
4,62
5,14
Температурный коэффициент электрического сопротивления а сереб-
серебра при 273 К равен 4,10- 10~3К~'. При переходе из твердого состояния
в жидкое удельное электросопротивление увеличивается почти в два ра-
раза и продолжает возрастать при дальнейшем повышении температуры:
Г, К . . . 1233,5 (тв) 1233,5 (ж) 1273 1373 1473 1573
р,мкОм-м . . 0,084 0,166 0,170 0,182 0,194 0,205
Абсолютная т. э. д. с. серебра положительна и в большой степени за-
зависит от чистоты материала. В интервале 0—900 °С она выражается
уравнением. £= 1,42 +0,00338^+0,000008П2, где t — температура, °С.
Абсолютный коэффициент т. э. д. с. при различных температурах1
Г, К 273 373 473 573 673 773 873 973 1073
е,мкВ/К. • ■ 1,42 1,81 2,42 3,16 4,07 5,13 6,73 7,75 9,31
Термопара платина — серебро в зависимости от температуры облада-
обладает следующим значением т. э. д. с :
т, к
73
173
273
373
Е, мВ
—0,14
—0,35
0
0,74
Г, К
473
573
673
773
Е. мВ
1,77
3,05
4,57
6,36
Г, к
873
973
1073
1173
£, мВ
8,41
10,75
13,36
16,20
Отрицательное значение т. э. д. с. означает, что ток от платины про-
протекает к серебру. Абсолютный коэффициент т. э. д. с. жидкого серебра
при 1234 К е=+9 мкВ/К.
Постоянная Холла серебра при комнатной температуре Л=—0,9Х
ХЮ-10 м3/Кл; при 800 К R=—0,98-100 м3/Кл.
73
Серебро — диамагнитный металл. Его удельная магнитная восприим-
ивость отрицательна и составляет при комнатной температуре % =
= —0,181 -10~9. С изменением температуры магнитная восприимчивость
практически не изменяется. В жидком состоянии магнитная восприимчи-
восприимчивость серебра ничтожно мала; при холодной обработке давлением сни-
снижается. Работа выхода электронов ср = 4,3 эВ Коэффициент вторичной
электронной эмиссии сгтах=1,5 при ускоряющем напряжении первичных
электронов 0,800 кэВ
Тепловые и термодинамические Температура плавления ^„л = 960,34 "С,
температура кипения ^Кип = 2167°С; характеристическая температура
6d = 225,3K, удельная теплота плавления Д//Пл= 104,6 кДж/кг, удельная
теплота сублимации, отнесенная к 298 К, Д#С\бл = 2640 кДж/кг. При
плавлении происходит увеличение объема на ДК = 5,33- 10~в м3/кг, или
Д1//1/0=0,052. С увеличением давления температура плавления серебра
возрастает и при 6 ГПа достигает 1588 К; dT/dP=60 К/ГПа. Атомную
теплоемкость [Дж/(кг-КI серебра высокой чистоты можно рассчиты-
рассчитывать но формуле с*т = @,055401+ 0,14414х10^4 Г—0Д6212Х Ю"8 Г2) X
Х451,53544.
Это выражение справедливо для интервала температур 273—1073 К.
В интервале 273—ТПЛ среднее значение ср = 237 Дж/(кг-К). Электрон-
Электронная теплоемкость серебра СрЛ=[6,8 мДж/(моль-К2)] -Т.
Теплопроводность X серебра высокой частоты в зависимости от тем-
температуры:
Т, К 3 15 42 273 300 600 900
Я,, Вт/(м-К). • 501,5 3330,5 1052,0 453,0 432,5 410,7 388,8
Температурный коэффициент линейного расширения а серебра высо-
высокой чистоты в зависимости от температуры:
т, к
5
7
10
12
15
«•10е, К"
0,0177
0,0386
0,112
0,1988
0,4084
Г, к
40
100
160
300
500
а 10е, К"
6,0
16,0
17,0
18,8
20,5
т, к
700
900
1000
1100
22,3
24,3
25,5
27,2
Молярная энтропия s° серебра в зависимости от температуры:
Т, К 298 500 1000 1500 2000 2500
s°, Дж/(моль-К) • . . 42,69 56,09 75,47 97,15 106,19 217,17
Давление насыщенного пара р серебра в зависимости от темпера-
температуры:
г, к
800
898
Р. Па
12,94-10-8
12,94-10-«
г, к
1024
1191
Р. Па
12,94-10-*
12,94.10-2
г, к
1436
1876
Р, Па
12,94
12,94-102
74
Давление паров серебра при температуре плавления A233,5 К)
34,23-10~2 Па. Поверхностное натяжение жидкого серебра при 1253 К
сг=930 мН/м. Поверхностная энергия кристаллического серебра v =
= 890 мДж/м2 для гранн A00), v = 781 мДж/м2 для грани (Ш), энер-
энергия дефекта упаковки 18 мДж/м2.
Динамическая вязкость г) серебра в зависимости от температуры:
Г, К 1293 1373 1463 1528 1593 1693
■П.мПа-с . . . 3,69 3,34 2,89 2,52 2,41 2,18
Параметры самодиффузии серебра (поликристалл) в интервале
773 —1123 К: предэкспонепциальный множитель D0 = 0,895-10~4 м2/с;
энергия активации £=192,17 кДж/моль
Параметры взаимной диффузии — предэкспонендиальный множитель
Do и энергия активации Е (основной элемент серебро; образующаяся
фаза — твердый раствор):
Диффундирующий
элемент
О
Fe
Со
Ni
Си
Ru
Pd
Sb
Те
Хе
Аи
т, к
685—1135
1020—1223
1020—1316
1020—1223
1033—1168
1066—1218
1008—1312
712—1215
1023—1223
773—1073
490—674
О„, м!/с
2,72-Ю-6
52-Ю-4
104- Ю-4
20-Ю-4
5,94-Ю-9
180-Ю-4
9,57-10-4
0,160-10-*
0,47-Ю-4
3,6-Ю-2
5,3-10-в
Н, кДж/моль
46
315,2
250,0
230,0
103,0
275,0
238,8
160,4
162,8
157,0
29,8
Оптические. Спектральный е
лучения:
и интегральный ет коэффициенты из-
Состояние металла
,
Неокисленный, жидкий
Неокисленный
—
Окисленный
Коэффициент излучрния
(гладкая поверхность)
ея=0,05 (Х=0,65)
8^=0,07 (*,=0,65)
ег=-0,02
ег=0,035
8Г=О,О21— 0,036
г, к
773—1023
—
373
773
383—1173
Отражательная способность серебра в области видимых длин воли
95 %, в области инфракрасных 98 %, а в ультрафиолетовой области 10 %
при длине волны 0,31 мкм. При выдержке на воздухе отражательная
способность серебра падает. Наибольшей отражательной способностью
обладает серебро, нанесенное в вакууме на стекло
Отражательная способность серебра (пв) в зависимости от длины
волны X (электролитическое полирование):
75
К мкм
0,251
0,288
0,305
0,326
0,357
0,385
V *
34,1
21,2
9,1
14,6
74,5
81,4
X, мкм
0,420
0,450
0,500
0,550
0,600
0,650
V %
86,6
90,5
91,3
92,7
92,6
94,7
>,, мкм
0,700
0,800
1,0
2,0
3,0
4,0
9,0
V %
95,4
96,8
97,0
97,8
98,1
98,5
98,7
Показатель преломления серебра в я в зависимости от длины волны X:
К
0
0
0
0
мкм
,188
,199
,249
,301
п
1,07
1,14
1,31
1,34
X, мкм
0,397
0,496
0,617
0,821
п
0,05
0,05
0,06
0,04
X, мкм
1,087
1,215
1,393
1,610
1,937
п
0,04
0,09
0,13
0,15
0,24
Примечание. Пленка толщиной 0,25—0,5 мкм. Поликристалл.
Показатель поглощения % в зависимости от длины волны К:
X. мкм
0,188
0,199
0,249
0,301
X
1,21
1,28
1,39
1,96
?., мкм
0,397
0,496
0,617
0,821
2,07
3,09
4,15
5,73
Я,, мкм
1,087
1,215
1,393
1,610
1,937
X
7,80
8,83
10,10
11,85
14,08
Механические свойства
Прочностные и пластические свойства серебра1 в большой степени зави-
зависят от его чистоты, предшествующей механической обработки и режи-
режимов последующего отжига. На временное сопротивление серебра большое
влияние оказывает не только температура н продолжительность последу-
последующего отжига, но и степень предшествующей холодной пластической де-
деформации. С увеличением степени деформации временное сопротивление
после отжига возрастает.
Характеристики прочности и пластичности серебра после отжига при
600 °С, 1 ч: о-в=127^156 МПа; o-02=25-f-27 МПа; 6=40-н60 %; ф=
=90%; £=72ч-75 ГПа; 0 = 26-^27 ГПа; ЯВ=255-т-25б МПа.
При повышении температуры модуль нормальной упругости Е сни-
снижается и при 700 °С составляет ~0,5 его значения прн комнатной тем-
температуре.
76
Модуль сдвига G в зависимости от температуры:
Т,°С . . . 27 130 225 399 590 655 811
СГПа . . 26,78 25,99 23,93 21,38 15,59 14,22 10,39
Коэффициент Пуассона серебра v=0,38. Сжимаемость серебра и =
= 1,01-10-" Па-1.
Химические свойства
В большинстве соединений серебро проявляет степень окисления +1,
известны соединения со степенью окисления +2 и +3.
В химическом отиошении серебро малоактивиый металл, нормальный
электродный потенциал реакции Ag—e=*=tAg+ фо = О,799 В. В ряду напря-
напряжений серебро расположено значительно дальше водорода. Соляная и
разбавленная серная кислоты на него не действуют. Растворяется сере-
серебро в азотной кислоте.
В атмосфере чистого сухого воздуха серебро не меняет вида. Опти-
Оптическими исследованиями установлено, что на воздухе поверхность сереб-
серебра покрывается тонкой пленкой оксида толщиной до 1,2 нм. При нагре-
нагревании серебра в атмосфере кислорода до 300—400 °С образуется более
толстая пленка оксида Ag2O, имеющая темно-бурый цвет. При избыточ-
избыточном давлении кислорода (до 20 МПа) и повышенных температурах се-
серебро может окислиться полностью. В твердом состоянии серебро прак-
практически не растворяет кислород. Напротив, в жидком серебре кислород
растворяется хорошо. Поэтому при затвердевании серебра происходит
выделение кислорода, иногда сопровождающееся разбрызгиванием ме-
металла.
Теплота образования Ag2O из элементов Д#обР=53,14 кДж/моль.
Водород растворяется в жидком и твердом серебре. Равновесная
концентрация водорода в твердом серебре пропорциональна парциаль-
парциальному давлению водорода в атмосфере. При повышении температуры
растворимость водорода в твердом металле также возрастает. В 0,1 кг
серебра чистотой 99,95 % при давлении водорода 98,1 кПа растворяет-
растворяется следующее его количество:
/, °С 600 700 800 900
Н2-106,м3 0,0!9 0,025 0,036 0,046
Диффундирующий в нагретое серебро водород взаимодействует с
растворенным в нем кислородом, частично восстанавливая оксиды, обра-
образованные различными примесями, что приводит к образованию водяного
пара внутри металла. Выходящий на поверхность пар способствует воз-
возникновению на поверхности металла трещин и газовых пор («водород-
(«водородная» болезнь).
Азот не растворяется ни в жидком, ни в твердом серебре. Большое
техническое значение имеет нитрат серебра—соль азотной кислоты,кото-
кислоты,которая широко используется при производстве светочувствительных матери-
материалов. Нитрат серебра AgNCh очень хорошо растворяется в воде. При
20 °С в 100 г воды растворяется 222 г нитрата, а при 100 °С — 925 г.
Известна серебряная соль азотистоводородной кислоты НЫз—азид се-
серебра AgNa — труднорастворимая в воде. Азид серебра при нагревании
и особенно при ударе взрывается.
Цианид серебра AgCN выпадает в виде белого осадка при добавле-
добавлении ионов CN~ к растворам солей серебра. В воде, а также в разбав-
разбавленных сильных кислотах цианид серебра практически нерастворим. Из
галогенидов серебра чрезвычайно легко растворим в воде фторид сереб-
серебра, другие галогениды труднорастворнмы.
.77
Сульфид серебра, или сернистое серебро, Ag2S выпадает в виде чер-
черного осадка при пропускании сероводорода в растворы солей серебра.
Ag2S — наиболее труднорастворимая соль серебра; теплота образования
этой соли составляет ДЯовр = 27,49 кДж/моль.
В присутствии сероводорода H2S серебро тускнеет в результате обра-
образования сернистого серебра. Скорость потускнения возрастает с увели-
увеличением влажности воздуха. Сульфидную пленку удаляют путем полиро-
полирования или нагревания металла до 400 °С; при этой температуре сульфид
серебра разлагается. Избежать потускнения серебра можно нанесением
на его поверхность тонкого слоя лака. Хорошие результаты дает катод-
катодная пассивация серебра в растворах некоторых минеральных солей Вы-
Высокая коррозионная стойкость серебра объясняется главным образом его
положением в ряду потенциалов и в меньшей степени способностью к
образованию защитной пленки на поверхности Высокое значение нор-
нормального электродного потенциала серебра предопределяет его высокую
коррозионную стойкость в паре с такими металлами, как алюминий,
хром, нержавеющая сталь
Со своим ближайшим аналогом — золотом — серебро образует неп-
непрерывные твердые растворы; аналогичный тип взаимодействия наблю-
наблюдается в системе серебро — палладий. При понижении температуры из
непрерывных твердых растворов выделяются Pd3Ag2 и PdAg. В системе
серебро — медь при 779 °С и 40% (ат ) Сн образуется эвтектика; пери-
тектический характер взаимодействия компонентов в системе серебро —
платина. С рядом элементов V, VI, VII и VIII А подгрупп периодической
системы — ванадием, танталом, вольфрамом, железом и иридием сереб-
серебро не взаимодействует Особенности взаимодействия серебра с такими
тугоплавкими металлами, как гафний, ниобий, молибден, ренин, не уста-
установлены. Большое число металлических соединений серебро образует с
элементами НА подгруппы — бериллием, магнием, кальцием, стронцием н
барием, а также с металлами III и IVA подгрупп — скандием, иттрием,
лантаном, титаном и цирконием.
Технологические свойства
Серебро — металл, обладающий высокими технологическими свойства-
свойствами. Оно легко поддается обработке и на холоду, и при нагреве
Низкие значения предела текучести и высокая пластичность серебра
обусловливают его большую склонность к глубокой вытяжке при ком-
комнатной температуре.
Области применения
Серебро широко применяется в различных отраслях народного хозяйст-
хозяйства: химии, электротехнике, электронике, медицине, ювелирном деле н
др. Большое практическое значение имеют сплавы серебра с медью, ме-
металлами платиновой группы и некоторые другие. Введение меди [3—•
50 % (по массе)] в серебро приводит к повышению его прочностных ха-
характеристик и сопротивления износу, при этом сохраняется также ряд
важных электрофизических характеристик, например высокая электро-
электропроводность, присущая серебру.
Из сплавов серебра с медью изготовляют слаботочные контакты,
ювелирные изделия, чеканят медали и т д ГОСТ 6836—72 регламенти-
регламентирует 12 марок сплавов серебра с медью.
Сплавы серебра с металлами платиновой группы — платиной и пал-
палладием — обладают очень высокой коррозионной стойкостью В соот-
соответствии с ГОСТ 6836—72 поставляются два сплава серебра с платиной
марок СрПл4 и СрПл12, содержащие соответственно в среднем около
78
А и !2 % Pt, а также два сплава серебра с палладием марок СрПд20 и
СрПд40, содержание палладия в которых около 20 и 40 %.
Известно более 400 марок припоев на основе серебра, содержащих
один, два и более легирующих элементов. Серебряные припои исполь-
используют главным образом для низкотемпературной панки сталей, медных,
никелевых и титановых сплавов, а также изделий из тугоплавких и ред-
редких металлов Припои на основе серебра обеспечивают хорошую смачи-
смачиваемость паяных изделий при сравнительно низких температурах, высо-
высокую прочность и пластичность соединений, их хорошее сопротивление
коррозии, возможность соединения разнородных металлов, наконец, воз-
возможность варьирования температуры пайки в пределах 650—1200°С.
Серебро или его соединения применяют в химической промышленно-
промышленности в качестве катализаторов при получении ряда органических соедине-
соединений. Соли серебра и прежде всего азотнокислое и хлорное серебро ис-
используют при изготовлении некоторых лекарственных препаратов, обла-
обладающих бактерицидными свойствами.
1.9. ЗОЛОТО [1—35, 77—801
Общие сведения и методы получения
Золото (Аи) — благородный металл желтого цвета с приятным блеском.
Известно с древних времен (за 12 тыс лет до н. э).
Среднее содержание золота в земной коре Aч-6)-10~7 % (по массе).
Золото наряду с его ближайшими аналогами по группе медью и се-
серебром относится к самородным металлам. Кроме того, известно до 20
минералов, содержащих, помимо золота, некоторые другие элементы, в
том числе медь, железо, теллур, селен. Самородное золото чаще всего
содержит до 10—15 % Ag При более высоком содержании серебра
C5—45 °/о) минерал становится серебристо-белым с зеленоватым оттен-
оттенком; си носит название электрум. Практически ~97 % всего добывае-
добываемого золота получают из самородного золота и лишь остальные ~3 %
из его теллуридов, образующих минералы калаверит (АнТе2), кренмерит
(Аи, Ag)Te, сильванит (AuAgTaTe4) и петунит (AgAuTe2). ГОСТ 6835—
80 регламентирует химический состав золота и его сплавов с серебром,
медью, платиной, палладием, а также примерные области применения
золота и его сплавов. Согласно ГОСТ в СССР выпускают две марки зо-
золота следующего химического состава (по примесям), %•.
Марка
3i999,9
Зл999
Аи
, HP
99
99
менее
99
9
0
0
РЬ
,003
,003
0
0
Ft-
,004
,04
0
0
sb
,001
,002
0
0
Bi
,002
,002
Всего
0,01
0,1
Характеристикой степени чистоты золота является его проба, которая
отражает содержание этого металла в 1000 ч сплава Так, проба 560 ука-
указывает, что данный образец содержит 56 % золота и 44 % примесей,
которыми могут быть серебро, медь и другие металлы.
Физические свойства
Атомные характеристики. Атомный номер 79, атомная масса 196,967
а. е м., атомный объем 10,2-10~6 м3/моль. Атомный радиус (металличес-
79
кий) 0,144 нм, ионный радиус Аи+ 0,137 нм, ковалентный радиус
0,134 нм. Конфигурация внешних электронных оболочек. атома
золота 5rf10 6s1. Природное золото состоит из стабильного изотопа
I97Au. Получено 20 радиоактивных изотопов с массовыми числами 184—
196, 198—204 и периодами полураспада от нескольких секунд до 185 сут.
Золото — мономорфный металл, имеет г. ц. к. решетку с периодом
а=0,40785 нм. Энергия кристаллической решетки 345 мкДж/кмоль.
Электроотрицательность 2,4.
Потенциалы ионизации атома золота /(эВ): 9,223; 20,5. Работа вы-
выхода электронов ф=4,53 эВ.
Плотность. При комнатной температуре плотность золота р==
= 19,299 Мг/м3; при плавлении и последующем повышении темпера-
температуры:
Г, К 1337 (тв) 1337 (ж) 1373 1473 1573
р,Мг/м3 . . . 18,474 17,361 17,221 17,099 16,95
Отношение dp/dT для жидкого золота равно—1,5 мг/(м8-К).
Электрические и магнитные. Удельная электрическая проводимость
0 золота в зависимости от температуры:
Г, К 73 293 673 1073
а, МСм/м. . . 167 43,5 12,8 8,35
Удельное электрическое сопротивление золота р в зависимости от тем-
температуры:
Г, К 73 293 673 1073
р, мкОм-м . . 0,006 0,023 0,057 0,102
Температурный коэффициент электрического сопротивления золота в
интервале 273—373 К равен а = 3,70-10~3К~'. При плавлении электри-
электрическое сопротивление золота возрастает в 2,08 раза.
В термопаре золото — платина золото проявляет отрицательную
т. э. д. с. по отношению к платине при температуре горячего спая 173,2 К.
В этом случае Е=—390 мкВ. С повышением температуры т. э. д. с. меня-
меняет знак и при 373,2 К £=+780 мкВ. Абсолютный коэффициент т. э. д. с.
е= + 1,1 мкВ/К.
Максимальное значение коэффициента вторичной электронной эмиссии
золота атах=1,46 и соответствует ускоряющему напряжению первич-
первичных электронов Ер, равному 0,75 кэВ. Постоянная Холла золота высо-
высокой чистоты при комнатной температуре #=(—0,69±0,0009) X
ХЮ-»° м3/Кл, при 800 К /?=(—0,74 + 0,0074) -Ю-10 м3/Кл.
Золото — диамагнетик; магнитная восприимчивость %==—0,142-Ю"9
при 293 К.
Тепловые и термодинамические. Температура плавления tnn —
= 1064,2 °С, температура кипения <Кип = 2877°С, характеристическая
температура 0d= 161,6 К, удельная теплота плавления ДЯПл =
= 64,4 кДж/кг, удельная теплота сублимации, отнесенная к 298 К,
Д#сУбл=1873 кДж/кг. При плавлении происходит увеличение объема на
ду=2,79-10-6 м3/кг, или ДУ/У=О,О55. При увеличении давления тем-
температура плавления золота возрастает и при 6,56 ГПа достигает 1565 К;
dT/dP=6Q К/ГПа. Удельная теплоемкость ср золота значительно воз-
возрастает при повышении температуры: при 1 К ср =0,088 Дж/(кг-К), а
при 5 К 4,5 Дж/(кг-К). Средняя удельная теплоемкость золота в ин-
интервале 273—373 К составляет 130 Дж/(кг-К). Электронная теплоем-
теплоемкость сэрЛ =[0,764 мДж/(моль.К2)]-Г.
80
Теплопроводность к золота чистотой 99,9 % в зависимости от тем-
температуры:
Г, К
2
8
30
К, Вт/(м-К)
1171
2805
795
г, к
150
273
373
К Вт/(м-к>
335
310
310
т, к
500
700
1000
X, Вт/(м-К)
303,4
289,7
271,7
Температурный коэффициент линейного расширения при низких тем-
температурах описывается формулой а = аТ+ЬТ3:
Г, К 5 7 9 11 13 15
а-106, К-1.- 0,0255 0,0753 0,1645 0,3062 0,5002 0,7652
При повышении температуры характер роста а существенно изменя-
изменяется и при температурах —100 К становится практически линейным:
Т, К
90
170
293
a-10fi К
10,94
12,93
14,0
т. к
373
573
773
а-ю" К
14,43
15,34
15,88
Г, К
973
1173
1373
а-10в К
17,18
18,74
20,15
Молярная энтропия s° золота в зависимости от температуры:
Г, К 298 500 1000 1500 2000 2500
s°, Дж/(моль-К) . 47,38 60,73 79,75 100,96 109,4 115,9
Давление насыщенного пара р золота в зависимости от температуры:
г, к
1669
1705
р.
1,
1,
Па
06
76
г, к
1762
1831
Р, Па
3,72
9,0
г, к
1897
1930
1966
Р. Па
18,8
31,0
47,58
Давление пара золота при температуре его плавления A337 К) рав-
равно 24,32-10-" Па.
Поверхностное натяжение сг жидкого золота при температуре плав-
плавления: ст= 1140 мН/м, da/dT=— 0,52 мН/(м-К). Поверхностная энер-
энергия v кристаллического золота v= 1165 мДж/м2 для грани A00) и v=
= 1020 мДж/м2 для грани A11). Энергия дефекта упаковкн 52 мДж/мг.
Динамическая вязкость золота при температуре плавления 11 =
=5,0 мПа-с.
Параметры самодиффузии (предэкспоненциальный множитель Do и
энергия активации Е) золота:
81
Состояние материала
Поликристалл . ...
Монокристалл ....
г, к
873—1227
Do 10*. м2/с
0,091
0,031
Е, кДж/моль
174,59
1п4,96
на)
Параметры взаимной диффузии элементов в золоте (по объему зер-
Диффундирующий
элемент
Ы*
Fe
Со
Ni
Си
Pt
Hg
т, к
773—1113
973—1243
973—1273
973—1273
973—1180
1076—1328
873—1303
О„, mVc
5,6-Ю-8
8,2-10—6
6,8-Ю-6
6,8-Ю-6
0,105-10—'
7,6-10-*
0,116-10-*
Е, кДж/моль
23,61
174,17
174,17
175,85
170,0
254,98
156,7
Примечание Образуется твердый раствор.
Оптические. Излучательная способность (спектральный ех и интег-
интегральный ет коэффициенты излучения) зОлота:
Состояние металла
Неокисленный, жидкий
Неокислеиный
е*
0,05—0,17
0,22
0,02**
0,03**
К мкм
0,65
0,65
т. к
473—1273
373
773
* Гладкая поверхность **
Отражательная способность золота (коэффициент отражения nD) в
зависимости от длины волны к:
к, мкм
0,251
0,288
0,305
0,326
0,357
0,385
«д. %
38,8
34,0
31,8
26,6
27,9
27,1
X, мкм
0,420
0,450
0,500
0,550
0,600
0,650
пр. %
29,3
33,1
47,0
74,0
84,4
88,9
X, мкм
0,700
0,800
2,0
4,0
9,0
nD, %
92,3
94,9
96,8
96,9
98,0
Примечание Электролитическое по^ИрОваНие.
82
Показатель преломления золота п в зависимости от длины волиы X.:
X, мкм
0,188
0,199
0,249
0,301
■
1,28
1,33
1,33
1,53
X, мкм
0,397
0,496
0,617
0,821
п
1,47
1,04
0,21
0,16
К мкм
1,087
1,215
1,393
1,610
1,937
п
0,27
0,35
0,43
0,56
0,92
Примечание Пленка толщиной 0,025—0,05 мкм.
Показатель поглощения х в зависимости от длины волны
X, мкм
0,188
0,199
0,249
0,301
0,397
0,496
X
1,19
1,25
1,63
1,89
1,95
1,83
0
0
1
1
1
1
мкм
,612
,821
,087
,216
,393
,610
X
3,27
5,08
7,15
8,145
9,52
11,21
К
1
3
4
6
8
МКМ
,937
,0
,0
,0
,0
X
13,78
17,6
23,2
34,5
44,0
Механические свойства
Золото — малопрочный, легко деформируемый металл.
Временное сопротивление золота при комнатной температуре (JB=
= 135—140 МПа, относительное удлинение 6 = 50%, НВ = 245-^-250 МПа.
Твердость по Виккерсу HV в зависимости от температуры:
т, °с . . . .
HV, МПа . .
. 25
. 216
200
18!
400
157
600
73,6
800
39,2
900
24,5
Микротвердость чистого золота при комнатной температуре 600 МПа;
при нагреве снижается до 367 МПа при 300 °С и до 152 МПа при 400 °С.
Модуль нормальной упругости Е у золота высокой чистоты в зависимо-
зависимости от температуры:
т,
Е,
иС . .
ГПа .
25
. 77,5
600
61,8
800
54
1000
45
В процессе пластической деформации золото упрочняется очень сла-
слабо из-за большой склонности к рекристаллизации в процессе деформи-
деформирования. Температура рекристаллизации близка к комнатной. Небольшие
добавки @,1—0,25 °/о) меди, серебра значительно повышают темпера-
температуру рекристаллизации. Сжимаемость золота х = 0,617- Ю-1' Па^1.
Химические свойства
Наиболее характерная степень окисления золота +3; известны соедине-
соединения золота со степенями окисления +1 и +2.
Золото — малоактивный в химическом отношении металл, нормаль-
83
ный электродный потенциал реакции Аи3+ + 3е—'•Аи при 298 К фо=
= 1,498 В. Для одновалентного золота Au++e—'•Аи, при нормальных
условиях этот потенциал составляет 1,962 В. В ряду напряжений метал-
металлов золото располагается правее водорода, причем дальше всех осталь-
остальных металлов. Поэтому в растворе соляной, серной и других кислот при
отсутствии окислителей золото ие растворяется. Хорошо растворяет зо-
золото смесь кислот, состоящая из 1 объема азотной кислоты и 3—4 объе-
объемов соляной («царская водка»). На воздухе золото не изменяет своего
цвета и не взаимодействует с кислородом даже при нагревании до 400 "С.
При обычных условиях поверхность золота покрыта тончайшим адсорби-
адсорбированным слоем кислорода, однако непосредственно, даже при нагреве,
золото не соединяется не только с кислородом, ио и с серой, и селеном.'
Оксид АигО и оксид Аи2О3 могут быть получены только косвенным
путем.
С водородом золото ие реагирует даже при высоких температурах.
Однако летучие гидриды типа АиН образуются в небольших количест-
количествах и при обдувке золота струей водорода при температурах выше 1425 °С.
Воздействуя на золото атомарным водородом, удается получить бес-
бесцветный твердый гидрид, который очень неустойчив. Водород крайне
незначительно растворяется в твердом золоте. Максимальная раствори-
растворимость при 900°С составляет ~8-10-4%.
При воздействии аммиака на водную суспензию Аи2О образуется
соединение АизЫ-ЫН3, которое после промывки разбавленной азотной
кислотой переходит в Au3N-H2O. В сухом состоянии оба соединения
взрывоопасны.
Золото не реагирует с углеродом даже при высоких температурах.
Соединение золота с этим элементом может быть получено косвенным
путем — воздействием ацетилена на раствор тиосульфатного комплекса
золота, при этом образуется желтый карбид Аи2С2, точнее ацетилид зо-
золота, который крайне взрывоопасен.
Золото реагирует с хлором, бромом и иодом. Реакция с бромом про-
протекает при комнатной температуре с образованием бромида AuBr-) С су-
сухим хлором и иодом золото вступает в реакцию только при нагревании,
при этом образуется хлорное золото АиС13. Теплоты образования АиС13
и АиВг3 соответственно равны 117,08 и 54,15 кДж/моль. В водном
растворе хлора (хлорной воде) золото легко растворяется.
Еще более активно, чем ионы хлора, действуют на золото ионы CN~.
В их присутствии золото окисляется даже кислородом воздуха. Этот
процесс лежит в основе получения золота цианидным выщелачиванием
из золотоносной руды. Со своими ближайшими аналогами — серебром и
медью — золото образует непрерывные твердые растворы, аналогичный
характер взаимодействия наблюдается при сплавлении золота с некото-
некоторыми элементами VIII группы — платиной и палладием. В системах зо-
золото— медь и золото — платина непрерывные твердые растворы суще-
существуют лишь при высоких температурах, при понижении температуры
наблюдается их распад с образованием упорядоченных металлических
соединений, так называемых фаз Курнакова. Золото образует ряд метал-
металлических соединений (ауридов) с электроположительными и переход-
переходными металлами ПА, ША, IVA, VIIA и VIIIA подгрупп. Ограниченные
твердые растворы и металлические соединения золото образует со мно-
многими элементами, более электроотрицательными по сравнению с иим.
Так, золото образует широкие области ограниченных твердых растворов
с металлами ПА подгруппы (цинком, кадмием, ртутью), ША подгруп-
подгруппы (алюминием, галлием, индием), IVA подгруппы (германием, оловом,
свинцом) и VA подгруппы (мышьяком, сурьмой). За пределами раство-
растворимости в этих системах образуются соединения, имеющие во многих
случаях переменные составы.
84
Характерная черта золота — большое разнообразие во взаимодействии
с другими элементами Периодической системы, связанное с образованием
твердых растворов и большого числа металлических соединений различ-
различного состава, с различной кристаллической структурой и различной при-
природой химической связи. Все это обусловливает возможность создания
на основе золота большого числа сплавов различного назначения.
Технологические свойства и области применения
Из золота марок Зл999,9 и Зл999 изготовляют полуфабрикаты в виде
полос, ленты, проволоки. Технология выплавки и последующего произ-
производства полуфабрикатов ие имеет каких-либо специфических особенно-
особенностей, так как чистое золото, а также большинство сплавов на его осно-
основе высокопластичные и технологические материалы.
Отечественная промышленность производит сплавы золота с различ-
различным количеством серебра, обладающие высокой коррозионной стойкостью
в различных агрессивных средах и хорошей электрической проводимо-
проводимостью. Их состав регламентируется ГОСТ 6835—80.
Химический состав золото-серебряных сплавов, %:
Марка
ЗлСр990—10
ЗлСр750—250
ЗлСрбОО—400
ЗлСр583—417
Ам
99,0±0,3
75,0±0,3
60,0±0,3
58,3 + 0,3
РЬ
0,003
0,005
0,005
0,005
Fe
0,05
0,18
0,18
0,18
Sb
0,005
0,005
0,005
0,005
Bi
0,005
0,005
0,005
0,005
Всего
0,1
0,28
0,28
0,28
Примечание Остальное Ag.
Сплавы золота с медью гораздо более прочны, чем сплавы с сереб-
серебром. Они обладают высокой упругостью и твердостью. Согласно
ГОСТ 6835—80 изготовляют две марки сплавов системы золото — медь
Их химический состав, %:
Марка
ЗлМ
98
58
Аи
,0±0
,3±0
,3
,3
0
0
РЬ
,005
,005
0
0
Fe
,01
,18
0
0
Sb
,005
,005
0
0
Bi
,005
,005
Всего
0,2
0,28
Примечание. Остальное Си.
Большое промышленное значение имеют сплавы тройной системы
золото — серебро — медь (ГОСТ 6835—80), которые применяют в элек-
электротехнической промышленности, ювелирном деле.
Высокой технологичностью, хорошим сопротивлением истиранию и
износу обладают сплавы золота с платиной и палладием. В нашей стра-
стране изготавливают четыре марки сплавов золота с платиной, содержащих
2, 5, 7 и 10 °/о Pt (ЗлПл2, ЗлПлб и т. д.) и три марки сплавов золота
с палладием, содержащих 16, 20 и 40 % палладия (ЗлПд16 и т. д.).
Сплавы золота с палладием широко используются для изготовления
электроконтактов и элементов термопар. В частности сплав ЗлПд40 имеет
85
по отношению к платине отрицательную т. э. д. с, равную 42 мВ при
273 К.
В стоматологии чаще всего используют сплавы, содержащие 75—90 %
волота, с добавками серебра и меди. Иногда в эти сплавы для повыше-
повышения их жидкотекучести вводят небольшое количество цинка и кадмия.
Состав некоторых зубопротезных сплавов, %:
Марка сплава
ЗлСрМ916
ЗлСрМЭОО
ЗлСрМ750
Аи
91,6
90,0
75,0
Ag
4,2
4,0
5—8,0
Си
4,2
6,0
9—14,2
са
0—5,0
Zn
0—0,8
П рочяе
0—8,0
Сплав ЗлСрМЭОО плавится при 1000 "С, имеет сгп = 260н-265 МПа,
твердость ИВ= 1370-н 1390 МПа.
Многие сплавы на основе золота широко применяются в качестве
припоев. Прежде всего следует упомянуть группу тройных сплавов сис-
системы Аи—Ag—Си, состав которых выбирают в зависимости от рабочей
температуры изделия и достижимой температуры пайки. Так, широко ис-
используемый в электротехнической промышленности припой марки
ПЗлМСр75 содержит 75 % Аи; 12,5 % Ag; 12,5 % Си и плавится в ин-
интервале температур (8904-900 °С). У припоев этой системы прослежи-
прослеживается определенная закономерность: по мере уменьшения содержания
золота снижается температура начала его плавления. Так, припой с
45 % Аи, 30—35 % Ag и 15—20 % Си, применяющийся в стоматологии,
плавится в интервале 690—820"С.
Определенное количество золота ежегодно расходуется на золоче-
золочение — покрытие золотом поверхности металлических и неметаллических
изделий в декоративных целях, а также в целях защиты от коррозии
и др. Существуют разные методы нанесения золота на поверхность:
гальваническое осаждение, катодное распыление, вакуумное осаждение,
покрытие сусальным золотом, газофазное осаждение и некоторые дру-
другие. Использование золота для различного вида покрытий и прежде все-
всего наносимых гальваническим осаждением непрерывно возрастает.
2. ЭЛЕМЕНТЫ
ВТОРОЙ ГРУППЫ
2.1. БЕРИЛЛИЙ П— 35, 81—921
Общие сведения и методы получения
Бериллий (Be) — легкий металл светло-серого цвета. Название элемен-
элемента происходит от греческого «берилл». Открыт в 1798 г. французским
химиком Л. Вокленом в минерале этого названия. Впервые бериллий
получен в 1828 г. независимо друг от друга Веллером и Бюсси путем
восстановления хлорида бериллия калием. В 1898 г. Лебо удалось по-
получить более чистый металл электролизом расплава, содержащего фто-
фториды калия и бериллия. Начало промышленного производства металла
относится к 30—40 гг. XX в.
Содержание берилия в земной коре 6-10~4 % (по массе).
86
Известно около 40 минералов, содержащих бериллий. Наиболее рас-
распространенные: берилл (~14% ВеО), хризоберилл (до 20% ВеО),
бертраидит (до 42 % ВеО), фенокит D6 % ВеО), гельвин A3,6 % ВеО),
барилид A5 % ВеО), эвклаз A7 % ВеО).
Бериллиевые концентраты перерабатывают в оксид или гидроксид
бериллия, из которых получают фторид или хлорид бериллия. Металли-
Металлический бериллий получают либо восстановлением фторида бериллия маг-
магнием, либо электролизом из хлоридного электролита.
При первом способе бериллий содержит 0,05—0,1 % Fe; 0,02—
0,03 % АЮ; 0,01—0,03 % Si; 0,01—0,02 % Мп; 0,03—0,05 % Mg;
0,003—0,005 % Си; 0,003—0,005 % Ni; при втором после вакуумного пе-
переплава 0,007 % Fe; 0,003 % AI; 0,02—0,03% Si; 0,003 % Ni; 0,002 Се;
0,002 % Си; 0,03 % Са.
Для получения бериллия более высокой чистоты его подвергают дис-
дистилляции в вакууме, зонной плавке и электролитическому рафинирова-
рафинированию. В нашей стране разработан способ получения высокочистого
(>99,9%) и ультрамелкозернистого (<10мкм) металлического берил-
бериллия, обладающего высокой технологичностью. Заготовки получают ме-
методами порошковой металлургии — горячим прессованием порошков при
1140—1180°С, полуфабрикаты и изделия — выдавливанием.
Бериллиевый прокат выпускают в виде прутков, труб и листов. Го-
рячепрессованные прутки выпускают диаметром от 20 до 200 мм, дли-
длиной до 1800 мм. Временное сопротивление разрыву прутков, отожжеи-
иых при 800 ±20°С в течение двух часов, составляет 550—700 МПа,
относительное удлинение >5 %. Трубы поставляются длиной до 1800 мм,
наружным диаметром от 100 до 260 мм с толщиной стенки от 10 до
50 мм. Механические свойства такие же, как и в случае прутков. Плас-
Пластины выпускаются толщиной от 0,8 до 1,0 мм, шириной 12 мм при дли-
длине от 20 до 54 мм.
Листы поставляются толщиной от 2 до 12 мм, шириной 300—700 мм,
длиной 400—1000 мм. Временное сопротивление разрыву горячекатаных
и отожженных листов равно 400—500 МПа, относительное удлинение
>4%.
Бериллий и его соединения весьма токсичны. Особенно опасны его
летучие соединения, а также образующаяся при обработке пыль, вызы-
вызывающие кожные заболевания и заболевания органов дыхания (берил-
лиоз).
Средняя концентрация бериллия в воздухе не должна превышать
2 мкг/м3, а вблизи предприятия 0,10 мкг/м3. При всех операциях при
работе с сухими порошками должна быть обеспечена полная герметиза-
герметизация с небольшим разрежением B6,6-10~4 МПа). Процессы должны быть
автоматизированы. Пары, газы и другие отходы обрабатываются для
очистки их от бериллийсодержащих веществ. Работающие с бериллием
должны быть обеспечены спецодеждой и бельем, которое следует менять
два раза в неделю, респираторами-«лепестками» и очками.
Физические свойства
Атомные характеристики. Атомный номер 4, атомная масса 9,013 а. е.м,
атомный объем 4,89-10~6 м3/моль. Атомный радиус 0,113 им, ионный
радиус 0,034 нм. Потенциалы ионизации J(sB) : 9,32 и 18,21. Электроот-
Электроотрицательность 1,5. Кристаллическая решетка гексагональная плотноупа-
кованная с периодами а=0,22860 нм и с=0,35840 нм; с/а— 1,5671; ми-
минимальное межатомное расстояние 0,222 им; координационное число 6;
6 конфигурация внешних электронов 2s2. Энергия кристаллической ре-
решетки 321,6 мкДж/кмоль. При 1254°С гексагональная а-модификация
переходит в кубическую р. Период решетки Р-модификации при 1254 "С
87
равен 0,25515 нм, а при 1280 °С — 0,25543 нм. При этом скачкообразно
изменяется удельный объем и резко увеличивается электрическое сопро-
сопротивление. В природе изотопы бериллия не обнаружены.
Свойства радиоактивных изотопов:
Массовое
число
6
7
8
9
10
11
Атомная
масса
6,022
7,019
8,008
9,0122
10,017
11,028
Энергия связи
на нуклон,
МэВ
4,41
5,33
7,02
6,42
6,45
5,69
Период полураспада
0,4 с
53 сут
10-" с
Стабилен
2,5-10е года
—
Энергия излучения,
МэВ
_
V, 0,453—0,485
Y, 0,055
Стабилей
Р, 0,56—0,65
—
Эффективное поперечное сечение захвата тепловых нейтронов 0.0090Х
ХЮ~28 м2, эффективное поперечное сечение захвата рентгеновских лу-
лучей 20-10~28 м2, эффективное поперечное сечение рассеяния 7,54-10~28 м2.
Работа выхода электронов сро=3,92 эВ.
Плотность при 298 К р = 1,8477 Мг/м3. Высокое давление незначи-
незначительно сказывается на плотности. При комнатной температуре и давле-
давлении 4 ГПа она равна 1,912, а при 8 ГПа— 1,955 Мг/м3. Это объясняет-
объясняется большой компактностью кристаллической решетки бериллия по срав-
сравнению с другими элементами.
Плотность р в зависимости от температуры:
т, к . .
р, Мг/м3
473
1,837
673
1,820
873
1,800
1073
1,779
1273
1,756
1556
1,690
Плотность р и атомный объем v
симости от температуры:
т. к
1556
1800
2000
2200
р. Мг/м3
1,690
1,662
1,639
1,616
V 10", М3/МОЛЬ
5,337
5,426
5,503
5,581
жидкого бериллия (99,
т, К
2400
2600
2750
р, Мг/м"
1,593
1,569
1,552
8 %) в зави-
и-Ю", м'/моль
5,661
5,748
5,811
Электрические и магнитные. Удельная электрическая проводимость
сг и удельное электрическое сопротивление р бериллия (чистота 96,5 %)
в зависимости от температуры.
Т, К . . •
а, МСм/м .
р, мкОм-м
30
25
0,04
293
15,2
0,066
600
6,25
0, ШО
1000
3,14
0,320
Температурный коэффициент электросопротивления при 273—373 К
a = 3,6>10~3 К. Абсолютный коэффициент т. э. д. с. при 298 К е=
=—3,3 мкВ/К, при Гс = 0,03 К бериллий обладает сверхпроводимостью.
Наибольший Коэффициент ВТОрИЧНОЙ ЭЛеКТрОННОЙ ЭМИССИИ (Jmax = 0,53
при ускоряющем напряжении первичных электронов 0,2 кэВ. Посгояь'лая
Холла при комнатной температуре #=+7,7-10-10 м'/КХ Магнитная
восприимчивость при 293 К % — — Ы0"9.
Тепловые и термодинамические. Температура плавления /ГЛ=1287°С,
температура кипения <кип=2450°С, характеристическая температура по
упругим постоянным 9d=1060 К, по теплоемкости 0d=1OOO К; темпе-
температура полиморфных превращений а=г±|3 1254 °С. Теплота плавления
Д//пл = 1625 кДж/кг, удельная теплота испарения Л//Исп=34395,1 кДж/
/кг, удельная теплота сублимации ЛЯСуб1 = 36714,7 кДж/кг.
Бериллий обладает высокой удельной теплоемкостью ср =
= 1826 Дж/(кг-К); по другим данным, она равна 2100 Дж/(кг-К).
Теплоемкость при температуре ниже 20 К и р=0,1013 МПа:
Г, К 1 2 4 6 10
ср,Дж/(кг-К) . . • 0,02512 0,51078 0,10927 0,18003 0,39816
Удельная теплоемкость ср в зависимости от температуры:
Г, К 293 373 473 573 773 973
ср, Дж/(кг-К)- • • . 1976 2081 2215 2353 2621 2889
Электронная теплоемкость бериллия СрЛ=0,21 мДж/(моль-К2) -Т.
Теплопроводность в зависимости от температуры:
Г, К ... 20* 60* 95* 373** 573** 773** 973** 1273**
\,Вт/(м-К) 2930,0 2005,0 1464,0 179,0 152,0 119,0 93,0 81,0
• Монокристалл. ** Бериллий, содержащий примеси алюминия и магния в
сумме 1,264 %.
Температурный коэффициент линейного расширения в интервале
B93—473 К) ацс=12-10"в К в зависимости от температуры:
Г, К 373 473 573 773 973
а-10е, К-1 12 13 14,5 16 17
Для бериллия, содержащего 1,264 % (Al + Mg):
Т, К ........ 293 373 573 773 973 1173 1373
a-W, К-1 13,9 14,3 16,0 16,7 17,7 18,7 19,6
Молярная энтропия s° в зависимости от температуры:
Т, К 298 500 1000 1500 2000 2500 3000
s°, Дж/(моль-К) • • 9,54 19,51 36,55 48,56 65,18 72,22 184,30
Поверхностное натяжение жидкого бериллия при 1553 К ст=
= 1145 мН/м.
Давление пара р бериллия в зависимости от температуры:
Т, К • • • 1000 1200 1400 1600 1800 2000
р, Па . . 3,62-Ю-о 2,39-Ю-3 2,41-Ю-1 7,26 9,18-10 6,90-Ю2
Давление пара при температуре плавления р = 4,26 Па.
Приведенный термодинамический потенциал Фт в зависимости от тем-
температуры:
89
г, к
298
500
1000
1500
Фг (газ)
Дж/(моль-К)
9,546
11,67
20,180
27,716
136,28
138,62
146,87
153,19
г, к
2000
2500
£000
ФТ
4>г (газ)
Дж/(моль.1<)
35,797
42,412
56,856
158,17
162,19
165,58
Параметры самодиффузии (по объему зерна):
Бериллнй
Поликристалл
Монокристалл перпендикуляр-
перпендикулярно оси с
То же, параллельно оси с . .
г. к
923—1973
833—1343
833—1343
Д„-1О\ мг/с
0,36
0,52
0,62
Е, кДж/моль
156,2
147,5
164
Параметры взаимной диффузии (по объему зерна) некоторых эле-
элементов в бериллии:
Основной элемент
Be
Be, монокристалл
Be, J_ оси с
Be, II оси с
Be, _L оси с
Be, II оси с
Be (поликристалл)
Диффунди-
Диффундирующий
элемент
Fe
Fe
Си
Си
Ag
Ag
Ag
Г, К
973—1373
973—1343
—
923—1173
923—1173
923—1173
До]0\ м'/с
1,0
0,67
0,90
0,35
1,76
0,43
6,9
Е. кДж/моль
221,9
216
192,2
192,2
181
164,5
196
Примечание. Образующаяся фаза — твердый раствор.
Оптические свойства. Спектральный коэффициент излучения гладкой
поверхности бериллия е^=0,61 (длина волны Я=0,65 нм), для окис-
окисленного твердого бериллия е^=0,35 (длина волны /.=0,65 им).
Интегральный коэффициент излучения &т в зависимости от темпера-
температуры:
Г, К 380 450 562 682 785 906 1040
ег 0,046 0,052 0,049 0,059 0,081 0,116 0,177
Отражательная способность (коэффициент отражения пц):
К, мкм 0,066 0,066 0,124 0,124
пп, %
Угол падения
5
20
55
20
80
80
90
Продолжение
Показатель преломления п:
X, мкм
0,062* 0,124* 0,3629 0,7257
0,48 0,45 1,025 1,015
* Пленка толщиной 0,03 — 0,1 мкм
При Я = 0,06 мкм показатель поглощения (пленка толщиной 0,03—
0,1 мкм) х = 0,2, а при длине волны Л. = 0,124 мкм %=1,4.
Механические свойства
Механические свойства бериллия в зависимости от чистоты и обра-
обработки:
t, °C 20* 300** 800** 1000**
оВ; МПа ... 554 294 88 49
б, % 7,5 60 90 130
у, % — 60 90 —
* Литой, чистота 99,9 % ** Деформированный.
Временное сопротивление при сжатии монокристалла при 20 °С
о£ж=1957 МПа, а поликристалла при 899—а^ж =56,8 МПа, а дефор-
деформированного чистотой 99,9 % при 20 °С сг^ж=1462. При 20 °С бериллий,
полученный горячим прессованием из порошка при 1067 °С и отожжен-
отожженный при 817 °С, имеет (ТдЖ=1419 МПа в продольном направлении и
асвж = 1051 МПа — в поперечном.
Механические свойства бериллия в зависимости от температуры и
термической обработки:
t. °с
500
700
900
1060
1208
Выдавливание и обработка
резгнием
О"в, МПа
512
422
312
256
244
б, %
0,28
О.СО
0,45
0,39
0,44
Выдавливание, обработка
резанием и отжиг при 800° С
ав, МПа
361
333
361
365
352
б, %
3,30
2,74
2,47
2,38
3,80
91
Механические свойства литого (выдавленного) бериллия в зависимо-
зависимости от температуры и направления вырезки образца:
1. "С
6, %
20
200
400
600
800
226/136*
275/115
191/100
178/110
63,8/48,1
0,36/0,3*
13,2/1,1
29,0/3,0
20,8/1,2
25,6/9,6
-/-*
8,0/—
32,8/-
23,2/0,3
24,0/8,9
* В числителе — в продольном направлении, в знаменателе—в поперечном.
Механические свойства бериллия (хлопьевидного, выдавленного) в
зависимости от температуры и направления вырезки образца:
/, "С
20
400
600
800
ав, МПа
322/194*
212/157
93,2/77,5
31,4/40,2
6. %
0,55/0,3
14,8/1,9
10,6/2,5
9,1/0,3
t. %
—/ —
9,6/0,3
7,2/0,6
4,2/—
* В числителе — в продольном направлении, в знаменателе — в поперечном.
Механические свойства бериллия, полученного методом порошковой
металлургии (горячепрессованного в вакууме — А и горячевыдавленно-
го — Б), при комнатной температуре:
А Б
Временное сопротивление разрыву оа, МПа .... 316 573
Предел текучести при растяжении оъ,2, МПа . . . 225 277
Относительное удлинение б, % 2,3 15,8
Модуль нормальной упругости при растяжении Е,
ГПа 311 290
Предел текучести при сжатии о q*, МПа .... 172 266
Модуль объемного сжатия К, ГПа 309 293
Коэффициент Пуассона v 0,024 0,032
Предел прочности при кручении тв, МПа .... 272 567
Предел текучести при кручении То,з, МПа .... 128 99
Модуль сдвига G, ГПа 150 147
Угол закручивания до разрушения, град 145 390
Работа разрушения образца без надреза по Шарпи
при ударном изгибе, Дж 1,11 5,67
Работа разрушения образцов при ударном растяже-
растяжении, Дж ........ Г ........ 1.94 6,22
92
Скорость установившейся ползучести е в зависимостн от напряжения
О и температуры:
Горячепрессопаниые блоки
в вакууме
Литой в вакууме, выдавленный
в горячем состоянии
t, °c
427
427
427
427
427
537
537
537
677
677
677
677
732
732
732
732
а, МПа
56,9
69,7
85,3
103,0
123,6
28,4
34,3
36,3
13,7
15,7
18,6
21,6
4,5
6,7
7,5
9,5
E. %/C 1
7,8-10-8
1,55-10-'
1,3-10-»
1,4-10-e
3,9-10-5
2,8-10-'
2,8-10-e
1,7-10-6
2,5-10-'
5,0-10—в
1,9-10-6
7,8-10—5
1,0-10-'
2,0-IO-e
1.4-10-5
8,3-10-6
t, °c
500
500
500
700
700
700
500
927
927
927
927
927
1090
1090
1090
1090
О, МПа
34,3
50,0
66,7
5,9
7,4
26,5
42,2
0,34
0,54
1,5
3,4
5,4
0,07
0,34
0,69
2,94
2
2
2
2
2
2
2
2
2
2
2
2
2
2
2
2
E,
,8-
,8-
,8-
,8-
,8-
,8-
,8-
,8-
,8-
,8-
,8-
,8-
,8-
,8-
,8-
,8-
%/c
ю-8
10-'
10-8
10-'
io-e
ю-5
ю-4
10-'
10~6
ю-5
ю-4
10-e
!0-5
io-4
Ю-3
Твердость бериллия по Брииеллю при 20 °С в зависимости от чистоты:
Be, % .... 99,99 99,95 99,9 99,5 98,9
НВ, МПа . .600—650 1110 980* 1370—1570 1530
* По другим данным 590—640 МПа.
Твердость бериллия чистотой 99,5 % в зависимости от температуры:
t, °C 20 300 400 600 800 1000
НВ, МПа . . . 1370—1570 863 883 598 206 88,3
HV МПа . . . 1670 — 1080 589 314 98,1
Механические свойства бериллия после облучения прн 703 К (флюенс
быстрых нейтронов 1025 м~2):
'„си' °С
25
200
300
430
600
340/670
300/560
270/400
190/350
130/190
3/0
35/5
45/26
40/25
17/5
Примечание. В числителе — до облучения, в знаменателе — после.
Облучение повышает прочность н снижает пластичность.
93
—273
317,5
-173
317,4
—73
315,9
27
311,1
200
281
400
272
600
262
750
254
Твердость бериллия чистотой 99,5—99,7 при 20 °С HRC 62—72.
Твердость НВ бериллия при 20 °С в зависимости от способа получе-
получения, МПа:
Литье в вакууме 1070—1250
Выдавливание 1160—1210
Литье с последующим выдавливанием в вакууме . . 1060
Выдавливание из стружки 1120
ч> из чешуйчатого металла 1320
Микротвердость бериллия по Кнуппу 260 МПа.
Микротвердость Н^ бериллия при различных нагрузках:
Нагрузка, Н . . . . 0,05 0,10 0,20 0,50 1,00 2,00 5,00
Яд , МПа 3960 4030 3850 3600 3470 3160 3000
Ударная вязкость при 20°С сн= 13,54-69,4 Дж/м2. Модуль нор-
нормальной упругости монокристаллов £■ ц с =370, £хс =280 ГПа.
Анизотропия £: в направлении прокатки £ = 305 ГПа, в поперечном
направлении £ = 313 ГПа, в направлении, нормальном к плоскости про-
прокатки, £=353 ГПа.
Модуль нормальной упругости £ в зависимости от температуры:
(, °С
Е, ГПа. .....
Модуль нормальной упругости £ прн 20 °С для монокристалла
<111> 229 ГПа, для <1010> 266 ГПа, а для <0001> 297 ГПа.
Сжимаемость у., по разным данным, @,78—0,93)-10-" Па~'.
Коэффициент Пуассона v = 0,05.
Скорость распространения звука 12600 м/с.
Бериллий склонен к хрупкому разрушению и обладает повышенной
чувствительностью к надрезу.
Химические свойства
Нормальный электродный потенциал реакции Be—2е=»±Ве2+ <ро = —1,7 В.
В соединениях проявляет степень окисления +2.
При обычных температурах и до 600 °С бериллий устойчив на воз-
воздухе, так как покрывается тонкой пленкой ВеО; при 700 °С начинается
окисление и с 800—1000 °С этот процесс протекает довольно быстро.
С водой бериллий практически не реагирует.
Выше 650 °С бериллий взаимодействует с азотом, образуя нитрид
BeN2, который может также образоваться при взаимодействии порошко-
порошкообразного элемента с аммиаком A000 °С) и с цианом (800 °С). Водород
до точки плавления не реагирует с бериллием, однако при термическом
разложении B000°С) бериллийорганических соединений образуется
ВеНг. С углеродом бериллий образует карбиды Ве2С и ВеСг. При горе-
горении порошка бериллия в кислороде образуется ВеО. В сухом кислороде
при давлении в несколько десятков мегапаскалей бериллий стоек до
650 °С, во влажном кислороде и водяном паре — до 600 °С, в углекис-
углекислом газе — до 700 °С.
Бериллий реагирует с серной и соляной кислотами, а также с разбав-
разбавленной азотной кислотой, в то время как концентрированная азотная
кислота практически не воздействует на бериллий. При взаимодействии
с растворами щелочей выделяется водород.
С фтором бериллий образует фторнд BeF2, с хлором — хлорид ВеС12,
с бромом — бромид ВеСгг, с иодидом — иодид Ве1г.
94
При взаимодействии с фосфором и мышьяком образуются фосфидг
и арсениды. С серой бериллий образует сульфид бериллия BeS. Боль-
Большинство солей бериллия, в том числе и сульфат, хорошо растворимы в
воде.
В расплавленном состоянии бериллий растворяет почти все металлы.
В расплавленных литии, натрии и калии он устойчив до 600 °С, при бо-
более высоких температурах начинает растворяться. При высоких темпе-
температурах взаимодействует с большинством металлов, образуя берилли-
ды. При взаимодействии с алюминием, кремнием дает эвтектики. Раство-
Растворимость примесных элементов мала.
Электрохимический эквивалент 0,046 мг/Кл.
Технологические свойства
При комнатной температуре бериллий хрупок. Изделия из бериллия по-
получают выдавливанием, прессованием, прокаткой, ковкой и штамповкой
в горячем состоянии. Прутки, трубы и профили получают горячим вы-
выдавливанием в защитных оболочках из низкоуглеродистой стали. Горя-
Горячее прессование проводят при 500—1100°С; при 510°С требуется давле-
давление 39,4 МПа, а при 1100°С — 0,5— 1 МПа. Тонкие листы н фольгу тол-
толщиной до 0,02 мм получают теплой прокаткой с промежуточными отжи-
отжигами. Проволоку диаметром <0,03 мм получают волочением.
Области применения
Малая плотность, высокая температура плавления, необычайно высокий
модуль упругости, уникальная теплоемкость и высокие значения электри-
электрической проводимости и теплопроводности обусловили использование
бериллия в различных областях новой техники. В ядерной технике ои
приобрел большое значение как замедлитель н отражатель тепловых
нейтронов и как конструкционный материал. Широко применяется бе-
бериллий в точных приборах, в частности в системах наведения и управ-
управления, авиационной технике, где от материала требуется высокая раз-
размерная стабильность. Склонность к хрупкому разрушению, повышенная
чувствительность к надрезу, недостаточная вязкость (вязкость разру-
разрушения промышленных сортов бериллия Kic = 9,5^-22 МПа-м'''*, анизо-
анизотропия механических свойств, плохая свариваемость, токсичность и вы-
высокая стоимость ограничивают применение бериллия.
Бериллий применяют для легирования различных сплавов. Алюми-
Алюминиевые сплавы с бериллием находят применение в авиационной и ракет-
ракетной технике.
Медные сплавы, легированные бериллием, так называемые бериллие-
вые бронзы, обладают высоким сопротивлением усталости и износу при
высоких температурах; их используют для изготовления пружин, шасси
самолетов, неискрящих инструментов.
В качестве огнеупорного материала для изготовления тиглей исполь-
используется оксид бериллия.
2.2. МАГНИЙ [1—35, 38, 93—106]
Общие сведения и методы получения
Магний (Mg) — серебристо-белый металл. Свое название элемент полу,
чил по местности Магнезии в Древней Греции. Впервые был выделен в
1808 г. в виде амальгамы из оксида магния англичанином Дэви. Метал-
Металлический магний получил в 1829 г. французский химик Бюссн, воздейст-
воздействуя парами кадия на расплавленный хлорид магния. Промышленное про-
95
изводство магния электролитическим способом было начато в Германии
в конце XIX в.
Теоретические и экспериментальные работы по получению магния
электролитическим способом в нашей стране были выполнены П. П. Фе-
дотьевым; процесс восстановления оксида магния кремнием в вакууме
исследовал П. Ф. Антипин.
Содержание в земной коре 2,1 % (по массе).
В свободном виде магний в природе не встречается, а находится в
виде силикатов, хлоридов, карбонатов и сульфатов. Для производства
магния главным образом используют магнезит, доломит и карналлит.
Магнезит (MgCO3) широко распространен в природе; содержит 40—
47 % MgO. Для производства магния используют высококачественный
магнезит с минимальным содержанием примесей. Чистый магнезит содер-
содержит 28,8 % Mg.
Доломит (CaCO3-MgCO3) содержит 18—25 % MgO. Чистый доломит
содержит 21,7 % Mg.
Карналлит (MgCl2'KCb6H?O) содержит 12—30% MgCl2; в чистом
карналлите 8,8 % Mg.
Металлический магний получают двумя способами: электролитичес-
электролитическим (около 70 %) и термическим (около 30 % общего производства).
Электролитический способ включает два основных процесса:
получение хлористого магния из исходного сырья и получение магния
из MgCb путем электролиза. Термические способы получения магния
(силикотермический, карбидно-термический) заключается в восстановле-
восстановлении его из обожженного магнезита или доломита. Первичный магний,
полученный путем электролиза или термическим способом, подвергают
рафинированию.
В соответствии с ГОСТ 804—72 в зависимости от химического соста-
состава установлены три марки первичного магния. Химический состав их
следующий:
£
Мг96
Мг95
Мг90
менее
я
1
99,96
95,95
90,90
0
0
0
Fe
,004
,004
,04
0
0
0
Si
,004
,004
,009
Примеси, °/
N1
0,002
0,0007
0,001
0
0
0
Си
,002
,003
,005
>
0
0
0
не более
А1
,006
,006
,02
0
0
0
Мп
,004
,01
,03
0
0
0
Na
,01
,005
,01
Ti
_
0,014
—-
ламен-
приме-
и
и*
ьп
0,04
0,05
0,1
Примечание. В магнин, идущем на изготовление магниеволнтвевых
сплавов, содержание натрня не должно быть более 0,005%. Калня и хлора в
мигнин всех марок — не более 0,005%, за исключением марки Мг96, в которой
массовая доля хлора ие должна превышать 0,003 %.
Магний поставляется в чушках массой 8,0±1,0 кг1. На торцы чушек
магния марок Мг95 и Мг96, отгружаемых без защитной смазки, масля-
масляной краской белого цвета наносят соответственно одну или две полосы.
1С целью снижения расходов на погрузо-разгрузочные операции
Березниковский титано-магниевый комбинат разработал технологию от-
отливки в водоохлаждаемые изложницы крупногабаритных чушек массой
245,25—294,3 кг,
96
Чушки транспортируют в крытых вагонах, контейнерах, автомашинах,
защищенных от атмосферных осадков; нх следует хранить в закрытых
вентилируемых складских помещениях.
В последние годы в СССР разработаны методы получения магния
повышенной чистоты (99,99 % Mg), что позволило повысить пластич-
пластичность и коррозионную стойкость этого металла и его сплавов. Для по-
полупроводниковых материалов и других целей освоено производство маг-
магния более высокой чистоты.
Отечественной промышленностью разработана технология получения
гранулированного магния. Жидкий металл разбрызгивается с помощью
вращающегося барабана с отверстиями. Получаются гранулы диаметром
0,5—2,5 мм, насыпной вес 8,34—9,31 Н; пикнометрическая плотность
1,7 Мг/м3; материал обладает хорошей сыпучестью и в отличие от по-
порошкового магния невзрывоопасен.
Физические свойства
Атомные характеристики. Атомный номер 12, атомная масса 24,32 а. е. м.,
атомный объем 14-10~в м3/моль, атомный радиус 0,162 нм, ионный ра-
радиус 0,074 нм. Электронная конфигурация 3s2. Первый потенциал иони-
ионизации 7=7,64 эВ. Электроотрицательность 1,2.
Магний обладает гексагональной плотноупакованной решеткой. Энер-
Энергия кристаллической решетки 150,2 мкДж/кмоль.
Кристаллическая структура магния:
Координационное число 6+6
Период решетки при 26 °С, нм:
а 0,3202
с 0,5199
Отношение с/а 1,623
Межатомное расстояние, мн:
rf, 0,31906
rf2 0,32030
Атомный диаметр для координационного чис-
числа 12 0,520
Для магния характерно перекрытие первой и второй зон Бриллюена.
Природный магний состоит из трех изотопов: 24Mg G8,60 %), 25Mg
A0—11 %) н 26Mg A1,29%). Эффективное поперечное сечение захвата
тепловых нейтронов 0,059-10~2S м2. Работа выхода электронов ф =
-3,64 эВ.
Плотность магния чистотой 99,9—99,99 °/о в литом состоянии при
20 °С р= 1,737 Мг/м3, деформированного р= 1,7388, а жидкого (при тем-
температуре плавления) р= 1,572ч-1,600 Мг/м3. По мере снижения содер-
содержания примесей в магнии плотность его уменьшается.
Плотность р магния различной чистоты при 20 °С:
щ. %
99,99
99,95
99,94
99,90
99,90
р, Мг/м3
1,7388
1,7387
1,7386
1,7381
1,7370
Состояние
Деформированный
»
»
»
Литой в землю
97
Плотность жидкого магния в зависимости от температуры:
Г, К • •
р, Мг/м3
921 953
1,580 1,582
983
1,582
1023
1,569
1043
1,564
1068
1,560
1078
1,559
1173
1,555
Электрические и магнитные. Удельная электрическая проводимость
магния о составляет 38,6 % от электрической проводимости меди при
293 К, 0=25 МСм/м.
Удельное электросопротивление магния при 293 К р = 0,043-т-
-нО,О47 мкОм-м. Небольшая анизотропия электросопротивления магния
связана с кристаллической ориентацией. Электрическое сопротивление
р зависит от состояния (литое, деформированное), что видно из следу-
следующих данных, мкОм-м:
Литой . . .
Прессованный
Катаный . .
0,0436—0,0449
0,0443—0,0460
0,0450—0,0477
Удельное электрическое сопротивление в зависимости от температуры:
Г, К ...
р, мкОм-м
81
0,01233
95
0,03053
273
0,04312
Т, К ...
р, мкОм-м
473
0,07576
573
0,09536
373
0,05915
Продолжение
673
0,11893
Температурный коэффициент электрического сопротивления в интер-
интервале 273-398 К а=3,9-М,3- Ю-3 К.
Абсолютный коэффициент т. э. д. с. е=—1,2 мкВ/К при 298 К.
Коэффициент вторичной электронной эмиссии атах=0,95 при ускоря-
ускоряющем напряжении первичных электронов 0,300 кэВ. Постоянная Холла
при комнатной температуре /? = 0,9 • 10—|0 м3/Кл. Ширина запрещенной
зоны при 200 °С для монокристалла Д£=0,69 эВ. Металлический магний
обладает парамагнитными свойствами: магнитная восприимчивость
Х=+0,5-10-9.
Тепловые и термодинамические. Температура плавления /M=650±
± 1 °С, температура кипения ^Кип = 1107±3 СС; с понижением давления
температура кипения снижается и при остаточном давлении 0,33 кПа
магний полностью испаряется (сублимирует). Характеристическая тем-
температура по упругим постоянным 6d=385,9 К, а по теплоемкости 406 К.
Удельная теплота плавления ДЯПЛ=357 кДж/кг, удельная теплога ис-
испарения при температуре кипения Д/Л,сп = 5498 кДж/кг, удельная тепло-
теплота сублимации Д#субл = 6120 кДж/кг, удельная теплоемкость в интерва-
интервале 293—373 К ср = 1047,5 Дж/(кг-К).
Теплоемкость магния при различных температурах:
т, к
20
40
80
150
V
Дж/(моль К)
0,36
3,36
12,47
20,40
V
Дж/(кг.К)
14,80
138,15
512,746
838,8
т, К
250
400
600
V
Дж/(моль-К)
23,93
26,3
28,6
Дж/(кг.К)
983,96
1081,41
1175,98
98
Удельная электронная теплоемкость ср = [1,3 мДж/(моль-К2)] -Т,
Теплопроводность X в зависимости от температуры:
Т К 293 373 573 673 923 973 1073 1273
к, Вт/(м-К) ... 167 167 163 130 78 81 88 100
Температурный коэффициент линейного расширения а:
Г, К 293—373 293—573 293—673 293—773
а-10", К 26 27,9 28,9 29,8
Коэффициент объемного расширения в твердом состоянии B73—
583 К) 13=82,5-10-в Кг1, а в жидком (924—1073 К) C=380-10-6 К.
Молярная энтропия при 298 К s°=113,04 Дж/(моль-К). Поверхностная
энергия v=728 мДж/м2. Энергия дефекта упаковки 310 мДж/м2.
Поверхностное натяжение магния <т при 681 °С составляет 563 мН/м,
а при 894 °С—502 мН/м. Поверхностное натяжение снижается при до-
добавке в магний щелочных и щелочноземельных элементов — кальция,
строицня, бария, лития, а также сурьмы, свинца и висмута. Особенно
заметно это снижение при введении этих элементов в количестве 0,2—
0,3% (ат.).
Динамическая вязкость х\ магния в жидком состоянии:
Т, К. 923
т), мПа-с 1,32
973 1073 1173
1,10 0,84 0,87
Магний обладает давлением пара, которое при температуре плавле-
плавления равно -3,325- Ю-2 Па, а при 1223 К 2,32 Па.
Параметры самодиффузии (предэкспоненциальный множитель Da и
энергия активации Е) магния (по объему зерен):
Состояние металла
Поликристалл ....
Монокристалл
Mg, II оси с
Монокристалл
Mg, ± оси с
т, к
743—G08
741—908
741—908
£>„ 10', м!/с
1,0
1,0
1,5
Е, кДж/(моль)
134
134,81
136,07
Параметры взаимной диффузии магния (по
Диффунди-
Диффундирующий
элемент
Не*1
Bet2
N*3
Аг*1
7, К
503—843
773—97 {
>773
503—843
Образующая фаза
Твердый раствор
» »
» »
» »
объему зерна):
Do, mVc
50- Ю-4
8,06-Ю-4
2,2
1
С, кДж/моль
166,4
156,5
97,5
216,7
*' Метод испаре ия в вакууме. ''Радиоактивный метод. •' Химический метод.
99
Физические свойства монокристаллов магния:
II с
£*, ГПа 51,300
р, мкОм.м 0,0385
а-106 в интервале, К:
293-373 26,4
373—473 28,7
Т. э. д. с.** £-106, мВ 1,87
45,700
0,0455
25,6
27,4
1,85
* В плоскости базнса минимальный модуль нормальной упругости Е — в на-
правлении под углом 53°45' к гексагональной оси, равен 43,700 ГПа.
** Термоэлсктродвижущая сила в паре с медью при разности температур
I С
Оптические свойства. Спектральный коэффициент излучения гладкой
твердой поверхности (окисленной) е^=0,2, длина волны Х=0,65 им.
Отражательные свойства (коэффициент отражения nD) в видимой и
в инфракрасной областях спектра в зависимости от длины волны X:
X, мкм . . .
nD, % . . .
0,5 0,6
72 73
1,0 - 2,0
74 77
3,0 4,0 9,0
80 83 93
Показатели преломления п и поглощения х (монокристалл, свет по-
поляризованный параллельио оптической оси крнсталла):
)., мкм
0,6
0,7
0,9
1,0
1,5
п
0,08
0,08
0,13
0,1
0,48
т
2,40
2,72
3,15
3,86
5,72
к, мкм
1,8
2,0
3,0
3,4
п
2,
2,
1,
1,
52
55
34
50
X
6,
5,
9,
12,
61
36
27
27
Механические свойства
В литом состоянии магний имеет низкие механические свойства, которые
могут быть повышены нагартовкой.
Механические свойства в лнтом и деформированном состояниях при
комнатной температуре:
Состояние
Деформирован-
Деформированный
ов, МПа
120
200
оад.«П.
30
90
8
12
О/
,0
,0
♦.
9
12
%
,о
,5
НВ, МПа
300
360
кси,
кДж/мг
61,2
Механические свойства литого магния (стабилизированный при тем-
температуре испытанием 50 ч) прн повышенных температурах:
100
t, °C 100 200 250 300 350 400 450 500
ав> МПа . . . 93,0 56,0 41,0 25,0 14,0 8,5 5,0 3,5
б, % 18,0 28,0 40 58 72,0 80,0 78,0 81,0
Механические свойства деформированного (прессованного) магния
при повышенных и низких температурах:
t, °С
200
250
300
350
400
450
— 196
—253
о , МПа
25
20
16
12
5
4
—
V МПа
60
30
20
18
1
6
160
210
6. %
42,5
41,5
58,5
95,0
60,0
65,5
5,0
5
36,5
92,5
95,5
98,0
93,5
95,5
7,0
8
KSU, кДж/м2
230
500
1250
1700
_
—
Твердоеть НВ в зависимости от температуры:
t, °С . .
НВ, МПа
20
260
200
160
400
49,0
600
9,8
Микротвердость отожженного магния при 20 °С //^=313 МПа, а ли-
литого (чистота 99,8; 99,9 %) //^=480 МПа.
Ударная вязкость KCU магния прессованного и отожженного при
350 °С, 30 мин:
t, °С. • •
KCU, кДж/м2
20
61,2
100
85,8
200
233
300
490
Модуль нормальной упругости магния Е в зависимости от темпера-
температуры:
t, "С —273 —180 20 100 20Э 300 403 450 6
Е, ГПа 49,3 47,1 44,1 42.2 40,2 38,2 35,3 33,3 26,г>
Модуль сдвига G= 17,854 ГПа. Сопротивление срезу после отжига
Тср= 116,7 МПа. Предел выносливости отожженного магния при ба.к'
5-Ю8 циклов 0д = 61,8 МПа. Величина аЕ повышается при криогенных
температурах. Так, при понижении температуры с 20 до —253 "С ан
повышается с 49,3 до 137,3 МПа. Дальнейшее снижение температуры
до —269 °С мало сказывается на пределе выносливости: он увеличива-
увеличивается до 144,2 МПа. Понижение давления с 1,01 МО5 до 0,665 Па не
влияет на предел выносливости. При улучшении вакуума до 0,665X
ХЮ~3 Па долговечность резко возрастает, а при более высоком вакуу-
вакууме снова меняется незначительно.
Сжимаемость х = 2,89'10~и Па~', коэффициент Пуассона v = 0,35.
Скорость распространения звука в твердом магнии 4800 м/с, ульт-
ультразвука 5,8 м/с. Коэффициент затухания ультразвука в твердом магнии
(горячепрессованиом) при частоте колебания 10 мГц 35—75 дБ/м, а при
20 мГц 70—180 дБ/м.
Декремент затухания колебаний горячепрессованного магния (99,9 %
Mg) при амплитуде 3-10~4 равен 0,08—0,10.
101
Химические свойства
Нормальный электродный потенциал (фо) реакции Mg—2e**Mg2+ ра-
равен— 2,38 В (по отношению к нормальному электроду), —1,55 В (по
отношению к водородному) и —1,83 В (по отношению к каломелевому).
Степень окисления +2.
Магний — химически активный металл. На воздухе окисляется с об-
образованием на поверхности пленки оксида MgO, имеющей плотность
3,6 Мг/м3; при температурах ниже 450 °С она обладает защитными
свойствами. При более высоких температурах пленка становится не-
неустойчивой и разрушается. Дальнейшее повышение температуры может
привести к воспламенению магния. При нормальном давлении темпера-
температура воспламенения магния равна 623 °С.
Магний практически не взаимодействует с холодной водой, а кипя-
кипящую воду разлагает энергично. В морской и минеральной воде магний
разрушается. В водных растворах большинства минеральных кислот и
солей магний растворяется. Ионы хлора способствуют значительному
коррозионному разрушению магния в водных растворах. Сульфаты,
нитраты и фосфаты также усиливают коррозионные воздействия воды
на магний. Он легко корродирует (анодно растворяется) в кислых и
нейтральных растворах. При коррозии или анодной поляризации в ще-
щелочных растворах магний покрывается трудно растворимыми пленками.
Из органических соединений коррозионное воздействие на магний ока-
оказывают метиловый спирт, глицерин и гликоль.
По данным Г. В. Акимова, И. А. Розенфельда и М. А. Тимоновоп, с
увеличением рН коррозия замедляется, а при рН= 11 -т-12 практически
прекращается. Магний стоек в растворах плавиковой и хромовой кислот,
соды, едких щелочей, а также в бензине, керосине, этиловом спирте и
минеральных маслах. Поэтому его можно использовать для изготовле-
изготовления трубопроводов, баков, цистерн, для транспортировки и хранения
этих жидкостей.
Магний хорошо растворяет водород: при температуре кристаллиза-
кристаллизации (жидкий магний) в нем растворяется около 50 см3/Ю0 г, а в твер-
твердом— около 20 см3/Ю0 f. При 660—700 °С магний вступает во взаимо-
взаимодействие с азотом, образуя нитрид магния Mg3N2. Магний при темпера-
температуре 500—600 °С вступает во взаимодействие с серой, образуя сульфид
MgS. Медь, железо и никель сильно снижают коррозионную стойкость
магния. Поэтому содержание железа не должно быть более 0,04 %',
меди — более 0,005 % и никеля — более 0,001 %. Магний практически не
взаимодействует ни в жидком, ни в твердом состоянии с такими туго-
тугоплавкими переходными металлами, как хром, молибден, вольфрам, же-
железо и др., однако некоторые тугоплавкие переходные металлы — мар-
марганец, цирконий, никель и кобальт — растворяются частично в жидком
магнии и даже входят, правда, в небольшом количестве в твердый рас-
раствор на его основе.
Хорошо растворимы в магнии и в твердом, и в жидком состояниях
металлы с плотно застроенной d-оболочкой, к которым, например, отно-
относятся цинк, кадмий, свинец, олово, висмут, таллий, индий. Наибольшей
взаимной растворимостью отличаются магний и кадмий, у которых наи-
наименьшее различие в атомных диаметрах и строении электронных обо-
оболочек. Перечисленные металлы образуют с магнием ряд соединений, ко-
которые в случае металлов IV и V групп подчиняются правилам
валентности (например, Mg2Sn, Mg2Bi и др.). С металлами 11 и 111
ление коррозии уменьшается почти в пять раз.
102
групп магний образует фазы, для которых правило валентности уже не
соблюдается.
Взаимодействие магния с элементами III группы Периодической си-
системы элементов с недостроенными d-оболочками имеет некоторые осо-
особенности. В эту группу входят скандий, иттрий, а также редкоземель-
редкоземельные металлы и торий. Эти элементы образуют с магнием ряд промежу-
промежуточных фаз и хорошо растворяются в нем в жидком состоянии.
Диаграммы состояния этих элементов с магнием — эвтектического типа.
Растворимость в твердом состоянии этих элементов в магнии невелика
и обычно составляет 2—5 % (по массе), или 0,2—0,5 % (ат.).
Со щелочноземельными металлами (кальций, стронций, барий) и
особенно со щелочными металлами магний не образует значительной
области растворимости в твердом состоянии, что в основном связано с
большим различием атомных диаметров. Исключением из этого правила
является литий, атомный диаметр которого отличается от атомного
диаметра магния всего на 2 %. В системах магния с натрием и калием
имеются области несмешиваемости в жидком состоянии. Системы маг-
магния с медью (серебром и золотом) относятся к эвтектическому типу.
Закономерность растворимости меди и золота в магнии в твердом сос-
состоянии трудно установить, так как эти элементы почти не растворяются
в твердом растворе на основе магния. Растворимость серебра при тем-
температуре эвтектики 16 % (по массе).
Влияние некоторых сред иа коррозионную стойкость магния и его
сплавов:
Неорганические среды
Дистиллированная вода при температуре до 100 °С +
Пресная вода, морская вода, пар —
Чистая фтористоводородная кислота +
Чистая хромовая кислота +
Прочие кислоты (водные растворы) —
Фтористые соли щелочных металлов +
Хлористые соли (водные растворы) —
Хроматы и бихроматы (хромовокислые натрий и калий) . . , +
Гидроксиды щелочных металлов (NaOH при концентрации до
40 % при 120 °С) +
Сода +
Водные растворы сульфатов, за исключением сернокислого
аммония —
Сера в твердом, расплавленном и газообразном виде . . . . +
Сероуглерод +
Ртуть —
Фтор -f-
Хлор —
Органические среды
Муравьиная, уксусная, соляная, валерьяновая, пальмитиновая, сте-
стеариновая, щавелевая, виннокаменная, молочная, винная, ли-
лимонная кислоты —
Метиловый спирт —
Этиловый спирт +
Бутиловый спирт . , +
103
Глицерин , ...■, —
Гликоль и гликолевые смеси . . . , , , , , —
Уксусный и этиловый эфиры . . . , , -{-
Формальдегид, ацетальдегид , , , , —
Трихлоральдегид .... »•••■, —
Ацетон •••#■• +
Нефть, мазут, керосин, бензии, метай, этан . , , -f-
Трихлорэтилен, четыреххлористый углерод +
Каменноугольная смола н ее производные (беизол, толуол, ксилол,
фенол, крезол, иафталии, лизол) ,....+
Камфора, копаловые смолы , . , , , . -f-
Каучук, резина , , +
Жиры и масла, не содержащие кислот +
Водный раствор мочевины, холодный +
То же, теплый —
Целлюлоза, сахар (бескислотный раствор) +
Примечание. Знак « + » указывает, что магний и его сплавы не разру-
разрушаются под влиянием среды, знак «—«—разрушение магния н его сплавов.
Электрохимический эквивалент 0,12601 мг/Кл.
Технологические свойства
Литейные характеристики. Объемная усадка при кристаллизацл i 4,2 °/о,
в твердом состоянии в интервале 649—20 "С 2 %.
Магний склонен к возгоранию, поэтому плавку ведут в железных
тиглях под слоем флюса.
Магний в слитках, а также изделия из магниевых сплавов неогне-
неогнеопасны. Опасность может представить магний в виде стружки, порошка
или пыли. Взаимодействие воды с горячим и расплавленным магнием
сопровождается взрывом.
Магний характеризуется при комнатной температуре низкой, а при
повышенных температурах хорошей технологической пластичностью.
Поэтому его обработку ведут при повышенных температурах.
Температура начала рекристаллизации 85 °С, конца рекристаллиза-
рекристаллизации 200 °С.
Прессование магния и его сплавов ведут в интервале 300—480 °С
(в зависимости от состава сплава) с небольшими скоростями @,008—
0,05 м/с), прокатку — выше 340°С, заканчивая ее при 225—250 С. При
холодной прокатке магний подвергают промежуточным отжигам. Для
ковки и штамповки используют закрытые штампы и фигурные бойки.
Магниевые сплавы очень хорошо поддаются обработке резанием.
Мощность, требуемая для снятия одинакового объема металла, при об-
обработке магниевых сплавов в 1,5—2,5 раза меньше, чем при обработке
алюминиевых, и в 6—7 раз меньше, чем при обработке стали. При ме-
механической обработке магния и его сплавов скорость резания в семь раз
выше, чем в случае сталей, и в два раза выше, чем в случае алюминие-
алюминиевых сплавов.
Магний и его сплавы легко свариваются, особенно аргонно-дуговой
сваркой.
104
Области применения
Магний используют главным образом для получения сплавов на его
основе и для легирования алюминиевых сплавов.
Благодаря большому химическому сродству к кислороду магний
применяют в качестве раскислителя в производстве стали и цветных
сплавов, а также для получения трудно восстановимых металлов (тита-
(титана, циркония, ванадия, урана и др.) путем вытеснения их из соединений.
Магний используют также для получения высокопрочного модифициро-
модифицированного чугуна. Для этой цели его вводят в количестве 0,3—1,2 % в
расплавленный чугун.
В химической промышленности порошкообразный магний применяют
для обезвоживания органических веществ (спирта, анилина и др.), а
также для получения магиийорганических соединений. Его используют
при получении тетраэтилсвинца, тетраметила и других препаратов, при-
применяемых в качестве добавок к нефтепродуктам и в фармакологии.
Магний в порошкообразном виде и в виде ленты используют в пиротех-
пиротехнике, в фотографии для моментальных съемок, в военной технике. Маг-
Магниевый порошок добавляют в состав твердого ракетного топлива.
В последние годы на основе магния созданы сплавы с особыми фи-
физическими и химическими свойствами (аиоды для источников тока, зву-
копроводы для ультразвуковых линий задержки, сплавы с высоким
демпфированием, для протекторной и катодной защиты и др.).
2.3. КАЛЬЦИЙ [1—35, 107—109]
Общие сведения и методы получения
Кальций (Са) — серебристо-белый металл. Открыт английским химиком
Дэви в 1808 г., однако в чистом виде получен только в 1855 г. Бунзеном
и Матиссеном путем электролиза расплавленного хлористого кальция.
Промышленный способ получения кальция разработан Зутером и Ред-
лихом в 1896 г. на заводе Ратенау (Германия). В 1904 г. в Биттерфель-
де начал работать первый завод по получению кальция.
Свое название элемент получил от латинского calx (calcis) — известь.
Содержание кальция в земной коре 3,60 % (по массе).
В свободном состоянии в природе не встречается. Входит в состав
осадочных и метаморфических пород. Чаще всего встречаются карбонат-
карбонатные породы (известняк, мел). Кроме того, кальций содержится во мно-
многих минералах: гипсе, кальците, доломите, мраморе и др.
В известняке присутствует не менее 40 % углекислого кальция, в
кальците — 56 % СаО, в доломите — 30,4 % СаО, в гипсе — 32,5 % СаО.
Кальций содержится в почве и морской воде @,042 %).
Металлический кальций и его сплавы получают электролитическим и
металлотсрмичсскнм способами. Электролитические способы основаны
на электролизе расплавленного хлористого кальция. Получающийся
металл содержит СаС12, поэтому его переплавляют, а для получения
высокочистого кальция перегоняют. Оба процесса проводят в вакууме.
Кальций получают также методом алюминотермического восстанов-
восстановления в вакууме, а также термической диссоциацией карбида кальция.
Физические свойства
Атомные характеристики. Атомный номер 20, атомная масса 40,08 а. е. м.,
атомный объем 26,20- 10~в м3/моль, атомный радиус 0,197 нм, ионный
радиус (Са2+) 0,104 нм Конфигурация внешних электронных оболочек
Зре4А2. Значения потенциалов ионизации атомов /(эВ): 6,111; 11,87;
105
51,21. Электроотрицательность 1,0. Кристаллическая решетка г. ц. к. с
периодом а=0,556 нм (координационное число 12), переходящая около
460 °С в гексагональную с а=0,448 нм (координационное число 6;6).
Энергия кристаллической решетки 194,1 мкДж/кмоль.
Природный кальций состоит из смеси шести стабильных изотопов
D0Са, 42Са, 4SCa, 44Ca, 46Са, 48Са), из которых наиболее распространен
♦°Са (96,97 %). Остальные изотопы C9Са, "Са, 45Са, 47Са и «Са) об-
обладают радиоактивными свойствами и могут быть получены искусст-
иенным путем.
Эффективное поперечное сечение захвата тепловых нейтронов
0,44-10—28 и2. Работа выхода электронов ф = 2,70-н2,80 эВ. Работа вы-
выхода электронов для грани A00) монокристалла 2,55 эВ.
Плотность. Плотность кальция при 20 °С р== 1,540 Мг/м3, а при
480°С 1,520 Мг/м3, жидкого (865 °С) 1,365 Мг/мз.
Электрические и магнитные. Удельная электрическая проводимость
а и удельное электрическое сопротивление р кальция (чистота 99,96 °/о)
в зависимости от температуры:
Т,К 293 500 750 1100
а, МСм/м 25 13,9 8,9 3,8
р, мкОм-м 0,038* 0,072 0,112 0,264
* По другим данным 0,041.
Удельное электрическое сопротивление при 273 К в зависимости от
давления:
Р, ГПа. . , . 10 30 50 70 90 120
р, мкОм-м • . 0,0101 0,0103 Q.0105 0,0108 0,0111 0,0115
Температурный коэффициент электросопротивления при 273 К а =
= 3,33-Ю-3 К-', при 298—398 К а = 4,57-10-» К. Абсолютный коэф-
коэффициент т. э. д. с. е=8,2 мкВ/К при 298 К.
Максимальное значение коэффициента вторичной электронной эмис-
эмиссии 0тач=О,6О при ускоряющем напряжении первичных электронов
0,200 эВ. Постоянная Холла при комнатной температуре R ——1,78±
±0,05- Ю-10 м3/Кл. Магнитная восприимчивость х= + Ы0"', объемная
+ 21,35-10~в.
Тепловые и термодинамические. Температура плавления /Пл = 852°С,
температура кипения ^КИп=14840С. Характеристическая температура
6.0=220 К. Удельная теплота плавления А//пл=216,39 кДж/кг, удель-
удельная теплота испарения при температуре кипения Д#ИСп = 3830—
—4169 кДж/кг Удельная теплота сублимации Д//Субл = 4405,0 кДж/кг.
Удельная теплоемкость ср = 624 Дж/(кг-К.). Удельная электронная теп-
теплоемкость Cjf=[2,9 мДж/(моль-К2I-7\
Удельная
т. К
20
40
80
V
теплоемкость
Дж/(кг К)
39,6
194,1
426,8
в зависимости от
т, к
150
250
400
ср, Дж/(кг
747,7
625
683,6
температуры:
К)
т, к
600
1000
ср. Дж/(кг К)
763,0
990,5
106
Удельная теплоемкость жидкого кальция 795,5 Дж/(кг-К)-
Теплопроводность к при 273 К равна 98 Вт/(м-К), при температуре
273—373 К Я= 125 Вт/(м-К). Температурный коэффициент линейного
расширения при 273—373 К <х=22-10-6 К, объемный при 273 -294 К
в = 71,7-10-в К-1.
Температурный коэффициент линейного расширения кальция чисто-
чистотой 99,0 %:
т, к
3
5
10
14
а Ю'К
0,0026
0,010
0,094
0,295
т, к
20
30
57
а-ЮТС1
1,0
3,3
10,75
Т, К
75
85
283
14,15
15,5
22,15
Молярная энтропия при 298 К s° = 41,66 Дж/(моль-К).
Поверхностная энергия а-Са для грани A00) v = 386 мДж/мг, а для
грани A11) v = 246 мДж/м2. Поверхностное натяжение жидкого кальция
при 850°С 0-420 мН/м.
Давление пара р в зависимости от температуры:
т. к
500
750
1000
1123
Р. Па
1,82-Ю-8
1,91-Ю-2
2,26-10
2,05-Ю2
т. к
1200
1400
1600
1800
Р. Па
6,06-102
5,95-103
3,25-10*
1,204-106
Т, К
2000
2250
2500
р. Па
3,39-10&
9,49-105
21,66-105
Приведенный термодинамический потенциал Фт в зависимости от
температуры:
Т, К
298
500
1000
1500
Фт (газ)
Дж/(моль-К)
41,69
44,79
56,94
69,26
154,98
157,37
165,63
171,95
Т, К
2000
2500
3000
Фт (газ)
Дж/(мольК)
88,49
110,23
125,44
176,90
180,96
184,40
Параметры самодиффузии кчльция в интервале 500 + 800 СС Д> =
= 8,3-10~4 м2/с, £=385 кДж/моль.
107
Механические свойства
Свойства после прокатки и отжига:
Обработка
Прокатка
<т , МПа
В
115
48—50
86—90
37
6, %
7
51
Ч>. %
36
58
нв,
МПа
170*
130
HRB
42
36
• Литая пластинка.
Свойства дистиллированного кальция (чистота 98,08 %) в зависимо-
зависимости от температуры:
t, °с
20
100
300
500
800
<т_, МПа
В
53,0
68,7
44,1
4,8
1,47
6. %
7,6
9,8
27
37
52
Ч>. %
3
13
27
90
100
НВ, МПа
125
117
92
17
2,0
Модуль нормальной упругости £=21 + 28 ГПа в зависимости от чис-
чистоты кальция
Модуль нормальной упругости Е (после отжига) в зависимости от
температуры:
Е, ГПа.
— 180
20,6
0
19
,6
200
17,7
400
15,7
600
12,3
Сжимаемость x = 5,92-101 Па-1.
Поверхностное натяжение жидкого кальция при 850 °С а=420 мН/м.
Химические свойства
Нормальный электродный потенциал реакции Са—2е^=Са2+ ф=—2,84 В.
В соединениях проявляет степень окисления +2.
Кальций — химически очень активный элемент, вытесняет почти все
металлы из их оксидов, сульфидов и галогенидов. Медленно взаимо-
взаимодействует с холодной водой, при этом выделяется водород, в горячей
ЗВде образуется гидроксид. С сухим воздухом при комнатной темпе-
температуре кальций не реагирует, при нагреве до 300 °С и выше сильно
окисляется, а при дальнейшем нагреве, особенно в присутствии кисло-
кислорода, воспламеняется, образуя СаО; теплота образования Д//Олр =
= 635,13 кДж/моль.
При взаимодействии с водородом при 300—400 °С образуется гид-
гидрид кальция СаН2 (ДЯобр= 192,1 кДж/моль), с кислородом прочное ч.
108
высокотемпературное соединение СаО. С азотом при температуре 400—
500 °С кальций дает Ca3N2, теплота образования Д#обр =
= 458,45 кДж/моль.
С фосфором кальций образует устойчивое и прочное соединение
СазРг> а с углеродом — карбид СаС2. С фтором, хлором, бромом и ио-
иодом взаимодействует, образуя CaF2) СаС12, СаВг2, Са12. При нагревании
кальции с серой образуется сульфид CaS, с кремнием — силициды Ca2Si,
CaSi и CaSi2.
Концентрированная азотная кислота и концентрированный раствор
NaOH слабо взаимодействуют с кальцием, а разбавленная азотная кис-
кислота бурно. В крепкой серной кислоте кальций покрывается защитной
пленкой CaSO4, которая препятствует дальнейшему взаимодействию;
разбавленная H2SO4 действует слабо, разбавленная соляная кислота —
сильно.
С большинством металлов кальций взаимодействует, образуя твер-
твердые растворы и химические соединения.
Нормальный электронный потенциал фо = — 2,84 В. Электрохимиче-
Электрохимический эквивалент 0,20767 мг/Кл.
Технологические свойства
Благодаря высокой пластичности кальция его можно подпереть обра-
обработке давлением всех видов. При 200—460 °С он хорошо прессуется,
прокатывается в листы, куется, из него легко получают проволоку и
другие полуфабрикаты. Кальций хорошо обрабатывается резанием (об-
(обточка на токарном, сверлильном и других станках).
Области применения
Применение металлического кальция обусловлено его высокой химиче-
химической активностью. Поскольку при повышенной температуре кальций мо-
может энергично соединяться со всеми газами, кроме инертных, его ис-
используют для промышленной очистки аргона и гелия, а также в каче-
качестве газопоглотителя в высоковакуумных приборах, например элек-
электронных трубках и т. д.
В металлургии кальций используют в качестве раскислителя и де-
сульфуратора стали; при очистке свинца и олова от висмута и сурь-
сурьмы; в качестве восстановителя при получении тугоплавких редких ме-
металлов, обладающих высоким сродством к кислороду (циркония, ти-
титана, тантала, ниобия, тория, урана и др.); в качестве легирующей
добавки к свинцово-кальциевым баббитам для повышения их механиче-
механических и антифрикционных свойств
Сплав свинца с 0,04 % Са обладает повышенной твердостью по срав-
сравнению с чистым свинцом. Небольшие добавки @,1 %) кальция повы-
повышают устойчивость против ползучести. Сплав кальция (до 70 %) с ции-
ком используется цля изготовления пенобетона.
Широко применяются лигатуры кальция с кремнием и марганцем,
с алюминием и кремнием в качестве раскислителей и добавок в произ-
производстве легких сплавов
Присадка кальцийлитиевых лигатур в незначительных количествах к
сплавам на основе железа (чугуну, углеродистым и специальным ста-
сталям) увеличивает их жидкотекучесть и заметно повышает твердость и
временное сопротивление.
Широкое применение получили соединения кальция. Так, оксид каль-
кальция используют в стекольном производстве, для футеровки печей, по-
получения гашеной извести. Гидросульфит кальция применяют в произ-
производстве искусственного волокна и для очистки каменноугольного газа.
109
Хлорная известь используется как" отбеливающее средство в текстиль-
текстильной и целлюлозно-бумажной промышленности, а также как дезинфици-
дезинфицирующее средство. Пероксид кальция идет на приготовление гигиениче-
гигиенических и косметических препаратов, а также зубных паст. Сульфид каль-
кальция служит для получения фосфоресцирующих препаратов, а в коже-
кожевенной промышленности — для удаления волосяного покрова кожи.
Соединения кальция с мышьяком ядовиты и опасны. Их используют
для уничтожения вредителей сельского хозяйства. Соединения кальция
с фосфором и цианамиды кальция служат для получения удобрений
(суперфосфат, азотистые удобрения и др.). Широко применяются ми-
минералы — мрамор, гипс, известняк, доломит и т. д.
2.4. СТРОНЦИЙ [1— 35, 51, 110, 111]
Общие сведения и методы получения
Стронций (Sr) — металл серебристо-белого цвета. Минерал, содержа-
содержащий стронций, был обнаружен в 1787 г. в Шотландии в свинцовом руд-
руднике недалеко от деревни Стронциан и назван стронцианитом.
В 1790 г. шотландские минералоги Кроуфорд и Крюикшенк подробно
исследовали этот минерал и обнаружили в нем новую «землю» (ок-
(оксид). Независимо от них их соотечественник химик Хоп установил, что
в этом минерале содержится новый элемент — стронций. К такому же
выводу пришел немецкий химик Клапрот. В те же годы известный рус-
русский химик акад. Т. Е. Ловиц обнаружил следы стронция в тяжелом
шпате. Результаты его исследований опубликованы в 1795 г. Однако
чистый металл был выделен лишь в 1808 г. Дэви. В 1924 г. Даннер
(США) получил чистый стронций восстановлением его из оксида ме-
металлическим алюминием (или магнием).
Содержание стронция в земной коре 4-Ю-2 % (по массе). В приро-
природе в свободном виде не встречается. Присутствует главным образом в
минералах —стронцианите (SrCO3) и целестине (SrSO4). Содержится
также в различных кальциевых минералах.
Металлический стронций в настоящее время получают преимущест-
преимущественно алюминотермическим методом. Оксид стронция смешивают с по-
порошком алюминия, брикетируют и помещают в электровакуумную печь
(вакуум 1,333 Па), где при 1100—1150 "С происходит восстановление
металла.
Стронций выпускают в соответствии с ЦМТУ 4764—56 трех марок
(Ч, ЧДА и ХЧ) в виде штабиков и кристаллов (друзы).
Химический состав штабиков и кристаллов стронция:
Марка
Ч
ЧДА
ХЧ
0
0
0
Допустимое содержание
Fe
,01
,005
,001
0
0
0
Си
,01
,005
,001
0
0
0
Si
,05
,01
005
ipHMecett,
0
0
0
Pb
,01
,005
,0004
не
0
0
0
более,
Сг
,007
,005
,001
%
0
0
0
(по массе)
Zn
,01
,005
,001
0
0
0
Cd
,007
,С02
,0003
Поставляется стронций в виде прутков или комкового металла. Во
избежание окисления стронций следует хранить под слоем керосина или
под лаковым покрытием. В случае непродолжительного хранения строн-
стронций заворачивают в пергаментную бумагу и упаковывают в герметич-
герметично закрывающиеся металлические банки. Для длительного хранения
ПО
банки заполняют смесью трансформаторного масла и парафина A : 1).
На крышке несмываемой краской наносят надпись «Огнеопасно, от во-
воды загорается». Хранят стронций в сухих закрытых помещениях. Не
допускается хранить стронций в одном помещении с кислотами, водой
и огнеопасными веществами.
Соли и соединения стронция токсичны (вызывают паралич, влияют
на зрение). При работе с ними следует соблюдать правила техники
безопасности с солями щелочных и щелочноземельных металлов.
Физические свойства
Атомные характеристики. Атомный номер 38, атомная масса 87,62 а. е. м,
атомный объем 33,7-10~6 м3/моль, атомный радиус 0,215 нм, ионный
радиус 0,127 им. Потенциалы ионизации J (эВ): 5,692; 11,026; 43,6.
Электроотрицательность 1,0. Стронций имеет г. ц. к. решетку (a-Sr) с
периодом а = 0,6085 нм, энергия кристаллической решетки
164,3 мкДж/кмоль, координационное число 12, межатомное расстояние
4,30 нм. При температуре 488 К происходит a—Р-превращение. Р-строн-
ций имеет гексагональную решетку с периодами а=0,432 нм, с —
= 0,706 им, с/а= 1,64. При 605 °С имеет место полиморфное превраще-
превращение Р~>-у. Образующая кубическая объемноцептрированная модифика-
модификация имеет период а=0,485 нм. Электронная конфигурация внешнего
слоя 5s2. Природный стронций состоит из четырех стабильных изотопов:
8iSr @,58%), 86Sr(9,88%), 87Sr G,2 %), 88Sr (82,58 %). Получено так-
также 14 искусственных неустойчивых изотопов Радиоактивный изотоп
90Sr с периодом полураспада 27,7 лет образуется при ядерных реак-
реакциях (делении урана). Эффективное поперечное сечение захвата теп-
тепловых нейтронов 1,21-Ю8 м2. Работа выхода электронов ф=2,35 эВ,
для монокристалла A00) <р=2,43 эВ.
Плотность р при 273 К равна 2,630 Мг/м3.
Электрические и магнитные. Удельная электрическая проводимость a
и удельное электрическое сопротивление р в зависимости от темпера-
температуры:
Г, К 20
а, МСм/м —
р, мкОм-м 0,0048
Температурный коэффициент электросопротивления в интервале тем-
темпера iyp 273—473 К a = 5,2.10-3 К.
Наибольшее значение коэффициента вторичной электронной эмиссии
а.,,^^0,72 при ускоряющем напряжении первичных электронов
0,100 кзВ.
Магнитная восприимчивость при температуре 293 К х= + 1,05-10~9.
Тепловые и термодинамические Температура плавления ^Пл = 770°С,
температура кипения £,<ип = 1380°С, характеристическая температура
9d = 129 К, удельная теплота плавления ДЯПц = 960 кДж/кг, удельная
теплота испарения ДЯИсп = 1763 кДж/кг, удельная теплота сублимации
при 298 К ДЯсубл = 2856 кДж/кг. Средняя удельная теплоемкость в ин-
интервале температур 273—373 К ср = 737 Дж/(кг-К). Удельная электрон-
электронная теплоемкость C'J1 =[3,6 мДж/(моль-К2)]-7\ Средний температурный
юэффициент линейного расширения a —23-10" K~l. Температурный
коэффициент линейного расширения в интервале 273—503 К a=20,6X
X Ю-6 К-'; при 503—773 К он составляет 22,2-10-» К, а при 813—
923 К равен 20,0-10-" К.
111
253
5,9
0,17
273
5,0
0,20
295
21,5
673
1,15
60
973
1,03
94
Температурный коэффициент линейиого расширения при низких тем-
температурах:
Г, К
3
5
6
a-WKT1
-0,034
—0,037
—0,020
Г, К
8
10
20
0,062
0,27
3,5
т, к
30
75
85
1 283
а,- Ш«К-1
8,2
17,8
18,45
22,45
Молярная энтропия s" в зависимости от температуры:
т, к
298
500
1000
52
66
90
s°
Дж/(моль
,33
,65
,35
s° (газ)
К)
164,62
175,38
189,82
т, к
1500
2000
2500
3000
S
112
204
208
213
о
s° (газ)
Дж/(моль-К)
,45
,31
,92
,40
198,24
204,27
209,08
213,40
Энергия атомизации при 0 К= 164,12 кДж/моль, а при 298 К=
= 163,7 кДж/моль.
Поверхностная энергия для грани A00) v = 303 мДж/м2, для грани
A11) v=193 мДж/м2. Поверхностное натяжение жидкого стронция при
770 °С а=350 мН/м.
Давление пара р в зависимости от температуры:
Г, К ... 500 540 5S0 620 660
р, Па ... 22,54-Ю-7 12,93-Ю-6 28,61 -10—Б 20,2-10-* 11,2-10—3
Давление пара при температуре плавления /> = 245,9 Па.
Приведенный термодинамический потенциал Фг в зависимостч от
температуры:
т к
298
500
1000
1500
Ф
52,
55,
67,
82,
т
ДжЛмоль
33
43
24
94
Фт (газ)
•К)
164,62
167,01
175,25
181,58
т к
2000
2500
.000
Ф
104
125
139
Т
Дж/(моль
,71
,14
,46
Фг (газ)
•К)
186,52
190,62
194,01
Оптические свойства. Отражательная способность (коэффициента от-
отражения По) и коэффициент поглощения а в зависимости от длины
волны (пленка толщиной 0,2 мкм):
112
%, мкм
0,124
0,138
0,155
0,177
«d- *
3
7
14
20
а, м-1
1,7-10'
2,5-10'
4,0-10'
5,6-10'
X, мкм
0,207
0,248
0,310
0,412
1,240
v %
17
14
32
60
85
а, м~~'
5,4-10'
4,0-10'
4,1-10'
5,1-10'
5,7-10'
Механические свойства
Механические свойства в зависимости от температуры:
t, °С
20
НО
200
300
400
450
550
600
700
а„, МПа
49,0
53,9
47,0
24,5
-2,0
1,0
в. %
1,0
—
5,3
10,5
19,0
20,0
8,0
33,0
40,0
*, %
11,0
13,5
30,0
45,0
50,0
16,0
99,0
99,9
НВ, МПа
190
180
90
60
48
38
3,0
2,5
2,0
Примечание. Литой стронций, чистота 99,9 %, испытание в среде аргона.
Модуль нормальной упругости £=16,0 ГПа; модуль объемного сжа-
сжатия К= 12,200 ГПа; модуль сдвига G=6,08 ГПа. Коэффициент Пуассо-
иа v = 0,280, сжимаемость и=8,36-10-" Па.
Химические свойства
Нормальный электродный потенциал реакции Sr—2e=?*Sr2+ cpo = 2,89 В.
Степень окисления +2.
Стронций — очень активный элемент, быстро окисляется на возду-
воздухе с выделением большого количества тепла, энергично разлагает воду.
С водородом взаимодействует при повышенной температуре 300—•
400°С, образуя гидрид SrH2 с температурой плавления 650°С. С кис-
кислородом образует оксид (II) SrO с температурой плавления 2430 °С,
при 500 °С и давлении 15 МПа — оксид (IV) SrO2. С азотом взаимо-
взаимодействует при 380—400 °С и дает соединение Sr3N2.
При нагревании стронций легко взаимодействует с галогенами, об-
образуя соответствующие соли: хлорид SrCl2 с температурой плавления
872 °С, бромид SrBr2 с температурой плавления 643 °С, фторид SrF2 с
температурой плавления 1190°С, иодид Srl2. С углеродом образует
карбид стронция SrC2, с фосфором — фосфид стронция SrP2, с серой
при нагревании — сульфиды.
С концентрированными азотной и серной кислотами взаимодейству-
взаимодействует слабо, с разбавленными энергично; со щелочами — NaOH, КОН
(концентрированными и разбавленными) также вступает в реакции.
С металлами образует твердые растворы и металлические соедине-
113
ния. В жидком состоянии смешивается с элементами ПА, ПВ — VB
подгрупп (Be, Mg, Zn, Cd, Hg, Al, Ga, In, Tl, Sn, Pb, Sb, Bi, As). Co
многими из них образует металлические соединения (Al, Mg, Zn, Sn,
Pb и др.). С некоторыми переходными и благородными металлами дает
несмешивающиеся системы. Для большинства металлов платиновой
группы характерно образование со стронцием фаз типа Лавеса. С эле-
элементами II1B подгруппы образует фазы типа АВ4.
Электрохимический эквивалент 0,45404 мг/Кл.
Технологические свойства
Стронций — ковкий и пластичный металл. Ковкой из него можно по-
получить тонкий лист, а прессованием при 230 °С — проволоку.
Области применения
В промышленности используют металлический стронций и его соедине-
соединения. Введение этого элемента и его соединений в сталь и чугун спо-
способствует повышению их качества. Имеются сведения об использова-
использовании стронция для раскисления и рафинирования меди; при этом также
повышается твердость. Введение 0,1 % Sr в титан и его сплавы повы-
повышает ударную вязкость; стронций увеличивает пластичность магния и
его сплавов, положительно влияет на свойства алюминиевых сплавов.
Соединения стронция используют в пиротехнике, в электровакуумной
технике (газопоглотитель), в радиоэлектронике (для изготовления фо-
фотоэлементов). Стронций входит в состав оксидных катодов, применяе-
применяемых в электронно-лучевых трубках, лампах СВЧ и др.
В стекловарении стронций используют для получения специальных
оптических стекол; он повышает химическую и термическую устойчи-
устойчивость стекла и показатели преломления. Так, стекло, содержащее 9 °/о
SrO, обладает высоким сопротивлением истиранию и большой эластич-
эластичностью, легко поддастся механической обработке (кручению, перера-
переработке в пряжу и ткани). В нашей стране разработана технология полу-
получения стронцийсодержащего стекла без бора. Такое стекло обладает
высокой химической стойкостью, прочностью и электрофизическими
свойствами. Установлена способность стронциевых стекол поглощать
рентгеновское излучение трубок цветных телевизоров, а также улуч-
улучшать радиационную стойкость. Фторид стронция используют для про-
производства лазеров и оптической керамики. Гидроксид стронция приме-
применяют в нефтяной промышленности для производства смазочных масел
с повышенным сопротивлением окислению, а в пищевой — для обработ-
обработки отходов сахарного производства с целью дополнительного извлече-
извлечения сахара. Соединения стронция входят также в состав эмалей, глазу-
глазурей и керамики Их широко используют в химической промышленности
в качестве наполнителей резины, стабилизаторов пластмасс, а также
для очистки каустической соды от железа и марганца, в качестве ката-
катализаторов в органическом синтезе и при крекинге нефти и т. д.
2.5. БАРИЙ [1—35, 51]
Общие сведения и методы получения
Барий (Ва) — мягкий серебристо-белый металл, быстро окисляющийся
на воздухе.
Название получил от греческого Papwo, что в переводе на русский
язык означает тяжелый. На существование бария в 1774 г. впервые
114
указал шведский химик К- Шееле, который при исследовании пиролю-
пиролюзита (природный диоксид марганца) обнаружил в нем «тяжелую зем-
землю»— оксид бария (барит). Английский химик Дэви в 1808 г. впервые
получил металлический барнй путем электролиза его соединений. Затем
в 1901 г. Гунтц получил металлический барий восстановлением оксида
бария алюминием.
Содержание бария в земной коре 0,05 % (по массе).
В природе барий встречается только в виде соединений. Основные
минералы бария — барит — тяжелый шпат BaSO4 ( — 65% ВаО) и ви-
витерит ВаСОз ( — 78 % ВаО). Эти минералы являются исходными для по-
получения бария; они также находят самостоятельное применение. Барий
получают восстановлением из оксида углем алюмииотермическим спо-
способом, а также электролизом из расплавленной смеси хлористого бария
и хлористого кальция.
Технически чистый барий получают нагреванием при 1100—1200°С
в вакууме @,133 Па) смеси оксида бария с порошком алюминия Пере-
Перегонкой в вакууме барий очищают до 99,5—99,9%. Барий выпускают
в виде кристаллов (друз), плавленых штабиков, слитков. Барий вы-
выплавляют двух марок Бр-1 и Бр-2.
Химический состав бария'
Марка
Бр-1
Бр-2
0
0
Fe
,005
,01
0
0
Содержание
Си
,005
,01
Si
0,01
0,05
примесеГ!
РЬ
0,001
0,007
%
0
0
не более
Сг
,005
,007
0,
0,
Zn
005
01
0
0
Cd
,001
,007
Барий в риде друз н слитков для непродолжительного хранения за-
завертывают в пергаментную бумагу и помешают в металлические герме-
герметически закрывающиеся банки со смесью трансформаторного масла и
парафина A 1). Банки укладывают в железную тару с надписью «Ог-
«Огнеопасно, от воды загорается». Хранить барий следует в сухих закры-
закрытых помещениях.
Барий в слитках поставляют по РЭТУ 1193—64. Содержание основ-
основного вещества — не менее 99,6 %, активного (металлического бария, не
вошедшего в химические соединения) — не менее 96,0 %.
Содержание контролируемых примесей, не более- 0 005 % Fe; 0,001 %
Cd; 0,005% Si; 0,005% Си; 0,005 %Pb; 0,005% Zn; 0,05% щелочных
металлов (в пересчете на натрий); 0,05% хлоридов; 0,005% Сг; оста-
остаток, нерастворимый в соляной кислоте — не более 0,025%.
Металлический барий в слитках без металлической оболочки завер-
завертывают в 3—4 слоя маслонепроницаемой бумаги, помещают в метал-
металлическую банку, завальцовывают ее и помещают в металлический кон-
контейнер.
Растворимые в воде и кислотах соли бария очень ядовиты. Чистый
сульфат бария не токсичен. Углекислый барий токсичен. Работа с ток-
токсичными соединениями требует мер предосторожности.
Физические свойства
Атомные характеристики. Атомный номер 56, атомная масса
137,34 а. е. м. Атомный объем 38,2-10~6 м'/моль. Атомный радиус
0,221 им; ионный радиус Ва2+ 0,138 нм. Потенциалы ионизации ато-
атомов, J (эВ); 5,910; 10,00; 37,1.
115
Электроотрицательность 0,9. Кристаллическая структура кубическая,
период решетки а=0,5019 нм, координационное число 8, межатомные
расстояния 0,434 нм, электронная конфигурация 6s2.
Полиморфное превращение о. ц. к.=г*г. п. у. происходит при 27 °С и
давлении 5,900 ГПа, период решетки а=0,390 нм; с=0,6154 нм; с/а—
= 1,58 Энергия кристаллической решетки бария 175,8 мкДж/кмоль.
Электронная конфигурация и основное состояние свободного атома ба-
бария и его ионов: 6s2 ('s0) для неионизированного бария; 6sBSi/2) для
Ва'+; 5р6(%) для Ва2+; 5p5Bs3/2) для Ва3+.
Изотопный состав бария:
Массовое
число
126
127
128
129
130
131
132
133 т
133
134
135 т
135
136
137 т
137
138
139
140
141
142
143
144
Содержание
в природном
барии, %
_
—
—
—
0,101
—
0,097
2,42
—
6,59
7,81
—
11, 2
71,66
—
—
—
Период
полураспада
5750 С
~ 720 с
2,4 сут
7200 с
—
11,5 сут
1,62
10 лет
—
1,20 сут
—
—
1,56 с
—
—
5100 с
12,8 сут
1080 с
360 с
30 с
Короткий
Форма и энергия излучения,
МэВ
Y; 0,226; 0,700; 0,990
—
/С = 3; v; 0,270
Р+, 1,6
—
/С = 3; у; 0,122; 0,214;
0,246; 0,372; 0,496; 0,618
И. П; у; 0,12; 0,168
/С = 3; у; 0,068; 0,081;
0,292; 0,360
—
И- П.; у; 0,269
—
—
И П; у; 0,661
—
—
fi—, 0,82A9 %); 2,23F0%);
2,38A5 %); у; 0,163; 1,427
6-; 1,0F0 °0), 4D0 %); у,
0,03; 0,16; 0,37; 0,54
Р~; 2,8
г»
Р-
Р-
Работа выхода электронов бария <р = 2,49 эВ; по грани монокристал-
монокристалла Ва {100} ср = 2,48 эВ.
Энергетические уровни ядер бария (нулевая энергия соответствует
основному состоянию):
116
Mac совое
число
132
133
134
Энергия, МэВ
0
1
0
0,12
0'288
0
0,794
1,361
1,395
1,831
1,956
Спин
—
1/2
—
0
Массовое
число
135
137
138
Энергия, МэВ
0
0,269
0,/о
0
0,661
0
1,43
1,89
2,21
2,30
2,44
2,63
Спин
3/2
3/2
—
0
2
—
—
—
3
—
Плотность. Рентгеновская плотность1 бария р=3,594 Мг/м3; пикно-
метрическая плотность р = 3,5 Мг/м3. Плотность при 1000 К Р=
=3,32 Мг/м3. Изменение плотности бария при плавлении
0,0526 кг/(м'-К).
Электрические и магнитные. Удельное электрическое сопротивление
бария при 78 К р=0,16 мкОм-м, при 298 К р=0,60 мкОм-м. Удельная
электрическая проводимость при 78 К ог=6,25 МСм/м, при 298 К 0=
= 1,67 МСм/м. Температурный коэффициент электрического сопротив-
сопротивления при 298 К <х = 3,6-10-3 Кг'- Изменение удельного электросопро-
электросопротивления при плавлении рПл/ртв= 1,62. Температура перехода в сверх-
сверхпроводящее состояние ГС=1,ЗК при давлении 5 ГПа, 3,05 К прн дав-
давлении 8,5—8.8 ГПа и —5,2 К при давлении 14 ГПа. Максимальное зна-
значение коэффициента вторичной электронной эмиссии бария ormax=O,83
при ускоряющем напряжении первичных электронов 0,400 кэВ. Маг-
Магнитная восприимчивость бария при 293 К х= +0,15-10~9.
Тепловые и термодинамические. Температура плавления бария <Пл =
= 710°С; температура кипения <кип=1640°С; характеристическая тем-
температура 6d=96IC Удельная теплоемкость в зависимости от темпера-
температуры cv:
Г, К 298 400 600 1000 1500
ср, Дж/(кг-К) .... 191,93 202,27 222,36 228,48 228,48
Удельная электронная теплоемкость бария съ£ =[2,7 мДж/(мольХ
ХКг)]-Т. Удельная теплота плавления бария при 983 К ДЯПл =
= 56 кДж/кг; тейлота испарения при 1910 К Д#ИСп=1289 кДж/кг.
Удельная теплота превращения 4,3 кДж/кг. Температурный коэффи-
коэффициент линейного расширения бария, содержащего 1 % Sr; 0,05 % Са;
0,03 % Mg; 0,02 % А1 и 0,01 % Fe в зависимости от температуры:
Т. К
3
5
10
а-дак—1
0,0375
0,200
1,73
т, к
20
30
65
а-КГК
6,58
10,55
16,15
т. к
85
273
283
а ЮвК~х
17,10
18,0
20,32
' По другим данным 3,76 Мг/м3.
117
Молярная энтропия s" в зависимости от температуры:
т, к
298
500
1000
1500
s°
s° (газ)
Дж/(моль К)
64,89
79,17
110,45
123,17
170,28
180,99
195,43
204,02
Т, К
2000
2500
3000
s°
s° (газ)
Дж/(моль К)
211,14
218,67
226,71
211,14
218,63
226,71
Поверхностная энергия для грани (ПО) v=215 мДж/м2. Энергия
дефекта упаковки для грани A00) 303 мДж/м2, для грани A11)
193 мДж/м2.
Поверхностное натяжение при температуре плавления а=330 мН/м.
Давление пара р в зависимости от температуры:
800 900 1000 1100 1200
К
Па . . ', 81,34-Ю-4 13,52-Ю-2 12,94-Ю-1 81,34-Ю-1 37,83
Давление пара бария при температуре плавления 9,7 Па.
Оптические. Отражательная способность (коэффициент отражения
пг> для пленки толщиной 0,2 мкм):
Я, мкм
0,138
0,155
0,177
"D
2
8
18
К, мкм
0,207
0,248
0,310
nD
25
30
34
К, мкм
0,412
0,620
1,24
"о
50
62
65
Показатель преломления п для пленки бария толщиной 0,2 мкм:
К,
о,
0,
0,
мкм
113
124
138
п
0,97
0,90
0,81
X
0
0
0
, мкм
,155
,177
,207
0
0
0
п
,63
,57
,61
1,
0,
0,
0,
мкм
248
310
412
0
0
0
п
,71
,84
Механические свойства
Временное сопротивление разрыву 0О литого бария чистотой 99,9 %
в зависимости от температуры:
t, °C 20 100 200 300 400 500 600
0В, МПа . . . 12,8 15,7 11,8 7,8 3,92 2,94 0,98
Относительное удлинение б и относительное сужение -ф литого бария
(возогнанного) чистотой 99,9 % в зависимости от температуры:
t, °С . , . . . 20 100 200 300 400 600
б, % 23 — — — — —
г|з, % .... 41 45 70 84 96 85
118
Твердость бария по Бринеллю НВ = 42 МПа.
Модуль нормальной упругости растяжения отожженного бария Е
в зависимости от температуры:
t, СС —187 20 470
Е, ГПа. . . . 13,7 12,6 7,85
Химические свойства
Нормальный электродный потенциал реакции Ва— 2e=s=>-Ba2+ фо=
= —2,92 В. В соединениях проявляет степень окисления +2.
Барий очень активен, от удара воспламеняется, легко разлагает во-
воду. При взаимодействии с барием образуются соединения ВаО, ВаО2,
ВазЫг. Барий энергично взаимодействует с кислотами (H2SO4l H3PO4,
НС1) и щелочами (КОН, NaOH), так же активно со сжиженным и га-
газообразным аммиаком, галогенами, серой, сернистым газом, серово-
сероводородом, с солями тяжелых металлов, вытесняя их, с этиловым спир-
спиртом и др.
С кислородом образует соединения ВаО, ВаО2 и ВаО4. Оксид ВаО
образуется при горении бария в кислороде, а также при термическом
разложении солей бария, содержащих кислород.
С азотом при 270—60U °С барий дает нитрид Ba3Nz. Кроме того, су-
существуют соединения Ba2N, BaN2.
Водород и барий взаимодействуют при нагревании до 180 °С с обра-
образованием гидрида ВаН2, который является сильным восстановителем.
Он самовозгоняется на воздухе.
При взаимодействии бария и серы образуется сульфид BaS; его по-
получают при действии смеси водорода и сероводорода на оксид или кар-
боиат бария. Существует соединение BaS*, образующееся при совмест-
совместном плавлении бария и серы в жидком NH3.
Сульфид BaS-—тугоплавкое соединение, обладающее люминесцент-
люминесцентными свойствами.
При взаимодействии с галогенами барий дает соединения
ВаВгг, Bal2, BaF2, BaClj. Они образуются при обычной температуре, за
исключением Ва12, который образуется при нагревании.
Барий и углерод образуют ВаСг из простых веществ при нагревании
их при 1250 °С в среде аргона и восстановлением оксидов и карбонатов.
Электрохимический эквивалент 0,7113 мг/Кл.
Области применения
Вследствие большой химической активности, а также из-за низких ме-
механических свойств барий используют в технике не в чистом виде, а в
виде солей и соединений.
Нерастворимый в воде и кислотах сульфат бария (барит) хорошо
поглощает рентгеновские лучи, поэтому его применяют при рентгено-
рентгенодиагностике Баритовые белила используют в качестве белой краски
(баритовая бумага). Углекислый барий (ВаСОз) входит в состав смеси
для цементации стали.
Сплавы свинец — барин используют в полиграфии, сульфат BaSO4 —
как белый пигмент для линолеума и бумаги, сплавы бария с никелем —
для изготовления электродов запальных свечей двигателей и в радио-
радиолампах. Титанат бария ВаТЮ3 — один из важнейших сегнетоэлектриков.
Титанат и алюминат бария используют для изготовления диэлектриков
и постоянных магнитов. В металлургии — для десульфурации, дегазации
и раскисления меди, свинца и некоторых жаропрочных сплавов. Барий
вводят в антифрикционные сплавы.
119
Оксид ВаО используют при изготовлении стекла, эмалей и термо-
термокатализаторов. Пероксид ВаО2 служит для получения пероксида водо-
водорода, для отбеливания тканей; его используют в качестве катализатора
крекинг-процесса, а также как компонент запальных смесей в алюмино-
алюминотермии и пиротехнике.
Азотнокислый барий Ba(NO3b служит для приготовления зеленых
бенгальских огней.
Платиносинеродистый барий [BaPt(CNN] используют для покрытия
некоторых фосфоресцирующих экранов и в других целях.
Фторид BaF2 применяют при изготовлении эмалей и оптических
стекол.
Соединения бария хорошо поглощают рентгеновские лучи и у-излу-
чеиие, поэтому их вводят в состав защитных материалов в рентгенов-
рентгеновских установках и ядерных реакторах. Окрашенные соли бария явля-
являются пигментами: ВаСгО4 — желтый, ВаМпО* — зеленый.
2.6. РАДИЙ [1—35, 112, 113]
Общие сведения и методы получения
Радий (Ra) — радиоактивный серебристо-белый блестящий металл, бы-
быстро тускнеющий на воздухе. Существование радия предсказано
Д. И. Менделеевым в 1871 г. Об открытии соединений радия сообщили
в 1898 г. супруги Пьер Кюри и Мария Кюри-Склодовская. Тщательное
изучение урановой смолки позволило открыть сначала полоний, а чуть
позже и радий. Металлический радий впервые получили в 1910 г.
М. Кюри-Склодовская и французский химик Дебьерн. Они использова-
использовали метод электролиза водного раствора хлорида радия с ртутным ка-
катодом с последующей перегонкой амальгамы радия. В ходе выделения
радия за его появлением следили по излучению, отсюда элемент полу-
получил свое название (от латинского radius — луч).
Радий относится к речким и рассеянным элементам. Содержание
его в земной коре Ы0~10 % (по массе) В урановых рудах, являющих-
являющихся главным его источником, на 1 т урана приходится не более 0,34 г
радия. Помимо урановых руд, возможные источники радия — некото-
некоторые природные воды, например воды нефтяных месторождений.
При извлечении радия из урановых руд в качестве инертного носи-
носителя добавляют барий Методы последующего их разделения основаны
иа лучшей растворимости в воде солей бария по сравнению с солями
радия. Для извлечения радия урановые руды сначала обрабатывают
серной кислотой, при этом радий и барий остаются в осадке в виде
сульфатов. Затем их переводят в карбонаты продолжительным кипя-
кипячением в содовом растворе и растворяют в крепкой соляной кислоте.
Отделение радия от бария производят с помощью дробной кристаллиза-
кристаллизации, каждая ступень которой приводит к обогащению кристаллов кон-
концентрата радием. Окончательное отделение радия ведут методом ион-
ионного обмена, пропуская раствор концентрата через колонну, заполнен-
заполненную сульфостирольным катионом. Элюирование (вымывание) осуще-
осуществляют раствором уксусно- или лимоннокислого аммония, причем ба-
барий вымывается при меньших концентрациях элюэнта.
Физические свойства
Атомные характеристики. Атомный номер 88. Гипотетическое мз-ювое
число 226 дано самому долгоживущему изотопу радия — «-радиоак-
«-радиоактивному 226Ra, имеющему период полураспада 1600 лет. Атомный ра-
радиус радия 0,235 нм, ионный радиус Ra2+ 0,144 нм.
120
Конфигурация внешних электронных оболочек 7s2. Потенциалы
ионизации / (эВ): 5,28; 10,14; 34,3. Радий имеет о. ц. к. решетку. Энер-
Энергия кристаллической решетки £1реш=130 мкДж/кмоль. Электроотрица-
Электроотрицательность радия 0,97. Все известные изотопы радия (известны изотопы
с массовыми числами 213, 215, 219 — 230) нестабильны. В природе как
члены естественных радиоактивных рядов встречаются 222Ra (специаль-
(специальное название — актнний-нкс, символ АсХ), 224Ra (специальное назва-
название — торий-икс, символ ThX), 226Ra и 228Ra (мезоторнй I, символ
MsThl). Работа выхода электрона ср=3,2 эВ.
Плотность радия 5,5—6,0 Мг/м3.
Раднй обладает слабыми парамагнитными свойствами: его маг-
магнитная восприимчивость при 293 К %= + 1,05-10~9. Удельное электри-
электрическое сопротивление определено только для жидкого радия: прн 1233 К
р= 1,71 мкОм-м. Температура плавления радия определеиа весьма при-
приближенно и по разным источникам колеблется в диапазоне ^Пл = 7004-
—960 °С; температура кипения ^„ип = 1140-ь1500°С Расчетное значение
удельной теплоемкости радия для 1223 К ср=136 Дж/(кг-К). Удель-
Удельная теплота плавления радия АЯпл = 37,05 кДж/кг, AtfCV6.i =
= 716,9 кДж/кг. Теплопроводность при 293 К Я. = 18,6 Вт/(м-К).
Давление пара р в зависимости от температуры.
т, к
460
489
519
553
р.
133,3-
133,3-
133,3-
133,3-
Па
Ю-"
ю-9
ю-8
10-'
т, к
593
638
691
754
832
р, Па
133,3-10-"
133,3-Ю-5
133,3-Ю-4
133,3- Ю-3
133,3-10-?
т, к
928
1058
1234
1479
1809
р
133,
133,
133,
133,
133,
3-
3
3-
3-
3-
10-1
101
ю2
103
Химические свойства
Нормальный электродный потенциал фо=—2,92 В. По химическим
свойствам радий более всего сходен с барнем, но более активен. При
комнатной температуре раднй соединяется с кислородом, образуя ок-
снд RaO, н с азотом, образуя нитрид RasN2. Предполагается наличие
устойчивого при нормальных условиях гидрида ЙаНг- Радий бурно ре-
реагирует с водой, при этом образуется сильное основание Ra(OH)j и
выделяется водород. Из гидроксида или карбоната RaC63 легко полу-
получаются другие соли радия. Все они постепенно разлагаются под дей-
действием собственного излучения, приобретая при этом желтую или ко-
коричневую окраску. Соединения радия обладают свойством автолюми-
автолюминесценции. В результате радиоактивного распада 1 г радия выделяет
каждый час 553,7 Дж тепла Поэтому температура радня н его солей
всегда примерно на 1,5 К выше температуры окружающей среды.
Области применения
В последнее время применение радия существенно сократилось, так как
широко используются искусственные радиоактивные изотопы. Он со-
сохранил некоторое значение как источник радона для радоновых ванн
A г радия выделяет в сутки около 1 мм3 радона). В небольших коли-
количествах в смеси с бериллием радий используют для приготовления
121
нейтронных источников, в смеси с сульфидом цннка — при производст-
производстве светосоставов. Иногда радий применяют для дефектоскопии литья,
сварных швов, а также для снятия электростатических зарядов.
2.7. ЦИНК [1-35, 50, 114, 1171
Общие сведения и методы получения
Цннк (Zn)—тяжелый легкоплавкий металл синевато-белого цвета.
Первые сведения о металлическом цинке относятся к V в. до и. э. Чи-
Чистый цинк долгое время не удавалось получить, хотя сплав его с
медью — латунь — был известен еще древним грекам и египтянам.
В 1746 г. Моргграф разработал способ получения металла прокали-
прокаливанием его оксида с углем без доступа воздуха в глиняных огнеупор-
огнеупорных ретортах с последующей конденсацией паров цинка в холодильни-
холодильниках. Начало производства цинка в промышленном масштабе относится
к XVII в.
Содержание цинка в земной коре 0,005 % (по массеI.
Известно 66 минералов циика, находящихся в полиметаллических
рудах, содержащих свинец, медь и железо. Важнейшие из этих мине-
минералов цинкит (красная цинковая руда) ZnO, сфалерит (или цинковая
обманка) ZnS, виллемит Zn2SiO4, каламин H2Zn2Si04, смит-сонит ZnCO3,
франклннит ZnFe2O4(Fe, Zn, Mn)O(Fe, Mn2O3).
В настоящее время половину производимого в мире цинка получа-
получают гидрометаллургическнм способом, а половину — пирометаллургиче-
ским. Независимо от способа получения производство цинка начинает-
начинается с обогащения цинковых руд, так как они содержат небольшие коли-
количества цинка (обычно 1—3 %). При селективной флотации получают
цинковые концентраты с 48—58 % Zn, 1—2 % Pb, <2 % Си, 5—10 % Fe
и около 30 % S и одновременно пиритные, медные и свинцовые кон-
концентраты.
Первая стадия переработки концентратов — обжиг. На всех совре-
современных заводах обжиг ведут в кипящем слое или во взвешенном со-
состоянии. В результате получают газы, содержащие 4-—6 % SCb, которые
поступают на производство серной кислоты.
При пирометаллургнческом производстве обжиг совмещают с агло-
агломерацией, добиваясь, чтобы шихта для последующей дистилляции бы-
была кусковой и газопроницаемой. Дистилляпию ведут в ретортах нагре-
нагревом до 1250—1300 °С смеси обожженного концентрата с коксом. Цинк
при этом восстанавливается и испаряется. Пары цинка в смеси с окси-
оксидом углерода направляются в конденсатор, в котором при температуре
450—500 °С образуется жидкий цинк.
Цинк, полученный дистилляционным способом, содержит от 1 до
3 % примесей, и его подвергают рафинированию сначала ликвацией
(от свинца и железа), затем ректификацией (от свинца, кадмия, меди,
мышьяка и других примесей). После ректификации металл содержит
99,995 % Zn.
Предварительно очищенный и подвергнутый 26-кратной зонной плав-
плавке в токе азота металл содержит 99,999995 % Zn.
В соответствии с ГОСТ 3640—79 цинк поставляют в виде чушек и
блоков. Химический состав — см. табл. с. 123. Цинк марки ЦВОО изго-
изготовляют в виде чушек массой 5 и 10 кг, цинк марок ЦВ0, ЦВ1, ЦВ,
Ц0А, Ц0, Ц1, Ц2, ЦЗ — в виде чушек массой 19—25 кг или в виде бло-
блоков массой до 1 т.
1 По другим данным 0,02 %.
122
ХИМИЧЕСКИЙ СОСТАВ ЦИНКА, %, ПО ГОСТ 3640-79 '
Марка
ЦВОО*
цво
ЦВ1
ЦВ
ЦОА
Ц0
ш
Ц2**
цз**
Zn,
не
менее
99,997
99,995
99,992
99,990
99,980
99,975
99,95
98,7
97,5
Примеси не более
РЬ
0,00001
0,003
0,004
0,005
0,011
0,013
0,02
1,0
2,0
Fe
0,00001
0,002
0,003
0,003
0,003
0,005
0,010
0,05
0,10
Cd
0,002
0,002
0,002
0,002
0,004
0,004
0,010
0,20
0,20
Си
0,0001
0,001
0,001
0,001
0,001
0,001
0,002
0,005
0,05
Sn
0,0001
0,001
0,001
0,001
0,001
0,001
0,001
0,002
0,005
As
0,0005
0,0005
0,0005
0,0005
0,01
0,01
Всего
0,003
0,005
0,008
0,010
0,020
0,025
0,050
1,3
2,5
* Содержание Al, Bi, Ni н Sb должно быть не более 0,00001 % каждого.
** Содержание Sbs;O,O2 7o.
Цинк марки ЦВОО хранят в закрытой таре, а остальных марок — в
сухом и чистом помещении.
Кроме компактного цинка, выпускается цинковый порошок, который
изготовляется ректификацией нли распылением жидкого металла. Его
используют в химической или металлургической промышленности, а так-
также для производства химических источников тока. Маркируются по-
рошкн так же, как и компактный цинк, но впереди ставится буква «П»,
например ПЦВ, ПЦО и т. д. Порошок упаковывают в герметичные ме-
металлические барабаны; масса нетто порошка в барабане 30, 40, 50 кг.
Хранить порошок следует в сухих закрытых помещениях.
Физические свойства
Атомные характеристики. Атомный номер 30, атомная масса
65,37 а. е. м., атомный объем 9,15-10~6 м3/моль, атомный радиус
0,139 нм, нонный радиус Zn2+ 0,83 нм. Значения потенциалов иониза-
ионизации / (эВ): 9,39; 17,96; 39,70. Электроотрицательность 1,6. Кристалли-
Кристаллическая решетка цинка — гексагональная плотноупакованная с периода-
периодами а=0,2664 и с=0,4946 нм, с/а~ 1,856. Энергия кристаллической ре-
решетки 131,5 мкДж/кмоль. Координационное число 6; 6. Межатомные
расстояния 2,66; 2,91 нм. Конфигурация внешних электронных оболо-
оболочек 3dI04s2. Природный цинк состоит из стабильных изотопов 64Zn
D8,89 %), «Zn B8,81 %), 67Zn B,07 %), 68Zn A8,61 %) н 70Zn @,62 %).
Известны девять радиоактивных изотопов, важнейшие из них 65Zn с пе-
периодом полураспада 250 дней.
Работа выхода электронов ф=4,24 эВ, для монокристалла с индек-
индексом грани @001) ср = 3,63 эВ.
Плотность цинка в зависимости от температуры:
Т, К ...
р, Мг/м3 .
298
7,13
692,5
6,02
873
6,81
1073
6,57
Электрические и магнитные. Удельная электрическая проводимость
О в зависимости от температуры:
Т, К. . .
а, МСм/м
113
45,5
293
16,4
373
12,7
773
2,74
123
Удельное электросопротивление р в зависимости от температуры:
т. к
90
195
273
р.
0
0
0
мкОм-м
,0162
,0334
,0545
Т,
293
464
573
к
,5
р.
0
0
0
мкОм м
,0592
, 1037
,1325
г, к
700
773
873
Р.
0
0
0
икОм и
,373
,366
,369
Температурный коэффициент электрического сопротивления а=
=4.17- Ю-з K-i при 273 К, 3,7-10"» К при 291—373 К.
Абсолютный коэффициент т. э. д. с. при 298 К е=+2,9 мкВ/К; для
оси, параллельной с, величина е=+0,4 мкВ/К, для оси, перпендикуляр-
перпендикулярной оси с, величина е=+21 мкВ/К. Для жидкой фазы при 733 К врасч=
=»—4; еЭксп=—6. Температура сверхпроводимости 70=0,875 К.
Максимальное значение коэффициента вторичной электронной эмис-
эмиссии аШах=1,41 при ускоряющем напряжении первичных электронов
0,700 кэВ. Постоянная Холла при комнатной температуре #=+0,9Х
ХЮ-Ш М3/Кл, при 693—923 К /?=— 0,52±0,02- Ю-10 м3/Кл. Магнитная
восприимчивость при 293 К х——0,175-10~9, для жидкого цинка %=
=—0,12-Ю-9.
Тепловые и термодинамические. Температура плавления (ал =
=419,5 °С, изменение объема при плавлении 0,69 ■ 10—6 м3/моль. Темпе-
Температура кипения ?кип = 907сС.
Температура кипения в зависимости от давления Р:
/МО". Па
0,0133
1,1330
1,3330
'кип- °С
490
552
553
Р ИГ"*, Па
1.6262
1,7995
39,69
'кип' °С
554
650
1120
/МО—4. Па
114,66
210,7
519,4
'кип1 ь
1230
1280
1510
Характеристическая температура 6в=305-т-319,7 К. Удельная тепло-
теплота плавления Д//пл=1Ю кДж/кг, удельная теплота испарения Д//исп =
= 1765 кДж/кг, удельная теплота сублимации при 298 К Д#субл =
= 1985,46 кДж/кг.
Средняя удельная теплоемкость ср при 273—373 К равна
394 Дж/(кг-К).
Удельная теплоемкость в зависимости от температуры:
г. к
20
40
80
срч II Т К
кДжДкт.К) 1
26,9
123,2
258
150
250
298
V
кДж/(кг-К)
377,2
379,1
388,4
7. К
400
600
1000
Ср-
кДж/(кг-К)
403,7
430,4
486,3
теплоемкость ср —
Теплоемкость жидкого цинка в интервале 693—1073 К равна
481 Дж/(кг-К). Удельная электронная
= [0,633 мДж/(моль-К2)]-7\
124
Теплопроводность А, при 273—373 К равна 119,0 Вт/(м-К). Тепло-
Теплопроводность в зависимости от температуры:
Г, К- • • •
X, Вт/(м-к),
73 273 473 573 673
118,5 112,7 104,7 101,0 96
Теплопроводность жидкого цннка:
Т К
%', Вт/(м-К)
692,5
49,5
773
54,1
873
59,9
1073
60,7
Температурный коэффициент линейного расширения а в зависимо-
зависимости от температуры:
Г, К • • ■
а-106, к-
73
22
173
28
273
30
473
34
Температурный коэффициент объемного расширения
Т, К- • ■
р-ю«, к-1
293—373
93,5
473—683
98,1
692—816
147
673
38
692—1191
217
Молярная энтропия
Г, К
298
500
1000
s°, Дж/(моль-К)
41,66
55,26
86,71
s в зависимости от температуры
т, к
1500
2000
s°, Дж/(моль К)
194,60
200,58
г, к
2500
3000
*°, Дж/(моль К)
205,23
209,00
Поверхностная энергия для грани @001) v=105 мДж/м2. Энергия
дефекта упаковки 220 мДж/м2
Поверхностное натяжение а при температуре плавления 810 мН/м.
Поверхностное натяжение в зависимости от температуры:
Г, К 783 823 873 913
а, мН/м 785 774 768 761
Динамическая вязкость т| в зависимости от температуры:
Г, К 723 773 823 873 923 973
т), мПа-с 31,07 27,26 24,28 21,9 19,0 18,29
Кинематическая вязкость v в зависимости от температуры:
Г, К 698 823 873 973 1073 1193
v-106,m2/c. ....... 0,45 0,33 0,23 0,23 0,20 0,19
Давление пара р в зависимости от температуры:
Г, К 298 573 773 973 1178,4
р, Па .... 1,50-10-4 1,67-10-1 1,68-Ю2 7,962-103 10,13- Ю*
125
Приведенный термодинамический потенциал Фт в зависимости от
температуры
Г, К 298 500 1000 1500 2000 2500 3000
Фг, Дж/(моль-К) 41,66 44,63 58,85 90,93 117,64 134,73 146,79
Параметры самодиффузпи (предэкспоненциальный множитель Z)o и
энергия активации Е) монокристалла (по объему зерна), интервал тем-
температур 473—688 К
D0-104, м2/с .... 0,39
E, кДж/моль . . . . 104,25
оси с
0,08
92,11
ПАРАМЕТРЫ ВЗАИМНОЙ ДИФФУЗИИ (ПО ОБЪЕМУ ЗЕРЕН)
Направление
диффузии
_
|| ОСИ С
J_ ОСИ С
—
J_ ОСИ С
|| оси с
|| оси с
J_ ОСИ С
Л оси с
|| оси с
|| оси с
X оси с
|| оси с
X оси с
Диффундирующий
элемент
S
Ni
Ni
Ag
Ag
Ag
Cd
Cd
In
In
Hg
Hg
Au
Au
т. к
593—723
563—663
563—663
823—923
544—686
544—683
544—686
544—686
533—686
533—686
D,. м'/с
1,2-10-"
8,1-10—*
4.3-10-6
8- 10-e
4,5-10-6
3,2-10-6
1.Ы0-6
1,2-10-6
1,4-10-6
6,2-10-"
5,6-10—e
7,3-10-"
9,7-10-6
2,9-10-6
Я, кДж/моль
139,98
136,2
122
119,32
115,56
108,86
86,0
85,5
81,47
79,97
82,5
84,3
124,47
124,43
Примечание Радиоактивный метод, образующаяся фаза — твердый рас-
раствор
Оптические свойства Коэффициент излучения от гладкой неокислен-
ной поверхности при 573 К ег=0,05.
Отражательная способность (коэффициент отражения hd)'
А,, МКМ
0.248*1
0.248*1
0,120
0,140—0,190*2
"о
65
70
20
90
Угол
падения
20
70
0
69,4
?v, МКМ
[*3
4*3
10*з
12*з
"о
80
97
98
99
Пчснка *2 Монокристалл *3 Полированный.
126
Показатель преломления п и поглощения % (пленка непрозрачная):
к
1
1
2
2
3
мкм
,23
,55
,14
,68
,19
1
0
1
1
1
п
,17
,95
,01
,26
,86
4
7
10
13
16
X
,л
,28
,65
,3
,6
Я,, мкм
4,0
5,0
7,0
8,0
10,0
л
2,58
3,77
7,6
9,05
15,3
X
21,3
26,2
36,1
40,7
47,6
Механические свойства
Механические свойства технического цинка при комнатной температуре:
Состояние
Лнтое . . . .
Деформированное
Отожженное
После прокатки и
закалки . . . .
ов, мш
120—140
120—170
70—100
226—245
О() 2, МПа
75
80—100
137—157
6. %
0,3—0,5
40—50
10—20
20—60
И, %
30
60—80
НВ, МПа
300—400
350—450
412
Временное сопротивление и предел текучести в зависимости от тем-
температуры
t, °С. . .
ов, МПа .
а^ 2 ■ МПа
-70
147
129
—40
137
126
20
111
104
ПО
71,6
150
49,0
250
22,6
330
12,7
Предел текучести OqX2 =29,4-"-68,6 МПа Микротвердость при 20 °С
монокристалла #м =323 МПа, поликристаллического цинка чистотой
99,98 % (нагрузка при испытании 0,1 Н) Н^ =510 МПа
Ударнля вязкость KCU в зависимости от температуры (прессован-
(прессованный, отожженный цинк при 200°С).
i, СС ....
KCU, кДж/м2
20
24
55
>893
ПО
858
Модуль нормальной упругости Е:
t, СС —269 —193 —273 20 125 225 325 40@
Е, ГПа 112,6 110,3 104,3 99,2 93,5 86,5 79,4 56,0
127
Модуль сдвига G=38 ГПа, модуль объемного сжатия /(=69,4 ГПа,
Предел выносливости ал в зависимости от скорости нагружения н
числа циклов (при переменном изгибе), МПа:
Химически чистый цинк
Круговой изгиб, 2800 об/мин:
число циклов 104 78,5
» » 105 44,1
» » 108 27,5
Круговой изгиб, 1400 об/мин:
число циклов 105 20,6
Чистый цинк
Круговой изгиб, 2800 об/мин:
число циклов 104 8,8
» » 105 3,9
» » 10« 1,8
Круговой изгиб, 60 об/мин:
число циклов 104 5,5
То же, число циклов 105 , . . , 3,7
То же, число циклов 10е , ", . 1,2
Сжимаемость цинка и= 1,72-10-" Па-'.
Коэффициент Пуассона v=0,249. Скорость звуковых волн при
293 К: продольных с; 4170 м/с, поперечных С( = 2410; удельное аку-
акустическое сопротивление Zs=29 МПа-с/м.
Скорость звука в расплаве при 692 К 2840 м/с, а при 23 К 2700. Ко-
Коэффициент поглощения звука в расплаве F92 К) 3,7-10~15 с2/м.
Химические свойства
Нормальный электродный потенциал реакции Zn—2e^*Zn2+ mo=
= -0,76 В.
На воздухе цинк тускнеет, покрываясь тонким слоем оксида, кото-
который предохраняет металл от дальнейшего окисления. Влажный воздух,
особенно прн наличии сернистого ангидрида или углекислого газа, вы-
вызывает разрушение цинка при комнатной температуре.
Большое влияние на скорость коррознн в нейтральной среде оказы-
оказывает температура: до 50 °С ее влияние незначительно, в интервале 50—
70 °С скорость коррозии возрастает, достигает максимума, а затем при
дальнейшем повышении температуры падает. Это объясняется тем, что
на поверхности возникает плотная защитная пленка, которая с повы-
повышением температуры образует продукты коррозии с низкими защитными
свойствами. При сильном нагревании на воздухе цинк сгорает, при этом
образуется дым белого цвета (ZnO).
В атмосфере сухого кислорода оксидная пленка на поверхности цин-
цинка появляется лишь выше —150 °С, до этой температуры ои остается
блестящим. Жидкий цннк прн 400 °С быстро окисляется и покрывается
серой коркой оксида. Растворимость водорода в расплавленном цинке
при 512 "С составляет 0,0018 см3 на 100 г металла. Водород вызывает
повышенную хрупкость и снижает пластичность.
При нагреве цинка в атмосфере азота прн 600 °С образуется нитрид
Zfi3N2; при взаимодействии с некоторыми органическими соединениями
Zn(N3J.
128
При нагреве до температуры кипения цинк растворяет незначитель-
незначительные количества (следы) углерода. Карбидных соединений не образует.
С сухими фтором, хлором, бромом и иодом при комнатной темпера-
температуре не взаимодействует. При высоких температурах вступает в реак-
реакцию. В присутствии паров воды цинк может воспламеняться с образо-
образованием соответствующего галогеннда (ZnCl2, ZnBr2 и т. д). С серой
цинк образует сульфид ZnS.
Органические и неорганические кислоты образуют с цинком соответ-
соответствующие соли (нитраты, сульфаты, ацетаты и др.). Цинк чистотой 99,9—
99,99 % легко растворяется в кислотах, а чистотой 99,999 % и более не
растворяется даже при нагреве.
Циик взаимодействует со многими цветными металлами—алюмини-
металлами—алюминием, медью и др.
Электрохимический эквивалент 0,33875 мг/Кл.
Технологические свойства
Температура литья цннка 430—450 °С. Линейная усадка 1,57%. Жид-
котекучесть (длина спирали) 110 см.
При обычной температуре цинк хрупок и плохо поддается обработ-
обработке давлением, но при 100—150 °С становится пластичным и из него
можно получать тонкие листы и проволоку. При повышении температу-
температуры пластичность цинка падает: при 200—250 °С он становится очень
хрупким и его можно истолочь в порошок.
Примеси свинца, висмута, сурьмы и мышьяка отрицательно влия-
влияют на технологические свойства циика. При горячей обработке давле-
давлением цинк, содержащий даже менее 0,05 % Sn, легко разрушается
вследствие выделения эвтектики.
Железо задерживает рекристаллизацию цинка и способствует иа-
клепу. При содержании железа >0,2 % в цинке образуется хрупкая
металлическая фаза FeZn?; при 0,2 % Fe хрупкость настолько возраста-
возрастает, что затрудняется прокатка.
При добавке 0,1—0,2 % Ti уменьшается зерно, повышается темпера-
температура рекристаллизации и уменьшается анизотропия механических
свойств.
Температура горячей обработки 150—200 °С, отжиг 50—100 °С. Тем-
Температура начала рекристаллизации 20 °С. Максимальная допустимая
(суммарная) деформация в горячем состоянии 96 %.
Механические свойства горячекатаного цинка чистотой 99,954 % в
зависимости от величины обжатия:
ОЗжатне, %
77,5
80,5
85,8
88,5
92,3
95,8
а_, МПа
139/149
139/158
135/155
156/176
184/205
203/220
аол. МПа
845/107
845/111
765/925
117/133
145/170
158/162
в, %
84/26
73/14
77/30
84/14
52/50
15/50
Ф, %
91/22
84/13
83/23
83/13
83/81
65/72
Примечание. В числителе приведены значения для продольных образ-
образцов, в знаменателе — для поперечных.
129
Механические свойства цинка в зависимости от температуры отжига:
Марка
ЦВ
ш
ЦВ
m
ЦВ
ш
ЦВ
Ц1
ГОТЖ' -^
Твердая
»
100
100
200
200
300
800
о_, МПа
137
226
80
140
80
140
25
130
в, %
60
15
20
28
17
16
2
10
Число изги-
изгибов (при 5 мм)
73
14
3
4,5
3
6
2
5
Примечание. Исходный материал — проволока диаметром 1,8 мм.
Области применения
Примерное назначение цинка различных марок:
— ЦВ00: для производства химически чистых реактивов; для нужд
электротехнической промышленности и для научных целей;
— ЦВО, ЦВ1: для нужд полиграфической и автомобильной промыш-
промышленности;
— ЦВ: для отливаемых под давлением особо ответственных дета-
деталей авиа- и автоприборов; для изготовления оксида цинка, применяемо-
применяемого в химико-фармацевтнческой промышленности; для химически чистых
реактивов; для получения цинкового порошка, используемого в произ-
производстве аккумуляторов;
— ЦОА: для листов, применяемых в производстве гальванических эле-
элементов; для отливаемых под давлением ответственных деталей авиа- и
автопрнборов; для изготовления цинковых сплавов, обрабатываемых
давлением; для горячего и гальванического оцинковаиия изделий и
полуфабрикатов; для изготовления высококачественных сухнх цинко-
цинковых белил; для изготовления цинкового порошка; для легирования алю-
алюминиевых сплавов;
— Ц0: для листов, применяемых в производстве гальванических эле-
элементов; для отливаемых под дав чен^ем отечественных деталей авиа- и ав-
топрийоров; для изготовления цинковых сплавов, обрабатываемых
давлением; для горячего и гальванического оцииковаиия изделий и полу-
полуфабрикатов, в том числе на непрерывных агрегатах оцинкования; для
изготовления муфельных и печных цинковых белил; для изготовления
цинкового порошка; для легирования алюминиевых сплавов;
— Ц1: для производства сплавов, обрабатываемых давлением (в том
числе для листов); для изготовления гальванических элементов (отлив-
кн); для гальванического оцинкования в виде анодов; для горячего
оцинкования изделий и полуфабрикатов; для изготовления муфельных
и печных сухих цинковых белил; для специальных латуней, медноцннко-
вых сплавов; для приготовления флюса при лужении жести для консерв-
консервных банок; для изготовления цинкового порошка, применяемого в хи-
химической и металлургической промышленности;
— Ц2: для производства листов; для медноцинковых сплавов и
бронз; для изготовления проволоки для металлизации; для горячего
оцинкования изделий и полуфабрикатов; для изготовления цинкового по-
порошка, применяемого в химической н металлургической промышленности,
130
— ЦЗ: для производства цинковых листов, в том числе предназна-
предназначенных для полиграфической промышленности, для обычных литейных
и свинцовистых медноцинковых сплавов; для горячего оцинкования из-
изделий и полуфабрикатов; для изготовления цинкового порошка, приме-
применяемого при производстве циика.
Значительное количество цинка идет на цинкование железа и спла-
сплавов на его основе в целях предохранения их от коррозии. Цинк исполь-
используется для получения сплавов с медью (латуни), с медью и оловом
(бронзы), с никелем (мельхиор), с медью и никелем (нейзильбер), а
также для изготовления подшипниковых сплавов (типа ЦАМ).
Широкое применение нашли изделия, получаемые литьем под давле-
давлением (авиационная, автомобильная и другие отрасли промышленности).
В последние годы цинк используют в космической технике (покрытия
стартовых конструкций для запуска ракет, краска из сульфида цинка
для покрытия космических кораблей). Сульфид цинка используется
для обнаружения а-, 0- и у- радиации, а цинксеребряные оксидные ба-
батареи вследствие высокой мощности (в 5—6 раз большей, чем мощность
лучших батарей других типов) служат в качестве источников энергии в
космических кораблях.
Антимонид цинка используют в качестве полупроводника, оксид цин-
цинка— при производстве резины и ее обработке, при производстве краски
(цинковые белила).
Цинк применяют также для изготовления медицинских препаратов.
2.8. КАДМИЙ [1—35, 51, 115—11»]
Общие сведения и методы получения
Кадмий (Cd)—серебристо-белый металл с синеватым отливом.
Открыт в 1817 г. немецким химиком Штромейером при минералоги-
минералогическом исследовании карбоната цинка. Свое название получил от гре-
греческого слова kadmeia, что значит нечистый оксид, а также цинковая
руда. Независимо от Штромейера немецкие ученые Герман, Карстен и
Мейснер в 1818 г. обнаружили кадмий в силезских цинковых рудах.
Первые упоминания о промышленном производстве металлического
кадмия относятся к концу 20-х годов прошлого столетия, однако масш-
масштабы этого производства до 1870 г. были ничтожно малы (не более
125 кг в год).
Заметно расширилось производство и применение кадмия к началу
текущего столетия.
Содержание кадмия в земной коре 0,00005 % (по массе).
Минералы кадмия — гринокит CdS и отавит CdCO3; встречается кад-
кадмий также в морских осадочных породах — сланцах, песчаниках и др.
Основной источник получения кадмия—полиметаллические цинко-
цинковые руды. Его выделяют из отходов цинкового производства, содержа-
содержащих 0,2—0,7 % Cd, путем их обработки разбавленной серной кислотой,
растворяющей оксиды кадмия н циика. Из раствора кадмий осаждают
цинковой пылью. Губчатый остаток (смесь кадмия и цннка) растворя-
растворяют в разбавленной серной кислоте и выделяют кадмий электролизом
этого раствора. Электролитический кадмий переплавляют под слоем ед-
едкого натра и затем отливают в слитки. Металл высокой чистоты полу-
получают электрохимическим способом, применяя глубокую очистку элект-
электролита от микропримесей, перегонкой кадмия и зонной плавкой. Чисто-
Чистота кадмия после такой обработки 99,99995 %.
Химический состав кадмия (ГОСТ 1467—77 —см, табл. на с. 132).
131
Марка
КдООО
КдОО
КдОАС
КдОС
Кд 1С
Кд2С
КдОА
КдО
Кд1
Кд2
Кадмий, не
менее
99,9997
99,997
99,98
99,95
99,90
99,5
99,98
99,95
99,93
99,83
ХИМИЧЕСКИЙ
СОСТАВ, %,
КАДМИЯ (ГОСТ 22860—77 И
1467—77)
Примеси, не более
РЬ
0,00003
0,0005
0,01
0,03
0,05
0,1
0,008
0,02
0,03
0,05
Ztl
0,00003
0,0009
0,010
0,01
0,01
0,2
0,001
0,004
0,005
0,01
Си
0,000001
0,00028
0,004
0,01
0,02
0,01
0,004
0,01
0,015
0,02
Fe
0,00002
0,0005
0,001
0,002
0,004
0,05
0,0003
0,002
0,004
0,01
Т1
0,00001
0,0001
0,002
0,005
0,01
—
0,002
0,005
0,015
0,08
Ni
0,000002
0,0001
0,002
—
—
0,001
0,002
—
Всего
0,0003
0,003
0,02
0,05
0,5
0,02
0,05
0,07
0,17
Примечания: 1. Марки КдООО и КдОО по ГОСТ 22860—77, остальные — по ГОСТ 1467—77.
2. В кадмии марки КдОО содержание сурьмы, мышьяка, олова должио быть не более 0,0001 % каждого.
3. Содержание примесей мышьяка, сурьмы и олова в кадмии марок КдОА, КдО и Кд1 не более 0,003% в сумме, для остальных
марок ие более 0,002 % каждого.
4. В кадмии марки КдООО содержание остальных нормируемых примесей должно быть, %, ие более; 0.00001 Sb; 0,00002 А1;
0,00004 As; 0,00008 Hg; 0,000001 Ga; 0,OO0O02Sn, Co и В (каждого); 0.000005 In, Bi и Р (каждого); 0,0000005 Ag.
5. Содержание нвкеля устаиавлнвается по соглашению изготоввтеля с потребителем.
Кадмий всех марок, кроме КдООО н КдОО, изготовляют в виде чушек
массой lO.OTl.S; 4,0ч::0,6 и O.S^O.l кг, а также в виде прутков диа-
диаметром e^l мм.
Кадмий марки КдООО изготовляют в виде чушек массой не более
1,0 кг. Чушки отливают в изложницах из спектральио-чистого графита.
Кадмий марки КдОО изготовляют в виде чушек или стержней длиной
не более 150 мм и массой не более 0,2 кг. По соглашению сторон кад-
кадмий марок, предусмотренных ГОСТ 1467—77, допускается изготовлять
в виде гранул, а также в виде слитков массой 100, 200 и 500 кг с до-
допускаемым отклонением =F20 %, приспособленных для механизированной
погрузки.
Чушки, слитки и плиты кадмия всех марок по ГОСТ 1467—77 по-
поставляют без упаковки; прутки всех марок, поставляемых по ГОСТ
1467—77, упаковывают в плотные дощатые ящики по1 ГОСТ 2991—76.
Чушки кадмия марки КдООО заворачивают в полиэтиленовую пленку
(каждую чушку в отдельности) и упаковывают в ящики из гофриро-
гофрированного картона нли фанерные ящики по ГОСТ 5959—80.
Предусмотрено изготовление кадмия марки КдОА в виде чушек и
прутков высшей категории качества.
Химический состав кадмия марки КдОА, %: >99,98Cd; <0,008Pb;
<0,001Zn; <0,004Cu; <0,0003Fe; <0,003S (As, Sb, Sn); <0,001Ni
(всего примесей 0,02 %).
Чушки изготовляют массой 10,0±1,5; 4,0±0,6; 0,5±0,1 кг. Диаметр
прутков 8± 1 мм.
Для производства химически чистых реактивов и для научных це-
целей выпускают кадмий высокой чистоты (ГОСТ 22860—77). Era хи-
химический состав:
м
Кд
Кд
Кд
арка
0000
000
00
Кадмий, %
не менее
99
99
99
,9999
,9997
,997
1-
3-
5-
РЬ
10-6
10-6
ю-4
1-
3-
9-
Примеси,
Zn
10-6
ю-5
10-6
1-
1-
3-
%. не
Си
10-е
10-е
Ю-4
более
5
2
5
Fe
10-е
ю-6
10-4
1
1
1
'
Т1
■ ю-6
• 10-6
•10-*
Продолзкение
Марка
Кд 0000
КдООО
КдОО
Примеси, %, не более
Ni
2-Ю-'
2-10—в
ыо-4
Hg
8-10-5
8-Ю-5
А1
2-Ю-6
2-10-5
As
4.10-6
ыо-*
Sb
1 ■ 10—g
ыо-*
Sn
2-10—•
ыо-4
Со
2-10-'
2-Ю-6
Продолжение
Марка
Кд 0000
КдООО
КдОО
2-
5-
In
Ю-6
ю—б
2
5
Bi
■ ю-6
•10-е
Примеси, %,
Ag
5-10-'
5-10-'
не более
5-
3-
Мп
10-е
ю-6
всего
0,0001
0,0003
0,003
133
Кадмий высокой чистоты выпускают в виде слитков массой 1 и 10 кг
или стержней длниой не более 150 мм и массой не более 0,2 кг.
Оксид кадмия (аэрозоль) и пыль кадмия, а также растворы его сое-
соединений токсичны и относятся к веществам 1-го класса опасности Осо-
Особую опасность представляют пары кадмия и его соединений. Признаки
отравления: сладковатый вкус во рту, сухость, боль в горле, кашель,
головная боль с головокружением, лихорадочное состояние, слабость,
боль в подложечной области. Пострадавшего следует вывести из зара-
зараженного места, облегчить доступ свежего воздуха и вызвать врача.
Предельно допустимая концентрация оксида кадмия в помещении
(ПДК) не более 0,1/0,3 мг/м3.
Все операции — сверление, фрезерование, зачистку и др., а также
разливку жидкого металла — необходимо выполнять в спецодежде при
обеспечении приточно-вытяжной вентиляции, используя респиратор типа
«Лепесток». Руководствоваться следует ГОСТ 12.1.007—76 и ГОСТ
12.1.005—76.
Физические свойства
Атомные характеристики. Атомный номер 48, атомная масса
112,40 а.е. м., атомный объем 13,01-Ю-6 мэ/моль, атомный радиус
0,156 нм, иониый радиус Cd2+ 0,099 им.
Потенциалы ионизации / (эВ): 8,991; 16,904; 44,5. Кристаллическая
решетка гексагональная с периодами а=0,296 нм, с=0,563 им, отноше-
отношение с/а= 1,882; энергия кристаллической решетки 116 мкДж/кмоль. Коор-
Координационное число 6; 6. Электронная конфигурация 4dlo5s2.
Природный кадмий состоит из смеси восьми стабильных изотопов с
массовыми числами: 106A,215%), 108 @,875%), ПО A2,39%),
111 A2,75%), 112B4,07%), 113A2,26%), 114B8,86%), 116G,58%).
Эффективное поперечное сечение захвата тепловых нейтронов 2450—
2900-10~28 м2. Работа выхода электронов <р=4,1 эВ. Электроотрицатель-
Электроотрицательность 1,7.
Плотность. Плотность кадмия при 293 К р=8,650 Мг/м3. Плотность
в зависимости от температуры:
Г, К 293 603 673 873
р, Мг/м3 8,650 8,010 7,930 7,720
Электрические и магнитные свойства. Удельное электрическое сопро-
сопротивление р и удельная электрическая проводимость а в зависимости от
температуры:
20
73
113
173
293
р, мкОм ■ м
0,0017
0,0166
0,0272
0,048
0,0757
с, МСм/м
36,8
13,3
7-.К
673
773
973
1273
р, мкОм.м
0,337
0,341
0,358
0,358
О, МСм/м
2,93
2,8
2,8
Температурный коэффициент электросопротивления при 273 К а=
= 4,24-10 К, в интервале 273—373 К а=4,0-10-3 К. Абсолютный
коэффициент т. э. д. с. при 298 К е=+2,8 мкВ/К, параллельно оси с ои
равен 0,0 мкВ/К, а перпендикулярно ей +3,2 мкВ/К. Абсолютный коэф-
134
фициент т. э. д. с. в жидкой фазе E94 К) е=0,0 мкВ/К. Температура
перехода в сверхпроводящее состояние 7^=0,54 К, критическое магнит-
магнитное поле 35,97 А/м. Максимальное значение коэффициента вторичной
электронной эмиссии атах=1.1 при ускоряющем напряжении первичных
электронов 0,400 кэВ.
Постоянная Холла при комнатной температуре /? = +0,531Х
ХЮ-'° м3/Кл, прн 593—873 К R = — 0,76±0,3- Ю-10 м3/Кл. Магнитная
восприимчивость при 14 К Х=—0,310-Ю-9, при 293 К %=— 0,176- Ю"9.
Тепловые и термодинамические. Температура плавления ?„л = 321 "С,
температура кипения 1КИЛ=766°С. Характеристическая температура во
по упругим постоянным 213,4 К, по теплоемкости 219,5 К (имеются дан-
данные о значении вв=172 К). Удельная теплота плавления ДЯПл =
= 57 кДж/кг, удельная теплота сублимации ДЯсубл=992 кДж/ю\
Удельная теплоемкость ср в зависимости от температуры:
Г, К 10 293 373 573 594 873
ср, Дж/(кг-К) . . 335 230 239 260 264 264
Удельная электронная теплоемкость с^л = [0,688 мДж/(моль-К8>)] -Т,
Теплопроводность X в зависимости от температуры:
Т, К 86 293 373 473 573 673
h Вт/м-К. . . . 104,7 92,8 87,9 90,7 104,7 43,9
Анизотропия теплопроводности к:
Г, К 10 20 60—180
Х,це, Вт/(м-К) 1000 700 940
XLC, Вт/(м-К) 940 420 630
Температурный коэффициент линейного расширения а в зависимости
от температуры:
Т, К 223 273 293 373 473 523 573
«•106,К-1. . . . 28,3 29,0 31,0 31,8 31,8 32,5 38
Молярная энтропия s° в зависимости от температуры:
Г, К 298 500 1000 1500
s°, Дж/(моль-К). . . . 51,79 65,77 94,46 201,34
Продолжение
Г, К 2000 2500 3000
s°. Дж/(моль-К). . . . 207,33 211,97 215,78
Поверхностное натяжение жидкого кадмия при температуре плавле-
плавления а=558 мН/м. Энергия дефекта упаковки 150 мДж/м2.
Давление пара в зависимости от температуры:
460
480
21
72
Р. Па
,36-10—з
,81-Ю-3
Т.К
500
520
22
63
р.
,44
,7-
Па
• Ю-2
Ю-2
540
560
р.
16,76
40,96
Па
• 10-1
• 10-1
135
Давление пара при температуре плавления р=14,8 Па.
Приведенный термодинамический потенциал Фг в зависимости от
температуры:
7\K
298
500
loop
1500
ФТ
Дж/
51,79
54,81
70,12
110,03
Ф^ (газ)
моль.К)
167,76
170,15
178,35
184,68
т,к
2000
2500
3000
ф
133
148
159
г
Дж/ (м
,64
,88
,72
ФТ
ОЛЬ-К)
189
193
197
(гез)
,66
,68
,07
Параметры самодиффузии по объему зереи (предэкспоиенциальпый
множитель Do и энергия активации Е);
Направление диффузии
Поликристалл
Монокристалл _1_ с
То же, II с
473—558
403—553
403—553
О„-10\ м»/с
0,14
0,10
0,05
Е, кДж/моль
82,48
79,97
76,2
Параметры взаимной диффузии (радиоактивный метод):
Диффундирующий элемент
Zn*
Ag*
т,к
453—573
453—573
Do, м*/с
1,6-10'
2,21-10-*
Е , кДж/моль
79,6
• Образующаяся фаза — твердый раствор.
Оптические. Отражательная способность (коэффициент отражения
По) полированного кадмия:
X, мкм.
nD, %
1,0 2,0 4,0 7,0 10,0 12,0
67 72 81 93 97 97
Показатель преломления и:
JL нм . 436,0 (ж) 546,0 (ж) 579,0 (ж) 589,0 (тв) 630,0 (тп)
и ... 0,39 0,546 0,82 1,13 1,31
Механические свойства
Временное сопротивление при растяжении а„=96,5 МПа, предел теку-
текучести а02=9,8 МПа, относительное удлинение 6=44 %, твердость по
Бринеллю НВ= 160-5-200 МПа,
136
Свойства кадмия (99,98) в эайисимости от температуры испытания:
—200
— 100
—30
0В, МПа
284/304
167/196
137/157
е, %
34/27
40/40
50/40
*. %
40/23
97/95
99/97
'исп'
•С
20
85
145
200
о„, МПа
68,7/108
58,9/88,3
39,2/68,7
19,6/29,4
6, %
42/50
72/36
95/84
90/50
76/96
94/90
88/86
93/86
Примечание. В числителе•— данные, полученные при скорости деформа-
деформации 2-10 ~2 С , в знаменателе — при скорости деформации 2-10 "~* с—1.
Временное сопротивление при сжатии (после отжига при 110—130 °С)
при комнатной температуре а£ж=89,3 МПа, при тех же условиях при
растяжении ав=68,7 МПа.
Твердость (НВ) в зависимости от температуры:
t, °С 0 100 200 300
НВ, МПа .... 275 88,3 44,2 25,5
Твердость при 20 СС отожженного кадмия #5=203-4-220 МПа.
Микротвердость при 20 °С Я^ =290 + 294 МПа.
Модуль нормальной упругости Е в зависимости от температуры:
t, °С
Е, ГПа.
—273 —190 —73 25 300
75,6 73,5 68,3 63,1 30,4*
• После отжига.
Модуль нормальной упругости при 20 °С монокристалла A11) £=•
= 29,8 ГПа, для A010) £=81,0 ГПа, а для @001) £=28,0 ГПа. Сжи-
Сжимаемость при 20СС %=2,13-10-" Па-1. Скорость распространения зву-
звуковых волн при 20 °С продольных с(=2700 м/с, в поперечных с( =
= 1500 м/с.
Химические свойства
Нормальный электродный потенциал реакции Cd—2e=p*Cd2+ (po=
=—0,402 В. Степень окисления +2. Электрохимический эквивалент
0,5824 мг/Кл.
При обычной температуре на воздухе кадмий устойчив. Во влажном
воздухе он покрывается пленкой оксидов, которая предохраняет металл
от окисления При нагреве на воздухе до 300 °С на поверхности кадмия
образуются цвета побежалости, при дальнейшем нагреве кадмий сгорает.
При нормальных условиях с водородом, азотом, углеродом кадмий
не взаимодействует. При нагреве образует с азотом химическое соеди-
соединение CdaN2. Большинство неорганических кислот и некоторые органи-
органические кислоты растворяют кадмий. Он стоек в разбавленных растворах
соляной кислоты, легко растворяется в азотной кислоте, значительно
хуже в серной. В щелочах нерастворим. Кадмий при взаимодействии с
галогенами образует галогениды; наиболее активным является хлор.
При нагревании с серой кадмий образует сульфид CdS. Известны
основные, двойные и комплексные соли кадмия. Соединения кадмия
ядовиты!
137
Кадмий взаимодействует с золотом, кальцием, литием, магнием, нат-
натрием, мышьяком, ртутью, никелем и другими элементами, образуя твер-
твердые растворы, химические соединения, эвтектики и т. д. Кадмий не об-
образует твердых растворов с алюминием, кремнием, висмутом, галлием,
железом, свинцом.
Для повышения коррозионной стойкости кадмиевых покрытий ис-
используют хроматирование.
Технологические свойства
Кадмий — пластичный и мягкий металл, хорошо куется, прокатывается
на листы и протягивается в проволоку. При нагреве до 80 "С становит-
становится хрупким.
Области применения
Кадмий входит в состав антифрикционных сплавов, сплавов на основе
меди (кадмиевая бронза) и магния, а также в состав припоев (сплав
Вуда). Кадмий используется в ядерных реакторах для управления цеп-
цепной реакцией. Амальгаму кадмия применяют в зубоврачебном деле. Не-
Небольшие добавки кадмия способствуют увеличению вибростойкости
свинца, используемого для бронирования кабеля. Одно из важнейших
назначений кадмия — антикоррозионные и декоративные покрытия же-
железа и стали, однако такие покрытия нельзя применять для деталей, ра-
работающих в атмосфере, содержащей SO2, а также для водопроводных
труб и предметов домашнего обихода. Сернистый кадмий и сульфат
кадмия используют для изготовления красок, резины, а также в тек-
текстильном производстве н мыловареннн.
Некоторые соединения кадмия (теллуриды, селениды и др.) представ-
представляют интерес в качестве полупроводниковых материалов.
2.9. РТУТЬ [1— 35, 120-122]
Общие сведения и методы получения
Ртуть (Hg) — серебристо-белый тяжелый металл, жидкий при комнат-
комнатной температуре. При замерзании ртуть становится белой, в твердом
состоянии легко поддается обработке и имеет зернистый излом. Само-
Самородная ртуть была известна за 2000 лет до и. э. Народы древней Индии
н Китая, а также греки и римляне применяли киноварь (природный
HgS) как краску, лекарственное и косметическое средство. Греческий
врач Диоскорид (I в. до н.э.), нагревая киноварь в железном сосуде
с крышкой, получил ртуть в виде паров, которые конденсировались на
ее внутренней поверхности. Продукт реакции был назван hydrargyros
(от греческого hydor — «вода» и argyros— «серебро»), т.е. жидким се-
серебром. Происхождение русского названия «ртуть» не установлено
Твердая ртуть впервые получена в 1759 г. в Петербурге М. П. Брау-
Брауном и М. В. Ломоносовым, которым удалось заморозить ее в смеси
снега с концентрированной азотной кислотой.
Ртуть — весьма редкий элемент. Ее среднее содержание в земной
коре — 4,5-10—6 % (по массе). Примерно в таком же количестве оиа
содержится в изверженных горных породах. Известно 35 рудных ми-
минералов, содержащих ртуть в таких концентрациях, при которых про-
промышленное использование этих минералов технически возможно и эко-
экономически целесообразно. Основной рудный минерал — киноварь HgS
138
с содержанием ртути 86,2 %. Из других минералов следует отметить
метацинабарит, самородную ртуть или лнвингстонит, кордероит, ртуть-
содержащие сульфасоли и т. д.
Ртутные руды делятся на богатые (~ 1 % Hg), рядовые @,2—0,3 %
Hg) и бедные @,06—0,12 % Hg). Основное промышленное значение
имеют телетермальные месторождения ртутных руд, которые разраба-
разрабатываются подземным способом. Встречается ртуть также в разрабаты-
разрабатываемых открытым способом вулканогенных месторождениях.
Существуют два основных способа извлечения ртути — пиро- и гид-
гидрометаллургический. В первом случае руды или концентраты, содержа-
содержащие ртуть в виде HgS, подвергают окислительному обжигу. Полученная
в результате обжига жидкая ртуть стекает в специальные приемники.
Для последующей очистки ее пропускают через высокий A,0—1,5 м)
сосуд с 10 %-ной НЫОэ, промывают водой, высушивают и перегоняют в
вакууме. Второй способ получения ртути состоит в растворении HgS
в сернистом натрии н последующем вытеснении ртути алюминием. Раз-
Разработаны способы извлечения ртути путем электролиза сульфидных
растворов.
Составы, методы поставки, приемки, анализа, транспортировки и
хранения ртути определяются ГОСТ 4658—73.
Наиболее широко используется ртуть, поставляемая по ГОСТ 4658—
73, который распространяется на ртуть, предназначенную для произ-
производства полупроводниковых материалов, для использования в вакуум-
электротехнике, при производстве контрольно-измерительных приборов,
реактивов, фармацевтических препаратов, а также в химической и ме-
металлургической промышленности.
Химический состав ртути по FOCT 4658—73
Марка
Р0
Р1
Р2
РЗ
РОу
Ртуть, %, не менее
99,9992
99,999
99,99
99,9
99,9996
Нелетучий остаток, %,
не более
0,0008
0,001
0,01
0,1
0,0004
Ртуть всех марок должна иметь серебристо-белый цвет, не содержать
механических примесей и полностью растворяться в азотной кислоте
плотностью 1,2 Мг/м3. Ртуть марок Р0, Р1 и Р2 не должна оставлять
следов на стенках стеклянного сосуда, белой гладкой бумаге или фар-
фарфоровой гладкой пластинке. Ртуть всех марок поставляют партиями
массой до 1000 кг (для Р0, Р1 и Р2) и до 1500 кг (для ртути марки
РЗ). Ртуть марки Р0 должна поставляться потребителю только после
контрольного хранения на складе в течение 5 сут и в том случае, если
за это время на ее поверхности не оказалось пленки. Ртуть марок Р0,
Р1 и Р2 разливают в баллоны емкостью по 500 мл из толстостенного
стекла с толщиной стенки не менее 4 мм. Баллоны вмещают по 5 кг
ртути. Ртуть марки РЗ разливают в стальные баллоны, вмещающие по
34,5 кг. На ярлыки, а иногда и на баллоны наносят цветные полоски:
' Переиздан в 1968 г.
139
голубого цвета — для ртути марки РО, белого — для Р1 и красного —
для Р2. Баллоны толстостенного стекла упаковывают в четырехгнездо-
вые ящики, футеруют резиной или засыпают чистыми сухими опилками.
Маркировку ящиков производят по ГОСТ 14192—77, включая знак
«Верх. Не кантовать». Гарантийный срок хранения ртути марок Р1 и
Р2 — 2 года, марки РО — 3 года.
Ртуть легко испаряется и ее пары сильно ядовиты, поэтому при ра-
работе с ртутью следует выполнять определенные требования по технике
безопасности, регламентируемые ГОСТ 4658—73.
■ Все работы с ртутью необходимо производить в специально обору-
оборудованных помещениях, оснащенных приточно-вытяжной вентиляцией и
специально оборудованными вытяжными шкафами. Предельно допусти-
допустимая концентрация ртути в рабочем помещении не должна превышать
0,01 мг/м3, скорость воздуха в рабочем проеме вытяжных шкафов
должна быть не менее 1 м/с, а температура воздуха в помещении — не
выше 40 °С.
Все работы с ртутью необходимо выполнять в спецодежде индиви-
индивидуального пользования: белом халате с длинными рукавами, перчатках
и головном уборе. С открытой ртутью нужно работать в очках.
При работе в атмосфере с содержанием паров ртути, в 5—6 раз
превышающим нормы, следует пользоваться противортутными противо-
противогазами марки «Г» с хлорированным активированным углем.
По окончании работы необходимо принять душ или в крайнем слу-
случае вымыть лицо с мылом, руки — с мылом и щеткой, рот и зубы про-
прополоскать слабым раствором марганцовокислого калия или 2 %-ным
раствором поваренной соли.
В помещении, где производятся работы с ртутью, нельзя хранить
пищевые продукты, принимать пищу и курить.
При остром отравлении ртутью необходимо дать внутрь 1—2 столо-
столовые ложки активированного угля на стакан воды, белковую воду (два
яичных белка на стакан воды), солевое слабительное, после чего немед-
немедленно доставить пострадавшего в медицинское учреждение.
Физические свойства
Атомные характеристики. Атомный номер 80, атомная масса 200,59
а. е. м., атомный объем 14,26- 10~в м3/моль, атомный радиус 0,157 нм,
нонный радиус Hg2+ 0,110 нм. Конфигурация внешних электронных обо-
оболочек 5d'°6s2. Потенциалы ионизации / (эВ): 10,43; 18,76; 34,21. Элект-
Электроотрицательность 1,44. Твердая ртуть имеет ромбоэдрическую решетку
с периодами а=0,3463 и с=0,671 нм. Известно семь устойчивых изото-
изотопов ртути с массовыми числами: 196 (распространенность 0,2 %) 198
A0%), 199 A6,8%), 200 B3,1 %), 201 A3,2%), 202 B9,8%) и 204
F,9 ft).
Эффективное поперечное сечение захвата тепловых нейтронов для
различных изотопов:
Массовое число
Сечение захватах
ХЮ28, м2
196
3100±
±1000
199
2500+
±800
200
<60
201
<60
202
<60
204
<60
Природ-
Природная ртуть
374±5
Среднее сечение захвата, полученное для максвелловского спектра
нейтронов для естественной ртути, равно B0±5)-10~28 м2. Полное се-
140
чение упругого и неупругого рассеяния тепловых нейтронов различных
энергий:
Энергия нейтронов, МэВ . 0,2 0,8 3,0 10,0 20,0 100,0
Сечение рассеянияхЮ28, м2 9,5 5,4 7,0 4,8 5,7 5,0
Работа выхода электрона <р=4,52 эВ. Сродство к электрону 1,54—
1,8 эВ.
Плотность ртути р в различном состоянии в зависимости от тем-
температуры:
Т,К . .
р,Мг/м3.
85 234,2(тв) 234,2 (ж) 273 293
14,383 14,193 13,690 13,596 13,546
Поверхностное натяжение сг ртути в зависимости от температуры:
293
313
333
353
373
о, мН/м
471,6
468,2
464,4
460,5
456,2
393
413
433
473
493
о, мН/м
452,0
447,2
442,0
431,2
425,2
513
533
553
573
593
613
а, мн/м
419,0
412,7
406,4
399,5
392,3
384,6
Динамическая вязкость ртутн г| при различных температурах:
т), мПа-с
273
1,685
293
1,554
323
1,407
373
1,24
473
1,052
573
0,95
Сжимаемость ртутн при 293 К х=4,05-10-" Па.
Электрические и магнитные. Удельное электрическое сопротивление
р ртути прн различных температурах:
15
89,5
223
227,5
р, мкОм ■ м
0,000188
0,0697
0,123
0,212
Г.К
233,8
237
273
293
р, мкОм.м
0,255
0,806
0,947
0,958
323
373
473
573
623
р, мкОм.м
0,985
1,0325
1,1427
1,270
1,355
Таким образом, при переходе ртути из твердого состояния в жидкое
ее электрическое сопротивление возрастает в трн с лишним раза. Тем-
Температурный коэффициент электрического сопротивления а ртутн опре-
определен для температур 15 и 273 К и равен соответственно 2-10~» и
0,89-Ю-3 К-',
141
Коэффициент чувствительности ртути в различных агрегатных со-
1 dp
стояниях к давлению гидростатического сжатия Р при 303 К — •
Р, ГПа
— -loin, па-1
р йР
Агрегатное состояние . .
0,0001 1,0
23,1 17,0
Ж Ж
3,0
12,0
Тв
Температура перехода ртути в сверхпроводящее состояние Тс-
= 4,12 К.
Абсолютный коэффициент т. э. д. с. в\ ртути в паре с медью:
Т.К.
е Hg (Си), мкВ/К
г,к
е Hg (Си),
мкВ/1<
г,к
Hg(Cu),
мкВ/К
73
123
173
1,3
1,75
1,95
233
238
273
3,60
7,20
7,84
323
373
423
9,51
11,55
13,39
Абсолютный коэффициент т. э. д. с. е=—3,4 мкВ/К прн 298 К.
Эффект Пельтье для спая железо — ртуть при различных темпера-
температурах.
Г,К • • •
П, мДж/К
291,4 372,64
6,9 5,8
455,3
6,32
Максимальный коэффициент вторичной электронной эмиссии ртути
Отах=1,6 при ускоряющем напряжении первичных электронов 0,3—
0,5 кэВ.
Постоянная Холла R для ртути при температуре 293 К и магнитной
индукции 6=1,0-7-1,24 Тл менее 0,2-Ю0 м3/Кл; по другим данным,
эта величина для ртути в жидком состоянии колеблется в пределах от
—7,46- 10~ю до —7,6-10~w м3/Кл. Ртуть диамагнитна. Магнитная вос-
восприимчивость % ртутн прн разных температурах н в различных агрегат-
агрегатных состояниях:
Т,К • ■
Состояние
Х-10» . .
560,5
Ж
—0,1637
295,5
Ж
—0,1681
293
Ж
—0,167
80
Тв
—0,118
Магнитная восприимчивость моиокристаллической ртути сильно за-
зависит от направления.
Тепловые и термодинамические. Температура плавления ртути ten =
=— 38,89 СС, температура кипения гкип=357,25 °С, характеристическая
температура 9D=357 К, критическая температура 1477 °С. Удельная те-
теплота плавления ДЯПЛ = 11,68 кДж/кг, удельная теплота испарения при
температуре кипения ДЯИСп = 304,6 кДж/кг, изменение объема при плав-
плавлении 3,7 %.
Теплопроводность ртути К при различных температурах:
142
г,к
К Вт/ (м-К)
тл
h Вт/(м.К)
, Вт/(м.К)
100
200
234,28 (ж)
48
29,6
7,639
293
373
573
8,447
9,475
11,69
873
1073
14,04
14,98
Удельная теплоемкость ртути сР в различных агрегатных состояниях:
7\К
ср. Дж/(кг-К)
Твердая
10
20
40
80
197,4
207,6
228,1
233
23,53
51,00
89,4
165,3
133,6
135,6
140,7
141,1
г,к
234,12
253
273
293
333
373
473
573
673
773
ср, Дж/(кг.К)
Жидкая
141,1
140,3
139,8
139,0
138,2
137,3
135,6
135,2
135,6
137,3
т.к
ср, Дж/
/(кг-К)
Газообразная
273
373
473
573
673
773
103,8
103,8
103,8
103,8
104,2
105,1
Удельная электронная теплоемкость ртути СрЛ=[1,81 мДжДмольХ
ХК2)]Г.
Молярная энтропия ртути при 298 К se=76,2 Дж/(моль-К). Стан-
Стандартная энтальпия атомнзацин ртути при той же температуре /=61,5
кДж/моль.
Температурный коэффициент линейного расширения а:
Т, К
а-10«
90—234 195—234
30 41
В интервале 273—423 К давление паров ртути (р, Па) С удовлетво-
удовлетворительной точностью можно подсчнтать по формуле
р= [(_ 16060/Г) + 8,025]. 133, 322,
а в интервале 423—673 К — по формуле
р=Ц— 103719/7")+ 7,879—0,00019]. 133, 322,
где Т — абсолютная температура,
143
Параметры диффузии ртути:
диффунди-
диффундирующий эле-
элемент
Hg
Li
Na
К
Rb
Cs
Ag
Au
r,K
238—533
298
298
298
280
298
289
298
I
D-IO". M2/c 1
I
0,93
0,86
0,71
0,53
0,64
1,11
0,73
Диффунди-
Диффундирующий эле-
элемент
Tl
Zn
Cd
Sn
Bi
Pb
Ba
Sr
Ca
ТЛ
298
298
298
298
298
298
280
282
283
D-10», мг/с
1,18
2,4
2,0
2,1
1,5
2,1
0,60
0,54
0,62
Примечание Для Hg самодиффузня (D0=l,4I0"
= 5,1 кДж/моль), в остальных случаях диффузия в амальгамах.
м7с;
Е =
Химические свойства
В соединениях проявляет степень окисления +2 н +1.
Ртуть является относительно стойким в химическом отношении эле-
элементом. По отношению к кислороду занимает место вблизи золота и
серебра. Из металлов подгруппы цннка ртуть наименее активна вслед-
вследствие высокой энергии ионизации. Нормальные электродные потенциалы
реакций диссоциации 2Hg->-(Hg2J+ + 2e, (Hg2J+^2Hg2++2e и Hg-»
->-Hg2++2e равны соответственно 0,80; 0,91 н 0,86 В. Электрохимиче-
Электрохимический эквивалент ртутн со степенью окисления +1 2,0789 мг/Кл, а со
степенью окисления +2 1,03947 мг/Кл. Ртутные соединения относитель-
относительно нестойки нз-за постоянной тенденции ртутн к переходу в атомную
форму.
В соляной и разбавленной серной кислотах, а также в щелочах ртуть
не растворяется. Легко растворяется в азотной кислоте, а при нагрева-
нагревании в концентрированной серной. Растворима в царской водке. Со сла-
слабыми кислотами ртуть не дает солей нли образует неустойчивые соли
типа Hg2CO3, которая прн нагревании до 180 °С разлагается на ртуть,
ее оксид н СОг.
С галогенами ртуть образует почти недиссоцнирующие, в большин-
большинстве своем ядовитые соединения. Практическое значение имеют йодная
ртуть Hgb, хлористая ртуть (каломель) Hg2Cl2 и хлорная ртуть (су-
(сулема) HgC^. Йодную ртуть получают воздействием йодистого ка-
калия на растворенные в воде солн ртути. В аналитической хи-
химии с помощью этой реакции выявляют присутствие ртутн. Йодная
ртуть существует в двух модификациях — красной и желтой. Переход
из красной модификации в желтую происходит при 127 °С; обратный
переход протекает медленно н требует переохлаждения. Каломель пред-
представляет собой бесцветные тетраэдрнческне кристаллы, постепенно тем-
темнеющие вследствие распада под действием света на сулему и ртуть.
Сулема имеет вид бесцветных кристаллов ромбической формы. Чаще
всего сулему получают прямым восстановлением ртутн.
Ртуть растворяется в расплавленном белом фосфоре, однако хими-
химических соединений не образует и прн остывании выделяется из распла-
расплава в химически неизменном виде.
144
Сернистую ртуть можно получить простым растиранием ртути с сер-
серным цветом при комнатной температуре. Сульфид ртутн HgS можно
легко получить, воздействуя на ртуть сероводородом прн повышенных
температурах.
На воздухе ртуть прн комнатной температуре не окисляется. При
продолжительном нагреве до температур, близких к температуре кипе-
кипения, ртуть соединяется с кислородом воздуха, образуя красный оксид
(II) ртути HgO, который прн дальнейшем нагревании снова распадает-
распадается на ртуть н кислород. В этом соединении степень окисления ртути
равна + 2 Известен и другой окснд ртутн — черного цвета. Степень
окисления ртутн в нем равна +1, его формула Hg2O Во всех соедине-
соединениях ртути (I) ее атомы связаны между собой, образуя двухвалентные
группы —Hg2— или —Hg—Hg—. Подобная связь сохраняется и в рас-
растворах солей ртути (I).
Известно существование гидрида HgH2, получаемого в результате
взаимодействия нодида ртутн и литий — алюминий гидрида. Однако
гидрид ртути очень неустойчив и распадается уже при 148 К.
Гидроксиды ртутн неизвестны. В тех случаях, когда можно ожи-
ожидать нх образования, они вследствие своей неустойчивости немедленно
отщепляют воду, образуя безводные оксиды.
Помимо галогенидов, известны и другие соли ртути Среди них сер-
сернистая ртуть HgS; известны соли ртутн (И) цианистой и роданистой
кислот, а также «гремучая ртуть» — соль гремучей кислоты—Hg(ONCJ.
Почти все соли ртути (II) плохо растворимы в воде. Исключение со-
составляет нитрат Hg(NO3J- При воздействии на солн ртути аммиака
образуются многочисленные комплексные соединения, например белый
плавкий преципитат HgCl-2NH3, белый неплавкий преципитат HgNH2Cl
и т. п. Известны два основных типа ртутьорганнческнх соединений:
R—Hg—R' н R—HgX, где R и R' — органические радикалы, X —кис-
—кислотный остаток. Этн соединения могут быть получены прн взаимодейст-
взаимодействии солей ртути с магний- нли литийорганнческими соединениями при
замещении в органических соединениях водорода ртутью (меркуриро-
вание), путем присоединения солей ртутн к ненасыщенным соединени-
соединениям н, наконец, разложением солей дназония в присутствии солей ртути
(реакция Несмеянова).
Растворимость металлов в ртутн, % (по массе):
Металл
Li
Na
К
Rb
Cs
Си
Ag
Аи
Mg
Са
Zn
Cd
Al
Температура, °С
20
0,047
0,6
0,5
1,3
3,5
0,003
0,035
0,13
0,30
0,3
2,1
5,9
0,002
100
0,13
1,4
2,5
3,7
5,1
0,015
0,23
0,75
1,25
0,80
7,5
22,0
0,012
200
0,54
2,7
5,9
6,0
23,0
0,06
1,0
2,4
3,2
1,5
21,0
52,0
0,07
300
1,1
3,5
—
—
0,18
3,0
12,0
4,1
2,4
42,0
88,0
0,17
350
1,6
—
—
—
0,40
11,0
50,0
5,1
_
90,0
0,85
145
Продолжение
Металл
Ga
In
Tl
Th
U
Sn
Pb
Sb
Bi
Pt
Mn
Температура, °С
20
1,2
57,0
42,0
0,002
0,005
0,6
1,3
3-10-5
1,4
0,1
0,003
100
2,0
77,0
56,0
0,005
0,04
20,0
18,0
10-5
26,0
0,98
0,03
200
300
350
Растворим неограниченно
To же
71,0
0,008
0,2
75,0
65,0
0,05
70,0
1,77
0,1
99,0
0,025
10,0
0,5
,
.
0,4
0,035
20,0
__
10,0
—
0,8
Теплоты растнорения (Я) металлов в ртутн:
Металл
AI
Ag
Си
Мп
V
Sb
Ni
Ni
Ti
Th
Th
t, °c
100—350
100—350
100-350
100—350
20—250
210—250
100—210
270-550
20—500
20—400
40—356
Н, кДж/моль
22,06
21,30
22,19
12,56—33,49
23,86
24,70
22,61
22,19
25,54
12,98
10,00
Металл
и
Gd
Sm
Nd
In
Tl
Cd
Zn
Sn
Bi
Pb
Pb
и °c
40—356
40—356
40—356
40—356
20
20
20
20
20
20
20
20
H, кДж/моль
21,17
23,40
32,40
22,44
0,92
—0,25
2,09
—0,54
—0,42
—0,84
— 1,25
—0,105
При растворении металлов в ртутн образуются амальгамы (амаль-
(амальгамированию подвержены только металлы, смачиваемые ртутью). Они
не отличаются от обычных сплавов, хотя прн избытке ртути представля-
представляют собой полужидкие смеси. Прн этом амальгамы могут быть либо
обыкновенными (истинными) растворами (Sn, Pb) и смесями (Zn, Cd),
либо химическими соединениями (элементы I группы). По взаимодейст-
взаимодействию с ртутью металлы можно условно разделить на пять групп:
— металлы, растворимость которых точно не установлена (Та, Si,
Re, W, Sb);
— металлы, практически нерастворимые в ртути [растворимость не
выше 2-Ю-5 °/о (по массе): Cr, Co, Fe, V, Be];
— металлы с очень низкой растворимостью (на уровне металлов,
указанных выше), но образующие с ней химические соединения (Ni,
Ti.Mo, Mn, U);
— металлы, не реагирующие с ртутью прн обычных температурах,
146
но взаимодействующие с ней при повышенных температурах илн после
предварительного измельчения (Al, Cu, Hf, Ge);
— металлы, образующие с ртутью твердые растворы, а некоторые из
них и химические соединения.
Соединения, получающиеся в результате амальгамирования, легко
разлагаются ниже температуры их плавления с выделением избытка
ртути.
Диаграммы состояния Аи—Hg, Ag—Hg, Pt—Hg и Sn—Hg имеют
характерные переходные точки, соответствующие разложению химиче-
химических соединений, образующихся прн амальгамировании в различных
температурных условиях. С этими соединениями ртуть образует ряд
металлических соединений Стали, легированные углеродом, кремнием,
хромом, никелем, молибденом и ниобием, не амальгамируются.
Области применения
Ртуть широко применяется прн изготовлении различных приборов (ба-
(барометры, термометры, манометры, вакуумные насосы, нормальные эле-
элементы, полярографы, электрометры и др.); в ртутных лампах, переклю-
переключателях, выпрямителях; как жидкий катод в производстве едких щело-
щелочей и хлора электролизом; в качестве катализатора прн синтезе уксус-
уксусной кислоты; в металлургии для амальгамирования золота и сребра;
при изготовлении взрывчатых веществ (гремучая ртуть); в медицине
(каломель, сулема, ртутьоргаиическне и другие соединения); в качестве
пигмента (киноварь); в сельском хозяйстве в качестве протравителя
семян и гербицида (органические соединения ртутн); в судостроении
для окраски (компонент краски) морских судов, а также в медицинской
практике.
3. ЭЛЕМЕНТЫ ТРЕТЬЕЙ ГРУППЫ
3.1. БОР [1—35, 123—1271
Общие сведения и методы получения
Бор (В) —в обычном состоянии кристаллы серовато-черного цвета?
очень чистый бор бесцветен. Элемент получил название от одного из
своих природных соединений — буры, илн натриевой соли тетраборной
кислоты, — Na2B4O7-10Н2О. По-арабски это соединение называли «бу-
«бурак» или «борак» (латинское borax). Бор впервые получен в 1808 г.
французскими химиками Гей-Люссаком и Тенаром путем совместного
нагрева борного ангидрида и металлического калия.
Общее содержание бора в земной коре 3-10~4 % (по массе). В при-
природе в свободном состоянии элемент не обнаружен. В составе многих
горных пород встречается в виде боросиликатов, боратов, бороалюмо-
силикатов, а также в виде изоморфной прнмеси к другим минералам.
Главные соединения бора, которые используются для его промышленно-
промышленного получения, — природные бораты, представляющие собой соли бор-
борных кислот. Различают орто-, мета- и пиробораты, а также солн поли-
полиборных кислот. Наиболее крупные месторождения природных боратов—
вулканогенно-осадочные — содержат до сотен миллионов тонн В2О3,
несколько меньше по запасам эндогенные месторождения (десятки мил-
миллионов тонн В2О3) и галогено-осадочные (миллионы тонн В2О3).
Элементарный бор получают нз природного сырья в несколько ста-
стадий. Сначала бораты подвергают разложению горячей водой или серной
кислотой, получая борную кислоту, а затем обезвоживанием получают
борный ангидрид. Восстановление ангидрида В2Оз металлическим маг-
147
иием дает бор в виде темно-бурого порошка, который очищают от при-
примесей, обрабатывая азотной и плавиковой кислотами. Очень чистый бор,
необходимый для производства полупроводников, получают восстанов-
восстановлением ВС13 водородом или разложением паров ВВг3 на раскаленной
танталовой проволоке. Чистый бор получают также термическим раз-
разложением бороводородов. В зависимости от способа и условий произ-
производства образуется бор различной степени кристалличности — от аморф-
аморфного и стеклообразного до кристаллического. Кристаллический бор
высокой степени чистоты получают зонной плавкой н вытягиванием.
Модификация получаемого бора зависит от температуры, которая в
различных процессах восстановления и диссоциации колеблется от
700 до 1600°С. При сравнительно низких температурах образуется
бор преимущественно ромбической модификации, при средних — тет-
тетрагональной, а при высоких — р-ромбоэдрической. Химический состав
[°/о {по массе)] твердого элементарного бора, поставляемого фирмами
«Coch-Light» (Великобритания) и «Borax Francais» (Франция):
Примесь
С
N
О
Na
Mg
AI
Si
P
S
Cl
К
Ca
Ti
Cr
Mn
Fe
Ni
Cu
Mo
Ba
Фирма-производитель н объект исследования
«Coch-LigM», твердый
0,3—1,4
0,02—1,0
0,1—0,2
0,007—0,017
0,14—0,17
0,006—0,016
0,105—0,17
0,005—0,006
0,002—0,006
0,004
0,002—0,01
0,62—0,7
Следы
0,002—0,004
0,007—0,018
0,12—0,195
0,002—0,005
«0,008
Fe гбнаружен
<0,01
«Borax Francais»
порошковый спрес-
спрессованный
1,7—2,5
3,5
3,5—4,5
0,022—0,045
0,015
0,03—0,035
0,8—0,86
0,006
0,02—0,03
0,002—0,005
0,017—0,025
0,36—0,37
0,013—0,015
0,33
0,01
1,60
4,0—4,5
0,005
0,3-0,5
Следы
плавленный элек-
электронным лучом
8,0
0,17—1,4
0,25-5,0
0,06—0,12
0,005
0,003-0,004
0,005
Следы
0,008-0,02
0,02—0,04
0,028—0,050
0,004
0,007—0,01
0,012—0,016
Не обнаружен
0,0080
0,003—0,004
Не обнаружена
Следы
>
Сумма
примесей.
1,43-3,94
16,2-18,8
8,58—14,7
Кристаллы а-моднфикацни получают кристаллизацией из эвтектиче-
эвтектического расплава Pt—В, [5-моднфикацию — главным образом зонной
плавкой и вытягиванием по методу Чохральского, хотя в некоторых
случаях рафинирование производят вакуумным переплавом в тиглях
из нитрида бора. Повышение чистоты бора может быть достигнуто
горизонтальной зонной очисткой в инертной атмосфере на подложках
из нитрида бора, бестнгельной зонной плавкой т. в. ч, и электронным
148
пучком и т, д. Лучшие результаты дает метод бестнгельной зоиной
плавки с вытягиванием, позволяющий, получить монокристаллы с СО-
держанием металлических примесей <10-4% (по массе), а также
~0,1 % (по массе) О2> 0,1 % (по массе) N2 и 0,01 % (по массе) Hj.
Максимальный диаметр монокристаллов бора 3—5 мм.
Пленки бора получают различными методами, из которых следует
отметить метод термического разложения трихлорида бора в присут-
присутствии водорода с осаждением на нагретую до 997—1017 °С грань
< 111 > р-кремния, метод вакуумного испарения и конденсации на
нагретую до различных B0—797°С) температур подложку из плавле-
плавленого кварца, слюды, каменной соли, сапфира или стекла, метод элек-
электронно-лучевого испарения и конденсации в вакууме 1,33-10~5 Па иа
подложки из тантала или ниобия (с подслоем из вольфрама, хлорис-
хлористого бария или без подслоя), разогретые до 297—1197°С, и т. п.
Ультрачистые пленки бора получают расплавлением и испарением кап-
капли иа вертикальном стержне бора. Варьируя температуру капли от 697
до 2497 °С, можно изменить скорость испарения в широких пределах,
управляя таким образом скоростью осаждения бора на подложке и со-
совершенством образующихся пленок. Известен также способ получения
пленок путем мгновенного охлаждения из жидкости. Применяют сле-
следующие схемы закалки: прокатка жидкой капли, центрифугирование и
захлопывание летящей каплн двумя медными шайбами и т. д. Кристал-
Кристаллическое строение пленок бора определяется условиями кристаллизации.
Так, пленки, получаемые методом термического разложения трихлорида,
имеют главным образом моно- и полнкристалличсское строение, мето-
методом вакуумного испарения —в основном аморфное; прн применении в
качестве подложек кремния н сапфира строение пленок зависит от .тем-
.температуры подложки — до 797 °С аморфное, при температуре до 897 °С
кристаллическое и т. д. При получении пленок путем закалки из жид-
жидкой фазы скорости охлаждения составляют 105—106 с-1, а толщина
пленок 40—120 мкм. В этом случае пленки имеют преимущественно
кристаллическое строение; для получения аморфного бора необходимы
более высокие скорости. Метод осаждения бора из газовой фазы на
подложку используют также для получениях борных нитей. В этом
случае осаждение производят на сердечник из вольфрама диаметром
15—16 мкм, толщина получаемого при этом борного слоя составляет до
50 мкм. В процессе осаждения происходит борнрование вольфрама под-
подложки н образуются борнды различного состава. В борном слое об-
обнаружены аморфная и а- н E-модификацин, имеющие монокрнсталли-
ческое строение с размерами кристаллитов 2—3 нм. Заметное влияние
иа структуру бора оказывают примеси, попадающие в слой из газовой
фазы или подложки. Так, присутствие углерода способствует образова-
образованию тетрагонального бора вместо E-ромбоэдрического.
Физические свойства
Атомные характеристики. Атомный номер 5, атомная масса 10,811 а. е. м.,
атомный объем 4,67-10~6 м3/моль, атомный раднус 0,083 нм, ионный
раднус В3+ 0,020 нм. Потенциалы ноннзаднн бора / (эВ): 8.30, 25,15,
37,92. Энергия атомнзацнн: 50345 кДж/кг при 0 К, 50810 кДж/кг при
298 К. Известно несколько кристаллических модификаций бора: про-
простая а-ромбоэдрнческзя с периодом а=0,506 нм н а=58,1°; тетраго-
тетрагональная с периодами а=0,101 нм, с=0,141 нм н сложная {5-ромбическая
с периодом а=0,101 нм н а=65,3°. Тетрагональная и а-ромбнческая
модификации при нагреве выше 1500 "С необратимо переходят в E-ром-
бическую модификацию, в которой обычно кристаллизуется расплавлен-
расплавленный бор. Атомы бора образуют во всех модификациях трехмерный кар-
149
кас, строение которого гораздо более сложное, чем у алмаза. Основная
структурная единица в кристаллах бора — 20-гранникн (икосаэдры),
в вершинах каждого нз ннх— 12 атомов. Икосаэдры соединены между
собой непосредственно с помощью промежуточных атомов, не входя-
входящих в их состав. При таком строении атомы в кристаллах бора имеют
координационные числа 4, 5, 6 н 5+2 (пять ближних соседей и два
более дальних). Энергия кристаллической решетки £=408 мкДж/кмоль.
Электронное строение внешних оболочек изолированного атома бора
2s22p'. С учетом координационных чисел это означает, что на каждую
присутствующую в кристаллическом боре связь приходится существенно
меньше двух электронов. Поэтому согласно современным представле-
представлениям в кристаллах бора имеется особый тип ковалентной связи — мно-
гоцеитровая связь с дефицитом электронов. В соединениях ионного типа
степень окисления бора +3. Известны два стабильных изотопа бора
с массовыми числами 10 (распространенность в природе 19 %) и 11
(81 %). Также известны радиоактивные изотопы с массовыми числами'
8, 12 и 13 с очень малыми (доли секунды) периодами полураспада.
Эффективное поперечное сечение захвата тепловых нейтронов 3838.0Х
ХЮ~28 м2 для изотопа 10В и 757-10~23 м2 для природной смеси изото-
изотопов. В последнем случае среднее сечение рассеяния, полученное экспе-
экспериментально для максвелловского спектра нейтронов, равно 4-10-?8мг.
Работа выхода электрона ф=4,5 эВ, сродство к электрону 0,3 эВ, элек-
электроотрицательность бора 2,01.
Плотность. Так называемый аморфный бор имеет плотность
2,354 Мг/м3. Плотность р кристаллического бора в зависимости от типа
кристаллической решетки, Мг/м3:
а-ромбоэдрнческая 2,46
Тетрагональная 2,36—2,37
Р-ромбоэдрическая 2,31—2,35
Плотность бора в жидком состоянии р=2,08 Мг/м3 (температура
испытания 2520 К), удельный объем v бора в зависимости от темпе-
температуры:
Т, К 293 2420 2520
v-W, м3/кг. . . 4,29 4,59 4,80
Электрические и магнитные. Кристаллический бор — полупроводник.
В обычных условиях он плохо проводит электрический ток. При нагре-
нагревании до 1073 К электропроводность увеличивается, причем знак про-
проводимости меняется (электронная прн низких температурах, дырочная
при высоких). Удельное электросопротивление бора прн комнатной тем-
температуре 104 Ом-м, при 573 К 1,0 Ом -м, а при 963 К 4,0-Ю-3 Омм.
Температурный коэффициент а электрического сопротивления р-ромбо-
эдрического бора, полученного зонной плавкой:
Т.
и-
к
103,
к-1 • •
200
—55
300
—79
500
—35
700
—22
910
— 11
Абсолютный коэффициент т. э. д. с. е, E-ромбического бора в паре с
медью и цинком:
Т,К 523 1173 2073
ех, мкВ/К- ... 700 300 100
150
Для аморфного бора ei=520-f-630 мкВ/К при 400 К, для аморфной
пленки бора 654 мкВ/К при 300 К и 285 мкВ/К при 1000 К. Значения
ширины запрещенной зоны равны Д£=1,42 эВ для электрических и
1,53 эВ для оптических измерений. Диэлектрическая проницаемость
р-ромбического бора, измеренная разными методами, е = 8,0-М0,0, а
аморфного бора 9,0. Подвижность носителей тока при комнатной тем-
температуре: электронов |Лп=Ю-4 м'/(В-с), дырок |хР = 0,55-10~2 мг/(В-с),
т. е. весьма низка. При измерении фотопроводимости бор ведет себя
как чувствительный, но инерционный проводник. Максимальные значе-
значения коэффициента вторичной электронной эмиссии сттах=1,2 при уско-
ускоряющем напряжении первичных электронов 0,150 кэВ. Бор — диамагне-
тик. Его магнитная восприимчивость % в зависимости от температуры:
Г, К
90 293 291 373 503 1373
—0,63 —0,62 —0,71 —0,73 —0,76 —0,77
Постоянная Холла кристаллического бора при магнитной индукции
В = 0, /?=G±1,5)-10-3 м3/Кл, аморфной пленки 8,64-10-3 мэ/Кл.
Тепловые и термодинамические. Температура плавления чистого
кристаллического бора ^«2075°С, температура кипения ?„иП=3707оС,
характеристическая температура 0d=1219 К, удельная теплота плавле-
плавления Д//„л = 2090±387 кДж/кг, удельная теплота сублимации при 298 К
А#еу1>л = 51935,4±1161 кДж/кг. Температуры и теплоты фазовых пре-
превращений не установлены. Изменение объема бора при плавлении
4,5±1,0%. Удельная теплоемкость ср в различном агрегатном состоя-
состоянии при нормальных условиях, Дж/(кг-К):
Кристаллический |3-ромбоэдри-
ческий 1025,8
Аморфный 1106,3
Газ одноатомный 1924,0
» двухатомный 2826,7
Теплопроводность Я бора в fi-ромбической модификации в зависимо-
зависимости от температуры:
т.к
3
6
10
20
\, Вт/(м-К)
8,1
39,0
86,0
186,0
г.к
30
45
50
60
К, Втдм-К)
262,0
313,0
328,0
323,0
г,к
100
200
300
1000
К Вт/(м-Ю
200
55,0
26,0
9,5
Температурный коэффициент линейного расширения бора в интер-
интервале 293-7-1023 К а= A,1-5-8,3)-10-" Кг'- Молярная энтропия кристал-
кристаллического бора s°=5,86 Дж/(моль-К), аморфного 6,54 Дж/(моль-К).
При повышении температуры до 1473 К бор начинает возгоняться в ва-
вакууме, а при 1873 К затемнение вакуумных приборов очень велико.
Давление паров р бора в зависимости от температуры:
151
т,к
1000
1200
1400
1600
р. Па Г, К
13-10-»
78-10-13
20-10—9
70,9-10-'
1800
2000
2200
2400
Р. Па
67,3-10-в
25,5-10—3
49,3-10-2
57,9-10—х
2600
2800
3000
Р, Па
43,9
238
1020
Давление пара при температуре плавления 0,348 Па. Поверхностное
иатяжеиие жидкого бора при 2373 К ст=1060 мН/м.
Известны параметры взаимной диффузии азота в бор. Для интер-
интервала температур 874-*-1473 К предэкспоненциальный множитель Do=
=^3,01 м2/с при энергии активации Я=256,65 кДж/моль.
Оптические. Кристаллический бор ие прозрачен, однако его очень
тонкие кристаллы пропускают свет, если источник этого света очень
силен. В этом случае в проходящем свете кристаллы бора оранжево-
красные. Тонкие слои бора прозрачны в инфракрасном свете, причем
порог адсорбции лежит около 1 мкм. Отражательная способность (ко-
(коэффициент отражения йв) поликристаллического Р-ромбоэдрнческого
бора в зависимости от длины волны X:
ft, мкм 0,25 0,27 0,31 0,41 0,62 1,24
nD, % 42 37 37 33 28 25
Показатель преломления п для поликристаллического бора в зави-
зависимости от длины волны Я:
Я,, мкм 0,207 0,248 0,310 0,412 0,620
п 0,9 1,6 2,7 3,4 3,3
Коэффициент а и показатель х поглощения бора в зависимости от
длины волны Я:
Длина волиы, мкм 0,207 0,248 0,310 0,410 0,620
а-107, м-1 . . . . 8 10 8 4 0,6
% 1,4 2,2 1,8 1,0 0,2
Обнаружена также спектральная чувствительность бора в области
0,85—1,2 мкм, однако не уточнено, является ли это следствием дейст-
действительного фотоэлектрического действия или объявипет^я чито терми-
термическим воздействием излучения.
Механические свойства
Временное сопротивление разрыву аморфной стекловидной нити ав —
= 1400-н4500 МПа в зависимости от качества нити. Временное сопро-
сопротивление при сжатии спеченного кристаллического бора, содержащего
1—5% В2О3, СТвЖ =280+550 МПа. Временное сопротивление при нз-
гибе зонноплавлеиого fS-бора при 20 °С стИзг=150 МПа, при 1000°С —
900 МПа.
Временное сопротивление при изгибе существенно зависит от каче-
качества подготовки поверхности образцов. Так, для плавленого поликри-
поликристаллического бора с полированной поверхностью образцов сгИзг =
152
= 315 МПа, но снижается до 105—140 МПа, если полирование не про-
проводится. Коэффициенты упругости монокристалла бора: Сц=т472 ГПа;
Ci2=245,5 ГПа; с33=482 ГПа; С44=2О1,8 ГПа; ef4=154 ГПа; Сев=
= 115,2 ГПа.
Модуль нормальной упругости Е при 293 К, ГПа:
Р-ромбоэдрический бор . . 390
Борное волокно 385—420
Модуль сдвига борного волокна при 293К G= 179,2 ГПа.
Твердость по Внккерсу HV при нагрузке 0,1 кг и выдержке 15 с в
зависимости от температуры:
*, °С 25 500 800 900
HV, МПа. . . 4800 2000 800 400
Твердость по минералогической шкале (по Моосу) 9,3.
Твердость по Кнупу |3-бора:
Поликристаллический чистотой 99,9 % 2415—2480
Мрнокристаллический E-бор, плоскость A011) .... 2110—2680
Микротвердость 6-бора при нагрузке 1 Н и выдержке 15 с при 20 °С
//^=3,1 ГПа, при 900V°C //ц=1,7 ГПа.
Сжимаемость при 303 К х<5,5-10-п Па-1, а при 293 К
3-Ю"1 Па-'. Коэффициент Пуассона ромбоэдрического горячепрессо-
ванного бора v=0,13, а борного волокна 0,21.
Звукопроводность. Скорость звука в монокристалле р-бора:
Тип волны
Продольная
Направление распро-
распространения звука
0001
0001
0010
1010
юТо
Скорость звуках
Х10~3. м/с
14,2
9,2
14,7
8,0
7,1
Химические свойства
Нормальный электродный потенциал реакции В + ЗН2О—Зег±Н3ВОз+
+ЗН+ фо=—0,73 В; электрохимический эквивалент 0,0373 мг/Кл.
В соединениях проявляет степень окисления +3, —3. При обычных ус-
условиях бор взаимодействует активно лишь со фтором, при этом кри-
кристаллический бор менее активен, чем аморфный. С повышением тем-
температуры активность бора возрастает, и он соединяется с кислородом,
серой и галогенами.
Средние энергии связей бора в случае простых ковалентиых связен
при координационном числе 3:
Связь
В—В
в—н
в—о
Энергия,
кДж/моль
330,7
380,9
514,9
Связь
В—N
В-С
B-F
Энергия,
кДж/моль
443,8
372,6
644,7
Связь
В—С1
В—Вг
В—I
Энергия,
кДж/моль
443,8
376,8
284,7
153
Бор и водород. Гидриды бора (бороводороды, бораны) получают
косвенным путем. По химическим свойствам бороводороды напоминают
кремневодороды.
С азотом бор образует при нагревании выше 1200 °С нитрид BN.
Модификации этого нитрида очень сходны с графитом или алмазом.
Эта аналогия характерна и для других соединений, содержащих одно-
одновременно бор и азот. Так, боразаи ВН3—NH3 подобен этану СН3—СН3,
боразен — этилену СН2=СН2 (BH2=NH2) и т. д.
Мелкие частицы бора медленно окисляются на воздухе даже при
комнатной температуре. При нагревании на воздухе до 973 К бор го-
горит красноватым пламенем, образуя борный ангидрид В2О3— бесцвет-
бесцветную стекловидную массу. Борный ангидрид образуется также при взаи-
взаимодействии бора с водяным паром. Эта реакция протекает при темпе-
температуре красного каления.
Бор и углерод взаимодействуют выше 1300 °С, когда образуются
карбиды В4С и Bi3C2.
При обычной температуре бор растворяется только в концентриро-
концентрированной азотной кислоте, которая окисляет его до борной кислоты НВО3.
Бор медленно растворяется в концентрированных растворах щело-
щелочей, образуя бораты, представляющие собой в большинстве случаев
соли полиборных кислот пВгОз-'иНгО.
Прн нагревании бор соединяется с галогенами, серой и селеном.
В галогенидах бор связан с галогенами тремя ковалентными связями.
Общая формула галогенидов ВГ3 (где Г — галоген). Строение молеку-
молекулы галогенидов отвечает плоскому треугольнику с атомом бора в цент-
центре. Теплота образования Д#обр галогеиидов — от 1109,5 (для BF3) до
37,7 (для В13) кДж/моль. Поскольку для завершения устойчивой вось-
миэлектронной оболочки атому бора в галогениде недостает пары элек-
электронов, молекулы галогеиидов, особенно BF3> присоединяют молекулы
других веществ, имеющих свободные электронные пары, например ам-
аммиака. При этом образуются комплексные соединения, в которых
координационное число бора равно 4. Важными комплексными соеди-
соединениями бора являются борогидриды, например Na[BH4], и борофтори-
стоводородная (фтороборная) кислота HfBFJ. Большинство солей этой
кислоты (фтороборатов) растворимо в воде.
Взаимодействие с фосфором и мышьяком наблюдается выше 1173 К.
Результат взаимодействия — фосфиды ВР и В3Р и арсениды BAs и
B6As
С большинством металлов бор при высоких температурах образует
бориды. Соединения с бором дают металлы IA—VIIIА подгрупп и цинк.
Элементы IB—IVB групп соединений с бором не образуют. Системы
Си—В, Аи—В и Ag—В являются простыми эвтектическими. Макси-
Максимальное число боридных фаз образуют переходные металлы III —-V11 [
групп. По характеру химической связи и физико-химическим свойствам
бориды подразделяют иа три класса:
а) бориды s-металлов (щелочных — бериллия, магния — и щелоч-
щелочноземельных);
б) бориды переходных металлов и РЗМ, в которых межатомная
связь носит ковалентный характер и осуществляется за счет валентных
sp-электронов бора и части нелокализованных валентных sd-электро-
нов металла;
в) соединения, образуемые р-элементами, которые могут быть ме-
металлами и металлоидами, например бориды Bi2Si, B6Si, &4Si и BeSi,
образующиеся при 1000 °С.
Установлено существование боридных фаз с разным содержанием
бора, так что состав этих фаз меняется от Ме& до МеВц и даже
AfeBso-ioo; п0 мере увеличения содержания бора наблюдается не толь-
154
ко усложнение структурных образований из атомов бора, но и усиле-
усиление связей В—В. Это дает возможность подразделять бориды переход-
переходных металлов на бориды с изолированными атомами бора (ТаВ, СггВ,
М02В, W2B, Mn2B, Co2B, N12B, MiuB), бориды с цепями из атомов бора
(VB, NbB, ТаВ, CrB, р-МоВ, P-WB, NiB, TiB, 6-МпВ, FeB, CoB,
а-МоВ, а-WB), бориды со сдвоенными цепями из атомов бора (TisB4,
V3B4, Nb3B4, Та3В4, СгзВ4, Мп3В4) и, наконец, бориды с сетками из ато-
атомов бора (Мо2В3, МоВ4, W2B5, ReB2, RuB3 и RuB2). В основе всех
структур боридов, содержащих бора больше, чем МеЪц, лежат икоса-
икосаэдры, характер упаковки которых определяет тот или иной структур-
структурный тип.
Технологические свойства
Бор отличается высокой хрупкостью при низких температурах; в пла-
пластичное состояние переходит лишь при 2007 К, а начинает пластически
деформироваться при 1797 °С. Плоскость двойникования в Р-боре
A011). Для получения изделий из бора применяют горячее или холод-
холодное прессование с последующим спеканием. Довольно широко применя-
применяются такие технологические операции с бором, как плавка и нанесение
на подложку.
На прочность борных нитей (в среднем сгв=4000 МПа, Оизг =
= 19000 МПа) большое влияние оказывают технологические условия,
под действием которых она может снижаться в 2—3 раза и более. Наи-
Наиболее опасный дефект, часто присутствующий в нитях, — наличие по-
посторонних включений или раковин вблизи границы раздела между серд-
сердцевиной и борным слоем.
Области применения
Бор в небольших количествах (доли процента) вводят в сталь и не-
некоторые сплавы для улучшения их механических свойств. Поверхност-
Поверхностное насыщение стальных деталей бором до глубины 0,1—0,5 мм (бори-
рование) улучшает механические свойства и коррозионную стойкость.
В последнее время волокна из бора все более широко применяют в ка-
качестве упрочьителя в композиционных материалах. Благодаря способ-
способности изотопа 10В поглощать тепловые нейтроны его применяют для
изготовления регулирующих стержней ядерных реакторов.
Широкая запрещенная зона, большой температурный коэффициент
электросопротивления, а также необходимые контактные свойства де-
делают бор перспективным для применения в термисторах. Бор применя-
применяют для изготовления нейтронных термометров и сопротивлений С вы-
высоким температурным коэффициентом, а также в качестве окон, про-
прозрачных для инфракрасного излучения. Газообразный BF3 применяют
в счетчиках нейтронов. Бор и его соединения — нитрид BN, карбид В4С,
фосфид ВР и др. — применяют как диэлектрики и полупроводниковые
материалы. Широко используются борная кислота и ее соли, прежде
всего бура.
3.2. АЛЮМИНИЙ [1—35, 128—137]
Общие сведения и методы получения
Алюминий (А1) — серебристо-белый металл; при обычных условиях по-
покрыт тонкой пленкой оксидов. Название алюминий происходит от ла-
латинского alumen (алюминиевые квасцы). Впервые алюминий в свобод-
свободном виде получил в 1825 г. датский ученый Эрстед, воздействуя амаль-
155
гамой калия на хлорид алюминия. Двумя годами позже, в 1827 г., не-
немецкий химик Ф. Вёлер также получил алюминий, заменив амальгаму
калия металлическим калием. Первый промышленный способ производ-
производства алюминия предложен в 1854 г. французским ученым Сенг-Клер-
Девилем. В 1865 г. русский физико-химик Н. Н. Бекетов предложил
способ получения алюминия путем вытеснения его магнием из рас-
расплавленного криолита. В 1886 г, Эру во Франции и Холл в США не-
независимо друг от друга предложили способ получения алюминия
электролизом глинозема, растворенного в расплавленном кри-
криолите.
По распространенности в природе алюминий занимает первое место
среди металлов. Его содержание в земной коре 8,8 % (по массе). Алю-
Алюминий входит в состав бокситов, нефелинов, алунитов, каолинов и дру-
других горных пород. Наиболее ценная алюминиевая руда — бокситы, в
них содержится около 50 % оксида алюминия.
Производство алюминия состоит из трех технологических процессов:
1) получение из алюминиевых руд глинозема (АЬО3);
2) получение первичного алюминия электролизом глинозема, раство-
растворенного в расплавленном криолите;
3) рафинирование первичного алюминия.
Глинозем получают из руд щелочным, кислотным, электротермиче-
электротермическим или комбинированным методами. Выбор метода зависит от
состава и характера примесей, входящих в состав алюминиевой
£уды-
Металлический алюминий получают электролизом глинозема (А12О3),
растворенного в криолите (Na3AlF6); в состав электролита входят не-
небольшие добавки других солей CaF2, MgF2, NaCl, которые повышают
эффективность работы электролизера. В электролите содержится
(Обычно 6—8 % глинозема; после того как в процессе электролиза коли-
.чество глинозема уменьшается до 1,5—2 %. вводят очередную его пор-
порцию. Электролиз ведут при температуре около 950 °С и напряжении
■4,0—4,5 В. Расход электроэнергии иа 1 т алюминия составляет
.— 15000 кВт'Ч. Катодом служит подина ванны, анодом — погруженные
в раепчав угольные обожженные блоки или набивные самообжигаю-
тциеся электроды. Черновой алюминий содержит ряд примесей, поэтому
его очищают продувкой хлором при 750—770°С в течение 10—15 мин,
а затем разливают в чушки. Таким путем получают алюминий чистотой
99,7—99,5 %. При условии применения очень чистых исходных
материалов удается получить первичный алюминий марок А85
и А8
Для получения алюминия высокой чистоты (А995—А95) первичный
алюминий технической чистоты дополнительно электролитически рафи-
рафинируют по трехслойному способу в расплавленных солях. Алюминий
особой чистоты (А999) получают или зонной плавкой, или дистилля-
дистилляцией через субгалогениды электрически рафинированного алюминия.
В соответствии с ГОСТ 11069—74 наша промышленность выпускает
13 марок алюминия, различающихся по содержанию примесей, основ-
основные из которых железо и кремний, переходящие в алюминий из глино-
глинозема (см. табл. на с. 157).
Первичный алюминий поставляют в форме чушек, слитков, катанки,
ленты и т. д.
Алюминий особой чистоты марки А999 контролируют по величине
остаточного электрического сопротивления при температуре жидкою
гелия, которое ие должно превышать 4-102 Ом-м.
Допускается контроль чистоты алюминия марки А999 по величине
затухания ультразвука, характеризуемого временем звучания, которое
не должно превышать 500 мке,
156
ХИМИЧЕСКИЙ СОСТАВ, %, ПЕРВИЧНОГО АЛЮМИНИЯ (ГОСТ 11069—74)
А1,
не менее
Примесн, не более
Fe
Si
Си
Zn
Ti
прочие приме-
примеси, каждая в
отдельности
сум-
сумма
Цветная маркировка
Примерное назначение
А999 99,999 —
А995
А99
А97
495
485
ад
V7E
\6
\5
45Е
10
99,995
99
99
,99
,97
99,95
99
99
99
99
99
99
99
99
,85
,80
,70
,70
,60
,50
50
0
Алюминий особой чистоты
0,001
Алюминий высокой чистоты
0
0
0
0
0
0
oooo
0,
0
0015
003
015
030
08
12
16
20
25
30
35"
50
0
0
0
0
0
0
oooo
0
0
,0015
,003
,015
,030
,06
,10
,16
,08
.20
,30
,12
,5
0
0,
0
0
0
0,
oooo
0,
0,
001
003
005
015
01
01
01
01
01
02
02
02
0
0
0
0
0
0,
oooo
0,
0
001
003
003
005
02
04
04
04
06
06
04
08
0
0
0
0
0
0
oooo
0
0
,001
,002
,002
,002
,01
,02
,02
,01*
,03
,03
,01*
,03
0,001
0,001
0.002
0,005
0,02
0,02
0,02
0,02
0,03
0,03
0,02
0,03
0,005
0,010
0,03
0,05
0,15
0,20
0,30
0,30
0,40
0,05
0.50
1,0
Одна зеленая полоса про-
продольная и одна зеленая по-
полоса поперечная
Две зеленые полосы про-
продольные и одиа зеленая по-
полоса поперечная
Трн зеленые полосы про-
продольные и одна зеленая по-
полоса поперечная
Четыре зеленые полосы про-
продольные и одна зеленая по-
полоса поперечная
Одна голубая полоса
Две голубые полосы
Одна белая полоса
Три белые полосы
Две белые полосы
Одна красная полоса
Одна желтая полоса
Две красные полосы
Для научно-исследователь-
научно-исследовательских целей, в полупроводни-
полупроводниковой н ядерной технике
Для производства фольги,
предназначенной для элек-
электролитических конденсато-
?ов
о же
Для производства проката
ответственного назначения.
для особой химической ап-
аппаратуры
То же
Для производства проката
То же
Для производства кабель-
кабельных- а токопроводящих изде-
изделий, плакировка, изготовле-
изготовление алюминиевых сплавов,
красочной пудры, порошка,
алюминиевой посуды
Для производства алюмини-
алюминиевой катанки н вайербарсов
Для изготовления сплавов
на алюминиевой и других
основах, алюминиевой посу-
посуды, для изготовления лига-
лигатуры и т. д.
* Для суммы Ti+V+Mn+Cr, •• Допускается содержагае железа не менее 0,18 %.
В алюминии марок А5Е и А7Е, предназначенных для изготовления
проводов и других кабельных изделий, ограничивается содержание ти-
титана, ванадия, марганца, хрома, так как они наиболее сильно снижают
электропроводность.
Удельное электрическое сопротивление р при 20 °С проволоки, изго-
изготовленной из алюминия марок А7Е и А5Е и отожженной при 350±
±20сС в течение 3 ч, должно быть не более 0,0277 мкОм-м для марки
А7Е и 0,0280 мкОм-м для марки А5Е.
Алюминий технической чистоты для производства деформируемых
полуфабрикатов поставляется в чушках с отношением примесей железа
к кремнию не менее 1,2: 1,0, а в слитках —не менее 1,0: 1,0. Для про-
производства деформируемых сплавов системы алюминий—магний алюми-
алюминий высокой и технической чистоты поставляют с содержанием натрия
s£ 0,002 %.
Физические свойства
Атомные характеристики. Атомный номер 13, атомная масса
26,981 а. е. м., атомный объем 10,0-Ю-6 м3/моль, атомный радиус
0,143 им, ионный радиус А13+ 0,057 нм. Электронная конфигурация
внешней оболочки атома алюминия 3s23p. Электроотрнцательиость 1,5.
Значения потенциалов ионизации 7(эВ): 5,984, 18,82, 28,44. Алюминий
состоит из одного стабильного изотопа 27А1. Установлено существова-
существование нескольких радиоактивных изотопов алюминия с массовыми числа-
числами 24, 25, 26, 28, 29 с периодами полураспада соответственно равными:
2,1; 7,6; 6,7; 138; 394 с.
Алюминий имеет г. ц. к. решетку с периодом (при 298 К) 0,404958 нм
для алюминия чистотой 99,9998 % и 0,404947 нм для алюминия 99,99 %.
Величина параметра решетки алюминия сильно зависит от температуры
(данные для алюминия чистотой 99,99 %):
г, к
20,2
54,9
74,8
106
а, им
0,403186
0,403219
0,403271
0,403412
Г, К
124,8
273
299,5
323
а, им
0,403528
0,404731
0,40496
0,405187
т, К
373
473
573
873
а, нм
0,405668
0,406680
0,407782
0,41170
Координационное число 12, кратчайшее расстояние между атомами
в кристаллической решетке 0,2863 нм. Энергия кристаллической решетки
314,1 мкДж/кмоль. Эффективное поперечное сечение захвата тепловых
нейтронов 0,21-Ю-28 мг. Работа выхода электронов ф=4,25 эВ, сродст-
сродство к электрону 0,52 эВ.
Плотность. Плотность р твердого и жидкого алюминия снижается
по мере увеличения степени его чистоты и температуры:
Т, К • •
р, Мг/м3
298
2,698
373
2,680
573
2,660
983 (тв)
2,550
933 (ж)
2,368
1073
2,332
1173
2,304
Плотность (Мг/м3) алюминия в зависимости От его чистоты:
158
Степень чистоты, %
99,25
99,40
99,75
99,971
99,996
Плотность
293
2,727
2,706
2,703
2,6996
2,6986
при температуре, К
1273
2,311
2,291
2,289
—
—
Электрические и магнитные. Удельная электрическая проводимость
алюминия а в зависимости от степени его чистоты и предварительной
обработки:
Содержание, %
Al
99,657
99,578
99,515
99,374
99,235
Fe
0,16
0,23
0,30
0,43
0,57
Si
0,15
0,16
0,15
0,16
0,16
Fe:Sl
1,07
1,44
2,0
2,68
3,56
p, mkOm-m
<т, МСм/м
нагартоваиный
0,02812
0,02816
0,02822
0,02829
0,02838
35,56
35,51
35,43
35,39
35,24
p, мкОмм
о, МСм/м
отожженный
0,02767
0,02771
0,02778
0,02783
0,02788
36,14
36,09
35,99
35,93
35,86
На удельную электрическую проводимость алюминия влияют также
степень деформации, режим термической обработки и другие факторы,
однако основное влияние оказывает природа примесей, присутствую-
присутствующих в металле. В зависимости от характера системы, образуемой алю-
алюминием с примесью, влияние ее на электрическую проводимость может
быть различным. По степени влияния на электрическую проводимость
алюминия металлы можно разделить иа три группы:
1. Металлы, оказывающие малое влияние, — золото, бериллий, ни-
никель, железо, кремний, цинк.
2. Металлы, снижающие электрическую проводимость в большей сте-
степени, — медь, серебро, магний.
3. Металлы, очень сильно снижающие электрическую проводи-
проводимость,—-титан, ванадий, марганец, хром.
Если легирующий элемент образует с алюминием твердый раствор,
то удельное электрическое сопротивление с увеличением концентрации
этого элемента увеличивается линейно: р=роA+ае), где р0-—удельное
электросопротивление чистого металла; с — концентрация растворенно-
растворенного элемента в твердом растворе, % (по массе); а — изменение удельно-
удельного электрического сопротивления, % от р0 на 1 % (по массе) раство-
растворенного элемента.
При термической обработке алюминия в случае образования твер-
твердого раствора электрическая проводимость понижается, а распад твер-
твердого раствора, наоборот, вызывает ее повышение.
Удельная электрическая проводимость о и удельное электрическое
сопротивление р алюминия сильно зависят от температуры (алюминий
чистотой 99,9%):
т, к
80
273
р, МкОм .м
0,0033
0,0262
а. МСм/м
304
38,2
т, к
600
950
р. мкОМ'М
0,062
0,110
о, МСм/м
16,1
9,1
159
Температурный коэффициент электрического сопротивления алюми-
алюминия в интервале 273—373 К в зависимости от чистоты металла меняется
от 4,33-Ю-3 до 4.0I0-3 К.
Температура перехода в сверхпроводящее состояние для алюминия
равна 1,175 К. Абсолютный коэффициент т. э. д. с. при 273 К е —
=—1,6 мкВ/К. Алюминий является парамагнетиком, т. е. его магнитная
восприимчивость положительна, а магнитная проницаемость больше еди-
единицы. Магнитная восприимчивость алюминия чистотой 99,999 и 99,99 %
%= 0,6276- Ю-9 и 0,6267-10~9 соответственно, а жидкого алюминия чис-
чистотой 99,9% х = 0,45-10~9 Магнитная индукция алюминия чистотой
99,5 % при 313 К В=2,27 Тл. Постоянная Холла R:
Т, К 20,4 83 273 573 873
/МО10, м3/Кл. . +8,01 —0,22 —0,33 —0,39 —0,41
Коэффициент вторичной электронной эмиссии amai=l,0 при ускоря-
ускоряющем напряжении первичных электронов 0,3 кэВ.
Тепловые и термодинамические. Температура плавления /Пл алюми-
алюминия в зависимости от чистоты металла:
Степень чистоты,
99
657
,2
99
658
,5
99
659
,6
,7
99
659
,7
,8
99
660
,996
,24
В момент плавления объем металла увеличивается для алюминия
чистотой 99,65% ча 6,25 %, для более чистого — на 6,6 %.
Температура кипения также сильно зависит от чистоты металла и по
последним данным гКип = 2520 "С.
Характеристическая температура 6d = 430,6 К (по упругим постоян-
постоянным) и 427 К (по теплоемкости). Удельная теплота плавления АЯПЛ =
=389,372 кДж/кг, а удельная теплота испарения Д//Исп = 10885 кДж/кг.
Удельная теплота сублимации Д#субл=12008 кДж/кг (при 298 К).
Теплоемкость алюминия технической чистоты:
Т. К
273
273—373
273—473
273—573
273—673
273—773
273—873
273—930 (тв)
273—930 (ж)*
273—973
273—1073
273—1173
273—1273
сср
р
Дж/(кг-К)
903,8
945,8
961,7
993,9
998,9
1010,3
1026,6
1035,4
1634,5
1598,5
1531,9
1482,5
1444,8
Истинная теплоемкость
удельная, Дж/(кг-К)
929,5
961,7
993,9
1026,2
1058,8
1091,1
1123,3
1141,7
1047,5
1056,3
1076,4
1096,5
1116,6
атомная. Дж/(моль-К]
25 078
25 958
26 795
27 674
28 553
29 475
30 354
30 814
28 261
28 512
29 014
29 600
30 103
При плавлении истинная теплоемкость алюминия снижается на 8,25 %,
160
Теплоемкость алюминия при низких температурах:
Т, К- ....... 2 4
ср, Дж/(кг-К) • •
0.П93 0,2843
10
1,6622
Удельная электронная теплоемкость с™ ={1,35 мДж/(моль-Ка)]-Г.
Теплопроводность X алюминия зависит от его чистоты и температу-
температуры; с увеличением чистоты она повышается:
Алюминий чистотой 99,994 %
т,
я,
т.
т,
ОС'
к
Вт/(м-К) • • •
к
Вт/(м-К) • • •
Температурный
к
10е, К-1 ...
3
1130,0—1172,0
Алюминий
295
i2l,5
коэффициент
40 60
2,05 6,0
чистотой
334
213,
линейного
160
1 17,5
6
3015,0
99,95 °/(
5
25
1 2970
720
188,4
расширения а
300
23,4
500
26,8
,0
35
1674,0
920
184,5
алюминия:
700
30,6
90
37,6
Температурный коэффициент объемного расширения E=113- 10~в К
при 933—1373 К-
Термодинамические характеристики (энтропия s, функция свободной
энергии Фг> энтальпия /) в зависимости от температуры:
Г, К
0
100
200
298
400
500
700
900
1000
1200
1400
1600
1800
2000
2200
2400
2600
2700
S, ДЖ/(МОЛь
0,000
6,9082
19,142
28,340
35,6799
41,5288
50,9617
58,6487
73,2941
78,6364
83,1540
87,0687
90,5186
93,6084
96,4010
98,9508
101,2954
102,4007
•К)
ф , Дж/(моль К)
Твердое состояние
.
48,2696
30,5636
28,3404
29,3117
31,1874
35,5459
39,8499
Жидкое состояние
42,6718
48,2361
52,8876
56,9404
60,4825
63,6435
66,4989
69,0947
71,4854
72,6074
J, кДж/(моль)
—4,5803
—4,1365
—2,2859
0,000
2,5455
5,1706
10,7935
16,9188
30,6180
34,8048
42,3411
48,2026
54,0641
59,9256
65,7871
71,6487
77,5102
80,4409
161
Динамическая вязкость г) алюминия в зависимости от температуры:
г, к
942
983
1017
л.
1
1
1
МПа с
,1603
,0909
,0231
1049
1077
1110
П.
0
0
0
МПа с
,9841
,9481
,9002
т, к
1133
1217
п.
0
0
МПа с
,8722
,7922
Кинематическая вязкость v в зависимости от температуры-
Т, К- • •
v-108, мг/с
943
50
973
48
1011
46
1068
43
Поверхностное натяжение при 933 К равно 914 мН/м Поверхност-
Поверхностная энергия v= 1040 мДж/м2, энергия дефекта упаковки 250 мДж/м2.
Параметры самодиффузии и взаимной диффузии (предэкспоиенци-
альный множитель Do и энергия активации Е):
Диффунди-
Диффундирующий
элемент
А1
V
Сг
Мп
Fe
Со
Zn
Ge
Nb
Sn
Аи
Cd
т, к
723—923
623—903
523—878
723—923
623—903
623—903
600—648
674—926
623—893
673—873
642—928
713—907
De, м*/о
1,71-10-4
6,05-10—^
3,01-10-и
0,22-10-4
4,1 10—I3
2,9-Ю-1?
1,4-Ю-4
0,48-Ю-4
1,66-10-И
0,245-10-4
0,131-10-4
1,04- Ю-4
Е, кДж/моль
142,35
82,0
64,4
120,58
58,2
65,73
128,95
121,4
«2,5
119
116,4
124
Давление пара в
т, к
900
1000
р. Па
6,1313-10-'
3,4713-Ю-6
зависимости
г, к
1300
1800
от температуры:
Р. Па
13,1404-10-?
2,4472-Ю2
Г, К
2300
2600
р
163,
931 •
, Па
59-Ю?
10?
Давление пара алюминия при температуре плавления 24,206-10~7 Па.
Оптические свойства. Отражательная способность (коэффициент от-
отражения tin) в зависимости от его чистоты-
Чистота алюминия,
% ...... 99,2 99,5 99,8 99,996
пв, % 75 84 86 90
162
Коэффициент отражения nD полированного алюминия в зависимости
от длины волны:
1., мкм . .
ад. % • •
1,0 2,0 4,0 7,0 10,0 12,0
71 82 92 96 98 98
Показатель преломления п и поглощения х в зависимости от длины
волны'для поликристаллического алюминия:
Л, мкм . . 0,4 0,7 2,0 3,0 4,0 6,0 8,0
я 0,32 1,26 1,75 3,2 4,8 9,5 15,6
X 3,72 6,40 16,1 29,5 30,0 44.4 58,1
Механические свойства
Механические свойства алюминия разной чистоты при комнатной тем-
температуре-
Чистота, %
99,99
99,8
99,7
99,6
99,5
<тв, МПа
22
25
26
—_
28
<rOl2. МПа
49
61
66
70
70
НВ, МПа
84—112
133
126—175
6, %
45,5
38,8
31,5
Полуфабрикаты и изделия из алюминия изготовляют в отожженном,
полунагартованном и нагартованном состояниях.
Механические свойства листов из алюминия технической чистоты в
отожженном (I) и нагартованном (II) состояниях:
ав,МПа .
а0 2, МПа
б,' % • •
I
80
30
35
и
150
100
6
Механические свойства отожженных листов технически чистого алю-
алюминия в зависимости от температуры'
t °С
20
150
200
о„, МПа
а
70
60
42
с02. МПа
30
29
25
ft %
35
55
65
t, "С
250
300
<V
МПа
28
18
ао,2'
МПа
17
10
6, %
10
80
Механические свойства отожженной алюминиевой проволоки диа-
диаметром 5 мм @,20 % Si; 0,15 % Fe) в зависимости от температуры:
163
w °c
20
100
200
300
<т„, МПа
759/766
666/722
561/654
380/407
в. %
42,0
42,0/39
42,6/40
44,0/42
.3
,3
,0
94
94
95
96
t. %
,2/94
,8/94
,1/94
,5/97
,0
,2
,7
,1
Продолжение
400
500
600
625
ов, МПа
289/371
217/263
124/166
085/117
б. %
44,7/40,5
43,3/43,3
41,1/47,0
36,0/51,2
■Ф. %
98,1/97,2
99,0/99,2
99,4
99,7
Примечание. В числителе приведены значения при
в знаменателе — при fpaCT =300 мм/мин.
раст
= 1 мм/мин,
Механические свойства алюминия различной чистоты при криоген-
криогенных температурах:
*псп- °с
27
—103
—163
— 196
—233
—253
—269
—272
—253
—269
—272
ав, МПа
99,5
74
98
114
153
308
328
291
308
328
291
99,99
49,8
40,6
46,0
128
262
277
307
261
277
307
26,1
7рн чистоте
99,997
40,8
42,4
64,5
125
216
275
257
214
275
257
214
в, %
алюминия, %
99,5 | 99,99
37
39
36
52
_
68
62
58
68
62
58
41
39
38
47
61
61
65
62
61
65
62
99,997
50
47
42
53
49
65
60
44
65
60
44
Временное сопротивление ав при сжатии литого алюминия рав-
равно 412 МПа. Микрлтвердость алюминия чистотой 99,85 °/о #^=230 МПа.
Влияние нейтронного облучения на свойства алюминия:
164
Состояние образца
До облучения
После облучения
ов, МПа
96
184
+91
о-0,2- МПа
48
121
+ 150
в, %
38,0
21,0
-45
Модуль нормальной упругости Е в зависимости от чистоты:
Чистота, % ... 99,25 99,98 99,98
Е, ГПа 71 67 63
Модуль сдвига G для алюминия чистотой 99,25 % равен 27 ГПа.
Коэффициент Пуассона v = 0,31, коэффициент сжимаемости х=
= 1,52-10-11 Па-'.
Предел выносливости Он при переменном изгибе в зависимости от
состояния материала, МПа:
Литое ,74,6
После деформации . , 78,5
» отжига .... 26,5
Ударная вязкость ая прессованного и закаленного в воде алюминия
при 20 °С составляет 710 кДж/м2.
Ползучесть технически чистого алюминия:
t, "С
100
100
200
о', МПа
88,3
147,2
44,1
е,
2,8-
2,8-
2,8-
%/с
ю-7
ю-5
ю-7
/. °с
200
300
300
с', МПа
73,6
5,9
19,6
2
2
2
,8
,8
,8
%/с
• ю-5
• ю-7
• ю-5
Скорость продольных Ci и поперечных с( волн в алюминии состав-
составляет 6300 и 3130 м/с соответственно, а удельное акустическое сопро-
сопротивление Zs = 17 Па-с/м.
Химические свойства
Нормальный электродный потенциал реакции А1—Зе^=А13+ фО= —1,66 В.
Электрохимический эквивалент равен 0,09316 мг/Кл
Во всех устойчивых соединениях алюминий имеет степень окисления
+ 3, при высоких температурах он может проявлять степень окисления
+ 1 и значительно реже +2.
Алюминий имеет высокую химическую активность, в ряду напряже-
напряжений он расположен среди наиболее электроотрицательных элементов.
Алюминий восстанавливает большинство металлических оксидов до
металла, энергично реагирует с галогенами, а при высоких температу-
температурах — с серой, азотом и фосфором В щелочах алюминий растворяется,
образуя алюминаты. При нагревании алюминий легко растворяется в
165
разведенных азотной и серной кислотах, но холодная азотная кислота
его пассивирует.
Обладая большим сродством к кислороду, алюминий на воздухе
быстро покрывается сплошной тонкой очень прочной и беспористой ок-
оксидной пленкой. Слой оксидов образуется в сухой атмосфере в течение
нескольких минут, достигая при комнатной температуре толщины 5—
10 нм. Если этот слой повредить, то немедленно возникает новый (са-
(самозащита). Пленка имеет высокое электрическое сопротивление (на-
(напряжение пробоя превышает 500 В) и в отличие от органических изо-
изоляторов выдерживает высокие температуры.
Окисление алюминия ускоряется выше температуры его плавле-
плавления; мелко раздробленный алюминий при нагревании на воздухе сго-
сгорает. Присутствие примесей магния, натрия, меди, кремния усиливает
окисление алюминия.
При температурах выше 100 "С алюминий образует с хлором соеди-
соединение А1С13. Прн атмосферном давлении хлорид алюминия возгоняется,
не плавясь, при 183 °С. Металлический алюминий образует с хлористым
алюминием при нагреве в вакууме выше 1000 °С субхлорид алюминия
А1С1; при охлаждении до 800 °С субхлорид алюминия вновь распада-
распадается на алюминий и нормальный хлорид алюминия.
С фотором алюминий образует соединение, которое возгоняется, не
плавясь, при температурах 1000—1100°С и атмосферном давлении.
При температуре выше 1000 °С алюминий образует с серой сульфид
A12S3, имеющий температуру плавления 1100 "С. Сульфид алюминия
полностью разлагается водой с образованием сероводорода.
Карбид алюминия АЦСз образуется при нагреве на воздухе до
2000°С; в вакууме —при 1000—1200°С. При нагреве выше 2000°С
А14СЭ распадается с выделением графита.
С азотом алюминий начинает соединяться при 700 °С с образова-
образованием нитрида A1N; наиболее энергично взаимодействие алюминия с азо-
азотом протекает при 830 °С. Нитрид алюминия легко гидролизуется:
A1N+3H2O-WU(OHK+NH3.
При нагревании алюминий реагирует с фосфором E00°С), образуя
соединение А1Р. Фосфид алюминия очень гигроскопичен, поэтому его
применяют в качестве осушающего вещества.
При взаимодействии алюминия с молекулярным водородом гидриды
не образуются. Однако водород — единственный газ, заметно растворя-
растворяющийся и в жидком, и в твердом алюминии.
Растворимость водорода в алюминии (см3/Ю0 г):
t, °С
300
400
500
600
Растворимость,
см'ДОО г
0,001—0,0072
0,005—0,0072
0,011—0,016
0,026—0,032
и °с
660 (тв)
660 (ж)
700
800
Растворимость,
см3/100 г
0,036—0,050
0,4—0,69
0,63—0,92
1,23—1,67
Вследствие резкого уменьшения растворимости водорода при перехо-
переходе металла из жидкого состояния в твердое происходит выделение ею
из алюминия, что приводит к пористости отливок и развитию дефектов
(расслоений) при их последующей деформации. Присутствие в алюми-
алюминии легирующих присадок сильно сказывается на растворимости в нем
водорода, особенно в жидком состоянии. Установлено, что медь, крем-
166
иий, олово снижают растворимость водорода в алюминии, а марганец,
хром, железо, церий и магний повышают.
Все металлы ограниченно растворяются в твердом алюминии; мак-
максимальной растворимостью в твердом состоянии обладают магний, медь,
цинк, серебро, галлий, германий; ряд элементов (К, Na, Rb, Cs, In, Tl,
Pb, Bi) имеет ограниченную растворимость в жидком состоянии и прак-
практически не растворяется в твердом состоянии.
Алюминий обладает высокой коррозионной стойкостью, что связа-
связано с его способностью легко пассивироваться. Наличие оксидной пленки
на поверхности алюминия создает существенную разницу между ста-
стационарным потенциалом алюминия в кислых и нейтральных средах и
стандартным электродным потенциалом алюминия. Коррозионная стой-
стойкость алюминия различных сортов определяется главным образом со-
содержанием железа; и меньшей степени влияет кремний при содержании
до 0,3 %, так как в отсутствие железа ои находится в твердом раство-
растворе. Влияние железа зависит от рН среды. В кислой среде, где процесс
идет с водородной деполяризацией, железо сильно снижает коррозион-
коррозионную стойкость алюминия; в нейтральной и щелочной средах содержание
железа до 0,5 % практически не влияет на коррозионную стойкость.
Коррозионная стойкость алюминия высокой чистоты в соляной кис-
кислоте:
Чистота алюминия, % .... 99,9992 99,9922
Потери массы, %, в НС1:
10 %-ной 0,34 1,76 ■
20%-ной 4,1 47,7
Технологические свойства
Алюминий обладает хорошими технологическими свойствами. Из него
могут быть изготовлены листы, проволока, трубы, профили и т. д. раз-
разных размеров, которые можно подвергать дальнейшей пластической
деформации (штамповке, вытяжке и др.) без существенных нагревов.
Алюминий имеет высокие литейные свойства, что позволяет получать
из него отливки сложной конфигурации:
Жидкотекучесть, мм, при длине:
прутка, отлитого в песчаную форму . • . . , 320
спирали, отлитой в кокиль 450
Объемная усадка кристаллизации, %••••. 6,5
Полная линейная усадка, % 1,7
Примечание. Заливка при 700°С.
Алюминий сваривается практически всеми методами сварки, включая
сварку плавлением. Обрабатываемость резанием чистого алюминия пло-
плохая из-за высокой вязкости материала. Сплавы алюминия хорошо об-
обрабатываются резанием. Обработку давлением (прокатка, прессование,
ковка) алюминия и его сплавов проводят в интервале 350—500 °С.
Температура рекристаллизации алюминия уменьшается с повышени-
повышением его чистоты:
AI, % . . 99,99 99,998 99,9992 99,9999
*рекр, °С • 150—200 50—100 37—20 —50
167
Области применения
Благодаря хорошему сочетанию физических, механических и технологи-
технологических свойств алюминий широко применяется в различных областях
народного хозяйства.
Широко используются алюминиевые сплавы в строительстве для из-
изготовления ограждающих и несущих конструкций, строительства мосюв,
силосных башен, бассейнов и т. д.
Свариваемые, коррозионностойкие алюминиевые сплавы (АД1, АМц,
АМгЗ, АМг5; АМгб и др.) применяют в судостроении для изготовлелня
корпусов судов и нх надстроек, трубопроводов, различного судового
оборудования. Применение алюминиевых сплавов позволяет значитель-
значительно облегчить судно, что приводит к повышению его грузоподъемности
или улучшению технических характеристик (повышение скорости).
Алюминиевые сплавы системы А1—Mg и А1—Zn—Mg применяют в
железнодорожном и автомобильном транспорте для изготовления гру-
грузовых пассажирских вагонов, цистерн, кузовов автомашин, что связано
с высокой удельной прочностью сплавов, позволяющей снизить массу,
и, следовательно, уменьшить расход горючего, высокой коррозионной
стойкостью и сопротивлением истиранию сыпучими грузами.
В нефтяной и химической промышленности алюминий и его сплавы
иашли широкое применение в качестве конструкционных материалов
для изготовления деталей нефтепромыслового оборудования (буриль-
(бурильные трубы, буровые вышки), аппаратуры для переработки нефти и хи-
химических процессов (конденсаторы, емкости, колонны). К достоинствам
алюминия и его сплавов в этом случае относится образование продук-
продуктов коррозии, не окрашивающих среду, не способных к искрообразова-
нию, отсутствие воздействия ча жизнедеятельность микроорганизмов.
Высокая электропроводность алюминия позволяет использовать его
для изготовления проводов, кабелей, электротехнических шин и т. д.
Относительно низкое сечение захвата тепловых нейтронов и малая чув-
чувствительность структуры и свойств к радиационным воздействиям, хо-
хорошая коррозионная стойкость в средах-теплоносителях позволяют
использовать алюминий и некоторые его сплавы в атомном реакторо-
строении для изготовления защитных оболочек тепловыделяющих эле-
элементов, трубопроводов и т. д. Наиболее часто используют технический
алюминий в реакторах с водяным охлаждением при температурах до
130 "С. С середины 20-х годов началось широкое применение алюми-
алюминия и его сплавов в авиастроении. Чистый алюминий применяют глав-
главным образом в виде фольги для сотовых конструкций. Высокопрочные
сплавы систем А1—Си—Mg и Al—Zn—Mg—Си используют для сило-
силовых элементов планера и крыльев самолетов. Ковочные и жаропрочные
сплавы используют для изготовления шасси, лопастей воздушных вин-
винтов, шпангоутов, а также для различных деталей двигателей. Около
70 % материалов, применяемых в современных дозвуковых самолетах,
приходится на алюминиевые сплавы.
Успешно применяют алюминиевые сплавы в военной технике для
корпусов и баков горючего ракет, для брони бронетранспортеров и
легких танков и т. д
В металлургии алюминий используют для раскисления стали, полу-
получения некоторых металлов методом алюмотермии.
Особенно широко алюминии и его малолегированные сплавы при-
применяют для изготовления предметов широкого потребления: посуда и
домашняя утварь; бытовые электроприборы, мебель и спортивный ин-
инвентарь; тара Для хранения и транспортировки пищевых продуктов.
В последнее время большим спросом пользуется алюминиевая посуда
с отДелкой наружной поверхности цветным эмалированием и антипри*
16Й
гарным покрытием рабочей поверхности. Для упаковочных материалов
применяют алюминиевую фольгу, а использование алюминиевых кон-
консервных банок позволяет уменьшить потребление дефицитного в на-
настоящее время олова.
3.3. ГАЛЛИЙ [1—35, 55, 138—143]
Общие сведения и методы получения
Галлий (Ga) — металл серебристо-белого цвета с синеватым оттенком.
Существование галлия было предсказано в 1871 г. Д И. Менделеевым,
который назвал его экаалюминием. Открыл галлий в 1875 г. француз-
французский химик Лекок де Буабодран спектральным анализом цинковой об-
маикн. Элемент назван галлием в честь Франции.
Содержание галлия в земной коре ~ 1,5• 10~3 % (по массе). Гал-
Галлий — рассеянный элемент, присутствует в виде изоморфной примеси во
миогнх минералах алюминия и железа, а также в цинковой обманке.
Известен один минерал галлия — галлит (CuGaS2), обнаруженный в
1958 г.; он встречается вместе с германитом в малых количествах.
Основной источник получения галлия в настоящее время — раство-
растворы глиноземного производства при переработке боксита и нефелина;
кроме того, возможно извлечение галлия из отходов электролиза алю-
алюминия, из угольной пены, из сульфидных полиметаллических руд и уг-
углей при их переработке.
Концентрация галлия в алюминиевых растворах после разложения
в процессе Байера 100—150 мг/л, по способу спекания 50—65 мг/л.
Этими двумя способами галлий отделяют от большей части алюмн-
иия карбонизацией, концентрируя галлий в виде Ga(OHK в последней
фракции осадка. Обогащенный раствор обрабатывают известью, полу-
получая галлиевый концентрат, содержание Ga2O3 в Котором достигает
~1 %• Возможно также выделение галлия электролизом на ртутном
катоде из оборотных растворов процесса Байера
Технический галлий получают электролизом или цементацией. Элек-
Электролит— раствор галлиевого концентрата в едком натре Температура
электролиза 50—70°С при расходе энергии 100 Вт-ч/г Ga. Цементирую-
Цементирующим металлом служит алюминий.
Получаемый электрохимическими методами галлий содержит значи-
значительное количество примесей, зависящее от состава исходного электро-
электролита. Черновой галлий подвергают очистке несколькими способами:
1) промывка горячей водой и фильтрация через пористые фильтры
(галлий чистотой 99,9 %);
2) промывка кислотами (содержание примесей снижается до 0,01 %);
3) вакуумная обработка (основана на различии в давлении паров при
высокой температуре между галлием и рядом примесей);
4) электролитическое рафинирование, т. е. растворение чернового
галлия в щелочном электролите в катодное осаждение чистого металла1
5) физические методы очистки (направленная кристаллизация, зон-
зонная плавка).
Сочетание рассмотренных методов очистки чернового галлия, позво-
позволяет получать металл чистотой 99,9996 °/о, который используют для син-
синтеза полупроводниковых соединений. Технический галлий поставляется
двух марок Гл-0 и Гл-1 (ГОСТ 12797—77) с содержанием галлня не
менее 99,99 и 99,9 % соответственно.
Содержание примесей, %. не более: Гл 0: 3• 10—4А1; 3-10~4Fe;
5-10-* Si; з-Ю-4 Mg; 2-Ю Си; l-10Ni, 1-10~4 Zn; 6-10~4 Pb;
Гл-1- 1-Ю-3 Al; 1 • Ю-3 Fe; 1-10 Si; M0-3Mg; 3-10-2 Си;
M0-4Ni; l-10-2Zn;6-10-2Pb.
169
Галлий выпускается в виде слитков цилиндрической формы массой
200—250, 400—500, 900—1000, 1000—1500 г. Хранение галлия осущест-
осуществляется в ящиках при температуре не выше 20 °С.
Физические свойства
Атомные характеристики. Атомный номер 31, атомная масса 69,72 а. е. м.
Природный галлий состоит из двух стабильных изотопов с массовыми
числами 69 F1,2%) и 71 C8,8%). Известно девять искусственных ра-
радиоактивных изотопов галлия:
Массовое
число
64
65
65 т*
Период
полурас-
полураспада
156 с
480 с
900 с
Массовое
число
66
67
68
Период
полураспада
0,392 сут
3,25 сут
4080 с
Массовое
число
70
72
73
Период
полураспада
1260 с
0,587 сут
0,207 сут
* Метастабильное состояние ядра.
Атомный объем 11,8-10-" м3/моль, атомный радиус 0,138 нм, ионный
радиус (Ga3+) 0,062 нм, конфигурация внешней электронной оболочки
галлия 4s24p'. Потенциалы ионизации атома / (эВ): 6,00, 20,51, 30,70.
Число спектральных линий нейтрального атома 55. Электроотрицатель-
Электроотрицательность 1,6
Галлию в твердом состоянии свойственны полиморфные превращения,
обнаруженные при кристаллизации металла под давлением из сильно
переохлажденного расплава. Известные полиморфные формы:
Фаза
a-(Gal)
Gall
Galll
<пл-
29,
—29
—42
°с
76
,8
Фаза
Р
V
б
16
—35
— 19
С
,3
,6
,4
Фаза
8
Аморфный
W
—28
—25
*
°с
,6
,3
* При —253 °С переходит в P-Ga.
Энергия кристаллической решетки 276,7 мкДж/кмоль.
Периоды решеток некоторых модификаций:
Фаза
a-Ga
(Gal)
a-Ga
(Gal)
Gall
P-Ga*
Y-Ga
Структура
Орторомбическая
To же
Тетрагональная
Моноклинная
Орторомбическая
т, к
297
4,2
297
248
220
Число
атомов
в элемен-
элементарной
ячейке z
8
8
4
4
40
Периоды решетки, нм
о
0,45258
0,45156
0,396
0,2766
1,060
ь
0,45186
0,44904
0,8053
1,356
С
0,76570
0,76328
0,437
0,3332
0,519
* Угол Р для p-Ga равен 92°02',
170
При давлении 1,2 ГПа и температуре ниже 2,4 °С a-Ga переходит в
Gall, а при давлении 3 ГПа и 50 °С существует форма Galll. При ат-
атмосферном давлении форма Gall нестабильна и переходит в a-Ga.
Уникальная орторомбическая структура галлия (a-Ga) характеризу-
характеризуется образованием атомных пар Ga2 и относительно слабой связью с
остальными атомами в ячейке, что обусловливает низкую температуру
плавления галлия, увеличение плотности и уменьшение электросопротив-
электросопротивления при плавлении, а также большое переохлаждение, необходимое
для кристаллизации.
Эффективное поперечное сечение захвата тепловых нейтронов равно
2,71-Ю-28 м2. Работа выхода электронов ф = 4,19 эВ.
Плотность твердого галлия при 302,65 К р=5,9037 Мг/м3, а жид-
жидкого при 302,8 К 6,0947 Мг/м3. Увеличение плотности при плавлении
3,20 %. Изменение плотности в зависимости от температуры:
т,
р.
к. . • ■
Мг/м3. .
325,9
6,080
422
6,005
675
5,840
873
5,720
1073
5,604
1383
5,445
Электрические и магнитные При 273 К удельное электрическое со-
сопротивление поликристаллического галлия р=0,4015 мкОм-м, а в точке
плавления р=0,449 мкОм-м.
Монокристалл галлия анизотропен, зависимость удельного электри-
электрического сопротивления по осям от температуры:
Г, К
83
123
173
0
0
0
а
,035
,061
,094
р, мкОм-м
Ь
0,017
0,029
0,044
0
0
0
с
,120
,203
,308
Г, К
223
273
293
0,
0,
0,
а
127
160
174
р, мкОм м
b
0,059
0,074
0,081
с
0,406
0,503
0,543
Температурный коэффициент электрического сопротивления твердо-
твердого галлия в интервале 273—295 К a=3,96-10~3 К. Коэффициент вто-
вторичной электронной эмиссии 0гаах=1>О8 при ускоряющем напряжении
первичных электронов 0,500 кэВ.
Постоянная Холла для твердого галлия R——0,63- 10~i0 м3/Кл. Тем-
Температура перехода в сверхпроводящее состояние для 69Ga 1,0897 К,
"Ga 1,0770 К и для природного галлия 1,0845 К. Электросопротивление
твердого поликрнсталлического галлия выше сопротивления жидкого,
отношение Р293/Р293= ^- Значения удельного электрического сопро-
сопротивления жидкого галлия при различных температурах:
Т, К 273 293 302,9 303 873
р, мкОм-м , . 0,2723 0,2584 0,2599 0,25795 0,378
Температурный коэффициент электрического сопротивления жидкого
галлия при температуре плавления а~8-10~в К. Постоянная Холла
для жидкого галлия R——0,39-10~10 М3/Кл. В твердом состоянии галлий
диамагнитен; магнитная восприимчивость при 80 К х=—0,35-10~9, при
290 К х=—0,31 - Ю~9. Это свойство галлия также анизотропно, отноше-
отношение по осям составляет 1 : 3,5 : 1,9. Жидкяй галлий незначительно диа-
диамагнитен, магнитная восприимчивость при 313 К х=+0,036 • 10~9. Маг-
Магнитная индукция галлия при 293 К В = 1,63 Тл.
Абсолютный коэффициент т. э. д. с, поликристаллического твердого
171
галлия вблизи температуры плавления е=1,5 мкВ/К, а жидкого при
303 К е=—0,26 мкВ/К.
Тепловые и термодинамические. Температура плавления tпл = 29,76 °С.
Температура кипения <кип=2205°С. Характеристическая температура
равна 0d--333 К. Плавление монокристалла галлия происходит в четы-
четыре этапа с разностью температур между ними: 0,0204; 0,0054; 0,036 °С,
для поликристаллического образца интервал плавления не превышает
0,005 °С. Удельная теплота плавления a-Ga ДЯпл = 80,177 кДж/кг. При
охлаждении галлий способен оставаться жидким до —40 °С.
Теплоемкость a-Ga в зависимости от температуры:
Г, К
15
30
100
150
V
Дж/(кг-К)
14,77
69,65
280,43
318,87
т. к
250
298
299,2
Дж/(кг-К)
358,51
363,91
368,1
г. к
302,2
302,5
302,8
V
Дж/(кгК)
480,4
1210,63
1511,49
Удельная теплоемкость жидкого галлия при температуре 320 К
Ср=399,04 Дж/(кг-К). Молярная энтропия s° и приведенный термоди-
термодинамический потенциал Фг изменяются следующим образом:
г, к
298
500
1000
S°
Дж/(моль
41,14
73,99
93,31
ф
•К)
41,
51,
68,
г
14
57
17
т. к
1500
2000
3000
S0
Дж/(моль
104,62
112,62
224,75
фт
К)
78,60
86,14
113,46
Молярная энтропия газообразного галлия при 298 К s° =
= 169,19 Дж/(моль-К).
Температурный коэффициент линейного расширения в интервале
223—293 К для поликристаллического галлия а = 20-10~6 К, а для мо-
монокристаллов 11,5; 31,5 и 16,5-10~в К вдоль осей а, Ь, с соответст-
соответственно. Температурный коэффициент объемного расширения |3 твердого
галлия в зависимости от температуры:
Т, К 273—293 223—273 173—273 123—273 93—273
Р-1О«, К-1 • • 59,5 60 59 55,5 52,5
Коэффициент
г, К
65
196,9
р-ю»
123
114
Р жидкого галлиг
к-1
,62
,99
Г, К
298,1
348,1
[ В
Г
зависимости
,.№*-*
110,72
108,8
от температуры
т.
456
518
К
,0
,7
Р-10"
106
104
к-1
,07
,76
Теплопроводность К твердого галлия анизотропна по осям a, b, a
40,0258, 100,0645, 20,0129 Вт/(М'К) соответственно, при этом она су-
172
щественно зависит от температуры, приобретая максимальное значение
при 2 К, равное 30019,356; 84548,239; 7787,448 Вт/(м-К) для осей а, Ь,
с соответственно.
Теплопроводность Я поликристаллического галлия в зависимости от
температуры:
Т, К- • • •
к, Вт/(м-К)
273 300 304 373
41 33 26 27
Давление пара р над твердым галлием низкое и
3,0- Ю-38 и 3,9-10-37 Па при 298,15 и 302 К соответственно.
Давление пара р для жидкого галлия:
составляет
Т, К •
р, Па .
1196,5
0,135
1220,3
0,2134
1248,9
0,4510
1289,2
0,960
1320,7
1,771
1472,7
16,80
Динамическая вязкость ц галлия в зависимости от температуры:
Т, К- •
т], мПа-с
326
1,89
574
1,03
675
0,88
773
0,814
1079
0,647
Поверхностное натяжение при 303 К ff=707 мН/м. Коэффициент
самодиффузии (предэкспонепциальный множитель Do) жидкого гал-
галлия 1,6-10 ~10 м2/с, а твердого монокристаллнческого Do—
= 6-10~19 м2/с; анизотропия диффузии у твердого галлия не наблюда-
наблюдается.
Оптические свойства (показатели преломления п и поглощения %,
коэффициент отражения по) жидкого и твердого галлия:
X, мкм
, %
X, мкм
. %
0,400
0,500
0,600
0,700
0,800
Жидкий
0,59
0,89
1,25
1,65
2,09
галлий
4,5
5,6
6,6
7,6
8,5
89,1
90,1
88,6
89,8
90,3
0,430
0,500
0,650
0,800
Твердый галлий
1,59
2,23
3,91
4,35
3,95
4,55
4,55
3,87
72
71
65
60
Механические и технологические свойства
Твердость по Бринеллю ЯВ = 25МПа. Временное сопротивление разры-
разрыву о"в проволоки из галлия 20—38 МПа, а относительное удлинение
S=2-f-40 %. Сжимаемость твердого галлия при 20 °С х=2-10-и Па~',
а жидкого 4-10-" Па-1. При ударных нагрузках галлий довольно хру-
хрупок, однако легко поддается обработке давлением и из него может быть
получена фольга толщиной около 20 мкм.
Химические свойства
Нормальный электродный потенциал реакции Ga—3e*±Ga3+ q>0=
=—0,52 В. В соединениях галлий проявляет степени окисления +1,
+2 и +З.Электрохимический эквивалент оавен 0,24083 мг/Кл.
173
На воздухе на поверхности металлического галлия обычно образу-
образуется тонкая пленка оксида, так что дальнейшее окисление незначитель-
незначительно; заметнее процесс окисления идет при 500 °С; при более высоких тем-
температурах металл сгорает до оксида. Галлий легко растворяется в азот-
азотной и серной кислотах, а реагируя с щелочами, образует амфотерный
гидроксид. По отношению к воде галлий весьма устойчив, не разлагая
ее даже при 100 СС. Галлий взаимодействует с галогенами (кроме иода),
даже на холоду образуя галогениды; с иодом галлий взаимодействует
только при нагревании.
Оксид галлия (III) ОагОэ получается при обезвоживании гидроксида.
Это вещество белого цвета с температурой плавления 1740 "С и плот-
плотностью 6,480 Мг/м3. Оксид галлия (I) Ga2O получается при нагревании
металла в атмосфере оксида углерода или в результате восстановления
оксида галлия (III). Это вещество с плотностью 4,770 Мг/м3 сублимиру-
сублимирует выше 650 °С. При растворении гндроксида галлия в щелочах обра-
образуются галлаты Me[Ga(OHL]. Галла ты щелочных металлов хорошо
растворимы, щелочноземельных — ограниченно растворимы. Известны
многочисленные галлийоргаиические соединения, которые получаются
действием соответствующих ртутьорганических соединений на галлий.
Соли галлия, полученные от сильных кислот, растворимы в воде и склон-
склонны (в водных растворах) к гидролизу.
Жидкий галлий — очень агрессивный металл, при повышенной тем-
температуре легко взаимодействует со всеми металлами. До температуры
600 "С галлий не взаимодействует только с вольфрамом, танталом, ре-
рением и бериллием.
Металлы III и IV групп, а также висмут образуют с галлием диа-
диаграммы состояния эвтектического типа или с ограниченной раствори-
растворимостью в жидком состоянии (кадмий, ртуть, таллий, висмут и свинец)-
Щелочные металлы дают с галлием высокотемпературные соединения.
Для галлия характерна ограниченная растворимость в твердом состоя-
состоянии со многими металлами.
Области применения
Широкое применение галлия началось лишь с 50-х годов нашего века,
после того как было установлено, что его интерметаллические соеди-
соединения обладают полупроводниковыми свойствами. Соединения типа
AIUBV (GaAs, GaP, GaSb) сохраняют полупроводниковые свойства да-
даже при повышенных температурах. Так, приборы, в которых использу-
используется GaAs, работают при температуре до 450 °С, а приборы с GaP —
до 1000 °С. Галлий — перспективный мате.риал для использования в сол-
солнечных батареях: солнечные элементы из GaAs стойки к космической
радиации. Арсенид галлия применяют также в качестве активной лазер-
лазерной среды.
Галлий используют как акцепторную добавку для легирования гер-
германия.
Легкоплавкие сплавы, которые галлий образует с рядом металлов
(Sn, Pb, In, T1 и др.), применяют в терморегуляторах, спринклериых
устройствах, в качестве жидкости для высокотемпературных термомет-
термометров и манометров. Сплавы на основе галлия используют для «холод-
«холодной пайки» различных материалов
В атомной технике галлий применяют в жидкометаллических радиа-
радиационных контурах как компонент рабочего низкотемпературного сплава.
Благодаря хорошей отражательной способности галлий широко ис-
используется дли изготовления зеркал; в люминесцентных составах для
ламп соединения галлия играют роль активаторов. Добавка галлия в
174
стеклянную массу позволяет получать стекла с высоким коэффициентом
преломления. Имеются данные об использовании изотопа галлия
G2Ga) для диагностики заболеваний.
3.4. ИНДИЙ [1—35, 43, 51, 53, 55, 144, 145]
Общие сведения и методы получения
Индий (In) — мягкий металл серебристо-белого цвета, рассеянный эле-
элемент. Открыт в 1863 г. Ф. Рейхом и Т. Рихтером при спектроскопичес-
спектроскопическом исследовании цинковой обманки. Свое название нндий получил по
цвету (сиияя) линии спектра.
Содержание индия в земной коре 1,4- Ю-5 % (по массе).
Собственные минералы иидия промышленного значения не имеют.
К ним относятся: индит FeliijS^ рекизит СиГпБг, джалиндит 1п(ОН)з,
сакуранит (Си, Zn, Ре)зAп, Sn)S4, а также самородный индий.
Повышенная концентрация индия наблюдается в сульфидных мине-
минералах (особенно в цинковой обманке), а также в сульфостаниатах свин-
свинца и цинка. Например, в килнндрите Pb6Sb2Sn6S2 содержится 0,1—
1 % In, франкеите Pb5Sb2Sn2Si2 — до 0,1 % In, в станнине — до 0,1 % In.
Главный источник получения иидия — отходы в промежуточные про-
продукты цинкового и свинцового производства, а в последнее время и от-
отходы производства олова.
При пирометаллургическом производстве цинка источником извлече-
извлечения индия служат пыли печей коксования брикетов и свинец, получен-
полученный при ректификационной очистке чернового цинка. При гидроме-
гидрометаллургическом производстве цинка таким источником служат возгоны
вельц- или фьюминг-процесса, а также меднокадмиевые кеки.
При получении свинца источником извлечения индия служат продук-
продукты рафинирования (медистые съемы и оксиды), а также продукты их
переработки (пыли и шлаки отражательной плавки медистых съемов).
При производстве олова источником извлечения индия могут быть
пыли и отработанный электролит. В перечисленных выше продуктах
содержание индия колеблется от тысячных до десятых долей процента,
поэтому технология извлечения индия состоит из трех основных ста-
стадий:
1) получения индиевого концентрата (содержание индия более
1-2%);
2) получения чернового индия;
3) рафинирования чернового металла.
Для перевода индия в раствор исходное сырье обрабатывают серной
кислотой, обычно применяя двустадийное выщелачивание Для более
полного извлечения иидия в раствор исходный материал иногда пред-
предварительно сульфатизируют. Для очистки раствора от примесей, кон-
концентрирования раствора и выделения индиевого концентрата использу-
используют сочетание различных методов:
1. Осаждение малорастворимых соединений индия. Этот способ ос-
основан на различии рН выделения гидроксида индия и других элементов.
Регулируя рН раствора, можно отделить основную массу цинка, меди
и кадмия от индия и в результате получить осадки, обогащенные инди-
индием.
2. Осаждение или растворение отдельных примесей. Обрабатывая
гидролитический концентрат раствором щелочи, удается отделить ин-
индий от таких примесей, как алюминий, цинк, свинец, олово, галлий, гер-
175
маний, которые образуют растворимые натриевые соли, переходящие в
раствор. Примеси меди, сурьмы, мышьяка удаляют осаждением их суль-
сульфидов из сернокислых растворов, применяя в качестве осадителя суль-
сульфид цинка.
3. Экстракция. В нашей стране для экстракции индия из- сернокислых
растворов используют экстрагент ди-2-этилгексилфосфорной кислоты
(Д-2-ЭГФК).
4. Цементация. Этот процесс, основанный на вытеснении металла из
раствора его соли более электроотрицательным металлом, осуществляют
с помощью цинковой пыли. Вначале выделяется медь (ее можно це-
цементировать и на железе), а затем после отделения меди на цинке це-
цементируется индий с частью кадмия, при этом железо и алюминий ос-
остаются в растворе. Часто используют амальгамный метод цементации,
заключающийся в извлечении индия и части примесей в амальгаму цин-
цинка с последующим извлечением из иее индия анодным растворением и
осаждением его на катоде. Черновой индий выделяют из предваритель-
предварительно концентрированных и очищенных растворов цементацией на алюми-
алюминиевых или цинковых листах или электролизом. Цементации иа алюми-
алюминии способствует присутствие соляной кислоты, которая растворяет
пассивирующие оксидные пленки на поверхности алюминия; кроме того,
цементация на алюминии дает возможность получить легко снимающий-
снимающийся осадок (в отличие от цементации на цинке). Полученный при этом
процессе губчатый индий прессуют в брикеты и плавят под защитным
слоем едкого натра. Черновой металл содержит обычно 96—99 % In.
Электролизом индий получают из сульфатных растворов, плотность
тока 100—150 А/м2, напряжение 2 В. Катоды — из нержавеющей стали,
аноды — графитовые.
Черновой индий подвергают рафинированию сочетанием нескольких
способов (химический, электрохимический, вакуумная дистилляция, зон-
зонная плавка и метод вытягивания слитка из расплава).
Химический способ рафинирования заключается в плавке губчатого
индия вначале под слоем щелочей, а затем под слоем солевого расп-
расплава ZnCl2 и NH4Cl, взятых в соотношении 3:1. Содержание примесей
после такой очистки составляет A-=-3) -Ю-4 %. Электрохимическое дву-
двукратное рафинирование позволяет получить индий с содержанием каж-
каждой примеси менее Ю-4 %.
При вакуумной дистилляции плавку индия ведут при разрежении
5,32 Па. В этом случае удаляются низкокипящие примеси — кадмий,
ртуть, цинк.
Зонная плавка и вытягивание слитка из расплава позволяют полу-
получать наиболее чистый металл для полупроводниковой промышленности.
Индий поставляют в виде слитков прямоугольной формы массой до
3 кг для индия марки Ин2, до 1 кг для остальных марок.
Химический состав различных марок индия по ГОСТ 10297—75:
Марка
ИнОООу
ИнООО
ИнОО
ИнО
Ин1
Ин2
In
99,9995
99,9992
99,999
99,998
99,995
99,96
5-
5-
5-
5-
1-
5-
Fe
ю-5
ю-5
ю-?
Ю-5
Ю-*
ю-3
Примеси, ие
Cd
ью-5
3-Ю-8
ью-5
1-10-'
1-10-4
5-Ю-3
Си
ыо-5
8-Ю-6
МО-5
МО-5
ЬЮ-'
1-10-5
более
As
5-Ю-5
5-Ю-5
5-Ю-5
Ы0-"
1-1И
4-10-3
Ni
2-10-5
2-10-5
2-Ю-5
4-Ю-5
3 • 10—*
5-10-*
176
Продолжение
Марка
ИнОООу
ИнООО
ИнОО
ИнО
Ин1
Ин2
In
99,9995
99,9992
99,999
99,998
99,995
99,96
Примеси, ие более
1
Sn |
5-10-5
1 • Ю-*
1 -10—*
2-10-*
5-Ю-*
5-Ю-'
Hg
2-10—6
2-Ю-5
2-Ю-5
4-Ю-5
1 ■ Ю-4
5-Ю-3
РЬ 1 TI
1 • Ю-4
5-10—5
1 ■ Ю-4
2-Ю-4
5-10-4
5-Ю-3
5-Ю-5
5-10-1
5-Ю-*
5-10-*
МО-3
2-Ю-з
Zn
5-10-6
2-Ю-5
МО-4
ью-*
l-10-i
3-Ю-3
Примечания: I. В индии марки ИнОООу содержание алюминия и магния
должно быть не более 3-10 -5 % каждого, серебра не более 1-10 ~5%. 2. В ин-
индии марки ИнООО (осч. 19-3) содержание элементов, %, должно быть ие более:
3-Ш—5А1; 340-вШ; 1 -10—*■ Ga;3-I0~5 Mg; l-10-6Mn; 5-10~5 Se; 5 10"-5S;
1 -10—6 Ag; 5■ 10—5 Te- 3- В индии марки ИнОО содержание алюминия и серебра
должно быть ие более i-Ю 4 % каждого (магния не более 3-10 б%) 4. Содер-
Содержание индня определяется условно как разность между 100 % и суммой содер-
содержания примесей, указанных в таблице.
Индий — токсичный металл.
Физические свойства
Атомные характеристики. Атомный номер 49, атомная масса 114,82
а. е. м., атомный объем 15,76-10~6 м3/моль. Индий состоит из двух изо-
изотопов 11Э1п D,33%) и 1151п (95,67%), последний имеет слабую E-ра-
диоактивность. Известен ряд радиоактивных изотопов индия, из кото-
которых важнейшим является 1141п:
Массовое
число
107
108
109
ПО т*
ПО
111
112
Период по-
полураспада
1800 с
3000 с
0,179 сут
0,208 сут
3960 с
2,84 сут
870 с
Массовое
число
112т
ПЗт
113
114
114 т
115т
115
Период по-
полураспада
1255 с
6240 с
} 72 с
49 сут
0,187 сут
6 -10" лет
Массовое
число
116 т
116
117 т
117
118
119
Период по-
полураспада
3230 с
13 с
6840 с
3940 с
270 с
1050 с
m — метастабильное состояние ядра.
Кристаллическая решетка индия — тетрагональная гранецентриро-
ванная с периодами а 0,4583 нм, с 0,4936 нм.
Энергия кристаллической решетки 244 мкДж/кмоль.
Атомный радиус иидия равен 0,166 нм, ионные радиусы 1п+ 0,130 нм,
1п3+ 0,092 им, электронная конфигурация внешней оболочки атома ин-
индия 5s25p'. Потенциалы иоиизации /, эВ: 5,785, 18,86, 28,0. Эффектив-
Эффективное поперечное сечение захвата тепловых нейтронов 190-10~28 м2.
Электроотрицательность 1,7, Работа выхода электронов <р=3,8 эВ.
177,
Плотность индия р = 7,3 Мг/м3, изменение плотности при плавлении
3,6%.
Электрические и магнитные. Удельное электрическое сопротивление
р индия при различных температурах:
Г,
4
20
81
К
,2
,6
р.
0
0
0
II
мкОм-м
,00322
,00537
,0215
т, К
273
293
353
Р.
0
0
0
мкОм-м
,0837
,0845
,0869
429
573
873
Г,
,9
К
(ж)
Р.
0
0
0
мкОм м
,290
,360
,440
Удельная электрическая проводимость о при 273, 293, 353 К соот-
соответственно 12; 11,9; 11,5МСм/м.
Температурный коэффициент электрического сопротивления в интер-
интервале 273—373 К а = 4,904- Ю-3 К.
Температура перехода в сверхпроводящее состояние 3,405 К.
Изменение удельного электрического сопротивления при плавлении
Рш/ртв = 2,18.
Абсолютный коэффициент т. э. д. с. в твердом состоянии при 273 К
е= +2,4 мкВ/К.
Постоянная Холла при комнатной температуре R=—0,24-Ю-10 М3/Кл,
а в интервале 423—773 К /?=—0,59-10-10 м'/Кл (для индия чистотой
99,999 %). Индий диамагнитен, его магнитная восприимчивость при
293 К X——0,56-Ю-9. Коэффициент вторичной электронной эмиссии
втах=1,41 при ускоряющем напряжении первичных электронов
0,500 кэВ.
Тепловые и термодинамические. Температура плавления индия
<пл=156,4°С, температура кипения <Кип=2000—2100°С. Характерно™.
ческая температура, определенная по теплоемкости, 6= 109 К. Давле-
Давление пара р в зависимости от температуры:
Г, К ... П96 1274 1320 1473
р, Па . . . 1,7346 7,448 17,64 147,18
Давление пара при температуре плавления 1,45-107 Па.
Удельная теплота плавления иидия АЯПЛ = 28,47 кДж/кг, удельная
теплота испарения ДЯИсп=2026,41 кДж/кг (при температуре кипения),
удельная теплота сублимации при 298 К ЛЯСУбл = 2063,86 кДж/кг.
Удельная теплоемкость индия при 273—373 К ср = 238,6 Дж/(кг-К), а
жидкого индия 259,5 Дж/(кг-К). Удельная электронная теплоемкость
^=[1,672 мДж/(моль-К2)]-7Л Температурный коэффициент линейно-
линейного расширения при 293—333 К а=3010~6 К (чистота 99,999%),
а объемного расширения при 273—298 К р=77- Ю-6 К.
Молярная энтропия s" и приведенный термодинамический потенци-
потенциал Фт в зависимости от температуры:
Г, К
298
500
1000
1500
s°
Дж/(моль-К)
57,861
80,386
100,985
113,044
57,861
62,216
77,037
87,169
т, К
2000
2500
3000
s°
фг
Дж/(моль К)
121,584
225,501
229,813
94,747
107,936
127,948
178
Изменение теплопроводности к индия в зависимости от температуры:
Т, К 250 400 500 600 700 800 900
№, Вт/(м-К). • • 87,0 80,0 39,3 42,1 45,0 47,5 50,0
Поверхностное натяжение жидкого индия 0 = 550 мН/м.
Динамическая вязкость г\ в зависимости от температуры:
Т, К 573 673 773
ц, мПа-с 1,22 1,10 0,85
Для поликристаллического индия при температурах 403—422 К
энергия активации самодиффузии равна £=88,6 кДж/моль. а пред-
экспоненциальный множитель £>о=8.О-1О-4 м'/с
Показатели преломления п и поглощения % поликристаллического
иидия в зависимости от длины волиы К:
X, мкм
0,55
0,60
0,80
1,0
1,5
п
0,70
0,795
1,32
1,81
2,19
■ 1
4,70
5,02
6,60
7,77
11,0
^,, МКМ
2,0
4,0
8,0
10,0
п
2,97
7,27
18,4
24,8
X
14,5
26,7
45,3
51,9
Механические свойства
Механические свойства при 20 °С: о„=3 МПа, 6 = 22%, i|> = 87%,
ЯВ=9 МПа.
Свойства индия чистотой 99,999 % в зависимости от температуры
испытания (скорость деформирования 0,023 с~'):
two, °С —196 —101 —58 —15 28 71
аи, МПа 13 13 6,4 4,4 2,9 2,0
б, % 35 34 38 50 57 54
Проволока диаметром 3 мм из иидия чистотой 99,9 % имеет при
20 °С 0В = 2,94 МПа, а при чистоте 99,7% ав=12,3 МПа. Временное
сопротивление при сжатии а°ж=2,2 МПа. Модуль нормальной упруго-
упругости £=10,5 ГПа при 20 °С и 8,83 ГПа при 100 °С. Предел выносли.
вости при испытаниях на изгиб на базе 10" циклов и при температуре
^5 5°С а« =10,8 МПа.
Химические свойства
Нормальный электродный потенциал реакции In—3e*±In3+ фо=—0,35 В.
Электрохимический эквивалент индия 0,39641 мг/Кл.
Индий — химический аналог галлия; образует соединения, отвечаю-
отвечающие степеням окисления +1, +2, +3; соединения со степенью окисле-
окисления +3 наиболее устойчивы.
При комнатной температуре индий не тускнеет иа воздухе; на нем
образуется тонкая пленка оксидов при нагревании выше 800 °С; горит
фиолетово-синим пламенем, образуя 1пгОз.
Иидий растворяется в серной, соляной кислотах, особенно активно
в азотной, в плавиковой кислоте — только при нагревании. Легко раст-
растворяется в концентрированных органических кислотах.
179
С азотом и водородом индий не взаимодействует. С кислородом
индий дает несколько соединений. Оксид индия (III) 1п2О3 представ-
представляет собой желтые кристаллы с о. ц. к. решеткой, а= 1,0105 нм,
^плг»2273°С, плотность 7,100 Мг/м3, практически нерастворим в воде,
но легко растворяется в кислотах. При нагревании выше 850 СС диссо-
диссоциирует, образуя оксид индия (I) 1п2О —черный порошок плотностью
6,300 Мг/м3. 1п2О легко окисляется па воздухе и хорошо растворяется
в соляной кислоте.
Гидроксид 1п(ОН)э образуется в виде белого студенистого осадка
при действии щелочей или аммиака на растворы трехвалентных солей
индия, легко растворим в кислотах, нерастворим в растворах аммиака.
Сера и сероводород при обычных температурах на индий ие действуют.
Сульфат иидия кристаллизуется из водных растворов в виде гидрата
ln2(SO4b-5H2O. Из сернокислых растворов в зависимости от темпе-
температуры и концентрации серной кислоты выделяются InjfSO^1 ЮНгО,
In2(SO4K-6H2O или кислая соль In2(SO4K-H2SO4-7H2O.
Сульфид In2S3 выделяется из слабокислых растворов и имеет две
модификации, а (порошок желтого цвета, гигроскопичен, имеет г. ц. к.
решетку, а==0,536 нм) и р (негигроскопична, имеет решетку типа шпи-
иелей, а =1,072 нм). Температура перехода а«=±р примерно 335 °С,
температура плавления 1050°С.
Индий взаимодействует с галогенами. С хлором и бромом реагиру-
реагирует при комнатной температуре, с иодом — при нагревании Хлорид ин-
дия 1пС13 получают хлорированием металла при незначительном на-
нагреве Это бесцветное легко летучее сильно гигроскопичное соединение.
Плотность 3,450 Мг/м3. При нагреве 1пС13 с индием образуются низшие
хлориды InCl и 1пС12.
Иодид индия 1п13 получают непосредственным сплавлением индия с
соответствующим количеством иода в ампуле или воздействием на ин-
индий раствора иода в бензоле или другом органическом растворителе.
Триодид индия очень гигроскопичен, он растворяется в спирте, эфире,
хлороформе.
Кристаллогидрат фторида иидия InF3-3H3O получается при раство-
растворении оксида или гидроксида индия в плавиковой кислоте. Это белое
кристаллическое вещество малорастворимое в воде. Безводный фторид
индия получается термическим разложением фтороиндата аммония
(NH4bInF6. Он практически нерастворим в воде, но разлагается кис-
кислотами.
Ни с одним из металлов индий не образует непрерывных твердых
растворов. Хорошо растворяются в индии такие металлы, как галлий,
таллий, олово, висмут, кадмий, магний, литий. Ограниченная раство-
растворимость в жидком состоянии наблюдается в "системах индия с алюми.
нием, железом, бериллием.
Скорость коррозии индия (99,9 %) при комнатной температуре:
Раствор
НС1
HNO3
H2SO4
СНзСООН
Концент-
Концентрация, %
1,0
1,0
1,0
1,0
РН
_
—
—
2,1
Потеря
массы
Х10\
кг/(мг-сут)
123
2920
176
130,3
Внешний вид
Блестящая поверхность
То же, видны протрав-
протравленные границы зерен
Блестящая поверхность
Серая, тусклая поверх-
поверхность
180
Продолжение
Раствор
СНзСООН
Лимонная кислота
Щавелевая кислота
Молочная кислота
Na2CO3
NaOH
Концент-
Концентрация, %
5,0
1,0
5,0
1,0
5,0
5,0
5,0
5,0
рн
_
2,15
—
1,45
—
—
—
Потеря
массы
XI»' ,
кг/(м2 • сут)
172,9
21,8
122,2
117,6
98,0
151,5
0,7*
2,5*
Внешний внд
То же
Блестящая поверхность
То же
Очень слабое потускне
ние
Блестящая поверхность
Очень слабое потускне-
потускнение
То же
Светло-серая пленка
* Увеличение массы.
Технологические свойства
Индий отличается хорошей жидкотекучестью, что позволяет получать
из него высококачественные отлнвки, высокой пластичностью, легко
обрабатывается давлением при комнатной температуре, при этом прак-
практически не нагартовывается1. Вследствие высокой вязкости плохо обра-
обрабатывается резанием.
Области применения
Добавка нндия к подшипниковым сплавам повышает их прочность,
твердость, увеличивает коррозионную стойкость, улучшает смачивае-
смачиваемость, что способствует улучшению протнвозадирных свойств подшип-
подшипников для авиационных двигателей.
Индиевая фольга используется в качестве контакта в ультразвуко-
ультразвуковых линиях задержки.
В США для регулирующих стержней ядерных реакторов использу-
используют сплав, содержащий 19 % In, 71 % Ag, 10 % Cd. Сплавы In—Sn—
Bi—Cd н In—Pb—Sn применяют в качестве припоев для соединения
металлов, стекла, керамики. В вакуумной технике применяют припои
из сплава In—Sn, обеспечивающие высокую плотность соединений.
Сплав 75 % Аи, 20 % Ag и 5 % In используют в ювелирном произ-
производстве («зеленое золото»). Индий используют в качестве легирующей
добавки к серебряным сплавам для стоматологических амальгам.
В настоящее время значительную часть индия, особенно высокой
чистоты, применяют в полупроводниковой электронике. Он идет на
производство интерметаллическнх соединений типа AUIBV (InSb, InAs,
InP), используемых в качестве материалов для фотоприемников, ра-
работающих в инфракрасной области. Инднй используется в качестве ле-
легирующей присадки для создания дырочной проводимости в германие-
германиевых кристаллах, а также для крепления к ним свинцовой проволоки.
Индий используют как легирующий элемент в алюминиевых сплавах
для повышения их прочностных свойств и улучшения обрабатывае-
обрабатываемости.
1 Рекристаллизация происходит при комнатной температуре в про-
процессе деформации,
181
3.5. ТАЛЛИЙ [1—35, 51, 53, 55, 146, 147, 163]
Общие сведения и методы получения
Таллий (Т1)—рассеянный элемент, металл. Открыт в 1861 г. англий-
английским ученым У. Круксом при спектроскопическом исследовании шла-
мов сернокислотного производства. Название получил благодаря ха-
характерной зеленой линии спектра от латинского thallus — зеленый
побег. Первым выделил новый элемент, а также установил его металли-
металлический характер и основные свойства К. О. Лями в 1862 г.
Содержание таллия в земной коре 3-10~4% (по массе). Большая
часть таллия находится в виде изоморфной примеси в сульфидных ми-
минералах свинца, цинка, медн, железа и в силикатах, где таллий заме-
замещает калий и рубидий. В сульфидах железа (пириты и марказиты)
содержится 0,1—0,5 % TI.
Собственные минералы таллия практического значения не имеют.
К ним относятся: лорандит TIAsS2 E8,7—59,7% Т1); врбаит
TI(As, SbKS5 B9,2—32% Т1); гутчинсонит P(Cu, Al, TlJAsS8
(-25% TI); крукезит (TI, Cu, AgJSe A6—19% Ti); авицениит
7Tl2CvFe203 (-80% TI).
Исходное сырье для производства таллия — отходы и полупродук-
полупродукты свинцово-цинкового, медеплавильного и сернокислотного производ-
производства, а татсже медно-кадмиевые кекн, получаемые при гидрометаллурги-
гидрометаллургической переработке цинковых огарков. Содержание таллия в этом слу-
случае колеблется от сотых до десятых долей процента, поэтому вначале
получают концентрат таллия. Его выделяют из растворов, образующих-
образующихся при непосредственном выщелачивании указанных выше продуктов
водой или кислотами, или проводят пирометаллургическое обогаще-
обогащение, основанное на летучести соединений Т!2О и T1CI. Продукты пиро-
металлургического обогащения выщелачивают водой или серной кис-
кислотой, а из растворов осаждают таллиевый концентрат в виде хлорида,
нодида, сульфида, хромата, бихромата или гидроксида таллия (в за-
зависимости от принятой технологии производства).
Другой довольно распространенный способ — цементация цинковой
пылью; при этом получают губку, обогащенную таллием, которую за-
затем растворяют в серной кислоте, а из раствора осаждают богатый
таллием концентрат. Еще более полно таллий цементируется амальга-
мой цинка.
В последнее время возросло значение экстракционных, сорбциоииых
и ионообменных способов извлечения и концентрирования таллия.
Дальнейшая очистка концентратов таллня основана на неодинако-
неодинаковой растворимости соединений таллия и сопутствующих ему металлов,
а также различии других физико-химических свойств разделяемых
элементов. Таллий выделяется в виде губки цементацией > на цинковых
листах из слабокислых очищенных растворов. Нагревание и перемеши-
перемешивание ускоряют этот процесс. Цементировать можно не только из раст-
раствора, но и из суспензии Т1С1 в воде или в 1 %-ной H2SO,t.
Таллиевую губку для получения компактного металла промывают,
прессуют и переплавляют при 350 СС под слоем щелочи, канифоли или
масла. Плавка под слоем щелочи позволяет одновременно очищать
металл, так как ряд примесей (цинк, свинец, хром и др.) переходят
в щелочной шлак. Более эффективно щелочное рафинирование идет в
присутствии окислителей (KNO3; NaNO3). Таким образом получают
металл, содержащий 5-10~2— Ю-3 % примесей.
Для получения металла высокой чистоты, в котором количество
примесей менее Ы0~5—Ы0~е%, используют способы электролитичес-
182
кого рафинирования и кристаллиза-
кристаллизационную очистку (зонная плавка);
применяют также амальгамное рафи-
рафинирование, т. е. растворение черново-
чернового таллня в ртути до концентрации
30—40 % и анодное разложение
амальгамы с последовательным уда-
удалением из нее растворенных метал-
металлов.
Слнтки металлического таллия
для защиты от окисления хранят под
прокипяченной дистиллированной во-
водой, слоем парафина или лака.
Соли таллня и другие его соедине-
соединения — токсичные вещества. Предель-
Предельно допустимая концентрация в воз-
воздухе 0,01 мг/м3. По отравляющему
действию таллий сходен со свинцом
и мышьяком.
Плавка таллия и его соединений,
а также все работы с таллийсодер-
жащими материалами должны прово-
проводиться на закрытом оборудовании с
хорошим отсосом воздуха, который
перед выходом в атмосферу должен
быть очищен.
Физические свойства
Атомные характеристики. Атомный
номер таллия 81, атомная масса
204,37 а. е. м. Атомный объем 17,24Х
Х10~6 м3/моль, атомный радиус
0,171 им, нонные радиусы Т1+ н Т13+
соответственно 0,149 и 0,105. Таллий
состоит из двух стабильных изотопов
203Т1B9,5%) и 2°5Т1 G0,5 %); имеет
естественные радиоактивные изотопы
20бТ1> 207Т)_ говт^ 2ioT| c периодами
полураспада 4,19; 4,79; 3,1; 1,32 мии
соответственно. Получено 11 искусст-
искусственных изотопов таллия, из которых
наиболее важный 204Т1 с периодом
полураспада 3,56 года. Потенциалы
ионизации атома / (эВ); 6,106; 20,42;
29,8.
Электронная конфигурация внеш-
внешней электронной оболочки атома
6s26p. Электроотрицательность 1,8.
Работа выхода электронов <р = 3,7эВ.
Прн атмосферном давлении и тем-
температуре ниже 233 °С таллий имеет
гексагональную плотноупакованную
решетку (г. п. у.) с периодами а =
= 0,34496 нм, с-0,55137 им (при
18°С); выше 233°С кристаллическая
н
и
2
S
<
в
о
о
S
о
ш
В"
S
S
х
5 с его
5
S
«
S
a
с
P
имесей
о.
с
со
с;
N
ЬЙ
0.
С
2
d
■а
и
£
мен
ЕС
та
1
0005
о
1
1
о
ю
л
-01
со
-01
со
о
—«
о
(N
ю
9-01
ю
—
ю
999
8?
лООО
н
0001
о
1
Л
О
Ю
ю
-01
ю
ю-
m
1
1 '
—1
■Я
1
о
см
л
1
О
<м
9-01
in
о
—
,999
S
8
н
001
о
о
1
о
Щ
-01
СО
О
со
I
■ '
ю
о
ю
о
—
о
<N
О
in
S
8?
о
ч
н
о
1
1
о
со
1
-01
-
1
1
°|
о
со
8-01
со
8-01
—
"ч
л.
в 2
183
решетка становится объемноцентрированной кубической (о. ц. к.), а =
=0,3871 нм (при 250°С). Энергия кристаллической решетки таллия
182,8 мкДж/кмоль. При высоких давлениях образуется третья модифи-
модификация у, имеющая г. ц. к. решетку.
Тройная точка, отвечающая равновесию фаз а, E и у, лежит при тем-
температуре 115°С и давлении 3,9 ГПа. Эффективное поперечное сечение
захвата тепловых нейтронов 3,4-10~28 м2.
Плотность. Плотность твердого а-Т1 р=11,850 Мг/м3, a р*-Т1
11,540 Мг/м3 (при 517 К).
Плотность р жидкого таллия в зависимости от температуры:
Г, К ... 579,5 603 853
р, Мг/м3 . 11,289 11,250 10,870
Изменение плотности при плавлении таллия равно 3,25 %.
Электрические и магнитные. Удельное электрическое сопротивление р
и удельная электропроводность с таллия в зависимости от температуры:
Г, К ...... 78 273 576 973 1073
р, мкОм-м . . . 0,037 0,15 0,74 0,843 0,877
а, МСм/м .... 27 6,65 1,35 1,19 1,14
Температурный коэффициент электрического сопротивления а—
= 5,177- Ю-3 К-1 при 273 К и 3,98-Ю-3 К -' при 373 К. Изменение
удельного сопротивления при плавлении рж/рТл = 2,06. Абсолютный коэф-
коэффициент т.э.д.с. при 273 К составляет е=+0,4 мкВ/К; постоянная Холла
У? = +0,24-10^10 м3/Кл; температура перехода таллия в сверхпроводящее
состояние Гс=2,39 К. Коэффициент вторичной электронной эмиссии
0Ъах=1,4 при ускоряющем напряжении первичных электронов 0,800 кэВ.
Таллий диамагнитен, магнитная восприимчивость а-TI Х = —0,249-10~9
B93 К) н р-Т1=—0,158- Ю-9 E08 К). Магнитная индукция таллия при
297 К 8=1,7+1,8 Тл.
Тепловые и термодинамические. Температура плавления таллия
7пл = 303°С, температура кипения ^Кип=1457°С, характеристическая
температура таллия 6п = 78,5 К, удельная теплота плавления
Д//пл = 21,101 кДж/кг, удельная теплота испарения А//„сп =
= 795,073 кДж/кг (при 1730 К), удельная теплота сублимации
а-Т1 876,297 кДж/кг, (J-T1 879, 228 кДж/кг (при 298 К), теплота поли-
полиморфного превращения а—»|5 равна 1,6747 кДж/кг. Молярная энтропия
s° в зависимости от температуры:
Г, К 298 500 1000 1500 2000 3000
s°, Дж/(моль-К) 64,267 78,586 107,851 120,244 220,979 230,818
Удельная теплоемкость при 293 К ср=129,79 Дж/(кг-К), среднее ее
значение в интервале 293—503 К составляет 135,652 Дж/(кг-К) (для
а-TI), в интервале 507,4—574 К 146,956 Дж/(кг-К) (для 0-Т1), а в
жидком состоянии 153,655 Дж/(кг-К) E75—773 К). Удельная электрои-
иая теплоемкость СрЛ= [1,47 мДж/(моль-К2)] -Т. Температурный коэф-
коэффициент линейного расширения при 293 К (а-Т1) а=28-10~6 К, при
513-553 К (Р-Т1) а=41,5-10-6 Кг1.
Зависимость давления пара от температуры:
т,
9,
К- •
Па .
1256
1,33-Ю3
1469
1,33-10*
2
1547
,66-10*
5,
1637
32-10*
10
1730
,13-10*
Теплопроводность в твердом состоянии при 293 К А=38,9 Вт/(м-К),
при 363 К Я.=40,1 Вт/(м-К)> а в жидком состоянии прн 623 К Я=
=24,7 Вт/(м-К).
184
Поверхностное натяжение при 600 К <т=401 мН/м. Динамическая
вязкость при температуре плавления Т)=2,64 мПа-с. Энергия активации
самодиффузни для монокристалла а-Т1 в интервале температур 408—
503 К параллельно оси с £=95,88 кДж/моль, а перпендикулярно этой
оси 94,62 кДж/моль, для р-Т! E03—553 К) £=83,74 кДж/моль.
Механические свойства
Механические свойства таллия при 20сС: а„=10 МПа, 6 = 40%, 1|) =
= 100%, ЯВ=20 МПа.
Свойства проволоки диаметром 2 мм из таллия чистотой 99,998 %
в зависимости от температуры:
'нсп1 °С
— 196
— 100
-82
-34
+ 13
V
МПа
33
7
10
13
18
в. %
15
47
45
14
■Ф, %
36
35
39
51
54
Модуль нормальной упругости Е при растяжении в зависимости от
температуры:
t, °С . . . —187 20 100 200
Е, ГПа 9,81 7,95 5,89 7,36
Технологические свойства
Таллий — мягкий ковкий металл, его можно подвергать холодной про-
прокатке на фольгу и прессованию на проволоку, однако при волочении
он рвется из-за низкой своей прочности.
Химические свойства
Нормальный электродный потенциал реакции Т1—е**Т\+, фо=— 0,335 В.
Электрохимический эквивалент таллия равен 0,70601 мг/Кл. От своих
аналогов галлнян индия Т1 сильно отличается по химическим свойствам.
В химических соединениях таллий может проявлять степень окисле-
окисления + 1 и +3; возможно образование соединений, в состав которых он
входит одновременно в двух степенях окисления. Однако соединения,
в которых таллий одновалентен, более устойчивы по сравнению с трех-
трехвалентными, поэтому он имеет большое сходство со щелочными метал-
металлами, образуя аналогичные соединения, в частности хорошо раствори-
растворимые в воде гидроксиды, растворимые нитраты, корбонаты; аналогично
щелочным металлам таллий (при степени окисления +1) входит в сос-
состав квасцов, шенитов, образует полисульфнды, полииоднды. Многие со-
соединения одновалентного таллия, как и щелочных металлов, изоморфны.
В то же время подобно Ag, Си, Аи, Hg, одновалентный таллий дает
малорастворнмые в воде галогениды, сульфиды и др.; при этом галоге-
ниды таллия подобно галогенидам серебра светочувствительны.
Для окисления одновалентных соединений таллия до трехвалентных
используют очень сильные окислители: царскую водку, перманганат ка-
калия, хлор, бром н др. Соединения трехвалентного таллня легко восста-
восстанавливаются в кислых растворах сероводородом, сульфатами и другими
восстановителями,
185
На воздухе металлический таллий быстро темнеет и покрывается
черной пленкой оксида Т12О, которая замедляет процесс дальнейшего
окисления.
Таллий хорошо растворяется в азотной, серной, хлорной кислотах с
образованием солей. В соляной кислоте таллий растворяется с трудом,
так как образуется пленка малорастворимого хлорида таллия. С щело-
щелочами металлический таллий ие вступает в реакцию. Вода, не содержа-
содержащая растворенного кислорода, на него ие действует; в присутствии кис-
кислорода таллий постепенно растворяется в воде с образованием гидрок-
сида (ТЮН).
С водородом таллнй реагирует только при определенных условиях
(в дуге постоянного тока между Си — анодом и Т1 — катодом при
давлении водорода, равном ~0,4 МПа) с образованием нестойкого
гидрида TIH.
Таллий легко вступает в реакцию с галогенами.
Хлорид Т1С1 — белый кристаллический порошок, имеет од.к. решетку
или г. ц. к. решетку типа NaCl, температура плавления 450 °С, плотность
7,000 Мг/м3.
Бромид TIBr — светло-желтый порошок с о. ц. к. или г. ц. к. решет-
решеткой, плотность 7,500 Мг/м3, температура плавления 460 °С.
Иодид ТП — ярко-желтый кристаллический порошок, ниже 174 °С
имеет ромбическую решетку и плотность 7,290 Мг/м3, а выше этой тем-
температуры— о. ц. к. решетку и плотность 7,450 Мг/м3, температура плав-
плавления ТП равна 440 "С.
Фторнд T1F — бесцветные кристаллы, плотность 8,360 Мг/м3, темпе-
температура плавления 327 СС, в отличие от других галогенндов хорошо раст-
растворим в воде.
Легко взаимодействуя с кислородом, таллий образует два оксида:
Т12О и Т12О3. При температурах выше 100 °С Т12О3 заметно диссоцииру-
диссоциирует Т12О3—-Т12О + О2.
Оксид (I) Т12О — черный гигроскопичный порошок, плотность
10,400 Мг/м3, температура плавления 580 °С, температура кипения
~И00°С. Оксид (III) Т12О3 — темно-коричневый кристаллический по-
порошок с кубической о.ц.к. решеткой, плотность 10,200 Мг/м3, темпера-
температура плавления 770 °С, но уже при 500 °С диссоциирует до закиси.
Гидроксид ТЮН — желтое кристаллическое вещество, плотность
7,440 Мг/м3. Плавится инконгруэнтно при 125°С. Хорошо растворяется
в воде и проявляет сильные щелочные свойства.
При нагревании таллий реагирует с серой и фосфором, образуя
T!2S и Т13Р.
В твердом таллии значительной растворимостью обладают металлы
In, Cd, Sn, Hg, Pb, Sb, Bi, Li, Na, Mg, Ca, в жидком — ограниченной
растворимостью А1, Ga, Cu, Zn. Переходные тугоплавкие металлы IV,
V и VI групп вообще ие растворяются в жидком таллии.
Области применения
Примерно 75 % таллия используется в электронике, электротехнике и
инфракрасной технике, 7% — в сельском хозяйстве, 3%—в формако-
логни, в остальных областях 15 %.
Бромид или иодид таллия применяют в сцннтилляционных счетчиках
для E- и у-излученнй как активатор щелочногалогенных кристаллофос-
форов.
Монокристаллы твердого раствора бромида и иодида таллия, харак-
характеризующиеся широкой областью пропускания инфракрасного излучения,
применяют для изготовления линз, призм н кювет оптических приборов,
работающих в инфракрасной области спектра.
186
Сульфид и оксисульфид таллия используют для изготовления фото-
фотоэлементов, чувствительных к воздействию инфракрасного излучения и
широко применяемых в авиации.
Карбонат таллия вводят в шихту прн производстве стекла с высоко
преломляющей способностью.
Водный раствор смеси таллневых солей, муравьиной и малоновой
кислот — жидкость Клеричи используют в минералогических исследова-
исследованиях, так как оиа отличается наиболее высокой плотностью по сравне-
сравнению с другими тяжелыми жидкостями и большой подвижностью.
Соли таллия можно использовать как катализаторы в органическом
синтезе, а также как антидетонаторы топлива в двигателях внутреннего
сгорания.
Таллий высокой чистоты используют для синтеза полупроводниковых
соединений типа TiAsJf2 (где X—Se, Те, S), необходимых для производ-
производства транзисторов, изоляционных покрытий; в газоразрядных лампах мо-
монохроматического излучения (зеленый цвет), служащих для градуиров-
кн спектральных приборов, контроля пленки, фотонегативов и т. д.
Радиоактивный изотоп 204Т1 применяют в качестве источника (}-из-
лучення в приборах для контроля толщины изделий и покрытий.
Ранее таллий широко применяли для приготовления ядов, предназ-
предназначенных для борьбы с грызунами, в настоящее время применение та-
таких ядов сократилось.
Введение таллия в подшипниковые сплавы придает им высокие ан-
антифрикционные свойства, а легирование этим элементом свинцовых спла"
вов значительно повышает их коррозионную стойкость. Амальгама тал-
таллия (8,35 °/о) обладает самой низкой из всех известковых двойных спла-
сплавов температурой затвердевания (—59 °С), которую можно еще пони-
понизить, добавляя индий. Ее применяют в низкотемпературных термометрах
и других приборах.
3.6. СКАНДИЙ [1—35, 43, 46, 51, 148—150]
Общие сведения и методы получения
Скандий (Sc) — редкоземельный металл серебристого цвета с желтым
отливом. Был предсказан в 1870 г. Д. И. Менделеевым, который условно
называл его экабором. В 1879 г. скандий был выделен из минерала га-
долинита шведским ученым Ларсом Нильсоном, который и дал ему
название в честь Скандинавии.
Содержание скандия в земной коре 6• 10—4 % (по массе). В незна-
незначительных количествах (менее 0,5 %) скандий содержится во многих
минералах (вольфрамитах, касситеритах, урановых рудах, бокситах и
др). Из собственных минералов скандия известны тортвейтнт
Sc2Si2O7, содержащий 30—40% Sc2O3, и стереттит Sc(PO4) -2H2O. Эти
минералы встречаются крайне редко и промышленных месторождений
не образуют.
Металлический скандий впервые получен в 1937 г. электролизом хло-
хлорида скандия в расплавленной солевой ванне, но продукт содержал
50 % примесей, главным образом железо и кремний. В настоящее время
скандий получают по нескольким технологическим схемам. Металл в ви-
виде оксидов извлекают попутно прн гидро- и пирометаллургической пере-
переработке вольфрамовых, оловянных, титановых, урановых руд и бокси-
бокситов. Оксиды скандия хлорируют или фторируют при 700—800 СС,
получая соответственно хлориды (ScCi3) и фторнды (ScFs) скандия.
Металлический компактный скандий извлекают прямым восстановле-
восстановлением его хлоридов или фторидов металлическим кальцием: 2ScF3+3Ca->-
187
—"■3CaF2 + 2Sc и последующей дистилляцией (возгонкой) в высоком ва-
вакууме A0-3—Ю-4 Па) при температурах 1600—1700 °С. Таким образом
получают металл чистотой >99,5 %•
Физические свойства
Атомные характеристики. Атомный номер 21, атомная масса 44,96 а.е.м.
Атомный объем 15-10~6 м3/моль, атомный радиус 0,164 нм, ионный ра-
радиус Sc3+ 0,083 им. Скандий состоит из одного устойчивого изотопа
45Sc. Известно 10 искусственных радиоактивных изотопов скандия:
Массовое
число
40
41
43
Период
полураспада
0,22 С
0,87 С
14 000 о
Массовое
число
44
44
46
46
Период
полураспада
2,44 сут
14 000 с
19,5 с
84 сут
Массовое
число
47
48
49
Период
полураспада
3,47 сут
1,83 сут
3420 с
Важнейший из этих изотопов 46Sc с периодом полураспада 84 сут,
применяющийся как радиоактивный индикатор.
Скандий существует в двух кристаллических модификациях: а и р.
При комнатной температуре устойчива а-модификация, имеющая гекса-
гексагональную решетку с периодами а = 0,33080 и с=0,52653 нм, с/а =1,593,
выше 1334—1350 °С устойчива ^-модификация с о.цлс. решеткой с пе-
периодом а=0,4541 нм. Энергия кристаллической решетки 390 мкДж/кмоль.
Скандий первый переходный элемент с одним Зй-электроном; электрон-
электронная конфигурация внешней электронной оболочки 3d4s2. Потенциалы
ионизации атома / (эВ): 6,56; 12,89; 24,75. Электроотрицательноегь 1,3.
Эффективное поперечное сечение захвата тепловых нейтронов 24 ■ 10~28 м2.
Работа выхода электрода ф = 3,3 эВ.
Плотность скандия (а-модифнкации) при 298 К составляет р=
=3,020 Мг/м3.
Электрические и магнитные. Удельное электрическое сопротивление
р и удельная электрическая проводимость скандия чистотой 99,96 %:
Т, К ■ • • •
р, мкОм-м.
а, МСм/м .
23 293
0,11 0,64
9,1 1,57
473
1,15
0,87
873
1,70
0,587
1273
2,10
0,476
Температурный коэффициент электросопротивления в интервале
298—373 К а=2,463-10-3 К (для скандия чистотой 99%), а в интер-
интервале 273—473 К а=4,25-10-3 К (чистота 99,9%). Абсолютный коэф-
коэффициент т.э.д.с. в твердом состоянии при 273 К равен е=—3,6 мкВ/К.
Постоянная Холла при 4,2 К #=— 0,3- Ю-10 м3/Кл, а при 293 К
—0,67- Ю-10 м3/Кл (чистота 99,999%).
Скандий — слабый парамагнетик, его магнитная восприимчивость
(а-модификацня) х=0,177-10-9 при 298 К и 0,236-10~9 при 273 К.
Коэффициент вторичной электронной эмиссии о*тах=0,83 при ускоря-
ускоряющем напряжении первичных электронов 0,2—0,25 кэВ.
Тепловые и термодинамические Температура плавления £Пл=1530°С,
температура кипения £Кип «2700 °С, Характеристическая температура
188
6D=231 К. Выше 1600 °С скандий летуч. Давление пара р в зависи-
зависимости от температуры:
Т, К • . . 1500 1600 1700 1800 Гпл
р, Па ... 0,06665 0,4173 2,107 8,924 22,79
Удельная теплота плавления ДЯПл=358,5 кДж/кг, удельная теплота
испарения ДЯЯсп=7319,39 кДж/кг A903 К), удельная теплота сублима-
тии ДЯСубл=8427,49 кДж/кг B98 К) и 7356,54 кДж/кг (прн 1793 К).
Удельная теплоемкость при 298 К ср = 559, 65 Дж/(кг-К). Темпера-
Температурный коэффициент линейного расширения а= 11,4-10~в К (при
673 К).
Молярная энтропия s' и приведенный термодинамический потенциал
Фт в зависимости от температуры:
Т, К 298 500 1000
s°, Дж/(моль-К) . . 37,68 50,91 68,66
, Д()
Фт, Дж/(моль-К)
37,68 40,60 50,95
2000 2500
Ю0,56 108,6
67,66 75,04
1500
81,6
59,28
3000
224,45
90,42
Т, К
s°, Дж/(моль-К) •
Фг. Дж/(моль-К).
Теплопроводность при 291 К А.= 15,5 Вт/(м-К).
Поверхностное натяжение прн 1673 К о = 800 мН/м.
Энергия дефекта упаковки 12 мДж/м2.
Механические свойства
Механические свойства литого скаидня в зависимости от температуры
Испытания:
"С
20
426
870
ств'
МПа
310
226
12
V
МПа
240
176
—
6,
4,
0,
%
0
5
ч-.
7,
1,
%
6
7
Механические свойства отожженного скандия в зависимости от:
исп- *-
—92
89
Z70
Од, МПа
280
400
320
б. %
4
10
13
ч>, %
4
2
7
t "С
452
633
814
<гв, МПа
230
170
90
6, %
5
25
Ф. %
9
20
40
Твердость по Бринеллю поликристаллического скандия чистотой
99 % ЯВ=750-5-1000 МПа, а чистотой 96—98 % 1200—1300 МПа, микро-
микротвердость Нц=750±50 МПа. Временное сопротивление при сжатии
а£ж=1000 МПа. Модуль нормальной упругости при растяжении отож-
жеииого скандия чистотой 99,1 % £=77,0 ГПа (при 23 °С), модуль сдви-
сдвига G=31,9 ГПа.
Химические свойства
Нормальный электродный потенциал реакции Sc—3esiSc3+, <po=
Электрохимический эквивалент 0,15579 мг/Кл.
-2,0 В.
189
Скандий — химически активный элемент, особенно при повышенных
температурах. На воздухе при комнатной температуре покрывается плен-
пленкой оксида (III) толщиной 15—60 им. Обычно в соединениях проявляет
степень окисления +3, однако при определенных условиях могут быть
получены соединения со степенью окисления +2.
С кислородом скандий реагирует уже при 200 °С, реакция протекает
значительно быстрее в присутствии паров Н2О, причем образуется оксид
(HI) Sc2O3, представляющий собой бесцветное кристаллическое туго-
тугоплавкое (<пл=2300°С) вещество.
С водородом скандий реагирует прн 450 "С, образуя гидрид ScH2,
имеющий кубическую решетку.
Реакция с азотом начинается выше 600 °С и наиболее активно проте-
протекает при 800 "С, завершаясь образованием нитрида ScN, предоставляю-
предоставляющего собой тугоплавкое (^Пл=2550°С) соединение с металлическими
свойствами.
С углеродом, бором и кремнием скандий образует тугоплавкие сое-
соединения выше 1000 "С [с бором — бориды ScB2, ScB4> ScBI2, с углеро-
углеродом—карбиды ScC (^л = 1900 °С), с кремнием — силициды SC5S13,
ScsSis, ScSi2].
Взаимодействуя с серой, теллуром, селеном при температурах около
1000 °С, скандий дает соединения типа Sc2X3— халькогеннды. С водой
металлический скандий не реагирует даже при 100 °С.
Скандий легко растворяется в кислотах (соляной, серной, азотной),
при этом с понижением концентрации скорость растворения металла в
них сильно снижается. К воздействию щелочей металл устойчив.
Диаграммы состояния построены для небольшего числа систем скан-
скандия. У этого элемента довольно отчетливо выражено сходство с магни-
магнием, а также титаном н цирконием.
Технологические свойства
Скандий — мягкий металл. В чистом состоянии н бескислородной среде
легко поддается ковке, прокатке, штамповке. Возможна также сварка
металла.
Области применения
Применение скандия ограничено. Оксид скандия идет на изготовление
ферритов для элементов памяти быстродействующих вычислительных
машин. Радиоактивный изотоп скандия 46Sc используется в нейтронно-
активационном анализе и в медицине. Разработаны перспективные
сплавы скандия: жаропрочные деформируемые сплавы системы
Mg— Sc—Y—Mg—Mn, конструкционные сплавы Sc—Си—Al, Sc—Ti
и др.1
Оксид скандия применяют для получения специальных стекол, гла-
глазурей, керамических изделий, в производстве ферритов с малой индук-
индукцией и др. У некоторых металлических соединений скандия (в частности,
у Scln) обнаружены ферромагнитные свойства. Халькогениды скандия
нашли применение в радиотехнике и радиоэлектронике как материалы
для изготовления оксидных катодов, терыисторов и т. п. Некоторые со-
соединения скандия входят в состав смешанных катализаторов разложения
i ■
1 Имеются данные о положительном влиянии малых добавок скан-
для (до 0,5 %) на механические и коррозионные свойства алюминиевых
С иЫВОВ.
190
хлористого водорода, некоторых кристаллофосфоров и люминофоров.
Возможно применение скандия и его сплавов в качестве геттеров, а так-
также в атомной энергетике.
3.7. ИТТРИЙ [1—35, 51, 151, 153]
Общие сведения и методы получения
Иттрий (Y) — редкоземельный металл светло-серого цвета. Свое назва-
название получил от шведского селения Иттербю. Открыт в 1794 г. финским
химиком И. Гадолином. Металлический иирий получен в 1828 г. немец-
немецким химиком Ф. Велером.
Содержание иттрия в земной коре около 2,8-10—3 % (по массе).
Иттрий присутствует во многих минералах, содержащих редкоземельные
элементы: лопарите, монаците, иттропаризите, эвксените, ксенотиме и др.
В иттропаризите, эвксените и ксенотиме содержится до 50 % Y и более.
Для отделения основной массы иттрия от других элементов лучшим
способом считается его отделение на ионообменных колоннах в процессе
разделения РЗМ иттриевой подгруппы.
Для получения иттрия высокой чистоты применяют метод металло-
термического восстановления его фторида с использованием в качестве
восстановителя стружки кальция. Затем путем переплавки в вакууме и
дистилляции получается иттрий чистотой 99,8—99 %• Для повышения
чистоты его подвергают дву- и трехкратной дистилляции.
Марки и химический состав, %, металлического иттрия:
Марка
УМ-0
УМ-1
УМ-2
УМ-3
УМ-4
У.
ие менее
99,76
98,74
98,01
96,16
93,8
Примеси, ие более
Gd, Tb,
Dy, Но
0,1
0,8
1,3
2,8
4,8
Fe
ыо-2
3-10-2
4-Ю-2
4-10—2
ЫО-1
Са
3- Ю-2
3-10—2
5-Ю-2
2-10-1
5-10-1
Си
5-Ю-2
l-10-i
ЫО-1
1 • 10-1
1 ■ 10-1
Мо или Та
5-Ю-2
3-10-1
5-10-1
7-10-*
7-10-»'
Иттрий поставляют в виде слитков, стержней диаметром 5—25 мм
и длиной до 150 мм, проката и других полуфабрикатов.
Физические свойства
Атомные характеристики. Атомный номер 39, атомная масса 88,905 а.е.м,
атомный объем 19,886-10~6 м3/моль, атомный радиус 0,181 нм, ионный
радиус Y+3 0,097 нм. Конфигурация внешних электронных оболочек ато-
атома 4d'5s2.
Природный иттрий состоит из одного устойчивого изотопа 89Y. Из-
Известно 18 искусственных радиоактивных изотопов, важнейшими из ко-
которых являются 90Y и 91Y, образующегося при делении урана и тория.
Ниже приведены периоды их полураспада:
191
Массовое
число
82
83
84
85
86
87 т*
Период
полураспада
4315 с
12 600 с
13 300 с
0,208 сут
0,625 сут
0,584 сут
Массовое
число
87
88 т*
88
89 т*
90 т*
91 т*
Период
полураспада
3,33 сут
3,7-10-* с
105 сут
14 с
2,68 с
3000 с
Массовое
ЧИСЛО
91
92
93
94
95
97
Период
полураспада
57 сут
13 000 с
0,416 сут
989 с
630 с
Короткий
- метастабильное состояние ядра.
Потенциалы ионизации / (эВ): 6,38; 12,23; 20,5. Электроотрицатель-
Электроотрицательность 1,2.
Иттрий существует в двух модификациях: а и |3. При комнатной
температуре устойчива а-модификация, имеющая гексагональную ре-
решетку с периодами а = 0,36474 нм и с=0,57306 им, с/а= 1,571. Выше
1475—1490 °С устойчива ^-модификация, имеющая о.ц.к. решетку с пе-
периодом а = 0,408 нм. Энергия кристаллической решетки 432 мкДж/кмоль.
Эффективное поперечное сечение захвата тепловых нейтронов
1,3 • 10~28 м2. Работа выхода электрона <р=3,3 эВ.
Плотность иттрия р=4,472 Мг/м3.
Электрические и магнитные. Удельное электрическое сопротив-
сопротивление р н удельная электрическая проводимость иттрия о1 чистотой
99,8 % в зависимости от температуры:
20
0,05
20
173
0,37
2,7
293
0,65
1,54
373
0,835
—
673
1,335
—
973
1,695
—
1273
1,906
—
г, к ...
р, мкОм-м.
а, МСм/м .
Электросопротивление иттрия может изменяться в зависимости от
ориентации зерен. По данным Е. М. Савицкого, электросопротивление
дистиллированного иттрия чистотой 99,8 % ПРИ 298 и 373 К после де-
деформации равно 0,45 и 0,504 мкОм-м соответственно, а после отжига
при 1273 К 0,51 и 0,60 мкОм-м соответственно.
Температурный коэффициент электрического сопротивления иттрия
чистотой 99,8% а = 3,6-10-3 К (при 273 К). Абсолютный коэффици-
коэффициент т.э.д.с. при 273 К е=+2,2 мкВ/К. Постоянная Холла иттрия чисто-
чистотой 99,9% при комнатной температуре R-—1,25- Ю-10, прн 100 К
#=—1,4-Ю-10, при 0 КЯ=—1,2-1О1Ом3/Кл.
Иттрий парамагнитен, его магнитная восприимчивость при 298 К
Х=+2,15-10~9. Магнитная индукция иттрия (99,2%) при 293 К
В = 0,56 Тл. В обычных условиях иттрий не обладает сверхпроводи-
сверхпроводимостью вплоть до температур Гс=0,08-н0,1 К, а при давлении 12,0—
17,0 ГПа температура перехода в сверхпроводящее состояние равна
~1,2—2,7 К. Коэффициент вторичной электронной эмиссии сттах=0,93
при ускоряющем напряжении первичных электронов 0,35 кэВ.
Тепловые и термодинамические. Температура плавления ^пл=1520°С,
температура кипения /„„„=3337 "С. Характеристическая температура, оп-
определенная по теплоемкости, 0d = 235 К, а по электросопротивлению
192 К- Удельная теплота плавления при 298 К ДЯПЛ= 193,08 кДж/кг,
удельная теплота испарения ДЯИСп = 4420 кДж/кг, удельная теплота
сублимации ДЯОуб=4756 кДж/кг.
192
Давление паров р в зависимости от температуры!
Г, К • • • 1700 1800 1900 210
р, Па. . . 60,27- Ю-3 28,616-10—2 11,56-Ю-1 12,54
Температурный коэффициент линейного расширения а в зависимости
от температуры:
г, к ....
а. 10'', К-1 •
298-573
7,6
298-873
9,3
298—1173
9,9
298—1273
10,1
Теплопроводность К иттрия (99,7 %) в зависимости от температуры!
Г, К
К, Вт/(м-К). • •
291 373 473 657 1145
15,8 15,5 17,5 20,5 16,0
Температуропроводность а иттрия чистотой 99,7 % в зависимости от
температуры:
т, к.
а-106 ы
Удельная
Г, к
273
298
323
373
2/с - .
теплоемкость
ср.
Дж/(кг • К)
283,03
306,01
309,39
317,87
323 373 473
9,3 8,0 6,5
ср в зависимости от температуры
Т. К
473
673
773
ср.
ДжДкг • к)
322,10
339,07
351,3
Г, К
973
1073
1273
673
5,3
ДжДкг • К)
402,17
439,37
528,38
Удельная электронная теплоемкость СрЛ= [8,5 мДж/(моль-К2)] -Т.
Поверхностное натяжение ст=900 мН/м при 1773 К-
Энергия дефекта упаковки 100 мДж/м2.
Энергия активации самодиффузии Е монокристалла параллельно оси
с 256 кДж/моль, перпендикулярно ей 276,2 кДж/моль. Предэкспоненци-
альпый множитель параллельно оси с £>0=0,82-10~4 м2/с, перпендику-
перпендикулярно оси с £>о = 5,2-10~4 м2/с
Молярная энтропия игтрия s° и приведенный термодинамический по-
тенимал Фг в зависимости от температуры;
Т, К 298 500 1000 1500 2000 2500 3000
Дж/(моль-К). • • • 4605 59,24 77,91 89,72 108,60 116,06 122,17
Фг, Дж/(моль-Ю
46,05 48,98 59,24 67,58 75,42 82,83 88,91
Механические свойства
Временное сопротивление при растяжении ств« 160 МПа, предел теку-
текучести при растяжении сто,г=68,7-н 144,2 МПа, относительное удлинение
около 1Q %• Временное сопротивление при сжатии ОдЖ = 804 МПа. Вли-
Влияние температуры на свойства иттрия чистотой 97,4 %:
193
t, °C 90 260 450 610
ав, МПа 310 270 210 90
б, % 3 2 7 13
г|>, % 7 25 35 70
Механические свойства (при растяжении) в зависимости от темпера-
температуры состояния материала:
Состояьие материала
Литой
Кованый
(Я =50%)
Комиатчая
205
Комнатная
205
425
176—225
130
379—376
164—226
152—180
ов. МПа
249—316
134
457—464
383-431
260—228
Твердость литого иттрия чистотой 99,8 % при температуре 20 °С
НВ 350 МПа. Твердость по Бринеллю дистиллированного пттрня дости-
достигает НВ 400—500 МПа, микротвердость Н ^ 1080—1130 МПа. Модуль
нормальной упругости Е в зависимости от температуры:
t, °С ...
Е, ГПа . .
-269
68,9
— 198
68,4
—73
65,7
27
63,3
127
61,5
Предел выносливости па базе 103 циклов ал=98,1 МПа.
Скорость установившейся ползучести иттрия при 525 °С и напряже-
напряжении 6,9 МПа е = 3,8- Ю-5 %/с, при напряжении 2,7 МПа 1,4- Ю-7 %/с.
Модуль сдвига при комнатной температуре G = 26,71 ГПа. Коэффи-
Коэффициент Пуассона v = 0,258. Сжимаемость х = 2,13-10~" Па.
Химические свойства
Нормальный электродный потенциал реакции Y—3e*tY3+, фо=—2,1 В.
Электрохимический эквивалент 0,30715 мг/Кл.
В соединениях проявляет степень окисления +3. В атмосфере возду-
воздуха при нормальных условиях иттрий весьма устойчив: он лишь слегка
тускнеет, но не теряет металлического блеска. При 370—425 "С на по-
поверхности иттрия образуется черная и плотная пленка оксидов: интен-
интенсивно*1 окисление начинается выше 760 "С.
Компактный иттрий медленно окисляется в кипящей воде, легко раст-
растворяется в серной, соляной и азотной кислотах, медленно — в уксусной
н почти инертен к плавиковой кислоте. В щелочных средах A н. раство-
растворы NaOH и NH4OH) при 30 °С иттрий не корродирует. Скорость корро-
коррозии иттрия в хлоридных и нитратных водных растворах снижается с
повышением рН среды. Наличие в растворах нитрат-ионов NOJfn осо-
особенно хлорид-ионов С1- сильно снижает коррозионную стойкость иттрия.
Иттрий легко взаимодействует с галогенами.
С водородом иттрий образует в интервале 314—1540"С устойчивые
металлические гидриды различного состава. При 760 °С иттрий взаи-
взаимодействует с азотом, образуя YN.
С кислородом иттрий дает оксид Y2O3, имеющий кубическую решетку
с периодом а= 1,061 нм, плотность 5,850 Мг/м3, температуру плавления
194
2415 "С, температуру кипения 4300 "С. Оксид иттрия практический не-
нерастворим в воде, отличается слабоосновными свойствами.
С металлами I, II и V главных подгрупп Периодической системы, а
также с хромом и ураном иттрий не смешивается в жидком состоянии;
с титаном, цирконием, гафнием, молибденом и вольфрамом образует
эвтектики; с редкоземельными металлами, скандием и торием — непре-
непрерывные ряды или широкие области твердых растворов; с остальными
элементами — сложные системы с наличием химических соединений.
Технологические свойства
Иттрий — металл достаточно пластичный. Поддается обработке давле-
давлением в горячем и холодном состояниях. Однако деформируемость его
зависит от степени чистоты. Так, в холодном состоянии недостаточно
чистый иттрий можно прокатать со степенью обжатия не более 10—
15 % за одни проход. Путем холодной прокатки с небольшими обжати-
обжатиями и промежуточными отжигами можно получить из иттрия ленту и
фольгу толщиной 0,5—0,05 ми. Горячая прокатка, а также горячая ков-
ковка и прессование легко осуществляются при 800—850 °С. Однако выше
760 °С происходит интенсивное окисление иттрия, поэтому обработку
его давлением при высоких температурах следует проводить, принимая
специальные меры против окисления и газонасыщения (вакуум, защит-
защитные оболочки, нейтральная атмосфера и др.).
Температура конца рекристаллизации технического иттрия 600"С, а
дистиллированного 450—500 °С.
Иттрий легко обрабатывается резанием (обточка, фрезерование,
сверление и др.), однако во избежание его возгорания скорости резания
необходимо поддерживать минимальными, а также применять постоян-
постоянное охлаждение эмульсией или маслом.
Иттрий легко сваривается дуговой сваркой с неплавящимся воль-
вольфрамовым электродом в атмосфере инертного газа. При сварке иттрия
с другими металлами оптимальные результаты достигаются при приме-
применении присадочного материала (например, хрома для улучшения диффу-
диффузии). Металлический иттрий, содержащий 0,1—0,3 % кислорода, отли-
отличается склонностью к растрескиванию в процессе сварки.
Области применения
В качестве осночы сплавов иттрий применяют редко, но широко исполь-
используют для легирования и модифицирования.
В настоящее время наиболее широкие области применения иттрия,
его соединений, сплавов и лигатур в промышленности следующие:
производство легированной стали; модифицирование чугуна; производст-
производство сплавов на основе никеля, хрома, молибдена и других металлов — для
повышения жаростойкости и жаропрочности; выплавка ванадия, тантала,
вольфрама и молибдена и сплавов на их основе — для увеличения плас-
пластичности; производство медных, титановых, алюминиевых и магниевых
сплавов; атомная энергетика; электроника — в качестве катодных ма-
материалов (оксиды иттрия), а также для поглощения газов в электрова-
электровакуумных приборах; изготонление квантовых генераторов — лазеров; про-
производство тугоплавких и огнеупорных материалов; химия — в качестве
катализаторов; производство стекла и керамики. Рафинирование метал-
металлов и сплавов от примесей (кислород, азот, водород и углерод), вызы-
вызывающих хрупкость сплавов, что особенно важно для тугоплавких хлад-
хладноломких металлов с объемноцентрированной кубической решеткой, а
также примесей, вызывающих хладноломкость (сера, фосфор, мышьяк в
195
стали, хромоникелевых и никелевых сплавах; свинец и висмут в медных
сплавах).
Имеются сведения об использовании изотопа 90Y в медицине.
4. ЭЛЕМЕНТЫ
ЧЕТВЕРТОЙ ГРУППЫ
4.1. УГЛЕРОД [1—35, 154, 155]
Общие сведения и методы получения
Углерод (С) —неметалл. Название происходит от слова уголь В при-
природе находится как в свободном состоянии, так н в виде многочислен-
многочисленных соединений. В качестве продуктов разложения древних формаций
существуют угли, главной составной частью которых является углерод.
Нефть, озокерит (горный воск) и асфальт также являются углерод-
углеродными соединениями, которые, очевидно, возникли при разложении древ-
древних организмов,
Углерод является главной составной частью животного и раститель-
растительного мира.
Содержание углерода в земной коре 0,14 % (по массе). В минера-
минералах углерод содержится в основном в форме карбонатов, производных
угольной кислоты.
Несмотря на большое многообразие твердых конденсированных сис-
систем углерода (угли, кокс, сажа, графит, алмаз и др), он имеет две
кристаллические модификации: гексагональную (равновесную) в виде
графита и кубическую (метастабильную) в виде алмаза. Углерод, по-
полученный при термическом разложении его соединений, имеет плотную
черную окраску. Ранее черный углерод считали особой аморфной мо-
модификаций элемента. Согласно последним данным, тонкая структура
бтой модификации отвечает графиту.
Графит образует довольно обширные месторождения. Хорошо сфор-
сформированные кристаллы графита встречаются редко. Графит гибок, мягок,
обладает слабым металлическим блеском, отличается маркостью. При-
Природный графит часто загрязнен другими элементами (до 20 %), поэтому
для нужд современной техники и прежде всего атомной энергетики ис-
используют искусственный графит высокой чистоты. Для производства
искуственного графита используют в основном нефтяной кокс как на-
наполнитель и каменноугольный пек как связующее. В качестве добавок
к наполнителю применяют природный графит и сажу. Иногда в качест-
качестве связующего используют некоторые синтетические смолы, например
фурановые или фенольные. Производство искусственного графита сос-
состоит из ряда механических операций (дробления, размола, рассева кокса
по фракциям, смешения кокса со связующими, формовки заготовок) и
термических отжигов при разной температуре и длительности. Графити-
зация — окончательная термическая обработка, превращающая углерод-
углеродный материал в графит, проводится при 3000—3100°С.
Углерод в форме алмаза представляет собой очень твердые, абсо-
абсолютно прозрачные (в чистом виде) кристаллы, сильно преломляющие
свет. Естественные грани алмаза часто являются гранями правильных
октаэдров; однако встречаются и другие формы кубической системы
среди ннх тетраэдр, что указывает на то, что алмаз принадлежит к тет-
раэдрической гемнэдрии кубической системы.
196
В природе алмазы встречаются главным образом в россыпях, т. е. в
наносных породах. В ряде мест алмазы обнаружены в оливинах вулка-
вулканического происхождения, в так называемых кимберлитовых трубках.
В послевоенный период налажено промышленное получение искусст-
искусственных алмазов как необходимого сырья для изготовления различных
паст и режущего инструмента.
Физические свойства
Атомные характеристики. Атомный номер углерода 6, атомная масса
12,01115 а.е.м, атомный объем 3,42-Ю-6 м3/моль. Атомный радиус ко-
валентный равен 0,077 нм; ионный радиус С4+ 0,02 нм. Конфигурация
внешних электронных оболочек атома углерода 2s22p2. Углерод состоит
из двух стабильных изотопов |2С и |3С, содержание которых соответст-
соответственно равно 98,892 и 1,108 %. Известны радиоактивные изотопы с мас-
массовыми числами 10, 11, 14, 15, период полураспада которых соответст-
соответственно составляет 19,1 с, 1224 с, 5567 лет, 2,4 с.
Аллотропические модификации — графит и алмаз. Графит имеет
гексагональную кубическую решетку, периоды который при комнатной
температуре: а=0,2456 нм, с=0,6696 нм. Алмаз имеет кубическую ре-
решетку с периодом а = 0,356679 нм. Потенциалы ионизации атома угле-
углерода / (зВ): 11,264; 24,376; 47,86. Электроотрицательность 2,5. Работа
выхода электронов <р=4,7 эВ. Эффективное поперечное сечение захвата
тепловых нейтронов 0,0034-10~28 м2.
Плотность. При комнатной температуре рентгеновская плотность гра-
графита 2,666 Мг/м3, пикнометрическая плотность 2,253 Мг/м3; при тех же
условиях рентгеновская плотность алмаза 3,515 Мг/м3, а пикнометриче-
пикнометрическая 3,514 Мг/м3.
Электрические и магнитные. Удельная электрическая проводимость
сг графита в зависимости от температуры:
Т, К 293 873 2773
о, МСм/м • • 0,077 0,104 0,067
Удельная электрическая проводимость алмаза при 293 К составляет
1,0 пСм/м
Удельное электрическое сопротивление графита' в зависимости от тем-
температуры:
Г, К 293 873 2773
р, мкОм-м • . 13,00 9,60 15,00
Температурный коэффициент электрического сопротивления графита
при 273 К и=0,4- 10~3К~'. При тех же условиях этот коэффициент для
алмаза @,2—0,8) ■ 10-3К-'.
В термопаре графит — платина при температуре горячего спая
373,16 К развивается т. э. д. с. £ = 0,7 мВ. Абсолютный коэффициент
т. э. д. с. е- + 11,06 мкВ/К.
Максимальное значение коэффициента вторичной электронной эмис-
эмиссии графита (Jmax=l,0 при ускоряющем напряжении первичных элект-
электронов 0,3 кэВ.
Постоянная Холла графита при комнатной температуре /? =
= —487-10-'° М3/Кл; при 365 К # = —441 • 100 М3/Кл. Магнитная вос-
восприимчивость графита (активированного) при 293 К х = —1,22-10—9.
Магнитная восприимчивость алмаза при 293 К 1=—0,492~ч.
Тепловые и термодинамические. Температура плавления графита
<пл= ( — 4000 °С), температура кипения tlu,n-= —4200 °С, характеристиче-
характеристическая температура вдоль оси х 9в = 2280 К, а вдоль оси г 9в = 760 К-
197
Характеристическая температура алмаза 6в=1860 К. Теплота сублима-
сублимации графита АЯСубл = 59700 кДж/кг. Энергия атомизации графита при
0 К Я°т=59 МДж/кг, а при 298 К Яат = 59,6 МДж/кг. Теплота атоми-
зации двухатомной молекулы С2
9QR
С, ДЯ
298
50,255 кДж/кг, трехатомной
= 111,908 кДж/кг.
При увеличении давления температура плавления графита возраста-
возрастает и при ~6 ГПа достигает 4620±100 К; при 4,8 ГПа теплота плав-
плавления графита Д//пл = 8710 кДж/кг. Начальный наклон dT/dP крнвоп
плавления составляет 250 К/ГПа. Тройная точка графит—алмаз—жид-
графит—алмаз—жидкость располагается при 3700 °С и давлении 11 ГПа. Согласно диаграм-
диаграмме при температурах 1027—1227 °С и давлении 5—6 ГПа возможен
переход графита в алмаз, однако указанного прямого перехода практи-
практически не наблюдается. В промышленности осуществляется только ката-
каталитический синтез алмазов. Существование металлического алмаза при
давлениях около 50 ГПа и температурах около 2227 °С пока остается
проблематичным.
Удельная теплоемкость графита в интервале 298—1000 К ср =710
Дж/(кг-К), алмаза в интервале 273—1200 К ср = 509 Дж/(кг-К). Теп-
Теплопроводность графита является свойством анизотропным. Теплопро-
Теплопроводность графита к в зависимости от температуры в направлении
оси с:
к', Вт/'(м'-КЬ
573
1,56
773
1,41
1273
1,255
1773
1,215
1873
1,255
Теплопроводность графита в зависимости от температуры в направ-
направлении, перпендикулярном осн с:
г, к
к, Вт/(м-К). .
573
281,0
773
251,0
1273
198,1
1773
188,5
1873
199,0
Теплопроводность алмаза в зависимости от температуры:
Т К
С Вт/(м-Ю
100
2910
150
1235
2500
628
293
545
Температурный коэффициент линейного расширения графита также
является анизотропной характеристикой. Для пиролитического графита
величина а в направлении, параллельном оси с, в зависимости от тем-
температуры:
т, к
30
50
100
140
180
а . 10й, К~х
3,8
8,7
17,6
21,5
24,1
т, к
220
270
523
773
1023
а ■ Ю", К
25,8
27,2
27,5
28,0
28,42
Т. К
1273
1773
2273
2773
а • 10е, К
28,9
29,54
30,5
31,52
Величина а в направлении, перпендикулярном оси с:
Т, К - • •
а-106, K-i
30
0,9
50
5,0
100
10,7
140
12,8
180
13,3
220
13,2
270
12,7
198
Величина а для алмаза в зависимости от температуры:
53—303 303—553 553—1103 1103—1703
0,64 2,25 3,73 5,67
Молярная энтропия углерода s° в зависимости от температуры:
Г, К
а-10\ К-1. ■
Г, К
s°, Дж/(моль-К)
298 500 ГООО 1500 2000 2500
5,73 11,72 24,53 33,78 40,9 46,63
Значения приведенного термодинамического потенциала углерода
Фг в зависимости от температуры:
Т, К 298 500 1000 1500 2000 2500
Фг, Дж/(моль-К) 5,73 6,«9 12,73 18,29 23,06 27,21
Изменение давления пара углерода р в зависимости от температуры:
Г, К
1700
1808
1900
р.
89,6
19,52
30,21
Па
• 10-ю
■ 10-'
т, к
2000
2200
2400
35
25
83
р.
,71
,02
,48
Па
• ю-«
• ю-4
•Ю-3
Г, К
2600
2800
3000
16
Р, Па
,38-10-1
20,9
185,4
Энергия дефекта упаковки графита 0,51 мДж/м2.
Параметры самодиффузии атомов углерода в поликристалле при-
природного графита в интервале температур 2273—2473 К £>0=@,4—
— 14,4) -10-* м2/с. Энергия активации самодиффузии углерода Е —
= 680 кДж/моль.
Параметры взаимной диффузии (предэкспонепциальный множитель
Do и энергия активации Е) элементов и углерода по объему зерна (во
всех случаях образуется твердый раствор):
Основной элемент
С
С
С II оси с
С ± оси с
С II оси а
С II оси с
С || оси а
С II оси а
С |] оси а
С || оси с
С II оси а
С || оси с
Диффунди-
Диффундирующий
элемент
Не
В
В
В
Ni
Ni
Ag
Ra
Th
Th
U
U
г. к
1510—2470
2213—2673
1973—2673
1973—2673
1073—1373
1073—1373
1053—1273
1673—2473
1673—2473
1673—2473
1673—2473
1673—2473
Do, м7с
7,0-Ю-8
3,02-10-4
6,32-Ю-1
7,1-Ю-4
1,02-Ю-2
2,2-Ю-4
9,28-Ю-1
1,18
1,33-10
2,48-10-*
6,76-10-1
3,85-10-?
кДж/моль
97,9
239,7
657,1
640,2
197,2
222,5
268,8
415,6
608
480
482
543
Излучательная способность углерода (графита)—коэффициенты из-
излучения спектральный е^ (в таблице отмечен звездочкой) и интеграль-
интегральный ег:
199
)., мкм
0,65
0,65
т, к
1573—2773
298
773
1100—1800
1200—2200
1200—2100
гладкая поверхность
0,78*
0,081
0,079
0,85—0,86
0,77*
0,62—0,56
порошок
0,9
0,65
0,72—0,58
Отражательная способность углерода (коэффициент отражения nD)
(графита):
к, мкм
Полированная
0,5
0,6
0,8
1,0
2,0
4,0
7,0
10,0
V %
поверхность
22
24
25
27
35
48
54
59
X, мкм
Монокристалл,
0,124
0,155
0,207
0,243
0,310
0,620
1,240
2,480
V %
поверхность чистая
8
2
40
56
40
35
48
63
OOO
Показатель
мкм
,243
,310
,412
п
1,2
2,6
2,4
преломления п в зависимости от длины волны
)
Примечание
Монокристалл
графита
0,
0,
мкм
620
5893
2
2
п
6
417
Примечание
Графит
Алмаз
Показатель преломления у алмаза составляет для красного света
(линия Фраунгофера) п=2,407, для синего света (линия Н) /1=2,465.
Рассеяние спета (дисперсия) также значительно и на этом основана
известная игра красок — «огонь» бриллиантов.
Показатель поглощения х Для монокристалла графита в зависимости
от длины волны 'к:
мкм
0
2
,243
,4
0
1
,310
,6
0,
1,
412
3
0
1
,620
,4
200
Механические свойства
Алмаз по твердости превосходит все другие вещества, поэтому его
можно шлифовать и вообще обрабатывать только алмазным порошком.
Несмотря на высокую твердость, алмаз очень хрупок.
Микротвердость алмаза по Кнуппу при 20 °С 88200 МПа. Микротвер-
дость, определенная при помощи обычной пирамиды, 78500 МПа. Вре-
Временное сопротивление при растяжении при комнатной температуре ав—
= 1760-4-1780 МПа; модуль нормальной упругости при растяжении Е=
= 1141,1 ГПа, в направлении [111] £=1202 ГПа, а в направлении [100]
£=1052 ГПа (данные относятся к комнатной температуре).
Графит в отличие от алмаза обладает незначительной твердостью.
По шкале Мооса твердость алмаза равна 10, а твердость графита 1,
Временное сопротивление при растяжении пористого графита а„=0,34+
-*-0,69 МПа, а электродного графита ап=3,43-И7,2 МПа (вдоль элект-
электрода). В поперечном направлении а„=6,18н-8,93 МПа. На нитях из
графита можно получить 0„=26-!-28 МПа; на «усах» из графита до-
достигнута прочность 480—500 МПа (данные относятся к комнатной
температуре). Графит сравнительно хорошо сопротивляется сжимаю-
сжимающим нагрузкам. Так, а"к реакторного графита при 20 °С составляет
20,6—34,3 МПа. В уплотненном графите эта характеристика может быть
доведена до 70 МПа. Сжимаемость графита х=3,24-10-" Па-', сжима-
сжимаемость алмаза х = 0,23-10-" Па-1.
Химические свойства
В соединениях проявляет степени окисления —4, +2 и +4.
Углерод, независимо от модификации, обладает малой химической
активностью. Он не растворяется в обычных растворителях, ио хорошо
растворяется в расплавленных металлах, особенно в металлах IVA—
V1IIA подгрупп Периодической системы. При охлаждении расплавов
углерод выпадает или в виде свободного графита, или в виде соедине-
соединений металла с углеродом. Алмаз отличается очень высокой химической
стойкостью. На него не действуют ни кислоты, ни основания. При на-
нагреве в кислороде выше 800 "С алмаз сгорает до СО2. Если алмаз на-
нагревать без доступа воздуха, то ои превращается в графит.
Графит легче поддается химическому воздействию, чем алмаз; при
нагреве в чистом кислороде он воспламеняется уже при 637—642 С.
Графит, смоченный концентрированной азотной кислотой, при нагреве
до красного каления вспучивается. При обработке концентрированной
серной кислотой в присутствии окислителей графит разбухает и стано-
становится темно-синим. Некоторые сорта черного углерода воспламеняются
в атмосфере кислорода уже при незначительном нагреве. Со фтором
черный углерод уже взаимодействует при обычной температуре. При
нагреве углерод соединиется со многими элементами: водородом, серой,
кремнием, бором и др. В природе наблюдается большое разнообразие
соединений углерода с водородом.
При взаимодействии с кислородом углерод образует два простых ок-
оксида. Продуктом полного сгорания углерода является диоксид СО2, при
неполном сгорании образуется оксид СО. Теплота образования СО2 при
окислении графита ДЯобр=395,2 кДж/моль, а СО Д//Овр= 111,5 кДж/
/моль, т. е. значительно ниже. СОг — бесцветный, негорючий газ со сла-
слабым сладковатым запахом. Он тяжелее воздуха в 1,529 раза, легко
сжижается при 20 °С и давлении 5,54 МПа, образуя бесцветную жид-
жидкость. Критическая температура СО2 31,4 СС, критическое давление
7,151 МПа. При нормальном давлении СО2 сублимируется при
201
•—78,32 °C. CO образуется в процессе сжигания угля при недостаточном
притоке воздуха, представляет собой ядовитый газ, не имеющий ни за-
запаха, ни цвета; он не поддерживает горения, но сам является горючим;
в 0,967 раза легче воздуха. При атмосферном давлении СО сжижается
при — 191,34°С и затвердевает прн —203,84 СС.
Углерод взаимодействует с серой. При пропускании ее паров над
раскаленным древесным углем образуется двусернистый углерод CS2
(сероуглерод). Низшие сульфиды углерода неустойчивы. Сероуглерод
представляет бесцветную жидкость удушливого запаха. Температура
кипения CS2 46,2 "С, затвердевания —110,6°С. Давление пара CS2
при 293 К равно 0,0385 МПа. Сероуглерод — эндотермическое соедине-
соединение, при его распаде освобождается около 64,5 кДж/моль. CS2 взрыво-
взрывоопасно, однако взрывная реакция широко не распространяется. Из дру-
других соединений углерода с серой следует отметить COS, представляю-
представляющее собой бесцветный газ, не имеющий запаха; COS легко воспламе-
воспламеняется. Образуется COS при совместном пропускании смеси паров серы
и оксида углерода через раскаленную трубку. COS сжижается при
^49,9 °С, а затвердевает при —137,8 °С.
Углерод вступает в реакции с азотом. При прокаливании без досту-
доступа воздуха различных органических продуктов (кожи, шерсти и др)
образуются соединения, содержащие одновалентный радикал CN. Про-
Простейшую кислоту HCN, являющуюся производной циана, называют си-
синильной, а ее соли цианидами. Синильная кислота — бесцветная жид-
жидкость, кипящая при 26,66 °С; в большом разведении имеет запах, сход-
сходный с запахом горького миндаля. Затвердевает HCN при —14,85 °С,
чрезвычайно ядовита. Цианиды калия и натрия широко применяются
при производстве золота, а также в гальванотехнике благородных ме-
металлов.
Имеются соединения углерода с галогенами. Фторид углерода CF4—
бесцветный газ с температурой кипения —128 "С, температурой плавле-
плавления —183,44 °С. Получают CF4 нли при непосредственном взаимодейст-
взаимодействии фтора и углерода нли при воздействии AgF на СС14 при 300 °С.
Четыреххлористый углерод ССЦ— бесцветная, негорючая жидкость со
слабым характерным запахом. ССЦ кипит при 76,86 °С и затвердевает
при —22,77 СС. При обычной температуре ССЦ химически инертен, не
реагирует нн с основаниями, ни с кислотами. ССЦ очень хорошо рас-
растворяет органические вещества; его часто используют в качестве рас-
растворителя жиров, масел, смол и др.
Соединения углерода с металлами, а также с бором и кремнием на-
называют карбидами. Карбиды подразделяют на два основных класса:
разлагаемые водой и не подвергающиеся действию воды. Карбиды,
разлагаемые водой, можно рассматривать как соли ацетилена; в соот-
соответствии с этим состав отвечает общим формулам Afe2C2, Me"C2 и
Me 2 (С2)з- Водой или разбавленными кислотами ацетилиды расщепля-
расщепляются с образованием ацетилена. Теплота образования некоторых кар-
карбидов, разлагаемых водой или разбавленными кислотами:
Карбиды
Li2C2
Na2C2
MgCa
Mg2C2
II
A Яобр- Карбиды
кДж/моль1] х v" н
57,96
17,15
88,39
79,75
СаС2
ВаС2
А14Сз
Ag2C2
Д Ярбр- Карбиды
кДж/моль |
60,67
20,8
167,23
350,02
ThC2
ис2
МпС2
Со3С
Ni3C
Д Яобр-
кДж /моль
192,5
87,77
14,93
37,75
41,01
202
К группе карбидов, устойчивых к действию воды или разбавленных
кислот, относятся соединения углерода с переходными металлами, а
также SiC. Кристаллическая структура карбидов, за исключением SiC,
кубическая, типа NaCI. Такие кабриды иногда называют металлоподоб-
ными соединениями, так как они обладают высокой электро- и тепло-
теплопроводностью, имеют металлический блеск. Соединение кремния с угле-
углеродом SiC — карборунд. Он обладает очень высокой твердостью, а по
своей кристаллической структуре подобен алмазу. Теплота образования
SiC Д#обр= 117,43 кДж/моль. К числу карбидов, стойких к воздействию
воды и неразбавленных кислот, относятся также В4С, Сг4С, Сг3С2 и
некоторые другие.
Области применения
Наиболее широкое применение углерод получил в металлургической
промышленности, прежде всего в доменном производстве, где исполь-
используется его способность восстанавливать железо из руд. Углерод в до-
доменном производстве применяют в виде кокса, который получают путем
нагрева каменного угля без доступа воздуха. Металлургический кокс
содержит до 90 % С, 1 % Н, 3 % О, 0,5—1 % N и 5 % золы, т.е. не-
несгораемых составных частей. Кокс горит синеватым пламенем без ко-
копоти, а его теплотворная способность составляет 30—32 МДж/кг. В ка-
качестве огнеупорного материала для плавильных тиглей, стойкого к быст-
быстрой смене температур, применяют графит. Его также используют для
изготовления карандашей, смазки, огнеупорной краски и др.
Графит, обладающий высокой электрической проводимостью, нахо-
находит разнообразное применение в электротехнике и гальванопластике
(электроды, микрофонные угли, некоторые сорта графита для ламп на-
накаливания и др.). Он является также одним из конструкционных мате-
материалов для ядерных реакторов. Производство графита в нашей стране
регламентируется ГОСТ 17022—81, который распространяется на основ-
основные виды естественного графита. Согласно этому ГОСТу производится
три марки графита смазочного ГС-1 до 3, дое марки графита тигельно-
тигельного ГТ, две марки графита литейного ГЛ, три марки графита аккумуля-
аккумуляторного ГАК, четыре марки графита электроугольного ГЭУ, три марки
графита элементарного ГЭ (служит для производства гальванических
элементов), две марки графита карандашного ГК, две марки графита
алмазного ГАЛ (для производства алмазов и других изделий, где тре-
требуются высокие инертность, чистота, электрическая проводимость). Со-
Содержание золы в низших сортах смазочного, электродного и литейного
графита 13—18 °/о, а в отдельных случаях до 25 % по массе (например,
В атомной энергетике применяют искусственный графит, способ по-
л\ ic-ния которого был разработан еще в конце прошлого века.
4.2. КРЕМНИЙ [1-35, 156—162]
Общие сведения и методы получения
Кремний (Si) — элемент темно-серого цвета с синеватым оттенком. От-
Открыт в 1811 г. Ж. Гей-Люссаком и Л. Тернаром. Полупроводниковые
свойства кремния выявлены и использовались еще до второй мировой
войны. Однако со времени создания германиевого транзистора A948 г.)
применение кремния временно сократилось, так как германий высокой
чистоты получить в чистейшем виде оказалось проще, чем кремний.
Производство высокочистого кремния для полупроводниковых приборов
£03
начало развиваться с конца 50-х годов, когда был разработай и освоен
процесс бестигельной зонной очистки этого элемента A958 г.). Преиму-
Преимущество кремниевых полупроводников по сравнению с германиевыми —
более высокие рабочие температуры (до 473 К против 333—353 К).
Кремний-—один из самых распространеиых элементов, занимающий
второе место после кислорода. В земной коре содержится 27,6 % (по
массе) кремния.
Основным источником получения технического кремния служит крем-
кремнезем БЮг. С этой целью кремнезем восстанавливают углеродом (кок-
(коксом) в шахтных электропечах при 1500—2750 "С. Кремний получают
также в виде сплава с железом (ферросилиций). Для этого в шихту
добавляют железную руду. Для получения высокочистого кремния ис-
используют его соединения: галогениды, силаны, галогеносиланы и т. д.
Способы получения кремния:
— восстановление тетрахлорида кремния (SiCI4) водородом;
— восстановление трихлорсилана (SiHCy водородом;
— термичеркое разложение моносилана на нагретых до 500—700 °С
кремниевых стержнях.
Недостаток последнего способа — возможность возгорания и взрыво-
опасность.
Дальнейшая очистка кремния осуществляется вертикальной бести-
бестигельной зонной плавкой (метод плавающей зоны).
Выращивание легированных монокристаллов кремния с заданным
типом проводимости осуществляется вытягиванием из расплава по ме-
методу Чохральского. Для наращивания эпитаксиальных пленок исполь-
используют перечисленные выше процессы получения кремния нз его соеди-
соединений, а также обратимую реакцию образования и разложения тет-
раиодида.
Кристаллический кремний, получаемый восстановигельной плавкой
кварца или кварцита и предназначенный для изготовления кремнийсо-
держащих сплавов, выпускается по ГОСТ 2169—69 следующего состава:
Марка кремния
КрОО
КрО
Kpl
Кр2
КрЗ
о 1, /о >
не менее
99,0
99,8
98,0
97,0
96,0
Fe
0,4
0,5
0,7
1,0
1.5
Примеси,
А1
0,4
0,4
0,7
1,2
1,5
%, ие
Са
0,4
0,4
0,6
0,8
1,5
более
сумма определяе-
определяемых примесей
1,0
1,2
2,0
3,0
4,0
* Содержание кремния устанаиливается как разность между 100 % и суммой
определяемых примесей.
Кристаллический кремний транспортируют без упаковки в крытых
железнодорожных вагонах и контейнерах, хранится в закрытых сухих
помещениях.
Кремний монокрнсталлический, получаемый по методу Чохральского
и предназначенный для производства эпитаксиальных структур, выпу-
выпускается по ГОСТ 19658—81 следующих марок: ЭКДБ (группы 1—6),
ЭКЭС (группы 7—8), ЭКЭФ (группы 9—14). Монокристаллический
кремний марки ЭКДБ легирован бором, ЭКЭС — сурьмой, ЭКЭФ —■
фосфором. Содержание кислорода в монокристаллах кремния диамет-
204
ром до 40 мм составляет ие более 5-10" атомов в 1 см3, а в монокри-
монокристаллах больших размеров —не более 7-Ю'7 атомов в 1 см3. Кристалло-
Кристаллографическая ориентировка монокристаллов— [Ш] или [100].
Характеристики кремния монокристаллического, полученного мето-
методом Чохральского:
Тип проводимости Электронный или дырочный
Среда выращивания Вакуум, гелий
Легирующий элемент Фосфор (д-тип), бор (р-тип)
Диаметр слитка, мм 40—60
Интервал удельного сопротивления,
Ом-м @,05—250)-Ю-2
Разброс удельного сопротивления по
торцу слитка, % 15—20
Плотность дислокаций, см~2 . . . ^г5-104
Диффузионная длина, мм ^0,1
Характеристики кремния монокристаллического, полученного мето-
методом бестигельной зонной плавки:
Тип проводимости Электронный или дырочный
Среда выращивания Вакуум, водород
Легирующий элемент Фосфор (д-тип), бор (р-тип)
Диаметр слитка, мм 28—32
Разброс удельного электрического со-
сопротивления по объему слитка, % . 7—35
Плотность дислокаций, см~2 . . . ==С5-104
Интервал удельного сопротивления,
Ом-м @,008—2000)-Ю-2
Каждый монокристалл кремния пакуют отдельно, помещая в поли-
полиэтиленовый пакет, который герметично заваривают. Заваренные пакеты
помещают в картонные или пластмассовые коробки с мягкой проклад-
прокладкой. Кремний хранится в упаковке предприятия-изготовителя при отно-
относительной влажности воздуха не более 80 %. При хранении монокри-
монокристаллы кремния должны быть защищены от возможных механических
повреждений, действия влаги и активных химических реагентов.
Физические свойства
Атомные характеристики. Атомный номер 14, атомная масса 28,08 а.е.м.,
атомный объем 12,04- К)-6 м3/моль, атомный радиус 0,134 нм, радиус
иона Si4+ 0,039 нм. Электронная конфигурация внешней электронной
оболочки 3s2p6. Потенциалы ионизации J (эВ): 8,149; 16,34; 33,46.
Электроотрицательность 1,9. Кристаллическая решетка кремния — куби-
кубическая типа алмаза с восемью атомами в элементарной ячейке; период
решетки а=0,54304 нм. Энергия кристаллической решетки 370 мкДж/
/кмоль. Координационное число 4. Под воздействием высокого давления
кремний переходит в тетрагональную сингонию прн 300 К. Переход со-
сопровождается изменением объема AV/V=—29 %.
205
Изотопный
Массовое
число
25
26
27
28
29
30
31
32
состав кремния
Содержание
в естественном
элементе
92,27
4,68
3,05
—
—
Период полу-
полураспада
0,22 с
2,1 с
4,0 с
2,6 года
650 лет
Форма
Р+
р-
р-
Энергия
излучен (я.
_
3,76
—
—
1,471
Эффективяое поперечное сечение захвата тепловы-х нейтронов
0,16-10~28 м2. Работа выхода электронов, определенная методом кон-
контактной разности потенциалов для р-кремния, <р = 4,2 эВ, для п-крсмиия
ф = 4,8 эВ.
Плотность. Плотность кремния р = 2,33 Мг/м3, при высоком давле-
давлении р = 2,55 Мг/м3; в жидкой фазе при различных температурах:
Г, К 1723 1753 1773 1813 1833 1873 1903
р, Мг/м3 .... 2,51 2,50 2,49 2,48 2,467 2,463 2,445
Электрические и магнитные. Удельное электрическое сопротивление
высокочистого кремния при 300 К р=23-102 Ом-м.
Изменение удельного электросопротивления кремния при плавлении
/ 0034
Р/Р ,
Удельная электрическая проводимость кремния в жидкой фазе при
различных температурах, определенная методом вращающегося магнит-
магнитного поля:
г, к . • • •
о-Ю-2, См/м
1723
12 860
1753 1773 1813 1833 1873
1265 11810 11 150 11 880 11570
Температурный коэффициент электросопротивления при 273 К <х =
= [(—1,8) —( + 1,7)]-10-' К-1.
Абсолютный коэффициент т. э. д. с. е=600-т-800 мкВ/К. Т. э. д. с. крем-
кремния по отношению к платине при 173,16 К £ = 37170 мкВ и при 373,16 К
£=—41560 мкВ.
Температура перехода в сверхпроводящее состояние пленки кремния
при 12—13 ГПа 7с = 7,1 К.
Постоя-ыная Холла R=—102 м3/Кл.
Ширина запрещенной зоны кремния при абсолютном нуле 1,21 эВ;
с повышением температуры уменьшается: Д£= A,21 -н3,6) • 10~4 Т эВ.
При 300 К А£= A,09--1,1) эВ.
Эффективная масса электрона mn=0,97m0.
» » дырок mp = 0,49mo.
Подвижность электронов |х„ =0,1350+0,1450 м2/В-с.
Подвижность дырок цр =0,0480+0,0500 м2/В-с.
Концентрация электронов пп=6,8:*1016 м~3.
Концентрация дырок др=6,8-1016 м~3.
Собственная концентрация электронов п, =3,85- Ю1в7'3/2е-1'21/2*г,
Диэлектрическая постоянная es= ll,7±2,0(f= 10 МГц).
206
Критическое давление, необходимое для перехода кремния в метал-
металлическое состояние, 1569,6 ГПа.
Магнитная восприимчивость при 293 К % — —0,112-10~9; в жидкой
фа о:
Г, К 1693 1723 1773 1813 1833
Х-10° —0,082 —0,084 —0,088 —0,089 —0,089
Тепловые и термодинамические. Температура плавления ^Пл — 1415°С,
температура кипения /Кщ = 3249°С, характеристическая температура
0D = 645, 690, 670 К; удельная теплота плавления ЛЯПя=1773 кДж/кг,
удельная теплота испарения ,\НЯС, = 13709 кДж/кг, удельная теплота
сублимации Д//Суб.1= 16115,38 кДж/кг. Молярная энтропия s° при раз-
различных температурах:
Г, К 298 500 1000 1500
s°, Дж/(моль-КЬ • 18,95 30,33 47,70 58,82
Г, К 2000 2500 3000
s°, Дж/(моль)-К)- • 94,81 101,38 106,74
Давление пара р:
Т, К- • 1000 1200
р, Па. . 1,81-10—!а 2,05-10-s
Г, К- • 2000 2200
/?,Па. . 1,4 13,1-10
1400 1600 1800
1,59-10-» 2,31-10-» 0,8-Ю-3
2400 2600 2800
8,4-10 4,02-Ю2 15,3-Ю3
Теплопроводность А монокристалла кремния р-типа высокой чистоты:
т, к
2
5
10
30
К, Вт/(м • К)
3,3
300,0
125,0
3200
т, к
60
100
140
200
К, Вт/(м • К)
2060
920
480
280
т, к
300
500
800
X, Вт/(м ■ К)
152
80,0
44,0
Теплопроводность кремния чистотой 99,99% при 1180 К ^=30,15
Вт/(м-К), при 1400 К Л=26,2 Вт/(м-К).
Удельная теплоемкость при 298,15 К с,> = 714 Дж/(кг-К).
Температурный коэффициент линейного расширения а монокристал-
монокристаллического кремния (р=20-102 Ом-см) при различных температурах:
т, к
20
30
100
а ■ 10» К
0,005
0,053
0,34
т, к
150
200
300
а ■ 10» К
0,52
1,41
2,5)
т, к
400
600
850
а ■ 10" К—1
3,20
3,86
4,08
207
Температурный коэффициент линейного расширения поликристалли-
поликристаллического кремния в интервале 293—1273 К а=3,82-10~6 К.
Параметры самодиффузии монокристаллического кремния:
Интервал температур, К
Предэкспоненциальный множитель Do .
Энергия активации Е, кДж/моль . . .
Кинематическая вязкость v жидкого кремния:
1498—1673
0,18
460
1373—1573
0,9
496
т, к
1693
1703
1713
v • 10", м2/с
0,348
0,328
0,315
т. к
1723
1753
1773
v • 10", мг/с
0,295
0,275
0,262
т, к
1833
1873
v ■ Ю«, м2/о
0,245
0,233
Параметры взаимной диффузии — предэкспоненциальный множитель
Do и энергия активации Е (образующаяся фаза—твердый раствор):
Диффундирующий
элемент
н
Не
Li
В
С
0
р
А!
Fe
Си
Zn
Qa
As
Ag
In, Tl
Sb
Аи
Bi
Интервал темпера-
температур, К
1365—1473
1240—1480
633—1133
1373—1673
1323—1673
.
1223—1548
1368—1548
1373—1623
1073—1373
1273—1543
1378—1633
1363—1353
1373—1623
1378—1633
1368—1633
1078—1523
1293—1653
Д„ м2/с.
9,4-10—7
0,11-Ю-4
9,4-Ю-7
17,1 -I0-4
1,9-Ю-4
0,27- !0-4
10,5- Ю-4
8,0-10—*
6,2-10-'
4-10-6
0,1-Ю-4
3,6-10—4
6,52-Ю-4
2-Ю-7
16,5-Ю-4
5,6-10-4
1.1-10-7
1,04-10-'
£, кДж/моль
46,05
121,42
75,78
355,04
12,98
240,74
365,88
334,87
83,44
93,30
134,81
339,13
344,32
154,07
376,8
381,01
108,02
448,0
Поверхностное натяжение кремния при 1723 К 0=860 мН/м.
Энергия дефекта упаковки кубической сингонии (типа алмаза) 50—
60 мДж/м2.
Поверхностная энергия для грани A11) v=1240 мДж/м2.
Оптические. Излучательпая способность (интегральный коэффициент
излучения Ет)'-
208
г, к
1173
1273
1373
1473
0,61
0,62
0,62
0,64
г, К
1573
1673
1773
0,67
0,72
0,190
т. к
1873
1973
2073
0,191
0,194
0,196
Примечание. Гладкая поверхность.
Отражательная способность* (коэффициент отражения
X, мкм .
0,5
34
32
0,8
29
1,0; 2,0; 4,0; 7,0; 10,0
28
* Полированные образцы.
Показатель преломления монокристалла кремния' « = 3,5 при Х=
= 2,5ч-4,0 и « = 3,42 при A.=70-f-330.
Коэффициент поглощения а монокристалла кремния р-типа:
К, мкм .
а, м—1 .
2,5 5,0 10,0
2 1,6 0,018
?0
0,0075
Механические свойства
Твердость полнкристаллнческого кремния при 293 К HRC 106
Микротвердость И^ монокристалла кремния с ориентацией [111
t, °С . .
Н„ ...
127 527 927
10 800 10 000 600
Микротвердость моиокписталла кремния с ориентацией [ПО] ffu =
= 11500 МПа, с ориентацией [112] Я^ 13300 МПа (Г=293 К).
Временное сопротивление при сжатии о^ж литого поликристалличе-
поликристаллического кремния чистотой 99,4 % в зависимости от температуры:
t, °С . . . 20 500 1000
0зЖ, МПа . 687 471 214
Временное сопротивление разрыву полпкристаллического кремния
при 20 "С а„= 16,7 МПа.
Модуль нормальной упругости Е поли- и монокристаллического
кремния при 20 °С, ГПа:
Поликристалл
Монокристалл \\ 11]
Монокристалл [ПО]
Монокристалл [100]
162,7
199
175
S3!
Коэффициент упругости монокристалла кремния при 20 °О
сп= 165,7 ГПа; Ci2=63,9 ГПа; с44=79,6 ГПа.
209
Химические свойства
В соединениях проявляет степень окисления +4, значительно реже +2
В кислотах, в том числе в плавиковой, кремний нерастворим Хоро
шо растворяется в смесн азотной и плавиковой кислот, менее интенсив-
интенсивно в азотной кислоте с добавками пероксида водорода и брома. Ще-
Щелочи (разбавленные и концентрированные) легко растворяют кпеч'Ч! ;
Присутствие пероксида водорода ускоряет процесс растворения кремния
в щелочах
Кремний проявляет большое сродство к кислороду и фтору С кисло-
кислородом кремний образует два соединения- SiO2 и SiO Образование SiO,.
сопровождается выделением большого количества тепла ЛЯ,оР=—913,42
кД/к/моль. Известны многочисленные модификации SiO2) например
i'i ярц, тридимит, кристобалит. Описаны волокнистая форма диоксида
кремния и очень плотный кремнезем с плотностью 3,01 Мг/м3, безвод-
безводный аморфный кремнезем Равновесная температура плавления SiO2
1723 "С. Быстрым нагреванием можно расплавить кварц при 1210 °С,
тридимнт прн 1680 °С Жидкий диоксид кремния кипит при 2590°С, за-
заметное испарение в вакууме начинается при 1300 "С. При охлаждении
расплавленного SiO2 получается прозрачное (в том числе для ультра-
ультрафиолетовых лучей) кварцевое стекло. В отличие от кристаллов S1O2
структура кварцевого стекла состоит из неупорядоченных кремнекисло-
родиых тетраэдров. Структуру кварцевого стекла имеют пленки, обра-
образующиеся при окислении.
Оксид (II) кремния SiO2 в природе не встречается Может быть по-
получен восстановлением диоксида при 1623 К, а также восстановлением
S1O2 углеродом. SiO — порошок темно-желтого цвета плотностью р =
= 2,16 Мг/м3. В твердом кремнии вблизи температуры плавления рас-
растворяется 5,6-10-3% (ат), а в жидком 4,5• 10—3% (ат.) О2.
Галогениды кремния могут быть получены прямым синтезом элемен-
элементов.
При этом фтор реагирует с кремнием уже при комнатной темпера-
температуре, а остальные галогены — при нагревании. Хлор кремния SiCl4
может быть получен действием хлора на нагретую смесь кремнезема и
угля. Представляет собой прозрачную бесцветную жидкость, сильно
дымящую на воздухе; плавится прн —72 °С и кипит при 57,2 °С. Бромид
кремния SiBr4 — бесцветная жидкость, дымящая на воздухе; темпера-
температура кипения 154 °С. Иодид кремния Sil4 — бесцветные кристаллы; тем-
температура плавления 120 °С, кипения 290 °С.
С азотом кремний образует одно устойчивое соединение — нитрид
кремния Si3N4 — с выделением большого количества тепла АЯобР =
= (-^753,14 кДж/моль). Реакция протекает выше 1300°С. Возможны
также соединения SiN, Si2N3 Вблизи температуры плавления раствори-
растворимость азота в твердом кремнии составляет 9-10~6% (ат.), в жи ikom
7-10-2% (ат.).
Водород непосредственно не взаимодействует с кремнием Водород-
Водородные соединения кремния—кремневодороды, или силаны, можно полу-
получить действием соляной кислоты на силицид магния. Силаны малоустой-
малоустойчивы, легко окисляются на воздухе, имеют специфический запах и силь-
сильно ядовиты Окисляемость силанов возрастает с увеличением их моле-
молекулярной массы Моносилан SiH4—бесцветный газ, образующий с
воздухом взрывчатую смесь. Температура затвердевания 185°С, кипе-
иня 111,9 °С, гидролизуется водой. По сравнению с другими кремнево-
дородами характеризуется максимальной термической устойчивостью.
Выше 400°С разлагается на кремний и водород. Как и углеводороды, сила-
силаны взаимодействуют с галогенами, которые замещают атомы водорода.
Практическое значение имеет трихлорсилан SiHCb, из которого путем
210
восстановления получают чистый кремний. Трихлорсилан — прозрачная,
легкоподвижная и горючая жидкость с плотностью 1,35 Мг/м3, очень
летучая (температура кипения 32 °С, сильно дымит на воздухе в резуль-
результате гидролиза.
Основное соединение кремния с углеродом — карбид кремния SiC.
При атмосферном давлении карбид кремния не плавится, а возгоняется.
Температура начала возгонки около 2000 °С; интенсивная возгонка про-
происходит выше 2500 °С. Карбид кремния существует в двух модификаци-
модификациях- C и а. Кристаллы C-SiC имеют кубическую структуру сфалерита,
a-SiC — гексагональную с многочисленными политипными формами
(около 20 политипных форм). Температура монотропного перехода низ-
низкотемпературной Р-модификации SiC в а-модификацию 2100 °С. Моди-
Модификация а может неограниченно долго существовать и при низких тем-
температурах.
Химически чистый карбид кремния бесцветен. Примеси могут окра-
окрашивать его от зеленого до сине-черного цвета. Зеленые кристаллы со-
содержат донорные примеси (Fe, Bi, Sb, As, P, N) и обладают проводи-
проводимостью я-типа. Кристаллы с голубой окраской имеют акцепторные
прнмеси (металлы II и III групп Периодической системы) и характери-
характеризуются проводимостью р-типа.
Вблизи температуры плавления кремния растворимость углерода в
твердой фазе 6,5-10-" °/о (ат.), в жидкой фазе 9-10~3 % (ат ).
При непосредственном взаимодействии кремния с фосфором выше
500 °С могут быть получены игольчатые кристаллы монофосфида крем-
кремния SiP
Известны соединения кремния с мышьяком- SiAs и SiAs2.
Растворимость гелня в кремнии может быть описана уравнением
lgC = — 5,9—2400/Г (в области 970—1200°С).
Большинство систем кремний — металл относится к эвтектическому
ТИПУ.
Эвтектическая температура, разность между температурой плавления
и эвтектической температурой и состав эвтектики в системах кремний—■
металл приведены ниже
Эле-
Элемент
А1
Ga
In
Tl
Sn
Pb
As
517
30
157
304
505
600
1345
Д Г
82
6-10—8
1 • 10-7
2-10—e
4-10-5
5-10—8
-259
Xe
0,120
5-10-10
2-10-"
3-I0-9
Ы0-7
9-10-10
0,595
Эле-
Элемент
Sb
Bi
Cu
Ag
Au
Zn
600
271
802
830
370
420
Д Г
1,1
3-10—8
281
131
693
0,2
0,003
Ь 10-1»
0,32
0,125
0,31
4-10—*
При взаимодействии с металлами, особенно переходными (металлы
ША—VIII групп), наблюдается образование силицидов. Большая часть
силицидов металлов характеризуется преимущественно металлической
связью, однако некоторые проявляют полупроводниковые свойства. Ся-
стемы кремний — металл характеризуются ограниченной взаимной рас-
растворимостью (твердые растворы замещения). При этом растворимость
кремния в металле больше, чем растворимость соответствующего метал-
металла в кремнии. Непрерывный ряд твердых растворов наблюдается в
211
системе кремний — германий. Большинство систем кремний — металл
характеризуется наличием ретроградного солидуса (со стороны кремния.
Растворимость металлов в кремнии:
Металл
Al
Ga
Sn
As
Sb
Cu
p
5
2
3
о
1
астворимость
950 °C
, 10 ■ 1020
,1-101»
,8-1019
.
,0-101»
,8-lQi'
ат ■ см 3
1250 "C
3,2-1O20
4,0- Ю19
6,2-1019
1,8-1021
6,2-IO19
—
Металл
Au
Zn
Fe
Co
Cr
Растворимость.
6
2
3
!»S
0-
2
8
°C 1
10"
1015
1015
ат
см-3
I2.i(i °C
1,0
4,3-
2,5-
1,5
1,0-
lQi'
10"
lOio
101"
1015
Технологические свойства
Чистый кремний характеризуется значительной хрупкостью. Пластиче-
Пластическая деформация возможна только при температурах, близких к тем-
температуре плавления, и в условиях всестороннего неравномерного сжа-
сжатия. Детали заданной конфигурации из кремния изготовляют резкой
алмазными пилами. Монокристаллы кремния могут быть получены вы-
вытягиванием из расплава через диафрагму по методу Степанова.
Области применения
Кремневые приборы, применяемые в радиоэлектронике, вычислитель-
вычислительной технике, оптике и т. д., отличаются повышенной надежностью, ком-
компактностью, высокими значениями к. п. д., способностью работать при
повышенных температурах 120—150 °С.
Монокристаллический кремний используют в электронике — для схем
на кремниевых диодах и транзисторах, не требующих мощных батарей
питания и безотказно работающих в условиях больших ускорений и по-
повышенных температур.
Кремниевые солнечные батареи применяют для зарядки аккумуля-
аккумуляторов питания электронной аппаратуры спутников и космических ко-
кораблей.
Кремниевые приборы используют в кибернетических машинах и
счетно-решающих устройствах.
Эпитаксиальные пленки кремния перспективны в микроэлектронике;
их применяют при изготовлении герметизированных сопротивлений, тон-
тонкопленочных конденсаторов, биполярных и униполярных транзисторов,
интегральных схем бытового и специального назначения.
Приборы, изготовленные на кремниевых кристаллах, нашли приме-
применение в ядерной физике, инфракрасной оптике и других областях тех-
техники.
Силовые кремниевые вентили, характеризующиеся высоким коэффи-
коэффициентом полезного действия, стабильностью работы в интервале темпе-
температур от —60 до +200 "С, простотой в эксплуатации, применяются в
выпрямляющих устройствах, используемых на электрофицированных
железных дорогах.
Исключительно важное практическое значение имеют и некоторые
соединения кремния.
Карбид кремния служит для изготовления полупроводниковых дио-
212
дов и транзисторов, термисторов, предназначенных для работы при
высоких температурах, а также детекторов ядерных частиц.
Светодиоды из карбида кремния обладают достаточной интеисив«
постью свечения при незначительном потреблении энергии и дают ши-
широкий спектр свечения, характеризуются также радиационной стой-
стойкостью.
Это соединение входит также в состав высокотемпературных термо-
термопар карбид кремния—карбид бора, развивающих при 2000 °С т. э. д. с.
до 600 мкВ/град.
Кварцевое стекло (SiCb) — незаменимый материал для получения
высокочистых полупроводниковых веществ. Это стекло имеет ничтожно
малый температурный коэффициент линейного расширения, отличается
высокой огнеупорностью, кислотостойкостью. Пленки, получающиеся при
окислении кремния, также представляют собой кварцевое стекло. Они
служат основным маскирующим и изолирующим средством при созда-
создании интегральных схем, а в МОП (металл — оксид — полупроводнико-
полупроводниковая структура)-структурах также выполняет роль активных элементов
твердой схемы. SiO2 является основным сырьевым материалом в произ-
производстве технического кремния.
Некоторые соединения кремния с переходными металлами использу-
используются при создании сверхпроводящих материалов.
Кремний входит в состав многих сплавов железа и цветных метал-
металлов, придавая им коррозионную стойкость, высокие литейные и меха-
механические свойства.
4.3. ГЕРМАНИЙ [1—35, 156—158. 162—167]
Общие сведения и методы получения
Германий (Ge) — элемент серовато-белого цвета в компактном состоя-
состоянии и серого в диспергированном. Существование и свойства этого эле-
элемента предсказаны в 1871 г. Д И. Менделеевым, который назвал его
экасилицием. Новый элемент был открыт А. Винклером в 1886 г. во
Фрайберге (Германия) в минерале аргиродите 4Ag2S^GeS2 и назван гер-
германием в честь роднны ученого. Практический интерес к этому элементу
возник в период второй мировой войны в связи с развитием полупровод-
полупроводниковой электроники. Начало промышленного производства германия
относится к 1945—1950 гг.
Содержание германия в земной коре составляет 7-10~4 % (по массе).
Основное количество элемента находится в рассеянном состоянии в си-
силикатах, сульфидах н минералах, представляющих собой сульфосоли.
Известно несколько минералов типа сульфосолей с высоким содержани-
содержанием германия, которые не имеют промышленного значения: аргнродит—
Ag8QeS6 E—7%), германит Cu3(Fe, Ge, Ca, Zn) (As, SL F—10%),
рениернт (Си, FeK(Fc, Ge, Zn, Sn) (S, AsL F,37—7,8%). Источниками
получения германия являются сульфидные руды, а также малометамор-
физированные угли и некоторые железные руды (до 0,01 % Ge).
В зависимости от состава исходного сырья применяют различные
способы его первичной обработки:
— выщелачивание серной кислотой с последующим выделением гер-
германия из растворов;
— сульфатизирующий обжиг материалов;
— возгонка сульфида GeS или монооксида GcO в восстановительной
среде;
— сульфатизирующий обжиг материала;
— восстановительная плавка в присутствии меди или железа;
— экстракция;
213
— ионообменная сорбция.
Германиевые концентраты могут быть выделен л из растворов сле-
следующими способами:
— осаждение в виде малорастворимых соединений;
— соосаждение с гидратами железа, цинка, с сульфидами цника,
меди и т. д ;
— осаждение из сернокислых растворов на цинковой пыли (цемен-
(цементация).
С целью получения четыреххлористого германия германиевые кон-
концентраты обрабатывают концентрированной соляной кислотой в токе
хлора. Образующийся тетрахлорид германия (QeCI4) отгоняют от хло-
хлоридов металлов, имеющих более высокие температуры кипения В ре-
результате гидролиза очищенного четыреххлористого германия получа-
получают диоксид германия QeO2 Элементарный германий получают восста-
восстановлением очищенного и просушенного диоксида чистым водородом.
Восстановленный германий подвергают дальнейшей очистке от примесей
фракционной кристаллизацией Из высокочистого германия методом
зонной плавки или по способу Чохральского выращивают монокристал-
монокристаллы с заданными электрофизическими свойствами. Промышленность вы-
выпускает поли- и монокристаллический германий. Поликристаллический
(зоииоочищенный) германий изготовляют трех марок: ГПЗ-1, ГПЗ-2
и ГПЗ-3 по ГОСТ 16154—80.
Германий марки ГПЗ-1 предназначен для получения монокристалли-
монокристаллического иелегированного и легированного германия, а также специаль-
специальных целей, марки ГПЗ-2 — для получения монокристаллического леги-
легированного германия и других целей, марки ГПЗ-3 — для получения
сплавов и заготовок для оптических деталей. Германий поставляется в
виде слитков в форме сегмента, каждый из которых упаковывают в по-
полиэтиленовый пакет. Слиток в полиэтиленовой упаковке помещают в
картонную или пластмассовую тару и уплотняют мягкой прокладкой,
обеспечивающей сохранность его при транспортировке и хранении. До-
Доставка осуществляется любым видом крытого транспорта.
Германий монокристаллический выпускается по ГОСТ 16153—70.
Монокристаллы германия выпускают электронного типа проводимости,
легированные сурьмой, и дырочного типа проводимости, легированные
галлием. Ориентация слитков [111].
Условия поставки и хранения монокристаллов германия такие же,
как и для зонноочищенного поликристаллического германия.
Физические свойства
Атомные характеристики Атомный номер 32, атомная масса 72,59 а е м ,
атомный объем 13,64-Ю^6 м3/моль, атомный радиус 0,139 нм, ионный
радиус Qe2+ 0,065 нм, Ge4+ 0,044 нм. Электронное строение свободного
атома германия 4s2p2. Потенциалы ионизации / (эВ): 7,88; 15,93; 34,21.
Электроотрицательность 2,0. Кристаллическая решетка германия — ку-
кубическая типа алмаза с периодом а = 0,5657 нм. Энергия кристалличе-
кристаллической решетки 328,5 мкДж/кмоль. Координационное число 4. Каждый
атом германия окружен четырьмя соседними, расположенными на оди-
одинаковых расстояниях в вершинах тетраэдра. Связи между атомами осу-
осуществляются спаренными валентными электронами. При высоких дав-
давлениях A3,0 ГПа) германий может перейти в тетрагональную сингонию
с.параметрами: а=0,593 нм, с=0,698 нм, с/а= 1,18.
Изотопный состав германия:
Массовое число ... 70 72 73 74 76
Распространенность в
природе, % 20,55 27,37 7,67 36,74 7,67
214
Радиоактивные нзотопы германия:
Массовое
число
65
66
67
68
69
71
75
77
78
Период
полураспада
90 с
8,7 с
1200 с
250 сут
40 лет
11,4 сут
82 мин
11 лет
1,5 года
Р+-
Р+-
Р+.
/С-з*
К-з;
К-з
D—
Р-.
Р-.
3
{
2
0
Форма и энергия излучения, МэВ
, 4
,7; 2,9; у 0,159; 0,214
* К-з — К-захват.
Эффективное поперечное сечение захвата тепловых нейтронов
2,8-10~28 м2. Работа выхода электронов монокристаллнческого германия:
ф=4,75н-4,95 эВ A11) (образец n-типа), ф=4,80 эВ A11) (образец
р-типа).
Плотность. Плотность германия, определенная рентгеновским мето-
методом, р = 5,324 Мг/м3, пикнометричеекпм р = 5,3234 Мг/м3 B98 К). Умень-
Уменьшение обьема при плавлении 5,5 %.
Плотность р германия в жидкой фазе:
Т. к
р. Мг/м3
Г, К
р, Мг/м»
Т, К
р. Мг/м»
1218
1251
5,51
5,49
1283
1403
5,46
5,41
1573
1673
1873
5,31
5,26
5,17
Электрические и магнитные свойства. Удельное электрическое сопро-
сопротивление монокристаллического высокочистого германия при 298 К
р=0,48-^0,60 Ом-м.
Удельное электрическое сопротивление р и удельная электрическая
проводимость а поликристаллического германия при различных темпе-
температурах:
т, к . .
р, Ом • м
а, См/м •
293
0,65
1,54
593
7,0-10-*
1,47-103
1273
1.5-10—в
6,7-10*
Температурный коэффициент электрического сопротивления при
273 К «=1,4-10-» К-1.
Относительное изменение электрического сопротивления германия вы-
высокой чистоты в зависимости от давлении Р:
215
Р, МПа
196
392
587
Др/р
303 К
+0,0261
+0,0566
+0,0911
,?48 К
+0,0287
+0,0610
+0,0981
Р, МПа
785
981
1177
Др/р
зоз к
+0,1297
+0,1761
+0,2283
348 К
+0,1434
+0,19Р6
+0.2609
Удельная электрическая проводимость германия а в жидкой фазе:
Т, К- . .
а, МСм/м
1218
1,52
1233
1,51
1251
1,66
1268
1,6
1363
1,51
1403
1,3о
1573
1,12
Абсолютный коэффициент т.э.д.с. е= + 600-=-800 мкВ/К при 298 К.
Т.э.д.с. по отношению к платине при температуре горячего спая 173,16 К
Е——26620 мкВ, при 373,16 £=+33900 мкВ (температура холодного
спая 273 К).
Абсолютный коэффициент т. э. д. с. германия е в жидкой фазе:
т.к..
е, мкВ/К
1233
—3,8
1243
—0,5
1251
-1,7
1268
—2,7
1283
—5,7
1363
-1,1
Постоянная Холла R:
Т, К- •
R, м3/Кл
293
+ 10-1
500 1000 1213—1283
-+10—* —0,3-Ю-' —0,36-10-"
Ширина запрещенной зоны: при Г=0 К А£0=0,785 эВ; при Г=300 К
А£=0,66 эВ, в зависимости от температуры dEfdT——4,4 -10~4 эВ/К, в
зависимости от давления dE/dP——0,51 • Ю-10 эВ/Па.
Эффективная масса электронов mn=l,58m0) эффективная масса ды-
дырок гор=0,379т0.
Подвижность электронов ц„=0,38-т-0,39 м2/(В-с), подвижность ды-
дырок цр = 0,18-^0,19 м2/(В-с).
Концентрация носителей тока электронов и дырок 1018 м~3.
Собственная концентрация носителей электронов 1,76-1016
7-3/2 е-0,78/2кТ_
Диэлектрическая постоянная статическая (низкочастотная
е5=15,8-И6.
Критическое давление, необходимое для перевода германия в метал-
металлическое состояние, 11,772 ГПа.
Магнитная восприимчивость в твердой фазе %= A,434±0,004) • Ю-9,
Магнитная восприимчивость в жидкой фазе:
т, к
1218
1233
1243
х- ю»
—0,088
—0,090
—0,091
1268
1283
1363
—0,092
—0,092
—0,092
7", К
1403
1458
х ■ ю»
—0,092
—0,092
216
Тепловые и термодинамические. Температура плавления /пл = 937°С,
температура кипения /„пп=2847оС, удельная теплота плавления
Д//„л = 443 кДж/кг, удельная теплота испарения Д//исп —4700 кДж/кг,
удельная теплота сублимации ДЯСубл=5223 кДж/кг. Характеристиче-
Характеристическая температура 0D = 4O6 К.
Молярная энтропия s° при различных температурах:
т
«°,
т,
К • •
Дж/(моль •
К .
Дж/(моль •
К) ■ •
К) '• '
298
31,09
2000
109,03
500
43,81
1
1000
62,55
2500
15,56
15 000
100,59
3000
120,92
Давление пара р в зависимости от температуры:
т,
р,
т,
р,
к ...
Па ...
к ...
Па ...
1092
12,95-10-'
12
12,
1687
,95-Ю-3
1230
95- Ю-5
1422
12,95- Ю-3
Продолжение
2075
12,95-10
Удельная теплоемкость при 298 К ср = 322,66 кДж/(кг-К).
Теплопроводность к (кристалл я-типа):
Т, К 273 ' 370 750 900 1210 1350 1500
X, Вт/(м • К) • • 60,7 50,25 33,7 26,0 25,0 26,7 28,0
Теплопроводность X
Т, к
0,6
7
10
40
X, Вт/(м • К)
0,01
135
170
760
(кристалл
Г, К
80
120
160
200
р-тнпа):
%, Вт/(м . к)
320
180
120
100
т. к
300
500
800
%, Вт/(м • К)
57
33,0
18,0
Температурный коэффициент линейного расширения при 298 К
« = 5,75-Ю-6 К, в интервале 73—273 К а = 4,5-106 Кг1, в интервале
273-533 К а=5,8.10-6 К.
Коэффициент самодиффузии (предэкспоыенциальный множитель) гер-
германия £>о= A0,8±2,4) -Ю-4 е~3'02/к7" м2/с, монокристаллического герма-
германия в интервале 1053—1203 К А>=7,8-10-4 м2/с
Энергия активации £=286,8 кДж/моль.
Параметры взаимной диффузии — преэкспоиенциальный множитель
А) и энергия активации Е (образующаяся фаза — твердый раствор):
217
Диффундирую-
Диффундирующий элемент
и
Li
Be
В
0
Р
Ti
Ti
Fe
Со
Ni
Си
Zn
Ga
As
A(?
In
Sn
Sb
Те
Та
Аи
т. к
973—1173
993—1197
973—1173
973—1173
1073—1203
373—488
1042—1203
973—1173
973—1173
973-1173
973—1173
973—1173
973—1173
1003—1233
973—1173
973—1173
973—1173
1043—1173
1023—1173
—
О„, м2/с
2,72-Ю-7
1,3-Ю-6
0,5-Ю-4
1,6-10ь
0,17-Ю-4
2,5-Ю-4
0,17
2,9-10-'
0,13-Ю-4
0,16-Ю-4
0,8-Ю-4
1,9-Ю-8
5,7-10—в
40-10—*
6,3-Ю-4
4,4-10-*
3-Ю-6
1,7-Ю-6
4,0-Ю-4
6,0-Ю-4
2,5-Ю-10
2,25-Ю-2
Е, кДж/моль
36,43
44,80
238,65
439,65
123,6
238,65
327,4
69,92
104,67
108,02
86,67
17,58
240,74
72,2
232,79
96,3
232,37
182,96
232,8
234,46
111,79
240,74
Кинематическая
т, к
1218
1233
1243
v • 10". м
0,135
0,131
0,124
ВЯЗКОСТЬ V
т, К
1251
1268
1283
жидкого германия:
V • 10°, м7с
0,122
• 0,119
0,116
т, к
1363
1403
1458
v ■ 10', м2/е
0,106
0,101
0,098
Поверхностное натяжение при 1233 К а = 600 мН/м.
Энергия дефекта упаковки кубической сингонии (алмаз) 90 мДж/м2.
Оптические свойства. Отражательная способность (коэффициент от-
отражения пв):
X., мкм
0,062
0,082
0,124
"о. %
5
32
48
Угол падения
20
20
20
X, мкм
0,155
0,365
0,365
52
50
100
Угол падения
20
0
90
Примечание. Отражательную способность определяли на пленочных
образцах.
218
Показатель преломления п монокристалла в зависимости от длины
волны Я:
к, мкм. 0,412 0,495 0,620 2,0—10,0 70—330
п. . . . 3,7 4,0 5,2 4,1—4,0 4,0
Показатель преломления германия п, определенный па пленочных об-
образцах:
X, мкм
0,012—0,041 0,240 0,620 1,2 2,0 4,0 7,0
0,9 !,2 4,8 4,7 4,3 4,2 4,0
Показатель поглощения %, определенный на пленочных образцах:
Л, мкм 0,012—0,031 0,248 0,495 0,620
У, ■ ■ 0,4 4,3 2,6 ! ,5
Показатель % поглощения монокристалла германия:
А, мкм
X ■ • •
0,412 0,435 0,546 0,620
2,3 2,7 1,75 1,2
Коэффициент а, поглощения монокристалла германия:
'к, мкм . . ,
а ■ 10-6, м-1
1,3 1,5
0,6 0,15
2,0
0,08
2,5—6,0
0,02
Механические свойства
Твердость (по Кнуппу) при различных температурах:
Л °С
600
650
700
750
нК, мпа
1727
1472
814
785
/, °с
800
850
900
910
НК, МПа
491
363
314
265
t, "С
930
940
950
Нц, МПа
294
285
235
Временное сопротивление а^ж и укорочение е при сжатии1
и °с
, МПа
Характер разрушения
20
400
700
800
900
940
121,6
191,1
67,7
59,8
65,7
63,8
(8=12,5%)
(e=23 %)
Хрупкий
Не разрушился*
То же
• Доведен до появления первой трещины.
219
Механические свойства монокристаллнческого германия [111] при
растяжении:
t, 'С 550-000 700
о„ МПа — 102
6, % 1—2 35
Примечание Чистота монокристалла харак-
характеризуется удельным электросопротивлением от
2-10 ~2ло 0,2 Ом-м.
Коэффициенты упругости монокристаллов:
t, °c
-200
0
Коэффициент упру-
упругости, ГПа
Си
131,5
129,3
с„
49,5
48,5
Си
684
67,2 |
t, "С
200
300
Коэффициент упру-
упругости. ГПа
си
126,5
125,1
ГЦ
47,6
47,2
Си
65,8
65,1
Химические свойства
В соединениях германий проявляет степень окисления +2 и +4, ре-
реже + 1 и +3. Нормальный электродный потенциал реакции Ge—2е«=£
*±Ge2+ фо=— 0,45 В.
В атмосфере сухого воздуха германий покрывается тонким слоем
оксидов толщиной около 2 нм, но не изменяет при этом своего цвета.
Во влажном воздухе германий, особенно поликристаллический, посте-
постепенно тускнеет. Заметное окисление начинается при 500 °С.
В ряду напряжений германий располагается после водорода — между
медью и серебром. Германий не взаимодействует с водой и не раство-
стся в разбавленной и концентрированной соляной кислоте. Растворя-
Растворяется в горячей концентрированной серной кислоте с образованием
Ge(SO4b и выделением SO2. При взаимодействии с азотной кислотой
образует осадок диоксида германия xGeO2-(/H2O. Хорошо растворяется
в царской водке и смеси HF+HNO,. Лучшим растворителем для гер-
германия является щелочной раствор пероксида водорода. Быстро раство-
растворяют германий расплавленные едкие щелочи. При этом образуются гер-
маиаты щелочных металлов, гидролизующиеся водой.
Диоксид GeO2 может быть получен прокаливанием германия на воз-
воздухе, прокаливанием сульфидов, растворением элементарного германия
в 3 %-ном пероксиде водорода в платиновом тигле с последующим вы-
выпариванием раствора и прокаливанием остатка. GeCb существует в двух
полиморфных модификациях: низкотемпературной а с тетрагональной
решеткой A123°С) и высокотемпературной E с гексагональной решеткой
(выше П23°С). Температура плавления GeO2 1725°С. При плавлении
образуется прозрачный расплав. Диоксид германия растворяется в воде
с образованием германиевой кислоты НайеОз, легко переводится в раст-
раствор щелочами с образованием солей германиевой кислоты — германатов.
При действии пероксида водорода на концентрированные растворы ''ер-
манатов получаются соли надгерманиевых кислот, образующие кристал-
кристаллогидраты, например Na2GeO5-4H2O.
Оксид GeO образуется при прокаливании германия с ограниченным
доступом воздуха или как промежуточный продукт при восстановлении
диоксида. GeO метастабилен и легко возгоняется выше 700 "С. Раствори-
Растворимость кислорода в германии описывается уравнением: lg Cmax=2,70—•
6050// E80—800 °С). Растворенный и расположенный в междоузлиях
220
монокристаллического германия кислород является электронейтральным
и вызывает инфракрасную абсорбцию при 11,7 мкм. Методом инфра-
инфракрасной абсорбции установлено образование пар кислорода с углеродом
в монокристаллах германия.
Имеется несколько соединений германия с водородом. Установлено
существование GeH — темного, легко взрывающегося порошка. Известны
также соединения типа германов GenHzn+z (например, Ge2H4, Ge2H6),
которые прн малых значениях п являются летучими. Моногерман
GeH4—бесцветный газ с температурой кипения 88,9 °С. Днгерман и трн-
герман при комнатной температуре и обычном давлении существуют в
жидкой фазе. Растворимость водорода в германии при 800 °С не пре-
превышает 1,5-10-7 % (ат.).
Углерод практически нерастворим в германнн. В жидком германнн
вблизи температуры плавления растворимость углерода оценивается в
0,23 % (ат-Ь По данным различных авторов определена концентрация
углерода в монокристаллическом германии от 7 -10—4 до 5,2 -10~3 %.
При нагреве германия до 700—750 °С в азоте или NH3 образуются
СезЫ4 и Ge3N2. Нитрид германия Ge3N2 представляет собой темно-корич-
темно-коричневые кристаллы, легко подвергающиеся гидролизу. Термический распад
на элементы начинается при 500 °С. Более стабилен нитрид Ge2NT4, кото-
который разлагается выше 1000 °С.
Непосредственное взаимодействие германия с галогенами начинается
около 250 °С. Наибольшее практическое значение имеет тетрахлорид
GeCU — основной промежуточный продукт при получении полупроводни-
полупроводникового германия. С иодом германий образует иодид Gel4 — вещество
желтого цвета с температурой плавления 146 °С и температурой кипения
375 "С. Gel4 используется для получения высокочистого германия мето-
методом транспортных реакций. Галогениды неустойчивы к воде.
Из соединений с серой известен дисульфид GeS2, который выделяет-
выделяется из сильнокислых растворов солей четырехвалентного германия при
пропускании интенсивного тока сероводорода. Кристаллический GcS2
представляет собой белые чешуйки с перламутровым блеском, расплав
застывает в янтарно-желтую прозрачную массу н обнаруживает полу-
полупроводниковые свойства Температура плавления GeS2 —825 °С. Моно-
Моносульфид германия GeS существует в аморфном и монокристаллическом
состояниях. Кристаллический GeS темно-серого цвета, плавится при
615 °С. Все халькогениды германия (сульфиды, селениды и теллуриды)
обнаруживают полупроводниковые свойства. С фосфором германии
дает соединение GeP.
Большинство систем германий — металл относится к эвтектическому
типу. Ниже приведены эвтектические температуры, разности между
температурами плавления и эвтектической температурой, а также состав
эвтектик в системах германий — металл:
Элемент
AI
Ga
In
Tl
Sn
Pb
As
'С
697
30
157
304
232
327
726
AT
236
0,007
0,2
0,3
0,9
0,1
78
0,28
5-10—5
5 • 10—4
4-10-4
0,003
2-10-*
0,58
Элемент
Sb
Bi
Cu
Ag
Au
Zn
Cd
590
571
644
654
356
398
324
ДГ
40
0,05
434
310
707
22
1,0
0,18
2-10-"
0,°6
0,25
0,27
0,044
0,002
221
Растворимость различных металлов в германии при некоторых тем-
температурах:
Металл
А1
Ga
Sn
As
Sb
Растворимость, ат-см ,
при температурах, °С
450
5,0- Ю2»
5,1-1020
3,6-102»
4,1-Ю18
850
4,0-102»
4,2-Ю29
2,0-102»
6,8-Ю19
1,4-1018
Металл
Си
Аи
Zn
Fe
Растворимость ат-см 3,
при Температурах, °С
450
1,2-Ю18
850
3,2-10"
7,0-1015
2,3-1018
1,5-1015
При взаимодействии с металлами, особенно переходными (железо,
никель, кобальт, марганец), наблюдается образование соединений —
германидов. Большинство германидов характеризуется преимуществен-
преимущественной металлической связью.
Системы германий — металл характеризуются ограниченной взаим-
взаимной растворимостью (твердые растворы замещения). При этом раство-
растворимость германия в металле больше, чем растворимость соответствую-
соответствующего металла в германии. Единственный элемент, с которым германий
образует непрерывный ряд твердых растворов, — кремний. Большинство
систем германий-—металл характеризуется наличием ретроградного
солидуса (со стороны германия).
Технологические свойства
Германий характеризуется сравнительно высокой твердостью, большой
хрупкостью и потому не может быть подвергнут холодной обработке
давлением. Деформирование возможно при температурах, близких к
температуре плавления, и в условиях всестороннего неравномерного
сжатия.
С помощью алмазной пилы слиток германия может быть распилен
на тонкие пластинки. Поверхность пластин шлифуется тонким корундо-
корундовым порошком на стекле и полируется на сукне с суспензией из окиси
алюминия.
Области применения
Германий играет исключительную роль в радиоэлектронике. Его приме-
применяют для изготовления кристаллических выпрямителей (диодов) и кри-
кристаллических усилителей (триодов), которые используются в вычисли-
вычислительной технике, телемеханике, радарных установках и т. д.
На основе германия созданы также мощные выпрямители с высо-
высоким к. п. д. для выпрямления переменного тока обычной частоты, рас-
рассчитанные на силу тока до 10000 А н выше.
Германиевые триоды широко используются для усиления, генериро-
генерирования или преобразования электрических колебаний.
В радиотехнике получили распространение пленочные сопротивления
от 1000 Ом до нескольких мегаом.
Благодаря значительному изменению проводимости под действием
излучения германий используется в различных фотодиодах н фотосо-
противленнях,
222
Германий находит применение для изготовления термистеров (при
этом используется сильная температурная зависимость электросопротив-
электросопротивления германия).
В ядерной технике применяются германиевые детекторы уизлУче"
ния.
Германиевые линзы, легированные золотом, являются неотъемлемой
частью приборов инфракрасной техники. Из диоксида германия изго-
изготовляют специальные оптические стекла с большим коэффициентом
преломления. Германий вводят также в состав сплавов для высокочув-
высокочувствительных термопар.
Значительно увеличивается потребление германия в качестве катали-
катализатора в производстве искусственного волокна.
Ряд соединений германия с переходными металлами имеет высокую
температуру перехода в сверхпроводящее состояние, в частности мате-
материалы на основе соединения Nb3GeG\,>22 К).
Предполагают, что некоторые органические соединения германия
биологически активны: задерживают развитие злокачественных образо-
образований, понижают кровяное давление, оказывают обезболивающее дей-
действие.
4.4. ОЛОВО П— 35, 50, 162, 167, 169, 170]
Общие сведения и методы получения
Олово (Sn) — серебристо-белый блестящий металл с голубоватым от-
оттенком. Известно с глубокой древности, начало промышленного приме-
применения относится к XIV в.
Содержание олова в земной коре 4-10~3 % (по массе). Всего извест-
известно 16 оловосодержащих минералов, представленных оксидами, сульфи-
сульфидами, силикатами, тиостаннатами, боратами, танталитами. Промышлен-
Промышленное значение имеют касситерит (оловянный камень) SnO2 и станнин
(оловянный колчедан) CuS-FeS-SnS2-
Олово получают из руд, содержащих касситерит; руды, содержащие
олово в виде станнина, в промышленном масштабе не разрабатываются.
Руду обогащают методами гравитационного разделения, флотации и
магнитной сепарации. Концентрат подвергают предварительной очистке
от примесей обжигом (для удаления серы н мышьяка), выщелачиванием
соляной кислотой (для удаления железа, висмута, сурьмы, мышьяка) с
последующим отделением магнетита и вольфрамита. Очищенный кон-
концентрат, содержащий 40—70 % Sn, плавят в смеси с углем и флюсами,
получая черновой металл.
Восстановительную плавку ведут в условиях, при которых оксид
олова (SnO2) восстанавливается до металла, а оксид железа (III) —до
оксида (II), переходящего в шлак. Из бедных концентратов олово из-
извлекают хлорированием, основанным на летучести хлоридов олова.
Для получения нз чернового олова металла стандартных сортовых
марок его подвергают рафинированию. Наиболее распространенные ме-
методы рафинирования — пирометаллургическое (огневое), вакуумное,
электролитическое.
Огневое рафинирование состоит из ряда последовательных операций,
в каждой из которых удаляется одна-две примеси. От железа черное
олово очищают медленным охлаждением расплава и отфильтрованием
выпадающих в осадок интерметаллидов, от меди — добавлением в рас-
расплав серы и отделением всплывающих ее сульфидов, от мышьяка и
сурьмы — введением в расплав алюминия н удалением всплывающих
иитерметаллидов AlSb и AlAs, от свинца — присадкой хлористого олова,
которое взаимодействует со свинцом, образуя удаляемый хлористый
223
Марка
Sn,
не менее
ХИМИЧЕСКИЙ
СОСТАВ, %
, ОЛОВА (ПО ГОСТ
360—75)
Примеси, не более
As
Fe
Си
РЬ
Bi
Sb
S
Zn
Al
сумма
определя
емых
примесей
ОВЧ-000
О1пч
01
02
Высшая категория качества
99,999
99,915
99,900
99,565
1-10-*
0,01
0,01
0,015
0,009
0,009
0,02
I ■ Ю-5
0,01
0,01
0,03
ью-3
0,025
0,04
0,25
5-10-6
0,01
0,015
0,05
5-Ю-5
0,015
0,015
0,05
0,008
0,008
0,016
0,002
0,002
0,002
3-10—*
0,002
0,002
0,002
О1пч
О1
02
ОЗ
О4
99,915
99,900
9,565
98,49
96,43
0,01
0,01
0,015
0,03
0,05
0,009
0,009
0,02
0,02
0,02
0,01
0,01
0,03
0,10
0,10
0,023
0,04
0,25
1,0
3,0
0,01
0,015
0,05
0,06
0,10
0,015
0,015
0,05
0,02
0,3
0,01
0,01
0,02
0,02
0,02
МО-3
0,085
0,1
0,435
Первая категория качества
0,085
0,1
0,435
1,51
3,51
Примечания. 1 По требованию потребителя массовая доля висмута в олове марки О1 должна быть не более 0,01 %
2. По согласованию потребителя с изготовителем в олове марок О1 и 02 первой категории допускается массовая доля свинца до
3 В олове марки ОВЧ, помимо указанных примесей, содержатся также 5-10"
Ga; 5-10 -
Ag; 1-10'
Аи; 1-10 ~
Со;
1-10
i; МО"
In.
свинец. Огневым рафинированием получают металл марки 01, повторе-
повторением цикла рафинирования — металл марки 01пч.
Вакуумная дистилляция позволяет наиболее эффективно удалять
свинец, висмут, а также заметное количество алюминия, кальция, индия.
При электролитическом рафинировании достигается высокое прямое
извлечение олова в катодный металл, основная масса примесей концент-
концентрируется при этом в одном продукте — шламе. Олово высокой чистоты
(99,999%) получают зонной плавкой в кварцевых или графитовых кю-
кюветах
Химический состав выпускаемых промышленностью марок олова по
ГОСТ 860—75 — см. табл. на с. 224
Олово всех марок изготавливают в виде чушек, олово марки
ОВЧ-000 — также в слитках, в виде прутков, а марок О1пч н 01—в
виде блоков, пригодных для механизированной транспортировки. Олово
следует хранить в закрытом помещении при температуре не ниже 12 °С.
В случае обнаружения на олове признаков «оловянной чумы» все слит-
слитки направляют на переплавку.
Физические свойства
Атомные характеристики. Атомный номер 50, атомная масса
118,69 а. е. м, атомный объем 16,29-10^в м3/моль, атомный раднус
0,158 iiv, ионный радиус Sn2+ 0,093 им, Sn'1+ 0,071 нм. Конфигурация
внешних электронных оболочек атома олова 5s2 5р2. Электроотрица-
телыюсть 1,8. Природное олово состоит из десяти изотопов: 112Sn
@,95%), 1I4Sn @,65%), II5Sn @,34%), Sn A4,24%), 1I7Sn G,57 %),
I18Sn B4,01%), u"Sn (8,58%), 120Sn C2,97%), 122Sn D,71%), I2"Sn
E,98 %). Последний изотоп слабо радиоактивен. Известно более десяти
искусственных радиоактивных изотопов олова-
Массовое
число
102
109
liO
111
113
Период
полураспада
0,167 сут
1080 с
0,171 с
2100 с
118 сут
Массовое
число
117 Ш*
119 m
121 m
121
123
Период
полураспада
14 сут
250 сут
400 сут
1,05 сут
2370 с
Массовое
число
124
125 m
125
126
127
Период
полураспада
136 сут
570 сут
9,9 сут
3000 с
5400 с
| — метастабильное состояние ядра.
Потенциалы ионизации атомов / (эВ): 7,332; 14,63; 30,7 эВ.
Сродство атома олова к электрону составляет 1,8 эВ, работа выхода
электрона <р=4,38 эВ. Эффективное поперечное сечение захвата тепло-
тепловых нейтронов 0,25-10 -2Э м2
Олово полиморфно, ниже температуры 13,2 °С существует а-модн-
фнкация (серое олово) с кубической решеткой типа алмаза и перио-
периодом решетки а=0,65043 нм, выше температуры !3,2°С устойчива |3-мо-
дификация (белое олово) с тетрагональной решеткой, имеющей перио-
периоды а=0,58312 нм, с=0,31814 нм, с/а=0,546. Энергия кристаллической
решетки 302 мкДж/кмоль. Переход {$->-а сопровождается резким
уменьшением плотности, в результате чего значительно (иа 25,6 %)
увеличивается удельный объем металла и он рассыпается в серый по-
порошок. Это превращение имеет наибольшую скорость при—33 °С,резко
225
ускоряясь в присутствии «зародышей» a-Sn, поэтому его н назвали
«оловянной чумой».
Плотность р белого олова при комнатной температуре 7,295 Мг/м3,
серого 5,846 Мг/м3.
Плотность олова при повышенных температурах:
Г, К 682 796 847 977
р, Мг/м3 6,834 6,761 6,729 6,640
При 499 К плотность твердого олова р = 7,184 Мг/м3, жидкого р =
=6,980 Мг/м3.
Электрические и магнитные. Удельное электрическое сопротивление
монокристаллического белого олова при 273 К составляет Рц с=
= 0,0909 мкОм-м, рлс =0,1308 мкОм-м. У поликристаллического оло-
олова высокой чистоты р = 0,115 мкОм-м, обычной чистоты 0,128 мкОм-м.
Удельное электрическое сопротивление р:
Г, К
89
195
273
293
р, мкОм-м
0,034
0,088
0,101
0,128
Г, к
364,5
473
498
508 (ж)
р, мкОм-м
0,182
0,203
0,220
0,476
Т, к
1023
1273
1773
р, мкОм • м
0,6122
0,636
0,805
Удельная электрическая проводимость:
Г, К 113 293 773
а, МСм'м 28,6 8,85 1,83
1273
1,47
1773
1,24
Изменение удельного электросопротивления при плавлении рж/ртв =
= 2,11.
Температурный коэффициент электрического сопротивления олова
при 273—373 К и=4,5-Ю-3 К, при 273 К 4,26-10~3 К", а для жид-
жидкого 0,565-Ю-3 К E05—1273 К). При 3,722 К олово переходит в
сверхпроводящее состояние. Абсолютный коэффициент т. э. д. с. олова
в твердой фазе при 273 К е=+0,1 мкВ/К, в жидкой е= —1,2 мкВ/К,
для монокристалла е=—0,7 мкВ/К (БпЦоси с) и е=—1,5 мкВ/К
(Sn_Lc). Постоянная Холла при комнатной температуре /?=—0,048Х
ХЮ-10 м3/Кл, при 523—573 К R=— 0,47- Ю-10 м3/Кл. Коэффициент
вторичной электронной эмиссии о"тах = 1,43 при ускоряющем напряже-
напряжении первичных электронов 0,6 кэВ.
Олово парамагнитно. Удельная магнитная восприимчивость % в за-
вшимости от температуры:
— для P-Sn
Т, К . . . 293 473 523 653 748
X - 10э . •. 0,026 0,0270 0,0361 0,0362 0,0362
— a-Sn
т \с
% • 10» '. ' '.
100 150 200 250 280
—0,267 —0,273 —0,289 —0,303 —0,312
— для монокристалла P-Sn при 293 К X ц с = 0,0241 -Ю"9,
= 0,0270-Ю-9.
226
Тепловые и термодинамические. Температура плавления олова Лы""
= 232 "С, температура кипения ^КИп=2270°С, характеристическая тем-
температура белого олова 0d=200 К, серого 212 К. Удельная теплота
плавления ДЯ„Л = 59,56 кДж/кг, удельная теплота испарения ДЯисп38
= 2446,7 кДж/кг, удельная теплота сублимации при 298 К А#субл=
= 2546 кДж/кг, теплота фазового перехода при 291 К 2,5 кДж/моль.
Молярная энтропия олова s° в зависимости от температуры:
К . . . .
Дж/(моль
К)
Т
К
Дж/(ыоль
К)
298
51,46
2000
123,00
500
66,44
1000
101,82
2500
129,83
1500
114,22
Продолжение
3000
23,40
Приведенный термодинамический потенциал Фт в зависимости or
температуры:
Г, К 298 500 1000 1500
Фг , Дж/(моль • К) .. 51,46 54,72 73,48 85,16
Продолжение
2000 2500 3000
93,57 100,19 107,39
Г, К
Фг , Дж/(моль • К) .
Удельная теплоемкость белого олова ср = 222 Дж/(кг-К), серого
217 Дж/(кг-К) (при 298,15 К и давлении 0,1013 МПа), при том же
давлении и температурах 1 К, 6 К и 10 К она равна 0,071; 5,32;
33,9 Дж/(кг-К) соответственно.
При других температурах удельная теплоемкость олова ср изменя-
изменяется следующим образом:
т, к
20
40
80
150
ср, Дж/(кг
B-Sn
107,84
172,71
206,25
К)
a-Sn
32,43
76,50
143,48
191,76
Т. К
250
400
600
1000
V
f» Sn
219,98
244,67
257,3
257,3
Дж/(кг К)
ce-Sti
214,0
244,67
257,3
257,3
Температурный коэффициент линейного расширения а:
Т, К 273 273—373 273—473
а- 106, К 21 26,2 31,6
Температурный коэффициент объемного расширения р жидкого
олова при давлении 0,1013 МПа в зависимости от температуры:
Т, К 505—673 673—973 505—1873
Р- 103, К-1 .... 0,105 0,105 0,10
Теплопроводность к олова в зависимости от температуры:
Г, К ИЗ 173 293 373 505 573 673 773
Я., Вт/(м • К) . 80,4 74 65 60 34,3 33,8 33,1 32,5
227
Температуропроводность а олова в зависимости от температуры:
Т, К 700 1000 1300
а ■ 10е, м2/с 17,0 16,8 16,6
Давление паров р олова в зависимости от температуры:
т. к
855
905
961
1024
1096
1
1
1
1
1
р,
,33
,33
,33
,33
,33
Пя
• ю-8
-10—'
• ю-6
-ю-5
■ ю-4
т, к
1179
1275
1387
1521
1685
г.
1,33
1,33
1,33
1,
13
Па
ю-3
ю-2
Ю-1
33
,3
т. к
1890
2155
2518
2995
Р. Па
1,33-102
1,33-103
1,33-10*
10,3-10*
Давление пара при температуре плавления 57,72-10~22 Па.
Поверхностное натяжение жидкого олова при 505 К а=554 мН/м,
поверхностная энергия v=704 мДж/м2.
Динамическая вязкость г\ в зависимости от температуры:
т, к
505
573
673
773
г], мПа-с
1,81
1,54
1,30
1,14
т. к
873
973
1073
1123
1\. мПа-с
1,04
0,95
0,89
0,86
т, к
1173
1273
1473
1573
ц. мПа-с
0,84
0,80
0,76
0,74
Параметры диффузии (предэкспоненциальный множитель Do и энер-
энергия активации Е):
Направление диффу-
диффузии Поликристалл, по 1 оси с \\ оси с
объему
Г К 403—528 433—500 433—500
А,-'О4, м2/с .... 0,78 10,7 7,7
Е, кДж/моль . . . 93,5 105 !07,2
Оптические. Отражательная способность (коэффициент отражения
пю) полированного олова в зависимости от длины волны X:
),, мкм 1,0 2,0 4,0 7,0 10,0 12,0
nD 54 61 72 81 84 85
Показатель преломления п тюликристаллического олова в зависи-
зависимости от длины волны К:
I, мкм .... 0,257 0,298 0,398 0,502 1,62
п 1,117 1,037 0,176 0,780 1,243
Показатель поглощения % поликристаллического олова в зависимо-
зависимости от длины волны %:
X, мкм . ... 0,257 0,298 0,398 0,505 0,62
х 3,333 2,762 1,906 3,575 4,789
228
Полная излучательная способность (интегральный коэффициент из-
излучения) олова ет 0,043 (при 300 К) и 0,05 (при 375 К).
Механические свойства
Модуль нормальной упругости Е олова в зависимости от температуры:
t, °С .
Е, ГПа.
—180
65,0
0
55,0
100
48,0
300
36,0
Модуль сдвига 0=16,8-5-18,1 ГПа, предел упругости сту = 1,5 МПа,
предел текучести литого олова Сто,2= 12 МПа, временное сопротивление
при растяжении литого олова ств=19—21 МПа, отожженного 17 МПа,
сопротивление срезу (литого) тср=20 МПа, относительное удлинениг
литого олова 5=45-f-60 %, отожженного 80—90 %. Временное сопротив-
сопротивление при сжатии СТдЖ=13,7 МПа, Твердость по Бринеллю литого ол >-
ва ЯВ = 49-^51 МПа; деформированного НВ-75 МПа (при 20°С), а
отожженного при 50 °С в зависимости от температуры:
НВ, МПа'
20
60
50
41
177
18
210
14
По данным ряда работ, выше 170°С олово становится хрупким,
Свойства олова чистотой 99,8 % в зависимости от температуры ис-
испытания:
t, "С
20
50
100
МПа
27,5
17,5
10,5
в, %
40
45
45
Ф. %
74
72
84
нв
МПа
76
60
41
t, °с
150
180
207
МПа
6,5
4,5
2,5
6, %
4!
10
0
Ч>. %
97
12
0
ни
МГ,|
2.3
1«
14
Высокотемпературная хрупкость олова вблизи температуры плавле-
плавления обусловлена примесями.
Механические свойства олова высокой чистоты (марки ОВЧ000) в
зависимости от температуры:
t, °C 20 !00 160 220
ств, МПа 14,7 11,4 7,3 1,9
сто,2, МПа .... 6,0 6,0 4,0 1,0
б, % 65 64 55 52
Механические свойства литого олова чистотой 99,74 % при низких
температурах:
t, "С 17 —196 -253
ств, МПа 36 71 73
б, % 29 4 0,6
ф, % 91 4 0
Олово высокой чистоты сохраняет хорошую пластичность (8=100%)
даже при низких температурах.
Коэффициент Пуассона олова v=0,330. Сжимаемость к=1,94-10-'1
Па-, скорость распространения звука в олове равна 2500 и 2270 м/с
при 281 и 505 К соответственно.
229
Химические свойства
В соединениях проявляет степень окисления +2 и +4. Нормальный
электродный потенциал реакции Sn—2e**Sn2+ фо=—0,136 В, окисли-
окислительно-восстановительный потенциал +0,15. Электрохимический эквива-
эквивалент олова составляет 0,61388 мг/Кл (степень окисления +2); 0,30833
мг/Кл (степень окисления +4).
В атмосферных условиях олово устойчиво, скорость коррозии в за-
закрытом помещении 0,0004 г/(м2-сут), в промышленной атмосфере
0,0067 г/(м2-сут), в морской атмосфере 0,011 г/(см2-сут).
В мягкой пресной н дистиллированной воде олово не корродирует,
в жесткой воде при рН = 7,4 и 8,6 скорость коррозии соответственно
равна 0,001 н 0,0045 г/(м2-сут). В минеральных и галогеноводородных
кислотах олово в присутствии кислорода и при повышенной температу-
температуре корродирует быстро. Плавиковая и циаинсто-водородная (синильная)
кислоты действуют на олово медленно; в лимонной и уксусной кисло-
кислотах при концентрации их ~0,75 % и комнатной температуре скорость
коррозии 0,05—0,1 г/(м2-сут). В молочной и масляной кислотах кон-
концентрацией ~1 % при комнатной температуре коррозия незначительна.
Олеиновая, стеариновая и щавелевая кислоты сильно действуют на оло-
олово при высоких температурах. Коррозия олова под воздействием фрук-
фруктовых соков при комнатной температуре составляет 0,1—2,5 г/(м2-сут),
при температуре кипения возрастает более чем в 10 раз. Смазочные ма-
масла, бензин, керосин на олово практически не влияют. Олово сильно кор-
корродирует в хлоре, броме и иоде при комнатной температуре, а во фторе
при температуре выше 100 °С.
Разбавленные соляная и серная кислоты слабо взаимодействуют с
оловом. В концентрированных растворах этих кислот, особенно при на-
нагреве, олово быстро растворяется.
При взаимодействии олова с соляной кислотой образуется хлорид
олова (II), а с серной — сульфат олова (IV). С азотной кислотой олово
взаимодействует тем интенсивнее, чем выше концентрация кислоты и
температура; в случае разбавленной кислоты образуется нитрат олова
(II) [Sn(NO3J], а в случае концентрированной — соединения олова
(IV), в основном нерастворимая р"-оловянная кислота (HiSnO3).
Концентрированные щелочи также растворяют олово, прн этом об-
образуются станниты — соли оловянистой кислоты H2Sn02.
На воздухе при комнатной температуре олово не окисляется, благо-
благодаря наличию поверхностной пленки SnO2. Выше 150°С окисляемость
увеличивается с образованием SnO и SnO2.
Оксид олова (II) SnO черного цвета, плотность 6,446 Мг/м3, темпе-
температура плавления 1040"С, температура кипения 1425°С. При нагреве
до 400—500 °С SnO легко переходит к оксид олова (IV) SnO2. Оксид
олова (IV) представляет собой белый порошок плотностью 7,009 Мг/м3;
температура плавления около 2000 °С.
Сера, сероводород и сернистый газ образуют с оловом сульфиды
SnS, Sn2S3; SnS2.
Сульфид олова (II) SnS получают нагреванием олова с серой и уг-
углем примерно до 900 °С. SnS — твердое вещество синевато-черного цве-
цвета, плотность 5,080 Мг/м3, температура плавления 880 °С, температура
кипения 1270°С.
Сульфид олова (IV) SnS2 получают в виде золотисто-желтых пла-
пластинок нагреванием амальгамы олова с серным цветом и хлористым ам-
аммонием до ~300°С, а аморфный — нагреванием в инертном газе аморф-
аморфного SnS с серой при —450 °С.
Сульфид олова S112S3 — синевато-черные кристаллы; выше 640 °С раз-
разлагаются на SnS и S.
230
Хлорид олова (II) SnCb получают растворением олова в концентри-
концентрированной соляной кислоте; из растворов оно кристаллизуется в виде бе-
белых кристаллов SnCl2-2H2O. Плотность SnCb 3,950 Мг/м3; температура
плавления 247°С, температура кипения 652°С. Хлорид олова (IV)
SnCl4—бесцветная жидкость, сильно дымящая на воздухе, температура
кипения 114 °С, температура плавления —33 °С, плотность 2,230 Мг/м3;
хлорид олова (IV) получают действием сухого хлора на жидкое олово.
Другие галогениды Sn (II) и Sn (IV) по способам получения и
свойствам во многом сходны с хлоридами.
Гидрид олова SnH4 можно получить, воздействуя на кислые раство-
растворы солей Sn (II) цинком. Это бесцветный ядовитый газ; он сжижается
при —52 °С, а при комнатной температуре постепенно разлагается на
олово н водород.
С азотом и аммиаком олово не реагирует, поэтому карбиды олова
получают косвенным путем.
С фосфором олово образует белые кристаллические нерастворимые
в воде фосфиды: SnP, SnP3, БгцРз плотностью 6,560, 4,100 и 5,181 Мг/м3
соответственно.
С углеродом, бором, молибденом, осмием, рением и вольфрамом
олово не взаимодействует. С алюминием, висмутом, кадмием, галлием,
германием, индием, свинцом, кремнием, таллием и цинком образует про-
простые эвтектические смеси. В твердом состоянии заметно растворяются
в олове висмут, кадмий, индий, свинец, сурьма и циик. Многие металлы
в твердом олове практически не растворяются, но образуют металличе-
металлические соединения.
Технологические свойства
Олово хорошо поддается выдавливанию на прутки и проволоку, а
также прокатке и ковке. Волочение и вытяжка затруднены, так как оло-
олово не упрочняется при комнатной температуре, что приводит к обрывам
в местах уменьшенного сечения При изготовлении фольги для улучше-
улучшения обрабатываемости давлением добавляют сурьму. Линейная усадка
олова 2,7 %, объемная усадка 2,8 %, жидкотекучесть 80 см. Обрабаты-
Обрабатываемость резаиием олова удовлетворительная, свариваемость хорошая,
возможна пайка мягким припоем.
Рекристаллизация деформированного олова начинается при комнат-
комнатной температуре; температура рекристаллизации олова при наличии при-
примесей сурьмы, свинца, висмута, меди и алюминия повышается в порядке
последовательности перечисления этих элементов.
Области применения
Олово применяют главным образом дли производства белой жести, раз-
различных припоев, баббитов, предохранительных легкоплавких сплавов,
бронз, латуней, для изготовления фольги и типографских сплавов. Оло-
Олово высокой чистоты используют в полупроводниковой технике.
Олово имеет высокую химическую стойкость, соли его безвредны,
поэтому этот металл широко применяют для лужения консервных ба-
банок и пищевой посуды. Оксид олова (IV) используют в производстве
эмалей и глазурей, для полирования стекла. Оксид олова (II) приме-
применяют для получения рубинового стекла. Кристаллическое SnS2 («су-
(«сусальное золото») входит в состав красок, имитирующих позолоту. Оло-
Олово является основной легирующей добавкой к серебряным сплавам,
применяемым в медицине.
231
Примерные области применения выпускаемых промышленностью ма-
марок олова.
ОВЧ — 000 — для полупроводниковой техники;
О1пч —для производства консервной жести;
01 —для производства жести, изготовления прутков, прово-
проволоки, ленты и других изделий, для электротехнических
целей и изготовления сплавов и припоев;
02 — для изготовления баббитов, сплавов, припоев, оловянно-
оловянного порошка, труб, фольги, лужения кухонной утвари и
котлов для варки пищи;
03 — для изготовления припоев и солей;
04 —для изготовления припоев, баббитов и сплавов, а также
модифицирования серого чугуна.
4.5. СВИНЕЦ [1—35, 171 — 176]
Общие сведения и методы получения
Свинец (РЬ)—тяжелый металл темно-серого цвета. Известен с глубо-
глубокой древности, более 7 тыс. лет. Содержание свинца в земной коре
0,004 % (по массе).
Самородный свинец в природе не найден, также крайне редко встре-
встречаются монометаллические свинцовые руды. Наиболее распространены
свинцово-цинковые руды, реже встречаются медно-свинцовые. Очень
часто свинец входит в состав так называемых полиметаллических руд,
котрые содержат также циик, медь, золото, серебро, кадмий и другие
металлы. Из важнейших минералов свинца можно назвать галенит
(свинцовый блеск) PbS (86,6% РЬ), булаижерит 3PbS-Sb2S3 E8,8%
РЬ), буронит 2PbS-Cu2S.Sb2S3 D2,4% РЬ), церусит (белая свинцовая
руда) РЬСОз G7,55 % РЬ), фосгенит (роговая свинцовая руда)
РЬС12'РЬСОз G6,0% РЬ). Руды, содержащие свинец, классифицируют
на сернистые, или сульфитные, в которых свинец присутствует в форме
сульфидов, и окисленные, содержащие оксиды металла. Наиболее рас-
распространены руды, в которых свинец находится в виде галенита (свин-
(свинцового блеска PbS).
В окисленных рудах свинец находится обычно в виде церуссита
РЬСО3. Окисленные руды называют карбонатными. Современная свии-
цово-цинковая промышленность перерабатывает почти исключительно
сульфидные руды, осуществляя переработку двумя способами — гидро-
или пирометаллургическим. Предпочтение по ряду причин отдают пнро-
металлургическому способу. При этом способе свинец извлекают вос-
восстановительной или реакционной плавкой. При использовании метода ре-
реакционной плавки предъявляются очень жесткие требования к качеству
свинцовых концентратов: содержание свинца в них не должно быть ме-
менее 70—75 %, а содержание отдельных примесей не должно превышать
] % SiO2; 1,5 % Си; 2 % Sb; 2 % As. Метод восстановительной плавки
применим для любых свинцовых руд и особенно для тех, которые вслед-
вследствие содержания в них разных примесей не могут быть переработаны
методом реакционной плавки.
Выплавленный тем или иным методом свинец загрязнен медью, сурь-
сурьмой, мышьяком и серой. Кроме того, обычно он содержит заметное ко-
количество серебра. Очистка свинца от серебра имеет большое значение
для получения серебра (см. 1.9 настоящего справочника). Для уда тения
остальных примесей проводят переплавку с доступом воздуха; мышьяк
и сурьма окисляются с образованием арсената и антимоната свинца,
которые всплывают на поверхность. Медь при этом образует со евин-
232
МАРКИ СВИНЦА В ЧУШКАХ СОГЛАСНО ГОСТ 3778—77
Марка
СО
С1С
С1
С2С
С2
сз
сзс
РЬ %
не менее
99,992
99,99
99,985
99,97
99,95
99,9
9Э.5
Ag
з-ю—4
0,001
0,001
0,002
0,0015
0,0015
0,01
Си
5 10—4
0.О01
0,001
0,002
0,031
0,002
0,09
Zn
0,001
0,001
0,001
0,002
0,001
0,005
0,07
Соде
Bi
0,004
0,005
0,006
0,002
0,03
0,06
0,15
зжание примесей %, не более
As
5 10—4
0,001
0,001
0.002
0,002
0,005
0,05
Sn
5-10—4
0,001
0,001
0,001
0,012
0,002
0.10
Sb
5-Ю-4
0,001
0,001
0,005
0,015
0,005
0,20
Fe
0,001
0,002
0,001
0,001
0,002
0,005
0,01
S (Мя
Ca Na)
0,002
0,002
0,003
0,003
0,015
0,04
всего
примесей
0,008
0,01
0,015
0,03
0,03
0,1
0,5
МАРКИ СВИНЦА СУРЬМЯНИСТОГО (ГОСТ 2252—81)
Марка
CCyl
ССу2
ССуЗ
ССу8
ССуЮ
ССуА
УС
ССу
ССуМ
CCyMl
ССуМ2
ССуМЗ
ССуМТ
ССуМО
Основные
Sb
4.0—6,0
2,5—3,5
До 6
6,0—8,0
100-120
2,0—7,0
5,0—6,0
0,4-0,6
0,4—0.6
0,15—0,3
0,4—0,8
0,8-0,95
0,3—0,45
0,15—0.25
0,
0,
0,
0,
0,
0
0
компоненты, %А
Си
_
05—0,15
02—0,05
02—0,05
02 0 05
02—О,'О5
02—0,05
02—0,05
As Те, Sn
.
,
0,08—0,2 As
0,03—0,05 Те
«J0.005 Те;
0,35—0,45 Sn
Sn
0,01
0,20
Не огр.
0,01
0,01
0,002
0,01
0,005
0,005
0,005
0,005
0,005
0,005
—
Си
0.05
0,1
0,20
0,002
0,002
0,20
_
0,002
—
Прнмеси, %
Zn
0,002
0,002
0,03
0,005
0,005
0,001
0,001
0,005
0,005
0,005
0,005
0,005
0,005
0,005
не более
Bi
0,05
0,05
0,05
0,05
0,05
0,03
0,03
0,05
0,05
0,05
0,05
0,05
0,05
0,05
0
0
0
0
0
0
0
0
0
0
0
0
0
0
Fe
,005
,01
,01
,005
,005
,005
005
005
005
005
005
005
,005
,005
0
0
0
0
0
0
0
0
0
0
0
0
0
As
01
03
03
005
005
05
005
005
005
005
005
005
005
* Остальное свинец.
цом тугоплавкий сплав, который тоже отделяется от расплава; при
этом из свинца удаляется вся сера. Рафинирование свинца, содержаще-
содержащего висмут, проводят, как правило, путем электролиза.
Содержание свинца в земной коре составляет 0,004 %.
В соответствии с ГОСТ 3778—77 производятся марки свинца, привел
денные в табл. на с. 233. Свинец отливают в чушки массой 30—40 кг,
которые транспортируют без упаковки; хранят свинец под навесом.
Марки свинца сурьмянистого в соответствии с ГОСТ 1292—81 приве-
приведены в таблице на с. 233.
Допустимое содержание свинца в воздухе промышленных помеще-
помещений Ы0"! кг/м3, а в воде 1-10—4 кг/м3.
Физические свойства
Атомные характеристики. Атомный номер 82, атомная масса
207,19 а. е. м, атомный объем 18,27-10~6 м3/моль. Атомный (металли-
(металлический) радиус свинца 0,174 нм, ионный радиус РЬ2+ 0,132 нм, кова-
лентный радиус 0,154 нм. Конфигурация внешних валентных электронов
6s26p2.
Значения потенциалов ионизации / (эВ): 7,415; 15,03; 31,93; 39,0.
Электроотрицательность 1,9.
При атмосферном давлении свинец обладает г. ц. к. структурой с пе-
периодом а = 0,49502 нм при комнатной температуре. Энергия кристалли-
кристаллической решетки 194 мкДж/кмоль. При приложении высокого давления
(до 13±1 ГПа) при 25 °С в свинце протекает фазовое превращение,
связанное с переходом г. ц. к. решетки (РЫ1 в г. п. у. решетку (РЬ II).
Периоды решетки РЫ1: а = 0,3265 нм, с = 0.5387 нм. Переход 1->-П
сопровождается резким изменением объема @,868 ± 0,289) • 10~6 м3/кг.
Работа выхода электрона ф = 4,0 эВ; для грани монокристалла A11)
ф=3,85 эВ, для A00) ф = 3,95 эВ.
Свинец существует в виде четырех стабильных изотопов с масеозы-
ми числами 204, 206, 207, 208, процентное содержание которых соответ-
соответственно следующее: 1,48; 23,6; 22,6; 52,3. Известны также радиоактив-
радиоактивные изотопы свинца'
Массовое
число
197
198
199
200
Период
полураспада
2520 с
8280 с
5400 с
916 сут
Массовое
ЧИСЛО
201
202
203
209
Период
полураспада
3,5 сут
3-Ю5 лет
2,166 сут
19 лет
Массопое
число
210
211
212
Период
полураспада
2466 С
0,441 сут
1608 с
Эффективное поперечное сечение захвата тепловых нейтронов 0,17х
ХЮ-28 м2.
Плотность. Плотность свинца р, вычисленная но периоду г. ц. к. ре-
решетки, приведенному выше, составляет 11,340 Мг/м3. Этой же величи-
величине равна плотность пнкпометрическая. При плавлении плотность свин-
свинца уменьшается на 3,44 %. Плотность жидкого свинца в зависимости от
температуры:
Т, К. ■ 600 623 722 823 923 1023 1123
р, Мг/м3 10,686 10,658 10,536 10,418 10,302 10,168 10,078
234
Электрические и магнитные. Удельная электрическая проводимость
свинца а в зависимости от температуры:
Г, К ИЗ 273 773 1273 1773
а, МСм/м 13,5 5,27 0,975 0,80 0,675
Удельное электрическое сопротивление р свинца в зависимости от
температуры:
Г, К ИЗ 273 773 1273 1773
р, МкОм-м. . . 0,0743 0,190 1,028 1,25 1,48
Температурный коэффициент электросопротивления свинца при
273 К а = 4,2-10-3 К.
Температура перехода в сверхпроводящее состояние при обычном
давлении Хс=7,19 К. Увеличение давления приводит к снижению Гс;
при Р=5 ГПа Гс=5 К, а при Р=13 ГПа Гс=3,55 К.. Фазовый пере-
переход РЫ->-РЫ1 практически не оказывает влияния па Тс. Т. э. д. с. тер-
термопары свинец — платина в интервале 173—373 К меняет свой знак.
При 173 К т. э. д. с. термопары £=—0,130 мВ, а при 373 К Е —
= -1-0,440 мВ. Абсолютный коэффициент т. э. д. с. е = —4,4 мкВ/К.
Коэффициент т. э. д. с. жидкого свинца при 623 К е = —5. Постоянная
Холла при комнатной температуре /? == +0,09 -10~10 м3/Кл В интервале
603—823 К /?=(—0,44±0,03)-Ю-10 м3/Кл (свинец чистотой 99,999%).
Магнитная восприимчивость х возрастает с ростом температуры:
Г, К . • 20,4 298 330
X ■ Ю1» . —0,132 —0,111 —0,075
Коэффициент вторичной электронной эмиссии o"mdx=l,l при значе-
значении ускоряющего напряжения первичных электронов 0,5 кэВ.
Тепловые и термодинамические. Температура плавления /„л =
= 327,44"С, температура кипения /Ки„=1745оС. При повышении дав-
давления температура плавления возрастает и при Р=6 ГПа свинец пла-
вшея при 989 К; при этом dT/dP = 54 К/ГПа.
Характеристическая температура, определенная по упругим констан-
константам, 0d= 105,3 К, а определенная по изменению теплоемкости 6о =
= 106,7 К.
Удельная теплота плавления АЯПЛ, отнесенная к 298 К, равна
23.4 кДж/кг. Удельная теплота сублимации A//cyo, отнесенная к 298 К,
равна 941,5 кДж/кг.
Изменение теплоты плавления в зависимости от температуры: Д#пл =
= (941 + 1,03 Т—1,01 ■ Ю-3 Г2) -20,2 кДж/кг.
Изменение теплоты сублимации свинца в зависимости от температу-
температуры: Д//субя= D7,14—0,00183Т) -20,2 кДж/кг.
Давление насыщенного пара р в зависимости от температуры:
Г, К 400 е.ОО 800
р, Па 1,44-Ю-1' 4,3-Ю-9 5,38-Ю-5
7\ К 1000 1200 1400
р, Па 1,45- Ю-2 5,88^ 10-1 8>1
Удельная теплоемкость:
Интервал температур, К 298 — Гпл Гпл—1000
сР, Дж/(кг-К) .... 127,6 129,5
Электронная теплоемкость свинца СрЛ=[3,13 мДж/(моль-К2)] -Т.
Теплопроводность свинца Я в зависимости or температуры:
Т, К ■ • • • 223 273 293 373 473 573 700—1300
Я, Вт/(м-К) • 36,2 35,5 35,0 34,2 32,8 31,5 15,9
235
Температурный коэффициент линейного расширения X свинца в за«
висимости от температуры:
Т, К. ■ • •
а • 10», К-1
73 173 273 373 573
26,5 27,3 28,3 29,2 31,3
Молярная энтропия свинца s° Дж/(моль-К), в зависимости от тем»
пературы:
Г, К 298 500 1000 1500 2000
s°, Дж/(моль • К). ■ 15,49 18,87 25,70 28,48 30,34
Поверхностное нагяжеиие жидкого свинца при 700 К а== 480 мН/м.
Поверхностная энергия свинца вдоль грани A00) v=546 мДж/ма,
а вдоль грани A11) v=348 мДж/м2. Энергия дефекта упаковки
50 мДж/ м2.
Динамическая вязкость г) свинца в зависимости от температуры:
Т, К 600 673 773 823 873 973 1073 1173
Г), мПа-с . . 2,56 2,17 1,81 1,68 1,56 1,38 1,28 1,23
Кинематическая вязкость v свинца в зависимости от температуры:
Г, К 533 553 583 648 723 823 883
V-108, м2/с - 0,245 0,232 0,220 0,205 0,19 0,17 0,155
Давление насыщенного пара свинца р в зависимости от темпера-
температуры:
Т, К - • 400 600 800 1000 1200 1400
р, Па . 1,44-10—хв 4,31-10-' 5,37-10—3 1,45 58,86 8,09-Ю2
Прн температуре плавления р —42,08-10~8 Па.
Параметры самодиффузии свинца поликристаллического в интерва-
интервале температур 480—597 К: £>0=7,56- Ю-4 мг/с, £=116,81 кДж/моль;
свинца монокристаллического в интервале температур 383—597 К:
£>0 = 6,66- Ю-4 м2/с, £=117,2 кДж/моль.
Параметры взаимной (предэкспоненциальный множитель Do н энер-
гия активации £) диффузии некоторых элементов в свинце (образую-
(образующаяся фаза — твердый раствор):
Диффундиру-
Диффундирующий
элемент
Na
Mg
Ti
Си
Cd
Ag
In
Sb
Аи
Bi
Hg
Hg
т. к
512—585
470—573
461—588
367- 598
—
473—573
Do, M2/c
6,3-10—4
0,40-10-*
0,58-10-*
7,9-10-'
0,41-10-*
4,6-10—e
6,3-10-*
0,29-10-*
4,1-10—7
0,58-10-*
0,54-10-*
1,05-10-*
E, кДж/моль
118,4
78,29
92,71
33,6
89,0
60,3
118,4
93
39,15
92,11
81,54
95,2
236
Оптические. Интегральный коэффициент излучения неокислениого
свинца при 373 К Ет=0,05; этот же коэффициент при 473 К для окис-
окисленного свинца 0,63.
Отражательная способность (коэффициент отражения ud) свинца
при разных длинах волн:
%, мкм 1,0 2,0 4,0—12,0
пп, % 70 93 94
Показатель
Я, мкм
0,70
0,80
0,90
1,0
1,1
1,2
преломления
п
1,68
1,51
1,44
1,41
1,42
1,46
п в зависимости ог
Я, мкм
1,3
1,4
1,5
1,7
2,0
2,5
1
I
1
1
2
3
"
,51
,59
,67
,90
,28
,20
длины волны
Я, мкм
3,0
4,0
6,0
8,0
10,0
12,0
X:
п
4,27
6,58
11,7
16,4
21,0
24,6
Показатель поглощения х в зависимости от длины волны %:
X, мкм
0,7
0,8
0,9
1,0
1,5
X
3,67
4,24
4,85
5,40
8,24
к, мкм
2,0
3,0
4,0
5,0
6,0
X
11,1
16,4
20,8
24,8
28,1
X, МКМ
7,0
8,0
9,0
10,0
11,0
12,0
X
30,9
33,6
35,8
37,4
39,2
40,5
Механические свойства
Механические характеристики свинца чистотой 99,998 % при комнат-
комнатной температуре: О"„=13,7 МПа; о"я = 4,1 МПа A07 циклов); £ =
= 15,7 ГПа; 6 = 24%; ^=100%; #В = 38-н42 МПа; #^=31,4 МПа.
Механические свойства в зависимости от температуры:
/, °с
— 196
—183
80
V мпа
49
43,2
7,8
36
40
24
НВ, МПа
—
30
150
195
265
<т„, МПа
4,9
3,9
2,0
6, %
33
20
20
НВ, МПа
14,4
12,0
7,0
Примечание. Поперечное сужение при всех температурах, кроме
—183 °С, равно 100 %, для этой темперапры нет данных.
Сжимаемость свинца х = 2,23-10~п Па~'.
Химические свойства
Нормальный электродный потенциал реакции Pb—2e=s±Pb2+ при 25 °С,
фо=—0,126 В. В электрохимическом ряду напряжений свинец распола-
237
гается перед водородом, однако в разбавленных кислотах он практичес-
практически не растворяется. Это связано отчасти с тем, что на чистом свинце
водород выделяется только при значительном перенапряжении. Величи-
Величина перенапряжения водорода на свинцовом электроде составляет 0,78 В.
В соединениях, например солях, свинец проявляет степень окисле-
окисления + 2, реже + 4, однако эти соединения свинца малоустойчивы.
В некоторых случаях на свинце образуется нерастворимый слой, за-
защищающий его от дальнейшего воздействия кислоты. Так, при взаимо-
взаимодействии свинца с серной кислотой образуется сульфат свинца, при
взаимодействии с плавиковой — фгорпд свинца. Хорошая стойкость
свинца в разбавленной серной кислоте имеет большое практическое зна-
значение в сернокислотном производстве. В разбавленной соляной кислоте
свинец также практически не растворяется. В азотной кислоте он легко
растворим благодаря своей сильной способности к окислению. На воз-
воздухе свинец медленно взаимодействует со всеми кислотами, в том чис-
числе с очень слабыми, и даже с водой, образуя гидроксид 2РЬ + Ог+
+2Н2О = 2РЬ(ОНJ. В концентрированной серной кислоте, особенно при
нагреве, свинец интенсивно растворяется с образованием растворимой
кислой соли Pb(HSO4h. В щелочах свинец также растворяется, хотя с
небольшой скоростью; более интенсивно реакция идет при пагреие и в
случае разбавленных растворов.
При нагрепе расплавленного свинца на воздухе до 475—675 °С об-
образуется оксид свинца РЬО, представляющий собой желтый порошок.
При воздействии сильных окислителей на РЬО образуется темно-бурый
порошок диоксида свинца РЬО2. Смешанный оксид РЬ3О4 является ре-
результатом взаимодействия РЬО и РЬО2 или нагрева мелкодисперсного
оксида РЬО на воздухе до 475—575 °С. Соединение РЬ3О4 имеет ярко-
красный цвет и его широко применяют при изготовлении масляных кра-
красок. Все соединения Pb(IV) —очень сильные окислители. При действии
на растворы солей свинца соляной кислоты получается хлорид свинца
РЬС12 в виде белого осадка, малорастворимый в холодной воде.
Сульфид свинца образуется в виде черного осадка при действии се-
сероводорода на его соли. Эта реакция используется при определении
содержания сероводорода в атмосфере.
Карбонат свинца РЬСО3, встречающийся в природе в виде церусси-
та, искусственно получают путем смешения водных растворов солей
свинца (II) с карбонатами щелочных металлов; при нагревании ныдр-
ляется основной карбонат свинца РЬ@НJ-2РЬСО3 (бетпла).
Известен гидрид свинца РЬН4, представляющий собой очень летучее
соединение. Свинец не взаимодействует с углеродом и азотом.
При взаимодействии свинца с более электроположительными метал-
металлами (Li, Na, К, Mg, Са, Ва, РЗМ, Ti, Zr, Hf) образуются иптерметал-
лические соединения, называемые плюмбидами. Элементы 1ПВ, IYB,
VA и VB, VIA, VIIA и отчасти VIIIA подгрупп со свинцом, как прави-
правило, не взаимодействуют. Известны соединения свинца с ураном UPb и
UPb2, радием, палладием и платиной. Из элементов IB подгруппы ин-
интерметаллические соединения со свинцом образует только золото
'(Au2Pb, AuPb2, AuPb3), a IIB подгруппы — ртуть (HgPb2). Известны
селенид PbSe и теллурид РЬТе свинца.
Элементы VIIB подгруппы с двухвалентным свинцом образуют га-
галоидные соли.
Технологические свойства
Свинец — очень пластичный металл, легко поддается пластической де-
деформации любого вида при комнатной температуре. Свинцовая струж-
стружка легко спрессовывается в монолитное изделие заданной формы при
давлении ~200 МПа.
233
Области применения
Низкая механическая прочность и высокая ползучесть свинца ограни-
ограничивают области его применения как конструкционного материала.
Свинец широко применяется при изготовлении пластин аккумулято-
аккумуляторов, при производстве кабелей для покрытия их химически устойчивой
и достаточно эластичной оболочкой. В химич-еской промышленности и
цветной металлургии свинец широко используется для защитных по-
покрытий химической и электрохимической аппаратуры, в частности внут-
внутренних поверхностей башен при производстве серной кислоты, травиль-
травильных и электролитических ванн и др. Значительное количество оксида
свинца используется в народном хозяйстве при производстве красок и
хрусталя. Как хороший поглотитель различного вида излучений свинец
находит широкое применение в атомной энергетике и рентгенотехнике.
Помимо чистого свинца, широко применяются сплавы на его осно-
основе— антифрикционные, типографские и припои. К антифрикционным
сплавам относятся свинцовые баббиты, обладающие значительной из-
износостойкостью и в то же время пластичностью, гарантирующей хоро-
хорошую прирабатываемость подшипников и вкладышей с сопряженными
с ними поверхностями. В парах с участием баббита достигается коэф-
коэффициент сухого трения, равный 0,12—0,2, а при смазке его удается сни-
снизить еще в 2—2,2 раза. Основные легирующие компонеты свинцовых
баббитов — натрий и кальций. Первый из них обеспечивает пластичную,
но достаточно прочную матрицу, содержащую мелкодисперсные выде-
выделения интерметаллида РЬ3Са. Состав свинцовых баббитов регламенти-
регламентируется ГОСТ 1209—78.
Сплавы свинца, легированные сурьмой и оловом в пределах до 30 %
(по массе), образуют группу так называемых типографских сплавов,
применяемых в полиграфии. Сурьма повышает прочность этих сплавов,
а олово снижает температуру их плавления и повышает жидкотеку-
честь. Эти сплавы обладают малой усадкой при затвердевании и мало
изменяют состав при многократных переплавах. Характеристики типо-
типографских сплавов, выпускаемых в нашей стране согласно ГОСТ
5235—74:
Марка
сплава
Ш1
Ш2
ШЗ
П1
П2
Мн
Лн
ЛиГ
Ст1
Ст2
Гс
Нт
К1
К2
Содержание*, %
Sb
19,5—20,5
15,0—16,5
14,0—15,0
17,0—18,0
12,0—14,0
14,0—15,5
11,0—12,0
11,5—12,5
15,5—16,5
12,5—13,5
2,7-3,3
4,0—5,0
24,5—25,5
5,0—7,0
Sn
6,7—7,3
2,7—3,3
3,7—4,3
1,8—2,2
5,7—6,3
4,2—4,8
5,5—6,5
6,5-7,5
4,7-5,3
1,8—2,2
14,5—15,5
4,5—5,5
29,0—31,0
начало
300
270
255
285
250
255
240
240
265
240
300
255
340
230
с
конец
310
280
265
300
260
265
245
245
275
250
310
265
350
240
ИВ, МПа
265-275
196—206
206—216
176-185
156—166
245—255
196—206
215—225
255-265
215—225
98—108
147—166
255-274
176—195
Основа — свинец.
239
Сплавы марок Ш1, Ш2 и ШЗ идут на изготовление шрифтов руч-
ручного набора; сплавы марок П1 и П2 — пробельных материалов; сплав
марки Мн предназначен для монотипного набора; сплавы марок Аи и
Ан1—для линотипного; Ст1 и Ст2—-для стереотипного; Гс—-для
гальваиостереотипного; Нт — для потных пластин. Сплавами марок К1
и К2 корректируют состав сплавов по содержанию сурьмы и олова.
Имеется несколько марок припоев на основе свинца с добавками
олова и сурьмы. Эти припои относятся к группе легкоплавких и служат
главным образом для пайки радиотехнических изделий и аппаратов, ко-
которые при эксплуатации не подвергаются нагреву до высоких темпера-
температур. Состав и свойства п-рипоев на основе свинца:
Марка
ПОС61
ПОС40
ПОССу18-2
ПОССу4-6
Состав, %
РЬ
38—40
59—61
80—81,5
90-92
Sb
1,5—2,0
5—6
Sn
60—62
39-41
17-18
3-4
Г„Л' К
456—459
456—508
456—550
518—538
Кроме рассмотренных выше сплавов, свинцовосурьмянистые сплавы
применяются при изготовлении деталей аккумуляторов, оболочек, кабе-
ий, листов, труб, а также в качестве шихтовых материалов при произ-
производстве баббитов, припоев, дроби, типографских и других литейных спла-
сплавов.
В последние годы в пашей стране имеется тенденция использовать
свинец только в юх областях, где он практически незаменим, например
в атомной эпергешке, а в опальных применяв заменители (например,
при производстве кабелей свинцовые оболочки заменяют алюминиевыми
и полиэтиленовыми).
4.6. ТИТАН [1—35, 177-181]
Общие сведения и методы получения
Титан (Ti) впервые открыт в виде диоксида в 1791 г. англичанином Гре-
гором в составе черного песка района Менаккан (провинция Корнуэлл,
Англия). Белый оксид неизвестного металла был иазваи менакканум.
В 1795 г. немецкий химик Клапорт, проанализировав красные пески в
Венгрии, обнаружил в иих металл, который назвал титаном. Впоследст-
Впоследствии (в 1797 г.) Клапорт установил, что неизвестный металл из черных
песков Англии, из красных песков Венгрии и коричневых минералов Ис-
Испании представляет один и тот же новый химический элемент, получив-
получивший название титан.
Первые попытки получить титан из его оксида путем восстановле-
восстановления углеродом относятся к двадцатым годам XIX в. Впервые металли-
металлический титан с примесями был выделен Берцелиусоч в 1825 г. путем вос-
восстановления натрием двойного фторида калия и титана.
Достаточно чистый титан впервые был получен Хунтером в 1910 г.
путем нагрева смеси тетрахлорида титана и гидрида натрия.
Способ получения высокочистого компактного и ковкого металличес-
металлического титана был предложен Ван Аркелем в 1924 г. Летучее соединение
титана (теграиоднд титана) подвергают термической диссоциации на
раскаленной нити в вакууме. Поскольку температура диссоциации сое-
240
динения значительно ниже температуры испарения металлического ти-
титана, последний кристаллизуется на раскаленной нити. Однако этот ме-
метод не получил достаточно широкого применения в связи с его дорого-
дороговизной, хотя так называемый иодидный титан используется в лабора-
лабораторной практике.
Титан входит в состав примерно восьмидесяти минералов. Наиболее
распространенные минералы — ильменит, титаномагиетит и рутил. Руды,
содержащие этн минералы, используют для производства диоксида ти-
титана и металлического титана.
В настоящее время промышленное распространение получил маг-
нийтермический метод, основанный на восстановлении тетрахлорида ти-
титана жидким магнием выше 600 °С. Восстановленный титан в виде
губчатой массы (титановая губка) оседает на стенках реактора. Метод
предложен Кролем в конце 30-х годов.
Согласно ГОСТ 17746—79 титан губчатый (ТГ) поставляют следу-
следующих марок, химический состав которых см. ниже:
Марка*
ТГ-90
ТГ-1С0
ТГ-110
ТГ-120
ТГ-130
ТГ-150
0
0
0
0
0
0
Fe
,06
,07
,09
,П
,13
,2
Si
0,01
0,02
0,03
0,03
0,04
0,04
Содержание,
N1
0,05
0,05
0,05
0,05
0,05
0,05
%.
с
0,
0,
0,
0,
0,
0,
не
02
03
03
С4
04
05
более
С1
0,08
0,08
0,08
0,08
0,10
0,12
0
0
0
0
0
0
N
,02
,02
,02
,03
,03
,04
о
0,04
0,04
0,05
0,06
0,08
0,10
* Цп 1ч>ы в обошаченин марки — твердость (ИВ, кгс/'мч2).
Губчатый титан упаковывают в герметичную тару емкостью от 250
до 500 л, изготовленную из алюминиевых сплавов или стали. Если металл
предназначен для длительного хранения, то в качестве тары используют
герметичные стальные бочки с эластичным мешком внутри (ГОСТ
15908—70). После упаковки и герметизации бочки вакуумнруют и за-
заполняют аргоном до избыточного давления.
Технически чистый титан в пашей стране выпускается двух марок
ВТ1-00 и ВТ1-0; на практике его принято называть сплавом, хотя ника-
никаких специальных добавок, кроме примесей, он не содержит.
Химический состав титана марок ВТ1-00 и ВТ1-0 (ОСТ 1.90013—71),
Марка*
ВТ 1-00
ВТ 1-0
с
0,05
0,07
Fe
0,20
0,30
Si
0,08
0,10
о
0,10
0,20
N
0,04
0,04
н
0,008
0,010
Другие
элементы
0,10
0,30
Основа — титан.
241
Физические свойства
Атомные характеристики Атомный номер 22, атомная масса 47,90 а. е. м.,
атомный объем, определенный по пикнометрической плотности, 10,6X
ХЮ ма/моль; а по рентгенографическим данным, 10,8-10~6 мэ/моль.
Атомный радиус согласно рентгеновским данным 0,145 нм. Конфигурация
внешних электронных оболочек атома 4s23dJ.
Потенциалы ионизации атома / (эВ): 6,83; 13,57; 28,14. Электроот-
Электроотрицательность 1,5.
При нормальных условиях титан имеет гексагональную кристалли-
кристаллическую решетку (а-модификация) с периодами а = 0,2951 нм, с =
6,4679 нм; энергия кристаллической решетки 470 мкДж/кмоль.
При 882,5 °С протекает полиморфное превращение a->(J, связанное
с образованием о. ц. к. модификации, период решетки которой при
900 "С a = 0,3306 нм.
Титан существует в виде пяти стабильных изотопов; данные об их
распространенности в природе и эффективном поперечном сечении зах«
вата тепловых нейтронов приведены ниже:
Массовое число ....
Содержание в естествен-
естественной смеси, % ....
Эффективное поперечное
сечение захвата тепло-
тепловых нсйтроновХЮ28, м2
46
7,95
0,6+
±0,2
47
7,75
1,7±
±0,3
48
73,45
8,3±
±0,6
49
5,51
1,9±
±0,5
50
5,34
0,2
Наряду со стабильными изоюпами существуют нестабильные с мас-
массовыми числами 43, 44, 45, 51; период полураспада их соответственно
равен 0,58 с, 1000 лет, 21 сут, 6 мин.
Работа выхода электронов, измеренная иа пленках методом авто-
автоэлектронной эмиссии, для a-титаиа ф = 4,0 эВ, а для р-титана 3,65 эВ.
Плотность. Плотность р чистого титана при 298±2 К, вычисленная по
данным измерений периодов решетки, равна 4,505 Мг/м3. В качестве
среднего значения в серии пикнометрических определений плотность но-
дидиого титана составляет 4,507±0,005 Мг/м3. Плотность a-титана при
1143 К равна 4,35 Мг/м3, плотность р-титана при 1173 К, рассчитанная
иа основании высокотемпературных измерений периодов решетки,
4,32 Мг/м3.
Электрические и магнитные. Удельная электрическая проводимость a
титана при различных температурах:
т, к
<т, МСм/м
<т, МСм/м
100
200
300
5,55
2,63
1,73
500
700
900
1,05
0,78
0,65
1100
1300
1500
0,58
0,64
0,59
Удельное электрическое сопротивление гитана р в зависимости от
температуры:
242
г, к
100
200
300
р, мкОм ■ м
0,180
0,380
0,580
т, к
500
700
900
р, мкОм-м
0,950
1,280
1,540
Т, к
1100
1300
1500
р, мкОм-м
1,740
1,570
1,670
Температурный коэффициент электрического сопротивления в интер-
интервале 273—293 К а=3,0-10~~3 K~J. При плавлении электросопротивление
титана возрастает в 2,06 раза.
Температура перехода в сверхпроводящее состояние для иодидиого
титана чистотой 99,99 % Гс = 0,387 К. Эту температуру (Гс) можно по-
повысить путем легирования титана р-стабилизирующими элементами.
В термопаре титан — платина титан проявляет положительную
т. э. д. с. по отношению к платине; в термопаре титан — вольфрам име-
имеет сначала положительную т. э. д. с, которая при 60°С проходит через
максимум, при 125 °С — через нуль, а при более высоких температурах
принимает отрицательные значения, около 1400°С т. э. д. с. этой термо-
термопары достигает 25 мВ.
Максимальный коэффициент вторичной электронной эмиссии огаах==
= 0,9 при ускоряющем напряжении первичных электронов 0,28 кэВ.
Постоянная Холла титана чистотой 99,99 % при комнатной темпера-
температуре R = —2,4-10^'° м3/Кл; при повышении температуры R возрастает и
при —670 К наблюдается переход от отрицательных значений к поло-
положительным.
Титан выше 73 К парамагнитен. Магнитная восприимчивость при
комнатной температуре составляет х=3,2-10~9 и с повышением темпе-
температуры возрастает приблизительно линейно от 73 до 1073 К. Температур-
Температурный коэффициент магнитной восприимчивости в этом интервале состав-
составляет около 0,0012-10~9 К. В области а5=*ф-превращения наблюдается
сильное возрастание восприимчивости. Магнитная восприимчивость
E-титаиа слабо зависит от температуры.
Тепловые и термодинамические. Температура плавления ^Ш1=16С8±
±5°С, температура кипения /„„„ = 3169 °С. Характеристическая темпера-
температура Gd = 430 К, удельная теплота плавления ДЯПЛ = 358,3 кДж/кг,
удельная теплота сублимации при 298 К АЯсубл = 9790 кДж/кг. Удельная
теплоемкость ср возрастает значительно при повышении температуры от
0 до 200 К, а затем почти линейно в интервале от комнатной темпера-
температуры до температуры а^Р-превращения. При 298 К удельная теплоем-
теплоемкость титана ср = 521 Дж/(кг-К). Электронная теплоемкость с^л =
= [3,52 мДж/ (моль • К2) ] ■ Т.
Теплопроводность Я титана чистотой 99,9 % в зависимости от тем-
температуры:
т. к
X, Вт/(м К)
X. Вт/(м-К)
10
70
293
5,23
36,0
21,9
373—633
873
1135
17,7
19,0
23,5
1215
1300
1500
25,25
29,0
35,15
Ниже комнатной температуры на температурной зависимости тепло»
проводности титана наблюдается максимум. В интервале температур от
комнатной до —770 К теплопроводность понижается.
243
Температурный коэффициент линейного расширения:
Т, К- • . ■
а • 10е, К-1
0-153
2,5
153—1133
9,2
1133—1233
10,5
Так, для а-штапа температурный коэффициент линейного расшире-
расширения а, определенный вдоль оси а в интервале 301—428 К, равен 9,5х
XlO-eK~', а при тех же условиях вдоль осп с, 5,6-10-вК~1. В области
температур полиморфного превращения титана (882,5 СС) значение ко-
коэффициента линейного расширения одинаково и для а-, н для (J-титаиа.
При а-^-превращении происходит уменьшения объема в пределах
0,15-0,3 %.
Тепловой эффект а->Р-прсвращения Д//а^р =87,4 кДж/кг.
Тройная точка титана расположена примерно при 8 ±0,7 ГПа и
640 °С±50. При давлении более 9 ГПа и температуре выше 900 °С
к-фаза переходит в гексагональную ю-фазу, периоды решетки которой
а = 0,4625 им, с —0,2813 нм Теплота а-ко-превращения А#а_>и =
=25,3 кДж/кг. Фаза со сохраняется после снятия давления прн ком-
комнатной температуре, обратное превращение со->-а после снятия давления
наблюдается лишь при температурах выше 600 °С. В процессе отжига
при 110°С со->а-превращение завершается через 17 ч. Превращение
сопровождается изменением объема AV/V=0,012.
Молярная энтропия титана s° в зависимости от температуры:
Г, К 298
«°, Дж/(моль- К). • 30,68
500 1000 1500 2000 2500
44,37 64,8 81,4 99,25 106,7
Давление пара р титана в зависимости от температуры:
т,
р,
к . . .
Па ....
1600
. . 111-Ю-5
1800
506-Ю-4
2000
1,04
2200
11,4
2400
76,3
2600
4!5
При темпераiype плавления давление паров титана состартяет
0,515 Па. Поверхностная энергия тигаиа v=1444 мДж/мг, поверх.я .-t-oe
натяжение при 2040 К а=1390 мН/м. Энергия дефекта упаковки а-ти-
тана 10 мДж/м2.
Параметры самодиффузии — предэкспоненциальный множитель Do и
энергия активации Е (поликристалл):
Фазы
а
р
т, к
923—1123
1173—1813
6,4-Ю-12
3,58-10—8
Е, кДж/моль
122,67
130,6
Параметра взаимной диффузии элементов в титане (по объему зе-
зерен):
Элемент—
основа
a-Ti
P-Ti
Ti
Ti
B-Ti
B-Ti
8-Ti
B-Ti
a-Ti
P-Ti
a-Ti
Ti
Ti
Ti
Ti
Ti
Ti
Ti
Ti
Диффунди-
Диффундирующий
элемент
н
н
Не
Be
В
С
С
N
N
О
О
Si
Sc
V
Cr
Fe
Co
W
U
т, к
888—993
1188—1573
1373—1773*1
1273—1973
1173—1573*2
П73—1843
1173—1673
1193—1473
963—1173
П73_1473*з
1273—1473
1173—1823
973—1473
1073—1473
1183—1273
973-1473
1223—1348
Do. M2/c
4,8-10—7
5,7-10-'
1,1-Ю-13
0,80-10-4
8,90-10-9
3,10-10—7
2,08.10-'
3,5-10-e
1,2-Ю-6
3,14-10-8
5,08-10-'
8,1 -10—6
1-10-4
3,1- 10—8
8-10-°
8,2- I0-8
1,6- I0-8
0,3-10-*
4,6- I0-8
E, кДж/моль
45,22
36,43
67,41
182,2
128,12
79,97
138,16
141,51
189,45
287,63
140,26
166,22
108,44
134,8
2«4,7
104,67
119,74
206,15
126,5
П р и ы е ч а н и е. Во всех сл>чапх, кроме отмеченных звездочками, образу-
образуется твердый раствор.
•' Образующаяся фаза TiB2. •' TiC " TiSb
Оптические. Излучательпая способность (спектральный г^) жидкого
титана 0,65 (длина волны 0,65 им)
Излучательная способность (интегральный е, коэффициент излуче-
излучения) в зависимости ог температуры (гладкая поверхность)'
Г, К 440" 609 833 1235 1200—1700**
ег
Окисленный
0,116 0,182 0,322 0,504 0,221—0,264
Неокисленный.
(фф ) в зависи-
зависиОтражательная способность (коэффициент отражения
мости от длины волны %■
К, мкм ....
2,0^ 3,0 4,0 5,0 6,0 8,0 10,0
66 72 77 84 86 90 92
♦ Полированный кристалл.
Показатель преломления п в зависимости от длины волны X:
X, мкм
0,40
0,50
0,61
0,70
п
1,71
2,10
2,62
2,67
X,
0
0
I
2
мкм
,8!
,92
2
,0
2
3
3
4
п
,98
,30
,30
,03
К
4
6
8
МКМ
,0
,0
,0
3
3
5
п
,31
,80
,81
245
Показатель поглощения х в зависимости от длины волны X:
1, мкм
0,40
0,50
0,61
0,70
2
2
3
3
•
,23
,82
,04
,20
-
0,
0,
1,
2,
мкм
81
92
2
0
3,40
3,54
3,70
4,47
X, МКМ
4,0
6,0
8,0
10,0
X
7,33
10,9
14,9
18,6
Механические свойства
Механические свойства титана высокой чистоты — электролитического,
переплавленного и прокатанного: ав = 225-7-230 МПа; с0 2= 103-j-105 МПа;
6 = 23-^25 %; г|> = 55^-60 %; HV = 790 + 800 МПа.
Механические свойства титана марок BTI-00, BT1-0 (отожженное
состояние):
Марка
ВТ 1-00
BTI-0
ов, МПа
294—441
392—539
о0 г, МПа
245
343
(тпц, мп»
147
196
б, %
25
20
Ч>. %
60
55
KCU, кДж/м1
1180
980
Временное сопротивление титана марок ВТ 1-00 (числитель) и ВТ 1-0
(знаменатель) в зависимости от температуры:
/, °С —253 —196 20 200—250
1180 834 294 _206
°в' МШ' " ' 1180 951 392 294
Предел текучести титана марок ВТ1-00 (числитель) н ВТ1-0 (знаме-
(знаменатель) в зависимости от температуры:
/, СС —253 —196 20 200—250
834 490 245 98,1
0-2' МПа Тога Ъ~ь' ж 15б"
Модуль нормальной упругости Е, сдвига G и коэффициент Пуас-
Пуассона v:
Марка
ВТ 1-00
ВТ 1-0
Е, ГПа
103,000
103,000
G, ГПа
39,200
39,200
V
0,35—0,38
0,35-0,38
Микротвердость мапшетермического титана плавленого и отожжен-
отожженного 1540—1600 МПа при 293 К; иодидного титана при той же темпе-
температуре и нагрузке 0,59 Н составляет 1570—2090 МПа.
246
Химические свойства
Нормальный электродный потенциал реакции Ti—2e=ptTi2+ фо =—1,75 В,
а реакции Ti—3e*±Ti3+ cpo=—1,21 В.
В соединениях проявляет степени окисления +2, +3, +4.
Титан хорошо поглощает водород. 1 моль титана способен сорбиро-
сорбировать до 2 молей водорода, причем наиболее интенсивно процесс этот про-
протекает выше 400—500 °С. При малом содержании сорбированного водо-
водорода внешний вид поверхности металла почти не меняется. Поглощение
водорода металлом и образование твердого раствора — экзотермический
процесс. Водород образует с титаном два гидрида TiH (у-фаза) с г. ц. к.
решеткой (а=0,446 им) при 62,4 % (ат.) Н и TiH2-x при большем со-
содержании водорода ТШ2_х-фаза переменного состава, которая по мере
увеличения количества водорода претерпевает тетрагональное иска-
искажение.
При взаимодействии титана с кислородом на его поверхности обра-
образуется пленка оксидов. При комнатной температуре толщина этой пленки
колеблется в пределах 0,17—25 нм в зависимости от длительности взаи-
взаимодействия, соответствующего 2 и 4 годам. При нагреве до 400—500 °С
начинается заметное окисление титана, приводящее к образованию ди-
диоксида титана ТЮ2, при этом часть кислорода растворяется в металле
(до 20 %), а остальные 80 % идут на формирование окалины. До
~800°С окисленный слой состоит исключительно из ТЮг со структурой
рутила, а металл на границе с оксидом обогащен кислородом. Выше
~800°С дополнительно образуются фазы TiO и Ti2O3. Цвет оксидного
слоя зависит от температуры и длительности окисления. При низких
температурах вначале наблюдаются желтый, голубой нли фиолетовый
цвета побежалости. В интервале 500—700 °С оксидный слой, еще прочно-
сцепленный с основным металлом, имеет темно-серый цвет. При более
высокой температуре образуется слой серого цвета, который легко от-
отслаивается.
Соединяясь при высоких температурах с углеродом, титан образует
карбид типа TiC (Д#= 191,7 кДж/моль). TiC по внешнему виду и свой-
свойствам весьма сходен с металлическим титаном, однако с большим трудом,
чем последний, поддается действию кислот. TiC обладает кристалличес-
кристаллической структурой типа NaCl и плавится при —3425 ±25 "С. При нагреве
TiC реагирует с галогенидами, кислородом, азотом.
С азотом титан взаимодействует при высоких температурах, образуя
нитрид TiN — вещество желтого цвета. Кристаллическая структура—
типа NaCl, температура плавления /Пл=2925±25 °С, теплота образова-
образования Д//Опр=334,26 кДж/моль. Нитрид титана обладает высокой элект-
электропроводностью.
С кремнием титан образует ряд интерметаллических соединений:
ThSi, Ti5Si3, TiSi, T1S12. Наиболее тугоплавкое из них TisSi3, имеющее
температуру плавления fnjl=2125±20°C.
Известны галогениды четырехвалентного титана: TiF4, TiCI4, TiBr4>
Til4; нх свойства:
Галогенид
TiF4
TiCl4
TiBr4
Til«
Д"обр'
кДж/моль
1642
802,43
681,34
511,06
Цвет
Бесцветный
»
Желтый
Темно-красный
—23
38
150
гкип' ^
282
137
232
377
247
При взаимодействии титана с его ближайшими аналогами — цирко-
цирконием и гафнием —возникают непрерывные ряды а- и Р-твердых раство-
растворов, с элементами VA группы — ванадием, ниобием и танталом — непре-
непрерывные |3- и ограниченные а-твердые растворы. По мере увеличения раз*
личия в металлохимических свойствах титана и взаимодействующих о
ним элементов возрастает тенденция к образованию химических соеди*
нений и снижению взаимной растворимости Титан не образует соедине-
соединений с более электроположительными металлами, чем он сам.
Тип структуры, периоды решетки и электронная концентрация со-
соединений титана с металлами и неметаллами:
Соединепие
TiCu
TiBe2
TiZn2
Til-V
TiAl3
Ti3Au
TiGa3
TiB2
TiB
Ti3Ga
TiC
Ti5Ge3
TiGe2
Ti5Si3
TiSi?
Ti3Sn
Ti3Sb
TiN
TiO
Ti3lr
TiCr2
TiU2
Ti3Pt
Ti2Co
TiFe
TiOs
TiRu
TiCo
TiRe5
TiNi
Тип
структуры
Bll
C15
CI4
Cl
ДО22
A15
ДО22
C32
B27
ЛО,9
В!
Д8,
С541
ДР8
С54
ДО]9
А15
В!
В1
AI5
С15
С32
А15
Е93
А2
В2
В2
А2
А12
А2
Элект-
Электронная
концент-
концентрация
с/а
2,5
2,66
2,7
3,0
3,25
3,25
3,25
3,3
3,5
3,75
4,0
4,0
4,0
4,0
4,0
4,0
4,25
4,5
5,0
5,25
5,33
5,33
5,5
5,66
6,0
6,0
6,0
6,5
6,5
7,0
Периоды решетки, нм
а
0,3108
0,645
0,5064
0,444
0,5436
0,5094
0,5558
0,303
0,612
0,576
0,4329
0,7552
0,8594
0,7475
0,8252
0,5916
0,5277
0,424
0,416
0,5009
0,6943
0,482
0,5032
1,13
0,2973
0,3077
0,3067
0,299
0,9587
0,302
*
_
—
0,306
—
—
—
0,5030
—
0,4783
—
—
—
—
—
—
—
—
—
—
—
г
0,5887
0,821
—
0,8596
—
0,8109
0,3227
0,45;>
0,464
—
0,5224
0,8864
0,5162
0,854
0,4764
—
—
—
—
—
0,284
—
—
—
—
—
—
—
—
Титан отличается высокой коррозионной стойкостью в ряде агрессив-
агрессивных сред, особенно в окисли 1ельных и хлорсодержащих. Так, титан
стоек в азотной кислоте во всем интервале ее концентраций начиная с
красной дымящейся при температурах до 100 °С. В "условиях более вы-
высоких температур в чистой азотной кислоте развивается интенсивная
коррозия. Присутствие ионов хлора в окислительном растворе, например
в случае FeC^ или СиС12, обусловливает возникновение при температу-
температуре кипения наряду с равномерной коррозией также и точечной. В средах,
248
содержащих ионы хлора, при комнатной температуре в присутствии
окислителей титан не корродирует. Это относится, например, к растворам
солей, в том числе к физиологическим растворам с NaCl, СаСЬ и MgCl2,
а также к морской воде. В кипящей морской воде титан также не раз-
разрушается. Титан стоек в водных растворах, содержащих гнпохлорат
натрия, диоксид хлора или хлор. Он стоек также в среде влажного хло-
хлора или брома, однако при содержании влаги менее 0.01 % титан может
прореагировать с хлором или бромом со вспышкой. Со слабыми раство-
растворами щелочей титан не реагирует ни при низких, ни при повышенных
температурах. Щелочи более высокой концентрации при нагреве, напри-
например 40 %-ный раствор NaOH, разрушают металл. Титан неустойчив в
ряде бескислородных минеральных кислот (плавиковой, соляной, фосфор-
фосфорной) при повышенных концентрациях и повышенных температурах. Ти-
Титан заметно взаимодействует с некоторыми органическими кислотами —
щавелевой, муравьиной, уксусной. Холодная деформация практически
не влияет на коррозионную стойкость титана.
Технологические свойства
Титан — высокопластнчный конструкционный материал. Он хорошо де-
форчируею) и .сксагональной модификации при комнатой темперагу-
ре и в кубической модификации при высоких температурах. Степень де-
деформации титана высокой чистоты при комнатной температуре может
достигать более 90 °/о. Сопротивление деформации а-титана при комнат-
комнатной температуре возрастает с повышением концентрации примесей, осо-
особенно кислорода. Критическое напряжение сдвига резко снижается с
повышением температуры, поэтому при нагреве деформации существен-
существенно облегчается.
Высокая технологическая пластичность титана позволяет изготавли-
изготавливать из него методами обработки давлением различные полуфабрикаты
и изделия: плиты, листы, полосы, поковки, прутки, проволоку, ленту, тру-
трубы и т. д. Габаритные размеры и свойства всех видов полуфабрикатов
регламентированы соответствующими ОСТами, ТУ и СТУ.
Ковку и штамповку титана и его сплавов производят в горячем сос-
состоянии методом свободной ковки и штамповки в закрытых штампах.
Используемое оборудование—гидравлические и кривошипные прессы.
Оптимальное обжатие за один нагрев в случае ковки или штамповки
40—50 % в области а-фазы и 70 % в области |3-фазы. Для титана мар-
марки ВТ1-00 температура начала деформации 947 °С, окончания 702 "С
Титан марок Вт1-00 и ВТ10 в отожженном состоянии обладает большим
запасом пластичности и хорошо штампуется в холодном состоянии. Раз-
Различные изделия из титана марок ВТ1-00 и ВТ1-0 можно получать гиб-
гибкой на холоду. Гибка в горячем состоянии допускает применение радиу-
радиуса загиба меньшей величины. Особенности сварки н пайки титана опре-
определяются его высокой химической активное гью при повышенных темпе-
температурах.
Недостатком титановых сплавов является их плохая обрабатывае-
обрабатываемость резанием.-Низкая теплопроводность титана затрудняет отвод теп-
тепла из зоны резания, металл налипает на инструмент, и он быстро выхо-
выходит из строя. При механической обработке титановых сплавов рекомен-
рекомендуется работать с малыми скоростями резания и обильной подачей ох-
охлаждающей жидкости.
Области применения
Титановые сплавы применяют в основном в химическом, тяжелом, энер-
i ешческом и транспортном машипосчроешш, в машиностроении для
легкой, пищевой промышленности, а также при изготовлении бытовых
приборов.
249
К стандартному оборудованию, изготовляемому из титана и его спла-
сплавов и серийно выпускаемому заводами, относятся запорная, емкостная
и перекачивающая аппаратура, включая насосы различных типов, тепло-
обменная аппаратура, сепараторы, центрифуги различных типов, гидро-
гидролизные аппараты и др.
Использование в народном хозяйстве оборудования, изготовленного
из титана и его сплавов, дает большой экономический эффект, так как
снижается материалоемкость, увеличиваются сроки эксплуатации, сни-
снижаются расходы на текущий и капитальный ремонты, повышается ка-
чсство готовой продукции.
4.7. ЦИРКОНИИ [1—35, 40, 51, 182—191]
Общие сведения и методы получения
Цирконий Zr — металл светло-серого цвета в компактном состояния
и темно-серого в порошкообразном.
Открыт в 1789 г. немецким химиком Клапротом в минерале цирконе.
Металлический цирконий впервые получен в 1824 г. шведским химиком
Берцелиусом путем восстановления фторцирконата калия натрием. Чис-
Чистый пластичный цирконий был получен лишь в 1925 г. термической дис-
диссоциацией иодида циркония по методу, предложенному голландскими
учеными Ваи Аркелем и Де Буром. Начало промышленного производст-
производства ковкого циркония относится к 50-м годам нашего столетия. Свое на-
название цирконий получил по минералу циркону.
Содержание циркония в земной коре 0,02 % (по массе). Известно
около 20 минералов, содержащих цирконий. Из них наиболее важными
являются циркон, бадделеит и эвдиалит.
Способы получения циркония подразделяются на две группы.
1. Металлотермическое восстановление:
а) восстановление фторцирконата калия I^ZrFe натрием (калием) и
фторида циркония кальцием;
б) восстановление четыреххлористого циркония магнием и натрием;
в) восстановление диоксида циркония кальцием или гидратом каль-
кальция.
2. Электролиз расплавленных сред.
Ковкий цирконий получают восстановлением четыреххлористого цир-
циркония магнием и путем электролиза.
Цирконий, используемый в виде порошка, получают восстановлением
фторцирконата калия натрием и восстановлением ZrO2 кальцием или
его гидридом.
Цирконий высокой чистоты может быть получен термической диссо-
диссоциацией паров иодида циркония.
Подавляющую часть циркония для превращения его в пластичный
компактный металл плавят в вакуумных дуговых печах с расходуемым
электродом. При плавке происходят дегазация металла, в частности уда-
удаление водорода, и испарение некоторых элементов. Для повышения од-
однородности состава проводят дуговой переплав.
Цирконий повыш-енной чистоты получают электронно-лучевой плав-
плавкой. Относительно небольшие количества циркония и сплавов на его ос-
основе превращают в компактный металл методом порошковой металлур-
металлургии. Исходный порошок циркония высокой чистоты получают электро-
электролизом, а также измельчением циркониевой губки в атмосфере аргона.
Цирконий кальциетермический производят в виде порошка, который
имеет серовато-черный цвет и предназначен в основном для электрова-
электровакуумной промышленности. Содержание циркония (общ.)—ие менее
98,0%, циркония (активи.)—не менее 92%; содержание примесей, %,
250
не более: 0,05 Fe; 0,05 Са; 0,003 С1. Влажность порошка >15 %. По-
Поставляется порошок в полиэтиленовых мешках массой до 3 кг, кото-
которые помещаются в металлические банки.
Цирконий натриетермический — металлический порошок, получае-
получаемый восстановлением фторцирконата калия натрием. Общее содержа-
содержание циркония 92—94%, примесей, %, не более: 0,3 Fe, 0,15 Са, 0,15 Mg.
Влажность порошка >14%. Поставляется в полиэтиленовых мешках
или банках массой не более 3 кг, которые помещают в железные ко-
коробки.
Физические свойства
Атомные характеристики. Атомный номер 40, атомная масса 91,22 а. е. м.,
атомный объем 13,97-10~6 мэ/моль, атомный радиус 0,159 нм, ионный
радиус 0,082 нм. Первый потенциал ионизации 6,84 эВ. Электроотрица-
телыюсть 1,4.
Цирконий существует в двух аллотропических модификациях: до
860°С а-цирконий с гексагональной плошоупакованпой кристаллической
решеткой, имеющей периоды: а = 0,3223 им; с = 0,5147 нм; координаци-
координационное число 6; 6; выше 862 °С — [5-цирконий с о. ц. к. решеткой, имеющей
период <з = 0,361 нм. Строение внешних электронных оболочек 4p24d2.
Энергия кристаллической решетки 584 мкДж/кмоль. Эффективное
поперечное сечение захвата тепловых нейтронов 0,18■ 10~23 м2.
Известно пять природных изотопов циркония:
Массовое число . . 90 91 92 94 96
Содержание, % . . 51,5 11,2 17,1 17,4 2,8
Эффективное попе-
поперечное сечение захва-
захвата тепловых нейтро- 0,1± 1,5+ 0,25+ 0,08+ 0,1±
нов х Ю28, м2 . . . +0,07 ±0,12 +0,08 +0,04 +0,1
Из искусственных радиоактивных изотопов наиболее важным явля-
является 95Zr с периодом полураспада 65 сут. Его используют в качестве
изотопного индикатора. Работа выхода электронов ср = 3,9-М,1 эВ.
Элсктроотрицательность 1,4.
Плотность. Плотность a-Zr при 293 К, по разным данным, p=6,49-f-
-Ьб,53 Мг/м3, P-Zr p=6,40 Мг/м3.
Электрические и магнитные свойства. Удельное электрическое сопро-
сопротивление при 298 К р = 0,388ч-0,46 мкОм.м, при 1073 К р= 1,43 мкОмХ
Хм.
Удельное электрическое сопротивление р и удельная электрическая
проводимость а для циркония чистотой 99,9 %:
т. к
100
200
300
500
700
р. мкОм • м
0,13
0,29
0,46
0,79
1,05
о, МСм/м
7,2
3,45
2,18
1,27
0,95
т, к
900
1100
1300
1500
1700
р, мкОм-м
1,23
1,34
1,16
1,27
1,39
о, МСм/м
0,81
0,75
0,86
0,79
0,72
Температурный коэффициент электросопротивления при 273—473 К
а=4,35-10-3К-\ а при 273—1073 К a = 2,93- 10-3K~'. Абсолютный
251
коэффициент т. э. д. с. при 298 К е=+9,5 мкВ/К. Коэффициент вторич*
иой электронной эмиссии отах=1,1 при ускоряющем напряжении пер-
вичиых электронов 0,35 кэВ. Температура перехода в состояние сверх-
сверхпроводимости Гс = 0,75 К. Постоянная Холла /?=+2,15-10-10 м3/Кл.
Цирконий парамагнитен. Магнитная восприимчивость увеличивается
линейно с повышением температуры до температуры перехода. Магнит-
Магнитная восприимчивость при 90 К %— +1,30-10~9, а при 293 К Х«"
+ 1,34-Ю-9.
Тепловые и термодинамические. Температура плавления <ал = 1852±
±10°С, температура кипения ^Кип=3600—3700 °С (по другим данным
4330 °С). Характеристическая температура вв=237; 290; 310 К (по раз-
различным данным). Удельная теплота плавления при 298 К Л//Пл =
=220 кДж/кг, удельная теплота сублимации Д//субл=6586 кДж/кг.
Удельная теплоемкость жидкого циркония B123 К) 367 Дж/(кг-К),
удельная электронная теплоемкость СрЛ = [2,78 мДж/(моль-К2)] -Т.
Удельная теплоемкость ср в зависимости от температуры:
Г, К 20 40 80 150 250 298 273—773
ср, Дж/(кг-К). • • 12,8 66 174 243 271 289 473
Теплопроводность к
т, К
3
11
36
273
X, Вт/(м-К)
0,70
30,20
48,60
29,5
в зависимости от температуры:
т, к
400
600
900
К Вт/(м-К)
26,74
24,6
25,61
т, к
1200
1600
1800
X, Вт/(м.К)
27,4*
34,4*
37,9*
Для циркония чистотой 99,99
Температуропроводность а в зависимости от температуры (иодидный
цирконий):
Т, К 900 1000 1135 1400 1600 1800 2000
e-lU<\ м?/с . . . 10,0 9,8 11,25 14,1 14,7 14,8 14,25
Температурный коэффициент линейного расширения а:
Г, К 0—593 593—1093 1173—1593
а- 106, к-1 . . . . 5,9 8,0 95
Объемный коэффициент линейного расширения E= 17,68- 10~в К.
Температурный коэффициент линейного расширения а монокристал-
монокристалла циркония в зависимости от температуры:
Г, К 293 373 473 573 773 973 1123
а.|а-10\ К-1 4,82 5,1 5,51 5,79 6,12 6,13 5,71
а||(,-10«, К-1 7,05 7,76 8,62 9,92 12,65 14,69 15,67
Коэффициент линейного расширения иодидного циркония (99,8 %) в
зависимости от температуры
Т К 373 473 573 673 773 873 973
«•10», К-1 • ■ • • 4,9 5,53 5,76 5,85 5,92 5,97 6,00
252
Молярная энтропия s° в зависимости от температуры:
298
500
1000 1500 2000 2500
3000
Г, К
s°, Дж/(мольХ
ХК) 38,77 52,59 73,35 89,68 98,89 114,25 1?0,37
Поверхностная энергия C-цирконня v = 1498 чДж/л!2; для грани A10)
1298 мДж/м2.
Энергия дефекта упаковки для г. п. у. решетки по данным рентгено-
рентгенографических исследований 220 мДж/м2.
Давление пара р в зависимости от температуры:
Г
р>
, к .
МПа .
65
1700
,66- Ю-5
53,
1900
12-Ю-3
18
2100
,62-10-1
2300
32,73
2500
359,7
Давление пара при температуре плавления 1,676 МПа.
Поверхностное натяжение жидкого циркония при 1850 °С а =
= 1400 мН/м.
Динамическая вячкосчь жидкого циркония при температуре плавле-
плавления 8,0 МПа-с.
Параметры самодиффузии поликристалла (по объему зерна):
Т, К ....
Е, кДж/моль
923— 1093
3-Ю-12
92,11
1193—1423
4- Ю-9
108,86
Параметры самодиффузии (предэкспоненциальиый множитель Д, и
энергия активации Е) циркония в (i-фазе-
т, к
1273—1523
1443—1773
1173—1773
2
2
Do
4.
,4-
,4-
ю-«
ю-8
ю-8
ь.
кДж/моль
108,
126,
159,
86
02
10
т, к
1173—1513
1173—1473
1173—1473
Do-
4,2-
1-
1-
М2/С
ю-9
ю-8
ю-8
Е
к Л ж,
1CU
113
113
ЧОЛЬ
48
04
04
Параметры взаимной диффузии (по объему зерен):
ft эле-
ГОВНО!
г
si
a-Zr
[i-Zr
Zr
Zr
2
Is
5»
II
H
H
в
в
Интервал
температур,
К
723—973
1073—1373
1188—1673
1373—1773
Образующая
фаза
Твердый рас iвор
То же
»
ZrB2
Do, M2/c
4,15-10-'
7,37-10-'
8,33-10-»
1,26-Ю-8
я,
кДж/моль
39,65
35,76
126
144,44
Ме-
Метод»
4
4
1
3
253
Продолжение
i элемент
OCHOBHOf
Zr
P-Zr
a-Zr
P-Zr
a-Zr
6-Zr
a-Zr
a-Zr
a-Zr
P-Zr
a-Zr
P-Zr
a-Zr
P-Zr
a-Zr
P-Zr
Zr
a-Zr
P-Zr
a-Zr
3-Zr
Zr
о
1*1 H
a. я
et £
.&<"
С
с
N
N
О
О
Si
V
Сг
Сг
Мо
Мо
Sn
Sn
Се
Се
Nb
Мп
Мп
Fe
Fe
и
Интервал
температур,
К
1173—1573
1373—1873
673—1098
1193—1913
<973
>973
1273—1473
873—1673
973—1123
1153—1373
873—1123
1153—1873
1193—1523
923—1093
873—1123
1153—1873
1273—1473
<1136
>1!36
1023—1133
1133—1373
1173—1323
Образующая
фаза
ZrC
Твердый раствор
То же
»
»
ZrSi2
Твердый раствор
То же
Твердый раствор
То же
»
у,
»
»
»
)>
»
»
»
Do, м2/с
3,44-Ю-2
3,57-10—в
—
1,5-10—в
9,13- Ю-9
69,2-Ю-4
1,1-10
1,12-10-1?
1,193-10-1?
3,85-10-»
6,22-10-i2
2,63-10-*
5-10-1?
2-Ю-1?
3,54-10-и
3,16-Ю-»
2,2
2,4-Ю-7
5,6-10-'
2,5- Ю-2
4,1- Ю-в
5,7-10-3
Е,
кДж/моль
171,66
143,5
164,12
128,53
124,77
236,3
234,4
122,2
75,4
171,2
103,7
286,5
163,29
92,11
105,9
173,2
138,16
126,2
138
200,2
125,6
318,2
Ме-
Метод*
3
1
2
2
2
2
3
* I — радиоактивный метод; 2 — химический; 3 — металлографический; 4 —
метод испарения в вакууме.
Оптические Спектральный (е^ ) и интегральный (ет) показатель из-
излучения:
Состояние
Неокисленное твердое
Неокисленное жидкое
Окисленное твердое . .
\
(к =0,65 нм)
0,32
0,30
0,4
ет
0,212—0,275A200—1700 К);
0,221—0,255 A400—2000 К)
0,142—0,684C51—1224 К)
Показатели преломления п и поглощения % поликристаллического
циркония в зависимости от длины волны:
X, мкм 0,4 0,8 1,2 1,6 2,0 2,5
л 1,0 1,5 2,2 2,5 3,0 3,0
% 2,4 3,2 3,8 4,0 4,1 4,3
254
Механические свойства
Временное сопротивление литого циркония (99,7 % Zr) при 20 "С ав =
= 575 МПа, а деформированного (катаного) 245 МПа.
" Механические свойства иодидного циркония:
и °с
20
200
OD, МПа
220
140
°П,2
МПа
80
50
6,%
45
55
300
400
ов,МПа
120
ПО
°0.2-
МПа
45
40
6, %
55
60
Механические свойства иодидного циркония (отожженный при 800 "С,
7 ч) в зависимости о г температуры испьпания'
'исп' с
20
-200
400
700
800
850
900
10С0
ав, МПа
275
196
157
78,5
29,5
24,5
29,4
9,8
ао_2. мпа
118
88
54
44*
.
—
6. %
15
.
.
40
■Ф. %
43
63
80
95
93
92
96
Анизотропии механических свойств иодидного циркония:
Обработка
Холодная прокатка (80 %
обжатия)
Рекристаллизация (800"С, 1 ч)
«V
вп*
900
230
МПа
ПП*
940
210
°П1Г
вп
480
80
МПа
ПП
400
130
в, %
ВП
5,5
30
ПП
2
18
* ВП — вдоль направления прокатки; ПП — поперек направления прокатки.
255
Свойства иодидного циркония при 20 °С в зависимости от режима
облучения:
Обработка после исходной холод-
холодной деформации (обжатне 50,4 %)
ов, МПа
.21
МПа
6, %
ь %
Исходная деформация . .
Облучение потоком 5,7-1023
иейтр/м2 при 50—60 "С . . .
Облучение потоком 1,5-1024
нейтр/м2
То же + отжиг при 523 °С,
100 ч . . . .
Облучение потоком 2,4-1024
нейтр/м2
То же + отжиг при 300 °С,
100 ч
597
657
613
574
577
634
646
584
652
530
11
8
8
7
14
26
21
23
' 19
24
Твердость в зависимости от состояния:
По Бринеллю, МПа:
Иодидный пруток
То же, кованый
Магниетермический, переплавленный
То же, после холодной деформации (обжатие 33 %)
То же, переплавленный в вакууме в графитовом тигле
Кальциетермический, спеченный в вакууме
По Виккерсу, МПа
Деформированный
Магниетермический, плавленый; прокатан при 850 °С,
отожжен
Плавленный в дуговой печи
Иодндный, плавленный в дуговой печи; прокован и про-
прокатан при 790 СС и на холоду, отожжен при 705 °С . .
То же; прокатан на холоду, отожжен при 750 °С . . .
По Роквеллу (HRB):
Иодидный, пруток
Магниетермический, переплавленный
Литой закаленный
Литой отожженный
638-687
670
98!
1840
1070—1220
1880
320
1800
1800
1040
730
25—30
68—76
89
85
Твердость (по Виккерсу) иодидиого циркония (99,99 % Zr) в зави-
зависимости от температуры:
t, °C .... 20 200 600 950 970 980 1020
HV, МПа. . . 903 540 235 98 59 39 24,5
Твердость (по Роквеллу, шкала В) циркония, нагретого в кислороде
в зависимости от температуры:
t, CC 500 600 800 900
HRB, МПа 90 85 89 92
256
Твердость циркония, нагретого в азоте в течение 1 ч при 700 °С, HRB
86, а в течение 24 ч, HRB 92 МПа.
Микротвердость Н^ при 20 °С:
Отожженный цирконий ........ 952
Иодидный (при нагрузке 0,2 Н) . . . . 1290
Магниетсрмический отожженный (при на-
нагрузке 2,94 Н) . . 1000—1800
Микротвердость Н ^ в зависимости от среды и температуры:
Нагрев в кислороде
t, "С • .
Hfi , МПа
Нагрев в азоте
500 600 700 800 900
2790 2790 3230 6680 8820
700 800 900 1000 1100 1120
2460 3790 6980 5020 4860 7360
/, °С • • •
//A , МПа .
Влияние вакуума и температуры на микротвердость
, МПа:
t, °с
900
1000
1100
1200
Воздух
2400
2900
3250
4000
Вакуум, Па
13,3
2200
2650
3000
3250
1,33
2000
2500
2750
3250
1,33.10-*
1500
1800
2100
2400
Ударная вязкость в зависимости от состояния циркония и температу-
температуры испытания:
t, "С
20
218
593
кси,
кДж/м2
33,7
36,9
59,1
t, "С
0
400
600
кси,
кДж/м2
2,26*
2,75*
3,92*
t, °с
—93
93
204
кси,
кДж/м2
170**
373+*
118**
t, °С
371
593
кси,
кДж/м2
184**
149**
* После прокатки при 600 °С. ** Иодидный, переплавленный.
Модуль нормальной упругости £=96,00-г99,0 ГПа.
Предел выносливости при переменном изгибе иодидного, плавленного
в дуговой печи циркония равен 55 МПа при 20 °С (образец с надрезом)
и 45 МПа при 400 °С.
Ползучесть иодидного, плавленного в дуговой печи циркония при
260 "С:
а, АП: .
Е, %/С
75,7 96,4 116,7
1,6-Ю-8 4,2-Ю-7 1,3-Ю-6
257
Продолжение
а, МПа 69,0 96,4 109,9
е, %/с 8,4-Ю-9 2,2-10—8 8,4.10-8"
Сжимаемость х= 1,12-10~и Па-'. Коэффициент Пуассона v= 0,33—
0,35.
Химические свойства
Нормальный электродный потенциал реакции Zr—4 e=<=tZr4+фо=—1,5 В.
В соединениях проявляет степень окисления +4.
При комнатной температуре цирконий обладает высокой коррозион-
коррозионной стойкостью на воздухе и во многих агрессивных средах.
Компактный цирконий при нагреве до 400—600 °С покрывается плен-
пленкой оксида. Цирконий в виде порошка при обычной температуре может
воспламеняться на воздухе.
Электрохимический эквивалент 0,2363 мг/Кл.
При температуре выше 600—700 °С цирконий активно взаимодейст.
вует с кислородом и азотом, образуя ZrO2 и ZrN, характеризующиеся
тугоплавкостью и высокой твердостью. При 300—1000 "С цирконий быст-
быстро адсорбирует водород, при этом он становится хрупким, более твер-
твердым; магнитная восприимчивость при насыщении водородом снижается.
При 1200—1300 "С в условиях высокого вакуума водород может быть
удален. При реакции с углекислым газом образуются оксиды и карби-
карбиды циркония, при реакции с парами воды при температуре около
300 °С — оксиды и гидриды.
Цирконий обладает высокой коррозионной стойкостью в серной, соля-
соляной и азотной кислотах до 100°С, а также в растворах щелочей (едко-
(едкого натра, едкого кали) и аммиака; хорошо растворяется в плавиковой
и кипящей серной кислотах. При 200—400 °С цирконий взаимодействует
с галогенами, образуя тетрагалогениды, при этом активность галогенов
по отношению к цирконию уменьшается с возрастанием атомного номера
галогена. Со фтором цирконий реагирует при комнатной температуре,
при этом образуется фторид циркония (ZrF4); взаимодействие с хлором
начинается при 200—400 °С, в результате чего образуется хлорид цир-
циркония (ZrCl4).
Изоморфные металлы, как правило, образуют с обеими модификация-
модификациями циркония непрерывные или ограниченные ряды твердых растворов.
Непрерывные ряды твердых растворов с обеими модификациями обра-
образуются в системах Zr—Ti, Zr—Hf, Zr—Se и др., с высокотемпературной
Р-модификацией — в системах Zr—Та, Zr—Nb. При взаимодействии цир-
циркония со многими переходными металлами — ванадием, хромом, молиб-
молибденом, вольфрамом, рением, никелем, железом — образуются ограничен-
ограниченные твердые растворы и химические соединения. В соответствующих
системах наблюдаются эвтектические и эвтектоидные превращения.
Растворимость бериллия, алюминия, индия в a-Zr при комнатной тем.
пературе не превышает десятых долей процента.
Технологические свойства
Цирконий поддается горячей и холодной обработке всех видов. Примеси
особенно кислород и азот, ухудшают способность к деформации. Поэтому
обработку давлением ведут в защитной атмосфере, которая предохраня-
предохраняет от возможного окисления и азотирования. Максимальные обжатия
при холодной обработке 70—80 %. Температура прокатки и ковки — до
850 °С.
258
Влияние среды на величину обжатия при прокатке циркониевых об»
разцов:
Среда
Воздух
Гелий
Вакуум 1,33 Па
То же, 1,33-Ю-2, Па ....
Обжатие, %, при <исп, "С
900
50
>90
>90
>90
1000
25
75
70
>90
1100
15
30
40
>90
1200
10
25
20
>90
Механическая обработка производится твердосплавным инструмен-
инструментом. При грубой обработке скорость резания 36,5 м/мин, подача за один
оборот 0,25 мм. Во избежание воспламенения стружки при перегреве
следует пользоваться острым, хорошо отполированным инструментом,
применяя обильное охлаждение.
Температура начала рекристаллизации циркония, очищенного зоиной
плавкой, составляет 270"С.
Сварку циркония осуществляют в инертной атмосфере (аргон, гелий)
способом аргоно-дуговой сварки. Возможна стыковая сварка, а в ряде
случаев сварка давлением. Крупные детали, а также детали сложной
формы после сварки отжигают при 800 "С.
Пайку производят твердыми припоями в атмосфере инертных газов.
Области применения
Цирконий и его сплавы применяют в атомной энергетике, металлургия,
машиностроении, электронике, производстве огнеупоров н т. д.
В атомной энергетике цирконий благодаря высоким коррозионным
свойствам, малому поперечному сечению захвата тепловых нейтронов,
хорошим механическим свойствам и высокой жаропрочности использу-
используют для оболочек тепловыделяющих элементов (твэлов).
В металлургии этот элемент используют для раскисления стали, мо-
модифицирования чугуна. Его вводят в качестве легирующей добавки в
специальные стали (нержавеющие, жаропрочные) в виде ферросилико-
циркоиия D0—45% Zr; 20—24% Si, остальное железо). Кроме того,
цирконий входит в состав цветных сплавов на основе магния, титана,
меди, никеля, свинца н др., куда его добавляют для повышения механи-
механических и других специальных свойств.
В машиностроении перспективно использование циркония для изго-
изготовления центрифуг, насосов, конденсаторов, испарителей, поршней, ша-
шатунов, тяг, лопастей турбин и др.
В электронике цирконий применяют для производства электровакум-
ных приборов в целях поддержания высокого вакуума (этот элемент
хорошо поглощает газы). В медицинской промышленности цирконий слу-
служит для изготовления зажимов, штифтов и др.
Благодаря низкой температуре воспламенения и высокой скорости
сгорания цирконий используют в пиротехнике, а также для фотовспы-
фотовспышек.
Циркон, не содержащий железа, применяют в производстве огнеупо-
огнеупоров, ^используемых для футеровки металлургических и стекловаренных
печей, а также в производстве строительной керамики, эмалей, глазурей,
абразивов, специальных стекол, хрусталя.
259
Диоксид и диборид циркония используют в качестве керамических по-
покрытий (керметы, обладающие высокой твердостью и стойкостью в ряде
агрессивных сред и выдерживающие кратковременный нагрев до
2750 °С). Соединения циркония применяют в качестве защитных покры-
покрытий сплавов, работающих при высоких температурах, для обработки
тканей с целью придания им водоотталкивающих и огнезащитных свойств,
в производстве красителей, а также в фармацевтической и парфюмерной
отраслях промышленности. Сверхпроводящие сплавы с цирконием —
перспективные материалы для магнитов в магнитогидродинамнческих
генераторах и термоядерных установках.
4.8. ГАФНИЙ [1—35, 192—194]
Общие сведения и методы получения
Гафний (Hf)—ближайший аналог циркония. Открыт в 1922 г. Костером
и де Хевиши — сотрудниками Института теоретической физики (Копен-
(Копенгаген) при изучении ими ряда циркониевых руд. В природных минера-
минералах гафний всегда сопутствует цирконию и разделение указанных эле-
элементов сопряжено с большими трудностями. Этим можно объяснить тот
факт, что гафний был открыт более чем на 130 лет позже циркония,
причем методом рентгеноспектрального анализа. Положение новых
спектральных линий было предсказано на основе электронной теории
Бора и Томсона. Распространенность гафния в земной коре 3,3-10~4 %
(по массе). Следовательно, этот элемент относится к группе редких.
Среднее отношение содержания гафния и циркония в минералах 0,01—
0,02. Известно более 20 минералов, содержащих цирконий и гафний; из
них наибольшее промышленное значение имеют циркон и баделит. Со-
Содержание диоксида гафния НГО2 в указанных минералах 0,5—2,0 и
1,0—3,0 % (по массе) соответственно. Пластичный гафний был получен
одновременно с пластичным цирконием иодидным способом. Промышлен-
Промышленное получение гафния в основном осуществляют магниетермическим ме-
методом путем восстановления четыреххлористого гафния магнием. Пер-
Перспективным является также электролиз фторгафната калия в хлоридно-
фторидном электролите с получением металлического порошка.
Металлургическое производство гафния получило значительное раз-
развитие в последние 25—30 лет в связи с созданием атомной энергетики.
В частности, разработаны методы очистки циркониевого сырья от гаф-
гафния, так как последний является сильнейшим поглотителем тепловых ией-
троиов. При этом было обнаружено, что гафний — превосходный мате-
материал для регулирующих стержней атомных реакторов на тепловых ней-
нейтронах, а кроме того, обладает высокой коррозионной стойкостью в го-
горячей воде и хорошими механическими свойствами. В настоящее время
в связи с расширением промышленного производства гафния его начали
применять в качестве легирующих добавок к некоторым сплавам спе-
специального назначения.
В нашей стране согласно ГОСТ 22517—77 выпускают иодидный гаф-
гафний двух марок ГФИ1 и ГФИ2.
Химический состав гафния ГФИ1, %: >99,8 2(Ш + Zr); 1,0 Zr; 0,005 N;
0,04 Fe; 0,005 Si; 0,05 Ni; 0,005 Ti; 0,005 Al; 0,01 Ca; 0,004 Mg;
0,0005 Mn; 0,01 C; 0,003 Cr.
Химический состав гафиия ГФИ2, %: >99,5 2(Hf + Zr); 1,0 Zr; 0,01 N;
0,1 Fe; 0,01 Si; 0,05 Ni; 0,01 Ti; 0,005 Al; 0,01 Ca; 0,004 Mg; 0,0005 Mn;
0,01 C; 0,003 Cr.
Осаждение гафния производят на нагретую молибденовую проволо-
проволоку. Массовая доля молибдена в гафиии за счет проволоки не должна
превышать 0,1—0,2 %.
260
Физические свойства
Атомные характеристики. Атомный номер 72, атомная масса 178,49
а. е. м., атомный объем 13,42 -Ю'6 м3/моль. Атомный (металлический)
радиус 0,159 нм, нониый раднус Hf4+ 0,082 нм, ковалентный радиус
0,1442 нм. Конфигурация внешних валентных электронных оболочек
атома гафния 6s25d2. Значения потенциалов ионизации /(эВ). 7,5±0,5;
15±12; 23,3±0,1; 33,3±0,1. Электроотрицательность 1,3. При обычных
условиях гафиий имеет гексагональную кристаллическую решетку (а-мо-
дификация) с периодами: а = 0,3197 нм, с = 0,5057 им, с/а= 1,582. При
1740±5°С происходит полиморфное превращение а->0. Высокотемпера-
Высокотемпературная Р-модификацня имеет о. ц. к. решетку с периодом а = 0,3615 нм.
Экстраполяция значения периода Р-гафния на комнатную температуру
дает значение периода а = 0,35 им. Гафиий существует в виде шести
стабильных изотопов:
Массовое
число
174
176
177
Содержание
изотопа в
естественной
смеси, %
0,18
5,15
18,39
Эффективное
поперечное
сечение за-
хпата тепло-
тепловых нейтро-
нейтронов X 10й, м2
1500+1000
15±15
380+30
Массовое
число
178
179
180
Содержание
изотопа в
естественной
смеси, %
27,08
13,78
35,44
Эффективное
поперечное
сечение за-
захвата тепло-
тепловых нейтро-
нейтронов Х102», м!
75±10
65±15
14±5
Наряду со стабильными изотопами существуют нестабильные
пы гафния:
изото-
Массовое
число
170
171
172
Период
полураспада
1,87 ч
16 Ч
5 лет
Массовое
число
173
175
179
Период Массовое
полураспада число
23,6 ч
70 дней
19 с
180
181
183
Период
полураспада
5,5 Ч
46 дней
64 мин
Изотопы с массовыми числами 179, 180 относятся к изомеричесмш
состояниям, из которых образуются стабильные изотопы гафния той же
массы. Работа выхода электронов для «-модификации 3,20 эВ, для
^-модификации 3,53 эВ.
Плотность. Плотность гафния р в значительной степени зависит от
содержания в нем циркония. Принято считать, что изменение содержа-
содержания циркония в гафнии на 1 % (по массе) изменяет плотность на 1 %.
Наиболее достоверным является значение плотности гафния при 298+
±2 К, равное 13,09+0,01 Мг/м3 при содержании 0,72 % (по массе) Zr.
Электрические и магнитные. Удельная электрическая проводимость
сг в зависимости от температуры:
261
т, к
100
200
300
а, мсм/м
7,15
3,58
2,44
Г, К
500
700
900
а, МСм/м
1,43
1,03
0,82
Удельное электрическое сопротивление р в
туры:
т, к
100
200
300
р, мкОм.м
0,14
0,28
0,41
Т. К
500
700
900
р, мкОм-м
0,70
0,97
1,22
г, к
1100
1300
1500
1800
зависимости
Т. к
1100
1300
1500
1800
<т, МСм/м
0,71
0,63
0,59
0,54
от темпера-
р, мкОм-м
1,42
1,58
1,71
1,84
Температурный коэффициент электросопротивления в интервале тем-
температур 273—373 К а = 4,4-10~3 К . Температура перехода в сверх-
сверхпроводящее состояние Гс = 0,128 К. В термопаре гафний—платина
гафний проявляет положительную т. э. д. с. по отношению к платине.
При 723 К э. д. с. указанной термопары достигает 6 мВ. Максимальный
коэффициент вторичиой электронной эмиссии сттах=1,16 при ускоряющем
напряжении первичиых электронов 0,7 кэВ.
Постоянная Холла R гафния чистотой 99,4 % в зависимости от тем-
температуры:
Г, К 0 56 100 200 273
R- 1010, м3/Кл —0,22 0 +0,12 +0,33 +0,43
Магнитная восприимчивость % возрастает с ростом температуры. При
комнатной температуре она составляет 0,42-10—9, а при 1673 К равна
+ 0,58- Ю-9.
Тепловые и термодинамические. Температура плавления ?пл=2230±
±15 °С, температура кипения /Кип = 5225°С, характеристическая темпе-
температура 9d = 219 К, определена при 20 К. С повышением температуры
6d снижается и достигает минимума, равного 178 К при 120 К. Удель-
Удельная теплота плавления гафния А//„л, отнесенная к 298 К, равна
122 кДж/кг. Удельная теплота сублимации АНсу5л, отнесенная к 298 К,
равна 3470 кДж/кг. Удельная теплоемкость гафния cv по мере повы-
повышения температуры непрерывно возрастает и при 298 К составляет
143 Дж/(кг-К). Изменение ср в зависимости от температуры:
т, к
300
400
500
600
700
800
900
ср- Дж/(кгХ
ХК)
143
146
148,4
151
154
157,4
160,2
Т. К
1000
1100
1200
1300
1400
1500
1600
V
Дж/(кг-К)
163
165
168,6
171,4
175
177
179,8
т, к
1700
1800
1900
2000
2100
2200
2300—3000
Дж/(кг-К)
182,6
185,4
188,2
191
193,8
196,6
198,8
262
Электронная теплоемкость сэ" — [2,6 мДж/(моль-К)]7\
%
Теплопроводность X
г, к
373
525
S25
>., Вт/(м-Ю
22,2
21,2
20,5
гафиия с
г, к
1200
1400
1600
1,5 % Zr в
*,, Вт/(м-К)
22,5
24,0
25,6
зависимости
г, к
1800
2000
от
темпе-
Вт/(м-К)
27,2
28,8
Температурный коэффициент линейного расширения а как средняя
величина между данной и комнатной температурой для а-гафния:
т. к
ЗСО
473
673
а -10", К™1
6,59
6,98
7,42
Г, К
873
1073
1273
ое-10'', К"
7,85
8,29
8,72
Т, К
1473
1673
1873
а. 10", К~"
9,15
9,57
9,98
При 1740±15°С гафиий претерпевает полиморфное превращение
азрьр, тепловой эффект этого превращения ДЯа^. р =37 52 кДж/кг.
Молярная энтропия гафния s° в зависимости 'от температуры изме-
изменяется следующим образом:
Т, К 298 500 1000 1500 2000 2500
s°, Дж/(моль • К) • • • 45,66 59,1 78,2 90,5 99,9 117,2
Поверхностное натяжение сг жидкого гафния при 2500 К о"=
= 1460 мН/м. Поверхностная энергия fl-гафния вдоль грани {110} v=
= 1345 мДж/м2. Гафний по сравнению с другими тугоплавкими метал-
металлами имеет низкое значение давления пара р как в твердом, так и в
жидком состоянии. Ннже приведены данные об изменении давления па-
пара в зависимости от температуры:
т к
1800
2000
1
9
р.
,54
,02
Па
■ю-»
■10-5
г, к
2200
2400
2
4
Р. Па
,52- Ю-3
,03-Ю-2
т. к
2600
2800
3
р.
,95
2
Па
•10-1
,70
При температуре плавления давление пара гафния р=9,23-10~8 МПа.
В общем виде изменение давления пара над твердым гафнием можно
описать уравнениями:
тв 31800 ± 150
lgp^f = = + 6,855 ± 0,072 A940 — 2464К);
30440 ± 240
+ 6,304 ± 0,085 B500 — 2550К).
263
Параметры самодиффузии для ^-гафния в интервале 058—2431 К
имеют следующие значения: £H=4,8-10~7 м2/с, энергия активации £=
= 183 кДж/моль. Энергия активации диффузии азота в гафнни при об-
образовании твердых растворов в интервале 1149—1307 К равна Е=
= 238 кДж/моль. Параметры диффузии кислорода при образовании
твердых растворов в интервале 773—1893 К Do= @,4—1,4) ■ 10~4 м2/с,
£=233 кДж/моль.
Оптические. Излучательная способность гафния (спектральный г ^ и
интегральный ег коэффициенты излучеиия):
т, к
1300
1500—2100
1100—1900
2000—2100
2150
1300—1700
1300—2100
1700—2000
Состояние
Неокисленный
.
Неокисленный
.
Неокисленный
X Ет.
гладкая поверхность
0,465*
0,445*
0,266—0,324
0,322—0,307
0,314
0,315—0,330
0,3—0,333
0,330
К им
0,65
0,65
* е, ; в остальных случаях е
Механические свойства
Твердость гафния при 20°С ЯУ=1800н-2000 МПа. Механические свой-
свойства в зависимости от температуры.
t. "С
20
150
270
370
0В, МПа
420
362
285
228
V МПа
228
195
152
107
6, %
33
40
50
53
Ф. %
38
45
56
58
Ударная вязкость KCU гафния, полученная на нестандартных об-
образцах, отожженных при 975 °С в течение 15 мин, равна 230—
300 кДж/м2. При повышении температуры KCU возрастает, достигая
при 307 °С 620 кДж/м2. Модуль нормальной упругости £=140 ГПа,
модуль сдвига G = 31,0 ГПа, коэффициент Пуассона v=0,33-^0,37,
сжимаемость при 30°С и давлении р=1170 МПа отвечает уравнению:
Д у/у=8,83- 10-8р—2,32- 10-13р2-
При75°С это уравнение имеет вид: AF/V=8,64-10"8 р—2,37'Ю-'3 р2.
Сжимаемость гафния при 27 °С х = 0,864-10~13 Па-1,
Предел выносливости иодидного гафния, определенный на полиро-
полированных образцах, при комнатной температуре сгя= 124-Т-133 МПа на
базе 2-Ю4 циклов; при 371 °С сгп=81 МПа на базе C—5) • 104 циклов.
264
Скорость установившейся ползучести е нодидного гафния при 400 "С
в зависимости от приложенного напряжения:
а, МПа 152 166 173 186 200
е %/с 8,4-10-w 2,0-Ю-8 1,0-10-' 2,4-10-" 2,8-10-
Микротвердость иодидного гафния при комнатной температуре Н^ —
= 2000 МПа.
Химические свойства
Нормальный электродный потенциал реакции Hf+H2O—4е*ШГО2+ +
+2Н + , фо=—1,7 В.
В соединениях, например солях, гафний проявляет степень окисле-
окисления +4 и гораздо реже +3 или +2; две последние степени окисления
для него нехарактерны.
При обычных условиях гафний стоек по отношению к горячей воде,
паро-воздушной смеси, щелочам, азотной кислоте, разбавленной соля-
соляной кислоте, жидкому натрию и в значительной степени растворяется
только в плавиковой кислоте и царской водке. Скорость коррозии гаф-
гафния при обычных условиях: в 10 %-ной H2SO4, 10 %-ной HNO3 и
10%-иой НС1 равна (8,9-4-9) Ю-3 мм/год, в 37 %-ной НС1 —3,ЗХ
XЮ-2 мм/год; в 50 %-ной NaOH — 4,6-10-'' мм/год; в 20 %-ной
NaCl — 2,2-10-3 мм/год.
Взаимодействие гафния с водяным паром начинается выше 375 °С;
при этом образуются диоксид и гидрид гафния. При этих же темпера-
температурах в результате сорбции водорода образуется гидрид HfH2 (б-фаза).
Гидрид гафния — фаза переменного состава и, как правило, содержание
водорода в ней всегда ниже отвечающего стехиометрическому составу.
Гидрид гафния устойчив при содержании в нем 34,5—57 % (ат-) Hf.
Растворимость водорода в a-Hf при 1052 К достигает 8,67% (ат.).
С кислородом гафний образует диоксид HfO2 — очень тугоплавкое сое-
соединение, устойчивое по отношению к химическому воздействию Темпе-
Температура плавления HfO2 /M=2905°C, температура кипения ^кип™»
= 5400 °С. Моноклинная модификация этого соединения устойчива до
1600 °С. Удельная теплота образования HfO2 из элементов при 298,15 К
АЯобР=—958,78 кДж/моль.
При высоких температурах гафний взаимодействует с углеродом,
образуя карбид HfC, имеющий кристаллическую решетку типа NaCl,
и плавящийся при 3890 °С. Карбид гафния хорошо проводит электри*
ческий ток, при нагреве взаимодействует с кислородом, азотом и гало-
галоидами. Теплота образования HfC АЯОбр = —187,06 кДж/моль.
Образование нитрида гафиия HfN связано со значительным выделе-
выделением тепла. Это соединение имеет кристаллическую структуру типа
NaCl, хорошо проводит электрический ток, обладает высокой твердо-
твердостью и химически инертно при обычных условиях, температура его плав-
плавления 2975 °С. Теплота образования HfN при 298,15 К АЯобр =
=—369 кДж/моль.
Из галогенидов гафния известны следующие: HfF4, HfCl4, HfBr4.
Для этих соединений характерен непосредственный переход при нагре-
нагревании из твердого в парообразное состояние при нормальном давлении;
температуры их возгонки ниже температур плавления, которые можно
установить лишь при давлении газовой фазы, превышающем атмос-
атмосферное:
265
Соедине-
Соединение
HfF4
HfCl4
HfBr4
Hfl4
Днобр'
кдж/моль
— 1824
— 1066,6
—941,4
—734,1
д"шг
кДж /кг
296
137
84
67
днсубл-
кДж/кг
740
313
201
170
'шг °С
927
427
422
482
'субл' °с
317
322
427
Гафний является полиморфным металлом и образует с рядом эле-
элементов твердые растворы. Непрерывные ряды твердых растворов он да-
дает с металлами, имеющими структуру, изоморфную одной из его поли-
полиморфных модификаций или двум модификациям. Так, при взаимодей-
взаимодействии гафиия с титаном и цирконием (аналоги гафния) образуются не-
непрерывные а- и |3-твердые растворы, с ниобием и танталом — непрерыв-
непрерывные Р-твердые растворы и ограниченные а-растворы. Это объясняется
тем, что кристаллическая структура последних двух элементов изо-
изоморфна структуре р-гафиия, кроме того, по своей кристаллохимической
природе эти элементы близки к гафнию. С элементами, в значительной
степени отличающимися от гафния по своим металлохимнческим свой-
свойствам, он образует ннтерметаллические соединения, прн этом наблю-
наблюдается ограниченная растворимость элементов в полиморфных модифи-
модификациях гафния. Гафний не образует интерметаллических соединений с
металлами более электроположительными, чем он сам. Некоторые све-
сведения о соединениях гафния с металлами:
Соединение
HfB
HfB2
HfCr2
Hf2Co
HfCo
HfCo2
HfGe2
HfFe
HfFe3
HfMn2
HfMn
HfNi5
HfRu
Hf2Rh
Hf2Rh3
HfPd3
HfRe2
HfOs
HfOs2
Hflr
Hflr3
Hf2Pt
HfPt3
HfSi
Тип структу-
структуры
NaCl (Bl)
Г. п. у., ZrB2
Mg№2
Ti2Ni
CsCl
MgCu2
Орторомб.
—
—
MgNi2
Ti2Ni
AuBeB
CsCl
Ti2Ni
Cu2Au
TiNi3
MgZn2
CsCl
MgZn2
Ti2Ni
Cu3Au
Ti2Ni
TiNi3
Геке.
Периоды решетки, им
а
0,462
0,314
0,5047
1,21
0,316
0,691
0,381
1,20
—
0,500
0,118
0,668
0,322
1,232
0,391
0,559
0,524
0,323
0,519
1,235
0,393
1,246
0,563
0,686
ь
0,347
1,6325
—
—
.—
1,50
—
—
1,633
—
—
—
•—
0,919
0,859
—
0,849
—
—
—
0,928
1,26
с
—
с/а =-3,234
—
—
—
0,377
—
—
с/а =3,263
—
—
—
—
—-
с/а =-1,643
с/а =1,637
—
с/а=1,635
—
—
—
с/а =1,634
с/а =1,84
<пл- °с
3250+100
1480
—
—
—
—
1542
2117
1585
—
—
—
—
—
—
—
—
—
•—■
—
—
—
266
Продолжение
Соединение
HfSi2
Hf.Sng
HfV2
HfW2
Тип структу-
структуры
Орторомб.
Mn5Si3
MgCu2
MgCu2
Периоды i решетки, им
а
0,367
0,841
0,737
ь
1,45
0,582
С
с =0,304
<пл- °С
1500
Технологические свойства и области применения
Гафний — тугоплавкий металл, однако сравнительно легко подвергает»
ся горячей пластической деформации, включая ковку, протяжку, вытяж-
вытяжку. При нагреве он энергично взаимодействует с кислородом и азотом
воздуха, поэтому нежелателен нагрев в газовых или пламенных печах,
работающих на жидком топливе. Целесообразнее нагревать металл в
расплавленных солевых ваннах; обычно используют хлоридные солевые
ванны, состав которых зависит от требуемой температуры нагрева. Ре-
Рекомендуется одноразовый нагрев металла для осуществления техноло-
технологической операции во избежание сильного загрязнения газовыми приме-
примесями. Пластическую деформацию гафния проводят в области темпера-
температур устойчивого состояния а-фазы. Рекомендуемые температуры нагрева
прутков для ковки 1080—1090 °С; прокатку осуществляют после нагре-
нагрева заготовки до 1000 °С. При горячей прокатке удается получить сте-
степень обжатия 15—20 % при каждом проходе, после чего необходим
15-мнн подогрев металла. Скорость прокатки в среднем 0,5—0,8 м/с.
Гафний хорошо поддается холодной прокатке, при. этом не снижаются
его коррозионные характеристики.
Гафний удовлетворительно сваривается методами дуговой сварки в
атмосфере гелия с использованием вольфрамового электрода. Учитывая
широкое использование гафния в атомной энергетике, разработана тех-
технология его сварки с циркалоем-2. Ударная вязкость сварных образцов
при комнатной температуре обычно выше, чем исходных материалов, а
при испытании на разрыв сварные образцы равнопрочны составляющим
этот образец материалам. Основная область применення гафния — атом-
атомная энергетика. Гафний — превосходный материал для регулирующих
стержней благодаря способности поглощать тепловые нейтроны, кроме
того, он обладает высокой коррозионной стойкостью в горячей воде,
достаточно пластичен и прочен. За последние годы гафнии начали ис-
использовать при создании жаропрочных сплавов на основе ниобия, мо-
молибдена, тантала. В настоящее время известно более 20 составов таких
сплавов, содержащих гафний. Определенное количество гафния расхо-
расходуется в электротехнической промышленности для изготовления иитей
ламп накаливания и электродов для газонаполненных разрядных трубок.
4.9. КУРЧАТОВИИ [1—35]
Общие сведения и методы получения
Курчатовий (Ки) — радиоактивный элемент, полученный искусственно;
первый трансурановый элемент, следующий за актиноидами. Открыт в
1964 г. советскими физиками в Объединенном институте ядерных ис-
исследований (г. Дубна) и назван в честь выдающегося физика И. В. Кур-
Курчатова. Синтез осуществлялся в результате слияния ядер плутония и
неона с последующим распадом ядра 264104 на изотоп 2в0104 и четыре
нейтрона igfPu-f \1п&-+шШ+а\п.
267
Физические свойства
Атомные характерстики. Атомный номер 104. Получены изотопы с мас-
массовыми числами 267, 259, 260 и 261. Наиболее долгоживущим является
Изотоп 2в1Ки (период полураспада 70 с). Электронная структура внеш-
внешних оболочек атома Qd^ls^.
Химические свойства
Курчатовий по химическим свойствам яилястся аналогом гафния. Из-
Известны хлориды курчатовия и гафния, которые при 400 "С находятся в
газообразном состоянии, а при снижении температуры до 50 °С пере-
переходят в адсорбированное состояние.
5. ЭЛЕМЕНТЫ ПЯТОЙ ГРУППЫ
5.1. АЗОТ [1—35, 195, 1961
Общие сведения и методы получения
Азот (N) — при обычных условиях бесцветный газ, не имеющий запа-
запаха. Основная составляющая атмосферного воздуха G8,2 % по объему),
открыт во второй половине XVIII в., по предложению Лавуазье назван
азотом.
Азот ■—неотъемлемая часть живых организмов. Неорганических сое-
соединений, содержащих азот, в природе встречается мало, за исключени-
исключением так называемой чилийской селитры NaNO3. Общее содержание аю-
та в земной коре, атмосфере н гидросфере составляет 0,04 %.
Чистый азот в лабораторных условиях обычно получают или терми-
термическим разложением его соединений, например нитрата аммония, или
пропуская воздух в замкнутом пространстве над раскаленной медью.
При этом медь, окисляясь, поглощает весь кислород. Наряду с азотом
в газовой фазе остается около 1 % аргона.
Для технических целей азот получают сжижением и фракциониро-
фракционированной перегонкой жидкого воздуха, которая основана на разнице тем-
температур кипения кислорода (—182,972 °С) и азота (—195,812 °С). При
перегонке из жидкого воздуха преимущественно испаряется азот, а ос-
оставшийся воздух становится все более насыщенным кислородом. Жид-
Жидкий азот поставляют потребителю в сосудах Дюара, газообразный —
в баллонах.
Физические свойства
Атомные характеристики. Атомный номер 7, атомная масса 14,0067 а. е.м.,
атомный объем 13,70-10~3 м3/моль. Атомный радиус азота (ковалеит-
ный) 0,062 нм. Конфигурация внешних электронных оболочек атома
2s22p3. Азот состоит из двух стабильных изотопов 14N и 15N, процент-
процентное содержание которых соответственно 99,635 и 0,365%- Кроме того,
известны четыре искусственных радиоактивных изотопа 12N, I3N, ieN,
17N, период полураспада которых 0,0125; 606; 7,4; 4,14 с соответственно.
При атмосферном давлении и температуре ниже —237,4 °С стабиль-
стабильна а-фаза N2, имеющая кубическую решетку; при 21 К период решет-
решетки а = 0,5667 нм. При —237,4 "С происходит полиморфное превращение
а=г±р с ДЯ=8,2 кДж/кг. Фаза Р обладает гексагональной кристалли-
кристаллической решеткой; при 50 К периоды решетки а = 0,4036 нм, с=0,6630нм.
268
Потенциалы ионизации атома азота / (эВ): 14,54; 29,60; 47,426. Элек-
Электроотрицательность 3,0.
Плотность. Плотность азота рентгеновская при 50 К составляв!
1,002 Мг/м3. При плавлении плотность азота снижается на 7,2 %•
Электрические и магнитные. Магнитная восприимчивость газообраз-
газообразного азота при 293 К %=— 0,43-10~9.
Тепловые и термодинамические. Температура плавления /пл =
=—210,012 °С, температура кипения txm = —195,812 °С. Удельная теп-
теплота плавления, отнесенная к 298 К, ДЯПЛ = 25,71 кДж/кг. Изменение
объема при плавлении Д1/=36-10-9 м3/кх, или ЛV/Vo=0,072. Теплота
сублимации при 298 К A//cy6jl =200,3 кДж/кг. Теплота атомизацни азо-
азота АНат =33,781 кДж/кг; теплота атомизации двухатомных молекул
Л//2-^? =33,781 кДж/кг; теплота атомизации трехатомных молекул
Д#ат = 22,126 кДж/кг.
Удельная теплоемкость азота в интервале 273—2500 К ср =
= 1040 Дж/(кг-К).
Теплопроводность азота X в зависимости от температуры при нор-
нормальном давлении:
Т, К ...... 63 123 273 573 973 1273
Я, Вт/(м ■ К) • ■ 0,0921 0,0813 0,244 0,455 0,640 0,7215
Молярная энтропия s ° азота (N2) в зависимости от температуры:
Г, К 298 500 1000 1500 2000 2500
s°, Дж/(моль • К) • . 191,6 206,7 228,2 241,9 252,1 260,2
Приведенный термодинамический потенциал Фт азота (N2) в зави-
зависимости от температуры:
Т, К 298 500 1000 1500 2000 2500
Фт , Дж/(моль • К) • 191,6 194,9 206,7 216,3 224,0 230,5
Давление паров азота (N2) при 63,5 К равно 12,95 кПа, а при
77,36 К — 98,1 кПа. Динамическая вязкость г\ сжиженного азота (N2)
при разных температурах:
Г, К 77,4 90,1 104,1 105,3 111,2
т),мПа-с .... 15,8 11,6 8,5 8,4 7,55
Показатель преломления света п в газообразном азоте при длине
волны 1 = 0,5893 мкм равен 1,000298.
Химические свойства
Высшая степень окисления азота +5, низшая —3. Известна степень
окисления азота, равная +2, +4.
В нормальных условиях азот очень инертен, так как состоит из двух-
двухатомных молекул N2, между атомами которых существует тройная
электронная связь; межатомное расстояние 0,10945 им. Тройная связь
обеспечивает большую устойчивость молекулы азота. Даже при нагре-
нагреве газа до 2700—3000 °С диссоциация молекул весьма незначительна.
Заметное расщепление молекулы азота на атомы происходит под воз-
воздействием тлеющего электрического разряда. Атомарный азот химичес-
химически очень активен. Так, при комнатной температуре он взаимодействует
со ртутью, а также с серой и фосфором. Молекулярный азот практи-
269
чески не взаимодействует ни с металлами, ни с металлоидами. Исключе-
Исключение составляет только литий. Образование соединения L'i3N медленно
протекает в атмосфере азота уже при комнатной температуре.
Имеется несколько соединений азота с водородом. Одно из наиболее
практически важных — аммиак. В настоящее время аммиак синтезиру-
синтезируют непосредственным переводом свободного азота воздуха в связанное
состояние по реакции: N2+3H2t*2NH3. Большую роль в процессе син-
синтеза аммиака играют катализаторы — чистое железо, оксид алюминия,
оксид калия. Аммиак представляет собой бесцветный газ с очень ха-
характерным запахом, хорошо растворимый в воде. При О "С в одном
объеме воды растворяется до 1200 объемов газа.
Из других соединений азота с водородом следует отметить гидра-
зин N2H4—бесцветную жидкость с температурой кипения 113,34 °С.
Гидразин является хорошим восстановителем. При его горении в атмо-
атмосфере воздуха или кислорода выделяется большое количество тепла.
Гидразин и все его производные сильно ядовиты.
Азидоводород, или азидоводородная кислота, HN3 — бесцветная
жидкость с температурой кипения 36 "С. Азидоводород и его соли —
азиды — взрывоопасны.
С кислородом азот образует ряд оксидов. Оксид с участием одно-
одновалентного азота N2O представляет собой бесцветный газ со слабым
запахом, малорастворимый в воде, не реагирующий ии с водой, ни с
кислотами, ни со щелочами.
Оксид NO с участием двухвалентного азота представляет собой бес-
бесцветный газ с температурой кипения —151,72 °С и затвердевания
—163,62 "С.
Диоксид NO2—бурый ядовитый газ, легко сгущается в краснова-
красноватую жидкость с температурой кипения 20,8 °С и затвердевания —11 °С.
NO2 является очень энергичным окислителем, многие вещества могут
гореть в атмосфере NO2. Оксид, образованный трехвалентным азотом,
N2O3, иначе азотистый ангидрид, представляет собой темно-сииюю жид-
жидкость, уже при низких температурах разлагающуюся на смесь N0 и
NO2.
Оксид, образованный пятивалентным азотом, N2O5, называемый
азотным ангидридом, в обычных условиях представляет собой белые
кристаллы, постепенно разлагающиеся на NO2 и О2. Это очень сильный
окислитель, при взаимодействии с которым воспламеняются многие ор-
органические вещества. Раствор N2O5 в воде дает азотиую кислоту HNO3,
принадлежащую к числу наиболее сильных кислот; в разбавленных
растворах она полностью распадается на иоиы Н+ и N0^".
Соединения азота с электроположительными элементами, главным
образом металлами, называются нитридами. Те нитриды, которые по
составу можно рассматривать как продукты замещения водорода в ам-
аммиаке, например LijN, Z113N2 и др., в большинстве случаев разлагаются
при воздействии воды с выделением аммиака. Переходные металлы
IV—VIA подгрупп образуют с азотом тугоплавкие нитриды, очень стой-
стойкие к термическому и другим видам воздействия, находящие широкое
применение в технике.
Области применения
Азот, добываемый в промышленности, широко используется в сельском
хозяйстве в виде азотсодержащих удобрений, в химической промышлен-
промышленности для синтеза соединений с широким спектром физико-химических
свойств.
Чистый азот используют также в качестве нейтральной атмосферы
при обработке металлов, а также для упрочнения поверхности изделий
270
из стали, сплавов титана и т. д. путем диффузионного насыщения, в ре*
зультате которого образуются нитридные фазы (азотирование). Соеди»
нения азота широко применяются в технике в качестве различных тра-
вителей на базе азотной кислоты, а также горючих смесей на базе раз-
различных азотводородных соединений. Аммиак является исходным сырьем
для производства различных видов азотсодержащих удобрений, азот-
азотной кислоты, карбанида и других веществ.
Ряд соединений азота — нитридов тугоплавких металлов — находят
применение* технике при создании твердых и упрочнении жаропрочных
сплавов.
Азот широко используется в сельском хозяйстве.
5.2. ФОСФОР [1—35, 197]
Общие сведения и методы получения
Фосфор (Р)—неметалл. Открыт в 1669 г. Брэндом (Германия), полу-
получившим светящееся в темноте вещество. Первоначальное название «хо-
л
лодный огонь», более позднее — фосфор, от греческого «phosphoros» —-
светоносный.
Лавуазье установил элементарную природу фосфора. В 1771 г. Шее-
ле предложил метод получения фосфора из костной золы путем прока-
прокаливания ее с углем.
Во второй половине XIX в. было организовано промышленное про-
производство фосфора из фосфоритов в ретортных печах; в начале XX в.
иа смену им пришли электрические печи.
Содержание фосфора в земной коре 8,0-10~2 % (по массе). Вслед-
Вследствие высокой реакционной способности фосфор в свободном состоянии
в природе не встречается. Все фосфорсодержащие минералы (около
190) представляют собой ортофосфаты.
Важнейшими из минералов, содержащих фосфор, являются апатиты
и фосфориты. Содержание фосфора (в пересчете на Р2О5) в апатитах
составляет от 20 до 41 %.
Фосфориты — минералы осадочного происхождения, главная состав-
составляющая которых — фосфаты кальция; кроме того, в них присутствуют
многочисленные включения кварца, кальцита, глауконита и др., а также
органические вещества. Содержание фосфора (в пересчете на Р2О5) в
фосфоритах 5—36 %.
В настоящее время фосфор получают, прокаливая фосфориты или
апатиты в электрических печах с песком (SiO2) и углем (С) без до-
доступа воздуха. Выделяющиеся пары фосфора конденсируются в прием-
приемнике под водой.
Условия поставки определяются модификацией фосфора. Фосфор
желтый технический ' согласно ГОСТ 8986—82 поставляют в специаль-
специальных герметичных стальных бочках, цистернах, предварительно иапол-
генных незамерзающим раствором хлоридов кальция и натрия. Над
желтым фосфором после заполнения бочки должен быть слой незамер-
незамерзающего раствора или воды не менее 50 мм и свободное пространство
не менее 5 % от общего объема. В цистернах слой жидкости не должен
быть менее 300 мм и свободное пространство не менее 10 % от объема
цистерны. Желтый фосфор хранят в закрытых складских помещениях;
срок хранения не ограничен.
Фосфор красный технический согласно ГОСТ 8655—82 постапляют
в стальных герметичных барабанах вместимостью 10 л или в металли-
металлических банках
1 В состоянии высокой чистоты — белый фосфор.
271
Красный фосфор хранят в сухих неотапливаемых закрытых склад-
складских помещениях из несгораемого материала. Срок хранения не огра-
ограничен. Не допускается хранение красного фосфора с другими горючими
материалами.
Желтый фосфор — сильно ядовитое вещество, предельно допустимая
концентрация паров его в воздухе рабочей зоны производственных по-
помещений 0,03 мг/м3. Смертельная доза для человека 0,05—0,15 г. Го-
Горящий фосфор тушат оксидом углерода СО2, раствором CuSOi или
песком. Воспламенившуюся от желтого фосфора одежду заливают во-
водой и снимают под током воды, так как фосфор может проникнуть че-
через ткань и продолжать гореть на коже. При ожогах кожи — промыть
большим количеством воды и обработать обожженные участки 1 %-ным
раствором медного купороса CuSO4-5H2O или раствором бикарбоната
натрия NaHCO3.
При попадании желтого фосфора в глаза — промыть 2 %-ным ра-
раствором бикарбоната натрия. Противоядием при отравлении фосфором
служит 2 %-ный раствор марганцевокислого калия КМпО4 или 1 %-ный
раствор медного купороса CuSO4-5H2O.
Красный фосфор токсичен, так как в его составе имеется примесь
желтого фосфора, легко воспламеняется от трения, ударов, при 210—
240 °С возможно самовоспламенение и самовозгорание при контакте с
окислителями.
Первая помощь при поражении красным фосфором аналогична ока-
оказываемой в случае желтого фосфора.
Физические свойства
Атомные характеристики. Атомный номер 15, атомная масса
30,973 а. е.м. атомный объем 13,93-10—в мэ/ш>ль. Атомный радиус
0,134 нм, ионные радиусы Р6+, Р3+, Р3- 0,035; 0,044; 0,186 нм соответ-
соответственно. Электроотрицательность 2,1. Конфигурация внешних электрон-
электронных оболочек 3s23jo3. Значения потенциалов ионизации / (эВ): 10,55;
19,65; 30,16.
Фосфор имеет один стабильный изотоп с массовым числом 31. По-
Получены шесть искусственных радиоактивных изотопов:
Массовое чис-
число 28 29 30 32 33 34
Период полу-
полураспада . . , 0,28с 4,45с 153с 14,3с 24,4с 12,4с
Наиболее важным является изотоп 32Р, широко применяемый как
меченый атом в химических и биологических исследованиях,
Известно 11 модификаций фосфора, важнейшие из них: белый, крас-
красный и черный. При температурах, близких к 25 °С, и давлении 101,3 кПа
термодинамически наиболее стабилен черный фосфор. Однако вследст-
вследствие малой скорости фазового перехода в этих условиях белый и крас-
красный фосфор могут длительно существовать как метастабильные формы.
Белый фосфор—белая воскообразная масса, образующаяся при кон-
конденсации паров фосфора и затвердевании жидкости. Существуют а- и
Р-формы белого фосфора. Высокотемпературная а-модификация имеет
кубическую решетку с приводом а= 1,851 нм. При температуре
—76,9°С и давлении 0,1 МПа стабильна C-модификация; с повышени-
повышением давления до 12 ГПа переход происходит при 64,5 °С. р-модифика-
ция имеет кубическую решетку с параметром а=0,2377 нм (при дав-
давлении 12 ГПа). В присутствии примесей белый фосфор приобретает
желтый цвет, поэтому технический фосфор называют желтым.
272
Красный фосфор — аморфное вещество; цвет — от коричневого до
фиолетового; образуется при нагревании белого фосфора без доступа
воздуха до 250—300 °С в течение нескольких часов. При длительном
нагревании красного фосфора выше 450 °С существуют его различные
кристаллические формы: триклннная, кубическая, тетрагональная и др.
Черный фосфор образуется при нагревании белого фосфора до
200—220 °С и давлении 1,2—1,7 ГПа. Указанное превращение в присут-
присутствии ртути и небольшого количества кристаллов черного фосфора осу-
осуществляется-при нормальном давлении и температуре 370°С в течение
8 сут.
Существуют аморфная и кристаллическая формы черного фосфора.
Кристаллы черного фосфора имеют ромбическую решетку с парамет-
параметрами: г! = 0,331 нм, 6 = 0,438 нм, с=1,050 нм. В элементарной ячейке —
8 атомов.
Энергия кристаллической решетки 315 мкДж/кмоль. Сродство ато-
атомов к электрону 0,8—0,9 эВ; энергия диссоциации молекул 5,0 эВ. Эф-
Эффективное поперечное сечение захвата тепловых нейтронов 19-10~30 м2.
Плотность. Белый фосфор: а-модификация имеет плотность р =
= 1,828 Мг/м3, ^-модификация 1,880 Мг/м3. Плотность желтого
2,223 Мг/м3, кристаллического черного 2,702 Мг/м3, аморфного черного
2,250 Мг/м3, красного от 2,000 до 2,400 Мг/м3.
Электрические и магнитные. Белый фосфор. По электрическим
свойствам а-белый фосфор близок к диэлектрикам. Удельная электри-
электрическая проводимость при 293 К 0=1О~15 См/м, удельное электрическое
сопротивление р== 1540 МОм-м.
Термический коэффициент электрического сопротивления при 273 К
а = 45,6-10~3 К~'- Ширина запрещенной зоны ДЯ«2,1 эВ; диамагни-
диамагнитен, магнитная восприимчивость %=—0,86- Ю-9.
Красный фосфор. Практически не проводит электрического
тока. Удельное электрическое сопротивление р=107—1012 Ом-м. Шири-
Ширина ?апрещеиной зоны Д£=1,55 эВ; магнитная восприимчивость % —
— ■—0,67-10~9; диэлектрическая проницаемость е==4,1.
Черный фосфор — полупроводник; при 298 К ширина запре-
запрещенной зоны Д£ = 0,33 эВ; удельное электрическое сопротивление р =
= 0,015 Ом-м; температурный коэффициент электрического сопротивле-
сопротивления а = 7,7-10~3 К; диамагнитен, удельная магнитная восприимчи-
восприимчивость х=—0,27-10-9.
Тепловые и термодинамические. Белый фосфор. Температура
плавления в зависимости от давления:
Р, МПа 0,098 22,736 50,764 93,688 140,238 183,456
tan, °C 44,1 50,01 59,85 70,18 81,79 92,01
Температура кипения /„„„ = 280,5 °С при атмосферном давлении.
Температура кипения в зависимости от давления:
Р, МПа . . 15,96 23,01 27,79 35,38 45,09 52,27 101,32
tmm- °С • 165 170 180 200 209 229 287,3
Удельная теплота плавления Д#Пл = 81,046 кДж/кг, удельная теп-
теплота испарения Л//„сп= 1892 кДж/кг, удельная теплоемкость при
298 К ср = 769,13 Дж/(кг-К), а теплопроводность Л = 0,56 Вт/(м-К).
Температурный коэффициент линейного расширения а=3,76'10~6 К
при 273—317 К. Молярная энтропия при 298 К s°=41,03 Дж/(моль-К).
Теплота образования белого кристаллического фосфора
17,5 кДж/моль.
Параметры самодиффузии белого а-фосфора в поликристаллическом
состоянии B73—313 К): Do= 1,07- Ю-7 м2/с, энергия активации Е=
273
=39,36 кДж/моль. Теплота перехода |3->-а 2,08 кДж/моль. При плав-
плавлении белого фосфора образуется жидкость, состоящая из молекул Р4
и склонная к переохлаждению. Давление пара Р4 при температуре
плавления 20,77 Па. Критические параметры: температура 968 К, Дав-
Давление 8,065 МПа. Зависимость динамической вязкости г) жидкого фос-
фосфора от температуры:
Г, К 316,2 321,1 326,65 333,2 342,7 352,9
т),МПа-с. ... 1,73 1,64 1,55 1,45 1,32 1,21
Кинематическая вязкость жидкого фосфора при 873 К v =
= 0,22-10~6 м2/с. Температурный коэффициент объемного расширения
жидкого фосфора при давлении 0,1013 МПа и температуре 323—333 К
Э=0,52-10—3 К~'. Поверхностное натяжение при температуре плавле-
плавления а = 52,3 мН/м.
Красный фосфор. Температура плавления t-nx — от 585 до
610 °С при давлении несколько десятков атмосфер. При обычном давле-
давлении красный фосфор расплавить нельзя, так как при сильном нагрева-
нагревании он, не плавясь, испаряется. Температура возгонки колеблется от
416 до 423 °С.
Давление паров красного фосфора в зависимости от температуры:
т. к
Р, Па
581,5
652,5
759,5
6,86-103
3,43-10*
5,351•10в
788
826
840
1,029-106
2,107-Ю6
2,793-106
862,5
866
907
968
4,224-Ю6
4,332-106
5,743- Ю6
8,056.10*
Удельная теплоемкость ср красного фосфора в зависимости от тем-
температуры:
Г, К ... 295—573 295—623 295—673 295—723 295—773
сР, Дж/
/(кг -К)- • 812,24 841,55 866,67 895,98 921,09
При 298 К для газообразного красного фосфора Р2 с„ =
= 1033,25 Дж/(кг-К), для Р4 сР=2169 Дж/(кг'К), для твердого со-
состояния при 298; 400; 600 К она соответственно равна 673,23; 851,15;
956,40 Дж/(кг-К).
Удельная теплота сублимации при 298 К Д#субл = 4123,34 кДж/кг,
удельная теплота плавления ДЯПЛ = 655,4 кДж/кг. Молярная энтропия
при 298 К для твердого состояния s°=22,85 Дж/(моль-К), для газо-
газообразного (Р2) 218,1 Дж/(моль-К).
Черный фосфор. Температура плавления около 1000°С при
давлении 1764 МПа. Давление паров р в зависимости от температуры:
Т, К ■ • 788 826 840
р, МПа. 0,833 1,891 2,803
Теплота образования черного кристаллического фосфора
39,35 кДж/моль. При нагреве до 560—580 °С под давлением собствен-
собственных паров черный фосфор превращается в красный.
Химические свойства
Фосфор проявляет степени окисления +5, +3, —3. Электрохимический
эквивалент фосфора со степенью окисления +5 равен 0,06421 мг/Кл.
274
Различные модификации фосфора резко различаются по химической
активности: белый, красный, черный (в порядке уменьшения активно*
сти).
Мелко измельченный белый фосфор самовоспламеняется на возду»
хе, в компактной форме возгорается при нагреве выше 50 °С.
Красный фосфор при нормальной температуре и влажности с пара»
ми воды и кислородом реагирует медленно, однако большие количест-
количества его при хранении на воздухе воспламеняются.
Черный фосфор более устойчив: его можно безопасно обрабатывать
на воздухе.
С водородом фосфор в обычных условиях ие взаимодействует, по-
поэтому соединения этих элементов получают косвенными путями, а имен-
именно: действием кислоты или воды на фосфиды металлов, кипячением бе-
белого фосфора с раствором едкого кали, термическим разложением низ-
низших кислот фосфора и др.
Известны следующие водородные соединения фосфора: фосфин РНз,
дифосфин РгН4 и твердые низшие гидриды фосфора, отвечающие общей
формуле РгпН„. Фосфин — сильный восстановитель.
Твердые низшие гидриды фосфора (РгпНп) являются полимерами
н во многих отношениях напоминают органические пластмассы и фос-
фосфатные стекла.
Фосфор образует с кислородом ряд оксидов.
Оксид фосфора (V) Р2О5, или фосфорный ангидрид, — белый, гиг-
гигроскопичный порошок, который возгоняется при 360 °С и атмосферном
давлении. Под действием света Р2О5 светится зеленым светом.
Фосфорный ангидрид взаимодействует с металлами, образуя смесь
фосфатов и фосфидов; с галогенидами, кроме фтора, не реагирует; де-
дегидратирует многие органические вещества; реагирует со спиртами, фе-
фенолами, эфирами, алкилфосфатами и др.; при сплавлении с основными
оксидами образует твердые фосфаты.
Оксид фосфора (III) РгО3, или фосфористый ангидрид, представля-
представляет собой летучие белые кристаллы, ядовит, хорошо растворяется в ор-
органических растворителях, при продолжительном хранении самопроиз-
самопроизвольно распадается. Обладает сильно выраженными восстановительны-
восстановительными свойствами, реагирует с хлором и бромом, образуя оксигалогениды.
Оксид фосфора (IV), или тетраоксид фосфора РО2(Р2О4), является
полимером (РО2)П, представляет собой блестящие прозрачные кристал-
кристаллы, которые возгоняются выше 780 °С, на воздухе расплываются, по-
поглощая влагу, хорошо растворяются в воде.
С фтором фосфор реагирует со взрывом; в атмосфере хлора и брома
белый фосфор воспламеняется на холоду; с красным фосфором реакция
протекает спокойно; с иодом белый фосфор взаимодействует при охлаж-
охлаждении, красный фосфор — прн подогревании. Галогениды фосфора чрез-
чрезвычайно реакционноспособны; химическая активность уменьшается от
фторидов к иодидам, аналогично уменьшается прочность.
При сплавлении фосфора с серой ниже 100 °С образуются твердые
растворы; выше 100 °С — кристаллические сульфиды P4S3, P4S5, P4S7,
PS
0
При смешении свежеперегнанного оксида фосфора (III) Р,|Об с рас-
рассчитанным количеством серы в атмосфере азота образуются оксисуль-
фиды фосфора: P2O3S2, P2O2S3, P4O4S3, РбОюБб. Известны и полимерные
сульфиды, состав которых соответствует молярному отношению
0 < Я/5 < 0,4.
С углеродом фосфор реагирует в парах при высоких температурах
(выше 2000 °С).
При взаимодействии хлорида фосфора (III) РС13 с ацетиленмагний-
иодндом (C2Mg2l2) образуется желтовато-белый аморфный осадок кар-
275
бида (РС3), ие растворяющийся в обычных растворителях и не разру-
разрушающийся кислотами и щелочами, но загорающийся при самом слабом
нагревании с выделением углерода
Пары фосфора реагируют с азотом в электрическом разряде, обра-
образуя твердые нитриды. Чистые нитриды белого цвета, при комнатной тем-
температуре инертны, не взаимодействуют с водой, хлором, соляной кис-
кислотой и разбавленной серной кислотой. Полностью разлагаются кипя-
кипящей концентрированной серной кислотой. Выше 500—700 °С нитриды
фосфора диссоциируют с образованием азота и элементарного фосфора.
С металлами, а также с более электроположительными элементами
(В, Si, As и др.) фосфор образует фосфиды, бурио реагирующие с водой
н минеральными кислотами.
Фосфиды металлов подгруппы меди термически неустойчивы, не
растворяются в азотной кислоте даже при кипячении, являются полупро-
полупроводниками.
Фосфиды металлов подгруппы цинка легко разлагаются водой и кис-
кислотами, в токе кислорода легко сгорают, сухой водород на них не дей-
действует, фтор действует уже при комнатной температуре, а хлор, бром и
иод — только при нагревании.
Фосфиды переходных металлов, а также лантаноидов и актиноидов
по физическим свойствам близки либо к полупроводникам (VP, NbP,
ТаР, CrP, MoP, WP, МпР), либокметаллам (TiP, ZrP, Ht'P). В химичес-
химическом отношении они относительно устойчивы, их химическая стойкость по-
понижается с уменьшением содержания фосфора. Фосфиды неметаллов и
так называемых полуметаллов — ковалентные соединения, представля-
представляющие собой либо диэлектрики, либо полупроводники. Фосфиды элемен-
элементов подгруппы бора уменьшают химическую активность от ВР к InP, a
ТеР при обычных условиях вообще не образуется.
Фосфиды элементов IV группы (Si, Ge, Sn, Pb) и V группы Периоди-
Периодической системы (As, Sb) в химическом отношении нестойки.
С кремнием фосфор образует Si2P и SiP, с германием GeP, с оловом
Sn4P3 и SnP4, со свинцом РЬ3Р2, с мышьяком AsP, с сурьмой SbP. Фос-
Фосфиды висмута не образуются.
При нагревании фосфора в парах НС1 образуется фосфин РН3, в
продуктах взаимодействия фосфора с НВг выделен бромид фосфония
РН4Вг, с HI — дииоднд фосфора РгЬ и иодид фосфония РН41.
При нагревании фосфора с водными растворами сильных щелочей об-
образуется фосфин РН3.
С водой фосфор не взаимодействует, но при температурах 600—
900 °С под давлением и в присутствии катализаторов (Pt, Ti, Zr, Си) об-
образуются фосфорная кислота Н3РО4 и водород.
Белый фосфор легко окисляется водными растворами солей метал-
металлов, имеющих низкий окислительно-восстановительный потенциал (Си,
Ag, Аи, РЬ и др.); красный и черный фосфор не окисляются.
Фосфорорганические соединения по своей структуре можно условно
разделить на фосфорсодержащие карбоновые кислоты и их производные
(эфиры, амиды и т. д.), а также фосфины, их производные и родствен-
родственные им вещества. Во всех этих соединениях имеется непосредственная
связь между фосфором и углеродом.
Области применения
Элементарный фосфор применяется в военном деле, в спичечной промыш-
промышленности, для производства термической фосфорной кислоты, полифосфа-
полифосфатов, хлоридов, сульфидов, фосфидов и других соединений.
В металлургии фосфор используют для легирования сталей (авто-
(автоматная сталь до 0,15% Р, нержавеющие стали до 0,3 % Р и и т. д.),
276
чугуна (фосфористый чугун до 0,8 % Р). Сплав медь — магний -*■ фосфор
(до 1,4 % Р) обладает высокой электропроводностью и слабо разупроч-
няется при нагреве; промышленный сплав меди с фосфором G % Р) от-
отличается сверхпластичностью в области температур деформирования
D00—600 °С); многие фосфорсодержащие сплавы применяют в качест-
качестве припоев; спеченные антифрикционные фосфорсодержащие сплавы (до
2 % Р), обладающие высокой механической прочностью, износостойко-
износостойкостью, прирабатываемостью, используют взамен железографита, бронзо-
графита и бронзы; спеченные фрикционные сплавы (до 1 % Р) применяют
для создания магнитио-мягких материалов, магнитопроводов и других
изделий; фосфорсодержащие сплавы наносят в виде покрытий для за-
защиты материалов от изнашивания, коррозии; пленки из сплавов Со—Р,
Ni—P, Со—Fe—Р, Со—W—Р ферромагнитны, их применяют для созда-
создания элементов памяти в вычислительных машинах.
Фосфор вводят в состав некоторых бронз (фосфористая бронза —
0,5—1,2 % Р), повышая их жидкотекучесть и стойкость против истира-
истирания.
Поверхностная обработка стальных изделий — фосфатирование —
обеспечивает защиту их от коррозии.
Фосфор используют как раскислитель в производстве сплавов цвет-
цветных металлов (до 1 % Р), что увеличивает их жаропрочность (фехраль,
хромаль и др.).
Применяют фосфор также для получения полупроводников — фосфи-
фосфидов галлия и индия, в состав других полупроводников его вводят в не-
небольших количествах в качестве необходимой добавки.
Фосфорная кислота используется для изготовления концентрирован-
концентрированных фосфорных удобрений (двойной суперфосфат, преципитат, нитро-
нитрофоска, нитрофос и др.). реактивов.
Фосфаты аммония применяют для пропитки тканей, пластика, дерева
для придания им огнестойких свойств; Фосфаты Fe, Na, К, Са — компо-
компоненты буровых жидкостей, зубных паст; фоефаш Са и аммония исполь-
используют для производства эмалей и в фармацевтической промышленности.
Мегафосфаты применяют в промышленное m для умягчения воды и
снижения ее коррозионной активности, для уаления накипи в паровых
котлах, вводят в состав некоторых моюших средств.
Полифосфаты применяют в производстве синтетических моющих
средств.
Фосфиды имеют следующие области применения: Фосфид бора — для
датчиков э. д. с Холла, полупроводниковых приборов, приемников
ИК-излучения, рабочих тел квантовых генераторов; фосфид меди —
для пайки лааушг. фосфид никеля — для создания износостойких покры-
покрытий на деталих машин.
Оксид (V) фосфора РгСц используется в качестве осушающего агента,
для дегидратации при получении метнлмечакрнлатных смол.
Широкое применение в промышленное!и нашли хлориды фосфора в
производстве красителей, инсектицидов, лекарств, поверхностно-активных
веществ и как эффективное хлорирующее средство
Области применения сульфидов фосфора — производство флотацион-
флотационных реагентов, антикоррозионных добавок к маслам и горючему, фос-
форорганических инсектицидов (тиофос, карбофос и др.). Фосфороргани-
ческие соединения — термостойкие ч огнестойкие лаки, клеи — для мо-
модификации полимеров, для получения неорганического каучука.
Атомная промышленность использует комплексные соединения фос-
фосфора для извлечения редких и трансурановых элементов из руд.
5.3. МЫШЬЯК [1—35, 157, 162, 195, 199—204]
Общие сведения и методы получения
Мышьяк (As)—элемент серого металлического цвета в компактном
состоянии и серого в диспергированном. Известен с глубокой древно-
древности.
Содержание в земной коре 5-10~4 % (по массе).
В природе находится в виде сульфидных руд, иногда в свободном
состоянии. Основные минералы: орпимент AS2S3, реальгар AS2S4 и арсе-
нопирит FeAsS. Сульфиды мышьяка встречаются вместе с сульфидами
других металлов (железа, никеля, кобальта).
Сырой (необработанный) элементарный мышьяк получают восстанов-
восстановлением его оксида углеродом или обжигом сульфидов до оксидов с по-
последующим их восстановлением. Получение ультрачистого мышьяка свя-
связано главным образом с производством полупроводниковых арсепидов
с большой подвижностью носителей. Принципиально ультрачистый мышь-
мышьяк может быть получен следующими методами:
— вакуумная возгонка;
— возгонка в водороде при повышенных температурах;
— дистилляция из раствора в свинце;
— выращивание монокристаллов мышьяка методом Бриджмена;
—- восстановление оксида (III) мышьяка;
— восстановление треххлористого мышьяка;
— термическое разложение арсина (мышьяковистого водорода);
— электроосаждение;
— парозонная очистка;
— зонная очистка арсенидов.
При определении содержания микропримесей в ультрачистом мышья-
мышьяке используют нейтронный активационный анализ и эмиссионную спект-
спектроскопию.
Большинство перечисленных методов очистки мышьяка связано с уда-
удалением серы и селена, являющихся донорами в арсенидах индия и гал-
галлия. Неблагоприятный коэффициент распределения не позволяет удалить
серу и селен зонной очисткой непосредственно из этих соединений. Из
перечисленных выше методов наиболее эффективны для удаления серы,
селена и теллура три: дистилляция мышьяка из его раствора в свинце,
выращивание монокристаллов мышьяка по методу Бриджмена и терми-
термическое разложение чистого арсина.
Плавка и выращивание монокристаллов мышьяка из расплава про-
проводится в толстостенных кварцевых ампулах, способных выдерживать
внутреннее давление не менее 100 атм. При выращивании монокристал-
монокристаллов по методу Бриджмена запаянную под вакуумом трубу помещают в
вертикальную печь с температурой 840 °С. Мышьяк плавится, и труба
опускается вниз со скоростью 1 см/ч.
Эффективность дистилляции мышьяка из раствора в свинце для уда-
удаления серы, селена и теллура:
Мышьяк
Исходный
Дистиллирован-
Дистиллированный из раствора в
РЬ:
при 600 °С
» 700 °С
Примеси, % (ат.)
S
A,1 -=-3,9) -Ю-6
1,1-Ю-9
6,6-Ю-8
Se
A,0-f-1,7)-Ю-4
2,7-10-s
7,4-10-'
Те
A,3ч-2,4)-10-'
2- Ю-8
2-10-8
278
В чистом виде мышьяк не ядовит, но соединения его токсичны. Сое*
дииения со степенью окисления +3 мышьяка действуют значительно
сильнее, чем соединения со степенью окисления +5. Мышьяковистый
водород — сильный гемолитический яд, треххлористый мышьяк сильно
раздражает слизистую оболочку. Еще более сильное раздражающее
действие оказывают арсины. Некоторые из соединений мышьяка обще-
ядовиты. Одним из возможных путей отравления является вдыхание со-
соединений мышьяка в виде пыли или капелек из растворов. Меры предо-
предосторожности: максимальная механизация и автоматизация работ, герме-
герметичность тары, уменьшение выделения пыли и непосредственного контак-
контакта с соединениями мышьяка, вентиляция производственных помещений,
дегазация спецодежды, спецпитание, богатое белками и витаминами.
Физические свойства
Атомные характеристики. Атомный номер 33, атомная масса 74,9216
а. е. м., атомный объем 12,98-10~6 м3/моль. Атомный радиус 0,148 нм,
ионный радиус As5+—0,047 им, As3+—0,069 нм, As3"—0,191 им. Электрон-
Электронная конфигурация изолированного атома мышьяка: 4s2 4р3.
Кристаллическая структура ромбоэдрическая с периодом: а =
= 0,4131 нм, а = 54°10'; координационное число 3; 3. Расстояние между
атомами внутри одного слоя 0,251 нм, в соседних слоях 0,315 нм (а-мо-
дификация). Энергия кристаллической решетки 254,2 мкДж/кмоль.
Известна ромбическая сиигония мышьяка с периодами: а=0,963 нм,
6 = 0,445 нм, с= 1,096 нм (^-модификация).
Потенциалы ионизации /(эВ): 9,81; 18,7; 28,3. Электроотрицатель-
Электроотрицательность 2,0.
В природе встречается один стабильный изотоп 75As. Остальные изо-
изотопы радиоактивны и получены искусственным путем; их характери-
характеристики:
Массовое
число
68
69
70
71
Период
полураспада
420 с
900 С
3120 с
2,58 сут
Массовое
число
72
73
74
76
Период
полураспада
1,08 сут
76 сут
17,5 сут
1,98 сут
Массовое
число
77
78
79
80
81
85
Период
полураспада
1,63 сут
5460 с
540 с
15 с
32 с
0,43 с
Работа выхода <р=5,11 эВ; 5,17 эВ (серый мышьяк).
Плотность. Плотность мышьяка ромбоэдрической сингонии, определен-
определенная пикнометрическим методом, р = 5,73 Мг/м3, рентгенографическим
методом, р = 5,778 Мг/м3.
Электрические и магнитные. Удельное электрическое сопротивление
мышьяка при 293 К р = 0,35 мкОм-м, удельная электропроводимость
0=2,86 МСм/м B73 К). Температурный коэффициент электросопротив-
электросопротивления « = 3,9-Ю-3 К.
Под давлением 14,0—22,0 ГПа мышьяк становится сверхпроводни-
сверхпроводником, температура перехода в сверхпроводящее состояние 7"с = 0,31 —
-т-0,5 К.
Постоянная Холла при 293 К # = +450.100 м3/Кл. Ширина за-
запрещенной зоны при 300 К Д£=1,2; 1,25 эВ. Подвижность электронов
279
ц.п=5-10-3; 6,5- Ю-3 м'/(В-'с). Подвижность дырок [хр=6,б'1О-'
м2/(В-с). Диэлектрическая постоянная статическая (низкочастотная)
е,—2,74.
Магнитная восприимчивость х=—0,073-Ю-9.
Тепловые и термодинамические. Температура плавления Л,л=817°С
C,55 МПа), температура кипения А„,п = 615°С, температура превраще-
превращения р->-а 270 °С, характеристическая температура 6 = 285 К. Удельная
теплота плавления Д//Пл = 290,9 кДж/кг C,5 МПау, удельная теплота
сублимации ДНсубл = 424,4 кДж/кг A05 Па, 615 °С).
В обычных условиях мышьяк возгоняется при 615 °С, не плавясь.
Молярная энтропия s° в зависимости от температуры:
Т, К 298 500 1000 1500
s°, Дж/(моль ■ К) 35,15 48,37 141,67 149,25
Г, К 2000 2500 3000
s°, Дж/(моль • К) 154,60 158,74 162,18
Давление пара р мышьяка в зависимости от температуры:
т, к
300
400
4
4
р,
,83-
,56-
Па
10-14
ю-7
г, к
500
600
6
р,
12
3,
Па
■ Ю-3
16
т, к
700
800
Р, Па
2,55-102
8,48-103
Удельная теплоемкость при 298,15 К £,,=329,5 Дж/(кг-К). Темпера-
Температурный коэффициент линейного расширения а=3,86' 10~в К.
Для монокристаллического образца мышьяка характерна резко вы-
выраженная анизотропия температурного коэффициента линейного расши-
расширения: для монокристалла мышьяка в направлении, параллельном оси
с, а || с= 44,3-10 К, в направлении, перпендикулярном оси с, а±с=
=3,1-Ю-» К-' C01—473 К).
Оптические свойства. Отражательная способность (коэффициент от-
отражения Hd) мышьяка'
К, мкм
0,310
0,411
0,620
V %
47
46
53
К, мкм
0,953
1,240
1,550
nD. %
70
65
52
к, мкм
2,070
2,480
1
V %
35
25
* Пленочные образцы. Показатель преломления
Я.=0,05893.
1,001552 при длине волны
Механические свойства
Твердость по Бринеллю при 20 °С ЯВ=1440 МПа.
Временное сопротивление при сжатии (мышьяк технической чистоты)
в зависимости от температуры:
280
100
180
100
141
200
108
200
65,7
300
36,3
300
18,6
400
12,3
400
5,2
скорость деформирования 10~2 с~]
Г, К 20
асвж, МПа 294
скорость деформирования 10~3 с~'
Г, К ■ 20
ol" МПа .... 337
Модуль нормальной упругости мышьяка при 20 °С £=7,75 ГПа.
Коэффициент упругости монокристаллического мышьяка (ГПа) при
293 К с'„ = 123,6; с,2=19,7; с,3=62,3; с,4=4,16; с33=59,1; С44=22,6;
Сбб=51,9.
Химические свойства
Нормальный электродный потенциал реакции As+2H2O—3 e=f*HAsO2+
+ЗН+, фо=О,25 В.
В соединениях проявляет степень окисления +5, +3, —3. На воздухе
при комнатной температуре мышьяк очень медленно окисляется с поверх-
поверхности. В диспергированном состоянии быстро переходит в AS2O3.
При воздействии азотной кислоты и царской водки образуется
мышьяковая кислота. Соляная кислота действует медленно и только
в присутствии воздуха. Водные растворы щелочей с мышьяком не вза-
имодействуют.
С кислородом мышьяк образует оксиды As?O3 и As2Os.
Гидриды мышьяка (твердые) получить очень трудно. Имеются сведе-
сведения о получении AsHo,62. Гидрид мышьяка AsH3 выделяется при гидро-
гидролизе AlAs.
Известно соединение AsN, которое может быть получено прямым
взаимодействием мышьяка с активированным азотом.
Мышьяк активно взаимодействует с серой, селеном и теллуром, об-
образуя соединения AS2S3, As2Se3, As2Te3 (соединения типа AVBVI). AS2S1
и As2Se3 при кристаллизации из расплавов склонны к стеклообразова-
нию, что нехарактерно для As2Te3. Ширина запрещенной зоны кристал-
кристаллических образцов As2S3 и As2Se3 равна 2,5 и 2,1 эВ соответственно.
У сульфида мышьяка возрастает фотопроводимость от длинноволновой
границы в сторону коротких волн. As2Te3—полупроводник я-типа с ши-
шириной запрещенной зоны 1 эВ.
В системе мышьяк—фосфор наблюдается широкая область твердых
растворов [от 26 до 100 % (ат.I; в интервале концентраций от 13 до
26 % (ат.) фосфора существует двухфазная область. Предполагается су-
существование соединения AsP.
Существует небольшая взаимная растворимость мышьяка и кремния.
Растворимость мышьяка в кремнии составляет при 1027°С 1,5.1021
атом/см3, т. е. 3 % (ат.). Известны соединения SiAs и SiAs2.
При взаимодействии мышьяка с щелочными металлами образуются
соединения типа Л3ВУ и А1ВУ. Слитием мышьяк дает соединения Li2As
(/„л=1000°С) и LiAs (fn,=550°C).
С металлами II группы Периодической системы мышьяк образует не.
сколько химических соединений. Соединения типа AUBV были первыми,
У которых открыты полупроводниковые свойства задолго до их обна-
обнаружения у германия и кремния. Соединение С<ЗзАз2 нашло практическое
применение. Многим соединениям типа А^В-; свойственны превращения
в твердом состоянии. В системах мышьяк — стронций и мышьяк — маг-
281
иий установлено существование соединений Sr3As2 и Mg3As2. Предпола-
Предполагается существование в этих системах более богатых мышьяком соеди-
соединений. Соединения типа Л11/}^ склонны к сильному переохлажде-
переохлаждению, а диарсенид кадмия CdAs2 можно легко получить в стеклообраз-
стеклообразном состоянии. Цинк и кадмий образуют с мышьяком по два соединения
Zn3As2, ZnAs2 и соответственно Cd3As2 и CdAs2. Все эти соединения в
поли- и монокристаллическом состоянии являются полупроводниками с
дырочной или электронной проводимостью с шириной запрещенной зоны
от 1,14 до 0,25 эВ.
С алюминием, галлием и индием мышьяк образует арсениды AlAs,
GaAs и InAs, имеющие большое практическое значение как полупровод-
полупроводниковые материалы. С редкоземельными металлами мышьяк образует
соединения с г. ц. к. решеткой типа NaCl.
В изученных системах мышьяка с другими переходными металлами
наблюдается образование одного или нескольких соединений стехиомет-
рического состава. Многие из них проявляют полупроводниковые свой-
свойства. В системах имеют место эвтектические превращения.
Технологические свойства
Данные о способах обработки мышьяка практически отсутствуют. Мышь-
Мышьяк характеризуется сравнительно высокой твердостью и хрупкостью при
комнатной температуре. Резкое разупрочнение наблюдается при темпе-
температурах выше 200 °С.
Области применения
Мышьяк давно используют в медицине и в сельском хозяйстве. Арсенид
натрия Na2HAsO3 применяют для уничтожения сорных трав, для борьбы
с вредителями сельского хозяйства, в животноводстве для борьбы с па-
паразитами.
Мышьяковистый ангидрид As2Os применяют как неизбирательный
гербицид, а также антисептик для пропитки древесины. Кроме того, он
входит в состав ряда патентованных препаратов.
Двойная соль уксуснокислой и метамышьяковистой меди
Си(СНзСООJ-2Си(АзО2J (швейнфуртская или парижская зелень) явля-
является красителем, находит применение также для борьбы с вредителями
сельского хозяйства, с личинками малярийного комара.
Арсенид магния используют в качестве люминофора при изготовле-
изготовлении люминесцентных ламп.
АэгОз применяют для обесцвечивания стекла, консервирования кож
и мехов.
Мышьяк технической чистоты является легирующей добавкой для
некоторых цветных сплавов, например для сплавов меди и свинца (при
производстве дроби).
Ультрачистый мышьяк имеет исключительно важное значение в про-
производстве полупроводниковых материалов.
Особое место среди этих материалов занимает арсенид галлия GaAs,
обладающий уникальными электрофизическими свойствами: большой
шириной запрещенной зоны, малой эффективной массой и большой под-
подвижностью электронов. Арсеиид галлия перспективен для изготовления
туннельных и излучательиых диодов, СВЧ-диодов и диодов Ганна, би-
биполярных и полевых транзисторов, импульсных и переключающих при-
приборов и инжекционных лазеров и т. д. Предполагается, что интеграль-
интегральные схемы на основе арсеиида галлия будут иметь преимущество в оп-
тоэлектронике и СВЧ-технике.
Арсенид индия также характеризуется малой эффективной массой и
высокой подвижностью носителей тока. На арсениде индия были полу-
282
чены р—я-переходы, которые дают значительные по величине фото-э. д. с.
Постоянная времени фотоэлемента, изготовленного из арсенида индия,
7 мкс. Арсенид индия — один из наиболее перспективных материалов для
изготовления сверхвысокочастотных транзисторов, предназначенных для
работы при низких температурах, а также один из лучших материалов
для термоэлектрогенераторов и инфракрасных детекторов.
Широко применяется в качестве полупроводниковых материалов
Cd3As2.
5.4. СУРЬМА [1—35, 205—209]
Общие сведения и методы получения
Сурьма (Sb) — металл серебристо-белого цвета с синеватым оттенком.
Известна человечеству с глубокой древности.
Латинское название stibium происходит от древнеегипетского «штем»,
«штим», греческого «стимми» или арбаского «стиби», в ряде стран Евро-
Европы и США принято название antimonium.
В 1789 г. французский химик Лавуазье включил сурьму в список про-
простых веществ и дал ей название «antimoine».
Русское название «сурьма» происходит от турецкого «сюрме», что пе-
реводится как «натирание» или «чернение бровей» (первоначальное при-
мснсггие сурьмы)
Содержание сурьмы в земной коре по данным разных исследовате-
исследователей 5-Ш^5—Ы0—'% (по массе).
Известно более 120 минералов сурьмы, в том числе самородная сурь-
сурьма, интерметаллические соединения, антимониды, сульфиды, простые и
сложные оксиды и гидроксиды, хлориды, силикаты, арсенаты и др.
Промышленное значение имеют немногие сульфиды, сульфосоли и
оксиды.
Антимонит (сурьмяный блеск, стибнит) Sb2S3. Химический состав:
71,7 % Sb, 28,3 % S; иногда содержит примеси мышьяка, серебра и зо-
золота (последние два металла, по-видимому, в виде механических приме-
примесей). Антимонитовые (иногда комплексные) руды являются главнейши-
главнейшими источниками сурьмы; в нашей стране, например, на их долю прихо-
приходится более 85 % всего производимого металла.
Тетраэдрит (блеклая руда) Cu,2Sb4Si3, или 3CuS-Sb2S3. Обычно об-
образует изоморфные смеси с теннантитом Cu,2As4Si3; содержит до 29,2 %
Sb. В некоторых разновидностях медь частично замещается серебром,
цинком, железом, ртутью, а сурьма мышьяком и висмутом.
Буланжерит Pb5Sb4S,i, или 5PbS-2Sb2S3, содержит 55,4% РЬ,
25.7 % Sb и 18,9 % S, иногда примесь галенита PbS и меди.
Джемсоинт Pb4FeSbeSu, или 4PbS-FeS-3Sb2S3, содержит 40—50%
РЬ, до 10 % Fe, около 30 % Sb, около 20 % S, часто примеси меди, цин-
цинка и серебра.
Бурноннт CuPbSbS3 содержит 13 % Си, 42,5 % РЬ, 24,7 Sb, 19,8 S и
обычно примеси железа и серебра.
Ливиигстонит HgSb4S7 содержит 22 % Hg, 53,4 % Sb, 24,6 % S.
Кермезит Sb2S2O, или 2Sb2O3-Sb2S3> содержит 74,9—75,2% Sb,
19.8 % S, 5,0 % О.
Валентинит Sb2O3 содержит 83,5 % Sb, 16,5 % О.
Сервантит Sb2O4, или Sb2O3-Sb2O5, содержит 79,2% Sb, 20,8 % О.
Стабиконит (Са, SbJ-Sb2O6(O-OH) содержит 57,9—75,0 % Sb.
Гидроромент Ca2-*Sb2(O, OHN_,-H2O содержит до 50,0% Sb.
По степени окисленности сурьмяные руды подразделяют на три ос-
основные группы: сульфидные (с окисленностью до 20 %), смешанные оксн-
283
сульфидные (до 60 % оксидов сурьмы) и окисленные (более 60 % окси«
дов сурьмы).
По вещественному составу сурьмяные руды классифицируют следую,
щим образом:
I. Собственно сурьмяные руды, в которых рудные минералы представ-
представлены антимонитом и продуктами его окисления. Такие руды дают боль-
большую часть сурьмы.
II. Комплексные сурьмяные руды: ртутно-сурьмяные, свинцово-сурь-
мяные, золото-сурьмяные, сурьмяно-вольфрамовые и сурьмяно-никелевые.
В соответствии с требованиями металлургического передела сурьмя-
сурьмяное сырье (концентраты) условно подразделяют по содержанию сурьмы
иа бедное (до 25 %), рядовое B5—45 %) и богатое .(более 45 %).
Богатые руды предпочтительнее обрабатывать по гравитационным
или комбинированным гравитационно-флотационным схемам, а рядовые
и бедные — методом флотации.
Окисленные руды подвергают дистилляционному обжигу, который ос-
основан на выделении сурьмы в виде летучего оксида (III) Sb2O3, улав-
улавливаемого из печных газов с целью последующего получения металла
восстановительной плавкой возгонов.
В зависимости от состава сырья металлическую сурьму получают
пиро- или гидрометаллургическими методами. К пирометаллургическим
методам относятся: осадительная (осадительно-восстановительная) и вос-
восстановительная плавки. Осадительная плавка, для которой используют
рядовое и богатое сульфидное и сульфидно-окисленное сырье, заключа-
заключается в вытеснении сурьмы из ее сульфида железом, которое вводят в
шихту в виде железной или чугунной стружки. Восстановительная плав-
плавка, для которой используют рядовое и богатое окисленное сырье, сурь-
сурьмяные пыли и возгоны, основана на восстановлении оксидов сурьмы (в
основном Sb2Ot) до металла твердым углеродом.
Кроме рассмотренных основных пирометаллургических способов пе-
переработки сульфидных сурьмяных концентратов, применяют также реак-
реакционную и окислительно-реакционную плавки, содовую плавку, плавку
на штейн, плавку иа возгон.
Гидрометаллургическим методом перерабатывают чисто сурьмяные и
комплексные концентраты. Этот метод включает две стадии: выщелачи-
выщелачивание сурьмы из сырья в растворителях и выделение металла из полу-
полученных растворов. Вторая стадия осуществляется либо цементацией
Цинком и алюминием, либо электролизом. Из электролитических способов
выделения сурьмы наиболее широко применяется электролиз сульфидно-
щелочных растворов.
Получаемый после пиро- и гидрометаллургической переработки сурь-
сурьмяного сырья черновой металл доводится до требований стандартов ме-
методами огневого и электролитического рафинирования. Огневое рафини-
рафинирование, основанное на окислении или сульфидировании содержащихся
в сурьме примесей, ведут в отражательных печах. При сульфидировании
используют элементарную серу, технический сульфид сурьмы (крудум)
Sb2S3 или сульфидный сурьмяный концентрат. В процессе сульфидиро-
вания удаляются железо, свинец, медь и другие примеси. Затем с при-
применением твердого каустика (92—98 % NaOH) удаляют мышьяк в виде
арсената натрия и серу при продувке воздуха под содовым шлаком. При
наличии благородных металлов применяют электролитическое рафиниро-
рафинирование, позволяющее концентрировать эти металлы в шламе. Электроли-
Электролитом служит сернокислый раствор SbF3, катодами — медные листы.
Для получения сурьмы особой чистоты используют химические спо-
способы, многократную возгонку в вакууме, зонную плавку в среде инерт-
инертного газа.
ГОСТ 1089—82 определены требования к сурьме, применяемой в
284
электронной, полупроводниковой технике, а также используемой для из-
изготовления сплавов, эмалей и др.
Химический состав различных марок сурьмы см. ниже.
Сурьму марок СуООООО, СуОООО, СуООО поставляют в слитках в виде
прутков массой от 0,5 до 2,0 кг. Сурьму марки СуООО изготовляют также
в виде порошка, сурьму марок СуОО, СуО, Су2 — в виде чушек массой
15—25 кг, сурьму марки Су 1Э —в виде чешуйчатых пластинок размером
до 70 мм и в виде чушек массой 15—25 кг. Слитки сурьмы марок
СуООООО, СуОООО, СуООО должны иметь чистую, гладкую поверхность се-
серебристого цвета. Поверхность сурьмы марки СуОО должна быть звезд-
звездчатой. На поверхности чушек сурьмы марки СуО, Су1Э и Су2 допуска-
допускаются пористость и инородные включения размером не более 4 мм.
Металлическая сурьма токсична. Основное ее количество попадает в
организм в виде пыли через органы дыхания, поэтому эффективным
средством защиты являются респираторы ПДК сурьмы 0,01 мг/м3. Сурь-
Сурьму следует хранить в закрытых помещениях, исключающих потери ме-
металла, загрязнение и попадание влаги.
Кроме кристаллической сурьмы, существует аморфная (желтая, чер-
черная и взрывчатая), Желтую сурьму получают пропусканием кислорода
через жидкий сурьмянистый водород при —90 °С; черную — быстрым
охлаждением паров; взрывчатую—электролизом 17—33 %-ного раствора
SbCb в соляной кислоте. Получаемая на катоде аморфная сурьма при
растирании легко взрывается, переходя в кристаллическую модификацию.
ХИМИЧЕСКИЙ СОСТАВ, %, РАЗЛИЧНЫХ МАРОК СУРЬМЫ
(ПО ГОСТ 1689—82)
Марка
СуООООО
СуОООО
СуООО
СуОО
СуО
Су1Э
Су2
Sb, ие менее
99,9999
99,999
99,99
99,9
99,6
99,4
98,8
РЬ
МО-5
Ы0-*
6-10-4
0,03
0,20
0,1
0,6
Примеси,
As
3- Ю-5
2- 10-4
5-Ю-4
0,01
0,02
0,2
0,2
не более
Fe
ью-5
2- I0-4
4-Ю-4
0,01
0,02
0,1
0,1
s
1-I0-»
5-10-5
5-Ю-4
0,01
0,10
0,1
0,1
Продолжение табл.
Марка
СуООООО
СуОООО
СуООО
СуОО
СуО
Су1Э
Су2
Sn
5-10—в
4-Ю-5
ыо-4
0,02
0,02
0,1
0,1
Si
1-Ю-4
МО-5
5-Ю-4
,
—
Прнмесн,
Zn
1-Ю-6
5- Ю-5
5- Ю-4
0,005
0,005
—
0,01
не более
I
В1
2-10—-
2-Ю-5
4-Ю-5
0,005
0,005
0,01
Аи
5-Ю-8
5-Ю-6
4-Ю-4
2-Ю-4
2-10—*
—
N1
5-Ю-6
2-Ю-6
2- Ю-4
0,008
0,016
—
-—
285
Продолжение табл
Марка
СуООООО
CyOOOO
СуООО
СуОО
СуО
Су1Э
Су2
1-
5-
5-
Си
1О-«
ю-«
ю-6
—
—
—
1
5
2
Примесн,
Cd
• ю-6
•10-6
•Ю-1
—
—
—
—
не более
Мп
I -10—«
5-10—*
2-Ю-4
—
—
—
—
Ag
ыо-«
4-10—с
1-Ю-5
—
—
—
—
Сумма нормируе-
нормируемых примесеЛ
9,3-1О-5
8,5-10-4
4,2-10-8
0,098
0,38
0,6
1.2
Физические свойства
Атомные характеристики. Атомный помер 51, атомная масса
121,75 а. е. м., атомный объем 18,19-10—в м3/моль, атомный радиус
0,161 нм, ионный радиус Sb6+ 0,062 нм, Sb3+ 0,09 им, Sb3- 0,208 нм.
Конфигурация внешних электронных оболочек 5s25/A Значения потен-
потенциалов ионизации /(эВ): 8,64; 16,7; 24,8. Электроотрицательность 1,9.
Сурьма известна в четырех модификациях: обычной — кристалличес-
кристаллической и трех аморфных—желтой, черной и взрывчатой. При обычных
условиях устойчива лишь кристаллическая сурьма, имеющая ромбоэдри-
ромбоэдрическую структуру, а=0,45064 нм, а=57,1 °. Энергия кристаллической
решетки 254 4 мкДж/кмоль. Природная сурьма состоит из двух стабиль-
стабильных изотопов: mSb E7,25 %) и 123Sb D2,75 %). Известно более 20 ра-
радиоактивных изотопов сурьмы с атомной массой от 112 до 135. Наибо-
Наиболее важны изотопы '22Sb, mSb и '25Sb с периодами полураспада 2,8 дня,
60,9 дней, 2,71 года соответственно. Эффективное поперечное сечение
захвата тепловых нейтронов 5,7-Ю8 м2. Работа выхода электрона
Ф=4,08 эВ, энергия кристаллической решетки 254,4 мкДж/кмоль, срод-
сродство к электрону 2,0 эВ.
Плотность. Плотность кристаллической сурьмы р=6,690 Мг/м3 при
293 К; при плавлении плотность уменьшается на 1,4% до 6,550 Мг/м3.
Плотность черной сурьмы 5,300 Мг/м3, взрывчатой 5,640—5,970 Мг/м3.
Электрические и магнитные. Удельное электрическое сопротивление
р и удельная электрическая проводимость сурьмы в зависимости от тем-
температуры:
Г К 78 273 450 650 850
р,'мкОм-м. . . . 0,08 0,39 0,46 1,08 1,44
а, МСм/м .... 12,5 2,56 2,17 0,92 0,69
Температурный коэффициент электрического сопротивления при 273 К
«==5,1-10-3 К-1, а в интервале 273—373 К 4,73-10 К.
Удельное электрическое сопротивление монокристалла сурьмы при
273 К: рпс = 0,263 мкОм-м, рс =0,360 мкОм-м, рс /рц,= 1,37.
Изменение электрического сопротивления при плавлении сурьмы
(904 К) Ртв/Рж = 0,71.
У твердой сурьмы э. д. с. положительна, плавление сопровождается
изменением знака т. э. д. с. Абсолютный коэффициент т. э. д. с. для по-
поликристалла равен е = +35 мкВ/К, для монокристалла в направлении,
параллельном оси с, е=+20,6 мкВ/К, перпендикулярном оси с <?=
= +46,8мкВ/К при 273 К и еПс=+24,2 мкВ/К и е ±с =+52,6 мкВ/К при
373 К соответственно.
286
Температура перехода в сверхпроводящее состояние Гс = 2,6+2,7 К.
Коэффициент вторичной электронной эмиссии атах=1.19 при ускоряю.
щем напряжении первичных электронов 0,600 кэВ.
Постоянная Холла при комнатной температуре Я = +210- 10-'° м3/Кл
и R——0,44 при 903—1253 К. Коэффициенты гальвано- и термомагнит-
термомагнитных явлений в сурьме (99,916 %):
т, к
291
325
2Э1**
В, Тл
0,8
1,10
0,309—0,683
«•10'",
М3/Кл
+219
+213
Р'-НР,
Л-м'.ЧВ-Кл)
+ 1,94
S*-102,
м8/(В.с)
+2,01
+2,62
Q*. 10".
mV(K-c)
+ 1,76
* P — коэффициент Эттингсгаузена; S — коэффициент Риги — Ледюка; Q —
коэффициент Эттингсгаузена — Нернста ** Мелкокристаллическая.
Сурьма диамагнитна, изменение магнитной восприимчивости х по-
поликристаллической сурьмы (99,96 °/о) в зависимости от температуры:
т, к
х- ю»
85 195 293 679
— 1,1 —0,85 —0,81 —0,75
Магнитная восприимчивость аморфной сурьмы при 293 К: Х=О,36Х
ХЮ"9; монокристалла сурьмы Хцс =—1.42- Ю-9, %±с=—0,50-10-9при
293 К и —1,73-Ю-9 и —0,50-Ю-9 прн 90 К соответственно.
Тепловые и термодинамические. Температура плавления гпл =
= 630,5 °С, температура кипения ^tHn= 1635 °С, характеристическая
температура 0В = 2О4 К, удельная теплота испарения Д#исп =
= 1371,6 кДж/кг, удельная теплота плавления Д#„л= 162,44 кДж/кг,
удельная теплота сублимации по различным источникам А//субл =
= 1570н-1712 кДж/кг. Удельная теплоемкость сурьмы при 298,15 К и
давлении 0,1013 МПа с„ = 206,98 Дж/(кг-К) (Sb); 170,76 Дж/(кг-К)
(Sb газ); 149,48 Дж/(кг-К) (Sb2 газ) и 166,24 Дж/(кг-К) (Sb4 газ).
Удельная теплоемкость ср в зависимости от температуры:
т, к
10
20
40
80
V
Дж/(кг-К)
2,09
26,28
83,20
152,27
т, к
150
250
293
V т к
Дж/(кг-К) |
190,72
204,52
208,79
400
623
923—1223
V
Дж/(кг.К)
212,73
224,83
274,65
Удельная электронная теплоемкость сэрл = [0,24 мДж/(моль-К2)] Т.
Теплопроводность к сурьмы (99,99%) невысокая (примерно в 20 раз
ниже, чем меди) и изменяется так:
т< К ...,.• 173 273 373 473 673 873 973
%, Вт/(м-К) • • • 22,7 18,84 17,0 15,95 18,06 23,23 21,0
287
Температурный коэффициент линейного расширения поликристалли-
поликристаллической сурьмы в зависимости от температуры:
г, к
а-10в,
273 473 673 873
9,2 9,6 10,0 10,3
Для монокристалла сурьмы (в интервале 273—673 К) ai = 8,lx
Х10~6 К (вдоль глазной оси симметрии) и а2= 19,5-10~6 К (пер-
(перпендикулярно к главной оси).
Температурный коэффициент объемного расширения р в зависимо-
зависимости от температуры:
Т. К
6, К
2,5 5 10 20 30 65 85 283
0,005 0,044 0,45 4,3 9,49 21,33 25,88 32,63
Молярная энтропия s ° и приведенный термодинамический потенци-
потенциал Фг сурьмы в зависимости от температуры:
Г, К 298 500 1000 1500
ЛДжДмоль-К) . 45,72 59,07 100,90 113,59
Фт, Дж/(моль-К) 45,72
Г, К 2000
s°, Дж/(моль-К) • 162,82
Фг, Дж/(моль-К) 87,96
48,61 61,38 76,78
Продолжение
2500 3000
167,01
103,37
170,44
114,29
Динамическая вязкость г] жидкой сурьмы в зависимости от темпе-
темпера 1\'ры
7", К. . . . 923 973 1023 1073 1123 1173 1275
1|МПа-с. . 1,50 1,26 1,16 1,08 1,05 0,99 0,902
Поверхностное натяжение а расплавленной сурьмы в зависимости
or revnepaiypu.
7", К • • • •
а, мН/м. . .
903
384
1023
368
1073
367
1173
361
1273
355
1373
348
Давление пара р при температуре плавления сурьмы в зависимости
от состава пара.
Состав пара . . . ZSb Sb Sb2 Sb4
p, Па 24,89 31,06-10-» 31,06-10—2 24,5
Изменение давления пара (S Sb) при более высоких температурах:
т, к
900
1000
1100
1200
р, Па
23,1
104,1
331
869
Т. к
1300
1400
1500
1600
Р, Па
2074
4442
9017
17 423
г. к
1700
1800
1873
1908
Р. Па
32 452
56 791
87 780
101 300
288
Давление пара при температурах ниже температуры плавления:
Г. К
486
516
Р. Па
1,33-10-8
1,33-10-'
г, к
547
617
Р. Па
1,33-Ю-8
1,33- Ю-4
г, к
1
700
881
Р. Па
1,33-Ю-2
1,33-10-1
Параметры самодиффузии (предэкспоненциальный множитель Da и
энергия активации Е):
Сурьма
Поликристалл (по объе-
объему) ....
Монокристалл:
|| с
± с
Г, К
657—856
733—903
733—903
Oj-101, м3/с
1,05
5,6
0,1
Е, кДж/моль
165
201,2
149,8
Параметры взаимной диффузии:
Диффундирующий элемент
Cd
Zn
т, к
473—693
613—703
2
0
£>„.
,14
,95-
М2/С
ю-7
ю-*
Е. кДж/чоль
120,16
91,3
Оптические. Отражательная способность (коэффициент отражения
Пп) полированной сурьмы:
I, мкм 0,6 1,0 2,0 3,0 4,0 9,0
nD, % 53 55 60 65 68 72
Показатель преломления для пленки толщиной 0,04—0,1 мкм:
X, мкм. .'..-. 0,050 0,062 0,083 0,124
п 0,87 0,70 0,40 0,45
Показатель поглощения % для пленки:
I; мкм . . 0,46 0,55 0,70
% 1,2 1,4 1,7
Механические свойства
Твердость по Бринеллю технической сурьмы #В=320-т-580 МПа, а б
и ч|) равны нулю, временное сопротивление при растяжении B0 °С)
Ов = 5-+-10 МПа, а при сжатии сГпЖ=84,4 МПа. С повышением чистоты
металла его прочностные свойства снижаются. После зонного рафиии-
289
рования твердость по Бринеллю равна 260 МПа, при этом пластич-
пластичность увеличивается, особенно при высоких температурах (данные для
СуООО):
t, "С ... 380 390 550
«,%..- 0 60 60
г|>, % ... 9 95 98
Микротвердость сурьмы //^=618 МПа, модуль сдвига G=20 ГПа,
модуль нормальной упругости £=58,02 ГПа (—187°С); 55 98 ГПа
B0°С); 47,01 ГПа D00°С); 32,73 ГПа F00°С). Сжимаемость х=
=2,48-10-" Па-1.
Химические свойства
Нормальный электродный потенциал реакции Sb + 4OH~—3e=F*SbOJ~ Ь
+2Н2О сро = — 0,67 В.
В соединениях проявляет степени окисления +3, +5, —3.
В обычных условиях чистая сурьма устойчива, на воздухе не окис-
окисляется и сохраняет свою блестящую поверхность даже в присутствии
влаги, при нагревании иа воздухе окисляется легко.
Сурьма нерастворима в воде, устойчива в концентрированной пла-
плавиковой кислоте, разбавленных соляной и азотной кислотах. С концен-
концентрированными соляной и горячей (90—95 °С) серной кислотами сурьма
образует соответственно треххлористую сурьму SbCl3 и сульфит сурь-
сурьмы Sb2(SO4K. В крепкой азотной кислоте сурьма также растворяется с
образованием Sb2O3 или Sb2O5, но при этом образующаяся на поверх-
поверхности сурьмы пленка оксидов сдерживает ее дальнейшее растворение.
Царская водка и смесь азотной и винной кислот легко растворяют
сурьму, а фосфорная и некоторые органические кислоты растворяют ее
слабее.
Растворы аммиака и гидроксидов щелочных металлов на сурьму не
действуют. Чистая сурьма устойчива также в расплавах углекислого
натрия, однако сухие щелочи калия и натрня при красном калении об-
образуют с сурьмой соответствующие антимонаты (соли сурьмяной кис-
кислоты).
С кислородом сурьма образует ряд соединений, из которых практи-
практическое значение имеют Sb2O3, SD2O4, Sb2Os.
С азотом сурьма не реагирует и соединений не образует.
С водородом сурьма образует сурьмянистый водород (стибин) SbH3.
С серой сурьма соединяется при сплавлении. Известны два сульфида
Sb2S3 и Sb2S5.
С галогенами сурьма образует соединения типа БЬлсз и Sbx5 (пента-
бромидов и пентаиодидов не образует). Практическое значение имеют
главным образом галогениды трехвалентной сурьмы, в частности хло-
хлориды и фториды (треххлористая сурьма SbCl3 и трехфтористая сурь-
сурьма SbF3).
Со многими металлами сурьма легко образует сплавы — антимони-
ды. Таким мягким металлам, как свинец и олово, она придает твер-
твердость, повышая их механические свойства; сплавам железа, наоборот,
сообщает хрупкость.
В ряде случаев сурьма образует химические соединения, например
Na3Sb, NaSb, K3Sb, KSb, Ca3Sb2, AlSb, GaSb, InSb, FeSb2, Cu,Sb, Cu2Sb,
Ni2Sb3, NiSb, Ag3Sb.
Co свинцом и оловом сурьма соединений не дает. С этими металла-
металлами в расплавленном состоянии сурьма смешивается в любых соотно-
соотношениях. Эвтектическая смесь с 11,1 % (по массе) Sb имеет температуру
плавления 252°С.
290
Особое положение среди сплавов с сурьмой занимают антимониды
индия, галлия, алюминия, кобальта, цинка, теллура, кадмия, кальция,
ртути, хрома, железа, цезия, калия и натрия, обладающие полупровод-
полупроводниковыми свойствами. Наибольший интерес представляет антимонид
индия, имеющий наибольшую величину подвижности носителей среди
всех известных полупроводниковых материалов.
Электрохимический эквивалент трехвалентной сурьмы 0,48059 мг/Кл,
пятивалентной 0,25235 мг/Кл.
Технологические свойства
Техническая сурьма хрупка в широком интервале температур. Для нее
характерен резкий хрупко-вязкий переход, температура которого сни-
снижается по мере повышения степени чистоты и уменьшения скорости
деформации. Сурьма чистотой 99,997% имеет £х = 300 — 310°С, а высо-
кочнстые монокристаллы пластичны при 20 °С и хрупки при —40 °С.
Области применения
Преимущественные области применения'
Су00000, СуОООО — полупроводниковая и электронная техника.
СуООО — для производства сурьмы высших марок, применяемых в
полупроводниковой технике.
СуОО — для изготовления специальных аккумуляторов, эмалей и
сплавов.
СуО — для изготовления специальных аккумуляторов, антифрикци-
антифрикционных и типографских сплавов.
Су1Э — для изготовления специальных аккумуляторов, антифрикци-
антифрикционных и типографских сплавов и эмалей
Су2 — для изготовления аккумуляторов, антифрикционных и типо-
типографских сплавов.
Известно более 200 различных сплавов промышленного значения,
содержащих сурьму, легирование которой повышает их механические и
литейные свойства. В основном это сплавы цветных металлов — свин-
свинца, олова, в которых присутствуют до 37 % Sb.
Основное количество (до 80 %) металлической сурьмы используется
для получения твердого аккумуляторного свинца, содержащего 4—
12 % Sb. Применение сурьмянистого сплава позволяет получать тонкие
и достаточно прочные отливки аккумуляторных решеток высокого ка-
качества, что обеспечивает небольшие габариты аккумуляторных бата-
батарей Кроме того, добавки сурьмы снижают влияние электрохимической
коррозии.
Сплавы на свинцовой основе с добавками сурьмы характеризуются
легкоплавкостью и обеспечивают высокое качество отливки шрифтов.
6—10 % первичной металлической сурьмы идет для приготовления
подшипниковых сплавов (баббитов) с содержанием 3—15 % Sb.
Сурьму вводят также в сплавы на основе свинца, используемые для
изготовления оболочек электрических кабелей @,7—1 % Sb).
Известное количество сурьмы расходуется для приготовления свин-
свинцовых сердечников пуль и артиллерийской шрапнели, а также охотни-
охотничьей дроби.
В последнее время особо чистую сурьму начали использовать для
получения иигерметаллических соединений с индием, галлием и алюми-
алюминием, применяемых в полупроводниковой технике. Чистую сурьму при-
291
меняют и как донорную добавку при производстве полупроводников из
германия.
Широкое применение в промышленности имеют ее соединения и
прежде всего оксид сурьмы (III), который используется как глушитель
эмалей, а также для приготовления стекла с малым коэффициентом
преломления. Большое количество Sb2O3 расходуется при производстве
огнестойких тканей. Применение Sb2O3 для эмалирования ограничива-
ограничивается изделиями, не связанными с приготовлением пищи, так как воз-
возможно образование ядовитых соединений трехвалентной сурьмы. Ок-
Оксид сурьмы (III) идет также на изготовление белил, обладающих вы-
высокой кроющей способностью.
Трехсернистая сурьма используется для изготовления зажигатель-
зажигательных смесей, применяемых в пиротехнике и при производстве спичек.
Пятисернистая сурьма широко используется в резиновой промышлен-
промышленности как наполнитель, придающий эластичность красной медицинской
резине.
Другие соединения сурьмы —соль Шлиппе Na3SbS4-9H2O, антимо-
нил тартрат калия, или рвотный камень K(SbO)C4H4H6-1/2H2O, щавеле-
щавелевокислая сурьма Sb2O(C2O4J и фтористые соединения SbF3(NH,iJSO4
и 4SbF3— используются в текстильной промышленности при травлении
и окраске тканей. Соль Шлиппе применяется также для очистки раст-
растворов при электролизе цинка.
Треххлористая сурьма служит исходным материалом для получения
органических комплексов, используемых в медицине и других областях,
а также для получения чистой Sb2O3, применяемой в металлургии полу-
полупроводников.
Фториды сурьмы SbF3 и SbFs применяются в качестве фторирующих
средств (замещение хлора и брома) неорганических и органических сое-
соединений.
Имеется ряд сурьмаорганических соединений, которые обладают
весьма ценными лекарственными свойствами и используются в меди-
медицине.
Радиоактивный изотоп mSb применяется в источниках у-излучения
и источниках нейтронов.
б.б. ВИСМУТ [1—35, 46, 51, 210—214]
Общие сведения и методы получения
Висмут (Bi)—серебристо-белый металл с розоватым оттенком.
Достоверных данных об истории и происхождении названия «висмут»
нет. Первые сведения о висмуте встречаются в трудах минералога и
металлурга начала XVI в. Георга Огриколы. В 1739 г. немецкий химик
Потт установил, что висмут является самостоятельным элементом, а ие
разновидностью сурьмы, свиица или олова, как это полагали ранее.
Символ элемента Bi впервые введен в химическую номенклатуру в
1819 г. шведским химиком Берцелиусом.
Содержание висмута в земной коре 2• 10—s % (по массе). Висмут
встречается в природе в самородном виде, в соединении с серой, селе-
селеном, теллуром и некоторыми другими элементами. Обладая высокой
степенью изоморфизма с мышьяком и сурьмой, висмут часто входит в
состав арсенидов и антимоиидов никеля, кобальта, железа. Кроме того,
для этого элемента характерно образование сульфовисмутитов свинца,
серебра и меди.
Собственно висмутовые месторождения встречаются крайне редко.
Известно более 70 минералов висмута. Из них промышленный инте«
292
pec представляют висмутин, или висмутовый блеск Bi2S3, самородный
висмут Bi, бисмит, или висмутовая охра Bi2O3, тетрадимит, или теллу-
ристый висмут BiaTeS, и бисмутит, или висмутит (ВЮJСО3.
Извлечение висмута из висмутсодержащих руд — сложный много-
многостадийный процесс, осуществляемый различными методами хнмико-ме-
таллургической переработки в зависимости от минералогического соста-
состава исходного сырья. Обогащение висмутовых руд проводится флотаци-
флотацией, гравитацией, магнитной сепарацией и др.
Основное количество висмута получают в результате металлургичес-
металлургической переработки полиметаллических медных руд и концентратов и при
производстве свинца на стадии его рафинирования. Из концентратов
висмут извлекают пиро- или гидрометаллургическим способом.
Из собственных руд висмут получают в малых масштабах. Сульфид-
Сульфидные руды перерабатывают осадительной плавкой с железным скрапом.
Из окисленных руд висмут восстанавливают углем под слоем легкоплав-
легкоплавкого флюса. Полученный черновой продукт содержит примеси сурьмы,
меди, мышьяка, свинца, цинка, селена, теллура и др. Далее черновой
висмут подвергают рафинированию огневым и мокрым способами, а так-
также электролизом из растворов или из расплавов солей. Первыми двумя
способами получают висмут чистотой 99,95 %. Висмут более высокой
чистоты получают гидрометаллургическнм рафинированием (цемента-
(цементацией серебра металлическим висмутом), кристаллофизическими метода-
методами (вытягивание из расплава, зонная плавка), двухстадийной перегон-
перегонкой, методом дистилляции.
ГОСТ 10928—75 предусматривает изготовление висмута шести ма-
марок: ВиОО, ВиО, Ви1, и Ви2 — в виде слитков массой не более 16 кг;
Ви1 и Ви2 — в виде гранул размером поперечного сечения 1—5 мм и
длиной до 10 мм; ВиО —в виде гранул сферообразной формы размером
до 5 мм; ВиОООО и ВиООО — в виде слитков массой 0,2—6,0 кг.
Химический состав висмута (по ГОСТ 10928—75):
Марка
ВиОООО
ВиООО
ВиОО
ВиО
Ви1
Ви2
В i. не менее
99,9999
99,999
99,98
99,97
97,7
96,5
РЬ
1-Ю-5
3-10-5
1,8-10-2
2-Ю-2
2,0
3,0
Примеси,
Zn
1 • 10-5
5-10-5
5-10-*
ЫО-з
5-10—3
МО
не более
Fe
ью-5
3-Ю-5
Ы0-3
2-10-3
5-Ю-3
1 ■ 10—2
Sb
5-10—•
1-10-5
2 Ю-6
5-Ю-4
5-Ю-3
2-10-?
Продолжение табл
ВиОООО
ВиООО
ВиОО
ВиО
Ви1
Ви2
Си
1 -10—в
5-10-в
1-Ю-4
4-10-*
1- Ю-2
1,8-10-2
Ag
5-10-'
5-10-6
2-10—6
310-5
1,8-10-1
4-10-1
Примеси
1
3
7
1
3
1
, ие более
As
10-5
Ю-6
Ю-5
Ю-5
ю-*
Ю-3
1
1
1
1
Те |
• ю-5
• ю-*
• ю-3
3
5
3
5
Со
•Ю-3
• 10-"
• ю-6
• Ю-»
—
293
Продолжение табл.
Марка
ВиОООО
ВиООО
ВиОО
ВиО
Ви1
Ви2
Примеси, ие более
Cd
5-Ю-7
мо-в
5-10—^
9-10-4
Мп
1-10—в
1 ■ 10—в
1 • 10-5
7-10—§
не
МО-5
5-10-5
Содержание примесей,
%, не более
Мо
2,5-Ю-5
5- Ю-5
N1
4-10—в
1.10-5
Продолжение табл.
Марка
ВиОООО
ВиООО
ВиОО
ВиО
Ви1
Ви2
Содержание примесей, %, не более
Sn
3- Ю-6
1-10-5
Сг
3-10—в
8-10—в
Аи
2-10-0
3-10—в
In
2-10—в
2- 10-е
еумма примесей,
не более
МО-4
МО-3
2-10-2
3-10—2
2,3
3,5
Примечание. По соглашению потребителя и изготовителя в висмуте
марки Ви! допускается содержание <^2,5 % РЬ, «0,2 % Ag, в висмуте марки
Вн2 - «0,45 % Ag.
Физические свойства
Атомные характеристики. Атомный номер 83, атомная масса
208,980 а. е. м., атомный объем 21,33 -10—в м3/моль, атомный радиус
0,182 нм, ионные радиусы Bi3+0,120 нм, Bi3~ 0,213 нм, Bi5+0,074 нм.
Конфигурация внешних электронных оболочек 6s26p3, Значения потен-
потенциалов ионизации / (эВ): 7,237; 19,3; 25,6. Электроотрицательность 1,9.
Висмут имеет ромбоэдрическую решетку с периодом а=0,47457 нм
и углом а=57°14'13". Энергия кристаллической решетки
208 мкДж/кмоль. При обычном давлении полиморфные превращения
отсутствуют; аномалии в свойствах, имеющие место при 75—112°С,
связаны с процессами деформации и рекристаллизации. При давлениях
2,500 ГПа и выше обнаружены другие модификации висмута.
Природный висмут состоит из одного изотопа с массовым числом
209. Установлено свыше 20 искусственных изотопов с массовыми числа-
числами от 198 до 215 и периодами полураспада от 102 с до 2-1017 лет. Из
радиоактивных изотопов наиболее важен 2I0Bi с периодом полураспада
5 сут. Эффективное поперечное сечение захвата тепловых нейтронов
@,034+0,002)-Ю-28 м2, работа выхода электронов ср = 4,4 эВ.
Плотность. Плотность висмута при комнатной температуре, опреде-
определенная пикнометрическим методом, р = 9,840 Мг/м3, рентгеновским,
9,807 Мг/м3. Известна зависимость плотности висмута от чистоты ме-
металла и способа изготовления образца (при 293 К):
Состояние .... Высоко- 0,03 %Sb Проволока Монокрис-
чистый талл
р Мг/м3 9,867 9,780 10,055 9880
294
С повышением температуры плотность висмута возрастает, достигая
максимума при температуре плавления, а при дальнейшем росте тем-
температуры вновь уменьшается:
Т, К • • • 293 7"пл 673 773 873 973 1073 1173
р, Мг/м3- . 9800 10,07 9,870 4,750 9,630 9,510 9,400 9,200
При затвердевании объем металла увеличивается на 3,3 %, что свя-
связано с наличием ковалентных связей в твердом висмуте и отсутствием
их в расплавленном.
Электрические и магнитные. Отличительной особенностью висмута
является более высокая удельная электрическая проводимость а в жид-
жидком состоянии по сравнению с твердым; удельное электрическое сопро-
сопротивление твердого висмута при 542 К р = 2,67 мкОм-м, а жидкого при
545 К р== 1,27 мкОм-м. Электросопротивление висмута при 278 К р цс=
= 1,27 мкОм.м. a pJ(,=0,99 мкОм-м. Отношение удельного электро-
электросопротивления жидкого висмута к таковому для твердого составляет II
оси с рж/Ртв = 0,35, J_ осн с рж/Ртв = 0,47.
Изменение удельного электрического сопротивления р и удельной
электрической проводимости а висмута при других температурах:
т, к
73
173
273
290,5
373
473
а, МСм/м
2,46
.
0,92
—
0,625
—
р, мкОм • м
0,348
0,756
1,068
1,200
1,565
2,145
Г, к
573
673
773
873
1023
1273
о. МСм/м
_
0,61
—
0,598
р, мкОм-м
1,289
1,342
1,399
1,4525
1,5355
1,675
Интересной особенностью висмута является увеличение (па ~200 %)
его электросопротивления под влиянием магнитного поля, что исполь-
используется для измерения индукции сильных магнитных полей.
Температурный коэффициент электрического сопротивления висмута
а = 4,2-10~3 К~' B73—373 К). Температура перехода в сверхпроводя-
сверхпроводящее состояние Тс * К, а при давлении 2,47 ГПа 7"с = 4,2 К.
Абсолютный коэффициент т. э. д. с. висмута при 273 К е = —70 мкВ/К,
при этом параллельно оси с—100 мкВ/К, а перпендикулярно е =
=—53 мкВ/К.
Т. э. д. с. Е по отношению к платине при температуре холодного спая
273 К и горячего 173,16 К и 373,16 К равна +7540 и —7340 мкВ со-
отве1ственно.
Коэффициенты гальвано- и термомагиитных явлений в висмуте:
г, к
291
325
В, Тл
0,393
0,629
0,830
1,057
1,04
1,09
R*.
—6
—5
—5
—4
10',
,33
,80
,28
,82
К-и'/(В
+35
+51
+58
+62
—
К л)
,3
,6
,3
,7
S* ■ 102,
mV(B-c)
—2,05
— 1,12
—0,55
—0,19
—
—4,05
Q*-10«,M
+ 17,
+23
+26,
+27,
+20
—
VK-o
8
4
1
5
* R— коэффициент Холла; Р — коэффициент Эттингсгаузена; 5 — коэффициент
Риги — Ледкжа; Q — коэффициент Эттингсгаузеиа — Нернсга.
295
Коэффициент вторичной электронной эмиссии <Xmai = l,15 при уск<5«
ряющем напряжении первичных электронов 0,550 кэВ.
Висмут — самый диамагнитный металл, его магнитная восприимчи-
восприимчивость х=—1,34-10-» при 293 К.
Тепловые и термодинамические. Температура плавления Лтл =
=271,0"С, температура кипения tKimt*'l557''C, характеристическая тем-
температура 9d==117 К.
Температура плавления в зависимости от давления Р:
Р, МПа • .
'пл. ^ • •
0
271
,1013
,0
101
267
,3
,5
2026
263,5
405
256
.2
,6
810
238
,4
,0
1013
228,8
Удельная теплота плавления висмута при 298 К ДЯПЛ =
= 54,69 кДж/кг. Удельная теплота сублимации при 1193 К в вакууме
А//Субл = 789,63 кДж/кг, при температуре кипения и обычном давлении
897,23 кДж/кг, при 298 К 947,6 кДж/кг, а при температуре плавления
1041,47 кДж/кг. Удельная теплота испарения Д//исп=857,49 кДж/кг
(при температуре кипения). Удельная теплоемкость ср висмута при
различных температурах:
т. к
10
25
50
100
150
V
Дж/(кг-К)
9,80
47,085
84,93
110,20
116,56
Г, К
200
293
373
473
544 (тв)
Дж/(кг-К)
119,82
128,95
136,07
150,72
141,51
т, К
544 (ж)
673
773
873
1073
1273
Дж/(кг-К)
142,35
148,21
156,16
157,42
166,21
175,42
Удельная электронная теплоемкость СрЛ=[0,021 мДж/(моль-К2I -Т.
Висмут является одним из худших проводников тепла среди метал-
металлов, его теплопроводность при 273 К составляет около 2 % теплопро-
теплопроводности серебра.
Теплопроводность К висмута в зависимости от температуры:
Поликристалл
т,
к
к •
Вт/(м
т,
•К)
к
Вт/(м
70
12,6
•К) .
293 540
8,41 7,29
Монокристалл
1,3 2,0
. . 200 800
870
16,4
6,0
900
1070
15,1
Теплопроводность висмута сильно анизотропна. При 291 К Л, ц с =»
= 6,65 Вт/(м-К), а ХХ1. = 9,25 Вт/(м-К).
Температурный коэффициент линейного расширения висмута при
273 К а—13,37.10~e К, при 293 К а=13,4.10-в К"'. При давлении
101,3 МПа температурный коэффициент линейного расширения состав-
составляет 12,94.Ю-» К B93 К); 12,98-10~в (90—288 К); 14,6-10~в
B73—540 К).
Средний температурный коэффициент линейного расширения моно-
монокристалла висмута в зависимости от температуры:
296
т. к
288—349,7
368,3—410,7
509,1—526,1
528,1—539,5
539,8—543,6
а. 10»,
К-1 (II с)
17,1
17,2
15,0
6,6
16,0
т, к
286,9—343,8
370,9—413,7
456—531,5
521,7—534
530,9—537,6
а-10',
K-4-Lc)
11,4
12,0
11,4
4,1
19,0
Температурный коэффициент объемного расширения Р висмута:
Т, К 2 5 20 28 58 75 283
Р-10» К-1 • • .0,0236 0,28 11,85 18,42 31,5 34,13 39,65
ал
Молярная энтропия s° и приведенный термодинамический потенци-
потенциФ
Т. К
298
500
1000
Дж/(моль-К)
56,85
71,13
112,83
<v
Дж/(моль-К)
56,85
59,91
80,68
т. к
1500
2000
2500
3000
Дж/(моль- К)
125,56
226,63
231,36
235,34
ДЖ/(МОЛЬ-К)
93,66
109,48
133,43
150,09
Поверхностное натяжение а жидкого висмута в зависимости от тем-
температуры:
t, °с. . .
о. мН/м . .
270
390
300
376
500
363
780
344
Поверхностное натяжение висмута в вакууме 300 мН/м при 365 °С
и 343 мН/м при 600 °С.
Динамическая т) вязкость жидкого висмута по данным различных
авторов:
т, к
548,8
652,1
576
596
Г), МПа.с
1,662
1,651
1,546
1,499
т. к
605
636
667
678
Г), МПа-с
1,462
1,384
1,299
1,278
т, к
715
754
844
970
Г), МПа-с
1,221
1,143
1,020
0,925
297
Кинематическая вязкость v жидкого висмута по данным различных
авторов:
т, к
548
593
653
0
0
о
', М'/С
195
165
15
т, к
723
763
823
V-10»
0,
0,
0,
, м»/с
13
125
115
Т, К
873
973
1073
V-10я, м!/с
0,1
0,097
0,085
При температуре плавления давления пара р висмута равно 62,52Х
ХЮ~5 Па. Начало значительного испарения висмута отмечается выше
1073 К. Давление пара р в зависимости от температуры:
т, к
848
870
896
937
Р, Па
47,23-Ю-3
92,41- Ю-3
17,93-10-2
56,35-10-2
т, к
954
1294
1450
1490
Р. Па
81,04-10-2
133,3
26,66-Ю2
53,32-10?
т, К
1513
1592
1643
1693
Р. Па
79,98- Ю2
26,660-103
53,320-103
10,1308-10*
Параметры взаимной диффузии (предэкспоненциальный множитель
и энергия активации Е):
Диффундирую-
Диффундирующий элемент
Ag
Cd
Sn
т, к
573—973
573—1173
573—1173
Образующая фаза
Твердый раствор
Жидкость
»
6,2-10-'
3,7-10-'
4,8-Ю-8
Е,
кДж/моль
26,8
25,8
14,6
Оптические. Интегральный коэффициент излучения при 298 К £г =
= 0,048, при 378 К ег = 0,061. Отражательная способность (коэффициент
отражения nD) пленки толщиной 0,04—0,1 мкм:
X, мкм 0,103—0,073 0,103—0,059
по, % 15—0,2 65-70
Угол падения . . 20° 80°
Показатель преломления п для пленки той же толщины:
А,, мкм 0,052 0,4 0,45 0,50 0,55
п . . 1,2 1,10 1,46 1,53 1,58
Показатель преломления п для пленки толщиной 0,3 мкм:
%, мкм . . . 0,60 0,70 0,80 0,85 0,90 0,95 1,00
п 1,82 2,52 3,05 3,18 3,56 3,63 4,07
298
Показатель поглощения X в зависимости от длины волны для плен-
пленки толщиной ~0,1 мкм:
К мкм .... 0,40 0,50 0,60 0,70 0,80 0,90 1,00
X 2,78 3,34 3,92 4,99 5,36 5,71 5,92
Механические свойства
Модуль нормальной упругости висмута при растяжении, по различным
данным, колеблется в интервале £=32,0-=-34,0 ГПа. Для отожженного
висмута модуль упругости в зависимости от температуры:
Е, ГПа 36,8 34,1 25,5
t,°C —187 19 230
Модуль сдвига G«12,4 ГПа.
Механические свойства висмута чистотой 99,999 % в зависимости от
температуры испытания:
'исп' °С
0
50
100
а , МПа
14/15
24/26
17/19
в. %
-/0
26/4
67/16
Ф. %
1/0
33/2
95/11
'исп'
°С
160
210
ав, МПа
14/16
-/12
е. %
45/65
_/52
Ф. %
88/99
—/96
Примечание. В числителе — свойства при скорости испытания
2-Ш"~2 с", в знаменателе — при 2-10 х с~х .
Временное сопротивление висмута чистотой 99,999 % при более низ-
низких температурах и скорости испытания 2-10~' с~':
<тв, МПа. .... 13,7 9,8 3,9
'исп. °С. . . . —45 —100 —200
Ударная вязкость KCU в зависимости от температуры:
>, °С 18 66 93 149 204 232
KCU, кДж/м2 ... 2 3 5 9 7 7
Работа удара для образцов без надреза:
L °С ■
КС, Дж
18 66 93 198 204 232
1,32 2,00 4,00 6,99 5,99 5,99
Твердость по Бринеллю отожженного висмута НВ = 94,2 МПа, мик-
микротвердость Яц=177 МПа.
Предел выносливости висмута при испытаниях на круговой изгиб в
зависимости от условий испытания:
299
Скорость
вращения
образца,
об/мин
2800
Число
циклов
10:!
10*
10й
10°
107
t, с
— 197
— 196
20
20
20
V
МПа
7,8
6,9
14,7
10,8
7,1
Скорость
вращения
образца,
об/мин
60
2
Число
циклов
105
10е
107
105
10"
t, сс
20
20
20
20
20
V
МПа
14,7
8,8
4,7
5,9
2,9
Ползучесть при испытаниях на изгиб:
t, °C 66 121
Нагрузка or, МПа ... 4,20 3,15
Скорость установившей-
установившейся ползучести е-Ш5 %/с 2,8 2,8
177
2,45
204
2,10
2,8 2,8
Коэффициент Пуассона v = 0,330, сжимаемости я = 2,86.10~" Па.
Химические свойства
Нормальный электродный потенциал реакции Bi + H2O—Зе=г±ВЮ++
+2Н+ фо=0,32 В.
В соединениях проявляет степени окисления —3, +1, +2, +3, +4,
+5, причем чаще всего +3. Висмут почти не окисляется при обычной
температуре в сухом воздухе, длительное время сохраняя серебристо-
белый цвет, а во влажном воздухе покрывается тончайшим слоем ок-
оксида.
При нагревании на воздухе выше температуры плавления висмут
легко окисляется, при температурах выше 1000 °С сгорает, образуя ок-
оксид висмута (III) Bi2O3.
Оксид висмута (IV) Bi2O4 получается при окислении оксида висму-
висмута (III) ферроцианидом калия в концентрированном растворе едкого
кали или персульфата аммония в разбавленном растворе едкого натра.
Оксид висмута (V) Bi2O5 — ангидрид не выделенной в свободном со-
состоянии висмутовой кислоты НВЮз. Соли висмута (III) легко гидроли-
зуются, переходя в основные соли, малорастворимые в воде.
Соединение висмута с водородом — висмутин, или гидрид висмута
BiH3,— очень нестойкий ядовитый газ, разлагающийся уже при ком-
комнатной температуре; получается при действии НС1 на сплав висмута с
магнием.
В соляной и разбавленной серной кислотах висмут не растворяется,
легко переходит в раствор при действии азотной кислоты или царской
водки, а также при нагревании с концентрированной серной кислотой.
При растворении металлического висмута или его соединений о концен-
концентрированной серной кислоте и дальнейшем концентрировании раствора
кристаллизуется кислый сульфат Bij(SO<K-H2SO<-6H2O, который при
нагревании до 350°С переходит в средний сульфат Bi2(S04b, хорошо
растворимый в кислотах.
Средний карбонат висмута неизвестен, основной карбонат образует-
образуется при обработке раствора соли висмута избытком карбоната щелоч-
300
ного металла; его состав колеблется в зависимости от концентрации
раствора и температуры.
С азотом висмут дает нитраты. При нагревании кристаллогидрата
Bi(NO3K-5H2O до 30 °С начинает выделяться азотная кислота, при
75,5 °С кристаллогидрат распадается на жидкую фазу и основную соль
состава Bi2O5-N2O5-H2O. Водой гидролизуется с образованием основ-
основных солей.
Основные нитраты висмута — продукты гидролиза азотнокислых
растворов ВНЫО3)з при разбавлении их водой или под действием
NaHCOs и NaNO3, органических оснований. Состав основных нитратов
зависит от температуры, концентрации и кислотности раствора.
Висмут легко образует галогениды. Однохлористый висмут BiCl—
неустойчивое твердое вещество черного цвета, получается растворением
металлического висмута в расплавленном BiCl;.
Двуххлористый висмут BiCl2 получается при медленном действии
хлора на висмут или при восстановлении треххлористого висмута в про-
процессе нагревания с фосфром, серебром, цинком, ртутью, оловом. Трех-
хлористый висмут В1С1з получают хлорированием металлического вис-
висмута или растворением Bi2O3 в соляной кислоте или висмута в царской
водке.
Висмут легко образует галогениды. Одпохлористый висмут BiCl—
в закаленной трубке с металлическим висмутом.
Трехфтористый висмут BiF3 получается осаждением из раствора
Bi(NO3K концентрированным раствором KF или действием HF на
Bi(OHK при нагревании.
Пятифтористый висмут B1F5 образуется при возгонке во время на-
нагревания BiFa в токе фтора.
Однобромистый висмут BiBr растворяется в воле и соляной кислоте
с выделением висмута; двухбромистый висмут BiBr2 образуется при
сплавлении висмута с трехбромистым висмутом, хороню растворяется
в соляной киг юте; трехбромистый висмут BiBr3 получается при нагре-
нагреве висмута в парах брома или при растворении порошка висмута в
в броме с последующей дистилляцией продукта.
Трехиодистый висмут Bil3 получают нагреванием висмута в парах
иода или смеси иода и висмута в углекислоте или водороде.
При воздействии сероводорода на оксид висмута образуется моно-
моносульфид висмута BiS — вещество, неустойчивое при нагревании на
воздухе и в парах воды.
Сульфид висмута Bi2S3 получается в виде черно-бурого осадка при
действии сероводорода на растворы солей висмута или при сплавлении
висмута с серой. Это вещество незначительно возгоняется при высоких
температурах в токе СО2; при нагревании его в токе водорода образу-
образуется металлический висмут. BiS3 легко растворяется в разбавленной
азотной кислоте при комнатной температуре, в любой концентрации
разлагается с выделением сероводорода, не растворяется в гидросуль-
гидросульфидах щелочных металлов и окисляется в растворе FeCl3 с выделением
элементарной серы.
Известны полные и неполные висмуторганические соединения, а так-
также гетероциклические соединения с атомом висмута в цикле.
Со многими металлами (Na, К, Ru, Cs, Ca и др.) висмут образует
тугоплавкие интерметаллические соединения — висмутиды, с сурьмой —
непрерывный ряд твердых растворов, с легкоплавкими тяжелыми ме-
металлами (Pb, Sn, Cd и др.) — эвтектики с температурой плавления от
33 до 156°С Электрохимический эквивалент лля висмута со степенью
окисления -)-5 равен 0,43316 мг/Кл, со степенью окисления 4-3-^
0,72193 мг/Кл.
301
Технологические свойства
При комнатной температуре висмут представляет собой хрупкий металл,
легко разрушающийся под воздействием внешней силы, вплоть до пре-
превращения в порошок. Поскольку при обычных температурах висмут
хрупок, его отливкам сразу придают нужную форму. При повышенных
температурах висмут приобретает пластические свойства, и его можно
подвергать обработке давлением различными способами. Так, горячим
выдавливанием через очко можно получить пруток, проволоку диамет-
диаметром до 0,1 мм и пластинки толщиной до 0,2—0,3 мм. Оптимальная тем-
температура деформации 150—250 °С. С повышением чистоты пластич-
пластичность висмута увеличивается.
Области применения
Висмут широко применяется в производстве легкоплавких сплавов.
В системе Bi—Pb—Sn—Cd существуют композиции, например сплав
Вуда, температура плавления которых около 55—70 °С. Имеются также
двойные и тройные легкоплавкие сплавы висмута с указанными элемен-
элементами, которые используются в производстве разного рода предохрани-
предохранителей, в противопожарных устройствах, в ваннах для термической об-
обработки и отпуска металлических изделий при низких температурах,
при изготовлении зубоврачебных отливок, а также клише с деревянных
матриц и т.д.
В черной и цветной металлургии применяют висмут в виде добавок
к нержавеющим сталям, чугунам и цветным сплавам. Добавка 2—4 °/о
Bi к нержавеющим хромоникелевым сталям улучшает их обрабатывае-
обрабатываемость резанием. Эффективна добавка висмута к чугуну в количестве
0,3—0,2 %, в результате чего образуется структура с графитом. Неболь-
Небольшие добавки висмута улучшают режущие свойства сталей, ие оказывая
влияния на прочность и коррозионную стойкость.
Висмут применяют при получении литой катодной меди с мелкозер-
мелкозернистой структурой, а также вводят в некоторые бронзы, что способст-
способствует улучшению их литейных и коррозионных свойств.
Алюминиевые сплавы с добавками висмута хорошо обрабатываются
на станках-автоматах и их используют для изготовления деталей в при-
приборостроении и радиотехнике.
Висмут широко применяется в виде добавок к подшипниковым
сплавам на алюминиевой основе.
Магнитные сплавы марганец—висмут используются для создания
очень стойких к размагничиванию постоянных магнитов, которые име-
имеют более высокую коэрцитивную силу по сравнению с магнитами из
других сплавов.
Тонкая пленка из сплава марганец — висмут обладает способностью
к магнитной записи, которую трудно нарушить случайными посторон-
посторонними полями.
Широкой областью применения висмута является стекольная про-
промышленность. Триоксид висмута употребляют также для изготовления
цветных эмалей и глазурей.
Висмут, его соединения и сплавы применяют также в холодильной
технике.
В последнее время висмут иашел применение в атомной технике, где
его используют в сплаве с ураном в жидком состоянии в качестве теп-
теплоносителя.
Большое применение висмут имеет в фармакологии при изготовле-
изготовлении антисептических и дезинфицирующих препаратов.
302
5.6. ВАНАДИЙ [1—35, 42, 45, 51, 215—219]
Общие сведения и методы получения
Ванадий (V) — металл серо-стального цвета.
Открыт в 1801 г. мексиканским минералогом А. М. дель Рио в свин-
свинцовой руде Самапанского месторождения. Позднее в 1830 г. шведский
химик Сефстрем, анализируя пробы железной руды месторождения Та-
борг, обнаружил в них новый элемент. Ои и дал ему название— по име-
имени легендарной северной богини красоты Ванадис.
Металлический порошок ванадия серебристо-белого цвета путем вос-
восстановления VC12 водородом впервые получил английский химик Роско
в 1869 г. Пластичный ковкий ванадий получен лишь в 1927 г. Морде-
ном н Ричем путем восстановления оксида ванадия (V) кальцием.
Промышленное значение металл приобрел лишь в начале XX в. Ис-
Использование его в металлургическом производстве в нашей стране в ви-
виде феррованадия началось с 1936 г.
Содержание ванадия в земной коре 1,5-10~2 % (по массе). Ванадие-
Ванадиевые руды очень редки. Ванадий, как правило, находится в полиметал-
полиметаллических рудах других металлов, в частности свинцовых, свипцово-
медных и свинцово-цинковых, а также в железных рудах, обычно пред-
представляющих собой титаномагнетиты. В некоторых магматических рудах
концентрация ванадия достигает 1 % V2O5.
Известно более 65 минералов, содержащих ванадий, из которых про-
промышленное значение имеют: патронит, карнотит, роскоэлит, моттрамит,
дуклуазит, ванадинит.
Из ванадийсодержащих руд (или их концентратов) ванадий извле-
извлекают либо непосредственным выщелачиванием растворами кислот и
щелочей, либо выщелачиванием продукта окислительного обжига (в сме-
смеси с поваренной солью) водой или разбавленными кислотами. Из раст-
растворов путем гидролиза выделяют оксид ванадия (V) V2O5. который
используют для выплавки феррованадия, а также производства метал-
металлического ванадия.
Ванадийсодержащие железные руды перерабатывают на сталь с по-
получением ванадиевых шлаков. Шлаки подвергают обжигу в смеси с
NaCl. Обожженный продукт выщелачивают водой, а затем слабыми
сернокислыми растворами, после чего получают технический оксид ва-
иадия (V).
Металлический ванадий получают либо непосредственным восста-
восстановлением оксида (V), либо в две стадии, т.е. сначала восстанавлива-
восстанавливают оксиды (V) до низшего оксида с использованием одного восстано-
восстановителя, а затем низший оксид — до металла другим восстановителем.
Разработан ряд методов получения металлического ванадия: каль-
цяетермический, при котором ковкий ванадий получают методом восста-
восстановления оксидов ванадия кальцием; алюминотермический, когда основ-
основным восстановителем металла является алюминий; метод вакуумного
углетермического восстановления оксидов ванадия (использование уг-
углерода наиболее перспективно); хлоридный, при котором хлорид вана-
ванадия (VC13) восстанавливается жидким магнием.
Существует также иодидный метод, заключающийся в диссоциации
иодида (VI2) и обеспечивающий получение ванадия наиболее высокой
чистоты, однако этот метод пока может быть использован лишь для
получения небольших количеств высокочистого металла.
Каждый из рассмотренных методов имеет свои преимущества и не-
недостатки, поэтому выбор того или иного метода определяется задача-
задачами в отношении качества конечного продукта, а также экономическими
соображениями и возможностями осуществления самого процесса.
303
Черновой металл рафинируют электролизом в солевой ванне, пере-
переплавкой в индукционных, дуговых и электронно-лучевых печах, зонной
плавкой в высоком вакууме (до чистоты 99,8—99,9 %).
Ванадий металлический в кусках, получаемый алюмииотермическим
методом, должен содержав ^95,0 + 0,5 % V, <2,0 % А1 и <0,3 % Fe.
Ванадий выпускают по ТУ 48-4-272—73 двух марок ВнМ-1 н ВнМ-2
в слитках цилиндрической формы длиной 200—800 мм и диаметром 80,
100, 120, 150 мм, массой от 8 до 80 кг. Химический состав и твердость
ванадия марок ВнМ-1 и ВнМ-2-
Марка
ВяМ-1
ВнМ-2
Содержание примесей, %, ие более
Fe
0,2
0,3
А1
0,2
0,3
Si
0,2
0,3
N2
0,01
0,02
н2
0,001
0,001
о,
0,03
0,05
с
0,03
0,04
Твердость НВ,
МПа, ие более
1100
1200
Порошкообразный ванадий, получаемый методом электролитического
рафинирования алюминотермического ванадия, выпускается трех марок;
их химический состав, %:
Марка
Вэл-1
Вэл-2
Вэл-3
V, %
не менее
99,9
99,7
99,5
1-
6-
1.
AI
Ю-2
Ю-2
10-1
Fe
Примеси, °/
МО-2
4-10-2
8-10-?
1-
2-
2-
Si
10-2
Ю-2
Ю-2
„, ие более
Ni
МО-2
5-Ю-2
l-10-i
5-
8-
2-
s
Ю-3
10-2
Ю-2
2-
4-
5-
с
Ю-2
ю-2
Ю-2
Примечание. Техночогия обеспечивает получение ванадия с содержа-
содержанием <8-Ю
N и< 1-10"
О.
Физические свойства
Атомные характеристики. Атомный номер 23, атомная масса 50,942
а. е. м., атомный объем 8,35-10~6 м3/моль. Атомный радиус 0,134 нм,
ионный радиус V2+ 0,072 нм, V3+ 0,067 нм, V4+ 0,061 им, V5+ 0,04 нм.
Конфигурация внешних электронных оболочек 3d34s2. Электроотрица-
тельиость 1,6. Значения потенциалов ионизации / (эВ): 6,74; 14,2; 29,7.
Ванадий имеет о. ц. к. решетку с параметром 0,30282 нм. Природ-
Природный ванадий состоит из двух изотопов 50V @,25 %) и 51V (99,75 %).
Известен ряд радиоактивных изотопов ванадия:
Массовое число ... 46 47 48 49
Период полураспада . 0,40 с 1870 с 16,0 с 33 сут
Массовое число . .
Период полураспада
Продолжение
52 53 54
228 с 0,959 сут 55 с
Эффективное поперечное сечение захвата тепловых нейтронов
4,98-Ю-28 м2. Сродство к электрону 0,8 эВ, работа выхода электрона
304
Ф=4,12 эВ. Работа выхода электронов ср для различных граней (hk{)
монокристалла:
(hkl) . .
Ф,эВ . .
. A00)
4,28
(ПО)
4,97
A11)
41,1
A12)
4,50
A16)
4,11
Энергия кристаллической решетки 503 мкДж/кмоль.
Плотность. Плотность ванадия при 298 К р=6,1 Мг/м3.
Электрические и магнитные. Удельная электрическая проводимость о
и удельное электрическое сопротивление р ванадия чистотой 99,9 %:
7, К
100
200
300
500
700
о, МСм/м
12,5
6,67
4,55
2,86
2,08
р, мкОм.м
0,08
0,15
0,22
0,36
0,48
7", К
900
1100
1300
1500
1800
о, МСм/м
1,70
1,45
1,27
1,14
1,00
р, мкОм.м
0,59
0,69
0,79
0,88
1,00
Температурный коэффициент электрического сопротивления а =
= 3,3-Ю-3 К при 273—473 К и 3,4-Ю-3 !<-' при 273—373 К.
Т. э. д. с. £ в паре с платиной при температуре холодного спая
273 К:
Г, К 373
Е, мВ .... 0,63
473 673
1,56 3,97
973
9,26
1173 1273
13,97 16,71
Абсолютный коэффициент т. э. д с. е в зависимости от темпера-
температуры:
Т. К •■• 33 73 173 273 373 473 573
е, мкВ/К . 0,0 +2,3 +1,7 +1,0 +0,7 +0,9 +1,3
Температура перехода в сверхпроводящее состояние 7"с = 5,31 К.
Постоянная Холла R ванадия чистотой 99,63 % в зависимости от
температуры:
Т, К ...»
/МО10, м3/Кл
301 293 20
+0,82 +0,7 +0,62
Ванадий парамагнитен; его магнитная восприимчивость при 298 К
х= +5,0- Ю-9, магнитная индукция при 301 К В = 0,3—2,9 Тл.
Тепловые и термодинамические. Температура плавления ванадия
*ПЛ=1917°С, температура кипения <Кип = 3392°С, характеристическая
температура 8о—399 К (по упругим постоянным) и 338 К (по тепло-
теплоемкости). Удельная теплота плавления ДЯПЛ = 345,41 кДж/кг, удельная
теплота сублимации А//Субл = 9001,62 кДж/кг, теплота испарения
8974,9 кДж/кг (при температуре кипения). Удельная теплоемкость в ин-
305
тервале 273—373 К ср= 498,23 Дж/(кг-К). Удельная теплоемкость в
зависимости от температуры:
Г, К 80 150 250 400
С2,,Дж/(кг-К) . . 199,63 378,66 462,48 512,34
Продолжение
Г, К 600 1000 1500
с0, Дж/(кг-К) • . 539,82 598,72 718,46
Удельная электронная теплоемкость сэрл = [9,82 мДж/(моль-К2)]-7'.
Теплопроводность X ванадия чистотой 99,82 % в зависимости от тем-
температуры:
Т, К .
Я. Вт/(м-К)
Т, К
Я,Вт/(м-К).
20 293 373 573 773
6,29 31,0 35,9 37,3 38,8
Продолжение
1173 1573 1773 1870
41,7 44,6 46,0 50,0
Температуропроводность а ванадия чистотой 99,82 % в зависимости
от температуры:
Г, К ...... 100—300 500 700 900
а-10е, м2/с ... 11,6 11,3 10,7 9,5
Температуропроводность ванадия чистотой 99,72 % в зависимости от
температуры: при температурах 1000, 1500, 1900 К соответственно а=
= 12,32-Ю-6, 12,00-Ю-6, 11,75-10-в м2/с.
Температурный коэффициент линейного расширения а ванадия чис-
чистотой 99,82 % в зависимости от температуры:
т, к
773
973
1173
1373
а. 10",
к-1
10,61
11,58
12,54
13,5
т, К
1573
273—373
273—573
273—973
а-Ю',
к-1
14,45
8,74
9,30
10,10
т, к
273—1173
273—1373
273-1573
273—1673
а -10»,
к-1
10,57
11,05
11,53
11,65
Молярная энтропия s° и приведенный термодинамический потенци-
потенциал Фт в зависимости от температуры:
т, к
298
500
1000
1500
s°,
Дж/(моль.К)
29,35
42,66
62,34
75,82
V
Дж/(моль-К)
29,35
32,19
42,83
51,71
т, к
2000
2500
3000
s°.
Дж/(моль-К)
87,25
104,50
111,37
V
Дж/(моль-К)
52,20
66,74
73,64
306
Энтальпия при 298 К /=5,27 кДж/моль.
Поверхностное натяжение ванадия при температуре плавления <т=
= 1750 мН/м. Поверхностная энергия v=1878 мДж/м2. Энергия де-
дефекта упаковки 26 мДж/м2 по плоскости A12). Давление паров р в
зависимости от температуры:
т, к
1400
1600
р.
50,0
11,66
Па
• ю-8
•10-5
т, к
1800
2000
79
9.9.
р.
,96
,73
Па
• ю-*
• ю-2
т. к
2200
2400
2600
34
р.
,39
30
189
Па
ю-1
,48
,14
При температуре плавления давление паров ванадия равно 30.57Х
Ю-1 Па.
Параметры самодиффузии (преджепоненциальный множитель Do и
энергия активации £):
Состояние
Монокристалл
Поликристалл
г, к
1873—2163
1273—1673
1153—1629
1629—2106
Do, м*/с
58-10-*
1,1-10-»
0,36-10-4
2,14-10-4
Е, кДж/моль
372,8
255,2
340,5
394,0
Параметры взаимной диффузии (основной элемент ванадий, обра-
образующая фаза твердый расгвор):
Диффундирующий
элемент
С
S
Fe
т, к
1118—1403
1320—1520
1115—1443
Do, м2/с
4,9- Ю-7
3,1-Ю-6
0,6-10-*
Е, кДж/моль
114,0
134,0
295,0
Оптические. Спектральный коэффициент излучения ванадия е^ для
длины волны 0,65 нм в зависимости от состояния:
Твердый 0,35
Жидкий 0,32
Окисленный твердый 0,7
Неокисленный при 1100—1700 К. 0,4—0,37
Интегральный коэффициент излучения для 1гокислешюго ванадия
при 1100—1600 К ef = 0,052+l,05-10-4 Т, а при 1600—1700 К ег =
= 0,113+0,67-Ю-4 Т.
307
Отражательная способность (коэффициент отражения По) полиро-
полированного поликристаллического ванадия:
I, мкм 2,0 3,0 4,0 5,0 6,0 8,0
nD, % 83 88 92 93 94 95
Показатель преломления п поликристаллнческого ванадия в зависи-
зависимости от длины волны X"
X, мкм. . . 2,0 3,0 4,0 6,0 8,0
п 2,08 2,44 3,24 5,20 7,00
Поглощательная способность ванадия (показатель поглощения %):
Я. мкм . . 2,0 3,0 4,0 6,0 8,0
% 6,43 8,81 11,5 16,8 20,2
Коэффициент поглощения при длине волны 0,004 мкм (для пленки)
се=0,9-107 м-'.
Механические свойства
Механические свойства нелегированного ванадия в зависимости от со-
содержания в нем газовых примесей:
Содержание
С
0,05
0,06
0,09
0,06
0,10
о
0,08
0,08
0,06
0,10
0,09
примесей, °/
Н
0,008
0,004
0,006
0,005
0,007
4
N
0,04
0,05
0,04
0,05
0,07
°о,2
МПа
385
422
445
465
522
294
364
392
448
448
б
32
34
36
38
26
72
69
68
82
68
Увеличение суммарного содержания газовых примесей приводят к
росту прочностных свойств н снижению пластичности.
При содержании кислорода, углерода, азота 0,18; 0,12; 0,1 % соот-
соответственно <Хв=580 МПа, а б и ф становятся равными нулю.
Модуль нормальной упругости нелегированного ванадия £= 126,5-г-
ч-139,4 ГПа, модуль сдвига G = 47,3 ГПа.
Механические свойства ванадия в зависимости от температуры ис-
испытания и размера зерна:
308
пв, IV Па б, %
Отжиг при 1000 °С; 1350 зерен
на 1 ммг
— 195
-98
27
227
427
627
727
827
1027
1227
1080
633
375
269
245
126
76
f6
34
14
1084
653
424
352
464
176
122
85
54
34
3,4
12,6
14,2
5,7
12,6
36,9
32,8
17,9
37,2
48,1
t, °С
2, МПа
МПа
б, %
Отжиг при 1600 °С; 60 зерен
на 1 мм2
—98
27
227
427
627
727
827
1027
1227
671
382
291
253
131
79
52
27
13
672
414
366
394
167
104
74
47
14
5,1
11,2
6,2
9,7
17,7
33,5
13,3
23,6
27,6
Механические свойства ванадия наиболее высокой чистоты (полу-
(получаемого иодидным методом), содержащего 0,012—0,015 % О, 0,005 % Н,
0,0007—0,0008 % N, после холодной прокатки со степенью деформации
90% и последующего отжига в течение 1 ч при 800 °С- £=141 ГПа,
ао2=П8 МПа, а„=222 МПа, 6=17 %, ■ф = 75 %, угОл загиба без раз-
разрушения а= 180°.
Прочностные свойства металлического ванадия можно повысить хо-
холодной деформацией (ковкой, прокаткой и др.), однако прн этом удли-
удлинение резко падает.
Механические свойства в зависимости от степени деформации:
Обработка перед испытанием
Отжиг 1 ч при 845 °С
Холодная прокатка:
обжатие 60 %
» 75%
» 80 %
Горячая ковка 1150—1450 °С . . .
МПа
530
710
765
990
330
<тв, МПа
565
745
820
1090
345
б, %
7
1—2,5
1—2,5
1—2,5
6
Примечание. Ванадий получен кальциетермическим методом.
Ползучесть ванадия s при напряжении 78,5 МПа характеризуется
следующими значениями:
8-Ю8, %/с 1,1 2,0 2,8 5,6 1,4
U °С 920 940 960 980 1000
Твердость по Бринеллю иодидного ванадия НВ = 628 МПа, микро-
микротвердость #^«650 МПа. Коэффициент Пуассона ванадия v = 0,35, сжи-
сжимаемость х = 0,62-10-11 Па-1.
Химические свойства
Нормальный электродный потенциал реакции V—2e*±V2+ tpo= 1,5 В.
В соединениях проявляет степень окисления от +2 до +5, наиболее
стойки и типичны соединения со степенью окисления +5.
309
Ванадий обладает высокой химической стойкостью в воде, водных
растворах минеральных солей, разбавленной соляной кислоте и в рас-
растворах щелочей. На холоду на него действуют разбавленные азотная
и серная кислоты. Плавиковая кислота, концентрированные азотная и
серная кислоты, царская водка растворяют ванадий.
Ванадий достаточно устойчив на воздухе при температурах, не
превышающих 300 °С. Взаимодействия его с азотом, кислородом и во-
водородом усиливаются при 600—700 "С. Коррозионная стойкость вана-
ванадия:
Среда
НС1
H2SO4
HNO3
5 %-ная
FeCl3,
10 %-ная
NaCl
NaCl
Промыш-
Промышленная ат-
атмосфера
Концент-
Концентрация, %
(по мас-
массе)
10
20
20
37
10
10
10
Разбав-
Разбавленная
или кон-
центри-
центрированная
20
—
t, °с
70
70
70
20
70
70
^кип
20
20
20
20
Скорость коррозии
(потеря массы)
Хсут)
36
220—230
275—720
130—180
30—38
18
150—180
Раство-
Растворяется
3600—
3800
ММ/ГОД
0,214
1,21 — 1,37
1,64—4,28
0,77—1,07
0,18—0,23
0,11
0,89—1,07
—
21,4—22,6
Не оказывает влия-
влияния
Некоторое разъеда-
разъедание
Условия прове-
проведения испытаний
Аэрация
»
Пропускание
азота
То же
Аэрация
Пропускание
азота
—
—.
Опрыскивание
При нагревании в воздухе и кислороде ванадий сгорает с образо-
образованием V2O5, в атмосфере водорода он поглощает его, в атмосфере
азота образует нитриды, а в атмосфере с избытком хлора сгорает, об-
образуя VC14.
Растворимость кислорода в ванадии с повышением температуры уве-
увеличивается и достигает максимального значения 1 %.
Оксид ванадия (II) VO получают нагреванием хлороксида ванадия
(III) VOC1 в токе водорода или нагреванием стехиометрических коли-
количеств V2O3 н порошка ванадия. VO не растворяется в воде, в атмосфе-
атмосфере хлора сгорает в VOC13, имеет основной характер, в разбавленных
кислотах растворяется, образуя соли ванадия (II)
Оксид ванадия (III) V2O3 получают нагреванием V9O5 или мегава-
надата аммония в атмосфере Н2 при 900 °С. В отсутствие воздуха
310
устойчив, а на воздухе постепенно окисляется, переходя в кристаллы
VO2, при' нагревании иа воздухе окисляется до V2Os. Имеет основной
характер, в воде, растворах щелочей, кислотах (за исключением азот-
азотной и плавиковой) не растворяется.
Оксид ванадия (IV) V2O4 получают при слабом нагревании V2O5
с углем, сплавлением V2O5 со щавелевой кислотой, медленным окисле-
окислением на воздухе V2O3. Оксид V2O4 амфотерен; при растворении V2O4
и его гидратов в неокисляющнх кислотах образуются растворы солей
ванадия, при растворении V2O4 в щелочах — растворы солей тетрава-
надислой кислоты.
Оксид ванадия (V) V2O5 получают нагреванием метаванадата ам-
аммония на воздухе, гидролизом VOC13, нагреванием на воздухе или в
кислороде порошкообразного ванадия, низших его оксидов и карбида.
V2O5 имеет две модификации: аморфную и кристаллическую. Водные
растворы V2O5 имеют кислую реакцию, реашруя со щелочами, дают
соли.
С фтором ванадий образует фториды VF, VF4, VF5, VF3-3H2O.
Трифторид ванадия VF3 получают взаимодействием HF с VC13 при
температуре темно-красного каления Если упаривать раствор У2Оз во
фтористоводородной кислоте, выделяется VF3-3H2O.
Тетрафторид ванадия VF4 получают взаимодействием сухого фто-
фтористого водорода с VC14.
Известны хлориды ванадия' VC12, VC13, VCI4, VOCI, VOC13. Дихло-
рид VCl2 получают путем пропускания паров VC14 и Н2 через стеклян-
стеклянную трубку, нагретую до темно-красного каления, или действием газо-
газообразного НС1 на феррованадий. VC12 — сильный восстановитель, вы-
выделяет металлы из растворов солей золота, серебра, платины.
Трихлорид VCl3 получают при нагревании VCl4; фиолетово-красиые
кристаллы VC13, хорошо растворимые в воде.
Тетрахлорид VCI4 получают хлорированием феррованадия хлором
при 150—200 °С.
Оксихлорид ванадия VOC1 — кристаллическое вещество, получаемое
нагреванием VC14 в атмосфере СОа при ~700°С или восстановлением
VOC13 водородом при температуре красного каления.
Окситрихлорид ванадия VOCI3 получают нагреванием V2O5 u токе
С12 при ~600°С.
Дииодид ванадия VI2 получают синтезом; он не растворяется в аб-
абсолютном спирте, бензоле, тетрахлориде углерода, сероуглероде; на воз-
воздухе частично окисляется.
Трииодид ванадия Vb получают нагреванием смеси элементов при
300°С; он растворяется в воде, в абсолютном спирте, не растворяется
в бензоле, тетрахлориде углерода, сероуглероде.
Известны три сульфида ванадия. VS, V2S3 и V2Ss.
Сульфид ванадия VS получают нагреванием V2S в среде водорода
при 850—1100°С или сплавлением V2O5 с серой при 400 °С в атмосфере
СО2 VS легко окисляется на воздухе, легко взаимодействует с HNO3.
Диванадийтрисульфид V2S3 получают, воздействуя CS2 на V2O5 при
700 °С, пентасульфид ванадия V2Ss — при нагревании на воздухе V2S3
с избытком серы при 400 °С.
С азотом ванадий образует нитриды. VN2 получается взаимодействи-
взаимодействием aioia с порошком ванадия при 750—850 °С, окисляется во влажном
воздухе, реагирует с горячей HNO3. VN отличается высокой химической
стойкостью; НС1 и H2SO4 на пего не действуют, HNO3 его окисляет.
Ванадий растворяет водород, причем растворимость уменьшается с
повышением температуры. Максимальное количество водорода, которое
ванадий может удерживать при комнатной температуре ~4 % (ат.).
311
Ванадий является перспективным металлом для создания сплавов,
работающих при температурах, более высоких, чем никелевые и кобаль-
кобальтовые жаропрочные сплавы.
Наиболее распространенными легирующими добавками ванадиевых
сплавов являются титан, ниобий, вольфрам, цирконий.
В системах ванадия с РЗМ наблюдаются широкие области расслое-
расслоения в жидком и твердом состояниях, незначительная растворимость
РЗМ в твердом ванадии.
Ванадий образует с E-титаном непрерывный ряд твердых растворов,
а с а-титаном— ограниченные твердые растворы; в системах с цирко-
цирконием и гафнием имеются соединения ZrV2 и ШУг-
Ниобий и тантал, расположенные с ванадием в одной подгруппе не-
неограниченно в нем растворимы в жидком и твердом состояниях. Однако
для этих систем характерен распад твердых растворов при низких тем-
температурах.
Непрерывные ряды твердых растворов наблюдаются в системах ва-
ванадия с хромом, молибденом и вольфрамом.
Электрохимический эквивалент ванадия 0,10560 мг/Кл.
Технологические свойства
Нелегированный ванадий — мягкий металл, легко поддающийся пласти-
пластической деформации. Предельное суммарное содержание примесей азота
и кислорода в ванадии, при котором сохраняется пластичность, позво-
позволяющая проводить обработку давлением, по мнению ряда исследовате-
исследователей, составляет 0,2 %.
В процессе холодной пластической деформации наиболее значитель-
значительное упрочнение ванадия достигается при обжатии до 15 %. При более
высоких обжатиях интенсивность упрочнения снижается.
Температура начала рекристаллизации ванадия высокой степени
чистоты 700—800 °С При легировании ванадия тугоплавкими металла-
металлами (Nb, Hf, Ti и др.) температура рекристаллизации повышается до
980—1100 °С.
Температура ковки и прессования слитков 1000—1450 °С.
Горячую обработку давлением производят с нагревом в атмосфере
аргона и других инертных газов. Для защиты от окисления и охруп»
чивания ванадия газовыми примесями при нагреве используют также
гальванические покрытия. Лучшие результаты получены при покрытии
никелем. Применяют также кремниевые покрытия.
Предварительно деформированные заготовки ванадия обрабатывают
давлением в холодном состоянии (прокатка, волочение или другие ме-
методы).
Из пластичного ванадия в холодном состоянии без промежуточных
отжигов можно изготовлять листы, прутки, тонкостенные трубы, про-
проволоку и т. п.
Добавки вольфрама и тантала снижают пластичность сплавов вана-
ванадия. Наиболее пластичны сплавы систем V—Ti и V—Zr.
Из сплавов ванадия, содержащих 5—20 % Ti, можно получать лис-
листы, прутки, трубы и другие изделия. Сплавы ванадия с содержанием
до 40 % Ti и небольшими добавками других элементов наиболее перс-
перспективны. Добавка 0,5—1,0 % С к этим сплавам способствует измель-
измельчению структуры и улучшению способности к деформированию ковкой.
У сплавов системы V—Zr пластичность повышается при содержании
до 3 % Zr, но заметно снижается при более высоком содержании этого
элемента. Добавка иттрия также улучшает пластичность ванадия.
Пластичность сплава с 1 % Si такая же, как и чистого ванадия Спла-
Сплавы V—Nb обладают малым запасом пластичности даже при очень вы-
высоких температурах.
312
Сварку ванадия плавлением можно производить электрической дугой
в инертных газах без присадочного материала, вольфрамовым электро-
электродом и электронным лучом в вакууме.
При сварке нелегированиого ванадия образуются пластичные соедч-
нения, допускающие изгиб на 180° (при радиусе оправки, равном тол-
толщине свариваемых деталей); прочность сварных соединений, выполнен-
выполненных без присадочного металла, равна прочности исходного материала.
Таким образом ванадий можно соединять с титаном, ниобием, тан-
танталом, хромом и медными сплавами, а также со сталями, содержащими
не более 7—8 % №.
Нелегироваииый ванадий легко обрабатывается резанием, как медь.
Для получения хорошей поверхности рекомендуется в качестве
смазки применять керосин и высокую скорость резания с небольшой по-
подачей. Высоколегированный ванадий обычно обрабатывается значитель-
значительно труднее, чем нелегированный, и в случае затруднений с удалением
твердого поверхностного слоя режущим инструментом он должен быть
удален шлифовкой.
Области применения
Основная область применения ванадия — черная металлургия, где его
широко используют в виде феррованадия для получения сталей специ-
специального назначения. При введении в сталь 0,15—0,25 °/о V резко повы-
повышаются ее прочность, вязкость, сопротивление усталости и износостой-
износостойкость. Ванадий — сильный раскислитель стали и карбидообразующий
элемент, способствующий измельчению структуры стали и чугуна, а так-
также замедлению роста зерна при нагреве.
Ванадий используется также в производстве сплавов на основе ти-
титана и на основе других тугоплавких металлов, предназначенных для
новой техники (авиационной, ракетной, ядерной энергетики). В частно-
частности, для .реакторостроеиня ванадий представляет особый интерес, по-
поскольку обладает малым эффективным поперечным сечением захвата
нейтронов и одновременно обладает достаточно высокими свойствами
при повышенных температурах.
Ванадий применяют как промежуточный материал (прослойка) при
плакировании стали и тугоплавких металлов титановыми, циркониевы-
циркониевыми сплавами, а также сплавами благородных металлов.
Благодаря высокой коррозионной стойкости в агрессивных химиче-
химических средах ванадий является перспективным материалом для химиче-
химического машиностроения и др.
Чистый металлический ванадий используют, кроме того, в производ-
производстве электронных приборов, отдельных деталей рентгеновской аппара-
аппаратуры и т. д.
Ванадий служит основой сверхпроводящих сплавов и других спла-
сплавов со специальными свойствами.
Соединения ванадия находят применение во многих областях про-
промышленности, в частности в химической — как катализаторы, в текс-
текстильной, лакокрасочной, резиновой, керамической, стекольной, в сель-
сельском хозяйстве, медицине и др
5.7. НИОБИЙ [1—35, 40, 42, 45, 220—226]
Общие сведения и методы получения
Ниобий (Nb) — металл серо-стального цвета.
Открыт в 1801 г английским химиком Хатчетом в минерале, най-
найденном в Колумбии, и получил вследствие этого название «Колумбии».
313
В 1844 г. немецкий химик Розе «открыл» этот элемент вторичной,
полагая, что он еще неизвестен, назвал «ниобием» в честь Ниобеи (до-
черн Тантала)—мифологической богини слез. Позднее было установ-
установлено, что ниобий н Колумбии — один и тот же элемент.
Считают, что металлический ииобнй впервые был получен в 1866 г.
шведским ученым Бломстрадом путем восстановления хлорида ниобия
водородом. Компактный пластичный ниобий получил A907 г.) немец-
немецкий химик Болтон. В промышленных масштабах ниобий начали вы-
выпускать в конце тридцатых годов XX в.
Содержание ниобия в земной коре 1-10—3 % (по массе). Он входит
в состав около 100 минералов, большей частью представляющих собой
сложные комплексные соли ииобиевой и танталовой кислот. В минера-
минералах в различных количествах содержатся железо, марганец, щелочные
и щелочноземельные металлы, а также редкоземельные элементы, ти-
титан, цирконий, торий, уран, олово, сурьма, висмут, вольфрам и др.
Наиболее важные минералы ниобия подразделяются на две группы:
1. Танталониобаты — соли ниобиевой и танталовой кислот. Основ-
Основными минералами в этой группе являются танталит и колумбит; в тан-
танталите преобладает тантал, в колумбите — ниобий. Общее содержание
ниобия и тантала в этих минералах, выраженное в виде суммы двух
оксидов (Nb2O5 + Ta2O5), составляет 82—86 %.
2. Титано (тантало) ниобаты — сложные соли титановой, ниобиевой
(танталовой) кислот. Почти все минералы этой группы содержат ред-
редкоземельные элементы. Соотношение между ниобием и танталом изме-
изменяется в широких пределах, но большей частью преобладает ниобий.
Наиболее важные минералы этой группы — пирохлор, лопарит, коппит,
бетафит.
Наиболее важные промышленные источники ниобия — колумбит
E0—76 % Nb2O5) и пирохлор D0—70 % Nb2O5). Меньшее значение
имеют фаргусонит C8—58% Nb2O5), эвксенит B1—34% Nb2O5) и ло-
лопарит G—20% Nb2O5).
Основным способом обогащения руд, содержащих колумбит и тан-
танталит, является гравитационное обогащение. В результате получают
коллективный концентрат, содержащий, помимо колумбита и танталита,
также касситерит, вольфрамит и некоторые другие минералы. Дальней-
Дальнейшее обогащение ведут, примения флотацию и электромагнитные методы.
Пирохлоровые и лопаритовые руды обогащают в основном также
гравитацией с последующим доведением до требуемых кондиций фло-
флотацией, электромагнитным и электростатическим методами.
Согласно техническим условиям, принятым в нашей стране, колум-
битовые концентраты I сорта должны содержать не менее 60 % Nb2Os,
II сорта — не менее 50 % Nb2O5.
В пирохлоровых концентратах, предназначенных главным образом
для выплавки феррониобия, должно содержаться не менее 37 % (Nb,
ТаJО5, а в лопаритовом концентрате — не менее 8% (Nb, Та)Об.
Кроме рудных концентратов, существенным источником ниобия яв-
являются шлаки оловянных заводов, в которых при выплавке олова Из
касситерита концентрируются оксиды ниобия. Шлаки содержат от 3
до 15% (Nb, TaJO5.
Металлический ниобий получают из рудных концентратов в три ста-
стадии: 1) вскрытие концентрата; 2) разделение ниобия и тантала и полу-
получение их чистых химических соединений; 3) восстановление и рафини-
рафинирование металлического ниобия.
Для вскрытия концентратов танталита — колумбита применяют сплав-
сплавление с щелочами (NaOH, КОН) или разложение плавиковой кислотой.
Для вскрытия лопаритовых концентратов используют способ хлориро-
хлорирования и сернокислый способ.
314
Разделение тантала и ниобия и очистку их соединений от примесей
осуществляют дробной кристаллизацией комплексных фтористых солей,
экстракцией органическими растворителями, разделением с помощью
ионообменных смол, ректификацией хлоридов, избирательным восста-
восстановлением пятихлористого ниобия.
Основные промышленные методы получения металлического нио-
бня — алюминотермический, натриетермический, карботермический.
При использовании всех методов, кроме алюминотермического, нио-
ниобий получают в виде порошка; при алгомотермическом методе получа-
получают сплав ниобия с алюминием, который удаляют при вакуумной перс-
плавке.
Компактный металл производят либо методами порошковой метал-
металлургии, спекая спрессованные из порошков ниобия штабики в вакууме
при 2573 К, либо электронно-лучевой и вакуумно-дуговой плавками.
Вакуумным спеканием получают ниобий чистотой более 99,6 % Nb,
дуговой плавкой — чистотой 99,7—99,8 % Nb, электронно-лучевой плав-
плавкой—чистотой 99,88—99,9% Nb.
Монокристаллы ниобия высокой чистоты получают бестигельной
электронно-лучевой зонной плавкой.
Ниобий выпускают в виде штабиков (ГОСТ 16100—79) и в слиткях
(ГОСТ 16099—80), а также в виде порошка (РЭТУ 1186—64 и ЦМТУ
05-40—67 с изменением № 1).
Ниобий в штабиках, полученных спеканием в вакууме, в зависимо-
зависимости от химического состава выпускают трех марок: Н6Ш00, Н6Ш0 и
Н6Ш1 (по ГОСТ 16100—79):
Марка
ниобия
Н6Ш00
НбШО
Н6Ш1
0
0
0
N
,03
,03
,05
0
0
0
Содержание
О
,02
,02
,04
С
0,03
0,03
0,06
примесей °/
Fe
0,03
0,08
0,08
, не
0
0
0
боле
Si
,01
,03
,03
i*
Та
0,1
0,4
0,4
0
0
0
Ti
,01
,1
,1
* Содержание водорода в ниобии всех марок не должно превышать 0,001 % и
гарантируется технологией производства
Штабики не должны иметь вздутий, трещин; поверхность должна
быть без масляных и жировых пятен.
Штабики, предназначенные для изготовления листов, лент, фольги и
проволоки, должны удовлетворительно обрабатываться давлением.
Химический состав ниобия в слитках (по ГОСТ 16099—80):
Марка
ниобия
Н61
Н62
НбЗ
0
0
0
N
,010
,010
,010
0
0
0
<
о
,010
,010
,015
Содержание примесей, %
0
0
0
с
,010
,010
,030
0
0
0
SI
,005
,010
,020
0
0
0
Та
,100
,150
,300
, ие более
Ре
0,005
—
0
т,
,005
—
W + Mo
0
0
0
,010
,020
,040
Примечание. Содержание железа и титана в ниобии марок Н62
и НбЗ не более 0,010 % и водорода в ниобии всех марок не более 0,001 %
гарантируется технологией изготовления.
315
Слитки обтачивают по боковой и торцовой поверхностям, чистота
поверхности должна быть не ниже 3-го класса.
На торце каждого штабика и слитка указывают марку материала и
номер партии. При хранении и транспортировании штабики и слитки
должны быть защищены от механических повреждений, влаги и воздей-
воздействия паров кислот и щелочей.
Ниобий в порошке (карботермический) поставляют по РЭТУ
1186—64. Содержание контролируемых примесей, %, не более- 0 10 N2
0,080 Fe, 0,50 О2, 0,030 Si, 0,40 Та, 0,03 Ti и 0,20 С. Порошок упако-
упаковывают в полиэтиленовые мешки, которые укладывают в крафт-мешки
и деревянные ящики.
Ниобиевый порошок для электронной техники получают из плавле-
плавленого металла и поставляют по ЦМТУ 40—67. Содержание контроли-
контролируемых примесей, %, не более: 0,01 W; 0,007 Fe; 0,005 Si; 0,01 Mo;
0,5 Та; 0,005 Ti; 0,02 N2; 0,3 O2; 0,02 С.
Порошок ниобия по гранулометрическому составу выпускается трех
классов. Размер зерен порошка 1-го класса 46—63 мкм, 2-го класса
— 10—53 мкм, 3-го класса 0,40 мкм.
Порошок ниобия упаковывают в полиэтиленовые или пластиковые
мешки, которые помещают в герметически запаянные железные банки
или полиэтиленовые банки с навинчивающимися крышками.
Физические свойства
Атомные характеристики. Атомный номер 41, атомная масса 92,906
а. е м, атомный объем 10,83-10~6 м3/моль, атомный радиус 0,147 нм,
ионный раднус Nb!+ 0,069 нм, Nb*+ 0,077 нм. Конфигурация внешних
электронных оболочек 4d'5s'. Природный ниобий состоит из одного
устойчивого изотопа Nb. Известны искусственные радиоактивные изо-
изотопы ниобия
Массовое
число
88
89
89 т
90
90т
91
Период по-
полураспада
14 мнн
6840 с
7200 с
14,6 ч
24 с
10* лет
Массовое
число
91т*
92
93
94
94 т
95
Период по-
полураспада
64 сут
10 с
3,65 года
2-104 лет
6,29 мии
35 сут
Массовое
число
95 т
96
97
97 т
98
99
100
Период по-
полураспада
4,75 сут
0,975 с
72 мин
60 с
51 мин
2,4 мин
3 мин
* m — метастабильное состояние ядра.
Значения потенциалов ионизации атома ниобия / (эВ): 6,88; 13,90;
28,1. Электроотрицательность 1,6. Ниобий имеет о. ц. к. решетку с пе-
периодом а = 0,330021 нм. Энергия кристаллической решетки 773 мкДж/
/кмоль. Эффективное поперечное сечение захвата тепловых нейтронов
1,1-Ю8 м2. Работа выхода электрона ф=3,99 эВ, положительная ион-
ионная эмиссия 5,52 эВ.
Плотность ниобия равна р = 8,570 Мг/м3.
316
Электрические и магнитные. Удельное электрическое сопротивление р
и удельная электрическая проводимость а ниобия чистотой 99,9 % в за-
зависимости от температуры'
Г, К
13
100
200
300
500
700
р, мкОм-м
0,005
0,05
0,10
0,15
0,24
0,32
а, МСм/м
200
20
10
6,67
5,0
3,13
т, к
900
1100
1300
1500
1800
р, мкОМ'М
0,40
0,46
0,52
0,57
0,65
а МСм/м
2,5
2,15
1,93
1,76
1,54
Термический коэффициент электросопротивления ниобия а = 3,95Х
ХЮ-3 К-1 B73—373 К) и 3,96-10-3 К B73—873 К). Электросопро-
Электросопротивление ниобия в зависимости от содержания кислорода:
О2, % (по массе) .... 0,03
р мкОм-м 0,1625
Изменение удельного электрического сопротивления при плавлении
Рж/Ртв=1,14.
Температура перехода в сверхпроводящее состояние Гс = 9,25 К.
Постоянная Холла R в зависимости от температуры:
0,
о,
161
1879
0
0
,315
,2567
0
0
,410
,2659
0
0
,565
,3060
Г, К 83 273 298 873
/МО10, м3/Кл . . . +0,92 +0,88 +0,72 +0,91
Ниобий парамагнитен. Мажитная восприимчивость в зависимости от
температуры.
298 289 14
+2,20 +2,28 +2,34
Г, К
Х-10»
Коэффициент вторичной электронной эмиссии аШах=1,2 при уско-
ускоряющем напряжении первичных электронов 0,375 кэВ.
Тепловые и термодинамические. Температура плавления /Пп =
= 2469°С, температура кипения timn — 4842 °С, удельная теплота плав-
плавления Д//Пл = 296,59 кДж/кг, удельная теплота сублимации при 298 К
Д//С1бл=7773 кДж/кг и удельная теплота испарения при температуре
кипения АН„СП=7359,1 кДж/кг.
Характеристическая температура ниобия 9О=276,2 К (по упругим
постоянным), 238 К (по теплоемкости), 223 К (по электросопротивле-
электросопротивлению).
Давление паров р ниобия в зависимости от
г, к
2700
2800
Р. Па
67,3?-Ю-3
17,35-10-»
т к
2900
3000
р Ш
42,04- 10-г
96,24-10—^
температурь
т. к
3100
3150
Р. Па
20,87-10-1
30,18-10-1
317
Давление пара при температуре плавления р=75,46-10~3 Па.
Температурный коэффициент линейного расширения а ниобия чис-
чистотой 99,9 % в зависимости от температуры:
Г, К • • •
а-106. K-1
7,6
0,02
20
0,2
50
2,2
75
3,«
104,2
5,14
182,1
6,52
282,1
7,07
Температурный коэффициент линейного расширения а ниобия чис-
чистотой 99,97 °/о в зависимости от температуры:
г, к
300
373
473
673
а-ю», К
7,08
7,12
7,34
7,83
т, к
873
1073
1273
а-10", К
8,33
8,81
9,29
1473
1673
1873
а-10». К
9,78
10,25
10,73
Теплопроводность X ниобия, содержащего 0,3% Та; 0,01 °/о С;
0,004 % О2; 0,001 % N2; 0,001 % Н2, в зависимости от температуры:
Г, К • • 373 573 773 973 117.3
%, Вт/(м-К) .... 53,2 55,5 57,8 60,1 62,4
Теплопроводность X ниобия чистотой 99,7 %, содержащего 0,17 % Та;
0,006 % Si; 0,025 °/о Ti и 0,03 % Fe, в зависимости от температуры:
Г, К 1400 1800 2000 2400
%, Вт/(м-К) 62,8 68,0 70,6 75,6
Температуропроводность а ниобия, содержащего 0,013 % С; 0,054 %
Fe; 0,014% Ti; 0,014% Si; 0,17% W; 0,04% Mo; 0,5% Та, в зависи-
зависимости от температуры:
Г, К 303—323 375 500 600 693 773 893 1053
а-106, mVc . . 22,6 22,5 21,1 22,2 22,0 22,9 22,6 23,0
Температуропроводность ниобия чистотой 99,9% при 1100—Н00 К
а=24,0-10-6 м2/с, а при 1800 К а = 23,4-10-6 м2/с.
Удельная теплоемкость ср ниобия п зависимости от температуры:
Г К 273 773 1173 1573 1773 1873
ср, Дж/(кг-К) 269,21 288,36 306,31 328,75 339,88 346,12
Удельная электронная теплоемкость СрЛ = [7,80 мДж/(моль-К2)]-7\
Поверхностная энергия ниобия v=2225 мДж/м2, поверхностное натя-
натяжение при 2773 К а = 2150 мН/м. Энергия дефекта упаковки для плос-
плоскости A12) 21 мДж/м2.
Параметры самодиффузии: энергия активации при 1973—2373 К Е—
=397,75 кДж/моль, предэкспоненцпальный множитель Do=l,3x
XI О-4 м2/с.
Параметры взаимной диффузии некоторых элементов в ниобии:
318
Элемент
н
с
N
V
Со
Ni
Zr
т к
333—873
1373—1673
633—933
1273—1673
1673—2603
1223—1363
1173—2273
£>„, м2/с
2,15-10-«
9,32-10-е
9,8-Ю-6
2,21-10-*
0,74-10-*
3,5-10—*
о,ыо-*
Е, кДж/моль
99,23
146,2
161,6
368
295,17
270
376,81
Молярная энтропия s° в зависимости от температуры:
Г, К 298 500 1000 1500
s°, Дж/(моль-К) • - 36,55 49,61 68,03 79,67
Продолжение
Г, К 2000 2500 3000
s° Дж/(моль-К) . . 88,46 95,79 111,60
Приведенный термодинамический потенциал Ф 7 в зависимости от
температуры:
Г, К 298 500 1000 1500
фг, Дж/(моль-К) 36,55 39,39 49,57 58,07
Продолжение
Г, К 2000 2500 3000
Фг, Дж/(моль-К) 64,39 70,00 75,57
Оптические. Излучательная способность ниобия в зависимости от
температуры:
Г, К 1600 2000 2200 2400 2800
Излучательность М,
Вт/м2 6,4 18,5 29,9 45,3 130,6
Интегральный коэффициент излучения при 1200—2100 К неокислеи-
ного твердого ниобия ег = 0,372-^0,322.
Отражательная способность (коэффициент отражения по) :
X мкм 1,0 2,0 3,0 4,0 6,0 8,0 10,0 15,0
Пд, % 75 93 95 96 96 96 96 97
Показатель преломления п поликристалла:
?., мкм 1,5 2,0 2,5 3,0 4,0 5,0 7,0 10,0
я 1,39 1,75 2,4 3,65 5,6 8,08 13,1 22,4
Показатель поглощения % поликристалла:
X, мкм .... 0,4 0,8 1,0 1,5 2,5 3,0 4,0
X 2,99 3,85 4,94 8,24 14,4 17,3 22,2
319
Механические свойства
Модуль нормальной упругости при растяжении в зависимости от тем-
температуры:
t, "С 20 400 2000
Е. ГПа ПО 88,4 34,3
Модуль сдвига G==37,5 ГПа, коэффициент Пуассона v = 0,38.
Сжимаемость при 30°С и —0,57-10-и Па-1. Механические свойства
ниобия зависят от чистоты, характера структуры и обработки.
Временное сопротивление ав при растяжении, МПа:
Деформированный 595
Отожженный 297
Лист толщиной 0,25 мм (отожженный) 352
То же, деформированный , . 700
Влияние температуры на свойства ниобия дуговой вакуумиой плавки:
'яоп- °С
20
315
480
650
870
1095
1205
1315
1372
а„, МПа
340
378
297
155
107
70
65
39
27
aQ2- МПа
253
188
132
70
66
57
53
28
19
в;, %
18,1
17,5
15,3
15,5
13,8
8,8
5,2
17,2
12,6
в. %
48,0
35,4
24,8
43,0
47,0
34,0
21,0
70,0
97,4
Ф. %
63,5
78,9
82,2
72,0
96,0
100,0
73,2
81,8
100,0
* Равномерное удлинение.
Примеси С, Н, О, N, изменяя прочность ниобия, сильно снижают его
пластичность и повышают температуру перехода в хрупкое состояние.
Влияние кислорода на свойства ниобия:
О, % 0,03 0,161 0,208 0,279 0,315 0,371 0,410
ств, МПа ... 288 537 642 697 959 960 922
б, % 29,3 16,9 17,7 20,7 20,5 10,4 9,8
Влияние углерода: при 0,05% С ав=600 МПа; 6=25%; ^=39%;
при 0,32 % С 0В = 48О МПа; 6 = 20 %; ijj = 33 %.
С понижением температуры происходит существенное упрочнение
ниобия при одновременном снижении относительного сужения. Темпе-
Температура перехода из вязкого состояния в хрупкое 200 "С,
Влияние примесей на температуру перехода в хрупкое состояние:
Состояние металла
Дуговой плавки, отжиг при
1200 °С
Электронно-лучевой плавки,
отжиг при 1200°С
То же, отжиг в вакууме . . .
Содержание примесей, %
Н
0,1
0,1
0,1
N
65
11
2
о
31,7
29
0,8
С
9
16
6
'х- °С
-185
—200
—272
320
Механические свойства технического ниобия в зависимости от тем-
температуры и содержания молибдена:
У
с
и
20
-70
-196
20
—70
—196
га
m
Ь
560
590
980
580
640
1000
МПа
1
о
<0,5% Мс.
520
560
950
24
23
15
2,9 % Мо
540
620
970
30
29
14
4
j
80
67
31
83
71
28
кси,
3700
2900
1900
3700
2600
50
у
исп'
20
—70
— 196
20
-70
— 196
с
ь"
640
670
1050
710
750
1180
МПа
1
3,9 °/
610
620
1030
4,7 7
660
720
1150
, Мо
31
30
10
, Мо
28
27
8
4
84
70
29
80
60
15
кси,
3700
2300
80
310
800
20
Механические свойства ниобия при комнатной температуре в зави-
зависимости от облучения:
Состоят»
Нсоблучешшй
Облученный
1 металле
V
МПа
470—510
511
Скорость установившейся ползучест
о*, ЛИ Га
173
13»
121
Е,
1,3-
1,1-
9,0
%/с
10-з
Ю-4
ю-5
а*. МПа
114
104
г,
2,2-
2,8-
—554
i e при
%/с
Ю-5
Ю-8
Од 2' МПа
397—420
495—510
980 °С:
а*-, МПт
68,7
121
107
19
6
1
9
5
6. %
,0—21,5
5-8,0
'. %/с
1-10-'
0-10—*
6-Ю-5
лист. ** Рскристатш^ованныи лист.
Предел выносливости при испытании в аргоне (температура 1090 °С)
на базе 2,6-106 циклов о>= 137 МПа.
Твердость по Бринеллю при 20 °С отожженного листа #В=735 МПа,
деформированного 1960—2450 МПа, литого материала 750 МПа.
Твердость по Вкккерсу HV в зависимости от температуры испы-
испытания:
t СС . .
HV, МПа
200 425 650 870 1095 1205
1320 1080 804 589 255 196
321
Твердость ниобия в зависимости от холодной деформации:
Обжатие %
0
10
20
30
пп
823
1019
1161
1259
МПа
НП
823
1019
1107
1166
Обжатие, %
40
50
60
HV,
пп
1288
1391
1450
МПа
НП
1245
1259
1293
Примечание. ПП — перпендикулярно направлению прокатки; НП — в на-
направлении прокатки.
Микротвердость отожженного ниобия //^=863 МПа, деформиро-
деформированного на 80 % ЯУ=2060 МПа.
Химические свойства
Нормальный электродный потенциал реакции Nb—3e=s=tNb3+ cpo = —1>1 В.
В соединениях проявляет степень окисления +1, +2, +3, +4, +5. Элек-
Электрохимический эквивалент 0,19256 мг/Кл.
При нормальной температуре компактный ниобий на воздухе устой-
устойчив. Окисление компактного металла начинается при 200—300 °С; по-
порошкообразного при 150 °С; выше 500 °С происходит быстрое окисление
с образованием оксида Nb2O5.
Ниобий устойчив против действия соляной, серной, азотной, фосфор-
фосфорной и органических кислот любой концентрации на холоду и при 100—
150°С. По стойкости в горячих соляной и серной кислотах он уступает
танталу. Ниобий растворяется в плавиковой кислоте и особенно интен-
интенсивно в смеси плавиковой и азотной кислот. Менее устойчив ниобий в
щелочах. Горячие растворы едких щелочей заметно разъедают металл;
в расплавленных щелочах и соде ниобий быстро окисляется с образо-
образованием натриевой соли ниобиевой кислоты.
Характерным свойством ниобия является способность поглощать га-
газы: водород, азот, кислород. Небольшие примеси этих элементов^ока-
элементов^оказывают существенное влияние на механические и электрические свойства
ниобия.
Кислород образует с ниобием твердый раствор внедрения и ряд ок-
оксидов: NbO, NbO2, Nb2O5. Оксиды NbO н NbO2 образуются при темпе-
температуре ниже 400°С, a Nb2O5 — при 400°С и выше. Оксид ниобия A1)
NbO имеет г. ц. к. решетку с периодом а=0,4203 ым, плотность
7,260 Мг/м3, температура плавления 1935 °С. Оксид ниобия (IV) NbO2—
полупроводник, структура тетрагональная (а = 0,482 нм, с=0,299 нм),
температура плавления 2080 °С. Оксид ниобия (V) Nb2O5 существует в
трех модификациях: L —ниже 900 "С, М — в интервале 900—1100 С и
Я —выше 1100 °С. Низкотемпературная модификация имеет ортором-
бическую структуру, плотность 4,950 Мг/м3, температура плавления
1510"С.
Водород —наиболее вредная примесь в ниобии, сильно снижающая
его пластичность Компактный ниобий начинает взаимодействовать с
водородом при 250 °С и очень быстро при 360 °С, образуя вначале твер-
твердый раствор, а затем гидрид (NbH), имеющий две модификации. По-
Поглощение водорода носит обратимый характер: при нагревании в ва-
322
кууме выше 600 °С газ удаляется и механические свойства металла вое-
станавливаются.
Ниобий поглощает азот уже при 600 °С, образуя раствор внедрения,
при более высокой температуре образуется нитрид (NbN), температу-
температура плавления которого 2300 °С. Азот может быть удален из твердого
раствора в ниобии нагреванием выше 1900 °С в вакууме или вакуумной
плавкой.
Углерод и углеродсодержащие газы (СО, СН4) взаимодействуют с
ниобием при 1200—1400"С с образованием твердого раствора и туго-
тугоплавких карбидов.
Ниобий с бором и кремнием образует тугоплавкие и твердые борнды
(NbB, Nb2B, NbB, Nb3B4> NbB2) и силициды (NbSi4, Nb5Si3, NbSi2).
Известны два фосфида (NbP и NbP2) и два сульфида (NbS, ЫЬ
ниобия с узкими областями гомогенности.
С галогенами ниобий образует ряд галогенидов, оксигалогенидов и
комплексных солей. Фтор действует на ниобий при комнатной темпера-
температуре, хлор — при температуре выше 200 °С, бром — выше 250 °С. Вые-
шие хлориды и фториды ниобия (NbF5 и NbCIs) — легкоплавкие, лег-
легколетучие соединения, весьма гигроскопичны, в воде гидролизуются с
образованием оксигалогенидов и гидратированных оксидов.
Ниобий взаимодействует с подавляющей частью элементов Перио-
Периодической системы. По характеру этого взаимодействия все элементы
классифицируются на четыре основные группы.
Первую группу составляют элементы, образующие с ниобием не-
непрерывные твердые растворы: Ti, Zr, Hf, V, Та, Mo и W.
Во вторую группу входят элементы, образующие с ниобием огра-<
ничейные твердые растворы: Си, Аи, Zn, Cd, Be, Ga, In, Tl, B, Se, Y,
La, Ac и лантаноиды: N, P, As, Sb, Bi, Cr, Mn, Fe, Co, Ni, Ru, Rh, Pd,
Os, Ir и Pt.
Третью группу составляют элементы VI и VII групп подгруппы Б,
образующие с ниобием соединения с ионным или ковалентным типом
связи: S, Se, Те, Ро, F, С1, В, А1.
Четвертую группу составляют элементы, не взаимодействующие е
ниобием: Li, Na, К, Pb, Cs, Fr, Ca, Sr, и инертные газы: Не, Ne, Ar,
Кг, Хс.
Ниобий обладает высокой химической стойкостью в различных аг-
агрессивных средах и, кроме того, отличается высокой стойкостью против
воздействия расплавленных металлов, применяемых в качестве тепло-
теплоносителей в реакторах.
Коррозионная стойкость ниобия в различных средах:
Среда
HNO3, концентрированная ....
H2SO4, 20 %-ная
H2SO4, 98 %-ная
НС1, 20 %-ная
HF, 40 %-ная
КОН, 40 %-ная , ,
NaOH, 40 %-ная
t, °С
25
21
21
20
20
100
20—100
100
ПО
Скорость коррозии,
мм/год
0,0000
0,0000
0,0004
0,0000
0,0000
0,0234
Растворяется
Быстро растворя-
растворяется
То же
323
Технологические свойства
Чистый ниобий легко поддается обработке давлением (ковке, прокатке,
волочению) и хорошо деформируется в холодном состоянии, сравни-
сравнительно медленно при этом нагартовываясь. Учитывая, что при нагреве
ниобий поглощает водород, азот, кислород, которые оказывают отри-
отрицательное влияние на его пластичность, горячая деформация возможна
только при применении специальной защиты (например, деформация в
среде инертного газа). После обжатия с высокой степенью G0—95%)
листы (нли другие изделия) перед дальнейшей холодной деформацией
подвергают отжигу при 1100-—1300 °С в среде инертного газа или в ва-
вакууме. Отжиг готовых изделий производят в основном для снятия на-
напряжений, вызванных обработкой давлением (или резанием), при 900—
1000 °С, в течение 1—5 ч, также в среде инертного газа или в вакууме.
Температура рекристаллизации ниобия повышается с увеличением
содержания кислорода и других газов. Температура начала рекристал-
рекристаллизации чистого ниобия 930—940°С, полная рекристаллизация проис-
происходит при 1200°С.
Легирование ниобия вольфрамом, танталом, цирконием, молибде-
молибденом повышает температуру рекристаллизации на 220—250 °С.
Зависимость температуры рекристаллизации ниобия чистотой 99,5 %
от степени деформации:
Степень деформации,
% 30 50 70 90
Температура начала
рекристаллизации, °С 1350 1200 1100 1050
Ниобий хорошо сваривается с титаном, медью, цирконием и други»
ми металлами. Сварку ведут в вакууме или нейтральной среде, приме»
няя различные виды дуговой и электронно-лучевой сварки. При пайка
на ниобий предварительно наносят электролитическим путем слой меди
или никеля.
Обработку ниобия резанием можно производить обычными режущи-
режущими инструментами, но в связи со склонностью к налипанию требуется
применять специальные смазочно-охлаждающие жидкости.
Области применения
Наиболее важные области применения чистого ниобия — производство
жаропрочных и других сплавов, атомная энергетика и химическое ап-
паратостроение. Металл используется для легирования медных, никеле-
вых и других цветных сплавов с целью повышения их прочности и жа-
жаропрочности. В виде ферросплавов ниобий добавляют в различные
стали для придания им необходимых физико-механических свойств. Ма-
Малые добавки ниобия модифицируют структуру и способствуют повы-
повышению коррозионной стойкости алюминиевых сплавов. Будучи введен
в титановые сплавы, ниобий повышает их прочность и коррозионную
стойкость. Небольшие присадки ниобия применяются для создания
сплавов с особыми физико-химическими свойствами (с повышенной элек-
электрической проводимостью и теплопроводностью, коррозионной стойко-
стойкостью и др.).
Некоторые соединения ниобия (карбиды, бориды) используются при
производстве сверхтвердых металлокерамических сплавов для повыше-
повышения их стойкости против износа и выкрашивания при механической об-
обработке сталей.
324
Благодаря отсутствию значительного взаимодействия с ураном, плу-
плутонием и жидкометаллическими теплоносителями, а также высокой
устойчивости при облучении и сравнительно небольшому захвату теп-
тепловых нейтронов, ниобий и его сплавы представляют собой ценные кон-
конструкционные материалы для атомной энергетики и ракетостроения.
В последние годы большое значение в атомной технике приобрели
сверхпроводящие ниобиевые сплавы; их используют при создании сверх»
мощных магнитов для новых атомных ускорителей, для отраж-ателей
горячей плазмы в термоядерных установках, а также при создании кван-
квантовых генераторов.
Ниобиевые жаропрочные сплавы используют в авиационных реак-
реактивных двигателях для изготовления турбинных дисков н неохлаждае-»
мых турбинных лопаток взамен охлаждаемых. Кроме того, ниобий
применяют для обшивки кромок крыльев и стабилизаторов в сверхзву-
сверхзвуковых самолетах, а также для изготовления различных деталей и узлов,
работающих при высоких температурах.
Ниобий — один из важных конструкционных материалов, применяе-
применяемых в радиотехнической и электротехнической промышленности (элек-
(электронные лампы радарных установок, катоды косвенного нагрева мощ-
мощных генераторных ламн и др.).
Антикоррозионные свойства ниобия позволяют применять его в ка-
честче химически стойкого материала в теплообменниках и конденса-
конденсаторах, для облицовки цистерн, для изготовления фильтров, мешалок,
трубопроводов и других деталей аппаратов химической промышленно-
промышленности. Соединения ниобия (в частности, Nb2O5) применяют в качестве ка-
катализаторов в химической промышленности, в производстве специаль-
специальных стекол и т. д.
Применение ниобия и его сплавов в аппаратуре химического маши-
машиностроения позволяет резко увеличить срок его службы и в ряде слу-
случаев способствует интенсификации процессов химического производ-
производства.
5.8. ТАНТАЛ [1—35, 56, 227]
Обшие сведения и методы получения
Тантал (Та)—металл серо-стального цвета с синеватым оттенком.
Открыт в 1802 г. шведским химиком Экебергом в минералах, най-
найденных в Финляндии и Швеции; назван по имени героя древнегреческой
мифологии Тантала, осужденного на вечную жажду, что было связано
с трудностями, возникшими при растворении оксида нового элемента
в кислотах. В чистом виде пластичный тантал впервые получен в 1903 г.
немецким химиком Болтоном. Промышленное производство таагала
началось в 1922 г. в США.
Содержание тантала в земной коре 2-10—4 % (по массе). Среди
других элементов тантал занимает 54-е место, что характеризует ого
как редкий металл. В природе почти всегда встречается вместе с нио-
ниобием. Тантал (как и ниобий) входит в состав около 100 минералов,
основными из которых являются танталит и колумбит (см. Ниобий).
Танталит и колумбит почти всегда содержат примеси титана, олова,
вольфраму и ряда других элементов. Плотность минералов сильно за-
зависит от соотношения содержания в них тантала и ниобия. Плотность
танталита 8,200 Мг/м3. Колумбит, не содержащий тантала, имеет плот-
плотность 5,000 Мг/м3. По соотношению этих величин можно ориентировочно
определить содержание в минерале тантала и ниобия.
Основным способом обогащения руд, содержащих танталит и колум-
колумбит, является гравитационное обогащение (мокрая отсадка, обогащение
325
на столах). В результате получают обычно коллективный концентрат,
содержащий, кроме танталита и колумбита, касситерит, вольфрамит и
некоторые другие минералы. Дальнейшее обогащение ведут, применяя
флотацию и электромагнитное разделение.
Примерный состав танталитовых концентратов: 12—30 % ND2O5;
j8—59,6 % Та2О5; 2,09—15,7% Fe2O3; 2,95—17,2% МпО; 0,25—6,4%
.'Ю2; 0,12—0,9 % SiO2.
По техническим условиям, принятым в нашей стране, танталитовые
концентраты I copra должны содержать 60—65 % Ta2Os и не более
10 % Nb2O5, II сорта — не менее 40 % Та2О5.
Кроме рудных концентратов, существенным источником тантала
(и ниобия) служат шлаки оловянных заводов, получаемые при выплав-
выплавке олова из касситеритовых концентратов. Шлаки содержат от 3 до
15 % (Та, NbJO5.
Переработку концентратов обычно осуществляют в три стадии:
1) вскрытие или разложение; 2) разделение тантала и ниобия и полу-
получение их чистых химических соединений; 3) восстановление и рафи-
рафинирование тантала.
Для вскрытия танталового концентрата применяют сплавление со
щелочами (NaOH, КОН) или разложение плавиковой кислотой.
В первом способе в результате плавления концентрата при 750—
800 "С с избытком щелочи образуются ортосоль (Na3Ta04) и оксиды
железа, марганца. После обработки сплава водой образуются мало-
малорастворимые политанталиты (NasTaeOi9-25H2O), которые разлагают
соляной кислотой, получая гидратированные оксиды тантала, которые
затем перерабатывают на чистые соединения.
Разложение плавиковой кислотой в настоящее время является ос-
основным способом; в этом случае тонко измельченный таиталитовый
концентрат при нагревании разлагают концентрированной плавиковой
кислотой.
Лопаритовые концентраты перерабатывают, используя два спосо-
способа — хлорирование и сернокислотный. Сущность первого состоит во
взаимодействии рудного концентрата с газообразным хлором при 749—
850 СС в присутствии древесного угля или кокса. Различие в лет\чести
хлоридов позволяет разделить основные ценные составляющие концен-
концентрата. Сернокислотный способ основан на разложении лопаритовою
концентрата серной кислотой и разделении ценных составляющих с ис-
использованием различий в растворимости двойных сульфатов титана,
ниобия и тантала, редкоземельных элементов со щелочными металлами
или аммонием.
Разделение тантала и ниобия из-за сходства свойств их химических
соединений является сложной задачей,
Известны следующие способы разделения тантала и ниобия: дроб-
дробная кристаллизация комплексных фтористых солей, экстракция органи-
органическими растворителями, разделение с помощью ионообменных смол,
ректификация хлоридов, избирательное восстановление пятихлористого
ниобия.
Способ дробной кристаллизации в настоящее время вытеснен более
совершенным — экстракцией Экстракционное разделение тантала и нио-
ниобия с одновременной их очисткой от примесей других элементов (Si,
Ti, Fe, Mn и др.) большей частью ведут из растворов фтористых со-
соединений тантала и ниобия, содержащих плавиковую и серную кислоты
(растворы получают в результате разложения рудных концентратов).
Экстракционное разделение тантала и ниобия состоит из трех ста-
стадий: 1) совместной экстракции тантала и ниобия с целью отделения их
от сопутствующих элементов (Fe, Mn, Ti, Sn, Si и др.); 2) избиратель-
избирательной реэкстракции ниобия из экстракта водой; 3) реэкстракции тантала
326
из растворителя водой или водными растворами солей, например фто-
фтористого аммония.
Разделение тантала и ниобия ректификацией целесообразно исполь-
использовать в том случае, когда рудные концентраты перерабатывают хлор-
хлорным методом, получая конденсат хлоридов тантала и ииобия (лонари-
товые концентраты).
При разделении смеси хлоридов технологическая схема разделения
состоит из следующих стадий: 1) предварительной ректификации для
отделения хлоридов тантала и ниобия от сопутствующих примесей;
2) основной ректификации (получения чистого NbCls и концентрата
ТаСЬ); 3) ректификации танталовой фракции (получение чистого
ТаС16).
Метод ректификации отличается высокой производительностью и
эффективностью разделения.
Металлический тантал получают восстановлением его соединений
высокой чистоты. Применяют восстановление тантала из ТагОб сажей
в одну или две стадии (с предварительным получением ТаС из смеси
Та2О5 с сажей в атмосфере СО или Н2 при 1800—2000 °С) — карботер-
мический способ. Электрохимическое восстановление из расплава, со-
содержащего фторотанталат калия K.2TaF7 и оксид ТагО5— электролити-
электролитический способ. Восстановление натрием K^TaF? при нагревании — нат-
риетермический способ. Возможны такие процессы термической
диссоциации хлорида или восстановление из него тантала водородом.
Обычно получают металл в виде танталового порошка чистотой
98—99 %■
Получение металла в компактном виде осуществляют путем спека-
спекания предварительно спрессованных из порошка заготовок прямым про-
пропусканием тока при 2500—2700 °С или косвенным нагреванием при
2200—2500 °С в вакууме. При этом чистота металла повышается до
99,9'—99,95 %• Для получения больших слитков и для рафинирования
применяют электровакуумную плавку в дуговых печах с расходуемым
электродом и в электронно-лучевых печах. В процессе вакуумного пе-
переплава общее содержание кислорода, азота и углерода снижается
от 0,1—0,5 до 0,01—0,05 %• Особо чистый компактный тантал (мо-
(монокристаллы) получают бестигельной электронно-лучевой зонной
плавкой.
Первичный танталовый порошок, получаемый в результате натрие-
термического восстановления и применяемый для изготовления твердых
сплавов, должен иметь следующий химический состав, %: >99,0
S (Ta + Nb), в том числе <0,5Nb; «0,08 Fe; «0,06 Si; <0,03Ti; «0,2 С.
Порошок комплектуют в партии массой до 100 кг и упаковывают в
пластиковые мешки.
Для электронной техники поставляют танталовый порошок повышен-
повышенной чистоты, имеющий следующее предельное содержание контролируе-
контролируемых примесей: 0,5 % Nb; 0,003 % Ti; 0,006 % Fe; 0,005 % Si;
0,02% (W+Mo); 0,02% С; 0,015% N2; 0,2% O2; 0,01% Нг;
0,001 % Na; 0,003 % Mg; 0,003 % Al; 0,003 % Ca; 0,003 % Cr;
0,003 % Mn; 0,003 % Co; 0,001 % Ni; 0,005 % Cu; 0,001 % Zr;
0,001 % Sn.
Для электровакуумных приборов поставляется порошок с содержа-
содержанием кислорода «0,01 %.
Слиткн тантала марки ТН-1, получаемые плавкой в вакууме, имеют
следующий химический состав, %: >99,85 S (Ta+Nb), в том числе
<1,0 Nb; <0,01 Ti; «0,01 Si; «0,01 Fe; «0,04 2 (W+Mo); «0,05 С.
Слитки имеют массу не более 50 кг н диаметр 70—
160 мм.
327
Физические свойства
Атомные характеристики. Атомный номер 73, атомная масса 180,948,
атомный объем 10,88 • 10—е м3/моль, атомный радиус 0,146 нм, ионный
радиус Та5+ 0,066 нм. Та4+ 0,077 нм, Та2+ 0,088 нм. Конфигурация
внешних электронных оболочек 5d36s2. Значения потенциалов иониза-
ионизации J (эВ): 7,7; 16,2; 22. Электроотрицательность 1,5. Природный тан-
тантал состоит из стабильного изотопа 131Та (99,9877 °/о) н радиоактивного
180Та @,0123 °/о) с периодом полураспада 1012 лет. Известны 15 радио-
радиоактивных изотопов тантала:
Массовое
число
172
173
174
175
176
Период по-
полураспада
44 мин
3,7 ч
1,2 ч
10,5 ч
8 ч
Массовое
число
177
178
179
180т*
182
Период по-
полураспада
66, 6 ч
9,35 мин
600 дн.
8,15 ч
115 дн.
Массовое
число
182 т*
183
184
185
186
Период по-
полураспада
16,5 МИН
5,0 ДН.
8,7 ч
50 мин
10,5 мин
• т — метастабильиое состояние ядра.
Тантал имеет о. ц. к. решетку с периодом а = 0,33074 нм, координа-
координационное число 8. Эффективное поперечное сечение захвата тепловых
нейтронов 21,3-10~28 м2, работа выхода Электронов для поликристалла
<р=4,12 эВ, для монокристалла [211] 4,352 эВ, положительная ионная
эмиссия 10 эВ, энергия кристаллической решетки 775 мкДж/кмоль
Плотность пря 298 К р= 16,500 Мг/м3.
Электрические и магнитные. Удельное электрическое сопротивление
р и удельная электрическая проводимость а тантала чистотой 99,9 %
в зависимости от температуры:
т, к
100
200
300
500
700
р, мком-м
0,050
0,10
0,15
0,24
0,33
о, МСм/м
20
10
6,67
4,17
3,03
Г, К
900
1100
1300
1500
1800
р, мкОм.м
0,42
0,49
0,56
0,62
0,71
о, МСм/м
2,38
2,04
1,79
1,62
1,41
При 3223 К удельное электрическое сопротивление тантала чистотой
99,9% составляет —1,08 мкОм-м, а удельная электрическая проводи-
проводимость 0,925 МСм/м.
Температурный коэффициент электросопротивления:
Г, К ■ 273 273—373 273—1273
а-103 К- • 3,47 3,17 3,0
Коэффициент чувствительности электросопротивления к давлению
гидростатического сжатия Р при 302 К A/р) (dp/dP):
Р, ГПа 1,0 3,0
(l/p)((dp/dPI010, Па-1 ... • 1,62 1,55
Температура перехода в сверхпроводящее состояние Гс = 4,47 К.
Абсолютный коэффициент т. э. д. с. при 298 К е=—5,0 мкВ/К.
328
Постоянная Холла Л=0,98- Ю-10 м3/Кл.
Коэффициент вторичной эмиссии атах=1,35 при ускоряющем напря-
напряжении первичных электронов 0,5 кэВ. Тантал парамагнитен, его маг-
магнитная восприимчивость при 293 К %=0,849-10~9, а при 2143 К %=
= 0,685- Ю-9.
Тепловые и термодинамические. Температура плавления £Ил=2997°С,
температура кипения /Кип = 5287°С. Характеристическая температура
0D, К:
По упругим постоянным 263,8
» теплоемкости ........ 240
» электросопротивлению .... 216
Удельная теплота плавления ДЯПЛ = 173,668 кДж/кг, удельная те-
теплота сублимации ДЯсубл = 4315 кДж/кг.
Удельная теплоемкость сР в зависимости от температуры:
Г, К
1
4
6
10
V
Дж/(кг-К)
0,0335
0,1716
0,3307
1,1723
т, к
20
80
273
500
У
Дж/(кг-К)
7,5159
95,386
142,35
146,54
т, к
1000
1500
2000
3000
дж/Гкг К)
152,82
161,19
171,66
234,46
Удельная электронная теплоемкость с^" = [6,15 мДж/(моль-К2)] -Т.
Теплопроводность Я в зависимости от температуры (прнмеси 0,3 %
Nb; 0,015 % С; 0,003 % О2; 0,002 % N2; 0,001 % Н2):
Г, К 273 373 673 873 1073 1273 1473
Ji, Вт/(м-К) 45,2 51,8 53,6 54,9 56,1 57,4 59,2
Температуропроводность а тантала в зависимости от температуры:
Г, К 1173 1800 2000 2400 2800 3000 3150
а- 10е, м2/с . . . 24,0 22,0 21,7 20,6 19,5 18,6 17,5
Температурный коэффициент линейного расширения а в зависимо-
зависимости от температуры:
Т, К 373 473 673 1073 1473 1873 2273 3273
а-10е, К~1 . . . 6,59 6,72 6,99 7,53 8,06 8,59 9,48 10,97
Молярная энтропия s° и приведенный термодинамический потенциал
Фг в зависимости от температуры:
Г, К 298 500 1000 1500
s° Дж/(моль-К). ■ • 41,45 54,97 73,89 85,41
Фг Дж/(моль-К) • • 41,45 44,42 54,93 63,30
Продолжение
Г, К 2000 2500 3000
s°, Дж/(моль-К) • • 93,83 100,57 106,22
Фг, Дж/(моль-К)- • 69,92 75,40 80,09
329
Давление
т, к
1900
2000
пара р
р,
44,88
54,78
в зависимости
Па
10-10|
г, к
2200
2600
01
г температуры:
р.
40,96
31,36-
Па
Ю-8
Т, К
2800
3000
р,
42,73
41,85
Па
• ю-*
• ю-3
Давление пара при температуре плавления р=77,52-10~2 Па.
Поверхностное натяжение жидкого тантала при 3273 К <х=2,4 мН/м.
Поверхностная энергия v=2388 мДж/м2. Энергия дефекта упаковки
ПО мДж/м2. Параметры самодиффузии поликристаллического тантала
в интервале 1423—2473 К: предэкспоненциальиый множитель £>о=
=0,12-10~4 м2/с, энергия активации £=413,2 кДж/моль; в интервале
2073—2773 К: D0=2,0-10-4 м2/с, £=460,5 кДж/моль. Параметры диф-
диффузии некоторых элементов:
Элемент
н
с
N
О
Nb
S
т, к
273—433
873—1673
1073—1573
1193—2757
1970—2100
6, МО-8
2,78-10-'
0,24-10-*
3-10-"
0,23-10-*
100-10-*
Е, кДж/моль
14,6
103,0
171,24
121,42
413,6
293
Оптические Спектральный коэффициент излучения неокисленного тан-
тантала ея=0,448н-0,442 (длина волны 0,65 нм, температура 1400—2000 К).
Отражательная способность (коэффициент отражения По) полиро-
полированного тантала.
Я, мкм 0,5 0,6 0,8 1,0 2,0 4,0 7,0 12,0
nD, % 38 45 64 78 90 93 94 95
Показатели преломления п и поглощения %:
X, мкм 0,05 0,1 0,15 0,30 0,40 0,50 0,60
п 0,05 0,7 1,2 2,0 2,4 2,7 2,2
г. . ■ 0,2 1,5 1,9 2,0 2,1 2,0 2,0
Механические свойства
Механические свойства тантала зависят от его чистоты (содержания
примесей, особенно кислорода) и температуры испытания. Примеси
внедрения способствуют повышению твердости по Бринеллю, временно-
временного сопротивления, предела текучести, но снижают характеристики пла-
пластичности и усиливают хладноломкость.
Механические свойства тантала различной чистоты;
330
Примеси, %
Состояние материала
исп'
°С
в
МПа
°0,2,
МПа
0,0016 0,
0,001 N,
0,003 С
0,0056 0,
0,013 N,
0,02 С
Тантал электронно-лучевой плавки
Холодно деформирован-
деформированный на 95 % и отожжен-
отожженный при 750 °С, 15 мин,
для снятия напряжений
Холоднодеформироваи-
ный на 75 % и рекрн-
сталлнзованный при
1200 °С, 1 ч
Тантал спеченный
Отожженная полоса
27
150
245
310
365
490
27
230
325
425
490
425
340
330
349
384
325
207
196
219
198
189
345
316
309
337
335
317
185
60
47
45
45
— 195
-73
27
205
427
538
760
928
1093
1204
1041
515
472
394
459
421
213
152
118
104
1040
510
404
249
235
184
119
87
57
53
Тантал электродуговой плавки
0,0035—
0,0059 О,
0,002—
0,003 N,
0,0015 С
Лист отожженный
27
1766
2057
2500
2767
310
31
19
12
4
,5
,2
,9
220
13
10
4
2
,7
,9
,5
,5
3
6
4
5
5
5
36
23
30
23
20
3,7
23
25
13
24
16
23
33
43
48
25
35
47
35
26
Механические свойства спеченного тантала технической чистоты по-
после холодной прокатки и отжига при испытании в аргоне:
'исц'
1649
1927
2204
о„, МПа
а=0,076
28,3
29,0
6.4
12,7
2,9
о02, МПа
мм/мнп
26,6
27,1
4,3
5,6
2,9
б. %
19,0
19,3
'исп' °С
1649
2204
3033
G МПа
а = 152 ъ
70,8
75,8
26,0
27,7
16,5
14,6
°0,'2-
МПа
ш/мин
52,7
48,9
12,4
11,3
9,1
7,8
6, %
29,7
30,2
43,5
46,0
47,8
50,8
Примечание. В числителе — выдержка 10 с, в знаменателе — 90 с
Механические свойства при 20 °С в зависимости от содержания при-
примесей:
Примеси, %
0,0560 0
МПа
204
420
МПа
183
351
б. %
36
26
Примеси, %
0,0225 N
0,0955 С
V
МПа
513
506
МПа
478
344
б, %
25
20
с
0,
0,
0,
Твердость в зависимости от содержания примесей:
%
0033
001
006
О, %
0,077
0,044
0,006
N,
ооо
*
027
010
007
НВ, МПа
900—1050
730—750
600—640
с
ооо
%
001
002
002
с
0
0
0
. %
006
004
006
N
ооо
%
009
005
001
НВ, МПа
560—600
550—570
5Й0—550
Электронно-лучевая плавка, позволяющая существенно снизить со-
содержание в тантале примесей, повышает его пластичность и снижает
температуру перехода в хрупкое состояние.
Механические свойства тантала в рекристаллизованном состоянии
при — 195°С:
Способ получения
Л'Па
Электронно-лучевая плавка .
Дуговая плавка
391
959
721
931
19,0
20
99
69
Температура перехода в хрупкое состояние тантала различной чи-
чисто 1Ы.
Способ получения
Электронно-лучевая плавка
0
0
N. %
,006
,0008
0.
0,
. /о
008
003
0
0
с, %
,0014
,003
'х- °с
—200
—250
Очень чистый тантал сохраняет высокую пластичность при темпера-
температурах, близких к абсолютному нулю.
Изменение механических свойств при комнатной температуре иод
воздействием облучения:
Без облучения
После облучения
457—506
597—618
6, %
19-23
17
Модуль нормальной упругости Е поликристаллического тантала в за-
зависимости от температуры:
t, °С . . . . . —196 20 400 1200
Е, ГПа . - - * 196 186 180 157
332
Модуль нормальной упругости Е монокристалла (в числителе — при
—253 °С, в знаменателе —при 23 °С):
[Ш] <Ш> <П0> <Ю0>
Е, ГПа 227/224 202/199 148/156
Модуль сдвига тантала G—70 ГПа, коэффициент Пуассона v=0,350,
сжимаемость и=0,53- Ю-'1 Па-1.
Предел выносливости сн тантала на базе 107 циклов после отжига
при 1400 °С, 1 ч (в числителе — при —73 °С, в знаменателе —при 23 °С),
МПа:
Лист толщиной 1 мм . 276/240
Проволока диаметром
1 мм 451/373
Характеристика ползучести тантала, полученного электронно-лучевой
плавкой (скорость установившейся ползучести е).
t, "С
750
750
1000
1000
1200
G, МПа
ПО
82,4
75,5
61,8
48,1
е', %/с
2,7-10-3
4,0-10-»
8,8-10-*
1,2-10-4
2,4-10-2
Л "С
1200
1200
1400
1400
G, МПа
24,5
17,7
17,7
10,8
1
2
7
1
в",
,3-
,8-
,2-
,6-
%/с
ю-4
10—6
Ю-*
10-4
* 6 — скорость установившейся ползучести.
Твердость по Бринеллю, МПа, листового тантала в зависимости от
состояния материала:
Отожженный , 450—1250
Деформированный 1250—3500
То же, после поглощения газов при нагре-
нагревании До 6000
Твердость по Виккерсу в зависимости от температуры:
прн
t °с
НУ, МПа ....
20 400
890 820
Микротвердость электролитического
20°СЯ =2310 МПа.
600
730
тантала
800
370
1000
290
чистотой
1200
210
99,96
Химические свойства
Нормальный электродный потенциал реакции Та—5еч=ьТа6+ гоо=
=—1,126В.
В соединениях проявляет степени окисления —1, +1, +2, +3, 4-4,
+ 5; наиболее типична +5. Электрохимический эквивалент 0,3749 мг/Кл.
Тантал — самый коррозионностойкий из всех недрагоценных метал-
металлов. Он стоек в соляной, серной, азотной, фосфорной и органических
кислотах всех концентраций вплоть до 100—150"С. В горячих соляной
и серной кислотах тантал отличается более высокой стойкостью, чем
ниобий. Тантал растворяется в плавиковой кислоте и особенно интен-
интенсивно в смесн плавиковой и азотной кислот,
333
В щелочах тантал менее устойчив. Горячие растворы едких щелочей
ааметно разъедают металл; в расплавленных щелочах и соде тантал
быстро окисляется с образованием натриевой соли танталовой кислоты.
При нормальной температуре таитал устойчив против окисления на
воздухе. При нагревании до 200—300 °С на его поверхности образуется
тонкая прочно сцепляющаяся с основным металлом пленка оксида. Хи-
Химические реагенты действуют на металл только в тех случаях, когда
оии вступают в реакцию с этой пленкой или проникают сквозь нее.
Ценным качеством является и то, что пленка оксида препятствует про-
протеканию электрического тока от металла к электролиту, если таитал
служит анодом. Выше 500 °С оксидная пленка становится пористой,
расслаивается и склонна к отделению от основного металла.
Повышение сопротивления тантала окислению возможно либо путем
модифицирования (изменения структуры образующегося на металле ок-
оксида), осуществляемого легированием соответствующими элементами,
либо путем предотвращения или хотя бы замедления контакта кисло-
кислорода с металлической поверхностью. В обоих последних случаях тре-
требуется применение защитных покрытий на основном металле или сплаве.
С кислородом тантал образует твердый раствор н оксид Ta2Q5. При
увеличении содержания кислорода в тантале до 1,5 % (ат.) происходит
пятикратное повышение прочностных свойств при сильном снижении
пластичности и коррозионной стойкости. Растворенный кислород выде-
выделяется при иагреве выше —2200°С в вакууме. Оксид тантала (V)
Та2О5 существует в двух модификациях. Температура плавления ТагОв
1620°С (по другим данным, 1872°С). Та2О5 имеет кислотный характер.
Тантал слабо реагирует с водородом ниже 350 °С; выше этой тем-
температуры скорость реакции растет примерно до 450 °С; при этой темпе-
температуре водород поглощается с максимальной скоростью и, кроме того,
образуется химическое соединение — низкотемпературный гидрид тан-
тантала (ТаН). Поглощенный водород придает металлу хрупкость, однако
при нагревании в вакууме выше 800 °С водород удаляется и механиче-
механические свойства восстанавливаются.
Тантал непосредственно реагирует с азотом с образованием трех
фаз: твердого раствора азота в тантале и нитридов Ta2N и TaN. Реак-
Реакция начинается около 300 °С, причем скорость ее возрастает с повыше-
повышением температуры до тех пор, пока при ~ 1100 "С не образуется TaN.
Поглощенный танталом азот вновь выделяется в условиях высокою
вакуума при температуре ~2000°С. Присутствие азота, как и кислоро-
кислорода, увеличивает твердость и прочность тантала и снижает его пластич-
пластичность.
Фтор действует на тантал при комнатной температуре. Тантал пол-
полностью инертен к действию влажных и сухих хлора, брома и иода до
150 °С. Воздействие хлора начинается около 250°С, а при —500 °С ре-
реакция протекает практически мгновенно. В присутствии паров воды кор-
коррозия, вызываемая хлором, резко замедляется. Бром действует на тан-
тантал при ~300°С, иод1—примерно при той же температуре; в результате
образуются ТаВг5 и Та1б соответственно.
Углерод и углеродсодержащие газы (например, СЬЦ, СО) при высо-
высокой температуре 1200—1400 °С взаимодействуют с танталом, образуя
твердые и тугоплавкие карбиды ТаС, которые плавятся при 3880 °С и
весьма устойчивы по отношению к кислотам.
С бором тантал образует бориды ТаВ2, представляющие собой туго-
тугоплавкие и твердые соединения (tnn «3000 °С), устойчивые против воз-
воздействия соляной и азотной кислот, а также царской водки, но медлен-
медленно разлагающиеся под действием горячих серной и фтористой кислот,
Бориды тантала быстро диссоциируют в расплавленных щелочах, кар-
карбонатах, бисульфатах и пероксидных соединениях,
334
С кремнием тантал образует силициды, основной из них дисилицид
TaSi2- Это соединение имеет температуру плавления ~2400°С, устой-
устойчиво против воздействия минеральных кислот, однако разлагается под
Д(_пствием фтористой кислоты.
Со многими металлами, имеющими изоморфную кристаллическую
структуру, размер атомов, близкий к размеру атома тантала, а также
близко расположенными к нему в ряду электроотрицательностн, тантал
образует непрерывные твердые растворы. К этим металлам, в частно-
частности, относятся ниобий, вольфрам, молибден, ванадий, Р-титан и др.
Ограниченные твердые растворы и металлические соединения тантал
образует с алюминием, бериллием, золотом, кремнием, никелем, т. е.
металлами, которые значительно отличаются по размерам атомов и
электроотрицательности С литием, калием, натрием, магнием и неко-
некоторыми другими элементами тантал практически не образует ни твер-
твердых растворов, ни соединений.
Технологические свойства
Тантал является пластичным тугоплавким металлом Он хорошо под-
поддается обработке давлением всеми существующими методами. Чистый
тантал медленно нагартовывается в процессе пластической деформации
ниже температуры рекристаллизации, что позволяет подвергать его
холодной деформации с большими (до 95 %) обжатиями без промежу-
промежуточных отжигов. Слитки тантала, подвергаемые холодной деформации
для получения листов, прутков и проволоки, предварительно обдирают
на токарном станке. В отличие от тугоплавких металлов VI группы тан-
тантал имеет достаточную пластичность при низкой температуре вплоть
до—196°С.
Пластичность тантала в зависимости от температуры:
/, °С —240 —100 50 200 350
ij>, % 72 82 84 83 81
Тантал сохраняет пластичность и при легировании для повышения
прочности при высоких температурах.
Горячую обработку давлением тантала целесообразно осуществлять
в вакууме, так как на воздухе в этом случае металл окисляется на зна-
значительную глубину, что приводит к большим его потерям при последу-
последующем удалении пораженного поверхностного слоя механической обра-
обработкой. Кроме того, пластичность металла при горячей деформации на
воздухе снижается.
Температура рекристаллизации тантала и его сплавов в зависимости
от степени деформации:
Степень деформации, % 2,5 10,0 50,0 90,0
Л1ЭЧ ор.
'рекр' "*■'•
тантала 1300 1275 1250 1200
сплава 90 % Та—10 % W . . . . — — 1340 1370
При температурах отжига до 1600 °С величина зерна практически не
изменяется. Значительный рост зерна в процессе отжига холоднодефор-
мированного тантала наблюдается при 2400 °С.
Основной вид термической обработки — отжиг. Нагрев для термиче-
термической обработки рекомендуется производить только в вакууме, так как
тантал поглощает из инертных газов примеси внедрения
Обработку резанием литого тантала или тантала, деформированного
вхолодную из слитков, лучше всего производить при малых скоростях
335
инструментом из быстрорежущей стали, заточенным со значительным
передним и задним углами, обеспечивающими высокую прочность ре-
режущей кромки.
Шлифования тантала следует по возможности избегать из-за его
склонности засаливать шлифовальный круг, что приводит к задирам
на металле.
Тантал характеризуется хорошей свариваемостью. Сварка плавлением
технического тантала, выполненная в условиях тщательной защиты от
атмосферных газов, позволяет получать пластичные швы, допускающие
изгиб до 180°.
Пайку тантала осуществляют либо в среде инертных га-<ов (аргон,
гелий), либо в вакууме.
Пайку тантала серебряными припоями можно производить только
по гальваническим покрытиям из меди, никеля или серебра.
Тантал наряду с вольфрамом, молибденом и ниобием относят к
«большой четверке» металлов, наиболее перспективных для создания
на их основе высокотемпературных конструкционных материалов для
самолетов, ракет, космических кораблей и т. п. Обычно тантал легируют
W, Mo, V, Nb, Ti, Zr, Hf, Re, Cr, Си и другими элементами.
Области применения
Примерно 60—70 °/о тантала применяют в электровакуумной технике и
электротехнике для изготовления радиотехнической, радиолокационной
и рентгеновской аппаратуры.
Высокая способность тантала поглощать газы используется для под-
поддержания глубокого вакуума в радиолампах и других электровакуум-
электровакуумных приборах.
Из тантала изготовляют арматуру, подвергающуюся нагреву в про-
процессе эксплуатации, — аноды, сетки, катоды косвенного накала и дру-
другие детали электронных ламп, особенно мощных генераторных ламп
В последнее время тантал приобрел важное значение для изготов-
изготовления электролшических конденсаторов как накопителей электрической
энергии, а также выпрямителей тока. Миниатюрные танталовые конден-
конденсаторы широко используют в передаточных радиостанциях, радарных
установках, электронно-счетных машинах и других устройствах.
В электротехнике танталовые листы используются для изготовления
нагревателей высокотемпературных вакуумных печей.
Коррозионная стойкость тантала в кислотах и других средах в со-
сочетании с высокой теплопроводностью и пластичностью делает его цен-
ценным конструкционным материалом для аппаратуры в химических и ме-
металлургических производствах Тантал применяют для изготовления
конденсаторов, подогревателей, облицовки аппаратов, мешалок и дру-
■ гнх деталей.
Карбиды тантала входят в состав некоторых марок спеченных твер-
твердых сплавов на основе карбида вольфрама, используемых для резания
сталей.
Тантал получил признание как протезный материал для восстанови-
восстановительной хирургии.
Тантал и его сплавы широко применяют в атомной энергетике и
космической технике. Его используют также для изготовления фильер
в производстве вискозы, танталовых тепловых экранов, контрольною
инструмента, диафрагм и сложных механизмов, где особенно важна
коррозионная стойкость. Тигли нз тантала применяют при очистке ред-
редкоземельных элементов. Тантал с вольфрамом и молибденом использу-
336
ют также в качестве одного из элементов для измерения температур
выше 2273 К.
В некоторых случаях тантал заменяет вольфрам и вольфрамовые
сплавы для изгоювления противовесов в управляющих механизмах са-
самолетов н ракет.
5.9. ЭЛЕМЕНТ № 105 (НИЛЬСБОРИЙ)[1—35, 333]
Общие сведения и методы получения
Элемент № 105 синтезирован в 1970 г. советскими учеными—Г. Н. Фле-
Флеровым с сотр. в Объединенном институте ядерных исследований
(г. Дубна) и американскими учеными — Гиорсо с сотр. в Беркли.
По предложению советских ученых назван нильсборием — химиче-
химический символ Ns (лат. Nilsbohrium) — в честь датского физика Нильса
Бора Это название пока не является общепризнанным.
Искусственно полученный элемент радиоактивен.
Физические свойства
Атомные характеристики Атомный номер 105. Электронное строение
изолированного атома 6s2p6d37s?.
Известны два нестабильных изотопа с массовыми числами 260 и
261 и периодом полураспада 1,4 с. Распад происходит с выделением
а-частиц.
т=г 6. ЭЛЕМЕНТЫ
ШЕСТОЙ ГРУППЫ
6.1. КИСЛОРОД [1—35, 195, 228—230]
Общие сведения и методы получения
Кислород (О) —бесцветный газ, не имеющий запаха. Открыт в 1772—
1774 гг. Шееле при сильном прокаливании селитры, а затем при воз-
воздействии серной кислоты на пиролюзит (диоксид марганца). Независи-
Независимо от Шееле в 1774 г. кислород получил Пристли, нагревая оксид рту-
ртути и сурик. Современное название элементу дал создатель теории горе-
горения Лавуазье, который считал, что кислород является составной частью
кислот, и потому назвал этот газ «Oxygene» (кислый).
Содержание кислорода в сухом воздухе 20,9 % (по объему), или
23 % (по массе). В земной коре в форме различных соединений содер-
содержится 47,3 % кислорода Общее содержание кислорода в литосфере,
гидросфере и атмосфере составляет —50 % по отношению к содержанию
всех остальных элементов.
В промышленности кислород получают путем фракционной перегон-
перегонки жидкого воздуха или фракционным сжижением воздуха. Значитель-
Значительные количества кислорода получают электролизом воды. Кислород,
полученный при сжижении воздуха, содержит до 3 % Аг, температура
кигк нпя которого близка к температуре кипения кислорода. В лабора-
лабораторных условиях кислород можно получить при термическом разложе-
разложении богатых этим элементом веществ. Кислород поставляют потребите-
потребителям в случае его ограниченного расхода в стальных баллонах, давле-
давление газа в которых достигает 15 МПа. Технический кислород первого
337
сорта содержит не менее 99,7% 02, второго —не менее 99,5% О2,
третьего — не менее 99,2 % О2.
Физические свойства
Атомные характеристики. Атомный номер 8, атомная масса 15,9994
а е м, атомный объем 10,89-10~3 м3/моль. Атомный радиус кислорода
(ковалептный) 0,066 нм. Конфигурация внешних электронных оболочек
атома кислорода 2s22p4. Кислород состоит из трех стабильных изото-
изотопов 16О, 17О и 18О, процентное содержание которых соответственно
равно 99,759; 0,037 и 0,204 %. Известны три искусственных радиоак-
радиоактивных изотопа ИО, 15О, 19О с периодами полураспада 72,1; 126 и
29,4 с соответственно. Ниже 23,85 К при атмосферном давлении ста-
стабильна ромбическая а-фаза с периодами о=0,5403 нм, 6 = 0,3429 нм,
с=0,5086 нм, 6 = 132,53°. В интервале (—249,15)-г(—229,23) °С ста-
стабильна 6-фаза, имеющая ромбоэдрическую структуру с периодами а=
=0,3307 нм, с- 1,1256 нм. Выше —229,23 °С существует кубическая мо-
модификация y c периодом а—0,683 нм. Потенциалы ионизации атома
кислорода J (эВ): 18,614; 35,15; 54,93. Электроотрицательность 3,5.
Плотность Плотность кислорода рентгеновская при 50 К равна
1,469 Мг/м3. При плавлении плотность кислорода снижается на 7,5 %.
Электрические и магнитные. Магнитная восприимчивость а-Ог в
интервале температур 2,5—4,2 К х=+50,7 [1—0,0172-(Г—2,905)] • 10"9.
Для той же модификации кислорода, но в интервале 14—20 К х=
= +49,3.1+0,00276 (Т—14,5)МО"9. Для |5-О2 при 20—23,7 К Х=
■=+54,9-10-9. Для у-О2 при 43,7—54,3 К х=+320-10-8. Функциональ-
Функциональная зависимость % = f{T) характеризуется скачками при 23,7 и 43,7 К.
Магнитная восприимчивость % жидкого кислорода в зависимости от
температуры:
Г, К - 64,3 70,8 77,5 90,1
Х-109 +284,9 +271,4 +259,6 +240,6
Магнитная восприимчивость газообразного О2 при 293 К Х=
«= + 107,8- Ю-9.
Тепловые и термодинамические. Температура плавления ?Пл =
=— 218,799 °С, температура кипения tKlln=—182,972 °С. Удельная тепло-
теплота плавления кислорода, отнесенная к 298 К, ДЯПЛ = 13,9кДж/кг, изме-
изменение объема при плавлении AV/V=0,075. Теплота сублимации при
298 К ДЯс,бЧ = 213 кДж/кг.
Теплота атомизации кислорода ДЯ^8 = 15,581 кДж/кг; двухатомной
молекулы О2 ДЯ^8 = 15,582 кДж/кг, трехатомной молекулы О3 АЯ^, =
= 12,577 кДж/кг.
Твердый кислород (при низких температурах) существует в трех
аллотропических модификациях а, в и у. Превращение а<=р протекает
при — 249,15 °С с ДЯ = 2,93 кДж/кг. Превращение б^у протекает прн
—229,23 °С, ДЯ=23,15 кДж/кг. С повышением давления возрастают тем-
температуры аллотропических превращений кислорода и температура его
плавления. При давлении 0,36 ГПа Л,л=—185,5 °С. Коэффициент dT/dP
кривой плавления равен на начальном участке 90 К/ГПа. Температура
P^Y-превращения при 0,4 ГПа равна —206 °С. Удельная теплоемкость
кислорода в интервале 298—1500 К с„ = 918 Дж/(кг-К). Теплопровод-
Теплопроводность кислорода Я в зависимости от температуры-
Т, К 73 273 573 973 1273
fc, Вт/(м-К).- 0,00695 0,0245 0,0476 0,0733 0,7215
338
Молярная энтропия s° кислорода (О2) в зависимости от темпера-
температуры:
Г, К 298 500 1000 1500 2000 2500
5°,Дж/(моль-К) • 205,2 220,7 243,6 258,1 268,8 279,3
Приведенный термодинамический потенциал Фт кислорода (О2) в
зависимости от температуры:
Г, К 2Э8 500 1000 1500 2000 2500
Фг, Дж/(моль-К) 205,2 208,6 220,9 231,0 239,2 246,0
Давление пара р кислорода (Ог) в зависимости от температуры:
Т, К ...... 54 62,5 74,5 90,18
р, Па 129,4 129,4 1294-Ю3 9,81-10*
Динамическая вязкость ц сжиженного кислорода (О2) при разных
температурах:
Г, К 90,1 111,0 111,8 125,6 138,4 145,6 154,2
т), МПа.с .... 19 12,5 12,4 10,8 10 9,65 9,15
Оптические. Показатель преломления света п в жидком кислороде
при длине волны А,=0,5893 мкм равен 1,221, а газообразного кислорода
1,000271. Молекула кислорода О2 при обычных условиях является па-
парамагнитной. Последнее обстоятельство указывает, что не все ее элект-
электроны образуют пары с противоположно направленными спинами.
Спектроскопические исследования показывают, что молекула Ог со-
содержит два неспаренных электрона. При обычной температуре диссоци-
диссоциация молекулы О2 на атомы ничтожна, она становится заметной лишь
выше 1700—1800 К.
Известно существование трехатомного кислорода (Оз) с молекуляр-
молекулярной массой 48 (озон), который можно считать аллотропической моди-
модификацией обычного двухатомного. Озон представляет собой неустойчи-
неустойчивую модификацию, которая может быть получена лишь при особых
условиях, в частности при электроискровом разряде в кислороде или в
воздухе, но быстро распадается, переходя в двухатомную Температура
кипения озона Lim=—111,34 °С, температура плавления ^„п=—251,24 °С,
магнитная восприимчивость при 92,16 К х= +150 • 10~э. В 100 объемах
воды при 273 К. растворяется 49 объемов озона и только 4,9 объема
обычного кислорода.
Химические свойства
Во всех соединениях, за исключением соединения со фтором, степень
окисления кислорода равна —2. В соединении со фтором (OF2) степень
окисления кислорода положительна и равна +2.
Кислород — элемент очень активный в химическом отношении. Ои
вступает во взаимодействие практически со всеми элементами Периоди-
Периодической системы, за исключением инертных газов. При таком взаимодей-
взаимодействии образуются химические соединения, которые принято называть
оксидами. Оксиды получают двумя методами, непосредственным соеди-
соединением элементов с кислородом или нагреванием гидроксидов или дру-
других кислородных соединений.
Непосредственное соединение элемента с кислородом гораздо более
интенсивно происходит при нагреве, в процессе реакции выделяется
большое количество тепла, которое может привести к самовозгоранию
вещества,
339
Образующиеся оксиды, как правило, термически устойчивы, за ис-
исключением оксидов благородных металлов. Соединения большинства
переходных металлов с кислородом устойчивы до 1250—1750 °С. Боль-
Большой термической стабильностью и стойкостью к действию различных
агрессивных сред отличаются оксид алюмнння AI2O3, оксид кремния
БЮг, оксид циркония ZrO2 и др.
Многие оксиды при нагреве с водородом или углем восстанавлива-
восстанавливаются, при этом получаются чистые металлы.
Технологические свойства и области применения
Кислород играет определяющую роль в существовании жизни на Зем-
Земле. С ним связано возникновение природы н последующее ее эволюци-
эволюционное развитие.
В технике и промышленности кислород применяется для интенсифи-
интенсификации различных технологических процессов (доменное и сталепла-
сталеплавильное производство, получение серной и азотной кислот). Кислород
обеспечивает получение высоких температур сгорания различных газов,
что находит широкое применение в высокотемпературной технологии
(газовая сварка, резка).
6.2. СЕРА [1—35, 231, 232]
Общие сведения и методы получения
Сера (S) — неметалл, представляющий собой хрупкие кристаллы жел-
желтого цвета.
Известна с древнейших времен (за 2000 лет до н.э.). Элементарную
природу серы установил французский химик Лавуазье. В 1822 г, Ми-
черлих обнаружил аллотропию серы. Название элемента связано с его
цветом — от латинского «sulfur» светло-желтый. Русское название «се-
«сера» происходит от санскритского «сира», что также означает светло-
желтый; имеетс-я и другое древнерусское название серы «жупель» —
сера горючая.
Общее содержание серы в земной коре составляет ~0,1 % (по
массе).
Сера встречается в природе как в свободном виде (самородная),
так и в соединениях.
Известно более 200 минералов, содержащих серу. Наиболее рас-
распространены соединения серы с различными металлами — сульфиды:
PbS—-свинцовый блеск; ZnS — цинковая обманка; CU2S—медный
блеск; FeS2 — пирит; HgS — киноварь и др. Широко распространены
в природе также сульфаты: Na2SO4- 10Н2О — глауберов»! соль; BaSO4—
тяжелый шпат; CaSO4-2H2O — гипс и др. В виде сульфатов натрия,
калия, магния и других элементов сера содержится в водах мирового
океана @,08—0,09 %), в углях, нефти, сланцах, природных газах.
Элементарную серу получают из самородных руд, используя се спо-
способность легко плавиться. Полученную серу очищают перегонкой в ра-
рафинировочных печах, где она нагревается до кипения и конденсируется
на стенках камеры в виде светло-желтого порошка или при температу-
температуре свыше 120 °С в виде жидкости, которую выпускают из камеры в
формы, где она застывает в виде лалочек.
Серу получают также из сероводорода H2S и восстановлением диок-
диоксида серы SO2-
Важными источниками получения серы являются пирит FeS2 и по-
полиметаллические руды, содержащие сернистые соединения меди, цинка
340
и других цветных металлов. Некоторое количество сери (газовая сера)
получают из газов, образующихся при коксовании и газификации угля.
Согласно ГОСТ 127—76 в зависимости от применяемого сырья серу
делят на природную (из серных руд) и газовую (из сероводорода и
оксида серы) и выпускают следующих видов: комовую, молотую,, гра-
гранулированную, чешуированную, литьевую и жидкую.
Физико-химические характеристики серы различных сортов:
Показатели*
1. S, %, не менее .
2 Золы, в том числе
Fe, Мп, Си, %, не
более
3. Кислоты в пере-
пересчете на серную
кислоту, %, не бо-
более
4. Органические ве-
вещества, %, не бо-
гсее ... .
5. As, %. не более .
6. Se, %, не более .
7. Fe, %, не более .
8. Мп, %, не более
9. Си, %, не более
10. Н2О, %, не более
Природная сера
9995
99,95
0 03
0,002
0,03
0,0000
0,000
0,02
0 00]
0,001
0,1
S990
99,90
0,05
0,004
0,06
0,0000
0,000
0,02
0,001
0,001
0,2
9950
99,50
0,2
0,01
0,3
0,000
0.000
0,02
0,001
0,001
1,0
9920
99,20
0,4
0 02
0,5
0,003
0,04
Газовая сера
9998
99,98
0,02
0,003
9985
99,85
0 1
0,005
9900
99,00
0,4
0 02
Не нормируется
0,0000] 0,01
1
0,05
Не нормируется
Не нормируется
1,0
»
0,02
0,2
0,5
Примечания. 1. Нормы по показателям 1—9 даны в пересчете на сухое
вещество. 2. Нормы по показателям 6—9 относятся к молотой сере. 3. Природная
сера, предназначенная для целлюлозно-бумажной промышленности, не должна
содержать селена. 4. В молотой природной сере сортов 9995 и 9990, предназначен-
предназначенной для резиновой и шинной промышленности, содержание влаги не должно пре-
превышать 0,05 %.
* Механические примесн (бумага, дерево, песок) не допускаются.
ГОСТ 127—76 содержит нормы по гранулометрическому составу ко-
моьои, гранулированной и молотой серы. По этому показателю грану-
гранулированная сера делится на два, а молотая на четыре класса.
Комовая, литьевая, гранулированная, чешуированная и молотая се-
сера не токсичны, но горючи. Жидкая сера токсичва, серная пыль взры-
взрывоопасна. Нижний предел взрываемости серной пыли 2,3 г/и3, темпера-
температура самовоспламенения 575"С. Попадание серной пыли в организм
человека вызывает воспаление слизистых оболочек, раздражение кож-
кожного покрова и другие заболевания. Сероводород — яд, сильно действу-
действующий на центральную нервную систему; сернистый газ, образующийся
при горении серы, вызывает раздражение слизистых оболочек. Поме-
Помещения, в которых производятся работы с серой, должны быть оборудо-
оборудованы приточно-вытяжной вентиляцией. Металлические части устройств,
аппаратов, емкостей должны быть заземлены в целях предотвращения
возникновения электростатических зарядов. В помещениях запрещается
применение открытого огня.
341
Физические свойства
Атомные характеристики. Атомный номер 16, атомная масса 32,064
а. е. м., атомный объем 15,38-10~6 м3/моль, атомный радиус 0,104 нм,
ионные радиусы S2" 0,174 нм, S+ 0,037 нм, S6+ 0,034 нм. Конфигура-
Конфигурация внешних электронных оболочек 3s23p4. Значения потенциалов иони-
ионизации / (эВ): 10,357; 23,4; 34,8. Сродство к электрону 2,07—2,33 эВ.
Электроотрицательность 2,6.
Существует ряд кристаллических и аморфных модификаций серы.
До 95,6 °С устойчива ромбическая, или a-S, с параметрами а= 1,04646
нм, Ь= 1,28660 нм, с = 2,44860 нм; в интервале 95,6—119,3 °С моноклин-
моноклинная, или C-S, с параметрами решетки а=0,090 нм, Ь= 1,096 нм, с= 1,102
нм; C = 86 16'. Энергия кристаллической решетки серы 223,0 мкДж/
/кмоль. Выше 119,3 С C-S переходит в жидкую k-S. При быстром на-
нагреве ромбическая a-S непосредственно превращается в подвижную
жидкость соломенного цвета X-S.
В жидкой сере наблюдается равновесие A,-S=<=tji-S+n-S и при 160 °С
в ней содержится 89,2 % ^-S; 4,1 % ц-S; 6,7 % я-S.
Аморфная темно-красная пластическая |x-S образуется при резком
охлаждении жидкой серы; она нерастворима в сероуглероде и быстро
переходит в ромбическую a-S.
Модификацию я-S можно отделить от \i-S, используя ее меньшую
растворимость в сероуглероде. В процессе хранения я-S переходит в
ц-S. При быстром охлаждении жидкой серы в бензоле образуется твер-
твердая нестабильная Y"S; существовать при комнатной температуре \-S
может только при отсутствии кристаллических зародышей. Модифика-
Модификации a, p, k и y состоят из восьмичленных циклов Ss, изолированных и
не плоских; модификация ц состоит из нерегулярно расположенных
зигзагообразных цепей. В жидкой сере наряду с молекулами S8 обра-
образуются по мере повышения температуры и частицы, молекулярная мас-
масса которых лежит в пределах S4—Sg.
При обычных условиях наиболее устойчивой является ромбическая
(а) сера. В парах серы с повышением температуры число атомов в мо-
молекуле постепенно уменьшается: S8-^Se-»-S4->-S2-»-S. При 800—1400 °С
пары серы состоят главным образом из молекул S2, а при 1700 °С — из
атомов серы S. Энергия диссоциации молекул серы S2<±2S равна 4,3
эВ; межатомное расстояние 0,212 нм.
Природная сера состоит из четырех стабильных изотопов:
Массовое число . . 32 33 34 36
Содержание, % . , 95,018 0,75 4,215 0,017
Получены искусственные радиоактивные изотопы, в том числе 3'S,
35S, 37S с периодами полураспада соответственно 2,66 с, 87,1 дня и
5,04 мин.
Эффективное поперечное сечение захвата тепловых нейтронов для ес-
естественной смеси изотопов серы составляет @,49±0,05) • 10~28 м2. Резо-
Резонансный интеграл захвата серы по поглощению 0,6-10~28 м2.
Плотность. Плотность модификаций серы при 293 К: ромбической (а)
р = 2,085 Мг/м3; моноклинной (р) 1,96 Мг/м3; аморфной (ц) 1,92 Мг/м3.
Плотность жидкой серы в зависимости от температуры:
Т, К 386 398 413 423 633
р, Мг/м3 .... 1,81 1,7988 1,7865 1,7784 1,6565
Плотность пара при 717,6 К и давлении 9,8-104 Па равна 3,64 кг/м3.
Изменение плотности при плавлении составляет 6,0 %.
342
Электрические и магнитные. Электрическая проводимость серы при
293 К составляет 5.10~22 См/м. Удельное электросопротивление в зави-
зависимости от температуры:
т, К
р, Ом-м
р, Омм
Ромбическая
Моноклинная
293
303
1,91-Ю15
3,90-1014
333
383
3,39
7,39
1013
10°
Жидкая
388
403
573
673
9,5-
2,0-
2,8-
7,7-
109
108
10е
10*
Ширина запрещенной зоны при 0 К Д£=2,6 эВ. Диэлектрическая
проницаемость серы при 566 К е=3,6-н4,0. Во всех состояниях твердая
и жидкая сера диамагнитна; магнитная восприимчивость:
Фаза аB93 К) РB93 К) Жидкая
X —0,485-10-» —0,464-10—» —0,49-10-»
Магнитная восприимчивость газообразной серы в зависимости от
температуры:
Г, К • • • • • 828 923 1023 1123
Х-Ю9 22 15 14,5 13
Молекулы S2 в парах парамагнитны.
Тепловые и термодинамические. Температура плавления ромбической
(а) серы <пп = 112,8°С, моноклинной (C) <Пл= 119,3 °С, температура
кипения ромбической серы /Кип = 444,6 °С. Изменение объема в процессе
плавления 5,1 %. Характеристическая температура 9с = 180 К. Критичес-
Критические параметры: температура 1313 К, давление 11,6 МПа, плотность
.0,403 Мг/м3. Удельная теплота плавления a-S при 385,8 К равна
49,82 кДж/кг, а f)-S при 392,3 К 38,52 кДж/кг. Удельная теплота испа-
испарения 717,6 К Д#исп = 287,21 кДж/кг, а перехода а^р 11,249 кДж/кг
при 368,6 К. Удельная теплота сублимации при 298 К ДЯсу6л =
=7431,1 кДж/кг.
Удельная теплота испарения:
Сера S2 S4 So S8
Г, К 890 890 892 763
ДЯИСП, кДж/кг . . , 1659,13 748,54 344,13 246,0
Удельная теплоемкость прн 298 К и давлении 0,1013 МПа:
Сера a-S 0-S S(ra3) S2(ra3) S8(ra3)
cp, Дж/(кг-К) • . 704,8 737,27 738,52 506,32 606,24
Удельная теплоемкость серы в зависимости от температуры (в чис-
числителе— a-S, в знаменателе—P-S):
Г, К 20 40 80 150 250
80,15 189,62 339,94 518,34 664,61
ср, Дж/(кг-К) ?922 18962 34244 528д4 69049
343
Теплоемкость S2 (газ) в зависимости от температуры:
Г, К 500 600 700 800
ср, Дж/(кг-К) . . 532,98 540,15 545,45 549,35
Продолжение
Г, К 900 1000 2000
ср, Дж/(кг-К) . . 553,25 555,9 573,52
Теплопроводность аморфной серы в интервале 283—288 К Я=
= 0,2094 Вт/(м.К), монокристаллической 0,46—0,477 Вт/(м.К).
Теплопроводность серы при 83 К Я=0,64 Вт/(м-К), при других тем-
температурах:
7, К .... 293*1 ЗЗЗ*1 368*1 373*2 423*3 47 *3
%, Вт/(м-К) • 0,2733 0,2442 0,2163 0,1558— 0,1386 0,1546
1,1663
*' Ромбическая. " Моноклинная. « Жидкая/
Температурный коэффициент линейного расширения при 273 К ром-
ромбической серы а=74,0-10-6 К~', моноклинной 80,0-10~в К~'.
Температурный коэффициент объемиого расширения E жидкой серы
при давлении 0,1013 МПа в зависимости от температуры:
Т, К .... 388 425 451 48, 551 630
Р-103, К • 0,430 0,490 0,298 0,344 0,366 0,388
Молярная энтропия s° при 298 К:
Сера a-S B-S S2(ra3) S4(ra3) Se(ra3)
s°, Дж/(моль-К) • • 31,90 32,57 227,8 306,1 376,0
Молярная энтропия s" в зависимости от температуры:
7, К 298 500 1000 1500
s°, Дж/(моль-К) • • • . 31,90 52,25 135,40 142,98
Продолжение
7, К • . 2000 2500 3000
s°, Дж/(моль-К) .... 148,38 152,65 156,08
Поверхностное натяжение а от температуры:
7, К 393 423 718
а, мН/м . • . . . 60,83 57,67 39,4
Динамическая вязкость ц жидкой серы в зависимости от температу-
температуры (до 433,3 К значения определены для очищенной, но недегазирован-
иой серы, остальные для дегазированной):
т,
396
408
422
К
,5
,5
Т), Ч
10
8
7
Па.с
,94
,66
,09
т.
429
432
К
.3
,2
П, мПа-с
7,19
9,48
т,
432
433
К
,5
,3
Т), мПа-с
14
77
45
32
т
438
463
473
К
,5
п.
0
19
21
мПа.с
,5- 103
,7-103
,5-103
344
Давление пара р серы при температуре плавления в зависимости от
состава пара:
Состав пара S Sa S8 2S
р. Па .... 26,46- Ю-?1 21,36-Ю-6 42,72- 10-1 42,72-10-1
Давление пара р серы BS) в зависимости от температуры:
Т, К ...... 300 390 400
р, Па ...... 37,14-10-^ 14,7-10-2 61,74-10-1
Продолжение i
Т, К 500 600 700
р, Па 677,2 10,97-103 76,05-103
Параметры самодиффузии (предэкспоненциальный множитель Do и
энергия активации Е) серы по объему зерен (в числителе—_1_с, в зна-
знаменателе— \\с):
£>„, м2/с Е, кДж/моль
Монокристаллическая, Г=582-н647К 8,32- 1Q-" —12,9 _
1,78.10»? 326,57
Поликристаллическая, Г>373 К - - 2,8-10" 195,94
Оптические. В компактном состоянии и в порошке ромбическая сера
имеет лимонно-желтый цвет. Показатель преломления ромбической серы
п = 2,0377, моноклинной 1,96, газообразной 1,001111 (при 273 К и дав-
давлении 0,1013 МПа). Показатель преломления п жидкой серы в зависи-
1 мости от температуры:
Г, К 398 413 453 463
и 1,9170 1,9095 1,9230 1,9255
Истинный угол оптических осей для ромбической серы 68°48', для
моноклинной 58°.
Механические свойства
Модуль нормальной упругости при 20°С £=18,0 ГПа; микротвердость
(нагрузка при испытании 0,2 Н, 10 с) Н^ =290 МПа; сжимаемость
х= 12,9-10-" Па-'.
Химические свойства
Нормальный электродный потенциал реакции S2"—2e^±S фо=—0,51 В.
В соединениях сера проявляет степени окисления —2, +2, +3, +4,
+5, +6.
Элементарная сера химически активна и взаимодействует при нагре-
нагревании со многими металлами и неметаллами (за исключением золота,
платины, азота, иода и инертных газов), с органическими и неорганичес-
неорганическими соединениями. При комнатной температуре во влажном воздухе
сера слабо окисляется, при 280 °С она горит в кислороде, а при 360 °С —
на воздухе. Смесь паров серы и кислорода взрывается.
Электрохимический эквивалент серы:
Степень окисления . +6 +4 +2
Электрохимический
эквивалент, мг/Кл « 0,05537 0,83060 0,16611
345
При обычных условиях сера с кислородом не взаимодействует. При
ц^греваиии на воздухе или в кислороде сера образует оксиды: SO2 —
Оксид серы (IV), или сернистый газ, представляющий собой бесцветный
газ с резким удушливым запахом, легко конденсирующийся в бесцвет-
бесцветную жидкость, кипящую при —10 °С, хорошо растворяющуюся в воде с
образованием сернистой кислоты H2SO3; SO3 — оксид серы (VI), серный
ангидрид, представляющий собой бесцветную легкоподвижную жид-
жидкость, кипящую при 44,7 "С и кристаллизующуюся при 16,9 °С; при
хранении в присутствии следов влаги превращается в длинные шелко-
шелковистые кристаллы, хорошо растворяется в воде, образуя серную кис-
кислоту H2SO4. Известны малоустойчивые оксиды серы: S2O, SO, S2O3, SO4,
SO7, S3O10.
Существует ряд кислородсодержащих кислот: H2SO3—сернистая кис-
кислота — непрочное соединение, существует только в водных растворах,
окисляется кислородом воздуха, превращаясь в серную кислоту H2SO4,
хороший восстановитель, двухосновная кислота, образует два ряда со-
солей: сульфиты и гидросульфиты!
H2SO4 — серная кислота — бесцветная маслянистая жидкость без за-
запаха, нелетучая, кристаллизующаяся при 10,3 °С, тяжелая, активно по-
поглощает пары воды, сильный окислитель, двухосновная кислота, образу-
образует два ряда солей: сульфаты и гидросульфаты, из которых практически
нерастворимы только BaSO4, PbSO4 и SrSO4.
H2S2O7 — пиросерная, или двусерная кислота. Растворением серного
ангидрида SO3 в серной кислоте получают олеум, состоящий главным
образом из пиросерной кислоты. При охлаждении олеума кислота выде-
выделяется в виде бесцветных кристаллов. Пиросерная кислота образует со-
соли — дисульфаты или пиросульфаты, которые при нагревании выше тем-
температуры плавления разлагаются, превращаясь в сульфаты.
H2SO2 — сульфоксиловая кислота; в свободном состоянии не выде-
выделена.
НгЗгОа—пероксодвусерная, или надсерная, кислота, обладает силь-
сильными окислительными свойствами, образует соли персульфаты.
H2S2O2 — тиосернистая кислота, образуется как промежуточный про-
продукт при различных реакциях.
H2S2O3 — тиосерная кислота — неустойчива, уже при комнатной тем-
температуре распадается, образует соли — тиосульфаты, которые значитель-
значительно устойчивее кислоты.
H2S2O4 — дитионистая кислота, существует только в виде солей.
Существует группа политионовых кислот, отвечающих общей форму-
формуле НгЗхОб, где х принимает значения от 2 до 6. К группе таких кис-
кислот принадлежат hbS^Oo (тетратионовая кислота) и Нг&гОв (дитионовая
кислота). Политионовые кислоты неустойчивы и известны лишь в водных
растворах. Соли их — полнтионаты — более устойчивы, некоторые из них
получены в виде кристаллов.
При обычных условиях сера с водородом ие соединяется, при нагре-
нагревании образует соединения, отвечающие общей формуле H^S* — суль-
фаны; H2S— сероводород; H2S2— двухсернистый водород; H2S3— трех-
сернистый водород и т. д. Водные растворы сульфанов обладают свой-
- ствами слабых двухосновных кислот. Сероводород H2S—бесцветный газ
с характерным запахом, ядовитый, немного тяжелее воздуха, горючий,
легко воспламеняется, сильный восстановитель, хорошо растворяется в
воде, образуя сероводородную кислоту, соли которой — сульфиды.
Остальные сульфаны — малоустойчивые желтоватые маслянистые
жидкости; растворимы в воде с образованием соответствующих кислот,
соли которых — полисульфиды.
Сера взаимодействует почти со всеми металлами (кроме золота, ири*
дия, платины), образуя сульфиды. При комнатной температуре сера
346
соединяется со щелочными н щелочноземельными металлами, а также с
Си, Ag, Hg; при иагреваиин — с Pb, Sn, Ni, Co, Zn, Mn, Cr, Al; в присут-
присутствии влаги — с Fe; тугоплавкие металлы и некоторые металлы платино-
платиновой группы взаимодействуют с серой прн высокой температуре
в мелкораздробленном состоянии; некоторые — с парами серы под дав-
давлением.
Различают основные сульфиды (Na2S, MgS), амфотерные (A12S3,
Cr2S3) и кислотные (MoS, WS3). Сульфиды могут соединяться друг с
другом, образуя тиосоли (например. Na2WS4 — тиовольфрамат
натрия).
Соединения серы с азотом получены косвенным путем. Известны
N4S4—азотистая сера — золотисто-желтые кристаллы с температурой
плавления 178 °С; при ударе и нагревании выше температуры плавления
разлагаются на элементы, в воде не растворяются; N2S4— четырехсер-
иистый азот — темно-красные кристаллы с температурой плавления 23 °С,
постепенно самопроизвольно разлагающиеся; при нагревании вспыхива-
вспыхивают, в воде не растворяются; N2Ss — сернистый азот.
При 800—900 °С сера взаимодействует с углеродом, образуя сероугле-
сероуглерод CS2 — бесцветную жидкость, которая кипит при 40 °С, плохо раст-
растворяется в воде; сероуглерод хорошо растворяет жиры, масла, смолы,
склонен к полимеризации. При взаимодействии углерода, кислорода и
серы при высокой температуре образуется серооксид COS. Известны не-
неустойчивые низшие сульфиды углерода: CS — белый налет, который уже
при —180 °С со взрывом превращается в коричневый продукт полимери.
зации CCS)*; несколько более устойчива C3S2—слезоточивая жидкость,
затвердевающая при 5 °С и склонная к полимеризации.
При сплавлении фосфора с серой, взятых в соответствующих соотно-
соотношениях, образуются тиоангидриды P4S3, P4S5, P4S7, P4S10, которые гид-
ролизуются во влажном воздухе с выделением фосфииа РН3.
Галогены, за исключением иода, непосредственно соединяются с се-
серой. Уже на холоду сера энергично взаимодействует со фтором, образуя
ряд соединений: SF6— бесцветный газ, термически и химически стойкий,
не реагирующий с водой, соляной кислотой, едким натром, водородом и
кислородом; SF4— бесцветный газ, энергично взаимодействующий с во.
дой, термически устойчивый до 600 °С, хороший фторирующий агент;
S2F10 И Др.
При полном отсутствии влаги уже при комнатной температуре сера
взаимодействует с хлором н бромом, образуя соединения: S2Cle —
оранжево-желтую маслянистую жидкость с температурой кипения
137 СС, хорошо растворяющую серу, дымящую во влажном воздухе; в
воде подвергается гидролизу; SC12 — красную жидкость с удушливым за.
пахом, гидролитически разлагающуюся водой; SC14 — белый порошок,
устойчивый только в твердом состоянии при низкой температуре; S2Br2 —
красную маслянистую жидкость, очень чувствительную к влаге воздуха;
прн температуре выше 90 °С разлагается на элементы.
Соединения серы с иодом неустойчивы, легко разлагаются. Полу-
Получены соединения Sil2, где х—от 2 до 6.
Кроме того, известны галогенопроизводные сульфанов, имеющие об-
общую формулу SX(XJ, где X — галогены. Многообразны оксигалогениды
серы общей формулы SO(A"J и SO2(XJ.
С водой и разбавленными кислотами сера не взаимодействует. Кон-
Концентрированная азотная кислота окисляет серу до серной кислоты. Со-
Соляная кислота не действует на серу, но в присутствии окислителей пе-
переводит серу в серную кислоту. Царская водка также окисляет серу до
серной кислоты. Концентрированная серная кислота на холоду на серу
не действует, с расплавленной серой реагирует с образованием сернисто-
сернистого газа SO2 и воды.
347
Со щелочами сера взаимодействует с образованием сульфидов и
сульфитов (реакция обратимая). При нагревании в растворе аммиака
NH3 сера образует полисульфид и тиосульфат аммония.
Расплавленная сера реагирует с оксидами щелочных металлов с об-
образованием сульфидов, сульфитов и сульфатов. С оксидами тяжелых
металлов сера заметно взаимодействует при 150—200 °С с выделением
сернистого газа.
В воде сера практически не растворяется, хорошо растворяется в
безводном аммиаке, сероуглероде и ряде органических растворителей
(феноле, бензоле, дихлорэтане и др.).
Области применения
Основной потребитель серы — химическая промышленность: около 60%
добываемой серы идет на производство серной кислоты. Большое коли-
количество серы расходуется в резиновой и целлюлозно-бумажной промыш-
промышленности, вискозном и спичечном производстве, в органическом синтезе
(получение сернистых красителей, сероуглерода, искусственных волокон,
фармацевтических препаратов, ускорителей вулканизации каучука). Серу
применяют при получении различных цементов, замазок, асфальтов,
дымного пороха, светящихся составов, бенгальских огней.
В сельском хозяйстве серу широко применяют в виде серного цвета,
используя для уничтожения некоторых вредителей растений; серные удо-
удобрения повышают морозостойкость растений и злаков.
Добавки серы улучшают обрабатываемость автоматных сталей и ан-
антифрикционные свойства спеченных антифрикционных материалов.
В медицине используют как элементарную серу, так и ее соединения.
Все сульфамидные препараты — это органические соединения серы.
Широко применяются соединения серы:
— FeS2 (пирит) — для получения серной кислоты; сульфиды щелоч-
щелочных и щелочноземельных металлов (Na2S, CaS и BaS) —в кожевенной
промышленности; сульфиды цинка ZnS и кадмия CdS служат основой
люминофоров; некоторые сульфиды обладают полупроводниковыми
свойствами и применяются в электронной технике; многие природные
сульфиды используются в металлургии для выплавки цветных и редких
металлов;
— оксид серы (IV) SO2 — для получения серной кислоты; для отбе-
отбеливания соломы, шерсти, шелка; как дезинфицирующее средство; для
лечения домашних животных;
— сульфиты калия K2SO3 и натрия Na2SO-3 для отбеливания некото-
некоторых материалов в текстильной промышленности при крашении тканей, в
фотографии;
— гидросульфит кальция Ca(HSO3b — при переработке древесины в
сульфитную целлюлозу, из которой затем получают бумагу;
— сульфат натрия Na2SO4 — при производстве стекла; глауберову
соль Na2SO4-10H2O в медицине; гипс CaSO4-2H2O для изготовления от.
ливочных форм и слепков с различных предметов, в строительстве, в
хирургии; медный купорос CaSO4-5H2O — в сельском хозяйстве, для при-
приготовления минеральных красок, для электролитического покрытия ме<
таллов медью; алюмокалиевые квасцы KAl(SO4b- 12Н2О — для дубле-
дубления кожи, в красильном деле;
— олеум H2S2O7 — для очистки нефтепродуктов, для производства ие->
которых красителей и взрывчатых веществ;
— серная кислота H2SO4 — для получения минеральных удобрений,
некоторых кислот (НС1, Н3РО4 и др.), взрывчатых веществ, красок, при
очистке керосина, нефтяных масел и продуктов коксохимического произ-
348
водства (бензола, толуола), при травлении черных металлов (снятия ока-
окалины), в свинцовых аккумуляторах;
— персульфаты — как средства для отбелки, в качестве окислителей
в лабораторной практике и для некоторых технических целей;
— тиосульфат натрия Na2S2O3— в фотографии как закрепитель, в
текстильной промышленности для удаления остатков хлора после от-
отбелки тканей, в медицине и ветеринарии;
— хлорид серы (I) S2CI2 — для вулканизации каучука.
6.3. СЕЛЕН [1—35, 51, 53, 233—236]
Общие сведения и методы получения
Селен (Se) —элемент темно-серого цвета с коричневым оттенком. Впер-
Впервые обнаружен Берцелиусом в 1817 г. в отходах сернокислотного про-
производства. Новое вещество имело свойства, сходные со свойствами тел-
теллура, и названо селеном (греческое название Луны), так как он встре-
встречается вместе с теллуром, открытым ранее и названным в честь Земли.
Содержание селена в земной коре 6-10~5% (по массе). В морской
воде содержится 0,004 мг/л селена.
Чистые селеновые минералы чрезвычайно редки. Важнейшие минералы
селена: берцелианит CuSe, тиеманит HgSe, науманнит Ag2Se, клауста-
лит PbSe, онофрит Hg(Se, S), халькоменит CuSeO3-2H2O. Описан са-
самородный селен. Практического значения селеновые минералы не
имеют.
Будучи аналогом и постоянным спутником серы, селен содержится
в небольших количествах в сульфидных минералах меди, цинка, свинца
и в виде примесей в самородной сере.
Промышленное производство селена началось в начале XX в. Источ-
Источниками промышленного получения селена служат шламы медеэлектро-
литных заводов, сернокислотного и целлюлозно-бумажного производства.
В шламах селен присутствует вместе с серой, теллуром, тяжелыми и
благородными металлами. Для извлечения селена шламы фильтруют
и подвергают либо окислительному обжигу (около 700 °С), либо нагрева-
нагреванию с коицентрнрованиой серной кислотой. Образующийся летучий оксид
селена SeO2 улавливают в скрубберах и электрофильтрах. Из растворов
технический селен восстанавливают оксидом серы (SO2) до элементарно-
элементарного состояния. Применяют также окислительное спекание шлама с содой
с последующим выщелачиванием селенита и селената натрия водой. Из
полученного раствора при помощи оксида серы (SO2) восстанавливают
элементарный селен.
Технический селен содержит 97,5—99 % Se. Для получения селена вы-
сокой чистоты его подвергают дистилляции в вакууме, перекристалли-
перекристаллизации, сульфитно-циклическому методу обработки и др.
Окислительно-восстановительный метод дает возможность получить
селен чистотой 99,999 %. Зонной плавкой можно повысить содержание
селена до 99,9999 %.
Наиболее чистый селен получают термической диссоциацией селено-
водорода (H2Se). Селен высокой чистоты содержит не более Ы0%
(по массе) примесей.
Технический селей, предназначенный для получения чистого селена,
выпускают трех марок: СТО, СТ1, СТ2.
Технический селен поставляют в виде порошка, слитков и гранул.
Размеры слитков и гранул устанавливаются соглашением сторон.
Химический состав, %, технического селена по ГОСТ 10298—79:
349
Марка
СТО
СТ1
СТ2
Se, не
99
99
97
менее
,4
,0
,5
0
0
0
Fe
,005
,015
,5
0,
0,
0,
Си
003
005
05
1
1
0
0
0
Примеси, не более
1
РЬ \ Hg
,003
,005
,05
0,001
0,005
0,05
|
0
0
0
Те
05
1
5
0
0
0
As
,003
,005
,5
0
0
0
s
,005
,02
,5
Технический селен следует хранить в сухом, пожаробезопасном за-
закрытом помещении. Гарантийный срок его хранения в неотапливаемом
складе — пять лет, в отапливаемом — восемь лет.
Селен высокой чистоты выпускают двух марок СВ4-1, СВ4-2 в виде
гранул или слитков массой не более 5 кг. У селена марки СВ4-1 содер-
содержание селена должно составлять 99,997 %, а у селена марки СВ4-2—
99,992 %.
Химический состав селена высокой чистоты по ГОСТ 6738—71:
Примесь
А1
Bi
Fe
Si
Cd
Co
Mg
Mn
Cu
Содержание
не
CB4-1
2-10-*
1 • 10—*
1-IH
1 • 10-*
MO-*
Ы0-*
5-10-5
1-10-'
2- Ю-5
примесей, %,
более
CB4-2
2-10-*
ью-*
з- ю-*
2-Ю-*
МО-*
1-10—*
5-Ю-5
5-Ю-5
Примесь
As
Ni
Sn
Hg
Ag
Pb
Sb
Те
S (суль-
(сульфатная)
Содержание
примесей, %,
не более
СВ4-1
5-10-*
5-Ю-5
1-10-*
Ы0-*
ын
1-10-4
Ы0-4
1-10-4
8-10-*
СВ4-2
5- 10-*
2-10-4
ЫО-4
1 -10—а
5- Ю-6
2-10-4
3- Ю-з
ЫО-з
l-10-з
Селен высокой чистоты следует хранить в сухом закрытом помеще-
помещении, безопасном в пожарном отношении. При хранении сроком до вось-
восьми лет масса (нетто) его должна быть не более 10 кг.
Селен особой чистоты выпускают марки ОСЧ-А и поставляют в виде
гранул диаметром до 6 мм, упакованных в полиэтиленовые пакеты мас-
массой от 100 до 500 г.
Химический состав селена особой чистоты ТУ 6-09-252—77:
Примесь
Fe
А1
Mg
Си
Ag
Pb
Ni
Содержание
примеси, %,
ие более
2-10—5
2-Ю-5
2-Ю-5
ыо-в
ыо-5
1-10-4
5-10-6
Примесь
Сг
Bi
Ti
Sb
Sn
Mn
Co
Содержание
примеси, %,
не более
5-10-6
5-10-6
5-10-5
6-10-6
5-10-5
ын
ыи
Примесь
Cd
Те
Hg
Si
S (суль-
(сульфатная)
As
Содержание
ппимеси, %,
не более
МО-5
2-Ю-5
1-10-4
МО-1
8-10-4
ЫО-S
350
Селен особой чистоты следует хранить в крытых помещениях при
температуре от —40 до +40vC. Гарантийный срок хранения 12 мес со
дня изготовления.
Физические свойства
Атомные характеристики. Атомный номер 34, атомная масса 78,96 а. е. м.,
атомный объем 16,42-10~6 м3/моль, атомный радиус 0,16 нм, ионный
радиус Se2- 0,198 нм, Se4+ 0,069 нм, Se6+ 0,035 нм. Электронная конфи-
конфигурация внешних оболочек 4s24p4. Значения потенциалов ионизации
J (эВ): 9,75, 21,5; 32,0. Электроотрицательиость 2,4. Селен состоит из
смеси шести устойчивых изотопов: 74Se @,87%); 76Se(9,02 %); 77Se
G,58 %); 78Se B3,52 %); 80Se D9,82 %); e2Se (9,19 %).
Известно 12 радиоактивных изотопов селена:
Мвссовое
число
70
72
73
75
Период
полураспада
2640 с
9,7 с
0,269 сут
121 сут
Массовое
число
77 т*
79 т
79
81 т
Период
полураспада
17,5 с
234 с
6,5-10* лет
3420 с
Массовое
число
81
83 т
83
84
Период
полураспвда
1080 С
67 С
1500 С
120 с
* т — метастабильное состояние ядра.
Селен существует в различных аллотропических модификациях:
аморфный селен (порошкообразный, коллоидный н стекловидный) и кри-
кристаллический (моноклинный — а- и E-формы и гексагональный у-форма).
Порошкообразный селен имеет красный цвет; плотность при 298 К
равна 4,250 Мг/м3. Получают его при восстановлении из растворов селе-
селенистой кислоты H2Se03 сильными восстановителями (оксидом серы (IV),
гидразином нли солянокислой солью гидроксиламина) в присутствии
сильных кислот, быстрым охлаждением паров селена и другими способа-
способами. Красный порошок при выдержке становится черным и при нагрева-
нагревании превращается в гексагональную модификацию.
Коллоидный селен получают восстановлением разбавленных водных
растворов растворимого селена оксидом серы (IV), гидразингидратом,
декстрозой, трнхлоридом титана или пропусканием электрическою тока
через раствор селенистой кислоты (анод—платиновый, катод — покрыт
селеном), а также другими способами. Цвет коллоидного селена зависит
от условий осаждения и изменяется от фиолетового до красного; плот-
плотность такая же, как и порошкообразного селена.
Стекловидный селен-—хрупкая масса черного цвета, обладает стек-
стеклянным блеском и представляет собой переохлажденную жидкость.
Плотность его при 298 К равна 4,280 Мг/м3. Получают стекловидный се-
селей при нагревании любой модификации селена выше 493 К с последу-
последующим быстрым охлаждением. При хранении в теплом месте стекловид-
стекловидный селен постепенно кристаллизуется в гексагональный.
Селен с моноклинной решеткой — кристаллы темно-красного цвета.
Получают его при низкотемпературном выпаривании сероуглерода, со-
содержащего растворенный Селен. Имеет две формы: а с параметрами а =
=0,9054 нм, 6=0,9083 нм, с = 1,601 нм, ^р = 90°42' и р с параметрами
а=0,931 нм, 6 = 0,807 нм, с= 1,285 нм, ^р = 93°08'. Плотность ct-Se
351
р=4,480 Мг/м3; fi-Se p=4,400 Мг/м3. Прн нагревании моиоклннная ре-
решетка переходит в гексагональную. Энергия кристаллической решетки
202,5 мДж/кмоль.
Селен с гексагональной решеткой — кристаллы серого цвета плотно-
плотностью 4,807 Мг/м3 при 293 К. Получают его из других форм селена путем
нагрева до температуры плавления и последующего медленного охлаж-
охлаждения до 453—483 К с выдержкой при этой температуре. Представляет
собой термодинамически стабильную при нормальных условиях модифи-
модификацию. Периоды решетки: а=0,4363 нм, с = 0,4959 нм, с/а —1,137.
Работа выхода электронов равна ф = 4,72 эВ, эффективное попереч-
поперечное сечение захвата тепловых нейтронов 12,3 -10~28 м2.
Электрические и магнитные. Селен гексагональной модификации
вплоть до температуры плавления — примесный полупроводник с дыроч-
дырочной проводимостью. Ширина запрещенной зоны для серого селена Д£=
= 1,8 эВ, для аморфного (пленка) при 293 К Д£ = 2,2-н2,3 эВ Чистый
стекловидный селен близок к изоляторам, его удельное электрическое
сопротивление при 293 К р«*1010 Ом-м. Удельная электрическая прово-
проводимость о селена сильно зависит от температуры, структуры и чистоты
образцов. Удельное электрическое сопротивление р и удельная электри-
электрическая проводимость о металлического селена в твердой фазе:
Т, К 78 273 291
о, См/м 11,1 12,5 8,3
р-102, Ом м. . . 9,0 8,0 12
Удельное электрическое сопротивление жидкого селена при 490 К
р= 1 Ом-м.
Температурный коэффициент электрического сопротивления селена
при температуре 273 К а = 0,6-10~3 К. Изменение удельного электро-
электросопротивления при плавлении рж/Ртв~1 Абсолютный коэффициент
т. э. д. с. для селена в твердой фазе при 298 К е = +914 мкВ/К. Наиболь-
Наибольшее значение коэффициента вторичной электронной эмиссии о"тах=1,4,
при ускоряющем напряжении первичных электронов 0,400 кэВ. Селен
диамагнетик, пары его парамагнитны. Магнитная восприимчивость %
Т, К • 293 900 >925(газ)
Х-10е —0,469 —0,3 >0
Все модификации селена обладают фотоэлектрическими свойствами
Диэлектрические свойава селена различных модификаций (tg б — угол
диэлеюрических потерь):
Частота, Гц
105
Ю5
105
ю5
Ю5
105
2105
2- !05
2-105
2-105
Кристаллический селен
123
153
173
193
233
291
123
193
273
291
1,1
2,6
3,0
2,6
2,0
2,1
0,9
3,1
2,6
2,8
352
Продолжение
Частота, Гц
Г, К
3-Ю8
3-Ю9
25-1010
Ю2
103
10*
ю5
10е
107
108
3-Ю8
298
298
298
Аморфный селен
298
298
298
298
298
298
298
298
0,251+0,006
0,154+0,004
1,101 ±0,027
A8,01+0,88)-10-4
D,01 ±0,04)-Ю-4
C,02+0,03)-10-*
E,01±0,05)-10-*
C,01+0,03)-10-4
B,01±0,02)-10-*
B,01±0,02)-10-4
E,02±0,05)-10-4
Диэлектрическая проницаемость аморфного селена при 290 К е=
=6,24±0,04. Так как селен имеет гексагональную кристаллическую ре-
решетку, то для него характерна анизотропия электрических свойств.
Тепловые и термодинамические. Температура плавления /Пл=217°С,
температура кипения ^Кип=657°С, характеристическая температура
eD=89 к.
Удельная теплота плавления при 298 К АЯПД=68,98 кДж/кг, субли-
сублимации при той же температуре Д//С5бл = 2619,3 кДж/кг, удельная тепло-
теплота испарения АЯИсп = 885,51 кДж/кг. Теплота полиморфного превраще-
превращения при 423 К равна 0,75 кДж/моль.
Теплопроводность X аморфного селена (чистотой 99,99999%):
Г, К 292 298 302 304 306 310 314
%, Вт/(м-К) ■ . . 0,487 0,499 0,519 0,540 0,615 0,6575 0,702
Теплопроводность монокристаллического селена X,, с при 20, 100,
400 К равна 50, 10, 1,005 Вт/(м-К) соответственно; Xхс при 14, 100,
400 К равна 10,0; 2,7; 0,314 Вт/(м-К) соответственно. Для поликри-
поликристаллического селена при 298 К теплопроводность равна 0,13 Вт/(м-К).
Удельная теплоемкость селена (Se) при 298 К и давлении 0,1013 МПа
ср = 321,17 кДж/(кг-К), газообразного (Se2) при тех же условиях cD=»
= 223,78 Дж/(кг-К).
Удельная теплоемкость селена ср в зависимости от температуры:
Г. К 20 40 80 150 250
ср, Дж/(кг-К) . . 43,44 110,18 202,38 274,69 307,49
Удельная теплоемкость газообразного (Se2) в зависимости от темпе-
температуры:
Т, К . . • . . 400 600 1000 1500
Дж/(кг-К)
229,42 233,41
235,56 236,07
Температурный коэффициент линейного расширения а стеклообраз-
стеклообразного селена в зависимости от температуры:
Т, К 153 193 233 275 293
«•10е, К.'1 •■• —36,6 -37,8 —43,5 -47,7 -50,0
353
Коэффициент линейного расширения а поликристаллического селена
в зависимости от температуры:
Т, К 153 233 273 353 413
а-10е, К-1 20,0 24,4 25,5 29,0 47,0
Молярная энтропия s° селена в зависимости от температуры;
Т, К ...... 298 500 1000 1500
s°, Дж/(моль-К) . 42,49 67,86 148,32 156,04
Продолжение :
Г, К 2000 2500 3000
s°, Дж/(моль-К) ■ 161,61 166,04 169,69
Энергия кристаллической решетки 202,5 мкДж/кмоль. Поверхностное
натяжение жидкого селена при 493 К 0=106 мН/м2. В парах селена ни-
ниже 1173 К в равновесии находятся четыре полимерные формы Se8q=t
4±See3=tSe43=tSe2; выше 1173 К доминирует Se2; выше 1773 К становится
ваметной диссоциация иа одноатомиые молекулы.
Давление пара селена (SSe):
Т, К • • • 340 377 417
р, Па ... 12,93-10-8 12,93-10-" 12,93-10—4
Т, К - - - 471 560 701
р, Па ... 12,93-10-? 12,93 12,93-10*
Давление пара р прн температуре плавления в зависимости от сос-
состава:
Состав пара . . . • 2Se Se Se2 See
p, Па 69,48-10-S 87,91-10~12 83,69-Ю-3 52,14-10—2
Параметры самодиффузии (предэкепоненциальный множитель Do н
энергия активации Е) поликристаллического селена:
Селен
Г, К
£>„, мг/с
Е, кДж/моль
Кристаллический
Аморфный . .
308—413
308—329
1,4-10—8
6,3- Юаё
49,4
219,90
Параметры взаимной диффузии в интервале 313—473 К (основной
элемент селен, образующаяся фаза твердый раствор):
Диффундирующий
элемент
In
Se
Те
Do, мг/с
5,15-Ю-10
4,78-Ю-"
6,0 10—12
Е, кДж/моль
30,8
37,5
50,0
354
Оптические. Отражательная способность (коэффициент отражения
Пц) селена в зависимости от состояния поверхности и длины волны Xs
Пленка аморфная
К, мкм 0,062 0,083 0,124 0,207 0,248 0,310 0,620
nD, % 10 20 23 15 20 27 23
Угол падения . . 20 20 20 20 20 20 20
Моноклинный
h мкм 0,083 0,124 0,177 0,207 0,310 0,411 0,620
яо, % И Н 9 11 20 22 18
Угол падения . . 2 2 2 2 2 2 2
Показатель преломления п в зависимости от состояния поверхности
и длины волны X:
Пленка толщиной 0,3—0,6 мкм
%, мкм. . . . 0,062 0,124 0,207 0,287 0,310 0,620
п 0,7 1,2 1,8 1,8 2,4 2,8
Монокристалл
h мкм. . . 0,310 0,5893
п 2,5 1,000895
Показатель % и коэффициент а поглощения в зависимости от состо-
состояния поверхности селеиа и длины волиы.
Пленка толщиной 0,3—0,6 мкм
I, мкм 0,062 0,083 0,124 0,207 0,248 0,310 0,411
X, % 0,4 0,8 1,2 0,8 1,1 1,3 0,8
Монокристалл, пленка
К, мкм. . . 0,083 0,124 0,177 0,207 0,310 0,411 0,620
а, м-1 .. 1-10* 6-10' МО7 2-Ю7 3-Ю7 2-Ю7 2-10»
Механические свойства
Твердость селена по минералогической шкале равна 2,0, по Бринеллю
-750 МПа.
При обычной температуре селей с гексагональной решеткой хрупкий,
но выше 60 °С становится пластичным. Модуль нормальной упругости
при растяжении при температуре 25 °С £=10,2 ГПа. Модуль сдвига
G=6,6 ГПа. Временное сопротивление технически чистого селена при
сжатии ОдЖв зависимости от температуры и скорости деформации:
t, °C 20 50 100 150
0сж (ё=10-2 с-Ц 39,2 28,4 18,6 8,8
0сж (ё=10-» c-i\ 24,5 16,3 9,8 ,4
в \ /
Сжимаемость х=9,08'10-" Па-',
355
Химические свойства
Нормальный электродный потенциал реакции Se—2e«=tSe2+ фо=—0,78 В.
В соединениях обычно проявляет степени окисления +4, +6, —2.
Электрохимический эквивалент селена со степенью окисления +6
равен 0,13637 мг/Кл.
По химическим свойствам селен близок к сере и теллуру, занимая
промежуточное положение между ними. По химическому поведению—■
типичный неметалл.
Элементарный селен, особенно аморфный и мелкодисперсный, хими-
химически активен. При нагревании на воздухе или в кислороде горит голу-
голубым пламенем. При комнатной температуре реагирует с фтором, хло-
хлором, бромом, не взаимодействует с кислородом. При высокой темпера-
температуре реагирует с водородом, с большинством металлов. Вода на селен
почти не действует при комнатной температуре, но прн нагревании идет
в небольшой степени обратимый гидролиз. Сильные окислители окисля-
окисляют селей до шестнвалентиого селена.
Соляная и разбавленная серная кислота на селен не действуют,
азотная кислота окисляет его до селенистой кислоты H2Se03, концентри-
концентрированная серная кислота растворяет металлический селен. Селен хоро-
хорошо растворяется в царской водке, в концентрированных растворах ще-
щелочей, в цианистом калии, реагирует с растворами солей серебра и
золота, растворяется в растворах сульфидов и полисульфидов щелочных
металлов. При взаимодействии селена с пероксидом водорода Н2О2, a
также с озоном О3 в присутствии влаги образуется селенистая кислота
H2Se03, соли которой (селениты) нерастворимы в воде, кроме солей
щелочных металлов. При действии сильных окислителей (пермапганат
калия и т. п.) селенистая кислота превращается в селеновую кислоту
НгБеО^ соли которой — селенаты — по свойствам сходны с сульфатами.
Все соединения селена ядовиты, поэтому при работе с ними следует
применять правила техники безопасности.
С кислородом селен образует ряд оксидов SeO, SeC>2, Se2O5, SeCV
Оксид селена (II) SeO образуется при нагревании оксида SeO2 до
1000 °С. Устойчив только в парах при высокой температуре. Оксид се-
селена (IV) SeO2—сильный окислитель—образуется при сгорании на воз-
воздухе или в кислороде, при растворении в воде дает селенистую кислоту.
Оксид селена (V) SeOs образуется при нагревании оксида селена
(VI) SeO3 до 513 К. При 260 °С он разлагается до SeO2, расплывается
на воздухе, в воде растворяется, образуя кислоту H2SeO4; сильный
окислитель, бурно реагирует со многими органическими веществами.
Оксид селена (VI) SeO3 образуется путем дегидратации селеновой
кисло.ты HsSeO4 фосфорным ангидридом с последующей отгонкой SeO3
в вакууме. Это бесцветное кристаллическое вещество, хорошо раствори-
растворимое в воде, химически активный, сильный окислитель.
Селей реагирует с водородом при температуре >200 °С, образуя
газ — селеноводород H2Se. Содержание селеноводорода в газовой смеси
в зависимости от температуры:
t,°C 203 250 350 504 640
Содержание, % -0 6,8 37,8 60,7 43,1
Селеноводород — это бесцветный газ с неприятным запахом, при на-
нагреве разлагается, сильный восстановитель, растворяется в воде, об-
образуя селеноводородную кислоту НгЗе. Соли этой кислоты — селе-
ниды.
С азотом селен образует тетраселентетранитрид, или азотистый се-
селей, Se4N4 — вещество оранжево-красного цвета, легко разлагающееся
со взрывом при нагревании до 200—230 °С или под действием легкого
356
удара с выделением красного селена, нерастворимое в холодной воде;
при кипячении медленно разлагается.
С серой селен образует соединения Se2S н SeS2. Растворимость се-
серы в твердом селене ~4 %. При введении в селен до 5 % S электро-
электропроводность его повышается.
С углеродом селен образует селеноуглерод CSe2. Он получается при
взаимодействии HSe с CCU при 500 °С. Селеноуглерод — золотисто-
желтая жидкость плотностью 2,650 Мг/м3, имеющая температуру ки-
кипения 125 °С.
С фосфором селен сплавляется в любых отношениях, в результате
чего получаются стекла: Se3P2, БезР,!, SesP2. Кристаллическое строение
имеет только Se3P4-
С кремнием селен образует летучий силицид SiSe и нелетучий SiSe2-
Эти силициды гидролизуются во влажном воздухе.
По составу галогениды селена очень разнообразны. Это гексафторид
селена SeFe, тетрафторид селена SeF,|, тетрахлорнд селена SeCU, дисе-
лендихлорид Se2Cl2, тетрабромид селена SeBr4, днселендибромид
SeiBr2. В парах существуют дихлорид селена SeCl2 и дибромид селена
SeBr2.
С иодом селен не взаимодействует. Получены оксигалогениды селена:
SeOF2, SeOCh, SeOBr2.
При пропускании паров селена в смеси с водородом над бором при
температуре 850—900 °С образуется селенид бора B2Se3. Очень гиг-
гигроскопичный, легко гидролизующнйся порошок с температурой плавле-
плавления 475 °С.
Селен и теллур сплавляются в любых отношениях с образованием
непрерывных твердых растворов.
Соединения селена с металлами носят название селенидов. Оии могут
быть получены как синтезом из элементов, так и косвенными методами.
Селеииды, как правило, обладают полупроводниковыми свойствами.
В воде растворимы только селениды щелочных и щелочноземельных ме-
металлов. В последнее время большое значение благодаря полупроводни-
полупроводниковым свойствам приобрели селеииды подгруппы цинка (AfeSe), под-
подгруппы германия (MeSe), подгруппы мышьяка (AJe2Se3). Все они хими-
химически стойки и растворяются только в концентрированных минеральных
кислотах при нагревании или в царской водке.
Известны селеиорганические соединения разных классов:
— алкилселеииды — диэтилселеиид (C2H6JSe;
•— арнлселеииды — дифенилселенид (CeH5JSe;
— диалкилселениды и диарилселениды типа RSe— SeR';
— галогеиоселениды — фенилселенобромид CeH5SeH;
— селеиолы (аналоги спиртов) — этанселеиол C2H6SeH;
— селеиолаты (аналоги алкоголятов) — фенилселенолат натрия
C6H5SeNa;
— селенокетоиы — диметилселенокетои CH3CSeCH3;
— селеноальдегиды типа RCHSe;
— селеиокарбоновые кислоты типа RCOSeH.
Некоторые классы соединений содержат связанный с селеном кис-
кислород. Существуют разнообразные гетероциклические соединения, в сос-
состав цикла которых входит селей.
Технологические свойства
Технологические свойства селена зависят от его термической обработ-
обработки, которая определяет микроструктуру поликристаллического селена,
образующегося при превращении из черной (аморфной) формы.
Селен обладает значительной хрупкостью при комнатной температу-
температуре, однако при повышении температуры до 373 К пластичность увеличи-
357
вается и селен поддается прессованию. Прессованные прутки селена
1,меют преимущественную ориентацию, зерен в направлении деформации.
Области применения
Важнейшие области применения селена — электротехника, металлур! ия,
<лекольная и резиновая промышленность.
Широкое использование селена в электротехнике основано на боль-
большой чувствительности его к незначительным колебаниям освещения:
<;н изменяет электропроводность под действием падающего иа него све-
света (фотоэлементы с запорным слоем для сигнальных установок, фото-
■ раизисторы для телевидения, ксерография, аппараты, работающие по
принципу снятия электростатического заряда на освещенных местах
оарабаиа, покрытого селеном, в электрорентгенографии).
Селен используют как полупроводниковый материал: из него изго-
изготавливают селеновые выпрямители, применяемые для зарядки аккуму-
аккумуляторов, для питания анодных и накальных цепей аппаратуры связи, а
ыкже в измерительных приборах.
В металлургии селен применяют как модификатор для создания мел-
мелкозернистой структуры стали. Присадка селена улучшает способность
малоуглеродистых и некоторых нержавеющих сталей к механической
1,оработке.
В стекольной промышленности селей используется для устранения
зеленоватого оттенка стекла, вызываемого примесями соединений желе-
железа: при добавке 0,25 % Se стекло окрашивается в розовый и красный
цвет, добавка 0,6 % Se придает стеклу черный цвет.
Особый интерес представляют не содержащие оксидов (сульфидные
II арсенидные) стекла с добавкой селена и теллура, ие пропускающие
инфракрасных лучей в очень широком интервале длин волн. Селей вхо-
входит в состав некоторых пигментов для керамики, глазурей н эмалей.
В резиновой промышленности селен используют для сокращения
продолжительности процесса вулканизации, повышения временного со-
сопротивления каучука, улучшения процесса его старения и повышения
iопротивления истиранию (на 50 %). Добавка селена при вулканизации
■ аучука придает ему огнестойкость.
В химической промышленности селей применяют как катализатор в
процессах гидрогенизации — дегидрогенизации, в процессах окисления
органических веществ, галогеиирования и др.
Добавка селена увеличивает стойкость смазочных масел против окис-
окисления.
Селен входит в состав различных дезинфицирующих веществ, инсек-
.ицидов, фунгицидов, гербицидов, некоторых фармацевтических препа-
препаратов. Применяется для изготовления красителей, в фотографии.
Несмотря на токсичность, селен используют в небольших количест-
количествах в медицине: как добавку к мылу (сульсеновоемыло), для производ-
производства некоторых лекарств. Селен также идет для синтеза различных се-
ленидов, обладающих полупроводниковыми свойствами.
Селен вводят в составы, применяемые для полирования медных галь-
> анических покрытий. Применяют селен также в качестве огнестойкого
^зедства для оболочек кабелей коммуникационных щитов.
Селеноводород НгЭе используют в химическом анализе в качестве
, ^агента для осаждения германия, оксид селена (IV) применяют при
ь^ганическом синтезе как окислитель и исходный продукт для получе-
ня различных органических соединений, добавляют к смазочным мас-
.,ам как аитиоксидант.
Некоторые селениды служат катализаторами; селенид кадмия CdSe
является основным красителем в производстве рубиновых стекол, в про-
производстве керамики и эмалей.
Оксихлорид селена SeOCb — один из самых сильных растворителей.
Он растворяет резину, клей, синтетические фенольиые смолы и другие
органические вещества, а также применяется как реагент для отделения
и очистки различных углеводородов н активирования древесного угля.
6.4.ЛЕЛЛУР [1—35, 157, 158, 164, 166,
235, 237—240, 242, 243]
Общие сведения и методы получения
Теллур (Те) — химический элемент серебристо-белого цвета с металли-
металлическим блеском.
Открыт в 1782 г. Рейхеиштейиом.
Содержание теллура в земной коре Ы0-е% (по массе); теллур по-
постоянно сопутствует сере и селену.
Теллур имеет много собственных минералов, но технический теллур
получают из отходов цветной металлургии н сернокислотного производ-
производства. Основной источник промышленного получения теллура — анодный
шлам, выделяемый при электролитическом рафинировании меди и со-
содержащий наряду с золотом, серебром и металлами платиновой группы
также селен, теллур, мышьяк, сурьму, висмут и другие элементы. Кроме
того, для получения теллура используется пыль каналов и пылевых ка-
камер, а также ил промывных башен сернокислого производства. Полу-
Полученный из промышленных источников технический теллур содержит 95—
99 % основного вещества.
Для глубокой очистки теллура используют химические и физические
методы. На стадиях химической очистки в основном осуществляют раз-
разделение селена и теллура. К физическим методам очистки относятся:
дистилляция в токе инертного газа или в вакууме, дистилляция соеди-
соединений теллура, зонная плавка и направленная кристаллизация.
Основной примесью теллура является селен; кроме того, в нем могут
содержаться серебро, сера, углерод и другие примеси.
Состав химически чистого и технического (ГОСТ 17614—80) теллу-
теллура различных марок:
Примеси, %, не более
Теллур, ие менее
Se
Pb
Си
S
Na
Si
Al
Fe
Всего примесей
ТВЗ
99,996
0,001
0,0001
0,0001
_
0,001
—
0,0001
0,0001
0,004
Марка
ТА1
99,93
0,01
0,001
0,002
0,05
0,01
0,001
0,001
0,001
0,07
геллура
Т1
99,0
0,1
0,2
0,05
0,05
0,05
0,05
0,1
0,15
1,0
Т2
96,0
1,5
1,0
0,3
0,2
0,3
0,2
0,1
0,15
4,0
Примечание. Содержание теллура определяется по разности; 100 минус
сумма определяемых примесей,
359
Физические свойства
Атомные характеристики. Атомный номер 52, атомная масса —
127,61 а. е. м., атомный объем 20,02-10-" м3/моль, атомный радиус
0,17 нм, ионные радиусы: Те6+ 0,056 нм, Те4+ 0,089 нм, Те2- 0,211 им.
Электронная конфигурация изолированного атома 5s2 р4. Значения
потенциалов ионизации / (эВ): 9,01; 18,8; 31. Электроотрицатель-
Электроотрицательность 2,1.
Теллур может находиться в аморфном и кристаллическом состоя-
состоянии. Кристаллический теллур имеет две модификации: а и {$; темпера-
температура полиморфного перехода а->{$, установленная по изменению элек-
электропроводности, 354 "С.
Теллур кристаллизуется в гексагональной модификации с периода-
периодами а=0,4457 нм, с=0,5929 нм. Координационное число 2; 4. Энергия
кристаллической решетки 199,5 мкДж/кмоль.
Изотопный состав естественного элемента:
Массовое
число
120
122
123
Содержа-
Содержание, %
0,089
2,46
0,87
Массовое
число
124
125
126
Содержание,
%
4,61
6,99
18,71
Массовое
число
128
130
Содержание,
%
33,79
34,49
Работа выхода электронов <р=4,73 эВ.
Плотность. Плотность при комнатной температуре аморфного тел-
теллура 6 Мг/м3, кристаллического гексагональной модификации — рент-
рентгеновская р=6,272 Мг/м3,'пикнометрическая р=6,25 Мг/м3. Изменение
плотности при плавлении теллура 7,7 %.
Плотность теллура в жидком состоянии в зависимости от темпера-
температуры:
т. к
758
828
883
р, Мг/м3 Т, К
5,77
5,76
5,71
943
1003
1063
р, Мг/м3
5,62
5,59
5,57
Т. К
1133
1173
1233
р, Мг/мэ
5,51
5,47
5,41
Электрические и магнитные. При комнатной температуре удельное
электрическое сопротивление р= 1,6 мОм-м, удельная электрическая
проводимость ст=0,625 кСм/м. Удельное электрическое сопротивление .
спектрально чистого теллура (99,99%) при 293 К р=3,7 мОм-м, а
удельная электрическая проводимость а=0,270 кСм/м, удельное элект-
электросопротивление теллура, содержащего менее 0,01 % примесей, при
293 К р=4,3б мОм-м.
Температурный коэффициент электрического сопротивления в ин-
интервале 273—373 К a=3,79-10~3 К. Теллур отличается сильно ви-
ражениой анизотропией электрических свойств. Удельное электрическое
сопротивление монокристаллического теллура: р ус=3,07 мОм-м;
рлс = 5,25 мОм-м.
360
Удельная электрическая проводимость а теллура в жидкой фазе в
зависимости от температуры:
т, к
743
758
773
с, См/м Г, К
20,20 || 828
20,40 883
20,85 943
о, См/м
23,30
23,80
25,00
т, к
1003
1063
1133
а, См/м
26,25
25,20
26,10
После плавления теллур в некотором температурном интервале со-
сохраняет полупроводниковый ход проводимости (примерно до 973 К),
а затем меняет его на металлический.
Электрофизические свойства теллура подтверждают его полупровод-
полупроводниковую природу. Ширина запрещенной зоны при 0 К Д£=0,32;
0,33 эВ. Вследствие малой ширины запрещенной зоны чистый теллур
уже при комнатной температуре обладает собственной проводимостью.
Собственная проводимость теллура при 293 К в направлении оси с
в два раза больше, чем в перпендикулярном направлении. Ширина за-
запрещенной зоны увеличивается с ростом температуры.
Температурная зависимость ширииы запрещенной зоны (dE/dT) =
= 1,9 10-" эВ/К.
В области примесной проводимости теллур — полупроводник р-типа.
Легирование его не приводит к проводимости я-типа.
Давление уменьшает ширину запрещенной зоны теллура и увели-
увеличивает электрическую проводимость. Зависимость ширины запрещен-
запрещенной зоны от давления (dE/dP) = — (Юн-13) • Ю-11 эВ/Па. При давле-
давлении 3 ГПа теллур приобретает металлическое состояние.
Эффективная масса электронов /я*: 0,75±0,04шо; @,106+0,003)X
Х'"о(J-c); @,256±0,006)т0(||с).
Подвижность электронов ця=0,189 м2/(В-с). Подвижность дырок
Ир=0,079 м2/(В-с).
Анизотропия т. э. д, с. не обнаружена.
Диэлектрическая постоянная статическая (низкочастотная) es =
= 5,0(||с), 2,2(J-c).
Абсолютный коэффициент т. э. д. с. при 298 К е = 300 + 500 мкВ/К,
в жидкой фазе при 723 К е=+22 мкВ/К.
Теллур характеризуется инверсией эффекта Холла вследствие изме-
изменения отношения подвижностей электронов и дырок с ростом темпе-
температуры. При достижении температуры начала собственной проводимо-
проводимости (температура, близкая к комнатной) знак постоянной Холла меня-
меняется с положительного на отрицательный. Это связано с большей
подвижностью электронов по сравнению с подвижностью дырок. Выше
523 К постоянная Холла еще раз меняет знак, вновь становясь поло-
положительной. Содержание примесей оказывает влияние на первую точку
и не оказывает на вторую. Коэффициент вторичной электронной эмис-
эмиссии агаах = 1,22 при ускоряющем напряжении первичных электронов
0,45 кэВ.
Сверхпроводимость. Под влиянием высокого давления теллур ста-
становится сверхпроводником:
Р, ГПа 4,3 7,0 8,4
Тс, К 2,05 4,28 4,25
361
Теллур — днамагиетик. Магнитная восприимчивость при 273 К Х==
= (—0,031) -Ю-9.
Тепловые и термодинамические. Температура плавления 1Ы^=
=449,95°С, температура кипения tKBn= 1012°С, характеристическая
температура 6я= 128,8 К, удельная теплота плавления Д#пл=
= 137,25 кДж/кг, удельная теплота испарения ДЯисп=820,9 кДж/кг,
удельная теплота сублимации ДЯСубл = 1300,24 кДж/кг.
Молярная энтропия s прн различных температурах:
Т, К • 298 500 1000 1500
s°, кДж/(моль-К) 49,46 64,06 112,43 164,10
Т, К 2000 2500 3000
s°, кДж/(моль • К) • 169,50 173,64 177,07
Давление пара р в зависимости от температуры:
Т, К • • • 423 469 527
р, Па ... 12,94-Ю-8 12,94-Ю-6 12,94-10-*
Т, К • • • 602 705 905
р, Па . . . 12,94-10-2 12,94 12,94-105
Состав пара: Те2.
Удельная теплоемкость при 293 К Ср —202 Дж/(кг-К).
Теплопроводность Я поликристаллического теллура в зависимости от
температуры:
Г, К
350
500
600
%, Вт/(м.К)
1,8
1,34
1,172
т, к
700
726
К, Вт/(м-к) Т, К
1,34
1,80
800
900
X, Вт/(м-к)
3,79
4,48
Теплопроводность монокристалла теллура:
Т, К 2,0 5,0 10 20 50 100
Ьхс Вт/(м-К) • • 90 300 100 35 10 5
Г, К 2,5 5,0 10 20 50 100
*, 1с, Вт/(м-К) • 450 700 270 75 20 10
Температурный коэффициент линейного расширения поликристалли-
поликристаллического теллура «=@,16-^-0,17)-Ю К , монокристаллического —
см. ниже:
т, к
2
5
10
20
30
50
—0,026
—0,274
— 1,81
—7,04
—9,08
—7,12
«хе.10МГ*|
0,027
0,340
2,48
11,34
19,2
23,6
Т. к
80
100
200
300
450
«||с.ю»,к-1
—4,66
—3,66
—2,18
—2,29
—2,69
а • 106, К~х
25,4
26,0
28,0
29,7
31,9
Кинематическая вязкость v расплава теллура:
362
т.к.
733
743
758
0
0
0
М2/С
,357
,301
,296
Г, К
773
828
883
v-10»,
0,282
0,283
0,222
т, к
943
1003
1063
V.
м
0,
0,
0,
10»,
171
16
159
т. к
1133
1173
1233
V
0
0
0
• 10е,
,154
,148
,142
Поверхностная энергия ^-теллура для грани A00) v = 520 мДж/ма,
для грани A11) 334 мДж/м2.
Параметры самодиффузии поликристаллического теллура в интер-
интервале 633—693 К: предэкспоненциальиый множитель Д)=3,5-10-8 м2/с,
энергия активации £=97,13 кДж/моль
Параметры взаимной диффузии (образующаяся фаза — твердый
раствор):
Диффу н диру ющий
элемент
S
Se
Ti
Те
Hg
Г, К
573—703
593—713
633—703
633—703
543—713
До, м»/с
2,0-Ю-9
2,6-10-'
3,2-Ю-2
3,5-Ю-"
3,4-10-ю
Е, кДж/моль
67,73
119,74
171,66
306,06
78,29
Оптические. Отражательная способность (коэффициент отражения
)
К. мкм
V
%
Поликристаллическая
пленка толщиной 0,3—0,6 мкм *
0,062
0,083
0,124
0,207
0,248
0,310
Пленка
0,411
0,620
1,240
3
15
30
34
35
52
57
52
52
А,, мкм
Полированный
0,6
0,8
1,0
2,0
4,0
7,0
V
%
образец
49
48
50
52
57
68
* Угол падения 20°.
Показатель преломления п в зависимости от длины волны Я:
л,
0
0
0
1
мкм
,73
,8
,93
,0
2
2
3
3
п
,18
,40
,15
,44
к, мкм
1,2
1,35
1,5
1,7
п
3,76
3,52
3,31
3,13
К
2
2
3
мкм
,0
,5
,0
3
3
4
п
,10
,63
.41
863
о,
о,
082
6
0,
1,
124
2
0
1
,207
,3
0,
1,
248
6
0,
2,
310
4
0,
3,
412
3
Для монокристалла теллура пхс =4,85 (Л,=8,0 мкм) и №цс=4,97
(Я=3,Э мкм).
Показатель поглощения х:
Я,мкм 0,062
X 0,2
Механические свойства
Микротвердость теллура при 20°С Н^—550 МПа; твердость по Бри-
иеллго НВ= 180^-270 МПа. Временное сопротивление разрыву при рас-
растяжении о-в=10,8 МПа B93 К).
Ориеитациоииая зависимость [hkl] модуля нормальной упругости В
монокристалла теллура при 293 К:
[hkl] [Ill] [ЮТО] [0001]
Е, ГПа 45,1 42,9 20,6
Коэффициенты упругости монокристалла теллура: сц = 32,65 ГПа,
с44=31,21 ГПа, с|2=9,15 ГПа.
Химические свойства
Нормальный электродный потенциал реакции Те—4е^±Те4+ фо=О,56 В.
В соединениях проявляет степень окисления +4, 1-6, —2 (реже).
При температурах, близких к комнатной, теллур устойчив против
окисления в атмосферном воздухе и кислороде, однако при нагревании
сгорает, образуя ТеО2 — белое негигроскопичное твердое вещество плот-
плотностью 5,75 Мг/м3. При нагревании ТеОг становится желтым и пла-
плавится около 733 "С. Оксид (IV) теллура малорастворим в воде и раст-
растворим в концентрированных кислотах и щелочах. При растворении в
щелочах образуются теллуриды — соли теллуристой кислоты НгТеОз.
С галогенами теллур реагирует непосредственно при обычной темпера-
температуре или при нагревании. При действии воды или кислоты на халько-
генид образуется халькогеноводород. Его можно получить и при не-
непосредственном взаимодействии элементов.
Азотная кислота окисляет теллур до теллуристых кислот. Смесь
азотной и хромовой кислот переводит теллур в теллуровую кислоту
Н2Те04; эта кислота получается также при растворении теллура в пе-
перекиси водорода.
С металлами II группы теллур образует соединения A"BVI (ZnTe,
CdTe, HgTe). Для этих систем характерно наличие одного эквиатомио-
го соединения и вырожденной эвтектики. При переходе от сульфидов к
селенидам и теллуридам увеличивается доля ковалентио-металлической
связи за счет уменьшения ионной составляющей и уменьшается ширина
запрещенной зоны. HgTe — уже полуметалл, а не полупроводник.
С германием, оловом и свинцом теллур образует соединения типа
/[ivgvi c важными для техники выпрямительными и фотоэлектриче-
фотоэлектрическими свойствами. В соответствующих системах образуются экви-
атомиые соединения /4IV Те—моиотеллуриды.
С металлами V группы —мышьяком, сурьмой и висмутим — теллур
образует соединения Аг ^.з . As2Te3 — полупроводник к-типа с ши-
шириной запрещенной зоны 1 эВ. SbjTe3 — полупроводник р-типа с вы-
364
сокой концентрацией носителей A019—2020 см~3), шириной запрещен-
запрещенной зоны Д£=0,19 эВ, с абсолютным коэффициентом т. э. д. с,
+ 100 мкВ/К и максимальной подвижностью дырок —0,0360 м2/(В-с).
Bi2Te3 — полуметалл, обладающий в примесной области металлическим
характером проводимости, а в собственной (выше 400 °С) — полупро-
полупроводниковой.
В системах теллура с алюминием, галлием и индием наблюдается
образование соединений типа А^В^1 с кристаллическими решетками
цинковой обманки или вюрцита, в которых 1/3 позиций для атомов Аш
вакантна. Образующиеся стехиометрические вакансии рассматриваются
как структурный компонент кристалла. Электрофизические характери-
характеристики соединений типа A^'B^1 устойчивы к воздействию ионизирую-
ионизирующего излучения. Наряду с соединениями А2В3 теллур образует с ме-
металлами III группы полупроводниковые соединения эквиатомного со-
состава AInBVi .
Теллуриды редкоземельных металлов характеризуются высокими
температурами плавления и низкой теплопроводностью.
Теллур взаимодействует с переходными металлами, образуя соеди-
соединения с полупроводниковыми свойствами, например FeTe2, МТ
СгТе2.
Технологические свойства
Теллур характеризуется высокой хрупкостью при комнатной темпера-
температуре. При температурах, близких к плавлению, поддается прессованию.
Области применения
Теллур применяется в качестве присадки к чугуну, стали, в том числе
нержавеющей, цветным металлам и сплавам (олово, свинец, медь).
Микродобавки теллура значительно улучшают структуру, механичес-
механические свойства и обрабатываемость чугуна и стали. Микродобавки тел-
теллура @,05—0,1 %) повышают механические и антикоррозионные свой-
свойства свница. Сплав свинца с теллуром применяют для изготовления хи-
химической аппаратуры, используемой в производстве серной кислоты.
Оловянистые сплавы (баббиты), содержащие теллур @,1—1,0%), ха-
характеризуются повышенной твердостью, прочностью и износостойкостью.
Теллур улучшает технологические свойства меди и медных сплавов, а
также повышает их теплостойкость.
Известно применение теллура в технике измерения температур. Тер-
Термопары теллур — медь и теллур — платина служат для измерения низ-
кнх температур (от —75 до 90 °С).
Теллур применяется в стекольной промышленности при производст-
производстве коричневого стекла и глазури.
Как полупроводник теллур самостоятельного значения не имеет, но
его многочисленные соединения (теллуриды) широко используются в
качестве полупроводниковых материалов.
Благодаря высокой чувствительности к различного рода излучениям
соединения теллура с металлами применяются в счетчиках излучения,
в дозиметрических приборах, телевизионных трубках н т.д.
Тугоплавкость и сравнительно низкая теплопроводность позволяют
использовать теллуриды редкоземельных металлов как материалы тер-
термоэлектрических генераторов.
Теллуриды применяются в качестве фотоэлементов,
365
6.5. ПОЛОНИЙ [1—35, 162, 244—246]
Общие сведения и методы получения
Полоний (Ро) — радиоактивный металл серебристо-белого цвета.
Полоиий-210 B10Ро) открыт в 1898 г. выдающимися физиками
М. Склодовской-Кюри и П. Кюри. Название получил в честь Польши —
родины М. Склодовской-Кюри. 2VOPo—природный изотоп, образую-
образующийся в радиоактивном ряду урана. Период полураспада — 138,4 сут.
Получают полоний из урановых руд.
Наиболее долгоживущий изотоп полония 209Ро получен искусствен-
искусственным путем. Его период полураспада 103 года. Содержание полония в
земной коре 2-Ю-14 % (по массе).
Физические свойства
Атомные характеристики. Атомный номер 84, атомная масса 210 а. е. м.,
атомный радиус 0,153 нм; ионный радиус полония Ро6+0,056 км,
Ро*+0,065 нм.
Электронная конфигурация изолированного атома полония:
2ed'°624
Потенциалы ионизации / (эВ): 8,20; 19,4; 27,3. Электроотрицатель-
Электроотрицательность 2,0.
Полоний существует в двух структурных модификациях а и 6.
а-Полоний имеет простую кубическую решетку, Р полоний — ромбо-
ромбоэдрическую. Кубическая модификация полония имеет период а =
=0,3359 нм при 283±10К, а ромбоэдрическая а = 0,3368 им, а = 98°144'
при 348±15К.
Изотопный состав (наиболее распространенные изотопы) полония
(кроме того, существуют короткоживущие изотопы с массовыми числа-
числами 194—199 и периодом полураспада 0,6—300 с):
Массовое число
200
201
202
203
204
205
206
207
208
209
210
211
212
213
214
215
216
217
218
Период
полураспада
660 с
1080 с
2520 с
1980 с
3,6 года
1,8 года
9 сут
5,7 года
2,93 года
103 года
138,4 сут
0,52 с
3,04-10-' с
4,2-Ю-6 с
1.64 -10—4 с
1,83-Ю-3 с
0,158 с
10 с
183 с
Форма
К-з; а, 5
К-з; а, 5
К-з; а, 5
К-з; а
К-з; а
К-з; а, 5
К-з; а, 5
К-з; а, 5
а, 5,109;
а, 4,877;
а, 5,298;
а, 7,434;
а, 8,776;
а, 8,336
а, 7,680;
а, 7,365;
а, 6,774,
а, 6,5
а, 5,998;
и энергия излучения1, МэВ
,84
,671
,575
,37
,218, 5,064; у,0,8
,10, 6+
4,734; К-З
К-з; у, 0,87; 0,55; 0,2; 0,1
v, 0,800
6,88; 5,56
10,536; 10,417; 9,489
9,069
9,5; р-
р—
Р
«« К-захват.
366
Работа выхода электронов по теоретической оценке составляет для
полония ф=4,8 эВ.
Плотность. Плотность се-полония, определенная рентгеновским ме-
методом, р=9,314 Мг/м3, Р-полония р=9,523 Мг/м3.
Тепловые и термодинамические. Температура плавления /M=246°C,
температура кипения *Кип=962сС, температура полиморфного ая*Р-
превращения 75 °С, удельная теплота плавления Д//Пл = 59,7 кДж/кг,
удельная теплота испарения ДЯВСп=480 кДж/кг, удельная теплота
сублимации ДЯОубл = 680 кДж/кг.
Молярная энтропия s° при различных температурах:
т, к
S". Дж/
/(моль-К)
. Д/
/(моль К)
298
500
1000
62,76
77,36
122,97
1500
2000
223,22
229,29
2500
3000
234,14
238,33
Давление пара р полония при различных температурах:
Т, К • • . 1035 1180 1375 1640 2040
р, Па . . .' 1,3-10-в 1,3-10-* 1,3-10-2 1,3 1,3-10?
Удельная теплоемкость при 298 К ср = 125 Дж/(кг-К).
Температурный коэффициент линейного расширения в интервале
180—303 К се=20,8-10-6 К-
Химические свойства
Нормальный электродный потенциал реакции Ро—Зе=?*Ро3+ фо=О,56 В.
В соединениях проявляет степени Олисления +4, +6, —2.
С кислородом образует оксид РоОг. Сразу после образования окси-
оксида тетрагональная решетка переходит в г. ц. к. решетку типа CaF2.
Взаимодействие углерода с парами полония до 700 °С не обнару-
обнаружено.
При исследовании взаимодействия полония с металлами I группы—
медью, серебром и золотом — установлено существование твердых рас-
растворов; в системе полоний — золото твердые растворы наблюдаются в
широком интервале концентраций. Промежуточных фаз не обнаруже-
обнаружено. Характер взаимодействия полония с медью и серебром установить
не удалось. Во всех случаях при исследовании взаимодействия метал-
металлы выдерживали в парах полония
При взаимодействии с металлами II группы стронцием и кальцием
установлено образование соединений SrPo и СаРо с г. ц. к. решетками
типа NaCl, а с магнием — соединения MgPo с г. ц. к. решеткой типа
NiAs. В системах кадмий — полоний, цинк — полоний и бериллий — по-
полоний образуются соединения CdPo, ZnPo и ВеРо с г. ц. к. решетками
типа ZnS. С ртутью полоний образует соединения HgPo с г ц. к. ре-
решеткой типа NaCl.
Тугоплавкие переходные металлы тантал, молибден, вольфрам не
взаимодействуют с парами полония до 700 СС Имеются данные о взаи-
взаимодействии полония с никелем В этой системе установлено существо-
существование двух соединений: NiPo со структурой типа NiAs и №РОг со
структурой типа Cd(OHJ.
367
Области применения
Полоний-210 используется как источник а-излучения. Сплав 210Ро с бе-
бериллием служит удобным источником нейтронов, применяемым при
анализе химического состава различных материалов.
6.6. ХРОМ [1—35, 247—249]
Общие сведения и методы получения
Хром (Сг) — твердый блестящий металл. Как самостоятельный элемент
был впервые выделен в 1797 г. Вокеленом из минерала крокоит, кото-
который открыл академик Паллас при изучении сибирских минералов в
1765 г. Свое название хром получил от греческого «chromos», что оз-
означает цвет, из-за различных цветов его соединений — от зеленого до
красного.
Содержание в земной коре 0,035 % (по массе).
В свободном состоянии хром не встречается. Из многочисленных руд,
содержащих хром, промышленное значение имеет только хромит
FeO-Cr2O3, в котором содержится более 65 % Сг2О3 (по массе), ос-
остальное FeO. Хром входит в состав многих минералов, в частности в
состав крокоита РЬСгС^; к другим минералам, содержащим хром, от-
относятся финицит, менахлоит или феникохлоит ЗРЬО-2Ст2О3, березовит,
трапакалит, магнохромит и др. Известна большая группа силикатных
минералов, содержащих хром, который придает этим минералам ха-
характерную окраску. Хромит относится к классу изоморфных минералов
кубической системы, известных под названием шпинелей, которые мож-
можно охарактеризовать общей формулой ХОУ2О3, где X — ион двухва-
двухвалентного металла, У—ион трехвалентного металла. В промышленных
хромовых рудах содержание С/гОз редко превышает 50 % (по массе).
Феррохром с содержанием 65—70 % Сг, используемый в металлургии,
получают прямым восстановлением хромовой руды с соотношением
Cr:Fe=3:l. Хромит восстанавливают углеродом, причем для получе-
получения феррохрома содержание оксида хрома в руде должно быть не ме-
менее 48%. В процессе плавки протекает реакция: РеО-Сг2Оз+4С->-
F 2C 4CO
Хром технической чистоты получают алюминотермическим, силико-
термическим, электролитическим и другими методами из оксида хрома,
который получают из хромистого железняка. Из методов производства
технически чистого металла, пригодного для дальнейшего рафинирова-
рафинирования, наиболее прост и экономически выгоден электролитический. Стои-
Стоимость электролитического хрома несколько выше, чем хрома, получае-
получаемого другими методами, но примеси из него могут быть удалены наи-
наиболее легко. Из методов очистки электролитического хрома от примесей
наиболее широкое применение получила обработка хрома в сухом очи- '
щенном водороде. В процессе рафинирования из металла удаляется
главным образом кислород, несколько понижается содержание азота и
других металлических н неметаллических примесей, особенно элемен-
элементов, имеющих высокое давление паров. Рафинирование электролитиче-
электролитического хрома проводится длительным нагревом при 1300—1500 °С в ус-
условиях непрерывного притока водорода. Глубокую очистку хрома
можно осуществлять также вакуумной дистилляцией с конденсацией
Паров на холодной поверхности.
Наиболее чистый хром для лабораторных исследований получают
иодидным методом. Этот процесс основан на образовании летучих
368
иодидов хрома (при 700—900 °С) и их диссоциации на нагретой по-
поверхности (при 1000—1100°С). Металлический хром после иодидного
рафинирования пластичен в литом состоянии (удлинение при растяже-
растяжении 9—18 %). Согласно ГОСТ 5905—79 производится пять марок хро-
хрома алюминотермическим способом, предназначенных для легирования
специальных сталей и сплавов:
Марка
Х99А
Х99Б
Х98,5
Х98
Х97
Примеси, не более
Сг, не
менее
99,0
99,0
98,5
98,0
97,0
Si
0,3
0,3
0,4
0,5
0,5
А1
0,2
0,5
0,5
0,7
1,5
Fe
0,6
0,6
0,6
0,8
1,2
с
0,03
0,03
0,03
0,04
0,05
s
0,02
0,02
0,02
0,03
0,04
р
,02
0,02
0,02
0,03
0,03
Си
0,01
0,01
0,02
0,04
0,05
Марка
Х99А
Х99Б
Х98.5
Х98
Х97
0
0
0
As
,01
,01
,01
.
0,
о,
0,
Bi
0005
0005
0005
.
0
0
0
I
Sb
,008
,008
,008
Тримеси
0
0
0
Zn
006
006
01
не
0
0
0
более
Pb
,0008
,0008
,001
0
0
и
Продолжение
Sn
,004
,004
,004
Co
0,005
табл.
N
0,04
0,05
Хром металлический упаковывают в стальные барабаны по ГОСТ
5044—79; барабаны должны быть окрашены в серый цвет.
Физические свойства
Атомные характеристики. Атомный номер хрома 24, атомная масса
51,996 а. е. м., атомный объем 7,23-10~6 м3/моль. Атомный (металли-
(металлический) радиус хрома 0,128 нм, ковалентный 0,118 нм. Электронная
конфигурация внешних оболочек 3d5 4а'1. Электроотрицательность 1,6.
Значения потенциалов ионизации / (эВ): 6,746; 16,49; 31. При атмо-
атмосферном давлении хром обладает о. ц. к. решеткой, при комнатной
температуре а=0,2884 нм. Энергия кристаллической решетки
337,5 мкДж/кмоль.
Хром существует в виде четырех стабильных изотопов с массовыми
числами 50; 52; 53; 54, процентное содержание которых соответственно
4,31 ±0,04; 83,76±0,14; 9,55±0,09; 2,38±0,02. Известны также радио-
радиоактивные изотопы хрома с массовыми числами 46, 47, 48, 49, 51, 55,
период полураспада которых соответственно равен 1,1 с, 0,4 с, 1 сут,
2520 с, 28 сут, 210 с соответственно. Эффективное поперечное сечение
захвата тепловых нейтронов З.ЫО8 м2,
369
Плотность Плотность хрома, вычисленная по периоду о. ц. к. ре-
решетки, приведенному выше, составляет 7,194 Мг/м3. Плотность пикно-
метрическая несколько ниже: 7,16 Мг/м3.
Электрические и магнитные. Удельная электрическая проводимость
а и электрическое сопротивление р в зависимости от температуры.
т. к
200
300
500
700
900
о, МСм/м
9,1
6,67
4,17
3,03
2,33
р, мкОм.м Г, К
1
0,110
0,150
0,240
0,330
0,430
1100
1300
1500
1800
о, МСм/м
1,86
1,54
1,32
1,07
р, мкОм • м
0,540
0,650
0,760
0,940
Температурный коэффициент электрического сопротивления хрома
се-103, К в зависимости от температурного интервала:
т, к
233—323
323—373
293—373
293—473
293—573
293-673
293—773
а-103, к
6,21
3,04
3,01
3,15
3,19
3,34
3,47
Т, К
293—873
293—973
293-1073
293—1173
293—1273
293—1373
293—1473
а-10»,
К
3,57
3,64
3,71
3,84
4,01
4,16
4,35
г, к
293—1573
293—1673
293—1773
293—1873
293—1973
293—2073
а-103, К
4,54
4,69
4,82
4,92
5,04
5,24
До температуры 0,08 К у хрома не обнаружена сверхпроводимость.
В термопаре хром — платина хром проявляет положительную
т. э. д с. по отношению к платине при температурах выше 293 К. Абсо-
Абсолютный коэффициент т. э. д. с. е претерпевает резкое изменение около
313 К. Т. э. д. с. пары хром — платина при 373 К достигает 2,5 мВ.
Постоянная Холла при комнатной температуре 7?=+3,63-Ю-10 м3/Кл.
Магнитная восприимчивость % хрома возрастает с ростом температу-
температуры. При 273 К она составляет +3,5-10~9, а при 1713 К +4,3-10~9,
Температура Нееля для хрома Гдг = 312 К; ниже этой температуры хром
переходит из парамагнитного в антиферромагнитное состояние. Работа
выхода электронов ф=4,58 эВ для поликристаллического материала.
Работа выхода для грани монокристалла A11) равна 3,88 эВ, для гра-
грани (ПО) ф=4,70 эВ, для грани A12) ф=4,05 эВ.
Тепловые и термодинамические. Температура плавления <„л=
= 1877±15°С, температура кипения Лшп=2200°С при давлении
0,1013 МПа; характеристическая температура хрома 9с=357 К.
Удельная теплота плавления хрома Д/-/пл, отнесенная к 298 К, равна
265,65 кДж/кг. Удельная теплота испарения хрома Д#исп=1798кДж/кг.
370
Удельная теплота сублимации ДЯсубл, отнесенная к 298 К, равна
7631,4 кДж/кг. Удельная теплоемкость сР хрома в зависимости от тем-
температуры:
т. к
56,1
59,5
61,1
63,5
66,9
68,0
72,4
74,2
81,6
84,8
СР'
Дж/(кг-К)
51
60,5
65,2
68,5
83,8
87,5
101
109,2
132,5
142,9
Г, К
93,2
96,1
105,8
123,1
141,6
162,9
181,6
200,1
222,1
244,1
ср.
Дж/(кгХ
хю
170
180
211
243
299
336
362
387
405
422
Г, К
274,0
281,5
291,1
293
823
873
923
973
1023
1073
1123
438
441
446
474
569
577
586
594
602
611
619
г, к
1173
1223
1273
1323
1373
1423
1473
1523
1573
1623
1673
V
Дж/(кгХ
ХК)
627
636
653
669
694
736
820
900
1067
1381
ИЗО
Электронная теплоемкость хрома с!,л=[1,4 мДж/(моль-К2)] -Г.
Теплопроводность J
т, к
10
20
50
К
Вт/(м.вд
335,0
586,0
326,1
1 в зависимости от температуры:
т, к
150
293
470
X.
Вт/(м
150
88
83
•К)
,5
,6
,8
г, к
720
1000
1200
К
Вт/(м-К)
73,7
69,15
62,85
г, К
1400
1600
К
Bi/(m
60,
52,
•К)
0
7
Температурный коэффициент линейного расширения а хрома в зна-
значительной степени зависит от чистоты материала: чем ниже степень
чистоты, тем больше а. В интервале 283—305,5 К среднее значение а=
=4,4-10—6 К; в интервале 305,5—333 К среднее значение се =
=7,47- 10~в К. При —311 К наблюдается аномалия в изменении а,
значения которого достигают минимума, равного 3,36 10~6 К. Мо-
Молярная энтропия хрома s° Дж/(моль-К) в зависимости от темпера-
температуры:
Т, К 298 500 1000 1500 2000 2500
s°, Дж/(моль-К) • 23,8 36,8 56,5 70,8 82,6 98,9
Поверхностное иатяжеиие а жидкого хрома при температуре, близ-
близкой к кристаллизации, а=1590 мН/м2. Поверхностная энергия хрома
вдоль грани (ПО) v=1378 мДж/м2. Энергия дефекта упаковки
300 мДж/м2. Давление пара р хрома в зависимости от температуры:
Т, К
р, Па
1560 1600 1650
1,47-10-1 3,26-10-1 8,36-10-1
1700 1750 1800
2,03 4,68 10,3
При температуре плавления р=9,9-102 Па.
Параметры самодиффузии хрома в интервале 1323—1673 К: пред<
экспоненциальный множитель Da~6,47■ 10~в м2/с; знергиа активации
£=247,86 кДж/моль,
371
Параметры взаимной диффузии некоторых элементов в хроме:
Диффундирую-
Диффундирующий элемент
С
N
N
Si
Ni
Mo
г, к
1073—1773
773—1173
413—453
1173—1973
1143—1443
1373—1673
А,,
8,3-
14,8-
1,6-
3,92-
3,5-
2,7-
М2/с
10-7
10-*
ю-8
Ю-*
10-8
10-'
Е, кДж/моль
117,23
13,63
115
95,29
190,92
242,83
Образующаяся
фаза*
Тв. р.
CrN
Тв. р.
CrSi2
Тв. р.
Тв р.
* Тв. р. — твердый раствор.
Оптические. Излучательная
ент излучения ег):
0,050**
0,052
0,057
7\ К
363
390
473
0,076
0,093
0,133
способность
7", К
573
677
836
(интегральный
0,293
0,396
0,608
-гаэффици
т, к
944
1012
1220
* Гладкая поверхность. ** Неокнсленный.
Отражательная способность (коэффициент отражения Пп) в зави-
зависимости от длины волны:
.... 300 500 1000 4000
"к, нм
nD,%
67
70 63
Показатель преломления п;
X, нм
253
302
400
0
0
1
п
,74
,70
,40
X, нм
5С0
600
700
2
3
3
п
,45
,20
,40
1, нм
800
900
1000
3
3
3
п
,7
,70
,85
I
X, нм
2000
4000
6000
3
3
4
п
,90
,40
,80
Показатель поглощения
Я, нм
253
302
400
500
600
X
2,70
3,10
4,15
5,05
5,05
К, нм
700
800
900
1000
2000 -
5
5
5
5
6
X
,10
,10
,20
,30
,20
К, нм
4000
6000
8000
10 000
X
13
19
25
34,
0
2
3
0
%, нм
12 000
14 000
16 000
18 000
X
41
47,
51,
57,
0
2
4
2
872
Механические свойства
Механические свойства при комнатной температуре иодидного хрома
после обработки давлением и рекристаллизационного отжига при
815°С (содержание примесей внедрения 0,005% О, 0,001 % N): аъ=
= 410 МПа; <то,2=360 МПа; 6=44%; г|з = 78%; ЯУ=1060 МПа.
При повышении температуры прочностные характеристики снижа-
снижаются (хром технической чистоты) и составляют:
t, °с
300
400
500
600
700
800
ов, МИа
193
224
278
242
203
179
V мпа
141
187
—
167
б, %
3
51
30
42
33
47
Ф, %
31,4
89
75
81
85
92
НУ, МПа
_
687
_
667
—
—
Повышение временного сопротивления сгв в интервале температур
400--600 °С можно объяснить деформационным старением, развиваю-
развивающимся под действием приложенного напряжения, и присутствием при-
месеп внедрения.
Модуль нормальной упругости Е иодидного хрома, определенный
при растяжении, в зависимости от температуры:
t, СС • . . 20 200 400 600 800
Е, ГПа . . 288,1 288,1 276 268 247
На кривых температурной зависимости модуль нормальной упруго-
упругости при 40 "С имеет ярко выраженный минимум.
Сжимаемость хрома при 30°С х=0,9-10~п Па. Скорость уста-
установившейся ползучести в при сжатии (напряжение 30,4 МПа, /=
= 1000°С) составляет 1,25-10~5 %/с, при растяжении (напряжение
46,4 МПа, *=950 °С) 0,88 %/с.
Хром обладает достаточной стойкостью к термоциклированию. Так,
клиновидные образцы чистого хрома выдерживают без разрушения 625
теплосмен в интервале 1100—70 °С; выдержка при каждой температуре
цикла 30 с. Микротвердость алюминотермического хрома прн 20 °С со-
составляет Я№ =1420 МПа.
Химические свойства
Нормальный электродный потенциал реакции Cr—2e^=tCr2+ фо=.
= —0,913 В, а реакции Сг— Зе=*±Сг3+ фо=—0,71 В. В соединениях
хром проявляет степени окисления +2, +3, +6, реже +4, +5, +1.
При нормальной температуре хром химически устойчив; почти не
окисляется на воздухе, даже в присутствии влаги. При нагреве окисление
протекает только на поверхности. Некоторые кислоты, например кон-
концентрированная азотная, фосфорная, хлорноватая, хлорная, образуют
иа хроме окисную пленку, приводя к его пассивации. В этом состоянии
хром обладает исключительно высокой коррозионной стойкостью и на
него не действуют разбавленные минеральные кислоты. Хром является
электроотрицательным по отношению к наиболее практически важным
металлам и сплавам, и если он С ними образует гальванопару, то ус-
ускоряет их коррозию,
373
Скорость коррозии электроосажденного хрома в различных кисло-
кислотах при 12 и 58 4С:
Кислота
Азотная, 10%-ная
Азотная, 100 %-ная дымящая
Лимонная, 10 %-ная ....
Плавиковая, 10%-ная . . .
Серная, 10 %-ная
Уксусная, 10 %-ная
Фосфорная, 10 %-ная ....
» 85 %-ная ....
Хлорная, 10 %-ная
Щавелевая
Скорость коррозии, мм/год, при
температуре, °С
12
0,000
0,000
0,000
25,400
0,2794
0,000
0,0254
0,000
0,0254
0,000
58
0,3048
0,1270
0,1778
254,000
0,3810
0,8636
0,0508
1,0668
0,0254
Электролитически осажденный хром содержит большое количество
растворенного водорода — до —5% (ат.). В данной системе возможно
образование СгН A,9% Н), СгН2 C,73% Н) или СгН3 E,49% Н),
которые обладают низкой термической стабильностью и легко разла-
разлагаются при незначительном нагревании. Теплота растворения водорода
в твердом хроме при 797—1097 °С составляет 105 кДж/моль Н2, теп-
теплота образования СгН2 А//Обр = 15,900 кДж/моль, Растворимость кис-
кислорода в твердом хроме при 1347 °С составляет 0,03% и снижается
при понижении температуры. Наиболее распространенным оксидом
хрома является Сг2О3 C1,6 % О), представляющий собой тугоплавкое
вещество зеленого цвета (зеленый хром), применяемое для приготов-
приготовления клеевой и масляной красок. Высший оксид хрома СЮ3— темно-
красные игольчатые кристаллы представляет собой хромовый ангид-
ангидрид, хорошо растворим в воде
С азотом хром образует прочные нитриды Cr2N A1,87 % N) и CrN
B1,22 % N). CrN весьма стоек в химическом отношении, не поддается
действию воды на холоду и при нагреве, не растворяется в щелочах,
практически не растворяется в кислотах, в том числе в царской водке.
Ценными свойствами обладают карбиды хрома. Карбид Сг23С6 име-
имеет плотность 7 Мг/м3, г. ц. к. решетку с периодом а= 1,0638 нм; тем-
температура плавления 1520 °С. Теплота образования Сгг3Сб в стандарт-
стандартных условиях ДЯобр=209,40 кДж/моль.
Карбид Сг7С3 имеет гексагональную решетку (а= 1,401 нм, с=
^0,4532 нм). Теплота образования карбида Д#обр= 177,96 кДж/моль.
Плотность 6,9 Мг/м3, температура плавления 1780 °С.
Карбид Сг3Сг кристаллизуется в орторомбической системе, а —
= 0,2821 нм, 6 = 0,553 нм, с= 1,147 нм; температура плавления 2168 К,
плотность 6,7 Мг/м3. Теплота образования при нормальных условиях
Д#Обр=87,95 кДж/моль. Временное сопротивление а„ при 900 °С и
выдержке 10 ч равно 49,05 МПа, а при 1000 °С и выдержке 100 ч
16,6 МПа.
С серой хром образует сульфиды CiS C8,1 % S), Cr2S3 D7,9 % S)
и Cr3S4 D5,1 % S). Сульфид CrS неустойчив при комнатной темпера-
температуре и распадается с выделением чистого хрома.
Ближайшими аналогами хрома являются молибден и вольфрам, с
которыми он образует непрерывные твердые растворы. По мере увели-
874
чения различия в физико-химических свойствах хрома и взаимодейст-
взаимодействующего с иим элемента растворимость уменьшается, а в пределе от-
отсутствует. Элементы IA подгруппы — литий, натрий, калий, рубидий к
цезий — при обычных условиях с хромом не взаимодействуют из-за
большого различия в размерах атомных диаметров. Золото, медь и се-
серебро крайне ограниченно растворимы в хроме. Бериллий образует с
хромом ограниченные твердые растворы с переменной по температуре
растворимостью, а также металлическое соединение СгВе2. Сведения
о взаимодействии хрома с магнием, кальцием, стронцием и барнем от-
отсутствуют. Возможность образования твердых растворов этих элемен-
элементов в хроме крайне ограничена из-за большого различия в величинах
атомного диаметра хрома и указанных элементов.
Крайне слабо выражена также склонность хрома к взаимодействию
с металлами ИВ подгруппы—цинком, кадмием и ртутью. С элементами
IIIA подгруппы—иттрием и лантаном — хром образует ограниченные
твердые растворы и металлические соединения — бориды и алюминиды;
некоторые из них, например СгВ, представляют практический интерес
при разработке сплавов с особыми свойствами. С элементами IVA под-
подгруппы — титаном, цирконием и гафнием — хром образует ограничен-
ограниченные твердые растворы и металлические соединения типа АВ2> относя-
относящиеся по своей кристаллохимической природе к фазам Лавеса. Эти
фазы TiCr2, ZrCr2> ШСг2 имеют при комнатной температуре структуру
типа MgCu2, а при нагреве претерпевают полиморфное превращение
MgCu2 — MgZn2. С кремнием хром образует силициды: Cr3Si, СгзБСг,
Cr5Si3, CrSi, CrSi2- В отличие от силицидов молибдена и вольфрама
силициды хрома не образуют прочных и жаростойких пленок, предо-
предохраняющих сплав от газовой коррозии.
С элементами VA подгруппы хром взаимодействует по-разному.
С ванадием хром образует непрерывные твердые растворы, а с нио-
ниобием и танталом — металлические соединения типа фаз Лавеса —
NbCr2 и ТаСг2. С марганцем и рением взаимодействие хрома практи-
практически одинаково — образуются ограниченные твердые растворы боль-
большой протяженности со стороны хрома и промежуточные соединения
типа а-фазы. С элементами VIII группы хром образует ограниченные
твердые растворы, а с некоторыми из них (кобальтом, железом, пла-
платиной, палладием, иридием и рутением), кроме того, металлические со-
соединения. Металлические соединения хрома с платиной, иридием, руте-
рутением имеют кристаллическую решетку типа р-вольфрама. В системах
хром — железо и хром — кобальт существует а-фаза, способствующая
повышению твердости и охрупчиванию сплавов.
Технологические свойства
Хром технической чистоты при комнатной температуре хрупок и при-
приобретает пластичность лишь при нагреве выше 200—225 "С. Хром от-
относится к группе хладноломких металлов, пластичность которых резко
падает при снижении температуры.
Области применения
Хром широко применяется в металлургии, главным образом в качестве
легирующей добавки к сталям различного назначения. Добавка до
3 °/о Сг к обычным углеродистым сталям значительно повышает их
механические свойства. Стали с содержанием 5—6 % Сг отличаются
повышенным сопротивлением коррозии. При содержании хрома более
10 % стали обладают высокой, коррозионной стойкостью (нержавею-
(нержавеющие). Хром в качестве легирующей добавки входит также в состав
375
жаропрочных сплавов иа основе никеля и кобальта. Сплавов иа основе
хрома не существует. Большое количество чистого хрома используется
в гальванотехнике; хромирование является надежным средством борь-
борьбы с коррозией. Хромовые покрытия, помимо высокой коррозионной
стойкости, обладают также высоким сопротивлением истиранию.
Хром в виде соединений используется при производстве огнеупор-
огнеупорных материалов и пигментов.
6.7. МОЛИБДЕН [1—35, 48, 162, 163, 165, 250—262]
Общие сведения и методы получения
Молибден (Мо) ■— металл серо-стального цвета в компактном состоя-
состоянии и темно-серого в диспергированном. Название получил от гречес-
греческого molybdos " (свинец) из-за внешнего сходства минералов молибде-
молибденита и свинцового блеска (галенита). В 1778 г. шведский химик Шееле
выделил молибденовую кислоту, а в 1781 г. его соотечественник Гьельм
получил чистый металл путем восстановления триоксида молибдена
углеродом. Молибден более высокой чистоты получен Берцелиусом, ис-
использовавшим в качестве восстановителя водород. Промышленное про-
производство молибдена относится к началу XX в., когда была разработана
технология получения металла в компактном виде методами порошко-
порошковой металлургии.
Молибден — мало распространенный элемент. Среднее содержание
его в земной коре 0,0003 % (по массе). Известно около 20 минералов
молибдена. Из них промышленное значение имеют четыре: молибденит
M0S2, повеллит CaMoCi, молибдит Гег^оООз^'/гНгО и вульфенит
РЬМоО4. В рассеянном состоянии молибден находится в лимоните и
некоторых сульфидных минералах, например в халькопирите. Из пере-
перечисленных минералов самый распространенный и наиболее важный для
производства молибденит MoS2.
Для обогащения молибденсодержащих руд используют флотацию,
которая позволяет отделить молибденит от пустой породы и сопутст-
сопутствующих минералов. Как доводочную операцию для отделения железа
иногда применяют магнитное обогащение. Очень ограниченно исполь-
используется гравитационное обогащение. Исходным сырьем для производства
ферромолибденнта и химических соединений [оксида (III) молибдена,
парамолибдата аммония, молибдата натрия и молибдата кальция]
служат молибденовые концентраты; требования к ним приведены ниже:
Марка
KW
КМ2
КМЗ
Мо, %, не менее
50
48
47
Примеси, %, не более
Р
0,07
0,07
0,15
As
0,07
0,07
0,07
Си
0,5
1,0
2,0
SiO2
5,0
7,0
9,0
Sn
0,07
0,07
0,07
Металлический молибден получают окислительным обжигом молиб-
молибденовых концентратов или гидрометаллургическими методами: разло-
разложение концентратов азотной кислотой, окисление молибденита кисло-
кислородом под давлением в щелочном растворе, обработка концентрата
щелочным раствором гипохлорита натрия. Одно из существенных пре-
преимуществ чисто гидрометаллургических схем — отсутствие выбросов в
атмосферу газов, содержащих серу, которые выделяются при окисли-
376
тельном обжиге. Гидрометаллургические методы разложения концент-
концентратов и промпродуктов удобно сочетать с последующим извлечением
молибдена (и рения) экстракцией органическими растворителями и
ионообменной сорбцией.
Основной промышленный способ получения металлического молиб-
молибдена ■— двухстадийное восстановление триоксида молибдена водо-
водородом:
МоО3 + Н2 ^ МоО2 + Н2О; Мо02 + 2Н2 £ Мо + 2Н2О.
Режимы восстановления определяют зернистость получаемого ме-
металлического порошка.
Молибденовый порошок высокой чистоты может быть получен осаж-
осаждением из газовой фазы из легколетучих высших галогенидов молиб-
молибдена MoCU и MoFe, которые легко очищаются перегонкой. Галогениды
могут быть восстановлены до металлического молибдена водородом.
Молибден можно получать электролизом (фосфатные и боратные
ванны, бескислородные галогенидные ванны, электролитическое рафи-
рафинирование).
Основные стадии технологии производства компактного молибдена
в виде штабиков илн брикетов:
1) прессование порошка в заготовку прямоугольного сечения в
стальных разъемных прессформах;
2) предварительное спекание при 1000—1100 °С в атмосфере водоро-
водорода в муфельных электрических печах;
3) высокотемпературное спекание (сварка) при 2200—2400 "С в ат-
атмосфере водорода; нагрев осуществляется электрическим током; раз-
разработана также технология вакуумного спекания молибдена в вакуум-
вакуумных печах косвенного нагрева с графитовыми нагревателями
Для получения крупных и профилированных заготовок используют
метод гидростатического прессования, обеспечивающий однородную
плотность.
В соответствии с ТУ 48-19-316—80 молибденовый порошок не дол-
должен содержать посторонних включений, а химический состав его дол-
должен соответствовать следующим нормам, % (по массе): >99,5 Мо;
«0,014 Fe; <0,005 Al; <0,005 Ni; <0,005 Si; «0,003 Mg; «0,015 Na;
<0,05 К; «0,007 Са; <0,4 W; «0,3 (О2+Н2О).
Гранулометрический состав: содержание зерен размером до 5 мкм—
не менее 92 %.
Молибденовый порошок упаковывают в банки из белой жести. Хра-
Хранят порошок в упаковке в сухом закрытом помещении, не содержащем
паров кислот, щелочей и других активных реагентов.
Молибденовые штабики для металлургических целей выпускают по
ТУ 48-19-73—78 трех марок.
Характеристика молибденовых штабиков:
Марка
МШ-В
МШ-1
МШ-2
Область применения
Для основы сплавов
То же
Для легирования
Размеры, мм, не менее
сторона
сечения
15
15
15
длина
500
400
400
377
Химический состав молибденовых штабиков:
0.
В
Mg
С
Al
Fe
Допустимые содержания
примесей, % (по массе)
МШ-В
0,001
0,004
0,001
0,012
МШ-1
0,002
0,005
0,004
0,014
МШ-2
0,002
0,02
0,004
0,014
имесь
сх
В
Si
Ni
Допустимые содержания примесей,
% (по массе)
. МШ-В
0,003
0,002
0,005
МШ-1
0,003
0,002
0,01
МШ-2
0,0014
0,005
Не огова-
оговаривается
Штабики всех марок упаковывают в плотные дощатые ящики, оби«
тые стальной лентой. Хранение производят в упаковке в сухом отап-
отапливаемом помещении. Срок хранения 5 лет.
Предусмотрен выпуск молибденового порошка и штабиков повышен-
повышенной чистоты марок МШЧ-1, МШЧ-2, МПЧ. Во всех марках допустимое
содержание молибдена не менее 99,77 %, допустимое содержание при-
примесей, не более: 0,005 % Fe; 0,01 % Al; 0,03 % Si; 0,01 % Mg; 0,005
(МШЧ-1 и МШЧ-2) или 0,009 (МПЧ) % С; 0,004 % S; 0,004 % Р;
0,001 % As; 0,0001 % Sn; 0,0001 % Pb; 0,0001 % Cd; 0,0001 % Bi;
0,001 % Cu; 0,001 % Zn; 0,2 % W; 0,004 % O2> а в марках МШЧ-1 и
МШЧ-2 также 0,002 % N2 и 0,001 % Н2.
Дополнительными химическими и физико-химическими методами со-
содержание отдельных металлических примесей и примесей внедрения мо«
жет быть снижено на 1—3 порядка и более.
Молибденовые штабики при необходимости перерабатывают метода-
ми пластической деформации на листы, ленту, прутки, проволоку.
Для повышения степени чистоты и получения крупных заготовок
молибдена массой до 2 т применяют вакуумную плавку в дуговых и
электронно-лучевых печах. Получаемые слитки характеризуются круп-
крупнокристаллической структурой. Для измельчения структуры литых за-
заготовок используют модификаторы, а также гарниссажную дуговую
плавку с разливкой металла в изложницы.
В результате дуговой вакуумной плавки с раскислением (С, Ti, Zr,
Hf) содержание газовых примесей в молибдене снижается ориентиро-
ориентировочно до следующих пределов, %: кислород—10~3—10~4; водород —
1—2-10—5; азот—10~3—10~1. Одновременно снижается содержание
легколетучих металлических примесей.
Химический состав порошка, штабиков и слитков молибдена дуговой
плавки, % (по массе):
При-
Примесь
Sn
Pb
Cd
Bi
Cu
Sb
Порошок
0,0001
0,0001
0,0001
0,0001
0,007
0,0001
Штабнк
0,0001
0,00007
0,0001
0,0001
0,0014
0,0001
Слиток
0,0001
0,00006
0,0001
0,0001
0,0006
0,0001
При-
Примесь
Zn
Mg
Al
Si
Fe
Порошок
0,0004
0,0010
0,0017
0,005
0,02
Штабик
0,0004
0,0010
0,0012
0,003
0,017
Слиток
0,0004
0,0005
0,0005
0,0013
0,002
378
Электронно-лучевая плавка обеспечивает получение молибденовых
слитков диаметром до 300 мм и больше. В результате такой плавки
значительно снижается концентрация кислорода, азота, углерода, крем-
кремния, железа, меди, марганца, никеля, кобальта.
Химический состав порошка и слитков молибдена электронно-луче-
электронно-лучевой плавки, % (по массе):
При-
Примесь
Fe
SiO,
Сг2О3
А12О3
Са
Порошок
0,01—0,02
0,005
0,002
0,005
0,009
Слиток
0,001
0,001
0,001
0,001
0,002
Прн-
месь
W
о2
N,
С
н2
Порошок
0,03
0,08—0,12
0,001
0,014
0
0
Слиток
0,03
,0013—0,0018
,0008—0,001С
0,006
0,0005
Молибден производят также в высокочнстом и монокристалличе-
монокристаллическом состояниях. Освоен выпуск монокристаллов молибдена диамет-
диаметром до 31) мм и длиной до 500 мм (ТУ 48-42-25—70) методом элек-
электронно-лучевой зонной плавки. Содержание примесей внедрения в моно-
монокристаллах молибдена, полученных такой плавкой, % (по массе):
0,0008 О2; 0,0004 Н2; 0,0006 N2, 0,001 С.
Содержание металлических примесей в монокристаллах молибдена
после зонной плавки (спектральный анализ):
При-
Примесь
Si
Fe
Си
Cr
Mn
Ni
Co
Распределен»
В ИСХОДНОМ
материале
20
40
40
10
70
10
е примесей С-Ю\ %
по зонам
I
25
1
11
20
2
1
2
II
23
1
8
20
2
1
2
ш
10
1
11
20
2
1
2
конечной
20
1
1
20
7
1
3
Чувстви-
Чувствительность
анализа
Х10~4, %
2
0,5
0,4
10
2
1
1
Методом плазменно-дуговой плавки можно получать монокристал-
монокристаллы молибдена диаметром до 60 мм и массой более 10 кг. Метод обес-
обеспечивает эффективную очистку от примесей внедрения, особенно от уг-
углерода [~0,0001 % (по массе)] и металлических примесей.
Крупные монокристаллы молибдена могут использоваться как ис-
исходные заготовки д.ля переработки на различные полуфабрикаты —
прутки, проволоку, ленту, лист и т. д.
Физические свойства
Атомные характеристики. Атомный номер 42, атомная масса 95,94 а. е. м.,
атомный объем 9,42-10~6 м3/моль, атомный радиус для координацион-
379
иого числа 8 — 0,139 нм. Ионный раднус Мо4+ 0,068 нм, Мов+ 0,065 нм.
Электронная конфигурация внешних оболочек: 4s2p6d6sl. Потенциалы
ионизации молибдена / (эВ): 7,29; 15,17; 27,00. Электроотрицательность
Мо4+ 1,6; Мо6+ 2,1.
Молибден имеет о. ц. к. решетку. Энергия кристаллической решетки
652 мкДж/кмоль. Полиморфных превращений не обнаружено. Значе*
иня периода кристаллической решетки молибдена в значительной сте»
пени определяются содержанием примесей внедрения, особенно угле-
углерода.
Значения периода решетки молибдена разной степени чистоты при
20 °С, определенные прецизионными методами'
Метод получения и вид
молибдена
Чи-
Чистота,
Прнмеси, %
Период
решетки а, им
Вероятная
о:шбка
Восстановление порошка
МоОз в сухом водороде
Порошок высокой чи-
чистоты
Промышленный . . , .
Электролиз расплавлен-
расплавленной соли
Металлокерамический
промышленный штабик .
Дуговая
плавка .
вакуумная
Порошок высокой чи-
чистоты
Промышленный . . , .
99,6
99,9
99,95
0,0015Fe
0,005Si
0.012С
<0,02Ni
<0,10О
0,004—
0,01С;
0,008-
0,01О;
0.005N
0,0050;
0,005N
0,314734
0,314672
0,31474
0,31472
0,31468
0,31472
0,31468
0,314700
0,314696
±0,00004
±0,00006
±0,0003
±0,0002
±0,002
±0,00001
±0,00003
Более низкое значение периода решетки @,3146 нм) было получе-
получено на образцах молибдена, очищенного электронно-лучевой зонной
плавкой.
Период кристаллической решетки в зависимости от температуры:
Т, К
1126
1162
1327
а, нм
0,31621
0,31623
0,31668
т, К
1510
1639
1819
а, нм
0,31706
0,31738
0,31782
т. к
1968
2073
а, нм
0,31832
0,3187
380
Изотопный состав природного молибдена:
Массовое число
Содержание в природной сме-
смеси, %
Массовое число
Содержание в природной сме-
смеси, %
Радиоактивные изотопы молибдена:
92
15,86
97
9,45
94
9,12
98
23,
95 96
15,7 16,5
Продолжение
100
75 9,62
Мас-
Массовое
число
Период
полураспада
Тип распада
Мас-
СОВОР
число
Период
полураспада
распада
89
90
91
93
27 мин
7,1 мин
5,7:2=2 ч
15,5±:0,5 мин
3-103 лет
Р+, К-з
-3
99
101
102
103
104
105
2,8 сут
14,6 мин
12 мии
70 с
1,6 мин
42 с
6-
о
Примечание: C — электрон, Р"^ — позитрон; К-з — К-захват.
Эффективное поперечное сечение захвата тепловых нейтронов B,4±
±0,2).10-28м2.
Работа выхода электронов поликристаллического молибдена ф =
= 4,29 эВ. Анизотропия работы выхода монокристаллического молиб-
молибдена ср.
(Ш) ....
Ф, эВ. . . .
A10)
4,95
A12)
4,60
A00)
4,35
A11)
4,14
A14)
4,18
A16)
4,02
Плотность. Плотность молибдена, определенная рентгенографическим
методом р= 10,218 Мг/м3, пикнометрическим 10,200 Мг/м3. Эксперимен-
Экспериментальные значения плотности молибдена в зависимости от метода полу-
получения Мг/м3:
р, Мг/м1
Порошок 10,28
Спеченный 9,6—10
Литой вакуумной плавки 10,17—10,20
Спеченный деформированный 10,20
Вакуумной плавки, деформированный , , 10,22
Электрические и магнитные. Удельное электрическое сопротивление
поликристаллического молибдена технической чистоты при 293 К р =
= 0,0570+0,0578 мкОм-м, высокочистого монокристаллического молиб-
молибдена при той же температуре р=0,05 мкОм-м; для монокристаллов мо-
молибдена чистотой 99,99% при 4,2 К р=0,045+ 0,102 нОм-м, а отно-
отношение Ргэз к/Р4,2^=1000. Сочетанием химических н физико-химических
методов очистки получены высокочистые монокрнсталлн молибдена с
381
P293R /P4,2r До 100000 и более; ргвз к/р.»,2 к; ДЛя полнкрнсталлического мо-
молибдена технической чистоты составляет 10—100, а при дуговой ваку-
вакуумной плавке может быть увеличено до 1000. В пределах достигнутой
точности измерений анизотропии электросопротивления монокристал-
монокристаллов молибдена не обнаружено.
Удельное электрическое сопротивление деформированного молибде-
молибдена иа 10—15 % выше, чем отожженного.
Малые добавки титана и циркония до —0,5 % (по массе) в сумме
приводят к увеличению удельного электрического сопротивления мо-
молибдена при комнатной температуре до 10—15 %•
Удельное электрическое сопротивление и электрическая проводимость
молибдена (чистотой 99,97 °/о) в зависимости от температуры:
т, к
13
100
200
300
500
700
Р,
мкОм. м
0,005
0,008
0,030
0,050
0,Ю
0,15
о,
МСм/м
200
125
33,4
20,0
10,0
6,67
Т, К
900
1100
1300
1500
1800
2000
Р.
мкОм. м
0,21
0,27
0,34
0,40
0,51
0,531
о,
МСм/м
4,77
3,71
2,95
2,50
1,97
—
т, к
2200
2400
2600
2800
2895
Р,
мкОм ■ м
0,592
0,655
0,718
0,782
0,814
МСм/м
.
Температурный коэффициент электросопротивления: при 273 К а=
= 4,33-Ю-3 К-1, в интервале 273—293 К а = 4,23-10~3 К". В области
температур от комнатной до 2400 К электросопротивление монокрис-
монокристаллов молибдена на 2—3 % ниже электросопротивления поликрис-
поликристаллической проволоки.
Изменение электросопротивления при плавлении (рж/ртв) = 1,23
Температура перехода в сверхпроводящее состояние, определенная
на массивных образцах, 7"с= 0,9-=-0,98 К, на тонких пленках, 7"с = 4-г-
-«-6,7 К.
Температура перехода в сверхпроводящее состояние для монокрис-
монокристаллов молибдена изотропна, а критическая величина напряженности
магнитного поля анизотропна (по аналогии с данными для монокрис-
монокристаллов ванадия, ниобия и тантала).
Значение абсолютного коэффициента т. э. д. с. молибдена е в зави-
зависимости от температуры:
Т, К • •
е, мкВ/К
300
—5
,57
500
11,12
700
14,94
1000
17,16
1400
14,94
2000
6,67
2400
2,87
Т. э. д. с. молибдена по отношению к платине при температуре го-
горячего спая 373,16 К £= + 1,450 мВ; температурная зависимость £Мо__Р1
В температурном интервале 700—1500 К выражается уравнением:
£Mo_Pt=— 6269+10,95 Г+0,015 Я—1,7-Ю-8 Я.
У неотожженных монокристаллов молибдена выявлена незначи-
незначительная анизотропия т. э. д. с. Монокристаллические прутки с ориен-
ориентацией [100] в паре с платиной при 373 К развивают т. э. д. с. на
0,11 мВ большую, чем прутки, ориентированные вдоль [ПО]. Высоко-
Высокотемпературный отжиг при 2273 К устраняет анизотропию т. э. д. с.
Вторично-эмиссионные свойства монокристаллов.
382
(hkl)
A00)
A11)
A10)
A12)
A02)
Поли-
Поликристалл
"max
1,52;
1,58
1,45;
1,40
1,35
1,14
1,25
1,27;
1,28
Epm- таВ
0,350—0,400
0,350 и
0,510
0,440—0,460
0,720—0,760
0,550
0,400
6mas
1,10
1,14
1,02
0,88
_
0,99
Epm*
кэВ
0,350
0,360
0,360
0,520—
0,560
0,370
^max
0,45
0,42
0,43
0,35
0,27
0,38
E"pm- кэВ
1,300—1,600
1,200—1,500
2,500—3,000
1,680—1,720
0,800—1,200
—
Примечание: <*хагх — максимальное значение коэффициента вторичной
эмиссии; 6Юах — максимальное значение коэффициента встииио вторичной эмис-
эмиссии; r)max—максимальное значение коэффициента неупругого отражения; Ерт >
Ерт, ЕрП1 — ускоряющее напряжение первичных электронов.
Постоянная Холла /?=1,8-Ю0 м3/Кл; в интервале 293—800 К прак-
практически не зависит от температуры.
Магнитная восприимчивость % в зависимости от температуры:
Г, К 14,2 20,4 62,8 298 2098
%■№> -И,82 +1,555 +1,13 +0,93 +1,11
Для молибдена чистотой 99,5% в интервале 873—2070 К A/у)Х
X(dx/dr)=0,88-10-8K-'.
Тепловые и термодинамические. Температура плавления tnn =
•=2622 "С, температура кипения *Кип=4804°С, характеристическая темпе-
температура 9d = 445K при низких температурах, 6в=380К при высоких тем-
температурах. Удельная теплота плавления АЯПЛ = 382 кДж/кг, удельная
теплота испарения при температуре кипения ДЯИСП=6191 кДж/кг,
удельная теплота сублимации при абсолютном нуле ДЯсУб1 =
=6754 кДж/кг, а при 298 К 6870 кДж/кг.
Давление пара р:
Г, К 1950 2050 2200
р, Ш 96,72-Ю-7 74,75-10—в 11,38-10-*
Продолжение
Г, К 2300 2400
р Па 57,0- Ю-4 25,0-Ю-3
Давление пара р жидкого молибдена:
Г, К 3000 3330 3750 4300 4580 4810 5077
р-10-5, Па ... 0,0001 0,001 0,01 0,1 0,25 0,50 1,0
Давление пара молибдена при температуре плавления р=3,47 Па.
Термодинамические свойства (энтальпия /, молярная энтропия s°
и приведенный термодинамический потенциал Фт) в твердом состоянии:
383
т, к
298
400
800
1200
1600
2000
2400
2800
2900*
3000*
J, Дж/(моль-Ю
0
2,489
12,970
24,225
36,736
50,376
65,188
81,171
112,928
117,112
s°, Дж/(моль-К)
28,5
35,7
53,7
64,7
74,1
81,7
88,8
94,6
110,7
120,5
Фу, , Дж/(моль-К)
28,5
29,5
37,57
44,97
51,17
56,52
61,29
65,64
71,79
73,09
' Жидкое состояние.
Удельная теплоемкость молибдена при 298 К с,,—248 Дж/(кг-К).
Удельная теплоемкость с„ при низких температурах:
т, к
1
3
с
10
20
Ср, Дж/(кг-К)
0,02-10-?
0,078-10—S
0,02-10-1
0,05-Ю-1
0,03
т, к
30
40
60
80
100
ср, Дж/(кг-К)
0,1
0,24
0,05
1
1.4
Т, К
120
160
200
240
^р. Дж/(кг-К)
1,7
2,0
2,4
2,4
Удельная электронная теплоемкость с^" =[1,82 мДж/(моль-К2)]'Г.
Температурный коэффициент линейного расширения в интервале
293—373 К а = 4,9-10-^5,2-Ю-6 К-
Значения а для молибдена чистотой 99,9 % в зависимости от тем-
температуры:
т,
а-
К
10*
к-* . .
10
0,03
со
0,2
С
ъ
0
-0
,8
70
1,82
90
2,
,7
64
166
4,
,9
37
234
4,
,8
89
293
5,0
Значения а монокристаллического молибдена в зависимости от тем-
температуры:
т, к
373
473
673
a-10s, К~1
5,57
5,76
6,21
г, к
873
1073
1273
ало", К
6,67
7,12
7,57
т, к
1473
1673
1873
аЛ0\ К
8,02
8,47
8,91
384
Теплопроводность X при повышенных температурах:
г, к
К Вт/(м.К)
Поликристалл
80
100
2О0
зов
375
188
162
140
138
132
Г, К
X, Вт/(и.К)
Монокристалл
600
800
1000
1200
1400
151,5
140,0
135
127
107,8
т, к
%, Вт/(м.К)
Монокристалл
1600
2000
2200
2400
104,2
98,5
96,0
92,2
Поверхностное натяжение молибдена при 2893 К сг= 1915 НмН/м.
Поверхностная энергия грани A10) монокристаллического молибде-
молибдена v=1940 мДж/м2.
Энергия дефектов упаковки 30 мДж/м2.
Параметры самодиффузии (предэкспоненциальный множитель Do и
энергия активации Е) молибдена:
Состояние
Монокристалл , , , ,
Поликристалл , . . ,
т, К
2123—2623
2123—2623
О,,, мг/с
о,ыо-4
0,5-10-*
Е, кДж/моль
386,02
405,7
Параметры взаимной диффузии для поликристаллического молиб-
молибдена:
Диффунди-
Диффундирующий
элемент
Н
В
С
с
N
Na*
Na
Si
S
К*
К
Сг
Со
Cs
W
и
и
т, к
1373—1773
1673—1973
—
1073—1273
1073—1273
1173—1373
2220—2470
1073—1273
1073—1273
1473—1623
1273—1743
2073—2448
1173—1479
1173—2273
Образую-
Образующаяся
фаза
Тв. р.
Мо2В
Мо2С
Тв. р.
То же
»
»
MoSi2
Тв. р.
То же
»
»
»
»
»
D,, мг/с
7,6-10—э
6,96-Ю-6
1,64-Ю-7
3,4-10—«
3- Ю-7
2,95-10-!*
4,2-10-и
56,1-10-и
3,2-10-»
5,5-Ю-13
1,78-10-1*
4,8-10-*
3,0-10-*
8,7-Ю-3
5- Ю-'
5- Ю-6
7,6-10-'
Е, кДж/моль
35,2
184,4
341,5
171,5
115,6
89
55,6
154,4
423,5
105,0
57,3
304,48
418,7
117,3
326,57
192,59
319,6
Монокристаллы.
385
Оптические. Коэффициенты излучения (спектральный е^ и интеграль-
интегральный ет) и излучательность (М):
Т, К
273
300
400
600
800
1000
J200
1400
J600
1800
2000
2200
2400
2600
2800
2895
Температура,
яркостиая
@,665 мкм)
_
958
1139
1316
1489
1658
1824
1986
2143
2297
2448
2519
цветовая
_
1004
1207
1411
1616
1823
2032
2244
2456
2672
2891
2997
к
радиа-
радиационная
557
708
864
1024
1187
1354
1523
1693
1866
2039
2122
Коэффициенты излучения
е. (^,=0,665 мкм)
0,420
0,419
0,415
0,406
0,398
0,390
0,382
0,375
0,367
0,360
0,353
0,347
0,341
0,336
0,331
0,328
0,096
0,121
0,145
0,168
0,189
0,210
0,230
0,248
0,265
0,281
0,290
М, кВт/м2
5,5
14,3
31,8
63,0
11,3
192
307
470
695
980
1160
Отражательная способность (коэффициент отражения по):
X, мкм
Поликристалл,
пленка *
0,124
0,155
0,207
0,310
0,620
10
10
35
45
50
>., мкм
V %
Полированный
поликристалл.
монокристалл,
пленка
0,5
0,6
0,8
1.0 •
2,0
46
48
52
58
82
Я, мкм
V %
Полированный
поликристалл,
монокристалл,
пленка
4,0
7,0
10,0
12,0
90
93
94
95
• Угол падения 0°.
В широкой области спектра коэффициент отражения для монокрис-
монокристалла молибдена в несколько раз превышает коэффициент отражения
для поликристалла. Разница в значениях nD для плоскостей A10),
A11) и плоскости A00) достигает 20%, что гораздо больше случай-
случайной ошибки измерений.
Показатель преломления и:
386
X, мкм
0,3
0,4
0,5
0,6
0,7
0,8
0,9
л
2,21
2,66
3,15
3,38
3,48
3,46
3,04
к, мкм
1,0
1,5
2,0
2,5
3,0
3,5
4,0
п
2,62
2,13
1,80
2,10
2,70
2,90
3,47
%, мкм
5,0
6,5
7,0
0,25*
0,50*
0,75*
1,0*
п
4,25
6,00
6,40
0,615
0,782
0,880
0,918
• Данные для пленки толщиной 0,137 мкм.
Механические свойства
Микротвердость Н^ поли- и монокристаллического молибдена при 20 "С,
МПа:
Поликристалл. Чистота 99,8 %. Нагрузка при испытании
0,39 Н 1920-2020
Монокристалл A11) . , . . , 1950
» A12) 10П
» (ПО) 2110
Монокристалл A11), отожженный прн 1000°С , . , 1940
То же, A12) 1830
То же, A00) 1780
То же, (ПО) 1990
Монокристалл A11), облученный дозой 24022 Н/м2,
отожженный 1970
То же, A12) 1940
То же, A00) 1920
То же, (ПО) 2100
Монокристалл A11), облученный дозой 2-10м Н/м2 , 1980
То же, A12) , 1980
То же, A00) , . , . , 2060
То яге, (ПО) . . 2130
Твердость молибдена по Бринеллю НВ при 20 °С, МПа:
Кованый, листовой ..... 2450—2500
Отожженная проволока , , . 1370—1815
Деформированный ..... 2000—2500
Твердость молибдена по Роквеллу при 20° С:
Неотожжениый , HRB 90—100
Отожженный . , HRB 95; HRC 22—27
Механические свойства (при растяжении) поликристаллического и
монокристаллического молибдена (комнатная температура): поликрис-
поликристалл— 0В = 490 + 981 МПа; 6 = 20 + 30%; ф=1+5%; монокристалл —
ов=294+343 МПа; 6=20+25 %; г|з=100 %
Механические свойства молибдена в зависимости от концентрации
примесей при 20 "С:
387
Материал
Газовые примеси, %
(по массе)
ав, МПа
490—981
490—590
294—343
—
20—30
20—25
—
1
100
нв,
МПа
Металлокерамнче-
ский молибден
после высокотем-
высокотемпературного спе-
спекания
Молибден дуго-
дуговой вакуумной
плавки (два пере-
переплава)
Монокрнсталли-
ческий молибден
с ориентацией
[ПО] и [111]
вдоль оси роста
(четыре прохода
зоной)
0,02
0,003
0,0008
0,0003
0,0004
0,004
0,001
0,0006
1470—
1970
1670—
1970
1570—
1670
Уменьшение содержания углерода от 0,017 до 0,004 % снижает со-
соответственно порог хладноломкости молибдена от 200 до —50 °С.
Анизотропия мехаиических свойств прн растяжении монокристаллов
молибдена B0 °С):
[А*/]
[100]
[ПО]
[111]
<JD, МПа
461
313
313
<то 2, МПа
156
176
196
6, %
17
22
20
Ф. %
70
100
100
НВ, МПа
63,7
71,6
50
Механические свойства полуфабрикатов из монокристаллов молиб-
молибдена:
Полуфабрикат
Проволока
Плющенка
Размеры
0 80 мкм
0 15 мкм
0,2X0,3 мм
ав, МПа
686
833
667
6, %
14
8—9
20—25
Првмечание. После деформации и рекристаллизациоииого отжига.
Механические свойства проволоки разного диаметра из монокрис-
монокристаллов молибдена:
388
Диаметр
проволоки,
мкм
300
80
60
40
15
Нагартоваяное
а„, МПа
О
1177
1765
1863
1952
1991
состояние
в, %
1.5
1.5
1.5
1.5
1.5
Отожженное
а , МПа
О
667
686
725
765
833
состояние
в, %
20
14
7
6
8—9
Механические свойства монокристаллов молибдена в зависимости от
масштабного фактора:
Диаметр, мм ..... 5 0,5
Временное сопротивле-
сопротивление, МПа 3530 4700
Относительное удлине-
удлинение, % 18 18
Механические свойства проволоки из монокристаллического молиб-
дена при 20 °С в зависимости от степени деформации (диаметр прово-
локн d):
d, мм . ,
gb, МПа.
1,5* 0,8* 0,3* 0,2* 0,8**0,5**
784 1030 1177 1275 618 588
4—5 3—4 2—3 2 22 23
• Без отжига. ** Отжиг при 900 °С, 1 ч.
Временное сопротивление разрыву в зависимости от температуры и
предварительной обработки:
Молибден повышенной чистоты (taisa—20aC)
.... Без 800 1000 1300 1500
отжига
.... 1060 883 628 442 392
'отж> С
Он, МПа
ав,
С
МПа
Молибден технический (tacu — 20
Без 800 1000
отжига
912 833 578
1200
471
1500
291
Молибден чистотой 99,31 %
nca>
ов, МПа.
—253 —196
530 530
'
исп. С
ав, МПа.
Деформированный молибден
20 200 400
1510 882 638
20
481
800
539
1200
255
Молибден дуговой плавки с 0,003 % О; 0,0003 Н и 0,001 N
, °С 20 105 225 320 455 550 693 787 977 1102
369
по:
Св. МПа 560 457 369 318 296 294 274 247 237 175
Предел текучести в зависимости от температуры и предварительной
Обработки:
Плавленый горячекатаный молибден
fHcn. °С 870* 345*
а02, МПа .... 345 218
26**
438
870**
79,5
1065**
58,8
* Без отжига. •* Отжиг при 1230 °С.
Молибден дуговой, плавки, рекристаллизованный.
Скорость деформирования 0,2 мин-1 в вакууме
tncn, °С 90 105 225 320 450 550
gOi2> МПа 449 324 209 193 179 167
Продолжение
tKCB, °C 693 787 895 977 1105
сто.2) МПа 137 130 127 125 ПО
Молибден дуговой плавки холоднокованый (обжатие 88 %).
Скорость деформирования 0,2 мин-1 в вакууме
/„сп. °С 30 382 572 907 1038
а02
МПа
655 503 400 392
210
Пластические характеристики молибдена в зависимости от темпе
ратуры и предварительной обработки:
Молибден чистотой 99,31 %
t»cn, °С 20 77
б, % 0 0
Ч>, % 4 3,3
Молибден повышенной чистоты (tvcn=20°C)
0T)K, C Без отжига 800 1000
6, %......... 3 (/исп = 200 °С) 8 15
Молибден технический (taca=20°C)
0Tm, °C Без 800 1000 1100
отжига
6, %........ 4 6 13 2,5
f
t
1300
25
1200
1
1500
2,5
455
48', 1
81,5
550
49,0
92,0
693
42,9
96,0
895
37,5
95,5
927
41,5
97,5
Молибден дуговой плавки рекристаллизованный.
Скорость деформирования 0,2 мин~1 в вакууме
/„сп, °С 30 105
6, % 29,0 50,5
ф, %. . 21,5 64,5
Молибден дуговой плавки холод нокованый (обжатие 88 %).
Скорость деформирования 0,2 мин~1 в вакууме
*исп, °С —70 573 721 907 1138
6\ % 1,8 18,1 16,6 17,6 44,7
Молибден плавленый горячекатаный. Отжиг при 1230 "С
НО 5
71,9
9?
26
46
36
870
46
84
980
49
75
1065
25
52
390
Параметры ползучести (е — скорость установившейся ползучести):
О, МПа
8, %/с
t, °С
а, МПа
Е, %/С
t. °С
Молибден дуговой плавки
288
278
237
202
170
137
240
185
154
114
4,28-10-1
6,46-10-1
7,65-10-?
2,55-10-?
5,5-10-3
1,1-10—s
3,7
3,5-10-1
4,3-10-?
7,0-Ю-3
870
870
870
870
870
870
980
980
980
980
106
157
129
105
89,
63,
77,2*
77,2**
45,1*
2,7-10—3
1,2
2,110—х
2,3-Ю-2
7,1-10-3
2,3-10-*
9,0-10-'
1,5-10-е
1,25-10-5
980
1095
1095
1095
1095
1095
1000
1000
1000
• Сжатие. ** Растяжение.
Модуль нормальной упругости Е поликристаллического молибдена
в зависимости от температуры:
t, °C 0 20 400 1200 2000
Е, ГПа 329 317 314 270 177
Модуль нормальной упругости Е монокристаллического молибдена
по кристаллографическим направлениям [hkl]:
\hkl) [Ill] [ПО] [100]
Е, ГПа 294 313 357
Коэффициенты упругости монокристаллов молибдена при 20 °С:
С,=460,0 МПа; с,2= 176,0 МПа; с44=П0 МПа.
Химические свойства
Нормальный электродный потенциал реакции Мо—Зе=е±Мо3+ шо=
=-0,2 В.
Для молибдена наиболее характерны соединения, в которых он про-
проявляет степень окисления +6. Важнейшие из ннх — триоксид молиб-
молибдена, молибденовая кислота и ее соли — молибдаты. Известны также
соединения, отвечающие степени окисления +5, +4, +3 н +2.
Молибден образует ряд оксидов: МоО2, МоО3, Мо4Оц, Мо17О47,
МоаО2з и Мо9О2б. Наиболее устойчивы нз ннх МоО3 и МоО2. МоО3 мо-
может восстанавливаться водородом до металла при 800—900 °С.
Оксид (IV) молибдена МоО^ — темно-коричневый порошок, получае-
получаемый восстановлением МоО3 водородом при 450—470 °С, практически
нерастворим в воде, водных растворах щелочей и неокнсляющих кис«
лот. Азотная кислота окисляет МоО2 до МоО3. Промежуточные оксиды
малорастворнмы в воде, серной и соляной кислотах, а также в раз-
разбавленных растворах щелочей.
Пределы растворимости кислорода в твердой фазе молибдена-зави-
молибдена-зависят от температуры и могут быть описаны'уравнением lgCmax=l,67—
—4870/J A200—1400 °С). При окислении молибдена на воздухе ниже
391
500 "С возникают двухфазные пленки оксидов: внешняя МоОз, внутрен-
внутренняя (очень тонкая) МоО2.
Молибденовая кислота Н2МОО4 малорастворима в воде (раствори-
(растворимость 2,126 г/л при 15 °С и 5,185 г/л прн 80 °С); растворяется в силь-
сильных минеральных кислотах.
Соли молибденовой кислоты — нормальные молибдаты щелочных
металлов — хорошо растворимы в воде, молибдаты щелочноземельных
металлов, свинца, железа, меди, цинка и других металлов в ней мало-
растворимы. Известны следующие молибдаты: нормальный молибдат
натрия Na2MoO4, парамолибдат аммония (NH4NMo7O24-4H2O, тетрамо-
либдат аммония (NH4JMo4O,3, молибдат кальция СаМоО4, молибдат
железа Fe2(MoO4b'nH2O, молибдат свинца РЬМоС>4, молибдат меди
СиМоО4. При действии восстановителей (SO2, H2S, цинка, глюкозы
и др ) на растворы молибденовой кислоты или кислые растворы молиб-
датов выделяются аморфные осадки темно-голубого цвета (молибдено-
(молибденовая синь), имеющие в зависимости от условий выделения состав:
Мо3О23-хН2О; Мо4Оп-д:Н2О.
Иэвестны нитриды молибдена M02N и MoN. В системе молибден—
азот при 1800 °С существует эвтектика Mo—Mo2N. При давлениях азо-
азота до 30 МПа и температурах до 1500 °С на молибдене образуются
пленки Mo2N. Прн более низких температурах нитриды образуются в
проточном NH3. Рост пленок подчиняется параболической зависимости
от времени. Пределы растворимости азота в твердом молибдене опре-
определяются уравнением: lg СШах=3,72—7940/< (900—1800 °С).
Давление диссоциации Mo2N : lg PNa=6,39— 5990/f (900—1800 °С).
Образование гидридов не установлено. Пределы растворимости в
твердом молибдене: lg С= Чг lg Р—3,93—2730/J (900—1500°С).
Известны карбиды Мо2С и МоС. Пределы растворимости углерода
в твердом молибдене: lg С=3,7—9070/J A700—2300 °С).
Для жидкого молибдена при 2780, 3450, 3380 н 4000°С концентра-
концентрация насыщения составляет соответственно: 4,30; 48,8; 50,1 и 53,0 % (ат.).
Образование Мо2С и МоС может происходить при нагревании молиб-
молибдена в различных атмосферах углеводородов. Скорость обезуглерожи-
обезуглероживания в атмосфере кислорода или в атмосфере Н2—СО—Н2О лимити-
лимитируется диффузией углерода из внутренних слоев к поверхности металла.
Далее протекает реакция образования СО и десорбция в газовую фазу.
Обезуглероживание происходит и при нагреве в атмосфере водорода
за счет образования СН4 A000—1500°С, 0,5 Па).
Молибден склонен к образованию комплексных соединений с фос-
фосфорной, мышьяковой, кремниевой и борной кислотами. Одна из рас-
распространенных солей подобного типа — фосформолибдат аммония
(NH)[P(MO)]6HO
K[Ci0L]2
Молибден образует три сульфида: M0S3, M0S2 и M02S3. Практиче-
Практический интерес представляют первые два. MoS2 встречается в природе в
виде минерала молибденита — основного источника получения молиб-
молибдена, а также может быть получен нагреванием без доступа воздуха
высшего сульфида, действием паров серы на молибденовый порошок,
сплавлением Мо03 с содой и серой. Высший сульфид MoS3 осаждается
при пропускании сероводорода в нагретые подкисленные растворы мо-
либдатов.
Молибден образует ряд хлоридов и оксихлоридов: МоСЬ, МоС14,
МоС13, МоС12, МоО2С12, МоОСЦ.
Существуют ограниченные растворы в жидком и твердом состояние
ях с медью, серебром н золотом. При взаимодействии молибдена с бе-
бериллием образуется несколько соединений: МоВе, МоВе2, MoBei2, МозВе
и МоВе20 или МоВе28; между молибденом и МоВе при 1800 °С образу-
образуется эвтектика.
392
Взаимодействия молибдена с магнием не установлено.
Методами порошковой металлургии получено соединение MoZn6,
а пропусканием газовой смеси MoCls и Аг через жидкий цинк — соеди-
соединение MoZn2 с орторомбнческой кристаллической решеткой.
Установлено, что в ртутн прн комнатной температуре растворяется
2-10—5 % (по массе) молибдена.
Со скандием, нттрием и лантаноидами молибден образует системы
эвтектического нли монотектнческого типа. Промежуточные фазы от-
отсутствуют. Взаимная растворимость компонентов не превышает деся-
десятых долей процента (по массе).
В системе молибден—бор установлено существование нескольких со-
соединений: М02В, MoB, MoB2, Mo2B5, MoBi2. Растворимость бора в твер-
твердом молибдене при 2000 °С не превышает 0,015 % (по массе). Не»
сколько соединений образуют между собой молибден и алюминий:
Мо3А1, Мо37А163, MoAl, MojAle, MoAii2, МоА16, МоА15 и МоА14.
Установлено существование соединения Mo3Ga с кубической струк-
структурой типа P-W и температурой перехода в сверхпроводящее состоя-
состояние 9,8 К.
С Р-титаном молибден образует непрерывные твердые растворы, а в
а-титане при 500—600 °С растворяется в количестве 0,3—0,5 % (по
массе).
В системе молибден—цирконий образуется фаза Лавеса Mo2Zr по
перитектической реакции при 1900 °С. Предельная растворимость мо-
молибдена в р-цирконии ~20 % (по массе), а циркония в молибдене.—
около 10 %•
В системе молибдей—гафний также образуется фаза Лавеса Mo2Hf,
имеющая узкую область гомогенности и два полиморфных превра-
превращения. " ~
С кремнием молибден образует соединения M03S1, M05S13, MoSij.
Растворимость кремния в молибдене при 1820 °С достигает 2,9% (по
массе).
В системе молибден—германий установлены следующие соединения:
Mo3Ge, Mo5Ge и MoGe2.
В системах с ванадием, ниобием и танталом наблюдается неограни-
неограниченная растворимость в жидком и твердом состояниях.
С фосфором молибден образует соединения МозР, МоР и МоР2.
В системах с мышьяком и сурьмой установлено существование фаз
M05AS4, M02AS3, M0AS2 и Моз8Ь7.
В системе молибден—висмут промежуточных фаз не обнаружено.
Молибден неограниченно растворяется в хроме и вольфраме в твер-
твердом и жидком состояниях. При взаимодействии с ураном установлена
промежуточная фаза. В системе имеются перитектнческое и эвтектоид»
ное превращения.
Данные о взаимодействии молибдена с марганцем противоречивы.
Можно предположить, что марганец в значительной степени растворя-
растворяется в твердом молибдене. В системе обнаружена также о-фаза, имею-
имеющая узкую область гомогенности.
В системе молибден—технеций установлено существование твердых
растворов и промежуточных фаз: |3-фазы с кубической решеткой типа
0-W и тетрагональной ст-фазы. Растворимость технеция в молибдене при
1200 н 1800°С соответственно 36 и 50% (ат.). Состав Р-фазы соответ-
соответствует 55% (ат.); область гомогенности о-фазы при 1200°С отвечает
65—74 % (ат.) технеция.
Подробно исследована система молибден—рений. При комнатной
температуре предельная растворимость рения в молибдене составляет
50% (по массе). В системе наблюдается образование сг- и /-фаз.
здз
Для систем молибдена с металлами VIII группы характерно обра-
образование промежуточных фаз, особенно часто образуются а- и е-фазы.
Наблюдается ограниченная растворимость компонентов друг в друге,
которая увеличивается с ростом температуры. Особенно значительные
области твердых растворов A0—20 % и более) существуют в системах
молибден—рутений, молибден—родий, молибден—осмий, молибден-
иридий, молибден—платина.
Технологические свойства
Температура перехода молибдена из пластичного в хрупкое состояние
(t)
Молибден
Металлокерамический ....
Дуговой вакуумной плавки , .
Монокристаллический . , . ,
Газовые примеси, %
о2
0,02
0,003
0,0008
Н2
0,0003
0,0004
0,004
0,001
0,0006
200—300
25
—196
Высокочистые монокристаллы очень пластичны. Так, монокристал-
монокристаллы диаметром 12 мм при комнатной температуре могут быть завязаны
двойным узлом, прокатаны в фольгу и протянуты в проволоку микрон-
микронных сечений.
Для увеличения выхода годного при получении полуфабрикатов нз
монокристаллов на первых стадиях деформации заготовки нагревают
до 600—800 °С. Молибден технической чистоты нагревают под перво-
первоначальную деформацию до 1500 °С. Полуфабрикаты (фольга, проволока,
плющенка) из монокристаллов молибдена сохраняют высокие пластиче-
пластические свойства, хотя находятся уже в полнкристаллическом состоянии.
Неблагоприятное влияние наклепа уменьшается при получении в
результате пластической деформации направленной структуры.
При отжиге холоднодеформнрованных образцов молибдена сущест-
существенного роста зерен не наблюдается до 1300°С; отжиг при 1400 "С при-
приводит к заметному росту зерен при степени деформации 10%; выше
1400 °С укрупнение зерен идет при всех степенях деформации; критиче-
критическая степень деформации, при которой происходит особенно интенсив-
интенсивный рост зерен, сдвигается до 7,5 %. Температура начала рекристалли-
рекристаллизации определяется степенью чистоты металла и составляет для метал-
локерамического молибдена 1260—1390 °С, для молибдена дуговой ва-
вакуумной плавки 950—1050 "С и монокристаллнческого 550—650 °С.
Молибден, полученный в виде штабиков методами порошковой ме-
металлургии, в дальнейшем подвергается ковке и волочению или про-
прокатке на лист. Температура ковки составляет 1250—1100 °С, а воло-
волочения 750—500 "С. После ротационной ковки заготовку перед волоче-
волочением подвергают термической обработке. При волочении нагрев
допускается на первых стадиях деформации, в дальнейшем волочение
осуществляется вхолодную. Окончательно проволоку подвергают тер-
термической обработке в вакууме или инертном газе для получения не-
необходимой структуры и механических свойств. При необходимости по-
получения монокрнсталлической структуры проволоку непрерывно пропу-
пропускают через горячую зону с температурой, обеспечивающей
394
формирование такой структуры путем рекристаллизации. В последнее
время для получения молибденовых прутков ротационную ковку заме-
заменяют прокаткой в калибрах в условиях всестороннего неравномерного
сжатия. Это резко сокращает количество дефектов, возникающих в про*
цессе пластической деформации, выравнивает механические свойства по
сечению, повышает технологическую пластичность, значительно улуч-
улучшает условия труда. Нагрев молибдена под обработку производят в ат-
атмосфере водорода.
Предварительная обработка литого молибдена и его сплавов — обыч-
обычно горячее прессование, в результате которого уменьшается ликвация,
измельчается грубая литая структура, а слиток приобретает форму,
удобную для дальнейшей обработки. Весьма эффективным оказался
метод гндроэкструзии.
Температуры начала прокатки 1200—1300 °С. Обжатия на начальных
стадиях — максимально возможные B0—40% за проход), что необхо-
необходимо для проработки всего поперечного сечення заготовки и измельче-
измельчения зерна. Листы молибдена толщиной 0,5 мм можно обрабатывать
вхолодную. Постепенное снижение температуры прокатки в известной
мере предохраняет металл от загрязнения примесями.
Молибден хорошо поддается обработке резаннем (токарная обработ-
обработка, фрезерование, сверление, расточка и т. д.). При такой обработке
используют смазочные серусодержащие масла. Шлифовку производят
кругами из оксида алюминия с применением охлаждения.
Молибден сваривается методами дуговой и контактной сварки в за-
защитной атмосфере аргона или гелия и с применением вольфрамового
электрода. Пайку молибдена производят мягкими и твердыми припоя-
припоями, в том числе медными и серебряными, без флюса.
Поверхностное натяжение молибдена при 2600 °С равно 1,915 Дж/м2.
Области применения
Молибден, полученный методами порошковой металлургии, в больших
количествах используется в качестве легирующей добавки к различный
сплавам, в том числе высококачественным легированным сталям.
Высокая коррозионная стойкость молибдена в серной, соляной, фос-
фосфорной кислотах, расплавах солей, стекла, в ряде агрессивных газовых
сред позволила применить его для изготовления оборудования химиче-
химической, нефтеперерабатывающей и стекольной промышленности. Молибден
используют при изготовлении массивных вентилей, теплообменников,
деталей оборудования для хлорирования при высоком давлении, дета-
деталей, работающих в иодидных средах, электродов для плавки стекла
и т. д. Молибденовые электроды применяют прн электролизе магния,
плутония, тория и урана нз расплавленных солей, в процессах восста-
восстановления и очистки израсходованного ядерного топлива, протекающих
в расплавленных смесях галоидных солей.
Благодаря близости значений коэффициентов термического расшире-
расширения кремния н молибдена последний является хорошим материалом для
дисков кремниевых выпрямителей. Применение молибденовой фольги в
качестве материала подложки для сульфида кадмня в солнечных бата-
батареях позволило в пять раз уменьшить ее массу по сравнению со стек-
стеклянной подложкой при одновременном увеличении гибкости и плас-
пластичности подложки.
Молибден и его сплавы, полученные методами порошковой метал-
металлургии, широко применяются в электротехнике, электронике, приборо-
приборостроении (контакты, ламели, аноды, сетки, вводы, спирали, электроды,
подвесы и т. д.). Наблюдается тенденция замены спеченного молибде-
395
на вакуумно-плавленым и даже монокристаллическим. Использование
вакуумно-плавленого молибдена позволяет значительно улучшить ра-
рабочие параметры электровакуумных приборов путем повышения стабиль-
стабильности работы деталей при повышенных температурах н уменьшения га-
зовыделення, увеличить выход годной продукции благодаря высокой
технологической пластичности, сократить время откачки при сборке при-
приборов. Лента из монокристаллов молибдена применяется в качестве
токовводов дуговых ламп. Сплавы молибдена с рением используются в
качестве подогревателей в водородных тиратронах и клипперных дио-
диодах и в качестве материала для упругих элементов подвесок, растяжек,
торсиоиов различных приборов.
Молибден и его сплавы широко применяются для изготовления
различных деталей (нагревательные элементы, тепловые экраны, крепеж-
крепежные детали, поддоны, направляющие, лодочки и т. д.) вакуумных на-
нагревательных печей и печей с защитной атмосферой.
Молибденовые сплавы используют для изготовления различных
деталей самолетов, ракет и космических аппаратов. Сплавы TZM ис-
используют для изготовления сопел ракетных двигателей иа твердом топ-
топливе, носовых конусов ракет, передних кромок летательных аппаратов,
рулей, панелей тепловой защиты, сотовых конструкций, а также раз-
различных крепежных деталей.
Высокая удельная прочность и коррозионная стойкость в парах и
расплавах щелочных металлов делают молибденовые сплавы перспек-
перспективными материалами энергосистем космических аппаратов Турбинные
лопатки н сопла из сплавов TZM н TZC успешно выдерживают дли-
длительные испытания в установках, в которых рабочей средой являются
пары цезия и калия.
Перспективной областью применения молибденовых сплавов явля-
является атомная энергетика. В ряде европейских и американских проектов
предусматривается применение молибдена и сплава TZM в ядерных
реакторах в качестве материала оболочек тепловыделяющих элементов
и пружинных деталей, работающих в жидких щелочных металлах,
Молибденовые сплавы используют для изготовления пресс-форм и
стержней машин для литья под давлением алюминиевых, цинковых и
медных сплавов.
Молибден и его сплавы применяют при обработке металлов давле-
давлением (оправки прошивиых станов, сильно нагруженные матрицы для
прессования фасонных профилей, матричные вставки и т. д), при ме-
механической обработке (молибденовые держатели при сверлении, шли-
шлифовке, фрезеровании для обеспечения требуемой жесткости станка).
Одной из возможных областей применения молибденовых сплавов
является их использоваине в виде высокопрочной проволоки для арми-
армирования композиционных материалов для работы при повышенных тем-
температурах.
6.8. ВОЛЬФРАМ [1-35, 48, 49, 162, 163,
165, 255—258, 263—271]
Общие сведения и методы получения
Вольфрам (W) — тяжелый металл светло-серого цвета в компактном
состоянии н темно-серого в диспергированном. Открыт в 1781 г. швед-
шведским химиком Шееле при разложении кислотой минерала тунгстена
(«тяжелый камень»), впоследствии названного шеелитом. В 1783 г. из
другого минерала — вольфрамита — была выделена вольфрамовая кис-
396
лота и получен порошок вольфрама путем восстановления углеродом
триокснда вольфрама. С историей открытия металла связаны и его
названия: вольфрам на русском, немецком, шведском и других языках
и тангстен на английском.
Большое промышленное значение вольфрам приобрел примерно че«
рез 100 лет после открытия. Стимулировало развитие вольфрамодобы*
вающей промышленности применение этого элемента в качестве леги-
легирующей добавки к быстрорежущей стали. Разработка Кулиджем в
1909 г. промышленного способа получения ковкого металла позволила
реализовать изобретение А. Н. Ладыгина A900 г.) и применить вольф-
вольфрам в качестве тел накала, а затем в радиоэлектронике. В конце двад-
двадцатых годов были разработаны твердые сплавы, основным компонентом
которых стал карбид вольфрама.
Содержание вольфрама в земной коре Ы0~4% (по массе).
В самородном состоянии в природе не встречается. Известно около
15 различных минералов вольфрама. Практическое значение имеют
минералы группы вольфрамита и шеелит. Вольфрамит представляет
собой твердый раствор вольфраматов железа и марганца (Fe, Mn)WC>4,
а шеелит — чистый вольфрамат кальция — CaWO4. Наиболее богатые
вольфрамовые руды содержат 0,2—2 % WO3.
• Вольфрамит, шеелнт и вольфрамовый скрап — исходные материалы
в технологической схеме получения чистого вольфрама. Вольфрамовые
руды обогащают методами гравитации, флотации, магнитной и элек-
электростатической сепарации, химического обогащения, получая концен->
траты, содержащие 55—65 % WO3, Разложение вольфрамовых коицен*
тратов осуществляется автоклавно-содовым способом, позволяющим пе*
реводить в раствор до 99,5 % W. Известны также методы разложения
концентратов кислотами, методы сорбции и экстракции из водных рас-
растворов, электротермии, хлорно-плазмеиной переработки. Получаемая
вольфрамовая кислота H2WO4 (кристаллический порошок желтого цве-
цвета) подвергается дополнительной очистке путем перевода в раствор
паравольфрамата аммония (NH4JWO4. При этом соединения марганца,
кремния, железа и кальция остаются в нерастворимом осадке. При по-
последующем осаждении паравольфрамата аммония из водного раствора
происходит очистка от молибдена, железа, мышьяка, серы. Параволь-
фрамат аммония подвергается прокалке при 500—850 "С, в результате
чего разлагается до WO3 чистотой не менее 99,5 %. При получении воль-
вольфрама с присадками оксидов кремния, калия, алюминия, тория послед-
последние вводятся в \УОз который повторно прокаливается. Восстановление
\УОз до металлического вольфрама производится водородом в две ста-
стадии: первое восстановление до WO2 при 650—670 °С и второе восста-
восстановление до вольфрама, содержащего менее 0,25 % кислорода, при
800—870 °С. Температура процесса изменяется в зависимости от коли-
количества и состава присадок. Полученный металлический порошок про-
просеивается, перемешивается, увлажняется раствором глицерина в спирте
и прессуется в штабики. Штабики подвергают предварительному спе-
спеканию в атмосфере сухого водорода при 1000—1300 °С и высокотемпе-
высокотемпературному спеканию в атмосфере влажного водорода при температурах
до 3000 °С. Нагрев штабиков при высокотемпературном спекании осу-
осуществляется пропусканием тока, составляющим приблизительно 93 %
от тока переплава. Штабики имеют следующие размеры: сторона сече-
сечения— не менее 7 мм и не более 15 мм, длина — не менее 300 мм. При
необходимости может быть получено и большее сечение — до 25X25 мм.
Штабики спеченного вольфрама служат исходными заготовками для
получения полуфабрикатов в виде листов, ленты, фольги, прутков, про-
проволоки, а также для переплава в электродуговых и электронно-лучевых
печах.
397
Содержание примесей в разных марках вольфрама (ВЧ, ВМ, ВА,
ВРА, ВТ) находится в пределах, % (по массе): 0,01—0,02 О; 0,02 SiO2;
0,001—0,002 А12О3; 0,005—0,010 Fe2O3; 0,002—0,005 СаО; 0,01 Мо;
0,001 Ni.
Средний гранулометрический состав вольфрамовых порошков, исполь-
используемых для получения штабиков, %:
Марка вольфрама
ВА
ВА (мелкозерни-
вч..;..:
Размеры
0-1
46
60
40
1-2
36
26
34
зерен, «
2-3
16
13
21
«км
3—4
2
0
5
Максималь-
Максимальный размер
единичных
зерен, мкм
5
3
4
Насыпная
масса, Мг/м"
<2,15
1,3—1,8
>2,5
Максимальное содержание примесей в вольфрамовом порошке ву-
сокой чистоты, % (по массе): 0,0001 Bi; 0,005 Fe; 0,001 Al; 0,002 Si;
0,002 Ca; 0,001 Mg; 0,005 Ni; 0,320 Mo; 0,008 C; 0,0035 S; 0,0035 P;
0,001 As; 0,0001 Pb; 0,0001 Sn; 0,0001 Cd; 0,0010 Zn; 0,2000 (O2+H2O);
0,003 Cu.
Максимальное содержание примесей в вольфрамовых штабиках вы-
высокой чистоты, % (по массе): 0,002 Si; 0,0035 Р; 0,0035 S; 0,008 С;
0,001 As; 0,001 Mg; 0,005 Fe; 0,001 Al; 0,0001 Sn; 0,0001 Pb; 0,0001 Cd.
Вольфрамовый порошок упаковывают в банки из белой жести с хо-
хорошо пропаянными швами. Хранят вольфрамовый порошок в сухом по-
помещении, не содержащем паров кислот и щелочей. Штабики плотно
упаковывают рядами в деревянные ящики. Срок хранения пять лет.
Наряду со спеканием компактный вольфрам высокой плотности по-
получают также методами осаждения из газовой фазы, электрохимическим
и плазменным осаждением, дуговой, в том числе гарннссажной, и элек-
электронно-лучевой плавками, выращиванием монокристаллов в специальных
кристаллизационных аппаратах с использованием электронного и плаз-
плазменного нагревов (электронно-лучевая зонная плавка, плазменно-дуго-
вая плавка). Плавка вольфрама в дуговых и электронио-лучевых печах
обеспечивает эффективную очистку от примесей и получение крупных
заготовок массой до 3000 кг, предназначенных для изготовления листов,
профилей, труб и других изделий методами фасонного литья, прессо-
прессования, прокатки. Для измельчения зерна с целью повышения техноло-
технологической пластичности применяют модификаторы и раскислителн (на-
(например, карбиды циркония, ниобия и т. д.), а также гарниссажную
плавку с разливкой металла в изложницу. Для снижения содержания
примесей и одновременно создания более мелкозернистой структуры ис-
используют дуплекс-процесс: электронно-лучевая плавка + электродуговая
плавка Наиболее глубокая очистка от примесей реализуется при вы-
выращивании монокристаллов вольфрама. При этом у вольфрама появ-
появляются особые свойства, присущие только монокристаллическому со-
состоянию, в частности анизотропия свойств, более высокая по сравнению
с поликристаллами эрозионная стойкость, высокая устойчивость к рас-
расплавам и парам щелочных металлов, к термоциклированию, облучению,
лучшая совместимость со многими неорганическими, в том числе метал-
металлическими, материалами и т. д.
Содержание примесей в вольфраме разных марок, % (по массе):
398
Характеристика вольфрама
С
G—10). 10—3
5-10-*
2-10-§
5-
1-
1-
О,
10—§
10-*
10-«
Другие
примеви
Металлокерамический
марки ВЧ
Монокристалл после
электронно-лучевой зон-
иой плавки, два прохода
по 4 мм/мин
Монокристалл после
илазменно-дуговой плав-
плавки, двойной переплав
1,5-10-3
7- Ю-*
3,5-10-*
89-Ю-З
78-
12-10-8
Физические свойства
Атомные характеристики. Атомный номер 74, атомная масса
183,92 а. е. м., атомный объем 9,54-10-' м3/моль, атомный радиус
0,140 нм, ионные радиусы W*+ 0,068 нм и We+ 0,065 им. Потенциалы
ионизации / (эВ): 7,98; 17,7; 24. Электроотрнцательность W4+ 1,6;
We+ 2,0.
Вольфрам — мономорфный металл с о. ц. к. решеткой. Энергия крис
таллической решетки 905 мкДж/кмоль. Координациониое число 8. Пе-
Период кристаллической решетки в зависимости от чистоты вольфрамаз
0,31648-5-0,31651 нм при 293 К; при 4,2 К составляет 0,3161 нм. Из-
Известна метастабильная фаза р, получаемая восстановлением \УОз водо-
водородом при 500 °С и отвечающая составу Wu-aA Температура иеобра»
тимого превращения р-их составляет 520 °С.
Электронная конфигурация изолированного атома Бв'
Изотопный состав вольфрама:
Массовое
число
173
174
176
177
178
179
181
185
187
188
189
Период
полураспада
960 с
2040 о
2,3 ч
21 сут
21,5 сут
2400 с
145 сут
73,2 сут
1,005 сут
65 сут
660 с
Форма и энергия излучения, мэВ
К-з*
К-з
К-з; Р+
К-з; у, 0,5; 1,2
К-з; Р+
К-з
К-з
р-, 0,426; 0,37; у, 0,056; 0,57;
0,77
Р~, 1,33; 0,63
6-
Р-
* К-з — /(-захват.
Эффективное поперечное сечеиие захвата тепловых нейтронов воль-
вольфрама A9,2±0,1)-10-28 м*.
Эффективное поперечное сечение захвата тепловых нейтронов есте-
естественных изотопов вольфрама:
399
Массовое число. .
а-1028, м2 . . . .
180
60+60
182
19+12
183
11 + 1
184
2,0+0,3
•186
34+3
Работа выхода электронов в вакууме <р = 4,51 эВ.
Анизотропия работы выхода монокристаллов вольфрама:
[Ш\ (ПО) A12) A00) A11) A16)
<р,эВ 5,35 4,80 4,69 4,40 4,32
Плотность. Плотность вольфрама, определенная пикнометрическим
способом, р= 19,23 Мг/м3. Для монокристаллического вольфрама она
составляет 19,246 Мг/м3.
Влияние обработки (волочения) на плотность р чистого вольфрама:
Диа-
Диаметр,
мм
5,6*
5,0
4,0
р, Мг/м»
17,0
18,45
19,00
Диа-
Диаметр,
мм
3,0
2,0
1.0
р, Мг/м1
19,20
19,22
19,23
Диа-
Диаметр,
мм
0,5
0,3
0,1
р, Мг/м»
19,22
19,22
19,21
Диа-
Диаметр,
им
0,05
0,03
р, Мг/м'
19,20
18,95
• Пруток.
Электрические и магнитные. Удельное электрическое сопротивление
и относительное электросопротивление для поликристаллического воль-
вольфрама при 300 К составляют 0,056 мкОм-м и 30—40 соответственно,
а для высокочистого монокристаллического 0,050 мкОм-м н 10000—
20000. Удалось получить высокочистые и совершенные монокристаллы
вольфрама с относительным электросопротивлением, составляющим не-
несколько десятков и даже сотеи тысяч. В пределах достигнутой точно-
точности эксперимента анизотропия удельного электросопротивления моно-
монокристаллов вольфрама не обнаружена. У вольфрама наблюдается умень-
уменьшение удельного электрического сопротивления с ростом давления, его
барический коэффициент A/р) {dpjdP) = 1,37- 10~и Па-1 при гидроста-
гидростатическом давлении 1 ГПа.
Влияние температуры на удельное электрическое сопротивление р и
удельную электрическую проводимость а вольфрама чистотой 99,5 %
(по массе):
т. к
43
100
200
300
500
700
900
р, мкОм • м
0,005
0,016
0,034
0,056
0,10
0,15
0,21
С, См/м
200
62,6
29,5
17,9
10
6,67
4,77
т, к
1100
1300
1500
1800
3200
3655
р, мкОм.м
0,27
0,33
0,40
0,51
0,995
1,175
а, См/м
3,71
3,03
2,5
1,97
1,05
0,855
Температурный коэффициент удельного электрического сопротивле-
сопротивления вольфрама при 273 К а=3,11-10-3 К, в интервале 273—473 К
а = 5,0'10-3 К.
400
Изменение удельного электросопротивления при плавлении вольфра-
вольфрама рж/Ртв=1,08.
Влияние пластической деформации на удельное электрическое сопро-
сопротивление р тянутой вольфрамовой проволоки (d — диаметр проволоки):
d, мм
Сварной
5,0
4.0
р, мкОм м
0,0613
0,0558
0,0548
1
d.
3
?
мм
,0
,0
,0
р.
0
0
0
мкОм м
,0545
,0546
,0558
d.
0
0
0
мм
.5
,3
,1
Р.
0
0
0
мкОм-м
,0582
,0602
,0655
d, мм
0,05
0,03
0,012
Р.
0
0
0
мкОМ' м
,0696
,0727
,0750
Влияние отжига на удельное электрическое сопротивление вольфра-
вольфрамовой тянутой проволоки:
г, к
р, мкОм м Г, К
р, мкОм м
Г, К
р, мкОм м
Г, К
р, мкОм м
573
673
0,0617
0,0600
0,0591
823
873
923
0,0547
0,0543
0,0530
973
1073
1273
0,0528
0,0523
0,0518
1473
2673
0,0500
0,0484
Т. э. д. с. вольфрама по отношению к платине при температуре го-
горячего спая 173,16 К £=—0,15 мВ; при 372,16 К £= + 1,120 мВ,
£w_p, = 109+4,2 <+30,6-10-3/2—7,6-10-° t3 (в интервале 700—1500 К).
Абсолютный коэффициент т. э. д. с. вольфрама е при различных
температурах.
Т, К 300 500 700 1000 1400 2000 24010
е, мкВ/К 1,07 7,53 12,66 17,57 19,60 15,05 8,3i9
Температура перехода в сверхпроводящее состояние Тс = 0,0154 К;
напряженность критического поля #0=91,54 А/м. В тонких пленках тем-
температура перехода вольфрама в сверхпроводящее состояние возраста-
возрастает до 1,7—4,1 К.
Вторичноэмиссионные свойства (анизотропия) при 20 °С:
Параметры
вторично-эмис-
вторично-эмиссионных свойств
<*тах
Ерт, кэВ
°тах
Е'рт > кэВ
Лтах
Ерт, кэВ
Кристаллографические
(Ш0)
1,66
0,780
1,18
0,480
0,6
1,400—
1,500
<ш>
1,58
0,670
1,12
0,560
0,55
1,450-
1,550
плоскости (Л
(ПО)
1,48
0,550
и 0,720
1,06
0,530
0,6
2,200—
2,600
. к, 1)
A16)
1,39
0,820
1,11
0,810
0,40
1,860—
1,900
Поли-
Поликристалл
1,42
0,700
1,10
0,400
0,45
•401
Продолжение
Примечание. omax — максимальный коэффициент вторичной электронной
эмиссии; 6тах — максимальный коэффициент истинно-вторичной эмиссии;
Лтах —максимальный коэффициент неупругого отражения электронов, Ерт,
Ерт< Ерт ~ ускоряющее напряжение первичных электронов.
Постоянная Холла вольфрама при 293 К #=4:0,856-10~10 м3/Кл.
Магнитная восприимчивость вольфрама при 298 К 7=0,32-Ю-9.
В интервале температур 300—1670 К (d%/dT)>Q, в интервале 1070—
2070 К A/х)(йх/^)=0,877-10-1() К'1.
. Тепловые и термодинамические. Температура плавления tun =
=3380 °С, температура кипения <Кип=5367°С. Характеристическая тем-
температура вольфрама, определенная по упругим постоянным, 0с =
= 384,3 К, по теплоемкости 378 К, по электросопротивлению 381 К,
рентгеновским методом 338 К. Удельная теплота плавления ДЯПЛ =
= 192,34 кДж/кг, удельная теплота испарения АЯИСп=4007 кДж/кг,
удельная теплота сублимации Д//субл=5000 кДж/кг. Давление пара р
в зависимости от температуры:
Т, К 2500 2600 2700 2800
р, Па 0,806-10-' 0,397-10—в 0,173-10—в 0,689-10—Б
Т, К 2900 3000 3100
р, Па 0,248-10-* 0,818-Ю-4 0,250-10—а
Давление пара вольфрама при температуре плавления р = 4,28 Па.
Молярная энтропия вольфрама s° в зависимости от температуры:
Т, К 298 500 1000 1500
s°, Дж/(моль-К) 33,64 46,61 64,78 76,15
Продолжение
Т, К 2000 2500 3000
s°, Дж/(моль-К) ..... 84,69 91,72 97,79
Удельная теплоемкость вольфрама при 298 К ср=136 Дж/(кт-К).
В интервале 300—360 К теплоемкость определяется уравнением. ср =
= 136,058+128,99-10-3 + 4,12-103-Т'-2+6,42-10-13-Г2. Удельная элек-
электронная теплоемкость с^= [0,90 мДж/(моль• К)] Т.
Теплопроводность А, вольфрама, содержащего 0,01 % (по массе) мо-
молибдена и следы железа, кремния, меди:
т к ^
Я,'Вт/(м'-К)'. '• • • • 418,7
Теплопроводность монокристаллического вольфрама высокой чисто-
чистоты при 4,2 К составляет 8-Ю4 Вт/(м-К); с ростом температуры в ин-
интервале 20—40 К уменьшается по кубической зависимости, дальнейшее
снижение теплопроводности до 100 К пропорционально Г2.
Температуропроводность а вольфрама в зависимости от темпера-
температуры:
402
16
1222
,0
30
904,
5
80
200,1
100
189,5
200
165,0
375
154,0
г, к
а-10».
М2/С
Т, К
а-10»,
м*/с
Г, К
а-10»,
м2/с
Г К
а-10»,
1100
1200
1300
46,3
44,3
42,4
1400
1500
1600
40,7
39,1
37,6
1700
1900
2000
36,3
34,1
33,2
2100
2200
2400
32,4
31,5
29,8
Примечание. Содержание примесей в вольфраме, % (по массе):
0,0001 Мо, 0,0001 На, 0,0001 N2, 0,001 О2, 0,02 С.
Температурный коэффициент линейного расширения а при различ-
различных температурах вольфрама чистотой 99,9 %:
Г, К
40
80
100
140
а. 10е,
К
0,4
1,8
2,3
3,2
г, к
180
373
473
а-Ю5.
к-1
3,7
4,3
4,5
Г, К
873
1273
1473
1873
а-10»,
к-1
5,29
6,07
6,46
7,23
т.к
°573
2173
3273
а-10»,
к-1
7,7
8,05
8,92
Температурный коэффициент линейного расширения в интервале
123—2403 К а=5,5-10-6 К.
Величина поверхностного натяжения жидкого вольфрама при тем-
температуре плавления ст=2300 мН/м.
Поверхностная энергия монокристалла вольфрама [кристаллографи-
[кристаллографическая плоскость A10)] v=2455 мДж/м2.
По данным рентгенографических исследований, энергия дефектов
упаковки вольфрама 300 мДж/м2.
Параметры самодиффузии поликристаллического вольфрама: в ин-
интервале 2273—2973 К предэкспоненциальный множитель D0=0,54-10~4,
энергия активации £=505 кДж/моль; в интервале 2013—2373 К Do=-
= 1,8-10-7, £=398 кДж/моль.
Параметры взаимной диффузии элементов по объему зерен (ос-
(основной элемент вольфрам)-
Диффунди-
Диффундирующий
элемент
Н
Li
Be
В
С
С
S
Nb
Та
г. к
1100—2400
1003—1403
1273—1473
1373—1773
2073—3073
1273—2173
2173—3473
1573—2673
1573—2673
Образующаяся фаза
Твердый раствор
То же
WBeu
W2B
W2C
W2C
Твердый раствор
То же
»
Do. м!/с
4, МО-7
(82±40)-10—*
2, 36. Ю-4
1,48-10-е
9,22-Ю-7
1,64-Ю-7
2,17.10-»
3,01-Ю-4
3,05-10-*
Е,
кДж/моль
3,8
231,1
280,31
269,0
169,1
435,43
284,0
576,0
586
403
Оптические. Излучательная способность (спектральный коэффициент
излучения е^ при Я=0,65 им от гладкой поверхности):
т, к
273—3273
1200—2600
289
Ех
0,43—0,
0,456—0,
0,024
1
38
422
373
773
1273
0,
0,
0,
г.
032
071
15
т.к.
1773
2273
1273—2573
352—1165
0
0
\
0,23
0,28
, 150—0,
,048—0,
291
803
моно-
моноОтражательная способность (коэффициент отражения
кристалла вольфрама при к= 0,3—0,5 мкм составляет 50 %.
Отражательная способность полированной поверхности поликри-
поликристаллического вольфрама.
X, мкм
0,5
0,6
nD. %
49
51
1
X, мкм
0,7
1,0
V %
54
62
X, мкм
2,0
3,0
V %
85
90
X, мкм
4,0
9,0
"о*
93
95
Коэффициент отражения прн Я=58,4 нм имеет следующие значения
для различных кристаллографических плоскостей (Ш) монокристалла
вольфрама.
(Ш) A00) (ПО) A11)
nD ,%.... 16 (±1,6) 10 (±1) 17 (±1,7)
Механические свойства
Твердость вольфрама по Виккерсу HV в зависимости от структурного
состояния и температуры'
/, -с
20
400
800
1100
Структурное
состояние
Спеченный
HV. МПа t. °C
3430
1320
932
804
20
20
20
Структурное
состояние
Прокатанный
Отожженный при
1473 К
То же, при 1773 К
HV МПа
4500
4600
3800
Микротвердость Н^ поли- и монокристаллического вольфрама при
20°С (нагрузка 0,39 Н): 3800 и 3480 соответственно.
Предел текучести вольфрама o"o,j в различных структурных состоя-
ниях:
404
Проволока диаметром 0,5—1,0 мм (<Ясп=20°С)
Состояние Холодно- Ото-
тяиутая жженная
<T0i2, МПа 1460 700—810
Вольфрам, отожженный в водороде при 1950 "С
Испытания на воздухе
tacn, °С 150 200 250 300 350 450 500
<то2, МПа 530 432 245 186 98,1 88,3 108
Испытания в среде гелия
/иоп, °С . 600 700 800
<то2, МПа 88,3 49,8 68,7
Испытания в вакууме
taCni °С 300 420 550 650 750 850 950 1050
ffOi2> МПа 196 147 127 118 98,1 И8 108 98,1
Вольфрам литой
/иоп, °С 200 300 400 550 650 1000 1400 1650 1925
(Г0,2) МПа .... 657 530 500 481 461 392 275 68,7 17,2
Вольфрам спеченный
/исп, °C 1400 1650 1925
(То,2, МПа 177 49,0 42,5
Лист толщиной 1,52 мм спеченный
taca, °С 2200 2403 2700 3000 3200
аоЛ, МПа 39,2 29,4 19,6 19,6 9,8
Вольфрам кованый и рекристаллизованный
/исш °C 320 649 871 1093
<то2, МПа. ..... 198 105,8 100 88,3
Вольфрам монокристаллический, ориентация [НО]
*исп> °С ..... 190 300 503 900 1273 1573 1800 2000
0о2> МПа .... 220 133 54,9 31,4 15,7 9,8 7,8 4,9
Временное сопротивление разрыву прн растяжении в зависимости от
температуры и условий обработки.
Вольфрам, отожженный при 1000°С
/исп, °С 20 100 200 420 550
ав, МПа 1471 1030 687 589 570
Продолжение
/„си. °С 650 750 850 950 1100
ств, МПа 539 549 461 412 392
Вольфрам деформированный и рекристаллизованный
*иоп, °С 300 350 400 500
ffe, МПа 432 412 363 333
405
Проволока деформированная
t, °C 20 200 400 500 800 1000
0В, МПа 1962— 1962 1373— 1177 883— 73д
2452 1766 1079
t, °C 1200 1500 1800 2000 2400 2700
ов, МПа 490 392 265— 108 53,9 19,6
235
ЛиСТЫ Оисп = 20°С)
Толщина листа, мм 1,020 0,508 0,254
(Тв, МПа 824 1373 2060
Прутки кованые (tKa=20cC)
Диаметр прутка, мм 8,75 6,35 2,54 1,27
ав, МПа 1471 481 1030 1373
Пруток диаметром 12,7 мм, рекристаллизованный при 2080 "С
Испытания в вакууме
*исп, °С 1370 1500 1650 2000
ов, МПа 219 196 147 68,7
Пруток спеченный, кованый шлифованный,
отожженный в водороде при 1950 "С.
Испытания на воздухе
t, °C 20 400 450 500
ов, МПа 618 392 373 441
Проволока тянутая (hcn—20oC)
Диаметр, мм 0,635 0,254 0,127 0,013
(Тв, МПа. ....... 1540 1717 2060 4120
Лист толщиной 1,52 мм, спеченный, прокатанный.
Испытания в аргоне.
Скорость растяжения изменялась от 0,012 до 0,1 с~х
/исп, °С 2200 2400 2500 3000 3200 3400
<тв) МПа 88,3 58,9 39,2 19,6 19,6 19,6
Монокристалл
/исп, °С 20 20 2000
[hkl] . [100] [ПО] [ПО]
ав, МПа 1079 961 18,6
Временное сопротивление разрыву ав монокристаллических прово-
проволок вольфрама, полученных по методу Пинча:
Диаметр, мм .... 0,160 0,149 0,142 0,125 0,070
ов, МПа 1035 1324 1344 1462 1746
Временное сопротивление разрыву в зависимости от температуры:
t, °C 1500 1750 2000 2250
<тв, МПа 73,57 56,89 40,22 23,54
Относительное удлинение б и относительное сужение ф:
Вольфрам кованый и рекристаллизованный
tacn, °С 300 350 400 500 600 770
у, % 30 35 50 50 50 6=57,9
406
Вольфрам спеченный, кованый, отожженный в водороде при 1590 "С.
Испытания в вакууме
/„сп. °С 20 200 300 420 550 850 880 1100
б, %........ 0 2 18 65 54 58 60 54
Вольфрам спеченный, кованый, отожженный в вакууме при 2000 "С
tacw °C....... 100 170 200 210 225 250 300 350
б, % О — 2 8 13 34 52 54
Ч1>, % О 0 8 — 14 25 50 68
Вольфрам спеченный, кованый
Скорость деформирования 0,05 м и и -1
/исп, °С 100 120 150 250 325 540 1375 1650 1950
б, % — — — — — — 32 32 21
У, % 0 6 20 40 52 75 — 40 25
Скорость деформирования 10 мин
tacn, °C 150 175 200 250 310
t|>, % 0 20 45 55 62
Скорость деформирования 100 мин
taca, °C 250 265 310 370 430 540
г|\ % 0 4 60 66 70 70
Вольфрам спеченный, рекристаллизованный в вакууме при 1925 "С
электрополированный
taca, °C 150 200 270 375 400
ф, % . 0 28 64 77 80
Вольфрам спеченный, рекристаллизованный в вакууме при 1925 "С,
травленый
tarn, °C 150 200 270 375 430
ф, % 0 12 56 77 82
Проволока диаметром 0,635 мм (tKv — 20°C)
Состояние...... Кованая Рекристаллизованная
б, % ••..-... 3 0
Монокристаллы (d —диаметр образца, 1ЯСп — 20 °С)
[Ш] . [ЮО] [ПО] [1101 [ПО]
d, мм 1,5 1,5 40 10—15
Л, % 2 15 18 15-18
г]), % 0 100 40 400
Монокристалл [ПО] при различных температурах испытания
*исп. "С ...... 20 300 600 900 1000 1500 1800 2000
б, % 10,5 34,0 52 60 62 48 56 59
ф, о/о 40,5 99 95 98 100 100 100 100
407
Изменение механических свойств в процессе ковки и ввлечения:
Диаметр,
мм
7
3
2,45
2,05
1,75
1,44
1,20
1,0
0,85
0,70
0,60
Степень
деформа-
ции, %
0
81,6
87,7
91,4
93,7
95,7
97,0
98,0
98,52
99,0
99,26
<тв, МПа
686,7
931,95
1088,9
1261,8
1438,1
1628,5
1707,4
1776,1
1815,5
2007,1
2109,1
6, %
!
0
0
0
0
0
0
0,6
1,0
4,8
3,7
4,2
Диаметр,
мм
0,50
0,30
0,24
0,172
0,122
0,095
0,085
0,045
0,032
0,021
0,015
Степень
деформа-
деформации, %
99,49
99,81
99,88
99^94
99,97
99,98
99,985
99,995
99,997
99,99
99,9995
<ТВ, МПа
2276,2
2413,2
2658,5
3002
3090
3148
3316
3492
3728
4169,2
4297,8
в. %
3,3
3,10
2,5
2,40
2,25
2,00
2,3
2,0
1,7
1,1
0,7
Модуль нормальной упругости Е в зависимости от температуры:
t, °C 17 800 1600 2400
Е, ГПа. . . , 393,8 371 324 224
Коэффициенты упругости монокристалла вольфрама при 17 °С: с\г-
= 512,6 ГПа; с,2=205,8 ГПа; ci4= 152,7 ГПа.
Химические свойства
Нормальный электродный потенциал реакции W+80H-—6e
+4Н2О <ро=—1,1 В.
При комнатной температуре вольфрам характеризуется высокой хи-
химической стойкостью на воздухе и в воде, но при нагревании окисляет-
окисляется. Заметное окисление начинается при 400—600 °С. С дальнейшим по-
повышением температуры вольфрам окисляется более интенсивно (пара-
(параболическая зависимость) с образованием WO3. Выше 1000 °С наблюда-
наблюдается испарение WO3; при 1250 °С скорость испарения равна скорости
образования. Пары воды интенсивно окисляют вольфрам при 600—700 °С
с образованием \¥Оз и \\Ю2.
В системе вольфрам—кислород известны четыре оксида WOs, WO2 и
промежуточные оксиды Wi8O|9 (или ХУОг.тг) и \V20O5s (или М'Ог.эо).
Состав оксидов может изменяться в некоторых пределах при сохране-
сохранении присущей им кристаллической структуры. Предел растворимости
кислорода при 1700"С равен 0,06% (ат.). Вольфрамовая кислота имеет
формулу H2WO4. Технически важные соли вольфрамовой кислоты: нор-
нормальный вольфрамат натрия Na2WO4, паравольфрамат натрия 5Na2O-
• 12WO3-flH2O, паравольфрамат аммония 5(NH4JO- 12WO3-nH2O, воль-
вольфрамат кальция CaWC>4. Для вольфрама известна метавольфрамовая
кислота HeWi2O3s-27H2O, которая в отличие от вольфрамовой кислоты
хорошо растворима в воде, как и большинство ее солей. Известны так-
также гетерополикислоты н их соли с фосфорной, мышьяковой, кремниевой
и другими кислотами.
В системе вольфрам—азот наблюдается образование нитридов W2N,
WN и WN2 (иитрнды образуются в проточной атмосфере NH3).
4Q&
В системе вольфрам—водород гидриды не образуются. Взаимодейст-
Взаимодействия с водородом не наблюдается вплоть до температуры плавления.
Твердый углерод и углеродсодержащне газы (СО, СН4, С2Н2) при
800—1000°С реагируют с вольфрамом с образованием карбидов W2C н
WC, присутствие которых является одной из причин его охрупчивания,
Вольфрам образует ряд хлоридов (WCle, WCb, WCU, WC12), фтори-
фторидов (WF6, WF4) и оксигалогенидов (WOjCb, W4OCI4, WOF4, WO2F2).
Фтор реагирует с вольфрамом уже при комнатной температуре, а при
150—300 "С реакция протекает с высокой скоростью с образованием ле-
летучего WFe. При 800 "С в результате взаимодействия с хлором образу-
образуется WCle; гексахлорид разлагается водой с образованием вольфрамо-
вольфрамовой кислоты.
Известны сульфиды WS3 и WS2. Пары серы и селена, а также H2S
и H2Se при температурах выше 400 °С образуют с вольфрамом дихаль-
когениды WS2 и WSe2.
Известен ряд фосфидов (WP2, W4P, W3P4, W2P) и арсенидов (W2As,
W4AS5, WAs, WAS2) вольфрама.
Соляная, серная, азотная и плавиковая кислоты всех концентраций,
царская водка не действуют на вольфрам при комнатной температуре.
При нагревании до 50 СС вольфрам устойчив в плавиковой кислоте, сла-
слабо взаимодействует с соляной и серной кислотами, заметнее — с азотной
кислотой и царской водкой. Смесь плавиковой и азотной кислот раство-
растворяет вольфрам.
Растворы щелочей прн комнатной температуре не реагируют с воль-
вольфрамом, а расплавленные щелочи при доступе воздуха окисляют его с
образованием вольфраматов. Интенсивность процесса усиливается в
присутствии окислителей (NaNOj, NaNO2, KCIO3, PbOj).
Вольфрам не смешивается с литием, натрием, медью, серебром и зо-
золотом ни в жядком, ни в твердом состояниях.
В системе вольфрам—бериллий известны соединения WBe2 с гексаго-
гексагональной структурой типа MgZn2 и WBei2 с объемноцентрированной
тетрагональной структурой типа ThMni2. Предполагается существование
WBe20 и WBe22.
С магнием, кальцием, цинком н ртутью вольфрам не взаимодейству-
взаимодействует ни в жидком, ни в твердом состоянии; не взаимодействует он также
с перегретыми парами ртути.
В системах вольфрама со скандием, иттрием, лантаном и лантанои-
лантаноидами наблюдаются широкие области несмешиваемости в жидком и
твердом состояниях. Предполагается наличие вырожденной эвтектики
со стороны иттрия и соединения WCe2.
Известен ряд боридов: W2B, WB, W2B5, WB,2.
Растворимость алюминия в вольфраме в температурном интервале
1100—1650 °С изменяется от 15,5 до 8,7 % (ат.) соответственно. Известны
также соединения WA112, W3A17, WA13, WA14, WA15, WAli2.
Галлий при 810 °C растворяет 0,001—0,008% (по массе) вольфрама.
В системе вольфрам—титан существует непрерывный ряд твердых
растворов между Р-титаном и вольфрамом. Растворимость вольфрама в
а-титане не превышает 0,7 %• Ниже 1250°С наблюдается распад твер-
твердого раствора на твердые растворы на основе E-титана и вольфрама,
В системе вольфрам—цирконий наблюдается образование по перитек-
тической реакции соединения W%Zt. Существуют заметные области вза-
взаимной растворимости компонентов, при этом твердый раствор на основе
р-циркония испытывает эвтектоидный распад на а-циркоиий и W2Zr.
В системе вольфрам—гафннй образуется соединение W2Hf.
Вольфрам—торий — система эвтектического типа с незначительной
взаимной растворимостью компонентов.
В системе вольфрам—кремний образуются соединения WSi2, \V5Si3,
W3Si2.
409
В системе вольфрам—германий растворимость вольфрама в жидком
германии прн 1700°С составляет 6% (по массе); в вольфраме растворя-
растворяется до 1 % (по массе) германия. Наблюдается образование соединения
W2Ge3.
С оловом и свинцом вольфрам не взаимодействует вплоть до 1700 "С,
при этом растворимость вольфрама в жидком свинце при 1200 °С менее
0,0056% (ат.).
Вольфрам неограниченно растворим в жидком и твердом состояниях
в ванадии, ниобни и тантале. С сурьмой н висмутом взаимодействия не
обнаружено.
С хромом и молибденом вольфрам образует непрерывные растворы
в жидком и твердом состояниях.
Вольфрам и уран неограниченно взаимно растворимы в жидком сос-
состоянии, а в твердом состоянии их взаимная растворимость незначитель-
незначительна. На температуры полиморфных превращений урана вольфрам влня-
ет мало.
В жидком плутонии растворяется 0,000072 и 0,000379 мольных долей
вольфрама при 750 и 950 °С соответственно.
Вольфрам не реагирует с парами полония вплоть до 700 °С.
Система вольфрам—марганец практически не изучена. Предполага-
Предполагается наличие растворимости компонентов в твердом состоянии и сущест-
существование промежуточных фаз.
В системе вольфрам—технеций при 1800 "С наблюдается раствори-
растворимость технеция в вольфраме до 55 % (ат.) и вольфрама в технеции до
12 % (ат.). Имеется а-фаза.
В системе вольфрам—рений в вольфраме растворяется до 30 % (ат.)
рения. Образуются два интерметаллических соединения \V2Re3 (а-фаза)
с интервалом гомогенности 43,5—71 % (ат.) рения и WRe3 (х-фаза с
узким интервалом гомогенности).
В системе вольфрам—железо образуются соединения: WeFe2, Fe2W.
Взаимная растворимость компонентов в твердом состоянии незначитель-
незначительна. Аналогичный характер носит взаимодействие вольфрама с кобаль-
кобальтом и никелем.
В системе вольфрам—рутений образуется одно соединение W3RU2
(а-фаза). Растворимость вольфрама в рутении 48% (ат.) и рутения в
вольфраме 23 % (ат.) при 2300 °С.
В системе вольфрам—родий существует одно соединение: е-фаза.
Растворимость родия в вольфраме не превышает 6 % (ат.).
Металлические соединения в системе вольфрам—палладий не обра-
образуются. Растворимость вольфрама в палладии не превышает 18,5 % (ат.),
В системе вольфрам—осмий существует соединение W3Os (а-фаза).
Растворимость осмия в вольфраме при 1800СС около 6,0 % (ат.).
В системе вольфрам—иридий существуют два металлических соеди-
соединения: а-фаза F9—71 % W) и е-фаза. Растворимость иридия в вольф-
вольфраме— 1 % при 1000 °С.
В системе вольфрам—платина металлические соединения отсутству-
отсутствуют. Максимальная растворимость вольфрама в платине — около 63,4 %
(ат.), платины в вольфраме — 3,8—5,7 % (ат.). Предполагается сущест-
существование соединения \VPt3.
Технологические свойства
Уменьшение суммарного содержания примесей внедрения с 0,12 до
0,03 % (по массе) сдвигает порог хладноломкости вольфрама с 700 до
200 °С. Наиболее низким значением порога хладноломкости и максималь-
4W
ной технологической пластичностью характеризуется высокочистый лю-
некристаллический вольфрам. Образцы такого вольфрама диаметром
1,5—2 мм выдерживают изгиб на 180° в жидком азоте. Монокристаллы
в виде цилиндров диаметром 25—30 мм могут быть подвергнуты 30 %-
ной осадке вхолодную без разрушения. Поликристаллический вольфрам
технической чистоты, полученный методом спекания или вакуумной
плавки, характеризуется небольшим сопротивлением деформации и хо-
хорошей пластичностью при 1600—2000 °С. Однако высокоактивное взаи-
взаимодействие металла с газами, а в ряде случаев и отсутствие соответст-
соответствующего нагревательного оборудования заставляют снижать температу-
температуру обработки, хотя при этом возрастают удельные давления в процессе
деформации. Горячую обработку давлением н термическую обработку
вольфрама проводят в инертной среде (водород). Термическая обработ-
обработка может проводиться в вакууме или атмосфере инертных газов. Опти-
Оптимальные режимы деформации и отжига устайавливают в соответствии
с диаграммами рекристаллизации. Температура начала рекристаллиза-
рекристаллизации литого вольфрама технической чистоты при степени деформации
>99 % составляет 1250 °С, а высокочистой монокристаллической заго-
заготовки при той же степени деформации 850 "С.
Вольфрамовые штабики после высокотемпературного спекания отли-
отличаются значительной хрупкостью при комнатной температуре, и их пос-
последующая обработка давлением производится при 1300—1350°С на ро-
ротационной ковочной машине до прутков диаметром 1—3 мм. Начинают
применяться и другие виды обработки, например прокатка по схеме все-
всестороннего неравномерного сжатия. Полученные прутки подвергают про-
протяжке в нагретом состоянии через твердосплавные и алмазные фильеры
до получения диаметра проволоки 10—12 мкм. При этом по мере уто-
утонения диаметра проволоки и формирования текстуры деформации темпе-
температура обработки снижается.
Листовой вольфрам получается ковкой или прокаткой штабнков в
нагретом состоянии. Горячая прокатка начинается при 1300—1400°С и
заканчивается прн 750—800 °С. Нагрев заготовок производится в атмос-
атмосфере водорода. Листы толщиной до 0,2 мм прокатывают при 200—300 °С,
В последнее время для получения полуфабрикатов из вольфрама, как
и других тугоплавких металлов, разработаны новые высокоэффективные
и производительные методы: прессование, гидроэкструзия, прокатка в за-
закрытых калибрах, прокатка в вакууме или инертной атмосфере, обработ-
обработка давлением с применением вибрации и т. д.
Для соединения вольфрама с вольфрамом и другими металлами ис-
используют методы сварки и пайки. Для стыкового соединения вольфра-
вольфрамовых деталей применяется метод дуговой сварки в инертной атмосфе-
атмосфере. Используется точечная сварка вольфрамовых деталей с никелевой
прокладкой между ними. Начинают применять электронно-лучевую
и лазерную сварки. Перспективной является термодиффузионная
сварка листового вольфрама с вольфрамом, а также с другими
металлами.
Пайка вольфрама производится с предварительным омеднением по-
поверхности в атмосфере водорода. Применяется пайка серебряными при-
припоями. При работе деталей в условиях высоких температур в качестве
припоя используют тантал. В качестве припоев используются также хро-
моникелевые, ниобиевые сплавы.
Для обработки резанием вольфрама используют инструменты из
твердых сплавов. При резании карборундовыми абразивными кругами
рекомендуются небольшие давления и высокие скорости вращения кру-
круга. В последнее время в технологии изготовления изделий из вольфрама
широко используется электроискровая резка.
411
Области применения
Общеизвестно применение вольфрама в качестве тел накала источников
света н электродов газоразрядных приборов. При этом в лампах нака-
накаливания используются спирали из спеченного вольфрама с алюмокрем-
нещелочиыми присадками (марки ВА), в меньшей степени — с присад-
присадками оксидов тория (марки ВТ) или комбинацией этих присадок (мар-
(марки ВМ). В последнее время все большее применение находят галогено-
вые лампы накаливания, которые служат вдвое больше обычных и ха-
характеризуются высокой светоотдачей. Мощными источниками света яв-
являются газоразрядные лампы, в которых катоды изготавливаются из
вольфрама с присадками ТЬОг, а аноды — из чистого вольфрама.
Трудно переоценить значение вольфрама в электронной технике, где
он используется в качестве эмиттеров электронов, подогревателей ка-
катодных узлов, прямонакальных катодов, вводов и других деталей элект-
электровакуумных н газоразрядных приборов. Следует отметить применение
вольфрама и его сплавов в качестве нагревателей вакуумных печей, кон-
контактов электроаппаратуры, регуляторов напряжения, электродов при
плавке и сварке и т. д.
Сообщается об использовании вольфрама для изготовления сопел
топливных ракетных двигателей, частей плазменных двигателей и иосо-
вых конусов ракет. Небольшая самодиффузия вольфрама является цен-
ценным свойством для ионизаторов ионных двигателей, где при высоких
температурах в течение длительного времени должна сохраняться по-
постоянная пористость.
Намечается новая область использования вольфрама и его сплавов —
в качестве материалов катодов термоэлектронных преобразователей
(ТЭП), которые могут служить бортовыми источниками питания косми-
космических кораблей.
6.9. ЭЛЕМЕНТ № 106 [1—35, 333]
Общие сведения и методы получения
Элемент № 106 в Периодической системе располагается в VIB подгруп-
подгруппе и 7-м периоде. Синтезирован впервые в 1974 г. в Объединенном ин-
институте ядерных исследований (г. Дубна).
Синтез осуществлен в циклотроне путем бомбардировки мишени из
свинца ускоренными ионами хрома:
^РЬ+^Ст-*259 106 + 2J*.
Было зарегистрировано более 60 спонтанно делящихся ядер с перио-
периодом полураспада 0,007 с.
Физические свойства
Атомный номер элемента 106. Электронное строение внешних электрон-
электронных оболочек атома 6s2ped47s2.
Известны два нестабильных изотопа с массами 259 и 263. Изотоп
263106 с периодом полураспада около секунды был получен в 1974 г. в
США.
7. ЭЛЕМЕНТЫ СЕДЬМОЙ ГРУППЫ
7.1. ВОДОРОД [1-35, 272, 273]
Общие сведения и методы получения
Водород (Н) — химический элемент, расположенный в Периодической
системе или в I, или в VII группах. Двойственное положение водорода
определяется особенностями его электронного строения и проявляемыми
в соединениях степенями окисления (см. Физические свойства). В связи
с тем что при степени окисления +1 водород не является
аналогом подгруппы лития, мы приняли решение поместить его в
VII группу.
В обычных условиях водород — газ без цвета, запаха и вкуса.
В трудах химиков XVI и XVII вв. неоднократно упоминалось о вы-
выделении горючего газа при действии кислот на металлы. В 1766 г. Ка-
вендиш (Англия) собрал и исследовал выделяющийси газ, назвав его
«горючий воздух». В 1787 г. Лавуазье определил «горючий воздух» как
новый химический элемент. Современное русское название «водород»
было предложено Соловьевым в 1824 г.
Широко распространен в природе. Соединения водорода в земной
коре (литосфера и гидросфера) составляют 1 % (по массе), в воде
11,19 % (по массе) водорода. Входит в состав бурых и каменных углей,
иефти, природных газов, глины, животных и растительных организмов,
ряда минералов. В свободном состоянии встречается редко: в неболь-
небольших количествах содержится в вулканических газах, в некоторых при-
. родных газах.
Основным сырьем для промышленного получения водорода служат
природные горючие газы, коксовый газ, газы нефтепереработки, продук-
продукты газификации угля и воды.
В промышленности водород получают главным образом из природ-
природного газа (СН4), смешивают его с водяным паром и кислородом и на-
нагревают до 1073—1173 К в присутствии катализатора — никеля. Водо-
Водород, добываемый из природного газа, самый дешевый. Получают водо-
водород и другими способами: конверсией оксида углерода из водяного и
паровоздушного газов, выделяемых при газификации угля; пропуская
постоянный электрический ток через 34 %-ный раствор КОН или 25 %-
ный раствор NaOH. Из коксового газа и газов нефтепереработки полу-
получают азотоводородную смесь.
Согласно ГОСТ 3022—80 технический водород в зависимости от спо-
способа получения выпускают в сжатом и несжатом виде трех марок: А —•
из азотно-водородной смеси; Б — электролизом воды; В — другими ме-
методами.
Нормы на физико-химические показатели различных марок водоро-
водорода— см. табл. на с. 414.
Технический водород транспортируют в стальных баллонах под дав-
давлением 15±0,5 МПа при 20 "С всеми видами транспорта в соответствии
с правилами перевозки опасных грузов. Хранят баллоны в спе-
специальных складских помещениях или на открытых площадках под
навесом, защищающим их от атмосферных осадков и прямых солнеч-
солнечных лучей.
Водород физиологически инертен; при высоких концентрациях вызы-
вызывает удушье, а наркотическое действие оказывает при высоких давле-
давлениях. В среде водорода работают с изолирующим противогазом.
413
НОРМЫ НА ФИЗИКО-ХИМИЧЕСКИЕ ПОКАЗАТЕЛИ РАЗЛИЧНЫХ МАРОК
ВОДОРОДА
1.
2.
8.
4.
5.
6.
7.
Показатели
Водород в пересче-
пересчете на сухой газ, %
(объемы.), не ме-
менее
Общая доля газов
(кислорода, азота,
оксида углерода,
метана, диоксида
углерода) в пере-
пересчете на сухой газ,
% (объемн.), не
более . ...
в том числе:
кислорода, % .
оксида углерода,
%
диоксида углеро-
да, % ....
Концентрация во-
водяных паров при
293 К н 101,3 кПа,
г/см3, не более:
в трубопроводах
и в резиноткане-
резинотканевых газгольде-
газгольдерах
в баллонах под
давлением . . .
Наличие щелочи .
Наличие серово-
сероводорода
Наличие хлора . .
Наличие масла , ,
А
99,99
0,01
0,01
Норма для марки
Б, сорта
высшего
да
0
0
Выдерживает
ГОСТ
0,5
0,2
Не опре-
определяется
То же
»
»
45
05
05
1-го
99,8
0,2
0,2
испытание по
3022—80, п, 4. 3. 4.
То же
0
0
,5
.2
25,0
0,2
в
выс-
высшего
98,5
1,5
0,3
0,2
0,2
25,0
1,0
сорта
1-го
97,5
2,5
0,4
0,3
0,2
25,0
1,0
2-го
95,0
5,0
0,5
1,2
1,0
25,0
1,0
Должен выдерживать испытания
по ГОСТ 3022—80, п. 4.6
Не опре-
определяется
То
же
»
Не опре -
деляется
То же
Должен вы-
выдерживать ис-
испытания по
ГОСТ 3022—80,
п. 4.7
То же, п. 4.
8
То же, п. 4.9
414
Физические свойства
Атомные характеристики. Атомный номер 1, атомная масса 1,00797 а.е.м.,
атомный объем 11,20 -10~6 м3/моль, атомный радиус 0,046 нм, ионный
радиус Н~ 0,154 нм. Строение внешних электронных оболочек Is', по-
потенциал ионизации / 13,595 эВ; сродство к электрону Н°-»-Н- 0,75 эВ;
электроотрицательность 2,1.
Молекула водорода Нг состоит из двух атомов, связанных ковалент-
но, неполярно, межатомное расстояние в молекуле 0,0741 нм; диаметр
молекулы 0,25—0,277 нм; степень диссоциации при 2773 К 0,0013, при
5273 К 0,95; энергия диссоциации 4,776 эВ. Кристаллическая решетка
водорода при 1,65 К гексагональная с периодами решетки а=0,376 нм,
с=0,613 нм; при 4,2 К — кубическая с периодом решетки а=0,535 нм;
координационное число равно 12. Природный водород состоит из смесн
двух устойчивых изотопов: легкого водорода — протия ('Н) с массой
1,008142 а. е.м., содержащегося в естественном элементе в количестве
от 99,9849 до 99,9861 %, и тяжелого водорода — дейтерия BН или D)
с массой 2,014735 а. е. м., содержание которого от 0,0139 до 0,0151 %.
В природных соединениях на 1 атом 2Н приходится 6800 атомов 'Н.
Искусственно получен радиоактивный изотоп — сверхтяжелый водо-
водород— тритий CН нли Т) с мягким р-излученнем н периодом полурас-
полураспада Ti/2= 12,262 года и массой 3,016997 а. е. м. Получен также крайне
неустойчивый изотоп 4Н.
Эффективное поперечное сечение захвата тепловых нейтронов для
'Н 332±2,0-10-81, а для 2Н 0,46+0,10-Ю-31, м2.
Плотность. Газообразный водород при 273 К и давлении 0,1013 МПа
имеет р=0,08987 Мг/м3; жидкий водород при 23,1 К — 0,0672 Мг/м3;
твердый водород при 13 К — 0,076 Мг/м3. Изменение плотности прн
плавлении составляет — 25,4 %.
Электрические и магнитные. Жидкий водород не проводит электриче-
электрический ток. Диэлектрическая проницаемость водорода при 273 К и давле-
давлении МО5 Па (е—l) = C,55±0,05)-10~4. Зависимость диэлектрической
проницаемости от температуры и давления:
Т, К 295 295 295 374,6 374,6 374,6
р-106, Па .... о .. 3 4,72 6,12 3 4,72 6,12
(е— I > -10* 4,72 8,66 11,992 3,775 6,666 9,883
Т. К 473,3 473,3 473,3 571 571 571
р. 10—6, Па 3 4,72 6,12 3 4,72 6,12
(е—1)-10* 2,991 5,276 7,820 2,412 4,406 6,262
Магнитная восприимчивость Н2 при 20 К %=—2,7-10-9, при 293 К
Х=—1,99-10-»; для D2 %=—0,994- Ю-9 (расчетные данные).
Тепловые а термодинамические. Температура плавления водорода
<пл=—259,2СС, температура кипения при давлении 0,1013 МПа <Кип=
=—252,5 °С, температура плавления дейтерия <Пл=—254,5 "С, темпера-
температура кипения <КИп=—249,9 °С. Критические параметры: температура
33,20 К, давление 1296 МПа, плотность 0,03102 Мг/м3. Удельная теплота
плавления водорода ДЯпл=58,0 кДж/кг, удельная теплота испарения
при температуре кипения Д#ИСп=450 кДж/кг, для дейтерия эти величи-
величины равны 48,9 кДж/кг и 303,55 кДж/кг соответственно.
Удельная теплоемкость газообразного водорода при 273 К и давле-
давлении 0,1013 МПа ср=14 208 Дж/(кг-К).
Удельная теплоемкость водорода н изотопов при температурах бо-
более 20 К и давлении 0,1013 МПа:
415
Г, К 400 600 1000 1509
ср, Дж/(кг-К)|
Н2(газ). . 14475,6 14545,1 14981,6 16008,5
О2(газ) 7254,9 7354,2 7858,0 8498,4
Т2 (газ) 4859,3 4990,2 5429,4 5842,1
Удельная теплоемкость водорода при температурах менее 20 К и дав-
давлении 0,1013 МПа:
Г, К 4 6 8 10 12 13,95
ср, Дж/(кг-К) ...... 1507 992 1063 1474 2177 3061
Из всех газов у водорода самая высокая теплопроводность. Тепло-
Теплопроводность X водорода в зависимости от температуры:
Г, К 16 30 80 200
%, Вт/(м-К) 0,108 0,141 0,053 0,131
Продолжение
Г, К 273 773 1300 2000
%, Вт/(м-К) 0,168 0,368 0,568 0,878
Температурный коэффициент объемного расширения газообразного во-
водорода прн давлении 0,1013 МПа 0=3,661-10-3 К A73 К), 3,658Х
ХЮ-3 К-1 D73 К), 3,656-Ю-3 К-1 F73 К), а жидкого 13,0-Ю'3 К"
A8 К). При давлении 40,52 МПа в интервале B73—373) К Р=2,95Х
ХЮ-3 К-1.
Стандартная энтальпия диссоциации молекул при 298 К /=
= 436,1 кДж/моль. Изменение молярной энтропии s" в зависимости от
температуры:
Г, К 298 500 1000 1500
s°, Дж/(моль-К) .... 130,67 145,74 161,22 178,90
Г, К 2000 2500 3000
s°, Дж/(моль-К) 188,44 196,32 202,97
Приведенный термодинамический потенциал Фг в зависимости от
температуры:
Г, К „ . . . . 298 500 1000 1500
Фт, Дж/(моль-К) 130,67 133,97 145,53 154,70
Продолжение
Г, К 2000 2500 3000
Фг, Дж/(моль-К) 161,98 168,1 173,37
Давление пара водорода при 9,6 К р= 129,36 Па, при 16,9 К р=
= 12,36-103 Па
Динамическая вязкость водорода г| при давлении 0,1013 МПа в за-
зависимости от температуры:
Г, К 288 298 323 373 473 522
т), мкПа-с 8,66 8,86 9,35 10,30 12,10 12,95
416
Динамическая вязкость ц водорода в зависимости от давления р
при 298 К:
р, МПа 0,1031 103,1 206,2 309,3 515,5
ц, мкПа-с. 8,86 9,05 9,31 9,60 10,30
Динамическая вязкость сжиженного водорода при низких темпера-
температурах:
Г, К 15 17 19 20 21
Г), мПа-с 2,34 1,88 1,55 1,42 1,31
Поверхностное натяжение жидкого водорода в 35 раз меньше чем
воды. При 20,2 К <7=2,13 мН/м. Сжимаемость твердого водорода при
4,2 К и давлении 0,98 ГПа и = 4,8-10-9 Па-'. Значение константы Сезер-
ленда С в различных интервалах температур:
Г, К 293—473 373—473 473—523 986—1095
С 73 86 105 234
Предэкспоненциальный множитель (самодиффузия водорода) Do=
= 1,28-10~4 м2/с в интервале 14—296 К. Для водорода, растворенного
в воде, прн температуре 291 К Д>=3,6- Ю-4 м2/с
Оптические. Твердый водород бесцветен. Показатель преломления
жидкого водорода (длина волны 0,5893 мкм) равен 1,12, газообразного
1,000132, поляризационная способность 0,62.
Интегральный коэффициент излучения гт гладкой поверхности водо-
водорода при толщине слоя 1 см и давлении 9,8-104 Па в зависимости от
температуры:
Г, К 6000 8000 10 000 12 000
гт 4,2-Ю-6 1,2-Ю-4 1,4-10-3 6,3-10-»
Химические свойства
Нормальные электродные потенциалы q>o реакций в водных растворах
при 25 °С:
Н+ + е- -> Н ф0 = — 2,106 В
Н+ + е--> 1/2Н2Фо = 0,00ОВ
2Н2О + 2е~ -> Н2 + 2ОН- ф0 = — 0,828 В.
Электрохимический эквивалент водорода (одновалентного) равен
0,01045 мг/Кл; дейтерия (одновалентного)—0,02088 мг/Кл. В соедине-
соединениях проявляет степень окисления +1, —1.
В нормальных условиях молекулярный водород сравнительно мало
химически активен: вступает в реакцию лишь с наиболее активными
неметаллами (со фтором, хлором и др.), но при нагревании вступает в
реакции со' многими элементами, присоединяется к ненасыщенным угле-
углеводородам. В реакциях является восстановителем, значительно реже
окислителем.
Атомарный водород более активен, чем молекулярный. Даже при
комнатной температуре он восстанавливает многие оксиды металлов,
непосредственно соединяется со многими неметаллами (серой, азотом,
фосфором, кислородом и др.).
417
С кислородом образует воду. Реакция экзотермическая, при нормаль-
нормальных условиях протекает очень медленно, выше 550 "С — со взрывом,
применение катализатора (платины) сильно увеличивает скорость реак-
ции. Взрывоопасной водородно-кислородная смесь становится при содер-
содержании 4—94% (объемн ) Нг, а водородно-воздушная смесь—при 4—
74 °/о (объемн.) Н2 Смесь водорода и кислорода 2 : 1 (объемн ) называ-
называется гремучим газом. При поджигании такой смеси происходит сильный
взрыв. Реакция между водородом и кислородом является цепной и про-
протекает по разветвленному механизму. При горении водорода в качест-
качестве промежуточного продукта, а также при действии атомарного водоро-
водорода на кислород образуется оксид водорода Н2О2.
Непосредственно взаимодействует с некоторыми металлами, образуя
гидриды. Гидриды щелочных и щелочноземельных металлов — белые
кристаллические вещества, энергично разлагающиеся водой с выделени-
выделением водорода, растворимые в расплавах солей и гидроксидов, сильные
восстановители. Известны также металлообразные и полимерные гид-
гидриды. Металлообразные гидриды по характеру химической связи близ-
близки к металлам- имеют металлический блеск, обладают значительной
электропроводностью, но очень хрупки. К ним отноенг гидриды титана,
ванадия и хрома. В полимерных гидридах (алюминия, галлия, цинка,
бериллия) атомы металла связаны друг с другом водородными «мости-
«мостиками». Они представляют собой белые, сильно полимернзованные ве-
вещества, при нагревании разлагающиеся на водород и металл.
Водород в небольших количествах растворяется во всех расплавах
металлов, во многих (Ni, Pt, Pd) хорошо. Так, в 1 объеме расплавлен-
расплавленного палладия растворяется 850 объемов водорода Водород диффун-
диффундирует в металлы, диффузия иногда сопровождается газовой коррозией,
что приводит к разрушению металла.
С азотом водород взаимодействует с образованием аммиака NH3 при
высокой температуре D50—550) °С, давлении B-107—3,5-107) Па и в
присутствии катализатора (осмия, рутения, железа, активированных ок-
оксидами калия, алюминия и др.). В нормальных условиях аммиак — бес-
бесцветный газ с удушливым резким запахом с температурой плавления
—77,7°С при 9,8-104 Па, температурой кипения 34,75 "С, очень хорошо
растворимый в воде (при 20°С в 1 объеме воды растворяется 700 объе-
объемов аммиака), несколько хуже в спирте, ацетоне, бензоле, хлороформе,
реакционноспособен.
Прн нагревании до 600 °С водород энергично взаимодействует с се-
серой, образуя сероводород H2S. Это бесцветный газ с характерным запа-
запахом, очень ядовитый, хорошо растворимый в воде, сильный восстанови-
восстановитель. Известны соединения типа H2SX — сульфаны, образующиеся при
добавлении к (NaH4JS* раствора соляной кислоты в избытке. Сульфа-
Сульфаны — это тяжелые жидкости желтого цвета, легко разлагающиеся с вы-
выделением серы.
В нормальных условиях углерод не взаимодействует с водородом.
В присутствии катализатора (никель) при 500—1000 °С образуется метай
СН4, при более высоких температурах — другие углеводороды. Метан —
бесцветный газ без запаха, почти в два раза легче воздуха, горючий,
взрывоопасный, почти нерастворимый в воде, температура кипения
■—162,6 °С, температура затвердевания —184 °С.
При комнатной температуре водород не взаимодействует с фосфором.
При кипячении белого фосфора нли действии соляной кислоты НС1 иа
фосфид кальция Са3Рг образуется фосфин РНз — бесцветный газ с чес-
иочиым запахом, очень ядовитый, горючий. Одновременно с фосфином
иногда образуется небольшое количество дифосфина Р2Н4, пары которо-
которого самовоспламеняются иа воздухе. Из дифосфина, подвергнутого на-
418
греванию или облучению, после отгонки Р2Н4 получается смесь высших
фосфниов (РН)* линейного и циклического строения.
С галогенами водород образует галогеноводороды. Реакция образо-
образования фтороводорода экзотермическая: взрыв происходит даже в тем-
темноте при —252 °С, с хлором и бромом реагирует лишь на свету, с ио-
иодом — только при нагревании.
В обычных условиях HF — бесцветный газ с резким запахом, смеши-
смешивается с водой в любых соотношениях, температура плавления —84,7°С,
температура кипения —20,6 °С; НС1—бесцветный газ с резким запахом,
дымит на воздухе, хорошо растворяется в воде (при 10 СС 1 объем во-
воды растворяет около 500 объемов НС1), температура плавления
—115,9°С, температура кипения —85 °С; НВг — бесцветный газ с рез-
резким запахом, при 0°С 1 объем воды растворяет 600 объемов НВг, тем-
температура плавления —87,2 °С, температура кипения —67 °С; HI — бес-
бесцветный газ с резким запахом, при 10 °С 1 объем воды растворяет 450
объемов HI, температура плавления —51,3 °С, температура кипения
—36,7 °С Все галогеноводороды, кроме HF, восстановители.
При нагревании водород взаимодействует с селеном и теллуром, но
менее энергично, чем с серой С оксидом углерода СО в зависимости от
температуры, давления, катализатора водород образует различные ор-
органические соединения (метанол, формальдегид и др). Ненасыщенные
углеводороды реагируют с водородом (катализатор Ni, Pt, Pd, Fe и др.),
образуя насыщенные соединения (реакция гидрогенизации). При нагре-
нагревании водород сравнительно легко восстанавливает оксиды некоторых
металлов до свободных металлов: восстановление СиО происходит при
250 °С, Ag2O при 100 °С, PdO восстанавливается на холоду с саморас-
каливаннем. Оксиды активных металлов (MgO, А12Оз) восстановить во-
водородом нельзя.
Водород плохо растворяется в воде. При 20 °С в 100 объемах воды
растворяется 1,82 объема водорода.
Еще меньше растворимость водорода в органических растворителях.
При высоких температурах водород растворяется в огнеупорных мате-
материалах.
Области применения
Водород используют в химической промышленности для производства
аммиака NH3, метанола СНзОН и других спиртов, альдегидов, кетонов;
для гидрогенизации твердого и тяжелого жидкого топлива, жиров и
различных органических соединений, для синтеза хлороводорода НС1;
для гидроочистки продуктов переработки нефти; при сварке и резке ме-
таллов горячим кислородно-водородным пламенем (температура до
2800 °С), а также при атомарно-водородной сварке (температура до
4000 °С). В металлургии водород применяют для восстановления метал-
металлов из их оксидов (получение молибдена, вольфрама и других метал-
металлов). Очень важное применение в атомной энергетике нашли изотопы
водорода — дейтерий и тритий.
Широко применяют соединения водорода. Аммиак NH3 — для про-
производства азотной кислоты и ее солей — нитратов, мочевины и других
азотных удобрений, синильной кислоты, соды, нашатырного спирта, а
также в холодильных установках. Оксид водорода Н2О2 используют для
отбелки тканей и меха, в медицине, как дезинфицирующее вещество, в
пищевой промышленности при консервировании продуктов, в сельском
хозяйстве для протравливания семян, в производстве ряда органических
соединений, полимеров, пористых материалов, в ракетной технике как
419
сильный окислитель. Гидрид кальция СаН2 применяют в порошковой
металлургии; гидрид натрии NaH — для снятия оксидной пленки с ме-
металлов. Безводный фтороводород HF применяют при органических
синтезах, а его водный раствор — плавиковую кислоту — при получении
фторидов, травления стекла, удалении песка с металлических отливок,
при анализе минералов; хлороводород НС1 используют для получения
соляной кислоты и ее солей —• хлоридов, в производстве синтетических
смол, каучука, хлористого этила из этилена и других веществ.
7.2. ФТОР [1—35, 272, 274]
Общие сведения и методы получения
Фтор (F) — газ бледно-желтого цвета, относится к галогенам.
Название «фтор» (по-гречески — разрушительный) предложил Ампер,
оно употребляется в настоящее время только в русской терминологии.
Впервые в 1886 г. фтор выделил французский химик Муассан элек-
электролизом жидкого безводного фтороводорода, содержащего примесь
кислого фторида калия KHF2.
Промышленное производство фтора началось с 30-х гг.
Относится к числу наиболее распространенных в природе элементов.
Среднее содержание его в земной коре составляет 6,25-10~2 %, в кис-
кислых изверженных породах (гранитах)—8,(Ы0~2%, в основных —
3,7-10~2%, в ультраосновных—1,0-10—2% (по массе). Фтор содержит-
содержится в вулканических газах, в термальных водах, в растительных и жн-
вотиых организмах, но главным образом входит в состав минералов.
Всего известно 86 фторсодержащнх минералов, важнейшими из ко-
которых являются: CaF2 — плавиковый шпат (флюорит), содержащий
48,7% F; Na3AIF3 —криолит, содержащий 54,3% F; Ca5F(PO4K —
фторапатит, содержащий 3,3 % F.
Главное промышленное значение имеет плавиковый шпат CaF2,
крупные месторождения которого находятся в СССР, США, Мексике,
КНР, Италии, ФРГ, ГДР, Испании, Франции, Англии.
Перспективным источником получения фтора для производства ми-
минеральных удобрений являются фосфаты.
Современный промышленный метод получения фтора — метод Муас.
сана. Сырьем является плавиковый шпат CaFa, из которого действием
серной кислоты при 130 °С получают фтороводород HF. Готовят элек-
электролит: в расплав из бифторида калия KHF2 вводят фтороводород до
содержания 40—41 % HF. Расплав (температура плавления 70 °С) под-
подвергают электролизу по режиму: температура 95—100 °С, напряжение
иа электродах 9—11 В, выход по току 90—95%. Фтор хранят как в
газообразном состоянии под давлением, так и в жидком состоя ши при
охлаждении жидким азотом.
Токсичен, предельно допустимая концентрация в воздухе примерно
2-10~4 мг/л. Воздействует на дыхательные пути, сердце, гла!а, цен-
центральную нервную систему, при попадании на кожу вызывает трудно
заживающие ожоги. Первая помощь при отравлении фтором заключа-
ется в кислородном дыхании; при поражении кожи — обильные промы-
промывания водой, затем спиртом и употребление пасты из Mg(OHJ.
Небольшие загрязнения аппаратуры (окалина, следы масла, влаги),
предназначенной для работы со фтором, могут привести к воспламене-
воспламенению, следствием которого может быть горение материала во фторе. По-
Поэтому все оборудование должно быть тщательно очищено и обработа-
обработано газообразным фтором для образования на поверхности защитной
420
пленки фторида металла. Фторирование элементарным фтором следует
проводить за защитными щитками, так как возможен взрыв.
Физические свойства
Атомные характеристики. Атомный номер 9, атомная масса 18,9984 а.
е. м., атомный объем 14,61 • 10~6 м3/моль, атомный радиус (ковалент-
ный) 0,071 нм, нонный радиус F-1 0,133 им, F+7 0,009 нм, строение
внешней электронной оболочки 2s22p5. Значение первых потенциалов
ионизации / (эВ): 17,418; 34,98; 62,65; электроотрицательность 3,0;
сродство к электрону 3,58 эВ.
Имеет одни стабильный изотоп I9F. Искусственно получено пять ра-
радиоактивных изотопов: I6F (период полураспада Т>/,<\ мс); 17F
(Т>/, =70 с); ISF (Г1/2 = Ш мин); 20F (T4l =11,4 с); 2IF [Т'/] =
= 5 с). Эффективное поперечное сечение захвата тепловых нейтронов
I9F<Cl0~30 м2. Среднее сечение захвата, полученное для максвелловско-
го спектра нейтронов, составляет C,9±2). 10~28 м2. Энергия связи мо-
молекулы F2 равна 159,6 кДж/моль. Ниже 55 К имеет кубическую ре-
решетку с периодом а = 0,667 нм.
Плотность. Плотность газообразного фтора при 273 К и давлении
0,1013 МПа р=0,001695 Мг/м3. В жидком состоянии при 86 К плот-
плотность р = 1,11 Мг/м3, в конденсированном состоянии в твердой фазе
при 68,9 К плотность составляет 1,300 Мг/м3. Плотность р сжиженного
фтора в зависимости от температуры:
Г, К 65 70 80 90 100
р, Мг/м3 1,640 1,610 1,540 1,470 1,390
Электрические и магнитные. Диэлектрическая постоянная 8 сжижен-
иого фтора в зависимости от температуры:
Г, К 54,7 60,51 64,41 75,01 83,21
е 1,57 1,56 1,55 1,53 1,52
Тепловые и термодинамические. Температура плавления элементар*
иого фтора <пл=—219,6 °С, температура кипения tK«n =—188,13 °С, при
—227,6 °С наблюдается фазовое превращение твердого фтора, имеющее
теплоту 0,7281±0,0004 кДж/моль. При температуре —188,13 °С и дав-
давлении 0,1013 МПа фтор конденсируется в жидкость желтого цвета.
Критические параметры: температура 144 К, давление 5,57 МПа.
При 298 К удельная теплота плавления t2 ДЯПЛ= 13,443 кДж/кг, удель-
удельная теплота испарения ДЯИСП= 178,9 кДж/кг. Теплота испарения жид«
го фтора в зависимости от температуры:
Г, К 125 95 85,03 70 53,54
ДЯисп. кДж/кг. . . 107,1 155,0 165,9 186 198
Удельная теплота сублимации ДЯсу6л фтора в зависимости от тем«
пературы:
Г, К 53,54 50 45,5 40 30 20
ДЯсубл. кДж/кг. . . 210,0 212,0 216,0 236,0 236,0 234,0
Удельная теплоемкость газообразного фтора (F2) при 298 К и дав-
давлении 9,84О4 Па Cj>=828 Дж/(кг-К). Изменение удельной теплоемко-
421
сти в зависимости от температуры при давлении 0,1013 МПа приведено
ниже:
Г, К ср, Дж/(кг.К) Г, К ср, Дж/(кг-К)
20 683,75 400 868,77
40 i<m ад 600 925>89
4U Шб.лз
Шб.лз 1000
80 3037,69 1500 998,53
Примечание. Значения Ср, приведенные слева, относятся
к F, справа — к F2 (газ).
Температурный коэффициент объемного расширения жидкого фтора
(F2) при 73 К 0 = 4,243-Ю К, при температуре 55—85 К Р= 3,0Х
Теплопроводность X в зависимости от температуры:
Т, К- 100 200 273 300
Я,Вт/(м-К) 0,0086 0,0182 0,0248 0,0269
Г, К 400 500 800 1000
Я, Вт/(м-К) 0,0344 0,0416 0,0628 0,0774
Газовая постоинная У?=219 Дж/(кг-К), энергия диссоциации моле-
молекул F2 при 298 К составляет 159 кДж/моль. Изменение атомной и мо-
молекулярной эитропии в зависимости от температуры:
Т, К • 298 500 1000 1500
лмол(р2)> дж/(моль-К) 202,85 219,81 244,63 259,83
.aT(Fra3), Дж/(моль-К) 158,76 170,36 185,39 193,97
Продолжение
Г, К 2000 2500 3000
«мол (F2), Дж/(моль-К) 270,80 279,43 286,54
saT(Fra3), Дж/(моль-К) 200,00 204,65 208,45
Степень термической диссоциации молекул F2 0,043 при 1000 К и
0,99 при 2000 К.
Поверхностное натяжение жидкого фтора при 80 К ст== 14,81 мН/м.
Поверхностное натяжение а сжиженного фтора на границе с насы-
насыщенным паром в зависимости от температуры'
Г, К 66 70 74 78
о, мН/м 18,9 17,7 16,5 15,4
Динамическая вязкость Г) жидкого фтора в зависимости от темпера-
температуры:
Г, К 69,2 73,2 75,3 80,9 83,2
г), мПа-с ...... 41,40 34,90 32,80 27,50 25,50
Давление паров фтора р в зависимости от температуры:
Г, К 95 НО 120 130 140
р-10—*, Па 26,94 97,13 160,72 270,48 432,18
422
Оптические. Цвет твердого фтора светло-желтый. Показатель пре-
преломления F2 «=1,000195.
Поляризационная способность иона F~ 0,57, а поляризуемость 0,99.
Химические свойства
Нормальный электродный потенциал реакции 2F~—2 е=Фр2 (газ) фо=
=2,85 В. Имеет высокую химическую активность, наиболее активен из
всех неметаллов, обладает очень высокой реакционной способностью,
в соединениях проявляет степень окисления— 1.
При низких температурах в электрическом разряде образуются фто-
фториды кислорода O3F4> O3F2, O2F2.
При взаимодействии фтора с разбавленным раствором NaOH образу,
ется OF2— сильный фторирующий агент и окислитель.
Реакция с азотом протекает в электрическом разряде с образованием
бесцветного газа грехфтористого азота NF3, который плавитси при
—208,5 °С, кипит при —129 °С. При действии фтора на HN3 в среде азо-
азота образуется желто-зеленый газ FN3 с температурой плавления —154 °С
и температурой кипения —192 °С.
С водородом взаимодействует с воспламенением (при комнатной
температуре со взрывом), образуя газ с резким запахом, хорошо рас-
растворимый в воде,— фгороводород HF.
С серой взаимодействует на холоду с выделением тепла, образуя га-
газообразные соединения S2F2, SF2, SF4 и SFa и жидкость S2Fio.
С древесным углем взаимодействует при комнатной температуре с
воспламенением, с графитом — при нагревании, образуя газы CF4, C2Fe
и др., а также твердые соединения (CF)n, C4F6 С алмазом фтор непо-
непосредственно не реагирует.
Реакции с галогенами экзотермичны. При 200—250 °С хлор образует
моиофтористый хлор C1F и трехфтористый хлор CIF3; при высокой тем-
температуре и давлении образуется пентафторнстый хлор ClFs. Бром и иод
воспламеняются в атмосфере фтора при обычной температуре, образуя
фториды галогенов BrF, BrF3, BrFs, IF5, IF7.
Получены фториды инертных газов, ксенона — XeF2, XeF4) XeF6, крип,
тона — KrF2, KrF4 и фторид радона, состав которого не установлен.
Фториды ксенона — бесцветные кристаллы, термодинамически устойчи-
вые окислители.
Фтор энергично соединяется с большинством металлов, образуя фто-
фториды. При взаимодействии со фтором щелочные и щелочноземельные ме-
металлы воспламеняются на холоду, Sn,Ti, Bi, Mo, W — при незначитель-
незначительном нагревании, Hg, Pb, U, V — при комнатной температуре, Pt — при
температуре красного каления, Fe, Си, Al, Ni, Zn — на холоду со фтором
не взаимодействуют, так как на их поверхности образуется защитный
слой фторида.
При взаимодействии фтора на холоду с основными оксидами образу-
образуются, как правило, фториды и кислород. Кислотные оксиды либо присо-
присоединяют фтор, либо замещают кислород на фтор.
При нагревании оксид углерода (II) СО присоединяет фтор, оксиды
азота N0 и NO2 присоединяют фтор при комнатной температуре. Стек-
Стекло реагирует со фтором очень медленно, в присутствии воды быстро.
Вода взаимодействует со фтором по реакции 2H2O+2F2=4HF+O2.
Гидроксиды металлов реагируют с образованием фторида металла и
кислорода. Водные растворы щелочей NaOH и КОН реагируют при0°С
с образованием OF2
При взаимодействии с кислотами фтор замещает водород, в солях
металлов— металлы, в более жестких условиях фтор вытесняет кислород
из этих соединений, образуя сульфурилфторид.
423
Фтор энергично реагирует с органическими соединениями, вступая в
реакции присоединения и замещения, образуя фторорганические соеди-
иения
Электрохимический эквивалент фтора составляет 0,19689 мг/Кл.
Области применения
Газообразный фтор впервые был использован для получения UFe, с по-
помощью которого удалось разделить изотопы урана.
Элементарный фгор применяют в жидком виде как окислитель жид-
жидких ракетных топлив. Его используют для получения: CIF3 — окислите-
окислителя жидких ракетных топлив; SF6 — диэлектрика; фторидов металлов Со,
Ag, Mn, Sb — фторирующих реагентов.
Фтористый водород широко используют для получения синтетическо-
синтетического криолита (сырье для получения А1), в производстве урана, для син-
синтеза фторуглеродов, в качестве катализатора синтеза бензина и при про-
производстве синтетических горючих веществ, для травления стекла.
Фториды азота применяют в производстве тетрафторгидразина для
сварки металлов, как окислители жидких ракетных топлив. Фториды
кислорода — как сильный фторирующий и окисляющий агент.
Фтористоводородную (плавиковую) кислоту применяют как раство-
растворитель, для травления стекла, а также реагент для получения фторидов.
Фторкаучуки используют для изготовления емкостей для хранения
горючего, уплотнителей, колец, диафрагм, клапанов и других изделий,
работающих в контакте с маслами, окислителями и другими агрессивны-
агрессивными средами при 200 °С и выше.
Фторпласты применяют в электро- и радиотехнике, авиации и ракет,
ион технике, машиностроении, химической и атомной промышленности, в
криогенной технике, в пищевой промышленности и медицине.
Интересными по свойствам оказались смешанные фторхлорпроизвод-
ные метана и этана.
Большая теплота испарения наряду с отсутствием токсичности позво-
позволили использовать эти соединения «фреоны» в качестве хладагентов хо-
холодильных машин. Препараты, содержащие фтор, применяют в медицине*
кой практике в качестве противоопухолевых, антидепрессивных, наркоти-
наркотических и других средств.
7.3. ХЛОР[1—35, 272, 274]
Общие сведения и методы получения
Хлор (О) —в свободном состоянии при нормальных условиях двухатом-
двухатомный газ С12 желто-зелеиого цвета, относится к галогенам. Впервые хлор
был получен в 1774 г. в Швеции Шееле взаимодействием соляной кнело.
ты с пиролюзитом МпО2. Однако только в 1810 г. Дэви установил, что
хлор — элемент и назвал его Chlorine (от греческого Chloros — желто-
зеленый).
В 1812 г. Гей-Люссак предложил для этого элемента название хлор.
В жидком виде был впервые получен в 1823 г. Фарадеем.
Среднее содержание в земной коре 1,7-10~2%; в кислых извержен-
изверженных породах 2,4-10~2 %; в основных и ультраосновных 5 • 10~3 % (па
массе).
Из-за чрезвычайной реакционной способности встречается в свободном
виде только в вулканических газах, в связанном виде находится в гор»
424
ных породах, в морской, речной и озерной водах, в растительных и жи-
животных организмах.
Основные минералы, содержащие хлор: галит NaCl (каменная соль),
сильвин КС1, сильвинит NaCl-KCl, карналлит KCl-MgCl2-6H2O, каинит
KCl-MgSO4-3HA бишофит MgCl2-6H2O и др.
Наиболее мощные залежн образуют каменная и калийные соли.
Основным способом промышленного получения хлора в настоящее
время служит электролиз водного раствора хлорида натрия; его осу-
осуществляют двумя методами:
1) диафрагменный метод (в электролизерах с твердым катодом и по-
пористой фильтрующей диафрагмой);
2) ртутный метод (в электролизерах с ртутным катодом).
По обоим методам на графитовом или оксидно-титано-рутениевом
аноде выделяется газообразный хлор.
Химический состав жидкого хлора, применяемого при производстве
отбеливающих средств, солей, хлорорганических соединений, а также для
очистки и стерилизации питьевой воды, по ГОСТ 6718—68:
Содержание хлора, % (объемн.), не менее 99,6
Содержание влаги, % (п0 массе), не более 0,05
Содержание треххлористого азота, % (по массе), не более . 0,005
Хлор очень токсичен, он сильно действует на слизистые оболочки глаз
и дыхательных путей. Предельно допустимое содержание хлора в воз-
воздухе производственных помещений не должно превышать 0,001 мг/л.
Вдыхание воздуха, содержащего 0,1—0,2 мг/л хлора, в течение 30—
60 мин опасно для жизни.
Для предупреждения отравлений следует герметизировать оборудо-
оборудование, использовать эффективную вентиляцию и противогазы.
Физические свойства
Атомные характеристики. Атомный номер 17, атомная масса
35,453 а. е. м., атомный объем 17,38-10~6 м3/моль, атомный радиус (кова-
лентиый) 0,099 нм, ионные радиусы С1~' 0,181 нм, CF+ 0,026 нм. Конфи-
гурация внешних электронных оболочек 3 s2 3 р5. Значение первый трех
потенциалов ионизации / (эВ): 13,01; 23,80; 39,9; сродство к электрону
3,76 эВ; электроотрицательность 3,0.
Молекула хлора состоит из двух атомов С12. Межъядерное расстояние
в молекуле газа 0,1998 нм.
Кристаллическая решетка хлора ромбическая (при 113 К) с периода-
периодами решетки, нм: а = 0,448; & = 0,624; с = 0,826; координационное число
равно 1.
Степень термической диссоциации, %: 0,35 A000 К); 37B000 К). При.
родный хлор представляет собой смесь стабильных изотопов 35С1
G5,77 °/о) и 37С1 B4,23 %). Из искусственных радиоактивных изотопов
важнейшие. 34С1 G,^=32,4 мин); 36С1 Gа =3,08-105 лет); 38С1 (Т,/2=
= 37,29 мин).
Эффективное поперечное сечение захвата тепловых нейтронов
17С1(естеств) C1,0±2,0) • 10~28 м2. Среднее сечение захвата, полученное
для максвелловского спектра нейтронов, составляет A6±3) • 10~28 м2.
Плотность. Плотность газообразного хлора при нормальных условиях
р = 0,003214 Мг/м3, насыщенного пара при 273 К 0,01221 Мг/м3, твердо-
твердого хлора при 170 К 1,900 Мг/м3. Плотность жидкою хлора при различ-
различных температурах:
Г, К....... 203 238 273 293 313 333
р, Мг/м3 1,6552 1,5649 Г»4б80 1,4085 1,3450 1,2760
425
Электрические и магнитные. Удельное электрическое сопротивление
(р) твердого хлора порядка 100 МОм-м; жидкого хлора (при темпера-
температуре 203 К) 100 ГОм-м, диэлектрическая проницаемость 8=2,048.
Хлор диамагнитен с удельной магнитной восприимчивостью у =
=—0,57 .Ю-9.
Тепловые и термодинамические. Температура плавления хлора /Пл =
=—101,0 °С, температура кипения tKiln=—34,1 "С. Критические парамет.
ры: температура 417,1 К, давление 7,61 МПа, плотность 0,573 Мг/м3.
Удельная теплота плавления С12 при 298 К ДЯПЛ =90,39 кДж/кг. При
298 К удельная теплота испарения С12 ДЯИСп=288,15 кДж/кг. Д#Исп
жидкого хлора в зависимости от температуры:
Г, К 203 238
ДЯИСП, кДж/кг 306,89 287,84
Удельная теплоемкость газообразного хлора при 298,15 К и давлении
0,1013 МПа ср=616,08 Дж/(кг-К) (С1) и 477,3 Дж/(кг-К) (Ci2). Удель-
Удельная теплоемкость С12 при 10 К ср = 18,84 Дж/(кг-К). При других тем-
температурах ср изменяется так:
Т, К ср, ДжДкг-К) Т, К ср, Дж/(кг-К)
20 218,33 400 497,88
40 676,16 600 516,22
80 1089,42 1000 528,91
150 1437,52 1500 535,96
Примечание. Слева приведены данные для CI, справа —
для С12 (газ).
Теплопроводность X хлора в зависимости от температуры:
Г, К Я, Вт/(м.К) Т, К к, Вт/(м.К)
200 0,0054 400 0,0124
273 0,0079 500 0,0158
300 0,0088 600 0,0188
350 0,0106 700 0,0215
Температурный коэффициент объемного расширения жидкого хлора 0 =
= 1,41-Ю-3 К при A72—239,4) К; 1,49-10~3 К при A93—239,4) К
и 1,53-10~3К~' при 233 К, а газообразного изменяется таким образом:
Г, К 273 273—373 373 473
(МО3, К 3,90 3,83 3,77 3,83
Энергия диссоциации молекул С12 при 298 К составляет 243 кДж/моль.
Молярная энтропия Cl2 s° в зависимости от температуры:
Г, К 298 500 1000 1500
s°, Дж/(моль-К) 223,1 241,3 266,8 282,2
Продолжение
Г, К 2000 2500 3000
s°, Дж/(моль-К) 293,2 301,7 308,8
Атомная энтропия saT и приведенный термодинамический потенциал
Фт газообразного хлора (С1) в зависимости от температуры:
Г, К 298 500 1000 1500
sdT, Дж/(моль.К) 165,2 176,8 192,5 201,3
Фг, Дж/(моль-К) 165,2 167 J 192,5 201,3
426
Продолжение
Т, К 2000 2500 3000
«ат,Дж/(моль-К) £07,5 212,3 216,1
Фг, Дж/(моль-К) 207,5 212,3 216,1
Давление пара р при температуре плавления 13,03-102 Па. Давление
насыщенных паров хлора в зависимости от температуры:
Т, К Р. кПа Т, К р, кПа
189 3,479 916,3 1180,6
216,3 32,24 349,6 2419,0
260,7 233,2 394,1 5273,1
283 484,9
Коэффициент диффузии (предэкспоненциальный множитель) хлора,
растворенного в воде, при 285 К D0=\,4-l0~9 м2/с; при 289,3 К £>о=
= 1,3- Ю-9 м2/с
Динамическая вязкость ц хлора в зависимости от температуры:
7\ К 219,9 237,7 293 423 523
т], мПа-с 0,569 0,494 0,0133 0,0188 0,0228
Поверхностное натяжение хлора при 201 К 0=33,0 мН/м. Константа
Сезерленда в интервале температур 293—523 К равна 351. Эбуллиоско-
Эбуллиоскопическая постоянная хлора 1,73.
Оптические. В твердом состоянии хлор желто-зелеиого цвета. Показа-
Показатель преломления газообразного хлора (длина волны 0,5893 мкм) п —
= 1,000768, поляризационная способность 0,30, поляризуемость 3,05.
Скорость звука в газообразном хлоре при 273 К 206 м/с.
Химические свойства
Нормальный электродный потенциал реакции 2С1~—2 е<±С12 (газ) <ро=
= 1,358 В.
Электрохимический эквивалент хлора (одновалентного) 0,36743 мг/
/Кл. Хлор весьма химически активен, непосредственно соединяется с
большинством металлов и неметаллов, замещает водород в углеводоро-
углеводородах, присоединяется к ненасыщенным соединениям.
В соединениях проявляет степень окисления —1, +1, +3, +4, +5,
+ 6, +7. Непосредственно с кислородом не соединяется, оксиды хлора
получают косвенным путем. Известны оксиды С12О; СЮ2; С12Ов; С12О7;
СЮз. Все они, кроме бесцветного СЬО7 имеют различных оттенков жел-
желтую окраску, все очень сильные окислители, являются эндотермически-
эндотермическими соединениями, мало стойки и могут самопроизвольно взрываться,
особенно СЮг и СЮз. Имеются соединения, состоящие из хлора, кис-
кислорода и фтора. Наиболее важным является перхлорилфторид FCIO3.
Известны кислородные кислоты хлора и их соли:
НС1О — хлорноватистая кислота и ее соли — гипохлориты; НСЮ2 —
хлористая кислота и ее соли — хлориты;
НСЮз — хлорноватая кислота и ее соли — хлораты;
НСЮ4 — хлорная кислота и ее соли — перхлораты.
Все кислородные соединения хлора сильные окислители. При рассмот-
рассмотрении свойств кислородных кислот и их солей следует отметить:
427
Усиление кислотных свойств, повышение устойчивости
НС1О НСЮа НСЮ3 НС1О4
-t- ^^—-——^-^——-——
Увеличение окислительной активности
Соответствующие соли значительно устойчивее свободных кислот.
Гипохлориты при хранении медленно разлагаются, хлораты и перхло-
перхлораты в определенных условиях могут взрываться.
С водородом взаимодействует со взрывом при обычных температурах
под действием активного света или катализаторов, образуя бесцветный
газ с резким запахом, дымящий на воздухе — хлороводород НС1 хоро-
хорошо растворимый в воде с образованием сильной кислоты — соляной.
Смесь хлора и водорода горит бесцветным или желто-зеленым пла-
пламенем, максимальная температура которого достигает 2200 °С. Смеси,
содержащие от 5,8 до 88,5 % водорода, взрывоопасны. Примеси N2,
СО, НС1 и СО2 снижают взрывоопасность таких смесей. Скорость рас-
распространения пламени в хлороводородных смесях также зависит от со-
соотношения в них водорода и хлора и ее максимальная величина 4,1 м/с.
Непосредственно соединяется с подавляющим большинством метал-
металлов, образуя соли — хлориды, большинство которых хорошо растворимо
в воде. Трудно растворимы AgCl и РЬСЬ. Щелочные металлы в присут-
присутствии следов влаги взаимодействуют с хлором с воспламенением.
При температуре выше 540 °С все металлы и сплавы взаимодейству-
взаимодействуют с хлором. Углеродистая сталь, медь и алюминий загораются в среде
хлора при температурах 230 °С, 280 и 180 °С соответственно; нержавею-
нержавеющие стали типа Х18Н8 стойки до температур C20—340) °С, монель ме-
металл — до 430 СС, никель и высоконикелистые сплавы типа инконель —
до 540 °С.
Непосредственно с азотом хлор не соединяется, косвенным путем по-
получают хлористый азот (азид хлора) C1N3 — бесцветный, сильно взры-
взрывающийся газ и треххлористый азот NCb — темно-желтую, летучую,
маслянистую жидкость с резким запахом, сильно взрывающуюся при
соприкосновении с веществами, способными хлорироваться.
При полном отсутствии влаги хлор взаимодействует с серой уже при
комнатной температуре, при нагревании активность взаимодействия воз-
возрастает— образуются соединения SCI4, SC12, S2CI2 и др. типа SnClm.
Непосредственно с углеродом хлор не соединяется, косвенным путем
получают CCU — тетрахлорметан — бесцветную, негорючую жидкость,
при обычной температуре химически инертную, гидролизующуюся во-
водой, хорошо растворяющую органические вещества.
Белый фосфор в атмосфере хлора воспламеняется на холоду, с крас,
иым фосфором реакция протекает спокойно. В обоих случаях образу-
образуется трихлорид фосфора РСЬ, который при дальнейшем хлорировании
превращается в пентахлорид PCls. При окислении трихлорида фосфора
РСЬ образуется оксихлорид РОСЬ, используе-мый в органическом синте-
синтезе как мягкий хлорирующий реагент.
С кремнием хлор образует ряд соединений: (SiCl)* — твердое жел-
желтое вещество, при 98 °С воспламеняется на воздухе, сильный восстано-
восстановитель, растворяется в КОН; Sii0Cli3 и SinCi2n+2 (я=3, 4, 10) —смоло-
—смолоподобные вязкие вещества, энергично гидролизуются, хорошо расшоря-
ются в бензоле, на воздухе легко окисляются; Si2Cle — бесцветная жид-
жидкость, при 500°С разлагается, очень чувствительна к воде; SiCl4— бес-
бесцветная подвижная жидкость, гидролизуется, дымит на воздухе.
С бором хлор образует: ВС1з — бесцветная легкоподвижная жид-
жидкость, легко гидролнзуется, дымит на воздухе, растворяется в спиртах;
428
ВгСЦ—бесцветная жидкость, легко разлагается, растворяется в воде;
(ВС1)*(.*: = 4,8) существуют при высокой температуре в газообразном
состоянии.
С другими галогенами хлор образует межгалоидные соединения: фто-
риды C1F, C1F3, C1F5 очень реакционноспособные вещества; бромид
BrCl — малоустойчивый желтый газ; иодиды IC1 — твердое вещество
красного цвета, неустойчивое, разлагается водой и 1С1з — рассеиваю-
рассеивающееся в воздухе желтое вещество, разлагается водой, при нагревании
растворяется в органических растворителях.
Хлор легко вступает во взаимодействие со щелочами на холоду с об-
образованием хлоридов и гипохлоритов, а при нагревании — хлоридов и
хлоратов. С Са(ОНJ образует важные технические соединения — хлор-
хлорную известь, ипохлорит и хлорат кальция.
Хлор растворим в воде B объема на 1 объем воды при 25 °С), час-
частично гидролизуясь с образованием раствора хлорноватистой НС1О и
соляной НС1 кислот Константа равновесия этой реакции составляет
1,56.10-" при 0°С; 3,16-Ю-4 при 15 °С-, 4,48-Ю-4 при 25 °С. Раствори-
Растворимость хлора в воде при общем давлении (газа и паров воды) 0,1013 МПа
в зависимости от температуры:
/, 'С 0 10 20 30 40 60 80 100
Растворимость,
Ю-3 кг/л 14,6 9,97 7,29 5,72 4,59 3,93 3,29 0
При температуре ниже 10 °С из насыщенного хлором водного раствора
выпадают кристаллогидраты переменного состава С12-яН2О (я = 6—8).
Растворимость хлора в водном растворе NaCl и других хлоридов мень-
меньше, чем в воде и сильно уменьшается с повышением концентрации соли
в растворе.
Растворяется хлор также в И-гептане, SiCU, ССЦ, TiCI4. SnCU,
С2Н4ВГ2 и других неводных средах.
Хлор взаимодействует почти со всеми оксидами металлов, с сульфи-
сульфидами тяжелых металлов (PbS, Cu2S, Ag2S, FeS) при температурах бо-
более низких, чем с соответствующими оксидами, образуя хлориды. С пе-
перекисью водорода в водном растворе хлор взаимодействует по реакции
СЬ+НгОэч^НО + Ог. Из соединений с водородом и металлами хлор мо-
может быть вытеснен более активным фтором, а сам хлор вытесняет бром
и иод из аналогичных соединений. Из кислородсодержащих соединений
хлор может быть вытеснен бромом и иодом.
Области применения
Хлор применяют как отбеливающее средство в текстильной и бумажной
промышленности; для стерилизации питьевой воды и обеззараживания
сточных вод; как исходное сырье для получения синтетического хлоро-
водорода, соляной кислоты, хлорной извести, хлоридов, хлоратов, гипо-
гипохлоритов; для извлечения олова из отходов белой жести; дли получения
различных органических хлорпроизводных; пластмасс, синтетических
волокон, растворителей, каучуков, заменителей кожи (павинол), средств
защиты растений (гексахлорана, хлорофоса); дефолиантов, дезинфици-
дезинфицирующих средств, лекарств, ядохимикатов; в анилипокрасочной промыш-
промышленности; в цветной металлургии для хлорирования руд с целью извле-
извлечения некоторых металлов (титана, ниобия, циркония); при получении
и очистке многих металлов.
Из соединений хлора широко применяют хлориды (NaCl — пищевая
промышленность, получение NaOH, Cl2; KC1 — калийное удобрение);
429
гипохлориты — отбеливающие и дезинфицирующие вещества; хлораты —
в пиротехнике, в производстве спичек; перхлораты — как компонент
твердых ракетных топлив.
7.4. БРОМ [1-35, 272, 274]
Общие сведения и методы получения
Бром (Вг) —красно-бурая жидкость с резким неприятным запахом, от-
относится к галогенам.
Бром открыт в 1826 г. во Франции химиком А. Ж. Баларом при изу-
изучении рассолов средиземноморских соляных промыслов; название эле-
элемента связано с его неприятным запахом (от греческого «бромос» —
зловонный).
Из-за высокой химической активности в свободном виде не встреча-
встречается, находится в виде бромидов в морской воде, в водах соляных озер,
нефтяных буровых скважин, в земной коре в верхних слоях залежей по-
поваренной соли.
Содержание в земной коре 1,6-10~4 % (по массе), оценивается 1015—
10|в тонн; в подземных буровых водах от 170 до 700 мг/л брома.
Бромиды NaBr, KBr, MgBr2 встречаются в отложениях хлоридов (в
поваренной соли, сильвине, карналите) и в подземных солевых раство-
растворах. Благодаря хорошей растворимости в воде бромиды редко образу-
образуют твердые минеральные формы. Из последних известны: бромирит
AgBr, эмболит Ag (C1, Вг), иодэмболит Ag (C1, Вг, I).
Сырьем для промышленного получения брома в СССР является озер-
иая и морская рапа, щелока от переработки калийных солей и буровые
воды нефтяных районов, содержащие бром в виде бромидиона Вг~. Его
выделяют, пропуская хлор через предварительно подкисленную реак-
реакционную смесь (рНЗ,5), а затем отгоняют из раствора водяным паром
или воздухом. Температура в реакционном пространстве (ПО—115) °С.
После этого бром отделяют от воды и очищают от примеси хлора ди-
дистилляцией.
За рубежом бром получают из морской воды, которую подкисляют
серной кислотой и обрабатывают хлором с дальнейшим выделением
брома из реакционной смеси.
Хи!\?ический состав реактива брома по ГОСТ 4109—79 приводится в
таблице:
Показатель
Бром, не менее
Остаток после прокаливания,
не более
Органические вещества, не бо-
Сульфаты, не более ....
Иода, не более
Норма, % (по массе)
химически
чистый (х. ч.)
99,6
. 0,002
0,01
0,003
0,025
0,0001
чистый для
анализа
(ч. Д. а )
99,3
0,002
0,02
0,005
0,05
0,0005
чистый (ч)
99,3
0,002
0,05
0,005
0,16
0,001
Хранят бром (реактив) в упаковке изготовителя в крытых складских
помещениях при температуре не выше 20 °С отдельно от органических
430
реактивов. Гарантийный срок хранения брома — один год со дия из-
изготовления.
Химический состав технического брома, предназначенного в качестве
исходного сырья в производстве витаминов, лекарственных средств, кра-
красителей, фреонов, реактивов, бромирующих агентов и др. по ГОСТ 454—
76 приводится в таблице:
Показатель
Бром, ие менее
Хлор, ие более
Органические вещества
Нелетучие вещества, не
Сульфаты в пересчете
не более
Вода, не более
не более
более
на SC>4~.
Норма, %
А
99,9
0,02
0,05
0,005
0,002
0,01
(по массе) для марок
Б
99,5
0,2
0,2
0,02
0,01
Должен выдержи-
выдерживать испытание по
п. 3.7 ГОСТа
Технический бром упаковывают в чистые сухие склянки емкостью
1 л, с толщиной стенок не менее 3 мм с навинчивающейся крышкой из
фторопласта или полиэтилена низкого давления с фторопластовым или
полиэтиленовым вкладышем; в эмалированные металлические контейне-
контейнеры емкостью 0,4 и 4 м3, или гомогенно-освинцованные контейнеры вме-
вместимостью 320 л. Перед заполнением контейнеры должны продуваться
сухим воздухом, подогретым в электронагревателе до 80 °С. Скляики с
бромом упаковывают в плотные деревянные ящики, имеющие гнезда.
Бром в склянках и контейнерах хранят в крытых складских помещени-
помещениях, исключающих попадание прямых солнечных лучей на тару с про-
продуктом.
Бром токсичен, в жидком состоянии действует на кожу, образуя дол-
го незаживающие язвы. Пары брома раздражают верхние дыхательные
пути, вызывают кашель, слезоточение, головокружение, носовое крово-
кровотечение. Предельно допустимая концентрация в воздухе рабочей зоны
производственных помещений составляет 0,5 мг/м3. Прн работе с бро-
бромом следует применять индивидуальные средства защиты (резиновые
перчатки и сапоги, прорезиненные фартуки, защитные очки; для защиты
от паров—противогаз марок В и БКФ), а также соблюдать правила
личной гигиены; не допускать попадания брома внутрь организма и на
кожу. При легком отравлении парами брома необходимо вдыхать аммн-
ак; в тяжелых случаях больного помещают в теплое помещение и дают
вдыхать кислород; обожженную бромом кожу многократно промывают
водой и раствором соды, смазывают мазью, содержащей бикарбонат
натрия, или ланолином.
Помещения, в которых производят работы с бромом, должны быть
оборудованы общей приточио-вытяжиой механической вентиляцией.
Физические свойства
Атомные характеристики. Атомный номер 35, атомная масса
79,904 а. е. м., атомный объем 19,61 -10~6 м3/моль, атомный радиус (ко-
валептиый) 0,119 нм, ионные радиусы Bi~ 0,196 им, Вг5+ 0,047 нм,
Вг7+ 0,039 нм. Конфигурация внешних электронных оболочек 4 s2 4 ръ.
431
Значения потенциалов ионизации /(эВ): 11,84; 21,6; 35,9. Сродство к
электрону Вг°->-Вг- 3,56 эВ. Электроотрицательиость 2,9. Молекула бро-
брома состоит из двух атомов Вг2, связь между которыми ковалеитная ие-
полярная; диссоциация на атомы становится заметной при температуре
около 1073 К; диссоциация наблюдается и при действии света. Кристал-
Кристаллическая решетка ромбическая с периодами решетки (нм): а = 0,449;
Й = О,668; с=0,874; координационное число равно 1.
Природный бром состоит из двух стабильных изотопов 79Вг E0,56 %)
и 81Вг D9,44 %). Искусственным путем получен ряд радиоактивных изо-
изотопов; наиболее интересным из них является 80Вг, на примере которого
И. В. Курчатов открыл явление изомерии атомных ядер.
Эффективное поперечное сечение захвата тепловых нейтронов для
79Вг и 8|Вг составляет A0,4±1,0) • К)-28 м2 и B,6±0,4)-Ю-28 м2 соответ-
соответственно. Среднее сечение захвата, полученное для максвелловского
спектра нейтронов составляет F±1)-10~28 м2.
Плотность. Плотность жидкого брома при 293 К р=3,120 Мг/м1,
твердого при 265,8 К около 3,400 Мг/м3.
Электрические и магнитные. Удельное электрическое сопротивление
твердого брома при 255,8 К р= 1,3-10" Ом-м; диэлектрическая прони-
проницаемость е==3,22 (при комнатной температуре). Молекулярный бром
диамагнитен. Магнитная восприимчивость % в зависимости от темпера-
температуры
Т, К 103 265 266 291
Х-109 —0,40 (тв.) —0,40(тв.) —0,40 (ж) —0,40 (ж)
Тепловые и термодинамические. Температура плавления /пл=—7,3 °С,
температура кипения (К1Ш = 58,78°С, критические параметры: темпера-
температура 575,1 К, давление 13,1 МПа, плотность 1,18 Мг/ма. Удельная теп-
лота плавлении Вгг АЯВЛ =67,57 кДж/кг, удельная теплота испарения
АН„сп= 187,568 кДж/кг. Удельная теплоемкость жидкого Вг2 при 298 К
Ср = 473,78 Дж/(кг-К); твердого брома при 10 К 38,94 Дж/(кг-К).
Удельная теплоемкость газообразного брома (Вг) сР = 260,18 Дж/(кгХ
ХК) при 298,15 К и давлении 0,1013 МПа, для Вг2 (газ) она изменяет-
изменяется так
Т, К • • 298 400 600 1000 1500
ср, Дж/(кг-К) 225,89 229,65 233,42 235,92 237,79
Температурный коэффициент объемного расширения Р-103, К (при
давлении 9,8-104 Па) 1,11 и 1,132 при температуре 273 и 293 К соот-
соответственно. Стандартная энтальпия диссоциации молекул при 298 К
/=192 кДж/моль.
Молярная энтропия s° Br2 в зависимости от температуры:
Г, К • • • • 298 500 1000 1500
s°, Дж/(моль.К) 151,77 264,48 290,43 305,80
Продолжение
Т, К 2000 2500 3000
s°, Дж/(моль.К) 316,77 325,31 332,35
Приведенный термодинамический потенциал при 298 К Вгг(ж.) Фт =
= 151,77 Дж/(моль-К), для Вг2 (газ) фт = 245,47 Дж/(моль-К). Дав-
Давление пара брома при температуре плавления р = 5,802 кПа. Давление
паров брома р в зависимости от температуры:
432
Т. К Р, Па Г, К Р, Па
131 12,93-Ю-8 174 12,93-10-5
142 12,93-10—в 202 12,93
155 12,93- Ю-4 247 12,93-10?
Коэффициент диффузии (предэкспонеициальный множитель Do) брома,
растворенного в воде, при температуре 298 К в зависимости от концент-
концентрации.
Концентрация, 0„ Концентрация,
моль/л £>„-1и, м/с ноль/л ZVW", м/с
0,00105 1,25 0,00230 1,22
0,00173 1,24 0,00309 1,202
0,00183 1,235 0,00429 1,193
0,00193 1,23 0,00501 1,18
Динамическая вязкость жидкого брома в зависимости от температуры:
Т, К 273 283 293 303 313 323 333
т], мПа-с 1,253 1,107 0,991 0,897 0,817 0,746 0,686
Поверхностное натяжение жидкого брома при 273 К о=44мН/м. Коэф-
Коэффициент поверхностного натяжения при 252 К а=62,1 мН/м. Константа
Сезерленда в интервале температур 463—873 К равна 533. Криоскопи-
ческая постоянная брома 8,31, эбуллиоскопическая постоянная 5,2.
Оптические. Твердый бром имеет бурый цвет с металлическим блес-
блеском. Показатель преломления (длина волны А = 5893 мкм) п= 1,001125,
поляризационная способность 0,26, поляризуемость 4,17.
Химические свойства
Нормальный электродный потенциал реакции 2Вг~—2е*±Вгг (жидкость)
фо= 1,066 В. Электрохимический эквивалент брома (одновалентного)
равен 0,82815 мг/Кл.
Химическая активность весьма высока: занимает промежуточное по-
положение между хлором и иодом, но расположен ближе к хлору. Силь-
Сильный окислитель, в соединениях проявляет степень окисления —1, +1,
+3, +5, +7. Непосредственно соединяется со многими металлами и не-
неметаллами, замещает водород в углеводородах, присоединяется к нена-
ненасыщенным соединениям.
С кислородом непосредственно не соединяется даже при высоких
температурах, оксиды образуются косвенным путем. Известные оксиды
брома: ВггО, ВгОг, ВгОз, ВгзОд. Все оксиды брома эндотермичны, при
нагревании, а иногда и самопроизвольно разлагаются, в некоторых слу-
случаях со взрывом.
Известны кислородные кислоты брома н их соли: НВгО — бромно-
ватистая кислота и ее соли гипобромиты; НВгО3— бромноватая кислота
и ее соли броматы; НВгО4— бромная кислота и ее соли перброматы.
Из кислородных соединений брома наиболее устойчивы соли кисло-
кислородных кислот, наименее — оксиды и кислоты.
При нагревании бром соединяется с водородом, образуя бесцветный
газ с резким запахом, хорошо растворимый в воде—бромводород НВг.
Бромводород легко окисляется, сильный восстановитель. Водный раст-
раствор его — бромводородная кислота.
С металлами бром образует соли бромоводородной кислоты — броми-
бромиды. Такие металлы как А1, К, Sb энергично реагируют с сухим бромом;
Fe, Zn, Bi, Na — с влажным; с Pb и Ag реакция идет очень медленно;
Та, Pb, Ag, Pt — устойчивы к действию брома даже при повышении тем.
433
иературы и в присутствии влаги. Большинство бромидов хорошо раст-
растворимы в воде. Трудно растворяется бромид серебра AgBr.
Соединения брома с азотом получают косвенным путем. Действием
избытка аммиака на бром можно получить вещество красного цвета
состава NBT3-6NH3, разлагающееся со взрывом при —70 °С. Известен
бромазид BrNe — красная жидкость с температурой плавления —45 °С.
Взаимодействие брома с серой сопровождается сильным разогревом,
иногда даже появляется пламя. Образуется бромистая сера БгВгг—
гранатово-красная маслянистая жидкость, легко разлагающаяся водой.
Известен также бромистый тионил SOBr2—маслянистая жидкость с
неприятным запахом, медленно разлагающаяся при обычных условиях
иа БгВгг и S.
С углеродом бром непосредственно не соединяется, соединения полу,
чают косвенным путем; известны: СВг4 и СвВг.
Бром непосредственно соединяется с фосфором. Реакция протекает
энергично; фосфор воспламеняется в броме и сгорает, образуя бесцвет-
бесцветную жидкость, разлагающуюся водой — бромид фосфора (III) РВг3.
При действии избытка брома на РВг3 образуется бромид фосфора (V)
РВг5.
Известно несколько неустойчивых химически активных соединений
брома с галогенами, образующихся при непосредственном соединении
элементов. Наиболее важными из них являются.
BrFe — трехфтористый бром — светло-желтая жидкость, с температу-,
рой плавления 8,8 "С, температурой кипения 127 °С;
BrF5 — пятифтористый бром — бесцветная жидкость, с температурой
плавления 62,7 °С, температурой кипения 40,5 °С, взаимодействующая
с водой со взрывом; BrCl — хлорид брома; IBr — бромид иода и др.
межгалоидные соединения.
Бром растворим в спирте, эфире, бензоле, хлороформе, сероуглероде,
четыреххлористом углероде, четыреххлористом титане. Взаимодействие
органических веществ с бромом сопровождается сильным разогревом,
а в отдельных случаях самовоспламенением. При растворении в воде
бром частично взаимодействует с ней, образуя бромистоводородную кис-
кислоту НВг и неустойчивую бромноватистую кислоту НВгО. Раствори-
Растворимость брома в воде 35 г/л при 20 "С, ниже 6 °С из водного раствора
брома осаждаются кристаллогидраты Вг2'8Н2О. Растворимость воды в
броме составляет около 0,05 %. Насыщенный водный раствор брома
имеет желто-бурую окраску и называется бромной водой. При стоянии
на свету из бромной воды выделяется кислород, а при нагревании —■
бром. Бром — сильный окислитель: он окисляет сульфиты и тиосульфа-
ты в водных растворах до сульфатов, нитриты до нитратов, аммиак до
свободного азота. Бром вытесняет иод из его соединений, но сам вы-
вытесняется из своих соединений хлором и фтором. Свободный бром вы-
выделяется из водных растворов хромидов также под действием сильных
окислителей (К2СГ2О7, КМпО4 и др.) в кислой среде. При растворении
брома в щелочах на холоду образуется бромид и гнпобромиг, а при по-
повышении температуры (около 100 °С) —бромид и бромат.
Области применения
Бром — исходный продукт для получения ряда бромидов и органичес-
органических производных (бромистого этила, дибромэтана и др), которые слу-
служат aHTHAeTOHaropajMH.
Бромиды Na, К, NH4 и некоторые броморганические соединения
(бромурал, ксероформ и др.) применяются в медицине; бромид серебра
AgBr используют для производства фотоматериалов. Другие соединения
брома применяют для получения красителей, инсектицидов, в фото- и
434
кинопромышленности, в качестве присадки к моторному топливу.
В частности, фторид брома (III) BrF3 применяют для фторирования не-
неорганических соединений.
7.5. ИОД [1-35, 272, 274, 275]
Общие сведения и методы получения
Иод (I) относится к галогенам, при комнатной температуре представ-
представляет собой темно-фиолетовые кристаллы со слабым металлическим блес-
блеском. В 1811 г., получай селитру, французский химик Бернар Куртуа об-
обратил внимание на то, что медный котел, в котором выпаривался золь-
зольный раствор, быстро разъедается. Оказалось, что под действием кон-
концентрированной серной кислоты из раствора выделялись тяжелые фио-
фиолетовые пары. В 1813 г. Ш. Гей-Люссак детально исследовал новое ве-
вещество, установил его элементарную природу и назвал его иодом (от
греческого «иоэйдес» — фиалковый или фиолетовый).
Содержание в земной коре составляет 4-10~5% (по массе). В сво-
свободном виде не встречается, в виде иодидов содержится в морской во-
воде @,06 мг/л), в некоторых видах морских водорослей, в водах нефтя-
нефтяных буровых скважин (от 10 до 50 мг/л). В виде органических соеди-
соединений входит в состав всех живых организмов. В организме человека
концентрируется главным образом в щитовидной железе. Встречается
также в виде солей иодата калия КЮ3 и периодата калия КЮ4, сопут-
сопутствующих залежам нитрата натрия.
Сырьем для промышленного получения иода в СССР служат воды
нефтяных буровых скважии, за рубежом — морские водоросли, а также
маточные растворы натриевой селитры. Для извлечения иода из нефтя-
нефтяных вод на них сначала действуют хлором или азотистой кислотой. Вы-
Выделившийся иод либо адсорбируют углем, либо выдувают воздухом. На
иод, адсорбированный углем, действуют едкой щелочью или сульфитом
натрия Na2SO3. Из продуктов реакции свободный иод выделяют действи-
действием хлора или серной кислоты и окислителя (НгЗСч+КгСггОу). При вы-
выдувании воздухом иод поглощают смесью диоксида серы с водяным па-
паром (SO2+H2Onap) и затем вытесняют под хлором. Сырой кристалли-
кристаллический иод очищают возгонкой.
Химический состав реактива иода по ГОСТ 4159—79 приводится в
таблице:
Показатель
Норма, % (по массе)
чистый Для
анализа
(ч. Д. а.)
чистый ( ч)
Иод, не менее
Нелетучий остаток, ие более
Хлор и бром (в пересчете на хлор), не бо-
более
Сульфаты (SO4-"), не более
99,9
0,01
0,005
0,01
99,5
0,04
0,015
0,01
Химический состав технического иода, предназначенного для произ-
производства лекарственных препаратов, синтетического каучука, редких ме-
435
таллов, реактивов и для других целей, по ГОСТ 545—76 приводится
ниже.
Показатель
Норма, % (по массе) для марок
А
99
0,01
0,08
0,05
0,8
Б
97
0,015
0,2
0,15
Не норми-
нормируется
Иод, не менее .
Хлорид и бромид, не более . . .
Органические вещества, не более .
Остаток при прокаливании, не более
Вода, не более ,
Иод транспортируют любым видом крытого транспорта, хранят в упа-
упакованном виде в крытых складских помещениях, исключающих попада-
попадание прямых солнечных лучей. Гарантийный срок хранения — 1 год со
дия изготовления.
Иод токсичен, пожаро. и взрывоопасен; пары иода ядовиты, раздра-
раздражают дыхательные пути, слизистую оболочку глаз. При попадании
внутрь организма больших количеств иода обнаруживается общее дей-
действие на кровь, нервную систему; может вызывать конъюктивиты, дер-
дерматиты, оказывает прижигающее действие на кожу. Предельно допу-
стимая концентрация иода в воздухе рабочей зоны производственных
помещений 1 мг/м3.
При работе с препаратом следует применять индивидуальные средст-
средства защиты (фильтрующий противогаз марки В или М, спецодежду,
обувь, герметичные очки, перчатки и другие защитные приспособления),
а также соблюдать правила личной гигиены. Не допускать прямого кон-
контакта с кожей и попадания препарата внутрь организма.
Подготовку проб и проведение анализов, связанных с выделением
свободного иода, необходимо проводить в вытяжном шкафу. Рабочие
помещения должны быть оборудованы приточно-вытяжной вентиляцией,
должна быть обеспечена максимальная герметизация технологического
оборудования. Препарат является окислителем, способствует самовозго-
самовозгоранию горючих материалов. Не допускается хранение иода с легковос-
легковоспламеняющимися веществами и горючими материалами.
Физические свойства
Атомные характеристики. Атомный номер 53, атомная масса
126,9045 а. е. м., атомный объем 25,72-10 м3/моль, атомный радиус
0,133 нм, ионные радиусы 1'~ 0,220 нм, Р+ 0,094 нм, 17+ 0,050 нм. Кон-
Конфигурация внешних электронных оболочек 5 s2 5 р5. Значения потенциа-
потенциалов ионизации атома иода 1(эВ): 10,44; 19,0; 31,4. Сродство атома иода
к электрону 1°-»-1~ 3,08 эВ, сродство к протону 6,4 эВ; электроотрица-
электроотрицательность 2,6. Молекула иода состоит из двух атомов Ь, свячь между
которыми ковалентная неполярная. Межатомное расстояние 0,270 нм.
Энергия диссоциации молекулы иода 1,54 эВ, степень термической дис-
диссоциации при 1000 К составляет 0,28, при 2000 К 0,89.
Кристаллическая решетка иода орторомбическая, периоды решетки
а=0,477 нм, 6 = 0,725 нм, с = 0,977 нм; энергия кристаллической решет»
ки 106,8 мкДж/кмоль.
Природный иод состоит из одного стабильного изотопа с массовым
числом 127. Известны 22 радиоактивных изотопа иода с массовыми чис-
436
лами 117—126, 128—139, характеризующиеся главным образом р. и
у-радиоактивностью. Из искусственно полученных радиоактивных изото-
изотопов важнейшими являются 131I (Tt/=8 сут), Ш1 G\/г=22 ч). Наиболее
долгоживущим является изотоп 129I (Ti/t == 1,7-107 лет).
Эффективное поперечное сечение захвата тепловых нейтронов |271 рав-
равно F,22±0,15)-10-28 м2; 1291 C2±3).1О-28 м2. Работа выхода электро-
электронов ромбического иода <р = 2,8 эВ, моноклинного 5,4 эВ, аморфного
6,8 эВ.
Плотность. Плотность кристаллическою иода при 293 К р=
= 4,94 Мг/м3, жидкого иода при 393 К 3,96 Мг/м3.
Электрические и магнитные. Удельная электрическая проводимость
при 273 К а=7,7-10-14 См/м; удельное электрическое сопротивление
1,3-1013 Ом-м. Ширина запрещенной зоны иода (пленка) при 293 К
ДЕ=1,83 эВ.
Диэлектрическая проницаемость твердого иода прн 296 К е== 10,3,
жидкого при 391 К 8=11,08. Угол диэлектрических потерь 5,5—4,0
при 290—295 К и частоте 108 Гц.
Магнитная восприимчивость %-Ю9 составляет —0,35, 6,85, 8,82 при
температурах 293, 1303 и 1400 К соответственно.
Тепловые и термодинамические. Температура плавления tnn =
= 113,6°С, температура кипения ;Кип=183°С, критические параметры:
температура 826 К, давление 1136,8-104 Па. Удельная теплота плавле-
плавления АЯПЛ = 62,17 кДж/кг, удельная теплота испарения жидкого иода
Л#исП= 164,45 кДж/кг. При нагревании иод сублимируется, превраща-
превращаясь в пар фиолетового цвета; при охлаждении пары иода кристаллизу-
кристаллизуются, минуя жидкую фазу. Удельная теплота сублимации при 386,7 К
АЯсувл = 238,48 кДж/кг, а при 298 К 246,0 кДж/кг. Изменение объема
в процессе плавления составляет 21,6 %. Удельная теплоемкость 12 (газ)
сР= 163,82 Дж/(кг-К).
Удельная теплоемкость 12 (газ) при давлении 0,1013 МПа в зави-
зависимости от температуры:
Г, К 218 400 600 1000 1500
ср, Дж/(кг-К) 145,38 146,56 148,14 149,32 150,5
Удельная теплоемкость твердого 12 в зависимости от температуры:
Г, К 20 40 80 150 250 298,15
ср, Дж/(кг-К) • • • 63,75 124,58 170,68 195,11 209,81 214,49
Теплопроводность К иода в зависимости от температуры:
Г, К • • 297,4 303 315,86
К, Вт/(м-К) 0,419 0,444 0,486
Температурный коэффициент линейного расширения в интервале
температур 83—290 К a=83,7.10-s Кг1, а при 273 К а=93,0х
Х10~6 К. Температурный коэффициент объемного расширения жид-
жидкого иода при давлении 9,8-104 Па в интервале температур 380—483 К
E = 0,8-10~3 К. Стандартная энтальпия диссоциации молекул иода
при 298 К /=151 кДж/моль Изменение молярной энтропии s° иода
(h) в зависимости от температуры:
Г, К • 298 500 1000 1500 2000 2500
s°, Дж/(моль-К) . . 116,81 260,01 306,43 321,58 332,64 341,26
437
Давление пара иода при 298 К 41,33 Па, при температуре плавле*
ния 120 К 65,6 Па. Давление пара р иода в зависимости от темпера»
туры:
Т, К Р. Па Т. К р. Па
161 1,33-Ю-8 226 1,33-10-3
169 1,33-10—7 242 1,33-10-*
178 1,33-Ю-8 262 1,33
188 1,33-Ю-5 285 13,3
199 1,33-10-* 312 133
212 1,33-Ю-3
Коэффициент диффузии (предэкспоненциальный множитель Do)
иода, растворенного в воде, при 298 К и концентрации 0,05 моль/л
составляет 1,25-10~9 м2/с; иода, растворенного в этиловом спирте при
281 К и концентрации 0,1 моль/л 0,90-Ю м2/с
Динамическая вязкость газообразного иода ц в зависимости от тем-
температуры:
Г, К 373 423 473 523 573 673 773 873
Л-108, Па-с 1730 1953 2175 2400 2630 3065 3505 3935
Константа Сезерленда в интервале 379—796 К равна 568. Криоско-
пическая постоянная иода 20,4, эбуллиоскопическая постоянная 10,5.
Скорость звука в парах иода при 273 К 108 м/с, сжимаемость при
273 К х= 13,6.10-" Па-1.
Химические свойства
Нормальный электродный потенциал реакции 21—2еч±12 (крист.) фо=
= 0,536 В. Электрохимический эквивалент иода (одновалентного) ра-
равен 1,31523 мг/Кл.
Химическая активность иода наименьшая в ряду природных гало-
галогенов, но все же он является энергичным окислителем, степень окисле-
окисления —1, +1, +3, +5, +7. При обычных условиях соединяется с боль-
большинством металлов и неметаллов.
С кислородом непосредственно не соединяется, косвенным путем по-
получают оксиды I2O4, bOjj, I4O9 и др. Наиболее важным является йодно-
йодноватый ангидрид или оксид иода (V) 12О5 — белое кристаллическое ве-
вещество, растворяется в воде с образованием йодноватой кислоты НЮз,
при нагревании свыше 573 К распадается на иод и кислород, сильный
окислитель. Остальные оксиды иода мало стойки. Известны кислород-
кислородные кислоты иода и их соли: НЮ — иодиоватистая кислота и ее со-
соли — гипоиодиты; НЮз — йодноватая кислота и ее соли — иодаты;
НЮ4 — йодная кислота и ее соли — периодаты.
При сильном нагревании иод соединяется с водородом (реакция об-
обратимая), образуя иодоводород HI — бесцветный газ, дымит на возду-
воздухе, с резким удушливым запахом, хорошо растворим в воде, темпера-
температура плавления —51°С, температура кипения —35°С, сильный восста-
восстановитель, молекулярный кислород постепенно окисляет его до иода уже
при комнатной температуре (под дейетвнем света реакция сильно ус«
коряется). Водный раствор иодоводорода является сильной кислотой,
соли которой — иодиды — по внешнему виду похожи на хлориды, поч-
почти все хорошо растворимы в воде.
Иод энергично взаимодействует с металлами, образуя соли — иоди*
ды. В соединениях с иодом многие металлы не проявляют своей выс«
438
шей валентности. Все иодиды, кроме Agl, C112I2, Hg2I2> хорошо раство-
растворимы в воде. После прибавления нескольких капель воды к смеси иода
или с порошком алюминия или с железными опилками, происходит
бурная реакция — выделяются густые фиолетовые пары иода и обра-
образуется АИз или РезЬ. Со ртутью иод реагирует при растирании в ступ-
ступке, образуя Hgl2. В отсутствии влаги с иодом реагирует лишь поверх-
поверхностный слой металла. Для многих металлов характерно образование
комплексных ионов (Hgl4~; РЫ4~).
Соединения иода с азотом получают косвенным путем. С водным
раствором аммиака (NH3) иод образует трехиодистый азот Шз —
черио-коричневое вещество, сильно взрывающееся даже при легком
прикосновении. При действии нода па азотистоводородную кислоту
HN3 в среде азота образуется азид иода Шз — бесцветное твердое
взрывоопасное вещество
Соединения иода с серой получены в растворе циклогексана взаи-
взаимодействием хлорсульфанов с иодидом калия (KI). При этом образу-
образуются иодсульфаны, отвечающие формуле SnIn, где п=2—6.
При нагревании 2 моль иода с 0,67 моль красного фосфора образу-
образуется иодид фосфора (III) РЬ — твердое красное вещество. Реакция
протекает энергично, с выделением теплоты и света. При совместном
плавлении фосфора и иода образуется соединение P2U.
При температуре выше 523 К иод соединяется с кремнием, образуя
белые кристаллы SiU, энергично взаимодействующие с водой.
Иод непосредственно соединяется с галогенами, образуя IC1, 1С1з,
IF5, IF7) IBr —малоустойчивые и химически чрезвычайно активные сое-
соединения.
Иод растворяется в щелочах, образуя нестойкие соли иодиоватистой
кислоты (НЮ), которые переходят в соли йодноватой кислоты (НЮз).
Иод является окислителем, но более слабым, чем хлор и бром. Он
окисляет сероводород (H2S) до элементарной серы, сернистую кислоту
(H2SO3) до серной кислоты (H2SO4), аммиак (NH3) до элементарного
азота, сам при этом восстанавливается до 1~. Легко выделяется в сво-
свободном состоянии из растворов солей даже под действием слабых окис-
окислителей (солей Fe3+ и Си2+). Сильные окислители (хлор, гипохлориты,
концентрированная HNO3) окисляют иод до йодной кислоты (НЮ4) и
ее солей. При растворении иода в йодистых солях образуются полиио-
диды (Mela, Mel$ и др.). Иод окрашивает крахмал в темио-сииий
цвет — это качественная реакция на иод.
В водных растворах частично гидролизуется. В воде растворяется
плохо @,3 г/л). Растворимость иода в воде (г/л) 0,1620; 0,3395;
0,9566 при температурах 273, 298, 333 К соответственно.
При растворении в воде, иод частично реагирует с ией, образуя
смесь кислот: нодоводородной (HI) и иодноватистой (НЮ). Лучше
иод растворяется в большинстве органических растворителей: сероуг-
сероуглероде (CS2), этиловом спирте (С2Н5ОН), диэтиловом эфире
(СгНбОСгНй), хлороформе (СНС1з), бензоле (QH6), ацетоне, бензине и
других. Очень легко иод растворяется в водном растворе иодида калия
(KI), образуя соединение бурого цвета К[1]. Растворы иода в углево-
углеводородах, их хлористых и бромистых производных, иитросоединеииях и
сероуглероде окрашены в фиолетовый цвет, а в органических раство-
растворителях, содержащих кислород, азот, серу и иод, — в коричневый.
Области применения
Применяют в медицине в виде йодной тинктуры A0 %-ный раствор
иода в этиловом спирте) как антисептическое и кровеостанавливающее
439
средство. Иод входит в состав ряда фармацевтических препаратов. Для
лечения базедовой болезни в организм вводят искусственно получаемый
радиоактивный 1311.
Элементарный иод и иодиды применяют как катализатор, при полу-
получении веществ и материалов высокой степени чистоты (для глубокой
очистки циркония, гафния и других тугоплавких металлов), а также в
фотографии, в аналитической химии.
Иодиды находят широкое применение в радиоэлектронике (реле па-
памяти, электрохимические диоды), в термоэлектрических преобразова-
преобразователях.
7.6. АСТАТ [1-35, 272]
Общие сведения и методы получения
Астат (At) — радиоактивный элемент; при нормальных условиях пред-
представляет собой черно-синие кристаллы. В природе встречается очень
редко. Впервые его удалось обнаружить среди продуктов естественного
радиоактивного распада радона, ничтожные количества обнаружены в
продуктах распада урана и тория.
Приблизительные подсчеты показывают, что в двадцатикилометро-
двадцатикилометровой толще земной коры содержится примерно 30 г астата. В весомых
количествам он не выделен.
В 1940 г. Э. Сегре, Д. Корсон и У Мак-Кенэи получили на циклотро-
циклотроне в Беркли (США) первый изотоп 2UAt, бомбардируя 209 Bi сс-части-
цами, разогнанными до скорости, близкой к скорости света.
Из продуктов облучения висмута удается выделить до 85 % астата
путем вакуумной дистилляции с поглощением астата серебром или пла.
тиной; возгонкой в вакууме при температуре C00—600) °С с последу-
последующей конденсацией астата на стенках приемника, охлаждаемого жид-
жидким азотом. Присутствие acTaia обнаруживают по характерному для
него сс-излучеиию.
Астат — летучий, имеет резкий запах, вдыхание его даже в неболь-
.ших количествах вызывает сильное раздражение дыхательных путей и
воспаление слизистых оболочек. Более значительное количество астата
может вызвать сильное отравление.
Астат впервые был обнаружен в 1943 г. австрийскими учеными Кар»
ликом и Бернертом.
В промышленности астат не получают.
Физические свойства
Атомные характеристики. Атомный номер 85, атомная масса 210 а. е. м.
Изменение ионных радиусов в зависимости от заряда ионов астата.
Ионные радиусы (нм) ионов астата: At = 0,227, At5+= 0,057, At7+ =
=0,063.
Астат проявляет в соединениях степень окисления —1; +1; +3; +5;
+7. Электроотрицательность 1,96.
Потенциалы ионизации / (эВ): 9,2; 20,1. Сродство к электрону
~2,8 эВ. Связь между атомами ковалентная неполярная.
Электронная конфигурация внешних оболочек атома астата 6s26p5.
Стабильных изотопов нет. Известно 22 а-радиоактивных изотопа, наи-
наиболее долгоживущий 210At с периодом полураспада 8,3 ч, а самый ко-
роткоживущий —- 214At B-10-6 с). Изотопы астата;
440
Массовое
число
202
203
203
204
205
206
207
208
208
209
210
211
212
213
214
215
216
217
218
219
Масса изото-
изотопа относи-
относительно 1ВО
_
—
—
—
—
—
—
—
—
—
—
05317
05675
05929
06299
03562
06967
07225
07638
Период
полураспада
43 С
102 С
420 с
1500 с
1500 с
0,108 сут
6480 с
0,262 с
6120 с
0,229 с
0,345 сут
0,3 сут
0,25 с
—
—2-10—° с
~10-4 с
~3-10—* с
0,018 с
1,5—2,0 с
5,4 с
Форма и энергия излучения, МэВ
К—з*; а, 6,50
К—з; а, 6,35
К—з; а, 6,10
К-з
К—з; а, 5,90
К-з
К-з (90%); а A0%), 5,75
К-з
К—з (>99 %), а @,5 %), 5,65
К-з (95%), а E%), 5,05; у,
0 2' 0 8
К—з (>99 %), а @,17 %), 5,519
C2 о/о); 5,437 C1 %); Ь ,355
C7%); у, 0,25; 1,15; 1,40
К-з E9 1 %); а D0,9 %)\ 5,862
V, 0,671
а
а, 9,2
а, 8,78
а, 8,00
а, 7,79
а, 7,02
«(99%), 6,63; Р @,1 %)
а (97 %), 6,27; рC%)
* К-з — К-захват.
Тепловые и термодинамические свойства. Температура плавления ас-
астата *пл = 300°С, температура кипения *КПп = 334°С.
Молярная энтропия s° в зависимости от температуры:
Г, К 298 500 1000 1500
s°, Дж/(моль-К) 121,42 151,73 321,92 337,61
Продолжение
Г, К 2000 2500 3000
s°, Дж/(моль-К) 348,46 357,09 364,21
Удельная теплоемкость астата при температуре 298 К с„ = 139,55
Дж/(кг-К). Стандартная энтальпия диссоциации молекул At2 при 298 К
равна 109 кДж/моль. Удельная теплота плавления астата при 298 К
д#пд= 113,642 кДж/кг, удельная теплота сублимации при 298 К
ДЯоУбл = 430,62 кДж/кг.
Давление пара р астата в зависимости от температуры:
Г, К 238 263 296
р, Па 12,936-Ю-8 12,936-Ю-6 12,936-Ю-4
Г, К 338 395 479
р, Па 12,936.10-2 12,936 12,936-10?
441
Давление пара астата при температуре плавления равно 48,118 X
Х103Па.
Энергия атомизации астата равна 90,85 кДж/моль. Приведенный
термодинамический потенциал Фг в зависимости от температуры:
Г, К 298 500 1000 1500
Фу, Дж/(моль-К) 121,42 128,07 204,98 246,77
Продолжение
Г, К 2000 2500 3000
Фг, Дж/(моль.К) 270,88 287,25 299,52
Химические свойства
Астат отличается низкой упругостью паров, мало растворим в воде,
лучше растворяется в органических растворителях. Из воды астат мож-
можно извлечь бензолом или четыреххлористым углеродом, из щелочных
растворов его экстрагировать нельзя. Астат хорошо адсорбируется на
металлах (Ag, Au, Pt), легко испаряется в обычных условиях и в ва-
вакууме.
Из-за малой доступности и короткого периода полураспада химиче-
химические свойства астата изучены мало. По химическим свойствам он бли-
близок к иоду и полонию, т. е. проявляет свойства как неметалла так и
металла.
Подобно иоду астат растворяется в большинстве органических рас-
растворителей, образует малорастворимую соль астатид серебра AgAt,
окисляется до пятивалентного состояния, образуя соль AgAtO3.
Как типичные металлы астат осаждается сероводородом даже из
сильно кислых растворов, вытесняется цинком из сернокислых раство-
растворов, образует устойчивые соли AtCl, AtBr, Atl; при электролизе выде-
выделяется на катоде.
Соединения астата со степенью окисления —1 являются сильными
восстановителями, со степенью окисления +5 — сильными окислителя-
окислителями. Все соединения асгата обладают амфотерными свойствами.
Области применения
Весьма перспективным является 211At для лечения заболеваний щито-
щитовидной железы. Имеются сведения, что радиобиологическое действие
а-частиц астата на щитовидную железу в 2,8 раза сильнее C-частиц
иода. При этом следует учесть, что с помощью иона роданида можно
надежно вывести астат из организма.
7.7. МАРГАНЕЦ [1—35, 162, 276—279]
Общие сведения и методы получения
Марганец (Мп)—металл серебристо-белого цвета в компактном со-
состоянии и светло-серого — в диспергированном. Марганец открыт
К. Шееле в 1774 г. Содержание его в земной коре составляет 9• 10 '2%
(по массе). Наиболее распространенные минералы марганца — пиролю-
пиролюзит и псиломелан.
442
Получают марганец восстановлением его оксидов кремнием в элек«
тропечах, электролизом раствором MnSO4 и другими методами.
Физические свойства
Атомные характеристики. Атомный номер 25; атомная масса 54,9381
а. е. м.; атомный объем 7,36-Ю-6 м3/моль, атомный радиус 0,130 им;
ионные радиусы: Мп2+ 0,091 им, Мп3+ 0,070 нм, Мп''+ 0,052 нм, Мп7+
0,046 нм. Потенциалы ионизации / (эВ): 7,432; 15,64; 33,69; электро-
электроотрицательность: Мп2+ 1,4; Мп3+ 1,5; Мп4+ 2,1; Мп7+ 2,5.
Марганец — полиморфный металл, имеет 4 модификации кубической
сингонии. Низкотемпературная «-модификация имеет сложную кубиче-
кубическую решетку с периодом о=0,89П9 нм (каждый атом имеет 10—12
соседей); энергия кристаллической решетки 286 мкДж/кмоль; (^-моди-
(^-модификация — кубическую решетку с периодом а=0,63145 нм (одна часть
атомов имеет 12 ближайших соседей, а другая часть—14); у-модифи-
кация — гранецеитрированную кубическую решетку с периодом а=
==0,38624 нм и б-модификация— объемноцеитриованную кубическую
решетку с а=0,29322 нм.
Электронная конфигурация внешних электронных оболочек изолиро-
изолированного атома марганца 3s2p6d54s2.
В природе встречается одни стабильный изотоп марганца — 55Мп,
Радиоактивные изотопы марганца приведены в таблице:
Массово е
число
49
50
51
52
53
54
56
57
58
Период полураспада
0,43 с
0,28 с
2700 с
5,7 сут
1,9-10е лет
290 сут
9360 с
102 с
66 с
Форма и энергия излучения, МэВ
Р
р+, 6,3; 6,7
в+, 2,16
Р+; К— з*
К-з
К—з
в-, 0,7; 1,05; 2,86
V,0,845; 1,755; 2,175; 3,02
p-t 2,6
6-
К-з — К-захват.
Работа выхода электрона а-марганца гр=4,52 эВ; C-марганца ф=
= 4,44 эВ; у-маргаица <р = 4,34 эВ (теоретический расчет).
Плотность. Плотность <х-Мп, определенная рентгеновским методом,
р=7,469 Мг/м3, пикнометрическим методом р=7,46 Мг/м3. Плотность
Р-Мп 7,244 Мг/м3 и 7,24 Мг/м3 по данным, полученным рентгеновским
пикнометрическим методами соответственно. Плотность у-Мп
1 М3
7,21 Мг/м3.
Объемные изменения, сопровождающие превращения, $-+у
б090%
0,77 %;
,%
Электрические и магнитные. Удельное электрическое сопротивление
р и удельная электрическая проводимость марганца а:
443
Т, К Р, мкОм.м о, МСм/м
273 2,58 0,388
573 2,87 0,350
973 3,07 0,325
Изменение удельного электросопротивления при плавлении рж/ртв —
=0,61.
Температурный коэффициент электрического сопротивления при 273 К
а=1,7-10-3 К.
Электрические свойства полиморфных модификаций марганца при
различных температурах:
Модификация
о, мкОм-м
а-103
Постоянная Холла при 298 К /? = 0,844-1010 м3/Кл.
Магнитная восприимчивость а-Мп при 4,2 К %= + 11,5• 10~9, при
293 К х=+9.63-10"9- Магнитная восприимчивость E-Мп при 293 К
Х=+8,80-10-9.
Тепловые и термодинамические. Температура плавления taa =
= 1244°С, температура кипения гКип=2119°С, характеристическая тем-
температура 6о=450 К, удельная теплота плавления ДЯПЛ = 267 кДж/кг,
удельная теплота сублимации при 298 К Д#субл=5057 кДж/кг. Тем-
Температура полиморфного превращения f ai;B=''270C) ' b«-v = Ю95°С,
/у-и-ПЗЗ-С
a
1,5—2
298
,6
P
1,64
1018
V
0,8
1351
6
0,69
1423
Теплоты превращений (кДж/кг): АЯа-»р =0,796; ДЯE1-7=0,755;
ДЯ?=гб =0,595.
Давление пара р марганца при различных температурах:
Г, К- ..• 800 900 1000 1100 1200
р, Па . . . 12,95-10—7 11,97-10-6 44,7.10-* 77,69-10-» 80-10-2
Давление пара марганца при температуре плавления р=120-Па.
Молярная энтропия марганца s" при различных температурах:
Г, К s°, Дж/(моль-К) Т, К s°. ДжДмоль-К)
298 38 2000 114,60
500 46,5 2500 217,86
1000 71,55 3000 221,75
1500 91,25
Удельная теплоемкость а-Мп определяется уравнением сР=393,5 +
+290,56-103 Т B98—1000 К); для р-Мп ср=635,28+50,33• 103 Гх
Х(Ю00—1374 К) Дж/(кг-К).
Удельная теплоемкость \-tAn в интервале 1374—1410 К ср =
= 810 Дж/(кг-К), б-Мп в интервале 1410—1450 К с„=860 Дж/(кг-К).
Значения теплоемкости при 298 К Для а-Мп ср=478 Дж/(кг-К), Р-Мп
ср = 488,1 Дж/(кг-К), y-Мп ср=502 Дж/(кг-К).
Удельная электронная теплоемкость СрЛ=[18 мДж/(моль-К2)]?'.
Теплопроводность X марганца чистотой 99,98 % при различных тем-
температурах
Г, К 7 10 56 103 273
h Вт/(м-К) 0,335 0,836 3,762 5,65 157,0
444
Температурный коэффициент линейного расширения а электрического
марганца:
Г, К 100—303 303—773 773—1073
а,-10е К 22 29,8 40,4
При 293 К а=22,3-10-« (а-Мп); а=24,9-10-6 К ф-Мп) а=
== 14,8-10-6 К (уМп).
Поверхностное натяжение жидкого марганца при 1250 °С а=
= 1750 мН/м.
Оптические. При Х=0,65 нм спектральный коэффициент излучения
от гладкой поверхности е^ =0,59, то жидкой фазы 8^ = 0,65.
Коэффициент поглощения пленочного образца при К= 0,004 мкм
а=0,9-107 м-1.
Механические свойства
Твердость при 20 °С #В=196 МПа, микротвердость при 20 °С #й =
=3840 МПа (нагрузка при испытании 0,2 Н, время 10 с).
Временное сопротивление разрыву ав = 706 МПа.
Модуль нормальной упругости Е при различных температурах:
/, °С —180 20 200 400 600 800
Е, ГПа. ...... 214 198 186 169 143 122
Ударная вязкость KCU электролитического марганца при 1000 "С
KCU = 245 кДж/м2 и при 1250"С KCU=294 кДж/м2.
Химические свойства
Нормальный электродный потенциал реакции Мп—2е^±Мп2+ фо=
=—1,05 В; проявляет в соединениях степень окисления +7; +4; +3;
+2.
Марганец активно окисляется при нагревании на воздухе. Известны
следующие оксиды марганца: МпО, Мп3О4, Мп2Оз, МпОг, Мп^СЬ. При
комнатной температуре и нормальном давлении Мп2С>7 — /жидкость.
В интервале 200—1000 °С одной из важнейших составляющих при по-
поверхностном окислении марганца является МпО. Предполагаемая об-
область гомогенности МпО 50—53% (ат.) кислорода. Мп2О3 существует
в температурном интервале 600—800 °С; МпО2 имеет тетрагональную,
гексагональную и ромбическую структуры.
В жидком марганце при 1275, 1280, 1510 и 1800 °С растворяется со-
соответственно 2,8; 2,2; 1,54 и 1 % (ат.) азота. В y-fAn при 1000 °С по
различным данным растворяется 3,8—9,8 % (ат.) азота. Предполагают
существование Mn(N3J-
В системе Мп—С предельная концентрация' твердого раствора
8,5 % (ат.) или 2 % (по массе) углерода. Установлено существование
карбидов Мп4С, Мп6С2, Мп8Сз, МпСз-
В системе Мп—S образуется соединение MnS.
В системе Мп—Р существуют соединения Мп3Р, Мп2Р, МпР.
В системе Ag—Мп имеется область несмешиваемости в жидком со-
состоянии, промежуточных фаз не образуется. Максимальная раствори-
растворимость серебра в 6-Мп 1,5 % (ат.). В системе Аи—Мп наблюдается об-
445
разование MnAu4, MnAu3 и MnAu2. В системе Си—Мп наблюдаются
широкие области твердых растворов Медь стабилизирует Y"Mn, об-
образуя непрерывный ряд твердых растворов. В системе Мп—Hg уста-
установлено существование соединений Mn2Hg5 и MnHg. Ниже 198 К со-
соединение MnHg антиферромагнитно.
При взаимодействии с цинком образуется промежуточная е-фаза,
которая испытывает превращение е-*-в'->-а'. Со скандием, иттрием и
лантаноидами марганец образует соединения типа /?Мп2 с гексагональ-
гексагональной решеткой типа MgZn2. Небольшие добавки РЗМ понижают темпе-
температуру у^б-превращения марганца.
Известны соединения марганца с титаном: TiMn, TiMn2; предпола-
предполагают существование TiMn3 и TiMn4. В системе Zr—Мп установлено су-
существование соединения ZrMn2.
В системе Мп—Si известны соединения MnSi, MnSi2, Mn3Si, в систе-
системе Мп—Sn установлено существование соединения Mn3Sn с точкой Кю-
Кюри 451 К. В системе Ge—Мп образуются соединения Mn3Ge2, Mn5Ge3,
Mn6Ge2, Mn3,25Ge.
Свинец и марганец ие смешиваются в жидком состоянии, и пре-
предельная растворимость марганца в жидком свинце составляет 8,7 %
(по массе).
Растворимость марганца в свинце при комнатной температуре —
-0,02% (ат.).
В системах с ванадием, ниобием и танталом образуется замкнутая
■у-область. В системах Мп—Та и Мп—Nb установлено существование
соединения ТаМпг и NbMn2 соответственно.
С мышьяком известны соединения Mn3As (ниже 273 К — ферромаг-
ферромагнетик), Mn2As (ниже 573 К — антиферромагнетик, а ниже 273 К —фер-
—ферромагнетик), МпзАвг, MnAs (ниже 313 К — ферромагнетик, выше
393 К—парамагнетик и в интервале 313—393 К — антиферромагие-
тик).
Методами порошковой металургии получен антимонид марганца
MnSb.
В системах Мп с Сг„ Мо и W образуется замкнутая ■уобласгь.
Хром, молибден и вольфрам повышают температуру ликвидуса и со-
лидуса марганца.
В системе Мп—Те с небольшим избытком атомов марганца сущест-
существуют соединения МпТе^оог-ынз и МпТег-
В системе Мп—Re установлено существование а-фазы. Рений повы-
повышает температуру ликвидуса и солидуса марганца, а также темпера-
температуры его полиморфных превращений.
В системах Fe—Мп и Со—Мп образуются широкие области твердых
растворов. Промежуточные фазы отсутствуют. В системе Со—Мп при
1145°С протекает перитектоидное превращение р-Мп + б-Мп*±у-Мп.
В системе Мп—Ni существуют соединения MnNi3 и MnNi.
Наблюдается заметная растворимость рутения и родия в y-tAn [до
10 % (ат.)], а также палладия [до 2 % (ат.)].
В системе Мп—Ir имеет место упорядочение с образованием Мп31г2;
в системе Мп—Pt образуются РШп4, РШп и Pt3Mn.
Технологические свойства
При комнатной температуре марганец — хрупкий металл. В темпера-
температурной области, отвечающей существованию у-фазы с ГЦК решеткой,
марганец проявляет высокие пластические свойства и поддается любым
видам обработки давлением. Эта область соответствует 1095—1133°С.
Для повышения технологической пластичности, в марганец следует вво-
вводить элементы, стабилизирующие существование у-фазы.
446
Области применения
До 90 % марганца используется в черной металлургии для раскисления,
десульфурацин н легирования стали. Марганец повышает вязкость,
твердость и износоустойчивость стали. Широкое применение получил
манганин — сплав меди с 11,5—13,5% Мп и 2,5—3,5% №. Сплав ха-
характеризуется относительно малым температурным коэффициентом элек-
электросопротивления и хорошей технологической пластичностью, позволяю-
позволяющей изготавливать из него ленту и проволоку, широко применяется в
электротехнических приборах.
Особыми физическими свойствами обладают сплавы системы Мп—Си
большой демпфирующей способностью, антиферромагнетизмом, высо-
высокими электросопротивлением и твердостью. У сплавов марганца, в част-
частности у сплавов этой системы, обнаружено еще одно интересное свой-
свойство— эффект механической памяти. При этом максимальное проявле-
проявление эффекта механической памяти наблюдается у сплава Мп—10%
(по массе) Си.
Карбонильные соединения марганца, например С6Н7Мп (СОK—анти-
(СОK—антидетонаторы моторного топлива. МпОг используется в производстве чу-
чугуна, стали, сплавов марганца, в стекольной промышленности при изго-
изготовлении глазури, эмали, в резиновой промышленности, при изготов-
изготовлении низкотемпературных катализаторов. МпО2 входит в состав шихты
для электродов и флюсов для электросварки.
МлС12 применяется для окрашивания тканей, а также в производ-
производстве других солей марганца.
Сульфат марганца (MnSO4) применяется в текстильной промыш-
промышленности, а также в качестве мнкроудобрений.
Перманганат калия (КМГ1О4) применяется в органическом синтезе.
7.8. ТЕХНЕЦИЙ [1—35, 162, 165, 280—282]
Общие сведения и методы получения
Технеций (Тс) получил свое название от греческого слова «техникос»,
что означает искусственный. В периодической системе элементов распо-
расположен в VIIA группе и 5-ом длинном периоде. В компактном состоя-
состоянии имеет серебристо-серый цвет. Технеций — радиоактивный элемент.
Существование технеция было предсказано Д. И. Менделеевым в 1870 г.,
а открыли этот элемент в 1937 г. Псрье и Сегрэ (Палермо).
Технеций может быть получен в заметных количествах как побочный
продукт в ядерных реакторах. Исходным сырьем для получения техне-
технеция являются отходы переработки ядерного юрючего или молибденовые
мишени, облученные нейтронами на реакторе или протонами и дейтро-
дейтронами на циклотроне. Для отделения технеция от сопутствующих эле-
элементов применяют химико-металлургические методы. Металлический по-
порошок технеция получают восстановлением солей (гептасульфнда тех-
технеция или пертехната аммония) водородом. В компактном виде
технеций получают методами порошковой металлургии или плавкой,
а изделия из него (прутки, проволока, лента, фольга) — методами пла-
пластической деформации.
Физические свойства
Атомные характеристики. Атомный номер 43, атомная масса 99 а. е. м.,
атомный радиус 0,1358 нм, ионные радиусы 0,057 (Тс7+), 0,072 нм
(Тс4+), 0,095 нм (Тс2+).
447
Электронная конфигурация внешних оболочек атома технеция:
2ed65l
p
Потенциалы ионизации / (эВ): 7,23; 14,27; 31,9; электроотрицатель-
электроотрицательность Тс5+— 1,9; Тс'+ —2,3. '
Кристаллическая решетка гексагональная плотноупакованная с пе-
периодами: а=0,2735 им, с=0,4391 им, е/а= 1,6055; координационное чис-
число 6. Известные изотопы технеция приведены ниже:
s
я
Q „
Mace
числе
92
93
94
95
96
97
98
99
*
Период
пол у распада
С
2
1
2
K-3-
258 с
9610 с
4,9 ч
,834 сут
4,3 сут
6-10» лет
5-10» лет
2-10» лет
- К-захват.
форма
и энергия
излучения МэВ
К-з
К—з
К-з
К-з
К—з
К-з
р-;
;*Р+, 4,1
> р
> р+
0,30
0,290
8
и
О о
100
101
102
103
164
105
106
107
Период
полураспада
15,8 с
840 с
240 с
50 с
18 с
600 с
37 с
29 с
Форма
и энергия
излучения, МэВ
■ ;
г"
>
у-
5—^
i—
2,8
1,20
Эффективное поперечное сечение захвата тепловых нейтронов B0±
±5) -10-28 м2; работа выхода электрона ф=4,4 эВ.
Плотность. Плотность, определенная рентгеновским методом р=
= 11,563 Мг/м3, пикнометрическим — р=11,5 Мг/м3.
Электрические и магнитные. Удельное электрическое сопротивле-
сопротивление р и удельная электрическая проводимость а технеция чистотой
99,9 % после отжига при 1400 "С:
7", К р. мкОм.м а, МСм/м Т, К Р, мкОм-м а, МСм/м
8
77
273
,4
0
0
0
,0024
,0250
,169
500
40
5
,9
773
1273
1800
0,427
0,593
0,67
2,34
1,69
1,49
Температура перехода в сверхпроводящее состояние 7'с=8,22—
11,20 К.
Магнитная восприимчивость Х'Ю9=+2,9; +2,7; +2,5 при темпе-
температуре 78, 298 н 402 К соответственно.
Тепловые и термодинамические. Температура плавления 2200 °С,
температура кипения 4700 °С, удельная теплота плавления Д//пл =
= 232,8 кДж/кг, удельная теплота сублимации ДЯсувл=6560 кДж/кг;
удельная теплоемкость ср = 245,47 Дж/(кг-К)-
Давление пара р в зависимости от температуры:
Т, К 1745 1950 2220 2540
р, Па 12,94-10-8 12,94-10—6 12,94-10-* 12,94-10-2
Молярная энтропия s° при различных температурах:
Т, К 298 500 1000 1500
s°, Дж/(моль-К) 33,47 46,44 65,69 78,70
448
г, к- • • • •
s°, Дж/(моль-К)
2000
89,t6
2500
107,78
Продолжение
3000
115,40
Теплопроводность технеция составляет, Вт/(м-К) 49,8; 50,5; 53,0
при температуре 300, 573 и 848 К соответственно.
Температурный коэффициент линейного расширения а-106 (К")
деформированного технеция чистотой 99,92 % в интервале 293—373 К
составляет 8,1 (вдоль направления прокатки); 7,2 (поперек направле-
направления прокатки); 8,9 (перпендикулярно плоскости прокатки).
Механические свойства
Механические свойства технеция, получеииого вакуумной плавкой, изу-
изучали на листовых образцах. При 20 °С сте=1471 МПа; 6=13%—де-
6=13%—деформированное состояние ов=735 ГПа; 6=57%—после вакуумного
отжига в течение 2 ч. Сжимаемость »с=0,27- 10~и Па-1.
Химические свойства
С водородом образует гидрид неизвестного состава.
Проявляет в соединениях степень окисления +7, +6, Н-5, +4, +2.
В системе Тс—О2 образуются два оксида: относительно нелетучий ТсСЬ
и летучий Тс2О7, имеющий температуру плавления 119,5 °С и кипения
3105 °С. Окисление технеция до Тс2О7 происходит в токе кислорода прн
400-600 "С.
Давление пара р Тс2О7 при различных температурах:
Г, К- • . • 273,5 396,6 446,2 546 583,5
р, Па ... 1,3-Ю-5 1,3-10—* 1,3- 1в—3 1,3-10—Э 1,013-Ю-1
Технеций может науглероживаться нли в газовой смеси (Н2+СвН6)
или при нагревании с графитом G00—1100°С). При 910°С растворяется
7—8 % (ат.) углерода.
Технеций не реагирует с азотом при 400—900 °С, но вступает с ним
во взаимодействие в атмосфере ЫНз при 700—1100 "С, образуя новую
фазу TcN0,76-
С серой технеций образует сульфиды Tc2S7 и ТсБг.
Ниже приведены галоидные и оксигалоидные соединения технеция:
Степень окисления
Тс'+
Тс6+
Тс5+
Тс*+
F2
TcO3F
TcF6;Tc0F4
TcF5
TcO3Cl
TcCl6
TcOCl3
TcCl4
Br,
ТсОВГз
Физико-химич.еское взаимодействие технеция с элементами периоди-
периодической системы в значительной мере аналогично рению. Технеций не
образует металлических соединений с элементами VIII группы. В сис-
системах технеция с металлами, имеющими гексагональную решетку, ру-
теннем, осмием и рением — образуются непрерывные ряды твердых рас*
449
творОв. С переходными металлами IIIA—VIA групп техиеций образует
одно или несколько соединений со сложными кристаллическими струк-
структурами (в основном о-, х- и Х-фазы). Предполагается также наличие
соединений со структурами [5-W и CsCI. Имеются данные о значительной
растворимости технеция в твердой фазе в системах с ванадием, нио-
ниобием, молибденом, вольфрамом.
Технологические свойства
Технеций характеризуется сильной склонностью к наклепу: в меньшей
степени, чем у рения, но в большей, чем у металлов платиновой группы.
При пластической деформации технеция следует делать частые проме-
промежуточные отжиги в вакууме нлн атмосфере инертных газов.
Области применения
Техиеций не нашел пока широкого примевения, несмотря на ряд важ-
важных физических свойств, которыми он обладает, например, сверхпрово-
сверхпроводимость. К основным причинам, затрудняющим применение технеция,
относятся' радиоактивность, малый объем производства.
Высокая температура перехода технеция и его сплавов в сверхпро-
сверхпроводящее состояние делает его перспективным сверхпроводником.
Возможно применение техиеция как ингибитора коррозии.
Большой период полураспада изотопа технеция "Тс делает возмож-
возможным изготовление из него источников C-излучения, активность которых
практически не меняется во времени. Фольгу, изготовленную из 89Тс,
можно использовать в качестве источника электронов в электровакуум-
электровакуумных приборах. Изотопы техиеция с малым периодом полураспада ис-
используют в медицине при диагностике опухолей.
7.9. РЕНИЙ [1—35, 48, 162, 250, 283—289]
Общие сведения и методы получения
Реннй (Re) в периодической системе располагается в VII А группе 6-го
длинного периода.
В компактном состоянии имеет серовато-белый цвет, в диспергиро-
диспергированном — черный.
Реиий был открыт в 1925 г. немецкими химиками супругами Валь-
Вальтером и Идой Ноддак. Существование этого элемента предсказал в
1872 г. Д. И. Менделеев, который назвал его двимарганцем. Это вы-
выдающееся предсказание явилось основой для открытия, сделанного
Ноддаками. В. и И. Ноддак впервые обнаружили рений в русской пла-
платиновой руде и выделили его в виде легколетучего оксида, предполо-
предположительно Re2O7. Открытый металл был назван рением в честь Рейн-
Рейнской области в Германии.
Промышленное получение рения относится к 50—60 гг. нашего сто-
столетия. Этот период характеризуется также интенсивным развитием ра-
работ по исследованию особенностей физико-химического взаимодействия
рения с элементами периодической системы и разработке на этой ос-
основе сплавов с рением для различных отраслей техники.
Реиий относится к группе рассеянных элементов. Он, как правило,
сопутствует минералам молибдена, меди, свинца, цинка, платины, нио-
ниобия и др. Рений характеризуется наименьшим кларком, который равен
450
примерно ЫО %. Как в нашей стране, так и за рубежом ведется по-
поиск новых источников этого металла. Имеются сообщения об обнару-
обнаружении рения в урановых рудах и угольных месторождениях. Найден
минерал рения — джезказганит, представляющий собой сложный суль-
сульфид рения Cu(ReMo)S4- Установлено присутствие реиия в органических
соединениях нефтяного ряда, в нефти, нефтяных битумах и горючих
сланцах.
Основными источниками получения рения, имеющими промышлен-
промышленное значение, являются молибденовые концентраты, отходы переработки
медистых сланцев, промышленные воды. Рений в виде различных со-
соединений извлекается из пылей обжига молибденовых концентратов,
при шахтной плавке медистых сланцев, из сбросных раствором при
гидрометаллургической переработке обожженных молибдеиовых концен-
концентратов. В существующих схемах извлечения рения различают две ста-
стадии: перевод соединений рения в раствор и их выделение из него. Пе-
Перевод в раствор соединений рения из ренийсодержащих продуктов осу-
осуществляется путем водного выщелачивания с добавлением окислителей,
спекания с известью и последующего водного выщелачивания, кислот-
кислотного или солевого выщелачивания. Из растворов соединения рения из-
извлекаются следующими способами: осаждением малорастворимых со-
соединений (перрената калия KReC>4, сульфида рения Re2S7); сорбцией на
ионообменных смолах и угле; экстракцией органическими растворите-
растворителями.
Способы получения металлического рения: восстановление перреиата
калия (аммония) водородом; восстановление двуокиси рения водоро-
водородом; электролитическое выделение реиия из водных растворов; терми-
термическая диссоциация галогеиидов и карбонидов рения. Последние два
метода используют для получения рениевых покрытий. Чистота полу-
получаемых металлических порошков рения достигает 99,99 %.
Для получения рения в компактном виде применяют методы порош-
порошковой металлургии, вакуумнодуговую и электроннолучевую плавки.
Методами электроннолучевой зонной и плазменнодуговой плавок могут
быть выращены монокристаллы реиия.
Для прессования штабиков рення используют, как правило, мелкозер-
мелкозернистый порошок, полученный восстановлением из перреиата аммония.
Порошок прессуют в штабики размером 6X6X200 мм или 9X9X400 мм,
которые затем спекают и сваривают в атмосфере водорода или в ва-
вакууме при 2400—2900 °С. Методами пластической деформации из шта-
штабиков получают полуфабрикаты в виде ленты, фольги, прутков, прово-
проволоки. Примерный состав порошков рения, полученных различными спо-
способами— см. табл. с. 452.
Вакуумная дуговая и электроннолучевая зонная плавки способст-
способствуют эффективной очистке реиия, особенно от газовых примесей:
Метод получения
Порошковая металлургия . .
Дуговая плавка
Электроннолучевая зонная
Содержание, % (по массе)
ог
0,07
0,01
0,001
нг
0,008
0,001
0,0001
0,006
0,002
0,0001
Согласно техническим требованиям чистота металлического рення
должна быть не менее 99,976 % (по массе).
451
Реииевый порошок упаковывается в мешкн из полиэтиленовой плен»
ки, которые вкладывают в мешки из бязи н помещают в деревянные
ящики. Каждый ящик обшивается бязью.
Хранят рений в закрытом помещении, не содержащем паров кислот
в щелочей.
Соединение
для получе-
получения порошка
рения
KReO4
NH4Re04
ReO2
СОСТАВ
ПОРОШКОВ РЕНИЯ
Содержание элементов, % (по массе), в порошках рения
Fe
0,02
0,0025
0,012
А1
0,002
0,0015
0,008
Мо
0,001
0,0005
N1
0,028
0,0015
Си
0,0035
0,005
0,0002
К
0,04
0,005
Na
0,06
0,005
Продолжение
Соединение
для получе-
получения порошка
реиия
KReO4
NH4ReO4
ReO2
Содержание элементов, % (по массе), в порошках рения
Са
0,1
0,006
0,002
РЬ
0,002
0,0001
Sn
0,0006
0,0001
Cd
0,001
0,0001
Mg
.0,05
SI
0,015
Физические свойства
Атомные характеристики. Атомный номер 75, атомная масса 186,31
а. е. м., атомный объем 8,85-Ю-6 м3/моль, атомный радиус 0,137 нм,
ионный радиус Re6+ 0,052 им.
Электронная конфигурация внешних электронных оболочек нейт-
нейтрального атома рения 5s2p6rf56s2; потенциалы ионизации атома / (эВ):
7,87; 16,6; 79; электроотрицательность Re5+— 1,8; Re6+—-2,1 и
Re'+ — 2,2.
Кристаллическая решетка—гексагональная плотиоупакованная.
Энергия кристаллической решетки 793 мкДж/кмоль. Координационное
число—6; 6. Влияние содержания кислорода на параметры кристалли-
кристаллической решетки рення:
Содержание О2,
% <ат.)
0,004
0,007
0,009
Периоды решетки, нм
а
0,2757
0,2759
0,2758
с
0,4463
0,4468
0,4467
с/ь
1,Ы9
1,620
1,620
В природе встречаются два стабильных изотопа рения' !85Re
C7,07 %) и !S7Re F2,93 %). Наиболее распространенные радиоактив-
радиоактивные изотопь\ рения приведены в таблице:
452
Массовое число
182
183
184
186
188
189
190
192
Пераод полураапада
64 ч
71 сут
38 сут
3,8 сут
16,9 ч
150 сут
168 с
6 с
Тип распада
К-3*
К-з
К-з, й-
f>~, К-з
i
J
J-
5-1
К-а — /(-захват.
Эффективное поперечное сечение захвата тепловых нейтронов 0,86 X
:-28
ХЮ
Работа выхода электронов <р в вакууме при Г=2500 К для поли-
поликристаллов реиия ф=4,99 эВ для монокристаллического рения по кри-
кристаллографическим плоскостям:
Ш1 .
Ф, 2В
@001)
5,53
A010)
5,15
B113)
4,83
Плотность. Реиий является одним из наиболее тяжелых металлов.
Его плотность, определенная рентгенографически при 293 К, р=
«=21,02 Мг/м3. Плотность рении во многом зависит от способа его по-
получения и чистоты:
Способ получения
Спеченный
Спеченный
Спеченный н прокованный
Осажденный из галогенидов
Литой
Метод определения плотности
Рентгенографический
Прямой
Прямой
Рентгенографический
Прямой
р, Мг/м>
20,53
20,9
21,03±0,01
21,04±О,01
21,01±0,01
Электрические и магнитные. Удельное электрическое сопротивление
рения в значительной степени определяется содержанием примесей и
предварительной обработкой. Влияние содержания газовых примесей
иа удельное электрическое сопротивление рения р и температурный ко-
коэффициент электрического сопротивлення а:
Способ получения
Электроннолучевая
плавка
Дуговая плавка с ре-
ниевым нерасходуе-
мым электродом
Содержание примесей, %
Ог
0,0021
0,0081
0,012
0,018
0,020
0,022
(по массе)
0,0005
0,0004
0,0003
0,0006
0,0006
0,0005
N2
0,0006
0,0005
0,0005
0,0008
0,0025
0,0008
Р
мкОм•м
0,1720
0,1851
0,2011
0,2052
0,2260
0,2285
а-10«,К—'
4,36
4,35
_
4,36
4,29
4,31
453
Влияние примесей на удельное электрическое сопротивление р и
температурный коэффициент электросопротивлеиия а рення:
Содержание
примесей,
% (по массе)
0.05W
0.10W
О.ОШо
0,048Мо
р нкОм • м
298 К
0,1985
0,1992
0,214
0,201
0,208
а. 10» К"
4,47
4,07
3,56
4,23
3,63
Содержание
примесей
% (по массе)
0, ЮМо
0,02ре
0,06Fe
0,1 OFe
р, мкОм. м
298 К
0,221
0,2006
0,2024
0,212
а 10»,
к-1
3,38
4,31
4,07
3,98
Удельное электрическое сопротивление р и удельная электрическая
проводимость рения а чистотой 99,9 %:
Т. К
100
200
300
500
700
S00
р, мкОм-м
0,040
0,116
0,190
0,330
0,452
0,560
о, МСм/м
25
8,62
5,28
3,03
2,21
1,79
Т. К
1100
1300
1500
1800
2273
2673
р, мкОм и
0,650
0,728
0,792
0,860
1,06
1,12
а, МСм/м
1,54
1,37
1,26
1,17
0,945
0,895
Температурный коэффициент электросопротивлеиия в интервале
273—373 К а=3,5-10-' К.
С увеличением степени деформации до 25 % удельное электросоп*
ротивление рения прн комнатной температуре возрастает примерно на
0,02 мкОм-м.
Наблюдается параболическая зависимость RIRp от давления, где
R — электросопротивление при данном давлении, Rp — электросопротив»
ление при давлении 2,94 ГПа.
Коэффициент анизотропности электросопротивления (рх/рц)для
моиокристалла рения при 293 К составляет 1,3.
Рений в паре с вольфрамом, молибденом, платниой характеризуется
высокой т. э. д с, достигающей при 1273 К 15—20 мкВ.
Постоянная Холла Я—3.15-10-" м'/Кл.
Температура перехода в сверхпроводящее состояние Гс —1,7 К.
Анизотропия вторичноэмиссиоиных свойств рения при 293 К:
Параметры вторично-
вмиссионных свойств
°mas
Ерт, КЭВ
Е'рт> кэВ
"lmax
Ерт, кэВ
0,
0,
1,
Монокристалл
(НЛО)
1,63
880—0,920
1,18
700—0,740
0,61
480—1,520
(hkll)
A120)
1,46
0,960—1,
1,06
0,940—0,
0,46
1,580-1,
000
980
620
Поликристалл
1,60
е,7бо
—
—
454
93
194
249
273
0,368
0,366
0,372
0,373
Продолжение
Примечание: атях — коэффициент вторичной электронной эмиссии
(КВЭЭ), 6 так—коэффициент, характеризующий истинно вторичную эмиссию,
*)тах~~ коэффициент, характеризующий иеупругое отражение электронов; индекс
т обозначает максимальное значение коэффициентов в зависимостях а(Ер),
f\(Ep), 6(Ep); £pm< ^оти £„„ — соответствующие, при которых достигаются
максимумы.
Наблюдается сильная эмиссия с трех плотноупакованиых плоскостей
монокристаллического рения в парах цезия
Рений — парамагнетик Магнитная восприимчивость % мало изме<
ияется в температурном интервале от 93 до 294,5 К:
Т. к %■ юэ т, к х-ю»
288 0,373
293,2 0,368
294,5 0,375
Тепловые и термодинамические. Рений имеет температуру плавления
*пл = 3180°С, температуру кипения (Кпа — 56^0°С, характеристическую
температуру 6d=415 К, удельную теплоту плавления ДЯПП=
= 178 кДж/кг, удельную теплоту испарения Д//Исп = 3822 кДж/кг,
удельную теплоту сублимации ДЯСубл=4180 кДж/кг. Молярная энтро-
энтропия рения s°=37,24 ДжДмоль^К) при 298 К.
Давление пара р рения при различных температурах, определенное
по методу Лэигмюра:
Г К Р, Па Г, К Р, Па
2494 12,16-10—§ 4000 10,5-101
2523 25,вО-10—6 4500 11,18-10?
2650 59,25-Ю-8 5000 72,99-102
2748 54,54-10-* 5500 34,237-10»
2999 72,3-Ю-3 5900 98, ЫО»
3453 35,7-10-1
Скорость испарения рения в зависимости от температуры:
Скорость нспаре- Скорость испаре-
1 • л ния, кг/с - ма '. К рения, кг/с • м1
2653 1,55-10-е 3295 1,39-10-»
2837 1,50-Ю-8 3641 1,34-10-2
3047 1,44-10-* 4040 1,27-10-1
Скорость испарения определяет максимальную рабочую температу-
температуру, которая при потере массы образца не более 1 % за 100 ч составля-
составляет для рения 2653 К-
Удельная теплоемкость cv рения при разных температурах в интер-
интервале 298-2273 К-
Л К ср, Т, к ср
Дж/(кг-К) Дж/(кг К)
298 137,9 1773 180
323 150,4 2273 200
1273 161,1
455
Удельная электронная теплоемкость с£™ =[2,35 мДж/(молЬ'Кг)]7".
Теплопроводность ревия составляет А=71,2—*59 Вт/(м-К). Это в
2 раза меньше теплопроводности молибдена, в 3 раза меньше вольфра-
вольфрама и в 5,5 раза меньше меди.
Температурный коэффициент линейного расширения для различных
интервалов температур имеет следующие значения:
Г, к о-10», к~* г, к а. 10». к—-8
293—373 6,6 293—873 6,7
293—473 6,6 293—973 6,7
293—573 6,6 293—1073 6,8
293—673 6,6 293—1173 6,8
293—773 6,7 293—1273 6,8
Для монокристаллов рення наблюдается значительная анизотропия
о. В интервале температур 77—300 К ацс«=6,9-10-в К и ахс-«
-З.в-Ю-'К-1.
Энергия дефектов упаковки (по данным рентгенографического ис-
исследования) 180 мДж/м2.
Оптические. Отражательная способность рения (коэффициент отра-
отражения nD) при угле падения 0°:
%, мкм 0,05 0,10 0,15 0,30 0,40 0,50 0,60
«д 40 30 45 52 50 50 50
Спектральный коэффициент излучения г^ рения в интервале 1810—■
3050 К для различной длины волны X
X, мкм ..... 0,4—0,5 1,о 2,5—3
е^ 0,41—0,44 0,36 0,23—0,27
Механические свойства
Механические свойства рения в значительной степени определяются его
чистотой и структурным состоянием.
Механические свойства деформированного и рекрнсталлизованного
металлокерамического реиия прн комнатной температуре:
Полуфабрикат
Пруток отожженный
Лист отожженный
Лист после прокатки
со степенью дефор-
деформации, %:
12,9
24,7
30,7
184,4
217,78
172,7
289,4
310,9
289
899
1591
1915
1932
1
,4
,57
,2
,8
"о
МПа
320
927
1682
2046
2128
Я
,7
,05
,4
°в
1113
1153,65
1716,8
2108
2211
S
*
%
24,0
28
8
9
2
21,7
30
24
1
1
Примечание. Для прутка расчетная длина образца составляет 12,7, а
для листа — 24,5 мм.
456
Особенно сильно на механические свойства рения влияют примеси
внедрения (кислород, азот, углерод), а также калий, кальций и др.!
Содержание газов, % (по массе)
О,
N,
НВ, МПа
литой
осадка на 40 %
4-отжт>
ав МПа | в, %
осадка на 40 %
-(-отжиг
0,0021 0,0005
Зонная электроннолучевая плавка
0,0006
1452
1285
522 21,1
Дуговая плавка с рениевым элетродом е атмосфере гелия;
сплавление с Re2Or
0,0081
0,012
0,018
0,020
0,022
0,0004
0,0003
0,0006
0,0006
0,0005
0,0005
0,0005
0,0008
0,0025
0,0008
1834
1874
2442
2550
2668
1785
1834
2305
2501
2668
—
645,5
721
814
845
—
16,1
11,0
9,2
5,0
Высокочистый монокристаллический рений характеризуется исклю-
исключительно высокой пластичностью: при растяжении прутка диаметром
3 мм его длина удваивается, он легко изгибается. Высокаи пластичность
монокристалла рення сохраняется и при инзких температурах. При
194 "С монокристалл рения выдерживает изгиб иа 96е.
Деформация способствует повышению прочности рення не только при
комнатной, но и при повышенных температурах. Механические свойст-
свойства рениевой проволоки диаметром 1,27—1,65 мм при повышенных тем-
температурах:
t "С
20
500
1000
1500
2000
2300
Отожженная
V
МПа
1172
787
588
262
53
« %
10
9
1—2
1—2
—
1—2
Ч>> %
10
19
2—3
2
—
2
Обжатие S
МПа
1491
1049
677
255
152
—
о %
8
7
2—3
2
23
—
%
Ф. %
6
9
1
1
1
—
Обжатие 15 %
МПа
2350
1196
855
276
103
—
о %
1
1
1
1
—
Ч>. %
2
1
3
10
4
—
Резкое повышение пластичности у рення начинается ие при темпе-
температуре начала рекристаллизации, как у других металлов, а при полном
завершении рекристаллизации. Тнердость в отожженном состоянии
WV=2500 МПа; в иагартованном — #V=6000 МПа.
Модуль нормальной упругости рения £»467 ГПа.
457
Химические свойства
Нормальный электродный потенциал реакции Re"—e*±Re фо=—0,4 В.
В соединениях проявляет степень окисления от +7 до —1.
Известны следующие оксиды рения: ReOifRejOs), Re2O7, ReO3,
Re2O5, ReO2, Re2O3) ReO(Re2O2) и ReiA Высшие оксиды имеют кислый
характер, низшие — основной. Существование ReCu и RejOj окончатель-
окончательно не установлено. Re2C>7 — высший н наиболее устойчивый оксид ре-
рения, полученный нагреванием рения или его оксидов иа воздухе нли в
кислороде при температLре выше 200 "С.
Рений не образует карбидов. Существуют лишь комплексные соеди-
соединения рения с участием углерода, например, карбонил реиии [Re(COMl2,
который образуется при взаимодействии окиси углерода и соединений
рения (оксид (VII) рения, перренат калия, перреиат аммония) при
250—270 °С под давлением 34—50 МПа. Бесцветные кристаллы карбо-
нила рения растворимы в органических растворителях н могут возго-
ниться.
Существуют следующие фториды рения: ReF?, ReFe, ReFs и ReF«.
ReF? получен пропусканием фтора под давлением 3,3-10' Па через ре-
рений, нагретый до 300—400 °С, и представляет собой летучий продукт.
При 105 °С получается ReFe с температурой плавления 188 °С; при
180 "С представляет собой яркожелтые кристаллы, выше 0°С — лимон-
но-желтые, после плавления — желто-бурая жидкость; пары ReFe прак-
практически бесцветны. Пяти- и четырехфтористый реиий получают соответ-
соответственно путем взаимодействия шестнфтористого рения с карбонилом
вольфрама и водородом или триоксидом серы.
Хлориды рення: ReCb, ReCle, ReCl5, ReCU, ReCl3.
ReCl5 — коричнево-чериое твердое вещество, очень летучее, с красно-
коричневыми парами. При нагревании ReCle диссоциирует на хлор н
треххлористый реиий.
Бориды рення: ReBr3 н ReBr«. Пары ReBr8 зелено-черного цвета,
ReBr«— темиозеленые.
Иодиды рения: Rel4, Rel3 н Rel.
Рений взаимодействует с фосфором при температурах выше 750—
800 СС с образованием следующих фосфидов. ReP3, ReP2. ReP и Re2P.
Соединения с серой Re2S7, ReS^ ReS3.
При пропускании аммиака над солями рения NH«ReO« и ReCl3 при
300—350 °С образуетси ReNo,«. Сообщается также о получении соеди-
соединения K2ReO3N.
Характерной особенностью взаимодействия рения с металлами IVA—
VIA групп является образование в соответствующих двойных системах
ог-их-фаз (структурный тип а-Mn). В системах с металлами IVA груп-
группы (цирконий, гафний) образуются также фазы Лавеса со структурой
типа MgZri2. Все эти соединении плавятся инкоигруэитио.
Интересной особенностью гексагонального реиия является его высо-
высокая растворимость в металлах VA и VIA групп с о. ц. к. решеткой; на-
например, растворимость рения в ванадии составляет 65 % (ат.), в вольф-
вольфраме при 1100°С — 32 % (ат.). Растворимость рения в изоморфных
а-модификациях титана, цирконии, гафния мала [0,5—0,4 % (ат.)], в то
время как в высокотемпературных модификациях этих металлов с
о. ц. к. решеткой она достигает 50 % (ат.) (например, в системе с ти-
титаном).
С платиновыми металлами (VIII группа) реиий взаимодействует с
образованием или непрерывного ряда твердых растворов, или твердых
растворов с ограниченной растворимостью. Промежуточных фаз в этих
системах не образуется.
458
Энергичное окисление рения с образованием Re2Or начинается при
нагреве его выше 600 °С. При этом строго выполняется линейный закон
окисления, что свидетельствует о полном отсутствии защитного действия
со стороны образующихся легкоплавких н летучих ReO3 и ResO7.
Наиболее устойчивым в агрессивных средах являетси литой реиий,
менее устойчив — металлокерамический; наибольшую активность прояв-
проявляет рений в порошкообразной форме.
Рений в компактной форме мало растворим в концентрированной
соляной, серной и плавиковой кислотах, а также в органических кисло-
кислотах (щавелевая, уксусная, лимонная). Интенсивно растворяетси рений
в азотной кислоте.
При длительной выдержке вступает во взаимодействие со щелоча-
щелочами, особенно в присутствии красной кровяной соли, активно взаимодей-
взаимодействует с расплавами щелочей.
Технологические свойства
Реиий, полученный методами порошковой металлургии и вакуумной
плавки, характеризуется высокой пластичностью, поэтому его можно
обрабатывать вхолодную. Однако даже при малых степенях деформа-
деформации, не превышающих нескольких процентов, резко возрастают степень
наклепа и сопротивление пластической деформации рения; одновременно
падает пластичность. В зависимости от степени чистоты максимально
допустимая суммарная степень обжатия составляет 30—60%. Поэто-
Поэтому при получении из рения изделий различного профиля методами пла-
пластической деформации необходимы частые промежуточные отжиги.
Горячую деформацию рения проводят в вакууме или среде инертных
газов, так как на воздухе возникает красноломкость, связанная с вы-
высокой окисляемостью реиия и образованием легкоплавкой эвтектики
Re—Re2Or (/Вл = 297°С). Горячая прокатка в вакууме проводится при
1350±50°С. Наряду с прокаткой рения в вакууме его можно прокаты-
прокатывать в защитных оболочках из стали, никеля илн молибдена.
Температура начала рекристаллизации литого рения понижаетси с
увеличением степени деформации с 1750 °С при 5 %-иой деформации до
1200 °С для 40—60%-ной деформации, металлокерамического рении со-
соответственно от 1850 °С при 5%-ной деформации до 1550Х при 30—
50 % деформации.
Области применения
Одна из наиболее перспективных областей применения рения — элек-
электронная промышленность. Показана возможность использования реиия
в качестве автоэлектронных эмиттеров, обеспечивающих высокие плот-
плотности токов эмиссии. Реиневые острия в автокатодах характеризуются
значительно большей стабильностью токов эмиссии, меньшим катодным
распылением по сравнению с вольфрамовыми остриями.
Сплавы на основе рения с присадками оксидов лентаиа, иттрия, са-
самария, тория и гексаборида лантана являются перспективными мате-
материалами для электродов импульсных газоразрядных ламп.
Сплавы рения с вольфрамом, молибденом, никелем (ВАР—5,
ВР—27ВП, HP—10ВП и др.) нашли применение в качестве подогрева-
подогревателей катодов, кернов оксидных катодов, вводов высокочастотной
энергии.
Тоикопленочные резисторы иа основе пленок рения характеризуются
высокой стабильностью сопротивления.
459
РенвЯ и его сплавы с вольфрамом и молибденом широко применяют
в качестве термоэлектродов высокотемпературных термопар, предназ-
предназначенных для измерения температур до 2873 К (термопары ВР5/20,
ВР10/20). Рекомендованы также термопары Ir/(Ir+6O % Re) и 1г/Aг+
,'+70% Re). Для работы в углеродсодержащих средах рекомендуются
термопары (Мо+20 % Re)/(Mo+50 % Re) и (Мо+20 % Re)/(Mo-K
+40 % Re).
Разработаны и применяются в приборостроении упругие элементы
в виде проволоки и ленты микронных толщин (торсионы и растяжки)
из сплава МР-47ВП [Мо—47 % (по массе) Re].
Реиий и его сплавы используют в качестне антифрикционных мате-
материалов. В частности, реиий и сплавы рения с кобальтом — перспектив-
перспективный материал для подвижных сопряжений, работающих при высоких
температурах в вакууме н инертных средах.
Сплавы реиия с вольфрамом и молибденом ВР—27ВП [W—27 %'
(по массе) Re] и МР-47ВП [Мо—47 % (по массе) Re] могут использо-
использоваться и в теизодатчнках, так как характеризуются высокими значения-
ми коэффициента тензочувствительности 5,6—5,8 н 4,5—5,2 соответст-
веино, что в 2—3 раза превосходит аналогичные характеристики дру-
других материалов, применяемых в тензометрии.
7.10. ЭЛЕМЕНТ № 107 [1-35, 333]
Общие сведения и методы получения
Элемент № 107 снитезироваи в 1976 г. в Объединенном институте идер-
ных исследований (Дубиа). Синтез осуществлен в результате ядерной
реакции ускоренных ионон хрома с висмутом,
Физические свойства
Атомный номер 107. Строение внешних электронных оболочек изолиро-
изолированного атома: б5*^57в'.
Получен одни изотоп элемента № 107 с массой 261 и временем жиз-
жизни, измеряемым миллисекундами.
8. ЭЛЕМЕНТЫ
ВОСЬМОЙ ГРУППЫ
8.1. ЖЕЛЕЗО [1-35, 290-294]
Общие сведения и методы получения
Железо (Fe) — блестищий светло-серый металл. Железо известно че-
человеку с доисторических времен. До середины XIV века в Европе и
Древней Руси железо получали путем восстановления руды древесным
100
СОСТАВ ЖЕЛЕЗА ПРОМЫШЛЕННЫХ МАРОК, ВЫПУСКАЕМЫХ В СССР
Железо
0.05ЖР
0.08ЖР
0.08ЖРО
Карбонильное рафинированное*
(99,95 %)
Карбонильное, порошок, класса А-1
Карбонильное, порошок, класса А-2
Карбонильное, порошок, класса В-3
Электролитическое (99,98 % Fe)
Сталь низкоуглеродистая,' шихтовая
5-
8-
8-
з.
5-
2-
5-
8-
2,5
с
Ю-3
10-?
10-3
10-2
10—1
Ю-3
10-?
• 10-2
5-
5-
7-
2-
5-
2,5
s
10-3
10-»
Ю-3
10-3
То—s
• 10-2
Содержание примесей, %
Р
3-10-3
3-Ю-3
3-10-8
3-10-3
1,5-10-2
N
4,5-10-2
7-Ю-з
О
3-10-2
3-10-2
3-10-2
МО-*
Мп
6-10-в
6-10-?
6-tO-»
<5-10-*
4-10-2
3,5-10-3
Продолжат»
Железо
0.05ЖР
0.08ЖР
0.08ЖРО
Карбонильное рафинированное•
(99,95 %)
Карбонильное, порошок, класса А-1
Карбонильное, порошок, класса А-2
Карбонильное, порошок, класса В-3
Электролитическое (99,98 % Fe)
Сталь инзкоуглеродистая, шихтовая
ОЗПС
Содержание примесей, %
S1
3-10-»
3-10-2
1-10-2
2.10-2
5-10—*
5-10-*
1-10—3
3-10-2
Сг
1-10-2
1-10-2
Ы0-2
<3-10-*
7-10-2
№
3-Ю-2
3-10-?
3-10-2
3-10-2
2-10-2
<5-10-*
9-10—2
2-10-1
Си
3.10-2
3-10-2
3-10-2
МО-3
Ы0-*
1-10—*
5-10-2
1,5-10-»
А1
5» 10-2
5.10-2
2.10-2
М0-*
5.10-?
другие
<2.10-2Mg<NrO-?Pb
l-10-*Mg <Ы0-*РЬ
<M0-*Mg,Co, Pb
<5- 10-*Са <3- 10-*Zo
4.10-Ш
npaxecefi Мп, SI, Сг, №. N. И составляет 0,04 %.
углем, так называемым сыродутным методом. Название «железо» про-
происходит от латинского слова Ferrum (феррум). Содержание его в зем-
земной коре составляет 5,1 % (по массе). В природе встречается глав-
главным образом в виде оксидов, сульфидов, силикатов, карбонатов, фос-
фосфатов и других минералов, в состав которых входит железо. Для про-
промышленного производства важнейшими рудными минералами являются
магнетит Fe3O4, гематит Fe2O3, лимонит FesO-H2O, сидерит FeCO3 и др.
В виде гидроксидов железо накапливаете в морских и континенталь-
континентальных осадках, образуя осадочные руды.
Содержание железа в промышленных рудах составляет 16—70 %.
Из них богатые руды (>50 % Fe), рядовые E0—25% Fe), бедные
(<25 % Fe). Руды, содержащие <50 % Fe, обогащают до содержа-
содержания 60 % Fe. Для обогащения применяют главным образом методы
магнитной сепарации или гравитационный. Рыхлые богатые руды, а
также концентраты обогащения подвергают агломерации (из концен-
концентратов готовят также окатыши). Содержание примесей в железной
руде для выплавки чугуна и стали, ограничивается: 0,1—0,3% S, Р и
Си и 0,05—0,09 % As, Zn, Sn, Pb. Примеси: Мп, Сг, Ni, Ti, V, Co в
основном являются полезными.
Самородное железо встречается в природе крайне редко. Получа-
Получают чистое железо в небольших количествах либо электролизом вод-
водных растворов его солей, либо восстановлением водородом оксидов
железа. Увеличивается производство чистого железа восстановлением
рудных концентратов водородом, природным газом и углем при срав-
сравнительно низких температурах.
Получение железа высокой степени чистоты методом вакуумной
дистилляции основано на различии упругости паров основного метал-
металла и примесей. На том же основана глубокая очистка железа мето-
методом зонного плавления, зонная очистка в твердом состоянии. Очист-
Очистку от примесей (С, N, О, S), наиболее сильно влияющих на свойст-
свойства железа, производят в атмосфере водорода.
Один из методов получения чистого железа (обычно в виде ните-
нитевидных кристаллов) — восстановление его галогеиидов.
Хранить порошкообразное железо высокой степени чистоты, на-
например карбонильное, очень трудно, так как даже 10-мин выдержка
его в вакууме A,33• 10—в Па) при комнатной температуре приводит
к образованию пленки адсорбироваиного кислорода.
В основном железо применяется в виде сплавов: сталей и чугунов,
которые составляют около 95 % всей металлургической продукции.
Весьма широкое применение в промышленности нашло также чистое
железо, благодаря высокой пластичности и уникальным магнитный
свойствам.
Составы промышленных марок железа, иыпускаемого в СССР, при-
приведены в таблице — см. табл. на с. 463.
Физические свойства
Атомные характеристики. Атомный номер 26, атомная масса
55,847 а. е. м.; атомный объем 7,09- 10~в м'/моль, атомный радиус
0,126 нм, ионный радиус Fe2+ 0,080 нм и Fe3+ 0,067 нм.
Строение внешних электронных оболочек атома железа — 3d'is'.
Потенциалы ионизации атома железа / (эВ): 7,90; 16,18; 30,64. Элек-
троотрицательиость 1.8.
Железо образует <;-, |3- (а немагн.)-, у. б- и е-кристаллические мо-
модификации — см. табл. на с. 463,
462
Фазовые превращения железа:
Вид превра.
щевий
Условия превращения
U °С
769
910
1392
27
давление,
Мпа
15 000
AV
у . %
ototo 1
Примечание
Магнитное превращение
(точка Кюри)
\ Почти все легирующие
> элементы, кроме Со, по-
) нижают температуру пе-
перехода
Энергия кристаллической решетки железа £=405,5 мкДж/(кмоль).
ХАРАКТЕРИСТИКИ КРИСТАЛЛИЧЕСКИХ МОДИФИКАЦИЙ ЖЕЛЕЗА
Модификация*
железа
са
1
Магнитные
свойства
a-Fe
o-Fe
Жидкое
железо
О. ц. к.
О. ц. к,
Р. ц. к.
О. ц. к.
Ближний
порядок
соответ-
соответствует
б-Fe
0,286645
0,2895
0,3637
0,2925
12
8
около
8
7,86
7,642
7,709
7,400
7,010
0,2478
0,2508
0,2572
0,25321
Ферромагнетик
Магнитиоуио-
рядочеииое
(аитиферро-
магнетик)
Парамагнетик
• Свойства я-вафм'Р'',1?- и в-желеэа даны при температурах соответственно
20, 900, 910 в 1400 "С. •• Плотность определена рентгеновским методом.
Природное железо состоит из четырех стабильных изотопов с мас-
массовыми числами 54, 56, 57 и 58. Состав изотопов железа:
Масвовое
число
52
53
54
55
56
57
58
59
60
Содержание в
элементе. %
—
5,84
91,68
2,17
0,31
—
—
Маеса изотопа относи-
относительно кислорода
52,96238
53,95654
54,95604
55,95286
56,95365
58,95350
—
Период полураспада
0,346 суп
534 с
__
2,9 лет
_
...
45сут
3,5 сут
463
Эффективное поперечное сечеине захвата тепловых нейтронов 2,43 X
O23 2
Работа выхода электронов железа <р=4,31 эВ; согласно теоретиче-
теоретическому расчету работа выхода электронов a-Fe q>=4,51 эВ, а p-Fe
Ч>=4,45 эВ. Методом термоэмиссии определено, что для Y"Fe ф=
=4,23 эВ.
Плотность. Плотность железа рентгеновская у=7,872 Мг/м3 и пик-
нометрическая у=7,86 Мг/м3, изменение Плотности при плавлении же-
железа равно 4,4 %.
Электрические и магнитные. Удельная электрическая проводимость a
и удельное электрическое сопротивление р железа зависит от его чис-
чистоты. Для железа чистотой 99,99 % при разных температурах эти ве-
величины имеют следующие значении:
Т, К • • •
а, МСм/м .
р, мкОм-м■
73
10Э
0,01
293
10
0,0971
473
5,55
0.18
873
1,57
0,64
1273
0,74
1,35
1623
0,78
—
Температурный коэффициент электрического сопротивления железа
а=6,57-10-3К-'.
Абсолютный коэффициент т. э. д. с. при 298 К е= + 17,0 мкВ/К.
Т. э. д. с. по отношению к платине при температуре горячего спая 173,16 К
£=—1,940 мВ и при 373,16 К £= + 1,980 мВ. Коэффициент вторичной
электронной эмиссии Стал =1,3 при ускоряющем напряжении первичных
электронов 0,35 кэВ. Постоянная Холла при комнатной температуре
/?^= +8,00-10-'° м8/Кл. Магнитные свойства модификации железа приве-
приведены ниже:
Фаза
a-Fe
p-Fe
Y-Fe
Температура,
К
1042
1042—1183
1183—1665
Параметр в
уравнении
Кюри—Вейса,
в, К
+770
+ 1090
—2790
Эффективный
магнитный мо-
меит в парамаг-
парамагнитной области
3.18
7,13
Точка
Кюри Г к
1042
Примечание
Чистота
99,9 %
Ферромагне-
Ферромагнетик при
1042 К
Индукция насыщения чистого железа при 20°С Ss=2,33 Тл. Удель-
Удельная намагниченность насыщении железа при 20° равна о«=0,218х
Х10~4 Тл-м'/кг.
Тепловые и термодинамические. Температура плавления firn = 1538°C,
температура кипения /Кип=2872':'С, характеристическая температура же-
железа, определенная по упругим постоянным 9d=478,1 К, а определенная
по теплоемкости 9о=445 К.
Удельная теплота плавления железа ДЯПл=272 кДж/кг, удельная
теплота сублимации ДЯсувл=6095 кДж/кг. Удельная теплота фазовых
переходов: у*±8 12,4 кДж/кг, а*=*у 16 кДж/кг.
Удельная теплоемкость железа ср=456 Дж/(кг-К).
Удельная электрониаи теплоемкость сР=[5 мДжДмоль-К4)] Т.
Теплопроводность при 273—373 К А,=74 Вт/(м-К):
404
К, Вт/(м К)
3,1
7,2
11,0
282,0
910,0
490,0
146,5
75,8
74,0
25,0
28,6
29,7
Г, К
0,5
1
1,5
5
20
40
100
273
298
1313
1523
1600
Примечание
99,94 % Fe
Чистота: 99,99 % Fe
0,005 % Ni, 0,0002 % Си
0,0001 % Ag
Армко-Fe (99,85 % Fe)
Температуропроводность железа а (примеси в %: 0,0927 С;
0,001 Si; 0,001 Мп; 0,002 S; 0,064 О2; 0,001 N2):
Г, К 273 293 873 1048 1173 1273
а-106, м2/с . . . 22,8 21,9 7,15 3,52 5,4 6,5
Температурный коэффициент линейного расширении железа а в ин-
интервале температур 90—303 К составляет 10,7-10—* К"', а в интервале
температур 303—1133 К а= 16,7-10-» К~', в интервале температур
273-373 К а= 12,1-10-'К-1.
Молярная энтропия газообразного железа при разных температурах
s" (газ):
Г, К 298 500 1000 2000 3000
so(ra3), Дж/(моль-К). . 180,49 193,68 210,05 225,53 235,59
Молярная энтропия s° твердого железа при разных температурах:
Г, К 298
s°, Дж/(моль-К)- 27,17
Поверхностная энергия а железа
Модификация a-Fe
(Ш)
1500
84,53
дф
(Ш)
а, мДж/ма
(ПО)
1480
A00)
2145
500 1000
41,19 66,78
(разных модификаций):
Y"Fe S-Fe
A
A11)
1370
1624
(ПО)
1407
Энергии дефекта упаковки a-Fe 140 мДж/мг.
Энергия активации самодиффузии a-Fe в интервале температур
973—1023 К равна 272,14 кДж/моль, а в интервале температур 1063—
1178 К 239,48 кДж/моль; y-Fe в интервале температур 1336—1666 К
270,05 кДж/моль; S-Fe в интервале температур 1680—1788 К
258,35 кДж/моль. Параметры взаимной диффузии железа и диффунди-
диффундирующих элементов — см. табл. на с. 466.
Зависимость давления р от температуры.
Г, К 1290 1480 1740 2120
р, Па 12,93-10—» 12,93-Ю—з 12,93-10-1 12,93-10-»
465
ПАРАМЕТРЫ ВЗАИМНОЙ ДИФФУЗИИ ЖЕЛЕЗ/
Модифи-
Модификация же-
железа
a-Fe
a-Fe
Y-Fe
a-Fe
Y-Fe
Y-Fe
a-Fe
Y-Fe
Fe
Y-Fe
a-Fe
Y-Fe
a-Fe
Y-Fe
Fe
a-Fe
a-Fe
Y-Fe
a-Fe
Y-Fe
a-Fe
a-Fe
Y-Fe
6-Fe
a-Fe
a-Fe
y-Fe
a-Fe
a-Fe
Y-Fe
a-Fe
Y-Fe
a-Fe
Y-Fe
a-Fe
•y-Fe
Диффун-
дирую-
дирующий эле-
элемент
н
в
с
С
Be
N
N
А1
Si
Р
Р
S
S
Са
Ti
Ti
V
Сг
Сг
Мп
Со
Со
Со
Ni
Ni
Ni
Си
Си
Nb
Mo
Hf
W
W
Аи
U
ЭЛЕМЕНТА
Предэкспо-
ненциальный
множитель
£>„, м2/с
6,42-10-8
5,66-10-8
2-10-'
6,2-10-'
0,1-10-4
о.ыо-*
4.67-10-8
3,35-10-'
3,23- 10-в
0,44-10-*
7,1-10-'
МО-6
1,68-10-*
2,42-10-*
0,8-10-4
3,15-10-*
0,15-10-*
8-10—2
6
1,8
0,76-10-*
0,2-10-*
8-10-2
5,5-10-4
1,4-10-4
1,3-10-4
1,4-10-*
0,47-10-*
0,57-10-*
5,3-10-?
0,44-10-*
9
3,8-10-2
МО-1
31-10-4
7-10-1
Интервал
температур,
К
573—1373
573—1373
623—1128
1173—1323
1273—1623
—
988—1153
1368—1620
973—1123
1223—1473
973—1173
1473—1623
1343—1573
1345—1598
973—1023
1373—1523
1719—1767
973—1123
1173—1473
873—953
1083—1173
873—1353
923—1023
1073—1323
1430
1073—1623
1430
973—1173
1373—1523
973—П73
L И ДИФФУНДИРУЮЩЕГО
Образую-
Образующаяся фаза
Твердый
раствор
То же
»
»
»
»
»
»
»
»
*
»
»
»
»
»
»
»
,)
»
»
»
))
■»
Энергия ак-
активации Е,
кДж/моль
8,03
8,03
87,92
80,38
135,65
241,5
76,52
144,86
54,43
200,97
167,47
182,96
204,73
223,58
276,33
247,0
261,21
S30
343,32
407,12
224,4
220,09
364,25
256,23
254,2
237,46
245,77
244,2
288
343,4
238,65
473,4
293,08
376,81
261,26
133
466
Оптические. Железо в компактном виде имеет светло-серый, а в диспер-
диспергированном состоянии — серый цвет.
Коэффициент излучения е^ гладкой поверхности железа, при Я,=»
■=0,65 нм:
Состояние е^
Окисленное жидкое ,.,.... 0,5
Неокисленное твердое 0,37
Окисленное твердое 0,7
Отражательная способность (коэффициент отражения nz>) полиро-
полированного железа:
Я, мкм 0,5 0,6 0,7 1,0 2,0 3,0 9,0
nD, % 55 67 59 65 78 84 94
Показатель поглощения х для железа в виде непрозрачной пленки в за-
зависимости от длины волны;
Я,, мкм 0,05 0,10 0,15 0,20
X 2,6 4,1 5,3 6,0
Пленка железа при длине волны X,=»0,004 мкм имеет коэффициент по-
поглощения а==1,Ы07 м-1.
Показатель преломления для непрозрачной пленки железа в зависи-
зависимости от длины волны:
А,, мкм 0,5 1,0 1,5 2,0
п 2,2 2,8 3,4 3,1
Механические свойства
Временное сопротивление разрыву ов Армко-железа * @,025—0,035 %
С) при разных температурах:
t, "С —180 —20 20 400 600 1100
ав, МПа .... 772 371 309 190 50 16,7
Предел текучести Оо,г Армко-железа @,035 % С) при разных тем-
температурах:
t, °С —195 —100 —20 20 649 982
Оо,2, МПа .... 586 401 216 112 27,5 17,6
Относительное удлинение S и относительное сужение i|) для Армко-желе-
Армко-железа @,035 °/о С) при разных температурах:
t,°C —180 —20 20 649 816 982
б, % 0 42 28 24 17 8
ф, % 0 75 73 — — —
* Армко-железо — это технически чистое железо (99,85% Fe), со-
содержащее около 0,15 % примесей С, Si, Mn, P, S н др.
467
Механические свойства
Степень чистоты
железа
Чистое вы-
выплавленное в
вакууме
Электролити-
Электролитическое
Карбонильное
Технически
чистое
о„,МПа
о
291,5
180—250
200—280
180—320
чистого железа
МПа
176,5
100—140
90—170
90—250
в %
50
50—
40
40—
30
40—
30
при 20
*. %
93
80-
70
80—
7ft
80—
70
"С:
Е, МПа
t__
210000
207000
20-
210000
в,
МПа
——
82000
—
ИВ
МПа
| м||
450—
600
550-
800
800—
900
Изменение ф и б литого и деформированного железа в зависимости
от температуры.
ВЛИЯНИЕ ТЕМПЕРАТУРЫ НА ОТНОСИТЕЛЬНОЕ СУЖЕНИЕ ф И
ОТНОСИТЕЛЬНОЕ УДЛИНЕНИЕ 6 ЛИТОГО И ДЕФОРМИРОВАННОГО
ЖЕЛЕЗА РАЗЛИЧНОЙ ЧИСТОТЫ
t, °с
700
800
900
1000
1100
№1
ф. %
31/42
42/29
22/15
19
36/59
в. %
14/53
25
15/9
15/11
28/40
№2
*.%
77/86
80/88
77/81
70/81
66/73
6,%
31/52
45/60
52/43
49/55
46/48
№3
*. %
82/86
87/85
33/37
28/33
70/77
в, %
35/46
36/39
19/28
21/27
46/57
№4
*. %
62~-
3/—
Щ-
16/-
в %
43/-
6/-
8/-
8/-
Примечание: в числителе приведены значения для литого железа, в зна*
иенателе — для деформированного
Содержание примесей в железе, %
О S Мп С р
№1
№2
№3
№4
0,
0,
0,
6,
07
04
06
25
0,
0,
0,
0,
02
01
01
01
0,
0,
0,
0,
05
03
01
06
0
0
0
0
,03
,02
,03
,02
0,009
0,01
следы
Твердость по Бринеллю ИВ Армко-железа в зависимости от тем-
температуры:
t, °С —70 17 100 600
НВ, МПа 755 785—1180 880 465
Твердость по Виккерсу HV карбонильного железа в зависимости от
температуры.
20
608
200
597
400
677
600
334
900
137
1000
98
1100
69
/, °С
HV, МПа . . . ,
Микротвердость электролитического железа (после отжига) при
20 °С Н^ =589—687 МПа.
468
Ударная вязкость KCU железа при разных температурах:
|, °С 20 100 200 600 700 1000 1200
KCU, кДж/м? . >2350 >3040 >2550 >2260 1860 > 1380 >1080
Модуль нормальной упругости Я железа при комнатной температу-
температуре 211,0—223,0 ГПа. Модуль нормальной упругости Е отожженного же-
леза при разных температурах:
t, °C —180 20 600 1200
Е, ГПа 223 211 167 ПО
Модуль нормальной упругости Е монокристаллического железа по раз-
разным направлениям кристаллической решетки при 20 °С:
I
bkl] [Ill] [110] [100]
ч, ГПа 284 222 132
Коэффициенты модуля нормальной упругости Е монокристалла железа
при 293 К: сц-»243,1 ГПа} с««»138,1 ГПа; С44-21.9 ГПа. Модуль сдви-
сдвига железа составляет 84,7 ГПа.
Предел выносливости при переменном изгибе при 20 "С у отожжен-
отожженного железа ов=»194 МПа.
Скорость распространения продольных волн й в стержне железа при
20 °С 5170; 5850 м/с, поперечных воли 3230 м/с; удельное акустическое
сопротивление Zs=45-10' Па-с/м.
Химические свойства
Нормальный электродный потенциал <р0"»—0,44 В (Fe2+) и —0,036 В
|(Fe8+). Степени окисления: +2, +3 (наиболее характерные) н +4, +6
(слабо выраженные).
Коррозионная стойкость железа зависит от его чистоты.
Во влажном воздухе при обычной температуре железо покрывается
ржавчиной (FesCVnrbO) рыхлого строения, котораи ие препятствует
дальнейшему окислению металла.
При нагревании железа в сухом воздухе выше 200 "С на его поверх-
поверхности образуется тонкая оксидная пленка, в некоторой степени защи-
защищающая металл от коррозии в обычных условиях (основа процесса во-
воронения). Дли защиты от коррозии железо покрывают цинком, никелем,
хромом и др., а также неметаллическими покрытиями — маслами, лака-
лаками, красками и т. д. Существует защита протектированием железа, ког-
когда к изделиям из него прикрепляют более активный металл (цинк
и др.), служащий аиодом, постепенно растворяющийся. Этот метод эф-
эффективен длн судов и конструкций, находящихся под водой. Железо
высокой чистоты отличается повышенной коррозионной стойкостью.
Кроме того, коррозионную стойкость железа в атмосфере и нейтраль-
нейтральных растворах повышает дополнительное легирование, особенно не-
небольшими добавками меди.
Железо легко растворяется в разбавленных кислотах с выделением
водорода и образованием ионов Fe'+. Концентрированная HNO3 пас-
бивирует железо, образуя тонкую пленку оксядов. Разбавленная HNO3
растворяет железо.
Концентрированная серная кислота F5—100 %) пассивирует железо,
в олеуме оно разъедаетси.
469
В щелочах, за исключением их концентрированных горячих раство-
ров, железо не растворяется.
С кислородом железо образует оксид (II) FeO, оксид (HI) Fe2O3
н окснд (II, III) Fe3O4 (соединение FeO и Fe2O3, имеющее структуру
шпинели). Гидроокснд (II) Fe(OHJ образуется при действии щелочей
иа водные растворы оолей железа. При соприкосновеини с воздухом
гндрокснд (II) Fe(OHJ переходит в гидрооксид (III) Fe(OHK.
Железо с серой образует твердые растворы весьма малой концент-
концентрации и соединения FeS и Fe2S.
Железо с азотом образует а-, \- и е-твердые растворы внедрения, а
также нитриды ■y'fF^N) и £(Fe2N). Азотирование и ннтроцемеитация
стальных изделий широко применяются в промышленности. Широко из-
известны сплавы железа с углеродом — стали и чугуиы. В структуре этих
чрезвычайно распространенных сплавов в равновесном состоянии при-
присутствуют при нормальной температуре — феррит и цементит (Fe3C),
а в серых чугунах, кроме того, графит. Растворимость углерода в
Y-железе значительно выше, чем в а(б)-фазе Наибольшая раствори-
растворимость углерода наблюдается в Y'Fe B,14% при 1147°С); в a-Fe—до
0,025 % при 727 °С и в fi-Fe —до ОД % при 1496 °С. Углерод в железе
образует твердые растворы внедрения.
Железо относится к металлам переходных групп и отличается не-
недостроенной З^-электронной оболочкой и имеет несколько кристалличе-
кристаллических модификаций, что определяет особенности его взаимодействия с
другими элементами.
Высокая растворимость углерода в у-железе и низкая в а-модифи-
кации является основой термической обработки сталей и чугунов. Наи-
Наиболее важные особенности взаимодействия железа с углеродом, опре-
определяющие получение различных структур и широкого диапазона
свойств, отражаются в диаграмме Fe—С. Влияние легирующих элемен-
элементов на строение и свойства сплавов железа прежде всего определяются
стабилизацией aF)- и уФаз железа, а также карбидообразованнем.
Стабилизируют феррит, хром, ванадий, образующие непрерывные ряды
о-твердых растворов, а также Mo, W, Nb, A!, Si, P, Со и другие эле-
элементы, образующие широкие области a-растворов. Непрерывные у-твер-
дые растворы с железом образуют Mn, Ni, Co. Широкие области у-рас-
творов с железом образуют С, N, а также Cr, Cu, Re
Электродный потенциал железа резко изменяется вследствие пол-
полного или частичного пассивирования, к которому оно особенно склонно.
Электрохимический эквивалент Fe (II) =«0,2893 мг/Кл, Fe(III)=>
= 1,19291 мг/Кл.
Технологические свойства
Поверхностное натяжение железа при температуре плавления a =1788—■
1840 мН/м, при 1550 °С а= 1,780 мН/м.
Динамическая вязкость г\ железа при разных температурах:
t, "С 1580 1590 1690 1782 1860
т), мПа-с. . • . 64,35 60,62 55,42 53,66 51,01
Кинематическая вязкость v железа при разных температурах:
t °С 1425 1460 1500 1600 1620
v-10«, мг/с 1,15 1,10 1,00 0,850 0,800
Железо н его сплавы хорошо обрабатываются давлением. В зависи-
зависимости от состава они хорошо обрабатываются резанием, свариваются.
470
Влияние давления н температуры при прокатке яа содержание примесей
в железе:
Условия ирокатки
Р Па
До прокатки
1,01-105
1,01-10е
1,33-Ю-8
1,33-10-3
t, °с
20
1000
1250
1000
1250
Содержание примесей %
О
0,011
0,034
0,040
0,009
0,009
N
0,009
0,016
0,023
0,012
0,010
н
0,0003
0,0009
0,0008
0,0006
0,0004
Области применения
Чистое железо используется для получения порошков, предназначенных
для изготовления деталей методом порошковой металлургии, сварочных
материалов, аккумуляторов и других изделий. Благодаря большой пла-
пластичности и хорошей деформируемости чистое листовое железо или низ-
низкоуглеродистая сталь применяется в тех случаях, когда требуется глу-
глубокая вытяжка, например для штамповки кузовов автомобилей. В связи
с высокой магнитной проницаемостью и с малой коэрцитивной силой
чистое железо н низкоуглеродистая сталь широко применяются в элек-
электротехнике в качестве магнитомягкого материала для изготовления ре-
реле, сердечников электромагнитов, статоров и роторов электродвигате-
электродвигателей, якорей, экранирующих деталей и т. д. Низкоуглеродистая прово-
проволока используется как проводниковый материал. Железо применяют
также для получения железобетона и железографита. Прямое восста-
восстановление железа нз руд природным газом и водородом открывает ши-
широкую перспективу промышленного использования дешевого чистого же-
железа. Железо используют для нанесения покрытий на поверхность ме-
металлических изделий с целью повышения поверхностной твердости и
износостойкости, восстановления изношенных деталей машин, в част-
частности, в автомобильной н тракторной промышленности. Соединения же-
железа (оксиды) являются минеральными красками, а такие соединения,
как Fe3O4, Y-Fe2O3 используют для производства магнитных материа-
материалов. Соли железа находят применение в создании берлинской глазури,
чернил н др.
Сплавы железа — стали и чугуны, выплавляемые ежегодно в коли-
количестве сотен миллионов тонн, представляют основные материалы со-
современной техники. Уникальный полиморфизм железа н сочетание его
большой распространенности с комплексом разнообразных физико-хи-
физико-химических характеристик послужили основой для разработки огромного
числа различных широко используемых в промышленности сплавов.
К ним относятся строительные, конструкционные и машиностроитель-
машиностроительные стали, высокопрочные, хладиостойкие, теплостойкие и жаропрочные
стали, коррозионностойкие и нержавеющие стали, инструментальные
стали для режущего, штампового и мерительного инструмента, шарико-
шарикоподшипниковые и пружинные стали, магнитомягкие и магнитотвердые
сплавы, различные специальные стали.
Наиболее широко применяемый в промышленности сплав для литья—
серый чугун, отличается малой усадкой, жидкотекучестыо, прочностью,
износостойкостью и другими качествами. Используются изделия нз ков-
ковкого и отбеленного износостойкого чугуна (например прокатные вал-
валки), а также специальные чугуны.
471
8:2. КОБАЛЬТ [1—35, 295—297]
Общие сведения и методы получения
Кобальт (Со) — тяжелый металл серебристого цвета с розоватым от«
ливом. Оксид кобальта известен человечеству с незапамятных времен.
Он применялся в Древнем Египте, Вавилоне, Китае для окрашивания
стекол и эмалей в синий цвет. В 1735 г. шведский химик Брандт по-
получил металл, который назвал «корольком кобольда». Вскоре это на«
звание было заменено на «кобольт», а затем — иа «кобальт».
Содержание кобальта в литосфере 1,8-10~* % (по массе). В земной
коре ои мигрирует в магмах, горячих и холодных водах. При магмати«
ческом дифференцировании он накапливается, главным образом, в
верхней мантии земли: его содержание в ультраосиовиых породах
2>10-а%. С магматическими процессами связано образование так на-
называемых ликвационных кобальтовых руд. Концентрируясь из горячих
подземных вод, кобальт образует гидротермальные местонахождения,
в которых он связан с Ni, As, S и Fe. В природе известно более 100 ко-
бальтсодержащих минералов, в том числе около 30 собственно кобаль*
товых, однако широко распространены только 4 из них. Это кобальтин
CoAsS, скуттерудит СоАзз, шмальтин-хлоантит (Со, Ni, Fe)As3-2 и
саффлорит (CoFe)As2. Характерной особенностью кобальта является
его способность образовывать промышленные концентрации в местона-
местонахождениях других металлов — никеля, меди и железа, — где он пред»
ставлен как кобальтовыми, так и кобальтсодержащими рудными мине»
ралами (пирит, петландит, асболаиы).
По минеральному и химическому составу различают три типа ко-
кобальтовых руд — мышьяковые, сернистые и окисленные. Главные мине-
минералы мышьяковых руд — арсениды (соединения Со, Ni и Fe с мышья-
мышьяком) или сульфоарсеииды (соединения с As и S). Среднее содержа»
вне кобальта в промышленных мышьяковых рудах обычно 1—2 %.
Сернистые кобальтовые руды относятся к типу комплексных руд нике«
ля, меди н железа. Среди них выделяются магматические медно-ннке-
левые, а также медно-колчеданные и скарново-магнетитовые. Несмотря
на невысокое среднее содержание кобальта (от тысячных до сотых н
десятых долей %), крупные размеры месторождений при комплексном
использовании руд позволяют вести экономически выгодиую добычу ко-
кобальта в значительных масштабах. Окисленные кобальтовые руды так-i
же принадлежат к комплексным. Широко распространенным типом этих
руд являются так называемые силикатно-иикелевые руды, содержащие
около 0,1 % Со. Другой тип этих руд — окисленные сернистые руды—»
более богаты кобальтом A—4 %), но встречаются крайне редко.
Главным нсточииком промышленного получения кобальта служат
никелевые руды, содержащие кобальт как примесь. Способ переработки
различных руд зависит от их конкретных составов. В конечном итоге
получают раствор хлоридов кобальта и никеля, содержащий иоиы
Cu2+, Pb2+ и Bi2+, которые осаждают действием H2S. После этого рас»
твор очищают от иона Fe2+ и по реакции 2CoCb+NaClO+4NaOH+;'
+ H20^-2Co(OHK|+5NaCl отделяют кобальт от никеля. Черный оса-
док Со(ОН)з прокаливают для удаления воды, а полученный окисел
Со3О4 восстанавливают водородом или углеродом. Металлический ко-
кобальт, содержащий до 2—3 % примесей (Ni, Fe, Си и др.), может быть
очищен электролизом.
Химический состав основных марок кобальта определен по ГОСТ
123—78 —см. табл. иа с. 473,
472
ХИМИЧЕСКИЙ СОСТАВ ОСНОВНЫХ МАРОК КОБАЛЬТА
Мар-
Марка
КО
KiAy
KIA
Kl
Ю
Со, не
менее
99,98
99,35
99,30
99.25
98,30
Примеси, % (по массе), не более
А1
0,001
Bi
0.0003
0,0004
0,0005
Fe
0,003
0,200
0,200
0,200
0,500
SI
0,001
Cd
0.0003
0,001
0,001
Mn
0,0005
0,03
0,07
0,07
0,10
Cu
0,001
0,02
0,03
0,03
0.08
As
0,0005
0,001
0,002
0,002
0,005
Продолжение
Мар-
Марка
КО
KlAy
KlA
Kl
K2
Co, не
менее
99,98
99,35
99,30
99,25
98,30
Mg
0,001
Ni
0,005
0,3
0,3
0,3
0,5
Примеси. %
Sn
0,0003
0,0004
0,001
—.
s
0,001
0,004
0,004
0,004
0,01
(по массе), не более
Sb
0,0003
0,0006
0,001
Pb
0,0003
0,0005
0,0005
—
с
0,005
0,02
0,02
0,03
0,10
P
0,0005
0,002
0,003
_
Zn
0,001
0,002
0,003
Изготовляют кобальт в виде слитков массой до 25 кг, целых катод»
иых листов с обрезанными кромками и пластин размерами от 20X20 ДО
500X500 мм, нарезанных из катодных листов. Гарантийный срок хра«
иения кобальта 20 лет со дня изготовления.
Физические свойства
Атомный номер 27, атомная масса 58,933 а. е. м., атомный объщ
6,7-Ю-6 м3/моль, атомный радиус 0,125 нм, ионные радиусы Cos+
0,078 нм и Со3+ 0,064 нм, конфигурация внешних электронных оболо-
оболочек 3d4s2. Потенциалы ионизации кобальта J (эВ): 12,69; 27,32; 53,66.
Электроотрицательиость 1,7. Сродство атома кобальта к элекгроиу со-
ставлнет 0,9 эВ, работа выхода электрона ф = 4,41 эВ. Кобальт имеет
две аллотропические модификации — высокотемпературную р с г. ц. к.-
решеткой с периодом а=0,354 им, и низкотемпературную а с г. п. у.«
решеткой с периодами а=0,25053 и с=0,409 им. Энергия кристалличе-
кристаллической решетки £реш=430 мкДж/кмоль. В природе элемент представлен
одним устойчивым изотопом 66Со (распространенность 99,83 %) с при-
примесью 0,17 % изотопа 57Со. Из полученных искусственно радиоактивных
изотопов наибольшее значение имеет еоСо с периодом полураспада
5,27 года. Его получают, облучая в реакторе 59Со нейтронами. Эффек-
Эффективное поперечное сечение захвата тепловых нейтронов изотопом 8вСо
составляет C8±0,5) • 10~28 м2. Среднее сечеиие захвата, полученное для
максвелловского спектра нейтронов, составляет G±1)-10~2а м2.
Плотность кобальта при 298 К р=8,9 Мг/м3. Плотность жидкого
кобальта при 1766 К р = 7,76 Мг/м3; коэффициент температурной зави-
зависимости плотности при этом —0,988 кг/(м3-К).
Электрические и магнитные. Удельная электрическая проводимость
кобальта при 273 К а= 17,22 МСм/м.
Удельное электрическое сопротивление р и температурный коэффиг
циент электрического сопротивления а в зависимости от температуры!
7\ К 0 20 0—100 400
р, мкОм-м . . 0,0520 0,0624 — 0,4329
а-Ю3, К~1 • • • 6,58 6,04 6,58 —
478
Коэффициент чувствительности электрического сопротивления!— « — 1
\ Р Ф/
к давлению гидростатического сжатия р при 297 К:
р, ГПа 0,0001 1,0 3,0
— •— -1011, Па-1 .... 0,96 0,90 0,80
Р dp
Удельное электрическое сопротивление жидкого кобальта при 1766 К
р=1,02 мкОм-м.
Коэффициент вторичной электронной эмиссии аШа1=1,2 при уско-
ускоряющем напряжении первичных электронов 0,7 кэВ.
Абсолютный коэффициент т. э. Д. с. кобальта е\ по отношению к
платине:
Г, К е. Г, К е,
373
473
573
673
773
—32,3
—39,8
—43,5
—46,0
—43,0
873
1073
1173
1273
—39,0
—28,8
—22,0
—14,0
Коэффициент Томсона S для кобальта:
Т, К 100 200 300
S, мкВ/К —8,4 —19,6 —25,4
Аномальная постоянная Холла Ri для кобальта в зависимости от
магнитной индукции В и температуры:
Т, К • • ■ • 83 296 373 457 573
В, Тл . . . . 0,1—1,6 0,4—2,1 0,1—1,6 0,1—1,5 0,1—1,5
fli-lO1», м3/Кл 1,51 5,88 8,65 13,6 21,2
Г, К 789 933 1133 1233 1303 1373
В, Тл . . . . 0,1 — 1,5 0,1—1,5 0,1—1,0 0,2—1,0 0,86 0,86
Ях-1010, м3/Кл 48,3 89,4 158,0 200,0 170,0 60,0
Поперечный четный гальваномагнитный эффект dR/R для кобальта
с 1,6 % примесей внедрения при 290 К:
Напряженность магнитного по-
поля Я, кА/м 477,5 795,8 1432,4
dRjR-W -4 —И —16
Продольный четный гальваномагнитный эффект для кобальта той же
чистоты при той же температуре и напряженности магнитного поля
Н= 1432,4 кА/м d/?/tf=0,002. Магнитные свойства кобальта в ферро-
ферромагнитном состоянии (при 293 К): удельная намагниченность насыще-
насыщения <jj=161-10-v Тл-м3/кг; общая намагниченность /=17900-10-* Т;
число магнетонов Бора на молекулу ns= 1,715.
.474,
Удельная иамагиичеииость насыщения кобальта при О К, получен-
полученная методом экстраполяции, as= 162,5-10-7 Тл-м3/кг. Константы маг-
нитострикции Xs монокристалла кобальта с г. п. у. решеткой (а-моди-
фикация) зависят от направления и колеблются в пределах от —Ы0~*
до +l,l-10-i. В поликристаллическом кобальте магнитострикция насы-
насыщения, измеренная в направлении намагничивания, ^ц = 0,71- Ю-4, а объ-
объемная магнитострикция насыщения wK——0,2-10~4. Как и другие фер-
ферромагнетики, кобальт обладает свойством поворачивать плоскость по-
поляризации света, распространяющегося вдоль направления насыщения
намагниченности. Характеристики этого магнитооптического эффекта
(эффекта Фарадея) при 300 К и индукции насыщения при 0 К и М„=
= 1820-104Тл:
Длина волны излучения
К, нм 546 500 1000 1500 2000
Удельное Фарадеевское вра-
вращение F- Ю-7, град/м ... 3,6 2,9 5,5 5,5 4,8
Коэффициент поглощения
а-10-', м-1 8,5 — 6,1 4,5 3,6
Характеристика качества,
град 0,85 — 1,8 2,4 2,7
Тепловые и термодинамические. Температура плавления кобальта
/пл—1494°С, температура кипения <кип=2Э57°С, характеристическая
температура 9о=445 К. Температура полиморфного a=f*P превращения
кобальта не может быть точно указана, поскольку при нагреве оно
протекает более или менее интенсивно при 477 °С, но не заканчивается
и при 600 °С, тогда как обратное превращение (при охлаждении)
отвечает температуре лишь 403 °С, т. е. запаздывает, особенно в присут-
присутствии примесей железа. Температура превращения ферромагнитного ко-
кобальта в парамагнитный 7V=1390 К. Расчетное значение удельной теп-
теплоты плавления Д//Ол =263,16 кДж/кг, удельная теплота сублимации
при 298 К Д#Субл=7215,6 кДж/кг, удельная теплота испарения при
температуре кипения Д//„оп=6502 кДж/кг, удельные теплоты превра-
превращения 4,24 и 15,6 кДж/кг, удельная теплота перехода в ферромагнит-
ферромагнитное состояние (по разным данным) меняется от 0 до 0,156 кДж/кг,
изменение объема при плавлении 3,5 %. Удельная теплоемкость кобаль-
кобальта при различных температурах:
Т. К Ср, Дж/(кр К) Т, К ср. Дж/(кг-Ю
20 4,75 400 451,6
40 40,4 600 509,3
80 183,9 1000 631,6
150 331,07 1500 682,5
250 406,3
Удельная теплоемкость жидкого кобальта при 1762 К с
= 1001,7 Дж/(кг-К). Удельная электронная теплоемкость с
=[4,7 мДж/(моль-К2)]-Т.
Теплопроводность А. кобальта в зависимости от температуры:
|Л=
Т К
С Вт/(м'к")
100
37,5
290
70,9
370
94,0
570
117
770
126,8
1070
107,0
1370
66,0
1670
11,0
475
Температурный коэффициент линейного расширения а:
Г, к а-ю», К~1
Т к
К
Давление
туры:
т, к...
р, 133,3 Па
У, К. . .
р, 133,3 Па
273
373
473
673
673
насыщенного
. . .
. • •
886
10-»»
1342
10-з
12,
13,
14,
И,
15,
0
1
2
5
7
пара р
930
10-»
1454
10-2
773
873
973
1173
кобальта
978
Ю-»
1586
10-1
16
16
16
16
,0
.0
,4
,9
в зависимости от темпера»
1033
ю-»
1744
1
1095
10-»
1950
Юг
1166 1247
10-6 10-*
Продолжение
2213 2558
10! 760
Поверхностное натяжение кобальта при 1766 К а=1873 мН/м, тем-
температурный коэффициент поверхностного натяжения dafdT=
=—0,49 мН/(м-К), динамическая вязкость жидкого кобальта при тем-
температуре плавления т) = 4,18 мПа-с, вязкость при 1766 К равна
0,2550 мПа-с.
Параметры самодиффузии и взаимной диффузии в твердом раство-
растворе кобальта:
Диффундирую-
Диффундирующий элемент
Со
Со
Ni
Ni
Интервал темпера-
температур К
1043—1323
1273—1573
1045—1321
1465—1570
0,50
0,20
0,34
0,10
Энергия активации Е,
кДж/моль
273,8
259,58
264,2
252,0
Энергия дефектов упаковки 26 мДж/м8. Поверхностная энергия по-
лнкристаллического р-кобальта v=1445 мДж/м2; для грани A00) v —
= 1368 мДж/м2, для грани A11) v=l 198 мДж/м2.
Оптические. Излучательная способность кобальта (коэффициент из-
излучения е ^ j) при его температуре плавления и длине волны 0,55 мкм
составляет 0,36 для твердой и 0,37 для жидкой фазы
Показатели преломления п и поглощения % кобальта при различной
длине волны:
fc, нм 500 5000
п 1,56 4,3
1 2,20 3,40
Механические свойства
Механические свойства кобальта при испытании на растяжение при ком«
натной температуре зависят от его обработки и чистоты:
476
Состояние и чистота материала
Литой, отожженный (99,9 %)
Кованый и нормализованный
при 800 °С (99,4%)
Горячая прокатка и отжиг при
380 °С (99,98%)
Литой после деформации и за-
закалки от 1200 °С в воде
(99,4%)
Порошок после спекания при
1300°С и прокатки при 1000°С
(99,7%)
О-, МПа
В
240—260
370
943
280
690
\г МПа
330
672
210
«■%
2,3
3,9
3,0
8,1
Твердость кобальта по Моосу меиьше 5,6. Временное сопротивление
при сжатии литого отожженного кобальта ав,сш=567 МПа, <7о,2=
fc=290 МПа, твердость деформированиого кобальта после отжига при
1200 °С //V=1320 МПа, твердость после отжига при 1300 °С НВш>
= 1240 МПа. При охлаждении до —180 °С твердость возрастает до
НВ=2200 МПа, при холодной прокатке с 30 %-иой степенью дефор-
деформации— до 2800 МПа, при добавлении 0,06 %С — вдвое.
Влияние температуры испытания на свойства прн растяжении ко-
кобальта чистотой 99,4 %, предварительно закаленного с 1200 °С в воде:
t, °С . -
ав, МПа.
а02, Д'Па
Я/% • ■
%
Значения коэффициентов упругости
293 К:
+20
280
210
3,9
8,1
'ГОСТИ
400
210
4,2
11,0
450
180
4,5
2,0
500
190
7,2
2,4
монокристаллов
800
87
0,65
2,8
кобальта
при
Модули упругости, ГПа
СП 263—307
с1г 152—165
с,3 102,7—133
с33 283—358
см 52-76
,-г
Упругие постоянные, Па
в„- D,73—6,22). 10-1?
8ц (—0,231 -5- — 0,277)- 10-U
s13 (—0,07- 0,163)-1011
S33 C,19-5-5,08)-10-1?
s44 A3,25—19,28). 10-4
Модуль упругости полнкристаллнческого кобальта £=196—206 ГПа,
модуль сдвига G=47—90 ГПа.
Данные по длительной прочности кобальта при 800 СС и напряжении
70 МПа:
Термическая обработка
Закалка с 1200°С
в воду
Отжиг при 800 °С, 1 ч
Время до разруше-
разрушения ч
0,05
1,0
6.%
3,9
М> %
3,5
4,8
477
Химические свойства
Нормальный электродный потенциал реакции Со—2е*±Со2+ <j>0=
=—0,27 В, а реакции Со—Зе^±Со3+ <f>0= +0,4 В. Окислительио-восста-
новительиый потенциал кобальта в кислых растворах для реакции
Со2+-*-Со3+ + е равен 1,81 В, а реакции Со->-Со3++Зе 0,4 В. Степень
окисления +2, +3. Электрохимический эквивалент кобальта Со2+ ра-
равен 0,306 мг/Кл, а кобальта Со3+ 0,204 мг/Кл. В простых соединениях
наиболее устойчив ион Со2+, в комплексных — ион Со3+. В электрохи-
электрохимическом ряду напряжений металлов кобальт расположен между же*
лезом и никелем. Он взаимодействует почти со всеми другими хими-
химическими элементами. Так, при нагревании кобальт легко соединяется с
галогенами, образуя га.Ж>геииды типа СоЯг- При действии фтора иа
порошок кобальта или CoCU кобальт может восстановиться до 3-х ва-
валентного и образовать коричневый фторид CoF3. Также при нагревании
кобальт взаимодействует с серой, селеном, фосфором, мышьяком, сурь-
сурьмой, углеродом, кремнием и бором, причем проявляет валентность от
+ 1 до +6. Сульфиды кобальта образуются в результате взаимодей-
взаимодействия свежевосстановленного кобальтового порошка с H2S. При 400 "С
образуется C03S4, а при 700 °С — CoS. Сульфид образуется и при
взаимодействии кобальта с сернистым ангидридом при 800 °С.
В разбавленных соляной и серной кислотах кобальт медленно рас-
растворяется с выделением водорода и образованием хлорида CoCU или
сульфата CoSO4. Разбавленная азотная кислота растворяет кобальт с
выделением окислов азота и образованием нитрата Co(NO3b. Концен-
Концентрированная азотная кислота пассивирует кобальт. Все соли кобальта
хорошо растворимы в воде. Едкие щелочи осаждают из водных рас-
растворов солей синий гидрооксид Со (ОН) 2.
В интервале —180н-0°С кобальт адсорбирует водород. Найдено,
что при атмосферном давлении в интервале 14,5—274 °С адсорбирован-
адсорбированный водород находится в диссоциированном состоянии, причем центры
адсорбции обладают различной степенью активности.
Растворимость водорода в кобальте при нормальном давлении:
t, °C 600 700 800 900 1000 1100 1200
Концентрация, см3/Ю0 Г . 0,9 1,22 1,85 2,51 3,30 4,31 5,40
/, °С 1300 1400 1492 1500 1550 1650
Концентрация, см3/Ю0 г . 6,70 7,75 8,65 21,6 23,2 24,3
При этом, начиная с температуры 1492°С и выше, кобальт нахо-
находится в жидком состоянии. Известны два гидрида: СоН, существование
которого определено косвенными методами, и СоНг, который выделен
экспериментально в виде темно-серого, почти черного кристаллического
вещества.
Прн нормальной температуре компактный кобальт стоек к действию
воды и воздуха, хотя порошок кобальта на воздухе воспламеняется.
Компактный кобальт начинает окисляться на воздухе выше 200 "С, ког-
когда иа его поверхности образуется пленка смеси оксидов. При темпера-
температурах ниже 900 °С окалина состоит из двух слоев — внешнего Со3О4 и
внутреннего СоО. Внутренний слой плотно пристает к кобальту и име-
имеет зеленоватую окраску, внешний слой в виде налета черного цвета
легко стирается. Оксид СозО4 распадается при 950 °С; поэтому выше
этой температуры двухслойная окалина на поверхности кобальта сме-
сменяется однослойной, состоящей только из СоО. Кроме этих соединений
с кислородом, известно соединение СоО-А1203 синего цвета, так назы-
называемая тенарова синь. Это соединение может быть получено прокали-
прокаливанием смеси СоО и АЬОз при температуре около 1000 "С. Раствори-
478
мость кислорода в кобальте, характеризуемая его концентрацией в рав-
равновесии с окисной фазой СоО:
а-Со р-Со
tt «с 600 700 800 875 875 945 1000 1200
Растворимость, %
(по массе) ... 0,6 0,9 1,6 2,05 0,58 0,7 0,8 1,3
Растворимость кислорода в жидком кобальте:
t, °С 1550 1600 1850
Растворимость,
Ю-2 %(по массе) 13,0 16,0 23,0
При взаимодействии с газообразным аммиаком прн 350—450 °С ко»
бальт образует нитриды Co3N и Co2N2, которые, однако, не являются
устойчивыми. Растворимость азота в кобальте невелика: при 1200°С
не установлено наличие растворенного в твердом кобальте азота; при
1600 °С в жидком кобальте растворяется всего 0,0047% (по массе)
азота. Легирование кобальта, особенно ниобием, танталом и хромом,
повышает растворимость азота в жидком металле.
Чистый углерод растворяется в кобальте лишь при 1000°С, но оксид
углерода взаимодействует с измельченным кобальтом, образуя карбид
Со2С уже при 200—227 СС. Углеродистый газ при 900 °С также реаги-
реагирует с кобальтом с образованием оксида (II) СоО.
Кобальт реагирует с водой при нагревании и в интервале 422—>
921 "С вытесняет водород, образуя СоО.
Комплексные соединения кобальта устойчивы и образуются легко.
Весьма многочисленны кобальт—амины—комплексные соединения Со3+,
содержащие аммиак и некоторые органические амнны. В литературе ши*
роко описаны многочисленные гексамины с разнообразными анионами,
например, хлорид [Co(NH3N]Cl3, сульфат [Со(МНз)бЬEО4K-5Н2О, ок*
салат [Со^НзШСгО^з^О, ферроцианид fCo(NH3N][Fe(CN)e]
и др. Молекулы аммиака в этих комплексных соединениях могут заме»
щаться другими нейтральными органическими молекулами, содержащи-
содержащими азот, а также водой, кислотными радикалами, этилендиамином.
Кобальт легко сплавляется с другими металлами, образуя многочис
леиные сплавы, обладающие рядом ценных свойств. Особенно подроб-
подробно изучены сплавы кобальта с металлами группы железа, а также тя-
тяжелыми и благородными металлами. С никелем и железом кобальт об-
образует непрерывный ряд твердых растворов. При охлаждении сплавов
Fe—Со в них протекают аллотропические превращения. При темпера-
температуре 700—750 °С в этой системе образуются упорядоченные сверхструк-
сверхструктуры. При температурах плавления кобальт растворяет до 39 % Сг, об-
образуя твердый раствор с г. ц. к.-решеткой. Хром снижает точку Кюри
кобальта, и легированные хромом кобальтовые сплавы становятся па»
рамагнитными при содержании порядка 16 % (по массе) Сг. Сплавы о
26 % Сг коррозионно устойчивы по отношению к минеральным кисло-
кислотам. В системе Со—Мп наблюдается полная взаимная растворимость в
твердом состоянии. Точка Кюри сплава с 38 % Мп снижается до 20 °С.
В системе Со—Мо образуется два твердых раствора: y на основе Со и
е на основе Мо с эвтектикой при 1350 °С. Максимальная растворимость
молибдена в кобальте достигает 26%, ио уже при 700° С оиа снижает-
ся до 2%. Весьма сходное строение имеет диаграмма кобальта с воль-
вольфрамом. Ликвидус диаграммы кобальта с ванадием соответствует
1248° С. При этом твердый раствор на основе кобальта содержит до
32 % V. С ниобием и танталом кобальт образует интврметаллиды
479
(JiosNb2 (при 1500 еС) и Со5Та2 (при 1550° С). При температуре
ления растворимость ииобия в-кобальте примерио 7 %, а тантала 13 %;'
при комнатной температуре — 4 н 8,5 % соответственно. В системе с
цирконием образуются соединения Co4Zr и Co2Zr. Кобальт растворяет
2 % Zr, 5—8 % Zn, очень немного Аи н РЬ, а с серебром не смешивает-
смешивается даже в жидком состоянии. Кобальт образует сплавы с алюминием и
титаном, максимальная растворимость А| и Ti соответственно составляв
ет7 и 10—16%.
Устойчивость кобальта к окислению при нагреве на воздухе харак-
характеризуется изменением его массы Дги:
/, °С 800 900 1000 1100 1200
Д/и, кг/м? 0,2 0,42 0,45 1,48 1,65
Коррозионная стойкость кобальта в жидкометаллическом теплоно-
теплоносителе исследовали только относительно натрия. Установлено, что пре-
предельная температура коррозионой стойкости кобальта в этом случае
для статических испытаний равна 1173 К, для динамических 923 К и
соизмерима с таковой для коррозионностойких никеля и хрома. Корро-
Коррозионную стойкость кобальта в различных средах можно повысить леги-
легированием.
Технологические свойства
Плавку и разливку кобальта ведут в вакууме, восстановительной или
защитной атмосфере. Кобальт трудно деформируется, однако его спо-
способность к деформированию можно повысить тщательной очисткой от
углерода и легированием 0,1 % Mg. Поддается кобальт и холодной
деформации с частыми (после 20%-ной деформации) отжигами при
900 С в вакууме. Соотношение а- н р-фаз в кобальте существенно вли-
влияет на его деформируемость при холодной прокатке. Установлено, что
в процессе холодной деформации происходит р-нж-превращение с уве-
увеличением составляющей с г. п. у. решеткой. Диаграмма рекристаллиза-
рекристаллизации кобальта ие построена, однако известно, что наклеп наиболее пол-
полно снимается отжигами при 900—1000° С. Из-за высокой хрупкости ко-
кобальт плохо обрабатывается резанием. Науглероживание улучшает
обрабатываемость резаннем, но затрудняет обработку давлением.
Области применения
Кобальт служит главным образом или основой, нли легирующим эле-
элементом в сплавах. Сплавы на основе кобальта применяют для изготов-
изготовления деталей, работающих при высоких температурах, например, ло-
лопаток турбореактивных двигателей. Наиболее жаропрочные кобальто-
кобальтовые сплавы сохраняют работоспособность до 1100 С, когда их предел
длительной прочности прн продолжительности действия нагрузки 100 ч
достигает 70 МПа.
Сплавы, содержащие до 50 % Со с добавками Cr, Ni и Мп, имеют
высокое сопротивление термической усталости. Сплавы с 30 7о Со, со-
содержащие также W, Si и С (так называемые стеллиты) применяют для
повышения износостойкости деталей машин и механизмов путем иаплав-
ки. Кобальтохромовые сплавы используют в стоматологической тех-
технике. Широкое применение кобальт получил в качестве составляющего
компонента магнитных материалов. Порошкообразный кобальт, а так-
также окснд СозО4 служат катализаторами: особенно широко кобальт при-
применяют в качестве твердого катализатора для реакций между газооб-
480
разными или жидкими веществами. Кобальтовые катализаторы особен-
особенно пригодны для реакции получения синтетической нефти по методу
Фишера—Тропша. В подобных реакциях очень важна степень развития
поверхности материала, иа которой проходит реакция. Одним из пу-
путей увеличения поверхности кобальта является его получение по ме-
методу Рсниея, когда первоначально получают сплав кобальта, например,
с алюминием, а затем, измельчив его до порошкообразного состояния,
выщелачивают каустической содой.
Фгорид CoF3 применяют как сильный фторирующий агент. Теиарова
синь и особенно силикат кобальта и калия используют как краски в
керамической и стекольной промышленности. Соли кобальта применяют
в сельском хозяйств? в качестве микроудобреннй, а также для подкорм-
подкормки животных.
8.3. НИКЕЛЬ [1—35, 296, 298—303]
Обшие сведения и методы получения
Никель (Ni) —металл серебристо-серого цвета, не тускнеющий на воз-
ДУхе.
В 1751 г. швед А. Кронштедт открыл элемент, который назвал никелем.
В 1775 г. его соотечественник металлург Т. Бергман убедил миогнх,
что никель—новый металл. В начале XIX в. французские химики Пруст
и Л. Тенар получили чистый никель и определили его магнитные свойства.
Через 50 лет после открытия никеля И. Рихтер получил «абсолютно»
чистый никель и в 1804 г. описал его метод получения и особые свойства:
большую сопротивляемость коррозии, жаростойкость, высокую пластич-
пластичность, ковкость, магнитные свойства. Однако примеси серы @,03 %)
значительно ухудшали механические свойства никеля. Лишь в 70-х го-
годах прошлого столетия металлурги нашли способ обработки расплавлен-
расплавленного никеля магнием, который связывал такие вредные примеси как
сера и кислород, и поэтому спрос на никель стал расти.
Содержание никеля в земной коре составляет 8-10~3% (по массе),
а в морской воде 0,002 мг/л.
Он входит в состав никелевых руд н самородных минералов. Боль-
Большой интерес представляет минерал аваруит — Ni2Fe, который содержит
около 67 % №.
Никелевые руды представляют собой в основном минеральное сое-
соединение (сернистые, мышьяковистые, кремнекислые). Наибольшее про-
промышленное значение имеют сульфидные руды; они обычно являются
комплексными медноникелевыми. Содержание никеля в сульфидных ру-
рудах колеблется от 0,5 до 4 и даже до 5 %• Никель входит в состав
следующих минералов, содержащих серу, пенталандит —- (Fe, NO9S3,
полиднмит—N13S4, милерит — NiS. Постоянно присутствуют в этих ру-
рудах в качестве примесей палладий, платина, родий, золото, серебро,
селен, теллур.
Гчдросиликатные руды состоят из комплекса минералов: гидросн-
лнкатов никеля [гарниерит — Ni4[Si4O10](OHL-4H2O; непуит (Ni, Mg)s
[SieOlo] • (ОН)в], никельсодержащих магниевых силикатов, хлоритов и
других. Содержание никеля в этих рудах 1—2 %. Получение чистого
никеля — весьма сложный многостадийный процесс. Из сульфидных руд
после предварительного обогащения получают никельмедные концент-
концентраты. Затем следуют процессы: агломерация, первичная плавка н полу-
получение штейна, переработка штейнов в конвертерах и получение файн«
штейна, обогащение файнштейна и разделение его на никелевые и
481
медные концентраты, переработка файнштейна различными способами
и получение металлического никеля. Общий процент извлечения нике*
ля из руды не превышает 70—75 %.
Ниже приведены сведения о химическом составе выпускаемых на-
нашей промышленностью марок никеля и примерном их назначении.
Никель, получаемый разными методами, имеет разную чистоту: пос-
после огневой рафинировкн —98,5 % Ni; электролитический (без дополни-
дополнительной рафинировки) —99,3-г99,5 %Ni; полученный путем разложения
карбонила никеля — до 99,9 % Ni. Наиболее высокую степень чистоты
обеспечивает рафинирование никеля, полученного двумя последними
методами. Для этого никель нагревают в токе водорода.
ХИМИЧЕСКИЙ СОСТАВ, % (ПО МАССЕ) НИКЕЛЯ, ПРЕДНАЗНАЧЕННОГО
ДЛЯ ПРОИЗВОДСТВА СПЛАВОВ, ПРОМЫШЛЕННЫХ ИЗДЕЛИИ
И ДРУГИХ ЦЕЛЕЙ (ГОСТ 849-70)
Марка
Н—0
Н-1 у
Н-1
Н—2
Н—3
Н—4
E(Ni+Co)
не менее
99,99
99,93
99,93
99,8
98,6
97,6
Со, не бо-
более
0,005
0,10
0,10
0,15
0,7
0,7
Примеси не более
С
0,005
0,01
0,01
0,02
0,10
0,15
Mg
0,001
0,001
0,001
—
А1
0,001
—
Si
0,001
0,002
0,002
0,002
—
—
Продолжение табл.
Марка
Н—0
Н—1у
Н-1
Н—2
Н—3
Н-4
0,
0,
0,
р
001
001
001
S
0,001
0,001
0,001
0,003
0,03
0,04
П римеси.
Мп
0,001
—
—
не более
Fe
0,002
0,01
0,01
0,04
—
Си
0,001
0,015
0,02
0,04
0;6,
1,0
0
0
0
0
Zl.
,0005
,0008
,001
,005
—
—
Продолжение табл.
Марка
Н—0
Н—1у
Н—1
Н-2
Н-3
Н-4
0,
0,
0,
As
0005
001
001
—
0
0
0
Cd
,0003
,0005
,001
—
.—
—
Примеси, не
Sn
0,0003
0,0005
0,001
—
более
Sb
0,0003
0,0005
0,001
—
—
—
0
0
0
Pb
,0003
,0005
,001
—
—
—
0
0
0
Bi
,0003
,0005
,001
—
—
—
Примечания: 1. По согласованию с потребителем допускается поставка
никеля марки Н—0, содержащего до 0,02 % Со, 2. Никель марки Н—0 со Знаком
качества должен соответствовать следующим нормам; % (по массе), ие более
0.0005Р, 0,0002Cd, 0,0002Pb, 0,0002Bi.
482
ХИМИЧЕСКИЙ СОСТАВ, % (ПО МАССЕ) НИКЕЛЯ, ОБРАБАТЫВАЕМОГО
ДАВЛЕНИЕМ И ПРИМЕНЯЕМОГО ДЛЯ РАЗЛИЧНЫХ ИЗДЕЛИЙ
В МАШИНОСТРОЕНИИ, ПРИБОРОСТРОЕНИИ И ДР. (ГОСТ 492—73)
Наименование металла
:1нкель полуфабрикатами
Никель полуфабрикат-
ный анодный непассиви-
рующийся
Никель полуфабрикат-
иый анодный
Марка
НП1
НП2
НШ
НП4
НПАН
НПА1
НПА2
Основной компонент
N14 Со,
не менее
99,9
99,5
9<)„}
99,0
99.4
99,7
99,0
Си
0,01-0,10
о2
0.03—0,3
S
0,002—0,01
Наименование метала
Никель полуфабрикатнып
Никель пол>фабрикат-
ный анодный непассиви-
рующийся
Никель полуфабрнкат-
пып анодный
Марка
ПП1
НП2
НПЗ
НП4
НПАН
НПА1
НПА2
Fe
0,04
0,10
0,15
0,30
0,10
0.10
0,'Ji
SI
0,03
0.15
0,15
0,15
0,03
0,02
o.i1;
0
0
0
0
0
0
Примеси,
Mg
.01
,10
,10
,10
,10
.10
Мп
0,002
0.05
0,20
0,20
0,05
0,10
0,15
0
0
0
0
0
г
Продолжение
ие более
Си
,015
,10
,15
,15
,1
,15
РЬ
0,001
0,002
—
—
0,
0,
0,
0,
0
0
S
001
005
015
015
,—
005
005
табл.
С
0
0
0
0
0
0
01
10
15
10
02
1
Продолжение табл.
Наименование металла
Никель полуфабрикат-
иый
Никель полуфабрикат-
нын анодный иепассиви-
рующиися
Никель полуфабрикат-
ныр анодный
Марка
НШ
НП2
НПЗ
НП4
НПАН
НПА1
НПА2
Р
0,001
0,002
—
—
Примеси
Bi
0,001
0,002
—
—
As
0,001
0,002
_
—
—
ие бол ее
Sb
0,001
0,002
—
—
Zn
0,005
0,007
_
—
—
—
Gd
0,001
0,002
_
—.
—
—
Продолжение табл.
Наименование металла
Никель полуфабрнкат-
ный
Марка
НП1
Примеси не
более
Sn
0,001
всего
0,1
Вид изделия
Проволока
прутки ленты,
листы и по-
полосы
Примерное назна-
назначение
Для деталей спе-
специального назна-
назначения
483
Продолжение таблицы
Наименование металла
Никель полуфабрикат-
ный
Никель полуфабрикат-
ный анодный непассиви-
рующийся
Никель полуфабрикат-
ный анодный
га
НП2
НПЗ
НП4
НПАН
НПА1
НПА2
Примеси не
более
Sn
0,002
—
—
—
—
всего
0,5 I
0,7 \
1,0 >
0,6 1
f
0,3
1,0 )
Вид изделия
Проволока,
прутки, ленты,
листы и полосы
Полосы
овальные
стержни
Примерное наз-
назначение
1 Для приборо-
} и машиностро-
' ения
1 Для злектро-
/ литического
покрытия
J
Примечания. 1. По соглашению сторон в никеле марки НП2 допускается
содержание циика до 0,02 %. По требованию потребителя в никеле марки НП1
содержание кремния должно быть не более 0,006 %. 2. Массовая доля кобальта
в никеле марки ПН2 должна быть не более 0,20 %, в никеле марки НП4 — 0,60 %,
в никеле марки НПА1 — 0,15%, в никеле марки НПАН —0,50%, в никеле маркн
НПА2-0.70 %.
Никель является весьма дифицитным металлом, и по возможности
его необходимо заменять другими более доступными материалами.
Никель марок Н выпускается в виде катодных листов или пластин,
слитков и гранул, а никель марок НП выпускается в виде полос, лент,
труб и проволоки.
Физические свойства
Атомные характеристики. Атомный номер 28; атомная масса —
56,70 а. е. м.; атомный объем — 6,60-10~6 м3/моль, атомный радиус
0,124 нм, ионный радиус Ni2+ 0,074 нм.
Строение внешних электронных оболочек никеля 3d3, 4s2.
Потенциалы ионизации атома никеля У(эВ): 7,633; 18,15; 36,16.
Никель имеет кубическую гранецентрированную кристаллнческую ре-
решетку с периодом а = 0,35238 нм, координационное число— 12. Энергия
кристаллической решетки никеля 426 мкДж/кмоль. В природе найде-
найдены пять стабильных и получен ряд искусственных изотопов никеля. Две
трети никеля, содержащегося в земной коре, приходится на долю ста-
стабильного изотопа 58№.
Стабильные изотопы никеля:
ховое
пело
58
60
61
62
64
Число
нейтронов
30
32
33
34
36
Атомная
масса
57,9597
59,9598
60,9540
61,9496
63,9476
Содержание,
% изотопа
67,76
26,16
1,15
3,66
1,16
484
Радиоактивные изотопы никеля:
Массовое
число
56
57
59
63
65
66
Период полураспада
6,4 сут
1,49сут
7,5-104лет
85 лет
2,564 ч
1,34 сут
Энергия излучения,
МэВ
_
0,835
0,069
0,063
Риу 0,6—2,10
Реакция образования
изОто па
Fe (а, 2п) и др.
Fe (а, п) и др.
Fe (а, п) и др.
№ (п, у)
№ (а, р) и др.
As (Л) и др.
Эффективное поперечное сечение захвата тепловых нейтронов нике-
никеля составляет 4,5-10—2S м2. Энергия связи глубоколежащих электронов
никеля:
Энергетическое состояние К L-,
ми м
Энергия связи, кэВ
III
8,353 1,017 0,879 0,860 0,112 0,073 0,073
Работа выхода электронов для никеля ф = 4,50 эВ. Вторичная элек-
электронная эмиссия накеля <ттах—1,3 при ускоряющем напряжении для
первичных электронов @,550 кэВ). Электроотрицательность 1,8.
Плотность. Определенная рентгеновским методом, плотность р =
8,897 Мг/м3, а определенная пикнометрически — 8,963 Мг/м3. Плотность
жидкого никеля (при температуре плавления) 7,77 Мг/м3. Плотность
никеля сильно зависит от его чистоты. Технический никель с содержа-
содержанием 98,5—99,5 % Ni имеет плотность 8,7—8,84 Мг/м3, а чистейший ни-
никель (99,99 %) —8,907 Мг/м3.
Электрические и магнитные. Удельное электрическое сопротивление
никеля р = 0,0684 мкОм-м, удельная электропроводность 0=13,ЗМСм/м,
абсолютный коэффициент т. э. д. с. е=—18,0 мкВ/К при 298 К.
С повышением чистоты никеля удельное электрическое сопротивле-
сопротивление р его уменьшается, а температурный коэффициент электрического
сопротивления а растет. Изменение электрических и термоэлектричес-
термоэлектрических свойств никеля* в зависимости от температуры:
т к
273
373
473
573
673
773
873
973
1073
1173
1273
р, мкОм м
0,082
0,120
0,175
0,258
0,330
0,370
0,405
0,440
0,473
0,510
0,550
рт /р273
1,000
1,463
2,140
3,150
4,030
4,520
4,840
5,370
5,740
6,220
6,740
Т. э д с.*1 при хо-
холодном спае @°) Е, мВ
0
— 1,85
—3,43
—4,86
—5,77
—6,50
—7,30
—8,30
—9,65
—
* 99,35 % Ni; 0,13 % Си; 0,28 % Fe; 0,17 % Si; 0,20 % Co; 0,040 % С. ** В паре
с платиной.
В области температур сверхпроводимости электросопротивление
никеля повышается при увеличении энергии облучающих частиц.
485
Температурный коэффициент электрического сопротивления никеля
при 293 К а=6,7-10-3К-'. Постоянная Холла R для никеля (99,999 %)
в зависимости от температуры:
Г, К 100 200 293
Я-Ш10, м3/Кл —0,52 —0,59 —0,6
Никель не обладает магнитной восприимчивостью и является ферромаг-
ферромагнетиком при температурах ниже 631 К (точка Кюри).
Тепловые и термодинамические. Температура плавления никеля
Л1л = 1455°С, температура кипения <K1Ill = 2730—2915° С, характеристи-
характеристическая температура 0D 476 К (по упругим постоянным) и 441 К (по
теплоемкости). Полиморфных превращений никель не имеет. Удельная
теплота плавления ДЯпл = 302 кДж/кг, удельная теплота испарения
Д//исп — 6376 кДж/кг. Удельная теплота сублимации при 0К АЯсубл =
=7213,86 кДж/кг.
Удельная теплоемкость никеля при 293 К ср = 450 Дж/(кг-К) при
631 К ср = 632 Дж/(кг-К), а жидкого при температуре плавления
655 Дж/(кг-К). Удельная электронная теплоемкость с™=[7,1 мДж/
(моль-К2)]-?". Теплопроводность при 273—373 К Я=88,5 Вт/м-К- Теп-
Теплопроводность никеля (99,99 %) имеет в зависимости от температуры
следующие значения:
Г, К 5 10 20 30 50 70 90
Я, Вт/(м-К) 1158 1690 1590 962 405 242 173
Продолжение
Г, К 500 6С0 800 1100 1200 1300 1400
А, Вт/(м-К) 71,4 62,8 68 74 75,5 85,6 100
Теплопроводность никеля зависит также от его чистоты:
т.к.
373
473
573
}. Вт/(м-К), никеля чистотой, %
99,1
60,7
53,59 E63 К)
99,942
82,89
73,27
64,06
т, К
673
773
1006
Л, Вт/(м.К) никеля чистотой, %
99,1 | 99,942
53,59 G63 К)
61,55
59,45
62,38
Температурный коэффициент линейного расширения а также зависит
от чистоты никеля, и чем чище металл, тем выше коэффициент линей-
линейного расширения. Зависимость а от температуры:
Т, К
273 573 643 663 673 873
13,5 16,6 26,0 15,0 17,6 17,8
Температурный коэффициент объемного расширения C = 38—39-10~eK~l.
Молярная энтропия s° твердого никеля при разных температурах:
Г, К 298 500 1000 1500
s°, Дж/(моль-К). 29,89 44,55 69,91 80,81
486
2000 2500 3000
101,91 110,49 117,52
Молярная энтропия s° никеля в парообразном состоянии в зависимос-
зависимости от температуры:
Г, К 298 500 1000 1500
s°, Дж/(моль-К) • • 182,21 194,52 211,73 221,69
Продолжение
Т, К- • • » • • • • 2000 2500 3000
s°, Дж/(моль-К) • ■ 228,47 233,62 237,73
Поверхностная энергия поликристаллического никеля v=
= 1440 мДж/м2, а в монокристаллах на гранях A00) v=1060 мДж/м2
и A11) v=926 мДж/м2. Энергия дефектов упаковки 450 мДж/м2.
Давление пара никеля р в зависимости от температуры:
Г, К 1330 1520 1770 2150
р, Па 12,93-10—5 12,93-Ю-3 12,93-Ю-1 12,93
При температуре плавления никеля давление пара равно 237 Па. По-
Поверхностное натяжение жидкого никеля при 1723 К о=1700 мН/м.
Динамическая вязкость никеля при 1823 К rj = 41,0 мПа-с.
Оптические. Цвет никеля в компактном состоянии серебристо-серый,
в порошке — серый.
Излучательная способность никеля:
Состояние е^ (^,=0,65 нм)
Неокисленный жидкий . 0,37
Окисленный твердый . . 0,9
Отражательная способность (коэффициент отражения по) электро-
электролитически полированного никеля:
к, мкм 0,251 0,305 0,420 0,500
nD, % 37,8 44,2 56,6 60,8
Продолжение
Л, мкм 0,700 1,00 2,00 3,00 4,00
nD, % 68,8 72,0 83,5 91,1 95,6
Показатель преломления п для пленки никеля толщиной 0,18—0,22 мкм:
Я,, мкм 0,062 0,083 0,124 0,248
п 0,87 0,95 0,95 1,20
Для поликристалла и пленки:
Л, мкм. . . . 0,30 1,00 3,00 8,0 12,0 18,0
п 1,31 2,44 3,96 5,93 9,09 14,44
Зависимость поглощения х поликристалла от длины волны:
к, мкм 0,05 0,20 0,5 1,0 8,0 12,0 18,0
X 3,2* 6,3* 3,06 5,00 27,99 39,10 52,99
: Для непрозрачной плеикн.
487
Механические свойства
Временное сопротивление при растяжении ав никеля при комнатной
температуре значительно изменяется в зависимости от его чистоты, со-
состояния и условий обработки и может колебаться в пределах 280—
720 МПа. Сильно изменяются также условный предел текучести ао,2,
относительное удлинение 6, относительное сужение \|э и твердость:
ао,2=78—426 МПа; 6=3—39 %; \|>=57—100 %; НВ=600—1600 МПа.
Механические свойства никеля высокой чистоты при 20° С:
Состояние металла
Отожженный
Лнтой
Кованый
Кованый (отож-
•\1Р /41 irii TTTI
женныи)
Холоднокатаный
лист
Холоднокатаный
(отожженный) лист
ав мпа
280—300
350—420
540—610
500—550
630—770
420—530
°о,2 МПа
140—210
280—330
190—240
590—740
100—180
6.%
40—50
20—30
31—37
42—44
1—2
35-45
НВ, МПа
700—900
600—ЬОО
1270—1580
900— 13 00
1300—1600
900— 1000
Влияние температуры испытания на свойства никеля чисто-
чистотой 93,3 %:
1 "С
20
100
200
300
400
500
600
ав, МПа
550
550
550
540
410
316
240
6 %
36
33
32
35
34
26
21
78
78
75
75
61
42
42
/. "С
700
800
900
1000
1100
1200
1300
ов, МПа
150
140
81
57
36
22
18
6,%
23
27
25
29
42
28
Ч.%
46
48
50
62
99
98
98
Влияние температуры испытания на свойства отожженного никеля
электроннолучевой плавки:
i, CC
20
100
200
300
400
500
а,., МПа
380
340
290
260
230
200
6.%
45
50
47
42
45
22
89
90
89
90
88
81
600
7С0
800
900
1000
1100
ов, МПа
160
ПО
79
51
35
33
6.%
53
66
68
85
77
67
Ф %
92
100
100
100
100
100
Прн пониженных температурах временное сопротивление никеля
значительно возрастает. Условный предел текучести при этом возраста-
488
ет, но менее заметно. Относительное удлинение и относительное суже«
ние изменяются по-разному, но их значении достаточно высоки:
t, °С +17 —196 —253
0В, МПа 450 630 790
6, % • 35 46 48
г|), % 77 89 69
Ударная вязкость никеля (99,4%) при 298 К KCU=3340—
—3680 кДж/м2. Спеченный никель имеет ударную вязкость 49—•
—78 кДж/м2.
Твердость никеля по Бринеллю прн 20° С в зависимости от состоя-
состояния:
Состояние ИВ, МПа
Отожженный 981
Отожженный (99,9%) 667—765
Литой 600—800
Кованый 1200—1580
Кованый, отожженный 900—1100
Холоднокатаный лист 1300—1600
Отожженный лист 900—1000
При *= —183°С НВ=1560 МПа.
Твердость по Виккерсу переплавленного в вакууме никеля в зави-
зависимости от температуры:
t, °С . 200 260 414 600 900 1000 1100
HV, МПа .... 638 598 549 432 265 118 88,3
Микротвердость отожженного никеля при 20° С H^ = 1760 МПа.
Модуль нормальной упругости никеля £=196—210 ГПа. Измене-
Изменение модуля нормальной упругости Е в зависимости от температуры:
t, °С . . . —269 20 120 200 300 380 480 520 590
Е, ГПа . . 240 196 200 163,8 172,5 190,7 190,7 187 181,5
Модуль сдвига G=73 ГПа.
Коэффициенты модуля нормальной упругости монокристалла нике-
никеля при 4 К составляют: Сп = 261,2 ГПа; ci2= 150,7 ГПа и с44= 131,7 ГПа;
при 20° С у размагниченного никеля: Сп = 250 ГПа; Ci2=160 ГПа и
си= 118,5 ГПа.
Предел выносливости Or прн переменном изгибе:
i, °С
20
20
246
20
20
246
246
о МПа
Н
275
176
265
177
88,3
99,1
68,7
Примечание
Деформированный, число циклов 107
Отожженный, число циклов 10'
Отожженный химически чистый. Кру-
Круговой изгиб, 2800 об/мин, число цик-
циклов 104
То же, число циклов 105
То же, число циклов 106
» »
То же, число циклов 107
Сжимаемость %=0,623-10-" Па-1
489
Химические свойства
Нормальный электродный потенциал, реакции Ni—2e:**Ni8+, фо=
«=—0,23 В; наиболее характерна степень окисления +2 (возможны
+ 1, +2, +3, +4). Электрохимический эквивалент 0,30409.
Никель является металлом сравнительно низкой химической актив-
активности. При обычных температурах, он покрывается тонкой защитной
окисной пленкой и не взаимодействует с влагой воздуха, водой и рядом
растворителей. Вода, насыщенная углекислотой, в присутствии ионов
хлора может вызвать точечную коррозию никеля.
Никель превосходно сопротивляется коррозии в щелочных растворах.
Сильные щелочи — едкий натрий и едкий калий — на никель не дей-
действуют, так же как и безводный аммнак. Однако он растворяется в
аммиачных растворах в присутствии (NH4JCO3 с образованием растзо-
рнмых аммиакатов, окрашенных в зеленый цвет.
Серная и соляная кислоты медленно взаимодействуют с никелем,
слабо корродирует никель в уксусной, олеиновой, карболовых, стеари-
стеариновой кислотах и в среде фруктовых соков (помидорный, лимонный,
виноградный) при комнатной и повышенных температурах. Никель
стоек в азотной и азотистой кислотах. Сухие газы — галогены, окислы
азота, сернистый газ и аммнак — при комнатной температуре на никель
не действуют.
Никель обладает высокой стойкостью против окисления прн повы-
повышенных температурах. Она сильно зависит ог примесей, примесн одни
из которых (например, марганец, сера) ухудшают, а другие (хром,
кремний, алюминий) повышают стойкость никеля.
В мелкодисперсном состоянии никель пирофорен и поглощает боль-
большое количество газов (Н2, СО и др.), что ухудшает его свойства.
При нагреве взаимодействие никеля с кислородом начинается с тем-
температуры 520° С. Из оксидов наиболее важен NiO, который представ-
представляет собой зеленоватые кристаллы, нерастворимые в воде. Гидрокснд
никеля образуется прн добавлении щелочей к растворам солей никеля.
Он имеет яблочно-зеленый цвет.
Никель не реагирует с азотом даже при температурах до 1400° С.
Растворимость азота в твердом никеле мала и составляет при 445° С
0,07 % (по массе).
При умеренных температурах в атмосфере водорода никель подвер-
подвержен «водородной хрупкости». Ее возникновение связано с диффузией
водорода и адсорбцией его по границам зерен и в порах, а также об-
образованием малоустойчивых гидридов.
Никель и сера, а также сернистые соединения при нагревании обра-
образуют низкоплавкие эвтектики.
При нагревании NiO с серой образуется моносульфид NiS.
Никель с галогенами образует прн нагревании соединения №х2.
Устойчивых карбидов никель не образует, но в твердом состоянии раст-
растворяет до 2,7 % (ат.) С. С бором образует устойчивые бориды (Ni3B,
Ni2B, NiB), а с кремнием силициды (Ni2Si, NiSi, NiSi2).
Большинство солей никеля разлагается прн прокаливании E00—
800° С). Одна из наиболее употребляемых солей никеля NiSO4-7H2O —
никелевый купорос. Он кристаллизуется из растворов в вида изумруд-
изумрудно-зеленых кристаллов.
Никель один из самых активных металлов — катализаторов. Ката-
Каталитическая активность никеля зависит от степени дисперсности порошка,
его чистоты и методики его получения. Каталитическими свойствами об-
обладают многие сплавы никеля с алюминием, молибденом и с другими
элементами, а также и некоторые соединения: оксид, сульфид, бориды
никеля и другие.
490
Никель с железом, кобальтом, палладием, платиной, марганцем, ро-
родием, медью, золотом образует непрерывные ряды твердых растворов.
С рутением, осмием, рением, хромом, молибденом, вольфрамом и вана-
ванадием он образует ограниченные, но широкие области твердых раство-
растворов. Серебро, таллий, свинец с никелем в жидком состоянии не смеши-
смешиваются. С рядом других элементов никель образует промежуточные
соединения.
Технологические свойства
Технологические свойства никеля зависят от присутствия в нем приме-
примесей, газовых и неметаллических включений. Даже небольшие коли-
количества примесей образуют фазы, которые располагаются по границам
зерен в виде эвтектик и резко понижают пластичность. Сульфид никеля
образует с никелем легкоплавкую эвтектику F25° С), что в конечном
итоге катастрофически снижает деформируемость никеля и прочность
при высоких температурах.
Существенно влияет на хрупкость никеля при температурах выше
600 °С газовая коррозия в серосодержащей среде. В связи с этим огра-
ограничено содержание серы в топливе (мазуте) до 0,5 % в отжиговых пе-
печах. Содержание серы в никеле для сохранения его пластичности не
должно превышать 0,002 % и даже 0,0006 %. Причиной хрупкости ни-
никеля при 600—800° С может быть также «водородная болезнь», при
которой образуются трещины по границам зерен при нагреве из-за выде-
выделения газов.
Металлический никель в чистом виде весьма пластичный металл.
Он хорошо обрабатывается в горячем или холодном состояниях,
поддается прокатке, ковке, волочению. Слиток диаметром 100 мм мож-
можно прокатывать в ленты толщиной 0,2 мм без отжига. Никель сильно
упрочняется прн деформации в холодном состоянии. Наклеп снимают
отжигом при температурах выше температуры рекристаллизации, кото-
которая в зависимости от чистоты никеля колеблется в пределах 200—
600° С.
Наилучшую пластичность имеет никель электроннолучевой плавки
вследствие малого количества примесей. В литом состоянии при 20° С
\|э=88,7 % и после горячей деформации i)j = 86,4 %. Такой никель мож-
можно прокатывать в холодном состоянии без отжига с обжатием бо-
более 96 %.
Вредное влияние очень небольших количеств серы (до 0,001 %) иа
пластичность никеля устраняет закалка в жидком азоте. Однако, ни-
никель становится хладноломким, если после закалки его выдерживать
при комнатной температуре в течение нескольких дней. Хрупкость воз-
возникает даже при содержании 0,000001 % S. Добавки магния и марган-
марганца, а также лантана, празеодима, церия, гафния и циркония резко по-
повышают относительное сужение никеля (с 6 до более 70 %), содержа-
содержащего 0,0012 % S.
Вредными примесями являются также висмут, свинец и сурьма, т. к.
они располагаются по границам зерен, вызывая межкристаллитное раз-
разрушение. Никель с 0,013 % РЬ или с 0,011 %Bi хрупко разрушается при
прокатке.
Электроннолучевая плавка наиболее полно очищает никель от при-
примесей. Ниже приведен состав никеля по содержанию кислорода, водо-
водорода и углерода после различных методов плавки:
Плавка
Индукционная . . . ,
Дуговая ,
Электроннолучевая , .
491
о
0,
0,
0,
2. %
0020
0030
0003
н
о,
0,
0,
2, %
0003
0003
0001
0
0
0
с, %
,015
,020
,007
При электроннолучевой плавке никель также очищается от летучих
металлических примесей.
Области применения
Никель применяется как основа для создания никелевых сплавов и как
легирующий элемент в других сплавах — на основе железа, меди и т. д.
В настоищее зремя никель и его сплавы используют для деталей
специального назначения, приборостроения, машиностроения, в ракет-
ракетной технике, атомных реакторах, для производства щелочных аккуму-
аккумуляторов, пористых фильтров, катализаторов и для антикоррозионного
электролитического покрытия деталей и полуфабрикатов.
Никель используется для катодов, анодов и других деталей элек-
электронной аппаратуры, а также для изготовления химической аппарату-
аппаратуры, медицинской техники и магнитострикторов. Никель входит в состав
сплава нитинол, обладающего «памятью» формы (иикелид титана).
8,4. РУТЕНИЙ [1—35, 198, 284, 304—307]
Общие сведения и методы получения
Рутений (Ru) — металл белого цвета со слабо голубоватым отливом,
относится к платиновым металлам. Открыт в 1844 г. русским химиком
Клауссом и назван им в честь России (латинское Ruthenia). Сообщение
об этом открытии появилось лишь в 1845 г., когда Берцелиус подтвер-
подтвердил результаты опыта Клаусса и признал рутений новым элементом.
Его содержание в земной коре составляет 5-10~7 %. Входит в состав
очень редкого минерала лаурита Ru(Os)S2, содержится в осмистом ири-
иридии (до 18 %), а также в самородной платине (до 0,05 %). В рассеян-
рассеянном состоянии рутений находят в сульфидных медноникелевых рудах.
Технологическая цепочка получения рутения включает растворение
платиновых концентратов в царской водке, сплавление осадка с каль-
кальцинированной содой, бурой, свинцовыми глетом и древесным углем,
окислительное сплавление с серебром на пористом сосуде из огнеупор-
огнеупорного материала (купелирование), последующую обработку азотной кис-
кислотой, сплавление осадка с бисульфатом натрия, растворение в воде,
фильтрование осадка, сплавление его с гидроокисью калия и нитратом
калия или перекисью натрия, повторное растворение в воде и, нако-
наконец,, выделение рутения либо пропусканием через раствор хлора, отгон-
отгонкой R11O4, улавливанием иона родия смесью метилового спирта и соля-
соляной кислоты с последующим выпариванием, либо улавливанием иона
родия в приемниках с соляной кислотой с последующим кипячением и
обработкой хлоридом аммония. В первом случае образуется оксихлорид
рутения RuOCU, во втором—гсксахлоррутенат (NH4KRuCl6. При про-
прокаливании этих соединений в атмосфере водорода при 1273 К получа-
получают рутениевую губку.
Химический состав, %, промышленного аффинированного порошка
рутения приводится по ГОСТу 12343—79:
Марка
РуА—1
РуА—2
Ru
99,
99,
>
95
90
Платино-
Платиновые (сум-
(сумма)
0,02
0,05
0
0
РЬ
,005
,010
0
0
Fe |
,01
,02
Тримеси
Si
0,005
0,010
не более
1
0
0
Л1
005
005
0,
0,
Ва
005
005
всего
0
0
05
10
492
Содержание углерода в аффинированном порошке рутения состав*
ляет в среднем 0,025 %; дуговая плавка и зонная очистка снижают erg
до 0,012 и 0,005 % соответственно. Содержание кислорода и водорода,
% (по массе), в рутении различной степени чистоты:
Плавка ■ О2 Н2
Дуговая вакуумная .... 0,012—0,006 0,0009
Электронно-лучевая с зонной
очисткой 0,016 0,0001
Физические свойства
Атомные характеристики. Атомный номер 44, атомная масса
101,07 а. е. м., атомный объем 8,28> 10~6 м3/моль, атомный радиус 0,134 им,
ионный радиус Ru4+ 0,067 нм, конфигурация внешних электронных оболо-
оболочек 4d75s', потенциалы ионизации / (э-В): 7,36; 16,6; 30,3. Электроотрица-
Электроотрицательность 1,42. Рутений имеет г. п. у. решетку с плотнейшей упаковкой ти-
типа Mg (A3) и периодами а = 0,27057 и с = 0,42815 нм. Энергия кристалли-
кристаллической решетки Яреш = 670 мкДж/кмоль. Известно 7 устойчивых изотопов
рутения с массовыми числами: 96,98,99,100, 101,102 и 104; наиболее
распространен 102Ru, содержание которого составляет 31,61 %• Искус-
Искусственно получены радиоактивные изотопы рутения с массовыми числа-
числами 94—107 и периодами полураспада от 4 мин до 1 года. Эффективное
поперечное сечение захвата тепловых нейтронов B,56±0,12)-10~28 м2;
среднее сечение рассеяния, полученное экспериментально для максвел-
ловского спектра нейтронов равно F±1)'10~28 м2. Работа выхода
электрона <р=4,6 эВ, сродство к электрону 1,4 эВ.
Плотность Плотность р твердого рутения при 273 К равна
12,06 Мг/м3, плотность рутения в жидком состоянии (при 2700 К)
10,9 Мг/м3.
Электрические и магнитные. Удельная электрическая проводимость
о рутения и его удельное электросопротивление р в зависимости от
температуры:
Г, К 273 298 373
о, МСм/м . . 14,65 13,48 10,80
р, мкОм-м . . 0,0683 0,07427 0,0926
Удельное электрическое сопротивление монокристаллического руте-
рутения анизотропно. Так при 4,2 К отношение значений электросопротив-
электросопротивлений р ||(,/pj,e=l,l 1, а при 300 К оно возрастает до 1,36. Температура
перехода рутения в сверхпроводящее состояние при напряженности
магнитного поля 0,578 А/м равна Тс = 0,47 К. Абсолютный коэффици-
коэффициент т. э. д. с. еь вычисленный по отношению к платине, в зависимости
от температуры:
Т, К е,, мкВ/К Г, К еи мкВ/К
473 —29,7 873 —44,3
573 —32,5 1073 —43,3
673 —38,8 1273 —47,0
773 —42,2 1473 —51,0
Постоянная Холла рутения при температуре 293 К и магнитной индук-
индукции В = 4,47 Тл # = 2,2-10~'° м3/Кл. Поперечный четный гальваномаг-
гальваномагнитный эффект для поликристаллического рутения, содержащего 0,01 %
примесей, при температуре 20,4 К и напряженности магнитного поля
493
31,8*10* А/м d#/# = 0,151. Значения магнитной восприимчивости руте-
рутения х В зависимости от температуры.
Г, К 18 103 173 233 293
Х-109 0,43 0,55 0,50 0,46 0,427
Тепловые и термодинамические Температура плавления рутения
*пл=2250°С, температура кипения /„„0 = 4077 С, характеристическая
температура 6D = 580 К, удельная теплота плавления АЯПЛ =
222,8 кДж/кг, удельная теплота сублимации при 298 К Д#Субл =
= 6416,3 кДж/кг, расчетная удельная теплота испарения при темпера-
температуре кипения АЯисп = 5857,3 кДж/кг. Удельная теплоемкость ср руте-
рутения в зависимости от температуры:
Г, К 20 40 80 150 250 400 600 1000 1500
ср, Дж/(кг-К) ... 1,7 18,6 99,3 187 237 246 255 279 298
По данным измерения удельной теплоемкости предполагают суще-
существование а, Р, V и б-модификаций рутения, причем переход a->-{i про-
происходит при 1032°С (скрытая теплота превращения 1,385 кДж/кг), пе-
переход P^-y при 1200° С (скрытая теплота не определена) и переход
Y->6 — при 1500° С (скрытая теплота превращения 9,5 кДж/кг). Одна-
Однако вопрос наличия полиморфизма в рутении до настоящего времени
остается дискуссионным, поскольку температурные зависимости т. э. д с.
н параметра кристаллической решетки не обнаруживают скачков в рай-
районе предполагаемых полиморфных превращений.
Теплопроводность рутения определена только для температурною
интервала 273—373 К, где ее среднее значение равно Л.= 116,3 Вт/(м-К).
Температурный коэффициент линейного расширения рутения при
323 К а=9,9Ы0~в К. Удельная электронная теплоемкость c3f=
[3 мДж/(моль-К2)]7\ молярная энтропия s°=28,5 Дж/(моль-К) Дав-
Давление пара р рутения и температура, при которой это давление \стпч и-
ливается:
Т, К
1657
1741
1833
1936
2051
2180
р. 133,3 Па
10-ю
ю-9
Ю-'
10-'
ю-»
10—g
т. к
2328
2496
2692
2929
3213
р. 133,3 П
ю-4
ю-3
10-3
Ю-1
1
Поверхностное натяжение рутения при температуре плавления а=
= 2050—2250 мН/м, коэффициент чувствительности поверхностного на-
натяжения к температуре daldT——0,31 мН/(м-К).
Механические свойства
Отожженный рутений имеет временное сопротивление разрыву при рас-
растяжении о"в = 490—500 МПа, предел текучести о,2=370—380 МПа,
относительное удлинение 6=3 %» сужение площади попере-
поперечного сечения \|> = 2 %, твердость по Бринеллю НВ 1790 —■
2160 МПа, твердость по Виккерсу HV—2550—4900 МПа. Пластичность
рутения очень мала, поскольку температура перехода из пластичною
состояния в хрупкое гораздо выше комнатной температуры и составля-
составляет примерно 1000° С. Модуль нормальной упругости рутения по разным
494
данным составляет £=422—462,8 ГПа, модуль сдвига G 160—170 ГПа.
Сжимаемость рутения и=0,31 • 10~" Па-1. Данные о влиянии темпера-
температуры на механические свойства рутения отсутствуют.
Химические свойства
Нормальный электродный потенциал реакции Ru—2e<±Ru2+ ф,, = 0,45 В;
степень окисления от +2 до +8, наиболее часто встречающиеся +3,
+ 4, +6, +8.
Окислительно-восстановительный потенциал рутения в кислотных
средах равен 0,874—0,9 В
Рутений достаточно пассивный металл, в нормальных условиях на
него не действуют кислоты, даже царская водка. Расплавленные щело-
щелочи в смеси с окислителями переводят рутений в растворимые в воде со-
соли — рутенаты Me2Ru04 и перрутенаты MeRuO4 (где Me — щелочной
металл), в которых рутений проявляет степень окисления +6 и +7 со-
соответственно. Из соединений 4-валентиого рутения известны RuC>2,
RuO(OHJ, RuCl4, RuS2, а также многочисленные комплексные соедине-
соединения Трехвалентный рутений известен в форме простых соединений ти-
типа RuCl3, Rul3, а также большого числа комплексных соединений типа
Me3[RuX6], Me2[RuJL5] и др. Соединений 2-валентного рутения получе-
получено мало. При 723—873 К рутений легко растворяется в воде, образуя
раствор бурого цвета.
Гидриды рутения не обнаружены. Растворимость водорода в руте-
рутении:
t, °с
Растворимость, 10~5, °/
/, °С
Растворимость, 10~5, °/
о (ат.) .
i> (ат.) .
1002
2,76
1213
5,69
1057
3,25
1326
7,73
1073
3,41
1374
7,80
1105
4,07
1455
10,4
Компактный рутений адсорбирует некоторое количество водорода; на-
наибольшей адсорбционной способностью обладает рутений, полученный
электроосаждением. Содержание адсорбированного водорода в поро-
порошковом рутении при комнатной температуре существеио зависит от
давления.
р, Па . . .
Содержание,
р Па . . .
Содержание,
ю-7'
10-*,
• • * я
м3/кг , .
м3/кг , .
200
, 263,8
2573
. 4040,7
533
1347,9
5200
7147,8
1226
2904,9
6852
7461,0
С повышением температуры абсорбция уменьшается, причем наиболее
резко при 400—450° С.
Диаграмма состояния рутений — кислород не изучена. Однако, из-
известно, что при нагревании на воздухе выше 400° С рутений легко окис-
окисляется до RuO2. Известна также четырехокись RuO4, открытая еще в
1860 г.
Взаимодействие рутения с азотом практически не изучалось.
Максимальная растворимость углерода в рутении при 1942° С дос-
достигает 0,36% (по массе); при температуре 1256°С она составляет
0,112%, а при 820° С—всего 9-10~4 %. Избыточный углерод выделя-
выделяется по базисным плоскостям кристалла в виде пластин графита не-
неправильной формы и различного размера.
По характеру взаимодействия с переходными металлами рутений рез-
резко отличается от других металлов платиновой группы, поскольку обра-
495
зует наиболее простые диаграммы с наименьшим числом химических
соединений. Непрерывные твердые растворы рутений образует с Осми-
Осмием, уехнецием, рением и кобальтом. Переходные металлы VA и VIA
группы растворимы в рутении в количестве до 52,5 % (ат.). Раствори-
Растворимость элементов II—IV групп существенно ниже и составляет 2—8 %
(ат.). Типичными соединениями в сплавах рутения являются Лавес-
фазы. В системах со скандием, иттрием и РМЗ иттриевой подгруппы
эти фазы имеют гексагональную решетку типа MgZn2, тогда как в си-
системе с РЗМ цериевой подгруппы — решетку типа MgCu2. С металлами
IV и V групп рутений образует соединения эквиатомного состава, а с
металлами VI группы — о-фазу с решеткой |3-U.
Технологические свойства
Рутений поставляют в виде порошка или прессованных и спеченных
прутков. Выплавляют рутений и его сплавы в индукционных дуговых
й электронно-лучевых печах в среде аргона или в вакууме. Полосы или
прутки из рутения можно изготовить ковкой в обжимках, свободной
ковкой или прокаткой. Ковку в обжимках проводят при 1150—1500° С,
а прокатку — при 1050—1250°С. Полосу рутения, прокатанную до
0,5 мм, можно далее раскатать при комнатной температуре до толщины
0,08 мм. Температура рекристаллизации рутения по различным данным
составляет от 1000° С для предварительной деформации 85 % до
1400°С для деформации 50 %• Эта температура зависит от его чисто-
чистоты, которая в свою очередь определяется способом его получения:
Плавка
Дуговая
Электронно-
Электроннолучевая
Pt
5
0,5
Pd
1
Содержание
Rh
10
0,03
Си
1
0,5
прнмесей, 1
5
0,65
SI
coco
о-3
Fe
30
% (по массе)
Ag
Не
0,01
Мп
опред
0,1
Мо
еляли
0,5
В!
1,0
Применительно к процессу горячей прокатки рутения изучен режим
оптимальных обжатий за проход и определены удельные давления ме-
металла на валки при прокатке в вакууме:
Температура прокатки,
°С 1200 1300 1400 1400 1400
Обжатие за проход, % 22 25 10 24 27
Давление, МПа .... 520,7 535,4 297,1 436,4 495,2
При прокатке в вакууме технологические свойства рутения выше, чем
при прокатке на воздухе, так как при этом не происходит газонасыще-
газонасыщения металла и образования поверхностного слоя окалины, наличие ко-
которой может привести к разрушениям по кромкам материала, подверг-
подвергнутого 30 %-ному обжатию. Прокатка рутения при 1100—1200°С не
приводит к упрочнению материала, так как при этих температурах и об-
жатиих порядка 30 % происходит динамическая рекристаллизация.
Наилучшим технологическим режимом прокатки вакуумплавлениого ру-
рутения является прокатка в вакууме при 1200—1400° С с единичными об-
обжатиями 20—25 % и суммарным обжатием до 75 %.
496
Области применения
Важное значение имеет рутений как сорбент водорода и катализатор
многих химических реакций. Ои входит в состав некоторых сплавов,
обладающих высокой твердостью и стойкостью против истирания и
окисления. Сплавы рутения с палладием являются лучшими мембран-
мембранными сплавами — катализаторами для реакций гидро- и дегидрогени-
дегидрогенизации циклогексана. Инида рутений используют как заменитель родия
или иридия в сплавах с платиной и палладием.
Комплексную аммонийную соль рутения «рутениевую красную» при-
меняют в качестве краски по фарфору, а некоторые соединения руте-
рутения — как стойкие красители в стеклах и эмалях.
8.5. РОДИЙ [1—35, 284, 304, 306]
Общие сведения и методы получения
Родий (Rh)—металл серебристо-белого цвета, один из платиновых ме-
металлов, открыт в 1803 г. английским исследователем Волластоном. Со-
Содержание родия в земиой коре составляет порядка 10~7 % по массе.
Родий не образует самостоятельных минералов. Он встречается в виде
примеси в самородной платине и других платиновых минералах. По-
Получают родий попутно с извлечением платины, палладия и иридия.
Его выделяют из растворов или в виде нерастворимых солей — хлор-
пентамминхлорида [RhCl(NH3M]Cl2) хлортриаммина [RhCl3(NH3b] —
или кристаллизацией хлорородиата аммония (NH<)s[RhCle]. Первым эта»
пом получения является обработка концентратов царской водкой. Ос-
Оставшийся осадок смешивают с кальцинированной содой, бурой, свин-
свинцовым глетом и древесным углем и плавят. Благородные металлы, в
том числе и родий собираются в свиниовом сплаве, который подверга-
подвергают купелированию. В результате последующей обработки азотной кис-
кислотой и фильтрования получают осадок, содержащий родий, иридий,
осмий. Осадок сплавляют с бисульфатом натрия, превращая родий в
растворимый в воде сульфатокомплекс Rh3+, обрабатывают водой, филь-
фильтруют и снова осаждают родий, добавляя гидроокись иатрия. Затем
путем растворения в соляной кислоте, обработки нитритом натрия и
щелочью, производят очистку раствора, после чего осаждают родий,
добавляя хлорид аммония. Осадок нагревают с соляной кислотой для
перевода родия в анион [RhCI6]3—. Далее, удалив примеси с помощью
катионнообменной смолы, восстанавливают родий до металла, добавляй
муравьиную кислоту. Выделенный при этом высокодисперсный порошок
родия нагревают в водороде до 1273 К и получают родиевую губку.
Марки и химический состав аффинированных порошков родия (ГОСТ
12342—81):
Марка
РдА-1
РдА-2
а
Родий
99
99,
менее
95
90
Сумма
о о
плати-
платиновых
02
03
0
0
РЬ
,005
,005
0
0
Примеси, не более
Fe
,01
,02
0
0
Si
005
005
Ва
0,005
0,005
О2 и ле-
летучие
0,01
0,02
всего
0,
0,
05
10
497
Родий, применяемый в приборостроении, аппаратостроении и других от-
отраслях промышленности, по химическому составу должен соответство-
соответствовать ГОСТ 13096—67:
Марка
Рд99,9
Рд99,8
X
"К
к
а
99
99
<и
к
Е
90
80
сумма
платино-
платиновых
0,05
0,09
0
0
Аи
,01
,03
0
0
Примеси, не
Уе
,02
,02
РЬ
0,01
0,02
более
Si
0,01
0,03
0
0
Ва
,005
,010
всего
0,
о,
10
20
Содержание примесей внедрения в родии не оговаривается. Экспе-
Экспериментально найдено, что среднее содержание углерода в аффиниро-
аффинированном порошке родия составляет 0,002 % (по массе). Содержание
примесей в родии, выплавленном в дуговой вакуумной печи и электрон-
электронно-лучевой печи с зонной очисткой: 0,001 % С; 0,003 % О2 и 0,0001 % Н2.
Физические свойства
Атомные характеристики. Атомный номер 45, атомнаи масса 102,905
а. е. м., атомный объем 8,37-10~6 м3/моль, атомный радиус 0,134 нм,
ионный радиус (Rh4+) 0,068 нм. Конфигурация внешних электронных
оболочек 4ds5sl. Потенциалы ионизации родия / (эВ): 7,46; 15,92;
электроотрицательность 1,45. Имеет г. ц. к. решетку с периодом
0,379 нм. Состоит из одного устойчивого изотопа и ряда радиоактив-
радиоактивных изотопов с предполагаемыми массовыми числами от 97 до 109 и
периодами полураспада от 44 с до 220 сут. Энергия кристаллической
решетки £реш=578 мкДж/кмоль. Эффективное поперечное сечение за-
захвата тепловых нейтронов A49±4) • 10~28 м2; среднее сечение рассе-
рассеяния, полученное экспериментально для максвелловского спектра ней-
нейтронов, равно E±1)-10~28 м2. Работа выхода электрона ф = 4,75 эВ,
сродство атома родия к электрону 1,5 эВ.
Плотность. Плотность родия при 293 К р= 12,44 Mr/м3; плотность
в жидком состоянии при 2239 К р= 10,8 Мг/м3.
Электрические и магнитные. Электрическая проводимость о родия,
определенная для температур 273, 298 и 373 К, равна соответственно
23,29; 20,2 и 15,98 МСм/м; удельное электросопротивление р в зави-
зависимости от температуры:
т, к
273
373
473
573
673
773
р, мкОм м
0,0394
0,0576
0,0758
0,0943
0,1132
0,1342
Г, К
873
973
1073
1173
1273
1373
р мкОм м
0,1567
0,1852
0,2058
0,2304
0,2551
0,2805
т, к
1473
1573
1673
1773
1873
1973
р, mkOw-m
0,3050
0,3298
0,3551
0,3806
0,4070
0,4338
Температурный коэффициент электрического сопротивления родия
определен для интервала 273—373 К, а = 4,57Л0-3 К. Коэффициент
чувствительности электросопротивления к давлению гидростатического
сжатия р при 299 К:
р, ГПа . . . . .
-i- . — • 10-u
0,001
1,65
1,0
1,62
3,0
1,56
498
Температура перехода родия в сверхпроводящее состояние Тв=>
=0,002 К. Абсолютный коэффициент т. э. д. с. ех родия, вычисленный
по отношению к платине:
Г, К 273 373 473 573 673
е1? мкВ/К +0,9 -fO,8 -fO,8 +0,6 +0,5
Г, К 773 873 1073 1273 1473
ех, мкВ/К +0,2 0 —0,4 —0,9 —1,5
Постоянная Холла родия чистотой 99,5 % при температуре 291 К и
магнитной индукции В = 4,9 Тл Я = 0,505> Ю0 м3/Кл. Поперечный чет-
четный гальваномагнитный эффект для поликристаллического родия при
4,22 К и напряженности магнитного поля // = 29,1-Ю5 А/м составляет
dR/R = l,546, а при 20,4 К и напряженности поля 29,9-105 А/м dR/R =
= 1,867. Значения магнитной восприимчивости % при различных темпе-
темпера i у pax:
Г, К • • 20 40 60 80
Х-Ю9 0,926 0,928 0,930 0,932
Г, К 100 200 290 623
Х-Юа 0,935 0,960 0,988 1,17
Тепловые и термодинамические. Температура плавления родия /пл =
= 1966°С, температура кипения ^Кип = 3627°С, характеристическая тем.
пература 6D=362—480 К. Удельная теплота плавления АНПЛ =
= 219,6 кДж/кг, удельная теплота сублимации при 298 К ДЯСУбл =
= 5403,3 кДж/кг, удельная теплота испарения при температуре кипе-
кипения Л//„сп = 4800,8 кДж/кг. Удельная теплоемкость ср родия в зависи-
зависимости от температуры:
Г, К 20 40 80 150 250 400 600 1000 1500
ср, Дж/(кг-К) ••• 2,7 26,6 114 196 234 256 274 307 349
Теплопроводность X в зависимости от температуры:
Г, К 100 200 300 400 500
I, Вт/(м-К) 185 156 152 144 137
Температурный коэффициент линейного расширения a = Rh при раз-
различных температурах:
Г, К 99 181 245 283 313
а-10е, К-1 5,9 7,4 7,9 8,45 8,5
Удельная электронная теплоемкость родия СрЛ=[4,65 мДж/(мольХ
ХК2)]Г молярная энтропия s°=31,8 Дж/(моль-К). На основании ре-
результатов скачкообразного изменения ряда физических свойств родия
от температуры высказывалось предположение о существовании двух
полиморфных модификаций, причем низкотемпературная модификация
имеет кубическую решетку с периодом 0,9211 нм, а переход ее в высо-
высокотемпературную модификацию с г. ц. к. решеткой происходит по раз-
разным данным от 1027—1047 до 1100—1200 °С. Однако, имеющиеся экс-
экспериментальные данные по электросопротивлению и изменению пара-
параметра решетки при высоких температурах не подтверждают предполо-
499
жения о наличии полиморфизма родия. Взаимосвязь между давлением
р пара и температурой, при которой это давление устанавливается:
т, к
1395
1467
1546
1635
1735
р, 133,3 Па
10-ю
10-9
Ю-8
Ю-7
10-»
т, к
1847
1976
2124
2303
2559
р, 133,3 Па
10-5
10-*
Ю-3
10-?
10-1
Т. К
2794
3121
3543
3990
р, 133,Л Па
1
10
102
760
Скорость сублимации родия при давлении насыщенного пара в зависи-
зависимости от температуры:
7", К . .
Скорость
кг/(м2-с)
сублимации,
ю-6
1847
1,3
1976
13
2124
120
Поверхностное натяжение родия вблизи температуры плавления сг=
=2000—2050 мН/м, коэффициент чувствительности к температуре
da
—~ =— 0,3 мН/(м-К). Энергия дефектов упаковки 180 мДж/м2, по-
поверхностная энергия для грани A00) v=2610 мДж/м2.
Оптические. Коэффициент излучения родия при температуре плав-
плавления и длине волны 0,65 мкм е^г=0,29 для твердого н 0,30 для жид-
жидкого состояния. Отражательная способность родия (коэффициеш отра-
отражения по) в зависимости от длины волны X:
к, мкм 0,500 0,650 0,800 1,00 2,00 4,00 7,00 10,00
nD, % 76 77 81 84 91 92 94 95
Родий обладает наиболее высоким коэффициентом отражения в ви-
видимой части спектра.
Механические свойства
Временное сопротивление разрыву родия по разным данным колеблется
в интервале ов= 411—550 МПа, предел текучести о0,2 = 65,0—75,0 МПа,
относительное удлинение 6=12—15%, сужение площади поперечного
сечения г|> = 6,0—20,0 %, твердость по Брипеллю ЯВ = 540—1360 МПа,
модуль нормальной упругости £=275—315 ГПа, модуль сдвига G —
= 150 ГПа, сжимаемость 0,36-10-" Па-1. Свойства родия существеиио
зависят от его чистоты. Холодная прокатка с 30 %-ным обжатием мо-
монокристаллического родия сопровождается повышением микротвердости
И от 1960 до 4700 МПа. Нагрев приводит к сильному разупрочнению
родия. При нагреве до 1200 °С микоотвердость снижается до 390 МПа,
а о*в до 78 МПа. Модуль упругости родия уменьшается по линейному
закону при нагреве до 800 °С, при более высоких температурах наблю-
наблюдается отклонение от линейности. Ползучесть родия 0^24=45,1 МПа,
при этом удельная прочность* составляет 380 м. Энергия активации
Здесь и далее удельная прочность — это прочность элемента, отне-
отнесенная к его удельному весу.
500
ползучести родия в интервале 837—1677 °С йри напряжениях от 9,8 до
72,6 МПа составляет 380,7 кДж/моль.
Химические свойства
Нормальный электродный потенциал реакции Rh—2e^±Rh2+ фо = О,8 В;
в соединениях проявляет степень окисления +3; окислительно — восста-
восстановительный потенциал родия в кислотных средах равен 0,7—0,73 В.
В мелкодисперсном виде родий легко растворяет газы — с этим связа-
связаны его каталитические свойства.
Химически родий очень пассивен. Он не растворяется в кислотах и
очень слабо растворим в царской водке. В растворимую форму перехо-
переходит при нагревании с дымящей серной кислотой, а также с расплавлен-
расплавленными пиросульфатами щелочей, перекисью натрия или бария. Гидро-
ксид Rh(OHK получают осаждением щелочами из растворов солей ро-
родия. Сероводород из этих растворов при кипячении осаждает сульфид
RI12S3, нерастворимый в кислотах.
Родий образует ряд соединений с галогенами, например RhCU,
RhCl3-4H2O и т.д.
Известны соли родия с общей формулой Me3[RhXe], где Me — од-
одновалентный металл, X — кислотный остаток, а также соли с форму-
формулой MczfRhCb] и т. д. Во вес эти соли родий входит в состав ком-
комплексного аниона. Наиболее изученными комплексными соединениями
родия являются его многочисленные аммиачные соединения, а также
соли комплексной кислоты H3[RhCl6] или хлорородаты.
Гидриды родия не обнаружены. При обычных условиях компакт-
компактный родий не поглощает водород. Растворимость водорода при 1000—
1500 °С составляет порядка 0,0002—0,0004% (ат.). Водород, хотя и не
слишком активно, адсорбируется родиевой чернью, причем его коли-
количество возрастает с увеличением дисперсности черни, снижением тем-
температуры и ростом давления. Влияние давления р на адсорбцию водо-
водорода родием при 293 К.
о Па
Адсорбция,
м3/кг . . .
Ю-5
4093
284
9625
472
28584
495
,2
55075
540
,3
108537
593
,4
При прокаливании на воздухе при 873—1273 К родий окисляется,
образуя черно-серый нерастворимый в кислотах порошок Rh2O3. Из-
Известны и другие оксиды родия, например RhO2, существующий как в
твердом, так и в газообразном состояниях. Этот оксид образуется в
интервале температур 1200—1400 °С, причем с повышением температу-
температуры упругость его паров возрастает. Взаимодействие родия с азотом
практически не изучено.
Максимальная растворимость углерода в родии наблюдается при
1694±15°С и составляет 0,45% (по массе). При 1250°С раствори-
растворимость углерода 0,007%, при 920 °С — лишь 0,00067%. При 1690 °С и
содержании 15 % (ат.) С образуется эвтектика. Карбиды родия до
настоящего времени не обнаружены. Избыточный графит в сплавах ро-
родий — углерод выделяется в шаровидной форме.
В системах с кобальтом, никелем и иридием родий образует непре-
непрерывные ряды твердых растворов, а в системах с золотом и серебром
наблюдаются широкие области несмешиваемости даже в жидком сос-
состоянии. В системах с переходными металлами и металлами В-подгрупп
родий образует лишь ограниченные твердые растворы, с большим ко«
501
личеством промежуточных фаз. Так, в сплавах с кальцием, стронцием,
барием, РЗМ и плутонием найдено большое количество фаз Лавеса со
структурой типа MgCu2; в сплавах с магнием, РМЗ, алюминием, гал-
галлием, индием, титаном, цирконием, кремнием и марганцем — соединений
типа CsCI эквиатомного состава; в сплавах с молибденом и вольфра-
вольфрамом— cf-фазы и т.д. Растворимость элемента в родии зависит от но-
номера его группы. Наиболее растворимы в родии металлы VA и VIA
групп. Влияние легирующих элементов на физико-механические свойст-
свойства родия изучено недостаточно.
Технологические свойства
Родий поставляют в виде порошка, прутков и проволоки. Выплавляют
родий и его сплавы в высокочастотных, индукционных, электронно-
электроннолучевых и дуговых печах или в вакууме или в среде аргона. В случае
перевода родия в компактную форму методами порошковой металлур-
металлургии необходимо, в первую очередь, тщательно контролировать грану-
грануляцию частиц, поскольку от иее зависит давление прессования и темпе-
температура спекания. Последнее обычно проводят при 1200 °С в водороде,
вакууме, или на воздухе. Имеются сведения, что температура перехода
родия из пластичного состояния в хрупкое ниже —196 °С, однако тех-
технический родий очень хрупок. Слитки родия деформируют при 1500 °С,
а дальнейшую горячую деформацию ведут при 1200—1450 °С, причем
даже в этих условиях родий интенсивно упрочняется. Монокрисгалли-
ческий родий заметно пластичнее и может быть прокатан вхолодную
с обжатием до 90 %. Для снятия наклепа рекомендуется отжиг родия
при температуре порядка 800 °С. Поскольку температура рекристалли-
ззЦии родия по разным данным составляет 800—1200 "С, отжиг при
более высоких температурах приведет к возникновению рекристаллизо-
ванных зерен и падению низкотемпературной пластичности родия. От-
Отжиг следует проводить в инертной среде, поскольку в противном слу-
случае, иа поверхности материала образуется окисная пленка. Необходи-
Необходимо отметить, что температура рекристаллизации, а следовательно и
температуры горячей деформации существенным образом зависят от
чистоты родия. Известно, например, что начало рекристаллизации ро-
родия, полученного электронно-лучевой плавкой с зонной очисткой, про-
происходит при 600 °С. Соответственно, должны быть понижены темпера-
температуры промежуточных отжигов.
Области применения
Благодаря своей высокой отражательной способности родий является
хорошим материалом для покрытия рефлекторов прожекторов и зер-
зеркал точных приборов. Его используют в качестве катализатора при
гидрировании органических соединений и в качестве припоя при пайке
молибдена и вольфрама. В ювелирном деле часто применяют электроли-
электролитические покрытия из родия, достаточно прочные и не тускнеющие.
Однако, главная область применения родия — легирование платины,
используемой в качестве конструкционного материала в химической
промышленности. Родий применяют в качестве материала для термо-
термопар, причем не только в сплаве с платиной, но и в сплаве с иридием.
502
8.6. ПАЛЛАДИИ [1-35, 198, 283, 304, 306, 308]
Общие сведения и методы получения
Палладий (Pd) •— металл белого цвета со слабым сероватым отливом,
относится к платиновым металлам. Открыт в 1804 г. английским уче-
ученым У. Волластоном и назван в честь астероида Паллас, открытого
незадолго перед этим.
Палладий относится к числу рассеянных элементов •—■ его содержа-
содержание в земной коре составляет Ь10~8%. Встречается в платине в виде
примеси. Источниками пол>чения палладия служат самородная плати-
платина и шламы никелевого производства. Процесс получения палладия
включает растворение самородной платины или шламов в царской вод-
водке с последующим выделением платины. При этом палладий вместе с
другими платиновыми металлами остается в солянокислом растворе.
Палладий отделяют путем последовательной обработки избыточным
количеством аммиака, а затем соляной кислотой. В итоге протекающих
реакций образуется осадок [РёСЬ^НзЫ, который восстанавливают
до порошка, обрабатывая в струе водорода. Сортамент и химический
состав, %, аффинированного палладия в слитках, получаемых перепла-
переплавом предварительно спрессованных порошков (ГОСТ 12340—81:
СОРТАМЕНТ И ХИМИЧЕСКИЙ СОСТАВ ПАЛЛАДИЯ В СЛИТКАХ
Марка
Пд
Пд
А-1
А-2
к
ЕС
Палл
99
99
нее
S
о
X
95
90
Сумм
0,
о,
-он
ч а
с п
025
050
Аи
0,005
0,010
РЬ
0,005
0,005
0
0
Fe
,01
,02
Примеси
0
0
Si
005
005
, не более
0
0
Sn
,001
,005
0,
0,
А1
005
005
кисло
и лет
чие
0,05
—
всего
0
0
05
10
Палладий, применяемый в приборостроении, аппаратостроении и дру-
других отраслях промышленности, по химическому составу должен соот-
соответствовать ГОСТ 13462—79:
Марка
Пд99,9
Пд99,8
Палладий,
не менее
99,90
99,80
Pt+Ir+
+Os
0,06
0,13
0
0
Примеси,
Аи
,006
,010
РЬ
0,006
0,006
не более
Si
0,005
0,006
Fe
0
0
03
04
всего
0,10
0,20
Типичное содержание примесей внедрения в палладии: 0,0097 ±
±0,0022 % О2, 0,00037±0,00009 % Н2 и 0,0004 % N2.
Физические свойства
Атомные характеристики. Атомный номер 46, атомная масса
106,4 а. е. м., атомный объем 9,28-10—6 м3/моль, атомный радиус
0,137 нч, ионный радиус Pd4+ 0,065 нм. Конфигурация внешних элек-
электронных оболочек 4d10. Потенциалы ионизации / (эВ): 8,33; 19,42;
503
33,4; электроотрицательиость 1,35. Палладий имеет г. ц. к. решетку с
периодом 0=0,38824 нм. Энергия кристаллической решетки £реш =
=390 мкДж/кмоль. Известно шесть устойчивых изотопов палладия с
массовыми числами 102, 104, 105 (распространенность в природе
22,23%), 106 B7,33%), 108 B6,71 %) и ПО A1,8%). Также известен
ряд радиоактивных изотопов с массовыми числами от 98 до 113 и пе-
периодами полураспада от 1,5 минут A13Pd) до 7-108 лет A07Pd). Эф-
Эффективное поперечное сечение захвата епловых нейтронов составляет
(8±1,5) • 10~28 м2; среднее сечение рассеяния, экспериментально полу-
полученное для максвелловского спектра нейтронов, равно C,6±0,6)Х
ХЮ~28 м2. Работа выхода электрона ср = 4,8 эВ, электроотрицатель-
электроотрицательиость 1,8; сродство к электрону 1,2 эВ.
Плотность. Плотность палладия при 293 К р= 12,16 Мг/м3 В жид-
жидком состоянии при температуре 1825 К плотность палладия р =
= 10,49 Мг/м3 при коэффициенте зависимости плотности от темпера-
температуры —1,266 кг/(м3-К).
Электрические и магнитные. Удельная электрическая проводимость
о палладия в зависимости от температуры:
Г, К 273 298 373
о, МСм/м 11,0 10,04 7,94
Удельное электрическое сопротивление р в зависимости от темпера-
температуры:
Г, К 73 173 273 373 473
р, мкОм-м . . 0,0214 0,0512 0,102 0,140 0,174
Г, К 573 673 773 873 973
р, мкОм-м . . 0,210 0,243 0,274 0,304 0,332
Г, К 1073 1173 1273 1473 1673
р, мкОм-м . . 0,356 0,376 0,400 0,448 0,495
Температурный коэффициент электрического сопротивления в ин-
интервале 273—373 К а = 3,79-10~3 К. Коэффициент чувствительности
1 dp
электросопротивления "• -—к давлению гидростатического сжатия р
при 299 К:
р, ГПа 0,0001 1,0 3,0
-i-. -l£- . ic-ii, Па-1 .... 2,10 2,04 1,93
Р dp
Сверхпроводимость до 0,1 К не обнаружена. Абсолютный коэффи-
коэффициент т. э. д. с. в[ палладия, измеренный по отношению к платине
Г, К • ■ 273 373 473 573 673 873
еи мкВ/К —9,6 —13,4 —16,3 —13,8 —21,7 —28,5
Г, К- ....... 107J 1273 1473 1673 1773
е1; мкВ/К —35,3 —41,4 —47,0 —51,0 —53,0
Коэффициент Томсона S палладия в интервале 20—300 К:
7 К 20 100 200 300
S, мкВ/К +1,9 -7,8 -12,1 -18,2
504
Максимальные значения коэффициента вторичной электронной
эмиссии палладия соответствуют широкому спектру значений энергии
первичных электронов @,42—1,0 кэВ) и составляют ота>, = 1,62—1,64.
Постоянная Холла R в зависимости от температуры при магнитной
индукции В = 0,87—0,92 Тл:
Г, К 299 318 337
R-W, м3/Кл . . . —0,845 —0,855 —0,844
Термомагнитные коэффициенты палладия при разных температурах:
Т, К 299 318 377
Магнитная индукция В,
Тл 0,87—0,92 0,87—0,92 0,87—0,92
Коэффициент Эттинг-
сгаузена Р-108, (К-м3)/
(В-А-с) +16,2 +17,8 +20,6
Коэффициент Риги — Ле-
дюка, S-103 м/(В-с) . . —0,487 —0,414 —0,378
Коэффициент Эттингсга-
узена — Нернста
Q-108, м2/(К-с) . . . +3,27 +3,26 +3,35
Поперечный четный гальваномагнитный эффект в палладии, содер-
содержащем 0,01 % примесей, при 78 К и напряженности магнитного поля
Я = 238,7 кА/м cf/?//? = O, 102. Магнитная восприимчивость палладия JC
в зависимости от температуры:
Г, К- • - 20 40 60 80 90 100 150
7-Ю9 7,32 7,37 7,49 7,54 7,56 7,50 7,06
Т, К 200 250 270 290 473 1073 1503
Х- 10е» 6,44 5,79 5,53 5,27 4,6 2,6 1,7
Тепловые и термодинамические Температура плавления палладия
<пл—1554°С, температура кипения <квп = 2877°С, характеристическая
температура 6г>=275 К, удельная теплота плавления АЯПЛ =
= 156,95 кДж/кг, удельная теплота сублимации при 298 К ДЯс>в11 =
=3545,1 кДж/кг, удельная теплота испарения при температуре кипения
Д#исп = 3399,4 кДж/кг. Удельная теплоемкость ср палладия в зависимо-
зависимости от температуры при нормальном давлении:
Т, К 20 40 80 150 250 400 600 1000 1500
ср, Дж/(кг-К). • 9 51 14 208 238 250 261 282 309
Теплопроводность палладия определена только для температуры
293 К, где А=76,2 Вт/(м-К). Температурный коэффициент линейного
расширения а палладия при температуре ниже 10 К может быть опре-
определен из уравнения а=[40,5 Т+0,435-Т3]-10-10, а при более высоких
температурах изменяется следующим образом:
Г, К 75 130 200 300
а-106, к-1 6,21 9,5 10,0 12,5
Удельная электронная теплоемкость палладия СрЛ=[9,57 мДж/(мольХ
ХК2I-7\ молярная энтропия $"=37,89 Дж/(моль-К). Взаимосвязь
505
между давлением пара р палладия и температурой, при которой это
давление устанавливается:
Г, К 1056 1114 1800 1253 1336 1430 1539
р, 133,3 Па . 10-1» 10-» 10-8 10-7 10-е jO-5
Г, К 1667 1820 2011 2246 2544 2931 3385
р, 133,3 Па . Ю-3 Ю-2 10-1 i 10 10? 760
Скорость сублимации палладия при давлении насыщенного пара в
зависимости от температуры:
Т, К 1430 1539 1667 1820
Скорость сублима-
сублимации, 10-8 кг/(м2-с) 1,6 15,0 150,0 1400
Поверхностное натяжение жидкого палладия вблизи температуры плав-
плавления 0=1500—1600 мН/м, а коэффициент чувствительности поверх-
поверхностного натяжения к температуре
da
— = 0,22 мН/(м-К)
аТ
Энергия активации самодиффузии палладия в температурном интер-
интервале 1323—1773 К £ = 266,3 кДж/моль при предэкспоненциальном мно-
множителе £>о = О,2О5- Ю-4 м'/с.
Энергия дефектов упаковки 90 мДж/м2. Поверхностная энергия для
грани A00) v = 1685 мДж/м2, для грани A11) v=1075 мДж/м2.
Оптические. Спектральный коэффициент излучения палладия при
температуре плавления и длине волны Х = 0,55 мкм 8^ j =0,33. Отра-
Отражательная способность (коэффициент отражения nD) в зависимости от
длины волны К:
X, мкм 1,0 2,0 4,0 7,0 10,0 12,0
nD, % .... о 72 81 88 94 97 97
Механические свойства
Отожженный палладий имеет временное сопротивление разрыву о3=
= 180—190 МПа, предел текучести 0о,2 = 49—52 МПа, относительное
удлинение 6=24—40 %■ сужение площади поперечного сечения i|>=80 %,
твердость по Внккерсу //V=490 МПа, твердость по Бринеллю НВ =
= 300—400 МПа. Модуль нормальной упругости палладия £=113ГПа,
коэффициент Пуассона v=0,393, модуль сдвига G при различных тем-
температурах:
t, °С —195 20 200 400 600 800 1000 1200
G, ГПа . . . . . . 52,9 49,0 48,7 46,9 42,6 37,0 27,9 20,8
Сжимаемость % палладия в зависимости от температуры:
(, °С 20 30 75
х, Ю-11 Па-1 0,37—0,57 0,305 0,309
606
Кратковременная и длительная прочность при ЮО-ч нагружении в за-
зависимости от температуры:
t, °C 20 300 500 700 900 1100 1350
ав, МПа 176,5 161,8 64,2 34,3 25,3 17,7 8,9
0ДЛ, МПа 166,7 122,6 23,5 17,6 8,3 2,8 1,2
Характеристики ползучести палладия: ffeu/iooo =1.08 МПа;
°1/24 = 4,5 МПа. Удельная прочность палладия при 1000°С 3,9 м.
Химические свойства
Палладий — наиболее активный металл среди элеменюв платиновой
группы. В соединениях проявляет степень окисления +2. Его окисли-
телыю-восстановительпый потенциал в кислотных средах равен 0,64—
0,83 В. Нормальный электродный потенциал реакции Pd—2e=p±Pd2+ фо =
= +0,987 В, электрохимический эквивалент палладия Pd2+ составляет
0,553 мг/Кл.
Палладий растворим в царской водке и в азотной кислоте. Образу-
Образует галогениды PdCl2-2H2O, PdBr2, Pdl2, а также сульфат PdSO4'2H2O,
нитрат Pd(NO3b и т. д. Характерно образование комплексных соеди-
соединений, например, [Pd(NH3JCU tPd(NH3LCl2], [Pd(NH3h(NO2J] и др.
Палладий интенсивно поглощает водород (при 20 °С до 800 объ-
объемов), с чем связана его высокая каталитическая активность. Принято
считать, что палладий образует с водородом две нестехиометрические
фазы: a(PdH0,o3) и |3(PdH0,59), которые иногда называют a-Pd и |3-Pd.
У насыщенного водородом палладия снижаются плотность, электро-
электропроводность, временное сопротивление разрыву и относительное удли-
удлинение. С повышением температуры растворимость водорода быстро
снижается, а скорость его диффузии возрастает.
При нагревании палладия на воздухе образуется оксид PdO, дис-
диссоциирующий при 870 °С. Предполагают наличие второго оксида, име-
имеющего формулу PdO2. Растворимость кислорода в палладии при 1200 °С
более 0,05 % (по массе).
Вплоть до 1400 °С палладий не растворяет азот; однако после пред-
предварительной дегазации в глубоком вакууме 1 объем палладия может
поглотить до 230 объемов азота.
Максимальная растворимость углерода в палладии 0,4 % (по мас-
массе) при 1400 °С, минимальная 0,05% при 800 °С. Данных о существо-
существовании карбидов палладия не имеется. В микроструктуре литого пал-
палладия, расплавленного в тигле из спектрально чистого графита, присут-
присутствуют выделения графита сферической формы. Твердость палладия с
увеличением содержания углерода возрастает; при этом пластичность
остается на достаточно высоком уровне.
В жидком состоянии палладий взаимодействует практически со все-
всеми металлами; в твердом состоянии полная взаимная растворимоаь
наблюдается в сплавах с золотом и родием. Для ряда металлов, в пер-
первую очередь тугоплавких, характерна значительная растворимость в
твердом палладии, достигающая в отдельных случаях 30—40 % (объ-
емн.). Активно взаимодействует палладий с РЗМ, растворяя большин-
большинство из них в количестве 10—15 % (объемн.). Магний также хорошо
растворим в палладии [предельная растворимость 20 % (по массе)],
причем сплавы с 8 °/о Mg обладают рядом ценных свойств и отлича-
отличаются хорошей технологичностью. Перспективной является система пал-
палладия с кремнием, в которой при 20 % легирующего получен аморфный
507
сплав с прочностью порядка 1300 МПа. С целью повышения прочност-
прочностных свойств перспективно легирование палладия 20 % (по массе) W,
12 % Re небольшими количествами Os и т. д. Двухкомпоиентиые диаг-
диаграммы состояния палладия исключительно сложны, для них характер-
характерно образование значительного количества химических соединений, упо-
упорядоченных фаз. Большое количество фаз Лавеса со структурой типа
MgCu2 обнаружено в сплавах палладия со стронцием, кальцием и ба-
барием. Соединения Курнакова типа NbPd3 с тетрагональной искаженной
решеткой и соединения Nb3Pd2 типа 0-фазы найдены в системы с нио-
ниобием. В сплавах с молибденом и вольфрамом выявлено наличие обла-
областей упорядочения в твердом растворе (так называемое «К-состояние»).
В системах с РМЗ найден ряд соединений стехиометрического состава
RPd3, RPd2. R2Pds, RPd, R3Rd2 н R5Pd2.
Технологические свойства
Палладий поставляют в виде порошка, слигков, прутков, жести, фоль-
фольги и проволоки. Для приготовления сплавов палладия в основном ис-
используют индукционные или друговые вакуумные печи, а термическую
обработку проводят в вакууме или в среде аргона или гелия. Изделия
из ггалладия чаще всего изготовляют штамповкой или холодной про-
прокаткой. Первоначальную обработку порошковых заготовок с целью их
компактирования производят осторожной ковкой при 1000—1100°С.
Слитки палладия куют при той же температуре. Аффинированная губ-
губка палладия хорошо прессуется без связующих материалов и после вы-
выдержки под давлением 40—60 МПа приобретает металлический блеск.
Для дополнительной очистки прессованных заготовок последние необ-
необходимо спекать в вакууме порядка 1,3-10—2 Па при температуре 1000—
1200 °С. Слитки аффинированного палладия подвергают высокотемпера-
высокотемпературной ковке и последующей холодной обработке. Температура перс-
хода палладия из пластичного состояния в хрупкое лежит ниже
—196 °С, поэтому он хорошо деформируется вхолодную, однако при
этом сильно упрочняется. Например, холодный наклеп 90 % приводит
к росту временного сопротивления разрыву от 200 до 400 МПа, тогда
как относительное удлинение резко снижается после первых 10 % де-
деформации и составляет лишь 10—12 %. Для снижения наклепа целе-
целесообразно применение промежуточных отжигов, которые кратковремен-
кратковременно проводятся при 800—1000°С. Отжиг лучше всего проводить в ат-
атмосфере гелия или аргона. Отжиг без инертной среды проводить нельзя,
т. к. кислород воздуха, взаимодействуя с адсорбированным водородом,
приводит к образованию раковин. Максимум пластичности палладия
соответствует температуре 500 °С, однако, если металл долго выдержи-
выдерживать при этой температуре, его пластичность снижается из-за взаимо-
взаимодействия с кислородом воздуха. Температура рекристаллизации пал-
палладия зависит от чистоты, степени и скорости предварительной дефор-
деформации, метода исследования и составляет 300—450 °С. При назначении
режимов обработки следует учесть, чго при температурах 25 и 250°С
палладий склонен к деформационному старению.
Области применения
Палладий в виде черни применяется как катализатор во многих хи-
химических производствах, в частности, при получении мономеров сии-
508
тетического каучука, полупродуктов для синтетических волокон, мою-
моющих средств и др. Чистый палладий применяют в производстве элек-
электрических контактов, в качестве фильтров для получения сверхчистого
водорода, для нанесения защитных и декоративных покрытий (палла-
дировапие). Из палладия изготовляют ювелирные изделия, а также
корпуса и некоторые детали часов. Все более широкое распространение
палладий находит в качестве заменителя платины. На его основе создан
ряд промышленных сплавов с исключительно ценными свойствами. Так,
сплавы палладия с рутением являются лучшими мембранными катали-
катализаторами, сплавы с другими платиновыми металлами, а также с золотом
и никелем используют как катализаторы при производстве аммиака
для изготовления жаропрочных твердых припоев, трубок стеклопла-
стеклоплавильных сосудов, фильер. Сплавы с серебром используют в качестве
диафрагм для очистки водорода.
8.7. ОСМИИ [1—36, 198, 284, 304, 306]
Общие сведения и методы получения
Осмий (Os) — металл синевато-серого цвета, относится к группе пла-
платиновых металлов. Открыт англичанином С. Теннантом в 1804 г. Четы-
рехокись осмия (OsO-i) обладает резким запахом, благодаря которому
осмий и был обнаружен.
Содержание осмия в земной коре примерно 5■ 10—в% (по массе).
Обычно осмий входит в состав осмистого иридия, который встречается
самостоятельно, а также в состав самородной платины. Осмий получа-
получают попутно с извлечением других платиновых металлов. Платиновые
концентраты обрабатывают царской водкой, осадок смешивают с каль-
кальцинированной содой, бурой, свинцовым глетом, древесным углем и пла-
плавят. Благородные металлы собираются в свинцовом сплаве, который
подвергают купелированию. Затем сплав обрабатывают азотной кисло-
кислотой, осадок сплавляют с бисульфатом натрия, охлаждают, обрабаты-
обрабатывают водой и фипьтруют, а оставшийся осадок сплавляют с гидро-
гидроокисью калия и нитратом калия или перекисью натрия. Охлажденный
сплав вновь обрабатывают водой, через полученный раствор пропуска-
пропускают хлор, затем раствор нагревают, летучие RuO4 и OsO4 улавливают
в приемниках с соляной кислотой и подвергают кипячению. При этом
Os04 вновь отгоняется, поглощается спиртовым раствором гидроокиси
натрия и после нагрева полученного раствора с хлоридом аммония ос-
осмий осаждается в виде [OsO2(NH3LlCl2. При прокаливании этого комп-
комплекса в атмосфере водорода получают металлический осмий. Химиче-
Химический состав, % (по массе) аффинированного порошка осмия определяет
ГОСТ 12339—79:
Марка
Ос А— 1
Ос А—2
Os не
99,
99,
менее
95
90
Примеси, ие более
сумма платино-
платиновых
0,02
0,05
Fe
0,01
0,03
всего
0,05
0,10
509
Физические свойства
Атомные характеристики. Атомный номер 76, атомная масса 190,2 а. е. м.,
атомный объем 8,49-10~° м3/моль, атомный радиус 0,136 нм, ионный
радиус Os4+ 0,065 нм. Конфигурация внешних электронных оболочек
5d66s2. Потенциалы ионизации / (эВ): 8,7; 17; 25; электроотрицатель-
иость 1,52. Имеет г. п. у. решетку с периодами а=0,275 и с = 0,432 нм.
Энергия кристаллической решетки £реш = 730 мкДж/кмоль. Известно
7 устойчивых изотопов осмия с массовыми числами 184 (распространен-
(распространенность в природе 0,018%), 186 A,59 %), 187 A,64%), 188 A3,3%),
189 A6,1 %), 190 B6,4%), 191 D1,0%). Также известны радиоактив-
радиоактивные изотопы осмия с массовыми числами от 183 до 194 и периодами
полураспада от 12 ч до 700 сут. Эффективное поперечное сечение за-
захвата тепловых нейтронов составляет A5,3±0,7) • 10~28 м2; среднее се-
сечение рассеяния, полученное экспериментально для максвелловского
спектра нейтронов, равно A1,1±1) ■ 10~28 м2. Работа выхода электрона
Ф = 4,7 эВ, сродство к электрону 1,4 эВ.
Плотность. Плотность твердого осмия при температуре 293 К р=
= 22,5 Мг/м3; расчетная плотность жидкого осмия при температуре
3000 К р = 20,1 Мг/м3.
Электрические и магнитные. Удельная электрическая проводимость а
осмия и его удельное электрическое сопротивление р в зависимости от
температуры:
Т, К ...... 273 298 373
0, МСм/м .... 11,42 10,36 8,05
р, мкОм-м. . . . 0,0812 0,0966 0,1243
Температурный коэффициент электросопротивления для температур-
температурного интервала 273—373 К а=4,20-10~3 К~'. Коэффициент вторичной
электронной эмиссии атах=1,7 при ускоряющем напряжении первичных
электронов 0,75 кэВ. Температура перехода в сверхпроводящее состоя-
состояние при напряженности магнитного поля //=0,817 А/м Гс = 0,71 К. Маг-
Магнитная восприимчивость при 298 К х=0,052-10-9.
Тепловые и термодинамические. Температура плавления осмия £Пл=
=3047 °С, температура кипения £Кип = 5000°С, характеристическая тем-
температура 6о = 500К, удельная теплота плавления Д//пл= 140,9 кДж/кг,
удельная теплота сублимации при 298 К ДЯсувл=4128,6 кДж/кг, а
удельная теплота испарения при температуре не более 1827 "С Д#исд=
= 4121,9 кДж/кг. Удельная теплоемкость cv осмия в зависимости от
температуры:
Г, К 273 400 600 1000 1500
ср, Дж/(кг-К) 129 133 137 144 154
Удельная электронная теплоемкость сэ" =[2,35 мДж/(моль-К!)]7'.
Теплопроводность осмия X в интервале 300—500 К примерно постоянна
и равна 86 Вт/(м-К). Температурный коэффициент линейного расшире-
расширения а:
Г, К 273 323 283—363
а-10», К-1 6,1 6,79 6,95—17,0
Удельная электронная теплоемкость осмия с™ =B,35 мДж/(мольХ
ХК2I7\ Молярная энтропия s" 32,7 Дж/(моль-К). Взаимосвязь между
510
давлением насыщенного пара р осмия и температурой, при которой
оно устанавливается:
7\ К Р, 133,3 Па Т, К Р, 133,3 Па Т, К Р, 133,3 Па
1085
1895
1996
2108
2234
10-ю
Ю-»
Ю-8
Ю-?
10-е
2375
2535
2719
2932
3193
10-5
10-*
Ю-3
Ю-2
10-1
3512
3900
4381
4880
1
10
102
760
Поверхностное натяжение жидкого осмия вблизи температуры плав-
плавления 0=2500—2600 мН/м, коэффициент чувствительности поверхност-
поверхностного натяжения к температуре -—- = — 0,33 мН/(м-К).
Скорость сублимации осмия при давлении насыщенного пара в зави-
зависимости от температуры:
Г, К 2375 2535 2719 2932
Скорость сублимации, 10~6 кг/(м2-с) 1,7 16 150 1500
Механические свойства
Осмий обладает значительной твердостью и хрупкостью, так что может
быть легко превращен в порошок. Твердость по Моосу 7, по Бринеллю
3500—39000 МПа, модуль нормальной упругости £ = 555—570 ГПа,
модуль сдвига 0 = 215,7 ГПа, сжимаемость 0,28-10-" Па-1.
Химические свойства
Окислительно-восстановительный потенциал осмия в кислых средах ра-
равен 0,85—1,0 В. В соединениях проявляет степень окисления +2, +3,
+4, +6, +8, причем наиболее часто +4 и +6.
Компактный осмий не растворяется в кислотах и царской водке;
однако, порошок осмия при нагревании в царской водке растворяется
легко.
Система осмий — водород изучена слабо. Считается, что компактный
осмий сорбирует мало водорода, осмиевая чернь несколько больше, од-
однако с повышением температуры сорбция уменьшается, причем особен-
особенно резко при 673—723 К, когда чернь переходит в губку. Сорбция водо- '
рода осмиевой чернью в зависимости от давления р:
р, Па 0,0075 0,09 0,208 0,332 0,433 1,487 6,132
Сорбция, Ю-6 м3/Ю0 г 69,5 579,9 717 778 908 1038 134
Гидриды осмия не обнаружены.
Установлено существование трех кислородных соединений осмия:
OsO2,. OsO2-H2O и OsO4. Есть сведения, что при высоких температурах
помимо OsO4 существует оксид OsO3. Оксид (IV) OsO2 является про-
промежуточным продуктом окисления. Гидроксид (IV) образуется при вос-
восстановлении кислых и щелочных растворов оксида (VIII) OsO4. По-
Последний образуется при действии окислителей на мелкораздробленный
осмий или раствор его соединений, а также может присутствовать в
виде пленки на поверхности компактного осмия, который постепенно
окисляется на воздухе. Оксид (VIII) OsO4 растворяется в воде, его
пары ядовиты.
511
Осмий единственный из Платиновых металлов образует нитрид с
предполагаемой формулой Os2N (кубическая решетка с периодом
0,356 нм).
Диаграмма состояния осмий — углерод не построена. Однако, име-
имеются сведения, что максимальная растворимость углерода в осмии при
температуре кипения составляет 4 % (по массе). Относительно воз-
возможности существования карбидов осмия единого мнения не сущест-
существует.
Осмий взаимодействует со фтором только при нагревании. При этом
образуется смесь фторидов OsF4, OsF6 и OsF8. Хлор реагирует с осми-
осмием с образованием различных хлоридов. Мелкодисперсный осмий заго-
загорается в парах серы с образованием OsS2. При нагревании в токе хлора
смеси порошка осмия со щелочными хлоридами образуются хлороосмиа-
ты состава Me2[OsCl6l. Осмнаты Me2[0s04] образуются при действии
спирта на щелочной раствор оксида (VIII) осмия. При действии хло-
хлористого аммония на раствор осмиата калия образуется осмиатетраам-
минхлорид [OsO2(NH3L]Cl2, иначе называемый солью Ферми, прокали-
прокаливанием и последующим восстановлением которой может быть получен
металлический осмий. Растворение OsO4 в концентрированном аммиач-
аммиачном растворе КОН приводит к образованию осмиамата калия KlOsOaN],
выделяющегося в виде желтого кристаллического порошка. Чувстви-
Чувствительной реакцией на осмий является красное окрашивание, возникающее
при нагревании солянокислого раствора осмиата OsO4 с тиомочевиной,
в результате чего образуется комплексное соединение [Os(NH2CsNH2)eX
ХС!3-Н2О.
Металлические системы, одним из компонентов которых является ос-
мнй, изучены сравнительно мало. Среди платиновых металлов осмий
образует наиболее простые диаграммы состояния с наименьшим чис-
числом химических соединений. Непрерывные ряды твердых растворов
осмий дает с рутением, технецием и рением. В жидком состоянии осмий
сплавляется почти со всеми металлами за исключением золота и серебра.
В твердом состоянии в осмии наиболее активно [до 50 % (ат.)] раство-
растворяются переходные металлы. Иттрий с осмием не образует твердых
растворов, а диаграммы состояния с другими РЗМ не построены, ст-фа-
за образуется в системах осмия с ниобием, танталом, молибденом и
вольфрамом; Лавес-фаза — с иттрием, скандием, гафнием; х-фаза — с
ниобием; соединения типа OsR2 с решеткой пирита — с серой; селеном и
теллуром; соединения с решеткой CsCl — с гафнием и т. д. С оловом н
цинком осмий соединений не дает. Влияние легирующих элементов на
физико-механичёские свойства осмия практически не изучено.
Технологические свойства
Из-за крайне низкой технологичности осмий практически не подверга-
подвергают обработке давлением. Как правило его используют либо в виде аф-
аффинированного порошка, либо в литом состоянии. Порошок осмия мо-
может быть спрессован в прутки. Выплавляют осмий в высокочастотных
или в дуговых печах в вакууме.
При работе с осмием необходимо иметь в виду, что его летучая
окись токсична. Поэтому все работы с осмием при повышенных темпе-
температурах необходимо проводить в инертном среде.
Области применения
Осмии применяется при каталитическом синтезе аммиака, при гидри-
гидрировании органических соединений; оксид (VIII) осмия используют для
окраски микроскопических препаратов, хлороосмиаты — для замены со-
512
лей золота в фотографин. Из сплавов осмия большое значение имеют
сплавы с иридием, применяемые для компасных игл (осей), трущихся
частей точных инструментов, а также в качестве наконечников перьев.
8.8. ИРИДИЙ [1—35, 198, 284, 304, 306]
Общие сведения и методы получения
Иридий (Ir) — металл серебристо-белого цвета, твердый и хрупкий,
принадлежит к платиновым металлам. Открыт англичанином С. Теннан-
том в 1804 г. и получил название вследствие разнообразия окраски его
солей («иридий» в переводе с греческого «радуга»).
В земной коре содержится примерно Ы0~7% (по массе). Встреча-
Встречается, главным образом, в виде осмислого иридия, который является са-
самостоятельным минералом, а также входит в состав самородной пла-
платины. Крайне редко встречается в самородном состоянии. Получают
иридий по очень сложной технологии, первый этап которой заключается
в обработке платиновых коицентратов царской водкой Полученный при
этом осадок смешивают с кальцинированной содой, бурой, свинцовым
глетом, древесным углем и плавят. Затем свинцовый сплав, в котором
собираются благородные металлы, подвергают купелированию и после-
последующей обработке азотной кислотой. Осадок сплавляют с бисульфндом
натрия, растворяют в воде и фильтруют. Оставшийся осадок сплавляют
с гидроокисью калия и нитраюм калия или перекисью натрия. При этом
иридий окисляется до нерастворимого оксида (IV) 1гО2. Охлажденный
сплав обрабатывают водой н осадок иридия растворяют в царской вод-
водке. При прибавлении к полученному таким образом раствору хлорида
аммония выпадает осадок гексахлороиридата аммония (NHUJIrCl6. Эту
неочищенную соль несколько раз перекристаллизовывают или же рас-
растворяют в разбавленном растворе сульфата аммония, который осажда-
осаждает примеси в виде сульфидов. При применении второго способа полу-
полученный paciBOp обрабатывают азотной кислотой и хлоридом аммония,
вновь осаждая гексахлоропридат более чистый от примесей. При про-
прокаливании последнего при 1000 °С в водороде получают чистый порошок
иридия, химический состав, %, которого по ГОСТ 12338—81 приводится
ниже:
Марка
ИА—1
ИА—2
Ir, не ме-
менее
99,95
99,90
Примеси не более
Сумма
плати-
платиновых
0,020
0,045
РЬ
0,005
0,010
Fe
0,01
0,02
Si
0,002
0,005
Al
0,005
0,005
Ва
0,001
0,005
Кислород
и летучие
0,01
0,01
Всего
0,05
0,10
Химический состав, %, иридия, применяющегося в полуфабрикатах
и изделиях приборостроения, аппаратостроения и в других областях
промышленности (ГОСТ 13099—67):
Марка
И99.9
И99.8
Иридий,
не менее
99,90
99,80
Примеси, не более
Pt+Pd+
-fRh
0,05
0,09
Аи
0,01
0,03
Fe
0,02
0,03
Pb
0,01
0,02
Si
0,01
0,02
Ва
0,005
0,010
Всего
о,ю
0,20
513
Физические свойства
Атомные характеристики. Атомный номер 77, атомная масса 192,22 а. е. м.,
атомный объем 8,62-10~6 м3/моль, атомный радиус 0,136 нм, ионный
радиус 1г4+ 0,068 нм, конфигурация внешних электронных оболочек
5d1Qs2. Потенциалы ионизации иридия / (эВ): 9,2; 17,0; 27. Иридии
имеет г. д. к. решетку с периодом 0,38312 нм. Энергия кристаллической
решетки £"реш=641,5 мкДж/кмоль. Состоит из двух устойчивых изотопов
с массовыми числами 191 (распространенность в природе 38,5%) и 193
F1,5 %)• Эффективное поперечное сечение захвата тепловых нейтронов
D40±20)-10~28 м2, работа выхода электрона ф = 4,7 эВ, электроотрица-
электроотрицательность 1,55, сродство к электрону 2,0 эВ.
Плотность. Плотность иридия при 290 К р=22,42 Мг/м3; расчетное
значение плотности жидкого иридия при температуре 2716 К р=
= 20,0 Мг/м3.
Электрические и магнитные. Удельная электрическая проводимость
а иридия:
Т, К 273 298 373
а, МСм/м 20,33 18,52 14,59
Удельное электрическое сопротивление р в зависимости от темпера-
температуры:
Т. К Р, мкОм-м Т, К Р, мкОм-м Т, К р, мкОи и
273 0,0462 873 0,1610 1473 0,3000
373 0,0646 973 0,1822 1573 0,3253
473 0,0830 1073 0,2038 1673 0,3757
573 0,1015 1173 0,2260 1773 0,3757
673 0,1201 1273 0,2503 1873 0,4009
773 0,1402 1373 0,2749 1973 0,1260
Температурный коэффициент электросопротивления иридия в интер-
интервале 273—373 К а=4,30-10-3 К~'. Коэффициент чувствительности элек-
1 dp
тросопротивления ~ к давлению гидростатического сжатия р при
296 К:
р, ГПа 0,0001 1,0 3,0
— — • Ю-11 Па-1 ... 1,39 1,37 1,33
Р dp
При температуре ниже 0,14 К иридий переходит в сверхпроводящее
состояние. Абсолютный коэффициент т. э. Д. с. иридия et по отношению
к платине:
Г, К 273 373 473 573 673
еи мкВ/К .... +0,8 +0,2 —0,1 —0,6 —0,9
Т К 873 1073 1273 1473 1773
elt мкВ/К ..-. —1,7 —2,4 —3,2 —4,7 —9,0
Коэффициент вторичной электронной эмиссии 0mn=l,8 при ускоря-
ускоряющем напряжении первичных электронов 0,8 кэВ.
Постоянная Холла при 293 К и магнитной индукции 6=0,5—1,1 Тл
ft = -f 0,402- Ю-10 м3/Кл. Термомагнитные коэффициенты иридия при
514
323 К: В = 0,5—1,1 Тл: коэффициент Риги—Ледюка S=0,55-103 м2/(В-с);
коэффициент Эттингсгаузена — Нернста Q——0,5-109 м2/(К-с).
Магнитная восприимчивость % иридия для ряда температур:
Т, К 293 473 1123 1423
Х-10» 0,14 0,17 0,26 0,31
Тепловые и термодинамические. Температура плавления иридия
<пл = 2447°С, температура кипения ?Кип=4577°С, характеристическая
температура по разным данным 8d=420—425 К, удельная теплота плав-
плавления ДЯПл=137,13 кДж/кг, удельная теплота сублимации при 298 К
Д#сувл = 3485,1 кДж/кг, удельная теплота испарения при температуре
кипения Д#исп = 3186,4 кДж/кг. Удельная теплоемкость ср иридия в за-
зависимости от температуры:
Т, К 20 40 80 150 250
ср, Дж/(кг-К) 2 22,5 111 127,8 128
Т, К 400 600 1000 1500
ср, Дж/(кг-К). .... 133 139 152 167
Удельная электронная теплоемкость СрЛ =[3,27 мДж/(моль-К2)]-7\
Теплопроводность X в зависимости от температуры:
Г, К 100 200 300 400 500
I, Вт/(м-к) 175 151 148 143 139
Температурный коэффициент линейного расширения а иридия:
Г, К 50 100 200 273 473
а-10<\ К 2,0 4,1 6,1 6,5 6,8
Т, К 673 873 1073 1273 1773
а-10°, К-1 7,11 7,42 7,72 9,02 10,18
Молярная энтропия s°=35,6 Дж/(моль-К). Поверхностное натяже-
иие жидкого иридия вблизи температуры плавления ст=2250—
■—2400 мН/м, коэффициент чувствительности поверхностного натяже-
da
ння к температуре—- =—0,31 мН/(м-К). Взаимосвязь между давле-
давлением насыщенного пара р иридия и температурой, при которой оно
устанавливается:
Г, К 1568 1648 1737
р, 133,3 Па ... Ю-10 10-9 10-»
Скорость сублимации иридия в зависимости от температуры при
давлении насыщенного пара.
Г, К 2071 2214 2379 2570
Скорость сублимации,
10-" кг/(м2-с) .... 1,7 16 160 1500
Энергия дефектов упаковки 190 мДж/м2.
Оптические. Спектральный коэффициент излучения иридия при дли-
длине волны Х=65 мкм при температуре плавления твердого иридия е^ =
515
= 0,30. Отражательная способность (коэффициент отражения Пи) в за-
зависимости от длины волны V
X, мкм 1,0 2,0 4,0 7,0 10,0 12,0
nD, % 78 87 94 95 96 96
Механические свойства
Механические свойства иридия определить достаточно сложно из-за
его хрупкости, поэтому литературные данные по свойствам противоре-
противоречивы. Так, приводятся сведения, что температура перехода из пластич-
пластичного состояния в хрупкое составляет для иридия 400 °С при испытаниях
на изгиб и 600 °С при испытаниях на растяжение. Временное сопротив-
сопротивление разрыву при комнатной температуре 0В = 49О МПа, предел теку-
текучести сто,2 = 88,2 МПа, относительное удлинение 6=6 % и сужение пло-
площади поперечного сечения i|>=10 %• Твердость иридия по шкале Мооса
колеблется в ичтервале 6,0—6,5, твердость по Бринеллю ЯВ=1600—
—2120 МПа, по Виккерсу HV= 1960—2350 МПа, модуль нормальной
упругости £=509,9—519,7 ГПа, модуль сдвига О = 210 ГПа, сжимае-
сжимаемость х=0,28-10~" Па~'. Пластичность монокристаллического иридия
значительно превосходит пластичность поликрнсталлического и достига-
достигает при комнатной температуре 6 = 70 %. Упругие константы иридия об-
обнаруживают заметную анизотропию, причем численные значения этих
констант значительно выше обычно встречающихся в г. ц. к.-кристаллах:
Ориентировка .
Е, ГПа ...
О, ГПа . , .
Модуль нормальной упругости иридия монотонно снижается с темпера-
температурой, не обнаруживая аномалий. Временное сопротивление разрыву
при 1000 "С о"в= 117,7 МПа, а относительное сужение (монокристалла)
iJ)~90%. Ползучесть иридия при сжатии характеризуется следующими
параметрами: oj"^ = 90,2 МПа; удельная прочность 420 м.
<юо>
464,8
266,7
<111>
649,2
199,6
Поликристалл
519,7
209,8
Химические свойства
Нормальный электродный потенциал реакции Ir—3e=s±Ir3+ фо= 1,0 В.
Окислительно-восстановительный потенциал иридия в кислотных средах
0,957—0,973 В. В соединениях имеет степень окисления +3, +4, реже
+ 1, +2, +6.
Иридий отличается большой стойкостью против действия химиче-
химических реагентов. Обычные кислоты на него не действуют. В компакт-
компактном состоянии он устойчив в царской водке и лишь в состоянии тон-
тончайшей дисперсности медленно в ней растворяется.
Сведений о взаимодействии иридия с водородом крайне мало. Диаг-
Диаграмма состояния иридий — водород не изучена, гидриды иридия не
обнаружены. Растворимость водорода в иридии при высоких темпера-
температурах:
tt °C 1393 1432 1521 1530 1581
Растворимость, 10~5 %
(ат.) 1,30 1,46 1,63 1,79 2,23
Имеются данные, что лист иридиевой жести, подвергнутый катодной
бомбардировке, поглощает 800-кратный объем водорода при комнат-
516
ной температуре. Иридиевая чернь поглощает 36 см3 водорода иа 1 см3
иридия. Растворение водорода в иридии сопровождается охрупчивани-
ем последнего.
При нагревании измельченного иридия в кислороде или на воздухе
при 1070 °С образуется оксид (IV) 1гО2. Известен также оксид (III)
1г2Оз, коюрый прн нагревании до 400 °С превращается в 1гСЬ или 1г.
Иридиевая чернь по составу представляет собой смесь порошков ме-
металлического иридия и его оксидов. Она как и платиновая чернь об-
обладает большой способностью к каталитическим реакциям, например,
превращает кислород в озон.
С азотом иридий ие взаимодействует и не растворяет его.
В системе иридий—углерод при температуре 2295°С образуется
эвтектика. Растворимость углерода при эвтектической температуре при-
примерно 0,2 % (по массе); при 1256 °С в иридии растворяется 0,0025 % С,
а при 800 °С — только 0,000328 %• При охлаждении растворимость уг-
углерода уменьшается, он выделяется в виде графита. Б целом диаграм-
диаграмма состояния иридий — углерод экспериментально не исследована.
Фтор, хлор и сера реагируют с иридием при температуре красного
каления. С фтором иридий образует IrF5 и IrF6. При действии хлора
в зависимости от температуры и образуются IrCl, IrCb и 1гС13. С серой
иридий дает сульфиды IrS, Ir2S3, IrS2 и Ir3Se, а также многочисленные
сульфаты (квасцы), имеющие формулу MIr(SO4J- I2H2O (Af = NH4, Na,
К, Pb, Cs). Изпестны также многочисленные комплексные соединения
иридия, например, аммиакаты различных составов с общей формулой
[1г(К'Н3)б]Хз и моноамины, отвечающие формуле М2[1г(РчЧ1з)СЫ.
Со всеми металлами за исключением систем с Y~Fe> Р-Со и Ni, ири-
иридий практически не образует непрерывных твердых растворов во всем
интервале температур и концентраций, а в системах с золотом и сереб-
серебром наблюдается широкая область несмешиваемости даже в жидком
состоянии. Область твердых растворов иридия с металлами невелика,
однако возрастает по мере увеличения номера группы Периодическоп
системы. Так, иридий растворяют 12 % (ат.) Ti, 18 % V, 16 % Nb и Та,
28 % Сг, 22 % Мо и W, 48 % Мл, 35 % Re и т. д. Характерной особен-
особенностью двойных систем иридия является наличие многочисленных про-
промежуточных соединений при ограниченной растворимости основных
компонентов. Такой тип диаграмм состояния характерен для иридия с
церием, бором, алюминием, галлием, кремнием, фосфором, серой, ак-
актиноидами, ураном и пр. Типичными промежуточными соединениями яв-
являются фазы Лавеса (системы с кальцием, цирконием, стронцием), <т-
и е-фазы (системы с переходными тугоплавкими металлами) и проме-
промежуточные соединения с кубической структурой Cu3Au (системы с вана-
ванадием, ниобием, танталом и хромом). Влияние легирующих элементов
иа свойства иридия изучено недостаточно.
Технологические свойства
Иридий поставляется в виде порошка, фольги, прутков и проволоки.
Для изготовления иридиевых сплавов применяют дуговую, электронно-
электроннолучевую или индукционную плавку в среде аргона, гелия или в вакууме.
В качестве исходного материала для плавки используют прессованный
и спеченный аффинированный порошок или губку. Прессование порошка
обычно ведут при давлении 390—600 МПа, последующее вакуумное
спекание — при 1600—2100 °С. 'Иридий — весьма хрупкий нетехнологич-
нетехнологичный металл, поэтому его обработку давлением следует проводить при
достаточно высоких температурах. Как правило, температура горячей
деформации иридия составляет 1000—1500 °С и лишь в отдельных слу-
517
чаях допускается ее снижение до 800 СС. Для повышения технологич-
технологичности иридия и снижения температуры подогрева применяют оболочку
из никеля. Показана также возможность вакуумной прокатки иридия
прн давлении 1,3—13,3 Па при температуре 1200 °С с обжатиями 30—
40 % за проход. Отмечается, что повышение глубины вакуума или по-
повышение температуры нагрева под прокатку в этом случае нежела-
нежелательны, ибо при этом происходит налипание металла на валки и ухуд-
ухудшение качества поверхности прокатанных листов. Небольшие добавки
циркония или окиси тория улучшают деформируемость иридия. Темпе-
Температура рекристаллизации холоднодеформированного иридия составляет
1200—1300 °С, поэтму при горячей деформации со степенью обжатия
более 10 % иридий разупрочняется вследствие рскристал.иич.ини.
Области применения
В чистом виде иридий применяют весьма ограниченно: в виде фольги
для неамальгамирующихся катодов, для изготовления тиглей, иридиро-
вания поверхности изделий, и т. д. Основное применение иридий нашел
в виде компонента сплава Pt—10 % 1г, из которого сделаны междуна-
международные эталоны метра и килограмма и который применяется для изгр-
товления специальных тиглей, контактов особо ответственных узлов в
технике слабых токов и т. д.
Металлический порошок иридия обладает каталитическими свойст-
свойствами; оксид (IV) иридия применяют для окраски фарфора в черный
цвет. Иридий применяют в сплавах с осмием для изготовления опор
стрелок компасов и других приборов, с родием и рутением — для под-
подготовления термопар.
Для изготовления некоторых видов термопар, например, иридий —
вольфрамовых или иридий — родий-иридиевых, применяют проволоку из
чистого иридия.
8.9. ПЛАТИНА
[I— 35, 198, 284, 304, 306, 309, 311]
Общие сведения и методы получения
Платина (Pt)—тяжелый тугоплавкий металл серебрисго-белого цвета
со слабым серым отливом.
Самородная платина в древности была известна в Египте, Эфиопии,
Греции и Южной Америке. В XVI в. в Южной Америке вместе с са-
самородным золотом обнаружили очень тяжелый белый тусклый металл,
который назвали платиной (от испанского plata — серебро). Перьо-
начально платину считали белым золотом, и самостоятельным металлом
она была признана лишь в середине XVIII в. Первое научное исследо-
исследование платины провел в 1748 г. У. Броунгрнг. Известны сообщения о
работах М дсль-Иля, который в 1773 г. получил ковкую платину. Па-
Патент на получение ковкой платины взят в 1773 г. Пьером-Франсуа Ша-
Оанэ. Однако, при тщательном изучении литературных данных установ-
установлено, что чистую платину впервые получил в 1803 г. Волластои.
Платина принадлежит к редким элементам: ее содержание в земной
коре составляет 5• 10~7 % (по массе). Основными источниками получе-
иня платины служат платиновые и сульфидные медно-никелевые руды.
Платиновые металлы встречаются совместно с такими сульфидными
минералами как пирротин, петлантид и пирит. Встречается в виде
вкраплений в минералах: поликсене B,5—11,9 % Fe, <8,8 % 1г, <6,8 %
518
Rh, <6,0 % Pd, <3,3 % Cu, <2,3 % Ru), ферроплатнне A2,0—28,1 %
Fe, <14,3%Ni, <14,0%Cu, <12,9 % Pd, «7,5 % Ir, <5,8 % Rh,
«3,0 %Bi), нриднстой платине «11,0% Os, <4,0 % Pd, <2,5 % Ru)
и т. д. Встречается платина и в самородном виде, тогда она имеет вид
зерен неправильной формы, редких мелких кристаллов или их сростков.
Технология получения платины включает обогащение руд, последую-
последующее их растворение и раздельное выделение из раствора различными
реагентами (аффинаж). Технологическая цепочка получения платины
из обогащенных исходных материалов включает следующие операции.
1. Растворение исходных материалов (шлихи, то есть платиновые кон-
концентраты с 70—90 % минералов платиновых металлов, платина само-
самородная, негодные для употребления изделия из платины н т. п.) в цар-
царской водке. Платина, растворяясь, переходит в комплексное соединение
ЩРЮб]. 2. Восстановление 1г4+ до 1г3+ посредством добавления к
раствору сахара (способ И. И. Черняева). 3. Осаждение платины из
раствора в виде хлорплатината аммония (NH4J[PtClel для чего к
раствору добавляют хлористый аммоний. 4. Фильтрование и промывка
хлорплатината аммония, с последующей сушкой и прокалкой в резуль-
результате чего образуется губчатая платина. 5. Прессование и сплавление
губчатой платины.
Платину выпускают в виде порошка, слитков, листов, фольги, про-
проволоки и различных изделий, например, тиглей, чашек для выпаривания
и пр. Плавят платину и ее сплавы, в основном, в высокочастотных
индукционных печах с тиглями из диоксида циркония, оксида магния,
алюминия. Плавку чаще всего ведут в вакууме или инертной атмос-
атмосфере.
Химический состав, %, платины аффинированной в слитках по ГОСТ
12341—81:
ХИМИЧЕСКИЙ СОСТАВ ПЛАТИНЫ АФФИНИРОВАННОЙ В СЛИТКАХ
Марка
ПлА-1
ПяА-2
UJ
Я
£
Я
а
99,95
99,90
0,
о,
6
Ч А
025
050
0
0
Аи
,005
,005
0
0
РЬ
,005
,005
Примеси, не
Fe
0,01
0,01
0
0
Si
005
005
более
0
0
Sn
,001
,005
0
0
Al
,005
,005
0
0
Sb
,001
,005
0
0
я
,05
,10
Этот ГОСТ распространяется на платину, применяемую для изготов-
изготовления сплавов, полуфабрикатов, химикалий и других целей.
Платина в полуфабрикатах и изделиях, применяемых в приборо-
приборостроении, аппаратостроении и других отраслях промышленности, постав-
поставляется по ГОСТ 13498—79:
Ш99,
Пл99,
Пл99,
91
9
8
Pt.
не менее
99,93
99,90
99,80
Ir+Pd+Rh
0,04
0,07
0,13
0,
0,
0,
Примеси, не
Аи
008
01
01
0
0
0
РЬ
,006
,ооз
,006
более
1
0
0
0
Si
,005
,006
,006
0
0
0
Fe
,01
,01
,03
всего
0
0
0
,07
,10
,20
519
Содержание газовых примесей в платине, выплавленной в электрон-
электронно-лучевых печах практически составляет 0,0023 % О2 и 0,00002 % Н2.
Физические свойства
Атомные характеристики. Атомный номер 78, атомная масса
195,09 а. е. м., атомный объем 9,09 -10—в м3/моль, атомный радиус
0,139 нм, ионный радиус Pt4+ 0,065 нм. Конфигурация внешних элек-
электронных оболочек M96s'. Значения потенциалов ионизации / (эВ): 8,96;
18,54; 28,5; электроотрицательность 1,44. Платина имеет г. ц. к. решет-
решетку с параметром а=0,320 нм. Энергия кристаллической решетки £реш =
= 510 мкДж/кмоль. Известен ряд природных изотопов платины с мас-
массовыми числами 190, 192, 194 (распространенность в природе 32,9 %)
196 B5,5%) и 198 G,19%). Изотопы с массовыми числами 190 и 192
слабо радиоактивны. Искусственно получены радиоактивные изотопы
платины с массовыми числами от 188 до 199 и периодом полураспада
от 31 мин до 10,5 сут. Эффективное поперечное сечение захвата тепло-
тепловых нейтронов для наиболее широко распространенных изотопов пла-
платины-
Массовое число 194 195 196 198
Сечение захвата, Ю-28 м2 . , 1,2 dt 0,9 27 ± 2 0,7 ± 0,7 4±0,5
Среднее сечеиие захвата, полученное для максвелловского спектра
нейтронов составляет (8—10)-10~28 м2. Работа выхода электрона ф =
= 5,32 эВ.
Плотность. Плотность платины р при 293 К 21,37 Мг/м3. В жидком
состоянии при 2042 К плотность 19,0 Мг/м3, а температурный коэффи-
коэффициент изменения плотности составляет —2,9 кг/(м3-К).
Электрические и магнитные. Удельная электрическая проводимость 0
платины в зависимости от температуры:
Т, К • • ■ . • 273 298 373
а, МСм/м . . 10,19 9,71 7,63
Удельное электрическое сопротивление р платины в зависимости от
температуры:
Г, К 73 173 273 373 473 573
р, мкОМ'М 0,0174 0,0587 0,0981 0,1365 0,1738 0,210
Г, К 673 773 873 973 1073 1173
р, мкОм-м 0,245 0,2788 0,8115 0,3430 0,3734 0,4027
Г, К 1273 1473 1573 1673 1773
р, мкОм.м 0,4307 0,4834 0,5080 0,5315 0,5538
Температурный коэффициент электрического сопротивления а в ин-
интервале 273—373 К равен 3,923-Ю-3 К. Коэффициент чувствительно-
чувствительности электрического сопротивления к давлению гидростатического жа-
1 do
тия — ■—L- при 296 К:
Р dp
р, ГПа 0,0001 1,0 3,0
1 dp
■ Ю-11, Па-i .... 1,92 1,88 1,78
Р dp
520
Сверхпроводимость платины при температурах до 0,1 К не обнару-
обнаружена. Абсолютный коэффициент т. э. д. с. платины е при различных тем-
температурах, вычисленный с помощью коэффициентов Томсона:
Т, К • ■ . . • 73 153 193 233 273 373
е, мкВ/К ■ • • +5,88 +1.18 —0,92 —2,78 —4,42 —7,3
Г, К 473 573 ' 673 773 873 973
е, мкВ/К • • • —9,2 —10,9 —12,5 —14,0 —15,6 —17,1
Т, К . ... 1073 1173 1273 1473 1673 1873
е, мкВ/К • • - —18,6 —20,1 —21,6 —24,6 —27,1 —30,6
Коэффициент Томсона S для платины имеет следующие значения:
Т, К- ...... 203 273 393
S, мкВ/К —9,6 —9,1 —9,2
Коэффициент вторичной электронной эмиссии атах составляет 1,8 и
соответствует ускоряющему напряжению первичных электронов 0,8—
1,0 кэВ. Постоянная "Холла R платины чистотой 99,9 % при магнитной
индукции В=0,54 Тл в зависимости от температуры:
Г, К 83 273 573 873
Я-10+10, м3/Кл. . . —0,203 —0,214 —0,253 —0,278
Термомагнитные коэффициенты платины при температуре 323 К:
5 = 0,5—1,1 Тл; коэффициент Риги—Ледюка 5 = —0,21 • 103 м2/(В-с). По-
Поперечный четный гальваномагнитный эффект dR/R поликристаллической
платины в зависимости от температуры и напряженности магнитного
поля Н:
Г, К. .... 20,4 40,4 20,4 20,4 78 78 78
Я, МА/м. . . 0,181 0,357 0,699 0,971 7,958 15,915 23,87
dR/R 120 360 990 1570 80 370 1020
Продольный четный гальваномагнитный эффект dR/R в поликристал-
поликристаллической платине при 20,4 К и напряженности магнитного поля Я=
= 2,66 МА/м равен 0,146. Удельная магнитная восприимчивость платины
% в зависимости от температуры:
Г, К 20 100 200 298 623 973 1493
Х-10° 1,094 1,065 1,028 0,982 0,795 0,45 0,30
Тепловые и термодинамические. Температура плавления платины
/пл=1772°С, температура кипения примерно ^Кип = 3827°С, характеристи-
характеристическая температура 0д = 235 К, удельная теплота плавления ДЯПЛ =
= 100,97 кДж/кг, удельная теплота сублимации ДЯсубл при 298 К
2854,07 кДж/кг, а удельная теплота испарения ДЯИСП при температуре
кипения 2577,3 кДж/кг. Удельная теплоемкость платины ср в зависимо-
зависимости от температуры при нормальном давлении:
Г, К 10 20 40 80 150
ср, Дж/(кг-К) 1,26 7,74 38,19 87,91 118,41
Г, К 250 400 600 1000 1500
ср, Дж/(кг-К) 132,04 134,71 140,24 161,83 166,23
521
Зависимость теплопроводности платины X от температуры:
Т, К 100 200 300 400 500
X, Вт/(м-К) ...... 85 79 74 73 73
Температурный коэффициент линейного расширения платины а при
температурах ниже 10 К определяется выражением: а= [19Г+0.0487] X
ХЮ~10, а при более высоких температурах имеет следующие значения:
т, к
3
5
10
20
а-10», к
0,007
0,0155
0,071
0,51
т, к
30
65
85
283
а-10
1
5
6
8
, к-1
,43
,01
,09
,92
т, к
473
573
673
773
а-Ш», К
9,09
9,30
9,42
9,53
2804
3130
3539
3980
1
10
№
760
Удельная электронная теплоемкость платины сэ" —16,43 мДж/
/(моль-К2)]-Т. Молярная энтропия s° 41,9 Дж/(моль-К). Взаимосвязь
между давлением насыщенного пара платины р н температурой, при
которой это давление устанавливается:
Г, К Р, 133,3 Па Г, К р, 133,3 Па Г, К Р, 133,3 Па
1403 10-i0 1858 Ю-5
1475 10-» 1988 10-»
1555 Ю-8 2140 10-3
1644 10-' 2322 10—3
1744 10-° 2540 10-1
Скорость сублимации платины при давлении насыщенного пара зави-
зависит от температуры:
Т, К 1858 1988 2140
Скорость сублимации, Мг/(м2-с) . . 1,9 18,0 170,0
Энергия дефектов упаковки 120 мДж/м2. Поверхностная энергия для
грани A00) v = 2480 мДж/м2, для грани A11) v=1580 мДж/м2. Пара-
Параметры самодиффузии и взаимной диффузии в платине:
„ , , , Прсдэкспонен- ~
Диффундирующий Интервал циальный множн- Энергия активации
элемент температур, К теЛЬ д мг;с В, кДж/моль
Pt 1523—1998 0,22-10-* 278,4
Ni 1316—1674 7,8-Ю-8 180,4
Си 2314—1734 4,8-10-е 233,2
Н 553—913 6,03-Ю-7 24,7
Оптические. Оптические свойства платины характеризуются ее коэф-
коэффициентом излучения 8 ц в зависимости от длины волны-X:
<К, мкм . . . . 0,20 0,30 0,40 0,50 0,60 0,70 1,0 2,0 4,0
ехг .... 0,63 0,58 0,48 0,41 0,36 0,31 0,27 0,18 0,1
При температуре плавления и длине волны 0,65 мкм твердая плати-
платина имеет еА г=0,33, а жидкая 0,38. Если Х=0,66 мкм, то при 1000 К
ЕК,Т =0>29, а при 2000 К 0,31, Полная излучательная способность пла-
платины (интегральный коэффициент излучения ет) в зависимости от тем-
температуры:
Г, К ... 300 375 500 775 900 1300 1800
ег . . . . 0,037 0,047 0,054 0,096 0,098 0,138 0,176
522
Отражательная способность (коэффициент отражения я») полиро-
полированной поверхности платины в зависимости от длины волны К:
\, мкм «о, % %, мкм nD, % %. мкм nD, %
0,251
0,288
0,305
0,326
0,357
0,385
33,8
38,8
398
41,4
43,4
45,4
0,420
0,450
0,500
0,550
0,650
0,700
51,8
54,7
58,4
61,1
66,5
69,0
0,800
1,00
2,00
3,00
4,00
9,00
70,3
72,1
80,6
88,8
91,5
95,1
Механические свойства
Механические свойства платины технической чистоты в различных сос-
состояниях:
ов, МПа oQ 2, МПа опц, МПа 6, % ф, %
Литая 170—270 30—70 — — 2,3—3,5
Холоднодеформи-
рованная .... 370 185 180 2
Отожженная . , 180 38—140 40 42 90
Твердость отожженной платины по Виккерсу HV=460 МПа, твер-
твердость по Брииеллю НВ=300 МПа. Модуль нормальной упругости пла-
платины £=147 ГПа, коэффициент Пуассона v=0,387. Модуль сдвига G
при различных температурах:
/, °С —195 0 200 400 600 800
G, ГПа 62,2 72,4 72,4 72,0 69,4 57,4
Продолжение
t, °C 1000 1200 1400 1600 1700
G, ГПа 47,1 41,3 36,6 33,0 28,6
Коэффициент сжимаемости х платины в зависимости от температуры:
t, X —189 0 133 164
х.Ю11Па-1 . . . 0,274 0,392 0,401 0,404
Механические свойства платины различной чистоты в зависимости от
температуры:
о«с ов, МПа о0B, МПа 6> % £ ов. МПа с^, МПа 6i %
20 136—168 75—105 40—43 600 84—109 51—66 30—33
200 90—157 62—103 35—40 700 77—93 40—54 30-38
400 94—142 54—92 34—40 800 73—91 39—47 28—35
500 98—136 50—87 32—35 900 60—78 30—46 28—33
Длительная прочность платины при 100-ч нагружеиии а\00 и коэффи-
коэффициент ее разупрочнения, равный отношению пределов прочности прн
кратковременном и длительном иагружении ct'qq /о"„:
' сс о'юоо °1оо/ав '• °с "looo °10о/ов
300 79,43 0,80 900 11,42 0,34
500 46,09 0,67 1100 5,00 0,28
700 22,66 0,36 1300 3,82 0,28
523
о,
57,
23,
46,
3
6
0
0
0,56
36
23,0
43,0
0,62
36
30,0
—
Предел ползучести ajj^o =1,37 МПа. Удельная прочность платины
прн этой температуре равна 7,0 м.
Характеристики жаропрочности коррозионной стойкости платины
при 1673 К в различных средах:
Исследуемый параметр Воздух Стекло Аргон
Скорость установившейся ползу-
ползучести е-103, с^1
Время до разрушения т-10~3, с .
Относительное удлинение б, %
Потеря массы Д/я, мкг/(м2-с) . .
Атмосферная коррозия платины больше силикатной. Сопротивление
ползучести и время до разрушения плачины в стекле тем меньше, чем
больше примесей содержится в керамической смеси. По сравнению с
испьпаниями на возд\хе при испытаниях в аргоне скорость ползучести
увеличивается, а время до разрушения уменьшается.
Химические свойства
Нормальный электродный потенциал реакции Pt—2e*±Pt2+ фо=
+ 1,188 В; окислительно-восстановительный потенциал платины в кис-
кислотных средах колеблется в пределах 0,39—0,792 В. Электрохимический
эквивалент платины Pt2+ равен 1,010 мг/Кл. В соединениях проявляет
степень окисления +2, +4 и значительно реже +1, +3.
Платина чрезвычайно устойчива к химическим воздействиям: не
окисляется при нагревании на воздухе, не подвергается действию кис-
кислот, за исключением царской водки, при взаимодействии с которой об-
образует платнпохлористоводородную кислоту.
Платиновая чернь, получаемая восстановлением растворов платино-
платиновых солей, адсорбирует большое количество водорода, не образуя оп-
определенных соединений. Растворимость водорода в платине при разных
температурах:
t, °с . . . .
Растворимость, %
(по массе) . . .
Растворимость, %
(объемн.) ....
0
0
309
,006
,014
0
0
727
,С09
,022
933
0,021
0,050
1036
0,036
0,086
]
0
0
139
,055
,131
0
0
1242
,084
,201
При нагревании в атмосфере кислорода образуются непрочные окси-
оксиды платины, состав которых для температуры 1200 JC зависит от дав-
давления р:
р, МПа .... 36 ' 36,6—113,3 113,3
Состав оксида . PtO2 PtO3 PtO4
Все оксиды платины термически неустойчивы; наиболее высокая тем-
температура термической диссоциации соответствует составу РЮг.
Растворимость углерода в платине в твердом состоянии нечезающе
мала. Форма выделяющегося графита зависит от условий кристаллиза-
кристаллизации и тигля, в котором проводится плавка. Прн использовании графи-
графитового тигля и плавке в высокочастотной электрической печи графит
выделяется в виде игл, а при дуговой плавке он принимает шаровидную
форму. Максимальная растворимость углерода в платине при 1700 °С
0,02 % (по массе),
524
Азот в платине практически нерастворим.
Фтор образует с платиной фториды PtF2 и PtF4, действием хлора на
губчатую платину при 513—523 К можно получить хлорид PtC^, кото-
который, диссоциируя при 853 К, дает хлорид PtCl. При 623 К хлор с пла-
платиной дает хлорную платину PtCl4. Известными солями платины явля-
являются хлороплатиниты, отвечающие комплексной кислоте НгР1СЦ и хло-
роплатипаты — соли платинохлористоводородной кислоты НгРЮв-НгО,
Получены также простые и комплексные бромиды и иодиды пла-
платины.
Платина достаточно активно взаимодействует с металлами. Системы
с расслоением Е жидком состоянии для платины неизвестны. Тугоплав-
Тугоплавкие металлы активно растворяются в платине. Легкие металлы (магний,
цинк, кадмЯЙ, алюминий, индий и др.) растворяются в количестве до
10—15 % (ат.). Слабо растворимы в платине бериллий, барий, эрбий, не-
неодим и другие. Образование твердых растворов в системах с платиной
сопровождается образованием большого количества химических соеди-
соединений. В таблице приводятся характеристики некоторых, наиболее бога-
богатых платиной соединений, встречающихся в двойных системах.
Систематические исследования влияния легирующих элементов на
свойства платины показывают, что ее наиболее эффективными упрочни-
телями являются никель, осмий, серебро, рутений, а удельное электро-
электросопротивление в максимальной степени повышается при легировании
медью, серебром и рутением.
ХАРАКТЕРИСТИКИ СОЕДИНЕНИИ ПЛАТИНЫ В ДВУХКОМПОНЕНТНЫХ
СИСТЕМАХ
Легирующий
элемент
Mg
La, Се, Pr
Sm, P3M
Y, Pr, Nd
Sc, Lu
Al
Ga
Tl
Ti
Si
Ge
Sn
V
Соединение
MgPt,
LaP6
EuPt5
YPt
ScPt3
Pt13Al3
(Pt4Al)
Pt4Ga
Pt3Tl
TiPts
Pt3Si
Pt2Ge
Pt3Sn
VPt2
Тип структуры
Кубическая сверхструк-
сверхструктура
CaCii5
SmPts
FeB
Cu3Pt
Тетрагональная сверх-
сверхструктура
Моноклинная искажен-
искаженная тетрагональная
Р13Т1
TiPt8
U3Si
Fe2P
Cu3Au
MoPt2
Период решетки, им
а
0,7824
0,5386
0,5305
0,701
0,3954
0,7732
0,7688
0,7174
0,5645
0,831
0,546
0,668
0,401
0,2724
ь
—
0,9100
0,4471
—
—
0,7742
—
—
—
—
0,8302
с
—
0,4376
0,2636
0,5552
—
0,7792
0,8844
0,785
1,3851
0,389
0,786
0,353
—
0,3786
В настоящее время успешно проводятся опыты по получению фоль-
фольги и микронной проволоки из сплавов платины с магнием, цирконием,
алюминием и некоторыми другими легирующими.
Как уже указывалось, платина обладает чрезвычайной устойчивостью
против действия самых различных агрессивных сред. Не наблюдается
ее заметной коррозии при температурах до 100°С в концентрированной
серной, 70 % и 95 %-ной азотной, фосфорной и селеновой кислотах; при
525
температуре 20 °С она устойчива в 40 %-ной плавиковой, 36 %-ной соля-
соляной, ледяной, уксусной и других кислотах, а также в царской водке, су-
сухом и влажном хлоре, фторе, сухом и жидком броме и иоде, влажном
сероводороде и др. Однако платина подвержена значительному корро-
коррозионному воздействию со стороны некоторых элементов, которые нося г
название «платиновые яды». Сюда относят мышьяк, бор, фосфор, крем-
кремний, олово, цинк, сурьма и т. д. Также интенсивно корродирует платина
в царской водке при кипении, а также бромистоводородной и йодисто-
водородной кислотах при 100 °С. Во всех этих случаях необходимо при-
применять специальные меры защиты.
Технологические свойства
Платина — мягкий технологичный металл; по способности к механичес-
механической обработке она превосходит другие металлы платиновой группы.
Большинство полуфабрикатов н изделий из платины и ее сплавов полу-
получают, применяя холодную обработку давлением с промежуточными от-
отжигами. Порошковые заготовки из платины компактируют осторожной
ковкой при 1000 °С; слиткн также обычно подвергают горячей ковке.
Проволоку получают протягиванием через волоки из карбида вольф-
вольфрама или алмазные. Протяжке подвергают заготовку, полученную
предварительной прокаткой или ковкой в обжимках. Платину можно
вытянуть в проволоку диаметром 1,3 мкм, используя серебряное по-
покрытие, которое затем удаляют азотной кислотой. Температура перехо-
перехода платины из пластичного состояния в хрупкое по данным испытания
на изгиб составляет —196°С. При холодной обработке платина может
сильно упрочниться за счет наклепа. При этом твердость может возра-
возрасти от 392 до 1103 МПа. Именно поэтому после определенной степени
холодной деформации следует проводить отжнг платины. Установлено,
что наивысшая пластичность платины достигается после кратковремен-
кратковременного отжига в инертной атмосфере при 800—1000 °С. Отжиг следует
проводить в защитной атмосфере или вакууме, т. к. в противном случае
окисная пленка, образовавшаяся на поверхности полуфабрикатов, может
привести к возникновению дефектов. Температура рекристаллизации
платины существенно зависит от ее чистоты; платина технической чис-
чистоты после 95 %-ной деформации рекристаллизуется при 800 °С; хими-
химической и физической чистоты — при 400 и 350 °С, соответственно.
Области применения
Около 90 % платины потребляется для научных и промышленных це-
целей; 10 % ■—для приготовления ювелирных изделий. Из платины делают
лабораторные приборы, применяемые в аналитических и физико-хнмичес-
кнх исследованиях. Платина служит материалом для фильтров, фильер,
термопар для измерения высоких температур, термометров сопротивле-
сопротивления, используется в качестве проволоки для обмотки печей электросо-
электросопротивления и т. д. Уникальная каталитическая активность, достаточная
пластичность и жаропрочность сделали платину наилучшим катализато-
катализатором для процесса окисления аммиака до азотной кислоты и в процессах
производства серной кислоты контактным способом, в реакциях гидро-
гидрогенизации, восстановления, производства витаминов и др. Платина с
небольшими добавками иридия является основным конструкционным
материалом для емкостей оптического стекловарения. На основе пла-
платины разработан ряд сплавов с уникальными свойствами; для растяжек
особо точных приборов, для изготовления магнитов сложной формы, для
626
различных узлов стеклоплавильных сосудов. Широко применяются так-
также сплавы на основе платины в медицине для изготовления шприцев и
зубных коронок. В последнее время установлено, что некоторые соеди-
соединения платины оказывают сильное противоопухолевое действие.
В целом из всей платины, используемой для технических целей, 50 %
применяется в качестве катализатора, около 25 °/о — в электротехнике,
радиотехнике, автоматике, телемеханике и медицине, остальные 25 % —
в различных отраслях промышленности.
9. ИНЕРТНЫЕ ГАЗЫ
9.1. ГЕЛИЙ [1—35, 312]
Общие сведения и методы получения
Гелий (Не) — при нормальных условиях одноатомный газ без цвета,
запаха и вкуса. Открыт в 1868 г. французским астрономом Жансеном
и, независимо от него, английским астрофизиком Локьером в атмосфере
солнца. Полученные ими спектроскопические снимки содержали яркую
желтую линию, которую нельзя было приписать ни одному из извест-
известных в то время элементов. В 1871 г. Локьер объяснил происхождение
этой линии наличием нового элемента, который назвали гелием от гре-
греческого слова helios — «солнце». На земле гелий впервые был выделен
в 1895 г. англичанином Рамзаем из радиоактивного минерала клевеита.
Содержание гелия в атмосфере земли 5,24-10~24% (объемн.). По
распространенности же во Вселенной гелий занимает второе место после
водорода, и на его долю приходится 23 % космической массы.
Основные источники промышленной добычи гелия — свободные и
растворенные в нефти гелионосные природные газы. От других газов
гелий отделяют глубоким охлаждением, т. к. он сжижается труднее
остальных газов. Все действующие установки получения гелия основаны
на одном принципе. Природный газ, предварительно очищенный от прн-
месей СО2> H2S и паров воды, в несколько этапов охлаждается до темпе-
температуры порядка —190 °С, при которой все его компоненты, исключая
гелий, конденсируются в жидкость. Газообразный гелий выводится через
верхнюю часть разделительного аппарата. На достигнутом технико-эко-
технико-экономическом уровне считается возможным осуществлять переработку
природного газа, содержащего 0,05—0,2 % гелия.
По действующим стандартам промышленный гелий выпускается двух
сортов: технический продукт, содержащий не менее 99,80 % Не, и про-
продукт высокой чистоты с содержанием гелия не менее 99,985 %. Гелий
хранят и перевозят в стальных баллонах емкостью 40 л под давлением
15 МПа. Баллоны окрашивают в коричневый цвет, надпись белая. На
заводах имеются надземные хранилища гелия в виде толстостенных
стальных труб диаметром 250—270 мм и длиной 24,5 н 80 м, располо-
расположенных на бетонных опорах. Здесь гелий хранят под давлением 12—
14 МПа.
Физические свойства
А томные характеристики. Атомный номер 2, атомная масса 4,003 а. е. м,,
атомный объем 19,43• 10~6 м3/моль, атомный радиус 0,122 им, потенциа-
потенциалы ионизации / (эВ): 24,580 и 54,403; электронная конфигурация Is2.
627
В газообразном состоянии представляет собой смесь изотопов sHe и
4Не, весьма близких по свойствам; однако, содержание 8Не составляет
всего 1,3-10~4 % в общем объеме Не. Жидкий гелий представляет собой
легкую прозрачную бесцветную жидкость. Гелий остается жидким под
давлением насыщенных паров вплоть до сколь угодно низкой темпера-
температуры. Для перевода в твердое состояние жидкость подвергают давле-
давлению. Твердый гелий — бесцветная прозрачная масса. Оба изотопа в
твердой фазе испытывают полиморфные превращения и могут иметь
о. ц. к., г. п. у. и г. ц. к.-решетки. Эффективное поперечное сечение захвата
тепловых нейтронов и среднее сечение рассеяния для максвелловского
спектра нейтронов:
Массовое число 3 4 Естествен-
Естественный Не
Эффективное поперечное сечение
захвата тепловых нейтронов,
Ю-28, м2 5400+200 0 —
Среднее сечение рассеяния, 10~28,
м2 1,0+0,7 — 0,8+0,2
Сродство атома гелия к электрону очень мало и составляет 0,08 эВ.
Сродство к протону 1,8 эВ. Энергия диссоциации молекулярного иона
Не^равна 2,24 эВ, подвижность иона Не^" в газовом разряде макси-
максимальна при 200 К и равна 0,0022 м2/(В-с); подвижность иона Не+ мо-
монотонно падает с температурой; максимальное значение порядка
0,0014 м2/(В-с) при 50 К. Коэффициент ион-электронной рекомбинации
в гелии при давлении 133,3 Па и температуре электронов 0,03 эВ равен
1,7-Ш-8.
Плотность, Плотность изотопа 4Не при 273 К и нормальном давлении
р = 0,17846 кг/м3; в жидком состоянии при 4,77 К плотность гелия
0.П39 Мг/м3.
Динамическая вязкость ц гелия при 298 К и различных давлениях р
р, МПа 0,098 6,76 13,4 20,1
Ч.мкПа-с .... 19,60 19,90 19,83 20,07
Продолжение
р, МПа 26,8 40,1 52,4 66,8
Т1, мкПа.с . . . . 20,15 20,42 21,03 21,54
Динамическая вязкость гелия ц при нормальном давлении и различ-
различных температурах:
Т, К . . . 53 73 173 273 373 473 573
г), мкПа-с . 6,40 7,90 14,00 18,60 22,81 26,72 30,55
П родолокение
Г, К ... 673 773 873 973 1073 1273
т], мкПа-с . 34,15 37,50 40,70 43,70 46,60 52,40
Поверхностное натяжение при 0 К для изотопов 3Не и 4Не ст=0,15
И 0,37 мН/м соответственно.
Растворимость гелия в воде и в сжиженных газах весьма мала. Так
при 293 К в 1 л воды растворяется около 8,8 мл гелия.
При комнатной температуре гелий отличается плохой адсорбцией.
Однако, в области температур жидкого гелия адсорбция резко возра-
возрастает, достигая сотен см3 на 1 г адсорбента.
528
Гелий отличается высокой проникающей способностью (различные
стекла н органические вещества).
Сжимаемость гелия, выраженная через значения произведений объ-
объема на давление, отнесенные к тем же величинам при нормальных ус-
условиях, приведена ниже:
т к
20,2
123,0
223,0
323,0
373,0
473,0
573,0
673,0
pV/P0V0 при давлении МПа
0
0,0745
0,4506
0,8165
1,1824
1,3654
1,7313
2,0972
2,46Л
0,1
0,0745
0,4512
0,8171
1,1829
1,3658
1,7317
2,0975
2,4633
1,0
0,0744
0,4558
0,8219
1,1876
1,3704
1,7361
2,1017
2,4674
5,0
0,0891
0,4768
0,8434
1,2086
1,3907
1,7559
2,1204
2,4855
10,0
0,1206
0,5042
0,8707
1,2348
1,4161
1,7805
2,1439
2,5081
Изотоп 4Не приобретает специфические свойства в результате пере-
перехода и сверхтекучее состояние. При давлении насыщенных паров этот,
так называемый Х-переход происходит при температуре 2,172 К. При
температуре Х-перехода происходит резкое изменение теплоемкости
и плотности. Нормальное состояние 4Но обозначается Не I, а сверх-
сверхтекучее Не II, которое являс1ся квантовой жидкостью, поскольку
дебройлевская длина волны атомов сравнима с их межатомным рас-
расстоянием. Изотоп 3Не при низких температурах также образует кван-
квантовую жидкость, однако свойства этих двух квантовых жидкостей раз-
различны, поскольку квантовая жидкость Не II состоит из бозе-, а кванто-
квантовая жидкость 3Не из ферми-частиц. Раствор этих изотопов обладает
свойствами обеих квантовых жидкостей. В жидкой фазе растворы рас-
расслаиваются, причем критическая точка расслоения соответствует 0,872 К
и концентрации 66,9 % 3Не. В растворах, содержащих менее 6,37 % 3Не,
расслоение не происходит. В эшх случаях можно достичь температур,
при которых примесные частицы испытывают сильное фермиевское вы-
вырождение и образуется своеобразный раствор ферми-жидкости в сверх-
сверхтекучей бозе-жидкости.
Тепловые и термодинамические. При давлении 10 МПа температура
плавления гелия /Пл=—269,7 °С. При нормальном давлении @,1 МПа)
температура испарения ^исп=—268,94 "С, температура перехода в сверх-
сверхпроводящее состояние 70 = 2,03 К. Удельные теплоты фазовых перехо-
переходов в указанных условиях: плавления ДЛПЛ = 5,22 кДж/кг, испарения
ДНисп=20,9 кДж/кг, теплота сверхпроводящего перехода равна нулю.
Изотоп 3Не испаряется при <исп=— 271,5 °С и 0,02 МПа. Удельная теп-
теплота испарения в этом случае АЯИсп=П,9 кДж/кг. Удельная теплоем-
теплоемкость гелня ср при низких температурах и нормальном давлении в за-
зависимости от температуры:
Г, К . 0,1
срDНе), Дж/(кг-К) • • -
срCНе), Дж/(кг-К) • • 530
0,5
3
1060
1,0
1104
1430
2,0
9802
2500
2,4
5002
3,4
9304
4,21
400
В интервале температур 273—1273 К и давлений ОД—20 МПа удель-
удельная теплоемкость гелия остается постоянной и равной 5190±420 Дж/
/(кг-К). Отношение ср/су= 1,67,
529
Теплопроводность гелия X при различных температурах:
Т, К 2,2 4,1 70 200
X, Вт/(м-К) • • • 0,018 0,027 0,058 0,115
Г, К 273 700 1500
к, Вт/(м-К) ■ • • 0,143 0,278 0,479
П родолжение
4273
0,941
Коэффициент объемного расширения |3 гелия в зависимости от тем-
температуры:
р, МПа
0,1
0,5
1,0
0,1
0,1
0,1
0,1
0,1
1,0
1,0
1,0
т, к
Жидкость
3,35
3,35
3,35
Газ
173
373
473
573
673
73
173
373
р-Ю3, к-1
96,14
53,10
38,66
3,658
3,658
3,658
3,658
3,658
0,3805
0,361
0,3704
р, МПа
1,0
1,0
1,0
10,0
10,0
10,0
10,0
10,0
10,0
100,0
100,0
г. к
Газ
473
573
673
73
173
373
473
573
673
373
473
р-103. К
0,3680
0,3672
0,3668
0,356
0,3116
0,4161
0,3902
0,3813
0,3770
0,8359
0,5944
Коэффициент Джоуля—Томсона \х для гелия при давлении 20 МПа:
т, к . .
И, К/МПа
83
-0,38
123
—0,52
173
-0,584
Т, К • ■ •
И, К/МПа .
373
-0,638
473
—0,641
273
—0,616
Продолжение
573
—0,597
14—
Коэффициент самодиффузии D гелия в интервале температур
296 К может быть подсчитан по уравнению £)= 1,62- (Т/273) '•71.
Коэффициент самодиффузии D при высоких температурах и нор-
нормальном давлении, полученный теоретически:
т, к ...
ZM04, м2/с
1000
13,3
2000
46,7
3000
98,6
4000
16,7
5000
167
6000
250
т, к . . •
ZM04, м2/с
7000
467
8000
595
10 000
898
12 000
1260
Продолжение
14 000 15 000
1670 1890
Взаимная диффузия в двухкомпонентной газовой смеси может быть
описана одним из двух уравнений:
530
D = Do G7273)" exp ( — SIT —
D = D0 G7273)" exp(—S/T),
где S и S' — эмпирические параметры, причем при 7">200 К в первом
уравнении и при 7">20 S — во втором; предэкспоненциальные множите-
множители Do можно принять за единицу. Данные по взаимной диффузии газо-
газовых смесей, содержащих гелий, приведены в таблице:
Система
3Не—4Не
Не—Ne
Не—Аг
Не—Кг
Не—Хе
Не—Н2
He-N2
Не—СО
Не—СН4
Не—О2
Не—воздух
Не—СО2
He-SFe
Do • Ю-4
м'/с
1,55
0,235
0,635
0,503
0,391
1,32
0,613
0,613
0,57
0,45
0,62
0, 2
0,35
а
1,501
1,509
1,552
1,609
1 ,644
1,510
1,524
1,524
1,750
1,710
1,729
1,720
1,627
S, К
—0,963
1,87
1,71
-32,65
—68,87
—
—
—
—
S'. К
1,894
2035
5416
—
—
—
—
т, к
1,74—1СС00
65—10000
77—10000
77—10000
169—10000
90—10000
77—10000
77—10000
298—10000
244—10000
244—10000
200—530
290—10000
Уравнение
Первое
»
»
»
»
»
»
»
Второе
»
»
»
Коэффициенты диффузии D метастабильиых атомов гелня в собст-
собственном газе в зависимости от степени метастабильности:
Т, К 20 40 77 150 300 500
£>-104, м2/с:
атомов Не B3S) ... 60 100 160 260 460 710
атомов Не B1 S) . . 45 75 120 210 370 570
Коэффициент диффузии D ионов Н j" в чужом газе при нормальных
условиях:
Основной газ Не Ne Ar Кг Хе
/МО4, м2/с 0,044 0,21 0,098 0,076 0,059
Продолжение
Основной газ Н2 N2 O2 СО СО?
ZM04, м2/с 0,28 0,098 0,103 0,094 0,07«
Коэффициент диффузии D ионов гелия Не+ в собственном газе при
плотности частиц газа 2,7-1025 м~3:
Г, К 77 195 300
ЛМО4, м2/с 0,086 0,194 0,26
Области применения
Гелий применяют для создания защитной инертной среды при плавке,
резке и сварке металлов, для хранения и транспортировки легко воспла-
воспламеняющихся веществ. С помощью гелня получают низкие D,2 К н ин-
531
же) температуры. Откачивание паров над жидкими изотопами 3Не и
4Не дает возможность получить температуры 0,2 и 0,7 К соответственно.
Растворением изотопа 3Не в изотопе 4Не, а также кристаллизацией изо-
изотопа 3Не получают еще более низкие температуры. Изотопы 3Не и 4Не
являются основными термометрическими веществами в газовых и кон-
конденсационных термометрах при температурах ниже 80 К. Широко при-
применяется гелий в воздухоплавлении; его подъемная сила составляет 0,92
подъемной силы водорода, им наполняют дирижабли, которые исполь-
используют в качестве воздушных радарных станций. Значительным остается
применение неуправляемых и привязных аэростатов, наполненных гели-
гелием, в метеорологической службе и для научно-исследовательских работ
в атмосфере; возросло применение наполненных гелием неуправляемых
воздушных шаров. Так в 1975 г. в США построен опытный летательный
аппарат — гибрид дирижабля и самолета — с полезной нагрузкой 182 т,
крейсерской скоростью 330 км/ч и дальностью полета до 16 тыс. км.
9.2, НЕОН П—35, 312]
Общие сведения и методы получения
Неон (Ne) — инертный газ без цвета и запаха, состоит из одноатомных
молекул. Открыт в 1898 г. англичанами Рамазаем и Траверсом при ис-
исследовании наиболее летучей фракции жидкого воздуха. Содержится
главным образом в атмосфере [ 1,8• 10~3 % (объемн.)]. В промышленно-
промышленности неон получают разделением воздуха при охлаждении. При этом ис-
используется летучесть неона, когда он вместе с гелием остается в газооб-
газообразном состоянии, в то время как остальные составляющие воздуха
«вымораживаются». В сыром неоне, помимо азота, содержится 40—60 %
неона и гелия в соотношении 3: 1; в нем может содержаться также
1—2 % водорода. Такой неон называют неоно-гелиевая смесь. В нашей
стране смесь транспортируют в баллонах емкостью 40 л под давлением
15 МПа. Баллоны окрашивают в светло-коричневый цвет, надпись белая.
Для получения чистого неона сырой газ вначале освобождают от азота
и водорода, причем азот вымораживают в ванне с жидким воздухом
под давлением 1—1,5 МПа, а водород удаляют с помощью окенда меди
при нагревании до 700 "С. Оставшуюся смесь неона и гелня разделяют
адсорбционным или конденсационным способами. В СССР выпускается
особо чистый неон с содержанием неона не менее 99,888% (объемн.).
Содержание примесей °/о (объемн.) не более. 0,1 Не; 0,001 О2; 0,01 Мг,
0,001 Н2 при содержании влаги не более 0,02-10^3 кг/м3. Неон особой
чистоты поставляют в стальных баллонах, окрашенных в черный цвет,
под давлением 15 МПа и с надписью белыми буквами «Неон особой
чистоты».
Физические свойства
Атомные характеристики. Атомный номер 10, атомная масса 20,179
а. е. м атомный объем 14,0-10~6 м3/моль, атомный радиус 0,162 нм, эле-
электронная конфигурация 2р6. Атмосферный неон состоит из смеси ста-
стабильных изотопов с массовыми числами 20 (распространенность в при-
природе 90,9 %), 21 @,3%) и 23 (8,8 %). Получено пять радиоактивных
изотопов — все короткоживущие: например, у изотопов 17Ne и 24Ne
периоды полураспада соответственно 0,1 с н 3,4 мин В твердом состо-
состоянии неон имеет г. ц. к.-решетку с периодом а=0,4462 нм (прн 10 К).
Потенциалы ионизации неона / (эВ)' 21,559; 41,07; 63,35.
632
Сродством к электрону не обладает. Сродство к протону 2,2 эВ. Под-
Подвижность иона Ne]*" в газовом разряде максимальна при 200 К и равна
7,5-10~4 м2/(В-с); подвижность ноиа Ne+ в этих же условиях снижает-
снижается с повышением температуры от значений порядка 5,7-Ю м2/(В-с)
при 50 К. Коэффициент ион-электронной рекомбинации в неоне при дав-
давлении 2—4 кПа и температуре электронов 0,03 эВ составляет 2-10~7.
Эффективное поперечное сечение захвата тепловых нейтронов для есте-
естественного неона равно C2±9) • 10~28 м2; экспериментально определен-
определенное сечение рассеяния для максвелловского спектра нейтронов равно
2,38-Ю-28 м2.
Плотность. В критической точке р = 0,484 мг/м3, в тройной точке р =
= 1,444 мг/м3. Газообразный неон при 273 К и 0,1 МПа имеет плотность
р = 0,89994 кг/м3; в жидком состоянии вблизи тройной точки р =
= 1,207 Мг/м3. В твердом состоянии в интервале 24—2 К плотность из-
изменяется от 1,4394 до 1,5073 Мг/м3.
Динамическая вязкость неона г\ при нормальном давлении в зависи-
зависимости от температуры:
Т, К 53 73 173 273 373 473 573
т), мкПа-с 8,38 11,49 21,82 29,75 35,46 42,48 47,85
Г, К . .
т), мкПас
673
53,00
773
57,96
873
62,55
973
66,89
Продолжение
1073 1273
71,00 78,55
Поверхностное натяжение жидкого неона при 25 К а=5,61 мН/м.
Сжимаемость неона, выраженная отношением произведения объема
на давление к тем же величинам при нормальных условиях, приведена
ниже.
г, к
65
123
173
223
273
323
373
473
573
673
0
0,2388
0,4506
0,6336
0,8166
0,9995
1,1825
1,3654
1,7313
2,0973
2,4632
P/V/PoV»
0,1
0,2380
0,4507
0,6340
0,8177
1,0000
1,1830
1,3659
1,7318
2,0977
2,4636
при дарлении,
1,0
0,2300
0,451
0,637
0,821
1,0044
1,1879
1,3710
1,7371
2,1033
2,4691
МПа
5,0
0,196
0,454
0,649
0,838
1,024
1,209
1,394
1,761
2,128
2,494
10,0
0,185
0,465
0,667
0,861
1,050
1,236
1,422
1,791
2,158
2,524
Магнитная восприимчивость неона в газообразном состоянии при
293 Кх=-0,33-10"9.
Тепловые и термодинамические. Критическая точка неона лежит при
температуре —228,6 °С и давлении 2,56 МПа, тройная точка — при
—248,34 °С и 31,86 МПа. Температура кипения /кяп=— 245,93 °С темпе-
температура плавления tali=—248,52 "С характеристическая температура нео-
неона GD = 74,6 К, удельная теплота плавления Д//пл=16,6 кДж/кг, удель-
удельная теплота испарения в точке кипения Д//Иеп = 85,9 кДж/кг, удельная
теплота сублимации при 0 К Д#Су0л = 92,9 кДж/кг,
533
Газообразный неон: теплопроводность при 273 К и 0,1 МПа К=
=0,0468 Вт/(м-К), удельная теплоемкость при 298 К и нормальном
давлении ср — 1030 Дж/(кг-К).
Жидкий неон: теплопроводность при нормальном давлении и темпе-
температуре 25,7 К Я,=0,1298 Вт/(м-К), удельная теплоемкость при тех же
условиях Ср = 1790 Дж/(кг-К).
Твердый неон: теплопроводность вблизи тройной точки \=
=0,3105 Вт/(м-К).
Температурный коэффициент объемного расширения |3 в интервале
температур 23—3 К снижается от 0,5154-10~6 до 0,18-Ю-6 К. Темпе-
Температурный коэффициент объемного расширения неона в зависимости от
давления и температуры приведен ниже:
р, МПа
0,098
0,098
0,098
0,098
0,098
0,098
0,98
0,98
т, к
173
373
473
573
673
773
73
173
Р-103, К
3,66
3,659
3,659
3,659
3,656
3,810
0,385
0,3635
р, МПа
0,98
0,98
0,98
0,98
9,8
9,8
9,8
9,8
Г, К
373
473
673
773
173
373
473
673
р.103, К
0,3708
0,3684
0,3672
0,407
0,334
0,420
0,3945
0,3805
Теплопроводность X газообразного неона при различных температу-
температурах и нормальном давлении:
Т К • •-... 25 30 90 273
Я.'Вт/(м-К) • • • 0,117 0,092 0,0205 . 0,0468
400
0,0598
650
0,0839
850
0,101
Продолжение
1300
0,133
т к
К, Вт/(м'к) '. '■ '.
Коэффициент самодиффузии иеона при нормальных условиях равен D=
=0,452-10—• м2/с Коэффициент самодиффузин D при высоких темпера-
температурах и нормальном давлении (получен теоретически):
Т, К 1000 2000 3000 4000 5000 6000
ZM04, м2/с . . . 3,93 12,7 25,2 41,1 60,7 83,8
Продолжение
Г, К 7000 8000 10 000 12 000 14 000 15 000
D-104, м2/с ... ПО 139 172 284 368 414
Коэффициент диффузии D метастабильных атомов неона CР2) в собст-
собственном газе при давлении 133,3 Па:
Т, К 20 40 77
£>-104, м2/с 19 33 56
зии ионов иеона Ne+ в собственном газе при плот-
Коэффициент диффузии к
иости частиц 2,7-1025 м~3:
Г, К 77 195
DW, м2/с 0,013 0,0303
300
0,041
534
Коэффициент диффузии D ионов иеона Ne+ и Ne^"B чужом газе при
нормальных условиях:
Основной газ
£М0\ м2/с, для иона:
Ne+
Основной газ
£>-104, м2/с, для иона:
Ne+
Net
Не
0,39
0,37
н2
0,27
0,26
Ne
0,14
N2
0,073
0,061
Ar
0,069
0,056
о2
0,074
0,062
Кг
0,052
0,040
Хе
0,039
0,030
Продолжение
СО СО2
0,070 0.054
0,058
0,044
Механические свойства
Максимальное значение временного сопротивления разрыву твердого
неона наблюдается при 10 К и составляет 0,01 МПа.
Химические свойства
В химическом отношении неон инертен; однако известны его соединения
с водой, например, Ne-6H2O. Растворимость неона в воде составляет
14,0-10~6 и 10,5- 10~в м3/л при температуре 273 н 293 К соответственно.
Области применения
Неон применяют, главным образом, для заполнения ламп накаливания,
газосветных и сигнальных ламп. Лампы, заполненные неоном, дают ха-
характерное красное свечение и используются в портах, на эродромах
и т. п. Перспективно применение неона в радиоэлектронике.
9.3. АРГОН [1—35, 312]
Общие сведения и методы получения
Аргон (Аг) при нормальных условиях одноатомный инертный газ без
запаха, цвета и вкуса. Впервые выделен в 1894 г. английскими учеными
Рэлеем и Рамзаем из атмосферного азота. В природе аргон встречается
только в свободном виде. Его концентрация в воздухе 0,93 % (объемн.).
В промышленности аргон получают в процессе разделения воздуха иа
азот и кислород при глубоком охлаждении. От примесей азота аргон
очищают дополнительной ректификацией, а от примесей кислорода —
химическими методами. Аргон может быть также получен как побочный
продукт из продувочных газов колонны синтеза аммиака. Химический
состав газообразного н жидкого аргона для использования в металлур-
металлургических процессах, а также правила его поставки, приемки, анализа и
хранения определяются ГОСТ 10157—79,
535
Химический состав аргоиа по ГОСТ 10157—79:
Содержание, % (объемн )
Аргон, не менее
Кислород, не более
Азот не более
Концентрация водяного пара при 293 К и
давлении 0,1 МПа, 103 кг/м3, не более
Сумма углеродсодержащих соединений в
Норма для сорта
высший
99,992
0,0007
0,006
0,007
0,0005
первый
99,987
0,002
0,01
0,01
0,001
Газообразным аргоном заполняют стальные баллоны или автореци-
пиенты под давлением 15 или 20 МПа при 293 К. Жидкий аргон зали-
заливают в транспортные цистерны или в специальные цистерны с порош-
порошковой, вакуумно-порошковой или вакуумно-многослойной изоляцией.
Газообразный и жидкий аргон транспортируют всеми видами транспор-
транспорта в соответствии с Правилами перевозок опасных грузов и Правилами
устройства и безопасной эксплуатации сосудов, работающих под давле-
давлением Гостехнадзора. Хранят баллоны с аргоном в специальных склад-
складских помещениях или на открытых площадках под навесом, защищаю-
защищающим от атмосферных осадков и от прямых солнечных лучей. Гарантийный
срок хранения газообразного аргона 12 мес со дня изготовления. По ис-
истечении гарантийного срока продукт перед использованием должен
быть проверен на соответствие ГОСТ 10157—79. При пайке, сварке,
резке и плавке особо ответственных изделий нли материалов, обладаю-
обладающих повышенной активностью, рекомендуется применять газообразный
аргон только высшего сорта
Физические свойства
Атомные (сарактеристики. Атомный номер 18, атомная масса 39,948
а. е. м, атомный объем 24,12-10~6 м3/моль, атомный радиус 0,192 нм,
потенциалы ионизации / (эВ); 15,755; 27,62. В твердом состоянии аргои
имеет г. ц. к. решетку с периодом а=0,5320 нм при 20 К. Электронное
строение изолированного атома Зр6. Известны стабильные изотопы арго-
аргона с массовыми числами 36, 38 и 40 (их содержание, соответственно,
0,337, 0,063 и 99,600 %), а также искусственные радиоактивные изотопы,
например, 35Аг, 37Аг и 39Аг с периодами полураспада 1,88 с, 34 дня и
265 лет соответственно. Преобладание тяжелого изотопа 40Аг связано с
его образованием при радиоактивном распаде одного из самых распро-
распространенных элементов — калия D0К). Эффективное поперечное сечение
захвата тепловых нейтронов для природного аргона составляет @,61±
±0,03)-Ю8 м2, среднее сечение рассеяния, экспериментально опреде-
определенное для максвелловского спектра нейтронов, равно A,5±0,5)Х
ХЮ~28 м2. Сродством к электрону не обладает. Сродство к протону
2,3 эВ. Энергия диссоциации молекулярного иона Ar J 1,1 эВ. Подвиж-
Подвижность иона Аг £ в газовом разряде максимальна при 150—200 К и рав-
равна 2,9-10—4 м2/(В-с); подвижность иона Аг+ в этих же условиях моно-
монотонно снижается с температурой от значения 2,2-10~4 см2/(В-с), кото-
которое она принимает при 50 К. Коэффициент ион-электронной рекомбина-
Б36
ции в аргоне при давлении 2—4 кПа и температуре электронов 0,03 эВ
равен 3-10-7.
Плотность. Критическая плотность аргона р=0,53б-10а кг/м3. Б га-
газообразном состоянии при температуре 273 К и давлении 0,1 МПа плот-
плотность р= 1,78403 кг/м3; в жидком состоянии при температуре 88 К
(вблизи тройной точки) р= 1,3998 Мг/м3. В твердом состоянии в интер-
интервале 15—48 К плотность изменяется от 1,77 до 1,717 Мг/м3.
Растворимость аргона в воде зависит от температуры и составляет
52,4- 10-в м3/л при 273 К и 18,1-Ю-6 м3/л при 353 К. Растворимость
снижается при добавлении в раствор электролитов.
Динамическая вязкость аргона ц при 298 К в зависимости от давле-
давления р:
р, МПа .
т), мкПа-с
0,098
22,50
14,7
29,35
2,45
23,20
19,6
32,25
4,90
24,25
29,4
38,30
9,80
26,80
Продолжение
39,2
45,10
р, МПа
т|, мкПа-с ....
Вязкость при нормальном давлении в зависимости от температуры:
Г, К 53 73 173 273 373 473 573
■П, мкПа-с . . . 4,70 6,30 14,05 20,85 26,95 32,23 36,80
Продолжение
Т, К 673 773 873 973 1073 1273
г\, мкПа-с . . . . 41,10 45,05 48,70 52,15 55,50 61,60
Поверхностное натяжение жидкого аргона при 85 К а= 13,2 мН/м.
Магнитные. Магнитная восприимчивость газообразного аргона при
90 К х=—0,49- Ю-9, а при 293 К —0,48-10"9.
Тепловые и термодинамические. Критическая точка аргона соответст-
соответствует температуре —122,15°С и давлению 4,7 МПа, тройная точка —тем-
—температуре —189,19°С и давлению 0,069 МПа, температура кипения
7кип = —185,707°С, температура плавления г„л=—189,3°С, характери-
характеристическая температура 6о=93,3 К. Удельная теплота плавления ДЯПЛ =
= 29,48 кДж/кг, удельная теплота испарения при температуре кипения
ДЯИСП= 163,5 кДж/кг.
Теплопроводность К аргона в газообразном состоянии в зависимости
от температуры:
280 400 1000 2000 3500 5000
1,67 2,22 4,36 6,67 10,2 13,1
Удельная теплоемкость при постоянном давлении ср = 520 Дж/(кг-К).
Значения температурного коэффициента объемного расширения C при-
приводятся ниже:
537
т. к
Я.-102,
Вт/(м-
> ■ ■
К) .
90
0,6
200
1,26
р. МПа
0,1
0,1
0,1
0,1
0,1
0,1
1,0
1,0
т. к
44—47
173
373
473
573
673
173
373
р-ю3. к
4,54
3,648
3,676
3,673
3,672
3,671
0,3952
0,3658
р МПа
1,0
1,0
1,0
10,0
10,0
10,0
10,0
100,0
т, к
473
573
673
373
473
573
673
373
р.Ю3, к
0,3680
0,3682
0,3683
0,3639
0,3822
0,3829
0,3832
1,1377
Коэффициенты Джоуля—Томсоиа ц для газообразного аргоиа при-
приведены ниже:
т, к
123
173
273
373
473
573
0,1
18,1
8,6
4,31
2,42
1,37
0,64
IX (/(/МПа) при давлении, МПа
1,0
—0,25
2,85
3,05
1,75
0,95
0,46
1,5
—0,46
0,94
2,36
1,75
0,79
0,37
2,0
—0,56
0,40
1,92
1,46
0,68
0,28
Коэффициент самодиффузии газообразного аргона в интервале тем-
температур 77—353 К может быть вычислен по уравнению £>=0,156Х
X (Т/273)'.92.
Коэффициент самодиффузни при высоких температурах и нормаль-
нормальном давлении, полученный теоретически:
г, к
1000
2000
3000
4000
1,
5,
10,
17,
, м'/с
51
03
4
8
Т, К
5000
6000
7000
8000
D0-l0\ м2/с
26,8
37,4
49,5
62,8
т, к
10 000
12 000
14 000
15 000
Do • Ю", м'/в
93,2
129
169
190
Параметры взаимной диффузии газовых смесей, содержащих аргон, мо-
могут быть подсчитаны по уравнениям, приведенным в разд. 9.1. Коэффи-
Коэффициенты для использования этих уравнений в случае аргона приведены
в таблице:
Система
Аг-Кг
Аг—Хе
Ar—Ne
Ar—N2
Ar—CH4
Ar—CO
Ar-O2
Ar—воздух
Ar—CO2
Ar-SFe
Do-101, Mz/c
0,140
0,122
0,79
0,17
0,172
0,17
0,167
0,165
0,177
0,114
a
1,556
1,563
1,519
1,752
1,785
1,752
1,736
1,749
1,646
1,596
s. К
47,3
59,9
39,8
_
89,1
145,4
т, К
169—10000
169—10000
242—10000
244—10000
307—10000
244—10000
243—10000
244—10000
276—1800
328—1000
Уравнение
Первое
»
»
Второе
»
»
»
»
»
538
Коэффициенты диффузии метастабильных атомов Аг (Фг) в собст-
собственном газе при давлении 133,322 Па:
Г, К 20 40 77 150 300
Д-104, ма/с 8 13 20 34 64
Коэффициент диффузии ионов аргона Аг+ в собственном газе при
плотности частиц газа 2,7- 10ш см~3:
Т, К • ■ • ■ 77 195 300
ZM0S ма/с . 0,013 0,0303 0,041
Коэффициент диффузии ионов аргона Аг+ и Ar2 B чужом газе при
нормальных условиях:
Основной газ .... Не Ne Ar Кг Хе
£>104, м2/с, иона:
Аг+
Arf
Основной газ . .
D-104, м2/с, иона:
Аг+ . . . .
0,37
0,37
н2
0,26
0,26
0,14
0,12
N2
0,061
0,054
—
0,049
о2
0,062
0,054
0,040
0,031
0,030
0,023
Продолжение
СО
0,058
0,051
со2
0,044
0,038
Механические свойства
Временное сопротивление на разрыв твердого аргона при —233 °С ств=
«= 1,6 МПа; твердость при 0 °С J7V = 3,7 кПа.
Сжимаемость аргона, выраженная через значения произведений объ-
объема на давление, отнесенные к тем же величинам при нормальных уело*
внях, приведена ниже.
г, к
173
223
273
323
373
473
573
673
pV/PqVq при давлении, МПа
0
0,6345
0,8173
1,001
1,1842
1,3674
1,7339
2,1003
2,4668
0,1
0,6316
0,8116
1,000
1,1837
1,3673
1,7341
2,1008
2,4675
1,0
0,6048
0,8010
0,9914
1,1795
1,3658
1,7361
2,1054
2,4736
5,0
0,4237
0,7206
0,9503
1,1611
1,3619
1,7504
2,1321
2,5078
10,0
0,6669
0,9262
1,1529
1,3648
1,7659
2,1550
2,5351
Химические свойства
Аргон не образует каких-либо валентных соединений с другими элемен-
элементами. Однако известны молекулярные соединения аргона, в которых
связь атомов осуществляется ван-дер-ваальсовымн силами. Наиболее
полно изучен кристаллогидрат Аг-6Н2О.
Области применения
Аргои используют в металлургических и химических процессах, проте-
протекающих в инертной среде, в частности, при аргоно-дуговой сварке и
резке алюминиевых и алюмнниевомагниевых сплавов, термической обра-
539
ботке легко окисляющихся материалов, при получении урана, плутония,
бериллия, тория, циркония и других металлов, для выращивания в его
среде кристаллов полупроводниковых материалов. Кроме того, аргон
применяют в светотехнике (в флюоресцентных лампах, лампах накали-
накаливания, разрядных трубках), в электронике (например, в тиратронах),
в ядерной технике (ионизационные счетчики н камеры), в газовых лазе-
лазерах, широко используемых ц цветном телевидении, объемной фотографии
и космической связи.
9.4. КРИПТОН [1—35, 312]
Общие сведения и методы получения
Криптон (Кг) — от греческого Kryptos, «скрытый» — инертный газ без
цвета и запаха. Состоит из идноатомных молекул. Открыт в 1898 г.
английскими учеными Рамзаем и Траверсом при спектроскопическом
изучении труднолетучнх фракций жидкого воздуха. Криптон — редкий
рассеянный газ, встречающийся, главным образом, в атмосфере, где его
содержание составляет 3-10~4 %. Это означает, что при нормальных
условиях 1 м3 воздуха содержится около 3 см3 криптона.
Криптон получают как побочный продукт при разделении иоздуха.
Криптон, как и ксенон, как наименее летучие компоненты, скапливаются
вместе с кислородом в самой теплой части разделительного аппарата,
откуда их и выделяют. Затем жидкий кислород подвергают ректифика-
ректификации, в результате чего получают криптоновый концентрат, содержащий
0,1—0,2 % криптона. Концентрат очищают от углеводов, сжижают н
продолжают процесс ректификации. Затем операцию очистки и ректифи-
ректификации повторяют еще раз. В итоге получают криптон или криптоно-
ксеноновую смесь. Химический состав криптона и крнптоно-кссноновой
смеси по ГОСТ 10218—77:
Содержание, % (объеми.)
Криптон
Ксенон
Кислород, не более
Азот в сумме с аргоном, не
более
СО2, не более
Углеводороды, не более
Водород, не более
Водяные пары, г/м3, не более
Криптой
чистый
Не менее
98,9 %
Не более
1 %
0,001
0,05
0,005
0,003
0,001
0,03
технический
Не менее
99,5% (в
сумме с
ксеноном)
Не норми-
нормируется
0,01
0,4
0,01
0,005
0,005
0,076
Криптоио-
ксеноновая
смесь
Не более
94,5 %
Не менее
5%
0,05
0,4
0,01
0,01
Не нормн-
П \7РТРЯ
рус i \~п
0,076
Криптон и криптоно-ксеноновую смесь хранят в специальных балло-
баллонах малой и средней емкости, окрашенных в черный цвет. В случае за-
заполнения крипа оном баллоны имеют в верхней части одну желтую по-
640
лосу и надпись крупными желтыми буквами «криптон». В случае запол-
заполнения смесью, баллоны имеют в верхней части две желтые полосы и
надпись желтыми буквами «криптон—ксенон». Гарантийный срок хра-
хранения продукта— 18 мес. со дня изготовления, после чего его следует
заново проварить на соответствие ГОСТ 10218—77.
Физические свойства
Атомные характеристики. Атомный номер 36, атомная масса 83,80 а. е. м,
атомный объем 27,90-Ю-6 м3/моль, атомный радиус 0,197 нм, потенциа-
потенциалы ионизации / (эВ): 13,996; 24,56; 36,9. В твердом состоянии имеет
г. ц. к. решетку с периодом с = 0,655 нм (при 4,2 К) н 0,571 нм (при
89 К). Электронное строение изолированного атома 4s24p6. Атмосфер-
Атмосферный криптон состоит из смеси шести стабильных изотопов с массовыми
числами 78 (содержание 0,35%), 80 B,27%), 82 A1,56%), 83
A1,55 %), 84 E6,9%) и 86 A7,37 %). Кроме того получено 15 радиоак-
радиоактивных изотопов криптона, наиболее долгоживущий из которых 87Кг
имеет период полураспада 77 мин. Эффективное поперечное сечение за-
захвата тепловых нейтронов для природного криптона составляет C1±
±2)-10~28 м2 при экспериментально определенном среднем сеченнн рас-
рассеяния для максвелловского спектра нейтронов G,2±0,7) • 10~28 м2.
Сродство атома криптона к протону 3,7 эВ.
Плотность. Плотность криптона при критической температуре р =
= 0,908 Мг/м3, в тройной точке р=2,826 Мг/м3. При 273 К и давлении
0,1 МПа плотность газа 3,7493 кг/м3; в жидком состоянии р =
= 2,413 Мг/м3. В твердом состоянии плотность зависит от температуры
и в пределах 114—12 К меняется от 2,799 до 3,092 Мг/м3.
Динамическая вязкость криптона т| при нормальном давлении в за-
зависимости от температуры:
Г, К 273 373 473 573
Ц, мкПа-с .... 23,30 30,60 37,25 43,25
Т, К • •
"П. мкПа-с
673
48,50
773
53,50
Продолжение
873
58,40
Растворимость криптона в воде зависит от температуры и составля-
составляет 99,1 • 10-« м3/л при 273 К и 28,5-10 м3/л прн 353 К.
Прн испарении 1 л жидкого криптона образуется 643,6 л газа. Сжи-
Сжимаемость криптона, выраженная значениями произведений объема на
давление, отнесенными к тем же величинам при нормальных условиях:
р, МПа
2,5
2,7
3,0
3,2
3,6
4,0
4,5
4,8
1,012
1,008
1,000
0,993
0,980
0,968
0,953
0,940
Р МПа
5,3
5,7
6,2
6,8
7,06
8,6
10,0
—
pV/РоП
B84 К)
0,937
0,918
0,901
0,884
0,863
0,841
0,821
—
р, МПа
5,0
5,4
5,8
6,4
7,8
7,8
8,8
10,2
PV/PgVo
E46 К)
1,182
1,880
1,874
1,868
1,862
1,859
1,856
1,877
541
Скорость распространения звука в криптоне при температуре 303 К и
частоте 83,78 кГц равна 224,36 м/с.
Магнитная восприимчивость газообразного криптона х=—0,35- 10"э.
В жидком состоянии при 91 К она равна —0,38-10~9.
Тепловые и термодинамические. Критическая температура криптона
—63,65 °С при давлении 5,4 МПа, тройная точка —157,22 °С при давле-
давлении 0,073 МПа, температура кипения tK]an =—153,2 °С, температура плав-
плавления ?пл=—156,45 °С, характеристическая температура 6В=71,7 К.
Удельная теплота плавления Д#„л= 19,535 кДж/кг, удельная теплота
сублимации при 0К Д#Субл= 133,3 кДж/кг, удельная теплота испарения
ДЯ„с=< 107,9 кДж/кг.
Теплопроводность X газообразного криптона в зависимости от тем-
температуры:
Т, К 125 225 300 500 700 900 1100
Я.-103, Вт/(м-К) • 4,2 7,2 9,7 14,9 19,6 23,8 27,5
Теплоемкость газообразного криптона при нормальных условиях ср =
•=248 Дж/(кг-К), температурный коэффициент объемного расширения
р при нормальном давлении:
Т, К 273 473 573
рМО3, К • • 3,311 3,5935 3,6756
Теплопроводность жидкого криптона Х=0,089 Вт/(м-К).
Теплопроводность Я твердого криптона в интервале температур 100—■
25 К изменяется от 0,209 до 1,5 Вт/(м-К). Теплоемкость при двух раз-
различных температурах:
Г, К 12 114
с„, Дж/(кг-К) • • 99 257
ср, Дж/(кг-К) . . 99,5 422,5
Коэффициент самодиффузии криптона при нормальных условиях D =
= 0,08 ■ 104 м2/с. Коэффициент самодиффузии D при высоких температу-
температурах и нормальном давлении, полученный теоретически:
Т, К 1000 2000 3000 40С0 5000 6000
£>-104, м2/с 0,853 2,83 5,67 9,32 13,8 19,2
Продолжение
Т, К 7000 8000 10С00 12 000 14 000 15 000
£•10*, мг/с 25,5 32,6 49,6 70,2 93,7 107,0
Параметры взаимной диффузии газовых смесей, содержащих криптон.
могут быть подсчитаны по уравнениям разд. 9.1 при подстановке коэф-
коэффициентов, приведенных ниже:
Система Do • Ю* м2/с о S, К 7", К Уравнение
Кг—Хе 0,0812 1,608 52,7 169—10 000 Первое
Кг—Н2 0,664 1,564 26,4 77—10 000 »
Кг—N2 0,13 1,766 — 248—10 000 Второе
КСО 0,13 1,766 — 248—10 000 »
Коэффициент диффузии ионов Кг+ в собственном газе, содержащем
2,7-1025 частиц в 1 м3 при 300 К, /3 = 0,022-10~* м2/с.
Коэффициенты диффузии D метастабильных атомов криптона
КгCР2) в собственном газе при давлении 133,322 Па:
Г, К 40 77 150 300 500
£М€4, м2/с ... 12 12 20 38 51
542
Коэффициент диффузии D ионов Кг+ в чужом газе при нормальных ус-
условиях:
Основной газ . . Не Ne Аг Хе Н2
£М0\ м2/с . . . 0,37 0,12 0,048 0,022 0,26
Продолжение
Основной газ . . N2 O2 СО СО2
D-101, м2/с . . . 0,053 0,054 0,05 0,037
Механические свойства
Максимальное временное сопротивление разрыву твердого криптона при
температуре —203 °С ав=4 МПа; твердость при температуре —243 "С
//V=2,5 МПа.
Химические свойства '
Криптон способен вступать в химические реакции. Известны фториды
KrF2 и KrF4, полученные при электрическом разряде и устойчивые толь-
только при пониженной температуре. Действием раствора Ва(ОНJ на KrF*
получен криптонат бария ВаКгО4. Подобно другим инертным газам, крип-
криптон образует соединения, связь в которых осуществляется межмолеку-
межмолекулярными силами, например Kr-6H2O; Kr-3C6Hs0H. Эти соединения ио-
сят название соединений включения или клатрантных соединений. Из
других немногочисленных соединений криптона следует упомянуть о
KrF2-2SbFs— веществе более устойчивом и менее летучем, чем KrF2.
Области применения
Криптон применяют, главным образом, в электровакуумной технике.
Криптоновые лампы накаливания служат дольше обычных, поскольку
тяжелые атомы криптона затрудняют испарение вольфрамовой нити.
9.5. КСЕНОН [1— 35, 312]
Общие сведения и методы получения
Ксенон (Хе) от греческого «xenos» (чужой) — инертный газ. Открыт в
1898 г. английскими учеными Рамзаем и Траверсом. Газообразный ксе-
ксенон не имеет цвета и запаха. Состоит из одноатомных молекул. На
Земле присутствует, главным образом, в атмосфере. Ксенон — весьма
редкий элемент. При нормальных условиях в 1000 м3 воздуха содержит-
содержится около 87 см3 ксенона, т. е. его содержание составляет порядка 0,9 X
хю-5 %.
В промышленности ксенон получают при разделении воздуха методом
глубокого охлаждения. Вследствие очень низкого содержания ксенона,
объем его производства невелик. Действительно, чтобы получить 1 м3
ксенона, необходимо переработать по меньшей мере 1Ы06 м3 воздуха.
Обычно ксенон получают способом ректификации из криптоно-ксеноно-
вой смеси (см. разд. 9.4). Установки для выделения ксенона всегда ми-
миниатюрны, поскольку при суточной работе аппарата производительно-
производительностью 35 000 м3 по кислороду, может быть получено ие более 3,5 м3
криптоно-ксеноновой смеси, из которой вырабатывается лишь 225 л газо-
газообразного илн 40 л жидкого ксенона.
543
По химическому составу ксенон должен соответствовать ГОСТу
10219—77:
Содержание, % (Объемы )
Ксенон, ие менее
Криптон, не более
Азот, не более
Кислород, не более
Меган, не более
СО2, не более
Водяной пар при 293 К и давлении 0,1 МПа,
г/м3, не более
Высокой
чистоты
99,990
0,005
0,002
0,0005
0,0001
0,0002
0,005
Чистый
99,96
0,02
0,01
0,001
0,001
0,001
0,01
Ксенон поставляют в стальных баллонах, окрашенных в черный цвет,
и снабжают желтой надписью «ксенон». Гарантийный срок хранения
продукта 18 мес со дня изготовления. При более длительном храпении
перед использованием продукт должен быть проверен на соответствие
ГОСТ 10219—77.
Физические свойства
Атомные характеристики. Атомный номер 54, атомная масса 131,3 а е. м,
атомный объем 36,76-10~6 м3/моль, атомный радиус 0,218 им, потенциа-
потенциалы ионизации / (эВ)- 12,127, 21,2; 32,1. У твердого ксенона г. ц. к. ре-
решетка, (при 10 К) а=0,613 им. Относительно низкие Значения первых
потенциалов ионизации определяются экранирующим Действием большо-
большого числа электронных оболочек. Электронная конфигурация изолирован-
изолированного атома 5s25p6. Природный ксенон является смесью девяти стабиль-
стабильных изотопов, среди которых наиболее распррстранены 129Хе (содержа-
(содержание 26,44 %), 131Хе B1,18 %) и l32Xe B6,89 %). Получено также 15 ра-
радиоактивных изотопов ксенона, среди которых особенно важен 135Хе
(период полураспада 9,13 ч), имеющий очень большое эффективное по-
поперечное сечение захвата тепловых нейтронов B,72-10—22 м2). Для при-
природного ксенона это сечение существенно меньше и равно C5±5)Х
ХЮ~28 м2 при среднем сечении рассеяния для максвелловского спектра
нейтронов D,3±0,4) • 10~28 м2. Энергия диссоциации молекулярного иоиа
Хс 2~ равна 1,0 эВ
плотность Плотность ксенона при критической температуре р=»
= 1,1 Мг/м3, в тройной точке р=3,399 Мг/м3, прн температуре 273 К и
давлении 0,1 МПа р = 5,8971 кг/м3. В жидком состоянии плотность ксе-
ксенона при нормальном давлении равна 3,057 Мг/м3. В интервале 160—
20 К плотность твердого ксенона меняется от 3,407 до 3,795 Мг/м3.
Динамическая вязкость ц ксенона при нормальном давлении в зави-
зависимости от температуры:
г, к . •
Т), МКПЭ'С
273
21,10
373
28,20
473
34,84
573
40,80
673
46,20
773
56,00
Растворимость ксенона в воде зависит от температуры и составляет
203,2- 10-6м3/л при 273 К и 40,3-Ю-6 м3/л при 353 К. Количество газа,
образующегося при испарении 1 л жидкости, равно 518,9 л.
544
Сжимаемость ксенона, выраженная через значения произведений объ-
объема на давление, отнесенных к тем же величинам при нормальных усло-
условиях:
р, МПл
2,5
2,6
2,7
2,8
3,0
3,1
3,2
pV/PnV,,
( "84 К)
0,697
0,691
0,685
0,677
0,670
0,659
0,650
р, МПа
3,6
3,8
4,0
4,3
4,6
4,9
5,3
PV/P0V0
B84 К)
0,628
0,612
0,598
0,576
0,552
0,522
0,537
р МПа
5,3
5,8
6,3
6,9
7,7
8,8
10,2
pV/PoVo
E10 К)
1,397
1,389
1,377
1,375
1,359
1,354
1,357
Магнитная восприимчивость ксенона при 293 К колеблется от
—0,51 -Ю-9 до —0,53- Ю-9.
Тепловые и термодинамические. Критическая температура ксенона
соответствует 16,74 °С при давлении 5,6 МПа, тройная точка — темпера-
температуре — 111,63 °С и давлению 0,08 МПа, температура кипения tKaa =
=—107,96 °С, температура плавления tnn=—111,65 °С, характеристичес-
характеристическая температура 0о = 65 К, удельная теплота плавления Д#Пл =
= 17,5 кДж/кг, удельная теплота испарения в точке кипения Д#„сп=
= 96,6 кДж/кг, удельная теплота сублимации при 0 К Д#С}бл =
= 122,5 кДж/кг.
При температуре 273 К и давлении 0,1 МПа теплопроводность
ксенона Х=0,05 Вт/(м-К). Теплоемкость газа при постоянном давлении
при 293 К ср= 150 Дж/(кг-К), теплоемкость жидкости в интервале
163—165 К при давлении 0,1 МПа ср = 340 Дж/(кг-К). Температурный
коэффициент объемного расширения при том же давлении и 303 К р=
= 3,552-Ю-6 К; при 373 К он равен 2,977-10-6, при 473 К 3,565-10-*,
а в интервале 160—20 К уменьшается от 12,96-Ю-4 до 3,32-10~4 К-
Теплопроводность % в интервале 180—25 К меняется от 0,226 до
1,81 Вт/(м-К), теплоемкость при постоянном давлении в интервале 150—
11 К снижается с 250 до 70 Дж/(кг-К), а теплоемкость при постоянном
объеме с с 160 до 70 Дж/(кг-К).
Коэффициент Джоуля—Томсона для ксенона:
т, к
298
323
373
423
Ц, К/МПа, при давлении, МПа
0,1
18,7
16,2
12,8
10,2
10
1,88
5,77
8,04
7,25
100
—0,82
—0,79
—0,74
—0,718
200
—0,94
-0,934
—0,934
—0,1011
Коэффициент самодиффузии ксенона при нормальных условиях D=
=0,048-10~4 м2/с Коэффициент самодиффузии при высоких температу-
температурах рассчитанный теоретически:
Т, К 1000 2000 3000 4000 5000 6000
D-10\ м2/с . . . -0,502 1,65 3,32 5,42 7,97 10,9
545
Продолжение
Т,К 7000 8000 10 000 12 000 14 000 15 000
ZM0*, м2/с . . . 14,4 18,2 27,2 37,7 49,4 55,7
Коэффициент взаимной диффузии в двойных газовых системах с ксе-
ксеноном может быть подсчитан по уравнению (разд. 9.2), коэффициенты
которого приведены ниже:
Система
Хе—Н2
Xe-N2
D0-IO' M2/c
0,54
0,106
1
1
а
,712
,789
S, К
16,9
—
т к
242—10 000
242—10С00
Коэффициент диффузии ионов Хе+ в собственном газе при плотно-
плотности частиц газа 2,7-1019 см~3 и температуре 300 К D = 0,016-10-4 м2/с.
Коэффициент диффузии метастабильных атомов ксенона CРг) в собст-
собственном газе при давлении 133,3 Па:
Т, К 20 40 77 150 ЗСО Е0О
D-104, м2/с .3 5 8 13 22 33
Коэффициент диффузии ионов Хе+ и Хе^"в чужом газе при нормаль-
нормальных условиях:
Основной газ Не Ne Ar Кг Хе
D-W, м2/с, иона:
Хе+ 0,36 0,12 0,045 0,029 —
Хе^" 0,36 0,12 0,043 0,026 0,017
Продолжение
Основной газ Н2 N2 O2 СО СО2
£>• 104, м7с, иона:
Хе+ 0,25 0,051 0,052 0,023 0,035
Хе^ 0,25 0,049 0,048 0,046 0,033
Химические свойства
Ксенон способен проявить степень окисления +1, +2, +4, +6, +8.
Ксенон — первый инертный газ, для которого получены соединения
с гексафторидами платниы, рутения, родия и плутония: XePtFe,
Xe(PtFeJ, XeRuFe. XeRhF6 н XePuF6. Известны также фториды ксенона
XeF2, XeF4, XeFe, XeF8. Для получения XeF4 достаточно простого пропус-
пропускания ксенона и фтора через нагретую трубку. Синтез XeF2 возможен
при облучении этой смеси ультрафиолетовыми лучами. Получить же фто-
фториды XeF6 и XeF8 можно только при высоких давлениях, порядка
20 МПа при температуре 327—527 "С. Фторид XeF4 является устойчивым
и достаточно долгое время сохраняется при комнатной температуре.
Наименее устойчив фторид XeFe, Для сохранения которого необходимо
снижение температуры до —196 °С. При осторожном унаривании рас-
раствора XeF4 в воде образуется весьма неустойчивый нелетучий окисел
ХеО3, являющийся сильным взрывчатым веществом Действием раство-
раствора Ва (ОНJ на XeF6 можно получить довольно устойчивые ксенонаты ба-
546
рия Ва3Хе05, натрия Na6Xe06 и др. Известны и солн, содержащие
(VIII) ксенон — перксенонаты, например Na4Xe0e'6H20. Действуя на
последний серной кислотой, можно получить высший окисел ХеО4. Из-
Известны двойные соли XeF2-2SbF5, XeF6-AsF3 и другие. Синтезированы
различные комплексные, соединения фторидов ксенона с фторидами ме-
металлов и неметаллов: ХеО, ХеО2, XeOF2, XeO2F2, XeOF4. В 1974 г. поя-
появилось сообщение, что получено соединение ксенона с азотом вида
FXeN(SO2FJ —белое кристаллическое вещество (порошок), медленно
разлагающееся с выделением ксенона и его дифторида.
Области применения
Ксенон применяют, главным образом, для производства ксеноновых га-
газоразрядных ламп, используемых при киносъемках, в телевизионных
студиях. В этих лампах электрическая энергия преобразуется в световую
при горении дугового разряда в атмосфере ксенона. Характерные осо-
особенности таких ламп — непрерывный спектр излучения, близкий к сол-
солнечному, и большой диапазон яркости и мощности.
Ксенои находит применение также в медицине и в научных исследо-
исследованиях. Благодаря высокой способности поглощать рентгеновское излу-
излучение он может быть использован как контрастное вещество при иссле-
исследовании головного мозга. Фториды ксенона находят применение как
мощные окислители и фторирующие агенты. В виде фторидов ксенона
удобно хранить и транспортировать чрезвычайно агрессивный фтор.
9.6. РАДОН [1—35, 312]
Общие сведения и методы получения
Радон (Rn) — радиоактивный инертный газ, не имеющий при нормаль-
нормальных условиях цвета, запаха и вкуса. Жидкий радой — бесцветная фос-
фосфоресцирующая жидкость, а твердый испускает ярко-голубое свечение.
Открытие радона — результат ранних работ по изучению радиоактивно-
радиоактивности. В 1899 г. американский физнк Оуэне обнаружил, что при распаде
тория образуется некая радиоактивная субстанция, которую можно уда-
удалить из растворов тория потоком воздуха. Эту субстанцию Резерфорд
назвал эманацией и доказал, что она представляет собой радиоактив-
радиоактивный газ.
Радон — одни из самых редких элементов. Содержание его в земной
коре глубиной до 1,6 км около 115 т. Образующийся в радиоактивных
рудах и минералах радон постепенно поступает на поверхность земли в
гидросферу и атмосферу. Средняя концентрация радона в атмосфере
6-Ю-'7 % (по массе). Для получения радона (его изотопа 222Rn) через
водный раствор соли радия пропускают газ (азот, аргон). Прошедший
через раствор газ содержит около 10~5 % радона. Для извлечения ра-
радона используют или его способность хорошо сорбироваться на пори-
пористых телах, например, на активированном угле, или специальные хими-
химические методы. Доступные количества чистого радона не превышают
1 мм3.
Физические свойства
Атомные характеристики. Атомный номер 86, атомная масса 222 а. е. м,
атомный радиус 0,22 им, потенциалы ионизации / (эВ); 10,745; 21,4±
547
±1,8; 29,4±1,0. Твердый радой имеет кубическую решетку. Электронное
строение изолированного атома 6s26p6. Три а-радиоактивных изотопа
радона встречаются в природе как члены естественных радиоактивных
рядов; 219Rn (член ряда актиноурана, период полураспада 3,92 с); 220Rn
(ряд тория, период полураспада 54,5 с) и 222Rn (ряд урана—радия,
период полураспада 3,823 сут). Изотоп 219Rn называется также актинон
(An), 220Rn — торон (Тп), а изотоп 222Rn называют истинным радоном
и часто обозначают просто Rn. Искусственно с помощью ядерных реак-
реакций получено около 20 изотопов радона с массовыми числами от 201 до
222. Для синтеза нейтроиодефицитных изотопов радона с массовыми
числами 206—212 в Объединенном институте ядерных исследований в
Дубне создана специальная газохроматографическая установка. Эффек-
Эффективное поперечное сечение захвата тепловых нейтронов радоном равно
0,72-Ю-28 м2.
Плотность. Плотность радона при 273 К и нормальном давлении рав-
равна примерно 9,9 кг/м3, плотность при критической температуре р =
= 1,2 Мг/м3, плотность жидкого радона в тройной точке 5,7 Мг/м3.
Динамическая вязкость в критической точке 1^ = 29,54 мкПа-с; вяз-
вязкость при 298 К и 0,1 МПа 229 мкПа-с.
Растворимость радона в воде при 273 К составляет примерно 50 %
(объемн.) или 5,1 -10-* м3/л. При 293 К растворимость 2,3-10-'* м3/л,
а при 303 К снижается до 1,69-10~4 м3/л. Растворимость в спиртах и
жирных кислотах возрастает с увеличением их молекулярной массы.
Тепловые и термодинамические. Нормальная температура кипения
<кип = — 62 °С, температура плавления ?пл = — 71 °С, критическая темпе-
температура 104,5 °С при критическом давлении 6,2 МПа, тройная точка соот-
соответствует температуре —71 °С и давлению 0,07 МПа, удельная теплота
плавления в тройной точке Д//Пл=14,7 кДж/кг. Удельная теплота испа-
испарения Д#исп=73,9 кДж/кг. Теплоемкость радона при 298 К и нормаль-
нормальном давлении ср = 90 Дж/(кг-К).
Химические свойства
Химически радон весьма пассивен, т. к. на его внешней оболочке нахо-
находится 8 электронов. Как и ксенон, радон дает фторид вероятного соста-
состава RnF2, который при 500 °С может восстанавливаться водородом до
элементарного радона. Найдены также фториды RnF4 и RnFe. Радон
может образовывать клатрантные (молекулярные) соединения с водой,
фенолом, толуолом и пр. Препаративная химия радона очень сложна,
поскольку, во-первых, недоступны сколько-нибудь существенные коли-
количества этого газа, а во-вторых, вследствие радиоактивного распада ра-
радон сильно разогревается. Может быть поэтому окислы и кислородсо-
кислородсодержащие кислоты радона пока не выделены.
Несмотря на свою химическую инертность радон —один из наибо-
наиболее токсичных ядов, что обусловлено его радиоактивными свойствами,
Области применения
Радон применяют в основном в медицине. На определении концентра-
концентрации радона в поверхностном слое воздуха основаны эмаиационные ме-
методы геологической разведки, позволяющие оценить содержание ураиа
и тория в прилегающих к поверхности горных породах. Радон приме-
применяют также в научных исследованиях. При работе с радоном необходи-
необходимо использовать герметичные боксы и соблюдать меры предосторожно-
предосторожности из-за его сильной токсичности.
548
10. ЛАНТАН И ЛАНТАНОИДЫ
Общие сведения и методы получения
Лантан расположен в Периодической системе элементов в III группе
и 4-м длинном периоде под номером 57.
К лантаноидам относится семейство из 14 элементов с порядковыми
номерами от 58 (церий) до 71 (лютеций), расположенных за лантаном.
Очень близкие по своим физико-химическим свойствам, эти элементы в
то же время имеют ярко выраженную индивидуальность. Каждому из
них присущи особые физические, химические или атомные свойства.
Лантаноиды разделяются на две подгруппы: цериевую (лантан, це-
церий, празеодим, неодим, прометий, самарии, европий) и иттрневую (га-
(гадолиний, тербий, диспрозий, гольмий, эрбий, тулий, иттербий, лютеций).
Это деление сначала основывалось на различии в растворимости двой-
двойных сульфатов, образуемых лантаноидами, с сульфатами натрия или
калия. В дальнейшем была установлена периодичность в изменении
свойств в пределах лантаноидов, соответствующая их разделению на
две подгруппы.
С увеличением атомного номера непрерывно уменьшаются радиусы
атомов и ионов лантаноидов (лантаноидное сжатие). Непрерывно пони-
понижается основность элементов от лантана к лютецию, что обусловливает
различие в растворимости солей лантаноидов и в устойчивости их комп-
комплексных соединений.
Лантаноиды имеют длительную историю открытия. Первыми были
открыты «иттриевые земли» финским химиком Гадолином в 1794 с. в
минерале, найденном в Швеции и назваииом позже гадолииитом.
В 1803 г. Клапорт и Берцелиус одновременно выделили из тяжелого
камня «бастенза» «иттриевую землю». В 1839 г. Мозандер выделил из
церисвых земель оксид (IV, III) церия, оксид (III) лантана и «ди-
дим» — двойной (смесь оксидов (III) неодима и празеодима). Через
четыре года он же получил из иттриевых земель тербиевую и эрбиевую
земли. В 1878 г. Мариньяк выделил из эрбиевых земель иттербий, а в
1879 г. Клеве открыл в них эрбий, тулий и гольмий. Тербий, эрбий и
иттербий — от названия селения Иттербю (Ytterby) в Швеции; тулий —
от названия полулегендарной страны Туле (греч. Thule); гольмий — ла-
тииское название Стокгольма — Holmia. В 1879 г. Лекок де Буабодран
получил из цериевых земель самарий, а в 1880 г. Мариньяк — гадоли-
гадолиний. Впервые самарий был выделен из минерала самарскита, найден-
найденного на Урале. Гадолиний назван в честь финского химика Гадолина
A760—1852 гг.). Используя предложенный в 1873 г. Д. И. Менделее-
Менделеевым метод дробной кристаллизации, Ауэр фон Вельсбах в 1885 г. раз-
разделил «диднм» на неодим н празеодим. Празеодим — от греческого
prasios — светло-зеленый (зеленый цвет соли) и неодим — от греческого
neus новый. В дальнейшем были открыты диспрозий, европий и люте-
лютеций. Последним из-за отсутствия стабильных изотопов был получеи
элемент с атомным номером 2=61. Он был получен в 1947 году Ма-
Марийским н Глендениным из осколков деления урана в ядерном реакторе
и назван нми прометнем. Прометий был получеи также при нейтронном
облучении неодима. В 1964 г. небольшие количества этого элемента
были получены финскими учеными из фосфатных остатков. Открытие
лантаноидов завершилось в начале XX в., но эффективные промышлен-
промышленные методы их разделения были разработаны в 50-е годы нашего сто-
столетия,
549
Суммарное содержание лантаноидов в земной коре относительно ве-
велико [0,01 % (по массе)]. Наиболее распростраиеиными среди иих яв-
являются лантан, церий и неодим. Элементы с нечетным атомным номером
содержатся в земной коре в меньших количествах по сравнению с их
ближайшими соседями с четными номерами. Содержание в земной коре
одного из наименее распространенных редкоземельных металлов — ев-
европия— составляет 1,2-10~4 % (по массе), что превышает содержание
ртути и висмута. Известно более 250 минералов, содержащих лантано-
лантаноиды, в 60—65 из них суммарное содержание лантаноидов достигает
5—8 % н выше. По химической природе минералы представ-
представляют собой фосфаты, фториды или фторкарбонаты, силикаты, си-
ликотитанаты, ниоботанталаты, титанониобаты. Несмотря на большое
количество минералов, содержащих лантаноиды, промышленное значе-
значение имеют лишь некоторые из них: монацит (Се, La, Th, Y)PO4, баст-
незит CeFCO3, ксенотим YPO4, апатит Са5(РО4)зР, эвксенит (минерал
сложных оксидов, содержащий иттрий и элементы иттриевой подгруп-
подгруппы). Минералы могут содержать некоторое количество тория или урана.
Соотношение между отдельными лантаноидами в минералах сильно ко-
колеблется. В монаците, бастнезите, лопарите преобладают элементы це-
риевой подгруппы; в ксенотиме, эвксените, гадолините — иттриевой под-
подгруппы.
Один из основных источников получения элементов цериевой под-
подгруппы — монацит.
Одним из основных источников сырья для извлечения элементов
иттриевой подгруппы служат эвксенит, ксенотим и хвосты переработки
урансодержащих руд. Потенциальным источником извлечения лантано-
лантаноидов являются апатиты.
Процессы переработки концентратов в зависимости от способа раз-
разложения разделяются на следующие группы: разложение плавиковой
кислотой; разложение серной кислотой; сплавление с щелочами (NaOH
в КОН); хлорирование.
Получаемые в результате этих процессов хлориды, оксиды и суль-
сульфаты являются исходным материалом для получения индивидуальных
редкоземельных металлов. С этой целью используют методы металлоке-
рамического восстановления безводных хлоридов, бромидов, фторидов
с помощью металлического кальция, магния, калия, лантана, электролиз
безводных хлоридов, расплавленных галоидов, восстановление водоро-
водородом и т. д. Для разделения редкоземельных металлов используют: 1) ре-
реакции, связанные с изменением валентности РЗМ, 2) реакции осажде-
осаждения, 3) фракционную кристаллизацию, 4) ионный обмен, 5) жидкост-
жидкостную экстракцию. Эффективная очистка редкоземельных металлов (лаи-
таиоидов) от примесей достигается дистилляцией н вакуумным пере-
10.1. ЛАНТАН [1-35, 150, 152, 245, 313, 314]
Лантан (La) — металл серебристо-белого цвета. В сухом воздухе
покрывается тонкой пленкой оксида синеватого цвета, предохраняющей
металл от дальнейшего окисления. Лантан кальциетермический трех
марок ЛаМ-1, ЛаМ-2 и ЛаМ-3 выпускается по ТУ 48-4-218-72:
Марка ЛаМ—1 ЛаМ—2 ЛаМ—3
Содержание суммы других
РЗМ (Се, Nd, Sm, Pr), %, не
более 0,10 0,20 0,50
550
Продолжение
Содержание прочих контроли-
контролируемых прнмесей, %, не более:
Fe 0,01 0,01 0,02
Са 0,01 0,03 0,02
Си . - 0,01 0,01 0,05
Та, Мо или Nb . ..... 0,02 0,20 0,30
Дистилляция и электроннолучевая плавка снижают содержание прн-
прнмесей в лаитане.
Каждый слиток лантана упаковывают в двойной полиэтиленовый
пакет, который заваривают. Пакеты с металлом упаковывают в дере-
деревянные ящики. Гарантийный срок хранения в упаковке 6 мес.
Физические свойства
Атомные характеристики. Атомный номер 57, атомная масса 138,91
а.'е. м., атомный объем 22,53- 10~в м3/моль, атомный радиус 0,1877 нм,
ионный радиус La3+ 0,1040 нм, ионный радиус La4+ 0,090 нм, La2+
0,114 нм.
Электронная конфигурация внешних электронных оболочек изоли-
изолированного атома: 4s2ped10/°5.s2pedl6s2.
Потенциалы ионизации атома / (эВ): 5,577; —11,06; 19,176; электро-
электроотрицательность 1,2.
Лантан имеет гексагональную структуру с соотношением осей с/а
~3,2, т.е. в 2 раза больше, чем для обычных гексагональных структур.
Такие структуры называют двойными гексагональными структурами с
последовательностью упаковки атомов ABAC.
Лантан существует в трех кристаллических модификациях: а, р и \.
При комнатной температуре устойчива а-модификация, имеющая гекса-
гексагональную решетку с параметрами а=0,3722 нм, с— 1,2144 нм. Энергия
кристаллической решетки 369 мкДж/кмоль. Координационное число 6;
6. Высокотемпературные модификации: р с г. ц. к. решеткой (a=O,53J35
нм), координационное число 12; у с о. ц. к. решеткой (а=0,426 им),
координационное число 8.
Природный лантан имеет следующий изотопный состав: 138La
@,089%*) и 139La (99,911 %). Период полураспада радиоактивного изо-
изотопа 133La — 3,2-10" лет, тип распада: Р+, у. В результате распада
получается стабильный изотоп |37Ва.
Эффективное поперечное сечение захвата тепловых нейтронов
8,9-Ю-28 м2.
Работа выхода электронов <р=3,3 эВ.
Плотность ot-La р=6,166 Мг/м3, плотность Y-La при 1160 К р=
= 5,97 Мг/м3.
Электрические и магнитные. Удельное электрическое сопротивление
р и удельная электрическая проводимость а лантана чистотой 98 %:
13
0,09
11
293
0,565
1,77
673
0,89
1,12
1193
1,27
0,78
Т, К
р, мкОм-м. . . .
а, МСм/м ....
Температурный коэффициент электрического сопротивления в интер-
интервале 273-373 К <х=2,2- Ю-3 К-1.
Изменение удельного электрического сопротивления при плавлении
рж/ртв=1,04.
551
Лантан — сверхпроводник. Температура перехода в сверхпроводя-
сверхпроводящее состояние для a-La 7С=4,90±0,10 К и p-La — 5,85±0,П К. С воз-
возрастанием давления до 2 ГПа наблюдается .понижение Тс на 0,5 К, что
связывается с а->р-переходом. С дальнейшим увеличением давления
То возрастает до 11 К и в области 10—23 ГПа практически не ме-
меняется.
Абсолютный коэффициент т. э. д. с. лантана е изменяется в интерва-
интервале 20—300 К от —4,5 до —2 мкВ/К.
Постоянная Холла для лантана R=—0,8- 1O~10 м3/Кл.
Лантан — парамагнетик, магнитная восприимчивость которого зави-
висит от температуры. Для a-La магнитная восприимчивость при ком-
комнатной температуре %=+0,729-10~9. Отмечается возрастание обратной
величины парамагнитной восприимчивости с повышением темпера-
температуры.
Тепловые и термодинамические. Температура плавления лантана со-
составляет 920°С; температура кипения 3454"С; характеристическая тем-
температура 6D = 135K, удельная теплота плавления ЛЯПЛ = 44,7 кДж/кг;
теплота испарения ЛЯИСп=2897 кДж/кг; удельная теплота сублимации
АЯС\-бл = 3102 кДж/кг. Температура а->р-перехода 310 °С, р-^у-перрхо-
да 861 "С. Удельная теплота перехода a-La»±p-La 2,865 кДж/кг, р-
La—v-La 22,92 кДж/кг.
Молярная энтропия s° лантана при различных температурах-
Г, К 298 500 1000 15Г0
s°, Дж/(моль-К) . 56,90 71,59 92,47 116,02
Продолжение
Г, К 2000 2500 3000
s°, Дж/(моль-К) • 125,65 133,07 139,21
Лантан имеет среди редкоземельных металлов одно из наиболее ннз-
ких значений давления пара р при температурах, близких к темпера-
температуре плавления:
Т, К 1273 1373 1473 1573 1673
р, Па 0,7Ы0-в 1,27.10-» 0,15-10-3 0,14-10-* 0,94-10-2
Продолжение
Г, К 1773 1873 1973 2073 2173
р. Па 0,52- 10-1 0,24 0,92 3,2 9,9
Удельная теплоемкость ср=1886 Дж/(кг-К). Удельная электронная
теплоемкость a-La сэ*= [10 мДж/(моль-К2)] -Т, для p-La СрЛ=
= [11,3 мДж/(моль-К2)]-Т.
Температурный коэффициент линейного расширения а= 10,4• 10—в К.
Теплопроводность ?^-La:
Г, К 100 300 500 700
X, Вт/(м-К) • • • 14,15 20,95 24,05 29
Параметры самодиффузии (по объему зерна) в интервале 805—
1044 К" предэкспоненциальный множитель £H= 1,5-10—• м2/с; энергия
активации Е= 171 кДж/моль.
552
Механические свойства
Лантан чистотой 98,2 % имеет твердость при комнатной температуре
НВ=314 МПа. С повышением температуры до 800 °С твердость пони-
понижается до 34,2 МПа. Особенно сильное размягчение наблюдается прн
550 °С, что связано с полиморфным превращением лантана.
При испытании на растяжение лантан при комнатной температуре
имеет Ств^ 167 МПа, 0О,2=114 МПа, 6=8,2 %. При испытании лантана
иа растяжение и сжатие в интервале температур 20—800 "С наблюда-
наблюдалось резкое возрастание пластичности при переходе в кубическую моди-
модификацию. Ударная вязкость KCU = 61,4 кДж/м2. Упругие свойства при
20 "С; модуль нормальной упругости £ = 38 ГПа; модуль сдвига G =
= 14,9 ГПа; коэффициент Пуассона v=0,288; сжимаемость и=4,12-
•10-" Па-1.
Химические свойства
Нормальный электродный потенциал реакции La—3e^±La3+ фо=—2,4 В.
В соединениях проявляет степень окисления +3, реже +4 и +2. В су-
сухом воздухе покрывается тонкой пленкой окиси, предохраняющей ме-
металл от дальнейшего окисления. Во влажном воздухе постепенно окис-
окисляется и превращается в гидрооксид. Заметное окисление начинается
при 300 °С. Прн 450 "С в кислороде сгорает до оксида с выделением
тепла.
Лантан образует оксид (III) La2O3 с температурой плавления
2300 "С и теплотой образования Д#обр=1793 кДж/моль, а также ок-
оксид LaO.
Лантан при комнатной температуре поглощает водород, а при тем-
температурах выше 300 СС образует гидриды. Пределы растворимости [Н]
в P-La: IgCmaX=2,4—1260/^ C00—750 °С). При 800—1000 °С гидриды
полностью разлагаются в вакууме.
Лантан активно взаимодействует с серой, образуя сульфиды. С хло-
хлором лантан активно взаимодействует при обычной температуре, с бро-
бромом и иодом вступает в реакцию только при нагревании. Лантан хо-
хорошо растворяется в минеральных кислотах и не взаимодействует со
щелочами. Известны карбиды лантана: La2C3 с температурой плавления
1415 °С (о. ц. к. тип U2C3) и LaC2, имеющий две модификации F-LaC2,
тетрагональная объемноцентрированная e-LaC2, кубическая, тип FeS2,
7"пл=2353°С). С медью, серебром, золотом лантан образует металличе-
металлические соединения стехиометрического состава. Есть данные о несмеши-
несмешиваемости лантаиа со щелочными металлами, например, натрием. Боль-
Большое количество металлических соединений стехиометрического состава
наблюдается в системах лантана с элементами II и III групп Периоди-
Периодической системы с незначительной взаимной растворимостью в твердой
фазе. Для систем лантана с тугоплавкими переходными металлами
IVA—VIA групп характерны широкие области несмешиваемости в жид-
жидком состоянии и незначительная взаимная растворимость в твердом со-
состоянии. Надо отметить, что в системах с германием, кремнием, оловом,
свинцом лантан образует значительное количество металлических со-
соединений, кристаллизующихся как непосредственно из расплава, так и
по перитектическнм реакциям. Аналогичный характер носит взаимодей-
взаимодействие лантана с мышьяком, сурьмой, висмутом. С металлами VIII груп-
группы лантан также образует металлические соединения при незначитель-
незначительной растворимости в твердой фазе этих металлов. С железом лантан
не образует металлических соединений, предполагается также наличие
несмешиваемости в этой системе.
553
Технологические свойства
При комнатной температуре лантан поддается ковке и прессованию, но
не обладает достаточной вязкостью. Из лантана дуговой или электрон-
электроннолучевой плавки методом прессования могут быть получены прутки
диаметром 1—5 мм, прессование проводят в стальных контейнерах на
гидравлическом прессе. Для предохранения от окисления заготовки лан-
лантана нагревают в атмосфере инертного газа — аргона или гелия.
В дальнейшем образцы можно деформировать на ленту и фольгу. В про-
процессе деформации образцы следует подвергать промежуточному отжигу
для снятия наклепа. Суммарное обжатие за проход может достигать
25—30 %. Из лантана была получена лента, а также проволока прокат-
прокаткой в ручьевых валках и протяжкой через фильеры.
Готовую продукцию рекомендуется хранить в минеральном масле
для предотвращения окисления и загрязнения, особенно при длительных
сроках хранения, превышающих 5—6 мес.
Области применения
Лантан и его соединения находят применение в электронной технике в
качестве геттеров, постоянных магнитов и т. д.
Сплав лантана с алюминием G2 % La) характеризуется высокой
скоростью поглощения СО и N2. Малая активность этого сплава по от-
отношению к водороду позволяет использовать его в качестве геттера в
водородных тиратронах, где необходимо максимальное поглощение всех
газов, за исключением водорода. Перспективным материалом для ка-
катодов электронных приборов является гексаборид лантана, характери-
характеризующийся малой работой выхода и способностью к автоэлектронной
эмиссии.
В электронике и плазменной технике применяют катоды из лантани-
рованного вольфрама. Добавка лантана к вольфраму понижает рабо-
рабочую температуру катода, а в плазмотронах обеспечивает стабильность
горения дуги.
Фторид лантана является хорошей матричной решеткой, т. к. прозра-
прозрачен для излучения от ультрафиолетовой области до инфракрасной.
Перспективным материалом для твердотельных лазеров является
окись лантана, вещество химически стойкое, тугоплавкое и с хорошими
оптическими свойствами. Удается улучшить оптические свойства моно-
монокристаллов рубина путем добавления в расплав ионов лантана [до
1,5 % (по массе)].
Соединение LaNi5—перспективная основа для разработки аккуму-
аккумуляторов водорода, что очень важно в связи с энергетической и эколо-
экологической проблемами. Одна молекула этого соединения может погло-
поглощать шесть атомов водорода.
10.2. ЦЕРИЙ [1—35, 150, 245, 312, 314, 315]
Церий (Се) — металл серебристо-белого цвета, быстро корродирующий
в сухом и влажном воздухе с образованием пленки. Церий кальциетер-
мический трех марок: ЦеМ—1, ПеМ—2 и ПеМ—3 выпускается по ТУ
48—4—216—72:
Марка ЦеМ—I ЦеМ—2 ЦеМ—3
Содержание суммы других
РЗМ (La, Nd, Sm), % не бо-
более ..... 0,10 0,20 0,50
554
Содержание прочих
руемых примесей, %,
Fe
Са
Си
Та, Мо или Nb . ,
контроли-
контролине более:
0,01
0,01
0,01
0,02
0,01
0,03
0,01
0,20
Продолжение
0,02
0,03
0,05
0,30
Металл может поставляться также при суммарном содержании осталь-
остальных РЗМ не более 0,01 % При поставке каждый слиток церия упако-
упаковывают в промасленную бумагу и помещают в двойной полиэтиленовый
пакет, который заваривают. Транспортировку производят в деревянных
ящиках крытым транспортом.
Физические свойства
Атомные характеристики. Атомный номер 58, атомная масса 140,12
а. е. м., атомный объем 20,69-10~e м3/моль, атомный радиус 0,1824 нм.
Ионный радиус Се3+ 0,102 нм, Се4+ 0,088 нм.
Электронная конфигурация внешних электронных оболочек изолиро-
изолированного атома церия: 4s2p6d10fI5s2p6d'6s2.
Потенциалы ионизации атома / (эВ): 5,65; 10,85; электроотрицатель-
электроотрицательность 1,2.
У церия четыре модификации: а, {$, y и б. а-модификация (низко-
(низкотемпературная) имеет г. ц. к. решетку с а=0,485 нм; ^-модификация
(промежуточная)—г. п. у. решетку (а=0,3673 нм, с= 1,1802 нм); у-мо-
дификация имеет г. ц. к. решетку с а=0,51606 нм (координационное
число 12); высокотемпературная б-модификация— о. ц. к. решетку с
а=0,411 нм. При охлаждении ниже 0°С высокотемпературная у-Фаза
церия с г. ц. к. решеткой переходит частично в E-фазу с гексагональной
решеткой и при дальнейшем охлаждении — в а-фазу с г. ц. к. решеткой.
При этом количество E-фазы при комнатной температуре увеличивается
в результате многократного аз*{$-превращения. Энергия кристалличе-
кристаллической решетки 356,1 мкДж/кмоль.
Церий имеет 4 стабильных и 12 искусственных изотопов. Природный
церий состоит из следующих изотопов. 136Се @,193%), 138Се @,25%),
140Се (88,48%), 142Се A1,07%). Изотопный состав церия:
Массовое
число
131
133
134
135
137
139
Период
полураспада
570 с
5,4 ч
70 ч
17 ч
8,7 ч
140 сут
Тип
превращения
§+, К-з
В+, К-з*
К-з
8+, К-з
К-з
К-з
Массовое
число
141
143
144
145
146
Период
полураспада
32,5 сут
33,4 ч
275 сут
180 с
660 с
Тип
превращения
>
5-
5-
5-
$-
* К-з — /С-захват.
Эффективное поперечное сечение захвата тепловых нейтронов церия
0,7-10~28 м2. Работа выхода электронов ф=2,84 эВ.
555
Плотность. Плотность \-Се р=6,76 Мг/м3, плотность а-, р- и 6-Се:
8,23, 6,66 и 6,70 Мг/м3 соответственно.
Электрические и магнитные. Удельное электрическое сопротивление
р н удельная электрическая проводимость ст церия чистотой 98 %:
Г, К • 24 298 1043
р, мкОм-м. . . . 0,34 0,753 1,23
а, МСм/м .... 2,94 1,33 0,81
Температурный коэффициент электрического сопротивления в темпе-
температурном интервале 273—373 К а=0,9.10-3 К. Изменение удельного
электрического сопротивления при плавлении рж/Ртв=1,Ю.
Церий — парамагнетик. Магнитная восприимчивость при 293 К %=
=+17,30-10-9.
Температура перехода из парамагнитного в магнитоупорядоченное
состояние (точка Нееля) 7V=12,5 К.
Постоянная Холла у-Се /?= + 1,92- К)-10 м3/Кл.
Т. э. д. с. Ев паре с медью:
Т, К • • 302,2—322,2 293—373 303—424 303—473,5
Е, мВ . 0,075 0,256 0,387 0,502
Тепловые и термодинамические. Температура плавления церия со-
составляет /Пл = 798°С, температура кипения /Кип=3257 °С, характеристи-
характеристическая температура 9d=138 К, удельная теплота плавления ДЯПЛ =
=37 кДж/кг, удельная теплота испарения Д#Исп=3105 кДж/кг, удель-
удельная теплота сублимации ДЯс>бл = 3337 кДж/кг.
> Тепловые характеристики полиморфных превращений:
Переход t, °C Теплота перехода, кДж/кг
а->Р —168 26,3
—23 1,94
726 20,93
Молярная энтропия s° церия при различных температурах:
Г, К 298 500 1000 1500
s\ Дж/(моль-К) • 69,62 85,31 110,21 133,72
Продолжение
Т, К 2000 2500 3000
s°, Дж/(моль-К) • 143,39 160,84 156,95
Церий, наряду с лантаном и празеодимом, имеет среди редкоземель-
редкоземельных металлов наиболее низкое значение давления пара р при темпера-
температурах, близких к температуре плавления:
Г, К ... 1273 1373 1473 1573 1673
р, Па . . . 0,99- 10—* 1,22-10-? 10,5- 10—3 7-10-» 3,7-10-1
Продолжение
Г, К ... 1773 1873 1973 2073 2173
р, Па ... 1,6 6,10 19,7 56,9 153
Для у-Се удельная теплоемкость ср = 193 Дж/(кг-К) удельная
электронная теплоемкость СрЛ = [7,5 мДж/(моль-К2)] -Т. Теплопровод-
Теплопроводность церия в интервале 299—303 К k=»10,88±l,25 Вт/(м-К).
Значение температурного коэффициента линейного расширения церия
при 298Ка=8,5-10-6К-1, а при 673 К 6,7-10-» К.
556
Энергия дефектов упаковки г. ц. к. решетки церия 5 мДж/м2.
Параметры самодиффузии церия (по объему зерна) в интервале
805—1044 К: предэкспоненциальный множитель D0=7,8-10-7 м2/с; энер-
энергия актипации £ = 85,7 кДж/моль.
Механические свойства
Твердость церия при комнатной температуре НВ=245,3 МПа.
Механические свойства церия при комнатной температуре: ств=
= 117,7—147 МПа, 0О,2=78—98 МПа, 6=30—35 %.
Ударная вязкость церия при комнатной температуре KCU = 29,9
кДж/м2.
Упругие характеристики церия (температура 20°С): модуль нор-
нормальной упругости Ё=30 ГПа, модуль сдвига G=12 ГПа, коэффициент
Пуассона v=0,248, сжимаемость х = 4,17-10-" Па-1.
Химические свойства
В соединениях проявляет степень окисления +3 и* +4. Церий образует
прочные оксиды Быстро окисляется (/„л = 1690°С, /кип=3500°С) в су-
сухом и влажном воздухе с образованием Се2О3. При температурах выше
180—200 °С Се2О3 окисляется до СеО2 (/„л=2727 °С). Предполагается
существование СеО. При взаимодействии с водородом в температурном
интервале 250—300 °С образуется гидрид. Давление диссоциации СеН*:
lgPW2 =8,68—10920// E00—750 СС). Пределы растворимости [Н] v.Ce:
lgCmax=2,8—1560# E50—650°С). При 200°С церий взаимодействует
с галогенами. Карбиды церия образуются при 1600 °С. Они неустойчивы
во влажном воздухе- СегСз (о. ц. к., <Пл>700°С) и СеСг (тетрагональ-
(тетрагональная, о. ц. к., /пл = 2300°С). Церий активно взаимодействует с азотом.
При 750—1000 "С образуются тугоплавкие нитриды. Взаимодействие с
серой приводит к образованию жаростойких и химически прочных суль-
сульфидов. Цернй разлагает воду с выделением водорода, растворяется в
соляной, серной н азотной кислотах. Мало растворим в плавиковой
(фтористоводородной) и фосфорной кислотах вследствие образования
защитной пленки. Церий, как и другие лантаноиды, пирофорный ме-
металл
Церий образует химические соединения с металлами IB группы
(СеСи4, СеСив, CeAg, CeAg2, CeAgs). Предполагают, что с металлами
IA группы церий, как и другие Р.З.М не взаимодействует как в жид-
жидком, так и в твердом состоянии.
Ряд соединений образуется при взаимодействии церия с элементами
II группы — цинком, кадмием, магнием, а также с элементами III груп-
группы — алюминием, бором, галлием, индием, таллием и др. Интересно
отметить, что при взаимодействии церия с другими Р.З.М, несмотря на
близость физико-химических свойств этих элементов, во многих систе-
системах наблюдается образование промежуточных фаз, ограниченная рас-
растворимость в твердом состоянии, эвтектоидные превращения.
Системы церия с тугоплавкими металлами IVA—VIA групп характе-
характеризуются наличием областей несмешиваемости в жидком состоянии,
отсутствием промежуточных фаз и ограниченной растворимостью в
твердом состоянии. Ограниченной растворимостью в жидком и твердом
состояниях и отсутствием металлических соединений характеризуется
система церий — уран. Церий неограниченно растворим в жидком плу-
плутонии и образует широкие области твердых растворов на основе е и
557
б-плутоиия. Неограниченной растворимостью в жидком и твердом со-
состояниях характеризуется и система Се—Th.
Церий не образует металлических соединений с марганцем, технеци-
технецием и рением, причем с марганцем установлена область несмешиваемости
в жидком состоянии.
В отличие от лантана церий образует с железом два металличе-
металлических соединения.
Взаимодействие церия с остальными металлами VIII группы Перио-
Периодической системы также характеризуется образованием нескольких ме-
металлических соединений.
Технологические свойства
Церий — ковкий и вязкий металл, хорошо обрабатывается давлением,
может деформироваться при комнатной температуре.
Способность церия к пластической деформации определяется в зна-
значительной мере степенью его чистоты. Для получения различных полу-
полуфабрикатов в виде прутков, проволоки, ленты используется церий, очи-
очищенный одно- или двухкратной дистилляцией с последующим электрон-
электроннолучевым переплавом. Высокая активность церия к компонентам
воздуха, особенно его сильная окисляемость, позволяет проводить об-
обработку давлением в вакууме или в атмосфере инертных газов (аргон,
гелий). Прессованием в стальных контейнерах исходных заготовок диа-
диаметром 10—20 мм могут быть получены прутки диаметром 1—5 мм.
Температура нагрева исходных заготовок 300—450 "С.
Для получения проволоки или ленты в процессе холодной деформа-
деформации необходимы промежуточные отжиги в инертной среде для снятия
наклепа. Так же как и лантан, церий характеризуется интенсивным на-
наклепом в процессе пластической деформации. Поэтому суммарная де-
деформация между промежуточными отжигами не должна превышать
25—30 %, а деформация за один проход — 5—б %• При получении про-
проволоки заготовки прокатывают предварительно в ручьевых валках, а
затем протягивают через фильеры. Получаемые изделия сохраняют тех-
технологическую пластичность, позволяющую изгибать их, свертывать в
спираль и т. д.
Области применения
В лазерной технике в качестве матричных решеток используется фто-
фторид трехвалентного церия. Диоксид церия нашел применение в твердо-
твердотельных лазерах, благодаря высокой химической стойкости, тугоплав-
тугоплавкости и хорошим оптическим свойствам. Применение оксидов церия,
а также других оксидов РЗМ позволило увеличить мощность твердо-
твердотельных лазеров непрерывного излучения.
Церий является компонентом различных геттерных материалов, под-
поддерживающих в электровакуумных приборах заданное остаточное дав-
давление и необходимый химический состав рабочей атмосферы. В качестве
активаторов стартеров тлеющего разряда вместо магния использовали
сплав церия с 20 % иттрия, что увеличило срок службы стартеров с
6000 до 15000 включений, обеспечивая высокую стабильность электри-
электрических параметров в течение всего срока службы стартеров. Предпола-
Предполагаются и другие композиции активаторов с участием церия.
Добавки церия и мишметалла оказывают эффективное модифициру-
модифицирующее воздействие на структуру чугуна, стали, сплавов цветных метал-
металлов на основе алюминия, магния, меди, титана, повышают их техноло-
технологическую пластичность, увеличивают выход годной продукции.
658
Добавки мишметалла (менее 1 %) к алюминиевым сплавам повы-
повышают их временное сопротивление на разрыв, жаростойкость, сопротив-
сопротивление вибрации, не увеличивая при этом электросопротивления, повы-
повышают технологическую пластичность этих сплавов. В США из этих спла-
сплавов изготавливают провода для линий электропередач.
Литейные алюминиевые сплавы с добавками церия и мишметалла
характеризуются высокими прочностными свойствами, высоким сопро-
сопротивлением износу и находят применение в автомобильной промышлен-
промышленности для изготовления деталей двигателей.
В СССР и за рубежом разработано большое количество магниевых
сплавов, содержащих добавки РЗМ, главным образом лантана, церия
и неодима. Основное назначение этих добавок — повышение прочност-
прочностных свойств при комнатной и повышенных температурах. Добавки це-
церия в сплавы МА8, МА20 повышают их прочность, пластичность, тех-
технологичность. Эти сплавы легко прокатываются в листы, хорошо сва-
свариваются. Сплавы магния с церием характеризуются одним из наибо-
наиболее низких коэффициентов затухания ультразвука и поэтому могут
использоваться как звукопроводные материалы.
Для крекинга нефти выпускаются катализаторы, исходным материа-
материалом для получения которых служит смесь хлоридов, содержащая окси-
оксиды церия, лантана, неодима и других РЗМ.
10.3. ПРАЗЕОДИМ [1—35, 150, 245, 312, 314, 315]
Празеодим (Рг) — металл белого цвета, тускнеющий на воздухе в ре-
результате образования оксидной пленки. Промышленностью выпускается
празеодим кальциетермический трех марок ПрМ—1, ПрМ—2 и ПрМ—3
по ТУ 48—4—215—72:
Марка ПрМ—1 ПрМ—2 ПрМ—3
Содержание суммы других
РЗМ (La, Ce, Nd), % не более 0,20 0,80 1,80
Содержание прочих контроли-
контролируемых примесей, % не более:
Fe 0,01 0,01 0,02
Са 0,01 0,03 0,03
Си 0,01 0,01 0,05
Та, Мо или Nb 0,02 0,20 0,30
Применяя многократную дистилляцию, дуговую или электроннолучевую
плавки, удается повысить чистоту металла до 99,99 %. Празеодим вы-
выпускают в виде слитков. Каждый слиток упаковывают в промасленную
бумагу и помещают в двойной полиэтиленовый пакет, который завари-
заваривается. Доставку осуществляют крытым транспортом. Гарантийный срок
хранения металла — 6 мес.
Физические свойства
Атомные характеристики. Атомный номер 59, атомная масса 140,907
а. е. м., атомный объем 20,81 -10-' м3/моль, атомный радиус 0,1828 нм,
ионный радиус Рг3+ 0,100 нм.
Электроотрицательность 1,2.
Электронная конфигурация атома празеодима: 4s2pedI0/25s2p6d16s2.
Потенциалы ионизации / (эВ): 5,42 и 10,55.
559
Празеодим существует в двух модификациях: низкотемпературная
а-фаза с г. п. у. решеткой (а=0,3664 нм, с— 1,1807 нм, с/а=3,222, коор-
координационное число 6, 6, энергия кристаллической решетки 354,7 мкДж/
/кмоль) и высокотемпературная Рфаза с о. ц. к. решеткой (а=0,413 им,
координационное число 8).
Празеодим имеет один стабильный изотоп 141Рг. Сведения о наибо-
наиболее распространенных радиоактивных изотопах приведены ниже:
Массовое
число
140
142
143
* К-з-
Период
полураспада
210 с
19,1 ч
13,5 сут
/С-захват.
Характер
излучения
Р+, К-з*
Массовое
число
144
145
146
Период
полураспада
17,5 МИН
6 Ч
24,6 мин
Характер
излучения
д
р
Эффективное поперечное сечение захвата тепловых нейтронов со-
составляет у празеодима 11 -10~28 м2. Работа выхода электронов <р =
= 2,7 эВ. -
Плотность. Плотность а-Pr рентгеновская р=6,782 Мг/м3; плотность
пикнометрическая р=6,47 Мг/м3. Плотность {S-Pr рентгеновская при
1087 К р=6,64 Мг/м3.
Электрические и магнитные. Удельное электрическое сопротивление
р и удельная электрическая проводимость а празеодима чистотой
99,7%:
Г, К ...
р, мкОм-ч .
а, МСм/м .
0
43
5
,024
,6
0
7
25
,130
,8
50
0,26
3,85
100
0,40
2,5
150
0,50
2,0
300
0,70
1,42
1093
1,32
0,76
Температурный коэффициент электросопротивления в интервале
273—373 К оо= 1,71 • Ю-3 К"- Изменение удельного электрического со-
сопротивления при плавлении рж/р1В=1,12.
Празеодим — сильный парамагнетик. Магнитная восприимчивость
а-Pr х= +37,80- Ю-9
Закон Кюри—Вейсса для празеодима выполняется только в интерва-
интервале от 77 до 503 К-
Постоянная Холла R= +0,709-10-10 м3/Кл.
Тепловые и термодинамические. Температура плавления празеодима
составляет ^пл=931 °С, температура кипения /Киа=3212°С, характерис-
характеристическая температура 8D=138 К, удельная теплота плавления ЛЯПЛ =
«=49,12 кДж/кг, удельная теплота сублимации АЯсубл=2523 кДж/кг.
Температура ?а_р=795°С, ДЯа_9.р=22,6 кДж/кг.
Молярная энтропия s° празеодима при различных температурах:
Т. к
298
500
1000
1500
Дж/(моль.К)
73,01
87,62
110,25
133,64
Т, К
2000
2500
3000
Дж/(моль-К)
143,25
150,75
156,82
560
Давление пара р в зависимости от температуры:
Г, К р. Па Г, К Р, Па
1273
1373
1473
1573
1673
0,526-
0,507-
0,279-
0,199
0,891
10-3
Ю-2
10-1
1773
1873
1973
2073
2173
3,87
0,11-102
0,325-102
0,854-10?
0,207.103
Удельная теплоемкое^ празеодима ср=191 Дж/(кг-К), удельная
электронная теплоемкость с рЛ=|7,28 мДж/(моль-К2)]-Г-
Теплопроводнос1ь а-Рг при 293 К а=13,2 Вт/(м-К)-
Температурный коэффициент лит много расширения а-Рг при 298 К
а=6,79±0,6-10~6 К, на монокристалле проявляется резкая анизотро-
анизотропия этого свойства Температурный коэффициент линейного расширения
при 673 К вдоль оси а равен 4,5-10~6 К, а вдоль оси с а=П,ЗХ
хю-« к-1.
Параметры самодиффузии (J-Pr (по объему зерна) при температурах
>1123 К- предэкспоненциальный множитель D0=5,8'10~4 м2/с; энергия
активации, Е— 169,5 кДж/моль.
Параметры взаимной диффузии
Криста ллическа я
решетка
гц.к.
г.ц.к.
О.Ц.К.
Диффунди-
Диффундирующий
эл ечепт
Со
Аи
Аи
Интервал Темпе-
Температур, К
743—1193
743—1193
£>„-10« М2/С
4,7
4,3
3,3
Е, кДж/моль
76,2
82,1
83,8
Механические свойства
Механические свойства празеодима прн комнатной температуре: твер-
твердость НВ=392 МПа предел текучести 0Oi2 = 98,l МПа, временное соп-
сопротивление разрыву 0В=111,7 МПа, удлинение 6 = 12%, ударная вяз-
вязкость KCU=64,5 кДж/м2.
Празеодим характеризуется следующими упругими свойствами прн
20 °С: модуль нормальной упругости £=32,6 ГПа, модуль сдвига G=>
= 13,5 ГПа, коэффициент Пуассона v = 0,305, сжимаемость х = 3,27х
X10-fi Па-1.
Химические свойства
В соединениях проявляет степень окисления +3.
Разлагает воду и растворяется в соляной, серной и азотной кислотах.
Слабо растворим в плавиковой и фосфорной кислотах благодаря обра-
образованию иа поверхности металла защитных пленок фторидов и фос-
фосфатов.
Празеодим быстро корродирует на воздухе, особенно активное окис-
окисление начинается при температурах выше 200 °С. Оксиды празеодима:
РГ2О3 с гексагональной решеткой типа ЬагОз или о. ц. к. решеткой типа
МпгОз (температура плавления 1400°С); оксиды Pr^u. PrOi,778, РгОьвоо,
Pri,8i8 с о. ц. к. решеткой типа Мп2Оз, РгвОц и РгОг с г. ц. к. решеткой
типа CaFb Празеодим поглощает водород при комнатной температуре.
Этот процесс значительно активируется при нагревании до 250—300 °С,
561
при этом происходит заметное увеличение объема металла. Пределы
растворимости водорода: при 650°С—16,5% (ат), при 850°С—
33% (ат.). Давление диссоциации PrH* : lg РНг = 8,11—10446//
F00-—800 °С). При нагревании до 900 °С празеодим взаимодействует с
азотом с образованием нитрида —хрупкого аморфного вещества черного
цвета, разлагающегося водой. С углеродом празеодим при нагревании
образует карбиды: РгС2 (тетр. о. ц. к., типа СаС2, ?пл = 2535°С, Рг2С3
(о. ц. к., тип U2C3). Характер взаимодействия празеодима с простыми
и переходными металлами Периодической системы аналогичен церию.
Технологические свойства
Празеодим высокой чистоты достаточно пластичен и может быть под-
подвергнут обработке давлением, как лантан и церий. При токарных ра-
работах скорость вращения патрона или сверла не должна превышать
60 об/мин во избежание перегрева металла.
Области применения
Празеодим применяется в производстве специальных стекол, художест-
художественного стекла, эмалей, глазурей. Присадка празеодима к керамике при-
придает ей приятный желтый цвет. Оксид празеодима входит в состав сте-
стекол с повышенными цветовыми и оптическими характеристиками, имити-
имитирующих драгоценные камии — александриты, аметисты, топазы,
хризолиты, рубины и др. Оксиды празеодима выпускают четырех марок:
ПО—0, ПО—1, ПО—2, ПО—3 с содержанием основного вещества соот-
соответственно 99,9; 99,5; 99,95 % (не менее).
Оксид празеодима используется в качестве исходного материала для
катализаторов со структурой молекулярных сит для крекинга нефтн.
Оксид празеодима оказывает влияние на низкотемпературное окисление
аммиака.
Празеодим используется в качестве модифицирующей и легирующей
добавки к некоторым маркам стали, а также сплавам на основе цвет-
цветных и тугоплавких металлов.
10.4. НЕОДИМ [1—35, 150, 165, 245, 312, 314]
Неодим (Nd) ■— металл белого цвета с желтоватым оттенком. Неодим
кальциетермический выпускается по ТУ 48-—4—205—72 трех марок:
Марка НМ—1 НМ—2 НМ—3
Содержание суммы других РЗМ
(Pr, La, Се, Sm), % не более . . 0,10 0,50 1,80
Содержание прочих контролируе-
контролируемых примесей, % не более:
Fe 0,01 0,01 0,05
Са 0,01 0,03 0,10
Си 0,01 0,05 0,05
Та, Мо или Nb 0,02 0,20 0,30
Многократной дистилляцией и последующими вакуумной дуговой или
электроннолучевой плавками может быть получен неодим чистотой
99,99 %• Неодим выпускают в виде слитков. Каждый слиток неодима
упаковывают в промасленную бумагу и и в двойной полиэтиленовый па-
пакет, который заваривают. Гарантийный срок хранения упакованных
Б62
слдтков неодима—6 мес. В компактном виде хранение и работа с нео-
неодимом не представляют опасности. Следует избегать контакта металла
с влагой.
Физические свойства
Атомные характеристики. Атомный номер 60, атомная масса 144,24
а. е. м., атомный объем 20,59-10~в м3/моль; атомный радиус 0,1822 нм,
ионный радиус Nd3+ 0,099 нм.
Электронная конфигурация внешних электронных оболочек изолиро-
изолированного атома неодима: 4s2perf10/35s2perf16s2.
Потенциалы ионизации / (эВ): 5,49 и 10,73; электроотрицатель-
электроотрицательность 1,3.
Неодим — полиморфный металл. Его низкотемпературная ое-моди-
фикация имеет г. п. у. решетку с параметрами: а = 0,3659 нм, с=
= 1,1799 им, с/а—1,6122, энергия кристаллической решетки 364,7
мкДж/кмоль. Координационное число 6; 6. Высокотемпературная Р-мо-
дификация имеет о. ц. к. решетку с а = 0,413 нм. Координационное чис-
число 8.
Неодим имеет 7 стабильных изотопов: 142Nd B7,09 %), 143Nd
A2,14%), 144Nd B3,83 %), 145Nd (8,29 %), I46Nd A7,26 %), 148Nd
E,74 %) и 150Nd E,63 %). Искусственным путем получены следующие
радиоактивные изотопы:
Массовое
число
137
138
140
141
Период
полураспада
3300 с
1320 с
3,3 сут
2,42 ч
• К-з—К-захват.
Характер
излучения
и
Р+; АГ-з*
Р+; АГ-з
Массовое
число
147
149
151
П ериод
полураспада
11,9 сут
1,8 ч
720 с
Характер
излучения
Р-
Эффективное поперечное сечеиие захвата тепловых нейтронов
48-Ю-28 м2.
Работа выхода электронов ср=3,3 эВ.
Плотность. Плотность (рентгеновская) a-Nd p = 7,003 Мг/м3, p-Nd
р=6,80 Мг/м3. Плотность a-Nd (пикнометрическая) р = 6,908 Мг/м3.
Электрические и магнитные. Удельное электрическое сопротивление р
и удельная электрическая проводимость а неодима чистотой 99,8 %:
Г, К ...
р, мкОмм.
о, МСм/м .
23
0,15
6,67
293
0,64
1,56
673
1,02
0,975
873
1,16
0,865
1173
1,38
0,726
Температурный коэффициент электрического сопротивления в интер-
интервале 273—373 К а=1,64-10-3 К.
Постоянная Холла при комнатной температуре /?== + 0,97.10~10
м3/Кл.
Неодим — парамагнетик. Его магнитная восприимчивость / =
= +39,20-Ю-9.
563
Точка Нееля (температура перехода от парамагнитного к магнито-
упорядоченному состоянию) 7V = 20 К-
Тепловые и термодинамические. Температура плавления (Пл =
= 1016°С, температура кипения (кип = 3127 °С. Характеристическая тем-
температура 9D= 138 К. Удельная теплота плавления ДЯПЛ = 49,52
кДж/кг, удельная теплота сублимации АЯоубл=2271 кДж/кг.
Температура полиморфного превращения 855 СС, теплота полиморф-
полиморфного превращения 20,66 кДж/кг.
Давление пара р неодима:
т. к
1237
1373
1473
1573
1673
0,
0,
0,
0,
0,
Р, Па
201-Ю-2
157-10-1
901-Ю-1
316
123-101
Г, к
1773
1873
1973
2073
2173
Р, Па
0,543-101
0,157-Ю2
0,412-102
0,988-10*
0,216-103
Температурный коэффициент линейного расширения неодима при
298 К а=9,98-10~6. Для монокристалла a-Nd наблюдается сильно вы-
выраженная анизотропия коэффициента термического расширения. При
673 К вдоль оси а а=6,5-10-6, а вдоль оси с a=ll,7-10~" К.
Теплопроводность a-Nd в интервале 299—303 К Я= 12,96 ±1,25
Вт/(м-К).
Удельная теплоемкость неодима с„ = 1,90 Дж/(кг-К), удельная
электронная теплоемкость СрЛ=[8,57 мДж/(моль-К2)]-7\
Механические свойства
Твердость НВ неодима, как и других редкоземельных металлов, зави-
зависит от содержания примесей:
Nd,
НВ,
% • •
МПа .
98
491
99
313,9
99
196
,6
,2
Твердость монотонно понижается с повышением температуры.
Механические свойства неодима чистотой 99% при 298 К: о0г—
= 158,9 МПа, 0„=183 МПа, 5=12,4%, KCU=142,2 кДж/м*.
Упругие свойства неодима: модуль нормальной упругости £ =
=38 ГПа, модуль сдвига G = 14,51 ГПа, коэффициент Пуассона v=
= 0,306, сжимаемость х = 3,06-10-и Па-».
Химические свойства
В соединениях проявляет степень окисления +3.
По отношению к кислотам и другим реагентам неодим ведет себя
аналогично лантану, церию и празеодиму. Но на воздухе окисляется
значительно меньше, чем лантан и церий, т. к. покрывается пленкой
оксидов, предохраняющей от дальнейшего окисления. Образуется оксид
Nd2O3 (/Пл = 2315 °С). Максимальная растворимость водорода состав-
составляет: lgcmax=2,5—1265//. С водородом неодим образует гидрид —
NdH3 с серой сульфид Nd2S3. Давление диссоциации РгН*: 7,25—9796//
F00—800°С). При 900"С неодим реагирует с азотом и образует
нитрид.
В результате нагрева в углеродсодержащей среде образуется кар-
карбид неодима NdC2.
564
Общий характер взаимодействия неодима с простыми и переходны»
ми металлами аналогичен церию и празеодиму.
Технологические свойства
Неодим высокой чистоты хорошо деформируется при комнатной тем-
температуре (до 70 °/о обжатия без разрушения). Промежуточные отжиги
в вакууме или атмосфере инертных газов позволяют повысить дефор-
деформируемость неодима. Получение ленты и проволоки из неодима осуще-
ставляется путем предварительного прессования, прокатки в гладких
или ручьевых валках и волочения. Температура рекристаллизации нео-
неодима чистотой 99,5 % не превышает 500 °С. Отжиг в течение 1 ч при
500 °С „снимает наклеп и устраняет текстуру деформации. При 700 °С
наблюдается интенсивный рост зерен.
Области применения
В составе мишметалла неодим используется как легирующая и моди-
модифицирующая добавка некоторых марок сталей. Известно благоприятное
влияние неодима на механические свойства магниевых сплавов. По
сравнению с лантаном, церием, празеодимом неодим наиболее эффек-
эффективно повышает сопротивление ползучести и пластичность. Одновремен-
Одновременно резко возрастает прочность магниевых сплавов при комнатной тем-
температуре и жаропрочность Неодим используют также как легирующую
добавку к алюминиевым сплавам. В жидком состоянии неодим приме-
применяют для экстракции плутония из жидкого урана.
Неодим используют для изготовления специальных стеклокерамиче-
ских глазурей. Кривая спектрального пропускания стекла, содержаще-
содержащего 4,3 % и более оксида неодима, аналогична кривой минерала александ-
александрита. Оксид неодима входит в состав стекол, имитирующих драгоцен-
драгоценные камни. Оксид неодима вместе с пятиокисью ванадия применяют
при изготовлении оптического стекла для фотометров, призм и т. д.
Оксид неодима является составным компонентом материала для ка-
катализаторов со структурой молекулярных сит, используемых для кре-
крекинга нефти.
Неодим находит применение в радиотехнической промышленности и
в производстве минеральных удобрений.
10.5. ПРОМЕТИИ П-35, 91]
Прометий (Рт) — радиоактивный металл, который был химически вы-
выделен в чистом виде из осколков деления урана. Выход изотопов 147Рт
и 149Рт при делении составляет 2,6 и 1,3 % соответственно. При су-
суточной работе реактора мощностью 100 МВт может быть получено
около 1,5 г осколочного прометия.
Прометий в виде изотопа 147Рт был получен в макроскопических
количествах из осколков уранового деления с помощью метода ионного
обмена и в хроматографнческих колоннах.
Физические свойства
Атомные характеристики. Атомный номер 61, атомная масса 147 а. е. м.
Ионный радиус Рт3+ 0,099 нм.
Электроотрицательность 1,3. Электронная конфигурация внешних элек-
электронных оболочек изолированного атома прометия: 4s2ptdl0fi5s2pedl6st.
565
Кристаллическая решетка — гексагональная (типа лантана) с перио-
периодами а=0,365 нм, с— 1,165 им, с/2а=1,60.
Наиболее распространенный изотопный состав прометия:
Массовое
число
141
142
143
144
146
Период
полураспада
204 с
19 ч
14 сут
1020 с
1440 С
Тип радиоак- | МассовОе
ТИВНОГО ЧИСЛО
распада
Р+, ЛГ-з*1
р-
г
147
148
148
149
Период
полураспада
720 С
120 с
42 сут
140 с
Тип радиоак-
радиоактивного
распада
$-
1-
• К-з—/(-захват.
Потенциалы ионизации атома прометия / (эВ): 5,55 и 10,90.
Работа выхода электронов ср=3,07 эВ.
Плотность. Плотность прометия (рентгеновская) р=7,26 Мг/м3, пик-
нометрическая р==7,22 Мг/м3.
Электрические и магнитные. Вычисленный магнитный момент изоли-
изолированного трехвалентного иона прометия ц,=2,68.
Тепловые и термодинамические. Температура плавления прометия
*пл=1080°С, температура кипения /Кип=2460°С1, удельная теплота
плавления Д#дл =56,02 кДж/кг, удельная сублимация Д#Субл =
=2400 кДж/кг.
Молярная энтропия s° в зависимости от температуры:
Т,К 298 500 1000 1500
s°, Дж/(моль-К) 72,01 86,57 108,45 132,38
Т.К. • . • • • 2000 2500 3000
5°, Дж/(моль-К) 142,01 149,46 154,73
Значение температурного коэффициента линейного расширения для
прометня а = 9-10-6 К.
Химические свойства
В соединениях проявляет степень окисления +3. По своим химическим
свойствам — типичный редкоземельный металл. Образует оксид РтгОз
с о. ц. к. решеткой типа МП2О3. Диаграммы состояния прометия с эле-
элементами периодической системы не изучены.
Области применения
Имеются данные об использовании 147Рт для атомных миниатюрных
батарей; 147Рт дает мягкое излучение, не требующее специальной за-
защиты, имеет период полураспада 2,7 года и дает 0-излучение в 0,22 МэВ,
что слабее радиевой смеси, нанесенной на некоторые светочувствитель-
светочувствительные приборы. Специалисты американских фирм разработали на его ос-
основе миниатюрную атомную батарейку, принцип действия которой за-
566
ключается в следующем: радиоактивное излучение улавливается фов<
фором, превращающим его в световую энергию, последняя воздействую*
на фотоэлемент и вызывает возникновение электрического тока.
Указывается, что такая батарея размером с канцелярскую кнопку имеет
ныходиую номинальную мощность в 20 МВт, нечувствительна к измене»
нню температуры, давления и других внешних воздействий. При повы-
повышенных температурах E24 °С) батарейка работает даже лучше, чем пря
комнатной температуре. Сообщается о возможности использования этих
батарей в полупроводниковых схемах, малогабаритных приемниках,
в аппаратуре, предназначенной для управляемых снарядов, для работы
на больших высотах и для океанографических исследований.
10.6. САМАРИЙ [1—35, 150, 162, 165, 312, 316]
Самарин (Sm) — металл серого цвета. Промышленностью выпускается
самарий лантанотермический по ТУ 48—4—207—72 трех марок: СмМ—1,
СмМ—2 и СмМ—3:
Марка СмМ—1 СмМ—2 СмМ—3
Содержание других РЗМ, %, не
более:
La 0,03 0,05 0,10
сумма Nd, Eu, Gd 0,10 0,20 0,50
Содержание прочих контролируе-
контролируемых примесей, % не более:
Fe 0,01 0,02 0,05
Са 0,01 0,01 0,02
Та, Мо или Nb 0,02 0,20 0,30
Самарий выпускают в виде слитков. Каждый слиток упаковывают в
двойной полиэтиленовый пакет, который заваривают. Гарантийный срок
хранения — 6 мес. Самарий при обычной температуре может хранить-
храниться на воздухе без образования оксидной пленки.
Физические свойства
Атомные характеристика. Атомный номер 62, атомная масса 150,35
а. е. м., атомный объем 19,95- 10~е м3/моль, атомный радиус 0,1802 им.
Ионный радиус Sm3+ 0,097 нм.
Электронная конфигурация внешних электронных оболочек атома
самария: 4s2p6dlt755s2p6rf16s2.
Потенциалы ионизации атома / (эВ): 5,63 н 11,07 эВ.
Электроотрицательность 1,3.
Самарий — полиморфный металл. Низкотемпературная а-модифика-
ция имеет ромбоэдрическую решетку с а = 0,3626 нм, с=2,618 нм,
с/а —1,6049. В усложненной гексагональной элементарной ячейке дли-
длина оси с в 4,5 раза превышает длину такой же осн в обычной гексаго-
гексагональной решетке, при этом соблюдается последовательность упаковки
АСАВСВСВАВА. Подобную кристаллическую структуру больше ие име-
имеет нн один элемент Периодической системы.
Р-модификация имеет о. ц. к. решетку (а=0,407 нм). Энергия кри-
кристаллической решетки 364,7 мкДж/кмоль.
567
В природе встречаются следующие изотопы самария:
Массовое число 144 147 148 149 150 152 154
Распространенность,
% 3,15 15,09 11,35 13,87 7,47 26,55 22,43
Искусственным путем получены следующие радиоактивные нзо-
топы:
Массовое
число
142
143
145
П ериод
полураспада
4380 с
540 с
340 сут
Характер
излучения
Р+; К-з*
Р+; К-з*
К-з
Массовое
число
146
151
Период
полураспада
7-Ю7 лет
80 лет
Характер
излучения
а
• /(-з — /(-захват.
Эффективное поперечное сечение захвата тепловых нейтронов 5600 X
X 10~28 м2. Значение поперечного сечеиия захвата может изменяться
для различных изотопов. Для 14eSm оно составляет E0000±20000) X
ХЮ-28 м2.
Работа выхода электрона самария ср=3,2 эВ.
Плотность. Плотность a-Sm p=7,537 Мг/м3, |5-Sm p=7,40 Мг/м3.
Плотность самария в зависимости от состояния металла (Мг/м3): ком-
компактного 7,499; переплавленного 7,509; возгонного 7,495.
Электрические и магнитные. Удельное электрическое сопротивление р
и удельная электрическая проводимость а самария чистотой 99,9%:
Т,К Р, мкОм-м с, МСм/м
73
123
293
0,52
0,74
1,05
1
1
0
,92
,35
,995
Температурный коэффициент электрического сопротивления в ин-
интервале 273—373 К сс=1,48-10-3 К.
Самарий — парамагнетик. Магнитная восприимчивость a-Sm % —
=8,49-Ю-9. Магнитный момент самария ц=1,74 мкВ. Точка Нееля
Ь=14 К. Коэффициент Холла при 298 К #=—0,2- Ю-10 м3/Кл.
Тепловые и термодинамические. Температура плавления самария
<пл=1073оС, температура кипения <кип= 1778°С, характеристическая
температура 9d=148 К, удельная теплота плавления ДЯПЛ =
=57,42 кДж/кг, удельная теплота испарения Д#Исп=1097 кДж/кг,
удельная теплота сублимации АЯсубл=1374 кДж/кг.
Температура полиморфного аз=ьр — перехода 855 °С, теплота пре-
превращения ДЯ о^р =20кДж/кг.
Молярная энтропия самария s° при различных температурах:
Т,К 298 500 1000 1500
s°. Дж/(моль-К) • • 68,12 82,72 104,98 128,70
т,к
Дж/(моль-К)
2000
240
2500
245,77
3000
250,38
568
Давление пара самария р=493 и 1330 Па при температуре 1273 и
1373 К соответственно.
Удельная теплоемкость при 273 К с,, = 1800 Дж/(кг-К); удельная
электронная теплоемкость с ^"=[11,5 мДж/(моль-К2)]-7'; теплопровод-
теплопроводность при 291 К Я=13,3 Вт/(м-К).
Среднее чначение температурного коэффициента линейного расшире-
расширения самария при 298 К а= 10,4- 10-в К.
Механические свойства
Механические свойства самария, как и других Р. 3. М. в значительной
степени определяются остаточным содержанием примесей.
Самарий чистотой 98,2 имеет ЯВ = 784,8 МПа, а чистотой 99,5% —
343—441,4 МПа.
Механические свойства самария чистотой 99,5 % при испытании на
растяжение: сг0,2 = 111,8 МПа, а„=123,6 МПа, 6=2,5 %, KCU=
= 17,2 кДж/м2.
Упругие свойства: модуль нормальной упругости £=34,13 ГПа, мо-
модуль сдвига 0=126,5 ГПа, коэффициент Пуассона v = 0,352, сжимае-
сжимаемость х=3,40-10-п Па-'.
Химические свойства
В соединениях проявляет степень окисления +2 и +3. Как и все РЗМ,
самарий активно взаимодействует с водородом, образуя гидриды SmH2
и SmH3. Давление диссоциации SmH* : \gP^ =6,496—9393// F00—
800 °С).
При взаимодействии с углеродом образуются карбиды SmsC (г. ц. к.
решетка), Sm2C3 (о. ц. к.), SmC2 (тетрагональная о. ц. к.). Известен си-
силицид SmSi2.
Самарий взаимодействует с азотом с образованием нитрида SmN.
С кислородом самарий образует оксид Sm2O3 (£Пл = 2320 °С, (Иип =
= 3527 °С). Известны оксиды SmO и SmO0,4. Окисление происходит при
нагревании, при комнатной температуре самарий ие окисляется.
По отношению к кислотам самарий ведет себя аналогично церию.
Установлено, что замена в соединении SmS 15—22 % (ат.) самария
атомами гадолиния и последующее охлаждение сульфида до —120 "С
приводит к разрушению кристаллов со взрывом. Природа взрыва свя-
связана с резким расширением кристаллической решетки. Характер взан-
мочейстпия самария с простыми и переходными металлами, полупровод-
полупроводниковыми элементами в основном аналогичен церию, празеодиму, нео-
неодиму.
Технологические свойства
Самарий высокой степени чистоты можно подвергать пластической де-
деформации при комнатной и повышенных температурах.
Области применения
Высокими магнитными характеристиками обладает соединение SmCo5:
точка Кюри, ГК=997К, намагниченность насыщения при комнатной
температуре составляет 0,9650 Тл, поле анизотропии — 16716—
23084 кА/м. SmCo5 используется в качестве мощных постоянных магни-
569
тов, коэрцитивная сила которых намного превышает коэрцитивную силу
других магнитов. Используется также в производстве ферритов — гра-
гранатов со специфическими магнитоэлектрическими свойствами.
Электроламповая промышленность выпускает в настоящее время
стартеры с самариевыми активаторами. Применение самариевых акти-
активаторов в 2,5—3 раза увеличивает срок службы и надежность работы
стартеров, значительно возрастает стабильность электрических пара-
параметров.
Работа нейтроиоактивационных детекторов основана на избиратель-
избирательном поглощении нейтронов определенной энергии изотопбм — мишенью,
помещенным внутри детектора.
Для нейтронных измерений изотопы РЗМ должны обладать боль-
большим сечением захвата нейтронов. Одним из таких материалов является
самарий. Его применяют также в производстве художественного стекла,
огнеупоров, катализаторов, керамических материалов.
10.7. ЕВРОПИЙ [1—35, 150, 162, 165, 312, 317]
Европий (Ей) — металл серебристо-белого цвета. Промышленностью
выпускается лантанотермнческнй европий по ТУ 48—4—217—72 трех
марок ЕвМ — ], ЕвМ — 2 и ЕвМ — 3:
Марка ЕвМ—1 ЕвМ—2 ЕвМ—3
Содержание суммы других РЗМ
(La, Nd, Sm и Gd), % не более 0,13 0,25 0,58
Содержание прочих контролируе-
контролируемых примесей, % не более:
Fe 0,01 0,02 0,05
Са 0,02 0,01 0,02
Си 0,01 0,01 0,02
Та, Мо или Nb 0,02 0,2 0,3
Европий выпускают в виде слитков. Каждый слиток европия упаковы-
упаковывают в промасленную бумагу и помещают в двойной полиэтиленовый
пакет. Гарантийный срок хранения упакованных слитков европия 3 мес.
Физические свойства
Атомные характеристики. Атомный номер 63, атомная масса
151,96 а.е. м., атомный объем 28,93-Ю-" м3/моль, атомный радиус
0,2041 нм, ионный радиус Еи3+ 0,097 нм; электроотрицагельность — 1,2.
Электронная конфигурация внешних электронных оболочек атома
европия: 4s2p6rf!0/65s2p6d16s2.
Потенциалы ионизации атома / (эВ): 5,63 н 11,07.
Европий имеет о. ц. к. решетку с а=0,4Б72 нм. Координационное
число 8. Энергия кристаллической решетки 364,7 мкДж/кмоль
Изотопы европия характеризуются высокими значениями эффектив-
эффективного поперечного сечения захвата тепловых нейгроиов:
Массовое число изотопа ... 151 152 153 154 155
Распространенность изотопов,
% 47,8 - 52,2 - -
Эффективное поперечное сече-
иие захвата тепловых нейтро-
нейтронов -Ю28 м2 , .,..», .9000 5500 420 15014000
570
Европий имеет среди Р. 3. М. наиболее низков значение работы вы-
выхода электрона ф=2,54 эВ.
Плотность. Плотность европия пикнометрическая р = 5,30 Мг/м3. Из-
Изменение плотности при плавлении европия 4,8 %.
Электрические и магнитные. Удельное электрическое сопротивление
р и удельная электрическая проводимость а европия:
Т,К 40 80 130 298
р, мкОмм 0,18 0,78 0,75 0,813
о МСм/м ..... 5,55 1,28 1,33 1,23
Наблюдается резкое изменение характера температурной зависимо-
зависимости электрического сопротивления и его уменьшение при переходе из
парамагнитною в антиферромагнитиое состояние (ШОК).
Температурный коэффициент электрического сопротивления в интер-
интервале 273—373 К а=4,80-10-3 К~!.
В температурном интервале 10—300 К абсолютный коэффициент
т. э. д. с. европия е изменяется от ■—7 до 25 мкВ/К. При этом на кри-
кривой температурной зависимости т. э. д. с. обнаружены два минимума:
при 20—25 и 88,8 К, которые связываются с наличием у европия анти-
антиферромагнитного превращения и влиянием растворенного водорода.
Европий — сильный парамагнетик. Значение его магнитной воспри-
восприимчивости при комнатной температуре %=+220-10~9.
Тепловые и термодинамические. Температура плавления европия
^пл = 822°С, температура кипения <Кип=1597°С, характеристическая
температура 0с =121 К, удельная теплота плавления АЯпл =
=60,77 кДж/кг, удельная теплота сублимации А#оубл=952 кДж/кг.
Молярная энтропия s° европия в зависимости от температуры:
Т,К 298 500 1000 1500
s", кДж/(моль-К) . . 71,23 85,476 106,55 129,60
Т,К 2000 2500 3000
s°, кДж/(моль-К) .... 228,65 233,59 238,24
Давление пара европия при 1273 К р=1333 Па; удельная теплоем-
теплоемкость европия ср=173 Дж/(кг-К); удельная электронная теплоемкость
с™ =[3,69 мДж/(моль-К2)]-Т.
Температурный коэффициент линейного расширения при 323 К а=
=331 -10-" К~!, в температурном интервале от —200 до +780 °С а=
=26- Ю-6 К.
Оптические. Отражательная способность (коэффициент отражения
по) европия в виде пленки толщиной 0,2 мкм:
Лт МКМ ^7~)* /о "* МКМ YI т\, /q
0,124
0,138
0,155
0,177
0,107
5
10
19
24
26
0,248
o,3ip
0,412
0,620
1,240
30
37
52
62
68
Механические свойства
Среди лантаноидов европий имеет минимальную твердость. Твердость
европия чистотой 98 % #В=98,1—147,1 МПа.
571
Химические свойства
В соединениях проявляет степень окисления +2 и +3.
Европий окисляется на воздухе и в воде. При этом образуются окси-
оксиды EuO, Eui6O2i, E113O4 и Еи2О3 (ГПл=2593 К). Стабильность низших
окислов дискуссионна. ЕигО3 характеризуется низкой работой выхо-
выхода — 2,6 эВ. Е113О4 имеет температуру плавления 2323 К, теплоту об-
образования Д#Обр = 3,93 кДж/моль
По отношению к кислотам европий ведет себя аналогично церию и
другим РЗМ.
Известен карбид европия EuCi «7±о,5 с тетраэдрической объемно-
центрироваиной решеткой типа СаС2.
При взаимодействии с водородом образуется ЕиН2 с орторомбиче-
ской решеткой, имеющий температуру плавления 826 °С.
Есть данные об образовании фосфида европия Еи3Р2, являющегося
ферромагнитным полупроводником с 7*=25 К-
Взаимодействие европия с элементами Периодической системы, в
том числе с простыми и переходными металлами носит такой же ха-
характер, как и с РЗМ.
Технологические свойства
Металлический европий настолько мягок, что его можно резать ножом
или бритвой. Из европия легко получают пруток или проволоку при
комнатной температуре. Но получение тонкой проволоки путем волоче-
волочения через фильеры вызывает большие трудности из-за низкого значе-
значения временного сопротивления разрыву.
Области применения
Благодаря большому эффективному поперечному сечению захвата теп-
тепловых нейтронов европий используют в материалах защитных экранов
для регулирующих стержней ядерных реакторов в виде порошкообраз-
порошкообразного оксида или металлокерамики из оксида на основе нержавеющей
стали. Регулирующие стержни, содержащие Еи2О3, используют со спе-
специальными покрытиями или в стальных оболочках.
Люминофоры цветных телевизоров на основе оксида иттрия активи-
активируются европием. Это повышает примерно иа 40 % яркость изображе-
изображения, позволяет лучше воспроизводить цветовые оттенки. Сообщается об
использовании европия для активации люминофоров из оксида гадо-
лииия.
Европий применяют в производстве магнитных сплавов, специальных
стекол, в медицине.
10.8. ГАДОЛИНИЙ [1—35, 150, 162, 312, 318]
Гадолиний (Gel) — металл серебристо-белого цвета. Выпускается гадо-
гадолиний кальциетермический трех марок по ТУ 48—4—210—72 ГдМ—1,
ГдМ—2 и ГдМ—3:
Марка ГдМ—1 ГдМ—2 ГдМ-3
Содержание суммы других РЗМ (Ей,
Sm, Tb, Y), % не более 0,1 0,08 1,3
572
Содержание
примесей, %
Fe . . .
Са . . .
Си ...
других контролируемых
не более:
0
0
0
,01
,01
,02
0
0
0
Продолжение
,03 0,04
,03 0,05
,2 0,3
Гадолиний выпускают в виде слитков, которые помещают в заваренные
полиэтиленовые пакеты. Срок хранения гадолиния 6 мес. Чистота гадо-
гадолиния может быть повышена многократной дистилляцией, электронно-
электроннолучевой плавкой.
Рекристаллизациониыми методами из высокочистого гадолиния, под-
подвергнутого предварительно дистилляции или электроннолучевой плавке,
могут быть получены монокристаллы.
Физические свойства
Атомные характеристики. Атомный номер 64, атомная масса
157,25 а. е. м., атомный объем 19,91 -10~6 м3/моль, атомный радиус
0,1801 им.
Иоииый радиус Gd+3 0,094 нм.
Электронная конфигурация внешних электронных оболочек свобод-
свободного атома гадолиния. 4s2jt>ed10f'5s2j06d'6s2.
Электроогрицательность 1, 3.
Потенциалы ионизации атома / (эВ): 5,98 и 12,1.
Гадолиний может существовать в двух модификациях: низкотемпе-
ра!урная а-модификация с г, п. у. решеткой (о=0,3634 им, с = 0,5781 нм,
с/о= 1,5910, координационное число 6; 6); высокотемпературная 0-мо-
дификация с о ц. к. решеткой (а = 0,406 нм, координационное число 8).
Энергия кристаллической решетки 364,7 мкДж/кмоль
Изотопный состав гадолиния:
Массовое
число изотопа
152
154
155
156
Распростра-
Распространенность. %
0,20
2,16
14,68
20,36
Массовое
число изотопа
157
158
160
Распространен
ность, %
15,64
24,96
22,01
Искусственным путем были получены следующие радиоактивные
изотопы .гадолиния:
Массовое
число
148
149
150
151
• К-з-
Период
полураспада
84 года
9 сут
2-10° лет
150 сут
/(■захват.
Характер
излучения
а
а; К-з*
а
а; К-з
Массовое
число
153
159
161
Период
полураспада
242 сут
18 ч
220 с
Характер
излучения
К-з
е-
Р-
573
Эффективное поперечное сечение захвата тепловых нейтронов
46000-Ю-28 м2. Эти значения могут изменяться для отдельных изото-
изотопов. Для 155Gd и 157Gd они составляют соответственно G0000±20000) X
ХМ-28 и A6000±6000).10-28 м2.
Работа выхода электрона составляет для гадолиния <р=3,07 эВ.
Плотность. Плотность (рентгеновская) a—Gd p = 7,886 Мг/м3, пикно-
метрическая р=7,96 Мг/м3.
Плотность fi = Gd р = 7,80 Мг/м3.
Электрические и магнитные. Удельное электрическое сопротивление
р и удельная электрическая проводимость а гадолиния чистотой 99,7 %:
Г, К 73 273 373
р, мкОмм . . . 0,37 1,43 1,50
а. МСм/м .... 2,7 0,70 0,668
Температурный коэффициент электрического сопротивления в интер-
интервале 273—373 К <х= 1,76- Ю-3 К-1.
У монокристаллов гадолиния удельное электрическое сопротивление
в значительной степени определяется кристаллографической ориентаци-
ориентацией. Удельное электрическое сопротивление, измеренное перпендикулярно
гексагональной оси рх = 139 мкОм-м, параллельно гексагональной оси
р ||=122 мкОм-м, коэффициент анизотропии рх/р ц =1,14.
Абсолютный коэффициент т. э. д. с. гадолиния е имеет отрицательное
значение и в температурном интервале 10—320 К изменяется в преде-
пределах от —1 до —6 мкВ/К.
Гадолиний — ферромагнетик. Магнитная восприимчивость при 293 К
Х=+2270-10~9. Как и для других РЗМ у гадолиния наблюдается силь-
сильная температурная зависимость магнитной восприимчивости, а в случае
монокристаллов проявляется и ориеитационная зависимость.
Точка Кюри гадолиния ГК=293,2К. Постоянная Холла прн комнат-
комнатной температуре #=0,95-10-!0 м3/Кл.
Тепловые и термодинамические. Гадолиний имеет температуру плав-
плавления ^пл = 1312°С, температуру кипения йшп=3233 °С, характеристи-
характеристическая температура 8ц = 155 К; удельная теплота плавления ДЯПЛ="
= 64,96 кДж/кг, удельная теплота сублимации Д#субл = 2,527 кДж/кг.
Молярная энтропия s° гадолиния в зависимости от температуры:
Г, К s°, Дж/(моль-К> Г, К s°, Дж/(моль-К)
298 65,98 2000 137,66
500 62,01 2500 145,10
1000 103,89 3000 151,21
1500 118,12
Температура полиморфного ссг*р превращения 1260 °С, удельная те-
теплота превращения ДЯа_^о=25 кДж/кг.
Давление пара гадолиния р:
Г, К Р, Па Г,К р. Па
1273 1,24-10—* 1773 5,69
1373 0,716-Ю-3 1873 3,0-10
1473 1,08-10—2 1973 1,30-102
1573 1,14-10-1 2073 4,96-10а
1673 0,901 2173 1,330-109
574
Удельная теплоемкость гадолиния ср=175 Дж/(кг-К); удельная
электронная теплоемкость с^= [9,2 мДж/(моль-К2I -Т.
Теплопроводность К монокристалла гадолиния в зависимости от
температуры:
Г, К 5 35
18,0
5
5
6,5
60
16,6
14,5
120
14,0
12,6
200
11,7
11,2
293
10,0
10,4
330
11,0
11,2
с, Вт/(М-К).
Я„а, Вт/(м-К). 6,5 17,5
Температурный коэффициент линейного расширения а поли- и моно-
монокристаллического гадолиния:
Г. К
298
673
Ось а
6,3
Ось с Средний а
8,28
13
8,9
Установлено, что для поликристаллического гадолиния а выше точ-
точки Кюри положителен, в точке Кюри и ниже ее до 220 К отрицателен,
а при более низких температурах снова положителен.
У монокристаллов гадолиния вдоль оси а в интервале температур
от 77 К до 298 К а положителен, вдоль оси с ниже 150 К он мал по
величине и тоже положителен, затем изменяет знак и резко возрастает
по абсолютной величине с температурой; минимальное значение а соот-
соответствует точке Кюри.
Механические свойства
Твердость НВ гадолиния зависит от степени его чистоты:
Gd, % 98 99 99,6
НВ, МПа . . . . 686,7 588,6 442
Твердость гадолиния в различных состояниях //6 = 510,1—637,7 МПа
(литой); ЯВ=951,6 МПа (кованый); ЯВ=559,2 МПа (отожженный).
Механические свойства гадолиния при 20 °С при растяжении: <т0 2=
= 182,5 МПа, <Тв=215,8 МПа, 6=10 %, KCU= 174,6 кДж/м2 (при 20°С).
Влияние температуры на механические свойства гадолиния:
Состояние
Литой
Кованый .
Температура 208 "С
ав, МПа
123,6
284,5
а02, МПа
107,9
206
о. %
6,8
4,2 .
Температура 420 °С
ав, МПа
96,1
132,4
°0,2' МПа
83,4
98,1
6. %
11,3
12,0
Временное сопротивление разрыву при сжатии <тв, сж=515 МПа.
Упругие свойства гадолиния: модуль упругости £ = 56,2 ГПа, модуль
сдвига G = 22,3 ГПа; %=2,6Ы0-п Па-1; коэффициент Пуассона v =
= 0,259.
Химические свойства
В соединениях проявляет степень окисления +3.
Гадолиний окисляется на воздухе. При длительном хранении на от-
открытом воздухе он постепенно тускнеет, покрываясь оксидной пленкой.
Известны оксиды гадолиния: Gd2O, GdO, Gd2O3 G„л =2395°С).
575
Прн взаимодействии с углеродом образуются карбиды: Gc^C, Gd3C,
Gd2C3) GdC2.
Гадолиний активно взаимодействует с водородом, образуя гидриды
GdH2 и GdHj. Предельная растворимость водорода в гадолинии при
650 °С составляет 25 % (ат.) при 800 °С — 30 % (ат.).
Характер взаимодействия гадолиния с другими элементами Периоди-
Периодической системы в основном аналогичен лаитану и другим лантаноидам.
Технологические свойства
Гадолиний характеризуется высокой технологической пластичностью.
Его можно обрабатывать давлением при комнатной температуре, ио
более предпочтительна горячая прркатка при 700—900 "С в защитных
оболочках. Гадолиний можно обрабатывать на токарных станках без
применения охлаждающих сред.
Области применения
Атомная энергетика является одной из перспективных областей приме-
применения гадолиния (регулирующие стержни в атомных реакторах, мате-
материалы защитных экранов).
В электронной технике используется для катодов борид гадолиния
GdB6. Применяется в производстве ферритов — гранатов для различ-
различных электронных приборов, обладающих специфическими магнитоэлект-
магнитоэлектрическими свойствами.
Перспективны магнитные сплавы гадолиния с железом, никелем и
магнием.
Гадолиний используют также в производстве специальных стекол,
катализаторов и для получения сверхнизких температур (благодаря его
высокой магнитной восприимчивости и высокой точке Кюри).
10.9. ТЕРБИЙ [1—35, 150, 3121
Тербий (ТЬ) — металл серебристого цвета. Промышленностью выпус-
выпускается кальциетермический тербий трех марок по ТУ 48—4—209—72:
Марка ТбМ-1 ТбМ-2 ТбМ-3
Содержание суммы других
P3JVf (Gd, Dy, Y) % не более 0,1 0,2 0,5
Содержание прочих контроли-
контролируемых примесей, °/о ие более:
Fe 0,01 0,02 0,05
Са 0,01 0,03 0,05
Си . . , 0,03 0,05 0,001
Та или Мо (в зависимости от
материала и аппаратуры) . 0,02 0,2 0,30
При необходимости рекристаллизациоиным отжигом предварительно
дистиллированного или вакуумплавлеиного тербия могут быть получе-
получены монокристаллы. Тербий выпускают в виде слитков, которые упако-
упаковывают в двойной полиэтиленовый пакет. Гарантийный срок хранения
тербия в упаковке 6 мес.
576
Физические свойства
Атомные характеристики. Атомный номер 65, атомная масса 158,924
а. е. м., атомный объем 19,03-10-' м3/моль, атомный радиус 0,1783 им;
ионный радиус ТЬ3+ 0,089 нм.
Электронная конфигурация внешних электронных оболочек изолиро-
изолированного атома 4s2p6dlof85s2/Af16s2.
Потенциалы ионизации / (эВ): 5,98 и 11,52, электроотрицательность
1,3.
Тербий — полиморфный металл. Низкотемпературная а-модификация
имеет г. п. у. решетку (а = 0,3604 нм, с=0,5698 нм, с]а= 1,5799, коорди-
координационное число — 6; 6). Высокотемпературная р-модификация имеет
о. ц. к. решетку (о=0,402 им, координационное число — 8). Энергия кри-
кристаллической решетки 864,7 мкДж/кмоль.
Тербий имеет один стабильный изотоп !59ТЬ и 16 искусственно полу-
полученных радиоактивных изотопов:
Массовое
число
149
151
152
153
154
155
156
Период
полураспада
1 ч
19 ч
17 ч
55 ч
21 ч
5,4 сут
5 сут
Характер
излучения
а К-з*
аК-з*
АГ-з, 6+
К-з*
Р+, К-з*
К-з*
К-з
Массовое
число
157
158
160
161
162
Период
полураспада
150 ч
108 лет
72 сут
72 сут
460 с
Характер
излучения
К-з
Р- К-з*
У
5-
* К-з — К-захват.
Эффективное поперечное сечение захвата тепловых нейтронов
45-10~28 м2. Работа выхода электронов ср = 3,09 эВ.
Плотность. Плотность а = ТЬ р = 8,234 Мг/м3, р=ТЬ 8,12 Мг/м3.
Электрические и магнитные. Удельное электрическое сопротивление
и удельная электрическая проводимость тербия при 298 К р= 1,16
мкОм-м и (т=0,86 МСм/м.
Температурная зависимость удельного электрического сопротивления
поли- и монокристаллического тербия характеризуется перегибом, ко-
который соответствует переходу из парамагнитного в антиферромагнитное
состояние. Наблюдается также заметная анизотропия удельного элект-
электрического сопротивления для монокристаллического тербия.
Тербий — ферромагнетик. Магнитная восприимчивость <х=ТЬ при
комнатной температуре % = + 1210-10~9. Температура перехода в ферро-
ферромагнитное состояние (точка Кюри) Тк=221 К. Температура перехода
в антиферромагнитное состояние (точка Нееля) 7V=229 К.
Постоянная Холла при комнатной температуре i?=4,3-10~!2 м3/Кл.
Тепловые и термодинамические. Тербий имеет температуру плавле-
плавления ^г,л = 1353°С, температуру кипения /КИП = 3041 "С, характеристиче-
характеристическую температуру 8D=158 К, удельную теплоту плавления Д#пл =
= 64,85 кДж/кг, удельную теплоту сублимации АЯсубл =2,445 кДж/кг,
577
Температура полиморфного перехода 1287 вС, теплота перехода-
32 кДж/кг.
Молярная энтропия тербия при различных температурах:
Т.К. s°, Дж/(моль К) .Т, К s°, Дж/(моль, К)
298 73,05 2000 142,34
500 87,53 2500 149,79
1000 108,70 3000 259,92
1500 122,68
Давление пара р тербия при различных температурах:
Г, К Р. Па Г, К р. Па
1273
1373
1473
1573
1673
0,552-10-*
0,686-10-»
0,608-10-г
0,408-10—1
0,217
1773
1873
1973
2073
2173
0,961
0,362-
0,1196
0,352-
0,936-
101
•102
102
10*
Удельная теплоемкость тербия ср= 179 Дж/(кг-К).
Удельная электронная теплоемкость СрЛ= [12,17 мДж/(моль-К2)) -Т.
Теплопроводность тербия при 291 К Л.= 10,2 Вт/(м-К).
Температурный коэффициент линейного расширения а для поли- и
монокристаллического тербья:
Г, К Ось а Ось с Средний а -10,», К
298 — — 10,3
673 9,1 17,9 12,1
Механические свойства
Тербий чистотой 99,8 % имеет твердость Я5=686,7 МПа. Временное со-
сопротивление разрыву тербия при 20 °С <jb= 166,8 МПа, ударная вязкость
KCU=3,5 кДж/м2 B93 К).
Упругие свойства: модуль нормальной упругости £=63,2 ГПа; модуль
сдвига, 0 = 25,4 ГПа; коэффициент Пуассона v=0,243. Сжимаемость
тербия х=2,5.10-1! Па~1.
Химические свойства
В соединениях проявляет степень окисления +2, +3.
При нагревании тербий окисляется, покрываясь оксидной пленкой.
Наряду с оксидом ТЬ2О3 (?Пл=2387°С) образуются низшие оксиды —
TbO,,7i8, TbOi,81, ТЬО, 83.
Тербий взаимодействует с углеродом, образуя карбиды: ТЬ3С
(г. ц. к., тип Fe2N), Tb2C3 (о. ц. к„ тип U2C3), ТЬС2 (тетр. о ц. типа
СаС2).
Водород растворяется и в а- и в р-Tb; при этом образуются гидри-
гидриды ТЬН2 с г. ц. к. решеткой и ТЬНз с гексагональной решеткой
Известен фосфид тербия ТЬР.
Для тербия справедливы основные закономерности взаимодействия
РЗМ с другими элементами Периодической системы,
578
Технологические свойства
Тербий — ковкий, вязкий металл. Может деформироваться при комиат-
иой температуре Для получения из него полуфабрикатов в виде лен-
ленты, прутков, проволоки желателен подогрев до 400—600 °С, при этом
нагрев и деформацию проводят в защитной атмосфере.
Области применения
Тербий применяется в производстве специальных стекол, магнитных
сплавов, катализаторов, фосфоров.
Предполагается использовать тербий в качестве легирующего ком-
компонента лазерных материалов, представляющих сложные оксидные со-
соединения, в частности ортоалюмината иттрия YAIO3.
Тербий можно использовать в качестве компонента материала — ми-
мишени в нейтроноактивационных детекторах, предназначенных для ана-
анализа нейтронных полей.
10.10. ДИСПРОЗИЙ [1—35, 165, 316, 319, 320]
Диспрозий (Dy)—серебристо-белый металл. Диспрозий кальциетерми-
ческий выпускается трех марок по ТУ 48—4—214—72:
Марка ДиМ-1 ДиМ-2 ДиМ-3
Содержание суммы РЗМ (ТЬ,
Gd, Er, Y), % не более ... 0,10 0,20 0,50
Содержание прочих контроли-
контролируемых примесей, % не более:
Fe 0,01 0,02 0,05
Са 0,01 0,02 0,05
Си 0,03 0,05 О.Ю
Та или Мо 0,02 0,20 0,30
Многократной дистилляцией, электроииолучевой плавкой и последую-
последующим рекристаллизациониым отжигом можно получать монокристаллы
диспрозия чистотой 99,9 % и более.
Каждый слиток диспрозия упаковывают в двойной полиэтиленовый
пакет, который заваривают. Гарантийный срок хранения упакованных
слитков диспрозия 6 мес.
Физические свойства
Атомные характеристики Атомный номер 66, атомная масса 162,50
а. е. м., атомный объем 19,03-10~в М3/моль, атомный радиус 0,1775 нм;
ионный радиус Dy3+ 0,088 им.
Электронная конфигурация внешних электронных оболочек свобод-
свободного атома: 4s2p6d10f95s2p6d16s2.
Потенциалы ионизации атома / (эВ); 5,93 и 11,67, электроотрицатель-
электроотрицательность— 1,3.
Диспрозий — полиморфный металл. Низкотемпературная а-модифика-
ция имеет г. п. у. решетку (а=0,3592 нм, с=0,5655 нм, с/а =1,5732, ко-
координационное число 6; 6) высокотемпературная Р модификация —
о. ц. к. решетку (а=0,398 им, координационное число 8), Энергия кри-
кристаллической решетки 364,7 мкДж/кмоль,
579
Изотопный состав диспрозия:
Массовое число
156
158
160
161
Распространен-
Распространенность, %
0,0524
0,0902
2,294
18,88
Массовое
число
162
163
164
Распространен-
Распространенность, %
25,53
24,97
28,18
Наиболее распространенные искусственные радиоактивные изотопы
диспрозия:
Массовое
число
157
159
Период
полураспада
8,2 ч
136 сут
Характер
излучения
р+; К-з*
К-з
Массовое
число
165
166
Период
полураспада
2,319 ч
3,37 сут
Характер
излучения
* К-з — /(-захват.
Эффективное поперечное сечение захвата тепловых нейтронов
1100-Ю-28 м2.
Работа выхода электронов ср = 3,09 эВ.
Плотность. Плотность a-Dy рентгеновская р = 8,540 Мг/м3, пикномет-
рическая р = 8,45 Мг/м3. Плотность |3-Dy 8,56 Мг/м1.
Электрические и магнитные. Удельное электрическое сопротивление
р и удельная электрическая проводимость о диспрозия:
23
273
393
750
1 30
1710
р, мкОм. м
0,030
0,90
1,05
1,35
1,68
1,95
о, МСм/м
33,4
1,11
0,95
0,74
0,595
0,512
Температурный коэффициент электрического сопротивления в интер-
интервале 273—373 К а= 1,19-10 К-1.
Температурная зависимость удельного электрического сопротивления
диспрозия характеризуется перегибом при 175 К, что соответствует пе-
переходу из парамагнитного в аитиферромагнитное состояние.
Для монокристалла a-Dy характерна четко выраженная анизотро-
анизотропия удельного электрического сопротивления- рх = 1,15 мкОм-м, р ц—
= 0,87 мкОм-м, коэффициент анизотропии р ± /р ц = 1,3-
Диспрозий — ферромагнетик Магнитная восприимчивость диспрозия
при комнатной температуре х=+630-10"Л Точка Кюри Гк = 85 К;
Точка Нееля Г* = 178,5 К.
Для диспрозия, как и для других тяжелых РЗМ характерны боль-
большие значения магнитокрнсталлической анизотропии и магнитострнкции.
При намагничивании вдоль оси а монокристалл диспрозия с гексаго-
гексагональной решеткой удлиняется в направлении оси а и сокращается в на-
направлении оси Ь. Величина магнитострикции при этом составляет
580
4,5-10—3 при 20 К. Вдоль оси с эффект в ферромагнитной области-зна-
области-значительно меньше.
Постоянная Холла диспрозия при комнатной температуре R——2,7Х
Х10-10 мз/Кл.
Тепловые и термодинамические. Диспрозий имеет температуру плав-
плавления гПл=1409°С, температуру кипения ^„n=2335°C, характеристичес-
характеристическую температуру 8ц=158 К, удельную теплоту плавления Д#пл =
= 64,20 кДж/кг, удельную теплоту сублимации ДЯСубл=1787 кДж/кг
Температура полиморфного аз^р превращения диспрозия 1384 °С,
теплота превращения ДЯ^^о =24,24 кДж/кг
Молярная энтропия s° диспрозия в зависимости от температуры:
Г, К ь<
298
500
1000
1500
'. Дж/(МОЛЬ'
74,78
89,16
110,13
123,89
: пара р диспрозия при
т.к.
1273
1373
1473
1573
р, Па
0,305
2,42
14,93
71,6
К) Г. К
2000
2500
3000
различных
Т, К
1673
1773
1873
s°. Дж/(моль К)
143,77
151,21
252,68
температурах:
Р. Па
285
965
1333
Удельная теплоемкость диспрозия сР = 169 Дж/(кг-К); удельнсч
электронная теплоемкость с~"— [9,12 мДж/(моль-К2)] -Т.
провод1
т, к
4,2
28
60
84
юсть
Я ||
5
16
13
11
л, и
а
,8
,2
,4
,6
>тдм-1ч;
к№с
5,0
13,3
12,2
10,6
монокристаллов диспрозия:
т. к
120
180
240
300
Я1|о
10,5
8,8
9,83
10,3
^ II«
9,2
8,8
11,0
11,5
Температурный коэффициент линейного расширения а поли- и моно-
монокристаллического диспрозия:
Т.К.
298
673
Ось а
4,7
Ось
20,
с
3
Средни;
i а-Ю',
10
9,9
к-1
Механические свойства
Твердость диспрозия чистотой 98,5 % ИВ = 833 МПа, чистотой 99,6 % —
539,55 МПа.
Твердость диспрозия в различных состояниях. НВ = 500 МПа (ли-
(литой), НВ=844 МПа (степень деформации 17%), НВ = 450 МПа (отож-
(отожженный).
Механические свойства диспрозия при испытании на растяжение:
581
Состояние
Литой
Кованый
Температура 205 "С
ав, МПа 1 а0 2, МПа
211
330,6
143
252
б, %
8,3
12,0
Температура 425 "С
<хв, МПа
200
ао2, МПа
184
б, %
4,2
Ударная вязкость KCU 22,3 кДж/м2.
Упругие свойства дисмюзия: модуль нормальной упругости £=
=63,18 ГПа; модуль сдвига G=25,40 ГПа; коэффициент Пуассона v=
=0,243; сжимаемость и=2,60- Ю-'1 Па-1.
Химические свойства
В соединениях проявляет степень окисления +3.
Диспрозий не окисляется на воздухе при комнатной температуре.
При нагревании образует оксид Dy2O3, который может иметь моноклин-
моноклинную структуру (<пл = 2340°С) и о. ц. к. структуру типа Мп2О3 (?пл =
=2150 °С).
С углеродом диспрозий образует карбиды Dy3C, Dy2C3 и DyC2.
Диспрозий в а- и ^-модификациях активно поглощает водород, из-
известны гидриды DyH2 с о. ц. к. структурой и DyH3 с гексагональной
структурой.
Характер взаимодействия диспрозия с элементами Периодической
системы аналогичен другим лантаноидам.
Технологические свойства
В высокочистом состоянии диспрозий может подвергаться пластической
деформации при комнатной температуре Для получения полуфабрика-
полуфабрикатов рекомендуется проводить деформацию при нагреве до 300—400 °С
и в защитной атмосфере.
Области применения
Диспрозий применяют в производстве высокоэрцитивных магнитных
сплавов, специальных стекол, управляющих элементов.
Перспективно применение диспрозия в радиоэлектронике, для ката-
катализаторов и в производстве керамических материалов.
Диспрозий используется в качестве детектора слабых нейтронных
потоков.
Окснд диспрозия применяют для окрашивания глазурей и эмалей.
10.11. ГОЛЬМИЙ [1—35, 245, 318]
Общие сведения и методы получения
Гольмий (Но)—серебристо белый металл. Гольмий кальциетермнчес-
кий выпускается трех марок по ТУ—48—4—211—72:
582
Марка ГоМ-1 ГоМ-2 ГоМ-3
Содержание суммы других
РЗМ (Ег, Dy, Y), % ие более 0,1 0,2 0,5
Содержание прочих контроли-
контролируемых примесей, % ие более:
Fe . 0,01 0,02 0,05
Са 0,01 0,03 0,05
Си 0,03 0,05 0,10
Та или Nb 0,02 0,20 0,30
Многократной дистилляцией, электроннолучевой плавкой и последу-
последующим рекрнсталлизационным отжигом можно получить монокристаллы
гольмия чистотой 99,9 % и выше.
Каждый слиток гольмия упаковывают в двойной полиэтиленовый па-
пакет, который заваривают. Гарантийный срок хранения упакованных
слнтков гольмня 6 мес.
Физические свойства
Атомные характеристики. Атомный номер 67, атомная масса 164,930
а. е. м, атомный объем 18,78-10~6 м3/моль, атомный радиус 0,1767 нм.
Ионный радиус Ноэ+ —0,086 нм.
Электронная конфигурация внешних электронных оболочек свобод-
свободного атома: 4s2p6dlof[05s2ped]6s2.
Потенциалы ионизации атома / (эВ): 6,02 и 11,80 эВ соответственно;
электроотрицательность 1,3.
Гольмий — полиморфный металл. Низкотемпературная а-модифика-
ция имеет г. п. у. решетку с параметрами <з=0,3578 нм, с=0,5629 нм,
с/а= 1,5702, координационное число 6; 6; высокотемпературная E-модн-
фикацня имеет о. ц. к. решетку с параметром а = 0,396 нм, координаци-
координационное число 8.
Гольмий имеет один стабильный изотоп. Наиболее распространенные
искусственные радиоактивные изотопы приведены ниже:
Массово»
число
160
161
162
* К-з-
Период
полураспада
156 с
2,4 ч
720 с
К-захпат.
Характер
излучения
Р+, К-з*
Р+, К-з
Р+, К-г
Массовое
ЧИСЛО
to to to
Период
полураспада
27 ч
3 ч
260 с
Характер
излучения
Эффективное поперечное сечение захвата тепловых нейтронов 64Х
XI О-28 м2.
Работа выхода электронов ф=3,09 эВ.
Плотность. Плотность а-Но р = 8,781 Мг/м3.
Электрические и магнитные. Удельное электрическое сопротивление
р и удельная электрическая проводимость а гольмия
Т.К. . .
р, мкОм-м
а, МСм/м
273
0,90
633
1,33
0,75
1113
1,79
0,55
1593
2,08
0,48
1713
2,20
0,45
583
Температурный коэффициент электрического сопротивления в интер-
интервале 273—373 К а=1,7-10 К.
Для кривой температурной зависимости электросопротивления голь-
гольмия характерен излом в области перехода из парамагнитного в анти-
ферромагннтное состояние.
Гольмий в монокристаллическом состоянии характеризуется значи-
значительной величиной анизотропии удельного электрического сопротивле-
сопротивления: рх= 102, р || =61 мкОм-м, р j_/p || =1,67.
Гольмий — ферромагнетик, Его магнитная восприимчивость при ком-
комнатной температуре х= + 420-10-9. Точка Кюрн 7"К = 19,4К. Точка Нее-
ля Гя = 132К.
Гольмий, как и .другие тяжелые РЗМ, характеризуется высокими
значениями магнитокристаллнческой анизотропии и магнитострикции.
Магнитострикция монокристалла гольмия как в базисной плоскости, так
и вдоль оси с резко увеличивается при достижении критической напря-
напряженности поля. Величина магнитострикции насыщения при 45 К равна
3lc = 3500-10-6, Ха=— 2300-10-в, Хь =—160-10-* (см. диспрозий).
Постоянная Холла гольмия при комнатной температуре У? = 1,5Х
ХЮ-!Ом3/Кл.
Тепловые и термодинамические Гольмий имеет температуру плавле-
плавления Л,л=1470°С, температуру кипения <ЬИп=2720оС> характеристическую
температуру 6D=161 К, удельную теплоту плавления А#пл =
= 85,86 кДж/кг, удельную теплоту сублимации А#субл=1823 кДж/кг.
Температура полиморфного превращения гольмия—1428 °С, теплота
превращения АЯа^р =28,45 кДж/кг.
Молярная энтропия s" гольмия при различных температурах:
Г, К s«, Дж/(моль-К) Т, К s°, Дж/(моль-К)
298 74,36 2000 143,35
500 88,74 2500 150,79
1000 109,71 3000 252,26
1500 123,47
Удельная теплоемкость гольмия ср=165 Дж/(кг-К). Удельная элек-
электронная теплоемкость сэрл— [7,9 мДж/(моль-К2) j -T
Теплопроводность X мопокрнсталлического гольмия, Bi/(m-K):
Т, К .... 20 50 130 200 300
Хпс . . . . 1,6 18,25 17,0 20,0 22,0
Х\\а. . . . 14,1 15,1 11,9 12,6 14,0
Температурный коэффициент линейного расширения моно- и поли-
поликристаллического гольмия а-106 К~'.
Г, К Ось а Ось с Средний о • 10е, К~х
673 4,9 18,4 10,7
Механические свойства
Твердость гольмия чистотой 98,2% #5 = 833,35 МПа, чистотой 99,5%
НВ = 490,5 МПа.
Влияние структурного состояния на твердость гольмия, МПа:
'Литой 745,56
Деформированный A3 % обжатия) . 912,33
Отожженный ......... 442
584
Механические свойства гольмия при 20 "С (усредненные данные раз-
различных работ): <То2=21,092 МПа, ов=28,56 МПа, 6=5,9 %■ KCU=
= 97,1 кДж/м2.
Упругие свойства гольмия при 293 К: модуль упругости Е —
= 67,10 ГПа, модуль сдвига G = 26,68 ГПа, коэффициент Пуассона v=
= 0,255. Сжимаемость 2,52-10-" Па.
Химические свойства
В соединениях проявляет степень окисления +3 На воздухе при ком-
комнатной температуре гольмий устойчив к окислению. При нагревании об-
образуется Но203 с температурой плаплення 2350 °С.
Карбиды гольмия: Но2С, Но3С, H02Q и НоС2. В системе гольмий —
водород наблюдаются широкие области твердых растворов в а- и fi-мо-
дификациях и гидриды НоН2 и НоН,.
По отношению к кислотам и другим реагентам гольмий ведет себя
как и остальные РЗМ. Общие закономерности взаимодействия РЗМ с
элементами Периодической системы справедливы в основном н для голь-
гольмия.
Технологические свойства
В высокочистом состоянии гольмий сравнительно мягок, пластичен, мо-
может подвергаться пластической деформации при комнатной температуре.
Области применения
Гольмий используют в производстве магнитных сплавов, сверхпроводни-
сверхпроводниковых материалов, катализаторов, специальных огнеупоров.
10.12. ЭРБИЙ [1— 35, 152, 317]
Общие сведения и методы получения
Эрбий (Ег) — металл серебристого цвета. Эрбий кальциетермпческий
выпускают трех марок по ТУ 48—4—212—72
Марка ЭрМ—1 ЭрМ—2 ЭрМ—3
Содержание суммы других
РЗМ (Dy, Но, Tm, Yb, Y), %
не более 0,1 0,2 0,5
Содержание прочих контроли-
контролируемых примесей, % не более:
Fe 0,01 0,02 0,05
Са . 0,01 0,03 0,05
Си 0,03 0,05 0,10
Та или Мо 0,02 0,20 0,30
Многократной дистилляцией, электроннолучевой плавкой и последу-
последующим рекристаллизационным отжигом получают монокристаллы эрбия
чистотой 99,9 %.
Эрбий выпускают в виде слитков, каждый из которых упаковывают
в двойные полиэтиленовые пакеты. Гарантийный срок хранения упако-
упакованных слитков эрбия 6 мес.
586
Физические свойства
Атомные характеристики Атомный номер 68, атомная масса—167,26
а. е. м., атомный объем 18,49-10~6 м3/моль, атомный раднус 0,1756 нм.
Ионный радиус Ег3+ 0,085 нм.
Электронная конфигурация внешних электронных оболочек свободного
атома эрбия: 4s2p6d10/u5s2p6d16s2.
Потенциалы ионизации атома / (эВ): 6,10 и 11,93, электроотрица-
электроотрицательность 1,3.
Эрбий имеет г. п. у. решетку с параметрами: а = 0,3560 нм, с=
= 0,5595 нм, с/а= 1,5692; координационное число 6; 6.
Изотопный состав эрбия: l62Er, I64Er, I66Er, 167Ег, 168Ег, 170Ег.
Эффективное поперечное сечение захвата тепловых нейтронов 170Х
ХЮ-23 м2.
Работа выхода электронов ср=3,12 эВ.
Плотность Плотность (рентгеновская) эрбия р = 9,045 Мг/м3, пикно-
метрическая р=9,040 Мг/м3.
Электрические и магнитные. Удельное электрическое сопротивление
р и удельная электрическая проводимость о эрбия:
83
0,20
5,0
293
0,85
1,18
513
1,20
0,83
993
1,75
0,57
1473
2,13
0-47
1713
2,25
0,44
т, к . ..
р, мкОм • м .
о, МСм/м .
Температурный коэффициент электрического сопротивления в интер-
интервале 273—373 К а=2,01 • 10 К.
Монокристаллический эрбий характеризуется сильно выраженной
анизотропией удельного электрического сопротивления: рХ(, =0,75 и
Р\Ю =0,44мкОм-м, р хс/р ||с =1,72.
На монокристаллах эрбия проявляется анизотропия абсолютного
коэффициента т. э. д. с. е: для поликристалла е=0,96 мкВ/К, для моно-
монокристалла (?с = 0,87, ео=1,П мкВ/К.
Эрбий — ферромагнетик. Его магнитная восприимчивость при ком-
комнатной температуре х= + 263-10-9. Точка Кюри 7"к = 19,6 К; точка Нее-
ля 7^ = 85 К.
Эрбий характеризуется высокими значениями магнитокристалличес-
кой анизотропии и магннтострикции (см. диспрозий и гольмий).
Постоянная Холла эрбия при комнатной температуре /?=—0,341 X
ХЮ-1Ом3/Кл.
Тепловые и термодинамические Эрбий имеет температуру плавления
^Л=1522°С, температуру кипения £КИп=2510 °С, характеристическую
температуру 9d = 163 К, удельную теплоту плавления АЯПЛ =
= 65,63 кДж/кг, удельную теплоту сублимации АЯСувл=1836 кДж/кг,
Молярная энтропия s° эрбия при различных температурах:
Т, К s°. Дж/(моль-К) Т, К s°, Дж/(моль-К)
298 73,14 2000 142,8
500 87,95 2500 150,25
1000 109,29 3000 257,2
1500 123,05
586
т к
1773
1873
1973
2073
2173
р. Па
0,533-102
0,841-102
0,193-Ю3
0,400-103
0,800-10s
Давление пара р эрбия при различных температурах:
Г, К р, па
1273 0,376-10-1
1373 0,216
1473 0,988
1573 0,367-101
1673 0,1188-Ю2
Удельная теплоемкость эрбия с ,, = 168 Дж/(кг-К).
Удельная электронная теплоемкость сэрл= [10,7 мДж/(моль-К2)] -Т.
Теплопроводность X монокристаллического эрбия:
Т, К 4,2 20 53 85 100 140 200—240
к1а, Вт/(м-К) 6,0 8,5 9,5 10,0 10,8 12,4 12,5
К1С, Вт/(м-К) 6-° 8,5 8,7 13,2 15,4 17,5 18,6
Температурный коэффициент линейного расширения а моно- н полнкрн-
сталлического эрбня:
Г, К Ось а Ось с Средний а-10», К
298 — — 12,3
673 7,5 19,5 11,5
Механические свойства
Твердость эрбия чистотой 98,2 % ЯВ=882,9 МПа, чистотой 99,6 %
НВ=490,5 МПа.
Влияние структурного состояния на твердость эрбия, МПа:
Литой 814
Деформированный A1 % обжатия) . 1069
Отожженный 470
Механические свойства эрбия при 20 °С (усредненные данные раз-
различных работ): о-0,2=215,8 МПа; ав=28,56 МПа, 6 = 4,6%; KCU=
= 15,8 кДж/м2. Временное сопротивление эрбия сжатию при 20 СС
0в,сж=765,2 МПа; относительное укорочение — 22 %.
Упругие свойства эрбия при 20 °С: модуль упругости £=73,38 ГПа;
модуль сдвига G=29,62 ГПа; коэффициент Пуассона v=0,238; сжима-
сжимаемость %=2,43-10-" Па-1.
Химические свойства
В соединениях проявляет степень окисления +3. При окислении эрбия
образуется оксид Ег2О3 (<Пл = 2400 °С). Карбиды эрбия: Ег2С (ромбоэд-
(ромбоэдрическая), Ег3С (г. ц. к., тип Fe4N), Er2C3 (тип Y2C3), ErC2 (тетрагональ-
(тетрагональная о. ц., тнп СаСг).
Эрбий активно взаимодействует с водородом, образуя гидриды ЕгНг
(г. ц. к.) и ЕгНз (гексагональная). Предельная растворимость водорода
в эрбии определяется уравнением lgcma^=l,66—155//.
Характер взаимодействия эрбия с другими элементами Периодиче-
Периодической системы аналогичен остальным лантаноидам
Технологические свойства
В высокочистом состоянии эрбий — пластичный металл, при комнатной
температуре возможны обжатия более 20 %.
587
Области применения
Эрбий применяют в производстве магнитных сплавов, ферритов, управ-
управляющих элементов, стекол, поглощающих инфракрасные лучи.
10.13. ТУЛИЙ [I— 35, 162]
Общие сведения и методы получения
Тулий (Тт) — металл серебристо-белого цвета. Тулий лантанотермичес-
кин выпускается трех марок по ТУ 48—4—213—72:
Марка ТуМ—1 ТуМ—2 ТуМ—3
Содержание других РЗМ, %
не более
La 0,03 0,05 0,08
суммы Er, Yb, Lu 0,10 0,20 0,50
Содержание прочих контроли-
контролируемых примесей, % не более:
Fe 0,01 0,02 0,05
Са 0,01 0,01 0,02
Си 0,01 0,03 0,05
Та, Мо нлн Nb 0,02 0,20 0,30
Каждый слиток тулия упаковывают в двойной полиэтиленовый пакет,
который заваривают. Гарантнйный срок хранения в упаковке 6 мес.
Физические свойства
Атомные характеристики. Атомный номер 69, атомная масса 168,934
а. е. м, атомный объем 18,14-Ю м3/моль, атомный радиус 0 1747 нм.
Ионный радиус Тт3+ 0,085 нм.
Электронная конфигурация виешннх электронных оболочек свобод-
свободного атома: 4s2p6rf'°f125s2p6dI6s2.
Потенциалы ионизации атома J (эВ): 6,18 и 12,05; электроотрица-
электроотрицательность 1,3.
Кристаллическая структура г. п. у. с периодами: а = 0,25374 нм, с=
= 0,5558 нм, с/а =1,5705 B5 СС), координационное число 6; 6.
Тулий, встречающийся в природе, состоит из одного стабильного изо-
изотопа le9Tm. Наиболее распространенные радиоактивные изотопы тулия
приведены ниже:
Массовое
число
165
166
167
" К-з -
Период
полураспада
30 Ч
7,7 ч
9,6 сут
К-зякагп:,
Характер
излучения
К-з*, р+
/С-з, р+
К-з
Массовое
число
170
171
П ериод
полураспада
134 сут
690 сут
Характер
излучения
518
Эффективное поперечное сечение захвата тепловых нейтронов 125Х
ХЮ-28м2.
Работа выхода электронов <р=3,12 эВ.
Плотность. Плотность тулия р=9,314 Мг/м3.
Электрические и магнитные. Удельное электрическое сопротивление
тулия чистотой 99,5 °/о при комнатной температуре р=0,90 мкОм-м.
Температурный коэффициент электрического сопротивления в интервале
273—373 К а=1,95-10~3 К.
Тулий — ферромагнетик. Его магнитная восприимчивость прн комнат-
комнатной температуре х= + 154'10~9. Точка Кюри 7"к = 22 К. Точка Нееля
Тулий характеризуется высокими значениями магнитокристалличес-
кой анизотропии и магнитострикции (см, диспрозий и гольмий).
Постоянная Холла при комнатной температуре R=—1,8-1010 м3/Кл.
Тепловые и термодинамические. Тулий имеет температуру плавления
<пл=1545°С, температуру кипения <Кип=1727°С, характеристическую
температуру 6ю=167 К, удельную теплоту плавления A#M= 104,66
кДж/кг, теплоту сублимации Л#Субл=1374 кДж/кг.
Молярная энтропия s° тулия при различных температурах-
Г, К s°, Дж/(моль'К) Т. К s°, Дж/(моль-К)
298 71,38 2000 139,33
500 85,61 2500 234,48
1000 106,15 3000 238,49
1500 119,57
Удельная теплоемкость ср = 160 Дж/(кг-К). Удельная электронная
теплоемкость с3^1 — G,15 м,Дж/(моль-К2)] -Т.
Теплопроводность X монокристаллического тулня:
Г, К 5 10 56 100 160 220 300
Яца, Вт/(м-К) ■ • 13,0 25,0 8,8 11,4 12,7 13,6 14,0
Я,|с, Вт/(м-К) . . 13,0 21,0 16,5 21,4 23,0 23,6 24
Температурный коэффициент линейного расширения а моно- и поли-
поликристаллического тулия:
т, к
298
673
Ось а
7,5
—
Ось
19,
—
с
7
Ср<
5ДНИЙ О'
13,
25,
10е,
3
0
к-1
Механические свойства
Твердость тулия чистотой 98,2 % ЯВ = 882,9 МПа, чистотой 99 % НВ=
= 539,6 МПа.
Влияние структурного состояния на твердость тулия, МПа:
Литой 774,99
Деформированный (9 % обжатия) . 981
Отожженный , 500
Химические свойства
В соединениях проявляет степень окисления +3.
С кислородом тулий образует Тт2О3 (/1Л = 2392 °С). Карбиды тулня:
ТтзС (г. ц. к,, тип Fe2N), Tm2C3 (тип Y2C3), TmC2 (тетрагональная о. ц.,
589
типСаСя). Тулнй растворяет водород и образует гидриды ТтН4 (г. ц. к.)
иТтНз {гексагональная). Известен нитрид тулия TmN,
Взаимодействие тулия с элементами периодической системы подоб-
подобно взаимодействию других РЗМ. Тулий не образует амальгам с ртутью.
Области применения
Тулий используют в производстве катодолюминофоров, в электротехни-
электротехнике и радноэлектроиике.
Изотоп !70Тт нашел применение в портативных рентгенопросвечива-
ющих приборах и для дефектоскопии металлов.
10.14. ИТТЕРБИЙ [1-35, 165, 245]
Общие сведения и методы получения
Иттербий (Yb) — металл серебристо-белого цвета. Иттербий лантапо-
термический выпускается трех марок по ТУ 48—4—204—72:
Марка ИтбМ—1 ИтбМ—2 ИтбМ—3
Содержание суммы других
РЗМ (La, Er, Tm, Lu), % не
более 0,13 0,25 0,58
Содержание прочих контроли-
контролируемых примесей, % не более:
Fe 0,01 0,02 5-Ю-2
Са 0,01 0,03 5-Ю—3
Си 0,01 0,01 2-Ю-2
Та, Мо или Nb 0,02 0,02 3-Ю-1
Многократной дистилляцией в высоком вакууме и электроннолуче-
электроннолучевой плавкой можно получить иттербий чистотой 99,9 %.
Каждый слиток иттербия упаковывают в дпоммой полиэтиленовый
пакет, который заваривают.
Физические свойства
Атомные характеристики. Атомный номер 70, атомная масса 173,04 а. е. м,
атомный объем 24,82-Ю-6 м3/моль, атомный радиус — 0,1993 нм.
Ионный раднус Yb3+ 0,081 нм.
Электронная конфигурация внешних электронных оболочек свобод-
свободного атома: 4s2/>6dl35s2ped16s2.
Потенциалы ионизации / (эВ) 6,25 н 12,17. Электроотрицатель-
Электроотрицательность 1,2.
Иттербий — полиморфный металл. Существуют низкотемпературная
а-модификация, имеющая г. ц к. решетку (а = 0,5483 нм, координаци-
координационное число 12) и высокотемпературная fi-моднфикация с о. ц. к. решет-
решеткой (а==0,444 нм, координационное число 8). Энергия кристаллической
решетки 364,7 мкДж/кмоль.
ч Иттербий имеет 7 стабильных изотопов.
Изотопный состав иттербия:
Массовое число 168 170 171 172
Распространенность, % . . . 140 3,034 14,34 21,88
590
Продолжение i
Массовое число . ..... 173 174 176
Распространенность, % ... 16,18 31,77 12,63
Некоторые искусственные радиоактивные изотопы иттербия приведены
ниже:
Массовое
число
166
169
• К-з-
Период
полураспада
2,58 сут
32 сут
/(-захват.
Характер
излучения
К-з*
К-з
Массовое
число
175
177
Период
полураспада
98 ч
1,8 ч
Характер
излучения
Эффективное поперечное сечение поглощения тепловых нейтронов
37-Ю-28 м2.
Работа выхода электронов ср==2,59 эВ.
Плотность. Плотность a-Yb (рентгеновская) р=6,97 Мг/м3, пик-
нометрическая р=7,02 Мг/м3. Плотность fi-Yb при 1071 К р=
= 6,56 Мг/м8.
Электрические и магнитные. Удельное электрическое сопротивление
р и удельная электрическая проводимость а иттербия-
40
0,06
16,7
160
0,20
5
298
0,27
3,7
г, к
р, мкОм-м . . . ,
<т, МСм/м ...
Температурный коэффициент электрического сопротивления в интер-
интервале 273—373 К а=1,30-10-3К-!.
Иттербий — парамагнетик. Магнитная восприимчивость иттербия
при комнатной температуре х=+",4Ы0"9. Постоянная Холла R*=
= +377.10-1Ом3/Кл.
Тепловые и термодинамические. Иттербий имеет температуру плав-
плавления ?ПЛ = 816°С, температуру кипения fKBn=1193°C, характеристи-
характеристическую температуру 9о=118 К, удельную теплоту плавления АЯПл =
= 44,3 кДж/кг, теплоту сублимации Л#Субл = 878,9 кДж/кг. Темпера-
Температура полиморфного ач±Р превращения 792° С, теплота превращения
ДЯ а_р =10,1 кДж/кг.
Молярная энтропия s° иттербия при различных температурах:
Г, К «° Дж/(моль-К) Т, К s°, Дж/(моль-К)
298 62,76 2000 212,59
500 76,11 2500 217,24
1000 95,98 3000 221,13
1500 118,28
Давление пара при 1273 К р = 26,600 Па. Удельная теплоемкость ит-
иттербия ср = 149 Дж/(кг-К).-Удельная электронная теплоемкость с?,л —
= [3,8 мДж/(моль-К2)]-7\
Температурный коэффициент линейного расширения иттербия при
температуре 298 и в интервале от 298 до 973 а = 24,96-10-6 и а =
= 29,9-Ю-6 К~' соответственно. Энергия дефекта упаковки для rt-Yb
10—15 мДж/м2.
591
Оптические. Отражательная способность (коэффициент отражения
По иттербия в виде пленки толщиной 0,2 мкм:
К МКМ П£) % >. MRM
о.пз
0,124
0,138
0,155
0,177
0,207
6
10
16
17
18
22
0,248
0,310
0,412
0,620
1,240
32
48
64
75
78
Механические свойства
Среди редкоземельных металлов иттербий, наряту с европием, харак-
характеризуется наиболее низкой твердостью: НВ=196 МПа при 20°С (чис-
(чистота металла 98 %).
Механические свойства иттербия при испытании на растяжение
представлены ниже:
/ с
20
205
сто
,2'
64
53
МПа
,7
,9
ав МПа
71,6
70,6
6. %
5,7
10,8
Ударная вязкость при 20° С KCU 72,1 КДж/м2.
Упругие свойства: модуль упругости £=17,85 ГПа, модуль сдвига
С=6,97 ГПа, коэффициент Пуассона v=0,284, сжимаемость х =
=2,43-10-и Па-1.
Химические свойства
В соединениях проявляется степень окисления +2 и +3. Иттербий с кис-
кислородом образует оксиды YbO и Yb2O3(W=2426eC).
Известны карбиды иттербия: Yb3C, Yb2C3, YbC2. YbC2 диссоциирует
при р<10-2 Па и 80 "С. -
С водородом иттербий образует гидрид YbH2. Имеются данные о
других гидридных фазах — YbH2,B5-
С азотом известно соединение YbN.
Характер взаимодействия с элементами Периодической системы, в
основном аналогичен другим РЗМ.
Технологические свойства
Иттербий — пластичный, мягкий металл. Легко деформируется при
прессовании при комнатной температуре.
Области применения
Иттербий применяют в производстве магнитных и других специальных
сплавов, катодолюминофоров, специальных стекол.
Находит применение в электротехнике и элетронике,
592
10.15. ЛЮТЕЦИЙ [1-35, 152, 321, 322]
Общие сведения и методы получения
Лютеций (Lu)— металл серебристо-белого цвета. Лютеций кальциетер-
мнчгскнй выпускается по ТУ 48-4-206-72 трех марок:
Марка ЛюМ—1 ЛюМ—2 ЛюМ—3
Содержание суммы других
РЗМ (Ег, Yb, Tm), % не более 0,1 0,2 0,5
Содержание прочих контроли-
контролируемых примесей, % не более:
Fe 0,01 0,02 0,05
Са 0,01 0,03 0,05
Си 0,03 0,05 0,10
Та, Мо или Nb 0,02 0,20 0,30
Многократной вакуумной дистилляцией, электроннолучевой плавкой н
последующим ргкристаллизационным отжигом получают монокристаллы
лютеция чистотой 99,9 %.
Каждый елток лютеция упаковывают в двойной полиэтиленовый
пак<т, который заваривают.
Физические свойства
Атомные характеристики. Атомный номер 71, атомная масса
174,97 а. е. м., атомный объем 17,79-Ю-6 м3/моль, атомный радиус
0,1735 им Ионный радиус Lu3+ 0,080 нм
Электронная конфигурация электронных уровней свободного аточа:
ywl"P5s2/t;6rf16s2.
Потенциалы ионизации атома У (эВ)' 6,15 и 13,9. Электроотрица-
Электроотрицательность 1,3.
Лютеций имеет г. п. у. решетку с параметрами: а=0,3505 нм, с =
""О.бббЗ нм, cla— 1,5832; координационное число 6; 6. Энергия кристал-
кристаллической решетки 364,7 мкДж/м2
Лютенций имеет два стабильных изотопа mLu(97,412 %) и 17eLu
B,588 °/о) и более 10 искусственных радиоактивных изотопов.
Массогсое
число
170
171
172
173
Период
полурас-
полураспада
2 сут
8,2 сут
6,7 сут
500 сут
Характер
излучения
Р+, К-з*
Р+, К-з
К-з
К-з
Массовое
число
174
177
177
1 178
Период
полурас-
полураспада
3,5 года
6,7 сут
6,98 сут
4,6 года
Характер
излучения
К-з
Р-
' /С-з—/<-захват.
Эффективное поперечное сечение захвата тепловых нейтронов
11Ы0~28 м2. Работа выхода электронов ф = 3,14 эВ
Плотность. Плотность лютеция р=9,835 Мг/м3.
Электрические и магнитные Удельное электрическое сопротивление
р и удельная электрическая проводимость а лютеция:
593
13
0,0471
21,3
100
0,207
4,84
2P8
0,68
1,47
г, к
р, мкОм-м...
а, МСм/м . . . ,
Температурный коэффициент электрического сопротивления в ин-
интервале 273—373 К а=2,40-10-3 Кг1.
Лютеций среди редкоземельных металлов характеризуется макси-
максимальной анизотропией удельного электрического сопротивления: р _,_/
/Р„ =2,4.
Лютеций — парамагнетик. Магнитная восприимчивость при комнат-
комнатной температуре 5С = +0,102-10~9. Постоянная Холла лютеция в темпера-
температурном интервале 40—320 К R = — 0,535-10-'° м'/Кл.
Тепловые и термодинамические. Лютеций имеет температуру плав-
плавления <Пл=1663°С, температуру кипения <КИп==3315°С, характеристи-
характеристическую температуру 8о=166 К, удельную теплоту плавления ■—Д#Пл =
= 68,25 кДж/кг, удельную теплоту сублимации Д//Субл = 2443 кДж/кг.
Молярная энтропия s° лютеция при различных температурах:
Г К s° Дж/(моль-К) Т. К s°, Дж/(моль.К)
2D8 49,16 2000 117,32
500 63,39 2500 236,36
1000 83,93 3000 240,92
1500 97,28
Давление пара р лютеция в зависимости от температуры:
Т, К р, Па Т, К Р, Па
1273 0,206-10-Б 1773 0,133
1373 0.359-10-4 1873 0,596
1473 0,421-Ю-3 1973 2,32
1573 0,366-10—2 2073 7,85
1673 0,248-10-1 2173 23,73
Удельная теплоемкость лютеция ср=154 Дж/(кг-К). Удельная элек-
электронная теплоемкость СрЛ = [3,26 мДж/(моль-К2)]-7".
Теплопроводность Я монокристаллического лютеция, Вт/(м-К):
Г, К 4,2 20 60 120 200 300
Лца, Вт/(м-К) . . 8,0 20,0 16,3 13,4 13,0 12,9
Я||с, Вт/(м-К) • . 30,0 40,0 28,8 26,4 24,1 24,5
Коэффициент термического расширения моно-и поликристаллического
лютеция при 673 К' а=10,2-10-6 К (вдоль оси а) а= 16,9- 10~e Кг1
(вдоль оси с), а= 12,5-106-К (средний).
Механические свойства
Лютеций чистотой 98,2 % имеет твердость при комнатной температуре
НВ=1177МПа.
Упругие свойства лютеция при 20° С: модуль нормальной упругости
£ = 84,36 ГПа, модуль сдвига G = 33,84 ГПа, коэффициент Пуассона
v=0,233, сжимаемость х = 2,43-10-пПа-1.
Химические свойства
В соединениях проявляет степень окисления +3.
Лютеций образует с кислородом оксид L.U2O3 (^пл—2467° С).
Известны карбиды лютеция. Lu3C (г. ц. к., тип Fe4N), LU2C3 (тип
594
Y2C3), LuC2 (тетр. о. ц., тип СаС2, а также гидриды лютеция LuH2,
L11H3 и нитрид лютеция LuN.
По отношению к другим элементам Периодической системы, а так-
также к различным реагентам, например, кислотам, лютеций ведет себя
практически аналогично остальным РЗМ.
Области применения
Лютеций используют при получении катализаторов и люминофоров.
И. АКТИНИИ И АКТИНОИДЫ
11.1. АКТИНИЙ [1—35, 323—325]
Общие сведения и методы получения
Актиний (Ас) от греческого aktis, что означает «луч» — радиоактивный
химический элемент III группы Периодической системы элементов, ме-
металл серебристо-белого цвета. Из-за высокой радиоактивности светит-
светится в темноте голубым светом. Открыт в 1899 г французским химиком
А Дебьерном при изучении отходов переработки урановой руды. Изо-
Изотопы 227Ас и 228Ас (мезоторийП) встречаются в природе в рудах ура-
урана и тория как члены естественных радиоактивных рядов. Поверхно-
Поверхностный слой земной коры толщиной 1,6 км содержит 11300 т изотопа
227Ас, ио по сравнению с другими элементами, содержание актиния очень
мало (примерно 6-Ю-10 % (по массе). Из-за чрезвычайной близости
химических свойств актиния и лаитана, выделение актиния в чистом
виде из природных объектов, содержащих лантан и другие РЗМ, свя-
связано с большими трудностями Поэтому миллиграммы 227Ас получают
искусственно при облучении нейтронами радия 226Ra. Для выделения
актиния применяют методы экстракции и хроматографии Металлический
актиний получают восстановлением галогенидов парами щелочных ме-
металлов
Физические свойства
Атомные характеристики. Атомный номер 89, атомная масса 227 а. е. м ,
радиус 0,203 нм, ионный радиус Асзь 0,111 нм, конфигурация внешних
электронных оболочек 6d'7s2 Значения потенциалов ионизации акти-
актиния / (эВ): 6,89±0,6; 11,5±0,4; третий потенциал неизвестен. Актиний
имеет г. ц. к. решетку с периодом 0,5311 нм. Стабильных изотопов не
имеет. Известно 23 радиоактивных изотопа актиния, наиболее долго-
живущий нз которых 227Ас (период полураспада 21,8 года) дает из-
излучение, состоящее на 98,8 % из Р-частиц и 1,2 % а-частиц. Второй по
устойчивости изотоп 228Ас (период полураспада 6,13 ч). Его также на-
называют мазоторий II, MsThll. Вероятность распада 227Ас с испусканием
а-частиц невелика, а энергия Р-частиц очень мала D6 кэВ), поэтому
обнаружить излучение, которое бы сопровождало радиоактивный рас
пад 227Ас долго не удавалось и до 1935 г. считали, что радиоактивный
распад этого изотопа не сопровождается излучением. Современные при-
приборы позволяют идентифицировать такое мягкое Р-излучеиие, но про-
проводить его количественное изучение и сейчас довольно трудно. Поэтому
в опытах с небольшим количеством 227Ас за его поведением, как прави*
ло, следят по изменению активности дочерних продуктов Эффектив»
ное поперечное сечение захвата тепловых нейтронов составляет E10+
595
+ 40)-10~28 м2. Электроотрицательность 1,00. Работа выхода электро-*
на ф = 2,7 эВ.
Плотность актиния р=10,1 Мг/м3.
Тепловые и термодинамические. Температура плавления актиния по
разным данным ^Пл=Ю50—1200° С, температура кипения („И11=
= —3297°С, расчетные значения удельных теплот плавления Д//П1 =
= 62,55 кДж/кг, испарения Д//Исп = 1748,9 кДж/кг.
Теплоты образования ДЯобр некоторых простых соединений трехва-
трехвалентного актиния при стандартных условиях:
Соединение.... AcF3 АсС1з Д.сВг3 Ас1з
ДНобр, кДж/моль 1758,4+41,8 1088,6±41,8 921,1±41,8 707,6±41,8
Удельная теплоемкость ср актиния в зависимости от температуры
при нормальном давлении.
Г, К 298 400 600 1000
ср, Дж/(кг-К) • 119,8 123,8 130,8 145,8
Химические свойства
В соединениях проявляет степень окисления +3.
Из-за высокой радиоактивности актиний слабо светится в темноте.
На влажном воздухе покрывается белой пленкой оксида, препятству-
препятствующего дальнейшему окислению. Почти все соли актиния белого цвета;
в растворах бесцветны. Большинство из них, кроме АсРО4, изоморфно
с соответствующими соединениями лантана. Актииий образует те же не-
нерастворимые соединения (гидроксид, фосфат, оксалат, карбонат, фтор-
силикат), что и лантан; однако, гидроксид Ас(ОНK имеет более основ-
основной характер. Актиний является опасным радиоактивным ядом.
Области применения
В смеси с бериллием 227Ас служит для приготовления нейтронных ис-
источников, в которых нейтроны образуются при облучении ядер бериллия
9Ве cs-частицами, испускаемыми дочерними продуктами 227Ас.
11.2. ТОРИЙ [1—35, 323, 326, 327]
Общие сведения и методы получения
Торий (Th) — радиоактивный химический элемент, первый член семей-
семейства актиноидов, входящих в 1П-ю группу Периодической системы эле-
элементов— серебристо-белый пластичный металл. Открыт в 1828 г. Бер-
целиусбм в Норвегии. Назван по имени бога грома в скандинавской
мифологии — Тора, а минерал—силикат тория — торитом — характерный
минерал верхней части земной коры — (гранитного слоя и осадочной
оболочки), —где его содержится 1,8-10—3 и 1,3-10-3% (по массе) со-
соответственно Это сравнительно мало мигрирующий элемент; в основ-
основном, он участвует в магматических процессах, накапливаясь в гранитах,
щелочных породах и пегматитах. Способность тория к концентрации сла-
слаба. Известно 12 минералов тория, содержащихся в полиметаллических
рудах. Торий содержится в таких рудах в виде силикатов, простых и
сложных оксидов, фосфатов, карбонатов в количестве от сотых до де-
десятых долей процента. Главные минералы тория монацит [3,5—10 %
(по массе) ThO2], торит [до 77 % (по массе) ТЮ2], торанит [45—93%
596
(по массе) (Th, U)O?]. Торий постоянно присутствует в тканях расте-
растений и животных.
Основной промышленный источник тория — морские и континенталь-
континентальные монацнтовые россыпи. Промышленное значение имеют два способа
разложения таких концентратов. Первый из них — сульфатизация, т. е.
обработка концентрированной серной кислотой при 200°С; второй —
обработка раствором щелочи при 140° С. В сернокислые растворы про-
продуктов сульфатизации переходят все РЗМ, торий и фосфорная кислота,
так как в моиацитовых концентратах торий содержится в виде фосфа-
фосфата. При доведении рН такого раствора до единицы фосфат тория осаж-
осаждается. Осадок отделяют и растворяют в азотной кислоте, после чего
нитрат тория экстрагируют органическим растворителем, из которого
торий легко вымывается в виде комплексных соединений. При щелоч-
щелочном разложении концентратов в осадке остаются гидроксиды всех ме-
металлов, а в раствор переходит трииатрийфосфат тория Осадок отделяют
и растворяют в соляной кислоте Понижая рН такого раствора до 3,6—
5, осаждают торий в виде гидрокепда Из выделенных и очищенных со-
соединений тория получают ThO2, ThCl4 и ThF4. Эти вещества являются
исходными для производства металлического тория металлотермическии*
методом или электролизом расплавленных солей К металлотеомическим
методам получения тория относят восстановченне ThO2 кальцием в при-
присутствии CaCU в атмосфере аргона при 1100—1200 °С (кальциетермиче-
ский метод), восстановление ThCU магнием при 830—930°С, восстанов-
восстановление ThCU кальцием в присутствии ZnCl3 с получением сплава тория и
последующим отделением цинка нагреванием в вакууме при 1100 °С.
Электролиз расплавленных солей ведется нз электролитов, содержащих
ThCl4 на NaCl или ванн, состоящих из смеси ThCU, NaCl и КС! Торий
выделяется на катоде и отделяется затем от электролита обработкой во-
водой или разбавленными щелочами. Во всех случаях торий получают в
виде порошка и для перевода его в компактное состояние применяют
методы порошковой металлургии или плавку в индукционных вакуумных
печах в тиглях из ZrO2 (или ВеО) или дуговую плавку с расходуемым
электродом. При применении метода порошковой металлургии произ-
производят вакуумное спекание порошка при 1100—1400 "С. Для получения
тория особо высокой чистоты используют метод термической диссоциа-
диссоциации иодида тория Типичный химический состав тория полученного раз-
различными методами, приводится ниже:
Метод плавки
Содержание примесей, АО , % (по массе)
Н,
Al Si Ni Cr Fe Be
Zr
Итукпионная
в тигле из ВеО
Индукционная
в 1игле из
ZrO2
Дуговая с рас-
расходуемым элек-
электродом
Дуговая
Кальциетермический торий
1500
4400
1000
300
270
140
10
—
—
1000
250
100
100
400
60
50
550
10
75
600
600
100
300
100
75
600
400
1000
—
—
— 1000
50
Иодидный торий
20 I 10 I 200 I 50 I 100
10
50
100
10 | -
597
Физические свойства
Атонные характеристики. Атомный номер 90, атомная масса 232,038
а. е. м., атомный объем 19,79-Ю"8 м3/моль, атомный радиус a-Th
0,180 им, P-Th 0,178 им, ионный раднус Th3+ 0,108 им, а ТЬ4+ 0,099 нм,
конфигурация внешних электронных оболочек 5rf105/06s26p66rf°7s2.
Значения потенциалов ионизации / (эВ): 6,95±0,06; 11,5±1,0; 20. То-
Торий имеет две модификации — низкотемпературную а с решеткой г. ц. к.
и периодом а = 0,5086 нм и высокотемпературную р с решеткой о. ц. к.
и периодом а=0,411 нм. Природный торий практически весь состоит
из одного долгоживушего изотопа 2з2Тп — родоначальника одного из
радиоактивных рядов. Период полураспада 232Th 1,39-1010 лет. С ним в
равновесии находится ничтожное A,37-10—8 %) количество изотопа
238Th. Кроме того, известно четыре короткоживущих изотопа с массо-
массовыми числами 234 (период полураспада 24,1 сут), 230 (8-Ю4 лет), 231
B5,6 ч) и 227 A8,17 сут), причем первые два относятся к радиоактив-
радиоактивному ряду урана—радия, а два последних — к ряду актиния. Из ис-
искусственно полученных изотопов наиболее устойчив 229Th, период полу-
полураспада которого равен 7340 лет. Эффективное поперечное сечение за-
захвата тепловых нейтронов для изотопа 2з0Тп равно B2,7±0,6) ■ 10~28 м2,
а для изотопа 232Тп G,56±0,11)-Ю3 м2; среднее сечение рассеяния,
экспериментально полученное для максвелловского спектра нейтронов
для 232Th составляет 12,5-Ю-28 м2. Работа выхода электрона ф=3,3 эВ.
Электроотрицательность 1,14—1,2.
Плотность. Плотность тория р при 298 К по данным различных ис-
источников колеблется в пределах 11,1—11,5 Мг/м3. В жидком состоянии
при температуре 1964 К р= 10,5 Мг/м3.
Электрические и магнитные. Для тория, имеющего отношение элек-
электросопротивлений при комнатной и при температуре жидкого гелия
58,8, получены следующие зависимости удельного электрического со-
сопротивления р температурного коэффициента электрического сопротив-
сопротивления а от температуры:
Г, К 273 293 293—2073
р, мкОм-м .... 0,191 0,1862 —
о, МСм/м .... 5,23 5,26 —
1 .... 3,3 3,3 2,1
Абсолютный коэффициент т. э. д. с. тория ех измеренный по отношению
к платине:
Т, К • • 673 773 873 973 1073 1173 1273 1373
ег, мкВ/К —2,5 —4,5 —6,5 —9,5 —13 —16 —19 —23
Температура перехода тория в сверхпроводящее состояние Гс=1,4 К.
Постоянная Холла при магнитной индукции 6=0,37—0,45 Тл и тем-
температуре 293 К /?= 1,2-10—10 м'/Кл. Поперечный четный гальваномаг-
иитиый эффект в поликристаллическом тории при напряженности м
магнитного поля #=238,7 кА/м для температуры 195 К dR/R = 0,03,
а для температуры 80 К 0,157. Магнитная восприимчивость % тория
в зависимости от температуры по данным различных источников:
Т, К 90 293 130—300
Я-10е 0,66 1,92 0,41
Коэффициент вторичной электронной эмиссии 0"тах=1,14 при ускоряю-
ускоряющем напряжении первичных электронов 0,6-1,0 кэВ.
Тепловые и термодинамические. Температура плавления тория по
разным данным <Пл= 1695—1757 °С, температура кипения /КИп = 3297—
598
—4787 "С, характеристическая температура 180 К, температура поли-
полиморфного превращения 1327—1357°С, удельная теплота плавления
ДЯПЛ = 67,4 кДж/кг, удельная теплота сублимации при 298 К Д#сУбл =
=2482,8 кДж/кг, удельная теплота испарения при температуре кипения
ДЯИсп=2202 кДж/кг, удельная теплота полиморфного превращения
12,1 кДж/кг. Удельная теплоемкость ~ср в зависимости от температуры
при нормальном давлении:
Г, К 20 40 80 150 250
ср, Дж/(кг-К) 19,9 60,5 92,5 107,6 115,2
Продолжение
1000 1500
175,3 216,2
Т, К 400 600
ср, Дж/(кг-К) 126,2 142,4
Удельная электронная теплоемкость тория СрЛ=[4,31 мДж/(мольХ
ХК2)]-7\
Теплопроводность К в зависимости от температуры:
Г, К • • • Ю0 300 400 600 900 1300 1500 1700
Ь, Вт/(м-К) 40,4 35,6 33,3 28,6 21,7 12,0 7,5 2,8
Температурный коэффициент линейного расширения a-Th в зависимо-
зависимости от температуры по данным различных источников:
Температурный 57— 293— 293— 293— 303—
интервал, К- • 293 373 573 873 127*
а-106, К-1 . . 9,8 11,3 13,1 13,7 12,5
Взаимосвязь между давлением насыщенного пара р тория и темпера-
температурой, при которой это давление устанавливается •
Т, К. • • •
р, 133,3 Па
1706 1813 1935 2075
10_8 10_7 ю-e ю-5
Молярная энтропия тория s°=53,42 Дж/(моль-К). Данные для
подсчета коэффициента самодиффузии тория и коэффициента диффу-
диффузии в нем некоторых элементов приводятся ниже:
Диффунди-
Диффундирующий
элемент
a-Th
P-Th
Н
С
Ра
и
Интервал
температур,
К
1373—1673
1723—1823
573—1173
1273—1473
963—1183
963—1183
Предэкспо-
ненциальиый
множитель
D», м2/с
7-10-2
10
2,92-10-7
1,26-10-?
2,21
Энергия
активации
Е кДж/
/моль
349,6
417,4
40,82 \
159,1 }
312,0
332,0
Примечание
Самодиффузия
»
Взаимная диффузия
Диффузия в a-Th
»
Оптические. Спектральный коэффициент излучения твердого тория
для длины волны 0,65—0,67 нм при температуре порядка 1673 К е^ —
=0,36—0,38 и колеблется, видимо, вследствие различного содержания
газов в тории. Для жидкого тория е^ =0,40.
599
Механические свойства
Механические свойства тория сильно зависят от способа получения и
чистоты:
Способ
получения
Кальциетер-
мический
То же
>
Иодидный
Состояние
и обработка
Литой
Холодная про-
прокатка с обжатием
25—50 %
То же и отжиг при
750 °С
Экструзия и отжиг
при 750 °С
Холодная про-
прокатка с обжатием
50—85 % и отжиг
при 650—850 °С
О , МПа
168—343
409—460
278
211—242
122—150
О 2, МПа
97—212
385—433
213
152—194
48—79
в, %
8—58
5—11
—
50-51
36—44
7-56
16—39
52
73—74
60—62
Твердость переплавленного в дуговой печи иодидного тория после хо-
холодной деформации и отжига //V = 320—420 МПа, тогда как у ана-
аналогичным образом обработанного кальциетермического тория она повы-
повышается до 650—1100 МПа. Растворение углерода в тории сопровожда-
сопровождается значительным упрочнением и снижением пластичности последнего.
Примеси кислорода и азота вследствие малой растворимости не влияют
иа свойства тория. Зависимость модуля нормальной упругости Е иодид-
иодидного тория от температуры:
/, °С 20 300 500
Е, ГПа .... 70,3 60,0 49,0
Коэффициент Пуассона тория v = 0,27—0,3, модуль сдвига, определен-
определенный различными методами G = 27,7—32,5 ГПа, предел выносливости
при испытаниях на кручение: для литого тория 0#=84— 88 МПа, для
холоднокатаного Or=105 МПа, для кованого при 873 К 0r = 91 МПа
(наибольшая длительность испытаний 5-Ю8 циклов). Влияние темпе-
температуры на свойства кальциетермического торпя при сжатии: eg ч 168—
183 и 97—120 МПа при температуре 25 и 300 °С соответственно. Ди-
Динамический модуль упругости тория Гд,ш = 82,0 и 59,0 МПа при тем-
температуре 25 и 650 °С соответственно.
Химические свойства
Торий наиболее часто проявляет степень окисления +4, реже +2 и 4-3.
Нормальный электродный потенциал реакции Th—4e=F*Th4+, фО=
=—2,1 В. Энтальпия образования иона Th составляет —759,5 кДж/моль.
Торий активно взаимодействует с большинством элементов Периодиче-
Периодической системы, причем по многим своим свойствам он близок к элемен-
элементам IVa группы.
При температуре выше 473 К торий реагирует с водородом, обра-
образуя гидриды ТШ2, ТпН3 и др. Растворимость водорода в тории растет
600
с температурой и составляет 13% (ат) при 650"С и околв 23% (ат)
при 900 "С. Полного удаления водорода из тория можно достичь, на-
нагревая последний в вакууме при 727—1027 "С.
Порошковый торий пирофореи на воздухе и в кислороде. Однако
компактный торий при температуре до 230 °С окисляется медленно, по-
покрываясь при этом защитной оксидной пленкой черного .цвета. Выше
400 °С окисление идет быстрее, причем образуется оксид ThO2 — един-
единственный, который плавится при 3473 К и обладает высокой термиче-
термической устойчивостью. Получают ThO2 термическим разложением нитрата,
оксалата или гидроксида тория. Теплота образования ThO2 АНовр =
=—1227,5 кДж/моль. При 1400°С в тории растворяется 0,9% (ат)
кислорода.
Растворимость азота в тории 0,8 % (ат) при 850 °С. Нитриды ThN
и Th2N3 образуются при нагревании в азоте выше 730—830 "С.
Эти нитриды разлагаются водой. Теплота образования нитрида ThN
ДЯа„р = —378,8 кДж/моль, а нитрида Th3N4 Д#обр = — 649,0 кДж/моль.
С углеродом торий образует ряд промежуточных соединений, а так-
также карбиды ThC и ThC2 они разлагаются водой с выделением метана
и ацетилена. Теплота образования Д//Обр различных соединений тория
с углеродом:
Соединение .... ThC0 75 TliC0 sl ThC0 91 ThC ThCt „
АЯобр, кДж/моль —69 ,'4 —98,'3 —118', 7 —123,7 —125',0
При высоких температурах торий с карбидом ThC образует непрерыв-
непрерывный ряд твердых растворов; при низких температурах растворимость
углерода в a-Th также достаточно велика [0,2—0,5 % (по массе)], чем
и объясняется его влияние на свойства.
Сульфиды различного состава могут быть получены путем нагрева-
нагревания тория с парами серы при 677—727 °С. Теплота образования Д//Обр
различных сульфидов:
Соединение .... Th2S3 ThS Th7S12 ThS2
ДНобр, кДж/моль —1081,4 —501,8 —2780,8 -710,9
Торий реагирует со фтором при комнатной температуре, с осталь-
остальными галогенами — при нагревании. Образующиеся галогениды имеют
общую формулу типа ThX4. Теплота образования ДЯобр некоторых га-
логенидов тория:
Соединение. . . . ThF4 ThCl4 ThBr4 Thl4 ThOF2
ДНобр, кДж/моль —2112,2 —1188,2 —963,8 —671,1 —1678,9
Наиболее важное промышленное значение имеют фторид ThF4 и хло-
хлорид ThCl4. Фторид получают действием HF на ThO2 при повышенных
температурах. Он мало растворим в воде и минеральных кислотах. Все
галогениды гигроскопичны и хорошо растворимы в воде. Для всех них
известны кристаллогидраты, выделяемые кристаллизацией из водных
растворов.
Наибольшее практическое значение имеют сплавы тория с ураном и
плутонием. Растворимость урана в тории при 1050"С менее 0,15 % (ат);
максимальная растворимость примерно 2,5% (ат) при 1450"С. Сплавы
торий—уран, облученные до высоких степеней выгорания, хорошо соп-
сопротивляются высокотемпературному распуханию. Плутоний хорошо
растворим в ее и 0-Th: его предельная растворимость в a-Th при 610 "С
достигает 33 % (ат) и снижается до 20 % (ат) ниже 400 "С. Однофазный
сплав Th—15% Pu отличается стабильностью размеров, а сплав
Th— 10% Pu обладает хорошей радиационной стойкостью. Среди
601
нерадиоактивных элементов наибольший интерес по взаимодействию с
торием представляет цирконий. Высокотемпературные р-нюдификацин
обоих элементов образуют непрерывный ряд твердых растворов, в то
время как растворимость циркония в a-Th составляет лишь
10—15% (ат). Это позволяет существенно изменять свойства ториево—
циркониевых сплавов с помощью закалки н отпуска.
Из-за большого размера атома торий образует широкие или непре*
рывные области твердых растворов только со скандием, иттрием, лан-
лантаном и лантаноидами за исключением европия и иттербия.
Коррозионные свойства. Коррозионная стойкость тория при темпе"
ратуре 800 °С в течение 30 мин в различных газах:
Среда
Воздух ....
Технический азот
Очищенный азот .
Технический аргои
Очищенный аргои
Изменение
массы, г/м2
60
44
20
10
7,5
При испытании тория в воде при 100 °С образуется прочная защит-
защитная пленка оксида. При температурах 177 °С и 200 "С эта пленка не-
непрочна и легко отслаивается. В результате 768-4 выдержки в воде при
177 °С чистый торий потерял в массе 3480 г/м2.
Коррозия в жидких металлах определяется величиной растворимос-
растворимости тория в соответствующих жидких металлах:
Жидкий
металл
№
Na-K
Li
Pb
Bi
Sn
Sb
In
Tl
Al
Растворимость тория, % (no
500
H. p
»
—
0,1
—
0,05
—
@0 | 700
H p
»
0,5
0,05
H. p
—
H. p
0,1
0,8
0,2
0,05
26,9
массе) при
800
H. p
0,44
1,7
1,9
0,3
0,25
0,27
32,7
температуре, "С
900
—
1,2
3,6
4,3
1,0
0,95
0,33
—
1000
—
Н. р
П. р
»
__
__
_
—
Примечание. Н р — не растворим; П.р — полностью растворим.
Технологические свойства
Плавка и обработка давлением. В производстве тория наиболее широ-
широкое применение получил метод дуговой вакуумной плавки с расходуе-
расходуемым электродом. С его помощью можно получать слитки диаметром
свыше 250 мм, а плотность слитков, выплавленных этим методом, вы-
выше, чем в случае плавки в индукционной печи Пластины относительно
чистого иодидного тория могут быть прокатаны вхолодную без проме-
промежуточных отжигов с суммарным обжатием до 99 °/о. Однако слитки то-
тория, особенно полученного кальциетермическим способом, необходимо
подвергать предварительной горячей деформации при температурах
602
640 950 СС. Для защиты тория от окисления его лучше всего нагревать
в атмосфере инертных газов, вакууме или соляных ваииах. При чер-
черновой обработке массивных заготовок<тория можно осуществлять на-
нагрев н на воздухе, а образующуюся легко осыпающуюся окалину уда-
удалять обдувкой или травлением Первичную обработку слитков кальцие-
термического тория обычно проводят посредством экструзии или ковки.
Экструзия является наиболее надежным способом первичной деформа-
деформации слитков: однако очень низкие антифрикционные свойства тория и
его повышенная иалипаемость на инструмент могут привести к повы-
повышению сопротивления деформации, задира-м и разрушению поверхности
заготовок. С целью устранения этого недостатка рекомендуется приме-
применять предварительные подогревы в соляных ваннах для образования
пленки солн, играющей роль смазки при деформации, или экструдиро-
вать торий в оболочках. С помощью экструзии с подогревом до 700—
960 °С из тория могут быть получены высококачественные прутки и
трубы.
Ковка также является удовлетворительным способом обработки
слитков тория Во избежание растрескивания боковых кромок слитков
рекомендуется их тщательная предварительная зачистка и удаление де-
дефектов Также весьма желательны небольшие (поверхностные) дефор-
деформации на начальных стадиях ковки и частые промежуточные отжиги.
Прокатке подвергают только слитки иодидного тория, ибо прокат-
прокатка — наиболее опасный с точки зрения возникновения трещин процесс.
Температура подогрева под прокатку 850—900 °С, единичные обжатия
при прокатке достаточно чистых слитков могут достигать 90 %, однако
практически, во избежание растрескивания не применяют обжатия бо-
более 20 %. Также как и при ковке, желательны частые промежуточные
огжиги. Для получения прутков из тория можно использовать сортовые
станы, предназначенные для прокатки стали. Необходимо учесть, что
торий склонен к значительному уширению; поэтому желательно исполь-
использовать закрытые, ромбические или квадратные калибры С помощью
волочения удалось получить ториевую проволоку различных диаметров
вплоть до 0,08 мм Основные проблемы и здесь связаны с высокой на-
липаемостью тория, что вынуждает применять специальные смазки или
защитные оболочки После первичной горячей деформации торий можно
легко деформировать вхолодную
Температура рекристаллизации Температура рекристаллизации тория
определяется способом его производства:
Деформация
(вытяжка)
1.25
1,7
2.5
5,0
Температура рекристаллизации, °С, тория
чальциетермнческого
550—575/650
540—550/650
520/625
520/625
иодидиого
550—575/700
520/600
510—520/600
500/575
Примечание. В числителе приведена температура начала, а в знамена-
знаменателе—конца рекристаллизации.
Практически для кальциетермического тория в литом и горячедеформи-
рованном состоянии рекомендуется часовой отжиг при 750 °С, а в холод-
нодеформированном состоянии — 640 °С, в результате чего в металле
можно получить рекристаллизованную структуру с размером зерна
0,4—0,5 мм. Для иодидного тория рекомендуемые температуры, соот-
соответственно, равны 600—700 "С.
603
Обработка резанием. Торий легко обрабатывается иа металлорежу-
металлорежущих станках, шлифуется и режется пилой. Однако, вследствие значи-
значительного налипания, образования длинной витой стружки и выделения
тепла, обработка резанием тория сопровождается интенсивным износом
инструмента. Для большинства операций обработки необходимо исполь-
использовать инструмент из быстрорежущей стали н выполнять требования по
геометрии режущей кромки. Если торий имеет оксидную пленку или
содержит значительное количество неметаллических включений, может
быть использован твердосплавный ииструмеит. При резке тория на вы-
высокопроизводительных механических ножовках во избежание заедания
полотна и самопроизвольного выгорания стружки, необходимо приме-
применять охлаждение эмульсией. Нарезать резьбу на изделиях из тория
лучше всего однопрофильными токарными резцами (при использовании
плашек стружка наволакивается на инструмент и рвет резьбу).
Плакирование. Плакируют торий в первую очередь алюминием и
цирконием с целью предотвращения его коррозии. Установлено, что наи-
наиболее перспективным методом плакирования являетсяг нанесение по-
покрытий с помощью обработки давлением. Так, плакирование алюминием
осуществляется путем совместной прокатки ториевых и алюминиевых
пластин при 260 °С с суммарным обжатием до 75 %. Эти условия обес-
обеспечивают разрушение пленок на контактных поверхностях листов и об-
разозаиие прочного контакта оболочки с сердечником. Если начальную
деформацию вести с малыми обжатиями, может произойти раскрытие
пакета; поэтому единичные обжатия в первых пропусках не должны
быть меньше 40 %. Прокатку тория, плакированного цирконием, ведут
при 650—815°С с суммарным обжатием 87,5 %. После прокатки плаки--
рованную полосу подвергают термической обработке при температурах,
соответствующих р-области циркония. С целью повышения качества
сцепления в этом случае может быть рекомендована прокатка при
980 °С в танталовых оболочках. Необходимым условием высокого ка-
качества сцепления между оболочкой и сердечником во всех видах пла-
плакирования является тщательная подготовка поверхности раздела меж-
между торием и плакирующим элементом.
Области применения
Торированные катоды используют в электронных лампах, а оксидиото-
риевые — в магнетронах н мощных генераторных лампах. Добавка
0,8—1,0 % ThO2 к вольфраму стабилизирует структуру иитей ламп на-
накаливания. Оксид тория ThO2 используют как огнеупорный материал,
для изготовления тиглей, стойких в расплавах химически активных ме-
металлов, а также как элемент сопротивления в высокотемпературных пе-
печах. Торий и его соединения широко применяют в составе катализато-
катализаторов окисления в органическом синтезе, для легирования магниевых и
других сплавов, а также как присадочный материал при сварке молиб-
молибдена с целью повышения пластичности шва.
Основное применение торий нашел в качестве ядерного горючего,
так как под действием нейтронного облучения природный торий 232Th
практически весь превращается в изотоп урана 233U. При работе с то-
торием необходимо соблюдать правила радиационной безопасности.
11.3. ПРОТАКТИНИЙ [1—35, 323, 324]
Общие сведения и методы получения
Протактиний (Ра)—радиоактивный химический элемент, относящийся
к актиноидам, блестящий светло-серый металл. Первый изотоп протак-
604
тиния, точнее, ядерный изомер — короткоживущий 234шра с периодом
полураспада 1,18 мин был обнаружен в 1913 г. Фаянсом и Герингом
в радиоактивном ряду урана — радия. В 1918 г. немецкий радиохимик
Ган совместно с австрийским физиком Майтнер и, независимо от них,
английские ученые-Соддн и Крастои получили долгоживущнй изотоп
23Фа, относящийся к радиоактивному ряду актиноурана. В этом ряду
протактиний является предшественником актиния (изотоп 227 Ас обра-
образуется при распаде 231Ра), что и отражено в его названии (от грече-
греческого protos — первый). Протактиний — одни из самых малораспрост-
малораспространенных элементов. На его долю приходится лишь Ы0-10 массы зем-
земной коры. О нахождении и миграции протактиния в биосфере известно
очень мало. В морской воде концентрация Ра составляет около 1X
ХЮ~19 г/л; в грунтах его значительно больше. В природе, как члены
естественных радиоактивных рядов встречаются 231 Ра и 234Ра (специ-
(специальное название последнего «уран-зет», символ UZ), а также 231п1Ра
(уран-икс-2, UX2). Искусственный 233Ра интенсивно аккумулируется рас-
растениями и животными. Получают протактиний преимущественно из от-
отходов эфирной очистки урановых концентратов. Методы его выделения
представляют собой различные комбинации соосадительных, экстракци-
экстракционных и ионообменных реакпий, разрабатываемых для каждого сырье-
сырьевого материала с учетом его конкретного состава. Необходимо помнить,
что изотоп 231Ра очень токсичен. Предельно допустимая концентрация
его в воздухе 4-10~и г/м\ Работают этим изотопом в герметичных
боксах со специальной фильтрующей системой.
Физические свойства
Атомный номер 91. атомная масса 231,036 а. е. м, атомный радиус
0,162 нм, ионные радиусы 0,106 нм для Ра3+ и 0,091 нм для Ра4+,
конфигурация внешних электронных оболочек 5/26d'7s2. Значения по-
потенциалов ионизации, начиная с 6-го / (эВ): 84; 100; 115; электроотри-
электроотрицательность 1,11—1,2. При низких температурах имеет тетрагональную,
а при высоких — о. ц. к. решетку Известны изотопы протактиния с мас-
массовыми числами 224'—237 и ядерный изомер 234"фа Наиболее устойчив
изотоп 231Ра, имеющий период полураспада 3,248-10'» лет. Эффективное
поперечное сечение захвата тепловых нейтронов B00±20) • Ю-28 ч2.
Работа выхода электрона <р=3,3 эВ. Плотность при 293 К р=
= 15,4 Мг/м3. Температура плавления (пл= 1575±20 °С, температура
кипения /кип = 4230°С. Удельная теплота плавления Л//П1 = 63,4
кДж/(кг-К), удельная теплота испарения при температуре кипения
А#„сп= 1993,7 кДж/кг-К. Температурный коэффициент линейного рас-
расширения а= 11,2-10 в К. Температура полиморфного превращения
*а_*3 -=1170°С. По твердости протактиний близок к урану. Температура
перехода в сверхпроводящее состояние ТС=2К.
Химические свойства
В соединениях протактиний проявляет степень окисления от + 2 до +5,
реже +4. В степени окисления +5 атомы протактиния не содержат
5/-электронов, поэтому в этом состоянии этот элемент похож не иа ак-
актиноиды, а на ниобий или тантал. Поверхность металлического протак-
протактиния обычно покрыта пленкой оксида РаО. В зависимости от условий
окисления могут быть получены РаО2, Ра6О14, Ра2О5, а также фазы пе-
переменного состава. Оксид РагСЬ можно сплавить с кислым сульфатом
и с оксидами щелочных и щелочноземельных элементов В первом слу-
605
чае он проявляет основные, а во втором — кислотные свойства. Извест-
Известны оксигалогениды протактиния, пента- и тетрагалогениды, фторпротак-
тинаты, сульфопротактииаты и оксалаты. Расчетные значения теплот
образования А#обр некоторых твердых соединений протактиния:
Соединение .... PaF4 PaCl4 PaBr4 Pal4 PaF5
ДЯобр, кДж/моль 1925,9—1946,8 1122,1 887,6 602,9 2260,9
Области применения
Большой интерес к протактинию связан с возможным использованием
тория для получения атомной энергии. При поглощении ядрами тория
232Th нейтронов образуется изотоп 233Th, который быстро распадается,
давая радиоактивный E-233Ра.
11.4. УРАН [1—35, 323, 328—331]
Общие сведения и методы получения
Уран (U)—радиоактивный химический элемент III группы периодиче-
периодической системы, представитель семейства актиноидов, серебристо-белый
блестящий металл, по внешнему виду похожий на сталь. Открыт в
1789 г. немецким химиком Клапротом и назван в честь планеты Уран.
В металлическом состоянии получен в 1841 г. французским химиком
Пелиго при восстановлении UC14 металлическим калием. Длительное
время уран представлял интерес только для узкого круга химиков и
находил ограниченное применение для производства красок и стекла.
Промышленная переработка урановых руд началась в 1898 г. в связи
с открытием радиоактивности. Ураи — характерный элемент гранитного
слоя и осадочной оболочки земной коры, где его содержание 2,5-10~4 %
(по массе). В кислых изверженных породах содержится 3,5-Ю-4 %,
в основных породах 5-10~5%, в ультраосновных породах мантии
3 • 10~7 %. Известно около 100 минералов урана, главным из которых
является разновидность уранинита — настуран или урановая смолка,
содержащая 40—76 % урана. Все урановые руды по содержанию урана
можно разделить на 5 сортов: очень богатые (свыше 1 %), богатые
A—0,5 %), средние @,5—0,25 %), рядовые @,25—0,1 °/о) и бедные (ме-
(менее 0,1 %). По химическому составу нерудной составляющей среди
этих руд различают силикатные (в основиом из силикатных минералов),
карбонатные (более 10—15 % карбонатных минералов), железоурано-
вые, сульфидные (более 8—10% сульфидных минералов), каустоболит-
ные (состоящие, в основном, из органического вещества). Химический
состав руд имеет решающее значение для выбора способа их переработ-
переработки. Из силикатных руд уран выщелачивают кислотами, из карбонат-
карбонатных — содовыми растворами, железоурановые (или железокисные) ру-
руды подвергают доменной плавке, а каустоболитовые обогащают путем
сжигания. В ходе геологической истории содержание ураиа в земной
коре уменьшилось за счет радиоактивного распада, который играет
важную роль в энергетике земной коры, являясь существенным источни-
источником глубинного тепла. В микроколичествах A0~5—10~8 %) уран обна-
обнаруживается в тканях растений, животных и человека.
Получают уран из урановых руд, содержащих 0,01—0,015 и даже
0,006—0,008 % урана (США). Руды, практически не обогащают, за ис-
исключением ограниченного способа равномерной сортировки, основанной
606
иа ^-излучении радия, всегда сопутствующего урану. В основном, руды
выщелачивают растворами серной, иногда азотной кислоты или раство-
раствором соды с переводом урана в кислый раствор в виде UO2SO4 или комп-
комплексных анионов [UO2(SO4K]4-, а в содовый раствор — в виде
[UO2 (CO3) з]4~- Для извлечения и концентрирования урана из раство-
растворов и пульп, а также для очистки от примесей применяют сорбцию на
ионообменных смолах и экстракцию органическими растворителями.
Далее из растворов добавлением щелочи осаждают уранаты аммония
или натрия или гидроксид U(OHL. Для получения соединений высокой
чистоты технические продукты растворяют в азотной кислоте и под-
подвергают аффинажным операциям очистки, конечными продуктами ко-
которых является UO3 или U3O8. Эти оксиды при 650—800 °С восстанав-
восстанавливаются водородом или диссоциированным аммиаком до UO2 с после-
последующим переводом его в UF4 обработкой газообразным фтористым
водородом при 500—600 °С. UF4 может быть получен также при осаж-
осаждении кристаллогидрата UF4-nH2O плавиковой кислотой с последую-
последующим обезвоживанием продукта при 460 °С в токе водорода. Основным
способом получения урана в промышленности является его кальциетер-
мическое или магниетермическое восстановление с выходом урана в
виде слитков массой до 1,5 т. Примерный состав слитков, полученных
этим способом: 0,0045 % Fe, 0,001 % Si, 0,003 % С. Металлический уран
получают также электролизом в соляных ваннах, содержащих UF4,
при 800—1200 °С. Черновой уран обычно подвергают рафинирующей
плавке в графитовых тиглях в высокочастотных вакуумных печах.
Очень важным процессом в технологии урана является обогащение его
руды изотопом 235U или выделение этого изотопа в чистом виде, так
как он является основным ядерным горючим. Осуществляется это ме-
методами газовой термодиффузии, центробежным и другими методами,
основанными на различии масс 235U и 238U. В процессах разделения
уран также используется в виде летучего гексафторида UF6. Уран и
его соединения радиационно и химически токсичны. Отравления ураном
возможны на предприятиях по добыче и переработке уранового сырья
н других промышленных объектах, где он используется в технологиче-
технологическом процессе. При попадании в организм уран действует на все органы
и ткани, являясь общеклеточным ядом. Предельно допустимая доза
при профессиональном облучении 0,05 Дж/(кг-год). В качестве профи-
профилактических мероприятий, предупреждающих возможное отравление
ураном, могут быть рекомендованы непрерывность технологических про-
процессов, герметичность используемой аппаратуры, предупреждающие за-
загрязнения воздушной среды, очистка сточных вод перед их спуском в
водоемы, медицинский контроль, соблюдение гигиенических нормативов
содержания урана и его соединений в окружающей среде.
Физические свойства
Атомные характеристики. Атомный номер 92, атомная масса 238,029
а. е. м, атомный радиус 0,153 нм, ионный радиус U3+ = 0,103; U4+ =
= 0,093; U5+ = 0,087; U6+ = 0,083 нм, атомный объем 12,50-10~6 м3/моль.
Конфигурация внешних элементов оболочек 5/36s26p66dI7s2. Первый по-
потенциал ионизации 6,2 эВ, последующие (с7-го): 104, 121, 137 и 126 эВ.
Уран имеет три аллотропические модификации: а (ромбическая решет-
решетка с периодами а = 0,285 нм, 6 = 0,587 нм и с=0,496 нм); E (тетраго-
(тетрагональная решетка с периодами при 1000 К: а=0,108 нм, с = 0,566 нм)
и высокотемпературную у (о. ц. к. с периодом при 1123 К 0,354 нм).
Энергия кристаллической решетки £реш=524 мкДж/кмоль. Природный
уран состоит из смеси трех изотопов: 238U с периодом полураспада
607,
4,51409 лет (его количество 99,2739%), 235U с периодом полураспада
7,13-108 лет @,7024%) и 234U с периодом полураспада 2,48-105 лет
@,0057%), Из 11 искусственных радиоактивных изотопов с массовыми
числами от 227 до 240 наиболее долгоживущий 233U (период полурас-
полураспада 1,62-10s лет), получаемый при нейтронном облучении тория. 235U
и 238U являются родоначальниками двух радиоактивных рядов. Уран —■
радиоактивный элемент. Ядра 235U и 238U делятся спонтанно, а также
при захвате как медленных (тепловых) B3Ю), так и быстрых B35U,
S38U) нейтронов с энергией не менее 1 МэВ. 238U -при захвате медлен-
медленных нейтронов превращается в 23Фи ядерные свойства которою близки
к свойствам 2"U. Эффективное поперечное сечение захвата тепловых
нейтронов и среднее сечение захвата, полученное для максвелловского
спектра нейтронов для различных изотопов урана:
Массовое число 233 234 205 236 238
Эффективное по-
поперечное сечение
захвата тепловых
нейтронов, 10~28m2
Среднее сечение
захвата, lO-2* м2 12,4±1,4
578+4 97±5 683±3 5,5±0,3 2,71±0,2
15,2±2,3 —
Работа выхода электрона ф = 3,3 эВ. Электроотрицательность 1,11—
1.2.
Плотность. Плотность р урана, вычисленная по данным о величине
периодов кристаллической решетки:
г, к ...
Фаза . . .
р, Мг/м3 .
т, к ...
Фаза . . .
р, Мг/м3 .
т, к ...
Фаза . . .
р, Мг/м3
293
а
19,06
935
а
18,37
1173
У
17,79
298
а
19,05
935
В
18,18
1373
Г
17,56
373
а
19,01
973
Р
18,13
'пл
ж
17,90
473
а
18,92
1000
р
18,11
2000
ж
17,28
573
а
18,82
1045
Р
18,07
3000
ж
17,25
673
а
18,70
1045
У
17,94
'кип
ж
15,01
773
а
18,59
1073
У
17,91
Экспериментально измеренная плотность оказывается ниже теоретиче-
теоретической и при комнатной температуре колеблется в пределах 18,7—19,0
Мг/м3.
Электрические и магнитные. Удельное электрическое сопротивление р
поликристаллического ураиа зависит от степени его чистоты:
р.
остаточное
0,00762A,6 К)
0,00955C,67 К)
0,0499E,2 К)
мкОм.м при температуре
20,4
0,0135
0,016
0,055
, К
0
0
0
п
,079
,085
,105
293
0,264
0,283
0,295
Температурный коэффициент электрического сопротивления при
293 К а=3,40-10~3 К. Коэффициент чувствительности электросопро-
электросопротивления — • к давлению гидростатического сжатия р при 293 К:
р dp
608
р, ГПа .
1 dp
P ' dp
О.ООО1
4,88
1,0 3,0
4,56 4,10
Электросопротивление a-U анизотропно и, например, при 293 К имеет
следующие зиачеиня в зависимости от кристаллографического направ-
направления [Ш]:
[Ш] [100] [010] [001]
р, МкОм-м . . 0,364±0,036 0,251±0,005 0,311±0,006
При температуре 0,68±0,2 К уран переходит в сверхпроводящее состо-
состояние. С повышением гидростатического давления до 0,1 ГПа температу-
температура сверхпроводящего перехода возрастает до 2,3 К.
Уран термоэлектрически положителен относительно меди и платины,
однако, температурный коэффициент термопар Си—U и Pt—U нестаби-
нестабилен. Так, при температуре менее 400 К абсолютный коэффициент
т. э. д. с. е\ термопары Си—U колеблется в пределах 4,3—5 мкВ/К.
Т. э. д. с. урана сильно зависит от текстуры.
Постоянная Холла урана в интервале температур 293—573 К и маг-
магнитных индукций В=0,5—1,7 Тл, #=+0,34- К)-'0 м3/Кл. Уран является
слабым парамагнетиком. Его магиитиая восприимчивость % в зависимо-
зависимости от модификации и температуры:
Т, К.
Фаза .
х- ю».
80
a
1,63
293
a
1,72
288—1193
Р
2,02
288—1193
Г
2,07
Тепловые и термодинамические. Температура плавления урана <пл=
= 1133°С, температура кипения ^КЯП=3862ОС, характеристическая тем-
температура 0D=2OO К, температура фазовых переходов (по разным дан-
данным) : а-+$ 662—667 °С, В->-\ 764—775 °С, теплоты фазовых превраще-
превращений и соответствующие объемные изменения приведены ниже:
Тип превращения
у-»-ж
Парообразование
Сублимация при
298 К
Удельная теплота
превращения, кДж/кг
11,9
2,5—19,0
82,7±3,4
1876,9±1,7
2207,6=1:44,1
Энтропия
превращения,
Дж/(моль-К)
3,00—3,05
4,52—4,65
—
—
—
AV/V,
1,0—1
0,6—0
7,6
—
—
%
,12
,7
Удельная теплоемкость сР урана в зависимости от температуры:
т. к
20
40
80
«p. Дж/(кг.К)
14,2
51,8
86,3
Г, К
150
250
400
103,6
113,15
124,4
Г, К
600
100&
1500
ср. дж/(кг-К)
144,9
178,6
160,9
609
Удельная электронная теплоемкость СрЛ>= [11 мДж/(моль-К2)] -Т. Теп-
Теплопроводность Я в зависимости от температуры:
Т К
к', Вт/(м-К)'
т к
С Вт/(м-К)'
200
17,8
900
32,4
300
22,5
1200
22,4
400 600
26,5 31,8
1410 1500
13,7 13,8
Температурный коэффициент линейного расширения а поликристалли-
поликристаллического изотропного урана в зависимости от температуры:
Т, К- • • •
а-106, K~J.
13—423
10,7
423—923
19,2
933—1043
10,9
1053—1383
19,4
Необходимо отметить две особенности термического расширения ураиа.
Первая из них состоит в том, что температурные коэффициенты линей-
линейного расширения всех трех модификаций резко анизотропны. Поэтому
при изменении температуры форма отдельных кристаллитов стремится
к изменениям и возникают значительные внутренние напряжения. Вто-
Вторая особенность — аномальное изменение коэффициентов термического
расширения при температурах ниже 40—50 К, в результате чего при
иагреве в области низких температур уран сжимается, а при охлажде-
охлаждении— расширяется. Обе указанные особенности иллюстрируются вели-
величиной температурных коэффициентов линейного расширения урана
вдоль главных направлений [hkl] для интервала 20—40 К:
Направление .
а-106, К-1- .
[100]
— 114,6
[010]
— 18,6
[ООП
+35,6
Объемное
расширение
—97,6
Молярная энтропия урана при 298 К 5°=50,2 Дж/К. Взаимосвязь меж-
между давлением насыщенного пара р и температурой, при которой это
давление устанавливается:
Г, К 1265 1337 1409 1498 1600
р, 133,3 Па . 10-1» 10-° 10-8 10~' 10-6
7\ К 1717 1854 2014 2206 2439
р, 133,3 Па . 10-5 10_4 10-з ю-2 10_1
Т, К 2729 3097 3579 3955
р, 133,3 Па . 1 10 100 760
Параметры, характеризующие самодиффузию в различных модификаци-
модификациях урана:
Фаза
Г
Р
а
т, к
1170—1200
1170—1380
951—1023
853—923
773—903
П редэкспоиеициальный
■множитель Do, м2/с
A,17—2,33) -10-'
A,0—11,0) -10-е
2,8-10-'
2,0-10-'
4,5-10-'
Энергия активации, Е,
кДж/моль
111,4—119,3
150,7—178,8
185,1—191,8
167,4
176,6—185,5
610
Параметры взаимной диффузии в уране;
Диффунди-
Диффундирующий
элемент
Сг
Мп
Fe
Со
Со
Ni
Си
Nb
Аи
Sr
La
Интервал
температур, К
1053—1353
1053—1353
1053—1353
1053—1353
964—1036
1053—1353
1053—1353
1053—1353
1058—1343
1073—1273
1123—1363
Пред экспонен-
экспоненциальный множи-
множитель О„, ма/с
5,47-10-'
1,81-Ю-8
2,65-Ю-8
3,51 -10~8
1,54 -10—«
5,36-Ю-8
1,96-10-'
4,87.10-*
4,86-10-'
2,38-10-*
1,17-10-?
Энергия
активации Е,
кДж/моль
102,7
58,2
50,4
52,7
115
65,6
100,7
165,5
127,88
196,78
233,2
Примечание
и
v-u
V-U
■y-U
6-U
v-u
v-u
7-U
7-U
и
и
Важное значение имеет диффузия в уране инертных газов—криптона
и ксенона, являющихся продуктами деления. Коэффициенты диффузии
D этих газов в уране, облученном до выгорания 0,17 %:
Г, К 573 673 773 973 1173
Газ 86Кч 86Кч 137Хе "'Хе 13'Хе
ZM02?, м2/с . . 7 15 8-Ю2 35-10? 800- 10а
Оптические. Спектральный коэффициент нзлучення урана е^ в жид-
жидком состоянии в вакууме равен 0,82. При температуре плавления и дли-
длине волны Я=0,670 нм он равен 0,34, в интервале 366—1323 К 0,453, а в
интервале 1323—1370 К 0,415. Коэффициент отражения чистой, оптичес-
оптически гладкой поверхности ураиа при длине волиы к — 0,660 нм nD—0,735,
Расчетная спектральная эмиссионная способность 0,265±0,015.
Механические свойства
Механические свойства урана зависят от вида обработки и чистоты.
Ниже приведены механические свойства урана при комнатной темпера-
температуре прн испытаниях на растяжение по разным даниым:
Вид обработан
Лнтье
Горячая прокатка в ^-области
с быстрым охлаждением
Закалка слитка из У"°бластн
Закалка слитка из Р-области
Прокатка при 500 °С с обжа-
обжатием 50 % (а-прокатка)
То же с обжатием 25 %
Прокатка при 300 °С с обжа-
обжатием 25 %
Прокатка в а-области, отжиг
в у-области
о МПа
340—480
400
600
580
710
630
980
390
а0 2, МПа
190—280
250
460
460
600
540
—
180
б, %
4—6
5—7
4
4
7
9
35
5
*. %
10—И
—
6
8
3
3
27
10
611
Вид обработки
Прокатка в а-области, закал-
закалка из ^-области
Прокатка и отжиг в а-обла-
а-области (при 550—600 °С)
О , МПа
580
600
1
оо2, МПа
250
430
Продолжение
6. %
9
7
*%
12
4
Таким образом, хотя прочность литого урана невысока, она может быть
существенно повышена в результате закалки из р и уобласти, а также
за счет деформационного наклепа. Механические свойства урана при
растяжении при повышенных температурах существенно зависят от ско-
скорости деформации:
t, "С 700 700 700 850 850 850
Скорость деформации,
10-1 с-1 43,7 2,9 0,2 43,7 2,9 0,2
ов, МПа 196,5 107,0 60,0 126,5 62,2 33,0
6, % 31,5 42,3 36,7 52,9 68,1 50,5
Твердость ot-U при комнатной температуре ЯУ=1960—2160 МПа и сни-
снижается до 100—140 МПа при 600 °С. При фазовом переходе а->{} твер-
твердость при комнатной температуре возрастает примерно в 3 раза. Изме-
Изменение ударной вязкости ураиа KCU при повышении температуры испы-
испытания:
t, "С ...... 20 100 200 300 400
ан, кДж/м2 ... 1,40 230 400 580 800
Продолжение ;
t, °C 500 600 700 800 850
ан, кДж/м2 . , • 1170 270 200 240 1200
Температура перехода урана из пластичного состояния в хрупкое колеб-
колеблется в широких пределах — от —196 до 100 СС и существенно зависит
от чистоты, скорости деформации, геометрии зерен и т. п.
Значения коэффициентов упругости монокристаллов a-U:
Модули
С»
С22
С33
С"
Съъ
С66
С12
С13
с23
нормальной упругости, ГПа, при
298 К
214,7
198,6
267,1
124,4
73,4
74,3
46,5
21,8
107,9
4К
114,3
211,1
286,0
139,6
82,0
89,2
28,6
34,7
112,9
Коэффициенты Пуассона
при
via
V?1
^13
V23
V32.
дм к
0,243
0,177
—0,017
-0,017
0,390
0,548
—
—
—
612
На основании данных об упругих коэффициентах монокристаллов при
комнатной температуре рассчитаны модуль нормальной упругости Е
П99 ГПа), модуль сдвига G (82,2 ГПа) и коэффициент Пуассона v
@,2087) полнкристаллического урана. Реальные значения этих коэффи-
коэффициентов зависят от вариантов термопластической обработки и колеблют-
колеблются в пределах 178—215 ГПа для модуля нормальной упругости, 71,4—■
85,6 ГПа для модуля сдвига и 0,20—0,25 для коэффициента Пуассона.
Термический коэффициент модуля нормальной упругости урана равен
—5,6-10~4 К. Данные о ползучести урана, так же как и другие его
свойства, имеют значительный разброс, что связано с особенностями
технологии получения материала, его текстурой и чистотой. Ниже при-
приведена ползучесть урана при 300 и 500 °С:
«У
О-
ь -
#ь
300
500
Обработка
Литье
Горячая прокатка
Горячая прокатка и за-
закалка из уобласти
Прокатка при 500 "С
Прокатка при 500 °С, от-
отжиг при 600 "С
Литье
Горячая прокатка
Горячая прокатка и за-
закалка из уобласти
На-
пря-
пряжение,
МП а
200
180
180
180
180
40
40
40
Дефор-
Деформация при
Нагруже-
нии, %
2,00
0,58
0,08
0,19
0,24
0,04
0,04
0,08
Скорость
установив-
установившейся пол-
ползучести 6.
6,38-10-8
2,77-Ю-8
6,94-10-"
8,08-10-8
1,1-10-'
3,6-10-'
9,7-10-'
3,6- 10-в
Сум-
Суммарная
деформа-
деформация ползу-
ползучести, %
2,83
0,81
0,17
0,57
0,79
0,87
2,80
26,7
(порвал-
(порвался)
Скорость ползучести урана при повышении температуры выше 673 К
резко возрастает. Закалка из Р- и у°бластей повышает сопротивляе-
сопротивляемость ползучести. Имеющиеся данные показывают, что предел выносли-
выносливости урана при знакопеременной нагрузке не зависит от частоты ко-
колебаний действующей силы, состава атмосферы испытания и содержа-
содержания примесей в металле. Деформация урана в а-области повышает
предел выносливости, а отжиг — снижает его. Предел выносливости
также зависит от направления деформации, в направлении прокатки
образцов он выше, чем в поперечном направлении.
Влияние облучения на свойства урана
Использование ураиа в атомной промышленности и других областях
предполагает его облучение. Изотоп 233U имеет малый период распада,
так что становятся заметными эффекты самооблучеиня. Поэтому ниже
приводятся некоторые данные по влиянию облучения на свойства урана.
Коэффициент радиационного роста. Под влиянием облучения в реак-
реакторе происходит радиационный рост урана. Непосредственной причиной
роста, т. е. изменения формы тела при неизменном объеме, является
удлинение вдоль направления [010] при сокращении вдоль [100] и
практической неизменности размеров вдоль [001]. Склонность урана к
радиационному росту характеризуется коэффициентом радиаци'онного
роста, представляющим отношение относительного удлннения образца к
его относительному выгоранию, т. е. относительному количеству атомов,
претерпевших деление под действием облучения. Коэффициент радиа-
613
ционного роста зависит от температуры облучения, интенсивности де-
деления атомов, характеристики облучаемых образцов, методики замера
и т. д., вследствие чего изменяется в широких пределах. Общие законо-
закономерности изменения коэффициента радиационного роста:
1. Коэффициент радиационного роста поликристаллических текстури-
рованных образцов урана в деформированном и рекристаллизованном
состояниях при —196 °С весьма велик. Так при выгорании 10~5 этот
коэффициент вдоль оси [010] составляет 11 500, однако снижается при
температуре 75 °С до 1200. Зависимость коэффициента радиационного
роста вдоль различных направлений псевдомонокристаллов от темпера-
температуры облучения:
, [010] [010] [010] [010] [100]
. —268 —253 —203 277 —253
, 52 500 47 100 8750 1600 —30500
№П
*, °с
Коэффициент роста
[100]
—203
—2000
[100]
277
—1600
[001]
—253
5000
[001]
—203
600
Коэффициент роста . . ,
2. При низких температурах облучения коэффициент радиационного
роста резко зависи,т от дозы облучения, снижаясь при малых дозах,
3. Коэффициент радиационного роста резко возрастает при увели-
увеличении степени холодной деформации, приводящей к созданию текстуры
[010]. В металле, прокатанном при более высоких температурах, радиа-
радиационный рост уменьшается и может даже стать отрицательным.
4. Фазовая перекристаллизация a-U путем нагрева до области р или
V-фазы понижает коэффициент радиационного роста до 15—20 за счет
устранения преимущественной ориентировки.
5. Измельчение зерна урана ие снижает коэффициента радиационно-
радиационного роста, если не меняется текстура образца. Однако при этом улучша-
улучшается качество поверхности за счет устранения «жеванности», т. е. мест-
местного складкообразования как результата неравномерного роста зерен.
Изменение свойств облученного урана. Под действием облучения
при 100—200 "С происходит резкое, в 50—100 раз, ускорение ползучести,
значительно ускоряется релаксация внутренних напряжений, возрастает
удельное электрическое сопротивление. Ниже приведен коэффициент
пропорциональности К между величиной прироста удельного электросо-
электросопротивления урана и выгоранием:
Уран
Электролитический холоднодеформи-
роваинын
Технической чистоты, холоднодефор-
мированный
Электролитический, отожженный в
а-области
Электролитический, закаленный из
р-области
Электролитический, отожженный в
V-оСластн
Технической чистоты, отожженный в
Y-области
K-W при температуре облучения,
°С
—268,5
56
17—20
35
250
—253
12,5
13,0
-196
6,0
2,9
5,5
614
Влияние облучения и отжига после облучения на механические свойства
урана:
Выгорание,
% (ат.)
Исходный
0,018
0,031
0,075
0,072
t, "С
—
150
150
150
300—400
СТВ, МПа
680
Облучение
510—590
530—650
620
550
авг. МПа
265
380—420
490—650
530—580
320
в. %
19
0,7—0,8
0,5—0,8
0,5
0,4
Отжиг после облучения A00 ч)
0,018
0,031
0,075
0,075
0,075
400
400
400
600
700
530
560
580
610
380
340
400
450
360
330
1,6
1.1
0,8
1,2
0,8
Таким образом, облучение существенно снижает прочностные, а особен-
особенно пластические свойства урана, тогда как предел текучести возрастает.
Циклическая термическая обработка в интервале 227—527 "С предвари-
предварительно облученных образцов снижает предел прочности при одновремен-
одновременном уменьшении плотности, так как при циклической термической обра-
обработке предварительно облученного урана в нем возникают и развивают-
развиваются трещины. Повышенные значения предела текучести ураиа сохраня-
сохраняются до 450 °С, а низкие значения удлинения — до 650 "С. При облуче-
облучении дозами 1020—1023 нейтрон/м2 наблюдается 10 %-иое повышение твер-
твердости урана. Облучение также способствует выравниванию состава
сплава (радиационная диффузия) и растворению избыточных, особенно
мелкодисперсных выделений. Под действием облучения происходит
разупрочнение упорядоченных сплавов и аморфизация интерметалличе-
интерметаллических соединений урана.
Распухание под действием облучения. Распухание урана под дейст-
действием облучения происходит в свизи с образованием продуктов деления,
главным образом криптона D %) и ксенона C5 %). Увеличение объема
составляет для a-U примерно 2,3 при выгорании 10 % атомов урана.
Размер и количество пузырьков газов — продуктов деления, образую-
образующихся в уране под облучением:
Температура облучения, °С . .
Выгорание, % (ат.) ....
Количество пузырьков в 1 см3,
10"
Средний размер пузырьков, нм
Увеличение объема за счет пу-
415
0,15
70
5
0,05
520
0,11
15
8—15
0,29
620
0,19
4
10-30
0,32
715
0,08
2,5
10—30
0,14
615
Увеличение объема, связанное с возникновением пузырьков, невелико и
достигает насыщения при выгорании 0,05—0,1 % (ат). При более высо-
высоком выгорании [для температуры облучения 600°С более 0,3% (ат))
наблюдается резкое искажение формы н большие локальные увеличения
объема, достигающие 100 %. Это так называемое разрушающее распу-
распухание или распухание второго рода, связанное с коалесценциеЙ газовых
пор, развитием и расширением трещин при выходе из них газа. Извест-
Известны факты распухания облученного при низких температурах урана в
процессе последующих отжигов при более высоких температурах. Рас-
Распухание этого типа можно уменьшить кратковременным отжигом метал-
металла в Р-области. Нагрев облученного урана сопровождается выделением
криптона и ксенона, коэффициенты диффузии которых приведены в
разд. 9.4 и 9 5. Выделение этих газов, особенно криптона, подчиняется
законам диффузии только при сравнительно низких температурах, а при
высоких температурах, порядка 1250 °С идет очень быстро,
Химические свойства
Проявляет степень окисления от +3 до +6, наиболее часто +Б Нор-
Нормальный электродный потенциал реакции U+2HSO—6е=*±Ъ'С f"+ 4H+
фо=— 0,82 В, а реакции U—Зе^г=из+, <ро=—1,7 В. _
Окислительно-восстановительный потенциал реакции U3+->-U4+-fe
в кислых растворах равен —0,61 В. Теплота образования Л/Л>бр и эн-
энтропия s основных ионов урана при 298 К:
Степень окисления . . , U3+ U4+ UOf4"
Д//обр, кДж/моль . . . 513,3±12,5 612,5±12,6 1046,7+8,4
s, Дж/(моль-К) . . . . 146,5 339,1±29,3 83,7±20,9
Уран растворяется в соляной и азотной кислотах и слабо — в концен-
концентрированной плавиковой кислоте. Для иона U6+ характерно образова-
образование иона уранила UO^"*" , соли которого окрашены в желтый цвет и хо-
хорошо растворимы в воде и минеральных кислотах. Соли U*+ окрашены
в зеленый цвет и менее растворимы. Ион уранила чрезвычайно способен
к комплексообразованию в водных растворах с органическими н неор-
неорганическими веществами. Наиболее важны для технологии карбонатные,
сульфатные, фторидные, фосфатные и другие комплексы. Известно
большое количество уранитов — солей не выделенной в чистом виде
урановой кислоты — состав которых меняется в зависимости от условий
получения. Ураииты плохо растворяются в воде.
При температуре 70 "С на поверхности урана в воде образуется
пленка оксида (IV), оказывающая защитное действие. При темпера-
температуре 100 °С уран медленно реагирует с водой, образуя О2 и Н2. Еще
более энергично эта реакция протекает с водяным паром при 200—
250 °С.
Теплота образования некоторых соединений урана с галогенами:
Соединение . . t
А#обр, кДж/моль .
Соединение . . .
ДЯОбр, кДж/моль .
Соединение . . (
ДЯОбр, кДж/моль ,
UF3
. 1469,6—1494,7
Ш3
. , 478,1±8,4
ш4
. . 509,1 ±4,19
UC13
893,9±8,4
UF4
1894±20,9
UF5
2057,8±25,1
UBr3
721,4±8,4
исц
1019,9±2,5
UC16 UF6
1094,8± 2188,0±
±8,4 ±1,67
616
Наиболее активно уран реагирует с фтором. Тетрафторид UF4, имею-
имеющий вид зеленых игольчатых кристаллов, малорастворимых в воде, об-
образуется при 500—600 °С. Вторым практически важным соединением
является гексафторид UFe — белое кристаллическое вещество, возго-
возгоняющееся без плавления при 56,4 "С.
С серой уран образует ряд соединений, важнейшее нз которых US
являетси ядерным горючим. Теплота образования US Д#Обр = 342,1±
±20,9 кДж/моль.
Уран взаимодействует с водородом уже при комнатной температуре,
образуя гидрид UH3. Теплота образования этого гидрида А//ОбР =
= 127,1 =i=0,12 кДж/моль. Растворимость водорода в технически чистом
уране в значительной степени определяется содержанием примесей, ко-
которые насыщаются водородом в первую очередь.
При температурах 450—650 °С и атмосферном давлении уран с азо-
азотом образуют нитрид U4N7. Повышение давления в этом же темпера-
температурном интервале приводит к образованию UN, U2N3 и UN2. Наиболь-
Наибольший интерес в качестве ядерного топлива вызывает мононитрид, теплота
образования которого А#обр = 285,5 кДж/моль. Реакция образования
моионитрида наиболее интенсивно протекает при 800°С. Растворимость
азота в уране при температуре плавления примерно 10~3 % (по массе),
а при температурах 427—927 °С — порядка 10~4 % (по массе).
Сплавы системы U—С, содержащие менее 4,8 % (по массе) углеро-
углерода, состоят из монокарбида UC и ураиа. При низких содержаниях уг-
углерода в системе образуется эвтектика при 1116,6 °С и 0,98% (ат.) С.
Растворимость углерода в уФазе ПРИ эвтектической температуре
0,3 % (ат), но снижается с температурой до 0,09 % (ат.). Растворимость
в Р-фазе меньше МО"8, а в а-фазе — меньше 3-10~4% (по массе).
Помимо UC уран с углеродом образует карбиды UC2 и UC3. Теплота
образования некоторых карбидов ураиа при 298 К:
Соединение UC0,sa UC0,see UC1>o32 UCb9o
—ДЯоор, кДж/моль . .87,9±4,19 97,5±3,8 96,3±4,19 88,3±5,86
Уран активно взаимодействует с кислородом. В порошкообразном
состоянии он пирофорен и горит ярким пламенем. Оксидная пленка на
уране образуется пря вылеживании иа воздухе при комнатной темпе-
температуре и имеет состав UO2. При окислении урана на воздухе при тем-
температуре выше 260—400 °С слои по толщине окалины располагаются в
последовательности:
U -*■ а - UO2 -> а - UO2+* -> Р ■ UO2 (U4O9) -> U3O7 -*■ UO2i67.
Энергия активации окисления ураиа сухим воздухом ниже 400 "С равна
в среднем 75,4 кДж/моль, а выше этой температуры 19,3 кДж/моль.
Помимо указанных, уран дает оксиды изО8> UO3 и U2O5. Оксид урана
(IV) при высоких температурах имеет широкую область гомогенности
от UO,,e до U2.27- Теплота образования важнейших оксидов урана:
Соединение ..... UO2 U4O9 U3O7 U3O8
—ЛЯобр, кДж/моль , , 1084,8 4515,0 3412—3437 3576,4
Растворимость кислорода в уране при температурах 1132, 1400, 2000 СС
составляет 0,05; 0,10; 0,40 % (ат.) соответственно.
По степени взаимодействия с ураном все металлы можно разделить
иа две группы. В первую входят элементы с малой растворимостью во
всех трех фазах урана (Be, Fe, Si, Та, Сг и др ). Вторая группа включа-
включает элементы с высокой растворимостью в у-фазе, причем Nb, Zr, Ti, Pu
и Hf полиостью растворимы, а Мо, V, Re и др. имеют растворимость
более 10 % (ат.). Наибольшее практическое значение имеют двойные и
617
тройные сплавы урана с молибденом, цирконием, алюминием, ниобием
и хромом Введение около 3 % (по массе) Мо позволяет полиостью из-
избежать образования р-фазы. В сплавах, содержащих ? % (по массе)
Мо, легко фиксируется метастабильная при комнатной температуре
у-фаза, имеющая о. ц. к. решетку, а соответственно я изотропные свой-
свойства. Добавки 1—2 % (по массе) Zr приводят к значительному упроч-
упрочнению урана и снижению скорости ползучести, а добавки 1,5—2,0 %
(по массе) Nb повышают радиационную стойкость сплавов урана.
Технологические свойства
Получение слитков урана. Известны многочисленные способы получения
слитков металлического урана восстановлением или электролизом. Наи-
Наибольшее распространение получили кальциетермический и особенно
магниетермический методы восстановления тетрафторида ураиа. Эти
процессы проводятся в специальных реакторах — бомбах. При магние-
термическом способе внутрь реактора помещают графитовые тигли с за-
загруженными прессованными брикетами из UF4 и магниевой стружки. При
кальцнетермическом способе тигель изготовляют из фторида кальция, а
брикеты — из UF4 и кальциевой стружки. Из загруженных реакторов
удаляют воздух, затем их промывают аргоном и проводят восстановле-
восстановление, помещая реактор в печь (магниетермический способ) или возбуж-
возбуждая реакцию специальным запалом (кальциетермический способ). В на-
настоящее время освоена технология получения магниетермическим спо-
способом крупногабаритных (диаметр 450 мм) слитков урана массой до
2 т. Это позволяет во многих случаях исключить последующий переплав
металла в печах. Последний производится с целью утилизации стружко-
вых отходов урана, увеличения массы слитков и очистки от примесей.
Для выплавки урановых слитков применяют главным образом плавку
под флюсом, индукционную или дуговую плавку с плавящимся и непла-
вящимся электродами, а также электроннолучевой переплав. Плавка
под флюсом служит для укрупнения слитка, который при этом способе
производства может достигать 10 т, другие способы плавки позволяют
получить уран повышенной чистоты.
Литье. Помимо получения крупногабаритных слитков, поступающих
на обработку давлением, разработана технология получения литьем ура-
урановых сердечников твэлов. Литьем получают цилиндры диаметром 29,
10 и даже 4,0 мм и длиной до 450 мм. При отливке стержней столь ма-
малого диаметра для повышения жидкотекучести урана применяют пере-
перегрев жидкой ваины на 473—573 К. Макрослитки отливают в изложни-
изложницы, которые изготовляют из графита и чугуна. Размеры изложниц
обычно увеличивают по сравнению с размерами слитка (нз-за усадки)
для диаметра на 1,8, а для длины иа 2,2 %.
Обработка давлением. Отливки диаметром 400—450 мм обычно под-
подвергают ковке или прессованию (экструзией), а дальнейшую их обра-
обработку можно проводить всеми методами. Ковку отливок проводят как
правило на прессах. Температура нагрева 635—640 °С, температура кон-
конца ковки 527 °С. Нагрев и подогревы производят в соляных ваннах. Это
позволяет добиться быстрого нагрева и прогрева заготовок, снизить
потери на окисление и использовать соляную рубашку в качестве смаз-
смазки. Продолжительность нагрева заготовки диаметром 450 мм составля-
составляет 3 ч, диаметром 175 мм—45 мин. Ковку на молотах не применяют по
соображениям техники безопасности нз-за разбрызгивания соляного по-
покрытия. Ковку ведут, сначала осаживая слиток вдоль его ося для раз-
разрешения первичной литой структуры, а затем в перпендикулярном на-
618
правлении от концов к центру, чтобы избежать растрескивания по тор-
торцам. Прн прессовании слитков различают у и а-прессование, причем
Y-прессование ведут при очень высокой (947—1037 °С) температуре с
достаточно большой скоростью движения прессштемпеля (не менее
40 мм/мин) и с примеиеинем мер против захолаживания (подогрев ин-
инструмента и теплоизоляция). В итоге сопротивления деформации сплава
настолько малы, что прессование можно вести с очень высокими вытяж-
вытяжками, коэффициент вытяжки составляет порядка 125. Это резко увели-
увеличивает проязводительность, позволяет применять многоочковые матрицы,
а также получать конечные заготовки из слитков без промежуточных
операций. Кроме того, при прессовании без смазки загрязненные поверх-
поверхностные слои остаются в прессостатке. Недостатком у-прессования яв-
является изменение размеров полученных с его помощью прутков вслед-
вследствие распухания. Поэтому при производстве методом прессования
сердечников твэлов применяют а-прессование с последующей Р-термооб-
работкой для устранения изгиба и роста текстурированного урана,
а-прессование проводится при температуре 632—637°С. Исходные заго-
заготовки имеют диаметр 170—180 мм и длину 530 мм. Коэффициент вы-
вытяжки в этом процессе не более 22—25, а скорость движения пресс-
штемпеля не выше 6—6,5 мм/с. Угол захода матрицы 90°. Время от вы-
выноса заготовки из печи подогрева до начала прессования не более 1 мин,
так же, как и время процесса. Перспективно применение медных оболо-
оболочек. Константы прессования урана: в режиме у-прессования (при 870 °С)
45 МПа, в режиме а-прессования (при 590 °С) 280 МПа. При прокатке
заготовок практически отсутствует проблема схватывания металла с
рабочим инструментом. Поэтому в отдельных случаях можно отказать-
отказаться от подогрева заготовок в соляных ваннах и заменить его нагревом
в аргоне и даже на воздухе. При этом необходимо принимать во внима-
внимание возможности значительного загрязнения поверхностных слоев ок-
оксидами, даже при использовании аргона с небольшими примесями кис-
кислорода. Кроме того, возможно возгорание урана, если подогрев ведут
до 600 °С. Технологичность урана при прокатке в зависимости от темпе-
температуры изменяется немонотонно. В интервалах температур 500—640 °С
и 767—1000 °С допустимы единичные обжатия до 80 %; при 300—500 °С
они составляют 50—75 %; P-U удается прокатать с обжатиями до 30 %.
Наиболее опасны с точки зрения разрушения температуры, близкие к
температурам фазовых переходов. Поэтому необходимо тщательно кон-
контролировать скорость прокатки, превышение которой может привести к
разогреву металла, фазовым переходам и разрушению. Так, скорость
а-прокатки не должна превышать 1,3 м/с. Наряду со скоростью, необ-
необходимо следить за окислением, ибо развитие этого процесса также со-
сопровождается повышением температуры. Прокатка урана при 600 °С и
выше называется горячей, так как полученные при этой температуре
заготовки имеют рекристаллизованную структуру. Теплую прокатку ве-
ведут при 200—400 °С. Большое распространение при производстве урано-
ных заготовок получила сортовая прокатка, а также прокатка труб и
листов. Разработана технология получения урановой фольги толщиной
25 мкм и менее. При этом горячую прокатку ведут до толщины 1,5—■
2,0 мм, после чего следует холодная прокатка с промежуточными отжи-
отжигами. Иногда применяют прокатку порошковых заготовок урана и
вакуумную прокатку. Волочение урана связано со значительными тех-
технологическими трудностями, особенно при больших диаметрах прутка
порядка 25—50 мм. Прутки меньшего диаметра можно подвергнуть хо-
холодному волочению. Его следует осуществлять с небольшими обжа-
обжатиями, частыми промежуточными отжигами с использованием в качестве
смазки коллоидно-графитового препарата с различными наполнителями.
Параметры волочения урановых прутков и проволоки;
619
Единичное обжатие, % . , ,
Напряжение волочения, МПа .
Коэффициент запаса напряже-
напряжения волочения
Коэффициент трения . , , ,
5,5
14,0
6,0
0,20
13,0
24,0
3,7
0,22
28,0
38,0
2,5
0,25
34,0
39,4
2,4
0,25
Для получения заготовок урана диаметром от 0,25 до 100 мм можно
применять ротационную ковку. Прутки диаметром 20 мм и меньше куют
при 25 °С; при большем диаметре прутков нх подогревают до 200—
300 °С. Единичные обжатия 15—25 %, суммарное обжатие может дости-
достигать 90 %; однако, во избежание образования волокнистых структур,
после 50—60 % обжатня следует отжиг. Глубокую вытяжку урана про-
проводят при температуре порядка 250 °С. При теплой вытяжке уран вы-
выдерживает деформации порядка 40—50 %. Наилучшими смазками для
этого процесса является смесь коллоидного графита с маслом. Давление
прижима 4,9—7,7 МПа. При вытяжке резиной листов толщиной 0,75—
2,5 мм напряжение равно 21—42 МПа.
Термическая обработка. Вид термической обработки зависит от на-
назначения изделия н стадии технологического процесса. Сердечники твэ-
лов обычно подвергают р-закалке для создания мелкозернистой квази-
квазиизотропной структуры. При изготовлении листов и проволоки использу-
используют отжиги для уменьшения наклепа и получения мелкозернистой рекри-
сталлизованной структуры, р-термообработка заключается в нагреве
урана до температур образования Р-фазы, выдержке для обеспечения
полноты а-*-Р-превращения и охлаждения до температур нижней обла-
области а-фазы. Рекомендуется проводить закалку сразу после окончания
а->-р-превращения, чтобы избежать роста зерна. Однако на практике это
время немного увеличивают, чтобы выровнять состав сплава и улучшить
структуру при последующем охлаждении. Благодаря увеличению анизо-
анизотропии, которым сопровождается р-мх-превращение, решетка урана во
время Р-закалки испытывает сильную деформацию. Поэтому Р-закален-
ный уран обычно отжигают при 500—580 °С для снятия напряжений.
|}-закалка является стандартным способом получения необходимых
структуры и свойств сердечников твэлов. Для выравнивания режимов
Р-закалки необходимо ограничивать время пребывания изделий на воз-
воздухе при переносе их в закалочную среду и контролировать скорость
охлаждения образца в закалочном баке. Если р-закалке подвергают
изделия после а-деформации, основная задача Р-закалки — снять тек-
текстуру. При термической обработке литых заготовок основная задача Р-
закалкн — измельчение зерна.
Сварка. Сварка урана имеет ряд особенностей, связанных с его вы-
высокой окисляемостью, большой жидкотекучестью и низким поверхност-
поверхностным натяжением A070 мН/м при температуре плавления). Сварку не-
необходимо проводить в защитной атмосфере, желательно в нижнем поло-
положении электрода. Обязательна тщательная зачистка свариваемых
поверхностей, причем сварку надо начинать не позже, чем через 30 мин
после зачистки. Предпочтительно применение неплавящегося электрода
нз торированного вольфрама. В качестве защитного газа можно исполь-
использовать гелнй, аргон или их смеси. Для получения качественных сварных
швов необходимо освобождать защитные газы от влаги, регулировать
скорость подачи газа к поверхности (примерно 1,7 м3/ч) и применять
специальные устройства для сварки
Пайка. Сведения о наиболее часто применяемых для пайки урана
припоях приведены ниже:
620
Состав припоя, %
(по массе)
Bi— 17Sn—26In
Sn—50In
Sn—32,3Cd
Температура
плавления, "С
78,9
115,6
177,0
Температура
пайки, °С
78,9
126,7
177,0
Прочность соединения
внахлестку на срез,
МПа
0,1141
0,0557
0,0799
Обычно ураи предварительно покрывают цинком. Паять уран с цинко-
цинковым покрытием можно обычным свинцово-оловянным припоем. Наилуч-
Наилучшие результаты при пайке дает ультразвуковой паяльник. Его звуковая
активность способствует измельчению оксидов на поверхности урана,
так что смачивание припоем осуществляется без использования флюса
или покрытия.
Обработка резанием. Особенности обработки урана резанием связа-
связаны с его высокой налипаемостью на рабочие поверхности инструмента
и быстрой иаклепываемостью. Кроме того, уран токсичен и пирофорен.
Поэтому при его обработке резанием необходимо выдержнвать некото-
некоторые общие рекомендации. Предотвращение коробления, получение глад-
гладкой поверхности детали и увеличение стойкости инструмента достигает-
достигается при мощном потоке охлаждающей жидкости (»38 л/мин). Наилуч-
Наилучшие результаты при точении урана дают резцы, армированные
карбидными пластинками с полированными рабочими поверхностями
Для уменьшения налипания. Для фрезерования желательно использовать
фрезы с карбидными зубьями, а для строжки — резцы с карбидными
пластинками. Малые отверстия сверлят сверлами с твердосплавными
пластинками, а для больших отверстий можно использовать быстроре-
быстрорежущие сверла. Образующуюся при всех операциях стружку необходимо
держать под слоем охлаждающей жидкости или быстро смывать в бак
с водой. Нарезание резьб в уране облегчается при применении в качестве
смазок дисульфида молибдена или ацетилсалициловой кислоты. При
ручном нарезании резьбы рекомендуется подогрев детали до 150 "С. При
бесцентровом шлифовании урана наилучшие результаты дают круги
из остеклованного карбида кремния.
Прочие вопросы технологии. Обезжиривание урана с поверхности
наилучшим образом осуществляется паром с трихлорэтиленом при 82—
85 "С в течение 60—90 с. Для травления поверхности как правило при-
применяют 50 %-ную азотную кислоту или смесь ортофосфорной и азотной
кислот, для электрополировки — серную кислоту с оксидом хрома. По-
Покрытия на уран наносят электролитическим или химическим способом,
а также методом погружения, путем заливки в изложницы, облицован-
облицованные изнутри металлом покрытия.
Области применения
Металлический уран используют, главным образом, в ядерных реакто-
реакторах, производящих плутоний и электроэнергию Одним из примеров при-
применения природного урана является его использование в твэлах магнок-
совых реакторов, предназначенных для производства энергии, накопле-
накопления плутония и форсирования строительства быстрых реакторов.
Обедненный изотопом 235U материал можно использовать в зоне воспро-
воспроизводства быстрых реакторов, а также применять в качестве защитного
материала против у- и рентгеновского излучения. Уран можно применят^
в качестве геттера в вакуумных трубках, электродного материала в вы-
621
соко- и низковольтных выпрямителях, источниках ультрафиолетового
излучения в электрических дугах. 236U является источником энергии в
ядерном оружии.
11.5. НЕПТУНИИ [1—35, 323, 324]
Общие сведения и методы получения
Нептуний (Np) — искусственно полученный радиоактивный элемент се-
семейства актиноидов. Представляет собой сравнительно мягкий металл
с серебристым блеском. Открыт в 1940 г. американскими учеными Мак-
милланом и Эйблсоном, которые нашли, что изотоп урана 239U, обра-
образующийся при облучении 238U нейтронами, быстро распадается, испус-
испуская (i-частицу и превращается в нзотоп элемента с атомным номером 93.
Название элемента происходит от названия планеты Нептун. Ничтож-
Ничтожные количества элемента в виде 237Np и 239Np найдены в урановых ру-
рудах, где эти изотопы образуются непрерывно за счет ядерных реакций
с нейтронами. Весомые количества 237Np образуются в качестве побоч-
побочного продукта при производстве плутония в ядерных реакторах. Метал-
Металлический нептуний получают восстановлением фторида NpF4 кальцием
при нагревании в инертной среде.
Физические свойства
Атомный номер 93, атомная масса 237,048 а. е. м, атомный радиус
0,150 им, ионные радиусы 0,102 нм для (Np*+) и 0,088 нм для (Np*+),
конфигурация внешних электронных оболочек 5f46s26d'7s2. Потенциал
ионизации нептуния / (эВ): 5,9; 11,7; 22,0. Атомный радиус нептуния
0,150 нм, ионный радиус Np3+ 0,102 нм, Np4+ 0,088 нм.
Известны а, р" и у-модификации нептуния, a-Np имеет ромбоэдриче-
ромбоэдрическую решетку с периодами а=0,473 нм, 6=0,49 нм и с=0,367 нм;
решетка p"-Np тетрагональная с периодами а = 0,49 нм и с=0,339 нм,
а решетка y-Np — о. ц. к. с периодом 0,353 им. К настоящему времени
известны 15 изотопов нептуния; самый долгоживущий 237Np, испускаю-
испускающий a-лучи, с периодом полураспада 2,14- 10е лет. В исследовательских
работах широко используется р"-радиоактнвный изотоп 239Np с периодом
полураспада 2,346 сут. Изотоп 237Np в результате ряда последователь-
последовательных превращений дает стабильный изотоп 209Bi. Цепочку этих превра-
превращений называют радиоактивным рядом нептуния. Эффективное по-
поперечное сечение захвата тепловых нейтронов составляет для 237Np
A70±5)-10-28 м2. Электроотрицательность 1,11—1,2.
Плотность нептунии р в зависимости от типа его кристаллической
решетки:
Модификация a P V
Г, К 293 586 873
р, Мг/м» .... 20,45 19,46 18,0
Температура плавления нептуния <„Я=637°С, температура кипения
гкип=3900°С, температуры полиморфных превращений а-+$ 280 °С и
Э-ку 577 °С. Удельная теплота сублимации ДЯ— 1666,9 кДж/кг. Теп-
Теплопроводность нептуния прн 300 К \=7J Вт/(м-К). Температурный
коэффициент термического расширения: a-Np a=4,l-10"' K~l при
273 К; изменение объема при плавлении 4,5%. Чистый нептуний —
ковкий и сравнительно мягкий металл,
622
Химические свойства
В соединениях проявляет степень окисления +3, +4, +5, +6, +7, но
наиболее часто +5.
По химическим свойствам нептуний во многом сходен с ураном и
плутонием. В образовании его химических связей участвуют 5f, 6rf и 7s
электроны. В растворах солей нептуний образует ионы Np3+, Np4+,
NpO £, а также NpO|+H NpO35~.
Теплота Д#Обр и энтропия s образования различных нонов нептуния
при 298 К:
Ион Np3+ Np4+ j
ДЯобр, кДж/моль . . 528,3±0,8 553,9±1,3 978,0 860,4
s, Дж/(моль-К) . . —129,8 —326,6 —26±8,4 —
Наиболее устойчив из них ион NpO^". Ионы нептуния склонны к гидро-
гидролизу и комплексообразованию. Из соединений четырехвалентного неп-
нептуния наиболее изучены оксид (IV) NpO2 — коричневый кристалличе-
кристаллический порошок, нерастворимый в кислотах, кроме смеси серной кислоты
с броматом калия, и гидроксид Np(OHL-nH2O — легко растворимая в
кислотах студенистая зеленовато-серая масса. Гидроксид нептуния по-
получается при осаждении солей Np4+ аммиаком и используется для по-
получения солей нептуния. Теплоты образования Д#обР некоторых прос-
простых соединений нептуния-
Соединение .... NpF3 NpCl3 NpBr3 Npl3 NpF4
ДЯ„бр, кДж/моль . . 1507,2±8,4 904,3± 728,5± 502,4± 1791,9
±4,2 ±4,2 ±4,2
Соединение .... NpClj NpBr4 NpOCl2 NpO2
Affoep, кДж/моль . . 98б,8±1,2 772,5±2,1 1028,3± 1074,7±
±1,2 ±2,5
Нептуний легко образует сплавы с плутонием и ураном, а также за-
заметно растворим в жидком кадмии. Получены его сплавы с алюминием,
бериллием, марганцем, металлами семейства железа и платины. Поми-
Помимо кислорода, нептуний легко вступает в реакции с водородом, азотом,
серой и другими элементами. При комнатной температуре реакции с
кислородом и азотом протекают очень медленно, а в соляной кислоте
нептуний полностью растворяется лишь при наличии фторсиликат-
ионов.
Области применения
Нептуний используют, в основном, для исследовательских целей. Изо-
Изотоп 237Np используют для получения изотопа 238Ри, который применяют
в космических исследоваииях и микроэиергетике.
11.6. ПЛУТОНИЙ [1—35, 323, 331]
Общие сведения и методы получения
Плутоний (Ри)—искусственно полученный радиоактивный химический
элемент семейства актиноидов, при обычных условиях блестящий бе-
белый металл. Открыт в 1940—1941 г. американскими учеными Сиборгом,
623
Макмилланом, Кеннеди и Валем, получившими изотоп 23»Ри в резуль«
тате облучения урана ядрами тяжелого изотопа водорода — дейтрона-
дейтронами. Назван в честь планеты Плутон. Период полураспада всех изотопов
плутония много меньше возраста земли и поэтому весь первичный плу-
плутоний, существовавший на планете в период ее формирования, полно-
полностью распался. Однако, ничтожные количества плутония 239Ри посто-
постоянно образуются при Р-распаде 239Np, поэтому следы плутония обнару-
обнаружены в урановых рудах.
В СССР первые опыты по получению 239Ри были начаты в 1943—
1944 гг., а в 1945 г плутоний был уже выделен из облученного нейтро-
нейтронами урана. В 1949 г. начал работу первый в СССР завод по радио-
радиохимическому выделению плутония. Промышленное производство 23эРи
основано на взаимодействии ядер 238Ри с нейтронами в ядерных реак-
реакторах Последующее отделение плутония от урана, нептуния и их вы-
высокорадиоактивных продуктов деления осуществляют радиохимически-
радиохимическими методами: соосаждением, экстракцией, ионным обменом и др. Ме-
Металлический плутоний обычно получают восстановлением фторидов
PuF2> PuF4 или оксида РиО2 парами бария, кальция или лития. Боль-
Большое количество плутония 239Ри получают в урановых ядерных реак-
реакторах.
Плутоний накапливается в морских организмах. Наземные растения
усваивают плутоний, главным образом, через корневую систему и на-
накапливают его до 0,01 % своей массы. В организме человека наиболее
токсичный 239Ри вызывает нарушение кроветворения, остеосаркомы и
рак легких.
С 70 годов XX века доля плутония в радиоактивном заражении ат-
атмосферы возрастает.
Основная опасность при обработке плутония состоит в возможности
попадания мелких частиц металла внутрь организма при дыхании.
Установлен допустимый размер этих частиц, равный 0,6 мкг, что экви-
эквивалентно примерно 0,04 мкКи. Ввиду такой высокой токсичности плу-
плутония, все операции, при которых может образовываться пыль или вы-
выделяться пары, должны проводиться в закрытой аппаратуре. При работе
с плутонием следует использовать защитные мероприятия, применяемые
в бактериологических лабораториях. К сожалению до настоящего вре-
времени имеется мало обезвреживающих процедур и нет способа достаточ-
достаточно надежной очистки. Это заставляет или предупреждать распростра-
распространение загрязнений тщательностью и аккуратностью при работе, или
вести очистку с помощью комплексообразователей или сильных кислот.
Физические свойства
Атомные характеристики. Атомный номер 94. Имеет изотопы с массо-
массовыми числами от 232 до 246. Наиболее долгоживущий а-радиоактивный
изотоп 244Ри с периодом полураспада 7,5-107 лет. Наиболее практиче-
практически важный 239Ри имеет период полураспада 24360 лет. В пыли, со-
собранной после взрывов термоядерных бомб, обнаружены следы изото-
изотопов 247Ри и 255Ри. Атомный радиус плутония 0,162 нм, ионный радиус
Ри3+ 0,100, а Ри4+ 0,090 нм. Конфигурация внешних электронных обо-
оболочек 5rf105/66526p6752. Электроотрицательность 1,11—1,2 Плутоний име-
имеет1 шесть аллотропических модификаций, из которых а, Р и \ обладают
сложной кристаллической структурой с ярко выраженными связями ко-
валентного характера:
624
Фазэ
а
6
V
б
■П
8
Тип решетки и простанст-
венная группа
Простая моноклинная,
Моноклинная объемио-
центрнрованиая, 12/т
Гранецентрированная
ромбическая Fddd
Гранецентрированная ку-
кубическая Fm3m
Объемноцентрированная
тетрагональная \4/ттт
Объемноцентрированная
кубическая /m3m
Тем-
Темпера-
тура,
°С
21
190
235
320
465
490
Периоды
а
0,6183
0,9284
0,3159
0,46371
0,334
0,36361
элементарной ячейки,
10~x нм
Ь
0,4822
1,0463
0,5768
—
—
—
с
1,0963
0,7859
1,0112
—
0,444
—
3»
101,79
92,13
—
—
—
—
Атомные радиусы различных модификаций плутония при 298 К и при
температурах нх существования:
Фаза ,,..,,. a, fS
Г, К 298 366
Атомный радиус, нм 0,158 0,160
Радиус прн 298 К, нм 0,158 0,159
V б т| е
508 593 738 763
0,1601 0,1640 0,1638 0,1622(
0,1589 0,1644 0,1644 0,1594
Эффективное поперечное сечение тепловых нейтронов для различных
изотопов плутония:
238
239
240
241
242
Массовое число ....
Эффективное поперечное
сечение захвата тепло-
тепловых нейтронов, Ю-28 м2 403±10 1028±13 287±7 1400±80 18,6±0,8
Среднее сечение захвата 239Ри, полученное экспериментально для макс-
велловского спектра распределения нейтронов, равно A2,1 ±1,7) X
XI О-26 мг.
Плотность. Расчетная плотность р плутония при 293 К в зависимо-
зависимости от модификации:
Фаза
р, Мг/м3
а
19,86
17,70
V
17,14
S
15,92
16,00
16,51,'
Экспериментальное значение плотности твердого плутония при темпе-
температуре плавления р= 16,24 Мг/м3. Плотность жидкого плутония доста-
достаточно точно подсчитывается по уравнению р= A7,63—1,52-10~3<)±
±0,04, где t — температура, измеряемая в "С.
Электрические и магнитные. Удельное электрическое сопротивление
различных фаз плутония и их температурный коэффициент электриче-
электрического сопротивления;
625
Фаза
а
а
а
а
а
а
Р
&
т, к
26
SO
100
150
273
376
420
505
625
735
р, мкОм.м
0,648
,280
,569
,535
,4645
,414
,085
,078
,004
1,021
и-10~', К"
+ 18,405 B6—50 К)
и —0,418 A26—273 К)
—0,62
—0,50
+0,72
+4,43
Абсолютный коэффициент т. э. д. с. плутония е в зависимости от
температуры и модификации по данным различных источников:
Фаза
а
а
а
Р
1
Л
е
т, к
20
100
300
400
500
600
725
800
е.
среднее значение
1,75
9,8
11,5
9,1
8,4
3,0
2^3
3,5
мкВ/К
разброс по разным данным
1,5-2,0
8,2—11,5
7,0—15,5
7,0—10,7
7,4—9,4
2,3-3,7
3,2—3,8
Постоянная Холла а-Pu, стабилизированного 3,4 % (ат) А1, и 6-Ри:
Г, К 77 293
#■101», Мз/Кл:
а-Ри —0,95±0,06 0,69=t0,05
б-Ри 1,62±0,15 0,П±0,1
Удельная магнитная восприимчивость % различных фаз плутония при
различных температурах:
Фаза а а р Р 6 у у
Г, К 273 393 405 413 483 497 503
Х-109 2,28 2,41 2,31 2,52 2,47 2,23 2,41
Фаза у б S S т) е е
Г, К 573 603 631 703 723 753 853
Х-10" 2,40 2,35 2,13 2,33 2,223 2,41 2,34
Тепловые и термодинамические. Температура плавления плутония
*ПЛ=639,7СС, температура кипения £Кип = 3235°С, температуры, теп-
теплоты ДЯ и энтропии s фазовых превращений:
Тип превращения .... а->8 6->v y-+8 8->-т) т)->е е-*ж
t, °C 122 205 318 452 476 639,7
АЯ, кДж/кг 15,4 2,74 2,54 0,16 7,62 11,59
s, Дж/(моль-К) .... 9,50 1,38 1,04 0,04 2,47 3,09
626
Объем плутония при плавлении уменьшается на 2,5 %. Удельная теп-
теплоемкость ср плутония в зависимости от температуры:
т, к
260
320
340
413
153
Дж/(£г-Ю
135,2
147,5
151,6
139,3
143,4
Теплопроводность %
т к...
01, Вт/(м-К) ....
Т, К
503
543
600
650
700
V
Дж/( кг • К)
147,5
151,6
155,7
155,7
155,7
773
873
923
948
плутония при разных температурах:
100 200
4,1 4,65
300 400
5,23 5,80
500 600
6,40 6,93
ж \рк
143
143
168
172
800
8,2
г-К)
,4
,4
,0
,1
1000
9,30
Зависимость среднего температурного коэффициента теплового расши-
расширения от температуры:
Температурный ин-
интервал, К 123— 403— 473— 593— 773—813 813—
373 473 573 773 873
а-10в, К .... 42,4 20,9 60,0 —15,4 —27,5 36,4
Представленные данные показывают, что в интервале 593—813 К плу-
плутоний, в отличие от других элементов, сжимается
Давление пара плутония (Па) в диапазоне температур 1393—
1373 К с точностью ±5 % может быть подсчитано по формуле
р= {—[A7,587±7,3)/Г] +7,895+0,047} • 133,322,
где Т — температура в градусах К.
Параметры самодиффузии различных фаз плутония-
Фаза S е е
Температурный интервал, К . 623—713 773—885 790—850
Предэкспоненциальный мно-
множитель Do, м2/с 4,5-Ю-7 2,2-10-в 3,0-10-'
Энергия активации Е,
кДж/моль 99,6 77,4 65,7±4,2
Имеются данные по диффузии алюминия в плутоний. При температуре
623—790 К он может быть рассчитан по значениям предэкспоненциаль-
ного множителя £>0=2,25-10—8 м2/с и энергии активации £=106,5
кДж/моль.
Механические свойства
Литой плутоний чистотой 99,8—99,96 % имеет при комнатной темпера-
температуре <хв=300—530 МПа, ао,2=210—315 МПа. Твердость по Виккерсу
составляет #К=2454— 2748 МПа, микротвердость а-Pu и Яц=2200—
3000 МПа, a f$-Pu 2700—3250 МПа. Предел текучести а-Pu при сжатии
Oq 2 примерно вдвое выше соответствующих значений при растяжении
и составляет порядка 1200 МПа. Относительное удлинение S плутония
при комнатной температуре невелико и составляет 0,5—0,6 % при 273 К
и 1,0 °/о при 100 °С, однако при более высоких температурах быстро воз-
возрастает При 180 °С плутоний обнаруживает эффект сверхпластичности!
627
его удлинение составляет 500 % и выше. Однако температурная область
этого эффекта довольно узка и уже при 190 "С удлинение падает до
300 %. Прочностные свойства а и fi-Pu очень чувствительны к темпе-
температуре. Так при температуре <х->|3 превращения ав составляет всега
90 МПа, т. е. снижается в 3—5 раз по сравнению с комнатной темпе-
температурой, а при 190 "С он составляет всего 20 МПа. Упругие свойства
(модуль нормальной упругости Е, модуль сдвига G, коэффициент Пу-
Пуассона v и модуль объемного сжатия К) плутония в зависимости от тем-
температуры:
-170
—80
20
60
100
140
170
200
220
260
300
330
380
430
Фаза
а
Р
У
S
Е, ГПа
122
112,4
98,4
93,5
87,2
41,5
39,2
37,8
37,1
34,7
32,2
17,5
17,2
16,8
G, ГПа
51
47
42,7
40,8
38,3
16,1
15,5
14,9
15,0
13,8
10,7
6,1
5,9
5,7
V
0,20
0,20
0,16
0,15
0,14
0,29
0,27
0,27
0,24
0,25
0,25
0,43
0,45
0,42
К, ГПа
67,7
62,6
48,4
44,5
40,5
32,9
28,5
27,3
23,8
23,1
21,5
41,5
56,9
34,4
Сжимаемость плутония, определенная при комнатной температуре,
для адиабатического процесса х=A,84—2,14)-Ю1 Па-1, а для изо-
изотермического процесса х= A,91—2,35) • 10-11 Па-1. Данных о влиянии
термической обработки на свойства высокотемпературных фаз плутония
практически иет. По-видимому, термообработка оказывает слабое влия-
влияние. Однако скорость установившейся ползучести 0-фазы, по крайней
мере, на два порядка выше в том случае, если эта фаза получена из
низкотемпературной а, а не из высокотемпературной ^-фазы плутония.
Химические свойства
В соединениях проявляет степень окисления от +2 до +7, наиболее
часто +4.
В соответствии с основными валентностями плутония его ионы в
растворе существуют в четырех состояниях окисления: Pu3+, Pu4+,
PuO^ (валентность +5) и РиО|+ (+6). Нормальный электродный по-
потенциал фо=—2,07 В; окислительно-восстановительный потенциал двух
реакций окисления плутония в зависимости от температуры:
t,°C 63 64 25 35,2 45,1 45,2
Потенциал реак-
реакции Pu3+->-Pu4+, В —0,95 — —0,97 —0,98 —0,99 —
Потенциал реак-
реакции Pu3+->Pu6+, В — —1,03—1,024 —1,02 — —1,015
628
Значения термодинамических функций образования ионов плутония в
различных кислотных средах:
Pu3+->-Pu4- Pu°-^Pu*+
57,1—60,0 -E37,2-540,1)
-A13,0-126,4) -154,9
Реакция ....
ДЯовр, кДж/моль ,
s, Дж/(моль-К) i
Реакция . . . ,
ДЯобр, кДж/моль ,
s, Дж/(моль-К) .
. Pu°->-Pu3+
. —E93,7—594,1)
—25,1
Pu3+->PuO^"
326,6—328,2
100,5—106,3
95,9—96,3
24,7
Ионы плутония дают характерное окрашивание водных растворов:
РцЗ+ — синее, Ри4+ — от желтого до коричневого, РиО^—красио-фио-
летовое, РиО f+"— розовато-коричневое Все ионы могут находиться в
растворе одновременно в равновесии. Ионы плутония всех степеней
склонны к гидролизу и комплексообразованию. Наиболее устойчивый из
гидроксидов — Ри(ОНL — бледно-зеленая студенистая масса. При ее
взаимодействии с кислотами образуются различные растворимые соли
плутония — сульфаты, нитраты, перхлораты и т. п. При прокаливании
нитрата Pu(NO3L или сульфата Pu(SO4J образуется диоксид (IV)
PuOj — желтовато-коричневый кристаллический порошок.
Плутоний активно взаимодействует с галогенами, особенно со фто-
фтором. Теплота образования ДЯобр некоторых галогенидов плутония
Соединение . . . PuF3 PuCl3 PuBr3 Pul3 PuF4 PuFe
ДЯобр, кДж/моль l553±; 960,4=t 785,9± 544,3:1: 1779zt 1800±
12,6 3,3 4,19 12,6 33,5 33,5
К настоящему времени получены сульфаты трех и четырехвалент-
четырехвалентного плутония.
Гидриды РиН2 и РиН3 образуются непосредственным соединением
плутония и водорода как правило при температурах порядка 100—
200 °С. Гидриды могут также образовываться в результате коррозии
металлического плутония во влажном воздухе. Реакция «плутоний—
водород» представляет интерес как метод получения порошкового плу-
плутония, так как порошок гидрида, приготовленный в результате взаимо-
взаимодействия водорода с массивным металлом, разлагается в вакууме при
400 °С с образованием мелкодисперсного металлического порошка.
С кислородом плутоний образует много соединений, включая двой-
двойные оксиды, пероксиды, гидроксиды и ряд более сложных оксидов, в ко-
которых плутоний присутствует вместе с другими металлическими элемен-
элементами. Теплота ДЯОбр и энтропия s образования некоторых оксидов плу-
плутония при 298 К:
Соединение Pu2O3 Pu2O3 PuOi.ef
Тип структуры .... Гексагональная о. ц. к. о. ц. к.
ДЯ, кДж/моль .... 1711:1:12,6 1727,4=1:20,9 895±6,2
s, Дж/(моль-К) , . • 142,3±20,9 144,0±12,6 80,4±10,5
Помимо указанных, известны оксиды РиО, РиО2 и фаза переменного
состава Ри2О3—Pu4O7. Плутоний быстро окисляется при нагревании иа
воздухе, пирофорен; растворимость кислорода в твердом плутонии нич-
ничтожна.
Установлено существование только одного нитрида плутония PuN.
Теплота его образования по разным данным колеблется в пределах
293,9—299,3 кДж/моль.
Добавки углерода практически не влияют на температуры полиморф1
ных превращений плутония, что свидетельствует о его ничтожной рас-
629
творимости. Установлено существование четырех карбидов плутония,
причем РиС и Ри2С3 обнаружены в литых сплавах, а Ри3С2 и РиСг —
только после соответствующей термообработки. Теплота образования
ДЯ некоторых карбидов плутония:
Соединение PuC0,7 PuC0)87 PuC0,e78 PuC1M
ДЯобр, кДж/моль . . . 16,7 51,9 47,7±2,8 102,1
Несмотря на большое количество известных к настоящему времени
двойных и более сложных диаграмм состояния плутония с другими ме-
металлами, общие принципы их классификации до сих пор не сформули-
сформулированы. Известно, однако, что растворимость второго элемента в двой-
двойных системах с плутонием весьма мала илн ничтожна. Наибольшую
растворимость имеют элементы в б-Pu. Растворимость в ней алюминия
составляет примерно 11,0% (ат.), галлия 12,5% (ат.), циркония —
до 70% (ат.). Хорошо растворяются в 6-фазе Sc, Dy, Ег и Lu. Рас-
Растворимость циркония в y-Pu равна 2—3 % (ат.), а в р"-Ри 3% (ат.).
В е-Pu растворяются Zr, Al, Ti, Zn, U в количестве более 5 % (ат.).
а в а-Pu — только нептуний (>5 %). Легированные алюминием, галли-
галлием и железом сплавы плутония имеют промышленное значение.
Плутоний — наиболее химически активный металл актиноидной груп-
группы; он подвергается заметному разрушению на воздухе. Свежеочищен-
ный плутоний, по цвету похожий на никель, быстро темнеет и окраши-
окрашивается цветами побежалости, а если находится достаточно долго в аг-
агрессивных условиях, покрывается порошковым налетом РиО2 оливково-
зелеиого цвета. В сухом воздухе массивный плутоний относительно
инертен, и его можно сравнительно легко хранить и обрабатывать. Наи-
Наилучшей атмосферой для хранения и обработки плутония является сво-
свободно циркулирующий сухой воздух. Попытки хранить металл в закры-
закрытом сосуде или уменьшить доступ кислорода приводят только к уско-
ускорению коррозии за счет взаимодействия с небольшим количеством влаги.
Вероятность такого взаимодействия возрастает и при хранении металла
в инертном газе. Снижение температуры также способствует возраста-
возрастанию скорости коррозии из-за повышения относительной влажности. При
низкотемпературной коррозии повышение влажности более вредно, чем
повышение температуры. Для снижения склонности плутония к низко-
низкотемпературной коррозии, помимо покрытий, следует рекомендовать его
легирование А1 и Ga. Для повышения сопротивляемости высокотемпе-
высокотемпературной коррозии эффективно легирование Se. Концентрированная
азотная кислота пассивирует плутоний, ио растворяет РиО2.
Технологические свойства
Несмотря иа относительно низкую пластичность а-Pu, его можно под-
подвергать различным видам холодной деформации, включая прокатку и
волочение. Сообщается в частности о том, что литой а-Pu можно про-
прокатать при комиатиой температуре до суммариой степени обжатия 90 %.
Более надежными, однако, следует считать сообщения, когда прокатка
слитков начиналась с температур, соответствующих E-области и только
заканчивалась при комнатной температуре. Отличительной особенностью
обработки плутония являются низкие скорости деформации. Деформи-
Деформированный таким образом металл не имеет признаков значительного на-
наклепа: его твердость возрастает слабо, а уширения рентгеновских ли-
линий практически не наблюдается. В деформированном плутонии имеют
место явная текстура и отчетливая рекристаллизация. Рентгенографи-
Рентгенографически показано, что зерно плутония растет при иагреве уже до 120 °С.
Термическая обработка плутония ограничена связанным с р"->а-превра-
щением изменением объема на 9%, низкой температурой превращения
630
и низкой пластичностью а-Pu. В результате совместного действия этих
факторов количество микротрещин в металле значительно возрастает,
что приводит к существенному снижению плотности. Высококачествен-
Высококачественным считается плутоний, имеющий плотность, равную 99 % теоретиче-
теоретической. Так гидростатическое сжатие а-Pu под давлением до 60 МПа при
90 °С приводит к возрастанию плотности всего иа 0,25% выше теоре-
теоретической и видимо связано, главным образом, с превращением остаточ-
остаточных фаз. Гидростатическое сжатие при 180 °С с последующим охлажде-
охлаждением под давлением до температур образования «-фазы приводит к
возрастанию плотности уже на 0,5 % и более. Количество трещин, воз-
возникающих в результате E->-а-превращения, зависит от качества метал-
металла, его массы и скорости охлаждения. Снижение скорости превращения
и увеличение размеров образцов способствует более интенсивному тре-
щинообразованию. В то же время развитие микротрещии не наблюда-
наблюдалось, когда превращение у-^Р-^а происходило в процессе непрерывного
охлаждения. Максимальное трещииообразование наблюдается в резуль-
результате у-*-Р-превращения и последующей закалки до отрицательных тем-
температур.
Режимы термической обработки влияют также на размер зерна плу-
плутония. Повышение скорости охлаждения и повышение температуры
нагрева пед закалку приводят к резкому измельчению зерна. Необхо-
Необходимо, однако, иметь в виду, что мелкозернистый плутоний чрезвычайно
хрупок. При проведении различных работ с плутонием следует прини-
принимать во внимание его исключительно высокую пирофорность при иа-
греве до 470—520 X. Для снижения пнрофориости плутония его следует
легировать S-стабилизаторами, в первую очередь, алюминием н крем-
кремнием.
Области применения
Плутоний 239Ри используют в атомных реакторах. Энергия, освобож-
освобождающаяся при расщеплении 1 г23эРи эквивалентна теплоте, выделяю-
выделяющейся при сгорании 4000 кг угля, т. е 239Ри — эффективный источник
атомной энергии. Изотоп 23Фи применяют для изготовления атомных
электрических батареек, срок службы которых достигает 5 и более лет.
Такие батарейки применяют, например, в генераторах тока, стимулирую-
стимулирующих работу сердца.
11.7. АМЕРИЦИИ [1—35, 323, 324]
Общие сведения и методы получения
Америций (Am) находится в 3-й группе VII периода Периодической
Системы элементов. Этот искусственно полученный радиоактивный эле-
элемент относится к актиноидам. Элементарный америций — металл сере-
серебристого цвета, синтезирован в конце 1944 — начале 1945 г. американ-
американскими учеными Сиборгом, Джеймсом, Морганом и Гиорсо в результате
облучения плутония 239Ри нейтронами. Название получил от слова «Аме-
«Америка» по аналогии с гомологом америция в ряду лантаноидов — евро-
европием, который занимает в ряду лантаноидов то же место, что америций
в ряду актиноидов. Для извлечения америция из отработанного ядер-
ядерного горючего используют соосаждеиие с солями лантана, хроматогра-
фические и экстракционные методы.
631
Физические свойства
Атомный номер 95, атомная масса 243 а. е. м., атомный радиус 0,184 нм,
ионный радиус Ат3+ 0,100 нм. Конфигурация внешних электронных обо-
ободочек америция 5f6s26p66d°7s2.
В зависимости от температуры америций существует в трех модифи-
модификациях. При комнатной температуре устойчива а-модификация с двой-
двойной г. п. у. структурой, подобной структуре a-La с периодами а=
=0,345 нм и с= 1,124 нм. При температуре 600° С устойчива фаза с
г. ц. к. решеткой и периодом 0,489 нм. Определенных данных о третьей
модификации пока нет. Предполагается, что она имеет о. ц. к. решетку.
Потенциалы ионизации америция У (эВ): 5,5; 10,9; 23,9. Электроотри-
Электроотрицательность 1,11—1,2.
Стабильных изотопов америций ие имеет. Известны изотопы с мас-
массовыми числами 237—246 и ядерные изометры 242mAm, 244тАт, а также
делящиеся ядерные изомеры 238m'Am, 240т'Ат, 242т'Ат, 244mfAm, быстрый
радиоактивный распад которых (с периодами полураспада от 60 мкс
до 14 мс) протекает путем спонтанного деления. Наиболее долгоживу-
щий (период полураспада 7370 лет) изотоп 243Ат а-радиоактинен; его
получение в миллиграммовых количествах связано с большими труд-
ностямн и было осуществлено только после 1960 г. Другой изотоп
241Ат, также претерпевающий а-распад с периодом полураспада 435
дет, образуется как побочный продукт в атомных реакторах из 23SPu и
может быть выделен из отработанного ядерного горючего в колнче*
ствах, доступных для взвешивания.
Эффективное поперечное сечение захвата тепловых нейтронов для
различных изотопов америпия:
Массовое число 241 242 243
Эффективное поперечное сечение
захвата тепловых нейтронов
Ю-23 м2 630±35 8000±1000 115
Плотность америция при нормальных условиях 13,671 Мг/м3.
Температура плавления амернцня /пл —850°С, температура кипения
£нип = 2610°С, теплота испарения при температуре кипения Д#Исп =
= 981,9 кДж/кг, температурный коэффициент линейного расширения
при 293 К: вдоль оси а а = G,5±0,2) ■ Ю-'К, вдоль оси с а=F,2±
±0,4)-10-вК-1.
Химические свойства
Проявляет степень окисления +3, +4, +5, +6, но особенно часто +3.
Переменная валентность америция объясняется тем, что энергия связи
5/ и 6d электронов с ядром оказывается весьма близкой, так что 5/-
электроны становятся валентными.
Теплота образования ДЯоеР различных ионов америция с учетом
гидролиза в водном растворе:
Ион Ат3+ Ат4+ ктО$ АтО|+
АЯобр, кДж/моль . . 679,5*12,5 488,2±25,1 869,6±12,1 715±11,3
Почти все исследования по химии америция выполнены с использо-
использованием изотопа 241Ат. Под действием собственного а-излучения
твердые соединения америция светятся в темноте. Америций — первый ак*
тиноид, для которого устойчива степень окисления+3. Растворы трехва-
трехвалентного америция окрашены в серо-розовый цвет. Для 4-валеитного аме-
америция известны твердые соединения АтОг, AmF4 и KAmF5. В водной
632
среде Am4+ существует только как комплексный фторидный ион; в дру-
других условиях он быстро восстанавливается водой до 3-валентного иона.
Теплота образования Д#Обр некоторых простых соединений америция
прн 298 К:
Соединение . . , , AmF3 AmCl3 AmB3 Aml3
ДЯобр, кДж/моль , , 1649,5 1043,3±12,6 845.7 611,3
Соединение . . , , AmOCl AmF4 AmO2
АЯобр, кДж/моль . . 1011,1±12,6 1674,7 1004,4z±= 12,6
При окислении иона Ат3+ в слабо щелочной среде можно получить
5-валентный америций в виде иона АтО^. В сильно кислых растворах
желтый ион АтО-|+распадается на Ат3+ и желто-коричневый ион 6-
валентного америция АтО^". Последний образуется также при окисле-
окислении кислых растворов АтО^" или при действии на Ат3+ некоторых силь-
сильных окислителей. Как 241АтО^" , так и 241АтО|+ в водных раст-
растворах энергично восстанавливаются под действием собственного силь«
ного а-излучения. Металлический америций гораздо более электрополо-'
жителей, чем уран, нептуний или плутоний, и может быть получен толь*
ко прн действии сильных восстановителей на его безводные соедине»
ния при высокой температуре. Наилучшие восстановители — барий н
лантаи. Подобно другим актиноидам, америций энергично реагирует
с газообразным водородом.
Области применения
В смеси с бериллием 241Ат применяют для изготовления нейтронных
источников. Этот изотоп служит также исходным материалом для полу-
получения в реакторах трансурановых элементов с высшими атомными но-
номерами. Около 36 % а-распадов этого изотопа сопровождается Vй3"
лучением с энергией около 60 кэВ, которое используют для многих из«
мерительных и калибровочных приборов.
11.8. КЮРИЙ [1-35, 323]
Общие сведения и методы получения
Кюрнй (Cm) — искусственно полученный радиоактивный химический
элемент семейства актиноидов, блестящий серебристый металл. В при-
природе не встречается. Первый его изотоп 242Ст был получен в 1944 г.
американскими учеными Сиборгом, Джеймсом и Гиорсо по ядерной ре-
реакции, в которой 239Ри облучали а-частицами. Назван в честь Кюри н
Склодовской-Кюри — основателей науки о радиоактивности. В атом-
атомных реакторах некоторые изотопы кюрия, например 242Ст, 244Ст мож-
можно накопить в килограммовых количествах за счет длительного облуче-
облучения нейтронами плутония или урана. От других актиноидов кюрий мож-
можно отделить ионообменными методами.
Свойства и области применения
Атомный номер 96, атомная масса 247 а. е. м, конфигурация внешних
электронных оболочек 5/76s26/7e6d'7s2.
Потенциалы ионизации / (эВ): 6,1; 11,9; 21. Электроотрицательность
1,11—1,2. Металлический кюрий существует в двух модификациях: прн
комнатной температуре он имеет двойную г. п. у. решетку с периодами
633
о=0,34±0,01 нм и с=1,193±0,002 нм, прн высокой температуре —
г. ц. к. решетку с периодом 0,504 нм. Известен ряд изотопов кюрия,
из которых самый долгоживущий 247Ст имеет период полураспада
1,64-107 лет. Периоды полураспада других изотопов кюрия:
Массовое число . . 242 243 244 245 246 248
Период полураспада,
годы 16,5 сут 35 18 2-10* 6,6-10» 4,2-105
Эффективное сечеиие захвата тепловых нейтронов составляет для
243CrnE00±30)-10-23 м2. Плотность кюрия р=19,2 Мг/м3. Температу-
Температура плавления /Вл=1340°С. Удельная теплота испарения Д#исп =
= 1508кДж/кг.
В соединениях проявляет степень окисления +4 н +3, причем наиболее
часто +3. Получены соединения трехвалентного (Ст2О3, СтСЬ др.)
и четырехвалентного (CmC2, CmF4) кюрия. Теплота растворения твер-
твердого кюрия в солянокислых растворах, протекающего с образованием
иоиа Ст3+, составляет 587 кДж/моль. Теплота образования хлорида
трехвалентного кюрия СтС13 равна Д#обр=—947±5,02 кДж/моль.
Сильное выделение тепла в препаратах кюрня, обусловленное его ра-
радиоактивным распадом, дает возможность использовать изотопы 242Ст,
244Ст н другие для создания малогабаритных источников электричес-
электрического тока. Срок непрерывной работы таких источников достигает нес-
нескольких месяцев. Изотопы г46Ст и 248Ст используют при синтезе дале-
далеких трансурановых элементов с помощью ускоренных многозарядных
ионов.
11.9. БЕРКЛИЙ [1-35, 323]
Общие сведения и методы получения
Берклий (Вк)—искусственно полученный в конце 1949 г. американскими
учеными Томпсоном, Гиорсо и Сиборгом радиоактивный химический эле-
элемент, относящийся к актннондам. Впервые берклнй получен в результа-
результате облучения на циклотроне оксида америция 241Ат2О3; однако изве-
известно, что изотоп 249Вк образуется также при многократном облучении
нейтронами плутония или урана в атомном реакторе. Из облученного плу-
плутония американские ученые Каннингем и Томпсон в 1958 г. впервые вы-
выделили берклий в количестве, доступном для взвешивания @,4 мкг).
Элемент назван в честь города Беркли (Калифорния, США), где были
проведены многочисленные опыты по синтезу н исследованию актино-
ндбв, в том числе и самого берклия.
Химическую идентификацию берклия проводят методом ионообмен-
ионообменной хроматографии.
Свойства и области применения
Атомный номер 97, атомная масса 247 а. е. м, строение внешних элек-
электронных оболочек 5/86s26/7e6dl7s2. Металлический берклий имеет две
модификации: г. ц. к с периодом а=0,4997±0,000 нм и двойную г. п. у.,
подобную структуре а-La, с периодами а=0,341 нм и с—1,107 нм. По-
Потенциалы ионизации / (эВ): 6,7; 12,4; 20,8. Стабильных изотопов не
имеет. Известны изотопы с массовыми числами 243—250 и ядерный изо-
мер 248тБк. Наиболее долгоживущие изотопы: 247Вк (период полурас-
полураспада 1380±250 лет; испускает а-частицы), 249Вк (период полураспада
314 сут; испускает более 99 % р-частиц и 2,2-10~3 % а-частнц). Темпе-
Температура плавления берклий 987 °С.
634
Наиболее часто проявляет степень окисления +3, возможна я +4. Хи-
Химические свойства берклия изучены очень слабо. В макроколичествах
получен оксид (IV) 249ВкОг. Исследования, выполненные с индикатор-
индикаторными количествами берклия, показали, что 3-валентный берклий силь-
сильными окислителями может быть переведен в состояние окисления +4.
Изотопы берклня применяют для исследовательских работ в области
ядерной физики.
11.10. КАЛИФОРНИЙ [1-35, 323]
Общие сведения и методы получения
Калифорний (Cf) — искусственно полученный радиоактивный химиче-
химический элемент семейства актиноидов. Впервые получен в 1950 г. амери-
американскими учеными Томпсоном, Гиорсо, Стритом и Сиборгом в виде
изотопа '"Cf, который образовывался в результате облучения мишени
из 24iCm ускоренными а-частицами. Назван по месту открытия (штат
Калифорния, США). Ряд изотопов калифорния с массовыми числами
249—252 получают в массовых количествах в ядерных реакторах при
длительном облучении плутония нейтронами.
Свойства и области применения
Атомный номер 98, атомная масса 257 а. е. м., расчетное значение ион-
иого радиуса CF+ 0,0915 нм. Конфигурация внешних электронных обо-
оболочек изолированного атома 5/96s26p66dl7s2. Потенциалы ионизации
атома / (эВ): 6,7; 12,5; 21,6. Металлический калифорний существует
в двух модификациях: г. ц. к. с периодом а=0,574 нм и г. п. у. с перио-
периодами а=0,399 н с—0,689 нм. Стабильных изотопов не имеет. Известны
изотопы с массовыми числами 242—256. Из ннх относительно устойчи-
устойчивы и могут быть получены в макроколичествах 249Cf (период полурас-
полураспада 470 лет), 250Cf (период полураспада 10 лет), 25ICf G00 лет) н
252Cf B,2 года). Эффективное поперечное сечение захвата тепловых ней-
нейтронов для изотопа 249Cf составляет (900±400) • 10~28 м2. Температура
плавления калифорния ?Пл = 900°С.
Наиболее типична степень окисления +3, менее типична +2. Первые
твердые соединения калифорния, имеющие формулы 249Cf2O3 н 249СЮС1,
Получены в 1958 г. К настоящему времени получены хлориды, фторнды,
бромиды, иодиды и другие соединения, в которых калифорний прояв-
проявляет различную валентность.
Препараты -52Cf могут быть использованы как источники нейтронов.
Этот изотоп в 3 °/о случаев испытывает спонтанное деление, сопровож-
сопровождающееся испусканием нейтронов. 1 мг изотопов испускает 2,2-109 ней-
нейтронов в секунду, что позволяет создавать очень компактные и мощные
источники.
11.11. ЭЙНШТЕЙНИЙ [1—35, 323]
Общие сведения и методы получения
Эйнштейний (Es) — искусственно полученный радиоактивный химиче-
химический элемент семейства актиноидов. Из трансурановых элементов он
открыт седьмым, идентифицирован группой американских ученых во
главе с Гиорсо в 1952 г. и назван в честь выдающегося физика Альбер-
Альберта Эйнштейна. Обнаруженный изотоп 2"Es с периодом полураспада
20,5 сут образовался при Р-распаде 253U н дочерних изотопов. В свою
очередь, 253U образовался в результате преимущественного и последо-
635
вательного захвата 15-и нейтронов ядрами 236U. Эйнштейний может быть
получен восстановлением фторида EsF3 литнем.
Свойства и области применения
Атомный номер 99, атомная масса 254 а. е. м, строение наружных обо-
оболочек изолированного атома 5/иб526рв6<*°752; ионный радиус Es3+
0,098 нм. Потенциалы ионизации / (эВ): 6,8; 12,6; 22,1. Стабильных
изотопов не имеет. Известны изотопы с массовыми числами от 243 до
256. Изучать эйнштейний можно используя макроколичества изотопов
253Es (период полураспада 20,5 сут), 254Es B76 сут) и 255Es C8,3 сут).
Эти изотопы получают путем облучения нейтронами образцов более лег-
легких элементов. Возможности получения эйнштейния ограничены, так
как для получения эйнштейния требуется много последовательных реак-
реакций захвата нейтронов н, соответственно, длительное время пребывания
образцов в реакторе с большой плотностью нейтронного потока.
До сих пор основные исследования эйнштейния проведены с наибо-
наиболее доступным короткоживущим изотопом 253Es, однако, возможно по-
получение и нзотопа 254Es.
Кристаллический эйнштейний имеет г. ц. к. решетку. Эффективное
поперечное сечение захвата тепловых нейтронов составляет для 254Es
B700±600)-Ш-28 м2. Температура плавления эйнштейния /„л=860°С.
В соединениях проявляет степень окисления -f 3, но может проявлять н
+ 2. Восстановительный потенциал реакции Es3++e-*-Es2+ относительно
нормального водородного потенциала составляет 0,2 В. В обычном вод-
иом растворе Es присутствует в виде иона Es3+ и окрашивает раствор
в зеленый цвет. Синтезированы и изучены некоторые соединения эйн-
эйнштейния, такие как Es2O3, EsCl3) EsOCl, EsBr2, ЕэВгз, Esl2, Esl3.
Мишенн из нзотопа 253Es используют для синтеза более тяжелых транс-
трансурановых элементов.
11.12. ФЕРМИЙ [1—35, 323]
Фермий (Fm) —искусственно полученный радиоактивный химический
элемент семейства актиноидов. Впервые идентифицирован американским
ученым Гиороо в 1953 г. в виде изотопа 255Fm с периодом полураспада
20,1 ч. Изотоп был продуктом р-распада 255U, образовавшегося в ре-
результате последовательного захвата 17 нейтронов ядрами 238U. Назван
в честь итальянского физика Ферми, внесшего большой вклад в разви-
развитие современной теоретической и экспериментальной физики.
Атомный номер 100, атомная масса 257 а. е. м, ионный радиус Fe3+
0,097 нм. Электронное строение наружных оболочек атома
5/126s26pe6d°7s2. Степень окисления: +2 и, наиболее часто встречающая-
встречающаяся +3. Потенциалы ионизации / (эВ): 6,7; 12,5; 22,5. Стабильных изо-
изотопов не имеет. Известно существование изотопов с массовыми числа-
числами от 244 до 258. В заметном количестве изотопы пока не выделены, и
поэтому все исследования проводили с его бесконечно малыми концент-
концентрациями. Установлено, что наиболее устойчив изотоп 257Fm (период по-
полураспада 100,5 сут); однако, получение его в ядерных реакторах, не-
несмотря на большую плотность нейтронного потока, крайне огртничено,
поскольку требует множества последовательных операций захвата ней-
нейтронов. Помимо уже упоминавшегося изотопа 254Fm, есть сведения о су-
существовании спонтанно делящегося изотопа 259Fm с периодом полурас-
полураспада 1,5 с. Восстановительный потенциал реакции Fm3++e->-Fm?+ от-
относительно нормального водородного потенциала равен 1,1 ±0,2 В.
Мишени изотопа 257Fm используют в исследовательских работах в об-
области ядерной физики, в частности, для синтеза н изучения свойств бо-
более тяжелых изотопов фермия.
636
11.13. МЕНДЕЛЕВИЙ [1—35, 323]
Менделевий (Md) — искусственно полученный радиоактивный химиче-
химический элемент семейства актиноидов. Назван в честь великого русского
ученого Менделеева. Первые атомы менделевия синтезировали в 1955 г.
американские ученые Гиорсо, Харви, Чоппин, Томпсои и Сиборг, которые
облучали ядра изотопа эйнштейния сильно разогнанными а-частицами.
При этом протекала ядерная реакция 253Es(a, «J56Md. Учеными Объ-
Объединенного института ядерных исследований в Дубне в 1962 г. для хи-
химических исследований были получены сотни атомов менделевия по ре-
реакции 233UB2Nei/,3nJ56Md.
Атомный номер 101, атомная масса 258 а. е. м. Электронное строение
внешних оболочек изолированного атома 5/136s26/?66d°7s2. Ионный ра-
радиус Md3+ 0,096 нм. Потенциалы ионизации / (эВ): 6,4; 12,0; 23,1.
Как и другие тяжелые актиноиды, менделевий способен в растворах
проявлять степень окисления +3. Кроме того известны степени окис-
окисления +2 и +1. Стабильных изотопов ие имеет. Известны изотопы с
массовыми числами 252, 254 и 258. Наиболее устойчив а-радиоактив-
ный изотоп 258Md, период полураспада которого 55 сут.
11.14. ЭЛЕМЕНТ 102 (НОБЕЛИЙ) [1-35, 323]
Нобелий (No) — элемент 102, искусственно полученный радиоактивный
химический элемент семейства актиноидов. Первой заявила о получении
атомов этого элемента в 1957 г. международная группа 'ученых, рабо-
работавших в Стокгольме (Швеция), которая и предложила назвать его в
честь Нобеля, основателя фонда международных (Нобелевских) пре-
премий. Однако, последующие опыты, выполненные в Беркли (США) и
Дубне (СССР), показали, что вывод стокгольмской группы был ошибо-
ошибочен. Первые надежные сведения об изотопах элемента 102 с массовыми
числами 251—256 получены в 1963—1967 гг. группой советских физи-
физиков под руководством Флерова в Дубне. Для синтеза этих изотопов
ядра U, Pu, Am и Cm облучали ускоренными ионами Ne, О и N. Совет-
Советские ученые предложили дать 102 элементу название «Жолиотий» в
честь Фредерика Жолио Кюрн. Общепринятого названия элемента 102
пока нет. До последнего времени его изотопы получены лишь в микро-
микроколичествах.
Атомный номер 102, атомная масса 254 а. е м, ионный радиус No3+
0,095 нм. Строение внешних электронных оболочек 5/H6s26pe6d°7s2, сте-
степени окисления 4-2 и 4-3. Первый потенциал ионизации Л = 5,8 эВ. По-
Получены изотопы с массовыми числами 251—259, наиболее долгоживу-
щий из которых 259No имеет период полураспада около 195 ч.
Установлено, что летучесть хлорида нобелия близка к летучести хлори-
хлоридов фермня и калифорния. Переход из типичной степени окисления +2
в 4-3 происходит под действием сильных окислителей.
11.15. ЭЛЕМЕНТ 103 (ЛОУРЕНСИЙ) [1-35, 323]
Лоуренсий (Lr) — искусственно полученный радиоактивный химический
элемент семейства актиноидов. Первые опыты по синтезу элемента 103
были выполнены в 1961 г. американскими учеными во главе с Гиорсо.
Результаты их опытов в дальнейшем не подтвердились, но данное аме-
американскими учеными название элемента в честь Лоуренса — известного
американского физика — пока сохраняется. В Периодической системе
это название заключено в скобки, так как оно не принято за оконча-
окончательное. Первые надежные сведения об изотопе 256Lr получены в 1965 г,
' 637
советскими физиками в Объединенном институте ядерных исследований
в Дубне. Они получили этот изотоп прн облучении мишени нз амери-
америция 243Ат ускоренными ионами 13О. Установлено, что ядра 256Lr нс-
пускают а-частицы н что период полураспада составляет около 35 с.
В 1969 г. в Дубне был получен изотоп 255Lr.
В 1971 г. американские физики сообщили о синтезе изотопов лоурен-
сия с массовыми числами 257—260. Все изотопы получены в ничтожно
малых количествах.
Атомный номер 103, атомная масса 256 а. е. м, ионный радиус Lr3+
0,094 нм. Электронное строение наружных оболочек изолированного
атома 5/H6s26/7e6d'7s2. Наиболее типична степень окисления +3. Пер-
Первый потенциал ноннзацнн /i =6 эВ. Стабильных изотопов не имеет. Ис-
Искусственно получены изотопы с массовыми числами 255—260. Наиболее
долгоживущим из иих является изотоп 260Lr, имеющий период полу-
полураспада около 3 мии. Химические свойства впервые изучены советскими
физиками в Дубне в 1969 г. Установлено, что хлорид LrCl3 мало летуч
и подобен хлоридам РЗМ. Лоуренсий, имеющий степень окисления +3,
экстрагируется из водных растворов теноилфторацетоном.
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Глинка Н. А. Общая химия. Л.: Химия, 1979. 718 с.
2. Даркен Л. С, Гурри Р. В. Физическая хнмня металлов. Пер. с
англ. М.: Металлургиздат, 1960, 582 с.
3. Кэй Дж. Лэби Т. Таблицы физических и химических постоянных.
Пер. с англ. М.: Физматгиз, 1962. 247 с.
4. Лившиц Б. Г., Крйпошин В. С, Липецкий Я. Л. Физические свой-
свойства металлов и сплавов. М.: Металлургия, 1971. 478 с.
5. Некрасов Б. В. Основы общей химии. М.: Химия, т. 1, 1965, 518 с;
т. 2, 1967, 401 с; т. 3, 1970, 415 с.
6. Свойства элементов. Справочник/Под ред. Самсонова Г. В. М.:
Металлургия, ч. I — Физические свойства, 600 с; ч. II — Химиче-
Химические свойства, 1976, 384 с.
7. Таблицы физических величин. Справочник/Под ред. Кикоина И. К.
М.: Атомиздат, 1976, 1006 с.
8. Теплофизические свойства вещества/Под ред. Голубинского В. И.
Киев: Наукова Думка, 1966. 173 с.
9. Теплофизические свойства газов/Под ред. Новикова И. И. М.:
Наука, 1973. 207 с.
10. Теплофизические свойства твердых веществ/Под ред. Самсоно-
Самсонова Г. В. М.: Наука, 1976, 140 с.
11. Термодинамические свойства индивидуальных веществ. Справоч-
Справочник/Под ред. Глушко Н. М. М.: Наука, т. 1, 1978, 327 с; т. 2,
1979, 870 с.
12. Уманский Я. С, Скакав Ю. А. Физика металлов. М.: Атомиздат,
1978. 352 с.
13. Физико-химические и теплофизические свойства металлов/Под ред.
Рыкалича Н. Н. М.: Наука, 1976. 213 с.
14. Григорович В. К- Периодический закон Д. И. Менделеева и элек-
электронное строение металлов. М.: Наука, 1966. 285 с.
15. Энциклопедия неорганических матер налов/Под ред. Федорчен-
ко И. М. Киев: Украинская Советская Энциклопедия, 1977, т. 1,
712 с; т. 2, 814 с.
16. Бобылев А. В. Механические и технологические свойства метал-
металлов. М.: Металлургия, 1980, 285 с.
17 Андерсон О. — В кн.: Динамика решетки. Пер. с англ. М.: Мир,
' 1968, с. 100—121.
18. Брандт Н. Б., Чудинов С. М. Электронная структура металлов.
М.: Изд-во МГУ, 1973, 332 с.
19. Термодинамические свойства нидивидуальиых веществ. Т. 2/Гур-
вич Л. В., Хачкарузов Г. А., Медведев В. А. и др. М.: Изд-но АН
СССР, 1962. 916 с.
20. Справочник по ядерной техннке/Под ред. Арцимовича Л. А. М.:
Физматгиз, 1963. 632 с.
21. Бокий Г. В. Кристаллохимия. М.: Наука, 1971. 399 с.
22. Келли А., Грове Г. Кристаллография и дефекты в кристаллах. Пер.
с аигл. М.: Мир, 1974, 496 с.
23. Лебедев В. И. Ионно-атомные радиусы н их значение для геохи-
геохимии и химии. Л.: Изд-во ЛГУ, 1969. 175 с.
24. Келоглу Ю. П., Захариевич К. М., Карташевская М. И. Металлы
и сплавы. Кишинев: Картя Молдовеняскэ, 1977. 264 с.
25. Популярная библиотека химических элементов. 3-е нзд./Под ред.
Петрянова—Соколова И. В. М.: Наука, 1977, с. 480—491.
26. Коттон Ф., Уилкинсон Дж. Современная неорганическая химия.
Пер. с аигл. М.: Мир, 1969, ч. 1—224 с; ч. II — 495 с; ч. III — 592 с.
27. Краткий справочник физико-химических величин/Под ред. Мишен-
ко К. П., Равделя А. А. М.: Химия, 1974, 200 с.
28. Трифонов Д. Н.. Трифонов В. Д. Как были открыты химические
элементы. М.: Просвещение, 1980. 224 с.
29. Деми Г. Курс неорганической химии. Пер. с ием. М.: Мир, 1972.
824 с.
30. Крестов Г. А., Фриш С. Э. Оптические спектры атомов. М.—Л.:
Физматгиз, 1963. 640 с.
31. Ревель А. Р., Глазов В. М. Периодический закон н физические
свойства электронных расплавов. М.: Наука. 307 с.
32. Гришков Г. Н., Мавриди Д. И., Клейн Г. А. — В кн.: Вторично-
эмнссиоииые и структурные свойства твердых тел. Ташкент: ФАН,
1970, с. 172—174.
33. Неймарк Е. М., Бурханов Г. С. Монокристаллы тугоплавких и ред-
редких металлов и сплавов. М.: Наука, 1972. 259 с.
34. Диогенов Г. Г. История открытия химических элементов. М.: Уч-
Учпедгиз, 1960. 72 с.
35. Смитлз К. Металлы. Справочник. Пер. с англ. М.: Металлургия
1974. 488 с.
36. Дриц М. Е. Металловедение легких сплавов. М.: Наука, 1965.
226 с.
37. Дриц М. Е., Бочвар Н. Р., Гузей Л. С. Двойные и многокомпонент-
многокомпонентные сплавы иа основе меди. М.: Наука, 1979. 248 с.
38. Диаграммы состояния систем на основе алюминия н магния/
Дриц М. Е., Бочвар Н. Р., Падежнова Е. М. и др. М.: Наука 1977
227 с.
39. Вигли Д. А. Механические свойства металлов при низких темпера-
температурах. Пер. с англ. М.: Мир, 1974. 227 с.
40. Зеликман А. А. Металлургия редких металлов. М.: Металлургия
1980. 328 с.
41. Карапетьянц М, X., Карапетьящ М. J1. Основные термодинамиче-
639
ские константы неорганических и органических веществ. М.: Хи-
Химия, 1968. 471 с.
42. Киффер Р., Браун X. Ванадий, ниобий, тантал. Пер. с нем М.:
Металлургия, 1968. 312 с.
43. Коган Б. И. Редкие металлы. М.: Наука, 1979. 356 с.
44. Кошелев Н. Ф. Механические свойства металлов для криогенной
техники. М.: Машиностроение, 1971. 361 с.
45. Мальцев М. В. Металлография тугоплавких редких и радиоактив-
радиоактивных металлов и сплавов. М.: Металлургия, 1971. 478 с.
46. Механические свойства редких металлов/Соколов Л. Д., Скуд~
нов В. А., Соленое В. М. и др. М.: Металлургия, 1972, 289 с.
47. Папиров И, И. Структура и свойства сплавов бериллия М.: Энер-
гоиздат, 1981. 267 с.
48. Савицкий Е. М., Бурханов Г. С. Металловедение сплавов тугоплав-
тугоплавких редких металлов. М.: Наука, 1971. 356 с.
49. Савицкий Е. М., Бурханов Г. С. Редкие металлы и сплавы. Фи-
Физико-химический анализ и металловедение. М.: Наука, 1980. 255 с.
50. Смирягин А. П., Смирягина Н. А., Белова А. В. Промышленные
цветные металлы и сплавы. М.: Металлургия, 1974. 488 с.
51. Справочник по редким металлам/Под ред. Плющева В. Е. М.: Мнр,
1965. 946 с.
52. Физико-химия редких металлов/Под ред. Тананаева И. В. М.: Нау-
Наука, 1972. 227 с.
53. Филянд Т. А., Семенова Е. И. Свойства редких элементов. Спра-
Справочник. М.: Металлургнздат, 1964. 912 с.
54. Химия металлических сплавов/Под ред. Жаворонкова Н. М. М.:
Наука, 1973. 239 с.
55. Химия и технология редких и рассеянных элементов. Т. 1—З/Под
ред. Большакова К. А. М.: Высшая школа, 1976, 365 с; 360 с;
319 с.
56. Цветные металлы. Свойства. Сортамент. Применение. Справочник/
Под ред. Баженова М. Ф. М.: Металлургия, 1973. 2080 с.
57. Клипов И. Я. Коррозия химической аппаратуры и коррозионно-
стойкие материалы. 3-е изд. М.: Машгиз, 1960. 511с.
58. Гиндин И. А., Лазарев Б. Т., Стародубов Я. Д. —ФММ, 1960,
т. 10, № 3, с. 472—479.
59. Сверхлегкие конструкционные сплавыу'Дриц М. Е., Свидерская 3. А.,
Елкин Ф. М, Трохова В. Ф. М.: Наука, 1972. 142 с.
60. Литий, его химия и технологня/Остроумко Ю. И., Бучихин П. И.,
Алексеев В. В. и др. М.: Атомиздат, 1960. 221 с.
61. Плющев В. Е., Степин Б. Д. Химия и технология соединений лития,
рубидия и цезия. М.: Химия, 1970. 408 с.
62. Савицкий Е М., Терехова В. Ф., Наумкин О. П. — Цветные метал-
металлы, 1961, № 5, с. 58—61.
63. Свойства лития^'Гришин В. К-, Глазунов М. Т., Аракелов А. Т.
и др. М.: Металлургиздат, 1963. 242 с.
64. Теплофизнческие свойства щелочных металлов/Шпильрайн Э. Э.,
Якимовей К А., Тоцкий Е. Е. и др. М.: Изд-во стандартов,' 1970.
486 с.
65. Ситтинг М. Натрий, его производство, свойство, применение. М.:
Атомнздат, 1961. 440 с.
66 Натрий и каппй/Алабышев А. Ф., Грачев К- Я., Зарецкий С. А.,
Лантратов М. Ф. Л.: Госхимиздат, 1959. 391 с.
67. Перельман Ф. М. Рубидий н цезий. М.: Изд-во АН СССР, 1960. 138 с.
68. Цезий/Под ред. Плющева В. Е М.: ИЛ, 1963. 180 с.
69. Гринберг Н. М.. Алексеев А. П., Любарский И. М. — ФММ, 1972,
выц. 6, т. 34, с. 1259—1263.
640
70. Гринберг Н. М„ Алексеев А. Н., Яковенко Л. Ф., Любарский И. М.
Физико-химическая механика материалов, 1970, № 3, с. 18—20.
71. Иванова В. С. Усталостное разрушение металлов. М.: Металлург-
издат, 1963. 272 с.
72. Металлургия меди, никеля н кобальта. Ч. I. Металлургия меди/ Ху-
Худяков М. Ф., Тихонова А. И., Деев В. И., Набойченко С. С. М.: Ме-
Металлургия, 1977. 292 с.
73. Пресняков А. А. — В кн.: Свойства медн и сплавов иа ее основе.
Алма-Ата: Наука, 1975, с. 3—10.
74. Севрюков Н. Н. Металлургия цветных металлов. М.: Металлургия,
1969. 408 с.
75. Малышев В. М., Румянцев Д. В. Серебро. М.: Металлургия, 1970.
311 с.
76. Головин В. А., Ульянова 3. X. Свойства благородных металлов и
сплавов. М.: Металлургия, 1964. 188 с.
77. Малышев В. М., Румянцев Д. В. Золото. М.: Металлургия, 1979.
288 с.
78. Соболевский В. И. Благородные металлы. Золото. М.: Знание,
1970. 48 с.
79. Петровская Н. В. Самородное золото. М.: Недра, 1973. 347 с.
80. Максимов М. М. Очерк о золоте. М.: Недра, 1977. 125 с.
81. Бериллий. Пер. с англ./Под ред. Рейрмана М. Б. М.: ИЛ, 1960.
616 с.
82. Давиденков Н. Н„ Сидоров Б. А., Шестопалов Л. М. и др. — Атом-
Атомная энергия. 1965, т. 18, № 6, с. 608—616.
83. Займовский А. С. — Атомная энергия, 1965, т. 18, вып. 4, с. 395—
400.
84. Кьеллгрен Б. Р. — В кн.: Справочник по редким металлам. Пер.
с англ. М.: Мир. 1965, с. 47—80.
85. Папиров И. И. Бериллий — конструкционный материал. М.: Маши*
ностроение, 1977. 160 с.
86. Папиров И. И., Тихвинский Г. Ф, Физическое металловедение бе-
бериллия. М.: Атомиздат, 1968. 452 с.
87. Папиров И. И. Окисление и защита бериллия. М.: Металлургия,
1968. 120 с.
88. Папиров И. И., Тихвинский Г. Ф. Пластическая деформация бе-
бериллия. М.: Атомиздат, 1973. 304 с.
89. Природа пластической деформации бериллия/Папиров И. И., Тих-
Тихвинский Г. Ф., Христенко И. Н. и др. Киев. Наукова думка, 1977.
148 с.
90. Силина Г. Ф., Зарембо Ю. И., Бертина Л. Э. Бериллий. Химическая
технология и металлургия/Под ред Спицына В. И. М.: Атомиздат,
1960. 120 с.
91. Хальд И., Сиборг Г. Трансурановые элементы. Пер. с аигл. М.:
ИЛ., 1959. 206 с.
92. Эверест Д. А. Химия бериллия. М.: Химия, 1968. 294 с.
93. Альтман М. Б., Лебедев А. А., Чухров М. В. Плавка и литье лег-
легких сплавов. М.: Металлургия, 1969. 680 с.
94. Беляев А. И. История магния. М.: Наука, 1974, 104 с.
95. Бондарев Б. И. Плавка и литье деформируемых магниевых спла-
сплавов. М.: Металлургия, 1973. 375 с.
96. Вяткин И. П., Кечин В. А., Мушков С. В. Рафинирование и литье
первичного магния. М.: Металлургия, 1974. 191 с.
97. Дриц М. Е, Магниевые сплавы для работы при повышенных тем-
температурах. М.: Наука, 1964. 231 с.
98. Дриц М. Е., Гурьев И. И.—Технология легких сплавов. 1967, №5,
с. 87—89.
641
99. Магниевые сплавы. Справочник, т. 1. М.: Металлургия, 1978,
232 с.
100. Магниево-литиевые сплавы/Дриц М. Е., Елкин Ф. М., Гурьев И. И.
и др. М.. Металлургия, 1980. 140 с.
101. Рейнор Г. В. Металловедение магния и его сплавов. Пер. с англ./
Под ред. Михеевой В. И. М.: Металлургия, 1964. 486 с.
102. Стрелец X. А., Тайц А. Ю., Гуляницкий Б, С. Металлургия маг-
магния. М.: Металлургия, 1970. 469 с.
103. Тимонова М. А. Защита от коррозии магниевых сплавов. М.: Ме-
Металлургия, 1977. 159 с.
104. Фавстов Ю К., Шульга Ю. Н., Рахштадт А. Т. Металловедение
высокодемпфирующих сплавов. М.: Металлургия, 1980. 272 с.
105. Эйдензон М. А. Металлургия магния и других легких сплавов. М.:
Металлургия, 1976. 191 с.
106. Эмли Е. Ф. Основы технологии производства и обработка магние-
магниевых сплавов. Пер. с аигл./Под ред. Дрица М. Е. М.: Металлургия,
1972. 488 с.
107. Доронин Н. А. Металлургия кальция. М.: Атомиздат, 1959. 92 с.
108 Доронин Н. А. Кальций. М.: Госатомиздат, 1962. 191 с.
109. Родяксен В. В. Кальций, его соединения и сплавы. М.: Металлур-
Металлургия, 1967. 186 с.
110. Бурков В. В., Подпорина Е. К. Строицнй. М.: Изд-во АН СССР,
1962. 179 с.
111. Сплавы арошхия/Бардин В. А., Вахобов А. В., Джураев Т. Д.
и др. М.: Гяредмет, 1974. 57 с.
112. Погодин С. А., Либман Э. П. Как добыли советский радий. М.:
Химия, 1971. 119 с.
113. Вдовенко В. М., Дубасов Ю. В. Аналитическая химия радия. М.:
Высшая школа, 1973. 213 с.
114. Кудрявцев Н. Т. Электролитические покрытия металлами. М.: Хи-
Химия, 1979. 351 с.
115. Лайнер В. И. Защитные покрытия металлов. М.: Металлургия,
1974. 559 с.
116. Лакерник М. М., Пахомова Г, Н. Металлургия циика и кадмия.
М.: Металлургия. 1969. 488 с.
117. Проскурин Е. В., Горбунов Н. С. Диффузионные цинковые по-
покрытия. М.: Металлургия, 1972. 247 с.
118. Далиев И. И. Металлургия кадмия. М.: Металлургиздат, 1962.
189 с.
119. Чижиков Д. М. Кадмий. М.: Изд-во АН СССР, 1962. 242 с.
120. Козловский М. Т., Зебрева А. И., Гладышев В. П. Амальгамы и их
применение. Алма-Ата: Наука, 1970. 390 с.
121. Мельников С. М. Металлургия ртути. М.: Металлургия, 1971.
476 с.
122. Теплофизические свойства ртути/Вукалович М. П., Иванов А. И.,
Фокин П. Р. и др. М.: Изд-во стандартов, 1971. 390 с.
123. Бор, его соединения и сплавы/Самсонов Г. В., Марковский Л. Я.,
Жигач А. Ф. и др. Киев: Изд-во АН УССР, 1960. 537 с.
124. Бор. Получение, структура и сиойства. Материалы IV Междуна-
Международного симпозиума. М.: Наука, 1974. 268 с.
125. Цагарейшвили Г. В., Тавадзе Ф. Н. Полупроводниковый бор. М.:
Наука, 1978. 77 с.
126. Шеарц Е. М. Бор и его соединения. Рига: Зинанте, 1966. 30 с.
127. Элементы главной подгруппы III группы Периодической системы
элементов. Учебио-методическое пособие. М.: Изд-во МАТИ, 1970.
34 с.
642
128. Беляев А. И. Металлургия легких металлов. М.: Металлургия,
1970. 365 с.
129. Газы и окислы в алюминиевых деформируемых сплавах/Добат-
кин В. И., Габидуллин Р. М,, Колачев Б. А., Макаров Г. С. М.:
Металлургия, 1976. 264 с.
130. Елагин В. И. Легирование деформируемых алюминиевых сплавов
переходными металлами. М.: Металлургия, 1975. 246 с.
131. Колачев Б. А., Ливанов В. А., Елагин В. И. Металловедение и тер-
термическая обработка цветных металлов и сплавов. М.: Металлур-
Металлургия, 1972. 480 с.
132. Металловедение алюминия и его сплавов. Справочник/Под ред.
Фридляндера И. Н. М.: Металлургия, 1971. 351 с.
133. Алюминий. Справочник Пер. с англ./Под ред. Туманова А. Т., Ква-
Квасова Ф. И., Фридляндера И. Н. М.: Металлургия, 1972. 663 с.
134. Промышленные деформируемые, спеченные и литейные алюминие-
алюминиевые сплавы. Справочник/Под ред. Квасова Ф. И. М.: Металлургия,
1972. 551 с.
135. Алюминиевые сплавы. Справочник. Пер. с нем./Под ред. Дрица
М. Е., Райтбарга JI. X. М.: Металлургия, 1970. 679 с.
136. Фридляндер И. Н. Алюминий и его сплавы. М.: Знание, 1965. 62 С,
137. Фридляндер И. Н., Колпачев А. А. — Изв. АН СССР, Металлы,
1980, № 4, с. 38—41.
138. Еремин Н. С. Галлий. М.: Металлургия, 1964. 168 с.
139. Иванова Р. В. Химия и технология галлия. М.: Металлургия, 1973.
394 с.
140. Коган Б. И., Вершковская О. В., Славиковская И. М. Галлий М.:
Наука, 1973. 472 с.
141. Пономарев В. Д. Химия и технология редких металлов, т. 2, Из-
Избранные труды. Алма-Ата: Наука, 1974. 251 с.
142. шека И. А., Чаус И. С, Митюрева Т. Т. Галлий. Киев: Гостехиз-
дат, 1968. 296 с.
143. Яценко С. П. Галлий, взаимодействие с металлами. М.: Наука,
1974. 220 с.
144. Macur G., Edwards R.. Wahebeck P. — J. Phys. Chem., 1966, v. 70,
№ 9, p. 2956—2965.
145. Рассеянные металлы/Под ред. Ивановой В. И. М.: Мнр, 1973. 94 с,
146. Дарвойд Т. И. Таллий н его применение в современной технике.
Пер. с англ. М : Цветметинформация, 1968. 72 с.
147. Григорович А. Н. Таллий и его промышленное получение. Алма-
Ата: Изд-во КазССР, 1960. 173 с.
148. Гордиенко С. П., Феночка Б. В., Фисенко В. В. Редкоземельные
металлы и их тугоплавкие соединения. Киев: Наукова Думка, 1971.
167 с.
149. Коган Б. И., Названова В. А. Скандий. М.: Изд-во АН СССР,
1963. 304 с.
150. Савицкий Е. М., Терехова В. ф. Металловедение редкоземельных
металлов. М.: Наука, 1975. 242 с.
151. Бондаренко Б. В, Царев Б, М. Вопросы теории и применения
редкоземельных металлов. М.: Наука, 1964. 86 с.
152. Гшнейдер К- А. Сплавы редкоземельных металлов. Пер. с нем.
М.: Мнр, 1964. 426 с.
163. Терехова В. Ф., Савицкий Е. М. Иттрий. М.: Наука, 1964. 159 с.
164. Уббелоде А. Р., Льюис Ф. А. Графит н его кристаллические соеди-
соединения. Пер. с англ. М.: Мнр, 1966. 256 с.
155. Шулепов С. В. Физика углеграфитных материалов. Челябинск:
Изд-во Гос. пед. ин-та, 1972. 340 с.
643
156. Глазов В. М., Земское В. С. Физико-химические основы легирова-
легирования полупроводников. М.: Наука, 1967, с. 22—27.
157. Угай Я. А. Введение в химию полупроводников. М.: Высшая шно-
ла, 1975. 302 с.
158. Фоменко В. С, Подчерняева И. А. Эмиссионвые н адсорбционные
свойства веществ и материалов. Справочник/Под ред. Самсоно-
еа Г. В. М.: Атомнздат, 1975. 300 с.
159. Ibach H. — Phys. Stat. Solidi, 1969, v. 31, № 2, p. 625—634. f
160. Konti A., Varshhi Y. P. — Canad. J. Phys., 1969, v. 47, p. 207.
161. Schumann P. Keenan W., Tone A., a.a. — J. Electrochem. Soc.'1971,
v. 118, № 1, p. 145—151.
162. Waber J. Т., Cramer D. T. — J. Chem. Phys., 1965, v. 42, № 12,
p. 4116.
163. Зеликман А. Н., Крейн О. E., Самсонов Г. В. Металлургия ред-
редких металлов. М.: Металлургия, 1978. 560 с.
164. Герасимов Я. И., Крестовников А. Н„ Горбов С. И. Химическая
термодинамика в цветной металлургии, т. 6. М.: Металлургия,
1974, с. 32—43.
165. Фромм Е., Гебхардт Е. Газы и углерод в металлах. Пер. с англ.
М.: Металлургия, 1980. 701 с.
166. Физико-химические свойства полупроводниковых веществ. Спра-
Справочник/Под ред. Новоселовой А. В. и Лазарева В. Б. М.: Наука,
1979. 524 с.
167. Ploog К. /. — J. Less-Common Metals, 1973, v. 31, № 1, p. 15—34.
168. Металлургия олоъа/Мурач Н. Н., Севрюков Н. Н., Полышн С. И.,
Быков Ю. А. М.: Металлургия, 1964. 351 с.
169. Самоделов А. П., Селиванов И. М., Михайлов В. В. Получение оло-
олова высокой чистоты. М.: Цветметинформация, 1970. 75 с.
170. Колодич С. М. Вторичное олово и переработка оловянного сырья.
М.: Металлургия, 1970. 234 с.
171. Лоскутов Ф. М. Металлургия свинца. М.: Металлургия, 1965. 528 с
172. Лунев В. Е. Слово о свинце. М.: Металлургия, 1964. 107 с.
173. Семионов А. А., Коган В. А. Полиграфическое металловедение. М.:
Книга, 1968. 295 с.
174. Лакерник М. М. Электротермия в металлургии меди, свинца и
циика. М.: Металлургия, 1971. 286 с.
175. Ловчиков В. С. Щелочное рафинирование свинца. М.: Металлур-
Металлургия, 1964. 150 с.
176. Производство свинца и иннка в капиталистических и развиваю-
развивающихся странах. Ч. III, Переработка свинцовых руд/ЦНИИ технико-
экономнч. исследов. М.: 1974. 108 с.
177. Корнилов И. И. Титан. М.-. Наука, 1975. 305 с.
178. Цвиккер У. Титан и его сплавы. М.: Металлургия, 1979. 510 с.
179. Сергеев В. В., Безукладников А. Б., Малыиин В. М. Металлургия
титана. М.: Металлургия, 1979. 264 с.
180. Применение титана в народном хозяйстве/Глазунов С. Г., Важе-
нин С. Ф., Зюков-Батырев Г. Д., Ратнер Ю. Я- Киев: Техника,
1975. 200 с.
181. Петрунько А. Н., Олесов Ю. Г., Дрозденко В. А. Титан в новой
' технике. М.: Металлургия, 1979. 160 с.
182. Ажажа В. М., Вьюгов П. Н., Рябчиков Л. Н., Финкель В. А. —
ФММ, 1972, т. 34, № 6, с. 1298—1300.
183. Металлургия циркония и гафния/Под ред. Нехамкина П. Г. М.:
Металлургия, 1979. 208 с.
184. Блюменталь У. Б. Химия циркония. Пер. с англ. М.: ИЛ., 1963.
341 с.
644
185. Дуглас Д. Металловедение циркония. Пер. с аигл. М,: Атомиздат,
1975. 360 с.
186. Зйймовский А. С, Калашников В. В., Головная И. С. Тепловыде-
Тепловыделяющие элементы атомных реакторов. М.: Атомиздат, 1966, 520 с.
187. Кручин А. В. Прокатка металлов в вакууме. М.: Металлургия,
1974. 246 с.
188. Иванов Л. И., Янушкевич В. А. — ФММ, 1964, т. 17, с. 112.
189. Материалы для ядерных реакторов/Под ред. Сокурского Ю. П.
М.: Госатомиздат, 1963. 386 с.
190. Осипов К. А., Сотченко А. Л.— Изв. АН СССР, ОТН, Металлур-
Металлургия н топливо, 1962, № 5, с. 82.
191. Рывкш Т. Ю., Розченков Б. С, Филатов В. М. Прочность сплавов
циркония. М.: Атомиздат, 1974. 160 с.
192. Металлургия циркония и гафиня/Барышников Н. В., Гёгер В. Э.,
Денисова Н. Д. и др. М.: Металлургия, 1978. 208 с.
193. Металлургия гафния. Пер. с англ./Под ред. Перельмана Ф. Н. М.:
Металлургия, 1967. 308 с.
194. Тонкое Е. Ю. — В кн.: Фазовые диаграммы элементов при высо-
высоком давлении. М.: Наука, 1979. с. 106—107.
196. Варгартик Н. Б. Справочник по теплофнзическим свойствам газов
и жидкостей. М.: Наука, 1972. 720 с.
196. Григорович В. К-, Шефтель Е. Н. Дисперсионное упрочнение туго-
тугоплавких металлов. М.: Наука, 1980. 302 с.
197. Веэер В. Дж. Фосфор и его соединения. Т. 1. Пер. с англ. М.: ИЛ,
1962. 687 с.
198. Рудницкий А. А. Термоэлектрические свойства благородных метал-
металлов. М.: Изд-во АН СССР, 1956. 148 с.
199. Блам С. — В кн.: Полупроводниковые соединения AIII BV. Пер. с
англ. М.: Металлургия, 1967. с. 123—133.
200. Вредные вещества в промышленности. Ч. II. Справочник Л.: Хи-
Химия, 1971. 624 с.
201. Розо М. Полупроводниковые материалы. М.: Металлургия, 1971.
156 с.
202. Расе N., Sounders G., Sumangen Z. — J. Phys. Chem. Solids 1970,
v. 31, № 7, p. 1467—1476.
203. Raisin C, Robin—Kandare S., Robin J. — Compt. Rend., 1972,
v. 274 B, № 8, p. 555—559.
204. Rosenblatt G., Lee P. —J. Chem. Phys., 1968, v. 49, № 7, p. 2995—
3006.
205. Сурьма/Под ред. Мельникова С. М. М.: Металлургия, 1977. 534 о.
206. Пресняков А. А. Хладноломкость. Алма-Ата: Наука, 1967. 199 с.
207. Шкляревский И. Н„ Усоскин А. И. — Оптика и спектроскопия.
1971, т. 31, № 4, с. 623—628.
208. Cordes H., Kim K. — i. Naturforsch, 1965, Bd. 20A, No. 9, S. 1197—
1200.
209. Aldred A.. Pratt J.— J. Chem. Eng. Data, 1963, v. 2, № 3, p. 429—
436.-
210. Глазков В. Н. Висмут. Ташкент: Наука, 1969, 115 с.
211. Металлургия вясмута/Полывянный И. Р., Абланов Н. Д., Батырбе-
кова С. А., Сысоев Л. Н., Алма-Ата: Наука, 1973. 133 с.
212. Скудное В. А., Соколов Л. Л., Гладких А. Н. и др. — МиТОМ,
1968, N° 12, с. 54—56.
213. Бенгус В. 3., Куклев В. А., Старцев В. А. — Физика низких тем-
температур. 1976, т. 2, № 9, с. 1185—1196.
214. White G. —J, Phys. С. Solid State Phys., 1972, v. 5, № 19, p. 2731-
/45
645
215/ Ефимов Ю. В., Барон В. В., Савицкий Б. М. Ванадий и его сплавы.
М.: Наука, 1969. 254 с.
216. Ростокер У. Металлургия ванадия. М.: ИЛ, 1959. 194 с.
217. Harupiko S., Sygcim — J. Phys. Soc. Japan, 1966, v. 22, № 12,
p. 2735.
218. Lundy Т., Me. Harque C — Trans. Met. Soc. AIME, 1966, v. 233,
p. 243—244.
«19. Peart R.— J. Phys. Chem. Solids, 1965, v. 26, No. 12, p. 1853—1861.
220. Горошенко #. Г. Химия ниобия и тантала. Киев: Наукова Думка,
1965. 483 с.
221. Прокошкин Д. А, Васильева Е. В. Сплавы ниобия М.: Наука,
1964. 333 с.
222. Осипов К. А. Исследования по жаропрочным сплавам. Вып. 2.
М.: Изд-во АН СССР, 1961, с. 28—32.
223. Корнилов И. И. —Изв. АН СССР. ОХН 1962, № 4, с. 8—10.
224. Лайнер Д. И., Цыпин Т. Н., Новиков А. В., Черкашина Н. В.—
Цветные металлы. 1972, № 8, с. 70—71.
225. Rhines Т. N.. Wray P. /. — Trans. ASM, 1961, v. 54, № 2, p. 117—
128.
226. Пресняков А. А., Черноусова К. Т., Чернышева Ю. П., Фрид-
Фридман Л. П. — Изв. вузов. Цветная металлургия, 1964, № 5,
с. 142—146.
227. Тугоплавкие редкие металлы. СправочннкДарлачев Д. Г., Доронъ-
кин Е. Д., Таубкин М. Б. и др. М.: Металлургия, 1977. 238 с.
228. Кислород. Справочник. Т. 1/Под ред. Глизманенко Д. Л. М.: Ме-
Металлургия, 1973. 463 с.
229. Кислород. Справочник. Т. 2/Под ред. Глизманенко Д. Л. М.: Me?
таллургия, 1973. 463 с
230. Глизманенко Д. Л. Получение кислорода. М.: Химия, 1965. 750 с.
231. Лекае В. М., Елкин Л. Н. Физико-химические н термодинамиче-
термодинамические константы элементарной серы. М.: МХТИ, 1964. 161 с.
232. Немчанинова Г. Л. Путешествие по шестой группе. М.: Просвеще-
Просвещение, 1976. 128 с.
233. БегналА К- Химия селена, теллура и полония. Пер. с англ. М.:
Атомиздат, 1971. 216 с.
234. Кудрявцева А. А. Химия и технология селеиа и теллура М.: Ме-
Металлургия, 1968. 339 с.
235. Hayes Т., Arakawa E., Williams M. — i. Appl. Phys., 1968, v. 39,
№ 19, p. 5527—5532.
236. Adams A., Baumann F, Stuke — J. Phys. State Solidi, 1967, v. 23,
No. 1, p. k99—klO4.
237. Блат Ф. Физика электронной проводимости в твердых телах. Пер.
с англ. М.: Мир, 1974. 460 с.
238. Глазов В. М., Чижевская С. Н., Глаголева Н. Н. Жидкие полупро-
полупроводники. М.: Наука, 1964. 244 с.
239. Кажлаева Р. И., Кулиев А. Л. —Изв. АН АзССР. Серия физико-
математических и технических наук, 1963, № 1, с. 137—138.
240. Охотин А. С, Пушкарский А. С, Горбачев В. В. Теплофизические
свойства полупроводников. М.: Атомиздзт, 1972, с. 89—100.
241. Чижиков Д. М., Счастливый В. П. Теллур и теллуриды. М.: Нау-
Наука, 1966. с. 5—23.
242. Nakajama Т., lkede У., Odajima A. — J. Phys. Soc. Japan, 1971,
v. 30, p. 885
243. Radoff P., Dexter R. — Phys. State Solidi, 1969, v. 35, p. 261.
«46
244. Крестов Г. А. Термохимия соединений редкоземельных и актиионд-
иых элементов. М.: Атомнздат, 1972. 264 с.
245. Gschneidner К. A.— J. Solid State Phys., 1964, v. 16, p. 275—426.
246. Witteman W. G. — i. Phys. Chem., 1960, v. 64, p. 434—440.
247. Салли А., Бренда Э. Хром. М.: Металлургия, 1971. 360 с.
248. Плимер Ю. Л., Игнатенко Г. Ф., Лаппо С, И. Металлургия хрома.
М.: Металлургия, 1965. 184 с.
249. Кожевников Г. Н., Зайков В. П. Электротермия сплавов хрома.
М.: Наука, 1980. 188 с.
250. Эмиссионная электроиика/Лрифов У. А., Азизов У. В., Вахидов
У. В., Касымов А. X. Рязань: Московский рабочий, 1974, с. 71—74.
251. Голубцов И. В., Несмеянов А. Я.— Вестник МГУ, Химия, 1965,
№ 5, с 31—33.
252. Кириллова М. М., Номерованная Л. В., Носков М. М.—ЖЭТФ,
1971, т. 60, № 1, с. 2252—2259.
253. Сплавы ыолнбдека/Моргунова Н. Н., Клыпин Б. А., Бояршинов
В. А. и др. М.: Металлургия, 1975. 235 с.
254. Носкова Н. И., Павлов В. А., Немнонов С. А. — ФММ, 1965, т. 20,
№ б, с. 920—925.
255. Савицкий Е. М., Бурханов Г. С. Монокристаллы тугоплавких в
редких металлов и сплавов. М.: Наука, 1972. 259 с.
256. Савицкий Е. М., Буров И. В., Литвак Л. Н. и др.—ЖЭТФ, 1966,
т. 36, вып. 7, с. 1310—1312.
257. Савицкий Е. М„ Буров И. В., Капустин В. И. — ДАН СССР. Фи-
Физика. 1976, т. 231, с. 75—77.
258. Савицкий Е. М., Бурханов Г. С, Сагитов С. И. и др. — ДАН СССР,
Химическая технология. 1977, т. 234, № 3, с. 644—645.
259. Hoffman E., Harrison R. W. Refractory Metal Alloys. N.Y.: Plenum
Press, 1968, p. 251—256.
260. Meckeiburg E. — Techn. Z61 Pract. Metallbearb, 1971, Bd. 65, №3,
S. 127—129.
261. Whitemire L. D., Brotzen F. «. — Trans. Met. Soc. AIME, 1967,
v. 239, № 6, p. 824—827.
262. laffee R. I. — J. Metals, 1964, May, p. 410.
263. Агте Х., Вацек И. Вольфрам и молибден. М.: Энергия, 1964. 326 с.
264. Савицкий Е. М., Поварова К. Б., Макаров П. В. Металловедение
вольфрама. М.: Металлургия, 1978. 250 с.
265. Электрические и эмиссионные свойства сплавов/Савицкий Е. М.,
Буров И. В., Пирогова С. В., Литвак И. Н. М.: Наука, 1978. 269 с.
266. Формообразование, сварка и пайка тугоплавких, редких металлов
и сплавов/Мальцев М. В., Саксольцева В. Г., Жустарева Е. Н.
и др. М.: Металлургия, 1971. 361 с.
267. Cezalzliuan A., Cleere J.-—J. Res. NBS, Phys. and Chem., 1971,
v. 75A, № 4, p. 289—290.
268. Chan I. S., Shin H. S., Byrne J, G. — Met. Trans., 1972, v. 3, № 12,
p. 3093—4007.
269. Christensen N. £. —Phys. Rev. В., 1974, v. 10, № 6, p. 2349—2390.
270. Morcom W. R., Worrell W. L, Sell H. G.. Kaplan H. T. — Metall
Trans., 1974, v. 6, № 1, p. 155—161.
271. Properties of Selected Superconductive Materials, NBS, Techn.,
"not. 724. United States Departament of Comerce Publication, 1972,
p. 91.
272. Барков С. А. Галогены и подгруппа марганца. М^ Просвещение,
1976. 112 с.
273. Галактионова Н. А. Водород в металлах. М.: Металлургия, 1967.
£47
274. Химия галлоидных «единений фтора/Николаев Н. С, Суховер-
Суховерхое В. Ф., Шишков Ю. Д. и др. М.: Наука, 1968. 348 с.
276. Ролсбен Р. Ф. Иодидные металлы и иодиды металлов. Пер. с англ.
М.: Металлургия, 1968. 524 с.
276. Савицкий Е. М., Бурханов Г. С, Заливин И. М. — ДАН СССР.
Техническая физика, 1972, т. 204, № 3, с. 593—595.
277. Убеллоде А. Плавление и кристаллическая структура. Пер. с англ.
М.: Мир, 1969. 420 с.
278. Ehiert F. — i. Inorg. Nucl. Chem., 1969, v. 31, № 9, p. 2705—2710.
279. Schmitz—Pranghe N. Dunner P.—i. Metallkunde, 1968, Bd. 59,
- № 5, S. 377—382.
280. Редкие металлы в цветных сплавах/Савицкий Е. М., Тылкина М. А.,
Грибуля В. Б., Казанская Н. К. М.: Наука, 1976, с. 31—43.
281. Спщын В. И., Голованов Ю. Н„ Балаховский О. А., Цветаев А. А.—
'• ДАН СССР, 1972, т. 205, № 6, с. 1421.
282. Trojnar E. Bazan С, Niemiec I. — Bull. Acad. Polon., Sci., Ser.
Sci, Chem., 1965, 13. №. 7p. 1035—1043.
283. Свойства и применение металлов и сплавов для электровакуумных
приборов/Андреева Р. Т., Ипатова С. И., Розинова Н. С. и др. М.:
Энергия, 1973. 336 с.
284. Джаффи Р„ Мейкат Д., Дуглас Р. Реиий и тугоплавкие металлы
платиновой группы. Пер. с англ. М.: ИЛ, 1963. 115 с.
285. Лебедев К. Б. Рений. М.: Металлургиздат, 1963. 100 с.
286. Сплавы редких металлов с особыми физическими свойствами/Са-
вицкий Е. М., Тылкина М. А., Кондратов Н. М. и др. М.: Наука,
1975, с. 205—209.
287. Савицкий Е. М., Тылкина М. А., Поварова К- Б. Сплавы рения.
М.: Наука, 1965. 335 с.
288. Савицкий Е. М., Тылкина М. А., Левин А. М. Сплавы рения в элек-
электронике. М.: Энергия, 1980. 215 с.
289. Тылкина М. А., Савицкий Е. М. Исследование и применение спла-
сплавов реиия. М.: Наука, 1975, с. 5—34.
290. Григорович В. К. Электронное строение и термодинамика сплавов
железа. М.: Наука, 1970. 292 с.
291. Гольдшмидт X. Дж. Металлография железа. Т. 1. Пер. с англ.
М.: Металлургия, 1972. 127 с.
292. Каменецкая Д. С, Пилецкая И. Б., Ширяев В. И. Железо высокой
степени чистоты. М.: Металлургия, 1978. 248 с.
293. Основы металлургии. Т. II. М.: Металлургиэдат, 1962. 786 с.
294. Гудремон Э. Специальные стали. Т. 1. Пер. с нем. М.: Металлургия,
1966. 736 с.
295. Казаринова 3. П. Никелевая и кобальтовая промышленность ка-
капиталистических и развивающихся стран в 1975 г. М.: Цветметин-
формация, 1977. 65 с.
296 Перелъман Ф. М., Зворыкин А. Я. Кобальт и иикель. М.: Наука,
1975, 215 с.
297. Химушин Ф. Ф. Жаропрочные стали и сплавы. М.: Металлургия,
1966. 672 с.
298. Береговский В. И., Кистяковский Б. В. Металлургия меди и никеля.
М.: Металлургия, 1972. 453 с.
299 Брабец В. И., Брабец О. А. — Цветные металлы, 1965, № 6,
с. 72—76.
300. Волкогон Г, М. Производство слитков иикеля и никелевых спла-
сплавов. М.: Металлургия, 1976. 96 с.
301. Гудима Н. В., Шейн Я- П. Краткий справочник по металлургии
цветные металлов. М,: Металлургия, 1975. 535 с.
'648
302. Матвеев Ю. А., Ейльман JI. С. Никель и епо сплавы вакуумной
плавки. М.: Металлургия, 1969. 176 с.
303. Пресняков А. А., Черепкова В. В. Природа провала пластичности
у металлических сплавов. Алма-Ата: Наука, 1970, 194 с.
304. 'Ливингстон С. Химия рутения, родия, палладия, осмия, иридия,
платины. Пер. с англ. М.: Мир, 1978. 366 с.
306. Сплавы благородных металлов/Липецкий Б. Л., Кручин А. В., Са-
Савицкий Е. М. и др. М.: Наука, 1977, с. 241—246.
306. Металловедение платиновых спльвов/Савицкий Е. М., Полякова
В. П., Горина Н. В\ и др. М.: Наука, 1975. 422 с.
307. Сплавы благородных ыеталлов/Рошан Н. Р., Полякова В. П., Са-
Савицкий Е. М. и др. М.: Наука, 1977, с. 103—109.
308. Савицкий Е. М., Полякова В. П., Тылкина М. А. Сплавы палладия.
М.: Наука, 1967. 213 с.
309. Головин В. А., Ульянова Э. X. Свойства благородных металлов.
М.: Металлургия, 1964. 188 с.
310. Платина, ее сплавы и композиционные материалы/Васильева Е. В.,
Волкова Р. М., Захарова М. И. и др. М.: Металлургия, 1980. 296 о.
311. Рытвин Е. И. Платиновые металлы и сплавы в производстве стек-
стеклянного волокна. М.: Химия, 1974. 261 с.
312. Финкелыитейн Д. Н. Инертные газы. М.: Наука, 1979. 199 с.
313. Спеддинг Ф., Даан А. Редкоземельные металлы. Пер. с англ. M.I
Мир, 1965. 608 с.
314. Parker I. G. Baroch С. Т. The Rare Earth Elements Ittrium and
Thorium Mater. Surv. Bur. Mines, 1972, p. 356.
316. Hirschnorm I. S. — J. Chem. Technik, 1971, May, p. 314.
316. Князев Ю. В., Носкова М. М. — ФММ, 1970, т. 30, вып. 1, 214.
317. Curry H.. Ledvold S., Spedding F. — Phys. Rev., 1960, v. 117, № 4,
p. 971—973.
318. Nellis W. I., Ledvold S. — Phys. Rev., 1969, v. 180, p. 581—590.
319. Никитин С. А., Слободчиков С. С, Чистяков О. Д.—ЖЭТФ, 1976,
№ 1, с. 104—114.
320. Boys D. W., Ledvold S. — Phys. Rev., 1968, v. 174, p. 377—380.
321. Arags — J. Less-Common Metalls, 1962, v. 4, p. 572—576.
322. Busch G., Kaldis E. Les elements des terres-rares, Paris-Grenoble,
1970, v. 1, No. 180, p. 359.
323. Лантаноиды и актиноиды/Келлер К, Браун Д., Фюже Ж- и др.
М.: Атомиздат, 1977, 287 с.
324. Черноруков Н. Г. Химия актиноидных элементов. Горький: Изд-во
ГГУ, 1978. 173 с.
326. Каралова 3. К., Мясоедов Б. Ф. Актиний. М.: Наука, 1982. 142 с.
326. Бадаева Т. А. Строение сплавов торня. М.: Наука, 1968. 116 с.
327. Торий. Пер. с англ./Под ред. Меерсона Г. А. М.: Госатомнздат,
1962. 301 с.
328. Сокурский Ю. Н„ Стерлин Я. М., Федорченко В. А. Ураи и его
сплавы. М.: Атомиздат, 1971. 445 с.
329. Уайэтт Л. М. Материалы ядерных энергетических установок. Пер.
с авгл. М.: Атомиздат, 1979. 253 с.
330. Харрингтон Ч., Рюэле А. Технология производства урана. М.:
Госатомиздат, 1961. 586 с.
331. Холден А. Н. Физическое металловедение урана. М.: Металлург-
издат, 1962. 268 с.
332. Плутоний. Справочник. В 2-х томах. М.: Атомиздат. Т. 1, 1971,
423 с; Т. 2, 1973, 448 с.
-333. Флеров Г. Н., Ильинов А. С. На пути к сверхэлементам. М.: Пе-
Педагогика. 1982. 128 с.
649
ПРИЛОЖЕНИЕ
ТАБЛИЦА 1
АТОМНЫЕ СВОЙСТВА
Элемент
<2
xS
Азот
Актиний
Алюминий
Амернцнй
Аргон
Астат
Барий
Бериллий
Берклий
Бор
Бром
Ванадии
Висмут
Водород
650
N
Ас
А1
Am
Аг
At
Ва
Be
Bk
Br
V
Bi
H
89
13
95
18
85
56
4
97
35
23
83
1
14,00670
227,00000
26,98100
243,00000
39,94800
210,00000
137,34000
9,01300
247,00000
10,81100
79,90400
60,94200
208,98000
1,00797
13,70-103
10,00
24,12
—
38,21
4,89
—
4,67
19,61
8,35
21,33
11,20
0,062
0,203
0,143
0,184
0,192
0,221
0,113
—
0,083
0,119
0,134
0,182
o;o46
0,015(N4-)
0,016 N3+)
0,171(N3-)
0,111
0,057(A13+)
0,100(Am8+
0,227(At-)
0,057(At5+)
0,063(At*+)
0,138
0,034
_ 0,100(Bk4-)
0,020(B8+)
0,196(Br-)
0,047(Br6+)
0,039(Br*+)
0,072(V?+)
0,067(V3+)
0,061(V4+)
0,040(V6+)
0,120(Bis+)
0,213(Bis~)
0,074(Bi6+)
0,154(H~)
О) к
ИЗ
Кристаллическая
решетка
1в
8
10
12
13
+5; +4;
+3; +2;
—3
Н-з
+3;(+1;+2)
От +3 до +6
+1; Н-З; Н-5;+7
+2
+2
Н-З; +4
Н-З; -3
Н-1,Н-3;Н-5;+7
Н-2;+3;Н-4;+5
От-НдоН-5
+1
Куб.
(Г<35,4К);
гекс.
G>35,4 К)
Г.ц.к.
Г.ц.к.
Г.п.у. (а);
гц.к.
Г.цк.
G-=4,3 К)
О.цк.
Г.п.у. (а)
Г.ц к.;
гексагон.
Ромбоэдр, (а);
ромбоэдр. (Р);
тетрагон.
Ромбич.
О цк.
Ромбоэдр.
Г.п.у.
(Г=1,65К);
г.ц.к.
(Т=4,20 К)
в =0,566;
о=0,404
Ь = 0,663
а =0,531
а = о,405
а= 0,345
с= 1,124;
а =0,489
а = 0,532
а = 0,474
а = 57,2°
а = 0,376
с = 0,613;
а =0,535
14,540
6,890
5,984
5,500
15,755
9,200
0,502
0,228
0,358
0,499;
0,341
1,107
0,506
58,1°;
0,101
65,3°;
0,101
0,141
0,449
0,668
0,874
0,303
5,910
9,320
6,700
8,300
11,840
6,740
7,237
13,595
2,70
4,25
2,49
3,92
4,50
4,12
4,40
3,00
1,00
1,50
11,11—1,20
1,96
0,90
1,50
2,01
2,90
1,60
1,90
2,10
651
Вольфрам
Гадолиний
Галлий
Гафний
Гелий
Германий
Гольмий
Диспрозий
Европий
Железо
Золото
Индий
Иридий
Иттербий
Иттрий
Иод
Кадмий
Калий
Калифорний
Кальций
652
2
W
Gd
Ga
Hf
Не
Ge
Но
Dy
Eu
Fe
Au
In
Ir
Yb
Y
I
Cd
К
Cf
Ca
3
74
64
31
72
2
32
67
66
63
26
79
49
77
70
39
53
48
19
98
20
4
183,92000
157,25000
69,72000
178,49000
4,00300
72,59000
164,93000
162,50000
151,96000
55,84700
196,96700
114,82000
192,22000
173,04000
88,90500
126,90450
112,40000
39,09800
251,00000
40,08000
9,54
19,91
11,80
13,42
19,43
13,64
18,78
19,03
28,93
7,09
10,20
15,76
8,62
24,82
19,88
25,72
13,01
43,50
26,20
0,140
0,180
0,138
0,159
0,122
0,139
0,065(We+/
0,068(W«+)
0,094
0,062(Ga»+)
0,082
0,065(Ge4-)
0,044(Ge4-)
0,177
0,177
0,204
0,126
0,144
0,166
0,136
0,194
0,181
0,086
0,088
0,097(Eu3+)
0,080(Fe4-)
0,067(Fe8+)
0,137(Au+)
0,130(In+)
0,092(In8+)
0,068(Ire+)
0,081(Yb3+)
0,097
0,133
0,156
0,236
0,197
0,220A-)
0,094A4-)
0,050A'+)
0,099
0,133
0,099(Cf8+)
0,104
Продолжение приложения
8
+4; +5; +6
+3
+1; +2; +3
(+3; +2); +4
—
+2; +4
(+i; +3)
+3
+3
+2;+3
+2; +3; +6
-f-1; (-f-2); (+3)
+ 1; +2; +3
От +1 до +6
+2;+3
+3
-l;+3;+5;+7
+2
+ 1
+3; (+2,
+2
9
О.ц.к.
Г.п.у. (а);
о.ц.к. (P)
Орторомб.
Г.п.у,
Г.п.у.,
о.ц.к. в
г.ц.к.
Куб. типа ал-
алмаза
Г.п.у. (а);
о.ц.к. (Р)
Г.п.у;
о.ц.к.
О.ц.к.
О.ц.к. (а);
г.ц.к. (у)
Г.ц.к.
Г.ц. тетрагон
Г.ц.к.
Г.ц.к. (а);
о.ц.к. (р)
Г. п. у. (а);
о.ц.к. (Р)
Орторомб.
Г.п.у.
О.ц.к.
Г.ц.к.;
г.п.у.
Г.ц.к,
10
а = 0,316
а= 0,363
с =0,578;
а = 0,406
о = 0,453
> = 0,452
с = 0,766
а = 0,319
с = 0,505
—
а = 0,566
а = 0,358
с= 0,563;
о = 0,396
а= 0,359
с =0,565;
о= 0,398
а = 0,457
о= 0,286;
0= 0,364
о = 0,408
о = 0,458
с — 0,494
а — 0,383
а= 0,548
о = 0,444
а=0,365
с= 0,573;
о = 0,408
о = 0,477
Ь = 0,725
с = 0,977
о= 0,296
с = 0,563
о = 0,525
й = 0,574;
а= 0,399
с = 0,689
а =0,556
И
7,980
5,980
6,000
7,500
24,580
7,880
6,020
5,930
5,630
7,900
9,223
5,785
9,200
6,250
6,380
10,440
8,990
4,339
6,700
6,1Ю
12
4,51
3,07
4,19
3,20
—
4,75—
4,95
(я-
тип);
4,80
(Р-
тип)
3,09
3,09
2,54
4,31
4,53
3,80
4,70
2,59
3,30
2,80
4,10
2,22
_
2,70
13
1,60
0VH-)
2,00
(W+)
1,30
1,60
1,30
—
2,00
1,30
1,30
1,20
1,80
2,40
1,70
1,55
1,20
1,20
2,60
1,70
0,80
—
1,00
1
Кислород
Кобальт
Кремний
Криптон
Ксенон
Курчатовий
Кюрий
Лаитан
Лоуренсий
Литий
Лютеций
Магний
Марганец
Медь
Менделевий
Молибден
Мышьяк
2
О
Со
Si
Кг
Хе
Ки
Cm
La
Lr
Li
Lu
Mg
Mn
Си
Md
Mo
As
3
8
27
14
36
54
104
96
57
103
3
71
12
25
29
101
42
33
4
15,99940
58,93300
28,08000
73,80000
131,30000
247,00000
138,91000
256,00000
6,94100
174,97000
24,32000
54,93810
63,54000
258,00000
95,94000
74,92160
5
10,89-103
6,70
12,04
27,90
36,76
—
22,53
13,10
17,79
14,00
7,36
. 7,21
9,42
12,98
6
0,066
0,125
0,134
0,197
0,218
—
0,188
0,157
0,174
0,162
0,130
0,128
0,139
0,148
7
0,013(O2+)
0,064(Co»+)
0,078(Co2+)
0,039(Si*+)
—
—
0,104(La3+)
0,090(La*+)
Q,114(La»+)
0,094(Lr3+)
0,068
0,080(Lu3+)
0,074
0,091(Мпг+)
0,070(Mn3+)
0,052(Mn*+)
0,046(Mn7+)
0,098
0,096(Md3+)
0,068(Mo*+)
0,065(Moe+)
0,047(AsB+)
0,069(As3+)
0,191 (As3-)
654
Продолжение приложения
10
12
13
(+2); -2
Ромбич. (а)
+2; +3
+4; (+2)
+8
+4
+3;+4
+3; (+4); (+2)
+3
+2
+2; +3; +4
+7
+2
+3
+4; +5; +6
(+3; +2)
+5; +3; -3
ромбоэдр, (р)
(Г=20К)
куб. (v)
(Г =50 К)
Г.п.у. (а);
гц.к. (Р)
Куб. типа
алмаза
Г.ц.к.
(Г=89К)
Г.ц.к.
(Г=10К)
Г.п.у.;
г цк.
Г.п.у. (а);
г.ц.к (р);
оц.к. (у)
О.ц.к.
Г.п.у.
Г.п.у.
Сл. куб (а);
куб. (р);
Г.ц.к. (у);
о.ц.к. (б)
Г.ц.к.
Од.к.
Ромбоэдр.
а =
= 0,540
= 0,343
0,509
132,53'
= 0,331
1,126;
= 0,683
= 0,251
0,409;
= 0,354
■ 0,543
0,571
0,613
а= 0,340
с= 1,193;
а = 0,504
0=0,372
с= 1,214;
а = 0,531;
о= 0,426
а = 0,350
а = 0,351
с = 0,555
а = 0,320
с = 0,520
а = 0,891;
0 = 0,631;
а = 0,386;
о = 0,293
о = 0,361
а= 0,315
а= 0,413
а = 54,1°
18
12
8
13
12
6
5
6
5
6
7
7
7,
с
U f
7,
9,
,614
,690
,149
,966
,127
,100
,577
000
390
150
640
432
730
4ПП
?! \j\j
290
810
4
—
,41
4,20
(p-Si)
4,80
(л-Si)
3
2
3
3,
30
38
14
64
4,52—
4,34
4,
4,
5,
40
29
11
3,50
1,70
1,90
— 1,11—1,20
1,20
0,97
1,30
1,20
1,40
(Mn2+)
1,50
(МпЧ-)
2,10
(Мп*+)
2,50
(Мп'+)
1,90
1,60
(Мо«+)
2,10
(Мо«+)
2,00
655
Натрий
Неодим
Нептуний
Никель
Нильсборий
Ниобий
Нобелий
Олово
Осмий
Палладий
Платина
Плутоний
Полоний
Празеодим
Прометий
Протактиний
656
Na
Nd
Np
Ni
Ns
Nb
No
Sn
Os
Pd
Pt
Pu
Po
Pr
Pm
Pa
11
60
93
28
105
41
102
50
76
46
78
94
84
59
61
91
22,98900
144,24000
237,04800
58,70000
92,90600
254,00000
118,69000
190,20000
106,40000
195,09000
244,00000
210,00000
140,90700
147
231,03600
23,80
20,59
—
6,60
10,83
16,29
8,49
9,28
9,09
20,81
—
—
0,192
0,182
0,150
0,124
0,147
0,158
0,136
0,137
0,139
0,162
0,153
0,183
—
0,162
0,098
0,099(Nd3+)
0,102(Np3+)
0,088(Np*+)
0,074(Ni«+),
0,069(Nb6+):
0,077(Nb«+)|
0,095(No»+)
0,093(Sn2+)
0,071(Sn4+)
0,069(Os*+):
0,065(Pd*+)
0,065(Pt*+)
0,100(Pu3+)
0,056(Po«+)
0,065(Po*+)
0,100(Prs+)
— I 0,099(Pm»+)|
0, l86(Pas+)
0,091(Pa*+)
Продолжение приложения
8
4-1
+3
+3; +4; +6
4-7
От +1 До 4-4
1 Г
4-1; 4-2; 4-3:4-4
+5
+2; 4-3
42;+4
+2; +3; 4-4;
+5; +6; +8
+2
4-2; 4-4; (+1);
(+3)
От 4-2 до 4-7
+6;+4
+з
+з
От 4-2 до 4-5
9
О.ц.к.;
г.п.у.
(Г=5К)
Г.п.у. (а)
о.ц.к. (Р)
Ромбич. (а);
тетрагон. (|3);
о.ц.к. (у)
Г.ц.к.
О.ц.к.
Куб.;
тетрагон.
(Г>286,35 К)
Г.п.у.
Г.ц.к.
Г.ц.к.
Моноклинная
(а);
моноклинная
(Р);
ромбич. (у);
г.ц.к. (б);
тетрагон, (ц);
куб. (е)
Куб. (а);
ромбоэдр, (р)
Г.п.у. (а);
о.ц.к. (р)
Г.п.у.
Тетрагон.;
о.ц.к.
10
а =0,429;
а = 0,377
с = 0,615
а = 0,366
с = 1,180;
а = 0,413
а = 0,473
6 = 0,490
с = 0,367;
а = 0,490
с = 0,339;
0 = 0,353
а = 0,352
а = 0,330
—
а = 0,650;
о = 0,583
с = 0,318
о = 0,275
с = 0,432
0 = 0,388
а = 0,319
а =0,618
Ь = 0,482
с = 1,096
Р= 101,8°;
о = 0,928
Ь= 1,046
с = 0,786
0 = 92,1°;
а = 0,316
Ь = 0,577
с= 1,016;
а = 0,464;
а = 0,470
с = 0,449;
а = 0,364
а = 0,335;
а = 0,389
а _ 98,1°
а = 0,366
с= 1,181;
а= 0,413
а = 0,365
с= 1,165
а = 0,389
с = 0,342;
а = 0,381
и
5,138
5,490
5,900
7,630
6,880
5,800
7,332
8,700
8,330
8,960
5,500
8,200
5,420
5,550
—
12
2,35
3,30
4,50
3,99
—
4,38
4,70
4,80
5,32
—
4,80
2,70
3,07
3,30
13
0,90
1,30
1,11 — 1,20
1,80
1,60
—
1,80
1,52
1,35
1,44
1,11—1,20
2,00
1,20
1,30
1,11—1,20
657
Радий
Радон
Рений
Родий
Ртуть
Рубидий
Рутений
Самарий
Свинец,
Селен
Сера
Серебро
Скандий
Стронций
Сурьма
Таллий
Таитал
Теллур
Тербий
Техиеций
Титан
658
2
Ra
Rn
Re
Rh
Hg
Rb
Ru
Sm
Pb
Se
S
Ag
Sc
St
Sb
Tl
Та
Те
Tb
Тс
Ti
3
88
86
75
45
80
37
44
62
82
34
16
47
21
38
51
81
73
52
65
43
22
4
226,02500
222,00000
186,31000
102,90500
200,59000
85,47000
101,07000
150,35000
207,19000
78,96000
32,06400
107,86900
44,96000
87,62000
121,75000
204,37000
180,94800
127,61000
158,92400
99,00000
47,90000
5
8,85
8,37
14,26
55,48
8,28
19,95
18,27
16,42
15,38
10,27
15,00
33,35
18,19
17,24
10,88
20,02
19,03
—
10,80
6
0,235
0,222
0,137
0,134
0,157
0,253
0,134
0,180
0,174
0,160
0,104
0,144
0,164
0,125
0,161
0,171
0,146
0,170
0,178
0,136
0,145
0,144
0,052(Re«+)|
0,068
0,110(Hg*+)|
0,149
0,067(Ru*+)
0,097(Sm4-)
0,132
0,198(Se*-)
0,069(Se*+)
0,035(Se«+)
0,174(S»-)
0,037(S+)
0,034(Se+)
0,133
0,083(Scs+)|
0,127
0,062(SbB+)
0,090(Sb'+)
0,149(TI+)
0,105(T13+)
0,066(Ta6+)
0,077{Ta*+)
0,088(Ta*+)
0,056(Te«+
0,089(Te*+
0,211(Tea-
0,089(Tb3+
0,057(Tc7+
0,072(Tc*+
0,095(Tca+
0,080(Tia+
0,062(Ti4+
Продолжение приложения
10
11
5,280
10,745
7,870
7,460
10,430
4,176
7,360
5,630
7,415
9,750
10,357
7,574
6,560
5,690
8,640
6,106
7,700
9,010
5,980
7,230
6,830
12
3,20
4,99
4,75
4,52
2,16
4,60
3,20
4,00
4,72
—
4,30
3,30
2,35
4,08
3,70
4,12
4,73
3,09
4,40
4,00
+2
От +7 До —1
+3
+ 1
От +2 до +8
+2;+3
+2; (+4)
-2; +4; +6
-2; +1; +4
+6
+3; +2 ■
+2
+3; +5
+ 1; +3
+ 1;+2;+3
+4;+5
+6; +4; -2
+2;+3
+7; +6; +5
+4;+2
+2;+4
О.ц.к.
Куб.
Г.п.у.
Г.ц.к.
Ромбоэдр.
О.ц.к.
Г.п.у.
Ромбоэдр, (а);
о.ц.к. (р);
Г.ц.к.
Геке.
Ромбич,
Г.ц.к.
Г.п.у.;
г.ц.к.
Г.ц.к. (а);
гегсагон.
(Р);
оц.к. (у)
Ромбоэдр.
Г.п.у.;
о.ц.к.
(при Г=506 К)
О.ц.к.
Геке.
Г.п.у. (а);
о.ц.к. (Р)
Г.п.у.
Г.п.у.
а == 0,276
с = 0,446
; 0,379
= 0,299
=70,5°
= 0,570
: 0,271
0,428
= 0,899
= 23,3°;
= 0,407;
= 0,495
= 0,436
: 0,495
: 1,046
= 1,267
= 2,449
= 0,409
= 0,331
= 0,526;
= 0,454
= 0,609;
= 0,432
= 0,706;
=0,485
= 0,451
= 57,1°
= 0,345
= 0,551;
= 0,387
а = 0,331
0 = 0,446
с =0,592
а = 0,360
с = 0,570;
а = 0,402
о = 0,274
с— 0,439
а = 0,295
с = 0,468
1,90(Тс5+)
2,30(ТсЧ)
Торий
Туллий
Углерод
Уран
Фермий
Фосфор
Франций
Фтор
Хлор
Хром
Цезий
Церий
Цинк
Цирконий
Эйнштейний
Эрбий
660
Th
Tm
С
и
Fm
Р
Fr
F
С1
Сг
Cs
Се
Zn
Zr
Es
Er
•
90
69
6
92
100
15
87
9
17
24
55
58
30
40
99
68
4
232,03810
168,93400
12,01150
238,02900
257,00000
30,97380
233,00000
18,99840
35,45300
51,99600
132,90500
140,12000
65,37000
91,22000
254,00000
167,26000
Б
19,79
18,14
3,42
12,50
13,93
95,49
14,61
17,38
7,23
67,84
20,69
9,15
13,97
_
18,49
6
0,359
(a)
0,356
/Ov
0,077
0,153
0,134
0,280
0,071
0,099
0,128
0,274
0,182
0,139
0,159
_
0,176
0,l08(Th3+)
0,085(Tm3+)
0,020(C«+)
0,103(U3+)
|0,097(Fms+)
0,035(PN-)
0,044(P'+)
0,186(Fr+)
0,133(F~)
0,009(F'+)
0,181(C1—)
0,026(Cl'+)
0,064(Cr2+)
0,035(Cr3+)
0,165
0,102(Ce3+)
0,088(Ce*+)
0,083
0,082
0,098
0,085
Продолжение приложения
8
+2; +3; +4
+3
+4; (+2); (-4)
От +3 до +6
+2; +3
+3; +5
+1
—1
+1;+3:+4
+5;+7
+2; +3; +6
(+4); (+D
+1
+3;+4
+2
+4
+з
+3
9
Г.ц.к. (а)
о.ц.к. (Р)
Г.п.у.
Геке, (графит);
Куб. (алмаз)
Ромбич. (а);
тетрагон. @);
о.ц.к. (v)
—.
Куб.
Куб. (Г<55 К)
Ромбич
(Г= ИЗ К)
О.ц к.
Оц.к
Г.ц.к (v);
о.ц.к. (б)
Г.п.у.
Г.п.у.;
о.ц к.
Г.ц.к.
Г.п.у.
10
о = 0,509;
а=4,11
о = 0,254
с = 0,556
а = 0,248
с = 0,670;
а= 0,357
а = 0,285
Ь = 0,587
с = 0,496;
а = 0,108
с= 0,566;
а = 0,354
—
а= 1,851
—
а = 0,667
а = 0,448
Ь = 0,624
с = 0,826
а = 0,288
а = 0,614
а = 0,516;
а = 0,411
а = 0,266
с = 0,495
а = 0,322
е= 0,515;
а = 0,361
—
а = 0,356
с = 0,559
и
6,950
6,180
11,264
6,20
6,700
10,550
3,980
17,418
13,01
6,746
3,893
5,650
9,390
S.840
6,800
6,100
12
3,30
3,12
4,70
3,30
—
—
1,80
—
—
4,58
1,81
2,84
4,24
3,90—
4,10
—
3,12
13
1,11—1,20
1,30
2,50
1,11—1,20
—
2,10
0,70
4,00
3,00
1,60
0,70
1,20
1,60
1,40
—
1,30
661
ТАБЛИЦА 2
ТЕПЛОВЫЕ И ТЕРМОДИНАМИЧЕСКИЕ СВОЙСТВА
Элемент
1
Азот
Актиний
Алюминий
Америций
Аргои
Астат
Барий
Бериллий
Берклий
Бор
Бром
Ванадий
Висмут
Водород
Вольфрам
Гадолиний
Галлий
Гафний
Гелий
Германий
Гольмий
Диспрозий
Европий
Железо
Золото
Индий
Иридий
Иттербий
Иттрий
Иод
Кадмий
Калий
Калифорний
Кальций
Кислород
Кобальт
Кремний
Криптон
Ксенон
Кюрий
<„л- °с
2
—210
1200
660
850
-189
304
710
1287
987
2075
—7
1917
271
—259
3380
1312
30
2230
—270
при
10 МПа
937
1470
1409
822
1538
1064
156
2447
816
1520
114
321
63
300
852
—218
1494
1417
—156
— 111
1340
'кип- °с
8
—196
~3297
2520
2610
—186
334
1640
2450
3707
59
3392
1557
—252
5367
3233
2205
5225
—269
@,1 МПа)
2734
2720
2335
1597
2872
2877
2050
4577
1193
3337
183
766
759
—
1484
—183
2957
3249
—153
—108
Од. к
4
432
—
93
96
1060
1219
339
117
384
155
333
178
—
406
161
158
121
478
162
109
420—425
118
235 (по ср)
192 (по р)
__
213
90
—
220
—
445
645
72
65
~
кДж/кг
5
25,7
62,5
389,4
—
29,5
113,7
56,0
1625,0
—
2090,0
67,6
345,4
54,7
58,0 (НJ
192,0
64,9
80,2
122,0
5,2
443,0
85,9
64,2
60,8
272,0
64,4
28,5
137,1
44,3
193,1
62,2
57,0
59,5
—
216,0
13,9
263,2
1773,0
19,5
17,5
662
Нисп. кДж/кг
ПРИ 'кип
6
1748,9
10885,8
981,9
163,5
430,5
1289,0
34395,0
51935,0
187,6
8974,9
857,5
450,0 (Н,)
4007,0
2527,0 (субл.)
3917,1
__
20,9
4700,3
1823,0
(субл.)
1834,0
(субл.)
952,2
6095,0
—
2026,4
3186,4
880,0
4420,5
164,4
886,0
2082,0
3830,0—4169,0
—
6502,0
13709,0
107,9
966,0
1508,0
ср. Дж/(кг-К),
при 298 К
7
1040,0
119,8
903,8
—
520,0
0,3
0,2
1976,0
—
1025,8
473,8
0,5
129,0
14208,0
136,0
175,0
1364,0
143,0
5190,0
322,0
165,0
169,0
178,0
0,5
0,130
238,6
128,0 B50 Ю
149,0
0,3
214,5
231,0
765,0
625,0 B50 К)
918,0
406,0B50 К)
714,0
248,0
150,0
' "
*,, Вт/(м-К),
при 298 К
8
0,2
221,5
—
0,1
—
194,0
—
26,0 C00 К)
—
31,0
8,4
0,2
160,0
10,2
33,0 C00 К)
22,2 C73 К)
0,1 B73 К)
60,7 (п-типа)
57,0 (р-типа)
22,011 а
14,01 а
10,9
—
74,0
310,0
87,0 B50 К)
148,0 C00 К)
15,8
0,4
103,0
97,1
125,0
0,02
70,9
152,0 C00 К)
0,01
0,05
а 10», К~1
9
23,4
6,2—7,5
3676,0
—
18
12 (|| с)
9 (хс)
1,1—8,3
1110,0 (объемн.)
8,7
13,4
2950,0 (объеми.)
4,5 D73 К)
8,3
20,0
6,6 C00 К)
3658,0 (объемн.)
5,7
10,7
10,0
33,1
12,1
14,0
30,0
5,7
24,9
7,6
93,0 B73 К)
30,0
84,0
22,0
-—
12,0 B73 К)
2,4
1000,0 G0 К)
3552,0 C73 К)
663
1
Лантан
Литий
Лютеций
Магний
Марганец
Медь
Молибден
Мышьяк
Натрий
Неодим
Неон
Нептуний
Никель
Ниобий
Олово
Осмий
Палладий
Платина
Плутоний
Полоний
Празеодим"
Прометий
Протактиний
Радий
Радон
Реннй
Родий
Ртуть
Рубидий
Рутений
Самарий
Свинец
Селей
Сера
Серебро
Скандий
Стронций
Сурьма
Таллий
2
920
180
1663
650
1244
1083
2622
817
98
1016
—248
637
1455
2469
232
3047
1554
1772
639
246
931
1080
1575
700—960
—71
3180
2053
-39
39
2523
1073
327
217
113
960
1530
770
630
303
3
3454
1342
3315
1107
2119
2573
4804
615
278
3127
—246
3900
2915
4842
2270
5000
2877
3827
3235
962
3212
2460
4230
1140—1500
—62
5630
3627
357
686
4350
1778
1745
657
445
2167
2700
1380
1635
1457
4
135
370
166
386
450
345
380
285
160
138
75
—
476
276
(по упругим
пост.)
238
(по ср)
200 (белое)
212 (серое)
500
275
235
—
—
138
—
—
415
362—480
357
55
580
148
105
89
180
225
231
129
204
79
5
44,7
416,0
68,2
357,0
267,0
239,0
382,0
290,9
117,0
49,5
16,6
—
302,0
296,6
59,6
140,9
156,9
100,9
11,6
59,7
49,1
56,1
63,4
37,1
14,7
178,0
219,6
11,7
27,4
222,8
57,4
23,4
69,1
49,8
104,6
—
960,0
162,4
21,1
664
Продолжение приложения
6
3102,0
(субл)
21290,0
2443,8
5498,0
5057,0
4790,0
6191,0
424,4
(субл. 615 °С)
3869,0
2271,0 (субл.)
85,9
1666,9 (субл.)
6376 ,
7359,1
2446,7
4121,9
3399,0
2577,3
1578,6
480,0
2523,0 (субл.)
2400,0
1822,0
1993,7
716,9
73,9
3822,0
4800,8
304,6
5857,0
1374,0
885,5
287,2
—
—
1763,0
1371,7
795,1
222
217
129
238
132
143
234
141
139
7
188,6
3517,0
154,0
1047,5
478,0
384,2
248,0
329,5
1224,0
190,0
1030,0
—
450,0
269,0
,0 (белое)
,0 (серое)
,0 B73 К)
,0 B50 К)
,0 B50 К)
,4 B60 К)
125,0
191,0
—
136,0
90,0
138,0
,0 B50 К)
,1 B33 К)
,0 B93 К)
367,0
0,273 B50 К)
180,0
127,6
320,0
984
237,0
558,0
737,0
209,0
129,8
397
150
7,
86,0
74
4
7
152
8
20,9
76,1
18,1
167,0
157,0
2 C50 К)
138,0
,0 B73 К)
12,9
0,05
7 C00 К)
88,5
53,2
65,0
C00—500 К)
76,2
0 C00 К)
6 B00 К)
13,2
—_
18,6
,0-59,0
,0 C00 К)
8,4
35,6
116,3
13,3
35,0
0,5
0,3
453,0
15,5
18,8
38,9
9
10,4
56,0
12,5 F73 К)
26,0
*- 22,3
16,7
5
3,9
72,0
10,0
0,5
41,0
13,5
7,1
26,2
6,1 B73 К)
12,8 B89—773 К)
8,0 (82—289 К)
42,4
20,8
6,8
9,0
11,2
—
—
6,6
8,7 B73—473 К)
41 A95-234 К)
90,0
9,9
10,4
28,3
25,5 B73 К)
74,0
18,8 C00 К)
11,4
23,0
10,8
28,0
1
Тантал
Теллур
Тербий
Технеций
Титан
Торий
Тулий
Углерод
Уран
Фосфор
Франций
Фтор
Хлор
Хром
Цезнй
Церий
Цннк
Цирконий
Эйнштейний
Эрбий
2
2997
450
1353
2200
1668
1695—
17^7
I/O*
1545
4000
1133
44
27
—220
—101
1877
28
798
419
1852
860
1522
3
5287
1012
3041
4700
3169
3297—4787
1727
4200
3862
280
677
— 188
2200
670
3257
907
3600—3700
—
2510
4
26
(по упругим)
пост.)
240
{ПО Ср)
216
(по р)
129
15»
—
430
180
167
1860 (алмаз)
200
—
—
357
39
138
305—320
237—310
—
163
б
173,7
137,2
64,8
232,0
3583,0
67,4
104,7
—
82,7
81,0
94,0
13,4
90,4
265,6
16,1
37,0
110,0
220,0
—
65,6
ТАБЛИЦА 3
ЭЛЕКТРИЧЕСКИЕ И МАГНИТНЫЕ СВОЙСТВА
Элемент
р-106, Ом м при
298 К
а-10—в, Ом/м при
298 К
а-10» К при
298-398 К
Азот
Алюминий
Аргон
Барий
Бериллий
Бор
Бром
666
0,0262
0,50
0,066
1010
1,3-10"
38,2
1,67
15,2
10-1°
4,33
—3,6
3,6
—79
Продолжение приложения
6
—
820,9
2445,0
(субл.)
6560,0
(субл.)
9790,0 (субл.)
2202,0—2844,0
1374,0 (субл.)
59700,0 (субл.)
1876,0
1891,9
178,9
(Т-85,2 К)
1288,1
1798,0
494,0
3105,0
1765,0
6357,0
1863,0 (субл.)
7
140,3
202,0
179,0
245,0
521,0
1152,0 B50 К)
160,0
710,0
113,1 B50 К)
769,1
136,5
828,0
497,9
474,0
236,0
271 (v-Ce)
193,0
394,0
289,0
168,0
8
45,2
1,8 C50 К)
10,2
49,8
21,9
35,6 C00 К)
18
545,0 (алмаз)
22,5 C00 К)
0,6
—
0,02 B73 К)
0,008
88,6
19,0
10,9
119,0
29,5
14,4
9
6,6 C73 К)
0,2
10,3
8,1
9,5
11,3
13,3
27,3 B70 К)
10,7
376,0
—
—
3830,0 (объемн.)
4,4
97,0
8,5
31,0
5,9
12,3
е, мкВ/К
5
-7,6
—3,3
520-630
D00 К)
Тс к
6
1,175
0,03
R-W м»/Кл
при 298К
7
-0,33 B73К)
+7,7
G±1,5)-107
"max ripii Ускоряю-
Ускоряющем напряжении
первичных электро-
электронов
8
1,0 @,3 кэВ)
0,83 @,4 кэВ
0,53 @,2 кэВ
1,2 @,15 кэВ
при 298 К
9
—0,43
0,6276
—0,480
+0,15
— 1,0
—0,62
-0,4
667
Ванадий
Висмут
Водород
Вольфрам
Гйдолиний
Галлий
Гафнии
Гелий
Германий
Гольмий
Диспрозий
Европий
Железо
Золото
Индий
Иридий
Иттербий
Иттрий
Иод
Кадмий
Калий
Кальций
Кислород
Кобальт
Кремний
Криптон
Ксенон
Лантан
Литий
Лютеций
Магний
Марганец
Медь
Молибден
Мышьяк
0,22
1,2
0,056
1,43 B73 К)
0,136 B73 К)
0,41
@,48—0,65) X
ХШ»
0,90 B73 К)
0,90 B73 К)
0,813
0,0971
0,023 B73 К)
0,0845
0,054
0,27
0,650
1,3-10"
0,0757
0,0623 B73 К)
0,038
0,0624
23-10е
0,565
0,0943
0,68
0,047
2,58
0,0168
0,057
0,35
4,55
0,83
17,9
0,70 B73 К)
7,35
2,44
1,54—2,09
1,11 B73 К)
1,11 B73 К)
1,23
10
43,5
11,9
18,52
3,7
1,54
7,7-10—ао
13,3
15,0
25
17,~22
4,35-Ю-4
1,77
10,7
1,47
25
0,388
58,8
20
2,86
3,4
4,2
3,11
1,76 B73—373 К)
3,96
4,4
1,4 B73 К)
1,7 B73—373 К)
1,19B73—373 К)
4,80 B73—373 К)
6,57
3,70
4,904
4,30
1,30B73—373 К)
3,6
4,24
5,81 B73 К)
4,57
6,04
—1,84 1,7
2,2 B73—373 К)
4,50
2,40 B73—373 К)
4,25
1,7
4,33 B73 К)
4,23
3,9
Продолжение приложения
5
1,0
—70
—
+ 1.07
—1ч—6
A0—320 К)
1,5
—
—
600—800
—
—7Ч-+25
A0—300 К)
+17,0
1,1
+2,4
0,8 B73 К)
—
+2,2
+2,8
— 15,6
-8,2
—
—20,0
B73 К)
+6004-800
—
—
—2
+ 12,2
—
-1,2
—
+1,7
+5,57
—
6
5,31
7
0,0154
1,0845
0,128
2,03
—
—
3,405
0,11—0,14
—
1,2—2,7
A2—17 ГПа)
0,54
—
—
7,1 (на
пленках
при 12,0—
13,0 ГПа)
4,90 а
5,85 р
—
—
—
—
—
0,90—0,98
0,31—0,5
A4-8-22 ГПа)
7
+0,7
—6,33-103
@,393 К)
+0,856
0,95
—0,63
+0,43
—
10*
+ 1,5
-2,7
8,00
—0,69
—0,24
0,402
+377
—1,25
+0,531
-4,2
— 1,78
5,88
— 104
—0,8
—2,0
0,535
-0,9
+0,844
—0,52
+ 1,8
+450
8
_
1,15 @,55 кэВ)
—
1,42 @,7 кэВ)
—
1,080 @,5 кэВ)
1,16 @,7 кэВ)
—
—
—
—
1,3 @,35 кэВ)
1,46 @,75 кэВ)
1,41 @,5 кэВ)
1,8 @,8 кэВ)
—
0,93 @,35 кэВ)
1,1 @,4 кэВ)
0,75 @,2 кэВ)
0,60 @,2 кэВ)
—
1,2 @,7 кэВ)
—
—
—
—
0,5 @,085 кэВ)
—
0,95 @,3 кэВ)
—
1,14 @,6 кэВ)
1,27 @,375 кэВ)
9
+5,0
— 1,34
—2,7(Т=20К)
+0,32
+2270
—0,31
0,42
—0,505*
±0,02
1,434
+420
+630
+220
—
—0,142
—0,56
0,14
+0,41
+2,16
0 ос
—и}ои
-0,176
0,53
+ 1,0
+ 107,8
—
—0,112
—0,346*
±0,005
—@,51-г-
4-0,53)
+0,729
+2,04
+0,102
0,50
+9,63
—0,0860
+0,93
—0,073
1
Натрий
Неодим
Неон
Никель
Ниобий
Олово
Осмий
Палладий
Платина
Плутоний
Празеодим
Протактиний
Радий
Рений
Родий
Ртуть
Рубидий
Рутений
Самарий
Свинец
Селен
Сера
Серебро
Скандий
Стронций
Сурьма
Таллий
Тантал
Теллур
Тербий
Технеций
Титан
Торий
Тулий
Углерод
Уран
Фосфор
Франций
Фтор
Хлор
Хром
Цезий
Церий
Цинк
Цирконий
Эрбий
670
2
0,0480
0,64
0,0684
0,15
0,128
0,0966
0,130
0,0981 B73 К)
1,46
0,705
—
1,71 (ж)
0,19
0,0394 B73 К)
0,958
0,1125
0,074
1,05
0,190
8,0-10*
1.9Ы021
0,0162 B73 К)
0,64
0,20
0,39
0,15 B73 К)
0,150
3,7-103
1,16
0,169
0,58 C00 К)
0,1862
0,90
13,000 (графит)
МО18 (алмаз)
0,264
1,54-1015
0,450
—
10"
0,15 C00 К)
0,1830 B73 К)
0,753
0,0592
0,46
0,85
3
21,1
1,56
13,3
6,67
8,85
10,36
10,04
10,19
0,685
1,42
—
—
5,28
20,2
1,04
8,65
13,48
0,995
5,27 B73 К)
12,5
5- Ю-22
62,0 B73 К)
1,57
5,0
2,56
6,65
6,67
0,27.10s
0,86
5,9
1,73 C00 К)
5,26
1,11
0,07 (графит)
1-10-18 (алмаз)
3,1 B73 К)
,0-15
—
—
—
6,67 C00)
5,52 B73 К)
1,33
16,4
2,18
1,18
1
1
1
1,
0
2
64
71
48
95
,9
01
4
4,34
B73—373
6,75
3,95
4,5
4,20
3,79
3,923
—0,418
B73—373
—
—
3,5
4,57
0,89
4,7
5,40
B73—373
4,2
0,6
—
4,10
4,25
5,2
4,73
5,177
3,47
3,79
—
—
3,0
3,3
B73—373
0,4
3,4
45,6
—
—
—
3,01
6,0
B73—373
3,7
4,35
B73—373
К)
К)
К)
К)
К)
К)
Продолжение приложеша
1
I
б
-4,4
— 18,0
—0,5
+0,1 (тв)
—
—9,6
-4,4
— 11,5
—
—
—
—
0,9
—3,4
—8,26
—29,7
D73 К)
—
-4,4
+914
1,42 B73 К)
—3,6
—
+35
+0,4
—5,0
300—500
—
—
—
—2,5
F73 К)
—
11,06
4,3—5,0
—
—
0,2
—
2,9
+9,5
0,96
6
—
—
9,25
3,722
0,71
—
—
—
—
2,0
1,7
0,002
4,154 (а)
3,949 (|8)
0,47
0,47
@,578 А/м)
7,19
—
2,6—2,7
2,39
4,47
2,05
D,3 ГПа)
8,22—11,20
0,387
1,40
—
0,68±0,2
—
—
—
0,875
0,75
7
—2,3
+0,97
—0,6
+0,72
—0,048
<о
—0,854
—0,214
0,69±0,05
+0,709
+3,15
0,505
-7,5
—5,9
2,2
-0,2
+0,09
—
0,9
—0,67
—
+210
+0,24
0,98
+0,24
4,3-10-2
—
—2,4
-1.2
-1,8
—487
0,34
—
—
3,63
-7,8
+ 1,92
+0,9
+2,15
—0,34!
8
—
1,3 @,55 кэВ)
1,2 @,375 кэВ)
1,43 @,6 кэВ)
1,7 @,75 кэВ)
1,62 @,55 кэВ)
1,8 @,8—1,0 кэВ)
1,60 @,7 кэВ)
1,6 @,3—0,5кэВ)
0,9 @,35 кэВ)
1,1 @,5 кэВ)
1,4 @,4 кэВ)
1,5 @,8 кэВ)
0,83 @,25 кэВ)
0,72 @,4 кэВ)
1,19 @,6 кэВ)
1,40 @,8 кэВ)
1.35 @,51 кэВ)
1,22 @,45 кэВ)
0,9 @,28 кэВ)
1,14 @,6—1 кэВ)
1,0 @,3 кэВ)
_
—
—
0,72 @,4 кэВ)
1,41 @,7 кэВ)
1,1 @,35 кэВ)
9
0,70
+39,20
—0,33±
±0,008
0
+2,2
+0,026
0,052
5,27
0,982
2,28 B73 К)
+37,80
.—
1,05
+0,368
0,988
—0,118
(80 К)
0,198
0,427
8,49
—0,111
—0,469
—0,485
—0,181
0,236
+ 1,05
—0,91
—0,249
+0,849
—0,31
+ 1210
+2,7
3,2
1,92
+ 154
—0,492
1,72
—0,86
—0,57
+3,5
0,22
+ 17,30
—0,175
+ 1,34
+263
671
Михаил Ефимович Дриц,
Петр Борисович Будберг, Геннадий Сергеевич Бурханов,
Александр Михайлович Дриц, Виктор Михайлович Пановко
СВОЙСТВА ЭЛЕМЕНТОВ
Справочник
Под общей редакцией
Михаила Ефимовича ДРИЦА
Редакторы издательства Л. М. Гордон, Г. А. Карцева
Художественный редактор Ю. И. Смурыгин
Технический редактор В. М. Курпяева
Корректоры 11. П. Собко, Ю. И. Королева
ИБ № 2704
Сдано в набор 22.06.84. Подписано в печать 26.11.84. Т-19266. Формат бумаги
84Х108'/з2- Бумага типографская № 2. Гарнитура литературная. Печать высо-
высокая. Усл. печ. л. 35,28. Усл. кр.-отт. 35,49. Уч.-изд. я. 50,07. Тираж 6500 экз.
Заказ 879. Цена 2 р. 90 к. Изд. № 0384
Ордена Трудового Красного Знамени издательство «Металлургия»,
119857, ГСП, Москва, Г-34, 2-й Обыденский пер., д. 14
Владимирская типография Союзполиграфпрома при Государственном
комитете СССР по делам издательств, полиграфии и книжной торговли
600000, г. Владимир, Октябрьский проспект, д. 7