Текст
В.Д.ГРЕБЕНЮК
АА.МАЗО
ОБЕСШИВАНИЕ
ВОДЫ
АМИ
МОСКВА, «ХИМИЯ», 1980
6П7.1:6С9.3
Г79
УДК 62&.1.934:628.166
Гребенюк В. Д., Маэо А. А.
Обессоливание воды ионитами. — М.: Химия,
1980 г. —256 с, ил.
В книге собраны и обобщены сведения, необходимые для
выбора технологической схемы и оборудования для обессоли-
вания любого типа воды. В ней приведены технологические
режимы получения воды, отвечающей высоким требованиям
предприятий химической, электронной, радиотехнической, ма-
шиностроительной отраслей промышленности.
Приведены основное оборудование и условия его эксплуа-
тации. Особое внимание уделено контролю качества обессо-
ленной воды.
Книга предназначена для инженерно-технических работ-
ников научных и проектных организаций химической, элек-
тронной, радиотехнической и машиностроительной отраслей
промышленности, а также для преподавателей и студентов
вузов.
256 с, 38 табл., 67 рис., список литературы 219 ссылок.
„ 31402-040
Г 050(01 )-80 40.80.2801000000.
© Издательство «Химия, 1980 г.
СОДЕРЖАНИЕ
Предисловие Ь
ГЛАВА 1. Общие сведения о воде и ее подготовке
перед иоиированием 7
Требования к воде .... 7
Выбор источника водоснабжения 8
Физико-химические показатели природных вод 9
Классификация вод . '3
Расчет динамики сорбции 16
Предварительная очистка воды 25
Очистка дистилляцией 25
Очистка с помощью минеральных коагулянтов 26
Очистка с помощью флокулянтов 27
Сорбциониая очистка воды 30
ГЛАВА 2. Физико-химические свойства ионитов 43
Полимеризационные гранулированные иоииты 46
Катеониты 46
Аииониты 60
Поликоидеисациоиные гранулированные иониты 65
Катеониты 65
Аниониты 66
Ионообменные мембраны 69
Ионообменные порошки и волокна 74
ГЛАВА 3. Первая ступень обессоливания воды 76
Работа катионитовых фильтров 76
Регенерация ионитов 78
Расчет рабочего нропесса на не полиостью регенерированной
катионообмеиной колонке 84
Декарбонизация Н-катиониров энной воды 87
Работа аииоиитовых фильтров на Н-катионировашюй воде,
свободной от ионов натрия 90
Влияние проскока натрия в Н-катионироваиную воду иа рабо-
ту анионообмеиника 93
ГЛАВА 4. Вторая ступень обессоливания воды 97
Смешанный слой ионитов, его особенности и соотношение
ионитов 97
Регенерация фильтра смешанного действия 102
Оптимизация расходов реагентов на регенерацию ионитов в
фильтре смешанного действия 104
Сорбция — десорбция угольной кислоты Ю5
Сорбция кремневой кислоты 109
ГЛАВА 5. Электрохимическое обессолнванне воды
113
Основы электродиализа ИЗ
Электрохимическая регенерация ноннтов 117
Обессоливание воды электродиализом 128
Удаление микрочастиц и микроорганизмов электрофильтро-
ванием 145
ГЛАВА 6. Выбор технологических схем получения особо
чистой воды и опыт их эксплуатации 152
Оптимизация по критериям закона об охране природы (мини-
мизация сброса реагентов в водотоки) 156
Выбор основного оборудования 163
Выбор дополнительного оборудования 169
Опыт эксплуатации промышленного фильтра со смешанным
слоем ионитов 169
Глубокое обесцвечивание и обессоливание воды 172
Комплексная установка для обессоливания подземных вод вы-
сокой минерализованиости 175
ГЛАВА 7. Финишная- очистка воды 178
Природные вещества органического происхождения в обессо-
ленной воде 178
Продукты деструкции ионитов 180
Микроорганизмы в обессоленной воде 181
Минеральные неэлектролиты в обессоленной воде 182
Система финишной очистки воды 184
ГЛАВА 8. Очистка воды в замкнутых циклах водообеспечения 189
Экономическое обоснование очистки воды в замкнутых циклах 190
Ионообменная очистка сточных вод гальванических произ-
водств 192
Ионообменная очистка и возвращение в производство исполь-
зованной особо чистой воды 201
Ионообменная очистка воды контуров охлаждения электрофи-
зической аппаратуры (ЭФА) 205
Удаление из воды кислорода 208
ГЛАВА 9. Эксплуатация иоиитов при получении высокоом-
ной воды 210
Подготовка ионитов к работе 210
Подготовка фильтров к рабочему циклу 212
Подготовка к работе фильтра со смешанным слоем ионитов 214
Требования к чистоте регенерирующих реагентов 216
Требования к щелочи 216
Требования к кислоте 219
Регенерация регенератов 219
Аналитический контроль в процессах обессоливания воды 221
Приложение 225
Литература
244
ПРЕДИСЛОВИЕ
Существует более 300 видов производств, потребля-
ющих обессоленную, или, как ее еще называют, деиони-
зированную воду. Наиболее крупными потребителями
такой воды являются предприятия химической, энерге-
тической, электронной, радиотехнической промышлен-
ности, а также многие машиностроительные заводы, где
обессоленную воду применяют для промывки деталей по-
_сле гальванопокрытий. Возросшие требования к каче-
ству выпускаемых продуктов и изделий непрерывно рас-
ширяют область применения обессоленной воды. Един-
ственным промышленным методом получения обессолен-
ной воды является; ионный обмен. Термические методы
получения обессоленной воды (дистиллята) используют
в основном на установках производительностью до
1 м3/ч, если требования к содержанию в воде солей ог-
раничиваются их концентрацией 5 мг/л.
Ионообменные установки размещены в различных
Географических регионах. На них обессоливают питье-
вую или техническую воду из источников е различаю-
щимся составом воды. Это вызывает необходимость
Варьировать схемы обессоливающих установок либо
технологический режим их эксплуатации.
Многочисленные статьи, посвященные обессоливанию
воды, разбросаны по разнообразным источникам, часто
малотиражным и труднодоступным. В силу разных при-
чин рекомендации, отдельных авторов противоречивы и
ire могут быть непосредственно использованы для прак-
тических нужд. Вместе с тем отсутствие издания, поль-
зуясь которым (не ставя специальной исследовательской
работы) можно выбрать технологическую схему, обору-
дование и регламент для получения обессоленной воды
5
заданного качества из имеющейся питьевой или техни-
ческой воды, ощущается уже давно. Недостаточно ква-
лифицированное применение ионообменной технологии
приводит не только к удорожанию обессоленной воды,
но и к повышенному сбросу высокоминерализованных
сточных вод, т. е. к загрязнению окружающей среды.
Тема глубокой очистки воды с помощью ионитов и
ионообменных мембран, естественно, не исчерпывается
настоящей книгой, которая представляет собой первый
опыт авторов в обобщении работ, относящихся к обессо-
ливанию воды ионитами на промышленных предприя-
тиях. Рост требований к чистоте воды, используемой в
технологических процессах, вызывает необходимость
дальнейшего совершенствования способов обессолива-
ния воды. Авторы будут признательны читателям за за-
мечания и советы.
Главы 1, 3, 4, 6—9 написаны А. А. Мазо, главы 2 и
5 — В. Д. Гребенюком, раздел на 205—210 стр. главы 8—
А. А. Мазо и А. А. Образцовым.
ГЛАВА -■■
ОБЩИЕ СВЕДЕНИЯ О ВОДЕ И ЕЕ ПОДГОТОВКЕ
ПЕРЕД ИОНИРОВАНИЕМ
ТРЕБОВАНИЯ К ВОДЕ
Каждая частная технология предъявляет свои тре-
бования к воде. В производстве синтетического каучука
применяют умягченную и частично обессоленную воду с
удельным электрическим сопротивлением, превышающим
1-Ю5 Ом-см; при получении особо качественных сортов
каучука используют глубокообессоленную воду. В про-
изводствах кинопленки и других фотоматериалов при-
меняют воду с остаточной минерализованностью на
уровне бидистиллята — удельное электрическое сопро-
тивление больше 5-Ю5 Ом-см. Здесь особенно важна
полная очистка воды от примесей органических веществ,
железа и кремневой кислоты. Производства химических
волокон также нуждаются в очень чистой обессоленной
воде, свободной от окрашенных органических веществ и
ионов переходных металлов.
Для паросилового хозяйства в зависимости от усло-
вий и параметров работы парогенераторов используют
воду умягченную, частично или полностью обессоленную.
Ионирование или кондиционирование воды для пароси-
лового хозяйства стало развитой специальной отраслью
водоподготовки, достижения и традиции которой учиты-
ваются при создании установок очистки воды и на дру-
гих производствах.
В последнее десятилетие широко развиваются пред-
приятия электронной и радиотехнической промышленно-
сти, где воду используют для промывки деталей полу-
проводниковых, электровакуумных и других приборов,
для приготовления ультрачистых электролитов, для ох-
лаждения прецизионной радиотехнической и электрофи-
зической аппаратуры.
Самые высокие требования к обессоленной воде, пе-
рекрывающие требования всех других отраслей промыш-
7
ленности, предъявляют производства электронной тех-
ники. В производстве электронных приборов применяют
обессоленную воду трех марок (А, Б и В), технические
требования к которой приведены ниже [1]:
Марка А Марка Б Марка В
Удельное электрическое
объемное сопротивле-
ние при 20±2°С,
МОм-см, не менее 18 10 1
Перманганатная окис-
ляемость в пересчете
на 02, мг/л, не более 1,0 1,0 1,5
Содержание, мг/л
кремневой кислоты <0,01 <0,05 <0,2
меди <0,005 <0,005 ^0,005
железа <0,03 ^0,03 <0,03
Содержание микроча-
стиц, >20 мкм Отсутствие Не рагламен-
Водородный показатель
рН 5,8-7,0 5,8-7,0
тируется
Воду марки А принято называть особо чистой. Ее,
как и воду марки Б, получают путем дополнительной,
так называемой финишной очистки воды марки В. Во-
ду марки В получают на установках централизованной
подачи воды. В зависимости от их производительности
различают установки УЦ-2, УЦ-10 и УЦ-25. Низкое
удельное сопротивление воды марки В, как правило,
обусловлено контактом обессоленной воды с воздухом,
содержащим диоксид углерода (причем при увеличении
содержания диоксида углерода в воздухе, находящемся
в равновесии с высокоомной водой, с 0,03% ДО 1%
удельное сопротивление упало бы до 2,2-105 Ом-см).
Однако низкое сопротивление может быть вызвано и
присутствием в воде примесей органического происхож-
дения. Это нежелательно, так как из такой воды, как
показали исследования [2], не удается получить воду
марок А и Б на установках финишной очистки.
ВЫБОР ИСТОЧНИКА ВОДОСНАБЖЕНИЯ
Воды открытых водоемов обычно загрязнены органи-
ческими веществами природного происхождения и отхо-
дами, попадающими с бытовыми и промышленными
8
сточными водами. Кроме того, состав воды открытых
источников подвержен сезонным колебаниям, особенно
во время паводков. Поэтому вода, получаемая из таких
источников, хотя и соответствует требованиям ГОСТ
2874—73 на питьевую воду, часто недостаточно свобод-
на от примесей, мешающих получению особо чистой
обессоленной воды. Предприятиям, применяющим в сво-
ей технологии высокоомную обессоленную воду, реко-
мендуется [3] в качестве источника для ее получения
использовать подземные (артезианские) воды, качество
которых более стабильно. Тем не менее артезианские
воды весьма разнообразны, и каждое предприятие (осо-
бенно таких точных отраслей промышленности, как про-
изводство кинопленки, радио или электронная) для мно-
гих технологических процессов вынуждено создавать
свою систему водоснабжения, отдельную от коммуналь-
ного хозяйства.
Например, в одном из городов водоснабжение обеспечивается
эксплуатацией двух десятков артезианских скважин с водой, близ-
кой по общему минеральному составу (5 мэкв/л), но резко отли-
чающейся от скважины к скважине содержанием железа (от 0,05
до 20 мг/л). В связи с «закольцованностью» водоснабжения содер-
жание железа в воде в каждый данный момент отличалосв большой
нестабильностью. Это заставило некоторые предприятия отключиться
от городского водопровода н включить водопроводы от местных ар-
тезианских скважин. Бывают случаи, когда предприятию выгоднее
самому перерабатывать исходную речную или артезианскую воду,
чем использовать хлорированную воду городского водопровода, ко-
торая по ряду показателей не. удовлетворяет требованиям производ-
ства.
ФИЗИКО-ХИМИЧЕСКИЕ ПОКАЗАТЕЛИ
ПРИРОДНЫХ ВОД
Природные воды, находящиеся в непрерывном кон-
такте с атмосферой, почвой, грунтом и недрами земли,
представляют собой различающиеся по составу раство-
ры минеральных веществ, газов и органических веществ.
Кроме того, природные воды являются средой обита-
ния микробов, растений и других живых организмов и,
следовательно, содержат продукты обмена веществ.
С совершенствованием аналитической техники в при-
родных водах находят все большее число элементов.
Так, в 50-е годы было известно 30—35 элементов, при-
сутствующих в воде, а в настоящее время число извест-
9
ных элементов достигает 60—65. Имеется несколько
классификаций природных вод. До того как обсуждать
их, рассмотрим некоторые показатели, общие для всех
вод.
Физические показатели качества воды. Темпера-
тура воды значительно колеблется для вод открытых
водоемов и весьма стабильна для подземных источни-
ков. Прозрачность и мутность вод открытых
водоемов зависит от* сезона (паводок) и сброса сточных
и ливневых вод.
Желтовато-зеленый цвет разных оттенков объясня-
ется присутствием в воде окрашенных органических ве-
ществ, главным образом гумусового происхождения
(гуминовые и фульвокислоты*) и коллоидных соедине-
ний железа. Различают четыре вкуса воды, обуслов-
ленные количеством, природой и соотношением солей и
органических веществ: соленый, горький, сладкий и кис-
лый. Запахи могут быть естественного и искусствен-
ного происхождения; для определения интенсивности
запахов по действующему стандарту используют пяти-
бальную систему.
Химические показатели качества воды. Водород-
ный показатель рН природной водь! колеблется в
пределах 6,5—8,5. Буферность воды определяется рас-
творенной в воде угольной кислотой и ионами НСОэ:
Н2С03 *==*: НСОз + Н+
[НСОП [H+j
Л' =
[Н2СОа]
[Н2С03|
рН = - Ig [H+] = - Ig К
[НСОз
Концентрация водородных ионов такой буферной си-
стемы с разбавлением меняется незначительно, так как
рН ее определяется не концентрацией кислоты и ее со-
ли, а отношением этих концентраций. Указанная буфер-
ная система играет большую роль как в процессах са-
моочищения воды, так и в процессах ее очистки и обез-
зараживания.
Окисляемость воды характеризуется присутст-
вием восстанавливающих примесей, главным образом
* Гуминовые и фульвокислоты и их соли являются основными
представителями гумусовых веществ.
10
Примесей органического происхождения. На практике
для определения окисляемости применяют в основном
два способа — перманганатный и бихроматный. Причем
методика первого значительно проще, чем второго. Од-
нако перманганатный метод позволяет определять мень-
ше окисляемых органических веществ, чем бихроматный.
Поэтому выбор способа зависит от поставленной зада-
чи. Перманганатный метод можно рекомендовать для
сравнения характера изменения во времени окисляемо-
сти одной и той же воды. Известно, что артезианские
воды отличаются наименьшей окисляемостью
(«2 мг 02/л),а поверхностные воды, содержащие много
фульвокислоты и других органических примесей,— наи-
большей.
В ряде случаев необходимо определить природу ор-
ганических веществ. В настоящее время разработаны
методики [4] разной степени трудоемкости и точности
для анализа следующих видов органических веществ:
гуминовые, фульвокислоты и их соли, к-арбоновые кис-
лоты, амины, амиды, сложные и простые сахара, слож-
ные эфиры. Косвенным доказательством присутствия в
воде ряда неокрашенных органических веществ служит
непропорционально малое уменьшение окисляемости
обесцвеченной воды по сравнению с необесцвеченной.
Азотсодержащие соединения (ионы NH*,
NOa, NO3) образуются главным образом в результате
разложения белковых веществ. Процесс разложения
протекает через стадии образования аминокислот и их
солей, аминов и амидов: чем больше в воде ионов NH4F
и N07, тем «моложе» источник загрязнения. В некото-
рых случаях эти загрязнения имеют минеральное про-
исхождение.
Хлориды и сульфаты (Ch, HSO4, SO*" ) поч-
ти всегда в тех или иных количествах присутствуют в
природных водах. Рост содержания этих ионов в дан-
ной природной.воде, как правило, определяется сбросом
в нее сточных вод промышленных предприятий.
В природных водах различают бикарбонатную и кар-
бонатную щелочность, обусловленную присутстви-
ем соответственно NaHC03 и ЫагС03. При некоторых
приемах обработки воды появляется и гидратная ще-
лочность. Из щелочных металлов преобладают ионы
натрия.
11
Жесткость воды определяется присутствием со-
лей кальция и магния. Их источником являются извест-
няки и доломиты. Обогащение воды солями жесткости
происходит в соответствии с реакцией
СаС03 + Н20 + С02 »- Са(НС03)2
Некарбонатная жесткость определяется присутстви-
ем кальциевых и магниевых солей серной, соляной и
азотной кислот.
Железо может присутствовать в природных водах
в виде солей, гидроксидов Fe(II) и Fe(III) и в виде
комплексных соединений с органическими веществами.
Форма присутствия железа зависит от рН среды и при-
роды органических веществ. Соотношение Fe2+ и Fe3+
определяется насыщенностью воды кислородом и диок-
сидом углерода. Несмотря на сравнительно малое со-
держание (от десятков мкг до нескольких мг в 1 л),
присутствие железа вносит очень большие осложнения
при использовании такой воды в технических целях.
Соединения кремния в природных водах обнару-
живаются в трех состояниях: ионное HSiOj (правиль-
нее H3S1O7), в виде полимерной кислоты [Si(OH)4]„ и
в виде коллоидных частиц (БЮг)*- (НгО)^. Содержание
кремния в подземных водах, как правило, на порядок
выше, чем в водах открытых водоемов. Несмотря на
сравнительно малое содержание кремния (1—20 мг/л),
он представляет большую опасность как накипеобразо-
ватель.
В чистой воде, контактирующей с воздухом, содер-
жание кислорода при данном давлении зависит
главным образом от температуры. Некоторое влияние на
насыщение воды кислородом оказывает содержание со-
лей.
Диоксид углерода встречается во всех водах.
Сравнительно большое содержание диоксида углерода
(в виде аниона солей) не может быть объяснено только
поглощением его из воздуха, а связано и с жизнедея-
тельностью населяющих воду микроорганизмов. В воде
имеет место следующее равновесие:
С02 + Н20 ц=ь Н2СОэ 4=fc H+ + HCO3" =«=fc 2H+ +COl-
Часть свободного диоксида углерода, необходимая
для равновесия с бикарбонатами, называется равновес-
12
ной; избыточный диоксид углерода (сверх равновесно-
го) называется агрессивным.
Микроэлементами называют примеси, присут-
ствующие в воде в количествах, значительно меньших
1 мг/л. К ним относятся I, Br, F, Со, Си, Se и ряд дру-
гих.
Правила отбора проб и методики определения более
семидесяти физико-химических показателей воды со-
браны в единое руководство [5].
КЛАССИФИКАЦИЯ ВОД
В связи с многообразием природных вод большое
значение приобретает их классификация. В. И. Вернад-
ский отмечает существование 485 видов природных вод
и делит их на четыре основные группы в зависимости
от степени минерализованное™ (в г/л):
Пресные <Ч Соленые 10—50
Солоноватые 1—10 Рассолы >50
В свою очередь пресные воды подразделяют на: во-
ды малой минерализованности (200 мг/л), средней мине-
рализованности (200—500 мг/л) и повышенной минера-
лизованности (500—1000 мг/л).
В 1946 г. опубликована классификация вод
О. А. Алекина [6], в основу которой положены два
следующих принципа: содержание преобладающих
ионов и соотношение между ионами. По преобладаю-
щему аниону все воды делят на три класса: гидрокарбо-
натные, сульфатные и хлоридные. Эти классы дают
представление о гидрохимическом «облике» воды.
Каждый класс по преобладающему катиону делят
на группы кальциевых, магниевых и натриевых вод.
В пределах группы выделяются четыре типа вод. Содер-
жание солей в различных типах вод можно представить
следующим образом [7]:
1 тип: HCO~>Ca2++Mg2+ (щелочные, мягкие во-
ды; солевой состав представлен соединениями
Са(НС03)2, Mg(HC03)2, NaHC03, Na2S04, NaCl).
2 тип: HCO~<Ca2++Mg2+<HCO;+SOT (воды
большинства рек и озер малой и умеренной минерали-
зованности, содержащие Ca(HC03)2, Mg(HC03)2,
CaS04, MgS04, MgCl2, NaCl).
13
3 тип: HCO,+SOr <Ca2++Mg2+,Cl>Na (воды
морей, океанов,* соленых озер, содержащие Са(НСОз)г,
Mg(HC03)2, CaS04, MgS04, MgCl2) NaCl).
В четвертом типе вод отсутствуют бикарбонат-ионы;
воды этого типа — кислые (болотные, вулканические,
кислые сточные воды).
Классификация О. А. Алекина представляет интерес
для гидрохимии, т. е. для характеристики вод с позиций
их генезиса. Для задач, связанных с очисткой воды, с
ее кондиционированием, значительно более интересной
является классификация, предложенная Л. А. Кульским
[8] на основе систематизации примесей в воде по их
фазово-дисперсному состоянию (табл. 1). При этом при-
родная вода рассматривается не как раствор солей, а
как система, которая в реальных условиях может быть
не только гомофазной, но и гетерофазной. Набор мето-
дов очистки воды предопределяется формой и составом
примесей, находящихся в воде (табл. 2).
Таблица 1. Систематизация примесей, присутствующих в воде,
по их фазово-дисперсиому состоянию [8]
Группа
Размер частиц,
мкм
Характеристика примесей
I — взвеси
II — коллоидные
растворы
Гетерогенная система
ю-1
ю-1—ю-а
Суспензии и эмульсии, обуслов-
ливающие мутность воды, а
также микроорганизмы и
планктон
Коллоиды и высокомолекулярные
соединения, обусловливающие
окисляемость p цветность воды,
а также вирусы
III — молекуляр-
ные растворы
IV — ионные, ра-
створы
Гомогенная система
ю-1—ю-3
ю-3
Газы, растворимые в воде, ор-
ганические вещества, придаю-
щие ей запахи и привкусы
Соли, основания, кислоты, при-
дающие воде минерализован-
ность, жесткость, щелочность
или" кислотность
14
Таблица 2. Классификация примесей воды по их фазово-дисперсному.состоянию и процессы, используемые
для их удаления [8]
Гетерогенные системы
Группа I
Механическое безреа-
гентное разделение
Адгезия на гидроксидах
алюминия или железа
и зернистых высоко-
дисперсных материа-
лах
Агрегация прн помощи
флокулянтов
Флотация
Бактерицидное воздей-
ствие на патогенные
микроорганизмы и
споры
Группа II
Окисление хлором, диокси-
дом хлора, озоном и др.
Адсорбция на гидроксидах
алюминия и железа, а
также на высокодисперс-
ных минералах
Агрегация при помощи вы-
сокомолекулярных флоку-
лянтов катионного типа
Вирулицидиое воздействие
Гомогенные системы
Группа III
Десорбция газов и легколе-
тучих органических сое-
динений при аэрировании
Окисление хлором, диокси-
дом хлора, озоном и др.
Адсорбция на активирован-
ных углях и других ма-
териалах
Экстракция органическими
растворителями
Эвапорация
Биохимический распад
Группа IV
Перевод ионов в мало-
диссоциированные сое-
динения
Перевод ионов в мало-
растворимые соедине-
ния
Фиксация ионов на
твердой фазе ионитов
Сепарация ионов при
различном фазовом
состоянии воды
Использование подвиж-
ности иоиов в элек-
трическом поле
Методы деминерализации различают по тому, что
удаляется.из раствора: вода или присутствующие в ней
соли. Вода удаляется дистилляцией, вымораживанием,
экстракцией кристаллогидратами или органическими
растворителями и обратным осмосом. К методам удале-
ния солей относятся ионный обмен и электродиализ.
РАСЧЕТ ДИНАМИКИ СОРБЦИИ
Принцип ионообменного метода заключается в сле-
дующем: воду пропускают через слой катионита в Н+-
форме, а затем через слой анионита в ОН~-форме. Ка-
тионит связывает ионы металла, а анионит—анионы со-
ли. При этом протекают следующие реакции:
[Кат] Н + Ме+ + А- я—*• [Кат] Ме+ Н+А-
[Ан] ОН+ Н+А- ч=Ь [Ан] А + Н20
Слабо диссоциирующая угольная кислота разлагает-
ся на диоксид углерода и воду,, и как правило, диоксид
углерода выдувается воздухом, в декарбонизаторе, стоя-
щем между катионитовой и анионитовой колоннами.
После исчерпания обменивающихся ионов водорода
и гидроксида иониты регенерируют, т. е. катионит обра-
батывают раствором кислоты, а анионит—раствором
щелочи. Таким образом, простейшая технологическая
схема ионообменного обессоливания воды представляет
собой: катионит—>-декарбонизатор—»-анионит.
Расчет показывает [9], что если бы затраты реаген-
тов на регенерацию составляли 1 эквивалент на 1 экви-
валент удаленных солей, то к. п. д. процесса ионооб-
менного обессоливания приближался бы к 5%. По при-
чинам, которые будут рассмотрены ниже, фактический
расход реагентов достигает 300—400% от стехиометри-
ческого, следовательно, к. п. д. ионного обмена вряд ли
превышает 1,0—1,5%. Такой к. п. д. ионного обмена для
обессоливания пресных вод на три порядка больше, чем
при дистилляции, и это определило широкое распро-
странение ионного обмена. Вторым, не менее важным
фактором использования ионитов, явилась возможность
резко увеличить глубину обессоливания, на два порядка
превышающую возможности дистилляции.
Для понимания закономерностей сорбционного про-
цесса рассмотрим следующие опыты. Колонки заполня-
16
Рис. I. Зависимость времени защит-
ного действия от длины слоя сор-
бента.
ют слоями сорбента возраста-
ющей длины и проверяют вре-
мя, в течение которого каж-
дый из них при заданном спо-
собе аналитического определе-
ния извлекаемого вещества
будет полностью задерживать
его. Откладывая по оси абс-
цисс длину слоев L, а по оси
ординат время защитного действия 0 (термин предло-
жен при разработке теории работы противогазов), полу-
чают график (рис. 1).
Для всех слоев длиннее La, 0 = kL (где к.— коэффи-
циент защитного действия, равный тангенсу угла накло-
на кривой к оси L, т. е.. время защитного действия слоя
длиною в 1 см.). Время защитного действия постепенно
увеличивается от нуля до постоянного значения. Имел-
но на этом участке длины! формируется фронт сорбции
перед дальнейшим параллельным его переносом вдоль
по слою. Это постепенное изменение ведет к некоторой
потере времени защитного действия по сравнению с тем,
которое было бы, если бы прямая линия шла из начала
координат (см. рис. 1, пунктирная линия).
Величину т определяют графически, продолжив пря-
мую из точки, соответствующей Lo, до пересечения с
ординатой. Тогда
6 = kl—т-
Это — известное выражение Шилова, описывающее
работу фильтрующего противогаза.
Если раствор пропускать через сорбент с заданной
скоростью, время защитного действия можно выразить
в объемах очищенного раствора V, а величину т — в по-
тере части сорбционной емкости колонны ту. Коэффи-
циент защитного действия при этом выражает емкость
единицы толщины или единицы массы (объема) сорбен-
та (ку). Тогда
V = KyL — Гу
2-360
17
Коэффициент kv характеризует поведение сорбента
в статических условиях, т. е. в условиях, когда слой
сорбента приведен в равновесное состояние с раствором;
т или ту характеризует кинетику процесса. Естественно,
что величина ку прямо пропорциональна максимальной
сорбционной способности сорбента а (последнюю опре-
деляют с помощью изотерм сорбции).
Слои сорбента имеют таким образом полную дина-
мическую емкость kZ, и динамическую емкость до прос-
кока (kL—т). Если первая определяется только приро-
дой сорбента, то вторая работой слоя (скоростью про-
пускания раство'ра, концентрацией его и т. д.).
На основании графика (рис. 2), представленного в
координатах состав — объем, можно определить емкость
сорбента, через который пропущен раствор (полная ди-
намическая емкость Еп). Она равна площади фигуры
Оабв. Площадь прямоугольника Оагв определяет дина-
мическую емкость до проскока или рабочую емкость
колонны Ер. Отношение Ер/Е п степень использования
сорбента в реальных динамических условиях (очевидны
преимущества I сорбента).
Определение полной динамической емкости колонны
и рабочей емкости (емкости до проскока), а также вре-
мени защитного действия слоя и потери времени за-
щитного действия при пропускании данного раствора с
заданной скоростью растворов меняющихся концентра-
ций, состава и т. д., проводят с помощью серии экспе-
риментов.
Колонку, диаметр которой в 20—30 раз больше диаметра зерна
сорбента, загружают сорбентом на разные высоты и при заданной
скорости пропускают раствор заданной концентрации. Отбирая и
анализируя через определенные промежутки времени пробы фильт-
рата, снимают так называемые выходные кривые.
* 1
< а
z
«а4
о
1?
tj
сь
1
I
г б
1 /
! '
1
11
/
1 /1
V 1
Объем, см3
1
//
г
"Г
i
б
/ 1
' 1
i
1 а-
в
Объем, см3
Рис. 2. Выходные кривые для,двух (I и II) сорбентов,
18
Построив график по типу, указанному на рис. 1, уэиают зави-
симость V от L и ту. Надо помнить, однако, что полученные данные
верны только для выбранных условий.
При определении V труднее всего найти значения
ху, поскольку произведение KyL представляет" собой по
существу полную сорбционную емкость слоя, а она оп-
ределяется в статических (равновесных) условиях из
изотермы сорбции; причем KV=aS/Cb (a — максималь-
ная сорбция; Со — исходная концентрация; S — пло!цадь
сечения сорбционной колонки). Величина ту, зависящая
от кинетических факторов и формы изотермы, в ранних
работах по теории динамики сорбции [10] давалась в
виде полуэмпирической зависимости:
xv = B0Kdu1-n[\gC0 — В]
где и — скорость пропускания раствора; d — диаметр частицы сор-
бента; Со — исходная концентрация раствора; и, В и Во — экспери-
ментально определяемые коэффициенты.
Таким образом, для выбора условий сорбционной
очистки раствора необходимо проделать большую и тру-
доемкую экспериментальную работу. Поэтому возникло
естественное стремление к поиску аналитического описа-
ния процесса сорбции [9, 11].
Историю развития теории динамики ионного обмена подразде-
ляют [12] на три этапа с характерными для них методами и сред-
ствами исследования. Первый связан с уравнением Шилова [13],
% этому этапу можно отнести отечественные работы [14, 15], сы-
гравшие значительную роль в организации, становлении и развитии
ионообменной технологии обессоливация воды. Расчет процессов в
них опирается на экспериментально полученные данные, выражен-
ные в виде диаграмм и графиков [14], либо на эмпирические урав-
нения, представляющие собой варианты уравнения Шилова [15].
Отметим, что в проектах и сейчас пользуются для расчетов назван-
ными уравнениями или графиками [16].
С ростом технического использования ионного обмена не только
для очистки воды, но и в других технологических процессах (разде-
ление и очистка веществ, гидрометаллургия, очистка сточных вод
и др.), начался второй этап, связанный с формулировкой системы
дифференциальных уравнений, описывающей модель динамики сорб-
ции, т. е. уравнении баланса веществ, кинетики и статики [9,
11, 17].
Обозначим через а(х, t) сорбированную массу ве-
щества, содержащегося к моменту времени t в единице
объема слоя сорбента на расстоянии х от входа в ко-
2»
19
t(0,t)=Cg(t)
C(X,t)
Рис. З. Схема, поясняющая принцип вывода уравнения материаль-
ного баланса [9].
Рис. 4. Изотермы сорбции:
/ — линейная; 2 —выпуклая; 3 — вогнутая.
лонну (рис. 3), а через С(х, t) — концентрацию этого ве-
щества в растворе, находящемся в колонне на расстоя-
нии х к моменту времени t. Очевидно, в растворе оста-
нется все, кроме того, что задержалось в слое сорбента
и в поровом пространстве между зернами сорбента в
данном слое. Тогда, при прохождении раствора через
бесконечно малый участок А*, материальный баланс ве-
щества можно записать уравнением:
дС
дх
да
дС
— и л_ - т + е dt
где и — линейная скорость пропускания раствора, е — пористость
слоя сорбента.
Для упрощения задачи пренебрегаем тем изменени-
ем концентрации вдоль по слою, которое может иметь
место из-за продольной диффузии.
В уравнение входят две искомые величины Сна.
Для его решения необходимо иметь еще одно уравне-
ние, связывающее эти величины, т. е.
a = f(C)
Если в каждом данном слое Ах успевает устанав-
ливаться равновесие в системе сорбент—раствор, доста-
20
точно было бы функциональной зависимости a = f(C),
называемой изотермой сорбции (методики и способы
исследований равновесных состояний сиртемы сорбент—
раствор изложены в работе [9]). Графическое изобра-
жение основных типов изотерм дано на рис. 4.
Линейная изотерма (1) описывается уравнением пря-
мой; выпуклая изотерма (2) — уравнениями Ленгмюра,
Фрёйндлиха и т. п.; вогнутая изотерма (3) не имеет
аналитических решений.
Решения систем уравнений материального баланса и
изотерм сорбции при бесконечно быстрой кинетике по-
казали [10, 11], что в случае линейной изотермы фронт
сорбции передвигается без деформации с постоянной
скоростью (рис. 5,а), в случае выпуклой изотермы про-
исходит постепенное обострение фронта (рис. 5,6), а
при вогнутой изотерме фронт сорбции размывается (рис.
5,в). Таким образом, для случая мгновенной кинетики
и выпуклой изотермы сорбции как раз и реализуется та
часть уравнения Шилова, которая записывается как
6 = kL.
Скорость всякого многостадийного процесса лимити-
руется самой медленной стадией. Для реализации акта
сорбции нужно, подвести сорбируемое вещество из рас-
твора к активной группе сорбента, а после сорбции это
вещество должно продиффундировать вглубь, чтобы
освободить поверхность для встречи с новыми частица-
ми поглощаемого вещества. Сам акт сорбции можно
считать мгновенным.
Установлено, что при работе с разбавленными рас-
творами процесс лимитируется диффузией в растворе,
т. е. внешней диффузией, а при работе со сравнительно
концентрированными растворами — диффузией в зерно,
или внутренней диффузией [18]. Не исключаются, од-
Рис. 5. Схема движения фронта
сорбции веществ, равновесие
которой описывается линейной
(а), выпуклой (б), или вогну-
той (в) изотермой.
а 6 в
21
нако, и случаи, когда, несмотря На низкую концентрацию
раствора, например, содержащего крупные молекулы,
лимитирующим фактором окажется внутренняя диффу-
зия, т. е. процесс, освобождающий поверхность сорбента
для взаимодействия с приближающимися к нему части-
цами. Видимо, нельзя исключать и изменение стадии,
лимитирующей процесс, по мере заполнения сорбента.
Так, можно себе представить, что вначале, когда сор-
бент свободен, скорость поглощения зависит от скоро-
сти подвода вещества к сорбенту (внешняя диффузия),
а по мере заполнения последнего процесс начинает сдер-
живать скорость освобождения поверхностных слоев
сорбента (т. е. внутренняя диффузия) [19].
Диффузионный процесс описывается первым и вто-
рым законами Фика. Решение задачи о степени запол-
нения частицы шарообразного сорбента Ф в результате
диффузии в него сорбируемого вещества в течение вре-
мени t привело к выражению:
®='-4-2^-л2В'
/1—1
где B = n2D/r2
Как видно из уравнения, степень отраоотки сорбента
Ф (полная отработка равна 1) зависит только от без-
размерного параметра В^. Имеется специальная табли-
ца [9] зависимостей Ш от t. Определив из кинетических
опытов, методика, которых изложена в работе [9], сте-
пень заполнения сорбента Ф, по таблицам находят со-
ответствующую величину В и вычисляют коэффициент
диффузии D.
Внещнедиффузионный механизм характеризуется
кинетическим коэффициентом (или коэффициентом мас-
сопереноса) р, с-1. Для ионообменной сорбции, по дан-
ным [9]
Р = 0,09ш«°.63/£/1'47
где w — постоянная для каждой пары обменивающихся ионов
(мыа-н=1, wMg-H = 0,62, мса-н=0,74); и —линейная скорость;
d— диаметр зерна.
Система из трех уравнений: материального баланса,
статики сорбции и кинетики сорбции может быть реше-
22
на различными вариантами, число которых определяет-
ся произведением числа форм изотерм (выпуклая, ли-
нейная и вогнутая) на число форм кинетики процесса
(внешняя, внутренняя и смешанная диффузии). Изве-
стно, что для вогнутой изотермы аналитическое решение
невозможно, а существуют только числовые решения.
Таким образом, решению любой задачи динамики сорб-
ции должно предшествовать определение кинетики про-
цесса (внешне- или внутридиффузионной).
Рассмотренные выше, закономерности относятся к
сорбции одного вещества. Если в растворе присутствует
смесь веществ и все они в той или иной степени сор-
бируются одновременно, задача значительно усложня-
ется.
Серьезные математические трудности, возникшие при
решении- задач динамики сорбции, вызвали необходи-
мость определенных упрощений и приближенных мето-
дов решения. Одним из примеров асимптотического ре-
шения системы уравнений для определения емкости слоя
катионита при обмене одновалентных ионов во внешне-
диффузионной области является выражение [20]:
F rv г I 1 + А у ^\ ' ■„ С-0* ill
Ер = С0У = С0(—— SL—^-^-j^ in ф -lj
где Со—исходное содержание солей, мэкв/мл; V — объем очищен-
ного фильтрата, мл; S — свободное сечение колонны, см2; и — линей-
ная скорость потока, рассчитанная на проницаемое сечение колон-
ны, см/с; А—ионное отношение; k — концентрационная константа
ионного обмена в зоне чистого компонента; L — высота слоя иони-
та, см; <р — заданная величина проскока (равная С: Со, где С —
концентрация извлекаемого вещества в фильтрате, мэкв/мл).
Концентрационная константа обмена находится из
уравнения Никольского:
1 1
О к &
где z — заряд ионов; / — номера ионов.
Наименее сорбируемым ионом, природных вод явля-
ется ион натрия, поэтому процесс идет так, как если бы
23
вода содержала только ионы натрия, но в количестве,
равном сумме всех катионов. Поэтому расчет Н-катио-
нирования при обессоливании воды можно проводить
по приведенному выше уравнению.
Очевидно, рабочая обменная емкость колонн будет
тем больше, чем меньше скорость пропускания воды и
чем больше коэффициент массопереноса, зависящий от
размера зерен. Чем больше высота слоя сорбента, тем
большей окажется полностью насыщенная его часть.
С увеличением глубины обессоливания (с уменьшени-
ем значения ср) рабочая обменная емкость будет падать.
Может быть задана и такая глубина очистки, которую
при данных условиях (L, и, (3) вообще нельзя реализо-
вать. Расчет по приведенному выше уравнению доста-
точно хорошо совпадает с экспериментальными данны-
ми (расхождение 5—10%) для <р = 0,05 [21].
Многообразие задач и условий сорбционной техно-
логии, для части которых нет строгого математического
описания, вызвало необходимость применения числовых
методов решения с помощью ЭВМ. Широкое использо-
вание ЭВМ на всех стадиях исследования процессов
сорбции, в том числе ионного обмена, характеризует
третий этап развития теории динамики сорбции. При
этом не только увеличивается число решенных задач, но
происходят и качественные изменения в подходе к их
решению: открылась возможность учета множества фак-
торов, характеризующих кинетику процесса (внешняя,
внутренняя и продольная) для линейной и нелинейной
изотерм сорбции одного или нескольких ионов. Очень
важной оказалась возможность быстрого получения кар-
тины распределения ионов по слою сорбента в зависи-
мости от условий проведения как рабочего процесса,
так и регенерации.
Наиболее полно достижения третьего этапа отраже-
ны в работах [9, 22, 23]. В работе [9] решения задач
Н-катионирования с использованием ЭВМ даны в виде
набора выходных кривых сорбции—десорбции в безраз-
мерных координатах, переход от которых к конкретным
величинам (времени работы колонны) достаточно прост
(некоторые результаты расчета процесса Н-катиониро-
вания с помощью ЭВМ представлены в гл. 3). В насто-
ящее время для расчетов применяют все три направле-
ния в области динамики сорбционных процессов,
24
ПРЕДВАРИТЕЛЬНАЯ ОЧИСТКА ВОДЫ
Начиная с 50-х годов появляются работы [24], по-
священные предварительной очистке воды перед ее
обессоливанием. Уже тогда было показано, что полно-
му обессрливанию больше всего мешают окрашенные
органические, вещества, относящиеся к гумусовым со-
единениям. Их присутствие в водах обусловливает цвет-
ность, запах и привкус, снижает прозрачность и поверх-
ностное натяжение воды. Наличие в воде органических
веществ считалось нежелательным с точки зрения так
называемого «старения» ионитов, причину которого ви-
дели в сорбции ими гумуса.
Позднее было показано [25], что есть и другая, бо-
лее существенная опасность, грозящая качеству обессо-
ленной воды. Гумусовые вещества, после того как ем-
кость ионитов по ним исчерпана, попадают в обессо-
ленную воду и снижают ее удельное электрическое
сопротивление и рН. Достаточно присутствия в обессолен-
ной воде 0,1 мг/л гуминовой кислоты или еще меньше-
го количества фульвокислоты, чтобы ее удельное сопро-
тивление стало значительно меньше требуемых
МО7 Ом-см. Таким образом, для получения высокоом-
ной воды из окрашенных природных вод требуется обя-
зательная предварительная очистка, которая произво-
дится тремя основными способами: дистилляцией воды,
коагуляцией и сорбцией примесей.
Очистка дистилляцией
Лучшим и наиболее универсальным методом предва-
рительной очистки воды является ее дистилляция. Од-
нако для получения больших объемов высокоомной во-
ды дистилляция часто становится технически невыгод-
ной из-за значительных энергетических затрат, расхода
воды на охлаждение конденсата и из-за трудностей ути-
лизации отходящего тепла. Кроме того, для работы
крупных дистилляторов требуется умягчение воды.
Данные табл. 3 иллюстрируют изменение состава
примесей органического происхождения в воде до и
после дистилляции [26].
При дистилляции основная часть органических при-
месей остается в «маточнике». Независимо от состава
25
Таблица 3. Состав примесей органического происхождений
в воде до и после дистилляции
Показатели
Содержание
аминокислот в пересче-
те на азот, мкг/л
белков в пересчете на
азот, мкг/л
карбоновых кислот,
мкэкв/л
сложных эфиров,
мкэкв/л
гуминовых кислот,
мкг/л
фульвокислот, мкг/л
Окисляемость, мг Ог/л
г. Москва
нсход-
иан во-
да от-
крытого
водоема
5
123
17
112
440
13400
9
ДИСТИЛ-
ЛЯТ
30
3
117
100
0,3
г. Ленинград
исход-
ная во-
да от-
крытого
водоема
6
125
22,2
100
540
9850
7,4
дистил-
лят
6,6
26,5
6,5
112
42
185
0,3
г. Воронеж
исход-
ная во-
да ар-
тезиан-
ская
20
68
8,5
95,0
10
1125
1.2
дистил-
лят
7.5
7.0
2,5
100
115
0,4
исходной воды окисляемость дистиллята везде одина-
кова. Дистиллят свободен от гуминовых кислот и на
90—98% уменьшается содержание фульвокислот. Глав-
ной причиной их попадания в дистиллят является несо-
вершенство перегонных аппаратов, работающих с опре-
деленным захватом сырой воды. Освободить воду от та-
ких летучих веществ, как сложные эфиры и карбоновые
кислоты, методом дистилляции невозможно.
Очистка с помощью минеральных
коагулянтов
Для удаления из воды коллоидно-дисперсных ве-
ществ частицы их должны быть достаточно крупными.
Укрупнение коллоидных частиц за счет их слипания под
влиянием молекулярных сил притяжения называется
коагуляцией, а технологический процесс обработки воды,
реагентами, который завершается коагуляцией ее колло-
идных примесей,— коагулированием. Коллоидные части-
цы, как правило, имеют определенный заряд. рН среды,
при котором заряд частиц равен нулю, называется изо-
электрической точкой коллоидной системы. Чем больше
рН среды отличается от рН изоэлектрической точки, тем
26
больше заряд частиц. Коллоидные частицы гумусовых
веществ при рН, характерных для природных вод, несут
отрицательный заряд.
Коагулянтами называются вещества, способствую-
щие образованию слипающихся хлопьев коллоидных ча-
стиц. К таким веществам относят соли поливалентных
металлов: сульфат алюминия АЬ^О^з- 18НгО, суль-
фат железа (II) FeS04-7H20, хлорид железа FeCl3 и
др. В результате гидролиза этих солей образуются прак-
тически нерастворимые в воде гидроксиды алюминия и
железа (III), являющиеся нестойкими компонентами
коллоидной системы:
Ala(S04)3 + 6HaO у 2А1(ОН)3 + 3H2S04
Вода, в которую вводят коагулянт, должна содержать
некоторую избыточную щелочность, необходимую для
нейтрализации кислоты, выделяющейся при гидролизе.
Оптимальная доза коагулянта зависит от рН среды,
солевого состава воды и температуры и, как правило,
устанавливается опытным путем для каждой данной
Таблица 4. Состав примесей органического происхождения
в воде до и после коагуляциониой очистки
Показатели
Содержание
аминокислот, мкг/л
белковоподобных ве-
ществ, мкг/л
редуцирующих Сахаров,
мкг/л
карбоновых кислот,
мкэкв/л
эфиров, мкэкв/л
сложных углеводов,
мкг/л
гуминовых кислот,
мкг/л
фульвокислот, мкг/л
Цветность, градусы
Окисляемость, мг Ог/л
р. Большая Невка
(техническая вода)
до очи-
стки
195
950
66
75
1100
, 772
3255
45
9,3
после
очистки
63
295
52
75
1037
46
1650
10
3,5
степень
стки,
%
67
70
22
0
6,3
94
50
78
64
оз. Юлемисте (вода
городского водопро-
вода)
до очн-
етки
8,5
24
215
224
65
179
7700
35
14
после
очистки
4,9
23
168
199
65
47
2600
5
5.4
степень
очи-
стки,
%
42
0
22
10
0
74
66
86
61
27
воды. Дозы коагулянтов варьируют в пределах 20—
100 мг/л сухой соли. Лучшие температурные условия
20—30 °С [27].
Коагуляционная очистка воды от основных органи-
ческих примесей характеризуется показателями, пред-
ставленными в табл. 4. Цветность воды,, как видно из таб-
лицы, снижается намного больше, чем окисляемость.
Это означает, что в воде присутствует значительное ко-
личество неокрашенных органических веществ [28].
При коагуляции из воды удаляются также нефте-
продукты [29] и детергенты [30] (исчерпывающие
сведения о коагуляционной очистке воды даны в рабо-
тах [8, 27]). В настоящее время получает развитие коа-
гуляционная очистка с помощью электрокоагуляторов,
при которой путем анодного растворения в очищаемую
воду вводят гидроксид металла. Дозу коагулянта
регулируют изменением электрических-параметров [31].
Очистка с помощью флокулянтов
В настоящее время начался выпуск органических полиэлектро*
литов — флокулянтов. Достоинством этих реагентов является to,
что они эффективны в малых дозах и в отличие от коагулянтов не
увеличивают содержание солей в обрабатываемой воде. Водораство-
римые анионные или катиотгаьте фЛбкулянты используют для освет-
ления природных вод повышенной мутности [32]. Работы по обес-
цвечиванию окрашенных вод немногочисленны и относятся к изуче-
нию взаимодействия флокулянта ВА-2 с гуминовыми кислотами, вы-
деленными из торфа.
Водорастворимые аниониты обладают положительным зарядом
макроиона и способны вызвать коагуляцию отрицательно заряжен-
ных коллоидов без добавления минеральных коагулянтов. Устаиов-
ленно [32], что водорастворимые аниониты взаимодействуя с гуму-
совыми веществами, образуют нерастворимые в воде комплексы в
виде твердой фазы, причем реакция идет между карбонильными и
фенольными группами гумусовых кислот и основными группами
флокулянта.
В работе [33] рассмотрена возможность замены коагуляцион-
ной предварительной очистки воды перед ее глубоким обессолива-
нием на обесцвечивание с помощью катионных флокулянтов, синте-
зированных на основе 2-метил-5-винилпиридииа, и флокулянтом
ВА-2, синтезированным на основе стирола и три метиламина. Кон-
центрация гумусовых веществ существенно не влияет иа процесс
хлопьеобраэования. Оптимальной следует считать среду с рН«7.
Изменение температуры от 5 до 50 °С почти не сказывается иа осаж-
дении гумусовых веществ. Экспериментально установленные опти-
мальные дозы флокулянтов: 0,6—1. мг/мг для гуминовых н 0,6—
0,7 мг/мг для фульвокислот (табл. 5),
28
Таблица 5. Оптимальные дозы флокуляита для осаждения
гумииовых и фульвокислот при их совместном присутствии в воде
Содержа-
ние кис-
лот,
мг/л*
5/10
5/25
5/25
5/15
2,5/12,5
2.5/1,5
2,5/5,0
2,5/2,5
1/25
Оптимальная доза фло-
куляита, мг/л
в экспе-
рименте
12 .
24
6
17
12
14
6
4
20
рассчитанная
по данным для
индивидуаль-
ных растроров
11,5
23,5
5,5
15,5
11,8
13,8
5.8
3,8
20,7
Содержание
кислот,
мг/л*
1/10
1/5
1/15
1.0/2.5
0,5/15
0,5/10
0,5/5,0
0,5/2,5
Оптимальная доза фло-
куляита, мг/л
в экспе-
рименте
10
6
14
3
13
8
4
3
рассчитанная
по данным для
индивидуаль-
ных растворов
8.7
4.7
12,7
2,7
12,35
8,35
4,35
2,35
* В числителе — содержание гумииовых кислот, в знаменателе — фульво-
кислот.
Исследование влияния природы солевого состава очищаемой во-
ды на эффективность флокулянтов показало, что катионы натрия
усиливают образование хлопьев, а ионы кальция — затрудняют.
Анионы, присутствующие в воде, по усилению процесса флокуляции
располагаются в ряд: H3Si04 >HC03>C1_>S04 Таким образом,
флокулянты целесообразнее использовать для вод с малой жест-
костью и преимущественно бикарбонатных.
В отличие от предварительной очистки дистилляцией обработ^
ка воды коагулянтами или флокулянтами недостаточна для после-
дующего получения высокормной обессоленной воды. Поэтому ее
нужно сочетать с сорбционной очисткой перед подачей воды на
обвссоливание ионитами. Как по-
казано в работе [33], при гакоы
сочетании способов очистки оки
сляемость снижается примерно в
4—5 раз по сравнению с исходной
(рис. 6).
Рис. 6. Окисляемость невской во
ды после ионита ИА-1:
/ — водопроводная вода без флокулян
та; 2 —то же+7 мг/л флокуляита; 3 —
техническая вода+7 мг/л флокуляита
29
с?
i
Г
0 1
С
3
_====£^^^ 2
i i i f |
' Z00 400 600 SOD ttt
(]рШденные объемы
10
Сорбционная очистка воды
Выбор сорбентов. Ассортимент сорбентов для пред-
варительной очистки воды, выпускаемых промышлен-
ностью, весьма разнообразен. Для очистки воды от ор-
ганических веществ используют активированные угли,
гелевые и макропористые аниониты и др. [34]. Акти-
вированные угли обладают замедленной кинетикой
сорбции из растворов, что требует больши-х площадей
фильтрации, плохой регенерируем остью с помощью реа-
гентов (остаточная емкость после первой регенерации
значительно меньше половины исходной), механической
непрочностью, высокой зольностью.
Аниониты, особенно макропористые, свободны от
многих перечисленных недостатков. Первичный выбор
лучших из них проводят в статических условиях при
контакте сорбентов с модельными растворами или с
данной водой в течение часа. Результаты исследования
[35] ряда отечественных и зарубежных образцов син-
тетических сорбентов представлены в табл. 6.
Таблица 6. Сорбционная способность ионитов
при времени контакта 1 ч
Ионнт,
пористость,
%
АВ-171
20
40
60
80
100
АВ-271
20
40
60
80
100
Сорбировано, мг/г
(в пересчете на
сухой ионнт)
фульво-
ки слоты
0.19
0.26
0,27
0,23
0,27
0,11
0,13
0,10
0,07
0,13
гумата Na
0,08
0,10
0,10
0,08
0,14
0,04
0,05
0,03
0,03
0,05
Ионнт,
пористость,
АВ-181
20
40
60
80
100
АВ-22
Зеролит
Асмит-259
Имак-5-40
ИА-1
Сорбировано, мг/г
(в пересчете на
сухой ионнт)
фульво-
кислоты
0.21
0.21
0,16
0,11
0,21
0,27
0,29
0,25
0,35
7,35
гумата Na
0,07
0,05
0,06
0,05
0,07
0,09
0,10
0,3
Величину сорбции вычисляют по формуле
a = (Co-Ct)V/l000g
где Со—исходная концентрация раствора, .мг/л; Ct — концентрация
ко времени /, мг/л; V—объем раствора, мл; g — навеска смолы, г.
30
После отбора лучших образцов (в данном случае
ими оказались отечественные сорбенты полимеризаци-
онного типа АВ-171 и конденсационного типа ИА-1) про-
водят кинетические исследования. Их целью является
определение характера стадии, лимитирующей процесс,
нахождение коэффициентов диффузии -и времени уста-
новления равновесия. Стадию, лимитирующую процесс,
определяют по следующему признаку: если перемеши-
вание раствора способствует ускорению сорбции, это
свидетельствует о преимущественном влиянии внешней
диффузии; прямое доказательство внутридиффузионно-
го механизма дает опыт с «прерыванием». Если после
перерыва возобновить сорбционный процесс и сорбци-
онная активность твердой фазы возрастет, можно с уве-
ренностью говорить о внутридиффузионном характере
процесса.
Сорбция гумусовых веществ. Внутридиффузионная
кинетика, по данным [25], лимитирует сорбцию гумусо-
вых веществ, т. е. сорбционную предварительную очи-
стку воды. Выражение, определяющее потерю емкости
за счет времени, необходимого для формирования фрон-
та сорбции (изотерма выпуклая), в этом случае выво-
дится из схемы, предложенной в работе [36]:
r2u-2,303
tv= ^(Кз-цСе^ -ф)-18Ф + (Кэ-1)[1в(1-ф) +0,434]}
где и — скорость пропускания раствора (в линейных или объемных
единицах); ф=С/С0, т. е. заданная степень очистки или отношение
концентрации сорбируемого вещества в очищенном и в исходном
растворе; D — коэффициент диффузии сорбируемого вещества в зер-
не сорбента (определяется в независимом опыте [38]); г — радиус
частицы сорбента; Кэ — эффективный коэффициент сорбции, опре-
деляемый из уравнения, описывающего равновесие в системе сор-
бент — раствор.
Анализ этого уравнения показывает, что потеря за-
щитного действия, выраженная в линейных или объем-
ных единицах сорбента, тем больше (а рабочий период
колонки тем меньше), чем больше скорость потока, ра-
диус зерен сорбента и заданная глубина очистки.
Из кинетических опытов определяют коэффициенты
диффузии и время установления равновесия в системах
ионит—раствор и строят изотермы сорбции. Изотермы
сорбции гуминовых и фульвокислот анионитами ИА-1 и
31
АВ-171, по данным [25; 37, с. 72—75], описываются
уравнением Ленгмюра
а = KiKjCp/C — К^р)
где а —максимальная сорбция; Ср —концентрация вещества в рав-
новесном состоянии системы; Ki, Кг — коэффициенты, которые зави-
сят от условий сорбции, таких, как размер зериа, рН среды, приро-
да сорбентов и способы их подготовки (их находят по табл. 7).
Та-блица 7. Коэффициенты Ki и Кг
при сорбции гумусовых веществ иоиитами
Система, противоиоиы
ИА-1+гумат Na
хлор
хлор
хлор
хлор
гидроксил
оксалат
ИА-1+гумат Na +
+2 мэкв/л NaCl
хлор
АВ-171+гумат Na
гидроксил
хлор
ИА-1 +фульвокислота
хлор
хлор
хлор
хлор
гидроксил
оксалат
ИА-1 -f- фульвокислота -f-
+5 мэкв/л СаС12
хлор
АВ-171 +ф ульвокислота
хлор
Радиус
зерна,
мкм
63
63
63
37
63
63
63
37
37
37
37
37
63
63
63
37
37
рН
среды
3,2
6,2
п,о
6,2
6,2
6,2
6,2
6,2
6,2
3,0
6,0
10,0
6,0
Л и ие й i
Вогнут
6,0
6,0
Кь
л/мг
1,01
0,75
0,79
0,68
0,37
0,47
1,02
0,55
1,19
0,64
0,36
0,56
0,27
1ЭЯ И 3 ОТ
ая и э от
0,69
0,09
К»,
мг/г
1,20-
1,21
0,88
0,85
0,82'
1,75
0,91
0,79
0,73
7,50
8,00
7,30
9,80
ер м а
е р м а
8,30
6,25
Для расчета динамики сорбции находят Кэ, преобра-
зовывая последнее уравнение:
а/а0 = Кэ-Ср/С0/[1 + (К, - 1)СР/С0]
где Кэ-1 + КлСо
В работах [25, 38] сопоставлены результаты экспе-
риментального определения сорбционнои емкости до
32
проскока гумусовых веществ с сорбционной ёмкостью,
рассчитанной по уравнениям; расхождения не превы-
шают 10—15%. Изменяя скорость потока, глубину очи-
стки, радиус зерна сорбента и сам сорбент (через зна-
чение Кэ), можно, определить потерю времени защит-
ного действия колонны для каждого варианта. В то же
время следует помнить, что это возлагает очень боль-
шую ответственность на точность определения коэффи-
циентов диффузии и равновесия в системах сорбент—
раствор, дающих исходные данные для расчета динами-
ки сорбции.
Итак, по. данным [26, 37], наилучшим сорбентом для
предварительной очистки воды оказался макропористый
анионит ИА-1, работающий в хлор-форме, при рН очи-
щаемого раствора, равном 3,0—3*5, Что касается раз-
мера зерен, его выбор ограничен характером дренаж-
ной системы и желательной скоростью пропускания во-
ды.
В Природных водах присутствуют гуминовые и .фуль-
вокислоты. Первые сорбируются хуже (см. значения Кг,
табл. 7), и их «проскок» практически лимитирует про-
цесс очистки. Поэтому величину т следует рассчитывать
по содержанию в очищаемой воде гуминовых кислот.
Если после коагуляционной очистки они отсутствуют,
рабочий период сорбционной колонны рассчитывают по
содержанию в воде фульвокислот, используя для этого
соответствующие значения Кэ и D.
То обстоятельство, что сорбция слабодиссоциирую-
щих гуминовой и фульвокислот идет лучше в кислой
среде и на анионите в солевой форме, указывает на не-
ионообмеыный механизм поглощения этих веществ и
Подсказывает экономинески и технологически выгодную
схему предварительной очистки воды [39]. Сорбцион-
ную колонну с ионитом ИА-1 следует устанавливать по-
сле катионита в Н-форме и следующего за ним декар-
бонизатора. Это освобождает от необходимости подкис-
лять воду, так как она подкисляется самопроизвольно
при катионировании. Таким образом, сорбционная ко-
лонна становится составной частью обессоливающей
установки. Как показал опыт промышленной эксплуата-
ции [40], эффективность сорбционной предварительной
очистки составляет 69—70^,. При совмещении коагу-
ляционной очистки с сорбционной вода на 80—85% ос-
33
Ёобождается от органических примесей. Дальнейшая,
более глубокая очистка воды от органических примесей
проводится на ионитах обессоливающей части уста-
новки.
Извлечение других органических веществ. Поверхно-
стные и артезианские воды содержат органические ве-
щества, относящиеся к различным классам соединений.
Установлено [41], что такие вещества, как сахара, бел-
ковоподобные вещества, аминокислоты проходят через
систему ионитовых колонн и попадают в глубокообессо-
ленную воду. Причем их количество зависит от состава
исходной воды и значительно превышает содержание
минеральных примесей. Максимальное извлечение этих
веществ из воды в ходе ее предварительной очистки
сорбционньщ Методом является необходимым.
В работе [42] сопоставлена способность некоторых
активированных углей и макропористых анионитов сор-
бировать различные аналитически определяемые орга-
нические соединения, растворенные в природных водах.
Для этого через слой сорбента высотой 60 см со ско-
ростью 7 м/ч пропускали по 100 объемов речных вод
после их Н-катионйрования, создающего наиболее бла-
гоприятные условия для сорбции (табл. 8).
Снижение содержания органических веществ различ-
ных классов из воды после Н-катионирования и сорб-
ции через различные сорбенты в процентах от исходно-
го содержания показано ниже:
Аминокислоты
Белковоподобиые
вещества
Гумииовые кисло-
ты . .
Карбоновые кис-
лоты . ,
Редуцирующие са-
хара ......
Сахара в гидро-
лиэатах
БАУ
40
30
86
18
58
66
КАД
62
62
80
27
50
31
ИА-1
25
72
88
17
43
41
СКТ-ВТУ-2
58
76
60,3
41
25
АВ-171
54
87
49
50
30
Не определяли
Как видно, лучше всего всеми сорбентами, извлека-
ются гуминовые и фульвокислоты. Известно, однако, что
активированные угли сорбируют гуминовые кислоты не-
обратимо [43, с. 147—154], а термическая регенерация
34
Таблица 8. Состав речной воды, профильтроданной через
различные сорбенты
Показатели
Содержание, мкг/л
аминокислот (в пересчете на
азот)
белковоподобных веществ (в пе-
ресчете на азот)
гуминовых кислот
фульвокислот
карбоновых кислот (мкэкв/л)
редуцирующих Сахаров
Сахаров в гидролизатах
Окисляемость, мг Ог/л
Исходная
вода
39
295
360
9680
23
632
1410
7,0
Вода после сорбента
БАУ
24
205
50
2900
11
265
477
3,07
КАД
15
114
70
3900
16
317
975
3,55
ИА-1
29
82
46
2000
9
360
835
2,64
Исходная
вода
25
178
500
16450
29
646
Не
13,8
Вода после
сорбента
СКТ-ВТУ-2 АВ-171
10
44
185
9140
17
483
12
25
256
2933
15
449
определяли
4,1
2.9
не восстанавливает начальную емкость углей. Из двух
сопоставленных ионитов большей емкостью по гумино-
вым кислотам обладает смола ИА-1.
Фульвокислоты извлекаются лучше смолами, чем
углями, причем емкости ионообменников по фульвокис-
лотам практически одинаковы. Но и в этом случае при-
менение ионита ИА-1 целесообразнее, так как он реге-
нерируется легче и с меньшими расходами реагентов.
Второй очень значительной группой соединений, ко-
торые, попадая в глубокообессоленную воду, могут вли-
ять на ее удельное электрическое сопротивление, явля-
ются карбоновые кислоты. Для их сорбции наиболее
пригодны уголь СКТ-ВТУ-2 и анионит АВ-171. Из этих
двух сорбентов предпочтение, безусловно, следует от-
дать иониту, так как его емкость может быть восстанов-
лена химическими реагентами. Для удаления простых и
сложных аминокислот также следует применять анио-
нит АВ-171.
Простые и сложные сахара, не влияющие на удель-
ное электрическое сопротивление, обессоленной воды, в
значительной степени сорбируются только углем БАУ.
Поэтому при выборе сорбентов для очистки воды сле-
дует руководствоваться не только величиной их емко-
сти и возможностью ее восстановления, но и необходи-
мостью удаления из воды того или иного соединения.
Для ориентировочной оценки распределения органических ве-
ществ в слоях указанных сорбентов были сняты соответствующие
¥1 80 120 160 200
Приведенные объемы
а
UO 80 120 №0
Приведенные объемы
б
200
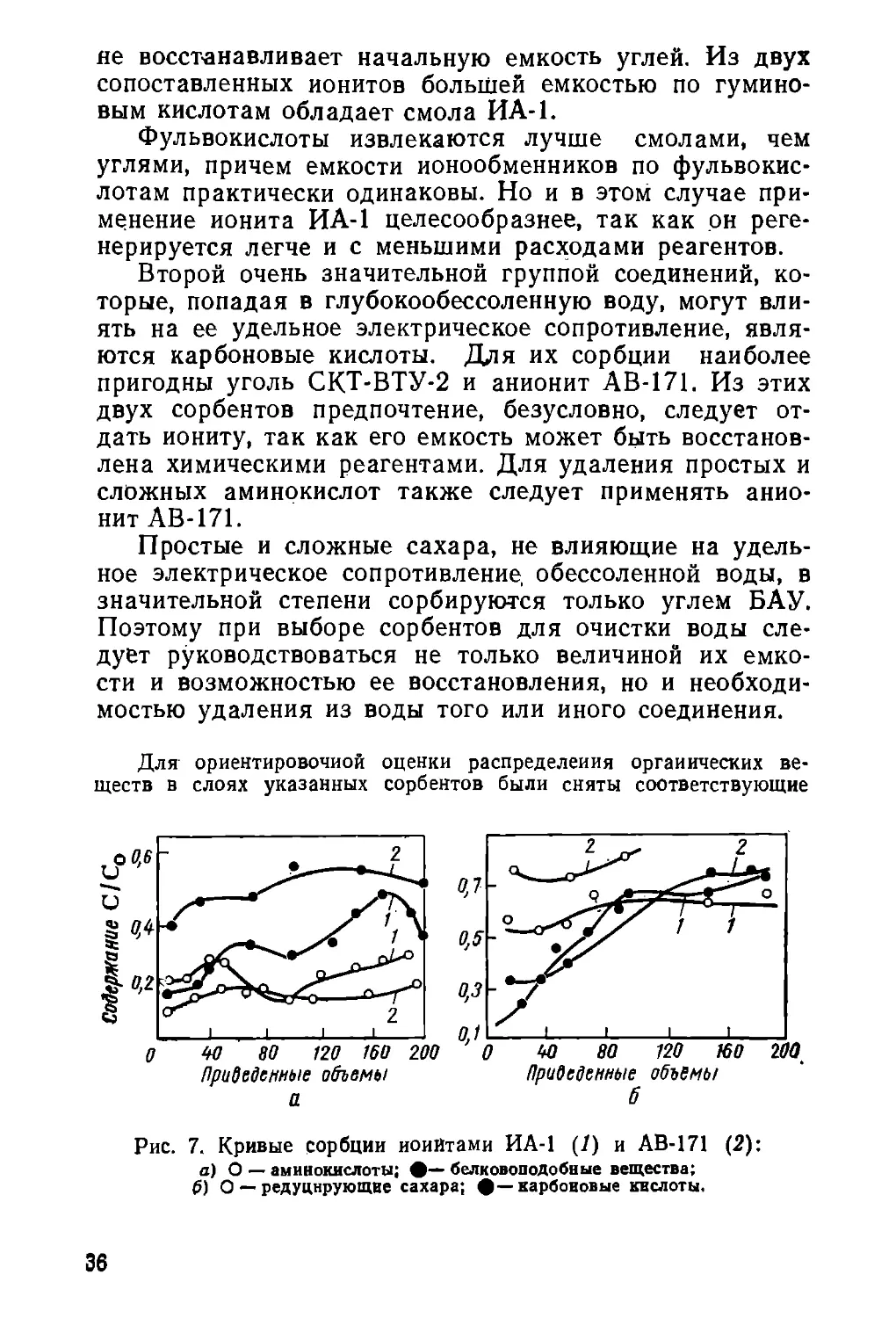
Рис. 7. Кривые сорбции иоийтами ИА-1 (1) и АВ-171 (2):
а) О — аминокислоты; #— белковоподобные вещества;
0) О — редуцирующие сахара; #—карбоновые кислоты.
36
Таблица 9. Классификация вод по окисляемости
и способам очистки перед ионообменным обессоливаиием
Окнсляе-
мость*,
мг Ог/л
<2"
2—5
5—10
10
УдеЛьное электрическое сопротивление обессоленной воды
0,3 МОм-см <1 МОм-см
>1 МОм.см
Без предварительной очистки
Без очистки Дистилляция или
Без очистки
Коагуляция
Коагуляция или
сорбция
Коагуляция
сорбция
Дистилляция или
коагуляция+
+сорбция
То же
• Окнсляемость воды рек европейской территории СССР дана в рабо-
те [45].
выходные кривые. Загрузка ионитов в хлор-форме равнялась 1 л
при высоте слоя 60 см; скорость протекания раствора 10 м/ч.
Фильтрат для анализа отбирали непрерывно фракциями по 10 л
каждая. Продолжительность рабочего периода колонны выбрана
равной 200 приведенным объемам; рН пропускаемой воды («3)
создавали предварительным катионироваиием исходной воды. Вы-
ходные кривые представлены на, рис. 7, а состав исходной воды —
в табл. 8. Применяя различные сорбенты и их сочетания, можно
удалить значительную часть органических веществ, растворенных в
воде. Однако, получить воду, полностью освобожденную от органи-
ческих веществ с помощью перечисленного набора средств, вряд ли
возможно.
Содержание и соотношение таких органических не-
электролитов, как сахара, белки, эфиры и т. п., изменя-
ются не только от одной географической зоны к другой,
но и в пределах одного региона. Поэтому нельзя ожи-
дать, что при одинаковых технологических схемах и ре-
жимах деминерализации обессоленные воды будут сов-
падать по количественному и качественному содержа-
нию органических веществ. В связи с этим следует от-
носиться с осторожностью к попыткам нормирования
сухого остатка высокоомной воды без учета состава ис-
ходной. В зависимости от загрязненности исходной во-
ды, выраженной через перманганатную окнсляемость,
рекомендуемые {44] способы предварительной очистки
приведены в табл. 9.
Удаление железа (обезжелезивание). Железистыми
называют воды, содержащие более 1 мг/л железа. Ка-
тионит сорбирует ионы двухвалентного железа пример-
37
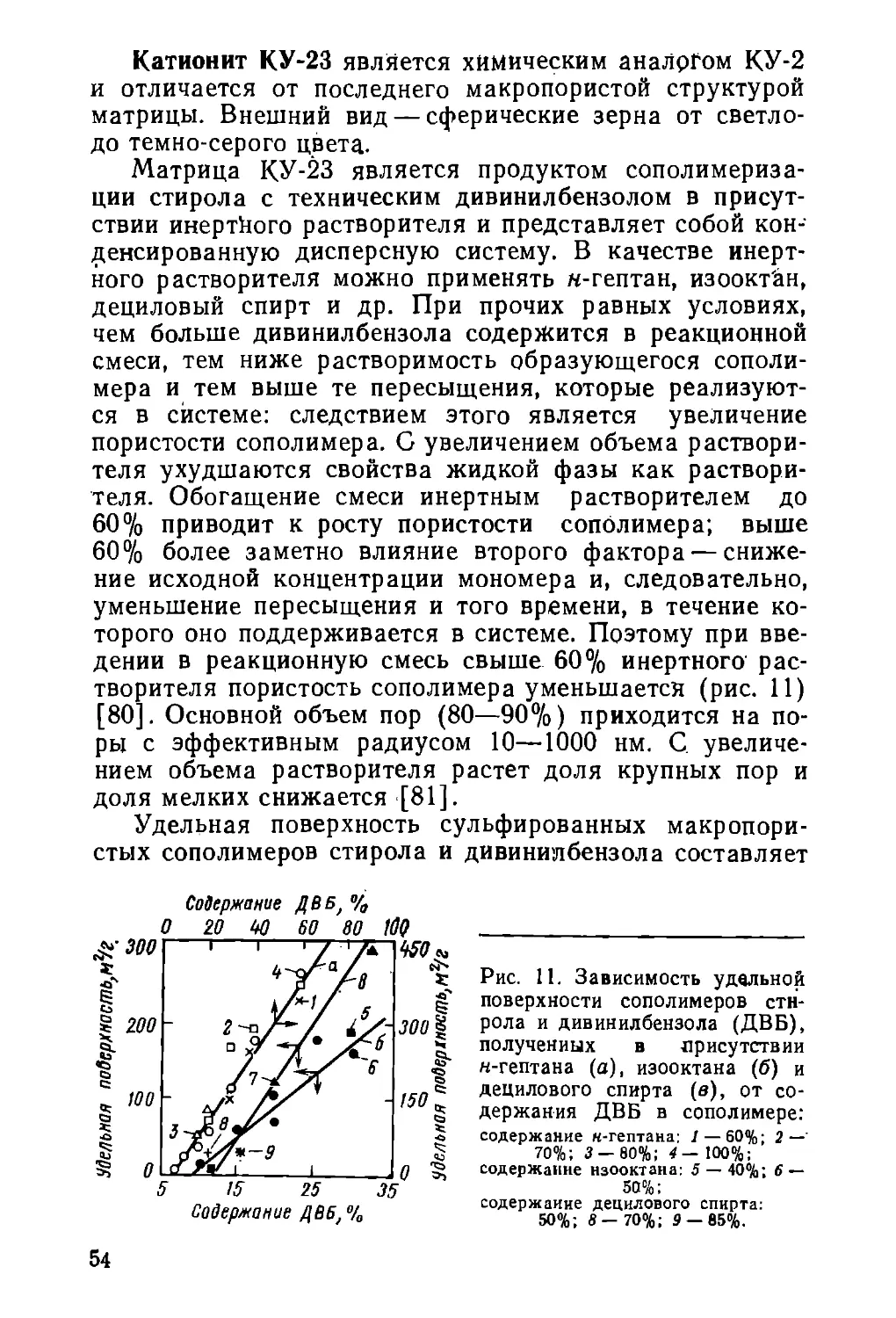
но так же, как и ионы кальция, а ионы трехвалентного
железа — еще более эффективно [46]. Можно было ожи-
дать, что при ионообменном обессоливании вода будет
одновременно и «обезжелезйваться». Этому процессу
мешают, однако, некоторые физико-химические особен-
ности соединении железа, присутствующих в природных
водах.
В водах, содержащих гумусовые вещества (открытые
источники), железо образует прочные комплексные со-
единения типа
RCOO-^Fe—OOCR
где R — анион гуминовой или фульвокислоты. В откры-
тых водоемах, хорошо аэрируемых, значительная часть
железа находится в виде соединений Fe(III) разной
степени гидролизованности. Произведение растворимо-
сти Fe(OH)3 равно 3,2-Ю-38, поэтому, даже сильнокис-
лотные катиониты не в состоянии сорбировать или рас-
творять соединения такого типа.
При коагуляционной и последующей сорбционной
очистках вода освобождается не только от окрашенных
(главным образом, гумусовых соединений), но и от
коллоидных и комплексных форм железа. Таким обра-
зом, очистка от органических веществ является одно-
временно актом обезжелезивания воды.
Предприятиям, потребляющим особо чистую обессо-
ленную воду, рекомендуется [1,3] всюду (где возмож-
но) получать ее из подземных вод, свободных, как пра-
вило, от органических загрязнений. Известно [47], что
более 25% всех водопроводов на территории РСФСР
получают подземную воду с содержанием железа от 1
до 5 мг/л.
В подземных водах, лишенных кислорода, железо
большей частью находится в форме раствора бикарбо-
ната Ре(НСОз)г; частично гидролизованного. Если бы
это вещество поступало на катионит в неокисленном и
негидролизованном виде или не окислялось бы в самом
катионитовом фильтре, можно было бы ожидать прак-
тически полного обмена ионов железа на ионы водоро-
да. Однако наряду с реакцией ионного обмена, скорость
которой определяется диффузионными процессами, идут
реакции гидролиза солей железа, окисления и перехода
в слабодиссоциирующие и практически нерастворимые
соединения, способные к образованию коллоидов. Сово-
38
купность таких процессов приводит к тому, что вода,
содержащая, например, в равновесном состоянии
0,16 мг/л железа в ионной форме, может характеризо-
ваться общим содержанием железа на уровне 2 мг/л
[47]. Катионит же поглотит только ионную форму же-
леза и растворит с поглощением часть наименее стой-
ких "продуктов гидролиза.
Суммарно уравнение реакции превращения двухва-
лентного железа в трехвалентное и последующего гид-
ролиза записывается в виде
4Fe2+ -f 02 -f 10Н2О *- 4Fe(OH)3 + 8H+
Выделение ионов водорода при работе катионита
могло бы сдерживать реакцию и даже сдвигать ее вле-
во, тем более, что количество ионов водорода в Н-ка-
тионированной воде определяется общим содержанием
солей, которое практически на два порядка больше ко-
личества ионов железа в воде.
По мере срабатывания верхних слоев катионита два
обстоятельства будут способствовать сдвигу реакции
вправо: наличие в слое ионов Fe(II), каталитически ус-
коряющих их превращение в ионы Fe(III), и частичное
поглощение катионитом ионов водорода, обменивающих-
ся на ионы натрия и кальция, которыми заполнен отра-
ботанный слой смолы. Образующиеся в этих условиях
гидроксид Fe(III) и другие продукты гидролиза уже
не будут участвовать в ионном обмене и транзитом прой-
дут в Н-катионированную воду, так же, как и та часть
подобных соединений железа, которая присутствовала в
исходной воде.
Количественное описание этих процессов пока за-
труднительно.В то же время присутствие железа в не-
ионной форме в Н-катионированной и обессоленной во-
дах удовлетворительно объясняется предложенной кон-
цепцией и свидетельствует о необходимости удаления
железа из железистых подземных вод перед их подачей
на обессоливающую ионообменную установку. Приведен-
ное выше уравнение подсказывает основные пути уда-
ления железа из воды. Это --аэрация (насыщение кис-
лородом) и подщелачивание (связывание ионов водо-
рода). В бикарбонатных водах последнее проходит
самопроизвольно с выделением стехиометрическогоколи-
39
чества диоксида углерода. Аэрацию можно проводить
продувкой воздухом, разбрызгиванием воды в воздухе
или подачей озона; в качестве других окислителей мож-
но использовать активный хлор, перманганат калия.
Под действием окислителей иониты «стареют», поэтому
желательно проводить обезжелезивание безреагентным
методом.
Удалению железа из подземных вод посвящена монография
[47], в которой обобщены как теоретические, так и технологические
аспекты проблемы. Учитывая специфику получения сравнительно не-
больших объемов особо чистой обессоленной- воды для производст-
венных иужд и специфику самих производств, потребляющих такую
воду, следует остановиться на методе упрощенной аэрации с после-
дующим фильтрованием.
Над открытым фильтром через отверстия в подающих трубах
разбрызгивается вода. Толщина слоя песка в фильтре обычно не
менее 1,2 м, а размер зереи от 0,8 до 1,6 мм. Большей грязеемко-
стью отличаются фильтры с двухслойной загрузкой общей толщиной
1,2—1,5 м и толщиной верхнего слоя 0,5 м. Для нижнего слоя ис-
пользуют кварцевый песок размером зерен 0,8—1,2 мм, а для верх-
него— антрацитовую крошку размером 0,9—2,4 мм. Скорость фильт-
рования иа открытых фильтрах достигает 10 м/ч. Как правило, с
уменьшением скорости пропускания воды грязеемкость фильтров
повышается, и поэтому открытые фильтры надо рассчитывать на
скорость, ие превышающую 5—7 м/ч.
В зависимости от принятой скорости фильтрования, исходного
содержания железа в воде и других факторов, продолжительность
работы фильтров, естественно, различна. При скорости фильтрова-
ния 5—7 м/ч и исходном содержании железа в воде 3—4 мг/л цикл
работы установки 60—100 ч. После этого фильтры промывают про-
тивотоком интенсивностью 15—18 л/(с-м2) в Течение 10^15 мин.
Объем промывных вод для
фильтров иа участке обезжеле-
зивания воды достигает 4% от
объема очищенной воды. Когда
работа обезжелезивающей ус-
тановки данного типа хорошо
отлажена, содержание железа
в фильтрате составляет 0,05—
0,1 мг/л.
Схема установки для уда-
ления железа методом упро-
щенной аэрации и фильтрова-
нием представлена на рис. 8.
Рис. 8. Схема аэрации воды:
/ — подающая труба; 2 — фильт-
рующая загрузка; 3 — дренаж.
В отличие от дистиллята, содержащего до 5 мкг/л
железа, технический конденсат бывает обогащен про-
дуктами коррозии. При получении из такого конденсата
особо чистой обессоленной воды необходимо предвари-
тельное обезжелезивание. Для этого используют суль-
фоугольные фильтры [48], работающие с эффективно-
стью 25—50%, или более эффективные магнетитовые
фильтры [49], намывные целлюлозные фильтры i[50],
намывные ионитовые фильтры [51] (носящие за рубе-
жом название powdex). Предложены анионитовые
фильтры [52], где удаление железа основано на коагу-
лирующем действии анионита в ОН-форме. Намывные
ионитовые фильтры работают с эффективностью, приб-
лижающейся к 100% за счет практически мгновенной
кинетики процесса. Здесь наряду с сорбцией ионов из
жидкой фазы происходит механическое задержание .ча-
стиц твердой фазы, коагуляция и образование комплек-
сов с анионитом-, если для намывного слоя берут смесь
катиоНо- и анионообменников.
Опыты {26, с. 176—179] показали пригодность на-
мывных ионитовых фильтров для извлечения из воды
гумусовых веществ, комплексующих железо и другие
металлы.
Острота проблемы обезжелезивания как этапа пред-
варительной очистки воды особенно выявилась в связи
с необходимостью использования ультрачистой воды
для производств микроэлектроники. Для финишной
очистки воды перед ее подачей на отмывку деталей
приборов используют микрофильтр с порами 0,2 мкм,
задерживающий микробные тела. Если из обессоленной
воды недостаточно удалено железо на предшествующих
этапах, то микрофильтры быстро забиваются.
Умягчение воды. При частичном обессоливании воды
электродиализным методом или с помощью обратного
осмоса в ряде случаев необходимо предварительно умяг-
чить воду, т. е. освободить ее от катионов кальция и
магния, способных при соответствующем анионном со-
ставе воды образовывать осадки на ионитных мембра-
нах или на мембранах (волокнах), используемых в ап-
паратах обратного осмоса.
Умягчение как этап предварительной очистки при
обессоливании относительно небольших масс воды це-
лесообразно проводить ионообменным, способом, суть
41
которого характеризуется реакциями (R — органическая
часть катионита):
2RNa + СаС12 - R2Ca + 2NaCl
2RNa + Ca(HC08)2 >- R2Ca + 2NaHCOe
Регенерация катионита, т. е. перевод его в натриевую
форму, проводится пропусканием через отработавший
слой сорбента 6—10%-ного раствора хлориДа натрия и
последующей отмывкой водой
R2Ga + 2NaCl »- 2RNa + CaCl2
По причинам, которые будут рассмотрены ниже, рас-
ход поваренной соли для регенерации превышает сте-
хиометрический в 2,5—5 раз. При работе с водой, име-
ющей высокое содержание солей, для умягчения целе-
сообразно использовать сильнокислотный катионит типа
КУ-2. При этом по сравнению с такими катионнообмен-
никами, как сульфоуголь или КУ-1, довольно значитель-
но сокращается расход соли на регенерацию [53]. Рас-
чет процесса умягчения воды подробно изложен в ра-
боте [54].
ГЛАВА
ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА ИОНИТОВ
Ионитами называют' вещества, способные в эк-
вивалентных количествах обменивать свои ионы на
ионы, содержащиеся в растворе. В зависимости от зна-
ка заряда обменивающихся ионов иониты делят на ка-
тиониты, аниониты и амфолиты. Катиониты обменива-
ются с раствором катионами, аниониты — анионами, а
амфолиты в зависимости от условий могут обменивать-
ся либо катионами, либо анионами. Реакция ионного
обмена между ионитом и раствором возможна потому,
что ионы в ионите находятся в диссоциированном состо-
янии.
Ионы, способные вступать в реакцию ионного обме-
на, получили название противоионов. Заряд противо-
ионов компенсируется противоположно заряженными
фиксированными ионами, которые химически связаны с
трехмерной матрицей или каркасом ионита.
В основу классификации- ионитов могут быть поло-
жены разные признаки. По степени диссоциации иони-
ты делят на сильноэлектролитные и слабоэлектролит-
ные. Сильноэлектролитные иониты диссоциированы
практически нацело, слабоэлектролитные — в небольшой
степени. Промежуточное положение между сильно- и
слабоэлектролитными ионитами занимают среднеэле&т-
ролитные.
Иониты могут быть природные (некоторые пески, гли-
нистые минералы, почвы) и синтетические (например,
синтетические смолы). По методу получений синтетиче-
ские иониты делят на полимериэационные и поликонден-
сационные.
Иониты могут иметь гелевую, изопористую или мак-
ропористую структуру. В гелевых и изопористых иони-
тах отсутствуют реальные поры. Эти иониты гомофазны,
в них нельзя выделить фазу ионита и фазу раствора.
2
43
Однако плотность заряда фиксированных ионов в этих
ионитах распределена неравномерно. Гелевые иониты
характеризуются непрерывным и нерегулярным измене-
нием плотности заряда фиксированных ионов в массе
зерна ионита. Условно в каждом зерне можно выделить
множество гелевых участков, в которых сосредоточены
все фиксированные ионы ионита, и межгелевые проме-
жутки, не содержащие фиксированных ионов. Различие
между гелевыми и изопористыми ионитами состоит, во-
первых, в различном распределении плотности фиксиро-
ванного заряда в гелевых участках: в изопористых ионитах
заряды распределены равномерно, а в гелевых —нерав-
номерно. Во-вторых, доля межгелевых промежутков в
изопористых ионитах примерно вдвое больше, чем в ге-
левых; например, процент межгелевых промежутков в
изопористых анионитах зеролит и де-асид и в гелевом
анионите АВ-17 [61] равен:
„ По данным измерения
электропровода- сорбции
мости
Зеролит FF-IP-2 25 11
Де-асид-3 ... 20 12
Зеролит FF-IP-7 24 11
АВ-17-8 16 6
Равномерное распределение плотности заряда фик-
сированных ионов и большая доля межгелевых проме-
жутков объясняют стойкость изопористых ионитов к от-
равлению органическими веществами.
Макропористые смолы содержат в своей структуре
реальные поры, которые в сухом состоянии заполнены
воздухом. Прилагая соответствующее давление, эти по-
ры можно заполнить ртутью и измерить таким образом
долю пор и их распределение по размерам.
Сведения о промышленных образцах ионитов, вы-
пускаемых в СССР, США, Англии, Франции, ФРГ, ГДР,
Швейцарии, Японии, Венгрии, Чехословакии и некото-
рых других странах собраны в справочнике [34], в кото-
ром отражена продукция около 200 фирм. Методы ис-
следования* свойств ионообменных материалов описаны
в монографии [53].
* Подготовка ионитов к испытаниям и методы их испытаний
стандартизованы в ГОСТ 10896—72, определение емкости в динами-
44
Отечественные ионообменные смолы напускаются четырьмя за-
водами: химическим комбинатом г. Черкассы (К.У-2-8, КУ-2-8чС,
КУ-2-20, КУ-2-23, АВ-29-12ГТ, АН-21, АН-22-8, АН-221), заводом
«Карболит» г. Кемерово (КУ-2-8, КБ-2, КБ-2-4, КБ-2-7П, КБ-2-10П,
КБ-4, КБ-4П-2), Новокемеровским химическим комбинатом г. Ке-
мерово (КУ-2-8чС, АВ-17-8, АВ-17-8чС, АН-18-8, АН-18П) и заво-
дом пластических масс г. Нижний Тагил (КУ-1, АН-1, АВ-16Г,
ЭДЭ-10П, АН-2ФН, АН-31). Зарубежными аналогами отечественных
ионитов являются:
Отечественные ионкты Зарубежные аналоги
КУ-2-8 Амберлит IR-120, дауэкс-50, диайон
SK-1A, зеролит 225, имак С-12, ле-
ватит S-100, вофдтлт KRS-200, ва-
рион KS, дуолайтС-2(5, алласьон
CS, кастель С-ЗООР, катекс 5
КУ-23 Леватит §Р-120, кастель С-300Р ам-
берлит 200, амберлит 15А, варион
KSM
КБ-2, КБ-2-4 Варион KS, вофатит СР, дуолайт
СС-3, йоиак С-270, пермутит Н-70,
пермутит С
КБ-2-7П, КБ-2-10П Варион KSM, дуолайт С-464, имак
Z-5
КБ-4, КБ-4П-2 Амберлит IRC-50, варион ,СР, зеро-
лит 226, цеокарб 226
АВ-17-8 Амберлит IRA-400, дауэкс-1, зеролит
FF, дуолит A-101D, кастель А-500,
диайон SA-10A, вофатит SBW, ле-
ватит М-500, варион АТ-6"6*0
АВ-29-12П Дуолайт А-162, варион AMD, диайон
РА-404, леватит МР-600, амберлит
А-29, амберлит IRA-910, релит 2AS
АН-22-8 Варион AED
КУ-1 Амберлит IRA-100, йонайк С-200, во-
фатит К
ЭДЭ-10П Дуолайт А-30, кастель А-100, вофа-
тит L-150, вофатит L-160, вофатит
L-165
АН-2ФН Амберлит IR-4B
ческих условиях — в ГОСТ 10895—64, определение обменной емкости
в статических условиях — в ГОСТ 10897—64, определение, химиче-
ской стойкости — в ГОСТ 10899—64, методы физико-химических ис-
пытаний — в ГОСТ 10898—64, определение осмотической стабиль-
ности— в ГОСТ 17338—71. Свойства выпускаемых в СССР катио-
нитов стандартизованы ГОСТ 20298—74, анионитов — ГОСТ
20301—74.
45
ПОЛИМЕРИЭАЦИОННЫЕ ГРАНУЛИРОВАННЫЕ
ИОНИТЫ
Катиониты
Сильнокислотные катиониты. Катионит КУ-2-8 яв-
ляется самым распространенным отечественным катио-
нитом. Это — гелевый ионит, содержащий один вид фик-
сированных ионов — сульфогруппы. Катионит представ-
ляет собой сферические зерна от желтого до коричнево-
го цвета.
Получают КУ-2 сульфированием гранулированного
сополимера стирола и дивинилбензола. В техническом
дивинилбензоле содержится до 50% м- и л-изомеров ди-
винилбензола, 40% м- и я-изомеров этилстирола, 7%
диэтилбензола и 3% нафталина [56]. Поэтому в катио-
ните КУ-2 содержатся не только звенья стирола и ди-
винилбензола, но и этилстирола [57]:
-сн-сн2—
SO,H
-сн-сн2
-сн-сн2—
С2Нб
При сополимеризации стирола и дивинилбензола об-
разуются макромолекулы в виде спиралей с периодом
идентичности 0,67 нм и тремя звеньями на виток (спира-
ли типа 3i). Элементарным молекулярным образовани-
ем является сульфогруппа, присоединенная к бензольно-
му ядру. Расстояние между соседними сульфогруппами
составляет 0,67 нм. Вследствие малого размера моле-
кул кросс-агента происходит сшивание не параллельных
спиралей полимера, а спиралей, расположенных под раз-
личными пространственными углами, причем вид спи-
рали в местах сшивок изменяется и в ионите появляют-
ся полости (рис. 9). Внутренняя сторона полости гидро-
фобна, а внешняя — гидрофильна. Водородные связи в
обезвоженном катионите связывают сульфогруппы толь-
ко соседних цепочек. Рассмотренный структурный по-
рядок распространяется на области размером около
1 нм. Наиболее вероятно присоединение сульфогруппы
46
в п- и ж-положении, поскольку о-положение стерически
невыгодно. При набухании ионита его внутримолеку-
лярная структура практически не меняемся. Увеличение
объема происходит за счет распрямления и раздвиже-
ния полимерных цепей [58, с. 9—21, 22—28]. Основные
физико-химические свойства катионита КУ-2 приведены
в Приложении, табл. 1.
Емкость ионита КУ-2, а также других ионообменных
смол, по данным [59], меняется в зависимости от рН
раствора следующим образом (в мэкв/г):
Ионит рН=3 рН=5 рН=7 рН-13
КУ-2 4,70 4,75 4,75 5,02
АВ-17 4,30 3,70 3,30 —
КУ-1 1,90 2,25 2,28 5,61
КБ-4 0,16 1,08 4,30 8,55
Слабая зависимость емкости ионита от рН равновес-
ного раствора свидетельствует о высокой степени моно-
функциональности этого ионита. Небольшое увеличение
емкости при высоких рН вызвано, по всей вероятности,
диссоциацией фенольных групп; наличие последних обу-
словлено нротеканием окислительных процессов, сопро-
вождающих синтез КУ-2.
Анализ плотности различных ионных форм катиони-
та КУ-2 (см. Приложение, табл. 2) показывает, что плот-
ность набухшего ионита всегда больше единицы и мень-
ше плотности сухого ионита. По мере увеличения экви-
валентной массы противоиона плотность ионита увели-
Рис. 9. Схема сшивания двух параллельных цепочек полистирола
дивинилбензолом (# — атомы углерода в алифатической цепи,
О — атомы углерода в бензольном кольце).
47
чивается (причем ату зависимость можно описать урав-
нением первого порядка и для сухих и для набухших
ионитов). Изменение размера гранул ионита практиче-
ски не влияет на его емкость, а плотность сухих и на-
бухших гетероионных форм катионита КУ-2 линейно за-
висит от его ионного состава [60].
С ростом содержания- связующего агента емкость су-
хих ионитов уменьшается. Масса каркаса ионита, содер-
жащего 1 мэкв сульфогрупп (М), может быть рассчи-
тана по уравнению "{64]:
М = 0,210* + 0,21йу + 0,184(1— х — у)
где х н у — доли бензольных колец, вошедших в каркас за счет
дивинилбензола и этилстирола соответственно; 0,210, 0,212'и 0,184 —
массы структурных единиц каркаса ионита, образованных соответ-
ственно дивинилбензолом, этилстиролом и стиролом, которые содер-
жат 1 ммоль бензольных колец, г.
Одновременно с уменьшением емкости при увеличе-
нии сшивки растет жесткость матрицы ионита; это при-
водит к уменьшению его набухания (см. Приложение,
табл. 3). Набухание уменьшается также при увеличении
ионного радиуса щелочных и щелочноземельных метал-
лов, так как при этом уменьшается радиус гидратирован-
ных ионов. Взаимодействие ионов указанных металлов
с водой в катионите КУ-2 носит электростатический ха-
рактер. Катионы металлов с заполненными внешними
электронными d-орбиталями способны образовывать с
молекулами воды комплексы вследствие контактного
взаимодействия электронных d-орбиталей ионов и непо-
деленных пар электронов молекул воды. Числа гидрата-
ции ионов щелочных металлов в катионите КУ-2 обычно
не превышают трех. По данным различных авторов, чис-
ла гидратации некоторых противоионов в катионите
КУ-2 приведены ниже:
Иои [66] [214]
2,9
2,9
2,7
2,6
3,2
6,7
н+
Li+
Na+
К+
Rb+
Cs+
NHj
Ca*+
Mg*+
Zn*+
3.4
3,9
4.6
зТэ
—
—
—
[21Б]
2.7
3,7
3,1
3,0
2,6
2,0
3.5
4,9
8,0
6.4
[216]
5.5
5,0
4,0
3,1
2,0
2,0
—
5,6
6.0
—
Влаго содержание,
skb H20
зкв ионита
12,4
12,4
10,6
9,0
8,5
8,45
П,6
9,7
11,6
12,2
48
Таблица 10. Константы обмена нонов щелочных
и щелочноземельных металлов на ион водорода [63]
Ион
Li+
Na+
К+
Rb+
Cs+
Mg2+
Ca"+
Sr*+
Ba^+
Ионный
радиус,
ни
0,078
0,098
0,133
0,140
0,165
0,078
0,106
0,127
0,148
КУ-2-2
0,9
1.5
1,6
2,1
2,5
2,1
3,2
6,3
8,2
КУ-2-4
0,7
1,4
1.7
2,1
2,9
1,8
2,0
3,9
6,4
КУ-2-12
0,7
1.4
2,2
3,0
3,9
1,4
2,4
6,0
10,8
КУ-2-16
0,7
1,5
2,2
3,4
4,5
1,0
2,0
6,1
10,5
КУ-2-20»
0,7
1,5
3,3
4,3
6,5
—
—
—
—
КУ-2'*
0,7
1,5
2,0
2,3
3,2
—
—
6,1
10,5
* Номинальное содержание дивииилбеизола 24%.
*• Промышленный катионит.
Очевидно, полная гидратная оболочка этих ионов
не образуется и одно координационное место занимает
фиксированный ион [65].
Судя по константам обмена (табл. 10), селективность
катеонита КУ-2 по отношению к металлам одной груп-
пы увеличивается по мере уменьшения радиуса гидра-
тированного иона. При одинаковом ионном радиусе се-
лективность тем выше, чем больше заряд иона. Это под-
тверждает электростатический характер взаимодейст-
вия ионов щелочных и щелочноземельных металлов с
фиксированными группами ионита. На электростатиче-
ский характер указанного взаимодействия указывает
также линейная зависимость логарифма коэффициента
распределения ионов щелочных металлов от обратной
величины расстояния наибольшего сближения фиксиро-
ванного иона и противоиона.
Наиболее существенно на кинетические свойства ка-
теонита КУ-2 влияет заряд противоиона: однозарядные
катионы более подвижны, чем двухзарядные, которые,
в свою очередь, более подвижны, чем трехзарядные.
При прочих равных условиях по мере увеличения ради-
уса гидратированных катионов эквивалентная электро-
проводимость к соответствующих ионных форм катео-
нита КУ-2 падает. Аналогичным образом влияет рост
4-360
49
константы обмена, характеризующей силу взаимодейст-
вия между фиксированным ионрм и противоионом [62]:
Протнвоион Н+ Li+ Na+ K+ Cu2+ №2+ Со2+ Mg2+ Ca2+ Ba2+ Fes+
К™, см2/(0мх
Хэкв) 69 6,0 7,3 9,8 3,2 3,3 3,0 3,7 2,4 1,1 0,76
Концентрация
иона в на-
бухшей смо-
ле, экв/л 2,4 1,9 2,4 2,3 2,6 2,0 2,1 2,0 2,1 1,5 2.1
С повышением содержания дивинилбензола в катио-
ните КУ-2 увеличиваются стерические препятствия при
движении противоионов. Поэтому подвижность противо-
ионов уменьшается при увеличении сшивки ионйта (см.
Приложение, табл. 3). Приведенные значения электро-
проводимости различных солевых форм ионитов можно
использовать для ориентировочного расчета коэффици-
ентов самодиффузии ионов D. Если подвижность иона
выразить через удельную электропроводимость ку то со-
отношение Нернста — Эйнштейна можно записать в
виде:
D = RTxt/гР* Е
где R — газовая постоянная; Г — абсолютная температура; 1—число
переноса противоиона в ионите; z—заряд иона; Е— число Фара-
дея; Е — емкость ионйта.
Полученные таким образом значения, как правило,
выше коэффициентов диффузии, измеренных независи-
мыми способами. Это объясняется тем, что при измере-
нии коэффициентов самодиффузии обменивающиеся изо-
топы движутся навстречу друг другу, и свободная вода,
поглощенная ионитом, остается непрдвижной. При изме-
рении электропроводимости все противоионы движутся
в одном направлении, вызывая электроосмотический по-
ток жидкости. Ясно, что в этом случае движение иона
тормозится в меньшей мере, чем в первом.
Теплофизические характеристики катионита КУ-2,
содержащего 50% влаги, следующие:
Коэффициент теплопроводности, Вт/(м-К) 1,6
Коэффициент температуропроводности, м/ч 1,0-Ю-3
Удельная теплоемкость, кДж/(кг-К) 0,38
При уменьшении влажности и температуры значения
указанных коэффициентов уменьшаются [67].
60
Рис. 10. Изменение осмотической
стабильности катионита КУ-2, со-
держащего 8% (1) и 16% (2) ди-
винилбензола после контакта с
электролитом хромирования (со-
став электролита: 200 г/л Сг203;
48 г/л Cr2(S04)3-6H20; 48 г/л
FeCl3-6H20; 8 г/л CuS04-5H20.
90
70
50
30
°\\
Р
•
ч?
0~
1
1
\
1
1
—а—1
-°-ЧЬ-а
П—
О
20 40
Число циклов
100
КУ-2 относится к химически
стойким ионитам. Так, при его
обработке 5 н. NaOH, 5 н. H2SO4,
1 н. HN03 и 10% Н202 емкость
уменьшается не более чем на
1—3% i[68]. Отмечается отсутствие каких-либо изменений емко-
сти и разрушения макромолекулы при регенерации КУ-2 13—26%-
ным раствором HN03 [69, 70]. В растворах, содержащих 150—
200 г/л СгОз, емкость КУ-2 после первого цикла сорбция — десорб-
ция несколько увеличивается, а затем в течение 100 циклов остается
практически постоянной. Аналогичное увеличение емкости при обра-
ботке сульфополистирольных ионитов сильными окислителями отме-
чается и другими авторами [71] и объясняется окислением метиле-
новых. мостиков с образованием альдегидных и карбоксильных
групп.
Небольшое увеличение емкости по сульфогруппам может быть
связано с вымыванием из' ионита незаполимеризовавшихся приме-
сей и разблокированием некоторых обменных центров. В пользу
этих соображений свидетельствуют полосы в области 1900—
1600 см-1 и их расширение в ИК-спектрах ионитов, обработанных
окислителями, а также более четкое проявление сульфогрупп в
спектрах работавших смол. С увеличением числа сшивок химиче-
ская стойкость КУ-2 повышается. Осмотическая стабильность КУ-2
при.контакте с окислителями постоянно уменьшается, что указывает
на изменение' механической прочности. Увеличение числа сшивок
способствует росту осмотической стабильности (рис. 10) [72].
Повышение температуры в присутствии окислителей резко сни-
жает химическую стойкость КУ-2. Например, кипячение катионита
в 40%-иом растворе HN03 в течение 2 ч разрушает его. Введение
катализаторов, ускоряющих разложение пероксида водорода, значн~
тельно ускоряет разрушение сульфополистирольных ионитов при
повышенной температуре. ДоказанЪ образование карбоксильных, ке-
тонных и спиртовых групп в метиленовых мостиках и при третич-
ных атомах углерода. Наибольшей окислительной способностью в
ряду таких окислителей, как К2Сг207> KBr03, H202) HN03,
(NH4)2SzOe, обладают смеси HN03 с КВг03 и К2Сг207 [73]. Замет-
ное влияние на химическую стойкость оказывают чистота и природа
мономеров, взятых для синтеза ионита. Скорость десульфироваиия
уменьшается в ряду смол, содержащих технический дивинилбензол
и м- и я-изомеры.
Катионит термически стоек; при его нагревании возможно про-
текание реакции термического гидролиза
RSOsH + Н20 ► RH + H2S04
4*
51
й образование сульфонов, дополнительно сшивающих цепи полй-
RSOsH + RH RS02R + H20
RSOaH + RSO3H »- RSOjR + H2S04
Последние две реакции протекают при температуре выше 150°С.
Первая реакция может протекать и при умеренном нагревании
Н-ф'ормы сульфокатиоиитов, однако скорость ее невелика. С увели-
чением числа сшивок и температуры скорость первой реакции уве-
личивается, причем ионам водорода приписывают роль катализато-
ров. Солевые формы КУ-2 значительно более стойки к нагреванию,
чем Н^форма, и хорошо переносят кратковременное кипячение в воде
(74]. Повышение температуры до 80"С в присутствии окислителей
(0,1 н. растворы НЫОз, КгСг207, HNOj+KjCrjOj, КВгОэ, КВгОэ+
+ HNO3, Н202) приводит к более значительным изменениям физи-
ко-химических характеристик ионита. Глубже протекают реакции
десульфирования, в матрицу ионита внедряются атомы кислорода,
брома и азота; в ней появляются кетонные и карбоксильные группы.
Предполагается, что атаке в первую очередь подвергаются С—Н-свя-
зи метиленовых групп и третичных атомов углерода.
Однако даже в таких жестких условиях за 50—150 ч обработки
влагосодержание ионита увеличивается не более чем на 10%, а
емкость его по сульфогруппам (судя по количеству свободной серы)
уменьшается не более чем на 13% [73]. Эти данные следует учиты-
вать при выборе агентов для обеззараживания ионообменных смол.
При ионизирующих облучениях катионита КУ-2 протекают те
же реакции, что и при термическом воздействии [75]. В присутствии
кислорода процесс деструкции ионита резко ускоряется. Например,
при дозе 1,4- 10е Дж/кг без доступа кислорода и в присутствии кис-
лорода образцы теряют соответственно 5 и 33% обменной емкости
и 1,5 и 32% массы. Вероятно, в процессе облучения растворенный
в воде кислород ускоряет разрыв цепей сульфированного полисти-
рола и поперечных связей дивинилбензола. Отмечается также, что
в присутствии кислорода «неактивная сера» в ионите не образуется,
а в продуктах деструкции присутствуют серная кислота и органиче-
ские сульфокислоты [76]. Радиационная стойкость катионита КУ-2
повышается по мере увеличения содержания дивинилбензола, судя
по относительному уменьшению емкости [75].
Доза облу-
чения,
10—10 Дж/кг
Емкость,
мэкв/г
Влаж-
ность,
%
Катионит КУ-2-4
2.0
И,1
40,2
6,94
3,53
1,15
12,7
22,3
31,8
Катионит КУ-2-8
2,0
1U
40,2
6,26
3,56
1,36
4,4
14,7
24,2
Катионит КУ-2-12
2.1
10,5
40,2
5,98
3„51
1,45
5,7
16.2
24,8
52
Доза облу- Емкость, Влаж-
чеиня, мэкв/г иость,
10-И Дж/кг %
Катионит КУ-2-16
2,0 5,69 5,8
11.1 3,48 15,6
40.2 J.64 23,4
Катионит КУ-2-24
2,0 4,99 3,9
1Г.1 2,95 12,8
40,2 1,44 22,5
Однако, если стойкость ионита оценивать по скорости десуль-
фирования, то существенного изменения заметить нельзя [75]. Вме-
сте с десульфированием ионита увеличивается трещиноватость, рас-
тет число слабоэлектролитных групп. Электропроводимость ионита
изменяется в пределах от +40 до —12% по кривой, имеющей мак-
симум при дозе 3 МДж/кг [61, с. 128]. Солевые формы ионитов не-
сколько более стабильны при облучении, чем Н-форма. Стабилизи-
рующее действие оказывают лишь определенные ионы (Fe3-1-, UOf+,
Cu2+ и др.) [77,. с. 23].
При фильтровании воды через ионит, опирающийся на дренаж,
слой деформируется. В случае ионита КУ-2-8 зависимость относи-
тельной деформации е (см/см) от давления сжатия Pi (МПа) опи-
сывается соотношением:
е = 0,01Р?'55
До 0,25—0,3 МПа деформация является упругой, выше указан-
ных значений зерна ионита начинают разрушаться [78].
Потеря давления (АР, МПа) при фильтровании воды со ско-
ростью v (м/ч) через слой ионита КУ-2 высотой Н (м), пористостью
(1—/) (%) и средним диаметром зерен d"^0,6 мм с точностью
до 10% описана формулой [79]:
/ v \ 1 22 "0.82
др = 6.1о-*^т=т) -U®
Катионит КУ-2-8чС представляет собой модифика-
цию катионита КУ-2-8 и отличается от него повышен-
ной чистотой. Получают катионит КУ-2-8чС длительной
обработкой катионита КУ-2-8 кислотой, щелочью и де-
ионизированной водой. Выпускают катионит в Н-форме
и применяют для глубокого рбессоливания воды, раз-
деления различных элементов, очистки витаминов, в пи-
щевой промышленности и медицине [57]. Физико-хими-
ческие свойства; химическая, термическая и радиацион-
ная стабильность этого катионита аналогичны соответ-
ствующим характеристикам катионита КУ-2-8 (см. При-
ложение, табл. 1).
рН фильтрата не менее 4, содержание железа не бо-
лее 0,05%, содержание хлор-иона не более 0,003 мг/г,
сорбционная емкость по стрептомицину не менее 10 мг/г.
Катионит КУ-2-20 отличается от катионита КУ-2 по-
вышенным (20%) содержанием дивинилбензола. Вы-
пускают его в Н-форме и применяют для очистки рас-
творов различных органических веществ (в том числе
антибиотиков) от минеральных ионов. Химическая и
радиационная стойкость катионита несколько выше, чем
у КУ-2.
53
Катионит КУ-23 является химическим аналогом К.У-2
и отличается от последнего макропористой структурой
матрицы. Внешний вид — сферические зерна от светло-
до темно-серого цвета.
Матрица КУ-23 является продуктом сополимериза-
ции стирола с техническим дивинилбензолом в присут-
ствии инертного растворителя и представляет собой кон-
денсированную дисперсную систему. В качестве инерт-
ного растворителя можно применять н-гептан, изоокт'ан,
дециловый спирт и др. При прочих равных условиях,
чем больше дивинилбензола содержится в реакционной
смеси, тем ниже растворимость образующегося сополи-
мера и тем выше те пересыщения, которые реализуют-
ся в системе: следствием этого является увеличение
пористости сополимера. G увеличением объема раствори-
теля ухудшаются свойства жидкой фазы как раствори-
теля. Обогащение смеси инертным растворителем до
60% приводит к росту пористости сополимера; выше
60% более заметно влияние второго фактора — сниже-
ние исходной концентрации мономера и, следовательно,
уменьшение пересыщения и того времени, в течение ко-
торого оно поддерживается в системе. Поэтому при вве-
дении в реакционную смесь свыше 60% инертного рас-
творителя пористость сополимера уменьшается (рис. 11)
[80]. Основной объем пор (80—90%) приходится на по-
ры с эффективным радиусом 10—1000 нм. С увеличе-
нием объема растворителя растет доля крупных пор и
доля мелких снижается [81].
Удельная поверхность сульфированных макропори-
стых сополимеров стирола и дивинилбензола составляет
Рис. 11. Зависимость удельной
поверхности сополимеров сти-
рола и дивинилбензола (ДВБ),
полученных в присутствии
к-гептана (а), изооктана (б) и
децилового спирта (в), от со-
держания ДВБ в сополимере:
содержание к-гептана: / — 60%; 2 —
70%; 3 — 80%; 4— 100%;
содержание нзооктана: 5 — 40%; 6 —
50%;
содержание децилового спирта:
50%; в-70%; 9 — 85%.
Содержание ДВВ^/о
О 20 W 60 80 WQ
Содержание ДВБ, %
54
Таблица 11. Удельная поверхность, суммарный объем пор
и средний эффективный радиус пор макропористых
сополимеров стирола с техническим дивинилбеизолом (ДВБ)
и сульфокатионитов на их основе
Содержание,
%
ДВБ
8
8
15
15
30
30
30
30
30
к-геп-
тана
0
100
0
70
0
30
50
60
100
Удельная
поверхность,
м2/г
суль-
фока-
тиоии-
тов
0
6,7
0
33
0
1,4
72
80
65
ИСХОД-
НЫХ
сопо-
лиме-
ров
0
32
0
58
0
1,7
123
148
167
Насыпная
плотность
сульфо-
катиони-
тов,
г/смЗ
0,75
0,63
0,78
0,48
0,70
0,64
0,55
0,43
0,31
Суммарный
объем пор,
смЗ/г
сульфо-
катиони-
тов*
0
0,19/0,38
0
0,42/0,40
0
-/0,12
0,43/0,48
0,44/0,64
0,15/2,00
исход-
ных
сопо-
лиме-
ров
0
0,32
0
0,27
0
0,9
0,45
0,91
1,69
Средний эф-
фективный
раднус пор,
им
суль-
фока-
тиони-
та
73,7
17,4
159,0
10,2
12,0
42,3
сопо-
лимера
20,0
9,3
106,0
7,3
12,3
20,3
* В числителе суммарный объем пор, определенный по сорбции паров
азота; в знаменателе — по истинной плотности образца.
около 50—80% от удельной поверхности исходных со-
полимеров. При сульфировании значительно увеличива-
ется средний эффективный радиус пор, мелкие поры
при этом исчезают. Авторы работы [82] объясняют это
капиллярной контракцией, связанной с испарением во-
ды, обладающей большим поверхностным натяжением
на границе с воздухом. Следует отметить, что суммар-
ный объем пор, приведенный в табл. 11, относится к су-
хим образцам ионита. Пористость набухших макропо-
ристых ионитов можно определить по измерению их
электропроводимости или сорбции сильных электроли-
тов [61]:
Содержание, %
дивиннлбензола 20 16 12 10 10 6
растворителя 50 50 50 50 76 50
Пористость, %
по электропроводимости 20 20 20 20 60 14
по сорбции электролитов — 36 — — 60 —
Эти методы применимы при содержании дивиннлбен-
зола не менее 8%. При более низкой сшивке ионита
55
увеличивается ошибка, связанная с сорбцией ко-ионов.
Методами измерения электропроводимости и сорбции
можно определить долю объема в ионообменных смо-
лах, в которой концентрация фиксированных ионов
очень мала (например, вследствие малой сшивки этих
участков). В таких участках концентрация ко-ионов и
противоионов практически совпадает с аналогичными
значениями для внешнего раствора. По отношению к
внешнему раствору эти участки являются «порой». При
высушивании объем «пор» сильно уменьшается, так как
они фактически представляют собой олабосшитый ионит.
Поэтому в сухом состоянии такую пору невозможно об-
наружить методом ртутной порометрии, по измерению
истинной плотности и сорбции паров азота. В набух-
шем состоянии «пора» является хорошим транспортным
каналом для миграции крупных ионов. Макропори-
стость товарных образцов КУ-23 характеризуется сле-
дующими показателями: пористость 30—60%, суммар-
ный, объем пор 0,12—1,4 см3/г, эффективный радиус пор
5—100 нм [57].
Основные физико-химические характеристики катио-
нита КУ-23 приведены в табл. 1. (см. Приложение).
По химической стойкости в растворах щелочей, кис-
лот и окислителей этот катионит не уступает КУ-2. На-
пример, после обработки 5 н. NaOH, 5 н. H2S04, 1 н.
HN03 и 10% H2O2 его емкость составляет соответствен-
но 100, 97, 94 и 92% от исходной [68]. Катионит харак-
теризуется высокой термостойкостью и может работать
в воде при температурах до ПО—120°С. Однако при
повышении температуры до 170 °С потери емкости за
6 ч составляют для КУ-23-15 и КУ-23-20 соответственно
7 и 20% [71].
Термостойкость солевых форм КУ-23 значительно
выше, чем стойкость Н-формы. По радиационной стой-
кости катионит мало отличается от КУ-2 [77, с. 24].
Макропористая структура КУ-23 обеспечивает обрати-
мость и высокую скорость обмена-крупных органических
ионов, однако снижает его обменную емкость в расчете
на единицу объема.
Слабокислотные катиониты. Катиониты КБ-2 и КБ-4-2 получа-
ют суспензионной полимеризацией метилового эфира акриловой кис-
лоты с дивинилбензолом (соответственно 2—3 и 4%) и последую-
щим омылением эфирных групп. Катионит монофункционален и
имеет гелевую структуру, характеризуемую формулой:
56
-сн2—сн—сн—сн2—
II
ноос соон
-сн—сн2—
-сн-сн2—
По внешнему виду катиониты представляют собой сферические зер-
на белого цвета. Основные физико-химические свойства катионита
КБ-2 приведены в Приложении (см. табл. 4). Благодаря близкому
расположению карбоксильных групп эти катиониты обладают по-
вышенной селективностью к поливалентным иолам. С некоторыми
поливалентными ионами они образуют комплексы, характеризуемые
следующими константами стабильности К [82]:
[U02R2] К =110" [CuR2I К = 3,8 10*
[U02Rs]- АГ= 210a [CaR2] AT = 2,7 10*
[NiR2] /С = 2,7-104
(R обозначает одновалентную матрицу иоиита). Катиониты КБ-2
и КБ-4 химически и термически стойки. Например, при кипячении
их в течение 30 мии в 5 и. NaOH, 5 и. H^SO* или в 1 и. HN03 об-
менная емкость снижается соответственно иа НО, 3 и 1% [57]. Ра-
диационная стойкость карбоксильных ионитов иа основе метакрило-
вой кислоты несколько ниже, чем сульфокатионитов иа основе сти-
рола и дивинилбензола. Значительные радиациоииохимические по-
вреждения наблюдаются уже при дозах 1 105 Дж/кг' [77, с. 25].
Катиониты КБ-2-7П и КБ-2-10П являются химическими анало-
гами катионита КБ-2 и отличаются от последнего количеством сши-
вающего агента (соответственно 7 и 10% дивинилбензола) и мак-
ропористой матрицей. По внешнему виду они представляют собой
сферические непрозрачные зерна белого цвета. Эти иониты получают
сополимеризацией метилового эфира акриловой кислоты с 7 или
10% дивинилбензола в присутствии порообразователя (30% изоок-
таиа). Полученные сополимеры подвергают омылению. Основные фи-
зико-химические свойства КБ-2-7П и КБ-2-10П приведены в При-
ложении (см. табл: 4).
При облучении моиофуикциоиальиых карбоксильных иоиитов на
основе акриловой кислоты значительные радиационные повреждения
наблюдаются при дозах более 1-10* Дж/кг. Солевые формы этих
ионитов менее стойки к действию ионизирующих излучений, чем
Н-форма [77, с. 25].
Катиониты КБ-4 и КБ-4.П-2 слабокислот.ные карбок-
сильные получают суспензионной сополимеризацией ме-
тилового эфира метакриловой кислоты с дивинилбензо-
лом (соответственно 6 и 2,5%) с последующим омыле-
нием. По внешнему виду катиониты представляют собой
сферические зерна от белого до желтого или розового
57
Цвета. Эти катеониты имеют гелевую структуру и содер-
жат только одну фиксированную группу. Предполагае-
мое строение следующее:
СН3
-СН2— С—
СООН
-сн—сн2—
—сн—сн2
Основные физико-химические свойства катионитов при-
ведены в Приложении /см. табл. 4), плотность различ-
ных солевых форм — в табл. 3. Эти катиониты отлича-
ются повышенной селективностью к поливалентным ме-
таллам; их применяют для удаления бикарбонатной
жесткости, для выравнивания рН, очистки рассолов и
т, д.
Степень набухания различных солевых форм катео-
нита КБ-4П-2 при 25 °С следующая: Н+ —76%; Na+ —
183%; Li+ —80%; К+ —80%; At3+ —81%; Са2+ — 79%
[79, с. 193—198]. К сожалению, авторы работы [79] не
приводят данных, указывающих на полноту перевода ка-
теонита КБ-4П-2 в указанные формы. Поэтому приве-
денные значения следует рассматривать как ориентиро-
вочные. Например, в работе [28, с. 13—17] дай другой
ряд солевых форм катионита КБ-4П-2, расположенных
в порядке убывания набухания:
Li+^K+>Na+>H+
Этот ряд обратен ряду избирательности сорбции ука-
занных ионов.
Для катионита КБ-4 в [83, с. 62] приведен следую-
щий ряд иабухаиия различных солевых форм:
Li+>Na+<K+<Cs+
Отмечается резкое уменьшение объема смол при пе-
реводе в Н-форму, которое может быть связано как с
образованием малодиссоциированных групп СООН, так
и с возникновением водородных связей между активны-
ми группами (типа карбоксил — карбоксильных). В сла-
бокислых средах макромолекулы К.Б-4П-2 в Н- и Си-
58
формах образуют гетерогенные глобулярные структуры,
которые при повышении рН среды до щелочного значе-
ния переходят в фибриллярную форму [81, с. 191].
Для многовалентных ионов сродство ионита КБ-4П-2
увеличивается с ростом рН и убывает в ряду:
Fe8+ > Cua+ > Th4+ > UOl+ > La»+ > Nia+ = Caa+
При обмене Na-формы этого же ионита получены
следующие коэффициенты диффузии: Си2+—(9,76—
9,92) • Ю-7; Zn2+— (5,88—5,94) • 10~7; Fe3+— (7,5—7,62).
• Ю-7 см2/с [57]. Удельная электропроводимость катио-
нита КБ-4П-2 в формах щелочных металлов уменьша-
ется в ряду
NHJ > Cs+ > К+ > Na+ > L1+
и составляет в 0,1 н. растворах при рН 10—(1—2) •
■Ю-1 См/и.
Для трехвалентных противоионов получен следую-
щий ряд:
Fe?+>Cr?+>Al!<+
В 0,1 н. растворах соответствующих солей удельная
электропроводимость указанных солевых форм состав-
ляет менее 0,5- Ю-1 См/м. Такую же электропроводи-
мость имеет Н-форма катионита. Низкая степень дис-
социации Н-формы катионита КБ-4П-2 подтверждается
также методами ЯМР [65]. Порядок расположения про-
тивоионов в обоих рядах отвечает подвижности гидра-
тированных ионов в воде [61, с. 98]. Для катионита
КБ-4 получены следующие ряды избирательности сорб-
ции
Н+ > Li+ > Na+ > К+ > Rb+ > Cs+
Саа+ > Sra+ > Ваа+ > Ra»+
и коэффициенты селективности /(Щ =1,02,,/(^=0,89 и
/Cg = 0,71.
Катиониты КБ-4 и КБ-4П-2 стойки к действию растворов кис-
лот, щелочей и окислителей. Например, при кипячении в течение
30 мин в 5 н. NaOH, в 5 н. H2S04 или 1 н. HN03 полная обменная
емкость их снижается максимум на 6,4%. При контакте с 10%-ным
растворвм Н202 в течение 48 ч емкость снижается на 1,6%. При
обработке в течение 8 сут при 18 °С 0,1—0,3 н. HN03, 0,1—0,25 н.
КВгОз, 0,1—0,25 н. HN03 в смеси с 0,1—0,5 н. К2Сг207, а также
нейтральными растворами КВгОз и (NH4)2S207 при 50 и 80 °С
свойства катионита КБ-4 меняются незначительно.
50
Радиационная стойкость монофункциональных карбоксильных
катиоиитов на основе сополимеров метакриловой кислоты ниже,
чем иа основе акриловой кислоты. Значительные радиационные по-
вреждения наблюдаются уже при дозах более ЫО5 Дж/кг. Солевые
формы менее стойки к действию ионизирующих излучений, чем
Н-форма [77, с. 25].
Катионит КБ-4-10П представляет собой моно-
функциональный карбоксильный катионит, являющийся
аналогом КБ-4 и отличающийся от него тем, что его
каркас модифицирован порообразователем. Катионит
получают суспензионной сополимеризацией метилового
эфира метакриловой кислоты с 10% динивилбензола в
присутствии 30% изооктана — порообразователя. Основ-
ные физико-химические свойства катионита приведены
в Приложении, табл. 4. Он применяется в водоподго-
товке для очистки воды в гальванических цехах, для
деионизации воды, обогащенной органическими вещест-
вами, в гидрометаллургии, для очистки рассолов в хлор-
ном производстве и" в других ионообменных процессах.
Аниониты
Сильноосновные аниониты. Анионит АВ-17 получа-
ют хлорметилированием сополимера стирола с 8% ди-
винилбензола и последующим аминированием триме-
тиламином. По внешнему виду анионит представляет
собой сферические зерна светло-желтого цвета. Анио-
нит имеет гелевую структуру и содержит группы чет-
вертичного аммониевого основания. Предполагаемое
строение анионита следующее:
—СН-СН2—
НС1
К
СН3
СНп
-сн—сн,-
-сн—сн2—
—сн-сн„-
С2Н5
Основные физико-химические свойства анионита
приведены в Приложении, в табл. 5, плотность различ-
ных солевых форм— в табл. 6. Числа гидратации и вла-
60
госодержание галогенидных форм АВ-17 приведены
ниже:
Иои
Г
Вг_
СГ
F"
ОН"
Числа гидратации
[216] [216]
1,4 1,2-
1,7 1,3
1.7
2,4 -
3,0 -
Влагосодержаиие, экв
НаО/экв иоиита
8.4
11,5
13.5
16,0
17,7
При комнатной температуре анионит АВ-17 харак-
теризуется высокой химической стойкостью к действию
кислот, щелочей и окислителей. Данные, приведенные
в табл. 12, показывают, что даже такие сильные окис-
лители, как пероксид водорода и бромат калия в кис-
лой среде, снижают полную обменную емкость ионита
не более чем на 20%. При нагревании химическая стой-
кость анионита АВ-17 существенно не меняется. Однако
соотношение между выходом реакций, приводящих к
деградации, инактивации и дезаминированию, изменяет-
ся в широких пределах. .Увеличение содержания диви-
нилбензола в анионите АВ-17 повышает его химическую
стойкость, но снижает термостойкость [85].
Таблица 12. Влияние окислителей иа полную обменную
емкость аиионита А В-17-8
(полная обменная емкость исходная 4,8 мэкв/г) [84]
Окислитель
1 М HN03
при 20°С
при 80 °С
0,1 М КВгОз при 20 °С
0,1 М КВгОз+1 М HN03 при 20 °С
0,1 М Н202
при 20°С
прн 80°С
0,1 М HaOz+l M HN03 при 20 °С
0,1 М (NH4)iSjOe при 20 °С
Полная
обменная
емкость,
% от
исходной
98
92
94
81
88
90
90
77
Механизм реакции
деструкции
дегра-
да-
ция
—
—
50
14
23
31
—
И
инакти-
вация
—
36
50
4
54
о/
/о
деэ-
амини-
рова-
иие
100
100
50
86
41
19
96
35
61
Термическая стойкость анионита АВ-17 при нагревании в воде
достаточно высока. При 100"С за 240 ч полная обменная емкость
ОН-формы уменьшается на 33%. При этом емкость по сильнооснов-
ным группам падает на 35%, а по слабоосновным — на 29%. Соле-
вые формы анионита более стойки к нагреванию, чем гидроксиль-
ная. Сушить Cl-форму рекомендуется1 при температуре до 110°С, а
ОН-форму—при 60°С в вакуум? в присутствии осушителя [85].
При удалении кремния из воды аннонит АВ-17 рационально исполь-
зовать при температуре не более 40—45 "С. При сорбции анионов
минеральных кислот' температура может быть повышена -до 85—
90 °С.
Радиационная стойкость анионита АВ-17 невелика. При облу-
чении электронами энергией 0,8—1,0 МэВ при мощности дозы
(1,1—1,4) -10* Дж/кг емкость ионита уменьшается на 44 и 52% при»
дозах соответственно 2,6-10а и 5,1 -Mr Дж/кг. При облучении анио-
нита появляются первичные и вторичные аминогруппы, гранулы рас-
трескиваются и измельчаются. Масса образца значительно умень-
шается. Ионная форма анионита не влияет иа его стойкость к иони-
зирующим излучениям. Повысить стойкость анионита АВ-17 можно,
увеличив содержание дивинилбензола в сополимере [57].
Вследствие сорбции анионитом АВ-17 крупных орга-
нических молекул его рабочая обменная емкость посте-
пенно уменьшается, а расход щелочи на его регенера-
цию увеличивается.
Анионит АВ-17-8чС является модификацией аниони-
та АВ-17 и отличается от него повышенной чистотой:
содержание ионов хлора допускается не более 5 мкг/л,
щелочи — 0,5 мкэкв/г, железа — 0,03%. СОз-формы —
7%. Аниониты выпускают в ОН-форме и применяют для
глубокого обессоливания воды, а также в ряде произ-
водств пищевой промышленности и в медицине [57].
Основные физико-химические свойства анионита
АВ-17-8чС приведены в Приложении, табл. 5.
Анионит АВ-171 (АВ-17П) является макропористым
аналогом анионита АВ-17. По внешнему виду он пред-
ставляет собой матовые сферические зерна слабо жел-
товатого цвета. Этот анионит обладает хорошими ки-
нетическими характеристиками и может быть применен
для очистки воды от органических примесей. Благодаря
макропористой структуре удельная поверхность анио-
нита АВ-171 достигает 300 м2/г, его удельный объем—■
от 5,0 до 8,5 мг/г, статическая обменная емкость по
0,1 н. НС1 —не менее 3,5—4,0 мэкв/г. Объем пор, по
данным измерения электропроводимости, составляет
27%, а по данным измерения сорбции сильных электро-
литов —32% [61].
62
Анионит АВ-29-12П получают хлорметилйрованием
с последующим аминированием диметилэтаноламином
макропористого сополимера стирола и дивинилбензола.
Предполагаемое строение следующее:
-СН2—СН—
I
О
Н»С—N.'
СН.
|\сн.
С2Н4ОН_
-СН2—СН—"
I
с
I
-СН„-СН—
По внешнему виду анионит представляет собой сфе-
рические зерна от белого до желтоватого цвета. Физи-
ко-химические свойства анионита АВ-29-12П приведены
в Приложении, табл. 5. Основность анионита АВ-29-12П
ниже, чем основность АВ-17, поэтому он хуже сорби-
рует анионы слабых кислот, в частности, угольной и
кремневой. Анионит АВ-29-12П химически и термиче-
ски менее стоек, чем анионит АВ-17; его следует при-
менять при температурах ниже 40 °С [57].
Слабоосновные аниониты. Анионит АН-18-8 получа-
ют хлорметилйрованием с последующим аминировани-
ем диметиламином сополимера стирола с 8% дивинил-
бензола. Предполагаемое строение следующее:
-СН-СНо—
НС1
СН2~ N<
СН3
СН3
-ен-сн,—
с2н5
ЛР
По внешнему виду анионит представляет собой сфе-
рические зерна серовато-желтого цвета. Его основные
физико-химические свойства приведены в Приложении,
табл. 7. Вследствие низкой основности анионит АН'18-8
рекомендуют использовать для сорбции анионов сильт
ных минеральных кислот при рН, равном 1,0—6,5. Этот
анионит обладает хорошей термической и химической
63
Стойкостью; ОН стоек к действию 5 н. растворов мине-
ральных кислот и щелочей.
Аниониты АН-18-10П и АН-18-12П являются макро-
пористыми аналогами анионита АН-18,' содержащими
соответственно 10 и 12% дивинилбензола. По внешнему
виду они представляют собой сферические зерна белого
и светло-желтого цвета. Эти иониты содержат третич-
ные аминогруппы (рКа — &,85) и некоторое число чет-
вертичных (pi(a = 4,7). Появление снльноосновных групп
в анионите объясняется взаимодействием, водорода тре-
тичных аминогрупп полимера с еще непрореагировав-
шими хлорметильными группами «соседей» с образова-
нием четвертичной группы. Аниониты обладают хорошей
химической и термической стойкостью; могут приме-
няться при температурах 60—70 °С. Основные физико-
химические свойства анионитов приведены в Приложе-
нии, табл.. 7.
Аниониты АН-21-6 и АН-21-14 получают аминирова-
нием гексаметилендиамином хлорметилированных сопо-
лимеров стирола соответственно с 6 и 14% дивинилбен-
зола. Предполагаемое строение:
—сн-сн2-
•HCI
:на
СН2—NH—(СН2)6—NH:
-сн-сн2-сн -сн2-
J HCI ~ HC1
СН2—NH-(CH2)<5—NH- СН3
-сн-сн2-
-сн—сн,-
По внешнему виду аниониты представляют собой
сферические зерна от светло-желтого до светло-корич-
невого цвета. Основные физико-химические свойства
анионитов АН-21-6 и АН-21-14 приведены в Приложе-
нии, табл. 7.
Анионит' АН-22-8 получают аминированием этилен-
диамином хлорметилированного сополимера стирола и
дивинилбензола. Предполагаемое строение следующее:
::н-сн2-
HCl HCI
сн2-йн-(сн2)2-ш2
- GH—СН2—- СН-СН2—
НС1 ~ НС1
CH2-NH-(CHj)2-NH-CHs
-сн-сн2—
64
По внешнему виду он представляет собой сферичес-
кие зерна от белого до Светло-желтого цвета. Основные
физико-химические свойства АН-22 приведены в Прило-
жении, табл. 7. Анионит АН-22 содержит первичные н
вторичные аминогруппы, поэтому в нейтральных раство-
рах ХЭН-форма этого анионита не обменивает свои про-
тивоионы. В этом случае ионный обмен возможен толь-
ко в кислых растворах. Анионит обладает повышенной
термостойкостью и может применяться при 100 °С. Он
стоек к действию концентрированных растворов кислот
и щелочей и к органическим растворителям, и нестоек
в растворах окислителей. Регенерируют анионит 2—4%-
ным растворами щелочей. Расход 100%-ной щелочи со-
ставляет та 100 г/экв ионита [57].
Анионит АН-221 является макропористым аналогом
анионита АН-22. Получают его аминированием этилен-
диамином хлорметилированного макропористого сопо-
лимера стирола с 12% дивинилбензола. Количество по-
рообразователя для сополимеризации — 80%. Основные
физико-химические свойства анионита АН-221 приве-
дены в Приложении, табл. 7. По внешнему виду он
представляет собой сферические зерна от белого до
светло-желтого цвета. В отличие от АН-22 анионит
АН-221 более стоек к действию окислителей. Остальные
химические и технологические свойства АН-221 анало-
гичны свойствам АН-22 [57].
ПОЛИКОНДЕНСАЦИОННЫЕ ГРАНУЛИРОВАННЫЕ
ИОНИТЫ
Катиониты
Катионит К.У-1, сильнокислотный, получают конден-
сацией сульфированного фенола с формальдегидом.
Предполагаемое строение следующее:
ОН
I
сна
5—360 65
ОН
.Jn-ch2-
SOsH
По внешнему виду катйонит представляет собой зер-
на неправильной формы черного или темно-коричневого
цвета. Катйонит содержит два типа ионогенных групп:
сульфогруппы —S03H и фенольные гидроксилы —ОН,
Основные физико-химические свойства катионита КУ-1
приведены в Приложении, табл. 1.
В концентрированных растворах щелочей водород-
ные связи фенольных гидроксилов разрушаются. Поэто-
му емкость катионита существенно повышается при
увеличении рН среды. Химическая стойкость катионита
КУ-1 невысока: он разрушается при действии концент-
рированных растворов щелочей и окислителей. В кислых
растворах и органических растворителях катйонит сто-
ек. При температуре выше 80 °С наблюдается значи-
тельное снижение обменной емкости (годовые потери
3-4%) [57].
Аниониты
Анионит АВ-16 ГС, сильноосновный, получают со-
кондеисацией пиридина с эпилхлоргидрином и полиэти-
ленполиаминами в присутствии хлорида аммония. Пред-
полагаемое строение элементарного звена:
—СНа—N-CHg—N-CH,—CH2-N—
III I
CHo CH2
I I
неон неон
I I
CH2 CH2
—СН2—N— N+Cl-
Анионит содержит вторичные и третичные амино-
группы алифатического ряда и пиридиновые группы. По
внешнему виду представляет собой сферические зерна
желтовато-коричневого цвета. Основные физико-хими-
ческие свойства анионита приведены в Приложении,
табл. 5. Он стоек к действию концентрированных рас-
творов кислот и щелочей, но малостоек к окислителям
[68]. В связи с особенностями строения анионит АВ-16
ГС способен образовывать комплексные соединения с
ионами меди, железа и другими тяжелыми металлами.
Он может быть использован для сорбции органических
соединений и очистки сточных вод. Обесцвечивающая
способность — не менее 85%.
Анионит ЭДЭ-10П промежуточной основности полу-
чают поликонденсацией полиэтиленполиаминов с эпн-
хлоргидрином. Предполагаемое строение элементарного
звена следующее:
CI-
—N+-CHa-CHa—NH-CH2—CH2—N—
СН4 СНа
НСОН НСОН
СНа СНа
—N-CH2—CH2—NH—ОНа-СНа—N—
Анионит содержит вторичные и третичные амино-
группы алифатического ряда и около 20% групп чет-
вертичных аммонийных оснований. По внешнему виду
анионит представляет собой красновато-коричневые зер-
на неправильной формы. Физико-химические свойства
ЭДЭ-10П приведены в Приложении, табл. 7. Анионит
стоек к действию кислот и щелочей; при кипячении в
течение 30 мин в 5 н. iNaOH или H2S04 или в 1 н. HN03
статическая обменная емкость анионита уменьшается
не более чем на 0,3%. В то же время окислители раз-
рушают этот анионит. Например, 10%-ный раствор пе-
роксида водорода при комнатной температуре уменьша-
ет полную обменную емкость ЭДЭ-10П на 60% 1[68].
Срок эксплуатации ЭДЭ-10П зависит от присутствия в
обрабатываемой воде примесей органических веществ.
При окисляемости 2 мг02/л анионит может работать
до 5 лет, а при окисляемости 19 мгОг/л только 2 года
[57].
Анионит АН-2ФН, слабоосновный, получают сокон-
денсацией фенола, формальдегида и полиэтиленполи-
Б*
67
аминов по реакции Маиииха в солянокислой среде.
Предполагаемое строение следующее:
—N—(CH2-CHa—NH—)„-CHa-CHa-N—
НО СНа НаС ОН
9 ф
сна сна
—N-(CHj—CHa-NH—)„-CHa-CHa-N—
По внешнему виду он представляет собой коричне-
вые или красиовато-коричиевые зериа неправильной
формы. Аииоиит АН-2ФН полифуикциоиалеи: он содер-
жит вторичные и третичные аминогруппы алифатичес-
кого ряда, а также некоторое число фенольиых групп.
В связи с этим иабухаемость иоиита минимальна при
рН 8 и увеличивается как при положительном, так и
при отрицательном отклонении рН от указанного зна-
чения [57]. Основные физико-химические свойства
аииоиита. АН-2ФН приведены в Приложении, табл. 7.
Этот аииоиит стоек к концентрированным растворам
кислот и щелочей и к органическим растворителям; зна-
чительно менее стоек ои к пероксиду водорода. Отме-
чено его разложение в водных' растворах при 60 °С.
Вследствие низкой основности для регенерации АН-2ФН
можно применять 2%-иый раствор iNaOH (в количест-
ве 50—60 г/экв поглощенных аииоиитов), щелочные рас-
творы после регенерации сильиоосиовиых аииоиитов, эк-
вивалентные количества аммиака и карбоната натрия.
Промывных вод при отмывке АН-2ФН после регенера-
ции щелочью намного больше, чем после регенерации
слабощелочными электролитами (например, содой или
аммиаком). Это объясняется амфотериостью этого
аииоиита.
К недостаткам АН-2ФН необходимо отнести его бт-
равлеиие гумусовыми веществами. При окисляемости
воды 19 мг Ог/л уже к концу первого года эксплуатаци-
онные показатели заметно ухудшаются. Вместе с тем,
при окисляемости воды до 3 мгОг/л анионит может ра-
ботать не менее 5 лет. Достоинствами АН-2ФН явля-
68
ются низкая стоимость и возможность регенерации со-
дой, аммиаком или сбросными щелочными растворами
[57].
ИОНООБМЕННЫЕ МЕМБРАНЫ
Гетерогенные мембраны получают прессованием сме-
си порошков полиэтилена и соответствующего иоиита.
Мембраны, поверхность которых армируется капроно-
вой или лавсановой тканью (в последнем случае марка
мембраны оканчивается индексом «Л»), имеют повы-
шенную кислотостойкость. Основные физико-химиче-
ские свойства гетерогенных мембран приведены в При-
ложении, табл. 9. В сухом состоянии длина листов мем-
бран, кроме мембраны МК-41, должна быть не менее
1420 мм, ширина — 450 мм; мембрана МК-41 имеет дли-
ну 2000 мм и ширину 500 мм. Толщина мембран, арми-
рованных капроновой тканью, составляет 0,3—0,4 мм,
лавсановой — 0,6 мм (за исключением мембраны МК-41,
толщина которой — ие более 0,5 мм). Листы должны
иметь ровную гладкую поверхность без вмятин, выпук-
лостей, посторонних включений, проколов и трещин.
Мембраны МК-40 и МА-40 выпускают в промышленном
масштабе, остальные — в виде опытио-промышлеииых
партий. После высушивания набухших ионообменных
мембран их свойства не восстанавливаются. Вероятно,
это связано с необратимой деформацией полиэтилено-
вой матрицы, в которую запрессованы зерна иоиита*.
Удельная электропроводимость ионообменных мембран состав-
ляет Ю-1 См/м и примерно на порядок меньше, чем удельная элект-
ропроводимость ионообменных смол, на основе которых изготовлены
соответствующие мембраны. Например, для катиоиообмеииой мем-
браны МК-40 это уменьшение в точке иэоэлектропроводимости со-
ставляет- «6,8. Зависимость удельной электропроводимости мембра-
ны МК-40 от удельной электропроводимости равновесного раствора
может быть выражена уравнением:
*«= e + 1lkd +bI<d + c
где а, Ь, с, d и е — параметры трехпроводиой модели [61, с. 116],
К,* = х£,/к, Кт=к"/н, кс, к? и х —удельные электропроводимости
* Подготовку ионообменных мембран к испытаниям проводят по
ГОСТ 17553—72, содержание влаги определяют по ГОСТ 17554—72,
равновесную обменную емкость — ГОСТ 17552^72, изменение разме-
ров при иабухации — ГОСТ 19180—73.
69
соответственно ионообменной смолы, ионообменной мембраны и рав-
новесного раствора. Электропроводимость ионообменной смолы так-
же зависит от электропроводимости равновесного раствора и может
быть рассчитана по приведенной формуле. В качестве первого при-
ближения для расчета электропроводимости катеонита КУ-2 и мем-
браны МК-40 можно пользоваться следующими параметрами трех-
проводной модели:
а Ь с d e
КУ-2 0,65 0,35 0,0 0,17 0,83
МК-40 0,18 0,72 0,10 0.15 0,85
Заметим, что параметры трехпроводной модели, как и электро-
проводимость ионообменных мембран, могут меняться от партии к
партии и даже в пределах одного листа мембраны. Данные- об элект-
ропроводимости в точке изоэлектропроводимости некоторых соле-
вых форм катионита КУ-2 приведены в Приложении, табл. 3. Плот-
ность, влагосодержание и электропроводимость ионообменных мем-
бран Щекинского химического комбината приведены в Приложении,
табл. 10,11. При увеличении температуры электропроводимость ионо-
обменных мембран Ht увеличивается согласно уравнению:
х, = х0 ехр (-: A/RT)
где хо—некоторая постоянная; А—энергия активации электропро-
водимости (для большинства гетерогенных мембран равная 16,7—
25,1 кДж/моль [86]); R — универсальная газовая постоянная; Т—
абсолютная температура.
Числа переноса ионообменных мембран зависят от
концентрации, природы и температуры равновесного
раствора, а также от условий проведения процесса—•
плотности тока и скорости потока жидкости. Для докри-
тических условий зависимость числа переноса противо-
иона td через ионообменную мембрану от электропровод
димости «отдающего» раствора можно рассчитать по
формуле [61]:
где tc — число переноса ко-иона в растворе.
При увеличении плотности тока до величин, превыша-
ющих критическую в 15 раз, числа переноса противо-
ионов через катионообменную мембрану меняются не-
значительно (для мембран МК-40 в 0,1 н. NaCl диапа-
зон изменений составляет 0,98—0,94). Для анионооб-
менных мембран соответствующие изменения много
70
больше —от 0,91 до 0,75. Авторы работы [88] объясня-
ют это различие в поведении катионо- и анионообмен-
ных мембран отличием интенсивности перемешивания
раствора при достижении критической плотности тока.
Для сравнительной характеристики гетерогенных ионо-
обменных мембран можно пользоваться числами пере-
носа противоионов, приведенными в Приложении, табл.
8,9.
Гидравлическая проницаемость обычных гетероген-
ных и гомогенных мембран невелика. Для МК-40 и
МА-40 в растворах NaCl (до 1 н. NaCl) она составляет
соответственно (2,1— 8,9) • 10~7 и (0,13—0,32)-Ю"7 см3-
•Н~'-с-1. С увеличением концентрации равновесного
раствора гидравлическая проницаемость гетерогенных
мембран увеличивается. Это увеличение связано с умень-
шением набухания зерен ионита, вкрапленных в мат-
рицу ионита, и увеличением зазора между зернами и
матрицей. Гидравлическая проницаемость гомогенных
мембран, как правило, ниже проницаемости гетероген-
ных и уменьшается при увеличении концентрации внеш-
него раствора. Это объясняется уплотнением ионита
вследствие его сжатия, уменьшением чисел гидратации
и количества свободной воды [89].
Электроосмотическая проницаемость ионообменных
мембран практически не зависит от плотности тока и
температуры, но зависит от гидратации противоиона;
чем больше гидратирован противоион, тем выше элект-
роосмотическая проницаемость мембран. С ростом кон-
центрации раствора электроосмотическая проницае-
мость гетерогенных мембран практически не меняется и
для растворов хлорида натрия составляет для мембран
МК-40 и МА-40 соответственно 1,5-Ю-3 и 0,8-Ю-3 см3-
•А-'-с-Ч[90].
Химическая стойкость мембран МК-40, МА-40 и
МА-41 достаточно высока; их можно использовать при
рН, равных 1—14. Мембраны с лавсановой армировкой
и мембрану МА-40 желательно применять при рН от 1
до 7. Поскольку катионообменные смолы химически
более стойки, чем анионитовые, то и мембраны, изготов-
ленные на основе катионитов, отличаются большей стой-
костью, чем мембраны на основе анионитов. По этой
причине анодную камеру в электродиализаторах часто
отделяют катионообменной мембраной МК-40Л, которая
71
остается стойкой в 6 н. растворах соляной И серной кис-
лот. Для сравнения укажем, что мембрана МА-40 до-
статочно стойка лишь в 5%-ных растворах этих кислот
и разрушается в растворах 1 н. HN03 и 2% H202 i[91].
Мембрана МА-41 более стойка к окислителям, щелочам
и кислотам; она сохраняет высокую селективность в
5%-ных растворах HN03 и Н2Ог.
Биполярные мембраны применяют в качестве источ-
ника ионов водорода и гидроксила. В этом отношении
они подобны биполярным электродам. Однако, в отли-
чие от последних, перенос тока через биполярные мем-
браны не связан с переходом электрона и, следователь-
но, с электродной реакцией. Таким образом, применяя
биполярные мембраны, можно обойти проблему изго-
товления стойких анодов и избежать образования газо-
образных продуктов электродных реакций.
Биполярные ионообменные мембраны состоят из двух
соединенных друг с другом слоев — катионо- и анионо-
обменной мембран. Их получают спрессовыванием валь-
цованных катионо- и анионообменных мембран толщи-
ной 0,25—0,30 мм. Поверхность биполярных мембран
армируют капроновой, либо лавсановой, либо полипро-
пиленовой тканью. Толщина биполярных мембран — не
более 0,5 мм, размер листа — 450X1470 мм; при набу-
хании толщина мембран увеличивается не менее чем
на 3%, я длина — на 20%. Поверхностное сопротивле-
ние биполярных мембран не должно превышать 20 Ом-
■см2, а удельное — 300 Ом-см. Перед применением би-
полярные мембраны замачивают в воде или в 0,6 н.
растворе NaCl. При получении растворов кислот и ще-
лочей концентрацией выше 1 н. следует применять
мембраны с полипропиленовой армировкой. Температур-
ный диапазон работы биполярных мембран 10—50-°С.
Некоторые физико-химические свойства выпускаемых
биполярных мембран приведены в Приложении, табл. 12
[87].
Гомогенные мембраны по сравнению с гетерогенны-
ми обладают более высокой электропроводимостью и
селективностью. В СССР на опытно-промышленной ус-
тановке получают гомогенные ионообменные мембраны
МК-Ю0, МА-100, МА-102, МК-Ю2, MKTI-102 и МАП-102
введением функциональных групп в матрицы, изготов-
ленные на основе термопласта, к которому привиты мо-
72
но- и дивинильные мономеры. Химический состав вы-
пускаемых гомогенных мембран дан ниже [87]:
Марка мен- Привитой мономер Термопласт Функциональ -
браны ные группы
МК-ЮО Стирол, ДВБ* Полиэтилен высо-
кого давления SOsH
MA-100 Стирол, ДВБ Полиэтилен высо-
v ' " кого давления j!j/p vq^
МА-102 2,5 МВП**, ДВБ Фторопласт C^4N
МК-Ю2 Стирол, ДВБ Фторопласт SOsH
МКП-102 Стирол, ДВБ Фторопласт S03H
МАП-102 2,5 МВП, ДВБ Фторопласт CjH4N
• ДВБ — дивинилбензол.
•* МВП — 2-метил-Б-вииилпиридин.
Мембраны МК-ЮО и МА-100 выпускают в набух-
шем состоянии соответственно в Na- и Cl-формах раз-
мером 500Х500Х0>3 мм. Высушивание мембран недо-
пустимо. Хранят мембраны в воде или в 0,6 н. растворе
NaCl.
Мембраны представляют собой гладкие листы ров-
ной поверхности без посторонних включений, проколов,
вмятин и трещин. Их прочность при растяжении долж-
на быть не менее 1000 Н/см2, относительное удлинение
при разрыве— не менее 30%. содержание влаги— (45±
±3)%, полная обменная емкость по 0,1 н. растворам
NaOH или НС1 кислоты (2,2±0,2) мэкв/г сухой мем-
браны. Равновесная обменная емкость мембран МК-ЮО
и МА-100 по 0,1 н. растворам NaCl или СаС1г должна,
быть не менее (2,2±0,2) и (1,8±0,2) мэкв/г сухой мем-
браны, удельное электрическое сопротивление в 0,6 н.
растворе NaCl — не более 150 Ом-см, число переноса в
0,01/0,2 н. NaCl —не менее 0,98 [87]. Свойства гомо-
генных мембран МК-ЮО и МА-100 приведены в Прило-
жении, табл. 13.
Исследование электрохимической активности мем-
бран МК-ЮО и МА-100 в растворах NaCl, HC1, HN03 и
NaOH различной концентрации показало, что электро-
проводимость мембран занимает промежуточное поло-
жение между электропроводимостью гетерогенных мем-
бран и ионитов [92, с. 18—20]. Это объясняется тем, что
силовые линии тока в гомогенных мембранах менее ис-
кривлены, чем в гетерогенных. В то же время набуха-
73
ние иОиообмеииых смол значительно выше, чем иабуха-
иие гомогенных мембран. Заметный рост электропрово-
димости аииоиообмеиной мембраны МА-100 при увели-
чении концентрации равновесного раствора кислоты
указывает иа присутствие в ней средне- и, возможно,
слабоосновиых групп. Вместе с тем, значительно боль-
шая электропроводимость ОН.-формы мембраны по
сравнению с С1-формой свидетельствует о том, что эта
мембрана, в основном, сильноосиовиая. Мембрана
МК-ЮО, по даииым [92, с. 18—20], проявляет сильно-
кислотные свойства. Диффузия электролита через ка-
тионообменные мембраны выше по сравнению с аиио-
нообмеииыми. Максимальная диффузия наблюдается
через Н- и ОН-форму мембран. Авторы отмечают, что
после испытаний в концентрированных растворах элект-
ролитов отщепилось 14% всех активных групп.
Имеются указания, что мембраны МК-ЮО и МА-100
химически стойки в 4 и. растворах NaOH, HC1 и HNO3,
а также в щелочных растворах, содержащих пероксид
водорода и гидразин [87]. В этом отношении привлека-
ют внимание мембраны на основе мономеров вииилпи-
ридииового ряда, обладающие высокой химической, тер-
мической и радиационной стойкостью. Температурный
диапазон применения мембран МК-ЮО и МА-100 неве-
лик— от 10 до 50 °С.
Мембраны МК.-Ю2 химически стойки к кислотам и
окислителям, их рекомендуют применять для отделе-
ния анодной камеры. Свойства мембраны МК-Ю2, со-
держащей 2, 5 и 8% дивииилбеизола, приведены ниже:
Содержание днвнннлбензо-
ла, % 2 5 8
Число переноса, доли 0,89 0,84 0,95
Удельное объемное сопротив-
ление, Ом-см 50 105 190
Статическая обменная емкость,
мэкв/г сухой мембраны
по 0,1 и. NaCl 2,3 2,1 1,8
по 0,1 и. СаС12 . 2,2 1,9 1,7
Влагосодержанне, % 56 40 38
ИОНООБМЕННЫЕ ПОРОШКИ И ВОЛОКНА
Ионообменные порошки получают измельчением то-
варных ионообменных смол и поставляют готовыми к
применению. Ионообменные порошки в виде намывных
74
фильтров используют Для деиоиизации воды (толщина
фильтра 5—7 мм) и для удаления взвешенных частиц
размером до 1 мкм (толщина фильтра 3—5 мм): 1 кг
фильтрующего слоя способен задержать до 0,1 кг при-
месей. Рекомендуемая скорость фильтрования—10 м/ч;
предельная температура для смешанного слоя 100—
120 °С. Продукты деструкции иоиов поглощаются са-
мим же намывным фильтром. Ионообменные порошки
весьма удобны в эксплуатации, но регенерации ие под-
лежат [87]. Основные физико-химические свойства
ионообменных порошков приведены в Приложении,
табл. 14.
Ионообменные волокна являются новым перспектив-
ным видом ионообменных материалов. Благодаря высо-
коразвитой поверхности они обладают лучшими по
сравнению с ионообменными смолами кинетическими
характеристиками. Ионообменные волокна имеют до-
статочно высокую обменную емкость и ие меняют свои
свойства при многократных циклах регенерации кисло-
тами и щелочами.
Другим важным преимуществом ионообменных во-
локон является возможность изготовления из них тка'-
ней и нетканых материалов. Последнее обстоятельство
является особо ценным в ряде специальных случаев,
когда традиционное аппаратурное оформление процесса
обессоливаиия воды оказывается неприемлемым.
ВНИИСВ (г. Калинин) выпускает укрупненные лабо-
раторные партии нетканых фильтров на основе суль-
фокатионитового волокна емкостью по 0,1 и. NaOH 2,3—
3,0 мэкв/г (размер листа фильтра 200X300 мм, толщи-
на 1—6 мм, масса до 300 г/м2, диаметр эксперимен-
тальных волокон 15—40 мкм [87]).
Высушивание набухших волокон приводит к их раз-
рушению. Синтезу и изучению физико-химических
свойств ионообменных волокон посвящены работы [93].
Основные свойства ионообменных волокон приведены в
Приложении, табл. 15.
ГЛАВА
ПЕРВАЯ СТУПЕНЬ ОБЕССОЛИВАНИЯ ВОДЫ
РАБОТА КАТИОНИТОВЫХ ФИЛЬТРОВ
Для обессиливания вода, очищенная от основной ча-
сти органических примесей и железа на стадии предва-
рительной очистки, проходит последовательно через ка-
тионо- и анионообменные фильтры. При контакте воды
с катионитом в Н-форме происходит обмен катионов
растворенных в воде солей на Н-ионы, при этом раство-
ренные в воде соли образуют соответствующие кислоты:
[Кат]Н + №С1 у [Кат]№ + НС1
2 [Кат] Н + MgS04 >- [KaxJjiMg + HaSO^
2 [Кат] Н + Са(НС03)а ► [Кат]2Са + 2С02 + 2НаО
Воду, прошедшую через катионитовый фильтр, на-
зывают Н-катионированной водой. При ее контакте с
анионитом в ОН-форме происходит сорбция анионитом
анионов сильных кислот:
[Ан]ОН + НС1 >■ [Ан]С1 + НаО
2[Ан]ОН + HaS04 ► [AH]aS04 4-2Н20
Образовавшийся при Н-катионировании диоксид уг-
лерода предварительно удаляют из воды аэрацией. Этот
процесс называют декарбонизацией.
Реакции, протекающие в слое катионита, обратимы.
В связи с этим в Н-катионированной воде наряду с кис-
лотами может находиться небольшое количество солей.
При значительной концентрации солей полностью обес-
солить воду с помощью одного, катионитового фильтра
либо невозможно, либо экономически нецелесообразно.
Первая ступень обессоливания предназначена для сорб-
ции из воды большей части солей (95—99%), преиму-
щественно катионов двухвалентных металлов и анионов
сильных кислот.
3
76
До проскока наименее сорбируемого иона в фильт-
рат все присутствующие в воде катионы располагают-
ся по слою катионообменного фильтра сверху вниз в
порядке, который определяется константой обмена этих
ионов на ион водорода. Имеет место следующий ряд
сорбируемости:
Ca"+>Mg2+>K+>Na+
На рис. 12 представлено распределение ионов в ко-
лонке со смолой КУ-2, отработавшей до проскока-
ионов натрия. Незаштрихованная часть слоя катионита
в Н-форме остается неиспользованной к моменту окон-
чания рабочего периода фильтра (проскок ионов нат-
рия). Эта часть обменной емкости ионита зависит от
таких факторов, как содержание солей в воде, скорость
пропускания воды через слой, размер зерен ионитов,
заданная глубина очистки, высота слоя сорбента. Пере-
численные факторы учитываются при расчете процессов
с помощью ЭВМ. Присутствующие в воде катионы вы-
тесняют ионы натрия, продвигая их вперед вдоль по
слою. Поэтому и выходная кривая, характеризующая ка-
чество фильтрата и мо-
мент проскока, и распре-
деление ионов по слою
будут такими, как если
бы вода содержала толь-
ко ионы натрия, но в ко-
личестве, равном сумме
всех катионов.
Проверка уравнения для
определения емкости слоя ка-
тиоиита (см. стр. 23) приве-
дена иа лабораторной колонке
с модельными растворами, ха-
рактерными для всего диапа-
зона пресных вод [21]. Значе-
ние Р определялось из незави-
симо снятой выходной кривой
Рис. 12. Исходное распределе-
ние ионов Na, К, Mg, Ca в
колоиие с катиоиитом КУ-2 пе-
ред регенерацией [9].
77
Число споеО
Либо использовалось его известное значение [9] (см. стр. 22). Рай-
хождение между опытом и расчетом колеблется в пределах 5—10%.
Параметры работы фильтра, определенные теоретически с помощью
безразмерных графиков, сравнивались с параметрами работы про-
мышленного фильтра [9]. Оказалось, что погрешность расчета или
неточность - в эксплуатации реактора находятся в тех же пределах
(5-10%).
Как график на рис. 12, так и уравнение для опреде-
ления емкости слоя катионита характеризуют работу
полностью отрегенерированного слоя ионита. Однако в
практике работы (кроме специальных случаев) обессо-
ливание воды никогда не проводят на полностью отре-
генерированных ионитах, что объясняется самим ха-
рактером процесса регенерации.
РЕГЕНЕРАЦИЯ ИОНИТОВ
После истощения емкости поглощения Н-катионито-
вые фильтры регенерируют кислотой
2[Кат]№ + HsS04 »- 2[Кат]Н + NajS04
[Кат]2Са + 2НС1 ■ * 2[Кат]Н + СаС1а
а анионитовые фильтры — раствором щелочи:
[AH]aS04 + 2NaOH *■ 2[Ан]ОН + Na2S04
Десорбция ионов, поглощение которых описывается
выпуклой изотермой, чаще всего идет по вогнутой изо-
терме и, следовательно, требует обязательного избытка
реагентов по сравнению со стехиометрическим. количе-
ством. Ряд десорбции будет обратным ряду сорбируе-
мости ионов, а именно:
Na+>K+>Mga+>Caa+
В свое время предложено было [53] выражать ко-
нечный результат регенерации через восстановленную
обменную емкость Ев, а степень регенерации а — через
отношение восстановленной обменной емкости к пол-
ной, т. е.
о = Ев:Еа
при этом Еа>Ев>Ер.
На степень регенерации ионитов влияют такие фак-
торы, как тип ионита, состав насыщенного слоя, приро-
да, концентрация и расход регенерирующего вещества,
температурные условия, время контакта. Наиболее
78
важной для расчета экономичности процесса является
зависимость степени регенерации от расхода реагентов
(расход реагентов выражают несколькими способами:
в эквивалентах на эквивалент пблной обменной емко-
сти ионитов [9]; в эквивалентах на эквивалент рабо-
чей обменной емкости [14, 15]; в кг реагента на 1 м3
фильтрующего слоя ионитов [14, 15]; в г на эквива-
лент содержания солей в очищаемой воде; в процентах
от величины рабочей обменной емкости).
Результаты ранних работ по обессоливанию [14],
где экспериментальные Данные по регенерации были
неразрывно связаны с последующим рабочим процес-
сом обессоливания конкретной воды, использовать для
иных условий невозможно. Общие закономерности реге-
нерации исследованы в работах [94], в которых пока-
зана целесообразность неполной регенерации катионитов
и частичного повторного использования последних фрак-
ций регенерата. Вопрос о затрате реагентов на регене-
рацию рассматривался также с позиций равновесной ди-
намики сорбции [1, 95].
Уравнения зависимости полноты регенерации от рас-
хода реагентов, выраженной через константы обмена,
но без учета кинетических факторов, оказались недоста-
точно точными, особенно при регенерации анионообмен-
ных фильтров [96]. С учетом внутридиффузионного
характера кинетики* процесса и состояния, предшеству-
ющего регенерации, расчеты велись послойным методом
с помощью ЭВМ [9].
Вначале определяется рабочий период до проскока при Н-катио-
нировании раствора заданного состава при полностью отрегенери-
роваином катионите; затем, зная распределение ионов по слою, ре-
шают послойно задачу распределения извлекаемых ионов в зависи-
мости от расхода реагента, затем снова считают распределение ио-
нов в цикле сорбции и т. д. Расчеты показали, что после 2—3 пол-
ных циклов сорбции — десорбции состояние сорбента и состав
Н-катионированной воды стабилизируются. По программе рассчиты-
вают влияние концентрации кислоты, ее расхода, скорости пропу-
скания и т. д. Условием, разрешающим использование программы,
является наличие справочных данных о константах обмена данных
ионов на данных ионитах и коэффициентов диффузии в них сорби-
руемых (десорбируемых) веществ. Необходима также н некоторая
предварительная экспериментальная работа, позволяющая опреде-
лить слойность данной колонки путем наложения экспериментальной
выходной кривой на набор теоретически рассчитанных выходных
кривых. Пример такого расчета показан на рис. 13, а. (Исходное
состояние слоя перед регенерацией см. рис. 12).
79
0,25 0J_ W
13 17 1 5 9 13 17 I
Число слоев
a
9 13 17 21
Рис. 13. Распределение ионов Na, К, Mg, Са по колонке с катиони-
рации кислотой
Цифры вверху — расход регенерирующего раствора
I 5 9 13 17 I 5 9 13 17 1 5 9 13 77 Z!
Число споед
б
том КУ-2 в процессе прямоточной (а) и противоточной (б) регече-
различной концентрации.
по отношению к стехиометрическоиу,
При противоточной регенерации возникают некото-
рые особенности. Прежде всего, регенерация идет через
слой ионита, полностью насыщенный извлекаемыми
ионами, а это, как показано в работе [97], приводит к
некоторой экономии реагентов по сравнению с регене-
рацией не полностью отработанного фильтра. Из срав-
нения данных послойного расчета на ЭВМ [9] прямо-
точной и противоточной (рис. 13,а и б) регенераций ка-
тионита КУ-2 (исходное состояние которого представ-
лено на рис. 12) можно сделать вывод о следующих пре-
имуществах последней: при равных затратах реагента
несколько увеличивается степень регенерации, меньшую
роль играет концентрация кислоты. В то же время при
противоточной регенерации освобождение слоя катиони-
та от ионов натрия затруднительно и для полного их
извлечения требуется намного больший расход реаген-
тов. Поэтому противоточную регенерацию практически
невозможно вести в режиме так называемой «голод-
ной» регенерации, а ожидаемое улучшение качества
фильтра благодаря отсутствию в нижнем «слое катиони-
та извлекаемых ионов реализуется только в начале ра-
бочего периода фильтра.
Противоточная регенерация представляет наиболь-
ший интерес при работе с минерализованной водой, со-
держащей мало натрия, или для умягчения воды. К не-
достаткам противоточной регенерации относится необ-
ходимость работы на фильтре, имеющем устройство
для сохранения неподвижности слоя катионита при по-
даче раствора снизу вверх. По совокупности указанных
причин этот способ регенерации не нашел широкого при-
менения при Н-катионировании.
В чередующихся актах сорбции—десорбции уже по-
сле 2—3 фильтроциклов распределение ионов в слое
ионита стабилизируется, а величина восстановленной
при регенерации обменной емкости фактически лимити-
руется десорбцией наиболее трудно извлекаемого иона.
Для случаев, когда распределение ионов после регенерации не
имеет значения (такие случаи будут описаны ниже), предложено
аналитическое описание регенерации в виде эмпирического уравне-
ния, обобщающего следующие исследования [98, с. 106—110]. Через
колонки с ионитами в заданной солевой форме при высоте слоя
40 см пропускали по одному эквиваленту регенерирующего раство-
ра различной концентрации. В фильтрате, соединенном с промыв-
ной водой, определяли содержание извлеченных ионоэ и отношение
82
2 3 4 fi
ot
0,75
0,50
0,25
б
i
,---'
S -Г
1 1 1
0,75
0,50
0,25
в
- 7
Л
V
' 1
1 1 1
0
0,75
0,50
0,25
1 2 3 4 /J
и
\
I I I I
2 3 Ч- у
Рис. 14. Зависимость а—ц для ионитов АН-31 (а), АВ-17-8 (б),
сульфоугля (в), КБ-4П-2 (г), КУ-J (д), КУ-2 (е).
Сплошная линия — расчет по уравнению (/), пунктирная — по уравнению (2);
точки на сплошной линии — экспериментальные данные.
восстановленной емкости к полной, характеризующей эффективность
регенерации. Установлено, что оптимальной концентрацией при ре-
генерации катионитов КУ-2 и КУ-1, сульфоугля, КБ-4П2 в кальцие-
вой форме являются соответственно 2,0, 1,05, 0,5 и 0,1 н. растворы
НС1. Катионит КУ-2 в натриевой форме лучше регенерировать 0,5—
0,7 н. раствором НС1. Для анионитов АВ-17, ЭДЭ-10П и АН-31
оптимальными являются соответственно 0,5, 0,25 и 0,25 н. раство-
ры NaOH.
Последующие опыты проводили уже с выбранными оптималь-
ными растворами. Для этого каждый ионит в заданной солевой
форме загружался в пять-шесть одинаковых колонок и через них
со скоростью 2—3 м/ч пропускали соответственно 1, 2, 3, 4, 5 и 6
эквивалентов кислоты или щелочи с последующей отмывкой водой.
В регенератах, соединенных с промывной водой, определяли содер-
жание извлеченных ионов. Получали набор зависимостей степени
регенерации а от расхода реагентов ц,, в эквивалентах на эквива-
лент полной обменной емкости ионита (рис. 14).
Анализ опытных данных показал, что каждый последующий эк-
вивалент реагента дает приблизительно такой же эффект, если от-
нести его к оставшейся в колонке части сорбированных ионов:
а=\-(\-а0)»
(1)
где а0 — степень регенерации при затратах стехиометрического ко-
личества реагента в виде раствора заданной концентрации, пропу-
скаемого с заданной скоростью.
В то же время с углублением регенерации эффективность из-
влечения ионов несколько изменяется. В результате сравнения экс-
9*
83
пернментальных данных введен поправочный коэффициент k н урав-
нение записано в виде:
о=1-(1-Оо)"»* (2)
Значения ао и k для разных ноннтов в наиболее часто встре-
чающихся солевых формах даны ннже:
Марка попита Вытесняемый нон ао *
КУ-2-8
КУ-2-8
КУ-1
СУ
КБ-4П-2
АВ-17-8
АН-31
ЭДЭ-10П
Уравнение описывает процесс регенерации и в том случае, ког-
да меняются условия опыта, например, скорость пропускания рас-
твора, его концентрация.
Для определения коэффициента k необходимо, чтобы в экспери-
менте были получены два значения а: при ц=1 и при цф1. Расход
реагентов для достижения заданной степени регенерации вычисляют
по следующей формуле:
1
*
Na+
Са*+
Са*+
Са*+
Са8*-
ег
сг
сг
0,67
0.60
0,53
0,60
0,70
0,42
0,83
0,83
1,20
0,67
0,56
0,80
0,90
0,50
2,0
2,0
Г Ш(1-а)Ъ
«*-[ln(l-eo) J
Для практически полной регенерации катноннта КУ-2 от ионов
кальция (95—97%) требуется примерно 6 эквивалентов кислоты на
1 эквивалент полной обменной емкости ноннта.
Для полного удаления ионов натрия достаточно 2,5
эквивалента кислоты на 1 эквивалент полной обменной
емкости катионита. В практике водоподготовки при ра-
боте с катионитом КУ-2 на регенерацию подают 1 экви-
валент серной кислоты на 1 эквивалент полной обмен-
ной емкости катионита (80—100 кг/м3 ионита). Восста-
новленная емкость при этом составляет 60% от полной,
т. е. около 800 экв/м3. Причем нижние слои в колонне
обогащены главным образом трудно десорбируемыми
катионами кальция и магния.
РАСЧЕТ РАБОЧЕГО ПРОЦЕССА
НА НЕ ПОЛНОСТЬЮ РЕГЕНЕРИРОВАННОЙ
КАТИОНООБМЕННОЙ КОЛОНКЕ
Расчеты [9] и экспериментальные исследования
[21] показали, что при обессоливании пресных вод ра-
бочий период колонки, заполненной не полностью реге-
нерированным катионитом, можно определять по тем
84
же уравнениям или Диаграммам в безразмерных коор-
динатах [9], приняв восстановленную обменную емкость
за полную. Непременным условием при этом должно
быть практически полное извлечение натрия.
Затраты кислоты для полного извлечения из слоя
ионов натрия зависят от ионного состава отработанного
слоя. Если он содержал только ионы натрия, то, под-
ставив в уравнение (2) а=0,99 или 0,999 и соответст-
вующие значения ао и к, находят ц, = 2,2 (или 2,5). Если
ионы натрия составляют некоторую долю в воде, а сле-
довательно, и в отработавшем слое, то расчет регене-
рации, приводящей к полному удалению натрия, ведут
по наиболее трудно десорбируемым ионам — ионам
кальция.
Действительно, кислота, подаваемая на катионит,
вначале реагирует со слоем в, кальциевой форме и из-
влекает кальции в виде соответствующей соли. Послед-
няя, передвигаясь по слою, вытесняет натрий из ниж-
ней части катионита. Необходимо, чтобы при регенера-
ции из слоя удалилось такое количество ионов кальция,
которое соответствовало бы содержанию ионов натрия в
слое (или превышало его). Пользуясь уравнением для
расчета расхода реагентов, находят соответствующее
значение ц. Расчет показывает, что если в отработав-
шем слое ионита содержится до 50% натрия, расход
кислоты для его полного удаления равен 1 эквиваленту
на 1 эквивалент £п (при десорбции кальция с ионитом
КУ-2 и СУ ао = 0,6). При меньшем содержании ионов
натрия в слое можно было бы уменьшить и расход кис-
лоты. Но при расходе кислоты до 1 эквивалента на 1 эк-
вивалент £п эффективность ее восстановления находит-
ся в линейной зависимости от затраты реагентов (см.
рис. 14).
Итак, в результате неполной регенерации (см. рис.
13) в нижней части слоя, освобожденного при соответ-
ствующих затратах кислоты от ионов натрия, содер-
жатся ионы кальция и магния. Расчеты показывают
[9], что при Н-катионировании пресных вод минерали-
зованностью до 10—20 мэкв/л в фильтрате за счет вы-
мывания из неотрегенерированной части слоя присут-
ствуют всего 0,1—0,05 мг/л кальция и магния, т. е. на
уровне чувствительности комплексонометрического ме-
тода их определения. Вот почему на первой ступени
85
обессоливания можно использовать не полностью от-
регенерированный катнонит, свободный от ионов нат-
рия.
Полная обменная емкость ионита Еа — есть химичес-
кая характеристика сорбента. Реализовать ее при экс-
плуатации ионита практически невозможно. Для эконо-
мических расчетов принято относить затраты реагентов
к объему обессоленной воды, т. е. к величине рабочей
обменной емкости £р. При регенерации восстанавлива-
ется примерно 60% емкости (ао = 0,6), и восстановлен-
ная емкость Ев будет равна 0,6 Е„. Таким образом, ес-
ли в лучшем случае ЕР = ЕВ, расход кислоты составил:
1:0,6=1,7 эквивалента на 1 эквивалент сорбированных
(десорбированных) ионов, или 17-0%■ Если из-за растя-
нутости фронта сорбции ионов натрия восстановленная
емкость используется, например, на 60% (см. рис. 12),
расход по отношению к Ер составит уже 1 0,6 0,6, или
280%, и т.д.
При обмене ионов водорода на ионы кальция и маг-
ния в силу их лучшей сорбируемости используется
большая часть восстановленной емкости. В связи с этим
экономически выгодно сорбировать раздельно щелоч-
ные и щелочноземельные катионы: первые — при отно-
сительном расходе кислоты 250—300%, вторые—170—
200% от стехиометрического. При совместной их сорб-
ции расход кислоты соответствует менее полному ис-
пользованию восстановленной емкости, т. е. большему
относительному расходу.
Условия, способствующие максимальному использо-
ванию восстановленной обменной емкости, т. е. мини-
мальному относительному расходу реагентов, будут сле-
дующие. При заданных высоте слоя ионита, исходной
концентрации солей и скорости пропускания воды пол-
нота использования ионита определяется главным обра-
зом величиной допускаемого проскока. В проскоке бу-
дут в основном наименее сорбируемые ионы натрия.
Фронт сорбции натрия в колонне образуется и переме-
щается так, как если бы концентрация ионов натрия
равнялась общему содержанию солей в воде. В связи
с этим в ходе вытеснения натрия его ионы будут пере-
ходить в фильтрат в виде концентрационной «волны»,
пик которой совпадает с проскоком солей жесткости
(рис. 15). Итак, отделят^ натрий от кальция и магния
86
Рис. 15. Выходные кривые по ио-
нам натрия (/), общей жесткости
.(2) и кислотности (3) при Н-ка-
гиоиировании на катионите КУ-2
раствора, содержащего СаСЬ,
MgCI2 и NaCl (Co=13,5 мэкв/л).
О 3;0 3,5 W *;5 $0
Объ ем, /I
целесообразно. Но в каком количестве выводить нат-
рий в фильтрат, являющийся исходным раствором для
обработки на анионите, определяется свойствами по-
следнего.
Н-катионированная вода представляет собой смесь
тех кислот, соли которых присутствовали в исходной
воде, т. е. в основном угольной, соляной и серной кис-
лот. Угольная кислота в присутствии более сильных
представлена как растворенный в воде диоксид угле-
рода, большая часть которого может быть удалена про-
дувкой воздухом в декарбонизаторе.
ДЕКАРБОНИЗАЦИЯ Н-КАТИОНИРОВАННОЯ ВОДЫ
Н-катаонированная вода, как правило, имеет рН,
равное 3—4. В таких условиях бикарбонат-ионы прев-
ращаются-в диоксид углерода (рис. 16), содержание ко-
торого рассчитывают по формуле:
Свх == 44ЩК + Снач
где Щк — бикарбонатная щелочность, мэкв/л; Снач — содержание
диоксида углерода в исходной воде, мг/л.
Удаление диоксида углерода в декарбонизаторах ос-
новано на стремлении растворенного в воде С02 прийти
в равновесие с парциальным давлением этого газа в
продуваемом воздухе. При этом вода, равновесно на-
сыщенная диоксидом углерода при 20 °С, содержит
1,69 мг/л СОг; с понижением температуры равновесная
концентрация увеличивается. Равновесная концентра-
ция — предел того, что' можно достигнуть при декарбо-
низации.
87
Одним из наиболее распространенных способов яв-
ляется декарбонизация с помощью вентиляторных гра-
дирен с насадками из деревянных реек (хордовая на-
садка) или колец Рашига (полые кислотоупорные
керамические цилиндры размером 25X25X3 мм). Дега-
заторы с кольцами Рашига работают эффективнее бла-
годаря большей поверхности контакта воды и воздуха:
масса 1 м3 насадки из колец Рашига — 0,5 т и поверх-
ность ее — 204 м2. Необходимую общую площадь по-
верхности насадки в декарбонизаторе (s, и2) находят
по формуле:
s^glKbC
где g — количество удаляемого из воды газа, кг/ч; ДС—средняя
движущая сила десорбции, кг/м3; К— коэффициент десорбции:
Методы расчета и правила проектирования дегазато-
ров (декарбонизаторов) подробно изложены в работах
[54]. Схема декарбонизатора с насадкой из колец Ра-
шига представлена на рис. 17. Насадку поддерживает
дно с отверстиями. Вода разбрызгивается сверху с по-
мощью распределительной системы и стекает по поверх-
ности насадки в поддон. Воздух, нагнетаемый вентиля-
тором в нижнюю часть градирни под дно, проходит слой
насадки снизу вверх и «омывает» воду. Вода выводит-
ся через гидравлический затвор. Практика работы обес-
соливающих установок показала, что остаточное содер-
жание диоксида углерода составляет, как правило, 10—
20% от исходного.
Представляет интерес новый вариант декарбониза-
ции [99], основанный на использовании многоступен-
чатого эжектора. Он представляет собой несколько по-
следовательно располо-
женных ступеней, состоя-
щих из конфузора и -ка-
меры смешения. Число
ступеней определяется со-
Рис. 16. Зависимость мольных
концентраций карбонатов (со_-
55 "« 5 6 1 8 9 W 11 11 отношения С02, HCOs н СО J )
рн от рН воды.
88
Рис. 17. Cxetoa ЬентиЛяторной
градирни с насадкой из колец
Рашига:
/ — вентилятор; 2 — насадка; 3 —
распределительные Патрубки; 4 —
люк; 5 — гидравлический затвор,
поставлением тенденции к
дроблению воды до ка-
пельного состояния и уси-
ливающейся тенденции к
коалесценции капель по
мере увеличения числа
ступеней. Принципиаль-
ная схема декарбониза-
ции с помощью эжекторов
представлена на рис. 18.
В работе [99] предлагается вариант декарбонизации
с помощью эжекторов с ее продолжением в декарбони-
заторе обычного типа. Степень удаления С02 из Н-ка-
тионированной воды зависит от давления и температуры
перед эжектором, эффективность декарбонизации близ-
COj
Рис. 18. Принципиальная схема декарбонизации с помощью эжек-
тора:
/ — Н-катиоиитовый фильтр; г —сопло; 3 — камера смешения; 4 — эжектор;
5 — воздухоотделитель; 6 — устройство, придающее потоку вращательио-по-
ступательиое движение; 7 — поплавок; в — регулирующий затвор.
89
ка к теоретической [99]; остаточное содержание Диок-
сида углерода колеблется между 5 и 20% соответствен-
но при 45 и 10 °С.
После декарбонизации Н-катионированная вода, в
которой содержатся все исходные анионы сильных кис-
лот (SO* , CI , N08) и кремневой кислоты, а также ос-
тавшаяся часть бикарбонат-ионов, подается на аниони-
товые фильтры.
РАБОТА АНИОНИТОВЫХ ФИЛЬТРОВ
НА Н-КАТИОНИРОВАННОЙ ВОДЕ,
СВОБОДНОЙ ОТ ИОНОВ НАТРИЯ
Аниониты разделяют на слабоосновные и сильноос-
новные. Первые функционируют только в кислой среде;
щелочная и даже нейтральная среда подавляют диссо-
циацию активных групп, и обмена ионов в этом случае
не происходит. Поэтому слабоосновные аниониты прак-
тически не сорбируют слабые минеральные кислоты,
например, кремневую. Сильноосновные аниониты функ-
ционируют в широком диапазоне рН и способны к сорб-
ции анионов сильных и слабых кислот не только из кис-
лой, но и из нейтральной и даже слабощелочной среды.
Слабоосновные аниониты легко регенерируются (за-
траты реагентов 1,2—1,5-кратные от стехиометрических)
и имеют большую обм'енную емкость при соответству-
ющих условиях. Сильноосновные аниониты трудно ре-
генерировать (затраты реагентов 5—10-кратные); они
имеют значительно меньшую емкость. Легкая регенера-
ция слабоосновных анионитов означает их сравнительно
легкую гидролизуемост.ь [198, с. 32—37], характеризу-
ющую обратимость реакции поглощения анионов кислот.
Очевидно, аниоиы сильных кислот обессоливаемой воды
целесообразно сорбировать на легко регенерируемом
слабоосновном анионите, который поэтому почти всегда
используют на первой ступени обессоливания. Ряд сор-
бируемости имеет следующий вид:
sor > (hsod > el- > нсо;
Благодаря тому, что в Н-катионированной воде всегда
присутствуют сульфат- и бисульфат-ионы, емкость анио-
90
Концентрация H2SO/i , %
О 20 W 60 80 WO
$■1,5 '
''"WO 80 60 W 20 0
Концентрации HCl,%
Рис. 19. Зависимость коэффициента изменения рабочей обменной
емкости аниоиитов Кер от анионного состава Н-катионированной
воды [14].
нита по серной кислоте всегда выше емкости по соля-
ной. Действительно, наряду с реакцией
2ROH + HaS04 ► R2S04 + 2H20
идет процесс, описываемый уравнением
ROH + HaS04 * RHS04 + Н20
(здесь Я — органическая часть анионита).
Для расчета емкости анионита по смеси сильных кис-
лот рекомендуется пользоваться графиком, представ-
ленным на рис. 19 [14]. Если пренебречь гидролизом
солевых форм анионита, можно считать, что сорбция
сильных кислот идет по очень выпуклой, почти прямо-
угольной изотерме, при которой имеет место параллель-
ный перенос фронта сорбции и практически полная от-
работка слоя смолы. При высоте слоя анионита, равном
или большем 1 м, с небольшим отступлением от истины
можно считать, что £Р=£В, а £„=«£„ за вычетом той
части обменной емкости, которая потрачена на погло-
щение анионитом сильных кислот из промывной Н-ка-
тионированной воды. Расход последней принимается
равным 10 объемам на 1 объем слабоосновного анио-
нита. Хорошо работающим можно считать декарбониза-
тор, в котором удаляется 80—90% С02. Оставшееся ко-
личество поступает на анионит вместе с анионами силь-
ных кислот. По мере сорбции последних и соответствую-
щего сдвига рН диоксид углерода частично переходит в
91
Н2СО3, диссоциирующую главным образом на ион би-
карбоната и ион водорода, и бикарбонат-ионы сорбиру-
ются анионитом. В соответствии с рядом сорбируемо-
сти бикарбонат-ионы первыми переходят в фильтрат и,
естественно, не могут изменить характера распределе-
ния по слою сульфат- (бисульфат-) и хлорид-ионов.
Рабочая емкость слабоосновных анионитов АН-31 по
бикарбонат-ионам определяется экспериментально. По
данным [199, с. 97—99], она составляет 0,25 и
0,50 мэкв/мл в слое высотой 40 см при скорости про-
пускания воды 20 м/ч (содержание свободного С02 со-
ответственно 0,3 и 1,0 мэкв/л). Эти данные относятся
к работе до проскока 0,05 мэкв/л (3 мг/л) ионов НСО„.
Можно принять, что при высоте слоя сорбента, остав-
шегося свободным от анионов сильных кислот, равным
или большим 50 см, средняя емкость слабоосновных
смол по бикарбонат-ионам составляет 300 экв/м3.
При нормативных затратах щелочи на регенерацию
слабоосновного анионита («60 кг/м3) восстановленная
емкость равна да 1000 экв/м3 [14], и только ее третья
часть может быть использована при сорбции бикарбо-
нат-ионов. Таким образом, фактические затраты щело-
чи в пересчете на сорбированные бикарбонат-ионы со-
ставляет около 5 экв/экв Ер.
Сильноосновные аниониты (АВ-17 и его аналоги)
имеют более высокую емкость по бикарбонат-ионам
(500—600 экв/м3). На восстановление указанной емко-
сти затрачивают 120 кг щелочи (3 кэкв), т. е. в пере-
счете на рабочую емкость те же 5—6 экв/экв. Следует
учесть, что слабоосновные иониты совершенно не" сор-
бируют кремневую кислоту; поэтому целесообразно рас-
ходовать емкость сильноосновных анионитов для удале-
ния кремния, а для сорбции бикарбонат-ионов, остав-
шихся в декарбонизованной Н-катионированной воде,
использовать слабоосновные аниониты. Если в Н-катио-
нированной воде после декарбонизации содержится би-
карбонат-ионов больше, чем анионов сильных кислот
(так бывает при обессоливании некоторых бикарбонат-
ных вод), целесообразно уже на I ступени обессолива-
ния использовать сильноосновный анионит. Это особен-
но необходимо, если в такой воде содержатся еще и зна-
чительные количества кремневой кислоты (например,
15—30 мг/л).
92
Сорбция анионов как сильных, так и слабых кислот
протекает на сильноосновном анионите по выпуклой
изотерме. Поэтому рабочая обменная емкость по всем
анионам близка к восстановленной, величину которой
легко найти по формуле:
а=1-(1-о0/
Сильноосновные аниониты, хотя и считаются монофунк-
циональными, содержат много слабоосновных функцио-
нальных групп, поэтому общая обменная емкость их от-
личается от емкости, которая определяется наличием
четвертичных аммониевых оснований, способных сорби-
ровать угольную и кремневую кислоты. Все расчеты
работы сильноосновных анионитов осложняются явле-
нием, носящим название «старения» или «отравления»
сорбента. Емкость нового (свежеприготовленного) анио-
нита АВ-17-8 по сумме анионов угольной и кремневой
кислот составляет 400—600 экв/м3 при 5-кратном коли-
честве щелочи на регенерацию [14]. Если на I ступени
обессоливания использовать сильноосновный анионит,
качество фильтрата улучшается, но расход щелочи на
регенерацию увеличится во много раз (что и ограничи-
вает применение таких сорбентов на I ступени обессо-
ливания). Сильноосновные аниониты в солевых формах
тоже гидролизуются, но значительно слабее, чем соле-
вые формы слабоосновных анионитов.
ВЛИЯНИЕ ПРОСКОКА НАТРИЯ
В Н-КАТИОНИРОВАННУЮ ВОДУ
НА РАБОТУ АНИОНООБМЕННИКА
В Н-катионированной воде в зависимости от состава
исходной воды, полноты регенерации, скорости иониро-
вания и других причин могут присутствовать катионы
натрия. Как уже было отмечено, проскок натрия в филь-
трат дает возможность более полно использовать вос-
становленную при регенерации емкость катионита.
В то же время с ростом содержания натрия в Н-катио-
нированной воде ухудшается сорбция анионитом ки-
слот.
Допустимая концентрация ионов натрия в Н-катионированной
воде, подаваемой на анионнт, найдена экспериментально [200,
с. 118—120]. Через колонии с аннонитами ЭДЭ-10П н АВ-17-8 (для
93
Рис. 20. Зависимость рабочей
обменной емкости Ет аниони-
тов ЭДЭ-10П (/) и АВ-17-8
(2) от содержания ионов нат-
рия Cnb в Н-катионированной
воде.
С
сравнения) при" высоте слоя 40 см со скоростью 10 м/ч пропускали
растворы, содержащие изменяющиеся количества ионов водорода и
натрия соответственно от 9,5 до 0 и от 0,5 до 10 мэкв/л. Средняя
рабочая емкость анионита в колонках, в зависимости от концент-
рации натрия в Н-катиоиированной воде, представлена на рис. 20.
Участок кривой / (ВС), параллельный кривой 2, отражает зависи-
мость Ер сильноосновного анионита АВ-17 от содержания нонов
натрия в контактирующем растворе. Такой >ход кривой 1 можно
объяснить тем, что при концентрации CNa>2,0—2,5 шкъ1п образую-
щийся в результате анионирования раствор щелочи подавляет дис-
социацию вторичных и третичных аминогрупп в фазе аниоиита, и
только группы четвертичных аммониевых оснований продолжают в
этих условиях сорбировать хлор-ноны. В пользу высказанного пред-
положения свидетельствует и емкость анионита ЭДЭ-10П на анало-
гичном участке, соответствующая содержанию сильноосновных групп
в этом анионите (15—25%).
Таким образом, кривую / можно разделить на два участка: АВ
показывает суммарное снижение Ер по слабым группам и по груп-
пам четвертичных аммониевых оснований, а ВС —только по сильно-
основным группам. Тогда аналитическое выражение для анионитов
можно представить как:
еР = « [(«с — aCNa) + («ел — ЬС№)]
где ес, еол — удельные емкости, обусловленные сильноосновными и
слабоосновными группами анионита, мэкв/мл; а и 6 — коэффициенты
снижения емкости по сильно- и слабоосновным группам анионитов
(для ЭДЭ-10П соответственно 0,01 и 0,4); Сш— концентрация
нонов натрия в Н-катнонированной воде, мэкв/л. Очевидно, для
произведения ЬС^ц, имеют место граничные условия 0<ЬСцл^есл,
так как при достижении bCNeL в фазе аиионнта образуется среда с
таким рН, прн котором практически прекращается диссоциация сла-
боосновных групп, а тем самым н обмен гидроксила на ион хлора.
Емкости анионитов, обусловленные слабо и сильно-
основными группами, обычно приведены в паспортных
данных; значения а и б определяют экспериментально.
Проскок ионов натрия сверх 0,1—0,2 мэкв/л заметно
снижает емкость слабоосновного анионита.
4 6
Сця,МЭКв/п
94
Проскок ионов натрия в фильтрат наступает на по-
следней стадии Н-катионирования (см. рис. 15). Ббль:
шая часть анионов будет таким образом поглощаться
анионитом в благоприятных условиях. Только последние
порции воды, содержащие ионы натрия, подавят дис-
социацию активных функциональных групп анионита,
и в фильтрат ионы натрия перейдут частично с гидрок-
сильными анионами, частично в виде нейтральных солей.
При расчете обессоливающей установки следует со-
поставить такие конкурирующие факторы, как меньший
расход кислоты на регенерацию катионита и увеличение
в связи с этим проскока натрия, и увеличение расхода
щелочи в связи с необходимостью чаще регенерировать
анионит при большем 0,2 мэкв/л проскоке натрия (так
как цена щелочи на порядок выше, чем цена кислоты,
обычно принимают повышенный расход последней).
Практика эксплуатации водоподготовительных уста-
новок электростанций показала, что при обессоливании
вод общей минерализованностью до 5—6 мэкв/л и содер-
жании ионов натрия до 20—25% общего содержания
солей для Н-катионирования на катионите КУ-2 с про-
скоком последних 0,1—0,2 мэкв/л (2—4 мг/л), можно
при регенерации катионита ограничиться расходом кис-
лоты, равным 1,0—1,5 эквивалента на 1 эквивалент пол-
ной обменной емкости катионита (80—120 кг H2S04 на
1 м3 сорбента) [14]. Так как катионит регенерируется
при этом на 50—60%, то затраты кислоты, отнесенные
к сорбированным в процессе Н-катионирования ионам,
составят 200—300% -от величины рабочей обменной ем-
кости.
Без ущерба для рабочей обменной емкости слабоос-
новного анионита задачу практически полного перевода
ионов натрия на катионит II ступени можно решать дву-
мя путями:
усреднением Н-катионированной воды в сборнике та-
кого объема, чтобы сгладить концентрационную «волну»
выходящего в фильтрат натрия;
используя на I ступени последовательно соединенные
в одном или в двух реакторах катионитовые колонны,
первая из которых при относительно «голодной» регене-
рации работает в режиме сорбции ионов кальция и маг-
ния, а вторая — в режиме сорбции натрия; только после
них ставится колонна с анионитом.
96
Ё последнем Случае слой первого катионйта можно
регенерировать избыточной кислотностью, остающейся
после полного удаления натрия из второго катионйта.
В такой комбинации можно использовать сульфоуголь
для сорбции ионов кальция и магния и катионит КУ-2
для сорбции натрия или применить комбинацию из ка-
тионитов КБ-4 и КУ-2 [100].
Для таких систем наиболее целесообразно применять
метод послойного расчета, изложенный в работе 1[9].
Система из двух соединенных катионитов I ступени обес-
соливания будет наиболее экономична и целесообраз-
на, когда избыток кислоты на регенерацию от ионов
натрия, будет равен удвоенному содержанию поглощен-
ных ионов кальция и магния. Это соответствует пример-
но отношению Na (Ca+Mg) в исходной воде, равному
1 1,5.
Если ограничить усредненный проскок Na после ка-
тионйта 0,1—0,2 мэкв/л, то после I ступени аниониро-
вания вода будет иметь такое же содержание минераль-
ных веществ. Наиболее вероятно присутствие в обессо-
ленной воде бисиликата и бикарбоната натрия. Крем-
невая кислота из исходной воды полностью перейдет в
фильтрат; угольная, как показано, задерживается слабо-
основным анионитом (малым использованием восстанов-
ленной обменной емкости из-за размытости фронта сорб-
ции бикарбонат-ионов).
Обессоленная вода после слабоосновного анионита,
когда нет проскока ионов натрия в Н-катионированную
воду, может быть слегка кислой как за счет гидролиза
отработанной солевой формы сорбента, так и за счет
бикарбонат-ионов, вытесняемых в фильтрат конкурирую-
щими ионами. Лучшая очистка воды при одноступенча-
том ионировании не может быть достигнута при затра-
тах реагентов, не выходящих за пределы 200—250% по
отношению к ионам, сорбированным каждым фильтром.
ГЛАВА
ВТОРАЯ СТУПЕНЬ ОБЕССОЛИВАНИЯ
ВОДЫ
Вторая ступень обессоливания предназначена для
удаления катионов натрия и анионов кремневой и уголь-
ной кислот. Ее осуществляют на последовательно соеди-
ненных фильтрах с сильнокислотным катионитом (на-
пример, КУ-2) и с сильноосновным анионитом (напри-
мер, АВ-17-8). Глубина обессоливания ограничена очень
•трудной отмываемостью сильноосновного анионита от
избытка щелочи, оставшейся после регенерации, и обра-
тимостью процесса из-за гидролиза сол«вых форм анио-
нита, усиленного в случае проскока ионов натрия после
катионообменника или за счет остаточной щелочности
в порах анионита.
Расчет процесса катионирования на II ступени ана-
логичен расчету I ступени, а расчет регенерации, прово-
дят по формуле (2) (см. стр. 84). Расчет анионирова-
ния на II ступени ведут по выходу в фильтрат наименее
сорбируемого аниона — бисиликата. Затруднения при
расчете возникают в связи с неопределенностью ионного
состояния кремния в растворе. Кремневая кислота мо-
жет находиться в нескольких формах — мономерной, по-
лимерной и коллоидной, причем превращение мономе-
ров в полимеры возможно в самом слое анионита, (про-
цесс удаления кремния рассмотрен далее). Поэтому ре-
генерируемость сильнооеновного анионита изменяется
во времени.
СМЕШАННЫЙ СЛОЙ ИОНИТОВ,
ЕГО ОСОБЕННОСТИ И СООТНОШЕНИЕ ИОНИТОВ
Для получения особо чистой воды (р>107 Ом-см)
необходимо исключить обратимость реакций ионного об-
мена. Это достигается с помощью смешанного слоя
4
7—зео
97
Время, мин Время, мин
а б
Рис. 21. Кинетические кривые сорбции ионов натрия на катиони-
тах (а) и ионов хлора на анионитах (б)-:
а) 1 — КУ-2-8; 2 — КУ-Э6; 3 — СУ; 4— КУ-1; 5 — КБ-4П-2; б) У —AB-17-6; 2 —
АВ-17-8; Л —АВ-27-4; 4 ~ АВ-27-8; 5 — ЭДЭ-10П; б — АН-31; 7 — АН-Зб; » —
АН-63; J — АН-64.
ионитов, когда в одном реакторе в перемешанном со-
стоянии находятся катионит в Н-форме и анионит в
ОН-форме {60]. Если диаметр зерна, равен 1 мм, то в
1 л смеси будет находиться при плотной упаковке 2-Ю5
контактов катионит—анионит. Благодаря очень близ-
кому соседству положительно и отрицательно заряжен-
ных ионитов в смеси, состоящей из сильнокислотного ка-
тионита и сильноосновного анионита, практически одно-
временно протекают следующие реакции (R — органиче-
ская часть ионита):
RH + NaCl ■<—v RNa + HCl RH + NaOH <—>- RNa + H20
ROH + HCI ^—*■ RCI + HsO NaOH + HCI ^=^ NaCl + HaO
ROH + NaCl ?—*■ RCI + NaOH
Реакции эти равновероятны и в сумме обеспечивают
необратимость процесса, трудно достигаемую при раз-
дельном ионировании. Очевидно, худшие кинетические
свойства одного из ионитов будут лимитировать работу
всего слоя. Практически равные кинетические характе-
ристики сорбентов КУ-2 и АВ-Л7 (рис. 21) благоприят-
ствуют их использованию в смешанном слое.
Испытывались и другие комбинации ионитов в смеси
[101], такие как. «слабый — слабый», «слабый — силь-
ный», «сильный — слабый» катионит и анионит. С по-
мощью названных комбинаций можно решать задачи
98
ионного обмена, но для глубокой очистки воды единст-
венно надежным является смешанный слой, состоящий,
из сильнокислотного катионита и сильноосновного
анионита. Особо важна роль последнего, так как конеч-
ная цель — удаление из воды кремния, идущее только на
сильноосновных сорбентах.
Все физико-химические и технологические особенно-
сти смешанного слоя, отличающие его работу от рабо-
ты раздельных колонн с теми же ионитами, являются
следствием сдвига реакции ионного обмена в сторону
образования малодиссоциированного соединения — воды.
Этот сдвиг обусловлен непосредственным соседством
разноименных ионитов. Следует остановиться на следу-
ющих особенностях смешанного слоя ионитов.
1. Качество фильтрата после смешанного слоя не за-
висит от концентрации солей в исходной воде. В зависи-
мости от исходного содержания солей меняется только
объем обессоленной воды (рис. 22).
2. Ряд сорбируемости на смещанном слое остается
тем же, что и на отдельно используемых ионитах, но се-
лективность смешанного слоя по отношению к различ-
ным ионам сглаживается. Действительно, благодаря ма-
лой степени диссоциации» воды скорость обмена резко
возрастает. При k>5 изотерма сорбции практически
прямоугольна [9] и дальнейшее увеличение констант,
например до 10 и больше, не имеет значения. Выравни-
вание селективности означает, что смешанный слой ра-
ботает с мало различающейся эффективностью при
обессоливании вод разного состава.
3. В связи с проявлением электростатических сил
притяжения между катионо- и анионообменными зер-
нами при смешивании иониты занимают объем, значи-
тельно превосходящий суммарный объем ингредиентов
Рис. 22. Зависимость удельного
электрического сопротивления
фильтрата после фильтра смешан-
ного действия от содержания со-
лей в исходной воде:
1 — Со=2; 2 — С0=1.64; 3 — С0=1,26; 4 —
Со=0,8 мэкв/л.
1
&* 6
ц$ 1
0
- \
ч- в
|\
12 IS 20
Объем, п
24
т
99
смеси, и образуют в связи с этим более проницаемый
слой с лучшей кинетикой-. Это позволяет вести процесс
с большей эффективностью и со скоростью, превышаю-
щей в 2—3 раза скорость раздельного ионирования.
4. Особенности, отмеченные выше, приводят и к глав-
ному технологическому преимуществу смешанного слоя:
фронт сорбции перемещается без размывания и, следо-
вательно, рабочая обменная емкость слоя практически
равна емкости, восстановленной при регенерации, т. е.
Ер=иЕп. Таким образом только с помощью смешанного
слоя можно приблизить расход реагентов при сорбции
ионов натрия к расходу при сорбции щелочноземельных
металлов.
5. Близкое «соседство» зерен катионо- и анионообмен-
ников позволяет устранить недостаток сильноосновных
анионитов — их плохую отмываемость от щелочи, остав-
шейся после регенерации. Для полной отмывки аниони-
та АВ-17 до рН фильтрата, близкого к 7, затрачивают
до 100 объемов обессоленной воды на 1 объем анионита.
В смешанном слое отмывка слоя приобретает принци-
пиально другой характер: щелочь, оставшаяся в порах
анионита, поглощается зернами катионита, а остатки
кислоты в порах катионита сорбируются анионитом сме-
шанного слоя. В результате рабочая емкость слоя не-
сколько уменьшается, но потери значительно меньше
тех, которых требует получение обессоленной воды, иду-
щей на отмывку отдельных слоев ионитов.
Итак, при использовании смешанного слоя результат
обессоливания не зависит от состава воды, содержания
солей и скорости ионирования. Получить глубокообессо-
ленную воду можно только с помощью смешанного слоя
ионитов, в технике называемого фильтром смешанного
действия; его можно использовать на любой ступени
обессоливания.
Предпочтительно, чтобы рабочая обменная емкость
ионитов в смешанном слое была одинаковой. Как было
показано, в смешанном слое ЕР^ЕВ, поэтому выбор со-
отношения катионита и анионита фактически определя-
ется емкостью, восстановленной лри заданных затратах
реагентов. Надо учитывать, что регенерация катионита
всегда более эффективна, чем регенерация сильнооснов-
ного анионита (см. а и k, стр. 84). Так, емкость АВ-17-8
не может быть больше 600 экв/м3, а у катионита КУ-2
100
Объем фильтрата, кратный объему анионита
Рис. 23. Зависимость удельного сопротивления и содержания ионов
HSiOg" от объема фильтрата, кратного объему аииоиита, при раз-
личном отношении катиоиита и аииоиита (К: А) в смешанном слое:
; —К А=1 1; 2— К:А-1 3'; 3— К:А=1:6; 4 — К:А-1:9: 5 —анионнт
АВ-17.
легко достигается емкость 1000—1200 экв/м3. Поэтому
при работе с водой, не содержащей свободных кислот,
оптимальным отношением катионита к аниониту явля-
ется 1 :2.
При обессоливании на ионообменной установке по-
сле I ступени в фильтрате, как правило, наряду с неко-
торым количеством нейтральных солей (0,1—0,2 мэкв/л)
присутствуют и свободные кислоты — НгС03 и НгБЮз.
Следовательно, долю анионита в смешанном слое надо
увеличить на сорбцию свободных кислот.
На рис. 23 представлен результат обессоливания Н-
катионированной воды и частично дегазированной во-
ды, содержащей следы натрия, 1 мэкв/л анионов силь-
ных кислот, 10 мг/л ионов НСОдИ 15 мг/л ионов HSiO '.
Как видно из рисунка, при небольшой концентрации ка-
тионов, не считая иона водорода, соотношение сорбен-
тов можно варьировать от 1 : 1 до 1 :6. В отсутствие ка-
тионита удельное сопротивление воды резко падает
(кривая 5). Следовательно, катионит нужен хотя бы
для извлечения следов натрия, из обессоленной воды и
ионов натрия, извлекаемых пропускаемой водой из пор
отрегенерированного, но недостаточно отмытого анио-
нита.
101
Конструктивные особенности фильтра смешанного
действия с регенерацией внутри реактора позволяют
изменять соотношение катионита и анионита от 1 1 до
1 :2. В специально выполненном фильтре для обессоли-
вания мало минерализованной воды конструкция позво-
лила выдерживать соотношение 1 :3, при этом удлинил-
ся рабочий период фильтра. В реакторах с выносной ре-
генерацией при выборе соотношения сорбентов исходят
из соотношения ионного состава воды и восстановленной
емкости ионитов.
РЕГЕНЕРАЦИЯ ФИЛЬТРА СМЕШАННОГО ДЕЙСТВИЯ
Перед регенерацией смесь ионитов должна быть раз-
делена. Обычно ее разделяют гидравлическим путем, по-
давая воду снизу вверх со скоростью и интенсивностью,
достаточными для подъема всего слоя. Катионит как
более тяжелый оседает раньш* анионита. Иногда эту
операцию повторяют 2—3 раза. Для разделения ионитов
необходимо и достаточно, чтобы их плотности в набух-
шем состоянии различались на 100—150 кг/м3.
Слой катионита занимает нижнюю часть колонны до
среднего дренажа, а анионит — верхнюю часть над сред-
ним дренажем.
После разделения слоев проводят регенерацию, од-
новременно направляя раствор щелочи -сверху вниз, а
кислоты снизу вверх с выходом растворов в средний
дренаж, либо регенерируя каждый слой поочередно та-
ким же образом, но защищая нерегенерируемый ионит
от попадания чужеродного реагента потоком обессолен*
ной воды вместо соответствующего регенеранта.
В отдельно работающих слоях менее отрегенериро-
ванным, как правило, является нижний слой; в фильтре
смешанного действия в связи с перемешиванием иони-
тов и солевые, и основные формы сорбентов распределе-
ны равномерно по всему слою. Поэтому для оценки сте-
пени регенерации ионитов здесь целесообразно Пользо-
ваться уравнением (2, см. стр. 84), а не проводить по-
слойный расчет.
Очевидно, полное разделение смеси, в 1 м3 которой
содержится 5-Ю9 пар «катионит—анионит», маловеро-
ятно. Невероятно и переведение солевых форм ионитов
в. полностью рабочие хотя бы потому, что по ЛИНИИ раз-
102
S:
I Л
О
ш
10 х
0,8 %
0,6 %
0,2 5
О 100 200300 400 500 600 700°
Объем фильтрата,крот-
ный объему анионита
Рис. 24. Зависимость удельного сопротивления и содержания ионов
HSiOa от-ионной формы ионитов КУ-2 и АВ-17 в смешанном слое.
Состав форм ионитов в смесн: / — Н+ ОН-=1 : 1; 2 — Н+ ОН- С1-=
«-I 0,5:0,5; 3 — Н+ Na+ ОН--0.5 : 0,5 : I; 4 — Н+ Na+ ОН- С1~ =
= 0,5 0,5 : 0,5 0,5.
дела у среднего дренажа на анионит будет попадать
кислота, а на катионит — щелочь. Поэтому необходимо
определить, влияние неполноты деления и неполноты ре-
генерации ионитов на качество и количество обессолен-
ной воды.
Исходя из практической необратимости реакций,
протекающих на смешанном слое, можно утверждать,
что наличие некоторой равномерно распределенной ча-
сти солевых форм ионитов не должно сказаться на ка-
честве фильтрата. Оно вызовет лишь уменьшение про-
должительности рабочего периода фильтра, которое со-
ответствует доле солевых (отработанных) форм хотя
бы одного из ионитов смешанного слоя. Однако при-
сутствие солевых форм анионита или катионита, спо-
собных к гидролизу, можно рассматривать как вариант
обратимости реакций.
В работе '[201, с. 92—96] исследована сорбция сме-
шанным слоем ионов, образующих негидролизующиеся
соединения. Наличие в фильтре смешанного действия
частично отработанных ионитов имитируется смешива-
нием полностью отрегенерированных ионитов с их go-
левыми формами, аниони'том в хлоридной и катионитом
в натриевой формах. На фильтр высотой слоя 40 см со
скоростью 30 м/ч подавали Н-катионированную воду,
в которой были хлор-, бикарбонат- и бисиликат-ионы
103
в количествах соответственно 1,0, 0,5 и 0,2 мэкв/л. Ре-
зультаты опыта представлены на рис. 24.
Опыты показали, что наличие в смешанном слое да-
же половины сорбента в солевой форме (а»0,5) не ска-
зывается на качестве фильтрата. Уменьшился только
его объем при введении в фильтр 50% анионита
в С1-форме. Смешанный слой, содержащий половину
отработанного катеонита, не уменьшал выхода обессо-
ленной воды, что вполне закономерно, поскольку обес-
соливалась Н-катионированная вода. Эти опыты, как
и теоретические расчеты [23], указывают на независи-
мость качества воды, прошедшей через фильтр, от пол-
ноты- регенерации и полноты разделения перед регене-
рацией ингредиентов смешанного слоя, когда формы
ионитов не гидролизуются. Распределение зерен иони-
тов после регенерации должно быть максимально рав-
номерным.
ОПТИМИЗАЦИЯ РАСХОДОВ РЕАГЕНТОВ
НА РЕГЕНЕРАЦИЮ ИОНИТОВ В ФИЛЬТРЕ
СМЕШАННОГО ДЕЙСТВИЯ
С помощью смешанного слоя ионитов получают обес-
соленную воду с удельным электрическим сопротивле-
нием до 10 МОм-см, независимо от затрат реагентов
на регенерацию в пределах 1—6 экв/экв Е„ сорбентов.
Вместе с тем, существует минимум расхода реагентов,
ниже которого невозможно с помощью смешанного слоя
получить высокоомную воду в объеме, превышающем
расход воды на подготовку фильтра к работе. Увеличе-
ние расхода реагентов имеет естественный предел, ког-
да прекращается прирост восстановленной обменной ем-
кости на единицу затраченных реагентов. Очевидно,
в затрате реагентов существует и оптимум.
На предприятиях, получающих сравнительно немно-
го обессоленной воды, себестоимость ее. достаточно вы-
сока (1—2 руб/м3). Для подготовки фильтра смешанно-
го действия используют, как правило, обессоленную во-
ду. В зависимости от цены реагентов, себестоимости
обессоленной воды и других факторов оптимальный рас-
ход реагентов на подготовку фильтров смешанного дей-
ствия «плавает» в некоторых пределах. Методу оптими-
104
<•> ч,и
X
^8,4
s>
^8,6
'$8,5
^8,4
V
\
- \
\
- 1
- 1
1
8>3o~i
ъ 1,8
$/,7
«М -s
's? 'Л
14* U
13.
'-]
А
\
- \
- \
1
—
а
\ /
1 1 1
//,2
//;/
//,(7
/0,5
ю,в
2 3 * 5
г
u с/
ч°т,
4 J
2,2
4'
2,0
1,9
1,8
О I 2 3 15
О 1 2 3 Ч 5 0 12 3 4 5
Расход оеагентов.экв/энО £п
Рис. 25. Зависимость себестоимости (руб/м3) регенерации аииоиита
Z, и катиоиита ZK в фильтрах смешанного действия от расхода ре-
агентов (экв/экв £п):
а, г — при себестоимости воды 1 руб/м3, кислоты 90 руб/т и щелочи 190 руб/т;
б, 3 —при себестоимости воды 1,6 руб/мэ, кислоты 90 руб/т и щелочи
190 руб/т;
в, е — при себестоимости воды 1 руб/м', кислоты 25 руб/т и щелочи 100 руб/т.
зации расходов реагентов на регенерацию ионитов
в фильтрах смешанного действия посвящена работа
[202, с. 101—105]. Графики на рис. 25 иллюстрируют
пределы колебания оптимума в зависимости от стоимо-
сти реагентов и воды.
СОРБЦИЯ — ДЕСОРБЦИЯ УГОЛЬНОЙ КИСЛОТЫ
Смешанный слой получил наибольшее распростране-
ние для окончательной очистки воды от бикарбонатов и
бисиликатов. Поэтому очень важно выяснить, насколько
изложенные выше закономерности распространяются на
сорбцию смешанным слоем бисиликат- и бикарбонат-
ионов, склонных к гидролизу.
В смешанном слое ионитов неотрегенерированная
часть каждого из них после перемешивания достаточно
равномерно распределена по всему слою и, как показа-
но, не влияет на удельное сопротивление воды, если со-
левые формы ионитов не гидролизуются.
105
Содержание солевой аюриы, %
Рис. 26. Зависимость максимального удельного сопротивления воды,
пропущенной через смешанный слой, от содержания в нем солевых
форм анионита:
/ —аннонит в ОН- и С1-формах; 2 — анионит в ОН- и НСОз-формах (р ис-
ходной воды 12 МОм'См).
Рис. 27 Кинетика отмывки НС03-формы анионита АВ-17 обессолен-
ной водой в динамических условиях при различной скорости про-
пускания.
Из рис. 26 видно, что даже незначительная примесь
бикарбонатной формы анионита в слое препятствует
получению высокоомной воды. Абсолютная же величина
добавки НСОз-ионов в воду> снижающая удельное со-
противление с 12—14 до 3—4 МОм-ем, очень мала —
10_6 экв/л. Отметим также, что промышленные фильт-
ры смешанного действия, подготавливаемые к работе
без излишней скрупулезности, после соответствующей
отмывки позволяют получать высокоомную воду (р>
>107 Ом-см).
Разрешение этого кажущегося противоречия найдено
при исследовании процесса отмывки водой анионита
в НСОз-форме. Продукты гидролиза вымываются обес-
соленной водой с закономерностью, представленной на
рис. 27. Обработка экспериментальных данных приво-
дит к следующему соотношению, выражающему полноту
отмывки анионита Ф:
Ф = с,/С0 = i _ к уТ
где Со и С< — содержание НС03-ионов в фазе сорбента в начале и
конце отмывки водой; t — время отмывки; К — коэффициент про-
порциональности.
106
Допустимое начальное содержание в слое НСОз-ио-
нов равно:
С„ = С,/(1-КУГ)
Поскольку определение НСОз-ионов в растворе значи-
тельно проще, чем в фазе сорбента, переходят от Ct
к Ct:
С( = ус(
где у — коэффициент распределения, который находят из независи-
мого опыта (например, для анионита АВ-17 он равен 15000).
Тогда
Далее в расчетах* можно перейти к выражению кон-
центрации в растворе через электропроводимость:
Такой переход в данном случае правомерен, так
как в растворе кроме Н+ и НСОа отсутствуют другие
ионы. Тогда то начальное содержание НС03-ионов в фа-
зе анионита С0, которое при заданном времени ее от-
мывки позволяет получать воду с заданным удельным
электрическим сопротивлением (удельной электропро-
водимостью), будет равно:
со = <%£* = У (!5н3- Ю« + 2,4к)/(1 - К V7)
Коэффициент К зависит от скорости, с которой ве-
дется отмывка анионита. Его определяют графически
из зависимости, выраженной в координатах 1/К—1/".
например, при отмывке анионита АВ-17 в НСОз-форме
с линейной скоростью пропускания и от 20 до 80 м/ч
К = u/ty + vh
где tf и v — экспериментально найденные эмпирические коэффициен-
ты, равные соответственно 103 и 7,8.
Как показал расчет, для получения с помощью
фильтра смешанного действия воды с удельным сопро-
тивлением 1, 2, 5 и 10 МОм-см при отмывке слоя после
регенерации в течение 60 мин со скоростью 25 м/ч ос-
таточная концентрация НСОз-ионов по всему слою анио-
107
б
20/ W 60 Н,см
/
- /
/
/
О 200 WO t;MUH
Рис. 28. Выходные кривые сорбции бикарбонат-ионов на смешанном
слое (а) и определение значения Н0 (б).
нита не должна превышать 284, 75, 18 и 6,5 экв/л влаж-
ной смолы. По отношению к полному насыщению анио-
нита АВ-17 НСОз-ионами («600 мэкв/л) это соответ-
ствует степени регенерации анионита 52, 87, 97 и 99,9%.
Высокая степень регенерации достигается при обра-
ботке анионита очень большим избытком щелочи (ква-
лификации «ч» или «чда»). В работе [102, с. 106^—113]
предложен другой метод, заключающийся в том, что
анионит вначале переводят в негидролизующуюся фор-
му с помощью избытка сильной кислоты, оставшейся от
регенерации катионита. Затем его регенерируют при
обычных расходах щелочи (2—4-кратные количества от
стехиометрических). Такой способ регенерации имеет
два преимущества: при пропускании кислоты через
слой анионита выделяются пузырьки СОг, способствую-
щие флотации и тем самым облегчающие отделение
слоя анионита от слоя катионита; кроме того, при ре-
генерации С1-форм анионита расход щелочи меньше,
чем при регенерации НСОз-формы, поскольку в послед-
нем случае наряду с извлечением НСОз-ионов происхо-
дит и их перевод в С03-ионы ![203, с. 117—125]:
RHCO, + 2NaOH >- ROH + Na^O» + Н20
Если НС03-ионы полностью удалены из фазы, иони-
та, остается решить, какой высоты должен быть сме-
шанный слой, чтобы НСОз-ионы, вымываемые из верх-
1-
240
160
80
0
-80
460
108
него, полностью отработанного слоя анионита не попа-
дали в фильтрат, а задерживались в колонке. Теорети-
ческое решение этой задачи затруднено из-за отсутст-
вия в литературе показателей константы обмена и ки-
нетической константы р. Используя известную методику
(см. стр. 17), величину Н нашли графически (рис. 28).
Для анионита АВ-18, содержащего 2% сорбента
в НСОз-форме, она оказалась равной 25 см при линей-
ной скорости обессоливания 25—35 м/ч.
СОРБЦИЯ КРЕМНЕВОЙ КИСЛОТЫ
Кремневая кислота относится к самым слабым ми-
неральным кислотам, соли которых присутствуют
в природной воде. Константа диссоциации кислоты по
первой ступени равна ЫО-10. Кремневую кислоту-мо-
гут сорбировать только сильноосновные аниониты с ак-
тивными группами типа четвертичных аммониевых ос-
нований. В анионите АВ-17 и его аналогах не все функ-
циональные группы относятся к этому типу. Поэтому
емкость по кремневой кислоте составляет только часть
общей емкости, если измерять ее по С1- или БО^-ионам.
Так, динамическая емкость смолы АВ-17-8 по сильноос-
новным группам составляет 690 экв/м3, а полная ем-
кость — 1100 экв/м3.
В процессе обессоливания кремневую кислоту вы-
тесняют все другие, в том числе и угольная. Из рис. 29,
представляющего процессы сорбции анионитом АВ-17-8
кремневой кислоты в присутствии соляной, видно, что
при сорбции имеет место практически полное хромато-
графическое отделение слоя, насыщенного соляной кис-
лотой, от слоя, заполненного ионами кремневой кисло-
ты. Это облегчило вывод [38] уравнения, описывающе-
го-удельную рабочую обменную емкость сильноосновно-
го анионита ер в фильтре смешанного действия в зави-
симости от присутствия конкурирующих ионов:
eP = eHSi o-/(l— S/2L)
Где 6hsioj — емкость насыщения по кремневой кислоте в отсутствие
конкурирующих ионов, равная числу сильноосновных групп в сор-
бенте, мэкв/мл; L — высота смешанного слоя, см; б — ширина фрон-
та сорбции по кремневой кислоте, см; / — обобщающий показатель,
равный
/ = ftHSiOjr/(UHSiO- + ha~ + ~^~ Лнсог)
(здесь hi = С,/е,)
109
/J. /7 2/ 15 29
Объем, /I
0> Ofi 1,2 1,6 10
СнСо~3'мэ"в/"
Рис. 29. Выходные кривые по удельному электрическому сопротив-
лению (1) кремневой кислоте (J?) и С1-ионам (3) при обессоливании
раствора, содержащего 0,4 мэкв/л ионов HSiQT.
Рис. 30, Зависимость рабочей сорбционнон емкости ер анионита
АВ-17 по ионам HSiOs от концентрации в воде ионов НСОэ,
На рис. 30 представлены рассчитанные по уравне-
нию и экспериментально полученные значения ер по
ионам HSiOa анионита АВ-17 в зависимости от кон-
центрации в воде ионов НСО^. Как следует из рисунка,
целесообразна максимальная отдувка СОг из воды пе-
ред ее подачей на фильтр.
Суммарная емкость анионита АВ-17-8 по анионам
слабых кислот находится в пределах 500—600 экв/м3
при затрате 4—5 экв/экв Е„ (или 160—200 кг NaOH на
1 м3 анионита). Соответственно 3Д и 4/s затраченной
щелочи, не превращенные в соли угольной и кремневой
кислот, используются на регенерацию слабоосновного
анионита на I ступени обессоливания. Указанная ем-
кость может быть положена в основу расчета фильтра
со смешанным слоем ионитов. Например, если на
фильтр подается вода с содержанием 0,2 мэкв/л уголь-
ной и 0,2 мэкв/л кремневой кислоты (или 15 мг/л), сме-
шанный слой, в котором 1 м3 анионита АВ-17-8, может
очистить 500 : 0,4= 1250 м3 воды.
Катионит фильтра смешанного действия всегда име-
ет некоторую избыточную емкость, если его объем со-
ставляет Уг или даже Уз объема анионита. Поэтому ка-
тионит не будет лимитировать процессы деминерализа-
ции на фильтре, и его емкость можно не рассчитывать.
Регенерируют катионит в фильтре смешанного действия
ПО
при расходе кислоты 1,5—2,0 экв/экв £п. Избыток кис-
лоты утилизуется для удаления из анионита фильтр_а
смешанного действия сорбированных ионов НСОа.
В таких условиях фильтрат представляет собой высо-
коомную воду; проскок кремния в зависимости от срока
эксплуатации анионита АВ-17 колеблется в пределах
0,05—0,20 мг/л.
При более глубоком удалении кремния необходимо
учитывать гидролиз анионита, не полностью отрегене-
рированная часть которого равномерно распределена по
всему смешанному слою. Расчет такого процесса, как
отмечалось ранее, затруднителен, а потому влияние
гидролиза кремневой формы анионита на качество обес-
соленной воды определяется экспериментально [103].
Опыты проводили на смешанном слое ионитов КУ-2-8чС
и АВ-17-8чС, взятых в объемном соотношении 1 : 2. Не-
полнота регенерации анионита по ионам кремневой кис-
лоты моделировалась следующим образом. Через смесь
ионитов соответственно в Н- и ОН-формах пропускали
Н-катионированный раствор силиката натрия, содержа-
щего 30 мг/л ионов кремневой кислоты, с таким расче-
том, чтобы на каждый 1 мл анионита приходилось 0,4,
0,2, 0,15, 0,10, 0,05 и 0,02 мэкв ионов Н$Ю~ (рис. 31).
Смесь ионитов извлекали затем из колонок с по-
мощью «обескремненной» воды, хорошо перемешивали
и снова заполняли колонки. Таким образом, достигали
равномерного распределения ионов по высоте смешан-
ного слоя. Через подготовленные колонки со смешанным
слоем со скоростью 20 м/ч
пропускали высокоом-
ную воду, содержащую
0,5 мг/л кремневой кис-
лоты (имитация глубоко-
го
Рис. 31. Кривые извлечения во-
дой кремневой кислоты из сме-
шанного слоя, содержащего в
1 мл анионита 0,4, 0,2, 0,10,
0,05, 0,02 мэкв ионов HSiO^
(соответственно кривые /—■5)
в зависимости от объема про-
пущенной воды.
0 200 500 10(1(1 1500 2000
Приведенные объемы
111
го «обескремнивания» после одноступенчатого обессо-
ливания). На рисунке представлена зависимость каче-
ства фильтрата от степени отрегенерированности анио-
нита и объема пропущенной воды; с помощью известной
методики ;[104] установлено, что кривые /—3 я 4, 5 опи-
сываются соответственно уравнениями (коэффициенты а
и b определяют графически i[103]):
Chsioj = а + bCUSiOj Сгаю- = a^s/0_
Удовлетворительные результаты дает расчет и по
эмпирическому уравнению, приведенному на стр. 109.
Для извлечения кремневой кислоты в результате гидро-
лиза оно записывается в следующем виде:
Chsso^- = vCHSiO-/(l - К /Г)
откуда
Chsjo- --= CHSiog- (l - К /F)/Y
где y принимается равным 50 000, а коэффициент К, зависящий от
скорости пропускания воды и, определяется из соотношения
K=u/iJ>+v« (if и v соответственно-равны 100 и 8).
Проведенные исследования показали,, что, как и при
получении воды, свободной от бикарбонат-ионов, необ-
ходимая полнота регенерации анионита от гидролизую-
щейся солевой формы резко возрастает с увеличением
заданной степени удаления из воды кремния. В отличие
от бикарбонатной формы, требуемая полнота регенера-
ции ионита, насыщенного кремневой кислотой, rie мо-
жет быть достигнута обработкой анионита кислотой.
Из-за образования в фазе ионита полимерных форм
кремневых кислот требуется обработка горячей ще-
лочью или другими реагентами, разрушающими поли-
мерную кремневую кислоту.
ГЛАВА
ЭЛЕКТРОХИМИЧЕСКОЕ ОБЕССОЛИВАНИЕ ВОДЫ
Технология ионообменного обессоливания воды до-
стигла высокого уровня развития и дальнейший про-
гресс в этой области может быть связан только с внед-
рением принципиально новых методов. Возрастающее
загрязнение окружающей среды растворимыми солями
заставило исследователей обратиться к идее электро-
диализа и электрохимической регенерации ионитов. По
сравнению с химической регенерацией электрохимиче-
ская обладает следующими преимуществами: отпадает
необходимость в расходе химических реактивов, сокра-
щается расход воды на собственные нужды установ-
ки, облегчается автоматизация и механизация про-
цесса.
При электрохимической регенерации смешанного
слоя ионитов не надо разделять иониты перед регенера-
цией и емешивать их после регенерации.
ОСНОВЫ ЭЛЕКТРОДИАЛИЗА
Деминерализация воды электродиализом основана
на способности набухших ионообменных мембран про-
пускать ионы только одного знака заряда. Указанная
способность объясняется высокой концентрацией непо-
движных (фиксированных) ионов, химически связанных
с каркасом, или матрицей мембраны. Заряд фиксирован-
ных ионов нейтрализуется эквивалентным количеством
ионов противоположного знака заряда (противоионов).
Между фиксированными ионами и противоионами су-
5
8—360
113
ществует ионная связь. Поэтому в набухшей мембране
пара фиксированный ион — противоион диссоциирова-
на. Так как концентрация фиксированных ионов вели-
ка, то при равновесии с разбавленными водными раст-
ворами ионы, одноименные с фиксированными (ко-
ионы), проникают в мембрану в очень незначительном
количестве. В связи с этим практически единственными
переносчиками тока в ионообменных мембранах явля-
ются противоионы.
Электродиализ*аторы, предназначенные для демине-
рализации, обычно выполняют в виде аппаратов фильтр-
прессного типа. Между двух прижимных рам у краев
расположены электродные камеры, а между ними друг
за другом, но отделенные одна от другой рамками —
катионо- и анионообменные мембраны.
В электродиализе электроды играют вспомогатель-
ную роль: они служат для подвода тока. Селективные
свойства катионо- и анионообменных мембран позволя-
ют осуществлять процесс обессоливания во всех чет-
ных камерах и процесс концентрирования раствора
в граничащих с ними нечетных камерах концентриро-
вания. Многокамерные аппараты выгодны тем, что
в них затраты электрической энергии на процесс элект-
ролитического разложения воды и преодоления омиче-
ского сопротивления раствора в электродных камерах
минимальны.
Основным элементом электродиализатора являются
мембраны. Если бы они не обладали селективностью по
отношению к знаку заряда ионов, то эффекта очистки
воды от солей не было бы. Чтобы удовлетворить требо-
ванию минимального расхода электрической энергии,
ионообменные мембраны должны обладать максималь-
ной селективностью, т. е. большими числами переноса
противоионов и хорошо проводить электрический ток.
Их толщина должна быть по возможности малой, что-
бы сопротивление электрическому току было невелико,
но достаточной для обеспечения прочности мембраны
к механическим нагрузкам, связанным с неравномер-
ным распределением гидравлического давления в каме-
рах обессоливания и концентрирования.
Селективность мембран в первую очередь определя-
ет выход по току. Выход по току отдельной камеры
114
Вт и селективность мембран- связаны между собой
соотношением.
Вт=7к+~?Г
где ?к и 1^ — числа переноса противоионов через катиоиообменную
мембрану.
Выход по току снижается еще и вследствие утечек
тока и диффузии солей из камер концентрирования
в камеры обессоливания.
Степень концентрирования раствора при электродиа-
лизе всегда ограничена, так как осмотический и элект-
роосмотический перенос воды, как правило, направлен
в ту же сторону, что и перенос соли. Опыт показывает,
что критическая концентрация рассола, например, при
обессоливании раствора хлорида натрия составляет
«4,5 н. что отвечает переносу 12 моль воды на 1 моль
соли.
При обессоливании природных вод, содержащих ио-
ны Са2+ и SO^-, степень концентрирования рассола
ограничена возможностью выпадения осадка в камере
концентрирования. Во избежание этого необходимо, что-
бы произведение концентраций указанных ионов не
превышало произведения растворимости сульфата каль-
ция. При обессоливании жестких вод нужно исклю-
чить нежелательное отложение CaS04 на мембранах
и в соединительных, каналах возможно при большом
расходе исходной воды на промывку; в этом случае со-
отношение объема продукта к объему промывных вод
составляет 1 1.
Плотность тока в электродиализаторах колеблется
в пределах 0,2—1,0 А/дм2, причем чем больше плотность
тока, тем выше производительность аппарата, но тем
значительнее, затраты электрической энергии на полу-
чение 1 м3 обессоленной воды. Для каждой* конкретно-
го случая существует оптимальная плотность тока, ко-
торая обеспечивает достаточно высокую производитель-
ность процесса при относительно небольшом расходе
электрической энергии. В зависимости от числа камер,
степени минерализации исходной и получаемой воды на-
пряжение на электродиализаторе бывает равным 300—
500 В, но иногда достигает 900—1000 В. Более, высокие
8*
115
напряжения нежелательны по соображениям техники
безопасности. Число электрически последовательно сое-
диненных камер в отдельном блоке опреснительного ап-
парата колеблется от 100 до 1000.
По режиму яитания электродиализные установки
разделяют на прямоточные, когда требуемая степень
обессоливания воды достигается за один проход жид-
кости через аппарат, и циркуляционные, когда вода
в процессе обработки проходит через аппарат несколько
раз. Встречаются и установки смешанного типа, напри-
мер, при обессоливании морской воды в малопроизводи-
тельных установках, где вода, подлежащая обессолива-
нию, многократно циркулирует через систему, а промы-
вочная вода в камерах концентрирования сбрасывается
после одного прохода.
По способу соединения камер в гидравлическую схе-
му электродиализаторы делят на аппараты с последова-
тельным и параллельным соединением цепи. При по-
следовательном соединении камер благодаря большо-
му пути, преодолеваемому обрабатываемой жидкостью,
лучше обеспечивается прямоточная работа электродиа1
лизаторов, но из-за перепада давлений в соседних ка-
мерах механическая нагрузка на мембраны увеличива-
ется. При параллельном соединении создаются лучшие
условия для удаления пузырьков воздуха из камер
и гидравлическое давление жидкости распределяется
более равномерно.
Деминерализация электродиализом основана иа от-
делении сравнительно небольшого количества минераль-
ных примесей от значительного объема воды. Это об-
стоятельство является весьма существенным при оценке
перспектив дальнейшего развития метода для демине-
рализации маломинерализованных вод. В настоящее
время электродиализ с ионообменными мембранами,
еще далек от совершенства. Усилия многих ученых ми-
ра направлены не только на изучение теории процесса,
но и на решение ряда научно-технических вопросов,
связанных с конструированием аппаратуры, повышени-
ем качества применяемых материалов, в частности
мембран и электродов. Современные аппараты, состоя-
щие из многих сотен камер, конструктивно сложны, так
как в сборке элементы каждой мембраны и рамки долж-
ны точно соответствовать другим деталям (несоответст-
116
вне хотя бы между одной парой элементов может сде^
лать аппарат неспособным к нормальной работе).
Считается, что содержание солей в обессоливаемой
воде, которую целесообразно подвергать электродиали-
зу, колеблется между 1 и 10 г/л.. В ряде работ отмече-
но значительно меньшее исходное содержание солей
для электродиализа воды. При концентрации больше
10 г/л более экономичным является выпаривание, при
котором стоимость 1 м3 пресной воды мало зависит от
исходного содержания солей. В случае электродиализа
воды, содержащей менее 1 г/л минеральных солей, за-
траты электрической энергии на преодоление омическо-
го сопротивления раствора в камерах обессоливания
значительны, и процесс становится менее экономичным,
чем метод ионного обмена. В последнее время найден
способ снижения нижнего предела концентрации обес-
соливаемого раствора введением в камеры обессолива-
ния смеси гранулированных катионита- и анионита. Этот
прием, хотя и вызывает усложнение конструкции аппа-
рата, позволяет получить воду, не только равную по
чистоте дистиллированной, но и глубокообессоленную.
ЭЛЕКТРОХИМИЧЕСКАЯ РЕГЕНЕРАЦИЯ ИОНИТОВ
Идея электрохимической регенерации ионитов была
выдвинута в 1948 г. [105]. Через колонку, заполненную,
например, Na-катионитом, пропускали постоянный
электрический ток и поток дистиллята, направленный от
анода к катоду. Ионы водорода, образующиеся на ано-
де, мигрировали к катоду, вытесняя на своем пути ионы
Na+ и переводя катионит в Н-форму. На выходе из ко-
лонки у катода получался раствор едкого натра. Анало-
гичным образом при противоположном направлении по-
тока дистиллята регенерируется анионит.
Описанный процесс пригоден не столько для элект-
рохимической регенерации ионитов, сколько для элект-
рохроматографического разделения ионов, сорбирован-
ных ионитом. К условиям электрохимической регенера-
ции ионитов для технологических целей предъявляют
специфические требования. Необходимо, чтобы регене-
рируемый слой имел минимальную толщину, а поток
117
омывающего раствора был замкнут и направлен перпен-
дикулярно электромиграции ионов. Наименьшая толщи-
на слоя ионита диктуется из необходимости минималь-
ных затрат электрической энергии на единицу продукта
и, следовательно, минимальных омических потерь на-
пряжения. Поперечное направление потока для тонкого
слоя ионита легче осуществить, чем продольное по чис-
то конструктивным соображениям. В целях сведения
к минимуму расхода воды на регенерацию необходимо
замкнуть цикл жидкости, омывающей ионит.
Количественную теорию электрохимической регене-
рации ионитор удалось создать лишь в 1969—1972 гг.
[106, 107]. Эта теория рассматривает два случая.
В первом противоионы в каждый момент времени рав-
номерно распределяются по объему колонки. Такой ва-
риант реализуется, например, при циркуляции охлаж-
дающего раствора через регенерируемый ионит. В этих
условиях зависимость степени регенерации ионита 7 от
безразмерного количества прошедшего электричества Q
может быть описана соотношением:
t|Q = 7 —[Y + ln(l-Y)l/u
где г| — коэффициент, учитывающий долю тока, переносимого про-
тивоионами с отдающей стороны мембраны (т] колеблется между
0,71 и 0,85); Q — безразмерное количество электричества, определяе-
мое из формулы_(? = 1Тр£с (i — ток; X — время регенерации; F —
число Фарадея; q0 — количество регенерируемого ионита); о — от-
ношение подвижностей замещаемого и замещающего ионов.
Вследствие гетерогенности самих ионитов величина
v не может быть найдена из соотношения электропро-
водимости ионитов, равновесных с растворами любой
концентрации. Так как величина v характеризует отно-
шение подвижностей противоионов в самом ионите, т. е.
в его гелевых участках, для вычисления необходимо
пользоваться величинами электропроводимости рассмат-
риваемых ионных форм в точке изоэлектроАроводимо-
сти. Экспериментальная проверка показала хорошую
применимость приведенного соотношения для описания
процесса электрохимической регенерации разнообразных
солевых форм различных ионитов [106, 108].
В том случае, когда ионным обменом между различ-
ными точками регенерируемой ионообменной колонки
118
можно пренебречь, кинетика электрохимической регене-
рации описывается уравнениями [107]:
V = 1 1/» < r)Q
Анализ уравнений показывает, что ионный обмен меж-
ду различными точками колонны снижает скорость
электрохимической регенерации. Действительно, с уве-
личением скорости циркуляции охлаждающего раство-
ра, ускоряющим ионный обмен между различными точ-
ками колонки, снижается скорость регенерации.
Если в ионите присутствуют два вида ионов, которые
заменяются третьим, в условиях постоянства состава
колонки в различных точках кинетика регенерации мо-
жет быть определена из соотношений:
"Й2 + «э<7а = "Л?1
<7i + </2 + <7з = <7о
где &i=—idx/Fdgt—1; кг——idxlFdqi—1; й] к cj) — соответственно
подвижность и количество /-иона.
Последние выражения удовлетворительно описывают
процесс регенерации, если отношение и^Щ не слишком
отличается от единицы [109].
Кинетика электрохимической регенерации гомоион-
ных форм слабоэлектролитных ионитов, для которых
величина v велика, описывается уравнением [110]:
При электрохимической регенерации бифункциональ-
ных ионитов, содержащих слабо- и сильнодиссоцииро-
ванные группы (например, Na-формы катионита КУ-1),
ионы водорода вначале замещают противоионы Na+,
локализованные около фенольных групп. Эта стадия
процесса описывается последним уравнением. Вторая
стадия, где происходит замещение ионов Na+, локали-
зованных около сульфогрупп, описывается уравнением,
приведенным на стр. 118 [111].
119
При повышении температуры скорость электрохими-
ческой регенерации ионнтов растет. В случае сильно-
электролитных ионитов это можно объяснить увеличе-
нием значения v: энергия активации электропроводимо-
сти для солевых противоионов больше, чем для ионов
водорода или гидроксила. Поэтому с увеличением тем-
пературы подвижность солевых противоионов растет
быстрее, чем ионов водорода и гидроксила и v увеличи-
вается. В случае слабоэлектролитных ионитов ускоре-
ние регенерации может быть связано с увеличением
степени гидролиза. Не исключено, что этот же фактор
в некоторой степени ускоряет регенерацию и сильно-
электролитных ионитов.
Особый интерес представляет рассмотрение влияния
концентрации раствора,' находящегося между зернами
ионита, на энергетические параметры процесса электро-
химической регенерации. Расход электроэнергии Wy
для достижения заданной степени регенерации у, вычис-
ляется по формуле:
т—
V
W-=^i(x)U(x)dx
о
где i(t) и £/(т)—функции изменения силы тока и напряжения
U во время регенерации.
При увеличении концентрации раствора электриче-
ское сопротивление ионообменной колонки понижается,
что способствует уменьшению расхода электроэнергии.
Вместе с тем для большинства практически важных си-
стем соотношение между v, v и константой обмена про-
тивоионов на ион водорода (в случае катионитов) или
на ион гидроксила (в случае анионитов) таково, что
с ростом концентрации раствора выход по току проти-
воиона падает и, следовательно, растет расход элект-
роэнергии. Поэтому зависимость расхода электроэнер-
гии от концентрации циркулирующего раствора (С)
может иметь экстремальный характер. Действительно,
при регенерации Na-формы катионита КУ-2 кривая
Wy — С проходит через минимум, который лежит в об-
ласти 0,01—0,03 н. растворов, а минимальный расход
электроэнергии для достижения 30, 60 и 85% -ной сте-
120
Рис. 32. Границы между зернами катио-
нита и анионита в электрическом поле.
пени регенерации при плотности
тока 4,45 А/дм2 равен соответ-
ственно 0,36, 0,96 и 2,3 кВт-ч/экв.
Аналогичные результаты получе-
ны при электрохимической реге-
нерации Na-формы катионита
КБ-4: минимальный расход элек-
троэнергии для достижения 60 и 80%-ной степени реге-
нерации при плотности тока 4,45 А/дм2 составил соот-
ветственно 0,3 и 0,6 кВт-ч/экв [ПО]. Прн большей плот-
ности тока расход электроэнергии увеличивается при-
мерно пропорционально квадрату плотности тока.
Кинетика электрохимической регенерации гранули-
рованных ионитов в присутствии электролита может
быть рассчитана из значения дифференциального выхо-
да по току (Лд). вычисляемого исходя из концепции
трехпроводной модели:
= 1-е/Кт _ с/Кт
Щ l + C/Vg-n/u ,+ l+(l/Yg-I)/u
где о — отношение лодвижностей замещаемого и замещающего
ионов в растворе; yg и Ye — доля противоионов соответственно в
растворе и ионите.
Среди электрохимических способов регенерации
ионитов наибольшее внимание привлекает регенерация
смешанного слоя. Еще в 1955 г. ее пытались применить
для непрерывного обессоливайия воды [112]. Однако
в то время не был изучен механизм переноса электриче-
ского тока в смешанном слое ионитов, который сводит-
ся к следующему {113]. В смешанном слое между зер-
нами катионнта К и анионита А в зависимости от на-
правления тока существуют четыре типа границ
(рис. 32):
К-К
А-А
К-А
А-К
Пусть ток проходит через систему слева направо,
а зерна ионитов соединяются между собой прямым кон-
тактом и частично через слой раствора, находящегося
121
между ними. На границе К—К катионы из леЁого зер^
на переходят в правое непосредственно через контакт
или через раствор, прн этом протекание тока не вызы-
вает никаких заметных концентрационных изменений
ни на самой границе, нн в ее окрестностях. Аналогично
ведет себя и граница А—А, движение носителей тока —
анионов противоположно направлению катионов. На
>- >-
границах К—А и А—К происходит смена природы носи-
телей тока. Переход от катнонной проводимости тока
*-
к анионной 'на границах К—А связан с накоплением
нонов солн, т. е. концентрированием раствора; переход
же от анионной проводимости к катнонной для границы
>-
А—К приводит к уходу нонов обоих знаков нз раствора
в ионообменный материал и, следовательно, к уменьше-
нию концентрации раствора у этой границы.
>-
Концентрирование раствора на границе К—А вызы-
вает диффузионный нлн конвективный перенос вещества
»-
в основную массу раствора, а нз нее — к границам А—К
с уменьшенным содержанием солен. Одновременно про-
исходит и перераспределение силовых линии тока. Со
>-
снижением концентрации солн у границ А—К растет
сопротивление и падает доля тока, протекающего через
>■
эти участки. Границы же К—А с увеличенной проводи-
мостью привлекают на себя дополнительную часть ли-
—■—*-
ннй тока. Более интенсивная работа границ К—А по
>-
сравнению с границами А—К приводит к накоплению
электролита в жидкой фазе. Однако это накопление не
беспредельно. Ему препятствуют процесс переноса но-
нов в электродные камеры и процесс диффузионного по-
глощения электролита зернами ноннта, который стано-
вится более интенсивным по мере увеличения концент-
рации солн в жидкой фазе. Поэтому в системе со вре-
менем устанавливается стационарное состояние.
Однако концентрация примесных ионов в воде, вы-
ходящей из камеры обессолнвання, заполненной сме-
шанным слоем ионитов, прн наложении поля постоянно-
го электрического тока будет выше, чем в отсутствие
122
тока {ИЗ]. Например, в отсутствие тока установка,
описанная в работе [114], позволяет получать воду
с удельным сопротивлением 22,4 МОм-см, а при плот-
ности тока 0,3 А/дм2 — с удельным сопротивлением
6 МОм-см. Предельно чистую воду можно получить
только в отсутствие тока, поэтому целесообразно вна-
чале регенерировать иониты, а затем уже очищать во-
ду, т. е. вести процесс периодически.
Электрохимическую регенерацию смешанного слоя
можно проводить в камерах обессоливання либо в ка-
мерах концентрирования. Прн электрохимической реге-
нерации смешанного слоя, сильноэлектролитных нонн-
тов в камере обессоливання выход по току возрастает
по мере увеличения плотности тока. Это объясняется
тем, что каждая мембрана (например, катионообмен-
*■
ная МК) граничит с зернами катионита (граница К—
>■ v
МК) и с зернами анионита (граница А—МК). Прн ука-
занном направлении электрического поля перенос тока
>-
на границе К—МК происходит за счет противоионов ка-
*■
тионита, а на границах А—МК — за счет ионов при-
месных солей и ионов Н+ и ОН-, образующихся при
►-
диссоциации воды. Перенос тока через границу А—МК
снижает степень регенерации катнонита. При увелнче-
*-
нин плотности тока сопротивление границ А—МК воз-
растает и доля тока, протекающего через них, падает.
В результате растет доля тока, протекающего через
*■
границы К—МК и, следовательно, повышается эффек-
тивность регенерации. Для смешанного слоя слабо-
электролнтных ионитов выход по току практически не
зависит от степени регенерации.
Учитывая, что на границе с ионообменными мембра-
нами ток протекает через оба ионита, уравнения, описы-
вающие кинетику электрохимической регенерации смеси
катионита и анионита в условиях, когда состав ионитов
по объему колонки одинаков, можно записать в виде:
•ПЛк<3 = Тк — [1п (I — Тк) + y"k]/~k
TltJaQ = Та — [Iir(I -^ Та) + Та]/~а
где t]„ и t]а—коэффициенты, учитывающие долю тока, переносимо-
го соответственно через кэтиоиит на границе с катиоиообменной
123
мембраной и через аниоиит на границе с аиионообмеиной мембраной;
индексы «к» и «а» показывают, что соответствующие величины от-
носятся к катиониту либо к аниониту.
Зависимость произведения г\цк от концентрации
С (экв/л) раствора электродных камерах для электро-
химической регенерации смешанного слоя ионнтов
КУ-2 н АВ-17 соответственно в Na- и Cl-формах может
быть аппроксимирована соотношением
ЛПк = 0,3+0,3/21000°
Расход электроэнергии для достижения заданной
степени регенерации ионитов в камере обессоливаиия
равен
W- = [W+ (1к/тк + /./т.) ЦС\ х-
причем
т_ =
v
F% (-
ЧЧк
(v-—[In(l-Y) + Yl)
где Ы1 — падение напряжения в камере обессоливаиия (как пока-
зали -эксперименты, оно практически не зависит от концентрации
электродных растворов и степени регенерации ионитов); / — толщи-
на электродных камер; т — коэффициент пропорциональности меж-
ду электропроводимостью раствора и его концентрацией.
Последнее уравнение позволяет с помощью обычных
методов найти ту концентрацию раствора в электрод-
ных камерах, при которой затраты электроэнергии на
регенерацию будут минимальными (рис. 33).
Заметное влияние на
кинетику электрохимиче-
ской регенерации сме-
шанного слоя ионитов в
камере обессоливаиия
0,04 0,08 ОД 0,16
Концентрация, экО/п
0,20
Рис. 33. Зависимость расхода
электроэнергии от концентра-
ции электродного раствора при
электрохимической регенерации
смешанного слоя Na- и
Cl-форм ионитов КУ-2 и АВ-17
соответственно, взятых в отно-
шении 1 1,4, при различной
плотности тока.
124
оказывает природа ионообменных мембран: при уста-
новке сильноэлектролитных мембран регенерация сме-
шанного слоя протекает быстрее, чем при установке сла-
боэлектролитных.
Рассмотрим причины такого влияния иа примере замены силь-
нокислотной катионообмениой мембраны иа слабокислотную. При
регенерации смешанного слоя ионитов в камере обессоливания ис-
>-
точииком ионов гидроксила является граница А—МК. При проте-
кании тока через эту границу ионы гидроксила, двигаясь через зерна
анионита, регенерируют их. Возникающий при этом поток иоиов Н+
движется в катионообмениой мембране и переводит ее в месте кон-
такта в водородную форму. Так как слабокислотные иониты в
Н-форме малоэлектропроводны, сопротивление границы повышается
и локальная плотность тока падает. В результате уменьшается гене-
рация иоиов гидроксила и как итог — степень регенерации аниони-
та. Аналогичен характер регенерации слабоосновной аиионообмен-
ной мембраны, применение которой по сравнению с сильноосновной
будет замедлять регенерацию катионита. В соответствии с этими
представлениями находятся результаты, показывающие, что в каме-
ре обессоливания степень регенерации анионита уменьшается по ме-
ре удаления от катионообмениой мембраны, а степень регенерации
катионита—ло мере удаления от анионообменной [116].
Как и в случае индивидуальных ионнтов кинетика
электрохимической регенерации смешанного слоя зави-
сит от состава протнвоионов. С заменой высокоподвиж-
ных нонов на малоподвижные снижается скорость ре-
генерации смеси, в то же время с увеличением доли
подвижного нона повышается степень извлечения мало-
подвижного.
Взаимное влияние протнвоионов на скорость реге-
нерации объясняется, во-первых, различной их гидра-
тацией. В большинстве случаев более подвижные про-
тивононы вызывают большую гидратацию системы, чем
менее подвижные. Поэтому в присутствии тех и других
нонов на долю менее подвижного приходится больше
воды, чем в чистой гомоионной форме. В результате
этого скорость менее подвижного иона увеличивается.
Для более подвижного нона наблюдается обратный эф-
фект.
Другой причиной наблюдаемого явления может быть
существование зависимого и независимого движения
ионов в гетероионных формах ноннта [61]. Согласно
этим представлениям, ноны в ионите могут двигаться
как независимо друг от друга (подобно ионам в иде-
альных растворах), так и по вакансиям — от одного
125
Рис. 34. Схемы электрохимической регенерации смешанного слоя.
ионитов.
фиксированного иона к другому. Такое движение ионов
также должно приводить к ускорению менее подвижно-
го иона в присутствии более подвижного и наоборот
к замедлению более подвижного. Независимое движе-
ние ионов в ионите отвечает параллельному соединению
фаз-проводников, движение ионов по вакансиям — по-
следовательному соединению. Результирующая электро-
проводимость зависит от доли каждого соединения фаз-
проводников и уменьшается с увеличением плохопрово-
дящей фазы. Следовательно, добавление более прово-
дящей фазы должно способствовать большей подвиж-
ности ионов менее подвижной и росту доли параллель-
ного соединения фаз-проводников [117].
Электрохимическую регенерацию смешанного слоя
ионитов можно осуществить по трем схемам (рис. 34).
В схеме а регенерация идет за счет переноса противр-
ионов ионитов в электродные камеры; место ушедших
противоионов занимают ионы Н+ и ОН-, мигрирую-
■*
щие в слой ионита соответственно от границ К—МА
■ч
и МК—А. В схеме б регенерация протекает в результа-
те перераспределения ионов в ионообменной системе
под влиянием поля электрического тока. Противоионы
соли, вышедшие из ионитов на границах А—К, удаля-
ются из системы потоком раствора, а их место занима-
ют ионы Н+ и ОН-, переносящие ток на границах К—А.
В схеме в регенерация смешанного слоя ионитов идет
по двум, указанным в схемах а и б направлениям.
126
При одинаковой плотности тока выход по току т)
ионов Na+ в указанных схемах регенерации (а, бив)
смеси ионитов КУ-2 и АВ-17 размещается в ряду
(рис. 35): г\а<.г\б<.Цв. Такой порядок, по всей вероят-
ности, связан с тем обстоятельством, что регенерация
по схеме а осуществляется в результате прохождения
■Ч
тока через границы МК—К. Регенерация по схеме б
■<
протекает благодаря переносу тока через границы А—К,
количество которых много больше. Наконец, в схеме в
используются оба указанные процесса и поэтому реге-
нерация протекает быстрее, чем в первом и во втором
случаях.
При одинаковой степени регенерации связь между
выходом по току и плотностью тока в схемах бив но-
сит антибатный характер, тогда как в схеме а — сим-
батный. Такой характер, вероятно, связан с тем, что
в схемах бив при постоянной скорости протока- и оди-
наковом количестве прошедшего электричества темпера-
тура протекающего раствора и его концентрация при
меньшей плотности тока будет ниже, чем при более вы-
сокой. Это замедляет скорость сорбции электролита
и повышает степень регенерации.
В схемах бив наиболее регенерируемыми оказыва-
ются нижние слои ионита, куда поступает дистиллиро-
ванная вода с малым содержанием примесных ионов.
В верхние слои ионита попадает вода, обогащенная
-<
солями, вышедшими в раствор на границах А—К, что
-<
повышает сорбцию противоионов на границах К—А
и снижает степень регенерации.
Рис. 35. Зависимость степени
электрохимической регенерации
Na-формы катионита К.У-2,
смешанной с Cl-формой анио-
нита АВ-17, при скорости по-
тока 3,5 об/мин от плотности
тока и схемы регенерации
(цифры у кривых отвечают
плотности тока в А/дм2, 6yKi
вы — схеме регенерации).
§.««
й 0,it
=5.
I 0,1
а
1в
- ///у^^
у 1 1
16
1 .
j^-~ 26
2а
1а
i
/ 2 3 4 5"
безразмерное количество
электричества
127
Г
о
2ау
^Ш^^Е^^^ ,
la
'1 2в
//26
1в
Рис. 36. Зависимость степени
регенерации от расхода элект-
роэнергии при схемах регене-
рации а, б и в смешанного слоя
ионитов КУ-2 и AB-I7, взятых
в отношении I 1,4 соответст-
венно в Na- и Cl-формах
(цифры у кривых отвечают
плотности тока, буквы — схеме
регенерации).
0,2 0,4-
Стьпень регенерации
0,6
Наиболее важным показателем при оценке того или
иного электрохимического способа регенерации являет-
ся расход электроэнергии,, который увеличивается с по-
вышением плотности тока. Причем каждое последую-
щее приращение степени регенерации связано с боль-
шими затратами электрической энергии, чем предыду-
щее. Заданная степень регенерации смеси ионитов КУ-2
и АВ-17 с наименьшими затратами достигается в схе-
ме б (рис. 36), так как по этой схеме падение напря-
жения имеет минимальное значение [118, 119].
ОБЕССОЛИВАНИЕ ВОДЫ ЭЛЕКТРОАНАЛИЗОМ
Апнараты без насадки. Электродиализаторы без
ионообменной насадки просты в изготовлении и эксплуа-
тации. Доступность промышленных образцов безнаса-
дочнЫх электродиализаторов предопределила широкий
фронт исследований в этом направлении (серийный вы-
пуск аппаратов налажен на Алма-Атинском электроме-
ханическом и на Тамбовском механическом заводах).
Подготовка воды перед обессоливанием электродиа-
лизом заключается в удалении железа и умягчении во-
ды катионированием. Степень концентрирования рассо-
ла определяется выпадением в осадок труднораствори-
мых соединений и в первую очередь сульфата кальция.
Для предупреждения выпадения осадка рассол обычно
подкисляют. Во избежание образования застойных зон
в камерах концентрирования около 80% полученного
рассола возвращают на циркуляцию. В работе [120]
описано применение электродиализатора ЭДУ-1000
с уменьшенным числом камер для обессоливания мос-
ковской водопроводной воды.
128
Исходная вода фильтровалась через сульфоуголь и пвдавалась
в камеры обессоливания. Параметры работы установки следую-
щие:
Расход воды, м3/ч
в камерах обессоливания ... 4
на промывку камер концентрирования
и электродных камер 0,4—0,6
Температура исходной воды, °С • '8
Напряжение максимального обессоливания, В 350
Плотность тока, А/дм2 0,17
рН . . 7,27
Эффект обессоливания, % 55
Расход электроэнергии, «Вт-ч
в электродиализаторе 0«3
на работу иасосов 1.2
При уменьшении жесткости с 7 до 2 мэкв/л содержание примесей
падало следующим образом (в мг/л):
СГ Sol" НСОз SiOa
Начальное 111 31 174 12
Конечное 72 17 71 8
При сроке службы электродиализатора 3—4 года амортизаци-
онные отчисления, составят 4—6 коп./м3. Таким образом, минималь-
ная стоимость 50% обессоливания воды электродиализом (без уче-
та затрат на обслуживание) равна 6—8 коп./м3.
Эти же авторы провели исследование обессоливания
воды с помощью электродиализатора ЭДУ-2, собранно-
го на основе мембран МК-40 и МА-40 размером 500Х
Х500 мм [121]. Корпусные рамки лабиринтного типа
с просечно-растянутой сеткой, образующие рассольные
и обессоливающие камеры, были изготовлены из двух
поливинилхлоридных пленок толщиной 0,6 мм. Длина
пути потока воды в камерах составила 180 см. Перед
электродиализом вода проходила очистку от железа,
осветление со взвешенным осадком, фильтрацию через
скорые механические и сульфоугольные фильтры. По-
лученные данные (табл. 13) показывают, что наиболь-
шее снижение содержания солей (65—76%) наблюда-
ется при скорости 3 см/с и напряжении на аппарате
30 В, или 3,3 В на ячейку (без учета падения напряже-
ния на электродах). Дальнейшее увеличение напряже-
9—360
129
Таблица 13. Обессоливание волжской воды в
электродиализаторе ЭДУ-2
Показатели
Напряжение, В
Плотность тока, А
Жесткость общая,
мэкв/л
Содержание, мг/л
С1-
SiO«-
всего солей
РН
Эффект обессолива-
ния, %
Расход электроэнер-
гии, кВт-ч/м3
Исход-
ная
вода
—
2,8
28
П.2
240
10
—
—
Обессоленная вода при скорости движения
воды в ячейках
9 см/с в см/с
15
1,2
1,4
17
7
165
9,7
34
0,05
50
1,9
0,67
9,3
6,1
103
4,6
59
0,26
15
0,9
1,2
13
7,1
123
8,7
51
0,06
50
1,25
0,56
7,2
6
81
4,1
68
0,26
3 см/с
15
0,42
0,8
11
e.i
96
5,9
61.
0,05
50
0,54
0,26
3,1
6
68
4,06
73
0,23
ния в 2,3 раЭа повышает эффект обессоливания всего
лишь на 10%, а расход электроэнергии — на 270%.
Проведенные технико-экономические расчеты (табл. 14)
показывают, что предварительное обессоливание элект-
родиализом речной воды перед деионизациеи ее ионным
обменом снижает стоимость обработки на 32%, капи-
тальные затраты уменьшаются при этом на 19%.
Критическая плотность тока линейно растет до кон*
центрации солей в исходной воде около 1 г/л (рис. 37).
Напряжение, соответствующее критической плотности
тока UKP, при концентрации солей в исходной воде ме-
нее 1-г/л и скорости потока 9 см/с составляет 1,1 В на
ячейку, а при содержании от 1,0 до 1,5 г/л — увеличива-
^ в.В
5: '
~* о,г
;
_ i i _i—i—i—■
Ofi 0,6 0,8 1,(1 1,1 J4
Каннгитроция, г//7
Рис. 37. Зависимость критической
плотности тока tHp при скорости
потока 9 см/с от концентрации со-
лей в исходной воде.
30
<5 Таблица 14. Калькуляция себестоимости глубокого обессоливания воды с начальным "содержанием солей
800 мг/л при производительности станции 300 м3/ч
Составляющие капитальных
затрат, тыс. руб.
Обессоливающее оборудование
(фильтры, электродиализато-
ры без смол н мембран)
Насосы-дозаторы, декарбони-
заторы, выпрямители, элек-
трооборудование и пр.
Трубопроводы, задвижки,
фланцы и пр.
КИП и автоматика
Смолы
Мембраны (руб.)
Итого
Трехсту-
пенчатый
ионный
обмен
90
ПО
146
170
758
1274
Электро-
диализ-f-
+трехсту-
пеичатый
иоииый
обнен
213
140
146
186
211
75
1031
Составляющие эксплуатационных
затрат, тыс. руб.
Электроэнергия на перекачивание н
ведение процесса
Реагенты с учетом транспортных
расходов
Амортизация
мембран и смол
основного оборудования
Текущий ремонт
Годовые затраты на зарплату с на-
числениями
Итого
Приведенные затраты
Себестоимость 1 м3 обессолеииой
воды (руб.)
Трехсту-
пенчатый
нонвый
обмен
19
330
128
24
67
10
580
733
0,22
Электро-
дналиэ-f-
+трехсту-
пенчатый
ионный
обмен
49
137
80
42
85
16
410
538
0,15
ется с 1,1 до 1,66 В. Интересно отметить, что при малом
межмембранном расстоянии (<0,3 мм) появление кри-
тической плотности тока вообще незаметно [122].
Об опыте обессоливания балхашской воды исходной
минерализацией 1280 мг/л до конечного содержания со-
лей 100 мг/л сообщается в работе [123]. При последо-
вательном включении шести электродиализаторов
ЭДУМ-300, скорости потока в камерах обессоливания
24 см/с (или 2 м3/ч) и напряжении на каждом аппарате
300 В расход электроэнергии составил 6,2 кВт-ч/м3,
в том числе на перекачивание — 3 кВт-ч/м3. Установка
работала нестабильно: после 67 ч работы в катодной
камере и близлежащих рассольных камерах наблюда-
лось отложение осадка, которое, по мнению авторов,
можно предотвратить подкислением рассола, введением
буферных камер, разделенных инертными диафрагмами.
В работе [122] сообщается об обессоливании арте-
зианской воды с помощью электродиализатора ЭДС-84.
В электродиализаторе 84 мембраны (МК-40 и МА-40
размером 400X400 мм), разделены на две секции. Меж-
мембранное расстояние 0,3 мм, коэффициент полезного
использования площади мембраны 0,9, коэффициент
увеличения сопротивления камер за счет введения не-
электропроводных прокладок 1,2. Перед электродиали-
зом вода фильтровалась через березовый активирован-
ный уголь и проходила через катионит КУ-2 в Н-
форме.
Увеличение напряжения на аппарате до 10 В резко
повышало удельное сопротивление обессоленной воды
(рис. 38). При дальнейшем увеличении напряжения ско-
рость роста удельного сопротивления диализата замед-
лялась. Затраты энергии на обессоливание артезиан-
ской воды от удельного сопротивления 4,5 до
20 кОм-см невелики и не превышают 1,5 кВт-ч/м3, про-
изводительность парных мембран составляет
0,55л/(ч-дм2) [122].
По мере увеличения длины хода потока диализата
степень обессоливания его увеличивается. Пользуясь
данными, приведенными на рис. 39, можно выбрать
нужную высоту электродиализатора или число ступеней
при заданной степени обессоливания и плотности тока
[124].
132
2,0
:J,6
!*2
sea
OA
0
ж
p 1
Л^?^?'- 38 л/ч
^я >■-80л/ч
о- 180 Л/Ч
л- 280Л/Ч
i i i i
40 80 120 160 200
Напряжение, В
2 -
^^---^-^■ш
40 80 110 160 200
Напряжение, В
ПроизВодительность^/ч
320 480 640 800^
40 80 120 160 200
Напряжение, В
40 80 120 160 200 о-
Напрл/кение, В
Рис. 38. Зависимость силы тока (а), удельного сопротивления (б),
рН диализата и концентрата (в) и расхода электроэнергии (г) от
падения напряжения на электродиализаторе на установках разной
производительности пци обессоливании диализата до удельного со-
противления 20 кОм-см (цифры у значков — производительность ус-
тановки, сплошные линии относятся к диализату, пунктирные — к
концентрату).
Обессоливание водопроводной воды до уровня дис-
тиллированной проводилось в 50-камерном аппарате
при рабочей поверхности каждой мембраны 60 см2
и межмембранном расстоянии 0,5 мм [125, с. 271 —
279]. Удельное сопротивление воды повысилось с 4—10
до 140—270 кОм-см; производительность установки при
этом изменялась от 2,5 до 0,5 дм3/ч. Исходная вода
фильтровалась через бумажный фильтр, раствор в рас-
сольных и электродных камерах стабилизировался сер-
ной кислотой.
В последующих работах авторы [126] на моделях
многокамерных аппаратов развили кинетический метод
133
исследования процесса электродиализа, позволяющий
изучать работу электродиализатора при различных
гидродинамических и электрических режимах. Ими
лолучен ряд эмпирических зависимостей для проекти-
рования аппаратов промышленного типа.
Электродиализаторы с близкорасположенными мем-
бранами были применены для локальной очистки про-
мывных вод после ванн кадмирования, хромирование,
никелирования и цинкования. Обессоленная вода воз-
вращалась на промывку деталей, а извлеченные со-
ли — в кроющие ванны. Энергетические затраты при
этом не превышали 1,0—1,5 кВт-ч/м3. Опытно-промыш-
ленная установка вместе с источником питания и пуль-
том управления (габариты 800X400X450 мм) позволя-
ла проводить очистку со средней производительностью
2 м3/ч. Данные о стабильности работы опытно-промыш-
ленной установки не приводятся [127].
При электрохимической деминерализации маломине-
рализованных вод в аппаратах без насадки основные
энергетические потери приходятся на преодоление оми-
ческого сопротивления раствора. Действительно, удель-
ное сопротивление деионизированной воды на один-два
порядка больше сопротивления ионообменных мембран.
Поэтому естественно стремление исследователей сокра-
тить межмембранное расстояние до минимально воз-
можного.
Наиболее перспективными являются конструкции
аппаратов с профилированными мембранами и проклад-
ками струнного типа [128]; из них аппараты с профили-
рованными мембранами более просты: собирают аппа-
раты наложением мембран друг на друга без примене-
ния прокладок, рамок, различных сепараторов и т. д.
К недостаткам их необходимо отнести малую гидрав-
Рис. 39. Зависимость степени
обессоливания от длины хода
потока диализата при содер-
жании солем в исходной воде
500 мг/л, скорости потока
4 см/с и различной плотности
тока:
/ — 10,9 А/м2; 2—16,4 А/м2; 3~
27,3 А/мг; 4 — 32,8 А/м2; 5 —
43,7 А/ма.
0 20 1*0 в0 НО 100
Длина кода потока см
134
лическую герметичность пакета мембран, в результате
чего появляются перетоки между камерами обессолива-
ния и концентрирования. Этот недостаток можно устра-
нить, применив водостойкие герметики либо повысив
давление стягивания пакета мембран. К сожалению, во-
достойкие герметики пока малодоступны, а повышенное
давление сжатия вызывает постепенное выравнивание
рубчиков на ионообменных мембранах вследствие теку-
чести полиэтилена.
Необходимо отметить, что удельное давление сжа-
тия гтакета мембран у электродных камер выше, чем
в центре пакета. Поэтому распределительные щели
в камерах, расположенных ближе к электродам, оказы-
ваются уже, чем в центре пакета. Это приводит к не-
равномерному распределению потоков в параллельно
работающих камерах и нарушению нормальной работы
всего аппарата. Указанные недостатки присущи и элект-
родиализаторам с прокладками струнного типа. Для
устранения их предлагается делать герметизирующие
рубчики и струны большего размера, однако это пред-
ложение нуждается в длительной проверке на много-
камерных (100—400 камер) аппаратах.
К недостаткам профилированных мембран необхо-
димо также отнести их коробление при набухании
и технологические трудности, связанные с большой точ-
ностью изготовления пресс-форм или прокатных станков.
Электрохимические свойства ионообменных мембран
практически не изменяются в процессе профилирования
[129]. Аппараты с прокладками струнного типа выгод-
но отличаются тем, что в них применяют стандартные
мембраны. Однако для изготовления прокладок струн-
ного типа необходимы специальные станки.
Аппараты с насадкой. Исследование механизма пе-
реноса электрического тока через смешанный слой иони-
тов позволило по-новому подойти к обессоливанию во-
ды в электродиализаторах с ионообменной насадкой.
Ранее считали, что чем выше плотность тока, тем более
чистой будет вода; теперь стало ясно, что, благодаря
разному механизму переноса тока на границах К—А
>-
и А—К существует такая плотность тока, при которой
удельное электрическое сопротивление обессоленной во-
ды будет максимальным (рис. 40).
135
SS
no
wo
80
GO.
20
- а-г /
д-г /
" о-U ш
/л „
Ю I I I 1 I
0,6 л/ч ^
• 8—~у-л
'л/ч ^^
. L 1
100 200 300 ЦОО 500 600 700 800
Плотность тока^А/дм2
Рис. 40. Зависимость удельного сопротивления ( ) и рН
( ) воды, обессоленной на различных нонитах, от плотности
тока:
/ —АВ-17-10П и КУ-242П; 2 — АВ-17-10П и КУ-2; Л — АВ-17 и КУ-2; 4 —
КУ-2-12П и АВ-17 (цифры у кривых — скорость потока).
Появление максимума на кривых р—i можно объяснить следую-
щим образом. Материальный баланс солей при электродиализе с
ионообменной насадкой определяется взаимодействием таких пото-
ков: входящим потоком <7вх, потоком, перенесенным через мембраны
qK, потоком, выходящим из аппарата <7вых, потоком, выходящим на
%
границах К—A «7,73V и потоком солей, сорбированных на границах
ТК-А'
В стационарных условиях
<7м — <?вх — <7вых
Учитывая, что в смешанном слое ионитов поверхность контактов
д—к много больше неэкранйрованной поверхности ионообменных
мембран, можно допустить, что через ионообменные мембраны пере-
носится только то, что сорбировано смешанным слоем ионнтов
(рис. 41):
•<7м:
А-к К-А
Как видно из рис. 41, величина </м проходит через максимум. Так
как <7i>x=const, величина </ВЫх должна проходить через минимум, н,
следовательно, удельное сопротивление воды — через максимум.
163
При быстром изменении плотности тока состав ионита не успе-
вает изменяться, количество сорбируемой соли остается практически
постоянным, а количество ионов, вышедших на границах К—А, уве-
личивается. Поэтому кривая р—I, снятая в этом режиме, имеет вид
гиперболы.
Таким образом, меняя плотность тока, можно плав-
но регулировать удельное сопротивление обессоленной
воды, что оказывается очень удобным при проведении
ряда исследовательских работ.
При обессоливании водопроводной воды, прошедшей
угольный и катионитовый фильтры, при постоянной
скорости потока и постоянном падении напряжения на
■электродиализаторе в течение каждого дня работы
удельное сопротивление выходящей воды сначала воз-
растает, а затем достигает некоторого предела. Сила
тока, протекающего через установку, меняется при
этом антибатно. Такое поведение рассматриваемой си-
стемы может быть связано с «отдыхом» ионитов в те-
чение ночи, когда примесные противоионы равномерно
распределяются по всему объему зерна. При включений
тока равномерное распределение противоионов наруша-
>-
ется: на границах А—К постепенно происходит регене-
рация ионитов, условия сорбции примесных ионов улуч-
шаются и удельное сопротивление обрабатываемой во-
ды постепенно повышаетсядостигая некоторого преде-
ла.
При этом солротивление камеры обессоливания уве-
личивается, а сила тока, протекающего через установку,
падает Такой характер изменения кривых р—т и i — т
дает основание говорить об
«отравлении» ионообменных 0
смол. Как показали иссле- 1
дования, «отравлению» под- Ц.
со
>
Рис. 41. Схема, поясняющая по- *
явление максимума на кривых ^
Р '■ Плотность тона
137
вергается анионит; замена гелевого анионита АВ-17
макропористым АВ-17П позволяет примерно в два раза
увеличить удельное сопротивление обессоленной воды
при одновременном повышении стабильности работы
электродиализатора (см. рис. 40).
«Отравление» ионитов уменьшает срок службы
электродиализатора, снижает его производительность
и ухудшает качество очищаемой воды. «Отравление»
Может происходить в результате разрушения ионита
в связи с его естественным старением либо в результате
сорбции различных «отравляющих» веществ. Такие ве-
щества могут присутствовать в обрабатываемых раство-
рах либо они появляются в насадке в результате дест-
рукции ионита и жизнедеятельности микроорганизмов,
живущих на ионитах.
Естественное старение ионитов в данных условиях
не может изменить их свойства в течение месяца, а в
дистиллированной воде после активированного угля
присутствие «отравляющих» веществ незначите-
льно.
Следовательно, причиной «отравления» ионитов мо-
гут быть либо продукты их собственной деструкции, ли-
бо продукты жизнедеятельности бактерий, живущих на
ионитах, что было подтверждено специальными иссле-
дованиями. Однако в реальных условиях роль «отрав-
ления» ионитов продуктами собственной деструкции
и продуктами жизнедеятельности микроорганизмов, ви-
димо, невелика. Но «отравление» ускоряется в электри-
ческом поле за счет электрофоретического вымывания
из ионитов незаполимеризовавшихся органических со-
единений. В ряде случаев «отравление» смешанных
слоев ионитов можно регенерировать 0,3%-ным раство-
ром Н2Ог (2,5 мл раствора на 1 г ионитов) [130]. К со-
жалению, указанный способ не всегда достаточно эф-
фективен, что связано с разным характером веществ,
сорбированных ионитами.
Ионообменные мембраны, работающие в контакте
со смешанным слоем ионитов, также подвержены «от-
равлению» продуктами, электроосмотически вымывае-
мыми из ионитов. Критический ток на катионитовой
и анионитовой мембранах после обработки вытяжками
антиполярных ионитов резко падает {рис. 42, кривые
1 и 2), причем на катионитовой меньше. После обра-
138
О 0,Ь 0,8 1,2 1,6 2,0 0 0,2 0,4 0,6 0,8 1,0
Напряжение, В Иапря/нение, В
а б
Рис. 42. Поляризационные кривые анионитовой (а) и катионито-
вой (б) мембран (при скорости потока 0,075 см/с):
1 — мембрана до обработки; 2 — мембрана, обработанная вытяжкой антнмо-
лярного ионита; 3 — мембрана 2, дополнительно обработанная Н202; 4— мем-
брана 2, выдержанная месяц в дистилляте; 5 — мембрана 4, обработанная
HjOj н механически защищенная.
ботки мембран 0,3%-ным раствором Н202 критический
ток на анионообменной мембране практически восста-
навливается (рис. 42а, кривая 3). Увеличение критиче-
ского тока наблюдается и на катионообменной мембра-
не (рис. 426, кривая 3). Изменение кинетических харак-
теристик мембран обусловлено изменением состояния
их поверхности — образованием пленок сорбированных
веществ [131]. После механического обновления по-
верхности мембраны величина критического тока вос-
станавливается.
Если мембраны, обработанные вытяжкой антипо-
лярного ионита, выдержать месяц в дистиллированной
воде, сорбированные отравляющие вещества внедряют-
ся в глубь мембран. Вид поляризационных кривых при
этом практически не меняется (рис. 42, кривая 4). По-
следующая обработка раствором пероксида водорода и
механическое обновление поверхности не приводят
к полному восстановлению критического тока (рис. 42,
кривая 5). Очевидно, что пероксид водорода плохо
разрушает отравляющие вещества, проникшие вглубь,
о чем свидетельствует также цвет мембран, поверхность
которых зачищалась [217, с. 96—100].
По мере уменьшения расстояния между мембранами
>-
число границ, на которых происходит выход соли К—А,
139
уменьшается, стремясь при толщине слоя в одно зерно
к нулю. Так как на оставшихся биполярных границах
при наложении электрического поля будет проходить
только сорбция ионов раствора, то более перспективно
применение насадочных аппаратов с минимальным меж-
мембранным расстоянием. Другим преимуществом ап-
паратов с тонкими камерами является достижение при
одинаковой производительности более высоких линей-
ных скоростей движения растворов относительно по-
верхности мембран. Это повышает критический ток
и интенсифицирует процесс электродиализа. Следует
учесть, что характер упаковки зерен насадки у стенок
камер аппарата иной, чем в его объеме. Флуктуации
истинной скорости потока раствора у стенок меньше,
чем в центральной части слоя. Поэтому уменьшение
толщины камер аппарата до размеров, близких к ли-
нейным размерам, элементов насадки, должно привести
к снижению флуктуации пористости зернистого слоя
и усреднению скорости движения как по толщине, так
и по высоте аппарата. В насадочные аппараты с тонки-
ми камерами исходный раствор можно подавать снизу.
Это улучшает газоотделение, уменьшает число застой-
ных зон и снижает разогрев аппарата. Осуществить
аналогичное питание электродиализаторов с большим
межмембранным расстоянием невозможно в связи с не-
избежным расслоением насадки.
Существует мнение, что применение ионообменной
насадки ограничено точкой изоэлектропроводимости
[132] или точкой изопредельности [133], выше которых
введение ионообменной насадки теряет смысл. Однако
для фиксации мембран вместо зернистой насадки
в электродиализатор необходимо ввести лабиринтную
прокладку либо сепаратор-турбулизатор, которые экра-
нируют мембраны. Поэтому применение ионообменной
насадки, исходя из соображении повышения электропро-
водимости камер электродиализатора, будет эффектив-
но, по крайней мере, до электропроводимости обраба-
тываемого раствора, равной электропроводимости в точ-
ке изоэлектропроводимости, умноженной на коэффици-
ент экранирования мембран.
С уменьшением межмембранного расстояния и уве-
личением скорости потока при заданной плотности то-
ка снижаются расходы электрической энергии на обес-
140
Расстояние между мем6рана^и,см
Рис. 43. Зависимость концентрации ионов Na+ (#) н С1- (О) в
растворе и доли ионов Н+ в катионите и ионов ОН- в анионите
от расстояния между мембранами при стационарном режиме рабо-
ты электродиализатора с насадкой К.У-2 и АВ-17, взятых в соот-
ношении 1 1 (ио емкости), при плотности тока 18 мА/см2.
соливание. При постоянной производительности аппара-
та с уменьшением межмембранного расстояния степень
очистки исходного раствора возрастает. Сравнительные
исследования показали, что затраты энергии на обессо-
ливание воды в аппарате с насадкой вплоть до содер-
жания солей в исходном растворе 8 г/л NaCl всегда ни-
же, чем в таком же аппарате без насадки [134, с. 114—
121]:
Затраты электрической энергии Электроднали- Электродиали-
эатор с насадкой затор струнный
При изменении удельного
сопротивления с 1,4 до
2,9 кОм-см, кВт-ч/м3 1,2 3,3
Прн снижении содержания
солей, кВт -ч/кг (удален-
ной соли)
с 1,0 до 0,3 г/л 11,5 13,1
с 8,0 до 7,0 г/л 2,5 3,0
с 8,0 до 6,2 г/л 3,7 3,9
Распределение противоионов между раствором
и смесью смол в стационарном режиме работы электро-
диализатора характеризуют результаты, представлен-
ные на рис. 43. Различия в ходе кривых, характеризую-
щих содержание ионов Na+ и С1~ в растворе, можно
объяснить следующим образом. Примесные ионы уда-
ляются из раствора при деминерализации в камере
обессоливания за счет миграции через мембраны
141
в электродные камеры, при этом они переходят в мем-
браны либо через зерна ионитов, либо непосредственно
из раствора. Учитывая, что электропроводимость смол
примерно на два порядка выше электропроводимости
раствора, первый путь более вероятен. Миграции ионов
по зернам ионитов предшествует переход их из раство-
ра в ионообменные смолы. Если сорбция примесных ио-
нов смесью смол в камере обессоливания идет по обыч-
ному механизму ионообменной сорбции, наибольшую
степень деминерализации раствора следует ожидать
в тех секциях, где поддерживается, высокое содержание
ионов Н+ и ОН- в ионитах. В камерах обессоливания
высокое содержание ионов Н+ в катионите наблюдается
в слое, прилегающем к анионитовой мембране, а ионов
ОН- — в слое, прилегающем к катионитовой мембране
(см. рис. 43). Именно в этих слоях и проходит эффек-
тивная сорбция соответственно ионов Na+ и С1~.
Однако эффективно ионы С1~ поглощаются также
в слое с самым низким содержанием ионов ОН- в анио-
ните. Такую «асимметрию» можно объяснить, если
учесть особенности переноса тока через ионообменные
мембраны. При плотности тока выше критической се-
лективные свойства мембран практически не ухудша-
ются, но эффективность работы анионитовой мембраны
резко падает из-за участия ионов ОН- в переносе тока.
Так, при плотности тока 20 мА/см2 число переноса гид-
роксильных ио-ноа ^он~ составляет 0,28, а соответствую-
щее этому содержание ионов ОН- в MeM6paje — 82%.
В то же время для катионитовой мембраны ^состав-
ляет 0,055, а содержание ионов Н+—3%. Очевидно,
различия в электрохимическом поведении мембран и яв-
ляются причиной аномально высокой степени деминера-
лизации раствора по иону С1_ вблизи анодной камеры.
Анионитовая мембрана может рассматриваться как слой
анионита с высокой сорбционной способностью. Таким
образом, в ближайшей к анодной камере секции образу-
ется как бы смешанный Н—ОН-ионитовый фильтр, и
поэтому здесь достигается высокая степень обессоли-
вания раствора [218].
Глубокое обессоливание воды в аппаратах с ионо-
обменной насадкой находит практическое применение
[135], например, для глубокого обессоливания дистил-
лированной воды [136]. В дистиллированной воде при-
142
сутствует много примесей. Так, содержание сухого ос-
татка может составлять 5 мг/л. Кроме того, в ней со-
держатся летучие органические вещества, переходящие
в воду вместе с паром. Удельное сопротивление дистил-
лированной воды составляет около 0,4 МОм-см, а прак-
тически редко превышает 0,1 МОм-см; окисляемость ди-
стиллированной воды колеблется в пределах- 0,1—
0,2 мг 02/л. Качество дистиллированной воды зависит
также от источника, сезона и времени работы дистил-
лятора.
Содержание примесей в обычной дистиллированной
воде (I) и воде, обессоленной с помощью смешанного
слоя ионитов (II), приведено ниже (в %):
Примесь
Примесь
А1
Fe
Са
Mg
Мп
Си
Zn*
5-10-9
1 • Ю-6
1 • Ю-8
I • Ю"5
3-10-»
ью-9
—
2-Ю-»
5Ю-«
6-10-.8
1•10-е
ЗЛО-"
ью-»
3 10-'
Ni
Sn
Pb
Ag*
Sb
Cr
8-10-'
5-10-»
2-10-'
—
5-10-s
3-10-»
3 10-8
1•10-»
7-10-»
3-10-10
3-10-8
1•10-8
* Содержание в исходной воде не определялось.
Разработанная установка, схема которой изображе-
на на рис. 44, работает в двух режимах — очистки воды
и регенерации смешанного слоя ионитов. При работе
установки в режиме очистки воды исходная дистилли-
рованная вода прокачивается через угольный фильтр 2
для удаления органических веществ. Далее вода про-
ходит камеру электродиализатора 10, заполненную сме-
шанным слоем катионита КУ-2чС и анионита АВ-17чС.
В катодной и анодной камерах аппарата циркулирует
0,01 н. раствор HN03. Место ушедших ионов занимают
ионы водорода и гидроксила, появляющиеся в резуль-
тате диссоциации воды. Таким образом, в этом режиме
осуществляется глубокое обессоливание воды и частич-
ная регенерация ионитов. Все камеры электродиализа-
тора имеют размер 5X66X180 мм.
После некоторого периода работы электродиализа-
тора в режиме обессоливания удельное сопротивление
выходящей воды начинает снижаться. Это вызвано по-
степенным переходом ионообменных смол в солевую
143
/ _ Обессоленная
Рис. 44. Схема установки ЛУГОВ-1:
/ — вентиль; 2— фильтр с активированным углем; 3— бак исходной воды;
4 — промежуточная емкость; 5 — сигнальная лампочка; 6 — ЛАТР; 7 — насос;
в—катод; 9 — катнонообмеиная мембрана; 10 — смешанный слой ноннтов;
//— анод; 12 — аннонообменная мембрана; 13 — измерительная ячейка; 14 —
потенциометр.
форму, так как протекающий ток не регенерирует их
полностью. При падении удельного сопротивления вы-
ходящей воды ниже заданного иониты регенерируют
при плотности тока 0^6—0,6 А/дм2 в течение 0,5 ч. Для
повышения стабильности работы установки смешанный
слой ионитов следует раз в неделю обрабатывать
0,3%-ным раствором. Н202.
В последние годы большое внимание уделяется
электродиализу с использованием в качестве насадки
ионообменных волокон [137]. Ионообменные волокна
по сравнению с гранулированными ионитами имеют бо-
лее развитую поверхность и, следовательно, лучшие ки-
нетические характеристики; размещение их в камерах
возможно различными способами. Из волокон можно
изготавливать специальные вкладыши в виде тканых
и нетканых материалов. Сообщается о более выгодных
энергетических характеристиках электродиализа с ис-
пользованием ионообменных волокон. Однако, произво-
димые в настоящее время ионообменные волокна еще не
обладают достаточной стойкостью в работе.
Частичное обессоливание воды электродиализом до
сих пор не получило широкого практического примене-
ния. Это объясняется прежде всего тем, что в большин-
144
стве случаев эксплуатация ионообменных обессоливаю-
щих установок не лимитируется содержанием сбрасы-
ваемых солей. Отработанные регенерационные раство-
ры разбавляют промывными водами и хозяйственно-
бытовыми сточными водами до норм, допускающих их
сброс в открытые водоемы (1 г/л). Другим сдержива-
ющим фактором является отсутствие достаточно мощ-
ных электродиализаторов, способных заменить сущест-
вующие ионообменные колонки. Наконец, не всегда
электродиализные обессоливающие установки работают
достаточно стабильно. Коллоидные частицы и органи-
ческие вещества, присутствующие в природной воде
и в самих ионитах, осаждаются на ионообменных мем-
бранах, «отравляя» их. Длительность экспериментов
и отсутствие надежных методик идентификации малых
концентраций указанных веществ чрезвычайно затруд-
няют исследования в этой области [219].
УДАЛЕНИЕ МИКРОЧАСТИЦ И МИКРООРГАНИЗМОВ
ЭЛЕКТРОФИЛЬТРОВАНИЕМ
Значительная часть примесей, загрязняющих воду,
находится в коллоидно-дисперсном состоянии. Наибо-
лее распространенным методом выделения дисперсной
фазы является коагуляция с последующим отстаивани-
ем и фильтрованием. Метод отличается малой ско-
ростью, громоздкостью оборудования, возможностью за-
грязнения дисперсной фазы и дисперсионной среды коа-
гулянтами. В ряде случаев (например, при работе
с защищенными коллоидами или высокочистыми жидко-
стями) метод вообще неприемлем.
Между тем известно, что ионообменные смолы за-
держивают коллоидные частицы и, в частности, микро-
организмы, однако, емкость ионообменных смол по
коллоидным частицам невелика. Это объясняется тем,
что поглощение коллоидных частиц ионитами происхо-
дит благодаря электростатическому взаимодействию
противоположно заряженных поверхностей ионита и ча-
стицы. Такой механизм взаимодействия обеспечивает
образование только монослоев частиц на поверхности
ионита. Второй и последующие слои частиц не могут
образоваться по тем же причинам, которые обусловли-
вают стабильность коллоидных растворов: слипанию
10—360
145
отдельных частиц препятствует электростатическое от-
талкивание одноименно заряженных двойных электри-
ческих слоев. Поэтому ионообменные смолы практиче-
ски не применяются для улавливания коллоидных час-
тиц. Вместе с тем иониты являются питательной средой
для развития разнообразной микрофлоры; после обра-
ботки на ионитах в жидкости, как Правило, содержит-
ся микроорганизмов больше, чем до обработки. Поня-
тен интерес исследователей к разработке таких методов
ионного обмена, которые бы исключали заражение об-
рабатываемых растворов микрофлорой [144].
Еще в 1960 г. было замечено, что в электродиализа-
торах происходит отложение частиц песка и глины. Это
дало основание Уилсону сравнить электродиализаторы
с электрофильтрами [138], что принципиально неверно.
В газовых электрофильтрах осаждение частиц аэрозоля
сопровождается их разрядом. Гидрозоли, попадая на
ионообменные материалы, не разряжаются. Поэтому
сходство между газовым электрофильтром и электро-
диализатором чисто внешнее (к сожалению, путаницу
вносит само название описываемого процесса — элект-
рофильтрование жидкостей) [139].
В процессе электрофильтрования жидкостей можно
выделить две стадии: транспорт дисперсных частиц и их
удерживание коллектором. Транспорт дисперсных час-
тиц осуществляется за счет сил электрофореза, электро-
осмоса и диполофореза. Скорость электрофореза uef
частицы произвольной формы в слабых полях достаточ-
но точно описывается формулой Смолуховского [140]:
uef = e£ d £//4ят| d /
где е — диэлектрическая проницаемость среды; Z,— потенциал части-
цы; dU/dl — градиент напряженности электрического поля; т| — вяз-
кость среды.
Если величины е, £ и ц для данной системы можно счи-
тать заданными, скоростью доставки частиц к поверх-
ности коллектора за счет сил электрофореза можно
управлять, изменяя напряженность электрического по-
ля. Электрофоретическая доставка будет ускорена в об-
ласти разбавленных растворов, где ^-потенциал частиц
выше, чем в концентрированных.
Во внешнем электрическом поле практически все
коллоидные частицы приобретают некоторый наведен-
146
ный дипольный момент. Ориентация дипольного момен-
та зависит от соотношения между Rel и Rel^o [141]
(Rel=p7ta/a, где ка—поверхностная электропроводи-
мость частицы; a — размер частицы; Rehso — значение
критерия Rel, при котором отсутствует поляризация ча-
стицы). В области разбавленных растворов, где велика
поверхностная электропроводимость и Rel>Rel,-S0, на-
веденный дипольный момент ориентирован по полю
и частица занимает стабильное положение (рис. 45).
В случае хорошо проводящих растворов, в которых по-
верхностная проводимость мала и ReKRel,S0, наведен-
ный дипольный момент частиц ориентирован против по-
ля. Так как время релаксации наведенного дипольного
момента частицы много меньше периода ее вращения,
то такое положение частицы также оказывается ста-
бильным.
Ионообменные смолы являются проводниками второ-
го рода с удельной электропроводимостью 0,01—1 См/м
(10-2—Ю-4 Ом-1-см-1). Поэтому электрическое поле
в системе ионит — раствор оказывается неоднородным
(рис. 46). Максимум электрического поля всегда лока-
лизован между-зернами ионитов, причем его положение
зависит от соотношения электропроводимости ионита к
и среды кт- Попадая в неоднородное электрическое по-
ле, ориентированный по полю диполь начинает двигать-
ся в сторону максимума поля. Диполь, ориентированный
против поля в неоднородном электрическом поле, дви-
жется в сторону минимума поля (рис. 47). Так как
и величина наведенного дипольного момента, и скорость
движения постоянного диполя (диполофорез) пропор-
циональны напряженности электрического поля, в целом
эффект диполофореза
квадратичен по полю.
Вблизи зерен ионита
коллоидные частицы мо-
гут транспортироваться
за счет электроосмотиче-
:кого потока жидкости
Рис. 45. Схема поляризации
коллоидных частиц. Rel > Reli
Ю*
147
Рис. 46. Неоднородное электрическое
поле в системе ионнт — раствор.
Рис. 47. Движение диполя в неодно-
родном электрическом поле.
через ионообменный материал. Если знаки заряда
частиц и противоионов совпадают, электроосмос спо-
собствует образованию осадка коллоидных частиц на
ионообменном коллекторе. Если же знаки зарядов
частиц и противоионов противоположны, электроосмос
препятствует осаждению коллоидов. Роль электроосмо-
тического потока особенно велика в непосредственной
близости от границы раздела ионит — раствор. Дело
в том, что по мере утоньшения пленки жидкости,
разделяющей частицы и коллектор, вязкость жидкости
возрастает. В связи с этим убывает скорость электро-
фореза и диполофореза. Непрерывное «отсасывание»
высоковязкой пленки внутрь гранулы ионита существен-
но ускоряет доставку коллоидных частиц к границе раз-
дела ионит—раствор.
Удерживание дисперсных частиц в системе нонит —
раствор возможно вследствие образования полислоев
осевших частиц на ионите и вследствие их фокусировки
в зазорах между зернами (рис. 48). Образование поли-
слоев частиц объясняется тем, что дисперсные части-
цы в электрическом поле приобретают наведенные ди-
польные моменты и определенным образом (по полю
или против поля) ориентируются по отношению к си-
ловым линиям поля. Таким образом, первый слой час-
тиц удерживается благодаря силам электростатическо-
го притяжения противоположно заряженных поверхно-
%0>'Кт
148
Рис. 48. Схема осаждений кол-
лоидных частиц н аиоиитах.
стеи ионита и частицы.
Второй и последующий
слои удерживаются бла-
годаря диполь — диполь-
ному взаимодействию,
возникающему между на-
веденными диполями дис-
персных частиц. При вы-
ключении электрического
поля наведенные диполь-
ные моменты исчезают, и частицы (кроме локализован-
ных в первом слое) вымываются потоком жидкости.
Таким образом осуществляется регенерация ионообмен-
ного электрофильтра.
Возможна также диполофоретическая фокусировка
дисперсных частиц в узких зазорах между зернами
ионита в областях максимума электрического поля. Но
она возможна только для частиц, дипольные моменты
которых ориентированы по полю, и заряд которых про-
тивоположен заряду противоионов ионита.
При сочетании двух условий дисперсные частицы си-
лами диполофореза и электрофореза будут затягивать-
ся в области максимума электрического поля, но осесть
на зернах ибнита не смогут, так как этому препятству-
ет противоположно направ-
ленный электроосмотиче- !В°
ский поток растворителя. _
Концентрированию дисперс-
ных частиц в областях мак-
симума электрического поля
благоприятствует также то
Рис. 49. Зависимость остаточной
концентрации суспензии монтмо-
риллонита в поле постоянного (Г)
и переменного (2) тока.
*Ш
|М
!«
" ,tV»
к
у.. т-
г
•
В 12 18 2*
Время* чаи
30
149
Потенции/] £,мв
Рис. 50. Зависимость количе-
ства осажденных глинистых
частиц от различных факторов:
Е-потенцнала (условия опыта ана-
логичны приведенным на рнс. 49);
концентрации хлорида натрия С
(при поле 5,2 В/см, скорости по-
тока 9.6 см/мии, начальной кон-
центрации суспензии 80 мг/л); ско-
рости потока v (при поле 5,2 В/см,
концентрации суспензии 80 мг/л);
концентрации суспензии С0 (при
поле 6,2 В/см, скорости потока
4 см/мни); напряженности электри-
ческого поля Ди (при скорости по-
тока 8 см/мни, концентрации сус-
пензии 80 м/л).
обстоятельство, что эти области являются застойными в
гидродинамическом отношении. При выключении элект-
рического поля наведенные дипольные моменты исчеза-
ют, и частицы вымываются потоком раствора.
Осаждению дисперсных частиц на ионообменном ма-
териале способствует также эффект усиления поля.
С принимающей стороны ионита создается слой обеднен-
ного по солевым ионам раствора; градиент потенциала
в нем растет по мере приближения к границе раздела
ионит — раствор. В результате увеличивается скорость
электрофореза и диполофореза частиц, дипольные мо-
менты которых ориентированы по полю. В диффузион-
ном слое увеличивается диполь — дипольное взаимодей-
ствие как между осевшими слоями частиц, так и между
отдельными частицами в растворе. При этом возможно
образование агрегатов частиц и их необратимая коагу-
ляция. Если учесть, что скорость диполофореза и ди-
поль -^ дипольное взаимодействие для крупных частиц
много больше, чем для мелких, следует ожидать поло-
жительного влияния эффекта усиления поля на элект-
рофильтрование.
В то же время эффект усиления поля на границе
раздела принимающая сторона ионита— раствор свя-
зан с возникновением конвективных потоков жидкости,
затрудняющих формирование осадка дисперсных частиц
на поверхности ионообменного материала [141].
о,ю- с,г-мо/!б
j j'
16 V, CM/MI
J 1
80 С0,мг/л
150
На рис. 49 показано влияние постоянного и перемен-
ного электрического полей на остаточную концентрацию
суспензии монтмориллонита, фильтруемого со скоростью
4 см/мин при напряженности электрического поля
5,2 В/см и начальной концентрации суспензии 80 мг/л
[142]. В качестве коллектора использована С1-форма
анионита АВ-17 высотой 4 см. При включении электри-
ческого поля (на рисунке показано стрелкой вверх)
концентрация дисперсных частиц в выходящем раство-
ре уменьшается примерно в 20 раз. Столь высокая сте-
пень очистки может сохраняться длительное время (бо-
лее 24 ч). При отключении электрического поля (стрел-
ка вниз) задержанные частицы вымываются потоком
раствора, фильтр регенерируется и может быть исполь-
зован вновь.
На рис. 50 показано влияние £ потенциала, концент-
раций солевого фона, скорости потока, напряженности
электрического поля и концентрации суспензии на мас-
су дисперсной фазы, задержанной 1 г загрузки за час.
ГЛАВА
ВЫБОР ТЕХНОЛОГИЧЕСКИХ СХЕМ ПОЛУЧЕНИЯ
ОСОБО ЧИСТОЙ ВОДЫ
И ОПЫТ ИХ ЭКСПЛУАТАЦИИ
Характерной особенностью сравнительно небольших
водоподготовительных установок (ВПУ, производитель-
ностью 2—25 м3/ч) является относительно высокий
удельный расход на заработную плату обслуживающе-
го персонала, иногда на порядок превышающий удель-
ные трудовые затраты на получение обессоленной воды
на электростанциях. На небольших ВПУ часто невоз-
можно организовать предварительную очистку воды,
практикуемую на электростанциях. Эти и другие отли-
чия позволяют по-другому решать вопрос о составе
оборудования обессоливающих установок, продолжи-
тельности межрегенерационного периода ионитовых
фильтров и т. д.
Опираясь на опыт эксплуатации существующих обес-
соливающих установок и теоретические разработки
в области ионного обмена и сорбции, выбирают опти-
мальную схему полного обессоливания пресной воды.
При этом учитывают, что особо чистая, высокоомная
вода принципиально не может быть получена без ис-
пользования в схеме ВПУ смешанного слоя ионктов,
практически исключающего обратимость реакций ионно-
го обмена.
Смешанный слой доводит до особо чистого состоя-
ния не только частично обессоленную воду (2С*=0,1—
0,2 мэкв/л), но и воду со значительно большим содер-
жанием солей.
По степени минерализованности воды подразделяют
на требующие и не требующие снижения общего содер-
жания солей до величины, позволяющей осуществить
полное обессоливание. К последним относятся воды, об-
щее содержание солей которых удовлетворяет следую-
6
152
тему условию: рабочий период Т ионообменной колон-
ны в непрерывном процессе обессоливания больше вре-
мени подготовки Тп колонны к работе. Рабочий период
реактора определяется из выражения
Т = Vep/GCum
где V — объем ионита в колоиие, м3; ер — удельная рабочая обмен-
ная емкость, экв/м3; G — производительность реактора, м3/ч; СПт —
общее предельное содержание солей в исходной воде, экв/м3.
Р-абочую обменную емкость катионита до заданного
проскока можно рассчитать по методике, предложен-
ной в работе 1[9], и по уравнению, приведенному на
стр. 84.
Обменную емкость сл«боосновных анионитов можно
определять из уравнения, данного на стр. 94 с коррек-
тировкой восстановленной обменной емкости влиянием
на нее заданного проскока натрия в процессе Н-катио-
нирования. Наиболее сложным является определение Ер
сильноосновного анионита по анионам слабых кислот —
угольной и кремневой. Для начальной стадии эксплуа-
тации анионита рекомендуется эмпирическое уравнение
(см. стр. 109). Но емкость сильноосновного анионита,
подверженного старению, уменьшается во времени.
В связи с этим могут быть рекомендованы некоторые
средние значения емкости, указанные в справочнике хи-
мика-энергетика (или в специальных исследованиях
[145]). Емкость катионита смешанного слоя определя-
ется по уравнению, приведенному на стр. 23.
Каким должен быть уровень предварительного обес-
соливания воды (способ обессоливания пока безразли-
чен),, чтобы на фильтре смешанного действия можно бы-
ло работать в соответствии с указанным выше услови-
ем, т. е. T=Vep/GCiim? Практика показала, что про-
мышленный реактор со смешанным слоем производи-
тельностью до 25 м3/ч подготавливается- к работе в те-
чение 6—8 ч (гидравлическое разделение ионитов в ре-
акторе, регенерация катионита и анионита, отмывка,
смешивание). По причинам, складывающимся на уста-
новке, межрегенерационный период фильтра смешанного
действия желательно увеличить до 24 или 48 ч. Уже от-
мечалось, что после I ступени обессоливания в фильт-
рате, как правило, содержатся катионы натрия и анио-
153
ны слабых кислот; анионы сильных кислот, присутству-
ющие в малых количествах, не решают сути процесса.
Какой проскок ионов натрия и анионов угольной и кремневой
кислоты можно допустить без ущерба для назначенного времени ра-
боты фильтра, рассчитывается следующим образом, Межрегенера-
ционный период Т равен 12, 24 и 48 ч; ему соответствуют Сцт для
реакторов со смешанным слоем, где через единицу анионита в еди-
ницу времени проходят 25 объемов очищаемой воды, а через едини-
цу катионита — 50 объемов (отношение анионита к катиониту рпг-
но 2:1). Если для регенерации катионита взяты 3 эквивалента кис-
лоты, а для регенерации анионита б эквивалентов щелочи на 1 экви-
валент Еп ионитов, то Еа смол составит соответственно 1300 и
500 экв/мэ (по сумме бикарбонат- и силикат-ионов). Очевидно, ка-
тионит не будет лимитировать процесс: его емкость больше, чем у
удвоенного количества анионита. Расчет показывает, что С\?т, С^т
Cjim составляют соответственно 1,7,.0,83 и 0,41 мэкв/л.
Однако не только dim, но-и более глубокая деминерализация
вод достигается с помощью одной ступени обессоливания на уста-
новке, состоящей из сильнокислотного катионита (дегазатора) сла-
боосновного ионита в случае, когда обессоливаиию подвергают прес-
ные воды с общим содержанием солей до 10 мэкв/л и содержанием
анионов сильных кислит до 5 мэкв/л.
Таким образом на установках не слишком большой
производительности, где удельные расходы высоки,
нельзя усмотреть оснований для традиционно исполь-
зуемой на крупных ВПУ II ступени обессоливания, со-
стоящей из сильнокислотного катионита и высокооснов-
ного анионита.
Поскольку при Ciim=0,2—0,4 мэкв/л межрегенера-
ционный период окажется в 5—6 раз больше времени
подготовки фильтра, можно интенсифицировать его ра-
боту с помощью дренажной системы, которая позволит
удвоить производительность и довести ее до 50 объемов
воды на 1 объем анионита в час (50—60 м/ч). При этом
качественные показатели воды не ухудшаются, а экс-
плуатироваться будет соответственно меньше ионитов.
Для прецизионных предприятий существенно важно,
чтобы обессоленная вода содержала меньше органиче-
ских веществ и микроорганизмов. Этому благоприятст-
вует меньшее время контакта воды с ионитами, следо-
вательно, оказывается полезной замена II ступени обес-
соливания смешанным слоем ионита при максимально
возможной интенсивности работы фильтра:
При регенерации катионита смешанного слоя избыт-
ки кислоты безвозвратно теряются, так как после ка-
154
тионита кислота подается на анионит для удаления
сорбированных бикарбонат-ионов, способных к гидроли-
зу. Что касается щелочи,' то 4/s ее, не израсходованные
при регенерации сильноосновного ионита, утилизируют-
ся при регенерации слабоосновного ионита. Это — до-
полнительный аргумент для отказа от традиционной
II степени обессоливания. Второй и окончательной сту-
пенью при. получении обессоленной воды с удельным со-
противлением 5—10 МОм-см и остаточным содержани-
ем кремния 0,1—0,2 мг/л является смешанный слой
ионитов.
При разработке классификации вод и выборе соот-
ветствующих технологических схем [[204, с. 154—157]
принимают во внимание следующие обстоятельства: об-
менная емкость ионитов почти не зависит от качествен-
ного состава катионов и существенно зависит от каче-
ственного анионного состава воды. Слабоосновные ани-
ониты практически не взаимодействуют с анионами
слабых кислот, сорбировать последние можно только
с помощью сильноосновных анионитов. Анионы сильных
кислот более экономично сорбировать на слабооснов-
ных, анионитах ввиду их легкой регенерируемое™. При
обёссоливании смешанным слоем на основе сильнокис-
лотного катионита и высокоосновного анионита создают-
ся благоприятные условия для сорбции анионов слабых
кислот, вследствие чего емкость последнего в смешанном
слое выше емкости его в монослое на 10—15% [38].
Исходя из взаимодействия ионитов с водами раз-
личного состава, можно предложить следующую клас-
сификацию вод, подвергаемых обессоливанию.
1. Частично или глубокообессоленная, но не «обес-
кремненная» вода; такой водой может быть дистиллят
или фильтрат после одноступенчатой ионообменной очи-
стки.
2. Дистиллят или конденсат, используемый в конту-
рах водяного охлаждения, в большей или меньшей сте-
пени насыщенный продуктами коррозии.
3. Воды, содержащие наряду с бисиликат- и бикар-
бонат-ионы.
4. Вода, содержащая анионы сильных кислот и би-
силикат-ионы; такой водой является, например, дилюат
электродиализных и фильтрат обратноосмотических
устройств.
165
5. Воды, содержащие анионы сильных и слабых кис-
лот (наиболее часто встречающиеся в природе).
6. Воды, отличающиеся преобладающим содержани-
ем бикарбонат-ионов (например, выше 5—6 мэкв/л).
В водах № 1—4 другие, не указанные иоиы могут
2,0
1.В
/
-
1
—L-
_L_
V
/ч
-2
J
J_
а
2
В
6 8 п
С0, мэкв/л
1 3 5
С0, нэнв/л
Рнс. 51. Зависимость себестоимости Z обессоленной воды от класса
неходкой воды, содержания в ией солей С (мэкв/л) и выбранных
схем обессоливания при производительности 1—2 мэ/ч:
а) нсходиая вода № 1: / — для ФСД; 2 — для схемы катноннт—>аиноннт
I ступени—►катконит—»аниоиит II ступени;
б) нсходиая вода JMb 3: / — для ФСД; 2 — для схемы катионит—*-декарбони-
эатор—»-ФСД;
в) исходная вода № 4: / — для ФСД; 2 — для схемы катионит—►аиионит'^»-
-►ФСД;
г) нсходиая вода № 5: / — для ФСД; 2 -— для схемы катионит —►декарбони-
эатор—►аиионит—►ФСД; 3 — для схемы катионит—►декарбоиизатор—► ани-
оиит—►катионит II ступени—► аиионит II ступени;
д> исходная вода № 6: /—для схемы катноннт—►цекарбоинзатор—►аиио-
нит—►-декарбоиизатор—►ФСД; 2 — для схемы катионит—► декарбовизатос—►
—► анионнт—►ФСД; 3— для схемы катионит—►декарбоиизатор -"► анионнт—»•
—»катионит Ц ступени—► а'ниоккт II ступени.
156
присутствовать в концентрациях, не влияющих иа вы-
бор схемы обессоливания.
В работе [205, с. 74—78] предложена методика тех-
нико-экономического сравнения эффективности конку-
рирующих схем для вод названных классов, показаны
пределы содержания солей, в которых выгодна та или
иная схема. С точки зрения формальной комбинатори-
ки число схем может бьпъ чрезвычайно большим. Их
выбор, естественно, ограничивался опытом обессолива-
ния воды с учетом того нового, что вносит в процесс
обязательное использование смешанного слоя ионитов.
В качестве конкурирующей рассматривалась традици-
онная двухступенчатая схема. Результат исследований
представлен на рис. 51, из которого видно, какая из
технологических схем и в каких границах дает возмож-
ность получить высокоомную обессоленную воду по
наименьшей цене. Двухступенчатая схема (рис. 51,г),
Таблица 15. Оптимальные технологические схемы получения
особо чистой.воды в зависимости от качественного
и количественного состава исходной воды
А— анноиит; Д — декарбонизатор; К — катионит; М.с. — макропористый сор-
бент; Н^Ф — намывной иоиитовый фильтр; ПК—прямоточная коагуляция;
ФСД— фильтр смешанного действия.
Класс
воды
1
2
3
4
5
5*
6
Схема обессоливания
ФСД
НИФ
НИФ—»ФСД
К-+ФСД
ФСД
К-^Д^ФСД
ФСД
К—>-А—>-ФСД
ФСД
К—>Д—>А—>-ФСД
ПК-+К—"Д-+
М.с.—»А—>-ФСД
К—»-Д—>-М.с.—»А—->-ФСД**
ФСД
К—>Д—»-А—>ФСД
К-+Д—*А-+Д—кФСД
Содержание солей, мэкв/л
(Продуктов коррозии,
мг/л)
До 1-2
(До 0,3)
(0,3—2,0)
До 1,1
1,1-5,5
До 1,5
1,5-9
До 1-2
2-9
1,5—9,0
1,5—9,0
До 1
До 5
Более 5
* Q предварительной очисткой.
** При окнсляемости менее 6 мг Ог/л.
157
оказалась неконкурентоспособной. Для практического
использования может быть предложена таблица вод
и схем их ионообменного обессоливания при получении
высокоомной воды (табл. 15).
Не исключается, конечно, что в условиях многотон-
нажного производства обессоленной воды с ограничен-
ной численностью обслуживающего персонала при про-
изводительности, для которой нет фильтра смешанного
действия с регенерацией внутри реактора, более эконо-
мической окажется традиционная двухступенчатая уста-
новка с фильтром смешанного действия на III ступени.
ОПТИМИЗАЦИЯ ПО КРИТЕРИЯМ ЗАКОНА
ОБ ОХРАНЕ ПРИРОДЫ
(МИНИМИЗАЦИЯ СБРОСА РЕАГЕНТОВ В ВОДОТОКИ)
Полное обессоливание и обескремнивание воды
в промышленных условиях возможно только с помощью
фильтров со смешанным слоем ионитов. Поэтому с по-
зиций минимизации сброса реагентов желательно дово-
дить любую воду до минимального содержания солей
безреагентным способом — дистилляцией, обратным ос-
мосом или электродиализом. Все три способа требуют
предварительной очистки (умягчение, удаление железа)
с большим или. меньшим расходом реагентов (коагу-
лянты, флокулянты).
Дистилляцию как метод предварительного обессоли-
вания воды на неэнергетических предприятиях трудно
реализовать. Кроме того, утилизировать большие ко-
личества тепла довольно сложно (санитарные органы
рассматривают Сброс теплой воды как тепловое за-
грязнение). При производстве сравнительно небольших
объемов обессоленной воды в качестве способов пред-
варительного обессоливания наибольший интерес пред-
ставляют обратный осмос и электродиализ.
Для обратного осмоса имеется несколько вариантов
технических решений [194]. Так, работают аппараты
типа фильтр-пресса с многокамерной укладкой ацетат-
целлюлозных мембран, со спиральной укладкой, с труб-
чатыми ячейками, состоящими из пористых трубок с на-
несенным на них раствором ацетатцеллюлозы, с мем-
бранами в виде тонких полых волокон. Зарубежные
фирмы выпускают обратно-осмотические аппараты про-
158
йзводительностью до 60 м3/ч. При использовании об-
ратного осмоса всякую воду желательно перевести по
указанной выше классификации из 5-го (6-го) класса
в четвертый, т. е. освободить от гидрокарбонатов во из-
бежание образования отложений на мембранах. Это
осуществляют подкислением воды, превращая все гид-
рокарбонаты в сульфаты или хлориды.
Обратным осмосом в рассоле задерживается 85—
95% солей, так что фильтрат представляет собой более,
чем в 10 раз разбавленный по сравнению с исходной во-
дой раствор. Если принять, что Сцт для фильтра сме-
шанного действия составляет 0,25—0,50 мэкв/л (в ис-
ключительных случаях—1 и даже 2 мэкв/л), то с по-
мощью обратного осмоса можно подвергать очистке
воду с исходной концентрацией солей до 10 мэкв/л (при
большем содержании используют две ступени обратно-
го осмоса).
Надо иметь в виду, что обратный осмос, как и лю-
бой другой способ, требует предварительной очистки от
органических и коллоидных веществ. Кроме того, объем
чистого фильтрата, который можно послать на фильтр
Смешанного действия, составляет всего 3Д—3/s от взя-
того объема воды, в то время как подкислять прихо-
дится всю воду. Оставшаяся часть воды представляет
собой рассол, сбрасываемый в водотоки или направляе-
мый на повторное обессоливание. Мембраны или полые
волокна время от времени заменяют либо обрабатыва-
ют для удаления железа компонентами на основе доро-
гостоящей лимонной кислоты [146].
Состав частично обеесоленной воды после обратно-
го осмоса характеризуется преимущественным содер-
жанием натрия из катионов и хлора из анионов. Селек-
тивность мембран по кремнию примерно 80-1-85%. При
получении с помощью обратного осмоса фильтрата, со-
держащего 0,5—1,0 мэкв/л холей, можно для полного
обессоливания использовать затем фильтр смешанного
действия соответствующей производительности. При
большем содержании солей до фи*льтра рекомендуется,
ставить систему катионит — анионит; в дегазаторе, ве-
роятно, необходимости нет. Регенерировать анионит
можно остаточной активностью щелочи после регене-
рации фильтра смешанного действия, а часть избыточ-
ной кислоты и кислых промывных вод после регенера-
159
ции катионита можно направлять на декарбонизацию
воды перед гиперфильтрацией.
Возможные технологические схемы:
предварительная очистка—^обратный осмос—*■
—>-фильтр смешанного действия
предварительная очистка—^обратный осмос—^ка-
теонит—>-анионит—у фильтр смешанного действия.
Обратным осмосом задерживается до 80—85% крем-
невой кислоты. Это очень важно, если учесть, что для
ее десорбции с сильноосновного анионита расходуется
в 10 раз больше стехиометрического объема щелочи.
Если требования предприятий к степени очистки от
кремния невысоки, можно рекомендовать почти безре-
агентный процесс обессоливания воды: предварительная
очистка—^обратный осмос—>-электродиализ с межмем-
бранной засыпкой ионитами [146]. С позиций охраны
природы предложенные схемы имеют большое будущее.
Электродиализ также (если не больше, чем. обрат-
ный осмос) дает возможности для безреагентного пред-
варительного обессоливания воды. Здесь сочетание
с ионным обменом для некоторых классов вод может
быть следующее.
1. Для вод со значительным преобладанием ионов
натрия над ионами двух- и трехвалентных металлов
(например, при их отношении 4:1) с учетом данных
[206, с. 158—162] можно предложить комбинированную
схему:
электродиализ—>-катионит—>-анионит—>-фильтр сме-
шанного действия
или
электродиализ—>-катионит —у дегазатор —у- анио-
нит—>-фильтр смешанного действия.
2. Для жестких вод:
умягчение с помощью Na-катионирования—>-элект-
родиализ—жатионит—^дегазатор:—ьанионит —у фильтр
смешанного действия.
3. Универсальная схема, пригодная для вод с мине-
рализованностью до 1 г/л (или 20 мэкв/л):
катионит—удегазатор —у электродиализ —>■ анио-
нит—ьфильтр смешанного действия.
Особый интерес представляет последняя схема. Ка-
тионит перед электродиализатором сорбирует все ка-
тионы. Н-катионированная вода имеет по сравнению
160
й нейтральной большую электропроводимость, что спо-
собствует более эффективному использованию энергии
Расход кислоты на регенерацию катионита можно сни-
зить на 25—30% при работе с хлоридными или суль-
фатными водами (а именно такими и являются высоко-
минерализованные воды) за счет использования кисло-
ты, вытекающей из рассольных камер электроднализа-
тора при обессоливании Н-катионированной воды. При
работе по схеме 2 аналогичным образом можно утили-
зовать рассол, представляющий раствор солей натрия.
При работе по схеме 3 в связи с известными законо-
мерностями работы анионита на Н-катионированиой ио-
де в последней при выходе из электродиализатора
должно содержаться минимальное количество (0,1—
0,2 мэкв/л) солей натрия, а для этого катионит должен
работать до проскока, не превышающего названных
значений.
Можно рекомендовать и вариант, гарантирующий
эффективную работу анионитового фильтра после элект-
родиализатора:
катионит I ступени—>-декарбонизатор—>-электродиа-
лиа—^катионит II ступени—>-анионит—мрильтр со сме-
шанным слоем ионитов.
По такой схеме катионит II ступени будет работать
в невыгодных условиях, когда предстоит сорбировать
небольшие количества натрия из кислой среды. В таких
случаях катионит должен быть полностью отрегенери-
рован (затраты кислоты 250% от Е„ слоя сорбента).
Экономичным процесс будет в том случае, если утили-
зировать регенерат катионитового фильтра II ступени
для регенерации катионитового фильтра I ступени.
Во всех предлагаемых схемах свободная (избыточ-
ная) щелочь после регенерации фильтров смешанного
действия утилизуется для регенерации фильтров со
слабоосновным анионитом.
Некоторые расчеты, характеризующие экономиче-
скую и экологическую целесообразность объединения
электродиализной и ионообменной технологии, пред-
ставлены в работе [9]. Проведены испытания [120]
экспериментальной установки электродиализ — ионный
обмен производительностью 4 м3/ч (рис. 52). Эффек-
тивность электродиализного частичного обессоливания
исходной воды с общим содержанием солей «500 мг/л
11—360
161
составляет 36—55% в зависимости от температуры по-
даваемой воды при общем расходе электроэнергии
1,5—2,0 кВт-ч/м3 частично обессоленной воды, при этом
на процесс переноса ионов расходуется не более
0,4 кВт-ч/м3.
В работе [207, с. 111—113] сделана попытка ре-
шить в общем виде задачу «стыковки» электродиализа
и ионного обмена. Получена зависимость минимальной
стоимости порционной электродиализной обработки во-
ды от начальной и конечной концентраций и экономи-
ческих параметров обоих методов.
Технически обоснованный расчет, учитывающий
большое число факторов как электродиализного, так
и ионообменного обессоливания, дан в работе [148].
Рассмотрены две схемы: упрощенная (рис. 53., а) и раз-
вернутая (рис. 53,6), работающие на водах с исходной
минерализованностью 500, 1000 и 3000 мг/л. При ис-
пользовании двухступенчатого электродиализатора про-
изводительностью на каждой ступени 100, 200 и 520
экв/ч (соответственно минерализованности исходных
вод) и стоимости электроэнергии 1,35 коп./ (кВт -ч), оп-
тимальным является электродиализное обессоливание
до минерализованности 2—3 мэкв/л. Это означает, что
для вод с высоким содержанием солей предварительное
обессоливание всегда следует проводить с помощью
электродиализа. С развитием электродиализаторов так
называемого «второго поколения» (аппараты с малым
межмембранным расстоянием) [128] или аппаратов
Исходная
Обвешенная
Soda
Рис. 52. Комбинированная схема электродиализ — ионный обмен:
/ — фильтр предварительно!! подготовки; 2 — электродйализатор; 3, 7 — про-
межуточные баки; 4, 8 — насосы; 5 — Н-катнонитовый фильтр; 6 — декарбо-
ннзатор; 9 — аиионитовый фильтр; 10 — фильтр смешанного действия.
162
Рис. 53. Принципиальная схема обессоливания воды в схеме элект-
родиализ — ионный обмен с одной ступенью анионирования (а) и
трехступенчатая схема обессоливания воды после электродиалиэа
(б):
/ — осветлитель; 2 — бак осветленной воды; 3 — механический фильтр; 4, 5 —
электродиализаторы I и II ступеней; 6, 7 — водород-катиоиитовые ступеичато-
противоточные фильтры; 8— анионитовый фильтр с высокоосиовным анионн-
том 8' — аииоиитовый фильтр I ступени; 9 — фильтр смешанного действия; 9' —
катирнитовый фильтр II ступени; 10 — анионитовый фильтр II ступени.
с межмембранным заполнением ионитами [149] откры-
вается возможность еще более глубокого безреагентного
обессоливания. В будущем вполне технологической мо-
жет стать схема обессоливания:
электродиализ I ступени—>-электродиализ II ступе-
ни—>-электродиализ III ступени—»-фильтр смешанного
действия.
Фильтр смешанного действия остается необходимым
для полного обессоливания и удаления кремния из воды,
которое принципиально неосуществимо с помощью
электродиализа.
ВЫБОР ОСНОВНОГО ОБОРУДОВАНИЯ
При обессоливании воды ионитами действует мно-
жество конкурирующих факторов. Так, увеличение ка-
питальных затрат приводит к уменьшению эксплуатаци-
онных расходов. И, наоборот, с увеличением последних
можно добиваться снижения капитальных затрат и не-
обходимых производственных площадей. Например, по-
вышение скорости фильтрования позволяет испольэо-
11*
163
вать фильтры меньшего диаметра, или меньшее число
фильтров и соответственно меньшие производственные
площади. Но при этом увеличивается расход реагентов.
Эти и другие конкурирующие факторы подробно иссле-
дованы в работах [9, 23]; для ряда конкретных случаев
выбран оптимум.
При проектировании не всегда удается учесть поло-
жительное или отрицательное влияние каждого фактора
на стоимость обессоленной воды из-за невозможности
их выражения в едином показателе, например в руб-
лях. Поэтому при выборе основного оборудования исхо-
дят из конструктивных особенностей механических
и ионообменных фильтров и характеристик существую-
щих ионообменных материалов.
При осветлении воды прямоточной коагуляцией ско-
рость пропускания обработанной коагулянтами воды
через механический фильтр не должна превышать 5 м/ч
в стационарном и 7—8 м/ч в форсированном режимах
работы. На ионитовых фильтрах Г ступени допускается
скорость до 15 м/ч, на II ступени при использовании
отдельных колонн — до 20 м/ч, при работе с фильтром
смешанного действия — 30—50 м/ч в расчете на полное
сечение фильтра. Для сорбции органических веществ
анионитом ИА-1р экспериментально определена опти-
мальная скорость 5—7 м/ч. Исходя из этих данных,
можно выбирать основное оборудование ионообменных
установок на заданную производительность. Дополни-
тельное оборудование — насосы, трубопроводы, емкости
для хранения воды и реагентов — выбирают на основе
требований гидравлики и производственных задач.
Расчет установки и выбор фильтров проводят с уче-
том того, что на разных этапах очистки их производи-
тельность не одинакова из-за расхода воды на подготов-
ку резервных фильтров к работе. Операции по подго-
товке анионита I ступени и ионитов в фильтре смешан-
ного действия проводят Н-катионированной водой
(20 объемов на 1 объем анионита I ступени и 30 объ-
емов на 1 объем анионита фильтра*); катионитовый
* Для отмывки сильноосновного анионита АВ-17-8 после реге-
нерации в отдельной колонне в зависимости от требований к каче-
ству фильтрата расходуют 50—100 объемов обессоленной воды. Для
сокращения расхода воды отмывку ведут по замкнутой схеме: ка-
тионит—>-анионит—исатионит.
164
фильтр подготавливают осветленной водой (10 объемов
на 1 объем). В связи с этим механический и Н-катио-
нитовый фильтры будут работать в двух режимах:
в стационарном и форсированном, когда идет регене-
рация одного из фильтров системы. Средняя произво-
дительность фильтров будет отличаться от заданной
производительности обессоливающей установки тем
больше, чем меньше рабочий период фильтров, т. е. чем
более минерализована вода. Для вод минерализован-
ностью 2, 4, 6 и 10 мэкв/л повышение расхода Н-катио-
нированной воды составит соответственно 7, 11, 15
и 23% от заданной производительности обессоливаю-
щей установки, а воды, осветленной с помощью механи-
ческого фильтра, на 10, 15, 23 и 35% (при расчете ис-
пользовали следующие значения рабочей обменной ем-
кости: катионита КУ-2 800 экв/м3, анионита АН-31
1000 экв/м3; и для ФСД —1000 объемов воды на 1 объ-
ем анионита АВ-17).
Высота загрузки механического и анионитовых
фильтров различна. Минимальной следует считать вы-
соту слоя, равную I м. Ионитовый фильтр можно за-
гружать на 60% высоты цилиндрической части. В фильт-
ре смешанного действия для удобства деления слоев
потоком воды снизу вверх высоту загрузки следует
ограничивать 50% высоты цилиндрической части
фильтра. Если содержание солей находится в пределах
4—6 мэкв/л и из них половина солей — бикарбонаты,
возможен такой выбор объема (высоты) загрузки
анионита I ступени, чтобы фильтр смешанного действия
и анионит I ступени одновременно выходили на регене-
рацию. Это создает большую экономию щелочи и Н-ка-
тионированной воды, идущих соответственно на регене-
рацию и промывку фильтра. Так как после катионита
имеет место разрыв струи, выход его на регенерацию
не отражается ца последующей работе фильтров. Поте-
ря напора воды при прохождении через слой ионитов
составляет 0,3—0,5 кг/см2 на 1 м загрузки. Само собой
разумеется, что чем выше слой сорбента, тем меньшую
относительную долю составляет та часть слоя, которая
затрачивается на формирование фронта сорбции.
Конструкция осветлительных и ионитовых фильтров
показана в специальном каталоге [195], а характери-
стики типоразмеров их приведены в Приложении,
165
табл. 17. Осветлительные и ионитовые фильтры защи-
щают от коррозии гуммированием (оклейкой листовой:
невулканизированной резиной с последующей вулкани-
зацией), оклейкой винипластовой фольгой или пласти-
ком, многократной окраской перхлорвиниловым или ба-
келитовым лаком за несколько раз с промежуточной го-
рячей сушкой каждого слоя, во время которой бакели-
товый лак полимеризуется. Описание технологии полу-
чения покрытий дано в работе [151].
Многие промышленные предприятия самостоятельно
изготавливают фильтры или модернизируют выпускае-
мые ионитовые фильтры (модернизация заключается
в изготовлении окон для наблюдения за происходящи-
ми в фильтре процессами, в частности, за взрыхлением
насадки). Фильтры смешанного действия небольшой
производительности (2—25 м3/ч) серийно не выпускают.
В Приложении, табл. 17 дан перечень и краткая харак-
теристика фильтров смешанного действия, разработан-
ных в лаборатории ионообменных процессов Воронеж-
ского госуниверситета [152].
Конструкция фильтров и схема фронтовых трубопро-
водов позволяет разделять и регенерировать иониты
внутри аппарата. Фронтовый трубопровод изготавлива-
ется из винипластовых или полиэтиленовых труб. За-
порная арматура — чугунная, футерованная полиэтиле-
ном, или винипластовая из массы холодного формова-
ния. Некоторые из указанных в Приложении аппаратов
эксплуатируются на промышленных установках по по-
лучению особо чистой воды на предприятиях Ере-
вана, Калуги, Куйбышева, Воронежа, Ленинграда и др.
Наиболее подробно описана конструкция фильтра сме-
шанного действия производительностью 25 м3/ч
(рис. 54). Опытный образец фильтра данной конструк-
ции прошел длительное испытание («5 лет) в про-
мышленных условиях. Полученные при этом положи-
тельные результаты позволили включить его в техно-
логическую схему установки по получению особо чис-
той воды.
Фильтр имеет сварной металлический корпус 4 диаметром
1000 мм с разъемными на фланцах эллиптическими верхним / и
нижним 9 днищами. Внутри корпус гуммирован полуэбонитом мар-
ки 1751. На корпусе имеется три смотровых окна 3 из оргстекла.
Загружают фильтр катионитом КУ-2 и аиионитом АВ-17 (соотно-
шение 1:2) высотой слоя 1800 мм. С помощью распределительных-
166
Рис. 54. «Ьильтр смешанного дейст-
вия с внутренней регенерацией иони
тов:
1 — верхнее днище; 2— верхнее распреде
лительное устройство; 3 —окна; 4 — кор
пус; 5 — среднее распределительное уст
ройство; 6 — опоры; 7 —решетка; 8 — ниж
нее распределительное устройство; 9 —
нижнее днище; 10 — гранулы из полнэти
лена; И — бетон кислотостойкий; /2 — ка
тионит; 13 — аниоиит.
устройств 2, 5 и 8 иониты регенери-
руют внутри аппарата с использова-
нием соляной кислоты.
Верхнее устройство предназначе-
но для равномерного распределения
по площади фильтрования исходной
воды, воды на отмывку, раствора ще-
лочи и вывода отработанного регене-
рациоииого раствора кислоты: оио
изготовлено из винипласта и состоит
из приемного коллектора 2 и радиаль-
ных распределительных труб / с от-
ветвлениями (рис. 55, а). Среднее
распределительное устройство, распо-
ложенное на границе раздела смол и
служащее для отвода через дренаж-
ные трубы / отработанного регенера-
циоиного раствора щелочи, — комби-
нированное трубчато-щелевое (рис.
55,6). В предлагаемой конструкции
выносной коллектор 2 изготовлен из
винипласта, а дренажные трубы, рав-
номерно расположенные по площади
поперечного сечения фильтра — из
нержавеющей стали, армированной
изнутри винипластом. По всей длине
трубы из нержавеющей стали и
винипласта нарезаны совмещающиеся поперечные щели соответствен-
но шириной 3 и 0,3 мм. Растворы протекают через щели в винипла-
стовых трубах. Для соединения труб используют эпоксидный клей,
которым покрыта и наружная поверхность труб из нержавеющей
стали.
Для нижнего распределительного устройства предлагается два
варианта: «ложное дно», в котором дренажный диск изготовлен из
углеродистой стали, гуммированной полуэбонитом марки 1751, а
щелевые колпачки — из винипласта, и комбинированное трубчато-ще-
левое. Последнее показано на рис. 55, в. Оно представляет собой
коллектор 2 с боковыми ответвлениями. Коллектор из нержавеющей
стали с внутренней и наружной сторон покрыт эпоксидным клеем.
Боковые ответвления по конструкции аналогичны дренажным трубам
среднего распределительного устройства. Нижнее днище фильтра
167
Рис. 55. Верхнее (а), среднее (б) и нижнее (в) распределительные
устройства:
/_ трубы; 2 — коллектор; 3 — щель; 4 — труба из стали 1Х18Н9Т; 5 -^ труба
винипластовая; 6 — бетон кислотостойкий.
заливается- кислотостойким бетоном. В качестве «подстилочного> ма-
териала под иониты используют полиэтиленовые гранулы размером
4—5 мм.
В нижнем и среднем распределительных устройствах описанной
конструкции, как показал опыт эксплуатации, устраняется недоста-
ток трубчато-щелевого распределительного устройства из нержавею-
щей стали, в котором вследствие коррозии размер щелей увеличи-
вается и становится возможным унос ионитов.
168
ВЫБОР ДОПОЛНИТЕЛЬНОГО ОБОРУДОВАНИЯ
Емкости для хранения реагентов, приготовления ре-
генерирующих растворов и хранения обессоленной во-
ды, емкости-мерники реагентов и другие подбирают по
производительности установки, в зависимости от часто-
ты регенераций (состава исходной воды) и других усло-
вий. Гуммированное оборудование, предназначенное
для этих целей, серийно выпускается промышленностью
[153] вместимостью от 0,25 до 1 и от 1 до 40 м3. Емко-
сти выполнены в двух вариантах: под налив и под вы-
давливание сжатым воздухом или инертным газом. При-
боры для измерения расхода воды и давления и насо-
сы подбирают в зависимости от производительности
фильтров и высоты их загрузки фильтрующим мате-
риалом.
Установку для получения высокоомной обессоленной
воды из данной природной или водопроводной воды
можно собрать из перечисленного оборудования. Наи-
большие затруднения вызывает необходимость гуммиро-
вания фильтров.
В СССР выпускают полностью укомплектованные
установки производительностью 2 и 10 м3/ч и предпола-
гается выпуск установки производительностью 25 м3/ч.
Эти установки для централизованной подачи обессолен-
ной воды получили название УЦ-2, УЦ-10 и УЦ-25.
В варианте, где на II ступени установлен смешанный
слой ионитов, установки получили название УЦ-2А
и УЦ-Юс [154]. Непосредственно их можно использо-
вать для обессоливания вод, свободных от органических
веществ и значительных количеств железа, так как
в установках отсутствует узел предварительной очистки
воды.
ОПЫТ ЭКСПЛУАТАЦИИ ПРОМЫШЛЕННОГО
ФИЛЬТРА СО» СМЕШАННЫМ СЛОЕМ ИОНИТОВ
Фильтр, конструкция которого описана выше, в течение многих
лет работает на II ступени обессоливающей установки (рис. 56)
производительностью 20—25 м3/ч (г. Воронеж). Исходная вода ха-
рактеризуется перманганатной окисляемостью <2 мг Ог/л, общей
жесткостью и щелочностью 4 мэкв/л, общей минерализованностью
5 мэкв/л и содержанием кремневой кислоты 12—15 мг/л. Катиони-
т,овый фильтр загружен катионитом КУ-2 (высота 2000 мм), анио-
169
Рис. 56. Схема установки для обессоливания артезианской воды
производительностью 25 мэ/с:
/ — катионнтовый фильтр (d=2000 мм); 2 — декарбоннзатор (cf=1000 мм); 3 —
Лак: 4—анионнтовый фильтр (о! —1400 мм); 5 — фильтр смешанного действия
(<*=1000 мм).
нитовый фильтр — аннонитом АН-31 (высота 1500 мм). Смешанный
слой состоит из 1 м3 набухшего анионита АВ-17 и 0,5 м3 катионита
КУ-2 (размер зерен соответственно 0,3—0,7 и 0,7—1,5 мм). Общая
высота загрузки — 1800 мм.
Получение смол нужных фракций достигалось сухим рассевом
товарных ионитов. Отсев ионитов составляет «50%, его использу-
ют в колонках I ступени. Схема трубопроводов фильтра смешан-
ного действия показана на рис. 57. На фильтр подают частично
обессоленную воду, характеризующуюся по ходу рабочего цикла:
удельным сопротивлением 0,05, 0,5
и 0,05 МОм-см, содержанием ионов
натрия — от 0,05 до 0,2 мэкв/л, уголь-
ной кислоты от 0,1 до 0,35 мэкв/л,
кремневой кислоты — от 12 до
15 мг/л. За один рабочий период по-
лучают 1000—1200 м3 практически
Рис. 57. Схема расположения трубо-
проводов фильтра смешанного дей-
ствия:
1 — подача воды; 2— вывод воды; 3— по-
дача щелочи; 4—подача кислоты; 5
Н-катионированная вода для промывки н
деления смол; 6 — Н-катионированная во-
да для «экранирования»; 7 — сжатый воз-
дух; 8 — спуск в канализацию; 9 — вода
для промывки среднего дренажа.
170
«обескремненной» высокоомной воды (р=10 МОм-см) при удельном
расходе технической соляной кислоты и щелочи 80—100 и 150—
180 г/м3.
По данным эксплуатации, потери ионитов на фильтре не пре-
вышают средних потерь на колонках I ступени и составляют 10 и
20% в год соответственно для катионита и анионита. Поскольку за-
грузка катионита в фильтр в 9 раз, а анионита в 2,2 раза меньше,
чем в колонках I ступени, то и потери ионитов, выраженные в аб-
солютных цифрах, во столько же раз меньше. Подготовка фильтра
к работе длится 6—8 ч.
Изменение основных показателей воды, обессоленной с помощью
фильтра смешанного дейстйия, представлено на рис. 58. Как видно
из рисунка, резкое снижение удельного сопротивления воды совпа-
дает с проскоком кремневой кислоты, увеличением окисляемости до
уровня исходной воды и увеличением содержания в воде гуминовых
и фульвокислот.
Катиониг I ступени регенерируют 7%-ным раствором техниче-
ской соляной кислотой при расходе 1 экв/экв Еа насадки фильтра,
равной 1,65 кэкв/м3. Восстановленная обменная емкость катионита
(6,28 м3) составляет при этом 6,0 кэкв, а рабочая — 5,5 кэкв, что
позволяет за один цикл работы Н-катионировать 1100—1150 м3 во-
ды. Анионитовый фильтр регенерируется избытком щелочи, затра-
ченной на регенерацию анионита АВ-17 в фильтре.
На анионит в фильтр смешанного действия подают 4—5 м3
4%-ного раствора щелочи. Регенерат, вытекающий через средний
дренаж, разбавляется обессоленной водой, которая подается снизу
вверх на слой катионита для его защиты от проникновения ще-
лочи. Регенерат сильноосновного анионита содержит большой из-
быток щелочи, а присутствующие соли (Na2C03, Na2Si03, NaCl) н"е
препятствуют его повторному использованию для регенерации сла-
боосновного анионита. На анионит I ступени подают регенерат силь-
ноосновного анионита либо непосредственно, либо через сборник
щелочи. В последнем случае нет необходимости в синхронизации ре-
генерации двух фильтров. Преимущество непосредственной подачи
регенерата с фильтра смешанного действия на анионит I ступени
§ 0 10 20 30 ¥1 50 60 70
Время, ч
Рис. 58. Изменение показателей воды, обессоленной с помощью
фильтра смешанного действия:
/ — удельное сопротивление; 2, 4 — содержание нонов HSiOT и окнсляемость
на входе в фильтр: 3, 5 — то же после фильтра.
171
заключается в том, что окончание его регенерации проводится' ще-
лочью, практически свободной от извлекаемых ионов. Общий расход
кислоты и щелочи при получении высокоомной воды из воды ука-
занного качества составляет соответственно 2,5—3,0 и 3,0—
3,5 экв/экв катионов и анионов соответственно в исходной и Н-кати-
онированной воде после декарбонизации.
Фильтр смешанного действия для обессоливания водопроводной
воды был использован в связи со срочной необходимостью получе-
ния высокоомной обессоленной воды на участке завода, лишенного
площади для развертывания полной схемы обессоливающей уста-
новки. Эксплуатировались описанные выше фильтры производитель-
ностью 20—25 м3/ч.
Емкость анионита АВ-17 по сумме всех анионов, присутствую-
щих в воде (декарбонизация не проводилась), варьирует в преде-
лах 500—550 экв/м3 при затрате на регенерацию 5—6-кратного объе-
ма щелочи. Для получения такой же емкости катионита (0,5 м3) на
регенерацию последнего расходовали до 2 кэкв соляной кислоты, из-
бытком которой удаляли нз анионита сорбированные ионы НС03.
При этом благодаря выделению диоксида углерода облегчалось раз-
деление слоев в фильтре. За рабочий цикл, который составлял всего
5 ч, из воды (состав которой указан «а с. 169) получали 100—
1.10 м3 высокоомной воды (р = 5—8 МОм-см) с содержанием крем.-
невой кислоты 0,2—0,5 mf/л.
Расход воды на регенерацию и отмывку фильтра не превышал
28—32 м3, т. е. 30% от объема обессоленной воды. Подготовка
фильтра к работе длилась 6—7 ч. При получении 1 м3 обессоленной
воды расходуется 1,2—1,5 кг щелочи и 1,8—2,0 кг соляной кислоты.
Особенно резко возрос расход щелочи, так как В схеме отсутство-
вал декарбониэатор. Этот опыт оптимизации по минимуму площади
убедительно подтвердил способность смешанного слоя иоиитов ка-
чественно обессоливать воду независимо от ее исходного состава.
ГЛУБОКОЕ ОБЕСЦВЕЧИВАНИЕ
И ОБЕССОЛИВАНИЕ ВОДЫ
Схема установки, предназначенной для получения
высокоомной воды окисляемостью менее 1 мг Оа/л из
озерной (речной) воды средней минерализованности
(4—7 мэкв/л), содержащей много гумусовых веществ
(окисляемость 10 мг Ог/л, цветность 30^40° по хлор-
платинаткобальтовой шкале) представлена на рис. 59.
Водопроводная вода подогревается в теплообмен-
нике и подается на осветлительный фильтр с двух-
слойной загрузкой (кварцевый песок и антрацит).
В линию подачи воды на расстоянии от фильтра, пре-
вышающем 50 диаметров трубопровода, насосом-доза-
тором непрерывно подается раствор коагулянта —
сульфат алюминия. Хлопьеобразование происходит
в водяной «подушке» осветлительного фильтра. На
172
Исходной
Вода
71
'\
7Х.
"Г TJ
Коагулянт
а
/~К
rj
7Х
Z1
Обессоленная
Вода
Рис. 59. Схема предварительной очистки и полного обессоливания
речной (озерной) воды:
/ — теплообменник; 2 — осветлительный фильтр; 3 — катионитовый фильтр; 4 —
декарбонизатор; 5 — бак декарбонизатора; 6 — насос; 7 — аннонит макропо-
ристый (ИА-1р); в — анионит слабоосновный (АН-31); 9 — фильтр со смешан-
ным слоем, ионитов (КУ-2 и AB-I7).
установке малой производительности в качестве послед-
него служил Н-катионитовый фильтр, имеющий высо-
кую цилиндрическую часть, тем самым и большую ка-
меру хлопьеобразования. Укрупнение хлопьев должно
продолжаться не менее 12—15 мин. Осветлительный
фильтр с двухслойной загрузкой осветляет за один ра-
бочий период 50—70 объемов воды на 1 объем насадки.
Так, фильтр диаметром 1000 мм (площадь фильтрации
0,78 м2) при высоте загрузки 1000 мм очищает 40—50 м3
коагулированной воды при дозе коагулянта 30—35 мг/л.
Перманганатная окисляемость осветленной воды со-
ставляет 50—60% исходной.
Вода, осветленная на механическоом фильтре, посту-
пает затем на Н-катионитовый фильтр, а из него на де-
карбонизатор. Освобожденная от большей части диок-
сида углерода Н-катионированная вода после декарбо-
низатора подается насосом на фильтр с макропористым
сорбентом (анионитом ИА-1р), затем на фильтр со сла-
боосновным анионитом (АН-31) и далее — в емкость
некондиционной обессоленной воды. При изучении
сорбции гумусовых веществ сорбентом ИА-1р по-
казано, что он обладает повышенной емкостью и луч-
шей кинетикой при работе в солевой форме и в кислой
среде [39]. Это и определило место йолонны в схеме
после декарбонизатора, а не после осветлительного
фильтра, как принято традиционно [14, 155].
В процессе коагуляции и последующего осветления
вода практически нацело освобождается от гуминовых
кислот, а в ней остаются хорошо растворимые фульво-
173
кислоты. Как показали расчеты, при исходном содержа-
нии фульвокислот 8—10 мг/л и работе до С/Со=0,1,
т. е. до проскока 0,8—-1,0 мг/л по фульвокислотам, на
фильтре с сорбентом ИА-1р очищается 170—200 объ-
емов воды, отнесенных к 1 объему загрузки фильтра
(приведенные объемы). Если критерием очистки избрать
сорбцию 50% органических веществ, оставшихся после
осветления и выраженных в перманганатной окисляемог
сти, на фильтре с сорбентом ИА-1р очищается. 500—
600 приведенных объемов осветленной воды. Для опре-
деления проскока можно использовать метод перманга-
натной окисляемости, но точнее и быстрее проскок уста-
навливается по оптической плотности, определенной
с помощью спектрофотометра.
В описываемой схеме обесцвечивания и обессолива-
ния озерной (речной) воды приготовление регенерирую-
щих растворов и отмывка загрузки всех фильтров, кроме
механических и катионитового, проводится Н-катиониро-
ванной водой. Преимущества ее использования очевид-
ны: при незначительной потере емкости сорбентов рас-
ход воды на отмывку и, следовательно, время отмывки
значительно сокращаются.
На описываемой установке минеральные ионы сорби-
руются в соответствии с восстановленной при регенера-
ции емкостью ионитов и составом исходной и декарбо-
низированной Н-катионированной воды.
Следует отметить, что определенной емкостью по
органическим веществам обладают и аниониты I и II
ступеней обессоливания [134, с. 168—173]. Это позво-
ляет следующим образом распределить нагрузку по
этапам очистки воды от органических веществ:
прямоточная коагуляция — от 40 до 50% исходного
содержания;
сорбция на ионите ИА-1р — от 50 до 60% оставше-
гося после прямоточной коагуляции;
сорбция на анионите АН-31 — от 30 до 40% оставше-
гося после сорбента ИА-1р;
сорбция на фильтре смешанного действия — от 20 до
30% оставшегося после предыдущего фильтра.
В результате очистки от органических веществ на
указанной установке при исходной окисляемости до
10 мг 02/л (содержание фульвокислот 12—14 мг/л) по-
лучается высокоомная вода окисляемостью 0,8—
174
1,2 мг 02/л. Описанная установка [40] более десяти
лет эксплуатируется на одном из заводов, где из озер-
ной воды (г. Таллин, оз. Юлемисте) получают высоом-
ную воду окисляемостью менее 1 мг Ог/л.
При окисляемое™ исходной воды 4—5 мг 02/л мож-
но отказаться от коагуляционной очистки и использо-
вать только сорбент ИА-1р. Рабочий период фильтра
определяется при этом заданной глубиной очистки во-
ды от органических веществ.
КОМПЛЕКСНАЯ УСТАНОВКА ДЛЯ ОБЕССОЛИВАНИЯ
ПОДЗЕМНЫХ ВОД ВЫСОКОЙ МИНЕРАЛИЗОВАННОСТИ
В глубинных артезианских водах, как правило, не
содержатся органические примеси в таких количествах,
которые требовали бы организации предварительной
очистки, но многие артезианские воды значительно ми-
нерализованы. Предварительное обессоливание такой
воды до уровня, позволяющего получать высокоомную
воду на серийно выпускаемых установках УЦ-10, мож-
но провести с помощью ионитовых фильтров, но значи-
тельно больших размеров, чем фильтры установок УЦ.
Вариант обессоливания солоноватых вод (минерализо-
ванностью 1,5—2,0 г/л), требующий очень большого
расхода ионитов и реагентов, описан в работе [208,
с. 166—169].
Более целесообразным является предварительное
обессоливание (опреснение) солоноватой воды методом
электродиализа и последующая ее обработка на ионо-
обменных установках. Схема комплексной установки
представлена на рис. 60. Она предназначена для полно-
го обессоливания воды с исходным содержанием солей
1,7 г/л (30 мэкв/л при общей жесткости 22 мэкв/л).
При электродиализе такой воды на поверхности мем-
бран и внутри них образуются отложения труднораство-
римых солей. Из-за накопления осадка увеличивается
омическое сопротивление и затрудняется протекание
и распределение рабочих растворов по камерам, что,
в свою очередь, способствует усилению поляризации
ионитовых мембран при более низких плотностях тока.
Перемена полярности электродов («переполюсовка»)
как один из методов предотвращения выпадения осад-
ков оказалась неэффективной. Распространенный метод
175
Исходная. Soda
1
Рис. 60. Схема комплексной установки для полного обессоливания
солоноватой артезианской воды:
/ — натрий-катиоиитовый фильтр; 2 — сборник умягченной воды; 3 — электро-
диализатор I ступени; 4 — электродналиэатор II ступени.
подкисления растворов в камерах концентрирования
также не дал положительных результатов. Поэтому во-
да перед поступлением в электродиализатор подверга-
ется умягчению с помощью фильтра с катионитом КУ-2.
Как показали исследования [206, с. 158—162], до-
статочным является и неглубокое умягчение до уровня,
когда соотношение ионов натрия к ионам кальцияи маг-
ния составляет 5: 1 или 10 : 1. Это позволяет проводить
так называемую «голодную» регенерацию натрий-ка-
тионитового фильтра при расходе 150—200% хлорида
натрия по отношению к общей жесткости воды. Умяг-
чению в одну ступень подвергают 145% воды по отно-
шению к объему опресненного дилюата.
Электродиализная установка непрерывно работает в
две ступени и состоит из трех аппаратов, один из кото-
рых запасной и может включаться в режим как I, так и
II ступени. Электродиализатор представляет собой аппа-
рат фильтр-прессного типа с 38 мембранами МК-40 и
МА-40; коэффициент использования их по площади 0,7.
Камеры создаются за счет рамок из паронита. В ка-
честве прокладок, выполняющих роль сепараторов-тур-
булизаторов, применяют перфорированный винипласт
высотой гофра 1,5 мм. Указанные детали, набранные в
определенном порядке, собирают в пакет и зажимают
между двумя плитами с помощью шпилек. Рассол и ди-
люат подают прямотоком, что позволяет стабилизиро-
л
-■к
1
1
1
Ь -1 *■
I
1__
— —, $
~Ч
i
I
||
£
£
ш
5 lib
ез1«о 52
fei* £
§ kS
s. § %
'£
%
176
вать режим работы электродиализатора. На выходе из
электродиализатора давление воды поддерживают по-
стоянным и равным 0,1 МПа.
Стабильная работа аппарата обеспечивается при ско-
ростях потока в камерах обессоливания, рассольных и
электродных, равных соответственно, 6, 3,5 и 20 м/с; про-
изводительность установки — 2,75 м3/ч. Выход по току
для двух ступеней в среднем составляет 70—80% при
расходе энергии 5 кВт-ч на 1 м3 опресненной воды
(0,2 кВт-ч/экв солей). При этом содержание солей
уменьшается до 250—300 мг/л, т. е. в 5—6 раз по срав-
нению с исходным.
В процессе электродиализной обработки воды умены
шается щелочность (содержание гидрокарбонатов): пос-
ле I ступени с 5,7 до 3,4 мэкв/л, а после II — до
1,3 мэкв/л. Это положительно сказывается на последую-
щей обработке воды: увеличивается продолжительность
рабочего периода высокоосновного анионита в фильтре
смешанного действия при одновременном улучшении ка-
чества обессоленной воды, определяемого по ее удельно-
му сопротивлению. Полное обессоливание опресненной
воды до удельного сопротивления 107 Ом-см произво-
дится с помощью ионообменной установки УЦ-2А, рабо-
тающей по схеме катионит->-декарбонизатор->-анионит->-
-ирильтр со смешанным слоем ионитов. Названная комп-
лексная установка безаварийно работает с 1968 г. на за-
воде им. Масленникова (г. Куйбышев) [26, с. 170—172;
197—199].
12-360
ГЛАВА
ФИНИШНАЯ ОЧИСТКА ВОДЫ
В воде, обессоленной с помощью ионитов даже до
удельного электрического сопротивления 5—10 МОм-см,
содержится ряд примесей, от которых бывает свободна
менее деминерализованная дистиллированная вода.
Это — органические вещества, источниками которых яв-
ляются плохо или совсем не сорбирующиеся ионитами
органические примеси исходной воды, механические ос-
колки и продукты деструкции ионитов, не диссоциирую-
щие на ионы минеральные вещества, комплексно свя-
занные с органическими соединениями, и, наконец,
микроорганизмы.
ПРИРОДНЫЕ ВЕЩЕСТВА ОРГАНИЧЕСКОГО
ПРОИСХОЖДЕНИЯ В ОБЕССОЛЕННОЙ ВОДЕ
Органические вещества — неэлектролиты из исходной
воды частично или полностью перейдут в фильтрат пос-
ле ионообменных фильтров. В ходе работы последних
содержание в обессоленной воде таких веществ, как са-
хара и белковоподобные соединения, меняется по зави-
симостям, представленным на рис. 61 (воронежская ар-
тезианская вода). Как следует из кривых, нет ни одного
участка рабочего периода фильтров ионообменной уста-
новки, когда обессоленная вода свободна от органиче-
ских неэлектролитов, присутствующих в исходной воде.
Каждый фильтр, обладая определенной емкостью по
органическим соединениям, вносит свой вклад в частич-
ное освобождение воды от таких веществ, как сахара и
белки. Волнообразный характер кривых свидетельствует
о смене актов их сорбции и десорбции в ходе цикла
7
178
обессоливания. Анализы показали [38], что содержание
сухого остатка в высокоомной воде, полученной на уста-
новке со смешанным слоем ионитов, составляет 1,0—
2,5 мг/л и определяется содержанием Сахаров и других,
не диссоциирующих на ионы органических и минераль-
ных примесей. Выяснено, что существенное влияние на
содержание органических веществ в обессоленном филь-
трате оказывают схемы ионообменных установок.
Содержание некоторых органических веществ в во-
де— исходной и обессоленной на установке с применени-
ем фильтра смешанного действия (№ 1) и без него
(№ 2) — приведено на следующей странице.
2000
1100
%
| 800
wo
у
1
я\
1.1 1 1
0 8 16 24 31 40 48
Время, ч
а
0 8 16 24 32 40 48
Время, ч
б
Рис. 61. Зависимость содер-
жания сложных Сахаров
(о), простых (б) и белко-
воподобных (в) веществ в
фильтратах после ионооб-
менных фильтров от време-'
ни сорбции с сорбентами
КУ-2 (1), ЭДЭ-10П (2) и
после фильтра смешанного
действия (3) ( ис-
ходная концентрация).
16 24 32 40 48
Время, ч
О
179
Содержание, мкг/л
гуминовых кислот
фульвокислот
карбоновых кис-
лот (мкэкв/л)
редуцирующих
Сахаров
аминокислот в
гидролизатах*
Окисляемость, мг Ог/я
Исход-
ная
вода
54
240Q.
10
1190
146
2.0
Вода с уста-
новки № 1
77
2
740
30
0.2
Вода с уста-
новкн М 2
23
160
4
830
32
0.2
* В пересчете на азот.
В качестве катионита использовался сорбент КУ.-2 на I
и II ступенях обессоливания. Анионитом I ступени в
обоих случаях был ЭДЭ-10П, а на II ступени — АВ-17
Приведенные данные свидетельствуют о том, что более
чистую обессоленную воду получают с помощью сме-
шанного слоя ионитов.
ПРОДУКТЫ ДЕСТРУКЦИИ ИОНИТОВ
Иониты характеризуют как вещества, не раствори-
мые в воде, хотя определение это условно. В работах
[38, 53, 156] показано, что вода, протекающая через ио-
ниты, соответствующим образом подготовленные к рабо-
те [157], извлекает из них продукты деструкции или при-
сутствовавшие внутри зерен мономеры и полупродукты
синтеза. Для их определения использовали спектроско-
пический метод в УФ- и ИК-области спектра [53, 156].
Однако опыт количественных определений [156] нельзя
признать удачным из-за условности эталонов сравнения.
Спектры поглощения воды в УФ-области до и после
контакта с ионитом представлены на рис. 62. ИК-спект-
ры сухих остатков водных экстрактов из ионитов анало-
гичны спектрам самих ионитов [161]. Особенностью вы-
мываемых из ионитов примесей являются их качествен-
ные и количественные изменения в зависимости от
характера противоиона в сорбенте. Оказалось [161], что
солевые формы ионитов отдают больше примесей, чем ос-
новные (Н- и ОН-формы). В связи с этим состав посту-
пающих в воду продуктов деструкции будет претерпе-
180
Рис. 62. Спектры поглощения
дистиллированной воды до (1)
и после (2) фильтрования че-
рез катиоиит КУ-2 ( ) и
анионит АВ-17 ( ).
6,10
от
I 0,06
I
| 0,04
**
\ 0,2
\ 0,1
N
V
20 260 300
\ Л, ММ
X 2
1 1
-■>--
МО
1
220 260
300 3*0
А., мм
ЗАО №
вать качественные изме- |
нения в ходе даже одного | °>ог
рабочего периода ионооб-
менных фильтров. По-
скольку процессу де-
струкции способствует
резкая смена концентраций внешней среды при переходе
от рабочего процесса к регенерации и обратно, следует
признать, что деструкция неизбежна и способы устране-
ния ее надо искать на пути совершенствования синтеза
ионитов и, в частности, синтеза из чистых мономеров.
Данные о количественном содержании продуктов де-
струкции в обессоленной воде пока отсутствуют. Можно
считать, что они составляют лишь доли миллиграмма в
1 л при одноразовом прохождении воды через слой ио-
нитов. С позиций неизбежности их деструкции особое
значение приобретает .укороченная схема обессоливания
со смешанным слоем на, II ступени.
МИКРООРГАНИЗМЫ В ОБЕССОЛЕННОЙ ВОДЕ
Иониты сорбируют бактериальные клетки [158], при-
чем скорость сорбции микробов лимитируется скоростью
их диффузии в частицу смолы, а размеры пор препятст-
вуют такому проникновению. Это позволяет предполо-
жить, что взаимодействие бактерий с ионитами сводится
главным образом к их адсорбции. Можно было бы ожи-
дать, что с помощью ионитов вода будет очищаться от
микроорганизмов. Однако в обессоленной воде содер-
жится на 1—3 порядка больше микроорганизмов, чем в
исходной водопроводной воде [53; 147, с. 133—137].
Значительное влияние на обсемененность воды микро-
бами оказывают простои в работе установок, рН среды,
в которой находится ионитная колонка, и другие фак-
торы [160]. Микробы размножаются в основном на ани-
онитах. Питательной средой для них являются поли-
181
аминная структура и аминные функциональные группы
анионита, а также сорбировавшиеся на нем из исходной
воды органические вещества — сахара и белки, комплек-
сующие микроэлементы. Метод посевов дает очень при-
близительную оценку содержания микроорганизмов в
воде. Рассматривая последние как микрочастицы, ме-
шающие технологическому процессу в микроэлектронике,
для определения микрочастиц следует применять метод
прямого счета [159]. Действительно, число микробов в
обессоленной воде, определенное методом прямого счета,
достигает 1 • 106 в 1 мл, а методом посева в этой же воде
определяют 100—200 колоний в 1 мл. Если принять за
форму микробов шаровидную диаметром 0,5 мкм, то сы-
рая биомасса 2-10е микроорганизмов в 1 л составит все-
го 10—20 мкг/л.
В работах [147, с. 133—137; 159] даны технологиче-
ские рекомендации, способствующие снижению обсеме-
ненное™ обессоленной воды микробами. Это прежде все-
го тщательная предварительная очистка воды, непрерыв-
ное использование фильтров, частая регенерация анио-
нита и неполная его отмывка от щелочи (если фильтр
должен стоять в резерве). Ультрафиолетовое облучение
воды оказалось недостаточным; радикальным средством,
освобождающим воду от микробов, является фильтрова-
ние через мембраны, поры которых меньше размера
микробов. Предложенные профилактические меры удли-
нят срок действия микрофильтров.
МИНЕРАЛЬНЫЕ НЕЭЛЕКТРОЛИТЫ
В ОБЕССОЛЕННОЙ ВОДЕ
Общая минерализованность обессоленной воды с
удельным электрическим сопротивлением 5—10 МОм-см,
выраженная через концентрацию NaCl, должна состав-
лять 0,05—0,01 мг/л. Между тем, в обессоленной высоко-
омной воде содержится значительно больше минераль-
ных веществ. Так, по данным [37, с. 102—106], в высоко-
омной воде (18—20 МОм-см), полученной из воды
московского водопровода, содержится: 1 • 10_7% ионов Са,
1 10-8% ионов Mg, Cr, Sn, Fe, A1, В и Si, Ы(Н% ионов
Си, Ti, Ni, Pb и Мп. Суммарное содержание названных
веществ (в ионном виде) предполагает значительно
большую электропроводимость, чем зафиксировано в
182
данной воде. Вероятно, многие из перечисленных эле-
ментов находятся в высокоомной воде не в виде ионов,
а в виде комплексных соединений с органическими ве-
ществами, в частности, с такими, как сложные сахара и
гумусовые вещества. Качество предварительной очистки
воды (•коагуляция, сорбция), безусловно, в значительной
мере определяет, и качество обессоленной воды. Если по-
следняя получена из дистиллята, в ней содержится
5 мкг/л железа; при получении обессоленного фильтрата
из артезианской воды с" исходным содержанием железа
0,3—1,0 мг/л, как правило, содержание его удается сни-
зить всего до 10—30 мкг/л.
Большую часть неэлектролитов в обессоленной воде
составляет кремневая кислота. Ее проскок в фильтрат
на удовлетворительно эксплуатируемых ионообменных
установках колеблется в пределах 0,05—0,20 мг/л. При-
чем, как показано в работе [162], проскок зависит от
«возраста» сильноосновного анионита, предназначенного
для обескремнивания воды. В ходе эксплуатации анио-
нита ухудшаются его кинетические свойства, изменяются
константы обмена и, как следствие, не только укорачива-
ется продолжительность рабочего периода фильтра, но и
ухудшается качество обессоленной воды. При этом уве-
личение расхода щелочи на регенерацию незначительно
улучшает свойства анионита.
При малых концентрациях солей кремневой кислоты
(2—20 мг/л) теоретически и практически исключается
ее полимеризация в самой Воде. В то же время в фазе
анионита создаются благоприятные условия для полиме-
ризации кремневой кислоты за счет образования соеди-
нений типа
ОН ОН ОН
I I I
■«.- О—Si—О— Si—О—Si—~^
ОН ОН ОН
Доказательством присутствия полимерной кремневой
кислоты в фазе анионита АВ-17 является то, что в ще-
лочном регенерате мономерной ионной формы ее со-
держится меньше, чем полимерной, что в обессоленной
воде, полученной с помощью долго работающего анио-
нита, обнаруживают больше полимерных форм кремне-
вой кислоты, чем мономерной. Полимерная кислота от-
183
крывается в обессоленной воде только после деполиме-
ризации в результате кипячения воды со щелочью. Она
появляется в воде в результате гидролиза солевой фор-
мы анионита. Для борьбы с этим анионит следует время
от времени регенерировать теплой или горячей щелочью.
СИСТЕМА ФИНИШНОЙ ОЧИСТКИ ВОДЫ
Высокоомную обессоленную воду перед ее непосред-
ственным использованием в прецизионных технологиче-
ских процессах, например, в микроэлектронике, подвер-
гают так называемой финишной очистке. Она заключа-
ется в освобождении воды от механических примесей,
избыточного против нормы содержания органических ве-
ществ, в окончательном обессоливании и улавливании
органических (микробы) и минеральных микрочастиц.
Система финишной, очистки воды состоит из блока
подачи воды, блока фильтров и фильтра для задержа-
ния микрочастиц. Блок подачи обессоленной воды на фи-
нишную очистку включает центробежный трехступенча-
тый насос, бак-накопитель и выпускной клапан, которые
смонтированы на одном каркасе. Насос выполнен как
моноблочный агрегат совместно с электродвигателем.
Вода в количестве 0,5 м3/ч подается на блок фильтров
при давлении 0,25 МПа (25 м вод. ст.).
Блок фильтров состоит из трех последовательно со-
единенных патронных фильтров. Первый предназначен
для очистки воды от механических частиц размером
2 мкм; второй — для сорбции растворенных органических
веществ; третий — для дополнительного обессоливания
воды до удельного электрического сопротивления
18 МОм-см. Вода, очищенная на блоке фильтров, пода-
ется на фильтр для задержания микрочастиц. Последний
состоит из пакета фильтродержателей, соединенных
между собой параллельно, в которые вкладывают дис-
ковые фильтры диаметром 142 мм.
Сорбция органических веществ. Несмотря на извест-
ную условность такого показателя, как перманганатцая
окисляемость, в практике он используется для сравни-
тельной оценки эффективности очистки воды от органи-
ческих примесей. При финишной очистке воды марки В
и Б до воды марки А окисляемость должна быть сниже-
на с 1,5—2,0 до 1,0 мг Ог/л, т. е. более чем на 50%. До-.
184
ДолниТельныМ и существенно информативным критерием
очистки воды служит ее оптическая плотность, опреде-
ленная на спектрофотометре при длине волны 220—
230 нм.
Испытания таких сорбентов, как активные угли Su-
per-Carb производства США и отечественные угли АГ-3,
АГ-5, АГ-Н, БАУ и СКТ показали, что-угли, обладающие
значительной зольностью (например, БАУ и СКТ) долж-
ны быть исключены из числа сорбентов, поскольку рас-
творимые составляющие зольности будут резко укорачи-
вать рабочий период фильтра со смешанным слоем иони-
тов. Угли Super-Carb и аналогичные ему угли марки АГ
(практически беззольные) можно использовать в системе
финишной очистки воды. Названным углям свойственен
общий недостаток — замедленная кинетика сорбции, тре-
бующая резкого снижения скорости фильтрации воды.
В табл. 16 показана зависимость эффективности очистки
обессоленной воды окисляемостью 2,0—2,5 мг Ог/л от
скорости фильтрации [164]. Отметим, что по показателю
«оптическая плотность» вода очищается углями значи-
тельно лучше, чем по окисляемости. Это означает, что
легко окисляющиеся примеси хуже сорбируются всеми
углями, -чем окрашенные фракции органических ве-
ществ.
Обессоливающая колонка позволяет пропускать воду
со скоростью 40—50 м/ч. Таким образом совместить ра-
боту фильтра с активным углем и фильтра со смешан-
ным слоем ионитов невозможно. Работа всей системы
лимитируется наименьшей скоростью пропускания воды
(8—10 м/ч).
Недостатком активированного угля .является также
малая эффективность его реагентной регенерации. По-
Таблица 16. Зависимость степени очистки воды от скорости
ее пропускания через сорбенты в долях к исходной
окисляемости (1) и оптической плотности (8), принятых за 100%
Скорость,
м/ч
4—5
8—10
16—20
Super-Carb
1 2
50 70
30 50
25 40
АГ-5
1 2
59 93
47 72
40 60
АГ-з
1 2
57 78
58 70
41 -
АГ-Н
1 2
63 85
59 72
49 55
185
этому желательно заменять угли синтетическими пори-
стыми сорбентами с Хорошими кинетическими свойства-
ми, например, макропористым анионитом АВ-17-2П на-
бухаемостью 5 мл/г или его аналогом АВ-17-10П. За
один рабочий цикл анионит очищает от 50 до 100 тыс.
объемов обессоленной воды (окисляемость снижается с
1,5—2,0 до 0,5—1 мг 02/л). Анионит регенерируется
пятью объемами 1,5 н. НС1 или столькими же объемами
6%-ного раствора NaCl в 1%-ном растворе NaOH.
Анионит АВ-17-2П работает эффективно при скоро-
стях фильтрации 40—50 м/ч, но при этом измельчается.
Поэтому для зарядки, фильтра № 2 следует отбирать
крупные фракции анионита, например 1,0—1,5 мм. Без
заметной потери сорбционной емкости анионит АВ-17-2П
работает 3—4 раза, а потом подлежит замене. Анионит
АВ-17-2П не является сильноосновным анионитом: его
солевые формы легко гидролизуются и поставляют на
следующий обессоливающий фильтр нежелательные ми-
неральные примеси. Поэтому перед зарядкой анионит
переводят в ОН-форму тремя объемами 0,5 н. NaOH и
затем отмывают обессоленной водой. В связи с гидроли-
зуемослъю анионит АВ-17-2П не используют в смешан-
ном слое в фильтре № 3, он может выполнять только
одну функцию — сорбцию органических веществ.
Эксплуатация фильтра №2 вносит значительные труд-
ности в функционирование системы финишной очистки.
Наиболее экономичной и целесообразной является глу-
бокая очистка воды от органических примесей на стади-
ях предварительной очистки и на стадии обессоливания
с помощью общезаводских ионообменных установок.
Глубокое обессоливание воды до удельного электри-
ческого сопротивления 18—20 МОм-см проводят с по-
мощью фильтра № 3, в который загружено 5 л смеси
анионита АВ-17-8чС и катионита КУ-2-8чС в отношении
(1,4—0,2) 1. Эти сорбенты не требуют подготовки к ра-
боте; после смешения их загружают в колонку. Рабочую
обменную емкость анионита АВ-17-8чС, лимитирующую
емкость смеси, принимают равной 500 мэкв/л. В обессо-
ленной воде, подаваемой на финишную очистку, удель-
ное электрическое сопротивление определяется главным
образом содержанием бикарбонат-ионов. Кремневая кис-
лота может присутствовать в концентрациях 0,05—
0,20 мг/л в зависимости от «возраста» анионита, качест-
186
Таблица 17. Рабочий период обессоливающего фильтра-патрона
системы финишной очистки в зависимости от качества воды,
подаваемой на очистку
Концентрация анионов.
мэкв/л
нсо;
0,017
0,005
0,001
0,005
0,005
0,005
0,017
0,005
0,001
HSIO-
_
—
—
0,003
0,0015
0,00075
0,003
0,003
0,003
Удельное
сопротивление,
МОм-см
1
2
5
2
2
2
1
2
5
Рабочий период
фильтра-патрона
в мэ очищен-
ной воды
96
330
1650
206
254
287
82
206
412
в ч работы
192
660
3330
412
508
574
164
412
824
ва исходной воды и условий эксплуатации обессоливаю-
щей установки. Глубина удаления кремния не сказыва-
ется на электропроводимости воды. Исходя из этих дан-
ных, рассчитывают продолжительность работы фильтра
№ 3 системы финишной очистки воды (табл. 17).
Из таблицы видно, насколько существенны глубина
очистки воды на централизованной установке и защита
полученной воды от контакта с атмосферой, в результате
которого вода из высокоомной (5—10 МОм-см) в .тече-
ние нескольких минут превращается в низкоомную (1,0—
1,5 МОм-см). На анионите АВ-17-18чС вода не только
очищается до удельного электрического сопротивления
18-—20 МОм-см, но из нее удаляется кремний до содер-
жания ионов HSiO^ менее 50 мкг/л. Анионит АВ-17-8чС
обладает и некоторой емкостью по органическим вещест-
вам, хотя и значительно меньшей, чем емкость сорбен-
тов АВ-17-2П и АВ-17-10П.
Смешанный слой ионитов из фильтров финишной
очистки воды можно регенерировать. При пропускании
через анионит 100—200 тыс. объемов воды могут ухуд-
шиться его кинетические свойства и, как следствие, сни-
зиться глубина обескремнивания и обессоливания. Если
после регенерации ионитов фильтр № 3 даст очищенную
воду меньшего удельного сопротивления и с большим
187
содержанием кремневой кислоты, это. следует считать
сигналом к замене сорбентов (замененные иониты можно
использовать на установке централизованной очистки
воды).
Механические примеси в обессоленной воде. Большин-
ство дренажных устройств ионитовых фильтров имеет
щели размером не менее 0,3 мм. Ионитовые материалы
при эксплуатации измельчаются и в той или иной мере
(в зависимости от условий работы фильтров) попадают
через дренажные устройства в следующие колонны и да-
лее в фильтрат. В работе {163] указывается на попада-
ние размельченных ионитов на полупроводниковые крем-
невые пластины, отмываемые обессоленной водой. Меха-
нические примеси задерживаются при микрофильтрации.
ГЛАВА
ОЧИСТКА ВОДЫ В ЗАМКНУТЫХ
ЦИКЛАХ ВОДООБЕСПЕЧЕНИЯ
Экономичное потребление любой воды, а тем более
кондиционированной, стало необходимостью. Оборотное
водоснабжение, понимаемое как многократное использо-
вание одной и той же воды, возможно только в том слу-
чае, если после каждого цикла использования вода очи-
щается до исходных кондиций. Очистка включает деми-
нерализацию, т. е. удаление минеральных веществ,
появившихся в технологическом процессе.
Выбор метода обессоливания зависит от прироста со-
лей, исходной минерализованности воды и требований к
ней. Если, например, для промывки деталей используют
обессоленную воду, то вся ее масса деминерализуется на
установке, схема которой обязательно завершается ионо-
обменными фильтрами. Когда детали промывают водо-
проводной водой и минерализованность ее не мешает
отмывке, приемлем и другой вариант очистки: всю воду
освобождают от мешающих примесей и только часть
предварительно очищенной воды деминерализуют в та-
кой степени, чтобы масса извлеченных солей была рав-
на их приросту в циркулирующей воде. Перед повтор-
ным употреблением предварительно очищенная вода и
деминерализованная ее часть смешиваются. Такую
очистку проводят так называемой «продувкой», т. е. за-
меной части более минерализованной воды менее мине-
рализованной (исходной) водой, обратным осмосом,
электродиализом и ионным обменом или сочетанием
этих методов. При выборе метода или их сочетания ру-
ководствуются не только экономическими, но и экологи-
ческими соображениями,
8
ЭКОНОМИЧЕСКОЕ ОБОСНОВАНИЕ ОЧИСТКИ ВОДЫ
В ЗАМКНУТЫХ ЦИКЛАХ
Экономический эффект (Э) от внедрения замкнутого
водообеспечения (потребление — очистка — потребление)
в сравнении с прямоточным (потребление — очистка —
сброс) можно рассчитать по формуле:
э_ (ZB + ZK + Z04)P
z;,(P-Pn)+(ZB + ZK)Pn
где Zb, Zk, Zoi, Zom —соответственно цены 1 м3 сырой воды, ее кон-
диционирования (обезжелезивание, умягчение и др.), очистки для
разрешения на сброс, очистки до норм, разрешающих повторное ис-
пользование; Р и Рп — годовой расход воды соответственно в тех-
нологическом цикле и на подпитку системы.
Для каждого данного производства уравнение реша-
ется с учетом конкретных обстоятельств, включающих
уровень требований городских очистных сооружений к
полноте очистки принимаемых сточных вод [166], или от-
вечающих условиям сброса сточных вод в водоем [196].
Если вещества, извлеченные из сточных вод, утилизиру-
ют, например, хромовый ангидрид, в числитель формулы
вводят годовой экономический эффект (Эу) от утилиза-
ции загрязняющих примесей.
В качестве примера рассматривается очистка сточных вод цеха
специальной обработки стальной фольги перед их сбросом в канали-
зацию и варианты очистки до кондиций, позволяющих направлять
воду в производство. Цех использует 60 м3/ч водопроводной воды
минерализованностью 5 экв/м3. Вода загрязняется органическими ве-
ществами, сброс которых в канализацию разрешен, и солями железа
(FeCls н FeCl2), которые удаляются перед сбросом воды подщела-
чиванием и осветлением (рис. 63, а).
Прирост солей составляет 2 экв/м3 в каждом акте использова-
ния воды. Для повторного использования воду дополнительно освет-
ляют, очищают сорбционным методом от органических веществ, а
солл извлекают ионообменным, обратно-осмотическнм и электродиа-
лизным способами (рис. 63,6, в, г). Ежечасно из воды необходимо
извлечь 120 экв солей. Для этого нониым обменом обессоливают
20 мэ/ч предварительно очищенной воды; обратным осмосом —
24 м9/ч на I ступени с выходом по обессоленной воде 15 м3/ч и
9 м9/ч на II ступени с выходом фильтрата 6 м3/ч; электродиалнзом
частично обессоливают (с 7 до 5 экв/м3) всю воду, прошедшую пред-
варительную очистку по схеме рис. 63, а, а затем пропущенную че-
рез осветлительный и сорбцнонный фильтры. Для сравнения ниже
представлены показатели трех конкурирующих схем (расчет прове-
190
Внанализа-
цишилина
\ доочистн'/
Фугат
-€к
I
На утилизацию
.3 .10
I
U:
I
*__,*
!
j
ь^
1/5
€^г
ГХ
у10
ъ
12-
«ч
I
ь*>
Рис. 63. Схемы подготовки сточных вод для сброса в канализацию
(а) и доочистки для повторного использования (б, в, г):
/ — усреднитель; 2 — насосы; 3—смеситель; 4 — осветлитель; 5 — песчаный
фильтр; 6 — отстойник промывочных вод; 7 — центрифуга; 8 — сборник очи-
щенных по схеме а сточных вод; 9 — механический фильтр; 10 — сорбциои-
ный фильтр; Л — катионитовый и анионитовый фильтры; 12 — обратио-осмо-
тнческнй аппарат; 13 — электродиализатор; 14 — сборник очищенных сточных
ДеН по Методике, изложенной в работе [155], с учетом исходных
данных по осмосу [1971 и электродиалиэу [9]):
Ионный Обрат- Элек-
обмен ный тродиа-
осмос лнз
Капитальные затраты, тыс. руб. 193 487 224
Стоимость оборудования, тыс.
руб. 43 206 76
Эксплуатационные затраты,
тыс. руб. 77 97 67
Приведенные затраты, тыс. руб. 116 194 112
Стоимость 1 м3 очищенной во-
ды, руб. 0,21 0,26 0,19
Недостатки и преимущества каждого метода деминера-
лизации по этим данным очевидны. Дополнительный рас-
чет показал, что в случае прироста солей на 4 экв/м3 и
более в каждом акте ее использования ионообменный
метод становится неконкурентоспособным из-за повы-
шающегося расхода реагентов и воды на подготовку
фильтров к работе и на подпитку системы.
Значение Z04 складывается из Z04 (рис. 63, а) и Z04
доочистки (рис. 63, б, в,г). При объединении в одну уста-
новку схема а и б, в, г стоимость возвращенной воды сни-
зится, поскольку уменьшатся трудовые затраты. Экономи-
чески выгодным оборотное водоснабжение будет в случа-
ях, когда Z'04 —Z04 меньше стоимости сырой воды и ее
кондиционирования. В ряде случаев невыгодность обо-
ротного водоснабжения из-за больших капитальных за-
трат при низких ценах на сырую воду можно рассматри-
вать как плату за экологическую целесообразность. Ути-
лизация извлеченных из воды примесей резко повышает
экономичность замкнутого водообеспечения.
ИОНООБМЕННАЯ ОЧИСТКА СТОЧНЫХ ВОД
ГАЛЬВАНИЧЕСКИХ ПРОИЗВОДСТВ
Состав промывных вод гальванических производств
определяется технологией процесса, а -концентрация
примесей — характером водопользования в целом и спо-
собами отмывки деталей в частности. На действующих
предприятиях, проектирование которых относится ко
времени, когда расходование воды не ограничивалось,
наиболее распространенной является промывка деталей
в одной ванне при затратах воды до 1000 л на 1 м2 по-
192
верхности металла. Расчет показывает, Что при выносе
с деталями 0,1—0,2 л/м2 электролита со средней концен-
трацией солей 200 г/л содержание их в промывных во-
дах увеличится всего на 0,5—1,5 мэкв/л. Анализ сточ-
ных вод ряда гальванических цехов подтвердил резуль-
таты этих расчетов.
В последнее время расход воды на промывку деталей
стараются сократить. Проектируют в основном каскад-
но-противоточные системы отмывки. В наиболее распро-
страненном случае использования двух ванн расход воды
удается уменьшить в 10—30 раз. Концентрация солей в
сточных водах при этом соответственно возрастает. Еще
большее сокращение расхода воды и концентрирование
примесей в сточных водах требует резкого увеличения
производственных площадей, что при существующих це-
нах на чистую воду не всегда реализуется по экономиче-
ским соображениям.
Следует отметить, что, варьируя способы отмывки,
можно изменить только концентрацию примесей в сточ-
ных водах, но отнюдь не абсолютное количество присут-
ствующих веществ. Последнее зависит от выноса элек-
тролита вместе с деталями из основной ванны. Поэтому
совершенствование процесса переноса деталей из галь-
ванической в промывочную ванну является главным и
решающим фактором экономичного использования воды.
Единственным практически осуществимым способом
возвращения промывных вод является метод ионного об-
мена, с помощью которого возвращается обессоленная
вода, а сорбированные примеси извлекаются из ионитов
при их регенерации. Целесообразность использования
ионного обмена как метода очистки и возвращения 85—
95% промывных вод ограничивается приростом содер-
жания солей от I до 5 мэкв/л (50—250 мг/л). Это сле-
дует учитывать при определении или разработке режи-
ма водопользования в гальваническом производстве.
Очевидно, при каскадно-противоточной отмывке в двух
или трех ваннах, в связи с высокой концентрирован-
ностью промывных вод, ионообменный метод их очистки
нецелесообразен, а предпочтителен обратный осмос или
электродиализ.
В промывных водах электрохимического цеха круп-
ного машиностроительного завода содержится до 30 раз-
личных ионов: катионы Na, Ca, Fe, Cu, Zn, Ni, Cd и др.
13—360
193
анионы H2SO4, HC1, HN03, HF, H3B03) сульфосалицило-
вой и других кислот. И это необходимо учитывать при
выборе марок ионитов и их соотношений, условий реге-
нерации и других факторов.
В зависимости от конкретных условий производства
предлагаются следующие варианты очистки сточных вод:
локальная очистка воды каждой ванны с помощью
переносных ионитовых колонок соответствующей произ-
водительности,
очистка общих усредненных сточных вод, разрешен-
ных для смешивания.
Могут быть и промежуточные варианты: локально-
групповая очистка, объединяющая несколько однотип-
ных ванн промывки деталей, и смешанная локально-
групповая, когда объединяются разные промывные воды
по признаку совместимости или целесообразности. На-
пример, может оказаться целесообразным смешивание
кислых и щелочных вод после ванн соответствующего
травления металлов. При этом не только частично ней-
трализуются сточные воды, но и плохо сорбируемые
анионы (типа алюминатов) перейдут в хорошо сорби-
руемые катионы. В основу объединения сточных вод мо-
гут быть положены и другие критерии, например, совме-
стимость извлеченных ионов при дальнейшей переработке
регенератов на электродиализаторах.
Выбор варианта очистки воды определяется характе-
ром гальванического цеха и химизмом взаимодействия
ионитов с индивидуальными веществами и их смесями.
Сточные воды, содержащие масла, детергенты,, клеи
и другие органические вещества, не могут непосредст-
венно подаваться на ионообменные установки. Их отде-
ляют либо подвергают очистке коагуляцией с добавкой
флокулянтов, электрокоагуляцией, сорбцией на активи-
рованных углях или макропористых анионитах, озониро-
ванием. Циансодержащие сточные воды обезвреживают
окислительным методом (лучше озоном).
Как правило, промывные воды гальванического про-
изводства имеют кислый характер; в них содержатся
ионы тяжелых металлов и ионы натрия, попадающие из
ванн щелочного травления и обезжиривания. В связи с
этим возможны два основных варианта подачи воды на
иониты: очистка после нейтрализации и очистка без ней-
трализации.
194
Ионообменная очистка после нейтрализации. Вода
нейтрализуется до рН 8,0—8,5 растворами соды или ще-
лочи, раствором извести. При этом основная масса со-
держащихся в сточных водах металлов выпадает в виде
соответствующих гидроксидов или основных карбонатов
(ионы никеля, меди и свинца более полно удаляются
в виде основных" карбонатов). Для перевода железа из
двух- в трехвалентное в аппарат для нейтрализации по-
дают воздух.
Нейтрализации может сопутствовать коагуляцион-
ная очистка от масел и других органических примесей.
Выбор метода осветления зависит от концентрации тя-
желых металлов, объема обрабатываемой воды и ряда
других факторов [166]. Следует иметь в виду, что освет-
ление должно быть достаточно полным для последующей
переработки воды любым из известных методов. В этих
целях независимо от полноты осветления после нейтра-
лизации необходимо предусматривать осветлительный
фильтр и на самой обессоливающей установке.
Нейтрализованные и осветленные воды разделяют на
две группы: содержащие соли только сильных кислот и
содержащие соли сильных и слабых кислот. Катионный
состав той или другой группы определяется ионами нат-
рия при нейтрализации щелочью и содой и ионами каль-
ция при обработке раствором извести. Кроме особых
случаев, при организации оборотного водоснабжения в
гальваническом производстве достаточная очистка обес-
печивается на одноступенчатых схемах катионит — анио-.
нит; но для второй группы вод рекомендуется использо-
вать схему катионит — анионит слабоосновный — анио-
нит сильноосновный.
Катионитовый фильтр рассчитывают по ионам Na+ или Са3+
для нейтрализации сточных вод известковым раствором. Слабооснов-
ный анионит рассчитывают по сумме анионов сильных кислот, при-
нимая рабочую обменную емкость равной 90% восстановленной при
регенерации. Сильиоосновный анионит рассчитывают по сумме анио-
нов слабых кислот, принимая рабочую обменную емкость анйонита
типа АВ-17 равной 300—400 экв/м9 при пяти-шестикратном расходе
щелочи на регенерацию. Высота слоя ионитов принимается более
J м, а скорость фильтрации до 15 м/ч.
Как и при обессоливании природных вод, когда
концентрация солей превышает 4—5 мэкв/л, рекоменду-
ется применять обратный осмос или электродиализ. Для
вод, содержащих соли слабых кислот (борной, кремне-
13*
195
вой, сульфосалициловой), предварительное обессолива-
ние экономично проводить обратным осмосом. При элек-
тродиализе анионы этих кислот практически не перено-
сятся из камер обессиливания в рассольные камеры, в
то время как в аппарате обратного осмоса через мем-
браны переносится только вода, а соли слабых кислот
преимущественно остаются в рассоле. Если предусмат-
ривается электродиализ или обратный осмос, целесооб-
разно нейтрализовать сточные воды щелочью, содой или
их смесью, а не известковым раствором, особенно когда
в воде содержатся анионы, образующие осадки с катио-
ном кальция. В гальванических цехах, где разрешается
применение водопроводной воды, ею подпитывают систе-
му на величину потерь воды при обессоливаиии.
Очистке без предварительной нейтрализации подвер'
гаются промывные воды, свободные от примесей, ме-
шающих функционированию ионитов или ионитовых
мембран (масла, детергенты и др.). Воды с рН в 2—4,
содержащие катионы тяжелых металлов и натрия, пода-
ют на сильнокислотный катионит КУ-2. Желательно
предварительно отделить тяжелые металлы от однова-
лентных. Для этого устанавливают последовательно два
катионитовых фильтра, из которых первый работает до
проскока тяжелых металлов, а второй — до проскока ио-
нов натрия. При регенерации фильтров и последующей
переработке регенератов такая схема имеет определенные
преимущества. Для расчета такой пары фильтров можно
пользоваться методикой, представленной в работах
[9, 165, с. 25—29]. Кислые промывные воды гальваниче-
ского цеха очищают в целях их возврата в производство
с помощью установок, работающих по схеме: предвари-
тельный фильтр->-сильнокислотные катиониты I и II сту-
пени->-анионит слабоосновный или предварительный
фильтр-^сильнокислотные катиониты I и II ступени->-
->-анионит слабоосновный->-анионит сильноосновный.
В отличие от нейтрализованных кислые промывные
воды с повышенной концентрацией солей тяжелых ме-
таллов не всегда можно деминерализовать электродиали-
зом или обратным осмосом из-за возможного образова-
ния осадков на ионообменных мембранах в первом слу-
чае или непрочности мембран при низких рН во втором.
Очистка без предварительной нейтрализации наибо-
лее целесообразна как локальная очистка, когда можно
196
утилизировать извлеченные из воды примеси в основном
технологическом процессе.
В настоящее время на Волжском автомобильном за-
воде (г. Тольятти) действует промышленная установка
ионитной очистки общего стока цеха гальванических по-
крытий производительностью 12 000 м3/сут. В состав
каждой технологической линии очистки входят фильтры
предварительной очистки от взвешенных частиц и орга-
нических примесей, катионитовый фильтр и два аниони-
товых со слабо- и сильноосновным анионитом. Растворы,
образующиеся при регенерации ионитов, обезврежива-
ются с помощью реагентов.
Регенерат катионитовых фильтров при очистке без
нейтрализации содержит катионы металлов, запрещен-
ные к сбросу в канализацию или водоем; его подвергают
нейтрализации и последующей традиционной переработ-
ке [166]. Регенерат анионита, если в нем нет токсичных
веществ, можно использовать для нейтрализации кислот-
ного регенерата. Таким образом, при организации обо-
ротного водоснабжения с пбмощью ионного обмена тра-
диционные способы очистки не исчезают, а переносятся
на относительно малые объемы регенератов: их объем в
100 и 200 раз меньше объема очищаемой воды, если при-
рост солей в процессе ее использования достигает соот-
ветственно 4 и 2 мэкв/л.
При экологической оценке ионообменной очистки
промывных вод надо помнить, что возвращение их в
производство сопровождается по меньшей мере утроен-
ным сбросом солей в водоемы по сравнению с приростом
в актах технологического использования воды и тради-
ционной очистки. В связи с этим ионообменная очистка
отработанных электролитов перед сбросом в канализа-
цию представляется бессмысленной как с экономической,
так и экологической точек зрения. Ионообменная очист-
ка электролита целесообразна только в случае его воз-
вращения в производство. Во всех остальных — отрабо-
танный электролит перед сбросом надо очищать тради-
ционным методом — осаждением, в котором расход
реагентов на обезвреживание близок к стехиометриче-
скому.
Если для отмывки деталей не требуется обессолен-
ная вода, а допускается содержание солей, при котором
прирост может быть снят безреагентным методом (об-
197
Рис. 64. Схема установки для очистки хромсодержащих промывных
вод и хромового электролита:
/ — сборник; 2 — осветлительный фильтр; 3 — катионнтовый фильтр; 4— анио-
ннтовый фильтр; 5 — катионнтовый фильтр для превращения регенерата анио-
ннта в хромовый ангидрид; 6 — катионнтовый фильтр для очистки электроли-
та от ионов Fe4- и Сг3+; 7 — емкость для кислоты; 8 — емкость для щелочи;
9 — емкость для обработанного электролита; 10 — аппарат для нейтрализации
кислых реагентов; // — сборник очищенного электролита; 12 — сборник очи-
щенной воды; 13 — сборник хромового ангидрида.
ратный осмос, электродиализ), последним надо отдать
предпочтение. Но в связи с технологическими преиму-
ществами ионообменного метода получает развитие и
другой путь — электрохимическая переработка регенера-
тов ионообменных фильтров (см. гл. 9).
Рассмотренные схемы очистки не затрагивают хром-
содержащих сточных вод. Для них предпочитают локаль-
ную очистку, при которой в производство возвращается
не только вся вода, но и извлеченные из нее соединения
шестивалентного хрома.
Хроматы (бихроматы) являются сильными окисли-
телями, поэтому для очистки хромсодержащих промыв-
ных сточных йод используют стойкие иониты на основе
сополимеров стирола и дивинилбензола, например, КУ-2
и АВ-17. Установка для локальной очистки промывных
вод после хромирования стальных деталей в стандарт-
ном электролите эксплуатируется уже десять лет на
Елецком агрегатном заводе [167]. Одновременно на этой
же установке на отдельном фильтре отработанный элек-
тролит очищают от накапливающихся в нем примесей
Fe(III) и Сг(Ш). Схема установки представлена на
рис. 64.
198
При очистке воды катионит 3 работает до проскока
Ионов кальция, а анионит 4 — до проскока ионов хро-
ма (VI). При этом часть воды обессоливается, а часть
просто умягчается. Очищенная вода направляется в цех
на промывку-деталей и частично используется для нужд
ионообменной установки (регенерация и отмывка анио-
нитовых фильтров). Регенерат катионита, содержащий
ионы железа, хрома(III) и кальция, нейтрализуют из-
вестковым раствором. Регенерат анионита, содержащий
главным образом хромат натрия и избыток щелочи,
Н-катионированием в аппарате 5 превращают в раствор
хромового ангидрида, которым корректируют электро-
лит.
Для очистки отработанного электролита используют
катионитовый фильтр 6. Электролит пропускают со ско-
ростью 1 м/ч вначале через механический, а затем че-
рез катионитовый фильтр. Один объем катионита на 70—
80% очищает 2—3 объема электролита от примесей же-
леза и хрома(III). Очищенный электролит возвращает-
ся в ванны хромирования. Регенерат фильтра 6 нейтра-
лизуют также известковым раствором.
Производительность установки по очистке воды 2—-
3 м3/ч, по электролиту 0,2—0,3 м3/ч; площадь под обо-
рудованием — 60 м2. Установка работает с годовым эко-
номическим эффектом 18 000 руб., затраты на реагенты
составляют 4,2 коп./м3 очищенной воды.
Расход воды на собственные нужды установки (10—
20%) компенсируется добавкой водопроводной воды.
Она очищается на этой же установке вместе с промыв-
ными водами, поэтому состав подпиточнои воды влияет
не только на ход очистки промывных вод, но и на тех-
нологию превращения регенерата анионитового фильтра
в хромовый ангидрид нужной степени чистоты.
На Елецком заводе пользуются подземной водой би-
карбонатного класса с очень малым содержанием хло-
ридов и сульфатов. Это и определило простоту схемы ио-
нообменной очистки и возвращения хромового ангидрида
в производство. Если с подпиточнои водой в систему обо-
ротного водоснабжения вводятся посторонние ионы
(сульфаты, хлориды) в количестве, сопоставимом с коли-
чеством анионов хрома (VI), выносимых из электроли-
та, схема ионообменной очистки промывных вод услож-
няется. Необходимо либо обессоливать на отдельной ус-
199
Тановке воду для подпитки системы оборотного водо-
снабжения, либо усложнить единую установку очистки
промывных вод.
По второму пути пошли на одном из заводов г. Куй-
бышева при создании установки для очистки хромсодер-
жащих сточных вод производительностью 40 м3/ч. В ка-
честве подпиточной используют артезианскую сульфат-
но-кальциевую воду минерэлизованностью более
30 мэкв/л, поэтому очистку промывных вод ведут по
схеме: катионит (КУ-2) -^ анионит сильноосновный
(АВ-17)—анионит слабоосновный (ЭДЭ-10П или
АН-31). Катионит работает до проскока солей натрия,
анионит АВ-17 — ионов хрома(VI), анионит ЭДЭ-10П —
ионов хлора. По сорбируемости на анионите АВ-17 анио-
ны располагаются в ряд [209, с. 103—107]:
сг2о|_ > стог > sor > noj > ci-
Поэтому большая часть сульфат- и хлорид-ионов вы-
тесняется на слабоосновный анионйт, а анионит АВ-17
обогащается бихромат-ионами. При благоприятном соот-
ношении примесей регенерат сильноосновного анионита
при последующем Н-катионировании может превратить-
ся в раствор хромового ангидрида с допустимым содер-
жанием примесей. Отметим, что полнота хроматографи-
ческого разделения ионов, присутствующих в хромсодер-
жащих сточных водах, зависит от их соотношения: чем
больше посторонних ионов, тем сложнее технология от-
деления хрома и возвращения его в производство. Мо-
жет, например, возникнуть необходимость в очистке
регенерата анионитового фильтра от посторонних при-
месей, мешающих возвращению хрома в производство.
Такая дополнительная очистка проводится на установке
в г. Куйбышеве.
Наиболее простой и надежной является локальная
ионообменная очистка хромсодержащих сточных вод с
подпиткой системы обессоленной водой из автономного
источника. При этом прирост солей в пром,ывной воде
(их природа и соотношение отдельных ионов) соответст-
вует составу электролита, что позволяет повторно исполь-
зовать не только воду (как на ВАЗе в г. Тольятти), но и
электролит. Выбор оптимального варианта требует уче-
та конкретных обстоятельств, складывающихся в произ-
водстве.
200
ИОНООБМЕННАЯ ОЧИСТКА И ВОЗВРАЩЕНИЕ
В ПРОИЗВОДСТВО ИСПОЛЬЗОВАННОЙ
ОСОБО ЧИСТОЙ ВОДЫ
В производствах микроэлектроники пластины после
травления и других операций очищаются водой" удель-
ным сопротивлением 18 MGm-см в трех каскадно-проти-
воточных ваннах [168]. Такая очистка гарантирует вы-
сокую степень отмывки при расходе особо чистой воды в
20—40 раз меньше, чем при одноступенчатой прямоточ-
ной отмывке. Тем не менее, несмотря на сравнительно
экономное использование воды, при заданной степени
очистки электролит, вносимый в промывную ванну кассе-
той с пластинами, очень разбавляется. Вода, вытекаю-
щая даже из первой (самой грязной) ванны, через ко-
роткое время после внесения кассеты характеризуется
минерализованностью в 10—100 раз меньшей, чем водо-
проводная вода, из которой получают высокоомную воду.
Это определяет целесообразность обессоливания боль-
шей части промывных вод и возвращения их в техноло-
гический процесс.
Для максимизации объема возвращаемой воды необ-
ходимо совершенствовать способ водопользования. На-
пример, перед каскадно-противоточными ваннами отмы-
вать кассеты с пластинами над канализационной решет-
кой особп чистой водой, подаваемой из «пистолета», в
/2 _ . . . _ .
г>
оГ
V Л
CL ¥
О 0,5 1,0 1,5 2,0
Удельное сопротивление,м0м-см
Рис. 65. Время отмывки пластин высокоомной водой (р =
= 18 МОм-см) после их обработки в смеси HCI+H2O2 до заданного
удельного сопротивления промывных вод (отмывка) (пояснение
кривых в тексте, пунктиром обозначено время выдерживания кассе-
ты в проточной воде — регламент).
201
Рнс. 66. Схема получения особо чистой во-
ды с рециркуляцией (фирма Millipore,
США):
/ — блок фильтров финишной очистки обессолен-
ной воды; 2 — измеритель удельного сопротивле-
ления; Я — фильтр для очистки воды от-мнкроча-
стиц; 4 — каскадно-противоточные ванны для от-
мывки приборов; 5 — автоматический блок врз
врата или направления на сброс использование)!
обессоленной воды; 6 — автоматический блок по-
дачи обессоленной воды.
течение 3—5 с (рис. 65, кривая /). Электролит (90—
95%), захваченный кассетой, смывается в канализацию,
и промывная вода еще быстрее достигает удельного со-
противления, при котором ее можно пускать на глубо-
кую очистку (рис. 65, кривая 2).
Объем возвращаемой воды зависит от ряда условий:
способа выноса деталей из электролита на промывку,
степени загрузки промывных ванн, размера фильтров и
задаваемой продолжительности их работы. Если в кас-
кадно-противоточные ванны кассеты загружают каждые
6 мин и затем последовательно переставляют из первой
ванны во вторую и третью и если для повторного ис-
пользования на очистку подается вода с удельным со-
противлением 0,5 МОм-см, то в ходе процесса, описы-
ваемого кривыми 1 и 2 (рис. 65), можно подать на
фильтр соответственно 25 и 60% промывной воды.
Фирма Millipore (США) [168] предлагает осуществ-
лять оборотное водоснабжение участка для отмывки де-
талей с помощью систем финишной очистки воды
(рис. 66). Нижний порог удельного сопротивления, при
котором можно направлять воду на систему финишной
очистки, определяется емкостью обессоливающей колон-
ны (патрона) и задаваемой продолжительностью его
работы без замены.
Локальная очистка на финишных колонках удобна в
том отношении, что не требует протяженных коммуника-
ций и дополнительного оборудования. В тех случаях,
когда нет необходимости в сорбционной очистке от орга-
нических веществ, можно на место соответствующей ко-
лонки ставить еще одну колонку со смешанным слоем.
А.
Обессоленная
202
Последнее гарантирует получение кондиционной водь!
даже при очистке от легко гидролизующихся соедине-
ний и увеличивает ресурс-системы.
Недостаток непосредственного использования финиш-
ных колонок для очистки промывных вод заключается в
том, что с их помощью очищается только часть той
воды, которую следовало бы очищать, если исходить не
из задаваемой продолжительности работы финишной ко-
лонки, а из сопоставления содержания солей в промыв-
ных водах и исходной водопроводной воде. Действи-
тельно, оборотное водоснабжение высокоомной водой
экономически оправданно при равенстве затрат на ее
очистку до нужных кондиций и затрат на водопроводную
воду и ее обессоливание до тех же кондиций. При рас-
чете затрат надо принимать во внимание не только по-
казатель содержания солей, но и их природу. Так, про-
мывные воды, характеризующиеся сложным анионным
составом (F-, SiF2 , СН3СОО- N0^ Р0| , SO2 , С1~)
требуют повышенного расхода щелочи при обессолива-
нии по сравнению, например, с бикарбонатной водой,
когда образовавшийся диоксид углерода удаляется в де-
карбонизаторе. Катионный состав промывных вод опре-
деляется присутствием одновалентных ионов (NHJ, К+,
Na+); по ним рабочая обменная емкость несколько мень-
ше, чем по двухвалентным, характерным для природной
воды. Поэтому для равенства затрат на обессоливание
возвращаемая вода должна, как правило, отличаться
меньшим содержанием солей, чем исходная водопро-
водная.
В производствах микроэлектроники большое число
операций завершается промывкой особо чистой водой. На
основе баланса веществ необходимо вначале рассчитать
состав промывных вод для случая, когда все, что выно-
сится из рабочей ванны, остается в промывных водах.
При использовании трех каскадно-противоточных ванн,
т. е. при весьма экономичном водопользовании, усред-
ненная концентрация примесей в промывных водах от
операции к операции меняется от 2 до 20 мэкв/л. Если
по технологии обработки пластин разрешается частично
смывать электролит до погружения кассет в промывные
ванночки, то, как указывалось выше, содержание солей
в промывных водах уменьшится на порядок; при этом
целесообразно практически все промывные воды, за-
203
Грязненные электролитами, подвергать ионообменной
очистке на установке централизованного обессоливания
воды или на установке-дублере. Если по соображениям
технологии на той или иной операции предварительная
отмывка кассет не допускается, то часть-промывных вод
из первой (наиболее грязной) ванны сбрасывают в ка-
нализацию; приемлемым будет сброс воды до удельного
сопротивления 0,05—0,1 МОм-см. Если на систему фи-
нишной очистки воды подают промывные воды с содер-
жанием солей 0,03 мэкв/л, на централизованную очистку
можно направлять воды минерализованностью 30—
40 раз большей, т. е. практически всю воду, кроме за-
траченной на смыв электролита в канализацию (на
смыв электролита с пластин расходуется 3—4% общего
расхода промывных вод).
Централизованная очистка промывных вод предпоч-
тительнее локальной очистки на финишных колонках,
так как на установке работают большие по объему и по
высоте слои ионитов (в которых хорошо используется
восстановленная при регенерации обменная емкость) и
где вполне технологичным является рабочий период
фильтров, равный 1—2 сут. Недостатком централизован-
ной очистки по сравнению с локальной являются удли-
нение коммуникаций и увеличение расходов на перека-
чивание воды. Оптимальный вариант очистки выбирают
с учётом конкретных условий данного производства. Не-
зависимо от выбранного варианта в водооборот не во-
влекают промывные воды, примеси которых не извле-
каются сорбентами и ионитами. Воды, содержащие перо-
ксид водорода, разбавляют до концентрации окислите-
ля 0,5—1,0 мг/л (не более). Если концентрация объеди-
ненных промывных вод, имеющих, как правило, кислот-
ный характер, не будет превышать 1 мэкв/л, то их мож-
но очищать по схеме: предварительный фильтр (аниони-
ты АВ-17-2П, АВ-17-10П, ИА-1р или активированные
угли марок АГ)->анионит высокоосновный (АВ-17-8)->
-»-фильтр смешанного действия.
При более высоком содержании солей и значитель-
ном присутствии катионов металлов рациональной бу-
дет схема: предварительный фильтр->-катионит-»-анио-
нит-мрильтр смешанного действия.
После очистки обессоленная вода( марки Б и В) на-
правляется на финишную очистку. Если прирост орга-
204
нических веществ невелик и окисляемость промывных
вод много меньше 1 мг Ог/л, можно не использовать
предварительный фильтр.
ИОНООБМЕННАЯ ОЧИСТКА ВОДЫ
КОНТУРОВ ОХЛАЖДЕНИЯ ЭЛЕКТРОФИЗИЧЕСКОЙ
АППАРАТУРЫ |ЭФА|
Такие аппараты и приборы, как генераторы радио-
волн, магниты ускорителей, мощные переключатели тока
охлаждают высокоомной водой (1—5 МОм-см), тем са-
мым предотвращаются утечки тока, снижается коррозия
и упрощаются необходимые компенсационные схемы.
Охлаждаемые системы выполнены из разнообразных
конструкционных материалов (медь, латунь, сталь, оло-
во, свинец, алюминий, стекло и др.). При контакте с
обессоленной водой последние в той или иной степени
корродируют, а растворимые продукты коррозии пере-
ходят в теплоноситель, изменяя его качество.
Взаимодействие особо чистой воды и конструкцион-
ных материалов изучалось одновременно в двух направ-
лениях: коррозия металлов в частично и полностью обес-
соленной воде и скорость и характер изменения удельно-
го сопротивления воды, контактирующей с материала-
ми. Необходимость второго направления связана с тем,
что первое не дает достаточной информации для расчета
способов очистки контура охлаждения ЭФА. Исследова-
ния по коррозии здесь не рассматриваются. Они изло-
жены в работе [169].
Для расчета процесса ионообменной очистки контур-
ной воды от растворимых примесей необходимо знать ско-
рость ее загрязнения в зависимости от следующих фак-
торов: природы конструкционного материала, начальной
электропроводимости обессоленной воды, содержания
в ней кислорода, величины теплопереноса, удельного объ-
ема воды в контуре. Методика и аппаратура для иссле-
дования изменений качества обессоленной воды в конту-
ре охлаждения ЭФА описаны в работах [210, с. 81—87].
Аппаратура изготавливается из стойких в воде материалов, на-
пример оргстекла, и надежно герметизируется. Кинетика ухудшения
качества воды определяется экспериментально снятием кривых х—t
в зависимости от перечисленных выше параметров. Рассматриваются
начальные участки кривых х—t (в пределах 1 ч) и принимается,
205
Рис. 67. Влияние природы кон-
струкционного материала на кине-
тику изменения электропроводно-
сти особо чистой воды (концент-
рация кислорода 10 мг/л, удель-
ный объем воды в контуре
14 л/м3):
/ — оргстекло; 2 ~ алюминий; 3 — сталь
марки 1Х(8Н10Т; 4 — медь; 5 — вини-
пласт; 6 — латунь.
что за это время поверхность ме-
талла не подвергается заметно-
му изменению, а соответствую-
щий участок кривых х—t близок
к линейному. Поэтому значение
Ах/At численно равно тангенсу
угла наклона начальной части
кривых х—t. Сравнивая кривые
(рис. 67), можно составить «ряд стойкости»материалов вводе. Из-
менение состава воды и условий эксплуатации охлаждаемой аппа-
ратуры могут изменить порядок в этом ряду.
Предложена [210, с. 88—94] и экспериментально проверена фор-
мула для расчета тор доли объема воды (G, %), непрерывная очист-
ка которой достаточна для сохранения заданной удельной электро-
проводимости всей массы воды, циркулирующей в замкнутом конту-
ре охлаждения ЭФЛ
_ J00 Ах
Х3 — Xqtj ЛГ
где к — коэффициент пропорциональности, имеющий размерность
времени; х3 и х0ч — заданная удельная электропроводимость воды
в контуре и электропроводимость доли очищенной воды; Дх/Д/ —
скорость изменения удельной электропроводимости воды при контак-
те с материалами охлаждаемой аппаратуры.
В этом уравнении основной устанавливаемой величиной являет-
ся Дх/Д<. Для ее нахождения проводят серию экспериментов, в каж-
дом из которых постоянными являются все параметры, кроме изу-
чаемого. В результате экспериментов было предложено уравнение
для описания скорости изменения электропроводимости воды в кон-
туре охлаждения ЭФА в зависимости от природы материала, тепло-
переноса, начальной или заданной электропроводимости воды в кон-
туре:
а м* Г Ki^i , "аУИзЗа 1 1
Ах/Д' = [ ахз-б + а' + Ь'дх3\Т
где q — тепловой поток через поверхность материала, кВт/м2; х3 —
заданная электропроводимость воды в контуре, мкСм/м; Si и Si —
соответственно поверхность, работающая в изотермических услови-
2 3 *
Время, ч
206
Таблица 18. Расчетные и экспериментальные величины «продувки» контуров охлаждения ЭФА в
зависимости от заданных электропроводимости воды хэ и тепловой напряженности
поверхности (q) материалов
10-4 СМ/Ы
Я.
кВт/на
Прирост
Дх/Дг
за счет
теплового
потока,
10-4 См/(м-ч)
Лх/Лг.
10-4 СМ/(МЧ)
расчетная
эксперимен-
тальная
Содержание
кислорода,
мг/л
«Продувка», необходимая для поддержания
заданной удельной электропроводимости
воды, %/ч
0,6-10-4 См/м
0.2-10-4 См/м
0.1-10-4 о/м
0,5
0,2
0,1
0,1
0,5
0,2
0,1
0,5
0,2
0,1
0,2
0,2
0
0
0
0
10
10
10
100
100
100
о
Г 5
—
—
—
0,066
0,026
0,013
0,657
0,263
0,131
0,099
0,35
2,4
0,165
0,376
2,413
0,756
0,613
2,53
Медь МБ
0,10.
0,32
1,95
0,33
0,15
0,40
—
0,75
0,68
—
6—7
6—7
6—7
0,1
6—7
6—7
6—7
6—7
6—7
6—7
23
38
175
Сталь 1Х18Н10Т
| - | - I 0,15 | 6-7 | 34 |
Алюминий АБ 000
| - I - I 0,6 | 6-7 | - |
Винипласт
| - | - | 0,06 | 6-7 | 14 |
0.2 | 0 | —
Примечание, и ч=0,07-10-4 См/м; удельный объем воды в контуре 7 л/м», температура — 30 "С.
269
289
456
223
456
46
7992
1100
8025
8425
| 500
| 2000
| 200
ях и в условиях теплопереноса, м2; V — объем воды в контуре, л;
а, Ь, а', Ь', с — коэффициенты, зависящие от природы материала и
состава воды; Ki, кг — коэффициенты пропорциональности (при за-
данных размерностях они равны единице).
Первое слагаемое уравнения характеризует изотермические ус-
ловия, второе относится к теплопередающей части поверхности ма-
териала, загрязняющего воду, и показывает прирост скорости загряз-
нения воды за счет теплового потока. При расчете Дх/Д/ в контуре,
изготовленном из разнородных материалов, принимается, что ско-
рости изменения электропроводимости каждым материалом — вели-
чины аддитивные. Однако, если продукты коррозии одного мате-
риала; осаждаясь на поверхности другого, образуют электрохимиче-
скую коррозионную пару, скорость загрязнения воды будет значи-
тельно выше рассчитанной по сумме скоростей для каждого мате-
риала.
Формула проверена для некоторых материалов (медь, нержавею-
щая сталь) в диапазоне изменения удельной электропроводимости
охлаждающей воды от 0,1 Ю-6 до 3-Ю-4 См/м (р=0,3—
10 МОм-см) и теплового потока от 0 до 600 кВт/м2. В табл. 18
представлены найденные по последнему уравнению величины «про-
дувки» контура .охлаждения ЭФА (охлаждаемый элемент и мате-
риал контура — медь, алюминий и сталь); значения а, а', Ь., Ъ' и с
для меди, поверхность которой соответствующим образом подготов-
лена, равны 3, 4, 76, 0,28 и 0,001.
Как видно из таблицы, при ужесточении требований к "чистоте
охлаждающей воды и увеличении теплоиапряженности поверхности
материала величина «продувки» возрастает. Однако в контуре из
меди прирост An/At за счет теплового потока через поверхность ма-
териала снижается при уменьшении удельной электропроводимости
воды. Снижение концентрации кислорода в воде, контактирующей
с медью, также снижает величину Дх/Д? и, следовательно, величину
«продувки». Это указывает на необходимость глубокой очистки воды
в контурах охлаждения, содержащих медные элементы, и целесооб-
разность удаления кислорода.
Для очистки воды контуров охлаждения ЭФА от рас-
творимых продуктов коррозии используют смешанный
слой ионитов, позволяющий резко Снизить электропро-
водимость очищенной доли воды, а тем самым соответ-
ственно уменьшить долю очищаемой воды (см. уравне-
ние на с. 206). Смешанный слой, как показано в работе
[211, с. 171 —173], способен сорбировать ионы меди даже
из ее гидроксида. Нерастворимые продукты коррозии и
другие микрочастицы лучше всего удалять с помощью
специальных микрофильтрующих устройств или намыв-
ных ионитовых фильтров.
Удаление из воды кислорода
При работе с водой контура охлаждения удаление
кислорода нагреванием исключается. Желательна тех-
нология фильтрационного типа, для чего можно исполь-
208
зовать специальные полимеры, способные к обратимым
реакциям окисления — восстановления. Такие полимеры
по аналогии с ионитами получили название редокситов
[170]. Они подразделяются на электронообменники и
электроноионообменники. Представителем первых явля-
ется смола ЭО-7, содержащая хинонгидрохинонные
группы.
Электроионообменники представлены смолами ЭИ-5,
ЭИ-5У и др. В них в качестве восстановителя использу-
ется диспергированная медь, задерживаемая матрицей
катионита силами адгезии. Медь с растворимым в воде
кислородом взаимодействует по реакции:
2еСи + 0,5О2 + Н2О »- Си(ОН)2
Гидроксид меди удерживается сорбционными силами
на матрице катионита, но частично переходит в фильт-
рат. Эта часть измеряется долями миллиграмма в литре
обессоленной воды [171]. Как показали исследования
[67, с. 171-—173], оксиды меди растворяются и полностью
извлекаются из воды смешанным слоем ионитов.
Полная емкость по кислороду для смол ЭО-7, ЭИ-5 и
ЭИ-5У составляет соответственно 10, 16 и 40 г Ог/л на-
бухшей смолы. При работе фильтрующих колонн из-за
размытого фронта сорбции, определяемого характером
кинетики процесса [172], рабочая емкость редокситов
значительно отличается от полной или восстановленной.
Расчет фильтров с редокситами сложен, так как
фронт сорбции имеет размытый характер, напоминаю-
щий сорбцию при вогнутой изотерме. Расчет [171] на ос-
нове теоретических представлений [172] показал, что при
работе со смолой ЭИ-5 фронт сорбции формируется на
слое редоксита высотой 1,3, 1,6 и 3 м соответственно
при пропускании воды через фильтр со скоростью 10, 15
и -20 м/ч. Это означает, что, как правило, кислород уда-
ляется в нестационарных условиях. Поэтому рабочий пе-
риод фильтров со слоями редокситов менее 1 м опреде-
ляют экспериментально в конкретных условиях. Емкость
отработавших редокситов может быть восстановлена по
методике, изложенной в работе [174—175].
14—360
ГЛАВА
ЭКСПЛУАТАЦИЯ ИОНИТОВ ПРИ ПОЛУЧЕНИИ
ВЫСОКООМНОЙ ВОДЫ
ПОДГОТОВКА ИОНИТОВ К РАБОТЕ
При получении высокоомной воды с помощью неболь-
ших установок подготовка ионитов и их регенерация от-
личаются некоторыми особенностями. Пригодными для
работы непосредственно в товарном виде являются иони-
ты КУ-2-8чС и АВ-17-8чС. Однако они дороги и исполь-
зуются, как правило, только в системах финишной очист-
ки обессоленной воды. Все остальйые иониты содержат
органические и неорганические примеси (полупродукты
синтеза, железо и др.), от которых необходимо освобо-
диться, учитывая требования к качеству обессоленной
воды.
Перед загрузкой ионитов фильтры заполняют 20—
25%-ным раствором хлорида натрия на высоту 0,5 м. То-
варные иониты порциями (по 15—20 кг) с интервалом
10—20 мин загружают в фильтры и выдерживают в этом
растворе сутки. Противоточной подачей исходной воды
иониты отмывают от мелочи, которая удаляется через
воздушник, цри этом следят, чтобы в канализацию не
попали и рабочие фракции сорбентов. Затем иониты от-
мывают водой (прямотоком) от избытка хлорида натрия.
При пропускании воды со скоростью 10 м/ч расход ее на
отмывку составляет 15—20 м3 на 1 м3 ионита. Для кон-
троля за степенью отмывки наиболее простым является
аргентометрический метод. Степень отмывки можно кон-
тролировать и с помощью кондуктометра: в конце от-
мывки удельное сопротивление (электропроводимость)
промывных вод должно быть близким к этому показате-
лю в исходной воде.
Обработка с помощью хлорида натрия предназначе-
на для двух целей: предупреждения растрескивания зе-
рен и «высаливания» некоторых органических примесей
9
210
из матрицы ионитов. Более полное удаление органиче-
ских примесей достигается попеременной обработкой ио-
нитов кислотой и щелочью с промежуточной промывкой
аодой [157] и проведением 2—3 фильтроциклов на слив
в канализацию.
Удаление железа из ионитов. Иониты, как правило,
загрязнены железом. Особенно нежелательно присутст-
вие железа в анионитах, с помощью которых завершает-
ся обессбливание воды. Железо удаляют из ионитов со-
ляной кислотой, пропуская через слой сорбента 2—
3 объема 3 н. («10%) раствора соляной кислоты со
скоростью 0,5—1 м/ч. Серная кислота тоже извлекает
железо из ионитов, но менее эффективно. Контролируют
процесс качественной реакцией на железо-(Ш) с родани-
стым калием или аммонием. Полное извлечение железа,
требующее больших расходов кислоты, как правило, не
проводится. Катионит в ходе указанной операции пере-
водится в Н-форму и после отмывки от кислоты готов к
работе; анионит подлежит переводу в ОН-форму.
После извлечения большей части железа иониты от-
мывают исходной водой: катионит — до кислотности про-
мывных вод, в 1,5—2 раза большей кислотности исходной
воды после ее Н-катионирования, анионит — до кислотно-
сти 1—2 мэкв/л. Кислотность промывных вод определяют
титрованием щелочью с индикатором метилоранж или
фенолфталеин.
Если на установке имеются запасные фильтры, то
подготовку ионитов к работе можно проводить в них с
последующей перегрузкой ионитов в соответствующие
фильтры. После одного-двух фильтроциклов (регенера-
ция— рабочий период — регенерация) со сбросом филь-
трата в канализацию установка готова к обессоливанию
воды.
Окраска анионита. Анионит АВ-17 в ОН-форме перед
загрузкой в фильтр смешанного действия окрашивают
0,1%-ным раствором тимолового синего для удобства ви-
зуального контроля за процессом деления и смешивания
смол. Тимоловый синий имеет две области перехода ок-
раски: при рН 1,2—2,8 — от красной к желтой, при
рН 8,0—9,6 — от желтой к синей. Для окрашивания на
1 л 0,1%-ного раствора красителя добавляют 0,2 г ед-
кого натра. Общий объем раствора красителя должен
быть равен объему ионита. Установлено, что вода и реге-
14*
211
нерирующие растворы не вымывают краситель из зе*
рен смолы.
Подготовка пористого сорбента ИА-1. Анионит ИА-1
предназначен для сорбции из воды органических приме-
сей. Между тем товарный анионит отдает в воду восста-
навливающие вещества. Особенностью подготовки сор-
бента ИА-1 является промывка водой противотоком от
мелочи и последующим прямотоком, перевод в ОН-фор-
му, а затем в солевую форму с промежуточными про-
мывками водой до перманганатной окисляемости про-
мывных вод в кислой среде 1,5—2,0 мг Оа/л.
ПОДГОТОВКА ФИЛЬТРОВ К РАБОЧЕМУ ЦИКЛУ
Эксплуатация фильтров заключается в периодиче-
ском проведении четырех операций, составляющих пол-
ный рабочий цикл: пропускание воды через фильтр,
взрыхление сорбентов перед регенерацией, регенерация
и отмывка их. от избытка реагентов и продуктов регене-
рации.
Взрыхление. При взрыхлении ионитов потоком воды,
подаваемым снизу, уносятся взвешенные вещества и из-
мельченные иониты, которые могут создавать повышен-
ное гидродинамическое сопротивление фильтрующего
слоя. Взрыхление обеспечивает последующий свободный
доступ регенерирующего раствора к зернам ионитов. Эту
операцию ведут интенсивностью 3—4 л/(с-м2) площади
фильтра в течение 10—15 мин. Сорбент для предвари-
тельной очистки воды (анионит ИА-1) и катионит взрых-
ляют исходной водопроводной или осветленной водой,
анионит — Н-катионированной или обессоленной водой.
При этом слой сорбентов «расширяется» на 30—50%. Во
время операции наблюдают за водой, вытекающей из
воздушника, чтобы своевременно прекратить или умень-
шить ее подачу до выноса потоком рабочих фракций
ионитов.
Регенерация и отмывка макропористого сорбента
ИА-1. Через сорбент, насыщенный органическими ве-
ществами, пропускают двух-трехкратный объем 2%-ного
раствора щелочи со скоростью 3—5 м/ч. Затем анионит
отмывают пятью-шестью объемами водопроводной (ос-
ветленной) воды от избытка щелочи и продуктов регене-
рации при скорости потока 10 м/ч.
212
Регенерация и отмывка катионита КУ-2. Катиониты
с малой сорбционнои емкостью, например, сульфоуголь,
регенерируют дешевой и доступной серной кислотой.
Этот процесс широко распространен и детально отрабо-
тан на водоподготовительных установках энергетических
предприятий [173]. При работе с катйонитом КУ-2, ем-
кость которого в 2—2,5 раза больше, чем емкость суль-
фоугля, регенерация серной кислотой всегда связана с
возможностью образования сульфата кальция в глубине
зерен («загипсовывание»), что повлечет за собой паде-
ние рабочей емкости от цикла к циклу. Во избежание
этого применяют раствор серной кислоты постепенно воз-
растающей концентрации от 1,5 до 5%.
В ряде случаев используют двойную регенерацию:
вначале 2—3 объемами 6%-ного раствора хлорида нат-
рия, а затем 3—5%-ной серной кислотой. Экономии рас-
хода серной кислоты при этом нет, так как для полного
удаления натрия затраты кислоты равны 2,5—3,0 экви-
валента на 1 эквивалент. Сульфат кальция из катионита
можно растворить и вымыть 1—2 н. раствором азотной
кислоты, пропуская его со скоростью 1—2 м/ч в течение
1—2 ч.
Обессоливающие установки малой производительно-
сти на приборостроительных, радиотехнических и других
предприятиях, как правило, не предусматривают запас-
ных фильтров, гарантирующих непрерывность работы
при «загипсовывании» одного из основных фильтров.
В связи с этим катионит регенерируют соляной кислотой,
не образующей осадков с сорбированными катионами.
В работе [9] показано, что при регенерации катионита в
смешанной Са-, Mg- и Na-форме оптимальным является
2 н. (7%-ный) раствор соляной кислоты, для Na- и К-
форм — 0,5—0,7 н. раствор. Расход кислоты в первом
случае может быть ограничен 1 экв/экв Еп КУ-2, равной
1,65—1,80 кэкв/м3; восстановленная обменная емкость
составит 50—60% полной, т. е. 850—1000 экв/м3.
Отмывку катионита после регенерации ведут исход-
ной водой прямотоком со скоростью 5—10 м/ч, пропу-
ская 5—7 объемов воды. Кислотность промывной воды
в конце промывки должна быть не больше удвоенной
кислотности исходной Н-катионированной воды. Прини-
мается, что в процессе отмывки 50% катионов, присут-
ствующих в промывной воде, задерживается катйонитом
213
(в основном ионы кальция и магния) При наличии ем-1
кости для сбора кислой воды последние фракции про-
мывных вод можно использовать для приготовления ре-
генерата и для частичной отмывки катионита после ре-
генерации.
Регенерация и отмывка слабоосновного анионита. Ем-
кость анионитов типа АН-31 или ЭДЭ-10П восстанавли-
вают 1—2%-ным раствором щелочи, расход которой со-
ставляет 50—75 кг/м3. При этом рабочая обменная ем-
кость анионитов колеблется в пределах 800—1000 экв/м3,
а относительный расход щелочи равен 150—180% по
отношению к количеству сорбированных ионов. Регене-
рат готовят на обессоленной или Н-катионированной
воде и пропускают через насадку фильтра со скоростью
1—2 м/ч (в течение 40—50 мин).
Отмывку ведут Н-катионированной или обессоленной
водой со скоростью 10 м/ч, расходуя при этом 8—
12 объемов воды на один объем смолы. Контролируют
степень отмывки анионита с помощью кондуктометра:
анионит считается отмытым, когда удельное сопротивле-
ние промывных вод достигает 50—100 кОм-см. Часть
промывных вод используется для приготовления раство-
ра регенерата.
Регенерация и отмывка сильноосновного анионита на
I ступени обессоливания. Анионит АВ-17, работающий на
I ступени обессоливания, регенерируют 0,5—1,0 н. рас-
твором гидроксида натрия при расходе последнего 80—
120 кг/м3. Регенерат пропускают со скоростью 1—2 м/ч.
Рабочая обменная емкость по сумме сорбируемых анио-
нов колеблется в пределах 400—500 экв/м3, а расход
щелочи составляет 500—600% от количества сорбирован-
ных анионов. Контроль за отмывкой ведут с помощью
кондуктометра, удовлетворяясь удельным сопротивлени-
ем 50—100 кОм-см.
ПОДГОТОВКА К РАБОТЕ ФИЛЬТРА
СО СМЕШАННЫМ СЛОЕМ ИОНИТОВ
Рассев ионитов для смешанного слоя. Перед регене-
рацией смешанный слой должен разделяться на слой
анионита (верхняя часть насадки фильтра) и слой катио-
нита.
214
Смесь товарных ионитов КУ-2-8 и АВ-17-8 не делится
на слои потоком воды, подаваемым снизу. Фракции ка-
теонита размером зерен больше 0,7 мм, а анионита —
менее 0,7 мм как в основных (Н- и ОН-), так и в соле-
вых формах перед загрузкой в фильтр смешанного дей-
ствия в воздушно-сухом состоянии отсеивают на сталь-
ных или латунных ситах (размер ячеек 0,7 мм). Более
мелкие фракции катионита и более крупные фракции
анионита используют в фильтрах I ступени обессолива-
ния. Фракции ионитов для смешанного слоя подготавли-
вают к работе так же, как и товарные сорбенты.
Деление смол. После истощения обменной емкости
смешанного слоя, которое узнают по резкому падению
удельного сопротивления фильтрата, иониты освобожда-
ют от образовавшихся и занесенных в фильтрующий
слой мелких частиц потоком водопроводной воды, на-
правленным снизу вверх интенсивностью 3 л/(с-м2). При
достижении крупными частицами иони*тов верхнего окна
фильтра интенсивность подачи воды снижают до 0,8—
1,0 л/(с-м2) и, продолжая подачу еще 10—15 мин, разде-
ляют иониты.
Регенерацию катионита ведут 3—3,5 объемами 1 н.
соляной кислоты на один объем катионита при скорости
потока 3—5 м/ч. Раствор подают снизу и пропускают че-
рез слой как катионита, так и анионита с выбросом ре-
генерата через верх. Этим достигается перевод анионита
в С1-форму, которая, в отличие от бикарбонатной, не
подвергается гидролизу в условиях неполной регенера-
ции и тем самым меньше влияет на качество фильтрата.
Отмывают всю загрузку от избытка кислоты обессолен-
ной или Н-катионированной водой, подавая ее в течение
40 мин одновременно через нижний и верхний дренаж с
выводом в средний.
Регенерация анионита. Через слой -анионита сверху
вниз пропускают 4—5 объемов 1 н. раствора щелочи со
скоростью 3—5 м/ч. Регенерат сбрасывают через сред-
ний дренаж. Одновременно снизу на катионит подают
воду интенсивностью 0,5—0,6 л/(с-м2). Вода предотвра-
щает попадание щелочи в граничащий с анионитом слой
катионообменника. Блокирующая промывная вода сбра-
сывается в средний дренаж. От избытка щелочи анионит
отмывают обессоленной водой в течение часа со ско-
215
ростью 10—15 м/ч, не прекращая подачи блокирующей
воды на катионит.
Регенерат, разбавленный блокирующей обессоленной
(Н-катионированной) водой, иснользуют непосредствен-
но или через промежуточную емкость для регенерации
слабоосновного анионита I ступени обессоливания.
Смешивание смол. Перед смешиванием воду спускают
до уровня загрузки и через нижний дренаж в течение
20—25 мин подают очищенный от пыли и масел сжатый
воздух интенсивностью 20 л/(с-м2). Фильтр заполняют
затем прямотоком водой и оставляют на 30—60 мин., в
течение которых происходит взаимопроникновение и
нейтрализация избытков кислоты и щелочи. Заключи-
тельная отмывка фильтра смешанного действия прово-
дится в ходе рабочего периода в течение 30 мин. Вода с
удельным сопротивлением менее 4—5МОм-см направля-
ется в бак частично обессоленной воды. Общий расход
воды на подготовку фильтра составляет около 20 объе-
мов смешанного слоя.
ТРЕБОВАНИЯ К ЧИСТОТЕ РЕГЕНЕРИРУЮЩИХ
РЕАГЕНТОВ
В многотоннажном производстве обессоленной воды
используют технические марки щелочи и кислоты (как
правило, серной) [173]. При получении высокоомной
воды в практике химических, электронных, радиотехни-
ческих и машиностроительных производств предпочита-
ют соляную кислоту и щелочь более чистые, чем техни-
ческие продукты. Выбор степени чистоты реагентов за-
висит не только от требований к качеству обессоленной
воды, но, как будет показано, и от степени предвари-
тельной очистки воды, особенно удаления из нее железа.
Требования к щелочи
В щелочи содержится ряд примесей, которые в той
или иной мере влияют на процесс регенерации ионитов.
Железо. Анионит обогащается железом из двух источ-
ников: щелочи, применяемой для регенерации, и Н-ка-
тионированной воды. Железо задерживается анионитом
не только в виде гидроксида в силу коагулирующего
действия анионита в ОН-форме, но и в виде аминокомп-
216
Лексов. Гидроксид железа попадает на анионит извне и
до известной критической насыщенности задерживается
слоем настолько прочно, что не вымывается обессолен-
ной водой ни в прямо- ни в противоточной схеме от-
мывки.
Поступающая на анионит Н-катионированная вода в
зависимости от ее кислотности частично растворяет свя-
занное с анионитом железо, продвигает его по слою и,
наконец, выводит в фильтрат в виде гидролизованных
солей и даже в виде гидроксида. Критической насьпцен-
ностью железом анионита (С** ) или катионита (C£)L)
* Кр,Э * ^ KJJtJv '
предложено называть такое его содержание в ионите,
которое не позволяет в заданных условиях получать
обессоленную воду с содержанием железа меньше
10 мкг/л. С£е не является константой, а зависит от при-
роды ионита, состава и минерализованности воды, ско-
рости ее пропускания через фильтр и определяется экс-
периментально [176] (значения C£f для различных ио-
нитов приведены в табл. 19).
Число фильтроциклов (JVa), в течение которых ани-
онит достигает критической насыщенности железом, рас-
считывают по формуле:
Na = Скр.аа/0ЩС£ + V (С* - С%)
где Сщв, Сдв, Сфе —соответственно содержание железа в щелочи
(г/кг), воде и фильтрате (г/м3); Gn—принятый расход щелочи,
кг/мэ; V — объем воды, очищенной при расходе щелочи, рав-
ном Ощ, м3; а — степень регенерации анионита от железа кислотой.
Приведенное уравнение позволяет решать ряд технологи-
ческих задач: выбор сорта щелочи для регенерации анио-
Таблица 19. Критическая насыщенность ионитов железом
(мг/л) в зависимости от кислотности Н-катиоиированной воды,
пропускаемой со скоростью 15 м/ч через слой высотой 40 см
Ионит
АН-31
ЭДЭ-10П
АВ-17-8
КУ-2-8
Кислотность Н-катионироваиной воды, мэкв/л
0,1
300
250
130
10 000
1
250
250
120
~-
2
200
220
100
—
5
150-
150
70
5000
10
50
50
30
500
20
—
—
500
217
Таблица 20. Число фильтроциклов, в течение которых
аниоиит АН-31 достигает критической насыщенности в зависимости
от содержания железа в воде и регенерирующем растворе
(Е =700—750 экв/мЭ: С =50 кг/мЗ: Сфв=0: с£|—см. табл. 19)
„Fe
съ .
0
5
10
20
30
5-10-5
». ч.
800
100
53
28
19
Содержание железа, % (Марка щелочи)
110-3
ч. Д. а.
400
89
50
27
18
2-10-3
ч.
200
73
44
25
17
3,5-0-3
ТР
114
67
38
23
16
7-10-3
ТХ-1
57
38
28
19
14
14-10-8
ТХ-2
28
23
19
14
11
7-10-2
Дт
6
5
5
5
4
нита и выбор требований к глубине удаления железа до
подачи воды на обессоливание установки; определение
частотности и глубины очистки анионита от железа с по-
мощью кислоты и др. В табл. 20 представлены резуль-
таты расчетов числа фильтроциклов для анионита
АН-31, обессоливающего воду с разным содержанием
железа при кислотности 2 мэкв/л.
Как следует из таблицы, чем больше в Н-катиониро-
ванной воде железа, тем меньшее значение имеет чисто-
та щелочи, и наоборот. Выбор марки щелочи в конкрет-
ных условиях определяется экономической или техноло-
гической' целесообразностью частоты обработки анионита
кислотой для удаления из слоя накапливающегося же-
леза. Если же вынужденно используется определенная
марка щелочи, то по приведенной выше формуле рас-
считывают частоту отмывки анионита кислотой, на необ-
ходимость которой указывается в работе [177] (для
промывки предпочтительнее использовать 1,5—2-крат-
ный объем 7-10%-ного раствора соляной кислоты, дли-
тельность контакта 1—1,5 ч).
Из технических марок щелочи для регенерации анио-
нита рекомендуется только щелочь ТР. Если использо-
вание других марок носит вынужденный характер, их
предварительно очищают от гидроксида железа, напри-
мер, на специальном фильтре с анионитом АН-31 или
ЭДЭ-10П.
218
Остальные примеси (кальций, магний, хлориды, суль-
фаты, соли кремневой и угольной кислот) не мешают
получению кондиционной воды на установках с фильтра-
ми смешанного действия на II ступени обессоливания.
Для регенерации анионита в установках финишной
очистки воды следует использовать щелочь самой высо-
кой квалификации.
Требования к кислоте
Различные сорта соляной кислоты существенно отли-
чаются друг от друга содержанием железа, остатком
после прокаливания, состоящим в основном из солей ще-
лочных и щелочноземельных металлов, и содержанием
свободного хлора.
Число фильтроциклов, в течение которых может быть
достигнуто С£рК» рассчитывают по формуле:
"к = с£к/У(С-С£е)(1-а)
Если а->-1, то Nk-*~°°- При регенерации катионита 2 н.
раствором соляной кислоты образуется ацидокомплекс
HFeCU, в котором железо входит в состав' аниона и по-
этому не задерживается катионитом. В связи с этим при-
сутствие железа в соляной кислоте не приводит к его
накоплению в катионите. Как показали исследования
[176], различия в показателе «прокаленный остаток» со-
ляной кислоты марки х.ч. и синтетической кислоты мар-
ки В при их равноэквивалентных расходах на регенера-
цию катионита КУ-2 незначительно изменяют рабочую
обменную емкость (2—5%). Выполнение требований к
высокоомной обессоленной воде обеспечивается при ре-
генерации катионита соляной кислотой не только марок
х. ч., ч. д. а. и ч., но и синтетической кислотой марок А,
Б и В. По показателю «свободный хлор» следует пред-
почесть синтетическую соляную кислоту марок А и Б.
Для регенерации катионита в системах финишной очист-
ки воды лучше, применять кислоту марок х.ч., ч. д. а.
и ч.
Регенерация регенератов
Ионообменный способ обессоливания пресных вод —
самый экономичный из известных методов [9] и единст-
венный, позволяющий полностью обессолить воду. В то
же время ионообменная технология, как дающая вторич-
219
ные загрязнения, с самого начала неэкологична. Вторич-
ные загрязнения представляют собой хорошо раствори-
мые соли, для захоронения которых нет надежных
средств. Даже в идеальном случае на обессоливание
воды ионитами нельзя затратить меньше 200% реаген-
тов, поскольку регенерируются катионит и анионит.
В практике обессоливания расход реагентов в 3—4 раза
превышает массу солей, извлеченных из воды.
В настоящее время еще допускается сброс в канали-
зацию растворов солей концентрацией до 10 г/л [178],
но а связи с прогрессирующей минерализацией пресных
вод даже такое разрешение нельзя считать постоянным.
Сброс солей непосредственно в водоемы тоже ограничен.
Радикальным решением, обеспечивающим уменьше-
ние сброса солевых растворов в водоемы, является пе-
реход к предварительному обессоливанию воды с по-
мощью электродиализа или обратного осмоса. Однако,
в силу ряда технических и экономических причин элек-
тродиализ и обратный осмос еще не стали методами
предварительного обессоливания в крупнотоннажном
производстве. Поэтому в качестве варианта компромис-
сного решения, направленного на сокращение сброса со-
лей в водоемы, можно принять электрохимическую реге-
нерацию регенерата анионитовых фильтров, заключаю-
щуюся в конверсии солей в повторно используемые ще-
лочь и кислоту [179]. Испытания такого варианта на
полупромышленной установке показали [212, с. 92—95],
что на получение 1 эквивалента щелочи расходуется
0,17 кВт-ч электроэнергии. Если принять, что затраты на
электроэнергию составляют 7з общих затрат на перера-
ботку регенерата, себестоимость полученной щелочи не
превышает 15 коп. за 1 кг и будет близка к стоимости
товарного реагента. Кроме того, в этом процессе в соот-
ветствии с составом регенерата образуется одновремен-
но кислота, пригодная для повторного использования.
Выделение кислоты из сернокислого - регенерата
Н-катионитовых фильтров оказалось более энергоемким
процессом [213, с. 90—93], требующим при соответствую-
щем подборе условий его проведения от 0,4 до 0,9 кВт-ч
для получения 1 экв кислоты. Ее стоимость во много раз
превышает стоимость товарной кислоты, а это, естест-
венно, будет тормозить внедрение процесса в практику
ионообменной деминерализации воды.
220
АНАЛИТИЧЕСКИЙ КОНТРОЛЬ В ПРОЦЕССАХ
ОБЕССОЛИВАНИЯ ВОДЫ
Анализ исходной воды. Промышленные предприятия
большей частью обессоливают воду питьевого качества,
т. е. водопроводную воду. Ее химический состав меняется
в широких пределах, но не должен превышать норм, ука-
занных в ГОСТ 2874—73 (см. Приложение, табл. 18).
По стандартным методикам большая часть показателей
воды определяется с чувствительностью, отличающейся
от возможного содержания в воде тех или иных веществ
на 1—2 порядка. Это вполне удовлетворяет требованиям
качества воды, из которой получают обессоленную воду.
Как правило, данные о составе водопроводной воды мо-
гут быть получены в лабораториях санитарно-эпидемио-
логических станций.
Отметим, что в ГОСТ на питьевую воду нет сведений,
достаточных для расчета процессов обессоливания и
контроля за ними. Так, не нормируется окисляемость
воды, содержание кремневой кислоты во всех возмож-
ных формах, содержание гумусовых веществ и других
органических соединений.
Для определения общей, бикарбонатной, карбонатной и гидрат-
ной щелочности используют методику руководств [5, 180], кремневую
кислоту и окисляемость можно определять по методикам, предло-
женным в книге «Унифицированные методы анализа вод» [5], или
по «Инструкции по анализу воды, пара и отложений в теплосило-
вом хозяйстве» [180]. Методы определения содержания в природных
водах органических веществ некоторых изложены в работах [4,5].
Универсальная обессоливающая установка содержит
узел предварительной очистки (коагуляция, осветление
и сорбция органических веществ), узел Н-катионирова-
ния, декарбонизации, ОН-ионирования на I ступени и
обессоливания воды на смешанном слое ионитов. Такая
схема может быть объединена с электродиализом или
обратным осмосом для частичного обессоливания воды
повышенной минерализованности. На каждом этапе об-
работки воды необходим соответствующий контроль.
Контроль за предварительной очисткой. Контроль за
очисткой от органических примесей ведут по перманга-
натной или бихроматной окисляемое™ [4, 5]. Определе-
ние с помощью спектрофотометра оптической плотности
воды до и после ее очистки дает дополнительную инфор-
мацию об эффективности последней. В результате пред-
221
варительной очистки цветность должна быть снижена до
5°, окисляемость уменьшена в 2—3 раза, прозрачность
осветленной воды должна быть больше 30 см. '
В последние годы получает развитие инструменталь-
ный метод определения общего органического углерода
(ООУ) в воде при его содержании не меньше 1 мг/л.
Это вполне приемлемая чувствительность метода для
оценки эффективности очистки воды от органических ве-
ществ любым из названных способов. Установки для
этих целей выпускают за рубежом [181]. В рекламных
проспектах указывается на возможность проведения в
автоматическом режиме 20—30 анализов в час. Выпуще-
ны н отечественные опытные установки [182].
Для контроля за степенью удаления железа из воды
необходимо полностью перевести железо в ионную фор-
му. Испытуемую пробу кипятят с соляной и азотной кис-
лотами [183], концентрируют до уровня, превышающего
в несколько раз чувствительность выбранного метода
анализа. Методики для определения относительно ма-
лых концентраций железа («10 мкг/л) изложены в ра-
боте [180]. Варианты развития методов определения же-
леза и сравнение их чувствительности и. точности даны
в работах [183, 184, 185]. Если вода в результате предва-
рительной очистки свободна от окрашенных органиче-
ских веществ (<5° по цветности), для быстрого и опера-
тивного анализа неионных форм железа можно исполь-
зовать его накопление при фильтровании через плотные
мембраны типа миллипор. По интенсивности окраски
фильтра судят о содержании железа в воде [185].
Степень умягчения воды контролируется на этапе ее
предварительной очистки по ГОСТ 4151—72 или по ме-
тодикам, приведенным в работах [5, 180].
Контроль за процессом Н-катионирования. При Н-ка-
тионировании воды первым переходит в фильтрат ион
натрия. Соответственно проскоку натрия снижается кис-
лотность Н-катионированной воды. В тех случаях, когда
состав воды стабилен, о проскоке ионов натрия можно
судить по изменению кислотности. Прямое определение
натрия проводят пламенно-фотометрическим методом
[180]. Появление щелочности в фильтрате после аниони-
та свидетельствует о присутствии натрия в Н-катиониро-
ванной воде. Для анализа вод, в том числе и для опре-
деления натрия, используют потенциометрические мето-
222
ДЫ с применением ионселективных электродов [186]. За-
рубежные фирмы, рекламируя такого рода приборы, как
одну из областей их применения называют контроль за
проскоком натрия при обессоливании воды.
Контроль за содержанием в Н-катионированной воде
железа в неионной форме проводится по методикам, из-
ложенным в работах [180, 184, 185]. В соответствии с ря-
дом сорбируемости ионное железо не должно появляться
в фильтрате, если катионит работает до проскока нат-
рия. Способность катионита задерживать какую-то часть
присутствующих в воде органических веществ или, на-
оборот, обогащать ими воду за счет деструкции зерен,
можно с наибольшей надежностью оценить с помощью
прибора для определения ООУ.
Контроль за степенью декарбонизации воды проводят,
сравнивая содержание диоксида углерода в воде до и
после дегазации.
Контроль за процессом ОН-ионирования на I ступе-
ни обессоливания. Достаточным является контроль по
удельному электрическому сопротивлению (электропро-
водимости) с помощью кондуктометров различных марок
[187]. После слабоосновного анионита фильтрат может
иметь удельное сопротивление 0,1—0,5 МОм-см. По со-
держанию солей такая вода соответствует дистилляту и
бидистилляту. Анионит I ступени обладает некоторой
емкостью по органическим веществам, сравниваемой по
окисляемости Н-катионированной воды и фильтрата
после анионита. Более объективны показатели, получен-
ные на приборе для определения ООУ. Содержание же-
леза в воде после анионита I ступени находят по назван-
ным выше методикам с предварительным концентриро-
ванием.
Работу сильноосновного анионита при его использова-
нии на I ступени обессоливания контролируют по проско-
ку бисиликат-ионов и по удельному сопротивлению, ко-
торое, как правило, значительно выше, чем после сла-
боосновного анионита. Остальные показатели (органиче-
ские вещества, железо) контролируют, как описано
выше.
Контроль за работой смешанного слоя. В воде после
смешанного слоя содержится очень мало примесей ион-
ного характера. Известно [188], что при концентрациях
соли, щелочи и кислоты на уровне Ю-7 моль/л (10—
20 мкг/л) на ионную силу растворов, на рН растворов,
223
на Степень диссоциации слабых кислот и оснований ока-
зывает значительное влияние концентрация ионов, обра-
зующихся при диссоциации воды. Это влияние создает
принципиальные ограничения для определения очень ма-
лых концентраций примесей. Так, вычисленные [188]
значения рН в растворах НС1 и КОН при концентрации
ЫО-8 моль/л равны соответственно 6,98 и 7,02 и отли-
чаются от рН чистой воды на величины, не превышаю-
щие погрешности в определении рН. Обессоленная во-
да, не защищенная от контакта с воздухом, содержит
1,3-Ю-5 моль/л растворенного диоксида углерода и име-
ет рН, равный 5,68. В такой воде по изменению показа-
теля рН можно определить присутствие НС1 или NaOH
только в количестве, большем ICh7 моль/л. Отметим, что
концентрирование примесей в особо чистой воде само по
себе весьма затруднительно [189] в связи со способ-
ностью такой воды извлекать примеси из посуды, в ко-
торой проводят концентрирование, и диоксид углерода
из воздуха. Поэтому содержание ионных примесей в глу-
бокообессоленной воде определяют кондуктометрически
в протоке, не допуская ее контакта с воздухом.
Измерение рН высокоомной воды, контактирующей с
атмосферой, очевидно, не имеет смысла. Кремневую кис-
лоту после фильтра смешанного действия определяют
по методике, изложенной в работе [180]. Разработана
методика [190], позволяющая определять 1—5 мкг/л
кремния в воде. Высокое удельное сопротивление воды
после смешанного слоя (5—10 МОм-см) свидетельству-
ет и об отсутствии в ней сколько-нибудь значительных
количеств органических электролитов [191].
Общее содержание органических веществ, в том чис-
ле продуктов деструкции самих ионитов, лучше всего оп-
ределять по содержанию общего органического углеро-
да. Содержание железа после соответствующего концен-
трирования находят по указанным выше методикам;
концентрацию железа 1—2 мкг/л можно найти кинетиче-
ским или хемилюминесцентным методами [192], слож-
ность которых сдерживает их внедрение в практику кон-
троля за обессоливанием воды. Катионит I ступени и
смешанный слой ионитов способны задерживать ионы
меди даже из ее гидроксида [212, с. 171—173]; для ана-
лиза меди в обессоленной воде при ее концентрации
1 мкг/л используют кинетический метод [193].
224
ПРИЛОЖЕНИЕ
Таблица 1. Свойства сильнокислотных катионитов (ГОСТ 20298—74)
Показатели
КУ-2-8
высшая
категория
качества
I сорт
КУ-2-8чС
КУ-2-20
КУ-1
КУ-23
днвиннлбензол: порообраз с-
ватель
ю: 60 | 12: во is: too зо: юо
Гранулометрический состав
размер зерен, мм
содержание рабочей фракции, %,
не менее
эффективный размер зерен, мм,
не более
коэффициент однородности, не
более
Содержание влаги, '%
Удельный объем в Н-форме, см3/г,
не более
Удельная поверхность, м2/г
Статическая обменная емкость,
мэкв/мл, не менее
полная
равновесная
Динамическая обменная емкость,
экв/м3, не менее:
с полной регенерацией ионита.
с заданным расходом регенери-
рующего вещества
Окисляемость фильтрата в пересчете
на Ог, мг/г, не более
Осмотическая стабильность, 7о, не
менее
0,315—1,25
96
0,5
1,6
50—60
2,9
1,70
1,6
520
0,3
90
94
0,5
1,7
50—601
2,9
1,65
1,5
500
0,3
85
0,4—1,25
95
0,5
1,6
50—60
3,0
1,65
1,5
1300
0,8
80
0,315—1,25
•95
30—40
2,0
2,10
0,4—
2,0
92
|45—55|
3,3
1,30
0,6
550
4,5
90
0,315—1,25
95 | 95
55—701
4,7
5—15
1,00
0,9
400
85
60—701
4,1
20—30
1,15
1,0
400
85
0,315—1,25
95 | 95
60—701
3,8
30—40|
1,25
1,1
400
60—70
4,1
'55—70
0,95
0,85
85 | 85
Таблица 2. Плотность некоторых катионитой
в различных солевых формах [60]
Ионная
форма
Н+
U+
Na+
К+
Rb+
Cs+
NH4+
Ag+
Mga+
Caa+
Sra+
Baa+
Cua+
Pba+
Hga+
Zna+
Fe»+
Al«+
Cr3+
Ce*
Th4+
• Заряд
КУ-2
набухший
1,18
1,20
1,25
1,29
1,40
1,51
1,20
1,63
1,26
1,30
1,38
1,50
1,33
1,67
1,63
1,35
1,32
1,29
1,34
1,48
1,51
иона не yi
cyxofl
1,39
1,43
1,50
1,52
1,78
2,00
1,35
2,17
1,48
1,49
,1,64
1,80
1,62
2,28
2,10
1,63
1,54
1,47
1,56
1,69
1,81
сазан.
КУ-1
набухший
1,21
1,21
1.24
1,25
1,31
1.38
1,22
1,36
1,24
1,25
1,28
1,32
1,26
1,38
1,45
1,28
—
1.24
1,27
1,32
сухой
1,38
1,38
1.40
1.42
1,55
1,65
1,34
1,65
1,38
1,39
1,45
1,51
1,45
1,64
1,75
1,45
—
1,34
1,38
1,46
~ '
КБ-1П-2
набухший
1,19
1,16
1,26
1,27
1,34
1,40
1,15
—
1,27
1,33
1,39
1,52
1,39
—
—
1,44
—
—
1,33-
—
—
сухой
1,28
1.41
1,53
1 1.60
1,83
2,04
1,31
—
1,46
1,52
1,78
2,03
1,57
—
—
1,65
—
—
1,41
—
—
Таблица 3. Удельная электропроводимость в точке
изоэлектропроводимости (xH3, См/м), влагосодержание
(W, г воды/мэкв ионита), плотность (р, г/см3),
полная обменная емкость (£п, мэкв/г влажой смолы),
отношение эквивалентных электропроводимостей данной формы
и Н-формы (и)
Ионнт
хга1№
№
Н-форма
КУ-2-2
КУ-2-4
КУ-2-6
КУ-2-8
КУ-2-10
КУ-2-12
КУ-2-16
КУ-2-2
КУ-2-4
КУ-2-6
КУ-2-8
КУ-2-10
КУ-2-12
КУ-2-16
КУ-2-2
КУ-2-4
КУ-2-6
КУ-2-8
КУ-2-10
КУ-2-12
КУ-2-16
0,330
0,303
0,262
0,267
0,234
0,180
0,167
0,049
0,048
0,039
0,037
0,029
0,020
0,185
0,250
0,115
0,092
0,078
0,062
0,032
0,007
0,680
0,521
1,269
0,288
0,225
0,175
0,176
Na-фо
0,645
0,486
0,247
0,255
0,206
0,160
0,166
К-фор
0,758
0,431
0,217
0,258
0,193
0,142
0,141
1,080
1,114
1,178
1,610
1,181
1,221
1,275
1,120
1,410
2,040
1,960
2,280
2,450
2,320
1,109
1,185
1,227
1,243
1,261
1,334
1,337
1,150
1,420
2,110
2,060
2,330
2,460
2,350
1,300
1,264
1,324
1,290
1,306
1,372
1,384
0,930
1,240
1,815
1,760
2,079
2,190
2,140
7,0
6,4
9,1
21,3
Са-форма
КУ-2-2
КУ-2-4
КУ-2-6
КУ-2-8
КУ-2-10
КУ-2-12
КУ-2-16
0,032
0,025
0,013
0,013
0,007
0,003
0,003
0,683
0,570
0,269
0,266
0,224
0,175
0.176
1,200
1,236
1,284
1,291
1,307
1,306
1.339
1,006 1
1,272
1,870
1,760
2,079
2,300
2,220
9,3
109
185
184
295
56
51
15*
Та блица 4. Свойства слабокислотных катионитов (ГОСТ 20298—74) Кемеровского завода сКарболит»
Показатели
Гранулометрический состав:
размер зерен, мм
содержание рабочей фракции,
'%, не менее
эффективный размер зерен,
мм, не более
коэффициент однородности,
не более
Содержание влаги, %
Удельный объем, см3/г, не более:
в Н-форме
в Na-форме
Полная статическая обменная ем-
кость, мэкв/мл, не менее
Окисляемость фильтрата в пере-
счете на Ог, мг/г, не более
Осмотическая стабильность, %, не
менее
КБ-2
0,315—1,6
93
0,5
2,0
70—80
4.0
9,0
2,5
1,0
60
КБ-2-4
0,315—1,6
90
—
—
65—75
3,5
6,5
2,7
1,0
—
КБ-4
0,315—1,6
90
0,5
2,0
55—65
2,5
4,0
3,0
1.0
60
КБ-4П-2
0,315—1.6
95
0,6
2,0
65—75
2,8
6,0
3,4
—
75
.КБ-2-7П
0,315—1,6
95
0,5
1.8
75—85
4,5
10,0
2,2
1,0
—
КБ-2-10П
0,315—1,6
95
—
—
65—75
3,0
5,5
3,0
1,0
—
КБ-М0П
0,315-1,
95
60—70
3,3
5,0
2,7
1.0
—
Таблица 5. Свойства сильноосновных анноннтов (ГОСТ 20301—74)
Показатели
Гранулометрический
состав
размер зерен, мм
содержание рабо-
чей фракции, %
не менее
эффективный раз-
мер зерен, мм,
не более
коэффициент од-
нородности, не
более
Содержание влаги, %
Удельный объем в
ОН-формв, см3/г
Удельная поверх-
ность, м2/г
АВ-17-8
А
«I
*А
к *
А (0
Э Е ш
Я р о)
а С г
0,355—
1,25
94
0,6
1,6
35—50
3,0±0,3
а
о
о
0,315—
1,25
93
0,6
1,6
35—50
з,о±о,з
АВ-17-8чС
35!
III
0,4-1,25
95
0,6
1,6
3,0±0,3
§■
0,4—1,25
94
0,6
1.6
з.о±о.з
о
U
2
i
Ю
<
0,4-1,6
92
0.6
1,6
60—65
4,4±0,4
АВ-29-12П
0,315—
1,25
92
0,65
1.6
55—65
3,7±0.3
25—35
АБ-17П
о"
5
<
0.315—
1.25
90
40—60
4,0±0,5
10—20
00
о*
g
1
и
<
0,315—
1.25
90
40—60
4,2±0,5
15-25
О
ё
7.
ш
<
0,315-
1.25
90
50-70
4,5±0,5
20—30
Продолжение
Показатели
Статическая обменная
емкость, экв/мл, не
менее
полная
равновесная
Динамическая обмен-
ная емкость, экв/м3,
не менее
Окнсляемость фильт-
рата в пересчете
на 02, мг/л, не
более
Осмотическая ста-
бильность, %, не
менее
АВ-17-в
высшая кате-
гория ка-
чества
1,10
1,00
690
0,65
90
I сорт
1,00
0,90
680
0,7
85
АВ-178чС
высшая кате-
гория ка-
чества
1,15
1,05
930
0,7
85
I сорт
1,10
1,00
930
0,7
85
АВ-16-ГС
1,70
—
—
—
80
АВ-29-12П
0,90
0,60
600
—
85
СО
С
о
А
<
0,80
0,70
550
—
90
АВ-17П
АВ-17-10П/0.8
0,75
0,65
—
—
—
АВ-17-12П/1.0
0,60
0,50
—
—
—
Таблица 6. Плотность некоторых аниоиНтов в различных
солевых формах [60]
Ионная
форма
он-
F-
С1-
Вг
I-
сюг
ВгОа
IOJ
сю;
no;
SCN-
СгО|-
МпОГ
ReO;
soj-
coj-
CraO|-
sa-
[FefCN).]3-
[Fe(CN),]«-
HCOO-
CHaCOO-
c2oj-
AB-17
набухший
1,10
1,12
1,13
1,26
1,39
l.'I
1,32
1,39
1,26
1,19
1,16
1.24
1,31
1,77
1,18
1,15
1,33
1,12
1,17
1,17
1,12
1.11
1,16
сухой
—
1,18
1,15
1.31
1,45
1,26
1,43
1,62
1,27
1,21
1,18
1,27
1,56
1,86
1,24
1,20
1,36
1,12
1,17
1,18
1,17
1,14
1,21
ЭДЭ-10П
набухший
1,13
1,14
1,17
1,29
1,61
1,33
1,41
1,86
1.42
1,27
1,26
—
—
—
1,32
1,19
1,53
1,14
1,31
1,30
1,15
1,15
1,32
сухой
—
1,29
1,34
1,42
1.77
—
—
—
—
1.43
1,31
—
—
—
1,49
1.27
1,66
1.24
1,37
1,36
1,29
1,32
1.41
АН-2Ф
набухший
1,16
1.17
1,19
1,28
1,56
1,28 ■
1,38
1,58
1,39
1,31
1,27
1,33
1,22
—
1,32
1,22
1,49
1.19
1,27
1,26
1,16
1,16
1,32
сухой
—
1,26
1,30
1,39
1,69
1.43
—
1,77
1,46
1,39
1,29
1,39
1,35
1,43
1.24
1,59
1,20
1,32
1,31
1,2в
1,23
1,36
Таблида 7. Свойства слабоосновных анионитов (ГОСТ 20301—74)
Показатели
Гранулометрический
состав
размер зерен, мм
содержание ра-
бочей фракции,
%, не менее
эффективный раз-
мер зерен, мм,
не более
коэффициент од-
нородности, не
более
АН-1
0,4-
2,0
95
АН-2ФН
0,4-
2,0
92
АН-31
0,4—
2,0
92
0,6
3,0
АН-18-8
0,315—
1,25
92
0,6
1,6
АН-21
1
О
X
<
0,315—
1,25
90
1
CI
X
<
0,315—
1,25
90
эдэ-юп
0,4—
1,8
92
АН-22-8
0,315—
1,25
92
0,5
1,8
АН-221
0,315—
1,25
90
АН-18П
С
о
i
ас
<
0,315—
1,25
92
с
X
<
0,315—
1,25
92
Содержание влаги,
%
Удельный объем в
ОН-форме, сма/г
Удельная поверх-
ность, м2/г
Полная статическая
обменная емкость
экв/л, не менее
Динамическая обмен-
ная емкость, экв/м3,
не менее
Окисляемость филь
трата в пересчете
на Ог, мг/л, ие
более
Осмотическая ста-
бильность, %, не
менее
40—50
2,7±
0,3
1,7
1100
<10
2,6±
0,3
2,6
<10
3,3±
0,2
2,6
30—50
2,3±
0,2
1700 1200
4,0 3,5
80
60
0,7
80
1,4
650
1,0
80
30—50
2,1±
0,3
—
1,85
—
—
—
20—40
1,8±
0,2
—
1,1
—
—
—
<Ш
3,4±
0,2
—
2,3
1000
4,0
80
30—50
2,3±
0,3
—
2,0
1000
—
85
40—60
2,7±
0,5
55—65
1,25
. 800
—
85
35—60
3,5±
0,3
15-25
1.0
—
—
95
35—60
3,2±
0,3
25—35
1,1
—
—
95
Таблица 8. Свойства ионообменных мембран
Показатель
МК-40
МА-40
Марка ионнта
Функциональные группы
Содержание ноиита, %
Прочность прн разрыве в на-
бухшем состоянии, Па, не
менее
Относительное удлинение при
разрыве, '%, не менее
Изменение размеров прн на-
бухании, %
по длине
по толщине
Содержание влаги, % не
более
Полная обменная емкость по
0,1 н. НС1 (или NaOH),
мэкв/г
Электрическое сопротивление
в 0,6 и. NaCl, не -более
поверхностное, Ом
удельное, Ом-см
Число переноса в 0,01/0,2 н.
NaCl, доли, не менее
Армирующая ткань
КУ-2
-SO»
65
1300
ЭДЭ-1
-NR
=NH
s=N
55
1300
20
8±2
30±5
40+5
2,6±0,3
12
220
0,98
20
8±2
30±5
40+5
3,8±0,4
12
240
0,94
Каир ои
* Прочность прн продавливанни 95 Н/си2.
** Определение проведено в растворах NaOH.
234
Щекинского химического комбината
МК-41
АВ-17
-&(№»),
65
1300
20
8±2
30±5
40+5
2,0±0,3
20
350
0,96
Кап
МК-42
КБ-4
—СООН
60
1300
20
8±2
30±5
32
3,4
10
225
0,92**
рон
МК-40Л
КУ-2
-SO,
60
1200
12
5±3
40±10
45
2,5±0,5
12
260
0,97
МА-41Л
АВ-17
-!$(СН8)з
60
1200
15
5±3
30±10
45
2,0±0,5
30
450
0,96
Л авса
МА-43Л
АВ-23
-с,н4йсн,
60
1200
15
5±3
40± 10
45
1,8±0,5
25
300
0,96
и
Таблица 9. Свойства ионообменных мембран Свердловского
химического комбината
Показатели
Марка ионнта
Функциональные группы
Прочность при разрыве,
Па
Набухаемость в воде, %
Удельное электрическое
сопротивление в 1 н.
NaCl, Ом см
Селективность в 0,1 н.
NaCl
Размеры мембраны, мм
Армирующая ткань
МКК-1
КУ-2
-SC£
1000—
1100
7—9
100—130
0,95
МАК-1
ЭДЭ-10П
-NR,
=NH
=N
1100—
1200
8—10
140—J 60
0,95
Непрерывная лента
шириной 1000 мм
МАК-2
AM
-1^(СНз)з
1000—1100
7—9
120—140
0,95
Капрон
МАК-6
МАК-8
МАЛ-2
МАЛ-6
МАЛ-8
Сильноосновные четвертичные аминоэфирные смолы
-NRS
900—1000
7—10
110—130
0,955
/NR,
\nr3
900—1000
7—10
110—130
0,955
1000X500'
-N(CHS)3
1500—1600
3—4
200—250
0,95—0,96
-NRS
1500—
1600
3—4
180—220
0,95—
0,96
/NRs
\nr3
1500—
1600
3—4
180—220
0,95—
0,96
1000X500
Лавсан
Таблица 10. Плотность й влагосодержание мембран [88]
Марка
мембраны
МК-40
МК-40Л
МК-41
МА-40
МА-41
МА-41 Л
МА-43Л
Ионная
форма
Na+
Na+
Na+
ci-
ci-
ci-
I-
Плотиость, г/сиЗ
воздушно-
сухие
1.25
1,24
1,23
1,15
1,27
1,18
1,16
набухшие
1,16
1.11
1.П
1,09
1,16
1,05
1,09
Влагосодержание, %
воэдушно-
сухне
5,6
5,1
9,6
4.3
6.5
5,5
3,5
набухшие
29,3
27,7
35,5
29,2
28.9
23,9
29,7
Таблица 11. Электропроводимость мембран в 0,1 н.
электролитов (105-СМ/м) [87]
Электролит
МК-40
МК-«
МА-40
МА-41
NaCl
КС1
СаС12
MgCl2
NaNOs
KNOs
Ca(NOs>,
NajSO,
K,S04
MgSO,
HC1
HNOs
H2SOt
NaOH
3,9
5,5
1,4
1,6
3.5
—
0,7
4,1
3,9
1,4
33,0
27,8
23,0
4,1
3.7
6,2
0,2
0,1
5,6
5,3
0.2
5.1
5,0
0,1
3.4
1.9
2.9
4,3
5,8
5.9
4.8
5,5
4,5.
4,7
4,8
1.2
1.1
0.9
10,4
6,5
1,8
2,0
2.3
3,3
3,3
2,9
2,4
3,3
2.7
1,9
2,3
2,2
5,3
3.7
2.5
4,8
3,3
4.8
3.5
2.8
2.2
3,3
2,2
4.9
4,5
—
6.3
3,0
4,3
8,0
Таблица 12. Свойства биполярных мембран [87]
Показатель
Тип монополярных мембран
Число переноса, доли
в 0.5 н. NaOH
в 0,5 н. НС1
Выход по току*, %
кислоты
щелочи
Падение напряжения на
мембране, В
МБ-1
МК-40
МА-40
0,20
0,02
82
88
12,7
МБ-2
МК-40
МА-41
0.16
0,01
86
94
12,9
МБ-З
МК-41
МА-41
0,01
0,23
80
83
1,22
МБ-4
МК-41
МА-43
0,01
0,21
—
—
1,91
• Рассчитай при коиверснн NaCl в НС1 и NaOH при плотности тока
0,6 А/дма с мембранами МА-41 и МК-40.
Таблица 13. Электрохимическая активность мембран МК-100
и МА-100 в растворах электролитов различной
концентрации [92, с. 18—20]
Меьбрана МК-100
с
SB, 9.
Ii
RS|x
>» to
Мембрана МА-100
8.
с
8.,
St-
ill
s
§
В
II
Раствор NaCl
0,1
0,5
1,0
2,5
4,0
7,6
9,5
12
13
10
97
96
94
85
0,80
0,11
0,19
0,32
0,72
0,76
8,4
98
91
90
86
0,83
0,06
0,26
0,39
0,53
0,61
0,5
1,0
2*5
4,0
66
82
95
85
Раствор НС1
0,83
0,80
0,62
0,62
4,4
5,1
8,9
7,9
10
17
36
41
0,86
0,86
0,85
0,79
0,66
0,99
1,9
2,9
Раствор HNOs
0,5
1,0
2,5
4,0
84
120
100
103
0,83
0,78
0,75
0,75
4,7
7,8
7,2
8,0
9,2
15,8
23,0
23
0,90
0,86
0,76
0,68
0,40
0,78
1,8
2,3
0,5
1,0
2,5
4,0
10
13
15
16
Раствор NaOH
0,95
0,90
0,87
0,81
0,17
0,52
0,62
0,94
24
32
41
42
0,89
0,74
0,60
0,60
1,0
2.9
4,4
4,6
Таблица 14. Свойства ионообменных волокон [87]
Волокно
ВИОН АН-1
ВИОН АС-1
ВИОН КН-2
Полная обменная емкость
(статическая), мэкв/г в растворе
0,1 н.
NaOH
4,5—6,0
0,1 н.
НС1
2,0—2,5
2,0—2,5
0,1 в.
NaCl
0,8-1,1
Фнзнко-мехянические
свойства
толщина,
текс
0,33—0,40
0,35—0,43
0.35—0,43
прочность
гс/текс
12—14
8—10
6—10
удлине-
ние, %
40—50
40—50
18—25
Объемное набухание,
% в растворе
воды
7—8
23
40—50
6%
HaS04
140
50
40—50
5%
NaOH
7—8
25
150—200
Равно-
весная
влаж-
ность,
%
4—5
8—10
15—20
Таблица 15. Свойства ионитовых порошков [87]
Показатель
Гранулометрический состав
размер частиц, мкм
содержание рабочей фракции, %, не менее
эффективный размер частиц, мкм
?
-8-
1
ПКУ
20—130
95
50
Z
3
I
8
20—130
95
50
■ч-ОН
?
ПАВ
5—90
95
50
т
2
4
Л
>>
5—60
95
30
=?
ПСГ-
5—50
95
20
=г
1
В
5—50
95
20
■?
ПАН
5—50
95
20
с
КУ-2
—
—
50
Продолжение
Показатель
Содержание
железа, %, не> более
ионов хлора, мг/г, не более
сухого вещества, %, не более
Удельный объем набухшего ионита, мл/г, не
более
Полная обменная емкость в статических усло-
виях, мэкв/г, не менее
по 0,1 н. НС1
по 0,1 н. NaCl
я
i
-8-'
сч
>
Ы
С
0,03
0,003
45
3,0
—
4.6
а?
z
1г
1
«?
>1
X
с
0.03
0,003
50
3,0
—
4,6
-ч-ОН
ш
<
С
0,015
0,005
35
3±0,3
3,5
?
7
>>
X
с
—
95
2,9
—
4,8
?
1
сг-
с
—
95
^_
—
8,5
«
Z
5
^
с
■—
95
—
7.5
•?
я
<
с
—
95
9.0
с
<?
Ъ
0.3
—
2.9
—
4,8
Таблица 16. Характеристика фильтров, рассчитанных
на рабочее давление 0,6 МПа
Марка
фильтра
Диа-
метр
фильт-
ра.
мм
высота
фильтрую-
щей
загрузки,
мм
Общая
высо-
та,
мм
Масса
конструк-
ции
фильтра,
кг
Опто-
вая
цена,
руб.
Завод-
изготовитель
Фильтры осветлительные вертикальные однокамерные
ФОВ-1,0-6
ФОВ-1,4-6
ФОВ-2,0-6
ФОВ-2,6-6
ФОВ-3,0-6
ФОВ-3,4-6
1000
1400
2000
2600
3000
3400
1000
1000
1000
1000
1000
1000
2912
3298
3620
4015
4385
4530
932
1600
2120
3755
4780
6254
430
660
840
1150
1150
1850
ко-
за-
Бийский
тельиый
вод
То же
Таганрогский
завод «Крас
ный котель
щик»
То же
Фильтры ионообменные параллельно-поточные I ступени
ФИПа-0,7-6
ФИПа-1,0-6
ФИПа-1,4-6
ФИПа:2,0-6
ФИПа-2,6-6
ФИПа-3,0-6
ФИПа-3,4-6
700
1000
1400
2000
2600
3000
3400
2000
2000
2000
2500
2500
2500
2500
3450
3714
3920
4930
5200
5470
5740
598
1015
1616
2590
4310
5260
7460
340
440
520
920
1320
1480
2000
Саратовский
завод тяже-
лого машино-
строения
То же
Бийский Ко-
тельный за-
вод
Таганрогский
аавод «Крас-
ный котель-
щик»
То же
»
>
16-360
Таблица 17. Характеристика фильтров смешанного действия
Наруж-
ный
диаметр,
мы
320
430
510
712
1016
1016
1216
Площадь
фильт-
рующей
поверх-
ности,
м2
0,071
0,126
0,196
0,385
0,785
0,785
1,131
Произво-
дитель-
ность,
мЭ/ч
2
4
6
12
25
25
35
Рабочее
дааленне,
МПа/цг
0,1
0,1
0,4
0,4
0,4
0,4
0,4
Общая
высо-
та,
ыы
2620
3485
3660
3800
4960
3900
4760
Высота
цилинд-
рической
■наста.
ыы
2215
3020
3000
2750
3800
2970
3700
Высота
загрузка, ыы
катио-
нита
300
300
350
700
600
650
500
аиио-
ннта
900
900
1050
700
1200
1000
1000
Материал
корпуса
распределитель-
ного устройства
Вини- Винипласт и
пласт оргстекло
Винипласт
Сталь Винипласт
СтЗ гум-
мирован-
ная
То же То же
То же Нержавеющая
сталь н вини-
пласт
» Винипласт
» Нержавеющая
сталь и ви-
нипласт
Масса фильтра,
кг
без
заполне-
ния
63
144
495
757
1596
1590
2300
с за-
полне-
нием
230
550
ИЗО
192:
486С
4210
7000
Таблица 18. Требования к воде питьевого качества
(ГОСТ 2874—73), методы испытаний и их чувствительность
Показатели
Цветность, градусы
Мутность, мг/л
Запах, баллы
Прозрачность, см
рН
Содержание, мг/л
сухого остатка
хлоридов
сульфатов
железа общего
марганца
меди
цинка
алюминия
гексаметафосфата
(в пересчете на
Р04)
трнполифосфата
(в пересчете
на Р04)
фтора
азота (аммоний-
ного)
свинца
полнакриламида
нитратов (в пе-
ресчете на N)
Общая жесткость.
мэкв/л
Норна
по ГОСТ
До 35
1,5
2
30
6,5—8,5
До 1500
350
500
1,0
0,1
1,0
5,0
0,5
3,5
3,5
0,7—1,5
—
0,1
2,0
10
10
гост,
метод испытаний
ГОСТ 3351—74
»
»
»
рН-метры
ГОСТ 18164—72
ГОСТ 4245-72
ГОСТ 4389—72
ГОСТ 4011—72
ГОСТ 4974—72
ГОСТ 4388—72
ГОСТ 18293—72
ГОСТ 18165—72
ГОСТ 18309—72
»
ГОСТ 4386—72
ГОСТ 4192—48
ГОСТ 18293—72
ГОСТ 19355—74
ГОСТ 18826—73
ГОСТ 4151—72
Чувствитель-
ность метода
или расхож-
дения в
параллельных
определениях
±5
±0,2
±1
±1-2
±0,1
10
0,5
2
0,05
0,01
0,02
0,005
0,0005*
0,01
0,01
0,05
0,05
0,0005
0,5
0,1
0,005—0,01
* Во взятой навеске (пробе).
16»
ЛИТЕРАТУРА
1. Луфт Б. Д., Шустина А. Л. Очистка деталей электронных при-
боров. М., Энергия, 1968. 320 с; Пивоваров Г Я., Самин-
ский Л. А. Технологические процессы электровакуумного про-
изводства. М., Энергия, 1975. 301 с.
2. Грановская Г. Л., Мазо А. А., Мелешко В. П. — Электронная
техника. Сер. 10, 1970, вып. 3, с. 60—66.
3. Причетт П. П. Очистка электронных приборов. Пер. с англ./Под
ред. Б. Д. Луфт и А. Л. Шустной. М. Энергия, 1964. 312 с.
4. Современные методы анализа природных вод. Сборник/Под ред.
К- Г. Лазарева. М., Изд-во АН СССР, 1962. 203 с.
5. Унифицированные методы анализа вод/Под ред. Ю. Ю. Лурье.
М., Химия, 1971. 375 с.
6. Алекин О. А. Основы гидрохимии. Л., Гидрометеоиздат, 1970.
445 с.
7. Посохов Е. В. Общая гидрогеохимия. Л., Недра, 1975. 208 с.
8. Кульский Л. А. Теоретические основы и технология кондицио-
нирования воды. Киев, Наукова думка, 1971. 495 с.
9. Сенявин М. М., Рубинштейн Р. Н., Комарова И. В. и др. Тео-
ретические основы деминерализации пресных вод. М., Наука,
1975. 324 с.
10. Дубинин М. М. Физико-химические основы сорбционной техни-
ки. М.—Л., ОНТИ, 1935. 385 с.
11. Рачинский В. В. Введение в общую теорию динамики сорбции
и хроматографии. М, Наука, 1964. 136 с.
12. Веницианов Е. В., Сенявин М. М. — Теория и практика сорб-
ционных процессов. Труды Воронежского гос. ун-та, 1978, вып.
12, с. 28-32.
13. Вознесенский С. А. Физико-химические процессы очистки воды.
М.—Л., Госстройиздат, 1934. 230 с; Чнутов К- В. Хромато-
графия. М., Химия, 1978. 128 с.
14.. Прохоров Ф. Г Руководящие указания по химическому обес-
соливанию воды ионитами. М. — Л., Госэнергоиздат, 1957. 192 с;
Шкорб М. С, Прохоров Ф. Г. Водоподготовка и водный режим
паротурбинных электростанций. М. — Л., Госэнергоиздат, 1961.
244
445 е.; Кот А. А. Водоподготовка и водный режим атомных
электростанций. М., Атомиздат, 1964. 343 с; Справочник хими-*
ка-энергетика/Под ред. С. М. Гурвича. М., Энергия, 1972, Т. I.
455 с.
15. Апельцин И. Э., Клячко В. А., Лурье Ю. Ю., Смирнов А. С.
Иониты и их применение. М., Стандартгиз, 1949. 819 с; Апель-
цин И. Э., Клячко В.. А. Подготовка воды для промышленного
и городского водоснабжения. М., Стройиздат, 1962. 340 с.
16. Санитарные нормы и правила. СНиП II — Г — 362, М., Стройиз-
дат, 1974.
17. Жуховицкий А. А., Забежинский Л. #., Тихонов А. А.—ЖФХ,
1945, т. 19, вып. 45, № 6, с. 253—262.
18. Гельферих Ф. Иониты. Пер. с нем./Под ред. С. М. Черноброва.
М., Издатинлит, 1962. 487 с.
19. Веницианов Е. В., Махалов Е. М., Рубинштейн Р. Я.— ЖФХ,
1973, т. 47, № 3, с. 665—669; Мелешко В. П., Кузьминых В. А.,
Шамрицкая И. Я.—ДАН СССР, 1977, т. 232, № 1, с. 134—137.
20. Рачинский В. В., Гарнецкий В. Л.— ЖФХ, .1968, т. 42, № 10,
с. 2591—2596.
21. Серебряков А. Е. Канд. дис. Новочеркасск, Новочеркасск, по-
литехи, ин-т, 1972.
22. Галкина Я. К-, Сенявин М. М. — ЖФХ-, 1969, т. 43, № 7,
с. 1783—1789;. Никашина В. А., Рубинштейн Р. Я.—ЖФХ,
1971, т. 45, № 11, с. 2842—2844; Сенявин М. М., Галкина Я. К-,
Комарова И. В., Махалов Е. М. 1пВ: III национальна кон-
ференция по «Водоподготовки воден режим и коррозия в ТЭЦ
и АСЦ». Варна, 11—13 октомбри 1976, р. 254—264.
23. Сенявин М. М. и др. Основы раечета и оптимизации ионооб-
менных процессов. М., Наука, 1972. 242 с.
24. Янсен С. Влияние органических веществ на процесс обессоли-
вания воды. Пер, с немецк./Под ред. Ю. М. Кострикина. М.,
1961. 20 с.
25. Brodsky A., Prochaska J., Kadlec V. — М. Н. Verein Grosskessel-
besitzer, 1964, № 90, S. 190—197ГГрановская Г Л. Канд. дис.
Воронеж, Воронежск. гос. ун-т, 1969.
26. Маэо А. А., Спирина А. Ф., Грановская Г. Л., Новикова Л. И. —
Теория и практика сорбционных процессов. Труды Воронежск.
ун-та, 1971, вып. 5, с. 176—178.
27. Бабенков Е. Д. Очистка воды коагулянтами. М., Наука, 1977.
365 с.
28. Грановская Л. Г., Семенов А. Д., Мазо А, А,, Спирина А. Ф. —
Теория и практика сорбционных процессов. Труды Воронежск.
ун-та, 1968, вып. 2, с. 83—86.
29. Швецова В. П., Логинова А. Я. — Энергетик, 1977, № \t с. ю—
11.
30. Пушкарев В. В., Трофимов Д. И. Физико-химические особен-
ности очистки сточных вод от ПАВ. М., Химия, 1975. 144 с.
31. Строкач П. П. — Электронная обработка материалов, 1975, № 4,
с. 51—57.
245
32. Вейцер Ю. И., Стерина Р. М.— Водоснабжение и санитарная
техника, 1965, № 9, с. 17—19; Вейцер Ю. И., Стерина Р. М. —
В кн.: Ионообменные материалы в иауке и технике. М., изд.
НИИТЭхим, 1969, с. 187—190; Стерина Р. М. Каид. дне. М.,
АКХ им. Панфилова, 1971.
33. Семенова Л. А., Грановская Г. Л., Маэо А. А. — Водоснабжение
и санитарная техника, 1977, № 12, с. 5—6.
34. Лурье А. А. Сорбенты и хроматографические носители. Спра-
вочник. — М., Химия, 1972. 320 с.
35. Мелешко В. П., Грановская Г. Л., Мазо А. А. — Водоснабжение
и санитарная техника, 1969, № 8, с. 3—5.
36. Венщианов Е. В., Махалов Е. М., Никашина В. А., Рубинш-
тейн Р. Н. — В кн.: Кинетика и динамика физической адсорб-
ции. М., Наука, 1973, с. 222—223.
37. Словинская Г. В., Грановская Г. Л., Мазо А. А. — Теория и
практика сорбциониых процессов. Труды Вороиежск. уи-та, 1969,
вып. 3, с. 72—75; Грановская Г. Л., Мазо А. А., Мелешко В. П.,
Славинская Г. В.—Теория и практика сорбциониых процессов.
Труды Вороиежск. ун-та, 1971, вып. 5, с. 46—51.
38. Маэо А. А. Докт. дис. Киев ИКХХВ АН УССР, 1974.
39. А. с. 436800 (СССР).
40. Грановская Г. Л., Маэо А. А., Мелешко В. П. и др. — В кн.:
Проблемы получения особо чистой воды. Воронеж, Изд-во ВГУ,
1971, с. 38—43.
41. Поройская С. М., Розиноер И. М. — В кн.: Иоииый обмен и
иониты. Л., Наука, 1970, с. 283—285.
42. Грановская Г. Л., Маэо А. А., Новикова Л. И. — Водоснабже-
ние и саиитариая техника, 1973, № 3, с. 3—4.
43. Грановская Г. Л.. Мазо А. А., Войтович В. Б., Спирина А. Ф.
Теория и практика сорбциониых процессов. Труды Вороиежск.
уи-та, 1966, вып. 1, с. 147—154.
44. Маэо А. А. — В кн.: Современные методы очистки промышлен-
ных сточных вод и внедрение их иа предприятиях отрасли.
Материалы семинара. М., Электроника 1974, с. 116—132.
45. Тарасов М. Н., Смирнов М. П.—В кн.: Материалы XXIII Гид-
рохимического совещания. Новочеркасск, 1969, с. '140-И41.
46. Васильев В. П., Пархоменко И. В.—Жури, иеорг. хим. 1968,
т. 13, вып. 1, с.240—244.
47. Зологоаа Е. С, Асе Г. Ю. Очистка воды о*г железа, фтора,
марганца и сероводорода. М., Стройиэдат, 1975. 176 с.
48. Швецова В. П. — Энергетика, 1967, J* 7, с. 23—25.
49. Лапшин М. И., Вознесенская А. М. — Теплоэнергетика, 1965,
№ 10, с. 26—28.
50. Шкроб М. С, Вихрев В. Ф. — В кн.: Водоподготовка. М. — Л.,
Энергия, 1966, с. 237—239.
51. Мартынова О. М. и др.—Теплоэнергетика, 1976, № 9, с. 10—12.
52. А. с. 463637 (СССР).
53. Мазо А. А. Канд. дне. Воронеж, Вороиежск. гос. уи-т, 1965.
246
54. Кастальский А. А. Проектирование устройств для удаления из
воды растворенных газов в процессе водоподготовки. М., Строй-
издат, 1957. 579 е., Кастальский А. А., Минц Д. М. Подготовка
воды для питьевого и промышленного водоснабжения. М., Выс-
шая школа, 1962. 558 с; Клячко А. А., Апельцин И. Э. Очист-
ка природных вод. М., Стройиздат, 1971. 280 с.
55. Полянский Н. Г., Горбунов Г. В., Полянская Н. Л. Методы ис-
следования иоиитов. М., Химия, 1976. 208 с.
56. Белов П. С, Бельфер С. И., Иванова И. И., Салдадзе К- М. —
ЖПХ, 1973, т. 46, № 9, с. 2031—2035.
57. Иоииты. Каталог/Под ред., А. Б. Пашкова. Черкассы, отд.
НИИТЭхим, 1975. 36 с.
58. Николаев А. В., Яхин В. С, Юрьев Г. С, Богатырев В. Л. —
Теория и практика сорбционных процессов. Труды Воронежск.
гос. ун-та, 1978, вып. 12, с. 9—21.
59. Салдадзе К- М., Пашков А. Б., Титов В. С. Высокомолекуляр-
ные ионообменные соединения. М., Госхимиздат, 1960. 360 с.
60. Богатырев В. Л. Иоииты в смешанном слое. Л., Химия, 1968,
212 с.
61. Гнусин Н. П., Гребенюк В. Д. Электрохимия гранулированных
иоиитов. Киев, Наукова думка, 1972. 178 с.
62. Трунов А. М., Морозов А. А. — Изв. вузов. Химия и хим. тех-
нол., 1969, т. 12, № 1, с. 36—39.
63. Колосова Г. М. Каид. дис. М. ГЕОХИ АН СССР, 1964.
64. Архангельский Л. К, Матерова Е. А., Кисельгоф Г. В. — Вестн.
ЛГУ. Сер. Химия, 1965, № 16, с. 74—82.
65. Манк В. В., Куриленко О. Д. Исследование межмолекулярных
взаимодействий в ионообменных смолах методом ЯМР. Киев,
Наукова думка, 1976, с. 80.
66. Grough Т. Е., Sharma H. £>., Subramanian N.—J. Chem. 1970,
v. 48, N 15, p. 917—923.
67. Решетникова А. К, Исаев Н. И., Шапошник В. А., Плеш-
ков А. И. — Теория и практика сорбциоиных процессов. Труды
Воронежск. гос. ун-та, 1974, вып. 9, с. 136—139.
68. Салдадзе К М., Кельман Б. Я. — В кн.: Химические активные
полимеры. М. Химия, 1969, с. 188—193.
69. Атрощенко В. И., Аснин Я. И., Никитская 3. А. — Хим.
пром-сть, 1960, № 7, с. 551.
70. Когановский А. М., Буравлев Е. П. — Хим. технол., 1977, № 6
(96), с. 23-24.
71. Полянский Н. Г Тулупов П. Е. — Усп. химии, 1971, 40, № 12,
с. 2250—2279.
72. Евсикова Л. П., Куролап Н. С, Углянская В. А., Крыси-
на О. Н. — Теория и практика сорбционных процессов. Труды
Воронежск. гос. ун-та, 1972, вып. 7, с. ПО—114.
73. Казанцев Е. И., Виноградов В. М. — Изв. вузов. Химия и хим.
техиол., 1970, т. 13, № 1, с. 54—59.
74. Полянский Н. Г., Тютюнников В. М. — Изв. вузов. Химия и
хим. технол., 1972, т. 15, № 11, с. 1666—1669,
247
75. Тулупов П. Е., Бутаев А. М., Гребень В. П., Касперович А И.—
ЖФХ, 1973, т. 47, № 4, с. 975—979.
76. Чистяков Д. А., Семушкин А. М., Кузин И. А., Иванов Е. В.—
ЖПХ, 1975, т. 48, № 4, с. 939—940.
77. Егоров Е. В., Макарова С. Б. Ионный обмен в радиохимии. М.,
Атомиэдат, 1971. 408 с.
78. Заостровский Ф. П., Согиина Л. П., Нудель А. М. — Изв. вузов.
Химия и хим. технол., 11973, т. 16, № 5, с. 789—792.
79. Марчевская Ю. М., Куриленко О. Д. — В кн.: Синтез и свойст-
ва ионообменных материалов/Под ред. К. В. Чмутова. М., Нау-
ка, 1968, с. 193—198.
80. Саддадзе К- М., Бруцкус Т. К- Уварова Э. А., Федцова М. А.—
Пласт, массы, 1972, № 2, с. 29—30.
81. Патина JI. А., Сакодынский К- Я.— В кн.: Ионный обмен и
хроматография. Воронеж, Изд-во Воронежск. гос. ун-та, 1976,
с. 106—107.
82. Чувелева 3. А., Юфрякова Н. К-, Назаров Н. П., Чму-
тав К. В. —ЖФХ, 1972, т. 46, № 5, с. 1147—1150.
83. Либинсон Г. С. Физико-химические свойства карбоксил""** »а-
тионитов. М., Наука, 1969. 112 с.
84. Виноградов В. М. Канд. дис. Свердловск. Уральский политехи,
ин-т,' 1971.
85. Тулупов П. Е.. Полянский Н. Г. — Усп. химии, 1973, т. 42, № 9,
с. 1650—1680.
86. Гнусин Н. П., Гребенюк В. Д., Певницкая М. В. Электрохимия
ионитов. Новосибирск, Наука, 1972. 200 с.
87. Ионитовые мембраны. Грануляты. Порошки. Каталог/Под ред.
А. Б. Пашкова. М., НИИТЭхим, 1977. 32 с.
88. Баренцев В. К, Певницкая М. В.— Изв. СО АН СССР. Сер.
хнм. наук, 1973, вып. 4, с. 134—138.
89. Певницкая М. В., Козина А. Д.—ЖПХ, 1974, т. 47, № 3,
с. 583—587.
90. Певницкая М. В., Козина А. А., Евсеев Н. Г.— Изв. СО АН
СССР, Сер. хим. наук, 1974, вып. 4, № 9, с. 137—140.
91. Урусов К- X., Пашков А. Б. — В .кн.: Ионообменные мембраны
в электродиализе/Под ред. К. М. Салдадэе. М., Химия, 1970,
с. 48—64.
92. Климова 3. В. и др.— В кн.: Электрохимическое обессоливание
морской и минерализованной воды. Тезнсы докладов Всесоюз-
ного совещания. Батуми, 14—16 апреля. М., НИИТЭхим, 1976,
с. 18—20.
93. Вольф А. А., Меос А. И. Волокна специального назначения. М„
Химия, 1971, 224 с; Чеботарев Р. Д. Канд. дис. Киев, ИКХХВ
АН УССР, 1978; Туманов А. Н. Канд. дис. Краснодар, Кубан-
ский гос. ун-т, 1974.
94. Мелешко В. П., Мазо А. А. — Труды Воронежск. гос. ун-та,
1953, вып. 32, с. 143—148; Мелешко В. П., Мазо А. Л.—Труды
Воронежского гос. ун-та, 1959, вып. 57, с. 61—67,
248
95. Рачинский В. В., Мелешко В. П. — ДАН СССР, 1967, т. 172,
№ 5, с. 1141—1144; Лурье А. А., Рачинский В. В., Мазо А. А.,
Мелешко В. П. Теорет. основы хим. технол., 1967, т. 1, № 6,
с. 796—802.
96. Анпилова Я. С. Канд. дис. Воронеж, Воронежск. гос. ун-т, 1969.
97. Мелешко В. П., Маэо А. А. — Труды Воронежского гос. ун-та,
1959, вып. 57, с. 61.
98. Мазо А. А., Анпилова Я. С, Парахневич М. В., Серебря-
ков А. Е. — Теория и практика сорбционных процессов. Труды
Воронежск. ун-та, 1971, вып. 6, с. 106—110.
99. Комарчев И. Г., Захаров А. А., Комарчева Я. И., Волен-
ман А. Б. — Теплоэнергетика, 1978, № 2, с. 60—62; Комар-
чев И. Г Богданов В. Ф. — Энергетик, 1978, № 3, с. 29—31.
100. Прохорова А. М., Алексеева Т. В. — Теплоэнергетика, 1976, №9,
с. 83—86.
101. Мазо А. А. и др. — В кн.: Ионообменные материалы и их при-
менение. Алма-Ата, 1968, с. 101—104.
102. Мазо А. А., Образцов А. А. — Теория и практика сорбционных
процессов. Труды Воронежск. ун-та, 1973, вып. 8, с. 106—113.
103. Зеленева Л. А., Грановская Г. Л., Мазо А. А. — Электронная
техника, сер. 7, 1976, вып. 1 (71), с. 43—46.
104. Батунер Л. А., Позин М. Е. Математические методы в хими-
ческой технике. Л., Химия, 1971, с. 706—713.
105. Heiman £., O'Donnell l. — i. Colloid. Sci., 1949, v. 4, p. 405—416.
106. Гребенюк В. Д., Гнусин Я. П., Бармашенко И. Б., Мазан-
ка А. Ф. — Электрохимия, 1970, т. 6, № 1, с. 139—142.
107. Гнусин Я. П., Гребенюк В. Д., Мигашин В. А. — Теорет. и экс-
перимент, химия, 1973, т. 9, № 5, с. 697—701.
108. Муха С. И., Гребенюк В. Д.—ДАН УССР, 1972, № 10, с. 933—
935.
109. Гребенюк В. Д., Гнусин Я. П., Муха С. И. — ЖФХ, 1971, т. 45,
№ 10, с. 2690.
ПО. Гребенюк В. Д., Гнусин Я. П.', Кошечкина Л. П. — Укр. хим.
журн., 1971, № т. 37, № 10, с. 1005—Ю08.
111. Гребенюк В. Д., Гнусин Н, П., Муха С. Я.— ЖФХ, 1973 т. 47,
№ 7, с. 1809—1811.
112. Walters W. R., Weiser D. W., Marer L. J. — Ind. Eng. Chem.,
1955, Nv. 47, № 1, с 61—67.
113. Гнусин Н. П., Гребенюк В. Д., Баженова С. Я.—ЖФХ, 1967,
т. 41, № 5, с. 1177—1179.
114. Гребенюк В. Д., Гнусин Я. Я.— Зав. лаб., 1966, т. 32, № 10,
с. 1290.
115. Гребенюк В. Д., Прохоренко Я. И. — Электрохимия, 1973, т. 9,
№ 1, с. 141.
116. Краснова Т. А., Гребенюк В. Д.—ЖФХ, 1976, т. 50, № 7,
с. 1745—1748.
117. Краснова Т. А., Исаев Я. И., Гребенюк В. Д. — Электрохимия,
1974, т. 10, № 10, с. 1461—1463:
118. Гребенюк В. Д., Гнусин Н. П., Прохоренко И. И. — Электрб-
химия, 1972, т. 8, № 8, с. 1262,
119. Краснова Т. Д., Гребенюк В. Д. — Электрохимия, 1977, т. 13,
№ 7, с. 970—974.
120. Смагин В. Н. Щекотав П. Д. — Теплоэнергетика, 1973, № 5
с. 17—20.
121. Смагин В. Н., Щекотав П. Д. — Водосиабжеиие и санитарная
техника, 1975, № 4, с. 18—21.
122. Лысенко Л. В. Каид. дис. Киев, ИКХХВ АН УССР, 1975.
123. Любман Н. Я. и др. — В кн.: Ионный обмен в гидрометаллур-
гии и очистке сточных вод. Алма-Ата, изд. ин-та Каэмеханобр,
1972, с.
124. Высоцкий С. П. — Энергетик, 1977, № 7, с. 27—28.
125. Теэиков И. И., Салдадзе К- М. — В кн.: Ионообменные мембра-
ны в электродиализе,/Под ред. Салдадзе К. М. М., Химия,
1970, с. 271—279.
126. Теэиков И. И. Канд. дне. М. 1979.
127. Белобров И. А. Канд.. дис. Краснодар, Кубанский политехи,
ин-т, 1974.
128. А. с. 216622 (СССР); А. с. 381364 (СССР).
129. Варенцов В. К- Канд. дис. Новосибирск, ИФХИМС СО АН
СССР, 1971.
130. А. с. 451634 СССР.
131. Гребенюк В. Д., Бармашенко И. Б., Писарук В. И. — ЖПХ,
1974, т. 47, № 9, с. 2027—2031.
132. Филимонова А. М. Канд. дис. М., НИФХИ им. Л. Я. Карпова,
1967.
133. Исаев Н. И. Докт. дис. Киев, ИКХХВ АН УССР, 1973.
134. Писарук В. И., Гребенюк В. Д., Вржосек И. И. — В кн.: Элект-
рохимия ионитов. Краснодар, Изд-во Кубанского ун-та, 1977.
Книга II, с. 114—121.
135. Решетникова А. К,- Канд. дис. Воронеж, Воронежск. гос. уи-т,
1973.
136. Гребенюк В. Д., Писарук В. И., Кульский Л. А. Лабораторная
установка для глубокого обессоливания воды инф. письмо № 25
ИКХХВ АН УССР. Киев, Наукова думка, 1974. 6 с.
137. Прохоренко Н. И., Гребенюк В. Д. — Укр. хим. жури., 1973.
т. 39, № 5, с. 536—537; Kedem О., Maoz Y. — Desalination, 1976,
N 19, p. 465—470; Kedem О., Tanny G., Maoz У. — Desalination,
1978, N 24, p. 313—319.
138. Деминерализация методом электродиализа/Под ред. Дж. Уил-
сона. М., Госатомиздат, 1963, 350 с.
139. А. с. 470503 (СССР).
140. Духин С. С, Куриленко О. Д., Гребенюк В. Д. — Коллоид,
журн. 1975, т. 37, № 5, с. 859—865.
141. Соболевская Т. Т., Гребенюк В. Д., Духин С. С—Коллоид,
журн. 1976, т. 38, № 2, с. 396—399.
250
142. Гребенюк В. Д., Куриленко О. Д., Духин С. С, Соболев-
ская Т. Т. — Коллоид, журн., 1975, т. 37, № 4, с. 737—743.
143. Гребенюк В. Д. и др.—Коллоид, журн., 1977, т. 39, № 6, с. 1147—
1151.
144. Лысенко Л. В. и др.— В ки.: Интенсификация процессов обез-
зараживания воды. Киев, Наукова думка, 1978, с. 26—30.
145. Прохорова А. М. Технологические показатели сильноосиовиого
аиионита АВ-17 при обессоливаиии воды. М„ Энергия, 1969.
62 с.
146. Шаяхметов А. Ш. и др. — Электронная техника. Сер. 7, 6 (70),
1975, с 44—47.
147. Мазо^А. А., Новоселецкий А. Г. — Теория и практика сорбцион-
ных процессов. Труды Воронежск. гос. ун-та, 1972, вып. 4,
с. 133—137.
148. Высоцкий С. П. — Электрические станции, 1977, № 6, с. 22—25.
149. Шапошник В. А. и др. — ЖШ, 1973, т. 46, с. 2659—2663.
150. Павлов Г. Д. — Водоснабжение и санитарная техника, 1976,
№ 1, с. 2—6.
151. Рейбман А. И. Защитные лакокрасочные покрытия в химиче-
ских производствах. Л., Химия, 1973, 336 с.
152. Мальцев С. П., Буркина Ф. Р. — Теория и практика сорбцион-
иых процессов. Труды Воронежск. гос. ун-та, 1972, вып. 4,
с. 179—183.
153. Гумироваииое химическое оборудование. М., ЦИНТИхимнефте-
пром, 1976. 47 с.
154. Установка централизованной очистки воды УЦ-10С. ВИМИ, ин-
формационный листок № 77—0258.
155. Обработка воды на тепловых электростанцнях/Под ред.
В. А. Голубцова. М. —Л., Энергия, 1966. 448 с.
156. Грановская Г. Л., Мазо А. А., Углянская В. А. — В кн.: Рефе-
раты депонированных рукописных работ, № 6. ВИМИ, 1973.
Корякин А. В., Аникина Л. И., Чиркова Т. С. — Жури, прикл.
спектроскопии, 1971, т. 15, № 1, с. 18—21; Корякин В. А.,
Аникина Л. И., Чиркова Т. С. — Жури. анал. хим., 1971, т. 26,
№ 4, с. 816—818; Желязкова В. Д., Сорока И. Я.— Обмен опы-
том в радиопромышленности, 1975, вып. 12, с. 10—12; Мань-
ко А. И., Кожевников А. В. — Техника средств связи. Сер. Тех-
ника проводной связи, 1976, вып. 5, с. 94—96.
157. Салдадэе К- М. — Пласт, массы, 1962, № 3, с. 51—56.
158. Звягинцев Д. Г —Микробиология, 1962, 31, вып. 2, с. 339—
343.
159. Новоселецкий А. Г., Шаяхметов А. Ш., Борисовский И. В.,
Мазо А. А. — В кн.: Вопросы техники полупроводникового про-
изводства. Воронеж, Изд-во Воронежск. гос. ун-та, 1976, с. 3—7.
160. Глухова М. Н.—Уч. зап. Горьковского ун-та. Сер. биол., 1970,
вып. 106, с. 23—26.
161. Грановская. Г. Л., Углянская В. А., Мазо А. А. Анализ методом
ИКС водных экстрактов из смол, применяемых в водоподго-
товке. Деп. ЦНИИ «Электроника», ДЭ-820, с. 11.
251
162. Мазо А. А., Зеленева Л. А., Зеленева О. А., Словинская Г. В.—
Теория и практика сорбционных процессов. Труды Воронежск.
гос. ун-та, 1976, вып. И, с. 42—46.
163. Эдельман Ф. Л. Микроэлектроника, 1974, т. 4, вып. 14, с. 21—22.
164. Мазо А. А., Северин А. В. — В кн.: Фнзикохимия полупровод-
никового материаловедения. Воронеж, Изд-во Воронежск. гос.
ун-та, 1978, с. 77—81.
165. Соколова Л. П., Никашина В. А., Новиков П. Д., Кац Ю. А. —
Теория н практика сорбционных процессов. Труды Воронежск.
гос. ун-та, 1975, вып. 10, с. 189—192.
166. Яковлев С. В., Ласков Ю. М. Канализация. М., Стройнздат,
1978. 223 с.
167. Евсикова Л. П., Куролап Н. С, Трубицин В. Н.— Водоснабже-
ние и санитарная техника, 1976, № 1, с. 5—7.
168. Шаяхметов А. Ш., Ветрова О. В.—Зарубежная электронная
техника, 1976, вып. 4, с. 22.
169. Маршаков И: К- и др. Защита металлов, 1975, т. 11, № 1,
с. 3—9.
170. Кассиди Г. Дж., Кун Г. А. Окислительно-восстановительные
полимеры. Пер. с англ./Под ред. В. А. Кропачева. Л., Химия,
1967. 270 с.
171. Бобринская Г. Л. Канд. дис. Воронеж, Воронежск. гос. ун-т,
1975.
172. Николаев Н. И. — Кинетика и катализ, 1968, т. IX, вып. 4,
с. 870—875.
173. Мещерский Н. А. Эксплуатация водоподготовительных устано-
вок электростанций высокого давления. М. — Л., Энергия, 1965.
464 с.
174. Бобринская Г А. и др.— Жури, прикл. хим., 1971, т. 44,
с. 1253—1256.
175. Бобринская Г. А., Кравченко Т. А., Шаталов А. Я-—Жури,
прикл. хим., 1972, т. 45, с. 1377—1378.
176. Мазо А. А. и др. — Электронная техника. Сер. 7, 1977, вып. 6
(85), с. 47—51.
177. Швецова В. П. — Энергетика, 1986, № 11, с. 27—29.
178. Санитарные нормы н правила. СНиП П—32—74. М., Стройнз-
дат, 1975. Ч. II, 30 с.
179. Романов М. Н. Канд. дис. Воронеж, Воронежск. гос. уи-т, 1971;
Уткин И. Н., Яковлев А. А., Швецова В. П. — Теплоэнергетика,
1975, № 10, с. 72—74.
180. Инструкция по анализу воды, пара и отложений в теплосило-
вом хозяйстве/Под ред. Ю. М. Кострикина. М., Энергия, 1967.
268 с.
181. Mitchell D. G. е. a. Anal. Chem., 1977, v. 49, N 8, p. 1235—
1238.
182. Страдомский В. Б., Белоусов А. П., Мухин В. М., Назаро-
ва А. А. — Гидрохим. материалы, 1977, т. 63, с. 32—51.
183. Мидэунава Фумио и 6>. — РЖХим, 1968, 21Г148; Мартыно-
ва О. И. и dp.— Труды МЭИ, 1972, вып. 128, с. 109—113.
252
184. Зенкевич Ю. В. и др. — Водоподготовка, води, режим и хим.
контроль на паросиловых установках, 1974, вып. 5, с. 152—155.
185. Иванова Е. С. — Энергетика, 1971, •№ 8, с. 33—34.
186. Гордиевский А. В., Зейналова Е. А. — Проблемы анал. хим.,
1977, т. 5, с. 136—150.
187. Козловская И. А. и др. — Проблемы и системы управления,
1976, № 8, с. 29—30.
188. Коренман И. М. Аналитическая химия малых концентраций.
М., Химия, 1967. 167 с.
189. Девятых Г. Г., Еллиев Ю. Е, Глубокая очистка веществ. М.,
Высшая школа, 1974. 160 с; Золотое Ю. Аг-РЖХнм, 1978;
1Г205.
190. Луковская Н. М., Билоченко В. А. — Укр. хим. журн., 1977,
т. 43, вып. 7, с. 756—759.
191. Мазо А. А., Тетерина Э. Г. — Электронная техника. Сер. 10,
1971, вып. 2 (42), с. 25—28.
192. Рычкова В. И., Черпухина С. Д. — Водоподготовка, води, ре-
жим и хим. контроль на паросиловых установках, 1974, вып. 5,
с. 146—150.
193. Долманова И. Ф., Пешкова В. М. — Труды ИРЕА, 1966, вып. 13,
с. 60—68.
194. Дытнерский Ю. И. Мембранные процессы разделения жидких
смесей. М., Химия, 1975, 232 с.
195. Водоподготовительное оборудование. Каталог. М. ГПИ «Сан-
техпроект», 1970, 87 с.
196. Черкинский С. Н. Санитарные условия спуска сточных вод в
водоемы. М., Стройиздат, 1977, 320 с.
197. Тезисы докладов II Всесоюзной конференции по мембранным
методам разделения смесей. 12—14 апреля 1977 т., г. Влади-
мир.
198. Мягкой С. И., Суслина Т. Г., Бардина Н. А. — Теория н прак-
тика сорбционных процессов. Труды Воронежск. гос. ун-та, 1969,
вып. 3, с. 32—37.
199. Анпилова Н. С, Парахневич М. В., Мелешко В. П., Ма-
зо А. А. — Теория и практика сорбционных процессов. Труды
Воронежск. гос. ун-та, 1968, вып. 2, с:. 97—99.
200. Серебряков А. Е., Мазо А. А., Романова Т. Г. — Теория н прак-
тика сорбционных процессов. Труды Воронежск. гос. ун-та, 1972,
вып. Т, с. 118—120.
201. Анпилова Н. С, Мазо А. А., Мелешко В. П., Образцов А. А. —
Теория н практика сорбционных процессов. Труды Воронежск,
гос. ун-та, 1968, вып. 2, с. 92—96.
202. Серебряков А. Е., Мазо А. А., Мелешко В. П.—Теория и прак-
тика сорбционных процессов. Труды Воронежск. гос. ун-та, 1972,.
вып. 7, с. 101—105.
203. Червинская С. К, Измайлова Д. Р., Анпилова Н. С. — Теория
и практика сорбционных процессов. Труды Воронежск. гос.
ун-та, 1966, вып. t, с. 117—125.
253
204. Мазо А. А., Серебряков А. Е.— Теория и практика сорбцнон-
ных процессов. Труды Воронежск. гос. ун-та, 197), вып. 5,
с. 154—157.
205. Серебряков А. Е., Мазо А. А., Мелешко В. П. — Теория и прак-
тика сорбцнонных процессов. Труды Воронежск. гос. ун-та, 1971,
вып. 6, с. 74—78.
206. Бедюх Г А., Малышева Л. Д., Лаврова 3. Д., Анищен-
ко И. А.—Теория и практика сорбцнонных процессов. Труды
Воронежск. гос. ун-та, 1971, вып. 5, с. 158—162.
207. Зубец Н. Н., Мазо А. А., Серебряков А. Е. — В кн.: Электрохи-
мия нонитов. Краснодар. Иэд-во Кубанского гос. ун-та, 1977.
Книга II, с. 111—113.
208. Мазо А. А., Серебряков А. Е., Дровянников И. Ф., Маль-
цев С. П. — Теория и практика сорбцнонных процессов. Труды
Воронежск. гос. ун-та, 1971, вып. 5, с. 166—169.
209. Куролап Н. С, Измайлова Д. Р. — Теория н практика сорбцн-
онных процессов. Труды Воронежск. гос. ун-та, 1978, вып. 12,
с. 103—107.
210. Образцов А. А., Разуваев Л. П., Мазо А. А., Маршаков И. К.—
Теория и практика сорбцнонных процессов. Труды Воронежск.
гос. ун-та, 1971, вып. 6, с. 81—87.
211. Кривобородова Н. А., Образцов А. А.—Теория и практика
сорбцнонных процессов. Труды Воронежск. гос. ун-та, 1974,.
вып. 9, с. 171—173.
212. Ивакина Е. И., Зубец Н. Н., Лаврова 3. Д., Лебедин-
ская Г. А.—Теория и практика сорбцнонных процессов. Труды
Воронежск. гос. ун-та, 1976, вып. 11, с. 92—95.
213. Бедюх Г. А. и др.—Теория и практика сорбцнонных процессов.
Труды Воронежск. гос. ун-та, 1972, вып. 7, с. 90—93.
214. Greekmore R. W Reilley С N. Anal. Chem., 1970, 42, p. 570—
575.
215. Куриленко О. Д., Гребенюк В. Д., Манк В. В. Исследование
состояния воды >в ионообменных смолах методом ЯМР. Вгсннк
АН УССР, 1973, 11, с. 28.
216. Sharma H. D., Subramanian N. Proton Magnetic Resonance Stu-
dies of ionic Solvstion in ion — exchange Resins. Part III. Malti-
valent Counterions. Can of Chem., 1971, v. 49, N 24, p. 3948—
3955.
217. Гребенюк В. Д., Гудрит Т. Д., Гречко С. В. и др. — Теория и
практика сорбцнонных процессов. Труды Воронежск. гос. ун-та,
1978, вып. 12, с. 96—103.
218. Краснова Т. А., Сотскова Т. 3., Гребенюк В. Д. — Электрохи-
мия, 1974, т. 10, № 12, с. 1850—1853.
219. Гребенюк В. Д. Электродналнз. Киев, Техника, 1976. 160 с.
220. Полипанов И. С, Кожевников А. В., Пикус М. 3. Синтез и
свойства ионообменных материалов. М., Наука, 1968. 208 с.
ВЛАДИМИР ДМИТРИЕВИЧ ГРЕБЕНЮК
АЛЕКСАНДР АРОНОВИЧ МАЗО
ОБЕССОЛИВАНИЕ
ВОДЫ
ИОНИТАМИ
Редактор
И. А. Захарьяиц
Художник
В. Н. Пахомов
Художественный редактор
A. К- Малкин
Технический редактор
B. В. Лебедева
Корректоры
И. Ф. Герасимова, Н. А. Иванова
ИБ 813
Сдано в иаб. 16.04.80. Подп. к печ. Б.08.80. Т-14371.
Формат бумаги 84Х108'/э2- Бумага тип. № 2.
Гари, литературная. Печать высокая.
Усл. печ. л. 13,44. Уч.-изд. л. 13,62.
Тираж 6000 экз. Заказ 360.
Цеиа 95 к. Изд. Гй 1651.
Ордена «Знак Почета» издательство «Химия».
107076, Москва, ул. Стромылка, д. 13.
Московская типография № 11 Союзполиграфпрома
при Государствеииом комитете СССР
по делам издательств, полиграфии
и книжной торговли.
Москва, 113106, Нагатинская ул., д.
Гребенюк В. Д., Мазо А. А.
Г79 Обессоливание воды ионитами. — М.: Химия,
1980.—256 с, ил.
В книге собраны и обобщены сведения, необходимые для
выбора технологической схемы и оборудования для обессоли-
вания любого типа воды.
31402-040
Г 40.80.2801000000
050(01 )-80 6П7.1:вС9.3