Автор: Тихонов В.Н.
Теги: неорганическая химия другие физико-химические методы анализа (кроме оптических) химия
Год: 1971
Текст
АКАДЕМИЯ НАУК СССР
ОРДЕНА ЛЕНИНА ИНСТИТУТ ГЕОХИМИИ И АНАЛИТИЧЕСКОЙ ХИМИИ нм. И. В. ВЕРНАДСКОГО
Серия «АНАЛИТИЧЕСКАЯ ХИМИЯ ЭЛЕМЕНТОВ»
АНАЛИТИЧЕСКАЯ ХИМИЯ
АЛЮМИНИЯ
В. И. Тихонов
О 0
ИЗДАТЕЛЬСТВО «НАУКА»
Москва 1971
УДК 546.621:543,545
Серия «Аналитическая химия элементов-»
Главный редактор академик А. П. Виноградов
Редакционная коллегия:
И. П. Алимарин, А. И. Бусее, А. П. Виноградов, А. Н. Ермаков, Ю. А. Золотов, А. В. Карякин, П. Н. Палей, С. Б. Саввин, И. В. Тананаев, М. П. Волынец (ученый секретарь)
Редактор тома «Аналитическая химия алюминия» А. И. Б у се в
». **
Адрес редколлегии:
Москва, В-334, Воробьевское шоссе, 47а, Ордена Ленина Институт геохимии и аналитической химяи им. В. И. Вернадского
Академии наук СССР
2-5-5
308-1970 (1)
ОТ РЕДКОЛЛЕГИИ
Институт геохимии и аналитической химии им. В. И. Вернадского АН СССР осуществляет издание серии монографий по аналитической химии отдельных элементов. Эта серия — «Аналитическая химия элементов» — составит около пятидесяти томов. Потребность в подобного рода издании давно назрела. У нас накопился огромный опыт многочисленных лабораторий и теперь стало возможным и необходимым его подытожить. Таким образом, возникло настоящее издание — серия «Аналитическая химия элементов»,— которое осуществляется впервые. Аналитическая химия любого элемента него различных соединений в настоящее время представляется чрезвычайно разнообразной как вследствие сложности современных объектов исследования и широты диапазона концентраций, которые бывает необходимо определить, так и вследствие разнообразия использующихся методов.
В связи с этим для монографий был разработан общий план как в смысле содержания, так и последовательности изложения материала.
В монографиях содержатся общие сведения о свойствах элементов и их соединений. Затем излагаются химические реакции, являющиеся основанием для аналитических целей. Методы как физические, так и физико-химические и химические излагаются применительно для количественного определения данного химического элемента, начиная с анализа сырья, далее типичных полупродуктов производства и, наконец, конечной продукции, металлов или сплавов, окисей, солей и других соединений и материалов. Как правило, приводятся принципы определения и, где это необходимо, дается точное описание всего процесса определения. Необходимое внимание уделяется быстрым методам анализа. Самостоятельное место занимает изложение методов определения так называемых элементов-примесей в чистых материалах.
Обращается внимание на точность и чувствительность методов в связи с общей тенденцией повышения чувствительности методов определения следов элементов-примесей.
Монографии содержат обширную литературу, доведенную до последних лет. Они рассчитаны на широкий круг химиков, в первую
3
очередь химиков-аналитиков исследовательских институтов и заводских лабораторий, различных отраслей хозяйства, а также на химиков-преподавателей и студентов химических высших учебных заведений. К составлению монографий привлечены наши крупнейшие специалисты, имеющие опыт работы в области аналитической химии того или иного химического элемента.
Отдельные тома серии «Аналитическая химия элементов» будут выходить самостоятельно, по мере их подготовки. Вышли в свет монографии, посвященные торию, таллию, урану, рутению, молибдену, калию, бору, цирконию и гафнию, кобальту, плутонию, бериллию, никелю, редкоземельным элементам и иттрию, технецию, прометию, астатину и францию, ниобию и танталу, протактинию, галлию, фтору, алюминию, селену и теллуру. Готовятся к печати монографии по аналитической химии нептуния, кремния, германия, радия, золота и др.
Мы обращаемся с просьбой ко всем читателям присылать свои замечания и отзывы о монографиях.
ПРЕДИСЛОВИЕ
Алюминий определяют при исследованиях разнообразных природных и промышленных объектов, при контроле производства, при анализе почв и т. д. Задача аналитиков усложняется тем, что в связи с требованиями по повышению качества продукции приходится определять все меньшее и меньшее содержание алюминия в чистых металлах и в других материалах и поэтому нужны надежные высокочувствительные методы определения. Для успешного контроля технологического процесса часто возникает необходимость выполнять анализ быстро, при этом очень нужны эффективные методы маскирования мешающих элементов или быстрые методы их отделения.
За последние 10—15 лет в аналитической химии алюминия достигнуты большие успехи. Наиболее существенным достижением явилось использование для определения алюминия нового метода объемного анализа — комплексометрии. Для фотометрического определения алюминия предложены новые высокочувствительные органические реагенты, разработаны разнообразные методы отделения алюминия от мешающих элементов. Число всех опубликованных работ по определению алюминия в настоящее время составляет несколько тысяч. В то же время имеется только одна работа, систематизировавшая все достигнутое в аналитической химии алюминия. Это — монография Фишера и других, составляющая часть многотомного издания Фрезениуса и Яндера [733]. Эта монография, вышедшая в 1942 г., к сожалению, в значительной степени устарела. Монографии Р. Пршибила «Комплексоны в химическом анализе» [347] и Е. Сендэла «Колориметрические методы определения следов металлов» [360] содержат описание комплексометрических и фотометрических методов определения алюминия, но в них не попали многие очень важные методы, опубликованные за последние 8—10 лет.
Используя опубликованную литературу и свой опыт работы, мы поставили целью систематизировать все известные методы определения алюминия. В монографии рассматриваются химические, физико-химические и физические методы определения алюминия. Наибольшее внимание уделено методам, позволяющим определять
5
алюминий быстро, с минимальным числом операций отделения. К сожалению, не все из этих методов могут быть внедрены пока в лабораториях из-за отсутствия некоторых реагентов, но можно считать, что внедрение их есть лишь вопрос времени.
Из-за ограничения объема монографии пришлось сильно сократить раздел по физическим методам определения алюминия, который мог бы явиться предметом специальной монографии.
В монографии использована литература, вышедшая до октября 1968 г. и частично — более поздняя; в списке литературы не приведены работы, потерявшие в настоящее время свое значение или же представляющие собой лишь повторение известных методов применительно к другим материалам.
Автор выражает благодарность доктору химических наук профессору А. И. Бусеву за помощь в создании монографии и рецензентам — докторам химических наук П. Я. Яковлеву и С. Б. Саввину за ряд ценных критических замечаний, которые позволили улучшить монографию.
Автор
Глава I
ФИЗИКО-ХИМИЧЕСКАЯ И ХИМИКО-АНАЛИТИЧЕСКАЯ ХАРАКТЕРИСТИКА АЛЮМИНИЯ И ЕГО СОЕДИНЕНИЙ
НАХОЖДЕНИЕ В ПРИРОДЕ
Алюминий по распространенности в земной коре занимает третье место. Содержание его в литосфере, по А. П. Виноградову, 8, 80%. В природе встречается исключительно в виде соединений. Алюминий входит в состав 270 минералов. Наиболее распространенные из них двойные силикаты (полевые шпаты, слюды и др.) и продукты их выветривания — глины. Из двойных силикатов важнейшие: калиевый полевой шпат или ортоклаз К [AlSi3O8], натриевый полевой шпат или альбит Na [AlSi3O8], кальциевый полевой шпат или анортит Са [Al2Si2O8], плагиоклаз (изоморфные смеси кальциевого и натриевого полевых шпатов: олигоклаз, андезин, лабрадорит); слюды: биотит, мусковит, цинвальдит и лепидолит. Близки к полевым шпатам нефелин Na [AlSiOJ и лейцит К IAlSi2O6L Известны двойные силикаты кальция и алюминия — цоизит, эридот и везувиан, двойной силикат магния и алюминия — кордиерит. Силикат алюминия Al2SiO5 встречается в виде минералов: кианита, силлиманита и андалузита. Из содержащих фтор алюмосиликатов можно отметить топаз А12(ОН, F)2[SiO4].
Окись алюминия встречается в виде корунда и наждака. Важнейший источник получения алюминия — боксит — состоит из минералов бемита и диаспора А1ООН и гидраргиллита (гиббсита) А1(ОН)3. Важным минералом алюминия является также криолит Na3AlF6.
В табл. 1 представлены минералы, входящие в состав руд, используемых для получения металлического алюминия. Из руд основным сырьем для получения алюминия служат бокситы. Затем используются нефелиновые сиениты и их разновидности (уртиты, силлиманитовые и кианитовые сланцы, алунитовые породы).
При производстве металлического алюминия сначала из руд получают глинозем А12О3, который подвергают электролизу из рас твора в расплавленном криолите (6—8% А12О3 и 92—94% Na3AlF6-).
7
Таблица 1
Рудообразующие минералы алюминия [505]
Минерал Формула Содержание A12O>, 0 n Сопутствующие минералы Промышленное значение
Гидраргил- AI (ОН)з; 65,4 Диаспор, бемит, окисли Основная ру-
Лит <2% Ре30з и <0,006% Ga2Os железа да для получения ал.о-миння
Бемит А1ООН. примеси SiCh, Fe^Os, Ga^Oa 84,97 Гидраргиллит, диаспор, окислы железа, цеолиты То же
Диаспор АЮОН; <7% Fe2O8; <5% Мп2Оз, СгаОз, <4% S1O2, <п.10~2% Оа2Оз 84,97 В бокситах с гидраргиллитом и бемитом; в метаморфических породах с корундом, дистеном, гематитом, рутилом и др. » »
Алунит КА1з (SOj)2(OH)6 37,0. Гидраргиллит, каолин, полевые шпаты щелочных металлов Имеет ограниченное значение
Кианит (дистен) A12SIO5 63,1 Андалузит, ставролит, корунд, турмалин, рутил и др. Важное сырье для алюминия
Андалузит A12SIO5 63,1 Корунд, мусковит, диаспор, пирофиллит и др. То же
Силлиманит Al2SiOs 63,1 Андалузит, корунд, шпинель, кордиврит и др. )> )>
Нефелин Na (AlSiOi) 35,0 Эгирит, альбит, микроклин, канкринит, содалит, цеолиты, сфен, ильменит н др. » » Имеет огра-
Лейцит К (AlSi2Os) 23,5 Щелочные пироксены, нефелин, ортоклаз, серицит ничейное значение Потенцналь-
Каолинит Ah (Si4Oi0)(OH)8 39,5 Обычно образует моно-минеральные массы ное сырье Для алюминия
Впервые металлический алюминий получен X. К- Эрстедом в 1825 г.
Алюминий имеет очень важное значение для народного хозяйства. Сплавы на основе алюминия служат важнейшим конструкционным материалом для авиации. Алюминиевые сплавы используются также и в других отраслях промышленности. Алюминий как легирующий компонент входит во многие важнейшие сплавы на основе (•»
8
меди, магния, титана, никеля, цинка и железа. Алюминий применяется для раскисления стали и при алюмотермическом получении некоторых металлов. В настоящее время ежегодная мировая выработка алюминия составляет около 5 млн. т (без СССР).
ФИЗИЧЕСКИЕ И ХИМИЧЕСКИЕ СВОЙСТВА АЛЮМИНИЯ
Алюминий — серебристо-белый легкий металл, хороший проводник тепла и электричества, пластичен, легко поддается механической обработке. Его кристаллическая решетка относится к гранецентрированной кубической системе; период а = 4,0494 А. Ниже приводятся основные физические константы алюминия [206, 3661:
Плотность (20° С), г/с.м3 .......................... 2,6989
Температура плавления, °C............................. 660
Температура кипения, °C.............................. 2500
Теплота плавления, кал/г-атом........................ 2520
Атомная теплоемкость (0° С), кал/г-а том-г рад...... 5,99
Теплопроводность (20° С), кал/см-сек-град........... 0,520
Электропроводность, олС’-слС1....................... 3,82- Нг3
Поперечное сечение захвата тепловых нейтронов, барн 0,215
Атомный радиус, А................................... 1,43
Ионный радиус иона А13+, А.......................... 0,57
Потенциалы ионизации, эв:
А1°-»А1+...................................... 5,984
А1+-»А12+ .....................................18,82
А12+->А13+.....................................28,44
Энергия ионизации для А1°-»А13+, ккал/г-атом .... 83
Сродство к электрону, ккал/г-атом...................12
Алюминий состоит из одного стабильного изотопа А12’ (100%). Искусственно получены радиоактивные изотопы с массами 24, 25, 26, 28 и 29 (табл. 2).
Алюминий находится в главной подгруппе III группы периодической системы элементов Д. И. Менделеева. Порядковый номер его 13, атомный вес 26,9815. Электронная конфигурация атома алюминия в невозбужденном состоянии ls22s22pe3s23p1. Валентными являются три электрона s- и р-подуровней последнего слоя, в соответствии с этим алюминий проявляет максимальную валентность 3+.
При высоких температурах алюминий может проявлять валентность 1 и реже—2. Эти валентные состояния алюминия неустойчивы, поэтому во всех устойчивых соединениях алюминий трехва лентен.
Алюминий обладает большим сродством к кислороду, поэтому всегда покрыт тонкой пленкой окисла, которая защищает его от дальнейшего окисления. Благодаря наличию окисной пленки алю-
9
Таблица 2
Радиоактивные изотопы алюминия [361, 374]
Изотоп Характер излучения Период полураспада Энергия излучения частиц, Мэв Реакция получения
А124 3+; a (-lO-so/o); у 2,1 сек. -8,5 (3+); 2(a) Mg (р, я)
А125 3+ 7,6 сек. 3,24 Mg (р, я); Mg (р, т)
А126 * 3+ 6,7 сек. 3,20 Na (а, я); Mg (р, у); Mg (р, я); Mg (d, я); Al (у, я)
А123 3+ (84%); э. з. (16%); у 8-IO6 лет 1,17 Na (а, я); Mg (р, у); А1 (р, ря); Si (d, а)
А128 3'; у 2,3 мин. 2,865 О (N, 2р); Mg (а, р); Mg->3~; Al(d, р); Al (я, у); Si (я, р); Si (Т. р)1 Р («. «)
А129 6,6 мин. 2,7 (-70%); 1,4 (-30%) Mg (а, р); А1(а,2р); Al (Не3, р); Si (я, р); Si (У, р): Р (Y, 2р)
* Возбужденное изомерное состояние ядра.
миний устойчив по отношению к воде даже при высоких температу-рах. В ряду напряжений алюминий стоит близко к самым активным металлам (щелочным и щелочноземельным), его нормальный электродный потенциал равен — 1,66 в в кислом растворен —2,35 в в щелочном. Несмотря на это, алюминий (вследствие образования защитной окисной пленки) почти не растворяется в сильно разбавленных кислотах и концентрированной HNO3, очень медленно растворяется в разбавленной и концентрированной H2SO4. В HNO3 и H2SO4 средних концентраций постепенно растворяется. Чистый алюминий очень медленно растворяется в НС1; алюминий, содержащий примеси других металлов, растворяется, напротив, легко. По отношению к СН3СООН и Н3РО4 алюминий устойчив.
Алюминий легко растворяется в растворах щелочей с образованием алюминатов и выделением водорода. Процесс растворения объясняется снятием с поверхности металла окисной пленки при действии гидроксильных ионов:
А1»Оз + 2ОН- + ЗН2О = 2 [ А1 (ОН)4]“.
Металл, лишенный пленки, растворяется в результате реакций:
2А13+ -|- 6Н+ (нз воды) = 2АР+ -|- ЗН2 ,
2АР+ + 8 ОН" = 2 [А1 (ОН)4]“.
10
Тонко измельченный алюминий при накаливании на воздухе сгорает с образованием А12О3. Вследствие своего высокого сродства к кислороду он вытесняет многие металлы из их окислов, на этом основан способ получения некоторых металлов (алюминотермия). С хлором алюминий взаимодействует со значительным выделением тепла; реагирует с жидким бромом, с иодом реакция идет лишь при нагревании. При обычной температуре алюминий с фтором не реагирует вследствие образования пленки A1F3. Реакция идет энергично при высоких температурах. С серой алюминий взаимодействует при температуре красного каления с образованием сульфида A12S3. При температурах выше 800° С с азотом образует нитрид A1N. При 1400° С энергично реагирует с углеродом с образованием карбида А14С3. При нагревании алюминий реагирует с селеном и теллуром со взрывом, при этом образуются Al2Se3 и А12Те3. При высоких температурах алюминий в виде пудры горит в атмосфере СО2 и СО с образованием А12О3 и углерода. При сжигании смеси порошков алюминия и фосфора образуется фосфид А1Р. С водородом алюминий непосредственно не взаимодействует, гидрид его (А1Н3)Ж получают косвенно.
СОЕДИНЕНИЯ АЛЮМИНИЯ
Окись алюминия
Окись алюминия имеет важное значение в аналитической химии алюминия, так как является весовой формой при его определении. Окись алюминия образуется при прокаливании гидроокиси и других соединений алюминия; полиморфна и существует в основном в трех различных формах: а-А12О3, 0 -А12О3 и у-А12О3 [761, 1107].
а - А12О3 — глинозем — белые кристаллы с гексагональной ромбоэдрической решеткой, а = 5,13 А, угол а — 55,16°; уд. в. 3,96, т. пл. 2050° С, т. кип. > 3000° С. Образуется при прокаливании гидроокиси и солей алюминия при 900—1200° С и выше. В природе встречается в виде минералов корунда, рубина и сапфира.
0-А12О3 — гексагональные кристаллы, уд. в. 3,30. Это устойчивая при очень высокой температуре модификация. Образуется при медленном охлаждении расплавленной а-А12О3. При температуре 1500—1800° С <х-А12О3 полностью может перейти в 0-А12О3.
у-А12О3 — кубическая модификация с уд. весом 3,40 — образуется при нагревании природной или искусственной гидроокиси и солей алюминия до 600—900° С. Выше 1000° С у-А12О3 переходит в а-А12О3; этот процесс полностью заканчивается при 1200° С.
Описано также несколько других неустойчивых модификаций А12О3.
Растворимость окислов в кислотах зависит от способа их получения. Полученная прокаливанием гидроокиси при температуре выше
11
1000° С а-А12О3 в кислотах и щелочах практически нерастворима. у-А12О3 отличается от других модификаций большей дисперсностью и гигроскопичностью и большей растворимостью в кислотах. Растворимость А12О3 в воде при 20° С, найденная кондуктометрическим методом, равна 1,04л<г А12О3/л или 1,02-10-8моль/л [1108], потенциометрическим титрованием — 0,96-10'5 моль/л [602]. Чем выше температура прокаливания при получении А12О3, тем она менее гигроскопична.
Гидроокись алюминия
Гидроокись алюминия может образоваться в аморфной и кристаллической форме.
При осаждении из кислых растворов на холоду небольшим избытком аммиака в присутствии аммонийных солей образуется «-гидроокись состава А1 (ОН)3 в виде белого хлопьевидного, аморфного геля. Эта гидроокись очень реакционноспособна и неустойчива. Легко растворяется в разбавленных растворах НС1 и NaOH, обладает большой адсорбционной способностью. а-Гидроокись при хранении под водой самопроизвольно переходит в другие формы. Этот процесс может протекать по двум направлениям одновременно. При одном образуется p-гидроокись, при 70° С быстро и непосредственно, а при 20° С медленно через промежуточную форму «/р.
p-Гидроокись представляет собой полигидроокись, продукт соединения нескольких молекул друг с другом при отщеплении воды. p-Гидроокись отличается от «-гидроокиси незначительной реакционной и абсорбционной способностью. Одновременно образуется у-гидроокись, продукт диспергирования получающегося кристаллического тригидрата байерита в р-гидроокиси.
у-Гидроокись в реакционном отношении также инертна. р-Гид-роокись неустойчива, в процессе старения осадка постепенно переходите кристаллическую форму—бемит—состава АЮОН (у-метагид-роокись). При осаждении из горячих растворов непосредственно образуется бемит в смеси с аморфной гидроокисью. Изомер бемита — диаспор (а-метагидроокись) — встречается в природе. Кристаллы обоих изомеров принадлежат к ромбической сингонии. а-АЮОН при 350—420° С, а у-АЮОН при температуре > 600° С переходят в а-А12О3. При повышении щелочности раствора превращение идет в сторону образования кристаллического тригидрата байерита состава А12О3-ЗН2О (моноклинные кристаллы). В природе встречается изомер байерита — гидраргиллит.
При осаждении большим избытком аммиака кроме a-гидроокиси сразу образуются также пслигидроокиси, несколько молекул гидроокиси связываются в цепь, отщепляя воду. Образование простейшего члена ряда поли гидроокисей — дигидрата — можно представить так:
2А1 (ОН)з + Н2О -» А1 (ОН)2-О-А1 (ОН)2 (или А12О3-2Н2О).
12
Эти соединения неустойчивы и при хранении под водой или в аммиачном растворе переходят в устойчивый тригидрат — байерит:
А1 (ОН)2-О-А1 (ОН)2 + Н»О = 2 А1 (ОН)з .
Кристаллические моногидрат (бемит) и тригидрат (байерит, гидраргиллит) представляют собой конечные продукты медленно протекающего процесса старения геля. Превращения а-гидроокиси можно изобразить следующей схемой [885]:
А13+ ЗОН-
700 с
{а/3?----4
мета гидрсокись (А (ООН)
Кристаллические байерит и гидраргиллит можно выделить непосредственно пропусканием СО2 в раствор щелочного алюмината (при быстром пропускании образуется байерит, при медленном—гидраргиллит):
2 [ А1 (ОН)4(- + СО2 = 2 А1 (ОН)з + СО3’ + Н2О .
Бемит и байерит в химическом отношении очень устойчивы. Бемит почти не растворяется в концентрированных растворах щелочей, трудно растворим в НО. Байерит, выделенный из раствора алюмината, на холоду плохо растворяется в НС1, HNO3 и H2SO4 и только при нагревании медленно переходит в раствор; в 30%-ном растворе NaOH гидроокись при нагревании растворима.
Произведение растворимости НАЮ2, по данным разных авторов, составляет: 4-Ю'13 при 15°С [889], 3,7-10"15 при 25° С [1172] и 1,3-10~14 при 18° С [734]. Для А1 (ОН)3 произведение растворимости ПР = 1,06-10-33 [805], по другим данным, 5,1 -10~33 [376].
Гидроокись алюминия — амфотерное соединение — может реагировать и с кислотами, и с основаниями с образованием солей. На этом основании обычно считают, что она является одновременно и основанием, и кислотой. Вычислена даже константа диссоциации так называемой одноосновной алюминиевой кислоты К=6,3-10’13 (при 25° С) [1279]. Однако Реми [1107] считает, что способность гидроокиси алюминия образовывать соли с основаниями объясняется не отщеплением Н+-ионов при диссоциации, а дальнейшим присоединением к А1 (ОН)3 ионов ОН’.
Реакция
AI (ОН)з = [А1О (ОН)2]- + Н+,
по мнению Реми, протекать не может.
13
Таким образом, в щелочных растворах А1 (ОН)3 ведет себя не как кислота, а как ангидрокислота и образует гидроксосоли; например, гидроксоалюминат калия К1А1(ОН)4].
Ионы Нт могут связывать ионы ОН" у ионов [А1(ОН)4]"; при этом устанавливаются следующие равновесия:
[А1 (ОН)!]" + Н+ Al (ОН)з + Н2О;
А! (ОН)э + ЗН+ Я А13+ + ЗН2О.
Этими равновесными реакциями, зависящими от концентрации ионов Н+, определяется амфотерный характер гидроокиси алюминия.
Соединения алюминия с фтором
Алюминий с фтором образует фторид A1F3 и фторалюминаты. Фторид может быть получен при пропускании фтористого водорода через алюминий или А12О3 при красном калении в виде бесцветных ромбоэдрических кристаллов. При нагревании возгоняется без плавления. Мало растворим в воде, при 25° С растворяется 0,559 г AlFs/100 г воды [620]. В химическом отношении A1F3 очень устойчивое соединение. Устойчив по отношению к кипящим растворам NaOH и КОН, к холодным и горячим кислотам, разлагается при сплавлении с Na2CO3 и NaOH. Образует несколько гидратов: A1F3-9H2O, A1F3-3H2O, A1F3-2H2O и др. При обычной температуре более устойчив тригидрат, все остальные гидраты при соприкосновении с водой переходят в тригидрат.
С фторидами щелочных металлов A1F3 взаимодействует с образованием комплексных соединений — фтор алюминатов типа М A1F4, M2A1F5 и M3A1F6 (М — щелочной металл). Фторалюминаты — белые, кристаллические, труднорастворимые в воде порошки. Из фторалюминатов наибольшее значение имеет криолит Na3AlF6. На образовании криолита основан один из важнейших весовых методов определения алюминия. Криолит встречается в природе и может быть получен искусственно; диморфен, образует кристаллы моноклинной и правильной систем (октаэдр); т. пл. его 1000° С.
Для искусственно полученного криолита растворимость в воде при 12 и 15° С составляет 0,041 и 0,061г/100 г воды соответственно [761].
Фторидные комплексы алюминия — очень устойчивые соединения; их константы нестойкости составляют [167]:
Ион ^нест Иои Ацест
[A1F6]3- 1,44-10"2° [AlFa] 1,0-Ю-15
[A1FS]2— 64,3-1О"20 [A1F2]+ 7,1-10-12
[A1F4]- 1,8-Ю"18 [A1F]2+ 7,4-IO"7
14
Хлорид алюминия. Безводный хлорид алюминия А1С13— бесцветные кристаллы моноклинной системы. Уже при обычной температуре заметно летуч и при 183° С возгоняется, не плавясь. Температура плавления (192,6° С) может быть достигнута только под давлением. Вблизи температуры сублимации хлорид алюминия в парообразном состоянии бимолекулярен, имеет формулу А1аС16, около 800° С полностью распадается на простые молекулы. А1С13 растворим во многих органических растворителях. На воздухе вследствие гидролиза дымит. В воде легко растворим, при 25° С в 100 г воды растворяется 44,38 г А1С13. Водный раствор безводного А1С13 из-за гидролиза имеет сильнокислую реакцию. Степень гидролиза Q,]N раствора составляет 2%, 0,001 W раствора — 4,5% [1107].
Из водных растворов А1С13 при выпаривании выделяется гексагидрат А1С13-6Н2О в виде бесцветных, расплывающихся на воздухе кристаллов. Гексагидрат хорошо растворим в воде. Ниже приводится растворимость его при различных температурах [1222]:
Т емпература, Растворимость, °C вес. %
О 30,48
5 30,82
10 31,66
30 31,96
Температура, °C
45
65
98
Растворимость, вес. %
32,17
32,32
33,23
Водный раствор А1С13-6Н2О вследствие гидролиза показывает кислую реакцию по лакмусу. pH растворов его от 2,5 до 3,7 при концентрации А1С13-6Н2ОотО,01 доО,5Л4. Гидролиз протекает с образованием оксихлоридов. При добавлении нейтральных солей (например, КС1) гидролиз подавляется.
Растворимость хлорида алюминия в воде уменьшается при добавлении НС1. Растворимость при 25° С составляет [761]:
Концентрация НС], %
5,09
19,43
40,98
Растворимость AlClj, вес. %
27,98
10,11
0,98
В соляной кислоте, насыщенной эфиром, растворимость еще меньше. По данным Гуча и Хэвенса [766], в 100 г эфирного раствора НС1 растворяется 4 мг А1С13-6Н2О. На этом основан метод отделения алюминия.
Известны оксихлориды алюминия состава А12ОНС15, А12(ОН)2С14, А12(ОН)3С13, А12(ОН)4С12, А12(ОН)6С1. При пептизации геля А1(ОН)3, отмытого от NH4+-hohob небольшими количествами НС1, образуются оксихлориды А1(ОН)С12, А1(ОН)2С1 (или А1ОС1).
15
Нитрат алюминия
Нитрат алюминия при выпаривании водных растворов выделяется в виде гидрата A1(NO3)3-9H2O. Известны также гидраты с 8,6 и 4 молекулами воды. Гидрат Al (NO3)3-9H2O — бесцветные ромбические кристаллы, расплывающиеся на воздухе. При 73,5° С этот гидрат переходит в A1(NO3)3-6H2O, из которого при 140° С образуется основной нитрат; последний при 200' С, в свою очередь, превращается в А12О3.
Al (NO3)3-9H2O хорошо растворим в воде и спирте; в 100 г воды при 25° С растворяется 63,7 г нитрата в пересчете на безводную соль. В воде нитрат алюминия гидролизуется; вследствие гидролиза растворы имеют pH от 2,5 до 3,7 (при концентрации от 0,01 до 0,5 Л4 соответственно). При нагревании растворов нитратов последние переходят в следующие основные нитраты: А1 (ОН) (NO3)2, A1(OH)2NO3, A12(OH)3(NO3)3 и др.
Сульфат алюминия
Безводный сульфат алюминия представляет собой белый порошок; при нагревании распадается с выделением SO2 или SO3. Относительно температуры полного разрушения сульфатов имеются противоречивые литературные данные (960, 800, 770, 760, и 750° С). Известны гидраты с 27, 18, 16, 10 и 6 молекулами воды. При обычной температуре из водных растворов кристаллизуется гидрат Al2 (SO4)3-• 18Н2О в виде октаэдров. Этот гидрат хорошо растворим в воде: при 20° С в 100 г воды растворяется 107,35 г гидрата или 36,15 а в пересчете на безводную соль [761]. При нагревании А12 (SO4)3-18Н2О, не плавясь, отдает гидратную воду. Полное обезвоживание сульфата происходит, по данным различных авторов, при температуре от 200 до 450° С. Вследствие гидролиза растворы сульфата алюминия показывают кислую реакцию; pH их от 2,8 до 3,7 при концентрации 0,01—0,5 М. Гидролиз протекает согласно схеме
A12(SOj)3 + 2Н2О АЬ (ОН)2 (SO4)2 + HaSCh .
При более сильном разбавлении гидролиз идет по второй ступени:
ALfSOOs + 4Н2О AI3(OH)iSOj + 2H2SO4.
Продукты гидролиза могут быть выделены и в кристаллическом виде; известен ряд таких основных сульфатов.
Гидролиз сульфата алюминия необходимо учитывать при осаждении алюминия в виде гидроокиси из растворов сульфатов.
Сульфат алюминия склонен к образованию двойных солей с сульфатами щелочных металлов и аммония, так называемых квасцов; общая формула их M’Al (SO4)2- 12Н2О (М' = К, Na, NH4+ и др.). Квасцы хорошо растворимы в воде, кристаллы их представляют октаэдры.
16
Перхлорат алюминия
Безводная соль неизвестна, известны гидраты с 15,12, 9 и 6 мо-( лекулами воды. Гидраты хорошо растворимы в воде. В 100 г воды при 14° С растворяется 564 г А1 (С1О4)3-9Н2О.
Фосфаты алюминия
Фосфат алюминия выделяется в виде труднорастворимого белого студенистого осадка при взаимодействии солей алюминия с растворимыми фосфатами. Если pH осаждения не больше 4,5, то состав образующегося осадка соответствует формуле А1РО4-хН2О (9711, при больших pH могут образоваться основные соли. При нагревании вода теряется, для полного удаления воды нужна температура 1200—1300° С. Фосфат алюминия меньше всего растворим при pH 4,07—6,93. Произведение растворимости его по одним данным 3,87* 10-11 [399], по другим — 1,64-10"20 [170]. Фосфат алюминия легко растворим в НС1 и HNO3, плохо растворим в СН3СООН.
Выделены гидраты А1РО4-3,5Н2О, А1РО4-2Н2О. Известны кислые фосфаты алюминия А1 (Н2РО4)3, А12(НРО4)3-8Н2О, А12Н3(РО4)2-•2,5Н2О. Пирофосфат алюминия образуется при осаждении алюминия из раствора хлорида при помощи Na4P2O7 в виде белого студенистого осадка, после высушивания при 110° С имеет состав А14 (Р2О7)3- ЮН2О, растворяется в избытке осадителя с образованием комплексного соединения.
Алюминат натрия
Алюминат натрия NaAlO2—белая, похожая на эмаль масса; на воздухе разрушается, в воде хорошо растворяется. Образуется при сплавлении А12О3 с NaOH или Na2CO3. При взаимодействии А1(ОН)3, осажденного при помощи NaOH, с избытком осадителя образуется гидр оксиалюми н ат:
AI (ОН)з + NaOH = Na [Al (ОН)4] .
Алюминаты при разбавлении их растворов гидролитически разлагаются с выделением кристаллической гидроокиси алюминия А1 (ОН)3“ (гидраргиллит).
Соединения с органическими кислотами
Соединения алюминия с некоторыми органическими кислотами (бензойной, янтарной, коричной, дифеновой) используются для весового определения алюминия. Многие другие органические кислоты (см. ниже) образуют с алюминием комплексные соединения и мешают количественному определению алюминия, поэтому аналитику необходимо считаться с этим.
17
Органические кислоты расположены ниже в порядке усложнения их состава.
Ацетаты алюминия. Ацетат алюминия А1(СН3СОО)3 из водных растворов в твердом виде нельзя получить, так как он сильно гидролизуется. В безводном состоянии может быть получен при умеренном нагревании А1С13 с уксусным ангидридом. При гидролитическом осаждении алюминия с помощью ацетатов всегда образуются основные ацетаты алюминия А1(ОН)(СН3СОО)2, А12О(СН3СОО)4, А1(СН3СОО)3-2А1О(СН3СОО) и др.
Растворы ацетатов алюминия гидролитически разлагаются с отщеплением СН3СООН, pH их от 3,65 до 4,64, в зависимости от концентрации. Основной ацетат А1(ОН)(СН3СОО)2 в воде растворим очень незначительно (2—3%), нерастворим в спиртах, ацетоне, эфире; растворимость в СНС13 ~0,03%. При 250—300° С разлагается:
А! (ОН) (СНзСОО)2 = АЮ(ОН) + (СН3СО)2О .
Оксалат алюминия в чистом виде выделить невозможно; по некоторым данным, выделен гидрат Al2 (QO^-nHaO. Для аналитической химии алюминия важнее образование растворимых оксалатных комплексов алюминия. Алюминий с оксалат-ионом дает несколько комплексов. В растворах, 0,5 М по НС1, образуется комплексный ион [А1(С2О4)]+, с уменьшением кислотности — комплексы с большим числом лигандов. Так, при pH 5 появляется комплексный анион [А1(С2О4)3]3“, при pH 2 — анион [А1 (С2О4)2]“. По мнению авторов работы [30], комплексы [АЦСаО^]* и [А1(С2О4)2]~ возникают лишь в незначительной степени. Для различных оксалатных комплексов алюминия найдены следующие значения Кнест-
Комплекс Киест
[Al (C2Oi)]+ 5.10-е [30]
[А1 (С2О4)2]- 1-КГ18 [515]
[AI (С2О4)з]3- 1,6-Ю’17 [515]
С малоновой кислотой НООС—СН2—СООН алюминий дает довольно прочный комплекс, но менее прочный, чем с оксалатами. В присутствии малоновой кислоты при действии аммиака А1 (ОН)3 осаждается только при стоянии или кипячении. Есть указания о возможности выделения из растворов гидрата комплексного малоната алюминия состава К3 [А1Ма13]-ЗН2О [693]. Потенциометрическим методом определена общая константа нестойкости его, равная 1,47-Ю"16 [694].
С янтарной кислотой HOOQCH^COOH алюминий в слабокислой среде образует труднорастворимые в воде основные сукцинаты, которые используются при весовом определении алюминия. Подробнее см. в разделе «Гравиметрические методы».
18
Алюминий с гликолевой кислотой дает комплекс состава 1 : 2. Этот комплекс малоустойчив, степень связывания алюминия в комплекс составляет только 55—60% [1030].
С солями молочной кислоты СН3СНОНСООН алюминий образует комплексы состава 1 : 2 и 1: 3; соединение Н3[А1(С3Н4О3)3] • 5Н2О выделено в твердом состоянии [1159].
Алюминий сяблочной кислотой дает комплекс состава 1 :1 [981]. При pH 4, ионной силе 1,0 и 27—30° С константа нестойкости определена равной 4,84-1СГ4 [981].
С винной кислотой и ее солями алюминий образует комплекс, как в кислой, так и в щелочной среде. Согласно исследованиям Кэдариу и др. [606—608], в кислых растворах появляется комплекс состава А1: тартрат = 2:1; константа равновесия этой реакции ~7,2-10“5. При pH выше 3,5—3,6 возникает комплекс состава 1 : 1, с константой устойчивости порядка 104. При образовании комплекса выделяются два иона Н+ на один атом алюминия [ 607]. Строение комплексного соединения можно представить так:
СОО-\ 1 \ СНОН \ | /А1-ОН.
СНОН / I / соо-
Есть указания, что в щелочных растворах могут возникать комплексы с соотношением А1 : тартрат =1:4 [606].
В кислой среде при рН< 5 алюминий с цитратами дает комплекс состава 1 : 1 [575, 606, 1050], в щелочных растворах — состава 1 : 2 [470]. Состав комплекса в кислой среде:
сн3соох
НО— С— СОО—^Al.
I / СН2СОО/
Три координационных места алюминия заняты цитратом, осталь ные — молекулами воды.
Соли бензойной и коричной ф-фенилакриловой) кислот с алюминием образуют труднорастворимые осадки, которые используются для весового определения алюминия (подробнее см. раздел «Гравиметрические методы»),
Гетерометрическим титрованием изучено образование комплексов алюминия сфталевой кислотой [573]. Установлено образование комплексного аниона состава [А1(С8Н4О4)2]“.
При дальнейшем прибавлении фталевой кислоты выделяется осадок К3А1(С8Н4О4)3. Если добавлять раствор алюминия к осадку, то последний растворяется при отношении А1 : фталат = 2 : 3;
19
авторы предполагают, что возникает недиссоциированное ковалентное соединение А12(С8Н4О4)3.
Алюминий дает комплекс состава 1:3 с крезотовой кислотой С6Н5СН=СНСООН [765].
В слабокислой среде (pH 4—5) алюминий ссалициловой кислотой образует растворимый комплекс состава 1 : 1 [605, 609, 674], которому приписывается формула
Пгсоо>а/он
—О 7 \Н2О.
При 26—28° С и различной ионной силе спектрофотометрическим методом найдены следующие значения константы образования этого комплекса [674]:
Ионная сила -Куст
0,02 (2,86±l,l)-101
0,05 (2,43 + 0,95)-104
0,20 (1,65 + 0,67).104
Экстраполированное значение Куст при р = 0 составляет 4,6-104. При X = 305 н.и молярный коэффициент погашения комплекса составляет 4,35-103 [674].
Для салицилатного комплекса состава 1 : 1 в литературе имеются и другие значения констант: Ауст = 5,42-1011 [1032] и АНест = = 8-Ю15 [36].
Есть указания о существовании других салицилатных комплексов алюминия: состава AlSal2 с Ауст = 4,09-10® и AlSal|~ с Куст = = 4,87-107 [1032].
Алюминий с сульфосалициловой кислотой С6Н3(ОН) (COOH)SO3H образует комплекс состава 1 : 1 [1005]. При 28 ± 0,5° С и ионной силе 0,2 спектрофотометрическим методом найдены следующие значения Кнест [1005]:
pH ^-нест
2,4 (2,48+0,05)-10~з
3,0 (5,37±0,11).10-4
4,0 (5,94±0,14).10-5
|3-Р езорциловая кислота с алюминием при соотношениях А1 : реагент, равных от 1 : 1 до 1 : 3, согласно данным работы [1105], дает только один комплекс состава 1 : 1, с максимумом поглощения при 300 нм. Оптимальный pH для протекания реакции 4,5—5. Строение комплекса можно представить так:
О-----АЬ +
20
Авторы работ [1031, 1032] указывают на существование комплексов с соотношением А1 : реагент = 1 : 2 и 1 : 3 и дают значения Куст для этих комплексов, равные 5,37-10® и 8,33-103. Для комплекса 1 : 1 Куст равна 4,52-10® [1032], что противоречит данным этих же авторов из другой работы [1031]. Поэтому эти данные, очевидно, ненадежны.
Алюминий образует с миндальной кислотой С6Н5 —СНОН—СООН три комплекса состава 1 : 1,1 : 2 и 1 : 3 [765, 1190], при pH < 5,8, 6,5 и 7,8 соответственно. В них имеются следующие комплексные ионы:
Соединения с кислотами, производными углеводов
Алюминий при рН< 5 дает с d-v люконовой кислотой С5Н11О5СООН многоядерную алюминиево-глюконовую кислоту состава А1.2С18О33Н34; при pH > 5 возникают соли с комп лексным анионом [А1СвН8О4]“ [452]. Имеется указание о существовании непрочного комплекса состава A1G3 (G — глюконат-ион), с общей Куст = 2,2- 1СГ6 [1242].
При взаимодействии с галактуроновой кислотой С4Н4(ОН)4СНОСООН в зависимости от pH появляются многоядерные соединения А1С18Н27О21 и А12(ОН)С18Н26О21 и одноядерное соединение А1С6Н7О7 [88].
С сахарной кислотой С4Н4(ОН)4 (СООН)2 образуется комплекс, содержащий три атома алюминия на две молекулы сахара [324].
Комплексы с полиаминополиуксусными кислотами (комплексонами). Комплексы с этим классом соединений имеют чрезвычайно важное значение для аналитической химии алюминия. На применении их основаны комплексометрические методы определения алюминия. Наиболее изучены комплексы алюминия с нитрнлотриуксусной (НТА), этилендиаминтетра-уксусной (ЭДТА), 1,2-диаминциклогексантетрауксусной (ДЦТА), диэтилентриаминпентауксусной (ДТПА) и оксиэтил этил енди-аминтриуксусной (ГЭДТА) кислотами. рК ступенчатой диссоциации
Рис. 1. Зависимость эффективной константы устойчивости комплекса алюминия с комплексоном III от pH [519]
важнейших четырех комплексонов, найденные при р. = 0,1 (KNO3)
при 20 °C представлены ниже.
Комплексон pKi рК« рКа рК< рКа
ЭДТА 2,02 2,66 6,21 10,31
ДТПА 1,80 2,55 4,33 8,60 10,58
ДЦТА 2,40 3,55 6,14 11,70
ГЭДТА 2,51 5,31 9,86
Все эти комплексоны с алюминием образуют комплексы состава 1:1. Для комплексов алюминия найдены показатели Клест [985]:
Комплексон Р^нест Комплексон Р^нест
ЭДТА 16,78+0,03 ДЦТА 18,73+0,05
ДТПА 18,51+0,01 ГЭДТА 12,54+0,05
Близкие данные получены другими авторами [519]; ниже приводятся эти данные вместе с рК образования кислых и основных замещенных комплексонатов алюминия.
Комплексон ЭДТА ГЭДТА ДТПА ДЦТА рКабс AIY рКобр AIYH рКобр AIYOH 16,5 3,4 8,0 14,4 2,4 9,3 18,7 4,3 6,6 18,9 3,4 6,3
На рис. 1 представлена устойчивости комплексоната
зависимость эффективной константы алюминия от pH [519].
Соединения с фенолами и их производными
Фенолы и их производные, за исключением салицилаль-о-амино-фенола, для количественного определения алюминия не используются. Сведения о соединениях алюминия с этим классом соединений даны, чтобы аналитик считался с возможным вредным влиянием их.
22
Пирокатехин. В кислом растворе даже в присутствии большого избытка пирокатехина возникает только комплекс состава 1:1с комплексным ионом
Для этого комплекса 1g Куст= 16,56 [691]; по другим данным, КНест= = 0,4-10~23>4 [500]. В нейтральных и щелочных растворах образуются комплексные анионы состава 1 : 2 и 1 : 3 [500, 691]:
Для комплексов 1 : 2 и 1 : 3 найдены lgKycT, равные 15,64 и 13,65 соответственно [691].
Тирон (двунатриевая соль пирокатехин-дисульфокислоты) во многом ведёт себя подобно пирокатехину, ’с алюминием дает комплексы состава 1 : 1, 1 : 2 и 1 : 3 [690, 1008] в кислых, нейтральных и щелочных растворах соответственно. Появляющиеся при этом комплексные ионы имеют следующее строение:
Для комплексов 1 : 1, 1 : 2 и 1 : 3 логарифмы ступенчатых констант устойчивости составляют соответственно: 17,02 ± 0,23; 16,49 ± ± 0,21 и 14,3 ± 0,07 [690]. .
Хромотроповая кислота с алюминием образует два комплекса состава 1 : 1 и 1 :2; 1g Куст = 17,53 ± 0,13 и 16,78+ ± 0,08 соответственно [690]. Комплекс состава 1 : 1 имеет такое строение:
Ю г л о н. Имеется указание о возникновении между юглоном и алюминием нескольких ^комплексов [327]. Однако авторами не
23
получены четкие данные, позволяющие подтверждать существование комплексов какого-то определенного состава.
С а л п ц и л а л ь - о - а м и н о ф е н о л с алюминием дает флуоресцирующее соединение, которое используется для флуори-метрического определения алюминия. По данным Туманова и Ефи-мычева [435], возникает еще одно соединение, не флуоресцирующее, пригодное для фотометрического определения алюминия. Ниже приводятся характеристики этих комплексов [435].
Время установления pH химического >.тах, нм -^1 : реагент А'нССТ е при >.тах равновесия, мин
Флуоресцирую- 5,5—5.8 10—15 405 1:2 2,02-Ю-7 9 200
щий комплекс
Нефлуоресци- 7,1—7,6 20—30 415 1:3 2,02-10“' 34500
рующий комплекс
Для флуоресцирующего соединения подобные же данные относительно состава комплекса, Хтах, оптимального pH приводят Сэйлор и Ледбеттер [1144]. В литературе имеются указания и о существовании комплекса состава 1 : 1 [55].
Соединения с оксихинолином и его производными
8-Оксихинолин (о-оксихинолин, оксин). Об оксихиноли-нате алюминия см. в гл. II.
8-0 ксихинальдин (2-метил-8-оксихинолин) в среде абсолютного этанола с алюминием дает комплекс состава 1 : 1 [1025].
Комплекс флуоресцирует, спектр поглощения дает пики при 315 и 358 нм. Комплекс менее устойчив, чем оксихинолинат алюминия. Уже при прибавлении воды (до 5%) комплекс быстро разрушается. Поэтому 8-оксихинальдин для определения алюминия не представляет интереса, но является важным реагентом для отделения мешающих элементов при его определении.
7-И одо-8-окси-5-хинолинсульфокислота с алюминием образует комплекс с Х,тах = 370 нм, который использован для фотометрического определения алюминия.
Соединения, содержащие две группировки 8-о к-сихинолина. Филлипс и др. [1059] изучили комплексообразование алюминия с соединениями, имеющими две группировки 8-оксихинолина. Из них 8,8'-диокси-5,5'-бихинолил и 8,8'-диокси-5,5'-бихинолилметан с алюминием дают комплексы с соотношением А1: реагент= 1 :3. Эти комплексы подобны оксихинолинату алюминия.
24
Соединения с три феннлметано выми красителями
В аналитической химии алюминия трифенилмстановые красители представляют ссбой i руппу наиболее важных по значению реагентов. Изучены комплексы алюминия с большим числом три-фенилметансвых красителей.
Условия образования комплексов будут подробно рассмотрены в разделе «Фотометрические методы». Здесь приводятся только некоторые данные о комплексах (табл.З).
Таблица 3
Свойства комплексов алюминия с трифенилметановыми красителями
Реагент AI : реагент '•max* нм 8
реагента комплекса
Алюминон 1 ; 1 535 12 400 3,8
Эриохромцианин R 1 : 3 430 520—535 67 500 6,0
Хромазурол S 1 : 2 г* 430 545 59 300 5,8
Ксиленоловый оран- 1 1 2* 435 555 21 100 3,3-3,5
жевый (ГН<3);
1 : 2
(pH >4,5)
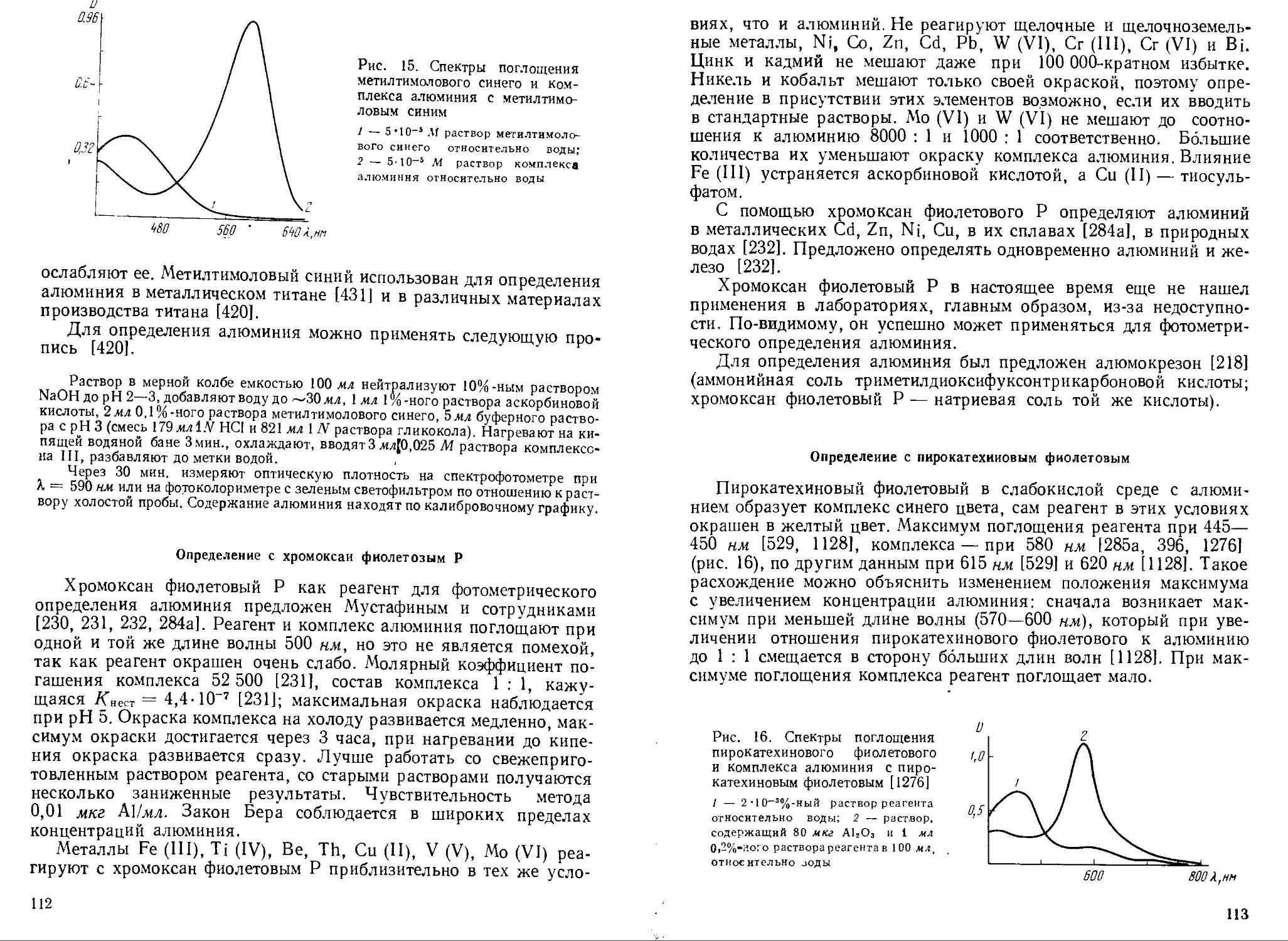
Метилтимоловый синий 1 : 1 435 585-590 19 000 3,5
Хромоксан фиолетовый Р 1 : 1 500 500 30 000 4,5
Сульфохром 1 1 3* 520 560 38 000 3,8-4,1
Кислотный хромчисто-голубой 1 : 3 540-550 20 000 6,°
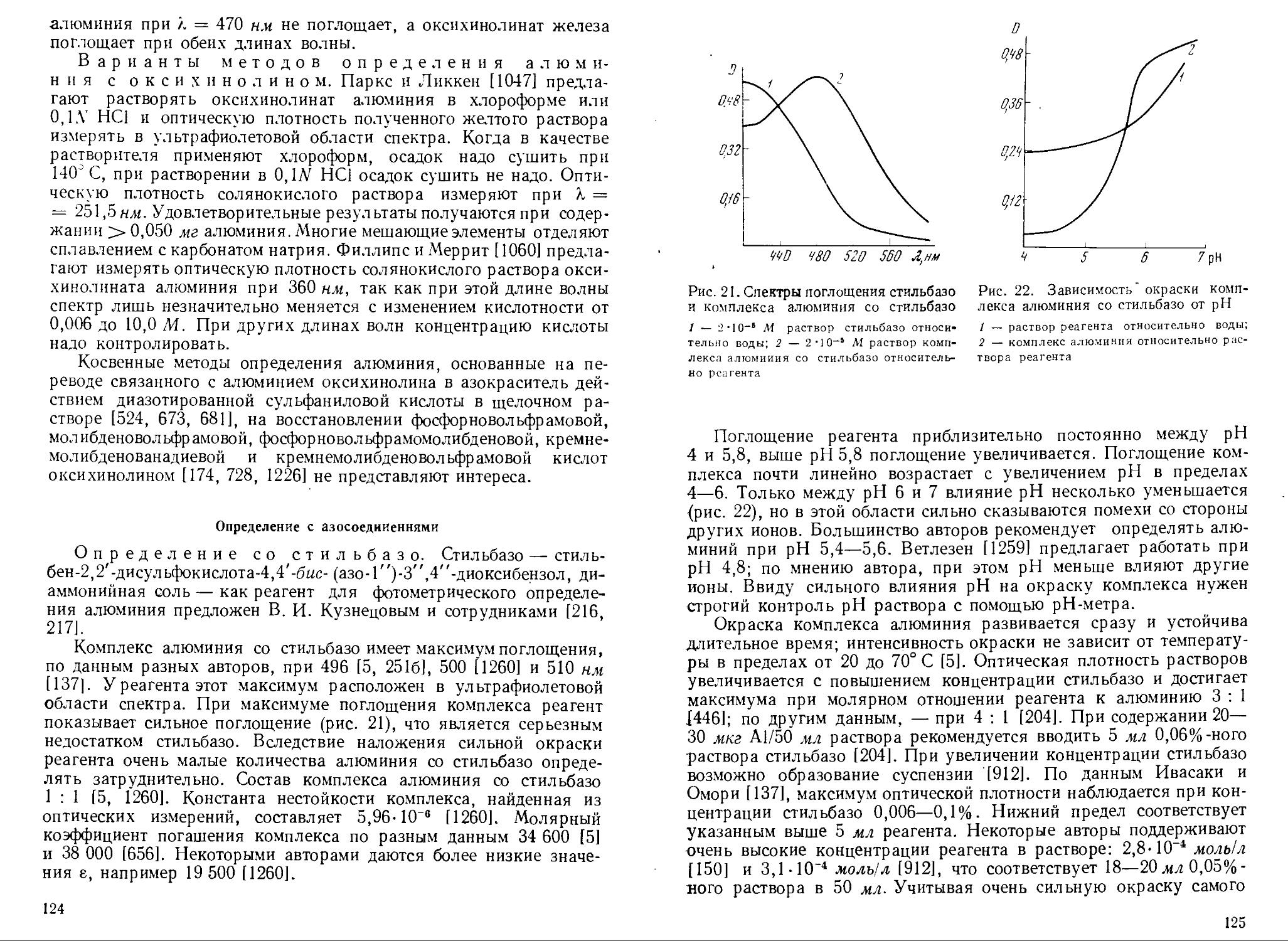
Пирокатехиновый фиолетовый 1 : 24* 445—450 580 25 000—29 000 5,8
Пирогаллолэвый красный 525 4,8-5,2
Ал омок резон 500 13 500 з,з
** Кнест = 2* Ю°бР= 2,0-10“; ’• Юнест = (3,10+0,93) 10-'; « Л’обр = 1019-13
(для монометаллического комплекса); Юобр = 1024>93 (общая, для биметаллического комплекса).
Соединения с о к си антрах инонами
Наиболее полно изучено комплексообразование алюминия с ализарином (1,2-диоксиантрахинон), а л и з ар и н о м S (1,2-диокси-антрахинон-3-сульфокислота, натриевая соль), хинализарином (1,2,5,8-тетраоксиантрахинон) и хинализаринсульфо-натом натрия.
25
Подробно см. раздел < Фотометрические методы».
С 2-феноксихинизарин-3,4-дисульфоновой кислотой алюминий при pH 6 дает комплекс состава 1 : 1, с лтах = 550н-560 нм [1039].
Комплексы с азосоединениями
Алюминий с о, о'-д иоксиазобензолом (о-азофенолом) образует комплекс состава 1 : 1, а в присутствии избытка реагента состава 1 : 2; для комплекса состава 1 : 1 рК = 3,1 [874].
Назаренко и др. [293] исследовали комплексы алюминия с рядом азосоединений. В табл. 4 приводятся некоторые данные об этих комплексах.
Таблица 4
Свойства комплексов алюминия с некоторыми азосоедииениями
Реагент Состав комплекса ^нест ^тах реагента, нм ?kmax комплекса, нм pH
2,2',4'-Триоксиазобензол 1:1 (pH 5) 1 : 2 (pH 6) 5,2-Ю"13 2,8.10“30 400-420 450-465 480 500-515 4,5 7
5-Хлоро-2-окси-беизолазо- -2'-иафтол 1 : 2 (pH 4—5); 1:2 (pH 7-8) 1,1.10"“ 510 540 526 544 4 7
2-Нафтолазо-2'-иафтол-4'-сульфокислота (эриохром сиие-чериый R) 1 : 2 (pH 4-5) 1 : 2 (pH 7-8) 2,4-Ю"41 520 530 530 590 5 7
Для комплексов с триоксиазобензолом авторы дают следующее строение:
Аналогичное строение предлагают авторы и для комплекса алюминия с 5-хлоро-2-окси-бензолазо-2'-нафголом.
26
С 4-(2-П иридилазо)резорцином алюминий дает комплекс состава 1 : 1 [1182], который для фотометрического определения алюминия не используется, так как мешаютмногие катионы.
Изучено комплексообразование алюминия со многими азосоединениями на основе хромотроповой кислоты [14а, 475, 947]. В табл. 5 приведены характеристики комплексов алюминия с двумя производными хромотроповой кислоты.
Таблица 5
Свойства комплексов алюминия с некоторыми производными хромотроповой кислоты (pH 5) [947]
Реагент Состав комплекса ^нест ?чтах’ нм е Чувствительность, мкг Al/cjtf (по Сендэлу)
2-(Пиридил-3-азо)-хромотропо-вая кислота * 1 : 3 10-13 580 5946 0,00453
2-(2-Карбоксипиридил-3-азо-)-хромотроповая кислота * 1 : 1 10~5 590 9747 0,00276
* Na-соль.
Из изученных Черкесовым и др. [14а, 475, 477] производных хромотроповой кислоты заслуживают внимания пикраминазохром (1,8-диоксинафталин - 3,6-дисульфокислота - 2,7-бис-[(азо-1)-2-окси-3,5-динитробензол]) и стильбазохром (стильбен-2,2'-дисульфокисло-та-4,4'-бис-[(азо-1)-1,8-диоксинафталин-3,6-дисульфокислота] ).Пикр-аминазохром с алюминием образует интенсивно окрашенный комплекс с максимумом поглощения при 650 нм (максимум поглощения реагента при 540 нм) (рис. 2). Состав комплекса 1 : 1, pH 5,5, рКн = = 5,5. Чувствительность реакции 0,02 мкг Ai/мл. Для стильбазо-хрома состав комплекса 1:1, рК = 5,6; оптимальное значение pH 5, молярный коэффициент погашения 5,8-104.
Рис.2. Спектры поглощения пикр-амииазохрома (1) и его комплекса с алюминием (2) [475]
27
Из азосоединений, предложенных для фотометрического определения алюминия, можно отметить также стильбазо и арсеназо I. Подробно см. в разделе «Фотометрические методы».
Комплексы с д и п и р и д и л о м и о-фенантролином
С 2, 2' - д и п и р и д и л о м (<х, а'-дипиридилом) алюминий дает комплекс состава Al (Dipy)3. Комплекс выделен в виде зеленых кристаллов, растворяющихся в тетрагидрофуране, бензоле и диоксане; в воде комплекс разрушается.
С 1,10-фенантролином (о-фенантролином) образуется комплекс состава [Al (Phen)3]3+. Комплекс выделен в виде белых кристаллов, растворяющихся в воде и щелочных растворах.
Глава II
ХИМИЧЕСКИЕ И ФИЗИКО-ХИМИЧЕСКИЕ МЕТОДЫ ОПРЕДЕЛЕНИЯ АЛЮМИНИЯ
качественные реакции иона алюминия
Для качественного обнаружения алюминия обычно используют образование окрашенных соединений, осаждение труднорастворимых соединений, флуоресцентные реакции, капельный метод. В табл. 6 приведены наиболее важные методы качественного обнаружения алюминия.
Алюминий открывают по цветным реакциям с ализарином [115, 762] и с рядом других реагентов и по флуоресцентным реакциям с морином [1048], с понтахром сине-черным R и др.
Алюминий можно осадить в виде гидроокиси, последнюю обработать раствором фторида; при этом образуется криолит и освобождаются ионы ОН', которые обнаруживают по окрашиванию фенолфталеина [132]. Эту реакцию можно выполнить и капельным методом с чувствительностью 0,4 мкг алюминия (при предельном разбавлении 1 : 7,3-104) [928]. При обменной реакции иона А13+ с CaF2 с образованием криолита освобождаются ионы Са2+, которые открывают с помощью б«с-(2-оксианил)глиоксаля; чувствительность метода 0,5 мкг А1 (предельное разбавление 1 : 105) [852].
Алюминий уменьшает скорость каталитической реакции окисления ализарина перборатом или перекисью водорода в присутствии кобальта. Это использовано для обнаружения алюминия с чувствительностью 0,1 мкг А1 (предельное разбавление 1 : 107) [918].
Алюминий можно обнаруживать по образованию характерных кристалловCsA1(SO4)2- 12Н2О [762], по образованию синего перла после прокаливания смеси осадка А1 (ОН)3 с раствором соли кобальта.
Алюминий определяют полуколичественно бесстружковым методом в магниевых [93, 405], медных [338], цинковых [339] и никелевых сплавах [93] с использованием алюминона и арсеназо I.
29
Таблица 6
Некоторые методы качественного обнаружения алюминия
Реагент Пробирочный метод (предельное разбавление) Капельный метод Окраска Примечание Литература
чувствительность, мкг предельное разбавление
Алюминон 1 : 5-105 Красная Большие количества Feудаляют экстрагированием в виде роданида Влияние Cr, Th, Ga и Ti устраняют обработкой разбавленной H2SOs их соединений с алюминоном Большие количества фосфатов, оксалатов и фторидов уменьшают чувствительность [1014]
Эрнохромцианин R 0,03 1 : 1,67-10° Фиолетовая Не мешают до 0,1 г-ион/л Fe(lH), связанного аскорбиновой кислотой, Си (11), связанной тиогликолевой кислотой, Со, Ni, Мп, Zn Ti, Zr, Th отделяют при помощи NaOH Мешают V (IV) и Be [745]
Алюмокрезон 0,007 1 : 5-10° Розовая Мешают Fe (III), Be, Ga, U (VI) [218]
Таблица 6 (окончание)
Реагент Пробирочный метод (предельное разбавление) Капельный метод Окраска Примечание Литература
чувствительность, мкг предельное разбавление
2,3-Окси-нафтойная кислота х* 1: «в 0,0002 1 : 107 Голубая флуоресценция на зеленом фоне Не мешают: Са, Sr, Ba, Mg, Zn, Cd, Hg, Pb, Sn, Ti, V, As, Sb, Bi, Cr, Mo, W, Mn, Co, Ni, Cu [474]
5,8-Дихлорхинизарин 1 : 2-10s (цветная реакция)2* 1 : 107 (флуоресцентная реакция)3* 0,002 1 : 10s Ярко-розовая с желто-зеленой флуоресценцией (в ультрафиолетовом свете соранжево-розовой флуоресценцией) . Мешают: Fe (HI), Си (II), Be, Th [219]
Салнцилаль-о-аминофенол 2 мкг/мл (при дневном свете) 0,05 мкг/мл (в ультрафиолетовом свете) 0,01 Желто-зеленая фл уоресценция При подкислении исчезает флуоресценция многих металлов, за исключением Al, Be и Zr. Не мешают: Ag, Pb, TI (I), Cd, Мп, La, Ce (III), Ca, Sr, Ba, Mg, Na, K, NH+, СГ, SO2-, BO^“ [816]
Соли Cu, Bi, Hg (II), Sb (II), Sn (II), Zn, Cr, Ti, Th, Zr, Ni, Co, Fe (III), Be, UO2+ и F“ уменьшают флуоресценцию
“ Чувствительность пробирочного метода 0,01 мкг.
•‘Чувствительность пробирочного метода 0,5 мкг.
•* Чувствнтельн ос гь пробирочного метода 0,1 мкг.
МЕТОДЫ ОПРЕДЕЛЕНИЯ АЛЮМИНИЯ
Гравиметр ячеек ие методы
Осаждение в виде оксихиноляната
8-Оксихинолин с алюминием образует труднорастворимое внутри-комплексное соединение состава Al(CeH8ON)3. Произведение растворимости его по одним данным—1- 10~1в [399)» по другим—1,03-10~29, [414, 415}. 8-Оксихинолин — не специфичный реагент для алюминия, как это видно из данных табл. 7. Однако при маскировании или отделении мешающих элементов алюминий определяют просто и сравнительно быстро в довольно сложных и различных по составу объектах.
Таблица 7
pH Для полного осаждения оксихинолннатов металлов
Металл pH Литература Металл pH Литература
А1 4.2-9,8 [819] Ru (III) Слабокислая среда [350]
Sb (III) >1,5 [360] Bi 5,0—8,3 [578]
In 2,5-3,0' [360] w 5,0-5,7 [722]
V (V) 2,7-6,1 [819] Hg(I) 5,2->8,2 [578]
Fe (III) 2,8-11,2 [819] Си (II) 5,3-14,6 [722]
Pd (II) 3,0-11,6 [578] Cd 5,4—13,3 [819]
Pu (VI) 3,5—9,0 [360] Ce >5,6 [360]
Ga 3,6-11 1578] U 5,7-9,8 [722]
Mo (VI) 3,6—7,3 [722] Мп (II) 5,9-9,5 [819]
Ti <3,7-8,7 [578] Y 5,9—9,3 I9"]
Cr (III) 3,7—12* 1360] Ag 6,1-11,6 [578]
Co 4,3-14,5 [722] Tl (III) 6,5-7,0 [982]
Ni 4,3-14,6 [722] La 6,5—>10,3 [578]
Th 4,4-8,8 [819] Sc 6,5—8,5 [1070]
Hf 4,5-11,3 [578] Pb 8,4-12,3 [819]
Zn 4,6-13,4 [722] Mg 9,4-12,7 [722]
Zr 4,7-12,5 [360] Ca 9,2—12,7 [819]
Hg (II) 4,8-7,4 [578]
• Осаждение неполное.
Из гравиметрических методов определения алюминия оксихинолиновый наиболее точен.
Оксихинолиновый метод, предложенный Бергом более 40 лет назад [559], критически рассмотрен в работах [627, 644].
32
Оптимальное значение pH осаждения. Оксихннолинат алюминия можно осаждать в слабокислой и щелочной среде. Чаще применяют осаждение из уксуснокислых растворов, хотя осаждение из аммиачных растворов можно сделать более избирательным, если вводить маскирующие вещества..
Гото [7701 для полного осаждения оксихинолината алюминия указывает pH 4,15—9,80. При осаждении из слабокислых растворов по данным работы [631] правильные результаты получаются при pH 4, 80—5,14, а при pH <4,48 результаты занижены. Согласно Миллеру и Чалмерсу [970], хорошие данные получаются при pH 4,4—6,7. Разноречивость литературных данных относительно оптимального значения pH можно объяснить различит прочих условий осаждения. По данным Классена и Бастингса [6441, после осаждения 5—30 лй алюминия при 50° С избытком (10 мл) 2,5%-ного раствора оксихинолина (общий объем раствора 150 ж) в фильтрате остаются следующие иоличества алюминия:
pH Количество А1, мы pH Количество А1, мкг
3,8 1000 4,8 30
4,0 75 4,9 28
4,3 50 5,0 26
4,5 41 5,3-7,0 22-20
4,7 31
ТЬким образом, наиболее полное осаждение алюминия достигается при pH 5,2 и выше.
Порядок прибавления реагентов и количество осадителя
Наиболее целесообразно к слабокислому анализируемому раствору прибавлять раствор оксихинолина и медленно добавлять CH3COONH4. При этом получаются более крупные кристаллы, чем при обратном порядке добавления реагентов [644,12081. Мнения о необходимом избытке осадителя разноречивы. Классен и Бастингс [644], а также Миллер и Чалмерс [970] считают, что при осаждении 5—30 мг алюминия должен быть избыток 8—15 мл 2,5%-ного раствора окенхинолина. По данным последних авторов [970], между величиной избытка осадителя и процентом ошибки существует приблизительная линейная зависимость; при избытке <[250 мг оксихинолина ошибки отрицательные, при большем избытке — положительные. Это позже было подтверждено статистически серией' опытов [964].
Как показал Штумпф [1208], скорость прибавления CH8COONH4 также имеет значение. При медленно* добавлении по каплям и при
33
пвскииинж перемешивании получается компактный, более чистый ©садок, и точность результатов повышается. При введении раствора ацетата струей образуется объемистый загрязненный осадок.
Относительно того, в какой момент и до какой температуры нагревать растворы, имеются различные рекомендации. Берг 15591 предлагал добавлять все реагенты к холодному раствору, содержа-« тему алюминий, затем после создания необходимого pH нагревать для коагуляции раствора. В более поздних работах рекомендовали нагревать раствор до 50—60° С1891] или до 100° С [1177]до добавления оксихинолина или до создания необходимого pH. Такой способ осаждения описан во многих работах (178 н др.]. Чалмерс и Басит (627] нашли, что нагревание растворов после прибавления всех реагентов (и после создания pH 5,2) дает точные результаты, независимо от избытка оксихинолина, в то время как при добавлении CH3COONH4 к нагретому до 90° С раствору наблюдаются отрицательные ошибки при малом и положительные — при большом избытке осадителя 1964, 970].
Положительные ошибки объясняются соосаждением оксихинолина. Причинами заниженных результатов, по мнению авторов, являются потерн осадителя при улетучивании, а также окклюзия многоядерных комплексов со смешанными лигандами, содержащих больше алюминия, чем в обычном оксихинолинате Al (CeHeON)3.
Масс-спектрометрическими исследованиями доказано образование комплексов состава Al2(H2O)2(C9HaON)l+ и А1(Н2О)(С8НвОЫ)|. Следовательно, для получения более точных результатов растворы лучше нагревать после прибавления всех реагентов.
Оксихинолин можно применять в виде растворов в уксусной илн разбавленной соляной кислоте. Этанольные растворы применять нецелесообразно, так как в присутствии этанола растворимость оксихинолината алюминия увеличивается [51, 887, 891]. По мнению Классена н Бастингса [644], лучше всего применять раствор оксихинолина в разбавленной НС1 (рН~3). Использование же раствора его в 1—2 М СНдСООН нежелательно, так как осадки при выпаривании прилипают к стенкам стаканов и не растворяются в анализируемом растворе. Кроме того, в этом случае труднее создать оптимальное значение pH 5,2—5,8. При 20—70° С и pH 5,7—7,0 в растворе остается неосажденным 20мкг алюминия. Авторы работы [644] предлагают вводить CH3COONH4 в растворы, нагретые до 70° С. Однако с учетом данных Чалмерса и Басита [627], лучше вводить ацетат аммрния в холодные растворы, а затем нагревать для коагуляции осадка. Хотя Кампф [8601 рекомендовал вводить небольшие количества тартратов для устранения частичного осаждения алюминия в виде основных ацетатов, делать это не следует, так как одновременно увеличивается растворимость оксихинолината алюминия.
Промывание осадка. Осадок оксихинолината алюминия рекомендовалось промывать горячей, теплой или холодной во-
данным Классена и Бастингса 1644], при этом в фильтрат незначительные количества алюминия:
Температура промывной воды, “С
100
80
60
25
яв А1/100 жл промывнов воды
2?
15
7
6
в
и
j-за частичного гидролиза оксихинолината алюминия часть окси» нолина переходит в фильтрат, поэтому промывание осадка горя-й или теплой водой ведет к потерям [1196, 1208]. При промывании лым объемом холодной воды потери незначительны.
Рекомендуют промывать осадки нейтральным 0,02%-ним рас-орст! оксихинолина [644]. При этом в 100 мл промывной воды со-ржптся ~ 5 мкг алюминия, независимо от температуры (в преде-х 20—100° С). Хорошие результаты получаются при промывании адка 2%-ным раствором CH8COONH4. Предлагаемое некоторыми торами промывание разбавленным раствором СН3СООН неприем-мо ввиду частичной растворимости в ней оксихинолината алюми-!я [51, 556]. Авторы работы [5271 промывали осадок водой, затем i мл эфира; это позволило сократить время высушивания при >0°С до 10 мин.
Высушивание осадка. Имеются различные реко-ндации относительно оптимальной температуры высушивания и зложения оксихинолината алюминия. На основании термограви-грического исследования найдено, что постоянный вес осадка стигается при 102° [692], 135° [583] н 160° С [867]. Превращение сихинолината в окись происходит, по данным разных авторов, и li.X)0° [692], 700° [583] и 600° С [867]. Можно рекомендовать вышивать осадок оксихинолината алюминия при 140—150° С и счи-эту температуру оптимальной.
Некоторые авторы прокаливают оксихинолинат до окиси. Одна-) при этом теряются преимущества оксихннолинового метода как ее точного из весовых методов определения алюминия. Фак-р пересчета у окиси значительно больше, чем у оксихинолината юминия; кроме того, появляется новый источник ошибки — гигроэпичность осадка. Поэтому при осаждении оксихинолином целе-бразно взвешивать алюминий именно в виде оксихинолината, или определять его титриметрическим броматометрическим методом. При определении алюминия гравиметрическим оксихинолиио* и методом из уксуснокислого раствора можно рекомендовать ующую методику [644].
Анализируемый раствор, содержащий от 2 до 20 мг алюминия, разбавляют до — 125 мл. К холодному раствору по каплям при помешивании добавляют 2М
NHtOH до появления слабого неисчезающего осадка А1(ОН)3. Затем вво-НС1 до исчезновения осадка и 5—10 капель избытка. Вводят оксихииолив
2*
35
из расчета 0,70 мл 2,5°о-ного раствора (25 г оксихинолина растворяют в 29 мл 6.W НС1 л разбавляют до 1 л) на каждый миллиграмм алюминия и избыток 10 .ил. Медленно при перемешивании добавляют 20 мл 20%-ного раствора CH3COONH4 с pH 6,5—7,0. Нагревают до кипения, оставляют на паровой бане 30 мин., затем охлаждают до 50° С. pH раствора после осаждения 5,2—5,8.
Раствор декантируют через взвешенный тигель Шотта «V» 4. Осадок промывают ~ 100 мл (не более) теплой (50—60° С) промывной жидкости *, прибавляя ее малыми порциями, затем дважды промывают холодной водой, порциями по 5 мл. Во время промывания следует избегать отсасывания осадка досуха во избежание образования компактной массы, которую трудно отмыть от солей.
Тигель с осадком высушивают до постоянного веса при 140—150° С. Фактор пересчета на алюминий 0,05873; на окись алюминия — 0,1110.
Ниже приведена методика осаждения оксихинолината алюминия из аммиачных растворов [644].
В анализируемый раствор объемом 100 мл вводят 5-кратный избыток винной кислоты (по отношению к алюминию), 1—2 г NH4C1 и 8—10 капель 0,04%-ного спиртового раствора бромкрезолпурпурового. Нейтрализуют аммиаком (1 : 1) до перехода окраски индикатора в пурпурную. Осаждают алюминий медленным прибавлением (по каплям) 2—3%-ного раствора оксихинолина в СН3СООН. Нагревают до кипения и слабо кипятят в течение 1 мин. После охлаждения до 60° С осадок отфильтровывают через тигель Шотта № 4 при умеренном отсасывании и промывают 100 ли холодной воды.
Далее продолжают как в варианте осаждения из уксуснокислого раствора.
При осаждении из аммиачных растворов винную кислоту вводят для удерживания алюминия в растворе. При определении малых количеств алюминия (< 5 мг/ЬЬмл раствора) осадки следует отфильтровывать только после охлаждения до комнатной температуры [51]. При слишком быстром прибавлении аммиака могут получиться завышенные результаты [51].
Влияние катионов и анионов. Осаждение оксихинолината алюминия из ацетатного буферного раствора не избирательно, не мешают в значительных количествах лишь Mg, Be, щелочные и щелочноземельные металлы. Было проведено много исследований с целью найти способы маскирования мешающих элементов. Особенно много работ по определению алюминия в растворах, содержащих железо. Попытки осаждать железо и алюминий фракцион-но при различных pH не дали удовлетворительных результатов [747].
Для разделения алюминия и железа Берг [51, 561] использует щавелевую, малоновую, винную и салициловую кислоты в качестве комплексообразующих агентов для алюминия в уксуснокислом растворе; железо осаждается в виде оксихинолината. По мнению Берга [51, 561], малые количества железа от больших количеств алюминия лучше отделять в присутствии винной кислоты, а большие количества железа от малых количеств алюминия — в присутствии
* Для приготовления промывной жидкости 8 мл 2,5%-ного раствора оксихи-нолииа разбавляют водой до 500 мл, добавляют 3 капли 0,1%-ного раствора бромкрезолпурпурового в 20%-ном этаноле и 2 М раствор NH4OH до пурпурной окраски (pH 6); объем доводят до 1 л.
36
малоновой кислоты пли смеси винной и малоновой кислот. Метод позволяет быстро определять алюминий и железо при совместном присутствии.
В присутствии малоновой или щавелевой кислоты титан количественно осаждается в виде оксихинолината и это позволяет отделять титан от алюминия [51, 128, 417]. Можно разделить Al, Fe и Ti, предварительно выделяя железо из сильноуксуснокислого раствора в присутствии винной кислоты и осаждая затем титан после прибавления малоновой (или щавелевой) кислоты. В фильтрате можно осадить оксихинолинат алюминия после прибавления аммиака. Методики анализа смесей А1 и Fe, а также Al, Реи Ti приводятся вмонэгра-фии Берга [51]. Определение алюминия в таких смесях рассмотрено также в работах [120, 121, 638, 995].
Пятницкий [348] исследовал растворимость оксихинолинатов алюминия и титана в растворах винной и щавелевой кислот и дал оптимальные условия осаждения титана в присутствии алюминия. Ввиду довольно значительной растворимости оксихинолината титана в растворах этих кислот нужно вводить избыток (10 мл) 2%-ного раствора оксихинолина. Титан лучше осаждать при pH 6. Введение винной кислоты, по мнению Пятницкого, излишне. Хорошие результаты получаются при применении одной щавелевой кислоты; более того, введение винной кислоты, по мнению автора, вредно, так как оксихинолинат титана в винной кислоте растворяется лучше, чем в щавелевой. Оптимальная концентрация последней 0,25 М.
Небольшие количества алюминия просто отделяются от значительных количеств магния осаждением из уксуснокислого раствора. При отделении больших количеств алюминия от малых количеств магния сначала выделяют оксихинолинатмагния из раствора едкого натра, содержащего тартраты, а затем в фильтрате определяют алюминий в виде оксихинолината [560].
Аналогично алюминий можно отделять от Zn, Cd и Си [51]. Описано отделение Си от А1 из азотнокислых [472], уксуснокислых и аммиачных [612] растворов, содержащих тартраты. Алюминий при осаждении в виде оксихинолината из уксуснокислого раствора отделяется от бериллия [1013], а в присутствии высоких концентраций карбоната аммония — и от урана, который образует с последним прочный комплекс [942]. Для полного отделения от урана необходимо переосаждение.
Хлориды, сульфаты, нитраты и перхлораты не мешают определению алюминия оксихинолиновым методом. Фториды мешают даже в малых количествах [77, 644]. Добавление 1—5 г Н3ВО3 уменьшает ошибку, но этим путем можно маскировать лишь до 2 .иаР'-иона [644]. Добавление бериллия (Be : А1>* 1) устраняет мешающее влияние фторидов вследствие образования его фторидного комплекса [398]. Тартраты не мешают, но в их присутствии образуется болеемелкий осадок. В присутствии цитратов и оксалатов осаждение полное только при pH > 7—8.
37
В присутствии фосфат-ионов оксихинолинат алюминия следует осаждать из аммиачного раствора, содержащего тартраты [51, 851, 942, 1100], и заканчивать определение объемным методом. Вильсон [1275] показал, что это отделение можно проводить из ацетатного буферного раствора, если сначала добавить оксихинолин к раствору, 1 N по НС1, и устанавливать pH ~ 5 при помощи аммиака или CH3COONH4. В этих условиях можно определять с достаточно высокой точностью 25 мг А12О3 в присутствии 50 мг Р2О5. Если pH доводить до ~ 5 раньше добавления оксихинолина, то осаждается фосфат алюминия, и результаты оказываются заниженными.
Кремневая кислота не мешает титриметрическому броматометрическому определению алюминия при осаждении его оксихинолином из уксуснокислых растворов; гравиметрический метод в этом случае неприменим.
В слабокислых растворах трудно маскировать мешающие катионы, напротив, в аммиачных растворах осуществить это легко. Чаще всего для этой цели используют цианиды. Принципы метода маскирования цианидами впервые были даны в работе Ланга и Райфера [916] и в особенности в работе Хечко [793]. Хечко определял алюминий в присутствии Fe, Со, Ni, Мо, Си и Сг, используя цианид. В аммиачном растворе, содержащем перекись водорода, Лендель и Ноулз [942] определяли алюминий вприсутствии Ti.Ta, Nb,Vи Мо. Касснер и Озир [865] объединили эти два способа и разработали метод, позволяющий определять алюминий в присутствии многих элементов.
При использовании комплексона III и цианида алюминий определяют в цинковых сплавах без предварительных разделений [157]. Гаснер [747] определял алюминий в присутствии Fe, Са и Н3РО4; железо после восстановления аскорбиновой кислотой переводил в ферроцианидный комплекс, а кальций — в цитратный комплекс.
Методы определения алюминия при маскировании цианидом разработаны для сталей [585, 793, 1061, 1196], ферромолибдена [857], для медных [698, 702, 1250] и цинковых [157, 1109] сплавов.
Для концентрирования малых количеств алюминия его оксихинолинат осаждают на коллекторах, например на оксихинолинате кальция. Метод был использован для выделения 0,001—0,01% алюминия из каменной соли [955].
Осаждение оксихинолината алюминия из гомогенных растворов
При гомогенном осаждении осадитель образуется равномерно во всем растворе или же постепенно достигается необходимое для осаждения значение pH. Осаждение из гомогенных растворов имеет ряд преимуществ перед обычным осаждением: осадки получаются крупнокристаллические, благодаря чему уменьшается соосаждение посторонних веществ. Такие осадки фильтруются быстрее и легче отмываются. Однако эти методы более продолжительны и требуют рас
38
хода значительных количеств иногда довольно дефицитных реагентов Поэтому они для обычных анализов неудобны, но незаменимы при выполнении особо точных анализов, например контрольных анализов или анализов стандартных образцов.
Предложенные способы гомогенного осаждения оксихинолината алюминия основаны на трех принципах: медленное образование осадителя в растворе; постепенное создание необходимого для осаждения значения pH; гомогенное осаждение из смеси растворителей.
Медленное образование осадителя в растворе. Для осаждения алюминия применяют не оксихинолин, а его производные, при] гидролизе которых образуется оксихинолин. Из иих лучше всего применять 8-ацетоксихинолин [827, 956], гидролиз которого при pH 5 и 60° С приводит к количественному осаждению оксихинолината алюминия. Для получения хороших результатов необходимо нагревание на водяной бане при 60° С 5 час.
Постепенное установление pH, необходимого для осаждения оксихинолината. При осаждении из гомогенных растворов для создания нужного pH обычно вводят ацетамид, уротропин или мочевину, при гидролизе которых образуется ацетат аммония или аммиак. Уротропин и ацетамид для гомогенного осаждения алюминия не годятся, первый из-за слишком быстрого, второй — из-за очень медленного гидролиза. Для этой цели лучше всего применять мочевину. Метод гомогенного осаждения с использованием мочевины описан в работе [1208]. Гидролиз мочевины только при температуре > 90° С протекает с достаточной скоростью. При 95° С осаждение оксихинолината алюминия заканчивается за 2—3 часа, в конце осаждения pH 4,4.
Раствор, содержащий не более 25—50 мг алюминия и 1,25—2 мл НС1 (уд. вес 1,19), разбавляют до 150—200 мл. На каждые 25 мг алюминия добавляют 5—6 мл 10% -ного раствора оксихинолина в 20?о-ной СН3СООН и 5 г мочевины. Нагревают почти до кипения, накрывают стакан часовым стеклом и выдерживают 2—3 часа при 95° С. Осаждение можно считать законченным, если отстоявшийся над осадком раствор не зеленовато-желтого, а оранжево-желтого цвета. После охлаждения осадок отфильтровывают через тигель Шотта № 3, а при малых количествах алюминия (—'10 ла)— через тигель № 4. Осадок промывают как обычно, высушивают при 140° С и взвешивают [1208].
При определении А12О3 в глиноземе (~ 65%) относительная ошибка ~ 0,10%, тогда как при обычном осаждении — 0,26% [1208].
Гомогенное осаждение из смеси растворителей. Эти методы основаны на том, что присутствие относительно больших количеств органических растворителей замедляет образование некоторых осадков. После улетучивания органического растворителя при нагревании создаются оптимальные условия для выпадения осадка. Этот прием имеет некоторые преимущества по сравнению с описанными выше. В этом случае в раствор сразу вводится необходимое количество осадителя и создается нужная среда.
39
Улетучивание органического растворителя вызывает постепенное образование осадка, причем pH раствора остается строго постоянным, что важно для осаждения алюминия в присутствии других ионов.
Ховик и Джонс [825, 826] предложили осаждать оксихинолинат алюминия из водно-ацетонового раствора.
К 2—Юлы раствора добавляют 50мл воды, 60мл ацетона, 4лы 5%-ного раствора оксихинолина, 40.мл 2АТ раствора СН3СОО\Н4. Раствор нагревают на водяной бане с температурой 70—75° С в течение 3 час. После охлаждения осадок отфильтровывают через тигель Шотта, промывают три раза водой и высушивают при 135-140° С.
По данным авторов, при определении 2—10 мг алюминия относительная ошибка метода составляет 0,2—0,7 %.
Значительные количества Mg и Са не мешают определению алюминия. В присутствии 420 мг Mg и 800 мг Са в осадок оксихинолината переходит < 0,1 мг Mg и Са. При pH 4,7—4,9 не мешает до 10мг кадмия; при pH <4,7 и >4,9 последний мешает сильно. С помощью радиоактивных изотопов показано, что соосаждаются значительные количества 1п,~ 0,5% Y,Ce и Sc [945]. Железо осаждается в широких пределах концентраций ацетатов, а цинк осаждается в незначительной степени [542].
Осаждение в виде гидроокиси
Осаждение алюминия в виде гидроокиси для отделения от других элементов или последующего гравиметрического определения— самый старый и распространенный метод. Значение его как гравиметрического метода сейчас невелико, так как имеются более точные методы, но он часто применяется для предварительного отделения алюминия от мешающих элементов. Гидроокись алюминия начинает осаждаться при pH несколько больше 4 [61, 591, 755], а по данным работы [9], даже при pH 3,5—4,0. Гиллебрандом и др. [89] приведены pH осаждения гидроокисей большого числа металлов. В дополнение к ним можно привести pH осаждения гидроокисей Ga, In и Sc, взятые из работы Остроумова [318], составляющие соответственно 3,4, 3,7 и 4,7. Гидроокись алюминия выделяют аммиаком, слабыми органическими основаниями и соединениями, выделяющими при нагревании аммиак, либо при гидролитическом осаждении с помощью солей неорганических кислот.
Осаждение аммиаком
Гидроокись алюминия чаще всего осаждают аммиаком. Это — самый распространенный, но не самый точный метод осаждения А1(ОН)3.
Важнейшими условиями для получения правильных результатов являются осаждение в присутствии достаточно больших коли
40
честв аммонийных солей, введение очень незначительного избытка аммиака и осаждение при температуре кипения. Добавление аммонийных солей необходимо для удержания в растворе магния, марганца и других металлов. Кроме того, аммонийные соли препятствуют чрезмерному повышению pH раствора и способствуют коагуляции осадка. В некоторых старых руководствах [1231] для устранения избытка аммиака рекомендовалось полностью удалять его кипячением после осаждения. Однако при таком кипячении незначительные количества А1(ОН)3 остаются в растворе [841, 842]. Есть также указания [1123], что обоими способами осаждения получаются хорошо согласующиеся результаты.
По Данным Яндера и Руперти [841], растворимость А1(ОН)3, сразу отфильтрованной после кипячения, составляет 1,2 мг А12О3/ л воды. При стоянии растворимость уменьшается; так, растворимость гидроокиси, отфильтрованной при 12—15° С, через 1—3 дня составляет 0,6 мг А12О3/л [841]. Близкие данные получили Реми и Кульман [1108]. Блюм [570] после промывания 0,1 мг А12О3 75 мл горячей воды в промывной воде нашел 0,5—2,9 мг А12О3.
Растворимость А1 (ОН)3 зависит от pH. Минимальная растворимость наблюдается при pH 6,0—7,8. Блюм [570] рекомендовал регулировать добавление аммиака по изменению окраски метилового красного (pH 4,4—6,2). Фрерс [732] предпочитает осаждать с индикатором феноловым красным (pH 7,5); предложено применять также розоловую кислоту (pH 6,2—8,0).
Осадок А1 (ОН)3 нельзя промывать водой, так как при этом он легко переходит в коллоидную форму и, кроме того, частично растворяется. Муравлев и Красновски [998] предложили промывать осадок А1(ОН)3 горячим 2%-ным раствором NH4NO3, к которому добавляют аммиак до изменения окраски метилового красного; если аммиак не вводить, то часть А1(ОН)3 переходит в раствор.
Избыток аммиака по возможности должен быть небольшим, так как в растворах с pH )> 9 гидроокись алюминия заметно растворима [842]. Ничтожная часть ее растворяется уже при pH 7—8 [662, 732].
Свежеосажденная гидроокись обладает следующей растворимостью в растворах аммиака различной концентрации при 20° С [761].
nh4oh,m NH4CI, вес. % г А1 (ОН)з/ЮО мл насыщенного раствора
0,50 5,0 0,0148
0,50 10,0 0,0010
1,00 5,0 0,0193
1,00 10,0 0,0085
1,00 30,0 0,0038
Для уменьшения растворимости А1(ОН)3 осаждение предлагается проводить по возможности из малого объема. По Тананаеву [404], при осаждении из концентрированных растворов аморфные осадки
41
имеют меньший объем и меньше сорбируют посторонние ионы. Осаждение А1(ОН)3 следует проводить из растворов хлоридов и нитратов. При осаждении из растворов сульфатов получается осадок, сильно загрязненный сульфат-ионом, вследствие склонности сульфатов к гидролизу с образованием основных сульфатов. Для полного удаления сульфат-ионов требуется более продолжительное прокаливание при более высокой температуре. Из растворов с высоким содержанием сульфатов целесообразно проводить переосаждение [732].
О формах А1(ОН)3, получающихся при осаждении аммиаком, см. подробно гл. I.
Гидроокись алюминия следует прокаливать при температурах не ниже 1200° С. По данным Милнера и Гордона [978], Вилларда и Танга [1273], гидроокись, основной сульфат и основной сукцинат алюминия необходимо прокаливать при 1200° С. Карч [862] считает, что А1(ОН)3 надо прокаливать в течение часа при 1300' С, но при совместном определении А1аО3 и Fe2O3 температуру прокаливания предлагает понижать до 1200° С во избежание потерь за счет улетучивания Fe2O3.
Неверны выводы некоторых авторов, например Дюваля [695], что для прокаливания гидроокиси А1 достаточна температур а 1030° С. Эрдей и Паулик [701] показали, что рекомендации Дюваля могут быть верными только при некоторых определенных условиях осаждения и что необходимая для прокаливания температура сильно зависит от условий осаждения. К подобному выводу пришли и авторы работ [832, 923]. Имелик и др. [832] показали, что постоянный вес можно получить при сравнительно низких температурах и без полного удаления воды; следовательно, получение постоянного веса в этих условиях не является критерием полного прокаливания.
Общеизвестно, что А12О3 гигроскопична. После прокаливания при 1400° С окись алюминия становится полностью негигроскопичной. Виль [1266] рекомендует прокаливать осадки 3 часа при 1400°С или час при 1500° С. Милнер и Гордон [978] также показали, что даже после прокаливания при 1100—1200° С осадки окиси алюминия гигроскопичны. По данным Мира и др. [968], после прокаливания при 1300°С А12О3 имела практически постоянный вес. По Фрику и Мей-рингу [735], негигроскопичный осадок получается при 1200—1300° С.
На основании всех этих данных можно сделать вывод, что оптимальной температурой для прокаливания АI (ОН)является 1200° С, но при этом взвешивать осадки надо быстро. Рекомендации относительно прокаливания при 1400 или 1500° С мало приемлемы, так как в лабораторных условиях нелегко получить такие высокие температуры.
Ниже приведена методика весового определения алюминия после осаждения аммиаком [89].
Раствор разбавляют до 200 .ч.г и вводят 5 aNH4Cl. Если растворы сильно кислые, то последний можно не вводить, так как необходимые количества его образуются при нейтрализации раствора аммиаком. Вводят несколько капель 0,2% -нога 42
спиртового раствора метилового красного и нагревают до кипения. Осторожно по каплям добавляют аммиак до изменения окраски раствора в желтую. Раствор кипятят 1—2 мин., и после осаждения осадка (в течение нескольких минут) фильтруют через фильтр с белой лентой. Стакан вытирают кусочком беззольного фильтра, который кладут на фильтр с осадком.
Осадок тщательно промывают горячим 2°о-ным раствором NH4\O3. нейтрализованным аммиаком по метиловому красному. Если необходимо, то переоса-ждают после растворения осадка в горячей НС1 (1 : 3). Осадок прокаливают при 1200° С в течение часа. Фактор пересчета на алюминий 0,5291.
Влияние других ионов. В условиях осаждения алюминия аммиаком осаждаются многие металлы. Алюминий этим методом отделяется лишь от щелочных и щелочноземельных металлов, Mg и небольших количеств Мп и Ni. Но даже в этом случае в зависимости от количеств посторонних ионов часто требуется пере-юсаждение. Алюминий полностью можно отделить от Мп и Ni, если растворы с pH 3 нейтрализовать медленно, чтобы в конце осаждения pH раствора не превышал 6,6—6,7. В этих условиях отделение от Си, Zn и Со не удается [570, 941]. Согласно данным Исибаси и др. 1835], при осаждении 50,4 мг алюминия аммиаком при pH 7,1—10,5 в присутствии 20-кратных количеств меди осадок А1(ОН)3 увлекает с собой до 5% последней. После переосаждения осадок содержит до -8% меди, соосажденной при первом осаждении. Количество соосаж-денной меди зависит от pH раствора, достигая максимума при pH 7,5—8,5 и быстро убывая при меньших и больших pH [411]. Близкие данные приводит Коваленко [169].
Изучая отделение цинка от алюминия при осаждении аммиаком в присутствии Zn65, Морачевский и Башун [270] нашли, что лучшие результаты достигаются при pH 5,5—5,8. Однако и в этом случае в осадок переходит 7—8% цинка (взято 27 мг А1 и 13,53 мг Zn). С повышением pH до 7 соосаждение цинка возрастает, а с увеличением pH до 9,4 — падает. После переосаждения при pH 5,5—5,8 осадок не содержит цинка. При pH 5,9—6,0 и 9,1—9,4 в осадке содержится до 1—2% и при| pH 6,6 — до 18% цинка (от введенного количества). При больших количествах алюминия (80 мг) и цинка (40мг) даже в оптимальных условиях (pH 5,5—5,8) и после переосаждения осадок содержит до 1—1,25% последнего.
В аналогичных условиях найдено, что после однократного осаждения в осадок переходит 10—20% Zn, а после переосаждения — незначительное количество его [821].
Поданным Блоха [569], при осаждении А1(ОН)3 из растворов, содержащих большие количества цинка, даже после четырех осаждений осадок содержит слишком много цинка, чтобы можно было определить алюминий весовым методом. После двукратного осаждения можно получить хорошие результаты, если анализируемый раствор медленно вводить в холодный раствор аммиака, содержащий NH4NO3 1569]. В осадке гидроокиси алюминия при этом содержится не больше 0,1% Zn. Этот метод Блох применил для определения алюминия
43
в цинковых сплавах. Такой способ осаждения обеспечивает лучшее отделение алюминия также от Ni, Со и Мп; в присутствии фосфатов при этом надо поддерживать pH 4,8—6,3 [905аГ
Морачевский и Башун [270] методом меченых атомов изучили соосаждение кобальта с гидроокисью алюминия. Лучшее отделение достигается при pH 5,5—6,0 в присутствии 5?о ХН4С1 и при пере-осаждении. Плотников [334] при использовании Cd115 нашел, что максимальное соосаждение кадмия с гидроокисью алюминия имеет место при pH 7—8.
Проведено большое число исследований с целью найти способы маскирования мешающих элементов. Мэйр и Гебауэр [961] осаждают алюминий в присутствии значительных количеств железа, восстанавливая его сернистой кислотой и удерживая в растворе с помощью тиогликолевой кислоты. Железо лучше всего маскируется в солянокислых растворах, нитраты мешают. Хэммель и Сендел [828], проверившие метод Мэйра и Гебауэра, нашли его чрезвычайно эффективным (до 40 жг Д12О3 с удовлетворительной точностью отделяются от равных количеств железа при одном осаждении; в присутствии больших количеств железа необходимо переосаждение). При применении метода Мэйра и Гебауэра особенно важно фильтровать и промывать гидроокись алюминия как можно быстрее; надо избегать длительного нагревания, чтобы не разрушить тиогликолевую кислоту (может осаждаться FeS). Промывная вода должна содержать тиогликолевую кислоту и NH4HSO3 (1 г NH4C1, 1 мл тиогликолевой кислоты и 2 мл 45%-ного раствора NH4HSO3 в 100 мл воды, раствор нейтрализуют аммиаком по метиловому красному).
В другом методе вместо сульфита используют солянокислый гидроксиламин [760]. Предложено также маскировать Fe (II) а, а'-дипиридилом после восстановления Fe (III) сернистой кислотой [710]. Осаждение А1(ОН)3 после восстановления Fe (III) гидроксил амином дает несколько худшие результаты [736]. При определении в медных сплавах алюминий осаждают аммиаком из растворов, содержащих аскорбиновую кислоту и комплексон III, которые удерживают в растворе Fe; Sn и Pb [261]. Другие авторы маскируют железо и никель с помощью цианидов [637, 1246].
Иногда алюминий и железо осаждают совместно и содержание алюминия находят по разности, после определения железа в аликвотной части раствора. Этот метод дает удовлетворительные результаты лишь при анализе материалов относительно простого известного состава. При анализе материалов сложного состава вводят поправки также на титан, фосфор и некоторые другие элементы, что сильно снижает точность метода.
При осаждении А1(ОН)3 из растворов, содержащих фосфаты в значительных концентрациях, могут соосаждаться фосфаты щелочноземельных металлов. В этом случае алюминий лучше осаждать при более низких pH бензоатом [1275]. Если для осаждения применяют аммиак, содержащий карбонат аммония, могут осаждаться карбо
44
наты щелочноземельных металлов. Если в анализируемых растворах присутствуют ванадий и мышьяк, то они могут осадиться вместе с А1 (ОН)з в виде труднорастворимых ванадатов и арсенатов. Ванадил-ион соосаждается с А1(ОН)3 уже при pH 3,4—4,1 [31]. Соосаждениемалых количеств La, У, Се н Ей начинается при pH 5—6 и увеличивается с повышением pH [273—275].
В присутствии силикатов, фосфатов, арсенатов, молибдатов и вольфраматов образуются основные соли соответствующих кислот. Фтор-ион действует на А1 (ОН)3 растворяюще. При одновременном введении аммиака и фторида образуется не А1(ОН)3, а основной фторид алюминия [622, 812]. В присутствии боратов осадок содержит труднорастворимые бораты алюминия и щелочноземельных металлов [643, 741]. Перед осаждением алюминия бораты удаляются кипячением раствора с соляной кислотой и метанолом [ 1168]. По данным Красновски [902], до 30% боратов все же не мешают определению алюминия, при его содержании до 10%. При осаждении из растворов, содержащих хром, рядом авторов рекомендовалось окислять хром до хромата хлорной, бромной водой [1232]или же персульфатом. Однако хромат-ион также соосаждается в большей или меньшей степени, в зависимости от условий осаждения. Чем выше pH и чем больше концентрация аммонийных солей, тем меньше соосаждение хромат-иона [309, 368]. Соосажденный хромат-ион вымывается с трудом. Максимальное соосаждение селенат-иона с гидроокисью алюминия имеет место при pH 6—7 и уменьшается с повышением pH [335].
Многие органические вещества, содержащие гидроксильные группы (лимонная и винная кислоты, крахмал, сахароза, глюкоза, " лактоза, изопропиловый, бутиловый, изовалериановый спирты), замедляют образование осадка А1(ОН)3 [666, 839], в присутствии органических оксикислот получаются заниженные результаты [501, 666].
Осаждение аммиаком можно применить и для выделения малых количеств алюминия, если использовать коллекторы (гидроокиси железа [758], циркония [954] или лантана [953]).
Осаждение гидроокиси алюминия слабыми органическими основаниями и соединениями, выделяющими при гидролизе аммиак
Из органических оснований для осаждения алюминия интерес представляют лишь те, которые слабее аммиака. Более сильные, чем аммиак, основания, предложенные для осаждения гидроокиси алюминия (этиламин, метиламин, пиперазин), применять нецелесообразно. Хотя гидразин как основание несколько слабее аммиака, выделенный им осадок гидроокиси алюминия склонен сильно сорбировать даже щелочные металлы, а также цинк [1148].
45
Из слабых органических оснований для осаждения алюминия могут быть использованы пиридин [270, 318—320], а-пиколин [318], фенилгидразин [804, 919, 976], акридин [1142], и-хлоранилин [1142], о-фенетидин [628]. Для осаждения гидроокиси алюминия можно также использовать вещества, выделяющие при гидролизе аммиак — мочевину, уротропин, амидохлориды ртути.
Осаждение пиридином. Пиридин введен в аналитическую химию для отделения алюминия и других трехвалентных и четырехвалентных элементов от двухвалентных Остроумовым [318— 320]. Пиридин C5H5N — слабое органическое основание с А'дис = = 1,6-10“9. Пиридин как осадитель для алюминия лучше, чем аммиак. При осаждении пиридином pH раствора возрастает медленно. Креме того, многие двухвалентные металлы (Мп, Ni, Со, Zn, Си и Cd) с пиридином образуют хорошо растворимые комплексные соединения и удерживаются в растворе, не загрязняя осадок А1(ОН)3.
Осаждение алюминия пиридином происходит по уравнению
A1CL + 3 CsHsN + 3 HtO = 3 CsHsN • НС1 % Al (OH)3.
Образующаяся при этом соль пиридина с пиридином образует буферную смесь. Введение избытка пиридина подавляет буферное действие соли пиридина и создает оптимальные условия для осаждения А1(ОН)3.
Кислый раствор объемом 100 мл нейтрализуют аммиаком до слабой мути, которую растворяют в 1—2 каплях НС1. Вводят 10 г NH4C1 и нагревают до кипения. В горячий раствор прибавляют по каплям, осторожно помешивая, 20%-ный раствор пиридина до изменения окраски метилового краснотой избыток 10—15мл. Нагревают до кипения и выдерживают на водяной бане для коагуляции и отстаивания осадка в течение 30 мин. Осадок отфильтровывают и промывают горячим 3%-ным раствором NH4C1, содержащим несколько капель пиридина. Далее продолжают, как при осаждении аммиаком.
При осаждении по предлагаемой методике pH раствора составляет ~ 6,5. В условиях выделения А1 (ОН)3 пиридином осаждаются также Fe, Cr, J, In, Ga, Ti, Zr, Th, Sc; не осаждаются Мп, Ni, Co, Zn, Cu, Cd, Mg, щелочные и щелочноземельные металлы. Бериллий осаждается неполностью. При осаждении пиридином образуется хорошо отстаивающийся и легко фильтрующийся осадок А1(ОН)3, не сорбирующий посторонних ионов. Присутствие аммонийных солей и нагревание способствуют получению более плотных осадков. Введение значительных количеств аммонийных солей резко снижает сорбцию осадком двухвалентных металлов.
Из растворов хлоридов и нитратов пиридин выделяет гидроокись алюминия без примеси основных солей. В присутствии сульфатов образуется осадок, загрязненный основными солями. В этом случае осаждение неполное, осадок плохо отстаивается, легко проходит через фильтр. Влияние до 2 г K2SO4, Na2SO4 или (NH4)2SO4 можно устранить добавлением 10—20 г NH4C1, но все же лучше избегать
46
введения сульфатов. Обычно однократное осаждение позволяет отделить алюминий от двухвалентных металлов. Только в присутствии очень высоких содержаний Мп, Со и Ni, например при анализе пиролюзита, некоторых руд кобальта, солей кобальта и никеля, приходится прибегать к переосаждению.
При отделении алюминия от цинка следует учитывать, что на холоду образуется осадок пиридино-хлоридного комплекса цинка, который растворяется при нагревании. Поэтому в присутствии цинка растворы надо фильтровать горячие.
Морачевский и Башун [270], используя метод меченых атомов, изучили полноту отделения алюминия от цинка и кобальта при осаждении пиридином. Отделение от кобальта удается при pH О- 6 и однократном осаждении даже в присутствии не очень высоких концентраций NH4C1 (2 г/100 мл). Но цинк при концентрации NH4C1 меньше 8 г/100 мл значительно осаждается с А1(ОН)3. При равных количествах алюминия и цинка (по ~ 28 мг) даже в присутствии 10 г NH4C1 после однократного осаждения отделяется лишь около 95% цинка. Перессаждение позволяет полностью отделить алюминий от цинка.
Несмотря на свои преимущества перед аммиаком [320], пиридин в аналитической практике не нашел широкого применения из-за того, что он ядовит и обладает неприятным запахом.
Осаждение а - п и кол и н ом. сс-Пиколин — метильное производное пиридина, метилпиридин CH3C5H4N с КДИс = 1,7-• 1О'\ несколько более сильное основание, чем пиридин. Количественно осаждает металлы, которые осаждаются пиридином, и, кроме того, бериллий [318]. При осаждении устанавливается pH 7,0. С помощью а-пикол ин а можно отделить алюминий от Мп, Zn,Con Ni.
Осаждение уротропином. Применение уротропина (гексаметилентетрамина) основано на том, что в кипящих растворах он распадается:
(CH2)eN4 + 6 НгО # 6 ЯСНО + 4 NH3.
Выделяющийся аммиак повышает pH раствора и при этом создаются условия для количественного осаждения гидроокиси алюминия.
Согласно Рэю [1103], осаждение А1 (ОН)3 из растворов хлоридов и нитратов не количественное; полное осаждение достигается из раствора сульфатов ввиду сильного гидролиза сульфата алюминия. Вусловиях осаждения алюминия осаждаются также Fe (III), Cr и Ti. В присутствии аммонийных солейМп,2п,Со и Ni не осаждаются. При однократном осаждении от алюминия отделяются Мп, Mg и Са. Отделение от кальция хуже, чем в аммиачном методе [886]. Для отделения от цинка и кобальта требуется переосаждение. Шушич [5021 указывает, что если при осаждении вводить HgCl2, то можно отделить алюминий от кобальта однократным осаждением (HgC1, пре
47
пятствует сорбции кобальта осадком гидроокиси алюминия). Полное отделение от никеля не достигается даже после переосаждения.
Рекомендации некоторых авторов об отделении алюминия от бериллия осаждением на холоду неприемлемы, так как на холоду алюминий также осаждается плохо.
Осаждение мочевиной. Мочевина в кипящем слабокислом растворе распадается на NH3 и СО2. При этом pH раствора постепенно увеличивается и создается оптимальная среда для осаждения А1(ОН)3. Преимущество мочевины как осадителя по сравнению с аммиаком — получение плотного, хорошо фильтрующегося и легко промывающегося осадка. Вследствие осаждения из гомогенного раствора сорбция посторонних ионов меньше, чем при осаждении аммиаком [1270, 1273]. Недостаток метода в большей продолжительности осаждения, чем в аммиачном методе (1,5—2 часа). Осаждение лучше вести из растворов сульфатов или в присутствии солей органических кислот (сукцинатов, бензоатов, фталатов, формиатов и др.). Из растворов нитратов и хлоридов осаждение менее удовлетворительное. По Вилларду и Тангу [1273], алюминий можно осадить в виде основного сульфата из раствора, содержащего мочевину, NH4C1 и (NH4)2SO4i при слабом кипячении в течение 1—2 час. Оптимальное значение pH 6,5—7,5 устанавливается при введении 4 г мочевины, 10—20 г NH4C1 и 1 г (NH4)2SO4 в объеме раствора 500 мл. Однократным осаждением достигается удовлетворительное отделение от Са, Mg, Мп и Cd. При отделении от Ni, Со и Zn необходимо переосаждение.
Осаждение прочими реагентами. При осаждении алюминия фенилгидразином [804] железо предварительно восстанавливают сульфитом аммония. Предложено также осаждать алюминий смесью тиосульфата и фенилгидразина в присутствии Na2SO3 для восстановления железа [256]. Железо не мешает даже в больших количествах, вместе с алюминием осаждаются только титан и фосфор. Серьезным недостатком фенилгидразина является его ядовитость, поэтому он не может быть рекомендован для осаждения алюминия.
Предложено осаждать алюминий в виде гидроокиси с акридином [1142]. Метод позволяет отделять алюминий от бериллия (А12О3 ; : ВеО = 1 : 5 до 10 : 1). Алюминий можно отделить от бериллия при соотношениях А12О3: ВеО от 1 : 16 до 1 : 3 с помощью п-хлоранилина [1142]. Описан способ отделения алюминия от железа о-фенетиди-ном [628]. Железо должно быть предварительно восстановлено до двухвалентного состояния сероводородом.
Алюминий в присутствии NH4C1 можно осадить в виде гидроокиси водной суспензией амидохлорида ртути ClHgNH2 [1180] при комнатной температуре (осадок отфильтровывают на следующий день). Метод позволяет отделить алюминий от марганца. Описан метод отделения алюминия от двухвалентных металлов, а в присутствии гидроксил амина также от железа с использованием амидохло
48
рида ртути [1181]. Однако этот метод нельзя рекомендовать для практического применения (мешают многие элементы, метод продолжителен, кроме того, соединения ртути ядовиты). В присутствии NH4C1 алюминий количественно осаждается моноэтаноламином в виде А1(ОН)3 [358]. Коренман и Файзиев [19L, 192] использовали этот метод для отделения алюминия от магния и цинка. Отделение от магния количественное при осаждении как при комнатной температуре, так и при нагревании. Отделение от цинка хуже, хорошие результаты получаются лишь после двух переосаждений.
Алюминий можно осадить гексаметиленди амином [194]. Описан метод осаждения А1(ОН)3 с этиленхлоргидрином [438].
Гидролитическое осаждение гидроокиси алюминия солями слабых неорганических кислот
Эти методы основаны на гидролитическом разложении солей алюминия с анионами слабых неорганических кислот с образованием А1 (ОН)3 и слабой кислоты, которую легко удалить из раствора нагреванием. Их можно рассматривать как методы осаждения из гомогенных растворов. Получающиеся осадки А1(ОН)3 чище, чем при осаждении аммиаком, плотные и легко фильтруются.
Для осаждения алюминия предложены тиосульфат натрия [618, 629], нитриты (калия, натрия или аммония) [1147], иодид-иодатная смесь [1200], карбонат аммония [907], гидразинкарбонат [847] и др.
Однако эти методы в настоящее время почти не применяются, так как непригодны для анализа материалов сложного состава (многие металлы, сопутствующие алюминию, мешают).
Осаждение тиосульфатом. В тиосульфатном методе выделяющиеся при гидролизе солей алюминия ионы Н+ связываются ионами S.3O3 в малоустойчивую H2S2O3, которая немедленно распадается на S, SO2 и Н2О. Образующийся SO2 удаляется при кипячении, а сера сгорает при прокаливании осадка. Кленнель [647], испытав различные осадители этой группы, нашел, что с тиосульфатом получаются лучшие результаты. Хотя тиосульфат восстанавливает Fe (III) до Fe (II), полное разделение алюминия и железа с одним тиосульфатом не достигается. Лучшие результаты получаются при использовании смесей тиосульфата с сульфитом натрия [367] или фенилгидразином [919].
Осаждение нитритом аммония. В этом методе при гидролизе образуется HNO2, которая распадается на NO и NO2. При осаждении алюминия нитритным методом анализируемый раствор нейтрализуют аммиаком до появления осадка, который растворяют в кислоте.
В раствор, содержащий достаточно большое количество аммонийных солей, Добавляют 20 мл 6%-ного раствора NH4NO2. Разбавляют до 200 мл н кипятят
49
~20 мин, до прч^ащения выделения окисдов азота, затем нагревают на водяной бане 15—30 мин. Фильтруют, промывают и прокаливают, как в аммиачном методе [877а].
Конгдон и Картер [652] отмечают высокую ^точность нитритного метода.
Осаждение смесью и о д и д а и йодата калия
К слабокислому' раствору, нейтрализованному последовательным добавлением аммиака до появления мути, и кислоты — до растворения осадка, прибавляют смесь равных объемов 25°о-ного раствора KJ и 7%-ного раствора KJO3. Через 5 мин.раствор обесцвечивают 20%-ным раствором Na2S2O3.Вводят небольшие количества смеси иодид-иодата, если при этом выделяется иод, его снова обесцвечивают добавлением 1 — 2 мл раствора Na,S2O3. Нагревают на водяной бане в течение 30 мин. После полного осаждения осадок отфильтровывают, промывают, прокаливают, как в аммиачном методе [877а].
Осаждение карбонатами. Маджумдар и Сен [949] получили хорошие результаты при осаждении А1 карбонатом аммония в присутствии Fe (II) и Сг, связанных в прочные комплексы с ос-пи коли новой (2-пиридинкарбоновой) кислотой. Комплекс Fe (II) не разрушается при обработке карбонатом аммония даже при рН^> >7,7. Комплекс Сг (III) образуется при кипячении раствора в течение нескольких минут с tx-пиколиновой кислотой и устойчив до pH 7,0. Оптимальные значения pH при отделении от Fe—5,8—6,85, от Сг—6,25—7,05. При меньших pH результаты занижены, при больших— завышены. При осаждении алюминия при pH 6,25—6,8 оба металла не мешают. Авторам работы [1176] удавалось отделять Юма А12О3 от 90 мг Fe2O3 при осаждении алюминия карбонатом аммония в присутствии ди пиридила.
С карбонатом аммония все же трудно добиться количественного осаждения алюминия, для этого надо поддерживать pH в очень узких пределах [907, 989]. Еще меньше значение метода осаждения с бикарбонатом аммония [882]. Осаждение гидрооксиси алюминия карбонатами бария или кальция также заслуживает мало внимания [1231].
Осаждение гидразинкарбонатом дает лучшее отделение алюминия от двухвалентных металлов, чем перечисленными выше карбонатами [847, 882]. При двукратном осаждении алюминий количественно отделяется от Мп, Zn, Со и N i, а в присутствии гидразина — также и от железа.
Осаждение прочими реагентами
Сульфид аммония из растворов солей алюминия осаждает А1(ОН)3. Осаждение неколичественн се, кроме того, алюминий отделяется при этом только от щелочных металлов. Поэтому метод не представляет никакого интереса. При осаждении А1 (ОН)3 из
50
алюминатного раствора двуокисью углерода получается плотный осадок [735].
Метод осаждения А1(ОН)3 с помощью суспензии HgO позволяет отделить алюминий лишь от щелочных металлов. Zn, Со, Ni, Be и Сг частично осаждаются. Возможно отделение от марганца, который осаждается лишь при длительном стоянии.
Осаждение алюминия в виде основных солен органических кислот
Осаждение в виде бензоата. Бензоатный гравиметрический метод—один из наиболее точных методов определения А1. Бензойная кислота впервые была использована в химическом анализе Кольтгофом, Стенгером и Московичем [892] для отделения титана и трехвалентных металлов от двухвалентных. При осаждении бензоатом образуется основной бензоат алюминия, который легче фильтруется и промывается, чем осадок, полученный при осаждении аммиаком; кроме того, сорбция посторонних ионов значительно меньше.
Относительно оптимального значения pH осаждения бензоата алюминия имеются различные литературные данные. В работах [846,1175] указывается, что титан и трехвалентные металлы полностью осаждаются бензоатом при pH 3—4. Для количественного осаждения бензоата алюминия приводятся следующие значения pH: 3,7 [834]; 3,0 и выше [1258]; 3,5 и выше [1175]; 3,5—4,0 [1033].
Для полного осаждения алюминия pH надо поддерживать, по крайней мере, не ниже 3,5 [1175, 1275].
В условиях выделения алюминия полностью осаждаются также Fe (III), Ti, Bi, Zr, Hf, Th, Sn (IV), Се (IV), Cr (III)* [846, 892, 1258], V(IV) [344, 491]; частично осаждаются U (VI), Ti (III),Cu (II), Pb, Sn [892]; не осаждаются V(V), Co, Ni, Mn, Zn, Cd, Ba, Sr, Mg, Fe (II), Ca, Hg (II), Ce (III), щелочные металлы [892]. Бериллий при pH 4,3 не осаждается, но соосаждается с бензоатом алюминия [834]. Из анионов в значительных количествах осаждаются фосфаты.
По данным Вильсона [1275], соосаждение Ca, Mg и Мп с бензоатом алюминия увеличивается с повышением pH; при pH 3, а после переосаждения и при pH 3,5 оно незначительно. Поэтому в присутствии Ca, Mg и Мп бензоат алюминия следует осаждать при pH, 3,5, при больших количествах указанных металлов необходимо пере-осаждение. Согласно Смел су [1175], при осаждении алюминия при pH 3,7—3,9 не мешают до 50 мг Со, Cr (VI), Ni и Zn; при переосаж-дении — до 100 мг этих металлов. При pH 5,5 и выше осадок алюминия студнеобразный, так как частично осаждается А1(ОН)3, с трудом фильтруется; и, кроме того, возрастает окклюзия посто-
По другим данным [344], осаждение хрома неполное.
51
ронних ионов. Поэтому при осаждении бензоата алюминия pH надо поддерживать не ниже 3,5 и не выше 4,0.
При определении алюминия бензоатным методом железо иногда предварительно отделяют едким натром [230], что мало удобно, так как необходимо переосаждение. Лучше' его предварительно восстановить до двухвалентного состояния сульфитом [117], гидросульфитом [3441, тиогликолевой кислотой [1277] или гидроксиламином или связать в комплекс. По мнению Вильсона [1277], при восстановлении сернистой кислотой осадок бензоата алюминия часто загрязняется железом; лучше использовать тиогликолевую кислоту. Согласно Вильсону, до 1 г железа не влияет на определение 20 мг алюминия. Тиоглпколевая кислота маскирует и восстанавливает также и некоторые другие ионы, при этом число мешающих ионов сильно сокращается. Не мешают Fe, Cu, Zn, Pb, Мп, Sn, вольфраматы, молибдаты; мешают только Ti, Cr, Zr, V (IV) и Th. Юрчик [854] успешно применил тиогликолевую кислоту для маскирования мешающих элементов при анализе руд, шлаков, чугуна и легированных сталей. Определению 0,5—5% алюминия не мешали 3% Мо, 3% Со, 6% Ni и 8% Мп; но V, Сг и Си завышали результаты.
Алфонси и Бусси [521] при определении алюминия в бронзах и латунях предварительно осаждают медь в виде тиогликолята. Объем осадка при этом большой, поэтому после осаждения лучше раствор с осадком разбавить в мерной колбе до метки и для определения алюминия отфильтровать только часть раствора.
При осаждении алюминия из растворов, содержащих хром, последний окисляют до шестивалентного состояния с помощью перекиси водорода в щелочной среде [117]. В присутствии фосфатов осадок бензоата частично содержит фосфат алюминия. В этих случаях Вильсон [1275] рекомендует растворить бензоат и затем определить алюминий весовым оксихинолиновым методом. В других работах бензоатный метод также применяют лишь для предварительного выделения алюминия. Например, при определении в магниевых, цинковых и медных сплавах после выделения в виде бензоата алюминий определяют комплексометрическим методом [976].
Бензоатный метод выделения и определения алюминия применен к медным [520, 521, 676, 1015], магниевым [362, 976, 1199] и цинковым [976] сплавам, к титановым концентратам [209], к фосфатным породам [1275]. Бензойная кислота была использована в схеме качественного анализа в присутствии фосфатов [537].
Для определения алюминия весовым бензоатным методом можно рекомендовать следующую методику * [1277].
К 100 мл слабокислого раствора, нагретого до 60—80° С, прибавляют 2 г NH4C1, 2aCiyCOONH, и 1 мл 80%-ной тиогликолевой кислоты. После восстановления железа вводят 20 ли 10%-ного раствора бензоата аммония, индикатор бромфеноловый синий и медленно прибавляют NH4OH (1 ; 1) при непрерывном переме
* Приводится с небольшими изменениями.
52
шивании до изменения окраски индикатора. Нагревают до кипения и осторожно кипятят в течение 5 мин. Помещают раствор на кипящую водяную баню на 15 мин.
Осадок сразу отфильтровывают через фильтр с белой лентой и пять раз промывают горячим промывным раствором (1 %-::ым по бензоату и 2°о-ным — по СН3СООН). Осадок смывают водой в стакан, в котором проводилось осаждение, иа фильтр наливают горячую 5.V НС1: фильтрат собирают в тот же стакан. Фильтр тщательно промывают горячей водой. Повторяют осаждение. Фильтруют и промывают. как указано выше. Фильтр с осадком прокаливают при 1200° С в течение 2 час. Фактор пересчета на алюминий 0,5291.
Осаждение бензоата можно проводить из гомогенных растворов.
К 350 м.1 бензоатного буферного раствора (48 aNH4Cl и 18 г бензойной кислоты в 2 л воды) добавляют 3 г мочевины и 50 м.г слабокпслого анализируемого раствора, содержащего 0,01—0,05 г алюминия. Быстро нагревают до кипения и выдерживают на паровой бане 1,5—2 часа. Осадок отфильтровывают через фильтр средней плотности, промывают 1%-ным раствором NH4NO3. Прокаливают до постоянного веса при 1250° С в платиновом тигле и взвешивают в виде А12О3 [834].
Зависимость полноты выделения алюминия от продолжительности осаждения характеризуется следующими данными [834]:
Время, мин. мг АЬОя/400 мл мг А12Оз/ЮО мл
pH фильтрата Ьремя, мин. рн фильтрата
30 3,15 6 60 3,80 0,01
50 3,63 0,2 90 4,00 0,01
55 3,70 0,01 120 4,08 0,01
Как обычно при гомогенном осаждении, осадки получаются более чистые, чем при обычном осаждении. Гомогенное осаждение в виде бензоата предпочтительнее, чем осаждение в виде сукцината. Осадок бензоата менее плотный, чем сукцинат, но его легче фильтровать и промывать.
Осаждение в виде сукцината. Это старый и, пожалуй, незаслуженно забытый метод выделения и весового определения алюминия. Имеет преимущества по сравнению с аммиачным методом, главное из которых — отделение от большего числа элементов, чем в аммиачном методе. Только немногим уступает по точности и удобству проведения анализа бензоатному методу.
Алюминий осаждают из кипящих растворов, содержащих янтарную кислоту и мочевину. В момент появления осадка алюминия pH 4,0—4,1 и конечный pH раствора 4,4—4,5 [1273]. Fe (III) начинает осаждаться при pH 2,0—2,1, Fe (II) —только при pH 5,5. Следовательно, можно устранить влияние железа, если его перевести в двухвалентное состояние. Метод в предложенном Виллардом и Тангом [1273] варианте довольно продолжительный, включает два осаждения с кипячением по 2 часа. Паркеру [1042] удалось значительно сократить продолжительность метода и сделать его удобным для массовых анализов.
Виллард и Танг [1273] для восстановления железа применили метабисульфит аммония и фенилгидразин. Паркер [1046] вместо фе-
53
нилгидразина использовал гидрохинон, более удобный и нетоксичный. Метабисульфит восстанавливает железо в первой стадии определения, а в дальнейшем оно удерживается в восстановленном состоянии с помощью гидрохинона. При нейтрализации анализируемых растворов аммиаком возможно резкое повышение pH и образование объемистого желатиноподобного осадка, который трудно фильтровать и промывать. Этого не бывает, если нейтрализацию проводить с помощью карбоната натрия. Нитраты мешают, окисляя гидрохинон. Поэтому при разложении материалов, плохо растворяющихся в одной соляной кислоте, для ускорения процесса растворения нельзя вводить азотную кислоту, лучше применять бромную воду или перекись водорода, которые затем удаляются выпариванием досуха и спеканием.
Для полного осаждения алюминия раствор кипятят в течение 45 мин. после появления осадка, объем раствора поддерживают ~ 500 мл. При соотношении Fe : А1 = 10 : 1 при однократном осаждении получаются удовлетворительные результаты (при анализе смеси 1 г железа и 100 мг алюминия найдено 98—100 .иг алюминия).
Паркер [1042] предлагает следующую пропись для определения алюминия в железе, сталях и шлаках.
Кислые анализируемые растворы нагревают До кипения и вводят 5 г KHSO3> кипятят еще 1—2 мин. Разбавляют водой до 400 мл и нагревают до кипения. В кипящий раствор вводят 5 г янтарной кислоты, 4 г мочевины и 5 г гидрохинона. Кипятят 1—2 мин. и снимают с плитки. Осторожно добавляют NaHCO3 (раствор или твердый) до появления неисчезающего осадка, который растворяют, добавляя 15%-ную НС1. Разбавляют до 600мл и нагревают до кипения. Продолжают кипячение в течение 45 мин, после появления осадка, следя за тем, чтобы объем раствора все время был не меньше500 мл. Осадок сразу отфильтровывают, промывают 2%-ным раствором NH4NO3. Прокаливают при 1200° С и взвешивают в виде А12О3.
Титан осаждается вместе с алюминием. В этом случае вводят поправку после фотометрического определения его с перекисью водорода, прокаленный осадок предварительно сплавляют с KHSO4. Продолжительность определения ~ 2 часа.
Относительная ошибка ~ 2%.
При анализе материалов, содержащих цинк, при осаждении необходимо вводить NH4C1; в этих случаях растворы надо нейтрализовать очень тщательно, избегая сильного увеличения pH, иначе возможно образование желатиноподобных осадков.
По данным Вилларда и Танга [1273], осаждением янтарной кислотой с мочевиной можно отделить при однократном осаждении 0,1 г алюминия от 1 г Мп и Си, 0,1 г Li, Со; переосаждением — от 1 г Ni Со и Zn.
Таким образом, алюминий от двухвалентных металлов этим методом отделяется значительно лучше, чем при осаждении аммиаком.
Осаждение в виде дифената. Аммонийная соль дифеновой (дифенил-2,2'-дикарбоновой или о,о'-дибензойной) кислоты с алюминием образует труднорастворимую основную соль [31. Растворимость осадка в воде 2,3-10-5 моль!л. Осадок практически
со
нерастворим в 0,2%-ном растворе реагента, в спирте и эфире; хорошо растворяется в кислотах и щелочах. Дифенат аммония осаждает и другие трехвалентные металлы, не осаждает щелочные и щелочноземельные металлы, Fe (II), Мп, Со, Ni, Zn и Cd. Полное осаждение дифената алюминия наблюдается при pH 3,2—5,0. При pH > 5,0 вместе с основным дифенатом частично осаждается А1(ОН)3. При оптимальных значениях pH дифенат аммония настолько полно осаждает алюминий, что количество неосажденного алюминия (найденное фотометрически с алюминоном) составляет < 0,03 мг.
Присутствие небольших количеств аммонийных солей способствует получению более плотного и легко фильтрующегося осадка. Оптимальные количества аммонийных солей (хлорида или нитрата) — 0,15 а на каждые 0,03 г алюминия; большие количества повышают растворимость осадка. Оптимальная температура при осаждении — 20—40° С.
Соосаждение Со, Fe (II), Ni и Мп с осадком дифената алюминия незначительно; для отделения от цинка необходимо переосаждение [3].
В присутствии двухвалентных металлов значение pH должно быть не выше 4,4; при больших pH соосаждение усиливается. Для осаждения алюминия рекомендуется следующая методика [3].
К азотно- или солянокислому раствору, содержащему не больше 0,1 гА12О3, добавляют 10—20 мл 1%-ного раствора NH4NO3 или NH4C1. Разбавляют водой до 75 мл, вводят 3—4 капли раствора метилового оранжевого и Доводят pH до 4,4 аммиаком или кислотой. Нагревают до начала кипения и осаждают алюминий при слабом кипении 3,4%-ным раствором дифената аммония (4,5 мл на 0,01 г А12О3). Осадитель вводят из бюретки по каплям в течение 10 мин. при энергичном помешивании. Стакан накрывают часовым стеклом и выдерживают на кипящей водяной бане в течение часа. После охлаждения раствора до 40—45°С осадок отфильтровывают через фильтр с белой лентой, промывают его сначала декантацией и после перенесения на фильтр промывают еще 5—6 раз. Осадок прокаливают при 1100— 1200° С и взвешивают А12О3.
В работе [3] указан способ приготовления дифената аммония.
Осаждение в виде соли коричной кислоты. Из нагретого до кипения слабокислого раствора коричнокислый аммоний осаждает алюминий в виде малорастворимой основной соли [321] состава
(CgHoCH = СНСОО)2\А1 но'7
При осаждении алюминия в растворе устанавливается pH 5,0— 5,1. Осадок имеет постоянный состав независимо от избытка осадителя и может применяться как весовая форма. Осадок основной коричнокислой соли алюминия хорошо коагулирует, быстро фильтруется и легко промывается. Присутствие до 5—10 г NH4C1, NH4NO3 и (NH4)2SO4 не мешает. При pH 5,0—5,1 осаждаются, кроме алюминия, также Fe (III), Cr (III), Ti, In, Ga, Be, U, Sc [85, 321, 322], Zr и Th
5S
1903). Титан и цирконий коричной кислотой полностью могут быть осаждены из более кислого раствора, при pH 1,9—2,1, и таким образом отделены от алюминия [85, 85а]. Полное отделение титана от алюминия достигается при соотношении ТЮ2 : А12О3 от 1 : 100 до 10 : 1.
В присутствии аммонийных солей двухвалентные металлы не осаждаются и могут быть отделены от алюминия. Но при малых количествах хлорида аммония (5 а) все же имеет место частичное соосаждение их. В присутствии 10 г NH4C1 алюминий полностью отделяется от Мп, Ni, Zn; для отделения от кобальта необходимо увеличить количество хлорида аммония до 15 г. Обычно необходимость переоса-ждения не возникает. Бабачев [23] считает, что отделение алюминия от двухвалентных металлов коричной кислотой предпочтительнее, чем пиридином; автор рекомендует поддерживать при осаждении pH 5,8—6,0.
Для осаждения алюминия в виде основной коричнокислой соли можно рекомендовать следующую методику [321].
К кислому анализируемому раствору объемом 60мл прибавляют 15 aNH4Cl, раствор осторожно нейтрализуют аммиаком (1 : 1) до появления слабой мути, которую растворяют в 2—3 каплях НС1 (уд. вес 1,12). Раствор разбавляют водой до 80—90 мл и нагревают до кипения. При слабом кипении раствора прибавляют медленно по каплям 20 мл раствора коричнокислого аммония (5%-ного по коричной кислоте). После окончания осаждения стакан накрывают стеклом и раствор слабо кипятятв течение 1—2 мин. Выдерживают на водяной бане 1—1,5 часа, время от времени перемешивая. После отстаивания осадок отфильтровывают через фильтр с белой лентой Декантацией. Оставшийся в стакане осадок промывают два раза Декантацией горячим промывным раствором (10 г NH4C1, 20 мл раствора реагента в 100 мл), расходуя по 20—25 мл его. Осадок переносят на фильтр и промывают горячей промывной жидкостью (20 мл раствора реагента и 280 мл горячей воды). Осадок высушивают, озоляют и прокаливают до А1аО3.
Осадок после промывания указанной выше промывной жидкостью, а затем спиртом можно высушить в тигле Шотта при 110° С.
Относительная ошибка метода 0,2—0,4% при содержании 0,025—0,050 г А1аО3.
Осаждение в виде других соединений. Один из самых старых методов выделения алюминия — ацетатный метод— почти не применяется из-за неколичественного осаждения, студнеобразного трудно фильтрующегося осадка, склонного к сорбции посторонних ионов. Обычно осаждают алюминий в виде основных ацетатов при pH 5,2—5,6. Однако, по данным Морачевского и Башун [270], полное осаждение алюминия происходит лишь при pH 7,5— 7,8. В этих условиях некоторые двухвалентные металлы, например цинк и кобальт, частично соосаждаются с алюминием. В присутствии коллектора железа алюминий можно осадить при pH 5,8—6,0 и его можно отделить от этих металлов. В работах 1921, 1024] также предлагалось использовать для более полного осаждения алюминия коллектор железо, которое затем отделяется от алюминия с помощью едкого натра [1024].
56
Формиатный метод применяется еще реже, чем ацетатный. Методы, основанные на выделении алюминия в виде основных салицилата и антранилата, не нашли применения.
Осаждение в виде криолита
На образовании труднорастворимого фторидного комплекса алюминия — криолита Na3AlFe — основаны очень важные методы определения алюминия: весовые, объемные и потенциометрические. Комплекс состава Na3AlF6 образуется при избытке NaF, большем 1,4%; при меньшем избытке состав комплекса соответствует формуле 4AlF3-llNaF [312, 401]. Криолит заметно растворим в воде: растворимость 0,39 г/л или 1,36 -10 ’3 моль/л [402]. Растворимость его сильно уменьшается в присутствии избытка фторида натрия. При избытке 0,02 моль NaF/л в фильтрате от криолита не обнаруживаются даже следы алюминия.
Наиболее обстоятельное изучение фторидного (криолитового) метода определения алюминия провел Яковлев [513]. Фторидный метод является одним из наиболее ценных весовых методов определения алюминия. Он очень селективен и позволяет просто и сравнительно быстро определить алюминий в материалах сложного состава: сталях, сплавах на основе Си, Ni и Со, при различных сочетаниях легирующих компонентов. Фториды Мо, W, V, Nb, Zr, Ti и Fe имеют значительно большую растворимость по сравнению с растворимостью криолита и остаются в растворе; не мешают также Со, Ni и Сг.
Для удержания некоторых металлов в растворе необходимо введение маскирующих реагентов. Для этой цели можно применить оксалат аммония (для многих металлов) и цитрат аммония (для Ni, Си и Ti). Лучше всего применять смесь насыщенного раствора оксалата аммония и 40 %-ного раствора цитрата аммония. В присутствии комплексона III фторид натрия количественно осаждает алюминий из слабокислого раствора, а Си, Fe, Со, Ni, Zn, Sn, Bi, Sb и Мп удерживаются в растворе [411.
Осаждение криолита необходимо проводить из сернокислых растворов. При осаждении из солянокислых растворов наблюдается соосаждение V, Ti и Fe. Поэтому анализируемые растворы предварительно надо выпаривать с серной кислотой до паров SO3. В присутствии значительных количеств Fe (III) соосаждается малорастворимая двойная соль железа 2FeF3 -5NaF (растворимость 2,4 г/л) [402]. Железо пытались восстановить до двухвалентного состояния, применяя Na2SO3 [397, 4021, KJ, Na2S2O3, H2S, гидроксиламин, гидразин, цинковую амальгаму. Лучшим восстановителем железа в криолитовом методе оказалась цинковая амальгама [5131. При встряхивании анализируемого раствора с цинковой амальгамой в течение 1—2 мин.Ре(Ш) количественно восстанавливается. Фторидный комплекс железа значительно лучше растворим, чем криолит. Поэтому
57
продолжительным промыванием (10—15 раз) 0,5%-ным раствором NaF комплекс железа можно полностью удалить с фильтра (следовательно, отпадает необходимость предварительного восстановления железа) [332]. Этот вариант для практического использования оказался более удобным, чем вариант с восстановлением цинковой амальгамой, поэтому он нашел широкое применение.
Важно правильно нейтрализовать анализируемые растворы. При недостаточной кислотности могут соосаждаться Ti, Fe и Zr, при повышенной кислотностивозможнозагрязнение растворов кремнием, выщелачиваемым из стеклянной посуды [513]. При анализе растворов, содержащих титан, надо нейтрализовать холодные растворы; при нейтрализации горячих растворов возможно выделение Ti (ОН)4, с трудом растворяющейся в кислоте. В присутствии титана и железа после осаждения осадок должен отстаиваться не дольше 20мин., во избежание получения завышенных результатов [513].
Тананаев и Талипов [402] определяли алюминий взвешиванием криолита. Осадок промывали 0,5%-ным раствором NaF, затем 50% -ним спиртом и после высушивания при 120—130°С взвешивали криолит. Осадки фильтруются очень долго, центрифугирование способствует ускорению процесса фильтрования. Аналогичный метод предлагался также Пеньковой [332] и Пендером [1054]. Однако центрифугирование мало приемлемо для массовых анализов, большой расход этилового спирта также является недостатком метода. К тому же криолит постоянного состава образуется только при строго определенных условиях [401]. Поэтому осаждение в виде криолита целесообразно использовать только для предварительного выделения алюминия, но не для его определения.
Осадок криолита необходимо растворить и алюминий определить в растворе соответствующим методом. Для растворения криолита лучше всего применять 40 мл смеси такого состава: 150 мл насы-щенного раствораН3ВО3, 250 мл НС! удельного веса 1,19 и 600 мл воды.
Ряд авторов после’растворения криолита осаждает алюминий аммиаком. В этом случае необходимо полностью удалить фтор-ион выпариванием раствора с серной кислотой до паров SO3, что сильно увеличивает продолжительность анализа. Яковлев [513] рекомендует осаждать алюминий в виде оксихинолината, без выпаривания раствора. Осаждению оксихинолината фтор не мешает, если перед прибавлением оксихинолина раствор подкислить, чтобы способствовать связыванию фтора в комплекс с бором. В этих условиях количественное осаждение оксихинолината алюминия происходит в присутствии 0,05 г фтор-иона при 8—10-кратном избытке Н3ВО3. Васильеву [77] в несколько иных условиях удавалось определять алюминий оксихинолинатным методом лишь в присутствии 0,003 г фтор-иона при 30-кратном избытке Н3ВО3.
Для определения алюминия криолитовым методом можно применять следующую методику [377а, 513].
Б8
К раствору прибавляют 5—7 мл H2SO4 (уд. вес 1,84) и выпаривают до паров SO3. Выделившиеся соли растворяют в 50—70.ил воды при нагревании. Нерастворимый осадок (SiO2, WO3 и Nb.,O6) отфильтровывают. После охлаждения раствор нейтрализуют аммиаком до начала выпадения гидроокисей, которые растворяют, прибавляя осторожно по каплям H2SO4 (уд. вес 1,84), и вводят избыток 5 капель. Прибавляют 25 мл маскирующего раствора (смесь (1 : 1) насыщенного раствора (NHj^CjOj и 40°о-ного раствора цитрата аммония); 60—80 мл 3,5°6-ного раствора NaF и перемешивают. Спустя 20 мин. осадок криолита отфильтровывают через два плотных фильтра, 10—15 раз промывают О,5?о-ным раствором NaF. Осадок на фильтре растворяют в 50—70.мл кипящей смеси Н3ВО3 и НС1 (150.ил насыщенного раствора Н3ВО3, 250 .мл НС1 (уд. вес 1,19) и 600 .мл воды). Фильтр промывают 5—6 раз горячей водой. Раствор нейтрализуют аммиаком (уд. вес 0,91) по метиловому красному, затем — НС1 (уд. вес 1,19) до перехода желтого цвета раствора в розовый и прибавляют избыток 5 капель. После охлаждения до 30—40° С вводят 20 мл 2,5%-ного раствора оксихинолина в 4%-ной СН3СООН и 10 мл 20%-ного раствора CH3COONH4. После перемешивания прибавляют еще 25 мл раствора CH3COONH4 и 5 мл аммиака (уд. вес 0,91). Раствор с осадком нагревают до 60— 70° С и выдерживают при этой температуре 10—15 мин. для коагуляции осадка. Осадку дают отстояться в течение 30 мин при комнатной температуре. После этого осадок отфильтровывают через два фильтра с белой лентой, промывают 8—10 раз промывной жидкостью (к 1 л воды прибавляют 12,5 мл 20%-ного раст-BopaCH3COONH4 и 2 капли аммиака). Фильтр с осадком помещают во взвешенный фарфоровый тигель, сверху насыпают 2—3 г безводной щавелевой кислоты, высушивают, озоляют при 400° С, прокаливают при 1100° С и взвешивают в виде А12О3. Продолжительность определения 4—5 час.
Относительная ошибка до 5% (при содержании алюминия 1%) и 2% — при 5—6% алюминия.
Криолитовый метод принят в качестве стандартного для анализа легированных сталей, некоторых ферросплавов и металлов.
Криолитовый метод описан для определения алюминия в сталях [403, 920], в интерметаллидных фазах, содержащих Ni, Со, Cr, Fe, Ti, Zr, V, Mo, W и Nb [512], в ферросплавах [29, 40, 332a], в силико-цирконии [39], в алюминиевых бронзах [41], в латуни, в шлаках, для отделения алюминия от титана [3911 и от бериллия [1104, 1126].
Описан метод весового определения алюминия в виде двойной соли с калием [301], но этот метод значительно хуже криолитового из-за большей растворимости осадка и практического применения не нашел.
Осаждение в виде фосфата
Метод основан на образовании алюминием в слабокислой среде труднорастворимого фосфата А1РО4. Метод уступает по точности другим весовым методам: оксихинолиновому, бензоатному, сукци-натному и др. Осаждаемая форма не имеет постоянного состава, а зависит от условий осаждения: pH раствора и отношения концентраций А1 : Р2О5 [971]. Осадок фосфата алюминия всегда увлекает с собой Р2О8, который нелегко удалить промыванием. При промывании водой возможно частичное растворение осадка [613] и гидролиз его [89]. Осадки лучше всего промывать горячим 5%-ным раствором NH4NO3. Лендель и Ноулз [940] указывают, что если при осаждении
59-
ввести мацерированную бумагу и промывать осадок до удаления хлор-иона, то можно получить точные результаты при определении миллиграммовых количеств алюминия. При осаждении больших количеств (0,1—0,2 г А12О3) результаты завышаются на 2—3% за счет сильной сорбции Р2О5. Фосфат алюминия начинает осаждаться при pH 3,5 [7831. Обычно его осаждают из растворов с pH 5—5,4 [89, 940, 1281]. В присутствии кальция надо осаждать из более кислых растворов, с pH 4—4,5, так как при pH 5,7—6,0 осаждается фосфат кальция [783]. Люф [937] указывает, что при осаждении из растворов, содержащих цинк, также надо поддерживать меньшие значения pH. Рэй и др. [1102] при определении алюминия в сталях получили хорошие результаты, осаждая фосфат алюминия при pH 3,7—3,9. Осаждение из щелочных растворов не дает удовлетворительных результатов, так как при этом частично осаждается А1 (ОН)3; кроме того, фосфат при высоких pH постепенно переходит в гидроокись [971]. Важным условием получения правильных результатов в фосфатном методе является применение 5—10-кратного избытка осадителя. При недостаточном избытке осадителя результаты получаются заниженными [940]. Минеральные кислоты легко растворяют А1РО4. Растворяюще действуют также лимонная, винная, щавелевая и другие кислоты [1251]; уксусная кислота не влияет.
В условиях осаждения алюминия осаждаются также Fe (III), Ti, Zr, частично V. Хром сильно сорбируется осадком алюминия и должен быть предварительно отделен. Хромат влияет мало [780], поэтому окисление Cr (III) до Cr (IV) уменьшает влияние хрома. В зависимости от условий и от количества, Мп, Zn и Са также могут соосаждаться с осадком А1РО4. Осаждение Fe (III) устраняется переведением его в Fe (II). Ряд авторов [531, 652, 745] для этой цели применяет тиосульфат. По мнению Гиллебранда и др. [89], тиосульфат для восстановления мало подходит, так как образующаяся при этом H2SO3 частично растворяет А1РО4 и получаются заниженные результаты; эти авторы предпочитают восстанавливать железо сероводородом.
При определении алюминия в стали Рэй и др. [1102] основную массу железа удаляют экстрагированием эфиром из раствора, 6V по НС1. Остатки железа и некоторые другие элементы удерживают в растворе смесью тиогликолевой кислоты и роданида аммония. Титан и цирконий предварительно отделяют гипофосфитом натрия и бромной водой; Cr, V, Mo, Sn, Мп, Zn, Ni и Со в тех количествах, в которых присутствуют в углеродистых сталях, не мешают. По данным авторов, при осаждении А1РО4 при pH 3,7—3,9 не мешают 500-кратные количества Cr, V, Мп, Ni и Со. Отделение от Fe, Cr, V, Sn, Мп, Zn, Mo, Ni и Со настолько полное, что, как правило, переосаж-дение не требуется. Для получения правильных результатов необходим строгий контроль pH. Лучшие результаты получаются при pH 3,7—3,9; при меньших pH осаждение неполное, при pH > 3,9 результаты завышены вследствие загрязнения осадка другими элемен
АП
тами. Нагревание способствует коагуляции осадка; осадки не следует оставлять на ночь.
Осадок А1РО4надо прокаливать при 1200° С [968, 1124], приболев высоких температурах осадок частично разлагается. Осадок гигроскопичен и взвешивать его следует быстро.
Осаждение в виде купфероната
Купферон, аммонийная соль нитрозофенилгидроксиламина, очень важный реагент в аналитической химии алюминия. Для весового определения алюминия применяется редко, но очень часто — для предварительного выделения его и удаления мешающих элементов. Хотя купферон осаждает многие металлы, но, регулируя среду, с ним можно отделить алюминий от многих металлов. Алюминий купфероном количественно осаждается при pH 4,6. В этих условиях осаждаются также Be, Ga, У,СеиЕг; неполностью осаждаются Cr (III), TI (III), In, Th и U (VI). Осаждением из кислой среды (IV кислота) от алюминия могут быть отделены Fe, Ti, V, Zr, Sn, Nb и Та. В свою очередь, осаждением при pH 4,5—4,6 алюминий можно отделить от Мп, Mg и щелочноземельных металлов.
Осадок купфероната алюминия не имеет постоянного состава, поэтому его переводят прокаливанием в А12О3. При отделении металлов от алюминия осаждением в более кислой среде с осадком купферонатов осаждаются также продукты окисления купферона, склонные к частичной сорбции алюминия. Лучшее отделение достигается при экстрагировании купферонатов. Поэтому отделение металлов осаждением в виде купферонатов, а также осаждение купфероната алюминия имеет ограниченное применение. В то же время методы с экстрагированием купферонатов нашли исключительно широкое применение (подробно см. гл. III).
Вместо купферона предложено использовать N-бензоилфенил-гидроксиламин [1152]. Условия осаждения алюминия и других металлов такие же, как и с купфероном. Преимущество этого реагента по сравнению с купфероном— в большей устойчивости к нагреванию, свету и воздуху. Осадки при нагревании получаются кристаллические и, по мнению автора, не загрязняются осадителем; оптимальная температура при осаждениия ~ 65° С. Полное осаждение алюминия происходит при pH 3,6—6,4. Шоум [1152] считает, что осадок алюминия можно сушить при 110° С и взвешивать. Фактор пересчета на алюминий 0,04064.
Триэтаноламинная соль 4-стильбенил-яитрозогидроксиламин а («стирилкупферон») с алюминием при pH—•! дает труднорастворимое соединение состава (CeHsCH=CHC6H4N (O)NO]3 Al, которое можно использовать для весового определения алюминия [688]. Для определения алюминия к нагретому раствору прибавляют NH2OH -НС1, устанавливают pH ~ 7, вводят 250 мл горячего раствора стирилкупферона и смесь
этанола с пиридином (4:1) в количестве, составляющем 15% от общего объема раствора. Осадок отфильтровывают, промывают и высушивают при 110° С. Фактор пересчета на алюминий 0,03627. При определении 4—12 мг алюминия относительная ошибка меньше 1,5%. Преимущества этого метода — осадок легко’фильтруется и обладает постоянным составом; кроме того, фактор пересчета небольшой.
Ji Осаждение в виде других соединений
Эмбелин С17Н26О4 с алюминием при pH 4,0—4,5 образует труднорастворимое в воде соединение А12( С17Н24О4)3 С17Н26О4, которое использовано для гравиметрического определения А1 [1101]. Осадок можно прокалить до А12О3 или же высушить при 105—110° С (предварительно отфильтровывают через тигель Шотта № 4). С эмбелином алюминий можно отделить от бериллия, который осаждается при pH 6,7—7,0.
Салицилгидроксамовая кислота при pH 6,0—7,5 с алюминием дает труднорастворимый белый осадок состава A1(C7H6O3N)(OH),. пригодный для его весового определения [1065]. Си, Fe, Ti, V и Мо определяют экстрагированием их гидроксаматов хлороформом иэ растворов с высокой концентрацией H2SO4. Не мешают фосфат-ионы, если необходимое значение pH устанавливать после добавления осадителя.
бмс-2-Пиридилгликоль при pH 5,2—8,0 количественно осаждает алюминий [564], что можно использовать для весового определения алюминия прокаливанием до А12О3. Реагент дает осадки также с Be и U(VI).
Предложено весовое определение алюминия осаждением гекс-аминкобальтихлоридом в присутствии фторидов натрия или аммония [1220]. Определению' алюминия не мешает бериллий, если Be : Al < 1 : 2.
Из слабокислого, нейтрального и аммиачного раствора алюминий количественно может быть осажден таннином в виде объемистого сорбционного соединения таннина и А1(ОН)3 переменного состава. Осадок легче фильтруется, чем при осаждении аммиаком. Осадки прокаливают до А12О3. Неудобство работы с таннином в том, что даже при малых количествах алюминия получаются очень объемистые осадки.
Методы отделения некоторых элементов от алюминия таннином уступают многим другим, и в настоящее время таннин для отделения и определения алюминия почти не применяется.
При взаимодействии солей алюминия и лития в аммиачном и щелочном растворах образуется соединение Li2O -2А12О3, которое использовано для весового определения алюминия [1027, 1089], но этот метод почти не применяется.
62
Титриметрические методы
Для определения алюминия предложены комплексометрические, ацидиметрические, алкалиметрические и другие титриметрические методы. Из них широко, применяются лишь комплексометрические методы.
Комплексометрическое титрование
Комплексометрические методы обладают высокой точностью, приближающейся к точности весовых методов, и в то же время требуют значительно меньше'времени для выполнения, чем последние. Благодаря этому комплексометрические методы нашли широкое приме 1ение при определении алюминия в различных материалах.
Алюминий с комплексоном III образует комплекс состава
-ООСН2С
-ООСН2С
/СНгСОО-^СНгСОО-
____________А1—
Н2О
Как трехвалентный металл с координационным числом 6, алюминий валентными связями присоединяется к карбоксильным группам и координационно связывается с аминогруппами и с молекулой воды. Такие комплексы преобладают в слабокислой среде. При рНД>8 преобладают гидроксокомплексонаты типа [A1(OH)(H2O)Y]2“ и [A1(OH)2Y]3-[773]. В незначительном количестве гидроксокомплексонаты образуются уже при pH 5—6 [12481.
Комплексонат алюминия — довольно прочный комплекс с константой нестойкости 10~16’13 [490, 1154]. Однако, несмотря на это, процесс его образования протекает довольно медленно. Это объясняется склонностью алюминия к образованию гидратированного иона [Al (Н2О)в]3\ Вследствие плотной упаковки молекул воды внутренней сферы гексаквоалюминиевого комплекса обменная реакция между ним и' комплексоном III при обычной температуре очень мала. При нагревании до кипения эта обменная реакция протекает быстро. Кроме того, имеет значение и то, что уже в слабокислой среде алюминий образует полиядерные гидр оксокомплексы типа А12 (ОН)Г, А13(ОН)Ги т.д. до А1„ (ОН)^ [551, 1028, 1118, ,1248], которые так же медленно реагируют с комплексоном III. Чтобы обеспечить количественное взаимодействие А1 с комплексоном III, растворы необходимо нагревать до кипения. Прямое титрование комплексоном III проводится в кипящих растворах, обратное
63
титрование — на холоду, но после введения комплексона III растворы необходимо кипятить. При обратном титровании комплексон III вводят в кислые (pH 1—2) или в щелочные (pH 12—13), но не в слабокислые (pH ~4) растворы.
Прямое' титрование комплексоном III
Титрование с ПАН и комплексонатом меди. Из прямых методов лучшим является титрование с индикатором 1-(2-пиридилазо)-2-нафтолом (ПАН) в присутствии небольших количеств комплексоната меди * [7191. Алюминий титруют в нагретых до кипения растворах с pH 3. Алюминий вытесняет медь из комплексоната, выделившаяся медь с ПАН образует окрашенный в красный цвет комплекс. После связывания всего алюминия комплексон III в конечной точке титрования разрушает комплекс меди с ПАН и окраска раствора из красной переходит в желтую (ком-плексонат меди несколько прочнее комплекса меди с ПАН, соответствующие р/Снест = 18,8 [347] и 18,3 [634]).
Титруемые растворы все время должны иметь температуру, близкую к температуре кипения. Лучше всего после титрования нагретых до кипения растворов нагреть их снова до кипения и оттитровать повторно. По указанию Флашки и Абдине [719], большое значение имеет способ нейтрализации анализируемых растворов. Лучше нейтрализовать кислые растворы ацетатом аммония до pH 4, затем добавлять уксусную кислоту до pH 3. Если кислый раствор нейтрализовать аммиаком до pH 3 и затем ввести ацетатный буферный раствор с pH 3, то получаются заниженные результаты. Причиной этого является местное повышение pH при нейтрализации аммиаком и образование полиядерных гидроксокомплексов алюминия, медленно реагирующих с комплексоном III.
Определению алюминия не мешают значительные количества К, Na, Са и Mg. Допустимы до 30 мг марганца в 100—150 мл титруемого раствора. Железо титруется количественно, поэтому можно определять сумму А1 и Fe [719]. Хром может присутствовать только в небольших количествах [430], так как в кипящих растворах ускоряется образование его комплексоната. Титан мешает [430], и должен быть удален, это можно сделать экстрагированием его купфероната хлороформом. Цинк титруется; на этом основано суммарное определение алюминия и цинка и введение поправки на содержание последнего [165,416]. Сульфат-ионы не мешают до 1,8 г, большие количества занижают результат [430]. Поэтому при разложении анализируемых образцов следует избегать введения сульфатов.
Конец титрования устанавливается очень четко, метод следует отнести к числу наиболее точных комплексометрических методов оп-
& * Некоторые авторы в качестве индикатора предлагают комплекс меди
64
ределения алюминия. Метод использован для определения алюминия в сталях [1884, 1185], в ферросплавах [146], в титановых [59], магниевых [416] и цинковых [165] сплавах, в силикатах [625], карбонатных породах [74], в материалах титанового производства [430]. См. также работы [73, 102, 133, 506].
Кислые растворы предварительно нейтрализуют аммиаком до pH 0—1 (но не выше). Вводят индикатор бромфеноловый синий и далее нейтрализуют 10%-ным раствором CHgCOONHj. добавляя его по каплям до серо-голубой окраски. Добавляют 5 мл СНдСООН. pH раствора должен быть 3 (по универсальной индикаторной бумаге); если надо, добавляют СН3СООН или CH3CC)ONH4. Вводят 5—6 капель 0,1°о-ного этанольного раствора ПАН и 2 мл ~ 0,005 М раствора комплексоната меди. Для приготовления последнего раствора 20 мл 0,05 М раствора CuSO4 титруют в присутствии 3—4 капель раствора ПАН и 2—3 мл ацетатного буферного раствора с pH 3 0,05 Л4 раствором комплексона III до появления зеленой окраски и разбавляют водой до 200 мл. Приливают воду до объема ~100 мл и нагревают до кипения. Горячий раствор титруют 0,05 М. раствором комплексона III до появления чисто-желтой окраски. Затем снова нагревают до кипения и дотитровывают. Конец титрования может считаться достигнутым, если после кипячения в течение 30 сек. не произойдет изменения окраски раствора из желтой в оранжевую [416, 719].
Титрование с гематоксилином. Е ели алюминий предварительно связать в комплекс с молочной или гликолевой кислотой, то возможно прямое титрование его с индикатором гематоксилином при pH 5,5—6 из горячих растворов [1167]. Переход окраски очень четкий. Метод испытан применительно к сплавам Ti и Al, Ni и А1 и др. Определение по методике [533] при pH 4,5—5 в растворах, нагретых до 60° С, менее точно.
Титрование с индикаторной системой комплексонат ванадия — органический реагент. Принцип этого метода, предложенного Шайо [1135], тот же, что и метода Флашки и Абдине [719]. Он основан на вытеснении ванадия из его комплексоната рядом элементов, в том числе и алюминием. В качестве органического реагента, образующего окрашенное соединение с выделившимся ванадием, применяют дифенилкарбазон, пирокатехиновый фиолетовый, морин, карминовую кислоту; титруют до обесцвечивания фиолетовой окраски (при pH < 5) или до перехода ее в бледно-розовую (при pH >5).
Титрование с хром чисто-голубым [247, 495]. Титруют нагретые до кипения растворы при pH 2 с указанным индикатором в присутствии небольших количеств меди до обесцвечивания фиолетовой окраски.
Титрование с хро м азуролом S. Метод прямого титрования с хромазуролом S (при pH 4, а перед концом титрования при pH 5), рекомендованный Тейсом [1227], не дает четкого перехода окраски раствора в эквивалентной точке и не представляет интереса [268, 625, 1066].
Другие методы прямого титрования алюминия приведены в табл. 8.
3 Аналитическая химия алюминия
65
Таблица 8
Методы прямого комплексометрического определения алюминия
Индикатор pH Примечание | Литература
1 Алюминон с метиленовым голубым 4,4 Титруют растворы, нагретые до кипения [871]
Алюмокрезон с метиленовым голубым 2 То же; в конце титрования окраска меняется из фиолетовой в голубую [268]
2-Окси-З-нафтойная кислота 3 Титруют растворы, нагретые до 50° С, в УФ до изменения флуоресценции от синей до зеленой [904]
Эриохромциаиии R 3,5-4,1 Титруют раствор, нагретый до кипения, до изменения окраски от красно-фиолетовой к желтой [800, 1215]
Пирокатехиновый фио- 3,5-4,5 В конце титрования окраска [792]
летовый 4,5-5 меняется от темно-синей к желтой [480, 533]
Галлеин 3,5 Титруют раствор, нагретый до кипения, в присутствии сульфосалициловой кислоты, повышающей устойчивость комплексона-та алюминия. Переход окраски от лиловой к красной [868]
Нафтилазоксин S 6 Титруют до розовой окраски, вводят!—2 капли 0,05 Л! раствора Си (NOsb и титруют до изменения желтой окраски в оранжево-розовую [738]
Ксиленоловый оранжевый * 3-4 Титруют в кипящих растворах до изменения красно-фиолетовой окраски в желтую [752]
Метилтимоловый синий 3-4 Титруют кипящие растворы до изменения окраски от синей к желтой [752]
* Для большей четкости точки эквивалентности применяют смесь индикатора с метиленовым голубым или метилтимоловым синим (3:1).
Обратное титрование комплексона III
Титрование с ксиленоловым оранжевым. Среди методов определения алюминия обратным титрованием наиболее точный—метод титрования с индикатором ксиленоловым оранжевым. Метод характеризуется очень резким изменением окраски раствора в эквивалентной точке.
Алюминий с ксиленоловым оранжевым при рН^>3 образует комплекс ярко-красного цвета, более прочный, чем комплек сонат алю
66
миния; поэтому прямое титрование с этим индикатором невозможно [822, 823, 894, 896]. Для обратного титрования можно использовать соли Pb, Th и Zn. Лучше всего применять соли свинца, дающие очень четкое изменение окраски раствора в эквивалентной точке (от желтой через оранжевую в красную). Оптимальное значение pH 5,0—5,5; при pH ниже 5 переход окраски менее резкий. Раствор соли свинца в качестве титранта нельзя применять, если титруемый раствор содержит большие количества сульфат-ионов, так как при этом образуется труднорастворимый PbSO4; в этих случаях лучше титровать раствором цинка. При титровании раствором тория pH надо поддерживать 2,3—3,5: при больших pH титрование невозможно, так как торий с индикатором образует более прочный комплекс, чем с комплексоном III [822, 823]. Титровать раствором цинка следует при pH 5.5, при меньших pH переход окраски менее четкий. Все три металла, применяемые в качестве титранта— Th, Pb и Zn,— образуют более прочные комплексонаты, чем алюминий, с рЛ'нес1 соответственно 23,2, 18,04 и 16,50; у комплексоната алюминия рКнест = = 16, 13 [347]. Несмотря на это, не наблюдается вытеснение алюминия из его комплексоната указанными металлами. Это объясняется большой чувствительностью ксиленолового оранжевого к Th, Pb и Zn и незначительной скоростью вытеснения, по сравнению со скоростью реакций образования окрашенных комплексов Th, Pb и Zn с ксиленоловым оранжевым.
Титрованию с ксиленоловым оранжевым не мешают значительные количества щелочных металлов и аммония (до Юг NaNO3, КС1 и NH4NO3; Юг Na3SO4 • ЮН2О несколько снижают результаты). Не мешают большие количества Mg, Са. Д и Ва, при титровании раствором тория не мешает также марганец.
Влияние многих катионов можно устранить, если использовать прием, предложенный Шайо [ИЗО, 1131]: избыток комплексона III оттитровывают раствором ацетата цинка, затем разрушают комплек-сонат алюминия нагреванием с фторидом и снова титруют раствором ацетата цинка. Расход титранта при втором титровании эквивалентен содержанию алюминия. Шайо в качестве индикатора применил бензидин и окислительно-восстановительную систему феррицианид — ферроцианид. Если этот индикатор заменить ксиленоловым оранжевым, то получается очень хороший, довольно специфичный метод, нашедший широкое применение в лабораториях.
Метод основан на реакции между комплексонатом алюминия и фторидом натрия:
A1Y" + 6 NaF = \а3А1Рб + NajY",
протекающей в слабокислой среде, в которой комплексонаты других металлов не реагируют с NaF.
При использовании фторида натрия количество Fe3+ в титруемом растворе не должно превышать 50 мг, в противном случае желтая окраска комплексоната железа будет затруднять фиксирование эк-
з*
67
Бивалентной точки. Соотношение Fe : Al не должно быть больше 10:1. Двухвалентное железо мешает определению алюминия, поэтому его предварительно окисляют азотной кислотой или персульфатом аммония [598].
Титан ведет себя подобно алюминию, но взаимодействует с комплексоном III неколичественно. Вследствие этого рекомендации некоторых авторов [62, 166, 679, 680] об определении в аликвотной части раствора содержания титана фотометрическим методом и введении поправки применимы лишь при его малых содержаниях. Титрование суммы алюминия и титана возможно при количествах ТЮ2, меньших 4 мг [229]. До 5 мг титана можно маскировать, если ввести перекись водорода (1 мл 1 %-кого раствора) перед добавлением комплексона III [854]. В присутствии больших количеств титана алюминий определяют при введении фосфатного буфера [166]. В этом случае титан осаждается в виде фосфата и титруется один алюминий. Однако присутствие фосфат-иона ухудшает четкость изменения окраски раствора в эквивалентной точке. Поэтому титан (если он присутствует в значительных количествах) лучше предварительно отделить, например, экстрагированием его купфероната. Указания некоторых авторов [31, 934], что небольшие количества титана не мешают, следует принимать с осторожностью. Действительно, влияние его незаметно при высоких содержаниях алюминия (30—50%), но может стать значительным при определении малых количеств алюминия.
Марганец образует устойчивый комплексонат, не реагирующий с фторидом. Однако в присутствии больших количеств его резкость перехода окраски индикатора ухудшается. До 5—10мг марганец практически не влияет [23, 598], большие количества необходимо отделять.
Гель кремневой кислоты затрудняет точное установление эквивалентной точки, поэтому его надо отделять.
Хром (III) образует окрашенный комплексонат сине-фиолетового цвета, что затрудняет фиксирование эквивалентной точки. По данным работы [854], до 30 мг Сг (III) не влияют на определение, при 40 мг фиксирование эксивалентной точки затруднительно, а при 60 мг —титрование невозможно. Хроматыи бихроматы не влияют на результаты определения алюминия. Поэтому Сг (III) лучше всего окислять до Сг (VI); до 50 мг Сг (VI) не мешает. Большие количества хроматов надо отделять от алюминия, например пропусканием анализируемого раствора после окисления хрома через катионит КУ-2 в Н+-форме. При этом СгО^ проходит через колонку, а алюминий сорбируется смолой; затем его извлекают кислотойи определяют описанным методом. Двухвалентные цветные металлы (Си, Cd, Со, Ni, РЬ) не влияют на определение алюминия. Однако некоторые из них (Си, Со, Ni) образуют окрашенные комплексонаты и затрудняют фиксирование эквивалентной точки. Кальций в значительных количествах (до ~ 60%) не мешает [71], но следует учесть, что он связывает часть фтор-ионов. Поэтому при высоких содержа
ниях кальция необходимо увеличить количество вводимого фторида натрия. По данным работы [854], 0,5—5,0% алюминия можно определить с высокой точностью, по крайней мере при содержании 3% Со, 3% Ni, 1% Си и 3% V, в присутствии молибдена титрование невозможно из-за трудности фиксирования Эквивалентной точки.
Водный раствор ксиленолового оранжевого мало устойчив, лучше применять смесь с хлоридом натрия (1 : 100), которая устойчива продолжительное время. Для увеличения контрастности перехода окраски применяют смесь ксиленолового оранжевого с метиленовым голубым [11731; в этом случае окраска в эквивалентной точке меняется от зеленой к красно-фиолетовой.
Титрование с ксиленоловым оранжевым описано для определения алюминия в сталях [712], в титановых сплавах [1173], ферротитане [63], магниевых сплавах [429], алюминиевой бронзе [260], в сплавах никеля с алюминием [263], в бинарных сплавах алюминия с медью [345], с цирконием [434], железом [345], с титаном [665], в тройных сплавах с цирконием и никелем [295], в бокситах, нефелиновых рудах и концентратах [16, 71, 558, 877], каолине [147, 680], в различных минералах, рудах и горных породах [23, 71, 166, 229, 372, 386, 1083], в огнеупорах [71, 135, 669, 685], шлаках [259, 447], сварочных материалах [1077].
Для определения алюминия можно рекомендовать следующую методику [71].
Анализируемый раствор разбавляют водой до 150—200 мл, вводят избыток 0,05 М раствора комплексона III (с учетом содержания элементов, реагирующих с комплексоном III в условиях определения алюминия). Нейтрализуют аммиаком (1 : 5) до pH 2—3 по тимоловому синему или по универсальной индикаторной бумаге и кипятят 3—4 мин. Прибавляют 20 мл ацетатного буферного раствора (250 г CH3COONH4 и 20мл ледяной СН3СООН в 1 л), 3—4 капли 0,1%-ного водного раствора ксиленолового оранжевого (или небольшое количество сухой смеси с NaCl). Избыток комплексона III оттитровывают 0,05 М раствором Zn (NO3)2 до изменения желтой окраски в красно-фиолетовую. Прибавляют 20 мл 4%-ного раствора NaF, кипятят 2—3 мин. После охлаждения освободившийся комплексон III, эквивалентный содержанию алюминия, оттитровывают раствором Zn (NO3)2.
Если титруемые растворы не содержат сульфат-иона в значительных количествах, то для обратного титрования лучше использовать 0,05 М раствор Pb(NO3)2.
Титрование с метилтимоловым синим. Этот индикатор является аналогом ксиленолового оранжевого и ' может быть использован в тех же условиях, что и ксиленоловый оранжевый. С обычно применяемыми титрантами — растворами тория, свинца и цинка — метилтимоловый синий образует окрашенные комплексы при несколько больших pH, чем ксиленоловый оранжевый. Оптимальные pH для тория 3—6 [422], для свинца и цинка 6,0—6,5 [163, 423].
Медведева и Мазель [253] титруют при pH 6,7—7,2.
Титрование цинком с индикатором дитизоном. Метод предложили Вэннинен и Рингбом [1248]. Избыток комплек
69
сона III титруютраствором цинка при pH 4,5 с индикатором дитизоном в водно-этанольной среде. Этанол добавляют для удержания дитизона в растворе. Окраска титруемого раствора в эквивалентной точке очень резко меняется от зеленовато-фиолетовой до пурпурнокрасной. По четкости перехода окраски этот метод один из лучших, наряду с методом с применением ксиленолового оранжевого.
Согласно авторам метода, точность метода зависит от избытка комплексона III. Однако позже Найдалом [10201 экспериментально было доказано, что ошибка титрования незначительна при любом (от 1 до 16О?6) избытке комплексона III. Это объясняется тем, что равновесная реакция между цинком и комплексонатом алюминия, наличие которой предполагали Вэннинен и Рингбом [1248], фактически не имеет места. Найдал [1020] показал, что комплексонат алюминия следует рассматривать как индифферентное вещество, неспособное вступать в реакцию с цинком. Метод титрования цинком с дитизоном обладает высокой точностью и воспроизводимостью. По данным Найдала [1020], при определении 0,02—2,0 ммолей алюминия найдено 99,93—100,04% от взятого количества последнего, стандартное отклонение составляет 0,063—0,072%.
Оптимальное значение pH 4,5; возможно титрование при pH 4,4— 5,0 [1020]. При более высоких pH переход окраски менее резок, кроме того, имеет место несколько завышенный расход раствора цинка. Это можно объяснить образованием гидроксокомплексов алюминия, сопровождающимся освобождением комплексона III. Заниженные результаты при меньших pH объясняются неполнотой реакции между алюминием и комплексоном III [1248]. Как показали Вэннинен и Рингбом [1248], необходимо добавлять комплексон III раньше буферного раствора, при обратном порядке введения получаются заниженные результаты вследствие образования гидроксокомплексов. При подготовке раствора к титрованию важное значение имеет способ нейтрализации (см. также метод с ПАН). После введения комплексона III кислые растворы, согласно Найдалу, надо нейтрализовать аммиаком до pH ~ 2 (по тимоловому синему), прокипятить, добавить буферный раствор (по каплям) и выдержать раствор горячим перед титрованием в течение 3 мин. [1020]. Слабая желтая окраска тимолового синего не мешает фиксированию эквивалентной точки. Гот-шальк [773] хорошие результаты получил при pH 4,1; есть указания [701], что можно обходиться без нагревания. Однако лучше придерживаться рекомендаций Найдала с небольшими изменениями: к кислому анализируемому раствору добавить комплексон III, нейтрализовать до pH 2—3 по тимоловому синему, ввести ацетатный буферный раствор с pH 4,5—4,7, нагреть до кипения и кипятить 2—3 мин., затем охладить под краном.
Концентрация этанола должна быть 40—50% [1248], при меньших концентрациях переход окраски не очень резкий. Оптимальное количество дитизона — 2—2,5 мл 0,025%-ного раствора в этаноле. При титровании таких количеств дитизона 0,001 М раствором цинка
*7П
индикаторная ошибка соответствует 0,12 мл последнего; этот объем надо вычитать из объема израсходованного раствора цинка.
Определению алюминия мешают катионы, взаимодействующие с комплексоном III в условиях титрования: Cd, Со, Cu, Ga, In, Fe (II), Fe (III), Th, Pb, Xi, Ti, V(IV), Zn, редкоземельные элементы; катионы, образующие с дитизоном прочные комплексы (Hg, Ag, платино-выеметаллы), катионыианионы. окисляющиедитнзон(Се (IV) ,Cr(VI), Мп (VII), Mo, V (V), Zr, персульфаты, перйодаты, нитриты). Влияние небольших количеств окислителей можно устранить введением 100 мг аскорбиновой кислоты.
Фториды, фосфаты, органические оксикислоты, сульфиды, цианиды мешают, так как взаимодействуют с алюминием или цинком. Щелочные и щелочноземельные металлы не мешают до концентрации 0,1 М, анионы СГ, SO*', С1О7, СН3СОО“ допустимы до концентрации 0,2 М. Концентрация Х’О<иона не должна превышать 0,1 М. Удобно устранять влияние многих катионов по методу Шайо с фторидом натрия [325, 326, 1288].
Ряд авторов определяет сумму алюминия и железа и вводит поправку на последнее после определения его в аликвотной части раствора [369, 567, 623, 751]. Метод титрования с дитизоном описан для определения алюминия в сталях, в металлическом уране и его сплавах [833, 1091], в цементе [623], в силикатах и горных породах [223а, 557, 567, 707, 751, 1244, 1288], в кислотных водах [639, 654] и в других материалах.
Метод определения алюминия титрованием раствором цинка по дитизону можно отнести к наиболее точным. Некоторым недостатком его считается необходимость применения этилового спирта. Расход спирта можно сократить до 10—15>ил на каждое титрование, если объем титруемых растворов уменьшить выпариванием.
Титрование раствором железа с применением салициловой или сульфосалициловой кислоты. Метод предложен Милнером и Вудхе-дом [976]. Широкому внедрению этого метода способствовали работы Башкирцевой и Якимец [42—46, 351]. Титрование обычно выполняется при pH ~ 6. После кипячения анализируемого раствора с комплексоном III растворы перед титрованием охлаждают. При титровании неохлажденных растворов (pH 5) наблюдается нечеткий переход окраски в эквивалентной точке вследствие вытеснения железом алюминия из его комплексоната [976]. Милнер и Вудхед [976] получили очень хорошие результаты при титровании 2,5—60.иг алюминия (с относительной ошибкой 0,2—0,8%) при pH 6,5. Однако, согласно исследованиям Башкирцевой и Якимец [45], в присутствии мешающих ионов лучше титровать при pH 4,8, так как влияние других ионов в этом случае значительно меньше, чем при pH 6. При pH 4,8 магний не мешает, а при pH 6 может присутствовать до 80 мг его. В 100 мл анализируемого раствора могут быть: при pH 4,8— 50 мг кальция, а при pH 6 только 5 мг. При добавлении, 0,5—
0,6 г сульфосалицилата натрия на 100 мл раствора не мешает до 30 .иг РО4". Не мешают щелочные металлы, сульфаты, нитраты, ацетаты. После кипячения с комплексоном III растворы лучше нейтрализовать горячие (70—803 С) во избежание гидролиза [461.
В кислый анализируемый раствор вводят избыток комплексона III. нейтрализуют аммиаком до pH ~2 (по универсальной индикаторной бумаге!, нагревают дс кипения и кипятят 2—3 мин. Нейтрализуют аммиаком по фенолфталеину, розовую окраску раствора обесцвечивают НС] (1 : 1) и вводят 2—3 капли избытка. Прибавляют 10 .ил ацетатного буферного раствора с pH 6 (500 г СН3СООХН4 и 20 .ил ледяной СН3СООН в 1 л). Кипятят 3 мин., после охлаждения вводят 2 ли 10°о-ного раствора сульфосалициловой кислоты и титруют 0.05 Л1 раствором. FeCl3 до изменения окраски из лимонно-желтой в золотисто-желтую [473].
Метод комплексометрического определения алюминия обратным титрованием раствором железа с применением сульфосалициловой кислоты нашел очень широкое применение в лабораториях. Его используют для определения алюминия в ферросплавах [160, 588, 589], бронзах [354, 976], в цинковых сплавах [976], в сплавах алюминия с торием [977], с кремнием [161], сурьмой и галлием [104], вшлаках [182, 350], в нефелиновых концентратах [138], в глиноземистых материалах [108], в горных породах, силикатах, огнеупорах [267, 277, 373, 975], в ТЮ2 [288], в почвах [209], алюминатных растворах [43. 44], в вулканизатах [55], золе резины [82] и др.
Титрование с использованием окислительно-восстановительных индикаторов. Имеется группа методов, в которых в качестве индикатора служит окислительно-восстановительная система ферри- и ферроцианид ц какой-нибудь органический реагент: бензидин [228, 244, 252, 302, 337, 853,876а, 1130, 1131, 1133, 1134], диметилнафтидин [21, 718, 720, 742, 980, 1006, 1007], дифениламин [242] или вариаминовый синий [703, 1256]. Конецтитрованияустанавливаюттакже потенциометрическим методом [1183]. Титрантом служит раствор соли цинка. Оптимальное значение pH 5,0—5,5. После достижения конечной точки титрования ионы Zn2+ связывают ферроцианид в малорастворимое соединение, окислительно-восстановительный потенциал системы ферри- и ферроцианид повышается и образуется окрашенный продукт окисления органического реагента. Селективность метода можно повысить по способу Шайо с помощью NaF (см. стр. 67).
На аналогичном принципе основан метод определения с окислительно-восстановительной системой Cu2+/Cu\ роданидом и вариами-новым синим В [848]. В качестветитрантаслужит0,1 М раствор ZnCL, содержащий СиС12 в концентрации 0,005 /И. Окислительно-восстановительную систему составляют ионы Си2 со следами Си'. Эта система в присутствии роданида аммония и вариаминового синего В служит индикатором. В эквивалентной точке появляются свободные ионы Си2' (а также ионы Си' в виде следов в раство-реСиС12). Одновалентная медь с роданидом аммония образует трудно растворимое соединение CuSCN, в результате окислителыю-
72
восстановительный потенциал системы повышается и вариаминовый синий В окисляется с образованием фиолетовой окраски. Оптимальное значение pH при титровании 5—5,5.
Титрование раствором цинка с индикатором э р и о х р о м ч е р н ы м Т. Методы титрования в щелочной среде менее специфичны, чем в слабокислой. Из них наиболее полно изучен метод определения алюминия титрованием раствором цинка с индикатором эриохромчерным Т. Индикаторе алюминием образует прочный комплекс, который не разрушается комплексоном III, поэтому возможно только обратное титрование. Однако и в этом случае принимают меры, чтобы комплекс алюминия с эриохромчер-ным Т не образовался (титруют при температуре ниже 10 С [633, 642] и даже при 2—5 С [1150]). Для улучшения резкости перехода окраски раствора в эквивалентной точке вводят различные растворители (этанол, метанол, изопропанол, ацетон, формамид), которые •ослабляют прочность комплексов алюминия и железа с эриохромчер-t ным Т [465, 614, 625, 876]. Большинство авторов проводит титрование при pH 10, среду создают с помощью аммиачного буферного раствора или пиридина [786], в качестве титрантов применяют раствор цинка, иногда растворы магния и марганца. Метод титрования с эрио-хромчерным Т мало селективный. Принимая во внимание все указанные недостатки, метод нельзя рекомендовать для определе-;ния алюминия.
Другие методы обратного титрования. В табл. 9 приведены прочие методы определения алюминия обратным титрованием.
Из большого числа предложенных методов обратного титрования наиболее широкое применение нашли методы с использованием ксиленолового оранжевого, дитизона и сульфосалициловой кислоты в качестве индикаторов. Сравнительное изучение комплексометрических методов выполнено авторами работ [268, 625, 800, 951, 1066]. Интересные данные приведены в работе [1066], авторы которой определили содержание алюминия в ацетате алюминия десятью различными комплексометрическими методами и полученные данные •сравнили с результатами весового оксихинолинового метода. Как •Оказалось, с индикаторами ПАН с комплексонатом меди, эриохром-•черным Т, дитизоном, ксиленоловым оранжевым и метилтимоловым •синим точность метода близка к точности весового оксихинолинового метода. Хотя и с эриохромчерным Т получены хорошие результаты, Однако его нельзя отнести к лучшим индикаторам по указанным выше причинам.
Физико-химические методы фиксирования эквивалентной точки. Кроме визуального фиксирования конца титрования применяют также фотометрическое 1684, 800,1240], потенциометрическое [757, 1080, 1081, 1183], амперометрическое [24,83] и высокочастотное [553] титрование с комплексоном III.
73
Таблиц а 9
Методы комплексометрического определения алюминия обратным титрованием
Индикатор Тнтрант pH Переход окраски в точке эквивалентности При мечания Литера гура
Ализарин S ПАН 4 (2-Пиридилазо)-резорцин (ПАР) Гематоксилин Пирокатехиновый фиолетовый Хромазурол S Th (NO3)4 CuCI2 или CuSO4 Pb (NO3)2 AlCIs C11SO4 AlCh CuSOa или Cu (NO3)2 3,5 4,3* 3 4-6 6,5-7,0 6,0 5 —6 5—6 4-6 От оранжевой к красной (нечетко) От желтой к красной То же От желтой к желто-оранжевой От желтой к р.эзовато-пур-пурной От желтой к зеленовато-синей От светло-синей или бледно-зеленой к темпо-снней От желтой к синей В расчетах используют эмпирический титр (на ~1% выше теоретического) Титруют растворы, нагретые до кипения Титруют охлажденные растворы В присутствии солей аммония раствор перед титрованием нагревают до кипения Титруют растворы, нагретые до 70° С Среду создают ацетатным буферным раствором, уротропином или пиридином Титруют при 60- 65“ С Для улучшения резкости перехода окраски рекомендовано вводить органический растворитель (ССЦ или дихлорбензол), в этом случае титруют до синей окраски слоя органически го растворителя 1381, 479, 593, 721, 784| (72, 1267] |349, 635, 922, 11511 [914] [1223] 1383, 905, 919, 1049, 1211| 146.4| [310, 315, 440, 484]
Индикатор Тнтрант pH Переход окраски в точке эквивалентности Примечания Литерат ура
Эриэхромцианин R I'лицин крезоловый красный Роданид аммония Цинкон Кальцеин W Омега-хром зеленый BLL Арсеназо Ацетил ацетон Зеленый Биндшедле-ра 1-Окси-2- или 2-окси-3-нафтойная кислота Смесь дифенилкарба-зона и комплексоната V ZhSOj Fe (Hi) CtiSOj Co (NO3)2 ZhSOj CuSO4 Th(NOs)4 ZnCI2 FeCIs FeCIs FeCIs I Z11SO4 6—6,3 4,1 6 5—7 8-9 4,8 3,5-3,6 5,5—6,2 3,5 3,0-4,0 5 ,0—5,5 От желтой к лилово-красн >й От зеленой к фиолетовой, после введения фторида от зеленой к синей От р повой к зеленовато-синей От желтой к фиолетовой От желтой к красной От красной к зеленой От желтой к синей От желтой к красной Титруют растворы, нагретые до 70—80° С Титруют при 40° С, конец титрования фиксируют фотометри чески при 582 нм Титруют горячие растворы; вводят фторид, кипятят, выделив шийея комплексон ill титру ют в горячих растворах Титруют в водио-ацетоповой среде (1:1) Титруют до тушения флуоро сценции кальцеина W в УФ Титруют в охлажденных до 1—3° С растворах в присутствии этанола [788, 795, 1132 [800] |1170, 1171] |93Д |873| 1807, 1240] |516] |183| |962| [737, 1249| [1043, 1158| |745]
Таблиц а 9 (окопчииие)
растворы нагреты до кнцення,
76
Определение алюминия в присутствии других элементов
Лучший способ определения алюминия в присутствии других металлов — использование фторида (см. выше).
Широко применяется последовательное титрование при разных pH, особенно при анализе смеси алюминия и железа. Сначала при pH 1—2 титруют железо с индикатором сульфосалициловой кислотой. Затем создают pH 5—6, и избыток комплексона III оттитровывают раствором соли железа с тем же индикатором. Описано множество аналогичных методов с применением других индикаторов для железа или же титрованием алюминия другими методами. Иногда определяют сумму алюминия и железа, затем в другой аликвотной части определяют железо, а содержание алюминия находят по разности. Однако при этом не следует применять те методы, в которых разница между величинами pH, рекомендуемыми для определения Fe и А1, незначительна. Например, в работе [509] железо титруют при pH 2 салициловой кислотой, а затем титруют алюминий при pH 3 с индикатором медь + ПАН. При определении алюминия и хрома в одном растворе использовано различие в прочности их комплексонатов при различных pH и в зависимости от продолжительности нагревания, так как комплексонат хрома образуется только после довольно длительного кипячения. В табл. 10 приведены способы определения алюминия в присутствии других металлов.
Определение алюминия другими комплексонами
Кроме комплексона III для определения алюминия предложены и другие комплексоны. Из них наибольшее значение имеет 1,2-ди-аминоциклогексантетрауксусная кислота (ДЦТА) [1084, 11691. Для комплекса алюминия с последней рДнест = 17,6 [1154]. ДЦТА имеет некоторые преимущества по сравнению с комплексоном 111 и комплексометрические методы с использованием ДЦТА весьма перспективны. В отличие от комплексона III, ДЦТА почти мгновенно реагирует с алюминием уже при комнатной температуре, большие количества нейтральных солей (NaCl, КМО3идр.) не мешают. Это использовано для упрощения хода анализа различных систем из нескольких катионов. Например, оказалось возможным определять алюминий в медных сплавах без предварительного отделения, маскируя медь тиомочевиной [1082]. В одной аликвотной части определяют сумму алюминия и железа титрованием избытка ДЦТА раствором нитрата свинца с ксиленоловым оранжевым при pH 5—5,5. В другой части раствора так же определяют железо после маскирования алюминия фторидом. Содержание алюминия находят по разности. Если в сплаве содержатся другие примеси, взаимодействующие с ДЦТА (РЬ. Zn, Ni, Мп, Sn), то сумму их находят в третьей аликвотной части
77
Таблица 10
Комплексометрическое определение алюминия в смеси с различными катионами
Металлы Способ титрования Литература
Al, Fe Прямое титрование Fe салициловой или сульфосалициловой кислотой при pH 1—2. После введения комплексона Ill избыток его титруют при pH — 6 раствором Zn с ксиленоловым оранжевым. Комплексоиат А1 разрушают фторидом, освободившийся комплексон III титруют так же (определение А1) То же, ио без NaF Обратное титрование избытка комплексона III раствором РЬ с ксиленоловым оранжевым при pH 5—5,5 (определение суммы Д1 и Fe). Комплексоиат А1 разрушают фторидом и титруют так же (определение А1); Fe находят по разности Обратное титрование избытка комплексона III раствором Th с ксиленоловым оранжевым при pH 2, / (определение суммы А1 и Fe). В аликвотной части раствора определяют Fe фотометрически с о-фенантролином; А1 находят по разности [23, 229, 667 J [23, 259] [1085] [1077]
Al, Cr Раствор нагревают с избытком комплексона III в течение 5 мин. при 40—50° С, после охлаждения титруют раствором FeCh по тироиу или сульфосалициловой кислоте (определение А1). Вводят снова комплексон III, кипятят 5 мин. после охлаждения титруют так же (определение Сг) Раствор с избытком комплексона III кипятят 5 мин., после охлаждения до 40° С титруют раствором FeCls по сульфосалициловой кислоте (определяют сумму Сг и А1). Подкисляют до pH 1, выделившийся комплексон III титруют при 60“ С так же (определение А1). Содержание Сг находят по разности Обратное титрование раствором Zn при pH 5 с окислительно-восстановительной системой ферри-ферроциа-нид и потенциометрической индикацией точки эквивалентности (определение суммы А1 и Сг). После обработки фторидом освободившийся комплексон III титруют так же (определение А1) [931] [930] [И83]
Al, Ti Обратное титрование избытка комплексона III раствором Bi с ксиленоловым оранжевым при pH 1 (0,1 М HNO3) — определение Ti. В том же растворе обратным титрованием избытка комплексона III раствором Zn с тем же индикатором при pH 5—6 определяют содержание А1 Для связывания Al, Ti и других металлов вводят комплексон III, избыток которого оттитровывают раствором Zn по ксиленоловому оранжевому, разрушают комплексоиат титана винной кислотой, освободившийся комплексон III титруют так же (определение Ti). В оттитрованный раствор вводят KF и разрушают комплексоиат А1, освободившийся комплексон III титруют так же (определение А1) [386] [63]
78
Таблица 10 (продолжение)
Металлы
Способ титрования
Литература
Al, V
Al, Zn
al, Zn
Al, Y
Al, Sc
Обратное титрование избытка комплексона III раствором Zn по ксиленоловому оранжевому — определение суммы А1 и V (IV). В другой части раствора после добавления 30%-ной Н2Ог (для разрушения комплексоната ванадия) А1 определяют титрованием избытка комплексона III раствором Zn по ксиленоловому оранжевому; V находят по разности
Прямое титрование прн pH 4,8—5,5 с индикатором комплексом Си с ПАН (определение суммы А1 и Zn). В другой части раствора А1 маскируют при помощи NH4F, a Zn титруют так же; А1 находят по разности Обратное титрование избытка комплексона III раствором Zn по эриохромчерному Т (определение суммы А1 и Zn). В другой части раствора А1 связывают смесью NH4F с винной кислотой и титруют один Zn. Содержание А1 находят по разности
Прямое титрование по ксиленоловому оранжевому в 2 N НС1 (определение Zr). После создания pH 3,5 обратным титрованием избытка комплексона III раствором Th с ксиленоловым оранжевым определяют содержание алюминия
Прямое титрование по ксиленоловому оранжевому, после маскирования А1 сульфосалнциловой кислотой (определение Y). В другой части раствора обратным титрованием избытка комплексона III раствором Zn по дитизону определяют сумму А1 и Y. Содержание А1 находят по разности
Прямое титрование при pH 2 с ксиленоловым оранжевым (определение Sc). В том же растворе обратным титрованием избытка комплексона III раствором Zn при pH — 6 с тем же индикатором определяют содержание алюминия
Al, Ga
Al, Fe, Сг
Обратное титрование избытка комплексона III раствором ZnCl2 при pH 6,5—7,5 с индикатором -эрио-хромчериым Т (определение суммы А1 и Ga); добавление NaF и титрование освободившегося комплексона III раствором ZnCl2 (определение алюминия)
Прямое титрование с сульфосалнциловой кислотой (определение Fe). Обратное титрование избытка комплексона III раствором Fe при pH 6 (определение А1). Кипячение с избытком комплексона III в течение 5—8 мин., после охлаждения обратное титрование, как указано выше (определение содержания Сг)
Прямое титрование при pH 1—1,5 с сульфосалнциловой кислотой (определение Fe). В другой части раствора при pH 5 комплексометрически определяют сумму А1 и Fe после окисления Сг (III) до Сг (VI); А1 находят по разности. В третьем растворе определяют содержание Сг объемным методом после окисления до хромата
[712]
[165]
[64]
[434]
[780а]
[112]
[71а]
[929]
[23]
79
Таблица 10 (окончание)
Металлы Способ титрования Литература
Al, Fe, Ti I Прямее титрование Fe при pH 1—1,5 с сульфосалициловой кислотой. В другом растворе также титруют сумму Fe и Ti в присутствии НгО». В том же растворе обратным титрованием с ксиленоловым оранжевым при pH 5 определяют содержание AI. Содержание Ti находят по разности [23]
Прямее титрование Fe при pH 1 с сульфосалицилс-вой кислотой. В том же растворе обратным титрованием избытка комплексона III раствором Fe при pH 4—5 с сульфосалициловой кислотой определяют сумму А1 и Ti. В отдельной аликвотной части определяют Ti фотометрически с Н2О2. Содержание AI находят по разности [661]
Al, Fe, Мп Прямое титрование Fe при pH 1 с сульфосалициловой кислотой. В другом растворе прямым титрованием при pH 8,5—9 в присутствии сегнетовой соли и небольших количеств диэтилдитиокарбамината натрия с индикатором кислотным хромтемно-синим определяют [350]
Мп. В третьем растворе обратным титрованием избытка комплексона III раствором CuSOj с ПАН при pH 6 определяют сумму Fe, Al и Мп. Содержание А! находят по разности
Прямое титрование Fe с сульфосалициловой кислотой при pH 1—1,5. В том же раствсре обратным титрованием избытка комплексона III при pH 6 раствором Fe с сульфосалициловой кислотой определяют сумму А! и Мп. В другом растворе прямым титрованием при pH 8,5—9 в присутствии сегнВтовой соли с индикатором кислотным хромтемно-синим определяют Мп. Содержание А1 находят по разности [351]
Al, Fe, Co Прямое титрование Fe при pH 1 с сульфосалициловой кислотой. После установления pH 6—7 титруют Со по мурексиду; раствор подкисляют до pH 4—5 и обратным титрованием избытка комплексона III раствором FeCIs определяют содержание алюминия [660]
Al, Fe, Прямое титрование Fe при pH 2 с салициловой кис- [72]
Mn, Mg. лотой. Обратным титрованием избытка комплексона
Ca III раствором CuSOi с ПАН при pH 3 в нагретом до кипения растворе определяют содержание алюминия. После установления pH 4,5 и нагревания до 60° С аналогичным титрованием определяют Мп. Доводят pH до 10, титруют так же и определяют сумму Са и Mg. В отдельном растворе осаждают Са в виде оксалата, после введения комплексона III титруют так же (определение Mg)
80
после маскирования меди тиомочевиной, а железа и алюминия — фторидом. В четвертой аликвотной части раствора находят медь титрованием без тиомочевины; железо и алюминий при этом маскируют фторидом. Маскирование фторидом проводится на холоду, что выгоднее, чем кипячение с фторидом в методах титрования комплексоном 1П, так как по указанию Пшибла и Весели [1084] при кипячении усиливается растворение криолита.
Применение ДЦТА упростило анализ систем, содержащих железо, алюминий и хром [1085]: оказалось возможным просто определять алюминий (и железо) вприсутствии Cr (III), а такжеА!, Fe и Cr (III) в присутствии хромата. Алюминий можно титровать на холоду в присутствии Cr (III), реагирующего с ДЦТА при кипячении. Затем в том же растворе можно определять Cr (III) после кипячения с избытком ДЦТА. Хромат в слабокислой среде не окисляет ДЦТА, поэтому можно определять А1 и Cr (III) в присутствии большого количества хромата. Такие определения с комплексоном III невозможны, так как последний частично окисляется хроматом при кипячении. Пшибл и Весели [1085] для определения алюминия и хрома рекомендуют следующие методики.
Определение А1 и Cr (III). Отбирают аликвотную часть анализируемого раствора, содержащую не больше 25 мг хрома. Добавляют ДЦТА в количестве, достаточном для связывания всего алюминия, и некоторый избыток. pH доводят до 5—5,5 уротропином (проверка индикаторной бумагой), разбавляют до 250 мл, вводят ксиленоловый оранжевый и титруют 0,05 М раствором Pb(NO3)2 до изменения слабой желто-зеленой окраски раствора до интенсивной фиолетовой (определение алюминия). Добавляют еще ДЦТА в количестве, достаточном для связывания всего хрома, и некоторый избыток, кипятят 10 мин., охлаждают, разбавляют до 500—600 мл. pH раствора доводят до 5—5,5 уротропином и титруют, как и при определении алюминия (определение хрома). При втором титровании окраска меняется так же резко, как и при первом.
Определение А1 и Сг (III) в присутствии хромата. Желтая окраска хромата не влияет на четкость изменения окраски раствора. В качестве титранта используют сульфат цинка (нитрат свинца образует осадок РЬСгО4, который медленно растворяется в ДЦТА). К кислому раствору, содержащему Al, Сг (III) и Cr (VI), добавляют избыток ДЦТА и титруют алюминий 0,05 М раствором ZnSO4, как указано выше. После повторного добавления избытка ДЦТА и кипячения раствора в течение 10 мин. определяютСг (III). Переход окраски в обоих титрованиях очень резкий.
ДЦТА использована для определения алюминия в высоколегированных жаропрочных сплавах [600], в медных сплавах [1082], силикатах [704, 1087], хромовых рудах и огнеупорах [507], марганцевых рудах [509], в основных шлаках [509].
Вилкинс [1268] определял алюминий с оксиэтилендиаминтетра-уксусной кислотой в присутствии марганца (образует с последней в кислой среде очень слабый комплекс) обратным титрованием раствором меди при pH 5 с флуоресцентными индикаторами (метилкальцеин или метилкальцеин синий).
Применение нитрилотриуксусной кислоты не имеет преимуществ по сравнению с комплексоном III [1249].
81
Ченг [633] сообщил о возможности использования для титрования и маскирования комплексона Хел-242, очень похожего по свойствам на комплексон III.
Определение с оксихинолином
Эти методы основаны на осаждении оксихинолината алюминия, растворении последнего в кислоте и бромато.метрическом определении связанного оксихинолина.
Условия осаждения оксихинолината алюминия см. на стр. 32. Использование титрования значительно сокращает продолжительность анализа. К тому же благодаря использованию на последнем этапе определения самого точного объемного метода—иодометрии—можно получить достаточно высокую точность. Поэтому эти методы весьма ценны. Обычный ход определения в отсутствие мешающих элементов сводится к следующему.
Выделяют оксихинолинат алюминия, фильтруют через бумажный фильтр (средней плотности) и промывают (см. стр. 35). Осадок растворяют в горячей смеси 30 мл НС1 (уд. вес 1,19) и 50 мл воды, прибавляя ее небольшими порциями. Фильтр промывают водой, раствор и промывную воду собирают в коническую колбу с притертой пробкой емкостью 300 мл, с меткой на 150 мл. Разбавляют до 150 мл и охлаждают до комнатной температуры. Раствор медленно титруют 0,1 или 0,2 7V раствором КВгО3, содержащим —20 г КВг/д. Перед концом титрования добавляют несколько капель 0,1%-ного раствора метилового красного и продолжают медленно титровать до желтой окраски. После этого добавляют еще 2 мл раствора бромата. Колбу закрывают стеклянной пробкой, перемешивают и спустя 2—3 мин. вводят ~ 2 г KJ, растворяют его, перемешивая раствор. Выделившийся иод титруют 0,1 N раствором Na2S2O3, в конце титрования добавляют крахмал. 1 мл 0,1 N раствора КВгО3 эквивалентен 0,2248 мг алюминия или 0,4248 мг окиси алюминия [644].
Мешающие вещества предварительно отделяют до осаждения оксихинолината алюминия или же маскируют в процессе осаждения.
Классен и др. [645] повысили избирательность метода путем осаждения оксихинолината алюминия из аммиачного раствора, содержащего цианид и комплексон III, при pH 8,5—10.
В этих условиях устойчивость оксихинолината алюминия значительно выше устойчивости его комплексоната, поэтому алюминий осаждается количественно. При использовании этого метода от алюминия отделяются многие металлы благодаря образованию цианидных комплексов и комплексонатов. Железо должно быть восстановлено до Fe (II). Для восстановления феррицианида применяют сульфиды [793], сульфиты [645, 702, 916, 1109, 1250] или просто кипячение щелочных растворов [585, 1061, 1196]. Лучшим восстановителем служат сульфиты. Определение 2—20 мг алюминия возможно в присутствии 0,5—1 г следующих элементов: Ag, As (III), As (V), Au, Cd, Ce (III), Се (IV), Co, Cu, Fe (II), Fe (III), Ge, Hg (I), Hg (II), La и РЗЭ, Mg, Мп, Mo (VI), Ni, Pb, Pd, Pt, Sb (V), Se (IV), Se (VI), Sn (IV), Те (IV), Те (VI), TI (I), TI (III), W (VI), Zn и щелочноземельные металлы. He мешает до 50 мг Y; при больших количествах
82
теряется ~ 0,5 мг алюминия. Хлориды, сульфаты, нитраты и перхлораты не мешают.
В этих условиях осаждаются Be, Bi, Ga, Hf, In, Nb, Sb (HI), Ta, Th, U и Zr. В присутствии скандия определяется только 80—90?о алюминия. Cr (VI) осаждается неполностью в виде оксихинолината; до 20 мг Cr (VI) мешает очень мало. Влияние Cr (III) значительно сильнее. Если содержание хрома < 20 мг, его влияние устраняют окислением до Cr(VI). Кроме того, хром можно связать в комплексонат кипячением с комплексоном III в течение 5 мин., при этом железо должно быть восстановлено кипячением с сернистой кислотой. Фториды до I мг не мешают, большие количества занижают результаты, даже в присутствии большого избытка Н3ВО8. Ортофосфаты не мешают, если не присутствует одновременно более 100 мг Fe (фосфаты препятствуют полному восстановлению Fe). Ванадий осаждается неполностью. Влияние ванадия меньше при pH <9. Титан полностью осаждается в виде оксихинолината при pH 9 и ниже, при pH >9 осаждение неполное.
Раствор, содержащий 2—20 мг алюминия, разбавляют до —100 мл, прибавляют 5 мл 20%-кого раствора лимонной кислоты и небольшой избыток 7 Л4 раствора NH4OH. Добавляют 3 г KCN и 1 г безводного Na2SO3. Перемешивают до растворения солей и разбавляют до 150—250 мл. Медленно нагревают до 80—90° С и поддерживают эту температуру 2 мин. Затем вводят 1 г комплексона III и выдерживают при температуре 80—90° С в течение 2 мин. После охлаждения до 70° С прибавляют при энергичном перемешивании по 0,70 мл 2,5%-ного раствора оксихинолина (25 г реагента растворяют в 29 мл 6 М НС1, разбавляют водой до 1 л) на каждый миллиграмм алюминия и избыток 20 мл. Нагревают до 80—90° С и выдерживают раствор при этой температуре 30 мин. После охлаждения до 50° С раствор отфильтровывают декантацией через бумажный фильтр средней плотности. Осадок промывают небольшими порциями теплой (50—60° С) промывной жидкости (см. стр. 35) декантацией. Расход промывной жидкости не должен превышать 100 мл. В конце дважды промывают холодной водой, порциями 5—10 мл. Осадок затем растворяют и заканчивают анализ так же, как описано выше при осаждении из слабокислых растворов [645].
При анализе стандартных образцов различных материалов (сталей, магнитных сплавов, бронз, латуней, магниевых и цинковых сплавов, стекла) по этой методике Классен и др. [645] получили очень точные результаты. При содержании от ~ 1 до ~ 7% алюминия расхождение с данными весового анализа составляло лишь 0,01 — 0,03%.
Аналогичный метод применил Мор [986] при определении алюминия в медных сплавах. Ройтель [1109] при анализе цинка и его сплавов использовал для маскировки цианид в сочетании с винной или лимонной кислотой. Если в сплаве присутствует магний, то он осаждается совместно с алюминием, поэтому необходимо определить его содержание и ввести поправку (следы магния во внимание не принимают). Результаты очень точные, если Zn : А1 100.
Согласно Геокалеску [753], оксихинолинат алюминия осаждают 30—35 мл 0,4 А' раствора оксихинолина. Раствор с осадком в мерной колбе разбавляют до
83
250 мл, фильтруют через сухой фильтр в сухую колбу. 100 мл фильтрата подкисляют 30 мл НС1 (1 : 1) и содержание оксихинолина в нем определяют броматометрически. Алюминий определяют по разности между объемами растворов окснхино-лина и титранта.
Ошибка определения <0,33%.
Предложен способ оксидиметрического определения оксихинолина, связанного в оксихинолинат алюминия, титрованием раствором V (V) [958] или Се (IV) [963]. Однако этот способ более продолжительный, чем обычные броматометрические методы определения алюминия, и точность титрования не может быть настолько высокой, как в иодометрии. Оксихинолинат алюминия определяют также потенциометрическим [69], амперометрическим [127] и высокочастотным [98] титрованием.
Определение с фторидом
В этих методах алюминий титруют фторидом с индикатором на ион А13+. Применяют и обратное титрование избытка добавленного фторида раствором соли алюминия [153].
Для прямого титрования можно применить следующую методику.
К анализируемому раствору прибавляют 20 мл ацетатного буферного раствора с pH 1,7 (50 мл \N раствора CH3COONa и 55 мл LV НС1 в 250 мл), вводят 1 мл 0,1%-ного раствора аскорбиновой кислоты для восстановления Fe (III) и 3 капли 0,1%-ного раствора ксиленолового оранжевого. Нагревают до кипения и кипятят 1 — 2 мин. Горячий раствор титруют O.OLV раствором NaF до перехода малиновой окраски в бледно-желтую. При титровании необходимо вводить твердый NaCl до насыщения. Если анализируемый образец сплавляют с Na2CO3, то при нейтрализации плава соляной кислотой образуется достаточное количества NaCl, необходимое для уменьшения растворимости криолита.
Титруют также с индикаторами гематоксилином [149, 368], салицилатом, роданидом железа [400], с флуоресцентным индикатором салицилаль-о-аминофенолом [817]. Предложен способ обратного титрования избытка добавленного фторида раствором алюмокалиевых квасцов с индикатором ализарином [33]. Относительная ошибка этих методов — 1 %.
Ацидиметрические методы
Алюминий переводят сначала в гидроокись или растворимый щелочной алюминат, а затем обработкой избытком фторида натрия или калия — во фторидный комплекс (криолит). При этом освобождаются ионы гидроксила, которые оттитровывают кислотой:
А1С13 + 3 NaOH = Al (ОН)3 -f-3 NaCl; Al (OH)3 -f- 6 NaF — NasAlFj 4- 3 NaOH.
В некоторых методах для удержания алюминия в растворе добавляют тартраты или глюконат натрия. После обработки фторидом предлагают ввести известный объем кислоты, избыток которой от-
84
титровывают раствором едкого натра. Известен метод [461], в котором алюминий осаждают в виде основного карбоната пропусканием СО2 через раствор щелочного алюмината. Осадок растворяют в избытке титрованного раствора фосфорной кислоты, после чего раствор, содержащий А1(Н2РО4)3, титруют щелочью. Иногда алюминий осаждают в виде гидроокиси, которую растворяют в известном объеме кислоты; избыток последней оттитровывают раствором щелочи. Описаны различные другие варианты ацидиметрического метода.
' Алкалиметрические методы
Основаны на образовании алюминием комплексов с органическими оксикислотами с выделением водородных ионов, которые оттитровывают щелочью. Анализируемый раствор и раствор соли оксикислоты должны быть нейтральными. Из солей оксикислотприменяюг тартраты, цитраты и оксалаты. Эти методы, так же как и ацидиметрические, в настоящее время в лабораториях почти не применяются.
Арсенатный метод
В этих методах алюминий осаждают в виде арсената, последний растворяют в кислоте и определяют иодометрически связанный арсенат [251, 436, 485—487]. В зависимости от условий образуются средний арсенат A1AsO4 или основной арсенат Al6(OH)3(AsO4)4. Лучше осаждать основной арсенат, так как при этом фильтрование происходит быстрее. Арсенатными методами, по-видимому, могут быть получены достаточно точные результаты, но серьезным недостатком их является токсичность арсенатов.
Прочие методы
Бобтельский и др. предложили гетерометрическое определение алюминия титрованием растворами оксихинолина [576] и фталата калия [574]. Во время титрования измеряют оптическую плотность, растворов; вследствие образования осадков оксихинолината илш фталата алюминия поглощение растворов возрастает, достигая максимума в эквивалентной точке. Недостаток метода — длительность, титрования (5—15 мин. при очень энергичном перемешивании).
Описан метод, в котором алюминий выделяют гидролитически с помощью иодид-иодатной смеси, при этом эквивалентно количеству алюминия выделяется иод, который оттитровывают тиосульфатом [359].
Предложено осаждать алюминий при помощи п-окси-т-нитро-фенилфосфината натрия и броматометрически титровать реагент, содержащийся в осадке [258]. Известен метод титрования алюминия
85
оксалатом. Конец титрования устанавливают графически по ослаблению свечения комплекса алюминия с морином [379]. Описан метод, в котором алюминий осаждают в виде оксихинолината и определяют в нем содержание азота азотометрическим методом [389]. Все эти методы определения алюминия мало перспективны.
Потенциометрическое титрование
Определение с фторидом. Потенциометрическое определение алюминия основано главным образом на титровании фторидом. Имеется несколько вариантов этого метода. В первоначальном варианте компенсационного потенциометрического титрования, предложенном Тредвеллом и Бернаскони [1232], анализируемый раствор титруют раствором фторида натрия в атмосфере СО2 в присутствии нескольких капель смеси Fe (III) и Fe (II), используя платиновый и каломельный электроды. Fe (III) с фторидом образует аналогичный криолиту, но менее прочный комплекс Na3FeF6. При титровании сначала реагирует А1, затем Fe (III); из-за связывания Fe (III) в комплекс резко изменяется величина окислительно-восстановительного потенциала системы Fe3+,Fe2'. Этот скачок потенциала соответствует эквивалентной точке. Для лучшего сдвига равновесия авторы предлагают использовать смесь воды и этанола (1 : 1), насыщенную хлоридом натрия. Титруемый раствор должен иметь pH не ниже 2,1. В растворах с меньшим pH фторидный комплекс разрушается и невозможно установить конец титрования. Вариант Тредвелла и Бернаскони оказался все же не очень удобным для практического применения. Скачок потенциала был не очень резким и одно титрование требовало 40— 50 мин. В дальнейшем другие авторы усовершенствовали его. Показано, что для более резкого изменения потенциала в эквивалентной точке Fe (III) надо вводить в небольших количествах [407]. Согласно Талипову и Теодоровичу [392], резкий скачок наблюдается при введении смеси Fe3+ и Fe2+ в соотношении 3,5 : 1. По мнению Поляк [340] и других [441], можно улучшить метод и сократить продолжительность титрования, если в момент, когда первоначальный потенциал начнет падать, добавить еще немного разбавленной кислоты. При этом потенциал системы возвращается до первоначального значения и остается постоянным до эквивалентной точки.
Однако Манхен [951а], Тараян и Овсепян [408] указывают, что этот прием не всегда приводит к правильным результатам. Лучше сразу установить необходимое значение pH. Согласно Манхену [951а], оптимальное значение pH — 3,6—4,0 при применении в качестве индикаторного раствора смеси 0,1 г FeCl3-6H2O и 20 г FeCl2-4H2O в 100 мл, подкисленной несколькими каплями 0,1 N НО, и pH 2,5—4,6 — при применении смеси 0,05 г FeNH4(SO4)2 и 0,05 г Fe (NH4)2 (SO4)2 в 100 м.л (подкисленной также). Тараян
86
и Свсепян [408] дают более низкие значения pH. По мнению этих авторов скачок наблюдается строго в эквивалентной точке при pH 2,2—2,5. Начальный pH титруемых растворов должен быть не выше 3,0—3,1. При pH выше 3 может образоваться гидроокись железа и скачок потенциала наблюдается раньше, до полного-связывания алюминия во фторидный комплекс. Авторы рекомендуют нейтрализовать анализируемые растворы (а также стандартные растворы шри установлении титра раствора NaF) в присутствии индикатора тропеолина 00 (pH перехода окраски 1,4—2,6).
Согласно Манхену [951а], предпосылкой для правильного опре-деленйя, кроме точного установления pH, является также добавление равных количеств фторида натрия через равные интервалы времени (после прибавления 0,5 мл NaF каждый раз надо ожидать 1 мин. до прибавления следующей порции). Для перемешивания нужно применять магнитную мешалку.
Метод Тредвелла и Бернаскони использован для определения алюминия в сталях [136], в магниевых [340, 999] и медных [136, 1192] сплавах, в бокситах.
Чирков [481] предложил метод определения алюминия потенциометрическим некомпенсационным титрованием фторидом, с использованием алюминиевого индикаторного электрода в паре, с электродом из нихрома. Оптимальное значение pH 3—7, насыщение раствора хлоридом натрия увеличивает резкость скачка потенциала [311, 412, 481]. Метод Чиркова по сравнению с методом Тредвелла и Бернаскони имеет ряд преимуществ: продолжительность титрования меньше и не нужно расходовать этиловый спирт. Метод Чиркова нашел широкое применение в лабораториях. Его используют для определения алюминия в стали [248, 418], в никелевых [95], цинковых [65] и магниевых [65, 66] сплавах, в шлаках [228], в почвах [8] и в других объектах. Исследованию этого метода посвящены! работы [151, 202, 311, 312].
Определению алюминия фторидным потенциометрическим методом мешают Fe (III), Ti (IV), Cu (II). Не мешают: Mg, Са, Мп,. Zn, Ni, Cd, W, Mo (VI), Cr (III), Fe (II), Zr, Ti (III), V, Nb, Si. Влияние многих элементов можно устранить восстановлением металлическим цинком, при этом Cu, Sb, As и Sn осаждаются, Fe (HI),. Ti (IV), Mo (VI) восстанавливаются и не мешают определению [95]. Предложено также устранять влияние Ti (IV) восстановлением' амальгамой [202]. Железо и некоторые другие мешающие элементы, предлагалось отделять щелочью [136, 412], медь отделяют электролизом [64].
Определение с другими реагентами. Алюминий можно титровать потенциометрически раствором едкого натра. Поляк [340] определяет алюминий в магниевых сплавах некомпенсационным титрованием раствором едкого натра, используя в качестве индикаторного сурьмяный и в качестве электрода сравнения — насыщенный каломельный электрод. Относительная
87
ошибка метода 3%, что приемлемо для ускоренных анализов. Метод прост; полный анализ, включая растворение пробы, длится 20 мин. Аналогичный метод описан в работе [450а].
Титрование щелочью с применением сурьмяного электрода использовано для определения алюминия в алюминатных растворах 1801. 986а].
Штамлер и Печниц [1192] определяют алюминий в медных сплавах компенсационным потенциометрическим методом, титруя раствором едкого натра. В качестве индикаторного электрода применяют хингидронный, электродом сравнения служит насыщенный каломельный. Медь и свинец предварительно отделяют электролизом. Алюминий осаждают аммиаком вместе с Fe и Мп и тем самым отделяют его от Zn и Ni. Затем после растворения гидроокисей в кислоте титруют алюминий щелочью, маскируя железо и марганец цианидом. Первый скачок потенциала, соответствующий нейтрализации свободной кислоты, происходит при pH 3,62; второй скачок, соответствующий взаимодействию алюминия со щелочью, наблюдается при pH ~ 6,7 (рис. 3 и 4). По разности объемов раствора едкого натра при двух скачках потенциалов определяют содержание алюминия.
В качестве титранта применяют также титрованный раствор буры [504]; индикаторным электродом служит Pt/Pt-чернь. Потенциометрическая индикация эквивалентной точки осуществляется также при титровании комплексоном III.
Рис. 3. Кривая титрования кислого раствора А1С13 (49,29 мг А1/50 мл) 0,1 (V раствором 1УаОН [1192]
Рис. 4. Дифференциальная кривая потенциометрического титрования кислого раствора А1С13 (49,29 мг А1/50 мл) 0,1 N раствором NaOH [1192]
1 — кривая титрования свободной кислоты; 2 — кривая титрования А1С1,
Амперэметрическое титрование
Амперометрическое титрование алюминия основано на испать* зовании в качестве титранта веществ, осаждающих алюминий или образующих с ним устойчивые комплексы. Титрант должен восстанавливаться на электроде (ртутном или платиновом). Возможно применение и невосстанавливающихся титрантов (например, NaF), если вводить в качестве индикатора эквивалентной точки вещество, дающее диффузионный ток (в данном случае ионы Fe3")- При амперометрическом определении алюминия в качестве титрантов используют фториды натрия или калия [52, 116, 439, 441—443, 493, 1239], оксихинолин [116, 286, 380], растворы солей железа, кальция и ванадила при обратном титровании избытка комплексона III [24, 86, 764].
Недостаток методов титрования оксихинолином или уротропином [483] в том, что для образования осадка алюминия нужно время.
Лучшие результаты могут быть получены при применении быстро реагирующих с алюминием соединений, например, фторида [1118а]. В этом случае ни алюминий, ни фторид не вступают в электродную реакцию. Поэтому для фиксирования эквивалентной точки применяют в качестве индикатора небольшие количества иона Fe3+ (0,5 мл 0,1 М раствора FeCl3). После превращения всего алюминия в труднорастворимый криолитный комплекс фторид связывает ионы Fe3+ в комплекс, и диффузионный ток Fe3+ исчезает, что указывает на конец титрования. Надо вводить поправку на количество фторида, реагирующего с Fe3+. Для уменьшения растворимости криолита предлагается титровать в растворе, содержащем 50% этанола. Этот метод использован для определения алюминия в высоколегированных сплавах [493], в медных сплавах [439, 443], в хромитах [52], в глинах и шамотах [441, 442] с применением вращающегося платинового электрода. В работе [52] показано, что конец титрования фиксируется лучше, если в качестве индикатора применять смесь ионов Fe3' и Си2+,
Бабенышев и Кузнецова [24] определяют алюминий титрованием избытка комплексона III раствором FeCl3 с амперометрической индикацией конца титрования. Сумму А1, Са и Mg определяют титрованием избытка комплексона III раствором нитрата кальция при pH 8, в другой части раствора после связывания алюминия триэтаноламином при pH 10 определяют сумму магния и кальция титрованием комплексоном III, а содержание алюминия находят по разности [86]. Алюминий определяют также титрованием избытка комплексона III раствором ванадил-иона VO2" (pH 4±0,5; ацетатный буферный раствор) по току окисления VO2+ на платиновом электроде при +0,6 в (относительно н.к.э.) [764]. Для увеличения специфичности метода вводят фториды и фосфаты.
89
Кондуктометрическое титрование
Методы определения алюминия кондуктометрическим титрованием основаны на образовании алюминием прочных комплексов с некоторыми органическими кислотами, или на осаждении его в виде труднорастворимых соединений. Пасовская [328—331] предложила несколько методов, основанных на образовании ацетатного, тартратного, оксалатного и лактатного комплексов алюминия. Определению алюминия не мешают Mg и Са; Fe необходимо восстанавливать аскорбиновой кислотой до Fe (II). Относительная ошибка этих методов ~1 %. В работе [959] предложено кондуктометрическое титрование алюминия раствором двунатриевой соли ванилиназина. С ней в среде, близкой к нейтральной, алюминий образует труднорастворимое соединение состава 1:1. Возможно определение алюминия и цинка при совместном присутствии, в этом случае второй излом соответствует концу титрования алюминия. Худякова описала метод автоматического кондуктометрического титрования для определения хлорида алюминия и соляной кислоты в одном растворе [464а]. В качестве титрантов можно использовать раствор буры или едкого натра. При титровании получаются два излома на кривой кондуктометрического титрования, первый соответствует титрованию соляной кислоты, второй — титрованию хлорида алюминия.
Некоторые авторы предлагают кондуктометрическое титрование в неводной среде: титруют алюминий раствором ЭДТА в диметил-формамиде [148] либо раствор оксихинолината алюминия раствором метоксилата калия в смеси бензола с этанолом [1236].
Кулонометрическое титрование
Этот метод представлен всего несколькими работами [200, 201, 838]. Костромин и др. [200, 201] определяют алюминий косвенно титрованием связанного оксихинолина электрически генерированным бромом. При определении алюминия в селене высокой чистоты [201] последний удаляют возгонкой в виде SeO2.
Сухой остаток растворяют в разбавленной H2SO4; устанавливают pH —9,6 (с помощью боратного буфера), удаляют мешающие элементы экстрагированием их диэтилдитиокарбаминатов хлороформом. Затем алюминий выделяют экстрагированием в виде оксихинолината бензолом. Выпаривают бензол, растворяют оксп-хинолинат в НС1 (уд. вес 1,19) и связанный оксихинолин определяют кулонометрическим титрованием на фоне 0,2 М KBr + 0,17V H2SO4. Конечную точку находят амперометрически с двумя платиновыми электродами, на которые накладывают напряжение 200 .ив. Предварительно кулонометрически титруют фон и вводят поправку.
В методе, предложенном Ивамото [838], выделяющиеся при образовании оксихинолината алюминия ионы Н+ титруют электрически генерированными ионами ОН”. Титрование проводят в водно-
90
этанольной среде (1 : 1). Конец титрования устанавливают по изменению pH раствора. В качестве инертного электролита используют сульфат натрия, концентрация которого должна составлять —0,05 Л1. Относительная ошибка до 8%. Ион СГ' влияет на определение; магний, щелочные и щелочноземельные металлы не мешают.
Другие электрохимические методы
Исследовалась возможность определения алюминия методом высокочастотного титрования с использованием в качестве титрантов едкого натра, гидроокиси бария, морина и эриохромцианина R [663]. Титрование весьма продолжительно (30 мин. и больше) при не очень высокой точности. Поэтому эти методы не представляют интереса.
Определение алюминия высокочастотным титрованием с использованием NaOH, Ва(ОН)2, NH4OH, триэтаноламина, СН3СООН, HF [1094, 1095, 1164] и оксихинолина не имеет преимуществ по сравнению с обычно применяемыми методами.
Описан метод разделения и определения алюминия и других компонентов раствора силиката, основанный на различной подвижности ионов [ 183]. Точность метода невысокая, при содержании 7—19% алюминия относительная ошибка достигает 8—12%.
Фотометрические методы
Фотоме1рические методы широко применяются в аналитической химии алюминия. Ион А13+ не обладает хромофорным действием, поэтому для определения алюминия используются исключительно окрашенные реагенты. Обзор фотометрических методов определения алюминия рассмотрен в работах [360, 421].
Определение с алюминоном
Спектры поглощения и состав комплекса. Для фотометрического определения алюминия наиболее часто применяется алюминон *. Для максимума поглощения комплекса алюминия с алюминоном указывается длина волны 528 [758]. 530 [780], 535 [776, 1287] и 540 нм [545]. По нашим данным, максимум находится при 535 нм (рис. 5). Алюминий и алюминон входят в комплекс в соотношении 1 : 1. В молекуле алюминона в образовании комплекса с алюминием участвуют солеобразующая и карбонильная группы хиноидного кольца. Строение комплекса можно пред-
* Алюминон — трехзамещенная аммонийная соль ауринтрикарбоновой кислоты, относится к группе красителей трифенилметанового ряда. Впервые предложен Хэмметом и Соттери в 1925 г. [788а].
91
ставить следующей формулой:
Влияние pH. Максимальная окраска комплекса алюминия наблюдается, по указаниям различных авторов, при pH 3,2—3,8 .[1287], 3,9—4,2 [1179, 1278] и 3,8 [780, 1117]. В присутствии тиогликолевой кислоты, добавляемой для устранения влияния железа и некоторых других металлов, рНтах смещается от 3,8 к 4,4 [7801 (рис. 6). При рНтах реагент поглощает мало, но с уменьшением pH окраска реагента сильно увеличивается. Наибольшая чувствительность метода наблюдается при pH 3,8—4,0. Однако при этих значениях pH нежелательно работать из-за наложения окраски реагента, малой устойчивости комплекса алюминия и опасности выделения свободной ауринтрикарбоновой кислоты. Нецелесообразно проводить определение также при рекомендуемых иногда в литературе очень высоких значениях pH — 6,0 [1203] и 6,3 [1120], так как при этом чувствительность метода сильно снижается.
Рис. 5. Спектры [поглощения алюминона и комплекса алюминия с алюминоном
1 — Л1 (pH 5,2) раствор алюминона относительно воды; 2 — комплекс алюминия с алюминоном относительно раствора реагента (концентрация алюминия 5*10“* М, pH 5,22)
Рис. 6. Влияние тиогликолевой кислоты на окраску комплекса алюминия при различных pH [780]
1 — раствор, содержащий 20 мкг AI/50 мл; 2 — то же н 0,08%-ную тиогликолевую кис лоту
92
Рис. 7. Зависимость pH от содержания кислоты (Ах, г-экв) в ацетатном буферном растворе (СН3СООН : СН3СООХа =1:1)
4 5 6 pH
Оптимальными значениями pH следует считать 4,4—4,75. При pH 4,4 в присутствии тиогликолевой кислоты изменение интенсивности окраски с изменением pH ничтожно. С другой стороны, если для создания среды применять ацетатный буферный раствор, то его буферная емкость наибольшая при pH 4,75 (р/( кислоты 4,75), следовательно, эти значения pH проще поддерживать постоянными (рис. 7). Обычно алюминий определяют при pH 4,4 [19, 38, 1074, 1114, 1119], 4,75 [223, 249, 267,449,468,780, 1086] или при pH 4,4—4,75 [776, 1203].
Ряд авторов рекомендует определять алюминий при pH 5,0— 5,3; хотя в этом случае чувствительность метода ниже, а зависимость окраски от pH больше, чем при pH 4,4—4,75, но, применяя ацетатный буферный раствор с большой емкостью, можно свести до минимума колебания pH. При pH 5,0—5,3 меньше наложение окраски избытка реагента, комплекс алюминия более устойчив, особенно при нагревании, поэтому последний вариант метода очень широко и успешно применяется при анализе самых разнообразных материалов [105, 155, 179, 336, 382, 545, 555, 649, 659, 697, 829, 938, 939, 955, 1037, 1053, 1162, 1194].
Ранее были предложены методы, в которых окрашенное соединение алюминия получали в слабокислой среде, а затем для уменьшения окраски избытка реагента снижали pH раствора смесью аммиака и карбоната аммония или аммиака и борной кислоты до 7,1—7,5 [1003, 1202, 1203, 1278, 1282]. Однако эти методы применять нецелесообразно, так как в слабощелочной среде вместе с ослаблением окраски избытка реагента сильно уменьшается и окраска комплекса алюминия.
Для создания среды лучше всего применять ацетатные буферные растворы. Бифталатные буферные растворы [262, 264] нельзя приготовить с такой большой буферной емкостью, как ацетатные, из-за меньшей растворимости фталатов.
Развитие окраски комплекса во времени. При обычной температуре окраска комплекса развивается медленно; нагревание ускоряет ее развитие (нагревать необходимо на
93
кипящей водяной бане). Относительно продолжительности нагревания имеются самые разнообразные рекомендации(от 4 до 20 мин.). Согласно Люку и Брауну [939], Юаню и Фискелу [1287], растворы необходимо выдерживать 5 мин. на сильно кипящей водяной бане. Крафт и Мейкпейс [659] рекомендуют нагревать в течение 15— 20 мин, или же нагревать 10 мин. и выдерживать на воздухе 10 мин. Ряд авторов считает необходимым нагревать 10 мин. [776, 1024], а Банерджи [545] — 20 мин. На основании собственного опыта работы считаем, что для практически полного развития окраски комплекса достаточно нагревать на кипящей водяной бане 5 мин. и затем охлаждать в водяной бане до комнатной температуры.
Некоторые авторы получают окрашенное соединение без нагревания и измеряют оптическую плотность через строго определенное время, например, измеряют через 30 ± 0,5 мин. [780]. Такой способ дает плохо воспроизводимые и менее точные результаты, чем метод с нагреванием, если даже измерять оптические плотности через строго определенное время. Поэтому для получения более точных результатов всегда нужно применять метод с нагреванием.
Температура фотометрируемых растворов несколько влияет на оптическую плотность [555, 1074, 1258]; чем выше температура, тем больше оптическая плотность. Поэтому температуру растворов необходимо по возможности поддерживать постоянной. Температура стандартного раствора при составлении калибровочного графика и температура исследуемого раствора могут отличаться не более, чем на 5° С [555].
Объем раствора во время развития окраски. Оптимальный объем раствора во время развития окраски 20—30 мл [545, 659, 1282]. С увеличением объема оптическая плотность уменьшается.
Количество алюминона. По данным Крафта и Мейк-пейса [659], оптимальное количество алюминона 3,3—5 мг, что достигается применением 10—15 мл алюминонового буферного раствора, содержащего 1 г алюминона в 3 л. Согласно Гранту [776], при содержании 60 мкг алюминия для получения максимальной оптической плотности нужно 4 мг алюминона в 50 мл раствора.
Применение защитных коллоидов. Для стабилизации алюминонового комплекса (лака) предложены различные защитные коллоиды: крахмал, желатин, гуммиарабик, глицерин. Все они увеличивают устойчивость алюминонового лака и не влияют на интенсивность его окраски, но лишь до некоторого предела, выше которого подавляется развитие окраски. В конечном объеме 100 мл оптимальные количества защитного коллоида составляют: крахмала — до 5 мл 2%-ного раствора [1284], гуммиарабика — 1—4 мл 1%-ного раствора [1029, 1287], желатина — 5 мл 1%-ного раствора [659, 939], глицерина — 20 .ил. Удобно заранее смешивать защитный коллоид с раствором алюминона и буферного раствора; это упрощает выполнение анализа.
Качество алюминона и приготовление его раствора. Как правило, реагент разных изготовителей дает с алюминием окраски неодинаковой интенсивности. Калибровочные графики, построенные с применением реагентов разных предприятий, даже разных партий одного и того же предприятия, не совпадают. Поэтому с каждой новой партией алюминона надо составлять новый калибровочный график. О приготовлении и свойствах алюминона имеется довольно обширная литература [813. 1146, 1179, 1202, 1292 и др.].
Во многих работах предлагают применять 0,1 °о- или 0,2%-ные растворы алюминона. Однако такие растворы сохраняются недолго и, кроме того, результаты получаются менее воспроизводимые, чем при использовании так называемого составного алюминонового раствора; составной алюминоновый раствор годен в течение многих месяцев.
Составной алюминоновый буферный раствор готовят следующим образом [939].
В стакан емкостью 2 л наливают 1 л воды и 80 мл ледяной СН3СООН и в них растворяют 500 г CH3COON’H4. 1 г алюминона растворяют в 50 мл и соединяют с буферным раствором. 2 г бензойной кислоты растворяют в 20 мл метанола (или этанола) и вливают в буферный раствор. Смесь разбавляют водой до 2 л.
Растворяют 10 г желатина в 250 мл воды при нагревании на кипящей водяной бане; время от времени перемешивают до полного растворения желатина. Теплый раствор желатина вливают в 500 мл воды при перемешивании. Охлаждают до комнатной температуры и разбавляют водой до 1 л. Растворы алюминона и желатина переводят в склянку емкостью 4 л со стеклянной пробкой, хорошо перемешивают и сохраняют в темном месте.
Окраска раствора алюминона при стоянии несколько ослабевает, особенно в первые сутки. Поэтому составной алюминоновый раствор перед использованием следует выдержать 3 дня. Раствор пригоден для работы в течение месяца.
Вместо раствора желатина можно вводить 800 мл глицерина [1053], в этом случае составной раствор алюминона получается более прозрачным. Оуэн и Прайс [1037] растворяют бензойную кислоту не в метаноле, а в изопропиловом спирте. Введение изопропилового спирта в раствор алюминона обеспечивает большую однородность окраски в фотометрируемсм растворе и, следовательно, лучшую воспроизводимость результатов. Раствор, приготовленный по методике Оуэна и Прайса * [1037], лучше сохраняется, иегоможно использовать сразу после изготовления.
Соблюдение закона Бера. По данным разных авторов, закон Бера соблюдается до 50 мкг [170, 649J, до 60 мкг [776] и до 70 мкг [1203] алюминия в 50 мл. Такая разноречивость объясняется неодинаковыми условиями определения: в первых
* В отличие от Люка и Брауиа [939], авторы растворяют бензойную кислоту в 750 мл изопропилового спирта (вместо 20 мл метанола).
95
двух работах определение проводится при pH 5,3 и 5,0—5,2, в последних — при pH 4,5.
Чувствительность реакции алюминия с алюминоном 0,05 мкг!мл [284].
Влияние катионов. Алюминон — не специфичный реагент на алюминий. Многие элементы с алюминоном образуют окрашенные соединения. Интервал pH взаимодействия металлов с алюминоном:
Элемент pH Элемент pH
Mo (VI) 1—4 Pb 6-9
Сг (III) 2-5,5 Co, Zn, Mn 7-9
Th, Sn (II), V (IV), U (VI) 2-7 Cd 7-11
Al, Fe (III), Ce (III) 2-9 Ni, Mg 9-11
Ti (IV) 2-11 Ca >11
Си (II), Be 4—9
Из других металлов наибольшие помехи проявляются со стороны Fe (HI), V (IV), Be и Си (II).
Чаще всего приходится считаться с влиянием железа. При А. = 525 нм комплекс Fe (III) с алюминоном окрашен в 2—2,5 раза меньше, чем соединение алюминия. Большие количества железа необходимо отделять от алюминия. Влияние небольших количеств Fe (III) устраняют восстановлением до Fe (II) тиогликолевой кислотой [586, 630, 632, 727, 938, 939], аскорбиновой кислотой или гидроксиламином [179, 406, 1052, 1203, 1287].
Тиогликолевая кислота (или ее аммонийная соль) восстанавливает Fe (III) до Fe (II) и связывает последнее в бесцветный комплекс. По данным Люка и Брауна [939], тиогликолевой кислотой можно устранить влияние 50 мг Fe (II), если раствор выдержать перед фотометрированием в течение 15 мин. Фотометрируемый раствор в кювете может потемнеть вследствие окисления кислородом воздуха. Поэтому, если присутствует много железа, необходимо дать раствору постоять в кювете несколько минут перед измерением оптической плотности (для восстановления железа) [1053].
Тиогликолевая кислота несколько ослабляет окраску комплекса алюминия, поэтому надо вводить ее в таких же количествах и в стандартные растворы.
Очень широкое применение нашла аскорбиновая кислота. Для восстановления 5 мг железа теоретически требуется ~10 мг аскорбиновой кислоты, но практически необходимо не меньше 75 мг ее [106]. Раствор после прибавления аскорбиновой кислоты надо выдерживать 5 мин. при 70—80° С. Следует учесть, что аскорбиновая кислота несколько ослабляет окраску комплекса алюминия с алюминоном.
При восстановлении железа гидроксиламином определение алюминия проводят при pH 5,0—5,2 [180] или 4,8 [1192а]. По дан
ным Юаня и Фискела [1287], при pH 4,8 гидроксиламин уменьшает окраску комплекса, а при pH 3,5 не оказывает влияния; поэтому авторы рекомендуют определять алюминий при pH 3,5. При восстановлении гидроксиламином допустимые количества железа меньше, чем при использовании тиогликолевой или аскорбиновой кислот. При pH 3,5 и кипячении в течение 5 мин. не мешают до 150 мкг железа; 200 мкг завышают результат на 3%, а 500 и 1000 мкг железа— на 6 и 35?ь соответственно [1287]. Согласно [1192а], при pH 4,8 не мешают трехкратные количества железа.
Предложено маскировать железо комплексоном III и эквивалентными количествами цинка [866]. Результаты удовлетворительны при 20-кратном избытке железа.
Однако этот метод, как и метод восстановления гидроксиламином, не представляет особого интереса. Наиболее эффективно влияние железа устраняется при использовании тиогликолевой и аскорбиновой кислот.
Известны способы одновременного определения алюминия и железа при совместном присутствии. По одному из них измеряют суммарное поглощение соединений этих элементов при X == 530 нм и в аликвотной части раствора определяют железо роданидом, а алюминий находят по разности [265]. В другой работе [307а] измеряют оптические плотности при % = 530 и 570 нм, т. е. при Хтах для комплексов алюминия и железа. Затем с помощью системы заранее составленных калибровочных графиков рассчитывают содержание обоих элементов.
Можно определять алюминий и железо после восстановления последнего гидроксиламином [299]; оптические, плотности измеряют при 430 и 540 нм. Содержание алюминия и железа находят с помощью специальной номограммы. Описан способ определения обоих элементов в одном растворе, основанный на фотометрическом определении железа ферроцианидом и определении алюминия алюминоном; на окраску железа вводят поправку [466). Однако необходимость суммарного определения алюминия и железа возникает очень редко.
Соединение хрома с алюминоном на холоду образуется медленно, поэтому в вариантах без нагревания он мешает мало. Согласно Шорту [1162], при pH 4,9—5,0 не мешает до 1 мг Сг, по Конкину [180] — до 0,84 мг. По данным Роллера [1120], при комнатной температуре 0,1 мг Сг(Ш) эквивалентны 0,001 мг алюминия при измерении оптической плотности через 30 мин. и 0,008 мг — через 11 час. В вариантах с нагреванием хром мешает сильно, 200 мкг Сг (III) по окраске эквивалентны 40 мкг А1 [1162, 1287]. Сг (VI) влияет меньше, чем Сг (III). Поэтому некоторые авторы предлагают окислять Сг до Сг (VI). По данным Крафта и Мейкпейса [659], не мешают до 2% Cr(VI), а по Коделлу иНорвитцу [649],— до 1%. Однако последующая проверка показала, что даже небольшие количества Сг (VI) мешают определению алюминия [545, 780]. Так,
4 Аналитическая химия алюминия
97
25 мкг Ст (VI) вызывают ошибку, эквивалентную 2 мкг алюминия [545].
Тяжелые металлы можно маскировать тиогликолевой кислотой. Медь с тиогликолевой кислотой образует настолько прочный комплекс, что оказывается возможным определять алюминий в медных сплавах. При больших количествах меди в присутствии тиогликолевой кислоты возникает зеленое окрашивание, но при измерении оптической плотности с зеленым светофильтром эта окраска мешает мало. Небольшие помехи значительных количеств меди компенсируют введением эквивалентных количеств меди в стандартные растворы и в холостую пробу [939, 1053]. Медь можно связать также в бесцветный комплекс с тиомочевиной [450].
В присутствии тиогликолевой кислоты не мешают 10 000-кратные количества цинка [1053]. Но если содержание цинка превышает 10 мг, маскирующая способность тиогликолевой кислоты падает, так как цинк связывает тиогликолевую кислоту и количество ее может оказаться недостаточными для устранения влияния железа и меди [939].
Большие количества кадмия можно маскировать тиогликолевой кислотой [1053]. В присутствии >0,1 мг свинца или висмута может образоваться осадок; в этих случаях рекомендуют нагревать раствор не дольше 3 мин., так как при более продолжительном нагревании возникает помутнение [1053]. В отсутствие тиогликолевой кислоты даже значительные количества свинца не мешают определению алюминия [1053]. Тиогликолевой кислотой можно маскировать до 10% олова [1053]. Следует иметь в виду, что олово и сурьма имеют тенденцию к гидролизу при pH определения алюминия.
. По данным Люка [938], в методе с применением тиогликолевой кислоты при измерении оптической плотности при X = 515 нм не мешают по 100 мкг следующих элементов: Ge, As (V), Sb (V), Mo (VI), Hg (II), TI (III), TI (I), Cd, Zn, Ni, Fe (III), Fe (II), Mn, Mg, Si, W, Ta, Nb, Y, In, U (VI), Ga, Се (IV), Ce (III), La, Sm, Nd, Pr, В, P, Ba, Sr, Са. Тяжелые металлы (Pb, Bi, Sn и Ag) вызывают помутнение, кобальт с тиогликолевой кислотой дает бурую окраску, которая несколько поглощает при 515 нм. Be, Sc, Cr (VI), Сг (III), V (V), V (IV), Cu (II), Cu (I), Zr, Hf, Ti и Th с алюминоном дают красные лаки; по окраске 100 мкг бериллия эквивалентны 75 мкг алюминия, 100 мкг скандия — 10 мкг алюминия, 100 мкг остальных элементов эквивалентны 5 мкг алюминия. Титан и цирконий в количествах до 20 мкг практически не мешают.
По данным Федорова и Соколовой [450], при применении смеси тиогликолевой и аскорбиновой кислот эффективность маскирования мешающих элементов больше, чем при использовании одной тиогликолевой кислоты.
Большие количества аммонийных солей несколько ослабляют окраску комплекса алюминия [223, 1162]. Также влияет хлорид 98
натрия (1 г его уменьшает оптическую плотность на 4—5% в присутствии 2—20 мкг алюминия, большие количества хлорида натрия мешают соответственно сильнее).
Влияние анионов. По данным Крафта и Мейкпейса [659], при указанном ниже содержании следующие анионы не мешают:
АииоиД Содержание» мг/мл Аииои Содержание, мг/мл
С1- 12 сю; 45
N03 60 sof 36
До 0,01 мг/мл фосфат-иона вызывают ошибку не больше 5—6% [659]. По другим данным, в 50 мл раствора максимально может содержаться 3 мг фосфат-иона, при этом ошибка не больше 3% [780]. Согласно Юаню и Фискеллу [1287], не мешают 20-кратные количества фосфат-иона; по Йоу и Хиллу [1282], не мешают до 2 мг Н3РО4. Фосфаты в количествах больших, чем указано выше, ослабляют окраску комплекса алюминия. Комплексообразующие анионы (тартраты, цитраты, фториды, оксалаты, комплексон III) мешают развитию окраски [1287]. Если в растворе присутствует перекись водорода, то она должна быть разрушена [1287]. Свободный хлор рекомендуют восстановить тиосульфатом [1163].
К анализируемому раствору прибавляют 2 мл 4%-ного раствора тиогликолевой кислоты, нейтрализуют аммиаком до pH 3 (проверка по универсальной индикаторной бумаге). Раствор переносят в мерную колбу емкостью 100 мл, добавляют 15 мл составного алюминонового раствора (приготовление см. стр. 95), перемешивают и помещают в кипящую водяную баню на 5 мин. После этого раствор помещают в холодную водяную баню. После охлаждения до комнатной температуры разбавляют водой до метки и перемешивают. Раствор наливают в кювету фотоколориметра и дают постоять 1—2 мин. (если в образце много железа). Затем измеряют оптическую плотность при X = 525 нм по отношению к раствору холостой пробы. Содержание алюминия находят по калибровочному графику, составленному в аналогичных условиях [938].
Грин [777] предложил применять для определения алюминия смесь алюминона и феррона. По указанию автора, со смешанным реагентом возможно определение алюминия в более широких пределах концентраций, чем при использовании одного алюминона, н нет необходимости в применении защитных коллоидов.
Определение с эриохромциаиииом R
Эриохромцианин R, впервые введенный в аналитическую химию Эгривом [699], является самым чувствительным реагентом на алюминий.
Свойства реагента и комплекса алюминия. Эриохромцианин R представляет собой кислотно-основной
4*
99
индикатор, показывающий несколько переходов окраски [796]: при pH 1,8—2,8 из оранжево-красной в розово-красную, при pH 4,5—6,2 из розово-красной в желтую и при pH 9,0—12,5 из желтой в сине-фиолетовую. Максимумы поглощения различных форм приведены ниже.
Окраска X, нм pH
Оранжево-красная 480 1
Розово-красная 515 3
Желтая 430 8
Сине-фиолетовая 5S0 13
Для максимума поглощения комплекса алюминия различные авторы дают разные длины волн (X в нм): 520—540 [250], 528 [1218], 530 [523, 759, 880, 881, 1247], 532 [656], 530—535 [796], 535 [568], 538 808], 540 [2856], 550 [1195]. Из них наиболее достоверное значение 530—535 нм (рис. 8). Положение максимума поглощения почти не зависит от pH и концентрации алюминия. По данным Хеге-дюса [796], имеют место лишь небольшие сдвиги максимума в зависимости от pH и концентрации алюминия. Большинство авторов [709, 808, 913, 1247 и др.] считает, что комплекс соответствует формуле A1(ER)3. Есть указания, что могут образоваться также комплексы с соотношением алюминия к реагенту 1 : 2 [808, 974] и 1 :1 [974]. Хегеман и Уилк методом изомолярных серий установили образование комплексов 1 : 1 (pH 3,0—4,7) и 1 : 2 (pH 6,3). Для комплекса 1 : 1 они нашли 1g /Суст =7,62 (pH 4,1) [800]. Хегедюс считает, что продукт взаимодействия алюминия с эриохромциани-ном R имеет переменный состав и относится к числу адсорбционных соединений. Молярный коэффициент погашения комплекса алюминия составляет 6,75-104 [656].
Многие авторы применяли водный раствор реагента. Но рас-
Рис. 8. Спектры поглощения эриохромцианина R (/) и его комплекса с алюминием (2)
творы эриохромцианина R устойчивы лишь в кислых растворах (pH до 3,5) [1212]. Особенно неустойчив реагент в области перехода красной окраски в желтую (pH 4—7). Реагент претерпевает процесс старения, но раствор реагента можно регенерировать подкислением. Для увеличения устойчивости эриохромцианина R предложено применять его никелевую соль [802]. При определении алюминия в присутствии железа лучшие результаты получаются с обесцвеченным реагентом [549].
Хромофорные группы эриохромцианина R легко разрушаются под влиянием многих восстановителей, например
100
бисульфита натрия. Восстановление хромофорных групп — обратимая реакция. Если комплекс алюминия разрушить бисульфитом натрия, то он снова образуется при добавлении 1 или 2 капель перекиси водорода. Хромофорные группы реагента более устойчивы в присутствии окислителей. Лучше всего стабилизировать реагент прибав лением NaCl, NH4NO3 и HNO3 [808]. На большую устойчивость окраски и лучшие комплексообразующие свойства такого нитрованного эриохромцианина R указывается в ряде работ [226, 568, 808, 8091. При применении нитрованного эриохромцианина R в растворах образуется азотистая кислота, которая делает окраску реагента неустойчивой из-за восстановления хромофорной группы. Эту кислоту можно разрушить добавлением мочевины и сульфаниловой кислоты. Растворы реагента, обработанные таким образом, остаются устойчивыми в течение 6 месяцев и даже дольше [809]. Предлагалось применять составной реагент эриохромцианина, гуммиарабика и буферного раствора [243, 1228].
Как и в случае алюминона, свойства эриохромцианина R зависят от способа изготовления [1247]; поэтому с каждой новой партией реагента надо составлять новый калибровочный график.
Развитие окраски во времени и влияние pH. Условия образования комплекса алюминия с эриохромцианином R наиболее обстоятельно изучили Милнер [972, 974] и Рихтер (1114].
Реакция между алюминием и эриохромцианином R протекает во времени и зависит от того, применяется ли свежеприготовленный, или выдержанный раствор реагента. Опыты Рихтера показали, что для количественного протекания реакции необходимы нагревание и кислая среда. Так, при pH 3,8 окраска развивается быстрее, чем при pH 5,4, кроме того, и воспроизводимость результатов лучше, чем при pH 5,4. По этим причинам Милнер [972], Рихтер [1114, 1115], Вальраф [1247] и другие [597, 759, 1097] считают более целесообразным определять алюминий при pH 3,8. Большинство авторов, однако, предлагает определять алюминий при высоких pH (5,4—6,1), так как при pH 3,8 окраска самого реагента значительно сильнее, чем при pH —6, и при последнем значении pH максимальная окраска комплекса больше, чем при pH 3,8 (рис. 9). Заслуживают внимания те методы, в которых используются преимущества при обоих pH. Например, окрашенные соединения получают в кислой среде, при pH 3,8 [974] и даже при pH 2,5 [754, 1218, 1257], через 20—30 мин. pH снижают до 6 для уменьшения окраски избытка реагента и измеряют оптическую плотность сразу же [974, 1257] или через 15 мин. [754]. По мнению авторов работы [1217], необходимо выдерживать растворы при pH 6 в течение 45 мин., чтобы окраска избытка реагента стала постоянной.
Для ускорения развития окраски целесообразно кипятить анализируемые растворы после прибавления всех реагентов и быстро
101
Рис. 9. Зависимость окраски комплекса алюминия с эрио-хромцианином R от pH (8311
1 — раствор реагента относительно воды; 2 и 3 — раствор комплекса алюминия относительно воды и раствора реагента соответственно
охлаждать в проточной воде [1114, 1247]. Температура фотометри-руемого раствора незначительно влияет на оптическую плотность. По данным работы [549], при 15—30° С температурный коэффициент равен 0,0035/1° для оптической плотности 0,30—1,08. При кипячении и быстром охлаждении температура фотометрируемого раствора практически не влияет на оптическую плотность [1247].
Для создания оптимальной среды применяют ацетатные буферные растворы. Нельзя применять буферные растворы, содержащие малоновую, винную и лимонную кислоты, так как они разрушают краситель. Предложено применять в качестве буферного раствора смесь анилина и анилинхлоргидрата (pH 4,8—5,2), который не влияет на поглощение комплекса алюминия.
Соблюдение закона Бера. По Хиллу [8081, закон Бера соблюдается до 80 мкг А1/50 мл; при высоких концентрациях алюминия отклонения от закона Бера можно уменьшить добавлением больших количеств эриохромцианина R.
Влияние катионов. Эриохромцианин R со многими металлами образует окрашенные комплексы. Ниже приводятся pH начала образования окрашенного комплекса [12121:
Элемент pH Элемент pH Элемент "pH
и (IV), Mo (VI) 0 Al, Be, In, U (VI) 2,5 Co 7,0
Fe (HI), Zr 0,5 Ce (III) 3,5 Mg 9,5
Ti 1,0 Си (II) 5,5 Mn 10,0
Ga, Th 1,5 Ni, La 6,5 Ca, Ba 11,0
V (V) 2,0
Как и в любом методе, прежде всего приходится считаться с влиянием железа. Для комплекса железа с реагентом А.тах = = 556 нм; хотя окраска его значительно меньше окраски комплекса алюминия, все же железо сильно мешает. Влияние последнего больше при высоких значениях pH [568], его устраняют с помощью аскорбиновой или тиогликолевой кислоты. Согласно Хиллу [8091, аскорбиновая кислота — лучший восстановитель для больших количеств железа, чем меркаптоацетат. При анализе сталей Хилл [810] предлагает использовать ее, а для железных руд можно при
102
менять и меркаптоацетат [809]. Тиогликолевая кислота и ее соли несколько уменьшают окраску комплекса алюминия, что следует учитывать при составлении калибровочного графика [809 , 925].
Хром с эрнохромцианином R образует комплекс, значительно менее окрашенный, чем комплекс алюминия [1114], и задерживает развитие окраски комплекса алюминия вследствие связывания части реагента [808]. Хром можно удалять в виде хлорида хромила. •Однако эта операция удлиняет анализ, поэтому предложены другие способы устранения его влияния. По Хиллу [808], добавление FeSO4 и 8-оксихинолина способствует образованию комплекса алюминия в присутствии больших количеств хрома. Ряд авторов [926, 1247] компенсирует влияние хрома введением таких же количеств его в стандартные растворы. Лили и Розин [926] для определения алюминия в сталях рекомендуют составлять несколько калибровочных графиков для разных содержаний хрома. При содержании 0—2% хрома наблюдается сравнительно хорошее совпадение с графиком, составленным без его введения.
Из других катионов определению 100 мкг алюминия не мешают 0,5 мг Ni, Со, Мо, Мп, W [926]. По другим данным [831] определению 4—150 мкг алюминия не мешают 3 мг Мп, 0,5 мг Сг и Sn, 0,3 мг Си и 0,15 мг фосфора. 5 мкг алюминия можно определять в присутствии 0,25 г цинка без предварительного отделения [831]. Не мешают заметные количества Cd, Pb и Sn. Влияние меди можно устранить введением тиосульфата натрия [250]. Таким образом, •оказывается возможным определять алюминий в медно-цинковых сплавах без отделения [250]. Присутствие мышьяка мешает мало [1195].
При анализах материалов сложного состава приходится прибегать к операциям отделения. Хилл [808] при анализе железных руд отделяет многие мешающие элементы от алюминия сплавлением пробы с карбонатом натрия. При выщелачивании плава в экстракт совместно с алкхминием переходит ванадий. Окрашенный комплекс V(IV) с эрнохромцианином R можно разрушить добавлением хлороформного раствора оксихинолина. Можно вводить поправку на ванадий, если известно его содержание (1% V эквивалентен 0,12% А1). Бериллий и цирконий дают окрашенные комплексы (2 мкг Be эквивалентны 1 мкг А1) [656]. Комплексы бериллия и циркония можно разрушить фторидами. Комплексон III разрушает все комплексы, за исключением комплексов этих элементов; торий образует комплекс только при низких pH и при высоких концентрациях эрио-хромцианина R. От многих элементов алюминий можно отделить при помощи NaOH [818].
Влияние анионов. Большие количества хлоридов ослабляют окраску комплекса алюминия; еще больше влияют сульфаты [1114]. Фториды и фосфаты сильно мешают даже в небольших количествах [522, 808, 1114]. Органические оксикислоты также мешают образованию комплекса алюминия.
103
Эриохромцианин R в присутствии хлорида цетилтриметилам* мония с алюминием образует тройной комплекс синего цвета с Хтах= = 587 нм и молярным коэффициентом погашения 1,17-105 [36161. Оптимальная среда — pH 5,3—6,3. Закон Бера соблюдается при 0,01—0,08 мкг М/мл. Определению алюминия этим методом мешают Р, Zr, Cu, Cr,Ga, Bi, Та, Ti, Pt, Ge, Be, Th и U.
Описано определение алюминия с солохромцианином RS, реагентом, подобным эриохромцианину R [540 , 541, 1071J. Максимальная разница между поглощением реагента и комплекса алюминия наблюдается при Х=546 нм и pH 6,1. Однако оптимальное значение pH 5,8. В этих условиях окраски очень устойчивы во времени и воспроизводимость хорошая. При pH 5, а также 6,0—6,1, по мнению авторов, окраски менее устойчивы во времени и воспроизводимость хуже. С солохромцианином PS образуют окрашенные комплексы те же металлы, которые реагируют с эриохромцианином R. Иногда встречаются работы с описанием применения солохром-цианина R; это лишь другое название эриохромцианина R.
Определение с хромазуролом S
Хромазурол S — натриевая соль 2,6-дихлордиметилсульфокси-фуксондикарбоновой кислоты. Сама кислота под названием «альбе-рон» была предложена Мустафиным и сотрудниками для фотометрического определения алюминия и бериллия [164, 285J. Затем хромазурол S был всесторонне исследован рядом авторов [18, 417, 592, 596, 772, 820, 1004, 1041, 1189] как реагент на алюминий.
Свойства реагента и комплекса алюминия. Хромазурол S имеет следующие максимумы поглощения [7, 592,950,1189]:
pH >, нм
6—7 430
—1 465
—3 495
12—13 590-600
Методами молярных отношений и изомолярных серий при pH 5,6—5,8 найдено, что алюминий и хромазурол S входят в комплекс в соотношении 1 : 2 [265а, 417, 427, 592, 820]. Авторы работы [636] указывают, что этот комплекс образуется при pH > 3,5, а при pH 3 образуется другой комплекс состава 1:1. Шривастава и др. [11891 также указывают на образование комплекса состава 1 : 1 (при pH 4). Этот комплекс показывает максимум поглощения при 570 нм [636], логарифм константы образования комплекса 5,20 [636]. По другим данным [1189], lg/Суст =4,3 (pH 4). Комплекс состава 1 : 2 имеет максимум поглощения при 545 нм [417, 592, 596, 636, 1041, 1189] (рис. 10); логарифм константы образования его
104
9,64 [636], молярный коэффициент погашения комплекса 59 300 1820]. Хромазурол S наряду с эриохромцианином R наиболее чувствительный реагент на алюминий.
Окраска комплекса алюминия с хромазуролом S развивается быстро. Для достижения максимальной окраски достаточно 10 мин., в дальнейшем окраска устойчива'в течение продолжительного времени. Интенсивность окрашивания не зависит от изменения температуры в широких пределах [1189]. Максимум окраски наблюдается при pH 5,8; с уменьшением pH окраска медленно убывает, а при pH выше 6,1 — падает очень резко (рис. 11). В области pH от 5,7 до 6,1 зависимость оптической плотности от pH незначительна. Кроме того, при этих pH реагент поглощает мало, а при pH 3—5,5 реагент сильно окрашен. Поэтому оптимальной средой следует считать pH 5,7—5,8.
При pH 4 порядок прибавления реагентов не влияет на результаты определения [1189], а при pH 5,6—5,8 он имеет существенное значение [417, 592]. Если анализируемый раствор слабокислый (pH 4—5), то окраска зависит от объема раствора перед добавлением хромазурола S (чем меньше объем, тем сильнее окраска). Этого не наблюдается при введении реагента в кислый раствор. Поэтому оптимальную среду лучше создавать не с помощью буферного раствора, а введением 5 мл 0,1 N НС1 и затем добавлением (после хромазурола S) 5 мл 2N раствора CH3COONa. pH таких растворов составляет 5,7—5,8.
На окраску комплекса алюминия влияет количество хромазурола S; с увеличением количества реагента оптическая плотность повышается. Однако большие количества реагента применять нежелательно из-за увеличения окраски холостой пробы. В присут-
Рис. 10. Спектры поглощения хромазурола S и комплекса алюминия с хромазуролом S
/ — 1,6*10-® М раствор хромазурола S относительно воды; 2 — 0,8*10”eAf раствор комплекса алюминия относительно воды
Рис. 11. Зависимость окраски хромазурола S и комплекса алюминия с хромазуролом S от pH
1 — 2 мл 0,1%-ного раствора хромазурола S относительно воды; 2 — 0,01 мг алюминия и 2 мл 0,01%-ного раствора хромазурола S относительно раствора реагента
105
твии 2 мл 0,1%-ного раствора хромазурола S можно определять до 0,030 мг алюминия. При больших количествах алюминия необходимо вводить соответственно большие количества хромазурола S.
Чувствительность метода 0,006 мкг А\/мл. На фотоколориметре можно еще определять 0,5 мкг алюминия в 100 мл раствора.
График зависимости оптической плотности от количества алюминия прямолинеен до 100 мкг А1/100 мл [1189].
Влияние катионов и анионов. Ниже приводятся значения pH, при которых образуются окрашенные комплексы некоторых металлов с хромазуролом S [683].
Металл pH устойчивости комплекса Металл pH устойчивости комплекса Металл pH устойчивости комплекса
Zr(IV) 1,5—5,5 Sc 3,0-6,5 Си (II) 4,5—7,0
Hf (IV) 1,5-7,0 In 3,5—5,5 Y 5,5-7,5
Fe (III) 2,5-4,5 Pd (II) 3,5-8,0 Cd 9,5-11,5
Th 2,5-7,2 U (VI) 4,0—6,0 Mg 10—12
Ti 2,5-6,0 Be 4,5-7,5
Из приведенных металлов многие образуют комплексы с хромазуролом S в тех же условиях, что и алюминий, следовательно, мешают определению алюминия. Например, ванадий (V) мешает мало, допустимы до 4 мг его [592], но допустимы лишь равные количества V (IV). Хром (VI) не мешает до 10 мг [820], а по другим данным [592], только до 1 мг; это противоречие несущественно, так как в условиях применения аскорбиновой кислоты Cr (VI) восстанавливается до трехвалентного. Cr (III) и Мо (VI) при pH 5 не мешают до 20-кратных количеств, большие количества ослабляют окраску комплекса алюминия [164]. Влияние Сг (III) слабее при меньших pH; так, при pH 5,8 допустимо содержание лишь равных количеств Сг (III). При pH 5 не мешают 100-кратные количества Zn, Мп, Со, Ni, As (V), V (V), Cd, Pb, Sb (III) [164]. Кальций и магний не мешают до соотношения к алюминию соответственно 10 000 : 1 и 2500 : 1, щелочные металлы допустимы в значительных количествах [417].
Sn (IV) и W (VI) мешают, так как ослабляют окраску комплекса алюминия. 1 мг W (VI) вызывает ошибку 2 отн.%.
Влияние железа при количествах до 3 мг/50 мл можно устранить восстановлением аскорбиновой кислотой. Большие количества железа, восстановленного аскорбиновой кислотой, снижают оптическую плотность комплекса алюминия [18, 1041]; поэтому предлагают вводить в стандартные растворы соответствующие количества железа. Предложено также маскировать железо тиогликолевой кислотой [820]. Тиогликолевый комплекс железа при pH 6 несколько поглощает, поэтому основную массу железа удаляют экстрагированием метилизобутилкетоном. Тиогликолевой кислотой можно маскировать до 0,5 мг Fe/50 мл. Си (II) можно маскиро 106
вать тиогликолевой кислотой и тиосульфатом. Влияние молибдат-иона можно устранить, связав его фосфат-ионом [1041]. Также устраняют помехи микрограммовых количеств титана. Влияние вольфраматов можно уменьшить добавлением ионов Са2+ [1041]. 4 мг Са2+ устраняет влияние 2 мг W (VI) при определении 20 мкг алюминия.
Из анионов определению алюминия не мешают значительные количества СГ-иона (до 3 г), нитраты, перхлораты, до 0,3 г суль-фат-иона, 50-кратные количества фосфат-иона, ионы СО32“, SO32“, S2O32', ацетаты. Мешают фториды, тартраты, цитраты, перекись водорода.
Описано определение алюминия с хромазуролом S в сталях [18, 78, 164, 378, 592, 596, 772, 820], в медных сплавах [164,997], в олове [371, 488], в цинковых сплавах [265а], в магнии [1004], в магниевых сплавах [417], в урановых сплавах [709а], в ферроборе [378], в материалах титанового производства [417], вжелезных рудах, агломератах, мартеновских шлаках [563], в минералах и горных породах [1113], в почвах и природной воде [415а]. Хромазурол S использован для дифференциального спектрофотометрического определения алюминия [265а, 417].
Ниже приведена методика для определения алюминия с хромазуролом S [417].
tgf К анализируемому раствору в мерной колбе емкостью 100 мл, содержащему до 30 мкг алюминия, прибавляют 2 мл 1%-ного раствора аскорбиновой кислоты, нейтрализуют 10%-ным раствором NaOH до pH 5—6 (проверка по универсальной индикаторной бумаге). Приливают 5 мл 0,12V НС1, воду до объема—50лы, 2мл 0,10% -кого раствора хромазурола S, 5 мл 2N раствора CH3COONa и доводят водой до метки. Через 10 мин. измеряют оптическую плотность раствора на спектрофотометре при X = 545 нм или на фотоколориметре с зеленым светофильтром по отношению к раствору холостой пробы. Содержание алюминия находят по калибровочному графику.
Хромазурол S с алюминием в присутствии хлорида цетилтриметиламмония образует синий тройной комплекс, который можно использовать для фотометрического определения алюминия [361а]. Оптимальное значение pH для образования комплекса 5,8—6,0; максимум поглощения наблюдается при 620 нм. Молярный коэффициент погашения комплекса 1,08-105. Закон Бера соблюдается при 0,01—9,06 мкг М!мл. Определению алюминия мешают Be, Ga, Ti, U, V, Zr, Си, Fe, Сг, Sn, Та; влияние Си и Fe (II) устраняют о-фенантролином.
Определение с ксиленоловым оранжевым
Ксиленоловый оранжевый — 3,3-бис- (N, N-дикарбоксиметил) -(аминометил)-о-крезолсульфофталеин — образует с алюминием интенсивно окрашенный комплекс красного цвета. Это использовано для фотометрического определения алюминия.
107
в
Рис. 12. Зависимость оптической плотности ксиленолового оранжевого и его комплекса с алюминием от pH
1 — 1 мл 0,1%-ного раствора ксиленолового оранжевого относительно воды*,
2 — 0,02 мг алюминия и 2 мл 0,1%-иого раствора ксиленолового оранжевого относительно раствора реагента
Рис. 13. Спектры поглощения ксиленолового оранжевого и комплекса алюминия с ксиленоловым оранжевым
1 — 5*10-5 раствор ксиленолового оранжевого относительно воды; 2 — 5*10-ьЛ! раствор комплекса алюминия относительно воды
Максимальное поглощение комплекса наблюдается при pH 3,4 + 0,1 [420, 696, 1036] (рис. 12). При pH 3 максимум поглощения комплекса находится при 555 нм, а у реагента — при 435 нм (рис. 13). При обычной температуре окраска комплекса развивается очень медленно, для полного развития окраски нужно около 4 час. Нагревание ускоряет образование комплекса. Для достижения максимальной окраски достаточно нагревать растворы на кипящей водяной бане в течение 3 мин. На основании изучения спектров поглощения при разных pH, а также при различных соотношениях реагента к алюминию, Отомо [1036] делает вывод, что при pH < 3 образуется комплекс состава 1:1с максимумом поглощения при 555 нм, а при pH > 4,5 образуется комплекс с соотношением реагента к алюминию 2:1с максимумом поглощения при 505 нм и в незначительном количестве комплекс состава 1:1. Поглощение раствора комплекса (Хтах = 555 нм) постепенно уменьшается при стоянии; в течение первых двух часов интенсивность окраски уменьшается на —10%. В изобестической точке (536 нм) поглощение остается постоянным несколько часов.
При pH 3,4 + 0,1 закон Бера соблюдается при содержании 5—25 мкг А1/25 мл [1036]. Чувствительность метода 0,001 мкг А\!см2 (по Сендэлу) для D= 0,001. Молярный коэффициент погашения комплекса при pH 3,4 + 0,1 составляет 21 100 [1036].
По данным Отомо [1036], определению 0,5 ммоля (—13 мкг) алюминия не мешают (если принять допустимой ошибку 5%) эквимолярные количества следующих элементов: Ba, Са, Cd, Си (II),
108
Hg (И), Мп (II), Pb, TI (III), U (VI), Co (II), Mg. Мешают определению эквимолярные количества Bi, Се (III), Сг (III), Fe (III), La, Nd, Ni, Pd, Sn (II), Th (IV), V (IV), Y, Zn, Zr (IV), Ti (IV). Небольшие количества Fe (III), Си (II), Bi, Ni, Pb, Cr (III) маскируют тиогликолевой кислотой [696]. Хлориды и нитраты не мешают. Большие количества сульфатов, фосфатов, тартратов и цитратов значительно уменьшают поглощение. Сильно мешают фториды, нитрилотриуксусная кислота и комплексон III.
Ксиленоловый оранжевый использован для определения алюминия в уране [67], в медных сплавах [261], в нефелиновых концентратах и нефелино-апатитовых рудах [17], в природных пигментах [2461. Казаков и Пушинов [154] определяли алюминий с ксиленоловым оранжевым в присутствии бериллия, маскируя его фторидом. Фторид несколько влияет на оптическую плотность комплекса алюминия, поэтому и в стандартные растворы и в холостую пробу надо вводить одинаковые количества фторида. Молот и др. [266] с помощью ксиленолового оранжевого определяли алюминий и железо при совместном присутствии. Железо определяли при pH 2,6, когда скорость образования комплекса алюминия незначительна. Окрашенное соединение алюминия получали при нагревании в течение 15 мин. при 100° С.
Вариант определения с применением комплексона III. Для увеличения селективности метода определения алюминия с ксиленоловым оранжевым используют комплексон III, маскирующий многие элементы [420]. Комплексы алюминия с комплексоном III и ксиленоловым оранжевым по прочности близки друг к другу. В растворах, содержащих комплексон III, комплекс алюминия с ксиленоловым оранжевым не образуется. Но если комплексон III добавить к уже образовавшемуся комплексу алюминия с ксиленоловым оранжевым, то окраска комплекса уменьшается лишь незначительно (на —10%). Это влияние можно компенсировать, вводя такие же количества комплексона III в стандартные растворы. Также, как и в варианте без комплексона III, наиболее интенсивная окраска наблюдается при pH — 3,5. При pH 4,5—5,5 окраска практически устойчива во времени, а при pH 3—4 уменьшается при стоянии. По истечении 30 мин. при любом pH окраска во времени изменяется незначительно, поэтому оптические плотности лучше измерять через 30 мин. после прибавления всех реагентов.
Комплексон III при pH 3 устраняет влияние следующих металлов при определении 20 мкг алюминия:
Металл Избыток металла Металл Избыток металла Металл Избыток металла
Fe (III) 1,5 In 6 Pb, Ce (III) 200
Си (II), Th 2 Bi 12,5 Co, Mo (VI) 250
Be 2,5 Gd 35 La 400
Zn, Ni 5 Pr (III), Nd 100
109
При pH 3—3,5 с ксиленоловым оранжевым не образуют окрашенных соединений и не мешают определению алюминия: щелочные металлы в значительных количествах, Sr (10 000 : 1), Са или Mg (2000 : 1), Cd (500 : 1), Мп (II) (250 : 1), W (VI) (100 : 1), Fe (II) (5 : 1). Катионы, не реагирующие с ксиленоловым оранжевым при pH 3, в количествах, превышающих указанные выше, ослабляют окраску комплекса алюминия. Некоторые элементы с ксиленоловым оранжевым образуют комплексы, близкие по устойчивости к комплексу алюминия с ксиленоловым оранжевым. Комплексы их образуются одновременно с комплексом алюминия, поэтому эти элементы ослабляют окраску комплекса алюминия. Такое влияние при pH 3 оказывают Fe (III), Zn, Y, Th, Cu, In, Bi и Ni в соотношениях, превышающих указанные выше. Некоторые элементы с ксиленоловым оранжевым образуют очень прочные комплексы, которые не разрушаются или разрушаются неполностью комплексоном III, вследствие чего они завышают результаты. При равных или меньших количествах по сравнению с алюминием мешают: V (V), V (IV), Сг (III), Zr, Ti (IV) и Ga.
Вариант с использованием комплексона III предложен для определения алюминия в материалах титанового производства [420].
Притчард [1088] определял алюминий в почвенных экстрактах с ксиленоловым оранжевым, маскируя Fe (III) и Fe (II) комплексоном III.
Ниже приводится пропись для определения алюминия с ксиленоловым оранжевым [420].
Анализируемый раствор в мерной колбе емкостью 100 ли нейтрализуют 10%-ним раствором NaOH до pH —3 (по универсальному индикатору). Прибавляют 1 мл 1 %-ного раствора аскорбиновой кислоты, 2 мл 0,1%-ного раствора ксиленолового оранжевого, 5 мл буферного раствора с pH 3 (смесь 179 мл LV НС1 и 821 мл 1 N раствора гликокола). Добавляют воду до 40 мл, нагревают на кипящей водяной бане 3 мин., охлаждают под струей холодной воды. Вводят Змл 0,025 М раствора комплексона III, разбавляют до метки водой и перемешивают. Через 30 мин. измеряют оптическую плотность на спектрофотометре при А. = 555 нм или на фотоколориметре с зеленым светофильтром в кювете с I = 3 или 5 см по отношению к раствору холостой пробы.
Содержание алюминия находят по калибровочному графику, который составляют в аналогичных условиях.
Определение с метилтимолозым синим
Метилтимоловый синий — 3,3-5uc-(N, N-дикарбоксиметил)-(аминометил)-тимолсульфофталеин — аналог ксиленолового оранжевого. Во многом подобен ему и с алюминием реагирует в тех же условиях. Метилтимоловый синий реагирует со многими металлами с образованием интенсивно окрашенных комплексов [422, 423, 426]. Многие из них разрушаются комплексоном III, а на окраску комплекса алюминия с метилтимоловым синим комплексон III практически не влияет. Поэтому, как и в случае применения ксиленоло-
110
Рис. 14. Зависимость оптической плотности растворов метил-тимолового синего и комплекса алюминия с метилтимоловым синим от pH
У — I мл 0.1%-ного раствора ме-тилтимоловогб синего (относительно воды); 2 — 0,02 мг алюминия и 1 .«л 0,1%-ного раствора метилтимолового синего относительно раствора реагента
вого оранжевого, для повышения селективности метода использу-ют комплексон 111 [420, 431].
Окраска комплекса максимальна при pH 3,5 (в присутствии больших количеств метилтимолового синего — при pH 3) (рис. 14). На холоду окраска комплекса алюминия развивается медленно, а при нагревании до кипения — мгновенно. Затем с течением времени окраска несколько ослабевает. Но это изменение очень незначительно и, если оптическую плотность всегда измерять через определенное время после прибавления реагентов, то получаются хорошо воспроизводимые результаты. Метилтимоловый синий имеет максимум поглощения при 435 нм, а комплекс алюминия — при 585—590 нм (рис. 15). При максимуме поглощения комплекса реагент поглощает незначительно, при одинаковых молярных концентрациях комплекс алюминия в сто с лишним раз интенсивнее окрашен, чем реагент. Это позволяет применять последний для определения малых количеств алюминия. Молярный коэффициент погашения комплекса при pH 3 и 590 нм составляет 1,9-104, состав комплекса 1 : 1 [420]. При средних концентрациях алюминия закон Бера соблюдается.
В присутствии 3 мл 0,025 М раствора комплексона III при pH g допустимо присутствие следующих металлов:
Металл Избыток металла Металл Избыток металла Металл Избыток металли
Be, Ni, Cr (III), Th 2,5 Zn, Co 100 Gd, W (VI) 500
Fe (III) 3 Mn, Ce (HI), 200 TI (1) 1000
Cu (II), Mo (VI) 3,5 Nd, Pr (III) Mg 2000
Bi 25 La 250 Ca 2500
Fe (11) 45 Y 300 Sr 10 000
In 80 Cd 400
Не мешают значительные количества щелочных металлов. Ga, V, Zr и Ti мешают даже в небольших количествах. Влияние Fe (III) до 0,9 мг при pH 3 устраняют аскорбиновой кислотой, но при больших pH, например, при pH 5, влияние его устранить не удается. До 3 мл 1%-ного раст-вора аскорбиновой кислоты не влияет на окраску комплекса алюминия, но большие количества несколько
Ш
Рис. 15. Спектры поглощения метилтимолового синего и комплекса алюминия с метилтимоловым синим
1 — 5*1C)-5 Л1 раствор метилтимоло-вого синего относительно воды;
2 — 5• 10-5 М раствор комплекса алюминия относительно воды
ослабляют ее. Метилтимоловый синий использован для определения алюминия в металлическом титане [431] и в различных материалах производства титана [420].
Для определения алюминия можно применять следующую пропись [420].
Раствор в мерной колбе емкостью 100 мл нейтрализуют 10%-ным раствором NaOH до pH 2—3, добавляют воду до —30 мл, 1 мл 1%-ного раствора аскорбиновой кислоты, 2 мл 0,1%-ного раствора метилтимолового синего, 5мл буферного раствора с pH 3 (смесь 179 мл!.У НС1 и 821 мл 1 N раствора гликокола). Нагревают на кипящей водяной бане Змин., охлаждают, вводят3 мл{0,025 М раствора комплексона III, разбавляют до метки водой.
Через 30 мин. измеряют оптическую плотность на спектрофотометре при X ~ 590 нм или на фотоколориметре с зеленым светофильтром по отношению к раствору холостой пробы. Содержание алюминия находят по калибровочному графику.
Определение с хромоксаи фиолетовым Р
Хромоксан фиолетовый Р как реагент для фотометрического определения алюминия предложен Мустафиным и сотрудниками [230, 231, 232 , 284а]. Реагент и комплекс алюминия поглощают при одной и той же длине волны 500 нм, но это не является помехой, так как реагент окрашен очень слабо. Молярный коэффициент погашения комплекса 52 500 [231], состав комплекса 1 : 1, кажущаяся Кнест = 4,4-10-7 [231]; максимальная окраска наблюдается при pH 5. Окраска комплекса на холоду развивается медленно, максимум окраски достигается через 3 часа, при нагревании до кипения окраска развивается сразу. Лучше работать со свежеприготовленным раствором реагента, со старыми растворами получаются несколько заниженные результаты. Чувствительность метода 0,01 мкг РА!мл. Закон Бера соблюдается в широких пределах концентраций алюминия.
Металлы Fe (III), Ti (IV), Be, Th, Си (II), V (V), Mo (VI) реагируют с хромоксан фиолетовым P приблизительно в тех же усло-112
виях, что и алюминий. Не реагируют щелочные и щелочноземельные металлы, Ni, Со, Zn, Cd, Pb, W (VI), Сг (III), Сг (VI) и Bi. Цинк и кадмий не мешают даже при 100 000-кратном избытке. Никель и кобальт мешают только своей окраской, поэтому определение в присутствии этих элементов возможно, если их вводить в стандартные растворы. Mo (VI) и W (VI) не мешают до соотношения к алюминию 8000 : 1 и 1000 : 1 соответственно. Большие количества их уменьшают окраску комплекса алюминия. Влияние Fe (III) устраняется аскорбиновой кислотой, а Си (II) — тиосульфатом.
С помощью хромоксан фиолетового Р определяют алюминий в металлических Cd, Zn, Ni, Си, в их сплавах [284а], в природных водах [232]. Предложено определять одновременно алюминий и железо [232].
Хромоксан фиолетовый Р в настоящее время еще не нашел применения в лабораториях, главным образом, из-за недоступности. По-видимому, он успешно может применяться для фотометрического определения алюминия.
Для определения алюминия был предложен алюмокрезон [218] (аммонийная соль триметилдиоксифуксонтрикарбоновой кислоты; хромоксан фиолетовый Р — натриевая соль той же кислоты).
Определение с пирокатехииовым фиолетовым
Пирокатехиновый фиолетовый в слабокислой среде с алюминием образует комплекс синего цвета, сам реагент в этих условиях окрашен в желтый цвет. Максимум поглощения реагента при 445— 450 нм [529, 1128], комплекса — при 580 нм [285а, 396, 1276] (рис. 16), по другим данным при 615 нм [529] и 620 нм [1128]. Такое расхождение можно объяснить изменением положения максимума с увеличением концентрации алюминия: сначала возникает максимум при меньшей длине волны (570—600 нм), который при увеличении отношения пирокатехинового фиолетового к алюминию до 1 : 1 смещается в сторону больших длин волн [1128]. При максимуме поглощения комплекса реагент поглощает мало.
Рис. 16. Спектры поглощения пирокатехинового фиолетового и комплекса алюминия с пирокатехиновым фиолетовым [1276]
I — 2-10_3%-ный раствор реагента относительно воды; 2 — раствор, содержащий 80 мкг А12О3 и 1 мл 0,2%-ного раствора реагента в 100 мл, относительно .доды
из
Рис. 17. Зависимость окраски комплекса алюминия с пирокатехиновым фиолетовым от pH [1276]
1 — реагент; 2 — раствор, содержащий 80 мкг А120з
Для состава комплекса также имеются различные литературные данные. Согласно Антону [529], алюминий и пирокатехиновый фиолетовый входят в комплекс в соотношении 1 : 1,5; по данным Танаки и Ямаеси [396], получается комплекс состава 1 : 2. Фактически образуется несколько комплексов. Опытами Рибы и других [1128] доказано существование монометаллического и биметаллического комплексов. Константа комплексообразования монометаллического комплекса 10 19>13, общая константа образования биметаллического комплекса 10 24>08. Молярный коэффициент погашения комплекса, по данным различных авторов, составляет 6,8-• 10 4 при 580 нм [396], 2,5—2,9-104 [1128] или 4,31 • 104 [285а].
Оптическая плотность комплекса достигает максимума при pH 5,9 [1276] и при дальнейшем увеличении pH остается постоянной (рис. 17). Окраска раствора реагента с повышением pH сначала увеличивается медленно, а начиная с pH 6,4 — довольно быстро. Наиболее благоприятные пределы pH для определения алюминия 5,9—6,1. Для создания среды можно применять ацетатный буферный раствор; так как в этой области pH емкость буферного раствора мала, то растворы предварительно надо нейтрализовать до этого значения pH. При оптимальных условиях максимальная окраска комплекса достигается через час, а затем остается постоянной несколько часов, нагревание ускоряет реакцию. Закон Бера соблюдается до 80 мкг А1/100 мл в присутствии достаточного избытка реагента (2 мл 0,15%-ного раствора) [1276]; по другим данным [396],— до 50 мкг А1/25 мл раствора.
С пирокатехиновым фиолетовым реагируют многие двух-, трех-и четырехвалентные металлы. Двухвалентные металлы реагируют при больших значениях pH, чем алюминий, и поэтому их влияние незначительно. Максимальная окраска трех- и четырехвалентных металлов наблюдается при следующих значениях pH [396, 1128]:
Металл pH Металл pH
Zr 2,20 Th 3,70
Bi 2,4 Ga 4,05
Sn (IV) 3,5 In 5,50
114
Максимумы поглощения комплексов этих металлов близки к максимуму для алюминия, молярные коэффициенты погашения их комплексов также близки к значению для алюминия — от 2,5-10* до 2,9-104 [1128]. Следовательно, все эти металлы мешают определению алюминия; мешают также Ti, Сг, V, и бораты. Fe (III) с пирокатехиновым фиолетовым образует неустойчивый комплекс вследствие окисления реагента, значит, оно также мешает.
Из двухвалентных металлов мешает медь при концентрации больше 2 ч. на млн. Практически не мешают до 5 мкг Zn, Mg, Мп, СаО и СеО2 в 100 мл и до 1 мг UO3; 1 мг бериллия и 5 мг окиси лантана вызывают ошибку—75%. Из анионов определению 80 мкг А12О3 мешают фосфаты и фториды при количествах больше 50 мкг.
Относительная ошибка метода от 0,7 до 6% при содержании А12О3 от 12 до 24%.
Пирокатехиновый фиолетовый как реагент для фотометрического определения алюминия не имеет преимуществ перед обычными реагентами на алюминий; в настоящее время в лабораториях не применяется. j ' 1 I J •
Определение с другими реагентами трифенилметаиового ряда
Кислотный хром чисто-голубой Б (хромоксан чисто-синий) с алюминием в слабокислбй и нейтральной среде образует соединение фиолетового цвета, сам реагент при pH <; 8 — золотисто-желтого, а при pH >8 — фиолетового цвета. Максимальное поглощение комплекса при 540—550 нм и pH 6* [494]. Алюминий и реагент входят в комплекс в соотношении 1 : 3 [494], молярный коэффициент погашения комплекса 20 000 [497]. Окраска комплекса постоянна в течение 8 час. Закон Бера соблюдается при 1—12 мкг А1/25 мл. Определению алюминия не мешают Zn, Mg, Ni, Cd, Pb, Мп, Co, 5-кратные количества In ийа. Двухвалентная медь мешает мало, ее влияние можно уменьшить введением тиосульфата. Трехвалентное железо сильно мешает, влияние его можно устранить аскорбиновой кислотой [196, 494, 496]. Сульфаты подавляют развитие окраски комплекса [196]. Метод использован для определения алюминия в магниевых и цинковых сплавах с относительной ошибкой до 6% при содержании 2—9% А1; метод предложен для определения алюминия в сере, при содержании его > 3-• Ю~4 %.
Сульфохром как реагент для фотометрического определения алюминия предложен в самое последнее время [237, 332в].
* В других работах тех же авторов [196, 497] указываются иные значения Хтах и РНтах (570—580 НМ и 5,4).
115
о
Рис. 18. Спектры поглощения сульфохрома и комплекса алюминия с сульфохромом [332а]
/ — 5*10*ь Л1 раствор реагента при pH 4,0; 2 — 4—5-Ю-6 А1 раствор
комплекса алюминия соответственно при pH 4,1; 3,9; 3,4
Сульфохром — 3,3'-диметил-4-оксифуксон(4')-5,5'-дикарбокси-2",4"-дисульфокислота (диаммонийная соль). Состав комплекса алюминия с сульфохромом 1:1. Максимум поглощения реагента 520 нм, комплекса—560 нм (рис. 18). Комплекс образуется при pH 3—6, оптимальная среда 3,8—4,1. Окраска на холоду развивается 2 часа, при нагревании до 50—80° С—в течение нескольких минут. Молярный коэффициент погашения комплекса 3,8 • 104, кажущаяся Кднс = (3,10 + 0,93)-10“6. Закон Бера соблюдается при содержании 1—45 мкг А1/50 мл. Сульфохром реагирует с Fe, Сг, Be, Zr, V, Ga, Sc; с Ti, W и Mo дает очень слабые окраски.
Сульфохром является чувствительным реагентом на алюминий. Недостаток этого реагента — близость максимумов поглощения его и комплекса алюминия, сильная окраска самого реагента в условиях определения алюминия.
Черкесов и другие [476] для определения алюминия в солях кадмия использовали галлеин при pH 4. Образующийся комплекс алюминия можно экстрагировать изобутиловым спиртом. Коэффициент распределения комплекса между органическим растворителем и водным раствором равен трем. Практически полное извлечение комплекса достигается после трех экстракций.
Определению алюминия не мешают 100 000-кратные количества кадмия.
Пирогаллоловый красный с алюминием образует окрашенный комплекс с максимумом поглощения при 525 нм и pH 4,8—5,2; это использовано для спектрофотометрического определения алюминия [395]. Максимальная окраска достигается за 10 мин. и остается постоянной в течение ~2 час. Закон Бера соблюдается до 0,5 мкг А1 !мл. Определению алюминия мешают уже небольшие количества Zr, Ga, In, Fe (HI), W (VI), F~, тартратов и значительные количества V (V) и Со. Не мешают 0,1 мг Cu (II), Ti и Be, 1 мг Mg, Са, Ba, Zn, Мп и As (III), до 50 мг KNO3, NaCl, (NH4)2SO4 и Na2S2O3. Влияние 0,1 мг Fe (III) и 1 .иг Cu (II) устраняют аскорбиновой кислотой.
116
Определение с оксихииолииом
Внутрикомплексное соединение алюминия с 8-оксихинолпнсм растворяется в органических растворителях, давая интенсивную желтую окраску. На фотометрировании экстракта основано определение алюминия. Наряду с алюминоном, оксихинолин является наиболее распространенным и одним из важнейших реагентов для фотометрического определения алюминия.
Свойства комплекса и условия его экстрагирования. Раствор оксихинолината алюминия в органическом растворителе, по данным разных авторов, показывает максимум поглощения при 380 [1289], 385 [670, 957], 388 [646], 389 [811, 864], 390 [994, 1264] и 395 нм [750, 983, 1191]. По нашим данным, максимальная окраска наблюдается при 395 нм. Максимум поглощения реагента находится в ультрафиолетовой части спектра, по данным работы [1201],— при 372 нм. При X < 370 нм реагент поглощает очень сильно, в пределах от 395 до 410 нм поглощает мало и, поддерживая постоянные условия экстрагирования, можно избежать ошибки за счет окраски реагента. На рис. 19 приведены спектры поглощения реагента и комплекса. Алюминий и оксихинолин входят в комплекс в соотношении 1 : 3. Для полной экстракции оксихинолината алюминия даются значения pH 4,5—11,5 [750, 910], 4,9—9,4 [1264], 4,2—9,8 [771] и 5—10 [994]. Указанные Моллером [983] очень узкие пределы pH неверны. Наиболее оптимальные условия для экстрагирования: в кислой среде pH 5, в щелочной pH 9 (рис. 20).
Камбара и Хаситани [858] считают, что для характеристики процесса экстракции более важно понятие pH полуэкстракции. Для
Рис. 19. Спектры поглощения 8-ок-сихинолина (/) и комплекса алюминия с 8-оксихинолином (2)
Рис. 20. Влияние pH на экстракцию оксихинолината алюминия [1264]
/ — холостая проба; 2 — раствор. Содержащий 160 мкг алюминия
117
оксихинолината алюминия эти значения pH составляют 4,05 и 11,27. Значения pH практически полной экстракции (на 99,9%) на единицу больше для кислого раствора (т. е. pH 5,05) и на 0,75 меньше для щелочного раствора (т. е. pH 10,5). По данным Виберлея и Бассета [1264], количество экстрагируемого реагента увеличивается быстрее при больших pH; в результате величина холостого опыта становится больше. По данным этих авторов, указанная величина постоянна при pH 5,0—7,0, поэтому эти значения pH рассматриваются как оптимальные. Джентри и Шеррингтон [750] нашли, что полная экстракция 0,05 мг алюминия при pH 8,9 имеет место при концентрации оксихинолина 1 %. По данным Виберлея и Бассета [1264], при pH 6,3 для полной экстракции 0,16 мг алюминия надо 2 мл 2°о-ного раствора оксихинолина. Есть указания [869], что лучшие результаты получаются при экстрагировании из растворов, нагретых до 60—70° С. Однако это лишь усложняет анализ. Многочисленные исследования показывают, что и при обычной температуре можно получить хорошие результаты. Некоторые авторы указывают на оптимальные объемы растворов при различных количествах алюминия [705]. Обычно заранее содержание алюминия в анализируемом растворе неизвестно, поэтому невозможно пользоваться данными авторов этих работ. Важно, чтобы объемы как исследуемых, так и стандартных растворов были одинаковыми (в пределах от 10 до 30 мл).
В качестве органического растворителя при экстрагировании большинство авторов применяет хлороформ. Предложены также бензол [316, 1209], четыреххлористый углерод [352, 534], трихлорэтилен [581, 933] и изоамиловый спирт. По мнению авторов работы [856], экстракция бензолом полнее, чем хлороформом, разделение слоев происходит быстрее. Кроме того, бензольный экстракт имеет большую оптическую плотность, чем хлороформный при одинаковых количествах оксихинолината алюминия. Райнес и Ларионова [352] провели сравнительное изучение различных растворителей. По их данным, чувствительность метода при использовании СС14, СНС13 и С6Н6 составляет 0,002 мг, бутилацетата — 0,005 мг, изоамилового спирта — 0,02 мг. Следовательно, предлагаемый некоторыми изоамиловый спирт мало подходит. При экстракции четыреххлористым углеродом растворы получаются более прозрачными. С точки зрения наименьшей растворимости в воде выгоднее применять четыреххлористый углерод, бензол и трихлорэтилен, имеющие растворимость 0,08; 0,082 и 0,1 г в 100 мл воды соответственно [375]. Изоамиловый спирт имеет большую растворимость •— 2,67 г, бутилацетат и хлороформ растворяются в количестве 0,5 и 1 г.
При экстрагировании алюминия из больших объемов растворов, например, при анализе воды, следует считаться с растворимостью хлороформа в воде; поэтому предлагали даже составлять отдельные калибровочные графики для каждого объема водного раствора. Эк
118
стракты часто содержат воду и бывают мутными. Для удаления следов воды можно встряхивать экстракт с безводным сульфатом натрия или же фильтровать через бумажный фильтр. Фильтрование проще и быстрее, но связано с частичным улетучиванием растворителя; обработка безводным сульфатом натрия, дольше, но может оказаться более целесообразной при одновременном выполнении большого числа анализов.
Окраска раствора оксихинолината алюминия довольно постоянна во времени. На солнечном свету хлороформный раствор его темнеет, вызывая увеличение оптической плотности и ошибку [957, 984]. Линнель и Рааб [927] исследовали устойчивость хлороформного раствора оксихинолината алюминия и установили, что он частично разлагается уже в темноте, а кислород и свет ускоряют разложение.
Закон Бера соблюдается, поданным Джентри и Шеррингтона [750], до 30 мкг А1/10 мл; такие же значения дают Виберлей и Бассет [1264] (до 160 мкг в 50 мл). В других работах указываются несколько большие пределы: 50—250 мкг PAIbQ мл [811] и до 120 мкг А1/20 мл [957].
Влияние катионов. С оксихинолином более 40 элементов образуют окрашенные комплексы. Условия их образования (pH осаждения) см. на стр. 32. Ввиду малой специфичности метода существенное значение имеет устранение влияния мешающих элементов. Для их маскирования широко применяются цианиды. Железо предварительно восстанавливают сульфидом или сульфитом. Применение цианидов бывает настолько эффективно, что оказывается возможным определять 0,0001% алюминия, например, в-никеле [137]. Перекись водорода применяется для маскирования элементов, образующих пероксидные комплексы [144 , 646, 657, 867].
Еще более эффективно применение смеси цианида и перекиси водорода [856, 864 , 938]. Люк [938] исследовал влияние 50 элементов на определение алюминия оксихинолином при использовании последней. Экстрагируя по 100 мкг различных металлов из такой смеси, Люк нашел, что при Х=400 нм не поглощают или поглощают очень мало элементы; Ge, As (V), Sb (V), Sn, Ag, Hg (II), Си (II), Си (I), Cd, Mo (VI), TI (III), TI (I), Zn, Ni, Co, Fe (III), Fe (II), Сг (VI), Сг (HI), Mn, Mg, Si, W, Ta, Nb, Hf, Th, Zr, Се (IV), Ce (III), V (V), V (IV), La, Sm, Nd, Pr, В, P, Ba, Sr и Ca. По 10 мг Fe (III), Fe (II), Ni, Zn, Си (II) и Си (I) показывают очень малое поглощение или не поглощают. Определению алюминия мешают Be, Ti, Ga, Y, In, Bi, Pb, U (VI) и Sc. Окраска за счет Be, Sc, Y и Pb исчезает при пропускании хлороформных растворов через стеклянную вату в другую делительную воронку, содержащую 15 мл буферного (аммиачного) раствора, и встряхивании в течение 3 мин. Классен, Бастингс и Виссер [646] для маскирования мешающих элементов применили смесь комплексона III и цианида. Алюми
11»
ний не экстрагируется из щелочных растворов (pH 8—9), содержащих комплексон III и цианид, хлороформным раствором оксихинолина. Спиртовым раствором оксихинолина алюминий можно экстрагировать после стояния в течение часа при комнатной температуре. Попытки сократить время выдержки нагреванием оказались безуспешными. При стоянии в течение 15, 30, 45, 60 и 90 мин. найдено соответственно 50; 60—70; 85—90; 100 и 100% алюминия. Fe (III) в данных условиях не образует достаточно прочного комплекса, чтобы не мешать определению алюминия. Поэтому предварительно восстанавливают железо сульфитом и затем переводят в ферроцианид добавлением цианида. Экстрагированием из щелочных растворов в присутствии комплексона III и цианида алюминий можно отделить от следующих элементов: As (III и V), Ba,Cd, Ca. Се (HI), Cs, Cr (III),Co,Cu, Ge, Au (III), La, Pb, Li, Mg, Mn, Hg (I и II), Mo, Ni, Pt (IV), Se (IV и VI), Si, Ag, Sc, Те (IV и VI), Th, Sr, Sn (IV), W, V (V) и Zn. При этом также отделяются анионы: бораты, фосфаты, иодиды, бромиды, фториды. В этих условиях Bi, Ga, In, Nb, Sb (III и V), Ta, Ti, U (VI) и Zr экстрагируются совместно с алюминием [646].
Если все эти элементы (и алюминий) реэкстрагироват ь из экстракта при помощи 2V НС1, добавить избыток перекиси водорода, а затем снова экстрагировать хлороформом при pH 7,5—8,5, то Nb, Та, Ti, V и U (VI) остаются в виде пероксидных комплексов в водном слое и отделяются от алюминия. Bi, Ga.Sbn Zr можно экстрагировать хлороформом в виде купферонатов из 2N НС1, а индий отделить экстрагированием диэтилдитиокарбамината хлороформом при pH 3—5. Гидроокись бериллия не мешает экстракции алюминия, если добавить 1—2 капли смачивающего реагента (тергитоль и др.). Незначительное количество бериллия, перешедшее в экстракт, можно отделить от алюминия дополнительным экстрагированием при pH 5. Если в анализируемом растворе присутствует V (IV), то он начинает экстрагироваться раньше алюминия и экстрагируется очень медленно. Если ввести 0,5—1 мг Ti, то экстракция V (IV) и А1 ускоряется. V (V) не экстрагируется, но при обработке бисульфитом V (V) переходит в V (IV).
Оптимальные количества комплексона III и цианида в этом методе следующие: для 0,1 г железа или стали требуется 1 г комплексона III и 3 г KCN; для 0,5 г — 3 и 5 г, для 1г — 8 г комплексона III и 8 г KCN соответственно.
Для связывания марганца необходим 20-кратный избыток комплексона III. По способу Классена и др. [646], до 25мкг тория не мешает определению алюминия, большие количества мешают экстракции алюминия. В присутствии 100 мкг тория алюминий совсем не экстрагируется. В этих случаях надо вводить большие количества оксихинолина для осаждения оксихинолината тория. Ес-
120
ли присутствует скандий, то увеличивают соответственно количество оксихинолина (1 мл 5%-ного раствора оксихинолина экстрагирует 1 мг Sc), иначе алюминий не экстрагируется. Относительная ошибка определения 0,04—7% алюминия в сталях по методу Классена и др. составляет от 1 до 10%. Методика описана в руководстве Сендела [360].
Марджерум и др. [957] при определении алюминия в тории последний маскируют натриевой солью 4-сульфобензоарсоновой кислоты в присутствии ацетатного буфера. Алюминий экстрагируют при pH 4,7—5,0 (в этих условиях экстракция тория ничтожна). В кислых растворах, содержащих сульфобензоарсоновую кислоту, может образоваться осадок; в присутствии буферной смеси этот осадок более растворим. В 100 мл раствора можно удержать до 0,25 г тория. Молярное отношение сульфобензоарсоновой кислоты к последнему должно быть, по крайней мере, 2:1, чтобы торий не экстрагировался хлороформом.
В тех случаях, когда маскирование недостаточно эффективно, мешающие элементы предварительно отделяют. В табл. 11 приведены способы маскирования и удаления мешающих элементов при определении алюминия оксихинолином.
Влияние анионов. Большие количества хлоридов, нитратов и сульфатов не мешают определению алюминия [750]. Не мешают бромиды и иодиды [646]. Перхлораты не мешают до 1 М концентрации. Если SiO2 находится в истинном молекулярном растворе, то не мешает при соотношении А12О3 : SiO2 = 1 : 4. В присутствии полимеризованной SiO2 при соотношении больше 1 : 4 результаты завышаются на 10% и выше. Перед определением алюминия целесообразно обрабатывать анализируемый раствор едким натром для перевода SiO2 в молекулярную форму [109]. Фториды уже в количестве 10 мкг мешают экстракции оксихинолината алюминия, введение борной кислоты не устраняет их влияния [646]. При определении алюминия в тории небольшие количества фторидов (до 500 мкг) не мешают, так как торий связывает фторид в прочный комплекс [957]. Согласно Джентри и Шеррингтону [750], до 0,15 г фосфатов мало влияет на определение алюминия, но Д> 200 мкг фосфорной кислоты мешает восстановлению железа [646]. До 0,2 г тартрата в 50 мл раствора мешает мало [750]; по другим данным, допустимо 0,3 г винной кислоты в 80 мл раствора [869]. Поэтому винную кислоту используют для маскирования небольших количеств железа [869]. 0,3 г винной кислоты маскирует 5,6 мкг железа. Некоторые авторы вводят винную кислоту для удержания алюминия в растворе в щелочной среде. В стандартные растворы в этом случае также вводят такие же количества винной кислоты.
Предложены методы одновременного определения алюминия и железа в одном растворе [2,281, 282, 458, 459, 949, 991, 992]. Оксихинолинаты экстрагируют при pH 5,2—5,5; оптические плотности измеряют соответственно при 390 и 470 нм. Оксихинолинат i. i2i
Таблица 11
Способы устранения влияния других элементов при определении алюминия оксихинолином
Способ Элементы Примечание Литература
Регулирование pH раствора Fe Экстракция оксихинолината железа при pH 2; 2,5 илн 2,8 [276,697, 750 869. 983,1098]
То же Си Экстракция оксихинолината меди при pH 2,8 [869]
Маскирование циа- 0,1 а Си, Ni, Со, Экстракция алюминия из рас- [750]
нидом в щелочной среде Zn,Cd, Си, Ni твора 2 a NH4NO3,1 г KCN, 1 мл NH4OH (1:1) в 45 мл воды
То же Со, Zn Промывание хлороформного экстракта раствором KCN [282, 957]
Маскирование смесью KCN и Na2S Fe Экстракция алюминия из раствора с 2 a KCN, 1 a N2S и 2 а NH4NO3. После прибавления KCN раствор нагревают 3 мин. при 50° С, затем после охлаждения вводят Na2S и экстрагируют оксихинолинат алюминия [750]
Маскирование смесью KCN и (ЧЩ.СОз и На железо вводят поправку [457]
Маскирование смесью (NH^aCOs и NH4OH (pH 9,5-10) и К раствору, 2 V по НС1, прибавляют 20 мл 30%-ной Н2О2, через 1 мин. нейтрализуют аммиаком по фенолфталеину и экстрагируют алюминий [534]
Н2О2 (pH 7,5—8,5) Ti, V, Nb, Та, U (VI) [646]
Н2О2 Nb, Th, U, Се Экстракция алюминия из раствора (pH 9,2), содержащего 5ло 30%-ной Н2О2 [8И]
Маскирование Fe, Ti, U, V, К раствору прибавляют 2 г вин- [864]
смесью K.CN, Н2О2 н Na2SOs Sn, Со, Ni, Мп, Си, Cr, Zn, Cd, Mo, Zr ной кислоты и 1 мл 3%-ной Н2О2. Через 5 мин. вводят 5 мл насыщенного раствора Na2SOs, еще через 3 мин. —1,3 г KCN; нагревают до 70—80°С, охлаждают, вводят 2 a NH4NO3, устанавливают pH ~ 8,9 н экстрагируют алюминий
Маскирование ДЦТА и цианидом Fe, Pb, Cu, Bi, Mg К раствору прибавляют тартрат, 5 мл 0,1%-ного раствора ДЦТА, после создания щелочной среды вводят цианид, окси-хннолнн н экстрагируют алюминий [5Ю]
122
Таблица 11 (окончание}
Способ Элементы Примечание Ли тература
Комплексообразо- Fe Экстракция алюминия из рас- [670]
вание с о-фенантро- твора с pH 5, содержащего 0,1 г
лино.м ,\Н2ОН-НС1, 2 мл 0,1%-ного раствора о-фенантролина
Комплексообразо- Fe, F Экстракция алюминия из рас- [1265]
вание Fe с 2,2'-ди- твора с добавлением 5 мл мае-
пиридилом и F-—с кирующего раствора (5 г NHjCl,
бериллием 17 г CH3COONa, 0,2 а 2,2'-ди-пиридила, 2 мл НС1 и 2 г BeSOt в 500 мл воды)
Экстракция оксихи- Cd, Co, Cu, Fe, Экстракция оксихинальдинатов [8И]
нзльдинатов ме- Mn, Ce, Ni, Pb, с помощью 5 мл СНС1з и 5 мл
шлющих элементов Sb, Sn, Zn, Ti 2,5%-ного раствора 8-оксихи-
при pH 9,2 нальдина в 5%-ной СНзСООН; двухкратное встряхивание водного слоя с СНС13 (по 5 мл) и экстракция оксихинолината алюминия
Экстракция Диэтил' дитиокарбаминатов Mn Fe, Cu, Ni При pH 5,2—5,4 Из растворов с pH 4,5 [960] [478 [
In При pH 4 [646 ]
Экстракция хлорид- Fe, Ga Экстракция хлоридов метил- [863]
ных комплексов изобутилкетоно.м, после установления pH 5,6—5,9 и добавления Na2S2O3— экстракция ок-
сихинолината алюминия; промывание экстракта 10 мл смеси (2 г KCN и 2 г комплексона III в 100 мл) с pH 10
Экстракция родани- Fe Экстракция роданида Fe смесью [1187]
Дов диэтилового эфира и тетрагидрофурана из 4 N НС1
Ti Экстракция роданида Ti диэтиловым эфиром [99]
Экстракция купфе- Zr, Ga, Bi, Sb Экстракция купферонатов хлоро- [457а,
ронатов формом из 2N НС1 или H2SO4; экстракция оксихинолин ата алюминия после разрушения купферона 657 ]
Экстракция комп- Ti, V, Zr Экстракция из раствора, 1М по [775]
лексов с N-бензоил- HClOaJ встряхивание водного
N-фенилгндроксил- слоя с хлороформом и экстрак-
амиНим ция оксихинолината алюминия
Электролиз на Многие Кислотность IM по H2SOi, сила [1264]
ртутном катоде металлы тока 5 а
Сплавление с » Сплавление с 2 г Na2COs при [1047]
Na2CO3 1000°С в течение 10 мин., вы-
щелачиванне в воде н экстрак-1 ция оксихинолината алюминия
123
алюминия при л = 470 нм не поглощает, а оксихинолинат железа поглощает при обеих длинах волны.
Варианты методов определения алюминия с о к с и х и н о л и н о м. Паркс и Ликкен [1047] предлагают растворять оксихинолинат алюминия в хлороформе или 0,1.V НС1 и оптическую плотность полученного желтого раствора измерять в ультрафиолетовой области спектра. Когда в качестве растворителя применяют хлороформ, осадок надо сушить при 140° С, при растворении в 0,1 А' НС1 осадок сушить не надо. Оптическую плотность солянокислого раствора измеряют при А, = = 251,5 нм. Удовлетворительные результаты получаются при содержании > 0,050 мг алюминия. Многие мешающие элементы отделяют сплавлением с карбонатом натрия. Филлипс и Меррит [1060] предлагают измерять оптическую плотность солянокислого раствора оксихинолината алюминия при 360 нм, так как при этой длине волны спектр лишь незначительно меняется с изменением кислотности от 0,006 до 10,0 М. При других длинах волн концентрацию кислоты надо контролировать.
Косвенные методы определения алюминия, основанные на переводе связанного с алюминием оксихинолина в азокраситель действием диазотированной сульфаниловой кислоты в щелочном растворе [524, 673, 681], на восстановлении фосфорновольфрамовой, молибденовольфрамовой, фосфорновольфрамомолибденовой, кремне-молибденованадиевой и кремнемолибденовольфрамовой кислот оксихинолином [174, 728, 1226] не представляют интереса.
Определение с азосоедииеннями
Определение со стильбазо. Стильбазо — стильбен-2, 2'-дисульфокислота-4,4'-бис- (азо-1,,)-3",4''-диоксибензол, ди-аммонийная соль — как реагент для фотометрического определения алюминия предложен В. И. Кузнецовым и сотрудниками [216, 217].
Комплекс алюминия со стильбазо имеет максимум поглощения, по данным разных авторов, при 496 [5, 2516], 500 [1260] и 510 нм [137]. У реагента этот максимум расположен в ультрафиолетовой области спектра. При максимуме поглощения комплекса реагент показывает сильное поглощение (рис. 21), что является серьезным недостатком стильбазо. Вследствие наложения сильной окраски реагента очень малые количества алюминия со стильбазо определять затруднительно. Состав комплекса алюминия со стильбазо 1:1 [5, 1260]. Константа нестойкости комплекса, найденная из оптических измерений, составляет 5,96-10“® [1260]. Молярный коэффициент погашения комплекса по разным данным 34 600 [5] и 38 000 [656]. Некоторыми авторами даются более низкие значения е, например 19 500 [1260].
124
Рис. 22. Зависимость’ окраски комплекса алюминия со стильбазо от pH / — раствор реагента относительно воды; 2 — комплекс алюминия относительно раствора реагента
Рис. 21. Спектры поглощения стильбазо и комплекса алюминия со стильбазо
1 — 2’10“6 Af раствор стильбазо относительно воды; 2 — 2ф10“5 М раствор комплекса алюминия со стильбазо относительно реагента
Поглощение реагента приблизительно постоянно между pH 4 и 5,8, выше pH 5,8 поглощение увеличивается. Поглощение комплекса почти линейно возрастает с увеличением pH в пределах 4—6. Только между pH 6 и 7 влияние pH несколько уменьшается (рис. 22), но в этой области сильно сказываются помехи со стороны других ионов. Большинство авторов рекомендует определять алюминий при pH 5,4—5,6. Ветлезен [1259] предлагает работать при pH 4,8; по мнению автора, при этом pH меньше влияют другие ионы. Ввиду сильного влияния pH на окраску комплекса нужен строгий контроль pH раствора с помощью рН-метра.
Окраска комплекса алюминия развивается сразу и устойчива длительное время; интенсивность окраски не зависит от температуры в пределах от 20 до 70° С [5]. Оптическая плотность растворов увеличивается с повышением концентрации стильбазо и достигает максимума при молярном отношении реагента к алюминию 3 : 1 1446]; по другим данным, — при 4 : 1 [204]. При содержании 20— 30 мкг А1/50 мл раствора рекомендуется вводить 5 мл 0,06%-ного раствора стильбазо [204]. При увеличении концентрации стильбазо возможно образование суспензии [912]. По данным Ивасаки и Омори [137], максимум оптической плотности наблюдается при концентрации стильбазо 0,006—0,1%. Нижний предел соответствует указанным выше 5 мл реагента. Некоторые авторы поддерживают очень высокие концентрации реагента в растворе: 2,8-10“4 моль/л [150] и 3,1 -10-4 моль!л [912], что соответствует 18—20 мл 0,05%-ного раствора в 50 мл. Учитывая очень сильную окраску самого
125
реагента, такие количества применять нельзя. Закон Бера соблюдается при содержании 10—100 мкг А1/100л<л [5] (или 2,5—20л<кг А1/25 мл [1260]). Чувствительность метода 0,06 мкг алюминия при работе с 1 мл раствора, в больших объемах чувствительность увеличивается [193].
Со стильбазо в тех же условиях, что и алюминий, реагируют Fe (III), Си (II), In, Ti, Ga, Bi, Sb, Sn, Th,Mo (VI), W (VI); в нейтральной или щелочной среде — Pb, Со, Ni, Zn, Cd, Be, Hg, Ca, Mg, Mn.
При pH 5,65 определению 30 мкг алюминия не мешает присутствие следующих элементов [1260]:
Элемент Избыток Элемент Избыток
Nb (V) 10 Ni, Zn, Cd, Pb 100
Cr (VI) 13 As (III) 300
As (V) 33 Ca, Mg, Mn, Co 1000
По данным других авторов [203, 204], допустимы несколько большие количества свинца (до 500 : 1) и цинка (до 1000 : 1), не мешает сурьма до соотношения 120 : 1. Серебро не мешает до 10 мг в 100 мл раствора [150]. По данным Агринской и Петрашеня [6], допустимо содержание до 0,25% молибдена и до 0,05% вольфрама. Эти авторы определяют алюминий в присутствии 12,6% V (IV). По данным Ветлезена и Оманга [1260], как V (IV), так и V (V) при отношении к алюминию большем, чем 1:1, увеличивают окраску. 50 мкг алюминия можно определять с удовлетворительной точностью в присутствии 500 мкг Cr (III) [1259]; SiO2 не мешает до соотношения 30 : 1 [203]. До 6,5 мг меди можно маскировать тиосульфатом [1259]; аскорбиновой кислотой устраняют влияние небольших ее количеств (0,5мг) [203].
Влияние Fe (III) можно устранить предварительным восстановлением. Гидроксиламином [6,845] можно восстанавливать железо лишь при рН<; 4,6, т. е. в тех условиях, в которых стильбазо применять нецелесообразно. Тиогликолевая кислота, комплексон III и малеиновая кислота [845] одновременно с устранением влияния железа оказывают влияние и на комплекс алюминия. Наиболее надежным средством для восстановления железа служит аскорбиновая кислота. С помощью последней, можно устранить влияние 5 мг Fe (III) в 50 мл раствора; большие количества железа уменьшают окраску комплекса алюминия [5]. При определении алюминия в стали необходимо или предварительно отделить железо, или составить калибровочный график на фоне раствора стали, не содержащей алюминия.
Из анионов определению алюминия не мешают 1 г сульфат-иона, по 0,1 г хлорид- и нитрат-иона; очень большие количества нейтральных солей мешают [84]. Определению алюминия мешают оксалаты, тартраты, цитраты, нитрилотриуксусная кислота, ком
126
плексон III, фториды, фосфаты. В присутствии 0,5 мг фосфат-иона возможно определение 0,03 мг алюминия. Алюминий можно определять со стильбазо и в присутствии фторидов, если связать их в комплекс введением ионов бериллия [289].
С помощью стильбазо определяют алюминий в сталях [4,5,287, 444, 845], в ферросплавах [2516], в различных материалах свинцового и медного производства [203, 204,446], в металлическом серебре [150], в стекле [245], в шлаках (]юсфорных печей [111] и других материалах.
Определение с арсеназо. Арсеназо— бензол-2-арсоновая кислота-( 1 -азо-7)-1,8-диоксинафталин-3,6-дисульфокислота, натриевая соль, с алюминием образует фиолетовый комплекс, который использован для фотометрического определения алюминия [198, 214, 215, 503]. Наибольшая интенсивность окраски комплекса наблюдается при 575—580 нм [214, 656] и pH 5,8 [198]. В этих условиях поглощение самого реагента довольно сильное. Как оптимальное значение pH указывается 5,1—5,8 [198, 214, 503] и 6,1— 6,8 [656]. Для создания среды лучше использовать в данном случае уротропин [198, 214]. Молярный коэффициент погашения комплекса 12000 [656]. Окраска развивается за 15 мин. и остается постоянной несколько часов [214, 215, 656]. С увеличением количества реагента оптическая плотность возрастает, достигая максимума при содержании 1,0 мл 0,05% -ного раствора в 10 мл фотометрируемого раствора. С дальнейшим увеличением количества реагента оптическая плотность уменьшается [215]. Чувствительность определения на фото колориметре 0,5 мкг А1/10 мл [215]. Закон Бера соблюдается при содержании 1—8 лелсг А1/10 мл [215] или 0—100 мкг А1/Ю0 мл [656].
В условиях определения алюминия Fe (III), Zr, Hf, Ga, In, Pd, Th и Tj образуют окрашенные соединения с арсеназо и, следовательно, мешают определению алюминия. Влияние железа устраняют аскорбиновой кислотой. Медь (до 10-кратного избытка) можносвязать вбесцветный комплекс с тиомочевиной [214]. 25-кратный избыток цинканемешает [214]. Бериллий сильно мешает (0,7 мкг «го эквивалентны 1 мкг алюминия) [656]. Не мешают до 10 мкг хрома [656], 40 мкг вольфрама [503]. Не мешают значительные количества щелочных и щелочноземельных металлов, магний и марганец. Фториды, фосфаты, оксикислоты и другие вещества, связывающие алюминий в комплекс, мешают. Сульфаты оказывают слабое влияние.
Определение с 5-сульфо -4' - диэтилами н--2',2-диоксиазобензолом. Реагент предложен Флорен-.цем [724] для спектрофотометрического определения алюминия в присутствии бериллия. В некоторых отношениях, например по интенсивности собственной окраски при максимуме поглощения комплекса алюминия, уступает алюминону, хромазуролуБ и др. .Преимущества реагента — не взаимодействует с бериллием, ком
127
плекс алюминия с ним инертен, поэтому возможно устранить влияние многих элементов с помощью комплексона Ill.
Максимум поглощения комплекса алюминия наблюдается при 535 нм (рис. 23), в этих условиях сам реагент поглощает сильно, поэтому оптическую плотность лучше измерять при 540 нм. В интервале pH 4—5 оптическая плотность меняется мало, после pH 5,5 поглощение сильно падает (рис. 24). Удобнее всего работать при pH 4,7, т. е. при максимальной емкости ацетатного буферного раствора.
При pH 4,7 состав комплекса 1:1. При pH 4,7 и А, = 540 нм. молярный коэффициент погашения комплекса алюминия 41 000, чувствительность метода 0,00066 мкг/см2 (по Сенделу). Закон Бера соблюдается до 0,6 мкг М/мл. Относительное стандартное отклонение метода 0,5% [724]. При обычной температуре комплекс алюминия образуется медленно. Для ускорения образования его необходимо нагревать растворы при 40° С в течение 15 мин. Комплекс устойчив, по крайней мере, 19 час., поглощение уменьшается только на 2% через 120 час.
Более 200 мкг бериллия мешают (образуется слабо окрашенный комплекс с реагентом, а также ослабляется окрдска комплекса алюминия). Степень ослабления окраски не зависит от концентрации алюминия, и закон Бера для последнего соблюдается даже при высоких концентрациях бериллия (15 мг/25 мл). Алюминий можно определять в присутствии относительно больших количеств бериллия, если с помощью заранее составленных графиков внести поправку на бериллий. При pH 4,7 с реагентом образуют окрашенные комплексы Fe, Сг, Со, Си, Ti, W, V, U и Th. За исключением кобальта и ванадия, эти элементы образуют значительно менее окрашенные комплексы, чем алюминий. Влияние этих металлов (за исключением железа и кобальта) устраняют с помощью комплексона 111, который разрушает их комплексы. Степень уменьшения
Рис. 23. Спектры поглощения 5-сульфо-4'-диэтиламин-2' ,2-ди-оксиазобензола и его комплекса с алюминием [724]
1 —3,6 • 10“3%-иый раствор реагента относительно воды; 2 — комплекс алюминия (6,7 мкг) относительно раствора^ реагента
128
Рис. 24. Влияние pH на^окрас-ку 5-сульфо-4'-диэтиламин-2',2-диоксиазобеизола и комплекса его с алюминием [724]
1 — раствор реагента относительно воды; 2 — комплекс алюминия (6,7 мкг) относительно раствора реагента
поглощения комплекса алюминия под влиянием комплексона III не зависит от концентрации алюминия, и если поглощение и анализируемых, и стандартных растворов измерять не позже, чем через 30 мин., то не наблюдается заметной ошибки. Комплекс железа разрушается комплексоном III, но даже малые количества этого элемента занижают результат определения алюминия. Комплексон III не действует на сильно окрашенный комплекс кобальта с реагентом (е = 31 000; 540 нм). Введением ферроцианида можно свести до минимума влияние железа и кобальта. Малые количества ванадия связывают в комплекс перекисью водорода.
При определении 5 мкг алюминия с помощью 2 мл 2%-ного раствора комплексона III и 2 мл 0,1%-ного раствора К4 [Fe (CN)e[ устраняют влияние 100 мкг/25 мл Ag, As (III), Be, Bi, Ca, Ce (111), Си (II), Hg (II), Li, Mg, Мп (II), Mo (VI), NH3, Nd, Ni, Pb, Pt, Sb (III), Sn (IV), Th, U (VI), W (VI), Zn, PO43~, SiO32~, 50 мкг/ 25 мл Ti (IV), 20 мкг/25 мл Fe (III), 10 мкг/25 мл Co, Cr (111), Zr, 500 мкг/25 мл Cl“, C1O4_, NO3_ и SO42-. В присутствии 0,1 мл 3%-ной Н2О2 устраняется влияние 20 мкг/25 мл V (V); в присутствии 1 мг бериллия устраняется влияние 100 мкг/25 мл фтор-иона; цитраты даже в количестве 10 мкг/25 мл сильно мешают.
Определение с оксиантрахннонамн
Определение с ализарином. Ализарин — первый фотометрический реагент на алюминий, предложенный Этеком в 1915 г. [535]. Однако его обычно не применяют из-за плохой рас-створимости в воде, а пользуются ализарином S (ализаринсульфо-нат натрия).
Ализарин S — кислотно-основной индикатор с двумя переходами окраски: при pH 3,7—5,2 (от желтой до буро-красной) и при pH 10—12 (от фиолетовой до бледно-желтой) [657]. Константы диссоциации ализарина S, как двухосновной кислоты, равны 3- 10-в и 3-10’10 [27]. Ализарин S и алюминий входят в комплекс в соотношении 1 : 3 [26, 535, 791, 1001]. Имеются и другие данные относительно состава комплекса. При pH 3,6—3,9 [1045] и 4,6 [269] ука-
5 Анд nuTuupi'va a тииип ялшииииа
1 ОО
зывается на образование комплекса 1:1. При образовании комплекса в щелочной среде с последующим подкислением в комплекс входят атом алюминия и две молекулы ализарина S [269]; комплекс такого же состава образуется и в присутствии кальция [269, 1045].
Максимум поглощения реагента лежит при 423 нм [1045]. Для максимума поглощения комплекса даются значения "К = 500 нм [34, 1024] и 475—480 нм [552, 1045]. Для коэффициента молярного погашения комплекса указываются значения 3700 [25] и 4100 [269]; для комплекса в присутствии кальция — 10 100 [269] и 18 000 [657].
Предлагаются различные значения оптимального pH: 3,6 [1001], 3,6—3,8 [1235], 3,92 [1024], 4,0 [791], 4,5 [1045], 4,4—4,65 [657], 4,6 [754]. Слишком низкие значения pH (3,6) нежелательны из-за быстрого выпадения лака и медленного развития окраски [791]. Оэлшлегером [1024] указывалось как оптимальное pH 3,92, при использовании буферного раствора с достаточно высокой емкостью и введении небольших количеств фосфатов получается очень стабильная окраска, которая долго не меняется. По данным Паркера и Годдарда [1045], максимальная окраска наблюдается при pH 4,55, при pH от 3 до 7 окраска развивается в течение 3 час. Нагревание способствует более быстрому развитию окраски. При pH 4,55 и нагревании до 60° С окраска полностью развивается за 15 мин. [1045]. В присутствии ионов кальция максимальная интенсивность окраски также наблюдается при pH 4,3—4,7; при pH 3,5, 3,9 и 4,5 и 60° С окраска полностью развивается в течение 30 мин.
Оптимальными условиями следует считать следующие: pH 4,3— 4,7 и нагревание при 60° С в течение 30 мин. (как в отсутствие, так и в присутствии кальция) [1045].
Изменения температуры фотометрируемого раствора от 20 до 30° С заметно не влияют на оптическую плотность [550]; изменение объема раствора от 25 до 45 мл при развитии окраски не оказывает влияния [550]. Некоторые авторы предлагали защитные коллоиды для повышения устойчивости окрашенного соединения (глицерин [535, 1235], гуммиарабик [1229], смесь крахмала и глицерина [1229]). Однако последние исследования показывают, что применять их нет необходимости.
Закон Бера соблюдается при содержании до 80 мкг А1/100 мл при применении 5 мл 0,01%-ного раствора ализарина S [550, 656]. Увеличивая количество ализарина S, определяемые пределы можно сместить даже до 200 мкг А1/50 мл [530]. В присутствии кальция окраска комплекса алюминия усиливается, при этом пик поглощения смещается в сторону длинных волн. В отсутствие алюминия кальций очень мало влияет на спектр поглощения реагента. При увеличении количества кальция до 500 мкг в 10 мл окраска раствора усиливается, с дальнейшим добавлением кальция окраска остается постоянной. При количествах последнего больше 1500 мкг растворы становятся мутными. Оптимальное количество кальция — 1000 мкг в 10 мл анализируемого раствора. Ион Li+ также вызы-
130
вает усиление окраски комплекса алюминия, но в меньшей степени. Если содержание лития >10 мг/мл, окраска комплекса алюминия становится слабее [584].
Определению А! не мешают (при концентрации 25 мкг’мл): Na, К, Mg, Zn, Cd, Ni, As (III), Co. Мешают, образуя окрашенные комплексы с ализарином S или изменяя интенсивность поглощения комплекса алюминия: Fe (II), Fe (III), Cr (III), Sb (III), Bi, W (VI), Mo (VI), V (V), Си (II), BO33-, Ca, Li, Sn (IV), Ti (IV), Pb, Mn(II), PO43", SiO32 . Sn (IV), Ti (IV), Pb и Мп (II) дают осадок или помутнение в конечном растворе; В, РЬ и Si мешают очень мало. Фосфаты уменьшают оптическую плотность растворов. Бериллий незначительно увеличивает окраску, 40 мкг бериллия эквивалентны 1 мкг алюминия [656]._ Влияние железа безуспешно пытались устранять лимонной [1001, 1283], винной, щавелевой и фосфорной [1001] кислотами. Железо можно маскировать тиогликолевой кислотой [754], цианидом, тиосульфатом [743]. 0,1—0,2 г твердого тиосульфата натрия устраняют влияние 5 мг Ре2О3/л.
Из анионов мешают фториды, фосфаты, цитраты и тартраты. Na2SO4 не мешает до концентрации 0,045 М [1045], (NH4)2SO4 оказывает более сильное влияние. Хлориды аммония и натрия незначительно уменьшают окраску соединения алюминия (до концентрации 0,02V их влияние ничтожно). Алюминий с ализарином S лучше всего определять в хлорнокислой среде.
Определение с хинализарином. Кольтгоф [888] для фотометрического определения алюминия предложил хинализарин (1,2,5,8-тетраоксиантрахинон). Однако в варианте Кольтгофа хинализарин пригоден лишь для качественного определения, так как окрашенный комплекс имеет тенденцию осаждаться. Хинализарин оказался пригодным и для количественного определения алюминия после того, как был найден растворитель для растворения окрашенного лака. Для этой цели применяют смесь бутилкарбитола с водой [532]. Окрашенный раствор фотометрируют при 570 нм. Алюминий и хинализарин входят в комплекс в соотношении 1 : 3 [532], по другим данным 2 : 3 [601]. Оптимальная среда pH ~ 5. Закон Бера соблюдается при 0,05—2,0 мкг М/мл. Определению алюминия не мешают 20-кратные количества Мп, Cd, Pd и Sn, 40-кратные количества/п и 1000-кратные количества Mg. ВлияниеСи и Fe устраняют введением 1 мл 1 %-кого раствора диэтилдитиокар-бамината через 20—25 мин. после добавления хинализарина.
К 1—2 мл анализируемого раствора, содержащего 0,5—20 мкг алюминия, прибавляют 40—50-кратное количество хинализарина (по отношению к алюминию) в виде 0,1%-ного этанольного раствора (1,4 М по NH4OH), 1 мл ацетатного буферного раствора с pH ~5 (6 ч. 5N СН3СООН и 4 ч. 5.V NH4OH). Затем вводят бутилкарбитол до содержания его в конечном растворе 40—50%.
Оптическую плотность измеряют при 570 нм [532].
Для определения алюминия можно использовать хинализарин-сульфонат. Реагент в среде абсолютного метанола с алюминием об-
5*
131
разует комплекс фиолетового цвета, раствор реагента светло-желтого цвета. Максимальное поглощение комплекса наблюдается при 560 нм, состав комплекса 1:1, оптимальная среда pH 0,3— 0,5 [1038]. Максимальная окраска достигается через 40 мин. и устойчива продолжительное время. Влияние действия света, порядка добавления реагентов и изменения температуры в пределах 15— 35° С ничтожно. Закон Бера соблюдается до 1,7 ч. на 1 млн. Чувствительность по Сенделу 0,02 мкг/см2. Катионы и анионы не мешают при следующих соотношениях:
Ион Избыток
Be. Sc, Ti (IV), Y, Zr, P4O*- 0,2
Th 0,5
Cu (II), SOf 60
Au (III), Ba, Bi, Ca, Cd, Co, Cr (III), Fe (II), Ga, Hg (II), In, K, Li, Mg, Мп (II), Ni, Pb, Pd (II), Sb (III), Sn (II), Sn (IV), Sr, Zn, U (VI), BO3r, Br~, J-, S2~, NO3“ и цитраты не мешают при 100-кратном избытке. В 50 мл раствора допустимы 3 мл воды, большие количества воды мешают развитию окраски. Использование смешанного растворителя (10 мл диэтилового эфира и 40 мл абсолютного метанола) уменьшает влияние Fe (III); в этом случае 60-кратные количества Fe (III) вызывают ошибку +2%.
Определение с другими реагентами
Кроме описанных выше для фотометрического определения алюминия предложены еще многие другие органические реагенты. В табл. 12 приведены некоторые сведения о реагентах, редко применяемых для фотометрического определения алюминия.
Методы определения алюминия нефелометрированием его купфероната [1034, 1122], фотометрированием фосфора, содержащегося в фосфате алюминия, в виде восстановленной фосфорномолибде-новой гетерополикислоты [ПО, 811] и методы, основанные на реакции фторидного комплекса титана и алюминия в присутствии перекиси водорода [455], не представляют интереса.
Назаренко и др. [292] изучили взаимодействие алюминия с полиоксифлавонами — кверцетином и рутином, но не дали рекомендаций об использовании их для фотометрического определения алюминия.
Флуориметрические методы
Определение с салицилаль-о-амииофеиолом
Из флуориметрических методов определения алюминия наибольшее применение нашел метод с салицилаль-о-аминофенолом (ман-ганоном) [37, 56—58, 168, 224, 227, 435, 671, 1144]. Максимум интенсивности флуоресценции комплекса алюминия с ним наблю-
Таблица 12 । Некоторые редко применяющиеся фотометрические методы определения алюминия Литература —. _; стГ О* £9 О стз о sf О О 05 > о * ю" ««-н - ©“ £5 1—1 и— ОС 1—>
Примечание Применяется для определения алюминия в металлическом церии, в солях и окислах рзэ Закон Бера соблюдается до 40 мкг А1/25 мл После образования лака для уменьшения окраски избытка реагента pH снижают до 6,8—7,1 Окраска развивается за 5 мин. при 50°С и устойчива 6 час. Закон Бера соблюдается до 40 мкг А1/25 мл Состав комплекса 1: 3 Из раствора с pH 8,6 (боратный буферный раствор) в присутствии хлорида метилкаприламмо-ния комплекс алюминия можно экстрагировать хлороформом
Влияние других элементов или иоиов i м -я • ► 1 О н " н 1-1'133 2 “ •• > х 3 О'’-?,0 ® а о и г— © 2 [5 О с/Э -г 1 н 15 5 3 4. 11 . <и . -1 U га £ s я > "га. га д; » Г । ». Л о. £ О га--^ II —l Z “ 4 OHtJXra X S £ О «О ° - L , -1'i х S СО Е 2 га 1- ffl s N 3 „000 га н aS^NbO . н га SSuoJx" га И Г 2,иГГ|‘?2* д SuU<gHO д д> к „=% =>„W S g о а Д о - га га <и Ц—* « Ч •_ Д । О о Z о з О g 2. XsUnSnhS So oofcfflcoo-e-Й с
е комплекса оо Ф оо 2 СОЮ ®
X Я Е К о. Ю 05 со - СО о. °? 1 А °- * СО СО
аг к Я * о ’"' о о о о 00 о г— со со сг со Ю UO LQ СО
Реагент 1 ОС 1 Г- CL Q. ч „ СО | СЗ сз S Ю 'х4 6 ® 1ч = -•g . ^2 га s о ч ч £ х t-= = 5 ° я § х х Y Yu а х о- х 9 5 5 я §_“? -0- £ g *4 < | 5х g-5 га s X 5 5 и ч е § & £ О § ё s *
132
133
Таблица 12 (окончание)
,ф Другие значения X.
** 1-(1оксиЧ-метил-2-фенилазо)-2’нафтол-4-сульфоновая кислота.
134
дается при pH 5,8 и 530 нм [56]. По данным Ефимычева и Туманова (435], а также Сэйлора и Ледбеттера [1144], состав флуоресцирующего комплекса алюминия с реагентом 1 : 2, константа нестойкости 2,02-10“7, молярный коэффициент погашения 9200 [435]. Бабко и др. [35] указывают, что при pH <'6,5 образуется комплекс состава 1:1, при pH выше 6,5 — состава 1 : 2. В работе [671] также указывается на образование комплекса состава 1:1.
Чувствительность флуориметрического метода определения алюминия с салицилаль-о-аминофенолом составляет 0,0025 мкг М/мл (58]. Интенсивность флуоресценции пропорциональна концентрации алюминия до 0,5 мкг/Ъ мл [58]. Флуоресценция достигает максимума через 15 мин. и в дальнейшем остается постоянной [56]; обычно измеряют ее через 40—50 мин. Содержание алюминия находят по калибровочному графику или методом добавок. Оптимальное количество реагента 0,3 мл 0,1%-ного раствора в 10 мл [56], при меньших и больших количествах реагента интенсивность флуоресценции меньше. Реагент применяют в виде раствора в ацетоне (присутствие до 10% ацетона не мешает, большие количества сильно снижают интенсивность флуоресценции).
Определению алюминия не мешают: до 100 мкг Ag, TI, Y в 10 мл\ до 10 мкг Bi, Cd, V, Mo, Gd, C2O42- в 10 мл\ до 7 мкг Fe (III) и Си (II) в 10 мл [168]. Большие количества Fe (III) и Си (II) гасят флуоресценцию; в этом случае алюминий определяют методом добавок. Олово мешает и должно быть полностью отделено [228].
Бабко и др. [37] при анализе NaCl и NaNO3 для повышения чувствительности и селективности предлагают экстрагировать комплекс алюминия изоамиловым спиртом из раствора с рН~ 6,4. Флуориметрический метод с салицилаль-о-аминофенолом использован для определения алюминия в НС1, HF, H2SO4, HNO3, Н2О2, СН3СООН [58], в GeCl4 [57], в солях лития, рубидия и цезия [57], в солях свинца [168], в солях кадмия высокой чистоты [224], в олове высокой чистоты [228]. Чувствительность метода 10~5—10“8%, относительная ошибка ~ 20%.
Определение с 8-оксихинрлином
Интенсивная зеленовато-желтая флуоресценция хлороформного раствора оксихинолината алюминия при освещении ультрафиолетовым светом положена в основу одного из важнейших флуоримет-рических методов определения алюминия [451, 651, 767, 779, 785, 827а, 1016, 1082, 1106, 1125, 1233, 1272]. Метод высокочувствительный, позволяет определять до 10-4% алюминия, влияние других металлов меньше, чем в фотометрическом методе. Оксихинолинат алюминия обычно экстрагируют хлороформом из растворов с pH 6—9. Интенсивность флуоресценции одинакова при измерении сразу и через 24 часа [767]. Наибольшая чувствительность метода — при использовании 2 мл 0,2%-ного раствора оксихинолина в 50 мл,
135
с 2 мл 2%-ного раствора реагента чувствительность несколько ниже, но воспроизводимость лучше [767]. С увеличением температуры в пределах 10—40° С имеет место очень незначительное уменьшение интенсивности флуоресценции. Хлороформный раствор оксихинолина также несколько поглощает ультрафиолетовый свет при концентрации выше 0,05%, но обычно содержание оксихинолина в флуориметрируемых растворах бывает меньше. Содержание алюминия находят по калибровочному графику, который составляют в пределах 0—5 мкг А\/мл.
Определению алюминия не мешают [1016]:
Элемент Содержание, мкг] мл
Мп 0,3
Си 1
Элемент
Zn
Са, Сг
Содержание, мкг!мл
5
10
По данным Риса [1082], не мешают также до 20-кратных количеств Со, Ni, Cd, Sn, Bi, TI, Mo (VI) и U (VI); не дают флуоресценцию Ce, Pb, Mg, Hg, Ag, Th, W [1233]. Fe, Ti и V гасят флуоресценцию оксихинолината алюминия. Равные количества титана не мешают, а железо до 5 мкг/мл практически также не влияет. Ванадий мешает больше, чем титан и железо. Галлий и индий не мешают лишь при содержании 15 и 3% от количества алюминия. При использовании различной чувствительности растворов оксихинолинатов алюминия и галлия к различным участкам возбуждающего излучения удалось определять их при совместном присутствии [651].
Из анионов не мешают СГ, SO42-, NO3", С1О4_, до 100 мкг/мл SiO2, до 60 мкг/мл СгО42-, до 30 мкг/мл РО43~, до 20 мкг/мл F~. Цитраты и тартраты мешают. Относительная ошибка метода в зависимости от содержания алюминия колеблется в пределах от 5 до 15%. Флуориметрический оксихинолиновый метод использован для определения алюминия в сталях и бронзах [767], в магнии [451], в уране [451], в солях висмута [451], в фосфатных породах [779], в растительных материалах [1125], в воде [1016], в вольфраме и окиси вольфрама [672].
'Определение с понтахромом сние-черным
Понтахром сине-черный R (эриохром сине-черный В) — цинковая или натриевая соль 4-сульфо-2-окси-а-нафталин-азо-0-наф-тола — с алюминием образует комплекс состава А1ОНО2 — — (C20HuN2SO3Na)2 [1252]. Раствор комплекса в органических растворителях (этанол, амиловый спирт) при освещении ультрафиолетовым светом дает красную флуоресценцию с максимумом при 593 нм [142]; рНтах 4,8—4,9 [141, 1252] (рис. 25). При содержании 0,05 мг А1 в 50 мл раствора максимальная интенсивность флуоресценции наблюдается с 1,5 мл 0,1% -ного раствора реагента
136
(в этаноле). При меньших и больших количествах реагента интенсивность флуоресценции сильно падает. Постоянная интенсивность флуоресценции достигается через час и затем остается постоянной (при 24°С). В пределах 10—25°С интенсивность флуоресценции незначительно увеличивается с уменьшением температуры (при 10°С лишь на 2% больше, чем при 25° С). Зависимость интенсивности флуоресценции от концентрации алюминия почти линейна до 0,05 мг А1 (с 1,5 мл 0,1 %-кого раствора реагента).
Чувствительность метода 0,0001 мкг]мл [1076]. Комплекс алюминия можно экстрагировать амиловым спиртом из растворов с pH 4,8—5,4 [142].
Определению алюминия мешают Fe, Си, Сг и Со. Их удаляют электролизом на ртутном катоде. Из элементов, которые не отделяются при электролизе, цирконий не мешает, а титан мешает незначительно, V (V) сильно гасит флуоресценцию [1252]. Мешают также галлий и большие количества никеля. Не мешают Li, Na, К, Rb, Cs, Be, Mg, Ca, Sr, Ba, Cd, Pb, TI (I); при концентрации до 4 мкг/мл не мешают Se, La, Мп, Ni, Zn, Hg, In, Sb (III) [1076]. Из анионов не мешают до 40 мкг/мл ВО33-, SiO32', NO3', РО43-, AsO43“, СО32', SeO42-, SeO|~, СГ, Br-, J- [1076]. С понтахром синечерным R можно определять 5-10“6% алюминия при навеске 1 г.
Понтахром сине-черный — один из наиболее распространенных и наиболее важных реагентов для флуориметрического определения алюминия. Реагент использован для определения алюминия в сталях [1252], бронзах [1252], магнии [142], сурьме [294], в минералах [1252], в вольфраме и окиси вольфрама 1672]. Смотри также работы [141, 290, 672].
Определение с морином
Алюминий с морином образует комплекс состава 1 : 1 [1214] с интенсивной зеленой флуоресценцией. Максимальная флуоресценция наблюдается в присутствии 40 мл этанола и 12 мл 0,15%-ного этанольного раствора морина (конечный объем раствора 100 мл). При меньших и больших количествах этанола и реагента интенсивность флуоресценции уменьшается [1261]. Интенсивность флуоресценции с уменьшением температуры возрастает, при тем
137
пературе ниже 15° С постоянна [1214]. Измерения можно проводить через 15—20 мин. после добавления морина. Оптимальное значение pH 3—3,3 [1261, 1269]. Константа устойчивости комплекса 2,96-• 105 [1214]. Be, Ga, In и РЗЭ флуоресцируют подобно алюминию. Pb, Zn и Мо дают флуоресценцию, если раствор недостаточно подкислен уксусной кислотой. Серебро гасит флуоресценцию. Fe и Сг с морином дают черные осадки. По данным Уилла [1269], определению 2 ч. на 1 биллион алюминия не мешают (в частях на биллион): Fe (Ш)< 10, Сг (III) < 30, Си (II) «С 20, Mg < 200, NH4+ < 500, Са, Со, Ni, Zn, Pb, SiO32- 1000, PO43X 3, F“ <5. He мешают C~ и NO3“, до 9 мг SO42- в 100 мл [1261]. Определяемые пределы алюминия 0,0005—0,005 мг в 100 мл [1269]; относительная ошибка метода до 5% [1214].
Морин представляет собой высокочувствительный реагент для флуориметрического определения алюминия. Недостатки его—мало специфичен, дает высокое значение холостой пробы; комплекс алюминия с морином чувствителен к изменениям температуры. Поэтому морин в настоящее время редко применяется для флуориметрического определения алюминия.
Определение с 2-окси-З-нафтойной кислотой
2-Окси-З-нафтойная кислота с алюминием при pH 3 образует комплекс с яркой голубой флуоресценцией. Состав комплекса при pH 5,8 1 : 1; Куст = 2,37-104 [875]. Реагент при рН> 2 дает зеленую флуоресценцию.
При определении алюминия к анализируемому раствору прибавляют 5 мл ацетатного буферного раствора с pH 5,8, 10 мл 10-1 М раствора натриевой соли 2-окси-З-нафтойной кислоты, разбавляют водой до 100 мл и через час измеряют интенсивность флуоресценции при возбуждении раствора светом с А. = 370 нм.
Определяемые пределы 0,2—12,5 .икг А1. Определению алюминия мешают Be, Sc, Zr, Ga, В, TI, Cu, U, Th, Sb, Bi, In, Ti, Sn, As, Сг (VI), no2-, so32-.
Реагент предложен для флуориметрического определения алюминия сравнительно недавно и еще не нашел применения в лабораториях; не обладает особыми преимуществами перед другими реагентами для флуориметрического определения алюминия.
Определение алюминия с кверцетином
Для флуориметрического определения алюминия можно использовать кверцетин — 3,5,5,2',4'-пентаоксифлавон; комплекс алюминия с реагентом дает интенсивную зеленую флуоресценцию [101]. Оптимальные условия для определения^—5 мл этанола, 1—2,3 мл 0,1 %-кого раствора реагента в объеме 14 мл, pH 4,4—5,0, температура 20—30° С. Интенсивность флуоресценции возрастает до мак-138
симума сразу после прибавления кверцетина и сохраняется постоянной в течение нескольких часов. Линейная зависимость между интенсивностью флуоресценции и количеством алюминия наблюдается при содержании 0,0015—0,0040 мг. Определению 0,003 мг алюминия не мешают: до 400 мг КС1, NaCl, KNO3, до 100 мг K2SO4, КВт, KJ, Ва, 40 мг Са, 45 мг Hg (II), 4,8 мг Mg, 40, мг Мп, 6 мг Со, 2 мг Ni, Ю мг AsO43-, 0,3 мг Sn (II), 0,03 мг РО43-, 0,01 мг V (V), 0,4 мг Си (II), 0,08 мг Mo (VI), 0,003 мг Fe (III) и 0,03 мг Сг (III).
Кверцетин, как реагент для флуориметрического определения алюминия, неспецифичен.
Определение с 1^-салицилидеи-2-амиио-3-оксифлуороном
Метод предложен Уайтом и др. [1262]. Оптимальные условия: содержание этанола 10%, количество реагента 4-кратное (в молях) по отношению к алюминию, pH 5,1—5,4 (рис. 26). В пределах 0—30° С температура заметно не влияет на интенсивность флуоресценции. Линейная зависимость между интенсивностью флуоресценции и количеством алюминия наблюдается при 0,001— 0,04 ммоля алюминия. Визуальная чувствительность 2 ч. на биллион.
Для реагента максимум возбуждения имеет место при 280 и 320 нм, максимум флуоресценции — при 385 нм", для комплекса соответственно при 445 и 525—530 нм. Алюминий и реагент входят в комплекс в соотношении 1 : 2. Комплекс можно экстрагировать бензолом. Влияние других ионов такое же, как и при определении другими реагентами. Железо в количествах, равных или больших, чем алюминий, уменьшает интенсивность флуоресценции и должно быть удалено. При молярном отношении Fe : Al = = 0,7 : 1 оно не мешает.
Реагент по специфичности подобен остальным обычно применяемым для флуориметрического определения алюминия реагентам, но превышает их по чувствительности. Он более чувствителен, чем салицилаль-о-аминофенол, 2-окси-З-нафтойная кислота, морин, понтахромовый сине-черный R. Поэтому этот новый реагент можно считать перспективным для флуориметрического определения алюминия.
Рис. 26. Зависимость интенсивности флуоресценции (Ф) комплекса алюминия с N-салицили-ден-2-амино-З-оксифлуороном в 10%-ном этаноле от pH [1262]
139
Определение с формилгидразоном салицилового альдегида
Формилгидразон салицилового альдегида с алюминием при pH 4,7—4,9 образует флуоресцирующий комплекс; отношение алюминия к реагенту в комплексе от 1 : 1 до 1 : 2 [817а]. Чувствительность реакции 0,08 мкг А1/25 мл. Линейная зависимость между интенсивностью флуоресценции и количеством алюминия^ имеет место при содержании 0,7—22 мкг А1/25 мл. Определению алюминия не мешают:
Элемент или соединение
Na, К, NH«+ Hg, Ca, Cd, Мп Sr, Ba, Pb, TI
Избыток
10 000
1000
100
Элемент нли Избыток
соединение
Ag, Hg, Bi, U, Co Ю
NaCl 200000
Na2SO4 loo
Мешают Fe (III), Cr (III), Ni, Zn и Си. Влияние 25 мкг Cu/25 мл можно устранить при помощи 0,3 мл 5%-ного раствора тиосульфата. 2,5 мкг Fe(III), 1 мкг Сг, 5 мкг Ni и 20—100 мкг Zn можно маскировать 1 мл 1 %-кого раствора тиогликолевой кислоты. Относительная ошибка метода 1 %.
Формилгидразон’ салицилового альдегида сравнительно мало чувствительный для флуориметрического определения алюминия реагент. Определению алюминия мешают многие металлы; мало мешают лишь щелочные и щелочноземельные металлы. Поэтому этот реагент не представляет интереса при флуориметрическом определении алюминия.
Определение с люмогаллиоиом
Люмогаллион — 2,2",4'-триокси-5-хлор- (1-азо- 1')-бензол-3-суль-фокислота — с алюминием образует флуоресцирующий комплекс состава 1 : 1 [3076, 307в].
Максимальная интенсивность флуоресценции наблюдается при pH 5, после нагревания при 80° С в течение 20 мин. Максимум флуоресценции комплекса находится при 576 нм. Комплекс алюминия можно экстрагировать н.бутиловым, н.амиловым или изоамиловым спиртами. Флуоресценция устойчива в течение 2 час. Закон Бера соблюдается при 0,1—2 мкг А1/25 мл. Определению алюминия мешают Fe (III), Ni, Со, Си (II), Sn (IV), Sc, Ti (IV), V (V),Cr (VI). Люмогаллион использован для флуоресцентного определения алюминия в морской воде [3076].
Определение с другими реагентами
Для флуориметрического определения алюминия предложен понтахромовый фиолетовый SW, похожий строением на понтахромо-вый сине-черный R. Метод очень чувствительный, зависимость 140
интенсивности флуоресценции от концентрации алюминия до 20 .икг/50 мл почти линейна. Недостатки реагента: требуется строгий контроль pH, флуоресценция гасится даже в присутствии малейших следов Fe [1252].
Цинковая соль 4-сульфо-2,2'-диоксиазонафталина не заслуживает внимания из-за сильного влияния pH и других ионов [101]. Для флуориметрического определения алюминия предложены также о,о -диоксиазобензол [1145], 8-оксихинальдин [763], салицилал-семикарбазид [188]. Коренман и Гришин [187] изучили оксиантрахиноновые красители, а Головина и др. [92] — некоторые флава-нбвидные красители в аспекте использования их для флуориметри-ческого определения алюминия. Для этой цели синтезирован ряд реагентов, содержащих о,о'-диоксиазогруппы [518]. Бабко и др. [28] провели сравнительное изучение некоторых реагентов для флуориметрического определения алюминия.
Применение флуориметрических методов требует использования очень чистых реагентов и воды. Дистиллированная вода должна быть очищена дополнительно с помощью ионитов. Реактивы должны быть по возможности самой высокой степени чистоты, или обычные реактивы нужно предварительно очищать. Буферные растворы рекомендовано очищать от примесей алюминия, пропуская через колонку с анионитом ЭДЭ-10П или активированным углем и использованием люмогаллиона для связывания алюминия. При применении оксихинолинового метода-буферный раствор встряхивают с хлороформным раствором оксихинолина. Все растворы надо хранить в кварцевой или полиэтиленовой посуде.
Полярографические методы
Возможность определения алюминия полярографическим методом впервые исследовалась Прайцлером [1078]. С тех пор появилось довольно много работ по полярографическому определению алюминия как прямыми, так и, особенно, косеенными’методами.
Прямые методы определения
Еще Прайцлер [1078] наблюдал хорошо выраженную волну алюминия на фоне 0,05М раствора хлорида бария с потенциалом полуволны — 1,75 в по отношению к насыщенному каломельному электроду (н. к. э.). Этот потенциал очень близок к потенциалу разряда Na, К или Ва, и волна алюминия не полностью выражена в присутствии больших концентраций указанных ионов. Волна водорода с Д1/2 = — 1,58 в при pH 3 на фоне 0,007 М раствора LiCl [377] предшествует и очень близка к волне алюминия. Потенциал полу
141
волны алюминия зависит! от концентрации кислоты [2101:
pH pH
1,9 —1,88 3,0 —1,76
2,15 -1,86 4,0 -1,66
2,6 -1,80
При pH < 3 волна алюминия маскируется волной водорода. Большие значения pH лимитируются гидролизом солей алюминия, вследствие чего пропорциональная зависимость между концентрацией алюминия и диффузионным током не наблюдается. Успех прямого полярографического определения алюминия зависит, следовательно, от очень строгого контроля pH. Оптимальная среда pH 3,5— 4,0. Интервал pH очень узок и, кроме того, он меняется в зависимости от концентрации алюминия. В качестве фона предлагались различные электролиты: хлориды калия, натрия [114], кальция [173, 460, 1111], магния [1040], бария [1078] и лития; глюконат кальция [47], хлорид тетрабутиламмония [1221], тетраалкиламмоний [806, 890], смесь диметилсульфоксида и ацетилацетона [782], салицилат натрия и др.
Высота волны алюминия зависит от pH раствора, а также от концентрации индифферентного электролита [173]. Форма волны алюминия легко меняется в зависимости от условий [1111]. По указанным причинам возможности использования прямых методов определения алюминия весьма ограниченны.
Косвенные методы определения
Косвенные методы определения алюминия основаны на двух принципах: на уменьшении высоты волны некоторых органических реагентов в присутствии алюминия, когда образовавшийся комплекс алюминия не восстанавливается, и изменении характера полярограммы некоторых красителей в присутствии алюминия вследствие образования комплекса [1271]. При добавлении алюминия в небольших концентрациях к раствору, содержащему избыток красителя, получается двойная волна. Первая соответствует количеству непрореагировавшего красителя, вторая пропорциональна концентрации комплекса алюминия.
В методах, основанных на образовании не восстанавливаемых комплексов алюминия, использованы оксихинолин [619, 678, 1047], хинализарин [364, 365], кислотный хром синий К [68, 413], эрио-хромчерный Т [53], четырехнатриевая соль ЭДТА [944].
Паркс и Ликен [1047] измеряли уменьшение высоты волны стандартного раствора оксихинолина после добавления анализируемого раствора, содержащего алюминий, и с помощью калибровочного графика рассчитывали содержание алюминия. Недостаток метода —
142
неполнота осаждения (~ 90%) оксихинолината алюминия в предлагаемых условиях даже при выдерживании растворов в течение часа.
Терентьева [413] определяет алюминий в алюмоорганоснлокса-нах дифференциальной полярографией, используя кислотный хром синий. После разложения образца фтористоводородной и серной кислотами, сплавления остатка с карбонатом натрия раствор плава полярографируют от 0 до — 0,8 в (относительно ртутного анода) и измеряют высоту второго пика (—0,7 в) от основания первого пика; абсолютная ошибка метода ±0,3%. Этот же реагент использован для определения алюминия в сточных водах [68] с относительной ошибкой ±4%.
Скобец и др. [364, 365] определяют алюминий в почвах, используя образование комплекса с хинализарином, который не восстанавливается на капельном ртутном электроде. Хинализарин на фоне смеси 0,1 М раствора NH4C1 и 0,1 М NH4OH образует волну с £i/2 = —0,6 в (относительно н.к.э.). В присутствии алюминия высота волны уменьшается пропорционально концентрации алюминия. Mg, Са, Мп и Zn маскируют комплексоном III, железо связывают в комплекс при помощи K4Fe (CN)e.
Для определения алюминия предложено также использовать уменьшение высоты волны эриохромчерного Т (с Е^2 = 0,625 в) в присутствии алюминия (вследствие образования комплекса).
Лидерсен [944] определял алюминий по уменьшению высоты волны четырехнатриевой соли ЭДТА в присутствии алюминия при pH 4,7. ,
Более многочисленны методы, основанные на образовании восстанавливаемых комплексов алюминия.
Определение с солохромовым фиолето-в ы м. Виллард и Ден [1271] предложили метод, основанный на образовании комплекса алюминия с диазокрасителем — натриевой солью 2-оксинафталин- (1-азо-1)-2-оксибензол-5-сульфокислоты (другие названия реагента: понтахромовый фиолетовый SW, со-лохромовый фиолетовый RS, суперхромфиолетовый В). Для красителя £i/2 = — 0,3 в (н.к.э.). В присутствии алюминия высота волны красителя уменьшается и появляется новая волна с потенциалом, на 0,2 в более отрицательным (рис. 27). Высота второй волны пропорциональна концентрации алюминия. Исследуя этот
Рис. 27. Полярографическая волна солохромового фиолетового 11110]
/ — в отсутствие алюминия; 2 — в присутствии алюминия (pH 4,6)
143
метод, Рейнолдс и Перкинс [1057, 1110] нашли, что высота волны комплекса алюминия повышается с увеличением pH. Они установили, что образуются два комплекса с соотношением алюминия к красителю 1 : 2 и 1 : 3, устойчивые при pH 4,2—5,0 и 5,7—7,0 соответственно (высота волны остается постоянной).
Обычно алюминий определяют при pH 4,7 (ацетатный буферный раствор). Определению алюминия не мешают 1000-кратные количества Be, В,Са, Mn, Mg и Zn [1056]. Особенно важно, что бериллий не влияет, так как при определении алюминия многими другими методами он мешает. Возможно определение алюминия в бериллии [1056].
Со, Ni, Fe, Ti и V с солохромовым фиолетовым RS образуют комплексы и мешают определению алюминия. Медь образует нерастворимый комплекс. Фториды, цитраты и оксалаты уменьшают высоту волны. Комплекс алюминия с солохромовым фиолетовым RS при обычной температуре образуется медленно, при нагревании до 60° С — в течение 2 мин. [739]. При содержании 0,01 — 1,5 мг А1/50 мл калибровочный график прямолинейный и проходит через начало координат [739]. Чувствительность метода 2-10~4%, относительная ошибка 3%.
С помощью солохромового фиолетового определяют алюминий в стали [739, 1121], ферротитане [778], в сплавах Fe — V, Fe — Zr и Fe — Ti [251a], в Pb — Sn-сплавах [566], в почвах [1], в рудах [257], цинковых покрытиях [257] и др. Предложены методы одновременного определения алюминия и цинка в магниевых сплавах [744], алюминия и магния в горных породах [708]. Предложено полярографическое определение алюминия по окислению его комплекса с солохромовым фиолетовым RS на вращающемся графитовом пиролитическом электроде [726]. Реагент и алюминий на фоне 0,2 М ацетатного буферного раствора с pH 4,7 дают анодные волны с Е</г = + 0,53 в и + 0,87 в, соответственно. По волне комплекса можно определять 25 мкг РЛ/мл. При pH 4,7 определению алюминия не мешают 20-кратные количества Ag, As, Be, Bi, Ge, Cd, Ca, Cr, Cu, Hg, Li, Mg, Mo, Ni, Pb, Pr, Sb, Sn, Th, TI, U, W, Zn, Zr, PO43‘ и растворенного кислорода. Мешают Fe (III), V (V), Ti (IV), Co, Mn и F".
Определение с суперхромгарнетом Y. Натриевая соль 5-сульфо-2,4,2-тригидроазобензола (суперхромгарнет Y) в ацетатном буферном растворе (рНЗ—6) дает четко выраженную волну. В присутствии алюминия высота этой волны уменьшается и появляется новая волна восстановления комплекса алюминия, смещенная в более отрицательную сторону; высота этой волны пропорциональна концентрации алюминия в растворе. На этом основано полярографическое определение алюминия [199, 653, 723]. Куни и Сэйлор [653] использовали суперхромгарнет Y для определения алюминия и галлия при совместном присутствии при pH 5,5; определению алюминия мешают Zn, Мп, Се (IV), Fe (HI), V (IV), 144
Рис. 28. Осциллограмма суперхромгар-нета V в ацетатном буферном растворе с pH 3,4 [725]
Рис. 29. Осциллограмма суперхромгар-нета Y в присутствии алюминия в ацетатном буферном'растворе с рН_3,4 [725]
Ni, Cd и Pb, не мешают Mg, Са, К, Na, Cs, фосфаты, нитраты, сульфаты и ацетаты. Относительная ошибка метода 3—5%. Костицына и Скобец [199] определяли алюминий в сплавах после связывания железа и меди в ферроцианидные комплексы. Определение проводили при pH 4,6; чтобы ускорить образование комплекса, растворы нагревали до 60° С. Относительная ошибка 5%. Флоренц и Изард [723, 725] определяли алюминий в соединениях тория и в бериллии осциллографической полярографией с использованием суперхром-гарнета Y. В ацетатном буферном растворе при pH 3,4—3,5 адсорбционный пик суперхромгарнета наблюдается при —0,3 в (относительно ртутного катода), при —0,51 в появляется новый пик, пропорциональный концентрации алюминия (рис. 28 и 29). Бериллий в высоких концентрациях уменьшает высоту пика, поэтому и при выполнении анализа, и при составлении калибровочного графика концентрация бериллия в растворе должна быть приблизительно постоянной (с отклонением 4- 3%). Оптимальная среда pH 3,4—3,5. Определению алюминия мешают Ni, Pb и Мо, которые удаляют электролизом на ртутном катоде. Относительная ошибка метода 2 %.
В соединениях тория алюминий определяют при pH 5,75 [723]. Для полноты образования комплекса растворы оставляют на ночь; в этом серьезный недостаток метода. Мешающие элементы удаляют электролизом на ртутном катоде. При содержании алюминия 0,04% и 0,001% относительная ошибка +3% и + 7% соответственно.
Определение с оксихинолином. Ден и др. [678] предложили метод одновременного определения А1 и Fe, а также Al, Fe и Ti полярографированием раствора оксихинолина-тов в диметилформамиде. Осажден и; в виде оксихинолинатов позволяет отделить эти металлы от щелочных и щелочноземельных металлов, а также от ионов NH4+, которые при высоких концентрациях мешают определению алюминия. Одновременное определение указанных металлов возможно благодаря большой разнице между величинами их Е</,. Раствор оксихинолината алюминия в диметилформамиде дает три волны с Ду, = — 1,75; —2,10 и —2,37 в. Из них наиболее выражена первая. Вода при содержании до 1%
145
не влияет ни на форму, ни на высоту этой волны, поэтому нет необходимости тщательно высушивать осадок, достаточно сушить его при 120° С. 50 мг высушенного и взвешенного осадка растворяют в диметилформамиде, разбавляют до 50 мл этим же растворителем и полярографируют. Для определения Fe, Ti, и Al пользуются волнами с Е<1г= —0,64; —1,37 и —1,75 в соответственно.
Определение с эриохром ф и о л е т о в ы м ВА. Микула и Кодел [969] использовали этот реагент для определения алюминия в титановых сплавах. Определение проводят при pH 4,6, для ускорения образования комплекса растворы нагревают 5 мин. на водяной бане с температурой 55—70° С. Полярографируют от —0,2 до —0,8 в по н.к.э. По высоте второй волны с помощью калибровочного графика определяют содержание алюминия.
Титан удаляют в виде купфероната, хром — в виде хлорида хромила. Си, Ni и Со, а также остатки хрома отделяют электролизом на ртутном катоде. Хлориды удаляются при выпаривании раствора с хлорной кислотой. Относительная ошибка метода 4% при содержании алюминия 1%.
Для косвенного полярографического определения алюминия предложены также диамант хром красный А [906], ализариновый черный SN [1057] и некоторые другие реагенты. Обзор полярографических методов определения алюминия приведен в работе [514].
Радиоактивационные методы
Радиоактивационный метод =— один из наиболее чувствительных методов определения алюминия. Чувствительность его 10-5% [234, 924, 1026]. Радиоактивационные методы определения алюминия основаны на ядерных реакциях:
А127 (я, т) А128 (Г = 2,3 мин.);
Al27(re,p)Mg27 (7’1/а = 9,5 мин.);
Al27 (я, a) Na24 (Т1/а = 15,0 час.);
А127 (а, я) рзо.
Из них чаще всего применяют первую реакцию. Анализируемый образец вместе с эталонами облучают в реакторе тепловыми нейтронами (поток 2-Ю10 — 3-1011 нейтрон]см2-с&1) в течение 1—5 мин. Затем в течение 1—2 мин. измеряют активность А128 по у-пику (Еу = 1,78 мэв) при помощи сцинтилляционного у-спектрометра. Чувствительность метода 10~5%, относительная ошибка 6—20%. Этим методом определяют алюминий в горных породах [594, 1112], в каолиновых глинах [235], алмазе[1112], графите[1026] и в растворах [859]. При определении алюминия в металлических Zr, Fe и Си по этой реакции предварительно отделяют цирконий осаждением в виде миндалята, железо — экстрагированием его хлорида эфиром,
146
медь — электролизом. Примеси А1 и V соосаждают с Fe (ОН)3 и после облучения (не разделяя) определяют алюминий у-спектро-метрическим методом [730].
Источником тепловых нейтронов служит также Ро-Ве-нейтронный источник [594], ядерная реакция Be9 (у, n) Be8 [1112]. Описан метод одновременного определения алюминия и кремния в рудах, основанный на различии их сечений активации по отношению к медленным и быстрым нейтронам [171]; использована ядерная реакция А1 27 (n, р) Mg 27. При использовании ядерной реакции А127 (n, a) Na 24 образец облучают 1,5 часа при потоке 5-10-7 нейтрон-см2/сек. Активность измеряют через 2 часа после облучения, т. е. после распада короткоживущих изотопов А1 28 и Mg 27. Определению алюминия не мешают магний и железо. Относительная ошибка метода 5% [1234].
Для определения алюминия можно использовать ядерную реакцию А127 (а, п) Р 30 [1022]. Источником а-частиц служит Ро 210 (— 15 мкюри), нанесенный на платиновую мишень. Время облучения 6 мин. Через 20 сек. после конца облучения измеряют активность образца на счетчике Гейгера-Мюллера в течение 6 мин. Вводят поправку на распад Ро 210. Между содержанием алюминия в образце и активностью образца имеется линейная зависимость. На точность метода влияют расстояние между источником а-частиц и образцом, время облучения, измерения и плотность образца. Ошибка метода 5%. м»
Радиоактивационный метод использован для определения алюминия в медных^рудах [236], в вольфраме [1096], в слюде [234] и нефти [234].
Спектральные методы
Спектральные методы определения алюминия нашли очень широкое применение при анализе металлов, сплавов и других материалов. Аналитические линии алюминия, используемые при спектральном .анализе, находятся в ультрафиолетовой области спектра. 3 табл. 13 приведены основные чувствительные линии алюминия. Наиболее чувствительные линии алюминия в дуге — линии с X = = 3961,531 ;3944,031 и 3082,161 А. Из них чаще всего пользуются линиями с X = 3082, 16 и 3961, 53 А. Самые чувствительные линии в искре — линии с X =3961, 53 1, 3944,031, 3092,711, 3082,161, 2816, 1811 и 2669, 17 II А. Наиболее часто используются линии с X = 3082,16 и 3092,71 А. ]
Определение в металлах и сплавах
Металлы и сплавы чаще всего анализируют непосредственно из компактных кусков. В тех случаях, когда металл неоднороден, его переводят в раствор, затем выпариванием и прокаливанием пере-водят в окисел. После измельчения порошок окислов в смеси с внут-
147
Таблица 13
Аналитические линии алюминия и их интенсивность
Длина Волны, А Энергия возбуждения линий,эв Интенсивность линий Длина волны, А Энергия возбуждения линий, эв Интенсивность линий
В дуге в искре в дуге в искре
6243,36 II * 15,1 80 3082,16 I 4,0 800 R 800 R
6231,76 11 15,1 — 35 2816,1811 4,6 10 100
3961,53 1 3,1 3000 2)00 2669,17 II 4,6 3 100
3944,031 3,1 2000 1000 2631,55 II 15,3 — 60
3092,71 I 4,0 1000 R 1000/?
*1 —линия, испускаемая нейтральным атомом;
II —линия, испускаемая ионизированным атомом; R — самообращающаяся линия.
ренним стандартом (иногда вводят еще различные носители) помещают в углубление угольного электрода и возбуждают спектры в дуге или искре. В большинстве случаев из приготовленной смеси порошка окислов, внутреннего стандарта и носителя прессуют брикеты. Ту же цель — уменьшение ошибки из-за неоднородности образцов — преследуют при анализе металлов и сплавов из растворов. Анализируемые растворы можно вводить в разряд по-разному. Самый простой способ — пропитывание угольного электрода анализируемым раствором. Так определяют алюминий в железе и стали [139, 152, 225, 668, 861, 1285], в никеле и его сплавах [603, 604, 844], в бронзах [917]. Такой способ введения не может обеспечить высокую чувствительность. Лучше вводить раствор непрерывно через отверстие в верхнем угольном электроде [650], с помощью фульгуратора [20, 60] или с помощью нижнего угольного электрода, смачивающегося при вращении раствором [554, 830].
Определение в железе, чугуне, стали иферросплавах
Алюминий в железе, если не требуется высокая чувствительность, можно определять спектральным методом непосредственно из образца металла.
При анализе восстановленного железа из образцов готовят брикеты весом 7—10 г, диаметром 20 мм и высотой 5—7 мм. Спектры возбуждают в течение 30 сек. без предварительного обжига в дуге переменного тока (5 а) при емкости 4 мкф, с верхним медным электродом. Используют аналитическую пару линий: А1 3092,71 — Fe 3098,2 А [341].
При анализе железной губки для получения более однородных образцов 0,2 г губки растворяют в ~8?V HNO3, с добавлением 1—2 мл H2SO4, раствор упаривают досуха и прокаливают при температуре не выше 900° С. Остаток измель-148
чают, 5 мг тонко истертого порошка помещают в кратер анода и смешивают с 5 мг графитового порошка. Смесь покрывают тонким слоем графита и испаряют до конца. В качестве источника возбуждения применяют дугу с постоянной температурой. Используют линию алюминия 3082,16 А. Средняя квадратичная ошибка метода 10—11% [950а].
При определении алюминия в железе методом глобульной дуги образец растворяют в HNO3, из раствора осаждают аммиаком гидроокиси, после высушивания их прокаливают в муфельной печи до окислов в течение 20 мин. при 700° С. Из прокаленного осадка прессуют брикеты. Источник возбуждения — дуга постоянного тока, брикет из анализируемого образца служит катодом. Ширина щели спектрографа 0,015 мм, экспозиция 40 сек., I = 7а. Аналитическая пара линий: А1 3082,16 — Fe 3029,24 А. Чувствительность метода (1—5)-10—3% [228а].
Чувствительность определения алюминия в железе можно повысить, применяя предварительное концентрирование.
2 г железа или стали растворяют в кислоте и железо удаляют экстрагированием метилизобутилкетоном. Водный раствор выпаривают досуха, растворяют в 10мл 6N НО, содержащей 10мг калия/мл, и вносят в отверстие пористого электрода с размерами: глубина 20 мл, диаметр 3 мм, толщина дна 0,6 мм. Нижний электрод, заточенный на усеченный конус, помещают на расстоянии 2 мм от верхнего. Ширину щели спектрографа устанавливают 0,010 мм. Спектры возбуждают в течение 40 сек. после 40 сек. предварительного обыскривания. Для возбуждения спектров применяют униполярный низковольтный искровой разряд с регулируемыми параметрами. Наибольшая интенсивность линии алюминия соответствует С = ЪОмкф, сопротивлению 2 ом и самоиндукции ЗОмгн при включении пористого электрода катодом. Аналитическая пара линий: А1 3961,53 — К 4044,14 А. Относительная ошибка метода 8% [1285].
При определении алюминия в легированных чугунах в качестве источника возбуждения целесообразно применять конденсированную или высокочастотную искру [565].
Прн возбуждении спектра высокочастотной искрой рекомендуются следующие условия.
Напряжение во вторичной цепи трансформатора 3000 в, ток питания трансформатора 0,8 а, величина зазора в задающем разряднике 0,9—1 мм. Емкость разрядного контура 0,01 мкф, емкость шунтирующего конденсатора 120 пф\ индуктивность катушки 0,01 мгн, аналитический промежуток 1,8мм, ширина щели спектрографа 0,015 мм. В качестве подставного электрода применяют пруток из электролитической меди с диаметром 5— 6 мм, заточенный в рабочей части на цилиндр с диаметром 1,6 мм. Спектры снимают без конденсора, расстояние от искры до щели спектрографа 100мм. Предварительное обыскривание в течение 35—40 сек., экспозиция 25—30 сек., фотопластинки спектральные типа 1; используется аналитическая пара линий: А1 3082,15 —Fe 3083,74 А. Определяемые пределы 0,04—2,0%, относительная ошибка не больше 4,5% [212а].
Авторы работы [388] исследовали различные методики определения малых количеств алюминия в стали и установили, что наилучшая воспроизводимость наблюдается в случае применения в качестве электродов стержней из исследуемого металла или при комбинации простого образца и угольного контрэлектрода. Спектры возбуждают в дуге переменного тока, используют кварцевый спектрограф средней дисперсии. Экспозиция 20—40 сек., предварительный обжиг 10—20 сек., ток от 3 до 6а. Аналитическая пара ли
149
ний: Al 3082,16 — Fe 3116, 63 А. Относительная ошибка метода 3— 6%.
В простых углеродистых и малолегированных сталях алюминий можно определять с использованием всех обычных источников возбуждения. При анализе с дугой переменного тока рекомендуются следующие условия определения.
Напряжение 220 в, ток дуги 5—6а, промежуток в разряднике 0,7—0,8 мм, аналитический промежуток 2 мм. Постоянный электрод — медный стержень с диаметром 7—10 мм, заточенный на усеченный конус с рабочей площадкой с диаметром 1,5леи. Спектрограф кварцевый, средней дисперсии, ширина щели спектрографа 0,015—0,02 мм. Спектры снимают с трехлинзовой конденсорной системой или без конденсора при расстоянии 180—200 мм от дуги до щели. Предварительный обжиг 30 сек. Экспозиция определяется чувствительностью фотопластинки (спектральные типа I). Используется аналитическая пара линий А1 3082,16 — Fe 3083,74 А; границы определяемых содержаний алюминия 0,02—1,5%.Относительная ошибка метода 3,5—5% [212а].
Аналогичная методика описывается в работе [1219].
Для определения алюминия в высоколегированных сталях с использованием конденсированной искры можно рекомендовать метод Комаровского [178а].
Напряжение 220 в, I = 3—3,5а, С = 0,005—0,01 мкф, катушка индуктивности отключена. Аналитический промежуток 2,5лси, постоянный электрод — пруток электролитической меди с диаметром 3—4 мм. Применяется спектрограф кварцевый, средней дисперсии, ширина щели спектрографа 0,025 мм. Предварительное обыскривание в течение 60сек., экспозиция зависит от чувствительности пластинки (спектральные типа I). Используется аналитическая пара линий А1 3082,16 — Fe 3083,74 А. Относительная ошибка метода 3,5%.
11.
По методу, предложенному Богдановой и Тагановым [54а[, хромоникелевые аустенитные стали анализируют с дугой переменного тока.
Ток дуги 5а, аналитический промежуток 2 мм. Постоянный электрод — медный пруток с диаметром 7 мм, заточенный на усеченный конус с площадкой диаметром 2 мм. Спектры снимают на кварцевом спектрографе средней дисперсии с освещением щели через цилиндрический конденсор при нерезком изображении источника на щели. Ширина щели спектрографа 0,020 мм. Предварительный обжиг в течение 20—30 сек., экспозиция 30—40 сек. Применяются фотопластинки диапозитивные или спектральные типа I. Аналитическая пара линий А1 3082,16 — Fe 3055,27 А и Al 3082,16—Fe 3116,64 А. Определяемые пределы 0,015—1,5% алюминия, относительная ошибка 3,3%.
Куделя [211] для определения алюминия в аустенитных сталях и сварных швах использует высокочастотную искру.
Для определения алюминия в магнитных сплавах в качестве источника возбуждения можно использовать дугу переменного тока* конденсированную и высокочастотную искру. При применении дуги переменного тока рекомендуются следующие условия работы [99а, 387].
Ток дуги 5а, ширина щели спектрографа 0,025—0,030 мм, аналитический промежуток 1,8—2,0 мм; предварительный обжиг 10 сек., экспозиция 20—30 сек.
150
Постоянный электрод—угольный стержень диаметром 5 мм , заточенный на полу сферу. Аналитическая пара линий: А1 2652,48 — Fe 2656,79 А. Определяемые пределы 5,0—15,0% алюминия. Относительная ошибка 4—8% .
Куделя [212] определяет алюминий в магнитных сплавах с использованием высокочастотной искры.
Применяется спектрограф средней дисперсии. Условия работы: ток питания генератора 0,8а, напряжение во вторичной цепи трансформатора 4000 в; емкость в колебательном контуре 0,01 мкф, емкость конденсатора, шунтирующего аналитический промежуток, 100 пф, аналитический промежуток 1 мм. Постоянный электрод — магниевый пруток, заточенный в рабочей части на цилиндр диаметром 1,6—1,8 мм. Предварительное обыскривание 40 сек, экспозиция 80 сек. Для уменьшения ошибки из-за неравномерности состава сплава снимают спектры 5 участков поверхности. Аналитическая пара линий: А1 3082,16— Fe 3047,61 или А1 3082,16 — Mg 3091,08 А. Определяемые пределы 4,0—16,0% алюминия, относительная ошибка 4,45%.
Ряд авторов предлагает определять алюминий в сталях, переводя образцы в раствор. Эти методы позволяют раздельно определять содержание общего и растворимого в кислотах алюминия. Общее содержание алюминия определяют непосредственно из компактного металла. Растворимый в кислоте алюминий определяют после растворения образца в кислоте, подвергая спектральному анализу полученный раствор.
По методу Левитина и Смирновой [225], Для определения общего содержания алюминия спектры возбуждают в дуге переменного тока при 5 а с медным электродом, заточенным на конус. Используют спектрограф средней дисперсии, ширина щели спектрографа 0,015 мм, аналитический промежуток 1 мм. Предварительный обжиг 10 сек, экспозиция 20 сек. Аналитическая пара линий: А1 3082,16 — Fe 3055,26 А. Для определения растворимого в кислоте алюминия 1 г образца растворяют в 10л1л НС1 (1 : 1), осадок А12О3Готфильтровывают и раствор обрабатывают концентрированной^НМОд для окисления железа. Синтетические эталоны готовят растворением железа «армко» с введением А1С13. Оба угольных электрода пропитывают анализируемым раствором, высушивают в течение 30 мин. при 400° С и спектры возбуждают при 5а с дуговым промежутком 1 мм. Концы электродов затачивают на полусферу. Относительная ошибка определения алюминия ~9%.
По другому методу [650] анализируемый раствор подают непрерывно к месту возбуждения через канал в верхнем электроде. Верхний электрод соединяют'с резервуаром, снабженным краном. В резервуар помещают 5л«л анализируемого раствора, кран открывают так, чтобы в минуту вытекало 10—20 капель раствора. Экспозиция 80 сек. В качестве источника возбуждения использована высоковольтная конденсироваииая искра типа Фейснера. Аналитическая пара линий: А1 3092,71— Fe 3116,6 А при содержании алюминия <0,001% и А1 3082,16 — Fe 3116,6 А для 0,03—0,08% алюминия.
Такой способ подачи анализируемого раствора в источник возбуждения позволяет определять малые количества алюминия в стали. Нанесение нескольких капель анализируемого раствора на графитовый электрод, как это рекомендуют некоторые авторы [139, 668, 861], не обеспечивает необходимую чувствительность при малых содержаниях алюминия.
151
Колбовский и Крижановская [175] при анализе сталей в виде растворов вводят хлорид натрия, который, по их мнению, увеличивает наклон графика.
Для ферросплавов характерно неравномерное распределение составляющих; для уменьшения ошибок, связанных с неоднородностью, ферросплавы переводят в раствор, либо после измельчения и перемешивания с порошком меди или ее окисью брикетируют.
Для определения алюминия в ферросилиции можно рекомендовать метод Веселовской [79а].
Ферросилиций измельчают в железной ступке в порошок (200 меш), последний тщательно перемешивают с медным порошком в соотношении 3 : 7. Из 1 г этой смеси прессуют брикеты диаметром 7 мм. Источник света — генератор ИГ-2, ток питания генератора За; емкость конденсатора 0,01 мкф, индуктивность катушки 10 мкгн, промежуток в разряднике 3,7 мм, аналитический промежуток 2,7 мм. Постоянный электрод — угольный пруток диаметром 5 леи, заточенный на усеченный конус с площадкой диаметром 1 мм. Ширина щели спектрографа 0,025 мм; предварительное обыскривание 60 сек., экспозиция 30 сек. Фотопластинки спек-ральные типа I или диапозитивные чувствительностью 0,5 ед. ГОСТ. Аналитическая пара линий А1 3082,16 — Си 3108 , 60 А. Определяемые пределы 1,50—5,0% алюминия. Относительная ошибка метода 2,9%.
По методу, описанному в работе [543], 0,5 г ферросилиция смешивают с 0,5 г порошка графита и 0,5 г СиО. Смесь прессуют в таблетки диаметром и высотой 10 мм. Спектры возбуждают в конденсированной искре от генератора Фейснера (емкость 1650 пф, самоиндукция 0,8 мая) с верхним угольным электродом при искровом промежутке 2 ми. Используют спектрограф средней дисперсии, ширина щели 0,005 ми. Аналитическая пара линий AI 3082,16 — Си 3063,41 А.
При определении алюминия в ферротитане измельченный образец наносят в виде полоски на никелевую пластинку, служащую нижним электродом, которую в процессе экспозиции равномерно перемещают [716]. Источником возбуждения служит дуга переменного тока. Аналитическая пара линий А1 2652,48 — Fe 2679,07 А. Относительная ошибка метода 1,35%.
Феррониобий анализируют аналогично, нанося смесь порошка образца с Fe2O3 и графитом на медный или никелевый медленно вращающийся (10 об/мин.) дисковый электрод. Аналитические линии: А1 2660,39 — Fe 2635,81 А. Определяемые пределы 0,50— 1,2% алюминия, относительная ошибка 4—5%.
Определение в никеле и никелевых сплавах
Никель можно анализировать непосредственно из образцов металла при помощи маломощной искры, получаемой с генератором ДГ-1 или ДГ-2 отключением питания дуги [346а].
Ток в первичной цепи 0,5 а, промежуток в разряднике 1,0 мм, искровой промежуток 1,0 мм. Применяется спектрограф средней дисперсии, ширина щели 0,020 мм. Аналитические линии: А1 3092,71 — Ni 3097,12 А.
Для получения более точных результатов никель предварительно растворяют в HNO3, полученный раствор выпаривают и остаток прокаливают в муфельной печи до окислов. Из 0,2 г окисла прессуют брикеты диаметром 5 мм. Брикеты ста
152
вят на цилиндрические графитовые подставки диаметром 10—12 мм. Вторым электродом служат спектральночистые угли. Источник возбуждения — активизированная дуга постоянного тока; используется кварцевый спектрограф средней дисперсии, ширина щели 0,012 мм. Аналитическая пара линий: А1 3092,71 — Ni 3066,44 А.
Описаны методы анализа никеля после растворения образца в кислоте [603, 604 , 844].
Образец растворяют в HNO3 и раствор разбавляют таким образом, чтобы в миллилитре раствора содержалось 100 мг Ni. 0,025 мл раствора помещают на торец угольного электрода диаметром 4,5 мм, предварительно пропитанного Зубным раствором полистирола в бензоле и высушивают в сушильном шкафу в течение 3 час. Для облегчения испарения труднолетучнх элементов применяют электроды с шейкой. Спектры возбуждают в дуге переменного тока (4,5 а), предварительный обжиг 15 сек., экспозиция 30 сек. Аналитическая пара линий: А1 3092,71 — Ni 3131,8 А. Эталоны в пределах 0,005—0,1% алюминия готовят растворением 1 г никеля 99,95% -ной чистоты в 5 мл HNOS и введением определенных количеств алюминия.
Нихром анализируют с использованием дуги переменного тока 1387].
Ток дуги 3—4 а, ширина щели спектрографа 0,02 мм, аналитический промежуток 1,5 мм. Постоянный электрод — никелевый пруток (илн угольный электрод) диаметром 8—9 мм, заточенный на полусферу. Предварительный обжиг 10 сек. Аналитическая пара линий: А1 3082,16—Ni 3097, 12 А; определяемые пределы 0,1—2,0% алюминия, относительная ошибка 3—4%.
Согласно данным Кудели [212а], точность определения алюминия в нихромах можно повысить использованием высокочастотной искры.
Определение в кобальте
Кобальт невысокой степени чистоты анализируют из литых металлических образцов.
Пробы отливают в кокиль в виде стержней диаметром 7—8 мм и длиной 40—50 мм. Используют спектрограф средней дисперснн, ширина щели 0,010 мм. Спектры возбуждают в дуге переменного тока, вторым электродом служит угольный электрод, заточенный на конус. Предварительный обжиг в течение 40 сек. Фотопластинки спектральные типа II. Аналитическая пара линий: А] 3092,71 — Со 2975,46 А, определяемые пределы 0,01—0,15% алюминия.
При необходимости получения более точных результатов, как и в случае никеля, растворяют кобальт в кислоте, соли высушивают и прокаливают до окислов.
Определение в хроме
При определении алюминия в хроме [159] используют спектрограф средней Дисперсии, спектры возбуждают в дуге переменного тока при 6а, задающем промежутке 0,8 мм н дуговом промежутке 3 мм. Второй электрод — медный стержень Диаметром 6—8 леи, заточенный на усеченный конус с площадкой 2 мм. Предварительный обжиг 10 сек., экспозиция 15 сек. Используют фотопластинки типа I. Аналитическая пара линий: А1 3082,16 — Сг 3077,83 А. Определяемые пределы 0.11—1,0% алюминия, средняя квадратичная ошибка метода 3%.
При определении алюминия и некоторых других элементов в хроме высокой чистоты Хвастовска [640] предлагает предварительно концентрировать примеси выделением их в виде комплексов с N-бензоилфенилгидроксиламином. Концентрат смешивают с графитовым порошком, в качестве носителя вводят AgCl.
Анализируемую смесь помещают в кратер угольного электрода (анод) диаметром 4 .и.и и глубиной 4 мм. Катодом служит графитовый электрод с коническим заостренным концом. Аналитический промежуток 2льи, навеска 35 .иг. Применяют кварцевый спектрограф средней дисперсии, источник возбуждения — дуга постоянного тока; экспозиция 20 сек. Стандартная ошибка метода —12%.
Определение в марганце
При определении 0,003—0,1% алюминия в марганце [113] анализируемый образец растворяют в HNO3, раствор выпаривают и остаток прокаливают при 200° С. Полученный порошок помещают в отверстие угольного электрода глубиной б мм и диаметром 2 мм и испаряют в дуге постоянного тока при 13а, дуговом промежутке 4,5 мм и экспозиции 90 сек. Используют спектрограф средней дисперсии, ширина щели 0,01 мм, пластинки чувствительностью 22 ед. ГОСТ. Эталоны готовят из раствора Мп (NO3)2. Используют линию алюминия А = 3092,7IA. Относительная ошибка метода 20%.
Определение в медных сплавах
Определение в бронзах. В оловянистых бронзах спектральное определение алюминия можно проводить по следующей методике [48а].
Используют спектрограф средней дисперсии, источник возбуждения — конденсированная искра, включенная по простой схеме (без прерывателя). Ток питания генератора 1,5—2 а, напряжение во вторичной цепи трансформатора 12 000 в; емкость конденсатора 0,01 мкф, индуктивность катушки 0,1 мгн. Аналитический промежуток Змм, ширина щели спектрографа 0,025 леи. В качестве постоянного электрода применяют графитовый или угольный стержень, заточенный на усеченный конус с площадкой диаметром 2—2,5 мм. Предварительное обыскривание 120 сек., применяют фотопластинки спектральные типа I или диапозитивные. Аналитическая пара линий: А1 3082,16 — Си 3073,90 А, определяемые пределы 0,01—0,2 % алюминия.
При определении малых содержаний алюминия (0,005—0,10%) в качестве источника возбуждения лучше применять дугу переменного тока. Об особенностях анализа различных марок оловянистой бронзы см. подробнее работу [212а].
При анализе алюминиевых бронз обычно применяют конденсированную искру [113а, 354, 511]. Можно рекомендовать следующие условия работы [113а, 354].
Используется спектрограф средней дисперсии, ширина щели 0,025 мм; напряжение 220 в, ток питания генератора 2а, напряжение во вторичной цепи трансформатора 13 000 в; емкость конденсатора 0,01 мкф, индуктивность катушки 0,01 — 0,05 мгн, зазор в задающем разряднике 2,5 мм, аналитический промежуток 1,8—• 2 мм. Постоянный электрод — угольный стержень диаметром 5—6 мм, заточенный на усеченный конус с площадкой диаметром 1,5—2 мм. Предварительное
обыскривание в течение 60—80 сек. Аналитические пары линий: А] 3082,16 — Си 2961,16 А, А1 3082,16 — Си 2824,37 А, А1 2816, 17 — Си 2824,37 А.
Бериллиевую бронзу анализируют после растворения образца в HNO3, выпаривания раствора и прокаливания остатка при 500° С до образования окислов. Одновременно с образцом растворяют и медь высокой чистоты, после прокаливания получается смесь окислов меди и составляющих пробы. Окислы тщательно растирают в агатовой ступке и прессуют в брикеты с диаметром 6 мм и весом 1 + 0,05 г. Эталоны готовят из чистых металлических Си, Ni, Fe, Al, Pb и Be таким же образом.
Источником возбуждения служит дуга постоянного тока (400 в, 5,8 а), поджигаемая мощным высокочастотным разрядом. Брикеты устанавливают на угольный электрод (катод) диаметром 10 мм. Электрод имеет небольшое углубление для удерживания капли расплава окислов. В качестве постоянного электрода применяют медный пруток диаметром 6—8 мм, заточенный на усеченный конус с округленным концом. Используется спектрограф средней дисперсии, ширина щели 0,02—0,025 мм, экспозиция 60 сек. Более подробное описание методики см. в работе [212а]. Аналитическая пара линий А1 3082,16 — Си 3088,13 А, определяемые пределы 0,002—0,40% алюминия, средняя квадратичная ошибка метода составляет 5%.
Бериллиевую бронзу анализируют также в виде раствора [107а].
Раствор подают в зону разряда с помощью фульгуратора. Спектры возбуждают с помощью генератора ИГ-2 илн ИГ-3, включенного по сложной схеме (С = 0,01 мкф, L = 0,15 мгн). Второй электрод — графитовый стержень, заточенный на усеченный конус. Аналитическая пара линий: А1 3092,71— Си 3093,99А. Средняя квадратичная ошибка 7—12 отн. %.
Для определения 0,001—0,1 % алюминия в бронзах, содержащих не меньше 80% Си и не больше 20% Sn, Zn и Pb, предложен метод спектрального анализа из растворов [917].
_ Раствор, полученный растворением образца в HF и HNO3, наносят на угольный электрод, являющийся анодом; катодом служит также угольный электрод. Спектр возбуждают в искре.
Определение в латуни. Латуни анализируют, используя в качестве источника возбуждения дугу переменного тока.
Условия определения в дуге: ширина щели спектрографа 0,015—0,020 мм, ток дуги 6—8 а; вторым электродом служит медный стержень диаметром 8—10 мм, заточенный на полусферу. Аналитический промежуток 2 льи. Предварительный обжиг 15 сек., экспозиция 20 сек. Аналитическая пара линий: А1 3082,16 — Си 2882,93 А [483а].
К анализу латуней успешно может быть применена глобульная дуга, питаемая переменным током [3316]. Этим методом определяется 0,002—0,20% алюминия, аналитическая пара линий: А1 3082,16 — Си 3088,13 А.
Определение в магниевых сплавах
При определении алюминия в магниевых сплавах в качестве источника возбуждения используют конденсированную искру и дугу переменного тока. Постоянным электродом служит пруток из особочистого магния или спектральночистого угля. Часто используют также парные электроды из анализируемого образца.
При анализе сплавов марок МА 4, МА 5, МЛ 4 и МЛ 5 с искровым возбуждением спектра рекомендуются следующие условия [387].
Спектрограф средней дисперсии, генератор ИГ, включенный по простой схеме. Ток питания генератора 2 а, емкость конденсатора 0,003—0,005 мкф', напряжение вторичного контура 12 000 в. Ширина щели 0,025—0,30 мм, аналитический промежуток 2 мм. Постоянный электрод — магниевый пруток диаметром 9 мм, заточенный на полусферу. Предварительное обыскривание 30 сек., фотопластинки спектральные типа I или диапозитивные. Аналитическая пара линий: А1 3587,06— Mg 3329,93 А или А1 3082,16—Mg 3073,99 А. Определяемые пределы 3—12% алюминия, относительная ошибка определения 5—6%.
Очень близкие условия указаны в работе [711].
При определении алюминия с дугой переменного тока используется спектрограф средней дисперсии, генератор ПС-39, ДГ-1 или ДГ-2, ток дуги 2а, ширина щели спектрографа 0,03—0,035 мм, аналитический промежуток 2 мм, предварительный обжиг 5—10 сек., экспозиция 30 сек. Фотопластинки спектральные типа I. Аналитическая пара линий: А1 3082,16— Mg 2915,52 А или А1 3944,03— Mg 3329,93 А. Определяемые пределы 2—13% алюминия, относительная ошибка 8,5% [212а].
Определение в титане и титановых сплавах
При анализе металлического титана и титановых сплавов чаще используются искровые источники света. В качестве постоянного электрода лучше применять магний или угольные электроды.
Анализ титанового сплава с конденсированной искрой проводится в следующих условиях [212а].
Генератор ИГ-2, включенный по простой схеме, напряжение 220 в, ток 3 а, емкость конденсатора 0,02 мкф, аналитический промежуток 0,8 мм, ширина щели спектрографа 0,03 мм. Предварительное обыскривание в течение 10 сек., экспозиция 30—40 сек. Постоянный электрод — магниевый пруток, заточенный на ци; линдр диаметром 1,8 мм. Аналитическая пара линий: А1 3944,03 — Ti 3987,61 А, определяемые пределы 0,8—6,5% алюминия, максимальное отклонение отдельных определений от среднего содержания алюминия составляет 3%.
В методе, предложенном Рангом и Брайаном [1127], спектры возбуждают между плоским образцом титанового сплава и графитовым контрэлектродом в искровом разряде при следующих параметрах: емкость 0,005мкф, индуктивность 0, сопротивление 0,5 ом, ток ВЧ-контура 12 а, аналитический промежуток 2 леи. Предварительное обыскривание в течение 30 сек. Аналитическая пара линий: А1 3044,03 — Ti 3904,78 А. В аналитический промежуток горизонтально продувают аргон, который препятствует окислению поверхности образца, имеющему место на воздухе. При содержании алюминия 6,6% относительная квадратичная ошибка составляет 0,9%.
При анализе титановых сплавов используют также высокочастотную искру [212а].
При определении алюминия в порошкообразном титане готовят брикеты весом 1 г, диаметром 8 мм и высотой 5 мм. Спектры возбуждают в дуге переменного тока (4 а); предварительный обжиг 40 сек., экспозиция 40 сек. Аналитическая пара линий: AI 3092,71 — Ti 3046,69 А [514а].
Титан повышенной чистоты предварительно переводят в двуокись прокаливанием в платиновом тигле при 1000—1100° С, или же растворяют металл в НС1 (уд. вес 1,19), выпаривают раствор с HNO3 для переведения хлоридов в нитраты, остаток прокаливают при 600° С в течение 30 мин. Анализ проводят в дуге постоянного тока (10 а). 20мг ТЮ2 тщательно перемешивают с 20 мг смеси угольного порошка с NtO (4 : 1). Смесь помещают в кратер угольного электрода (анода), размеры кратера — диаметр 4 мм, глубина 5 мм. Общая длина анода 16 леи, на протяжении 10 леи электрод обтачивают до диаметра 4 мм. В качестве постоянного электрода применяют угольный стержень диаметром 6 мм, заточенный на конус. Используется кварцевый спектрограф средней дисперсии. Аналитическая пара линий: А1 3082,16 — Ni 3080,76 А [253а].
Титан можно анализировать методом просыпки [310а]. Двуокись титана просыпают с помощью специального прибора сквозь дугу переменного тока (18а). Необходимо применять спектрограф с дисперсией около 4 а/мм (ДФС).
Описан метод анализа титана из раствора [212а] с использованием дуги постоянного тока (4—6а).
Нижний электрод (анод) в виде графитового диска диаметром ~20 мм и тол’ щиной Змм погружают в анализируемый раствор (раствор титана в НС1) и вращают со скоростью 6 об/мин. В качестве постоянного электрода применяют графитовый стержень.
Определение в цинке^и цинковых сплавах
Алюминий в цинке можно определять, используя^дугу или искру. При анализе с помощью искры применяют сложную схему генератора ИГ-2 или ИГ-3, емкость во вторичной цепи 0,01—0,02 мкф, индуктивность 0,15—0,55 мгн. Оба электрода — из анализируемого металла. Предварительное обыскривание в течение 10 сек., экспозиция 60 сек.; фотопластинки типа I. Аналитическая пара линий при использовании как дуги, так и искры: А1 3092, 71— Zn 3075, 90 А.
В сплаве ЦАМ-4-3 алюминий определяют спектральным методом, используя кварцевый спектрограф средней дисперсии с трехлинзовой системой освещения щели; ширина щели 0,025 мм, источник возбуждения генератор ИГ-2 (или ИГ-3), включенный по сложной схеме (С = 0,01 мкф, L = 0,01 мгн, один цуг за полу-период питающего тока). Второй электрод — угольный, заточенный на усеченный конус, или медный стержень, заточенный на плоскость. Межэлектродный промежуток 2,0 мм, предварительное обыскривание 60 сек. Аналитическая пара линий: А1 2567,99 — Zn 2525,81 А.
Описан метод контроля ванн для цинкования, содержащих до 0,5% А1 и 0,5% РЬ [1075].
Плоский образец цинка служит катодом, графитовый подставной электрод — анодом. Спектры возбуждают при помощи генератора в дуговом режиме (3 а; 55 мкф, 360 мгн) и гасящем сопротивлении 50 ом. Предварительное обыскривание
в течение 20 сек,, экспозиция 10 сек. Искровой промежуток 3 леи. Аналитические Линии алюминия 3961,53 А при 0,015—О,О6?'о и 3082,16 А при 0,06—0,30% алюминия. Внутренним стандартом служит линия цинка 3018,3 А. На щель ставят ступенчатый ослабитель. Ошибка анализа 2,7%.
Определение в уране и урановых сплавах
Металлический уран предварительно переводят в окисел U3Og и анализируют методом фракционной дистилляции с носителями Ga2O3 [152] или ВаСО3 [79].
В первом случае смесь U3O8 и Ga2O3(l :49) помещают в глубокий канал графитового электрода и спектр возбуждают в дуге постоянного тока при 10 а. Экспозиция 30 сек. Определяют до 0,002% алюминия. Аналитическая пара линий: А1 3082,16—Сг 3040,8 А. Относительная ошибка метода 5—10%.
По другому методу в пробу U3O8 вводят 10% ВаСО3 и 5% угольного порошка [79]. 25 мг полученной смеси помещают в отверстие угольного электрода диаметром 3,5ми и глубиной бльи. На расстоянии 5мм от рабочего конца на протяжении 4 мм диаметр электрода уменьшают до 2,5 мм. Спектры возбуждают в дуге переменного тока при 18 а с верхним угольным электродом, заточенным на усеченный конус с площадкой диаметром 2 мм и фотографируют в течение 30 сек. на спектрографе ИСП-51 с камерой УФ-85А. Ширина щели 0,015 мм, щель освещается однолинзовым конденсором. Аналитическая пара линий: А1 3944,03— Ва 3995,6 А. Чувствительность метода 10-3%, квадратичная ошибка при трехкратной съемке спектров составляет 9—11%. В этом методе носитель ВаСО3 не влияет на процесс испарения, но способствует возбуждению атомов алюминия. Угольный порошок ослабляет спектр урана и усиливает спектр алюминия.
При определении алюминия в урановых сплавах предварительно отделяют уран ионообменной хроматографией [1092].
После растворения пробу * пропускают через колонку диаметром 1,5 см и высотой 33см, содержащую 7 г анионита деацидит FF (60—120 меш), со скоростью 1 мл/мин. Смолу предварительно промывают 150 мл НО (1,86 : 1,0). Алюминий вымывают 90ли НО (1,86 : 1,0). К элюату добавляют 1 мл раствора, содержащего 20 мг FejOg'H 0,5 мг Sc/мл. Вводят индикатор метиловый красный, аммиак до желтой окраски раствора накипятят в течение 3—5 мин. Осадок отделяют центрифугированием, промывают раствором NH4C1, растворяют в 0,5 мл НС1 (уд. вес 1,19) и разбавляют до 5мл.
Спектры возбуждают в искровом разряде (L = 0,13 мгн, С = 0,005 мкф); вспомогательный промежуток 1,8 мм, аналитический промежуток 1,5 ми. Раствор подают в разряд при помощи вращающегося (4 об/мин) графитового диска диаметром 12,8 мм и толщиной 3,2ми, погруженного в раствор на глубину 1ми. Ширина щели спектрографа 0,015 мм, экспозиция 2 мин. При содержании алюминия > 0,02% пробу обыскривают в течение 30 сек. и экспозицию уменьшают до 30 сек. Аналитические пары линий: А1 3944,03—Sc 3907,48 А и А1 3961,53—Sc 3911,81 А.
Методика позволяет определять 0,005—0,2% алюминия в сплавах, содержащих до 10% Fe, Мо, Nb и Ti, 5% Сг, 1% Ge, 0,6% Si и 0,05% V. Квадратичная ошибка отдельного определения при содержании алюминия 0,01% составляет 7%.
* В работе приводятся способы переведения в раствор сплавов урана с Zr, с Мо и Si, с Мо, Ti и Nb, с Fe, V, Ge и Сг.
Определение в других металлах и сплавах
Алюминий в олове определяют спектральным методом, используя искровое возбуждение [483а]. При определении алюминия в кадмии образец растворяют в HNO3 (уд. вес 1,4), раствор выпаривают, соли прокаливают до окислов и возбуждают спектр в дуге постоянного тока с поджигом от активизатора [483а]. При определении алюминия в кристаллическом кремнии образец растирают в агатовой ступке до получения мелкого порошка, который смешивают с чистой СиО в соотношении 1:20, и из проб весом по 0,25 г готовят брикеты. Подробно см. в работе [483а].
При спектральном определении алюминия и других примесей металлический цирконий и его соединения переводят в ZrO2 [313].
Спектры возбуждают в дуге постоянного тока (10а); электроды угольные. Образцы ZrO2, смешанные с графитовым порошком в отношении 1 : 1, испаряют из канала электрода глубиной 3 мм и диаметром 3 мм. Ширина щели спектрографа 0,015дш;экспозиция 20сек. Аналитическая пара линий:А1 2660,39 — Со 3147,06А (кобальт — внутренний стандарт).
Металлический кальций также предварительно переводят в окись [1138].
Об определении алюминия в сплавах золота см. работу [830], а об определении в платиновых металлах — работы [20 , 60].
Спектральное определение алюминия в других материалах
При анализе прочих материалов чаще всего образцы вводят в разряд в виде порошков или брикетов. При введении в виде порошков анализируемый образец засыпают в кратер угольного электрода диаметром 3—4 мм и глубиной 4—6 мм. Для лучшего разогревания в угольном электроде делают перетяжку ниже дна канала. Порошок анализируемого вещества обычно смешивают с порошком внутреннего стандарта и угля. В некоторых случаях введение носителей способствует улучшению процесса испарения алюминия. Так, при анализе Nb2O5 для преимущественного испарения алюминия в начальный момент горения дуги переменного тока пробу смешивают с носителем AgCl [279].
Электроды можно применять оба угольные, или же верхний электрод можно брать медный. Образцы предлагалось насыпать на движущийся медный электрод [233], в этом случае слойДробы лучше закрепить бакелитовым лаком [3461. Предложено определять алюминий методом^просыпки, для создания вертикального потока воздуха в зоне дуги применяют пылесос [353]. Смешивание анализируемого образца £с плавнями NaPO3 и Na2B4O7 [11161, Ы2СО3 и Н3ВО3 [774, 935], Na2CO3 и Na2B4O7 [304] способствует уменьшению ошибок из-за неоднородности проб.
159
Широко применяется изготовление брикетов из порошка анализируемого вещества. Брикеты готовят прессовкой смеси анализируемого вещества с порошками SiO2 и угля, никеля и угля, с порошком меди или угля. Брикетирование способствует более равномерному испарению анализируемого образца.
Определение алюминия спектральным методом проводят также в растворах. Анализ растворов более длительный, чем анализ порошков и брикетов, требует изготовления специальных приспособлений для подачи раствора в разряд. Этот способ введения проб в разряд целесообразно применять в тех случаях, когда из-за неоднородности материалов другие способы дают плохую воспроизводимость. Для перевода анализируемых образцов в раствор применяют сплавление с различными плавнями. Шлаки переводят в раствор сплавлением с едким натром в серебряной чашке, плав выщелачивают горячей водой с добавлением НС1 [748]. Шлаки можно сплавлять также с NaOH и Na2O2 [748] или со смесью Na2CO3 и Na2B4O7 (2:3) [134]. Силикаты растворяют в HF и HNO3, затем в НС1 [297, 298], или сплавляют с NaOH в никелевом тигле, плав выщелачивают в воде с добавлением НО [803].
Применяют следующие способы введения раствора в разряд: вводят в кратер угольного электрода [47], наносят на конец угольного электрода, пропитанного полистиролом [410], вводят через осевое отверстие в нижнем электроде [748], с помощью фульгурато-ра [134], при помощи вращающегося графитового диска [297, 298], вводят в виде аэрозоля с помощью пульверизатора. Рекомендовано вводить в разряд беззольный фильтр, пропитанный анализируемым раствором [100].
Характеристики точности и чувствительности спектральных методов определения алюминия в некоторых неметаллических материалах приведены в табл. 14.
Очень малые количества алюминия в металлах и других материалах определяют после предварительного концентрирования химическими методами. Многие методы концентрирования приведены в работе [254]. Краткая характеристика этих методов дана в табл. 15.
Для спектрального определения алюминия перспективны фотоэлектрические методы [323, 387а].
Метод пламенной фотометрии
Для определения алюминия эмиссионной фотометрией пламени могут быть использованы линии 394,4 и 396,15 нм и молекулярная полоса алюминия при 484 нм. Алюминий в водных растворах возбуждается с трудом, поэтому чувствительность таких прямых методов определения невысокая.
Некоторые авторы предлагали косвенный метод по уменьшению поглощения кальция. Метод более чувствителен, чем прямой метод
Таблица 14
Анализ различных материалов спектральным методом
Объект Определяемые пределы,- % Относительная ошибка, % Литература
Силикаты 5-10-1-4,0 2—3 [197]
Кварцевый песок 1.10-3—1,0 2 [799а]
Стекольный песок 1.10-3—0,5 [789]
Железная руда >5.10-2 8-10 [179]
Мартеновские шлаки 3-5 [134]
» » 2—25 [748]
Доменный шлак 2,6-6,4 [303а]
» » 1—3 [304]
Агломераты 3,7-16,7 [303а]
1-3 [304]
Известняк 1.10-1—1 7,8 [778а]
Магнез ит [517а]
Стекло 1,3-8 2,3 [923а]
» 1-10-1-1,0 1,7 [796а]
Циркониевый концентрат 1.10-2—1.10-1 5 [176]
Вольфрамовый ангидрид 3-10-3-1.10-1 10 [973]
Пятиокись ниобия 5. Ю-З—1, Ю-1 10—12 [279]
Окись хрома [124]
Цемент [233]
Шлаки никелевого производства 5-10-1-8,0 [489а]
Электролит гальванических ванн для 6-7 [100]
цинкования и никелирования
Бинарная смесь Nb с А1 7 [353]
Четыреххлористый титан 4-10-3—2,5.10-1 2-20 [48]
Технический бор 1.10-2—2-10-1 [122]
Т еллур 5,4—12,1 [510а]
Кремний высокой чистоты >0,6.10-5 7-10 [489]
Слюда 3-9 [333а]
РС13 и РС15 >10"5 30 [207а]
SiCl4 и SiHCls lO-8—10-з [1240а]
Полиэтилен | >5-10-2 5,5 [454]
Полипропилен I 4.10-3—4.10-1 8-15 [303]
определения в водных растворах; интенсивность излучения кальция уменьшается почти линейно с увеличением количества алюминия от 20 до 250 мкг!мл [1002]. Однако многие ионы, например, NO3~, Fe (III), Ti (IV), Cr (III) и другие, также ослабляют интенсивность излучения кальция.
6 Аналитическая химия алюминия
161
Таблица 15
Методы концентрирования при спектральном определении малых количеств алюминия
С с я Объект Способ концентрирования Чувствительность, % Относительная ошибка, %
1 Si, SiOa Отгонка SiF4 6-10"7 36
2 SiCl4, SiHCls Отгонка SiCl4 и SiF4 6-10‘7 36
3 SiO-a Отгонка SiF4 7-10-7 25—30
4 SiHCl3 Отгонка с СС14 1-10-7 15—20
5 Ge, GeOe, GeCl4 Удаление Ge в виде GeCl4 10"7—2.10-8 13
6 Ga, GaCls Экстракция Ga эфиром 1•10-5
7 Арсенид галлия Отгонка As в виде AsCls, АзВгз, экстракция Ga эфиром 1.10-5 30—40
8 In Экстракция бромида In эфиром 5-10-5 30
9 Антимонид индия Экстракция In и Sb в виде бромидов 5-Ю"5 30
10 Фосфид индия Отгонка Р в РН3, экстракция бромида In эфиром ЗЛО"5 15
И Т1 Экстракция хлорида Т1 эфиром 5•IO"5 30
12 As Отгонка As в виде хлорида МО'5
13 Sb Экстракция Sb бутилацетатом З-Ю"7 20
14 Р Экстракция оксихинолината А1 l-10-e 15
15 Pb Осаждение PbSO4 1-10-5 20
16 Bi Осаждение B1J3 или основного нитрата 1-Ю"5 20
17 Sn Отгонка SnCl4 3-10"* 15
18 В, ВгОз, Н3ВО3 Отгонка BF3 1-10-5
19 в Удаление В в виде борномети-лового эфира 2-10-5 30
20 S Сжигание серы 5-Ю'6 10—30
21 Se Отгонка после переведения в SeO2 1-10-5 20—35
22 J Возгонка Лиз смеси с угольным порошком 1 -Ю'6 10—25
23 HF, НС1, HNO3 Испарение кислоты с угольным порошком 4-Ю"8
24 HC1, HF. HeSOj, CH3COOH То же 3-10-8 15
* Источники возбуждения: дуга постоянного тока — 1, 2, 4—18, 23; газоразрядная трубка с полым катодом —3, 24; дуга переменного тока — 19—22.
Хегеман и Остеррид [7991 показали, что интенсивность молекулярной полосы алюминия при 484 нм значительно возрастает при введении в распыляемый раствор NH4C1 в высоких концентрациях (до 20%); введение НС1 еще усиливает излучение. Для улучшения распыления рекомендуется вводить до 4% СН3СООН. По указанию авторов, можно повысить интенсивность излучения также введением метанола. Некоторые авторы для усиления излучения алюминия вводят бутанол [797, 798, 8931. Все эти методы неселективны, определению алюминия мешают Na, К, Са, Fe и другие элементы. Приходится сначала определять их содержание и вводить такие же количества в стандартные растворы.
Для повышения чувствительности метода вводят также оксихинолин [676, 6771, однако и этот способ не представляет особого интереса.
Наибольшего внимания заслуживают те методы, в которых алюминий предварительно переводят в комплекс с органическими соединениями, в пламя вводят растворы этих комплексов в органических растворителях. Алюминий вводят в пламя в виде растворов куп-фероната в метилизобутилкетоне [703,729, 10731, 2-теноилтрифтор-ацетоната в метилизобутилкетоне [7031, в виде раствора ацетил-ацетоната в хлороформе [1149] или метилизобутилкетоне [7291.
Эшелман и др. [7031 установили, что излучение алюминия при 396,2 и 484 нм возрастает в 100 раз, если алюминий вводить в аце-тилено-кислородное пламя не в виде водного раствора соли, а в виде раствора купфероната или 2-теноилтрифторацетоната в метилизобутилкетоне. Благодаря выделению алюминия в виде комплексов селективность определения также значительно возрастает. Экстрагирование в виде теноилтрифторацетоната проводится при pH 5,5—6,0. При промывании экстракта 0,1 M HNO3 удаляются небольшие количества щелочных и щелочноземельных металлов, которые могут при высоких концентрациях частично экстрагироваться. Zr, Ti, Th, U (VI), Fe (III), Се (IV) и Си предварительно отделяют в виде теноилтрифторацетонатов из растворов с pH 1. До 10 мг Zn, Ni, Fe (III) и Си можно удалить экстрагированием их ди-этилдитиокарбаминатов хлороформом.
Во многих случаях для отделения мешающих элементов лучше применять N-нитрозофенилгидроксиламин. Алюминий в этом случае экстрагируется в широких пределах pH. Интенсивность излучения только немного меньше, чем при экстрагировании теноилтрифторацетоната. При анализе стали основную массу железа целесообразно предварительно удалить электролизом на ртутном катоде или экстракцией хлорида железа из 5—7 M НС1 метилизобутилкето-ном. Оставшиеся в растворе после этого небольшие количества железа удобно удалять экстракцией N-нитрозофенилгидроксилами-ном из НС1 (1 : 9).
Из магниевых сплавов алюминий селективно экстрагируется метилизобутилкетоном при pH 2,4—4,5 в виде комплекса с N-нит-
t*
163
розофенилгидроксиламином. Магний не экстрагируется, а содержание других компонентов не превышает допустимые пределы.
Метод применен для определения алюминия в сталях, бронзах, магниевых и цинковых сплавах, а также в минералах [7031.
Атомно-абсорбционный метод
В атомно-абсорбционном методе для образования паров алюминия используют нагретую до 2400° С графитовую кювету [305— 307] и пламена — ацетилено-кислородное [626, 686], водороднокислородное [626, 686] и пламя смеси С2Н2 и N2O [506а, 5146, 525, 615].
Методы с использованием пламени (абсорбционная фотометрия пламени). Можно использовать линии 309,27 (фактически неразрешенный дублет 309,27 и 309,28) и 396,2 нм. Для линии 309,27 нм при использовании пламени смеси С2Н2 — N2O и (50% О2 + 50% N2) — С2Н2 найдена чувствительность 1-10"4% [526, 1274]. Для линии 396,2 нм в кислородно-ацетиленовом пламени чувствительность составляет 6-Ю"4 —8-Ю"4 % [686, 1174]. Рамакришна и др. [1099] приводят следующие значения чувствительности различных резонансных линий алюминия, полученные в пламени смеси С2Н2 — N2O:
X, нм Чувствительность (1 ч на млн./1% поглощения)
309,27 1,2
396,1 1,0
398,2 1,8
394,0 2,2
X, нм Чувствительность (1 ч на 1 млн./1% поглощения)
237,3 3,5
257,5 7,0
265,2 8,5
По этим данным, линии 309,27 и 396,1 по интенсивности одинаковы.
Амос и Томас [525] определяли алюминий с использованием пламени С2Н2 со смесью 50% О2 + 50% N2, щелевой горелки (щель 0,45х 30 мм). Минимально обнаруживаемое количество алюминия по линии 309,27 нм составляет 1,7 мкг!мл. Определению алюминия не мешают до 20 мг!мл Си, Zn, Си, Pb, Mg, Na, РО43-, SO42-. Присутствие 10—20 Fe (III) мг!мл и 2—5% НС1 снижает результаты определения алюминия; для уменьшения ошибки нужно вводить их в стандартные растворы.
Рамакришна и др. [1099] изучили влияние большого числа ионов на определение алюминия по линии 309,27 нм при использовании пламени смеси С2Н2 и N2O. Определению 20 мг AIM не мешают до 200 мг/л NH4+, Li, Na, К, Rb, Cs, Си (II), Ag, Be, Mg, Ca, Sr, Ba, Zn, Cd, Hg(I), Hg (II), Zr, Се (IV), Sn (II), Sn (IV), Pb, Sb (V), Cr (III), Bi, Fe (III), Co, Ni, Pd (II), F~, СГ, Br", J", NO3", SO4+
164
НРОГ, soh В40г, НСО3-,СОГ, Sioh VO3-, HAsO4‘-\ SeO32 , M0O42 , TeO32~, WO42~, UO42 , цитраты, тартраты, оксалаты, ЭДТА, НО, H2SO4, HNO3 и HCIO4. Уксусная кислота при концентрации 5% увеличивает на 10% поглощение. Титан также усиливает поглощение, поэтому его содержание в анализируемых и стандартных растворах должно быть одинаково. Наибольшее влияние при определении 20 ч. на 1 млн. алюминия оказывает Ti (IV) (80 ч. на 1 млн.); увеличение количества Ti до 300 ч. на 1 млн. не вызывает заметного возрастания поглощения. Калибровочный график прямолинейный при 5—60 мг КМ л. Чувствительность метода 1 ч. на 1 млн. Относительная ошибка метода — 2%.
Аналогичный метод описан при определении алюминия в цементе [615]. Авторы работ [626, 686] определяли алюминий атомно-абсорбционным методом с использованием ацетилено-кислородного и водородно-кислородного пламени. Алюминий вводили в виде раствора его купфероната в метилизобутилкетоне; экстракцию проводили при pH 3,5. Светопоглощение экстракта измеряли при 394,4— 396,2 нм при спектральной ширине прибора 6,2 нм. Калибровочный график почти прямолинейный при содержании 50— 1500 мкг АМмл^ля ацетилено-кислородного пламени и при 500— 2500 мкг КМ мл для водородно-кислородного пламени. С ацетилено-кислородным пламенем чувствительность в 9 раз выше, чем при использовании последнего. Существенное влияние на чувствительность оказывает положение фотометрируемого участка пламени. Максимум поглощения наблюдается на расстоянии 19 мм от сопла горелки, а на расстояниях 15 и 24 мм поглощение уменьшается вдвое. Уменьшение количества ацетилена при постоянном потоке кислорода снижает поглощение алюминия. При изменении отношения кислород: ацетилен от 2,7, до 4,5 поглощение уменьшается вдвое.
При концентрации 750 мкг КМмл стандартное отклонение метода 53 мкг/мл.
Авторы работы [5146] определяют алюминий в стали атомноабсорбционным методом с использованием пламени смеси ацетилена и закиси азота, вводя в пламя раствор купфероната алюминия в органическом растворителе (метилизобутилкетоне, циклогексаноне, н. бутилацетате или изопропиловом спирте).
Атомно-абсорбционный метод с использованием графитовой кюветы. Испарение в графитовой кювете имеет существенное преимущество по сравнению с пламенем. Продолжительность процесса испарения в кювете в 1000 раз больше, чем в пламени. Большинство соединений при использовании графитовой кюветы сильно диссоциирует и меньше сказывается влияние третьих компонентов. Посторонние труднолетучие соединения в большинстве случаев не влияют на скорость испарения алюминия в графитовой кювете. Николаев [306] показал, что даже 100000-кратные количества Fe, Ni, Со, Сг, Ti и Си не мешают определению алюминия.
1R5
Николаев и Алесковскнй [305—307] с применением графитовой кюветы определяли от 0,00002 до — 38% алюминия в Fe, Сг, Ni, W, Nb, Та, Mo, Ti, Cu, Cd, Sb, в сталях, бронзах, латуни, силумине, в никелевом сплаве, феррованадии, силикокальции и графите. Относительная ошибка — 5% при содержании алюминия 0,5— 1,5%, при больших содержаниях ошибка меньше. Продолжительность анализа двух проб составляет 35 мин.
При применении графитовой кюветы чувствительность метода значительно выше, чем в пламени. Николаеву и Алесковскому удавалось определять алюминий в бидистиллате при содержании 8-10“7%; оптическая плотность раствора была 0,12, т. е. достаточно большая (объем анализируемого раствора 0,020 мл). Абсолютная чувствительность метода 1,5-1О'П г, относительная 2,5-10"5% (при навеске 6-10“5 г).
При определении алюминия атомно-абсорбционным методом с графитовой кюветой используют линии 309,27 нм. Нагретую до 2400° С кювету помещают в наполненную аргоном (3 атм) камеру с кварцевыми стеклами. Подробно см. работу [307].
Применение графитовой кюветы описано в работах [125, 2401.
Рентгеноспектральный метод
При рентгеноспектральном определении алюминия главным образом пользуются спектрами флуоресценции, возникающими при облучении анализируемого образца рентгеновскими лучами. Реже прибегают к применению первичных рентгеновских спектров, получающихся при прямом возбуждении образца электронами больших энергий.
Для рентгеновского флуоресцентного определения используется A-излучение алюминия. Указывается [1129], что Si, Са и Fe не влияют на определение алюминия. Однако, согласно Савелли [1143], интенсивность линий А1 — /Са увеличивается в присутствии Si (4% SiO2 эквивалентны 0,1% А12О3). Поэтому надо вводить поправку на SiO2.
Измерение интенсивности линий А1 — К-+ проводится на рентгеновском флуоресцентном спектрометре (XRD — 3, XRD — 5, фирмы Филипс) с хромовой и вольфрамовой трубками. Трубка с хромовым анодом лучше, так как в этом случае интенсивность флуоресцентного излучения у алюминия в 4 раза выше, чем с трубкой с вольфрамовым анодом [544, 620, 1178]. На трубки подают напряжение 40—50 кв, ток 20—50 ма. В качестве кристаллов анализаторов для разложения лучей в спектр используются пентаэритрит и этилен-диамнндитартрат. Детектор для измерения интенсивности спектральных линий представляет собой газопроточный пропорциональный счетчик с амплитудным анализатором (смесь 90% аргона и 10% метана). Рекомендуются особо тонкие пленки для окон пропорцио' нальных счетчиков.
166
Для их приготовления 1 г поливинилацетата растворяют в 400 г СН2С1г, в раствор опускают микроскопическое стеклышко, затем его вынимают и высушивают. Подрезанную с краев пленку осторожно отделяют. На сторону пленки, обращенную внутрь счетчика, напыляют слой алюминия (~ 0,1 нм).
Метод приготовления перлов позволяет более точно определять алюминий [1129]. При определении в минералах гранулометрические условия имеют немаловажное значение.
Чувствительность определения алюминия рентгеновским флуоресцентным методом обычно указывается п-10-3%, согласно авторам работы [620] — 10“5%. Относительная ошибка определения алюминия при содержании 10—40% составляет 1,5—2%.
Метод использован для определения алюминия в глинах, каолине [143, 1012, 1018, 1243], в различных минералах [1018], в продуктах флотации глин и бокситов [1161], в сплавах алюминия с железом [462].
Прочие методы
Радиометрическое определение алюминия в силлиманитовых рудах и продуктах обогащения с применением Fe55 и Со60 [1071; анализ смеси оксихинолинатов Al, Ga и In с использованием их инфракрасных спектров [794], определение алюминия в сплавах железа по величине термоэлектрического потенциала [901], седи-ментометрическое определение алюминия [1035] и термометрическое определение (по изменению температуры анализируемого раствора после прибавления титранта) [1137] используются редко
Глава III
МЕТОДЫ ОТДЕЛЕНИЯ АЛЮМИНИЯ ОТ СОПУТСТВУЮЩИХ ЭЛЕМЕНТОВ
ОСАЖДЕНИЕ ОРГАНИЧЕСКИМИ И НЕОРГАНИЧЕСКИМИ РЕАГЕНТАМИ
Методы отделения осаждением алюминия
Для отделения алюминия могут быть использованы все методы осаждения, которые описаны в разделе «Весовые методы». К ним можно добавить лишь один метод — выделение алюминия в виде хлорида. Этот метод применяется, главным образом, для отделения основной массы алюминия при определении других компонентов анализируемого образца, например, при определении примесей в алюминии высокой чистоты. Для определения алюминия метод не годится ввиду неполноты его выделения.
Метод выделения алюминия в виде хлорида предложен Гуном и Хэвенсом [748], в дальнейшем усовершенствован другими авторами [715, 716, 1157]. Метод основан на малой растворимости хлорида алюминия в смеси соляной кислоты и эфира, насыщенной хлористым водородом. Оптимальные условия для отделения: концентрация эфира в смеси 50% и температура 0° С. По данным Зайделя и Фишера [1157], растворимость А1С13 падает до 0,8 мг А1/100 мл 44,3%-ной НС1 при 0°С. В 100мл смеси НС1 и эфира (1 : 1)при 0эС растворимость еще ниже — 0,15 мг алюминия [715]. Метод позволяет отделять алюминий от Be, Fe(III), Со, Zn, Mn, Ca.SOf, РОГ-Ввиду малой растворимости хлоридов Ni, Mg, К, NH^ и Na эти металлы могут присутствовать только в очень небольших концентрациях. Отделение от хрома неудовлетворительно. В присутствии больших количеств титана или ванадия необходимо переосажде-ние. Методика отделения приводится Гиллебрандом и др. [89].
Методы отделения осаждением мешающих элементов
Отделение щелочью. Это самый распространенный метод отделения мешающих элементов от алюминия. Гидроокись алюминия в избытке едкого натра растворяется с образованием
алюмината (см. гл. I), а гидроокиси других обычно сопутствующих элементов нерастворимы в нем. Недостаток метода в том, что сначала алюминий вместе с другими элементами осаждается в виде гидроокиси. Обычно осадки гидроокисей, особенно Fe (III) и Сг, объемистые, поэтому часть гидроокиси алюминия захватывается ими и даже при повышении концентрации едкого натра полное растворение ее невозможно. В результате получаются заниженные результаты (по алюминию).
Успешное применение метода отделения щелочью может быть лишь в том случае, когда составление калибровочного графика или установление титров рабочих растворов проводится точно в таких же условиях, в которых выполняется анализ. Тогда этот метод оказывается более удобным и быстрым, чем, например, отделение сопутствующих элементов от алюминия электролизом с применением ртутного катода или хроматографическое отделение.
Для лучшего отделения нагретый до кипения слабокислый анализируемый раствор надо вводить медленно при непрерывном перемешивании в горячий концентрированный раствор едкого натра.
Предлагалось вводить анализируемый раствор через воронку, имеющую трубку с очень маленьким внутренним диаметром (1 мм [1115] и даже 0,4 мм [1069]). Согласно Рихтеру [1115], лучшее отделение достигается осаждением при комнатной температуре. По теории осаждения Тананаева [404], аморфные осадки нужно осаждать из концентрированных горячих растворов, в этом случае со-осаждение меньше. Поэтому осаждение щелочью лучше проводить из горячих растворов. Чем больше концентрация NaOH, тем меньше адсорбция алюминия. Можно применять 6N растворы NaOH. Небольшие количества железа остаются в фильтрате (чем выше концентрация NaOH, тем больше железа переходит в фильтрат). Поэтому не следует применять очень высокие концентрации NaOH, если небольшие количества железа мешают. Fe (II) сильно адсорбирует алюминий, поэтому его предварительно надо окислить до Fe (III). С увеличением количества алюминия относительный процент адсорбции его на Fe (ОН)3 уменьшается [1024]:
Количество Сорбируется Количество Сорбируется
А1, мкг А1, % А1, мкг А1, %
10 И 70 3,4
30 4,7 90 3,3
50 4,4 100 3,4
С увеличением количества железа адсорбция алюминия возрастает. Верц и Нейбергер [1258], а также некоторые другие авторы для уменьшения адсорбции алюминия применили предварительное магнитное обогащение. Однако такой прием усложняет анализ и его рекомендовать нельзя. Сойте [1160] указывает, что алюминий лучше отделяется от железа, если осадок Fe (ОН)3 гомогенизировать
169
механическим перемешиванием. Хилл [809] проверил этот метод и нашел, что при этом алюминий отделяется неполностью. Для уменьшения адсорбции алюминия на Ре(ОН)3Хилл предлагает вводить в анализируемый раствор большие количества элемента, подобного в химическом отношении алюминию, но не мешающего последующему определению алюминия. При фотометрическом определении с эрнохромцианином R для этой цели лучше подходят Li, В, Zn и особенно смесь последнего с бором. При отделении с едким натром ванадий сопутствует алюминию. Хром, как амфотерный элемент, также оказывается в фильтрате, но в присутствии железа он полностью осаждается. В отсутствие железа часть титана переходит в фильтрат; в присутствии железа титан осаждается количественно.
Коренман и сотрудники исследовали возможность отделения ряда элементов от алюминия с помощью едкого натра [185, 186, 189, 190]. Гидроокись магния очень сильно адсорбирует алюминий, в прокаленном осадке MgO может содержаться до 30—40% А12О3 [185]. В условиях осаждения при комнатной температуре теряется 1—7% алюминия с У(ОН)3 [190] и 3—20% алюминия с La (ОН)3 [189]. При осаждении из кипящих растворов достигается практически полное отделение [189, 437]. С Cd(OH)2 наблюдаются незначительные потери (~1,5%) алюминия [186].
Иногда алюминий вместе с железом, хромом и некоторыми другими элементами предварительно выделяют в виде гидроокиси осаждением аммиаком или уротропином для отделения от двухвалентных металлов. После растворения осадка в кислоте проводят отделение с помощью NaOH [524, 777, 1003]. Этот метод особенно следует рекомендовать при анализе образцов, содержащих кальций и магний, сильно адсорбирующих алюминий. Пшибл и Весели [1083, 1085] отделяют титан от алюминия осаждением едким натром в присутствии триэтаноламина, удерживающего алюминий в растворе.
Анализируемый раствор разбавляют до 100 мл, прибавляют 20—50 мл 20% -ного раствора триэтаноламина и 2 мл 2 М раствора NaOH (до обесцвечивания раствора). Кипятят 1 мин., осадок отфильтровывают, промывают сначала 5 раз горячим 1%-ным раствором триэтаноламина, затем 2 раза водой. В фильтрате определяют алюминий комплексометрическим методом.
Притчард улучшил отделение с помощью едкого натра введением диаминциклогексантетрауксусной кислоты (ДЦТА) для связывания алюминия в комплекс [1087]. При этом алюминий лучше отделяется от магния, в присутствии ДЦТА алюминий не соосаждает-ся с Mg(OH)2.
Растворы едкого натра надо применять по возможности свежеприготовленные и хранить их в полиэтиленовой посуде. Со старыми растворами, содержащими поглощенный из атмосферы СО2, получаются плохие результаты.
Алюминий может быть отделен от мешающих элементов также сплавлением с NaOH. Эффективным методом отделения является и 170
сплавление с Na2CO3. При этом алюминий отделяется от тех же элементов, что и при осаждении раствором NaOH. Метод сплавления с Na.,CO3 в некоторых случаях даже предпочтительнее, так как при этом от алюминия отделяются и щелочноземельные элементы. В фильтрат вместе с алюминием переходят V, Mo, Sn и Zn. Если Fe, Со и Ni находятся в количествах, более чем 100-кратных по отношению к алюминию, сплавление с Na2CO3 не дает полного отделения.
Отделение другими неорганическими осадителями. Таймни и Тэндон 11218] отделяют от алюминия As(V), Sb (III), Sb (V), Te(IV), Se (IV), Mo (VI), Hg (II), Au (III), Pt (IV), Re (VII) в виде сульфидов. Для этого раствор обрабатывают избытком 1 М раствора Na2S, затем подкисляют соляной кислотой до концентрации 6 N для As, Pt, и Re, 2N в случае Se и 1 N в присутствии остальных элементов. Относительная ошибка определения алюминия 0,7%.
Предложено также отделять In от А1 в виде сульфида из раствора с pH 2,5, содержащего монохлоруксусную кислоту [2201. Отделение цинка в виде сульфида дает лучшее отделение от алюминия, чем при осаждении аммиаком [611]. Пильц [1063] отделяет железо в виде FeS после восстановления Fe (III) тритиокарбонатом натрия или аммония. Метод связан с применением редкого реагента и не обладает преимуществом по сравнению с другими методами отделения. Железо можно отделять от алюминия в виде сульфида из растворов, содержащих винную кислоту [1155].
Бурке и Дэвис [600] удаляют марганец кипячением хлорнокислых растворов с NaClO3. Двуокись марганца имеет тенденцию увлекать с собой некоторые металлы, но алюминий, поданным авторов, не соосаждается.
Гордон и др. [756, 768] отделяют железо от алюминия гомогенным осаждением в виде перйодата. Осаждение лучше проводить из растворов нитратов с pH 1,1—1,2. При полном осаждении железа имеет место соосаждение алюминия; поэтому рекомендуют двукратное осаждение.
При отделении железа от алюминия ферроцианидом для уменьшения соосаждения последнего вводят ZnCl2 [33].
Описан метод отделения титана гидролитическим осаждением в виде Ti (ОН)4 кипячением раствора, содержащего сульфосалициловую кислоту, при pH > 9,4 [393]. Фосфат-ионы отделяют осаждением в виде Li3PO4 [523] из сильнощелочного раствора; метод не эффективен. Олово от алюминия можно отделить в виде метаоло-вянной кислоты [820]. Метод отделения хрома осаждением в виде РЬСгО4 после предварительного окисления [1141] представляет мало интереса.
Отделение с органическими осадителями. В дополнение к описанным в разделе «Весовые методы» осадителям можно привести еще следующие. Фениларсоновой кислотой отделяют от алюминия титан и железо при pH 1,5—1,7 [105,
171
106]. В фильтрате остается весь алюминий, 2—5л<кгТЮ; и < 1 мкг Fe. Такие количества титана и железа не мешают определению алюминия алюминоном. Для отделения титана предлагалось использовать n-оксифениларсоновую кислоту [845]. Изучены условия осаждения большого числа металлов с помощью различных изомеров фенилендиарсоновой кислоты [1064]; на основании этого исследования можно разработать методы отделения многих металлов от алюминия. Осаждением в виде купферонатов от алюминия можно отделить титан, железо и некоторые другие элементы [453, 1051].
Бэнкс и Эдвардс [547] отделяют торий от алюминия осаждением в виде оксалата в присутствии избытка диметилоксалата и щавелевой кислоты. Алюминий удерживается в растворе в виде оксалатного комплекса. Этилксантогенат калия KSCSOC2H5 позволяет отделять цинк от алюминия [1254]. Осаждение цинка наиболее эффективно при pH 5—5,5. Для отделения алюминия от индия предложено двукратное осаждение последнего гексаметилендиамином в присутствии аммонийных солей [195].
ЭКСТРАКЦИОННЫЕ МЕТОДЫ ОТДЕЛЕНИЯ
Экстракция хлоридных комплексоз
Многие элементы можно отделить от алюминия в виде хлоридных комплексов экстракцией их органическими растворителями. Оптимальные значения кислотности для экстрагирования приведены в монографии Моррисона и Фрейзера [280].
Экстракция диэтиловым эфиром. Из органических растворителей наибольшее применение нашел диэтиловый эфир. Хотя это не лучший экстрагент, но более доступен, чем другие растворители. Оптимальная концентрация НС1 при экстракции — 6,2 N. При однократной экстракции смеси равных объемов водного слоя и слоя органического растворителя железо экстрагируется на —99% [659]. Часть Fe (III) восстанавливается эфиром до Fe (II), которое не экстрагируется эфиром [1058, 1258]. Верц и Нейбергер [1258] предлагают окислять восстановившееся железо при помощи КС1О3. Алюминий полностью остается в водном слое.
Экстракцией эфиром из 6 N НО от алюминия отделяют также галлий [653] и некоторые другие металлы.
Экстракция изопропиловым эфиром. Согласно Крафту и Мейкпейсу [659], изопропиловый эфир более эффективный экстрагент, чем диэтиловый эфир. Железо экстрагируется на 99% с ним при кислотности от 6,5 до 8 N, а с диэтиловым эфиром только при 6,2 N. Кроме того, изопропиловый эфир менее растворим в солянокислых растворах. Ионы РО43~, МоО42-
172
и V03~ частично экстрагируются изопропиловым эфиром, когда железо присутствует в виде Fe (III); алюминий не экстрагируется.
Экстракция амилацетатом. Уэллс и Хантер [12531 показали, что амилацетат экстрагирует железо лучше, чем диэтиловый и изопропиловый эфиры. После двух экстракций при равных объемах водного слоя и растворителя экстрагируется 99,95% железа, с изопропиловым эфиром после трех экстракций 99,9% железа (взят 1 г Fe). В этих же условиях экстрагируются >—83% Mo(VI), —68% Sn(IV), —14% V(V), 0,2 % Ti и 0,5% Со. Не экстрагируются Ni, Сг, Ca, Mg и Си (II). Алюминий экстрагируется на 0,1% (с диэтиловым и изопропиловым эфирами, как уже указывалось, не экстрагируется совсем). При определении малых количеств алюминия экстракция на 0,1% практически не имеет значения. При экстрагировании смесей Fe и Al (в соотношении от 100000:1 до 5000:1) Уэллс и Хантер [1253] получили от 99 до 104% от введенного количества алюминия, процент экстрагирования железа после двух экстракций составлял 99,88—99,97%. Преимущество амилацетата также в том, что не надо строго соблюдать концентрацию НС1.
Экстракция метилизобутилкетоном. Это эффективный растворитель для отделения Fe (III), Мо (VI), Ga, Те (IV) от алюминия [145, 156, 592, 772, 820, 857, 1216]. Коэффициенты распределения при экстракции из 6 V НС1 для некоторых металлов имеют следующие значения [1451:
Элемент *Р Элемент Кр
Те (IV) 360 Сг (Ш) 25Л0-3
Bi 3,1-10-4 Al, Ni 2,5-10-4
Сг 5,15-10-г Со < 2,5-10-2
Железо и молибден экстрагируют из 8 А НС1 [592, 857], а теллур— 6 N [145]. Двукратным экстрагированием с использованием по 20 мл метилизобутилкетона (при таком же объеме водного слоя) можно практически полностью удалить 0,5 г железа. Для отделения 1 г железа нужны 2—3 экстракции с использованием по 30 мл растворителя.
Экстракция прочими растворителями. Эллиот и Робинзон [700] для экстрагирования хлоридных комплексов применили дихлордиэтиловый эфир. Оптимальная концентрация НС1 при этом 9 N. Экстракция железа этим растворителем несколько хуже, чем другими описанными выше. Некоторое преимущество дихлордиэтилового эфира в том, что растворитель несколько тяжелее воды, что удобно при повторных экстракциях. В качестве растворителей используют также изоамиловый спирт, метиламилкетон [213], бутилацетат [12161 и смесь диэтилового эфира с тетрагидрофураном [1186].
173
Экстракция купферонатов
Экстракция купферонатов мешающих элементов при определении алюминия нашла очень широкое применение. На рис. 30—32 приведены графики зависимости процента экстракции купферонатов от pH. В ряде случаев отделение может быть достигнуто экстракцией купфероната алюминия 11162]. Практически полная экстракция купфероната алюминия наблюдается при pH 3,5 и выше (555, 703, 1162, 11931. Даже при pH 0,5 экстрагируется некоторое количество алюминия. Поэтому отделение Fe, Ti, Zr, V и других элементов лучше проводить из более кислых растворов. Обычно экстрагируют из 1 М растворов НС1 или H2SO4. При экстрагировании из 1 N растворов кислот наблюдаются незначительные потери алюминия, которыми можно пренебречь. Миллер и Чалмерс (9701 после обработки стандартного раствора алюминия купфероном и экстрагирования дихлорбензолом в водной фазе определяли содержание алюминия; абсолютная ошибка для алюминия в их опытах составляла 1—5 мкг.
Иногда в литературе встречаются неверные указания относительно оптимального значения pH для экстрагирования купферо-
Рнс. 30. Зависимость экстракции купферонатов от pH [1193]
1 — алюминий; 2 — бериллий; 3 — лантан; 4 — скандий; 5 — иттрий; 6 — сурьма
Рис. 31. Зависимость экстракции купферонатов от pH [1193]
1 — титан; 2 — цирконий; 3 — торий; 4 — ванадий (V); 5 — молиб -ден (VI); 6 — вольфрам (VI)
Рис. 32. Зависимость экстракции купферонатов от pH [1193]
1 — медь; 2 — свинец; 3 — ртуть;
4 — цинк; 5 — кобальт; 6 — марганец; 7 — железо
174 _________________________________
натов мешающих элементов. Например, в работе [550а] указывается на невозможность точного определения алюминия после экстрагирования купферонатов на основании данных, полученных при pH 2. Из таких растворов алюминий частично экстрагируется в виде купфероната и, безусловно, должны получиться заниженные результаты.
Купферонаты образуются не сразу, поэтому после добавления купферона растворы надо выдержать несколько минут перед экстрагированием. Согласно наблюдениям Шорта [1162], в присутствии 2—3 г NH4C1 купферонат железа экстрагируется легче. Если железо находится в виде Fe (II), его надо предварительно окислить. После удаления купферонатов экстрагированием из сильно кислой среды при анализе некоторых материалов удается определять алюминий сразу, не прибегая к другим методам отделения (после разрушения избытка купферона выпариванием с HNOS и H2SO4, или HNO3 и НС1О4 до паров SO3 или НС1О4). Если после удаления купферонатов из кислой среды остаются еще элементы, мешающие определению алюминия, то последний можно выделить из раствора экстрагированием купфероната при pH 3,5. Так поступают, например, Корбет [655] при определении алюминия в титане алюминоном, Шорт [1162] при определении алюминия в железе, Руни [1121]'и др. Попытки реэкстрагировать алюминий из хлороформного раствора купфероната не дали удовлетворительных результатов [787, 1218]. Поэтому остаток, полученный после выпаривания хлороформа и разложения избытка купферона, нужно растворить в кислоте или сплавить с карбонатом натрия и выщелочить плав в воде. При определении значительных содержаний алюминия удовлетворительные результаты могут быть получены и без разложения остатка купферона, если при экстрагировании применять небольшие количества купферона и для определения брать маленькие аликвотные части водного слоя [417, 418, 420].
При использовании высокочувствительных фотометрических методов в конечном фотометрируемом растворе концентрация купферона оказывается ничтожной. Обычно применяют свежеприготовленный 6%-ный водный раствор купферона; раствор купферона во избежание разложения нужно охлаждать. Для экстрагирования купферонатов предложены следующие органические растворители: хлороформ, диэтиловый эфир, бензол, четыреххлористый углерод, о-дихлорбензол, смеси хлоро<]юрма с бензолом и диэтилового эфира с бензолом (1:1), смесь равных объемов бензола, диэтилового эфира и ацетона. Хотя указывают [9701, что лучшие результаты получаются при использовании о-дихлорбензола, наиболее эффективным экстрагентом следует считать хлороформ. о-Дихлорбензол неудобно применять, так как он кипит при значительно более высокой температуре (180—183°С), чем хлороформ (58—61,5° С). Для экстрагирования купферонатов можно рекомендовать следующую методику.
175
5—10 мл анализируемого раствора, 1 Л' по НС1, помещают в делительную воронку, прибавляют 5—7 мл 6%-ного водного раствора купферона (при высоких концентрациях отделяемых металлов берут больше) и встряхивают 0,5—1 мин. для коагуляции купферонатов. Через 4—5 мин. вводят 15 мл хлороформа (при больших осадках берут больше) и встряхивают 1 мин. Экстракт отбрасывают, в водном слое проверяют полноту осаждения прибавлением нескольких капель раствора купферона. Появление белого осадка указывает на полноту осаждения, в противном случае добавляют еще купферон и повторяют экстрагирование до получения бесцветного экстракта. Водный слой встряхивают дважды, прибавляя по 10 мл хлороформа, для извлечения избытка купферона.
К водному слою или к части его в стакане прибавляют 2 мл НС1О4 (уд. вес 1,54) и 2—3.ил HNO3 (уд. вес 1,4) и выпаривают до паров НС1О4. Если раствор при этом не бесцветный, разложение остатков органических веществ повторяют. В бесцветном растворе определяют алюминий соответствующим методом.
Экстракция комплексов с N-бензоилфенилгидроксиламином
N-бензоилфенилгидроксиламин — аналог купферона (подробно см. стр. 61). Полнота экстракции некоторых элементов при оптимальных pH характеризуется следующими данными [6401:
Элемент pH Экстрак-ция, % Элемент pH Экстракция, % Элемент pH Экстрак-ция, %
Fe 2-3 100 А1 6 100 Zn 9-11 100
Bi 2-13 100 РЬ 7—11 97 Мп 10 100
Сг 3-4 23 Hg 7,5-9 88 Со, Cd 10-11 100
Си 4-11 100 Ni 9-11 97
Максимальная экстракция алюминия, по данным Хвастовска и Минчевски [640, 641], наблюдается при pH 6.
На рис. 33 представлена зависимость процента экстракции комплексов некоторых металлов от pH. Экстракция комплексов с N-бензоилфенилгидроксиламином использована для отделения от алюминия Ti, Zr, V [263, 776], щелочных и щелочноземельных металлов [703], для концентрирования примесей алюминия и других элементов при определении их в серебре и хроме высокой чистоты [6401.
Рис. 33. Зависимость экстракции комплексов некоторых металлов с N-бензоилфенилгидроксиламином от pH [640]
/ — железо; 2 — медь; 3 — алюмк»
ннй;74 — xdom; 5 — цннк; 6 — мар-
ганец
176
Экстракция оксихииолииатов
Экстракцию оксихинолинатов для удаления мешающих определению алюминия элементов обычно не применяют. Наоборот, стараются создать такие условия, в которых оксихинолинат алюминия экстрагируется, а мешающие элементы остаются в водном слое. См. стр. 82.
Экстракция оксихинальдинатов
8-Оксихинальдин (2-метил-8-оксихинолин) со многими металлами образует труднорастворимые соединения. С алюминием в обычных условиях не реагирует [811, 815]. Осадки оксихинальдинатов металлов можно отделить фильтрованием, но лучше их экстрагировать хлороформом. Хайнек и Рангел [811] изучили условия экстракции оксихинальдинатов многих металлов. При pH 9,2 могут быть экстрагированы комплексы Zn, Ni, Со, Pb, Sn (IV), Sb (III), Мп (II), Cd, Cu, Fe (II), Fe (III). Плохо экстрагируются Ti и Ce (HI). He экстрагируются Ta, Mg, Cr, Mo, W, V, Nb, Th, U, Zr. Эти авторы использовали экстракцию оксихинальдинатов при фотометрическом определении алюминия в виде оксихинолината. Из металлов, которые не экстрагируются в виде оксихинальдинатов, до 1 мг Та, Cr (III), Cr(VI), Mo(VI), W (VI), V (V), до 0,25 мг Mg не мешают экстракции оксихинолината алюминия. Nb, Th, U, Се можно маскировать связыванием в пероксидные комплексы. Пероксидный комплекс церия частично переходит в хлороформный слой, но при добавлении безводного сульфата натрия влияние его уменьшается. Ошибка, вызываемая 1 мг церия, в этом случае составляет 1 %. Цирконий рекомендуется удалять в виде куп-фероната. Описанный способ отделения мешающих элементов Хайнек и Рангел [811] применили при определении алюминия в алюминиевых бронзах и нержавеющих сталях. Ошибка определения составляет 0,028 и 0,14% при содержании 0,5—1,5 и 1,5—7,0% алюминия, соответственно.
Эшбрук и Ритчей [534] считают оксихинальдин лучшим реагентом для удаления мешающих элементов при определении алюминия с оксихинолином. Эти авторы экстрагируют оксихинальдинаты при pH 9,5—10,0. В отличие от Хайнека и Рангела они указывают, что марганец не экстрагируется в виде оксихинальдината. Однако образование комплекса марганца подтверждают и другие авторы [993].
Экстракция роданидов
Некоторые элементы могут быть отделены от алюминия экстракцией их роданидов. Метод применяется главным образом для отделения железа. Следует иметь в виду, что в некоторых условиях алюминий также может экстрагироваться. По данным Бока [577], процент экстракции роданида алюминия увеличивается с понижением температуры и увеличением концентрации роданида.
Чтобы свести до минимума потери алюминия, роданид нужно вводить в концентрации не больше 1 М. В этих условиях, т. е. при 1 М NH4SCN и 0,5 М НО, создаются наиболее благоприятные условия для экстракции роданида железа. Согласно Боку [577], при этом процент экстракции железа составляет ~ 89%. Роданид железа экстрагируется диэтиловым эфиром [577, 706, 1235], амиловым спиртом [1001], смесью амилового спирта и эфира [409, 568] и бутилового спирта и эфира [19]. Шпеккер и др. [1186, 1187] показали, что коэффициент распределения роданида железа между диэтиловым эфиром и солянокислым раствором сильно увеличивается при добавлении тетрагидрофурана, в то же время коэффициент распределения роданида алюминия не меняется.
30 мл раствора, 1,2 Л' по НС1, помещают в делительную воронку, добавляют 12 мл НС1 (уд. вес 1,19), 15 мл раствора NH4SCN (500 г/л). Роданид железа экстрагируют смесью 30 мл диэлтилового эфира и 30 мл тетрагидрофурана. Повторяют экстракцию с 20 мл эфира и 20 мл тетрагидрофурана после введения 10 мл раствора NH4SCN. Затем встряхивают еще раз с 20 мл эфира и 20 мл тетрагидрофурана [1186, 1187].
По этой методике авторы получили хорошие результаты по алюминию даже при концентрациях NH4SCN, значительно превосходящих указанные выше оптимальные (1 до 4 М NH4SCN), при 2—3-кратной экстракции из растворов с кислотностью 0,5—3 N по НС1 и при соотношении Fe: А1 от 1 : 30 до 30: 1 [1186]. Процесс отделения длится 10 мин.
Живописцев и Минин [119] использовали экстракцию роданида для отделения титана от алюминия.
Экстракция диэтилдитиокарбаминатов
Наиболее обстоятельное исследование экстракции с помощью диэтилдитиокарбамината натрия проведено Боде [579]. Алюминий не экстрагируется при любых pH; оптимальные значения pH для экстрагирования диэтилдитиокарбаминатов многих металлов приведены в монографии Моррисона и Фрейзера [280]. В дополнение к этим данным можно указать, что диэтилдитиокарбаминат марганца довольно хорошо экстрагируется четыреххлористым углеродом из растворов с pH 5,0—5,5 [424, 428, 432]. При pH 4—6 от алюминия могут быть отделены Fe, Mn, Zn, Ni, Со, Си, Cd, Bi, Se, Ag, As (III), Sb(III),Sn(IV),Pb, Mo, V, In, Ga и TI. Эккерт [697] при определении алюминия в никелевых сплавах успешно удалял никель и примеси Со, Fe, Мп и Си в виде диэтилдитиокарбаминатов. Из различных карбаминатов в данном случае, по мнению Эккерта, диэтилдитиокарбаминат дает наилучшие результаты. При использовании, например, пиперидиндитиокарбамината получаются заниженные результаты (на 10—20%). При отделении больших количеств никеля из органических растворителей лучше всего применять хлорпроизводные углеводородов. Эфиры, высшие спирты и
178
сложные эфиры плохо растворяют карбаминат никеля. При отделении других элементов с успехом могут применяться также четыреххлористый углерод, высшие спирты и сложные эфиры.
Экстракция ацетилацетоиатов
Ацетилацетон с многими металлами образует комплексы, которые можно экстрагировать как ацетилацетоном, так и СС14, СНС13, СвН6, ксилолом.
Ацетилацетонаты различных элементов экстрагируются при следующих значениях pH [280]:
Элемент pH Элемент pH Элемент pH
А1, Мп 4 Ga, U (IV) 2,5 Th 5,8
Be 2 In 2,8 Ti 1,6
Се >4 Fe 1,5 u (VI) 4-6
Сг(Ш) 0—2 Мо (VI) -0,8-0,0 Zn 5,5-7
Со (III) -0,3-2 Pu(IV) 2-10 Zr 2-3
Си, V (IV) 2,0
Максимальное экстрагирование ацетил ацетон ата алюминия А1(С5Н7Ог)3 наблюдается при pH > 4 [1198] (рис. 34). Как и в случае экстрагирования купферонатов, с помощью ацетилацетона при pH 0 от алюминия могут быть отделены в виде ацетилацетона-тов многие элементы; сам алюминий может быть отделен в виде аце-
тилацетоната от Ca, Mg, Мп и других Миллер и Чалмерс [9701 использовали ацетилацетон для отделения алюминия от других элементов при микроанализе силикатов (из навесок 10 мг). При pH 6—7 ацетилацетонат алюминия полностью экстрагируется диэтиловым эфиром. После реэкстрагирования алюминия 6N НО его определяли весовым оксихинолиновым методом с относительной ошибкой 0,4%. При pH 6—7 не экстрагируются многие составные компоненты силикатов. Экстрагируется —3% кобальта и хрома, однако эти элементы в силикатах содержатся в небольших количествах и не мешают определению. Бериллий сопровождает алюминий. Алимарину и Гибало [14] удалось отделить бериллий от алюминия экстракцией ацетил ацетон ата бериллия при pH 9
элементов.
Рис. 34. Зависимость экстракции ацетилацетоиатов алюминия (/), галлия (2) и индия (3) от pH [1198]
хлороформом из растворов, содержащих комплексон III. В этих условиях экстрагируется только комплекс бериллия, а комплексы алюминия и многих других металлов не экстрагируются. Экстракция ацетилацетоната бериллия не зависит гот концентрации комплексона III и ионов SO42-, СГ, NO3“ и NH4+.
Экстракция теноилтрифторацетонатов
Теноилтрифторацетон использовали Гольдштейн и др. [763] для отделения Th, Zr, Fe и некоторых других элементов от алюминия при определении его в окиси тория. В качестве органического растворителя можно применять метилизобутилкетон. Мешающие элементы наиболее полно отделяются из растворов с pH 1,5, содержащих ацетаты (концентрация 2 Л4). В этих условиях Fe, Th, Zr и Си экстрагируются очень хорошо, Ti, U, Мо и V экстрагируются частично. Алюминий экстрагируется при pH 5—5,5 [584, 763] при концентрации ацетатов 1 М. Оптимальное количество 0,5 М раствора реагента составляет 10 мл (реагент растворяют в метилизобутилкетоне).
Эшелманидр. [703] использовали экстракцию теноилтрифтораце-тоната алюминия метилизобутилкетоном из растворов с pH 5,5—6,0. 0,5—1 М по ацетату. Алюминий затем определяли методом фотометрии пламени. При анализе материалов сложного состава авторы предварительно удаляли из анализируемого раствора Zr, Ti, Th, U (VI), Fe (III), Се (IV) и Си экстракцией их теноилтрифторацетонатов при pH ’.
Экстракция триизооктичамином
При определении алюминия в бериллиевых материалах с помощью 5-сульфо-4-диэтиламино-2,2-диоксиазобензола Флоренц [724] предлагает предварительно отделять мешающие элементы (Fe, Со, Cu, Ti, V, W, U и Th) экстракцией их триизооктиламином из 8 М НС1.
Раствор выпаривают почти досуха и остаток растворяют в 5 мл 8 М НС1. Раствор переносят в делительную воронку емкостью 50 мл с помощью 5 мл 8 М НС1. Добавляют 10 мл 5%-ного раствора триизооктиламина в толуоле, насыщенного перед использованием 8М НС1, и экстрагируют в течение 1мин. Водный слой спускают в коническую колбу емкостью 150 мл, органическую фазу промывают 5 мл 8 М НС1, промывную воду переносят в ту же коническую колбу. Добавляют 1 мл 15 М HNO3 и 3 мл 72%-ной HCiO4 и выпаривают почти досуха. Разбавляют в мерной колбе до соответствующего объема и заканчивают определение алюминия спектрофотометрическим методом с 5-сульфо-4-диэтиламино-2,2-диоксиазобензо-л эм.
Экстракция три-п-окт илфосфинокисью
Экстракция с использованием три-м-октилфосфинокиси позволяет отделить от алюминия большое число элементов. По данным Уайта [1263], 0,1 М раствором три-м-октилфосфинокиси в цикло
180
гексане из 1 М НС1 полностью экстрагируются Cr (VI), Au (I), Hf, Fe (III), Mo (VI), Sn (IV), U (VI), Zr; частично экстрагируются Sb (III), Bi, Cd, In, Hg (II), Pt (II) и Zn. Из 7 Л1 НО полностью экстрагируются Sb (III), Cr (VI), Ga, Au (I), Hf, Fe (HI), Mo (VI), Sn (IV), Ti (IV), U (VI), V (IV), Zr.
Ишимари [8371 изучил экстракцию 6СГ ионов раствором три-н-октилфосфинокиси в толуоле. Бурке и Дэвис [600] использовали этот метод отделения при определении алюминия в многокомпонентных жаропрочных сплавах, сочетая его с предварительным отделением основной массы мешающих элементов электролизом на ртутном катоде. По данным Бурке и Дэвиса, из 6 М НО раствором три-n-октилфосфинокиси в циклогексане количественно экстрагируются Ti, Zr, Hf, Au, Ga, U (VI), Nb, Sn, In, Sc, Th, Os, Mo, As (III), W, Fe (III), Hg и V. Алюминий в этих условиях не экстрагируется, коэффициент распределения его равен 10“3. Не экстрагируются также Y, РЗЭ, В, Mg, Be, щелочные и щелочноземельные металлы.
Экстракция прочими экстрагентами
Бабко и Михальчихин [32] отделяют Fe (III) от Al экстракцией хлороформом комплекса железа с а-нитрозо-Р-нафтолом при pH — 1,5. Живописцев и Минин [119] экстрагируют хлороформом комплекс Fe (III) с диантипирилметаном из 5—6 N НО. Железо можно отделить от алюминия в виде гексароданоферрата трибутиламмо-ния экстрагированием изоамилацетатом из растворов с pH 1—5 [1291], либо экстракцией его комплекса с пиридил-азо-нафтолом при pH 1 —2 [1216].
Бенке и Эдвардс [547] отделяют торий от алюминия экстракцией окисью мезитила из раствора, насыщенного нитратом лития. Кислотность экстрагируемого раствора должна быть 1 М по HNO3.
Циглер [1290] указал на возможность отделения индия от алюминия (15:1) экстракцией дихлорметаном дибутиламмонийиндий-сульфида, образующегося при взаимодействии индия с дибутилами-ном в присутствии полисульфида.
Банерджи и др. [546] отделяют алюминий от бериллия экстракцией бутиратов хлороформом или этилацетатом из растворов, содержащих комплексон III. Алюминий в виде бутирата экстрагируется при pH 3,40, но в присутствии комплексона III, добавляемого до введения масляной кислоты, он не экстрагируется и остается в водной фазе. Не мешают СГ, NO3", SO42-, SiO32~, Mg, Zr, Ti (IV) и небольшие количества фторидов. Фосфаты мешают. Влияние до 4 мг P2OS можно устранить добавлением к смеси ZrOCl2 и комплексона III (для связывания избытка циркония). Метод успешно применен к анализу бериллиевых руд. Бериллий от алюминия можно отделить экстракцией раствором ди-(-2-этилгексил)-фосфорной кислоты в керосине из растворов сульфатов [621].
181
Комплекс бериллия экстрагируется из более кислых растворов, чем комплекс алюминия. При pH 2,2 экстрагируется70% Веи 12% А1. Однако кривые зависимости процента экстракции от pH для бериллия и алюминия, приведенные автором, очень близки друг к другу, поэтому эффективность разделения этим методом сомнительна.
Алекперов и др. [101 изучили возможность разделения алюминия и галлия экстракцией раствором нафтеновых кислот в смеси керосина и диэтилового эфира (1:1). Оптимальное значение pH 3,5—3,6. При однократной экстракции извлекается 80% Ga.
ХРОМАТОГРАФИЧЕСКИЕ МЕТОДЫ РАЗДЕЛЕНИЯ
Разделение на катионитах
Алюминий от других элементов можно отделить на катионитах, используя различие в сорбции при той или иной кислотности растворов, различие в отношении к комплексообразующим агентам и амфотерность алюминия.
Разделение при регулировании кислотности растворов. Значение этих методов не столь велико, как методов, основанных на комплексообразовании, но в ряде случаев они могут оказаться полезными. Применяют их главным образом для отделения Be, Zr и U от алюминия.
Гордеева и Просвирякова [94] изучили условия отделения бериллия от алюминия и железа на катионите КУ-2. Все три металла сорбируются при кислотности ют 2N НС1 до pH 4. Бериллий элюируют 150—200мл 0,5N НС1 (или HNO3); алюминий начинает выходить в элюат при пропускании ~ 300мл 0,5tV НС1. Общее количество разделяемых ионов не должно превышать 5—6 мг на 1 г катионита, в противном случае часть алюминия вымывается с последними порциями бериллия. Титаи десорбируется вместе с бериллием. Алюминий можно извлечь затем пропусканием 20—25 мл 4 N НС1.
В аналогичной работе Стрелов [1205] снимает бериллий с катионита AG 50WX8, пропуская 375 мл 1 N НС1 со скоростью 3—4 мл/мин. В присутствии > 60 мг железа бериллий лучше элюировать 425 мл 1,2N HNO3. Алюминий количественно остается в колонке и может быть извлечен пропусканием 500мл 2 ЛНС!.
Бериллий от алюминия отделяют также пропусканием раствора, 0,5—0,7 N по H2SO4, через катионит сульфокислотного типа FN. При этом алюминий задерживается в колонке, а бериллий проходит в фильтрат. Алюминий затем извлекают 2—4АГНС1 или H2SO4 [1241 ]. Относительная ошибка при отношении Be : Al от 1 : 8 до 4 : 1 не превышает 3%.
Стрелов [1204] отделяет цирконий от алюминия на катионите БиорадАС 50WX8. Последний элюируют 400мл 2N НС1 со скоростью 2—2,5 мл/мин. Для десорбции циркония нужно пропускать 400 мл 5 N НС1 или 250 мл 3N H2SO4. Мешают анионы, образующие прочные комплексы с цирконием (фторнды и оксалаты).
В работе [4981 также отделяют цирконий от алюминия при кислотности 2 N по НС1, используя катионит вофатит KPS-200. Уса-тенко и Гуреева [445] провели сравнительное изучение некоторых
182
катионитов для разделения этих элементов. Из исследованных ими катионитов цирконий лучше всего сорбируется катионитом КУ-1 (при максимальной кислотности 1,5 N), а затем СБС-Р — при 1,25 N и хуже всего — вофатитом Р (при кислотности 0,75 N). Наибольшая разность в кислотности для сорбции циркония и алюминия наблюдается у сульфоугля, КУ-1 и МОФ-1. Алюминий не сорбируется сульфоуглем и катионитом КУ-1 из растворов с кислотностью 1,5 N. В ряде работ [49, 177] указывается на возможность разделения циркония и алюминия пропусканием раствора, 1 N по НС1, через катионит КУ-2.
Стрелов [1207] отделяет уран (VI) от алюминия, используя различие в коэффициентах распределения между катионитом Биорад AG 50 W х 8 и 1 N H2SO4 (9,6 и 126, соответственно).
Уран десорбируют 350 мл \N H2SO4 со скоростью 3—4 мл/мин, алюминий — 400 мл 3 N НО.
При разделении на катионите амберлите IR-120 [433] уран элюируют 150 мл 1 Л’ H2SO4, алюминий — 150 .ил 2 Л’ НС1.
С помощью катионитов, регулируя кислотность, алюминий отделяют от щелочноземельных металлов и магния [394], от лития [584] и от фосфорной кислоты [158].
Для отделения алюминия от мешающих элементов при анализе железа, стали и сплавов Sn,— Pb использована колонка с целлюлозой [565а, 566]. С помощью целлюлозы, обработанной 0,1 М раствором ди-(2-этилгексил) фосфорной кислоты в циклогексане, возможно отделение А1 от Ga, In и Т1 селективным вымыванием сорбированных элементов соляной кислотой различных концентраций. TI, Ga, In и Al элюируют 0,3;0,7; Зи8Л1НС1, соответственно [624].
Ряд авторов для отделения алюминия от мешающих элементов применяет силикагель [448, 450, 883—885]. Кельшюттер и др. [885] на силикагеле отделяют алюминий от кальция и цинка. Все три металла из растворов с pH 4 поглощаются силикагелем, затем кальций можно извлечь пропусканием ацетатного буферного раствора с pH 5,75, цинк вымывают ацетатным буферным раствором (pH 5,2). Алюминий остается на колонке. Его десорбируют пропусканием 50 мл НС1 (1 : 1) и промыванием колонки водой. Федоров и Соколова [448, 450] при определении алюминия в легированных сталях отделяют кобальт с помощью силикагеля. Морачевский и Зай- цев [272] для отделения таллия и галлия от алюминия применили искусственные и природные фосфориты.
Разделение с использованием комплексообразования. От некоторых металлов алюминий отделяют путем использования различия в устойчивости комплек-^сонатов.
При определении алюминия в железных рудах, глинистых карбонатных шпатах и топливе к анализируемому раствору добавляют избыток комплексона III 183
для связывания алюминия и железа, устанавливают pH 5,3, кипятят 2 мин. н после охлаждения раствор пропускают через колонку с вофатитом KPS-2OO. Кальций и магний сорбируются катионитом, а алюминий и железо проходят через колонку. В фильтрате сумму последних определяют комплексометрически [737].
В аликвотной части раствора определяют железо, а алюминий находят по разности.
По Бабачеву [539], при определении алюминия в смесн с Fe, Сг, Са н Mg сначала в анализируемом растворе (pH 1,5—2) титруют железо комплексоном III с сульфосалицнловой кислотой. К оттитрованному раствору добавляют избыток комплексона III для связывания алюминия н хрома, после нагревания до кипения устанавливают pH 5 и продолжают кипятить 10 мин. Холодный раствор вводят в колонку с КУ-2 нлн вофатнтом KPS-200 в аммонийной форме. Прн этом кальций н магний сорбируются. Колонку промывают водой и в фильтрате после разрушения комплексоната алюминия добавлением NaF тнтруют потенциометрически освободившийся комплексон III, эквивалентный содержанию алюминия, раствором ацетата цинка в присутствии феррн- н ферроцианида.
В другой работе того же автора [538] для отделения алюминия от железа н титана анализируемый раствор с pH 1,5—2 после нагревания до 50—60° С и добавления нескольких капель Н2О2 титруют комплексоном III с индикатором сульфо-салнциловой кислотой. Оттитрованный раствор пропускают через катноннт КУ-2 или вофатит KPS-200. Титан и железо элюируют водой, затем алюминий десорбируют 37VHC1 н в элюате определяют его титрованием избытка комплексона III раствором цинка в присутствии индикатора ксиленолового оранжевого прн pH 4,6. Метод использован для анализа цемента, глнн, шлаков.
Аналогичная методика использована для отделения Fe, Al н Ti от Мп [22]. Различие лишь в том, что после титрования железа и титана в раствор вводят избыток комплексона III, устанавливают pH 3,3—4,4, кипятят 1—2 мин и пропускают через колонку с теми же катионитами. В этих условиях марганец не образует комплексоната н сорбируется катионитом, а алюминий в виде комплексоната проходит в фильтрат, где определяют его, как указано выше. Метод использован для анализа металлургических шлаков, марганцевых руд.
Предложено отделять тнтан от алюминия прн пропускании их смеси (pH 1—2), содержащей комплексон III н Н2О2, через колонку с катионитом дауэкс-\V50 X 8 [757]. Тнтан в виде комплексоната проходит в фильтрат, алюминий сорбируется. Его элюируют 150 мл 4 N НС1.
Аналогичная методика предложена для отделения алюминия от кобальта [617].
Анализируемый раствор обрабатывают комплексоном III, затем подкисляют до pH ~2, добавляют5—10 ли 6%-нон Н2О2 и кипятят 2 мин. После охлаждения раствор пропускают через колонку с катионитом амберлит IR-120; при этом комплексонат алюминия разрушается н алюминий поглощается катионитом, а кобальт проходит в фильтрат. Алюминий затем десорбируют 4N НС1.
Алюминий в виде комплексоната можно отделять от бериллия, пропуская раствор с pH 2,5—4,5, содержащий комплексон III, через катионит амберлит IRA-120 в №+-форме [1019].
От магния и кальция алюминий отделяют в виде цитратного комплекса пропусканием раствора с pH 4 через катионит дауэкс-•50W х 8 в НН4+-форме [528]. Алюминий проходит в фильтрат, а кальций и магний задерживаются на колонке.
Метод использован для анализа известняков и доломитов.
При анализе хромово-железных руд [528] хром окисляется до Сг (VI) прн сплавлении образца с Na2O2. После растворения плава раствор, 0,1—0,2 N по H2SO4, пропускают через колонку. Сг (VI) проходит через колонку, остальные металлы задерживаются на колонке. Остатки Сг (VI) вымывают с помощью 140 мл 0,1 N H2SO4 н 50 мл воды. Затем вымывают магний и никель 200 мл 1 М ацетатного буферного раствора с pH 6; железо десорбируют 180мл 5%-ной лимонной кислоты. Оставшийся алюминий извлекают, пропуская 150мл 4 N НС1.
1 ал
При анализе бронз [3551 алюминий отделяют от меди в виде цитратного комплекса из аммиачных растворов, используя катионит СБС.
Из смеси 80—90% тетрагидрофурана и 0,6 М НС1 железо отделяют от А1, Со и Ni на катионите дауэкс-50 х 8 [897].
Титан в виде пероксидного комплекса можно отделить от алюминия, используя сильнокислотный катионит [473, 1206].
Цывина н Конькова [473] пропускают анализируемый раствор, 0,75 Л’ по НС1, содержащий несколько капель Н2О2, через катионит КУ-2 в Н+-форме. Тнтан проходит в фильтрат, а алюминий сорбируется катионитом. Его десорбируют 50 мл ЗА’ НС1.
Стрелов [1206] отделяет тнтан от алюминия н некоторых других элементов, пропуская анализируемый раствор, 0,3 А по H2SO4, через колонку с катионитом Биорад AG 50WX8 в Н+-форме. Титан избирательно извлекается 350 мл 1 N H2SO4 в присутствии 1% Н2О2. Колонку промывают 100 мл 0,1 N НС1 и десорбируют Fe (III), Be, Mg, Си, Mn, Zn, Ni и Co, пропуская 400 мл 2N НС1 н алюминий — 400 мл 3 N НС1.
Хром от алюминия предлагалось отделять в виде роданидных комплексов [Cr (SCN)41~, [Cr (SCN)6K2 и [Cr(SCN)e]"3 на катионите вофатит KPS-200 в Н+-форме [1055].
Для отделения алюминия от Be, Ca, Mg, Mn, Zn и Си использовано образование алюминием устойчивого комплекса с тироном [90, 91]. Алюминий можно отделить в виде сульфосалицилатного комплекса из растворов с pH 10 от меди [355, 952], Ni, Zn и Мп [952]. Медь отделяют от алюминия в виде тиосульфатного комплекса [356] на КУ-2 в №+-форме, а железо — в виде пирофосфатного комплекса [255].
Методы, основанные на амфотерности алюминия. Алюминий — амфотерный металл—отделяют как от катионов,так и анионов сорбцией на катионитах в ЫН4-форме из растворов с pH 2,5—3,0. Для его десорбции используют при этом растворы щелочей [222,238, 239, 356, 357]. Лазарев [222] при определении алюминия в сплавах альнико и бронзах раствор пропускает через колонку с СБС в Н+-форме, затем алюминий извлекает 300 мл 1 А раствора NaOH и 50 мл воды со скоростью 3,5 мл!мин.
Рябчиков и Осипова [3561 при отделении алюминия от меди предлагали предварительно переводить последнюю в аммиачный комплекс, а алюминий — в алюминат. При пропускании через КУ-2 в №+-форме медь задерживается на колонке, алюминий проходит в фильтрат.
Разделение на анионитах
Наибольшее значение имеют методы, основанные на образовании хлоридных комплексов. Наиболее обстоятельное исследование сорбции хлоридных комплексов на анионитах выполнено Краусом и Нельсоном [207]. По их данным на анионите дауэкс-1
185
сильно сорбируются хлоридные комплексы следующих металлов: Cu (I),Ag (I), Au (III), Zn, Cd, Hg (II), Ga, TI (III), Ge (IV), Zr, Sn (II), Sn (IV), Hf,V(V). Sb (III), Sb (V), Bi, Pa (V), Mo (VI), W (VI), Те (IV), Po (IV), U(IV), U (VI), Тс (VII), Re (VII), Fe (III), Co (II), Ru(IV), Rh (IV), Os (III), Pd (II), Ir (IV), Pt (IV). Слабо сорбируются Си (II), Sc, In, Ti (III), Ti (IV), Pb (II), V(IV), As (III), As (V), Nb (V), Та (V), Cr (III), Se (IV),Mn (II), Fe (II), Rh (III), Ir (III). He сорбируются щелочные и щелочноземельные металлы, Be, Mg, Al, Y, рзэ, TI (I), Ac, Th и Ni.
Хортон и Томасон [8191 для металлов, обычно встречающихся в сплавах Fe, Cu, U, Sn и РЬ, приводят следующие коэффициенты распределения для 9 М НС1 и дауэкс-1:
Металл kp Металл Kp
Fe (II) Zr 100
Cu (II) 8 U (VI) 500
Cd, Со(II), W(VI) 40 Zn (IV) 5-103
Sb (III), Sn (II) 50 Fe (III) 3-104
Zn 60 Sb(V) 2.10s
Mo (VI) 90 Cr(VI), Mn(VII), Tc(VII), V(V) Высокий
По данным этих авторов, из 9 М НО не сорбируются (КР<~ 2): Al, Mn(II), Cr(III), Ni (II), V (IV), Ti (III), Ti (IV), Th, Mg, рзэ, Be и Pb. Таким образом, из 9 M НО от алюминия могут быть отделены почти все металлы, содержащиеся в сплавах Fe, Cu, U, Sn и РЬ и мешающие определению алюминия с алюминоном. Возможности разделения расширяются, если раствор пропускать через анионит дважды при различных кислотностях. Так, свинец из 9 М НО не сорбируется, но сильно поглощается 2 М НО. Поэтому Хортон и Томасон [8191 после пропускания раствора 9 М по НО через анионит предлагают снизить кислотность элюата до 2 М НО и пропустить через другую колонку с анионитом.
Зависимость сорбции хлоридного комплекса Fe (III) насильноосновном анионите амберлит IRA-400 от кислотности характеризуется следующими данными [5901:
HCl, M Сорбция, %
10,4 99,8
9,4 99,7
8,3 99,6
6,7 99,6
НС1, М Сорбция, %
6,2 99,6
5,2 99,5
4,2 89,6-93,0
Таким образом, отделение от железа удовлетворительно из 5—10 М НС1. Для отделения железа от алюминия применены также аниониты OAL [9081, амберлит LA-1 [386] и АВ-17 [8, 378, 895]. Для отделения Си [278, 10231, Zn [172, 317], Pb [317] и Со [843] обычно используют растворы соляной кислоты 8; 2—2,5; 2,5 и 9 М, соответственно. Галлий отделяют на сильноосновных анионитах OAL и L из 7 М или 6 М НО [899]. В работе [104] описан анализ сплавов
1яа
Al — Sb — Ga с использованием способа разделения в виде хло-ридных комплексов.
Титан очень слабо поглощается на анионитах в виде хлоридно-го комплекса; прибавление Н2О2 не повышает сорбции [580]. Таким образом, титан от алюминия отделить в виде хлоридного комплекса невозможно. Плутоний отделяют на анионите дауэкс-I из 8М НС1 [979] или 12 М. НО [705]. Коэффициент распределения плутония из 8 М НС1 равен 1400, из 12 М НС1 — 8000 [979]. Уран отделяют на сильноосновном анионите деацидит-FF из 8 М НО [1237] или из 10—ИМ НО в присутствии Ш [572]. Теллур от алюминия отделяют на анионите ЭДЭ-10П из 6 М НО [382].
Казанцев и др. [1551 провели сравнительное изучение различных анионитов (АВ-17, АМП, ЭДЭ-10П, АН-2Ф, АН-22, АН-31) с целью использования их для разделения металлов в виде хлоридных комплексов. Алюминий не сорбируется всеми анионитами при кислотности 0,1—11 N НО; Ni и Се (III) всеми анионитами поглощаются примерно одинаково (1—15%). Медь практически не сорбируется-до ЗА концентрации НО; максимальная адсорбция ее (—50%)= на ЭДЭ-10П, АН-31 и АН-2Ф наблюдается в 9 —11 N НО. Максимальная сорбция Fe (III) всеми анионитами наблюдается из 9—НА НО и лучше всего на АВ-17 и АМП. Цинк всеми анионитами начинает сорбироваться уже из 0,1 А НО (максимальная сорбция из 2—5 А НО).
Нельсон и др. [10121, а также Пахолков и Рылов [331а] изучили возможность отделения алюминия от других металлов в виде фторидного комплекса. Из растворов HF — НО и HF — H2SO4. алюминий сильноосновными анионитами не поглощается, слабоосновными анионитами (ЭДЭ-10П, АН-2Ф) сорбируется в значительной степени, что позволяет отделить его от многих металлов. Наибольшая сорбция наблюдается из 0,1 А НО и H2SO4 при 2 М HF). С увеличением концентрации НО и H2SO4 и уменьшением концентрации HF сорбция сильно убывает. Бериллий поглощается сильноосновными анионитами из раствора, 0,01 А по НО и 1 Al по HF, что позволяет отделить его от алюминия.
По данным работы [733а], наибольшее различие коэффициентов распределения циркония и алюминия имеет место в растворах 0,06 М по НО и 0,8 М по HF. Для циркония и некоторых других металлов найдены следующие коэффициенты распределения:
Металл КР Металл КР Металл «р
Fe 0 Ti 9,1 Zr 18,4
V 1,2 Nb 10,5 Al о 20
Sn 2Д Hf 11 Та 22
Железо полностью проходит через колонку и мешает определению алюминия, поэтому его отделяют в виде купфероната.
Алюминий от бериллия можно отделить в виде оксалатного комплекса [384, 385]. Из оксалатных растворов при pH 1—4,5
1 Q7 *
последний не сорбируется анионитом АВ-16, а алюминий при pH 4—4,5, напротив, сорбируется хорошо (КР = 545). Если присутствует железо, то оно также сорбируется.
Описано разделение алюминия и бериллия в виде оксалатных комплексов с помощью ионной флотации [943] при pH 4 (233 С) и использовании в качестве флотирующего агента хлорида тетра-дециламина Ci4H29NH2-НС1, растворенного в метаноле, при молярном отношении Al: Be = 2:1. Оксалатный комплекс бериллия диссоциирует при разбавлении, бериллий проходит через колонку и отделяется от алюминия.
Алюминий от некоторых металлов, например от кальция, можно отделять в виде цитратного комплекса на анионитах дауэкс-2 или дауэкс-50 в цитратной форме; кальций проходит в фильтрат, а алюминий и железо остаются на колонке. Затем алюминий можно извлечь концентрированной НС1, а железо—1АНСИ1139, 1140].
Fe (III) и V (IV) предлагали отделять от алюминия в виде роданидных комплексов [571, 1224, 1225].
Железо отделяют из 0,68 М раствора роданида (pH 2) на амберлите IRA-400А. После пропускания анализируемого раствора колонку 15 раз промывают 0,68 М раствором KSCN, подкисленным НС1 до pH 2 (по 10мл). Алюминий при этом практически полностью (~ 99%) проходит через колонку, а железо в виде комплексного аниона сорбируется анионитом. Относительная ошибка метода 1%.
При отделении V (IV) в виде роданидного комплекса на анионите амберлит IRA-400, по данным Бока и Шулера [580], коэффициенты распределения из растворов с кислотностью 0,1 М по НС1 имеют следующие значения:
nh4scn, м Кр NH4SCN, М КР
0,1 220 1,00 3220
0,25 3655 2,00 2875
0,50 4335
При концентрации роданида 0,5—2 М как в 0,1 М НС1, так и в 1,0 М НС1 наблюдается одинаково хорошая сорбция ванадия (99,7— 99,8% и 99,6—99,7%, соответственно). V (V) сорбируется в виде комплексного иона [VO (SCN)4]2~. При отделении 10—20 мг N (IV) от 20—50 мг А1 относительная ошибка определения алюминия С 0,8%.
Ванадий от алюминия предлагали отделять в виде пероксидного комплекса на анионите вофатит L-150 [1000].
К 5 мл анализируемого раствора, ~ W по HNO3, добавляют 3 г набухшего анионита вофатит L-150, 10 мл воды, перемешивают в течение 10 мин. При этом пероксидный комплекс ванадия сорбируется смолой. Смолу отфильтровывают, промывают 20—30 мл воды, фильтрат кипятят для удаления Н2О2, затем определяют алюминий с алюминоном.
Цирконий от алюминия можно отделить в виде сульфатного комплекса. Коркиш и Фараг [898] установили, что сорбция циркония сильно убывает с повышением концентрации H2SO4; полная
сорбция наблюдается при 0,05—0,2 N H2SO4. До 10 г Na2SO4 и (NH4)2 SO4 в 100 мл раствора не влияют на сорбцию циркония, но при количествах больше 10 г сорбция его уменьшается. Хлорид натрия еще больше снижает сорбцию циркония, количественная сорбция его имеет место до концентрации 0,25 г NaCl/ЮО мл. Нитраты снижают адсорбцию циркония еще больше, чем хлориды. Допустимо до 0,1 г NaNOg/100 мл. В оптимальных для циркония условиях Sn (II), V (V), Mo(VI), W (VI), U (VI) сорбируются анионитом; Mg, Са, Си (II), Zn, Cd, Ti (IV), Th, Cr (III), Mn, Fe (III), Co, Ni, РЗЭ проходят в фильтрат. Фосфаты мешают отделению циркония.
Описаны методы отделения от алюминия молибдена [271], урана [1021, 1238] и плутония [536, 850] на анионитах из азотнокислых растворов.
По методу Урубея и др. [1238] уран от алюминия отделяют, пропуская анализируемый эфирный раствор, 0,03 М по HNO3, со скоростью 0,5 мл/мин через колонку с анионитом дауэкс-1, предварительно промытую 50 мл 1 М HNO3, а затем 50 мл 0,03 М HNO3 в диэтиловом эфире. Уран, имеющий в этих условиях небольшой коэффициент распределения (~ 4,5), проходит в фильтрат, а алюминий полностью сорбируется анионитом. Вместе с ним сорбируются также торий и железо. Колонку промывают 0,03 М раствором HNO3 в эфире. Алюминий десорбируют 1 М HNO3. Относительная ошибка метода 1%.
Для отделения плутония от алюминия раствор, 7—8 М по HNO3, пропускают через колонку с деацидитом-FF, предварительно обработанную 7—8 М HNO3; затем колонку промывают 60 мл 7 М HNO3 [536, 850].
Назаренко и др. [2911 для повышения селективности отделения тория от алюминия и некоторых других элементов применили анионит АВ-17, обработанный тороном. При этом анионит фактически превращается в катионит, поглощающий катионы тория. Оптимальная кислотность 0,05 N по НС1, скорость пропускания 0,5 мл/мин.
Гелис [749] при анализе сталей, используя колонки и с анионитом, и катионитом, разделял компоненты стали.
Другие методы хроматографического отделения
Бабко и Гридчина [29] предлагают отделять алюминий от циркония электродиализом. Разделение основано на различной способности их к образованию полиионов в растворе. Накагава [296] отделяет А1 от Fe и Ti, используя избирательное извлечение Ti (IV) и Fe (III) из солянокислых растворов с помощью N-додеценилтри-алкилметиламина, растворенного в керосине; Ti и Fe извлекаются из растворов НС1 с концентрациями 8 N и Д> 6 N, соответственно. Алюминий не извлекается ни из сернокислых, ни из соляно- -кислых растворов.
Опубликовано много работ по применению распределительной хроматографии для отделения алюминия от мешающих элементов.
Рис. 35. Разделение алюминия (/), галлия (2), индия (3) н таллия (4) методом хроматографии на бумаге [624]
А — Б — бумага обработана ди-(2-этилгекснл)фосфорной кислотой; подвижный растворитель 1 М НС1 (Л) 8 М НС1 (Б и Б)
Маги и ^Скотт [946] описали метод разделения и определения Al, Ga, In и Т1 методом хроматографии на бумаге Ватман № 1 в смеси растворителей СеН5ОН — СН3ОН — концентрированная НО (50 вес. ч. : 30 об. ч. : 30 об. ч.). Для Al, In, Т1 и Ga найдены значения Rf 0,10; 0,24; 0,50 и 0,76, соответственно. Для обнаружения зон хроматограмму опрыскивают раствором оксихинолина в смеси СН3ОН — СНС13 — Н2О (48:48:4), помещают в атмосферу аммиака при 80° С на 10 мин., промывают горячей водой, высушивают при 120° С в течение 2 час. и наблюдают желтые зоны, флуоресцирующие в ультрафиолетовом свете. Оптимальные количества для разделения 20—500 мкг. После элюирования зон хлороформом"' алюминий можно определять спектрофотометрическим методом. Для Си, Fe(III), Cd, Ni, Сг и Zn найдены значения Rf, равные 0,25; 0,40; 0,33; 0,15 и 0,35. Следовательно, эти металлы мешают разделению. При разделении тех же элементов авторы работы [624] в качестве неподвижной фазы использовали бумагу Ватман № 1, пропитанную 0,1 М раствором ди-(2-этилгексил)-фосфорной кислоты в циклогексане. В качестве подвижных фаз служили 1 М и 8 М НО; /?гдляА1, In, Т1 и Ga в 1 Л4НС1:0,00; 0,32; 0,78 и 0,92; в 8 Л4НС1 — 0,78; 0,89; 0,17 и 0,04, соответственно. На необработанной реагентом бумаге значения Rf для всех четырех элементов близки и разделение невозможно; на обработанной бумаге такое разделение осуществить легко (рис. 35).
Для разделения Al, Ga, In и Т1 предложен также метод хроматографии на бумаге с использованием бутанола, насыщенного 2 N НС1, в качестве растворителя [97]. Для обнаружения алюминия хроматограмму опрыскивают раствором алюминона после предварительной обработки хлористым водородом (красное пятно); R/ для алюминия — 0,05. После выделения алюминий определяют весовым методом. Авторы работы [713] для разделения Al, Ga, In и Т1 друг от друга, а также для отделения от других элементов испытали различные смеси растворителей. Лучшей оказалась смесь пентанол-1 — 4 N НС1. Описан метод отделения алюминия от некоторых катионов электрофорезом на бумаге [731]. Электролитом служил 0,06 М раствор диэтилентриамина, pH раствора 11, градиент потенциала 10 в/см, время миграции 1 час. Ti, Be, Al и Са можно разделить методом хроматографии на бумаге с применением неор
ганических растворителей NaOH и NH4OH [1165]. Для развития хроматограммы наиболее эффективен 0,5 N раствор NH4OH. Значения Rf для Ti, Be, Al и Са равны 0,00; 0,67; 0,87 и 0,96, соответственно. Для открытия элементов на хроматограммах их опрыскивают насыщенным раствором ализарина в 96%-ном этаноле, затем выдерживают в парах NH3 и СН3СООН.
Алимарин и др. [12] отделяли галлий от алюминия в системе НС1-три-н.бутилфосфат. В качестве носителя в колонках использован фторопласт-4, неподвижным фоном служил трибутилфосфат, элюентом — 0,1 N НО.
Описан метод определения алюминия в алюминиевых бронзах с использованием хроматографии на бумаге [997]. В качестве растворителя применяли смесь н.бутанол-концентрированная НО — вода (75 : 15 : 10). Участок хроматограммы, соответствующий алюминию, вырезали, обрабатывали кипящей водой, подкисленной соляной кислотой. В элюате алюминий определяли фотометрически с хромазуролом S.
В ряде работ [987, 988, 996, 1153] описано отделение А1 от Be, Ga, In, TI, Fe и Си методом газо-жидкостной хроматографии. Металлы предварительно переводят в_'трифторацетонатные комплексы, которые экстрагируют бензолом.
ОТДЕЛЕНИЕ МЕШАЮЩИХ ЭЛЕМЕНТОВ ЭЛЕКТРОЛИЗОМ НА РТУТНОМ КАТОДЕ
Электролиз на ртутном катоде служит одним из важнейших методов отделения мешающих элементов от алюминия. Метод особенно ценен при анализе материалов сложного состава, так как при электролизе одновременно удаляется большое число металлов.
Электролизом на ртутном катоде отделяются следующие металлы: Fe, Cr, Со, Ni, Си, Zn, Мо, Cd, Sn, Pb, Bi, Hg, TI, In, Ga, Ge, Ag, Au, Pt, Pd, Rh, Ir, Re. He отделяются: Al, Ti, Zr, V, U, Th, Be, Nb, Ta, W, P, As, Sc, Y, РЗЭ, Mg, щелочные и щелочноземельные металлы. Марганец отделяется неполностью, часть его окисляется до МпО2 и выделяется на аноде, может также окислиться до МпО4", окрашивая раствор в малиновый цвет. Дюбель и Флюршютц [689] считают, что если во время электролиза в электролит добавить несколько капель 30%-ной перекиси водорода, то достигается количественное отделение марганца. Хром медленно удаляется при электролизе. Поэтому при анализе сталей, содержащих 5% хрома, большую часть его рекомендуется отделять до электролиза в виде хлорида хромила [555]. Небольшая часть железа всегда -остается в электролите. Однако эти остающиеся количества железа не мешают во многих фотометрических методах определения алюминия, если восстановить железо аскорбиновой кислотой до Fe (II). В электролите могут остаться также следы хрома и молибдена.
Электролиз на ртутном катоде главным образом применяется как предварительный метод отделения основной массы мешающих элементов. Как правило, остающиеся после электролиза в электролите элементы удаляют еще каким-нибудь другим методом.
Следы Реи Си, а также Ti, Zr и V удаляют экстракцией их купферонатов хлороформом.Следы некоторых металлов удаляют экстрагированием их оксихинолинатов и оксихинальдинатов.
Остающиеся в электролите металлы отделяют от алюминия сплавлением с Na2CO3 [1047], осаждением при помощи NaOH в присутствии Н2О2 [1156] либо двукратным осаждением аммиаком в присутствии NH4C1 [814]. Алюминий вместе с Ti, Zr, V и остатками железа отделяют от хрома и фосфатов экстрагированием купферонатов при pH 3,5, затем алюминий отделяется от Ti, Zr, V, и Fe при экстрагировании купферонатов последних из 4 N НС1 [555].
Для охлаждения электролита электролизер снабжают водяной рубашкой [1038, 1264] или же спиральным холодильником [568, 776]. Охлаждение нужно для создания оптимальной температуры —40° С, так как при температуре >• 40— 50° С электролиз происходит медленнее. Охлаждение электролита позволяет использовать сравнительно высокий ток (5—8 а) для быстрого удаления мешающих элементов и предотвращает растворение ртути. В ряде работ предложено перемешивание (механическое с помощью стеклянной мешалки, приводимой во вращение от электромотора [776, 1264], или же с помощью магнита [568, 656, 689]). Перемешивание верхней части ртути, по мнению некоторых авторов, создает постоянно чистую поверхность ртути и способствует быстрому осаждению [1264]. Удобство использования магнита в том, что выделяющиеся на поверхности ртути ферромагнитные металлы (Fe, Со, Ni, Сг), не образующие амальгам, проходят в слой ртути и поверхность ртути всегда остается чистой. Благодаря этому несколько сокращается продолжительность электролиза [689].
Электролиз проводят из сернокислых, хлорнокислых и уксуснокислых, но не из солянокислых растворов. Хлор-ион вообще должен отсутствовать в электролите. Если хлор-ион присутствует в анализируемых растворах, его удаляют выпариванием с H2SO4 или НС1О4 до паров SO3 или НС1О4 (лучше всего выпаривать дважды).
Хайнек и Рангел [811] предпочитают проводить электролиз из хлорнокислых растворов. При этом летучие кислоты легко удаляются перед электролизом, во время электролиза испарение незначительное и, кроме того, во время электролиза не образуются труднорастворимые соли, что иногда наблюдается при электролизе из сернокислых растворов.
Холлер и Йегер [814] проводят электролиз из уксуснокислых растворов. Уксусная кислота при электролизе сильно пенится, поэтому авторы вводят 2—3 капли веществ, уменьшающих вспенивание (октиловый спирт или антифоам LFX). Недостаток метода в том, что уксусная кислота не может быть растворителем при разложении многих образцов.
Обычно рекомендуемая концентрация H2SO4 — 0,1—0,2 N.
1 по'
При меньших кислотностях электролиз происходит медленно, при слишком высоких концентрациях кислоты возможно растворение образовавшейся амальгамы. Оптимальное количество ртути 20 — 30 мл. Сила тока 4—15 а, напряжение 4—12 в. При оптимальных условиях электролиз заканчивается через 40—60 мин. Конец электролиза можно установить проверкой наличия тех или иных ионов в электролите капельным методом. Об очистке ртути см. работу 1343].
Электролиз на ртутном катоде в лабораториях применяется редко из-за токсичности ртути. Его можно применять лишь в исключительных случаях, но лучше всего заменять по возможности другими методами.
ДРУГИЕ МЕТОДЫ ОТДЕЛЕНИЯ
Из других методов отделения можно указать на удаление мешающих элементов выпариванием, возгонкой и дистилляцией.
Широко известен метод удаления хрома в виде хлорида хромила. Sn, As и Sb часто удаляют в виде бромидов обработкой смесью НВг— Вг2 [260, 938]; олово можно удалять еще в виде хлорида повторным выпариванием с НС1 до прекращения выделения густых белых паров 1378, 488]. При определении алюминия в боре последний удаляют обработкой смесью концентрированных HNO3 и HF [284].
Сингх и др. [1166] отделяют уран от алюминия фотолитическим методом. Основную массу алюминия выделяют в виде фторида. К 'фильтрату после отделения осадка добавляют 10 мл этанола и выдерживают на солнечном свету. При фотолитической реакции уран почти полностью (на 99%) осаждается в виде NH4F • UF4 • Н2О и отделяется от оставшейся части алюминия.
7 Аналитическая химия алюминия
1QQ
Глава IV
ОПРЕДЕЛЕНИЕ АЛЮМИНИД
В ПРИРОДНЫХ И ПРОМЫШЛЕННЫХ ОБЪЕКТАХ
ОПРЕДЕЛЕНИЕ АЛЮМИНИЯ В МИНЕРАЛАХ, РУДАХ И ПРОМЫШЛЕННЫХ КОНЦЕНТРАТАХ
Для перевода в раствор минералов, руд и промышленных концентратов применяются следующие методы: обработка смесью HF и H2SO4 (или НС1О4) с последующим сплавлением сухого остатка с K2S2O7; сплавление с NaKCO3, Na2CO3, Na2B4O7 или со смесью Na2CO3 и Na2B4O7; спекание с Na2CO3; сплавление с NaOH, Na2O2 или со смесью NaOH и Na2O2; сплавление с KHSO4 или K2S2O7; растворение в смеси кислот НС1, HNO3 и НС1О4, выпаривание до паров НС1О4 и сплавление остатка с K2S2O7.
Определение алюминия в рудах
Бокситы, нефелиновые концентраты, нефелино-апатитовые руды, криолит и фторид алюминия разлагают сплавлением с едким натром в серебряных, никелевых или железных тиглях. В указанных материалах алюминий определяют главным образом комплексометрическим методом. Для определения в нефелино-апатитовых рудах и нефелиновых концентратах Артемьева [16] предлагает следующую методику.
3—4 г NaOH расплавляют в железном тигле и после охлаждения вводят 0,25 г образца. Смачивают смесь несколькими каплями этанольного раствора NaOH и сплавляют при 600—700° С в течение 15—20 мин. Плав растворяют в горячей воде, прибавляют 15 мл 20%-ного раствора NaOH и кипятят 20 мин. После охлаждения разбавляют в мерной колбе до 250 мл и фильтруют через двойной сухой фильтр.
100 мл фильтрата нейтрализуют НС1 по бумаге конго красный, прибавляют 5—20 мл 0,05 М раствора комплексона III и нагревают до 50° С. Затем подщелачивают аммиаком до розовой окраски индикатора, добавляют 20 мл ацетатного буферного раствора с pH 5,2—5,8 и кипятят 1—2 мин. После охлаждения вводят 5—7 капель 0,1 %-кого раствора ксиленолового оранжевого и избыток комплексона III титруют 0,05 Л1 раствором ZnSO4.
Относительная ошибка метода < 2%.
Бусев и др. [71] для определения алюминия в боксите, шамоте, клинкере и других материалах предложили более селективный метод с использованием фторида натрия.
1 г образца разлагают тем или иным методом.. Отделяют кремнекислоту и фильтрат разбавляют водой до 250 мл. Аликвотную часть этого раствора (50 мл) разбавляют водой до ~ 200 .ил, прибавляют от 10 до 60 .ил 0,05 М раствора комплексона III (в случае боксита 60 мл, шамота — 40 .ил, клинкера 15 мл, сырьевой цементной смеси 10 мл). Нагревают до ~50с С, нейтрализуют раствор аммиаком (1 : 1) по фенолфталеину и обесцвечивают прибавлением по каплям НС1 (1 : 1). Вводят 20 мл ацетатного буферного раствора (500 г CH3COONH4 и 20 .ил 80?о-ной СН3СООН разбавляют водой до 1 л). Кипятят 2—3 мин., быстро охлаждают под струей холодной воды, прибавляют 3—4 капли 0,1?о-ного раствора ксиленолового оранжевого и избыток комплексона III оттитровывают 0,05 М раствором Zn(NO3)2 до изменения окраски раствора из желтой в фиолетовую. К оттитрованному раствору добавляют 40мл 4%-ного раствора NaF и кипятят 2—3 мин. Раствор быстро охлаждают и освободившийся комплексон III титруют 0,05 Л1 раствором Zn (NO3)2. Расход Zn(NO3)2 при втором титровании эквивалентен содержанию алюминия.
При определении алюминия в боксите предложен аналогичный метод, но с использованием в качестве титранта раствора CuSO4 [877]. В этом случае в эквивалентной точке окраска раствора меняется от зеленой до сине-фиолетовой. Переход окраски менее четкий, чем при титровании цинком. Алюминий в нефелиновых концентратах можно определять также обратным титрованием раствором соли железа с сульфосалнциловой кислотой после разложения образца сплавлением с едким натром [138].
Для определения алюминия в криолите и фтористом алюминии можно применить весовой оксихинолиновый метод [123].
0,2 г образца сплавляют в серебряном тигле с 3 г NaOH при 700° С в течение 10 мин. Плав выщелачивают водой при нагревании, после охлаждения раствор разбавляют в мерной колбе до 200 мл. Фильтруют через плотный фильтр в сухой стакан, отбрасывая первые порции фильтрата. Отбирают 100 мл (при анализе криолита) или 50 мл (в случае A1F3) и в них определяют алюминий весовым оксихинолиновым методом.
Для определения алюминия в железных и марганцевых рудах предложен весовой фосфатный метод [1102]. Ввиду невысокого содержания алюминия большее применение нашли, однако, фотометрические методы: с оксихинолином [144, 864], с эриохромциани-ном R [463, 808, 855], с хромазуролом S [596].
Каснер и Озир [864] предложили следующий метод для определения алюминия в железных рудах.
2 г руды растворяют в 20 мл НС1 (уд. вес 1,19) при нагревании. Добавляют 5—10мл HNO3 (уд. вес 1,42), 12—15мл 60—70%-ной НС1О4, нагревают до выделения густых паров НС1О4 и дают выделяться парам в течение 5 мин. для дегидратации кремневой кислоты. Охлаждают, разбавляют до 75—100 мл и фильтруют. Фильтр промывают 1%-ной НС1, затем горячей водой. Остаток на фильтре сплавляют с пиросульфатом и раствор плава присоединяют к основному фильтрату; разбавляют до 1 л. К 100мл этого раствора прибавляют 15 aNH4Cl, 5—6 капель индикатора бромкрезолпурпурного и нагревают почти до кипения. Прибавляют NH40h (I : I) до пурпурной окраски раствора, кипятят 1 мин. Фильтруют и про-
7*
1ПК
мывают осадок 2%-ны.м горячим раствором NH4CI. Осадок полуторных гидроокисей растворяют в 20 мл горячей HCI (1 : 1), фильтр промывают горячей 5°о-ной НС1, затем горячей водой до удаления кислоты.
Раствор и промывные воды разбавляют в мерной колбе до 250 .ил. К аликвотной части этого раствора 25 .ил добавляют 0,2 г винной кислоты, 1 .ил NH4OH (уд. вес 0.9) и 1 .ил 3°0-ной Н2О2. Через 5 мин. добавляют 5 м.1 насыщенного раствора Na2SO3, примерно через 3 мин. вводят раствор 1,3 г K.CN в 5 мл воды, нагревают до 70—80° С, охлаждают и добавляют 2 г NH4NO3. Устанавливают pH раствора аммиаком или соляной кислотой до 8,9 + 0,3. Добавляют 5 мл 2?6-ного раствора оксихинолнна в хлороформе и встряхивают 2 мин. Через 2 мин. слой СНС13 спускают в мерную колбу емкостью 50 мл. Экстракцию повторяют до полного выделения алюминия. Экстракт разбавляют хлороформом до 50 мл. Оптическую плотность экстракта измеряют при 389 нм. Содержание алюминия рассчитывают по калибровочному графику.
Относительная ошибка метода 1 — 7% при содержании алюминия 0,03—2%.
Итикуни [144] описал простой фотометрический оксихинолиновый метод определения алюминия в железных рудах.
Железо от алюминия отделяют на анионите в виде хлоридного комплекса из 9 А' НО. К элюату добавляют 1мл 3%-ной Н2О2, аммиак для нейтрализации кислоты и экстрагируютоксихинолинаталюминия. Экстракт фотометрируют при 420 нм.
Определению 3,3—23,3 мкг алюминия не мешают до 2 мг ванадия и 2 мг железа. Недостаток метода в том, что он применим только к лимониту, не содержащему Ni, Сг и Мп.
Хорошим методом определения алюминия в железных рудах является фотометрический метод с хромазуролом S [596].
2,5 г руды растворяют в НО (2 : 1), раствор выпаривают досуха, остаток растворяют в НС1 (1 : 1) и фильтруют. Остаток обрабатывают HF для удаления SiO2. Затем сплавляют с пиросульфатом, раствор плава объединяют с основным фильтратом и объем раствора доводят до 500 мл. Аликвотную часть этого раствора (20 мл) разбавляют до 500 мл и из нее для определения отбирают 10.ч.л. Прибавляют 10 мл 2%-ного раствора аскорбиновой кислоты, выдерживают 10 мин. Затем вводят 50 мл ацетатного буферного раствора с pH 5,6 (50 aCH3COONa-3H2O и 3 мл ледяной СН3СООН в I л), прибавляют 10мл 0,1%-ного раствора хромазурола S в 50%-ном этаноле, выдерживают 10 мин. и фотометрируют в кюветах I = 1 см при 545 нм по отношению к раствору холостого опыта.
Для получения более точных результатов по этой методике следует вводить в стандартные растворы при составлении калибровочного графика эквивалентные количества железа.
Описан ряд методов фотометрического определения алюминия в железных рудах с эриохромцианином R [463, 808, 855]. Определение проводят при pH 6, многие мешающие элементы маскируют с помощью тиогликолевой кислоты [808,855]. На ванадий вводят поправку, для чего готовят раствор как для определения алюминия, но^ добавляют 2 мл 2,4%-ного раствора NaF, доводят до метки и измеряют оптическую плотность по сравнению с холостой пробой. Значение этой оптической плотности вычитают из оптической плотности анализируемого раствора.
Для определения алюминия в марганцевых рудах [508], а также в хромовых рудах и огнеупорах [507] предложен комплексометрический метод с использованием диаминоциклогексантетрауксус -ной кислоты (ДЦТА).
При определении в марганцевых рудах 0,2 г образца сплавляют с Na КСО3, плав выщелачивают в 200 лы воды; подкисляют соляной кислотой, прибавляют немного 3°о-ноп Н,О, и кипятят для разрушения избытка последней. После охлаждения прибавляют 10 мл 50°о-ного раствора CH3COONH4, аммиак до pH 2,2 и оттитровывают Fe (III) комплексоном III с салициловой кислотой. К оттитрованному раствору прибавляют 2 мл 0,05 М раствора Cu (II), 2—3 капли 0,1°о-ного раствора ПАН, нагревают до кипения и оттитровывают алюминий раствором ДЦТА.
Аналогичный метод описан для определения алюминия в хромовых рудах и огнеупорах после сплавления образца с KHSO4 1507]. В растворе плава устанавливают pH 4—6, кипятят для образования комплексонатов Fe(III), Al и Cr (III). Вводят оксихинолин, подщелачивают аммиаком, нагревают при 80° С для осаждения оксихинолинатов Fe (III) и Al. Спустя 10 мин. фильтруют, осадки растворяют в НО. В растворе определяют железо и алюминий, как и при анализе марганцевых руд, но в этом случае индикатором для Fe (III) служит освободившийся из раствора оксихинолин. Присутствие последнего не мешает титрованию алюминия; Cr(III) маскируется комплексоном III и не мешает.
Определение алюминия в силикатных и карбонатных породах
При определении алюминия в силикатных и карбонатных породах наибольшего внимания заслуживают комплексометрические методы с использованием ксиленолового оранжевого в качестве индикатора. Можно рекомендовать различные варианты, предложенные Бабачевым и др., так как они наиболее просты [23].
Анализ клинкера, цемента, карбоната и других материалов, содержащих железо, алюминий и небольшие количества титана
0,5 г образца сплавляют с Na2CO3 или со смесью Na2CO3 и Na2B4O7, плав растворяют в НС1. Кремнекислоту выделяют двукратным выпариванием с НС1. К раствору после отделения кремния добавляют 5—6 капель HNO3 (уд. вес 1,4), нагревают до кипения и кипятят 2—3 мин. Прибавляют 8—10 капель 10%-ного спиртового раствора салициловой кислоты (можно использовать и водный раствор сульфосалициловой кислоты), нейтрализуют 10%-ным раствором аммиака до сине-фиолетовой окраски (pH 1 —1,5). Нагревают до 50—60° С и титруют 0,025 М. раствором комплексона III до исчезновения сине-фиолетового окрашивания (определение железа).
Прибавляют раствор комплексона III в количестве, необходимом для связывания предполагаемого содержания алюминия и избыток 10 мл. Нагревают до кипения, нейтрализуют 10%-ным раствором аммиака до pH 5, прибавляют 10 мл ацетатного буферного раствора с pH 5 (500 г CH3COONH4 и 20 мл ледянойСН3СООН в 1л), снова нагревают до кипения и кипятят 2—Змии. После охлаждения избыток комплексона III титруют раствором ацетата цинка по ксиленоловому оранжевому.
Если не надо определять кремний, то алюминий и железо осаждают аммиаком, отфильтровывают, растворяют осадок в НС1 и в растворе определяют их, как описано выше.
Относительная ошибка метода 1—2% при содержании 5—6% А12О3.
107
Анализ глин, керамических изделий и других материалов, содержащих Fe, Al и Ti
Фильтрат после выделения кремнекислоты разбавляют в мерной колбе до 250 мл. В 100 .ил фильтрата определяют железо комплексометрически с салициловой кислотой. В других 100 мл раствора определяют сумму Fe, Ti и Al. Для этого в раствор с pH 1—1,5 прибавляют несколько капель 396-ной Н2О2, салициловую кислоту и титруют комплексоном III сумму Fe и Ti. После установления pH 5 в том же растворе определяют алюминий комплексометрически с ксиленоловым оранжевым. При количествах титана больше 10 мг результат определения получается завышенным из-за трудности фиксирования эквивалентной точки при титровании суммы железа и титана. Надо брать небольшие аликвотные части и титровать очень осторожно.
Анализ портландцемента, металлургических шлаков и других материалов, содержащих Fe, Al и Мп
В растворе после отделения кремнекислоты Fe, Al и Мп (после окисления персульфатом аммония) осаждают аммиаком. Осадок сразу растворяют в НС1 (1 : 1) и нескольких каплях Н2О2. Полученный раствор (~ 100 мл) нейтрализуют аммиаком (1 : 1) до появления слабой мути, которую растворяют 2—3 каплями НС1 (1 : 1). Вводят 2—3 г NH4C1, нагревают до кипения и по каплям при непрерывном перемешивании прибавляют 10—15 мл 5%-ного раствора коричнокислого аммония. Раствор с осадком кипятят 2—3 мин. и оставляют на водяной бане в течение часа, изредка перемешивая. Осадок отфильтровывают, промывают горячей водой, содержащей NH4NO3 и коричнокислый аммоний (Юг NH4NO3,10 мл 5%-ного раствора ксричнокислого аммония в 1 л). Осадок на фильтре растворяют в НС1, промывают холодной водой. Раствор разбавляют в мерной колбе до 250 мл. В 100 .ил этого раствора определяют железо и алюминий комплексометрически, как на стр. 194.
Анализ материалов, содержащих Fe, Al и Сг,
Из солянокислого раствора после отделения кремнекислоты осаждают Fe, Al и Сг коричнокислым аммонием, как в предыдущей методике. Осадок растворяют в H3SO4 (1 : 2). В одной аликвотной части определяют железо комплексометрически. В другой части раствора окисляют Cr (III) персульфатом аммония до Cr (VI) и алюминий определяют комплексометрически, как описано на стр. 197, с учетом содержания железа. В третьей части раствора определяют хром титримет-рическим методом после окисления до Cr (VI).
Притчард [1087] определяет алюминий в силикатах комплексометрически с помощью ДЦТА.
0,2 г силиката сплавляют в течение 10 мин. при 650—750° С в серебряном тигле с 2,5 г NaOH. Плав выщелачивают горячей водой, прибавляя к раствору в конце несколько капель НС1 (1 : 1). Раствор переносят в мерную колбу емкостью 250 мл, содержащую 100 мл горячей 2N НС1, после охлаждения разбавляют до метки водой. 50 мл этого раствора переносят в полипроленовый (полиэтиленовый) стакан, добавляют 60 мл 5% -ного раствора NaOH. Сразу же вводят 10 мл 0,08 М раствора ДЦТА (к суспензии 14 г ДЦТА в воде прибавляют по каплям 5А' раствор NaOH до растворения и разбавляют до 500 мл), немного бумажной массы, нагревают 1 час на паровой бане, затем дают медленно охладиться и фильтруют. Осадок промывают 6 раз (порциями по 6 мл) холодным 2%-ным раствором NaOH. Фильтрат подкисляют НС1 (1 : 1) по бромкрезоловому зеленому. Затем добавляют по каплям 5N раствор NaOH до синей окраски раствора.
Прибавляют 25мл буферного раствора с pH 5,5 (200 г уротропина и 40 мл НС1) (уд. вес 1,19 в 1 л), 5 капель 0,1%-ного раствора ксиленолового оранжевого и избыток ДЦТА оттитровывают 0,025 М раствором ZnCl2 до перехода оранжевой окраски в малиновую.
198
Метод позволяет определять 10 мг А1 в присутствии 20 мг Si, 4 мг Fe, 2 мг Са и Mg, 0,6 мг Ti и 0,7 мг Мп.
При анализе силикатов и других горных пород Эванс [7041 также использовал ДЦТА.
Сначала определяют сумму элементов Al, Fe иТ1, для чего к части раствора, соответствующей навеске0,05 г, прибавляют воду примерно до 80 мл и 2 мл 20%-ной Н2О2. Вводят 20 мл 0,015 М раствора ДЦТА (или достаточный избыток, чтобы на обратное титрование пошло 5—10 мл титранта), доводят pH до 3,5—3,7 при помощи 4—5 мл 10%-ного раствора CH3COONa. Нагревают до 50°С, охлаждают, добавляют 50 мг индикаторной смеси (смесьо-дианизидин-N, N, N', N'-тетра-уксусной кислоты с NaCl в соотношении 1 : 200) и титруют избыток ДЦТА 0,01 М раствором соли меди до погашения синей флуоресценции, наблюдаемой в ультрафиолетовом свете в темном помещении. К другой части раствора после разбавления до ~90лы добавляют 2мл 20%-ной Н2О2, 5 мл 4%-ного раствора NH4F, тщательно перемешивают и вводят 10 мл 0,015 М раствора ДЦТА. pH доводят до 3,5—3,7 при помощи 10%-ного раствора CH3COONa, добавляют 50 мг индикатора и титруют также. Расход ДЦТА в этом титровании после введения поправки на индикатор (10 мг индикаторной смеси эквивалентны 0,01 мл 0,01 М раствора Си) соответствует содержанию железа. Алюминий находят по разности.
Предложен ряд методов комплексометрического определения алюминия в силикатах титрованием избытка комплексона III раствором цинка по дитизону. По одному из них железо и титан предварительно осаждают в виде купферонатов [1244].
Осадок купферонатов отфильтровывают и промывают 4—5 раз холодной промывной жидкостью, содержащей 13 мл НС1 (уд. вес 1,19) и 2 мл 6%-ного раствора купферона в 100 мл. Избыток купферона из фильтрата извлекают, экстрагируя его с 5—8 мл СНС13. Не отделяя слоя СНС13, раствор нейтрализуют аммиаком по метиловому оранжевому, снова подкисляют несколькими каплями НС1 (уд. вес 1,19). В зависимости от содержания алюминия добавляют 10—25 мл 0,05 М раствора комплексона III и столько ацетатного буферного раствора (80 г CH3COONH4 н 60 мл ледяной СН3СООН в 1 л), чтобы раствор стал желтым, и избыток Юзы. Кипятят 10 мин, после охлаждения в проточной воде вводят равный объем этанола и несколько капель 0,025%-ного раствора дитизона в этаноле до зеленой окраски раствора. Если раствор имеет бурую окраску, добавляют еще этанола. Затем избыток комплексона III титруют 0,05 М раствором ZnCl2 до изменения окраски раствора в красную.
Беннет и др. [557] при определении алюминия в алюмосиликатах титрованием цинком по дитизону отделяют железо и титан экстракцией купферонатов хлороформом, что точнее, чем фильтрование через бумажный фильтр.
В аналогичном методе для силикатов Вайбель [1265] отделял Fe, Ti, Zn, Ga, V и некоторые другие элементы с нитрозофенилгидроксиламином. При этом алюминий отделяется от всех мешающих элементов, встречающихся в обычных горных породах, содержащих мало марганца. В заметных количествах последний мешает определению алюминия, так как в этих условиях хотя и не количественно, но все же титруется вместе с алюминием [424, 4281.
Предложено отделять железо и титан также экстрагированием хлороформом их соединений с N-бензоилфенилгидроксил-амином [707].
Титрование с дитизоном использовано при анализе цементов [623]. Определяют комплексометрически сумму железа и алюминия, в части раствора определяют железо объемным хроматометрическим методом. В аналогичном методе для каолина [751] сумму определяют так же, но в присутствии титана вводят 2 мл 10%-ного раствора винной кислоты, в другой части раствора определяют железо титрованием комплексоном III при pH 2 сульфо-салициловой кислотой. Содержание алюминия находят по разности.
Заслуживает внимания метод, который предложили Залесски и Войнович [1288].
К аликвотной части раствора прибавляют известный объем комплексона III для связывания Al, Fe и Ti, устанавливают pH 5—6 с помощью ацетатного буферного раствора, вводят винную кислоту и раствор (NH4)2HPO4 для разрушения комплексоната титана. Избыток комплексона III титруют раствором ZnCl2 по дитизону. Затем для разрушения комплексоната алюминия вводят насыщенный раствор NaF и освободившийся комплексон III титруют также. Расход ZnCl2 во втором титровании эквивалентен содержанию алюминия.
Относительная ошибка метода 0,5%.
Для определения алюминия в силикатных и карбонатных породах можно применить комплексометрический метод титрования избытка комплексона Шсолью железа с сульфосалнциловой кислотой [161, 373, 975, 1074]. Милнер и Вудхед [975] удаляют Ti, Fe, Zr и некоторые другие металлы в виде купферонатов, затем осаждают алюминий в виде бензоата. После растворения осадка бензоата в НС! алюминий определяют комплексометрически. Сочеванова и Сочеванов [373] для определения алюминия в железистых карбонатных породах предлагают следующую методику.
0,5 г образца растворяют в разбавленной НС1. Нерастворимый остаток отфильтровывают, Fe (II)в фильтрате окисляют 10—15 каплями 30%-ной Н2О2, которую разлагают кипячением. Холодный раствор нейтрализуют аммиаком до появления мути, которую растворяют2—3 каплями НС1. Прибавляют 15 мл 25%-ного раствора уротропина и нагревают до80—90°С (кипятить не следует). Осадки отфильтровывают, промывают 8—10 раз теплым 0,5%-ным раствором уротропина, смывают в стакан, в котором проводилось осаждение. Остатки на фильтре растворяют, обрабатывая их 6—8 раз горячей 5%-ной H2SO4. Добавляют 5 мл H2SO4 (уд. вес 1,84) и нагревают до полного растворения гидроокисей и разбавляют водой в мерной колбе до 250 мл.
Для определения железа к 25 мл этого раствора приливают 75 мл воды, аммиаком или 50%-ным раствором CH3COONH4 создают pH 1,0—2,0, нагревают до 40—50° С, после добавления 20 капель (0,7—0,8 мл) 25%-ного раствора сульфосалициловой кислоты титруют комплексоном III до лимонно-желтой окраски. К оттитрованному раствору прибавляют 20 капель (0,7—0,8лы)НС1 (уд. вес 1,19), вводят избыток комплексона III, нагревают до кипения, нейтрализуют аммиаком по фенолфталеину, розовую окраску обесцвечивают 2—3 каплями НС1. Добавляют 20 мл ацетатного буферного раствора (500 г CH3COONH4 и 20 мл ледяной СН3СООН в 1 л), кипятят 3 мин. После охлаждения титруют 0,1 М раствором FeClg до перехода лимонно-желтой окраски в золотисто-желтую.
О комплексометрическом определении алюминия в минералах или породах из микронавесок см. работу [166].
200
Описаны фотометрические методы определения алюминия в силикатных и карбонатных породах: с алюминоном [10741 и эриохром-цианином R [241, 1116, 1247].
Ниже приводится методика определения алюминия в кварцевом песке с алюминоном [1074].
0.1 г кварцевого песка растворяют в 5 .мл 40°о-ной HF и 5 каплях H2SO4 (уд. вес 1,84) в платиновом тигле. Остаток после выпаривания прокаливают и сплавляют с 0.5 г \а2СО3. Плав выщелачивают горячей водой и раствор переносят в химический стакан. Добавляют в тигель 5 мл НС1 (уд. вес 1,19) и осторожно нагревают 5 мин. Добавляют горячую воду и оставляют на плитке еще на 5 мин., затем выливают в тот же стакан. Раствор кипятят 5 мин., охлаждают и разбавляют в мерной колбе до 100 .мл. Для определения алюминия берут аликвотную часть 50 мл (при содержании до 0,1% А1) или 25 и 10.мл при содержании соответственно 0,1—0,5% и 0,5—2°о А1. Если присутствует > 2%А1, раствор разбавляют до 250 мл и берут соответствующую аликвотную часть.
Аликвотные части переносят в мерную колбу емкостью 100 мл, прибавляют каплю 1 %-ного раствора л-нитрофенола и аммиак по каплям до пожелтения раствора. Затем добавляют НС1 (1 : [) по каплям до исчезновения желтой окраски. Вводят 16 капель 1%-ного раствора тиогликолевой кислоты, 16 мл раствора алюминона (0,25 г алюминона растворяют в 250 мл воды; в нем размешивают 5 а гуммиарабика, добавляют 87 г CH3COONH4, 126 мл НС1 (1 : 1) и разбавляют водой до 500 мл). Объем в колбе доводят примерно на 5 мл ниже метки и колбу помещают в кипящую водяную баню на 10 мин. После охлаждения объем доводят водой до метки и измеряют оптическую плотность.
Определение алюминия в фосфатных породах
Джексон [8401 и Бартон [550] для определения алюминия в фосфатных породах применили фотометрический метод с ализарином S. Мешающие элементы удаляют экстрагированием их куп-феронатов хлороформом [8401.
К части водного слоя добавляют 0,5 мл H2SO4 (1 : 1) и выпаривают до паров SO3. Охлаждают и содержимое стакана при помощи 40 мл воды переносят в мерную колбу емкостью 100 мл. Добавляют 3 мл 0,1 %-ного раствора ализарина S, 10 мл 3 А’ раствора NH4OH и 5 мл 5N раствора СН3СООН. Разбавляют до метки и измеряют оптическую плотность при 370 нм по холостой пробе.
Абсолютная ошибка метода от 0,02 до 0,10% при содержании от 0,9 до 1,8%.
Определение алюминия в шлаках
Для определения алюминия в шлаках можно рекомендовать комплексометрические методы, из них лучший — с индикатором ксиленоловым оранжевым.
Федоров и Озерская [447] предлагают следующий метод.
В железный тигель помещают 0,25—0,5 г шлака, прибавляют 8—10 г Na2O2, перемешивают и сплавляют при 800—850° С, периодически перемешивая. Тигель •охлаждают, помещают в стакан, накрывают часовым стеклом и выщелачивают плав 80—ЮОлы воды. Раствор плава выливают в мерную колбу емкостью 500 мл, .после охлаждения разбавляют водой до метки и оставляют на 12 час. для лучшего отстаивания осадка. Фильтруют через сухой фильтр в сухую колбу, первые порции «фильтрата отбрасывают. 100 мл фильтрата кипятят 8—10 мин. для разрушения избытка Н2О2. После охлаждения вводят 25 мл 0,05 М раствора комплексона III,
201
нейтрализуют НС1 (уд. вес 1,19) по фенолфталеину, прибавляют 15 .ил буферного раствора (500 г CH3COONH4 и 30 мл ледяной СН3СООН в 1 л) и кипятят 3—4 мин. После охлаждения избыток комплексона III оттитровывают 0,05 Л1 раствором ZnCl2 в присутствии 0,2—0,3 г индикатора (смесь ксиленолового оранжевого с NaCl в отношении 1 : 100).
По методу Ленской и Вержбовской [228] шлаки разлагают так же.
При комплексометрическом титровании алюминия применяют окислительно-восстановительный индикатор: 1 мл смеси (10мл 10°о-ного раствора K3Fe(CN)6. 10.мл 1%-ного раствора K4Fe (CN)6 и 30 мл воды) и 1 мл 1°о-ного раствора бензидина. Титруют цинком до появления синевато-зеленого окрашивания. Вводят 50 мл 3%-ного раствора NaF, кипятят 3 мин., охлаждают, прибавляют 1 мл смеси ферри-и ферроцианида, 0,5 мл раствора бензидина и снова титруют.
Для определения алюминия в титановых шлаках и концентратах предложен обратный комплексометрический метод (титруют избыток комплексона III раствором тория с индикатором ализарином S) [479]. При анализе шлаков фосфорных печей [111] и шлаков медной и свинцовой плавок [446] используют стильбазо. В литературе иногда описываются неоправданно сложные методики анализа [363].
Определение алюминия в огнеупорных материалах
Для определения алюминия в хромомагнезитовых огнеупорах можно использовать метод, описанный в работе [135].
0,5 г образца спекают при 850—950° С с Na2CO3. Спек растворяют в смеси НС1 (уд. вес 1,19) с НС1О4 и нагревают на песчаной бане для удаления СгО2С12. Остаток обрабатывают несколькими каплями НС1 (уд. вес 1,19) и 50 мл горячей воды. Отфильтровывают SiO2, фильтрат разбавляют в мерной колбе до 250 мл. В 50 мл этого раствора после установления pH 5,5 определяют алюминий комплексометрическим методом с использованием ксиленолового оранжевого в качестве индикатора, титранта ацетата свинца и NaF для повышения селективности метода.
Аналогичный метод описан в работе [71].
Шамотные материалы разлагают также по методу, описанному в работе [664].
В никелевом тигле сплавляют 10 г NaOH, к охлажденному плаву добавляют 1 г образца, увлажняют смесь этанолом, сверху насыпают еще 2 г NaOH и сплавляют на слабом пламени до окончания вспучивания смеси. После этого нагревание усиливают (до раскаления тигля). Плав выщелачивают горячей водой, прибавляют НС1 (1 : 1) до полного растворения осадка и раствор разбавляют в мерной колбе до 250 мл. В 20 мл фильтрата определяют железо комплексометрическим методом при pH 2,0 с салициловой кислотой.
В том же растворе алюминий определяют комплексометрически с ксиленоловым оранжевым, применяя в качестве титранта раствор цинка. Абсолютная ошибка метода меньше 0,2%.
В глинах и огнеупорах алюминий определяют также фотометрическим методом с эриохромцианином R при pH 3,8; для маскирования Fe (III) вводят тиогликолевую кислоту [597, 759].
202
Определение алюминия в материалах титанового производства
Для определения алюминия в промежуточных продуктах титанового производства (расплавы хлоридов, возгоны и др.) предложен комплексометрический метод, заключающийся в прямом титровании с индикатором ПАН в присутствии комплексоната меди после удаления мешающих элементов экстрагированием их купферонатов хлороформом [430].
1—2 г образца обрабатывают при нагревании 30 мл НС1 (1 : 1), раствор фильтруют через фильтр с белой лентой с добавлением бумажной массы. Фильтр с осадком промывают горячей водой, озоляют в платиновой чашке, остаток сплавляют с 3 г NaaCO3 и 1,5 г Na2B4O7. Выщелачивают в воде с добавлением 30 мл НС1 {1 : 1). Раствор плава соединяют с первоначальным фильтратом и объем доводят водой в мерной колбе до 250 мл.
Отбирают 25 мл раствора в делительную воронку, прибавляют 10 мл 6%-ного раствора купферона, 15 мл СНС13 и встряхивают 30 сек. Слой СНС13 сливают, к водному слою прибавляют купферон до прекращения выделения купферонатов железа и титана (на что указывает белый цвет образующегося осадка), приливают СНС13 и снова экстрагируют. Экстрагирование повторяют до получения бесцветного хлороформного слоя.
Водный слой сливают в коническую колбу емкостью 250 мл, нейтрализуют 10%-ным раствором CH3COONa до pH ~3 по бумаге конго красный. Приливают 10 мл ацетатного буферного раствора с pH 3 (смесь 9 мл 2 М раствора CH3COONH4 и 491 мл 2М раствора СН3СООН), 2 мл ~0,005 М раствора комплексоната меди, 5—6 капель 0,1%-ного раствора ПАН в этаноле, приливают воды до 80—100 мл и нагревают до кипения.
Горячий раствор титруют 0,05 Л1 раствором комплексона III до чисто-желтой окраски. Затем снова нагревают до кипения и дотитровывают.
Относительная ошибка метода 1%. Метод нельзя применять к материалам, содержащим заметные количества хрома.
Для фотометрического определения алюминия в материалах титанового производства предложены хромазурол S [4171, ксиленоловый оранжевый [4181 и метилтимоловый синий [4201.
Определение алюминия в прочих материалах
Флоренц [724] предлагает для определения алюминия в бериллиевых материалах фотометрический метод с 5-сульфо-4'-диэтиламино- 2' , 2-диокси азобензолом.
Аликвотную часть слабокислого анализируемого раствора, содержащую 15 мкг алюминия и 10 мг бериллия, переносят в мерную колбу емкостью 25 мл. Добавляют 2 мл 0,1%-ного раствора К4 [Fe(CN)6], 2,5 мл 1 М ацетатного буферного раствора с pH 4,7 (СН3СООН и CH3COONa в соотношении 1 : 1) и Змл 0,03%-ного раствора 5-сульфо-4'-диэтиламино-2',2-диоксиазобензола. Разбавляют водой до 20 мл и помещают колбу в водяную баню с температурой от 40 до •55° С на 15 мин., затем охлаждают до комнатной температуры. Через 15 мин. измеряют оптическую плотность при 540 нм в кювете I = 1 см по отношению к холостой пробе.
Если раствор содержит больше 200 мкг бериллия, то вводят поправку иа его поглощение и ослабление окраски бериллием (см. стр. 128).
203
Флоренц [724] предлагает и другой вариант — определение после предварительного отделения мешающих элементов экстракцией триизооктиламином. Подробно см. стр. 180.
Для определения алюминия в соединениях тория можно использовать метод, предложенный Гольдштейном и др. [763].
0,1 г образца, содержащего 0,0005—0,15% алюминия, растворяют при слабом кипячении в 20 лы HNO3 (1 : 1), содержащей несколько капель HF. После окончания растворения вводят 3 ли 72%-нои НС1О4 и выпаривают до появления паров НС1О4. Охлаждают до комнатной температуры, добавляют 5 лы воды, 8 мл 50%-ного раствора CH3CCONH4 и доводят pH до 1.5 при помощи НС1О4. Раствор переносят в делительную воронку и объем его доводят водой до 25 лы. Добавляют Юлы 0,5 Л1 раствора теноилтрифторацетона в метилизобутплкетоне и встряхивают 5 .мин.
Водный слой спускают в другую делительную воронку и повторяют экстрагирование тем же количеством реагента.
Водный слой переносят В другую делительную воронку и промывают встряхиванием Юлы растворителя в течение 3 мин. При экстрагировании отделяются Fe, Zr, Си и большая часть Th.
Если присутствуют Ti, V, Мо, Мп и Со, то к раствору после экстрагирования добавляют 2лы 2%-ного раствора диэтилдитиокарбамината натрия, доводят pH до 9 и экстрагируют с помощью 20 мл СНС13 в течение 2 мин. Водный слой переносят в стакан и разбавляют до 75 мл. Добавляют 5 мл 0,2 М раствора нитрилотриуксус-ной кислоты, 2 мл 3%-ной Н2О2, 2 мл ацетатного буферного раствора с pH 8 (200 г CH3COONH4 и 70мл NH4OH (уд. вес 0,9) в 1 л) и 2мл 2%-ного раствора оксихинолина с СНС13. pH раствора доводят до 8 при помощи NH4OH (1 : 1).
Раствор переносят в делительную воронку и экстрагируют дважды, применяя по 20 мл СНС13, в течение 2 мин.
Если в образцах содержится также Ni, Zn и Cd, экстракт встряхивают с 100 лы щелочного раствора цианида (40 г NH4NO3 и 20 a KCN растворяют в воде, вводят 10 лы NH4OH (уд. вес 0,9) и разбавляют водой до 1 л) в течение 2 мин. Экстракт переносят в мерную колбу емкостью 50 мл, содержащую 1 г безводного Na2SO4, разбавляют до метки хлороформом и измеряют оптическую плотность при 390 нм в кювете I = 1 см по отношению к холостой пробе.
Определение можно заканчивать и флуориметрическим методом, в этом случае в анализируемом растворе должно быть от 1 до 10 мкг алюминия.
Для определения алюминия в соединениях вольфрама описан фотометрический метод с помощью арсеназо [503]; вольфрам мешает определению алюминия (допустимо присутствие до 40 мкг вольфрама). Вольфрам отделяют предварительно с помощью Р-нафтохино-лина. Избыток последнего, мешающий определению алюминия, отделяют прибавлением щелочи до сильнощелочной реакции.
1 г образца сплавляют с 1 г Na2CO3. Плав выщелачивают в НС1 (1: 1). Добавляют Злы 2%-ного раствора Р-нафтохинолина и упаривают до 3—5 мл. Прибавляют Юлы воды, образовавшийся осадок отфильтровывают. Фильтрат нейтрализуют по фенолфталеину 20%-ным раствором NaOH и прибавляют избыток 2 мл. При этом р-нафтохинолин выпадает в осадок. Раствор с осадком переносят в мерную колбу емкостью 50 мл и разбавляют до метки водой. Часть раствора отфильтровывают, аликвотную часть фильтрата нейтрализуют НС1 (1 : 10) по фенолфталеину, прибавляют 1 каплю ]0%-иого раствора аскорбиновой кислоты, 1 мл 0,05%-ного раствора арсеназо 1 и 0,2мл 25%-ного раствора уротропина.
Растворы переносят в мерную колбу емкостью 50 лы, доводят до метки водой и измеряют оптическую плотность с зеленым светофильтром в кювете Z = 5 см.
Чувствительность метода 2 мкг А1/50 мл.
204
.Метод позволяет определять 2-Ю-4 — 2-1О-2?о алюминия в WO3. в вольфрамовой кислоте, в металлическом вольфраме и других вольфрамовых препаратах. Относительная ошибка метода до 12%.
В стекле алюминий можно определить комплексометрическим методом [54].
0,5—1,0 г стекла разлагают смесью кислот HF и H2SO4. Остаток солей после двукратного выпаривания растворяют при нагревании в 3—5 .и.; НС1 (уд. вес 1,19) и разбавляют в мерной колбе до 250 мл. К аликвотной части этого раствора 50— 100-чл прибавляют избыток 0,025 Л1 раствора комплексона 111. Нагревают до кипения и горячий раствор нейтрализуют аммиаком по бумаге конго красный, приливают 10.ил ацетатного буферного раствора с pH 5 (27,22 г CH3COONa-ЗН2О и 4,9 мл НС1 (уд. вес 1,19) в 1 л) и охлаждают до комнатной температуры.
Прибавляют 6—7 капель раствора смеси ферри- и ферроцианида (0,2 г K3Fe(CN)6 и 0,1 г K4Fe (CN)6 в 30 мл воды), 2—3 капли 1°о-ного раствора диме-тилнафтидина в ледяной СН3СООН и избыток комплексона 111 оттитровывают 0,025 М раствором ацетата цинка до первого появления фиолетово-розового окрашивания раствора. Прибавляют 40 мл насыщенного раствора NaF, нагревают до кипения и кипятят 3 мин. Дают раствору постоять 5—7 мин., охлаждают до комнатной температуры, снова вводят такие же количества ферри- и ферроцианида и диметилнафтидина и титруют также. Расход цинка во втором титровании эквивалентен содержанию алюминия.
Описан метод определения алюминия в стекл со стильбазо [245].
ОПРЕДЕЛЕНИЕ АЛЮМИНИЯ В ПОЧВАХ, МАТЕРИАЛАХ ОРГАНИЧЕСКОГО ПРОИСХОЖДЕНИЯ И В ВОДЕ
Определение алюминия в почвах
При определении подвижного алюминия в почвах существенное значение имеет правильный выбор экстрагента. Этому вопросу посвящены многие работы. В качестве экстрагентов предлагались 1 М раствор CH3COONH4 при pH 4,8 и 1 N растворы КО, NaCI, СаС12, ВаС12. На основании критического рассмотрения литературных данных и собственных экспериментов Литл [933] пришел к выводу, что удовлетворительное извлечение подвижного алюминия достигается при использовании 1 N раствора КС1. Использование же 1 М раствора CH3COONH4 не рекомендуется, так как при этом получаются заниженные (pH 4,8), либо завышенные (pH 4,0) результаты.
Алюминий в почвах можно определять фотометрическими методами с алюминоном, оксихинолином и хромазуролом S. Если экстракт почвы бесцветный, то в нем сразу можно определить алюминий. Если он окрашен за счет органических веществ, то выпаривают досуха в присутствии 10 мл 30%-ной Н2О2. Если присутствуют фториды, то выпаривают досуха с 2 мл H2SO4 (уд. вес 1,84). Из подготовленного таким образом экстракта можно приготовить окрашенные растворы для фотометрического определения алюминия. Опре
205
деление алюминия в готовой почвенной вытяжке можно выполнить по методикам, приведенным в разделе «Фотометрические методы», а также по методу, приведенному в работе [933].
5 г воздушно-сухой почвы обрабатывают 50 мл 1 Лт раствора KCI. На следующий день суспензию отфильтровывают через бумажный фильтр, остаток на фильтре промывают 5 раз, используя по 5 мл экстрагента. Фильтрат и промывные воды собирают для анализа. Алюминий определяют фотометрическим оксихинолиновым методом [581]. Окспхпнолинат алюминия экстрагпруют трихлорэтиленом из щелочных растворов, содержащих комплексон 111, тиогликолевую кислоту и KCN для устранения влияния железа и других металлов.
Оптическую плотность экстракта измеряют при 410 нм [933].
Определение алюминия в материалах органического происхождения
Для определения алюминия в растительных материалах можно использовать метод Мидлтона [9671.
Пробу сухих и тонко измельченных листьев, содержащую 0,008—0,032 мг алюминия и 0,02—0,08 .чг железа, помещают в колбу Кьельдаля емкостью 100 мл. Добавляют 5 мл HNO3 (уд. вес 1,42) на каждые 0,5 г листьев и после смачивания листьев кислотой вводят 0,5 мл НС1О4 (уд. вес 1,70) и 0,5 мл H2SO4 (уд. вес 1,84). Содержимое колбы осторожно нагревают до ослабления выделения бурых паров и затем усиливают нагревание до бурной реакции. После окончания реакции большую часть избытка НС1О4 удаляют нагреванием в течение 5 мин.
После охлаждения добавляют 25 мл воды и выпаривают до объема 5—6 мл. Охлажденный раствор переносят с помощью 10 мл воды в делительную воронку. Добавляют 1 мл 0,6%-ного раствора оксихинолина в 2%-ной СН3СООН, медленно нейтрализуют 5 М аммиаком, приливают 5 мл ацетатного буферного раствора (0,1 А’ раствор CH3COONH4 в 5A’CII3COOII доводят до pH 2,85) и перемешивают. Затем добавляют 10мл 0,3%-ного хлороформного раствора оксихинолина и встряхивают.
Оптическую плотность экстракта измеряют при 470 нм и по графику рассчитывают содержание железа.
Для определения алюминия к водному слою медленно добавляют 4,5 мл 5М NH4OH при перемешивании, вводят 10 мл хлороформного раствора оксихинолина и встряхивают. Оптическую плотность экстракта измеряют при 385 нм в кювете I = 1 см по отношению к холостой пробе.
Обычно содержащиеся в листьях Са, Mg, К, Р и Мп не мешают определению. Чувствительность метода 1,5 ч. на I млн.; относительная ошибка 1,4%.
Холак и др. [639] определяют алюминий в биологических материалах с ализарином S после озоления образца (подробно см. [360]).
Стаффорд и Уатт [12031 разрушают органические материалы в колбе Кьельдаля серной, азотной и хлорной кислотами. Затем удаляют железо и некоторые другие металлы экстракцией их купфе-ронатов хлороформом. Алюминий определяют фотометрически с алюминоном. Талер и Мюльбергер [1217] определяют алюминий в биологических материалах с эрнохромцианином R. Образец разлагают озолением. Предварительно многие мешающие металлы удаляют экстракцией купферонатов из раствора с pH 0,4. Затем при pH 4,8 экстрагируют купферонат алюминия. После удаления СНС13
206
остаток сплавляют с Na2CO3 и в растворе плава определяют алюминий.
Для определения алюминия в резине предложен комплексометрический метод обратным титрованием избытка комплексона III раствором железа с сульфосалнциловой кислотой [55]. Образец резины сжигают в фарфоровом тигле, золу растворяют в НС1 (1 : 1). Осаждают алюминий и железо в виде гидроокисей и после растворения в НС1 алюминий определяют комплексометрически. В другом варианте алюминий и железо отделяют в виде гидроокисей; при высоком содержании этих металлов проводят предварительное разделение на анионите ЭДЭ-10П [82].
Алюминий в полиэтилене можно определять по методу Болле-тера [581].
Образец сжигают или разлагают кислотой. В последнем случае 2 г пробы кипятят с 20 мл H2SO4 (уд. вес 1,84), добавляют 20 мл HNO3 (уд. вес 1,4) и снова продолжают кипячение. Если остается черный остаток углерода, вводят больше HNO3. Добавляют 5 мл 70%-ной НС1О4 и выпаривают. Остаток растворяют в воде и разбавляют до 100 мл.
В другом способе разложения 5 г образца смешивают с 2 а смеси K2SO4 и KNO3 (3 : 1) и сжигают в платиновом тигле. Остаток нагревают с 1 мл H2SO4 (уд. вес. 1,84), растворяют в 10 мл 10%-ной H2SO4 и разбавляют водой до 100мл. К 50мл полученного раствора прибавляют 1 мл 10%-ного раствора тиогликолевой кислоты, нейтрализуют аммиаком по фенолфталеину и вводят 10 мл избытка NH4OH (уд. вес 0,9). Добавляют 1 мл 1 М раствора NaCN, 5 мл 2%-ного этанольного раствора оксихинолина, 10 мл трихлорэтилена и встряхивают. Экстракт фильтруют через бумажный фильтр и фотометрируют при 390 нм.
При определении 10—100 мкг алюминия относительная ошибка 3%.
Для определения алюминия в полипропилене используют фотометрический оксихинолиновый метод. Мешающие элементы предварительно удаляют с оксихинальдином [1017].
1 г образца нагревают с 15лл H2SO4 (уд. вес 1,84) до превращения смеси в черную массу. После охлаждения добавляют 5 мл 30%-ной Н2О2 и нагревают. Добавление последней повторяют еще 2—3 раза. Избыток Н2О2 разрушают кипячением и раствор разбавляют водой до 100 мл. Аликвотную часть (20 мл) этого раствора (20—ЮО.чкг А1) переносят в делительную воронку, разбавляют водой до ~ 40мл, вводят 1 мл 33%-ного раствора винной кислоты, 1 мл 33%-ного раствора CH3COONH4 и 5 мл 2,5%-ного раствора оксихинальднна в 5%-ной СН3СООН.
Устанавливают pH 8—9 добавлением NH4OH (уд. вес 0,9) и экстрагируют ок-сихинальдинаты титана и железа 15мл СНС13. Экстрагируют еще два раза, используя по 1,5 мл раствора оксихинальдина и 7,5 мл СНС13. В водную фазу, содержащую алюминий, вводят 1,5 мл 2,5%-ного раствора оксихинолина в 5%-ной СН3СООН и экстрагируют оксихинолинат алюминия 7 мл хлороформа. Экстракт разбавляют до 25 мл хлороформом и спектрофотометрируют при 395 нм.
Определение алюминия в воде
Гиблер [754] провел сравнительное изучение четырех фотометрических методов определения алюминия в воде: с гематоксилином, эрнохромцианином R, ализарином S и алюминоном. По его мнению, лучшим является метод определения с алюминоном.
207
Предварительно из воды удаляют ионы F- (при концентрации > 1 мг/мл) и органические вещества обработкой с H3SO4 (уд. вес 1,84) до паров SO3. После их удаления к 50 мл нейтральной воды в мерной колбе емкостью 100 мл добавляют 2 мл 1°о-ного раствора тиогликолевой кислоты, затем через 2 мин. добавляют 15 мл «составного» алюминонового раствора (см. стр. 95). Колбу помещают на 15 мин. в кипящую водяную баню, затем охлаждают и измеряют оптическую плотность при 530 нм. pH растворов должен быть 5,3—5,4 [754].
Аналогичный метод используют Рольф и др. [1119].
Для определения алюминия в чистой воде Мотодзима предложил фотометрический оксихинолиновый метод [9941.
500 .ил воды осторожно кипятят с 5 мл НС1 (уд. вес 1,19). После охлаждения Добавляют 2 мл 2%-ного раствора оксихинолина в СН3СООН. pH раствора доводят до 5,5—6 при помощи 1 N раствора NaOH, 1 М NH4OH или 4 М раствора CH3COONa. Раствор переносят в делительную воронку и доводят объем до 525 мл. Добавляют Юл.? СНС13 и энергично встряхивают 2 мин. После разделения слоев экстракт переносят в другую делительную воронку, содержащую 50 мл цианидно-карбонатнон промывной жидкости *. После встряхивания экстракта с промывной жидкостью слой СНС13 переносят в коническую колбу, содержащую 1 г безводного Na2SO4, встряхивают осторожно для удаления капель воды н измеряют оптическую плотность при 390 нм по холостой пробе.
Хаситани и Ямамото [459] одновременно определяют алюминий и железо в морской воде.
250—330 мл морской воды отфильтровывают от механических примесей. Фильтрат подкисляют 1 мл НС1 (уд. вес 1,19) и кипятят 1 мин. К холодному раствору прибавляют 7,5мл раствора Be(NO3)2, содержащего 10 мг Be/мл, для устра нения влияния фторидов. Вводят3 мл 1 %-ного раствора оксихинолина с СН3СООН добавляют CH3COONH4 и NH4OH до pH 5,0—5,5. Разбавляют водой до 400 мл и экстрагируют 10 мл СНС13. Экстракт промывают 10 мл 0,1 М раствора KCN для удаления меди и фотометрируют в кювете I = 1 см при 390 и 470 нм.
Содержание алюминия и железа рассчитывают по формулам
СА1 = Аэм — 0,746 -Aj-o/0,0310;
CFe = As7o/O,O134,
где СД| и CFe — содержание алюминия и железа в анализируемой воде, мкг/л; /13!!о и Д470 — оптические плотности при 390 и 470 нм.
Метод позволяет определять 14—252 мкг Al/л и 9—156 мкг Fe/л.
Соломин и Фесенко [369, 3701 для определения алюминия в кислотных водах угольных шахт предложили комплексометрический метод. Предварительно алюминий и железо осаждают в виде гидроокисей, после растворения осадка в кислоте в части раствора определяют сумму этих металлов обратным титрованием раствором цинка по дитизону, в другой части — железо прямым титрованием комплексоном III при pH 1,0—1,5 с индикатором сульфосалициловой кислотой.
* Для приготовления промывной жидкости к 100 мл 30%-ного раствора (NH4)2CO3 добавляют 50 мл 13%-ного раствора KCN и разбавляют водой до 400 мл; устанавливают pH 9—10 при помощи 20%-ного раствора NH4C1; примеси мешающих металлов удаляют экстрагированием хлорофромным раствором окси-хииолина.
208
ОПРЕДЕЛЕНИЕ АЛЮМИНИЯ В МЕТАЛЛАХ И СПЛАВАХ*
Определение алюминия в железе, стали и ферросплавах
Для растворения сталей применяют различные кислоты и их смеси: НС1 (конц., 2:1, 1 : 1), HNO3 (1 : 1), НС1О4, H2SO4 (1 : 9), смеси НС1 и HNO3, НС1О4 и HNO3, H2SO4 и HNO3. Большинство образцов сталей можно растворять в НС1 (1 : 1), для разложения карбидов в конце растворения добавляют HNO3. Для растворения некоторых образцов высоколегированных сталей лучше использовать царскую водку. Для растворения ферросплавов в зависимости от состава применяют НС1 (1 : 1), H2SO4 (1 : 1 или 1 : 4), царскую водку, смесь HF и HNO3.
Алюминий в сталях может быть в металлическом виде (растворимый в кислотах) и в виде окисла (нерастворимый в кислотах). Для раздельного определения «растворимого» и «нерастворимого» алюминия образец стали растворяют в НС1 (1 : 1) илиН25О4 (1 : 9), окисляют железо небольшим количеством HNO3. Нерастворимый осадок отфильтровывают, промывают, фильтрат разбавляют в мерной колбе до метки и в части раствора определяют «растворимый» алюминий. Фильтр с остатком озоляют, прокаливают, сплавляют с небольшим количеством пиросульфата, плав выщелачивают в воде и в полученном растворе определяют «нерастворимый» алюминий.
Весовые методы определения алюминия. При содержании 0,1—7% алюминий в сталях можно определять весовым фторидным (криолитовым) методом. Этот метод в качестве стандартного включен в ГОСТ 12357-66 для легированных и высоколегированных сталей [377а].
Метод основан на отделении алюминия от мешающих элементов фторидом натрия из слабокислого раствора, растворении осадка криолита в смеси борной и соляной кислот, осаждении алюминия оксихинолином с последующим прокаливанием до окисла.
2 г стали при содержании 0,1 — 0,5% алюминия и 1, 0,5, 0,2 а при содержании 0,5—1; 1—2 и 2—7% алюминия, соответственно, помещают в стакан емкостью 250—300 мл, приливают 25 мл НС1 (уд. вес 1,19), стакан накрывают часовым стеклом и умеренно нагревают до растворения пробы. Затем, слегка сдвинув часовое стекло, осторожно, по каплям, приливают HNO3 (уд. вес 1,4) до прекращения вспенивания раствора и избыток ее 5—10 мл. Раствор нагревают до удаления окислов азота. После охлаждения раствора приливают 10—15 мл H2SO4 (уд. вес 1,84) и выпаривают до появления паров SO3. Содержимое стакана охлаждают, приливают осторожно 80—100 мл воды и нагревают до растворения солей. Часовое стекло споласкивают водой и осадок (кремневой, вольфрамовой, ниобиевой и других кислот) отфильтровывают через два фильтра с белой лентой. Фильтр с осадком промывают 4—5 раз горячей H2SO4 (1 : 100), собирая фильтрат и промывные воды в стакан емкостью 400 мл. Фильтр с осадком помещают в платиновый тигель, озоляют, прокаливают при 900—1000° С; после охлаждения остаток смачивают 2—3 каплями воды, прибавляют 2—3 мл H2SO4 (1 : 4) (при наличии в осадке окислов W, Nb и Та добавляют 5—6 мл кислоты), 3—5 мл 40% -ной HF выпаривают до удаления паров SO3, прокаливают при 900—1000° С и сплавляют с 2—3 г KHSO4.
* Определение алюминия в металлах и сплавах описано также в гл. II (см. «Спектральные методы»).
9ПО
Плав выщелачивают в 20—30 мл H2SO4 (1 : 9), раствор плава присоединяют к основному фильтрату. Затем из полученного раствора осаждают алюминий в виде криолита. Дальнейший ход анализа см. на стр. 59.
Эллиот и Робинзон [700] определяют алюминий весовым оксихинолиновым методом после удаления основной массы железа экстракцией дихлордиэтиловым эфиром и отделения алюминия от многих мешающих элементов (Си, Ni, Мп, Со и др.) осаждением аммиаком в присутствии NH4CL Осадок растворяют в кислоте и после добавления комплексона III и создания щелочной среды осаждают алюминий в виде оксихинолината.
Дюбель и Флюршютц [689] определяют алюминий в магнитных сплавах весовым оксихинолиновым методом после удаления мешающих элементов электролизом на ртутном катоде. Метод дает хорошо воспроизводимые результаты. При анализе сплава «альнико» с —8,8% А1 отклонения отдельных, результатов от среднего арифметического составляют 0,01—0,04% Подобный метод использован для микровесового определения алюминия (вес проб 0,02—0,05 г) [878].
Алюминий в сталях можно определять весовым фосфатным методом [1102].
2 г стали (при содержании > 0,04% алюминия) или 5 г (при содержании < 0,04%) растворяют в 30 мл 12N НС1. К раствору добавляют 10 мл 20%-ного раствора гипофосфита натрия, 20 мл бромной воды и выпаривают до малого объема. Если присутствуют титан и цирконий, они осаждаются при этом в виде белого кристаллического осадка. Фильтруют; выпаривают фильтрат досуха, остаток смачивают 12 N НС1 и повторяют выпаривание. К остатку добавляют 30 мл НС1 (1 : 1) и нагревают для растворения солей. Фильтруют; осадок, содержащий крем-некислоту и нерастворимый алюминий, промывают горячей 5%-ной НС1.
Если требуется определить общее содержание алюминия, то кремнекислоту удаляют обработкой HF, остаток сплавляют с KHSO4 и плав выщелачивают водой. Полученный раствор присоединяют к основному фильтрату.
Раствор выпаривают до малого объема и кислотность его доводят до 6 N по НС1. Раствор объемом 30 мл встряхивают в делительной воронке с равным объемом диэтилового эфира, насыщенного соляной кислотой. Эфирный слой отбрасывают, из водного слоя удаляют эфир нагреванием. Содержание кислоты в растворе нейтрализацией аммиаком (1 : 1) уменьшают до 5%. Добавляют 5 мл 80%-ной тиогликолевой кислоты для связывания никеля, хрома и других металлов, а также остат ков железа в комплексы. Вводят 5—8 г NH4SCN или 10 мл насыщенного раствора его. Осторожно дообавляют аммиак (1 : 1) до pH 0,5. Вводят Юлы 10%-ного раствора (NH4)2HPO4 и перемешивают. Добавляют по каплям 40%-ный раствор CH3COONH4 до pH 3,7—3,9. Нагревают 5 мин. при 50—60° С при непрерывном перемешивании раствора. После оседания осадок фосфата алюминия отфильтровывают, промывают 5%-ным раствором NH4NO3, прокаливают и взвешивают в виде А1РО4. Если осадок не совсем белый, то его растворяют в НС1 (уд. вес 1,19) и повторяют осаждение.
Комплексометрические методы. Для определения алюминия в сталях можно применить комплексометрический метод с использованием ксиленолового оранжевого [363].
Раствор стали нейтрализуют до начала выделения гидроокисей, которые растворяют в нескольких каплях H2SO4 (1 : 1), нагревают до кипения и вливают тон
210
кой струей при постоянном перемешивании в мерную колбу емкостью 500 мл, содержащую 100 мл горячего раствора NaOH или КОН (200 г/л). После доведения до метки и отстаивания осадка фильтруют и в части фильтрата определяют алюминий комплексометрическим методом, обратным титрованием избытка комплексона III раствором цинка по ксиленоловому оранжевому. Концентрацию раствора цинка устанавливают по стандартному образцу стали, проведенному через весь ход анализа.
Относительная ошибка определения ~2% при содержании алюминия 5%.
Описанный метод отделения мешающих элементов с помощью NaOH наиболее быстрый, но следует учесть, что вместе с алюминием в фильтрат переходят ванадий и молибден; если титровать медленно при энергичном перемешивании, то последний не мешает [712]. Влияние ванадия устраняют добавлением 30%-ной перекиси водорода [712].
После отделения мешающих элементов едким натром алюминий можно определять прямым комплексометрическим методом в присутствии комплексоната меди и ПАН [1184]. Небольшие количества ванадия и молибдена не оказывают заметного влияния.
Описан комплексометрический метод с применением диаминциклогексантетр ауксусной кислоты (ДЦТА) [600]. Многие мешающие элементы удаляют электролизом на ртутном катоде, прочие отделяют экстрагированием раствором три-н. октилфосфинокиси в циклогексане. Метод более сложный, чем описанные выше, но зато получаются более точные результаты. Абсолютная ошибка метода 0,02% при содержании алюминия — 3%.
Комплексометрические методы используют и для анализа ферросплавов. Предложено [63] определять комплексометрически алюминий и титан в ферротитане, проводя последовательное титрование в одном и том же растворе.
При рН~5 оттитровывают избыток комплексона III раствором цинка по ксиленоловому оранжевому. Затем вводятЮ—15мл 20%-ного раствора винной кислоты, устанавливают необходимую среду и титруют освободившийся комплексон III, эквивалентный содержанию титана, раствором цинка. К оттитрованному раствору прибавляют фторид, разрушают комплексонат алюминия и освободившийся комплексон III, эквивалентный содержанию алюминия, оттитровывают раствором цинка.
Относительная ошибка определения титана до 1,2%, алюминия — до 2,8%
При анализе ферротитана применяют также обратное титрование раствором соли железа по сульфосалициловой кислоте после отделения мешающих элементов с помощью едкого натра [160]. В ферросилиции алюминий определяют после удаления мешающих элементов электролизом на ртутном катоде. Если присутству-ет>-1% марганца, его удаляют осаждением едким натром в присутствии перекиси водорода. Сначала при pH 2 титруют железо с салициловой кислотой, затем при pH 5 определяют алюминий обратным титрованием раствором железа.
Фотометрический метод с алюминоном. Алюминий в железе можно определять по методу Шорта [1162].
211
10 г железа растворяют в НС1 (уд. вес 1,19), окисляют железо минимальным количеством HNO3. Выпаривают раствор досуха, остаток растворяют в 80 .ил НС1 и снова выпаривают до начала выделения солей. Добавляют 50 мл НС1 (уд. вес 1,12) и раствор переносят в делительную воронку. Экстрагируют железо этиловым или изопропиловым эфиром. Водный слой переносят в стакан и нагревают на паровой бане для удаления эфира. Окисляют несколькими каплями HNO3 и выпаривают раствор почти досуха: Добавляют небольшой объем НС1 (уд. вес 1,12) и повторяют экстракцию эфиром, поддерживая объем водного слоя как можно меньше. Нагревают для удаления эфира, добавляют несколько капель HNO3 и снова выпаривают до малого объема.
Разбавляют до 50 мл и добавляют 3 г NH4C1; pH раствора (контролируют с помощью pH-метра) доводят до 0,3—0,4. Раствор переносят в делительную воронку и добавляют 0,1 г купферона, растворенного в малом количестве воды. Спустя 5 мин. экстрагируют хлороформом. При необходимости экстрагирование повторяют до получения бесцветного слоя СНС13. Водный слой нагревают в течение нескольких минут для удаления СНС13 и объем раствора доводят водой до 50 или 100 мл. В аликвотной части раствора определяют алюминий фотометрически с алюминоном.
Метод пригоден для анализа железа высокой чистоты.
Крафт и Мейкпейс [659] определяют алюминий с алюминоном в малолегированной стали после удаления железа экстрагированием изопропиловым эфиром и хрома в виде хлорида хромила.
Согласно ГОСТ 11658—65, алюминий в чугуне и нелегированной стали определяется алюминоном без отделения. Железо восстанавливают аскорбиновой кислотой до Fe (11), которое не мешает определению алюминия. В сталях при наличии в них титана и ванадия этот ГОСТ предусматривает предварительное удаление железа экстракцией эфиром и отделение титана и ванадия осаждением в виде купферонатов, т. е. также, как и в методе Шорта [1162].
При анализе высоколегированных сталей метод определения с алюминоном усложняется. В наиболее точных стандартных методах вводят еще операцию отделения электролизом на ртутном катоде. Так, в методе, предложенном Бендиго [555], сначала удаляют хром в виде хлорида хромила, затем многие металлы отделяют электролизом на ртутном катоде, при pH 3,5 экстрагируют хлороформом купферонаты алюминия и других металлов и, наконец, из экстракта после удаления СНС13 и создания сильнокислой среды удаляют Ti, Zr, V и некоторые другие металлы в виде купферонатов. Такие сложные методы можно применять для арбитражных анализов или для установления состава стандартных образцов. Для обычных анализов достаточно точные результаты могут быть получены и более простыми методами.
Фотометрическийметод с хромазуролом S. По методу Хосоя и др. [820], основную массу железа удаляют экстракцией метилизобутилкетоном. Остатки железа и некоторые другие металлы маскируют тиогликолевой кислотой.
0,5 г железа или стали растворяют в 20 мл НС1 (1 : 1) с добавлением 1 мл HNO3. Полученный раствор нагревают и выпаривают досуха. К остатку прибавляют 20 мл НС1 (1 : 1) и нагревают для растворения солей. Отфильтровывают кремнекислоту и другие нерастворимые вещества. Остаток прокаливают, обраба
212
тывают с помощью HF, сплавляют с K2S2O7 и раствор плава соединяют с фильтра том.
Объединенные фильтраты концентрируют до 10 ли, переводят в делительную воронку с 7.VHC1 и экстрагируют железо метилизобутилкетоном (2 раза по 20 ли). Стой кислоты выливают в стакан, выпаривают досуха, затем кипятят 2—3 мин. с 5 мл царской водки. Снова выпаривают досуха, .остаток растворяют в 5 ли НС1 (1 : 1), раствор охлаждают и разбавляют в мерной колбе до 100 ли.
Для определения алюминия в мерную колбу емкостью 100 ли отбирают 10— 20 ли раствора, добавляют 1 ли 10°о-ного раствора тиогликолевой кислоты, 2 мл 0,1 % -ного раствора хромазурола S. pH доводят до 5,6—5,8 с помощью 0,2 Л1 растворов СН3СООН и CH3COONa, используя pH-метр, и разбавляют до метки водой. Через 20 мин. измеряют оптическую плотность при 550 нм по отношению к раствору контрольного опыта, который готовят также, вводя малые количества железа, не содержащего алюминий. Содержание алюминия находят по калибровочному графику.
Так как тиогликолевая кислота несколько ослабляет окраску комплекса алюминия, то такие же количества ее надо вводить в стандартные растворы.
Степин и сотрудники [3781 предлагают определять алюминий в трансформаторной стали без предварительного отделения мешающих элементов, используя тиогликолевую кислоту для их маскирования. Очевидно, очень малые количества алюминия этим методом определять нельзя, так как большие количества железа будут мешать вследствие образования фиолетового комплекса Fe (III) с тиогликолевой кислотой.
Астанина и Пономарев [181 также определяют алюминий без предварительного отделения, восстанавливая железо аскорбиновой кислотой. Присутствие больших количеств Fe (II) несколько уменьшает окраску комплекса алюминия, поэтому в стандартные растворы при составлении калибровочного графика надо вводить количества железа, соответствующие его содержанию в анализируемом растворе.
По мнению Брокмана и Келлера [592], алюминий в сталях без отделения железа при восстановлении его аскорбиновой кислотой, можно определять лишь в тех случаях, когда не требуется получить высокую точность. Согласно этим авторам, кроме ослабления окраски комплекса алюминия, аскорбиновая кислота также уменьшает устойчивость окраски во времени.
В ферроборе алюминий определяют с хромазуролом S после отделения мешающих элементов в виде хлоридных комплексов на анионите АВ-17 [378].
Фотометрический оксихинолиновый метод. Кассиер и Озир [864] при определении алюминия в стали связывают титан, ванадий и некоторые другие примеси в пероксидные комплексы. Железо после восстановления сульфитом и многие другие примеси связывают в комплексы с помощью цианида. Какита и Иокогама [856] несколько улучшили метод Касснера и Озира и дали ускоренный метод определения алюминия в железе и стали; по данным авторов продолжительность определения 20 мин.
0,5—1 г образца растворяют при нагревании в 6—10 мл HNO3 (1 : 1) и Юли 60%-ной НС1О4. Продолжают нагревание в течение нескольких минут после-
213.
^растворения. Раствор разбавляют в мерной колбе до 500 мл. Для определения отбирают аликвотную часть 5—25 мл, добавляют 1 мл Н2О2, 2 мл 10% ного раствора винной кислоты, 10 мл насыщенного раствора Na2SO3, 5 мл 20%-ного раствора KCN.
Раствор нагревают до 70° С для восстановления Fe (III); после охлаждения переносят в делительную воронку, добавляют 2 мл 50%-ного раствора NH4NO3 и 3 мл 3%-ного раствора оксихинолина. Доводят pH до 8,6—9,2 при помощи НС1 или NH4OH. Вводят 15 мл бензола, энергично встряхивают 1 мин. После разделения слоев водный слой отбрасывают, оптическую плотность бензольного слоя измеряют на фотоколориметре по отношению к холостой пробе. Содержание алюминия .находят по калибровочному графику, составленному в аналогичных условиях.
Относительная ошибка метода 1—4% при содержании 0,15—1,7% [856].
При определении алюминия оксихинолиновым методом мешающие элементы удаляют электролизом на ртутном катоде [12641, экстракцией купферонатов [1289], либо экстракцией амилацетатом из концентрированной НС1 (железо).
Другие фотометрические методы. Описаны различные варианты определения алюминия с эриохромцианином R. Методы предварительного отделения применяются те же, что и при использовании описанных выше методов. Предложено отделение мешающих элементов с помощью NaOH, с введением (для уменьшения окклюзии алюминия) больших количеств цинка и Н3ВО3 [809], электролизом на ртутном катоде [568, 878, 880, 909, 1245, 1258], экстрагированием эфиром [831, 1258], удалением в виде купферонатов [568, 831]. Эриохромцианин R (также, как и некоторые другие предложенные для определения алюминия в сталях реагенты—ализарин S [656, 1024], стильбазо [4, 5, 1259] и другие) не нашел широкого применения.
Определение алюминия в меди и медных сплавах
Весовые методы. Алюминий в медных сплавах можно определять весовым оксихинолиновым методом, маскируя мешающие элементы при помощи KCN, винной кислоты и комплексона III [6821.
1 или 0,2 г сплава растворяют в 15 мл 4.V HNO3 и 15 мл 4/V НС1. Добавляют 30 мл 50%-ного раствора винной кислоты, нейтрализуют 7 М аммиаком до pH 7—8 (в присутствии большого количества цинка нли кадмия — до исчезновения осадка). После охлаждения добавляют Na2SO3 нз расчета 1 г на каждые 0,1 г пробы, разбавляют водой до 100—125 мл, добавляют 5 г KCN и 10 мл раствора комплексона 111 (10 г комплексона 111 растворяют в 100 мл конц. аммиака). Кипятят 3 мин., добавляют по каплям 0,5%-ный раствор оксихинолина. Необходимое количество оксихинолина рассчитывают по формуле:
х = 0,02 V + а/3 ,
где V — общий объем раствора, мл; а — предполагаемое количество алюминия, мг.
Раствор нагревают, выдерживают 30 мин. при температуре, близкой к температуре кипения, и фильтруют при 70° С. Осадок промывают 100 мл горячего 0,1 М раствора аммиака, высушивают при 135° С и взвешивают.
Определению алюминия не мешают Си, Zn, Sn, Fe, Pb, Ni, Co и Sb.
214
Весовой бензоатный метод определения алюминия после отделения основной массы меди тиогликолевой кислотой дает удовлетворительные результаты, но он более сложен, чем описанный выше оксихинолиновый [521].
Титриметрические мет од ы. Титриметрический оксихинолиновый метод определения служит для быстрого определения алюминия [986].
0,1; 0,2 или 0,5 г сплава при содержании 10, 5 и 1% алюминия, соответственно, растворяют в разбавленной HNO3. После удаления окислов азота кипячением раствор разбавляют горячей водой примерно до 100 мл. Добавляют 5 мл насыщенного на холоду раствора Na2SO3, 25 мл (для латуней 35 мл) маскирующей смеси (lOOaNaCN, 50 а комплексона 111 и 300мл конц. аммиака в 1 л). Осаждают алюминий, прибавляя при температуре кипения 10 мл раствора оксихинолина (40 г-реагента растворяют в 120 мл ледяной СН3СООН, разбавляют до 1 л, нейтрализуют и слабо подкисляют уксусной кислотой), и помешивают до коагуляции осадка. Раствор с осадком оставляют в теплом месте примерно 1 мин. и фильтруют через неплотный фильтр. Осадок 5 раз промывают горячей водой. Фильтрат отбрасывают, осадок на фильтре растворяют в 20 лм горячей НС1 (уд. вес 1,19). Фильтр промывают водой. Фильтрат и промывные воды собирают в коническую колбу емкостью 300 мл. После охлаждения добавляют из бюретки 0,1 7V раствор КВгО3— КВг до обесцвечивания капли метилоранжа. Добавляют 10 мл 5%-ного раствора KJ и выделившийся иод титруют 0,1 Лг раствором тиосульфата.
Для определения алюминия в медных сплавах предложены; комплексометрические методы с индикаторами ксиленоловым оранжевым [260], салициловой или сульфосалициловой кислотами [354, 976].
Фотометрические методы. Для определения алюминия в медных сплавах можно рекомендовать фотометрический метод с эриохромцианином R [2501.
0,1 г латуни растворяют в 2 мл HNO3 (уд. вес 1,40). Раствор переносят в мерную колбу емкостью 100 мл, вводят 8 мл НС1 (1 : 1) и разбавляют до метки водой. 5 мл раствора переносят в мерную колбу емкостью 100 мл, приливают 40 мл воды, 0,1 мл 4%-ного раствора аскорбиновой кислоты, 0,25 мл 15%-ного раствора Na2S2O3 и взбалтывают. Добавляют 2,5 мл 0,075%-ного раствора эриохромцианина R, 20 мл 40%-ного раствора CH3COONa и разбавляют до метки водой.
Через 2 мин. измеряют оптическую плотность на фотоколориметре с зеленым светофильтром в кювете I = 2 см по отношению к воде; вводят поправку на холостую пробу.
Раствор эриохромцианина R готовят так: 0,15 г реагента растворяют в 50 мл воды, прибавляют 5 г NaCl, 5 a NaNO3, 0,4 мл HNO3 (уд. вес 1,40) и разбавляют водой до 200 мл.
Продолжительность определения 10—12 мин., относительная ошибка 3%.
Дозинель [687] при определении алюминия в медных сплавах с эриохромцианином R для маскирования мешающих элементов вводит тиогликолевую кислоту. Не мешают до 10% Sn и РЬ, до 30% Мп, до 1% Р, Sb и As. Определение проводится при pH 5,1—5,2; при количествах меди больше 40 мг pH должен быть 4,0. В присутствии Ni и Fe вводят поправки (1% Ni и 1% Fe эквивалентны 0,005 и 0,008% алюминия соответственно).
215-
Алюминий в медных сплавах можно определять алюминоном, маскируя мешающие элементы тиогликолевой кислотой [939].
0,2 г марганцевой бронзы растворяют в 5 мл НС1 (уд. вес 1,19) и 5 мл 30%-ной Н2О2. После растворения пробы раствор кипятят 2 мин. для удаления избытка Н2О2. Раствор в мерной колбе разбавляют до 200 .ил. Ю.ил этого раствора переносят в мерную колбу емкостью 100 мл, добавляют 4 мл раствора тиогликолевой кислоты (1 : 24) и 15 мл «составного» алюминонового буферного раствора (о приготовлении см. на стр. 95). Перемешивают и ставят колбу в энергично кипящую водяную баню (химический стакан емкостью 400 мл) на 5 мин. Снимают с водяной бани, через 1 мин. ставят в холодную воду.
После охлаждения до комнатной температуры раствор доводят до метки водой и измеряют оптическую плотность при 525 нм по отношению к холостой пробе. Содержание алюминия находят с помощью калибровочного графика. Для составления графика берут 0; 0,01; 0,02; 0,03; 0,04; 0,06; 0,08 и 0,10 лаА1, добавляют 1 мл раствора СиС12 (5лгСи/.мл), разбавляют водой до Юлл, добавляют тиогликолевую кислоту и далее продолжают как описано выше.
При определении алюминия алюминоном в сплавах меди с оловом и цинком («пушечный металл») многие мешающие элементы предварительно удаляют электролизом на ртутном катоде [1086].
Определение алюминия в цинке и цинковых сплавах
Титриметрические методы. Для определения алюминия в цинковых сплавах предложены комплексометрические методы с индикаторами комплексом меди с ПАН и сульфосалициловой кислотой. Однако эти методы требуют предварительного отделения алюминия от мешающих элементов. Проще определять алюминий в цинке и цинковых сплавах фотометрическими методами с алюминоном и эриохромцианином R.
1 г цинка растворяют при слабом нагревании в 15 мл НС1 (1 : 1). Нерастворимый остаток, состоящий главным образом из свинца, отфильтровывают и промывают холодной водой. Фильтрат и промывные воды разбавляют в мерной колбе до 200 мл. Аликвотную часть этого раствора (5 или 10 мл при содержании 0,08 — 0,24% и 0,025—0,08% алюминия соответственно) переносят в мерную колбу емкостью 200 мл, разбавляют водой до 100—150 мл, добавляют 5 мл 0,1%-ного раствора эриохромцианина R. Спустя 5—7 мин. добавляют 15 мл буферного раствора с pH 6 (если взята аликвотная часть 5 мл; для 10 мл берут 20 мл буферного раствора). Разбавляют водой до метки, через 5 мин. измеряют оптическую плотность при 530 нм.
Цинк не мешает определению алюминия при содержании последнего > > 0,002%, a Fe (II), Cd, Pb и Sn в тех количествах, в которых присутствуют в цинке, также не мешают [831].
При анализе цинковых сплавов для маскирования мешающих элементов необходимо вводить тиогликолевую кислоту. Методы определения алюминия в медных сплавах с алюминоном и эриохромцианином R можно использовать и для определения его в цинковых сплавах.
.216
Определение алюминия в олове и оловянных сплавах
Алюминий в олове определяют фотометрическими методами с алюминоном [938], хромазуролом [488], эриохромцианином R [2271 и оксихинолином [654]. Во всех случаях олово надо предварительно удалить выпариванием в виде бромида или хлорида.
1 г олова помещают в кварцевый стакан, погруженный наполовину в холодную воду, добавляют 2 мл НС1 (уд. вес 1,19), 2,5 мл НВг и по каплям осторожно под часовое стекло вводят 1,5—2 мл брома. После прекращения бурной реакции часовое стекло убирают, споласкивают, и стакан переносят на стол, покрытый тефлоном, под инфракрасную лампу для окончательного разложения пробы и удаления олова. Раствор выпаривают при 85—90° С до чуть влажного остатка, добавляют 1 мл НС1 (1 : 1) и выпариваютдосуха. Вводят еще 0,5 мл НС1 (1 : 1) и снова выпаривают досуха.
Сухой остаток растворяют в ацетатном буферном растворе с pH 5,4; объем полученного раствора должен составлять 10 мл. К этому раствору прибавляют 0,2 мл 5%-ного свежеприготовленного раствора аскорбиновой кислоты, 0,3 мл 0,3%-ного раствора хромазурола S. Через 5 мин. измеряют оптические плотности на фотоколориметре с зеленым светофильтром в кюветах I = 2 см. Содержание алюминия находят по калибровочному графику [488].
Лельчук и др. [227] для определения алюминия в олове высокой чистоты предложили фотометрический метод с эриохромцианином R. Разложение пробы и удаление олова проводят описанным выше методом.
После трехкратного выпаривания с НС1 (1:1) сухой остаток растворяют в 6 каплях НС1 (1 : 4) и с помощью буферного раствора переводят в мерную колбу емкостью 25мл. Добавляют 0,5мл 5%-ного свежеприготовленного раствора аскорбиновой кислоты, перемешивают, вводят 0,5 мл 0,075%-ного раствора эриохром-цианина R, содержащего 5 a NaCl, 5 г NaNO3 и 0,4 мл HNO3 (уд. вес 1,4) в 200 мл. Доводят до метки буферным раствором с pH 8,3 (для его приготовления к 460 мл 2А1 СН3СООН добавляют 540 мл 2 МNH4OH). Через 7мин. измеряютоптическую-плотность на фотоколориметре с зеленым светофильтром по отношению к воде. Вводят поправку на холостую пробу.
Чувствительность этого метода 10-5—5-10“6%, относительная ошибка 10— 15%. Продолжительность анализа 4—5 час.
Авторы указывают на необходимость очистки НС1, НВг и Вг2 от следов алюминия трехкратной перегонкой в кварцевом перегонном аппарате.
Хромазурол S и эриохромцианин R, очевидно, можно использовать и для определения алюминия в сплавах олова, после предварительного отделения мешающих элементов.
По методу Люка [938] алюминий в олове и в сплавах олова определяют фотометрическим методом с алюминоном. Олово, а также сурьму и мышьяк удаляют выпариванием после добавления НВг и Вг2. Если образец содержит больше 5% свинца, то его отделяют осаждением в виде PbSO4. После этого раствор подвергают электролизу с ртутным катодом для удаления мешающих элементов. Затем некоторые оставшиеся в электролите металлы отделяют от алюминия экстрагированием купферонатов хлороформом. После установления в водной фазе pH 5 выделяют алюминий экстрагированием
917
«го оксихинолината хлороформом. После удаления хлороформа и основной массы оксихинолина и разрушения остатков органических веществ с помощью НС1О4 остаток растворяют в воде и алюминий определяют фотометрическим методом с алюминоном.
Определение алюминия в никеле и никелевых сплавах
Для определения алюминия в никелевых сплавах можно рекомендовать комплексометрический метод [253], основанный на титровании избытка комплексона III в присутствии индикатора метилтимолового синего с использованием фторида для повышения селективности.
0,1 г сплава растворяют при нагревании в НС1 (уд. вес 1,19), раствор разбавляют в мерной колбе до 250 мл. Для определения алюминия отбирают аликвотную часть, содержащую 4—Юлосг алюминия, добавляют 15—30 мл 0,025 М раствора комплексона III и кипятят 2—3 мии. Нейтрализуют аммиаком по бромтимоловому синему до изменения окраски из желтой в зеленовато-голубую. Приливают 5 мл ацетатного буферного раствора с pH 7,0 и оставляют в теплом месте на 10 мин. После охлаждения вводят индикатор метилтимоловый синий (в смеси с KNO3 в соотношении 1 : 100) и титруют 0,025 М раствором соли свинца или цинка до изменения окраски раствора из зеленой в фиолетовую. Прибавляют 20ли 4%-ного раствора NaF, кипятят 2—3 мин., после охлаждения добавляют еще некоторое количество индикатора и подщелачивают разбавленным аммиаком до зеленой окраски уаствора. Выделившийся комплексон III титруют раствором соли свинца или циика. 1 мл титранта соответствует 0,67426 мг алюминия.
Для приготовления буферного раствора разбавляют 50 ли 98%-ной СН3СООН .до 250 мл и добавляют 90 мл NH4OH (уд. вес 0,9); после охлаждения разбавляют водой до 500 мл, прибавляют раствор бромтимолового синего и в случае необходимости— аммиак или кислоту до зеленовато-голубой окраски (pH 7,0—7,2).
Определению алюминия не мешают до 10% Fe (III), Си (II), Со; > 1% Ti мешает. Для 4—10 jus алюминия относительная ошибка метода < 1%, для 1—Змг — ошибка 1%.
Алюминий в никелевых сплавах можно определять алюминоном [697].
Содержание алюминия в пробе должно составлять 3—20 мкг. После растворения образца в возможно малом объеме HNO3 (1 : 1) раствор обрабатывают НС1 (уд. вес 1,19) и выпаривают досуха. Остаток растворяют в бидистиллате и переводят в делительную воронку. Устанавливают pH 5,2 при помощи ацетатного буферного раствора (470 мл NH4OH (уд. вес 0,9) и 430 мл ледяной СН3СООН разбавляют водой до ] л). Добавляют 2 мл 5,7%-ного раствора диэтилдитиокарбамината натрия и экстрагируют 15—20 мл этиленхлорида, СНС13 или трихлорэтилена. Экстракцию повторяют (добавляя каждый раз по 2 мл, а в конце — 0,5 мл раствора диэтилдитиокарбамината) до тех пор, пока органическая фаза будет совершенно бесцветной. Водную фазу спускают в стакан, нагревают на песчаной бане до исчезновения запаха органического растворителя. Охлаждают, переносят в первую колбу емкостью 50 мл, добавляют 2 мл ацетатного буферного раствора и 2 мл раствора алюминона (0,1 г алюминона и 0,5 г желатина растворяют в 50 мл бидистнллата, добавляют 10 мл ацетатного буферного раствора и 20 мл 2%-ной бензойной кислоты в метаноле и разбавляют бидистиллатом до 100 мл). Колбы ставят на 20 мин. на кипящую водяную баню. После охлаждения растворы доводят до метки бидистиллатом и измеряют оптическую плотность. Содержание алюминия находят по калибровочному графику.
Стандартное отклонение метода i 6%.
Не мешают определению алюминия или количественно отделяются Ni, Со„ Си, Мп, Mo, V, Pb, Zn, Cd, Sn и Si. Металлы W, Ti и Сг требуют дополнительного отделения перед определением алюминия.
Кузнецов и Голубцова [215] предлагали определять алюминий & хромо-никелевых сплавах с арсеназо после удаления мешающих элементов электролизом на ртутном катоде и осаждением в виде купферонатов.
Определение алюминия в титане и титановых сплавах
Алюминий в металлическом титане можно определять фотометрически алюминоном [545, 649, 655] и метилтимоловым синим [431].
Во всех этих методах титан и некоторые другие металлы, содержащиеся в металлическом титане в виде примеси, предварительно отделяют в виде купферонатов фильтрованием [545, 649] или экстрагированием [431, 655] их. Наиболее эффективен метод отделения мешающих элементов экстрагированием их купферонатов, предложенный Корбетом [655].
0,5 г металлического титана растворяют в 30 мл 57VHC1 при нагревании. После растворения объем раствора доводят до 20 ли при помощи НС1 (уд. вес 1,19) и разбавляют водой до 100 мл. Добавляют 2 г NH4C1 и охлаждают до 10° С. Раствор переводят в делительную воронку емкостью 500мл и добавляют 80 ли 9%-ного, раствора купферона. Энергично встряхивают 1 мин. для коагуляции осадка. Спустя 5 мин. добавляют 50 мл СНС13 и встряхивают 1 мин. После разделения слоев хлороформный слой сливают, из водного слоя повторяют экстрагирование-титана, прибавляя 5 мл раствора купферона и 25 мл СНС13. Экстрагирование.-повторяют до тех пор, пока оба слоя не станут бесцветными.
Водный слой фильтруют через бумажный фильтр, выпаривают почти досуха: и разбавляют водой до 20 мл. Устанавливают pH 3,5, прибавляя НС1 или NH4OH (измеряя pH с помощью pH-метра). Раствор охлаждают до 10° С, переносят в делительную воронку, приливают 2 мл раствора купферона, встряхивают 1 мин. и оставляют стоять на 5 мин. Добавляют 10.и л СНС13 и встряхивают 1 мин. После разделения слоев хлороформный слой сливают в платиновую чашку. Экстрагирование повторяют дважды, используя по Юлы СНС13. УдаляютСНОзвыпариванием и сжигают органические вещества при 500° С.
К остатку в платиновой чашке приливают 5 мл НС1 (уд. вес 1,19) и нагревают до полного растворения. Раствор переносят в мерную колбу емкостью 50 мл,. споласкивают чашку30мл воды. Добавляют Юли 20%-ного раствора СНзС00ИН4 и 5 мл 0,2%-ногораствора алюминона. pH раствора доводят до 4,9—5,0, прибавляя разбавленные растворы НС1 или NH4OH (pH измеряют с помощью рН-метра). Объем раствора доводят до 50 мл и измеряют оптическую плотность на фотоколориметре в кюветах I = 1 см с зеленым светофильтром.
Относительная ошибка метода 10% *.
В приведенной методике многие мешающие элементы отделяются от алюминия. Несмотря на это, Банерджи [545] предлагает вводить
* По нашему мнению, в методе Корбета целесообразно изменить операцию приготовления окрашенного раствора. Лучше использовать «составной» алюминоновый раствор и нагревать для ускорения развития окраски (см. методику на стр. 95). Такой метод приготовления окрашенного раствора рекомендуется в других двух работах по определению алюминия в титане алюминоном [545, 649].
219.
в растворы перед добавлением алюминона тиогликолевую кислоту для маскирования следов элементов, которые неизбежно вводятся вместе с реагентами.
По методике Банерджи к подготовленному для определения алюминия раствору (после операций отделения) добавляют 1 мл 1 %-ного раствора тиогликолевой кислоты. Спустя 5 мин. вводят 1 каплю 0,1%-ного раствора метакрезолпурпуро-вого и аммиак (1 : 1) до исчезновения красной окраски. Объем раствора доводят до 25 мл, добавляют 15 мл «составного» алюминонового раствора и далее продолжают как описано выше (см. стр. 219).
Метод определения алюминия с метилтимоловым синим рассматривается в работе [431]. В этом методе многие мешающие элементы также удаляют с помощью купферона. Для повышения селективности метода использован комплексон III.
В титановых сплавах алюминий можно определять комплексометрическим методом с индикатором ксиленоловым оранжевым [1083, 1173].
После растворения сплава отбирают от раствора аликвотную часть, содержащую 2—40 мг титана и 2—70 мг алюминия, разбавляют водой до 1Q0 мл, прибавляют 20—50 мл 20%-ного раствора триэтаноламина, 2 М раствор №ОН до обесцвечивания смеси и кипятят 1 мин. Осадок отфильтровывают, промывают сначала 1%-ным горячим раствором триэтаноламина, а затем 2 раза водой. Фильтрат после отделения Ti (ОН)4 подкисляют HNO3 (1 : 4) до pH 4, прибавляют избыток комплексона III, вводят уротропин до pH 5—5,5 и титруют раствором Pb (NOs)a с индикатором ксиленоловым оранжевым, используя NaF для повышения селективности [1083].
Определение алюминия в магнии и магниевых сплавах
Алюминий в магнии лучше всего определять фотометрическим методом с алюминоном. Этот метод можно успешно применять и к анализу магниевых сплавов.
0,1 г сплава (при анализе металлического магния вес пробы надо увеличить) растворяют в 5мл НС1 (1 : 1), добавляют I—2 капли 30%-ной Н2О2 и нагревают до полного растворения. Раствор кипятят до объема 2 мл, охлаждают и разбавляют в мерной колбе до 500 мл. Аликвотную часть раствора, содержащую 0,02—0,06 мг алюминия (при анализе металлического магния можно определять из всего раствора), переводят в мерную колбу емкостью 100 мл и разбавляют водой до 10 мл. Добавляют 15 мл «составного» алюминонового буферного раствора и далее продолжают, как описано выше при анализе медных сплавов [939], см. стр. 216.
В литературе опубликованы также методы определения алюминия с применением 0,2%-ного водного свежеприготовленного раствора с алюминоном; но точность и воспроизводимость такого метода хуже, чем при применении «составного» раствора алюминона.
Как быстрый и точный метод можно рекомендовать дифференциальный спектрофотометрический метод с хромазуролом S [417].
0,1 г сплава растворяютв 2мл НО (1 : 1). Раствор разбавляютв мерной колбе до 500 мл и для определения отбирают 5 мл раствора в мерную колбу емкостью 100мл. Приливают последовательно 2мл 1%-ного раствора аскорбиновой кислоты,
5 мл 0,1 N НО, воду до объема—50 мл, 5 .ил 0,12%-ного раствора хромазурола S, 5 мл 2 -V раствора CH3COONa и доводят до метки водой.
Через 10 мин. измеряют оптическую плотность на спектрофотометре при 545 нм в кювете I = 1 см по отношению к раствору, содержащему 0,075 мг алюминия. Содержание алюминия находят по калибровочному графику. Для составления графика берут 0,080; 0,085; 0,090; 0,095 и 0,100л«г алюминия, готовят окрашенные растворы и оптические плотности измеряют по отношению к раствору, содержащему 0,075 мг алюминия.
Методика составлена применительно к сплавам, содержащим 7,5—10% алюминия. Для сплавов с меньшим содержанием алюминия нужно соответственно увеличить вес пробы.
Относительная ошибка метода ~-1%.
Алюминий в магниевых сплавах можно также определять фотометрическим методом с эриохромцианином R [66, 1156].
При определении содержания алюминия в магниевых сплавах наиболее точные результаты можно получить весовыми методами— юксихинолиновым и бензоатным. При определении оксихинолиновым методом нужно вводить поправку на содержание железа и цинка, а в бензоатном методе — только на содержание железа.
Определение с оксихинолином. 0,1 г сплава, содержащего 7—10% алюминия (при меньших содержаниях берут большую навеску), растворяют в 2 мл НС1 (1 : 1). Раствор разбавляют водой до 100 мл. Холодный раствор нейтрализуют аммиаком до появления мути, которую растворяют, прибавляя по каплям 2 М НС1, и вводят избыток 5—10 капель. Прибавляют 10 мл 2,5%-ного раствора оксихинолина в 5%-ной СН3СООН и медленно при непрерывном перемешивании вводят 12.мл 10%-ного раствора CH3COONa. Далее алюминий определяют весовым (см. стр. 33) или объемным броматометрическим методом.
Определение с бензоатом аммония. 0,5—1 г сплава (в зависимости от содержания алюминия) растворяют в 20 мл НС1 (1 : 1). После растворения сплава вводят 8—10 капель HNO4 (уд. вес 1,4) и раствор кипятят до удаления окислов азота. Если раствор мутный, его фильтруют, собирая фильтрат в стакан емкостью 300 .мл. Фильтр промывают 6—8 раз горячей 2%-ной НС1. Холодный раствор объемом 100—120 мл нейтрализуют аммиаком (1 : 1) до появления неисчезающей слабой мути. Затем прибавляют 1 мл ледяной СН3СООН и 25 мл 25%-ного раствора NH4C1. Медленно при помешивании вводят 30 мл 10%-ного раствора бензоата аммония. Раствор с осадком нагревают до кипения и кипятят не более 5 мин.
Горячий раствор фильтруют через фильтр с белой лентой, стенки стакана тщательно споласкивают и осадок на фильтре промывают 10 раз промывной жидкостью (к 100 мл 10%-ного раствора бензоата аммония добавляют 80мл воды, 20 мл ледяной СН3СООН и разбавляют до 1 л). Фильтр с осадком после подсушивания прокаливают в платиновом или фарфоровом тигле при 1100—1200° С в течение часа.
Содержание алюминия рассчитывают по формуле
% А1 = р1'*00 — (% Fe. 1,43) J -0,5291 ,
где а — вес осадка, г; 1,43 — коэффициент пересчета Fe на Fe2O3; 0,5291 — фактор пересчета А12О3 на Al; b — вес сплава, г.
Относительная ошибка метода 2—3% [66, 467].
Удобны комплексометрические методы, позволяющие определить содержание алюминия в готовых растворах за 10—15 мин. Из них можно рекомендовать прямое титрование с использованием в качестве ин-
221
дикатора ПАН и комплексоната меди [4161, обратное титрование избытка комплексона III раствором Pb (NO3)2 с ксиленоловым оранжевым [66]. В первом методе вводят поправку на содержание цинка, во втором — на цинк и марганец. Как экспресс-метод можно рекомендовать потенциометрическое титрование раствором едкого натра [340, 450а]. Почти все эти перечисленные методы описаны в работе [66].
Определение алюминия в уране, тории, плутонии и их сплавах
Алюминий в уране определяют фотометрическим оксихинолиновым методом [534, 775, 1072].
2 г урана растворяют в 4 мл 127V НС1, раствор нагревают, вводят по каплям HNO3 (уд. вес 1,42) для окисления урана и разбавляют в мерной колбе до метки. К аликвотной части раствора, содержащей 4—150 мкг алюминия, прибавляют 25 мл 30%-ного раствора (NH4)2CO3. Устанавливают pH 8,8—9,2 с помощью NH4OH (уд. вес 0,9) или НС1 (уд. вес 1,19). Вводят 5 мл 8%-ного раствора тиогликолевой кислоты, 5 мл 0,2 7V раствора KCN для связывания урана, железа и других элементов.
Алюминий экстрагируют Ю.ю 3%-ного хлороформного раствора оксихинолина в течение 90 сек. Экстрагирование повторяют еще два раза. Экстракты собирают в мерную колбу емкостью 50 мл, содержащую ~ 1 г Na2SO4, доводят до метки хлороформом и измеряют оптические плотности при 392 нм по отношению к воде [1072].
Метод Грангера [7751 аналогичен и отличается только тем, что для маскирования мешающих элементов применяют тиогликолевую кислоту, комплексон III и карбонатно-цианидную смесь.
В анализируемый раствор вводят 5 капель 92%-ной тиогликолевой кислоты, 4%-ный раствор комплексона 111 в достаточном количестве и карбонатно-цианидную смесь (100 г Na2CO3, 40 г NaHCO3 и 30г KCN (или 23 г NaCN), растворяют в 960 мл теплой воды). Для 2,5—5 г урана нужно 25 мл раствора комплексона 111 и 100 мл карбонатно-цианидной смеси. Эти маскирующие вещества позволяют устранять влияние всех элементов, за исключением Ti, Zr и V. Последние предварительно отделяют экстракцией хлороформом их комплексов с М-бензоил-Ь1-фенил-гидроксиламином [775].
Алюминий в урановых сплавах можно определять комплексометрическими методами, например обратным титрованием раствором цинка по дитизону [833, 1090, 1091]. Уран и железо предварительно отделяют от алюминия на анионите деацидит-FF из растворов с 9 М НС1.
Алюминий в сплавах плутония определяют фотометрическим оксихинолиновым методом после отделения плутония и некоторых других элементов на анионите в виде хлоридных комплексов [705, 850], экстрагированием купферонатов [648] и оксихинальди-натов [8501.
0,5 г (или меньше) сплава растворяют в 5 мл НС1 (уд. вес 1,19) (в конце при нагревании на песчаной бане). Раствор переносят 6 М НО в мерную колбу емкостью 50 мл и разбавляют до метки. Аликвотную часть раствора, содержащую^
ООП
100— 500 мкг алюминия, выпаривают до объема не более 0,5 мл. К холодному раствору добавляют Змл HNO3 (уд. вес 1,4) и продолжают выпаривать до объема 0,2 мл. Добавляют 5 мл НС1 (уд. вес 1,19) и снова нагревают до выделения газов. Охлаждают раствор до комнатной температуры и переносят на колонку с анионитом.
Колонку диаметром 6 мм заранее заполняют анионитом дауэкс 1 X 8 до высоты 12,5см и промывают смесью 12 Л4 по НС1 и 0,12 М по HNO3 (3 раза по 5 мл). Раствор пропускают через колонку, применяя слабое отсасывание, в мерную колбу емкостью 25 мл со скоростью 40 + 5 капель в 1 мин. Элюат и промывные воды (разбавленная НО) выпаривают почти досуха. Остаток разбавляют водой примерно до 10 мл и нагревают до 00—70° С. Алюминий осаждают 1 мл 2%-ного раствора оксихинолина, 1 мл 1 Л1 раствора KCN и 3 мл 2Л4 раствора CH3COONH4 при перемешивании. Выдерживают осадок при 60— 70°С в течение 15 мин. После охлаждения до комнатной температуры осадок отфильтровывают при отсасывании. Осадок промывают малыми порциями воды, затем растворяют в 15 мл НС1 (уд. вес 1,19), разбавляют водой до 100 мл в мерной колбе и измеряют оптическую плотность при 360 нм по сравнению с водой.
Точность метода характеризуется относительным стандартным отклонением меньше 2%.
По методу Джонса и Филипса [850] плутоний предварительно отделяют на анионите деацидит-FF в нитратной форме. Остающиеся в элюате мешающие элементы удаляют экстракцией их оксихиналь-динатов из аммиачного раствора, содержащего винную кислоту и перекись водорода. Затем экстрагируют оксихинолинат алюминия хлороформом и измеряют оптическую плотность экстракта при 390 нм.
При содержании 0,1—1% алюминия Относительная ошибка <6% [705].
Для определения алюминия в тории можно рекомендовать метод Мидлтона [967].
Первый вариант — маскирование тория 4-сульфобензоарсоновой кислотой. 1 г тория растворяют при нагревании в 50 мл HNO3 (1 : 1) и H2SiFe (1 : 2). Выпаривают избыток HNO3 и разбавляют водой до 100 мл в мерной колбе. Аликвотную часть раствора, соответствующую 0,25 г тория, переносят в химический стакан, содержащий 25 мл разбавленного раствора ацетата (200 г CH3COONH4 и 100 .ил ледяной СН3СООН в 1 л), 20 мл 0,1%-ного раствора о-фенантролина, 1 мл 10%-ного раствора NH2OH-HC1 и 10 мл 0,24 М раствора 4-сульфобензоарсоновой кислоты. Разбавляют водой примерно до 100 мл и pH доводят до 4,8.
Через 15—20 мин. раствор переносят в делительную воронку, встряхивают в течение 3 мин. с 20 мл 1%-ного хлороформного раствора оксихинолина. После разделения слоев экстракт помещают в мерную колбу емкостью 25 мл, содержащую 1—2 г безводного Na2SO4. Хорошо встряхивают, дают стоять 15 мин. для осушения СНС13 и измеряют оптическую плотность при 390 нм по отношению к раствору холостой пробы, проведенной через весь ход анализа.
Второй вариант — маскирование ацетатным раствором. 2—3 г тория растворяют, как в первом варианте. Берут аликвотную часть, соответствующую ~1 г тория, добавляют 1 мл раствора NH2OH-HC1 и 10 мл раствора о-фенантролина. Спустя несколько минут (для полноты образования комплекса Fe (11) с о-фенантро-лином) добавляют 100 мл концентрированного раствора ацетата *. Доводят pH
* Раствор 300 г CH3COONH4 и 300 мл ледяной СН3СООН в 1 л заранее очищают, трижды экстрагируя 1%-ным хлороформным раствором оксихинолина (порции по 100 мл)’, оксихинолин удаляют промыванием хлороформом, применяя также порции по 100 мл.
до 4,8 в делительной воронке, экстрагируют 20 мл хлороформного раствора оксихинолина. Экстракт переносят в делительную воронку, содержащую 25 мл разбавленного раствора ацетата (состав этого раствора приведен выше в первом вари-: анте), 20 мл раствора о-фенантролина, 1 мл NH2OH-HC1 и 50 мл воды. Снова встряхивают, отделяют слой СНС13, сушат его и измеряют оптическую плотность. Если присутствуют Zn, Си, Со и Ni, их влияние устраняют встряхиванием экстракта со 100мл раствора состава: 40aNH4NO3, 20 г KCN и 10мл NH4OH (уд. вес 0,9) в 1 л.
Определение алюминия в других металлах и сплавах
Алюминий в свинце и сурьме определяют по методу Люка [938] с алюминоном, а в металлическом серебре — с помощью стильбазо [150]. В кальции алюминий можно определять фотометрическим оксихинолиновым методом [1188].
Глава V
ОПРЕДЕЛЕНИЕ ПРИМЕСЕЙ
В АЛЮМИНИИ ВЫСОКОЙ ЧИСТОТЫ
Для определения примесей в алюминии высокой чистоты применяют главным образом фотометрические методы. Используются также полярографические, спектральные и радиоактивационные методы. Щелочные металлы определяют методом пламенной фотометрии.
В табл. 16 приведены наиболее важные фотометрические методы определения примесей в алюминии высокой чистоты.
Для определения некоторых примесей предложена амальгамная полярография с накоплением [75, 80, 81, 129, 936]. Определяемые примеси концентрируют осаждением на стационарном ртутном электроде, образовавшаяся амальгама подвергается анодной поляризации. По глубине пиков полярограммы судят о концентрации примеси. Чувствительность метода характеризуется следующими данными:
Элемент |Чувствитель-носгь, % Элемент Чувствительность, % Элемент Чувствительность, %
Си Ю-З—10-6 Ga 10“’ Pb 10-6
Zn 6-IO”5 In 1-10-6 Sb 2-10-5
Cd 2-10-6 Sn 3-10-5 Bi 2-Ю-6
Относительная ошибка составляет 10—20%.
Литий с чувствительностью 10“4% может быть определен методом пламенной фотометрии [1062]. В анализируемые растворы вводят изопропиловый спирт и ацетон. Фотометрируют по линии 670,7 нм в водородно-кислородном пламени. Воспроизводимость метода от 0,0001 до 0,0002% при содержании 0,0003—0,0004%. Метод пламенной фотометрии применяют также для определения натрия 11136]. Для повышения чувствительности метода основную массу алюминия предварительно выделяют в виде А1С13 -6Н2О или три-этилбромида; чувствительность метода 1,2 10'4% при навеске 1 г.
Таблица 16
Фотометрические методы определения примесей в алюминии высокой чистоты
Элемент Реагент Чувствительность, % Относительная ошибка, % Литература
Си Диэтилдитокарбаминат * 2-10"4 [96]
Дитизон * 2-10"4 [96]
Неокупроин * (2,9-диметил-1,10-фенан- 5-Ю'4 5 [740.
тролин) * [197]
Дитиофосфат никеля * 210~3 20 [70, 129]
Оксалилгидразид * ЗЛО-4 20 [66]
Be Ацетилацетон * 10"4 [386а]
Mg Титановый желтый 104 15-20 [129]
Са Глиоксаль-бис-(2-оксианил) 10-3-10“4 15 [129]
Zn Дитизон * 5-10-3 20 [129, 456]
ПАН * 5 [1068]
В Ацетилхинализарин 10"4 10 [300]
1,1-Диантримид 10"4 [870]
Ga Родамин Б 20 [1044]
РЗЭ Арсеназо III [333]
Si Восстановленный кремнемолибдено- 2-10"4 20 [129]
вый комплекс
Кремнемслибденовая кислота * 2 10-* 5-15 [96, 768а]
Ti Диантипприлметан 5 • 10~3 20 [129, 130]
Салицилгидроксамовая кислота * 2-10"4 10—20 [13]
Zr Арсеназо III 10'4 15—20 [129]
Sn Фенилфлуорон 2-10-5 20 [129]
Pb Дитизон * 10'4 10 [66]
P Восстановленный фосфорномолибдено- 10~4 25 [129]
вый комплекс
V n-Фенетидин 2* 2-10"4 10 [911]
Фосфорновольфрамовая кислота 5-10-5 25 [129]
As Молибденовая синь 5-Ю-5 10-20 [129]
Sb Метиловый фиолетовый * 2-10-5 10-15 [129]
Cr Дифеиилкарбазид IO'5 20 [129]
u Арсеназо III * 5-Ю"4 [221]
Mn Перйодат калия IO'5 20 [129]
Fe о-Фенантролин ю-4 20 [129]
» 5•10"4 [839]
Роданид и антипирин * 2-10"4 5 [1210]
Ni а-Фурилдиоксим * 5-10-5 20 [66]
* Экстракционно-фотометрический метод.
** Каталическая реакция окисления хлоратом калия.
При использовании спектрального метода некоторые примеси можно определять непосредственно без обогащения, но чаще всего их приходится предварительно концентрировать. Без обогащения определяют Mg, Си и Si с чувствительностью 5-10-5%, 2-10“5% и 2-10“4/o соответственно [129]. Дегтярева и др. [103] определяют примеси 34 элементов в алюминии высокой чистоты без обогащения.
Анализ проводят методом фракционной дистилляции из угольных электродов в дугу постоянного тока. Спектры возбуждают при двух режимах дуги — при токе 7 а в течение 20 сек. и при 12 а в течение 30 сек. Таким образом.разделяют легколетучие и труднолетучие элементы, что позволяет повысить чувствительность анализа труднолетучих элементов без уменьшения чувствительности определения легколетучих элементов. Спектры регистрируют одновременно на двух спектрографах ИСП-22 и ИСП-51 с камерой F-270, отфокусированных на один источник света. Внутренним стандартом служит золото.
С целью концентрирования примесей основную массу алюминия выделяют в виде А1С13-6Н2О по методу Гуча и Хэвенса [766] обработкой раствора хлористым водородом [76, 129, 162, 610]. Концентрат упаривают до малого объема и после высушивания в виде смеси с угольным порошком вводят в разряд методом вдувания [76, 129], или же по методу Карабаша и др. [162]. По последнему методу остатки алюминия переводят в нитрат, выпаривают, прокаливают до А12О3. Затем в кратер угольного электрода вводят 40 мг концентрата (А12О3 с примесями), смачивают двумя каплями 20%-ного спиртового раствора бакелита и сушат на электроплитке. Бакелит предохраняет пробу от выбрасывания. При этом достигается такая чувствительность:
Элемент Чувствительность, % Элемент Чувствительность, % Элемент Чувствительность, %
Be, Cd 6.10-6 Ва 4-10--> Mn, Cu 5.10-6
Mg 10'5 V, Со, Ni, Sb 4-Ю-5 Zn 2-10-‘
Са, Ti 6.10-5 Mo, Pb, Sn 2-Ю-5
Чувствительность для кремния по данным работы [76] составляет 2-10-4%. Относительная ошибка 20%.
Примеси можно концентрировать испарением их в вакууме; предварительно анализируемый раствор выпаривают и прокаливают алюминий до А12О3 [129]. Чувствительность определения Fe и Si составляет 10“4%, Си, Mg, Ti, Pb — 10“5%; Мп, Sn, Ag — 10-в%. Примеси концентрируют также отгонкой в высоком вакууме без растворения образца [438].
Методом испарения при 1100—1150° С и осаждением на медном электроде, снабженном холодильником, можно определять цинк до содержания 4-10"7% при навеске 5г с относительной ошибкой 15% 11009].
Примеси в алюминии для спектрального определения можно концентрировать и следующими способами.
997
1/~ 9 Аналитическая химия алюминия
Осаждение тиоацетамидом в щелочном растворе, с коллектором Т1+ (1067]; по этому методу концентрируются Ca, Cd, Со, Cr, Си, Fe, Mg, Мп, Ni, Pb, Ti, Zn. В качестве внутреннего стандарта вводят бериллий.
Осаждение пирролидиндитиокарбаминато.м аммония и тионалидом в уксуснокислой среде (pH 4) с коллектором Т1+ [1067]; осаждаются Cd, Со, Си, Fe, Ga, Мо, Ni, Sb, Sn, V, Zn. Внутренним стандартом служит также бериллий.
Удаление алюминия отгонкой в виде металлорганического соединения при обработке с помощью CjHjBrflOlO], Остаток растворяютв HNO3, добавляют угольный порошок, 30 .иг In, смесь высушивают и прокаливают. Метод позволяет определять до 2-10-6—5-10“5% Fe, Си, Сг, Ag, Pb, Мп, Со и Ni.
Концентрирование примесей экстрагированием их пирролидиндитиокарба-минатов и дитизонатов хлороформом [879]. Чувствительность метода I0-5—10~3%; относительная ошибка 5—15%.
Примеси Си, Cd, Ag, Zn, Pb и Au концентрируют на коллекторе Вi2S3. Чувствительность определения: 3-10~7% Ag, 2-10-е% Си, Pb, 8-КГ7 % Cd, 6-10~5% Zn, 8-10“6% Аи. Относительная ошибка 20—40% [129].
Опубликовано более 40 работ по определению примесей в алюминии высокой чистоты активационным методом. Анализируемый образец и эталоны облучают в ядерном реакторе потоком нейтронов 1012 — 1013 нейтрон! см2 сек и измеряют активности образующихся при этом радиоактивных изотопов с помощью сцинтилляционного у-спектрометра. Время облучения (в зависимости от определяемых примесей) от нескольких часов до нескольких недель. Большей частью предварительно разделяют примеси на группы различными методами: осаждением на носителях, экстракцией, ионообменной хроматографией. Известен метод определения примесей с использованием у-спектрометрии и без химического разделения; селективность метода при определении отдельных элементов достигается выбором соответствующего времени облучения и охлаждения [5951. Предложен метод активационного анализа без разрушения образца с применением Ge (Li)-детекторов у-излучения, обладающих высокой разрешающей способностью [1093].
Чувствительность определения отдельных элементов активационным методом: 10~3% Ti, 8 10-4% О2, 10~4% Fe, Si, 5-10~5% С, Zr, V, 10“®—10“8% Си, Ag, Au, Zn, Cd, Sc, Ga, Sn, Th, U, P, As, Sb, Мп, Co. Относительная ошибка 10—50%.
В некоторых методах для облучения использованы протоны с энергией 17 мэв (в циклотроне) (определение Fe, Со и Ti). Облучают также дейтронами в циклотроне, а-частицами (для кислорода и углерода), ядрами Не-3 (определение кислорода и циркония) и жесткими у-лучами в бетатроне (определение кислорода).
Для определения примесей в алюминии высокой чистоты предложены также масс-спектрографический метод [717, 965] с чувствительностью 10 е ат. %, относительной ошибкой 15—20% и рентгенофлуоресцентный метод для определения ванадия с чувствительностью 2 10“4% [911]. Водород определяют методом вакуум-плавления. Углерод можно определять методом сожжения и потенциометрическим титрованием раствором Ва (ОН)2 [714]; чувствительность метода 10~4%.
ЛИТЕРАТУРА
1. Абарбарчук И. Л., Костицына К- П., Скобец Е. М. Почвоведение, № 2, 114 (1962).
2. Авая, Миёси, Мотодзима. Бунсэки кагаку, 6, 503 (1957); РЖХим., № 8, 24887 (1958).
3. Агафонова В. И., Рязанов И. П. Изв. вузов СССР. Химия и хим. технол., 10, 1200 (1967).
4. Агринская Н. А. Зав. лаб., 23, 279 (1957).
5. Агринская Н. А., Петрашень В. И. Труды Новочеркасского политехи, ин-та, 31, 45, 63 (1955).
6. Агринская Н. А., Петрашень В. И. Труды Новочеркасского политехи, ин-та, 72, 13 (1959).
7. Адамович А. П., Моргуль-Мешкова О. В., Юцис Б. В. Ж-, аналит. химии, 17, 678 (1962).
8. Айзенберг Н. Н. Труды Всес. ии-та н.-и. и проект, работ огнеуп. пр-стн, вып. 37, 115 (1965).
9. Аксельруд Н. В., Фиалков Д. А. Укр. хим. ж., 16, 283 (1950).
10. Алекперов Р. А., Гейбатова С. С., Ахундова 3. А. Азерб. хим. ж., № 6, 123 (1964).
11. Алимарин И. П., Абдель Разик Ф. А., Каменев А. И. Зав. лаб., 34, 160 (1968).
12. Алимарин И. П., БолыиоваТ. А., ЕршоваН. ИКиселева А. Д. Вестник МГУ, Химия, № 4, 55(1967).
13. АлимаринИ.П., БорзенковаН. П.,ЗакаринаН. А. Зав. лаб., 27, 958 (1961).
14. Алимарин И. П., Гибало И. М. Ж. аналит. химии, 11, 389 (1956).
14а. АлыковН.М., Казаков Б. И., Черкесов А. И. Сб. «Физико-химические исследования природных сорбентов и ряда аналитических систем». Саратов, Изд. Саратовского ун-та, 1967, стр. 87.
15. Арикова И. Бунсэки кагаку, 9, 806 (1960); РЖХим., 12 Д 79 (1961).
16. Артемьева В. Д. Зав лаб., 30, 1331 (1964).
17. Артемьева В. Д. Зав. лаб., 33, 426 (1967).
18. Астанина А. С., Пономарев А. И. Сб. «Проблемы большой металлургии и физической химии новых сплавов». М., «Наука», 1965, стр. 300.
19. Ахмедли М. К-, Баширов Э. А. Уч. зап. Азербайджанского ун-та № 7, 25 (1955).
20. Бабаева А. Е., Евстафьева О. Н. Ж. аналит. химии, 13, 304 (1958).
21. Бабачев Г. Н. Ж- аналит. химии, 13, 716 (1958).
22. Бабачев Г. И., Николаева А. Строит, материали и силнкатна пром-ст., 7, 18 (1966).
23. Бабачев Г. Н., Петрова М., Раева Л. Научн. сообщ. Гос. Всес н.-и. ин-та цементи. пром-сти, № 17 (48), 60 (1964).
24. Бабенышев В. М., Кузнецова О. М. Ж. аналит. химии, 15, 568 (1960).
25. Бабко А. К- Ж. прикл. химии, 12, 1560 (1939).
26. Бабко А. К. Науков! зап. Ки1в. держ. ушв., 2, 59 (1936).
27. Бабко А. К- Науков! зап. Ки1в. держ. ушв., 3, 49 (1937).
9* 229
28. Бабко А. К., Волкова А. И., Гетьман Т. Е. Ж. аиалит. химии, 22, 1004 (1967).
29. Бабко А. Д., Гридчина Г. И. Ж. прикл. химии, 36, 1722 (1963).
30. Бабко А. К., Дубовенко А. И. Ж. иеорган. химии, 2, 1924 (1957).
31* . Бабко А. К... Золина А. И. Бюлл. Всесоюзного и.-и. ин-та минерального сырья, № 11, (187), 4 (1958).
32. Бабко А. К., Михальчихин Т. Т. Укр. хим. ж., 22, 676 (1956).
33. Бабко А. К., Назарчук Т. К. Укр. хим. ж., 20 , 678 (1954).
34. Бабко А. К., Пилипенко А. Т. Колориметрический анализ. М.— Л., Гос-химиздат, 1951.
35. Бабко А. Д., Пилипенко А. Т., Пятницкий И. В., Рябушко О. П. Физико-химические методы анализа. М., «Высшая школа», 1968.
36. Бабко А. К., Рычкова Т. Н. Ж. общ. химии, 18, 1617 (1948).
37. Бабко А. К., Чалая 3. Н., Дкумова М. А. Авт. свид. СССР, № 154433, 1963; Бюлл. изобр. № 9, 1963.
38. Бадеева Т. И., Молот Л. А., Фрумина Н. С., Петрикова К. Г. Уч. зап. Саратовского ун-та, 75, 100 (1962).
39. Барбаш Т. Л., Петрова Н. П., Силаева Е. В. Труды ВНИИСО*, 2, 108 (1964).
40. Барбаш Т. Л., Ханова Т. Ф. Труды ВНИИСО, 1, 56 (1964).
41. Баусова И. В. Труды Ин-та металлургии Уральского филиала АН СССР, вып. 3, 125 (1959).
42. Башкирцева А. А. Кандидатская диссертация. Свердловск, Уральский политехи, ин-т, 1956.
43. Башкирцева А. А. Труды Уральского политехи, ин-та, сб. 130, 89 (1963).
44. Башкирцева А. А., Прудникова Л. Д. Зав. лаб., 26, 1107 (1960).
45. Башкирцева А. А., Якимец Е. М. Зав. лаб., 25, 1166 (1959).
46. Башкирцева А. А., Дкимец Е. М. Труды Уральского политехи, ин-та, сб.
58, 76 (1957).
47. Безуглый В. Д. Зав. лаб., 25, 277 (1959).
48. Белецкий М. С., Дружинина И. К., Янковская В. Г. Сб. «Титан и его сплавы», вып. 8. М., Изд-во АН СССР, 1962, стр. 247.
48а. Белькевич Я- П. Руководство по спектральному анализу металлов. Л., Судпромгиз, 1955.
49. Белявская Т. А., Чмутова М. Д. Научи, докл. высш, школы. Химия и хим. технол., № 2, 305 (1958).
50. Беляева И. И. Почвоведение, № 2, 106 (1966).
51. Берг Р. Применение о-оксихинолина в аналитической химии. М.,ОНТИ, 1937.
52. Беркович М. Т., Сирина А. М., Лагунова Н. Л. Труды Уральского н-и. хим. ин-та, вып. 11, 26 (1964).
53. Берлинов X. Строит, материали и силикатиа пром-ст, 6, № 2,19 (1965).
54. Бильтюкова Э. П., Есечко А. М. Стекло. Бюлл. Гос. н.-и. ин-та стекла, № 4, (ИЗ), 27 (1961).
54а. Богданова В. Т., Таганов К. И. Сб. «Современные методы анализа в металлургии». М., Металлургиздат, 1955.
55. Богина Л. А., Мартюхина И. П. Каучук и резина, № 10, 34 (1961).
56. Божевольнов Е. А. Труды Всес. н.-и. ии-та хим. реактивов, вып. 22, 70 (1958).
57. Божевольнов Е. А., Серебрякова Г. В. Сб. «Методы анализа химических реактивов и препаратов», вып. 11. М., Издание ИРЕА, 1965, стр. 15, 19.
58. Божевольнов Е. А., Янишевская В. М. Ж. Всес. хим. об-ва им. Д. И. Менделеева, 5, 356 (1960).
59. Бондарева Э. Г., Шардакова М. А., Кобяк Г. Г. Уч. зап. Пермского уи-та, № 141, 279 (1966),
* Всесоюзный научно-исследовательский институт стандартных образцов И спектральных эталонов.
60. Боровик С. А., Бабаева А. В., Ушакова Н. И., Рудый Р. И. Ж. аиалит. химии, 13, 580 (1958).
61. Бриттон X. Т. С. Водородные иоиы. М.— Л., ОНТИ, Химтеорет., 1936.
62. Бродская В. М. Сб. «Методы химического анализа минерального сырья», вып. 8. М., «Недра», 1965, стр. 5.
63. Бруйле Е. С. Ж- прикл. химии, 39, 1192 (1966).
64. Бруйле Е. С., Домбровская Н. С. Ж. прикл. химии, 36, 2305 (1963).
65. Буданова Л. М., Володарская Р. С. Зав. лаб., 19, 157 (1953).
66. Буданова Л. М., Володарская Р. С., Канаев Н. А. Анализ алюминиевых и магниевых сплавов. М., «Металлургия», 1966.
67. Будешинский Б. Ж- аналит. химии, 18, 1071 (1963).
68. Бузланова М. М., Курочкина Н. А. Зав. лаб., 31, 947 (1965).
69. Бусев А. И. Ж. аналит. химии., 8, 299 (1953).
70. Бусев А. И., Борзенкова Н. П. Зав. лаб., 27, 13 (1961).
71. Бусев А. И., Петренко А. Г., Быховская И. А. Зав. лаб., 27, 659 (1961).
71а. Бусев А. И., Сухорукова Н. В., Терземан Л. К-, Бабенко Н. Л. Вестник Московского ун.-та. Химия, № 2, 1968, стр. 119.
716. Буянов Н. В., Попова Т. А., Бабаев М. В., Назаренко В. Ф. Зав. лаб., 18, 299 (1952).
72. Вакамацу С. Бунсэки кагаку, 9, 238 (1960); РЖХим., № 20, 80742 (1960).
73. Вакамацу С. Тэцу то хаганэ, 44, 1067 (1958); РЖХим., № 9, 3107 (1959).
74. Вакамацу С. Тэцу то хаганэ, 47, 298 (1961); РЖХим., 6 Д 155 (1962).
75. Васильева Л. Н., Виноградова Е. Н. Ж. аналит. химии, 18, 454 (1963).
76. Васильева Л. С., Громошинская Т. Ф. Ж- прикл. спектроскопии, 1, 324
(1964).
77. Васильев К- А. Зав. лаб., 6, 432 (1937).
78. Вербицкая В. А., Степин В. В.,Онорина И. А., СтуденскаяЛ. С. Труды ВНИИСО, 2, 52 (1965).
79. Верный Е. А., Егоров В. Н. Ж. аналит. химии, 15, 24 (1960).
79а.Веселовская И. М. Зав. лаб., 15, 940 (1949).
80. Виноградова Е. Н., Васильева Л. Н. Ж- аналит. химии, 17, 579 (1962).
81. Виноградова Е. Н., Васильева Л. Н., Иобст К. Зав. лаб., 27, 525 (1961).
82. Витальская Н. М., Пантаева Н. Ф. Каучук и резина, № 6, 53 (1962).
83. Владимирова В. В., Сонгина О. А. Информация Гиредмета, № 10, 84 (1959).
84. Власов Н. А., Морген Э. А. Изв. физ-хим. н.-и. ин-та при Иркутском ун-те, 6, 200 (1964).
85. Волков И. И., Остроумов Э. А. Ж. аналит. химии, 19, 1223 (1964); Труды Ин-та океанологии АН СССР, 79, 81 (1965).
85a.Волков И. Н., Остроумов Э. А. Ж- аналит. химии, 23, 863 (1968).
86. Вен Юань-кай, Ли Хувй-чжень. Яосюэ сюэбао, 7, № 3, 99 (1959); РЖХим., № 3, 8828 (1960).
87. Гайбакян Г. С. Изв. АН Арм. ССР, Биол. и с-х. н., 9, 67 (1956); РЖХим., № 5, 15767 (1957).
88. Гапоненков Г. К-, Проценко 3. И. Ж. неорган. химии, 9, 841 (1964).
89. Гиллебранд В. Ф., Лендель Г. Э., Брайт Г. А., Гофман Д. И. Практическое руководство по неорганическому анализу. М., Госхимиздат, 1960.
90. Головатый Р. Н. Укр. хим. ж., 24 , 653 (1958).
•91. Головатый Р. Н., Котовская М. Н. Укр. хим. ж., 25, 791 (1959).
92. Головина А. П., Алимарин И. П., Кузнецов Д. И., Филюгина А. Д. Ж. аналит. химии, 21, 163 (1966).
93. Голубцова Р. Б. Ж. аналит. химии, 12, 420 (1957).
94. Гордеева М. Н., Просвиряков В. Д. Уч. зап. ЛГУ, № 297, 5 (1960).
95. Горелова А. А., Поляк Л. Д. Зав. лаб., 25, 285 (1959).
96. Городенцева Т. Б., Долгорукова Г. С., Ворожбацкая К- Ф., Вербицкая В. А., Студенская Л. С., Шварев В. С. Труды ВНИИСО, 2, 34 (1965).
97. Госима Амо. Тиру дайгаку гакугэй гакуоу кэикю хакоку, 1, 496 (1957); РЖХим, № 23, 77162 (1958).
98. Гото, Такэяма. Нихои киидзоку гаккайси, 20, 212 (1956); РЖХим., № 6, 19644 (1957).
231
99. Гохштейн Я- П. Зав., лаб., 5, 28, 158 (1936).
99а. Гранберг И. А., Сухенко К- А., Развязкина К-А., Либерман Р. Г., Серебряная Р. Г. Зав. лаб., 17, 1093 (1951).
100. Грищенко М. П„ Шаевич А. Б. Изв. АН СССР, Сер. физ., 19, 203 (1955).
101. Давыдов А.Л., Девекки В. С. Зав. лаб., 10, 134(1941).
102. Дандзука Т„ Уэно К- Буисэки кагаку, 8, 126, (1959); РЖХим., № 11, 42359 (1960).
103. Дегтярева О. Ф., СиницынаЛ. Г., Проскурякова А. Е. Ж. аиалит. химии, 18, 510 (1963).
104. Денисова И. Е., Цветкова Е. В. Зав. лаб. 27, 656 (1961).
105. Долаберидзе Л. Р., Политова Ю. В., Гвелесиани Л. Т., Джалиашвили А. Г. Зав. лаб., 30, 1439 (1964).
106. ДолаберидзеЛ. Р., Политова Ю. В., Гвелесиани Л. Т., Джалиашвили А. Г. Труды Кавказского ии-та минералки, сырья, вып. 5 (7), 81 (1963).
107. Дорош В. М. Сб. научных трудов Иркутского и.-и. ии-та редк. мет., вып. 8. 38 (1959).
107а. Дубинский И. Г., Ерко В. Ф. Зав. лаб., 25, 1483 (1959).
108. Дубова О. А., Бегельфед К- П., Сазонова П. А., Фунтикова К- М. Стекло и керамика, № 9, 49 (1960).
109. Дуброво С. К- Ж. прикл. химии, 25, 1151 (1952).
ПО. Дымов А. М., Коренева В. В. Изв. вузов СССР. Черная металлургия, № 3, 192 (1961).
111. Евзлина Б. Б. Сообщ. о и.-и. работах и новой технике и.-и. ии-та по удобрениям и иисектофуигисидам, вып. 8, 87 (1958).
112. Егорова Л. Г. Труды Ии-та металлургии и обогащения АН КазССР, 12, 151 (1965).
113. Ерко В. Ф., Бугаева И. И. Физ. сб. Львовского уи-та, вып. 4(9), 490 (1958).
113а.Ермакова М. Д., Яковлева 3. Д. Зав. лаб., 23, 592 (1957).
114. Ермолаева Е. В., Коробка Л. А. Бюлл. иаучио-техи. ииформ. Всес. и.-и. ии-та огнеупоров, 2, 84 (1957).
115. Жаровський Ф. Г. Наук зап. Ки1вськ. уи-та, 16, № 15, 147 (1957).
116. Жданов А. К-, Кожевников И. В. Зав. лаб., 18, 529 (1952).
117. Жень Цзин-Хуэй, Тао Цзун-сян. Хуасюэ шицзе, 13, 210 (1958); РЖХим., № 15, 53124 (1959).
118. Живописцев В. П., Калмыкова И. С., Пятосин Л. П. Уч. зап. Пермского унта, 25, вып. 2, 108 (1963).
119. Живописцев В. П., Минин А. А. Зав. лаб., 26, 1346 (1960).
120. Жуковская С. С. Зав. лаб., 3, 102 (1934).
121. Жуковская С. С., Балюк С. Т. Зав. лаб., 3, 485 (1934).
122. Забияко В. И., Булычева И. Б. Труды Уральского и.-и. хим. ии-та, вып. 11, 82 (1964).
123. Забияко В. И., Салтыкова М. Б. Зав. лаб., 29, 652 (1963).
124. Забияко В. И., Салтыкова М. Б. Труды Уральского и-и. хим. ии-та, вып.
11, 5 (1964).
125. Зайдель А. И. Основы спектрального анализа. М., «Наука», 1965.
126. Зайдель А. И., Прокофьев В. К,., Райский С. М., Шрейдер Е. Д. Таблицы спектральных линий. М., Физматгиз, 1962.
127. Занько А. М. Доповщ! АН УССР, 6, 27 (1940).
128. Занько А. М., Бутенко Г. А. Зав. лаб., 5, 415 (1936).
129. Зинченко В. А., Потапова Т. А. Сб. «Методы анализа веществ высокой чистоты». М., «Наука», 1965.
130. Зинченко В. А., Рудина С. И. Зав. лаб., 27, 956 (1961).
131. Золотавин В. Л., Санников Ю. И. Труды Уральского политехи, ии-та, сб. 81, 228 (1959).
132. Золотухин В. К- Ж. аиалит. химии, 12, 271 (1957).
133. Ивамото Т. Буисэки кагаку, 10, 190 (1961); РЖХим., 1 Д 41 (1962).
134. Иванова 3. И., Коваленко П. И., Эристова М. Г., Ипатова Л. С. Сб. «Физико-химические методы анализа и контроля производства». Ростов-н/Д, Ростовский ун-т, 1961, стр. 164.
OQQ
135. Иванова Й. Годишиик Н.-и. ии-та металлургия и обогат., 2, 167 (1961).
136. Иванов Б. Т., Безяйко С. М. Зав. лаб., 15, 511 (1949).
137. Ивасаки И., Омори Т. Когё ёсуй, №М, 30 (1963); РЖХим., 11 Г 90 (1964).
138. Ижак И. Г. Зав. лаб., 30, 1449 (1964).
139. Иида М. Буисэки кагаку, 9, 209 (1960); РЖХим., № 21, 84427 (1960).
140. ИноуэТ. Когё ёсуй, № 34, 34 (1961); РЖХи1*., 15 Д 50 (1962).
141. Исибаси М., Сигэмацу Т., Нисикава И. Буисэки кагаку, 6, 568 (1957); РЖХим, № 9, 28419 (1958).
142. Исибаси М., Сигэмацу Т., Нисикава И. Нихои кагаку дзасси, 81, 259 (1960); РЖХим, № 21, 84424 (1960).
143. Исики Й. Буисэки кагаку, 14, 1120 (1965); РЖХим., 13 Г 103 (1966).
144. Итикуни М. Буисэки кагаку, 13, 1040 (1964); РЖХим., 13 Г 113 (1965).
145. Ито С., Хаяси К-, Удзумаса Я- Буисэки кагаку, 12, 257 (1963); РЖХим., 21 Г 41 (1963).
146. Йонэяма Й., Камада Т. Буисэки кагаку, 10, 187 (1961); РЖХим., 21 D 51 (1961).
147. Йорданова Н., Пройнова 3. Строит, материали и силикатиа пром-ст., 8, № 21 (1967).
148. Йосимура Т., Ногути X., Хара X. Киидзоку хёмэи гидзюцу, 18, 333 (1967); РЖХим., 10 Г 59 (1967)
149. Кабанник Г. Т., Назарчук Т. Н. Зав. лаб., 28, 546 (1962).
150. Кабанова О. Л., Дедюшенкова М. А. Ж. аиалит. химии, 18, 780 (1963).
151. Кабанов Б. Н., Поляк. Л. Я- Ж. аиалит. химии, 13, 538 (1958).
152. Кавагути X., Накадзима Т., Такахаси М. Дэики сикэисё ихо, 22, № 3, 175(1958); РЖХим., № 1, 1008 (1959).
153. Казаков Б. И., Емжин В. В., Черкесов А. И. Зав. лаб., 33, 697 (1967).
154. Казаков Б. И., Пушинов Ю. В. Сб. «Новые исследования по аналитическому пр 1менеиию органических реагентов». Саратов, 1967, стр. 15.
155. Казанцев Е. И., Соколова К- В., СосновскихЛ. К- Труды Уральского политехи. ии-та, № 14837 (1966).
156. Какита Я-, Судо Э., Намики М. Нихои киидзоку гаккайси, 24, 363 (1960); РЖХим, 11 Д 174 (1961).
157. Какита Я-, Хосоя М., Амано М. Нихои киидзоку гаккайси, 21, 551 (1957); РЖХим., № 11, 35897 (1958).
158. Калина В. И., Леве И. Ф. Бюлл. иаучио-техи. информации Украинского и.-и., ии-та металлов, № 3, 92 (1957).
159. Каменский Д. М. Зав. лаб., 24, 755 (1958).
160. Каменский Д. М., Никифорова К- И. Зав. лаб., 28, 413 (1962).
161. Капустина А. И., Константинова И. М., Михеева 3. И. Труды Вост.-сиб. фил. АН СССР, вып. 43, 90 (1962).
162. Карабаш А. Г., Пейзулаев Ш.И., Слюсарева Р. Л., Мешкова В. М. Ж- аиалит. химии, 14, 598 (1959).
163. Каролев А. Н., Койчев М. К- Зав. лаб. 25 , 546 (1959).
164. Кашковская Е. А., Мустафин И. С. Зав. лаб., 24, 1189 (1958).
165. Киносита С. Буисэки кагаку, 14, 1154 (1965); РЖХим., 16 Г 127 (1966).
166. Классово Н. С. Ж. аиалит. химии, 20, 1747 (1950).
167. Клейнер К- Е. Ж. общ. химии, 20, 1747 (1950).
168. Климов В. В., Дидковская О. С., Козаченко В. И. Зав. лаб., 28, 952 (1962).
169. Коваленко И. Н. Уч. зап. Ростовского и/Д уи-та, 40, 45 (1958).
170. Коваленко И. Н. Уч. зап. Ростовского и/Д уи-та, 60, 87 (1959).
171. Коган Д. И. Научные труды Иркутского и.-и. ии-та редк. мет., вып. 11,
48 (1963).
172. Кодзима. Буисэки кагаку, 6, 369 (1957); РЖХим., № 4, 11031 (1958).
173. Козлова А. А., Портнов М. А. Зав. лаб., 9, 287 (1940).
174. Кокорин А. И., Ропот В. М. Уч. зап. Кишиневского уи-та, 56, 105 (1960).
175. Колбовский Ю. Я., Крижановская М. К- Физ. сб. Львовского уи-та, вып. 4 (9), 402 (1958).
176. Колечкова А. Ф., Останина Н. М. Труды Всес. ии-та и.-и. и проекта, работ огиеуп. пром-сти, вып. 37, 55 (1965).
177. Колобова К- К- Труды Всес. ин-та н.-и. и проектн. работ огнеуп. пром-сти, вып. 37, 74 (1965).
178. Колыпгоф И. М., Сендэл Е. Б. Количественный анализ. М.— Л., Госхим-издат, 1948, стр. 342.
178а. Комаровский А. Г. Анализ жаропрочных сплавов спектральным методом. М., Машгиз, 1952.
179. Комиссаренко В. С. Зав. лаб., 22, 453 (1956).
180. Конкин В. Л. Бюлл. научно-техн, информ. Укр. н-и. ин-та металлов, № 2, 76 (1957).
181. Конкин В. Д. Кандидатская диссертация. Харьков, Укр. н.-и. ин-т металлов, 1953.
182. Конкин В. Д., Жихарева В. И. Зав. лаб., 27, 143 (1961).
183. Константинова Б. П., Ошуркова О. В. Изв. АН СССР, Серия химич., № 8, 1648 (1967).
184. Копылова В. П., Назарчук Т. Н. Ж- аналит. химии, 20, 892 (1965).
185. Коренман И. М. Сб. «Передовые методы хнм. технол. и контроля производства», Изд. Рост, ун-та, 1964, стр. 339.
186. Коренман И. М., Вербицкая Т. Д. Труды по химии и хим. технол. (Горький), вып. 2 (10), 248 (1964).
187. Коренман И. М., Гришин И. А. Труды по химии и хим. технол. (Горький), вып. 2, 383 (1958).
188. Коренман И. М., Ефимычев В. С. Труды по химии н хим. технол. (Горький), 4, № 2, 323 (1961).
189. Коренман И. М., Назарова Г. В. Труды по химии и хим. технол. (Горький), вып. 2 (10), 255 (1964).
190. Коренман И. М., Новикова А. М. Труды по химии и хим. технол. (Горький), вып. 2 (10), 259 (1964).
191. Коренман И. М., ФайзиевУ. Труды по химии и хим. технол. (Горький), вып. 2 (13), 164 (1965).
192. Коренман И. М., Файзиев У. Труды по химии и хим. технол. (Горький), вып. 2 (16), 301 (1966).
193. Коренман И. М., Фрум Ф. С., Карженкина Е. К- Уч. зап. Горьковского унта, вып. 4, 131 (1953).
194. Коренман И. М., Челышева С. Ф. Ж- аналит. химии, 18, 145 (1963).
195. Коренман И. М., Челышева С. Ф. Труды по химии и хим. технол. (Горький), вып. 3 (14), 103 (1965).
196. Коренман И. М., Шеянова Ф. Р., Осипова Н. И. Труды по химии и хим. технол. (Горький), № 2, 395 (1962).
197. Королев В. В., Вайнштейн Э. Е. Ж. аналит. химии, 13, 627 (1958).
198. Костерная А. Ф., Заворовская Н. А. Сб. научн. работ ин-тов охраны труда ВЦСПС, № 1, 82 (1962).
199. Костицына К- П., Скобец Е. М. Зав. лаб., 29, 1059 (1963).
200. Костромин А. И., Ахмадиев М. X. Зав. лаб., 29, 402 (1963).
201. Костромин А. И., Круглов А. И. Уч. зап. Казанского ун-та, 124, №3, 173 (1965).
202. Кочарян А. Сб. студ. научн. тр. Ереванского уи-та, № 8, 197 (1958); РЖХим, № 23, 77233 (1958).
203. Красильникова Л. Н., Максой Л. И. Сб. научн. трудов ВНИИЦветмета, № 1, 3 (1956).
204. Красильникова Л. Н., Максай Л. И. Сб. научн. трудов ВНИИЦветмета, № 3, 87 (1958).
205. Красюкова Н. Г. Сб. «Материалы по геологии и полезным ископаемым Бурятской АССР», вып. 10, 238 (1966).
206. Краткая химическая энциклопедия, том 1. М., изд-во «Советская энциклопедия», 1961.
207. Краус К. А., Нельсон Ф. Химия ядерного горючего. Доклады иностранных ученых иа Междунар. конференции по мирному использованию атомной энергии. М., Госхимиздат, 1956, стр. 353.
г 207а. Кротова И. К-, Кошелева М. М. В сборнике трудов научного института по удобрениям и инсектофунгисидам, М., Госхимиздат, 1962, стр. 3.
208. Круглова М. Н., Городенцева Т. Б., Долгорукова Г. С., Ворожбицкая К.Ф. Студенская Л. С., Барбаш Т. Л., Силаева Е.В. Тр. ВНИИСО, 2, 75 (1965).
209. Крупский И. К-, Александрова А. М-, Хижняк А. И. Почвоведение, № 10, 93 (1961).
210. Крюкова Т. А., Синякова С. И., Арефьева Т. В. Полярографический анализ. М., Госхимиздат, 1959, стр. 254.
211. Куделя Е. С. Автомат, сварка, № 6, 28 (1959).
212. Куделя Е. С. Зав. лаб., 26, 1128 (1960).
212а. Куделя Е. С. Спектральный анализ металлов и сплавов. Киев, Гостехиз-дат УССР, 1961.
213. Кузнецов В. И. Ж. общ. химии, 17, 175 (1947).
214. Кузнецов В. И., Голубцова Р. Б. Зав. лаб., 21, 1422 (1955).
215. Кузнецов В. И., Голубцова Р. Б. Зав. лаб., 22, 161 (1956).
216. Кузнецов В. И., Драпкина Д. А. Труды Всес. н.-и. ин-та хим. реактивов, вып. 21, 18 (1956).
217. Кузнецов В. И., Каранович Г. Г., Драпкина Д. А. Зав. лаб., 16, 787 (1950).
218. КульбергЛ. М., МолотЛ. А. Укр. хим. ж., 21, 256 (1955).
219. КульбергЛ. М., Мустафин И. С. ДАН СССР, 77, 285 (1951).
220. Куненкова Е. Н., Остроумов Э. А. Ж- аналит. химии, 19, 955 (1964).
221. Кураха ТСакакибара М., Сибуя С., Огура М. Бунсэки кагаку, 15, 569 (1966); РЖХим. 1 Г 130 (1967).
222. Лазарев А. И. Сб. «Современные методы анализа в металлургии». М., Ме-таллургнздат, 1955, стр. 182.
223. Лебедев О. П., Власова Н. И. Сб. научн. трудов н.-и. горнорудного ин-та УССР, 7, 293 (1963).
223а. Лебедева М. И., Исаева Б. И., Прохоров В. И. Труды Тамбовского нн-та хим. машиностр., вып. 2, 1968, стр. 56.
224. Лебедь Н. Б., Панталер Р. П. Зав. лаб., 31, 163 (1965).
225. Левитин Р. 3., Смирнова В. И. Физ. сб. Львовского ун-та, вып. 4 (9), 497 (1958).
226. Лельчук Ю. Л., Соколович В. Б., Дрелина О. В. Изв. Томского политехи, нн-та, 128, 101 (1964).
227. Лельчук Ю. Л., Соколович В. Б., Курышева Е. А. Изв. Томского политехи, ин-та, 128, 106 (1964).
228. Ленская К- К-, Вержбовская Е. И. Сб. трудов ЦНИИЧЕРМЕТа, вып. 24, 185 (1962). -
228a. Лившиц Е.В., МосоваЛ. Н. Зав. лаб., 25, 952 (1962).
229. Ли Кай-юань. Хуасюэ тунбао, № 2, 43 (1961); РЖХим., 6, Д 84 (1962).
230. Лисенко Н. Ф. Кандидатская диссертация. Саратов, Гос. ун-т, 1967.
231. Лисенко Н. Ф., Мустафин И. С. Ж. аналит. химии, 22, 25 (1967).
232. Лисенко И. Ф., Мустафин И. С., МолотЛ. А. Изв. вузов СССР. Химия и хим. технол.,‘‘5, 712 (1962).
233. Лихоед Л. С., Носенко Н. И. Физ. сб. Львовского ун-та, вып. 4 (9), 497 (1958).
234. Лобанов Е. М., Мингалиев Г. Г. Сб. «Активационный анализ элементного состава геологических объектов». Ташкент, «Фан», 1967, стр. 77, 93.
235. Лобанов Е. М., ЧанышевА.И., Дутов А. Г., Аширов М. Г., Худайберга-нов. А. Труды 1-го Всес. координац. совещания по активац. анализу, 1962. Ташкент, «Наука», 1964, стр. 94.
236. Лобанов Е. М., Чанышев А. И., Чаньииева Т. И., Галанин Ю. Н. Намихин Л. В., Киреев В. А. Сб. «Ядерная физика и ее применение», ч. I. Ташкент, «Фан», 1966, стр. 38.
237. Лукин А. М., Петрова Г. С., Этинген Н. Б., Молот Л. А., Архангельская А. С. Авт. свид. СССР, 213405, 1967; Бюлл. изобр. № 10, 1968.
238. Лурье Ю. Ю., Филиппова Н. А. Зав. лаб., 13 , 539 (1947). -
239. Лурье Ю. Ю., Филиппова Н. А. Зав. лаб., 14, 159 (1948).
9.ЧК
240. Львов Б. В. Атомио-абсорбциоииый спектральный анализ. М., «Наука», 1966.
241. Лю Го-цзюнь. Кэсюэ туибао, № 20, 637 (1958); РЖХим., № 15, 5312' (1959).
242. Лю Цзинь, Цзинь Вэн-ин. Цзяиьчжу цайляо чуиъе, № 16, 31 (1959); РЖХим; № 18, 73059 (1960).
243. Ляо Чжень-цзян. Ухаиь дасюэ цзыжань кэсюэ сюэбао, № 1, 24 (1959); РЖХим., № 3 , 8853 (1960).
244. Ляшенко А. Г. Обогащение руд, № 5, (23), 23 (1959).
245. Максимова О. С., Кучинский В. А. Уч. зап. Рижского политехи, ин-та, 6, 272 (1962).
246. Малеванный В. А., Шумина В. А. Лакокрасочные материалы и их применение, № 4, 75 (1967).
247. Маленская В. П. Труды по химии и хим. техиол. (Горький), вып. 2, 321 (I960)
248. Малинина Р. Д., ПтушкинаЕ. В.Сб. трудов ЦНИИЧЕРМЕТа, вып. 19, 61 (1960).
249. Мальцев В. Ф. Бюлл. научно-техн, информ. Всес. н.-и. трубного ин-та, № 3, 108 (1957).
250. Мальцев В. Ф. Лукьяненко Л. П., Кукуй Д. М. Зав. лаб., 27, 807 (1961).
251. Мамедов Н. А. Автореферат кандидатской диссертации. Баку, Азерб. инд. ии-т, 1953.
251а. Маэкава С., Ионэяма И. Нихон киндзоку гаккайси, 25, 651 (1961). РЖХим, 20 Д 46 (1962).
2516. Маэкава С., Като К- Бунсэки кагаку, 17, 70 (1968); РЖХим., 21Г 106 (1968).
252. Марголис Л. Д. Зав. лаб., 28, 290 (1962).
253. Медведева А. П., Мазель М. И. Сб. «Спектр, и хим. методы анализа материалов». М., Металлургиздат, 1964, стр. 166.
253а. Меламед Ш. Г., Салтыкова А. М. Зав. лаб., 23, 573 (1957).
254. Методы анализа веществ высокой чистоты. М., «Наука», 1965.
255. Минева Г. Химия и индустрия (Бълг.), 32, 117 (I960).
256. Митузас Й. Научн. тр. вузов Литвы. Химия и хим. техиол., № I, 38 (1961); РЖХим., 20 Г 58 (1963).
257. Миура. Нихон киндзоку гаккайси, 19, 310 (1955); РЖХим., № 10, 29336 (1956).
258. Михайленко М. И. Сб. «Исследования в области фармации». Одесса, 1959, стр. 105.
259. Михайлов М., Бенев Б. Минное дело и металлургия, 16, 27 (1961).
260. Миядзима Ц. Бунсэки кагаку, 13, 362 (1964); РЖХим., 2 Г 43 (1965).
261. Миядзима. Ц- Бунсэки кагаку, 13, 1042 (1964); РЖХим., 14 Г 124 (1964).
262. Молот Л. А. Кандидатская диссертация. Саратов. Гос. уи-т, 1952.
263. Молот Л. А., Архангельская А. С., Трусова, М. И., Мустафин И. С., Зав. лаб., 34, 408 (1968).
264. Молот Л. А., Кульберг Л. М. Ж.аиалит. химии, 11, 198 (1956).
265. Молот Л. А., Кульберг Л. М. Уч. зап. Саратовского уи-та, 42, 79 (1955).
265а. Молот Л. А., Мустафин И. С., Андронова А. П. Сб. «Применение органических реагентов в анализе». Саратов, Саратовский уи-т, 1967 (1968), стр. 61.
266. МолотЛ. А., Мустафин И. С., Загребина Р. Ф. Изв. вузов СССР. Химия и хим. техиол., 9, 873 (1966).
267. Молот Л. А., Мустафин И. С., Иванова А. И., Петрикова К- Г., Ковалева В. С., Аграновская Л. А. Сб. «Передовые методы химической технологии и контроля производства», Ростов-и/Д, уи-т, 1964, стр. 329.
268. Молот Л. А., Мустафин И. С., Немкова Н. К- Изв. вузов СССР. Химия и хим. техиол., 10, 1060 (1967).
269. Молот Л. А., Мустафин И. С„ Фрумина Н. С. Труды Комиссии по аиа-лит. химии, 11, 1960, стр. 231.
270. Морачйвский Ю. В., Башун 3. С. Изв. АН СССР, Отд. хим. наук., 10, 1185 (1956).
271. Морачевский Ю. В., Гордеева М. Н. Зав. лаб., 23, 1066 (1957).
272. Морачевский Ю. В., Зайцев В. И. Труды Комиссии по аналит. химии, 15, 260 (1965).
273. Морачевский Ю. В., Зайцев В. Н. Уч. зап. ЛГУ, Серия хим. наук, 18, 272, 134 (1959).
274. Морачевский Ю. В., Новиков А. И. Труды Комиссии по аналит. химии, 9 (12), 121 (1958).
275. Морачевский Ю. В., Новиков А. И. Уч. зап. ЛГУ, Серия Хим. наук, 18, №272,112,123(1959).
276. Мории Ф. Нихон кагаку дзасси, 82, 1507 (1961); РЖХим., 20 Д 31 (1962).
277. Морковчина К- С., Пиндус А. М., Зав. лаб., 28, 805 (1962).
278. Морозова О. В., Мельникова 3. Е., Степин В. В. Труды ВНИИСО, 2, 60 (1965).
279. Морошкина Т. М., Малинина Т. Ф. Ж. аналит. химии, 16, 245 (1961).
280. Моррисон Л., Фрейзер Г. Экстракция в аналитической химии. Л., Госхим-издат, 1960.
281. Мотодзима К„ Хаситани X. Бунсэки кагаку, 6, 642 (1957)) РЖХиМ-f № 9, 28394 (1958).
282. Мотодзима К., Хаситани Х-, Кацуяма К.. Бунсэки кагаку, 9, 517 (1960); РЖХим., 3 Д 142 (1961).
283. Мусакин А. П. Зав. лаб., 9, 507 (1940).
284. Мустафин И. С., Кашковская Е. А. Ж- аналит. химии, 13, 215 (1958). 284а.Мустафин И. С. Лисенко Н. Ф. Ж. аналит. химии, 17, 1052 (1962).
285. Мустафин И. С., Матвеев Л. О. Зав. лаб., 24, 259 (1958).
285а.М устафин И. С., Молот Л, А., Архангельская А. С. Ж- аналит. химии, 22, 1808 (1967).
2856.М устафин И. С., Молот Л. А., Борисова Г. М.Сб. «Применениеорганических реагентов в анализе». Саратов, Саратовск. ун-т, 1967 (1968), стр. 71.
286. Мухина 3. С. Зав. лаб., 17, 289 (1951).
287. МухинаЗ. С., Никитина Е. И., БудановаЛ. М., Володарская Р. С., Поляк, Л. Д., Тихонова А-А. Методы анализа металлов и сплавов. М., Оборонгиз, 1959.
288. Навяжская Э. А., Спорыхина В. С. Лакокрасочные материалы и их применение, № 4, 52 (1962).
289. Назаренко В. А., Бирюк Е. А- Сб. «Современные методы анализа в метал* лургии». М., Металлургиздат, 1955, стр. 188.
290. Назаренко В. А., Бирюк Е. А. Сборник трудов Гиредмета, 2, 77 (1959).
291. Назаренко В. А., Бирюк Е. А., Полуэктова Е. Н. Радиохимия, 5, 497 (1963).
292. Назаренко В. А., Бирюк Е. А., Равицкая Р. В. Укр. хим. ж., 34, 408 (1968).
293. Назаренко В. А., Тху Лям Нгок, Драницкая Р. М. Ж. аналит. химии, 22, 1175 (1967).
294. Назаренко В. А., Шустова М. Б., Равицкая Р. Ц-, Никонова М. П. Зав. лаб., 28, 537 (1962).
295. Назарчук Т. Н., МеханошинаЛ. Н. Ж- аналит. химии, 20, 260(1965).
295а. Назарчук Т. Н., Механошина Л. Н. Ж. аналит. химии, 20, 260 (1965).
296. Накагава Г. Нихон кагаку дзасси, 81, 747 (1960); РЖХим., 5 Д 41(1961).
297. Нака К., Мацумаэ Г., Танака Д. Бунсэки кагаку, 12, 928 (1963); РЖХим, 13 Г 103 (1964).
298. Нака К.., Мацумаэ Г., Танака Д. Нагоя когё гидзюцу сикэнсё кококу, 13, 300 (1964); РЖХим., 7Г Г114 (1965).
299. Намики X., Ходано X. Когё ёсуй, 18, 24(1960); РЖХим, 13 Д 66 (1961).
300. Немодрук А. А., Палей П. Н., Хэ Хуань-И. Зав. лаб., 28, 406 (1962).
301. Нехамкина М. А. Кандидатская диссертация. Москва, ИОНХ АН СССР, 1947.
302. Нечаева Е. А., Лапидус Э. С. Зав. лаб., 25, 544 (1959).
303. Нэгиси Р. Бунсэки кагаку, 11, 202 (1962); РЖХим., 6 Г 144 (1963).
303а. Никитина 0. И. Сб. Тр. Укр. н.-и. ин-та металлов, вып. 6, 1960, стр. 283.
А ио читиаагчля Vuuna алюминия •ва
304. Никитина О. И., Гудырина. Л. Л., Коломиец Л. П. Ж. прикл. спектро скопии, I, 319 (1964).
305. Николаев Г. И. Ж- аиалит. химии, 19, 63 (1964).
308. Николаев Г. И. Ж. аналит. химии, 20, 445 (1965).
307. Николаев Г. И., Алесковский В. Б. Ж- аналит. химии, 18, 816 (1963).
307а.Нисида X. Бунсэки кагаку, 12, 56 (1963); РЖХим., 5 Г 92 (1964).
ЗбТб.Нисикава Я-, Хироки К-, Морисигэ К-, Цутияма Н., Сигэмацу И. Бунсэки кагаку, 17, 1092 (1968); РЖХим, 5Г170(1969).
307в.Нисикава Я-, Хироки К-, Сигэмацу Ц. Бунсэки кагаку, 16, 692 (1964); РЖХим. 4 Г 82 (1969).
308. Новиков А. И. Ж. иеоргаи. химии, 4, 2161 (1959).
309. Новиков А. И. Изв. вузов СССР. Химия и хим. технол., 3, 239 (1960).
310. Носака X., Нагасима К., Фудзисиро М. Титаниуму, 7, 101(1959); РЖХим., № 11,42450 (1960).
310а. Нэдлер В. В. Спектральный анализ сталей и сплавов. М., ОНТИ, 1961.
311. Овсепян Е. Н., Тараян В. М. Научн. труды Ереванск уи-та, 53, 85 (1956).
312. Овсепян Е. Н., Экимян М. Г. Изв. АН Арм. ССР, Сер. физ., матем., естеств. и техн, н., 8, № 5, 41 (1955).
313. Ода Н., Идохара М. Бунсэки кагаку, 10, 246 (1961); РЖХим., 1Д 128 (1962).
314. Ода Н., Идохара М., Цукасима К- Нихон киндзоку гаккайси, 25, 781 (1961); РЖХим., 22 Д 48 (1962).
315. Ока, Му то, Вада. Сэйсан кэикю, 9, №7, 303 (1957); РЖХим., № 15,49976, (1958).
316. ОкудаЙ. Сато Й. Фудзи сэйтецу чихо, 9, 207 (1960);РЖХим., 10 Д 31 (1961).
317. Онуки С., Ватануки К-, ЙосиноЮ. Бунсэки кагаку, 15, 924(1966); РЖХим., 9 Г 157 (1967).
318. Остроумов Э. А. Новые методы химического анализа с применением органических оснований. М., Госгеолиздат, 1952.
319. Остроумов Э. А. Новые методы химического анализа с применением пиридина и гексаметилентетрамина. М., Изд-во геол, лит., 1940.
320. Остроумов Э. А. Применение органических оснований в аналитической химии. М., Изд-во АН СССР, 1959.
321. Остроумов Э. А., Волков И. И. Труды Ин-та океанол. АН СССР, 47, 150 (1961).
322. Остроумов Э. А., Волков И. И. Ж. аналит. химии, 15, 719 (1960); 17, 461 (1962); 18, 52, 1452 (1963); 19, 216, 1073 (1964).
323. Ото, Хамагути, Мацумото, Йосинака, Накао. Нихон киидзоку гаккайси, 20, 315 (1956); РЖХим., № 17, 57784 (1957).
324. Павлинова О. В., Альбота Л. А. Уч. зап. Черновицкого ун-та, 21, 81 (1956).
325. Павлов Н. Н., Кузнецов А. Р. Зав. лаб., 29, 1059 (1963).
326. Павлов Н. Н., Кузнецов А. Р. Научн. труды Московского техиол. ин-та легкой пром-сти, вып. 28, 61 (1963).
327. Павловская М. П., Рейбель И. М., Айзенберг Л. Н., Айзенберг Р. С. Труды Кишиневского с.-х. ин-та, 26, 149 (1962).
328. Пасовская Г. Б. Ж. аналит. химии, 12, 760 (1957).
329. Пасовская Г. Б. Ж. аналит. химии, 20, 392 (1965).
330. Пасовская Г. В. Изв. вузов СССР. Химия и хим. технол., 5, 43 (1962).
331. Пасовская Г. Б. Изв. вузов СССР. Химия и хим. технол., 8, 345 (1965). 331а.Пахолков В. С., Рылов В. В. Труды Уральского политехи, ин-та, № 148, 68 (1966).
ЗМб.Пашевкин Б. П. Зав. лаб., 25, 1468 (1959).
332. Пенькова Е. Ф. Зав. лаб., 18, 548 (1952).
332а.Пенькова Е. Ф., Яковлев П. Я- Зав. лаб., 18, 655 (1952).
3326.Петренко А. Г. Сб. «Химический анализ цветных и редких металлов». Новосибирск, СО АН СССР, 1964, стр. 3.
332в.Петрова Г. С., Лукин А. М., Этинген Н. Б., Молот Л. А., Архангельская А. С. Ж- аналит. химии, 24, 1332 (1969).
238
333. Пинаева С. Я., Буданова Л. М. Зав. лаб., 32, 1209 (1966).
333а. Пластинин В. В. Зав. лаб., 25, 577 (1959).
334. Плотников В. И. Ж. иеорган. химии, 4, 2775 (1959).
335. Плотников В. И. Сборник трудов Всес. н.-и. горно-металлург. ин-та цвети, мет., № 5, 1959, стр. 65.
336. Поволоцкая Г. Л. Металлург, и хим. пром-сть Казахстана. Научно-техи. сб., № 6(16), 66 (1961).
337. Поволоцкая Г. Л., Вальдман Д. А., Ханина Н. М. Металлург, и хим. пром-сть Казахстана. Научно-техн, сб., № 5 (15), 71 (1961).
338. Подчайнова В. Н. Труды Уральского политехи, ин-та, сб. 57, 38 (1956).
339. Подчайнова В. Н., Антонова Н. Г., Рось М. Л. Сб. «Методы анализа черных и цветных металлов». Свердловск— Москва, Металлургиздат, 1953, стр. 91.
340. Поляк Л. Д. Зав. лаб., 12, 268 (1946).
341. Полякова Р. С., Соловьева 3. В. Сборник трудов ЦНИИЧЕРМЕТа, вып. 37, 118 (1964.)
342. Полуэктов И. С. Методы анализа по фотометрии пламени. М., изд-во «Химия», 1967.
343. Пономарев А. И. Методы химического анализа силикатных и карбонатных пород. М., Изд-во АН СССР, 1961, стр. 93.
344. Пономарев А. И., Шескольская А. Я- Ж- аналит. химии, 11, 102 (1956).
345. Попова О. И., Годованная И. И. Ж- аналит. химии, 20, 355 (1965).
346. Прокопьева А. И. Физ. сборник Львовского ун-та, вып. 4 (9), 446 (1958).
346а. Прокопьева А.Н., Таганов К- И. Зав. лаб., 15, 299 (1949).
347. Пршибил Р. Комплексоны в химическом анализе. М., ИЛ, 1960.
348. Пятницкий И. В. Наук. зап. Кжвсьск. ун-ту, 14, 131(1955).
349. Радько В. А. Труды Уральского политехи, ин-та, сб. 163, 98 (1967).
350. Радько В. А., Якимец Е. М. Зав. лаб., 27, 1464 (1961).
351. Радько В. А., Якимец Е. М. Зав. лаб., 27, 1465 (1961).
352. Райнес М. М., Ларионов Ю. А. Зав. лаб., 14, 1000 (1948).
353. Родионова С. К., Штейнберг А. Н. Сб. «Проблемы большой металлургии и физической химии новых сплавов». М., «Наука», 1965, стр. 277.
353a. Розенберг И. В., Ломберг М. И. Количественный спектральный анализ бронз. М., Оборонгиз, 1953.
354. Розенберг М. И. Зав. лаб., 24, 1060, 1166 (1958).
355. Рябчиков Д. И., Бухтиаров В. Е. Ж- аналит. химии, 7, 377 (1952).
356. Рябчиков Д. И., Осипова В. Ф. Ж. аналит. химии, 11, 278 (1956).
357. Рябчиков Д. И., Сенявин М. М. Ж- аналит химии, 8, 195 (1953).
358. Рязанов И. П., Черкесов А. И. Уч. зап. Саратовского ун-та, 25, 3 (1951).
359. Саксин В. Ф., Соболева А. А. Уч. зап. Ярославского технол. ин-та, 9, 113 (1966).
359а. Салихов В. Д., Ямпольский М. 3. Уч. зап. Курского пед. ин-та, 23, 236 (1966).
360. Сендэл Е. Б. Колориметрические методы определения следов металлов. М„ «Мир», 1964.
361. Сиборг Г., Перлман И., Холлендер Д. Таблицы изотопов. М., ИЛ, 1956. 361а. Сидзё И., Такэути И. Бунсэки кагаку, 17, 61 (1968); РЖХим, ЗГ 65 (1969).
3616. Сидзё И., Такэути И. Бунсэки кагаку, 17,323 (1968); РЖХим., 1Г71 (1969).
362. Силаева Е. В., Камаева Л. В. Труды ВНИИСО, 1, 70 (1964).
363. Силаева Е. В., Крючкова Л. М. Труды ВНИИСО, 2, 88 (1965).
364. Скобець Е. М., Абарбарчук И. Л., Костицына К. П. Доповщ! Укр. Акад, Дльскогоспод. наук, № 3, 9 (1960).
365. Скобець Е.М., Абарбарчук И. Л., Костицына К- П. Наук прац. сьтьско-господ. наук, 11, 125 (1960).
366. Славинский М. П. Физико-химические свойства элементов. М., Металлургиздат, 1952.
367. Соболева Т. А. Сб. «Методы анализа черных и цветных металлов». Свердловск—Москва, Металлургиздат, 1953, стр. 31.
10
239
368. Солодовников П. П. Ж- аиалит. химии, 16, 237 (1961).
369. Соломин Г. А., Фесенко Н. Г. Гидрохимические материалы, 33, 128 (1961).
370. Соломин Г. А., Фесенко Н. Г. Сб. «Современные методы анализа природных вод». М., Изд-во АН СССР, 1962, стр. 57.
371. Соколович В. Б., Лельчук Ю. Л., Беспрозванных Б. И. Изв. Томского политехи. ии-та, 128, 112 (1964).
372. Сочеванова М. М. Зав. лаб., 29, 143 (1963).
373. Сочеванова М. М., Сочеванов В. Г. Зав. лаб., 26, 543 (1960).
374. Справочник химика, т. I. Л.— М., Госхимиздат, 1963.
375. Справочник химика, т. III. М.— Л., «Химия», 1965.
376. Справочник химика, т. II. М.— Л., «Химия», 1965.
377. Справочник химика, т. IV. М.— Л., «Химия», 1965.
377а. Стали (легированные и высоколегированные). Методы химического анализа, ГОСТ 12357-66. М., 1967.
378. Степин В. В., Курбатова В. И., Круглова М. Н., Крючкова Л. М., Вербиц-кая В. А. Труды ВНИИСО, 1, 62 (1964).
379. Столяров К- П., Григорьев Н. Н. Ж. аиалит. химии, 17, 565 (1962).
380. Стрекалова О. С. Кандидатская диссертация. Казань, Гос. уи-т, 1956.
381. Стрельникова Н. П. Зав. лаб., 23, 1308 (1957).
382. Стрельникова Н. П., Павлова В. Н. Зав. лаб., 26, 425 (1960).
383. Струкова М. П., Кириллова И. В. Ж- аиалит. химии, 21, 1236 (1966).
384. Суворовская Н. А., Воскресенская М. М., Мельникова Т. А. Научи, сообщ. ин-та горного дела, 10, 148 (1961).
385. Суворовская Н. А., Лопатина Г. И. иаучн. сообщ. ии-та горного дела, 6, 30 (1960).
386. Судзуки Т. Буисэки кагаку, 13, 524 (1964); РЖХим, 9Г 97 (1965).
386а. Суда 3., Огава X. Бунсэки кагаку, 13, 406 (1964); РЖХим., ЗГ 130 (1965).
387. Сухенко К- А. Спектральный анализ сталей и сплавов. М., Оборонгиз, 1954.
387а. Сухенко К- А., Филатов Ф. И., Галонов П. П., Моисеева К- А., Метелина Л. Д. Сб. «Фотоэлектрические методы спектрального анализа». М., Оборонгиз, 1961, стр. 44.
388. Такао Л., Миёси С. Тэцу то хагаиэ, 47, 145 (1961); РЖХим., 18 Д 55 (1955).
389. Такиура, Такино, Тангэ. Якугаку дзасси, 75, 724 (1955); РЖХим., № 11, 32716 (1956).
390. Такэути Ц., Судзуки М. Буисэки кагаку, 10, 58 (1961); РЖХим; 23 Д 51 (1961).
391. Талипов Ш., Софейкова 3. Г. Зав. лаб., 13, 816 (1947).
392. Талипов Ш., Теодорович И. Зав. лаб., 15, 1031 (1949).
393. Танака. Буисэки кагаку, 6, 13 (1957); РЖХим, № 20, 66353 (1957).
394. Танака, Масая. Нихои кагаку дзасси, 84, 582 (1963); РЖхим., 4Г 65 (1964);
85, 119 (1964); РЖХим; 22 7 49 (1964).
395. Танака К-, НакагаваИ., Хонда С. Буисэки кагаку, 10, 1148 (1961); РЖХим., 15 Д 49 (1962).
396. Танака К-, Дмаёси К- Буисэки кагаку, 13, 540 (1964); РЖХим., ЮГ 64 (1965).
397. Тананаев И. В., Абилов С. Т. Ж. прикл. химии, 15, 61 (1942).
398. Тананаев И. В., Виноградова А. Д. Ж- аиалит. химии, 14, 487 (1959).
399. Тананаев И. В., Виноградова А. Д. Ж- иеоргаи. химии, 2, 2455 (1957).
400. Тананаев И. В., ЛевинаМ. И. Зав. лаб., И, 804 (1945).
401. Тананаев И. В., Лельчук Ю. Л. Ж. аналит химии, 2, 93 (1943).
402. Тананаев И. В., Талипов Ш. Зав. лаб., 8, 23 (1939).
403. Тананаев И. В., Яковлев П. Я. Зав. лаб., 14, 1155 (1950).
404. Тананаев Н. А. Зав. лаб., 4, 1348 (1935).
405. Тананаев Н. А., Тихонов В. Н. Научи, докл. высшей школы, Металлургия, № 1, 259 (1959).
406. Тарасов Н. Я-, Машковский П. В. Труды иаучио-техи. об-ва черной металлургии. Укр. респ. правд., 4, 98 (1956).
407. Тараян В. М. Зав. лаб., 8, 273 (1929).
240
408. Тараян В. М., Овсепян Е. Н. Научи, тр. Ереванского уи-та, 53, 75(1956).
409. Тартаковский В. Я- Зав. лаб., 4, 1023 (1935).
410. Таскаева Т. П., Парыгина Г. К- Сб. «Доклады межвузовской научной конференции по спектроскопии и спектральному анализу». Томск, Гос. уи-т, 1960, стр. 69.
411. Тацуо Й. Нихои кагаку дзасси, 84, 502 (1963); РЖХим., 12 Г 10 (1964).
412. Темянко С. В., Хозова И. В. Сб. «Современные методы анализа в металлургии». М., Металлургиздат, 1955, стр. 28.
413. Терентьева Е. А. Зав. лаб., 28, 807 (1962).
414. Тиновская Е. С. Ж. аиалит. химии, 5, 345 (1950).
415. Тановская Е. С. Сб. «Химия, технология и применение производных пиридина и хииолииа». Рига, Изд-во АН Латв. ССР, 1960, стр. 253.
415а. Тишкова Н.Ф. Научн. докл. высш, школы. Биол. и., № 9, 126 (1968).
416. Тихонов В. Н. Ж. аиалит. химии, 17, 422 (1962).
417. Тихонов В. Н. Ж- аиалит. химии, 19, 1204 (1964).
418. Тихонов В. Н. Ж. аналит. химии, 20, 941 (1965).
419. Тихонов В. Н. Ж. аналит. химии, 20, 1219 (1965).
420. Тихонов В. Н. Ж. аиалит. химии, 21, 275 (1966).
421. Тихонов В. Н. Ж- аналит химии, 21, 829 (1966).
422. Тихонов В. Н. Ж- аиалит. химии, 21, 1172 (1966).
423. Тихонов В. Н. Ж- аиалит. химии, 22, 658 (1967).
424. Тихонов. В. Н. Кандидатская диссертация. Свердловск, Уральский политехи. ии-т, 1961.
425. Тихонов В. Н. Научн. труды Тульского пед. ин-та, Химия, вып. 1,3(1967).
426. Тихонов В. Н. Научи, труды Тульского пед. ин-та, Химия, вып. 1, 9 (1967).
427. Тихонов В. Н. Научн. труды Тульского пед. ии-та, Химия, вып. 1, 19 (1967).
438. Тихонов В. Н. Труды Всес. н.-и. алюминиево-магниевого ин-та, вып. 47, 145 (1961).
429. Тихонов В. Н. Труды Всес. н.-и. алюминиево-магниевого ин-та, вып. 51, 78 (1963).
430. Тихонов В. Н., Гранкина М. Д. Зав. лаб., 29, 653 (1963).
431. Тихонов В. Н., Гранкина М. Д. Зав. лаб., 32, 278 (1966).
432. Тихонов В. Н., Никитина А. П. Зав. лаб., 28, 662 (1962).
433. Тоносаки К-, Отомо М. Нихон кагаку дзасси, 80, 41 (1959); РЖХим., № 3, 8813 (1960).
434. Трамм Р. С., Певзнер К- С. Зав. лаб., 31, 163 (1965).
435. Туманов А. А., Ефимычев В.С. Ж- аналит. химии, 22, 700 (1967).
436. Турчинский М. Л., Найман Л. 3. Зав. лаб., 30, 673 (1964).
437. Уварова, К- А., Пих М. С., Сикора К- П. Труды ИРЕА, вып. 29, 139 (1966).
438. Удзумаса fl., Хаяси К., Нуриси Ю. Бунсэки кагаку, 14, 902 (1965); РЖХим, 22 Г 73 (1966).
439. У My-ай, Сюй Шу-минь. Ухань дасюэ цзыжаиь кэсю сюэбао, № 1, 38 (1959); РЖХим, № 18, 73058 (1960).
440. Уно. Нихон сио гаккайси, 11, №3, 139 (1957); РЖХим., № 18, 43075 (1958).
441. Усатенко Ю. И., Беклешова Г. Е. Зав. лаб., 19, 147 (1953).
442. Усатенко Ю. И., Беклешова Г. Е. Зав. лаб., 20, 266 (1954).
443. Усатенко Ю. И., Беклешова Г. Е., Гренберг Е. И., ГенисМ. Я-, Кар пуша Е. Е. Зав. лаб., 21, 26 (1955).
444. Усатенко Ю. И-, Гренберг Е. И., Копелиович В. И. Зав. лаб., 18, 1063 (1952).
445. Усатенко Ю. И-, Гуреева Л. И. Зав. лаб., 22, 781 (1956).
446. Файнберг С. Ю., Бляхман А. А. Сборник иаучи. трудов Гиицветмета, № 12, 119 (1956).
447. Федоров А. А., Озерская Ф. А. Сб. ЦНИИЧЕРМЕТа; вып. 31, 195 (1963).
448. Федоров А. А., Соколова Г. П. Сб. «Новые методы анализа иа металлургических и металлообрабатывающих заводах». Днепропетровск, изд-во «Металлургия», 1964, стр. 17.
449. Федоров А. А., Соколова Г. П. Сборник трудов ЦНИИЧЕРМЕТа, вып. 24, 128 (1962).
241
450. Федоров А. А., Соколова Г. П. Сборник трудов ЦНИИЧЕРМЕТа, вып. 31, 162 (1963).
450а. Федорова М. В., Вахрина Г. И., Варова Л. Н., Щуплецова А. И. Сб. «Пути технического прогресса в магниевой промышленности». Пермь, Пермское книжное издательство, 1959, стр. 98.
451. Фиолетово А. Ф. Ж. аналит. химии, 14, 739 (1959); 17, 302, 520 (1962).
452. Ф1алков Я- А., Григорьева В. В., Давиденко Н. К-, Перишкина Н. Г. Фар-мацевтичний ж., № 1, 10 (1959).
453. Фогельсон Е. И-, Калмыкова И. В. Зав. лаб., 11, 359 (1945).]
454. Фраткина Г. П. Зав. лаб., 24, 1373 (1958).
455. Фукамути X., Идэно Р., Днагида М., Иноцумэ Г. Бунсэки кагаку, 10, 1929 (1961); РЖХим., 11 Д 79 (1962).
456. Харковер М. 3-, Ворожбицкая К- Ф. Труды ВНИИСО, 3, 75 (1967).
457. Хаситани X. Нихон гэнсирёку гакайси, 4, 287 (1962); РЖХим., 7Г 126 (1963).
457а.Хаситани X., Кацуяма К-, Сагава Т., Мотодзима К- Бунсэки кагаку, 16, 596 (1967); РЖХим., 17 Г 139 (1968).
458. Хаситани X., Мотодзима К- Бунсэки кагаку, 7 , 478 (1958); РЖХим-, № 16, 56918 (1959).
459. Хаситани X., Ямамото К- Нихон кагаку дзасси, 80,727,1959; РЖХим., № 9, 34556 (1960).
460. Хлопин И. Я- Зав. лаб., 14, 156 (1948).
461. Хондзё Т. Ибараки дайгаку когакубу кэикю сюхо, 7,41(1959); РЖХим., 16Д 68 (1961).
462. Хонма Н-, Симодзаки Ц. Кэикю дзицуёки хококу, 12, 379 (1963) РЖХим, ИГ 140 (1964).
463. Хуан Хуэй-шин. Хуасюэ шицзе, 13, № 4, 168 (1!\58); РЖХим., № 6, 19098(1959).
464. Хуан Чжень-цюань, Хуан Ган-цюань. Ухань дасюэ цзыжань кэсюэ сюэбао, № 2, 48 (I960); РЖХим., № 24, 96158 (1960).
464а.Худякова Т. А. Труды Горьковского политехи, ии-та, 13, № 5, 37 (1957).
465. Цанит В. Л., Киша Г. Гласиик хем. друштва Београд, 28, № 3—4, 143 (1963).
466. Цап М. Л. Авт. свид. СССР, № 155647, 1963; Бюлл. изобр. № 13, 1963.
467. Цветные металлы и сплавы. Методы испытаний. М. Стандартгиз, 1959.
468. Цеханович В. Н. Труды Воронежского ун-та, 32, 149 (1953).
469. Цзянь Цуй-линь. Хуасюэ сюэбао, 23, 324 (1957); РЖХим., № 12, 39357 (1958).
470. Цимблер М. Е., Дереновский В.И., Просяник Н. С. Труды Киевского ии-та ииж. води, х-ва, вып. 8, 159 (1959).
471. Цинберг С. Л. Зав. лаб., 2, 13 (1933).
472. Цинберг С. Л. Зав. лаб., 4, 1161 (1935).
473. Цывина Б. С., Конькова О. В. Зав. лаб., 25, 403 (1959).
474. Черкесов А. И. ДАН СССР, 118, 309 (1958).
475. Черкесов А. И., Алыков Н. М., Казаков Б. И. Сб. «Физико-химические исследования природных сорбентов и ряда аналитических систем», вып. 2. Саратов, 1967, стр. 102.
476. Черкесов А. И., Казаков Б. И.., Шилин П. А. Там же, стр. 18.
477. Черкесов А. И., Казаков Б. И., Щепко В. И. Зав. лаб., 34, 786 (1968).
478. Чернихов Ю. А., Добкина Б. М. Зав. лаб., 25, 131 (1959).
479. Чернихов Ю. А., Добкина Б. М., ХерсонскаяЛ. М. Зав. лаб., 21, 638 (1955).
480. Чжан Ти-хэн, Цзао Фэй-юнь. Хуасюэ шицзе, 14, 181 (1959); РЖХим., № 4 13072 (1960).
481. Чирков С. К- Зав. лаб., 14, 783 (1948).
482. Чулков Я- И--, Соловьева Л. А. Вестник техн, и экон, информ, и.-и. ии-та техи.-экои. исслед. Гос. Ком-та Сов. мин. по химии, № 10, 1060, стр. 32.
483. Чуносов В. И. Цемент, № 5, 22 (1955).
483а. Шаевич А. Б., Шубина С. Б. Промышленные методы спектрального анализа. М., «Металлургия», 1965.
242
484. Шафран И. Г., Парташникова М. 3., Рачкова Т. И. Авт. свид. СССР, № 131135, 1960; Бюлл. изобр.№ 16, I960.
485. Шахтахтинский Г. Б., Мамедов И. А. Азерб. хим. ж., № 1, 45 (1959).
486. Шахтахтинский Г. Б., Мамедов И. А. Труды Азербайджанского иидустр. ин-та, вып. 14, 59 (1956).
487. Шахтахтинский Г. Б., Мамедов И. А. Труды Азербайджанского иидустр. ин-та, вып. 19, 273 (1957).
488. Швайгер М. И-, Руденко Э. И. Зав. лаб., 26, 939 (1960).
489. Швангирадзе Р. Р-, Мозговая Т. А., Ж- аналит. химии, 12, 708 (1957).
489а. Шварц Л. М- Нилова Н. С. Изв. АН СССР, серия физ., 19, 96 (1955).
490. Шварценбах Г. Сб. «Комплексометрия». М., Госхимиздат, 1958.
491. Шемякин Ф. М. Зав. лаб., 11, 986 (1934).’
492. Шемякин Ф. М., Барская С- И. Зав. лаб., 16, 278 (1950).
493. Шемякин Ф. М., Беляков Н. И. Зав. лаб., 20, 552 (1954).
494. Шеянова Ф. Р., Маленская В. П. Зав. лаб., 23, 907 (1957).
495. Шеянова Ф. Р., Маленская В. П. Труды Комиссии по аналит. химии, 11, 1960, стр. 243.
496. ШеяноваФ. Р. Маленская В. П. Труды по химии и хим. технол. (Горький), вып. 3, 552 (1958).
497. Шеянова Ф. Р., Маленская В. П. Труды по химии и хим. техиол. (Горький), вып. 3, 560 (1959).
498. Шихова М., Кацарова М. Строит, материали и силикатиа пром-ст., 4, № 3, 24 (1963).
499. Шишкина Н. И. Кандидатская диссертация. Свердловск, Уральск, н.-и. ии-т черных металлов, 1955.
500. Шнайдерман С. Я. Изв. Киевского политехи, ии-та, 29, 122(1960).
501. Шпилев Ф. С., Оголова В. И. Тр. Дагестанск. с.-х. ии-та, 11, 233 (1959).
502. ШушиК С. К- Зб. Рол,апривредиог. фак ун-т Београду, 4, 93 (1956); РЖХим. № 2, 4283 (1959).
503. Щербаков В. Г. Стегендо 3. К- Сборник трудов Всес. и.-и. ии-та твердых сплавов, № 5, 281 (1964).
504. Щиголь М. Б., Бурчинская Н. Б. Ж- аналит. химии, 11, 106 (1956).
505. Эгель Л. Е. Руды черных, цветных и редких металлов и их промышленное значение. М., Госгортехиздат, 1962, стр. 80.
506. Эндо И. Буисэки кагаку, 7, 611 (1958); РЖХим., № 16, 56830 (1959).
506а. Эндо И., Oxama X., Накахара Ю. Буисэки кагаку, 16, 364(1961); РЖхим., 19Г 139 (1968).
507. Эндо И., Такаги Н. Буисэки кагаку, 8, 491 (1959); РЖХим., № 17, 69226 (1960).
508. Эндо И., Такаги Н. Буисэки кагаку, 8, 829 (1959); РЖХим., № 17, 69227 (1960).
509. Эндо И., Такаги Н. Буисэки кагаку, 9, 998 (I960); РЖХим., 15 Д 118 (1961).
510. Юаса Т. Буисэки кагаку, 11, 1269 (1962); РЖХим, 22 Г 86 (1963).
510а. Юделевич И. Г., Ковалева В. Г. Зав. лаб., 24, 754 (1958).
511. Ю. Цинь-юнь. Хуасюэ шицзе, 13, № 5, 226 (1958); РЖХим, № 15, 53185 (1959).
512. Яковлева Е. Ф. Сборник трудов ЦНИИЧЕРМЕТа, вып. 24, 58 (1962).
513. Яковлев П. Я- Кандидатская диссертация. Электросталь, завод «Электросталь», 1951.
514. Яковлев П. Я-, Малинина Р. Л., Рогинская Л. К- Сборник трудов ЦНИИЧЕРМЕТа, вып. 49, 67 (1966).
514а. Яковлев П. Я-> Федоров А. А., Буянов Н.В. Анализ материалов металлургического производства, М., Металлургиздат, 1961, стр. 290.
' 5146. Янагисава М., Такэути Ц. Когё кагаку дзасси, 70, 2254 (1967); РЖХим., 22Г 76 (1968).
515. Яцимирский К- Б., Васильев В. П. Константы нестойкости комплексных соединений. М., Изд-во АН СССР, 1959.
243
516. Abdel Raheem A. A., Moustafa A. S., Abdel-Aziz Amin. Z. anal. Chem., 175, 19 (1960).
517. Abrahamczik E. Mikrochemie, 33, 209 (1948).
517a. Absolon K. «Rudy», 12, 184(1964).
518. Aguila J. Taianta, 14, 1195 (1967).
519. Aikens D. A. Bahbah F. J. Anal. Chem., 39, 646 (1967).
520. Alfonsi B. Anal. chim. acta, 20, 277 (1959).
521. Alfonsi B., Bussi M. Anal. chim. acta, 22, 383 (1960).
522. Allen F., Wandrowski B., Hille E. Angew. Chem., 48, 273 (1935).
523. Alien F., Weiland H., Knippenberg E. Z. anal. Chem., 96, 91 (1934).
524. Alien F., Weiland H., Loofman H. Angew. Chem., 46, 668 (1933).
525. AmosM. D., Thomas P. E. Anal. chim. acta, 32, 139(1965)-
526. Amos M. D., Willis J. B. High Temperature Premixed Flames in Atomic Absorption-Speetroscopy. V Australian Spectroscopy conference. Perth, 1965.
527. Angelis, G., Petronio В. M. Rassegna chim., 13, 3 (1961); РЖХим., 7 Д 141 (1962).
528. Anil K-, Sen Asit K- Taianta, 13, 1313 (1966).
529. Anton A. Anal. Chem., 32, 725 (1960).
530. Apostolache S. Rev. chim. (RPR), 11, 664 (1960); РЖХим., 17Д43 (1961).
531. Arnold I. 0. Steel Works Analysis. London, 1907, p. 199.
532. Artigas J., Cintat M. An Real soc. esp. fis. у quim., В 59, 511 (1963);
РЖХим., 17 Г 60 (1964).
533. Asensi M. G. An Real Soc. esp. fis. у quim., В 58, 525 (1962); РЖХим.,
13 Г 70 (1963).
534. Ashbrook A. W., RitceyG. M. Canad. J. Chem., 39, 1109 (1961).
535. Atack F. A. J. Soc. Chem. Ind., 34, 936 (1915).
536. Atkins D. H. F, Jenkins E. N. Atomic Energy Res. Establ., № C/R 2161 (1960).
537. Austin G. J. Analyst, 72, 443 (1947).
538. Babacev G. N. Chim. analyt., 48, 258 (1966).
539. Babacev G. N. Tonind.-Zeitung, 90, 214 (1966).
540. Bacon A. Analyst,, 77, 90 (1952).
541. Bacon A., Davis H. C. R. A. E. Report N M 7889A, 1948.
542. Bailey T. H„ Lyle S. J. Taianta, 12, 563 (1965).
543. Baldi F., Passeri R. Metallurgia ital., 48, suppl., N 1, 8 (1956); РЖХим., № 2 , 4737 (1957).
544. Balis E. W„ Bronk L. B., Pfeiffer H. G., Welbon W. W., Winslow E. H., Zemany P. D. Anal. Chem., 34, 1731 (1962).
545. Banarjee D. K. Anal. Chem., 29, 55 (1957).
546. Banarjee D. K-, Sundaram A. M., Sharma H. D. Anal. chim. acta, 10, 256 (1954).
547. Banks С. V., EdwardsR. E. Anal. Chem., 27, 947 (1955).
548. Bdnyai E., Gere E. B.., Erdey L. Taianta, 4, 133 (1960).
549. Barracina-Gomes., Gasco-Sancher L., Fernandez-Cellini. An Soc. espan. Fi-sica Quim., Ser. B56, 861 (1960); РЖХим, 18 Д 53 (1961).
550. Barton C. J. Anal. Chem., 20, 1068 (1948).
550a. Bartura J., Bodenheimer W. Israel J. Chem., 6, 61 (1968).
551. Basset C. Acta Chem. Scand., 6, 910(1952).
552. Behr A., Blanchet M. L., Malaprade L. Chim. analyt., 42, 501 (1960).
553. Bellomo A., Bruno E. Atti Soc. Pelorit. Sci. fis., mat. e natur, 5, 327 (1960); РЖХим, 2 Д 32 (1962).
554. Belohlavek 0. Hutn. listy, 14, 809 (1959).
555. Bendigo В. B., BellR. K- J. Res. Nat. Bur. Standards, A64, № 3, 285 (1960).
556. Benedetti-Pichler A. Mikrochemie (Pregl-Festschr.), 1929, S. 6.
557. Bennet H., Hawley W. G., Eearley R. P. Trans. Brit. Ceram. Soc., 61, 201 (1962).
558. Bensch H., Helmboldt 0., Koster M., HUbner K-, Protzer H. Z. Erzbergbau und Metallhiittenwes., 20, 522 1957).
559. Berg B. Z. anal. Chem., 71, 369 (1927).
244
560. Berg R. Z. anal. Chem., 71, 378 (1927).
561. Berg R. Z. anal. Chem., 76, 197 (1929).
562. Bermeio F., Margalet A. Inform, quim. analit., 18, 35(1964); РЖХим., 23 Г 74 (1964).
563. Bhargava О. P., Hines IF., Granty. Anal. Chem., 40, 413 (1968).
564. BhatA. N., GuptaR. D.,JainB. D. Proc. Indian Acad. Sci., A63, 356 (1966). '
565. Bieber B., Drexlerova J. Hutn. listy, 21, 50 (1966).
565а.Bishop J. R. Analyst, 81, 291 (1956).
566. Bishop J. R., Liebmann H. Analyst, 78, 117 (1953).
567. Bisque R. E. J. Sediment. Petrol., 31, 113 (1961).
568. Blair D., PowerR., GriffithsD. L., Wood J. H. Taianta, 7, 80 (1960).
569. Bloch L. Anal. chim. acta, 32, 233 (1960).
570. Blum W. J. Am. Chem. Soc., 38, 1281, 1290, 1295 (1916).
571. BoaseD. G., Foreman J. K- Taianta, 3, 82 (1960).
572. BoaseD. G., Foreman J. K- Taianta, 8, 187 (1961).
573. Bobtelsky M., Bar-Gadda I. Anal. chim. acta, 9, 446 (1953).
574. Bobtelsky M., Bar-Gadda I. Anal. chim. acta, 9, 525(1953).
575. Bobtelsky M., Goldschmidt J. M. E. Bull. Res. Council. Israel, A7, 121 (1958).
576. Bobtelsky M., Wellwart G. Anal. chim. acta, 10, 151 (1954).
577. Bock R. Z. anal. Chem., 133, 110, 115 (1951).
578. Bock R., Umland F. Angew. Chem., 67, 420 (1950).
579. Bode H. Z. anal. Chem., 142, 414(1954); 143, 182(1954); 144, 90, 165 (1955).
580. Bok L. D. C.; Schuler V. C. 0. J. S. Afric. Chem. Inst., 11, 1 (1958).
581. Bolleter W. T. Anal. Chem., 31, 201 (1959).
582. Bolomey R. A., Wish L. J. Am. Chem. Soc., 72, 4483 (1950).
583. Borrel M., Paris R. Anal. chim. acta, 4, 267 (1950).
584. Bosholm J. J. prakt. Chem., 29, 65 (1965).
585. Box F. W. Analyst, 71, 317 (1946).
586. Bravo A. C. S., Diaz C. R. Pol. Acad. Cienc. fis., mat. у natur., 24, 67 (1961); РЖХим., 3 Г 80 (1962).
587. Bresny В., Kurcova A. Hutn. listy, 18, 204 (1960).
588. Brhacek L. Chem. listy, 52, 1820 (1958).
589. Brhaiek L. Coll. Czechoslov. Chem. Commun., 24 , 2811 (1959).
590. Bril J. Mikrochim. acta, N 2, 212 (1958).
591. Britton H. T. S. J. Chem., 127, 2157 (1925).
592. Brockmann H., Keller H. Arch. Eisenhuttenwesen, 35, 367 (1964).
593. BrookesH. E., Johnson C. A. J. Pharmacy and Pharmocol., 7, 836 (1955).
594. Brownell G. M., Bramadat K-, Knutson R. A., Turnock A. C. Trane. Roy.
Soc. Canada, Sec., 4, 51, 19(1957).
595. Brum D. Nukleonik, 3, N 7, 318 (1961); РЖХим., 14 Д 15 (1962).
596. Buck L. Chim. analyt., 47, 10(1965).
597. Budan F. Radex-Rundschau N 2, 129 (1966).
598. Budewski O-, Simova L. Докл. Волг. АН, 14, 179 (1961).
599. Burke К- E. Anal. Chem., 38, 1608 (1966).
600. Burke К- E., Davis C. Anal. Chem., 36, 172 (1964).
601. Burriel M. F., Belli T. C. An. Real. Soc. espafiola fis у quim., В 50, 957. (1954); РЖХим., № 23, 55274 (1955).
602. Busch W., Z. anorg. Chem., 161, 169 (1927).
603. Bykowski W. Chem. analit. (Polska), 6, 265 (1961).
604. Bykowski W. Przegl. elektron. 83, 231 (1962).
605. Cadariu I., Goina T. Studia Univ. Babe?. Bolyai. Ser. Chem., 7, 15 (1962);
РЖХим., 24 В 71 (1964).
606. CUdariu I., Goina T. Studia. Univ. Babe?. Bolyai. Ser. Chem., 8, 27 (1963) РЖХим., 14 В 90 (1966).
607. Cadariu I., Oniciu L. Studia Univ. Babe?-Bolyai. Ser. Chem., 5, 39 (1960);
РЖХим., 22 В 28 (1962).
608. Cadariu I., Oniciu L. Studii si cercetari §tiin. Acad. RPR. Fil. Cluj., Ser. 1, 5, 95 (1954); РЖХим., № 7, 19475 (1956).
245
609. Cadariu I.. Oniciu L. Studii si cercetari Chim. Acad. RPR.. Fil. Cluj., 12, 69(1961); РЖХпм., И В 65 (1963).
610. Caldararu H. Rev. chim. (RPR), 14 . 399(1963); РЖХим., 5 Г 157 (1964).
611. Caldwell J.R.. Mover H. Г. J. Am. Chem. Soc., 57. 2372 (1935).
612. Calvet J. Compt.‘rend.. 195, 148 (1932).
613. Camp L. .11. Iron Age. 65, 17 (1900).
614. Canic V.. Kist T. Tehnika. 19. X 1; Hem. ind., 18. 5—7 (1964).
615. Capacho-Delgado L.. Manning D. C. Analyst. 92, 553 (1964).
616. Capitan-Garcia F.. Homan M.. Rev. Univ, industr. santander. 9. 17(1967;; РЖХим.. 15 Г 64 (1968).
617. Capizzi F. 31. Ann. chimica. 51 563 (1961); РЖХим., 7 Д 46 (1962).
618. Carnot G. Compt. rend., Ill, 914 (1890).
619. Carruthers C. Ind. eng. chem., Anal. Ed., 15. 1102 (1943).
620. Carter Fl. H. Ind. Eng. Chem., 20, 1195 (1928).
621. Cattrall R. II7. Austral. J. Chem., 14, 163(1961).
622. Cavignac H. Compt. rend., 158. 948 ((1914).
623. Celleja J.. Fernandez P. J. 31. Cementohormigon, 25, 651 (1959): РЖХим., № 14, 56693 (1960).
624. Cerrai E., Ghersini G. J. Chromatogr.. 16, 258 (1964).
625. Chablo A. Chem. analit. (Polska), 9. 501 (1964).
626. Chakrabatri C. L.. Lyles G. R., Dowling F. B. Anal. chim. acta, 29, 489 (1963).
627. Chalmers R. A-, BasitM. A.. Analyst, 92, 680 (1964).
628. Chalupny R., Breisch R. Z. angew. Chem., 35, 233 (1922).
629. Chancel J. E. Z. anal. Chem., 3, 391 (1861).
630. Chariot G. Anal, chim., acta, 1, 223(1947).
631. Chemical Analysis Sub-Comittee of the Britisch Ceramic Research Association, Trans. Brit. Ceram. Soc., 51, 438 (1952).
632. Chenery E. M- Analyst, 73, 501 (1948).
633. Cheng R. L. Proceedings of the International Symposium on Mikrochemistry, Oxford— London — New York— Paris, 1960, p. 465.
634. Cheng R. L., Bray R. H. Anal. Chem., 27, 782 (1955).
635. Cheng R. L., Warmuth F. J. Chemist-Analyst., 48, 74 (1959).
636. Chiacchierini E., Ascenzo G. Ann. chimica, 56, 1485 (1966).; РЖХим., 14 Г 58 (1967).
637. Chirnside R. C. Analyst, 59, 278 (1934).
638. Chirnside R. C., Pritchard C. F., Rooksby H. P. Analyst., 66, 399 (1941).
639. Cholak J., Hubbard D. M., Story R. V. Ind. Eng. Chem., Anal. Ed., 15, 57(1943).
640. Chwastowska J. Proceedings of the Analytical Chemical conference. Budapest, 1966, p. 45.
641. Chwastowska J., Minczewski J. Chem. analit. (Polska), 9, 791 (1964).
642. Cimerman C., Alon A., Mashal J. Taianta, 1, 314 (1958).
643. Classen A. Z. anorg. Chem., 142, 257(1925).
644. Classen A., Bastings L. Analyst, 92, 614 (1967).
645. Classen A., Bastings L. Analyst, 92, 618 (1968).
646. Classen A., Bastings L., Visser J. Anal. chim. acta, 10, 373 (1954).
647. Clennel J. E. J. Inst.-Met., 28, 253 (1922).
648. Cleveland J. M., Nance P. D. U. S. Atomic Energy comm. Rept. REP-53 (1955).
649. Codell M., Norwitz G. Anal. Chem., 25, 1437 (1953).
650. Colin R. H., Gardner D. A- Anal. Chem., 21, 701 (1949).
651. Collat J. U7., Rogers L. B. Anal. Chem., 27, 961 (1955).
652. Congton L. A- Carter J. A. Chem. News, 128, 98 (1924); Chem. Zbl., 95, 1. S. 2458 (1924).
653. Cooney B. A., Saylor J. H. Anal. chim. acta, 21, 276 (1959).
654. Coppins U7. C., Price IV'. Metallurgia, 48, 149 (1953).
655. Corbett J. A. Analyst, 78, 20(1953).
656. Corbett J. A., Guerin B. D. Analyst, 91, 490 (1966).
657. Corey R. H., Rogers H. W. J. Am. Chem. Soc., 49 , 216 (1927).
246
658. Coursier J., Saulnier J. Anal. chim. acta, 14 , 62 (1956).
659. Craft С. H., Makepeace G. R. Ind. Eng. Chem., Anal. Ed., 17, 206 (1945).
660. Crt?an I. <4., Bercea E. Rev. chim. (RSR), 18, 370 (1967); РЖХим., 7 Г 47 (1968).
661. Cri^an I. .4., Lakatos A. Rev. chim. (RSR), 17, 557 (1966); РЖХим.. 4 Г 103 (1957).
662. Cross C. F. Chem. New, 39, 161 (1879).
663. Cruse K-. RettesheimG. Z. anal. Chem., 152, 19(1956).
664. Cuerrin G., Sheldon M. V., Reilley C. N. Chemist-Analvst, 49, N 2, 36 (1960).
665. Culp S. L. Chemist-Analyst, 56, 29 (1967).
666. Curtman L. J., Dubin A. J. Am. Chem. Soc., 34, 1485 (1912).
667. Cyllum M. Canad. J. Chem., 34, 915 (1956).
668. Gzajka Z. Przegl. odlewn., 16, 169 (1966).
669. Czernieg J., Gregorowicz Z. Zesz. nauk. Politechn. slaskiej, N 108, 59(1964).
670. Dagnail R. M., West T. S„ JoungP. Analyst, 90, 13 (1965).
671. Dagnail R. M., Smith R., West T. S. Taianta, 13, 609 (1965).
672. Danneil A. Techn-Wiss. Abhande. Osram Ges., 7, 350 (1958); РЖХим., № 13, 51659 (1960).
673. Darbey A. Am. Dyestuff Rept., 42, 453 (1953).
674. DasB., Aditya S. J. Indian Chem. Soc., 36, 473(1959).
675. Davenport W. H. Anal. Chem., 21, 710 (1949).
676. Debras-Guedon J. Bull. Soc., franp. ceram., N 62, 7 (1964).
677. Debras-Guedon J., Voinovitch 1. Compt. rend., 249, 242 (1959).
678. Dehn H., Gritzner G., Gutman V. Mikrochim. acta, № 3, 422, 426 (1958).
679. Dempir J. Stavivo, 38, 28 (1960).
680. Dempir J. Stavivo, 41, 183 (1963).
681. Deterding H. C., Taylor R. G. Ind. Eng. Chem., Anal. Ed., 18, 127 (1946).
682. DetmurD. A., Aller H. C. Reel. Trav. chim. Pays-Bas, 75, 1429 (1956).
683. Dey A. K. Mikrochim. acta, № 2—4, 414 (1964).
684. Dlnnin J. 1Rinser G. R. Geol. Surv. Profess. Paper, N 424—B, 329 (1961).
685. Dippel С. P, Silikattechnik, 17, 293 (1966).
686. Dowling F. B., Chakrabatri C. L., Lyces G. R. Anal. chim. acta, 28, 392 (1963)-
687. Dozinel C. Chim. analyt., 38, 244 (1956).
688. Drefahi G., Geissler A., Z. anal. Chem., 160, 34 (1958).
689. Diibel WFlurschiltz W. Chem. techn., 12, 538 (1960).
690. Dubey S. N., Mehrotra R. C. J. Indian Chem. Soc., 42, 685 (1965).
691. Dubey S. N., Mehrotra R. C. J. Inorg. and Nucl. Chem., 26, 1543 (1964).
692. Dupuis T., Duval C. Anal. chim. acta, 3, 191 (1949).
693. Dutt N. K., Bose P. J. Indian Chem. Soc., 30, 431 (1953).
694. Dutt N. K., Bose P. Z. anorgan. und allgem. Chem., 295, 131 (1958).
695. Duval C. Inorganic Thermogravimetric Analysis. Amsterdam, 1953, p. 105.
696. Dvorak, J., Nyketovd E. Mikrochim. acta, N 6, 1082 (1966).
697. Eckert G. Z. anal. Chem., 153, 261 (1956).
698. Edward W. T. Analyst, 73, 556 (1948).
699. Eegriewe E. Z. anal. Chem., 76, 438 (1929); 108, 268 (1937).
700. Elliot C., Robinson J. W. Anal. chim. acta, 13, 209, 235 (1955).
701. Erdey L., Paulik F. Acta chim. Acad. Sci. Hung., 7, 45 (1955).
702. Erwards W. T. Analyst, 73, 556 (1948).
703. Eshelman H. C., Dean A. J., Mines O., Rains T. S. Anal. Chem. 31, 183 (1959).
704. Evans И. B. Analyst, 92, 685 (1967).
705. Evans H. B., Hashitani H. Anal. Chem., 36, 2032 (1964).
706. Eveleth D. F., Myers V. C. J. Biol. Chem., 113, 449 (1936).
707. Falchi G., Tonani F. Period, mineral., 31, 389 (1962); РЖХим., 14 Г 130 (1964).
708. Faucherre J., Fromage F., Noizet D. Compt. rend., C262, 1520 (1966).
709. Feigl F., Goldstein D. Anal. Chem., 29, 456 (1957).
709a. Ferlin C., Lelievre B. Bull. Soc. chim. France, 3415 (1968).
710. Ferrari C. Ann. Chim. applic., 27, 479 (1937).
247
711. Fijalkowski J. Chem. analit. (Polska), 4. 455 (1959).
712. Filipov D., Kirtcheva .V. Докл. Болг. АН, 17, 467 (1964).
713. Fisel S., Gabe I.. Poni M.. Studii $i Cercetari Chim. Acad. RPR. Fil. Iasi. Chim., 13, 33 (1962); РЖХим., 18 Г 49 (1963).
714. Fischer J., Schmidt W. Z. Erzbergbau und Metallhiittenwesen, 9, 25 (1956).
715. Fischer W., Seidel IF. Z. anorg. Chem., 247, 333 (1941).
716. Fischer W., Zumbusch .V. Z. anorg. Chem., 252, 249 (1944).
717. Fitzner E. Aluminium (BRD), 40, 741 (1964).
718. Flaschka H., Abdine H. Mikrochim. acta, № 1, 37 (1955).
719. Flaschka H., Abdine H. Z. anal. Chem., 152, 77 (1956).
720. Flaschka H., Franschitz IF. Z. anal. Chem., 144, 421 (1955).
721. Flaschka H., Haar K-, Bazen J. Mikrochim. acta N 4, 345 (1953).
722. Fleck H. R., Ward A. M. Analyst, 58, 388 (1933).
723. Floerence T. M. Anal. Chem., 34, 496 (1962).
724. Floerence T. ,W. Anal. Chem., 37, 704 (1965).
725. Floerence T. M. Izard D. B. Anal, chim., acta, 25, 386 (1961).
726. Floerence T. M., Miller F. J., Zittel H- E. Anal. Chem., 38, 1065 (1966).
727. Foglino M. L., Spagliardi G. P. Metallurgia ital., 50, 372 (1958); РЖХим., № 9, 30992 (1959).
728. Folin O., Ciocalteu V. J. Biol. Chem., 73, 627 (1927).
729. Fornaseri M., Turi B. Metallurgia ital., 58, 245 (1966); РЖХим, 19 Г 94 (1967).
730. Fourne L., Deschamps N., Albert P. Compt. rend., 254, 1640 (1962).
731. Frame H. D., Strain H. H., Sherma J. Anal. Chem., 34, 170 (1962).
732. Freru J. N. Z. anal. Chem., 95, 119 (1933).
733. Fresenius R., Jander G. Handbuch der analystischen chemie, Teil 3, Bd.
III. Berlin, 1942, S. 310.
733а.Freund H., Miner F. J. Anal. Chem., 25, 564 (1953).
734. Fricke R. Koll. Z., 49, 241 (1929).
735. Fricke R., Meyring K- Z. anorg. Chem., 188, 127 (1930).
736. Friedheim C., Hasenclever P. Z. anal. Chem., 44, 606 (1965).
737. Friese G. Z. angew. Geol., 6, 279, 615 (1960).
738. Fritz J. S., Abbink J. E., Payne M. A. Anal. Chem., 33, 1381 (1961).
739. Fromage F. Ann. Univ. Assoc, reg. etude et rech. scient., 2, 8 (1963—-1964); РЖХим., 11 Г 89 (1964)
740. Fuelton J. IF., Hestings J. Anal. Chem., 28, 174 (1956).
741. Funk H., Waiter H. Z. anal. Chem., 67, 88 (1924—1925).
742. Furlani D. A. Gazz. Chim. ital., 90, 1380 (1960); РЖХим., 12 Д 54 (1961).
743. Gad G., Nauman K. Gas- und Wasserfach, 80, 58 (1937).
744. Gage D. G. Anal. Chem., 28, 1773 (1956).
745. Gamsjager H., Schwarz-Bergkampf E. Mikrochim. acta, N 1—2, 194 (1962).
746. Garzon R. L. Inform, quim. analit., 14, 64 (1960); РЖХим., 9 Д 137 (1961).
747. Gassner K. Z. anal. Chem., 152, 417 (1956).
748. Gegus E. Acta chim. Acad. Scient. hung., 28, 65 (1961).
749. Gelis P. Chim. analyt., 49, 30 (1967).
750. Gentry С. H. R., Sherrington L. G. Analyst, 71, 432 (1946).
751. German A., Glanta G. Rev. chim. (RPR), 14, 424 (1963); РЖХим., 8 Г 114 (1964).
752. Geyer R., Bormann R. Z. Chem., 7, 30 (1964).
753. Gheocalescu $. Metallurgia ^iconstr. mas., 12, 247 (1960). РЖХим., № 20, 80852 (1960).
754. Giebler G. Z. anal. Chem., 184, 401 (1961).
755. Gilchrist R. J. Res. Nat. Bur. Standards, 30, 89 (1943).
756. Ginsburg L., Millar K., Gordon L. Anal. Chem., 29, 46 (1957).
757. Giuffre L., Capizzi F. M. Ann. chimica, 49, 1834 (1959); РЖХим, № 15, 61020 (1960).
758. Glasner A., Sarah S. Israel J. Chem., 3, 143 (1965).
759. Glemser O., Raulf E., Giesen K. Z. anal. Chem., 141, 86 (1954).
760. Gloor K.., Pentsch R. Rev. mater, et trav. publies, N 470, 304 (1954).
248
761. Gmelin L. Handbuch der anorganischen Chemie, Svstem № 35. Aluminium. Teil A. Abt. 1, Berlin, 1934—1935; Teil B, 1934.
762. Goke G. Lab.— Prax., 11, 37 (1959).
763. Goldstein G., Manning D. L., Menis 0. Taianta, 2, 52 (1959).
764. Goldstein G., Manning D. L., Zittel H. E. Anal. Chem., 35, 17 (1933).
765. Goina T., Ristca 1. Studia Univ. Babe^-Bolyai. Ser. Chem., 10, 65, 69 (1965);
РЖХим, 17 В 76, 17 Г 77 (1966).
766. Gooch F. A., Havens F. S. Am. J. Sci., 2, 416 (1896).
767. Goon E., Petley J-, McMullen W. H., Wiberley S. E. Anal. Chem., 25, 608 (1953).
768. Gordon L., Ginsburg L. Anal. Chem., 29, 38 (1957).
769. Gotkowska A. Chim. analit. (Polska), 10, 749 (1965).
770. Goto H. Sci. Rep. Tohoku Imp. Univ., 26, 391 (1937).
771. Goto H. Sci. Rep. Tohoku Imp. Univ., 26, 418 (1938).
772. Goto H., Kakita Y., Hosoya M. J. Japan Inst. Metals, 24, 32 (1960); РЖХим., № 19, 77035 (1960).
773. Gottschalk G. Z. anal. Chem., 172, 192 (1960).
774. Govindaraju M- K.- Publ. groupmen avencem. methodes Spectrogr. juile, sept., 221, 208 (1960); РЖХим, 8 Д 142 (1962).
775. Granger C. 0. Developm. and Engng Group U. K. Atomic Energy Author. Rept., № 219 (c); 1960.
776. Grant J. J. Appl. Chem., 14, 525 (1964).
777. Green H. Metallurgia, 57, 157 (1958).
778. Green H. Metallurgia, 71, 243 (1965).
778a.Gregorowicz Z. Chem. analit. (Polska), 3, 783 (1959).
779. Grimaldi F. S., Levine H. Geol. Survey Bull., № 992, 39 (1953).
780. Groot C., Peekema R. M., Troutner V. H. Anal. Chem., 28, 1571 (1956).
780a.Grosskreutz W-, Schultze D., Wilke V. T. Z. anal. Chem., 232, 278 (1967).
781. Guerreschi L., Romita R. Ricerca Scient., 27, 3361 (1957); РЖХим., № 16, 5305 (1958).
782. Gutmann V., Schober G. Mikrochim. acta, № 5, 959 (1962).
783. Gwyer A. G. C., Pullen N. D. Analyst, 57, 701 (1932).
784. Haar K., Bazen J. Anal. chim. acta, 10, 23 (1954).
785. Haar f(., Umland. Z. anal. Chem., 191, 81 (1962).
786. Habrechte M. Hutn. listy, 18, 138 (1963).
787. Hadorn H. Mitt. Gebiete Lebensmittel unters. Hyg. (Berl.), 48, 314 (1934).
788. Halasz A., Jdnosi A., Villanyi K- Veszpremi vegyipari egyet. kozl., 5, 151 (1961); РЖХим., 24 Д 179 (1962).
788a. Hammet L. P., Sottery S. T. J. Am. Chem. Soc., 47, 142 (1925).
789. Haranczyk C., Kogut E. J. Szklo i Ceram., 8, 318 (1957).
790. Hatfield W. D. Ind. Eng. Chem., 16, 233 (1924).
791. Haywood F. W., Harrison F., Wood A. R. J. Soc. Chem. Ind., 62, 187 (1943).
792. Hazan I., Feik F., Rorkisch J. Z. anal. Chem., 210, 171 (1965).
793. Heczko T. Chemikerzeitung, 58, 1032 (1934).
794. Heeb R. Z. anal. Chem., 170, 95 (1959).
795. Hegediis A. J. Kohasz. lapok, 9, 335 (1954); РЖХим., № 7, 11861, (1955).
796. Hegediis A. J. Mikrochim. acta, № 5—6, 831 (1963).
796а. Hegemann F., Caimann V. Glastechn. Ber., 29, 239 (1956).
797. Hegemann F., Hert W. Ber. Dtsch. keram. Ges., 35, 258 (1958).
798. Hegemann F„ Hert W„ Smidt W. Glastechn. Ber., 31, 81 (1958).
799. Hegemann F., Osterried Q. Ber. Dtsch. Keram. Ges., 40, 424 (1963).
799a.Hegemann F., Sybel C. Glastechn. Ber., 28, 190, 307 (1955).
800. Hegemann G., Wilk G. Ber. Dtsch. Keram. Ges., 39, 483 (1962).
801. Hejja A. Vegyipari Kut. int. Kozl., 1, 8 (1953); РЖХим., № 9, 25938 (1956).
802. Henry S., Haniset P. Ind. Chim. beige, 27, 24 (1962); РЖХим., 22 Д 47 (1962).
803. Herman P., Hainski Z., Louverier J., Voinovitch I. A. Publ. Groupmen avan-cem. methodes spectrogr., oct.-dec., 455 (1961); РЖХим, 3 Г 118 (1963).
804. Hess W. H., Campbell E. D. J. Amer. Chem. Soc., 21, 776 (1899); Chem. Zbl., 70, II, 631 (1899).
249
805. Heyrovsky J. J., Chem. Soc., 117, 20 (1920).
806. Heyrovsky J. Coll. Czechoslov. Chem. Commun., 25, 3120 (1960).
807. Hibbs L. E., Wilkins D. H. Taianta, 2, 16 (1959).
808. Hill U. T. Anal. Chem., 28, 1419 (1956).
809. Hill U. T. Anal. Chem., 31, 429 (1959).
810. Hill U. T. Anal. Chem., 38 , 654 (1966).
811. Hinek R. J., Wrangell L. J. Anal. Chem., 28, 1520 (1956).
812. Hinrichsen W. Z. anorg. Chem., 58, 83 (1908).
813. Holaday D. A. J. Am. Chem. Soc., 62, 989 (1940).
814. Holler A. C., Yeager J. P. Ind. Eng. Chem., Anal. Ed., 14, 719 (1942).
815. Hollingshead R. G. W. Oxine and its Derivatives, vol. I. London, 1954, vol. Ill, 1956.
816. Holzbecher Z. Chem. listy, 47, 680 (1953).
817. Holzbecher Z. Chem. listy, 52 , 430, 1822 (1958).
817a.Holzbecher Z., Pulkrab P. Coll. Czechoslov. Chem. Commun., 27, 1142 (1962).
818. Hopfer G. Lab.— Praxis, 8, № 11, 122 (1956).
819. Horton A. D., Thomason P. F. Anal. Chem., 28, 1326 (1956).
820. Hosoya M., Kakita Y., Goto H. Sci. Repts Res. Inst. Tohoku Univ., A 13, № 4, 206 (1961).
821. Hotynska B. Rudy i metall niezel., 10, 54 (1965).
822. Houda M., Kprbl J., Bazant V., Piibil R. Chem. listy, 51, 2259 (1957).
823. Houda M., Kprbl J., Bazant V., Prtbil R. Coll. Czechoslov. Chem. Commun., 24, 700 (1959).
824. Houghton G. U. Analyst, 68, 208 (1943).
825. Howick L. C., Jones J. L. Taianta, 8, 445 (1961).
826. Howick L. C., Jones J. L. Taianta, 9, 1037 (1962).
827. Howick L. C., Trigg W. W. Anal. Chem., 33, 302 (1961).
Wa.Hozdic C. J. Assoc. Offic. Analyt. Chemists, 49, 1187 (1966).
828. Hummel R. A., Sandell E. B. Anal. chim. acta, 7, 308 (1952).
829. Hunter A. H., Coleman N. T. Soil Sci., 90, 214 (1960).
830. Hyman H. M. Appl. Spectroscopy, 16, 129 (1962).
831. Ikenberry L. C., Thomas A. Anal. Chem., 23, 1806 (1951).
832. Imelik B., Mathieu M. V., Prettre M-, TechnerS, J. Chem. Phys., 51, 651 (1954).
833. Ind. Group. U. K. Atomic Energy Author., IGO-AM/S-159 (1959).
834. Irving R. J. Taianta, 12, 1046 (1965).
835. Ishibashd M., Fujinaga T., Sato M. Bull. Inst. Chem. Res. Kyoto Univ., 37, 267 (1959).
836. Ishii H-, Einaga H. Bull. Chem. Soc., Japan, 39, 1721 (1966).
837. Ishimori T., Kimura K-, Fujino T., Murakami H. J. At. Energy soc. Japan, 4, 117 (1962).
838. Iwamoto R. T. Anal. chim. acta, 19, 272 (1958).
839. Jackson H., Phillips D. S. Analyst, 87, 712 (1962).
840. Jackson W. A. J. Agric. and Food Chemistry, 7, 628 (1959).
841. Jander G., Ruperti 0. Z. anorg. Chem., 153, 233, 253 (1926).
842. Jander G., Veber R. Z. anorg. Chem., 131, 266 (1923).
843. Jarman L., Mattie M. Taianta, 9, 219 (1962).
844. Jaxa-Bykowska E., Jaxa-Bykowski W. Acta Chim. Acad. Scient. Hung., 30, 335 (1962).
845. Jean M. Anal. chim. acta, 10, 526 (1954).
846. Jewsbury A., Osborn G. H. Anal. chim. acta, 3, 642 (1949).
847. Jilek A., Lukas J. Coll. Czechoslov. Chem. Commun., 2, 63 (1930); Chem. Zbl., 101, I. S. 3466 (1930).
848. Johannsen W., Bobowski E., Wehber P. Metall, 10, 211 (1956).
849. Jokelleovd D. Silikaty, 11, 37 (1967).
850. Jones I. G., Phillips G. Atomic Energy Res. EstabL, № 12, 2879 (1960).
851. Jung E. Z. fiir Pflanzenernahrung u. Diiungung, 26, 1 (1932).
852. Jungreis E., Lerner A. Anal. chim. acta, 25, 199 (1961).
853. Jurczyk J. Chem. analit. (Polska), 10, 441 (1965).
250
854. Jurczyk J. Z. anal. Chem., 210, 324 (1965).
855. Kadlec J. Hfltn. listy, 17, 59 (1962).
856. Kakita J., Jokohama G. Sci. Repts. Res. Inst. Tohoku Univ., As, 332 (1956).
857. Kakita J.. Sudd E., Namiki M. Sci. Repts Res. Insts. Tohoku Univ., Д 13, 199 (1961).
858. Kambara T., Hashitani H. Anal. Chem., 31, 567 (1959).
859. Kamemato G., Jamagishi S. Bull. Chem. Soc. Japan. 36, 1411 (1963).
860. Kampf L. Ind. Eng. Chem., Anal. Ed., 13, 72 (1941).
861. Kar В. C. J. Scient. and Industr. Res., 13, Sec. B:, 855 (1954).
862. Karch Z. Szklo i Ceram., 7, 317 (1956).
863. Kassner B., Agermann W. Z. Chem., 7, 438 (1967).
864. Kassner J. L., Ozier M. A. Anal. Chem., 23, 1453 (1951).
865. Kassner J. L., Ozier M. A. J. Am. Ceram. Soc., 33, 250 (1950).
866. Kawamura F., Namiki H. Bull. Fac. Engng. Jokohama Nat. Univ., 8 261 (1959).
867. Keattch C. J. Taianta, 11, 543 (1964).
868. Kekedy L., Bologh G. Studia Univ. Bade— Bolyai. Ser. Chem., 9, 101 (1964), РЖХим, 5 Г 15 (1962).
869. Kenyon 0. A., Bewick H. A. Anal. Chem., 24, 1826 (1952).
870. Kerin D. Mikrochim. acta, № 5, 670 (1964).
871. Kindu P. C. Naturw., 48, 644 (1961).
872. Kinnunen J., Merikanto B. Chemist-Analyst, 42, 16 (1953).
873. Kinnunen J., Merikanto B. Chemist-Analyst, 44, 50 (1955).
874. Kirby J. R., Milburn R. M., Saylor J. H. Anal. chim. acta, 26, 458 (1962).
875. Kirkbright G. F., West T. S., Woodward C. Anal. Chem., 37, 137 (1965).
876. Kiss T. A. Z. anal. Chem., 208, 334 (1965).
876a. Kiss T. A., Doric T. Chem. and Ind., № 45, 1567 (1968).
877. Klein P., Skrivanek V. Chem. listy, 56, 72 (1962).
877a. Klinger P. Arch. Eisenhflttenwes., 13, 21 (1939).
878. Klinger P., Kock W., Blaschczyk G. Angew. Chem., 53, 243 (1940).
879. Koch 0. G. Mikrochim. acta, № 1, 92 (1958).
880. Koch W. Arch. Eisenhiittenwes., 12, 69 (1938).
881. Koch W. Stahl und Eisen, 58, 952 (1938).
882. Kodzu T. J. Chem. Soc. Japan, 54, 682 (1933); C. A., 24, 5675 (1933).
883. Kohlschiitter H., Getrost H. Z. anal. Chem., 167, 264 (1959).
884. Kohlschiitter H., Getrost H., Hofmann G., Stamm H. Z. anal. Chem., 166, 262 (1959).
885. Kohlschiitter H., Miedtank S., Getrost H. Z. anal. Chem., 192, 381 (1963).
886. Kollo C., Georgian N. Bull. Soc. Romania, 6, 111 (1924).
887. Kolthoff I. M. Chem. Weekblad., 24, 606 (1924).
888. Kolthoff I. M. J. Am. Pharm. Assn., 17, 360 (1928).
889. Kolthoff I. M. Z. anorg. Chem., 112, 185 (1920).
890. Kolthoff I. M., Lingane J. J. Polarography. Inersience Publischers, Inc., New York, 1952.
891. Kolthoff I. M., Sandell E. B. J. Am. Chem. Soc., 50, 1900 (1928).
892. Kolthoff I. M., Stenger V. A., Moskovitz B. J. Am. Chem. Soc., 56, 812 (1934).
893. Konopicky K-, Schmidt W. Z. anal. Chem., 174, 262 (I960).
894. Korbl J., Pribil R. Chemist-Analyst, 45, № 4, 102 (1956).
895. Korbl J., Pribil R. Chem. listy, 51, 1061 (1957).
896. Korbl J., Pribil R., Emr A. Chem. listy, 50, 1440 (1956).
897. Korkisch J., Ahluwalia S. S. Anal. chim. acta, 34, 308 (1966).
898. Korkisch J., Farag A. Z. anal. Chem., 166, 81 (1959).
899. Korkisch J., Нагап I. Anal. Chem., 36, 2308 (1964).
900. Kovarik M., Moucka M. Z. anal. Chem., 150, 416 (1956).
901. Krajina A., Dolezal J. Taianta, 14, 1433 (1967).
902. Krassnowski O. W. Z. anal. Chem., 79, 175 (1930).
903. Krishnamurty K-, Venkateswarlu C. Rev. trav. Chim., 71, 668 (1952).
904. Kristiansen H. Anal. chim. acta, 25, 513 (1961).
905. Kriz M. Sklar a ceramik, 6, 140 (1956).
251
905a.Krleza F. Glasnik hem. i tehnol. В i H, 13—14, 15 (1964—1965).
906. Kroupa M. Hutn. listy, 13, 922 (1958).
907. Kuebler W., Shaneman W. J., Gallagher J. Chemist-Analyst, 18, 6 (1929).
908. Kulcickyi I., Svacha F. Coll. Czechoslov. Chem. Commun., 23, 1582 (1958); Chem. listy, 52, 340 (1958).
909. Karjakovic-Boganovic M., Plepelic R. Kemija u industriji, 11, 700 (1962).
910. Lacroix S. Anal. chim. acta, 1, 260 (1947).
911. Landi M. F., Battaglia A. Metallurgia ital., 59, 650 (1967); РЖХим., 8 Г 134 (1968).
912. Landi M. F., Braicovich L. Metallurgia ital., 54, 389 (1962); РЖХим., 12Г61 (1963).
913. Lange B. Kolorimetrische Analyse, 1952, p. 93.
914. Langmyhr F. J., Kristiansen H. Anal. chim. acta, 20, 524 (1959).
915. Langmyhr F. J., Storm A. R. Acta chem. Scand., 15, 1461 (1961).
916. Lang R., Reifer J. Z. anal. Chem., 93, 161 (1933).
917. Larsson A. Yernkontorets ann., 137, № 6, 172 (1953); РЖХим., № 8, 23964 (1954).
918. Laszlovszky J. Mikrochim. acta, № 3, 441 (1962).
919. Leimbach G. Ber. dtsch. chem. Ges., 25, 3161 (1922).
920. Leo R-, Kbnig G. Metallurgie und Giessereitechnik, N 3, 26 (1955).
921. Lepper H. A. Official Methods of Analysis of the Association of Official Agricultural Chemists, 1950, p. 97.
922. Lewis L. L., Nardozzi M. J., Melnick L. M. Anal. Chem., 33, 1351 (1961).
923. Lewis J. H., Taylor C. A. J. Appl. Chem., 8, 223 (1958).
923а.Liebman A. M. Anal. Chem., 29, 899 (1957).
924. Lightowlers E. C. Anal. Chem., 34, 1398 (1962).
925. Lilie H. Chem. Technik, 9, 364 (1957).
926. Lilie H., Rosin H. Z. anal. Chem., 160, 261 (1958).
927. Linnell R. H., Raab T. H. Anal. Chem., 33, 154 (1961).
928. Liteanu C., Cosma M. Studia Univ, Babe?-Bolyai. Chem., № 2, 63 (1959); РЖХим., 12 Д 78 (1961).
929. Liteanu C., Crisan I. Studii yi cercetari Chim. Acad. RPR Fil. Cluj, 12, 261 (1961); РЖХим., 13 Г 46 (1933).
930. Liteanu C., Crisan I., Calu C. Rev. chim. (RPR), 10, 351 (1959); РЖХнм., № 6, 22061 (1960).
931. Liteanu C., Crisan I., Calu C. Studia Univ. Babes-Bolyai. Chem., № 2, 105 (1959); РЖХим, 12 Д 53 (1961).
932. Liteanu C., Lucacs I., Strusievici C. Anal. chim. acta, 24, 200 (1961).
933. Litlle I. Austral. J. Soil. Res., 2, 76 (1964).
934. Longuyon I. G. Ber. Deutsch, keram. Ges., 35, 155 (1958).
935. Lounamaa N. Spectrochim. acta, 7, 356 (1956).
936. Lovasi J., Zombory L. Mikrochem. J., 11, 277 (1966).
937. Luff G. Chem. Ztg., 46, 366 (1922).
938. Luke C. L. Anal. Chem., 24, 1122 (1952).
939. Luke C. L., Braun К- C. Anal. Chem., 24, 1120 (1952).
940. Lundell G. E. F„ Knowles H. B. Ind. Eng. Chem., 14, 1136 (1922).
941. Lundell G. E. F., Knowles H. B. J. Am. Chem. Soc., 45, 676 (1923).
942. Lundell G. E. F., Knowles H. B. J. Research Natl. Bur. Standards 3, 86, 91 (1929).
943. Lusker J. A., Sebba F. J. Appl. Chem., 15, 577 (1965).
944. Lydersen D. Z. anal. Chem., 139, 401 (1953).
945. Lyle S. J., Southern D. L. Taianta, 11, 1239 (1964).
946. Magee R- J., Scott I. A. P. Taianta, 3, 131 (1959).
947. Majumdar A. K-, Chatteriee K- Mikrochim. acta, № 4, 663 (1967).
948. Majumdar A. K-, Savariar С. P. Z. anal. Chem., 174, 197, 269 (1960).
949. Majumdar A. K-, Sen B. Anal. chim. acta, 8, 378, 384 (1953).
950. Malat M. Anal. chim. acta, 25, 289 (1961).
9itia.Malinek M., Soudny M. Hutn. listy, 16, 358 (1961).
951. Malissa H., Kotzian H. Anal. chim. acta, 26, 128 (1962).
252
551a. Manchen. W. Neue Hfltte, 1, 163 (1956).
952. Marczenko Z. Chem. analit. (Polska), 4, 437 (1959).
953. Marczenko Z. Chem. analit. (Polska), 9, 1093 (1957).
954. Marczenko Z., Mojski M. Chem. analit. (Polska), 12, 1155 (1967).
955. Marczenko Z., Stepien A. Chem. analit. (Polska), 5, 247 (1960).
956. MarecD. J., Salesin E. D., Gordon R. L., Taianta, 8, 293 (1961).
957. Margerum D. W., Sprain W., Banks С. V. Anal. Chem., 25, 249 (1953).
958. Mathur N. R., Bhargaoa S. P. Indian J. Chem., 1, 138 (1963).
959. Matyja R. Chem. analit. (Polska), 8, 533 (1963).
960. Maxwell J. A., Graham R. P. Chem. Rev., 46, 482 (1950).
961. Mayr C., Gebauer A. Z. anal. Chem., 113, 200 (1938).
962. Me Lean E. O., Heddleson M. R., Bartlett R. T. Proc. Soil Sci. Soc. Amer..
22, 382 (1960).
963. Mehlig J. P., Dernbach C. J. Chim. analyt., 32, 80 (1943).
964. Mendelowitz A. Anal. chim. acta, 14, 235 (1956).
965. Meneirier M. Mem. scient. Rev. metallurgie, 64, 241 (1967); РЖХим., 11 Г
118 (1967).
966. Meyer S., Rech D. G. Mikrochim. acta, № 5, 720 (1959).
967. Middleton R. R. Analyst, 89, 421 (1964).
968. Afieftr W., Roch P., Rratzert J. Angew. Chem., 43, 250 (1930).
969. Mikula J. J., Codell M. Anal. chim. acta, 9, 467 (1953).
970. Miller С. C., Chalmers R. A. Analyst, 78, 686 (1953).
971. Miller L. B. Soil Sci., 26, 435 (1928).
972. Millner T. Z. anal. Chem., 113, 83 (1938).
973. Millner T., Horkay R. Acta techn. Acad. Scient. hung., 33, 201 (1961).
974. Millner T., Ranos F. Z. anal. Chem., 113, 102 (1938).
975. Milner G. W. C., Woodhead J. L. Anal. chim. acta, 12, 127 (1955).
976. Milner G. W. C., Woodhead J. L., Analyst, 79, 363 (1954).
977. Milner G. W. C., Woodhead J. L. Repts Atomic Energy Res. Establ., № 1400, 1954
978. Milner О. I., Gordon L. Taianta, 4, 115 (1960).
979. Miner F. J., Degrazio R. P., Forrey C. R., Jones T. C. Anal. Chim. acta.
22, 214 (1960).
980. Miscicka M., Bober J. Szklo i ceram., 11, 60 (1960).
981. Misra M. R., Nana R. R. J. Indian Chem. Soc., 42, 267 (1965).
982. Moeller T. Anal. Chem., 22, 686 (1950).
983. Moeller T. Ind. Eng. Chem., Anal. Ed., 15, 346 (1943).
984. Moeller T., Chonen A. J. J. Am. Chem. Soc., 72, 3546 (1950).
985. Moeller T„ Shu-Rung-chu. J. Inorg. and Nucl. Chem., 28, 153 (1966).
986. Mohr E. Chem. Techn., 11, 598 (1959).
986a.Мо/йоп P. H. H., Van Neste W. A. R. Anal. chim. acta, 39, 267 (1967).
987. Morlc G. P., Sweet T. R. Anal. Chem., 37, 1552 (1965).
988. Moric G. P., Sweet T. R. Anal. chim. acta, 34, 314 (1966).
989. Moser L. Monatsh., 53, 39 (1929).
990. Moshier R. W., Schwarberg J. E. Taianta, 13, 445 (1966).
991. Motojima R. J. Chem. Soc. Japan. Pure. Chem. Sect., 76, 903 (1955).
992. Motojima R., Hashitani H. Bull. Chem. Soc. Japan, 29, 458 (1956).
993. Motojima R., Hashitani H., Inahashi T. Anal. Chem., 34, 571 (1962).
994. Motojima R., Ishiwatari N. J. Nucl. Sci. and Technol., 2, 13 (1965).
995. Moyer H. V., Remington W. J. Ind. Eng. Chem., Anal. Ed., 10, 212 (1941).
996. Mukhedkar A. J., Rulkami S. B., Chaphalkar R. P. J. Univ. Poona, Sci. and Technol., № 32, 47 (1966).
996a.M ukherje A. R., Dey A. R. Z. anal. Chem., 152, 424 (1956).
997. Munshi R. N., Dey A. R. J. prakt. Chem., 18, 233 (1962).
998. Murawleff L., Rrassnowski 0. Z. anal. Chem., 69, 389 (1926).
999. Murthy A. S., Sarrna T. P., Raghava Rao B. S. V. Z. anal. Chem., 145 418 (1955).
1000. Musil J. Hutn. listy, 23, 649 (1968).
1001. Mussakin A. P. Z. anal. Chem., 105, 351 (1936).
253
1002. Mutaguti M. Rept. Cast Res. Lab., № 6, 71 (1955).
1003. Myers V. C„ Mull J. W., Morrison D. B. J. Biol. Chem., 78, 595 (1928).
1004. Nakagawa J., Tanaka T., Honda S. Bull. Govt-Industr. Res. Inst., Osaka,
12, № 2, 199 (1961); РЖХим., 20 Д 45 (1962).
1005. Nanda R. K-. Aditya S. Indian Chem. Soc., 40, 660 (1963).
1006. Narebski W. Bull. Acad, polon. Sci. Ser. heol. giograph., 10, 185 (1962).
1007. Narebski W. Kwart. geol., 6, 1 (1962).
1008. Nasanen R., Veivo J. Suomen kern., 29, B213 (1956).
1009. Neeb К- H. Z. anal. Chem., 194 , 255 (1963).
1010. Neeb К- H. Z. anal. Chem., 221, 200 (1966).
1011. Nelson F., Rusch K- M., Kraus K- A. J. Am. Chem. Soc., 82, 339 (1960).
1012. Nicolas J., Douillet P., Quintin M. Bull. Groupe franc, argiles, 19, № 1, 5 (1967); РЖХим, 7 Г 86 (1968).
1013. Niessner M. Z. anal. Chem., 76, 135 (1928).
1014. Nieuwenburg C. J., Untenbrock G. Anal. chim. acta, 2, 88 (1948).
1015. Nigaud L. Chim. analyt., 47, 180 (1965).
1016. Noll C. A., Stefanelli L. J. Anal. Chem., 35, 1914 (1963).
1017. Novak K-, Mika V. Chem. prumysl., 13, 360 (1963).
1018. Novotny M. Sklar a keramik, 16, № 7, 1 (1966).
1018a.Nowicka-Jankowska T., Minczewski J. Chem. analit. (Polska), 10, 129 (1965).
1019. Nudparni M. N., Varde M. S., Athawaba V. T. Anal. chim. acta, 16, 421 (1957).
1020. Nydahl F. Taianta, 4, 141 (1960).
1021. Ockenden H. M., Foreman J. K- Analyst, 82, 592 (1957).
1022. Odeblad E., Odeblad S. Anal. chim. acta, 15, 114 (1956).
1023. Oehlmann F. Chem. Technik, 8, 544 (1956).
1024. Oelschlager W. Z. Anal. Chem., 154, 321, 329 (1957).
1025. Ohnesorge W. E., Burlingame A. L. Anal. Chem., 34, 1086 (1962).
1026. Okada M. Repts. Govt. Chem. Industr. Res. Inst., Tokyo, 58, 7 (1963); РЖХим, 2 Г 155 (1964).
1027. Oka J., Murata A. J. Chem. Soc. Japan, 69, 179 (1948).
1028. Okura T., Goto K-, Jotuyanagi T. Anal. Chem., 34 , 582 (1967).
1029. Olsen A. L., Gee E. A., McLendon V. Ind. Eng. Chem., 18, 60 (1926).
1030. Oniciu L., Halos R. Studia Univ. Babe^-Bolyai. Chem., 7, № 2, 7 (1962); РЖХим., 24 В 70 (1964).
1031. Oniciu L., Schmidt E. Studii :?i cercetari chim. Acad. RPR, 11, 363 (1963); РЖХим., 4 В 131 (1966).
1032. Oniciu L., Schmidt E., Cadariu I. Rev. romaineChim., 9, 849(1964); РЖХим., 17 В 74 (1966).
1033. Osborn С. H., Jewsbury A. Anal. chim. acta, 3, 108 (1949).
1034. Ostertag H., Cappelliez J. Compt. rend., 246, 1550 (1958).
1035. Ostrowski S. Zesk. nauk. Politechn. gdafisk., № 7 , 59 (1957).
1036. Otomo M. Bull. Chem. Soc. Japan, 36, 809 (1963).
1037. Owen A. G., Price W. J. Analyst, 85, 221 (1960).
1038. Owens E. G., Joe J. H. Anal. Chem., 31, 384 (1959).
1039. Owens E. G„ Joe J. H. Taianta, 8, 505 (1961).
1040. Page J. A., Simpson D. H., Graham R. P. Anal. chim. acta, 16, 194 (1957).
1041. Pakalns P. Anal. chim. acta 32 , 57 (1965).
1042. Palmer S. M., Reynolds G. T. Z. anal. Chem., 216, 202 (1966).
1043. Pande C. S., Srivastrawa T. S. Z. anal. Chem., 173, 195 (1960).
1044. Parissakis G., Issoponlos P. B. Mikrochim., № 1, 28 (1965).
1045. Parker C. A., Goddard A. P. Anal. chim. acta, 4 , 517 (1950).
1046. Parker R. I. Metallurgia, 55, 103 (1957).
1047. Parks T. D.t Lukken L. Anal. Chem., 20, 1102 (1948).
1048. Patrovsky V. Chem. listy, 47, 676 (1953).
1049. Patrovsky V., Huka M. Coll. Czechoslov. Chem. Commun., 21, 1599 (1956).
1050. Pattnaik R. K-, Pani S. J. Indian Chem. Soc., 38, 349 (1961).
1051. Payne S. T. Light Metals, 17, 195 (1954).
1052. Pelch M., Englisch L. Soil Sci., 57, 167 (1944).
254
1053. Pellowe E. F., Hardy F. R. F. Analyst, 79, 225 (1954).
1054. Pender H. W. Anal. Chem., 31, 1107 (1959).
1055. Pentscheff N. P., EvtimowaB. Доклады Болг. АН, 18, 1127 (1965).
1056. Perkins M., Reynolds G. F. Anal. chim. acta, 18, 616, 625 (1958).
1057. Perkins M., Reynolds G. F. Anal. chim. acta, 19, 625 (1958).
1058. Philip J. C., Brandley A. J. Chem. Soc., 103, 795 (1913).
1059. Phillips J. P., Deye J. F., Leach T. Anal. chim. acta, 23, 13.1 (1960).
1060. Phillips J. P., Merrit L. L. J. Am. Chem. Soc., 71, 3984 (1949).
1061. Pigott E. C. J. Soc. Chem. Ind. (London), 58, 139 (1939).
1062. Pilgrim W. E., Ford W. R. Anal. Chem., 35, 1735 (1963).
1063. Pilz W. Math-naturwiss. Kl. Abt. 11b, 162, 47 (1953); Monatsch. Chem.,
84, 471 (1953).
1064. Pitsch R., Ludwig P. Mikrochim. acta, № 6, 1115 (1964).
1065. Poddar S. N., Sengupta N. R., Adhya J. K- Sci. and Cult., 29, 258 (1963).
1066. Poethke W., Jockel C. Pharmazie, 19, 203 (1964).
1067. Pohl F. A. Z. anal. Chem., 142, 19 (1954).
1068. Pohl H. Aluminium (BRD), 38, 162 (1962).
1069. Pohl H. Z. anal. Chem., 133, 322 (1951).
1070. Pokras L., Bernays P. M. J. Am. Chem. Soc., 73, 7 (1951).
1071. Pollak F. F., Pellowe B. S. Metallurgia, 16, 281 (1950).
1072. Pollock E. N. Energia nucl., 10, 496 (1963).
1073. Podobnik B., Dular M., Korosin J. Mikrochim. acta, № 4, 713, (1966).
1074. Poole P., Segrove H. D. J. Glass. Technol., 39, 205, 7 (1955).
1075. Porta A. Metallurgia, 50, 325 (1958); РЖХим, № 9, 31072 (1959).
1076. Possidoni A. J. F. An. Asoc. quim. argent., 57, 96 (1963); РЖХим., 16 Г 72 (1964).
1077. Povondra P., Elias F. Hunt, listy, 17, 665 (1962).
1078. Prajzler J. Coll. Czechoslov. Chem. Commun., 3, 407 (1931).
1079. Pribil R., Cihalik J., Dolezal J., Simon V., Zyka J. Ceskosl. farmac., 2, 223 (1953).
1080. Pribil R., Koudela Z., Matyska B. Chem. listy, 44, 222 (1950).
1081. Pribil R., Koudela Z., Matyska B. Coll. Czechoslov. Chem. Commun., 16, 80 (1951).
1082. Pribil R., Vesely V. Chemist-Analyst, 54, 46 (1965).
1083. Pribil R., Vesely V. Hutn. listy, 18, 512 (1963).
1084. Pribil R„ Vesely V. Taianta, 9, 23 (1962).
1085. Pribil R„ Vesely V. Taianta, 10, 233, 383, 1287 (1963).
1086. Price J. B., Payne S. T. Analyst, 74 , 641 (1949).
1087. Pritchard D. T. Anal. chim. acta, 32, 184 (1965).
1088. Pritchard D. T. Analyst, 92, 103 (1964).
1089. Prociv D. Coll. Czechoslov. Chem. Commun., 1, 95 (1929).
1090. Product. Group U. K. Atomie Energy Author. Rept., № 27 (S) (1962).
1091. Product. Group. U. K. Atomie Energy Author. Rept., № 29S (S) (1962).
1092. Product. Group. U. K. Atomie Energy Author. Rept., № 390 (S), 1964.
1093. Prussin S. G-, Harris J. A., Hollander J. M. Anal. Chem., 37, 1127 (1965).
1094. Pungor E., Zapp E. E. Magyar kern, folyoirat, 65, 436 (1959); РЖХим., № 15, 61044 (1960).
1095. Pungor E„ Zapp E. E. Z. anal. Chem., 171, 161 (1965); 197, 404 (1963).
1096. Quittner P., Simonits A., Elek A. Taianta, 14, 417 (1967).
1097. Radmacher W., Sdimitz W. Brenstoff-Chemie, 38, 225 (1957).
1098. Raine P. A. Analyst, 74, 364 (1949).
1099. Ramakrishna T. V., West P. W., Robinson J. W. Anal. chim. acta, 39, 81 (1967).
1100. Raman N. V., Vacudeva M. A. R. J. Scient. and Industr. Res., BC18, № 12, В 537 (1959).
1101. Rao С. B., Venkateswarlu V. Z. anal. Chem., 178, 277 (1961).
1102. Ray H. N., Biswas S. S., Ray S. Z. anal. Chem., 228, 114 (1967).
1103. Ray P. Z. anal. Chem., 86, 13 (1931).
1104. Ray P., Chattopadhya A. K- Z. anal, anorg. Chem., 169, 99 (1928).
255
1105. Reddi M. L. N., Seshaiah U. V. Indian J. Chem., 2, 34 (1964)
1106. Rees W. T. Analyst, 87, 202 (1962).
1107. Remy H. Lehrbuch der anorganischen Chemie. В. I., Leipzig, 1957.
1108. Remy H., Kuhlman A. Z. anal. Chem., 65, 161, 166 (1924—1925).
1109. Reutel C. Metall und Erz., 38, 170 (1941).
1110. Reynolds C. F. Z. anal. Chem., 173, 24 (1960).
1111. Reynolds G. F., Webber T. J. Anal. chim. acta, 19, 293 (1958).
1112. Rhodes D. F., Mott W. E. Anal. Chem., 34, 1507 (1962).
1113. Ribeiro С. M. E. Tecnica, 29, № 370, 533 (1967); РЖХим., 14 Г 75 (1968).
1114. Richter F. Z. anal. Chem., 126, 426 (1944).
1115. Riditer F. Z. anal. Chem., 127, 113 (1944).
1116. Rinaldi F„ Aguzzi P. Metallurgia ital., 59, 655 (1967); РЖХим., 11 Г 109 (1968).
1117. Rinck E., Feschotte P. Compt. rend., 240, 1618 (1955).
1118. Ringbom A. Complexation in Analytical Chemistry. Intersience, New York, 1963.
1118а.Ringbom A., Wilkman B. Acta chem. Scand., 3, 22 (1949); C. A., 43, 7861 (1949).
1119. Rolfe A. C., Russel F. R., Wilkinson N. T. J. appl. Chem., 1, 170 (1951).
1120. Roller P. S. J. Am. Chem. Soc., 55, 2437 (1933).
1121. Rooney R. C. Analyst, 83, 546 (1958).
1122. Rossote R. Chim. analyt., 38, 250 (1956).
1123. Royen H. J., Greewe H. Arch. Eisenhflttenwes., 4, 17 (1930).
1124. Royen H. J., Greewe H. Arch. Eisenhflttenwes., 7, 517 (1934).
1125. Rubins E. J., Hagstrom G. R. J. Agric. and Food Chem., 7, 722 (1959).
1126. Rume V. Chem. prumysl., 5, 480 (1955).
1127. Runge E. F., Bryan F. R. Appl. Spectroscopy, 13, 116 (1959).
1128. Ryba O., Cifka J., Jezkova D., Malat M., Suk V. Coll. Czechoslov. Chem. Commun., 23, 71 (1958).
1129. Sagrera J. L. Rev. cienc. apl., 21, 97 (1967); РЖХим., 21 Г 46 (1967).
1130. Sajo I. Acta chim. Acad. Sci. hung., 6, 333, 251 (1955).
1131. Sajo I. Kohasz. lapok, 9, 445 (1954); РЖХим, № 18, 58410 (1956).
1132. Sajo I. Magyar kern, folyoirat, 59,319 (1953); РЖХим., № 15, 36407 (1954).
1133. Sajo I. Magyar kern, folyoirat, 60,269 (1954); РЖХим., № 16, 34698 (1955),
1134. Sajo I. Magyar kern, folyoirat, 62, 56 (1956); РЖХим., № 19, 61792 (1956).
1135. Sajo I. Taianta, 10, 493 (1963).
1136. Sajo I., Posgay G., Horvath M. Femipari kutato int. kozl., 6, 307 (1966); РЖХим., 6 Г 137 (1968).
1137. Sajo I., Sipos B. Z. anal. Chem., 222, 23 (1966).
1138. Salska S., Held S. Chem. analit (Polska), 3, 543 (1958).
1139. Samuelson 0., Lunden L., Schramm K. Z. anal. Chem., 140, 330 (1953).
1140. Samuelson 0., Sjoberg B. Anal. chim. acta, 14, 121 (1956).
1441. Sarudi I. Z. anal. Chem., 163, 34 (1958).
1142. Sastri C. L., Sriramula G., Raghava R. Bh. S. V. Scient. and Industr. Res., 14, № 4, B171 (1955).
1143. Savelli C. Metallurgia ital., 59, 671 (1967); РЖ Хим.. 8 Г 110 (1968).
1144. Saylor J. H., Ledbetter J. W. Anal. chim. acta, 30, 427 (1964).
1145. Saylor J. H., Ledbetter J. W. Anal. chim. acta, 32, 398 (1965).
1146. Scherrer J. A., Smith W. H. Bur. Stand. J. Research (USA), 21, 105 (1938).
1147. Schirm E. Chem. Ztg., 33, 877 (1909).
1148. Schirm E. Chem. Ztg., 35. 897 (1911).
1149. Schmidt W., Konopicky K., Kostyra J. Z. anal. Chem., 206, 174 (1964).
1150. Schmitz B. Dtsch. Apoth. Ztg., 95, 637 (1955).
1151. Schmitz W. Bergbau-Rundschau, 11, 661 (1959).
1152. Scheme S. C. Analyst, 75, 27 (1950).
1153. Schwarberg J. E., Moshier R. W., Walsch J. H. Taianta, 11, 1213 (1964).
1154. Schwarzenbach G., Gut R., Anderreg G. Helv. chim. acta, 37, 937 (1954).
1155. Schwarz-Bergkampf E. Z. anal. Chem., 83, 345 (1931).
1156. Scooles P. H., Smith D. V. Analyst, 83, 615 (1958).
256
1157. Seidel W., Fischer W. Z. anorg. Chem., 247, 367 (1941).
1158. Sen A. B., Chahan V. B. Z. anal. Chem., 195, 255 (1963).
1159. Sen A. B., Kapoor S. N. J. prakt. Chem., 22, 314 (1963).
1160. Seuthe A. Stahl u. Eisen, 64, 493 (1944).
1161. Shiou Chuan-Sun. Anal. Chem., 31, 1322 (1957).
1162. Short H. G. Analyst, 75, 420 (1950).
1163. Shull К- E. Amer. Water Works Assoc., 52, 779 (1960).
1164. Singh D. R., J. Scient. Res. Banaras Hindu Univ., 10, 152 (1959—1960).
1165. Singh D. R., Saxena G. C. Indian J. Chem., 2, 251 (1964). ,
1166. Singh K-, Sahoo B., Patnaik D. Proc. Indian Acad. Sci., A50, 129 (1959).
1167. Singhal G. K-, Tandon K- N. Taianta, 15, 707 (1968).
1168. Singleton W., Chirnside R. C. J. Soc. Class. Techn., 12, № 45, 18 (1928).
1169. Sir Z., Pribil R. Coll. Czechoslov. Chem. Commun., 20, 871 (1955).
1170. Skrivanek V., Klein P. Rudy, 11, № 3, 89 (1963).
1171. Skrivanek V., Klein P. Z. anal. Chem., 184, 360 (1961).
1172. Slade R. E. Z. Electrochem., 17, 265 (1911).
1173. Slama J. Hutn. listy, 19, 51 (1964).
1174. Slavin W., Manning D. C. Anal. Chem., 35, 253 (1963).
1175. Smalls A. A. Analyst, 72, 14 (1947).
1176. Smith G. F„ Cagle F. W. Anal. Chem., 20, 574 (1948).
1177. Smith G. S. Analyst, 64, 577 (1939).
1178. Smith H. F„ Royer R. A. Anal. Chem., 35, 1098 (1963).
1179. Smith W. H., Sager E. E., Siewers I. J. Anal. Chem., 21, 1334 (1949).
1180. Solaja P. Chem.-Ztg., 49, 337 (1925).
1181. Solaja P. Z. anal. Chem., 80, 334 (1930).
1182. Sommer L., Novotna H. Taianta, 14, 457 (1967).
1183. Sosin Z., Strzeszewska I. Chem. analit. (Polska), 9, 425 (1964).
1184. Spauszus S., Milller W. Kohass. lapok, 95, 439 (1962); РЖХим., 18 Г 119 (1963).
1185. Spauszus S., Schwarz C. Neue Hiitte, 7, 180 (1962).
1186. Specker H„ Hartkamp H. Z. anal. Chem., 140, 353, 1437 (1953).
1187. Specker H., Kuchtner M., Hartkamp H. Anal. Chem., 142, 166 (1954).
1188. Sprain W., Banks С. V. Anal. chim. acta, 6, 363 (1952).
1189. Srivastava S. C., Sinha S. N., Dey A. K- J. prakt. Chem., 20, 70 (1963).
1190. Srivastava S. N., Manohar J. Indian Chem. Soc., 37, 299 (1960).
1191. Stacy В. D. Biochemie, J. (Proc.), 56, 47 (1954).
1192. Stammler M., Pegnitz A. D. Metall, 13, 103 (1959).
1192a.Stanescu G. Comun. inst. cercetari chim., 1, 304 (1957—1962); РЖХим., 20Г81 (1964).
1193. Stary J., Smizanska J. Anal. chim. acta, 29, 545 (1963).
1194. Steele M. C. Am. Foundryman, 25, 56 (1954).
1195. Steele M. C., England L. J. Anal. chim. acta, 16, 148 (1957).
1196. Steele S. D., Russel L. Iron and Steel (London), 16, 182 (1942).
1197. Stefan A., Turkiewicz E. Rudy i metall nizel., 12, 76 (1967).
1198. Steinbach J. F., Freiser H. Anal. Chem., 26, 375 (1954).
1199. Stenger V. A., Kramer W. R., Beshgetoor A. W. Ind. Eng. Chem., 44, 797 (1952).
1200. Stock A. Ber. dtsch. Chem. Ges., 33, 548 (1900).
1201. Stone K- G., Friedman L. J. Am. Chem., Soc., 69, 209 (1947).
1202. Stafford N., Wyatt P. F. Analyst, 68, 319 (1943).
1203. Stafford N., Wyatt P. F. Analyst, 72, 54 (1947).
1204. Strelow F. W. E. Anal. Chem., 31, 1974 (1959).
1205. Strelow F. W. E. Anal. Chem., 33, 542 (1961).
1206. Strelow F. W. E. Anal. Chem., 35, 1279 (1963).
1207. Strelow F. W. E. J. S. Afric. Chem. Inst., 16, № 2, 38 (1963).
1208. Stumpf К. E. Z. anal. Chem., 138, 30 (1953).
1209. Sudd E. J. Chem. Soc. Japan, 72, 718 (1951).
1210. Sudd E. Sci. Repts. Res. Insts. Tohoku Univ., A8, 375 (1956); РЖХим., № 13 , 44820 (1957).
257
1211. Suk V., Malat M. Chemist-Analyst, 45, 30 (1956).
1212. Suk V., Miketukood V. Coll. Czechoslov. Chem. Co mm tin., 24, 3629 (1959).
1213. Swank U. V., Mellon A. A. Ind. Eng. Chem., Anal. Ed., 9, 406 (1937).
1214. Szabo Z., Beck M- Acta chim. Acad. Sci. hung., 7, 211 (1954).
1215. Szarvas P., Koronddn I., Raisz I. Magyar kem. lapja, 22,149 (1967); РДХи., 21 Г 130 (1967).
1216. Szucs A. I., Klug 0. N.Chem. analit, (Polska), 12, 939 (1967).
1217. Tabler H., Muhlberger F. H. Z. anal. Chem., 144, 241 (1955).
1218. Taimni I. K-, Tandon S. N. Anal. chim. acta, 21, 502 (1959).
1219. Takao Z., Miyoshi S. Tetsu-to-Hagane Overseas, 1,№ 2, 28 (1961); РЖХин., 19 Д 52 (1962).
1220. Takasima J. J. Chem. Soc. Japan, Pure Chem. Sec.,80,619 (1959); РЖХим., № 11, 42381 (1960).
1221. Talesnick I., Page J. A- Taianta, 10, 1055 (1963).
1222. Tanaka H. J. Soc. Chem. Ind. Japan Suppl., 33, 489B (1930).
1223. Taylor M. P. Analyst, 80, 153 (1955).
1224. Teicher H., Gordon L. Anal. Chem., 23, 930 (1951).
1225. Teicher H., Gordon L. Anal. chim. acta, 9, 507 (1953).
1226. Teitelbaum M. Z. anal. Chem., 82, 366 (1930).
1227. Theis M. L. Z. anal. Chem., 144, 105 (1955).
1228. Thran W. E. Anal. Chem., 20, 1117 (1948).
1229. Thrun W. E. Ind. Eng. Chem., Anal. Ed., 2, 8 (1930).
1230. Todeasa A., Ciolan D., Kovacs A., Turcanu C. Rev. chim., 9, 577 (1958).
1231. Treadwell F. P. Kurzes Lehrbuch der analytischen Chemie, Bd. 2, 1930.
1232. Treadwell F. P., Bernasconi. Helv. chim. acta, 13, 500 (1930).
1233. Tullo W., Stringer W. J., Harrison G. A. F. Analyst, 74, 296 (1949).
1234. Turner S. E. Anal. Chem., 28, 457 (1956).
1235. Underhill E. P., Peterman F. I. Am. J. Physiol., 90, 1 (1929).
1236. Underwood E. E., Underwood A. L. Taianta, 3, 249 (1960).
1237. United Kingbom Atomic Energy Auth. Ind. Group. IWO—AM/S-159 (1959).
1238. Urubay S., Korkisch J., Janauer G. E. Taianta, 10, 673 (1963).
1239. Varma A. Bull. Chem. Soc. Japan, 35, 1444 (1962); РЖХим., 15 Г 74 (1963).
1240. Vassiliadis C., Kawassiades С. T., Hadjioannon T. P., Colovos G. Anal. chim. acta, 36, 115 (1966).
1240a.Vecsernyes L. Magyar Rem. folyoirat., 72, 372 (1966); РЖХим,. 10 Г 153 (1967).
1241. Vetejlka R., Maiacek J. Coll. Czechoslov. Chem. Commun., 25, 2245 (I960).
1242. Villa L., Magarian S. Bull. Assoc, franc, chimistes indscuir, 20, № 1, 1 (1958); РЖХим., № 18, 60421 (1958).
1243. Voinovitch I. A. Chem. analit. (Polska), 7, 511 (1962).
1244. Voinovitch I. A., Lefranc-Kouba A. Chim. analit., 42, 543 (1960).
1245. Wacykiewicz K- Prace inst. Min-wa huth., 7, 35 (1955).
1246. Wainer E. J. Chem. Education, 11, 526 (1934).
1247. Walraf M. Zement-Kalk-Gips, 9, № 5, 186 (1956).
1248. Wanninen E., Ringbom A. Anal. chim. acta, 12, 308 (1955).
1249. Wehber P. Z. anal. Chem., 158, 321 (1957).
1250. Weidmann H. Z. MetalL, 44, 565 (1953).
1251. Weinland E. F., Ensgrober F. Z. anorg. Chem., 84, 340 (1914).
1252. Weissler A., White С. E. Ind. Eng. Chem., Anal. Ed., 18, 530 (1946).
1253. Wells J. E., Hunter D. P. Analyst, 73, 67 (1948).
1254. Wenger P., Abramson E., Basso Z. Helv. chim. acta, 29, 49 (1946).
1255. Wenturello G. Ann. chimica, № 4, 46 (1956).
1256. Werner 0. Metall (Berl.), 3, 146 (1949).
1257. Werner 0. Z. Ver. deut. Chem., Beih., 48, 92 (1944).
1258. Were W., Neuberger A. Arch. Eisenhuttenwes., 26, 205 (1955).
1259. Wetiesen С. V. Anal. chim. acta, 24, 294 (1961).
1260. Wetlesen C. U., Omang S. H. Anal. chim. acta, 24, 294 (196D.
1261. White С. E., Lowe C. S. Ind. Eng. Chem., Anal. Ed., 12, 229 (1940).
1262. White С. E., McFarlane H. С. E., Fogt J., Fuchs R. Anal. Chem., 39, 367 (1967).
258
1263. White J. C. Oak Ridge National Laboratory, Paper presented at Pittsburgh Conference on Analytical Chemistry and Applied Spectroscopy. Pittsburg, 1957.
1264. Wiberley S. E., Basset L. G. Anal. Chem., 21, 609 (1949).
1265. Wiebe I M. Z. anal. Chem., 184, 322 (1961).
1266. Wiele H. Angew. Chem., 67, 126 (1955).
1267. Wilkins D. H. Anal. chim. acta, 18, 372 (1958). ,
1268. Wilkins D. H. Anal. chim. acta, 23, 309 (I960).
1269. Will F. -Anal. Chem., 33, 1360 (1961).
1270. Willard H. H. Anal. chim. acta, 22, 1372 (1950).
1271. Willard H. H., Dean J. A. Anal. Chem., 22, 1264 (1950).
1272. Willard H. H., Horton C. A. Anal. Chem., 24, 862 (1952).
1273. Willard H. H., TangN. K. Ind. Eng. Chem., Anal. Ed„ 9, 357(1937); J. Am. Chem. Soc., 59, 1190 (1937).
1274. Willis J. B. Nature, 207, 715 (1965).
1275. Wilson A. D. Analyst, 88, 18 (1963).
1276. Wilson A. D., Sergeant G. A. Analyst, 88, 109 (1963).
1277. Wilson H. N. Anal. chim. acta, 1, 330 (1947).
1278. Winter 0. B„ Thrun W. E., Bird 0. D. J. Am. Chem. Soc., 51, 2721 (1929).
1279. Wood J. K. J. Chem. Soc., 93, 423 (1908).
1280. Woodward C., Freiser H. Taianta, 15, 321 (1968).
1281. Wrangell M. V., Koch E. Landw. Jahrbuch., 63, 682 (1926).
1282. Yoe J. H., Hill W. L. J. Am. Chem. Soc., 49, 2395 (1927).
1283. Yoe J. H., Hill W. L. J. Am. Chem. Soc., 51, 2721 (1929).
1284. Yoe J. H., Hill W. L. J. Am. Chem. Soc., 50, 748 (1928).
1285. Yokoyama Y. Sci. Repts. Res. Insts. Tohoku Univ., A13, 8 (1961).
1286. Youngdahl C. A., De‘Boer F. E. Nature (Engl.), 184, № 4679, 54 (1959).
1287. Yuan T. L., Fiskell J. G. A. J. Agric. and Food Chem., 7, 115 (1959).
1288. Zalessky Z., Voinovitch I. A. Ind. ceram., №'532, 287 (1961).
1289. Zibulsky H., Slowinski M. F-, White J. A. Anal. Chem., 31, 280 (1959).
1290. Ziegler M. Z. anal. Chem., 180, 348 (1961).
1291. Ziegler M., Glemser 0. Z. anal. Chem., 157, 19 (1957).
1292. Zulkowsky F. Am. Chem. Pharm., 202, 200 (1880).
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
Алюминат натрия 17 Алюминон 25, 91 Алюмокрезон 25, 113 Амперометрическое титрование комплексоном III 89 фторидом 89
Атомно-абсорбционное определение с использованием графитовой кюветы 165 пламени 164
Весовые методы определения осаждением
акридином 48
амннохлорндом ртутн 48 аммиаком 40 ацетатами 56 бензоатом 51
бензоатом нз гомогенных растворов
бис-2-пнрнднлглнколем 62 гексамннкобальтнхлоридом 62 гидразннкарбонатом 50 днфенатом аммония 54 иоднд-нодатной смесью 49 карбонатом аммония 50 корнчнокнслым аммонием 55 купфероном 61 моноэтаноламнном 49 мочевиной 48
нитритом аммония 49 8-окснхннолином 32 8-окснхннолнном нз гомогенных ра-
створов 38 а-пнколнном 47 пнрнднном 46 салнцнлгндроксамовой кислотой 62 стнрнлкупфероном 61 танинном 62 тиосульфатом 49 уротропином 47 о-фенетнднном 48 феннлгндразнном 48 фосфатом 50
фторидом 57 п-хлораннлнном 48 эмбелнном 62 янтарной кислотой 53
Высокочастотное титрование 91
^ндроксокомплексонат алюминия 91
Гидролиз солей алюминия 15, 16
Гидроокись алюминия 12
Зависимость экстракции комплексов металлов с N-бензоилфеннлгндро-кснламнном от pH 176
Зависимость экстракции купферонатов металлов от pH 174
Значения pH осаждения окснхиноли-натов металлов 32, 33
Значения pH экстракции ацетилаце-тонатов 179
Изотопы алюминия 9, 10
Качественные реакции нона алюминия 29
Комплексометрическое определение алюминия в смесях с ванадием 79 галлием 79 железом 77, 78 железом и кобальтом 80 железом и марганцем 80 железом, марганцем, магнием и кальцием 80 железом и титаном 80 железом н хромом 79 иттрнем 79 скандием 79 титаном 78 хромом 78 цинком 79 цирконием 79
Комплексометрическое определение алюминия обратным титрованием с индикаторами
ализарином S 74
260
арсеназо 75
ацетилацетоном 75
бис-(глнцнн) метнленднхлорфлуо-ресценном 76
гематоксилином 74
глицннкрезоловым красным 75
дитизоном 69
днфеннлкарбазоном н комплексо-натом ванадия ( ) 75
днфеннлкарбазоном н о-фенантролн-ном 76
кальценном W 75
ксиленоловым оранжевым 66
метнлтнмоловым снннм 69
нафтнлазоксином S 76
1-OKCH-2- нлн 2-оксн-З-нафтойной кислотой 75
окислительно - восстановительной системой феррн- н ферроцианидом и органическим реагентом (днметнлнафтиднн, бензидин н др.) 72
окислительно-восстановительной системой Cu2+/Cu+, роданидом н вариаминовым снннм 72
ПАН 74
ПАР 74
пнрогаллолкарбоиовой кислотой 76 пирокатехиновым фиолетовым 74 роданидом 75
сульфосалнциловой кислотой 71
хромазуролом S 74
цннконом 75
эрнохромчерным Т 73
Комплексометрическое определение алюминия прямым титрованием с индикаторами алюминоном с метиленовым голубым 66
алюмокрезоном с метиленовым голубым 66
галлеином 66
гематоксилином 66
комплексонатом ванадия и органическим реагентом 65
ксиленоловым оранжевым 66
метнлтнмоловым синим 66
нафтнлазоксином S 66
ПАН и комплексонатом медн 64
пнрокатехиновым фиолетовым 66
хромазуролом S 65
хром чисто-голубым 65
эриохромцианином R 66
Комплексометрическое определение алюминия с инструментальным фиксированием конца титрования 73,89
Комплексометрическое титрование алюминия с помощью
ДЦТА 77 оксиэтиленднамннтетрауксусной кислотой 81
Комплексы алюминия глнколятный 19 комплексоната 21 лактатные 19 малонатный 18 оксалатные 18 с азосоеднненнямн 26 салицилатные 20 с галактуроновой кислотой 21 с d-глюконовой кислотой 21 с о,о-дноксназобензолом 26 с 2,2'днпнрнднлом 28 с крезотовой кислотой 20 с 8-окснхннальднном 24 с ПАР 26 с пнкрамнназохромом 27 с пирокатехином 23 с Р-резорцнловон кислотой 20 с салнцнлаль-о-амннофенолом 24 с сахарной кислотой 21 с тнроном 23 с хромотроповой кислотой 23 с юглоном 23 с яблочной кислотой 19 со стнльбазохромом 27 сульфосалнцнлатный 20 тартратные 19 фталатный 19 фторидные 14 цитратные 19
Кондуктометрическое титрование 90 Коэффициенты распределения хло-рндных комплексов металлов на анноннте 186
Кулонометрическое титрование 90
Методы разделения осаждением с помощью едкого натра 168 карбоната натрия 171 купферона 172 оксалатов 172 п-окснфеннларсоновон кислоты 172 перйодата 171 сульфидов 171 феннларсоновой кислоты 171 ферроцианида 171 хлоратов 171 этнлксантогената калня 172
Методы разделения экстракцией ацетнлацетонатов 170 бутиратов 181 в виде гексароданоферрата трнбу-тнламмоння 181 ди-(2-этилгекснл)фосфорной кислотой 181
264
диэтилдитиокарбаминатов 178
комплексов с N-бензоилфенилгид-роксиламином 176
комплексов с диантипнрнлметаном 181 комплексов с а-ннтрозонафтолом 181 комплексов с триизооктиламином 180
купферонатов 174
окисью мезитила 181
оксихинальдинатов 177
роданидов 177
теноилтрнфторацетонатов 180
три-п-октилфосфннокисью 180
хлоридных комплексов 172
Методы разделения электролизом на ртутном катоде 191
Методы хроматографического разделения
на катионитах
основанные на амфотерности 185
с использованием комплексообразования с
комплексоном III 183
перекисью водорода 185
пирофосфатами 185
роданидами 185
сульфосалициловой кислотой 185
тиосульфатами 185
тироном 185
хлорид-ноном 185
цитратами 184
на анионитах в виде комплексов нитратных 189
оксалатных 187
пероксидных 188
роданидных 188
сульфатных 188
фторидных 187
хлоридных 185
цитратных 188
на бумаге 189
Минералы алюминия 7
Окись алюминия 11
Определение алюминия химическими методами в
бериллиевых материалах 203, 204
биологических материалах 206
боксите 195
воде 207, 208
глинах 198
железе 211
железной руде 195
каолине 200
карбонатных породах 195, 200, 201
керамических изделиях 199
клинкере 195, 197
криолите 195
магнии н его сплавах 220
марганцевой руде 195, 196
материалах титанового производства 203
медных сплавах 214
нефелиновых концентратах 194
никелевых сплавах 218
огнеупорах 196, 197, 202
олове и его сплавах 217
полипропилене 207
полиэтилене 207
почве 205
растительных материалах 206
резине 207
силикатах 198, 199, 201
соединениях вольфрама 204
соединениях торня 204
сталях 209—214
стекле 205
титане и в его сплавах 219
ферротитане 211
фосфатных породах 201
фториде алюминия 195
хромовой руде 196, 197
цементе 197, 198, 200
цинковых сплавах 216
шамоте 195, 202
шлаках 198, 201, 202
Определение примесей в алюминии высокой чистоты
амальгамной полярографией 225
пламенной фотометрией 225
спектральными методами 227
фотометрическими методами 226
Отделение алюминия методами ионообменной хроматографии от
бериллия 182, 185, 197, 188, 190
ванадия 188
галлия 183, 186, 190, 191
железа 184—186, 188
нндия 183, 190
кальция 183—185, 188
кобальта 183—186, 190
литня 183
магния 183—185
марганца 184, 185
меди 185, 186
молибдена 189
никеля 184, 185
плутония 187, 189
свинца 186
таллия 183, 190
теллура 187
титана 184, 185, 190
тория 189
урана 183, 187, 189
фосфорной кислоты 183
хрома 184,
цинка 183, 185, 186
циркония 182, 187—189
Отделение алюминия методами осаждения от бериллия 168 железа 168, 169, 171, 172 золота 171 индия 171, 172 иттрия 170 кадмия 170 кальция 168 кобальта 168 лантана 170 магния 170 марганца 168, 171 молибдена 171 мышьяка 171 олова 171 платины 171 рения 171 ртути 171 селена 171 сульфатов 168 сурьмы 171 теллура 171 титана 170—172 тория 172 фосфатов 168, 171 хрома 170 цинка 168j 171, 172
Отделение алюминия методами экстракции от бериллия 179, 181 ванадия 174, 178, 180, 181 висмута 178 вольфрама 180, 181 галлия 173, 178, 181 гафния 181 железа 172—174, 177, 178, 180, 181 золота 181 индия 178, 181 кадмия 177, 178 кобальта 177, 178, 180 марганца 177, 178 меди 177, 178, 180 молибдена 173, 178, 181 мышьяка 178, 181 никеля 177, 178 ниобия 181 олова 177, 178 осмия 181 ртути 181 свинца 177, 178 селена 178 серебра 178 скандия 181 сурьмы 177 таллия 178 теллура 173 титана 174, 178, 180, 181
тория 180, 181 урана 180, 181 хрома 181 церия 180 цинка 177, 178 циркония 174, 177, 180, 181 Отделение алюминия осаждением в виде хлорида 168
Пламенная фотометрия 160 Полярографическое определение алюминия косвенными методами с помощью ализаринового черного SN 146 днамант хром красного А 146 кислотного хромсинего 143 8-окснхннолина 142, 145 солохромого фиолетового RS 143 суперхромгарнета Y 144 хинализарина 143 четырехнатрневой соли ЭДТА 143 эрнохром фиолетового ВА 146 Полярографическое определение алюминия прямыми методами 141 Потенциометрическое титрование раствором едкого натра 87 фторидами 86
Радиоактивацнонные методы определения алюминия 146
Рентгеноспектральный метод анализа 166
Рудообразующие минералы алюминия 8
Соли алюминия нитрат 16 основной ацетат 18 перхлорат 17 сульфат 16 фосфат 17 фторид 14 хлорид 15
Спектральное определение алюминия в агломератах 161 боре 161 бронзах 154 вольфрамовом ангидриде 161 железе 148 железной руде 161 известняке 161 кадмии 159 кальции 159 кобальте 163 кремнии 159, 161 латуни 155 магнезите 161 магниевых сплавах 156 марганце 154
никеле 152
нихроме 153
окиси хрома 161
олове 159
платиновых металлах 159
полипропилене 161
полиэтилене 161
пятиокиси ниобия 161
силикатах 161
слюде 161
стали 149
стекле 161
теллуре 161
тетрахлориде кремния 161
тетрахлориде титана 161
титане 157
титановых сплавах 156
уране н урановых сплавах 158
феррониобии 150
ферросилиции 152
ферротитане 150
хроме 153
немейте 161
цинке н его сплавах 157
циркониевом концентрате 161
цирконии 159
чугуне легированном 149
шлаках доменных и мартеновских 161
шлаках никелевого производства 161
электролите гальванических ванн 161
Спектральное определение алюминия
после концентрирования 160, 162
Титриметрические методы определения алюминия
алкалиметрические 85
арсенатные 85
ацидиметрические 84
гетерометрическое титрование 86
фторидные 84
через оксихииолинат 82
Трифенилметановые красители, свой-
ства комплексов с алюминием 25
Удаление мешающих элементов отгонкой 193
Физические и химические свойства
алюминия 9
Флуориметрическое определение алюминия с использованием
о,о-диоксиазобеизола 141
кверцетина 138
люмогаллиона 140
морина 137
оксиантрахиноновых красителей 141
2-окси-З-нафтойной кислоты 138
8-оксихинальдина 141
8-оксихинолина 135
понтахромового фиолетового SW 140
понтахромового сине-черного R 136 салицилал-семикарбазида 141 салицилаль-о-амииофенола 132 1\’-салицилиден-2-амино-3-оксифлуо-
роиа 139
флаваноидных красителей 141 формилгидразона салицилового аль-
дегида 140
цинковой соли 4-сульфо-2,2'-диокси-нафталина 141
Фотолитическое отделение урана 193 фотометрическое определение алюминия с реагентами
ализарином S 25, 129
алюминоном 25, 91
алюминоном и ферроном 99
антрапурпурином 134
апигенином 133
арсеназо 127
галлеином 116
гематоксилином 133
диаминочистосииим ФФГ 134
калмагитом 133
кальцихромом 134
кислотным хром чисто-голубым Б 25, 115
ксиленоловым оранжевым 25, 107 метнлтимоловым сииим 25, ПО а-метнлформау рин-3,3'-днкарбоно-вой кислотой 134
натриевой солью о-карбокси-фе-нил-азохромотроповой кислоты 134
8-оксихинолином 117
пирогаллоловым красным 25, 116 пирокатехиновым фиолетовым 25, 113
сендахромом 133
стильбазо 124
5-сульфо-4'-диэтил амии-2,2'-ди-оксиазобензолом 127
сульфохромом 25, 115
ферроном 133
хинализарином 25, 131
хинализаринсульфонатом 26, 131
хромазуролом S 25, 104
хромоксан фиолетовым Р 25, 112 эриохромцианином R 25, 99
ОГЛАВЛЕНИЕ
От редколлегии....................................................... 3
Предисловие ......................................................... 5
Глава I.
Физико-химическая и химико-аиалитическая характеристика алюминия я его соединений..................................................... 7
Нахождение в природе........................................... 7
Физические н химические свойства алюминия...................... 9
Соединения алюминия............................................. 11
Глава И.
Химические и физико-химические методы определения алюминия .... 29
Качественные реакции иона алюминия.............................. 29
Методы определения алюминия..................................... 32
Гравиметрические методы..................................... 32
Титриметрические методы................................• • 63
Фотометрические методы...................................... 91
Флуориметрические методы................................... 132
Полярографические методы................................... 141
Радиоактивационные методы.................................. 146
Спектральные методы........................................ 147
Рентгеноспектральный метод................................. 166
Прочие методы.............................................. 167
Глава 111.
Методы отделения алюминия от сопутствующих элементов......... 168
Осаждение органическими и неорганическими реагентами .... 168
Методы отделения осаждением алюминия.................... 168
Методы отделения осаждением мешающих элементов....... 168
Экстракционные методы отделения................................ 172
Хроматографические методы разделения........................... 182
Разделение на катионитах................................... 182
Разделение на анионитах ................................... 185
Другие методы хроматографического отделения.............. 189
Отделение мешающих элементов электролизом на ртутном катоде . . 191
Другие методы отделения........................................ 193
265
Глава IV.
Определение алюминия в природных и промышленных объектах.......... 194
Определение алюмнння в минералах, рудах и промышленных концентратах....................................................... 194
Определение алюминия в рудах ........................... 194
Определение алюмнння в силикатных и карбонатных породах 197
Определение алюминия в фосфатных породах................ 201
Определение алюминия в шлаках........................... 201
Определение алюминия в огнеупорных материалах........... 202
Определение алюминия в материалах титанового производства 202
Определение алюминия в прочих материалах.................. 203
Определение алюминия в почвах, материалах органического происхождения и в воде............................................... 205
Определение алюминия в почвах................................. 205
Определение алюминия в материалах органического происхождения 20&
Определение алюминия в воде................................... 207
Определение алюмнння в металлах и сплавах..................... 209
Определение алюминия в железе, стали и ферросплавах . . . . 209
Определение алюминия в меди и медных сплавах........... 214
Определение алюминия в цинке и цинковых сплавах........... 216
Определение алюминия в олове и оловянных сплавах....... 217
Определение алюминия в никеле и никелевых сплавах .... 218
Определение алюминия в титане и титановых сплавах .... 219
Определение алюмнння в магнии и магниевых сплавах . . . . 220
Определение алюмнння в уране, торнн, плутонии и их сплавах . 222
Определение алюминия в других металлах и сплавах..........224
Глава V.
Определение примесей в алюминии высокой чистоты................... 225
Литература.............. ......................................... 229
Предметный указатель . . ........... 260
Аналитическая химия алюминия (Серия «Аналитическая химия элемеитов>). Т и-х о и о в В. Н. Институт геохимии и аналитической химии им. В. И. Вернадского. Изд-во <Наука>. 1971 г., стр. 266.
В монографии рассматриваются химические свойства алюминия, свойства важнейших соединений его, имеющих значение в аналитической химии, методы обнаружения алюминия, способы отделения его от мешающих элементов, химические, физико-химические в физические методы определения алюминия.
Большое место уделено определению алюминия в различных природных и промышленных объектах.
В книге приведена большая библиография по аналитической химии алюминия.
Монография предназначается для химиков-аналитиков, работающих в научно-исследовательских н в заводских лабораториях, для преподавателей н аспирантов; может быть использована студентами вузов.
Таблиц 16. Иллюстраций 35. Библ. 1292 назв.
АЛЮМИНИИ