Автор: Семенова И.В.
Теги: испытания материалов товароведение силовые станции общая энергетика газовая коррозия
ISBN: 5-9221-0246-Х
Год: 2002
Похожие
Текст
УДК 620.193.197 @75.8, 076)
СЗО
ББК 34.437
Семенова И.В., Флорианович Г.М., Хорошилов А.В. Коррозия
и защита от коррозии / Под ред. И.В. Семеновой — М.: ФИЗМАТЛИТ,
2002. - 336 с. - ISBN 5-9221-0246-Х.
Изложены теоретические основы газовой и электрохимической коррозии, рас-
рассмотрены виды коррозии, коррозионная характеристика металлов, сплавов и
неметаллических материалов. Приведены методы защиты машин и аппаратов
от коррозии.
Для студентов высших учебных заведений химико-технологических и маши-
машиностроительных специальностей.
Рецензенты:
член-корреспондент РАН профессор Ю.М. Полукаров
(Институт физической химии РАН);
кафедра «Технология электрохимических производств»
РХТУ им. Д.И. Менделеева (зав. кафедрой профессор,
заслуженный деятель науки РФ В.Н. Кудрявцев,
доцент кандидат технических наук Т.Е. Цупак)
© ФИЗМАТЛИТ, 2002
ISBN 5-9221-0246-Х © И.В. Семенова, Г.М. Флорианович,
А.В. Хорошилов, 2002
Предисловие
Предисловие
Современное развитие производства предъявляет высокие тре-
требования к надежности и стойкости конструкционных материалов и
совершенствованию методов их защиты.
В свете этого возрастает роль дисциплин коррозии в подготовке
инженеров технологов и механиков.
В книге обобщен многолетний научный и педагогический опыт
авторов. Современное состояние электрохимической и коррозион-
коррозионной науки во многом определяется трудами российских ученых, с
которыми авторы на протяжении многих лет работали и сотрудни-
сотрудничали.
Мы отдаем дань уважения и памяти нашим наставникам и учи-
учителям, соратникам и друзьям, известным российским ученым: ака-
академику А.Н. Фрумкину, академику В.Е. Казаринову, профессору,
д.х.н. Г. А. Тедорадзе, профессору, д.х.н. Н.Т. Кудрявцеву, академи-
академику Я.М. Колотыркину, труды и научные концепции которых легли в
основу этой книги.
На протяжении ряда лет руководство Московского государствен-
государственного открытого университета (МГОУ) проводит плодотворную ра-
работу по организации процесса создания учебной литературы для
вузов.
Выражаем глубокую благодарность ректору МГОУ профессо-
профессору А.Н. Ковшову за внимательное и чуткое отношение к нашей ра-
работе, профессиональные советы и поддержку, что во многом способ-
способствовало изданию книги.
В настоящее время имеется дефицит учебной литературы по кор-
коррозии. Учебные издания в этом направлении практически отсутству-
отсутствуют или имеют 25-30-летний срок давности.
Предлагаемое учебное пособие является первым полномасштаб-
полномасштабным изданием для химико-технологических и машиностроительных
специальностей. Оно построено по общесистемному принципу, но-
носит достаточно универсальный характер и отвечает программе кур-
курсов коррозии, включенных в федеральный компонент государствен-
государственных образовательных стандартов.
Курсы коррозии в качестве самостоятельных дисциплин введе-
введены в учебные планы ряда химико-технологических, металлургиче-
металлургических и химико-машиностроительных специальностей. Учебные про-
программы этих курсов близки и содержат много общих вопросов. Это
определило возможность создания единого учебного пособия. Оно
содержит четыре части.
Часть I посвящена теории коррозионных процессов, протекаю-
Предисловие
щих в газовых и жидких средах. Основой для изложения этих вопро-
вопросов являются знания, полученные при изучении физической химии,
и в частности таких ее разделов, как электрохимия и адсорбционные
процессы.
Часть II знакомит читателей с отдельными видами коррозии, име-
имеющими место в природных и технологических средах. В ряде слу-
случаев решающее влияние на характер и скорость коррозионных
разрушений оказывает кристаллическая и фазовая структура метал-
металлических материалов. Отмечается глубокая взаимосвязь науки о кор-
коррозии, физики металлов и металловедения.
Часть III учебного пособия посвящена изложению коррозионных
характеристик ряда металлов и сплавов, а также неметаллических
материалов. В части IV изложены основные методы защиты машин
и аппаратов от коррозии.
Настоящее учебное пособие предназначено для студентов хими-
химико-технологических и политехнических институтов, академий и тех-
технических университетов очной и дистанционной форм обучения.
Оно будет полезно также студентам машиностроительных, энер-
энергетических, нефтехимических и других смежных специальностей,
аспирантам, слушателям институтов повышения квалификации, ра-
работникам проектных организаций и промышленных предприятий.
Краткие сведения об авторах. Семенова Инна Владиславовна —
профессор Московского государственного открытого университета
(МГОУ), д.т.н., профессор, академик АПЭ. Автор около 200 публи-
публикаций, книг, авторских свидетельств и внедрений. Область научных
интересов: физическая химия гетерогенных процессов, коррозион-
ностойкие материалы в окислительном синтезе, природоохранные
технологии.
Флорианович Галина Матвеевна — научный консультант при ди-
дирекции ФГУП НИФХИ им. Л.Я.Карпова, д.х.н., профессор. Лауреат
государственной премии СССР. Заслуженный химик РФ. Автор бо-
более 250 научных публикаций. Область научных интересов: электро-
электрохимическая кинетика, теория коррозии металлических материалов и
практика их противокоррозионной защиты.
Хорошилов Андрей Владимирович — научный сотрудник лабо-
лаборатории термодинамических основ неорганического материаловеде-
материаловедения ИОНХ РАН им. Н.С.Курнакова, к.х.н. Автор около 40 публикаций
и книг. Область научных интересов: теоретические основы карбо-
карбонатной коррозии сталей, синтез и свойства новых неорганических
жаростойких материалов, термодинамика гетерогенных процессов.
Предисловие, главы 1,2 (за исключением 2.2), 3, 6, 7 (за исключе-
исключением 7.1.1 и 7.1.2), 9, 10 (за исключением 10.1.2 и 10.1.4) написаны
Предисловие
И.В. Семеновой; глава 4 — Г.М. Флорианович и И.В. Семеновой
(разд. 4.1-4.3, 4.4.1, 4.6, 4.7 и 4.17); глава 8 — А.В. Хорошило-
вым (разд. 8.1) и И.В. Семеновой (разд. 8.2). Приложение написано
А.В. Хорошиловым. Подбор и оформление графического материала,
компьютерная верстка проведены А.В. Хорошиловым. На начальном
этапе работы частично материалы по разделам 2.2, 5.1, 5.3; 7.1.1-
7.1.2; 10.1.2, 10.1.4 были представлены И.И. Реформатской в рамках
выполнения договора с МГОУ. Литературная обработка, редактиро-
редактирование и оформление этих материалов проведены: 2.2; 7.1.1 и 7.1.2 —
И.В. Семеновой и А.В. Хорошиловым; 5.1 и 5.3 — И.В. Семеновой
и Г.М. Флорианович; 10.1.2 и 10.1.4. — И.В. Семеновой.
Рукопись книги прошла широкую апробацию. Авторы считают
своим приятным долгом выразить признательность и благодарность
своим рецензентам члену-корр. РАН, профессору, д.х.н. Ю.М. Полу-
карову, профессору, д.х.н. A.M. Сухотину, профессору, д.х.н., засл.
деятелю науки РФ В.Н. Кудрявцеву, доценту, к.т.н. Т.Е. Цупак,
профессору, д.х.н. Ю.А. Попову, профессору, д.т.н. Н.П. Глазову за
положительную оценку нашего труда, ценные советы и пожелания,
которые были учтены при ее окончательном оформлении.
Авторы с благодарностью примут критические замечания и пред-
предложения, способствующие улучшению настоящего учебного пособия.
ГЛАВА 1
ВВЕДЕНИЕ В СПЕЦИАЛЬНОСТЬ
1.1. Методические рекомендации по изучению курса
«Коррозия и защита от коррозии»
Настоящее учебное пособие предназначено для студентов выс-
высших учебных заведений, изучающих дисциплины коррозии, введен-
введенные в Государственные образовательные стандарты по направлени-
направлениям «Химическая технология неорганических веществ и материалов»
и «Энерго- и ресурсосберегающие процессы в химической техноло-
технологии, нефтехимии и биотехнологии».
Основная цель курса — формирование у студентов системы зна-
знаний по обоснованию и реализации ресурсосберегающих решений
при выборе конструкционных материалов и защите их от коррозии
во всех сферах природной и производственной деятельности.
Несмотря на очевидную дифференциацию природных и промыш-
промышленных условий, разнохарактерность организационно-управленчес-
организационно-управленческих структур, различие в специфике трудовых процессов, необходима
разработка единой научной методологии, объединяющей следующие
основополагающие направления инженерного противокоррозионно-
противокоррозионного обеспечения:
• анализ обратимых и необратимых деградационных процессов,
протекающих в материалах при различных условиях их экс-
эксплуатации;
• количественная оценка общих и локальных потерь; нормиро-
нормирование способов, средств и критериев получения информации о
состоянии объектов;
• создание и выбор коррозионностойких материалов;
• разработка комплекса мероприятий по защите металлов от кор-
коррозии.
Курс «Коррозия и защита от коррозии» является комплексной
дисциплиной и базируется на знаниях, полученных при изучении
фундаментальных химических и общеинженерных дисциплин.
В результате изучения дисциплины «Коррозия и защита от кор-
коррозии» студенты должны знать:
• основы теории коррозионных процессов в газовых и жидких
электропроводящих средах;
• общие сведения о состоянии и изменении свойств конструкци-
конструкционных материалов под влиянием техногенных и антропогенных
факторов;
1.1. Методические рекомендации по изучению курсов 7
• основные источники коррозионного воздействия на конструк-
конструкционные материалы при строительной и производственной де-
деятельности, их качественные и количественные характеристи-
характеристики, методы и способы прогнозирования надежности оборудо-
оборудования и последствий коррозионного воздействия;
• концепцию комплексного обеспечения защиты материалов от
коррозии.
Используя эти знания, студенты должны уметь:
• оценить характер влияния окружающей или производственной
среды на закономерности течения коррозионных процессов;
• выбрать конструкционный материал;
• обосновать конструкцию аппарата и комплекс мероприятий по
защите оборудования и транспортных коммуникаций от корро-
коррозионного воздействия окружающей среды.
Курс «Коррозия и защита от коррозии» включает аудиторные и
лабораторные занятия. Кроме того, раздел выбора оборудования, ма-
материала для его изготовления, а также способа защиты оборудования
от коррозии входит в задание по дипломному проектированию для
всех химико-технологических специальностей.
Ниже приводится список рекомендуемой литературы в соответ-
соответствии с видом учебной деятельности.
Литература для изучения курсов коррозии
и защиты от коррозии
1. Жук Н.П. Курс теории коррозии и защиты металлов: Учеб. пособие. -
М.: Металлургия, 1976. 472 с.
2. Жук Н.П. Курс коррозии и защиты металлов: Учебник. - М.: Металлур-
Металлургия, 1968.407 с.
3. Шлугер М.А., Ажогин Ф.Ф., Ефимов Е.А. Курс коррозии и защиты ме-
металлов: Учеб. пособие. -М.: Металлургия, 1981. 215 с.
4. Климов И.Я. Коррозия химической аппаратуры. Коррозионностойкие
материалы: Учеб. пособие. -М.: Машиностроение, 1967. 462 с.
5. Колотыркин Я.М. Металл и коррозия. - М.: Металлургия, 1985. 88 с.
6. Кеше Г. Коррозия металлов. - М.: Металлургия, 1984. 400 с.
7. Киш Л. Кинетика электрохимического растворения металлов. - М.: Мир,
1990. 972 с.
8. МамуловаН.С, Сухотин A.M., Сухотина Л.П., Флорианович Г.М., Яко-
Яковлев А.Д. Все о коррозии: Справочник. - С-Пб.: Химиздат, 2000. 517 с.
9. Улиг Г.Г., Реви Р. У. Коррозия и борьба с ней. Введение в коррозионную
науку и технику. - М.: Химия, 1988. 455 с.
10. Флорианович Г.М. Теоретические основы коррозии металлов в раство-
растворах электролитов в активном состоянии. - М.: МХТИ, 1987. 48 с.
8 Введение в специальность Гл. 1
11. Лабораторный практикум по коррозии и защите металлов / Под ред.
Т.Е. Цупак - М.: РХТУ им. Д.И. Менделеева. 2001. 172 с.
12. Скорчеллетти В.В. Теоретические основы коррозии металлов. - М.:
Химия, 1973.263 с.
Литература к дипломному проекту для
химико-технологических специальностей. Раздел: «Выбор
оборудования в коррозионностойком исполнении»
1. Защита от коррозии, старения и биоповреждений машин, оборудования
и сооружений: Справочник / Под ред. А.А.Герасименко. - М.: Машино-
Машиностроение, 1987. Т.1. 688 с; Т.2. 784 с.
2. Коррозия конструкционных материалов: Справочник / Под ред. В.В. Ба-
Батракова. - М.: Металлургия, 1990. Т. 1. 344 с; Т.2. 320 с.
3. Туфанов Д.Г. Коррозионная стойкость нержавеющих сталей, сплавов и
чистых металлов: Справочник. 5-е изд. - М.: Металлургия, 1990. 320 с.
4. Коррозия: Справочник / Под ред. Л.Л. Шрайера. - М.: Металлургия,
1981.320 с.
5. Структура и коррозия металлов и сплавов. Атлас: Справочник / Под ред.
Е.А. Ульянина. -М.: Металлургия, 1989. 400 с.
6. Клипов И.Я., Удыма П.Г., Молоканов А.В., Горяинова А.В. Химическое
оборудование в коррозионностойком исполнении: Справочник. - М.:
Машиностроение, 1970. 589 с.
1.2. Социальные, экологические и экономические
аспекты проблемы борьбы с коррозией металлов
Общество не может развиваться без потребления. Для удовле-
удовлетворения своих потребностей люди организуют хозяйственную дея-
деятельность. Основой этой деятельности является производство. Для
функционирования производства необходимы аппараты, вспомога-
вспомогательное оборудование, коммуникации.
В современном мире численность населения Земли быстро воз-
возрастает. В 1850 г. оно составляло 1,2 млрд человек, к 1950 г. уве-
увеличилось до 2,5 млрд. человек, а к середине 1987 г. — до 5 млрд
человек.
Соответственно растут и потребности людей, причем не про-
пропорционально росту их численности, а более высокими темпами.
Удовлетворить эти непрерывно умножающиеся потребности можно
только за счет развития производства.
Так, если за последнюю четверть века население планеты возрос-
возросло в 1,6 раза, то объемы основных производств — в 2-5 раз.
Необходимость в массовой транспортировке разнообразного сы-
сырья из районов добычи газо- и нефтепродуктов в районы потребления
1.2. Некоторые аспекты проблемы борьбы с коррозией металлов 9
и переработки привело к строительству широкой сети коммуника-
коммуникаций.
Промышленность Российской Федерации имеет более 20000 пред-
предприятий с разнообразными технологиями производства.
Оборудование для них изготавливают на основе сплавов черных
и цветных металлов, а также из природных или искусственных хими-
химически стойких материалов. Со временем оно стареет или разрушает-
разрушается вследствие коррозии. Это приносит не только большие экономиче-
экономические потери, но и приводит к глобальным экологическим катастрофам.
Экономический и экологический ущерб, наносимый нашей пла-
планете коррозией металлических изделий, оборудования и конструк-
конструкций, неисчислим. В последние годы, например, только в Соединен-
Соединенных Штатах Америки ежегодные потери от коррозии составили 300
миллиардов долларов, что соответствует 6 % национального дохода
всей страны.
В Российской Федерации ежегодные потери металлов из-за их
коррозии составляют до 12 % общей массы металлофонда, что соот-
соответствует утрате до 30% ежегодно производимого металла. Кроме
столь огромных связанных с коррозией прямых потерь, существу-
существуют еще большие косвенные потери. К ним относятся расходы, обу-
обусловленные потерей мощности металлического оборудования, его
вынужденными простоями из-за аварий, а также расходы на ликви-
ликвидацию последствий аварий, часто носящих характер экологических
катастроф.
Как правило, металлическое изделие, пришедшее в негодность
вследствие коррозионных разрушений, отправляют на переплавку. В
этом случае общие потери будут включать безвозвратные потери ме-
металла, перешедшего в продукты коррозии, стоимость изготовления
металлических изделий и косвенные потери. По статистическим дан-
данным безвозвратные потери составляют 8-12% от первоначальной
массы металла. Стоимость изготовления металлических конструк-
конструкций зачастую превосходит стоимость самого металла. К косвенным
потерям относят расходы, связанные с отказом в работе металличе-
металлического оборудования, с его простоями и ремонтом.
Суммарно в большинстве стран потери от коррозии составля-
составляют 4-6 % национального дохода.
Росту потерь от коррозии способствует постоянное интенсивное
развитие наиболее металлоемких отраслей промышленности, например,
энергетики (тепловой и атомной), транспорта (в том числе трубопро-
трубопроводного), металлургии, химической, нефтяной и нефтехимической
промышленности и др., а также ужесточение условий эксплуатации
металла как в промышленности, так и в городском хозяйстве. Все это
10
Введение в специальность
Гл. 1
указывает на исключительную важность проблемы борьбы с корро-
коррозией металлов, а следовательно, и на большую значимость развития
научно-технических работ в данной области. Но главное, что опреде-
определяет необходимость первоочередного решения проблемы научного
подхода к поиску оптимальных путей противокоррозионной защиты
металлов, связано с безвозвратностью затрат на борьбу с коррозией
металлических изделий и конструкций и невосполнимостью израс-
израсходованных при этом земных ресурсов.
Химическая промышленность производит в настоящее время свы-
свыше 90 тысяч наименований разнообразных химических продуктов.
Но лишь 1/5 от этого количества производится на основе всесторон-
всесторонних и действительно научных разработок. Технология производства
около 80 % из них не оптимизирована.
Необходимо отметить, что создание самых совершенных машин
и аппаратов не гарантирует их от разрушений. Повышение надежно-
надежности, экологической безопасности технических систем предъявляет
особо жесткие требования к качеству конструкций и монтажа.
В условиях несовершенства производства, нарушения техноло-
технологий эксплуатации, износа оборудования вероятность «отказов» и
аварий возрастает.
В настоящее время общий металлофонд Российской Федерации
составляет 1,6 млрд т. Его распределение по отраслям промышлен-
промышленности представлено в табл. 1.1.
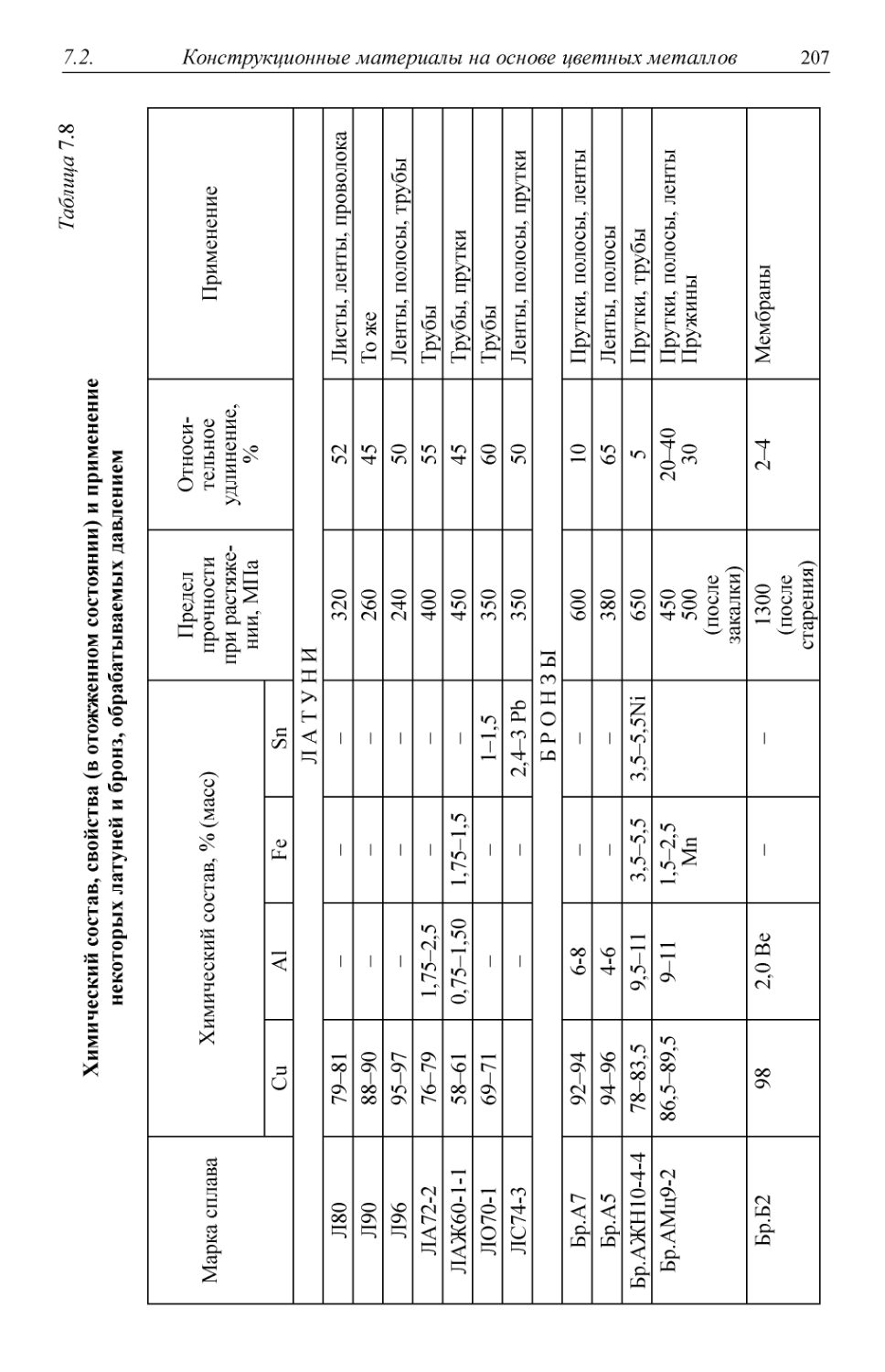
Таблица 1.1
Распределение металлофонда Российской Федерации по отраслям (млн т)
Общий
Промышленность
Транспорт
Сельское хозяйство
Прочие конструкции
1600
750
400
150
300
При этом 40-50 % машин и сооружений работает в агрессивных
средах, 30 % — в слабо агрессивных, и только около 10 % не требует
активной антикоррозионной защиты.
Степень удовлетворенности страны основными средствами защиты
металлоконструкций существенно ниже необходимой. В частности,
потребность в лакокрасочных покрытиях и ингибиторах удовлетво-
удовлетворяется на половину, а в защите готового металлопроката, например,
в трубах с покрытиями — менее чем на 30 %.
Наибольшие потери от коррозии несут топливно-энергетический
комплекс (ТЭК), сельское хозяйство, химия и нефтехимия. Так, поте-
1.2.
Некоторые аспекты проблемы борьбы с коррозией металлов
11
ри металла от коррозии составляют: в ТЭК—30%, химии и нефтехи-
нефтехимии — 20 %, сельском хозяйстве — 15 %, металлообработке — 5 %.
В настоящее время проблема коррозии усугубляется резким ста-
старением основного металлофонда, физическим и моральным изно-
износом, совершенно недостаточной степенью возобновляемости и ре-
реновации (реконструкции, ремонта) (таблица 1.2).
Таблица 1.2
Старение и ремонт металлоконструкций
Конструкции
Городские мосты, путепроводы, туннели
Водопроводные и канализационные сети
Оборудование котельных и ТЭЦ
Магистральные:
— нефтепроводы
— газопроводы
— резервуары
Трубопроводные сети г. Москвы:
— теплоснабжения
— газоснабжения
В эксплуатации
22 тыс. ед.
270 тыс. км
49,6 тыс. км
150 тыс. км
> 40 тыс. ед.
8 тыс. км
6 тыс. км
Требуют
ремонта
или замены
40%
>30%
35%
> объема
вновь
сооружаемых
>50%
3%
Большая часть из 800 млн тонн потенциально опасных сварных
конструкций выработала свой ресурс на 50-70%. Значительная часть
сооружений исчерпала свой плановый ресурс и вступает в период
интенсификации отказов.
Нефтегазовые сооружения (трубопроводные, магистральные и
промысловые системы, несущие конструкции нефтеперерабатыва-
нефтеперерабатывающих заводов и т.д.) эксплуатируются в условиях воздействия до-
добываемых, транспортируемых, перерабатываемых углеводородных
продуктов и агрессивных коррозионных сред.
Анализ причин отказов и аварий нефтегазовых сооружений сви-
свидетельствует о превалирующем влиянии коррозионного фактора. В
нефтедобывающей промышленности и транспорте нефти 70 % отка-
отказов произошло по причине коррозионных повреждений (таблица 1.3).
Для нахождения путей практического решения тех или иных за-
задач, возникающих в результате коррозионного разрушения различ-
различных металлических объектов, необходимо, в первую очередь, знание
законов такого разрушения, т.е. теории коррозии металлов. Это тре-
требует рассмотрения общих вопросов, к которым, кроме механизма
коррозии металлов, следует отнести такие разделы, как:
• диагностика конструкций и оборудования потенциально опас-
12
Введение в специальность
Гл. 1
Таблица 1.3
Статистика отказов оборудования нефте-газовых систем
Система
Нефтеперера-
Нефтеперерабатывающая
промышлен-
промышленность и транс-
транспорт нефти
Газопроводы
Внутрипромы-
словые трубо-
трубопроводы
Вид отказа
Коррозия
70%
36,7%
95%
Брак стро-
ительно-
монтаж-
ных работ
15%
10%
Брак ма-
материалов
2%
13,3%
Механи-
Механические
повреж-
повреждения
10%
13,9%
Нару-
Нарушение
эксплу-
эксплуатации
3%
26,1%
ных производств и объектов;
• оценка прочности и остаточного ресурса эксплуатируемых кон-
конструкций и оборудования объектов повышенной опасности;
• разработка ресурсосберегающих технологий сварки и смежных
процессов для повышения надежности работы конструкций;
• сертификация и нормирование, как основа обеспечения каче-
качества оборудования;
• экологические и социально-экономические проблемы обеспе-
обеспечения надежности эксплуатации потенциально опасных объек-
объектов.
Целевым назначением описываемых в учебнике материалов ука-
указанных направлений является изложение научных основ коррозии
металлов и способов практического использования этих основ при
выборе и реализации оптимальных путей противокоррозионной за-
защиты металлических изделий и конструкций.
1.3. Термины и стандарты
Машины и аппараты, изготовленные из металлов и сплавов, при
эксплуатации в природных или технологических средах, подверже-
подвержены коррозии. Коррозия происходит от латинского слова «corrodere» —
разъедать. Коррозией металлов называют самопроизвольное разру-
разрушение металлов и сплавов вследствие их взаимодействия с окружа-
окружающей средой. В основе этого взаимодействия лежат химические и
электрохимические реакции, а иногда и механическое воздействие
внешней среды. Способность металлов сопротивляться воздей-
воздействию среды называется коррозионной стойкостью или химиче-
1.3. Термины и стандарты 13
ским сопротивлением материала. Металл, подвергающийся корро-
коррозии, называют корродирующим металлом, а среда, в которой про-
протекает коррозионный процесс - коррозионной средой. В результате
коррозии изменяются свойства металла и часто происходит ухудше-
ухудшение его функциональных характеристик.
Металл при коррозии может частично или полностью разрушать-
разрушаться. Химические соединения, образующиеся в результате взаимодей-
взаимодействия металла и коррозионной среды, называют продуктами корро-
коррозии. Продукты коррозии могут оставаться на поверхности металла
в виде оксидных пленок, окалины или ржавчины. В зависимости от
степени адгезии их с поверхностью металла наблюдаются различ-
различные случаи. Например, ржавчина на поверхности железных сплавов
образует рыхлый слой, процесс коррозии распространяется далеко в
глубь металла и может привести к образованию сквозных язв и сви-
свищей. Напротив, при окислении алюминия на поверхности образуется
плотная сплошная пленка оксидов, которая предохраняет металл от
дальнейшего разрушения.
Коррозия является физико-химическим процессом и закономер-
закономерности ее протекания определяются общими законами термодинами-
термодинамики и кинетики гетерогенных систем. Различают внутренние и внеш-
внешние факторы коррозии. Внутренние факторы характеризуют влияние
на вид и скорость коррозии природы металла (состав, структура и
т.д.). Внешние факторы определяют влияние состава коррозионной
среды и условий протекания коррозии (температура, давление и т.д.).
Противокоррозионной защитой называют процессы или сред-
средства, применяемые для уменьшения или прекращения коррозии ме-
металла. Основные понятия, термины и определения в области корро-
коррозии стандартизированы (ГОСТ 5272-68.). В системе государствен-
государственных стандартов единой системы защиты от коррозии, старения и
биоповреждений (ЕСЗКС) вопросы коррозии выделены в класс под
номером «9». Следующая цифра, отделенная точкой от цифры «9»,
соответствует определенной классификационной группе стандарта:
1 — Организационно-методические правила и нормы;
2 — Общие требования к выбору конструкционных материалов
и комплексной защите;
3 — Металлические и неметаллические неорганические покрытия;
4 — Лакокрасочные, полимерные покрытия;
5 — Временная противокоррозионная защита;
6 — Электрохимическая защита;
7 — Защита от старения;
8 — Защита от биоповреждений;
9 —Общие вопросы коррозии и защиты металлов.
14 Введение в специальность Гл. 1
1.4. Классификация коррозионных процессов
Коррозионные процессы классифицируют по механизму взаимо-
взаимодействия металлов с внешней средой; по виду коррозионной среды
и условиям протекания процесса; по характеру коррозионных раз-
разрушений; по видам дополнительных воздействий, которым подвер-
подвергается металл одновременно с действием коррозионной среды.
По механизму процесса различают химическую и электрохими-
электрохимическую коррозию металлов.
Химическая коррозия — это процесс взаимодействия металла с
коррозионной средой, при котором окисление металла и восстанов-
восстановление окислительного компонента среды протекают единовременно
в одном акте. Продукты взаимодействия пространственно не разде-
разделены.
Электрохимическая коррозия — это процесс взаимодействия ме-
металла с коррозионной средой (раствором электролита), при котором
ионизация атомов металла и восстановление окислительного компо-
компонента коррозионной среды протекают не в одном акте и их скорости
зависят от электродного потенциала.
По виду коррозионной среды и условиям протекания различают
несколько видов коррозии.
Газовая коррозия — это химическая коррозия металлов в газовой
среде при минимальном содержании влаги (как правило не более
0,1%) или при высоких температурах. В химической и нефтехи-
нефтехимической промышленности такой вид коррозии встречается часто.
Например, при получении серной кислоты на стадии окисления ди-
диоксида серы, при синтезе аммиака, получении азотной кислоты и
хлористого водорода, в процессах синтеза органических спиртов,
крекинга нефти и т.д.
Атмосферная коррозия — это коррозия металлов в атмосфере
воздуха или любого влажного газа.
Подземная коррозия — это коррозия металлов в почвах и грунтах.
Биокоррозия — это коррозия, протекающая под влиянием жизне-
жизнедеятельности микроорганизмов.
Контактная коррозия — это вид коррозии, вызванный контак-
контактом металлов, имеющих разные стационарные потенциалы в данном
электролите.
Радиационная коррозия — это коррозия, обусловленная действи-
действием радиоактивного излучения.
Коррозия внешним током и коррозия блуждающим током. В пер-
первом случае — это коррозия металла, возникающая под воздействием
1.4.
Классификация коррозионных процессов
15
тока от внешнего источника. Во втором случае — под воздействием
блуждающего тока.
Коррозия под напряжением — коррозия, вызванная одновремен-
одновременным воздействием коррозионной среды и механических напряже-
напряжений. Если это растягивающие напряжения, то может произойти рас-
растрескивание металла. Это очень опасный вид коррозии, особенно
для конструкций, испытывающих механические нагрузки (оси, рес-
рессоры, автоклавы, паровые котлы, турбины и т.д.).
Если металлические изделия подвергаются циклическим растя-
растягивающим напряжениям, то можно вызвать коррозионную усталость.
Происходит понижение предела усталости металла. Такому виду
коррозии подвержены рессоры автомобилей, канаты, валки прокат-
прокатных станов.
Коррозионная кавитация — разрушение металла, обусловленное
одновременным коррозионным и ударным воздействием внешней
среды.
Фреттинг-коррозия — это коррозия, вызванная одновременно
вибрацией и воздействием коррозионной среды.
Устранить коррозию при трении или вибрации возможно пра-
правильным выбором конструкционного материала, снижением коэф-
коэффициента трения, применением покрытий и т.д.
По характеру изменения поверхности металла или сплава разли-
различают несколько видов коррозионных разрушений (рис. 1.1).
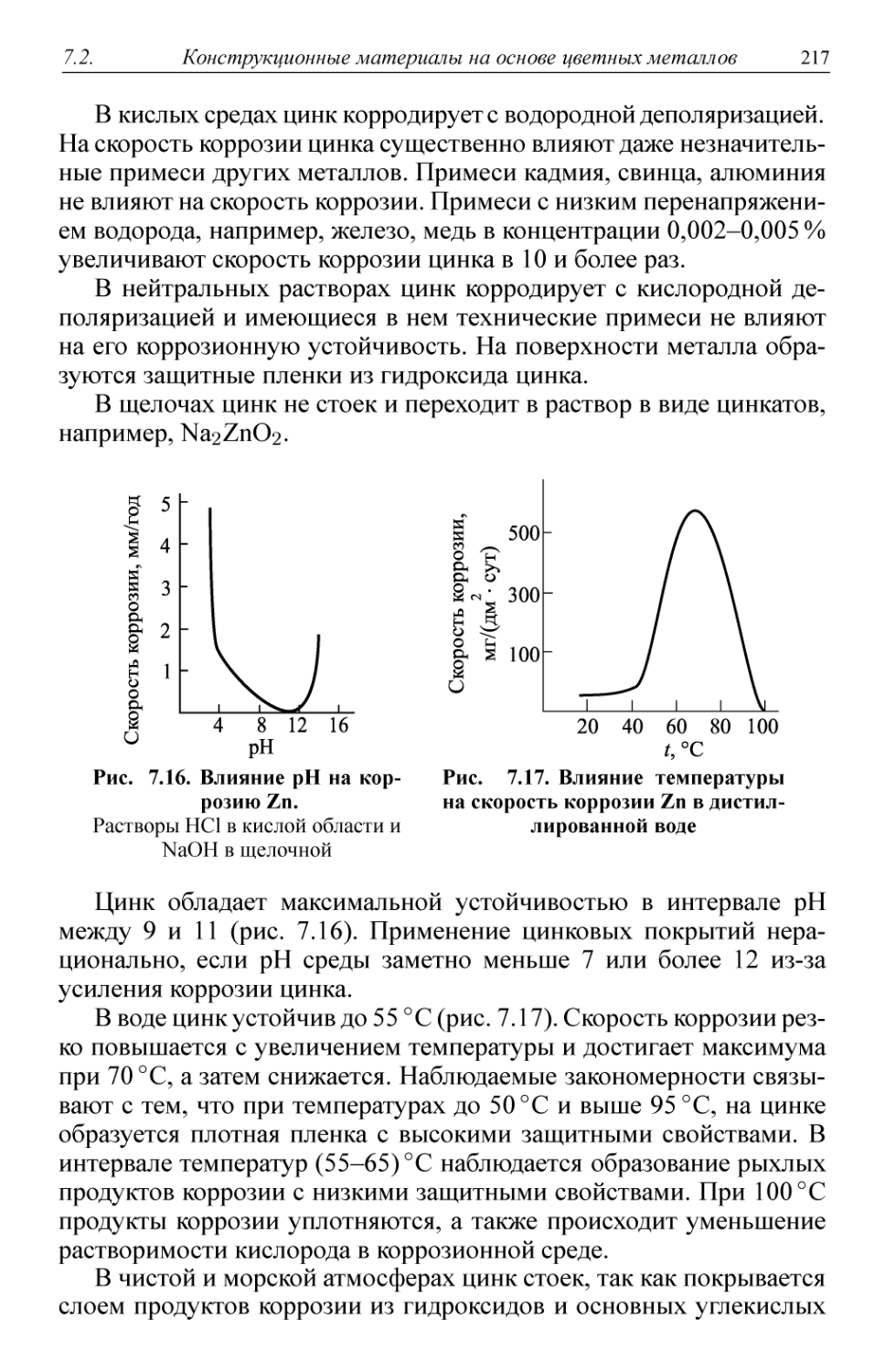
Рис. 1.1. Виды коррозии:
а — сплошная равномерная; б — сплошная неравномерная; в —
структурно-избирательная; г — пятнами; д — язвами; е — точками
(питтинговая); ж — подповерхностная; з — межкристаллитная
Коррозия называется сплошной (рис. 1.1, а и б), если она охва-
охватывает всю поверхность металла. Сплошная коррозия может быть
равномерной (рис. 1.1, а), если процесс протекает с одинаковой ско-
скоростью по всей поверхности металла, и неравномерной (рис. 1.1,6),
16 Введение в специальность Гл. 1
когда скорость процесса неодинакова на различных участках поверх-
поверхности. Равномерная коррозия наблюдается, например, при коррозии
железных труб на воздухе.
При избирательной коррозии (рис. 1.1, в) разрушается одна струк-
структурная составляющая или один компонент сплава. В качестве при-
примеров можно привести графитизацию чугуна или обесцинкование
латуней.
Местная (локальная) коррозия охватывает отдельные участки по-
поверхности металла (рис. 1.1, г, д, е). Местная коррозия может быть
выражена в виде отдельных пятен, не сильно углубленных в тол-
толщу металла (рис. 1.1, г); язв - разрушений, имеющих вид раковины,
сильно углубленной в толщу металла (рис. 1.1, д), или точек (пит-
тингов), глубоко проникающих в металл (рис. 1.1, е).
Первый вид наблюдается, например, при коррозии латуни в мор-
морской воде. Язвенная коррозия отмечена у сталей в грунте, а питтин-
говая — у аустенитной хромоникелевой стали в морской воде.
Подповерхностная коррозия (рис. 1.1, ж) начинается на поверх-
поверхности, но затем распространяется в глубине металла. Продукты кор-
коррозии оказываются сосредоточенными в полостях металла. Этот вид
коррозии вызывает вспучивание и расслоение металлических изде-
изделий.
Межкристаллитная коррозия (рис. 1.1, з) характеризуется раз-
разрушением металла по границам зерен. Она особенно опасна тем, что
внешний вид металла не меняется, но он быстро теряет прочность
и пластичность и легко разрушается. Связано это с образованием
между зернами рыхлых малопрочных продуктов коррозии. Этому
виду разрушений особенно подвержены хромистые и хромоникеле-
вые стали, никелевые и алюминиевые сплавы.
Щелевая коррозия вызывает разрушение металла под прокладка-
прокладками, в зазорах, резьбовых креплениях и т.д.
1.5. Показатели коррозии
Скорость коррозии может быть определена по изучению зависи-
зависимости изменения какого-либо показателя процесса во времени. Ис-
Истинная или мгновенная дифференциальная скорость коррозии в мо-
момент времени т\ равна первой производной от величины показателя
(у) от времени, т.е. ду/дт при т = т\. Чаще на практике определяют
среднюю интегральную скорость процесса за время т, т.е. Ау/Ат.
Наиболее употребительными показателями процесса коррозии явля-
являются: глубинный, изменение массы, объемный, механический и др.
Глубинный показатель (Кп) оценивает глубину коррозионного
1.5. Показатели коррозии 17
разрушения металла в единицу времени (например, мм/год). Воз-
Возможно также измерение толщины образующейся на металле пленки
продуктов коррозии в единицу времени.
Массовый показатель (К^) характеризует изменение массы (га)
образца металла в результате коррозии, отнесенное к единице по-
поверхности металла S икединице времени г (например, г/(м2-ч)):
Этот показатель может быть отрицательным, если масса металла за
время испытания т после удаления продуктов коррозии уменьши-
уменьшилась. Он может быть и положительным, если масса образца за время
испытаний увеличилась.
Если известен состав продуктов коррозии металла, то можно сде-
сделать пересчет положительного показателя изменения массы в отри-
отрицательный по формуле:
К~ - К+ Пок ' Аш (\1)
- К
ПМе ' ^Т-ОК
где К^ и К+ — соответственно отрицательный и положительный
массовый показатель коррозии; AMq — атомная масса металла; Аок —
атомная масса окислителя; пМе — валентность металла; пок — валент-
валентность окислителя.
В случае равномерной коррозии металла можно сделать пере-
пересчет от отрицательного показателя изменения массы (К^, г/(м2-ч)) к
глубинному показателю Кп (мм/год):
К- • 8,76
АП = , A.3)
рМе
где рМе, г/см3 — плотность металла.
Объемный показатель коррозии (Ку) указывает объем поглощен-
поглощенного или выделившегося в процессе коррозии металла газа AV, при-
приведенного к нормальным условиям, и отнесенный к единице поверх-
поверхности металла и к единице времени (например, см3/(см2-ч)):
KV = f. A.4,
Используется также механический показатель коррозии KMQX. Он
характеризует изменение какого-либо механического свойства ме-
металла за время коррозионного процесса, выраженное в процентах.
18 Введение в специальность Гл.1
Например, прочностной показатель (К^):
К, = |2L, A.5)
где аТ — изменение предела прочности при растяжении за время т
коррозии; аТо —предел прочности при растяжении до коррозии.
Существуют также показатель изменения электрического сопро-
сопротивления, применяемый при исследовании коррозии тонкого листо-
листового материала, очаговый показатель {К^\ характеризующий число
очагов коррозии, отнесенное к единице поверхности металла и к
единице времени, и др.
Вопросы для самопроверки
1. Охарактеризуйте динамику роста численности населения Земли.
2. Какие факторы характеризуют увеличение потребностей людей
в промышленном производстве?
3. Назовите основные показатели ущерба, наносимого коррозией.
Какие виды потерь вы знаете?
4. Охарактеризуйте состояние металлофонда Российской Феде-
Федерации.
5. Назовите причины выхода из строя оборудования и транспорт-
транспортных коммуникаций. Приведите цифровые данные.
6. Какова цель и задачи курса «Коррозия и защита металлов»?
7. Что должен знать и уметь студент после изучения дисциплины
«Коррозия и защита металлов»?
8. Дайте определение термина «коррозия».
9. К какому типу процесса — гомогенному или гетерогенному —
относится коррозия?
10. Приведите определение химической и электрохимической кор-
коррозии.
11. Перечислите основные виды коррозии.
12. Как можно классифицировать процесс коррозии по виду раз-
разрушений?
13. Охарактеризуйте основные показатели коррозионного процесса.
Литература
1. Мазур И.И., Молдаванов О.И., Шигиов В.К Инженерная эколо-
экология. - М.: Высшая школа, 1996. Т 1. 636 с; Т 2. 655 с.
2. ГОСТ 5272-68. Коррозия металлов. Термины: Курс коррозии и
защиты металлов. - М.: Государственный комитет СССР по стан-
стандартам.
Часть I
Основы теории коррозии
металлов
ГЛАВА 2
ГАЗОВАЯ КОРРОЗИЯ МЕТАЛЛОВ
2.1. Общая характеристика процессов газовой коррозии
Газовая коррозия протекает при контакте металлов с газами в
отсутствии электропроводящих растворов.
В природных условиях газовая коррозия встречается редко, а в
технологических процессах, особенно в металлургических и хими-
химических производствах, — достаточно часто.
Как правило, газовая коррозия протекает по химическому меха-
механизму.
Химическая коррозия металлов — это самопроизвольный окис-
окислительно-восстановительный процесс, подчиняющийся законам ге-
гетерогенных химических реакций, которые осуществляются одновре-
одновременно в одном акте в точке взаимодействия металла с компонентом
агрессивной среды. Металл в процессе химической коррозии вы-
выступает в роли восстановителя, он отдает электроны и окисляется.
Компонент агрессивной среды выступает в роли окислителя, акцеп-
акцептора электронов. В процессе реакции он восстанавливается. В роли
окислителей могут быть О2, СЬ, НС1, SO2, CO2 и т.д.
Пример. В промышленности синтез хлористого водорода из хло-
хлора и водорода осуществляют при 1000-1200 °С. Если при этом
применяют металлические печи, то внутренняя поверхность пе-
печи подвержена газовой коррозии. В зависимости от содержания
хлора и водорода в смеси газов протекают реакции:
Fe + С12 = FeCl2
или
2Fe + 3Cl2 = 2FeCl3.
Железо выступает в качестве восстановителя, хлор — окислите-
окислителя, а на поверхности металла образуется солевая пленка.
Наиболее часто химический механизм реализуется в процессах
газовой коррозии и в жидкой среде неэлектролитов.
Для большинства процессов основным условием осуществления
химической коррозии является отсутствие на поверхности металла
пленки воды. Это требование может быть достигнуто при соблюде-
соблюдении одного из трех условий:
• реагирующие газы содержат минимальное количество влаги
(как правило, не более сотых долей процента);
2.1. Общая характеристика процессов газовой коррозии 21
• контакт металла и газов осуществляется при высоких темпера-
температурах, превышающих «точку росы», когда конденсация влаги
на поверхности металла не происходит;
• металл находится в среде неполярных органических соедине-
соединений.
В технологических процессах часто вводят стадию осушки газов
для снижения их коррозионной активности.
Пример. Влажный хлор является коррозионноактивной средой.
В нем стойки только титан или графитовые материалы. Поэтому
заключительной стадией производства хлора является осушка
газа серной кислотой, что позволяет снизить содержание влаги
до 0,003-0,04 %. При соблюдении этих условий скорость коррозии
резко снижается и возможно применение стальной аппаратуры и
трубопроводов. Аналогичную операцию проводят при получении
брома, понижая на последних стадиях процесса содержание влаги
до 0,003-0,01 %.
Академик П.А. Ребиндер классифицировал формы связи воды с
материалом в зависимости от энергии связи. Вода в адсорбционных
слоях (физико-химическая связь) отличается от свободной воды как
по химическим, так и по термодинамическим свойствам. Диэлек-
Диэлектрическая постоянная адсорбированной воды в 40 раз меньше, чем
у свободной воды, а температура замерзания на несколько десятков
градусов ниже. Предполагают, что при контакте металла с газами,
содержащими до 0,05% Н2О, на поверхности металла находится
только физико-химически связанная вода.
Область существования высокотемпературной газовой коррозии
определяется интервалом температур. Нижняя граница соответству-
соответствует температуре конденсации пара на поверхности металла. Это со-
состояние, называемое «точкой росы», зависит от парциального дав-
давления паров воды. Для воздуха при атмосферном давлении оно оце-
оценивается температурой, равной 240-250 °С, а для отходящих газов
теплоэлектростанций — 90-100 °С.
При температурах, превышающих «точку росы», начинается об-
область химической газовой коррозии.
Верхняя температурная граница определяется такими свойства-
свойствами металла, как жаростойкость и жаропрочность.
Жаростойкость характеризует способность металла сопротив-
сопротивляться коррозионному воздействию газов при высокой температуре.
Жаропрочность определяет способность материала в условиях
высокотемпературного воздействия сохранять хорошие механиче-
механические свойства, длительную прочность и сопротивление ползучести.
Металл может быть жаростоек, но не жаропрочен, и наоборот —
жаропрочен, но не жаростоек.
22 Газовая коррозия металлов Гл. 2
Так, например, жаропрочные стали на основе железа можно экс-
эксплуатировать при температурах до 700° С, алюминиевые и медные
сплавы — до 400-450 °С, свинец — до 150 °С. Эффективное сочета-
сочетание жаропрочности и жаростойкости достигается в сплавах системы
никель-хром — до 1000° С.
Высокотемпературное взаимодействие металлов с окислитель-
окислительной средой имеет место при многих химических процессах.
Примеры. При производстве серной кислоты стадия обжига се-
серосодержащего сырья протекает при 700-800° С, а контактное
окисление диоксида серы SO2 при 420-550° С. При получении
азотсодержащих соединений конверсия метана СН4 осуществля-
осуществляется при температуре 700-800° С, синтез аммиака NH3 при дав-
давлении 35-40 МПа и 400 °С, окисление аммиака при производстве
азотной кислоты при 750-800 ° С, синтез хлористого водорода НС1
при 1000-1200°С, хлорирование метана при 400-450°С, получе-
получение метилового спирта СН3ОН при 375-400° С, крекинг нефте-
нефтепродуктов выше 450 °С.
Во всех приведенных примерах поверхность аппаратов подверга-
подвергается воздействию агрессивной газовой среды, что должно привести
к образованию на металле оксидных или солевых соединений.
2.2. Структура металлов и ее влияние
на коррозионные процессы
Механизм образования поверхностных соединений, их адгезия к
металлу и свойства влияют на процесс коррозии. В свою очередь эти
показатели во многом определяются структурой и составом металла.
Большинство металлов за исключением металлических стекол
имеют кристаллическую структуру. В узлах кристаллической ре-
решетки расположены положительно заряженные ионы, а электроны
свободно перемещаются в металле.
Наименьшая часть пространственной решетки, которой присущи
все свойства симметрии решетки в целом, называется элементарной
ячейкой. Если эта ячейка является кубом, то и соответствующая ей
решетка будет кубической. Простой кубической решеткой называет-
называется такая решетка, у которой атомами или ионами заняты лишь вер-
вершины ее элементарных ячеек. Такой тип решетки имеют, например,
кристаллы поваренной соли NaCl.
Решетка, у которой кроме вершин атомом или ионом занят центр,
называется объемноцентрированной. Такое кристаллическое стро-
строение имеют литий, натрий, калий, ванадий, хром, а-железо (при
температурах до 900 °С).
Гранецентрированной называется такая решетка, у которой ма-
2.2. Структура металлов и ее влияние на коррозионные процессы 23
термальными частицами заняты центры граней. Такой тип кристал-
кристаллической решетки имеют алюминий, никель, медь, свинец, серебро,
золото, платина, 7-железо (в интервале температур 900-1400 °С).
Гексагональная ячейка имеет в основании шестиугольник. По та-
такому принципу кристаллизуются бериллий, марганец, кадмий, титан
и др.
Различают также плотноупакованные кристаллографические плос-
плоскости и решетки.
В ряде случаев кристаллографическая структура определяет кор-
коррозионную устойчивость металлов и их сплавов.
Реальные металлические материалы, как правило, являются по-
поликристаллическими, то есть состоят из множества отдельных кри-
кристаллов, которые в общем случае имеют неправильную форму и
называются кристаллитами или зернами. В отличие от идеальных
кристаллов, в которых атомы кристаллической решетки расположе-
расположены строго периодично, реальные кристаллы всегда имеют наруше-
нарушения регулярности структуры (разупорядоченность), которые назы-
называются дефектами. Основными причинами отсутствия у реальных
конструкционных металлических материалов идеального кристал-
кристаллического состояния являются неравновесные условия кристаллиза-
кристаллизации металла, присутствие в его составе легирующих и примесных
элементов, деформация кристаллической решетки вследствие воз-
воздействия на нее в процессе изготовления изделий механических,
термических, радиационных и других факторов.
В настоящее время существует несколько способов классифика-
классификации дефектов металлических конструкционных материалов:
• по морфологическим признакам — наружные, внутренние, вне-
внедрения, в сочленениях и др.;
• по происхождению (генетическим признакам) — литейные, сва-
сварочные, термические, деформационные, коррозионные и др;
• по структурным признакам — трещины, поры, избыточные фа-
фазы, неметаллические включения, границы зерен и др;
• по геометрическим размерам—макро- (> 1 мм), микро- (~200-
1000 мкм) и субмикро- (~ 0,1-200 мкм) дефекты;
• по геометрическим признакам — точечные, линейные, двух-
двухмерные.
Дефекты кристаллических решеток изменяют заданные свойства
металлов, влияют на его химические и электрохимические характе-
характеристики. Дефекты структуры, выходящие на поверхность металла,
обладают повышенной реакционной способностью и они являются
24
Газовая коррозия металлов
Гл.2
Рис. 2.1. Точечные дефекты в кристаллах:
а — вакансия; б — дислоцированный атом; в — дефект Френкеля; г —
примесные атомы внедрения. Стрелками указаны направления смещения
атомов в кристаллической решетке
первыми очагами коррозии. Посторонние примеси концентрируют-
концентрируются у линейных дислокаций и дырок по границам зерен. Эти сегре-
сегрегации могут увеличивать окисление металла, облегчать образование
питтингов. Любой вид неоднородности усиливает как химическую,
так и электрохимическую коррозию.
Существует четыре основные типа точечных дефектов — вакан-
вакансии, примесные атомы замещения и внедрения, дислоцированные
атомы, дефекты Френкеля. Вакансии (рис. 2.1, а) являются наиболее
часто встречающимися точечными дефектами и представляют собой
свободные узлы в кристаллической решетке.
Образованию вакансий, в первую очередь, способствуют тепло-
тепловые колебания атомов. Вакансии возникают также при воздействии
на металл механических напряжений, радиоактивного излучения и
др. При образовании вакансий кристаллическая решетка искажается,
и ближайшие к ней соседние атомы смещаются от своего равновес-
равновесного положения. Например, для металлов с гранецентрированной
2.2. Структура металлов и ее влияние на коррозионные процессы 25
кубической (ГЦК) решеткой такое смещение для ближайших сосед-
соседних атомов составляет 0,84% межатомного расстояния (в сторону
вакансии), для второго слоя атомов — 0,25 % (в сторону от вакан-
вакансии), для третьего слоя — 0,03 % (в сторону вакансии).
Технически чистые металлы, к которым относятся конструкци-
конструкционные материалы, всегда содержат в структуре примесные атомы
внедрения и/или замещения (рис. 2.1, г), являющиеся дефектами не
только физической, но и химической природы. Примесные атомы за-
замещения располагаются в узлах кристаллической решетки, замещая
атомы основного металла. Примесные атомы внедрения располага-
располагаются в междоузлиях кристаллической решетки (рис. 2.1, г). При об-
образовании сплавов атомы внедрения появляются в том случае, если
отношение атомных диаметров растворенного и основного металлов
не превышает 0,59.
К похожим дефектам относятся дислоцированные атомы (рис.
2.1, б) — атомы основного металла, смещенные из своих равновес-
равновесных положений в междоузельные пространства. Преимуществен-
Преимущественными местами расположения дислоцированных атомов являются
пустоты наибольшего объема, поскольку в этом случае искажения
решетки будут минимальны.
Образование вакансий и дислоцированных атомов может проис-
происходить одновременно. В этом случае образуются парные дефекты,
называемые дефектами Френкеля (рис. 2.1 в). Энергия, необходимая
для их образования, существенно выше, чем энергия, необходимая
для образования индивидуальных вакансий или дислоцированных
атомов, вследствие чего концентрация дефектов Френкеля в метал-
металлических материалах гораздо ниже, чем остальных точечных дефек-
дефектов.
Точечные дефекты играют существенную роль в процессах диффу-
диффузии ионов металла при образовании поверхностных оксидных пленок.
При легировании ионы легирующего компонента могут входить
в решетку основного металла, образуя твердые растворы замещения
или вытеснения.
Линейными (одномерными) дефектами кристаллической решет-
решетки являются дислокации. Дислокации возникают как в процессе за-
затвердевания охлаждающегося металла, так и при механических или
иных воздействиях на металл. В конструкционных материалах дис-
дислокации образуют сплошные сетки. В зависимости от условий изго-
изготовления металлических изделий плотность дислокаций в них может
изменяться от 103-104 см~2 (в хорошо отожженных материалах) до
109-1010 см~2 (в пластически деформированных материалах). Сред-
Средняя плотность дислокаций в поликристаллических материалах со-
составляет 106-108 см~2.
26
Газовая коррозия металлов
Гл.2
• • • • • • *
• • • • •j^
Рис. 2.2. Строение границ в простой кубической решетке:
а — граница скручивания; б — двойник с когерентной границей; в, г —
границы зерен, разориентированные под большим углом (г — общий вид)
В реальных металлических материалах количество дислокаций
таково, что они образуют сплошную трехмерную сетку с узлами, в
которых происходит пересечение отдельных дислокаций. Расстоя-
Расстояние между узлами сетки дислокаций оценивается как ~ 10~4 см.
К плоскостным и поверхностным дефектам кристаллической ре-
решетки (рис. 2.2 и 2.3) относятся границы, разделяющие различно
ориентированные области — границы зерен (рис. 2.2, а, в, г), блоков
(разориентированных под малыми углами областей одного зерна,
рис. 2.3, б), двойников (кристаллов, решетки которых являются зер-
зеркальным отражением друг друга, рис. 2.2, б), а также границы, раз-
разделяющие участки решетки с различной упаковкой атомных слоев.
Типы границ различаются углом разориентировки О (рис. 2.3, а). Ве-
Величина О для блоков обычно составляет 0,01 рад (~1°), для зерен эта
величина может достигать десятков градусов. В этом случае границы
представляют собой широкие полосы нарушения кристаллической
2.2.
Структура металлов и ее влияние на коррозионные процессы
27
ХГТТ1
±±
ZT
It
It
It
31
IE
п
л
/
п
йтп
jLtjj
чПВД
TXtj
ТТЛ
¦ч u
1 1 п
Рис. 2.3. Образование малоугловой
границы:
а — расположение двух кристаллов
с углом разориентировки Q; б —
малоугловая граница
структуры, обеспечивающие плав-
плавный переход от одной ориента-
ориентации решетки к другой. Чем больше
величина О, тем выше энергия
кристаллической решетки. Во всех
случаях энергия решетки, содержа-
содержащей поверхностные дефекты, вы-
выше, чем содержащей линейные де-
дефекты. Граница, все атомы которой
одновременно принадлежат обо-
обоим соприкасающимся кристаллам
(зернам), называются когерентны-
когерентными (рис. 2.2, б), в противном случае
граница некогерентна.
Дефекты кристаллической ре-
решетки способствуют протеканию
в металле процессов диффузии и
фазовых превращений. Так, напри-
например, хорошо известен вакансион-
ный механизм диффузии, когда атомы легирующих или примесных
элементов перераспределяются в металле вследствие последователь-
последовательного перемещения в вакантные узлы. Взаимодействие дефектов, при-
приводящее к снижению энергии кристаллической решетки, является
распространенным для металлических материалов явлением.
Основная часть металлических конструкционных материалов про-
производится путем выплавки, технологии осуществления которой мно-
многоступенчаты и определяются требуемыми свойствами производимо-
производимого материала. Общей чертой процессов выплавки металлов и сплавов
является нагрев рудных материалов и полуфабрикатов до высоких
температур, превышающих температуру плавления наиболее туго-
тугоплавкого компонента, и последующее охлаждение до температуры
затвердевания и далее до комнатной температуры. Зависимость тем-
температур плавления элементов от их номера в периодической системе
Менделеева приведена на рис. 2.4.
Процесс затвердевания жидкого металла сопровождается изме-
изменением его агрегатного состояния с жидкого на твердое. Структура
ближнего порядка, когда упорядоченное расположение атомов рас-
распространяется только на наиболее близких соседей (характерно для
жидких тел или твердых тел, находящихся в аморфном состоянии),
изменяется при этом на структуру дальнего порядка, когда практи-
практически во всем объеме материала соблюдается регулярное располо-
расположение атомов (характерно для кристаллических твердых тел).
28
Газовая коррозия металлов
Гл.2
о
о
1
*<*
1
ч О
"^О-
о
¦
1
— —
т)—
ё
р
.—-с
_———
нч
о
>&
—о—
PQ
)—-
3
i
2
о
——
е
|
—о
о
— —
а
Рн
)—
1;
п
О-
—0
Я
Рч1
О—^
^О
ей
О-
1—
и ¦¦
1
— —
—о
3
— —
e/v
— —
ел
у
Й
б о.
р"
PQ
__о
О
-?"
Я"
I
§
х аз
5 «
Ом
Ом
н
Si
н
о
о
QQ
2.2. Структура металлов и ее влияние на коррозионные процессы 29
Объем тела при его затвердевании уменьшается на 2-6%, что
является следствием уменьшения межатомных расстояний. Эффект
тем больше, чем более компактная решетка характерна для затвер-
затвердевшего металла.
Вследствие уменьшения объема металла при его затвердевании в
структуре реального слитка, как правило, присутствуют макродефек-
макродефекты—трещины, раковины, полости. Кроме макродефектов затвердев-
затвердевший металл содержит большое количество микродефектов — вакан-
вакансий, дислокаций, дефектов упаковки, границ раздела.
Любой вид неоднородности, как то по составу, наличию приме-
примесей, очагов остаточного напряжения, электропроводности отдель-
отдельных участков, приводит к увеличению скорости коррозии. Для того,
чтобы устранить или уменьшить эти явления, проводят такие техно-
технологические операции как закалка, отжиг и др.
В подавляющем большинстве металлические конструкционные
материалы являются многокомпонентными сплавами, в состав кото-
которых входят легирующие (вводимые специально для придания
материалу необходимых свойств) и примесные (попадающие в ма-
материал с рудными материалами в процессе выплавки и металлурги-
металлургических переделов) элементы. Вступая друг с другом во взаимодей-
взаимодействие компоненты сплавов могут образовывать фазы — однородные
по структуре (кристаллическому строению) и составу (концентра-
(концентрации компонентов) области, ограниченные поверхностями раздела.
Конструкционные материалы, как правило, содержат несколько фаз,
относительное количество которых может существенно различаться.
Фазы постоянного состава называют химическими соединениями
или интерметаллоидами.
Многие металлы испытывают аллотропическое превращение. Ал-
Аллотропическим или полиморфным превращением называют изме-
изменение решетки кристаллического тела. Такое изменение происходит
изотермически и характеризуется температурой фазового равнове-
равновесия (То) двух аллотропических разновидностей. Например, железо
при температурах до 910 °С и при 1401-1539 °С образует а-фазу и
кристаллизуется в виде кубической объемноцентрированной решет-
решетки, а в интервале температур 910-1401 °С образует 7~ФазУ в виДе
кубической гранецентрированной решетки.
В сплавах могут существовать твердые растворы. Твердые рас-
растворы называются непрерывными, если они образуются при любом
соотношении компонентов.
Различают твердые растворы замещения и внедрения. В раство-
растворах замещения атомы компонентов могут замещать друг друга в
любом узле решетки. В растворах внедрения атомы растворенного
30 Газовая коррозия металлов Гл. 2
компонента располагаются в междоузлиях решетки растворителя.
Для описания сплавов используют диаграмму состояния или диа-
диаграмму равновесия, представляющую собой зависимость фазового
строения, химического состава от температуры.
Простейшим примером является сплав, имеющий в своем составе
два химических элемента (компонента). Согласно правилу фаз Гиббса
число степеней свободы (число независимых переменных, действу-
действующих на систему, которые можно изменять, не нарушая количество
и состав существующих фаз) равновесной системы (Ссв) опреде-
определяется количеством ее компонентов (Кком), количеством фаз (Ф) и
количеством переменных параметров П. Для металлических мате-
материалов внешними независимыми параметрами чаще всего являются
температура Т и давление Р, т.е. Ппар = 2. В общем случае:
ССВ = ККОМ-Ф + П. B.1)
2.3. Основы термодинамики процессов коррозии
металлов
Многие реакции, протекающие при коррозии, являются обрати-
обратимыми. Законы термодинамики дают возможность определить веро-
вероятность образования соединения в тех или иных условиях.
На целенаправленном смещении равновесия основан один из ме-
методов защиты металлов от газовой коррозии — создание защитных
атмосфер.
Для определения состояния вещества в термодинамике исполь-
используют такие понятия, как внутренняя энергия (U), энтальпия (Н), эн-
энтропия (S), изобарно-изотермический потенциал (G), химический
потенциал (/i).
Изменение внутренней энергии в процессе связано с количеством
выделяемой теплоты (Q) и величиной совершаемой системой рабо-
работы (А):
AU = Q-A. B.2)
В случае химической реакции, протекающей при постоянном объеме
системы, изменение внутренней энергии равно взятому с обратным
знаком тепловому эффекту реакции.
Энергия вещества при постоянном давлении характеризуется эн-
энтальпией (Н). Последняя больше внутренней энергии на величину
работы, которую может совершить система при постоянном давлении:
B.3)
При постоянном давлении и при условии, что в ходе процесса
2.3. Основы термодинамики процессов коррозии металлов 31
совершается только работа расширения
A = PAV или B.4)
АН = AU + PAV. B.5)
Сравнивая уравнение B.2) с уравнением B.3) видим, что
АНР = -Q, B.6)
где АНР — энтальпия при постоянном давлении.
Равновесие связано не только с различием в энергии молекул, но
и с вероятностью состояний исходных веществ и продуктов реакции,
с возможностью протекания реакций.
Величина, которая позволяет количественно определить вероят-
вероятность состояния, называется энтропией, ее изменение обозначает-
обозначается AS, а размерность — Дж/(моль-град.)
В химических реакциях, идущих при постоянном давлении, од-
одновременно изменяются и энтальпия и энтропия, а процесс протека-
протекает в направлении, при котором уменьшается общая движущая сила
реакции.
Движущая сила называется свободной энергией или изобарным
потенциалом (AG). По международному соглашению 1961 г. изо-
изобарный потенциал назван «свободной энергией Гиббса». Его раз-
размерность — Дж/моль. Изобарный потенциал является свойством ве-
вещества, выражающим одновременно как его энтальпию (энергию),
так и присущую ему энтропию (степень беспорядка).
Основное уравнение термодинамики, связывающее эти величи-
величины, имеет вид:
AG = АН - TAS. B.7)
Изобарный потенциал связан с константой равновесия простым со-
соотношением:
AG = -RT In К. B.8)
Рассмотрим реакцию окисления металла:
Me + О2 ^ МеО2
В газовой атмосфере, содержащей кислород, уравнение для изобар-
но-изотермического потенциала будет иметь вид:
AG = -RT ЫК -RT In a02. B.9)
Выражая изменение энергии Гиббса через величины равновесно-
32 Газовая коррозия металлов Гл. 2
го Pq2 и парциального Р<э2 давлений кислорода, получим:
AG = -RT\n^r-RT\nP02 = -ДГ1п§2.. B.10)
Уравнение позволяет оценить возможность протекания процесса
окисления. Если Pq2 > Pq2, to процесс окисления возможен, так как
в этих условиях AG < 0. Если Pq2 < Pq2 , то окисление невозможно,
ибо при этом AG > 0.
Этот принцип используют для предотвращения газовой корозии в
ряде технологических операций, например, в металлургии. Снижая
парциальное давление Ро2 в газовой среде, предохраняют металл от
окисления при высоких температурах.
2.4. Коррозия металлов в неэлектролитах
Коррозия в неэлектролитах — это коррозия в жидкостях, не про-
проводящих электрический ток. К неэлектролитам относятся, например,
бром, расплавленная сера, многие органические вещества (бензол,
хлороформ, фенол и т.д.), жидкое топливо (нефть, керосин, бензин),
смазочные масла.
Коррозия металлов и сплавов в безводных растворах неэлектро-
неэлектролитов протекает с меньшей скоростью, чем в растворах электроли-
электролитов, и преимущественно по химическому механизму. Однако все же
приводит к значительным разрушениям металлической аппаратуры.
Расплавленная сера химически активна и реагирует почти со все-
всеми металлами. В ее присутствии сильно корродирует медь, олово,
свинец, в меньшей степени — углеродистая сталь и титан, и незна-
незначительно — алюминий.
Влажный хлор вызывает сильную коррозию аппаратуры. В его
среде стоек только титан и неметаллические материалы. При сни-
снижении концентрации влаги до 0,04 % возможно применение сталь-
стальной аппаратуры. Для увеличения коррозионной стойкости стальных
поверхностей при возможных проскоках недостаточно осушенно-
осушенного хлора рекомендуется покрывать стальные детали защитным сло-
слоем никеля. Так, при толщине никелевого слоя ЗОмкм такие детали
сохраняют коррозионную стойкость при 20° С в хлоре, влажность
которого составляет 0,3 %.
Жидкий бром взаимодействует при комнатной температуре со
многими металлами. К ним относятся медь, серебро, алюминий,
олово, титан, хром, железо, углеродистые стали и т.д. Для хранения
жидкого брома предложены стальные емкости, гомогенно освинцо-
освинцованные внутри. Применяют также покрытия из чистого никеля.
2.4. Коррозия металлов в неэлектролитах 33
Большинство органических жидкостей, не содержащих воды и
других примесей, инертны по отношению к стали. Но присутствие
влаги, даже в незначительных количествах, создает агрессивную сре-
среду, химическая коррозия переходит в электрохимическую, и процесс
окисления металла ускоряется. Так, сталь в тетрахлориде углерода
является коррозионностойкой. При попадании следов влаги проис-
происходит гидролиз ССЦ:
CCU + Н2О = СС13ОН + НС1
Образуется агрессивная электропроводная среда, которая вызы-
вызывает сильную коррозию стали.
Коррозионная активность нефти и продуктов ее переработки опре-
определяется содержанием в ней соединений серы — сероводорода, и
меркаптанов (тиоспиртов с общей формулой (R-SH)). Эти соеди-
соединения вызывают коррозию кобальта, никеля, свинца, олова, меди и
других металлов за счет образования на поверхности сульфидов и
меркаптидов металла типа RS-Me-SR.
Чем больше в жидких продуктах серы, тем сильнее коррозия. Так,
в мазуте, содержащем 3,7 % серы, скорость коррозии стали @,12 % С)
в 6 раз больше, чем в мазуте, содержащем 0,5 % серы.
Сталь может корродировать при соприкосновении с бензинами,
так как углеводороды бензинов окисляются под действием кислоро-
кислорода воздуха, образуя органические кислоты.
Металлические изделия, работающие в растворах неэлектроли-
неэлектролитов, готовят из материалов, устойчивых в данной среде. Высокохро-
Высокохромистые стали используют при изготовлении аппаратуры для перера-
переработки нефти. Широко применяют нанесение на поверхность стали
защитных покрытий.
Вопросы для самопроверки
1. Укажите условия, при которых протекает газовая коррозия.
2. Что называется жаростойкостью и жаропрочностью металла?
3. Приведите определение химического механизма коррозии. При
каких условиях он реализуется в газовой фазе?
4. Какие типы кристаллических решеток вам известны?
5. Какие вы знаете дефекты кристаллических решеток?
6. Какие изменения структуры металла происходят при его за-
затвердевании?
7. Приведите основное уравнение термодинамики.
8. Проанализируйте влияние парциального давления кислорода
(Ро2) на возможность протекания реакции окисления метала.
ГЛАВА 3
ФИЗИКО-ХИМИЧЕСКИЕ
ЗАКОНОМЕРНОСТИ ГАЗОВОЙ КОРРОЗИИ
МЕТАЛЛОВ
3.1. Термодинамическая вероятность образования
продуктов окисления на поверхности металла
В природных условиях большинство металлов находятся в свя-
связанном состоянии в виде оксидов или солей. Следовательно, для
них это состояние является термодинамически наиболее устойчи-
устойчивым. Для того, чтобы из природных соединений получить металлы
или сплавы, которые используются как конструкционные матери-
материалы, нужно затратить энергию. Таким образом, в промышленных
условиях большинство металлов и сплавов находятся в термодина-
термодинамически неустойчивом состоянии.
Стремление металлов перейти из металлического в ионное со-
состояние характеризуется величиной уменьшения свободной энер-
энергии (AG0) и составляет сущность процессов химической коррозии.
Ниже (табл. 3.1) приводятся данные по изменению энергии Гибб-
са для реакций перехода металла в ионное состояние при взаимодей-
взаимодействии их с кислородом.
В начале таблицы расположены наименее коррозионноустойчи-
Таблица 3.1
Изменение свободной энергии для реакций окисления металлов в
атмосферных условиях B5 °С; 0,1 МПа)
Реакция
К^К+
Са ^Са2+
Na ^Na+
Mg ^Mg2+
Al ^Al3+
Mn ^Mn2+
Zn ^Zn2+
Cr ^Cr3+
Fe ^Fe2+
Cd ^Cd2+
Co ^Co2+
Изменение свобод-
свободной энергии при
образовании оксида,
кДж/г-экв.
-360,9
-356,3
-340,3
-307,3
-239,5
-192,2
-153,6
-150,3
-127,3
-117,2
-105,5
Реакция
Ni ^Ni2+
Sn ^Sn2+
Pb ^±Pb2+
Cu ^Cu2+
Hg^l/2Hg2+
Ag ^Ag+
Pd ^±Pd2+
Ir^Ir3+
Pt ^±Pt2+
Аи ^Au3+
Изменение свобод-
свободной энергии при
образовании оксида,
кДж/г-экв.
-102,6
-91,8
-90,9
-46,14
-9,42
-8,51
+16,54
+17,84
+36,0
+65,73
3.1. Термодинамическая вероятность образования продуктов окисления 35
500
700
900 1100
Температура, К
1300 1500
1700
Рис. 3.1. Влияние температуры на AG0 образования некоторых оксидов
металла:
1 — Au2O3; 2 — Ag2O; 3 — PtO; 4 — СиО; 5 — РЬО; 6 — МО; 7 — FeO; 8 —
Fe2O3; 9 — Cr2O3; 10 — ТЮ2; 11 — А12О3; 12 — MgO
вые металлы (К, Са, Na, Mg).Peaкция ионизации этих металлов со-
сопровождается убылью свободной энергии и вероятность перехода
их в окисленное состояние тем больше, чем значительнее уменьше-
уменьшение AG0. Эти металлы в природе встречаются в виде руд и солей.
В конце таблицы находятся наиболее коррозионноустойчивые ме-
металлы (Pd, Ir, Pt, Аи). Положительное значение изменения свободной
энергии системы указывает на невозможность самопроизвольного
протекания реакций ионизации. В природных условиях золото, пла-
платина, иридий и палладий являются термодинамически устойчивыми.
Они, как правило, встречаются в самородном состоянии.
Таблица 3.1 дает общую приближенную характеристику. В за-
зависимости от условий эксплуатации устойчивость металла может
в значительной степени меняться. Например, в растворах азотной
кислоты алюминий и хром устойчивее меди. А в растворах щело-
щелочей магний более стоек, чем алюминий или цинк, что объясняется
образованием поверхностных защитных пленок.
На равновесие реакций ионизации оказывает влияние температу-
температура и давление. Для заключения о возможности осуществления корро-
коррозионного процесса при изменении внешних параметров необходимо
определить знак изменения изобарного потенциала.
При изучении влияния давления исходят из примерных границ
36 Физико-химические закономерности газовой коррозии металлов Гл. 3
технически возможного применения парциального давления кисло-
кислорода Р02 от 10~5 до 109 Па.
Как показывают справочные данные (рис. 3.1) для значительного
количества металлов с повышением температуры термодинамиче-
термодинамическая вероятность процесса окисления металла снижается. Это же
относится и к образованию солей.
3.2. Основные стадии газовой коррозии металлов
Образование продуктов коррозии осуществляется в результате
протекания ряда последовательных и параллельных реакций. На
рис. 3.2 представлена схема образования сплошной оксидной пленки
при окислении металла кислородом из газовой фазы.
Процесс окисления металла протекает в несколько стадий:
1. ионизация металла и переход его в форме ионов и электронов
в слой оксида;
2. перемещение ионов металла Меп+ и электронов в слое оксида;
3. перенос кислорода из газового потока к поверхности оксида;
4. адсорбция кислорода на поверхности;
5. превращение адсорбированного кислорода в ион О2~;
6. перемещение ионов кислорода О2~ в слое оксида;
7. реакция образования оксида.
В некоторых случаях отдельные стадии процесса могут выпадать
или трансформироваться. Но в общем все стадии процесса взаимо-
взаимосвязаны и протекают последовательно. Суммарная скорость процес-
процесса определяется скоростью самой медленной реакции. Например,
если медленно протекает стадия
C), то процесс лимитируется внеш-
внешней диффузией, если A), B) или
F) — имеет место внутридиффу-
Ме о
пе
-О
2- ' зионный контроль процесса.
Q «4 О
адс 2 Отличительной особенностью
газовой коррозии металла являет-
Рис. 3.2. Схема процесса образова- ся в отдельных случаях затухание
ния оксидной пленки на металле процесса во времени. Это происхо-
происходит тогда, когда на поверхности ме-
металла образуется защитная пленка. Если эта пленка является сплош-
сплошной и имеет хорошую адгезию с поверхностью, то она изолирует
металл от контакта с агрессивной средой и коррозия прекращается.
Первым этапом этого процесса должна быть адсорбция окислите-
окислителя на поверхности, закономерности которой будут разобраны ниже.
3.3. Адсорбция газов на поверхности металлов 37
3.3. Адсорбция газов на поверхности металлов
Адсорбцией называют изменение концентрации вещества на гра-
границе раздела фаз. Адсорбционное равновесие, т.е. равновесное рас-
распределение вещества между пограничным слоем и граничащими
фазами, является динамическим и быстро устанавливается.
Частицы, которые находятся на поверхности твердого тела, обла-
обладают избыточной энергией.
За счет этого молекулы окружающей среды притягиваются к ме-
металлу и концентрируются на его поверхности. Этот процесс протека-
протекает всегда самопроизвольно и с положительным тепловым эффектом.
Различают два вида адсорбции: физическую и химическую.
Физическая адсорбция обусловлена вандер-ваальсовскими сила-
силами. Энергия связи между молекулами адсорбата и поверхностью ме-
металла невелика (порядка 40-50 кДж/моль). Равновесие устанавлива-
устанавливается быстро. Адсорбированные вещества могут быть легко удалены
с поверхности. Физическая адсорбция наиболее отчетливо проявля-
проявляется при низких температурах, близких к температуре конденсации
адсорбата.
Хемосорбцией называется процесс адсорбции, сопровождающий-
сопровождающийся химической реакцией между молекулами адсорбированного ве-
вещества и металлом. Энергия связи между атомами оценивается ве-
величинами 150-160 кДж/моль. Связь, возникающая между металлом
и окислителем, имеет ионный характер. Металл отдает атому адсор-
адсорбированного вещества электроны. Процесс хемосорбции протекает
очень быстро (доли секунды). Внешняя поверхность адсорбирован-
адсорбированной пленки при этом заряжается отрицательно, а внутренняя — по-
положительно.
Количество адсорбированного вещества, отнесенное к единице
поверхности, зависит от температуры среды и концентрации адсор-
адсорбата в газовой или жидкой фазе.
Функциональная зависимость между равновесным количеством
адсорбата на поверхности твердого тела и концентрацией или дав-
давлением Р (если адсорбат является газом) при Т = const называется
изотермой адсорбции.
Впервые теоретическое обоснование изотермы адсорбции было
дано Ленгмюром. Им было сделано несколько допущений, упроща-
упрощающих модель процесса.
Предполагалось, что:
• поверхность адсорбента энергетически однородна;
• частицы адсорбата на поверхности никак не взаимодействуют
друг с другом;
38 Физико-химические закономерности газовой коррозии металлов Гл. 3
• на один активный центр поверхности приходится одна частица
адсорбированного вещества;
• может образовываться только мономолекулярный адсорбцион-
адсорбционный слой.
Скорость процесса адсорбции г>ад будет прямо пропорциональ-
пропорциональна давлению газа Р и величине свободной поверхности металла
A-0):
Ут = КадРA-в), C.1)
где Кад — константа, характеризующая скорость процесса адсорб-
адсорбции.
Скорость обратного процесса — десорбции — будет прямо про-
пропорциональна поверхности, занятой реагирующими молекулами:
^дес = ^дес©, C.2)
где Кдес — константа, характеризующая процесс десорбции, а в —
доля поверхности металла, занятая части-
частицами адсорбата.
При установлении равновесия ско-
рость адсорбции равна скорости десорб-
десорбции:
^ад = ^дес- C.3)
-?** Приравнивая правые части уравнений
т» ^ т* C.1) и C.2), получаем:
Рис. 3.3. Изотерма \ / \ /•> j
Ленгш°Ра КадР A - в) = Кдесв. C.4)
Решая уравнение C.4) относительно в, получим:
в = КадР C 5)
Адес + ^ад^
Разделив числитель и знаменатель на Кдес и обозначив Кад/Кд&с =
= 6, получим:
0 А
1
где b — адсорбционный коэффициент.
Уравнение C.6) носит название изотермы. Ее графическое выра-
выражение дано на рис. 3.3.
При в = 1 получается горизонтальный участок, отвечающий
образованию заполненного монослоя.
При слабой адсорбции (в мала) или при низком давлении газа
(мало Р) можно принять, что 1 + ЪР = 1 и тогда из C.6) получим:
в = ЬР. C.7)
3.3. Адсорбция газов на поверхности металлов 39
При этих условиях степень заполнения поверхности мала и про-
пропорциональна давлению.
Выражение C.7) отражает закон распределения и носит название
изотермы Генри.
При высоком давлении справедливо допущение 1 + ЪР = ЪР и
мы получаем из уравнения C.6):
6 = 1.
Это означает, что все активные центры на поверхности металла
полностью заполнены адсорбированным веществом и дальнейшее
увеличение его парциального давления в газовой фазе не влияет на
количество вещества, адсорбированного на поверхности твердого
тела. Этому состоянию отвечает правый участок на кривой изотер-
изотермы, т.е. прямая линия (рис. 3.3).
Если на поверхности металла адсорбируется смесь газов, то сте-
степень заполнения поверхности г-м газом рассчитывается по уравне-
уравнению
е = ^ , C.8)
где сумма берется по всем «п» компонентам газовой смеси.
В большинстве случаев поверхность твердого металла энергети-
энергетически неоднородна. Она представляет собой серию элементарных
площадок, обладающих различной теплотой адсорбции.
Экспериментальные данные более точно описываются уравнением:
lna0P, C.9)
где / — коэффициент, отражающий функцию распределения, а uq —
адсорбционный коэффициент при наибольшей теплоте адсорбции.
Выражение C.9) получило название логарифмической изотермы
адсорбции. Экспериментально она впервые была описана в работах
А.Н. Фрумкина и А.И. Шлыгина. Теоретический вывод уравнения
этой изотермы сделан М.И. Темкиным.
Адсорбция может быть мономолекулярной и полимолекулярной.
В последнем случае на поверхности адсорбента образуется несколь-
несколько слоев. Первый мономолекулярный слой обусловлен силами взаи-
взаимодействия между поверхностью твердого тела и адсорбатом. Вто-
Второй и последующие слои удерживаются ван-дер-ваальсовскими
силами. Слои адсорбата распределяются по поверхности неравно-
неравномерно. На некоторых участках их может быть два или три слоя. Одно-
40 Физико-химические закономерности газовой коррозии металлов Гл. 3
временно могут остаться участки, закрытые монослоем или совсем
свободные от адсорбата (рис. 3.5).
ПОП
Рис. 3.4. Изотерма адсорбции Рис. 3.5. Схема заполнения по-
поверхности адсорбента при много-
многослойной адсорбции
На рис. 3.4 представлена изотерма адсорбции кислорода. Участ-
Участки ab и be отвечают мономолекулярной адсорбции, участок cd —
полимолекулярной. На рис. 3.5 представлена схема заполнения по-
поверхности металла адсорбированным веществом по теории Брунау-
эра.
3.4. Адсорбция кислорода на поверхности металла
и образование оксида
Молекулы О2 адсорбируются на поверхности металла обратимо.
Количество адсорбата на единицу поверхности возрастает с увели-
увеличением соотношения Pq2/Ps, где Pq>2 — давление кислорода над
адсорбатом, a Ps — давление насыщенного пара кислорода при изу-
изучаемой температуре. Как видно из рис. 3.6 вид экспериментальной
зависимости сходен с изотермой на рис. 3.4.
Первоначально происходит мономолекулярная адсорбция, а на-
начиная с некоторого значения Pq2/Ps, имеет место многослойная фи-
физическая адсорбция.
Скорость адсорбции, как правило, возрастает во времени и про-
происходит тем быстрее, чем выше температура. На рис. 3.7 приведены
кинетические кривые адсорбции кислорода на серебре.
Существует мнение, что первоначально образуется адсорбцион-
адсорбционный слой, который позже превращается в слой оксида.
Первые порции кислорода поглощаются с выделением значитель-
значительного количества теплоты и, следовательно, с понижением изобарного
потенциала, т.е. самопроизвольно. Тепловой эффект адсорбции кис-
кислорода имеет тот же порядок, что и теплота образования оксида. По-
Поэтому адсорбцию кислорода можно рассматривать как химическое
3.4. Адсорбция кислорода на поверхности металла и образование оксида 41
§ 140
| 120
I 100
80
60
I 40
I 20
g
10
|4
I 3
!
2
10 15
т, мин.
20
Рис. 3.6. Изотерма адсорбции кис-
кислорода на алюминии при 77 К (по
данным Скорчеллетти)
Рис. 3.7. Кинетика адсорбции кисло-
кислорода на серебре при различных темпе-
температурах (Ло2 = 200 мм рт. ст.)
взаимодействие О2 с поверхностью металла. Последующие порции
кислорода поглощаются с меньшим тепловым эффектом.
Химическая связь между адсорбированным кислородом и метал-
металлом имеет ионный характер. Электроны металла притягиваются к
атомам кислорода. Последние превращаются в отрицательные ча-
частицы О<2~. Пока на поверхности имеется только монослой кислоро-
кислорода, образование оксида как новой фазы не происходит. Оксид будет
сформирован в том случае, когда взаимное расположение катионов
металла и анионов О2~ будет отвечать структуре кристаллической
решетки оксида. Существует мнение, что переход от хемосорбиро-
ванного слоя кислорода к оксиду происходит легче, если существу-
существует кристаллохимическое соответствие между решетками металла и
оксида и расстояние между ионами металла в оксиде и в решетке
металла близки.
Адсорбированные ионы О2~ могут проникать под поверхность
металла и формировать оксид в глубине. Схемы строения хемосор-
бированного слоя и оксида металла представлены на рис. 3.8.
Образование хемосорбированного слоя кислорода происходит бы-
быстро. Стадия проникновения ионов кислорода вглубь и формиро-
формирование оксида протекает обычно в 104-105 раз более медленно.
Тонкий слой оксида (в несколько десятков ангстрем) имеет мел-
мелкокристаллическую структуру. При повышении температуры на нем
возникают отдельные более крупные зародыши. С течением времени
зародыши захватывают всю поверхность металла и первичная мел-
мелкокристаллическая пленка оксида нацело перекристаллизовывается
в более крупные кристаллы.
42 Физико-химические закономерности газовой коррозии металлов
Гл.З
АААА
\
Me Me Me Me
Me
\
Me Me Me Me' Me
Me Me Me Me
\/ \ / \ / \ / \ /
Me Me Me Me Me
' V \/ \/ \/ \
a
Me Me Me Me Me'
/ \/ \/\ /\ /\
б
Рис. 3.8. Схема строения слоя хемосорбированного кислорода на метал-
металле (а) и строения оксида (#).
Me — металл; О — кислород
В атмосферных и промышленных условиях большинство метал-
металлов покрыто пленкой продуктов коррозии. Жаростойкость металлов
во многом определяется свойствами пленок.
3.5. Пленки на поверхности металлов
Поверхностная пленка, которая образуется на металле, опреде-
определяет его коррозионную устойчивость в агрессивной среде. Пленки
классифицируют в зависимости от их толщины. Различают:
• тонкие (невидимые) пленки толщиной от мономолекулярного
слоя до 40 нм;
• средние пленки (видимые благодаря интерференционному ок-
окрашиванию как цвета побежалости), имеющие толщину 40-
500 нм;
• толстые (видимые) пленки толщиной более 500 нм.
Толщина образуемых пленок во многом определяется условиями
окисления. В табл. 3.2 приведены данные значений толщины пленок
и оксидных слоев на железе в зависимости от условий их образования.
Таблица 3.2
Толщина пленок на железе
Металл
Железо
@,04% С)
Железо
Условия получения
Выдержка несколько дней в сухом
воздухе при комнатной температуре
Нагревание на воздухе при 400 °С
Время нагрева, мин
1
1,5
2,0
2,5
3,0
Цвет пленки
желтый
оранжевый
красный
фиолетовый
синий
Нагревание на воздухе в течение
7 суток при 900° С
Толщина
пленки, нм
1,5-2,0
46
52
58
68
72
и 600 мк
Класси-
Классификация
Тонкие
пленки
Пленки
средней
толщины
Толстые
пленки
3.5.
Пленки на поверхности металлов
43
Продукты коррозии, которые образуются на поверхности метал-
металла, могут тормозить дальнейший процесс коррозии.
Одним из основных условий, характеризующих эту способность,
является сплошность получаемой пленки.
Критерий сплошности впервые был сформулирован Пиллингом
и Бедворсом. Условие сплошности выполняется тогда, когда молеку-
молекулярный объем химического поверхностного соединения (например,
оксида) больше объема металла, израсходованного на образование
молекулы оксида. Соотношение объемов образованного оксида и ис-
исходного металла может быть легко подсчитано.
Предположим, что окисляется 1 грамм-атом металла. Его объ-
объем можно определить по формуле:
рМе
C.10)
где Ам& — атомная масса металла; рм& — плотность металла.
Объем полученного оксида будет равен:
VOK = ^- C.11)
П • рок
где Мок — молекулярная масса оксида; п — число атомов металла
в молекуле оксида; рок — плотность оксида.
Соотношение между объемом оксида и объемом металла:
Уок
Уме
П • Аме • рок
C.12)
Очевидно, что при Уок/Уме > 1 образуется сплошная пленка, при
/Уме < 1 пленка не получается сплошной.
Таблица 3.3
Соотношение объемов оксида и исходного металла
Металл
К
Na
Li
Са
Sr
Mg
Ва
Cd
Оксид
К2О
Na2O
Li2O
CaO
SrO
MgO
BaO
CdO
Vqk/Vmc
0,45
0,55
0,59
0,63
0,66
0,79
0,73
1,21
Металл
Al
Zn
Ag
Ni
Cu
Cr
Fe
W
Оксид
А12Оз
ZnO
Ag2O
MO
CuO
Cr2O3
Fe2O3
WO3
Уок/Умъ
1,28
1,55
1,58
1,65
1,74
2,07
2,14
3,35
Значения указанного соотношения для некоторых оксидов ме-
металлов приведены в табл. 3.3. На основании данных таблицы можно
определить металлы, оксиды которых не образуют сплошной пленки.
44 Физико-химические закономерности газовой коррозии металлов Гл. 3
Пример. Металлы К, Na, Li, Ca, Sr, Mg, Ba — представители
щелочных и щелочноземельных металлов, — имеют отношение
Уок/Уме < 1- По условию сплошности Пиллинга и Бедворса они
образуют рыхлые пористые пленки.
Сплошность пленки является необходимым, но недостаточным
условием для проявления защитных свойств. Реально, когда V0K x
х V^ ^> 1, может происходить такое возрастание внутренних на-
напряжений, которое приводит к вспучиванию и отслаиванию пленки,
что снижает ее защитные свойства.
Ориентировочно можно считать, что достаточно хорошими за-
защитными свойствами обладают пленки на металлах, удовлетворяю-
удовлетворяющие условию:
2,5 > VOJVMQ > 1.
Дополнительными условиями, обеспечивающими защитные свой-
свойства пленки, являются их хорошая адгезия к металлу и физико-
химические свойства. Так, например, при окислении меди при 500 ° С
образуется пленка, которая легко отслаивается от металла. Поэтому
медь не используется как жаростойкий материал.
Поверхностная пленка должна быть прочной, эластичной и иметь
близкий с основным металлом коэффициент термического расшире-
расширения.
3.6. Кинетика газовой коррозии металлов
Скорость коррозии определяют количественно, изучая во вре-
времени изменение какого-либо показателя коррозионного процесса.
Наиболее часто при изучении коррозии используют следующие по-
показатели:
• изменение толщины образующейся пленки продуктов коррозии
(глубинный показатель Ки, мм/год);
• изменение массы образца металла (массовый показатель К^9
г/(м2-ч);
• объем поглощенного или выделившегося в процессе коррозии
металла газа (объемный показатель Ку, см3/(см2-ч).
В процессе изучения кинетики устанавливают функциональную
зависимость между выбранным показателем процесса и временем:
ПОКАЗАТЕЛЬ = / (т).
Полученное уравнение называют кинетическим. Скорость газо-
3.6.
Кинетика газовой коррозии металлов
45
вой коррозии наиболее часто выражают через скорость роста оксид-
оксидной пленки:
v = dh/dr,
где v — скорость процесса; h — толщина оксидной пленки; г —
время процесса.
Существует несколько вариантов зависимости скорости роста
пленки во времени.
3.6.1. Линейный закон роста пленки
Рассмотрим случай, когда пленки не образуют сплошного и плот-
плотного слоя (Vq^/Vmq < 1), не являются защитными, и окисляющий
газ может свободно проникать через них к поверхности металла и
вступать с ним в химическую реакцию. Схе-
Схематически такой процесс представлен на
рис. 3.9.
Скорость реакции в этом случае не зави-
зависит от толщины пленки и может быть выра-
выражена уравнением:
Me О
dh
—
C.13)
где h — толщина пленки на металле; т —
время коррозии металла; кс—константа ско-
скорости химической реакции; Со — концен-
концентрация окислителя на поверхности металла.
После разделения переменных и инте-
интегрирования получим: Рис. 3.9. Схема процес-
процесса образования пори-
h = К\Т + А^ C.14) стой оксидной пленки на
металле
где К\ = кС'Со — величина, постоянная для
данной концентрации окислителя; А^ — постоянная интегрирова-
интегрирования, численно равная толщине пленки перед опытом.
В большинстве опытов значение постоянной А^ близко к нулю,
и тогда уравнение C.14) принимает вид:
h = Кгт.
C.15)
Таким образом, рост пористой (незащитной) пленки контролиру-
контролируется скоростью химической реакции окисления (кинетический кон-
контроль) и протекает во времени по линейному закону.
Линейный закон наблюдается при высокотемпературном окисле-
окислении на воздухе щелочных и щелочноземельных металлов, а также
46 Физико-химические закономерности газовой коррозии металлов
Гл.З
металлов, оксиды которых возгоняются при высоких температурах
(например вольфрам, молибден). В качестве примера на рис. 3.10
приведены экспериментальные кривые окисления магния.
3.6.2. Параболический закон роста пленок
Параболический закон окисления металлов впервые был уста-
установлен Г. Тамманом для случая взаимодействия серебра с парами
йода.
Если на поверхности металла образуется сплошная защитная плен-
пленка A4K/14ie > 1), то процесс коррозии во времени будет замедляться.
На скорость коррозии будет влиять диффузия компонента через слой
пленки и в этом случае следует воспользоваться уравнением Фика:
dh
dC
C.16)
где Кд — коэффициент диффузии.
Если принять, что в процессе окисления устанавливается стаци-
стационарный режим диффузии, т.е. не происходит накопления диффун-
300
- 250
10 20 30 40
Время, ч
60
1100°
0 100 1000
Время, мин.
Рис. 3.10. Окисление магния в кислоро- Рис. 3.11. Параболические кри-
де при различных температурах вые окисления железа на воздухе
при повышенных температурах
дирующего вещества в каком-либо сечении пленки, то производную
dC
—— можно заменить соотношением:
dh
dC
~dh
Со — С\
C.17)
где Cq — концентрация кислорода на внешней поверхности пленки
3.6. Кинетика газовой коррозии металлов 47
на границе с воздухом; С\ — концентрация кислорода на внутренней
поверхности пленки на границе с металлом.
Тогда скорость коррозии на единицу площади сечения будет равна:
dh -гг Со - С\ (~ , Qs
т?-к*——• (ЗЛ8)
Если внутренняя диффузия лимитирует скорость всего процесса,
то весь кислород, достигший металла, успевает вступить в реакцию
и С\ -> 0. Тогда: dh c
fT = K*T- <ЗЛ9>
После интегрирования получим
h2 = К2т. C.20)
В этом уравнении
К2 = 2КдС0. C.21)
Уравнение C.20) характеризует параболический закон роста пле-
пленок.
В качестве примера на рис. 3.11 приведены экспериментальные
зависимости скорости окисления железа при различных температу-
температурах.
Параболический закон роста оксидной пленки за исключением
начальных участков, наблюдается при окислении вольфрама, меди,
железа, никеля, а также при образовании галогенидных пленок на
серебре.
3.6.3. Сложные законы роста пленок
Диффузионно-кинетический контроль кинетики процесса имеет
место в том случае, когда скорости диффузии и химической реакции
окисления соизмеримы.
Уравнение, описывающее такой процесс, носит название уравне-
уравнения Эванса и имеет вид:
& + т = с°т- C-22)
С введением принятых обозначений К\ = ксСо и К2 =
имеем:
Kxh2 + K2h = КхК2т. C.23)
Уравнение отражает сложно-параболический закон роста пленок.
Если пленка очень тонкая, что отвечает начальной стадии окисле-
окисления, то первый член уравнения значительно меньше второго. Поэто-
48 Физико-химические закономерности газовой коррозии металлов Гл. 3
му можно пренебречь первым членом уравнения, и тогда получаем
линейный закон роста пленки.
Если же толщина пленки велика, то, пренебрегая вторым чле-
членом уравнения, получаем уравнение параболического закона роста
пленки.
Иногда рост пленки по толщине происходит медленнее, чем это
должно следовать из диффузионного механизма процесса окисления.
Затухание процесса коррозии в таких случаях объясняют уплотнени-
уплотнением пленки или появлением дефектов, которые тормозят диффузию.
Для ряда металлов установлена логарифмическая зависимость
скорости окисления от времени, которая описывается уравнением:
h = \n(kr), C.24)
где к — константа.
Логарифмический закон роста пленки установлен эксперимен-
экспериментально для окисления на воздухе алюминия и цинка в интервале
25-225 °С, никеля до 650 °С, железа до 375 °С, меди до 100 °С.
Проанализируем приведенные зависимости. Щелочные и щелоч-
щелочноземельные металлы, которые имеют отношения объема оксида к
объему металла Vok/Vmq меньше единицы, окисляются по линейно-
линейному закону. По уменьшению скорости окисления эти металлы распо-
располагают в ряд:
К > Na > Ва > Са > Mg.
Линейный ход кинетической зависимости характерен и для ме-
металлов, оксиды которых летучи при высоких температурах. К этой
группе относятся металлы Mo, Os, Ru, Ir, V, W.
Для ряда технически важных металлов наблюдается параболиче-
параболическая зависимость скорости окисления во времени. Приближенно по
возрастанию устойчивости к газовой коррозии в атмосфере воздуха
можно расположить в ряд следующие металлы: W < Fe < Со <
< Си < Ni. К этой же группе относятся и Mn, Be, Zn, Ti.
В группу металлов, дающих пленки с наиболее высокими защит-
защитными свойствами и окисляющихся по логарифмическому закону,
входят Si, Al, Cr. Они расположены в ряд по возрастанию устойчи-
устойчивости.
Нужно отметить, что окисление некоторых металлов (Fe, Ni, Cu,
Al, Zn, Ti, Та) с изменением внешних условий происходит по разным
законам.
Можно определить общую тенденцию к снижению самотормо-
самоторможения окисления металлов с ростом температуры.
3.7. Оксидные пленки на поверхности железа 49
3.7. Оксидные пленки на поверхности железа
При высоких температурах на железе возможно образование сле-
следующих соединений: закись железа FeO, закись-окись железа РезС>4
и оксид железа a-Fe2O3. Все эти соединения обнаружены в ока-
окалине. Непосредственно к металлу примыкает закись железа FeO,
далее следуют РезС>4 и Fe2C>3. Соотношение толщин оксидов FeO:
Fe3O4:Fe2O3 близко к 100:10:1.
Закись железа FeO носит название вюстит и имеет кубическую
решетку. Кристаллографическая ячейка содержит четыре иона Fe2+
и четыре иона О2~. Оксид устойчив при температурах выше 570-
575 °С. В окалине вюстит находится в метастабильном переохла-
переохлажденном состоянии. В этом оксиде содержится кислород в количе-
количествах, превышающих стехиометрические. Растворяющийся в оксиде
кислород ионизируется, отбирая электроны у части двухвалентных
ионов железа Fe2+, которые переходят в трехвалентные ионы Fe3+.
Как показали рентгенографические исследования, при таком про-
процессе образуется большое количество вакансий в кристаллической
решетке. Это создает благоприятные условия для диффузии Fe2+ и
перемещения электронов посредством перехода Fe2+ ^ Fe3+ + e.
Как будет показано далее, вюстит не обладает защитными свой-
свойствами.
Закись-окись железа РезО4 носит название магнетит и имеет кри-
кристаллографическую решетку типа шпинели. В решетке на каждый
ион Fe2+ приходится два иона Fe3+ в правильном кристаллографиче-
кристаллографическом чередовании. РезО4 обладает электронной проводимостью. Это
объясняется тем, что строгое чередование ионов Fe3+-Fe2+-Fe3+ в
структуре оксида обеспечивает легкость перехода электрона от одно-
одного катионного узла к другому. Магнетит устойчив во всем интервале
температур от комнатной до точки плавления железа A538 °С). За-
Защитные свойства выше, чем у вюстита.
При нагревании в окислительной среде до 220 °С магнетит пере-
переходит в 7~Fe2O3. В этом случае изменяется состав оксида с РезО4 на
Fe2O3 без изменения кристаллографической структуры. При нагре-
нагревании до 400-500 °С образуется a-Fe2O3.
Оксид железа (III) — Fe2O3 — носит название гематит и имеет
структуру ромбоэдрической решетки. Гематит существует в широ-
широком интервале температур, но выше 1100 ° С частично диссоциирует.
50 Физико-химические закономерности газовой коррозии металлов
Гл.З
И
к
1
3.8. Механизм химической коррозии
В процессе образования защитных пленок участвуют частицы
Меп+, О2~ и электроны. Электрически заряженные частицы и элек-
электроны перемещаются в кристаллической решетке продуктов корро-
коррозии. Зона роста пленки связана со скоростью движения частиц. Если
превалирует скорость диффузии ионов или атомов металла, то обра-
образование оксида происходит на внешней поверхности пленки. Наобо-
Наоборот, если сквозь пленку диффундирует главным образом кислород,
то зоной роста пленки будет граница между пленкой и металлом. В
Зона роста большинстве случаев скорости диффузии
частиц соизмеримы, и тогда зона роста
находится внутри пленки. Схематично
это положение изображено на рис. 3.12.
Принято считать, что для большин-
большинства случаев основным направлением
диффузии является движение атомов или
ионов металла через пленку наружу, и, в
меньшей степени, диффузия кислорода в
обратном направлении.
Оксидные и солевые пленки на ме-
металлах имеют ионную кристаллическую
структуру. Они обладают, как правило,
ионной, а в некоторых случаях, и элек-
электронной проводимостью.
Металлы (электронные проводники)
имеют величину удельной проводимости
при обычной температуре от 106 до 104 Ом-см. Проводимость
определяется движением свободных электронов.
Полупроводники имеют величину удельной проводимости при
обычной температуре от 105 до 10~10 Ом~1-см~1. Движение элек-
электронов может быть обусловлено тепловой флуктуацией (п-проводи-
мость) или перемещением связанных ковалентных электронов по
вакантным местам (дыркам) валентной зоны (р-проводимость).
Носителями зарядов являются также положительно или отрица-
отрицательно заряженные ионы. Ионная проводимость обозначается как
^к + Па — 1? где пк и па — числа переноса катионов и анионов.
Ионные кристаллы обладают различными типами проводимости:
ионной (пк + па = 1), электронной (пэ = 1) и смешанной (пк + па +
+ пэ = 1). Здесь пэ — число переноса электронов.
Следует различать два типа направленного перемещения частиц
в пленке:
к:
и
и* ,
к-
И '
и •
Металл Оксидная пленка
Рис. 3.12. Схема процес-
процесса окисления металла по
Вагнеру
3.8.
Механизм химической коррозии
51
• движение ионов в сторону их меньшей концентрации, т.е. про-
процесс диффузии;
• перемещение ионов под влиянием электрического поля, или
миграцию.
В таблице 3.4 приведены атомные и ионные радиусы некото-
некоторых элементов. Как показывают данные таблицы, ион металла име-
Таблица 3.4
Атомные и ионные радиусы (по Паулингу)
Название элемента
Водород
Алюминий
Магний
Калий
Кальций
Титан
Хром
Железо
Кобальт
Никель
Медь
Цинк
Молибден
Серебро
Свинец
Кислород
Сера
Хлор
Символ атома
Н
А1
Mg
К
Са
Ti
Сг
Fe
Со
Ni
Си
Zn
Mo
Ag
Pb
О
s
Cl
Атомный
радиус, А
-
1,43
1,62
2,23
1,97
1,49
1,25
1,26
1,25
1,25
1,28
1,31
1,39
1,44
1,74
0,6
1,04
1,07
Ион
H+
Al3+
Mg2+
к+
Са2+
т1з+
Сг3+
Сг6+
Fe2+
Fe3+
Со2+
Ni2+
Cu+
Zn2+
Mo6+
Ag+
Pb2+
o2-
s2-
cr
Ионный
радиус, А
1,27
0,50
0,65
1,33
0,99
0,69
0,65
0,52
0,75
0,67
0,82
0,78
0,96
0,74
0,62
1,26
1,21
1,40
1,84
1,81
ет меньший радиус, чем соответствующий атом металла. Следова-
Следовательно, от металла сквозь пленку будут двигаться, в основном, ионы
металла и электроны (см. рис. 3.12). Диффузия ионов кислорода про-
происходит навстречу ионам металла. Ионизация кислорода при этом
осуществляется на внешней поверхности пленки.
Радиус ионов металлов меньше, чем радиус иона кислорода. По-
Поэтому металлические ионы имеют большую подвижность при диф-
диффузии и зона роста пленки сдвинута к внешней границе.
Диффузия в твердом теле при температурах ниже температуры
52 Физико-химические закономерности газовой коррозии металлов
Гл.З
плавления кристаллов может осуществляться по одному из двух ме-
механизмов:
1) движением атомов или ионов между узлами кристаллической
решетки;
2) движением атомов или ионов через пустые узлы в решетке
или по дислокациям и границам зерен.
Первый механизм (рис. 3.13) реализуется при образовании ок-
оксидов, ионы металлов которых имеют небольшие размеры по срав-
Ме
МеО
Me
МеО
о
• о •
о • о
о • о •
Vd"i о
о • о •
• о V о
• -1 О-з
О-2 е-4
п
Рис. 3.13. Схема диффузии
при росте пленки типа ZnO.
Избыточные катионы Zn и
эквивалентные им электроны
находятся в междоузельном
пространстве и могут в нем
перемещаться: 1 — катионы
металла в узле решетки; 2 —
анион кислорода; 3 — кати-
катион металла в междоузельном
пространстве; 4 — электрон
Рис. 3.14. Схема диффузии при росте
пленки С112О:
1 — адсорбированный атом кислорода; 2 —
атом кислорода, ассимилируя от соседних
ионов металла два электрона, превращает-
превращается в ион; 3, 4, 5, 6, 7 — катион метал-
металла перемещается по пустым местам; 8, 9,
10, 11 — электрон переходит от катиона
меньшей валентности к катиону большей
валентности; а, б — двух- и трехвалентный
катион металла; в — анион кислорода; г —
электрон; д — атом кислорода
нению с параметрами решетки. По такому принципу образуются
пленки AgCl, ZnO, AI2O3.
Второй механизм более вероятен в том случае, когда возможно
образование оксидов с пустыми узлами в кристаллической решетке.
По такому механизму образуются пленки С112О, FeO (рис. 3.14). При
3.8. Механизм химической коррозии 53
этом превалирует диффузия катионов металла и электронов через
пленку наружу.
В соответствие с приведенными механизмами различают два типа
оксидов:
• оксиды с избытком ионов металла по сравнению со стехиомет-
рическим составом; эти оксиды увеличивают свою электропро-
электропроводимость при нагреве в восстановительной атмосфере;
• оксиды с избытком ионов кислорода по сравнению со стехио-
метрическим составом; эти оксиды увеличивают электропро-
электропроводимость при нагреве в окислительной атмосфере.
Ионно-электронная теория окисления металлов, которая сейчас
наиболее признана, была разработана Вагнером. Им был выдвинут
постулат о том, что в пленке происходит не только диффузия ионов за
счет градиента концентраций, но осуществляется, главным образом,
направленная миграция ионов в электрическом поле, создаваемом
разницей потенциалов на внешней и внутренней поверхностях оксида.
Предполагалось, что процесс роста пленки — результат работы
своеобразного гальванического элемента, у которого поверхность
металла на границе с пленкой является анодом, т.е. поставляет кати-
катионы и электроны, а поверхность пленки на границе с реагентом —
катодом, на котором атомы кислорода принимают электроны. Плен-
Пленка, обладая смешанной ионно-электронной проводимостью, работа-
работает одновременно как внутренняя и внешняя цепь замкнутой ячейки.
Образовавшиеся на поверхности металла положительные ионы
и электроны перемещаются в пленке раздельно.
Электроны перемещаются с большей скоростью. Диффузия ио-
ионов протекает в результате перемещения их по дефектным местам
кристаллической решетки оксида.
Адсорбированные из газовой фазы молекулы кислорода диссоци-
диссоциируют на внешней поверхности оксида. Атомы кислорода, принимая
электроны, превращаются в ионы О2~, которые начинают двигать-
двигаться навстречу ионам металла. Таким образом, внешняя поверхность
пленки, на которой кислород принимает электроны, является катод-
катодной поверхностью.
Встречная диффузия ионов металла и кислорода протекает в элек-
электрическом поле. Это означает, что уравнения кинетики и ее основные
константы могут быть выведены, исходя из электрических парамет-
параметров и закономерностей: величин ионной и электронной проводимо-
проводимости, чисел переноса ионов и электронов, закона Ома.
Соответствующие расчеты приведены в специальной литературе.
Рассчитанные по Вагнеру и экспериментально полученные значения
54 Физико-химические закономерности газовой коррозии металлов Гл. 3
констант скорости реакции при газовой коррозии некоторых метал-
металлов обнаруживают большую сходимость. Например при окислении
Си до Си2О при 1000°С Красч = 6,6-10"9, а Копыт = 6,2-Ю"9. Для
образования AgBr при взаимодействии с газообразным Вг — соот-
соответственно 2,7-101 иЗ?8-10"и.
Константа скорости окисления тем больше при прочих равных
условиях, чем больше изменение свободной энергии и чем выше
удельная электропроводимость материала пленки. Если оксид об-
обладает электроизолирующими свойствами, дальнейшее окисление
не происходит. Этим объясняется, например, стойкость алюминия к
процессам окисления.
3.9. Влияние внутренних и внешних факторов
на скорость газовой коррозии
3.9.1. Влияние состава пленки
Защитные свойства поверхностных пленок зависят от природы и
состава сплава.
При высоких температурах (выше 800°С) скорость окисления
стали уменьшается по мере повышения содержания в ней углерода.
Обезуглероживание сталей при этом также уменьшается. Это связа-
связано с интенсификацией процесса образования оксида углерода (II) —
СО. Сера, фосфор, никель и марганец, присутствующие в сплаве,
практически не влияют на высокотемпературное окисление железа,
а титан, медь, кобальт и бериллий незначительно снижают скорость
газовой коррозии. Хром, алю-
1 |^ миний и кремний сильно за-
замедляют окисление железа из-за
образования прочных защитных
оксидных пленок. Эти элементы
широко применяют для легиро-
легирования стали с целью повышения
ее жаростойкости (рис. 3.15).
д- 2 8 12 16 20 24 28 32 Хром, введенный в сталь в ко-
О Содержание элемента, % личестве до 30%, значительно
__„ повышает ее жаростойкость.
Рис. 3.15. Влияние легирующих эле- А „
ментов на относительную скорость га- Алюминии вводят в сталь в
зовой коррозии стали количестве до 10%, что еще
больше повышает ее жаростой-
жаростойкость. Аналогичным свойством обладает кремний при введении его
в сталь в количестве до 5 %. Однако стали с высоким содержанием
0,5
Л
3.9. Влияние внутренних и внешних факторов на скорость газовой коррозии 55
алюминия и кремния обладают повышенной хрупкостью и твердо-
твердостью, что затрудняет их обработку. Поэтому основой жаростойкого
легирования является система Fe-Cr с добавочным введением крем-
кремния и алюминия в количестве до 4-5 %.
Ванадий, вольфрам и молибден сильно ускоряют окисление стали
при высокой температуре. Это обусловлено летучестью и легкоплав-
легкоплавкостью образуемых ими оксидов.
При высокой температуре более жаростойкой является аустенит-
ная структура стали. С увеличением содержания феррита жаростой-
жаростойкость двухфазных сталей уменьшается, а степень окисления повы-
повышается. Это объясняется тем, что на двухфазных сталях образуются
пленки с большими внутренними напряжениями, что приводит к их
разрушению.
Деформация металла также способствует разрушению пленки и
увеличивает скорость коррозии.
3.9.2. Влияние температуры
Температура оказывает значительное влияние на процессы га-
газовой коррозии. Как было показано ранее, термодинамическая веро-
вероятность осуществления большинства реакций, которые приводят к
образованию защитных пленок, с повышением температуры падает.
В то же время рост температуры способствует увеличению скоро-
скорости реакции. Поэтому в пределах термодинамической возможности
(когда значение энергии Гиббса
AG0 меньше нуля) с увеличени-
увеличением температуры скорость корро-
коррозии возрастает (рис. 3.16).
Температура оказывает вли-
влияние на константу скорости хи-
химической реакции и на коэффи-
коэффициент массопередачи в процессе
диффузии.
Для обоих случаев имеет ме-
место экспоненциальная зависи-
зависимость:
60
50
40
30
20
k =
C.25)
где к — константа скорости хи-
химической реакции или коэффи-
коэффициент диффузии; А — посто-
постоянная, формально равная к при
10
700 800 900 1000
Температура, °С
Рис. 3.16. Скорость окисления некото-
некоторых металлов в атмосфере кислорода
56 Физико-химические закономерности газовой коррозии металлов
Гл.З
экстраполяции на 1/Т = 0; Е — энергия активации химической
реакции или процесса диффузии; R — газовая постоянная, рав-
равная 8,32 кДж/моль; Т — абсолютная температура.
Если прологарифмировать уравнение C.25), то получим:
C.26)
2,ЗЯТ
Таким образом, температурная зависимость в координатах 1/Т —
— \gk выражается прямой линией, для которой E/2^RT равно тан-
тангенсу угла наклона.
При окислении металлов могут наблюдаться случаи, когда при
невысоких температурах процесс идет в кинетической области, т.е.
лимитируется скоростью химической реакции. При повышении тем-
температуры коэффициент скорости химической реакции возрастает в
несколько раз быстрее, чем коэффициент диффузии. Это приводит
к тому, что при определенной температуре (для многих металлов —
800-900°С) скорость химической реакции уравнивается со скоро-
скоростью диффузии, а потом и превышает ее. Процесс начинает кон-
контролироваться стадией диффузии. На зависимости lgA; — 1/Т этот
эффект будет отмечен изломом, изменением наклона прямой линии.
Температура может оказывать также влияние на состав образу-
образующихся пленок. На рис. 3.17 приведена температурная зависимость
окисления железа на воздухе, а в табл. 3.5 — состав образующихся
пленок.
Таблица 3.5
Состав оксидных пленок на железе в зависимости от температуры
Температура, °С
<400
400-575
575-730
Состав пленки
Fe2O3
Fe3O4;Fe2O3
FeO;Fe3O4;Fe2O3
Закон роста
Логарифмический
Параболический
Параболический
Как показывают экспериментальные данные (рис. 3.17), в коор-
координатах lg K+ — 1/Т отмечено четыре участка (ограничены штри-
штриховой линией) с изменением наклона. Три нижние участка отвечают
изменению состава оксидной пленки и кинетическому закону роста.
Верхний участок, при температуре более 800 °С может быть связан
с изменением лимитирующей стадии процесса.
Колебания температуры при нагреве металла, попеременные на-
нагрев и охлаждение увеличивают скорость окисления металлов. В
оксидной пленке возникают термические напряжения, образуются
трещины и она начинает отслаиваться от металла.
3.9. Влияние внутренних и внешних факторов на скорость газовой коррозии 57
3.9.3. Влияние давления и состава газа
Если парциальное давление окислителя ниже давления диссо-
диссоциации образующего соединения, то, как было показано ранее, тер-
термодинамически окисление металла прекращается.
Если окисление металла лимитируется химической реакцией, то
скорость коррозии увеличивается пропорционально корню квадрат-
квадратному от величины давления кислорода.
Если скорость реакции определяется процессом диффузии в за-
защитной пленке, то четкой зависимости от давления газа не наблю-
наблюдается.
+ Температура, °С
т 1100 900 800 700 600 500
2 -
1 -
\
\
-
б
1
1
ь
'XI
400 600 800 1000
Температура, °С
11
A/7)-104
13
Рис.
3.17. Температурная зависимость окисления железа в координатах
К+ — температура (а) и lg K+ — 1/Т (б).
Вертикальными линиями отмечено изменение наклона
Существенное увеличение скорости окисления металла с повы-
повышением содержания и концентрации кислорода в газовой среде на-
наблюдается только при невысокой концетрации кислорода в какой-
либо нейтральной атмосфере. Дальнейшее увеличение парциально-
парциального давления кислорода в газовой смеси не сопровождается пропорци-
пропорциональным увеличением скорости газовой коррозии. Например, ско-
скорость окисления железа и меди при 800-1000 °С в чистом кислороде
примерно вдвое больше, чем на воздухе, хотя парциальное давле-
давление кислорода меняется в пять раз. Скорость окисления металлов
58 Физико-химические закономерности газовой коррозии металлов Гл. 3
в рассматриваемых случаях контролируется диффузией катионов в
защитной пленке. На лимитирующую стадию парциальное давление
кислорода непосредственного влияния не оказывает.
Большое влияние оказывают примеси. Загрязнение воздуха СО2,
SO2, парами воды вызывает повышение скорости газовой коррозии
низкоуглеродистой стали в 1,3-2,0 раза. При увеличении содержания
оксида углерода (II) — СО — скорость окисления стали понижает-
понижается. Это явление связывают с тем, что при большом содержании СО
на границе сталь-газ устанавливается равновесие: 2СО^ С + СО2.
Образующийся при этом атомарный углерод диффундирует в сталь
с образованием карбида железа — цементита. Происходит наугле-
науглероживание стали. Аналогичный процесс при высоких температурах
может иметь место и в атмосфере углеводородов. Например, в среде
метана устанавливается равновесие
СН4 ^ С + 2Н2
и также отмечается науглероживание стали.
В процессе горения топлива возможно образование оксида ва-
ванадия. Зола с V2O5 попадает на поверхность стальных деталей и
способствует повышению скорости окисления стали. Явление полу-
получило название ванадиевой коррозии. Причина ванадиевой коррозии
заключается в легкоплавкости V2O5 и способности растворять желе-
железо и оксидные пленки на железе с образованием соединений ванадия:
Fe2O3 + V2O5 = 2FeVO4
4Fe + 3V2O5 = 2Fe2O3 + 3V2O3
Образующиеся V2O3 и FeVO4 принимают участие в последую-
последующих реакциях:
V2O3 + О2 = V2O5
6FeVO4 + 4Fe = 5Fe2O3 + 3V2O3
Аналогичным образом оксид пятивалентного ванадия V2O5 реа-
реагирует с оксидами никеля и хрома. При этом защитная пленка раз-
разрушается, в ней образуются поры и скорость коррозии металла уве-
увеличивается.
В технике аппаратура, изготовленная из стали и чугуна, часто
подвергается воздействию температуры и других газов: СО2, SO2,
паров воды. Проведенные исследования показали, что при 900° С
скорость окисления железа изменяется в ряду:
Н2О > СО2 > О2 > SO2
3.10. Теории жаростойкого легирования 59
Влияние состава газовой среды на примере О2, Н2О, CO2 и SO2 и
температуры на коррозию отдельных металлов показано на рис. 3.18.
Железо обнаруживает достаточно высокую коррозию во всех ис-
исследованных газовых средах, которая значительно увеличивается в
интервале 700-900°С.
Хром обладает высокой жаростойкостью во всех четырех атмо-
атмосферах.
Никель относительно устойчив в среде О2, H2O и СО2, но сильно
корродирует в атмосфере SO2.
Кобальт наибольшую скорость коррозии имеет в среде SO2, ко-
которая значительно возрастает при переходе от температуры 700° С
к900°С.
Медь наиболее быстро корродирует в атмосфере кислорода, но
устойчива в среде SO2.
Принято считать, что различия в скорости коррозии металлов в
различных газах в значительной степени определяются защитными
свойствами образующихся на металле пленок продуктов коррозии.
3.10. Теории жаростойкого легирования
Во многих химических процессах металлические конструкции
и изделия эксплуатируются в жестких условиях, при повышенных
температурах, больших давлениях, высокой агрессивности среды.
Чистые металлы, как правило, являются коррозионностойкими и
требуют дополнительных мер защиты.
Современная техника противокоррозионной защиты располагает
рядом эффективных способов для увеличения стойкости металлов
и сроков их эксплуатации. Применительно к условиям газовой кор-
коррозии одним из наиболее часто используемых способов является
жаростойкое легирование с целью получения сплавов, обладающих
повышенной коррозионной устойчивостью.
В настоящее время существует три наиболее обоснованные тео-
теории жаростойкого легирования, которые не противоречат, а скорее
дополняют друг друга.
Согласно первой теории, разработанной Вагнером и Хауффе, не-
небольшая добавка легирующего элемента окисляется и, растворяясь
в оксиде основного металла, уменьшает число дефектов в кристал-
кристаллической решетке основного металла. Это приводит к упорядочи-
упорядочиванию структуры и снижает скорость диффузии ионов в защитной
пленке.
Данная теория имеет довольно ограниченную область примене-
применения. Если скорость окисления металла определяется не диффузией
60 Физико-химические закономерности газовой коррозии металлов Гл. 3
1000
600
200
1000
2 600
я 200
оост
—
-
О2
-
Н2О
3d
1240
3750^.
1800
—^
CD
а
Увеличен
600
200
со2
¦изо —
1000 -
600 -
200
700 °С
900 °С
Рис. 3.18. Скорость газовой коррозии некоторых металлов
в атмосферах:
О2, Н2О, СО2 и SO2 за 24 часа при 700 °С и 900 °С
3.10. Теории жаростойкого легирования 61
ионов или при легировании в оксидной пленке образуется новая фа-
фаза, то изложенные выше предположения жаростойкого легирования
неприменимы.
Согласно второй теории, разработанной А.А. Смирновым, Н. Д. То-
машовым и др., на поверхности металла образуется защитный
оксид легирующего элемента, который препятствует окислению
основного металла.
Применительно к этой теории легирующий компонент должен
обладать перечисленными ниже основными свойствами.
1. Оксид легирующего элемента должен удовлетворять условию
сплошности, т.е. отношение объемов оксида и металла долж-
должно быть больше единицы: Уок/Уме > 1. В табл. 3.6 приведены
обобщающие данные по некоторым свойствам оксидов хрома,
алюминия и кремния. Эти элементы являются основными до-
добавками для повышения жаростойкости железа. Как показыва-
показывают данные таблицы это условие для вышеназванных элементов
выполняется.
2. Легирующий элемент должен образовывать оксид с высоким
электрическим сопротивлением. Большое омическое сопротив-
сопротивление (низкая электропроводимость) является одним из основ-
основных условий для формирования защитных свойств пленки, так
как при этом движение ионов в слое оксида затрудняется.
3. Энергия образования оксида легирующего элемента должна
быть больше энергии образования оксида основного металла,
т.е.
m/ MemOmn/2 '
где Me7 — легирующий компонент; Me — основной металл.
Это условие обеспечивает стойкость оксида легирующе-
легирующего компонента в присутствии основного металла. Оксид ком-
компонента добавки оказывается более устойчивым, чем оксид
основного металла. Если это условие не соблюдается, то ок-
оксид легирующего элемента будет восстанавливаться основным
металлом.
Приведенные в таблице 3.6 данные по теплотам образова-
образования оксидов железа, АЬОз, СГ2О3 и SiO2 подтверждают сфор-
сформулированное выше правило. Более того, если первоначально
образуется смешанный оксид, то в дальнейшем в соответствии
с условиями термодинамического равновесия, он переходит в
чистый оксид легирующего компонента.
Например, при окислении железа легированного алюминием,
62 Физико-химические закономерности газовой коррозии металлов
Гл.З
имеет место образование оксида железа FeO. Но далее возмо-
возможен процесс:
3FeO + 2A1 = А12О3 + 3Fe
4. Размер ионов легирующего элемента должен быть меньше, чем
размер иона основного металла (см. табл. 3.6). Это облегчает
диффузию легирующего элемента к поверхности сплава, на
котором образуется защитная пленка.
Таблица 3.6
Некоторые свойства оксидов элементов, повышающих жаростойкость железа
Свойства
Отношение V0?^/Vmq
Электропроводимость,
Ом-см при 1000 °С
(порядок значения)
Ионный радиус металла в
оксиде, А
Теплоты образования:
кДж/моль
кДж/атом
Оксид
FeO
-
102
0,75
269,2
269,2
Fe2O3
2,14
-
801,8
400,9
AI2O3
1,28
Ю-7
0,54
1674,7
837,4
Сг2Оз
2,07
ю-1
0,6
1122,0
561,0
SiO2
1,9
ю-6
0,41
818,2
818,2
5. Оксиды легирующих компонентов должны иметь высокие тем-
температуры плавления и возгонки и не образовывать низкоплав-
низкоплавких эвтектик. Это требование обеспечивает сохранение окси-
оксида при высоких температурах в твердой фазе. Переход оксида
в жидкое состояние облегчил бы протекание в нем диффузи-
диффузионных процессов. Частичная возгонка оксида увеличила бы
пористость пленки, что способствует снижению ее защитных
свойств.
6. Легирующий компонент и основной металл должны образовы-
образовывать твердый раствор при данном составе сплава. Только при
этом условии удается обеспечить сплошную пленку оксида ле-
легирующего компонента по всей поверхности сплава.
Эта теория жаростойкого легирования находится в хорошем со-
согласии с целым рядом практических данных.
Экспериментально было установлено наличие защитного слоя
оксида, преимущественно образованного легирующим компонентом
сплава (хрома или алюминия) для ряда жаростойких железных спла-
сплавов. На рис. 3.19 показано значительное снижение скорости окисле-
окисления железа от концентрации легирующей добавки — алюминия.
3.10.
Теории жаростойкого легирования
63
Третья теория жаростойкого легирования основана на постула-
постулате об образовании двойных оксидов, обладающих высокими защит-
защитными свойствами.
Эта теория применительно к сплавам железа была наиболее пол-
полно сформулирована В.И. Архаровым. Повышение жаростойких
свойств железных сплавов может быть достигнуто при соблюдении
двух условий:
• устранение при окислении железа на поверхности соединений
со структурой вюстита;
• образование на поверхности сплава оксидов типа шпинели с
возможно меньшими параметрами кристаллической решетки.
Как известно, при окислении железа образуются различные ок-
оксиды, отличающиеся по составу и защитным свойствам. Оксиды со
структурой вюстита (FeO) обла-
обладают меньшим защитным дей-
действием при газовой коррозии,
чем другие оксиды железа со
структурой шпинели (БезО^
Fe2O3).
Пониженные защитные свой-
свойства вюстита объясняются тем,
что в структуре FeO легко осу-
осуществляется диффузия ионов
О
12 3 4 5 6 7:
Содержание алюминия, %
Рис. 3.19. Влияние легирования желе-
железа алюминием на относительную ско-
скорость окисления на воздухе при 900 ° С.
Скорость окисления чистого железа (к)
принята за 100
металла. Скорость окисления
железа заметно возрастает при
температурах 500-600 °С. Этот
эффект совпадает с началом об-
образования вюститной фазы.
Если в состав железа ввести
легирующие элементы, способствующие образованию двойных ок-
оксидов типа FeCr2O4, FeA^O^ NiFe2O4, NiCr2O4 и др., то возмож-
возможность возникновения вюститной фазы будет затруднена. Экспери-
Экспериментально это выражается в повышении температуры образования
вюстита, фиксируемого рентгенографическими методами (табл. 3.7).
Данные таблицы показывают, что даже при низкопроцентном ле-
легировании основные легирующие компоненты жаростойких желез-
железных сплавов заметно повышают температуру начала появления вю-
вюститной фазы.
Более высокие защитные свойства наблюдают у оксидов РезС>4
и 7-Fe2O3, характеризующихся структурой шпинели. Эта структура
имеет более плотную решетку с меньшими расстояниями между от-
64 Физико-химические закономерности газовой коррозии металлов
Гл. 3
Таблица 3.7
Минимальная температура образования вюстита при легировании железа
Состав
Чистое Fe (Армко)
Fe+l,03%Cr
Fe + l,5%Cr
Fe+l,0%Co
Fe + 10%Co
Fe + l,14%Si
Fe + 0,4%Si+l,l%Al
Fe + 0,5%Si + 2,2%Al
Температура в °С, при которой рентге-
рентгенографически замечены первые следы
FeO в оксиде
575
600
650
650
700
750
800
850
дельными узлами и характеризуется отсутствием дефектов. Поэтому
шпинельная структура препятствует диффузии ионов.
Установлено, что железо в пассивном состоянии, а также легиро-
легированные стали имеют поверхностные слои с кристаллографической
решеткой шпинельного типа.
Еще более высокими защитными свойствами обладают поверх-
поверхностные сложные оксиды типа БеО-МегОз или Fe2O3-MeO, если ле-
легирующий компонент имеет меньший ионный радиус по сравнению
с железом (см. табл. 3.6).
Отмечают закономерную связь между уменьшением параметров
кристаллической решетки и эффектом повышения жаростойкости.
Очевидно, что внедрение в структуру шпинели новых катионов с
меньшим ионным радиусом будет уменьшать параметры решетки и
затруднять диффузию ионов кислорода и основного металла.
Установлено, что слой оксидной пленки, примыкающий к поверх-
поверхности высокохромистой стали, имеет состав БеО-О^Оз, а внешний
слой — a(Fe, СгJОз.
На хромоникелевых сплавах при высоких температурах образу-
образуется защитная пленка шпинельной структуры — ТЧЮ-О^Оз, а на
хромоалюминиевых железных сплавах — сложные оксиды: m(FeO-
•Cr2O3)+n(FeO-Al2O3).
3.10. Теории жаростойкого легирования 65
Методические рекомендации к главе 3
Вопросы для самопроверки
1. Какой термодинамической функцией характеризуется вероят-
вероятность перехода металлов в ионное состояние?
2. Укажите наиболее и наименее коррозионноустойчивые металлы.
3. Перечислите основные стадии газовой коррозии металлов.
4. Какой процесс называется адсорбцией?
5. Что называется изотермой адсорбции? Приведите уравнения.
6. Каким образом происходит образование оксида на поверхности
металла?
7. Охарактеризуйте свойства поверхностных пленок на металле.
8. Какие показатели определяют защитные свойства пленок?
9. Какие кинетические законы роста пленок вам известны?
10. Охарактеризуйте состав и свойства оксидных пленок на железе.
11. Как описывается процесс диффузии ионов в поверхностной
пленке?
12. Разберите влияние внутренних и внешних факторов (состава
сплава, температуры, давления и состава газовой среды) на
закономерности газовой коррозии.
13. Укажите металлы, стойкие в среде SO2, СО2, Н2О (пары) и О2.
Темы самостоятельных работ к главам 2 и 3
1. Дефекты кристаллических решеток и их влияние на коррози-
коррозионное поведение металлов.
2. Оксидные пленки на железе. Их структура. Защитные свойства.
3. Влияние температуры и давления на термодинамическую ве-
вероятность образования оксидных поверхностных соединений.
4. Влияние технологических параметров (температура, давление,
состав атмосферы) на коррозионную устойчивость металлов.
Литература к главам 2 и 3
1. Томатов К Д. Теория коррозии металлов. - М.: Изд-во АН СССР,
1959.590 с.
2. Эванс Ю.Р. Коррозия и окисление металлов. - М.: Машгиз, 1962.
380 с.
66 Физико-химические закономерности газовой коррозии металлов Гл. 3
3. Скорчеллетти В.В. Теоретические основы коррозии метал-
металлов. -М.: Химия, 1973. 263 с.
4. Соколовская Е.М., ГузейЛ.С. Металлохимия. - М.: Изд. Москов-
Московского университета, 1986. 264 с.
5. Дамаск А., Дине Дж. Точечные дефекты в металлах. / Под ред.
Б .Я. Любова. - М.: Мир, 1966. 282 с.
6. Жуков А.П., Малахов А.И. Основы металловедения и теории кор-
коррозии. - М.: Высшая школа, 1991. 169 с.
7. ФрумкшА.Н., БагоцкшВ.С, ИофаЗ.Л., Кабанов Б.Н. Кинетика
электродных процессов. - М.: Изд. МГУ, 1952.
8. Шлыгин А.И., Фрумкин А.Н. II Acta physecochemica. UPSS. 1935.
V. З.Р. 791.
9. ТемкинМ.ИЛ ЖФХ. 1941. Т. 15. С. 296.
ГЛАВА 4
ЭЛЕКТРОХИМИЧЕСКАЯ КОРРОЗИЯ
МЕТАЛЛОВ
Обязательным условием реализации электрохимического вида
коррозии является наличие электропроводящей среды — растворов
кислот, щелочей или солей.
В природных условиях электрохимическая коррозия встречает-
встречается повсеместно. Это, например, атмосферная, морская, подземная
коррозия и др.
Такому виду разрушений подвержены магистральные трубо-
трубопроводы по транспортировке нефти и газа.
В промышленности электрохимический вид коррозии реали-
реализуется в тех случаях, когда процессы протекают в водных тех-
технологических средах. Например производство неорганических
кислот H2SO4, HNO3, HC1, процессы получения минеральных
удобрений, хлора, щелочей и т.д.
4.1. Явления на границе раздела фаз металл-электролит
Процессы электрохимической коррозии протекают в водных рас-
растворах. При соприкосновении металлической поверхности с раст-
раствором электролита происходит взаимодействие металла с заряжен-
заряженными частицами раствора и переход ионов метала в раствор. По
представлениям А.Н. Фрумкина и его школы в этом случае протека-
протекают два сопряженных процесса:
• переход ионов из металла в раствор с образованием сольва-
тированных (в водных растворах — гидратированных) ионов
(окислительный или анодный процесс):
Me + mH2O = Меп+ • шН2О + пе
• и переход этих ионов из раствора с выделением их на поверх-
поверхности металла в виде нейтральных атомов, входящих в состав
кристаллической решетки металла (восстановительный или ка-
катодный процесс).
Скорости прямого и обратного перехода в общем случае неоди-
неодинаковы. Если растворение металла происходит быстрее, чем его оса-
осаждение, то металл по отношению к электролиту заряжается отри-
отрицательно. В результате скорость растворения металла уменьшается,
а скорость его осаждения растет. Сдвиг потенциала в отрицатель-
отрицательную сторону продолжается до тех пор, пока не будет достигнуто
68
Электрохимическая коррозия металлов
Гл. 4
равновесное значение потенциала (Ер). При равновесном состоянии
устанавливается динамическое равновесие между скоростями рас-
растворения металла и осаждения его ионов, то есть плотность анодного
тока (га) становится равной плотности катодного тока (гк):
Ч = Ч = го,
D.1)
где го — плотность тока обмена, которая характеризует скорость
процесса постоянного обмена ионами между металлом и раствором.
При равновесном потенциале одновременно должны осуществля-
осуществляться два условия:
• на фазовой границе отсутствуют электрохимические и химиче-
химические превращения;
• потенциал самопроизвольно переходит к одной и той же вели-
величине как от более высоких, так и от более низких его значений.
Возникновение разности потенциалов между металлом и раство-
раствором означает, что на границе раздела фаз (металл / электролит) долж-
должны появиться на некотором расстоянии друг от друга положительно
и отрицательно заряженные слои, которые и образуют двойной элек-
электрический слой — ДЭС (рис. 4.1).
Металл
Металл
Металл
Е-х?1
Е
J
Ill
\l
ll\l
их
II |\
1
1
1
1
1
1
Рис. 4.1. Распределение зарядов и изменение потенциала в двойном слое:
а — по Гельмгольцу (плотная часть ДЭС); б — по Гун и Чапмену (диффузная часть
ДЭС); в — по Штерну (при адсорбции ионов)
4.2. Термодинамика электрохимической коррозии 69
При переходе катионов металла в раствор поверхность металла
заряжается отрицательно. К ней притягиваются положительно заря-
заряженные анионы. Возникает двойной электрический слой (ДЭС), ко-
который подобен структуре плоского конденсатора (рис. 4.1, а). Такие
представления о строении ДЭС были выдвинуты немецким ученым
Гельмгольцем. Одна из обкладок конденсатора совпадает с плоско-
плоскостью, проходящей через поверхностные заряды в металле, а дру-
другая — с плоскостью, соединяющей центры тяжести зарядов ионов,
находящихся в растворе, но притянутых электростатическими сила-
силами к поверхности металла.
Толщина ДЭС принимается равной радиусу гидратированного
иона аг, и весь скачок потенциала Е происходит в этой области
(рис. 4.1, а).
Гуи развил представления Гельмгольца о структуре ДЭС, приняв,
что слои не плотные, а размытые, поскольку плотный ДЭС будет
постоянно разрушаться тепловым движением ионов (рис. 4.1, б). В
этом случае ДЭС состоит из плотной и диффузной частей этого слоя.
Соответственно скачок потенциала разбивается на две части: Фх
(пси-прим) — изменение потенциала в диффузной части двойного
электрического слоя и Е — Ф1 — изменение потенциала в плотной
части ДЭС. Толщина диффузного слоя в растворах средних концен-
концентраций оценивается как 10~7-10~6см.
Штерн ввел еще одно дополнение в картину о структуре двой-
двойного слоя. По его представлениям наряду с образованием плотной
части этого слоя в результате максимального приближения ионов
к поверхности электрода необходимо учитывать и специфическую
адсорбцию дипольных молекул и ионов (рис. 4.1, в).
4.2. Термодинамика электрохимической коррозии
Причиной электрохимической коррозии является термодинами-
термодинамическая неустойчивость металлов в среде электролита.
Величина равновесного потенциала зависит от температуры и ак-
активности реагирующих веществ и может быть рассчитана по урав-
уравнению Нернста:
Ер = Е0 + ^1п^, D.2)
где Eq — стандартный потенциал металла; R — газовая постоянная;
Т — абсолютная температура; аШп+ — активность ионов металла
в г-ион/л; аме — активность металла, которую принимают равной 1;
п — число электронов, участвующих в реакции. Если представить
все константы при температуре 298 К и выразить зависимость в де-
70
Электрохимическая коррозия металлов
Гл. 4
сятичных логарифмах, то
= Ео
0,059
1пал
D.3)
Если активность ионов металла в растворе равна единице, то
второй член уравнения Нернста превращается в нуль. Электродный
потенциал при этом становится равным стандартному потенциалу.
Таким образом стандартный электродный потенциал представляет
собой частный случай равновесного потенциала. Значение стандарт-
стандартных потенциалов для некоторых металлов приведены в табл. 4.1.
Таблица 4.1
Стандартные потенциалы металлов
Реакция
К+ + е <=± К
Ва2+ + 2е +± Ва
Mg2+ + 2е Т± Mg
А13+ + Зе Т± А1
Ti2+ + 2е +± Ti
Ti3+ + Зе ^ Ti
Мп2+ + 2е Т± Мп
Сг2+ + 2е Т± Сг
Zn2+ + 2е +± Zn
Сг3+ + Зе ^ Сг
Fe2+ + 2е Т± Fe
Cd2+ + 2е Т± Cd
Мп3+ + Зе ^ Мп
Со2+ + 2е ^ Со
М2+ + 2е Т± Ni
Мо3+ + Зе ^ Мо
Sn2+ + 2е ^ Sn
Потенциал, В
-2,925
-2,900
-2,370
-1,660
-1,630
-1,210
-1,180
-0,913
-0,762
-0,740
-0,440
-0,402
-0,283
-0,277
-0,250
-0,200
-0,136
Реакция
РЬ2+ + 2е <=± РЬ
Fe3+ + Зе ^ Fe
Н+ + е Т± 1/2Н2
Sn4+ + 4е Т± Sn
Bi3+ + Зе +± Bi
Sb3+ + Зе +± Sb
Cu2+ + 2е <=± Си
Со3+ + Зе ^ Со
Си+ + е +± Си
Ag+ + е т± Ag
Hg2+ + 2е +± Hg
Pd2+ + 2е т± Pd
Ir3+ + Зе ^ Ir
Pt2+ + 2е +± Pt
Аи3+ + Зе ^ Аи
Аи+ + е ^ Аи
Потенциал, В
-0,126
-0,037
0,000
+0,007
+0,215
+0,240
+0,337
+0,418
+0,521
+0,799
+0,854
+0,987
+1,150
+1,190
+1,500
+1,690
В реальных условиях коррозии металла в реакциях обмена участ-
участвуют не только ионы металла, но и другие компоненты раствора.
В этих случаях устанавливаются стационарные или необратимые
значения потенциалов. Необратимые потенциалы не могут быть от-
отнесены к прямой и обратной реакциям одного и того же процесса и
их нельзя вычислить по уравнению Нернста.
Измерить абсолютное значение потенциала в настоящее время
технически невозможно, он может быть замерен только по отноше-
отношению к какому-то электроду сравнения. В качестве основного электро-
электрода сравнения принят стандартный водородный электрод. Наиболее
4.2. Термодинамика электрохимической коррозии 71
часто в качестве электрода сравнения применяют каломельный и
хлор-серебряный электроды.
Существуют и другие виды электродов сравнения, с которыми
можно более подробно познакомиться в учебниках по физической
химии и электрохимии.
В настоящей книге в таблицах и на графиках потенциалы приве-
приведены по отношению к стандартному водородному электроду (с. в. э.).
Процесс электрохимической коррозии представляет собой сово-
совокупность двух сопряженно протекающих реакций.
Металл является донором электронов и на его поверхности про-
протекает анодная реакция:
Me — ne ^ Меп+.
Катодная реакция, которую называют катодной деполяризующей
реакцией, протекает с участием компонентов электропроводящей
среды. В качестве последней чаще всего выступают водные растворы
кислот, щелочей или солей.
Акцепторами электронов могут быть либо ионы Щ или молеку-
молекулы ЩО (водородная деполяризация):
НзО+ + е = I/2H2 + H2O в кислых растворах,
2Н2О + 2е = Н2 + 2ОН~ в щелочных растворах,
либо кислород 02 (кислородная деполяризация):
О2 + H2O + 4е = 4ОН~ в нейтральных и щелочных растворах,
О2 + 4Н+ + 4е = 2Н2О в кислых растворах.
рН влияет на величину равновесного потенциала.
Запишем уравнение Нернста для водородной деполяризации:
?р(н+/н2) = ?о(н+/н2) + 0,059 lg он, D.4)
Если учесть, что стандартный потенциал водородного электрода
принят равным нулю, а десятичный логарифм активности водород-
водородных ионов есть величина рН, взятая с обратным знаком, то получим:
Яр(н+/н2) = -0,059рН. D.5)
Это означает, что при изменении рН на единицу потенциал водород-
водородного электрода уменьшается на 59 мВ.
Потенциал кислородного электрода положительнее водородного
электрода на 1,23 В, т.е.
Яр(о2/он-) = !'23 " 0,059рН. D.6)
72 Электрохимическая коррозия металлов Гл. 4
В кислой среде при рН = 0 и при ан+ = 1 моль/л: ?7р(Н+/Н2) = О,
а ?7р(о2/он-) = +1,23В. В нейтральной среде при рН = 7 и при
ан+ = Ю моль/л: #р(Н+/н2) = -0,415 В, а ?р(о2/он-) = +0,815 В.
Для электрохимических реакций свободная энергия Гиббса рас-
рассчитывается по уравнению
ДС° = -nFAE, D.7)
где F — число Фарадея, п — число электронов, участвующих в реак-
реакции, АЕ — разность равновесных потенциалов катодной и анодной
реакции:
АЕ = Ерк - ?ра. D.8)
4.3. Диаграммы Пурбе
Бельгийский ученый Пурбе предложил метод изучения равнове-
равновесий в системах элемент-вода. Суть метода состоит в исследовании
всех возможных равновесий в системе и в представлении результатов
в виде табличных данных и в виде графических зависимостей в ко-
координатах потенциал-рН. Последние получили название диаграмм
Пурбе.
Диаграммы используют для определения границ термодинамиче-
термодинамической устойчивости соединений и заключений о возможности проте-
протекания реакций. В последнее время получили распространение ком-
комплексные исследования, в том числе и с использованием диаграмм
Пурбе, для разработки отдельных моделей коррозионных процес-
процессов. При построении диаграмм учитывают три типа равновесий в
системе металл-вода.
1. Равновесный обмен электрическими зарядами:
Men+ + ne ^ Me D.1)
Эти равновесия не зависят от рН, а зависят только от потенциала.
Линии, которые характеризуют этот процесс, параллельны оси рН.
2. Ионно-молекулярные равновесия, не связанные с величиной
потенциала. Они зависят только от величины рН:
Men+ + nOH" <=> Me(OH)n D.II)
На диаграмме Пурбе им отвечают линии, параллельные оси потен-
потенциалов.
3. Равновесия, которые зависят как от потенциала, так и от рН:
Me(OH)n + ne ^ Me + nOH" D.III)
4.3.
Диаграммы Пурбе
73
Потенциал такого электрода определяется уравнением:
и(ОН-/Ме)
- 0,059рН
D.9)
Линия равновесия имеет наклон относительно двух осей.
Примеры. Рассмотрим фрагмент диаграммы /?-рН для воды (рис.
4.2). Основные реакции и соответствующие им уравнения при-
приведены в таблице 4.2. Линии 2 и 3 соответствуют электрохими-
электрохимическим равновесиям воды с продуктами ее восстановления —
водородом (линия 2) и окисления — кислородом (линия 3). При
потенциалах, лежащих выше линии J, вода окисляется, а при по-
потенциалах ниже линии 2 — восстанавливается.
Кривые 2 и 3 приведены для случая, когда активности ионов
равны 1.
1,6 Г
1,2
0,8
0,4
0,0
-0,4
-0,8
-1,2
12
16
рН
Рис. 4.2. Диаграмма Е-рН для воды при
25 °С
Кривая /; соответствует равенству активности ионов Н+
и ОН~, находящихся в равновесии друг с другом. В таблице 4.2
это обозначается как Н+/ОН~.
Часто линию 2 обозначают буквой «#», а линию 3 буквой «а».
Их наносят в виде пунктира на диаграммы Пурбе системы эле-
элемент-вода для выделения области устойчивости воды.
Боле сложный случай равновесий наблюдают в системе Zn-
Н2О, в которой возможно образование нескольких различных
ионов (табл. 4.3).
Диаграмма имеет четыре области (рис. 4.3):
I — область термодинамической устойчивости Zn (область
катодной защиты);
II и IV — области растворения Zn (области коррозии);
III — область пассивности.
Линия / отвечает условию равновесия процесса ионизации
цинка. Ниже этой линии находится область термодинамической
74
Электрохимическая коррозия металлов
Гл. 4
Таблица 4.2
Данные о равновесиях в воде при 25 °С и 0,1 МПа
Обозначение
на рис. 4.2
1
(на рисунке не
приведено)
1'
2
3
Реакция
н2о ^ н+ + оы
Н+/ОН"
Н2 <=* 2Н+ + 2е
2Н2О^О2+4Н++4е
Уравнение
lg[OH]- =-14 + pH
рН = 7
Е = 0,00 - 0,059рН-
-0,0295 lgPH2
Е= 1,228 - 0,059рН+
+0,0147 lgP02
устойчивости металла, выше происходит растворение Zn.
При значениях рН, соответствующих левой части диаграммы
(область II) образуются катионы Zn2+, в области IV — анионы
HZnO^. Между ними находится зона III (облать пассивации), где
происходит образование нерастворимого гидроксида Zn(OHJ.
Линии 6' и 7' определяют значения рН, отвечающие равно-
равновесию между Zn2+, HZnO^ и ZnO2," для частного случая ра-
равенства активностей ионов: Zn2+/HZnO^npn рН = 9,21 (кривая
6'); HZnO^/ZnO^npn рН = 13,11 (кривая 7'). Слева от линии в1
находится область преобладания ионов Zn2+, справа — область
преобладания HZnO^~. Аналогично, слева от линии 7' — область
преобладания HZnO^, справа — ZnO2,".
Рис. 4.3. Диаграмма ?7-рН для системы Zn-H2O
4.3.
Диаграммы Пурбе
75
Линии 2л\4 отвечают равновесию химических реакций и по-
поэтому не зависят от потенциала.
Линии 3 и 5 отвечают равновесиям электрохимических ре-
реакций растворения Zn до Zn(OHJ и ZnO^", которые зависят от
потенциала и рН.
Таблица 4.3
Данные о равновесиях в системе Z11-H2O при 25 ° С
Обозначение
линии на
рис. 4.3
1
2
3
4
5
6
6'
7
7'
Реакция
Zn +± Zn2+ + 2e
Zn2+ + 2Н2О т± Zn(OHJ + 2Н+
Zn + 2Н2О т± Zn(OHJ + 2H+ + 2е
Zn(OHJ +± HZnO^ + Н+
Zn + 2Н2О +± ZnO2." + 4Н+ + 2е
Zn2+ + 2Н2О т± HZnO^ + 3H+
Zn2+/UZnO~
HZnO^ т± ZnO2." + Н+
HZnO^/ZnOa"
Уравнение равновесия
? = 0,763 + 0,0295
lg [Zn2+] = 12,26-
-2рН
Е = -0,400 - 0,059рН
lg [HZnO2-] =
= -15,37+ рН
Е = 0,441 -0,1182рН+
+0,0295 lg[ZnO2"]
[HZnO2-j
S [Zn2+]
= -27,63 + ЗрН
рН = 9,21
[znorj _
[HZnO^]
= -13,11+pH
pH = 13,11
При разработке термодинамической модели пассивного состоя-
состояния хрома в кислых растворах использовали комплексный метод ис-
исследования. Он включал термодинамические расчеты и построение
диаграммы Пурбе, экспериментальные электрохимические исследо-
исследования и определение свойств поверхностных пленок методами in siti
(в месте нахождения) и perse (само по себе), т.е. после отделения
пленки от поверхности металла.
На рис. 4.4 линии, обозначенные цифрами, отражают состоя-
состояние равновесия и получены расчетным путем для реакций, при-
приведенных в табл. 4.4. Кривые А и В построены по эксперимен-
экспериментальным данным резистометрических поляризационных кривых,
т.е. при определении местной скорости коррозии в условиях, ко-
когда из-за наложения катодного тока выделения Н2 скорость анод-
анодного растворения металла не эквивалентна измеряемой анодной
плотности тока.
Линия / отвечает равновесию реакции образования гидрида
хрома СгН. Выше этой линии находится металлический хром, а
76
Электрохимическая коррозия металлов
Гл. 4
ниже — поверхность хрома покрыта пленкой СгН. Электроно-
спектральным методом было подтверждено образование СгН на
поверхности металлического хрома.
Кривая А отражает зависимость изменения потенциала Е^ —
Рис. 4.4. Диаграмма Е-рН для системы Сг-Нг О
для рН < 6 и Е < 0
начало области активного растворения хрома — от рН. Активное
растворение хрома определяется кинетикой окисления гидрид-
ной пленки по реакциям 2 и //. Кривая А пересекает линию 2
при рН = 1,8, после чего круто падает с ростом рН. При рН > 5,2
растворение хрома в виде Сг2+ прекращается и начинается ре-
реакция гидратообразования.
Потенциал Ев отвечает началу процесса пассивации на хроме.
Кривая В на рис. 4.4 описывает зависимость изменения ^в от рН.
В области пассивации происходит образование оксидной пленки
на поверхности гидрида СгН по реакциям 7, 9 и 10. Электронно-
спектральным и эллипсометрическим методами было показано,
что оксид является гидратированным, с внедрением в фазу неко-
некоторого количества Н+, он отвечает структуре двойной пленки
4.3.
Диаграммы Пурбе
11
Таблица 4.4
Данные о химических и электрохимических реакциях с участием Сг и его
соединений (Е < 0,0 В, рН < 6)
Обозна-
Обозначение
линии на
рис. 4.4
1
2
3
4
5
6
7
8
9
10
11
Реакция
Сг + Н+ + е +± СгН
Сг2+ + Н+ + Зе т± СгН
Сг2+ + 0,5Н2 + 2е = СгН
СгН + 2Н+ т± Сг2+ + 1,5Н2
СгН + ЗН+ т± Сг3+ + 2Н2
Сг2+ + 2е <=± Сг
Сг2О3 + 8Н+ + 8е т± СгН + ЗН2О
Сг(ОНK + ЗН+ + е <=± Сг2+ + ЗН2О
Сг(ОНK + ЗН+ + Зе +± Сг + ЗН2О
Сг(ОНK + 4Н+ + 4е т± СгН + ЗН2О
Сг3+ + Н + 4е т± СгН
Уравнение
Е = -0,09 - 0,059рН
Е = -0,64 - 0,019рН+
+0,019 lg[Cr2+]
Е = 0,95 + 0,031 х
xlg[Cr2+]
? = -0,91+
+0,031g[Cr2+]
Е = -0,45 - 0,059рН
Е = -0,14-0,177рН-
-0,059 lg[Cr2+]
Е = -0,51 - 0,059рН
Е = -0,40 - 0,059рН
Е = -0,58 - 0,015рН-
-0,059 lg[Cr2+]
Примечание. [Сг2+] и [Сг3+] — активность ионов
Cr|CrH|Cr2O3, обладающей n-проводимостью и представляет со-
собой толстый фазовый слой («23 нм).
Начиная с рН = 2,25 наклон кривой Е^—рН изменяется со
значения 0,059 В/рН на значение 0,177 В/рН. Положение этого пе-
перегиба совпадает с пересечением линий 7 и 10 с линией 8. Это
отвечает процессу осаждения Сг(ОНK, предшествующему обра-
образованию СГ2О3. При потенциалах Е ^ 0,1В анодное осаждение
Сг(ОН)з и СГ2О3 становится одинаково возможным.
По мере увеличения потенциала в области пассивации про-
происходит дегидрирование пленки и она становится однослойной
Сг/Сг2О3. Эта пленка обладаетр-типом проводимости. На грани-
границе Сг/Сг2О3 реализуется n-p-контакт, обладающий вентильным
действием и затрудняющий протекание анодного процесса.
При росте потенциала в пленке появляется примесь Cr(VI),
что приводит к улучшению ее защитных свойств. Степень гид-
гидратации пленки уменьшается. Дальнейшее повышение потенци-
потенциала приводит к образованию высших оксидов хрома. Эти оксиды
анодно или химически образуют хроматы, переходящие в рас-
раствор.
78 Электрохимическая коррозия металлов Гл. 4
4.4. Закономерности кинетики электродных реакций
Если электрод находится при равновесном потенциале Ер, то ток
в электрической цепи равен нулю. Если потенциал электрода сме-
смещается относительно равновесного значения, например, становится
равным Ер + АЕ, то начинается направленный переход электронов
или ионов через границу фаз и ток в цепи становится отличным от
нуля. Возможен и другой вариант: если пропускать через электрод
ток, например, от внешнего источника постоянного тока, то потен-
потенциал электрода отклонится от равновесного значения на величину
АЕ. Сдвиг потенциала АЕ = Е — Ер при прохождении тока через
электрод называется поляризацией электрода.
Изучение кинетики электродного процесса состоит в установле-
установлении связи между поляризацией электрода АЕ и скоростью электро-
электрохимической реакции г.
Графическую зависимость плотности тока от потенциала на-
называют поляризационной кривой и широко используют при изучении
коррозионных процессов.
Для экспериментального определения зависимостей Е — lg г ис-
используют трехэлектродные ячейки с основным (исследуемым) элек-
электродом, вспомогательным (обычно платиновым) электродом и элек-
электродом сравнения. Через основной и вспомогательный электроды
пропускают ток (измеряя его соответствующим прибором), для чего
накладывают на основной и вспомогательный электроды напряже-
напряжение от внешнего источника, и при этом измеряют потенциал основ-
основного электрода относительно электрода сравнения. Такие измерения
производят при различных плотностях тока, и в результате получа-
получают совокупность точек, что позволяет построить кривые Е — lgi.
В отличие от этого, так называемого гальваностатического мето-
метода измерений, существует метод потенциостатический, при котором
задают постоянные во времени значения потенциала основного элек-
электрода по отношению к электроду сравнения (с помощью специаль-
специальных приборов - потенциостатов) и измеряют токи в цепи основной-
вспомогательный электроды.
Важным признаком электрохимических реакций является экви-
эквивалентность их скорости плотности тока г. Такая эквивалентность
следует из закона Фарадея. Сущность этого закона состоит в том, что,
например, для реакции растворения металла величина потери мас-
массы металла в течение определенного времени позволяет рассчитать
скорость его растворения, а из нее — плотность анодного тока:
nFAm /л лп\
Ds±T
4.4. Закономерности кинетики электродных реакций 79
где Ам — атомная масса металла, Am — убыль массы металла за
время т, S — площадь электрода, п — число электронов, F — число
Фарадея, г — время.
В форме, наиболее удобной для практического использования, в
уравнении для скорости электрохимической реакции, принято выра-
выражать эту скорость через плотность тока г (например, в А/см2).
Любой электродный процесс состоит из ряда стадий. К ним от-
относятся:
• подвод реагирующих веществ к поверхности электрода из объ-
объема раствора;
• перенос заряженных частиц (электронов или ионов) через гра-
границу раздела фаз;
• отвод продуктов реакции в объем раствора.
Скорость электродного процесса определяется скоростью самой
медленной стадии, которая называется лимитирующей.
Если скорость электрохимической реакции определяется стади-
стадиями массопереноса, то возникает концентрационная поляризация.
Кинетика процесса в этом случае лимитируется диффузией, основ-
основные закономерности которой будут рассмотрены ниже.
4.4.1. Диффузионная кинетика. Концентрационная
поляризация
Перенос вещества при электродных процессах может осуществлять-
осуществляться несколькими путями.
При прохождении тока вблизи электрода концентрация веществ
меняется, так как одни компоненты раствора вступают в электрод-
электродную реакцию, а другие образуются в результате реакции. Возникает
разница концентраций в приэлектродном слое и в объеме раствора.
Это приводит к молекулярной диффузии.
Вторым способом массопереноса служит перемещение частиц
под действием электрического поля. Электростатическими силами
ионы притягиваются к противоположно заряженным электродам.
Это явление вызывает миграцию ионов.
Перенос вещества с потоком движущейся жидкости называют
конвекцией. Этот перенос можно создать искусственно, применяя
размешивание. В естественных условиях к конвекции может приве-
привести местное разогревание электролита в зоне реакции, образование
газа и отрыв его пузырьков от электрода и т.д.
Чаще всего процессы диффузии изучают в двух вариантах: в непе-
ремешиваемых электролитах в стационарных условиях или при кон-
контролируемом конвективном режиме.
80
Электрохимическая коррозия металлов
Гл. 4
Если изменение концентрации реагирующего вещества (Со — С)
происходит в диффузионном слое толщиной S, то, согласно первому
закону Фика:
^L = KDCo~C, D.11)
dm , ,
где — число грам-ионов, переносимых диффузией в единицу
времени к (или от) 1 см3 поверхности электрода; KD — коэффициент
диффузии; С и Со — концентрации потенциалопределяющих ионов
у поверхности электрода и в объеме раствора соответственно.
Если все ионы, которые подходят к электроду, сразу разряжаются,
то по закону Фарад ея имеем:
dm
где п — заряд частицы, a F — число Фарад ея.
D.12)
dm
Если в это уравнение подставить значение —— из уравнения
D.11), то получим:
г = KD
nF.
D.13)
Е п
Наибольший ток, который называют предельным диффузионным
током, наблюдается когда С ^0, т.е. когда каждый приближающийся к
электроду ион немедленно вступает
в электрохимическую реакцию. Соот-
Соответственно имеем:
D.14)
Таким образом, предельная плот-
плотность тока диффузии не зависит от по-
потенциала (рис. 4.5).
Замедленность диффузионной ста-
стадии электрохимического процесса
приводит к возникновению концен-
концентрационной поляризации, значение которой определяют по уравне-
уравнению:
^^§-0- <4Л5>
Рис. 4.5. Зависимость концен-
концентрационной поляризации от
плотности тока
Из уравнений D.13) и D.14) имеем:
L=l_c_
iv Co
D.16)
4.4. Закономерности кинетики электродных реакций 81
и тогда
^(±) D.17)
График этой зависимости приведен на рис. 4.5.
В коррозионных процессах для анодной стадии растворения ме-
металла концентрационная поляризация наблюдается редко. В сопря-
сопряженных катодных реакциях диффузионные ограничения часто име-
имеют место.
4.4.2. Стадия замедленного разряда — ионизации
Если самой медленной стадией электрохимического процесса
является переход заряженных частиц через границу раздела фаз, то
имеет место замедленная стадия разряда — ионизация.
Теория, описывающая кинетические закономерности переноса
заряда через границу раздела фаз, называется теорией замедленного
разряда. Впервые в качественной форме она была сформулирована
М. Фольмером и А.Н. Фрумкиным.
Основная причина влияния скачка потенциала на скорость элек-
электрохимических реакций заключается в том, что скорость таких реак-
реакций лимитируется стадией переноса заряда, энергия активации ко-
которого является функцией потенциала на границе металл-раствор.
В подобных случаях количественная связь между скоростью элек-
электрохимического процесса и электродным потенциалом описывает-
описывается уравнением, носящим название уравнение Фольмера-Фрумкина.
Применительно к реакции D.1) для простейшего случая протекания
процесса в одну стадию, т.е. при одновременном отщеплении п элек-
электронов, это уравнение имеет вид:
га = кам exp \finF (Е - Ер) /RT]. D.18)
Здесь га — скорость анодной реакции, выраженная в единицах плот-
плотности тока; а — активность реагента (в данном случае — металла);
/3 — коэффициент переноса для анодной реакции, Е — электродный
потенциал металла в данных условиях; Ер — равновесный элек-
электродный потенциал реакции D.1). Индекс «а» показывает, что речь
идет об анодном процессе, индекс «м» — что речь идет о метал-
металле, exp [f3nF (Е - Ер) /RT] = ePnF(E-Ep)/RT^ где е _ основание
натурального логарифма.
Таким образом, скорость электрохимической реакции зависит от
потенциала, изменяясь по экспоненциальному закону. Это — особен-
особенность любого электрохимического процесса, в том числе и процесса
растворения металла. Для последнего случая следует учитывать, что
82 Электрохимическая коррозия металлов Гл. 4
активность металла (ам), как правило — величина постоянная, так
что уравнение D.18) следует переписать в виде:
ia = k exp [finF (Е - Ер) /RT]. D.19)
В форме, наиболее удобной для практического использования,
уравнение D.19) целесообразно прологарифмировать:
lnia = In A; + finF (Е - Ер) /RT,
или после перевода натуральных логарифмов в десятичные:
lg ia = k' + /3nF (E - Ev) /2,ЗДТ, D.20)
, , Ink
raefc =—.
Введение обозначения:
2,3RT/f3nF = b D.21)
приводит к уравнению
E = a' + blgiu, D22)
где а' — постоянная, а
b = d\giJdE D.23)
— характеристика скорости растворения металла.
Поскольку закон, лежащий в основе зависимости га от Е, выра-
выражающейся уравнением D.22), был сформулирован ученым Тафелем,
уравнение это называется уравнением Тафеля. Величину b соответ-
соответственно называют тафелевым наклоном (имея ввиду наклон линей-
линейных кривых в координатах Е — lg ia, широко используемых при ре-
решении научных и прикладных задач, связанных с исследованием
электрохимического растворения металлов).
Понятие «наклон» означает, что при изменении плотности тока
в 10 раз, что эквивалентно изменению логарифма этой величины
на единицу, потенциал электрода, выраженный в мВ, изменяется на
величину Ъ.
Величина наклона b является важной характеристикой и в ряде
случаев служит аргументом для заключений о кинетике электрохи-
электрохимических реакций.
Например, наклон поляризационных кривых в координатах Е —
— lg i позволяет сделать заключение о числе электронов, участву-
4.5. Общая характеристика электрохимического коррозионного процесса 83
ющих в реакции. Рассмотрим случай, когда происходит раство-
растворение металла в одну стадию:
Me = Мепе + пе
Предположим, что металл может переходить в раствор как в фор-
форме одновалентных Ме+, так и двухвалентных Ме2+ катионов. В
любом случае для описания скорости реакции применимо урав-
уравнение D.22), где наклон Ъ = 2,3RT//3nF. Поскольку, как правило,
/3 ~ 0,5, то при температуре 20 °С при подстановке численных
значений констант RylF получаем:
для случая п = 1 величина Ь = 118 мВ;
для случая п = 2 величина Ь = 59 мВ.
При анализе уравнения D.18) было показано, что в области малых
значений поляризации, когда АЕ = Е — Ev<^ —— (чаще всего, когда
АЕ не превышает 25 мВ), можно
разложить экспоненту в ряд и тогда
получается:
D.24)
где го — плотность тока обмена.
Таким образом, вблизи равно-
равновесного потенциала должна наблю-
наблюдаться линейная зависимость меж-
между Е и г. Тогда поляризационная
кривая в общем случае имеет вид,
изображенный на рис. 4.6 в коорди-
координатах Е — lgi.
Участок АВ отвечает малому
Рис. 4.6. Общий вид поляризаци-
поляризационной кривой
значению поляризации и линейной зависимости Е от г. На участке
ВС наблюдается тафелевская зависимость между Е и lg г. И, наконец,
CD — это область предельного диффузионного тока.
Основные закономерности, разобранные в этом разделе, приме-
применимы при анализе реакций, лежащих в основе процесса электрохи-
электрохимической коррозии.
4.5. Общая характеристика электрохимического
коррозионного процесса
В простейшем случае коррозии металлов с образованием их рас-
растворимых продуктов (т.е. ионов Меп+) коррозионные процессы при-
84
Электрохимическая коррозия металлов
Гл. 4
нято называть процессами рас-
растворения металлов. Образование
ионов металла из его атомов, на-
например, в кислом растворе элек-
электролита можно представить сово-
совокупностью реакций:
Me = Меп+ + пе
D.IV)
в которой электроны освобожда-
освобождаются, и
Рис. 4.7. Зависимость скоростей ре-
акций разряда деполяризатора A) Н3О +е = A/2)Н2+Н2О D.V)
и ионизации металла B)
в которой электроны, освободив-
освободившиеся в реакции D.IV), присоединяются к ионам водорода. В ре-
результате на металле одновременно протекают две реакции — анод-
анодная D.IV) и катодная D.V).
Перенос электронов осуществляется на поверхности металла, а
перемещение ионов — в электролите. Явления, которые при этом
происходят, изображены на рис. 4.7.
При протекании электрохимического процесса анодный и катод-
катодный потенциалы Еа и Ек выравниваются и принимают значение
потенциала ЕСТ. Этот потенциал называют стационарным или сме-
смешанным (компромиссным) потенциалом.
При ЕСТ соблюдается равенство катодного и анодного токов, т.е.
liv Ъ
кор?
D.25)
где гкор — скорость коррозии или саморастворения металла.
Если бы при этом электродные процессы не протекали, то потен-
потенциалы электродов сравнялись бы и наступила полная поляризация.
В действительности анодный и катодный процессы продолжают-
продолжаются. Присутствие в растворе деполяризаторов обеспечивает протека-
протекание реакций, в результате которых образуется Н2 или ОН~. Таким
образом, если из двух реакций противоположенного направления,
одновременно протекающих на металле в отсутствие внешнего тока,
одна является реакцией растворения, а другая - реакцией восстанов-
восстановления какого-либо окислительного компонента раствора, например,
ионов водорода, то это и есть коррозионный процесс.
Под коррозией, таким образом, понимают самопроизвольный
процесс, идущий на металле в условиях, когда металл погружен
в раствор и ток от внешнего источника через него не проходит.
4.5. Общая характеристика электрохимического коррозионного процесса 85
Рис. 4.8. Катодная (СВА) и анодная
(CDE) поляризационные кривые,
измеренные на металле при проте-
протекании на нем реакций выделения
водорода и растворения металла
Изучать процессы коррозии
можно и при наложении внешнего
тока. Для получения информации о
скорости коррозии нужно пропус-
пропускать через металл ток (поляризо-
(поляризовать его) и использовать принцип
построения поляризационных кри-
кривых.
Если электрод подключить к
отрицательному полюсу источника
тока, то его потенциал сдвигается
в отрицательную сторону. Подклю-
Подключение электрода к положительному
полюсу дает возможность сдвигать
потенциал в положительную сторо-
сторону. Если фиксировать при этом од-
одновременно значения тока и потен-
потенциала, то можно получить катодную и анодную поляризационные
кривые.
В соответствии с принятым при рассмотрении коррозионных про-
процессов правилом знаков анодное направление реакции рассматрива-
рассматривается как прямое и анодный ток — как положительный, а катодный
ток — как отрицательный. Суммирование токов приводит к полу-
получению величины внешнего тока, протекающего через электрод и
фиксируемого приборами при измерениях. При одновременном про-
протекании на электроде одного катодного и одного анодного процессов
со скоростями соответственно гк и га внешний ток имеет знак тока,
большего по абсолютной величине. Так, при |гк| > |га| внешний ток
гвн отрицателен и по абсолютной величине равен |гк| — |га .
Если токи различного направления сильно различаются друг от
друга, внешний ток практически совпадает с большим из них. Так,
при |гк| ^> \га\ внешний ток гвн = \га\ — \гк\ практически равен га, так
как током гк в последнем равенстве можно пренебречь.
На рис. 4.8 приведены поляризационные катодная (СВА) и анод-
анодная (CDE) кривые выделения Н^ и растворения металла.
Для определения тока коррозии следует проэкстраполировать ли-
линейные участки кривых СВА и CDE до пересечения их друг с другом
в точке К. Соответствующие этой точке потенциал Екор и плотность
тока гкор называются потенциалом коррозии и скоростью коррозии.
Потенциал коррозии часто называют также стационарным или кор-
коррозионным потенциалом. Иногда применяют термин потенциал сво-
свободной коррозии. Прямые АК и КЕ выражают зависимость от по-
86 Электрохимическая коррозия металлов Гл. 4
тенциала истинных скоростей парциальных процессов выделения
водорода и растворения металла.
При катодной поляризации скорость выделения водорода возрас-
возрастает, а скорость растворения металла уменьшается. Таким образом,
при помощи катодной поляризации можно защитить металл от кор-
коррозии. Это явление называется протект-эффектом и используется
при защите металлических конструкций. Оно может быть осуще-
осуществлено или при помощи соединения защищаемого металла с другим
металлом, имеющим более отрицательное значение равновесного
потенциала, или при помощи внешней катодной поляризации.
Предложенное описание коррозионных процессов справедливо
лишь в том случае, если поверхность металла равнодоступна как
для анодной, так и для катодной реакций. Для металла с идеально
однородной поверхностью (например, для жидкого металла) выпол-
выполнение такого условия не подлежит сомнению. Для обычных твер-
твердых (даже очень чистых) металлов из-за неизбежной неоднородно-
неоднородности их поверхности выполнение указанного условия неочевидно.
Это явилось причиной появления на первых этапах развития учения
об электрохимической коррозии металлов представлений, получив-
получивших название теории микроэлементов. Теория предполагала, что ка-
катодное восстановление окислителя (например, выделение водорода)
может происходить только на некоторых участках поверхности кор-
корродирующего металла, а растворение металла возможно на других
участках, так что существует пространственное разделение катод-
катодной и анодной реакций, позволяющее рассматривать коррозионный
процесс как функционирование большого числа «короткозамкнутых
гальванических элементов».
Теория микроэлементов, оказав в целом положительное влияние
на развитие науки о коррозии, не позволяла проводить количествен-
количественную оценку процессов общей коррозии. Академиком Я.М. Колотыр-
киным было показано, что коррозионное поведение твердых метал-
металлов в растворах электролитов можно объяснить, не прибегая к пред-
представлениям о локальных элементах. Напротив, следует принять, что
поверхность металла равнодоступна и для катодной, и для анодной
реакций, составляющих коррозионный процесс. Это, в частности,
было экспериментально подтверждено следующим опытом.
На примере растворения в H2SO4 никеля было показано, что реак-
реакция разряда ионов НзО+ не влияет на скорость растворения металла
(рис. 4.9). Анодная поляризационная кривая 3 на этом рисунке при
потенциалах вблизи потенциала коррозии отклоняется от тафелевой
прямой вследствие снижения анодного тока в результате протекания
катодной реакции выделения водорода B на рис. 4.9) с соизмеримой
4.5. Общая характеристика электрохимического коррозионного процесса 87
скоростью. Внесение поправки на эту реакцию путем алгебраиче-
алгебраического суммирования внешнего анодного тока и скорости выделе-
выделения водорода (найденной газометрически и выраженной в единицах
плотности тока) приводит к получению линейного отрезка поляри-
поляризационной кривой D на рис. 4.9), проходящего через точки анодной
поляризационной кривой, лежащие при достаточно положительных
потенциалах. Приведенные данные показывают, что кинетика анод-
анодного растворения металла остается одной и той же как в присутствии,
так и в отсутствие параллельно протекающего процесса выделения
водорода.
-?,В(с.в.э.)
ОД
0,05
кор
-1ё/(/,А/см2)
Рис. 4.9. Катодная G) и анодная C) поляриза-
поляризационные кривые, измеренные на никеле в 1 н.
H2SO4;
2 — полученная газометрически парциальная кривая
выделения водорода, 4 — найденная алгебраическим
сложением кривых C) и B) парциальная кривая рас-
растворения никеля
Описанные работы составили основу современной теории рас-
растворения металлов. Из них вытекала правомерность приложения к
коррозионным процессам, протекающим на твердых металлах, ко-
количественных законов электрохимической кинетики.
Таким образом, молено считать, что далее на неоднородных ме-
металлах катодные и анодные реакции, составляющие в совокупности
процесс коррозии, не являются пространственно разделенными; при
коррозии имеет место статическое распределение во времени и в
Электрохимическая коррозия металлов
Гл. 4
пространстве этих двух процессов.
В этом случае анализ электрохимических коррозионных процес-
процессов состоит в изучении физико-химических закономерностей от-
отдельно катодных и анодных реакций и условий их совместного осу-
осуществления.
4.6. Коррозионный процесс с водородной деполяризацией
Коррозию металлов, при которой катодная реакция осуществля-
осуществляется с выделением водорода, называют коррозией металлов с водо-
водородной деполяризацией.
Коррозия металлов с водородной деполяризацией имеет место:
• при высокой активности ионов Н+, т.е. в растворах кислот,
например, кислотное растворение железа, цинка и других ме-
металлов;
• при достаточно отрицательных значениях потенциала иониза-
ионизации металла, например, коррозия магния в воде или растворах
солей.
На практике с такими явлениями сталкиваются при хране-
хранении и перевозке кислот, при кислотном травлении металлов, при
получении кислот на стадии абсорбции.
Термодинамически протекание коррозии с выделением водорода
возможно, если Еа < Е^.
Значения равновесного потенциала водородного электрода в за-
зависимости от рН для парциального давления водорода рц2 =0,1 МПа
и рИ2 = 5 • 10~8 МПа (последнее отвечает парциальному давлению
Н2 в атмосфере) представлены в табл. 4.5.
Таблица 4.5
Равновесный потенциал водородного электрода при 25 °С в зависимости
от рН среды
Давление водорода рн2, МПа
5-Ю-8
ОД
Ер, В при рН среды:
0
+0,186
0
7
-0,228
-0,415
14
-0,641
-0,828
Катодный процесс выделения водорода состоит из стадий:
• массопереноса гидратированных ионов водорода к поверхн
сти металла;
• электрохимической стадии разряда НзО+ и образования Н2;
4.6. Коррозионный процесс с водородной деполяризацией 89
• отвода Н2 от поверхности металла.
В щелочных растворах концентрация ионов НзО+ крайне мала
и выделение водорода происходит за счет восстановления молекул
воды:
2Н2О + 2е = Н2 t +2OH"
В большинстве случаев коррозия металлов происходит в раство-
растворах с высокой концентрацией НзО+ и поэтому концентрационная
поляризация по НзО+ не наблюдается.
Главными причинами катодной поляризации является замедлен-
замедленная стадия электрохимического разряда или концентрационная по-
поляризация по молекулярному водороду, связанная с отводом газооб-
газообразного продукта.
Кинетика и механизм выделения Н2 являются большим и са-
самостоятельным вопросом, в изучение и развитие которого значи-
значительный вклад внесли работы ученых научной школы академика
А.Н. Фрумкина. Эти работы широко освещаются в учебниках по
электрохимии. Мы приведем только краткие, основные сведения.
В широком интервале плотностей тока скорость реакции выделе-
выделения Н2 описывается уравнением Тафеля. При плотностях тока мень-
меньших, чем 10~4-10~5 А/см2, зависимость изменения потенциала от
плотности тока является линейной.
Для многих металлов наклон b в координатах Е — Igi равен
118 мВ, что отвечает механизму замедленной стадии разряда с пере-
переносом одного электрона, хотя не исключены и другие механизмы.
Константа а в уравнении Тафеля D.22) зависит от материала като-
катода или материала инородных катодных включений в составе сплавов
и численно определяется как величина перенапряжения при плотно-
плотности тока, равной 1 А/см2. Наиболее высокое перенапряжение наблю-
наблюдается на свинце, ртути, кадмии, цинке.
Поляризация вследствие замедленной диффузии молекулярного
водорода носит название газовой концентрационной поляризации.
Она сопровождает процесс водородной деполяризации, начиная с
самых низких плотностей катодного тока.
В большинстве случаев поляризационная кривая выделения Н2
имеет вид, изображенный на рис. 4.6 (участки АВ и ВС).
На некоторых металлах выделение Н2 сопровождается процес-
процессом наводороживания. При образовании водорода адсорбированный
атом водорода Надс поглощается металлом и диффундирует в его объ-
объем. Атомы Надс скапливаются внутри плоскостей и вакансий кристал-
кристаллической решетки и там рекомбинируются в молекулы Н2. Давление
90
Электрохимическая коррозия металлов
Гл. 4
внутри металла увеличивается и происходит разрыв сплошности ме-
металла.
Таким образом, коррозия металлов с водородной деполяризацией
характеризуется:
• большой зависимостью скорости коррозии металла от рН рас-
раствора;
• большой зависимостью коррозионной стойкости сплавов от их
природы и содержания в них катодных примесей;
• увеличением скорости коррозии во времени, что связано с ро-
ростом посторонних примесей на поверхности металла в резуль-
результате его расторения;
• возможностью появления водородной хрупкости металлов.
4.7. Коррозионный процесс с кислородной
деполяризацией
Процессы коррозии металлов, у которых катодная реакция осу-
осуществляется с участием растворенного в электролите кислорода,
называются коррозией с кислородной деполяризацией.
С кислородной деполяризацией корродируют металлы, находя-
находящиеся в атмосфере или соприкасающиеся с водой и растворами
солей. Это могут быть обшивка судов в речной или морской во-
воде, оборудование охладительных систем химических заводов, маги-
магистральные трубопроводы и т.д. Коррозия металлов с кислородной
деполяризацией является самым распространенным коррозионным
процессом.
Таблица 4.6
Равновесный потенциал кислородного электрода при 25 °С в зависимости
от рН среды
Давление кислорода ро2, МПа
0,021
0,1
^Р(о2/он-) 9 в при рН среды:
0
+1,218
+1,229
7
+0,809
+0,815
14
+0,381
+0,400
В таблице 4.6 приведены зависимости значений равновесного по-
потенциала кислородного электрода от рН. Зависимости представлены
для значений давления кислорода ОД и 0,021 МПа (парциальное дав-
давление О2 в атмосфере).
Значения ?7р(О2/он-) очень положительны, поэтому этот процесс
наблюдается во многих случаях.
4.7.
Коррозионный процесс с кислородной деполяризацией
91
Катодный процесс восстановления О2 включает следующие по-
последовательные стадии:
• растворение кислорода воздуха в электролите;
• перенос растворенного кислорода в объеме электролита к по-
поверхности металла;
• ионизация кислорода;
• массоперенос ионов ОН~ от металла в глубь электролита.
В большинстве случаев наиболее медленными стадиями катод-
катодного процесса являются в спокойных электролитах диффузия кис-
кислорода, а при перемешивании раствора — ионизация кислорода.
В перемешиваемом электролите перенапряжение кислорода при
небольших отклонениях от равновесного потенциала находится в
линейной зависимости от плотности тока. При более высоких значе-
значениях поляризации наблюдается тафелевская зависимость между Е
nig г.
Величина а зависит от материала катода. Для ряда металлов (Fe,
Си, Аи, Pt) постоянная Ъ равна ОД0-=-0,13. Это свидетельствует о том,
что причиной перенапряжения кислорода является замедленность
стадии ассимиляции первого электрона (п = 1).
Однако процесс разряда кислорода осложняется концентрацион-
концентрационной поляризацией. Она возникает вследствие затруднения транспор-
транспортировки кислорода к катоду. Следствием этого, как было разобрано
ранее (см. 4.4.1), является появление предельного диффузионного
тока, не зависящего от потенциала.
Рис. 4.10. Общая поляризационная кри-
кривая для процесса кислородно-водородной
деполяризации
92
Электрохимическая коррозия металлов
Гл. 4
В действительности рост потенциала не может продолжаться без-
безгранично. При достаточном смещении потенциала в сторону отри-
отрицательных значений начнется процесс выделения водорода, который
будет наложен на кислородную деполяризацию. Таким образом, об-
общий вид поляризационной кривой в координатах Е — г представлен
на рис. 4.10. Участок ABC отвечает восстановлению О2. Отрезок
CKD = ij) — предельный диффузионный ток. Отрезок СК характе-
характеризует восстановление О2 на предельном диффузионном токе. Уча-
Участок KDF отвечает совместному процессу ионизации О2 и выделения
Н2. Пунктиром обозначена парциальная кривая выделения Н2.
4.8. Анодная реакция растворения металлов
На рис. 4.11 представлен общий вид поляризационной кривой
анодного растворения металла. Молено различить несколько участ-
участков — активное растворение, пассивация и нарушение пассивности.
В условиях активного растворения скорость процесса при сдви-
сдвиге потенциала Е в положительном направлении закономерно воз-
возрастает. По достижении же некоторого определенного потенциала
скорость растворения резко снижается. Потенциал, при котором это
происходит, называют потенциалом пассивации {EndiC). В этой обла-
области вопреки уравнению электрохимической кинетики скорость рас-
растворения металла снижается при сдвиге потенциала в положитель-
I
Активное состояние
Переходная область
Нарушение пассивности
Логарифм скорости растворения
Рис. 4.11. Зависимость скорости растворения металла от потенциала.
Переходная область соответствует неустойчивому пассивному состоянию металла
4.9. Закономерности растворения металлов в активном состоянии 93
ную сторону, что может быть вызвано образованием оксидных или
гидроксидных пленок.
При смещении Е от потенциала Ешс в положительном направ-
направлении скорость растворения металла, как правило, практически не
изменяется. Металл в этом интервале потенциалов пассивен. Следу-
Следует отметить, что хотя величина тока полной пассивации может быть
ничтожна мала, она никогда не достигает нулевого значения.
По достижении определенного потенциала (Епп на рис. 4.11)
снова имеет место рост скорости растворения металла при сдви-
сдвиге Е в положительную сторону: происходит нарушение пассивного
состояния металла, которое принято называть его активацией или пе-
перепассивацией. Скорость растворения вновь растет с увеличением
положительного значения потенциала. При этом отличие от области
активного состояния состоит в том, что металл растворяется с обра-
образованием ионов высшей степени окисления. Так, железо в активной
области переходит в раствор в виде двухзарядных ионов, а в области
перепассивации — в виде трехзарядных ионов.
4.9. Закономерности растворения металлов в активном
состоянии
Растворение металлов в области активного состояния характери-
характеризуется линейной зависимостью между потенциалом Е и логарифмом
плотности тока.
При рассмотрении механизма анодной реакции растворения ме-
металлов возникает вопрос: связан ли переход металла из кристалли-
кристаллической решетки в раствор с одновременным (в одном акте) отщепле-
отщеплением всех п валентных электронов, участвующих в реакции D.IV),
или такое отщепление осуществляется через ряд последовательных,
например, одноэлектронных стадий:
Me = Ме+ + е D.VI)
Ме+ = Ме2+ + е D.VII)
Me(n-i)+ = Men+ + e
К настоящему времени однозначно установлено, что в подавля-
подавляющем большинстве случаев процессы растворения металлов много-
многостадийны.
Тогда возникает вопрос о том, какая из стадий определяет суммар-
суммарную скорость. Ответ на этот вопрос можно проиллюстрировать на
примере двухстадийного процесса растворения металла Me, проте-
94 Электрохимическая коррозия металлов Гл. 4
кающего с образованием ионов Ме2+ (т.е. при п = 2). Такой процесс
можно представить в виде схемы:
Me -+ Ме+ + е D.IX)
Ме+ -+ Ме2+ + е D.Х)
В этом случае возможны два варианта:
1. Стадия D.IX) протекает заметно медленнее следующей за ней
стадии D.Х) и поэтому лимитирует суммарную скорость про-
процесса. Из тафелевой зависимости для первой стадии
ia = k exp \fiF (Е - Ev) /RT] D.26)
коэффициент Ъ будет определяться уравнением Ъ = 2,3RT/f3F
(где /3 = 0,5) и окажется, таким образом, равным 118мВ (см.
раздел 4.4.2)
2. Лимитирующей является стадия D.Х). В этом случае образую-
образующиеся в стадии D.IX) ионы Ме+ будут накапливаться у поверх-
поверхности металла до тех пор, пока не будет достигнута их концен-
концентрация, обеспечивающая возможность протекания обратного
процесса (восстановления Ме+ до металла). Тогда на металле
установится равновесие
Me ±+ Ме+ + е D.XI)
Соответствующий этому равновесию потенциал будет опреде-
определяться уравнением:
Е = Ер + B,3i2T/F) lgaM+, D.27)
где Ер — равновесный потенциал реакции D.XI). Если подставить
Е из уравнения D.27) в уравнение D.20), то после преобразований
получим уравнение:
где К' — константа. При п = 1, получим:
6=^=^0,059 «0,04В. D.29)
Такой «нестандартный» наклон прямолинейной зависимости lg ia
от Е может служить одним из признаков электрохимической реак-
реакции растворения металла до двухзарядных ионов Ме2+ по двух-
стадийному механизму с замедленной стадией отщепления второго
электрона.
4.10. Анодное растворение металлов с участием компонентов раствора 95
4.10. Анодное растворение металлов с участием
компонентов раствора
Изложенные в предыдущих разделах вопросы механизма корро-
коррозионных процессов относились к случаям, когда скорости собствен-
собственно анодных реакций растворения металлов не зависели от состава
раствора. В действительности же нередко на скорости процессов
растворения, явно лимитирующимися электрохимическими стадия-
стадиями, влияет не только потенциал, но (при постоянном потенциале) и
концентрации некоторых компонентов раствора, чаще всего анионов
электролита. Эти эффекты нашли объяснения на основе развитого
Я.М. Колотыркиным учения, согласно которому электрохимические
реакции ионизации атомов металла, как правило, включают ста-
стадии химического или адсорбционно-химического взаимодействия
поверхностных атомов металла с компонентами среды. Такое взаи-
взаимодействие приводит к образованию устойчивых или промежуточ-
промежуточных комплексов металла с компонентами раствора непосредственно
в электрохимической стадии. При хемосорбции компонента, участ-
участвующего в реакции растворения металла, реализуется определенная
прочность связи между адсорбированной частицей и электродом и
определенная степень заполнения поверхности, возрастающие по
мере смещения потенциала в положительном направлении и опре-
определяющие скорость растворения металла.
В качестве участников реакции при растворении металлов мо-
могут выступать различные анионы, а также молекулы растворителя.
При одновременном нахождении в растворе нескольких компонен-
компонентов различной природы возможно их участие либо в параллельных,
либо в последовательных стадиях.
При параллельном протекании двух реакций растворения метала
с участием анионов А^ и А^":
Me + МГ -> Me(Ai)j,ni"^)+ + ще" D.ХП)
Me + qA^ -+ Me(A2)Jn2"g)+ + n2e"
эти анионы могут либо не мешать друг другу (при малых степенях
заполнения в), так что каждая из реакций будет протекать на всей
поверхности электрода, либо может иметь место конкурирующая ад-
адсорбция указанных анионов, при которой идет их «борьба» за место
на электроде и соответственно за участие в электродной реакции. В
первом случае скорость растворения металла выражается уравнением:
96 Электрохимическая коррозия металлов Гл. 4
ia = кгарАг exp (PiniFE/КГ) + k2a%2 exp (f32n2FE/RT),l D.30)
где a — активность анионов, Ди^ — коэффициенты переноса.
Из D.30) следует, что при определенных соотношениях между
активностями анионов А^ и А^ одним из слагаемых в выражении
для %а можно пренебречь. В этих условиях суммарная скорость про-
процесса практически определяется скоростью одной из реакций D.XII)
или D.ХШ). При «промежуточных» значениях активностей анионов
А^ и А^ и потенциалов, когда оба слагаемых в уравнении D.30) со-
соизмеримы, зависимость ia от адх, «а2 и Е заметно отличается от той,
которая имеет место в растворах, содержащих ионы только одного
вида.
Указанный механизм независимого, параллельного протекания
двух реакций реализуется сравнительно редко. Чаще же адсорбция
одного из анионов приводит к изменению условий и закономерно-
закономерностей адсорбции другого аниона. Например, возможно выполнение
уравнения:
ia = fciGi exp (pimFE/RT) + к2в2 exp (/32n2FE/RT), D.31)
где 0i и 02 — степени заполнения поверхности электрода анионами
А^ и А<2~.
Взаимное влияние частиц, адсорбирующихся на металле при его
растворении, может иметь и иной характер. А именно, возможно, что
адсорбция одного из компонентов будет способствовать адсорбции
другого компонента с образованием комплекса, включающего обе
адсорбированные частицы.
В результате конкурирующей адсорбции двух находящихся в рас-
растворе частиц — участников реакции растворения металла, одна из
них может вызвать замедленное растворение. Это может быть в тех
случаях, когда частица Ai, растворение с участием которой проис-
происходит медленнее, чем с частицей А2, обладает большей адсорбци-
адсорбционной способностью. Вытесняя с поверхности кинетически более
активный компонент А2, частица Ai будет тормозить растворение.
По такому механизму замедляется, например, растворение железа в
серной кислоте под действием добавок ионов хлора.
Адсорбированные на металле частицы могут тормозить раство-
растворение и в отсутствие в растворе второй адсорбирующей частицы.
По теории Колотыркина, функции адсорбирующегося компонента
(стимулирование или замедление растворения) определяются соот-
1 Здесь и ниже величина Ер в уравнении для га включена в константу
4.11. Коррозионные диаграммы 97
ношением прочностей связи адсорбированного компонента с метал-
металлом и с сольватирующими его молекулами. Для проявления частицей
ускоряющего действия на растворение металла она должна быть до-
достаточно прочно связана и с металлом, и с раствором. Если связь с
сольватной оболочкой относительно слаба, а с металлом очень проч-
прочна, частица утрачивает связь с раствором, остается на поверхности
металла и замедляет его растворение.
При оценке роли компонентов среды в процессе растворения
металла необходимо принимать во внимание, что его поверхность
обычно энергетически неоднородна, т.е. адсорбция даже одной и той
же частицы на одних участках поверхности может быть стимулиру-
стимулирующей, а на других — ингибирующей. То же относится и к частицам
разной природы при их совместном нахождении в растворе. Суще-
Существенно при этом, что прочность связи адсорбированной частицы с
металлом, а, следовательно, и производимый ею эффект, зависит от
потенциала. Это, в частности, может приводить к отклонению кри-
кривой Е — lgi, характеризующей электрохимическое поведение ме-
металла, от обычной прямолинейной зависимости, что наблюдается,
например, при растворении железа в солянокислых растворах. Сти-
Стимулирующая адсорбция — процесс очень быстрый по сравнению с
адсорбцией ингибирующей.
4.11. Коррозионные диаграммы
Отдельно полученные анодные и катодные поляризационные кри-
кривые еще не описывают скорость коррозионного процесса. Последняя
определяется скоростью протекания самой медленной, лимитирую-
лимитирующей стадии. Эту стадию называют контролирующим фактором. Для
его определения наибольшее распространение получил графический
метод.
По этому методу анализ коррозионных систем принято проводить
с помощью диаграмм, на которых графически отражена кинетика
анодной и катодной реакций. Наиболее удобную форму диаграмм
предложил английский коррозионист Эванс. На этих диаграммах
значение потенциала откладывается по ординате, а по оси абсцисс
откладывают величины и анодного, и катодного токов, вне зави-
зависимости от того, что они имеют противоположенное направление
(рис. 4.12).
Вверх по ординате откладывают отрицательные значения потен-
потенциала. Отмечают стационарное значение ЕаиЕки снимают анодную
и катодную поляризационные кривые. Точка пересечения этих кри-
кривых указывает на максимальную плотность тока коррозии imax. При
Электрохимическая коррозия металлов
Гл. 4
-Е
д
-Е
\
Рис. 4.12. Виды контроля коррозионного процесса
этом устанавливается общий потенциал коррозии Екор.
Коррозионные диаграммы позволяют определить тормозящий
(контролирующий) фактор процесса коррозии. Это очень важно при
выборе метода защиты от коррозии, так как, как правило, наиболее
эффективно воздействовать на лимитирующую стадию процесса.
Значительная поляризация процесса видна из большой величины
наклона соответствующей поляризационной кривой. Пологая кри-
кривая указывает на малую затрудненность реакции. Например, при
значительной анодной поляризации и малой величине катодной по-
поляризации потенциал коррозии Екор близок к катодному потенциалу
Ек до прохождения тока.
Если АЕа^АЕк, то коррозия протекает с анодным торможением,
если АЕК ^> АЕа, то коррозия протекает с катодным контролем. Если
АЕК « АЕа — имеет место смешанный контроль.
Н.Д. Томашов определил, что в практических условиях встреча-
4.12. Зависимость скорости коррозии от состава раствора 99
ются шесть основных случаев контроля коррозии, которые представ-
представлены на рис. 4.12.
Катодный контроль (АЕК ^> АЕа):
^.Тормозящий фактор — трудность реакции восстановления мо-
молекул О2. Встречается в нейтральных растворах при хорошем пере-
перемешивании.
Б. Тормозящий фактор — диффузия кислорода. Диаграмма харак-
характерна для коррозии в неперемешиваемых нейтральных растворах.
Так корродируют железо, цинк и некоторые другие металлы.
В. Лимитирующий фактор — трудность реакции разряда ионов
водорода. Характерна для процесса коррозии железа и цинка в кис-
кислых растворах.
Г. Смешанный катодно-анодный контроль (АЕК « АЕа). Диа-
Диаграмма характерна для коррозии железа, сталей, алюминия и других
металлов в пассивном состоянии.
Д. Смешанныйкатодно-омическийконтроль (АЕК^> АЕа, R^ 0).
Коррозия протекает в среде с низкой электропроводностью. Напри-
Например, коррозия подземных трубопроводов.
Е. Смешанный катодно-анодно-омический контроль (АЕк^АЕа,
R^O). Наблюдается этот вид контроля у металлов, склонных к пас-
пассивации при большом омическом сопротивлении электролита, на-
например, при атмосферной коррозии сталей.
4.12. Зависимость скорости коррозии от состава раствора
Если известны зависимости парциальных скоростей двух реак-
реакций, составляющих коррозионный процесс, от потенциала и от со-
состава раствора, то можно получить выражения для потенциала кор-
коррозии и скорости коррозии в зависимости от состава раствора. В
качестве примера ниже рассмотрен случай коррозии металла с во-
водородной деполяризацией. При этом принято, что процесс коррозии
определяется реакциями:
Me <=* Ме2+ + 2е
Скорости парциальных анодной и катодной реакций суммарного
коррозионного процесса выражаются в этом случае уравнениями:
га = А;аехр [2[3F(E - EV)/RT] и D.32)
iK = ккая+ exp [aF(E - Ep)/RT], D.33)
100 Электрохимическая коррозия металлов Гл. 4
где ан+ — активность ионов Н+, /3 и а — коэффициенты переноса
для анодной и катодной реакций.
Условием протекания коррозионного процесса в отсутствие внеш-
внешнего тока является равенство скоростей га и гк. Из этого равенства
следует:
А;аехр [2f3F(Emp - Ep)/RT] = ккая+ exp [aF(Emp - Ep)/RT].
D.34)
Значение Екор вместо Е в этом уравнении подставлено потому, что
равенство D.34) реализуется только при потенциале коррозии.
Решение уравнения D.34) относительно Етр приводит (после
логарифмирования обеих его частей) к выражению:
^ wfh D-35)
или
fh D-36)
где К" — константа.
Из уравнения D.36) следует, что с ростом рН раствора потенциал
коррозии линейно смещается в отрицательном направлении, причем
наклон прямой Екор — рН равен:
dEmp/ dpH = 2,3i?T/B/3 + a)F. D.37)
Если принять /3 = а = 0,5, то dEKOp/ dpH « 40 мВ.
Полученное выражение D.36) для потенциала коррозии можно
использовать для вывода уравнения зависимости скорости корро-
коррозии от рН раствора. Для этого в уравнения D.19) следует вместо Е
подставить Екор из D.36), а га заменить на гкор. Такая подстановка с
учетом того, что Ер включено в константу, приводит к следующему
выражению для гкор:
гкор = fcexp [(V - ^Щ^рн) 2/3F/2,3i?TJ . D.38)
Уравнение D.38) в логарифмической форме имеет вид:
lgiKop = К + [к" - BУ^рн) 2/3^/2,ЗЛГ. D.39)
Объединение констант приводит к уравнению:
lgiKOp = ir"-^pH. D.40)
4.13.
Растворение двух металлов при их контакте
101
Уравнение D.40) показывает, что в случае, если коррозионный
процесс описывается реакциями D.VI) и D.VII), причем металл рас-
растворяется до Ме2+, логарифм скорости коррозии линейно снижается
с ростом рН раствора. Наклон прямой, выражающей такую зависи-
зависимость, при а = /3 = 0,5 равен d lgiKOp/ cfpH = —1,33.
Рассмотренный пример показывает, что, зная зависимости от со-
состава раствора (в частности от рН) скоростей парциальных реакций,
составляющих коррозионный процесс, можно установить, как с из-
изменением состава раствора меняется скорость коррозии. С другой
стороны, этот пример показывает, как важно располагать инфор-
информацией о зависимости скоростей парциальных реакций от состава
раствора.
4.13. Растворение двух металлов при их контакте
Если образцы двух разных металлов (Mi и М^) находятся в рас-
растворе в контакте друг с другом, для описания коррозионного пове-
поведения каждого из них можно использовать те же подходы, что и при
рассмотрении коррозии одного металла. А именно, построить зави-
зависимости Е — lg гк и Е — lg га для того и другого металлов (в расчете на
Ем2
кор
кор
кор
• М
1 кор
1 /М2
•М2(МГМ2)
1кор
Рис. 4.13. Схематические зависимости Е — lg га G, 3)
uE-\giKB,4)
для Mi G, 2) и Мг C, 4), а также зависимость от
потенциала суммарных плотностей катодного E) и анод-
анодного F) тока, характеризующих систему, состоящую из
контактирующих металлов Mi
102 Электрохимическая коррозия металлов Гл. 4
единицу поверхности каждого из металлов) и проанализировать эти
зависимости. Ниже рассмотрен случай коррозии с водородной депо-
деполяризацией. Для простоты принято, что поверхности обоих образцов
одинаковы.
Указанные зависимости в схематическом виде приведены на
рис. 4.13. В соответствии с данными этого рисунка, в отсутствие кон-
контакта Mi и М2 корродируют со скоростями соответственно г^ и г^
(при Е^?± и Е^?). При контакте Mi и М2 зависимости от потенциала
суммарных скоростей катодного и анодного процессов для системы в
целом характеризуются штриховыми прямыми 5 и 6. Условие равен-
равенства этих скоростей выполняется при Е = Е^~М2 (см. рис. 4.13).
Таким образом, на обоих контактирующих металлах в отсутствие
внешнего тока устанавливается потенциал E^?±~M2. При этом потен-
потенциале на Mi с большой скоростью выделяется водород (эта скорость
.Mi(Mi-M2L
равна гН2 ), в то время как сам металл растворяется с очень
« .Mi(Mi-M2L тт
низкой скоростью, равной гкору '). На другом металле, напротив,
, .М2(М1-М2)ч
водород выделяется медленно (со скоростью гЯ2 ), а процесс
с- , .М2(М1-М2)ч
растворения идет быстро (его скорость равна гкор ).
4.14. Растворение железа в кислых растворах
Для иллюстрации практического применения изложенных выше
методов исследования электрохимических реакций рассмотрим ме-
механизм коррозии железа.
Стандартный электродный потенциал железа равен E®q2+ /Fe =
= —0,44 В, a E®q3+ /Fe = —0,037 В. Поэтому при коррозии железа в
раствор переходят катионы Fe2+.
Здесь рассматривается механизм, предложенный Бокрисом и по-
получивший широкое распространение. Этот механизм не учитывает
участия анионов раствора в процессе растворения и поэтому требует
внесения существенных поправок, что будет показано ниже.
Рассмотрим растворение железа в кислых растворах. Анодное
растворение этого металла ускоряется с ростом рН раствора: тафе-
левы прямые для растворов с постоянной концентрацией сульфата,
но переменной кислотностью, с ростом рН раствора закономерно
смещаются в направлении, соответствующем сдвигу потенциала в
отрицательную сторону. Наклон тафелевых прямых, независимо от
рН, составляет 40 мВ (рис. 4.14), а эффект ускорения растворения
характеризуется десятикратным увеличением га (при Е = const) при
увеличении рН на единицу (рис. 4.15). Другими словами, порядок
4.14.
Растворение железа в кислых растворах
103
анодной реакции растворения железа по ионам водорода равен —1.
Это с учетом найденного тафелевого наклона дает возможность при-
принять следующую схему процесса.
-Е, В (с. в. э.)
0,4
0,3
0,2
0,1
4 3 2 2
-lg / (/, А/см )
Рис. 4.14. Анодные поляризацион-
поляризационные кривые для железа в растворах
H2SO4 + Na2SO4 при 1 н. концен-
концентрации сульфата и различных рН:
1 — 0,2; 2— 1,2; 3 — 2,3
рН
Рис. 4.15. Зависимость скоро-
скорости растворения железа в рас-
растворах H2SO4 + Na2SO4 при
Е = -0,2ВотрНприС8О2- =
1
На поверхности железа адсорбируются молекулы Н2О, подвер-
подвергаясь при этом диссоциации. Такая диссоциативная адсорбция при-
приводит к образованию поверхностного комплекса Fe(OH)^c
D.XIV)
За адсорбционной стадией D.XIV) следует электрохимическая
реакция отщепления первого электрона от атома железа, связанного
с частицей ОН~:
Fe(OH)"c U Fe(OH)a
D.XV)
причем стадия D.XV) предшествует замедленной стадии отщепле-
отщепления второго электрона и поэтому является равновесной. Стадия, ли-
лимитирующая скорость всего процесса, имеет вид:
Fe(OH)a
FeOH+ + e
D.XVI)
и сопровождается диссоциацией комплекса FeOH+ в растворе:
FeOH+ + Н+ ?5 Fe2+ + H2O D.XVII)
104 Электрохимическая коррозия металлов Гл. 4
То, что схема D.XIV)-D.XVII) соответствует приведенным экс-
экспериментальным данным, вытекает из уравнения для скорости ре-
реакции, отвечающего этой схеме. С учетом замедленности стадии
D.XVI) для скорости растворения железа справедливо уравнение:
Ч = ?а(РеОн)адс exp (CFE/RT). D.41)
Величину а(РеОнадс) можно найти с помощью уравнения Нернста для
стадии D.XV):
Е = Ер + — Ы^^, D.42)
F a
подставив в него «(РеОн)~ из уравнения диссоциации для стадии
D.XIV):
a(FeOH)-c = К/аи+. D.43)
Совместное решение уравнений D.42) и D.43) приводит к выраже-
выражению:
«(Реон)адс = k'a'l exp (FE/RT). D.44)
Подстановка D.44) в D.41) дает уравнение для скорости растворения
железа:
-lg ia (i, А/см ) . 7 / -1
ia = k'a'l exp [A + /3) FE/RT].
D.45)
Как видно, требуемые уравнением
D.45) тафелев наклон dE/ d\gia =
= 2,3i?T/(l + p)F (при /3 = 0,5
равный 40 мВ) и порядок реакции по
~о~~ ионам Н+ dlgia/dlgaR+ = — 1 при
Е = const действительно совпадают
с соответствующими эксперименталь-
Рис. 4.16. Зависимость скоро- Ными значениями.
сти растворения железа в рас- ^
творах H2SO4 + Na2SO4 при Растворение этого металла ускоря-
Е = -0,2 В от CSO2- при рН = ется не только с ростом рН, но (при
= з,о4 постоянных рН) и с ростом концентра-
концентрации анионов раствора, например суль-
сульфата (рис. 4.16), причем порядок реакции по анионам близок к еди-
единице. Такой результат согласуется с предположением о том, что за
рассмотренными выше стадиями D.XIV) и D.XV) следуют стадии
(FeOH)aiIC + (ШО^адс = Fe2+ + SO2" + Н2О + е D.XVIII)
/аде
ИЛИ
+ (SO^")aAC = Fe2+ + SO^" + ОН" + е D.XIX)
4.15. Механизм анодного растворения сплавов 105
которые лимитируют скорость всего процесса. При этом совокуп-
совокупности последовательных реакций D.XIV), D.XV), D.XVIII), а также
D.XIV), D.XV), D.XIX) протекают параллельно, так что для сум-
суммарной скорости растворения железа можно записать:
%а = A;/a(FeoH)?WC%so- exP (PFE/КГ) +
(PFE/RT). D.46)
Если принять, что константы скоростей реакции с участием ионов
обоих видов близки по величине (к = к' « к"), то уравнение D.46)
можно переписать в виде:
+ aso24~) exP (/3FE/RT), D.47)
или, обозначая сумму (%so- + aso2~) чеРез ac? а также учитывая
D.XIV) и D.XV) и логарифмируя, в виде:
lgia = к'" + рН + lgac + A + /3) FE/2.3RT. D.48)
С последним уравнением хорошо согласуется найденная экспе-
экспериментально зависимость скорости растворения железа от состава
кислых сульфатных растворов, показавшая, что lg ia при Е = const
линейно связан с суммой lg ac + рН (ac — суммарная аналитическая
концентрация сульфата).
4.15. Механизм анодного растворения сплавов
В предыдущих разделах были рассмотрены законы растворения
индивидуальных металлов. При этом было показано, что эти законы
применимы и для описания коррозионного поведения систем, состо-
состоящих из двух разных металлов, находящихся в растворе в контакте
друг с другом. Иначе обстоит дело со сплавами, представляющими
собой твердые растворы. Простое приложение к ним представлений,
развитых для индивидуальных металлов, оказывается недостаточ-
недостаточным. Ряд особенностей коррозионно-электрохимического поведения
сплавов может быть объяснен только при дополнительном привле-
привлечении некоторых новых представлений.
Действительно, составляющие сплав металлы из-за различия их
природы имеют разные скорости растворения и различаются по дру-
другим кинетическим характеристикам. В то же время в подавляющем
большинстве случаев в стационарных условиях сплавы растворяют-
растворяются равномерно, т.е. их компоненты переходят в раствор с близкими
скоростями. Объяснить это можно несколькими причинами.
106 Электрохимическая коррозия металлов Гл. 4
Предположим, что имеется сплав, состоящий из разных метал-
металлов (более активного компонента А и более благородного компонен-
компонента Б). Механизм растворения, предложенный В. Мюллером, а также
Н.Д. Томашовым, пока нашел подтверждение лишь для растворения
очень небольшого числа сплавов. Суть его сводится к следующему.
Принимается, что непосредственно в первый момент соприкоснове-
соприкосновения сплава с раствором каждый из компонентов сплава растворяется
с той же скоростью, с какой он растворяется в индивидуальном со-
состоянии, т. е. А — очень быстро, а Б — медленно. Это приводит к
обогащению поверхности компонентом Б, что, в свою очередь, вызы-
вызывает снижение скорости перехода в раствор А (в расчете на единицу
видимой поверхности электрода) и увеличение скорости выхода из
сплава Б (так как А теперь растворяется с меньшей, а Б — с большей
доли поверхности). Изменение степени покрытия электрода в ком-
компонентами А и Б происходит до тех пор, пока вд и 0б не достигнут
значений, удовлетворяющих условию равномерного и стационарно-
стационарного растворения сплава. В этом случае соотношение концентраций
ионов обеих металлов в растворе то же, что отношение масс этих
металлов в сплаве.
Степень «неравномерности» растворения компонентов сплава ха-
характеризуют коэффициентом избирательности, или коэффициентом
селективности Z. Это — величина, показывающая, во сколько раз
отношение количеств А и Б в растворе отличается от отношения
количеств этих металлов в сплаве. Например, для компонента А
где гА и г^ ' — скорости растворения в расчете на единицу видимой
поверхности сплава, Сд и Сб — концентрации А и Б в сплаве.
В нестационарном режиме растворения сплава АБ Z& > 1 (отно-
(относительное содержание А в растворе больше, чем в сплаве). В стаци-
стационарных условиях Za = Z^ = 1.
Следует иметь в виду, что последний из рассмотренных меха-
механизмов предполагает сохранение г а и г^ при растворении сплава (в
расчете на единицу поверхности, занимаемой данным компонентом)
такими же, какими они были при растворении соответствующих ин-
индивидуальных металлов.
В отличие от этого другой механизм — замедленная диффузия бо-
более активного компонента в объеме сплава — предполагает отличие
i(c) отг(м) (г(м) —скорость растворения индивидуального металла).
В согласии с этим механизмом, первоначально также имеет место
4.15. Механизм анодного растворения сплавов 107
преимущественный переход в раствор компонента А и обогащение
поверхности компонентом Б. Однако, по этой теории изменение со-
состава сплава распространяется и в глубь твердой фазы. В течение
нестационарного периода толщина 6 поверхностного слоя изменен-
измененного состава возрастает, причем в этом слое существует градиент
концентраций А и Б: содержание А меняется практически от нуля на
границе сплав-раствор до объемной концентрации Сд в сплаве на
глубине 5 от его поверхности; содержание Б на тех же границах ме-
меняется примерно от 100 % до Сб. В соответствии с этим происходит
встречная диффузия компонента А из объема сплава к его поверх-
поверхности и Б — от поверхности в глубь сплава. Скорость перехода А
в раствор определяется величиной S, снижаясь при ее увеличении.
Эта скорость зависит и от коэффициента диффузии D компонента А
в слое 6.
Стационарный режим растворения сплава достигается тогда, ко-
когда соотношение скоростей диффузии А в сплаве и растворения Б
с поверхности обеспечивает равномерное растворение сплава. Это
условие выполняется при определенной толщине поверхностного
слоя измененного состава S = 5Ст (обычно составляющей 10~6-
10~5 см). Скорость растворения сплава в стационарном режиме ли-
лимитируется, таким образом, диффузией А в объеме сплава.
Растворение сплавов по механизму замедленной диффузии А в
твердой фазе, исследованное в работах В.В. Лосева и других ученых,
доказано для латуней, сплавов олово-цинк, индий-цинк и многих
других.
Растворение сплавов в условиях, когда скорость процесса до-
достаточно велика, так что поверхностный слой измененного состава
конечной толщины образоваться не может, происходит по механиз-
механизму Колотыркина. Согласно этому механизму, один из компонентов
сплава растворяется по кинетике, свойственной этому компоненту в
индивидуальном состоянии, а переход в раствор второго компонен-
компонента определяется поведением первого и потому описывается той же
кинетикой. Поясним это.
Пусть С а ^> Сб. Поскольку для чистых А и Б ^а ^ А Дв
начальной стадии растворения переходит в раствор с большей ско-
скоростью, оставляя на поверхности атомы Б. Лишенные связей с со-
соседями, атомы Б приобретают способность переходить в раствор со
скоростью, превышающей скорость растворения Б в индивидуаль-
индивидуальном состоянии. По причине некоторого снижения поверхностной
концентрации А в этих условиях, скорость растворения А, напро-
напротив, понижается по сравнению со скоростью растворения А из чи-
чистой металлической фазы. Скорость выхода Б в раствор определя-
108
Электрохимическая коррозия металлов
Гл. 4
-Е,
0,6
0,5
0,4
0,3
0,2
В (с
в.э.)
3'
i
5
1
4
-lg/
1 1
3 2
(i, А/см2)
i
1
Рис. 4.17. Зависимость от потенциала парци-
парциальных скоростей растворения
железа A-4) и хрома G7-37) из сплава Fe-0,85 % Сг
при различных рН: 1, I1 — 0,03; 2, 21 — 1,84;
3, З7 —3,01; ? — 3,91
ется скоростью растворения А, поскольку чем эта последняя выше,
тем больше вероятность потери атомами Б соседей и тем больше
скорость их выхода из решетки.
Если же С а <С Сб при «а ^ *б > поверхность в начальных ста-
стадиях процесса сильно обогащается компонентом Б. Скорость рас-
растворения сплава в целом определяется кинетикой растворения этого
компонента, в то время как компонент А растворяется сразу по-
после его попадания на поверхность (что возможно после растворения
Б, который, таким образом, лимитирует скорость растворения А).
Компонент Б в этих условиях играет определяющую роль, причем
скорость его растворения хотя и слабо, но повышена по сравнению
со скоростью растворения чистого металла. Компонент же А раство-
растворяется значительно медленнее, чем чистый металл, и по кинетике,
предписываемой компонентом Б.
В соответствии с механизмом Колотыркина, существуют гранич-
граничные составы сплавов, характеризующие переход от сплавов, кине-
кинетика растворения которых определяется одним из компонентов, к
сплавам, растворяющимся по кинетике, свойственной второму ком-
компоненту.
Изложенные представления можно иллюстрировать на примере
коррозионно-электрохимического поведения сплавов железо-хром.
Механизмы растворения составляющих эти сплавы металлов замет-
заметно отличаются друг от друга. Растворение железа, как указывалось
выше, ускоряется с ростом рН раствора. Скорость того же процесса
для хрома от кислотности не зависит.
На рис. 4.17-4.20 показано влияние кислотности сернокислых
растворов на стационарные парциальные скорости активного рас-
4.15.
Механизм анодного растворения сплавов
109
4 -
5 -
творения железа и хрома из сплавов раз-
различного состава. На рис. 4.17 представ-
представлены зависимости от потенциала парци-
парциальных скоростей растворения железа и
хрома из сплава Fe-0,85 % Cr в раство-
растворах различной кислотности. Отношение
количеств железа и хрома, переходящих
в раствор, как это следует из сравнения
токов на парциальных кривых для железа
и хрома, хорошо согласуется с отноше-
отношением этих элементов в исходном сплаве,
что говорит о равномерном растворении
сплавов. С ростом рН раствора скорость
растворения железа из сплава при всех
потенциалах возрастает. То же наблюда-
наблюдается и для растворения хрома из сплава.
Результаты, представленные на рис.
4.17, суммированы на рис. 4.18. Послед-
Последний показывает, что закономерности вли-
влияния рН на кинетику активного растворе-
растворения железа и хрома из их сплавов с 0,85% хрома аналогичны соответ-
соответствующим закономерностям для чистого железа (<91gi^e'Cr/<9pH =
= 1). Иная картина наблюдается для сплава с 13 % Сг. В этом случае,
как следует из рисунков 4.19 и 4.20, указанные закономерности сов-
совпадают с известными для хрома.
Рис. 4.17-4.20 показывают, что сплавы Fe-Cr можно разделить
0 12 3 4
рН
Рис. 4.18. Влияние рН рас-
раствора на парциальные ско-
скорости растворения
железа G) и хрома B) из спла-
сплава Fe-0,85 % Cr в растворах
H2SO4 + Na2SO4 при Е =
=-0,34В
0,3 -
0,2 -
-lg / (/, А/см2)
Рис. 4.19. Зависимость от потенциала парци-
парциальных скоростей растворения
железа G, 2) и хрома C, 4) из сплава Fe-13 % Cr в
растворах H2SO4 + Na2SO4 при различных рН: 7,
3 — 0,0; 2, ?—1,78
3
5
ПО Электрохимическая коррозия металлов Гл.4
на две группы: сплавы, растворяющиеся по кинетике, свойственной
железу, и сплавы, кинетические характеристики которых совпадают
с соответству-ющими характеристиками хрома. Граничному составу
сплава, разделяющими сплавы Fe-Cr на эти две группы, отвечает
сплавРе-12%Сг.
Все рассмотренные выше механизмы растворения сплавов объ-
объясняют равномерный характер этих процессов в стационарных усло-
условиях. В некоторых случаях сплавы даже в
-lg i (i А/см2) стационарном режиме растворяются не рав-
равномерно, а избирательно, т.е. с преимуще-
преимущественным переходом в раствор более актив-
активного компонента (это имеет место, напри-
например, при коррозии латуни в морской воде,
когда наблюдается эффект обесцинкования
латуни). В таких случаях обычно первона-
J{—^—з—4~ чально в растворе обнаруживается избыток
рН компонента А, затем относительное содер-
Рис 4 20 Влияние рН жание А и Б в растворе становится таким
раствора на парциаль- же> как в сплаве (что соответствует условию
ные скорости растворе- Z = 1), и наконец опять А оказывается в
ния избытке, причем избыток А (т.е. Z^ > 1)
железа G) и хрома B) из сохраняется в течение всего последующего
творах H2"sO4/O+CNa2SO4 пеРи°Да растворения сплава. Причина тако-
при Е = -0,4 В го явления заключается в том, что, перейдя в
раствор в заметных количествах, компонент
Б снова осаждается на электроде. Осаждение происходит электро-
электрохимически и возможно потому, что состав поверхностного слоя на
электроде становится отличным от исходного состава сплава. В этом
случае на поверхности сплава удается наблюдать нарастание тол-
толстого пористого осадка чистого металла Б. Растворение сплавов по
механизму такого обратного осаждения более благородного компо-
компонента называется псевдоизбирателъным.
4.16. Аномальные явления при растворении металлов
Наряду с многочисленными данными, подтверждающими элек-
электрохимический механизм растворения металлов, иногда получают
результаты, не согласующиеся с этими представлениями.
Это относится, например, к явлению ускорения выделения водо-
водорода на некоторых металлах при смещении их потенциала от Екор
в положительном направлении. По законам электрохимии в этих
условиях объем выделяющегося водорода должен уменьшаться. В
4.16.
Аномальные явления при растворении металлов
111
1
действительности же выход по току Н2 возрастает. Например, для
алюминия в некоторых растворах выход по току этой реакции пре-
превышает 100% в 10 раз.
Из большого числа аномальных явлений едва ли не первое ме-
место занимает эффект независимости скорости растворения метала,
находящегося в активной области, от потенциала Е. Это относит-
относится к растворению амальгам щелочных металлов, железа, никеля,
хрома, цинка, алюминия и его сплавов, кобальта, марганца, титана,
германия, меди, сплавов на основе железа. Для этих металлов было
установлено, что выход по току реакций
их растворения в определенных условиях
превышает 100%.
На рис. 4.21 представлены кри-
кривые растворения железа, хрома и ни-
никеля при смещении потенциала актив-
активной области в отрицательную сторону.
Как видно из приведенных данных при
отрицательных значениях потенциала не
реализуются свойственные электрохими-
электрохимическим реакциям тафелевые зависимости
между скоростью растворения металла и
потенциалом.
Описанные эффекты отклонения в по-
поведении металлов от законов электрохи-
электрохимической кинетики имеют место в самых
разных условиях и носят систематический
характер. Для этих эффектов был установлен термин «аномальные
явления» при растворении металлов.
Аномальное растворение железа при катодной поляризации уси-
усиливается при введении в раствор окислителей, в частности Н2О2,
Сг2Оу~. Ускорение этого процесса в кислых средах наблюдается при
переходе от чистого железа к сплавам на его основе. Увеличение ско-
скорости растворения металла при переходе от анодной поляризации к
катодной установлено и для платинированного титана в морской во-
воде, содержащей ионы Са2+ и Mg2+.
Вызывает несомненный интерес и то, что процессы аномального
растворения тормозятся по достижении потенциалов пассивации.
При рассмотрении этого явления наибольшее внимание исследо-
исследователей привлекли представления о возможном растворении метал-
металлов по химическому механизму наряду с процессом электрохимиче-
электрохимического растворения. Первым эту мысль сформулировал А.Н. Фрум-
кин, указавший на возможность снижения энергии активации уда-
4 3 2
-lg / (/, А/см2)
Рис. 4.21. Зависимость от
потенциала скоростей рас-
растворения
хрома G), железа B) и никеля
C) в 1 н. серной кислоте при
50°С
112 Электрохимическая коррозия металлов Гл.4
ления атомов металла из кристаллической решетки за счет энергии,
освобождающейся при разряде ионов водорода.
При истолковании химического растворения необходимо прини-
принимать в расчет реакции протекания процесса через стадии комплек-
сообразования металла с компонентами раствора. Поскольку в каче-
качестве таких комплексообразователей способны выступать компонен-
компоненты, обладающие окислительными свойствами, растворение можно
рассматривать как процесс непосредственной передачи электрона
от металла лиганду в адсорбированном промежуточном комплексе
металл-окислитель.
Такая физическая картина явлений не противоречит эксперимен-
экспериментально установленной независимости скорости химического раство-
растворения металлов от потенциала.
Правомерность сказанного определяется и полученными резуль-
результатами измерений с применением метода спектроскопии электро-
электроосаждения. Из этих результатов следует, что при потенциалах, соот-
соответствующих аномальному растворению метала, адсорбция молекул
воды на его поверхности может сопровождаться заметным перено-
переносом заряда в поверхностном комплексе, усиливающимся при сдвиге
потенциала в положительном направлении. В связи с этим возможно,
что в указанных условиях ускорение электрохимического растворе-
растворения может полностью компенсироваться снижением реакционной
способности такого комплекса.
4.17. Пассивность
Пассивность — это состояние высокой коррозионной стойкости
металлов и сплавов, находящихся в агрессивной среде, в определен-
определенной области потенциалов (рис. 4.11).
Скорость процесса растворения металла в области пассивации
становится и может сохраняться сколь угодно долго на несколько
порядков величины (в отдельных случаях до 10 порядков) более
низкой, чем в области активного растворения.
С точки зрения термодинамики смещение потенциала электрода
в положительную сторону должно приводить к увеличению термо-
термодинамической вероятности протекания электрохимической реакции
растворения металла. В действительности этого не происходит.
Явление пассивации наглядно показывает, как на практике зача-
зачастую трудно бывает реализовать термодинамическую возможность.
Открытие пассивации более 150 лет назад связывают с именем
английского физика М. Фарадея, хотя первое описание этого явления
встречается в трудах М.В. Ломоносова A738 г).
4.17.
Пассивность
113
L
-1
-2
ll
-3 i
-4 /
-5
-6
О
о у*к
^A;-
к
r
3
A
41
1
Обратимся к рис. 4.22, на котором на примере железного электро-
электрода изображена поляризационная кривая в растворе серной кислоты.
Как видно, при анодной поляризации первоначально (участок 7) на-
наблюдается рост плотности тока, который характеризует область ак-
/, А/см
10
10
10
10
10
10
-0,50-0,25 0 0,25 0,50 0,75 1,00 1,25 1,50 1,75 2,00 2,25
Е, В (с.в.э.)
Рис. 4.22. Стационарная анодная поляризационная кривая железа в деаэри-
деаэрированном растворе 0,5 М H2SO4 при 25 ° С по данным различных авторов:
1 — Франк; 2 — Франк и Вайль; 3 — Хербслеб и Энгель
тивного растворения металла. Зависимость плотности тока от потен-
потенциала хорошо описывается тафелевской кривой. При более положи-
положительных потенциалах (участок 2) происходит отклонение от прямо-
прямолинейной зависимости и появляется область, где значения тока мало
зависят от потенциала. Это явление связывают с образованием на по-
поверхности металла солевой пленки из FeSC>4. Пленка образуется из-
за недостаточно быстрого отвода от поверхности ионов растворяю-
растворяющегося металла. Вблизи электрода создается высокая концентрация
ионов Fe2+, так что произведение активностей ионов Fe2+ и SO2"
превышает величину произведения растворимости соли, и образует-
образуется осадок. Величина тока зависит от интенсивности перемешивания
электролита, т.е. от скорости отвода образующихся ионов Fe2+.
При переходе через Епас, который часто называют Фладе-потен-
циалом, наблюдается резкое, на несколько порядков, снижение плот-
плотности тока и металл переходит в область пассивного состояния. Здесь
величина тока не зависит от потенциала и скорости размешивания
электролита.
114
Электрохимическая коррозия металлов
Гл. 4
В области потенциалов отрицательнее ~ +0,5 В (с.в.э.) желе-
железо растворяется в виде Fe2+. При потенциалах от +0,5 до +0,8 В
(с.в.э.) в раствор одновременно переходят ионы Fe2+ и Fe3+. При
потенциалах положительнее +0,8 В @,8-1,7 В) растворение железа
происходит с образованием ионов Fe3+. Равновесные потенциалы
образования окислов железа (вюстита FeO, магнетита РезС>4 и гема-
гематита а-^ъОз) при 25 °С имеют следующие значения:
Fe + Н2О т± FeO + 2Н+ + 2е
^Fe/Feo = -0,04 - 0,059рН
3Fe + 4Н2О т± Fe3O4 + 8Н+ + 8е
?Fe/Fe3o4 = -0,09 - 0,059рН
2Fe + ЗН2О т± a-F2O3 + 6Н+ + бе
^Fe/a-Fe203 = ,05 - 0,059РН
Fe3O4 + Н2О т± 3Fe + 2Н+ + 2е
D.ХХ)
D.50)
D.XXI)
D.51)
D.ХХП)
D.52)
Равновесный потенциал образования 7-F2O3 не известен.
Наиболее высокими защитными свойствами обладает оксид 7-
однако поверхностные пленки на железе состоят из смеси ок-
оксидов РезС>4 и 7-F2O3 с различным соотношением количества ком-
компонентов, меняющимся по толщине пленки. Вследствие этого, как
отмечалось ранее, защитная способность пассивирующих пленок на
поверхности железа не велика. Толщи-
Толщина пассивирующих пленок, образующих-
образующихся на железе, зависит от кислотности рас-
раствора и потенциала металла.
Область пассивности при дальнейшем
смещении потенциала электрода в поло-
положительную сторону сменяется областью
перепассивации, в которой вновь наблю-
наблюдается рост тока (участок 4 на рис. 4.22).
Подобная картина зависимости плотности
тока от потенциала характерна не только
для железа в серной кислоте, но и для мно-
многих других металлов.
Переход металла в пассивное состоя-
состояние большинством исследователей до сих
пор связывается с образованием на по-
поверхности металла защитных гидратиро-
о
1
Рис. 4.23. Зависимость по-
потенциала пассивации (?7Пас)
хрома от рН среды в рас-
растворах:
на + кс1 G) и h2so4 +
+ Na2SO4 B) при постоян-
постоянных A н.) суммарных кон-
концентрациях анионов
4.17. Пассивность 115
ванных оксидных пленок. Вероятность их устойчивости с очевидно-
очевидностью определяется величиной рН раствора. В полном соответствии
с этим в многочисленных исследованиях было установлено, что по-
потенциалы пассивации металлов с ростом кислотности агрессивной
среды сдвигаются в положительном направлении. Это демонстриру-
демонстрируют, в частности, данные рис. 4.23. На нем представлена зависимость
потенциала пассивации хрома от рН в сернокислых и солянокислых
растворах. Рисунок показывает, что с ростом рН Ешс этого металла
смещается в отрицательном направлении (в данном случае на 58 мВ
при изменении рН на единицу).
Такой же эффект способны вызывать и окислительные компонен-
компоненты среды, например, Н2О2, К2СГ2О7, КМ1Ю4, Fe3(SO4J-
В настоящее время не вызывает сомнения, что в водных раство-
растворах электролитов пассивирующими частицами являются и молекулы
воды. Действующим началом в них с очевидностью является кисло-
кислород молекул Н2О. С учетом этого обстоятельства можно заключить,
что кислородсодержащие окислители (как пассиваторы) могут рас-
рассматриваться в качестве частиц, обладающих кислорододонорной
способностью по отношению к металлам.
Однако определяющая роль в формировании пассивного состоя-
состояния принадлежит потенциалу. В работах Я.М. Колотыркина и Н.Я. Бу-
нэ по изучению коррозии никеля в 0,5 М H2SO4 в присутствии раз-
различных окислителей было показано, что роль добавок сводится к
изменению потенциала электрода, который и определяет электрохи-
электрохимические и коррозионные свойства металла, в том числе и переход
его в область пассивации.
Закономерности поведения металла в пассивном состоянии во
многом определяются свойствами пассивирующих пленок. Так,
если пленка медленно взаимодействует с электролитом, имеет по-
полупроводниковую проводимость, то практически вся приложенная
разность потенциалов падает внутри пленки, и тогда область пасси-
пассивации может наблюдаться до очень высоких значений потенциала.
При этом практически весь протекающий через систему ток будет
расходоваться на прирост толщины оксидной пленки. Подобный вид
зависимости наблюдается на титане, тантале, ниобии.
Если поверхностные пленки обладают высокой электронной прово-
проводимостью, то при анодной поляризации на границе пленка-раствор
может возникнуть разность потенциалов, достаточная для протека-
протекания процесса разложения молекул воды с образованием кислоро-
кислорода, или возникнет процесс перепассивации. В любом случае этим
явлениям будет отвечать рост тока (участок 4 на рис. 4.22). Пере-
Перепассивация связана с изменением свойств пассивирующей пленки,
116 Электрохимическая коррозия металлов Гл.4
результатом чего являются локальные разрушения и образование
питтингов.
Для рассматриваемого примера коррозии железа в сернокислых
растворах рост плотности тока отвечает одновременному протека-
протеканию двух процессов — питтингообразованию и выделению кисло-
кислорода.
Одна из признанных теорий, нашедших экспериментальное под-
подтверждение, была предложена в 80-х годах Макдональдом и сотруд-
сотрудниками. Она объясняет природу поведения метала и пленок в области
пассивного состояния и достаточно хорошо согласуется с экспери-
экспериментальными результатами.
Модель базируется на представлении об оксидной пленки на ме-
металле как кристаллической структуре с большим количеством то-
точечных дефектов — кислородных и катионных вакансий (см. гл. 2).
Вакансии кислорода образуются на границе металл-пленка и погло-
поглощаются на границе пленка-раствор. Именно их движение в пленке в
направлении от границы с металлом к границе с раствором приводит
к росту толщины оксидной пленки. Здесь можно привести аналогию
с механизмом образования оксидных пленок при газовой коррозии.
Другой взаимосвязанный процесс — это движение катионных
вакансий в пленке от границы раствор-пленка к границе пленка-
металл, который и обуславливает растворение металла.
В целом процесс формирования оксидного слоя сопровождается
параллельным процессом растворения металла. В зависимости от
толщины пленки меняются закономерности ее роста. С уменьше-
уменьшением толщины пленки логарифмический закон роста переходит в
параболическую зависимость.
Методические рекомендации к главе 4
В результате изучения материала этой главы, студенты должны
знать:
• сущность физико-химических явлений на границе металл -
электролит и их влияние на закономерности электродных реак-
реакций;
• основные характеристики электрохимического коррозионного
процесса;
• термодинамические и кинетические закономерности катодных
и анодных реакций, составляющих основу коррозионного про-
процесса;
• особенности электрохимического поведения металлов в актив-
активном и пассивном состояниях.
4.17. Пассивность 111
Вопросы для самопроверки
1. Приведите известные вам примеры из технологической прак-
практики, которые сопровождаются электрохимической коррозией
аппаратуры.
2. Как образуется двойной электрический слой? Опишите его
строение.
3. На основании каких термодинамических величин можно сде-
сделать заключение о возможности протекания коррозии?
4. Что представляют собой диаграммы Пурбе?
5. Что называется концентрационной поляризацией? Приведите
основные уравнения.
6. Приведите основное уравнение кинетики электрохимической
реакции с замедленной стадией разряда-ионизации.
7. Приведите уравнение Тафеля. В каких координатах реализует-
реализуется прямолинейная зависимость между плотностью тока и по-
потенциалом.
8. Охарактеризуйте коррозионный процесс с водородной деполя-
деполяризацией.
9. Охарактеризуйте коррозионный процесс с кислородной депо-
деполяризацией
10. Изобразите поляризационную кривую растворения металла.
Какие участки выделяют на ней?
11. Каковы закономерности ионизации металла в активном состо-
состоянии?
12. Охарактеризуйте влияние компонентов раствора на растворе-
растворение металлов в активном состоянии.
13. Что называется коррозионной диаграммой? Как она строится?
Какие виды контроля коррозионного процесса вам известны?
14. Какие аномальные явления наблюдаются при растворении ме-
металлов?
15. Чем характеризуется пассивация металла? Каковы закономер-
закономерности поведения металла в пассивном состоянии?
Задания для самостоятельных и контрольных работ
1. Строение двойного электрического слоя. Определите его роль в
возникновении скачка потенциала на границе металл-раствор
и влияние на кинетику электродных процессов.
118 Электрохимическая коррозия металлов Гл.4
2. Термодинамика электродных процессов. Термодинамическое
условие возможности протекания коррозионного процесса.
3. Основные закономерности электрохимической кинетики. По-
Понятие о концентрационной поляризации и предельном токе
диффузии.
4. Электродные реакции с замедленной стадией разряда-иониза-
разряда-ионизации. Основные уравнения. Физический смысл констант «а» и
«6» в уравнении Тафеля.
5. Основные характеристики коррозионного процесса. Сопряжен-
Сопряженные реакции. Коррозионные процессы с водородной и кисло-
кислородной деполяризацией.
6. Анодная реакция ионизации металлов. Основные стадии реак-
реакции. Закономерности растворения металлов в активном состо-
состоянии.
7. Виды коррозионного контроля. Принцип построения коррози-
коррозионных диаграмм.
8. Поведение металлов в пассивной области. Причины возник-
возникновения пассивности. Способы перевода металла в пассивное
состояние.
Литература к главе 4
1. Дамаскин Б.Б., Петрий О. А. Введение в электрохимическую кинети-
кинетику. - М.: Высшая школа, 1983. Гл. IV. § 68-70. С. 347-382.
2. Антропов Л.И. Теоретическая электрохимия. - М.: Высшая школа, 1984.
Гл. 8, С. 182-192; Гл. 18, С. 386-394; Гл. 23, Гл. 24.
3. Скорчеллетти В.В. Теоретические основы коррозии металлов. - М.:
Химия, 1973.263 с.
4. Томатов К Д., Чернова ГП. Теория коррозии и коррозионно стойкие
материалы. - М.: Металлургия, 1986. 359 с.
5. Томатов ИД., Чернова ГЛ. Пассивность и защита металлов от корро-
коррозии. - М.: Наука, 1965. 208 с.
6. Сафонов В. А. Инженерно-химическая наука для передовых технологий:
Труды пятой сессии. / Под ред. В.А. Махлина. - М.: 1999. Т. 1. С. 207.
7. Фрумкин А.Н. Избранные труды. Электродные процессы. - М.: Наука,
1977.335 с.
8. Дамаскин Б.Б., Петрий О.А., Цирлина ГА. Электрохимия. - М.: Химия,
2001. С. 624.
Часть II
Виды коррозии. Влияние
конструктивных факторов
на развитие коррозийных
разрушений машин
и аппаратов
Понятие «химическое сопротивление материалов» охватывает
широкий круг явлений, сопровождающих взаимодействие материа-
материала с окружающей средой. Простейший вид коррозии — равномерное
поверхностное разрушение металла. Однако, как правило, коррозия
на разных участках оказывается более или менее неравномерной. В
случае, например, точечной коррозии на фоне почти неповрежден-
неповрежденной поверхности с большой скоростью развиваются глубокие точеч-
точечные поражения — питтинги — быстро приводящие к перфорации
стенок и выходу аппаратов из строя. Иногда коррозия металлов но-
носит «ножевой» или «канавочный» характер: вдоль сварных швов
образуются узкие глубокие канавки.
Часто преимущественному разрушению подвергаются границы
зерен металла, связь между зернами ослабевает, что резко ухудшает
механические свойства металла и может привести к растрескиванию
аппарата. Этот вид коррозии называется межкристаллитной (МКК).
Опасность растрескивания особенно велика, если аппарат находится
под действием динамических и механических нагрузок. В некоторых
случаях воздействие среды приводит к глубоким изменениям состава
и свойств материала. Например, наводороживание, обезуглерожива-
обезуглероживание, азотирование — эти явления наиболее часто наблюдаются при
газовой коррозии.
Разнообразие коррозионных процессов и явлений свидетельству-
свидетельствует о необходимости их систематизации.
ГЛАВА 5
ЛОКАЛЬНЫЕ ВИДЫ КОРРОЗИИ.
МЕТОДЫ ИСПЫТАНИЯ МАТЕРИАЛОВ
НА СТОЙКОСТЬ ПРОТИВ КОРРОЗИИ
5.1. Локальные виды коррозии
Несмотря на многообразие форм проявления коррозионных про-
процессов на металлических материалах, существует классификация,
позволяющая более или менее четко относить каждое из наблюдае-
наблюдаемых на практике коррозионных поражений к определенному классу.
В один класс выделены так называемые локальные коррозионные
процессы, общей чертой которых является то, что все они протека-
протекают на сравнительно небольших по площади участках поверхности
металла и развиваются с крайне высокой скоростью. В результате
происходит быстрая потеря металлическими конструкциями эксплу-
эксплуатационных свойств из-за разрушения их сравнительно небольших
участков. Повышенная опасность локальных коррозионных процес-
процессов связана с тем, что из-за малых размеров пораженных ими пло-
площадей поверхности и высоких скоростей растворения металла в
них существование самого очага зачастую обнаруживается только
в момент выхода оборудования из строя. Постоянное ужесточение
условий эксплуатации металлического оборудования и вовлечение в
промышленную сферу все новых металлических конструкционных
материалов приводит к тому, что с течением времени доля локальных
коррозионных поражений неуклонно возрастает.
К основным видам локальной коррозии относится питтинговая,
язвенная, щелевая, межкристаллитная, селективное вытравливание
и контактная коррозия.
Питтинговая коррозия (ПК) является одним из наиболее опас-
опасных видов локальной коррозии. Ей подвержены многие пассивиру-
пассивирующиеся металлы и сплавы.
Язвенная коррозия по характеру своего развития очень напомина-
напоминает ПК, однако локализация коррозионного процесса при этом менее
острая, и диаметр очагов язвенной коррозии гораздо больше, чем
при ПК. Диаметр язв, как правило, существенно больше их глубины.
Язвенная коррозия протекает как на пассивнных, так и на активно
растворяющихся металлах. Повышенной склонностью к язвенной
коррозии обладают углеродистые и низколегированные стали.
Щелевая коррозия проявляется в условиях, когда из-за близости
122 Испытания материалов на стойкость против коррозии Гл. 5
расположения двух поверхностей (то есть в местах застоя раство-
раствора) возникают узкие зазоры или щели. При этом не имеет большого
значения, что явилось причиной образования щели — особенно-
особенности металлической конструкции или свойства структуры металла.
Щелевой коррозии подвержены многие металлы и металлические
изделия.
Межкристаллитная коррозия (МКК) возникает в поликристал-
поликристаллических материалах, преимущественно сплавах железа, алюминия
и меди, протекает на границах зерен и является следствием различия
химического состава тела зерна и его зернограничных областей.
Селективное вытравливание характерно для конструкционных
материалов, состоящих из двух или более фаз, сильно отличающих-
отличающихся по своим свойствам, вследствие чего одна из них подвергается
преимущественному растворению, тогда как другие растворяются с
гораздо более низкими скоростями. Это приводит к образованию в
металле полостей различной глубины и конфигурации, вследствие
чего металл теряет свою сплошность, а, следовательно, и эксплуа-
эксплуатационные качества. Характерен этот вид растворения для нержаве-
нержавеющих сталей, когда селективному растворению подвергаются выде-
выделяющиеся по границам их зерен карбиды.
Контактная коррозия развивается при возникновении контакта
между двумя или более разнородными металлами.
Отличительной чертой процессов локальной коррозии является
поражение ими малых участков поверхности металлических кон-
конструкций, скорость растворения металла в которых существенно
превышает скорость растворения основной доли поверхности. Ско-
Скорость проникновения очагов локальной коррозии в глубь металла
может достигать десятков см/год. Большинство процессов локаль-
локальной коррозии (за исключением селективного растворения и контакт-
контактной коррозии) носит вероятностный характер. Указанные черты хотя
и являются общими, но не раскрывают особенностей механизма ло-
локальных коррозионных процессов. Более важны сходства, наблюда-
наблюдаемые при рассмотрении механизма процессов локальной коррозии
металлов.
Как правило, все локальные коррозионные процессы протека-
протекают через несколько последовательно сменяющих друг друга ста-
стадий, каждой из которых соответствует свой лимитирующий процесс.
Основными являются:
• стадия зарождения, соответствующая нарушению равномерно-
равномерного протекания коррозии и переходу процесса к стационарному
развитию очагов локальной коррозии; стадия имеет достаточ-
достаточно высокую продолжительность и называется индукционным
5.7.
Локальные виды коррозии
123
периодом тинд;
• стадия устойчивого функционирования очага локальной корро-
коррозии, в течение которой происходит катастрофически быстрое
разрушение локально активированных участков металла;
• завершающая стадия развития — залечивание (репассивация)
очагов локальной коррозии.
В процессе развития локальных коррозионных процессов часто
происходит переход одного вида в другой. Так, например, началь-
начальной стадией развития язвенной, межкристаллитной и щелевой кор-
коррозии, а также ряда коррозионно-механических повреждений при
коррозионно-усталостных процессах или при статической коррозии
под напряжением, часто является питтинговая коррозия. Вид корро-
коррозии, подобный питтинговой, развивается а местах несплошности и
отслоения покрытий различного типа.
5.1.1. Питтинговая коррозия
К питтинговой коррозии склонно подавляющее большинство ме-
металлов (Fe, Ni, Co, Mn, Cr ,Ti, Al, Mg, Zr, Nb, Та, Си, Zn и др.) и
конструкционных материалов на их основе. Питтинговая коррозия
возникает в морской воде, растворах солей, в охлаждающих системах
холодильных машин, в системах оборотного водоснабжения химиче-
химических предприятий. Термин «питтинг» применяют для описания как
точечной коррозии, так и специфических коррозионных поражений
(рис. 5.1). Название питтинг обычно используют применительно к
глубоким точечным поражениям.
В зависимости от условий формирования и развития (темпера-
(температура, кислотность, химический состав раствора) форма питтингов
Рис. 5.1. Крупный питтинг на поверхности нержавеющей стали 03Х18Н11.
а — хЗОО; б - xlOOO; в — х8000
124 Испытания материалов на стойкость против коррозии Гл. 5
может быть различной. Питтинги бывают полусферические, цилин-
цилиндрические, полиэдрические, открытые, закрытые и т.д. На внутрен-
внутренней поверхности питтингов сосуществуют области пассивного со-
состояния и активного растворения. Для железа и никеля, например,
в кислых растворах разность между потенциалами дна питтинга и
пассивной поверхности образца может достигать 1 В.
Полусферическую форму имеют так называемые полированные
питтинги. Их внутренняя поверхность блестяща, что свидетельству-
свидетельствует об изотропном, не зависящем от структуры, растворении, близком
по механизму к электрополировке. Такие питтинги наблюдались на
железе, нержавеющих сталях, алюминии, тантале, сплавах на основе
никеля, титана, кобальта.
Ограненные (кристаллографические) питтинги и питтинги непра-
неправильной формы (анизотропно растущие в различно ориентирован-
ориентированных зернах металла), как правило, являются травлеными. Они обнару-
обнаружены на железе, углеродистых, низколегированных и нержавеющих
сталях, никеле, алюминии, цинке, хроме. Форма кристаллографи-
кристаллографических питтингов соответствует правильным пирамидам, призмам,
и сложным многогранникам, как правило, ограниченным низкоин-
низкоиндексными плоскостями кристаллической решетки, а тип огранки
определяется пустотами кристаллической решетки, образовавшими-
образовавшимися на начальных стадиях зарождения питтингов.
Часто крупные (полусферические) питтинги возникают в резуль-
результате слияния множества более мелких кристаллографических (рис. 5.1).
Для протекания питтинговой коррозии необходимо выполнение
ряда условий:
• питтинг образуется на поверхности металлов, находящихся в
пассивном состоянии (см. рис. 4.11);
• развитию питтинга способствуют дефекты пассивирующей
пленки (структурные неоднородности, посторонние включе-
включения, поры). Особенно уязвимы для питтинга ребра, риски, гра-
границы лакокрасочных покрытий;
• в растворе должны одновременно присутствовать активаторы
питтинговой коррозии и пассиваторы металла.
Стимуляторами питтинговой коррозии металлов в водных сре-
средах являются ионы Cl~, Br~, J~, CN~, SO^". Анионы-активаторы в
тех или иных количествах присутствуют в подавляющем большин-
большинстве природных и технологических сред, в которых эксплуатируется
металлическое оборудование и конструкции.
Относительная эффективность действия анионов-активаторов
располагается в ряду С1~ > Br~ > J~. Однако в зависимости от
5.1. Локальные виды коррозии 125
конкретных условий (температуры среды, концентрации аниона-
активатора, природы металла) она может изменяться.
Основными требованиями к анионам-активатором должны быть
их высокая адсорбируемость на поверхности металла и способность
образовывать с компонентами металла растворимые комплексы.
Пассиваторами металла могут быть различные анионы, как пра-
правило, содержащие кислород (ОН~, NO^, SO^", C1OJ), но наиболее
универсальным пассиватором является вода. Образование питтингов
протекает по электрохимическому механизму.
Электрохимическими критериями питтингостойкости металлов
являются граничные потенциалы питтинговой коррозии — питтин-
гообразования Епо, репассивации Ерп и критический потенциал Екр.
Потенциал питтингообразования Епо характеризует нарушение
пассивного состояния. Он является наименьшим потенциалом, при
достижении которого начинается стабильный процесс образования
питтингов.
Потенциал репассивации Ерп характеризует переход из области
образования питтингов в пассивное состояние.
Для каждой конкретной системы металл/раствор существует оп-
определенный критический потенциал Екр, разграничивающий обла-
области устойчивого пассивного состояния (отрицательнее Екр) и обла-
области питтинговой коррозии (положительнее Екр). При сколь угодно
долгом пребывании металла в области потенциалов отрицательнее
Екр металл будет сохранять пассивное состояние, не подвергаясь
питтинговой коррозии. При потенциалах положительнее Екр воз-
возможно возникновение ПК. Длительность пребывания металла в ква-
квазипассивном состоянии при потенциалах положительнее Екр будет
определяться разностью между фактическим потенциалом метал-
металла Е и величиной Екр. Чем она больше, тем скорее произойдет на-
нарушение пассивности и на поверхности металла разовьется питтинг,
то есть тем меньше будет тинд.
Потенциалы Ерп и Екр практически не зависят от исходного со-
состояния металлической поверхности (степени окисленности, шеро-
шероховатости и т.д.). Их можно рассматривать как объективную харак-
характеристику коррозионной системы металл-раствор, определяемую
физико-химическими параметрами обеих составляющих. Потенци-
Потенциал Епо, напротив, чувствителен к состоянию поверхности металла,
условиям аэрации, небольшим колебаниям температуры и состава
раствора, то есть не является объективной характеристикой питтин-
питтингостойкости металла, но может служить косвенной характеристикой
величины тинд.
Основными практическими критериями питтингостойкости ме-
126 Испытания материалов на стойкость против коррозии Гл. 5
таллических материалов являются базисы питтингостойкости АЕпк,
АЕпо, и АЕри, определяемые как разность между граничными по-
потенциалами питтинговой коррозии (Епк, Епо, и Ерп) и потенциалом
свободной коррозии Екор металла. Базисы питтингостойкости АЕпк
и АЕрп являются наиболее надежной характеристикой склонности
металла к питтинговой коррозии. Чем они больше, тем меньше веро-
вероятность возникновения стабильных питтингов. Базис питтингостой-
питтингостойкости АЕП0 является дополнительным.
Условия растворения металла в полости питтинга существен-
существенно отличаются от наблюдаемых на поверхности металла. Внутри-
питтинговый раствор обогащен анионом-активатором, имеет пони-
пониженную, по сравнению с объемной, кислотность и, в ряде случаев,
обезвожен. Это обеспечивается миграционным подводом анионов-
активаторов, затрудненным диффузионным отводом продуктов рас-
растворения из полости питтинга и гидролизом солей растворяющихся
металлов, протекающим по реакциям:
Ме = Меп+ + пе E.1)
Меп+ + шН2О -+ Ме(ОН)^"т)+ + тН+ E.П)
Костанта равновесия реакции E.II) равна:
к _ [Ме(ОН)т J • [Н J ( ..
[Меп+] • [Н2О]- ' К }
С другой стороны величину К можно определить из стандартной
энергии Гиббса:
AG0 = -ВТЫК. E.2)
Подставляя из E.II) в E.1) величину К, можно определить [Н+] —
кислотность образующегося в питтинге раствора. Подробные расче-
расчеты носят оценочный характер, поскольку из-за высокой концентра-
концентрации солей во внутрипиттинговом растворе использование коэффици-
коэффициентов активности возможно только с известной долей приближения.
рН внутрипиттингового раствора зависит от материала, подверга-
подвергающегося питтинговой коррозии. Дня сталей расчетные и измеренные
(путем замораживания и последующего определения рН) кислотно-
кислотности внутрипиттинговых растворов составляют от ~ 3,5 до 0. Такое
различие определяется тем, что при растворении металла в питтинге
на нержавеющей стали в раствор наряду с ионами Fe2+ переходят
и ионы легирующих элементов — Ni2+, Cr3+, Мо3+, степень гидро-
гидролиза которых выше, чем железа.
Основной причиной возникновения питтингов является дефект-
дефектность (неоднородность) структуры реальных металлических мате-
5.1. Локальные виды коррозии 127
риалов. Эффективность действия дефектов структуры металла как
стимуляторов питтинговой коррозии различна и убывает в ряду: вто-
вторичные фазы > сегрегации примесей > дислокации > точечные де-
дефекты. Среди вторичных фаз наиболее опасными промоторами пит-
питтинговой коррозии многих металлических конструкционных мате-
материалов являются сульфидные (оксидосульфидные) неметаллические
включения. Облегчение зарождения питтингов сульфидными вклю-
включениями вызвано ухудшением защитных свойств пассивирующей
пленки, образующейся в местах их выхода на поверхность металла,
и образованием микрощелей на границе металл/сульфидное вклю-
включение.
Затруднение репассивации и увеличение скорости растворения
металла в очаге локальной коррозии обусловлено накоплением в
нем и его окрестностях высокоэффективных стимуляторов корро-
коррозии — H2S и (или) HS~, образующихся при растворении сульфид-
сульфидного включения по реакциям:
MeS + 4Н2О = Ме2+ + SO^~ + 8H+ + 8е
MeS + 2H+ =Me2++H2S
2MeS + 4H2O = 2Me2+ + S + SO^~ + 8H+ + Юе
Кроме того, при растворении сульфидных включений раствор в
питтинге еще более подкисляется в соответствии с реакциями:
S + ЗН2О = H2SO3 + 4H+ + 4е
S + ЗН2О = HSO3" + 5Н+ + 4е
H2SO3 + Н2О = HSO^ + 3H+ + 2е
^ + Н2О = SO2" + 3H+ + 2е
Термическая обработка и холодная деформация металлов могут
оказывать влияние на их склонность к питтинговой коррозии вслед-
вследствие изменения дефектности структуры, причем степень и направ-
направление влияния могут быть различными и зависят как от свойств
самого металла, так и от конкретного типа его обработки. Так, на-
например, слабые деформации могут приводить к росту склонности
металлов к питтинговой коррозии вследствие повышения плотности
дислокаций, появления линий скольжения и т.п., а сильные дефор-
деформации, повышающие однородность его структуры, могут, напротив,
способствовать увеличению питтингостойкости.
128 Испытания материалов на стойкость против коррозии Гл. 5
Интенсификацию питтинговой коррозии, как правило, вызывает
рост температуры, однако интервалы ее наиболее сильного влияния
для материалов различной природы различны.
Увеличение концентрации аниона-активатора Сак (в рассматрива-
рассматриваемом случае С1~ и Вг~) при постоянной температуре также способ-
способствует смещению рассматриваемых потенциалов в отрицательном
направлении. Последнее обнаружено для нержавеющих и углероди-
углеродистых сталей.
Изменение рН раствора при постоянной величине Сак практи-
практически не влияет на величину Ерп. При определенной критической
величине рН происходит изменение электрохимического состояния
металла — реализуется возможность его самопассивации. В послед-
последнем случае (в средах от слабокислых до слабощелочных) Екор сталей
также слабо зависит от рН раствора, то есть их базисы АЕрп и АЕпк,
а, следовательно, и питтингостойкость, практически не зависит от
рН среды.
Изменение условий аэрации коррозионной среды оказывает вли-
влияние на питтингостойкость металлических материалов посредством
изменения Екор за счет изменения скорости катодной реакции.
Наиболее существенное влияние на питтингостойкость сплавов
оказывает их химический состав, что ярко проиллюстрировано на
примере Fe и его сплавов. Введение в железо Cr, Ni, а также Ni и Мо
соответственно в сплавы Fe-17Cr-Ni и Fe-17Cr-14Ni-Mo приводит к
росту граничных потенциалов питтинговой коррозии. Для каждого
из рассматриваемых элементов существует определенная область
концентраций, в пределах которой легирование оказывает наиболее
сильное влияние на питтингостойкость сплава.
5.1.2. Язвенная коррозия
Язвенная коррозия, как правило, протекает на поверхности актив-
активно растворяющихся металлов (в некоторых случаях коррозионные
язвы могут образовываться и при слиянии питтингов, растущих на
пассивном металле) и по характеру своего развития напоминает пит-
тинговую коррозию, вследствие чего четкая квалификация локально-
локального коррозионного процесса часто бывает затруднена. Склонностью
к язвенной коррозии обладают углеродистые и низколегированные
стали, эксплуатирующиеся в водных хлоридсодержащих средах, на-
например, водоводы, водопроводы, теплоэнергетическое оборудова-
оборудование.
Стойкость углеродистых и низколегированных сталей против яз-
язвенной коррозии в значительной степени зависит от их структур-
5.7.
Локальные виды коррозии
129
ных и структурно-фазовых составляющих. Резкое снижение стой-
стойкости сталей против язвенной коррозии происходит при выделении
в их структуре сульфидных неметаллических включений на основе
кальция. Существенно меньшую и имеющую практическое значе-
значение только для углеродистых сталей опасность представляют вклю-
включения сульфида марганца. Для сталей с феррито-перлитной струк-
структурой склонность к язвенной коррозии возрастает при образовании
непрерывной сетки тонкодисперсных перлитных выделений.
Механизм действия сульфидов на основе кальция подобен опи-
описанному ранее для питтинговой коррозии нержавеющих сталей. Их
более высокая, по сравнению с сульфидами марганца, коррозион-
коррозионная опасность объясняется более высокой скоростью растворения в
электролитах.
Механизм действия перлитных фаз следующий. Перлит имеет
слоистую пластинчатую структуру с соотношением толщин феррит-
ной и цементитной пластинчатых фаз G-8): 1. Толщина пластин в
зависимости от условий термической обработки может меняться
примерно в 10 раз, в частности для феррита — от 0,1 до 1,0 мкм,
причем чем тоньше пластины, тем более они искривлены. В ней-
нейтральных средах феррит растворяется на 1-2 порядка величины
быстрее, чем цементит. С усилением кис-
кислотности раствора скорость растворения
феррита возрастает еще на несколько по-
порядков величины, а скорость растворения
цементита если и изменяется, то не более,
чем в 10 раз.
При коррозии в нейтральном растворе
локальная среда в микрозазоре, оставлен-
оставленном растворяющейся ферритной пласти-
пластиной, подкисляется, скорость растворения
феррита еще более возрастает. Чем тонь-
тоньше пластины в перлитовой колонии, тем
быстрее закисляется среда в первых об-
образовавшихся зазорах и тем выше ско-
скорость дальнейшего растворения феррит-
ных пластин. Скорость же растворения
феррита матрицы металла при этом бу-
будет оставаться неизменной. Потерявшие
связь с металлом цементитные пласти-
пластины выкрашиваются, образуя коррозион-
коррозионные язвы. Рассмотренный механизм име-
имеет общие черты с питтинговой и щелевой
Рис. 5.2. Благоприятные
места для развития ще-
щелевой коррозии (показаны
стрелками).
77 — изолирующее покрытие;
Г — газовый пузырек; О —
узкое отверстие; В — резь-
резьбовое соединение с шайба-
шайбами, фланцами, прокладками;
М — граница соприкосно-
соприкосновения раствора с металличе-
металлическим изделием
130 Испытания материалов на стойкость против коррозии Гл. 5
коррозией, поскольку локальное подкисление раствора стимулирует
коррозионный процесс. Видна общность с МКК, поскольку в обоих
процессах происходит вытравление потерявшей связь с металличе-
металлической матрицей карбидной фазы.
5.1.3. Щелевая коррозия и влияние конструктивных факторов
на этот вид корозии
Щелевая коррозия возникает в тех случаях, если конструкция
содержит узкие щели, зазоры, застойные места, или если металли-
металлический материал обладает технологическими дефектами типа ми-
микрощелей или микротрещин (рис. 5.2). Часто началом щелевой кор-
коррозии является развитие в указанных дефектах коррозионных пит-
тингов. Интенсификации щелевой коррозии способствует изменение
свойств раствора в щелях и зазорах — с течением времени он под-
подкисляется, становится более концентрированным по агрессивным
анионам.
Если коррозионный процесс на основной поверхности изделия
протекает с кислородной деполяризацией, то вследствие диффузи-
диффузионных затруднений доставки кислорода в места щелей и зазоров
раствор в них будет обеднен кислородом. Это особенно важно для
случая коррозии оборудования, находящегося в пассивном состоя-
состоянии, например, для коррозии оборудования химической промышлен-
промышленности, изготовленного из нержавеющих сталей. Снижение скорости
катодной реакции вследствие уменьшения концентрации кислорода
в растворе может привести к переводу металла в активное состояние,
то есть к резкому (на несколько порядков величины) возрастанию
скорости его растворения.
Склонность к щелевой коррозии снижается с увеличением степе-
степени легированности сталей, однако, как и в случае питтинговой кор-
коррозии, стали одного марочного состава могут обладать резко различ-
различной стойкостью против рассматриваемого вида локальной коррозии.
Наиболее стойкими материалами являются суперсплавы, содержа-
содержащие повышенные количества хрома, никеля и молибдена, а также
сплавы на основе никеля.
5.1.4. Межкристаллитная коррозия
Границы зерен являются двухмерными дефектами, имеющими
макроскопические (до микронов) размеры двух измерений. Вслед-
Вследствие высокой дефектности металла зернограничного слоя, обуслов-
обусловленной плохим сопряжением соседних зерен, скорость диффузии
компонентов сплава в зернограничных областях на несколько по-
5.1. Локальные виды коррозии 131
рядков величины превышает скорость объем-
объемной диффузии. Это способствует облегчению
в зернограничных областях процессов сегрега-
сегрегации примесных элементов и зарождения и роста
новых фаз.
Межкристаллитной коррозии (МКК) под-
подвержены легко пассивирующиеся металличе-
металлические материалы, например, нержавеющие ста- „ е „ v
Рис. 5.3. Характер
ли, сплавы на основе никеля, алюминии и его коррозиОнного раз-
сплавы. Причиной МКК является ускоренное рушения стали,
растворение металла границ зерен (рис. 5.3). Сталь 09Х18Н14 с
Практически важен случай, когда скорость рас- 0,75% Si после отпус-
творения приграничных областей на несколько ка при 650 с
порядков величины превышает скорость растворения основного ме-
металла. При этом происходит нарушение связи между отдельными
зернами металла и их последующее выкрашивание, вследствие ко-
которого металлические конструкции теряют свои эксплуатационные
свойства.
Скорость развития МКК зависит от потенциала металла. Наибо-
Наиболее интенсивное ее развитие происходит при потенциалах активно-
пассивного перехода ~ +0,35 В (рис. 5.4, область /) и потенциалах
начала транспассивной области 1,15-^-1,25 В (рис. 5.4, область //).
Первая область соответствует потенциалам, возникающим при кон-
контакте нержавеющих сталей со слабоокислительными средами, вто-
вторая — с сильноокислительными. Механизмы развития МКК в ука-
указанных областях могут принципиально различаться.
Для нержавеющих сталей ускоренное растворение металла, при-
прилегающего к границам зерен, может быть вызвано двумя факторами:
обеднением приграничных зон хромом и возникновением в указан-
указанных областях сегрегации примесей, способствующих резкому уве-
увеличению скорости коррозии металла.
Сегрегации примесных элементов распространяются на расстоя-
расстояние нескольких межатомных расстояний и могут быть равновесны-
равновесными (более узкими), и неравновесными. Независимо от типа сегре-
сегрегации концентрация в них примесных элементов в десятки и сотни
раз выше, чем в теле зерна. Это приводит к ярко выраженной ге-
гетерогенности состава металла и, как результат, резкому локальному
увеличению скорости растворения зернограничных областей. Наи-
Наиболее сильными промоторами МКК являются сегрегации примесей
фосфора, кремния и модифицирующего элемента бора.
Обеднение зернограничных областей нержавеющих сталей хро-
хромом происходит вследствие выделения карбидов хрома. Процесс
132
Испытания материалов на стойкость против коррозии
Гл.5
О
0,2
2 0,4
ffl 0,6
э
I °'8
I
с ьо
1,2
1,4
5 4 3 2
-lg/(/, А/см2)
Рис. 5.4. Схематические анодные поляри-
поляризационные кривые стали типа Х18Н10Т
в закаленном, не склонном G) и сен-
сенсибилизированном, склонном B) к МКК
состоянии.
I — первая область склонности к МКК
(слабоокислительные среды); II — вторая
область склонности к МКК (сильноокисли-
(сильноокислительные среды)
карбидообразования происходит следующим образом. При нагреве
металла и его выдержке при повышенных температурах в процес-
процессах термической обработки углерод, обладающий повышенной, по
сравнению с хромом, скоростью диффузии в металле, поставляется
в приграничные области не только с границ зерен, но и из объема
металла. Подобные эффекты возникают в результате термических
обработок и в процессе сварки.
Хром вследствие низкой скорости диффузии поступает только из
приграничных областей и его количество не успевает восполнять-
восполняться посредством диффузии из объема металла. Опасность термиче-
термической обработки определяется соотношением температуры и времени
выдержки при ней металла. Таким образом в окрестностях выделе-
выделений карбидной фазы образуется обедненная хромом зона. Поскольку
карбиды хрома образуют непрерывную цепочку вдоль границ зерен,
сплошная зона металла в приграничных областях оказывается обед-
обеднена хромом.
5.1. Локальные виды коррозии 133
При контакте с агрессивной средой обедненные хромом области
подвергаются преимущественному растворению. Чем больше раз-
разность концентраций хрома в теле зерна и его приграничных обла-
областях, тем выше скорость МКК. Избирательное растворение зерногра-
ничных областей инициирует развитие МКК в слабоокислительных
средах, то есть в первой области потенциалов.
Легирующие элементы сталей оказывают влияние на склоность
к карбидообразованию. Ni, Si, Co облегчают образование карби-
карбидов вследствие повышения активности углерода. Mo, W, V, Nb, Mn,
напротив, снижают активность углерода. Развитие МКК в сильно-
сильноокислительных средах (вторая область потенциалов) часто является
результатом наложения нескольких факторов, наиболее существен-
существенными из которых являются: избирательное растворение избыточных
фаз, неустойчивых в сильноокислительных средах; избирательное
растворение обедненных хромом приграничных областей; специфи-
специфическое действие хромат-ионов, образующихся в результате раство-
растворения стали; избирательное растворение приграничных областей,
являющихся местами сегрегации примесей.
В ряде случаев развитие МКК начинается с образования на гра-
границах зерен питтингов. Облегчению МКК способствует изменение
свойств электролита, заполняющего канавки, образовавшиеся в ре-
результате первоначального растворения приграничных областей. Как
и в случае питтинговой коррозии, с течением времени электролит
подкисляется и становится более концентрированным, чем объем-
объемный.
Разновидностью МКК является так называемая «ножевая» корро-
коррозия, при которой коррозионный процесс локализуется в очень узких
приграничных областях металла. Ножевая коррозия характерна для
многослойных сварных швов. Этому виду коррозии обычно под-
подвержены стабилизированные титаном стали, эксплуатирующиеся в
азотной кислоте, и стали с высоким содержанием молибдена. Низко-
Низкоуглеродистые и стабилизированные ниобием стали указанному типу
разрушения не подвержены.
5.1.5. Селективное вытравливание
Селективное вытравливание (структурно-избирательное раст-
растворение) свойственно многофазным конструкционным материалам с
сильно различающимися по электрохимическому поведению компо-
компонентами структуры. В условиях эквипотенциальное™ поверхности
скорость растворения (при одном и том же потенциале) различных
фазовых составляющих конструкционного материала может разли-
134 Испытания материалов на стойкость против коррозии Гл. 5
чаться от нескольких раз (при одинаковом характере растворения,
например, активном) до нескольких порядков величины (если одна
из составляющих находится в активном, а другая — в пассивном
состоянии).
При селективном вытравливании конструкция теряет свои функ-
функциональные свойства вследствие образования полостей различной
глубины и конфигурации, возникающих из-за преимущественного
растворения одной из фазовых составляющих материала.
Селективному вытравливанию подвержены сплавы на основе ме-
меди — хорошо известное явление, называемое «обесцинкованием»
латуней. При селективном вытравливании интерметаллида РезА1
из алюминиевой бронзы на ее поверхности образуются ярко вы-
выраженные разрушения типа коррозионных язв. Частными случая-
случаями структурно-избирательного растворения является развитие МКК
нержавеющих сталей в сильноокислительных средах, когда преиму-
преимущественному растворению подвергаются выделяющиеся на грани-
границах зерен карбидные фазы, зарождение питтингов вследствие пре-
преимущественного растворения включений сульфида марганца, развитие
язвенной коррозии углеродистых и низколегированных сталей, спро-
спровоцированное выделением в их структуре включений сульфида каль-
кальция.
5.1.6. Контактная коррозия
Контактная коррозия развивается в растворах электролитов при
контакте металлов, обладающих различными электрохимическими
свойствами, например, системы углеродистая сталь/нержавеющая
сталь, углеродистая сталь/алюминий (или его сплавы) и др. Контакт-
Контактная коррозия может возникать также в случаях, если различие элек-
электрохимических свойств обусловлено применением пайки или сварки
при изготовлении конструкции из одного и того же металла; или при
контакте деталей, изготовленных из металла одной и той же марки,
но существенно различающегося по своим свойствам в ее пределах.
Механические напряжения, приводящие к изменению электрохими-
электрохимических характеристик металла, также могут вызвать возникновение
контактной коррозии при соединении деталей из одного и того же
металла, но по-разному механически обработанных. Таким образом,
плохо продуманные с точки зрения конструкционного оформления
сложные металлические объекты могут досрочно выходить из строя
вследствие контактной коррозии.
При контактной коррозии на поверхности обеих составляющих
системы реализуется компромиссный потенциал, определяемый пе-
5.1. Локальные виды коррозии 135
ресечением суммарных анодной и катодной поляризационных кри-
кривых. Скорости растворения обеих составляющих системы при этом
потенциале будут отличаться от индивидуальных скоростей раство-
растворения каждой из составляющих в том же растворе.
Если бы раствор электролита обладал бесконечной электропро-
электропроводностью, эквипотенциальность поверхности распространялась бы
на сколь угодно большое расстояние. В реальных случаях, когда экс-
эксплуатационная среда обладает конечной электропроводностью, эк-
эквипотенциальность будет соблюдаться лишь на части поверхности
биметаллической системы, непосредственно прилегающей к месту
контакта. По мере удаления от места контакта потенциал каждой из
составляющих системы будет все сильнее отклоняться от компро-
компромиссного потенциала, приближаясь к собственному значению. Зона
эквипотенциальное™ тем протяженнее, чем выше электропровод-
электропроводность среды. Такое поведение обусловлено наличием в слабоэлек-
слабоэлектропроводной среде омических потерь — IR погрешности.
При контакте двух электрохимически разнородных металлов ано-
анодом называется тот, потенциал которого более отрицательный, а
катодом — металл с более положительным потенциалом. В зави-
зависимости от потенциала, который приобретает система, скорость рас-
растворения катода может быть выше, ниже или равна его собственной
скорости растворения в том же электролите.
Скорость растворения анода зависит, в первую очередь, от раз-
разности потенциалов между анодом и катодом, но существенное влия-
влияние могут оказать также процессы ионизации кислорода, вторичного
осаждения продуктов растворения анода и др. Поскольку электрод-
электродные потенциалы одного и того же металла сильно зависят от соста-
состава, температуры, условий аэрации и других характеристик среды,
величина компромиссного потенциала также будет определяться не
только природой составляющих ее металлов, но и характеристиками
среды.
Часто имеющим место на практике случаем контактной коррозии
является образование пар дифференциальной аэрации. Пары диффе-
дифференциальной аэрации образуются, когда вследствие различной ско-
скорости катодного процесса на разных участках металлоконструкции,
изготовленной из одного и того же металла, реализуется различный
потенциал свободной коррозии. Этот вид коррозии характерен для
подземных сооружений, когда катодная реакция протекает в усло-
условиях диффузионных ограничений подвода основного деполяризато-
деполяризатора — кислорода. Различия в концентрации кислорода, как прави-
правило, обусловлены пролеганием сооружений в грунтах с различными
свойствами.
136 Испытания материалов на стойкость против коррозии Гл. 5
Еще один случай контактной коррозии наблюдается тогда, когда
при одинаковой катодной реакции различные потенциалы свобод-
свободной коррозии на разных участках металлоконструкции возникают
вследствие изменения закономерностей анодной реакции. Само из-
изменение вызвано тем, что металл контактирует со средой различно-
различного состава. Такая ситуация также часто встречается при подземной
коррозии протяженного оборудования, пролегающего в грунтах, от-
отличающихся по составу и кислотности.
Подобный случай возникает и при эксплуатации теплопередаю-
щего оборудования. В этом случае коррозия протекает в условиях
теплопередачи, и изменение потенциала обусловлено воздействием
температуры. В ряде случаев воздействие может быть столь зна-
значительным, что одним участкам поверхности металлоконструкций
соответствуют потенциалы пассивной, а другим — активной обла-
области. Рассматриваемый вид коррозии характерен для теплообменного
оборудования различных отраслей промышленности.
5.2. Коррозионно-механическое разрушение металлов
Металлические конструкции, работающие в условиях одновре-
одновременного воздействия агрессивных сред и механических напряжений,
подвергаются более сильному разрушению.
В химической промышленности можно найти многочисленные
примеры совместного влияния этих двух факторов.
Процессы синтеза аммиака, мочевины, метилового спирта
протекают в агрессивных средах, в условиях повышенных темпе-
температур при движении газового потока под давлением 35-40 МПа.
Вибрационные сита, грохоты, фильтры работают в условиях
коррозионноактивной среды и механических нагрузок.
Коррозионному растрескиванию подвержены выпарные ап-
аппараты, трубопроводы, автоклавы и др. аппараты.
Не менее опасное разрушение металла имеет место при одно-
одновременном воздействии на него агрессивной среды и переменных
нагрузок. Такой вид воздействия испытывают компрессоры и на-
насосы, роторы, диски и лопатки турбин и т.д.
Различают два вида механических напряжений — внутренние и
внешние. Внутренние напряжения возникают при термической и ме-
механической обработке деталей, при сварке. Внешние, приложенные
извне напряжения, могут быть статическими и переменными.
Под влиянием механических напряжений меняется структура по-
поверхностного слоя металла, что может вызвать изменение потенци-
потенциала на его отдельных участках, разрушение защитных пленок, и как
следствие этого — изменение скорости коррозии.
5.2. Коррозионно-механическое разрушение металлов 137
Различают следующие виды коррозионного разрушения металла
под воздействием механических нагрузок:
• коррозионное растрескивание;
• коррозионная усталость;
• коррозионная кавитация;
• коррозионная эрозия или фреттинг-коррозия.
Коррозионные разрушения не относятся к процессам локальной
коррозии, но имеют с ними множество общих черт. Коррозионно-
усталостные процессы или процессы при статической коррозии под
напряжением сопровождаются возникновением трещин, при фрет-
тинг-коррозии отмечают образование питтинга.
Коррозионные процессы при механических нагрузках протекают
через три последовательные стадии: инкубационный период, отвеча-
отвечающий отсутствию видимых разрушений; период образования очагов
коррозии; период быстрого масштабного разрушения.
Наличие механических напряжений в металле, лежащих в упру-
упругой области или связанных с деформацией, приводит к нарушению
сплошности защитных пленок. Обычно растягивающие или сжима-
сжимающие напряжения мало влияют на скорость равномерной коррозии.
Если под действием коррозионной среды происходит локализация
механического фактора, то это приводит к быстрому разрушению
конструкции.
Протекание коррозионного растрескивания под напряжением про-
происходит при совместном действии коррозионной среды и механи-
механических воздействий. В начальный период зарождение трещины про-
происходит в результате растрескивающего действия при хемосорбции
активных ионов коррозионной среды. Зарождение трещин может
быть связано с возникновением туннелей (размером порядка 0,05 мкм)
и питтиингов на участках металла, имеющего дефекты, например,
на границах зерен, включениях, скоплениях дислокаций. Развитие
трещины и разрыв происходят при превалирующем влиянии меха-
механического фактора.
5.2.1. Коррозионное растрескивание металлов
Коррозионное растрескивание (КР) — это разрушение метал-
металла вследствие возникновения и развития трещин при одновремен-
одновременном воздействии растягивающих напряжений и коррозионной сре-
среды. Оно характеризуется почти полным отсутствием пластической
деформации металла.
КР — это опасный вид разрушения металлов. В химической ап-
аппаратуре КР наиболее часто наблюдается в конструкциях, которые
138
Испытания материалов на стойкость против коррозии
Гл.5
имеют остаточные напряжения после термической или механиче-
механической обработки, при монтаже и сборке оборудования, при сварке, в
условиях эксплуатации при повышенных давлениях и температурах.
На возникновение КР и его интенсивность оказывают большое
влияние характер агрессивной среды, ее концентрация и состав. КР
в напряженном состоянии подвержены почти все металлы и спла-
сплавы. На долю КР в химической, нефтегазовой и теплоэнергетической
отраслях промышленности приходится от 20 до 40 % всех коррози-
коррозионных разрушений.
Для КР характерны следующие особенности:
• образование трещин сопровождается возникновением хрупко-
хрупкости металла;
• возможно возникновение межкристаллитных и транскристал-
литных трещин с разветвлениями;
• время индукционного периода до образования трещины зави-
зависит от величины приложенных растягивающих усилий.
КР сталей происходит в растворах, содержащих H2S, NH3, CO2,
нитраты, хлориды, кислоты и щелочи (рис. 5.5). Углеродистые стали,
содержащие более 0,2 % С и имеющие ферритно-перлитную или пер-
перлитную структуру, менее склонны к КР. Наиболее чувствительной
rHW
Рис. 5.5. Типичный вид КР в воде, содержащей 200 мг/л С1 , темпе-
температура 320 ° С, х900:
а — сталь 03Х16Н4С2, межкристаллитное разрушение, слабо ветвящаяся
трещина, огибание ^-феррита; б — сталь 03Х12К12Н2, транскристаллит-
ное разрушение; в — сталь 03Х12К12Д2, межкристаллитное разрушение,
ветвящаяся трещина
5.2. Коррозионно-механическое разрушение металлов 139
является мартенситная структура. Все режимы термической обра-
обработки, вызывающие появление мартенсита, делают сталь склонной
кКР.
Полуферритные и ферритные хромистые стали менее склонны к
коррозионному растрескиванию, чем аустенитные хромоникелевые
стали.
КР аустенитных хромоникелевых сталей отмечено на ряде хи-
химических производств. Это явление связывают с нестабильностью
аустенита в нержавеющих сталях.
Легирование углеродистых сталей, введение стабилизирующих
добавок, увеличение содержания никеля не изменяет существенно
склонность аустенитных сталей к коррозионному растрескиванию.
Цветные металлы и сплавы также подвержены КР. Коррозионное
растрескивание наблюдается у алюминиевомагниевых и медноцин-
ковых сплавов.
Магниевые сплавы в напряженном состоянии корродируют с КР в
растворах хлоридов, сульфатов, карбонатов, хроматов. Сплавы меди
с цинком, оловом, алюминием разрушаются в присутствии паров
аммиака.
5.2.2. Коррозионная усталость металла
Усталость металла — это разрушение его под влиянием периоди-
периодической динамической нагрузки при напряжениях значительно мень-
меньших, чем предел прочности. В химической промышленности достаточ-
достаточно часто наблюдаются случаи такого разрушения деталей аппаратов
и машин. Усталостное разрушение обычно сопровождается обра-
образованием меж- и транс-кристаллитных трещин, развитие которых
идет главным образом в период приложения растягивающих напря-
напряжений (рис. 5.6). Склонность металла к усталостному разрушению
характеризуется пределом выносливости.
Под этим понятием понимают величину
максимального напряжения, при котором
усталостное разрушение металлов не на-
наступает через 107 и более циклов. При
одновременном воздействии на металл пе-
переменных напряжений и коррозионной
среды число этих циклов уменьшается, т.е.
предел усталостной прочности снижается.
На величину коррозионной устало- Рис. 5.6. Усталостная тре-
сти влияет среда. Например, усталостная щина в конденсаторной
прочность стали типа XI3 в вакууме зна- трубке из латуни Л63
140 Испытания материалов на стойкость против коррозии Гл. 5
чительно выше, чем на воздухе, в пресной воде предел усталости
снижается в 1,5-3 раза, а при переходе от пресной к морской воде
снижается еще в 2 раза.
Режим термической обработки сплавов изменяет предел их кор-
коррозионной усталости. В результате закалки с последующим отпус-
отпуском значительно повышается усталостная прочность по сравнению
с состоянием после отжига или нормализации.
5.2.3. Фреттинг-коррозия
Коррозию при трении называют фреттинг-коррозией. Она ха-
характеризуется возникновением повреждений на соприкасающихся
номинально неподвижных поверхностях, совершающих небольшие
периодические относительные смещения. Этот процесс происходит
в различных болтовых, шлицевых, замковых, заклепочных соеди-
соединениях. В процессе работы эти соединения совершают повторные
относительные перемещения, в результате чего происходят меха-
механические нарушения поверхностных оксидных пленок. Соприкаса-
Соприкасающиеся поверхности при фреттинге никогда не разъединяются, и,
следовательно, продукты разрушения не имеют выхода из зоны кон-
контакта. Это усиливает коррозию и износ металлов.
Скорость фреттинг-коррозии зависит от природы метала, состава
среды, температуры, удельной нагрузки.
Защиту от фреттинг-коррозии осуществляют рациональным вы-
выбором контактирующих материалов, нанесением покрытий, приме-
применением смазок.
5.2.4. Кавитационная эрозия
Кавитационная эрозия наблюдается при эксплуатации гидротур-
гидротурбин, гребных винтов, насосов, клапанов, запорных устройств в тру-
трубопроводах. Она обусловлена нестационарностью потока жидкости,
обтекающей твердое тело. Кавитация — это процесс образования и
исчезновения пузырьков в жидкости. Исчезновение пузырьков со-
сопровождается гидравлическим ударом, который и является причи-
причиной кавитационной эрозии. Возникновение пузырьков происходит
в области низкого давления, а исчезновение — в области высокого
давления. Таким образом, область кавитационного разрушения часто
бывает значительно удалена от зоны возникновения пузырьков.
Первоначально происходит прогрессирующее разрыхление мате-
материала, приводящее к образованию многочисленных микротрещин.
Затем начинается выкрашивание мелких частиц. При определенных
условиях кавитационная эрозия может в тысячи и даже сотни ты-
5.3. Испытания металлических материалов 141
сяч раз превосходить скорость коррозионного разрушения в той же
среде. На разрушение деталей при кавитационном действии жидких
коррозионных сред большое влияние оказывают состав и структура
сплава и скорость потока.
5.3. Методы испытаний металлических материалов
на стойкость против различных видов коррозии
5.3.1. Основные методы испытаний материалов
Необходимость испытаний металлических материалов на стой-
стойкость против различных видов коррозии обусловлена требованиями
длительной безопасной эксплуатации конструкций и оборудования.
Критерии оценки коррозионной стойкости материалов могут быть
качественные и количественные. Качественным критерием является
оценка изменений, произошедших в ходе коррозионных испытаний
с внешним видом испытуемых образцов и коррозионной средой.
Оценка изменений внешнего вида образца может быть визуальной
или проводиться с применением микроскопов — определяется из-
изменение морфологии поверхности металла и ее окраски. Об изме-
изменениях в коррозионной среде судят по нарушению ее цветности и
появлению в ней нерастворимых продуктов коррозии. Разновидно-
Разновидностью качественных методов являются индикаторные методы, осно-
основанные на изменении цвета специально добавляемых в коррозион-
коррозионную среду реактивов под действием продуктов растворения испы-
испытуемого материала. В практике испытаний сталей таким реактивом
часто является смесь ферро- и феррицианида калия, в результате
взаимодействия которой с ионами двухвалентного железа образу-
образуется «турбулевая синь» — ярко окрашенные области синего цвета.
Качественным индикатором при исследовании коррозии алюминия
и его сплавов является ализарин, окрашивающий зоны преимуще-
преимущественного растворения в красный цвет.
Количественные критерии оценки коррозионной стойкости ма-
материалов определяются особенностями применяемого метода ис-
испытаний — ими, как правило, являются различные физические и
физико-химические величины, например, значение токов и потенци-
потенциалов, потери массы (или привес) металла, глубина проникновения
коррозии, количество и место расположения очагов локального по-
поражения металла, наличие и глубина коррозионных трещин и т.д.
Наиболее часто используемым количественным критерием корро-
коррозионной стойкости металлов является скорость его равномерного
утончения (мм/год). Для сталей разработана десятибалльная шкала
142 Испытания материалов на стойкость против коррозии Гл. 5
коррозионной стойкости, согласно которой каждому баллу стойко-
стойкости соответствует определенная скорость утончения металла.
Все существующие в настоящее время методы испытаний могут
быть подразделены на полевые, натурные и лабораторные. Первые
два типа испытаний проводят в естественных условиях, они требу-
требуют длительного времени (месяцы) и различаются тем, что в первом
случае о коррозионной стойкости материала судят по поведению
образцов-свидетелей, устанавливаемых в интересующие узлы экс-
эксплуатирующегося оборудования, а во втором — испытаниям под-
подвергают опытные образцы аппаратов (или конструкций). Результаты
обоих указанных типов испытаний не обладают высокой надежно-
надежностью. В случае полевых испытаний это связано с тем, что воздей-
воздействие агрессивной среды на образцы-свидетели и элементы металли-
металлической конструкции не всегда полностью совпадает. Например, при
проведении коррозионных испытаний образцов-свидетелей в пото-
потоке движущейся жидкости условия ее течения вблизи их поверхно-
поверхности могут существенно отличаться от реализуемых на поверхности
элементов оборудования (может возникать локальная турбулизация
потока, застойные зоны, кавитационные эффекты и др.).
Надежность результатов лабораторных испытаний определяет-
определяется адекватностью моделирования реальных условий эксплуатации и
правильностью выбора критериев коррозионной стойкости. Лабора-
Лабораторные методы испытаний, как правило, являются ускоренными (в
некоторых случаях используют экспресс-методы). Преимуществами
ускоренных методов лабораторных испытаний является резко сокра-
сокращенное время испытаний (часы, для экспресс-методов — минуты),
возможность их многократного повторения с целью получения веро-
вероятностных оценок, возможность строгого контроля условий испытаний.
При моделировании процессов коррозии следует руководство-
руководствоваться принципами, перечисленными ниже.
Ускорение коррозионного процесса не должно быть вызвано из-
изменением его механизма. Например, при определении стойкости
углеродистых и низколегированных сталей против питтинговой и
язвенной коррозии даже незначительное увеличение агрессивности
среды (повышение температуры, концентрации раствора, пониже-
понижение рН) может привести к переводу стали в активное состояние, то
есть смене механизма коррозионного процесса.
При моделировании условий испытаний необходимо учитывать
особенности состава реальной коррозионной среды. Например, при
моделировании процессов атмосферной коррозии необходимо учи-
учитывать температуру, влажность и анионный состав реальной эксплу-
эксплуатационной среды.
5.3. Испытания металлических материалов 143
Для наиболее эффективного ускорения коррозионного процесса
необходимо выявить основной контролирующий фактор и воздей-
воздействовать именно на него. Например, если коррозионная активность
одного из компонентов агрессивной среды явно превалирует, в мо-
модельных условиях целесообразно увеличить именно его концентра-
концентрацию, контролируя при этом сохранение неизменности механизма
коррозионного процесса.
Методы испытаний должны разрабатываться с учетом особенно-
особенностей химического состава испытуемого материала. Например, мо-
модельные среды, рекомендуемые в качестве стандартных для опреде-
определения склонности коррозионностойких сталей против питтинговой
коррозии, нельзя использовать при испытаниях углеродистых и низ-
низколегированных сталей, поскольку последние в них не пассивиру-
пассивируются;
Необходим правильный выбор критериев коррозионной стойкости.
5.3.2. Испытания материалов на прочность против локальных
видов коррозии
Для испытания материалов на локальные виды коррозии суще-
существует две основные группы методов исследования - химические и
электрохимические. В отдельную подгруппу можно выделить фи-
физические методы исследования поверхности металла, применяемые
обычно в сочетании с химическими или электрохимическими (оп-
(оптическая и растровая электронная микроскопия, рентгеноспектраль-
ный микроанализ, Оже-электронная и рентгеновская фотоэлектрон-
фотоэлектронная спектроскопия и др.).
Химические методы исследования заключаются в создании и под-
поддержании в течение определенного времени контакта между испыту-
испытуемым материалом и средой, содержащей анионы-активаторы и име-
имеющей окислительно-восстановительный потенциал. Методы просты
в исполнении, не требуют задействования специальной аппаратуры
и позволяют определять стойкость различных металлических мате-
материалов.
Например, для изучения питтинговой коррозии существует нес-
несколько различных типов химических испытаний. Наиболее широкое
распространение получили испытания, заключающиеся в простой
экспозиции металлов в агрессивных средах в течение определен-
определенного времени при определенной температуре. В качестве анионов-
активаторов растворы чаще всего содержат С1~ ионы, а требуемое
значение EYQ^_0X поддерживается введением окислителей различного
типа, к которым, в первую очередь, относятся Fe3+, H2O2,
144 Испытания материалов на стойкость против коррозии Гл. 5
и др. Основным показателем питтингостойкости является услов-
условная скорость питтинговой коррозии определяемая гравиметриче-
гравиметрическим методом и рассчитываемая по формуле:
E.3)
где VUK — скорость питтинговой коррозии в г/(м2-ч), Am — суммар-
суммарная потеря массы металла, a S — суммарная площадь поверхности
параллельно испытываемых образцов. Количество и глубина обра-
образовавшихся на поверхности металла питтингов являются дополни-
дополнительными показателями, определяемыми при помощи оптической
микроскопии.
В настоящее время химические испытания нержавеющих ста-
сталей на стойкость против питтинговой коррозии стандартизованы в
США и России. Оба стандарта предусматривают выдержку сталей в
10%-м растворе РеОз-бБ^О (активность С1~-иона в 10%-м раство-
растворе FeCl3-6H2O соответствует его активности в морской воде).
Разновидностью химических испытаний является широко ис-
используемый в различных целях (в том числе — для выявления де-
дефектов, являющихся очагами локальной коррозии на поверхности
стальных изделий, защищенных металлическими или неметалличе-
неметаллическими покрытиями) метод цветных индикаторов. Сущность метода
заключается в накладывании на поверхность металла пористого ги-
гигроскопичного материала (часто — фильтровальной бумаги), пропи-
пропитанного испытательным водным раствором, содержащим анионы-
активаторы и окислители Кз|Те(С1Ч)б] и K4[Fe(CN)e] в различных
соотношениях, и выдерживания его на поверхности металла в те-
течение некоторого определенного времени. По истечении указанного
срока с поверхности металла аккуратно удаляют указанный материал
и подсчитывают на нем количество синих пятен, возникших в ме-
местах образования питтингов по реакции иона Fe2+, образующегося
в очагах локальной коррозии, с Кз|Те(С1Ч)б] и К4|Те(С1Ч)б]. Коли-
Количество синих пятен и является критерием склонности испытуемого
материала к питтинговой коррозии.
Еще одна модификация химических испытаний заключается в
подсчете (с использованием оптического микроскопа) очагов ПК,
образовавшихся на поверхности нержавеющей стали после нанесе-
нанесения на нее капли раствора NaCl.
Испытания на стойкость против МКК являются обязательными
для всех производимых коррозионностойких сталей. Их проводят
химическими методами, основанными на длительном кипячении об-
образцов металла в агрессивных средах. Около 80 % марочного соста-
состава производимых сталей, включая наиболее широко используемые
5.3. Испытания металлических материалов 145
стали типа Х18Н10Т6, Х17М13МB-3)Т и др., испытывают методом
AM, заключающемся в кипячении образцов в растворе 100 мл Н2 SO4
(р = 1,835 г/см2) + 160 г CuSO4 + 1000 мл Н2О + медная стружка.
Время испытаний зависит от марки стали, и для образцов стали
08Х18Н10Т составляет 24 ч, для образцов стали 12Х18Н10Т— 15 ч.
Потенциал, устанавливающийся на образцах, составляет +0,35 В. За
рубежом аналог метода известен как метод Штрауса.
Вторым наиболее распространенным методом является метод
АМУ, продолжительность кипячения образцов в котором составля-
составляет 8 ч. Состав испытательного раствора 50 г C11SO4 + 250 мл H2SO4
(р = 1,835 г/см2) + 1000 мл Н2О + медная стружка. Потенциал, уста-
устанавливающийся на образцах сталей, также составляет +0,35 В.
В обоих методах испытывают по четыре образца стали одной
и той же марки. Критериями склонности к МКК является наличие
поперечных трещин на поверхности образца, изогнутого после про-
проведения испытаний на угол 90°, или проникновение коррозии на
глубину более ЗОмкм, определяемом при помощи оптического ми-
микроскопа. Первый критерий качественный, второй — количествен-
количественный.
Достаточно широко применяемым методом химических испы-
испытаний является метод ДУ, известный за рубежом как метод Гюи.
Он заключается в кипячении образцов сталей в 65 ± 2 %-м раство-
растворе HNO3 в течение 5 циклов, каждый из которых имеет продол-
продолжительность 48 ч. Метод предназначен для контроля склонности к
МКК низкоуглеродистых сталей средней степени легированности,
например, 03Х16Н15МЗ, 03Х17Н14М2, 03Х18Н11, 03Х18Н12 и др.
Потенциал, устанавливающийся на поверхности испытуемых образ-
образцов, составляет 0,8-1,2 В.
Испытания на стойкость против МКК высоколегированных ста-
сталей типа 03Х21Н21М4ГБ и 03ХН28МДТ проводят методами В или
ВУ, заключающимися в кипячении образцов в течение соответствен-
соответственно 144 и 48 ч. Составы испытательных растворов для указанных ме-
методов следующие: ПО г CuSO4 + 55 мл H2SO4 + 1000 мл Н2О + 5 г
цинковой пыли, потенциал +0,35 В; 50% C11SO4 + 40 г Fe2(SO4K,
потенциал 0,8-0,9 В.
Электрохимические методы исследований и испытаний
Преимуществом электрохимических методов, в первую очередь,
является то, что они позволяют определять стойкость металличе-
металлических материалов в реальных условиях эксплуатации. Кроме того,
указанные методы обладают высокой экспрессностью. Их главным
146 Испытания материалов на стойкость против коррозии Гл. 5
недостатком является сложность аппаратурного оформления и вы-
высокие требования к квалификации персонала, однако популярность
электрохимических методов с течением времени все увеличивается.
Электрохимическими критериями питтингостойкости металлов
являются граничные потенциалы ПК — питтингообразования Епо,
репассивации Ещ, критический потенциал питтинговой коррозии
ЕПК и их расположение относительно потенциала свободной корро-
коррозии Екор.
Существует два основных типа электрохимических исследова-
исследований — потенциодинамические и гальваностатические. Оба метода
основаны на определении граничных потенциалов ПК.
Наиболее важным из указанных потенциалов является Епк, объ-
объективно отражающий физико-химическое состояние металла и не
зависящий от исходного состояния поверхности.
Электрохимические методы испытаний впервые в мире были
стандартизованы в нашей стране и рекомендованы для определения
питтингостойкости нержавеющих сталей, легко пассивирующихся
в нейтральных водных средах. Согласно стандарту оба типа испы-
испытаний проводят либо в условиях, моделирующих реальные условия
эксплуатации металла, либо при следующих условиях: естественная
аэрация, один из двух составов: №1 — 0,5 моль/л NaCl, 25 °С, е «
« 4,3 • 10~2 Ом-см (упрощенная модель морской воды); №2 —
0,3 г/л Na2SO4 + 0,4г/л NaCl, 50 °С, е « 8 • 10~4 Ом^-см (упро-
(упрощенная модель загрязненной хлоридом оборотной воды). Удельная
электропроводность растворов е приведена для 20 °С.
Перед проведением обоих типов испытаний погруженный в рас-
раствор образец не менее 1 ч выдерживают в испытательном растворе
до достижения стационарного значения Екор, принимая за таковое
изменяющееся за последние 30 мин не более, чем на ЗОмВ. После
этого начинают поляризацию образца.
Гальваностатическую поляризацию проводят током imin = 0,3 Ах
хм, регистрируя потенциал в течение не менее 30 мин. За величи-
величину Епк принимают среднее значение Е за последние 25-30 мин при
условии, что амплитуда его колебаний не превышает 30 мВ.
Потенциодинамическую поляризацию начинают от установив-
установившегося значения Екор сначала в анодном направлении, а затем из-
изменяя направление развертки Е на противоположное. Из поляриза-
поляризационной кривой определяют Епо — как потенциал начала резкого
роста тока. Потенциал Ерп определяют как потенциал пересечения
кривых прямого и обратного хода.
Одним из электрохимических методов испытания материалов на
склонность к МКК является метод потенциостатического травления.
5.3. Испытания металлических материалов 147
Метод заключается в травлении металлографических шлифов испы-
испытуемой стали в растворе 1 М НС1 + 0,4 М NaCl (T = 25 ± 5 °С). Од-
Одновременно в электрохимической ячейке испытывается несколько
образцов. Перед проведением испытаний образцы катодно восста-
восстанавливают в течение 5 мин при потенциале — 0Д5В (относительно
насыщенного хлорсеребряного электрода х.с.э.), а затем поляризуют
в течение 15 мин. при потенциале +0,1 В. После завершения поля-
поляризации образцы извлекают из ячейки, промывают, высушивают и
изгибают на угол 90°. Сталь считается стойкой, если на поверхности
изогнутых образцов не появились трещины. Метод является элек-
электрохимическим аналогом методов AM и АМУ и предназначен для
испытания сталей типа Х18Н10Т.
5.3.3. Испытания материалов на прочность
при коррозионно-механических воздействиях
Для оценки склонности материала к КР проводят испытания
образцов в исследуемой коррозионной среде при постоянном рас-
растягивающем напряжении или при постоянной величине и скорости
деформации.
В первом случае определяют зависимость времени до разруше-
разрушения образца от величины напряжения. Критерием стойкости металла
по отношению к КР служит время до разрушения образца при поро-
пороговом механическом напряжении аП, ниже которого не происходит
растрескивания при сколь угодно длительных испытаниях.
В основе второй группы методов лежат испытания образцов с
предварительно созданными трещинами с использованием принци-
принципов механики линейного разрушения. Критерием стойкости к КР
в этом случае является коэффициент интенсивности напряжения в
вершине трещин, приводящий к началу стабильного роста трещины
с последующим разрушением. Этот критерий определяется постро-
построением диаграммы «интенсивность напряжения Ki — скорость роста
трещины da/ dr»9 где а — глубина трещины.
Для определения коррозионно-усталостной прочности материа-
материала применяют методы линейной механики разрушения. В качестве
критерия стойкости материала принимают напряжения (условный
предел усталости), при воздействии которых происходит разруше-
разрушение после некоторого числа циклов, называемых базой испытаний.
Долговечность материала растет с повышением его чистоты, уме-
уменьшением шероховатости поверхности, увеличением диаметра изде-
изделия. Поэтому форма и качество образцов для испытаний регламен-
регламентируется (ГОСТ 25.502-79 и ГОСТ 2189-73).
148 Испытания материалов на стойкость против коррозии Гл. 5
5.3.4. Коррозионный мониторинг
Эффективным способом оценки коррозионного состояния обо-
оборудования (на стадиях его проектирования, эксплуатации, ренова-
реновации) является коррозионный мониторинг - система наблюдений и
прогнозирования коррозионного состояния объекта с целью полу-
получения своевременной информации о его возможных коррозионных
отказах.
«Жизненный цикл» любого аппарата или конструкции включает
четыре стадии: проектирование, изготовление, эксплуатация, рено-
реновация (реконструкция, ремонт).
К настоящему времени ученые и практики уже подошли к раз-
разработке физико-химической модели сопротивляемости разрушению
конструкций, эксплуатируемых в условиях воздействия экологиче-
экологических и коррозионно-опасных сред.
На стадиях проектирования мониторинг заключается в правиль-
правильности выбора конструкционных материалов с учетом особенностей
их эксплуатации и расчета долговечности конструкции. На стадии
эксплуатации мониторинг заключается в периодической диагности-
диагностике коррозионного состояния оборудования. Регламент мониторинга
определяется условиями эксплуатации диагностируемой системы.
При коррозионном мониторинге на стадии эксплуатации обору-
оборудования используются такие методы непрерывного (или периоди-
периодического) контроля его состояния, как: визуальный осмотр; осмотр
труднодоступных участков оборудования при помощи телеметриче-
телеметрических систем; определение технологических свойств коррозионной
среды (окислительно-восстановительного потенциала, наличия про-
продуктов растворения элементов металлической конструкции, измене-
изменения концентрации коррозионно-активных агентов и др.); определе-
определение потенциала металла; определение скорости коррозии образцов-
свидетелей; определение электрического сопротивления образцов-
свидетелей; ультразвуковая, магнитометрическая и акустическая де-
дефектоскопия.
Мониторинг на стадии реновации включает контроль техниче-
технических решений по конструкционным и восстановительным работам и
прогнозирование его дальнейшей эксплуатации с учетом этих работ.
5.3. Испытания металлических материалов 149
Методические рекомендации к главе 5
Вопросы для самопроверки
1. Какие виды коррозии называют локальными? Каковы их харак-
характерные признаки?
2. Что называют питтингом?
3. Назовите характерные признаки питтинговой коррозии.
4. Что такое щелевая коррозия? Как влияют конструктивные осо-
особенности аппаратов на возникновение этого вида коррозии?
5. Охарактеризуйте основные особенности межкристаллитной
коррозии и условия ее возникновения.
6. Как протекает селективное вытравливание металлов?
7. Каков механизм контактной коррозии?
8. Какие виды коррозионно-механических разрушений вам из-
известны?
9. Укажите примеры химических процессов, в которых имеет ме-
место коррозионно-механическое разрушение.
10. Что такое коррозионное растрескивание и коррозионная уста-
усталость металла?
11. Что называют фреттинг-коррозией? В каких условиях она про-
протекает?
12. Что называют кавитационной эрозией? В каких условиях на-
наблюдают этот вид разрушения?
13. Какие разновидности стандартных методов испытания матери-
материалов на стойкость против коррозии вам известны?
Задания для самостоятельных и контрольных работ
1. Опишите локальные виды коррозии. Выявите их основные при-
признаки и условия возникновения.
2. Питтинговая коррозия. Дайте характеристику этому явлению.
Укажите основные критерии. Опишите механизм возникнове-
возникновения питтингов и методы испытаний материалов на стойкость к
этому виду коррозии.
3. Межкристаллитная коррозия. Характеристика этого вида кор-
коррозии, условия возникновения. Методы испытаний материалов
против МКК.
4. Контактная коррозия. Причины ее возникновения. Влияние кон-
конструктивных особенностей машин и аппаратов на возникно-
возникновение контактной коррозии. Приведите примеры из практики.
ГЛАВА 6
КОРРОЗИЯ МЕТАЛЛОВ В ПРИРОДНЫХ
И ТЕХНОЛОГИЧЕСКИХ СРЕДАХ
Машины, аппараты, металлоконструкции в зависимости от свое-
своего назначения работают в природных или промышленных средах.
Характер технологической среды оказывает значительное влия-
влияние на закономерности коррозионных процессов и требует принятия
различных решений для осуществления основной инженерной зада-
задачи — защите металлов от коррозии.
В соответствие с принятой классификацией в этой части книги
будут рассмотрены основные закономерности протекания коррози-
коррозионных процессов в природных условиях. Это атмосферная, почвен-
почвенная и морская коррозия.
Технологические среды химических производств отличаются боль-
большим многообразием, различным сочетанием коррозионно-активных
компонентов, и в каждом конкретном случае требуют своего реше-
решения. Поэтому в этой части книги будут рассмотрены общие вопро-
вопросы — влияние конструктивных факторов на развитие коррозионных
разрушений машин и аппаратов и некоторые виды газовой коррозии,
которые приводят к специфическим деструктивным изменениям ме-
металлов и сплавов.
6.1. Коррозия металлов в природных средах
Большинство металлоконструкций эксплуатируется в природных,
естественных средах. Значительное количество стальных сооруже-
сооружений эксплуатируется в атмосферных условиях. Магистральные и
промысловые трубопроводы, водоводы, обсадные колонны скважин
нефтяных и газовых месторождений работают под землей. Общая
масса стали, находящаяся под землей, превышает 200 млн тонн,
а поверхность стальных сооружений, подвергающихся почвенной
коррозии, составляет более полутора миллиардов квадратных мет-
метров.
Металлические конструкции портов, причалов, судов находятся
в постоянном контакте с водой и подвержены морской коррозии.
Все виды коррозионных процессов в природных условиях проте-
протекают по электрохимическому механизму. Однако каждая природная
среда обладает своими особенностями.
6.1.
Коррозия металлов в природных средах
151
6.1.1. Атмосферная коррозия металлов
Атмосферная коррозия — это коррозия сооружений и оборудо-
оборудования, эксплуатирующихся в нормальной земной атмосфере.
Скорость коррозии и вид коррозионного разрушения зависят от
природы металла, влажности, загрязненности атмосферы (ГОСТ
16350-80). В среднем скорость коррозии металлов в атмосфере ниже,
чем в почве и морской воде.
Основным стимулирующим фактором атмосферной коррозии яв-
является вода. При относительной влажности воздуха до 60 % следы
влаги на поверхности металла отсутствуют. В этом случае коррозия
протекает по химическому механизму. Об-
Образующиеся на поверхности оксидные
пленки обладают защитными свойствами и
тормозят развитие коррозионных разруше-
разрушений (рис. 6.1).
При относительной влажности воздуха,
равной 60-70%, начинается конденсация
влаги и на поверхности металла появля-
появляется адсорбционная пленка воды. Относи-
Относительная влажность, при которой начинается
конденсация влаги на поверхности металла,
называется критической влажностью. Она
зависит от состояния металла и от степени
загрязнения воздуха.
При относительной влажности, близкой
к 100 %, или при непосредственном увлаж-
увлажнении металла (дождь, туман), на поверхно-
поверхности происходит образование видимых фазо-
фазовых слоев воды.
Указанные три типа состояний значи-
значительно отличаются по механизму протека-
протекания процесса коррозии.
В области сухой коррозии, как указы-
указывалось выше, реализуется химический ме-
механизм процесса и скорость разрушения металлов невелика. Рост
оксидной пленки происходит в первые секунды и минуты. После
двух-трех часов дальнейшее утолщение пленки прекращается. Пре-
Предельная толщина пленок на железе — 30-40 А, на нержавеющих
сталях — 10-20 А.
При образовании адсорбционного слоя влаги (толщиной порядка
нескольких молекулярных слоев) на поверхности металла появля-
°0 20 40'60 80 100
Относительная
влажность, %
Рис. 6.1. Коррозия же-
железа в воздухе, содержа-
содержащем 0,01 % (об.) SO2.
Выдержка 55 дней
152
Коррозия металлов в природных и технологических средах
Гл. 6
кор
а
*кор *
-Е
\
я*
^кор
б
1
1
г
кор г
Рис. 6.2. Коррозионные диаграммы:
а — влажная коррозия (АЕа > АЕК); б —
мокрая коррозия (АЕК > А ДО
-Е -Е ется электролит. В этих усло-
условиях реализуется электрохи-
электрохимический механизм и ско-
скорость коррозии значительно
возрастает. Пленка влаги имеет
небольшую толщину, кислород
проникает через нее беспре-
беспрепятственно и катодный про-
процесс не затруднен. Анодный
процесс осложняется тем, что
продукты коррозии экраниру-
экранируют поверхность металла. Так
как пленка влаги очень тонкая,
то весьма существенны омиче-
омические потери, но, в целом, процесс контролируется анодным тормо-
торможением (рис. 6.2, а).
При образовании фазовых пленок в области мокрой коррозии
затруднятся доставка кислорода и наблюдается катодное торможение
процесса (рис. 6.2, б).
Железо и сталь в обычных условиях подвергаются общей равно-
равномерной коррозии. Характер протекания атмосферной коррозии су-
существенно зависит от конструктивных особенностей изделия. Нали-
¦ чие узких щелей и зазоров,
в которых возможны капил-
капиллярная конденсация и застой
влаги, усугубляют атмосфер-
атмосферную коррозию и могут при-
привести к образованию корро-
коррозионных язв (рис. 6.3).
Загрязнение атмосферы
газами, пылью резко ускоря-
ускоряет коррозию. Это явление на-
наблюдают в промышленных
центрах, особенно в присут-
присутствии в воздухе SO2, NH3,
Рис. 6.3. Влияние конструктивных осо-
особенностей изделий на центры капилляр-
капиллярной конденсации влаги и усиление атмо-
атмосферной коррозии:
а — щель или зазор в деталях конструкции;
Ь — поры в защитном покрытии или в оксид-
оксидной пленке; с — неплотности в резьбовых и
винтовых соединениях
H2S,C12,HC1.
Обнаружено резко сти-
стимулирующее коррозию вли-
влияние низких концентраций
SO2. Так, присутствие в атмосфере SO2 в концентрациях 15-
35мкг/м3 увеличивает скорость коррозии в десятки и сотни раз. В
это же время высокие концентрации SO2 увеличивают скорость кор-
6.1. Коррозия металлов в природных средах 153
розионных разрушений только в 5-7 раз.
В работах Ю.Н. Михайловского предложена физико-механичес-
физико-механическая модель атмосферной коррозии, которая позволяет связать ин-
интенсивность коррозионных разрушений с параметрами окружающей
среды. Это служит основой для прогнозирования коррозионного по-
поведения металлов и разработки способов их защиты.
Стойкость металлов к атмосферной коррозии зависит от их хи-
химической природы и состояния поверхности. Ниже приведены при-
приближенные данные по стойкости некоторых металлов в городской
атмосфере (табл. 6.1).
Таблица 6.1
Стойкость металлов в атмосфере
Металл
Скорость коррозии, мкм/год
РЬ
4
А1
8
Sn
12
Си
12
Ni
32
Zn
50
Fe
200
Для защиты от атмосферной коррозии используют различные ор-
органические, неорганические и металлические покрытия. Эффектив-
Эффективно легирование стали небольшими количествами меди, никеля, фос-
фосфора и хрома.
6.1.2. Почвенная коррозия металлов
Различные трубопроводы, силовые кабели и кабели связи, опо-
опоры, емкости и другие металлические конструкции эксплуатируются
в подземных условиях. В США, например, затраты на текущий ре-
ремонт и замену вышедших из строя труб составляют несколько сот
миллионов долларов в год.
Почва и грунт представляют собой сложную природную среду,
особенности которой надо учитывать при рассмотрении протекаю-
протекающих в ней процессов коррозии.
Вода в грунте присутствует в виде связанной, капиллярной и гра-
гравитационной. Связанная вода, входящая в состав гидратированных
химических соединений, не оказывает влияния на коррозию.
Высота подъема капиллярной влаги зависит от эффективного ра-
радиуса пор грунта. Уровень грунтовых вод и пористость грунта опре-
определяют влажность, которая влияет на скорость коррозии.
Гравитационная влага перемещается по грунту под действием си-
силы тяжести и также влияет на режим влажности почвы. Разные почвы
по разному удерживают влагу. Тяжелые, глинистые почвы удержива-
удерживают влагу длительное время, песчаные почвы — более проницаемы.
С увеличением влажности почвы ее коррозионная активность по-
повышается до тех пор, пока не достигнет некоторого критического
154
Коррозия металлов в природных и технологических средах
Гл. 6
уровня. В дальнейшем с увеличением влажности ее активность пада-
падает. Это связывают с уменьшением доступа кислорода, необходимого
для осуществления катодной реакции.
Для каждого вида почвы существует свое значение критической
влажности, при которой коррозионные потери достигают максиму-
максимума. Для глинистых почв это значение лежит между 12 и 25 %, для
песчаных — между 10 и 20 %.
При малой увлажненности почвы велики омические потери, что
затрудняет протекание электрохимических процессов. Значение рН
для большинства почв находится в границах рН = 6,0-7,5. Одна-
Однако, встречаются также щелочные суглинки и солончаки, имеющие
значение рН = 7,5-9,5, и кислые, гумусовые и болотные почвы с
рН = 3,0-6,0. Такие почвы отличаются высокой агрессивностью.
Минерализация почвы может меняться в широких пределах — от
10 мг/л до 300 мг/л, что тоже сказывается на скорости коррозии.
Минералогический и гранулометрический состав грунтов, так же
как и влажность, влияет на омическое сопротивление. Так, в сухом
песчано-глинистом грунте удельное сопротивление почвы составля-
составляет 240000 Ом-см, а во влажном песчано-глинистом грунте — 900
Ом-см. Этот показатель также влияет на агрессивность почвы. Ниже
приведены данные, характеризующие взаимосвязь между электро-
электросопротивлением и агрессивностью почвы (табл. 6.2).
Таблица 6.2
Зависимость коррозионной агрессивности грунта от удельного
сопротивления почвы
Удельное
сопротивле-
сопротивление, Ом-см
Агрессив-
Агрессивность грунта
<500
Особо
высокая
500-1000
Высокая
1000-2000
Повышенная
2000-10000
Средняя
>10000
Низкая
Большое значение имеет воздухопроницаемость почв. Затрудне-
Затруднение доступа кислорода снижает скорость коррозии. По этой причине
песчаные почвы часто более агрессивны, чем глинистые. Если трубо-
трубопровод пролегает последовательно в глинистых и песчаных почвах,
т.е. в условиях неравномерной аэрации, то возникают микрогальва-
микрогальванические коррозионные зоны: на глинистом участке — анодная, а
на песчаном — катодная (рис. 6.4). Разрушение металла протекает
на тех участках, к которым затруднен доступ кислорода. Анодные
и катодные участки могут быть значительно удалены друг от друга.
Расстояние между ними может составлять несколько сотен метров.
В большинстве почв процесс коррозии протекает с катодным тор-
6.1.
Коррозия металлов в природных средах
155
Катодная зона
(коррозии нет)
Анодная зона (коррозия) - - У
Рис. 6.4. Схема коррозии подземного трубопровода в условиях различной
аэрации почв
можением из-за трудности транспорта кислорода (рис. 6.5, а). В рых-
рыхлых, хорошо аэрируемых почвах наблюдается анодное торможение
(рис. 6.5, б). При возникновении коррозионных пар, в которых анод-
анодные и катодные участки значительно удалены друг от друга, процесс
характеризуется омическим торможением (рис. 6.5, в).
Помимо равномерной коррозии подземные металлические соору-
сооружения подвержены питтингу и коррозионному растрескиванию (КР).
Питтинг возникает чаще всего на нижней части трубопроводов, где
имеется постоянный контакт с грунтом. КР обнаруживают в катод-
но поляризованных трубопроводах в местах нарушения защитных
покрытий.
Для защиты изделий от подземной коррозии используют электро-
-Е
*ко
Рис. 6.5. Случаи контроля коррозионного процесса для различных
условий почвенной коррозии:
а — коррозия в большинстве почв с превалирующим катодным контро-
контролем; б — коррозия в рыхлых, сухих почвах (анодный контроль); в —
коррозия при большой протяженности (превалирующий омический
контроль)
156 Коррозия металлов в природных и технологических средах Гл. 6
химические методы, а также нанесение изолирующих (битумных,
полимерных) многослойных покрытий.
Блуждающие токи являются причиной серьезных коррозионных
разрушений подземных коммуникаций и сооружений в промыш-
промышленной зоне. Блуждающие постоянные токи появляются вследствие
утечки в грунт постоянного тока, потребляемого наземным и подзем-
подземным рельсовым транспортом (метро, трамвай, электрифицированная
железная дорога), электросварочными агрегатами. Участки, где блу-
блуждающие токи входят из земли в металлическую конструкцию, ста-
становятся катодами, а там, где ток стекает с металла в почву—анодами.
Интенсивность коррозионных повреждений находится в прямой за-
зависимости от величины блуждающих токов и подчиняется закону
Фарадея. Протекание тока величиной в 1 А в течение года соответ-
соответствует растворению около 9 кг железа. В некоторых неблагоприят-
неблагоприятных случаях были зарегистрированы блуждающие токи величиной
до 200-500 А. Отсюда видно насколько интенсивными могут быть
повреждения от блуждающих токов. Если анодная область равно-
равномерно распределена по большой поверхности, коррозионные потери
могут и не вызывать аварийных разрушений, но в местах нарушения
неметаллического защитного покрытия коррозионные разрушения
происходят быстро.
Для защиты трубопроводов от действия блуждающих токов ис-
используют дренаж — соединение металлической шиной источника
блуждающих токов, например, рельсов, с их приемником, например,
трубопроводом. Если дренаж установить невозможно, то в направле-
направлении рельса закапывают специальный анод из чугуна, который соеди-
соединяют с анодной областью трубопровода медным проводником. То-
Тогда блуждающий ток вызывает коррозию только этого специального
анода. Если дополнительного анода недостаточно, то в цепь меж-
между анодом и трубой включают источник постоянного тока противо-
противоположного направления. Для уменьшения разрушающего действия
блуждающих токов используют также изолирующие прокладки в
местах стыка трубопровода.
Подземная коррозия может интенсифицироваться микроорганиз-
микроорганизмами. В почве обитают два вида микроорганизмов: аэробные, жиз-
жизнедеятельность которых протекает только при наличии кислорода,
и анаэробные бактерии, развивающиеся при отсутствии кислорода.
Коррозия металлов, вызванная или усиленная воздействием микро-
микроорганизмов, носит название биологической или биохимической.
Аэробные бактерии могут быть двух видов: одни окисляют серу,
другие — осаждают железо. Первый вид бактерий лучше всего раз-
развивается в кислой среде (рН = 3-^-6). Они окисляют серу до серной
6.1. Коррозия металлов в природных средах 157
кислоты. При этом на отдельных участках концентрация серной кис-
кислоты может доходить до 10%. Такое подкисление среды вызывает
резкое увеличение скорости коррозии.
Аэробные бактерии, перерабатывающие железо, развиваются в
интервале рН = 4-=-10. Сущность их деятельности заключается в
том, что они поглощают железо в ионном состоянии, а выделяют его
в виде нерастворимых соединений. Неравномерное отложение этих
соединений приводит к увеличению гетерогенности поверхности,
что усиливает коррозию.
Анаэробные бактерии в основном восстанавливают серу из суль-
сульфатов, находящихся в почве. Этот тип бактерий развивается при
рН = 5,5-^8,0. В результате их жизнедеятельности ионы SO^" вос-
восстанавливаются до S2~ с выделением О2. Последний начинает при-
принимать активное участие в катодном процессе. Присутствие в корро-
коррозионной среде сульфидов и сероводорода приводит к образованию
на поверхности изделия рыхлого слоя сульфида железа. Коррозия
имеет питтинговый характер.
6.1.3. Морская коррозия металлов
Портовые сооружения, причалы, суда, оборудование морских неф-
нефтепроводов подвержены воздействию морской коррозии.
Морская вода представляет собой раствор разнообразных солей,
главным образом хлоридов, сульфатов и карбонатов натрия, магния,
калия, кальция и т.д. Она является электролитом, ее электропровод-
электропроводность достаточно высокая и составляет B,5-3,0)-10~2 Ом~1-см~1,
имеет нейтральную или слабощелочную реакцию (рН = 7,2-=-8,6).
Присутствие в морской воде ионов хлора, т.е. ионов-активаторов,
делает эту среду высоко коррозионно-активной.
Соленость морской воды определяют в промиллях (%о). Промил-
лей называется количество твердых веществ в граммах, растворен-
растворенное в 1000 г морской воды, при условии, что все галогены замене-
заменены эквивалентным количеством хлора, все карбонаты переведены
в оксиды, органические вещества сожжены. В этом случае 1%о =
= 0Дмас.%. Средняя соленость воды в океане 3-3,5 %о. Но она
значительно колеблется в различных водных бассейнах.
Так, содержание солей в %: в заливе Кара-Богаз —16; в Крас-
Красном море — 4,1; в Средиземном море — 3,9; в Атлантическом
океане — 3,5; в Черном море — 1,7; в Финском заливе — 0,4; в
речной воде — 0,03.
В морской воде содержится большое количество микроорганиз-
158
Коррозия металлов в природных и технологических средах
Гл. 6
мов, способствующих ускорению коррозии и обрастанию соприка-
соприкасающихся с водой металлоконструкций.
Коррозия в морской воде протекает по электрохимическому ме-
механизму исключительно с катодным контролем. Присутствие ионов-
активаторов (С1~) препятствует образованию пассивных пленок на
поверхности металлов. Высокая электропроводность исключает про-
проявление омического торможения.
Зависимость скорости коррозии железа от концентрации NaCl в
аэрированном водном растворе проходит через максимум при со-
содержании NaCl« 3 %. Уменьшение скорости коррозии объясняется
снижением растворимости кислорода в воде с ростом концентра-
концентрации NaCl.
Увеличение скорости потока ведет к усилению коррозии вслед-
вследствие улучшения аэрации поверхности металла. Кроме того, высокие
скорости потока способствуют эрозионному разрушению металла.
Повышенное содержание кислорода в поверхностных слоях во-
воды вызывает усиленную коррозию в области ватерлинии судов, на
участках гидросооружений, находящихся близко к поверхности или
периодически омываемых водой (рис. 6.6).
На погруженных в воду конструкциях закрепляются или развива-
развиваются многие растительные и животные организмы. Это явление на-
называется обрастанием. Ми-
Морская коррозия
Образование FeCl/
Fe
Д 1
Воздух
w Уровень воды
¦ Катоднаязона~~
- Анодная зона ~
Морская вода
кроорганизмы ускоряют раз-
разрушение противокоррозион-
противокоррозионных покрытий. Появляются
локальные очаги оголенной
металлической поверхности,
которые провоцируют интен-
интенсивное разрушение металла.
Основным видом защиты
от морской коррозии явля-
являются противокоррозионные
и противообрастающие лако-
лакокрасочные и металлизацион-
ные покрытия и электрохи-
электрохимическая защита.
Среди лакокрасочных покрытий наиболее эффективны толсто-
толстослойные покрытия на эпоксидной основе с ограниченным содержа-
содержанием растворителя или без растворителя.
В защитные композиции добавляют вещества, обладающие про-
тивообрастающим действием. Они носят название биоцидов. Наи-
Наиболее часто применяют оксиды меди (I) и (II). Они, вымываясь из
Рис. 6.6. Схема коррозии железа, погру-
погруженного в морскую воду
6.2. Влияние конструктивных факторов 159
покрытия, образуют в морской воде труднорастворимые комплексы.
Кроме того у соединений меди отсутствует кумулятивный эффект
для морских организмов.
Для защиты судовых конструкций чаще всего используют алю-
алюминий с легирующими добавками, например, цинком или лантаном.
Алюминиевые покрытия в сочетании с лакокрасочными покрытиями
обладают высокой стойкостью в морской воде, имеют повышенную
стойкость к эрозии.
Для борьбы с морской коррозией широко используют электро-
электрохимическую защиту (ГОСТ 26301-85 и ГОСТ 26251-84). Защита
подводной части крупнотоннажных судов осуществляют автомати-
автоматическими системами катодной защиты.
6.2. Влияние конструктивных факторов на развитие
коррозионных разрушений машин и аппаратов
При проектировании химического производства, как правило,
уделяют основное внимание анализу характера агрессивной среды
и условиям протекания процесса. Руководствуясь этими данными,
выбирают материал, обладающий достаточным химическим сопро-
сопротивлением.
Столь же пристального внимания заслуживает рациональное кон-
конструирование отдельных узлов и аппаратов. Неудачное конструиро-
конструирование во многих случаях может явиться причиной образования за-
застойных зон, зазоров, концентрации напряжений и других явлений,
способствующих возникновению и протеканию коррозии.
Вместе с тем уже на стадии проектирования можно предусмот-
предусмотреть такие конструктивные решения отдельных узлов аппарата, ко-
которые значительно снизят или устранят возможность возникновения
процесса коррозии.
При конструировании оборудования следует обращать внимание
на характер обработки поверхности металла, контакт соединитель-
соединительных элементов из различных материалов, режим распределения по-
потоков теплоносителя, наличие щелей и зазоров, возможность обра-
образования застойных зон.
Гладкая поверхность металла имеет меньше различных дефек-
дефектов в виде царапин, неровностей и т.д. На шероховатой поверхности
легче скапливается грязь, пыль и другие вещества. Это особенно
характерно для производства удобрений, солей. Металлическое обо-
оборудование и конструкции с шероховатой поверхностью в этом случае
покрываются различными веществами. Если эти вещества гигроско-
гигроскопичны и легко впитывают влагу, то они прилипают к поверхности
160 Коррозия металлов в природных и технологических средах Гл. 6
металла, создаются местные очаги с высокой концентрацией элек-
электролита, что способствует усиленной коррозии.
Если в конструируемом аппарате есть детали, выполненные из
различных металлических материалов, то возникает опасность про-
проявления контактной коррозии (см. 5.1.6.). В этом случае еще на ста-
стадии проектирования обязательно должны быть приняты меры по
предотвращению или ослаблению этого явления. Обычно применя-
применяют один из двух возможных приемов.
Контактирующие детали из разнородных металлов изготавлива-
изготавливают с различной величиной поверхности. При этом деталь с наимень-
наименьшей поверхностью должна быть выполнена из более благородного
металла (втулки вентилей, поршневые кольца насосов и т.д.).
Если такой способ оказывается невозможным, то детали из раз-
разных материалов должны быть изолированы друг от друга. Этот спо-
способ предотвращения электрохимической контактной коррозии ча-
часто применяют при проектировании трубопроводов, в строительных
конструкциях. Особое внимание при этом надо уделить свойствам
прокладочного материала. Он должен быть инертным по отношению
к рабочей среде, способным выдерживать температурные и механи-
механические нагрузки, иметь высокую износостойкость. Особое внимание
следует уделить монтажу контактных узлов. Если монтаж выполнен
неаккуратно, то возможно возникновение застойных зон, щелей и
других очагов усиленного развития коррозии.
Многие химические и нефтехимические процессы протекают при
повышенных температурах. Коррозионные процессы в этих услови-
условиях имеют свои особенности. Чем выше температура, тем интенсив-
интенсивнее происходит разрушение металла. Скорость коррозии в условиях
теплопереноса может изменяться до двух порядков.
Поверхность металла, соприкасающаяся с теплоносителями и
хладагентами, подвергается дополнительному коррозионному воз-
воздействию. Например, теплообменники являются одним из наименее
стойких видов оборудования. В 92 % случаев причиной отказа в ра-
работе теплообменника является коррозия теплопередающих поверх-
поверхностей.
В изотермических условиях при равенстве температур металла
и технологической среды в определенном интервале температур на-
наблюдается эффект резкого увеличения скорости коррозии пассиви-
пассивирующихся металлов и снижение потенциала свободной коррозии.
Металл из пассивного состояния переходит в активное. Эта тем-
температура по определению Я.М. Колотыркина названа предельной
температурой самопассивации. Очевидно, что в реальных услови-
условиях надо стремиться работать при таких температурах, при которых
6.2. Влияние конструктивных факторов 161
металл еще сохраняет способность к самостоятельному переходу в
пассивное состояние.
При конструировании аппаратов следует предусмотреть равно-
равномерное распределение теплового потока, исключить возможность
локального перегрева. Во многих промышленных аппаратах, в кото-
которых протекают высокотемпературные процессы, такие меры преду-
предусмотрены.
Примеры. В производстве аммиака между катализаторной ко-
коробкой, в которой осуществляется реакция при температуре 350-
420 °С, и корпусом аппарата предусмотрен канал, внутри которо-
которого циркулирует холодный газ. Таким конструктивным приемом
предохраняют стенки аппарата от перегрева.
Если в химическом процессе используют реакторы с рубаш-
рубашкой, то внутри реактора должна быть установлена мешалка для
обеспечения равномерного перемещения жидкости мимо тепло-
передающей поверхности.
Змеевики, кипятильники и другое оборудование для нагре-
нагрева технологических сред должны быть полностью погружены в
жидкость.
Для теплообменного оборудования наиболее распространенны-
распространенными являются локальные виды коррозии, такие как питтинговая, ще-
щелевая и межкристаллитная.
При проектировании конструкций должны быть обозначены ме-
места и способы сварки. При сварке металлов в зоне шва и в околошов-
околошовной зоне создаются большие растягивающие напряжения. В зонах,
расположенных вдоль шва, где металл нагревается выше критиче-
критических температур, меняется структура металла. Это может привести
к растрескиванию металла.
При конструировании сварных узлов и деталей следует преду-
предусматривать ряд мер: избегать скопления швов, исключить точеч-
точечную сварку, при которой особенно велика концентрация напряжений,
применять местный отжиг и т.д.
Очень опасными в коррозионном отношении зонами в аппаратуре
являются зазоры и щели. В них может происходить концентрирова-
концентрирование рабочего раствора, нарушаться аэрация, что неизбежно приведет
к развитию местной коррозии. С этой точки зрения опасны преры-
прерывистые сварные швы, в которых вследствие неплотного прилегания
материала друг к другу образуются щели и зазоры, являющиеся при-
причиной возникновения щелевой коррозии.
Образование застойных зон жидкости в аппаратах и трубопро-
трубопроводах сильно увеличивает возможность возникновения коррозии за
счет образования микропар неравномерной аэрации. Этому способ-
162
Коррозия металлов в природных и технологических средах
Гл. 6
Осадок
IV
Рис. 6.7. Основные стадии
формирования очагов кана-
вочной коррозии:
/ — формирование осадка
Fe3O4, FeCO3, FeS; // — эро-
эрозионный износ осадка в обла-
области нижней образующей тру-
трубы; /// — образование галь-
гальванопары (АЕ ~ 200 мВ);
IV — разрушение металла в
области нижней образующей
трубы, образование трещин
ствует и отложение различных осад-
осадков в застойной зоне.
В качестве примера рассмотрим
механизм возникновения коррозии
на нефтепроводах северных нефтя-
нефтяных месторождений.
Наиболее опасным видом разру-
разрушения внутренней поверхности тру-
трубопровода является канавочная кор-
коррозия, очаги которой имеют вид
прямоугольной канавки шириной до
5 см и длиной до 10-12 м, располо-
расположенной в области нижней образую-
образующей трубы. Для канавочной корро-
коррозии характерная высокая скорость
разрушения D-8 мм/год, в отдель-
отдельных случаях до 18 мм/год). Этот вид
разрушения почти всегда сопрово-
сопровождается разрывами труб, что при-
приводит к значительному экологиче-
экологическому ущербу. Первый случай был
зафиксирован в 1977 г. на Самот-
лорском месторождении всего через
8 лет после начала промышленной
эксплуатации на трубопроводе диа-
диаметром 820 мм при обводненности
нефти 30 %.
В последующие годы только на
Самотлорском месторождении еже-
ежегодно фиксируется 20-25 случаев ка-
канавочной коррозии.
На рис. 6.7 представлена схема
формирования очагов канавочной
коррозии. Первоначально на вну-
внутренней поверхности трубопровода
образуется осадок из оксидов и со-
солей железа в результате коррозион-
коррозионного процесса и выделения из объема
пластовой воды.
Часть осадка уносится потоком
жидкости, поверхность трубы об-
обнажается. Образуется гальванопара,
происходит разрушение трубы и по-
появление трещины.
Предупредительными мерами являются рациональное констру-
конструирование. В рационально сконструированных узлах устранена воз-
возможность скапливания влаги и продуктов коррозии, предусмотрена
возможность удаления осадка.
6.3.
Некоторые случаи газовой коррозии металлов
163
На рис. 6.8 представлены
варианты конструкций аппа-
аппаратов с нижним сливом жид-
жидкости. Из них вариант «а» яв-
является наиболее неудачным,
так как нижняя часть аппа-
аппарата постоянно будет запол-
заполнена раствором и осадком.
Наиболее удачна конструк-
конструкция «в», так как она спо-
способствует быстрому и бес-
беспрепятственному удалению
жидкости.
Рис. 6.8. Конструкции аппаратов с ниж-
нижним сливом жидкости:
а — неудачная; б — улучшенный вариант;
в — удачная
6.3. Некоторые случаи газовой коррозии металлов
в технологических средах
В химической промышленности многие технологические про-
процессы или их определенные стадии протекают в газовой среде в
условиях повышенных температур и давлений.
При температурах от 100 до 200-300° С многие газы не опасны.
Химическая активность газов и скорость газовой коррозии металлов
сильно возрастают при температурах выше 200-300 °С. Так, хлор
начинает действовать на железные сплавы при температуре выше
200 °С, хлористый водород — выше 300 ° С, диоксид серы, диоксид
азота, пары серы — выше 500 °С.
Эти особенности поведения технологических газовых сред и ши-
широкая эксплуатация их в промышленности, требует более подробного
рассмотрения поведения металлов в реальных условиях.
6.3.1. Обезуглероживание стали
При высоких температурах многие технологические процессы в
газовой фазе осложняются декарбюризацией или обезуглерожива-
обезуглероживанием стали. Суть этого явления заключается в том, что при темпе-
температурах выше 650 °С помимо образования поверхностной оксидной
пленки происходит обеднение слоя металла, прилегающего к плен-
пленке, углеродом. Содержание углерода в поверхностных слоях стали
уменьшается.
Процесс наблюдается часто в окислительной атмосфере, содер-
содержащей О2, Н2О или СО. Он может иметь место и в среде водорода.
Декарбюризация сопутствует многим химическим процессам. На-
164 Коррозия металлов в природных и технологических средах Гл. 6
пример, обжиг серосодержащего сырья при производстве серной
кислоты осуществляют при температуре 750-850 °С, конверсию ме-
метана в различных окислительных средах (О2, Н2О, CO2) — при тем-
температурах 700-1000 °С. К этой же группе процессов можно отнести
многочисленные реакции горения, окислительного крекинга и т.д.
Декарбюризация понижает твердость и прочность стали, снижает
срок службы изделий.
В основе явления обезуглероживания лежит процесс восстанов-
восстановления цементита — Fe3C:
Fe3C + I/2O2 = 3Fe + CO
Fe3C + СО2 = 3Fe + 2СО
Fe3C + H2O = 3Fe + CO + H2
При температуре выше 650 °C коэффициент диффузии углерода
становится больше коэффициента диффузии атомов металла. В ре-
результате этого более подвижные атомы углерода диффундируют в
зону реакции и реагируют с окислителем. Скорость диффузии угле-
углерода в стали превышает скорость окисления металла.
В начальные моменты времени, когда защитная пленка еще не
сформирована, декарбюризация обычно не наблюдается. По мере за-
замедления окалинообразования появляется все утолщающийся слой
обезуглероженной стали. При дополнительном нагреве он может со-
составлять в глубину несколько миллиметров.
С повышением в газовой среде содержания Н2О, CO2,02 степень
декарбюризации увеличивается. Напротив, возрастание в газовой
среде содержания СО и СН4 уменьшает степень обезуглероживания.
Добавление в сталь алюминия и вольфрама уменьшают склон-
склонность к декарбюризации. Хром, марганец и кобальт незначительно
влияют на процесс. Кремний, никель, ванадий почти не оказывают
влияние.
6.3.2. Водородная коррозия
Водородная коррозия может сопутствовать многим технологиче-
технологическим процессам, протекающим при повышенных температурах от
200 °С и давлениях от 300 МПа в средах, содержащих водород. Эти
условия отвечают таким процессам, как гидрирование угля и нефти,
синтез аммиака и метанола и др.
Наблюдаются два вида повреждения металла водородом — водо-
водородная хрупкость и водородная коррозия. Часто эти явления накла-
накладываются друг на друга. Если в газе присутствует аммиак, то может
происходить также и азотирование металла.
6.3. Некоторые случаи газовой коррозии металлов 165
При контакте азотно-водородной смеси с металлом в условиях
повышенных температур и давления молекулярный водород на по-
поверхности металла диссоциирует. Образовавшийся атомарный во-
водород диффундирует в решетку металла и растворяется в нем. При
снижении температуры из-за уменьшения растворимости водород
стремится перейти в газообразное состояние внутри металла. В этом
случае в металле возникают большие напряжения, приводящие к
необратимой хрупкости.
Водородная коррозия является результатом химического взаимо-
взаимодействия водорода с карбидной составляющей стали. Внешне прояв-
проявление водородной коррозии означает сильное снижение прочности
стали без заметного разрушения поверхности. Появление водород-
водородной коррозии связывают с несколькими явлениями:
• обезуглероживание стали вследствие восстановления водоро-
водородом составляющей металла — цементита Без С:
Fe3C + 2Н2 = 3Fe + СН4
• проникновением водорода внутрь стального изделия и образо-
образования там хрупкого твердого раствора водорода в железе;
• появление по границам зерен растрескивания в результате вну-
внутреннего давления из-за образования в порах СН4.
Как показывают экспериментальные данные появлению внеш-
внешних признаков водородной коррозии предшествует инкубационный
период, который в зависимости от условий может продолжаться до
1000 часов.
При температуре выше 300° С на поверхности металла парал-
параллельно с реакцией обезуглероживания протекает процесс хемосорб-
ции водорода и его распад на атомы. Диаметр атома водорода со-
составляет 0,1 нм, и он обладает большой подвижностью.
Проникая внутрь металла, атомы водорода образуют твердый рас-
раствор в железе, а также, частично, вступают в реакцию со свободными
атомами углерода:
С + 4Н = СН4
В отличие от реакции обезуглероживания образование СН4 про-
происходит не на поверхности, а внутри металла. Развивается высокое
внутреннее давление. На поверхности металла появляются вздутия
и трещины.
Термодинамические расчеты показывают, что при температурах
300-600° С и повышенных давлениях водорода происходит почти
полное разложение цементита.
166
Коррозия металлов в природных и технологических средах
Гл. 6
Реакция образования СН4 является обратимой и идет с умень-
уменьшением объема. Поэтому повышение давления сдвигает равновесие
этой реакции вправо и снижает температурную границу протекания
реакции. В нефтехимических производствах, работающих в восста-
восстановительной атмосфере при давлениях до 50МПа рабочую темпе-
температуру ограничивают до 200 °С.
Скорость водородной коррозии в значительной степени зависит
от глубины обезуглероживания стали. На этот процесс оказывают
влияние давление водорода, температура и т.д. (рис. 6.9).
Обычными конструкционными материалами в восстановитель-
восстановительных средах являются стали 20 и 30ХМА. Они эксплуатируются до
температуры 300 °С. Для изделий, работающих при более высоких
температурах, в металл вводят легирующие добавки. В качестве до-
добавок используют элементы, повышающие сопротивляемость стали
обезуглероживанию, как то хром, молибден, ванадий. Хром допол-
дополнительно препятствует проникновению водорода в металл.
Как видно из рис. 6.10, проникновение водорода в хромистую
сталь зависит от температуры газа и содержания хрома в металле.
I4
1-4 1
S 4
f 3
700 °С
. 600 °С
500 °С
20 40 60
80 100 120 140160
т, ч
Рис. 6.9. Зависимость глубины обе-
обезуглероживания стали 35 (в мм)
от времени при давлении водорода
20 МПа и разных температурах
2 4 6 8 10 12 14
Содержание хрома, %
Рис. 6.10. Зависимость глубины
проникновения водорода в сталь от
содержания в ней хрома
(давление Нг 30 МПа, время испыта-
испытания 300 часов)
При содержании в железных сплавах 6 % хрома химическая стой-
стойкость сплава при 600 °С и давлении 30 МПа достаточно высокая.
Медь и медные сплавы также подвержены водородной коррозии.
Это явление связано с восстановлением закиси меди С112О, которая
входит в виде включений в состав многих медных сплавов:
Си2О + Н2 = Н2О + 2Си
Образующиеся пары воды создают внутри металла высокое дав-
давление, что приводит к возникновению трещин и потере пластич-
6.3.
Некоторые случаи газовой коррозии металлов
167
Нитридный Основной
слой металл
200
4 5 6
0,1 0,2 0,3 0,4 0,5 0,6
Расстояние от наружной поверхности, мм
Рис. 6.11. Изменение твердости HV по толщине.
а — Стенка кармана термопары колонны синтеза аммиака из
стали 18ХЗМБ, 1 — 14000 ч. работы при 500-550 °С, 2 —
51840 ч. работы при 490-525 °С. б — Стенка трубки Фильда
колонны синтеза аммиака из стали Х18Н10Т, 30800 ч. работы
при-500°С
ности. Мерой борьбы против этого явления является снижение со-
содержания закиси меди в сплавах. При концентрации С112О не более
0,01 % явления водородной коррозии не наблюдается.
В условиях синтеза аммиака азото-водородо-аммиачная смесь бо-
более опасна для стали, чем чистый водород. В этом случае кроме всех
видов водородной коррозии может происходить азотирование стали.
В условиях работы колоны синтеза аммиака происходит не толь-
только образование аммиака, но частично его диссоциация на поверхно-
поверхности металла с образованием атомарного азота. Последний реагирует
с атомами железа или легирующих элементов, образуя нитриды. В
результате поверхность стали насыщается азотом и становится хруп-
хрупкой.
С увеличением содержания хрома в сталях степень воздействия
водорода и аммиака уменьшается. При содержании хрома выше 11%
на поверхности стали образуется твердый и плотный нитридный
слой, который препятствует диффузии азота вглубь металла. Это
подтверждают данные рис. 6.10 и 6.11.
На стали 18X3MB глубина нитридного слоя составляет 3-4 мм и
плотность его в 2 раза больше, чем основного металла. На деталях
из стали XI8Н1 ОТ глубина нитридного слоя 0,3 мм, но плотность его
в 10 раз выше, чем у основного металла.
168
Коррозия металлов в природных и технологических средах
Гл. 6
ЗОМПа
6.3.3. Карбонильная коррозия
Карбонильная коррозия имеет место в технологических процес-
процессах, протекающих с участием углерода (II) при повышенных дав-
давлениях и температурах. К таким процессам относятся, например,
получение метилового и бутилового спиртов, конверсия метана и
окиси углерода.
При нормальных условиях СО инертна по отношению к метал-
металлам. При высоких температурах и давлениях оксид углерода вступает
в реакцию со многими металлами и образует карбонилы. Например:
Fe + nCO = Fe(CO)n
Железо с СО может образовывать три соединения: тетракар-
бонил — Fe(COL, пентакарбонил — Fe(COM и нонакарбонил —
Fe(CO)g. Все эти соединения достаточно неустойчивые и разлагают-
разлагаются при повышении температуры. Наиболее устойчивое соединение
среди них — Fe(COM при температуре выше 140° С практически
полностью диссоциирует на Fe и СО (рис. 6.12). Аналогичные со-
соединения оксид углерода (II) может
образовывать со многими металла-
металлами. На рис. 6.12 представлена ско-
скорость образования пентакарбонила
железа — Fe(COM — при разных
условиях. Все кривые имеют мак-
максимум.
Левая восходящая часть кри-
кривой отвечает увеличению скоро-
скорости процесса с ростом темпера-
температуры. Правая ниспадающая часть
кривой отвечает стадии разложе-
разложения Fe(COM.
Карбонильная коррозия вызы-
вызывает разрушение и разрыхление по-
поверхностного слоя металла на глу-
глубину до 5 мм. Изменение структуры металла на большем расстоянии
от поверхности уже не происходит.
Для защиты от карбонильной коррозии применяют хромистые
стали с содержанием 30 % Сг, хромоникелевые стали с содержанием
23 % Сг и 20 % Ni и марганцевые бронзы для работы при темпера-
температуре до 700 °С и давлении до 35 МПа. При более низких параметрах
возможно применение менее легированных сталей типа Х18Н9.
Сырьем для синтеза мочевины CO(NH2J является ТЧНз и СО2.
12
о
О
та
о т
о О
100 140
180 220
t,°C
260
Рис. 6.12. Скорость образования
пентакарбонила железа в зависи-
зависимости от температуры при разных
давлениях
6.3.
Некоторые случаи газовой коррозии металлов
169
Процесс протекает при температуре 175-190 °С и давлении 20 МПа.
Хромистые нержавеющие стали различных марок непригодны для
изготовления основных аппаратов. Наибольшую стойкость имеют
стали, легированные молибденом и хромникельмолибденовомедные
стали. Важным фактором для повышения коррозионной устойчиво-
устойчивости является тщательная очистка газов от сероводорода и дополни-
дополнительное введение в систему кислорода в количестве 0,5-1,0 об.% от
содержания СО2. В табл. 6.3 приведены данные по скорости корро-
коррозии материалов в условиях синтеза CO(NH2J-
Таблица 6.3
Скорость коррозии металлов и сплавов при синтезе CO(NH2J при 100 %-м
избытке NH3
Металл или сплав
ОООХ16Н15МЗ
Х17Н13М2Т
Х17Н13МЗТ
ОХ11Н16МЗТ
Ст.З
ОХ13
Тантал
Молибден
Содержание Ог по
отношению к СОг,
об.%
0,5-0,6
-II-
-II-
-||-
-||-
-II-
-II-
-||-
Температура, °С
190
190
190
190
150
190
165
190
Скорость
коррозии,
мм/год
0,06
0,08
0,05
0,04
>20
>15
0,0
1,8
6.3.4. Сернистая коррозия
Сера и ее соединения — сернистый ангидрид (SO2), сероводород
(H2S), меркаптаны или тиоспирты и т.д. являются достаточно агрес-
агрессивными, коррозионноактивными веществами. Наиболее активным
компонентом при высокотемпературной газовой коррозии является
сероводород. Он даже более опасен, чем диоксид серы.
Сернистый газ SO2 является исходным продуктом при производ-
производстве серной кислоты. Его получают при обжиге серного колчедана,
сжигании серы, из сероводорода при утилизации отходящих газов
металлургических производств.
Чугунные детали скребков конверторных печей кипящего слоя,
зубья и гребки колчеданных печей, котлы-утилизаторы, сухие элек-
электрофильтры, газоходы обжиговых газов в производстве серной кис-
кислоты часто выходят из строя вследствие газовой коррозии.
В результате коррозии черных металлов в сернистом газе при тем-
температурах 300 °С и выше образуется слоистая окалина, состоящая из
FeS,FeOHFe3O4.
170 Коррозия металлов в природных и технологических средах Гл. 6
При температуре газа более 400 °С для деталей из чугуна харак-
характерно увеличение объема металла, достигающего 10 % от начальной
величины. При этом резко снижается прочность материала. Детали
испытывают коробление, трескаются и разрушаются. Это явление
называется «ростом» чугуна и объясняется внутренним окислением
металла. Максимальный рост чугуна наблюдается при 700 °С.
К ростоустойчивым чугунам относятся высоколегированные хро-
хромистые чугуны, карбидный чугун типа «пирофераль» и «чугаль»
Сернистый газ при высоких температурах окисляет никель. При
этом образуется окалина, в состав которой входят NiS и NiO:
3Ni + SO2 = NiS + 2NiO.
Рост пленки подчиняется параболическому закону.
Сернистый никель образуется и при действии на металл серово-
сероводорода:
Сульфид никеля с металлическим никелем образует легкоплав-
легкоплавкую эвтектику с температурой плавления около 625 °С. Образование
этой эвтектики в сталях, содержащих никель, происходит преиму-
преимущественно по границам зерен, вызывая разрушение металла.
Стали с содержанием никеля выше 15 % очень чувствительны к
действию сернистого газа. В процессе окисления они теряют ме-
механическую прочность. Поэтому при работе с газовой средой, со-
содержащей диоксид серы, при температурах до 400° С используют
углеродистые стали, а при более высоких температурах — хроми-
хромистые стали.
Наиболее употребительны жаростойкие стали — 4Х9СА, Х6СЮ,
XI7, ОХ17Т, Х18СЮ, Х25Т. Интенсивное образование окалины про-
происходит при температурах выше 800-1000 °С. К жаропрочным ста-
сталям в этой среде относятся Х5М, Х6СМ, XI8Н12Т, Х23Н18. Рабочая
температура для этих сплавов 550-600 °С (для Х23Н18 — 1000 °С).
Сухой сернистый газ реагирует с алюминием очень медленно.
Поэтому алюминий используют для защиты от коррозии деталей и
узлов теплообменников и контактных аппаратов.
Сухой сероводород при комнатной температуре не представляет
опасности для обычных углеродистых сталей. С повышением тем-
температуры опасность сероводородной коррозии углеродистых сталей
значительно увеличивается. При температуре выше 300°С железо
подвергается сильной коррозии в серосодержащих газовых средах.
Легирование хромом в количестве > 12 % повышает коррозион-
коррозионную стойкость при температурах до 700-800 °С. При коррозии хро-
6.3.
Некоторые случаи газовой коррозии металлов
171
I
к"
3
Он
Он
-Q
Б
а
§
5,08
3,81
2,54
1,27
0,20
_
0,10
0,05 \
^0,02
5 10
Содержание
\
\
\
V \
\д
\ \
15 20
хрома, масс.%
мистых сталей образуется окалина, наружный слой которой состоит
из сернистого железа. Хром в этом слое практически отсутствует.
Весь окисленный хром сосредотачивается во внутреннем слое, ко-
который и обладает защитным свойством. Хорошей химической стой-
стойкостью в атмосфере сероводорода обладают ферритные сплавы, со-
содержащие 25-30 % хрома.
Особую опасность представляет совместное присутствие серни-
сернистых соединений и других коррозионно-активных компонентов. Так,
в нефтяной промышленности при термической переработке серни-
сернистых нефтей особую опасность
представляет смесь сероводорода и
водорода при повышенных давле-
давлениях. Из приведенных на рис. 6.13
данных видно, что скорость корро-
коррозии хромистых сталей увеличива-
увеличивается с ростом концентрации серо-
сероводорода в парах нефти. При этом
увеличение концентрации H2S в 10
раз вызывает рост скорости корро-
коррозии более чем в 12-15 раз.
При сгорании топлива обра-
образуются сложные газовые смеси,
содержащие в своем составе О2
и различные оксиды, в том числе
и примеси серы. В этих случаях
наблюдают сульфидно-оксидную
коррозию. Защитная пленка на ме-
металле состоит, как правило, из
нескольких слоев. Наружный слой обогащен кислородом и состоит
из оксида металла, а внутренние слои, прилегающие к поверхности
металла, содержат повышенное количество серы и сульфидов. Ес-
Если при сгорании топлива образуется зола, в состав которой входит
оксид ванадия V2O5, то скорость коррозии увеличивается очень бы-
быстро. Причины ванадиевой коррозии сталей были разобраны ранее.
Хромистые стали с содержанием 4-6 % Сг считаются полужаро-
полужаростойкими. Стали этого класса вследствие своей доступности,
повышенной коррозионной устойчивости и прочности широко при-
применяются в нефтяной промышленности для изготовления крекинг-
установок. Жаростойкость этих сталей на воздухе и в топочных газах
со значительным содержанием сернистых соединений при темпера-
температурах 500-600 °С примерно в 3 раза выше жаростойкости нелегиро-
нелегированных сталей.
Рис. 6.13. Зависимость скорости
коррозии хромистых сталей в па-
парах нефти от содержания хрома
F50° С).
Цифры на кривых обозначают содер-
содержание Н2 S, %.
172
Коррозия металлов в природных и технологических средах
Гл. 6
Присадка молибдена A-1,5) % повышает жаростойкость и жаро-
жаропрочность стали. Кремний также оказывает положительное влияние
на коррозионную стойкость сталей в атмосфере сероводорода.
Алюминий устойчив в газовых средах, содержащих сернистые
соединения. Добавка его к железу в количестве не менее 4 % оказы-
оказывает защитное действие до 800 °С при сероводородной коррозии.
Хромистые стали, дополнительно легированные алюминием и
кремнием, а также церием, таллием и кальцием, обладают наиболь-
наибольшей устойчивостью против газовой коррозии в области высоких тем-
температур (выше 700 °С) в средах, содержащих сернистые соединения.
6.3.5. Коррозия в среде хлора и хлористого водорода
Поведение металлов в среде газообразных хлора и хлористого во-
водорода принципиально отличается от действия других агрессивных
сред. Связано это с тем, что хлористые соли, которые образуются
на поверхности металла, обладают низкой температурой плавления,
а в ряде случаев при повышении температуры возгоняются. Боль-
Большинство таких реакций имеет положительный тепловой эффект. Это
приводит к значительному местному повышению температуры и об-
образующиеся хлориды плавятся и разлагаются.
Таблица 6.4
Температуры плавления солей и оксидов некоторых металлов
Хлориды
Формула
А1С13
FeCb
FeCl3
CuCb
NiCb
РЬС12
TiCU
CrCl3
i Op
192
ВОЗГ.
672
304
630
973
ВОЗГ.
501
ВОЗГ.
1152
Оксиды
Формула
АЬОз
FeO
Fe2O3
Cu2O
MO
PbO
TiO2
Сг2Оз
i Op
^пл? ^
2015
1360
1540
1230
1950
1290
разл.
1560
1550
Сульфиды
Формула
A12S3
FeS
Fe2S3
Cu2S
MS
PbS
Cr2S3
i Op
^пл? ^
1100
1193
-
110
793
-
разл.
Защитные свойства хлоридных пленок низкие, в некоторых слу-
случаях металлы в токе хлора возгораются. В табл. 6.4 приведены тем-
температуры плавления хлоридных солей ряда металлов. Для сравнения
указаны температуры плавления оксидов и сульфидов.
При низкой температуре в атмосфере сухого хлора стойки многие
6.3.
Некоторые случаи газовой коррозии металлов
173
металлы. С повышением температуры начинают протекать экзотер-
экзотермические реакции металлов с хлором и происходит воспламенение.
Температура воспламенения зависит от величины теплового эффек-
эффекта и определяется природой металла. В табл. 6.5 приведены темпе-
температуры воспламенения некоторых металлов и сплавов в атмосфере
хлора.
Таблица 6.5
Температуры воспламенения ряда металлов и сплавов в атмосфере сухого
хлор-газа
Материал
Железо и сталь
Никель
Свинец
Медь
Титан
Температура воспламенения, °С
-150
> 500
90-100
200
<20
В сухом хлористом водороде при комнатной температуре удовле-
удовлетворительно стойки ряд металлов и сплавов. С повышением темпе-
температуры стойкость металлических материалов постепенно снижается
до определенной для каждого металла температуры. Максимально
высокие температуры, допустимые при длительной работе металлов
и сплавов в сухом хлоре и хлористом водороде приведены в табл.6.6.
Наиболее стойкими материалами в сухом хлоре за исключением
благородных металлов является никель и его сплавы.
Таблица 6.6
Верхние допустимые температуры применения металлов и сплавов
в сухом хлоре и хлористом водороде
Материал
Платина
Золото
Вольфрам
Никель
Инконель (80% Ni, 14% Сг, 6% Fe)
Медь
Углеродистая сталь Ст.З
Нержавеющая сталь 12Х18Н9Т
Серебро
Температура, °С
Хлор
1200
-
-
550
-
100
150
300
-
Хлористый водород
1200
870
600
510-600
480
100-120
260-350
450-500
230
174 Коррозия металлов в природных и технологических средах Гл. 6
Поверхностные пленки, образующиеся на никеле и хромонике-
левых сталях, обладают малой летучестью и удовлетворительными
защитными свойствами.
Методические рекомендации к главе 6
После изучения материала, изложенного в главах 5-6, студенты
должны знать разновидности коррозионных процессов, протекаю-
протекающих в естественных и промышленных условиях и их закономерно-
закономерности.
Студенты должны уметь оценить характер влияния окружаю-
окружающей среды, предложить и обосновать оптимальную конструкцию
аппарата, предотвращающую коррозионные разрушения.
Вопросы для самопроверки
1. Какие виды коррозии металлов в природных средах Вам из-
известны?
2. Как меняется механизм атмосферной коррозии в зависимости
от влажности воздуха?
3. Как влияют конструктивные особенности металлоизделий на
развитие атмосферной коррозии?
4. Какие закономерности характеризуют почвенную коррозию,
каков ее механизм?
5. Как влияют блуждающие токи, наличие в почве бактерий на
развитие коррозионных процессов в этой среде.
6. Охарактеризуйте основные закономерности морской коррозии.
7. Какие конструктивные факторы влияют на развитие коррози-
коррозионных процессов? Приведите примеры.
8. Какие случаи газовой коррозии, приводящие к деструкции ме-
металла, Вам известны?
9. Охарактеризуйте процессы обезуглероживания стали, водород-
водородной коррозии.
10. Какие явления характерны для карбонильной коррозии? Какие
при этом протекают процессы?
11. Какие закономерности отличают поведение металлов в среде
сернистых соединений?
12. Каковы особенности поведения металлов в среде галогенов?
6.3. Некоторые случаи газовой коррозии металлов 175
Задания для самостоятельных и контрольных работ
1. Коррозия в природных условиях. Механизм процесса. Влия-
Влияние природных факторов на течение коррозионных процессов.
Методы защиты.
2. Принципы выбора оптимальной конструкции аппарата с позиций
предотвращения очагов коррозионных разрушений. Конструк-
Конструктивные решения, принимаемые при контакте двух разнородных
металлов, проведении теплообменных процессов, возможно-
возможности возникновения застойных зон.
3. Опишите случаи газовой коррозии, сопровождающиеся деструк-
деструктивным разрушением металла, обусловленные составом техно-
технологической среды.
Литература к главам 5 и 6
1. У лиг Г.Г., Реви У. У Коррозия и борьба с ней. Введение в коррозионную
науку и технику. - М.: Химия, 1988. 455 с.
2. Михайловский Ю.Н. Атмосферная коррозия металлов и методы их за-
защиты.-М., 1983.
3. Морская коррозия: Справочник / Пер. с англ. под ред. М.М. Шумахера.
-М., 1983.
4. Розенфелъд И.Л. Коррозия и защита металлов. - М.: Металлургия, 1970.
448 с.
5. Попов Ю.А. Теория взаимодействия металлов и сплавов с коррозионно-
активной средой. - М.: Наука, 1995. 200 с.
6. Фреймам Л.И., Макаров В.А., Брыскин И.Е. Потенциостатические мето-
методы в коррозионных исследованиях и электрохимической защите. - Л.:
Химия, 1972.240 с.
7. Защита подземных металлических сооружений от коррозии. - М.: Строй-
издат, 1990. 303 с.
8. Стрижевскш И.В., Сурис М.А. Защита подземных теплопроводов от
коррозии. -М.: Энергоатомиздат, 1983. 344 с.
9. Защита от коррозии, старения и биоповреждений машин, оборудования
и сооружений: Справочник / под ред. А.А. Герасименко. - М.: Метал-
Металлургия, 1987. Т. 1. 128 с.
10. Митина А.П., Горичев И.Г., Хорошилов А.В., Коничев B.C. Теоретиче-
Теоретические основы карбонатной коррозии стали. - М.: ВНИИЭгазпром, 1992.
55 с.
Часть III
Коррозионная
характеристика металлов
и сплавов.
Неметаллические
материалы и защитные
покрытия
ГЛАВА 7
КОРРОЗИОННАЯ ХАРАКТЕРИСТИКА
МЕТАЛЛОВ И СПЛАВОВ
7.1. Конструкционные материалы на основе железа
Конструкционные материалы на основе железа — чугуны и ста-
стали — являются самыми распространенными конструкционными ма-
материалами как по объему их производства, так и по частоте исполь-
использования.
Железо существует в двух аллотропических формах а и j. а-
железо называется ферритом, оно магнитно, имеет ОЦК решетку
и стабильно при Т < 910°С и Т > 1401°С. Устойчивая при вы-
высоких температурах форма феррита называется E-феррит. 7~железо
имеет ГЦК решетку, не обладает магнитными свойствами и называ-
называется аустенитом. ПДК в воде — 0,1 мг/л. Железо (так же, как хром
и марганец) относится к черным металлам. В природе оно всегда
существует в окисленной форме (в виде руд), содержащей в своем
составе также С, О, S, Mn, Cr, Ni и другие элементы.
Стандартный потенциал для реакции Fe2+ + 2е ^ Fe равен
—0,44 В, а для реакции Fe3+ + Зе ±=> Fe равен —0,036 В. Однако
реально измеряемый на практике потенциал значительно отличает-
отличается от равновесного.
В присутствие кислорода или других окислителей железо пас-
пассивируется и его стационарный потенциал приближается к +0,1 В.
Если в растворе находится ион водорода или галоидные ионы, потен-
потенциал железа сдвигается в отрицательную сторону и может достигать
значений —0,6 В.
В большинстве сред, за исключением растворов минеральных
кислот, при коррозии железа образуются нерастворимые продукты
коррозии — ржавчина.
Первичный анодный процесс приводит к образованию ионов
двухвалентного железа Fe2+. В нейтральных растворах образует-
образуется гидроксид Fe(II)-Fe(OHJ, растворимость которого равна 1,64 х
х 10~3 г/л. При наличии в растворе О2 протекает дальнейшая реак-
реакция — образование гидроксида трехвалентного железа Fe(OHK:
4Fe(OHJ + О2 + 2Н2О = 4Fe(OHK
Последний имеет растворимость « 4,8 • 10~8 г/л, т.е. значительно
меньше, чем Fe(OHJ.
7.1.
Конструкционные материалы на основе железа
179
Образование ржавчины происходит в растворе в непосредствен-
непосредственной близости от корродирующей поверхности. Ржавчина покрывает
металл рыхлым слоем. Она обладает плохим сцеплением с металли-
металлической поверхностью и поэтому плохо защищает железо от коррозии.
Состав ржавчины может быть переменным и его выражают общей
формулой:
nFe(OHJ • mFe(OHK • gH2O
где n9m9q — целые числа.
Железо не является коррозионностойким материалом. В атмо-
атмосферных условиях скорость его коррозии в 5-10 раз превышает ско-
скорость коррозии цинка, никеля, меди.
Практически все конструкционные материалы на основе железа
в тех или иных количествах содержат в своем составе углерод. Рас-
Рассмотрим диаграмму фазового равновесия Fe-C. Первым исследова-
исследователем указанной диаграммы был Д.К. Чернов, который обнаружил
так называемые «критические точки» (температуры): 770 °С — маг-
магнитное превращение (точка Кюри); 910 °С — превращение а —>> j;
1401 °С —превращение 7 ^ a(S); 1534°С —плавление; 3200 °С —
кипение. Однако поскольку растворимость самого углерода в желе-
железе низка и при превышении предела его растворимости выделяется
карбид железа — цементит (Fe3 С), то как правило, рассматривают не
стабильную диаграмму состояний Fe-C, а метастабильную Fe-Fe3C
(рис. 7.1). На диаграмме соответственно сплошными и пунктирны-
пунктирными линиями обозначено метастабильное и стабильное равновесие.
Линии АВ, ВС, CD являются линиями солидус, линии АН, HN, JE —
ликвидус. Линии NH, NJ, ES, E7S7, GO, GS, GP, OS, PK, P'K', PQ,
МО, очерчивают области равновесий, имеющих место в твердой фа-
фазе. Линии HJB, E'C'F, ECF являются линиями эвтектического, а ли-
линии P'S'K7 и PSK — эвтектоидного равновесия. Указанным линиям
соответствуют следующие температуры (табл. 7.1.)
Таблица 7.1
Температуры, соответствующие линиям эвтектического и эвтектоидного
равновесия в системе Fe-Fe3C
Температура
Т,°С
Линия на диаграмме Fe-Fe3C
HJB
1493
E'C'F
1153
ECF
1147
P'S'K'
738
PSK
723
Содержания углерода, соответствующие основным точкам на диа-
диаграмме Ёе-БезС, приведены в табл. 7.2.
180
Коррозионная характеристика металлов и сплавов
Гл. 7
ч
ч
ч
Ь Чч
h-l
ч
ч
ч
h-l
1496 °С
/<—
Fe3C
ч
Ч
/
чЛ*^ъ
{
с
(
(
7>
N
f)
N
-4
Q
1Г
о
/
4
/о
о
СП
" СП
О
1 CN
>
С
с<
^1
О
н
)
О о
О tn
О CD
^ 4
о
CN
и
V4
О
о
о
00
СП
г-
р
и
ч
4
СП
CN
о
•,80 Ах
f\0,02 S(
Р
<D
8
О
S
о
Об
-
и
Об
S
ч:
о чо о
о сп о
С""- 1П 1П
On о
СП СП
fe
7.1.
Конструкционные материалы на основе железа
181
Таблица 7.2
Содержание углерода, отвечающее характерным точкам
на диаграмме C
Концентрация
С, масс.%
Точка на диаграмме Fe-Fe3C
В
0,53
Концентрация
С, масс.%
С
4,30
CI
4,25
Н
0,10
J
0,16
Е
2,06
Точка на диаграмме Fe-РезС
S
0,80
S'
0,69
Р
0,025
Q
0,006
О
0,50
Е'
2,03
7.1.1. Стали и чугуны
Сплавы системы Бе-БезС подразделяются на стали и чугуны в за-
зависимости от содержания в них углерода. К первым относятся спла-
сплавы, содержание углерода в которых не превышает 2,03 %. Структура
сталей определяется содержанием в них углерода. В момент пол-
полного затвердевания структура сталей, содержащих менее 0,1% С,
чисто ферритная (E-феррит). Полное затвердевание сталей, содержа-
содержащих 0,1-0,16% С, заканчивается образованием ферритно-аустенит-
ной структуры, содержание E-феррита в которой изменяется от 0 (то-
(точка J) до 100 % (точка Н). Стали с содержанием углерода 0,16-0,51 %
имеют ферритно-аустенитную структуру, образование которой свя-
связано с расходом в процессе охлаждения первоначально образовав-
образовавшегося E-феррита. Сплавы, содержащие 0,51-2,03 % С, имеют чисто
аустенитную структуру, образование которой начинается с первых
моментов затвердевания жидкого металла.
Во многих нержавеющих сталях аустенит нестабилен и способен
превращаться в мартенсит. Мартенсит имеет тот же состав, что и
исходный аустенит, но иную «игольчатую» структуру. Прочность
и твердость стали при этом повышаются, коррозионные свойства
меняются незначительно.
Чугуны имеют в своем составе более 2,03 % С и подразделяются
на доэвтектические B,03 % < С < 4,25 %) и заэвтектические (С >
> 4,25 %). В структуру доэвтектических чугунов входят: аустенит
(основная составляющая) и перлит (эвтектическая смесь Fe и РезС).
Переохлаждения, реализуемые в реальных процессах металлурги-
металлургического производства чугуна, способствуют выделению в структу-
структуре сплавов не цементита, а графита, имеющего так называемую
«крабовидную» форму. Серый цвет излома чугунов с аустенитно-
графитовой эвтектикой дал им название серых. В отличие от серых,
белые чугуны имеют светло-серый гладкий излом, а в их состав вхо-
182 Коррозионная характеристика металлов и сплавов Гл. 7
дит аустенитно-цементитная эвтектика. В заэвтектических чугунах
основной структурно-фазовой составляющей является графит (или
цементит).
Кроме углерода в состав сталей всегда входят и многие другие хи-
химические элементы, как специально вводимые для придания металлу
определенных свойств и называемые легирующими, так и неизбеж-
неизбежно попадающие в металл из рудных материалов. Такие элементы
называются примесными.
Примесные элементы могут образовывать с железом твердые рас-
растворы замещения (если их атомный диаметр отличается от атомного
диаметра Fe не более, чем на 15 %) или внедрения (если их атомный
диаметр составляет не более 0,59 % атомного диаметра Fe). Взаи-
Взаимодействуя друг с другом или с железом, примесные элементы об-
образуют в структуре сталей неметаллические включения — оксиды,
сульфиды или оксидосульфиды, количество, химический состав и
структура которых определяются технологией выплавки металла.
К сталям обычного качества относятся сталь 1, сталь 2, сталь 3 и
т.д., различающиеся содержанием углерода @,15-0,45 %) и механи-
механическими свойствами.
Маркировка качественных сталей — сталь 10, 15, 20 и т.д. соот-
соответствует среднему содержанию в них углерода (в сотых долях %).
Стали с содержанием легирующих компонентов не более 3-5 %, объ-
объединены в группу углеродистых или низколегированных. Их область
применения: основная масса оборудования и металлоконструкций.
В соляной кислоте скорость растворения углеродистых сталей
экспоненциально возрастает с концентрацией НС1.
В серной кислоте скорость коррозии возрастает по такому же за-
закону до концентрации H2SO4, равной 47-50%. В более концентри-
концентрированных растворах скорость процесса уменьшается, что связано с
образованием пассивных оксидных и сульфатных пленок на поверх-
поверхности.
В азотной кислоте пассивация железа наступает при концентра-
концентрации кислоты около 50%. При концентрации азотной кислоты 94-
100 % железоуглеродистые сплавы вследствие явления перепассива-
перепассивации вновь сильно разрушаются.
В плавиковой кислоте низколегированные стали разрушаются
очень быстро, если концентрация кислоты не превышает 50%. В
более концентрированных растворах железо устойчиво.
Допускается транспортировка плавиковой кислоты концентраци-
концентрацией не ниже 60 % в стальных баллонах.
В щелочах концентрацией до 30% железо довольно устойчиво.
При более высоких концентрациях NaOH защитные пленки на по-
7.1. Конструкционные материалы на основе железа 183
верхности железа растворяются с образованием ферратов —
В концентрированных щелочах, особенно при высокой температуре,
сплавы на основе железа подвержены коррозионному растрескива-
растрескиванию — так называемой «каустической хрупкости».
В органических кислотах углеродистые стали подвержены силь-
сильной коррозии, которая увеличивается при доступе кислорода и с
повышением температуры.
В спиртах, бензоле и органических растворителях железоуглеро-
железоуглеродистые стали коррозионноустойчивы.
7.1.2. Легирование сталей, как способ повышения
коррозионной стойкости
Для придания сталям определенных механических свойств или
коррозионной стойкости в их состав вводят легирующие элемен-
элементы. Легирующие элементы образуют с железом твердые растворы,
а взаимодействуя друг с другом или с примесными элементами —
неметаллические включения или избыточные фазы.
Химический состав сталей соответствует стандартам, обознача-
обозначаемым для различных стран-производителей следующим образом:
ГОСТ — Россия (или СССР); AISI — США; B.S. — Великобрита-
Великобритания; A.F.N.O.R. — Франция; DIN — Германия (ФРГ); SIS — Шве-
Швеция, MSZ — Венгрия; CSN — Чехия (Чехословакия). Для обозначе-
обозначения химического (марочного) состава сталей согласно отечествен-
отечественной классификации используется цифровое и буквенное обозначе-
обозначение. Каждому из легирующих элементов присвоена определенная
буква русского алфавита: X — Сг; Н — Ni; М — Мо; Г — Мп; Ю —
А1; Ф — W; С — Si; Т — Ti; Д — Си; Б — Nb; A — N. За буквой,
обозначающей химический элемент, следует одно- или двузначное
целое число, соответствующее концентрации легирующего элемен-
элемента в массовых %. Первая цифра аббревиатуры, обозначающей марку
стали, соответствует концентрации углерода в сотых долях масс. %.
Согласно стандартам, содержание легирующих и примесных эле-
элементов в стали каждой определенной марки колеблется в некоторых
допустимых пределах.
Низколегированные стали содержат в своем составе легирующие
элементы в количестве нескольких процентов, вводимых, в основ-
основном, для придания сталям определенных механических или техно-
технологических свойств.
В особую группу следует выделить коррозионностойкие стали,
в состав которых обязательно входит хром в количестве 12 и более
(до 30) масс.%. Стали указанной группы разработаны специально
184
Коррозионная характеристика металлов и сплавов
Гл. 7
для эксплуатации в особо агрессивных условиях, что характерно
для химической промышленности, где углеродистые и низколеги-
низколегированные стали нестойки. Классификация, номенклатура и химиче-
химический состав отечественных коррозионностойких сталей представле-
представлены ГОСТ 5632-72.
Хром обладает высокой склонностью к пассивации в средах раз-
различной кислотности и анионного состава. Он устойчив также к пит-
тинговой коррозии. Поляризационная кривая растворения хрома в
серной кислоте приведена на рис. 7.2 (кривая 2). Область пассива-
пассивации наступает при более отрицательном потенциале, чем у железа, а
-1,20
-0,80
-0,40
0,00
0,40
0,80
lj2°
1,60
2,00
1
8 7 6 5 4 3:
-lg / (/, А/см )
Рис. 7.2. Зависимость скорости растворения от потен-
потенциала для различных металлов:
1 — железо; 2 — хром; 3 — никель. 1 н. Н2 SO4, температура
комнатная
критический ток пассивации примерно на два порядка меньше. Это
означает, что хром обладает более высокой склонностью к пассив-
пассивности, чем железо.
Пассивность хрома обеспечивается образованием на его поверх-
поверхности слоя оксида СГ2О3.
Железо и хром имеют одинаковый тип кристаллической решет-
решетки — ОЦК, с близкими параметрами решетки и дают непрерывный
ряд твердых растворов (рис. 7.3). Преобладающей твердой фазой
является а-фаза (феррит). При содержании менее 11,5-12% Сг при
температурах не выше 865-1400 °С существует 7~фаза (аустенит).
При концентрации Сг 20-75 % при температурах не выше 800-850 °С
образуется сг-фаза, которая является интерметаллическим соедине-
соединением Fe-Cr (рис. 7.3).
В системе Fe-Cr реализуется правило Таммана. Согласно этому
7.1.
Конструкционные материалы на основе железа
185
5
1800
1600
1400
1390
1200
y-Fe
и
°«г юоо
% 910
g 800
600
400
200
i
Сг, % (по массе)
15 25 35 45 55 65 75 85 95
1
ч
ч *,
» г
~7 *
мм
L
^^^.^—'
23B2)
J
1
5830 °С
1 1 1
^-CrFe
1507 °С
a-Fe,
-815 °С
i i i i
^^
Cr
i
, ¦ a+a \
f%
; ';
\
\
\
1 1 IU
<¦¦¦]
-' 1830
°C
0
Fe
20
80
40 60
Cr, % (ат.)
Рис. 7.3. Диаграмма состояния системы Fe-Cr
100
Cr
правилу скачкообразное повышение устойчивости сплава происхо-
происходит при доле благородных или коррозионноустойчивых атомов в
сплаве, равной п/8, где п — целое число A, 2, 3, 4, 6).
Сплавы железо-хром, содержащие 11,8 масс.% Сг, имеют в ре-
решетке твердого раствора 1/8 долю атомов Сг. При этом появляется
первая граница устойчивости, характеризующаяся стойкостью спла-
сплава к холодной разбавленной HNO3. При содержании 23,7 мае. % Сг,
что соответствует 2/8 атомным долям хрома в сплаве, появляется вто-
вторая граница устойчивости, характеризующаяся стойкостью сплава в
горячей разбавленной HNO3.
Около 35,8 масс.% Сг, т.е. приблизительно при 3/8 атомных долях
хрома в сплавах, появляется граница устойчивости к таким активным
средам, как царская водка.
186
Коррозионная характеристика металлов и сплавов
Гл. 7
Я -0,3
& од
I0'3
30
10 20
Сг, %
Рис. 7.4. Зависимость по-
потенциала пассивации спла-
сплавов Fe-Cr в 0,1 н H2SO4 от
содержания хрома в сплаве
10 15 20
Сг, %
Рис. 7.5. Влияние содержания хро-
хрома в сплаве Fe-Cr на критический
ток пассивации в растворах:
1 — 10%-й H2SO4; 2, 3 — 3%-го
раствора Na2 SO4 при рН = 3 (кривая
2) и рН = 7 (кривая 3)
Введение хрома в железо способствует улучшению пассивиру-
емости и увеличению устойчивости пассивного состояния сплавов
Fe-Cr. При достижении концентрации хрома, равной 12 %, происхо-
происходит смещение критического потенциала пассивации сплавов в отри-
отрицательную сторону до значения, равного Екр чистого хрома (рис. 7.4).
При указанном содержании хрома происходит и резкое скачкообраз-
скачкообразное снижение критического тока пассивации, т.е. уменьшения ско-
скорости растворения металла (рис. 7.5).
Характеристики питтингостойкости сплавов Fe-Cr также претер-
претерпевают существенное улучшение при достижении 12 % Сг (рис. 7.6).
При концентрации в сплавах 17% Сг про-
происходит второе резкое улучшение питтинго-
питтингостойкости. Сплавы, содержащие более 40 %
Сг, как и чистый хром, в водных средах во-
вообще не подвергаются питтинговой корро-
коррозии.
Скачкообразное увеличение коррозион-
коррозионной стойкости сплавов Fe-Cr при достиже-
достижении 12% Сг обусловлено происходящими
при этой концентрации изменениями соста-
состава и свойств пассивирующей пленки. Так,
пассивирующие слои сплавов с низким со-
содержанием хрома состоят из оксидов желе-
железа. Они близки по своему составу к оксидам,
н-2
13
25 40
Сг, %
Рис. 7.6. Влияние кон-
концентрации хрома на ско-
скорость питтинговой кор-
коррозии сплавов Fe-Cr в
10%-м растворе
х6Н2О
образующимся на поверхности чистого железа. В сплавах, содержа-
содержащих более 12% Сг, внешние (контактирующие с раствором) слои
пассивирующей пленки обогащены хромом, входящим в состав ок-
оксида СГ2 Оз.
7.1.
Конструкционные материалы на основе железа
187
Основным недостатком хромистых сталей является их высокая
склонность к хрупкому разрушению. Для преодоления этого недо-
недостатка коррозионностойкие стали легируют никелем. Благодаря вы-
высокой прочности, пластичности и коррозионной стойкости никель
используют и как основу для изготовления коррозионностойких кон-
конструкционных материалов.
Так же, как и хром, при температурах, близких к температуре
плавления, никель образует с железом непрерывный ряд твердых
растворов, имеющих, однако, ГЦК решетку (рис. 7.7). При сниже-
снижении температуры 7-твердый раствор распадается на а + j. Равно-
Ni, % (по массе)
10,5 20,8 31 41,2 51,24 61,18 71 80,78 90,44
С
40 60
Ni, % (ат.)
80
100
Ni
Рис. 7.7. Диаграмма состояния системы Fe-Ni
весная концентрация Ni в а-твердом растворе достигает ~ 7,5% .
При концентрации в сплаве ~ 74 % никеля происходит образование
интерметаллического соединения FeNi3. Никель снижает скорость
диффузии углерода в кристаллической решетке сплавов на основе
железа, тем самым препятствуя выделению карбидной фазы.
Электрохимическое поведение никеля в активном состоянии во
многом сходно с рассмотренным ранее поведением железа. Однако,
188 Коррозионная характеристика металлов и сплавов Гл. 7
активное растворение никеля в серной кислоте имеет специфиче-
специфическую особенность — на анодной поляризационной кривой имеется
точка перегиба и, следовательно, два тафелевых участка (рис. 7.2,
кривая 3). Предполагается, что наличие второго тафелевского участ-
участка обусловлено тем, что в сернокислых средах растворение Ni про-
происходит по двум параллельным путям: с участием сульфат-ионов и
с участием молекул Н2О. Оба процесса дают вклад в общий ток, и
каждый из них доминирует в соответствующей области рН. Ширина
пассивной области никеля в кислых водных средах (+0,43—hi,35 В)
существенно ниже, чем хрома @,0- + 1,10 В), а скорость растворе-
растворения в пассивном состоянии приблизительно на два порядка величи-
величины выше. Пассивность обеспечивается образованием на поверхно-
поверхности защитного слоя, состоящего из NiO (подслой толщиной ~ 4 А,
прилегающий к металлу) и Ni(OHJ (подслой толщиной ~ 6 А, кон-
контактирующий с электролитом).
Введение в сталь никеля способствует не только улучшению ме-
механических свойств вследствие аустенизации структуры, но и облег-
облегчает пассивацию и повышает устойчивость пассивного состояния,
в том числе в средах, провоцирующих развитие таких локальных
коррозионных процессов как питтинговая и щелевая коррозия. По-
Повышение коррозионной стойкости сталей вследствие легирования
их никелем не связано с изменением состава и свойств пассивирую-
пассивирующей пленки — никель в составе пассивирующих пленок не обнару-
обнаружен. Недостатком хромоникелевых аустенитных сталей является их
низкая стойкость портив коррозионного растрескивания, минимум
которой приходится на наиболее широко распространенные стали
типа 18Cr-8Ni. Более 70 % всех производимых нержавеющих ста-
сталей являются сталями аустенитного класса, содержащими ^ 17%
хрома и свыше 10 % никеля.
Построение тройных диаграмм для такой системы является слож-
сложным процессом и поэтому используют их изотермические срезы.
Пример таких срезов для системы Fe-Cr-Ni представлен на рис. 7.8.
На рис. 7.8 б. обозначены составы промышленных сталей.
Для большего повышения коррозионной стойкости в состав хро-
хромоникелевых нержавеющих сталей вводят молибден. Молибден улуч-
улучшает пассивируемость сталей в неокислительных средах, сужая
область активного растворения, и способствует существенному сни-
снижению их склонности к питтинговой и щелевой коррозии за счет
затруднения питтингообразования, облегчения репассивации, сни-
снижения скорости растворения металла в очагах локальной коррозии
и увеличения индукционного периода.
7.1.
Конструкционные материалы на основе железа
189
Fe
Сг 10 20 30 40 50 60 70 80 90 Ni Cr 10 20 30 40 50 60 70 80 90 Ni
Рис. 7.8. Фазовое равновесие в системе Fe-Ni-Cr при 400 °С (а) и комнатной
температуре (б).
а — феррит; 7 — аустенит (мартенсит); а — сигма-фаза. Области практических
составов сплавов: 1 — ферритные Сг-стали; 2 — аустенитные стали типа 18-8; 3,
4 — аустенитные стали повышенной коррозионной стойкости; 5 — жаростойкие
Ni-сплавы. По сторонам треугольника отложены концентрации элементов в % (по
массе)
Молибден и вольфрам имеют ОЦК кристаллическую решетку
и обладают ограниченной растворимостью в железе. Увеличение
устойчивости пассивного состояния хромоникельмолибденовых ста-
сталей объясняется вхождением молибдена в состав пассивирующих
слоев. Предполагается, что при потенциалах пассивной области ста-
сталей, где молибден подвергается перепассивации, то есть растворя-
растворяется с образованием молибдат-ионов, происходит образование сме-
смешанных оксидов хрома и молибдена, обладающих более высокими
защитными свойствами, чем оксид хрома.
Основным недостатком хромоникельмолибденовых сталей явля-
является их низкая стойкость в окислительных средах. Для придания хро-
хромистым и хромоникелевым сталям высоких прочностных характе-
характеристик их дополнительно легируют вольфрамом. Кроме улучшения
механических свойств вольфрам, подобно молибдену, увеличивает
коррозионную стойкость сталей, однако его действие оказывается не
столь эффективным.
Углерод является необходимым легирующим элементом в сталях
мартенситного класса (стали 30X13, 40X13, 95X18 и др.), где он
обеспечивает высокие прочностные характеристики. В сталях дру-
других структурных типов углерод является вредной примесью. Так,
он образует карбиды хрома (типа Сг2зСб), что снижает содержание
хрома в сплаве.
Марганец в концентрациях 6-9 % в комбинации с никелем обеспе-
190 Коррозионная характеристика металлов и сплавов Гл. 7
чивает по сравнению с хромоникелевыми сплавами более высокий
предел растворимости углерода и азота, повышенную стабильность
аустенита.
Азот является сильным аустенитообразующим элементом. Он
очень полезен в аустенитных и аустенито-ферритных сталях. Азот
упрочняет твердый раствор сильнее, чем углерод, повышает стой-
стойкость против питтинговой коррозии, замедляет выделение карбид-
карбидных и интерметаллидных фаз. Однако, присутствие азота в сталях
ферритного класса нежелательно, так как он отрицательно влияет на
их механические свойства.
Медь, введенная в стали, повышает их стойкость в минеральных
кислотах.
Титан и ниобий образуют карбиды TiC и NbC и тем самым уда-
удаляют углерод из твердого раствора. При их введении в сталь повы-
повышается стойкость сталей против локальных видов коррозии.
Элементы S, Pb, Se вводят в сплавы для повышения механической
обрабатываемости. А1 и Si повышают жаростойкость, микродобавки
редких металлов (бор и цирконий) улучшают механические свой-
свойства.
Таким образом, важнейшим направлением повышения коррози-
коррозионной стойкости конструкционных материалов является противо-
противокоррозионное легирование.
Регулирование фазового состава сталей. Реальные стали являют-
являются гетерогенными системами, содержащими в твердом растворе —
металлической матрице — посторонние фазы (так называемые из-
избыточные фазы и неметаллические включения). Избыточные фазы
(к ним относят карбиды, нитриды, силициды, бориды) и неметал-
неметаллические включения (оксиды и сульфиды) образуются в результа-
результате взаимодействия примесных и легирующих элементов сталей и
отличаются от металлической матрицы химическим составом, кри-
кристаллической структурой и электрохимическими характеристиками.
Несмотря на относительно небольшое количество (от сотых до де-
десятитысячных долей масс.%) посторонние фазы вносят свой вклад в
интегральную скорость анодного и катодного процессов и характер
растворения металла.
Влияние фаз на коррозионную стойкость сталей определяется
тем, насколько и каким образом различаются электрохимические ха-
характеристики фазы и металлической матрицы при потенциале сво-
свободной коррозии Екор стали. Если при Екор скорость растворения
какой либо фазы оказывается ниже, чем твердого раствора, то посте-
постепенное ее накопление на поверхности стали приведет к снижению
общей скорости растворения за счет уменьшения доли растворяю-
7.1.
Конструкционные материалы на основе железа
191
щейся поверхности и затруднения диффузионных процессов подво-
подвода и отвода участников электрохимической реакции. Если при Екор
скорость растворения фазы превышает скорость растворения метал-
металлической матрицы, то происходит ее избирательное растворение,
часто приводящее к развитию локальных коррозионных процессов.
Таким образом, добиться повышения коррозионной стойкости
нержавеющих сталей, сравнимого с достигаемым при дополнитель-
дополнительном легировании достаточно большим количеством дорогостоящих
и дефицитных легирующих элементов, можно регулированием их
фазового состава. Для нержавеющих сталей это достигается предот-
предотвращением образования в их структуре карбидов хрома и марга-
нецсодержащих сульфидов, осуществляемым различными способа-
способами — рафинированием металла или модифицированием его эле-
элементами, обладающими более высоким, чем Сг и Мп, сродством к
углероду или сере, и образующими с ними более стойкие соедине-
соединения. Оба способа реализуются на стадиях выплавки и переплавов
металла.
7.1.3. Жаростойкие сплавы на основе железа
Сплавы на железной основе широко применяются при повышен-
повышенных температурах. Жаростойкие сплавы устойчивы к газовой кор-
коррозии. Однако к ним могут предъявляться и ряд дополнительных
требований. Сплавы могут быть про-
просто жаростойкие, жаростойкие и одно-
одновременно жаропрочные, жаростойкие с
определенными механическими и тех-
технологическими свойствами (например,
с повышенным пределом ползучести, с
высоким омическим сопротивлением и
т.д.).
Хром увеличивает химическое со-
сопротивление железных сплавов к газо-
газовой коррозии. Скачкообразное повыше-
повышение устойчивости хромистых сталей от
содержания в них хрома обнаружено
и при определении их жаростойкости
(рис. 7.9).
Границы переходов в устойчивое со-
состояние могут несколько сдвигаться.
На коррозионную стойкость хромистых
сталей большое влияние оказывает со-
36
Рис. 7.9. Относительная ско-
скорость окисления сплавов на
воздухе D8 часов, 1000° С) в
зависимости от содержания
хрома в сплаве
192 Коррозионная характеристика металлов и сплавов Гл. 7
держание углерода и термическая обработка. После закалки хром и
углерод находятся в твердом растворе и сталь обладает высокой кор-
коррозионной стойкостью. При отпуске после закалки выпадают карби-
карбиды хрома. При этом 1 % С может связать около 10-12 % Сг. Углерод
образует с хромом как минимум три весьма прочных карбида: ку-
кубический Сг2зСб, тригональный СГ7С3 и орторомбический СГ3С2.
Количество карбидов и их состав зависят от содержания в спла-
сплаве углерода. В результате образования карбидов содержание хрома
в твердом растворе уменьшается и коррозионная стойкость стали
снижается. Чем выше температура отпуска, тем больше выпадает
карбидов хрома и тем ниже коррозионная стойкость стали. Поэтому
для обеспечения высокой коррозионной стойкости хромистой стали
с увеличением содержания углерода необходимо вводить дополни-
дополнительные количества хрома.
Жаростойкость хромистых сталей определяется содержанием в
них хрома, что видно из табл. 7.3.
Таблица 13
Влияние содержания хрома в стали на жаростойкость
Содержание хрома, масс.%
5-6
14-15
17
25
30
Температура устойчивой работы, ° С
600-650
800
1000
1100
1200
Хромистые стали с 4-6 % Сг считаются полужаростойкими. Вслед-
Вследствие своей доступности и повышенной, по сравнению с углероди-
углеродистыми сталями, коррозионной устойчивостью они широко применя-
применяются для изготовления крекинг-установок, котлов паронагревателей.
Отдельные марки этого типа сплавов, содержащие присадки Мо и
V, обладают повышенной устойчивостью к водородной коррозии и
применяются в установках для синтеза аммиака. В атмосфере топоч-
топочных газов с содержанием в них сернистых соединений эти сплавы
могут работать при температурах 500-600 °С.
Добавление к хромистым сплавам молибдена A-1,5 % ), а также
Ni и Ti повышает их жаропрочность, т.е. возможность работать в
нагруженном состоянии при высоких температурах. Это является
очень важным фактором, так как простые хромистые стали, обладая
высокой жаростойкостью, имеют низкую жаропрочность (табл. 7.4).
Сшъхромы — это железные сплавы, легированные хромом и
кремнием. При добавлении кремния к хромистым сталям их жа-
7.1.
Конструкционные материалы на основе железа
193
Таблица 7.4
Жаростойкость и жаропрочность хромистых сталей
Марка стали
1X13
12X17
15X25
12X13
40Х9С2
20Х23Н18
Жаростойкость. Температура
образования окалины, ° С
750
870
1100
800
850
1050
Жаропрочность.
Температура работы, °С
500
525
550
550-600
600-650
1000
ростойкость и жаропрочность значительно повышаются.
Сильхромы с малым содержанием углерода (до 0,25 % ) приме-
применяются реже из-за сравнительно невысокой жаропрочности. Если
содержание хрома в сплаве более 20 %, то добавочное легирование
кремнием не дает заметного эффекта. Наибольшее применение на-
нашли сильхромы с содержанием углерода 0,3-0,5 %.
Сильхромы широко применяются в химической промышленно-
промышленности для установок, работа которых протекает при повышенных тем-
температурах и сопровождается высокими требованиями к жаропроч-
жаропрочности материалов. Это, например, рекуператоры, теплообменники,
пароперегреватели, колосниковые решетки и т.д.
Хромали и фехрали — это хромистые стали дополнительно леги-
легированные алюминием. Их состав:
хромали — A5-30 %) Сг; A-7 %) А1; до 1 % Si; до 0,25 % С
фехрали — D-14 %) Сг; A-7 %) А1; до 1 % Si; до 0,25 % С
Таким образом хромали характеризуются более высоким содер-
содержанием хрома. Примесь алюминия более эффективно повышает жа-
жаростойкость железного сплава, чем добавка хрома (рис. 7.10). Же-
Железный сплав с 7-10 % А1 (без хрома) уже устойчив к окислению на
воздухе при температурах до 1100-1200 °С, приближаясь по жаро-
жаростойкости к нихрому с 80 % Ni и 20 % Сг.
Как видно из рис. 7.10 сильное снижение скорости газовой корро-
коррозии на воздухе при 1200 °С для системы Fe-Cr наблюдается при 30 %
Сг, в то время как в системе Fe-Al — при 8 % А1. Однако железоалю-
миниевые сплавы очень хрупки, плохо куются и не технологичны.
В химической промышленности сплавы на основе железо-хром-
алюминий нашли широкое применение и служат заменителями ни-
нихрома. Это одни их самых жаростойких сплавов. Хромаль стоек до
1200 °С, фехраль, более дешевый — до 1000 °С. Оба сплава хорошо
противостоят разрушению в окислительной атмосфере, менее стой-
стойки в восстановительной атмосфере (Б^, СО, Н2О) и неустойчивы
194
Коррозионная характеристика металлов и сплавов
Гл. 7
8 12 16 20 24 28 32
Сг или А1, масс.%
Рис. 7.10. Зависимость скорости окис-
окисления сплавов Fe-Cr и Fe-Al на возду-
воздухе при 1200 ° С от содержания в сплаве
легирующего компонента
в газовой среде, содержащей
хлор.
Добавка вольфрама до 1-
3 % повышает жаропрочность,
жаростойкость сохраняется до
900 °С. Дополнительное леги-
легирование кобальтом повышает
жаропрочность без снижения
жаростойкости. Сплав канталъ
(состав: 30 % Сг, 5 % А1, 3 % Со,
@,2-0,8)% С, остальное — же-
железо) имеет максимальную тем-
температуру длительной эксплуата-
эксплуатации—1250 °С.
Хромоникелевые стали соче-
сочетают высокую пластичность и
вязкость с достаточной прочностью и коррозионной стойкостью при
повышенных температурах и хорошей свариваемостью. Хромистые
и хромо-никелевые сплавы можно сочетать в одной конструкции.
Наибольшее распространение из хромо-никелевых сталей полу-
получили сплавы с содержанием 18 % Сг и 8-9 % Ni. Сопротивление га-
газовой коррозии удовлетворительное до 800-900°С. Их используют
для изготовления печной арматуры, труб, теплообменников, рото-
роторов электронагревателей (марки 08Х18Н10,12Х18Н9, 08Х18Н10Ти
ДР-)-
В условиях работы с большой ударной нагрузкой эти сплавы
должны содержать углерода не выше 0,1 %, а с более высоким леги-
легированием по Сг и Ni — не более 0,15 %. Если необходимо обеспе-
обеспечить только повышенное сопротивление окислению, то допускается
содержание углерода до 0,5 %. В газовых средах, содержащих серни-
сернистые соединения, хромо-никелевые сплавы неустойчивы и уже при
400 °С заметно окисляются.
Железные сплавы с содержанием 23% Сг и A3-18)% Ni жа-
жаростойки при температуре 1100°С. Представителями этого класса
сталей являются 20Х23Н13 B2-25 % Сг и 12-15 % Ni) и 20Х23Н18
B2-25% Сг и 17-20% Ni). Содержание углерода до 0,20-0,25%.
Для получения повышенной коррозионной стойкости этих сталей
отношение процентного содержания углерода к хрому не должно
превышать 0,01. Обе марки являются жаропрочными и жаростойки-
жаростойкими аустенитными сталями и применяются в наиболее ответственных
случаях.
Дополнительное введение кремния в количестве 2-3 % еще боль-
7.1. Конструкционные материалы на основе железа 195
ше увеличивает сопротивляемость окислению при повышенных тем-
температурах. Состав двух марок этого типа сталей приведен ниже:
• 20Х20Н14С2 — A9-22)% Сг; A2-15)% Ni; 2,3 % Si; C^ 0,2%;
20Х25Н20С2 — B3-27)% Сг; A8-21)% Ni; 2,3% Si; C^ 0,2%;
Сталь 20Х20Н14С2 применяется для изготовления котлов, нефте-
нефтеочистительной аппаратуры. Сталь 20Х25Н20С2 используется в хи-
химическом машиностроении для изготовления деталей, работающих
в агрессивных средах и при повышенных температурах в нагружен-
нагруженном состоянии: печные конвейеры, крепежные соединения, ящики
для цементации.
Введение в сплавы дополнительно вольфрама повышает сопро-
сопротивление ползучести (марка 45Х14Н14В2М).
Введение марганца повышает устойчивость к высокотемпера-
высокотемпературному окислению в средах, содержащих сернистые соединения,
до900°С.
К жаростойким чугунам относятся хромистые, никелевые, алю-
алюминиевые и кремнистые чугуны.
Хромистые чугуны приобретают коррозионную стойкость только
при условии содержания хрома в твердом растворе в количестве, до-
достаточном для достижения устойчивости по правилу Таммана. Пер-
Первый порог устойчивости соответствует содержанию 11,7 масс.% Сг.
Первоначально хром вступает в реакцию с углеродом, содержащемся
в чугуне, и образует карбиды типа СГ7С3. При этом 1 % С связывает
около 10% Сг, что вызывает сильное обеднение твердого раствора
хромом. Основные марки хромистых чугунов Х28 и Х34 содержат
B6-30) % Сг и C2-36) % Сг соответственно. Хромистые чугуны хо-
хорошо сопротивляются механическому износу, прочны на изгиб и
растяжение, обладают удовлетворительными литейными свойства-
свойствами. Они устойчивы к газовой коррозии до температуры 1100° С,
жаропрочность до 600°С. Из них готовят печную арматуру, части
барабанных сушилок, плавильные горшки, реакторы, автоклавы и т.д.
Никелевые чугуны — СЧЩ-1 и СЧЩ-2 — устойчивы к воздей-
воздействию расплавов щелочей. Чем больше содержится в чугуне никеля,
тем выше его стойкость. Никелевые чугуны жаропрочны и жаро-
жаростойки.
Никеле-хромо-кремнистый чугун — нихросилалъ — имеет состав:
1,8-3,0% Сг, 13-20% Ni, 5-7% Si, 1,7-2,0% С и 0,6-0,8% Мп. Он
характеризуется повышенной жаростойкостью, жаропрочностью и
вязкостью.
196 Коррозионная характеристика металлов и сплавов Гл. 7
Никеле-медно-кремнистый чугун — нирезист — отвечает соста-
составу: 2-4 % Сг, 11-16 % Ni, 1,5-2,5 % Si, 2,8 % С, 6-7 % Си и 2 % Мп.
Он жаростоек до 600 °С и жаропрочен до 550 °С. Применяется при
повышенных нагрузках.
Алюминиевые чугуны жаростойки. Чугун марки «Чуголь» имеет
состав: 5,5-7,0% А1, 1,0-2,3% Si, 2,5-3,2% С и 0,6-0,8% Мп. Он
имеет хорошую жаростойкость — 900 ° С, но пониженную жаропроч-
жаропрочность — 400°С. Применяется при малых механических нагрузках,
но высоких температурах. Из алюминиевых чугунов готовят тигли
для расплавленных солей, цементационные ящики.
Кремнистые сплавы — ферросилиды — содержат до 14-18%
кремния и до 0,4-0,8 % углерода. Они обладают низкими прочност-
прочностными свойствами, высокой твердостью и хрупкостью, чувствитель-
чувствительны к перепадам температур. Изделия из таких сплавов получают
обычно методом литья.
Кремнистый чугун — силалъ (С-21-40) состава: 5-10% Si, 2,4-
2,5 % С, 0,5-0,6 % Мп является доступным жаростойким (до 850 °С)
и достаточно жаропрочным материалом. Он используется для изго-
изготовления колосников и деталей печной аппаратуры.
7.1.4. Современные коррозионностойкие сплавы и стали
В зависимости от структуры коррозионностойкие стали подраз-
подразделяются на:
• мартенситные и мартенсито-ферритные, к которым относятся
конструкционные @8X13,12X13,20X13), высокоуглеродистые
инструментальные C0X13, 40X13, 95X18) и хромоникелевые
мартенсито-ферритные A4Х17Н2Д2Х17) стали;
• ферритные @8Х17Т, 08Х17Т1); к ним относятся и суперферри-
суперферриты, содержащие пониженное количество С, N и О (например,
015Х18М2Б);
• аустенитные, к которым относятся хромоникелевые стали типа
XI8H1 ОТ, хромоникельмолибденовые стали с содержанием 2-4%
Мо (например, 03Х17Н14М2, 10Х17Н13МЗТ, 08Х17Н13М2Т),
хромоникельмарганцевые и хромомарганцевые стали (напри-
(например 20Х13Н4Г9,10Х14АГ15,07Х21Г7АН5), высоколегирован-
высоколегированные коррозионностойкие сплавы на основе железа (например,
03ХН28МДТ);
• аустенито-ферритные (например, 08Х22Н6Т, 03Х25Н5АМ2,
06Х225Н7М2Б);
• аустенито-мартенситные (содержащие 12-17 % Сг) и мартенси-
7.1. Конструкционные материалы на основе железа 197
то-стареющие (например, 08Х15Н5Д2Т, 09X15Н8Ю, 0Х13Н8-
Д2ТМ).
В последние годы большое внимание уделяется разработке су-
суперсталей с повышенным содержанием Сг B2-28 %), Ni B4-28 %),
Mo D-8 %), N (до 1 %) и др.
В зависимости от назначения коррозионностойкие стали подраз-
подразделяются на стойкие против различных видов локальной коррозии—
межкристаллитной, питтинговой и коррозионно-механического из-
износа.
Стали аустенитного класса. Стали этого класса имеют ГЦК ре-
решетку твердого G) раствора. Они немагнитны, обладают высокой
пластичностью в интервале от 196 до 800°С; отличаются высокой
жаростойкостью и сопротивлением коррозии в растворах электро-
электролитов.
Условно стали разделяют на три группы по содержанию углерода:
• С^ @,08-0,12)% — стали типа Х18Н10, Х18Н10Т(Б), Х17Н-
13М2C)Т;
• С^ @,02-0,03)% —стали типа Х18Н11,Х17Н14М2C);
• С ^ @,02-0,03)% (при S < 0,015-0,020%, Р ^ 0,02-0,030%) —
стали типа Х20Н25 и Х25Н21 с 2-6 % Мо.
До недавнего времени свыше 70 % от общего объема производ-
производства коррозионностойких сталей приходилось на группу с повы-
повышенным содержанием углерода @,08-0,12%). В ГОСТ 5632-72 и в
стандарте США AISI эта группа представлена марками: 12X18Н9Т,
12Х18Н10Т, 08Х18Н10 (AISI 321), 12Х18Н9 (AISI 302), 08Х18Н10
(AISI 304), 08Х18Н12Б (AISI 347), 08Х17Н13М2Т и др.
Начиная с 70-х годов наметилась устойчивая тенденция роста
объема производства второй группы сталей — низкоуглеродистых
типа 06Х18Н10, 02-03Х18Н11 (AISI 304 L), 02-03X17H14M2-3.
В отечественной практике получили распространение стали
03Х18Н17 и 03Х17Н14МЗ.
Сталь 03X18Н11 применяется для изготовления оборудования и
трубопроводов в производстве азотной кислоты и аммиачной се-
селитры. Для изготовления сварного оборудования этих производств
в настоящее время применяют сталь марки 03Х19АГЗН10 взамен
03Х18Н11, что обеспечило снижение металлоемкости оборудования
на 20%.
Сталь 03Х17Н14МЗ используется для изготовления аппаратуры
в производстве карбамида и капралактама, фосфорной кислоты и
минеральных удобрений.
198 Коррозионная характеристика металлов и сплавов Гл. 7
Разработаны и внедрены в производство новые марки 03X18Н16-
МЗ-ВД и 02Х25Н22АМ2-ПТ. Первая марка применяется в производ-
производстве медицинского инструмента и имплантантов. Она соответству-
соответствует требованиям международного стандарта ИСО 5832/1-87. Вторая
марка стали заменила импортные стали 2RE69 и 25USFEP для изго-
изготовления оборудования, работающего в наиболее жестких условиях
синтеза карбамида, а также в сернокислых, азотнокислых и серо-
водородосодержащих средах.
Эффективным способом повышения коррозионной стойкости хро-
моникелевых сплавов в сильноокислительных средах является ле-
легирование их кремнием.
Стали 03Х8Н22С6 и 02Х14Н19С6Б применяются для сварного
оборудования, работающего в атмосфере концентрированной HNO3
при температурах до 110 °С.
Разработанная в последние годы азотсодержащая сталь 03Х20Н-
16АГ6 применяется в криогенном машиностроении для изготовле-
изготовления сварных крупногабаритных аппаратов, работающих под давле-
давлением и при периодической смене температур от 20 °С до —269 °С.
Стали ферритного класса. Это — хромсодержащие (от 11 % до
30% Сг) сплавы железа, имеющие ОЦК решетку а-твердого рас-
раствора. Они не уступают в ряде сред по коррозионной стойкости
аустенитным сталям, но имеют более низкие механические характе-
характеристики, ферромагнитны и склонны к межкристаллитной коррозии
(МКК). Наибольшее влияние на склонность к МКК оказывают угле-
углерод и азот.
По содержанию углерода ферритные стали делят на три группы:
• с высоким содержанием С @,08-0,15 %);
• с содержанием С @,02-0,04 %) и Ni @,02-0,04 %);
• с низким содержанием С (^ 0,01-0,02 %) и Ni (^ 0,01-0,02 %).
В последнее десятилетие созданы стали марок 04X15СТ, 04X17Т,
04Х19МАФТ с пониженным содержанием углерода, которые по ком-
комплексу механических и коррозионных свойств вплотную приближа-
приближаются к хромо-никелевым сталям аустенитного типа.
Внедрение метода вакуумно-индукционной выплавки, снижение
содержания углерода и азота, оптимизация содержания хрома и мо-
молибдена позволили создать уникальные коррозионностойкие фер-
ферритные стали при минимальных затратах.
В России созданы стали 015Х18М2Б и 01Х18М2Т-В4 с повы-
повышенной стойкостью к растрескиванию, питтинговой и щелевой кор-
коррозии. Сталь 01Х18М2Т-В4 применяют для изготовления сварного
теплообменного оборудования, работающего при температурах 20-
7.1. Конструкционные материалы на основе железа 199
300 °С и давлении до 1,6 МПа в среде каустической соды, хлорорга-
нических продуктов, в нефтеперерабатывающей промышленности.
Суперферриты типа 25Cr-2Mo (E-Brite), 25Cr-4Mo-4Ni (MONIT),
28-30Cr-3Mo (A129-X) и 28-30Cr-4Mo-2Ni (A129-4-2) обладают ис-
исключительной стойкостью против всех видов локальной коррозии.
Их используют при изготовлении теплообменников для работы в
концентрированных хлоридных растворах и в морской воде.
Ферритные стали с пониженным (марки 04X15 СТ, 04Х19МАФТ)
и низким содержанием углерода и азота (марки 01Х18М2Т, 01X25-
М2Т), являются перспективными коррозионностойкими сталями.
Стали аустенитно-ферритного класса (ГОСТ 5632-72) по срав-
сравнению с аустенитными характеризуются более высокой прочностью
(в 1,5-2 раза), стойкостью к МКК и к растрескиванию в хлоридных
и щелочных средах.
Существуют три поколения аустенитно-ферритных сталей, со-
содержащих:
• С ^ 0,12 %, стабилизированных титаном (марки 08Х22Н6
(ЭП53) и 08Х21Н6М2Т (ЭП54));
• С ^ 0,03 % (марки 03Х23Н6 и 03Х22Н6М2);
• С ^ 0,03 %, дополнительно легированные азотом.
Наилучшим комплексом свойств обладают низкоуглеродистые
стали третьего поколения. Наиболее перспективна среди них сталь
марки 03Х24Н6АМЗ (ЗИ130). После закалки при температуре 1070—
1120 °С в стали формируется двухфазная аустенитно-ферритная струк-
структура с соотношением аустенита и феррита в пределах 40-50 %. Эта
сталь является высокоэффективной технологичной коррозионностой-
кой сталью. Вследствие повышенной прочности ее целесообразно
применять при эксплуатации в условиях коррозионно-эрозионного
изнашивания. Из этой стали изготовлено оборудование для произ-
производства экстракционной фосфорной кислоты, минеральных удобре-
удобрений, карбамида и капралактама.
Современные аустенитно-ферритные стали благодаря своим осо-
особым коррозионным и механическим свойствам являются наиболее
перспективными для использования во многих областях химиче-
химической, нефтехимической, нефтегазодобывающей промышленности, в
морском строительстве и при опреснении морской воды.
Промышленное применение высоколегированных сплавов на ос-
основе системы Fe-Cr-Ni обусловлено особыми физико-механически-
физико-механическими свойствами, стойкостью в сильно агрессивных средах, окалино-
стойкостью и способностью к упрочнению.
Сплавы 06ХН28МДТ и 03ХН28МДТ предназначены для рабо-
работы в условиях производства H2SO4 различных концентраций до
200 Коррозионная характеристика металлов и сплавов Гл. 7
80°С, сложных минеральных удобрений, экстракционной фосфор-
фосфорной кислоты. Сплав ХН30МДТ (ЭК 77) предназначен для работы в
фосфорной кислоте с содержанием фтора до 1,8 % при температуре
до 120 °С. В зарубежной практике для аналогичных целей использу-
используются сплавы Cromfer 2328 и Саникро-28 (Швеция).
Для изготовления различной химической аппаратуры, подверга-
подвергающейся одновременному воздействию агрессивной среды и механи-
механическим напряжениям, применяется высокопрочный дисперсионно-
твердеющий сплав ХН40МДТЮ (ЭП543).
7.2. Конструкционные материалы на основе
цветных металлов
В промышленности наряду с легированными сталями и чугунами
широко используются другие металлы и сплавы на их основе.
7.2.1. Алюминий и его сплавы
Алюминий и его сплавы по масштабам производства и примене-
применения в промышленности занимают одно из первых мест.
Плотность алюминия равна 2,7, температура плавления 658°С,
хорошо поддается сварке, прокатке, ковке и другим механическим
операциям. Механические свойства алюминия невысоки и в значи-
значительной степени зависят от характера термической обработки. ПДК
в воде 0,04 мг/л.
Стандартный электродный потенциал алюминия для реакции
А13++3е ^ А1 равен —1,66 В, т.е. он является достаточно актив-
активным металлом. Однако алюминий обладает высокой коррозионной
стойкостью во многих агрессивных средах благодаря склонности к
пассивированию.
Коррозионная стойкость металлов оценивается десятибалльной
шкалой (ГОСТ 13819-68). В случае равномерного разрушения ме-
металла скорость коррозии определяют по уменьшению массы метал-
металла после удаления продуктов коррозии. Эти сведения для алюминия
приведены в табл. 7.5.
В пассивном состоянии поверхность алюминия покрыта плен-
пленкой, состоящей из AI2O3 или AI2O3H2O толщиной от 5 до 100 нм в
зависимости от условий эксплуатации. Пленка на алюминии обла-
обладает хорошим сцеплением с металлом и удовлетворяет требованию
сплошности. Поэтому коррозионная стойкость алюминия во многом
определяется величиной рН раствора (рис. 7.11). Пленка на алю-
алюминии образуется при рН = 3-9. Алюминий стоек в атмосферных
7.2.
Конструкционные материалы на основе цветных металлов
201
Таблица 7.5
Шкала коррозионной стойкости алюминия и алюминиевых сплавов
Балл
Уменьшение
массы, г/(м2-ч)
Балл
Уменьшение
массы, г/(м2-ч)
1
^ 0,0003
6
0,031-0,154
2
0,0003-
0,0015
7
0,154-0,31
0,0015-
0,003
8
0,31-1,54
4
0,003-
0,015
9
1,54-3,1
5
0,015-
0,031
10
>3,0
условиях и в средах, содержащих H2S, SO2, NH3, в воде при нагре-
нагревании. В нейтральных растворах солей коррозия алюминия зависит
от природы аниона. Галоидные ионы разрушают оксидную плен-
пленку. Причем ионы F~ и С1~ оказывают более сильное разрушающее
действие, чем ионы Вг~ и J~. Стойкость алюминия высока в рас-
растворах солей, обладающих окислительными свойствами, таких как
хромокислые и азотнокислые. Поэтому алюминий применяют в про-
производстве аммиачной селитры и капралактама.
Коррозионная стойкость алюминия велика в концентрированных
растворах азотной и серной кислот, которые обладают высокими
окислительными свойствами.
При высоких концентрациях HNO3 коррозионная стойкость алю-
алюминия выше, чем нержавеющей
стали марки 12Х18Н9. Поэтому
алюминий используется в произ-
производстве концентрированной азот-
азотной кислоты по методу прямого
синтеза.
Средние концентрации серной
кислоты опасны для алюминия. Но
он стоек в разбавленной и концен-
концентрированной H2SO4 при 20°С, а
в олеуме — при температурах до
200 °С. Это позволяет использовать
алюминий в производстве олеума и
хлорсульфоновой кислоты.
В фосфорной и уксусной кисло-
кислотах, а также во многих органиче-
органических средах алюминий при комнат-
комнатной температуре устойчив.
Алюминий и его сплавы широ-
широко применяют в промышленности
в производстве уксусной кислоты и
1,3
1Д
I0'5
ё о,з
ОД
4 8 12 16
рН
3%NaCl+HCl«- ^3%NaCl+NaOH
Рис. 7.11. Зависимость скорости
коррозии за 24 часа — G) и элек-
электродного потенциала B) алюминия
от рН хлоридного раствора
202
Коррозионная характеристика металлов и сплавов
Гл. 7
формальдегида. Алюминий достаточно стоек к действию уксусной
кислоты любых концентраций от 1 до 99 масс.% при температу-
температурах, не превышающих 65°С. В кипящих растворах кислоты алю-
алюминий нестоек за исключением концентраций 98-99,8 % СНзСООН
(табл. 7.6).
Таблица 7.6
Скорость коррозии алюминия в уксусной кислоте (мм/год)
Алюминий
(99,7%)
Концентрация
кислоты, масс.%
3-30
-
40
-
98-98,8
-
-
Температура, °С
20
кипение
20-50
кипение
20
50
кипение
Скорость коррозии,
мм/год
0,011
9Д
0,08
6,4
0,001
0,007
0,17
Сильное влияние на разрушение алюминия и его сплавов оказы-
оказывает капельножидкая и парообразная ртуть. Достаточно непродол-
непродолжительного контакта алюминия со ртутью, чтобы он начал быстро
разрушаться в жидких средах, а иногда и во влажной атмосфере.
Как показали исследования американских специалистов, коррозию
алюминия в уксусной кислоте вызывает присутствие ртути в кон-
концентрации 0,000004 масс.%.
В производстве формальдегида из алюминия (чистота ^99,5 %)
изготавливают реакторы, дистилляционные колонны, теплообмен-
теплообменники. Алюминиевые колонны для разделения формальдегидных рас-
растворов работают под давлением от 0,01 до 0,05 МПа. Для аппаратов
с большим давлением употребляют сплав, легированный (в %): 3,5
Mg; 0,25 Сг; 0,1 Си; 0,1 Мп; 0,2 Zn; 0,45 Fe + Si. Срок службы этого
сплава, так же как и чистого алюминия оценивают в 10 лет.
Сернистые соединения в газовых средах на алюминий не дей-
действуют. Поэтому алюминий применяют при изготовлении аппаратов
для вулканизации каучука и переработки сернистых нефтей.
Сухой хлористый водород и газообразный NH3 так же не дей-
действуют на алюминий. В щелочах защитная пленка на алюминии рас-
растворяется, коррозия протекает с водородной деполяризацией.
Коррозионная стойкость алюминия зависит во многом от наличия
примесей в его составе. При необходимости иметь алюминий мак-
максимальной коррозионной устойчивости, применяемый для изготов-
изготовления химической аппаратуры и плакирующего материала, следует
использовать алюминий высокой чистоты, например, марки АВ1 и
7.2. Конструкционные материалы на основе цветных металлов 203
АВ2 с содержанием алюминия 99,90% и 99,85% соответственно,
или, в менее ответственных случаях, марки А00 и АО с содержанием
алюминия 99,7 % и 99,6 % .
Сплавы алюминия — дюралюмины — содержат: B,0-7,0) % Си;
@,4-1,8)% Mg; @,3-0,9)% Мп (марки Д1, Д6, Д8, Д16, Д20).
Сплавы алюминия — силумины — имеют состав: @,8-13,0)% Si;
@,2-4,5)% Си; @,5-13)% Mg (марки АЛИ, АЛ13, АЛ20, АЛ25).
Дюралюминий обладает высокой механической прочностью и
низкой коррозионной устойчивостью. Его применяют в химической
промышленности, защищая от коррозии плакированием чистым алю-
алюминием.
Силумины обладают хорошими литейными свойствами и кор-
коррозионной стойкостью в окислительных средах. Их поверхностный
защитный слой состоит из AI2O3 и SiO2. Однако эти пленки разру-
разрушаются в щелочах и в плавиковой кислоте:
SiO2 + 2NaOH = Na2SiO3 + Н2О
SiO2 + 4HF = SiF4 + 2H2O
Добавление марганца или магния в алюминиевомедный сплав
улучшает его механическую прочность и коррозионную устойчи-
устойчивость. Эти сплавы под названием магналии содержат от 4 до 12%
Mg, до 1 % Мп и иногда 0,1 % Ti (марки АМц и АМг) и сочетают в
себе высокие механические и противокоррозионные свойства.
Сплавы на основе алюминия нестойки при контакте со многи-
многими металлами и сплавами. Особенно опасен контакт с медью и ее
сплавами, а также с железом и сплавами на его основе.
7.2.2. Магний и его сплавы
Магний имеет плотность, равную 1,74. ПДК в воде — 40,0 мг/л.
Как конструкционный материал магний и его сплавы используются
в авиастроении и при изготовлении протекторов.
Стандартный потенциал реакции Mg2++2e ^ Mg равен —2,37 В.
Способность к пассивации у магния велика, но ниже, чем у алюми-
алюминия.
Магний неустойчив в кислотах, особенно при повышенных кон-
концентрациях. Исключение составляют хромовая и плавиковая кислоты.
В присутствии окислителей происходит пассивация магния, а в
HF на поверхности металла образуется нерастворимая пленка MgF2.
Магний неустойчив в органических кислотах, в нейтральных со-
солевых растворах и даже в чистой воде.
Коррозия магния протекает с водородной деполяризацией. По-
204 Коррозионная характеристика металлов и сплавов Гл. 7
этому даже незначительное загрязнение магния металлами, имею-
имеющими низкое водородное перенапряжение (такими, как Fe, Ni, Co,
Си) сильно понижают его коррозионную устойчивость.
При повышенных температурах магний легко окисляется на воз-
воздухе. Окисление жидкого магния идет с ускорением и может про-
произойти самовозгорание. Добавка 0,001-0,01% бериллия в магний
значительно увеличивает его жаропрочность и позволяет поднять
рабочую температуру расплава с 680 °С до 800 °С.
Наиболее распространенными сплавами на основе магния явля-
являются сплавы с алюминием (до 10 %), цинком (до 3 %) и марганцем
(до 2,5%).
Широкое применение нашли литейные магниевые сплавы (МЛ-4
и МЛ-5) в качестве протекторов для защиты стальных конструкций
в почвенных и морских условиях.
7.2.3. Медь и медные сплавы
Медь — тягучий вязкий металл светло-розового цвета, легко про-
прокатывается в тонкие листы, хорошо проводит теплоту и электриче-
электрический ток. Плотность меди равна 8,96. Общее содержание меди в
земной коре составляет 0,01 %. ПДК в воде составляет 0,001 мг/л.
Стандартный электродный потенциал медного электрода для про-
процесса Си+ + е —>> Си равен +0,52 В, а для процесса Си2+ + 2е —>> Си
составляет +0,337 В. Таким образом, термодинамически более ве-
вероятным процессом является образование двухвалентных ионов ме-
меди. Обычно при коррозии медь переходит в раствор с образованием
Си2+. Стационарный потенциал меди в растворе 3 % NaCl составля-
составляет +0,05 В, а в растворе IN HC1 1-0,15 В. Поэтому медь в обычных
условиях не вытесняет водород из растворов, т.е. не может корроди-
корродировать с водородной деполяризацией.
В растворах комплексообразователей (KCN, NH3) или окислите-
окислителей (HNO3, H2O2) или даже при продувании через растворы кисло-
кислорода или воздуха, скорость окисления меди существенно увеличи-
увеличивается (табл. 7.7).
Окислительные кислоты, такие, как азотная и хромовая, даже
разбавленные, вызывают коррозию меди и медных сплавов.
Способность к пассивированию у меди выражена слабо. В ат-
атмосферных условиях медь устойчива, на ее поверхности создаются
защитные слои типа СиСОзСи(ОНJ.
Более 50 % меди используется в электротехнической промышлен-
промышленности, 30-40% — для изготовления сплавов, а остальная часть —
для изготовления теплообменников, холодильников, вакуумных ап-
7.2.
Конструкционные материалы на основе цветных металлов
205
Таблица 1.1
Влияние аэрации кислорода на скорость коррозии меди в кислотах
Кислота
Соляная
Серная
Лимонная
Уксусная
Концентрация, %
4
6
50
6
Скорость коррозии, мг/(см2-сут.)
при пропуска-
пропускании водорода
105
22
29
8
при пропуска-
пропускании кислорода
8600
920
170
143
паратов.
Медь со многими металлами дает твердые растворы. Поэтому
структура медных сплавов в основном однородна. Медь сообщает
сплавам термодинамическую устойчивость.
Для медных сплавов характерны те же основные условия протека-
протекания коррозионного процесса, что и для чистой меди: они достаточно
устойчивы в солевых растворах и в разбавленных неокислительных
кислотах. Медь может применяться в промышленности в производ-
производстве формалина в колоннах дистилляции, если формалиновые смеси
не содержат муравьиной кислоты и в аппараты не попадает воздух. В
кипящей смеси формальдегида, воды и метилового спирта скорость
коррозии меди не превышает 0,05 мм/год.
Медь имеет температуру плавления 1083 °С и не является жаро-
жаростойким материалом. Однако в некоторых конструкциях она эксплу-
эксплуатируется при повышенных тем-
температурах. ^
Легирование меди другими
компонентами может существен-
но изменить скорость газовой
коррозии сплава. Наиболее силь-
но повышается стойкость меди к
газовой коррозии при легирова-
нии ее бериллием (до 2,5 %), маг-
нием (до 5 %) и алюминием (до
5%) (рис. 7.12). Для работы при
i/бо
i/so
1/юо
1/120
1/140
Be
1
высоких температурах до 900° С
применяют алюминиевые (до
10 % А1) и бериллиевые бронзы.
Латуни — это сплавы меди с
цинком (до 45 % Zn). Специаль-
Специальные латуни дополнительно леги-
легируются Si, Al, Ni, Cr, Mn и др.
2 3 4 5 6 7
Me, масс.%
10
Рис. 7.12. Влияние добавок маг-
магния, бериллия и алюминия на ско-
скорость окисления меди на воздухе при
800° С.
F — отношение скорости окисления
сплава к скорости окисления чистой
меди
206 Коррозионная характеристика металлов и сплавов Гл. 7
Специальные латуни по коррозионной стойкости не уступают меди.
Введение в простую латунь алюминия, марганца или никеля повы-
повышает стойкость сплава к атмосферной коррозии, а введение крем-
кремния — в морской воде.
Механические свойства, химический состав и области примене-
применения латуней и бронз даны в табл. 7.8.
Латуни широко применяются в качестве материала для труб кон-
конденсаторов в паросиловых установках, особенно для корабельных
конденсаторов, охлаждаемых быстро протекающей морской водой.
Для простых латуней характерен вид коррозии, который называ-
называется обесцинкованием. Латунь на отдельных участках поверхности
подвергается специфическому разрушению, в результате которого
возникает рыхлый слой меди. Вначале в раствор переходят одновре-
одновременно цинк и медь. Затем ионы меди вторично выделяются из рас-
раствора, а образовавшийся осадок меди, выполняя роль добавочного
катода, ускоряет электрохимическую коррозию латуни. В результа-
результате в раствор переходят ионы цинка, и с течением времени коррозия
распространяется так глубоко, что приводит к образованию сквоз-
сквозных повреждений. Если процесса обесцинкования не происходит, то
скорость разрушения латуней в морской воде невелика и составляет
0,008-0,01 мм/год.
Для уменьшения обесцинкования латуней сплав дополнительно
легируют оловом, никелем, алюминием, а чаще всего мышьяком в
количестве 0,001-0,012%.
Латуни в условиях эксплуатации склонны к коррозионному рас-
растрескиванию. Это явление наблюдается при наличии в атмосфере
аммиака или сернистого ангидрида, а также в растворах, содержа-
содержащих аммиак, комплексные аммиачные или цианистые соли. Допол-
Дополнительное легирование латуней небольшими добавками кремния
@,5 %) повышает их стойкость к коррозионному растрескиванию.
Кремнистые латуни, содержащие не более 1 % Si при 20 % Zn, обла-
обладают хорошими механическими и технологическими свойствами.
Для изготовления теплохимических аппаратов чаще всего при-
применяют латуни марок ЛМц58-2 с содержанием марганца 1-2% и
ЛО70-1 с содержанием олова 1-1,5 % . Латунь ЛО70-1 стойка в мор-
морской воде, поэтому ее называют «морской латунью» или «адмирал-
«адмиралтейским металлом».
Бронзами называют сплавы меди с оловом, а также с алюминием,
кремнием, марганцем и т.д.
Оловянистые бронзы содержат не более 13,8% Sn, чаще — 8-
10% Sn. Они представляют собой твердые растворы. Оловянистые
бронзы имеют хорошую коррозионную устойчивость в разбавлен-
7.2.
Конструкционные материалы на основе цветных металлов
207
I
да
К й
о а
И
О L,
х Ы
х ю
щ ?
3= «
3
§¦
I
о
о
X
О
Предел
*гн
нен]
к
Он
тельно
прочности
'о4
мае
ей
В
О
ческш
К
X
лава
х
о
а
|У]
Он
удлинен
при растяже-
нии, МПа
СП
и
н
3
лока
о
о
Он
с
сты, лент
К
320
1
1
1
79-81
о
00
о
260
1
1
1
88-90
о
3
ю
Он
н
о
нты, поло
о
240
1
1
1
95-97
ю
400
1
1
«о
,75-2,
76-79
(N
72-
<^
/бы, прут
Он
450
1
О
75-1,^
о
58-61
—^
ю
S
350
i
i
69-71
70-
О
s
н
Он
с
о
НТЫ, ПОЛО
о
350
4-3
(N
1
1
со
и
со
д
о
Рч
PQ
3
н
д
ё
сы,
п
|
Ь2н
Он
О
600
1
1
6-8
92-94
Он
3
о
НТЫ, ПОЛО
S
380
1
1
4-6
94-96
Он
\Г5
утки, тру(
Он
650
5Ni
5-5,
со
¦?
со
9,5-11
78-83,5
J
53
<^
Он
PQ
3
д
ё
сы,
о
о
с 3
Он Он
20-40
30
о о
УГ) О
^ УС)
9-11
86,5-89,5
Он
(после
закалки)
мбраны
2-4
1300
1
1
PQ
00
PQ
Он
гп
экэоп)
старения)
208
Коррозионная характеристика металлов и сплавов
Гл. 7
ных минеральных неокислительных кислотах, в морской воде, в
щелочных растворах (исключая аммиачные). Они имеют хорошие
антифрикционные свойства и обладают прекрасными литейными
качествами.
Алюминиевые бронзы содержат до 9-10 % А1 и имеют однофаз-
однофазную структуру. Эти бронзы стойки в разбавленных растворах кислот,
в том числе в соляной, фосфорной, уксусной, лимонной и многих
других органических кислотах. Особенно высокой коррозионной
стойкостью отличается алюминиевая бронза с содержанием 9,8%
А1 и алюминиевая бронза, содержащая дополнительно 4 % железа
(Бр.АЖ9-4).
Кремнистые бронзы могут содержать до 15 % кремния, но только
при содержании кремния до 3-4 % сплав имеет структуру твердого
раствора.
В химической промышленности применяются кремнистые брон-
бронзы, дополнительно легированные марганцем (Бр.КМцЗ-1) и нике-
никелем (Бр.КН1-3). Они используются для изготовления аппаратуры,
работающей под давлением, а также для реакторов взрывоопасных
веществ, так как такие бронзы не дают искр при ударе.
7.2.4. Никель и его сплавы
Стандартный электродный потенциал никеля Ni2+ + 2е ^ Ni
равен —0,25 В. ПДК в воде — 0,01 мг/л. Никель обладает способно-
способностью к пассивации, что объясняет его повышенную коррозионную
устойчивость (табл. 7.9).
Таблица 7.9
Шкала коррозионной стойкости никеля и его сплавов
Балл
Коррозионная стой-
стойкость, г/(м2-ч)
1
<0,0001
2
0,0001-0,005
3
0,005-0,01
4
0,01-0,05
Балл
Коррозионная стой-
стойкость, г/(м2-ч)
5
0,05-0,1
6
0,1-0,5
7
0,5-1,0
8
1,0-5,0
9
5,0-10,0
Никель характеризуется прочностью, тугоплавкостью, пластич-
пластичностью, способностью к механической обработке. Плотность рав-
равна 8,91, температура плавления 1455 °С.
В неокисляющих, разбавленных кислотах НС1 (до 15 %), H2SO4
(до 70 %), в ряде органических кислот никель достаточно устойчив.
Коррозия никеля чаще всего протекает с кислородной деполяриза-
7.2. Конструкционные материалы на основе цветных металлов 209
цией. Поэтому большое влияние на скорость коррозии никеля оказы-
оказывает присутствие кислорода или воздуха, перемешивание, наличие
окислителей. Коррозия никеля ускоряется в растворах в присутствии
окислителей — FeCl3, CuCl2, HgCl2, AgNO3, NaClO.
Никель обладает высокой коррозионной стойкостью при повы-
повышенных температурах во многих органических средах, в том числе
в жирных кислотах, спиртах. Поэтому из никеля изготавливают ап-
аппаратуру для пищевой промышленности.
Особым свойством никеля является его устойчивость к щелочам
всех концентраций и температур. Никель является лучшим материа-
материалом при изготовлении аппаратов для выпарки и плавления щелочей.
Стойкость в этой среде он сообщает сплавам железо-никель.
Как конструкционный материал никель находит ограниченное
применение вследствие своей дефицитности и возможности замены
его нержавеющими сталями.
Никель находит широкое применение в качестве защитного галь-
гальванического покрытия и как компонент для изготовления различных
сплавов.
Высокой коррозионной стойкостью обладают сплавы никеля с
медью, молибденом и сплавы систем Ni-Mo-Cr и Ni-Cr-Fe.
Сплавы никеля с медью. Никель с медью дает непрерывный ряд
твердых растворов. Сплавы, содержащие менее 50 атом.% никеля,
по коррозионным характеристикам ближе к чистой меди, а при со-
содержании Ni более 50 атом.% ближе к никелю.
Наиболее известен сплав монелъ-металл, содержащий 70 % Ni,
28 % Си и 1,5-2,5 % Fe. Он имеет повышенную коррозионную стой-
стойкость по сравнению с чистыми компонентами, входящими в его со-
состав. Сплавы этого типа обладают также высокими механическими и
технологическими свойствами, имеют большую прочность, хорошо
прокатываются, отливаются, обрабатываются давлением и резанием.
Монель-металл стоек в неокислительных неорганических кислотах
при невысоких концентрациях, в растворе Н3РО4 высокой концен-
концентрации и в растворах плавиковой кислоты всех концентраций при
всех температурах при ограниченном доступе воздуха.
Сплав монель-К F6 % Ni, 29 % Си, 0,9 % Fe, 2,75 % А1, 0,4 % Мп,
0,5 Si, 0,15% С) отличен тем, что увеличивает свои прочностные
характеристики при старении.
Никель-медные сплавы применяют в аппаратах, работающих в
среде H2SO4, HC1, Н3РО4 и т.д. Сплав монель-К применяют для
изготовления деталей, несущих значительную силовую нагрузку.
Сплавы никеля с молибденом носят названия хастеллоев. Они
представляют собой твердые растворы и обладают прочностью, пла-
о
Он
210 Коррозионная характеристика металлов и сплавов Гл. 7
стичностью и химической стойко-
стойкостью. В промышленности они пред-
16 Ь ~"Ч> ставлены марками Н65М-ВИ (ЭП982-
, . ВИ), Н70МФВ-ВИ (ЭП814А-ВИ),
ь \ Хастеллой В-2, Nimofer S6928.
& ° ' При содержании молибдена вы-
выше 15% никель-молибденовый сплав
стоек в растворах минеральных кис-
кислот. При содержании молибдена вы-
и 5 10 15 20 25 ше 20% коррозионная устойчивость
Содержание Мо, масс.% г , П Л о ч
^ сплавов особенно высока (рис. 7.13).
Рис. 7.13. Зависимость скоро- Сплав «Хастеллой В» (марка
СТИ КОррОЗИИ СПЛава Nl-Mo В тталлуглчч ало/ хт- Ас
10%-йНС1при70°Сотсодер- Н70МФ), содержит 70% Ni и 25-
жания молибдена 29 % Мо. Он обладает устойчивостью
в соляной и фосфорной кислотах всех
концентраций при высокой температуре, в серной кислоте при тем-
температуре кипения (при концентрации более 60% до 150°С), в раз-
различных хлорпроизводных. Нестоек в окислительных средах.
Дополнительное введение хрома привело к созданию сплава «Ха-
«Хастеллой С» (марка ХН65МВ). Его состав: 65 % Ni, 16 % Мо, 15 % Сг,
4 % Fe. Этот сплав стоек в окислительных средах, в холодной азотной
кислоте всех концентраций, в кипящей азотной кислоте концентра-
концентрации до 70%, в растворах, содержащих СЬ, С1О~, Fe3+, Cu2+ и в
растворах HF.
Сплавы Ni-Mo хорошо обрабатываются, свариваются и ошли-
ошлифовываются и являются ценным конструкционным материалом для
химических производств.
Сплавы никеля с хромом — нихромы — могут содержать до
35% хрома при условии сохранения пластичности. Сплавы этого
состава представляют собой твердые растворы Ni-Cr на основе j-
структурной решетки никеля.
Они представлены марками ХН58В (ЭП795), Nicrofer 6030 и име-
имеют высокую стойкость в растворах азотной кислоты в присутствии
фтор-иона при высокой температуре. Сплавы, содержащие 25-30%
хрома, применяются для изготовления толстой проволоки и лент.
Для получения очень пластичных нихромов, например, для протяж-
протяжки проволоки диаметром 0,01-0,30 мм, содержание хрома в сплаве
не должно превышать 20 %.
Никель-хромовые сплавы известны как жаростойкие материалы.
Одновременно они обладают коррозионной стойкостью и в агрессив-
агрессивных средах. Эти сплавы так же как и нержавеющие стали устойчивы
в окислительных средах, например, в азотной кислоте.
7.2. Конструкционные материалы на основе цветных металлов 211
Нихромы нашли широкое применение как жаростойкий и очень
жаропрочный материал. Эти сплавы имеют аустенитную структуру
и обладают высоким омическим сопротивлением.
Разновидностью нихромов являются сплавы типа нимоник. Они
применяются для конструкций, работающих при высоких нагрузках
и температурах.
Применяется также хромистый сплав на никелевой основе под
названием инконелъ. Отличительной способностью инконеля явля-
является сохранение высокой прочности и сопротивления ползучести
при повышенных температурах. Этот сплав применяется для изго-
изготовления химических аппаратов, работающих под давлением при
высоких температурах.
Никелъ-хромомолибденовые сплавы (марки ХН65МВ, ХН65МВУ,
Хастеллой С-276, Хастеллой С-22, Nicrofer S5923hMo) обладают вы-
высокой стойкостью в широкой гамме высоко агрессивных сред: в рас-
растворах хлоридов меди (до 20%) и железа (до 35%); в растворах
серной, фосфорной, уксусной и муравьиной кислот, загрязненных
хлор- и фтор-ионами; в сухом хлоре, влажном хлористом водороде.
Никелевые сплавы характеризуются высокой стойкостью против
общей и локальной коррозии, хорошо свариваются, технологичны
при изготовлении различных видов аппаратов. Применение матери-
материалов этой группы для сред с высокими параметрами агрессивности
позволяет увеличить срок службы и надежность оборудования.
7.2.5. Олово
Стандартный равновесный потенциал олова равен —0Д36 В. Ста-
Стационарный потенциал в растворе 0,5N NaCl равен —0,25 В. ПДК в
воде — 0,112мг/л. Олово — серебристо-белый металл, медленно
тускнеющий на воздухе. Оно может существовать в двух модифика-
модификациях. Обычная металлическая модификация с плотностью 7,31 (/3-
фаза) носит название «белое олово». Более легкая металлоидная фор-
форма (а-фаза) с плотностью 5,75 носит название «серое олово». Белое
олово устойчиво при температуре выше +13 ° С, серое олово — при
температуре ниже +13 °С. Максимальная скорость перехода белого
олова в серое олово устанавливается при —48 °С. Аллотропическое
превращение белого олова в серое олово аналогично по внешнему
проявлению коррозионному разрушению. Начавшееся превращение
ускоряет процесс перехода. Это явление получило название оловян-
оловянной чумы. Введение в олово 0,5 % Bi или Sb исключает подобное
явление.
Олово обладает недостаточно высокими механическими свой-
212 Коррозионная характеристика металлов и сплавов Гл. 7
ствами, способность к пассивации выражена слабо. Оно устойчиво
в природных водах, в растворах нейтральных солей, в пищевых сре-
средах. Олово широко применяется для защитных покрытий при изго-
изготовлении консервной жести.
В органических пищевых средах при отсутствии или недостатке
кислорода олово имеет более отрицательный потенциал, чем же-
железо. Поэтому в закрытых консервных банках не образуется ржав-
ржавчины. В атмосферных условиях, напротив, железо обладает более
отрицательным потенциалом, поэтому открытые банки во влажной
атмосфере быстро ржавеют.
Олово устойчиво в разбавленных растворах серной и соляной
кислот, в органических кислотах. При повышении концентрации
минеральных кислот ускоряется коррозия олова. В азотной кислоте
олово сильно разрушается. Неустойчиво оно также в щелочах. Олово
устойчиво в атмосферных условиях.
Олово как конструкционный материал практического примене-
применения не имеет вследствие высокой себестоимости и невысокой меха-
механической прочности. Олово применяется для получения бронзы и
сплавов, обладающих антифрикционными свойствами. Наибольшее
применение из последних получили оловянные баббиты. В их состав
входит до 90 % олова. Мягкие легкоплавкие сплавы олова и свинца
используются в качестве припоев.
Сплавы на основе олова широко применяются в электротехнике.
Станиоль — материал, применяемый для электроконденсаторов. Он
состоит на 95 % из олова.
7.2.6. Свинец
Стандартный электродный потенциал свинца для процесса РЬ2+ +
+ 2е ^ РЬ равен —0Д26 В. ПДК в воде — 0,006 мг/л. Коррозионная
стойкость свинца определяется во многом устойчивостью продуктов
его коррозии.
Свинец — мягкий металл, имеющий невысокую температуру
плавления C27,4 °С), низкую теплопроводность, высокую плотность
A1,3) и плохие литейные свойства.
В качестве коррозионного материала применяется свинец чистоты
не менее 99,2 %. Примеси Си, Sn, As, Fe, Bi увеличивают прочност-
прочностные показатели, но уменьшают пластичность. Примеси мышьяка
придают свинцу хрупкость. Коррозионная стойкость свинца опре-
определяется растворимостью продуктов его коррозии. Растворимость
солей свинца отличается на несколько порядков в зависимости от
природы аниона (табл. 7.10).
7.2.
Конструкционные материалы на основе цветных металлов
213
Соль
Раствори-
Растворимость (г)
в100гН2О
Соль
Раствори-
Растворимость (г)
в100гН2О
Растворимость солей свинца
Уксуснокислая
РЬ(С2Н3О2J
27
Углекислая
РЬСОз
1,7-1(Г4
Азотнокислая
Pb(NO3J
54,3
Хлористая
РЬС12
0,041
Фосфорнокислая
РЬ3(РО4J
1,3-Ю
]
Таблица 7.10
Сернокислая
PbSO4
4,2-10
"идроксид
РЬ(ОНJ
0,014
Из приведенных данных видно, что в азотной и уксусной кисло-
кислотах свинец неустойчив, так как нитраты и ацетаты свинца раствори-
растворимы. Свинец неустойчив так же в щелочах, так как гидроксиды свинца
легко расторяются в избытке щелочи с образованием плюмбитов —
РЬО^", и плюмбатов — PbOg" •
Напротив, в серной и фосфорной кислотах свинец отличается
высокой коррозионной стойкостью. Это относится и к растворам
их солей. Нерастворимые продукты коррозии свинца осаждаются на
поверхности и образуют беспористую, прочно связанную с металлом
пленку, толщиной от тысячи до нескольких тысяч молекулярных
слоев.
Так, в горячей серной кислоте при концентрации до 80 % и в хо-
холодной H2SO4 при концентрации до 96 %, образуется нерастворимая
соль PbSC>4. При более высоких концентрациях серной кислоты и в
олеуме свинец неустойчив. В этих условиях протекает реакция:
PbSO4 + H2SO4 ^ Pb(HSO4J
Бисульфат свинца обладает хорошей растворимостью и скорость
коррозии свинца резко возрастает.
Добавки к свинцу 0,03-0,10 % Те улучшают коррозионную стой-
стойкость свинца как при более высоких концентрациях H2SO4, так и
при более высоких температурах. Например, в 78 % H2SO4 легиро-
легированный свинец стоек при 100—115 °С (табл. 7.11).
Добавка теллура повышает сопротивление свинца усталости и
коррозии, когда сплав эксплуатируется в качестве обкладочного ма-
материала и труб. Отмечается также способность теллуристого свинца
нагартовываться при холодной обработке и повышенное сопротив-
сопротивление его вибрационным и механическим нагрузкам.
В соляной кислоте свинец стоек до концентрации 10 %. В жестких
водах, содержащих CaSC>4 и кремниевую кислоту, свинец устойчив.
214
Коррозионная характеристика металлов и сплавов
Гл. 7
Таблица 7.11
Скорость коррозии свинца и его сплавов в серной кислоте
Материал
Свинец
Сурьмянистый
свинец
Теллуристый
свинец
Концентрация
H2SO4,Macc.%
45-53
40-50
78
78
98
50
78
95,6
78
95,6
Температура, °С
20
90
53-57
95-100
90
40
100-115
20
100-115
20
Скорость кор-
коррозии, мм/год
0,02-0,08
0,09-0,11
0,18
0,24
0,36
0,016-0,018
0,16
0,44
0,06
0,17
Но он корродирует в подземных водах, содержащих органические
кислоты или большой процент углекислоты. В этих условиях обра-
образуются бикарбонаты свинца РЬ(НСОзJ? обладающие существенной
растворимостью. Свинец показывает высокую стойкость в атмосфе-
атмосфере, особенно в индустриальных атмосферах, содержащих H2S, SO2,
H2SO4.
Следует отметить высокую токсичность свинца.
Свинец находит применение в химической промышленности в
виде листового материала для футеровки химических аппаратов,
гальванических ванн, кристаллизаторов, для изготовления трубо-
трубопроводов и газоходов. Он применяется также для оболочек кабелей
связи, для защиты от рентгеновского облучения, для изготовления
аккумуляторов.
Свинец применяется в сернокислотной промышленности как об-
кладочный материал для небольших емкостей (вакуум-сборники,
мерники) и в сопряженных узлах аппаратов (рис. 7.14); для гомоген-
гомогенного свинцевания крышек аппаратов, как конструкционный матери-
материал для труб холодильников. Низкий коэффициент теплопроводности
не позволяет эффективно использовать свинец в теплообменной ап-
аппаратуре, а высокая плотность приводит к утяжелению конструкций.
Верхний температурный предел применения свинца 120 °С. Для за-
защиты от коррозии оборудования применяется рольный свинец марки
С2 (ГОСТ 3778-56).
Сплав свинца, легированный 6-12% Sb, обладает повышенны-
повышенными механическими и литейными свойствами. Он известен под на-
названием «твердый свинец» или гартблей (ГОСТ 1292-57). Из него
изготавливают детали насосов промывных кислот и узлы аппаратов,
7.2.
Конструкционные материалы на основе цветных металлов
215
испытывающие нагрузки (рис. 7.15).
Рассмотрим примеры. При произ-
производстве серной кислоты первой ста-
стадией процесса является обжиг пи-
пирита Fe2S. Полученный обжиговый
газ проходит стадию очистки. Из 2-
й промывной башни газ выходит при
температуре 30-40° С. Мокрый элек-
электрофильтр устанавливается после 2-
й промывной башни. В аппарат по-
поступает газ, содержащий 7-8 % SO2
при температуре 45-50 ° С. В электро-
электрофильтре газ очищается от наиболее
крупных капель тумана, основной
массы селена и мышьяка. Рассмот-
Рассмотрим пример антикоррозийной защи-
защиты этого аппарата (рис. 7.14).
Корпус аппарата выполнен из
стали СтЗ и защищен кислотоупор-
кислотоупорным кирпичом по подслою из изобу-
тилена марки ПГС толщиной 5 мм
на клее 88-Н. Между полиизобути-
леном и кирпичом находится слой
силикатной кислотоупорной замазки
толщиной 5 мм. Крышка стальная
выполняется гомогенно освинцован-
освинцованной, распределительная решетка —
из отвержденного листового фаолита.
Коронирующие электроды изготов-
изготовляются из освинцованной стальной
проволоки диаметра 1,8 мм. Осади-
тельные электроды выполняются в
виде шестигранных свинцовых труб,
собранных в пакеты по 168 труб.
На рис. 7.15 приведена схема ан-
антикоррозионной защиты сборника
промывной кислоты. Стальной кор-
корпус оклеивается полиизобутиленом и
футеруется кислотоупорным кирпи-
кирпичом на силикатной кислотоупорной
замазке. Шаровой клапан и вкладыш
сборника выполнены из сурьмяни-
сурьмянистого свинца — гартблея. Сифон изготовлен из стальной освин-
освинцованной трубы. Крышку аппарата защищают свинцом или ре-
резиной.
Сплав свинца с 1 % Ag и 1 % As используется в качестве матери-
материала для нерастворимых анодов, применяемых в электрохимических
производствах для получения диоксида марганца и пероксида водо-
водорода.
""""--^
¦ 1
IToA-j
i
1 I
i
Рис. 7.14. Антикоррозион-
Антикоррозионная защита мокрого элек-
электрофильтра:
1 — стальной корпус; 2 —
полиизобутилен ПСГ F =
= 2,5 мм в два слоя на
клее 88-Н со сваркой швов);
3 — шпатлевка силикат-
силикатной кислото-упорной замаз-
замазкой; 4 — кислотоупорный
кирпич; 5 — решетка из от-
отвержденного листового фао-
фаолита (S = 20 мм)
216
Коррозионная характеристика металлов и сплавов
Гл. 7
Рис. 7.15. Антикоррозионная защита сборника
промывной кислоты:
1 — корпус из углеродистой стали; 2 — поли-
изобутилен F = 2,5 мм в два слоя на клее 88-
Н со сваркой швов); 3 — шпатлевка силикатной
кислотоупорной замазкой; 4 — кислотоупорный
кирпич; 5 — вкладыш из гартблея; 6 — прокладка;
7 — клапан из гартблея; 8 — шнуровой асбест с
андезитовой замазкой
7.2.7. Цинк
Цинк нашел широкое применение в качестве защитного покрытия
железных и стальных изделий. Цинк—легкоплавкий (?пл = 419° С),
мягкий и малопрочный металл. ПДК в воде — 0,01 мг/л. Стандарт-
Стандартный электродный потенциал цинка Zn2+ + 2е ^ Zn равен —0,76 В.
В 3 %-м растворе NaCl электродный потенциал цинка равен —0,83 В.
Цинк может корродировать как с водородной, так и с кислородной
деполяризацией.
7.2.
Конструкционные материалы на основе цветных металлов
217
В кислых средах цинк корродирует с водородной деполяризацией.
На скорость коррозии цинка существенно влияют даже незначитель-
незначительные примеси других металлов. Примеси кадмия, свинца, алюминия
не влияют на скорость коррозии. Примеси с низким перенапряжени-
перенапряжением водорода, например, железо, медь в концентрации 0,002-0,005 %
увеличивают скорость коррозии цинка в 10 и более раз.
В нейтральных растворах цинк корродирует с кислородной де-
деполяризацией и имеющиеся в нем технические примеси не влияют
на его коррозионную устойчивость. На поверхности металла обра-
образуются защитные пленки из гидроксида цинка.
В щелочах цинк не стоек и переходит в раствор в виде цинкатов,
например,
I
и
500
&
300
100
8
рН
12 16
100
Рис. 7.16. Влияние рН на кор-
коррозию Zn.
Растворы НС1 в кислой области и
NaOH в щелочной
20 40 60 80
t,°C
Рис. 7.17. Влияние температуры
на скорость коррозии Zn в дистил-
дистиллированной воде
Цинк обладает максимальной устойчивостью в интервале рН
между 9 и 11 (рис. 7.16). Применение цинковых покрытий нера-
нерационально, если рН среды заметно меньше 7 или более 12 из-за
усиления коррозии цинка.
В воде цинк устойчив до 55 ° С (рис. 7.17). Скорость коррозии рез-
резко повышается с увеличением температуры и достигает максимума
при 70 °С, а затем снижается. Наблюдаемые закономерности связы-
связывают с тем, что при температурах до 50 °С и выше 95 °С, на цинке
образуется плотная пленка с высокими защитными свойствами. В
интервале температур E5-65) °С наблюдается образование рыхлых
продуктов коррозии с низкими защитными свойствами. При 100° С
продукты коррозии уплотняются, а также происходит уменьшение
растворимости кислорода в коррозионной среде.
В чистой и морской атмосферах цинк стоек, так как покрывается
слоем продуктов коррозии из гидроксидов и основных углекислых
218 Коррозионная характеристика металлов и сплавов Гл. 7
солей цинка. В загрязненных SO2, SO3, HC1 средах индустриальных рай-
районов устойчивость цинка и цинковых покрытий заметно снижается.
Цинк используется для защиты стали от атмосферной коррозии.
Применяется для получения медных, никелевых, магниевых спла-
сплавов, в производстве аккумуляторов и как протектор при электрохи-
электрохимической защите железных сплавов.
7.2.8. Кадмий
Кадмий — серебристо-белый, мягкий металл. Плотность равна
8,65. Стандартный электродный потенциал кадмия Cd2+ + 2е ^ Cd
равен —0,40 В, а стационарный потенциал в 0,5н. растворе NaCl —
—0,52 В. ПДК в воде составляет 0,005 мг/л.
Кадмий — тягучий и ковкий металл, который легко прокатывает-
прокатывается в листы и вытягивается в проволоку.
Способность к пассивации у кадмия невелика. Поэтому в кон-
контакте с железом, обладающим склонностью к пассивации, в боль-
большинстве случаев кадмий оказывается анодом. Кадмий употребляют
в основном для нанесения анодных покрытий на сталь и на алюми-
алюминиевые сплавы.
Кадмий сходен по коррозионному поведению с цинком. В ней-
нейтральных растворах кадмий корродирует с кислородной деполяри-
деполяризацией. В отличие от цинка скорость коррозии кадмия с увеличением
рН понижается.
Вследствие менее отрицательного электродного потенциала кад-
кадмий имеет большую устойчивость в кислых и нейтральных раство-
растворах по сравнению с цинком. В щелочах он вполне устойчив.
Кадмий устойчив к морской воде и морской атмосфере. Присут-
Присутствие в газах SO2 и SO3 приводит к быстрому разрушению кадмия.
Кадмий используется для получения сплавов с медью. Высокая
токсичность кадмия ограничивает его применение в качестве защит-
защитного покрытия.
7.2.9. Титан и его сплавы
Титан — легкий (плотность 4,5) и тугоплавкий металл (?пл =
= 1725 °С). Он сочетает достаточную прочность с высокой пластич-
пластичностью и коррозионной стойкостью. Содержание титана в земной
коре достигает 0,58 % и по своему распространению среди конструк-
конструкционных металлов он находится на четвертом месте после алюми-
алюминия, железа и магния.
ПДК в воде — 0,06 мг/л. Стандартный электродный потенциал
титана для процесса Ti2+ + 2е ^ Ti равен —1,63 В, а для процес-
процесса Ti3+ + Зе ^ Ti равен -1,21 В.
7.2. Конструкционные материалы на основе цветных металлов 219
Таким образом, титан является термодинамически активным ме-
металлом. Однако титан склонен к пассивации и вследствие этого инер-
инертен во многих средах. Например, в морской воде при 25 °С потенциал
титана близок к +0,09 В, т.е. положительнее, чем у цинка, железа,
алюминия и меди в этой среде. Титан устойчив в средах, обладаю-
обладающих окислительными свойствами и содержащих хлорид-ионы. Так,
титан устойчив в растворах: БеОз концентрации до 3 0 % и до 100 ° С,
СиС12 — до 20 % и 100 °С, HgCl2 всех концентраций до 100 °С, А1С13
до 25% и до 60°С, NaCl всех концентраций до 100°С, в 100%-й
хлоруксусной и дихлоруксусной кислотах до 100 °С. Он устойчив
в царской водке, растворах гипохлорита натрия до 100° С, хлорной
воде, газообразном хлориде до 75 °С. Таким образом, титан может
применяться для изготовления аппаратов, насосов и коммуникаций
для работы с указанными веществами. Титан стоек в азотной кислоте
любых концентраций вплоть до температуры кипения. Скорость кор-
коррозии титана в дымящей азотной кислоте не превышает 0,1 мм/год.
В растворах соляной кислоты титан корродирует с выделением
водорода. Он стоек только в разбавленных растворах НС1: при 60 ° С
не выше 3% НС1, при 100 °С — не выше 0,5% НС1. С увеличе-
увеличением концентрации и повышением температуры соляной кислоты
скорость коррозии увеличивается. Снизить скорость растворения Ti
можно добавлением в раствор окислителей — К2СГ2О7, KM11O4,
Н2О2, O2,HNO3.
Титан растворяется в растворах плавиковой кислоты тем интен-
интенсивнее, чем выше концентрация кислоты.
При средних температурах (до 35 °С) титан стоек в растворах
фосфорной кислоты концентрации до 30 %. При 100 °С титан начи-
начинает корродировать в Н3РО4 3 %-й концентрации.
Характер зависимости скорости растворения титана от концен-
концентрации серной кислоты имеет сложный характер. Отмечается два
максимума скорости растворения — при концентрациях 40 % и 75 %.
Исследователи связывают такое явление с изменением физико-хими-
физико-химических свойств и электропроводности в системе H2SO4-H2O.
Сухой газообразный хлор вызывает сильную коррозию титана,
так что возникает опасность воспламенения. При наличие в хлоре
даже незначительных следов влаги порядка 0,005 %, коррозия титана
в хлоре прекращается.
В разбавленных щелочах, до концентрации 20% NaOH, титан
устойчив. В более концентрированных растворах и при нагреве он
медленно реагирует с образованием соли титановой кислоты —
Na2TiO3.
220
Коррозионная характеристика металлов и сплавов
Гл. 7
Таблица 7.12
Коррозионная устойчивость титана и нержавеющей стали типа 18-8
в некоторых средах
Коррозионная среда
H2SO4,75 % + HNO3,25 %
Царская водка
50 %-я муравьиная
кислота
50 %-я уксусная кислота с
добавкой 5 % NaCl
Атмосферная коррозия
B4 м от моря). По данным
5-летних исследований
Температура, °С
90
25
90
90
Показатель коррозии, мм/год
Ti
10,95
0,00083
0
0,0018
0,00
Сталь 12Х18Н9
0,183
очень быстрое
растворение
0,35
0,474
0,0011
Титан обладает высокой коррозионной стойкостью во многих
органических средах, в которых стали типа 12Х18Н9 корродируют
(табл. 7.12).
Исключительное свойство титана — это его полная коррозионная
устойчивость в морской воде и морской атмосфере.
Более высокие физико-механические и коррозионные свойства
титана могут быть достигнуты при его легировании такими метал-
металлами, как А1, Мо, Та, Nb, Zn, Си и т.д.
Сплавы титана с алюминием имеют более высокую прочность и
коррозионную стойкость, но они менее пластичны.
Сплавы системы титан-цирконий представляют собой однофаз-
однофазный твердый раствор. Эти сплавы обладают прочностью, пластич-
пластичностью и коррозионной устойчивостью. Так, при введении в Ti 5 %
Zr устойчивость сплава в 15 % растворе НС1 при 60 ° С повышается
в 2 раза, а при введении 50 % Zr — в 160 раз.
У сплавов титан-молибден наблюдается высокая коррозионная
стойкость в соляной, серной и фосфорной кислотах. Так, в 5%-м
растворе Н2 SO4 при 100 ° С скорость коррозии Ti при добавлении 3 %
Мо уменьшается в 23,5 раза, а при добавлении 5 % Мо — в 117,5 раза.
Сплавы титан-тантал обладают повышенной коррозионной стой-
стойкостью. Сплав титана с 5 % Та имеет высокую коррозионную стой-
стойкость в 18 %-й НС1 при 90 °С, при обязательном присутствии СЬ, как
окислителя. Сплав титана с 20 % Та стоек в 5 %-й НС1 при 100 °С.
Титан и его сплавы применяются в химической промышленно-
промышленности для изготовления аппаратуры в производстве серной кислоты,
хлора и ряда органических продуктов. Титан нашел промышлен-
промышленное применение в качестве основы для электродов ОРТА (окисные
7.2.
Конструкционные материалы на основе цветных металлов
221
рутениевотитановые аноды) при электрохимическом производстве
хлора, гипохлоритов, хлоратов.
При легировании титана палладием (от 0,01 % до 5,0%) и пла-
платиной повышается его коррозионная стойкость в растворах H2SO4,
НС1, Н3РО4 и в органических кислотах.
Для существенного снижения скорости коррозии необходимо вве-
ввести в сплав @,2-0,5)% Pd. Недостаточное легирование сплава пал-
палладием @,05-0,1) % может привести к обратному эффекту — увели-
увеличению скорости его растворения.
Титан, легированный палладием или платиной, как конструкци-
конструкционный материал для химической промышленности обладает редким
и ценным сочетанием свойств — коррозионной стойкостью в окис-
окислительных и неокислительных кислых средах. В таблице 7.13 приве-
приведена сравнительная характеристика коррозионной стойкости титана
и сплава титана с 0,2 % Pd.
Таблица 7.13
Коррозионная устойчивость титана и сплава Ti с 0,2 % Pd
Коррозионная
среда
Соляная
кислота
Серная
кислота
Фосфорная
кислота
Муравьиная
кислота
Хлористый
алюминий
Хлористый
кальций
Концентрация,
масс.%
5
5
5
85
25
73
Температура, °С
Кипения
Кипения
150
Кипения
Кипения
177
Скорость коррозии,
мм/год
Ti
19,3
25,4
8,15
4,26
51,3
2,13
Ti + 0,2%Pd
0,10
0,51
0,15
0,10
0,025
0,00
Коррозионная стойкость сплава, как правило, устанавливается не
сразу, а после некоторого взаимодействия с коррозионной средой, во
время которого происходит обогащение поверхностного слоя сплава
палладием или платиной.
7.2.10. Тантал
Тантал—тяжелый металл, с плотностью равной 16,6 серебристо-
серого цвета. Обладает хорошей пластичностью и высокими меха-
механическими свойствами, хорошо обрабатывается и сваривается.
222 Коррозионная характеристика металлов и сплавов Гл. 7
Из всех известных металлов обладает наиболее высокой корро-
коррозионной стойкостью, которая определяется свойством его защитных
пленок. Тантал стоек в соляной и азотной кислотах при всех концен-
концентрациях и температурах, в фосфорной кислоте — при концентрациях
до 35 % и температурах не выше 145 °С. Тантал нестоек только в пла-
плавиковой кислоте вследствие образования соединения TaFs, раство-
растворимого в HF, и в щелочах, в которых также образуются растворимые
соединения — танталаты.
При нагревании в водородной атмосфере тантал поглощает водо-
водород до 740 объемов с образованием гидридов. Наводораживание так-
также возможно при комнатной температуре при катодной поляризации
тантала в электролитах. Поглощение металлом водорода приводит к
сильному увеличению хрупкости тантала.
Тантал окисляется на воздухе при температурах выше 300 °С с
образованием высшего оксида Та2Об. Он неустойчив в газообразном
фторе даже при комнатной температуре, разрушается в среде брома
при 300 °С, и йода при 1000 °С.
С Mo, W, Nb и Ti тантал образует непрерывный ряд твердых
растворов. Сплавы тантала имеют повышенные прочностные харак-
характеристики. Как конструкционный материал тантал находит приме-
применение в химическом машиностроении. Из него изготавливают тепло-
обменную аппаратуру для получения брома из смеси хлора и брома,
для дистилляции соляной и азотной кислот из неочищенного сырья,
при получении бромида этилена и хлористого бензола, при регене-
регенерации серной кислоты. Из тантала изготавливают нагреватели, рабо-
работающие в особо агрессивных средах, например, в смеси хромовой и
серной кислот, при дистилляции пероксида водорода. В ряде случа-
случаев тантал используют для плакировки аппаратуры из углеродистой
стали.
Методические рекомендации к главе 7
После изучения материала, изложенного в главе 7, студенты
должны знать:
• коррозионные характеристики основных металлов;
• основные принципы легирования сплавов.
Студенты должны уметь выбрать конструкционный материал
для оборудования, работающего в конкретных технологических сре-
средах.
7.2. Конструкционные материалы на основе цветных металлов 223
Вопросы для самопроверки
1. Охарактеризуйте электрохимические свойства железа.
2. Что такое ржавчина? Обладает ли она защитными свойствами?
3. Какие сплавы называются сталями?
4. Охарактеризуйте коррозионные свойства железа и низколеги-
низколегированных сталей в минеральных и органических средах.
5. Добавки каких элементов повышают коррозионные свойства
сталей?
6. Что называется легированием и с какой целью его проводят?
7. Как влияет хром на коррозионные свойства сплавов?
8. Охарактеризуйте электрохимические и коррозионные свойства
алюминия. Какие сплавы алюминия вам известны? Укажите
области их применения.
9. Охарактеризуйте основные свойства магния. В каком виде ис-
используется магний как конструкционный материал?
10. Перечислите электрохимические и коррозионный свойства ме-
меди. Что такое латуни и бронзы? Каков их состав, свойства,
области применения?
11. Дайте характеристику никелю как конструкционному матери-
материалу. Укажите основные сплавы на основе никеля и области их
применения
12. Что представляет из себя олово? Какое явление называют оло-
оловянной чумой? На чем основано применение олова в пищевой
промышленности?
13. Какие сплавы на основе олова вам известны? Перечислите их,
укажите состав и области применения.
14. Дайте характеристику свинцу как конструкционному материа-
материалу. Как связана коррозионная стойкость свинца с растворимо-
растворимостью его солей и гидроксида?
15. Приведите электрохимическую и коррозионную характеристи-
характеристики цинка и кадмия. Укажите основные области применения.
Проведите сравнительную оценку возможности применения
двух металлов.
16. Охарактеризуйте основные свойства титана. Укажите области
его применения.
17. Перечислите электрохимические и коррозионные свойства тан-
тантала. В каких областях он находит применение как конструк-
конструкционный материал?
224 Коррозионная характеристика металлов и сплавов Гл. 7
Задания для самостоятельных и контрольных работ.
1. Коррозионные характеристики железа и углеродистых сталей.
2. Современные коррозионно-устойчивые стали.
3. Коррозионные характеристики определенных представителей
цветных металлов и сплавов.
ГЛАВА 8
НЕМЕТАЛЛИЧЕСКИЕ МАТЕРИАЛЫ
И ЗАЩИТНЫЕ ПОКРЫТИЯ
Наряду с металлами и сплавами в химической промышленности
широко применяются неметаллические конструкционные материа-
материалы. В высокоагрессивных средах, которые встречаются в природных
и промышленных условиях, оборудование, даже выполненное из ле-
легированных сплавов, имеет ограниченный срок эксплуатации.
Дополнительным резервом для организации противокоррозион-
противокоррозионной защиты являются неметаллические материалы. Из них могут
быть изготовлены отдельные аппараты или детали к ним, как напри-
например, из стекла, ситаллов (рис. 8.2), винипласта, фаолита (рис. 7.14),
графита (рис. 8.9).
В другом варианте неметаллические материалы используют как
футеровки, обкладки и другие защитные покрытия для изоляции
металлического корпуса от контакта с активной средой. Часто такие
покрытия бывают многослойными (рис. 8.1, 8.3).
Все это требует знания свойств неметаллических коррозионно-
стойких материалов и техники использования их при организации
противокоррозионной защиты.
Неметаллические материалы обладают многообразием свойств:
широким диапазонам величин по теплопроводности, невысокой плот-
плотностью, хорошей адгезией с металлами, стойкостью в агрессивных
средах. Но большинство неметаллических материалов, особенно ор-
органического происхождения, устойчивы только до температуры 150—
200 °С, не выдерживают резких перепадов температур, плохо подда-
поддаются механической обработке.
По химическому составу неметаллические материалы подразде-
подразделяются на материалы неорганического и органического происхожде-
происхождения.
К неорганическим материалам относятся горные породы, сили-
силикатные материалы, керамика и т.д. К органическим материалам отно-
относятся полимерные материалы, материалы на основе каучука, графит
и его производные и т.д.
С точки зрения конструктивных особенностей неметаллические
покрытия разделяются на вкладыши и монолитные толстослойные
покрытия. Принципиальным различием между ними является то,
что вкладыши могут быть самостоятельным конструкционным эле-
элементом, работающим по принципу сосуд в сосуде. В отличие от
вкладышей (облицовки) работоспособность монолитных покрытий
226 Неметаллические материалы и защитные покрытия Гл. 8
и их механическая устойчивость может быть обеспечена только при
условии адгезии с подложкой. Облицовки и покрытия различают-
различаются по толщине. Для вкладышей (облицовок) характерна толщина до
нескольких десятков миллиметров, а толщина монолитных полимер-
полимерных покрытий обычно не превышает 1,5-2 мм.
Для всех покрытий в высокоагрессивных средах важную роль
играет изолирующий механизм, т.е. покрытие должно предотвра-
предотвратить непосредственный контакт среды и подложки. Эту проблему
можно решить двумя путями: увеличить толщину мономерного по-
покрытия в рамках одного материала или использовать многослойные
различные композиционные материалы типа «сендвичного» покры-
покрытия. Увеличение толщины монопокрытия приводит, как правило, к
возникновению внутренних напряжений и нарушению их механиче-
механической устойчивости.
Наиболее часто в химической и нефтеперерабатывающей про-
промышленности используют для противокоррозионной защиты ком-
композиции многослойных покрытий из различных материалов.
В покрытиях, как правило, выделяют три зоны с различным функ-
функциональным назначением:
• грунт, т.е. слой, прилегающий к защищаемой поверхности и
определяющий стабильность связи с подложкой:
• основное покрытие (средняя часть), которое определяет изоли-
изолирующие и механические свойства покрытия;
• верхний слой, непосредственно контактирующий с агрессив-
агрессивной средой. Этот слой используют иногда для придания допол-
дополнительных специфических свойств покрытия, таких как абра-
зивостойкость, смачиваемость и т.д. Далее мы рассмотрим при-
примеры таких решений.
8.1. Неорганические конструкционные материалы
Химическая стойкость материалов неорганического происхожде-
происхождения определяется химическим и минералогическим составом, пори-
пористостью, типом структуры. К кислотостойким материалам относятся
те, в которых преобладают нерастворимые или труднорастворимые
кислотные оксиды — кремнезем, низкоосновные силикаты и алю-
алюмосиликаты. Гидратированные алюмосиликаты типа каолина не об-
обладают кислотостойкостью
Материалы, содержащие основные оксиды, обладают стойкостью
в щелочах, но разрушаются при действии минеральных кислот. К
ним относятся, например, известняки, магнезиты и строительные
цементы.
8.1. Неорганические конструкционные материалы 227
Большое значение имеет и минералогический состав материала.
Так, природные горные породы, являющиеся во многих случаях по-
полиминералами, вследствие различия коэффициентов термического
расширения отдельных составляющих, склонны к растрескиванию
при перепаде температур. При кристаллической структуре материа-
материала его стойкость выше, чем при аморфной.
8.1.1. Природные силикатные материалы
К природным кислотостойким материалам относятся граниты,
бештауниты, андезиты и асбест.
Граниты состоят из 70-75 % SiO2, 13-15 % А12О3, 7-10 % окси-
оксидов магния, кальция и натрия. Термостойкость до 250 °С.
Бештауниты содержат 60-70% SiC>2. Они тверды, тугоплавки,
термостойки до 800 °С и кислотостойки.
Андезиты E9-62 % SiO2) кислотостойки, хорошо поддаются ме-
механической обработке, но имеют невысокую прочность.
Асбест представляет собой дигидрат силиката магния 3MgOx
x2SiO2-2H2O. Он огнестоек и кислотостоек.
Широкое применение горных пород ограничивается трудностью
их обработки и громоздкостью сооружений. Однако в ряде случаев
они являются незаменимыми материалами.
Из гранита изготавливают корпуса электрофильтров, поглоти-
поглотительные башни в производстве азотной и соляной кислот, аппараты
бромного и йодного производства.
Бештауниты используют как футеровочный материал для аппа-
аппаратов, применяемых при получении минеральных кислот.
Андезиты так же применяются для футеровки и как наполнитель
в кислотостойких цементах и бетонах.
Асбест используется как вспомогательный материал в вид нитей,
фильтрующей ткани, наполнителя, для изоляции корпусов аппара-
аппаратов.
8.1.2. Искусственные силикатные материалы
Каменное литье представляет собой плавленные материалы, име-
имеющие кристаллическое строение. Их получают путем плавления
горных пород с добавками при 1400-1450 °С и последующей тер-
термической обработкой отлитых изделий. Сырьем служат базальты,
диабазы, шихта из осадочных пород, металлургические шлаки. На-
Например, плавленный диабаз имеет состав: 47-48% SiO2, 15-16%
А12О3, 15-16 % FeO + Fe2O3, 11-12 % CaO, 6-7 % MgO, 2-4 % K2O.
228 Неметаллические материалы и защитные покрытия Гл. 8
Каменное литье характеризуется высокой химической стойко-
стойкостью по отношению к любым реагентам, кроме плавиковой кис-
кислоты. Оно имеет высокую механическую прочность (а при сжатии
200-^400 МПа), большое сопротивление истиранию. Применять их
можно при температурах не выше 150 °С.
На химических заводах широко применяют изделия из каменно-
каменного литья для изготовления аппаратов и как футеровочный материал.
Диабазовыми плитками футеруют аппараты емкостью 6-8 м3 для
хранения и перекачки минеральных кислот, сатураторы для получе-
получения аммиачной селитры и сульфата аммония путем нейтрализации
минеральных кислот аммиаком. Из литья изготавливают шаровые
мельницы: внутри мельницы футеруют плитками из базальта и за-
заполняют шарами из каменного литья.
Из плавких горных пород получают фасонные изделия, трубы,
желоба, абсорбционные колонны. Плитки используют при строи-
строительстве зданий химических заводов.
Рассмотрим пример противокоррозионной защиты гидратора
ацетилена — основного аппарата в производстве ацетальдегида
по методу Кучерова (рис. 8.1). В основе лежит реакция:
сн ^ сн + 2о
95-98° С
Катализатор получают при взаимодействии ртути с сернокис-
сернокислым железом в присутствии серной кислоты:
Hg + Fe2(SO4K >HgSO4 + 2FeSO4
H2SO4
Особенностью этого процесса является то, что катализатор
получают в том же аппарате, где протекает основная реакция.
Таким образом, коррозионная среда содержит серную и азотную
кислоты, металлическую ртуть и разбавленную уксусную кис-
кислоту в смеси с другими органическими соединениями. Гидратор
ацетилена является основным аппаратом. Он представляет со-
собой цилиндр высотой 20 м и диаметром ~ 1 м, собранный из
пяти стальных царг. Изготовлен из стали 10Х17Н13М2Т. Изну-
Изнутри гидратор защищен комбинированным покрытием. Листовой
полиизобутилен наклеен на стальную поверхность при помощи
термопренового клея в два слоя с перекрытием швов. Далее поло-
положено 2 ряда кислотоупорной диабазовой плитки на кислотостой-
кислотостойкой замазке. Листовой полиизобутилен создает непроницаемый
подслой и предохраняет футеровку от повреждения при темпера-
температурных колебаниях и механических сотрясений. В узкие штуце-
штуцера вставлены на диабазовой замазке вкладыши, выполненные из
диабаза, ситалла или фарфора. Такая комбинированная защита
позволила увеличить срок службы аппарата в 1,5 раза — 3 года
вместо нормативных 2-х лет (рис. 8.1).
Неорганические конструкционные материалы
229
УзелЗ
Узел 2
Узел 1
УзелЗ
3 4
Узлы 1 и 2
Рис. 8.1. Схема антикоррозионной защиты гидратора ацетилена:
1 — углеродистая сталь; 2 — клеевая прослойка; 3 — полиизобутилен ПСГ или
резина на основе НК; 4 — кислотоупорная замазка; 5 — кислотоупорная плитка;
6 — патрубок из плавленого диабаза, фарфора или ситалла
Силикатное стекло обладает высокой прозрачностью, хорошей
механической прочностью, стойкостью к воздействию химических
реагентов, низкой теплопроводностью. Стекольная промышленность
выпускает много сортов стекол, отличающихся свойствами и целе-
целевым назначением. Основу силикатных стекол составляет диоксид
кремния SiC>2 F5-75 %), в качестве добавок используют оксиды ще-
щелочных и щелочноземельных металлов (Na2O, K2O, CaO, MgO) и
кислотные оксиды.
Силикатное стекло широко применяется в качестве конструкци-
230 Неметаллические материалы и защитные покрытия Гл. 8
онного и футеровочного материала. Их него изготавливают холо-
холодильники со змеевиками, ректификационные колонны, отдельные
элементы аппаратуры.
Термостойкое стекло готовят из малощелочной шихты, имею-
имеющей состав: 63,3 % SiO2; 5,5 % А12О3; 13,0 % СаО; 4,0 % MgO; 2,0 %
Na2O; 2,0% F. Такое стекло имеет термоустойчивость до 1000—
1100°С, выдерживает давление до 4,5-5,0МПа. Его прочность на
изгиб 600-800кг/см2.
Алюмомагнезиалъное стекло, используемое для изготовления стой-
стойких фильтрующих тканей, имеет состав: 71 % SiO2; 3 % А12Оз; 3,5 %
СаО; 2,5 % MgO; 1,5 % К2О; 13-15 % Na2O. На алюмомагнезиальное
стекло при 80-100°С слабое действие оказывает соляная кислота,
более сильное — серная. Фосфорная кислота при комнатной темпе-
температуре и концентрации до 60 % слабо действует на стекло, с повы-
повышением температуры ее разрушающее действие усиливается. Ткани
из волокон, полученных из алюмомагнезиального стекла, применя-
применяются в фильтр-прессах и барабанных фильтрах, в том числе и для
фильтрации щелочей.
Кварцевое стекло получают путем плавления наиболее чистых
природных разновидностей кристаллического кварца, горного хру-
хрусталя, жильного кварца или кварцевого песка с содержанием 98-99 %
SiO2.
Непрозрачное кварцевое стекло имеет состав: 99,95% SiO2; 0,01%
А12О3; 0,004% Fe2O3; 0,028% СаО; 0,012% MgO; 0,041 % Na2O.
Плавку кварцевых песков производят в электрических печах. Гра-
Графитовый стержень погружают в массу песка и нагревают электри-
электрическим током до 1700-1800 °С. Прилегающие к стержню слои песка
постепенно расплавляются. Полученный кварцевый слиток подвер-
подвергают дальнейшей обработке.
Кварцевое стекло устойчиво по отношению ко всем минеральным
и органическим кислотам любых концентраций при высоких темпе-
температурах. Исключение составляют плавиковая кислота при комнатной
температуре и фосфорная кислота при температуре выше 250 °С.
Растворяют кварцевое стекло и концентрированные растворы щело-
щелочей, особенно при нагревании. Хлор, бром и йод не действуют на
кварцевое стекло даже при температурах выше 500 °С. Из техни-
технического кварцевого стекла готовят автоклавы, реакторы, абсорберы,
реторты, трубы и т.д.
Изделия из кварцевого стекла выдерживают длительное время
температуру 1100-1200 °С, и кратковременно —1300-1400 °С. Квар-
Кварцевое стекло имеет низкую плотность B100 кг/м3), высокие меха-
механические свойства, пропускает ультрафиолетовые и инфракрасные
8.1. Неорганические конструкционные материалы 231
лучи, газонепроницаемо до 1300 °С. Аппараты из кварцевого стекла
используют, например, при получении реактивной соляной кислоты.
Ситаллами называются стеклокристаллические материалы, по-
полученные при определенных условиях кристаллизации стекол. Если
в качестве сырья используется стекло с добавкой минерализаторов,
то получают технические ситаллы, а если используют металлур-
металлургические шлаки то получают шлакоситаллы. Технические ситаллы
тверды, устойчивы к действию минеральных (кроме плавиковой) и
органических кислот и щелочей, в 5 раз прочнее обычного стекла,
имеют термостойкость до 1000 °С. Их них изготавливают реакцион-
реакционные аппараты малой емкости, различные детали химической аппа-
аппаратуры, такие, как горелки, чехлы для термопар, узлы ректифика-
ректификационных колонн. Трубы из ситаллов применяют в теплообменниках
при больших перепадах температур. Подшипники, изготовленные из
ситаллов, хорошо работают без смазки при температурах до 540 °С.
Ситаллы по химической стойкости превосходят силикатные эма-
эмали и стекла; они близки к каменному литью из плавленного диабаза
или базальта. Например, ситаллы марок АС-05, С-0,23; 224-18; Т-В6;
ТС-81 обладают достаточно высокой стойкостью в слабых и концен-
концентрированных растворах серной кислоты. Из технических ситаллов
выпускаю трубы с буртами и гладкими концами, а также фасонные
части к ним (рис. 8.2). Срок службы таких труб определяется прак-
Рис. 8.2. Способы соединения ситалловых труб:
а — без буртов; б — с буртами; 1 — трубы; 2 — накидные фланцы или хомуты; 3 —
муфта из химически стойкого материала; 4 — резиновые кольца; 5 — прокладки из
химически стойкого материала
тически долговечностью материалов прокладок. Их используют для
транспортировки H2SO4 при температурах до 80 °С. Срок службы
оценивают в 5-6 лет.
Шлакоситаллы прочны, устойчивы к действию минеральных (кро-
(кроме плавиковой) и органических кислот, но имеют пониженную тер-
232 Неметаллические материалы и защитные покрытия Гл. 8
мостойкость — 200-250 °С. Они предназначены для строительных
конструкций, и в качестве облицовочного материала используют-
используются при изготовлении деталей конвейеров, грохотов, элеваторов. Си-
таллы показали устойчивость в условиях воздействия агрессивных
газов (хлор, хлористый водород, хлориды и бромиды некоторых ме-
металлов) при высоких температурах.
8.1.3. Керамические материалы
Керамические и огнеупорные изделия готовят обжигом до спека-
спекания силикатных материалов и веществ, понижающих температуру
плавления шихты. Основным сырьем служат глины, содержащие
более 20 % AI2O3. К рассматриваемым материалам относятся кисло-
кислотоупорная эмаль, каменно-керамические изделия, фарфор.
Кислотоупорная эмаль представляет собой стеклообразную мас-
массу, получаемую сплавлением горных пород (кварцевый песок, глина,
мел) с плавнями (бура, сода, поташ) при высоких температурах —
1250-1300 °С. Кроме того в состав эмалей входят оксиды NiO, CaO,
ТЮ2, ZrO2, S11O2, СГ2О3 и др. для придание ей особых свойств.
В минеральных и органических кислотах устойчивость кислото-
кислотоупорных эмалей высока. Обычные кислотоупорные эмали устойчи-
устойчивы к горячим щелочным растворам концентрации до 5 %. Специаль-
Специальные кислотоупорные эмали могут эксплуатироваться как в кислотах,
так и в кипящих растворах щелочей концентрации до 10 % и углекис-
углекислых щелочей концентрации до 40 %. Изделия с эмалевыми покры-
покрытиями работают в жидких средах до 200 °С, а в газообразных — до
600-700 °С. Для специальных эмалей эти показатели соответственно
равны 250 °С и 1000 °С. Морозостойкость стальной эмалированной
аппаратуры достигает —70 °С, а чугунной — не менее —30 °С.
Основной причиной выхода из строя эмалированных аппаратов
является различие в коэффициентах термического расширения ме-
металла и эмали, что приводит к большим внутренним напряжениям и
растрескиванию. Для эмалирования применяют стали, содержащие
не более 0,1% С.
Эмалированная аппаратура применяется в химической промыш-
промышленности в процессах хлорирования и нитрации, при производстве
взрывчатых веществ и синтетического каучука, разнообразных орга-
органических, фармацевтических и пищевых продуктов. Кислотоупор-
Кислотоупорной эмалью покрывают резервуары, реакторы, вакуум-аппараты, ав-
автоклавы, дистилляционные и ректификационные колонны, теплооб-
теплообменники и т.д.
Эмаль типа Т5 эксплуатируют в растворах серной кислоты до
8.1. Неорганические конструкционные материалы 233
температур их кипения. Максимальная скорость разрушения наблю-
наблюдается в 5 %-й H2SO4 (табл. 8.1).
Стекловидные покрытия получают путем совместного нагрева-
нагревания металла и стекла до температуры размягчения стекла. Такой ме-
метод защиты называют остеклованием, а покрытия — стеклоэмалевы-
ми. Они обладают более высокими эксплуатационными показателя-
показателями, чем эмалевые. Скорость разрушения стеклоэмалевого покрытия
в 5 %-й H2SO4 составляет 0,00021 мм/год. Трубы со стеклоэмалевым
покрытием обладают высокой механической прочностью, устойчи-
устойчивы к ударным, вибрационным и изгибающим воздействиям. Такие
трубы можно сваривать в стык.
Таблица 8.1
Химическая стойкость эмалевых покрытий в H2SO4 при температуре
кипения
Концентрация H2SO4, масс.%
Скорость коррозии, мм/год
5
0,01968
20
0,00796
40
0,00394
Применение стеклопластиковых труб для транспортировки неф-
нефти является весьма перспективным с учетом их 100 %-й коррозион-
коррозионной стойкости. Начиная с 1993 г. стеклопластиковыми трубами им-
импортного производства были оснащены участки нефтегазосбора се-
северных месторождений. За время эксплуатации стеклопластиковых
труб коррозионных осложнений не возникло. Широкое внедрение
стеклопластиковых труб сдерживает их стоимость. Импортные тру-
трубы примерно в 4-5 раз (в расчете на 1 км) дороже стальных труб. Во
второй половине 90-х годов производство стеклопластиковых труб
налажено в России. При этом отечественная продукция дешевле.
Разрыв в стоимости со стальными трубами составляет примерно 2-
2,5 раза.
Керамические кислотоупорные материалы подразделяют на
плотные и пористые.
Плотная кислотоупорная керамика характеризуется малым водо-
поглощением, однородностью, мелкозернистостью. Пористая кера-
керамика отличается пористостью и высоким влагопоглощением. Состав
керамических изделий представлен в табл. 8.2.
Керамические изделия должны обладать большой твердостью,
чтобы выдерживать механические нагрузки, максимальной плотно-
плотностью, низкой пористостью, хорошей термической стойкостью, низ-
низкой теплопроводностью.
Изделия из плотной керамики обладают высокой кислотостойко-
стью в минеральных кислотах за исключением плавиковой и фос-
234
Неметаллические материалы и защитные покрытия
Гл. 8
Таблица 8.2
Состав керамических изделий
Изделие
Кислото-
Кислотоупорные
плитки
Кислото-
Кислотоупорный
кирпич
Аппаратур-
Аппаратурная керамика
Фарфор
Химический состав, масс.%
SiO2
51-68
55-70
50-67
60-67
AI2O3
28-34
15-25
23-34
20-22
Fe2O3
1-5
1-5
1-1,4
0,3-0,4
CaO
1-2,5
1-2,5
1-1,4
0,4-0,5
K20 + Na20
0,5-5
0,5-2
2-6
4-4,5
Порис-
Пористость, %
2-4
4-8
<1
<0,l
форной кислот, а некоторые виды керамики — в растворах щелочей
низких и средних концентраций. Недостатком керамических изде-
изделий является их хрупкость и чувствительность к резким перепадам
температур. Поэтому при эксплуатации таких изделий изменять тем-
температуру нужно постепенно, не более 2-3 °С в минуту.
Керамические детали и аппараты не переносят ударов, толчков,
изгибов и т.д. Из керамики изготавливают футеровочные плитки,
трубопроводы, детали реакторов, холодильников, абсорберов и т.д.
Рассмотрим в качестве примера антикоррозионную защиту
основного оборудования с использованием кислотоупорного кир-
кирпича и угольных блоков при получении экстракционной фосфор-
фосфорной кислоты сернокислотным способом. Процесс описывается
уравнением:
Ca5F(PO4K + 5H2SO4 = 5CaSO4 + ЗН3РО4 + HF
В результате основной и побочных реакций в газовую фазу
переходят SiF4 и HF, в растворе находятся серная и фосфорная
кислоты, а в осадке — сульфат кальция и неразложившаяся часть
минерала, которую называют фосфогипсом. Температура в экс-
экстракторах 70-75° С. Высокая агрессивность горячих растворов
кислот требует специальной антикоррозионной защиты оборудо-
оборудования.
Стальные корпуса экстракторов (рис. 8.3) футеруют по под-
подслою полиизобутилена кислотоупорным кирпичом, угольными и
графитовыми блоками. В процессе работы поверхность футеров-
футеровки покрывается тонким слоем гипса, который защищает ее от
истирания.
Футеровка брызгоуловителя, который подвергается механи-
механическому и коррозионному воздействию, осуществляется угольными
блоками по резиновому подслою на замазке арзамит-4 (рис. 8.4).
Брызгоуловитель после полуторагодичной эксплуатации в уело-
Неорганические конструкционные материалы
235
Рис. 8.3. Защита стенки экстрактора:
1 — корпус стальной; 2 — полиизобутилен
ПСГ F = 2,5 мм) в два слоя на клее 88-
Н; 3 — шпатлевка андезитовой замазкой
F=5 мм); 4 — кирпич кислотоупорный в
1/2 кирпича на андезитовой замазке; 5 —
угольные блоки 550x195x115 мм на замазке
арзамит-4
Рис. 8.4. Защита брыз-
гоуловителя:
1 — корпус стальной;
2 — резина 1751 F =
= 1,5 мм) в три слоя;
3 — блоки угольные
F = 60 мм) на замазке
арзамит-4
виях воздействия брызг кремнефтористоводородной и фосфор-
фосфорной кислот при 65 ° С находился в хорошем состоянии.
Фарфор представляет собой тонкокристаллический материал, не-
непроницаемый для воды и газов. Получают его при температуре обжи-
обжига 1300-1450 °С. Фарфор кислотостоек, не разрушается плавиковой
кислотой, тверд, износостоек, имеет высокие прочностные свойства
и термостойкость, выдерживает резкое колебание температур B0-
1000 °С), имеет низкую пористость. Аппаратура, изготовленная из
фарфора, выдерживает нагрев на открытом огне.
Фарфор применяют для изготовления аппаратов в фармацевтиче-
фармацевтической, пищевой, парфюмерной промышленности, т.е. в тех областях,
где требуется особая чистота выпускаемой продукции. В химиче-
химической промышленности из него изготавливают аппараты небольшой
емкости, вакуум-аппараты, фильтры, тигли, чаши и т.д. Его исполь-
используют также для футеровки металлических аппаратов и шаров для
шаровых мельниц.
Для изготовления огнеупоров и отдельных изделий использует-
используется пористая керамика. Огнеупорная керамика должна выдерживать
236 Неметаллические материалы и защитные покрытия Гл. 8
высокую температуру, не деформироваться и не подвергаться разру-
разрушению при резких сменах температуры.
Имеется несколько групп огнеупоров: динасовые (кислые), полу-
полукислые, шамотные, тальковые и др. Они отличаются химическим
составом и предназначаются для работы в определенных средах.
Основное применение огнеупоры находят в виде футеровочного и
строительного материала для аппаратов и печей, работающих при
высокой температуре.
Изделия из пористой керамики находят применение при изго-
изготовлении фильтровальных элементов и диафрагм для электролити-
электролитических ванн. Из пористой керамики готовят фильтрующие плитки,
поролитовые плитки, фильтры для кислородных установок. Их при-
применяют в каталитических процессах на конечных стадиях тонкой
очистки газов.
На фильтр-прессах используют пластины из пористой керамики
для фильтрации суспензий.
В электрохимической промышленности пористую керамику при-
применяют для изготовления диафрагм для электролизеров.
8.1.4. Вяжущие материалы
К минеральным вяжущим веществам относятся цементы. Они
содержат в своем составе тонкоизмельченный кислото- или щелоч-
ностойкий наполнитель. Для щелочных сред используют цементы,
в которых наполнителем служат основные оксиды — СаО и MgO, a
для кислых сред — цементы с наполнителем SiO2. Кислотостойкие
цементы готовят путем смешения тонкоизмельченного наполните-
наполнителя (кварцевого песка, гранита, базальта и т.д.) с водным раствором
силиката натрия. Такие цементы устойчивы к действию концентри-
концентрированных кислот (кроме HF и Н3РО4), менее стойки в воде и раз-
разрушаются в растворах щелочей и карбонатов щелочных металлов.
Они имеют высокую механическую прочность и хорошую адгезию
к металлам и другим материалам.
Цемент используют для футеровки металлической и другой аппа-
аппаратуры, для скрепления плиток, кирпичей, блоков и создания проч-
прочных непроницаемых швов.
Бетон представляет из себя твердое камневидное тело. Его по-
получают из бетонной смеси, которую готовят из цемента, воды и на-
наполнителей — гравия, щебня, кварцевого песка и т.д. Твердая фаза
бетона состоит из веществ, образующихся в результате взаимодей-
взаимодействия частичек цемента с водой, и из зерен непрореагировавшего
цемента.
8.1. Неорганические конструкционные материалы 237
Основным продуктом гидратации силикатов кальция, составляю-
составляющих основу цементного клинкера, являются гидросиликаты кальция,
подобные тобермориту, которые с течением времени изменяют свой
состав в сторону увеличения соотношения СаО к SiC>2. Твердая фаза
имеет очень развитую поверхность (порядка 200 м2/г). Удлиненная
форма кристаллов и беспорядочное расположение их в пространстве
приводит к образованию пор и зазоров между ними. Наличие непро-
реагировавших клинкерных составляющих еще больше усугубляет
неоднородность структуры.
Вода является составной частью бетона. По форме связи ее с
твердым скелетом различают химическую, физико-химическую и
физико-механическую связанную воду. Наиболее прочной формой
связи является химическая вода. Ее удаление из бетона возможно
лишь при температуре выше 100 °С, т.е. при дегидратации цементно-
цементного камня. Физико-химической связью обладает адсорбционная влага
в порах и капиллярах, радиус которых менее 10~7см. Вода в ад-
адсорбционных слоях отличается от свободной воды по химическим
и термодинамическим свойствам. Диэлектрическая постоянная ад-
адсорбционной влаги в 40 раз меньше, чем у свободной воды, а тем-
температура замерзания на несколько десятков градусов ниже. Физико-
механический тип связи воды в бетоне является наименее прочным.
Она может быть полностью удалена из бетона при его высыхании.
Вода в порах и капиллярах бетона насыщена ионами Са+ и ОН~,
поэтому рН ее равен 12-12,7. Гидроксид кальция переходит в раствор
вследствие протекания реакций гидратации клинкерных материалов.
Гидроксид кальция имеет растворимость 1,3 г/л и является одной
из наиболее растворимых составных частей бетона. При эксплуата-
эксплуатации его концентрация может снижаться, что оказывает существен-
существенное влияние как на устойчивость самого бетона, так и на стальную
арматуру в случае применения железобетона.
Бетоны имеют невысокую прочность при растяжении и изгибе.
Для устранения этого недостатка бетон армируют стальной армату-
арматурой (стержни или проволока). Такой материал называю железобето-
железобетоном. Состояние стальной арматуры во многом определяет области
применения и срок службы железобетонных конструкций. В плот-
плотном бетоне при толщине слоя 20-35 мм арматура надежно защище-
защищена, так как окружена щелочной средой с рН = 11,5-12,5. В этих
условиях сталь пассивируется и находится в состоянии повышенной
коррозионной устойчивости. При значениях рН ниже 11,5 действие
пассивации прекращается и начинается коррозия стали. Снижение
щелочности бетона происходит в результате внешнего воздействия
агрессивных сред. Поэтому особое значение приобретает разработка
238
Неметаллические материалы и защитные покрытия
Гл. 8
бетонов, обладающих повышенной химической устойчивостью.
Кислотоупорный бетон готовят из силиката натрия (жидкое стек-
стекло), ускорителя твердения Na2SiF6 и природных кислотоупорных
наполнителей типа андезита, диабаза, маршаллита, кварца, отходов
кислотоупорной керамики. Такой бетон обладает высокой механи-
механической прочностью и химической устойчивостью. Он стоек во всех
кислых средах за исключением HF и Н3РО4. Его используют для со-
сооружения фундаментов, изготовления крупногабаритных изделий —
башен, резервуаров, отстойников и др.
200 мм 120 мм
Рис. 8.5. Антикоррозионная защита перекрытия грану-
грануляционной башни:
I — кислотоупорные керамические плитки C0 мм); 2 —
битуминоль; 3 — кислотостойкий асфальт D0 мм); 4 —
листовой полиизобутилен; 5 — холодная битумная грун-
грунтовка; б — цементная стяжка; 7 — шлакобетон; 8 — шлак;
9 — железобетонная плита; 10 — слой листового асбеста;
II — нержавеющая сталь из 08Х18Н10Т B мм); 12 —
кислотоупорный кирпич
Рассмотрим в качестве примера антикоррозионную защиту гра-
грануляционной башни в производстве аммиачной селитры (рис. 8.5).
Аммиачную селитру получают по реакции:
NH3 + HNO2 = NH4NO3 + О2.
Сырьем служит газообразный NH3 и 50-55 %-я HNO3. Произ-
Производство состоит из стадий: нейтрализация азотной кислоты ам-
аммиаком, упаривание растворов до плава аммиачной селитры и
8.1. Неорганические конструкционные материалы 239
грануляция аммиачной селитры.
В качестве основного конструкционного материала приме-
применяется сталь 08Х18Н10Т. Кристаллизацию плава производят в
грануляционных башнях путем разбрызгивания капель плава и
охлаждения их потоком воздуха. Строительные конструкции под-
подвергаются воздействию растворов HNO3, плава и пыли NH4NO3,
оксидов азота. Температура при работе достигает 80 °С в верхней
части башни. Пыль и гранулы NH4NO3, попадающие на кон-
конструкции, образуют пересыщенные растворы, проникающие в
поры строительного материала. Водные растворы NH4NO3 име-
имеют рН = 4ч-5 и в бетоне взаимодействуют с гидросиликатами
кальция. Вследствие этого происходит разрушение составляю-
составляющих цементного камня и бетон быстро теряет прочность. Кри-
Кристаллизация аммиачной селитры в порах сопровождается увели-
увеличением объема и вызывает дополнительные напряжения в мате-
материале и его разрушение. С целью предохранения грануляционной
башни используют бетон на низкоалюминатных цементах и за-
заполнителях из твердых пород. Дополнительно бетон армируется
стальной сеткой. На рис. 8.5 представлен пример защиты пере-
перекрытия ствола грануляционной башни. Основу перекрытия со-
составляет железобетонная плита (9). Снизу перекрытие защищает
от действия пыли аммиачной селитры, влаги и колебания тем-
температур стальное перекрытие (толщина 2 мм) из 08Х18Н10Т A1)
и асбестовая прокладка A0). В верхней части перекрытия слой
шлака (8) покрыт шлакобетоном G), затем по цементной стяжке
F) положена битумная грунтовка E), листовой полиизобутилен
D% асфальт C) и керамическая плитка G).
Бетоны, получаемые из обычного сырья с добавками полимерных
материалов, носят название полимербетонов. В качестве связующего
могут быть использовадны фурановые, эпоксидные, полиэфирные,
акриловые и другие смолы. Такие бетоны обладают высокой плотно-
плотностью, кислото- и щелочестойкостью, отличными физико-механичес-
физико-механическими свойствами. Их применяют для покрытия полов, армирования
конструкций, строительства дорог.
В химической промышленности много конструкций работает при
высоких температурах. Для этих условий разработан жаростойкий
бетон, обладающий высокой термо- и жаростойкостью. Он отли-
отличается составом наполнителя (хромистый железняк, шамот и др.).
Температура начала деформации под нагрузкой — 1000-1100°С.
Такой бетон можно применять в виде отдельных блоков и изготав-
изготавливать печи без металлического кожуха. Он нашел применение при
изготовлении колчеданных печей в производстве серной кислоты.
240 Неметаллические материалы и защитные покрытия Гл. 8
8.2. Коррозионностойкие неметаллические материалы
на основе органических соединений
На базе органических соединений основано производство боль-
большого числа коррозионностойких материалов. Учитывая разнообра-
разнообразие исходных соединений, множество вариантов их комбинирова-
комбинирования, можно констатировать, что число таких материалов велико и в
будущем будет увеличиваться. Поэтому остановимся на основных
классах этих соединений и их представителях.
Наиболее широко в химическом машиностроении используют-
используются пластические массы, материалы на основе каучуков и графито-
угольные материалы.
8.2.1. Полимерные материалы
Полимерные материалы изготавливают из высокомолекулярных
органических соединений. Исходным сырьем, как правило, служат
низкомолекулярные соединения.
В табл. 8.3 приведены исходные соединения и повторяющиеся
звенья некоторых высокомолекулярных соединений, имеющих прак-
практическое применение.
Макромолекулы могут иметь линейную, разветвленную или про-
пространственную структуру. Высокомолекулярные соединения, кото-
которые при нагревании приобретают пластичность, а при охлаждении
вновь возвращаются в твердое состояние, называются термопла-
термопластичными.
Полимеры, которые при нагревании переходят в твердое состо-
состояние, и при снижении температуры не восстанавливают первона-
первоначальных свойств, называются термореактивными. Из них нельзя
получить пленки, волокна.
Наиболее широко используемыми в противокоррозионной тех-
технике термопластами является полиэтилен, полипропилен, фторопла-
фторопласты, поливинилхлорид и полиизобутилен.
Основная часть химически стойких покрытий на основе реак-
топластов содержат в качестве полимерной основы эпоксидные,
фенолформальдегидные, эпоксиноволачные, полиэфирные и винил-
эфирные смолы, а также как низкомолекулярные, так и высокомоле-
высокомолекулярные карбо- и гетероцепные каучуки: полибутадиеновые, хлор-
преновые и др.
Термопластичные и термореактивные полимерные материалы,
во-первых, имеют принципиальные различия в закономерностях их
взаимодействия с агрессивными средами, а, во-вторых, эти матери-
8.2.
Коррозионностойкие неметаллические материалы
241
Таблица 8.3
Исходные соединения и повторяющиеся звенья некоторых
высокомолекулярных соединений
Наименование полимера
Полиэтилен
Полипропилен
Полиизобутилен
Поливинилхлорид
Полистирол
Фторопласт-3
(трифторхлорэтилен)
Фторопласт-4
(тетрафторэтилен)
Исходный мономер
сн2 = сн2
СНз - СН = СН2
СНЗЧ
;с = сн2
СН37
СН2 = СНС1
СН2 = СН
с6н5
CF2 = CFC1
CF2 = CF2
Повторяющееся звено
-СН2 -СН2-
-СН-СН2-
СН3
СН3
-с-сн2-
1
СН3
-СН2-СН-
С1
-СН2-СН-
с6н5
F F
-с-с-
F C1
-CF2-CF2-
алы наносят на защищаемый металл по различной технологии.
Для материалов на основе гидрофобных термопластичных по-
полимеров характерны низкая растворимость и непроницаемость для
нелетучих электролитов. Однако это свойство может теряться при
попадании в раствор следов органических растворителей. Для ле-
летучих электролитов время пробоя таких покрытий весьма незначи-
незначительно.
Особенностью реактопластов является то, что все полимеры этой
группы в той или иной степени проницаемы для воды. Для основ-
основной массы электролитов перенос воды в полимеры осуществляется
с большей скоростью, чем других составных частей раствора. На
практике это приводит к набуханию полимеров. Однако реактопла-
сты как изолирующий материал имеют ряд преимуществ. Для них
характерно наличие ступенчатого профиля распределения кислот по
координате диффузии, что затрудняет проскок кислоты к основно-
основному материалу. Это позволяет обеспечить работу в режиме полной
изоляции от действия агрессивных кислот. При этом такой режим
изоляции может быть обеспечен как для нелетучих, так и для лету-
летучих кислот. Материалы на основе реактопластов позволяют получать
242 Неметаллические материалы и защитные покрытия Гл. 8
монолитные покрытия, не имеющие стыков, что имеет особое зна-
значение для работы в высокоагрессивных средах.
Однако, проницаемость большинства реактопластов все же явля-
является достаточно высокой в агрессивных средах. Для решения этих
противоречий в настоящее время принята и осуществляется концеп-
концепция создания многослойных полимерных конструкций. Например,
создана система антикоррозионных покрытий «ВИКОР», которые
представляют собой толстослойные полимерные покрытия A-2 мм)
и предназначены для защиты внутренней поверхности технологиче-
технологического оборудования, работающего в условиях воздействия химиче-
химически агрессивных сред.
Высокополимерные материалы могут применяться в виде кон-
конструкционных материалов, футеровок, лаков, паст.
Свойства полимеров зависят от химического состава, молекуляр-
молекулярной массы, формы макромолекул, типа связи между молекулами,
структуры, дисперсности.
8.2.2. Простые полимеризационные пластические массы
Пластические массы получают из полимеров, которые при на-
нагревании и давлении приобретают и устойчиво сохраняют форму в
результате охлаждения и отверждения.
Свойства простых пластмасс представлены в таблице 8.4.
Полиэтилен—термопластичный полимер. Исходный мономер —
этилен С2Н4 — получают из природных газов. Получение полиме-
полимера может быть осуществлено по методу высокого или низкого дав-
давления. Полиэтилен высокого давления имеет молекулярную массу
1800-2500, полиэтилен низкого давления — 2500-3500. Последний
обладает более высокими прочностными показателями и химиче-
химической стойкостью. При обычной температуре полиэтилен представ-
представляет собой твердый упругий материал, сохраняющий свои свойства
до 60-70 °С. При температурах 110-120 °С он приобретает высокую
эластичность.
На холоде полиэтилен не растворяется ни в одном растворителе,
при 70-80°С он растворим во многих углеводородах. Полиэтилен
устойчив к воздействию кислот, щелочей и растворов солей, но легко
разрушается при соприкосновении с окислительными средами. По-
Полиэтилен может быть использован как самостоятельный конструкци-
конструкционный материал. Из него готовят трубы, детали насосов, различную
арматуру. Методом вакуум-формирования возможно изготовление
крупногабаритной аппаратуры.
Полиэтилен можно сваривать непосредственным соединением
8.2.
Коррозионностойкие неметаллические материалы
243
I
о
>*_'
2
о
4,
О
г
о
s о
ё
о
II
о
2
о
и
О
Он
с
I
Он
с
I 3
§1
16
С с5
Б i
tr4
S о
Он О
^
Si
it
о
о
е2
I
I
IP
244 Неметаллические материалы и защитные покрытия Гл. 8
нагретых листов без применения присадочного материала. Разрабо-
Разработаны способы точечной сварки и газопламенного напыления поли-
полиэтилена на металлические конструкции, что обеспечивает хорошую
защиту от коррозии.
Полиэтилен наносят на поверхность металла, загрунтованную ла-
лаком, методом напыления или вихревым способом. В первом случае
частицы порошкообразного полиэтилена пропускают через воздуш-
воздушно-ацетиленовое пламя. Частицы оплавляются до пластического со-
состояния и при ударе о металлическую поверхность сцепляются с
ней и образуют сплошное покрытие. Во втором случае порошко-
порошкообразный полиэтилен потоком воздуха наносится на нагретую до
250-300 °С поверхность металла.
Полипропилен по сравнению с полиэтиленом более прочен (табл. 8.4).
Он может длительно работать под нагрузкой при 100°С. Темпера-
Температура размягчения 160-170 °С, морозостойкость (—30-;—35) °С. Про-
Пропилен обладает высокой стойкостью в кислотах (в H2SO4 — до 96 %,
в концентрированной HNO3), в органических растворителях, арома-
ароматических углеводородах, минеральных и растительных маслах. Он
неустойчив в олеуме, хлорсульфоновой кислоте, дымящей азотной
кислоте и бромной воде.
Из полипропилена готовят листы различной толщины, трубы,
электротехнические и машиностроительные детали, газонепрони-
газонепроницаемую пленку. Его широко используют для футеровки аппаратов.
Срок службы — 6-8 лет.
Исходным сырьем для поливинилхлорида является хлорвинил
СН2 = СНС1. Это — газ, конденсирующийся в жидкость при —14 ° С.
Поливинилхлорид представляет собой порошок с плотностью 1,4 кг/м 3,
который можно перерабатывать на твердые материалы {винипласт)
и мягкие пленочные материалы.
Винипласт — термопластический материал с молекулярной мас-
массой от 1800 до 120000. Винипласт стоек почти во всех минеральных
кислотах (за исключением HNO3 высокой концентрации и олеума),
щелочах, растворах солей, органических растворителей. Он пласти-
пластичен при нагревании до 140 °С и ему можно придать любую форму.
Однако винипласт имеет и недостатки, ограничивающие его при-
применение: низкий предел рабочей температуры D0-50 °С), низкая
ударная вязкость, большой коэффициент линейного термического
расширения, постепенная деформация под нагрузкой.
Из винипласта готовят аппаратуру, работающую при темпера-
температурах от +50 до — 20 °С, но не несущую механических нагрузок.
Винипласт легко сваривается. Он применяется как самостоятельный
материал для изготовления труб, вентиляторов, теплообменной ап-
8.2. Коррозионностойкие неметаллические материалы 245
паратуры. Широко используется для изготовления вентиляционных
систем в помещениях с агрессивной средой.
Для защиты аппаратов применяется пленочный винипласт тол-
толщиной 0,6-0,9 мм. При помощи перхлорвинилового клея он хорошо
приклеивается к дереву, металлу и бетону.
Полистирол — твердый материал, устойчив к воздействию рас-
растворов кислот, щелочей, светостоек. Но он растворяется в органиче-
органических растворителях. Полистирол является отличным диэлектриком
при температурах от —80 до +110 °С. Его используют для изго-
изготовления изоляторов, фасонных изделий, лент и труб для изоляции
проводов.
Фторопласты обладают исключительно высокой химической стой-
стойкостью и являются непревзойденными материалами в антикорро-
антикоррозионной технике.
Политетрафторэтилен — фторопласт-4 является полимером
тетрафторэтилена [-CF2-CF2-]n? т.е. полностью фторированного эти-
этилена. Он обладает высокой химической стойкостью, разрушается
только расплавами щелочных металлов, фтором и фторированным
керосином.
Важным свойством фторопласта-4 является его теплостойкость,
он не изменяет своих свойств в интервалах температур от —190 до
+260 °С. Отмечают также его низкий коэффициент трения и проч-
прочность при низких температурах.
Фторопласт-4 является отличным диэлектриком, стоек против де-
деформации и не хрупкий. Молекулярная масса фторопласта может
доходить до 400000-500000.
К недостаткам фторопласта-4 относится его низкая адгезия к ме-
металлам и другим материалам. Фторопласт-4 используется в виде хи-
химически стойких труб, шлангов, прокладок, сальниковой набивки,
клапанов и фильтров для кислот.
В отечественной и зарубежной промышленности имеется опыт
применения футерованных фторопластом-4 насосов, труб и фасон-
фасонных частей к ним. Успешно применяются теплообменники из фто-
фторопласта-4 (тефлона). Они представляют собой пакеты из трубок
диаметром от 2 до 6,35 мм и толщиной стенок 5-15 % от диаметра
трубок. Трубки смонтированы в пакеты в форме листов или цилин-
цилиндров с площадью теплообмена до 4500 м2.
Фторопласт-3 — является полимером трифторхлор-этилена [-CF2
-CFCl-]n. Он выпускается в виде мелкодисперсного, легкосыпучего
порошка и плавится при температуре 210 °С. Применение фторопла-
ста-3 допускается до 70° С, при отсутствии механической нагруз-
нагрузки — до 100°С. Он не смачивается водой, не набухает в ней, не
246 Неметаллические материалы и защитные покрытия Гл. 8
разрушается под действием разбавленных азотной, серной, соляной
кислот, концентрированных растворов щелочей.
Фторопласт-3 используется для изготовления фасонных изделий
и уплотнительных элементов.
Большим преимуществом фторопласта-3 является возможность
получения из него пленки и нанесение его на металлическую поверх-
поверхность для защиты от коррозии. Такое покрытие хорошо держится на
изделиях из углеродистой и легированной стали, на алюминии и его
сплавах.
Пленки из фторопласта-3 наносят на металлические поверхности
из суспензии смеси этилового спирта с ксилолом. Затем смесь вы-
высушивается сначала при 50-60 °С, а потом при 150 °С. Высушенное
покрытие сплавляется при 260-270 °С в течение 10-20 минут. Пленки
из фторопласта-3 устойчивы к кислотам, растворам солей. Их при-
применяют для защиты аппаратуры при производстве хлорпоизводных
и для хранения особо чистых веществ.
8.2.3. Сложные поликонденсационные пластические массы
Из этого класса пластмасс наиболее распространенными явля-
являются феноло-формалъдегидные пластические массы. Большое рас-
распространение на их основе нашли композиционные материалы с
наполнителями и слоистые пластики.
Образование фенол-формальдегидных смол происходит по реак-
реакции поликонденсации с выделением воды.
Поликонденсацию фенолов с альдегидами осуществляют в при-
присутствии кислых или основных катализаторов. При использовании
кислого катализатора и при избытке фенола получают новолачную
(термопластичную) смолу; а в присутствии щелочного катализатора
и при избытке формальдегида получают резольную (термореактив-
(термореактивную) смолу.
При нагревании или в присутствии отвердителей смолы пере-
переходят в полимеры, имеющие сетчатое строение. В зависимости от
наполнителя фенопласты подразделяют на прессованные, волокни-
волокнистые и слоистые. Свойства фенопластов приведены в табл. 8.5.
Из асбоволокнита получают изделия общетехнического назна-
назначения (переключатели, фланцы, рукоятки, шестеренки). Материал
стоек к воздействию воды, слабых растворов кислот, щелочей, до-
достаточно термостоек — до 300 °С.
Фаолит изготавливают на основе резольной смолы и асбеста. Он
стоек в кислотах: серной (средних концентраций до 50°С), соля-
соляной (всех концентраций до 100 °С), уксусной, фосфорной (до 80 °С),
8.2.
Коррозионностойкие неметаллические материалы
247
1
К
о
U
00 ^Гн
-н V ^
00 ;_J
S |=г
о о о
о
О
8
8
о
§
ffl
н ч
I
н
s
я
о
и
I
CN О
i
-I
о
8
О О ^
m t^ ^
о
о
I
8
8.
о 3
§»
О Л
ffl И
о
я
о <п о
I I о
о <о >о
о
-
о
^-L. чо ^ч
о
^1-
Р
2 °
е
11
Й 8
I!
in я
I
Iе
248 Неметаллические материалы и защитные покрытия Гл. 8
лимонной (до 70 °С). Также устойчив в растворах различных солей
(до 100 °С), в том числе натрия и кальция, в атмосфере газов: хло-
хлора и сернистого ангидрида до 90-100 °С. Фаолит нестоек в азотной
кислоте, плавиковой кислоте и щелочах.
Из фаолита готовят разнообразную аппаратуру: емкости, ректи-
ректификационные башни, холодильники, барботеры, арматуру, трубы и т.д.
По сравнению с винипластом, для которого предельно допусти-
допустимая температура 40-50° С, фаолит можно эксплуатировать до 130—
150 °С. Фаолит сравнительно хрупок, однако по механической проч-
прочности он превосходит кислотостойкую керамику.
Стекловолокниты — прочный, устойчивый к вибрационным на-
нагрузкам материал, обладает высокой удельной прочностью, стоек к
действию агрессивных сред и микроорганизмов.
Текстолит — это прессованный материал, изготовляемый из
хлопчатобумажной ткани или других слоистых материалов (напри-
(например, асбестовая ткань), пропитанных фенол-формальдегидной смо-
смолой и отвержденных. Пропитанные смолой пакеты прессуются между
нагретыми плитам гидравлических прессов при температуре 145—
150°С. Текстолит прочнее фаолита. Он применяется для изготов-
изготовления деталей, передающих усилия: шестерен, роликов для тросов,
муфт и т.д.
Стеклотекстолит относится к волокнистым материалам. В ка-
качестве наполнителей применяют стекловолокнистые материалы в
виде ориентированных элементарных волокон, стекложгутов или
стеклотканей различных переплетений. Вид наполнителя оказыва-
оказывает основное влияние на свойства стеклотекстолита. Прочностные
свойства стеклотекстолитов высокие. По удельной прочности они не
уступают, а иногда и превышают аналогичный показатель для стали,
дюралюминия и титана. Стеклопласты хорошо противостоят дей-
действию ударных и динамических нагрузок и обладают способностью
гасить колебания элементов конструкций. Они стойки к воздействию
растворов электролитов, масел, жидких топлив. Из них изготавлива-
изготавливают крупногабаритные конструкции для хранения и транспортировки
агрессивных жидкостей.
Прочностные свойства и теплостойкость могут быть повышены,
если применять в качестве связующего материала эпоксидные, по-
полиэфирные или кремнийорганические полимеры.
Силиконовые смолы или кремнийорганические полимеры содер-
содержат в основной цепи кремний и кислород (полисилоксаны, общая
формула R^SiO, где R — радикал). В зависимости от характера свя-
связи молекул и природы радикалов силиконы могут быть получены в
виде смол, каучукоподобных веществ, масел. На основе этих соеди-
8.2. Коррозионностойкие неметаллические материалы 249
нений производят жаростойкие лаки, смазки, силиконовые каучуки
и слоистые пластики.
Кремнийорганические покрытия можно нанести обычными ме-
методами: окунанием, распылением, кистью. Полное отверждение про-
происходит в течение 5-10 часов при температуре 200-250 °С.
Лаки могут длительное время эксплуатироваться в рабочей зоне
при температуре свыше 200 °С. Особенно ценны в этом отношении
фенил-силиконы. Смешивая их с оксидами титана, получают покры-
покрытия, стойкие к нагреву до 600 °С.
Силиконовые каучуки применяются для прокладок и уплотните-
уплотнителей, работающих при высоких температурах.
Покрытия из силиконовых полимеров устойчивы в кислороде,
озоне, влажной атмосфере при температурах до 500-550 °С. В каче-
качестве наполни-телей применяют алюминий, титан.
Широко используются в химической промышленности компози-
композиции на основе эпоксидных смол.
Эпоксидные смолы — продукты поликонденсации многоатом-
многоатомных фенолов с эпоксигидрогруппой (например, эпихлоргидрином).
Эпоксидные смолы имеют хорошую адгезию к металлу и после от-
отверждения становятся устойчивыми к действию щелочей, бензина,
ацетона, соляной кислоты, растворов неорганических солей.
Такие покрытия используют для защиты от коррозии дымовых
труб, выпарных аппаратов, сушилок, насосов для перекачивания го-
горячих жидкостей, крекинг-установок.
8.2.4. Каучуки и резины
Каучуки — это высокомолекулярные соединения, которые ис-
используются для получения резин, эбонитов и лаков, клеев, вяжущих
веществ. Каучуки имеют линейное строение, обладают высокой эла-
эластичностью, широким диапазоном рабочих температур. При темпе-
температуре 100° С они становятся хрупкими, а при температуре 200° С
разжижаются (табл. 8.6).
Натуральный каучук (НК) получают из млечного сока каучуко-
каучуконосных тропических растений. Сок обрабатывают кислотами и затем
вальцуют образующийся продукт.
Синтетические каучуки (СК) получают полимеризацией непре-
непредельных соединений. В зависимости от вида исходного материала и
условий их обработки изготавливают каучуки с различными свой-
свойствами и стойкостью (табл. 8.7).
Резина и эбонит — продукты вулканизации каучука. Ее проводят
в присутствии веществ-вулканизаторов (часто серы, оксидов метал-
250
Неметаллические материалы и защитные покрытия
Гл. 8
Таблица 8.6
Характеристика синтетических каучуков
Название каучука
Бутадиеновый (СКБ)
Бутадиенстирольный
(СКС)
Изопреновый
Бутадиеннитрильный
(СКН)
Хлорпреновый
(наирит)
Бутилкаучук
Силиконовый (СКТ)
Исходные мономеры
Бутадиен
сн2 = сн - сн = сн2
Бутадиен
сн2 = сн - сн = сн2
Стирол
СН2=СН
с6н5
Изопрен
сн2=с-сн = сн2
сн3
Бутадиен
сн2 = сн - сн = сн2
Акрилонитрил
СН2 = СН - CN
Хлорпрен
сн2=с-сн = сн2
С1
Изопрен
сн2=с-сн = сн2
сн3
Изобутилен
/СН3
сн2=с(
чсн3
Кремнийорганические
соединения
R
HO-Si-OH
R
Специальные свойства
Повышенная тепло-
бензо- и масло стойкость
-«-
Повышенная химическая
стойкость
Работает в широком ин-
интервале температур
от-60 до 300°С
лов) при повышенной температуре. В зависимости от количества
введенного вулканизатора получают мягкую резину B-4 % S), по-
полужесткую A2—20 % S) и жесткую резину C0-50% S). Последняя
носит название эбонит.
Резины обладают уникальной способностью к обратной дефор-
деформации в сочетании с высокой эластичностью и прочностью, сопро-
8.2.
Коррозионностойкие неметаллические материалы
251
s
О
и
2
03
i
QQ
H
О
03
2
и
X
a w S
I ё rf«
Д4 л
н -
5 и
С
I
Cg Й
03 й
S О
i
1
i-
iX
II
з S
252 Неметаллические материалы и защитные покрытия Гл. 8
тивляемостью к истиранию, воздействию агрессивных сред, газо- и
водонепроницаемостью.
Бутадиен-стиролъный каучук (СКС) — сополимер бутадиена и
стирола. Эбониты на его основе характеризуются высокой химиче-
химической стойкостью. Они стойки в сухом и влажном хлоре, в концен-
концентрированной уксусной кислоте до 65 °С, могут эксплуатироваться
длительное время в 36 %-й соляной кислоте до 80 °С.
Бутадиен-нитрилъный каучук (СКН) — сополимер бутадиена и
нитрила акриловой кислоты. Резины на его основе обладают бензо-
маслостойкостью, высокой сопротивляемостью абразивному износу
и высокой теплостойкостью (до 100 °С).
Хлорпреновый каучук носит название наирит. Основным сырьем
для его получения являются дешевые и доступные газы — ацетилен
и хлористый водород.
Наириты растворяются в органических растворителях и дают
маловязкие и концентрированные растворы, которые легко можно
наносить на защищаемую поверхность. Невулканизированные по-
покрытия из наирита являются термопластичными. Они размягчаются
при температуре выше 40°С. Если их выдержать несколько дней в
растворе серной кислоты или хлористого натрия при 60-70° С, то
покрытие вулканизируется и приобретает свойства резины. Такие
покрытия отличаются хорошим сопротивлением старению, могут
работать в кислотах, щелочах и растворах солей до 70 °С. Выдержи-
Выдерживают кратковременный нагрев до 90-95 °С.
Гуммированием называется покрытие химической аппаратуры
резиной или эбонитом. Внутреннюю поверхность аппарата обкла-
обкладывают одним, двумя или более слоями сырой листовой резины с
последующей вулканизацией. Вулканизация производится в специ-
специальных котлах, обогреваемых острым паром. Она может быть произ-
произведена заполнением аппарата кипящей водой, водными растворами
солей, имеющими температуру кипения выше 100°С. Сырая рези-
резиновая смесь при нагревании превращается в прочную эластичную
резину. Обкладками из хлоропреновых каучуков защищают трубо-
трубопроводы, электролизеры, резервуары.
Сырая резина в железнодорожных цистернах подвергается само-
самовулканизации без подогрева, которая летом завершается за месяц.
Эбониты обладают хорошей адгезией к металлу. Это свойство ис-
используется для создания двухслойного покрытия, которое часто при-
применяется на химических заводах. Нижний слой делают из эбонита, а
верхний слой выполняют из мягкой резины. Такие покрытия устой-
устойчивы к действию соляной, плавиковой, уксусной, лимонной кислот,
щелочей и растворов солей до 65 °С. Они разрушаются только в силь-
8.2.
Коррозионностойкие неметаллические материалы
253
Рис. 8.6. Схема защиты
концов трубок от корро-
зионно-эрозионного изно-
износа резиновым покрытием
из наирита:
1 — трубная доска; 2 —
трубы; 3 — резиновое по-
покрытие
но окислительных средах — в концентри-
концентрированной серной кислоте и в азотной кис-
кислоте.
В качестве примера рассмотрим за-
защиту теплообменной аппаратуры ре-
резиновыми покрытиями. Тонкие и ба-
бакелитовые покрытия стальных труб
теплообменных аппаратов достаточно
хорошо защищают сталь от коррозии.
Но они не защищают ее от эрозии и ин-
интенсивного гидроабразивного износа.
Между тем, часть теплообменной аппа-
аппаратуры подвергается сильному износу
под воздействием вод со взвешенными
механическими твердыми частицами.
В этом случае надежная защита от кор-
коррозионного и абразивного износа мо-
может быть достигнута только с помо-
помощью резиновых покрытий. Покрытия
из наирита показали хорошие защит-
защитные свойства. Опыт эксплуатации та-
таких теплообменников имеется на неко-
некоторых заводах России и США (рис. 8.6).
Следует учесть только, что у гуммированного теплообменни-
теплообменника будет снижен коэффициент теплопередачи по сравнению с теп-
теплообменником без защитного покрытия.
Бутилкаучук является продуктом совместной полимеризации изо-
бутилена и изопрена. Он отличается инертностью к воздействию
агрессивных сред, высокой газонепроницаемостью и малой водона-
бухаемостью. Резины на его основе противостоят действию некото-
некоторых органических растворителей.
Силиконовые каучуки обладают высокой теплостойкостью до 250-
300 °С и морозостойкостью до —50 -=—60 °С. Их недостатком явля-
является сравнительно низкая коррозионная устойчивость.
Фторкаучуки являются непревзойденным материалом по хими-
химической стойкости и теплостойкости. Изделия на их основе можно
эксплуатировать в сильно агрессивных средах и окислителях до тем-
температуры 200 °С. Недостатком этого вида каучука является его высо-
высокая усадка, что затрудняет его применение для защиты химической
аппаратуры.
8.2.5. Графитовые материалы
Материалы на основе угля и графита находят широкое примене-
применение в химической промышленности. Графит обладает высокой хи-
254
Неметаллические материалы и защитные покрытия
Гл.
200
100!
50
мической стойкостью и теплопро-
теплопроводностью. По теплопроводности
он превосходит хромоникелевые
стали и свинец в 3-5 раз (рис. 8.7).
Кроме того он обладает свойством
самосмазывания, на его поверхно-
поверхности в меньшей степени отклады-
откладывается накипь и загрязнения, чем
на других материалах.
Одновременно с этим гра-
графит обладает малой деформацией
и является хрупким материалом.
Особенно большим недостатком
графита является его высокая по-
пористость, доходящая до 30-35 %.
Искусственный графит гото-
готовят из нефтяного кокса и каменно-
каменноугольного пека путем нагревания
до 1200° С и дальнейшего прока-
прокаливания при 300° С без доступа
воздуха.
Для уменьшения пористости
графит пропитывают различны-
различными порозаполняющими вещества-
веществами. Последние должны обладать
инертностью к агрессивным средам и незначительно снижать теп-
теплопроводность материала.
Наиболее часто применяется пропитка графита бакелитом и фе-
ноло-формальдегидными смолами. После пропитки изделия подвер-
подвергают термической обработке, постепенно повышая температуру до
120-130 °С. Количество смолы, проникающей в поры графита, дохо-
доходит до 20 % от веса основного материала. В результате пропитки гра-
графита увеличивается его механическая прочность, теплопроводность
почти не изменяется, но температурный предел работы снижается
с 400 °С до 150-160 °С. Вместо фенол-формальдегидных возможно
применение кремнийорганических и эпоксидных смол.
В высококонцентрированной серной кислоте при температуре
200-250 °С фенол-формальдегидная пропитка разрушается и мате-
материал становится непригодным к эксплуатации. В настоящее время
освоены способы получения непроницаемого графита, обладающего
высокой химической стойкостью в H2SO4 при высоких температу-
температурах. Детали теплообменных аппаратов из графитовых блоков, пропи-
12 3 4 5 6
Рис. 8.7. Теплопроводность углегра-
фитовых материалов и металлов:
1 — алюминий; 2 — бакелитирован-
ный графит (игурит); 3 — тантал;
4 — углеродистая сталь; 5 — антегмит
АТМ-1; 6—свинец; 7—нержавеющая
сталь 12Х18Н9; 8 — титан
8.2.
Коррозионностойкие неметаллические материалы
255
танные политетрафторэтиленом (фторопласт-4), становятся непро-
непроницаемыми в концентрированной серной кислоте. При погружении
графитовых блоков в расплавленный цирконий или кремний, получа-
получают непроницаемый графит, устойчивый в 80 %-й H2SO4 при 200 °С.
На основе графитового порошка и фенол-формальдегидной смо-
смолы получают материал под названием антегмит. Графитовый пресс-
порошок и смолу прессуют в горячих формах, а затем подверга-
подвергают термической обработке. Антегмит АТМ-1 — антикоррозионный
и антифрикционный теплопроводный материал. Он обладает пони-
пониженной (примерно в 2 раза) теплопроводностью и повышенной проч-
прочностью по сравнению с пропитанным графитом. Физико-механические
свойства АТМ-1 могут быть улучшены при термической обработке.
Рис. 8.8. Схема структуры углеграфитовых материалов:
/ — антегмит АТМ-1; // — бакелитированный графит; г — графит; с — фенол-
формальдегидная смола
Хотя химический состав бакелитированного графита и антегмита
ATM-Практически одинаков, отождествлять эти материалы по экс-
эксплуатационным свойствам нельзя. Как видно из рис. 8.8 в бакелити-
рованном графите непрерывная фаза состоит из графита, а отвердев-
отвердевшая феноло-формальдегидная смола является порозаполнителем. В
антегмите АТМ-1 непрерывная фаза состоит из отвердевшей смолы,
а порошкообразный графит является наполнителем.
Бакелитовые лаки получают растворением резольной смолы в
спирте. Обычно наносят 4-5 слоев лака, причем каждый слой сушат
при температуре 160-170 °С. Бакелитовые лаки широко используют
в химической промышленности. Они стойки по отношению к боль-
большинству агрессивных сред, за исключением окислителей, щелочей
и некоторых органических соединений. Недостатком бакелитового
лака является его хрупкость.
Графитовые материалы инертны к воздействию серной, соляной,
плавиковой кислот, к растворам солей, ко многим органическим со-
соединениям, но разрушаются щелочами, фтором и бромом. Они ши-
широко применяются при изготовлении теплообменников, крупнога-
256
Неметаллические материалы и защитные покрытия
Гл. 8
Рис. 8.9. Теплообменный
аппарат блочного типа из
пропитанного графита (од-
ноходовой по вертикаль-
вертикальным каналам):
1 — верхняя графитовая
крышка; 2 — графитовый
блок; 3 — стальная стяжка;
4 — боковая чугунная пли-
плита; 5 — нижняя графитовая
крышка; 6 — нижняя чугун-
чугунная плита; 7 — верхняя чу-
чугунная плита
баритной аппаратуры — реакторов, испа-
испарителей, абсорберов, конденсаторов. Из
них изготавливают также арматуру, дета-
детали насосов, футерованные плитки, элек-
электроды.
Высокая теплопроводность графито-
графитовых материалов делает их непревзойден-
непревзойденными для изготовления теплообменной
аппаратуры, работающей в высокоагрес-
высокоагрессивных средах. В производстве хлори-
хлористого водорода применяют холодильни-
холодильники из игурита, которые служат по семь
лет и более. На ряде химических заводов
работают абсорбционные колонны, изго-
изготовленные из бакелитированного графита
и заполненные фторопластовыми кольца-
кольцами. В Германии на этой стадии производ-
производства применяют аппараты из пропитан-
пропитанного графита — игурита, выполненные в
виде многокамерных абсорберов для по-
получения соляной кислоты, работающие
по принципу прямотока и противотока.
На рис. 8.9 представлен теплообмен-
теплообменник, выполненный из пропитанного гра-
графита.
Методические рекомендации к главе 8
После изучения материала, изложен-
изложенного в главе 8, студенты должны знать
свойства и коррозионные характеристи-
характеристики неметаллических материалов неорга-
неорганического и органического происхожде-
происхождения;
Студенты должны уметь выбрать оптимальный вариант кон-
конструкционных материалов или их композиций для организации про-
противокоррозионной защиты химического аппарата или оборудования.
8.2. Коррозионностойкие неметаллические материалы 257
Вопросы для самопроверки
1. Перечислите виды неорганических конструкционных матери-
материалов.
2. Что представляют собой природные и искусственные силикат-
силикатные материалы?
3. Какие керамические материалы вам известны?
4. Каков механизм разрушения бетонов?
5. Перечислите виды конструкционных материалов на основе ор-
органических соединений.
6. Какие полимерные материалы вам известны?
7. Охарактеризуйте простые полимеризационные пластические
массы.
8. Где применяют фаолит, текстолит? К какому классу соединений
они относятся?
9. Что представляют собой каучуки и резина?
10. Где и как применяют графитовые материалы?
Темы для самостоятельных и контрольных работ
Охарактеризуйте коррозионные свойства неорганических кон-
конструкционных материалов. Приведите примеры их промышленного
применения.
Конструкционные материалы на основе органических соедине-
соединений. Простые и сложные пластические массы. Каучуки и резины.
Графитовые материалы. Приведите коррозионные характеристики.
Литература к главам 7 и 8
1. Клипов И.Я. Коррозия химической аппаратуры. Коррозионностойкие
материалы: Уч. пособие. -М.: Машиностроение, 1967. 462 с.
2. Томашов К Д., Чернова Г.П. Теория коррозии и коррозионностойкие
конструкционные материалы. - М.: Металлургия, 1986. 359 с.
3. Акшенцева Л.П. Металлография коррозионностойких сталей и спла-
сплавов. - М.: Металлургия, 1991. 287 с.
4. Улъянин Е.А. Коррозионностойкие стали и сплавы: Справочник. - М.:
Металургия, 1980. 208 с.
5. Конструкционные материалы: Справочник / Под ред. Б.Н. Арзамасо-
ва. - М.: Металлургия, 1990.
6. Плудек В.Р. Защита от коррозии на стадии проектирования / Пер с
пол.-М.: Мир, 1980.
258 Неметаллические материалы и защитные покрытия Гл. 8
7. Сайфуллин PC. Физикохимия неорганических полимерных и компози-
композиционных материалов. - М.: Химия, 1990. 240 с.
8. Способы защиты оборудования от коррозии / Под ред. Б.М. Строкан,
A.M. Сухотина. -Л.: Химия, 280 с.
9. Реформат екая И. И. II Международная школа повышения квалификации
«Инженерно-химическая наука для передовых технологий» / Под ред.
В.А. Махлина. -М.: 1999. Т. 1. С. 185.
10. Свистунова Т.В. II Международная школа повышения квалификации
«Инженерно-химическая наука для передовых технологий» / Под ред.
В.А. Махлина. -М.: 1999. Т. 2. С. 176.
Часть IV
Методы защиты машин
и аппаратов химических
производств от коррозии
Основным условием противокоррозионной защиты металлов яв-
является уменьшение скорости коррозии. Уменьшить скорость корро-
коррозии можно:
• путем подбора соответствующих коррозионностойких спла-
сплавов;
• изменением состава агрессивной среды;
• применением защитных покрытий;
• изоляцией металла от агрессивной среды слоем более стойкого
материала;
• электрохимическими методами защиты.
Первую группу методов защиты применяют на стадии изготовле-
изготовления металла, в процессе его термической и механической обработки.
Принципы легирования и создания сплавов с определенными кор-
коррозионными и эксплуатационными характеристиками рассматрива-
рассматривались ранее.
Вторая группа методов борьбы с коррозией — это обработка сре-
среды с целью уменьшения ее агрессивности путем введения ингибито-
ингибиторов коррозии. Эти методы находят все более широкое применение.
Нанесение изолирующего покрытия на поверхность металла поз-
позволяет в значительной степени снизить скорость его коррозии. Этот
метод является универсальным и его давно применяют. Различают
органические, например, лакокрасочные, и неорганические (галь-
(гальванические, фосфатные и т.д.) покрытия. В ряде случаев для по-
повышения защитного действия комбинируют неорганическое и ор-
органическое покрытие. Особенно часто применяют фосфатирование
в качестве промежуточного слоя, обеспечивающего хорошую адге-
адгезию к металлу. В этом случае защитная способность органического
покрытия возрастает в несколько раз.
К электрохимическим методам борьбы с коррозией относятся та-
такие, в основе которых лежит принцип непосредственного воздей-
воздействия на скорость протекания сопряженных анодных и катодных
реакций. Прежде всего это выражается в изменении потенциала за-
защищаемого металла. Различают катодную и анодную электрохими-
электрохимическую защиту.
ГЛАВА 9
ЗАЩИТА МЕТАЛЛА ОТ КОРРОЗИИ
ПОВЕРХНОСТНЫМИ ТОНКОСЛОЙНЫМИ
ПОКРЫТИЯМИ
К рассматриваемому виду покрытий относятся неорганические
защитные пленки, гальванопокрытия и лакокрасочные покрытия.
Защита металла от коррозии полимерными материалами рассматри-
рассматривалась в главе 8.
Выбор того или иного вида покрытия зависит от сроков эксплуа-
эксплуатации изделий и скорости коррозии. На рис. 9.1 представлены обоб-
обобщенные данные по изменению доли экономически выгодных спосо-
40-
20-
10
20 30
Д, годы
40
50
Рис. 9.1. Распределение Р удельного веса различных способов
защиты в зависимости от требуемой долговечности Д стальных
конструкций в объеме применяемых противокоррозионных
средств:
1 — электрометаллизация (80 мкм) + ЛКП (лакокрасочное покры-
покрытие); 2 — горячее цинкование F0-80 мкм); 3 — ЛКП A20 мкм) по
пескоструйнообработанной поверхности; 4 — низколегированная
сталь без ЛКП; 5 — ручная металлизация A50-200 мкм); 6 —
ручная металлизация A50-200 мкм) + ЛКП; 7 — ЛКП A20 мкм)
на поверхности с ручным удалением ржавчины. 7, 2, 4, 6 — 0,5-
1,0 мм/год; 3, 7 — 0,05 мм/год
бов противокоррозионной защиты в зависимости от требуемой дол-
долговечности и степени агрессивности среды. Из рисунка видно, что
применение лакокрасочных покрытий выгодно при долговечности
не более 10 лет и скорости коррозии металла до 0,05 мм/год.
262 Защита металла от коррозии поверхностными покрытиями Гл. 9
Повышение долговечности при скорости коррозии металла 0,5-
1,0 мм/год может быть достигнуто путем применения комбинирован-
комбинированных металлизационных лакокрасочных покрытий. Например, горя-
горячее цинкование плюс лакокрасочное покрытие, ручная металлизация
плюс лакокрасочное покрытие. Использование этого вида защиты
позволяет увеличить продолжительность защиты до 30 лет и более.
9.1. Фосфатные и оксидные защитные пленки
Большинство металлов в атмосферных условиях покрыты оксид-
оксидными пленками. Однако эти пленки не всегда обеспечивают защиту
от коррозии.
Методами химической и электрохимической обработки можно
создать на поверхности фосфатные или оксидные покрытия, которые
обладают высокой адсорбционной способностью, электроизоляци-
электроизоляционными свойствами, повышенной твердостью и износостойкостью.
При дополнительной обработке пассивирующими растворами, сма-
смазочными или лакокрасочными материалами значительно повышает-
повышается коррозионная стойкость металлов и сплавов.
9.1.1. Фосфатирование
Технология процесса фосфатирования проста. Фосфатирование
применяют для черных и цветных металлов и оно состоит в обра-
образовании малорастворимых фосфатов железа, марганца или цинка.
Основан метод на свойствах солей фосфорной кислоты. Фосфорная
кислота — Н3РО4 — может образовывать три вида солей:
• однозамещенные - дигидрофосфаты Ме^РО^;
• двухзамещенные - моногидрофосфаты МеНРО4;
• трехзамещенные - фосфаты Мез(РО4J
(где Me — двухвалентный металл).
В воде растворяются только фосфаты аммония и щелочных ме-
металлов. Двух- и трехзамещенные фосфаты железа, марганца и цинка
малорастворимы. Следовательно, если создать условия для их обра-
образования, то они будут оставаться на поверхности металла.
При взаимодействии металла с фосфорной кислотой первона-
первоначально образуются дигидрофосфаты:
Me + 2Н3РО4 = Ме(Н2РОJ + Н2
При снижении концентрации фосфорной кислоты получают вто-
вторичные и третичные соли:
Ме(Н2РО4J т± МеНРО4 + Н3РО4
9.1. Фосфатные и оксидные защитные пленки 263
ЗМе(Н2РО4J т± Ме3(РО4J + 4Н3РО4
В образовании фосфатной пленки участвуют продукты взаимо-
взаимодействия фосфорной кислоты с металлом и вещества, входящие в
состав раствора для фосфатирования.
Предполагается, что образованию фосфатной пленки предше-
предшествуют реакции ионизации железа:
Fe <=> Fe2+ + 2e
и выделение водорода:
2Н+ + 2е <=> Н2 t
Железо, переходящее в раствор, связывает фосфорную кислоту
и равновесие реакций смещается вправо. Выпадающие в осадок ди-
и трифосфаты кристаллизуются на поверхности стального изделия,
образуя плотную кристаллическую пленку.
Фосфатирование заканчивается после того, как вся поверхность
покроется сплошной пленкой и выделение водорода прекратится.
Фосфатные пленки обладают хорошей адгезией, имеет высокораз-
высокоразвитую шероховатую поверхность. Они являются хорошим грунтом
для нанесения лакокрасочных покрытий и пропитывающих смазок.
Фосфатирование используют для изделий, которые эксплуатируют в
морской воде, в тропических районах. Недостатком фосфатных пле-
пленок является низкая прочность и эластичность. Они имеют короткий
срок эксплуатации.
9.1.2. Оксидирование
Оксидирование — это процесс образования оксидных пленок на
поверхности металлических изделий.
Современный метод оксидирования — химическая и электрохи-
электрохимическая обработка деталей в щелочных растворах.
Электрохимическое оксидирование ведут в растворе 4 %-го едко-
едкого натра при 65-120 °С и анодной плотности тока от 2,5 до 10 А/дм2.
Продолжительность анодной обработки не превышает 60 минут.
Качественное покрытие состоит из магнитной окиси железа, по-
получающейся в результате последовательных превращений:
Fe ->> Na2FeO2 -+ Na2Fe2O4 -+ Fe3O4
Оксидирование черных металлов носит также название вороне-
воронения. Его осуществляют в растворе состава (г/л): NaOH — 600-700;
NaNO2 — 200-250; NaNO3 — 50-100. Температура — 135-145 °С,
264 Защита металла от коррозии поверхностными покрытиями Гл. 9
время 30-90 мин. В процессе происходит растворение железа с об-
образованием соединений Na2FeO2 и Na2Fe2O4, из которых образуется
поверхностная пленка оксида железа —
Na2FeO2 + Na2Fe2O4 + 2H2O = Fe3O4 + 4NaOH
Оксидная пленка на малоуглеродистой стали имеет глубокий чер-
черный цвет, а на высокоуглеродистых сталях — черный с сероватым
оттенком. Для повышения антикоррозионных свойств оксидирован-
оксидированное изделие погружают на 2-3 мин в горячий 2-3 %-й раствор мыла,
а затем на 5-10 мин в минеральное трансформаторное или машин-
машинное масло при температуре 105-120 °С. После этой операции по-
поверхность покрытия становится блестящей, с равномерной черной
окраской. Возможно оксидирование и магниевых сплавов — в хро-
хромовокислых электролитах с последующим нанесением лакокрасоч-
лакокрасочных покрытий. Толщина оксидных пленок составляет 0,8-1,5 мкм.
Противокоррозионные свойства поверхностной пленки оксидов
невысоки, поэтому область применения этого метода ограничена.
Основное назначение его — декоративная отделка. Почти все стрел-
стрелковое оружие и ряд точных приборов подвергают воронению, в ре-
результате чего изделия приобретают красивый черный цвет. Воро-
Воронение используют и в том случае, когда необходимо сохранить ис-
исходные размеры изделия, так как оксидная пленка составляет всего
1,0-1,5 микрона.
9.1.3. Пассивирование
Для защиты от коррозии применяют метод пассивирования —
обработка металла в растворах хроматов или нитратов.
Для пассивирования оцинкованных изделий применяю раствор:
8-10мл/л H2SO4 и Na2Cr2O7-2H2O — 200 г/л. Время обработки 5-
30 с. От времени обработки зависит окраска пленки. При выдержке
5 с. цвет пленки радужный с зеленоватым оттенком, а масса пленки
составляет 0,9-1,2 г/м2. При дальнейшем увеличении времени цвет
меняется от желтого до коричневого.
Для пассивирования алюминия используют раствор бихромата
калия B00 г/л) и 2 мл/л HF.
Пассивация меди в хроматных растворах дает особенно хорошие
результаты при защите изделий, соприкасающихся с парами SO2
и растворами нейтральных солей. Стальные детали можно обраба-
обрабатывать в 60-90 %-м растворе нитрита натрия. В результате они не
ржавеют в течение двух лет.
9.1. Фосфатные и оксидные защитные пленки 265
9.1.4. Анодирование
Анодирование — это процесс образования оксидных пленок на
поверхности алюминия. В обычных условиях на поверхности алю-
алюминия присутствует тонкая пленка оксидов AI2O3 или AI2O3 x пБ^О,
которая не может защитить его от коррозии. Под воздействием окру-
окружающей среды алюминий покрывается слоем рыхлых белых продук-
продуктов коррозии. Процесс искусственного образования толстых оксид-
оксидных пленок может быть проведен химическим и электрохимическим
способами.
Пленки, образующиеся при анодной обработке алюминия, обла-
обладают достаточной толщиной и рядом ценных свойств. Они защища-
защищают металл от коррозии и являются хорошим подслоем под лакокра-
лакокрасочные покрытия. Анодные пленки на алюминии обладают большим
сопротивлением к истиранию, имеют высокое омическое сопротив-
сопротивление и хорошо окрашиваются, что позволяет придать изделиям из
анодированного алюминия красивый вид. Для анодного окисления
используют два типа электролитов.
В растворах слабых кислот (борная, винная, лимонная) и их солей
оксидная пленка не растворяется. В этом случае получают беспори-
беспористые, плотные, не проводящие электрический ток покрытия толщи-
толщиной до 1 мкм. Такие пленки используют в качестве электроизоляци-
электроизоляционных покрытий в производстве конденсаторов.
Электролиты второго типа содержат растворы серной, хромовой
и щавелевой кислот, в которых происходит частичное растворение
оксидной пленки алюминия. В этих электролитах получают пори-
пористые пленки толщиной от 1 до 50 мкм.
На практике анодирование алюминия и его сплавов проводят в
растворах серной кислоты концентрацией 180-200 г/л, хромового ан-
ангидрида C %-го) и щавелевой кислоты C-10%-й) с плотностью тока
80-200 А/м2, при напряжении до 24 В в течение 15-60 мин. Катоды
выполняются из свинца или стали марки 12X18Н9Т.
Для повышения защитных свойств изделие после оксидирования
обрабатывают паром или горячей водой и далее в горячих растворах
хроматов и бихроматов. При обработке паром в порах пленки обра-
образуется гидроксид алюминия, а в хромовых растворах - более стойкие
соединения типа (А1ОJСЮ4.
Оксид образуется на поверхности алюминия в результате анод-
анодного окисления:
2А1 + ЗН2О = А12О3 + 6Н+ + бе
Он состоит из двух слоев: плотного барьерного слоя толщиной
266 Защита металла от коррозии поверхностными покрытиями Гл. 9
0,01-0,1 мкм, расположенного непосредственно на поверхности ме-
металла, и внешнего пористого слоя толщиной до 200-400 мкм.
Химическое оксидирование алюминия и его сплавов осуществля-
осуществляют в щелочных хромистых растворах состава (г/л): Na2CrC>4 — 15;
NaOH — 2,5 и Na2CO3 — 50 при температуре 90-95 °С в тече-
течение 5-10 мин. Образуются пленки толщиной 3-4 мкм с невысокими
механическими и диэлектрическими свойствами. Процесс простой,
быстрый и не требует специального оборудования.
9.2. Гальванические покрытия
Одним из способов защиты от коррозии является нанесение по-
поверхностных гальванических покрытий. Электроосаждение имеет
ряд преимуществ перед другими методами защиты, т.к. оно позво-
позволяет:
• регулировать толщину слоя;
• экономно расходовать цветные металлы;
• наносить покрытия из металлов, имеющих высокую темпера-
температуру плавления, как то хром, никель, медь, серебро, платина.
Защитные электрохимические покрытия должны обладать:
• способностью изолировать изделие от агрессивной среды;
• собственной коррозионной стойкостью;
• заданными физико-механическими свойствами.
Все эти качества определяются условиями зарождения и роста
кристаллов.
Получение осадков с высокими защитными свойствами возмож-
возможно при введении в электролит различных добавок и поверхностно-
активных веществ, которые часто имеют жесткие экологические нор-
нормативы. Поэтому совершенствование процессов электрохимических
покрытий уже не может базироваться на поисках органических до-
добавок, а требует детального физико-химического изучения законо-
закономерностей роста кристаллов. В последнее время появилось много
научно-исследовательских и обзорных работ в этом направлении.
Было показано, что образование монослоя адсорбированных ато-
атомов следует рассматривать как первую стадию электроосаждения
металлов. Она играет важную роль в определении характера после-
последующего роста и свойств покрытий.
Многочисленные исследования показали, что для большинства
систем монослои состоят из нейтральных атомов, имеют однород-
однородное распределение, и их адсорбция может быть описана изотермами
Фрумкина и Темкина.
9.2. Гальванические покрытия 267
Анионы Cl~, Br~, J~, SO^" влияют на образование монослоев,
конкурируя с адсорбированными атомами и оказывая влияние на
свойства поверхности.
Монослои металлов отличаются по своим физическим свойствам
от массивного металла. Так, адсорбция серебра на платине снижает
работу выхода электронов с 5,8 до 2,7 эВ. При толщине более трех
монослоев работа выхода становится равной чистому металлу.
Активные центры играют важную роль в процессах электрокри-
электрокристаллизации, определяя число возникающих кристаллов.
Введение ряда поверхностно-активных веществ (ПАВ) влияет на
число активных центров и процессы зарождения кристаллов. Элек-
Электроосаждение металлов происходит, как правило, при высоких пере-
перенапряжениях. Электроосажденные слои в присутствии ПАВ имеют
размер кристаллов на несколько порядков меньше, чем при обычной
кристаллизации, т.к. адсорбция примесей тормозит линейный рост
кристаллов, а высокое перенапряжение способствует возникнове-
возникновению большого числа кристаллов. В этом случае осадки получаются
твердые, малопластичные, а иногда и хрупкие.
Адсорбция примесей вызывает нарушения в построении кри-
кристаллической решетки, которая содержит точечные (вакансии и при-
примеси), линейные (краевые и винтовые дислокации) и плоскостные
дефекты. Высокая концентрация вакансий обуславливает резкое по-
повышение скорости диффузионных процессов, количество дефектов в
кристаллической решетке увеличивается. Дефекты кристаллической
решетки оказывают существенное влияние на физические свойства
образующихся осадков. В некоторых случаях на электроде возникает
жидкоподобная структура — металлические стекла. Не имея границ
зерен, они являются однородными метастабильными системами и
часто обладают более высокой коррозионной стойкостью по сравне-
сравнению с кристаллическими осадками такого же химического состава.
Вид покрытия, его толщина и назначение регулируются ГОСТ
9.303-84, и ГОСТ 9.306-85.
Защитные антикоррозионные покрытия могут быть анодными и
катодными.
Металлические покрытия должны быть непроницаемыми для
коррозионных агентов. Однако, если в металлическом покрытии есть
дефекты в виде пор, царапин, вмятин, то характер коррозионного
разрушения основного металла определяется электрохимическими
характеристиками обоих металлов. По отношению к стали цинко-
цинковое покрытие является анодным, а медное покрытие - катодным.
Поэтому первоначально начинает разрушаться цинк. При этом он
защищает от разрушения железо или сталь тем дольше, чем боль-
268 Защита металла от коррозии поверхностными покрытиями
Гл. 9
ше толщина покрытия, т.е. является протектором (рис. 9.2, а). Медь
является катодным покрытием по отношению к железу, т.к. имеет
потенциал более положительный. Поэтому разрушению будет под-
подвергаться железо и тем в большей степени, чем выше пористость
медного покрытия (рис. 9.2, б).
(О,
О2
Н2О
Fe
Рис. 9.2. Схема, поясняющая действие анодных (а) и катодных (б) по
отношению к основному металлу металлических покрытий
9.2.1. Цинкование и кадмирование
Цинковые покрытия применяются для защиты от коррозии дета-
деталей машин, трубопроводов, стальных листов. Цинк — дешевый и
доступный металл. Он защищает основное изделие механическим
и электрохимическим способом, так как при наличии пор или ого-
оголенных мест происходит разрушение цинка, а стальная основа не
корродирует.
Покрытия из цинка занимают доминирующее положение. С по-
помощью цинка защищают от коррозии примерно 20 % всех стальных
деталей и около 50% производимого в мире цинка расходуется на
гальванические покрытия.
В последние годы получили развитие работы по созданию защит-
защитных гальванических покрытий из сплавов на основе цинка: Zn-Ni (8-
12% Ni); Zn-Fe; Zn-Co @,6-0,8% Co). При этом удается повысить
коррозионную стойкость покрытия в 2-3 раза.
Цинкование проводят в кислых, цианидных и цинкатных элек-
электролитах. Осаждение цинка происходит с высоким выходом по току.
Цинковые покрытия отличаются высокой степенью чистоты, хими-
химической стойкостью и хорошими механическими свойствами.
Применение цианидных электролитов обеспечивает получение
более мелкозернистых покрытий. Их используют для обработки де-
9.2.
Гальванические покрытия
269
талей сложной формы. Однако эти электролиты экологически опас-
опасны. В некоторых случаях цианидные электролиты заменяют на ще-
щелочные цинкатные.
Все большее распространение получают цинковые комбиниро-
комбинированные электрохимические покрытия (КЭП). Из сульфатного элек-
электролита получают КЭП с включениями корунда до 0,4-0,5 масс.% .
Из цинкатного электролита с порошком карбонильного никеля по-
получают КЭП с содержанием никеля 6-12 мас.%. На основе цинка
получают также покрытия с частицами полимеров — капрона и по-
полиамида, содержание которых в КЭП составляет 0,9-3,1 мас.%. Эти
покрытия в 1,5 раза более стойки к воздействию кислот, чем чистые
цинковые покрытия.
Кадмий имеет более близкий потенциал к железу, чем цинк. Ха-
Характер защиты кадмием зависит от коррозионной среды. Во влажной
атмосфере и в присутствии хлор-ионов потенциал кадмия становит-
становится электроотрицательнее потенциала железа и кадмий электрохими-
электрохимически защищает металл от коррозии.
Необходимо учитывать высокую токсичность и дефицитность
кадмия. Поэтому его применяют только для защиты особо важных
деталей.
Для цинкования и кадмирования предложены электролиты, в ко-
которых металлы находятся в виде простых солей или в виде ком-
комплексных соединений. Наибольшее применение получили сульфат-
сульфатные электролиты. Их состав (г/л):
Цинкование
ZnSO4 — 200-250
Na2SO4 — 50-100
A12(SO4K—20-30
Декстрин — 8-10
рН = 3,5-=-4,5
Кадмирование
CdSO4 — 40-60
(NH4JSO4—240-250
Препарат ОС-20 — 0,7-1,2
Диспергатор НФ — 50-100
Уротропин — 15-20
Катодная плотность тока для цинкования 100-400 А/м2, для кад-
кадмирования — 80-120 А/м2. Температура электролита для обеих про-
процессов—15-30° С.
9.2.2. Покрытия из олова и свинца
Олово в контакте со сталью является катодом, так как его потен-
потенциал имеет более положительное значение по отношению к железу.
Однако в среде органических кислот олово образует комплексные со-
соединения и потенциал его становится более электроотрицательным.
270 Защита металла от коррозии поверхностными покрытиями Гл. 9
В этих средах олово выступает как анод. Покрытия из олова приме-
применяют в пищевой промышленности, при изготовлении печатных плат
и т.д.
Около 50% добываемого олова расходуется на изготовление
белой жести. С целью повышения коррозионной устойчивости про-
производят оплавление оловянных покрытий. Блестящее оловянирова-
ние — это нанесение на поверхность металлических изделий блестя-
блестящего слоя олова. По пористости и коррозионной стойкости они не
отличаются от матовых покрытий, но обладают повышенной твер-
твердостью.
Для оловянирования применяют кислые и щелочные электроли-
электролиты. Кислые электролиты просты по составу и работают при комнат-
комнатной температуре. Они применяются для покрытия деталей простой
конфигурации. Состав кислого электролита для покрытия оловом
(г/л): SnSO4 — 20-^25; H2SO4 — 50-И00; препарат ОС-20 — 2-=-5.
Температура 15-30° С, плотность тока— 100-200 А/м2.
Для покрытия оловом сложных деталей применяют щелочной
электролит состава (г/л): Na2Sn(OHN — 45^-90; NaOHCBo6. — 7-И7;
CH3COONa — 15. Температура 60-80 °С, плотность тока — 50-
200 А/м2.
Свинец устойчив в среде серной кислоты и ее соединений. Сви-
Свинец, как и олово, не может защищать стальные изделия электро-
электрохимически. Поэтому применяют свинцовые беспористые покрытия
большой толщины (до 300 мкм), которые механически защищают де-
детали из черных металлов в средах, содержащих серную и хромовые
кислоты и их соли. Необходимо учитывать высокую токсичность
свинца.
Для покрытия изделий свинцом в промышленности применя-
применяют борфтористоводородные или фенолсульфоновые электролиты.
Осадки хорошего качества получают только в присутствии органи-
органических добавок. Состав электролитов (г/л):
Борфтористоводородный
Pb(BF4J — 125-200
HBF4 — 40-600
Клей столярный — 0,5-1,0
Фенолсульфоновый
Pb(HOC6H4SO3J — 170-180
HOC6H4SO3HCBo6 — 20-25
Клей столярный — 0,4-0,5
Электролиз проводят при температуре 15-30 °С и плотности тока
50-200 А/м2.
9.2. Гальванические покрытия 271
9.2.3. Никелевые покрытия
Покрытие никелем используют для защиты от коррозии и для
декоративной отделки деталей. Никель обладает стойкостью на воз-
воздухе, в растворах щелочей и в некоторых кислотах.
Никель в паре с железом является катодом, так как имеет более
электроположительный потенциал, чем железо. Никель может защи-
защищать сталь только механическим путем, следовательно, покрытие не
должно иметь пор и должно иметь большую толщину — 20-25 мкм.
Существует несколько разновидностей никелевых покрытий.
Никелирование матовое — нанесение на поверхность металли-
металлических деталей матового слоя никеля. Основным компонентом элек-
электролитов для получения матовых осадков никеля является сульфат
никеля. В раствор вводят также сульфат натрия или магния для полу-
получения пластичных и полируемых покрытий, а также борную кислоту
для поддержания устойчивого значения рН.
Блестящее никелирование используют для защитно-декоративной
отделки поверхности. При этом отпадает необходимость полирова-
полирования покрытия. Блестящий никель можно наносить на детали со слож-
сложным профилем, он обладает способностью сглаживать неровности.
Для получения блестящих покрытий в состав раствора электролита
вводят специальные добавки — блескообразователи. Блестящие ни-
никелевые покрытия обладают пониженной коррозионной стойкостью
по сравнению с матовыми покрытиями.
Никелирование черное — электролитическое нанесение на по-
поверхность металлических изделий слоя никеля черного цвета. Та-
Такое покрытие используют как с защитно-декоративной целью, так и
для уменьшения коэффициента отражения света. Оно нашло приме-
применение в оптической промышленности и в некоторых отраслях ма-
машиностроения. У черного никеля низкие показатели коррозионной
стойкости, пластичности и прочности сцепления с поверхностью.
Поэтому применяют предварительное оловянирование или осажде-
осаждение матового никеля. Если применить предварительное цинкование,
а затем осадить черный никель, то покрытия приобретают такую
же коррозионную стойкость, как если бы они были покрыты толь-
только цинком. Часто черный никель наносят на изделия из меди или
латуни.
Применяют также химический способ нанесения никеля на по-
поверхность металлических изделий. Химически восстановленный
никель отличается повышенной коррозионной стойкостью и твер-
твердостью. Он позволяет получать равномерные по толщине осадки,
отличающиеся высокими декоративными свойствами и малой пори-
пористостью.
272 Защита металла от коррозии поверхностными покрытиями Гл. 9
Усовершенствование процессов никелирования идет по пути со-
создания новых электролитов и сплавов на основе никеля. Разработаны
новые метансульфоновые растворы, из которых получают пластич-
пластичные никелевые покрытия с низкими внутренними напряжениями.
Многослойные в два-три слоя никелевые покрытия обладают
большей коррозионной стойкостью, чем однослойные. Первый слой
никеля осаждают из простого никелевого электролита, а 2-й слой из
электролита, содержащего серу в составе органических добавок. По-
Потенциал никеля, содержащего серу, имеет более отрицательное зна-
значение, чем потенциал никеля без включений серы. Поэтому второй
слой электрохимически защищает от коррозии первый слой нике-
никеля. Таким образом обеспечивается более высокая защита основного
изделия.
Используют также двухслойное покрытие, называемое «сил-ни-
кель». Оно состоит из первого блестящего слоя никеля. Второй слой
получают из электролита, содержащего в виде суспензии каолин. В
ходе электролиза каолин осаждается вместе с никелем и включается
в осадок.
Покрытия из сплавов Ni-W используются при изготовлении пу-
пуансонов штампов для производства телевизионных трубок. Совер-
Совершенствуются процессы соосаждения Ni с фторопластом и M0S2.
Введение в матрицу покрытия алмазных и других неметаллических
составляющих позволяет существенно повысить твердость и изно-
износостойкость никелевых покрытий.
Использование многослойных никелевых покрытий обеспечива-
обеспечивает значительную экономию никеля и повышает их эксплуатационные
свойства.
9.2.4. Хромирование
Хромовые покрытия широко применяют для защиты от коррозии
и механического износа различных машин и аппаратов.
Хромовые покрытия бывают защитно-декоративные и функцио-
функциональные. Хром по отношению к стали является катодом, и при их
контакте разрушаться будет сталь. Поэтому хромовые покрытия на
стали должны быть сплошными и беспористыми.
Стальные изделия могут быть защищены от коррозии в атмо-
атмосферных условиях однослойным хромовым покрытием толщиной
не менее 40 мкм.
Для деталей из меди и медных сплавов осаждают хром по ни-
никелевому подслою. Детали из цинковых, алюминиевых, магниевых
сплавов покрывают хромом после нанесения многослойного покры-
покрытия.
9.2. Гальванические покрытия 273
Основными компонентами электролитов для хромирования явля-
являются оксид хрома (VI) СГ2О3 и серная кислота. В водном растворе
соединения Сг (VI) образуют смесь, состоящую из кислот Н2СГ2О7
и Н2СЮ4. В растворе эти кислоты находятся в динамическом рав-
равновесии:
2Н2СЮ4 т± Н2Сг2О7 + Н2О.
При электролизе на катоде одновременно происходит восстанов-
восстановление Сг+6 до Сг+3 и до металлического хрома, а также разряд ионов
водорода. Выход по току хрома не превышает 15-25 %. Хромирова-
Хромирование — очень сложный процесс. Хром выделяется на катоде только
при очень высоких плотностях тока A000-3000 А/м2). Причем для
каждой температуры имеется минимум плотности тока, ниже кото-
которого хром не осаждается.
Изменяя режим электролиза можно получить блестящие, матовые
(серые) или «молочные» осадки хрома. Блестящие осадки имеют
наиболее высокую твердость, хорошее сцепление с основным ме-
металлом и наименьшую хрупкость. Матово-серые осадки отличаются
высокой хрупкостью. Покрытия «молочным» хромом имеют высо-
высокую твердость, пластичность, значительно меньшую пористость и
более высокую защитную способность.
Стальные детали приборов и машин, работающих в жестких
условиях эксплуатации, покрывают двумя слоями хрома: нижний —
молочный и верхний — блестящий. Это обеспечивает хорошую за-
защиту от коррозии и высокую износостойкость при необходимых
декоративных качествах.
Хромирование черное применяется для защитно-декоративной
отделки деталей, поверхность которых наряду с коррозионной стой-
стойкостью должна иметь низкий коэффициент отражения света. По
сравнению с другими покрытиями черного цвета черное хромовое
покрытие отличается повышенной коррозионной стойкостью. Нано-
Наносят черный хром по подслою молочного или блестящего хрома или
никеля. Черные хромовые покрытия состоят на 75 % из металличе-
металлического хрома и на 25 % из оксидов хрома.
Традиционные процессы получения хромовых покрытий из рас-
растворов, содержащих соединения Сг (VI), экологически опасны. ПДК
для Сг (VI) равно 0,02 мг/л, а для Сг (III) — 0,07 мг/л. В связи с этим
отработанные гальваностоки проходят сложную систему очистки.
Первоначально соединения Сг (VI) восстанавливают до Сг (III). Ес-
Если процесс восстановления проводят химическим путем, то приме-
применяют бисульфит натрия — NaHSO3. Для полного восстановления
соединений Сг (VI) требуется 5-7-кратный избыток бисульфита и
274 Защита металла от коррозии поверхностными покрытиями Гл. 9
рН = 2 -=- 2,5. В процессе очистки часть NaHSC>3 разлагается с вы-
выделением SO2, что приводит к дополнительному загрязнению атмо-
атмосферы. Заключительная стадия очистки состоит в подщелачивании
раствора до рН = 8,0-8,5 и осаждении Сг(ОН)з вместе с другими
примесями в осадок.
С целью улучшения экологической ситуации очень привлекательно
выглядит идея получения осадков хрома их электролитов, содержа-
содержащих соединения Сг (III). На этом пути возникают трудности, связан-
связанные с низким рН гидратообразования Сг(ОН)з, инертностью аква-
комплексов Cr(H2O)g+, образованием прочных внутриорбитальных
комплексов и сложной конструкцией электролизера.
Разработанные электролиты на основе соединений Сг (III) не поз-
позволяли получить толстые слои. При достижении толщины в несколь-
несколько микрон выделение хрома прекращается. Введение в раствор
слабых лигандов, таких как муравьиная или малоновая кислоты,
а также ряда добавок позволяет получать толстые осадки хрома
(до 100-200 мкм). Использование новых электролитов дало возмож-
возможность проводить осаждение хрома с выходами по току до 25-45 % и
скоростью 0,8-1,6 мкм/мин вне зависимости от времени.
В процессе электролиза растворов, содержащих ионы Сг3+, со-
соединения Сг (VI) оказывают вредное влияние. Это требует усложне-
усложнения конструкции электролизера и разделения диафрагмой или мем-
мембраной анодного и катодного пространства, так как шестивалентные
ионы хрома (Сг6+) в основном образуются в результате химического
взаимодействия с озоном, выделяющимся на аноде. Применение но-
новых оксидных материалов, имеющих высокое перенапряжение для
реакции образования соединений Сг (VI), позволило резко снизить
выход по току Сг6+ и избежать конструктивного усложнения элек-
электролизера.
Таким образом, открываются перспективы для промышленного
освоения новых передовых технологий нанесения защитных хромо-
хромовых покрытий.
9.3. Жаростойкие защитные покрытия
Одним из способов защиты аппаратов от газовой коррозии явля-
является нанесение на их поверхность жаропрочных или жаростойких
покрытий.
К защитным покрытиям предъявляют ряд требований. Они долж-
должны быть сплошными и непроницаемыми для агрессивной среды,
обладать высокой прочностью сцепления с металлом, не ухудшать
технологические свойства основного металла и т.д.
9.3. Жаростойкие защитные покрытия 275
Различают следующие методы нанесения металлических защит-
защитных покрытий:
1) диффузионный;
2) распыление металла;
3) горячий метод — погружение изделия в расплавленный металл;
4) механотермический или плакирование.
Разберем каждый из методов более подробно.
9.3.1. Термодиффузионный метод покрытия
Термодиффузионный метод был разработан в 1938 году Н.А. Из-
гарышевым и Э.С. Саркисовым и получил практическое примене-
применение. Сущность метода состоит в поверхностном насыщении основ-
основного металла атомами легирующего компонента в результате диффу-
диффузии его при высоких температурах. Тем самым удается значительно
снизить расход легирующего металла.
Для создания термодиффузионного покрытия должны существо-
существовать следующие необходимые условия:
• возможность образования твердого раствора основного метал-
металла с металлом покрытия;
• атомный радиус металла покрытия не должен превышать атом-
атомный радиус основного металла, что обеспечивает свободу пе-
перемещения атомов вглубь кристаллической решетки.
Термодиффузионные покрытия на железе могут создавать метал-
металлы: Си, Аи, Zn, Ti, Al, Si, Cr, Mo и т.д. Из них наибольшее применение
в промышленности нашли покрытия:
• алюминием — термоалитироеание;
• хромом — термохромироеание;
• кремнием — термосилщирование.
Термоалитирование проводят в металлической емкости, которая
может выдерживать нагрев до 900-1000 °С. В эту емкость загружа-
загружают очищенные от грязи и окалины стальные детали и тщательно
засыпают реакционной смесью. Смесь состоит из 49% порошко-
порошкообразного алюминия или железо-алюминиевого сплава в порошке,
49 % оксида алюминия AI2O3 и 2 % хлористого аммония NH4CI. За-
Засыпка производится плотно, толщина засыпки около дна не менее
10 см. Емкость снабжена клапаном, позволяющем избыточным газам
выходить наружу (рис. 9.3).
Инертный наполнитель — AI2O3 — не дает возможность части-
частицам алюминия слипаться и при повышении температуры сплавиться
276 Защита металла от коррозии поверхностными покрытиями
Гл. 9
V/////////////////////
Рис. 9.3. Схема процесса термоалитиро-
вания:
1 — печь; 2 — клапан; 3 — реакционная
смесь; 4 — железный ящик; 5 — изделия
в общую массу. Он способ-
способствует сохранению алюминия
в диспергированном состо-
состоянии и обеспечивает общее
пористое состояние реак-
реакционной смеси, облегчаю-
облегчающее протекание диффузион-
диффузионных процессов. Хлористый
аммоний вводится для вы-
вытеснения воздуха с целью
предотвращения окисления
изделия и для создания осо-
особой газовой атмосферы. При
нагревании до 900-1000 °С
NH4CI разлагается. При этом могут протекать реакции:
NH4C1 <=> NH3 + НС1
2NH4C1 = 2NH3 + Cl2 + Н2
При воздействии СЬ или НС1 на алюминий происходят реакции:
2А1 + ЗС12 = 2А1С13
2А1 + 6НС1 = 2А1С13 + ЗН2
Хлористый алюминий является летучим соединением и быстро
достигает поверхности стального изделия. На поверхности протека-
протекает обменная реакция:
s
0,2
У,
1000>i
^950^1
0&^\ 900 °С
г
/
6AlCl3 + 2Fe = 2FeAl3 + 9Cl2
0
т, ч
12 900 1000
t,°C
Освобожденный хлор вза-
взаимодействует с алюминием
и вновь дает летучий хлори-
хлористый алюминий.
Таким образом осуще-
осуществляется перенос металла
покрытия на металл изделия
через газовую фазу. Затем
происходит диффузия атомов
алюминия в поверхностный слой детали. Нагрев ведут при 950-
1000°С в течение 5-6 часов. Глубина защитного слоя тем больше,
чем выше температура и продолжительность процесса (рис. 9.4).
Обычно получают поверхностные слои толщиной от 0,3 до 0,6 мм.
Рис. 9.4. Влияние продолжительности и
температуры процесса алитирования на
толщину защитного слоя
9.3.
Жаростойкие защитные покрытия
277
50 100
Время, ч
150
Жаропрочность покрытия обеспечивают оксиды типа AI2O3 и
FeAl2O4. Внешний слой наиболее обогащен алюминием, средний
слой близок по составу к интерметаллическому соединению FeAl3,
далее вглубь идет твердый раствор алюминия в железе с постепен-
постепенным снижением содержания алюминия.
Термоалитирование значительно повышает жаростойкость сталь-
стальных изделий (рис. 9.5). Они могут эксплуатироваться продолжитель-
продолжительное время при температурах 800-
900 °С. Обеспечивают хорошую за-
защиту против газовой коррозии в
атмосферах, содержащих соедине-
соединения серы. При температурах выше
1000 Тих защитные свойства пада-
падают.
Диффузионное насыщение ста-
стали алюминием является одним из
самых надежных способов защи-
защиты от действия кислорода при вы-
высоких температурах. Алитированые
изделия могут использоваться вме-
вместо жаростойких сталей.
Внешний алитированный слой
обладает повышенной хрупкостью.
Поэтому алитированию подвергают-
подвергаются изделия в собранном виде.
Алитированные изделия находят широкое применение для защи-
защиты от газовой коррозии оборудования нефтеочистительных и нефте-
нефтеперегонных установок, деталей газогенераторов, муфельных печей
и т.д.
Термохромирование — процесс насыщения поверхности изделий
из стали или чугуна хромом. Его проводят при температуре 1000—
1500 °С в смеси порошкообразного хрома или феррохрома, каолина
и хлористого аммония. Процесс продолжается 8—16 часов. За это
время получают слой толщиной 50-200 мкм. Содержание хрома во
внешнем слое покрытия превышает 50 % и состав слоя представляет
собой твердый раствор Fe-Cr.
Термохромированные изделия обладают высокой жаростойко-
жаростойкостью, твердостью и жаропрочностью. Они широко применяются в
химической и нефтехимической промышленности, особенно в окис-
окислительных средах, и в деталях, испытывающих повышенные нагруз-
нагрузки от трения.
Термосилицирование является аналогичным технологическим про-
Рис. 9.5. Повышение жаростой-
жаростойкости стали при термоалитирова-
нии поверхности (t = 800 °С).
1 — сталь с покрытием; 2 — сталь
после термоалитирования
278 Защита металла от коррозии поверхностными покрытиями
Гл. 9
цессом. Оно осуществляется с применением смеси порошков — фер-
ферросилиция, шамота и хлорида аммония, или в газообразной среде
соединений кремния — SiF4, SiCU. Процесс ведут при температуре
1100-1200 °С в течение 10-24 часов. При этом протекает реакция:
4Fe + 3SiCl4 = 3Si + 4FeCl3
Глубина защитного слоя составляет 0,8-1,0 мм. Поверхность си-
лицированных изделий тверда, износостойка. Такое покрытие хоро-
хорошо защищает углеродистую сталь от газовой коррозии.
В табл. 9.1 приводится сравнительная характеристика термодиф-
термодиффузионных видов покрытий.
Таблица 9.1
Влияние термодиффузионных покрытий на максимальную температуру
эксплуатации и свойства металлических изделий
Вид покрытия
Термохромирование
Термоалитирование
Термосалицирование
Максимальная тем-
температура длительной
эксплуатации, °С
800
950
1000
Дополнительные свойства,
сообщаемые обрабатывае-
обрабатываемым изделиям
Увеличивается жаропроч-
жаропрочность, твердость и устойчи-
устойчивость к износу
Повышается жаростойкость
Увеличивается хрупкость
Повышается износоустойчи-
износоустойчивость
Метод термолегирования является одним из широко используе-
используемых методов противокоррозионной защиты.
Изделия, легированные в поверхностном слое, обычно гораздо
дешевле, чем изготовленные целиком из высоколегированного спла-
сплава. Они сочетают в себе высокую жаропрочность и жаростойкость,
тогда как высоколегированные жаростойкие сплавы часто обладают
недостаточной жаропрочностью.
Кроме того, поверхностный защитный слой позволяет сохранить
хорошие механические свойства изделий в то время, как в легиро-
легированных сплавах эти свойства часто ухудшаются.
9.3.2. Горячий метод или метод погружения в расплавленный
металл
Это старейший и наиболее простой способ нанесения метала на
стальные листы, проволоку и готовые изделия. «Горячие» покрытия
образуются при погружении защищаемого металла в расплав метал-
металла, используемого для покрытия. В качестве последних применяют
9.3. Жаростойкие защитные покрытия 279
металлы, имеющие невысокую температуру плавления: цинк (?пл =
= 419 °С), олово (?пл = 232 °С), свинец (?пл = 327 °С), алюминий
(?ПЛ = 658°С).
Перед нанесением на металл покрытия его обрабатывают флю-
флюсом, состоящим из 52-56% хлорида аммония, 5-6% глицерина и
остальное — хлорид покрываемого металла. Флюс защищает рас-
расплав от окисления и, кроме того, удаляет с поверхности оксидные и
солевые пленки. К числу недостатков этого способа относятся срав-
сравнительно большой расход наносимого металла, неравномерность по-
покрытия по толщине и невозможность нанесения металла на резьбу,
в узкие отверстия и т.д.
Горячее лужение используют в пищевой промышленности. Горя-
Горячее цинкование применяют для защиты готовых изделий от коррозии
в атмосфере и в воде.
В химическом машиностроении используют нанесение на железо
или сталь алюминия. Алюминиевые покрытия получают в ваннах
с расплавленным алюминием, нагретым до 780-800°С, погружая
детали на 40-50 мин.
Большое применение нашел способ горячего свинцевания. Горя-
Горячие свинцовые покрытия применяют для защиты мешалок, кранов,
различной арматуры. При толщине покрытия в несколько миллимет-
миллиметров на железе получают плотный беспористый слой свинца.
Для защиты особо ответственных аппаратов, или при работе с
очень агрессивными средами применяют гомогенное свинцевание.
По этому способу свинец наносится на предварительно луженую
поверхность защищаемой конструкции в виде капель расплава, ко-
которые смачивая деталь и растекаясь по поверхности, образуют гомо-
гомогенное покрытие. Например, емкости, покрытые методом гомоген-
гомогенного свинцевания, применяются для хранения и транспортировки
брома.
9.3.3. Металлизация напылением
Сущность метода состоит в нанесении расплавленного металла
на поверхность защищаемого изделия с помощью струи сжатого воз-
воздуха или инертного газа. Частицы расплавленного металла, двигаясь
с большой скоростью, ударяются о поверхность основного металла
и сцепляются с ней, образуя металлическое покрытие. Металл по-
поступает в распылитель в виде проволоки и расплавляется либо в
газовом пламени, либо в электрической дуге, создающейся между
двумя электродами. Проволока подается специальным механизмом
со скоростью до 2,5 м/мин.
280 Защита металла от коррозии поверхностными покрытиями
Гл. 9
Покрытия наносят с целью защиты изделий от коррозионного
воздействия среды, для восстановления изношенных трущихся по-
поверхностей, для придания изделиям жаростойкости. Металлизацией
можно покрывать большие сложной формы конструкции в собран-
собранном виде.
На рис. 9.6 приведена схема устройства электрометаллизатора
проволочного типа. Концы проволок, по которым проходит элек-
электрический ток, выходя из наконечника D), встречаются и возникает
вольтовая дуга, под действием которой концы проволок расплавля-
расплавляются. Струя сжатого воздуха через сопло E) распыляет расплавлен-
расплавленный металл.
5 6
Рис. 9.6. Схема устройства электрометалли-
электрометаллизатора:
1 — проволока; 2 — корпус аппарата; 3 —
механизм для протягивания проволоки; 4 —
наконечник; 5 — воздушное сопло; 6 — элек-
электрическая дуга; 7 — металлизируемая деталь
Вместо двух проволок можно взять три и подавать на них ток
от трехфазного источника тока. В этом случае образуется сочетание
электрических дуг, горящих между концами различных проволок.
Такой металлизационный аппарат применяют обычно для получе-
получения псевдосплавов (искусственных сплавов железа с медью, цин-
цинком, алюминием и т.д.). Полученные таким образом псевдосплавы
обладают очень высокими антифрикционными свойствами.
При газовой металлизации происходит более мелкое и равно-
равномерное распыление металла. При электрической металлизации из-за
невозможности одинакового оплавления концов проволоки в напы-
напыленном слое обнаруживают частицы различных размеров — от 10 мкм
до 100 мкм. Такая неоднородность частиц по размерам ухудшает
физико-механические свойства металлизированных покрытий.
Основной металл детали в процессе металлизации нагревается
весьма незначительно, поэтому он не претерпевает структурных из-
изменений и его усталостная прочность не понижается.
Получаемое покрытие имеет чешуйчатую структуру и высокую
9.3. Жаростойкие защитные покрытия 281
пористость. При металлизации расходуется большое количество ме-
металла на угар и распыление, покрытие имеет пористую структуру,
неравномерную толщину и низкую адгезию к металлу. Толщина по-
получаемого слоя обычно равна 0,5-0,7 мкм.
Метод напыления применяется в промышленности для защиты
крупногабаритных конструкций в собранном виде, например, газ-
газгольдеров, резервуаров и т.д. В химическом машиностроении он
не нашел широкого применения вследствие недостатков, указанных
выше. Известно только применение алюминиевых покрытий, полу-
полученных подобным способом, для защиты от коррозии оборудования
заводов, перерабатывающих сернистые нефти, вулканизационных
котлов и подобных аппаратов.
9.3.4. Плакирование — термомеханический способ
Плакирование является наиболее совершенным методом защи-
защиты малостойких металлов сплавами или металлами, обладающими
повышенной коррозионной стойкостью.
Способ плакирования заключается в том, что на матрицу основ-
основного металла накладывают с обеих сторон листы другого металла,
затем весь пакет подвергают горячей прокатке. В результате термо-
термодиффузии на границе раздела металлов получают прочное много-
многослойное изделие.
Для плакирования применяют металлы и сплавы, обладающие
хорошей свариваемостью: углеродистые и кислотостойкие стали,
дюралюмины, сплавы меди.
В качестве защитного покрытия для плакирования используют
алюминий, тантал, молибден, титан, никель, нержавеющие стали.
Толщина плакирующего слоя колеблется от 3 до 40% от тол-
толщины защищаемого металла. Плакированную сталь можно подвер-
подвергать всем видам механической обработки, в том числе штамповке и
сварке.
Металлургическая промышленность выпускает углеродистую сталь
в виде листов марок Ст.З, 10, 15К, 20К и др., плакированную хро-
хромистыми, хромо-никелевыми и другими высоколегированными ста-
сталями @8Х17Т, 08X13, 10Х17Н13М2Т, 15Х25Т, 12Х18Н10Т и др.)
различной толщины. Известны также сплавы, плакированные ме-
медью, серебром, алюминием. В электрохимической промышленности
нашли широкое применение бианоды - плакированные электроды,
основу которых составляет титан или тантал, а защитный слой со-
состоит из платины, родия, иридия.
Метод плакирования позволяет экономить дорогостоящие метал-
282 Защита металла от коррозии поверхностными покрытиями Гл. 9
лы или высоколегированные сплавы и находит широкое применение
в промышленности.
9.4. Лакокрасочные защитные покрытия
Лакокрасочные покрытия — один из самых распространенных и
надежных способов защиты от коррозии. Они дешевы и доступны,
имеют простую технологию нанесения на поверхность, легко вос-
восстанавливаются в случае повреждения, отличаются разнообразием
внешнего вида и цвета.
Ежегодно более 80 % металлоизделий, используемых в народном
хозяйстве, подвергаются окрашиванию. В 1999 г. производство ла-
лакокрасочных материалов достигло 26,7 млн.т. Это свидетельствует
об огромных масштабах средств, вовлеченных в сферу производства
этого вида противокоррозионной защиты.
Эффективность применения лакокрасочных покрытий, как по-
показывают данные рис. 9.1, целесообразна при условии долговечно-
долговечности эксплуатации не более 10 лет и скорости коррозии металла до
0,05 мм/год. Если требуется повышение долговечности или скорость
коррозии металла составляет 0,5-1,0 мм/год, то следует применять
комбинированные покрытия. Например, цинковые плюс лакокрасоч-
лакокрасочное покрытие. Такое покрытие позволяет увеличить срок защиты
до 30 лет.
Лакокрасочные покрытия классифицируются по условиям экс-
эксплуатации и по внешнему виду в соответствии с ГОСТ 9894-61.
Защитные действия лакокрасочного покрытия заключаются в со-
создании на поверхности металлического изделия сплошной пленки,
которая препятствует агрессивному воздействию окружающей сре-
среды и предохраняет металл от разрушения.
Компонентами лакокрасочных материалов служат пленкообразу-
пленкообразующие вещества, растворители, пластификаторы, пигменты, на-
наполнители, катализаторы (сиккативы).
Лаки — это коллоидные растворы высыхающих масел или смол
в органических растворителях. Защитное твердое покрытие образу-
образуется вследствие испарения растворителя или полимеризации масла
или смолы при нагревании или под действием катализатора.
Краски представляют собой суспензию минеральных пигментов
в пленкообразователе.
Эмали — это раствор лака, в который введены измельченные
пигменты.
Пленкообразователи — это природные масла, естественные или
искусственные смолы. Масла по своему составу представляют собой
9.4. Лакокрасочные защитные покрытия 283
сложные эфиры, т.е. являются продуктом взаимодействия кислот и
спиртов. В основу классификации масел положена их способность к
высыханию.
Наиболее распространенный масляный пленкообразователь —
олифа. Натуральную олифу получают из высыхающих раститель-
растительных масел, обработанных при 300 °С с целью частичной полимери-
полимеризации. На воздухе олифа окисляется и полимеризуется до твердого
состояния.
Растворители пленкообразующих веществ придают лакокрасоч-
лакокрасочным покрытиям такую вязкость, при которой они легко наносятся на
поверхность. В дальнейшем растворители испаряются. Растворите-
Растворителями могут быть: спирты, ацетон, бензин, скипидар, толуол, ксилол,
этил ацетат и др.
Пластификаторы или смягчители — это вещества повышающие
эластичность пленок после высыхания. К ним относятся касторовое
масло, каучуки, дибутилфталат, трикрезилфосфат, эфиры адипино-
вой кислоты.
Количество пластификаторов, вводимых в смесь, составляет 20-
75 % от массы пленкообразователя.
Краски и пигменты вводят в состав лакокрасочных композиций
для придания им определенного цвета. Краски растворяются в рас-
растворителях, а пигменты находятся в них в нерастворимом мелкодис-
мелкодисперсном состоянии. Размер частиц
от 0,5 до 5 мкм. В качестве пигмен-
пигментов используют охру, сурик свин-
свинцовый, хром свинцовый, цинковые
белила, порошки металлов. Пигмен-
Пигменты повышают твердость, атмосфер-
атмосферную и химическую стойкость, изно-
износостойкость и т.д.
Наполнители — это инертные ве- Рис. 9.7. Строение лакокрасоч-
щества, которые вводят в лаки и ной пленки:
краски для снижения расхода пиг- 1 ~~ пленкообразователь; 2 — на-
наполнитель; 3 — пигмент; 4 — ме-
ментов, а также для улучшения ан-
антикоррозионных свойств пленки. К
ним относятся мел, тальк, каолин, асбестовая пыль и др.
Наполнители образуют прочную основу всей пленки. Частицы
наполнителя распределяются в пленке между частицами пигмента
и заполняют имеющиеся в ней промежутки. Благодаря этому плен-
пленка приобретает повышенную влагостойкость и антикоррозионные
свойства. Схема строения лакокрасочной пленки представлена на
рис. 9.7.
284 Защита металла от коррозии поверхностными покрытиями Гл. 9
Сиккативы или катализаторы представляют собой магниевые и
кобальтовые соли жирных органических кислот. Их вводят в состав
композиций для ускорения высыхания масляных пленок.
Успешная противокоррозионная защита лакокрасочными мате-
материалами в значительной степени зависит от соблюдения технологии
получения покрытий. Основными факторами, влияющими на срок
службы покрытия, являются:
• способ подготовки поверхности;
• методы нанесения и отверждения лакокрасочного покрытия;
• толщина комплексного покрытия.
Способы подготовки поверхности были рассмотрены ранее. Для
оценки влияния подготовки поверхности можно привести такой при-
пример. Срок службы покрытия эмалью МЛ-12 C слоя), нанесенной
по грунтовке ГФ-12 при пескоструйной обработке поверхности —
7 лет, при абразивной обработке — 9 лет, при обезжиривании —
3 года, при фосфатировании с активатором — 12 лет. Активатор
способствует формированию на поверхности малопористого мелко-
мелкокристаллического фосфатного слоя с хорошей адгезией к металлу.
Размер кристаллов 5-20 мкм.
Метод нанесения также оказывает влияние на срок службы по-
покрытия. Так, срок службы покрытия алкидной эмалью ПФ-115 (жел-
(желтой) при нанесении в электрополе — 12 лет, пневмораспылением —
11 лет, безвоздушным распылением — 10 лет, струйным обливом —
9 лет, окунанием — 8 лет. Разницу в сроках службы покрытий объяс-
объясняют различной структурой сформированных покрытий. Более мелкие
и плотноупакованные структуры образуются при нанесении покры-
покрытий методом электростатического распыления.
Существуют противоречивые мнения по вопросу выбора толщи-
толщины защитного лакокрасочного покрытия. По некоторым данным за-
защитные свойства покрытия пропорциональны его толщине, по дру-
другим — повышение толщины не всегда приводит к увеличению его
долговечности. Поэтому в каждом отдельном случае подбирается
оптимальная толщина лакокрасочного покрытия.
Выбор лакокрасочного покрытия определяется условиями его
эксплуатации. Для защиты аппаратов от воздействия кислот, ще-
щелочей, растворителей и агрессивных газов готовят лакокрасочные
покрытия на основе фенолоформальдегидных, полихлорвиниловых,
эпоксидных и фторорганических полимеров.
Лакокрасочные покрытия на основе эпоксидных соединений устой-
устойчивы в растворах NaOH (до 25 %) при нагревании до 125 °С, в со-
соляной (до 25 %), серной (до 70 %), фосфорной и азотной кислотах.
9.4.
Лакокрасочные защитные покрытия
285
Они эластичны, влаго- и атмосферостойки в средах, содержащих
СЬ, НС1, хлороформ. Обладают высокими электроизоляционными и
механическими свойствами.
Лаки и краски на основе полихлорвинила устойчивы к азотной,
соляной, серной, уксусной и другим кислотам, щелочам и маслам.
Они хорошо зарекомендовали себя в атмосферах, содержащих SO2,
SO3, N2O3, NH3, HC1. Их используют для защиты гальванических
ванн, аппаратов химводоочистки и др.
Полиуретановые лаки и краски применяют для защиты изделий
из магниевых и алюминиевых сплавов. Они стойки в атмосфере
нефтепродуктов.
Термостойкие покрытия получают на основе кремнийорганиче-
ских соединений. Они могут длительно работать при температуре
до 300 °С, кратковременно выдерживают 500-800 °С. Такие краски
и эмали используют для окрашивания вентиляционных и сушильных
установок, теплообменников и др.
Таблица 9.2
Распределение основных видов лакокрасочных покрытий
Тип
лакокрасочного
материала
ВСО
Водные
Порошковые
Органоразбавляемые
США
Европа
Япония
Общий объем производства, млн. т
6,4
7,9
2,0
Доля в общем объеме, %
2,7
11
5,2
55
15,0
11
12,3
55
1,4
11
3,6
80
Требования по экологии создают самые большие сложности при
разработке прогрессивного ассортимента лакокрасочных материа-
материалов. По данным зарубежных фирм газовые выбросы, включающие
растворители, составляют 100-185 г/м2 окрашиваемой поверхности.
В 1991 г. на автомобильных производствах Европы этот показатель
составлял 90г/м2. В 1993 г. он снизился до 50г/м2. Этому способ-
способствовало создание новых прогрессивных лакокрасочных материа-
материалов, отвечающих современным экологическим требованиям: с вы-
высоким сухим остатком (ВСО), водоразбавляемые и порошковые. В
табл. 9.2 показана общая тенденция к переходу на использование эко-
экологически благоприятных лакокрасочных материалов в трех основ-
основных регионах мира.
Материалы с высоким сухим остатком (ВСО) позволяют сокра-
сократить на 30% потребление органических растворителей, снизить в
286 Защита металла от коррозии поверхностными покрытиями Гл. 9
среднем на 20-30 % расход лакокрасочных материалов, а также уве-
увеличить в 1,5-2 раза срок службы покрытия. В нашей стране эти ма-
материалы находятся на стадии промышленного внедрения: полиэфир-
меламиновая эмаль ПЭ-1282 (содержание нелетучих соединений —
65 %, режим сушки — 30 минут при 130 °С); эпоксиперхлорвинило-
вая эмаль ЭП-2154 (соответственно — 50 % и 3-5 часов при 20 °С);
эпоксидная грунт-эмаль ЭП-5227.
Водоразбавляемые лакокрасочные материалы занимают одно из
ведущих мест в ассортименте продукции, отвечающей современ-
современным экологическим требованиям. Водные материалы применяются
в основном при окрашивании изделий методом электроосаждения.
Для этой цели используются водоразбавляемые лакокрасочные ма-
материалы на основе пленкообразователей-электролитов. Для электро-
электроосаждения используют грунтовки В-КЧ-0207, В-КФ-093, ВЭП-0190,
эмали В-ФЛ-11990, МС-278, В-ЭП-2100.
Порошковые краски — новый вид современных лакокрасочных
материалов. Их применение позволяет практически исключить опас-
опасность загрязнения окружающей среды, снизить пожаро- и взрывобе-
зопасность при работе. В настоящее время ведутся работы, направ-
направленные на усовершенствование и удешевление этого вида покрытий.
Новым классом современных лакокрасочных материалов явля-
являются модификаторы ржавчины.
Эффективность грунтовок-модификаторов определяется не только
природой пленкообразователя, но и наличием специальных добавок,
обеспечивающих пропитку ржавчины и максимальную стабилиза-
стабилизацию продуктов коррозии. Промышленность выпускает грунтовки-
модификаторы на основе водоразбавляемых пленкообразователей
(ВА-ВА-0112, ВД-ВА-01 ГИСИ, ВД-К4-0184, ВД-К4-0251), и эпок-
эпоксидные модификаторы (ЭП-0180, ЭП-0199 и ЭП-0191).
Одним из направлений повышения защитных свойств покрытий явля-
является направленная модификация серийных лакокрасочных материа-
материалов. В качестве модификаторов могут быть использованы различные по-
поверхностно-активные вещества, выпускаемые промышленностью.
Защитные свойства таких покрытий обусловлены образованием на
поверхности комплексов, обеспечивающих пассивность металла.
Замедлить протекание анодного коррозионного процесса можно
и введением в лакокрасочную композицию ингибиторов коррозии. К
ним относятся хроматы, фосфаты металлов, азотсодержащие и си-
лаксановые соединения. Эффект действия таких соединений связан с
растворением ингибитора в диффундирующей воде из внешней сре-
среды и последующей адсорбцией его ионов или молекул на активных
центрах металла.
9.4. Лакокрасочные защитные покрытия 287
Методические рекомендации к главе 9
Вопросы для самопроверки
1. Какие поверхностные тонкослойные покрытия вам известны?
2. Охарактеризуйте свойства фосфатных и оксидных защитных
пленок.
3. Какие существуют виды гальванических покрытий?
4. Перечислите разновидности жаростойких защитных покры-
покрытий.
5. Из каких компонентов состоят лакокрасочные покрытия? В чем
сущность их защитного действия?
Темы для самостоятельных и контрольных работ
1. Поверхностные тонкослойные защитные покрытия, получае-
получаемые электрохимическим методом. Перечислите виды покры-
покрытий. Охарактеризуйте их защитные и механические свойства.
2. Жаростойкие покрытия. Способы получения. Защитные и фи-
физико-механические свойства.
3. Лакокрасочные покрытия. Состав. Новые модификации лако-
лакокрасочных покрытий.
ГЛАВА 10
ЭЛЕКТРОХИМИЧЕСКИЕ МЕТОДЫ
ПРОТИВОКОРРОЗИОННОЙ ЗАЩИТЫ
МЕТАЛЛОВ. ЗАЩИТНЫЕ СРЕДЫ
10.1. Электрохимическая защита
Электрохимическая защита является способом противокоррози-
противокоррозионной защиты металлических материалов, основанным на снижении
скорости их коррозии путем смещения потенциала до значений, со-
соответствующих крайне низким скоростям растворения. Сущность
метода состоит в уменьшении скорости электрохимической корро-
коррозии металла при поляризации электрода от источника постоянного
тока или при контакте с добавочным электродом, являющимся ано-
анодом по отношению к корродирующей системе.
На рис. 10.1 приведена схема, поясняющая снижение скорости
растворения металла при различных способах его электрохимиче-
электрохимической защиты. В зависимости от на-
направления смещения потенциала ме-
металла электрохимическая защита под-
подразделяется на катодную и анодную.
Электрохимическую защиту при-
применяют в том случае, если потенциал
свободной коррозии Екор конструкци-
конструкционного материала располагается в об-
области активного растворения (Е\) или
перепассивации {Е2), то есть материал
растворяется с высокой скоростью.
При катодной защите снижение
скорости растворения металла проис-
происходит вследствие смещения потенци-
потенциала в область значений, отрицатель-
отрицательнее Екор. Например, если потенциал
свободной коррозии Е\ металла рас-
располагается в области активного рас-
растворения (скорость растворения ii),
то сдвиг потенциала в отрицательную
сторону до значения Е% приводит к снижению скорости растворения
до величины гз, оказывающейся ниже г\. Аналогичное снижение ско-
скорости растворения металла происходит и в случае, когда потенциал
Рис. 10.1. Способы снижения
скорости растворения метал-
металлов при электрохимической за-
защите
10.1. Электрохимическая защита 289
свободной коррозии Е2 металла располагается в области перепас-
перепассивации. При смещении потенциала в отрицательную сторону до
величины Е/± скорость растворения снижается до i±. Различие за-
заключается в том, что в первом случае снижение скорости растворе-
растворения металла достигнуто без изменения характера его растворения —
металл остался в активном состоянии. Во втором случае скорость
растворения снизилась вследствие перехода металла из активного в
пассивное состояние.
При анодной защите потенциал защищаемой конструкции сме-
смещают в область, положительнее Екор. При этом происходит переход
металла из активного в пассивное состояние. Так, если потенциал
свободной коррозии Ei металла располагается в активной области,
и соответствующая ему скорость растворения равна ii, то при его
смещении в положительную сторону до значения Е^ скорость рас-
растворения снижается до величины i^.
10.1.1. Катодная защита
Катодная защита применяется в тех случаях, когда металл не
склонен к пассивации, то есть имеет протяженную область актив-
активного растворения, узкую пассивную область, высокие значения кри-
критического тока (гкр) и потенциала (Екр) пассивации. Осуществле-
Осуществление катодной защиты возможно различными способами: снижением
скорости катодной реакции (например, деаэрацией растворов, в ко-
которых протекает коррозионный процесс); поляризацией от внешнего
источника тока; созданием контакта с другим материалом, имеющим
в рассматриваемых условиях более отрицательный потенциал сво-
свободной коррозии (протекторная защита).
Катодную защиту с использованием поляризации от внешнего ис-
источника тока применяют для защиты оборудования из углеродистых,
низко- и высоколегированных и высокохромистых сталей, олова,
цинка, медных и медноникелевых сплавов, алюминия и его сплавов,
свинца, титана и его сплавов. Как правило, это подземные соору-
сооружения (трубопроводы и кабели различных назначений, фундаменты,
буровое оборудование), оборудование, эксплуатируемое в контакте
с морской водой (корпуса судов, металлические части береговых
сооружений, морских буровых платформ), внутренние поверхности
аппаратов и резервуаров химической промышленности. Часто ка-
катодную защиту применяют одновременно с нанесением защитных
покрытий. Уменьшение скорости саморастворения металла при его
внешней поляризации называют защитным эффектом.
Основным критерием катодной защиты является защитный по-
290 Электрохимическая противокоррозионная защита. Защитные среды Гл. 10
тенциал. Защитным потенциалом называется потенциал, при ко-
котором скорость растворения металла принимает предельно низкое
значение, допустимое для данных условий эксплуатации. Харак-
Характеристикой катодной защиты является величина защитного эффек-
Z = (K0- Кг)/Ко - 100 %, A0.1)
где Kq [г/(м2 -ч)] — скорость коррозии металла без защиты, К\ [г/(м2 х
хч)] — скорость коррозии металла в условиях электрохимической
защиты. Коэффициент защитного действия К3 [г/А] определяют по
формуле:
К3 = (Аш0 - Ami)/iK, A0.2)
где Дто и Ami — потери массы металла соответственно без ка-
катодной защиты и при ее применении (г/м2), гк [А/м2] — плотность
катодного тока.
При организации катодной защиты отрицательный полюс внеш-
внешнего источника тока присоединяют к защищаемой металлической
конструкции, а положительный полюс — к вспомогательному элек-
электроду, работающему как анод. В процессе защиты анод разрушается
и его необходимо периодически заменять.
Источниками внешнего тока при катодной защите служат станции
катодной защиты, обязательными элементами которых являются: пре-
преобразователь (выпрямитель), вырабатывающий ток; токоподвод к за-
защищаемой конструкции, электрод сравнения, анодные заземлители,
анодный кабель.
Станции катодной защиты бывают регулируемые и нерегулируе-
нерегулируемые. Нерегулируемые станции катодной защиты применяются в том
случае, когда изменения сопротивления в цепи тока практически
отсутствуют. Указанные станции работают в режиме поддержания
постоянного потенциала или тока и применяются для защиты ре-
резервуаров, хранилищ, высоковольтных кабелей в стальной броне,
трубопроводов и др.
Регулируемые станции катодной защиты применяются при нали-
наличии в системе блуждающих токов (близость электрифицированно-
электрифицированного транспорта), периодических изменений сопротивления растека-
растеканию тока (сезонные колебания температуры и влажности грунтов),
технологических колебаний (изменение уровня раствора и скоро-
скорости течения жидкости). Регулируемым параметром может служить
ток или потенциал. Частота расположения станций катодной защиты
по длине защищаемого объекта определяется электропроводностью
эксплуатационной среды. Чем она выше, тем на большем расстоянии
друг от друга будут располагаться катодные станции.
10.1. Электрохимическая защита 291
Анодные заземлители, соединяющие положительный полюс ка-
катодной станции с землей, изготавливаются из различных материа-
материалов — стали, графита, ферросилицида, титана, платинированного
титана и др. Схема расположения анодных заземлителей определя-
определяется конфигурацией защищаемой конструкции. Мощность станции
катодной защиты определяется максимальным сопротивлением рас-
растеканию тока с анодных заземлителей. С целью снижения указанного
сопротивления анодные заземлители располагают либо на участках
грунта, обладающих минимальным сопротивлением, либо в специ-
специальных коксовых обсыпках.
Засыпка представляет собой толстый слой кокса, в которую до-
добавляют гипс и поваренную соль в соотношении 4:1. Такая засыпка
имеет высокую электропроводность.
Для защиты водных объектов аноды устанавливают на дне рек и
морей. При защите заводской аппаратуры аноды погружают в тех-
технологические среды.
Катодную защиту внешним током применяют как дополнитель-
дополнительное средство к изоляционному покрытию. При этом изоляционное
покрытие может иметь повреждения. Защитный ток протекает в
основном по обнаженным участкам металла, которые и нуждают-
нуждаются в защите.
Применяют катодную защиту внешним током и к конструкциям,
имеющим значительные повреждения, что позволяет приостановить
дальнейшее распространение коррозии.
Использование катодной защиты сопряжено с опасностью так на-
называемой перезащиты. В этом случае вследствие слишком сильного
смещения потенциала защищаемой конструкции в отрицательную
сторону может резко возрасти скорость выделения водорода. Резуль-
Результатом этого является водородное охрупчивание или коррозионное
растрескивание материалов и разрушение защитных покрытий.
10.1.2. Протекторная защита
Протекторная защита является разновидностью катодной за-
защиты. К защищаемой конструкции присоединяют более электро-
электроотрицательный металл — протектор — который, растворяясь в окру-
окружающей среде, защищает от разрушения основную конструкцию.
После полного растворения протектора или потери контакта с защи-
защищаемой конструкцией, протектор необходимо заменить.
Протектор работает эффективно, если переходное сопротивление
между ним и окружающей средой невелико. Действие протектора
ограничивается определенным расстоянием. Максимально возмож-
292 Электрохимическая противокоррозионная защита. Защитные среды Гл. 10
ное удаление его от защищаемой конструкции называется радиусом
защитного действия протектора.
Протекторную защиту применяют в тех случаях, когда получе-
получение энергии извне для организации катодной защиты связано с труд-
трудностями, а сооружение специальных электролиний экономически
невыгодно.
Протекторную защиту применяют для борьбы с коррозией ме-
металлических конструкций в морской и речной воде, грунте и других
нейтральных средах. Использование протекторов в кислых раство-
растворах нецелесообразно вследствие высокой скорости саморастворе-
саморастворения.
В качестве протекторов можно применять металлы: Al, Fe, Mg,
Zn. Однако использовать чистые металл в качестве протекторов
не всегда целесообразно. Так, например, чистый цинк растворяет-
растворяется неравномерно из-за крупнозернистой дендритной структуры, по-
поверхность чистого алюминия покрывается плотной оксидной плен-
пленкой, магний имеет высокую скорость собственной коррозии. Для
придания протекторам требуемых эксплуатационных свойств в их
состав вводят легирующие элементы.
В состав цинковых протекторов вводят Cd @,025-0,15%) и А1
@,1-0,5%). Содержание таких примесей, как Fe, Cu, Pb стараются
поддерживать на уровне не более 0,001-0,005 %. В состав алюмини-
алюминиевых протекторов вводят добавки, предотвращающие образование
оксидных слоев на их поверхности — Zn (до 8 %), Mg (до 5 %), а
также Cd, In, Gl, Hg, Tl, Mn, Si (от сотых до десятых долей процен-
процента), способствующие требуемому изменению параметров решетки.
Магниевые протекторные сплавы в качестве легирующих добавок
содержат А1 E-7 %) и Zn B-5 %); содержание таких примесей, как
Fe, Ni, Cu, Pb, Si поддерживают на уровне десятых или сотых долей
процента. Железо в качестве протекторного материала используют
либо в чистом виде (Fe-армко) либо в виде углеродистых сталей.
Цинковые протекторы применяют для защиты оборудования, экс-
эксплуатирующегося в морской воде (морских судов, трубопроводов,
прибрежных сооружений). Применение их в слабосоленой, пресной
воде и грунтах ограничено вследствие образования на их поверхно-
поверхности слоев гидрооксида Zn(OHJ или оксида цинка ZnO.
Алюминиевые протекторы применяют для защиты сооружений,
эксплуатирующихся в проточной морской воде, а также для защиты
портовых сооружений и конструкций, располагающихся в прибреж-
прибрежном шельфе.
Магниевые протекторы преимущественно применяют для защи-
защиты небольших сооружений в слабоэлектропроводных средах, где эф-
10.1. Электрохимическая защита 293
фективность действия алюминиевых и цинковых протекторов низка,
— грунтах, пресных или слабосоленых водах. Однако, из-за высокой
скорости собственного растворения и склонности к образованию на
поверхности труднорастворимых соединений, область эксплуатации
магниевых протекторов ограничивается средами с рН = 9,5-10,5.
При защите магниевыми протекторами закрытых систем, напри-
например резервуаров, необходимо учитывать возможность образования
гремучего газа вследствие выделения водорода в катодной реакции,
протекающей на поверхности магниевого сплава. Использование
магниевых протекторов сопряжено также с опасностью развития
водородного охрупчивания и коррозионного растрескивания обору-
оборудования.
10.1.3. Анодная защита
Анодную защиту применяют при эксплуатации оборудования в
хорошо электропроводных средах и изготовленного из легко пасси-
пассивирующихся материалов — углеродистых, низколегированных не-
нержавеющих сталей, титана, высоколегированных сплавов на основе
железа. Анодная защита перспективна в случае оборудования, из-
изготовленного из разнородных пассивирующихся материалов, напри-
например, нержавеющих сталей различного состава, сварных соединений.
При анодной защите потенциал активно растворяющегося метал-
металла смещают в положительную сторону до достижения устойчивого
пассивного состояния (рис. 10.1). В результате происходит не только
существенное (в тысячи раз) снижение скорости коррозии металла,
но и предотвращается попадание продуктов его растворения в произ-
производимый продукт. Смещение потенциала в положительную сторону
можно осуществлять от внешнего источника тока, введением окис-
окислителей в раствор или введением в сплав элементов, способству-
способствующих повышению эффективности протекающего на поверхности
металла катодного процесса.
Анодная защита пассивирующими ингибиторами-окислителями
основана на том, что в процессе их восстановления возникает ток, до-
достаточный для перевода металла в пассивное состояние. В качестве
ингибиторов могут быть использованы соли Fe3+, нитраты, бихро-
маты и др. Применение ингибиторов позволяет защищать металл в
труднодоступных местах — щелях, зазорах. Недостатком этого спо-
способа защиты является загрязнение технологической среды.
Действие окислителя на металл аналогично действию анодной
поляризации. Известны работы Я.М. Колотыркина и Н.Я. Бунэ, в
которых два одинаковых образца никеля подвергали различной об-
29'4 Электрохимическая противокоррозионная защита. Защитные среды Гл. 10
работке. Один образец выдерживали в растворе 1 н. H2SO4, в ко-
котором содержалось некоторое количество окислителя (Fe2(SO4K?
Н2О2, К2СГ2О7 или КМ1Ю4). Второй образец в растворе 1 н. H2SO4
без окислителей поляризовали потенциостатическим методом. Дан-
Данные обоих опытов совпали. Это свидетельствует о том, что как при
химической, так и при электрохимической обработке пассивное со-
состояние металла определяется величиной потенциала, независимо
от способа его достижения.
При анодной защите методом катодного легирования в сплав вво-
вводят добавки (чаще благородный металл), на котором катодные реак-
реакции восстановления деполяризаторов осуществляются с меньшим
перенапряжением, чем на основном металле. Например, как было
показано ранее, в сплавах титана с небольшим количеством пал-
палладия происходит селективное растворение титана, а поверхность
непрерывно обогащается палладием. Палладий выступает как про-
протектор и пассивирует сплав. Аналогичный эффект наблюдается и для
хромистых сталей при введении в сплав благородных металлов.
Анодная защита от внешнего источника основана на пропускании
тока через защищаемый объект и на смещении потенциала коррозии
в сторону более положительных значений.
Установка для анодной защиты состоит из объекта защиты, като-
катода, электрода сравнения и источника электрического тока.
Основным условием возможности применения анодной защи-
защиты является наличие протяженной области устойчивой пассивности
металла при плотности тока растворения металла не более A,5-
бДИО-1 А/м2.
Основным критерием, характеризующим состояние поверхности
металла, является электродный потенциал. Обычно возможность
применения анодной защиты для конкретного металла или спла-
сплава определяют методом снятия анодных поляризационных кривых.
При этом получают следующие данные:
• потенциал коррозии металла в исследуемом растворе;
• протяженность области устойчивой пассивности;
• плотность тока в области устойчивой пассивности.
Эффективность защиты определяют как отношение скорости кор-
коррозии без защиты к скорости коррозии под защитой.
Как правило, параметры анодной защиты, полученные в лабора-
лабораторных и производственных условиях, хорошо согласуются между
собой. В зависимости от конкретных условий эксплуатации область
защитных потенциалов при анодной защите лежит на 0,3-1,5 В поло-
жительнее потенциала свободной коррозии, а скорость растворения
металлов при этом может уменьшится в тысячи раз.
10.1. Электрохимическая защита 295
Существенным ограничением применения анодной защиты яв-
является вероятность возникновения локальных видов коррозии в об-
области пассивного состояния металла. Для предотвращения этого яв-
явления на основании предварительных исследований рекомендуют
такое значение защитного потенциала, при котором локальные виды
коррозии не возникают; или в раствор вводят ингибирующие добав-
добавки. Например, анодная защита стали 12Х18Н10Т в растворах хлори-
хлоридов в присутствие ионов NO^ предотвращает образование питтин-
гов и снижает скорость растворения стали в 2000 раз. В ряде случаев
вследствие повышенной опасности возникновения локальных кор-
коррозионных процессов применение анодной защиты неэффективно.
Резкий рост критического тока пассивации металлов с увеличением
температуры агрессивных сред ограничивает применение анодной
защиты в условиях повышенных температур.
При стационарном режиме работы установки величина тока по-
поляризации, требуемого для поддержания устойчивого пассивного
состояния, постоянно меняется вследствие изменения эксплуатаци-
эксплуатационных параметров коррозионной среды (температуры, химическо-
химического состава, условий перемешивания, скорости движения раствора и
др.). Поддерживать потенциал металлоконструкции в заданных гра-
границах можно путем постоянной или периодической поляризации. В
случае периодической поляризации включение и выключение тока
производят либо при достижении определенного значения потенци-
потенциала, либо при его отклонении на определенную величину. В обоих
случаях параметры анодной защиты определяют опытным способом
в лабораторных условиях.
В качестве катодов используют малорастворимые материалы, на-
например, Pt, Та, Pb, Ni, платинированную латунь, высоколегирован-
высоколегированные нержавеющие стали и др. Схема расположения катодов проек-
проектируется индивидуально для каждого конкретного случая защиты.
Для успешного применения анодной защиты объект должен от-
отвечать следующим требованиям:
• материал аппарата должен пассивироваться в технологической
среде;
• конструкция аппарата не должна иметь заклепок, количество
щелей и воздушных карманов должно быть минимальным, свар-
сварка должна быть качественной;
• катод и электрод сравнения в защищаемом устройстве должны
постоянно находится в растворе.
В химической промышленности для анодной защиты наиболее
пригодны аппараты цилиндрической формы, а также теплообменни-
теплообменники. В настоящее время анодная защита нержавеющих сталей при-
296 Электрохимическая противокоррозионная защита. Защитные среды Гл. 10
меняется для мерников, сборников, цистерн, хранилищ в производ-
производстве серной кислоты, минеральных удобрений, аммиачных раство-
растворов. Описаны случаи применения анодной защиты теплообменной
аппаратуры в производствах серной кислоты и искусственного во-
волокна, а также ванн для химического никелирования.
10.1.4. Кислородная защита
Кислородная защита является разновидностью электрохимиче-
электрохимической защиты, при которой смещение потенциала защищаемой ме-
металлоконструкции в положительную сторону осуществляется путем
насыщения коррозионной среды кислородом. В результате этого ско-
скорость катодного процесса настолько возрастает, что становится воз-
возможным перевод стали из активного в пассивное состояние. По-
Поскольку величина критиче-
критического тока пассивации спла-
bob Fe-Cr, к которым отно-
сятся и стали, существенно
зависит от содержания в них
хрома, ее эффективность воз-
возрастает с увеличением кон-
центрации хрома в сплаве.
Кислородная защита приме-
применяется при коррозии тепло-
теплоэнергетического оборудова-
оборудования, эксплуатирующегося в
<->
t4
о
1
[г
I
„ 8 , 10
со2'г/л
12 14
Рис. 10.2. Зависимость скорости коррозии
низколегированной стали в воде при тем-
температуре 300° С от концентрации кисло-
кислорода в воде
воде при высоких парамет-
параметрах (высокая температура и
давление). На рис. 10.2 представлена зависимость скорости коррозии
низколегированной стали от концентрации кислорода в высокотем-
высокотемпературной воде. Как видно, увеличение концентрации растворен-
растворенного в воде кислорода приводит к первоначальному росту скорости
коррозии, последующему ее снижению и дальнейшей стационар-
стационарности. Низкие стационарные скорости растворения стали (в 10-30
раз ниже имеющих место без защиты) достигаются при содержании
кислорода в воде ~ 1,8 г/л. Кислородная защита металлов нашла
применение в атомной энергетике.
10.2. Изменение состава среды как метод противокоррозионной защиты 297
10.2. Изменение состава среды как метод
противокоррозионной защиты
В промышленных условиях эксплуатации в ряде случаев умень-
уменьшение потерь от коррозии может быть достигнуто при помощи из-
изменения состава агрессивной среды. Используют два приема:
• удаление из агрессивной среды веществ, вызывающих корро-
коррозию металлов;
• введение в агрессивную среду специальных веществ, кото-
которые вызывают значительное снижение скорости коррозионного
процесса. Такие вещества называются замедлителями или ин-
ингибиторами коррозии.
10.2.1. Снижение агрессивности коррозионной среды
Значительное изменение состава коррозионной среды может быть
достигнуто одним из перечисленных способов:
• удалением кислорода при помощи деаэрации раствора, насы-
насыщения его азотом или добавления в него поглотителей кисло-
кислорода;
• удалением кислот путем нейтрализации раствора гашеной из-
известью или едким натром;
• удалением солей из воды, идущей на питание паровых котлов,
путем обработки ее ионообменными смолами;
• вакуумированием.
В случае металлов, пассивирующихся в данной среде, присут-
присутствие в ней кислорода или других окислителей способствует про-
процессу пассивации и ведет к торможению коррозии. Во всех осталь-
остальных случаях окислители стимулируют коррозию металлов. Железо
в аэрированных водных растворах корродирует с кислородной депо-
деполяризацией:
4Fe + 6Н2О + ЗО2 = 4Fe(OHK
Для снижения концентрации растворенного кислорода добавля-
добавляют гидразин или сульфит натрия. Между гидразином и растворен-
растворенным кислородом идет реакция:
N2H4 + О2 = N2 + 2Н2О
Избыток гидразина разлагается на аммиак и азот:
3N2H4 = N2 + 4NH3
298 Электрохимическая противокоррозионная защита. Защитные среды Гл. 10
Присутствие в воде аммиака ведет к увеличению щелочности и по-
поэтому имеет положительный эффект.
Применение сульфита натрия менее эффективно чем гидразина,
т.к. увеличивает содержание солей в воде:
Na2SO3 + 1/2О2 = Na2SO4
Обработка водных растворов гашеной известью широко приме-
применяется в промышленности. Таким образом регулируют рН раство-
растворов, а также снижают содержание в них солей. При подщелачивании
растворов образуются гидроксиды металлов, которые имеют более
низкую растворимость, чем соответствующие соли. Часть гидрок-
сидов выпадает в осадок и содержание ионов металлов в растворе
снижается.
Для глубокой очистки воды с целью предотвращения образова-
образования накипи в паровых котлах проводят ионообменную обработку.
Как правило, применяют серию ионообменных аппаратов. Перво-
Первоначально используют катионнообменные смолы и воду очищают от
катионов металла. На последующих стадиях проводят анионнооб-
менную очистку и освобождаются от анионов сильных и слабых
кислот.
10.2.2. Ингибиторная защита
Согласно стандарту ISO 8044-1986 ингибиторами коррозии (ИК)
называют химические соединения, которые, присутствуя в коррози-
коррозионной системе в достаточной концентрации, уменьшают скорость
коррозии без значительного изменения концентрации любого корро-
коррозионного реагента. Ингибиторами коррозии могут быть и компози-
композиции химических соединений. Содержание ингибиторов в коррози-
коррозионной среде должно быть небольшим.
Эффективность ингибиторов оценивается степенью защиты Z
(в %) и коэффициентом торможения 7 (ингибиторный эффект) и
определяется по формулам:
Z = Kl~K2 . ЮО = ^-^ • 100, A0.3)
где К\ и К2 [г/(м2-ч)] — скорость растворения металла в среде без
ингибитора и с ингибитором соответственно; %\ж%2 [А/см2] — плот-
плотность тока коррозии металла в среде без ингибитора и с ингибитором
соответственно. При полной защите коэффициент Z равен 100 %.
Коэффициент торможения показывает во сколько раз уменьшает-
10.2. Изменение состава среды как метод противокоррозионной защиты 299
ся скорость коррозии в результате действия ингибитора:
7= — = -. A0.4)
ii2 Z2
Z и 7 связаны между собой:
Z = (l--Y 100, A0.5)
7= • A0.6)
1 l-Z/100 V ;
Ингибиторы подразделяются:
• по механизму своего действия — на катодные, анодные и сме-
смешанные;
• по химической природе — на неорганические, органические и
летучие;
• по сфере своего влияния — в кислой, щелочной и нейтральной
среде.
Действие ингибиторов обусловлено изменением состояния по-
поверхности металла вследствие адсорбции ингибитора или образова-
образования с катионами металла труднорастворимых соединений. Защитные
слои, создаваемые ингибиторами, всегда тоньше наносимых покры-
покрытий.
Ингибиторы могут действовать двумя путями: уменьшать пло-
площадь активной поверхности или изменять энергию активации кор-
коррозионного процесса.
В результате адсорбции ингибитора происходит изменение струк-
структуры двойного электрического слоя, в том числе и величины адсорб-
адсорбционного скачка потенциала Ф2. Экранирование части поверхности
(в) сплошной пленкой ингибитора исключает ее из коррозионного
процесса, который протекает на поверхности, равной A — в).
Катодные и анодные ингибиторы замедляют соответствующие
электродные реакции, смешенные ингибиторы изменяют скорость
обеих реакций. Адсорбция и формирование на металле защитных
слоев обусловлены зарядом частиц ингибитора и способностью об-
образовывать с поверхностью химические связи.
Катодные ингибиторы замедляют катодные реакции или актив-
активное растворение металла. Для предотвращения локальной коррозии
более эффективны анионные ингибиторы. Часто для лучшей защи-
защиты металлов используют композиции ингибиторов с различными
добавками. При этом может наблюдаться:
• аддитивное действие, когда ингибирующий эффект отдельных
составляющих смеси суммируется;
300 Электрохимическая противокоррозионная защита. Защитные среды Гл. 10
• антагонизм, когда присутствие одного из компонентов ослаб-
ослабляет ингибирующее действие другого компонента;
• синергизм, когда компоненты композиции усиливают ингиби-
ингибирующее действие друг друга.
Влияние ингибиторов на коррозию можно оценить сравнением
скоростей коррозионного процесса в отсутствии и в присутствии
ингибитора.
Одним из методов изучения механизма действия ингибиторов является
снятие поляризационных (анодных и катодных) кривых. На рис. 10.3
представлены такие кривые для случая кислотной коррозии. Тормо-
Торможение ингибитором одной из стадий коррозионного процесса вызывает
увеличение поляризации. Чем выше эффективность действия ингиби-
ингибитора, тем круче наклон соответствующей поляризационной кривой. На
рис. 10.3 в полулогарифмических координатах показаны кривые катод-
-6 -5
-3 -2 -1
i, (/, А/см2)
Рис. 10.3. Поляризационные кривые, поясняю-
поясняющие эффективность действия ингибитора.
А\ и А2 — анодные поляризационные кривые;
К\ и if2 — катодные поляризационные кривые в
отсутствии {К\ и ii) и присутствии (if2 и А2)
ингибитора
ной (К) и анодной (А) поляризации для раствора кислот в присутствии и
отсутствии ингибитора. Экстраполяция линейных (тафелевских) участ-
участков поляризационных кривых позволяет определить потенциалы кор-
коррозии ?7кор1 и ?^коР2, и скорости коррозии — гкор1 и гкор2. Сопоставление
этих величин показывает, что в присутствии ингибитора Екор смещается
в сторону более положительных значений, а скорость коррозии умень-
уменьшается. Используя значения гкор1 и гкор2, можно оценить эффективность
ингибитора и найти Z и 7»
Неорганические ингибиторы. Способностью замедлять корро-
коррозию металлов в агрессивных средах обладают многие неорганиче-
неорганические вещества. Ингибирующее действие этих соединений обуслав-
10.2. Изменение состава среды как метод противокоррозионной защиты 301
ливается присутствием в них катионов (Са2+, Zn2+, Ni2+, As3+, Bi3+,
Sb3+) или анионов (CrO2", Cr2O2~, NO^? SiO2~? PO3~).
Неорганические катодные ингибиторы ограничивают скорость
коррозии металлов путем повышения перенапряжения катодного
процесса и сокращения площади катодных участков.
Экранирующие катодные ингибиторы — это соединения, кото-
которые образуют на микрокатодах нерастворимые соединения, отлага-
отлагающиеся в виде изолирующего защитного слоя. Для железа в вод-
водной среде такими соединениями могут быть ZnSO4, ZnCb, а чаще
Са(НСО3J.
Бикарбонат кальция Са(НСОзJ — самый дешевый катодный
экранирующий ингибитор, применяемый для защиты стали в си-
системах водоснабжения. Бикарбонат кальция в подщелоченной среде
образует нерастворимые соединения СаСОз, осаждающиеся на по-
поверхности, изолируя ее от электролита.
Катодные ингибиторы, повышающие перенапряжение катодно-
катодного процесса, применяются в тех случаях, когда коррозия проте-
протекает с водородной деполяризацией. В качестве ингибиторов при-
применяют соли, содержащие катио-
катионы некоторых тяжелых металлов
(AsCl3, Bi(SO4K). Происходит кон-
контактное осаждение этих металлов
на стали, вследствие чего повыша-
повышается перенапряжение водорода. На
рис. 10.4 показано влияние неболь-
небольшой добавки AS2O2 @,045 % в пере-
пересчете на мышьяк) на скорость кор-
коррозии углеродистой стали в серной
кислоте.
Анодные неорганические ингиби-
ингибиторы образуют на поверхности ме-
металла тонкие (~ 0,01 мкм) пленки,
которые тормозят переход металла
в раствор. К группе анодных замед-
замедлителей коррозии относятся химические соединения — пленкообра-
зователи и окислители, часто называемые пассиваторами.
Катодно-анодные неорганические ингибиторы, например KJ, КВг
в растворах кислот, тормозят в равной степени анодный и катодный
процессы за счет образования на поверхности металла хемосорбци-
онного слоя.
Пленкообразующие ингибиторы защищают металл, создавая на
его поверхности фазовые или адсорбционные пленки. В их число
20
80 100
40 60
H2SO4, %
Рис. 10.4. Зависимость скоро-
скорости коррозии стали в растворах
H2SO4:
1 — H2SO4; 2 — H2SO4 + As3+
@,045 %)
302 Электрохимическая противокоррозионная защита. Защитные среды Гл. 10
входят NaOH, Na2CO3 и фосфаты. Наибольшее распространение по-
получили фосфаты, которые широко используют для защиты железа и
стали в системе хозяйственных и коммунальных стоков.
В присутствии фосфатов на поверхности железа образуется за-
защитная пленка. Она состоит из гидроксида железа, уплотненного
фосфатом железа. Для большего защитного эффекта фосфаты часто
используются в смеси с полифосфатами.
Пассиваторы тормозят анодную реакцию растворения металла
благодаря образованию на его поверхности оксидов:
Me + пН2О ->> МеОп + 2пН+ + 2пе
Эта реакция может протекать только на металлах, склонных к пас-
пассивации.
Пассиваторы являются хорошими, но опасными ингибиторами.
При неверно выбранной концентрации, в присутствие ионов С1~
или при несоответствующей кислотности среды, они могут ускорить
коррозию металла, и в частности вызвать очень опасную точечную
коррозию.
Хроматы и бихроматы натрия и калия используются как ингиби-
ингибиторы коррозии железа, оцинкованной стали, меди, латуни и алюми-
алюминия в промышленных водных системах. В случае железа действие
хроматов описывают реакциями:
2Fe + 2Na2CrO4 + 2H2O = Cr2O3 + Fe2O3 + 4NaOH
6Fe3O4 + 2Na2CrO4 + 2H2O = Cr2O3 + 9Fe2O3 + 4NaOH
Оксидная пленка состоит из 25 % Сг2О3 и 75 % Fe2O3.
Нитриты применяются в качестве ингибиторов коррозии многих
металлов (кроме цинка и меди) при рН более 5. Они дешевы и эф-
эффективны в случае присутствия ржавчины.
Защитное действие нитритов состоит в образовании поверхност-
поверхностной оксидной пленки по уравнению:
2Fe + NaNO2 + 2H2O = Fe2O3 + NaOH + NH3
Силикаты относятся к ингибиторам смешанного действия, умень-
уменьшая скорости как катодной, так и анодной реакций.
Общая формула силикатов — xSiO2Me2O. Действие силикатов
(рис. 10.5) состоит в нейтрализации растворенного в воде углекис-
углекислого газа и в образовании защитной пленки на поверхности металла.
10.2. Изменение состава среды как метод противокоррозионной защиты 303
°>20
0,15
0,05
о
ОД 0,2 0,3 0,4
Концентрация Na2Si03, %
Пленка не имеет постоянного со-
состава. По структуре она напоминает
гель кремневой кислоты, в которой
адсорбируются соединения железа и
соли жесткости. Ее толщина обычно
равна « 0,002 мм.
Полифосфаты — растворимые в
воде соединения метафосфатов об-
общей формулы (МеРОз)п- Защитное
действие полифосфатов состоит в
образовании непроницаемой защит-
защитной пленки на поверхности металла. В водных растворах происходит
медленный гидролиз полифосфатов, в результате образуются орто-
фосфаты:
Рис. 10.5. Зависимость скорости
коррозии стали в нейтральных
водных растворах от концентра-
концентрации N
Н2О =
нро?- = н+
Н+
В присутствии Са2+ и Fe3+ на поверхности образуется непрони-
непроницаемая защитная пленка:
2РО^~ + ЗСа2+ = Са3(РО4J I
РО^~ + Fe3+ + 2H2O = FePO4 • 2Н2О |
Наибольшее распространение в промышленности получил гекса-
метафосфат натрия. Фосфаты и полифосфаты находят применение
в качестве замедлителей коррозии стали в воде и холодильных рас-
рассолах. Большой эффект достигается при совместном использовании
фосфатов и хроматов.
Органические ингибиторы. Многие органические соединения
способны замедлить коррозию металла. Органические соединения —
это ингибиторы смешанного действия, т.е. они воздействуют на ско-
скорость как катодной, так и анодной реакций. Значительное влияние
на развитие теории ингибирующего действия специальных добавок
оказали исследования А.Н. Фрумкина и его сотрудников. Современ-
Современные представления электрохимической кинетики позволяют в ря-
ряде случаев предвидеть направление течения той или иной реакции
при введении в электролит специальных добавок. Удалось объяс-
объяснить основные закономерности, наблюдающиеся при использовании
в качестве ингибиторов галоидных ионов, органических катионов и
соединений молекулярного типа. Экспериментальные данные пока-
показали, что многие химические соединения адсорбируются на поверх-
304 Электрохимическая противокоррозионная защита. Защитные среды Гл. 10
ности металла в соответствии с изотермами Ленгмюра или Темкина.
Выявление зависимости эффективности ингибитора от химиче-
химической структуры органического соединения является важнейшей на-
научно-технической задачей. При изучении реакционной способности
отдельных классов соединений, обладающих единым центральным
реакционным ядром, свойства конкретного соединения можно про-
прогнозировать, исходя из сведений о других соединениях этого класса.
Если в качестве стандартного берут соединение, описываемое в
общем виде X-Y-H, то по отношению к нему следует рассматривать
соединение X-Y-R, отличающееся радикалом R. Если эти вещества
не вызывают блокировки поверхности, а изменяет только энергию
активации реакции коррозии, то справедливо уравнение:
где 7R и 7н — коэффициенты торможения реакции коррозии со-
соответственно каждым из соединений; р — реакционный параметр,
принятый за единицу для стандартного соединения; а — константа.
Если реализуются оба механизма действия ингибитора — бло-
блокировка поверхности и снижение энергии активации, то применяют
уравнение:
ig(W-m) = р(г- ig(eR/eH), (ю.8)
где в — степень заполнения поверхности каждым из ингибиторов.
Различные аспекты этой проблемы рассматриваются в ряде моно-
монографий и обзорах.
Органические ингибиторы адсорбируются только на поверхно-
поверхности металла. Продукты коррозии их не адсорбируют. Поэтому эти ин-
ингибиторы применяют при кислотном травлении металлов для очист-
очистки последних от ржавчины, окалины, накипи. Органическими ин-
ингибиторами коррозии чаще всего бывают алифатические и аромати-
ароматические соединения, имеющие в своем составе атомы азота, серы и
кислорода.
Амины применяют как ингибиторы коррозии железа в кислотах
и водных средах.
Тиолы (меркаптаны), а также органические сульфиды и дисуль-
дисульфиды проявляют более сильное ингибирующее действие по сравне-
сравнению с аминами. Основные представители этого класса—тиомочеви-
на, бензотриазол, алифатические меркаптаны, дибензилсульфоксид.
Органические кислоты и их соли применяют как ингибиторы кор-
коррозии железа в кислотах, маслах и электролитах, а также как инги-
ингибиторы процесса наводороживания. Наличие в органических кисло-
кислотах амино- и гидроксильных групп улучшает из защитные свойства.
10.2. Изменение состава среды как метод противокоррозионной защиты 305
Среди этой группы особенно выделяют бензоат натрия.
Спирты, особенно многоосновные — эффективные ингибиторы
коррозии. В водных системах охлаждения — этиленгликоль НОСН2-
СН2ОН, в морской и речной воде — глюконат натрия NaOOC(CHO-
НLСН2ОН.
Необычайно широко применение ингибиторов в промышленности.
В щелочных средах ингибиторы используются при обработке ам-
фотерных металлов, защите выпарного оборудования, в моющих со-
составах, для уменьшения саморазряда щелочных источников тока.
В последние годы появились новые смесевые ингибиторы для
защиты стальной арматуры в железобетоне. Эти соединения — лиг-
носульфонаты, таннины, аминоспирты — способны образовывать с
катионами железа труднорастворимые комплексы. Среди них осо-
особое внимание заслуживают таннины, благодаря их положительному
влиянию на бетон и способности взаимодействовать с прокорроди-
ровавшей сталью. Новый класс ингибиторов — это мигрирующие ин-
ингибиторы. Они обладают способностью диффундировать через слой
бетона и адсорбироваться на поверхности стальной арматуры, замед-
замедляя ее коррозию. Впервые мигрирующие ингибиторы — MCI 2000
и 2200 были применены американской фирмой Cortec Corporation. В
настоящее время появились отечественные разработки — ингибитор
ИФХАН-16.
Из ингибиторов для нейтральных сред следует выделить группу
ингибиторов для систем охлаждения и водоснабжения. Видное место
здесь занимают полифосфаты, поликарбоксильные аминокислоты,
так называемые комплексоны — ЭДТА, НТА и др.; и их фосфорсо-
фосфорсодержащие аналоги — ОЭДФ, НТФ, ФБТК. Комплексоны защищают
металлы только в жестких водах, где они образуют соединения с
катионами Са2+ и Mg2+.
В мягких водах хорошие результаты получены с солями высших
карбоксилатов, на основе которых созданы ингибиторы ИФХАН-31
и -34. Они надежно защищают охлаждающие системы, состоящие
из различных конструкционных материалов (Fe, Си, Al, Zn и их
сплавы).
Летучие ингибиторы являются современным средством защиты
от атмосферной коррозии металлических полуфабрикатов и гото-
готовых изделий на время их хранения и транспортировки. Принцип
действия летучих ингибиторов коррозии заключается в образовании
паров, которые диффундируют через слой воздуха к поверхности
металла, и защищают ее.
Летучие ингибиторы коррозии раньше использовались преиму-
преимущественно для защиты военной техники и энергетического оборудо-
306 Электрохимическая противокоррозионная защита. Защитные среды Гл. 10
вания. В последние годы к известным летучим ингибиторам НДА,
КЦА, Г-2, ИФХАН-1, ВНХ-Л-20, ИФХАН-100, ВНХЛ-49 добавился
ряд новых — ИФХАН-8А, -112, -118 и ВНХ-ЛФ-408. Установлена
способность лучших летучих ингибиторов защищать металл от кор-
коррозии длительное время (более 3-х месяцев) даже после удаления их
из упаковочного пространства — эффект последействия.
На практике получили применение пассивирующие растворы ИФ-
ХАН-39А и ИФХАН-33-ЛГ, которые применяют для защиты окси-
оксидированной и фосфатированной стали взамен их промасливания.
Они пропитывают пористые покрытия и после сушки придают ему
антикоррозионную стойкость. В последние годы видное место за-
заняли ингибированные восковые составы. Объединяя в себе полез-
полезные качества тонкопленочных покрытий и масел, они формируют
на поверхности металлов тонкие пластичные пленки. Наличие в них
ингибиторов в совокупности с гидрофобностью воска обеспечива-
обеспечивает сильный эффект антикоррозионного последействия. В настоящее
время ведущую роль в практике противокоррозионной защиты игра-
играют пленкообразующие ингибированные нефтяные составы. Широ-
Широкую известность получили Мовиль, Мовитин, ИФХАН-29А, НГ-216,
Оремин, ИФХАН-30А и -30Т.
Коррозионная активность нефти колеблется в очень широких
пределах. Это обусловлено различным содержанием в ней коррози-
онноактивных примесей и сероводорода. В нефти может содержать-
содержаться также неэмульгированная вода и вода в виде устойчивой эмульсии.
Концентрация солей в воде может достигать 10 %. Опасность корро-
коррозии оборудования сохраняется на всех стадиях — при добыче, транс-
транспортировке, хранении и переработке нефти. Поэтому одни и те же
типы ингибиторов используются как на стадии добычи, так и на ста-
стадии переработки нефти. Ингибиторы, которые добавляют в нефть,
адсорбируются на поверхности металла полярной группой таким
образом, что углеводородная цепь оказывается на внешней стороне
образовавшейся пленки, вызывая гидрофобизацию поверхности. К
ней присоединяется масло или другие углеводороды, благодаря чему
на поверхности металла возникает двойная пленка, препятствующая
протеканию коррозии. Хорошими защитными свойствами обладают
соединения, в молекулу которых входят кислород и длинная угле-
углеводородная цепь с более чем десятью атомами углерода. Широкое
применение в нефтедобыче получила технология рассредоточенно-
рассредоточенного ингибирования, суть которого заключается в приближении точек
его подачи к наиболее коррозионно-опасным участкам. Кроме отече-
отечественного ингибитора Олазол-Т2П, применяют импортные продук-
продукты Корексит-6350 (Налко-Эксен), ИСА-148 (Серво).
10.2. Изменение состава среды как метод противокоррозионной защиты 307
Проблема внутренней коррозии газопроводов является одной из
важнейших проблем в газовой промышленности. Почти все место-
месторождения содержат в составе газа большое количество СО2 (до 20
об.%), а в некоторых случаях и сероводород (до 25 об.%) — напри-
например, Астраханское месторождение. Защита ингибиторами внутрен-
внутренней поверхности трубопроводов является одним из действенных ме-
методов противокоррозионной защиты.
Ингибитор коррозии — антивспениватель ИФХАНГАЗ-1 полу-
получил широкое применение в газовой промышленности. В результате
взаимодействия ингибитора с сероводородом на поверхности метал-
металла возникает прочное соединение, которое затрудняет протекание
электрохимических реакций.
Ингибиторы коррозии серии СЕКАНГАЗ (Секангаз 9, 9Б и 10)
разработаны совместно ВНИИГАЗом, ИФХАН и французской фир-
фирмой СЕКА. Их основу составляют производные жирных аминов. Эти
вещества представляют собой полярные молекулы, адсорбирующие-
адсорбирующиеся на поверхности металла. Жирная липофильная цепочка удержива-
удерживает масляный слой, который препятствует контакту воды с металлом.
Совместно с немецкими фирмами БАСФ и ХЕХСТ созданы ин-
ингибиторы Сепакор 5478 и Додиген 4482-1. Ингибитор Сепакор 5478
рекомендован для непрерывной закачки в пласт. Расход ингибитора
составляет 14 л на 1 млн м3 газа. Ингибитор подается в скважину
в виде 16% раствора в метаноле. В результате испытаний показа-
показано, что общая скорость коррозии составила 0,005 мм/год, а степень
защиты от охрупчивания достигла 98 %. Аналогичные результаты
получены и для ингибитора Додиген 481. Его термостабильность
равна 200° С и он рекомендован для технологий, предусматриваю-
предусматривающих как непрерывную, так и периодическую закачку в скважины и
наземные трубопроводы.
Методические рекомендации к главе 10
После изучения материала, изложенного в главах 9-10, студенты
должны знать:
• методы защиты машин и аппаратов от коррозии;
• технологию применения конкретного метода и оценку его эф-
эффективности.
Студенты должны уметь на основе анализа технологических
параметров выбрать и обосновать оптимальный метод защиты обо-
оборудования от коррозии.
308 Электрохимическая противокоррозионная защита. Защитные среды Гл. 10
Вопросы для самопроверки
1. Основные принципы, положенные в основу метода электрохи-
электрохимической защиты.
2. Поясните сущность метода анодной защиты.
3. Поясните сущность метода катодной защиты.
4. Что представляет из себя протекторная защита? Какие металлы
применяют в качестве протекторов?
5. В каких условиях применяется кислородная защита? Сущность
этого метода.
6. Как можно снизить агрессивность коррозионной среды? При-
Приведите примеры.
7. Что называется ингибиторами? Каков механизм их действия?
8. Какие неорганические ингибиторы вам известны? На чем осно-
основан их принцип действия?
9. Приведите примеры органических ингибиторов и укажите об-
области их применения.
Темы для самостоятельных и контрольных работ
1. Опишите сущность метода электрохимической защиты. Ука-
Укажите ее разновидности.
2. Обоснуйте сущность противокоррозионной защиты при изме-
изменении состава рабочей среды. Приведите примеры из произ-
производственной практики снижения агрессивности коррозионной
среды. Объясните сущность ингибиторной защиты. Приведите
примеры.
Литература к главам 9 и 10
1. Кузуб B.C. Анодная защита металлов от коррозии. - М.: Химия, 1983.
182 с.
2. Прикладная электрохимия / Под ред. А.П. Томилова. - М.: Химия, 1984.
520 с.
3. Аколъзин А.П., Жуков А.И. Кислородная коррозия оборудования хими-
химических производств. - М.: Химия, 1985. 240 с.
4. Вапнер Я.В., Дасоян М.А. Технология электрохимических покрытий. -
Л., 1972.316 с.
5. Цупак Т.Е., Новиков В. Т., Начинов Г.Н., Ваграмян Т.А. Лабораторный
практикум по технологии электрохимических покрытий. - М.: Химия,
1980.160 с.
10.2. Изменение состава среды как метод противокоррозионной защиты 309
6. Фокин М.Н., Емельянов Ю.В. Защитные покрытия в химической про-
промышленности. - М.: Химия, 1982. 256 с.
7. Елисаветский A.M. и др. Лакокрасочные покрытия. Технология и обо-
оборудование: Справочник. — М.: Химия, 1992. 412 с.
8. Лакокрасочные покрытия / Под ред. Е.Н. Владычиной. - М.: Химия,
1972. 304 с.
9. Бэкман В., Швенк В. Катодная защита от коррозии: Справочник / Под
ред. И.В. Стрижевского. -М.: Металлургия, 1984. 495 с.
10. Иосселъ Ю.Я., Кленов Г.Э. Математические методы расчета электрохи-
электрохимической коррозии и защиты металлов: Справочник. - М.: Металлургия,
1984.271 с.
11. Иванов В. Т., Глазов Н.П., Макаров В.А. Математическое моделирова-
моделирование электрохимической защиты // В сб. Итоги науки и техники. Сер.
Коррозия и защита от коррозии. - М.: ВИНИТИ, 1987. Т. 13. С. 117.
12. Красноярский В.В. Электрохимический метод защиты металлов от кор-
коррозии. -М.: Машгиз, 1961. 125 с.
13. Антропов Л.К, Макушин Е.М., Панасенко В.Ф. Ингибиторы коррозии
металлов. -Киев: Технпса, 1981. 183 с.
14. Алексеев С.Н., Ратинов В.Б., Розенталъ Н.К., Кашурников Н.М. Инги-
Ингибиторы коррозии стали в железобетонных конструкциях. - М.: Строй-
издат, 1985.272 с.
15. Решетников СМ. Ингибиторы коррозии металлов. - Л.: Химия, 1986.
144 с.
16. Иванов Е.С. Ингибиторы коррозии металлов в кислых средах: Спра-
Справочник. — М.: Металлургия, 1986. 175 с.
17. Розенфелъд И.Л., Персианцев В.П. Ингибиторы атмосферной корро-
коррозии. - М.: Наука, 1985. 278 с.
18. Герасименко А. А., Александров Я.И, Андреев И.Н. и др. Защита от кор-
коррозии, старения и биоповреждений машин, оборудования и сооружений:
Справочник. - М.: Машиностроение, 1987. 784 с.
310
Приложение
ПРИЛОЖЕНИЕ
Таблица ГОСТов по коррозии и защите от коррозии
ГОСТ 51161-98
ГОСТ 5272-68
ГОСТ 5632-72
ГОСТ 6032-75
ГОСТ 9.011-79
ГОСТ 9.017-74
ГОСТ 9.019-74
ГОСТ 9.020-74
ГОСТ 9.021-74
ГОСТ 9.024-74
ГОСТ 9.039-74
ГОСТ 9.040-74
ГОСТ 9.301-86
ГОСТ 9.302-88
ГОСТ 9.710-84
ГОСТ 9.902-81
ГОСТ 9.903-81
ГОСТ 9.904-82
ГОСТ 9.905-82
ГОСТ 9.906-83
Трубопроводы стальные магистральные. Общие требования
к защите от коррозии
ЕСЗКС. Коррозия металлов. Термины
Стали высоколегированные и сплавы коррозионностойкие,
жаростойкие и жаропрочные
Стали и сплавы. Методы испытания на межкристаллитную
коррозию ферритных, аустенито-мартенситных, аустенито-
ферритных и аустенитных коррозионно стойких сталей и
сплавов на железоникелевой основе
ЕСЗКС. Полуфабрикаты из алюминия и алюминиевых спла-
сплавов
ЕСЗКС. Алюминий и сплавы алюминиевые. Методы ускорен-
ускоренных испытаний на общую коррозию
ЕСЗКС. Сплава алюминиевые и магниевые. Методы ускорен-
ускоренных испытаний на коррозионное растрескивание
ЕСЗКС. Магний и сплавы магниевые. Методы ускоренных
испытаний на общую коррозию
ЕСЗКС. Алюминий и сплавы алюминиевые. Методы ускорен-
ускоренных испытаний на межкристаллитную коррозию
ЕСЗКС. Магний и сплавы магниевые. Методы ускоренных
испытаний на общую коррозию
ЕСЗКС. Коррозионная агрессивность атмосферы
ЕСЗКС. Металлы и сплавы. Расчетно-экспериментальный ме-
метод определения коррозионных потерь в атмосферных усло-
условиях
ЕСЗКС. Покрытия металлические и неметаллические, неор-
неорганические. Технические требования
Покрытия металлические и неметаллические неорганиче-
неорганические. Методы контроля
ЕСЗКС. Старение полимерных материалов. Термины и опре-
определения
ЕСЗКС. Материалы полимерные. Методы ускоренных испы-
испытаний на коррозионную агрессивность
ЕСЗКС. Стали и сплавы высокопрочные. Методы ускоренных
испытаний на коррозионное растрескивание
ЕСЗКС. Сплавы алюминиевые. Метод ускоренных испыта-
испытаний на расслаивающую коррозию
ЕСЗКС. Методы коррозионных испытаний. Общие требова-
требования
ЕСЗКС. Станции климатические испытательные. Общие тре-
требования
Приложение 311
ГОСТ 9.907-83
ГОСТ 9.908-85
ГОСТ 9.912-89
ГОСТ 9.914-91
ЕСЗКС. Металлы, сплавы, покрытия металлические. Методы
удаления продуктов коррозии после коррозионных испыта-
испытаний
ЕСЗКС. Металлы и сплавы. Методы определения показателей
коррозии и коррозионной стойкости
ЕСЗКС. Стали и сплавы коррозионно-стойкие. Методы уско-
ускоренных испытаний на стойкость против питтинговой корро-
коррозии
ЕСЗКС. Стали и сплавы коррозионно-стойкие. Методы испы-
испытаний на стойкость против межкристаллитной коррозии
Аббревиатура
АПП — активно-пассивный переход.
ДЭС — двойной электрический слой.
ГЦР — гранецентрированная решетка.
ИК — ингибитор коррозии.
КР — коррозионное растрескивание.
КРН — коррозионное растрескивание под напряжением.
КЭП — комбинированные электрохимические покрытия.
ЛКМ — лакокрасочные материалы.
МКК — межкристаллитная коррозия.
ОЭС — оже-электронная спектроскопия.
ОЦР — объемноцентрированная решетка.
ПДК — предельно допустимая концентрация.
ПК — питтинговая коррозия.
ТЭК — теплоэнергетический комплекс.
Принятые обозначения
А — анион. а — активность.
А — величина работы. а — степень диссоциации.
^ме — атомная масса метал- а — фаза.
ла. b — адсорбционный коэффи-
[А], [В], ..., [D] — концен- циент в уравнении изотер-
трации химических реаген- мы.
тов. Ьа — тафелевский наклон.
ао — адсорбционный коэф- Ссв — число степеней свобо-
фициент. ды.
аМеп+ — адсорбционный ко- 6 — толщина диффузионного
эффициент. слоя.
312
Приложение
D — коэффициент диффузии.
е — элементарный заряд,
электрон.
Е — энергия, энергия актива-
активации.
Е — потенциал.
Ер —равновесный потенциал.
Eq — стандартный потенци-
потенциал.
Екр — критический потенци-
потенциал.
^шр — потенциал свободной
коррозии металла.
^пас — потенциал пассива-
пассивации.
^по — потенциал питтинго-
образования.
^пк — потенциал питтинго-
вой коррозии.
^рп — потенциал репассива-
ции.
^red-ox — окислительно-вос-
окислительно-восстановительный потенци-
потенциал.
^пп — потенциал перепасси-
перепассивации.
/ — коэффициент, отражаю-
отражающий функцию распределе-
распределения в уравнении изотермы.
F = 96491,2 к/г-экв — число
Фарад ея.
G — изобарно-изотермичес-
кий потенциал, свободная
энергия Гиббса.
h — толщина оксидной плен-
пленки.
А^ — исходная толщина ок-
оксидной пленки перед опы-
опытом.
Н — энтальпия.
г — плотность тока.
/
га-> гк — плотность анодного и
катодного тока.
го — плотность тока обмена.
^шр — плотность тока (ско-
(скорость) коррозии.
— сила тока.
&ъ ^2? &з? • • • ? ki — константы
скорости.
кад — константа скорости ад-
адсорбции.
кдес — константа скорости де-
десорбции.
К — катион.
К — константа равновесия.
Ка — прочностной показа-
показатель коррозии.
т — массовый показатель
коррозии.
К^ — очаговый показатель
коррозии.
Ку — объемный показатель
коррозии.
Кд — коэффициент диффу-
диффузии.
^шм — число компонентов.
^мех — механический показа-
показатель коррозии.
Кп — глубинный показатель
коррозии.
/i — химический потенциал.
т — масса.
М — молекулярная масса.
Me — металл.
п — число электронов.
па—число переноса анионов.
пк — число переноса катио-
катионов.
пэ — число переноса электро-
электронов.
TVa — число Авогадро.
L — дислокация.
Р — давление.
Приложение
313
Ps — давление насыщенного
пара.
Ро2 — парциальное давление
кислорода.
Pq2 — равновесное давление
кислорода, упругость дис-
диссоциации оксида.
р — реакционный параметр в
реакциях ингибирования.
в — величина поверхности
металла.
Q — количество теплоты.
R — газовая постоянная.
р — плотность.
si, S2 — плоскости кристал-
кристаллических решеток.
S — площадь.
S — энтропия.
т — время.
тинд — время индукционного
периода.
тпит — время жизни питтинга.
t — температура в °С.
Т — абсолютная температура
в К.
То — температура равнове-
равновесия твердой и жидкой фаз.
Т§ — температура замерзания
(затвердения).
U — внутренняя энергия.
v — скорость химической ре-
реакции.
^ад — скорость адсорбции.
^пк — условная скорость пит-
тинговой коррозии.
^дес — скорость десорбции.
V — объем.
Ф1 — изменение потенциала
в диффузной части двойно-
двойного электрического слоя.
Ф2 — изменение потенциала в
адсорбционной части двой-
двойного электрического слоя.
О — угол разориентирования
кристаллов.
П — число переменных пара-
параметров.
Ф — число фаз.
аи — пороговое напряжение.
7 — фаза.
7 — ингибиторный эффект,
коэффициент торможения.
Z — степень защиты.
314
Предметный указатель
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
Адгезия 13, 36, 44, 225, 226,
236, 245, 252
Адмиралтейский металл 206
Адсорбат 37, 39, 40^2
Адсорбция
газов 37—40
диссоциативная 103
изотерма Ленгмюр а 37-39
изо т ерма л огарифмич еская
(Темкина) 39
кислорода А0-А2
мономолекулярная 39, 40,
41
полимолекулярная 39, 40,
41,42
смеси газов 39
уравнение 38-39
физическая 37, 39, 40^2
химическая 37, 39, А0-А2
Азот 167, 190
Активаторы питтинговой кор-
коррозии 124-128, 143
Активное растворение метал-
металлов 92-94, 112-113
Активное состояние 93
Активность 69, 70, 71, 77, 81
Алюминий 170, 172, 193, 194,
200-203,275,276
влияние на скорость окис-
окисления 54, 200
свойства оксида 61,62
сплавы 193,194,196,203
Аммиак 167
Андезит 227
Анодная защита 289, 293-296
Анодирование 265, 266
Аномальное растворение
110-112
Антегмит 255
Асбест 227
Асбоволокнит 246
Атмосферная коррозия 14,
151-153
Атомные радиусы 51
Атомы дисслоцированные
23-25
Аустенит 181, 189, 196, 197
Базальт 227
Базис питтингостойкости 126,
146
Бетон 236-239
Бештаунит 227
Биоциды 158
Бронза 134, 206, 207, 208
алюминиевая 134, 208
кремнистая 208
В
Вакансии 24, 25, 116,267
Ванадий
влияние на скорость окис-
окисления 58, 164
Ванадиевая коррозия 58
Винипласт 244-245
Влажность критическая 151
Внутренняя энергия 30
Вода 21, 151,237
адсорбированная 21, 237
Водородная
деполяризация 71, 88-90
коррозия 164-167
хрупкость 164
Водородный электрод 70
Вольфрам 189
влияние на скорость окис-
окисления 48, 55
Воронение 264
Вюстит49, 64, 114
Предметный указатель
315
Газовая постоянная 55-56, 69
Газовая концентрационная по-
поляризация 89, 91
Гальвано статический метод
78,145-146
Гематит 49, 114
Гидратация 67
Гранит 227, 228
Граница раздела фаз 67-69
Графит 181, 182, 253, 254, 255
Графитовые материалы 21,
253-256
д
Давление
равновесное 32, 40
парциальное 32, 57
Двойной электрический слой
(ДЭС) 68
Деполяризатор 71,84
Деполяризация
водородная 71, 88
кислородная 71, 90
Дефекты кристаллической
структуры 23-30
Диабаз 227, 228, 229
Диаграммы
потенциал -рН 72, 73, 74
коррозионные 91-99, 152,
155
Пурбе 72-75
состояния системы
Fe-C 180
Fe-Cr 185
Fe-NiUl
Дислокации 23-26, 127, 267
Диполь 68, 69
Диффузия 46,47, 50-54,79-81
влияние на скорость газо-
газовой коррозии 46
законы Фика 46, 80
Дюралюмины 203
Ж
Жаропрочность 21
сталей 22, 170
Жаростойкость 21, 54, 59-64,
170,192,193,277
Жаростойкие сплавы 62, 170,
192, 193, 194, 195, 196
Железо
диаграммы состояния 180,
185, 187, 189
пленки оксидные 49, 54, 56,
62,64
растворение 102-105
свойства оксидов 49
температурная устойчи-
устойчивость 49, 64
Железобетон 237
Зависимость тафелевская 83,
84, 94, 96, 104
Зависимость скорости корро-
коррозии от состава раствора 99-101
Закон
распределения (Генри) 39
Тафеля 82
ФарадеяПЪ, 80, 156
Фика 80
Защита от коррозии
анодная 288, 289, 293-296
катодная 288, 289-291
кислородная 296
протекторная 291-293
Защитный эффект 289
И
Изобарно-изотермический по-
потенциал 30, 34, 35
Изотерма
Ленгмюра 37-39
316
Предметный указатель
Темкина 39
уравнение 39
Ингибиторы 298-307
неорганические 300-303
органические 303-307
эффективность 298-299
Индукционный период 122,
123,125
Инконель211
Ионные радиусы 51
К
Кавитационная эрозия 140
Кадмий 218
Кадмирование 268-269
Каломельный электрод срав-
сравнения 71
Каменное литье 227-229
Канталь 194
Карбид
железа 179, 192
хрома 131-132, 184, 189,
192, 195
Катодная защита 288, 289-291
Каучуки 240, 249-253
Керамика огнеупорная
235-236
Керамические материалы
232-236
Кинетика
газовой коррозии 44^8
диффузионная 79-81
закон роста пленки
линейный 45^6
параболический А6-А1
логарифмический 48
электродных реакций
78-79
Кислородная защита 296
Кислородная деполяризация
71,90
Кобальт 59, 60, 194
Конвекция 79
Константа
равновесия 31, 32
скоростиЗЯ, 81-82
Концентрационная поляриза-
поляризация 79-81
Коррозия
атмосферная 14, 151-153
биологическая 156
ванадиевая 111
газовая 14
диаграммы 97-99, 152, 155
избирательная 16
кавитационная 16, 140
канавочная 162
контактная 14, 122,
134-136
межкристаллитная 16,
122,130-133
морская 157-159
ножевая 133
общая {определение) 12
питтинговая 121, 123-128,
143-145
потенциал 84
подземная 14, 153-157
при трении 15, 140
продукты 13
радиационная 14
скорость 44, 45, 78, 79-81,
82,83
сплошная 15
фреттинг 15, 140
химическая (опред.) 14
щелевая 16, 121
эл ектрохимич еская
(опред.) 14
язвенная 121, 128-130
Коррозионно-механическое
разрушение 136-137
Коррозионное растрескивание
136,137-139
Коррозионная усталость 136,
139-140
Конструкционные особенности
влияние на коррозию 121,
152,159-163
Предметный указатель
317
Коэффициент
защитного действия 290
избирательности 106
Краски 282-286
Кремний
влияние на скорость окис-
окисления 54, 194-195, 198, 203
оксид 203,221,229
Кристаллизация металла 27,
28
Кристаллографическая струк-
структура 22-27
Л
Лаки 158, 282-288
Лакокрасочные покрытия 158,
282-288
Латунь 16, 107,205-207
Легирование 183-191
Ленгмюр
изо т ерма 3 7-3 9
Локальная коррозия (виды)
121-123
Лужение 279
состояние 10
статистика 10
Метод
АМУ 145
ВУ 145
ДУ 145
испытаний 141
против локальных видов
коррозии 143
при коррозионно-механи-
ческом воздействии 147
электрохимический 145
Механизм химической корро-
коррозии 50-54
Миграция 51-54
Молибден 172, 188
влияние на скорость окис-
окисления 188
сплавы 209-210
Монель-металл 209
Мониторинг коррозионный
148
Морская латунь 206
Морская коррозия 157-159
М
Магналии 203
Магнетит 49, 114
Магний 203-204
Марганец 189-190
Медь 134, 190,204-208
Межкристаллитная коррозия
16, 122, 130-133
Металл
изменение свободной энер-
энергии 34-3 5
структура 22-30
схема окисления 36, 45, 50,
52-54
Металлизация напылением
279-281
Металлофонд
Н
Наводораживание металла 89,
164-168
Нернста уравнение 69, 70, 71
Никель 55, 170, 184, 208-211
диаграмма состояния 187
сплавы 189, 194, 195, 196,
199,209-211
устойчивость в газовых
средах 59, 60
Никелирование 271-272
Нимоник 211
Ниобий 190
Нирезист 196
Нихром 210
Нихросилаль 195
Ножевая коррозия 133
318
Предметный указатель
О
Обесцинкование латуни 16,
134
Оксидирование 263-264
Олифа 283
Олово 211
белое 211
серое 211
покрытия 269
«Отказы» оборудования, ста-
статистика 12
П
Пары дифференциальной
аэрации 135
Пассивация металлов 92-93
Пассивность 92, 93, 112-116,
184,186,288-291,293-296
Пассивирование 264
Перлит 129, 181
Перепассивация 92-93,
112-116,288
Питтинг (точечная коррозия)
123
Питтинги 16, 121, 123-128
Питтинго стойкость 125, 126,
144,186,288
Плакирование 202, 203, 222,
Пластификаторы 283
Пленки
на железе 42, 49-50, 56
на металле 42, 46^8, 54
оксидные 42, 43, 49
пассивирующие 112-116
фосфатные 262-263
Пленкообразователь 283
Плотность тока коррозии 85
Показатель коррозии 16-18,44
Покрытия
гальванические 266-273
жаростойкие защитные
274-281
лакокрасочные 282-286
стекловидные 229-232, 233
Поливинилхлорид 244
Полимерные материалы
240-242
Полипропилен 244
Полистирол 245
Полиэтилен 242
Поляризационная кривая
(определение) 78, 83, 84-85
Порядок реакции по Н+ при
растворении^^ 103
Постоянная газовая 56, 69
Потенциал
водородного электрода 88
кислородного электрода
90-91
коррозии 85, 190
критический 125, 146
необратимый 70
пассивации 113-114, 288,
289
перепассивации 115, 288,
289
питтинго образования 125,
145-146
равновесный 69, 78
«свободной» коррозии 84, 85
стандартный 70
стационарный 70, 84
репассивации 125, 126
Потенциостатический метод
78,145-146
Потери от коррозии 10-12
Почвенная коррозия 153-157
Правило
Таммана 184
фаз (Гиббса) 30
Проводимость (р — п) 50
Протекторная защита 86,
291-293
Работа 30
Равновесие 31
Предметный указатель
319
адсорбционное 38
диаграмма Пурбе 72-77
Разность потенциалов
механизм возникновения
67-69
Растворение металла 92
в активном состоянии
93-95
избирательное ПО, 191
селективное 134, 221
Ржавчина 178
Реакция
анодная растворения ме-
металлов 71, 81, 92-94
катодные сопряженные 71
Резины 249-253
Реновация 11
Репассивация 125
Ресурсосберегающие решения
10-12
ионизации 81-83, 94, 96
Сплошность пленки 43, 44, 61
Стали
аустенитные 181, 189, 196,
197
аустенитно-ферритные
181, 189, 196, 199
мартенситные 181, 189,
196
ферритныеШ, 189, 196,
198
Стандарты 12-13
Станиоль 212
Стекло 229-230
Стеклотекстолит 248
Стойкость коррозионная 141
алюминия 200-203
никеля 208-210
шт/ш 201, 208, 214, 220,
221
Свинец 212-216
покрытия 269-271, 279
Свободная энергия Гиббса 31,
34,35,61,72
Сегрегация 23-27
Селективность (коэф.) 106
Селективное вытравливание
16,106,110,122,133-134,206
Сиккативы 284
Силаль 196
Силиконовые
смолы 248
каучуки 249
Сил-никель 272
Силумины 203
Сильхром 192
Ситаллы 231
Скорость
газовой коррозии 44^5
электрохимической корро-
зии 78, 81-83
Стадия замедленного разряда-
Тантал 221-222
Тафелевская зависимость 82,
94, 96, 99, 100, 104, 105
Тафелев наклон 82, 83, 89, 91,
94
Текстолит 248
Температура
влияние на скорость газо-
газовой коррозии 55-57
Теория
жаростойкого легирования
59-64
замедленного разряда 81-83
микроэлементов 86
Термины 12-13
Термоалитирование 275-277
Термодинамика
газовой коррозии 30-32, 34
процессов коррозии 30, 34,
69, 88, 90
электрохимической корро-
коррозии 69, 73-77, 88, 89
320
Предметный указатель
Термодинамическая устойчи-
устойчивость 72-77
Термосилицирование 275,
277-278
Термохромирование 275,
277-278
Титан 21, 218-221
Ток
диффузионный предельный
80
коррозии 85-87
обмена 68
Транспассивация (перепасси-
(перепассивация) 92, 113-116, 288-289,
293-296
Турбулевая синь 141
Угол разориентировки 26-27
Уравнение
Генри 39
для водородного электрода
71,88
Нернста 71
Тафеля 82, 94, 96, 99, 100,
104
Фарадея1%, 80, 156
Фика 46
Эванса 47
Усталостная прочность 137,
139-140
ц
Цемент 236-239
Цементит 58, 164, 181, 182
Цинк 216-218
Цинкование 268-269
Числа переноса 50
Число Фарадея 79
Чугун
алюминиевый 196
кремнистый 196
никелевый 195
никелъ-медно-кремнистый
196
никель-хромо-кремнистый
195
хромистый 195
Ф
Факторы коррозии
внутренние 13
внешние 13
Фаолит 246, 248
Фарадей (закон, число) 78, 79,
80, 156
Фарфор 235
Феррит 178, 181,189, 196, 198
Ферритно-перлитная структу-
структура 181
Ферросилид 196
Фехраль 193
Фик (закон) 80
Фосфатирование 262-263
Фреттинг-коррозия 15, 140
Фторопласт-3 245
Фторопласт-4 245
X
Хастеллой 209, 210
Хемосорбированный слой
40^2
Хемосорбция 37
Химический потенциал 30
Хлор 21, 172-174
Хлористый водород 172-174
Хром 34, 35,43,45, 51,55,60,
ПО, 111, 114, 184, 185
влияние на скорость окисле-
Предметный указатель
321
ния при высоких темпера-
турах 35, 43, 54, 166-171,
191-194
свойства оксида 62,
184-187
сплавы 108, 109, 126,
166-168,186,210-211
Хромали 193
Хромирование 212-21А
Хрупкость 165, 183, 187
Ш
Шкала коррозионной стойко-
стойкости 201, 208
Шлакоситаллы 231
Шпинель 49, 64
Щелевая коррозия 16,
121-122, 130
Экономический ущерб от кор-
коррозии 9-12
Электроды сравнения
водородный 70
каломельный 71
Электрохимическая защита
288-296
Электрохимическая коррозия
14,67-116
Энергия
внутренняя 30
Гиббса 31
Энтальпия 30
Энтропия 30
Я
Явления на границе раздела
фаз 67-69
Язвенная коррозия 15,121,128
Эбонит 249-253
Эванс (коррозионные диа
граммы) 97-99
Эквипотенциальная поверх-
поверхность 135
ОГЛАВЛЕНИЕ
Предисловие
ГЛАВА 1
ВВЕДЕНИЕ В СПЕЦИАЛЬНОСТЬ
1.1. Методические рекомендации по изучению курса «Коррозия и защита от
коррозии» 6
1.2. Социальные, экологические и экономические аспекты проблемы борь-
борьбы с коррозией металлов 8
1.3. Термины и стандарты 12
1.4. Классификация коррозионных процессов 14
1.5. Показатели коррозии 16
Литература 18
Часть I. Основы теории коррозии металлов
ГЛАВА 2
ГАЗОВАЯ КОРРОЗИЯ МЕТАЛЛОВ
2.1. Общая характеристика процессов газовой коррозии 20
2.2. Структура металлов и ее влияние на коррозионные процессы 22
2.3. Основы термодинамики процессов коррозии металлов 30
2.4. Коррозия металлов в неэлектролитах 32
ГЛАВА 3
ФИЗИКО-ХИМИЧЕСКИЕ ЗАКОНОМЕРНОСТИ ГАЗОВОЙ КОРРОЗИИ
МЕТАЛЛОВ
3.1. Термодинамическая вероятность образования продуктов окисления на
поверхности металла 34
Оглавление 323
3.2. Основные стадии газовой коррозии металлов 36
3.3. Адсорбция газов на поверхности металлов 37
3.4. Адсорбция кислорода на поверхности металла и образование оксида . 40
3.5. Пленки на поверхности металлов 42
3.6. Кинетика газовой коррозии металлов 44
3.6.1. Линейный закон роста пленки 45
3.6.2. Параболический закон роста пленок 46
3.6.3. Сложные законы роста пленок 47
3.7. Оксидные пленки на поверхности железа 49
3.8. Механизм химической коррозии 50
3.9. Влияние внутренних и внешних факторов на скорость газовой коррозии 54
3.9.1. Влияние состава пленки 54
3.9.2. Влияние температуры 55
3.9.3. Влияние давления и состава газа 57
3.10. Теории жаростойкого легирования 59
Методические рекомендации к главе 3 65
Литература к главам 2 и 3 65
ГЛАВА 4
ЭЛЕКТРОХИМИЧЕСКАЯ КОРРОЗИЯ МЕТАЛЛОВ
4.1. Явления на границе раздела фаз металл-электролит 67
4.2. Термодинамика электрохимической коррозии 69
4.3. Диаграммы Пурбе 72
4.4. Закономерности кинетики электродных реакций 78
4.4.1. Диффузионная кинетика. Концентрационная поляризация 79
4.4.2. Стадия замедленного разряда — ионизации 81
4.5. Общая характеристика электрохимического коррозионного процесса . 83
4.6. Коррозионный процесс с водородной деполяризацией 88
4.7. Коррозионный процесс с кислородной деполяризацией 90
4.8. Анодная реакция растворения металлов 92
4.9. Закономерности растворения металлов в активном состоянии 93
4.10. Анодное растворение металлов с участием компонентов раствора ... 95
4.11. Коррозионные диаграммы 97
4.12. Зависимость скорости коррозии от состава раствора 99
4.13. Растворение двух металлов при их контакте 101
4.14. Растворение железа в кислых растворах 102
4.15. Механизм анодного растворения сплавов 105
4.16. Аномальные явления при растворении металлов ПО
4.17. Пассивность 112
Методические рекомендации к главе 4 116
Литература к главе 4 118
324 Оглавление
Часть II. Виды коррозии. Влияние конструктивных
факторов на развитие коррозийных разрушений машин
и аппаратов
ГЛАВА 5
ЛОКАЛЬНЫЕ ВИДЫ КОРРОЗИИ.
МЕТОДЫ ИСПЫТАНИЯ МАТЕРИАЛОВ НА СТОЙКОСТЬ ПРОТИВ
КОРРОЗИИ
5.1. Локальные виды коррозии 121
5.1.1. Питтинговая коррозия 123
5.1.2. Язвенная коррозия 128
5.1.3. Щелевая коррозия и влияние конструктивных факторов на этот вид
корозии 130
5.1.4. Межкристаллитная коррозия 130
5.1.5. Селективное вытравливание 133
5.1.6. Контактная коррозия 134
5.2. Коррозионно-механическое разрушение металлов 136
5.2.1. Коррозионное растрескивание металлов 137
5.2.2. Коррозионная усталость металла 139
5.2.3. Фреттинг-коррозия 140
5.2.4. Кавитационная эрозия 140
5.3. Методы испытаний металлических материалов на стойкость против раз-
различных видов коррозии 141
5.3.1. Основные методы испытаний материалов 141
5.3.2. Испытания материалов на прочность против локальных видов кор-
коррозии 143
5.3.3. Испытания материалов на прочность при коррозионно-механичес-
ких воздействиях 147
5.3.4. Коррозионный мониторинг 148
Методические рекомендации к главе 5 149
ГЛАВА 6
КОРРОЗИЯ МЕТАЛЛОВ В ПРИРОДНЫХ И ТЕХНОЛОГИЧЕСКИХ
СРЕДАХ
6.1. Коррозия металлов в природных средах 150
6.1.1. Атмосферная коррозия металлов 151
6.1.2. Почвенная коррозия металлов 153
6.1.3. Морская коррозия металлов 157
6.2. Влияние конструктивных факторов на развитие коррозионных разру-
разрушений машин и аппаратов 159
6.3. Некоторые случаи газовой коррозии металлов в технологических средах 163
6.3.1. Обезуглероживание стали 163
Оглавление 325
6.3.2. Водородная коррозия 164
6.3.3. Карбонильная коррозия 168
6.3.4. Сернистая коррозия 169
6.3.5. Коррозия в среде хлора и хлористого водорода 172
Методические рекомендации к главе 6 174
Литература к главам 5 и 6 175
Часть III. Коррозионная характеристика металлов
и сплавов. Неметаллические материалы и защитные
покрытия
ГЛАВА 7
КОРРОЗИОННАЯ ХАРАКТЕРИСТИКА МЕТАЛЛОВ И СПЛАВОВ
7.1. Конструкционные материалы на основе железа 178
7.1.1. Сталиичугуны 181
7.1.2. Легирование сталей, как способ повышения коррозионной стойко-
стойкости 183
7.1.3. Жаростойкие сплавы на основе железа 191
7.1.4. Современные коррозионностойкие сплавы и стали 196
7.2. Конструкционные материалы на основе цветных металлов 200
7.2.1. Алюминий и его сплавы 200
7.2.2. Магний и его сплавы 203
7.2.3. Медь и медные сплавы 204
7.2.4. Никель и его сплавы 208
7.2.5. Олово 211
7.2.6. Свинец 212
7.2.7. Цинк 216
7.2.8. Кадмий 218
7.2.9. Титан и его сплавы 218
7.2.10. Тантал 221
Методические рекомендации к главе 7 222
ГЛАВА 8
НЕМЕТАЛЛИЧЕСКИЕ МАТЕРИАЛЫ И ЗАЩИТНЫЕ ПОКРЫТИЯ
1.1. Неорганические конструкционные материалы 226
8.1.1. Природные силикатные материалы 227
8.1.2. Искусственные силикатные материалы 227
8.1.3. Керамические материалы 232
8.1.4. Вяжущие материалы 236
326 Оглавление
8.2. Коррозионностойкие неметаллические материалы на основе органиче-
органических соединений 240
8.2.1. Полимерные материалы 240
8.2.2. Простые полимеризационные пластические массы 242
8.2.3. Сложные поликонденсационные пластические массы 246
8.2.4. Каучуки и резины 249
8.2.5. Графитовые материалы 253
Методические рекомендации к главе 8 256
Литература к главам 7и8 257
Часть IV. Методы защиты машин и аппаратов
химических производств от коррозии
ГЛАВА 9
ЗАЩИТА МЕТАЛЛА ОТ КОРРОЗИИ ПОВЕРХНОСТНЫМИ
ТОНКОСЛОЙНЫМИ ПОКРЫТИЯМИ
9.1. Фосфатные и оксидные защитные пленки 262
9.1.1. Фосфатирование 262
9.1.2. Оксидирование 263
9.1.3. Пассивирование 264
9.1.4. Анодирование 265
9.2. Гальванические покрытия 266
9.2.1. Цинкование и кадмирование 268
9.2.2. Покрытия из олова и свинца 269
9.2.3. Никелевые покрытия 271
9.2.4. Хромирование 272
9.3. Жаростойкие защитные покрытия 274
9.3.1. Термодиффузионный метод покрытия 275
9.3.2. Горячий метод или метод погружения в расплавленный металл . . . 278
9.3.3. Металлизация напылением 279
9.3.4. Плакирование — термомеханический способ 281
9.4. Лакокрасочные защитные покрытия 282
Методические рекомендации к главе 9 287
ГЛАВА 10
ЭЛЕКТРОХИМИЧЕСКИЕ МЕТОДЫ ПРОТИВОКОРРОЗИОННОЙ
ЗАЩИТЫ МЕТАЛЛОВ. ЗАЩИТНЫЕ СРЕДЫ
10.1. Электрохимическая защита 288
10.1.1. Катодная защита 289
10.1.2. Протекторная защита 291
Оглавление 327
10.1.3. Анодная защита 293
10.1.4. Кислородная защита 296
10.2. Изменение состава среды как метод противокоррозионной защиты . . 297
10.2.1. Снижение агрессивности коррозионной среды 297
10.2.2. Ингибиторная защита 298
Методические рекомендации к главе 10 307
Литература к главам 9 и 10 308
Приложение 310
Предметный указатель 314
LV. SEMENOVA, G.M. FLORIANOVICH, A.V. KHOROSHILOV
CORROSION AND CORROSION PROTECTION
edited by Prof. LV. SEMENOVA. Handbook for students of higher
educational establishments
ABOUT THE AUTHORS
LV. SEMENOVA:
LV SEMENOVA, Doctor of Technical Sciences, Professor of Moscow
State Open University, 22, P.Korchagin Ulitsa, 129805, Moscow, Russia.
Academician of Academy of Industrial Ecology.
Scientific interests: physical chemistry of heterogeneous processes,
corrosion-resistant materials, environmental protection technologies.
G.M. FLORIANOVICH:
G.M. FLORIANOVICH, Doctor of Chemical Sciences, Scientific
adviser, Karpov Institute of Physical Chemistry, 10, Vorontsovo Pole,
103064, Moscow, Russia. Winner of State Prize, USSR; Merited Chemist
of Russia.
Scientific interests: electrochemical kinetics, theory of metallic mate-
materials corrosion, corrosion protection.
A.V. KHOROSHILOV:
A.V. KHOROSHILOV, Candidate of Chemical Sciences, Research
assistant, Laboratory of Thermodynamics Foundations of Inorganic Mate-
Materials Technology, Kurnakov Institute of General and Inorganic Chemistry,
Academy of Sciences, 31, Leninsky Prospect, 119991, Moscow, Russia.
Scientific interests: theoretical foundations of steel carbonate corro-
corrosion; synthesis and properties of new heat-resistant materials; thermody-
thermodynamics of heterogeneous processes.
ABSTRACT
The handbook presents theoretical foundations of gaseous and electro-
electrochemical corrosion, types of corrosion, corrosion performance of metals,
alloys and non-metallic materials as well as methods of protecting ma-
machines and apparatuses from corrosion.
Analysis of electrochemical laws of dissolution of metals and alloys is
linked with the problem of metallic materials protection against corrosion.
The handbook describes ways of application of electrochemical laws
for the prediction of metals corrosion behavior and for optimization of
methods of corrosion protection and analyses present day methods that
have found wide application.
For students of higher educational establishments specializing in chemi-
chemical technology and engineering.
CONTENTS
Foreword
Chapter 1. INTRODUCTION
1.1. Methodological recommendations to the course
CORROSION AND CORROSION PROTECTION 6
1.2. Social, ecological and economic aspects of the problem of righting metal
corrosion 8
1.3. Terms and standards 12
1.4. Classification of corrosion processes 14
1.5. Corrosion indices 16
Part I. FUNDAMENTALS OF METAL CORROSION
THEORY
Chapter 2. GASEOUS CORROSION OF METALS
2.1. General characteristics of gaseous corrosion processes 20
2.2. Metal structure and its effect on corrosion processes 22
2.3. Fundamentals of thermodynamics of metal corrosion processes 30
2.4. Metal corrosion in non-electrolytes 32
Chapter 3. PHYSICO-CHEMICAL LAWS OF GASEOUS CORROSION OF
METALS
3.1. Thermodynamic probability of formation of oxidation products on metal
surface 34
3.2. Basic stages of gaseous corrosion of metals 36
3.3. Adsorption of gases on metal surface 37
3.4. Oxygen adsorption on metal surface and formation of oxide 40
3.5. Films on metal surface 42
3.6. Kinetics of gaseous corrosion of metals 44
3.6.1. Linear law of film growth 45
Contents 331
3.6.2. Parabolic law of film growth 46
3.6.3. Complex laws of film growth 47
3.7. Oxide films on iron surface 49
3.8. Mechanism of chemical corrosion 50
3.9. Effect of internal and external factors on gaseous corrosion rate 54
3.9.1. Effect of film composition 54
3.9.2. Effect of temperature 55
3.9.3. Factor of pressure and gas composition 57
3.10. Theories of heat-resistant alloyage 59
Methodological recommendations to Chapters 2 and 3 65
Chapter 4. ELECTROCHEMICAL CORROSION OF METALS
4.1. Performance on dividing boundary between metal-electrolyte phases ... 67
4.2. Thermodynamics of electrochemical corrosion 69
4.3. Purbe diagrams 72
4.4. Mechanism of electrode reaction kinetics 78
4.4.1. Diffusion kinetics. Concentration polarization 79
4.4.2. Stage of slow discharge - Ionization 81
4.5. General characteristics of electrochemical corrosion process 83
4.6. Corrosion process with hydrogen depolarization 88
4.7. Corrosion process with oxygen depolarization 90
4.8. Anodic reaction of dissolution of metals 92
4.9. Mechanism of dissolution of metals inactive condition 93
4.10. Anodic dissolution of metals with participation of solution components . 95
4.11. Corrosion diagrams 97
4.12. Dependence of corrosion rate on solution composition 99
4.13. Dissolution of two metals on contact 101
4.14. Dissolution of iron in acid solutions 102
4.15. Mechanism of anodic dissolution of alloys 105
4.16. Anomalies in metal dissolution 110
4.17. Passivity 112
Methodological recommendations to Chapter 4 116
PART II. TYPES OF CORROSION. EFFECT OF
STRUCTURAL FACTORS ON CORROSIVE
DETERIORATION OF MACHINES AND APPARATUSES
Chapter 5. LOCALIZED TYPES OF CORROSION. METHODS OF
CORROSION RESISTANCE TESTING OF DIFFERENT MATERIALS
5.1. Types of localized corrosion 121
5.1.1. Pitting corrosion 123
5.1.2. Honeycomb corrosion 128
332 Contents
5.1.3. Crevice corrosion. Effect of structural factors on crevice corrosion . . 130
5.1.4. Intergranular corrosion 130
5.1.5. Selective etching 133
5.1.6. Contact corrosion 134
5.2. Mechanical corrosion failure of metals 136
5.2.1. Corrosion cracking of metals 137
5.2.2. Corrosion fatigue 139
5.2.3. Fretting corrosion 140
5.2.4. Cavitation erosion 140
5.3. Methods of testing resistance of metallic materials to different types of
corrosion 141
5.3.1. Basic methods of testing materials 141
5.3.2. Testing resistance of materials to localized corrosion 143
5.3.3. Testing resistance of metallic materials to corrosive mechanical attack 147
5.3.4. Corrosion monitoring 148
Methodological recommendations to Chapter 5 149
Chapter 6. CORROSION OF METALS IN NATURAL AND TECHNOLOGICAL
ENVIRONMENTS
6.1. Corrosion of metals in natural environments 150
6.1.1. Atmospheric corrosion of metals 151
6.1.2. Soil corrosion of metals 153
6.1.3. Sea-water corrosion of metals 157
6.2. Effect of structural factors on propagation of corrosive deterioration of
machines and apparatuses 159
6.3. Some cases of gaseous corrosion of metals in technological environments . 163
6.3.1. Steel decarbonization 163
6.3.2. Hydrogen corrosion 164
6.3.3. Carbonyl corrosion 168
6.3.4. Sulphur corrosion 169
6.3.5. Corrosion in chlorine and hydrogen chloride medium 172
Methodological recommendations to Chapter 6 174
PART III. CORROSION PERFORMANCE OF METALS
AND ALLOYS. NON-METALLIC MATERIALS AND
PROTECTIVE COATINGS
Chapter 7. CORROSION PERFORMANCE OF METALS AND ALLOYS
7.1. Iron-based structural materials 178
7.1.1. Steel and cast-iron 181
7.1.2. Steel alloyage as a way of raising corrosion resistance 183
7.1.3. Iron-based heat-resistant alloys 191
Contents 333
7.1.4. Present-day corrosion-resistant alloys and steels 196
7.2. Structural materials based on non-ferrous metals 200
7.2.1. Aluminum and its alloys 200
7.2.2. Magnesium and its alloys 203
7.2.3. Copper and its alloys 204
7.2.4. Nickel and its alloys 208
7.2.5. Tin 211
7.2.6. Lead 212
7.2.7. Zinc 216
7.2.8. Cadmium 218
7.2.9. Titanium and its alloys 218
7.2.10. Tantalum 221
Methodological recommendations to Chapter 7 222
Chapter 8. NON-METALLIC MATERIALS AND PROTECTIVE COATINGS
8.1. Inorganic structural materials 226
8.1.1. Natural silicate materials 227
8.1.2. Artificial silicate materials 227
8.1.3. Ceramic materials 232
8.1.4. Cementing materials 236
8.2. Corrosion-resistant non-metallic materials based on organic compounds . . 240
8.2.1. Polymeric materials 240
8.2.2. Linear polymerizational plastics 242
8.2.3. Three-dimensional polycondensational plastics 246
8.2.4. Caoutchouk and rubber 249
8.2.5. Graphitic materials 253
Methodological recommendations to Chapter 8 256
PART IV. CORROSION PROTECTION OF MACHINES
AND APPARATUSES IN CHEMICAL MANUFACTURING
Chapter 9. CORROSION PROTECTION OF METALS BY MEANS OF THIN
SURFACE COATINGS
9.1. Phosphate and oxygen protective films 262
9.1.1. Phosphating 262
9.1.2. Oxidizing 263
9.1.3. Passivation 264
9.1.4. Anodizing 265
9.2. Galvanic coatings 266
9.2.1. Zinc plating and cadmium plating 268
9.2.2. Tin and lead coatings 269
9.2.3. Nickel coatings 271
334 Contents
9.2.4. Chrome-plating 272
9.3. Heat-resistant protective coatings 274
9.3.1. Thermodiffusional method of coating 275
9.3.2. Hot method or molten metal submersion 278
9.3.3. Metal pulverization 279
9.3.4. Plating, a thermomechanical method 281
9.4. Varnish and paint protective coatings 282
Methodological recommendations to Chapter 9 287
Chapter 10. ELECTROCHEMICAL METHODS OF CORROSION
PROTECTION OF METALS. PROTECTIVE MEDIA
10.1. Electrochemical protection 288
10.1.1. Cathodic protection 289
10.1.2. Contact protection 291
10.1.3. Anodic protection 293
10.1.4. Oxygen protection 296
10.2. Change in medium composition as a method of corrosion protection .... 297
10.2.1. Reducing the aggressiveness of corrosive medium 297
10.2.2. Inhibitional protection 298
Methodological recommendations to Chapter 10 307
APPENDIX 310
Учебное издание
СЕМЕНОВА Инна Владиславовна
ФЛОРИЛНОВИЧ Галина Матвеевна
ХОРОШИЛОВ Андрей Владимирович
Коррозия и защита от коррозии
Редактор Салецкая О. В.
Оригинал-макет: Третьяков Е. В.
Оформление переплета: Логунов А. А.
ЛР № 071930 от 06.07.99. Подписано в печать 12.04.02.
Формат 60x90/16. Бумага офсетная №1. Печать офсетная.
Усл. печ. л. 21. Уч.-изд. л. 19,5. Тираж 3000 экз.
Заказ тип. №
Издательская фирма
«Физико-математическая литература»
117864 Москва, Профсоюзная, 90
Отпечатано с готовых диапозитивов в ФГУП «Московская
типография № 6» Министерства РФ по делам печати,
телерадиовещания и средств массовых коммуникаций
109088 Москва, Ж-88, Южнопортовая ул., 24
ISBN 5-9221-0246-Х
9 785922 102469