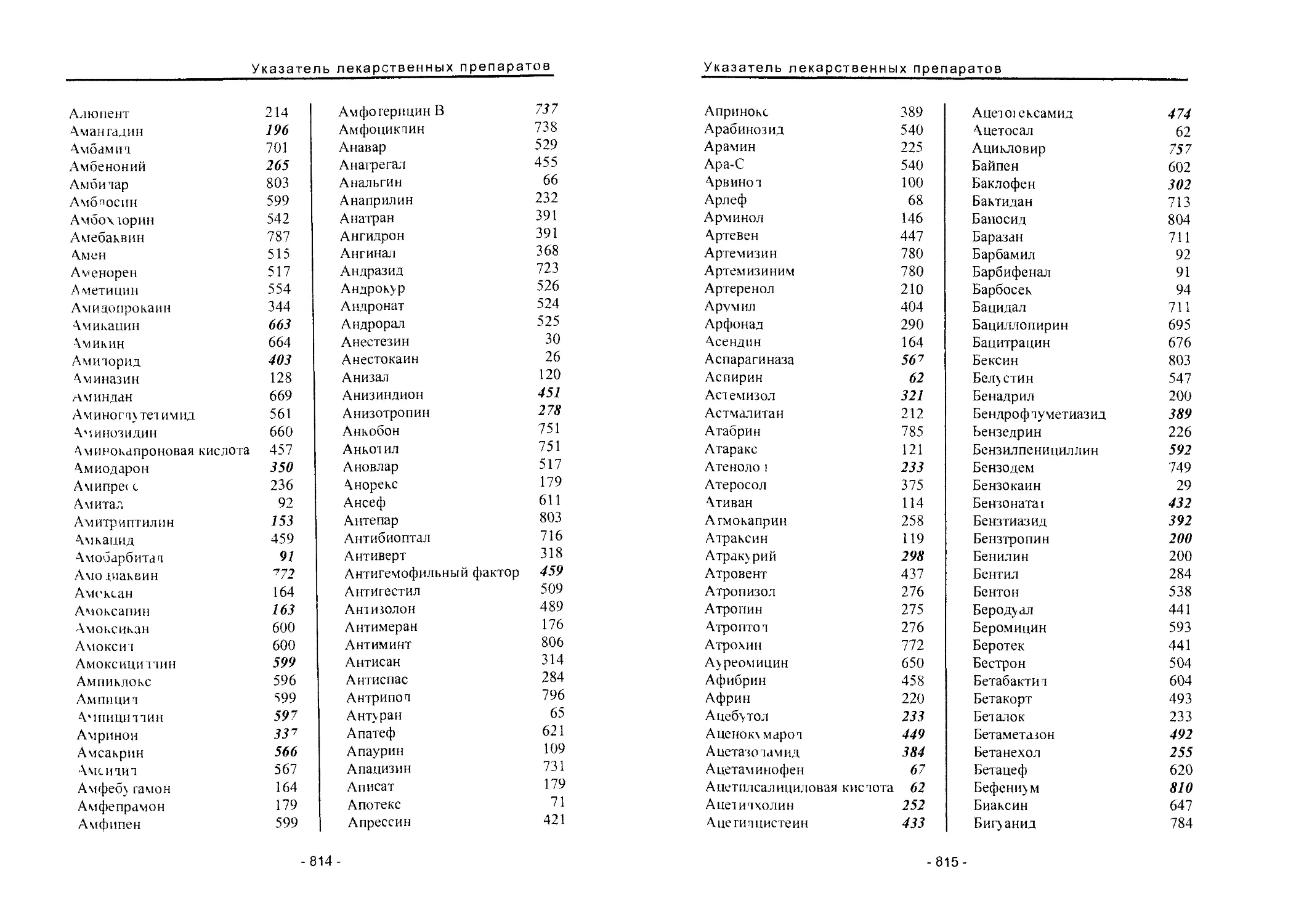
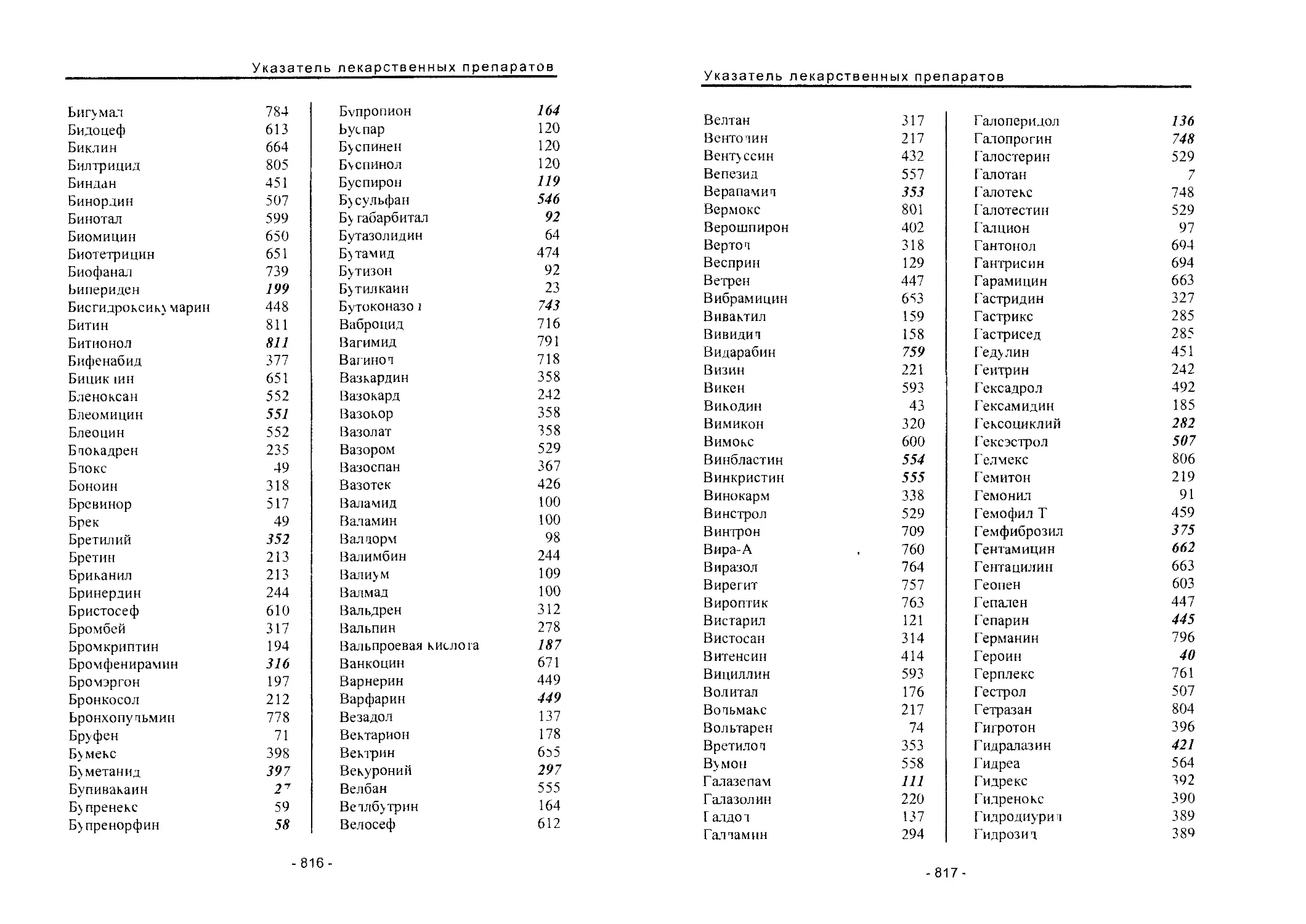
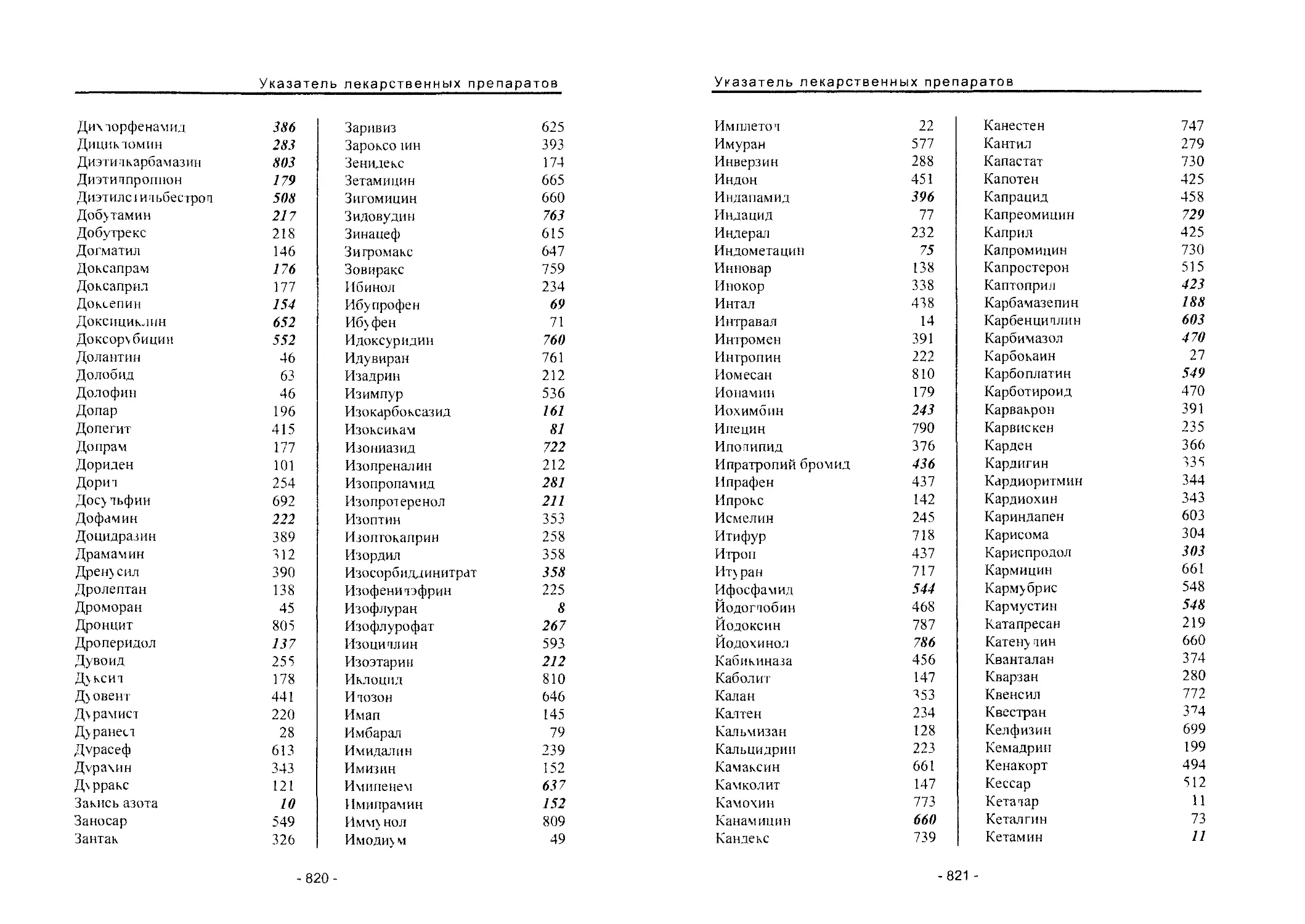
Автор: Вартанян Р.С.
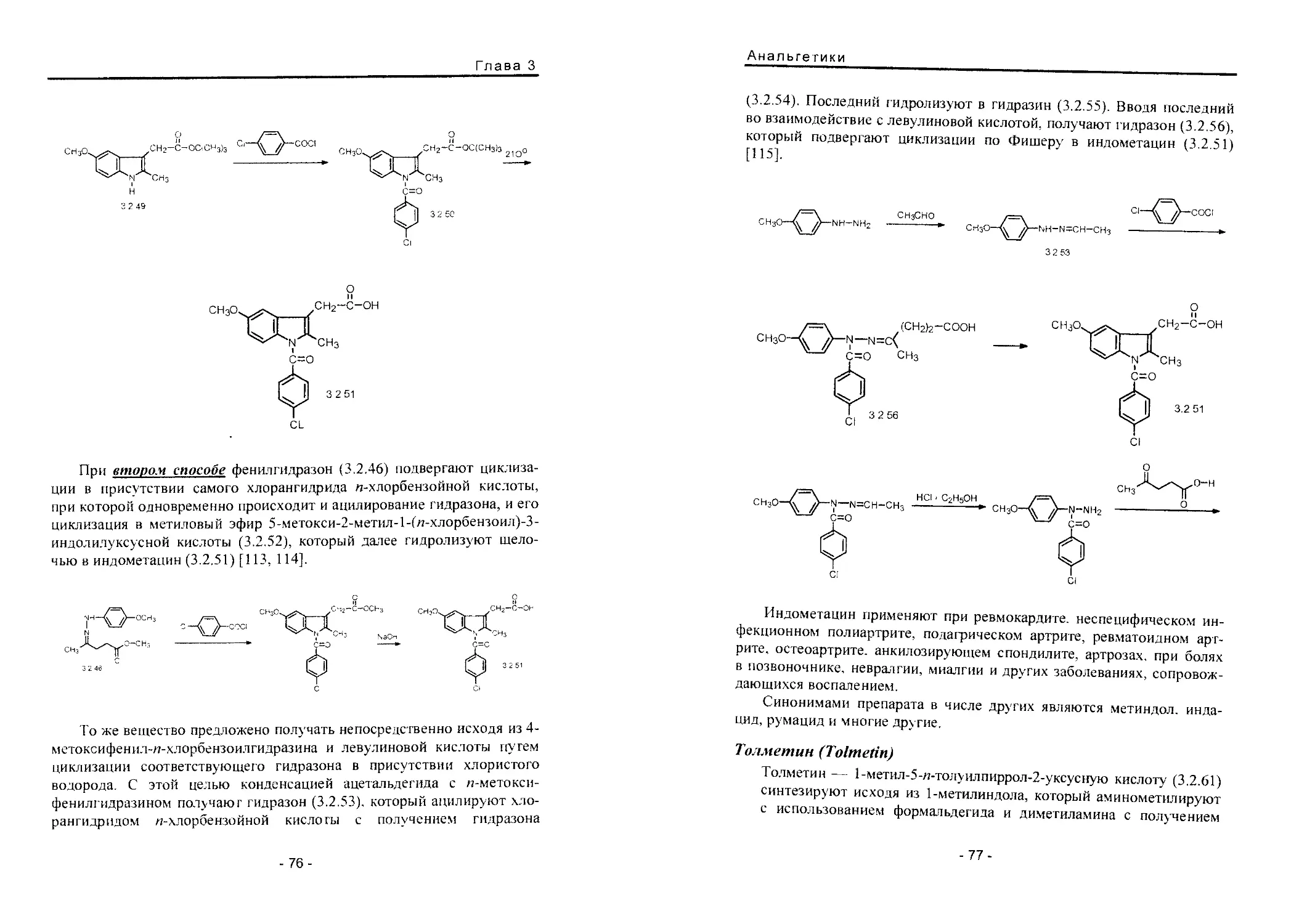
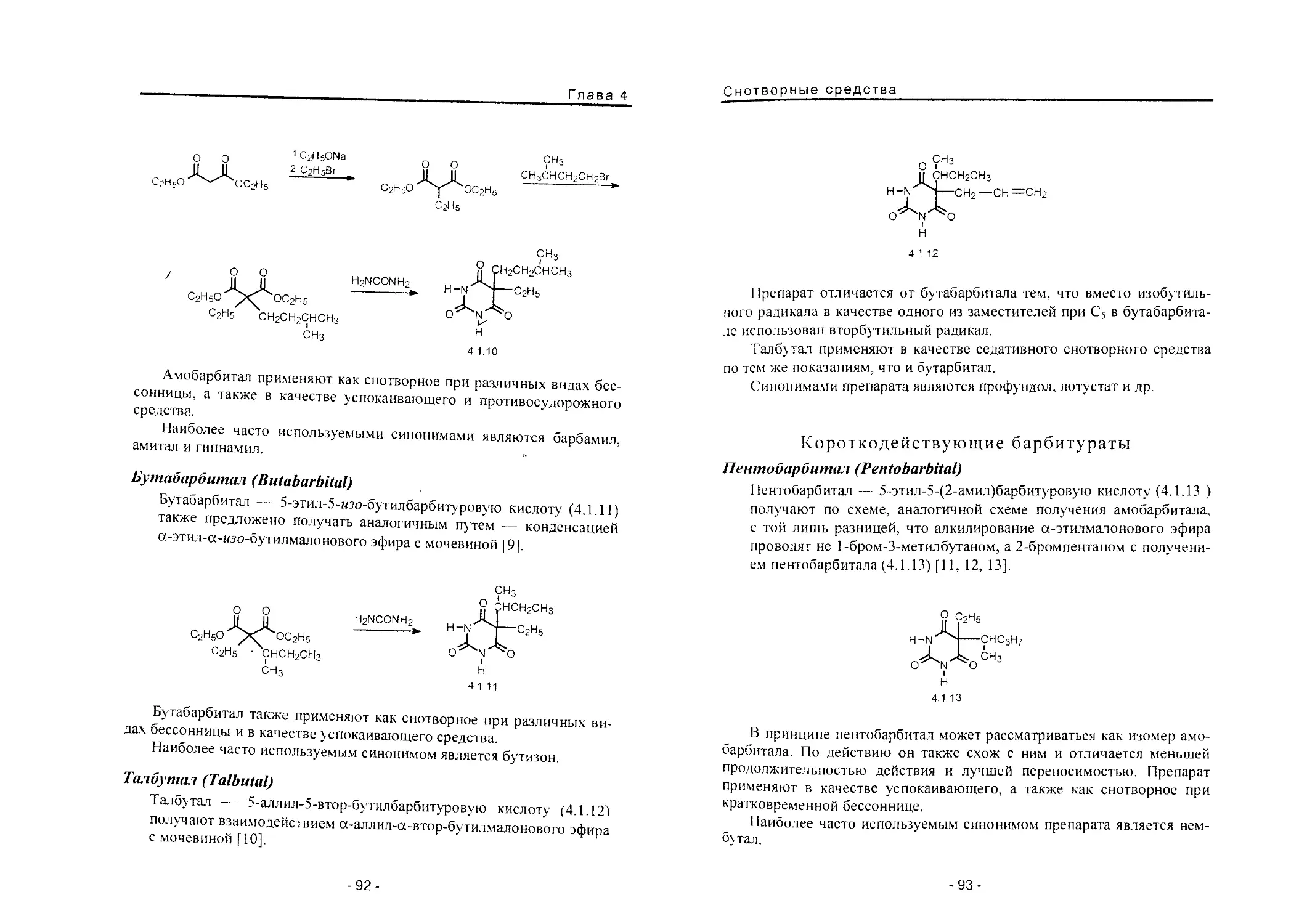
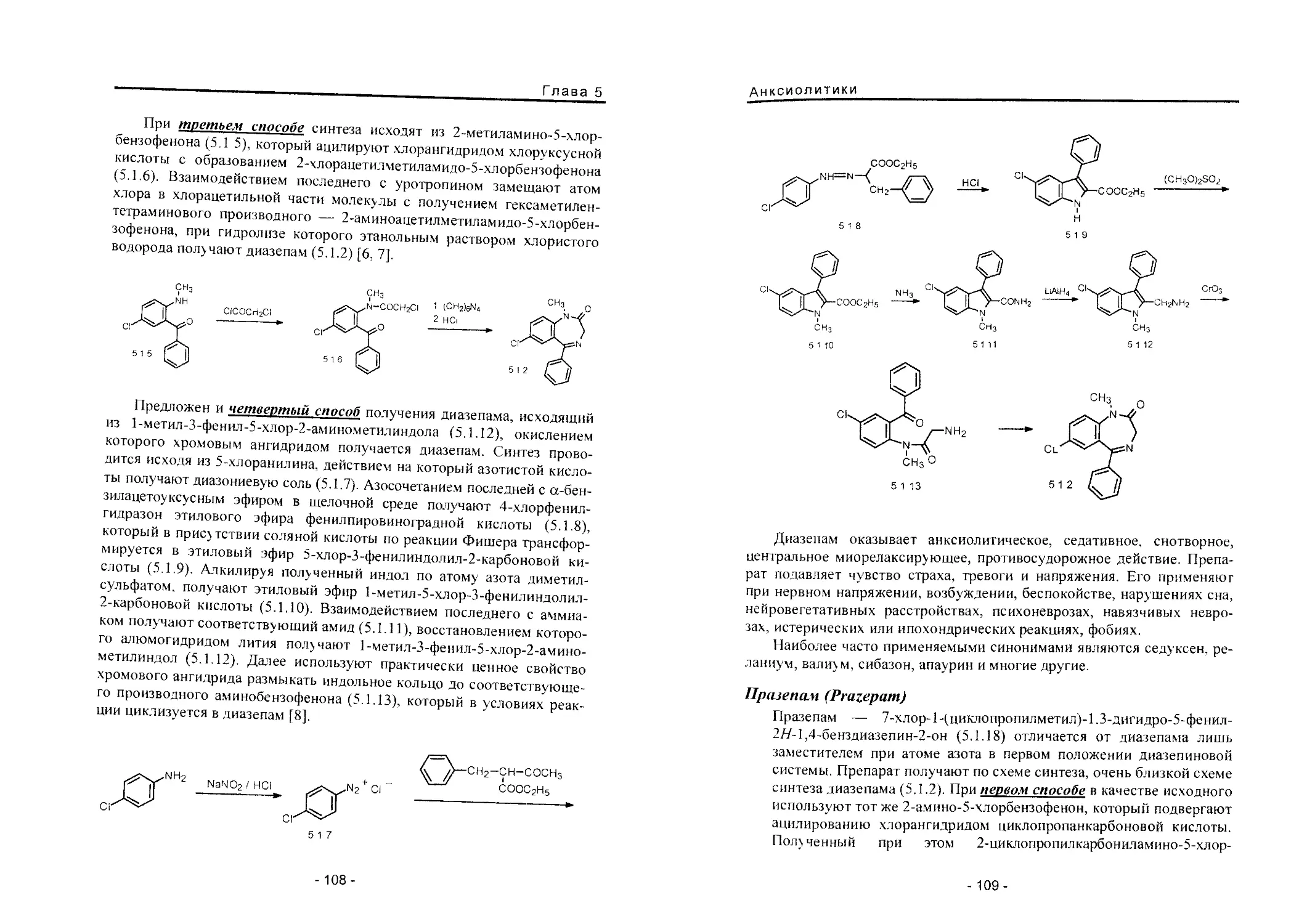
Теги: фармакология общая терапия токсикология химическая технология химические производства медицина фармакопея лекарственные средства
ISBN: 5-89481-218-6
Год: 2004
Р.С. Вартанян
СИНТЕЗ
ОСНОВНЫХ
ЛЕКАРСТВЕННЫХ
СРЕДСТВ
Медицинское информационное
агентство
Р. С. Вартанян
СИНТЕЗ ОСНОВНЫХ
ЛЕКАРСТВЕННЫХ
СРЕДСТВ
Медицинское информационное агентство
Москва - 2004
УДК 615.012
ББК 35.66
В18
- М.: Медицинское
Вартанян Р. С.
В18 Синтез основных лекарственных средств,
информационное агентство, 2004. — 845 с.
ISBN 5-89481-218-6
В книге описан синтез более 700 лекарственных препаратов, в
основном входящих в «Эссенциальный список лекарственных средств»,
рекомендуемый ВОЗ, под их генерическими названиями. Практически
для всех описываемых препаратов приводятся ссылки на методы их по-
получения (около 2200), а также их наиболее распространенные синони-
синонимы. Синтез различных групп лекарств, в основном, излагается в том
порядке, в котором они традиционно приводятся в общепринятых кур-
курсах фармакологии. Практически все главы начинаются с общепринятого
определения препаратов с данным типом активности, приводится крат-
краткая характеристика всей группы, классификация рассматриваемых пре-
препаратов, и далее описывается их синтез, каждый из которых завершает-
завершается областью применения данного препарата.
Для фармацевтов, провизоров, химиков, биологов, токсиколо-
токсикологов, технологов в области производства лекарственных препаратов и др.
специалистов.
УДК 615.012
ББК 35.66
© Р.С. Вартанян, 2004
© ООО "Медицинское информационное
агентство". Оформление, 2004
Все права защищены. Никакая часть книги не
может быть воспроизведена в какой бы то ни
было форме без письменного разрешения вла-
владельцев авторских прав
ISBN 5-89481-218-6
Светлой памяти моего отца, учителя, науч-
научного руководителя, моего ближайшего друга
и страстного болельщика, академика
САРКИСА АМБАРЦУМОВИЧА ВАРТАНЯНА
посвящаю
От автора
Настоящая книга, как впрочем, наверное, и любая другая, представ-
представляет собой попытку самовыражения и давно назревшей необходимости
в систематизации тех сведений, которые накапливались в течение более
чем тридцати лет моей работы в области синтеза лекарственных препа-
препаратов и, собственно, семи лет работы над самой книгой. На мой взгляд,
результат может заполнить тот явный пробел, который имеется в лите-
литературе по этому вопросу.
Первоначальный план этой книги довольно сильно отличался от на-
настоящего варианта. Предполагалось показать синтез препаратов в дина-
динамике. Для некоторых препаратов это был направленный синтез массива
потенциально активных веществ, из которых в результате сотрудниче-
сотрудничества химиков, биологов, фармакологов, токсикологов, технологов
и других людей самых разных специальностей впоследствии рождался
препарат. Иногда новый препарат появлялся в результате приложения
возможностей нового реагента или нового доступного исходного веще-
вещества.
Предполагалось вкратце затронуть историю создания хотя бы неко-
некоторых препаратов. Хотелось привести известные курьезные случаи при
работе над ними, привести зачастую весьма любопытные истории рож-
рождения их названий и не менее интересные истории, связанные с измене-
изменением сферы применения препарата после прохождения клинических
испытаний. Однако в какой-то момент времени я понял, что выхожу за
рамки возможного формата для одного человека и что эта работа
не сможет быть закончена в разумные сроки.
Поэтом)', в ряду нескольких альтернативных подходов, я остано-
остановился на предлагаемом, не беллетризованном варианте, в котором син-
синтез различных групп лекарств, в основном, излагается в том порядке,
в котором они традиционно излагаются в общепринятых курсах фарма-
фармакологии. Это было сделано с весьма определенной целью — гармонизо-
гармонизовать предлагаемый материап с тем курсом фармакологии, который про-
проходят будущие медики и фармацевты.
Практически все главы начинаются с общепринятого определения
препаратов с данным типом активности, приводится краткая характери-
характеристика всей группы, классификация рассматриваемых препаратов, и да-
далее описываются конкретные синтезы, каждый из которых завершается
областью применения данного препарата.
Из многотысячного массива лекарств, имеющих хождение на фар-
фармацевтическом рынке, мною, в основном, описаны лекарственные пре-
препараты, которые входят в «Эссенциальный список лекарственных
средств», рекомендуемый ВОЗ, под их генерическими названиями.
Конечно, практически для всех описываемых более чем 700 препа-
препаратов, что примерно вдвое больше чем в «Списке», приводятся ссылки
на методы их получения (около 2200), а также их наиболее распростра-
распространенные синонимы. Однако с целью избежать любого недопонимания
изложение ведется только на основе названий генериков.
Самая большая глава — антибиотики — формально не подходит
для изложения в книге с таким названием, но поскольку основное вни-
внимание в ней сосредоточено на описании синтетической части получения
полусинтетических антибиотиков, считаю, что она обязательно должна
была войти в настоящую книгу.
Несомненно, что после вышеуказанных сокращений текст был при-
приведен к определенному алгоритму, и, используя весьма небольшой сло-
словарь (а именно, тот весьма ограниченный набор фраз, традиционно
применяемый для описания синтезов любых химических соединений),
оказалось практически невозможно представить описания самих синте-
синтезов менее однообразными, и я прекрасно осознаю, что собственно
в этой части результат получился более чем тривиальным.
Однако весьма надеюсь на то, что семь лет, ушедшие на написание
этой книги, были потрачены не зря и что она может заинтересовать тех,
кто работает или планирует начать работу в данной увлекательнейшей
области биологически активных соединений — синтеза лекарственных
препаратов.
Р. С. Вартанян
20.07.2002 г.
6АПК
АД
АКТГ
АДФ
АМФ
АПФ
АТФ
ГАМК
ДОФА
ЖКТ
ЛПВП
ЛПНГ1
лпонп
дппп
МАО
МБК
МИ К
мРНК
НПВС
ПСБ
тРНК
ФИО
ФСК
цАМФ
ЦНС
Список сокращений
- 6-аминопенициллановая кислота
артериальное давление
адренокортикотропный гормон
аденозиндифосфат
аденозинмонофосфат
ангиотензин-превращающий фермент
аденозинтрифосфат
гамма-аминомасляная кислота
дигидроксифенилаланин
желудочно-кишечный тракт
липопротеиды высокой плотности
липопротеиды низкой плотности
липопротеиды очень низкой плотности
липопротеиды промежуточной плотности
моноаминооксидаза
минимальная бактерицидная концентрация
минимальная ингибирующая концентрация
мессевджерная РНК
нестероидные противовоспалительные средства
пенициллинсвязывающйе белки
транспортная РНК
фактор некроза опухоли
факторы, стимулирующие колонии
циклический аденозинмонофосфат
центральная нервная система
Глава 1
Общие анестетики
В настоящее время термин «общая анестезия» (наркоз) в хирурги-
хирургической практике означает состояние организма с обратимой потерей
сознания при контролируемом уровне депрессии нервной системы
и включающем следующие компоненты: анальгезию (отсутствие бо-
боли), амнезию (отсутствие памяти), подавление рефлекторной деятель-
деятельности (брадикардия, ларингоспазм) и снижение тонуса скелетной мус-
мускулатуры.
Соответственно, общими анестетиками считаются препараты, кото-
которые вызывают обезболивание, ослабляют рефлекторную и мышечную
деятельность и. в конечном счете, вызывают потерю сознания.
Идеальный анестетик должен обладать всеми перечисленными вы-
выше свойствами, а также большой широтой терапевтического индекса
и незначительными побочными эффектами.
В анестезиологии применяются препараты, которые блокируют или
подавляют нейрологические импульсы, опосредованные центральной
нервной системой (ЦНС). и позволяющие проводить хирургические,
акушерские и диагностические процедуры безболезненно.
Общие анестетики подразделяются на два типа — ингаляционные
(галотан, энфлуран, изофлуран, метоксифлуран, закись азота) и неинга-
неингаляционные (барбитураты, кетамин и этомидат).
1.1. Ингаляционные анестетики
Задачей ингаляционной анестезии является достижение такой кон-
концентрации (парциального давления) препарата в мозге, которая доста-
достаточна для достижения требуемой степени анестезии. Для этого молеку-
молекулы анестетика должны пройти путь из легких в мозг через разные
биофазы, поэтому ингаляционные анестетики должны быть растворимы
в крови и тканевых жидкостях.
Механизм, согласно которому ингаляционные анестетики проявля-
проявляют свой эффект, неизвестен. Поскольку они не принадлежат к единому
-6-
Общие анестетики
химическому классу соединений, не выявлены также корреляции струк-
структура-активность. Ингаляционные анестетики неспецифичны, поскольку
они взаимодействуют не со специальными рецепторами, и поэтому для
них не существует специфических антагонистов. Взаимодействие инга-
ингаляционных анестетиков с клеточными структурами может быть описано
только как Ван дер Вальсовские взаимодействия. Существует ряд гипо-
гипотез, объясняющих действие ингаляционных анестетиков, однако ни од-
одна из них не может адекватно описать весь спектр вызываемых ими
эффектов.
Действие общих анестетиков может быть объяснено блокадой ион-
ионных каналов или определенными изменениями в механизмах высвобож-
высвобождения нейротрасмиттеров
Из ряда предложенных механизмов можно упомянуть 3 гипотезы:
1. Гидратная гипотеза. Молекулы анестетиков могут образовы-
образовывать гидраты со структурированной водой, что может заторма-
затормаживать функции мозга на соответствующих участках. Однако
не выявлены корреляции между способностью образовывать
гидраты и активностью ингаляционных анестетиков.
2. Гипотеза ионных пор. Анестетики блокируют ионные каналы
путем взаимодействия с клеточными мембранами, уменьшая
приток ионов Na+ и увеличивая приток ионов К+ в клетку, что
приводит к развитию анестезии.
3. Гипотеза текучести мембран. Анестетики стабилизируют,
скорее — фиксируют в определенном состоянии, мембраны
клеток, затрудняя их способность к текучести, что вызывает
изменения в работе ионных каналов.
Выбор конкретного анестетика или их комбинации производится
в зависимости от типа медицинского вмешательства. Долгое время
в качестве ингаляционных анестетиков широко применялись эфир, хло-
хлороформ, трихлорэтилен, этилхлорид или хлорэтан, а также циклопро-
циклопропан. Сегодня чаще всего в медицине используются следующие ингаля-
ингаляционные анестетики: галотан, энфлуран, изофлуран, метоксифлуран
и закись азота.
Галотан (Halotane)
Галотан — 2-бром-2-хлор-1,1,1-трифторэтан A.1.2) получают путем
присоединения фтористого водорода к трихлорэтилену и при одно-
одновременном замещении атомов хлора в присутствии треххлористой
сурьмы при 130 °С. Полученный при этом 2-хлор-1,1,1-трифторэтан
-7-
Глава 1
A.1.1) подвергается далее бромированию при 450 °С с образовани-
образованием галотана [1, 2, 3].
С12С=СН-С1
HzF2/SbCI3
Br2 450° С I i
F3C-CH2-CI " *" F~?~?~H
F CI
111 112
Галотан является широко применяемым современным ингаляцион-
ингаляционным анестетиком. Он начинает действовать очень быстро, приятен для
пациента и достаточно безопасен. Единственным препятствием к его
применению является его гепатотоксичность. Применяется в хирургии
при краткосрочных и длительных вмешательствах.
Наиболее распространенным синонимом галотана является фторо-
тан.
Энфлурин (Enflurane)
Энфлуран — 2-хлор-1,1,2-трифторэтилдифторметиловый эфир
A.1.4) получают хлорированием на свету 2-хлор-1,1,2-трифтор-
этилметилового эфира в 2-хлор-1,1,2-трифторэтилдихлорметиловый
эфир A.1.3) с последующим замещение атомов хлора на фтор в ди-
хлорметильной группе фтористым водородом в присутствии пяти-
хлористой сурьмы или смесью трехфтористой сурьмы с пятихлори-
стой сурьмой [4, 5].
CI F
F-C-C-O-CH3
Н F
С12
CI F CI
F-C-C-O-C-H
Н F CI
1 1 3
H2F2/ SbC!3
SbF3 / SbCI5
9"? ?
F-C-C-O-C-H
H F F
1 1 4
Энд,)луран обладает практически всеми свойствами галотана и при-
применяется по тем же показаниям. Абсорбируется хуже.
Синонимом препарата является этран.
Изофлуран (Isoflurane)
Изофл>ран — 2-хлор-2-(дифторметокси)-1,1,1-трифторэтан A.1.8)
получают исходя из 2,2,2-трифторэтанола. С этой целью 2,2,2-
тр'лфторэтанол первоначально метилируют диметилсульфатом
и полеченный при этом метиловый эфир A.1.5) подвергают хлори-
хлорированию молекулярным хлором с получением 2-(дихлорметокси)-
-8-
Общие анестетики
1,1,1-трифторэтана A.1.6). Далее взаимодействием A.1.6) с фтори-
фтористым водородом в присутствии пятихлористой сурьмы атомы хлора
в последнем замещают на атомы фтора. Полученный эфир A.1.7)
вновь подвергают хлорированию молекулярным хлором с получе-
получением изофлурана [6, 7].
CF3-CH2-OH
H2F2/SbCI5
cf3-ch2-ochci2 > cf3-ch2-ochf2
! 1 7
CF3-CH2-OCH3
1 1 5
Cl2
Cl2
CF3-CH— OCHF2
CI
1 1.8
Изофлуран аналогичен по действию энфлурану, однако из-за
несколько острого запаха его применение иногда вызывает определен-
определенные трудности.
Синонимом изофлурана является форан.
Метоксифлуран (Methoxyflurane)
Метоксифлуран — 2,2-дихлор-1,1-дифторэтилметиловый эфир
A.1.10) получают исходя из 1,1-дифтор-2,2,2-трихлорэтана, кото-
который подвергают дегидрохлорированию гидроокисью калия в 1,1-
дихлор-2,2-дифторэтилен A.1.9), к которому в присутствии гидро-
гидроокиси калия присоединяют метанол [8].
CI F
CI—С-С-Н
i i
F
КОН
ч /
С=С
СН3ОН/КОН
CI F
CI
с'
1.1 9
Н-С-С-ОСН3
CI F
1 1 10
Метоксифлуран является весьма мощным ингаляционным анесте-
анестетиком, вызывающим отличное расслабление скелетной мускулатуры.
Однако его относительно высокая растворимость, вызывающая медлен-
медленный выход пациента из состояния анестезии, несколько ограничивает
его применение. Другим недостатком метоксифлурана является то, что
продуктами его биотрансформации являются ионы фтора, что может
привести к развитию почечной недостаточности. Поэтому рекомендует-
рекомендуется использовать метоксифлуран для анестезии при вмешательствах про-
продолжительностью не более 2 ч.
-9-
Глава 1
Весьма часто встречающимся синонимом метоксифлурана является
пентран.
Закись азота (Nitrous Oxide)
Закись азота A.1.11) получают либо термическим разложением
нитрата аммония, либо окислением аминосульфоновой кислоты
азотной кислотой [9, 10, 11].
NH4NO3
H2N, 0
но о
N2O
1 1 11
2Н2О
HNO3
N2O
1.1 11
Н2О
H2SO4
Закись азота, которую называют также веселящим газом, является
слабым анестетиком. Обычно ее применяют совместно с гипнотиками,
анальгетиками и миорелаксантами. Ввиду отсутствия у него какого-
либо депрессивного влияния на дыхание его иногда называют идеаль-
идеальным анестетиком. Однако, согласно последним сообщениям, примене-
применение закиси азота в течение более 2 ч противопоказано, поскольку он
вызывает резкое уменьшение уровня метионинсинтетазы, что, в свою
очередь, может вызвать у пациентов резкое понижение уровня витамина
В|2со всеми вытекающими последствиями.
1.2. Неингаляционные анестетики
Для введения пациента в наркоз в современной анестезиологии, как
правило, сочетают несколько препаратов, применяемых как до начала
ингаляционной анестезии, так и параллельно с этой процедурой; при
этом кроме специальных средств используют и ряд соединений, лишь
формально классифицируемых как неингаляционные анестетики и яв-
являющихся представителями других фармакологических классов соеди-
соединений (анальгетиков, транквилизаторов, нейролептиков и др.).
Следует отметить, что при неингаляционной анестезии контроль
за процессом и его регулирование осуществлять значительно труднее,
чем при ингаляционной анестезии. Однако простота техники внутри-
внутривенной анестезии, ее разнообразные комбинированные формы (нейро-
лептанальгезия, атаралгезия, транквиланалгезия) делают эти варианты
общей анестезии весьма полезными в клинике.
При общей анестезии в качестве краткодействующих специальных
средств для неингаляционного наркоза применяются кетамин и этоми-
-10-
Общие анестетики
дат, а также ряд препаратов, принадлежащих к совершенно разным хи-
химическим классам, в том числе краткодействующие барбитураты —
тиопентал и метогекситап, опиоидные анальгетики — морфин и фента-
нил, а также ряд бензодиазепиновых транквилизаторов — диазепам,
лоразепам и мидазолам, т. е. препараты, которые упоминаются в данном
разделе как неингаляционные анестетики, несмотря на то, что даже
формально они таковыми не являются и не проявляют всех четырех,
присущих анестетикам по определению, характерных свойств.
Кетамин (Ketatnine)
Кетамин — 2-(о-хлорфенил)-2-B-метиламино)циклогексанон A.2.4)
синтезируют исходя из 2-хлорбензонитрила, который вводят в ре-
реакцию с магнийбромциклогексаном с получением 1-B-хлорбен-
зоил)циклопентана A.2.1). Последний бромируют молекулярным
бромом в соответствующий бромкетон A.2.2), который при взаимо-
взаимодействии с водным раствором метиламина образует метилимино-
производное A.2.3) с одновременным гидролизом третичного атома
брома. При дальнейшем кипячении продукта реакции в декалине
происходит перегруппировка с расширением цикла, и образуется
кетамин. Предложены и другие объяснения механизма реакции
трансформации метилиминопроизводного A-2.3) в конечный про-
продукт, в частности — через промежуточное образование эпоксисое-
динения, однако ни один из них нельзя считать удачным и досто-
достоверно доказанным [12, 13].
Д^.,0 =НзМН2
.-Л-СН3
Кетамин — специальное средство для неингаляционного наркоза,
используемое при кратковременных хирургических вмешательствах,
которое вызывает состояние, называемое диссоциативной анестезией,
и которое обеспечивает амнезию и анальгезию, сохраняя у пациента
нормапьное дыхание и мышечный тонус. Кетамин практически не имеет
мышечнорасслабляющих свойств.
Премедикация морфином и скополамином, бензодиазепинами или
б>тирофенонами понижает дисфорический эффект кетамина.
Синонимами препарата являются кетанест, кеталар и др.
-11
Глава 1
Этомидат (Etomidate)
Этомидат — этиловый эфир 1-(а-метилбензил)имидазол-5-карбо-
новой кислоты A.2.8) получают по следующей схеме, которая,
очевидно, является частным случаем получения производных
имидазола, взаимодействия а-аминокарбонильных соединений с
тиоиианатами. Реакцией а-метилбензиламина с этиловым эфиром
хлоруксусной кислоты получают М-этоксикарбонилметил-N-l-
фенилэтиламин A.2.5), который далее подвергают формилирова-
нию муравьиной кислотой. Полученный при этом N-этоксикарбо-
нилметил-1Ч-формил-1М-1-фенилэтиламин A.2.6) далее подвергают
С-формилированию этилформиатом в присутствии этилата натрия,
и полученный продукт без выделения обрабатывают раствором
гиоцианата калия в соляной кислоте. В результате происходящей
при этом реакции тиоцианат иона с альдегидной карбонильной
группой и одновременно происходящего гидролиза N-формамидной
защиты происходит известная реакция гетероциклизации с получени-
получением 5-этоксикарбонил-2-меркапто-1-A-фенилэтил)имидазола A.2.7).
Тиольную группу в последнем удаляют окислительным детиониро-
ванием при взаимодействии со смесью азотной и азотистой кислот
(азотная кислота в присутствии нитрита натрия), которое, по-
видимому, протекает через стадию образования неустойчивой
сульфиновой кислоты, которая чрезвычайно легко теряет SO2, что,
в итоге, приводит к получению искомого этомидата [14, 15].
— СН2-СООС2Н6
rt—Nh -CH2 -COOC2H5
1 25
Ch3 CHO
,СН— NH-CH2-COOC2r
1 C2H5ONa/ HCOOC2H5
2 KSCN / HCI
HS
V=N 1 HNO3/[NaNO2:
^CH—N I 2 Na2CO3
iH-p
COOC2H5
COOC2H5
Этомидат — производное имидазола. структурно не похожее на
другие анестетики, является средством для ингаляционного наркоза,
длительность действия которого зависит от введенной дозы. Препарат
не проявляет анальгетических свойств и обладает противосудорожнои
активностью. Поскольку его внутривенное введение вызывает быструю
-12-
Общие анестетики
потерю сознания, его можно классифицировать и как седативный гип-
нотик. Из-за плохой растворимости в воде с рН выше 3 в клинике он
применяется в виде растворов в пропиленгликоле, что вызывает болез-
болезненность при инъекциях. Более того, препарат вызывает послеопераци-
послеоперационную тошноту и рвоту, что несколько ограничивает его применение.
Скорость, с которой наступает потеря и затем восстановление сознания,
несколько меньше таковой у барбитуратов.
Синонимом препарата является гипномидат и др.
В хирургической практике практически используются два барбиту-
барбитурата, тиопентал и метогекситал. Однако следует знать, что барбитураты
являются гипнотиками и в терапевтических дозах имеют весьма слабые
анальгетические и мышечнорасслабляющие свойства, которыми должен
обладать общий анестетик.
Тиопентал (Thiopental)
Тиопентал — 5-этил-5-A-метилбутил)-2-тиобарбитуровую кислоту
A.2.10) получают алкилированием этилмалонового эфира 2-бром-
пентаном в присутствии этилата натрия. Полученный при этом
этил-A-метилбутил)малоновый эфир A.2.9) вводят в реакцию гете-
гетероциклизации с тиомочевиной, также используя в качестве основа-
основания этилат натрия [16, 17].
СНз
HsC2-O'
О-С2Н5
С2Н5
H5C2-1
H7C3-9H
H5C2O
1 2 10
Тиопентал является барбитуратом ультракороткого действия, ис-
используется для гладкого и приятного для пациента осуществления ане-
анестезии. Выход из состояния анестезии при применении обычных тера-
терапевтических доз происходит уже через 15 мин после введения.
Тиопентал имеет прямое дозозависимое угнетающее действие на мио-
миокард, на ЦНС и в меньшей степени действует на гладкую мускулатуру
сосудов. Применяют для наркоза при непродолжительных хирургиче-
хирургических операциях.
Барбитураты вообще и тиопентал в частности переводят в раство-
растворимую форму обработкой основаниями. Поэтому очень часто тиопентал
поступает на рынок под названием тиопентал натрия. В данном случае
образование соли происходит за счет атома серы в ентиольной форме.
- 13-
Глава 1
Наиболее распространенными синонимами тиопентала являются
пентотал, трапанал, фармотал, интравал и др.
Метогекситал (Methohexital)
Метогекситал — 5-аллил-1-метил-5-A-метил-2-пентинил)барбиту-
ровую кислоту A.2.15) синтезируют по классической схеме получе-
получения производных барбитуровой кислоты, а именно: взаимодействи-
взаимодействием производных малонового эфира с производными мочевины.
Исходный аллил-A-метил-2-пентинил)малоновый эфир A.2.14) по-
получают последовательным алкилированием самого малонового
эфира, сначала 2-бром-З-гексином с получением A-метил-2-пенти-
нил)малонового эфира A.2.13), а затем аллилбромидом. 2-бром-З-
гексин A.2.12), в свою очередь, получают исходя из реактива Нор-
Нормана, синтезируемого из 1-бутина и этилмагнийбромида, взаимо-
взаимодействием с уксусным альдегидом и последующим бромированием
полученного карбинола A.2.11) трехбромистым фосфором. Вводя
диалкнлированный таким образом малоновый эфир A.2.14) во
взаимодействие с N-метилмочевиной, получают метогекситал
A.2.15) [18].
РВгз
Н5Сг-С=С-МдВг
н5с2-с=с-сн-сн3
Вг
1,2.12
0
н5с2-о'^>
НдС2 ""С —С СН
СНз
+ снз-с-н *•
IX
Н5С2 -0''^^'^О-С2Н5
Н5С2-С5С-СН-СН3 *¦
ОН
1.2.11
О О
16C2-O'Y'^O-C2H5
i
Н5С;-С=С-СН-СНз
0
м
С^О-СгНб CH3NHCONH2
СН2-СН=СН2
1.2.14
1.2.13
-^ Н5С2^С^С
СН2=С1+—ОН2-Вг
СНз
-CH°^rV°
iH3V"H
Н2С О
Метогекситал также является барбитуратом ультракороткого дейст-
действия и применяется по тем же показаниям, что и тиопентал. Имеет
несколько меньшее время действия, чем тиопентал, однако в клинике
эта разница слабо различима.
Синонимами препарата являются пентотал, интравал, фармотал, ра-
вонал и др.
-14-
Общие анестетики
Как уже было отмечено, в практике анестезиологии в качестве
вспомогательных веществ широко применяются также опиоидные
анальгетики, в частности — морфин, фентанил, альфентанил и суфента-
нил.
морфин
СН2-СН2— N V- N^
Н2ОСН3
-Nv_X 8
N-C-C2H5
альфентанил
суфентанил
Синтез этих соединений описывается в разд. 3.1. «Опиоидные
анальгетики».
Кроме опиоидов для снятия беспокойства у пациентов во время
анестезии очень часто применяются и бензодиазепины: диазепам, лора-
зепам и мидазолам, которые проявляют анксиолитический, седативный,
противосудорожный эффекты, вызывают амнезию и мышечное рас-
расслабление.
диазепам
мидазолам
Глава 1
Синтез первых двух описывается в разд. 5.1. «Бензодиазепины>>, где
одновременно показан и синтез структурных аналогов мидазолама (ал-
празолам и др.).
Поскольку средства для наркоза относятся к разным классам хими-
химических соединении, общих закономерностей между их химическим
строением и активностью не существует, Установлены лишь частные
закономерности для отдельных рядов соединений (барбитураты, бензо-
диазепины и др.).
Список литературы
1. US Pat. 2.921.098A960).
2. Brit. Pat. 767.774A955).
3. Brit. Pat. 805.764A957).
4. US Pat. 3.469.011 A969).
5. US Pat. 3.527.813A970).
6. US Pat. 3.535.388A970).
7. US Pat. 3.535.425A970).
8. Brit. Pat. 928.786A960).
9. Archibald E. H The Preparation of Pure Inorganic Substances. New
York: Wiley, 1932. — P. 246.
10. Schenk A. Handbook of Preparative Inorganic Chemistry. 2nd ed.
New York: Academic Press, 1963. — Vol. 1. — P. 484.
11. US Pat. 2.11.276A938).
12. US Pat. 3.254.124A966).
13. Belg. Pat. 634.208A963).
14. US Pat. 3.354.173A967).
15. Janssen P A. J. et al./'Arzneim Forsch. — 1971. Vol. — 21. —
P. 1234.
16. US Pat. 2.153.729A939).
17. US Pat. 2.876.225A959).
18. US Pat. 2.872.448A959).
Глава 2
Местные анестетики
Местные анестетики — это препараты, применяемые с целью вре-
временного и обратимого устранения болевой чувствительности опреде-
определенных участков тела путем блокирования проведения импульсов
в нервных волокнах.
В клинике местные анестетики применяются различными способа-
способами в самых разных случаях, требующих местного обезболивания начи-
начиная с простейших процедур по удалению небольшого участка повреж-
поврежденного поверхностного слоя кожи и до сложнейших операций по
пересадке органов. Местные анестетики широко применяются в клини-
клинике для обезболивания начиная со стоматологических процедур и до ги-
гинекологических вмешательств.
В терапевтических концентрациях местные анестетики обратимо
блокируют нервную передачу, вызывают местную потерю чувствитель-
чувствительности, устраняют при этом чувство боли и предотвращают мышечную
активность.
В отличие от общих анестетиков эти препараты вызывают потерю
чувствительности определенного участка без потери пациентом созна-
сознания.
Местные анестетики применяют для облегчения переносимости бо-
боли и болезненности, при раздражениях и зуде, связанных с нарушением
целостности кожи и слизистых оболочек (порезы, укусы, раны, сыпи,
аллергические состояния, грибковые инфекции, кожные язвы, трещи-
трещины).
Их применяют при проведении офтальмологических процедур, та-
таких как тонометрия, гониоскопия, удаление инородных тел, и при ма-
малых хирургических вмешательствах.
Местные анестетики широко применяются в хирургии, гинекологии
и стоматологии.
В определенных случаях местные анестетики (лидокаин, прокаина-
мид) могут применяться в качестве антиаритмических средств.
-17-
Глава 2
Местные анестетики могут быть классифицированы как по принци-
принципиальным способам их клинического применения, так и на основании
их принадлежности к определенному химическому классу соединений.
С медицинской точки зрения, согласно методам клинического при-
применения, местную анестезию можно дифференцировать следующим
образом.
Поверхностная анестезия
Местное применение препаратов этого ряда на слизистых оболоч-
оболочках носа, рта, гортани, трахеобронхиального древа, глаз, мочевого
и жел>дочно-кишечного трактов (ЖКТ) вызывает поверхностную
анестезию.
С этой целью применяют бензокаин, циклометикаин, гексилкаин,
кокаин, лидокаин и тетракаин.
Инфилътрационная анестезия
Прямое введение местного анестетика в кожу или более глубоко
расположенные ткани для хирургического вмешательства называют
инфильтрационной анестезией.
С этой целью в основном применяют лидокаин, мепивакаин, бупи-
вакаин, этидокаин и прокаин.
Проводниковая, или регионарная, анестезия
Введение местного анестетика в индивидуальный нерв или группу
нервов при небольших хирургических вмешательствах с целью блоки-
блокирования чувствительности, двигательной активности часто называют
проводниковой, или регионарной, анестезией. Этот метод часто приме-
применяется при хирургических вмешательствах на плече, руке, шее, ноге.
Чаще всего с этой целью применяют лидокаин, мепивакаин и бупи-
вакаин.
Спинномозговая анестезия
Спинномозговая анестезия заключается в введении местных анесте-
анестетиков непосредственно в спинномозговую жидкость, что вызывает сим-
симпатическую блокаду, потерю чувствительности и мышечное расслабле-
расслабление путем воздействия анестетика на всем пути спинномозгового нерва.
Метод применяется при больших хирургических вмешательствах.
Как правило, с этой целью применяют лидокаин, мепивакаин и бу-
пивакаин.
-18-
Местные анестетики
Эпидуральная анестезия
Под эти термином понимают введение местных анестетиков в обо-
оболочку спинного мозга, в межпозвоночное пространство. Эпидуральная
анестезия применяется при акушерских и гинекологических вмешатель-
вмешательствах, не требующих очень быстрого развития анестезии.
С этой целью применяют лидокаин, мепивакаин, бупивакаин, эти-
этидокаин и хлорпрокаин.
В качестве местного анестетика для офтальмологического вмеша-
вмешательства в клинике впервые в 1884 г. был применен алкалоид — кокаин.
Сегодня в связи с опасностью развития наркомании и высокой токсич-
токсичностью его клиническое применение сильно ограничено. Однако рас-
расшифровка его структуры, попытки его синтеза, выведения закономер-
закономерностей структуры-активности, упрощения предполагаемой
фармакофорной части молекулы явились одним из мощных стимулов
для развития химии синтетических лекарственных средств. Первым
синтетическим местным анестетиком, внедренным в клиническую прак-
практику в 1905 г., явился прокаин (новокаин). Позже были синтезированы
тысячи соединений с аналогичными свойствами, однако лишь около 10-
12 соединений нашли применение на практике. В 1947 г. был внедрен
лидокаин, а в 1963 г. — бупивакаин (местный анестетик длительного
действия).
Как агенты, блокирующие проводимость в аксонах и дендритах, ме-
местные анестетики отличаются от соединений, блокирующих нейрональ-
ную передачу в синапсах.
Предложен механизм действия местных анестетиков, согласно ко-
которому они являются блокаторами натриевых каналов.
Согласно этому механизму, молекулярными мишенями действия
местных анестетиков являются вольтажзависимые натриевые каналы,
имеющиеся во всех нейронах. Процесс местной анестезии соответст-
соответствующими препаратами схематично можно представить следующим об-
образом.
В состоянии покоя между аксоплазмой и внешней частью клетки
существует определенный потенциал покоя. Этот потенциал покоя
обеспечивается относительными концентрациями ионов Na~ и К" вдоль
мембраны нерва.
При стимулировании нерва мембрана деполяризуется, в эгом рай-
районе открываются натриевые каналы и ионы Na^ устремляются в клетку.
У пика деполяризации открываются выходные калиевые каналы. По-
Последние покидают клетку, и клетка реполяризуется.
Этот процесс длится 1-2 мс, после чего нервная клетка, передав не-
необходимый импульс, восстанавливает свой ионный градиент.
-19-
Глава 2
Полагают, что после введения в организм местного анестетика
в виде водорастворимой соли, в зависимости от его рКя и рН тканевой
жидкости, устанавливается равновесие между основной и катионной
формой применяемого препарата. Полагают также, что только основная
(незаряженная) форма препарата может пройти и проходит через соеди-
соединительную ткань, окружающую нервное волокно через фосфолипиды
плазматической мембраны в аксоплазму. В аксоплазме основание вновь
ионизируется в той мере, которая определяется внутриклеточной рН.
Предполагают, что далее препараты селективно связываются с внутри-
внутриклеточной поверхностью натриевых каналов и блокируют вход ионов
Nah в клетку. Это приводит к торможению процесса деполяризации,
необходимого для распространения потенциала действия, к повышению
порога электрического возбуждения нерва и, тем самым, к устранению
чувства боли.
Поскольку процесс связывания анестетиков с ионными каналами
обратим, то после прекращения введения препарат диффундирует об-
обратно в сосудистую систему и метаболизируется, а функция нервной
клетки полностью восстанавливается.
Механизм действия бензокаина несколько отличается от изложен-
изложенного выше. Предположительно, он действует путем растворения в фос-
фолипидной мембране и растягивает ее. Это деформирует натриевые
каналы, что, в свою очередь, своеобразным способом понижает натрие-
натриевую проводимость.
Аналогичный механизм растягивания (изменение текучести) мем-
мембраны был предложен и для объяснения механизма действия общих
анестетиков.
С химической точки зрения общие анестетики можно классифици-
классифицировать как сложные эфиры я-аминобензойной кислоты и диалкилами-
ноалканолов или же как анилиды диалкилзамещенных по аминогруппе
а-аминокислот.
При формализованном рассмотрении все применяемые местные
анестетики состоят из трех частей: ароматического кольца (липофиль-
ная часть), промежуточной углеводородной цепи и аминной части
(гидрофильная группа). Замещение в ароматическом кольце и в
аминной части меняет как растворимость, так и степень связывания
-20-
Местные анестетики
части меняет как растворимость, так и степень связывания анестетиков
с рецепторами, что, в свою очередь, определяет силу и продолжитель-
продолжительность действия препаратов. Принято считать, что способность вызывать
аллергические реакции, стабильность и, в ряде случаев, токсичность
также обусловлены строением этой связующей цепочки, которая, в
свою очередь, определяет место биотрансформации и инактивации пре-
препарата — либо ферментативным гидролизом в плазме (сложноэфирные
анестетики), либо разложением в печени (аминоа.мидные анестетики).
Интересно, что ряд антигистаминных, антихолинергических и адре-
нергических препаратов, имеющих аналогичную химическую структу-
структуру, также проявляют местноанестезирующие свойства. Возможно, что
и они, взаимодействуя с внутренней аксоплазматической мембраной,
уменьшают ионный поток и, в частности, поток ионов Na* внутрь нерв-
нервных клеток.
2.1. Местные анестетики ряда аминоэфиров
Прокаип (Procaine)
Прокаин — 2-диэтиламиноэтиловый эфир 4-аминобензойной кис-
кислоты B.1.1), больше известный под названием новокаин, получа-
получают двумя путями. Первый способ заключается в непосредствен-
непосредственном взаимодействии этилового эфира 4-аминобензойной кислоты
с 2-диэтиламиноэтанолом в присутствии этилата натрия. Второй
способ синтеза исходит из 4-нитробензойной кислоты, которую
взаимодействием с хлористым тионилом трансформируют в хлор-
ангидрид B.1.2) и далее этерифицируют 2-ди-этиламинотанолом,
после чего нитрогруппу в полученном сложном эфире B.1.3) вос-
восстанавливают в аминогруппу водородом в присутствии никеля Ре-
нея[1,2, 3, 4].
С2НЕ
Н2 / Raney Ni
COO—CH2-CH2-N
c2h5
C2H5
21 3
-21 -
Глава 2
HO-CH2-CH2-N
Р2Н5
С2Н5
Прокаин является местным анестетиком с коротким периодом дей-
действия. Применяется для купирования болевого синдрома различного
генеза, широко используется при инфильтрационнои, проводниковой,
эпидуральной и спинномозговой анестезии, для потенцирования дейст-
действия основных препаратов при общей анестезии. Может вызывать аллер-
аллергические реакции.
Наиболее распространенными синонимами прокаина являются но-
новокаин, адрокаин. имплетол, мелкаин.
Хлорпрокаин (Chloroprocaine)
Хлорпрокаин — 2-диэтиламиноэтиловый эфир 2-хлор-4-амино-
бензойной кислоты B.1.5) является хлорированным в о-положении
по отношению к карбонильной группе бензольного кольца анало-
аналогом прокаина. Синтез препарата осу ществляют прямым взаимодей-
взаимодействием гндрохлорида хлорангидрида 4-амино-2-хлорбензойной кис-
кислоты 12 14) и гидрохлорида 2-диетиламиноэтанола. Необходимый
для синтеза гидрохлорид хлорангидрида 4-амино-2-хлорбензойной
кислоты получают взаимодействием 2-хлор-4-аминобензойной кис-
кислоты с хлористым тионилом [5].
HO-CH2-CH2-h
Р2Н5
¦соон
SOCI2
с2н5
HCI
H2N
с2н5
/У- COO—CH2-CH2-N
С2Н5
2 1 5
Хлорпрокаин показан при необходимости быстрого достижения
эффекта обезболивания и используется для инфильтрационнои анесте-
анестезин, блокирования периферической нервной передачи, спинальной
и эпидуральной анестезии.
-22-
Местные анестетики
Синонимом препарата является нескаин.
Тетракаин (Tetracaine)
Тетракаин — 2-диэтиламиноэтиловый эфир 4-бутиламинобензой-
ной кислоты B.1.6) также является структурным аналогом прокаи-
прокаина, в котором аминогруппа в бензольном кольце замещена бутиль-
ным радикалом. Методы, предложенные для его синтеза, повторяют
вышеописанные методы синтеза прокаина или хлорпрокаина, но
с использованием вместо 4-аминобензойной кислоты 4-бутилами-
нобензойной кислоты. Предложен также вариант синтеза, исходя-
исходящий непосредственно из прокаина B.1.1). путем его непосредствен-
непосредственного взаимодействия с масляным альдегидом и одновременным
восстановлением водородом с использованием в качестве катализа-
катализатора п&чладия на угле [6].
1СП3СН2СН2СОН
С2Н5
/)—COO—CH2-CH2-N
Р2Н5
C2H5
Тегракаин -— мощный местный анестетик длительного действия.
В основном используется при спинномозговой анестезии.
Наиболее популярными синонимами тетракаина являются понтока-
ин и бутилкаин.
Кокаин (Cocaine)
Кокаин — 3-0-бензоилокси-2C-метоксикарбонилтропан B.1.13)
фактически можно считать практическим и, в определенном смыс-
смысле, идеологическим родоначальником анестетиков ряда аминоэфи-
ров. Алкалоид кокаин был выделен в 1860 г. из листьев кокаинового
куста (Eryihroxylon coca), содержащего разные алкалоиды, произ-
производные экогонина B.1.11), значительная часть которых приходится
на долю кокаина. В 1898 г. была установлена его структура.
Большая часть добываемого из естественных источников кокаина
получается полусинтетическим путем. С этой целью омылением смеси
алкалоидов, извлеченных из листьев кокаина, получают экогонин
B.1 11), карбоксильную группу которого метилируют с получением
метилового эфира экогонина B.1.12). Полученный продукт далее бен-
зоилируют по спиртовой гидроксильной группе с получением кокаина
B 1 13). Этот процесс соответствует превращениям, указанным на пер-
первой схеме синтеза кокаина.
-23-
Глава 2
Первый синтез кокаина был осуществлен в 1902 г. Из предложен-
предложенных вариантов наиболее рациональными можно считать следующие две
схемы его синтеза.
Первый способ синтеза исходит из калиевой соли этилового эфира
ацетондикарбоновой кислоты, электролизом которой получают этило-
этиловый эфир сукцинилдиуксусной кислоты B.1.7), которая при дальней-
дальнейшем взаимодействии с метиламином образует 1-метил-2,5-дикарбэто-
ксиметилиденпирролидин B.1.8). Восстановление двух двойных связей
в этом соединении приводит к получению 1-метил-2,5-дикарбэтокси-
метилпирролидина B.1.9). Последний подвергают внутримолекулярной
циклизации в условиях реакции Дикмана с использованием в качестве
конденсирующего средства этилата натрия с получением этилового
эфира тропин-2-карбоновой кислоты B,1.10). Восстановлением кето-
группы в последнем и последующим гидролизом карбэтосильной груп-
группы получают тропин-2-карбоновую кислоту или экогонин B.1.11). Ме-
Метилирование карбоксильной группы последнего в сложный эфир
B.1.12) и дальнейшее ацилирование гидроксильной группы хлорангид-
ридом бензойной кислоты приводит к рацемической смеси 3-бен-
зоилокси-2-метоксикарбонилтропанов B.1.3), из которой, пользуясь
меньшей растворимостью, выделяют Б,Ь-кокаин. Разделение оптиче-
оптических изомеров осуществляют через соли D-бром-камфор-Р-сульфоновой
кислоты, однако при гидролизе происходит отщепление не только
бромкамфорсульфонильной группы, но и бензоильной. в связи с чем
после разделения осуществляют повторное бензоилирование [7].
о
Н5С2ОСС-СН2-С —СН2-СООК
2-СО-СН2-СОСС2Н5 СЬзцн^
СН2-СО-СНг-СОСС2Н5
21?
Н6С2ООС
Г Т C2H«ONa
-СН N СН-СООС2Н5
СН3
N
СНз
N
СНз
2 1 9
СНз
N
2.1 12
:оос^5 ^„; ^YC00H
ОН
2111 он
сн3
N
21.13
СООСНз
осо-
-24-
Местные анестетики
Согласно второму способу, исходят из тропанона, который подвер-
подвергают метоксикабонилированию метиловым эфиром угольной кислоты
в присутствии натрия с получением натриевой соли B.1.14), которую
после кислотного гидролиза, восстановления карбонильной группы по-
полученного кетоэфира амальгамой натрия или электролитически ацили-
руют хлорангидридом бензойной кислоты с получением искомого про-
продукта [8].
(сн3оJсо
Na
СН3
N
сооснз
COCI
соосн.
2.1.14 О—Na
2.1.13
ОСО-
Как и в предыдущем случае, конечным продуктом является раце-
рацемат, из которого выделяют левовращающий изомер. Позднее были
предложены и другие методы синтеза [9, 10].
Кокаин лишь в исключительных случаях используется как поверх-
поверхностный анестетик в офтальмологии ввиду его сильного действия на
ЦНС и быстрого возникновения к нему пристрастия.
2.2. Местные анестетики ряда аминоамидов
Лидокаин (Lidocaine)
Лидокаин — 2-(диэтиламино)-№B,6-диметилфенил)ацетамид B.2.2)
синтезируют исходя из 2,6-диметиланилина путем его взаимодейст-
взаимодействия с хлорангидридом хлоруксусной кислоты с получением а-хлор-
2,6-диметилацетанилида B.1.1) и дальнейшим его взаимодействием
с диэтиламином [11].
С2Н5
0 С:
-nh-c-ch2n(
с
СНз 2.2 2
Лидокаин — наиболее широко применяемый местный анестетик.
Его отличная терапевтическая активность, быстрота достижения эффек-
эффекта и достаточная продолжительность действия делают его пригодным
-25-
Глава 2
практически для любого клинического применения. Препарат стабили-
стабилизирует клеточные мембраны, блокирует натриевые каналы, способству-
способствует выходу ионов К+ из клеток и ускоряет процесс реполяризации кле-
клеточных1 мембран. Применяют при терминальной инфильтрационной,
проводниковой, эпидуральной и спинальной анестезии при оператив-
оперативных вмешательствах в стоматологии, отоларингологии, акушерстве
и гинекологии. Применяют также при желудочковой экстрасистолии
и тахикардии, особенно в острой фазе инфаркта миокарда.
Синонимами препарата являются анестокаин, ксилокаин, нефлуан
и многие другие.
Мепивакаин (Mepivacaine)
Мепивакаин — >ч-B,6-диметилфенил)-1-метил-2-пиперидинкар-
боксамид B.2.3). Для его синтеза предложено два основных метода.
Согласно первому способу, мепивакаин получают, вводя во взаимо-
взаимодействие этиловый эфир 1-метилпиперидин-2-карбоновой кислоты
с 2,6-диметиланилиномагний бромидом, который получают, обра-
обрабатывая 2,6-диметиланилин этилмагнийбромидом [12, 13, 14].
C2H5MQBr
^Ы
СНз
223
Согласно второму способу, взаимодействием 2,6-диметиланилина
с хлорангидридом пиридин-2-карбоновой кислоты первоначально полу-
получают 2,6-ксилидид^ а-пиколиновой кислоты B.2.4), ароматическое пи-
пиридиновое кольцо которого восстанавливают в пиперидиновое водоро-
водородом с использованием в качестве катализатора платины на угле.
Полученный при этом 2,6-ксилидид а-пипеколиновой кислоты
B.2.5) метилируют в мепивакаин формальдегидом при одновременном
восстановлении водородом с использованием в качестве катализатора
палладия на угле [15].
CHj
=ч H2/Pt—C/HCI
СНз
224
-26-
Местные анестетики
NH-
(CH2O)n/ H2Pd-C
225
223
Мепивакаин по своим свойствам сходен с лидокаином, однако об-
обладает более продолжительным действием.
Синонимами мепивакаина являются карбокаин и эстрадурин.
Бупивакаин (Bupivacaine)
Бупивакаин — К-B,6-диметилфенил)-1-бутил-2-пиперидинкарбокс-
амид B.2.7) химически сходен с мепивакаином и отличается лишь
заменой в пиперидиновом кольце N-метильного заместителя на
N-бутильный. Для его синтеза также предложено два метода. Пер-
Первый способ исходит из а-пиколин-2,6-ксилидида B.2.4). Алкилиро-
ванием последнего бромистым бутилом получают соответствую-
соответствующую соль пиридиния B.2.6). Эту соль восстанавливают водородом
в пиперидиновое производное, используя в качестве катализатора
окись платины с получением бупивакаина [13, 16].
Н2 RO
CH3
Ч=( N—'
СН3 С4Н8
227
пипе-
Второй способ исходит непосредственно из хлорангидрида пипе-
ридин-2-карбоновой кислоты, которую вводят во взаимодействие с 2,6-
диметиланилином. Образующийся при этом амид B.2.8) алкилируют
далее бромистым бутилом в бупивакаин [17, 18, 19].
СН3 Н
22 8
СН3
СН3 С4Н9
227
Как лидокаин и мепивакаин, бупивакаин используется для ин-
инфильтрационной, спинальной и эпидуральной анестезии, блокирования
-27-
Глава 2
нервной передачи. Наиболее важное отличительное его свойство —
более длительное время действия. Препарат в основном применяют для
оперативных вмешательств в урологии и нижнеторкальной хирургии
длительностью до 3-5 ч; в абдоминальной хирургии — длительностью
до 45-60 мин, Используют для блокады тройничного нерва, крестцового
и плечевого сплетений, при вправлении вывихов, при эпидуральной
анестезии при кесаревом сечении.
Наиболее распространенным синонимом бупивакаина является
маркаин.
Этидокаин (Etidocaine)
Этидокаин — М-B.6-диметилфенил)-2-(этилпропиламино)бутан-
амид B.2.12) также является анилидом а-диалкиламиноамино-
кислоты, однако последовательность реакций для его получения не-
несколько отличается от рассмотренных выше. На первой стадии
синтеза 2,6-диметиланилин вводят во взаимодействие с хлорангид-
ридом ос-броммасляной кислоты с получением броманилида B.2.9).
Далее с целью повышения выхода продукта последующей реакции
нуклеофильного замещения галогена на пропиламинную группу
осуществляют замещение атома брома в полученном амиде на атом
йода. Полученное при этом йодопроизводное B.2.10) с легкостью
вступает во взаимодействие с пропиламином, образуя аминоамид
B.2.11), который далее повергают N-этилированию диэтилсульфа-
том в этидокаин [20, 21].
н6сгоос -сн
СНз
N
соон
2 1 10 О
СН3
СНз
СНз
NH-C-CH-NH-C3H7
с2н5
2211
(C2H5O)SO2
О
и
С2Н5
с2н5
2212
Этидокаин по своим фармакологическим свойствам сходен с мепи-
вакаином, однако, в определенной степени, обладает и свойствами мы-
мышечного релаксанта.
Синонимом препарата является дуранест и др.
-28-
Местные анестетики
Прилокаин (Prilocaine)
Прилокаин — 2-(пропиламино)-о-пропионтол\идид B.2.14) по сво-
своему строению относится к той же группе, что и этидокаин, и струк-
структурно отличается от последнего тем, что во время синтеза вместо
2,6-диметиланилина использован о-толуидин вместо фрагмента
масляной кислоты; в структуру препарата включен фрагмент про-
пионовой кислоты, а концевая пропилэтиламинная группа заменена
на пропиламинную. С целью синтеза прилокаина о-толуидин вводят
во взаимодействие с бромангидридом бромпропионовой кислоты,
и полученный при этом бромпропионилтолуидид B.2.13) далее
вводят во взаимодействие с пропиламином с получением искомого
прилокаина [22, 23].
СНз
-NH2
Вг—С-СН-Вг
СН3
,СНз
' ^* NH-C-CH-Br
СНз
сн3
/Г\_ °
\_У NH -С -СН -NH —СзН7
сн3
2 2 14
По своим фармакологическим параметрам прилокаин сравним с ли-
докаином. однако по причине ряда токсических проявлений препарат на
практике используется редко.
Известными синонимами прилокаина являются цитанест и ксило-
нест.
2.3. Поверхностные анестетики
Бензокаин (Benzocaine)
Бензокаин — этиловый эфир 4-аминобензойной кислоты B.3.1).
Классическим и оптимальным способом получения бензокаина яв-
является восстановление этилового эфира 4-нитробензойной кислоты
в бензокаин водородом, получаемым прямо в реакционной среде
при взаимодействии железных опилок с разбавленными кислотами
[24, 25. 26].
[Н]
23 1
Бензокаин применяется при поверхностной анестезии на коже или
на слизистых оболочках в виде аэрозолей или мазей для облегчения бо-
-29-
Глава 2
Местные анестетики
лей при зуде и ожогах, порезах, укусах, и т. д. Начинает действовать
через 15-30 с после применения и действует в течение 12-15 мин.
Синонимами препарата являются анестезин, дермопласт и др.
Циклометикаин (Cyclomthycaine)
Циклометикаин — этиловый эфир 3-B-метилпиперидино)пропил-о-
циклогексилоксибензойной кислоты B.3.4) получают по нижепри-
нижеприведенной схеме. Алкилированием 2-метилпиперидина 3-хлорпро-
панолом-1 получают 3-B-метилпиперидино)пропанол-1 B.3.2),
спиртовую группу которого замещают на хлор с помощью хлористо-
хлористого тионила. Полученный при этом 3-B-метилпиперидино)пропил-
хлорид-1 B.3.3) далее вводят во взаимодействие с 4-циклогексило-
ксибензойной кислотой с получением циклометикаина [27, 28].
но-,сн,п-с
c-ch2v0-n J
-СОО<СН2)з— N
234
СН3
Циклометикаин также применяется при поверхностной анестезии
на коже или на слизистых оболочках при порезах, > кусах, а также при
урологических обследованиях.
Известным синонимом препарата является сурфакаин.
Список литературы
1. Einhdrn A et al./Ann, 371, 125,131,142, 162 A909).
2. US Pat. 812.554A906).
3. Ger. Pat. 179.627A904).
4. Ger Pat. 194.748A905).
5. US Pat. 2.460.139A949).
6. US Pat. 1.889.645A932).
7. Willstatter R. et al./'Ann. 434, 111 A923).
8. Robinson J > J. Chem. Soc, 111, 762 A917).
9. Tufariello J. et al.//Tetrahedron Letters. 1978, 1733.
10. Tufariello J. et al./J. Am. Chem. Soc. 101, 2435 A979).
11. US Pat. 2.441.498A948).
12. US Pat. 2.799.679A957).
13 Ekenstram B. et al./ 'Acta. Chem. Scand. 11. 1183 A957).
14 RinderknechtHJIUelx. Chim. Acta. 42, 1324 A959).
15. US Pat. 4.110.331A977).
16. Brit. Pat. 869.978A959).
17. US Pat. 2.792.399A957).
18. US Pat. 2.955.111 A960).
19 TullarB F;,J. Med. Chem. 14, 891 A971).
20. US Pat. 3.812.147A974).
21. US Pat. 3.862.321A975).
22. Brit. Pat. 839.943A958).
23. Lofgren N. et al,//Acta Chem. Scand. 14, 486, 490 A960).
24. LimpnchtA.,/Ann. 303, 278 A898).
25 Org. Syn. 8,66A928).
26. Org. Syn. Coll. Vol. I. 240 Bnd ed., 1941).
27. US Pat. 2.439.818A948).
28. Me Elvain S et al.//J. Am. Chem. Soc. 68, 2592 A946).
-30-
Глава 3
Анальгетики
Анальгетиками называются препараты, устраняющие или облег-
облегчающие чувство боли, которое сопутствует многим патологическим
состояниям. Трудно перечислить все те ситуации, при которых необхо-
необходимо применение анальгетиков. Это касается, например, мышечных или
головных болей, при которых обычно используют анальгетики типа
аспирина, не вызывающие никаких проблем, связанных с возможным
развитием зависимости. Более интенсивные боли, возникающие во вре-
время и после хирургических вмешательств, как правило, устраняются вве-
введением опиоидных анальгетиков типа морфина или меперидина. К со-
сожалению, даже весьма кратковременное применение этих анальгетиков
может привести к развитию привыкания, к формированию лекарствен-
лекарственной зависимости и толерантности.
При хронических болях, связанных с хроническими воспалитель-
воспалительными реакциями (ревматоидный артрит и др.), пациенты могут годами
применять анальгетики из ряда нестероидных противовоспалительных
средств (НПВС).
Боль — очень важный защитный феномен, сопутствующий многим
патологическим состояниям. Однако, выполняя свою сигнализирую-
сигнализирующую функцию, боль при чрезмерной интенсивности может, в свою оче-
очередь, усугубить течение основного заболевания* а в некоторых случаях
— например, при тяжелой травме — способствовать развитию шока.
Проблема облегчения болевых ощущений так же стара, как само
человечество. Наверное, с достаточной уверенностью можно утвер-
утверждать, что именно выделение старейшего из известных болеутоляющих
средств — морфина — из опийного мака в начале XIX столетия послу-
послужило имп>льсом для интенсивного развития химии, фармакологии,
фармации.
Анальгетики делятся на две группы: опиоиды (морфиноподобные
вещества), которые воздействуют преимущественно на ЦНС. и неопио-
иды (НПВС или жаропонижающие анальгетики), влияющие преимуще-
преимущественно на периферическую нервную систему.
Опиоиды и неопиоиды различаются по многим параметрам, среди
-32-
Анальгетики
которых следует особенно выделить следующие: опиоиды являются
более мощными анальгетиками, однако они не обладают противовоспа-
противовоспалительным действием; опиоиды могут вызвать зависимость и толерант-
толерантность, поэтому их применение должно быть кратковременным. Кроме
того, неопиоидные анальгетики редко применяются в инъекционной
форме.
Несмотря на то. что препараты обеих групп устраняют боль, их
фармакологическое действие различно, в связи с чем указанные группы
рассматриваются раздельно.
3.1. Опиоидные анальгетики
Опиоиды подразделяются на три большие подгруппы по действию
на опиоидные рецепторы: агонисты, смешанные агонисты-антагонисты
и антагонисты.
Опиоидные агонисты имеют сродство к опиоидным рецепторам,
имитируя активность эндогенных опиоидных анальгетиков. Смешанные
агонисты-антагонисты являются полусинтетическими производными
морфина, которые проявляют агонистическую активность в отношении
одних опиоидных рецепторов и антагонистическую — в отношении
других. Опиоидные антагонисты связываются с опиоидными рецепто-
рецепторами, но не активируют их. Эти соединения не используются для аналь-
анальгезии. Их терапевтическое значение заключается в том, чтобы устра-
устранить побочные эффекты, возникающие при абсолютной или
относительной передозировке или непереносимости больным препара-
препаратов, а также для лечения случаев зависимости от опиоидов.
Агонисты включают природные алкалоиды опия (морфин, кодеин,
смесь природных алкалоидов — пантопон и омнопон); их аналоги (гид-
рокодон и гидроморфон, оксикодон и оксиморфон); производные мор-
финана (леворфанол); ряд синтетических соединений производных фе-
нилпиперидина (меперидин, промедол); 4-анилидопиперидины (фент-
нил. суфентанил, альфентанил); производные дифенилгептана (метадон,
пропоксифен).
Смешанные агонисты-антагонисты включают производные морфи-
нана (налорфин, буторфанол), фенантрена (налбуфин), бензоморфана
(пентазоцин, дезоцин), ориправина (бупренорфин).
Антагонистами являются налоксон, налтрексон.
Общепринято считать, что действие опиоидов опосредуется опре-
определенными рецепторами. Предполагается существование нескольких
типов опиоидных рецепторов: ц, к, 8, а. Некоторые из них, в свою оче-
-33-
Глава 3
редь, подразделяются на подтипы. Не исключено, что опиоидные ре-
рецепторы локализованы в мембранном фрагменте синаптосомальной
фракции, и, возможно, они являются гликопротеинами. Они подверже-
подвержены конформационным изменениям в определенных условиях, что, веро-
вероятно, и предопределяет их селективное связывание с агонистами или
антагонистами.
Опиоиды имеют различную химическую структуру, и их относи-
относительный анальгетический потенциал зависит от множества разных фак-
факторов, включая их сродство к специфическим местам связывания на
рецепторах, от проявляемой активности на самих рецепторах и фарма-
кокинетических особенностей.
Разные типы опиоидных рецепторов были постулированы именно
для объяснения различного действия опиоидов.
Рецепторы, воздействие на которые вызывает реакцию организма,
аналогичную таковой при введении морфина, — анальгезию, депрессию
дыхания, миоз, расстройства ЖКТ и эйфорию — были названы ц-ре-
цепторами. Рецепторы, воздействие на которые вызывает эффекты, ана-
аналогичные эффектам, вызываемым кетазоцином, — анальгезию, седа-
тивный эффект, миоз — были названы к-рецепторами. Анальгетические
рецепторы, вызывающие также психотомиметические реакции: дисфо-
дисфорию галлюцинации, стимуляцию дыхательной и сердечно-сосудистой
систем, мидриаз — характерные для соединений класса агонист-
антагонист типа N-аллилнорметазоцина, были названы ст-рецепторами.
Рецепторы, реагирующие на воздействие энкефалинов и вызывающие
анальгезию и высвобождение гормона роста, были названы 5-рецеп-
торами.
Несмотря на то, что многочисленные исследования подтверждают
тот факт, что воздействие на разные рецепторы вызывает различный
эффект, их точная природа и роль еще окончательно не выяснены.
Физиологическая роль эндогенной опиоидной системы не ограни-
ограничивается лишь болью или анальгезией. Она однозначно играет роль
в регуляции эндокринной, поведенческой, терморегуляционной, им-
иммунной и гастроинтестинальной систем, равно как и участвует в меха-
механизмах развития привыкания и зависимости от опиоидов. Не исключе-
исключено, что эндогенные опиоиды могут взаимодействовать со многими
другими нейротрансмиттерными системами.
Концепция, согласно которой опиоиды вызывают анальгезию в ре-
результате взаимодействия с определенными рецепторами, была предло-
предложена много лет назад, однако до 1973 г. специфические места связыва-
связывания опиоидов не были идентифицированы как рецепторы и не было
-34-
Анальгетики
определено их распределение. Частота распределения мест связывания
опиоидов значительно варьирует в различных регионах ЦНС и особен-
особенно высока в структурах мозга, ассоциированных с физиологическими
функциями, связанными с действием опиоидов, что указывает на корре-
корреляцию между местом связывания и эффектом. Опиатные рецепторы
найдены и вне ЦНС и, в частности, в вагусе и в ЖКТ.
Нейрохимические данные свидетельствуют, что опиоидные рецеп-
рецепторы в мозге ассоциированы с пресинаптическими структурами, функ-
функционируя путем уменьшения высвобождения нейротрансмиттеров.
Полагают, что взаимодействие агонистов с опиоидными ц-рецепто-
рами приводит к увеличению оттока из клетки ионов К+ и одновременно
создает затруднения притоку ионов Са2+ внутрь клетки, что делает ней-
нейрон менее возбудимым.
Агонисты к-рецепторов непосредственно ингибируют вход ионов
Са " в нейроны, просто уменьшая их поток через вольтажзависимые
кальциевые каналы. Эти подтверждается фактами, указывающими, что
повышенные концентрации ионов Саъ ослабляют действие морфина,
а пониженные — усиливают, Действие морфина на восприятие боли
отличается от действия местных анестетиков. Местные анестетики
уменьшают и ослабляют восприятие боли, препятствуя передаче сигна-
сигнала от места проявления боли. Опиоиды же очень мало воздействуют на
аксональное проведение, скорее блокируя межнейрональную передачу
болевых импульсов на разных уровнях интеграции ЦНС.
В мозге и других тканях были ^ббнаружены эндогенные олигопеп-
тиды связывающиеся с участками опиоидных рецепторов и действую-
действующие аналогично опиоидам. Первыми из них, которые были выделены
и расшифрованы, являлись метэнкефалин и лейэнкефалин. Пептид
с намного большей молекулярной массой и с аналогичной активно-
активностью — бета-эндорфин был найден в подмозговом и дуговидном при-
придатках
Другой пептид, названный динорфином, был идентифицирован
позднее. Эндогенным опиоидным пептидам приписывается и много
др>гих различных функций, включая участие в нейропередаче, однако
механизм их опиоидного действия не ясен.
Опиоиды вызывают побочные реакции, которые ограничивают их
применение. К ним относятся угнетение дыхания, тошнота, рвота, запо-
ро1, повышение уровня артериального давления, задержка мочеиспуска-
мочеиспускания, потоотделение, зуд и другие, наиболее опасной из которых, ко-
конечно, является депрессия дыхания. Опиоиды вызывают зависимость
и привыкание.
-35-
Глава 3
Агонисты
Наиболее широко в качестве агонистов в медицинской практике ис-
используются алкалоиды опия — морфин и кодеин. Однако широкое при-
применение нашли и полусинтетические производные (гидроморфон, ок-
симорфон, гидрокодон, оксикодон), которые, в определенных случаях,
оказываются более предпочтительными для применения, и чисто синте-
синтетические мощные соединения (метадон, меперидин, фентанил, суфента-
нил и др.).
Опиоидные агонисты действуют в первую очередь на ц-рецепторы.
Необходимо знать, что следует избегать применения соединений этого
класса при черепно-мозговой травме, бронхиальной астме и других ги-
поксических состояниях, при острой алкогольной интоксикации, судо-
судорожных состояниях и острых болях со стороны органов брюшной по-
полости.
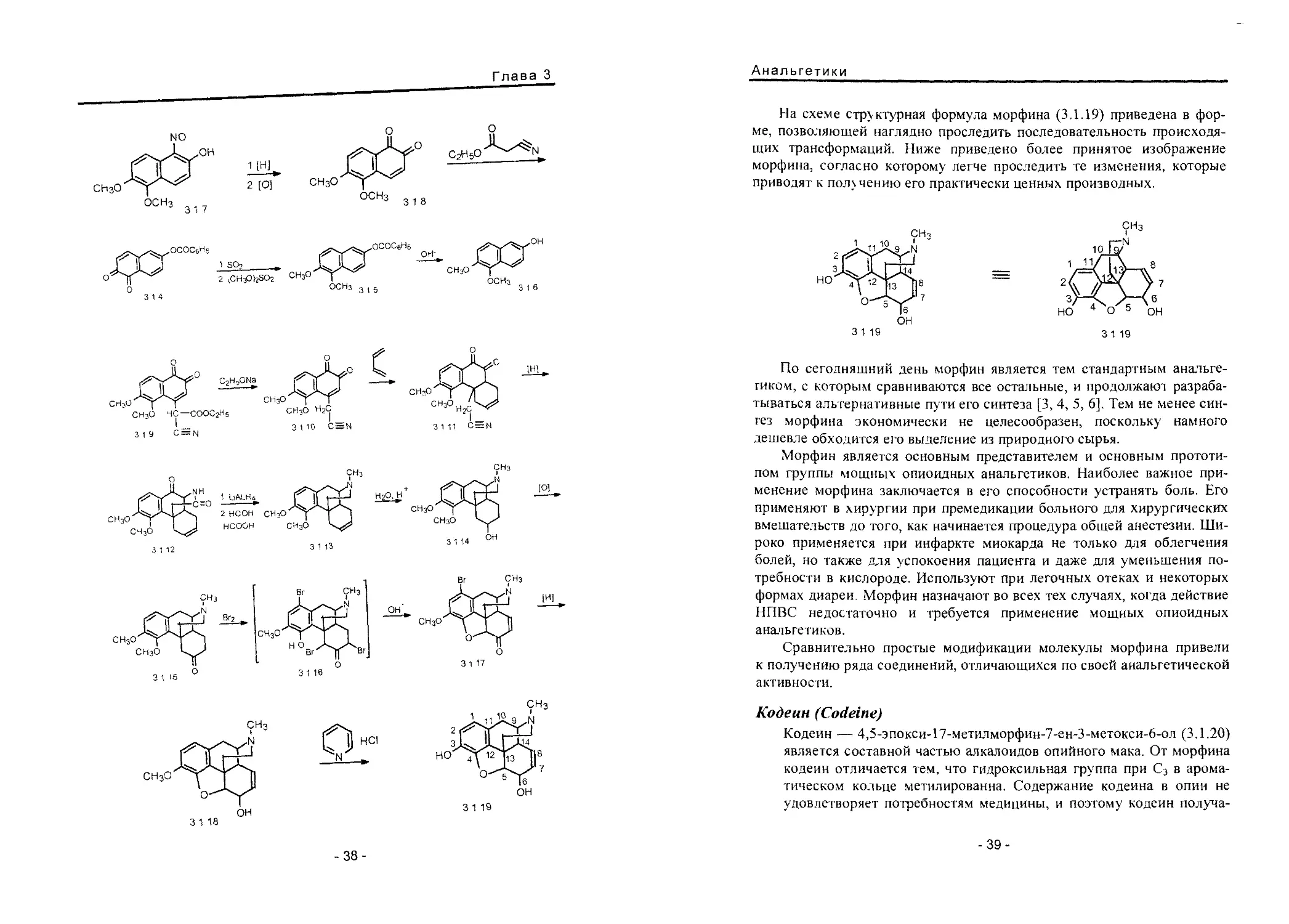
Морфин (Morphine)
Морфин — 4,5-эпокси-17-метилморфин-7-ен-3,6-диол C.1.19) явля-
является самым старым из известных анальгетиков. Практически его
получают из опиума — высушенного млечного сока недозрелых го-
головок опийного мака, анальгетические свойства которого известны
более чем 3000 лет. Растение содержит большой ряд и других алка-
алкалоидов, которые подразделяются на группы фенантренов и бензил-
изохинолинов. Однако предложены и синтетические способы полу-
получения морфина. Один из предложенных виртуозных многостадий-
многостадийных способов синтеза морфина описывается ниже.
В рассматриваемом способе синтеза морфина исходят из 2,6-диок-
синафталина C.1.1), который взаимодействием с хлористым бензоилом
трансформируют в монобензоат C.1.2) и далее взаимодействием с азо-
азотистой кислотой переводят в 1-нитрозопризводное C.1.3). Далее после-
последовательным восстановлением нитрозогруппы водородом (с использо-
использованием в качестве катализатора палладия) и дальнейшим мягким
окислением продукта треххлористым железом получают 6-бензилокси-
1,2-нафтохинон C.1.4). Последний с помощью четырехокиси серы вос-
восстанавливают в 6-бензилокси-1,2-нафтогидрохинон, который метили-
метилируют диметнлсульфатом в 5,6-диметокси-2-бензоат C.1.5), и далее ще-
щелочным гидролизом трансформируют в 5,6-диметокси-2-нафтол C.1.6).
Применяя последовательно те же стадии синтеза, а именно: нитрозиро-
вание, восстановление и окисление теми же реагентами, получают 5,6-
-36-
Анальгетики
диметокси-1,2-нафтохинон C.1.8). Проведением реакции Кновенагеля
с циануксусным эфиром в присутствии ферроцианида калия достигается
окисление продукта конденсации. Продукт реакции C.1.9) гидролизует-
ся и декарбоксилируется далее в 5,6-диметокси-4-цианометил-1,2-
нафтохинон C.1.10), на основе которого далее ведется построение вна-
вначале фенантреновой, а далее морфинановой систем. С этой целью 5,6-
диметокси-4-цианометил-1,2-нафтохинон C.1.10) вводят в реакцию 4т 2
циклоприсоединения с бутадиеном-1,3 с получением с умеренными вы-
выходами 3,4-диметокси-9,10-диоксо-13-цианометил-5,8,9,10,13,14-гекса-
гидрофенантрена C.1.11). При восстановлении полученного дикетона
C.1.11) водородом с использованием меднохромокисного катализатора
был получен кетолактам C.1.12), При обработке последнего алюмо-
гидридом лития обе карбонильные группы (и кетонная, и амидная)
подвергаются исчерпывающему восстановлению, и далее вторичный
атом азота метилируется смесью формальдегида и муравьиной кисло-
кислоты в рацемический метиловый эфир р-Аб-дигидродезоксикодеина
C.1.13). Обработкой последнего Ц+)-дибензоилвинной кислотой выде-
выделяют искомый (+)метиловый эфир р-А6-дигидродезоксикодеина. По-
Последний подвергают гидратации в присутствии горячей разбавленной
серной кислоты с получением метилового эфира Р-дигидротебаинола
C.1.14). Энергичной обработкой гидроксидом калия в диэтиенгликоле
происходит частичное деметилирование до Р-дигидротебаинола, окис-
окислением которого в системе /и/?е/я-бутилат калия — бензофенон получа-
получают Р-дигидротебаинон C.1.15). Полученный таким образом (З-дигидро-
тебаинон C.1.15) подвергают далее бромированию 3 молями брома
в уксусной кислоте в (-)-1-бромкодеинон C.1.17), который выделяют
в виде 2,4-динитрофенил-гидразона. Очевидно, что на этой стадии син-
синтеза происходит образование двойной связи при Ст-Cg и одновременно
оксидного мостика при С4-С5. Более того, при этом происходит и обра-
обращение конфигурации при С!4, т. е. изоморфинановая система изомери-
зуется в морфинановую. Дальнейшим восстановлением (-)-1-бромко-
деинона C.1.17) алюмогидридом лития получают кодеин" C.1.18), кото-
который деметилируют в искомый морфин C.1.19) гидрохлоридом пириди-
пиридина [1,2].
.ОСОС6Н5
ОСОС6Н5
2 [OJ*
-37-
Глава 3
Ch3O
2 [О]
осн3
317
оснз 318
.ОСОС6Н;
сн3о
оснз
315
СН3О
ОСИз
3 1 6
3 ! 9 C=N
СНэО
3 111 0=
1Н1
СН3О
3 1 14
СНэ
[О]
СН30
он.
сн3о
3 1 17
[И]
СНз
СН3!
3 1 18
HCI
НО'
3 1 19
-38-
Аналыетики
На схеме структурная формула морфина C,1.19) приведена в фор-
форме, позволяющей наглядно проследить последовательность происходя-
происходящих трансформаций. Ниже приведено более принятое изображение
морфина, согласно которому легче проследить те изменения, которые
приводят к пол>чению его практически ценных производных.
сн3
о 5 он
3 1 19
31 19
По сегодняшний день морфин является тем стандартным анальге-
анальгетиком, с которым сравниваются все остальные, и продолжают разраба-
разрабатываться альтернативные пути его синтеза [3, 4, 5, 6]. Тем не менее син-
синтез морфина экономически не целесообразен, поскольку намного
дешевле обходится его выделение из природного сырья.
Морфин является основным представителем и основным прототи-
прототипом группы мощных опиоидных анальгетиков. Наиболее важное при-
применение морфина заключается в его способности устранять боль. Его
применяют в хирургии при премедикации больного для хирургических
вмешательств до того, как начинается процедура общей анестезии. Ши-
Широко применяется при инфаркте миокарда не только для облегчения
болей, но также для успокоения пациента и даже для уменьшения по-
потребности в кислороде. Используют при легочных отеках и некоторых
формах диареи. Морфин назначают во всех тех случаях, когда действие
НПВС недостаточно и требуется применение мощных опиоидных
анальгетиков.
Сравнительно простые модификации молекулы морфина привели
к получению ряда соединений, отличающихся по своей анальгетической
активности.
Кодеин (Codeine)
Кодеин — 4,5-эпокси-17-метилморфин-7-ен-3-метокси-6-ол C.1.20)
является составной частью алкалоидов опийного мака. От морфина
кодеин отличается тем, что гидроксильная группа при С3 в арома-
ароматическом кольце метилированна. Содержание кодеина в опии не
удовлетворяет потребностям медицины, и поэтому кодеин получа-
-39-
Глава 3
ют полусинтетическим путем из морфина путем селективного ме-
метилирования ароматической гидроксильной группы при С3. Обыч-
Обычные метилирующие агенты приводят к метилированию обеих гид-
роксильных ipynn. Селективное метилирование гидроксильной
группы при С3 в ароматическом кольце можно осуществить при по-
помощи диазометана, нитрозометилуретана или нитрозометилмоче-
вины. Однако применение этих реагентов представляет определен-
определенные сложности для осуществления реакции в промышленных
масштабах. Было предложено в качестве метилирующих средств
применять хлорид триметилфениламмония или метилтолуолсульфо-
нат диметиланилина в присутствии алкоголятов натрия. В основном
кодеин получается метилированием 3-гидроксильной группы фе-
нольного кольца морфина этилатом триметилфениламмония [7, 8].
СН3О
По своим свойствам кодеин близок к морфину, но его болеутоляю-
болеутоляющие свойства выражены слабее и препарат в меньшей степени вызывает
привыкание. Препарат очень эффективен при оральном применении
и используется для облегчения средних и умеренных болей. Часто ис-
используется в качестве противокашлевого средства.
Синонимами препарата являются кодил, акутус и др.
Героин (Heroin)
Героин — 3,6-диацетил-4,5-эпокси-17-метилморфин-7-ен C.1.21)
получают одновременным ацетилированием двух гидроксильных
групп морфина уксусным ангидридом или ацетилхлоридом [9, 10].
СНз
сн3соо
ООССНз
-40-
Анальгетики
Обладая большей по сравнению с морфином растворимостью в ли-
пидах, он быстрее проходит через гематоэнцефалический барьер, одна-
однако действует так же, как и морфин, в который он трансформируется
в мозге. Наркотическое действие, угнетение дыхания, токсичность, ма-
малая широта терапевтического действия, большая опасность привыкания
обуславливают отсутствие каких-либо его преимуществ перед морфи-
морфином.
Использование героина в медицине запрещено, поскольку нет таких
терапевтических целей, которых нельзя было бы достигнуть другими
препаратами.
Гидроморфон (Hydromorphone)
Гидроморфон — 4,5-эпокси-3-гидрокси-]М-метил-6-оксоморфинан
C.1.22) является соединением родственным морфину и отличается
отсутствием двойной связи в положении Су-С8 и наличием кето-
группы вместо гидроксильной при С6. Препарат получают изомери-
изомеризацией морфина в присутствии палладиевого или платинового ката-
катализаторов [11, 12]. Другим способом получения является окисление
дигидроморфина [13, 14].
Pd or Pt
Гидроморфон более растворим, чем морфин, и примерно в 8 раз ак-
активнее последнего при парентеральном приеме. Большая растворимость
позволяет уменьшить объем инъекционной жидкости, что имеет значе-
значение при необходимости многократных инъекций. Начинает действовать
быстрее, но время его действия короче, чем у морфина. Обладает боль-
большим седативным эффектом и меньшей способностью вызывать эйфо-
эйфорию. Гидроморфон имеет то же применение, что и морфин. Побочные
реакции аналогичны.
Синонимом препарата является дилаудид и др.
Оксиморфон (Oxymorphone)
Оксиморфон — 4,5-эпокси-3,14-дигидрокси-К-метил-6-оксоморфи-
нан C.1.26) химически сходен с гидроморфоном. Отличается от
-41 -
Глава 3
гидроморфона наличием гидроксильной группы при Св. Препарат
получают исходя из тебаина C.1.23), который, окисляя пероксидом
водорода в муравьиной кислоте, переводят в 14-гидроксикодеинон
C.1.24). Двойную связь в последнем восстанавливают водородом,
трансформируя это соединение в оксикодон C.1.25). Последний де-
метилируется бромистым водородом в оксиморфон [15, 16].
СН3О
СНз
ОСНз
Н2/ Pd
СНз
НВг
СН3О
Оксиморфон примерно в 10 раз активнее морфина. Вызываемые им
эйфорический, равно как и рвотный, эффекты выражены значительно
сильнее, чем у морфина. Оксиморфон проявляет также слабую противо-
кашлевую активность. Побочные реакции аналогичны таковым у мор-
морфина. Препарат предназначен для облегчения умеренных и сильных
болей при хирургических и гинекологических вмешательствах и после-
послеоперационных болей.
Синонимом препарата является нуморфан и др.
Оксикодон (Oxycodone)
Оксикодон — 4,5-эпокси-3-метокси-14-гидрокси->}-метил-6-оксо-
морфинан C.1.25), синтез которого из 14-гидроксикодеинона C.1.24)
был описан выше, может быть получен и другими способами, на-
например, окислением кодеина бихроматом калия в уксусной ки-
кислоте [17], также является структурным аналогом морфина и ко-
кодеина.
-42-
Анальгетики
СН3О
В отличие от гидрокодона его применяют в качестве анальгетика
в комбинации с другими препаратами, такими как аспирин или ацета-
минофен. Оксикодон сходен с морфином по эффективности продолжи-
продолжительности действия и предпочтителен для орального применения.
Синонимами препарата являются роксикодон, проладон, перкдан,
эутаген, оксикон и многие другие.
Гидрокодон (Hydrocodone)
Гидрокодон — 4,5-эпокси-З-метокси-М-метил-б-оксоморфинан
C.1.27) — соединение, химически родственное морфину и кодеину.
Гидрокодон получают изомеризацией кодеина C.1.20) над палла-
диевым или платиновым катализаторами [18]. Препарат предложе-
предложено получать также гидрированием кодинона [19] и окислением ди-
гидрокодеина [20].
сн3о
Pd or Pt
СН3О
Гидрокодон проявляет выраженные анальгетические и противокаш-
левые свойства, что является его основным клиническим применением.
Может вызвать зависимость и привыкание.
Синонимами препарата являются дикодид, детуссин, викодин и др.
Леворфано.ч (Levorphanol)
Леворфанол — (-)-3-гидрокси-1чт-метилморфинан C.1.35) является
производным морфинана. Синтез леворфанола осуществляют исхо-
исходя из циклогексанона путем его конденсации с циануксусной кис-
-43-
Глава 3
лотой по Кновенагелю, при которой происходит одновременное де-
карбоксилирование с образованием 1-циклогексенилацетонитрила
C 1 28) Восстановлением нитрильной фуппы последнего водоро-
водородом в присутствии кобальта Ренея получают 2-A-циклогексенил)
этиламин C.1.29). Полученный амин далее ацилируют хлорангид-
ридом 4-метоксифенилуксусной кислоты C.1.30) с образованием
амида 2-A-циклогексенил)-4-метоксифенилуксусной кислоты C.1.31).
Циклизация последнего хлорокисью фосфора приводит к получению
1-D-метоксибензил)-3,4,5,6,7,8-гексагидрохинолина C.1.32). Имин-
ную связь восстанавливают водородом в присутствии никеля Ренея
с получением 1-D-метоксибензил)-1,2,3,4,5.6,7.8-октаагидрохино-
лина C.1.33), который метилируют формальдегидом в присутствии
никеля Ренея в 1-D-метоксибензил)-2-метил-1,2,3,4,5,6,7,8-окта-
агидрохинолин C 1 34) На последней стадии синтеза в 1-D-
метоксибензил)-2-метил-1,2,3,4,5,6,7,8-октаагидрохинолин C.1.34)
подвергают циклизации с одновременным деметилированием в 3-
гидрокси-М-метилморфинан — леворфанол C.1.35), оптические ан-
антиподы которого далее разделяют с помощью (+)-винной кислоты
[21,22].
о
6
соон
.ch-cn
Н2 / Ranay—Со
3 1 30
3 1 29
POCI3
3 1 31
СНз
Ch3O
\\ //
\J
-44-
Анальгетики
Нг Ranay—Ni
3 1 32
¦ОСНз
2 Н2 / Ranay—N1
3 1 33
¦OCi-Ц
Правовращающий изомер не является анальгетиком, однако обла-
обладает противокашлевыми свойствами. Левовращающий изомер — лево-
меторфан проявляет активность сходную с морфином, однако ряд по-
побочных эффектов, таких как тошнота и рвота, а также способность
вызывать запоры выражены слабее. В инъекционной форме он в 4-8 раз
эффективнее морфина. Продолжительность действия также больше, чем
у морфина. Препарат рекомендован для облегчения от умеренных до
сильных болей при печеночных и почечных коликах, при инфаркте
миокарда, серьезных травмах, при болях во время опухолевых заболе-
заболеваний и для облегчения послеоперационных болей.
Синонимами препарата являются дроморан, леводроморан и др.
Метадон (Methadone)
Метадон — 6-диметиламино-4,4-дифенил-3-гептанон C.1.37) полу-
получают алкилированием дифенилацетонитрила 1-диметиламино-2-
пропилхлоридом в присутствии амида натрия. Полученный при
этом 4-диметиламино-2,2-дифенилвалеронитрил C.1.36) вводят да-
далее во взаимодействие с этилмагнийбромидом и гидролизуют [23,
24, 25, 26]. Полученный в результате рацемат разделяют при помо-
помощи (т-)-винной кислоты, выделяя (-)-метадон [26, 27, 28, 29].
сн3
-ch-ch2-n(
он3
C5N
—N
СН-,
с2н5
3 1 37
-45-
Глава 3
Метадон является синтетическим опиоидом действующим на ц-ре-
цепторы и с качественными и количественными характеристиками ана-
аналогичными морфину. Принципиальная разница заключается в большей
эффективности при оральном приеме и большей длительности дейст-
действия. Кроме использования в качестве мощного анальгетика, препарат
применяется и для лечения наркомании, поскольку замещает на рецеп-
рецепторе другие атонисты.
Синонимами препарата являются физептон, мефенон, долофин и др.
Меперидин (Meperidine)
Меперидин — этиловый эфир 1-метил-4-фенилпиперидин-4-карбо-
новой кислоты C.1.39) является синтетическим опиоидным аналь-
анальгетиком. Его синтез осуществляют путем алкилирования бензил-
цианида К,К-бмс-B-хлорэтил)-К-метиламином в присутствии амида
натрия с образованием 1-метил-4-фенил-4-цианопиперидина C.1.38)
и последующим его кислотным этанолизом в меперидин [30, 31,
32].
С!СН2СН2 ^ NaNH2
N-Cri3 '
CSn
Меперидин относится к анальгетикам ряда фенилпиперидинов. Эти
соединения также являются агонистами, хотя структурно сильно отли-
отличаются от морфина. Препарат проявляет и антихолинергическую актив-
активность. Как и морфин, он вызывает выброс гистамина и спазм гладкой
мускулатуры. Практически неактивен при оральном применении. Боль-
Большинство фармакологических свойств и показаний к применению сход-
сходны с таковыми у морфина, однако у препарата отсутствуют противо-
кашлевые свойства. При парентеральном введении активность состав-
составляет примерно Vg таковой у морфина. Меперидин широко используется
при премедикации и сбалансированной анальгезии. Предпочтителен для
применения в акушерской практике по причине быстрого наступления
анальгезии и короткого времени действия.
Наиболее часто употребляемыми синонимами являются петидин,
долантин и демерол.
Про.чедо.г (Promedol)
Промедол — 1,2,5-триметил-4-фенил-4-пропионилоксипиперидин
-46-
Анальгетики
C.1.45) также относится к анальгетикам, относящимся к ряду фе-
фенилпиперидинов, и в определенном смысле представляет собой
«обращенный» меперидин, в котором, в отличие от меперидина,
карбонильная группа присоединена к четвертому положению пипе-
ридинового кольца через кислородный, а не через углеродный атом.
Синтез этого соединения в принципе отличается от синтеза мепери-
меперидина и основан на использовании 1,2,5-триметилпиперидин-4-она.
Последний получается из диметилвинилэтинилкарбинола C.1.40),
продукта конденсации винилацетилена с ацетоном по реакции Фа-
Фаворского, который далее подвергают дегидратации в винилизопро-
пенилацетилен C.1.41). Тройную связь в винилизопропенилацети-
лене далее гидратируют в разбавленной серной кислоте в метаноле
и в присутствии солей двухвалентной ртути (реакции Кучерова).
Полученный при этом винилизопропенилкетон C.1.42), в основном
в виде метоксипроизводных продуктов присоединения метанола
к активированным двойным связям, вводят в реакцию гетероцикли-
зации с метиламином с получением 1,2,5-триметилпиперидин-4-она
C.1.43). Последний подвергают действию фениллития с получени-
получением 1,2,5-три.метил-4-фенилпиперидин-4-ола C.1.44). Ацилировани-
ем последнего хлорангидридом пропионовой кислоты получают
промедол [33].
/f
-сес— сн=сн2
С =С-С=С— СН =СН2
3 141
H2O'H*Hg2+ Hf\ ff
>н2с=с-с-сн=сн-сн3
Н3С
СН,
сн3
3 1 43
CH5COCI
Препарат быстро всасывается и оказывает сильное анальгезирую-
щее действие, как при парентеральном, так и при оральном приеме. Это
соединение меньше угнетает дыхательный центр, чем морфин. Оказы-
Оказывает спазмолитическое действие на гладкую мускулатуру. Применяют
в качестве болеутоляющего средства при хирургических вмешательствах
травмах и заболеваниях, сопровождающихся болевыми ощущениями.
Синонимом препарата является тримеперидин.
-47-
Глава 3
Лоперамид (Loperamide)
Лоперамид — 1-D-хлорфенил)-4-гидрокси-К,К-диметил-а,а-дифе-
нил-1-пиперидин-бутирамид C.1.55), предложенный в качестве
анальгетика, получают путем алкилирования 4-D-хлорфенил)-4-
гидроксипиперидина C.1.50) бромистым 1Чт,М-диметил-C,3-дифе-
нилтефагидро-2-фурилиден)аммонием C.1.54) в присутствии осно-
основания.
Исходный 4-D-хлорфенил)-4-гидроксипиперидин C.1.50) получают
взаимодействием 1-бензилпиперидин-4-она C.1.48) с 4-хлорфенилмаг-
нийбромидом и последующим дебензилированием продукта C.1.49)
путем восстановления водородом с использованием в качестве катали-
катализатора палладия на угле.
Исходный 1-бензилпиперидин-4-он C.1.48) синтезируют по реак-
реакции Дикмана внутримолекулярной циклизацией М-бензил-К,К-ди(Р-
карбетоксиэтил)амина C.1.46), легко получаемого взаимодействием
бензиламина с этилакрилатом, в 1-бензил-3-карбэтоксипиперидин-4-он
C.1.47) и последующего кислотного гидролиза и термического декар-
боксилирования.
-ch2-n(
СН2-СН2—СООС2гЬ
C2HsONa
Ch2-CH2—СООС2Н5
сн2
1 3147
о
6
-о-
MgBr
Бромистый >4,1чт-диметил-C,3-дифенилтетрагидро-2-фурилиден)ам-
моний C.1.54) синтезируют исходя из этилового эфира дифенилуксус-
ной кислоты, который вводят во взаимодействие с окисью этилена
в присутствии гидроксида натрия с получением 2.2-дифенилбутиро-
лактона C.1.51). При взаимодействии последнего с бромистым водоро-
водородом в уксусной кислоте происходит раскрытие лактонного кольца с об-
образованием 2,2-дифенил-4-броммасляной кислоты C.1.52). Последнюю
переводят в хлорангидрид C.1.53) с помощью хлористого тионила
и далее взаимодействием с водным раствором диметиламина циклизуют
-48-
Анальгетики
в искомый бромистый М,М-диметил-C,3-дифенилтетрагидро-2-фурили-
ден)аммоний C.1.54). Вводя последний в реакцию с 4-D-хлорфенил)-4-
гидроксипиперидином C.1.50), получают искомый лоперамид C.1.55)
[34, 35, 36].
Н-С-СООС2Н5
NaOH
3 1 51
ВГСН2СН2 -С-СООН
3 1 52 Г 1
ВгСН2СН2 -C-COCI
3 1 53 Г |]
В настоящее время лоперамид чаще применяется в качестве препа-
препарата от диареи, а не в качестве анальгетика и даже переведен в список
лекарств безрецептурного отпуска, поскольку его действие на ЦНС
незначительно. Препарат снижает тонус и моторику гладкой мускула-
мускулатуры кишечника вследствие связывания с опиатными рецепторами ки-
кишечника. Применяют для симптоматического лечения острой и хрони-
хронической диареи различного генеза.
Синонимами препарата являются имодиум, диссенте, блоке, брек
и др.
Дифеноксилат (Diphenoxylate)
Дифеноксилат — этиловый эфир 1-C-циано-3,3-дифенилпропил)-4-
фенилпиперидин-4-карбоновой кислоты C.1.58) также является
препаратом ряда 4-фенилпиперидинов. На практике применяются
два способа его получения. Первый способ заключается в алкили-
ровании 2,2-дифенил-4-бромбутиронитрилом этилового эфира 4-фе-
нилпиперидин-4-карбоновой кислоты C.1.56), который, в свою оче-
очередь, получается путем, аналогичным синтезу меперидина, исходя
из 1-бензил-4-фенил-4-цианопиперидина. Последний подвергают
этанолизу в присутствии кислоты и последующему дебензилирова-
-49-
Глава 3
нию. Вторым способом является синтез, осуществляемый путем
алкилирования дифенилацетонитрила этиловым эфиром 1-B-хлор-
этил)-4-фенилпиперидин-4-карбоновой кислоты C.1.57), получае-
получаемой из этилового эфира 4-фенилпиперидин-4-карбоновой кислоты
путем взаимодействия с C-хлорэтанолом или же взаимодействием
с этиленоксидом и последующим замещением на хлор образующей-
образующейся в результате раскрытия эпоксидного кольца гидроксильнои груп-
группы хлористым тионилом [37, 38].
HN X, + ВгСН2СН2 -C-C = N
СООС2Н5
3.1.56
N=C-C-CH2CH2-N
CL-CH2CH2-N
3 1 57
СООС2Н5
СООС2Н5
Препарат является структурным аналогом меперидина и лоперами-
да, однако практически повторяет все фармакологические свойства ло-
перамида. Аналогично лоперамиду основным показанием для его прак-
практического применения является лечение диареи.
Синонимами препарата являются реасек, ломотил и др.
Фентанил (Fentanyl)
Фентанил — 1-фенэтил-4-К-пропиониланилинопиперидин C.1.63)
является весьма мощным внутримышечным или внутривенным
анальгетиком. Синтез фентанила осуществляют исходя из 1-бен-
зилпиперидин-4-она C.1.48), который конденсируют с анилином
с получением соответствующего основания Шиффа C.1.59). Двой-
Двойную связь в последнем восстанавливают алюмогидридом лития
и полученный 1-бензил-4-анилинопиперидин C.1.60) ацилируют
ангидридом пропионовой кислоты. Полученный при этом 1-бензил-
4-1^-пропиониланилинопиперидин C.1.61) подвергают дебензили-
рованию водородом с использованием в качестве катализатора
палладия на угле с выделением 4-М-пропиониланилинопиперидина
-50-
Анальгетики
ладия на угле с выделением 4-М-пропиониланилинопиперидина
C.1.62), который далее алкилируют 2-фенилэтилхлоридом с полу-
получением фентанила C.1.63) [39, 40].
/—\ н
2—N V-N-
3 1 60
Фентанил по анальгетическому действию превосходит морфин
примерно в 100 раз. Оказывает угнетающее действие на дыхательный
центр, замедляет сердечный ритм. Фентанил используется в анестезио-
анестезиологии как самостоятельно, так и в сочетании с дроперидолом, для ней-
ролептаналыезии, при премедикации разными видами наркоза, при по-
постоперационной анальгезии. В отличие от морфина не вызывает
выброса гистамина. Применяют в условиях специализированных ста-
стационаров.
Синонимами препарата являются фентанест. лепрофен и др.
Апьфентанил (Alfentanyl)
Альфентанил — М-[1-[2-D-этил-4,5-дитидро-5-оксо-1//-тетразол-
. 1-ил)этил]-4-(метоксиметил)-4-пиперидил]анилинопропионамид
C.1.71) является следующим представителем препаратов этого же
класса анилидопиперидинов, отличающихся от фентанила наличи-
наличием второго заместителя в 4-м положении пиперидинового кольца и
заменой фенильного радикала в арилэтильном заместителе при ато-
атоме азота пиперидинового кольца на ароматический гетероцикл —
тетразолон. Синтез альфентанила заключается в алкилировании N-D-
-51 -
Глава 3
метоксиметил;-4-пиперидил)-пропионанилида C.1.68) 1-D-этил-4,5-
дигидро-5-оксо-1Я-тетразол-1-ил)этил-2-хлоридом C.1.66).
М-D-метоксиметил)-4-пиперидил)-пропионанилид C.1.68) полу-
получают исходя из 1-бензилпиперидин-4-она C.1.48) путем его конден-
конденсации с анилином в присутствии циановодородной кислоты. Полу-
Полученный при этом 4-анилино-4-циано-1-бензилпиперидин C.1.64)
далее подвергают алкоголизу с получением 4-анилино-4-карбэтокси-
1-бензилпиперидина C.1.65), который восстанавливают алюмогидри-
дом лития в 4-анилино-4-гидроксиметил-1-бензилпиперидин, кото-
который в реакционной среде метилируют йодистым метилом до 4-ани-
лино-4-метоксиметил-1-бензилпиперидина C.1.66). Полученный про-
продукт ацилируют с помощью пропионового ангидрида в 1-бензил-4-
метоксиметил-4-К-пропионил-анилинопиперидин C.1.67) и далее
подвергают дебензилированию водородом с использованием в каче-
качестве катализатора палладия на угле в 4-метоксиметил-4-М-пропионил-
анилинопиперидин C.1.68).
1-D-этил-4,5-дигидро-5-оксо-1Я-тетразол-1-ил)этил-2-хлорид
C.1.66) синтезируют исходя из этилизоцианата и азида натрия. Получен-
Полученный в результате реакции 2+3 циклоприсоединения 4-этил-4,5-дигидро-5-
оксо-1Я-тетразол C.1.69) далее подвергают алкилированию 1-бром-2-
хлорэтаном с получением 1-D-этил-4,5-дигидро-5-оксо-Ш~тетразол-1-ил)
этил-2-хлорида C.1.70), который и вводят в взаимодействие с 4-метокси-
метил-4-К-пропиониланилинопиперидином C.1.68) с получением альфен-
танила C.1.71) [41,42,43].
;н2—n
^vCN
C2H5OH / H_
¦СООС2Н5
-52-
Анальгетики
СН2ОСНз
Н2 / Ра —С
СН2ОСН3
з168
N=N
3 1 69
3.1.68 + 3.1.70
о
BrCH2CH;CI C2HSv A CH2CH2CI
9
N=N
3.1.71
CH2OCH3
N-C-C2H5
Главное отличие альфентанила от фентанила заключается в более
коротком времени его действия. Применяется в анестезиологической
практике наряду с барбитуратами при кратковременных хирургических
вмешательствах.
Синонимами препарата являются алфента, рапифен и др.
Суфентанил (Sufentanyl)
Суфентанил — л-D-(метоксиметил)-1 -[2-B-тиенил)этил]-К-фенил-
пропанамид C.1.72) — препарат аналогичный альфентанилу и от-
отличается от него заместителем у азота пиперидинового кольца.
Синтез во многом повторяет элементы синтеза альфентанила,
и лишь на последней стадии алкилирование 4-метоксиметил-4-Ы-
пропионил-анилинопиперидина C.1.68) проводится метансульфо-
натом 2-гидроксиэтилтиофена [44, 45, 46].
S
L
S CH2CH2-O-SO;-Ch3
асн2осн3
N-C-CsHs
3 172
-53-
Глава 3
Суфентанил превосходит фентанил по активности в 5-10 раз. При-
Применяется в анестезиологической практике при хирургических вмеша-
вмешательствах.
Синонимом препарата является суфента и др.
Смешанные агон исты-антагонисты
Препараты этой группы проявляют и агонистическую, и антагони-
антагонистическую активность. Принято считать, что агонистическая активность
проявляется благодаря их взаимодействию с ц-рецепторами, а антаго-
антагонистическая — на других (в частности, на к- и а-рецепторах). Механизм
их действия мало понятен. Несмотря на то, что их действие может про-
проявиться в виде анальгетического эффекта, определенного угнетения ды-
дыхания и в виде других проявлений, свойственных препаратам типа мор-
морфина, они могут блокировать и даже обращать эффекты агонистов,
а также отменять абстинентный синдром у пациентов с зависимостью
к опиоидам. Интересно, что может возникнуть толерантность к агони-
стическим свойствам этих препаратов, но не возникает толерантности к
их антагонистическим свойствам. Зависимость может возникнуть и при
их длительном применении.
Эта группа соединений используется для анальгезии в случаях уме-
умеренных и сильных болей. Они менее эффективны чем морфин, однако
они не вызывают сильной депрессии дыхания при передозировках.
Налорфин (Nalorphine)
Налорфин — N-аллилнорморфин C.1.75) получают исходя из мор-
морфина путем его полного ацетилирования, т. е. трансформацией в ге-
героин C.1.21), с целью временной защиты гидроксильных групп
и далее подвергают деметилированию. Для этого героин C.1.21)
повергают воздействию бромциана. Полученное при этом N-циано-
производное C.1.73) гидролизуют раствором соляной кислоты
в деметилированный морфин — норморфин C.1.74), вторичную
аминную группу которого подвергают алкилированию аллилброми-
дом [47, 48].
CEN
сн3соо
BrCN
ООССН3
HCI
ООССНз
3 1 73
-54-
Анальгетин
Н2С=СН-СН2— Вг ,
3 1.75
Налорфин обладает более слабой, чем у морфина, анальгетической
активностью, однако самостоятельного значения в качестве анальгетика
не имеет. Его применяют в качестве антагониста наркотических аналь-
анальгетиков. Он устраняет вызываемые агонистами опиатных рецепторов
угнетение центра дыхания, брадикардию, рвоту и т. п.
Налорфин являлся первым соединением, использовавшимся при
передозировках наркотиков, и в частности героина. Однако он прояв-
проявляет ряд побочных эффектов, в том числе может вызвать зрительные
галлюцинации, и поэтому в некоторых странах запрещен к примене-
применению.
Наиболее популярным синонимом препарата является наркан.
Пентазоцин (Pentazocine)
Пентазоцин — 1,2,3,4,5,6-гексагидро-6,11-диметил-3-C-метил-2-
бутенил)-2,6-метано-3-бензазоцин-8-ол C.1.81) является произ-
производным бензоморфана. Синтез пентазоцина осуществляют исходя
из 3,4-диметилпиридина, Подвергнув последний действию йоди-
йодистого метила, получают 1,3,4-триметилпиридиний йодид C.1.76),
который вводят во взаимодействие с 4-метоксибензилмагний-
хлоридом с получением 2-метоксибензил-3,4-диметил-1,2-дигид-
ропиридина C.1.77). Двойную связь при С5 полученного соеди-
соединения восстанавливают водородом с использованием в качестве
катализатора палладия с получением 2-метоксибензил-3,4-диме-
тил-1,2,3,4-тетрагидропиридина C.1.78). Последний подвергают
внутримолекулярному алкилированию и одновременному деме-
деметилированию эфирной связи бромистоводородной кислотой, в ре-
результате чего образуется 2-гидрокси-2,5,9-триметилбензо-6-мор-
фен C.1.79), который подвергают N-деметилированию бромцианом
с получением 2-гидрокси-5,9-диметилбензо-6-морфена C.1.80). Ал-
килирование последнего 1-бром-3-метил-2-бутеном дает пентазо-
пентазоцин [49, 50J.
-55-
Глава 3
сн3
сн3 сч3о-
СНз
3 1 76
снз
/усн3
N
Ch3
3 1 77
Н2/
СНз
N СН2—<Л Л*
Cri3
-ОСНз =
сн3о
3 1 78
¦сн3
сн3о
3 1 79
Вг
-сн2-сн=с<
СНз
СНз
н3с
>с=сн-сн2
сн3
СНз
3.1 81
Пентазоцин — слабый антагонист морфина. Он значительно слабее,
чем налорфин или леваллорфан, но обладает сильно выраженным
анальгетическим эффектом. Пентазоцин является первым анальгетиком
агонист-антагонистического действия появившимся на фармацевтиче-
фармацевтическом рынке. По анальгетической активности уступает морфину, однако
в значительно меньшей степени угнетает дыхательный центр. В качест-
качестве агониста он, в основном, воздействует на к-рецепторы. При оральном
применении по активности сравним с кодеином. Отмечены случаи воз-
возникновения толерантности. Пентазоцин применяют при болях различ-
различной интенсивности и для премедикации перед оперативным вмешатель-
вмешательством.
Наиболее часто встречающимся синонимом препарата является
фортрал.
Налбуфин (Nalbuphine)
Налбуфин — 17-(циклобутилметил)-4,5а-эиоксиморфинан-3.6а,14-
триол C.1.85) синтезируют исходя из оксиморфона C.1.26). кого-
-56-
Анальгетики
рый после зашиты гидроксильных групп путем ацетилирования
подвергают действию бромциана с получением N-цианопроизвод-
ного, далее — гидролизу соляной кислотой с получением 14-гидро-
ксидигидронорморфона C.1.82). Трансформацию последнего в ис-
искомый налбуфин C.1.85) осуществляют либо восстановлением
карбонильной группы полученного 14-гидроксидигидронормор-
фона боргидридом натрия C.1.83) и дальнейшим алкилированием
продукта циклобутилметилбромидом, либо ацилированием C.1.82)
хлорангидридом циклобутанкарбоновой кислоты C.1.84) и даль-
дальнейшим одновременным восстановлением двух карбонильных
фупп в полученном соединении алюмогидридом лития в искомый
продукт [51, 52].
1 (СНзСОйО
2 BrCN
3 на
но о о
3 1 26
I NaBH4
lwlh4
)Н УЧ
\/~СН2-В
O
но о Он
3 1 83
НО О Он
3 1 85
Налбуфин является мощным анальгетиком и в качестве такового по
активности равен морфину. По строению сходен с оксиморфоном
и опиоидным антагонистом налоксоном. Побочные эффекты выражены
значительно меньше, чем у налорфина. Налбуфин назначают в качестве
препарата для облегчения переносимости умеренной и острой боли.
Применяется в качестве дополнительного средства при сбалансирован-
сбалансированной анестезии, для пред- и послеоперационной анальгезии, при гинеко-
гинекологических вмешательствах.
Наиболее распространенным синонимом налбуфина является ну-
баин.
-57-
Глава 3
Бупренорфин (Buprenorphine)
Бупренорфин — 17-(циклопропилметил)-а-( 1,1 -диметилэтил)-4,5-
эпокси-18,19-дигидро-3-гидрокси-6-метокси~а-метил-6,14-этеномор-
финан-7-метанол C.1.91) получают исходя из одного из алкалоидов
морфина — тебаина C.1.23). Синтез бупренорфина начинают на
основе продукта реакции 4+2 циклоприсоединения тебаина и ме-
тилвинилкетона. Результирующий продукт 7-ацетил-6,14-эндо-
этано-тетрагидротебаин C.1.86) далее восстанавливают водородом
с использованием в качестве катализатора палладия на угле в 7-аце-
тил-6,14-эндо-этано-тетрагидро-тебаин C.1.87). Последний вводят во
взаимодействие с /ире/и-бутил-магнийхлоридом с получением 6,14-
эндо-этано-7-B-гидрокси-3,3-диметил-2-бутил)-тетрагид-ротебаина
C.1.88). Полученный продукт деметилируют с помощью бромциана
с получением 6,14-эндоэтано-7-B-гидрокси-3,3-диметил-2-бутил)тет-
рагидронор-тебаина C.1.89). Ацилируя последний хлорангидридом
циклопропанкарбоновой кислоты и дальнейшим восстановлением
введенной карбонильной группы получают N-циклопропилметил-
6,14-эндо-этано-7-B-гидрокси-3,3-диметил-2-бутил)-тетрагидронор-
тебаина C.1.90). Конечный бупренорфин C.1.91) получают селектив-
селективным деметилированием метоксигруппы, связанной с ароматическим
кольцом, при высокотемпературном воздействии на 3.1.90 гидрооки-
гидроокисью калия [53, 54J.
н?с=сн-с-сн3
СН3О О ОСНз
Э 1 86
СН3О
осн3
онзО
3 1 87
СН3О
BrCN
СН3О
-58-
Анальгетики
Бупренорфин проявляет свойства анальгетика центрального дейст-
действия, не угнетает дыхательный центр, не вызывает развития привыкания
и лекарственной зависимости. В общем, препарат лишен дисфорическо-
го и психотомиметического эффектов. В отличие от остальных рассмот-
рассмотренных агонистов-антагонистов бупренорфин проявляет частичный
агонистический эффект и на ^-рецепторах. Блокирует эффекты морфина
примерно на 30 ч. Проявляет ряд некоторых уникальных эффектов,
не свойственных соединениям этого ряда. Препарат применяют при
болевых синдромах средней интенсивности различного генеза.
Наиболее распространенным синонимом является бупренекс.
Опиоидные антагонисты
Опиоидные антагонисты соединения имеют выраженную антагони-
антагонистическую активность и, в отличие от смешанных агонистов-
антагонистов, не проявляют агонистической активности.
Эффективность и сила опиоидных антагонистов варьируют в зави-
зависимости от типа опиоидных рецепторов — д-, 5, к, а, с которыми они
взаимодействуют. Полной ясности о механизме их действия нет. Одна-
Однако высказано предположение, что они антагонизируют действие эндо-
эндогенных опиатных пептидов.
Эти соединения являются антагонистами и по отношению к агони-
стам-антагонистам. Они антагонизируют действие агонистов, смешан-
смешанных агонистов-антагонистов. К ним не возникает зависимости и толе-
толерантности. К ним не возникает также привыкания и пристрастия. Их
используют при передозировках опиоидных анальгетиков или при их
непереносимости больными, а также при лечении наркомании.
Налоксон (Naloxone)
Налоксон — (-)-17-(аллил)-4,5-эпокси-3,14-дигидроксиморфинан-6-
он C.1.92) получают алкилированием 14-гидроксидигидронормор-
финана C.1.82) аллилбромидом [55, 56, 57, 58].
-59-
Глава 3
но
=сн-сн2
н2с=сн-с
Н2С=СН-СН2-Вг
Следует отметить, что N-аллильное замещение в ряду производных
морфина, как правило, приводит к антагонистическим свойствам. На-
локсон в несколько раз сильнее налорфина в качестве антагониста. Пре-
Препарат блокирует опиатные рецепторы, кстраняет центральное и перифе-
периферическое действие опиоидов, в том числе и угнетение дыхания.
Налоксон применяют при передозировке наркотических анальгетиков.
Синонимами препарата являются наркан, талвин и др.
Налтрексон (Naltrexone)
Налтрексон — (-)-17-(циклопропилметил)-4,5-эпокси-3,14-дигидро-
ксиморфинан-6-он C.1.93) является N-циклопропилметильным
производным оксиморфона C.1.82). Одним из методов получения
является путь, аналогичный синтезу налоксона и заключающийся в
применении вместо аллилбромида циклопропилметилбромида [59].
[>-СН2-Вг
но о о
3 1.93
Препарат не имеет агонистических свойств. По своим фармаколо-
фармакологическим характеристикам налтрексон сходен с налоксоном, однако
отличается от него по двум важным показателям — большей продолжи-
продолжительностью действия и тем. что его метаболит 6-C-налтрексол также
является мощным антагонистом. Налтрексон потенциально гепатоток-
сичен. Налтрексон применяют для блокады фармакологических эффек-
эффектов опиоидов при их передозировке.
Синонимами препарата являются налотрекс, трексан и др.
-60-
Анальгетики
3.2. Нестероидные противовоспалительные
средства, или жаропонижающие
анальгетики
Огромное количество препаратов, принадлежащих к различным
классам соединений, проявляют анальгетическое, жаропонижающее
и противовоспалительное действие. При этом они лишены многих не-
нежелательных эффектов, присущих опиоидным анальгетикам (депрессия
дыхания, привыкание и т. п.). Их называют ненаркотическими анальге-
анальгетиками, аспириноподобными веществами, жаропонижающими анальге-
анальгетиками и др., чтобы отличить от опиоидов, и нестероидными противо-
противовоспалительными и жаропонижающими анальгетиками, чтобы отличить
от глюкокортикоидов. Точный механизм действия этих препаратов
окончательно не выяснен. Полагают, что он может быть связан с их
способностью ингибировать синтез простагландинов, что уменьшает
сенсибилизирующее влияние последних на чувствительные окончания,
а это, в свою очередь, уменьшает эффект действия медиаторов и, в ча-
частности, брадикинина. Однако аналыетическая и противовоспалитель-
противовоспалительная активность этих препаратов не всегда коррелирует с их способно-
способностью подавлять синтез простагландинов. Существуют и другие
предположения о механизме действия ненаркотических анальгетиков.
Эксперименты на животных указывают на то, что анальгетическое дей-
действие этого ряда препаратов является периферическим, однако не ис-
исключено, что ацетаминофен может иметь и центральное действие, бло-
блокируя передачу болевых импульсов.
В общем, неопиоидные анальгетики характеризуются тремя основ-
основными видами действия: анальгетическим, противовоспалительным
и жаропонижающим; применяются для облегчения головной боли, ми-
алгии, артралгии; не обладают седативным и снотворными эффектами.
Эйфория, привыкание и лекарственная зависимость при их применении
не возникают.
Нестероидные противовоспалительные и жаропонижающие аналь-
анальгетики классифицируются как:
• производные арилкарбоновых кислот (аспирин, дифлусинал
и др.);
• пиразолоны (фенилбутазон, метамизол и др.) и прочие (в част-
частности, ацетаминофен и фенацетин);
• производные антраниловой кислоты (флуфенамовая кислота,
мефенамовая кислота, меклофенамовая кислота);
• производные арилуксусной кислоты (диклофенак, фенклофенак);
-61 -
Глава 3
• производные арилпропионовой кислоты (ибупрофен, кегопро-
фен, напроксен, фенопрофен и др.);
• производные индолил/инденуксусной кислоты (индометацин,
с>линдак и др.);
• оксикамы (пироксикам, изоксикам).
Производные салициловой кислоты
Аспирин (Aspirin)
Аспирин — ацетилсалициловая кислота C.2.2) получается ацетили-
рованием салициловой кислоты C.2.1) ангидридом или хлорангид-
ридом уксусной кислоты [60. 61, 62, 63].
;оон о
(СН3СОJО
О-С-СНз
3.2.1
3.2.2
Препарат оказывает анальгетическое, жаропонижающее и противо-
противовоспалительное действие, а также уменьшает агрегацию тромбоцитов.
Полагают, что основным механизмом его действия является необрати-
необратимое ацетилирование циклооксигеназы, в результате чего нарушается
синтез простагландинов. простациклинов и тромбоксана. Вследствие
этого уменьшается пирогенное влияние простагландинов на центры
терморегуляции и на чувствительные нервные окончания, что приводит
к понижению их чувствительности к болевым медиаторам. Необрати-
Необратимым нарушением синтеза тромбоксана А2 в тромбоцитах объясняют
антиагрегантное действие аспирина.
Аспирин сегодня используется в количествах больших, чем любое
другое лекарственное средство. Аспирин широко применяется при го-
головных и невралгических болях, при ревматических состояниях, при
болевых синдромах разной этиологии, для устранения болевых ощуще-
ощущений при менструациях. Его применяют при лихорадочных состояниях,
профилактике и лечении тромбозов и эмболии, профилактики и лечении
ишемических нарушений и мозгового кровообращения.
Аспирин является препаратом, имеющим наибольшее число сино-
синонимов. Синонимами препарата являются ацетосал, кислота ацетилсали-
ацетилсалициловая, цетосал и офомное количество других.
В медицинской практике используются и неацетилированные сали-
цилаты.
-62-
Анальгетики
Дифлунисал (Diflunisal)
Дифлунисал — 2'.4'-дифтор-4-гидрокси-3-бифенилкарбоновую ки-
кислоту C.2.5) синтезируют исходя из диазониевой соли, получаемой
из 2,4-дифторанилина и шо-амил-нитрита, и анизола в присутствии
солей одновалентной меди, осуществляя классическую схему полу-
получения биарилов Полученный при этом 4-B,4-дифторфенил)анизол
C.2.3) деметилируют йодистым водородом в 4-B,4-дифторфенил)-
фенол C.2.4), Последний вводят во взаимодействие с двуокисью уг-
углерода в присутствии основания по методу Кольбе с получением
дифлунисала C.2.5) [64. 65, 66, 67].
c5h,,ono
HI ' СНзСООН
СО2 / К2СОз
324
Являясь ингибитором, дифлунисал (простагландин синтетазы) про-
проявляет анальгетическое, жаропонижающее и противовоспалительное
действие. Препарат применяют для долговременного и кратковременно-
кратковременного симптоматического облегчения слабых и умеренных болей, при ос-
теоартритах и ревматоидных артритах.
Синонимами препарата являются долобид, адомал, ноладол и др.
На практике применяются и другие производные салициловой ки-
кислоты в виде солей.
Салицилат магния (magnesium salicylate) и салицилат натрия
(sodium salicylate) менее эффективны, чем соответствующие дозы аспи-
аспирина, однако лучше переносятся больными, чувствительными к аспири-
аспирину. Хопинмагнийтрисалицилат (chohnemagnesiurntmahcylate) представ-
представляет собой смесь салицилата холина и салицилата магния с тем же
действием, что и у аспирина, однако лучше переносится больными,
у которых наблюдаются желудочно-кишечные явления при приеме ас-
аспирина.
-63-
Глава 3
Пиразолоны
Значительною роль в качестве анальгетиков, противовоспалитель-
противовоспалительных и жаропонижающих средств в медицине играют производные пира-
золона. К ним относятся антипирин, бутадион, амидопирин, фенилпира-
зон, сульфинпиразон, метамизол натрия (анальгин) и некоторые другие.
По анальгезирующей и противовоспалительной активности они близки
к производным салициловой кислоты. Хотя механизм их действия вы-
выяснен не полностью, полагают, что производные пиразолона так же. как
и аспирин, ингибируют биосинтез простагландинов, а также уменьшают
проницаемость капилляров и препятствуют развитию воспалительной
реакции. Серьезным ограничением для широкого применения пиразо-
лонов в медицине являются случаи возникновения при их применении
агранулоцитоза.
Наиболее широко в медицине применяется метамизол натрия, хотя
в некоторых странах он запрещен, а также комбинированные препараты
на его основе и, в частности, баралгин, представляющий собой комби-
комбинированный препарат на основе анальгина со спазмолитиком 4'-(это-
ксипиперидин)карбметоксибензофеноном и ганглиоблокатором 2,2-ди-
фенил-4-пиперидилацетамидом.
Фенилбутазон (Phenylbutazone)
Фенилбутазон — 4-бутил-1,2-дифенил-3,5-пиразолидиндион C.2.6)
получают в одну стадию взаимодействием гидразобензола с бутил-
малоновым эфиром [68, 69].
,NH—HN.,
О О
С4Нд
СГ N
С4Нд
3 2 58
Фенилбутазон применяется для снятия слабых и умеренных болей,
при головной боли, ревматоидных артритах и остеоартритах.
Синонимами препарата являются алговерин, азолид, бутазолидин
и др.
Сульфинпиразон (Sulfwpyrazone)
Сульфинпиразон — 1,2-дифенил-4-2-(фенилсульфннил)этил-3.5-
пиразолидиндион C.2.8) является аналогом фенилбутазона; его по-
по-64-
Анальгетики
лучают аналогичным способом — конденсацией гидразобензола
с 2-B-фенилтиоэтил)малоновым эфиром в пиразолдион C.2.7) с по-
последующим окислением тиолового эфира перекисью водорода в ук-
уксусной кислоте в сульфоксид — сульфинпиразон C.2.8) [70, 71J.
328
Сульфинпиразон применяется по тем же показаниям, что и фенил-
фенилбутазон.
Синонимами препарата являются антуран и энтурен.
Метамизол натрия (Metamizole sodium)
Метамизол натрия — 1-фенил-2,3-диметил-4-метиламинопиразо-
лон-5-К-метансульфонат натрия C.2.16) получают многостадийным
синтезом исходя из ацетоуксусного эфира и фенилгидразина. Их
взаимодействие приводит к получению 1-фенил-З-метилпиразо-
лона-5 C.2.9). Метилированием последнего йодистым метилом по-
получают 1-фенил-2,3-диметилпиразолон-5 C.2.10). Это соединение
самостоятельно используется в медицине в качестве жаропони-
жаропонижающего и противовоспалительного анальгетика под названием ан-
антипирин. Последний подвергают нитрозированию нитритом натрия
в кислой среде с получением 1-фенил-2,3-диметил-4-нитрозопира-
золона-5 C.2.11). Восстановление ннтрозопроизводного C.2.11)
разными восстановителями приводит к получению 1-фенил-2,3-
диметил-4-аминопиразолона-5 C.2.12). Последний вводят во взаи-
взаимодействие с бензальдегидом с образованием легко выделяющегося
-65-
Глава 3
кристаллического 1-фенил-2,3-диметил-4-бенилиденаминопиразо-
лона-5 C.2.13), который метилируют по иминному атому азота ди-
метилсульфатом с получением четвертичной соли C.2.14). Гидро-
Гидролизом полученной соли получают 1-фенил-2,3-диметил-4-метил-
аминопиразолон-5 C.2.15). Обработка последнего водным раствором
смеси бисульфита натрия и формальдегида приводит к получению
5-М-метансульфоната натрия 1-фенил-2,3-диметил-4-метилами-
нопиразолона C.2.16) — искомого метамизол натрия [72, 73, 74,
75].
CH3t
ON СНз
Х^ .N-СНз
О N (Н]
6
a—ch=n + сн3
0<4l-CH3
[ I] CH3OSO2
32 14
НгО
CH3-HNv CH3
O-_N.N-CH3
3215
NaOSO2CH2
NaHSO3/ CH2O
32 16
Метамизол натрия обладает выраженным анальгетическим, жаро-
жаропонижающим свойством и слабо выраженным противовоспалительным
действием и очень удобен в случаях, когда необходимо быстро создать
в. крови высокую концентрацию препарата. Метамизол натрия приме-
применяют при болях различного происхождения (почечной и желчной коли-
колике, невралгии, миалгии. при травмах, ожогах, головной и зубной боли).
При применении препарата возможны аллергические реакции, при дли-
длительном применении — гранулоцитопения.
Синонимами препарата являются дипирон, анальгин и многие дру-
другие.
-66-
Анальгетики
Производные я-аминофенола
Ацетаминофен (Acetaminophen)
Ацетаминофен — л-ацетаминофенол C.2.80) получают взаимодей-
взаимодействием л-амнофенола с уксусным ангидридом [76, 77].
-NH2
(СН3СОJО
НО
о
-NH-C-СНз
32 17
В отличие от описанных НПВС ацетаминофен лишен противовос-
противовоспалительных и противоревматических свойств. Недавно было показано,
что он, как и аспирин, также ингибирует действие циклооксигеназы
в мозге и даже мощнее, чем аспирин. С другой стороны, механизм
анальгетического действия ацетаминофена не совсем ясен, поскольку он
слабо действует на периферическую циклооксигеназу.
Ацетаминофен широко применяется в качестве анальгетика и жаро-
жаропонижающего средства. Асетаминофен предназначен для умеренной
анальгезии. Он так же эффективен, как и аспирин, и используется для
анальгезии при головной боли (от слабой до умеренной), миалгии, арт-
ралгии, хронических болях при онкологических, послеоперационных
болях и т. д.
Синонимами препарата являются параацетамол, тайленол и многие
другие.
Производные антраниловой кислоты
Производные антраниловой кислоты являются прямыми структур-
структурными аналогами производных салициловой кислоты. Они обладают
анальгезирующей, противовоспалительной и жаропонижающей актив-
активностью. По анальгезирующей и жаропонижающей активности они
близки к пиразолонам, а по противовоспалительной активности превос-
превосходят салицилаты. Механизм действия этого ряда нестероидных проти-
противовоспалительных анальгетиков не окончательно выяснен.
Флуфенамовая кислота (Flufenamic acid)
Фл>фенамовая кислота — Н-(а,а,а-трифтор-.м-толил)антраниловая
кислота C.2.18) получается взаимодействием 2-хлорбензойной ки-
кислоты с 3-трифторметиланилином в присутствии поташа и медных
опилок [78, 79].
-67-
Глава 3
С ООН
CF3
-=< Си / К2СО3
Флуфенамовая кислота показана при умеренных болях и при дис-
менорее, но ее не следует применять более одной недели вследствие
возможной нефротоксичности, желудочно-кишечной токсичности
и анемии. Часто применяют совместно с антикоагулянтом варфарином,
действие которого усиливается при совместном применении с флуфе-
флуфенамовои кислотой.
Синонимами препарата являются арлеф, флексокутан, ромазал
и др.
Мефенамовая кислота (Mefenamic acid)
Мефенамовую кислоту — М-B,3-ксилил)антраниловую кислоту
C.2.19) получают примерно аналогичным способом — взаимодей-
взаимодействием калиевой соли 2-бромбензойной кислоты с 2,3-диметил-
анилином в прис>тствни ацетата двухвалентной меди [80, 81].
COOK
Применяют по тем же показаниям, что и флуфенамовую кислоту.
Синонимами препарата являются паркемед, понстан, понстел
и др.
Меклофенамовая кислота (Meclofenamic Acid)
Меклофенамовую кислоту — 1чг-B,6-дихлор-.и-толнл)антраниловую
кислоту C,2.20) получают аналогично флуфенамовои кислоте взаи-
взаимодействием калиевой соли 2-бромбензойной кислоты с 2,6-ди-
хлор-3-метиланилином в присутствии дв>бромистой меди в среде
N-этилморфолина и диглима [82, 83].
-68-
Анальгетики
H2N
CuBr2
3 2 20
Препарат применяют по тем же показаниям, что и фл\фенамовую
кислоту.
Синонимом препарата является мовенс.
Нифлумиковая кислота (Niflumic acid)
Нифлумиковая кислота — 2-3-Aрифторметил)анилино никотино-
никотиновая кислота C.2.9) получается либо взаимодействием 2-хлор-
никотиновой кислоты с 3-трифторметил-анилином [84, 85, 86],
либо 2-аминоникотиновой кислоты с 1-бром-З-трифторметил-
бензолом [87].
а:
kZ.../=<
~\//
Применяют по тем же показаниял1, что и описанные выше препа-
препараты.
Синонимами препарата являются актол, флунир, форенол, нифлу-
рил и др.
Производные пропионовой кислоты
Этот ряд противовоспалительных, анальгетических и жаропони-
жаропонижающих соединений (ибупрофен, напроксен. кетопрофен, фенопрофен)
в равной мере можно называть как производными пропионовой кисло-
кислоты, так и производными фенилпропионовой кислоты. Механизм их дей-
действия окончательно не ясен, однако полагают, что он также связан
с подавлением активности простагландина синтетазы.
Ибупрофен (Ibuprofen)
Иб\профен — 2-D-шо-бутилфенил)пропионовую кислоту C.2.23)
можно синтезировать разными методами [88, 98]. Первым спосо-
-69-
Глава 3
дом (простейшим) является синтез ибупрофена. заключающийся
в ацилировании мзо-бутилбензола хлорангидридо.м уксусной кисло-
ш. Полученный при этом шо-бутилбензофенон C.2.21) вводят во
взаимодействие с цианидом натрия с получением оксинитрила
C.2.22). который под действием йодистоводородной кислоты в при-
с>тствии фосфора превращается в 2-D-шо-бутилфенил) пропионо-
в\ю кислоту C.2.23). последовательно проходя стадии дегидрата-
дегидратации, восстановления и гидролиза.
СНз
НзС-СН-СН2-
А1С13
СНч-С-С!
9
н3с-сн-сн2
3 2 21
NaCN
3 2 22
HI / Р.
СНз
н3с-сн-сн2
3 2 23
Второй способ синтеза ибупрофена заключается в хлорметилиро-
вании изо-бутилбензола с получением 4-мзо-бутилбензилхлорида
C.2.24). Взаимодействием последнего с цианидом натрия получают
4-мзо-б\тилбензилиианид C.2.25), который алкилируют в присутствии
амида натрия йодистым метилом в 2-D-шо-бутилбензил)-пропионитрил
C 2 26). Гидролиз последнего в присутствии основания приводит к ибу-
профену C.2.23).
H3C-CH-CH2-^ h— CH2-CI
3 2 24
Ибчпрофен является первым препаратом из производных пропио-
новой кислоты, разрешенных к клиническому использованию. Ибупро-
фен проявляет анальгетическое. жаропонижающее и противовоспали-
противовоспалительное действие, которое сравнимо и даже превосходит таковое
-70-
Анальгетики
аспирина и ацетаминофена. Переносится лучше аспирина, и случаев
побочных реакций наблюдается мало. Применяют для лечения ревмато-
ревматоидного артрита, при различных формах суставных и внесуставных рев-
ревматоидных заболеваний, а также при болях, возникающих в результате
воспалительных поражений периферической нервной системы, при обо-
обострении подагры, невралгии, миалгии, анкилозирующем спондилите,
радикулите, травматическом воспалении мягких тканей и опорно-
двигательного аппарата. Как вспомогательное средство используется
при инфекционно-воспалительных заболеваниях ЛОР-органов, аднекси-
те, первичной дисменорее, головной и зубной болях. Не рекомендуется
больным с язвой желудка или перенесшим таковую.
Наиболее распространенными синонимами ибупрофена являются
бр>фен, ибуфен, мотрин, реб>ген и др.
Напроксен (Naproxen)
Напроксен — 2-F-метокси-2-нафтил)-пропионовая кислота C.2.15)
может быть получена методами синтеза, описанными для ибупро-
ибупрофена, а также методами, которые будут описаны ниже для синтезов
фенопрофена C.2.21) и кегопрофена C.2.27) исходя из 2-ацетил-
илн 2-хлорметил-6-метоксинафталина [99, 100, 101].
сн3
„С Н-С ООН
сн3о
3 2 27
Аналогично другим препаратам этого ряда напроксен проявляет
анальгетическое, жаропонижающее и более длительное противовоспа-
противовоспалительное действие. Вызывает ослабление и исчезновение болевого
синдрома, в том числе и болей в суставах, уменьшение скованности
и припухлости суставов. Применятся по тем же показаниям, что и ибу-
профен.
Синонимами препарата являются напросин, пропаксен, апотекс.
Фенопрофен (Fenoprofen)
Фенопрофен — 2-C-феноксифенил)пропионов>ю кислоту C.2.32 )
получают синтезом, исходящим из 3-гидроксиацетофенона, кото-
который этерифицируют бромбензолом в присутствии поташа и медных
опилок с получением 3-феноксиацетофенона C.2.28). Карбониль-
н\ю гр\пп\ последнего восстанавливают боргидридом натрия,
-71 -
Глава 3
и полученный спирт C.2.29) бромируют трехбромисым фосфором.
Взаимодействием полученного бромопроизводного C.2.30) с циани-
цианистым натрием получают 2-C-феноксифенил)пропионитрил C.2.31),
который гидролизуют в искомый фенопрофен C.2.32) [102, 103].
C=N
сн-снз
соон
СН-СНз
Н2О/ Н
Химически и фармакологически фенопрофен сходен с вышеопи-
вышеописанным рядом соединений. Применяют для лечения симптомов ревма-
ревматоидного артрита и остеоартрита. однако фенопрофен проявляет и ряд
нежелательных побочных эффектов.
Синонимами препарата являются налфон, диета и др.
Кетопрофен (Ketoprofen)
Кетопрофен — 2-C-бензоил)пропионовую кислоту C.2.37) синте-
синтезируют исходя из 3-метилбензофенона, который подвергают бро-
мированию с получением 3-бром-метилбензофенона C.2.33). Взаи-
Взаимодействием последнего с цианистым натрием получают 3-циано-
метилбензофенон C.2 34), который вводят во взаимодействие с ди-
этиловым эфиром угольной кислоты в присутствии этилата натрия.
Пол>ченное таким образом производное циануксусного эфира
C.2.35) алкилируют йодистым метилом, и полученный продукт
C.2.36) подвергают кислотному гидролизу с получением кетопро-
фена C.2.37) [104, 105, 106].
СН2 C_N c2H5ONa / СО(ОС2НЕ>2
О"
СООС2Н5
сн _
СН3|
н2о/ н
-72-
Анальгетики
Кетопрофен применяют для облегчения слабых и умеренных болей,
при ревматоидном артрите, остеоартрите, анкилозирующем спондилите,
подагре, боли в позвоночнике, невралгии, миалгии. Применяют также
при неосложненных травмах, в частности спортивных, при растяжении
или разрыве связок и сухожилий мышц. Препарат проявляет ряд неже-
нежелательных побочных эффектов на почечную и печеночную функции,
ЖКТ.
Наиболее распространенными синонимами являются алревмат, фас-
тум, кеталгин, реупрофен и др.
Производные уксусной кислоты
В качестве противовоспалительных, анальгетических и жаропони-
жаропонижающих соединений в медицине кроме производных пропионовой ки-
кислоты весьма широко применяются и другие препараты и, в частности,
производные уксусной кислоты (диклофенак, феклофенак, алклофенак
и др.). Полагают, что их противовоспалительное, анальгетическое и жа-
жаропонижающее действие также обусловлено подавлением активности
простагландин синтетазы.
Диклофенак (Diclofenac)
Диклофенак — 2-[B,6-дихлорфенил)-амино]-фенилуксусную ки-
кислоту C.2.42) синтезируют исходя из 2-хлорбензойной кислоты
и 2,6-дихлоанилина. Взаимодействием последних в присутствии
гидроокиси калия и меди получают И-B,6-дихлорфенил)антра-
ниловую кислоту C.2.38), карбоксильную группу которой подвер-
подвергают восстановлению алюмогидридом лития. Полученный при этом
2-[B,6-дихлорфенил)-амино]-бензиловый спирт C.2.39) подвергают
далее хлорированию хлористым тионилом в 2-[B,6~дихлорфенил)-
амино]-бензилхлорид C.2.40) и далее, действуя цианидом натрия,
превращают в 2-[B,6-дихлорфенил)-амино]-бензилхцианид C.2.41).
Гидролиз нитрильной группы последнего приводит к диклофенаку
C.2.42) [107, 108].
LrtLH4
-73-
Глава 3
CH2CI
CH2C = N
NaCN
СН2СООН
NaOH
3.2.40
3 2.41
3 2.42
Диклофенак обладает всеми свойствами, присущими ряду препара-
препаратов — производных пропионовой кислоты, а по силе противовоспали-
противовоспалительного и анальгетического действия превосходит аспирин, анальгин
и ибупрофен. Применяют при остром ревматизме, ревматоидном арт-
артрите, остеоартрите, анкилозируюшем спондилите, артрозах, при бо-
болях в позвоночнике, невралгии, миалгии. Редко вызывает побочные
эффекты.
Наиболее распространенным синонимом является вольтарен.
Фенклофенак (Fenclofenac)
Фенклофенак — о-[B,4-дихлорфенокси)фенил]уксусная кислота
C.2.45) получается синтезом, исходящим из 2,4-дихлорфенола и 2-
хлорацетофенона. взаимодействием которых в присутствии гидро-
гидроокиси натрия и порошкообразной меди получают соответствующий
2-ацетил-2',4!-дихлор-дифениловый эфир C.2.43). Последний вво-
вводится во взаимодействие с серой и морфолином с получением по
методу Вильгеродта тиоамида C.2.44), который далее гидролизуют
в искомый фенклофенак [109, НО].
/—\
S / H-N О
3 2.44
3.2 45
Препарат применяется по тем же показаниям, что и диклофенак.
Синонимом препарата является фленак.
-74
Анальгетики
Индолил/инденуксусные кислоты
Препараты этого ряда (индометацин, толметин, сулиндак и др.) яв-
являются очень эффективньши нестероидными противовоспалительными
препаратами с сильно выраженной анальгетической активностью. Яв-
Являются сильными ингибиторами биосинтеза простагландинов.
Индометацин (Indometacin)
Индометацин — 1-(/?-хлорбензоил)-5-метокси-2-метилиндол-3-ук-
сусную кислоту C.2.51) предложено получать разными методами.
Во всех случаях предлагаемые способы синтеза исходят из 4-ме-
токсифенилгидразина. Согласно первому способу, осуществляют
реакцию получения индолов из фенилгидразона C.2.46) по Фишеру
с использованием в качестве карбонильной компоненты метилового
эфира левулиновой кислоты, а в качестве кислоты — хлористого
водорода в этаноле с получением метилового эфира 5-метокси-2-
метил-3-индолилуксусной кислоты C.2,47). Продукт гидролизуют
щелочью до 5-метокси-2-метил-3-индолилуксусной кислоты C.2.48),
из которой с использованием /и/эеш-бутилового спирта и хлорида
цинка в присутствии дициклогексилкарбодиимида получают трет-
бутиловый эфир 5-метокси-2-метил-3-индолилуксусной кислоты
C.2.49). Последний подвергают ацилированию по индольному ато-
атому азота хлорангидридом я-хлорбензойной кислоты в диметилфор-
мамиде, используя в качестве основания гидрид натрия. Получен-
Полученный /и/^еот-бутиловый эфир 1-(я-хлорбензоил)-5-метокси-2-метил-3-
индолилуксусной кислоты C.2.50) далее подергают термическому
расщеплению до соответствующей кислоты — индометацина
C.2.51) [111, 112].
СНз)зОН / ZnCI2
-75-
Глава 3
Cri3O.
CH2-C-OCiCW3K
CH3O.
.СН2-С-ОС(СН3Ь ,
I 32 SO
CH3O.
3 2 51
При втором способе фенилгидразон C.2.46) подвергают циклиза-
циклизации в присутствии самого хлорангидрида я-хлорбензойной кислоты,
при которой одновременно происходит и ацилирование гидразона, и его
циклизация в метиловый эфир 5-метокси-2-метил-1-(/?-хлорбензоил)-3-
индолилуксусной кислоты C.2.52), который далее гидролизуют щело-
щелочью в индометацин C.2.51) [113, 114].
XtX
о
,снг-с-он
То же вещество предложено получать непосредственно исходя из 4-
метоксифенил-я-хлорбензоилгидразина и левулиновой кислоты путем
циклизации соответствующего гидразона в присутствии хлористого
водорода. С этой целью конденсацией ацетальдегида с «-метокси-
фенилгидразином получают гидразон C.2.53), который ацилируют хло-
рангидридом «-хлорбензойной кислоты с получением гидразона
-76-
Анальгетики
C.2.54). Последний гидролизуют в гидразин C.2.55). Вводя последний
во взаимодействие с левулиновой кислотой, получают гидразон C.2.56),
который подвергают циклизации по Фишеру в индометацин C.2.51)
[115].
СН3СНО
COCI
СНз
=с<
(СН2J-СООН
3 2 53
СН3О.
3 2 56
НС! • С2Н5ОН
-^ /-N—N=CH-CH3 1 » СН
— с=о
Индометацин применяют при ревмокардите, неспецифическом ин-
инфекционном полиартрите, подагрическом артрите, ревматоидном арт-
артрите, остеоартрите. анкилозирующем спондилите, артрозах, при болях
в позвоночнике, невралгии, миалгии и других заболеваниях, сопровож-
сопровождающихся воспалением.
Синонимами препарата в числе других являются метиндол. инда-
цид, румацид и многие другие.
Толметин (Tolmetin)
Толметин — 1-метил-5-л-толуилпиррол-2-уксусную кислоту C.2.61)
синтезируют исходя из 1-метилиндола, который аминометилируют
с использованием формальдегида и диметиламина с получением
-77-
2-диметиламинометил-1-метилиндола C.2.57) Последний метили-
метилируют йодистым метилом с получением соответствующей четвер-
четвертичной соли C.2.58). Взаимодействием последней с цианистым
натрием получают 1-метил-2-пирролил)аиетонитрил C.2.59),
который ацилируют по свободному а-положению индольного
кольца хлоангидридом 4-метилбензойной кислоты с использовани-
использованием хлористого алюминия. Полученный при этом 1-метил-5-я-
гол>илпиррол-2-ацетонитрил C.2.60) подвергают далее щелочному
гидролизу с получением толметина C.2.61) [116, 117, 118].
(CH3,2NH
СН,
СИ
СНз
3 2 57
СН3
3 2 58
CHjCN
NaCN
=\ JCX
^ // S N CHjCOOH
О СЧ3
Толмегин, как и все вышеописанные препараты, ингибирует синтез
простагландинок и проявляет выраженные анальгетические, противо-
противовос палительные и жаропонижающие свойства. Применяется для снятия
слабых и > меренных болей при ревматоидных артритах и остеоартри-
тах.
Синонимами препарата являются толектин, толмекс и др.
Сулиндак (Sulindac)
Сулиндак -— 5-фтор-2-метил-1-[л-(метилсульфинил)бензилиден]-
инден-3-уксусная кислота C.2.67) получается многостадийным син-
синтезом, исходящим из «-фторбензалдегида, конденсацией которого
с ангидридом прошюновой кислоты в присутствии ацетата натрия
получают 4-фтор-а-метилкоричную кислоту C.2.62). Восстановле-
Восстановлением двойной связи с водородом с использованием в качестве ката-
катализатора палладия на угле получают 4-фтор-а-метилдигидро-
коричную кислоту C.2.63). В присутствии полифосфорной кислоты
послеанюю циклизуют в 5-фтор-2-метил-3-инданон C.2.64). Полу-
Полученный кегон вводят в реакцию Кневенагеля с циану ксусной кисло-
кислотой и далее декарбоксилируют до 5-фтор-2-метилиден-3-у ксусной
кислоты C.2.65). Конденсацией последней с л-меркаптобен-
зальдегидом в присутствии метилата натрия получают 5-фтор-2-
-78-
Анальгетики
метил-1-D-метилтио-бензилиден)-3-инден-уксусную кислоту C.2.66),
атом серы в которой окисляют перйодатом натрия до искомого
сульфоксида C.2,67) — сулиндака [119, 120, 121, 122].
СНз
,сн=с-соон
СН3СНгСООМа
,сн2-сн-соон
3 2 64
Н2СООН
3 2 65
ОНС-
CH3ONd
Cri2COOH
NalO4
СН2СООН
3 2 66
3 2 67
Сулиндак применяется для снятия слабых и умеренных болей, при
ревматоидных артритах и остеоартритах.
Синонимами препарата являются супрол, имбарал и др.
Оксикамы
Оксикамы являются представителями еще одного ряда противовос-
противовоспалительных, анальгетических и жаропонижающих соединений, меха-
механизмом действия которых, по всей вероятности, является угнетение
синтеза иростагландинов. Эти препарат способны ослаблять болевой
синдром средней интенсивности.
Пироксикам (Piroxicam)
Пироксикам — 1,1-диоксид 4-гидрокси-2-метил-Н-2-пиридил-2#-
1,2-бензотиазин-З-карбоксамида C.2.78) получают исходя из саха-
сахарина C.2.79). Описаны два способа синтеза сахарина. Обычно исхо-
исходят из толуола, который сульфируют хлорсульфоновой кислотой
с получением изомерных 4- и 2-толуолсульфохлоридов. Изомерные
продукты разделяются вымораживанием. Жидкую фракцию 2-толу-
-79-
Глава 3
олсульфохлорид C 2.68) отделяют от кристаллического 4-толуол-
сульфохлорида и вводят во взаимодействие с аммиаком с получени-
получением 2-толуолс>льфонамида C.2.69). Окислением последнего перман-
ганатом калия или оксидом шестивалентного хрома в серной
кислоте получают сахарин — имид о-сульфобензойной кислоты
C.2.70) [123.'124, 125, 126].
CISO3H
[О]
SCbCI
SO2-NH2
3 2 68
3 2 69
3 2 70
Альтернативный путь получения сахарина исходит из метилового
эфира о-амино-бензойной (антраниловой кислоты). Последний подвер-
подвергают диазотированию азотистой кислотой, и полученную диазониевую
соль C.2.71) вводят во взаимодействие с двуокисью серы в присутствии
двухлористой меди с получением метилового эфира о-сульфобензойной
кислоты C.2.72). Взаимодействием последней с молекулярным хлором
пол\чают метиловый эфир о-хлорсульфонилбензойной кислоты C.2.73),
взаимодействием которой с аммиаком получают метиловый эфир о-суль-
фониламид бензойной кислоты C.2.74). Последний в присутствии хло-
хлористого водорода циклизуется в сахарин C.2.70).
n2 с:
3 2 71
NH3
СООСН3
3 2 73
3 2 74
^СООСНз
4so2—он
С12
3 2 70
Взаимодействием сахарина с гидроокисью натрия осуществляют
замещение имидного атома водорода сахарина на натрий с получением
натриевой соли C.2.75). Последнюю вводят во взаимодействие с мети-
метиловым эфиром члоругольной кислоты с получением замещенного саха-
сахариновым фрагментом метилового эфира уксусной кислоты C.2.76). Под
действием метилата натрия в диметилсульфоксиде последний подверга-
подвергается перегруппировке в 1,1 -диоксид 3-метоксикарбонил-3,4-дш идро-2-
-80-
Анальгетики
#-1,2-бензотиазин-4-он C.2.77). Последний метилируют метилйодидом
по атому азота с получением 3.2.78 Наконец, вводя полученный про-
продукт во взаимодействие с 2-аминопиридином, получают пироксикам
C 2.79)
^N-СНгСООСНз
CH3ONa DK'SO
Как уже было отмечено, пироксикам также относится к нестероид-
нестероидным противовоспалительным средствам. Применяется при воспали-
воспалительных и дегенеративных заболеваниях опорно-двигательного аппара-
аппарата, сопровождающихся болевым синдромом. Препарат применяют при
ревмокардите, неспецифическом инфекционном полиартрите, подагри-
подагрическом артрите, ревматоидном артрите, остеоартрите, анкилозирующем
спондилите, артрозах, при болях в позвоночнике, невралгии, миалгии
и других заболеваниях, сопровождающихся воспалением.
Синонимами препарата являются фелден, дексикам, роксен и др.
Изоксикам (Isoxicam)
Изоксикам — 1,1-диоксид 4-гидрокси-2-метил-К-E-метил-3-изо-
ксазолил)-2//-1,2-бензотиазин-3-карбоксамида C.2.80) получают
аналогично пироксикаму, используя на последней стадии амидиро-
вания 1,1-диоксида 3-метоксикарбонил-3,4-дигидро-2-#-1,2-бензо-
тиазин-4-она C.2.78) вместо 2-аминопиридина З-амино-5-метил-
изоксазол [127, 128, 129, 130].
СООСНз
H2N
О СНз
3 2 78
3 2 80
Применяют по тем же показаниям, что и пироксикам.
Синонимами препарата являются флоксикам и млаксикам.
-81 -
Глава 3
1.
2.
3.
4.
5.
6.
7.
8.
9.
10.
11.
12.
13.
14.
15.
16.
17.
18.
19.
20.
21
22.
23.
24.
25.
26.
27.
28.
29.
30.
31.
32.
33.
34.
35.
36
Список литературы
Gates et al./'J. Am. Chem. Soc, 72. ?28, 1141, 4839 A950).
Gates, Tschudui. Am. Chem. Soc, 74, 1109 A952).
Gates, Tschudi'U. Am. Chem. Soc, 78, 1380 A956).
Ijima I. et al. 'J. Org. Chem., 43, 1462 A978).
Bijsterveld E. J., Sinnige H. JJ/Rec. Trav. Chim. 95, 24 A976).
Beyerman H. С et al./VRec Trav. Chim. 97, 127 A978).
Ger. Pat. 247.180A912).
Rodionow Wt 'Bull. Soc. Chim. France, 39, 305 A926).
SnyderhkR. et al.'J. Am. Chem. Soc, 80, 3708 A958).
Small, Lutz. Chemistry of the Opium Alcaloids/ 'Public Health
reports, Washington. 1932. Suppl. No. 103.
Ger. Pat. 365,683A922).
Ger. Pat. 623.821A935),
Rappoport Z et al.'.'J. Org. Chem, Ц, 1 103 A950).
US Pat. 2.628.962A953).
US Pat. 2.806.033A957).
Weiss H. D 'J. Am. Chem. Soc, 72, 5891 A955).
Ger. Pat. 411.530A925).
Ger. Pat. 623.821 A935).
Mannich С et al.'/Arch. Pharm. 258, 295 A920).
Ger. Pat. 415.097A925).
Schnider О et aL'-'Helv. Chim. Acta. 33, 1437 A950).
Schmder O. et al.Helv. Chim. Acta. 33, 1437 A950).
Ger. Pat. 890.506A944).
Ehrhart G. et al.'/Ann. 561- 52 A948).
Shultz H. et al.//J. Am. Chem. Soc. 69, 2454 A947).
Easton R et al.,' J. Am. Chem. Soc. 69, 2941 A947).
US Pat. 2.644.010A953).
US Pat. 2.983.757A961).
Larsen A. et al.<;J. Am. Chem. Soc. 70, 4194 A948).
US Pat. 2.167.351 A939).
Ger. Pat. 679.281 A937).
Smissman E. et aL7J. Am. Chem. Soc. 81. 1201 A959).
Назаров //. Я.//Ж. Общ. Х., 26, 3117 A956).
Stokbroekx R A../J. Med. Chem. 16, 782 A973).
US Pat. 3.714.159A973).
US Pat. 3.884.916A975).
-82-
Анальгетики
37. US Pat. 2.898.340A959).
38. US Pat. 4.086.234 A978).
39. US Pat. 3.141.823 A964).
40. US Pat. 3.164.600A965).
41. US Pat. 4.167.574A979).
42. Ger. Pat. 2.819.873A978).
43. Janssens F. et. al.//J. Med. Chem. 29, 2290 A986).
44. Ger. Pat. 2.610.228 A976).
45. US Pat. 3.998.834A976).
46. Daele van G. H. P. et al./'/Arzneimittel-Forseh. 26, 1521 A976).
47. US Pat 2.364.833A944).
48. US Pat. 2.891.954A959).
49. Belg. Pat. 611.000 91962).
50. Archer S et al.//J. Med. Chem. 7, 123 A964).
51. Brit. Pat. 1.119.270A968).
52. US Pat. 3.393.197A968).
53. Brit. Pat. 1.136.214A968).
54. US Pat. 3.433.791 A969).
55. US Pat. 3.254.088A966).
56. Ger. Pat. 1.183.508A962).
57. Brit. Pat. 939.287 A963).
58. Olofson R. A et al.//Tetrahedron Letters. 1977. 1567.
59. US Pat. 3.332.950A967).
60. Gerhardt d Ann. 87, 149 A853).
61. US Pat. 3.235.583A966).
62. US Pat. 2.731.492A956).
63. Ger. Pat. 2.635.540 A959).
b4. Hannah J. et al.AJ. Med. Chem. 2, 1093 A978).
65. US Pat. 3.674.870A972).
66. US Pat. 3.681.445A972).
67. US Pat. 3.714.226 A973).
68. US Pat. 2.562.830 A948).
69. Brit. Pat. 812.449A959).
70. US Pat. 2.700.671 A955).
71. Pfister R. et al./Helv. Chim. Acta. 44, 232 A961).
72. Ger. Pat. 476.663A922).
73. Ger. Pat. 421.505A920).
74. Ger. Pat. 254.711 A911).
75. Ger. Pat. 259.577A911).
-83-
Глава 3
76 Lumwre M et al Bull Soc Chim France [3] 33, 785 A905)
77 1 SPat 2 998 450A961)
78 MoffeitR et al J Am Chem Soc 82 1605 1.1960)
79 Fr Pat M 1 341 A961)
80 US Pat 3 138 636A964)
81 Ger Pat 1 163 846A961)
82 LSPat 3 313 848A967)
83 Ger Pat 1 149 015A961)
84 Ger Pat 1 470 014A964)
85 Belg Pat 657 266A964)
86 LSPat 3 415 834A968)
87 US Pat 3 337 570A967)
88 Brit Pat 971 700A964)
89 US Pat 3 228 831 A966)
90 US Pat 3 385 886A968)
91 Brit Pat 1 9514 812A976)
92 LSPat 3 959 364A976)
91 Brit Pat 1 160 725A967)
94 LSPat 4jJ1 478 A977)
95 Bnt Pat 1 535 690A977)
96 Walker J et al Tetrahedron Letters 1977,3707
97 Pmhey J et al / Tetrahedron Letters 1980, 965
98 Shion Г etal /J Org Chem 43.2936A978)
99 Harmon J etal ,J Med Chem 13,203A970)
100 US Pat 3 904 682A975)
101 US Pat 4 009 197A977)
102 US Pat 3 600 437A971)
103 Fr Pat 2 015 718A971)
104 Fr Pat VI 6 444 A971)
105 LSPat 3 641 127A972)
106 Pinna G et al Farmaco Ed Sci 35, 684 A980)
107 US Pat 3 558 690A971)
108 US Pat 3 778 470A973)
109 Brit Pat 1 308 327A971)
110 US Pat 3 766 263A973)
111 US Pat 3 161 654A964)
112 Shen Г etal 'J Am Chem Soc 85-488A963)
113 )amamotoH Chem Pharm Bull 16, 17A968)
114 iamamoto H et al Chem Pharm Bull 16, 647 A968)
-84-
Анальгетики
115 Germ Pat 1 795 674A968)
116 US Pat 3 752 826A973)
117 Carson J etal J Med Chem 14,646A971)
118 Fr Pat 1 574 570A969)
119 Ger Pat 2 039 426A971)
120 US Pat 3 647 858A972)
121 LSPat 3 654 349A972)
122 ShumanR etal /J Org Chem 42, 1914A977)
123 Ger Pat 1 943 265A970)
124 US Pat 3 591 584A971)
125 LombardinoJ etal J Med Chem 15, 848A972)
126 LombardinoJ etal. J Med Chem 16,493A973)
127 Ger Pat 2 208 351 A972)
128 US Pat 3 787 324A974)
129 LombardinoJ etal//J Med Chem 14,973A971)
130 ZinnesH etal/J Med Chem , 25, 12A982)
Глава 4
Снотворные средства
(гипнотики и седативные
препараты)
Снотворные средства — это препараты, способствующие развитию
и нормализации сна. Однако сон, вызываемый большинством препара-
препаратов, по своему течению отличается от естественного сна.
Около 100 лег бромиды, затем хлоральгидрат и в последующем
барбитураты были единственными препаратами, способными облегчить
состояние пациентов, страдающих бессонницей и пациентов с невроти-
невротическими расстройствами.
Однако сегодня известны многие соединения различных химиче-
химических классов, которые могут вызвать различную степень депрессии
ЦНС, снимать беспокойство и вызывать сон — они могут быть класси-
классифицированы как гипнотики и седативные препараты. Эффекты, вызы-
вызываемые этими препаратами, находятся в непосредственной зависимо-
зависимости от применяемых доз, проявляясь в различной степени депрессии
ЦНС — от седации и сна до полной потери сознания.
Седация — это средняя степень депрессии ЦНС, в то время как
гипноз — это степень депрессии ЦНС, близкая к естественному сну.
С химической точки зрения снотворные — седативные и гипнотические
препараты — классифицируются как барбитураты, бензодиазепиновые
гипнотики и т п. За редким исключением любое из этих соединений
может быть применено для достижения седагивного эффекта или со-
состояния сна. В настоящее время менее токсичные бензодиазепины, по-
этом> они все более вытесняют класс барбитуратов по причине возмож-
возможности возникновения к ним хронической зависимости.
Препараты обоих классов в принципе являются депрессантами
ЦНС, а вызываемые ими некоторые эффекты, если не все, очевидно свя-
связаны с воздействием на рецепторный комплекс у-аминомасляной кисло-
кислоты (ГАМК).
-86-
Снотворные средства
4.1. Барбитураты
Действие барбитуратов на ЦНС выражается самым широким обра-
образом — от небольших изменений в поведении пациента, до проявления
более выраженных эффектов, таких как седация, сон или общая анесте-
анестезия, зависящих, как правило, от введенной дозы.
Фармакологическая основа подобной депрессии ЦНС весьма слож-
сложна по своей природе. Препараты действуют на различных участках
ЦНС, вмешиваясь в передачу импульсов в синапсах и, в общем, тормозя
передачу импульсов в спинной мозг.
Несмотря на то, что полный механизм действия барбитуратов в на-
настоящее время выяснен не полностью, кажется весьма вероятным, что
барбитураты усиливают ГАМК-индуцированный поток хлорид ионов
в нейрональную ткань, в результате чего мембрана клетки гиперполяри-
гиперполяризуется
Дру1ие эффекты барбитуратов на ЦНС, возможно, также связаны со
свойством барбитуратов повышать пропускающую способность мем-
мембран
Высказываются предположения, что молекулы барбитуратов про-
проникают в липидныи слой мембран и понижают жесткость их структур-
структурной организации. Гипотетически возможно, что, как и некоторые другие
препараты других классов, например, такие как общие анестетики, они
также могут действовать путем изменения способности мембран клеток
пропускать ионные потоки, воздействовать на высвобождение ней-
ротрансмиттеров, изменять конформацию ферментов. Т. е. не исключе-
исключено, что они действуют не по рецепторному механизму, а своим физиче-
физическим npiicy гствием в мембране. Однако ни одна из выдвинутых гипотез
не выдерживает строгой критики.
Клинически полезные барбитураты условно подразделяют на
4 группы.
1. Долгодействующие барбитураты F-8 ч) — мефобарбитал,
метарбитал, фенобарбитал.
2. Барбитураты средней продолжительности действия D-6 ч) —
амобарбитал, бутарбитал, талбутал.
3 Короткодействующие барбитураты B—4 ч) — пентобарбитал,
секобарбитал.
4 Барбитураты ультракороткого времени действия A0-30 мин) —
метогекситал, тиопентал, тиамилал.
Несмотря на то, что данная классификация весьма удобна для прак-
практического медицинского персонала, следует учитывать, что продолжи-
-87-
Глава 4
тельность времени действия препарата, особенно первых трех групп
соединений, кроме структуры самого соединения зависит от различных
факторов, таких как лекарственная форма, путь введения, патология,
при которой применяется препарат, общее время лечения и т. д.
Барбитураты применяются в течение короткого времени для лече-
лечения бессонницы, поскольку к барбитуратам при ре1улярном примене-
применении (в среднем в течение около трех недель) может возникнуть толе-
толерантность.
Барбитураты применяются также для контроля острых конвульсив-
конвульсивных состояний и для лечения различных форм эпилепсии. Препараты
применяют для пред- и постоперационной седации, а также для седаиии
в дневное время с целью устранить у пациента чувство беспокойства,
нервозности и напряжения. Барбитураты применяются также для лече-
лечения кататоничесих и маниакальных реакций и в качестве средств, ис-
используемых в психоанализе (наркоанализ и наркотерапия).
Барбитураты ультракороткого времени действия применяются
в анестезии.
Барбитураты — производные барбитуровой кислоты получают в ре-
результате конденсации производных малоновой кислоты с производны-
производными мочевины.
R2
i-C2H5
R3-HN NH2
Они являются слабыми кислотами, образующими соли по втором)'
положению кольца. В литераторе описаны определенные закономерно-
закономерности, касающиеся корреляций структура-активность в этом ряд> соеди-
соединений.
Как правило, для проявления центрального депрессивного действия
барбитураты должны содержать два заместителя при Cj гидрированного
пиримидинового кольца. 5,5-диэтилпроизводное (производное барбиту-
барбитуровой кислоты) является слабым гипнотиком, тогда как барбитураты
с одной этильной группой и другим заместителем (с более длинной уг-
углеводородной цепью) проявляют более сильный гипнотический эффеы
Более того, препараты с разветвленным алкильным заместителем
имеют большую гипнотическую активность, чем с заместителями
с нормальной углеводородной цепью.
-88-
Снотворные средства
Барбитураты с фенильной группой при С5 менее сильные гипноти-
кн, чем соединения с алифатическим или алициклическим заместите-
заместителем, однако они имеют выраженное антиэпилептическое и противосу-
дорожное действие.
N-метилирование повышает липидную растворимость препаратов и
уменьшает- длительность действия препаратов. Оно может придать пре-
препарату также антиэпилептические свойства, тогда как метилирование по
обоим атомам азота приводит к соединениям, вызывающим судороги.
Замещение атома кислорода во втором положении на серу (тиобар-
битураты) вызывает выраженное повышение коэффициента распреде-
распределения липид — вода у 5,5-дизамещенных барбитуратов
Эти соединения имеют большую силу в качестве гипнотиков, чем
их кислородные аналоги при внутривенном введении, однако их малая
водорастворимость и локализация в жировом депо делают их непригод-
непригодными для орального применения в качестве гипнотиков. Их в основном
используют в качестве внутривенных анестетиков (барбитураты ультра-
ультракороткого действия).
Долгодействующие барбитураты
Фенобарбитал (Phenobarbital)
Фенобарбитал — 5-этил-5-фенилбарбитуровую кислоту или 5-этил-
5-фенилгексагидропиримидин-2,4,6-трион D.1.4) предложено син-
синтезировать разными способами [1, 2, 3, 4]. I
Принципиального различия между ними нет. Первый способ за-
заключается в том, что бензилцианид подвергают этанолизу в кислой сре-
среде с получением этилового эфира фенилуксусной кислоты, метилено-
вую группу которого подвергают ацилированию диэтиловым эфиром
щавелевой кислоты с получением диэтилового эфира фенилоксобутан-
циоевой кислоты D.1.1), которая при нагревании легко теряет окись
углерода с превращением в фенилмалоновый эфир D.1.2). Алкилирова^
ние последнего эгилбромидом в присутствии этилата натрия приводит
к образованию а-фенил-а-этилмалонового эфира D.1.3), конденсацией
которого с мочевиной получают фенобарбитал D.1.4) [1].
-СН2-СООС2Н5
СООС2Н5
СООС2Н5
-89-
Глава 4
соос2н5
От
СООС2Н5
4 1 2
1 C2H5ONa
2 С2Н5Вг
42NCONh2
4 1 3
?
СООС2Н5
Второй способ синтеза фенобарбит&ча заключается в получении
а-фенилциануксусного эфира D.1.5) конденсацией бензилцианида с ди-
этиловым эфиром угольной кислоты в присутствии этилата натрия. Ал-
килированием эфира 4.1.5 этилбромидом получают а-фенил-а-этил-
циануксусный эфир D.1.6), который далее циклизуют в 4-имино-
производное D.1.7) Кислотным гидролизом последнего получают
фенобарбитал D.1.4] [2].
-CH2-C=N
1 C2H5ONa
2 ОС(ОС2Н5J
А 1 5
СООС2Н5
4 1 в
H2NCONH2
С2Н5
4 1 4
41 7
Фенобарбитал оказывает успокаивающее, снотворное и противосу-
дорожное действие. Широко применяется при лечении эпилепсии, хо-
хореи и спастических параличей и применяется в качестве составной час-
части большого числа комбинированных препаратов, в частности валокор-
валокордина и корвалола.
Наиболее распространенным синонимами являются люминал, фе-
немал, гипнотал и очень многие другие.
Мефобарбитал (Mephobarbital)
Мефобарбитал — 5-этил-1-метил-5-фенилбарбитуровую кислоту
D.1.8) получают по одной из схем. используемых для синтеза фено-
фенобарбитала, но с применением метилмочевнны [5].
-90-
Снотворные средства
Препарат используется в качестве седативного средства для снятия
беспокойства и напряжения, а также при больших и малых эпилептиче-
эпилептических припадках.
Синонимами препарата являются барбифенал, энфенемал, метил-
фенобарбитал.
Метарбитал (Metharbital)
Метарбитал — 5,5-диэтил-1-метилбарбитуровую кислоту D.1.9) по-
получают конденсацией диэтилмалонового эфира с метилмочевиной
[6. 7].
h-N
С2Н5
4 1 9
Метарбитал, как и фенобарбитал и мефобарбитал, оказывает проти-
вос\дорожное действие. Применяют при больших и малых эпилептиче-
эпилептических припадках.
Синонимами препарата являются эндиэмалум, гемонил, метабар-
битал.
Барбитураты средней
продолжительности действия
Амобарбитал (Amobarbital)
Амобарбитал — 5-этил-5-шо-амилбарбитуровую кислоту D.1.10),
как и все барбитураты, получают взаимодействием производных
малоновой кислоты с производными мочевины. В частности, с це-
целью получения амобарбитала а-этил-а-шо-амилмалоновый эфир
вводят во взаимодействие с мочевиной (в присутствии этилата на-
натрия) с получением амобарбитала D.1.10) [8, 9].
-91-
о о
U II
1 C2H5ONa
2 С2Н5Вг
С2Н5О
ОС2Н6
сн3
СН3СНСН2СН2Вг
о о
H2NCONH2
С2Н5 СН2СН2СНСН3
СНз
сн3
Я Ch2CH2CHCH3
-N J-C2H5
н
4 1.10
Амобарбитал применяют как снотворное при различных видах бес-
бессонницы, а также в качестве успокаивающего и противосудорожного
средства.
Наиболее часто используемыми синонимами являются барбамил,
амитал и гипнамил.
Бутабарбитал (Butabarbital)
Бутабарбитал — 5-этил-5-шо-оутилбарбитуровую кислоту D.1.11)
также предложено получать аналогичным путем — конденсацией
сс-этил-а-шо-бутилмалонового эфира с мочевиной [9].
о о
с2н5о
H2NCONH2
¦ СНСН2СН3
сн3
4 1 11
Бутабарбитал также применяют как снотворное при различных ви-
видах бессонницы и в качестве успокаивающего средства.
Наиболее часто используемым синонимом является бутизон.
Талбутал (Talbutal)
Талбутал — 5-аллил-5-втор-бутилбарбитуровую кислоту D.1.12")
получают взаимодействием а-аллил-а-втор-бутилмалонового эфира
с мочевиной [10].
-92-
Снотворные средства
СНз
СНСН2СН3
сн2—сн=сн2
I
н
4 1 12
о
Препарат отличается от бутабарбитала тем, что вместо изобутиль-
ного радикала в качестве одного из заместителей при С5 в бутабарбита-
ле использован вторбутильный радикал.
Талбутал применяют в качестве седативного снотворного средства
по тем же показаниям, что и бутарбитал.
Синонимами препарата являются профундол, лотустат и др.
Короткодействующие барбитураты
Пентобарбитал (Pentobarbital)
Пентобарбитал — 5-этил-5-B-амил)барбитуровую кислоту D.1.13 )
получают по схеме, аналогичной схеме получения амобарбитала,
с той лишь разницей, что алкилирование а-этилмалонового эфира
проводят не 1-бром-З-метилбутаном, а 2-бромпентаном с получени-
получением пентобарбитала D.1.13) [11, 12, 13].
ос2н5
"^ CHC3H7
J СН3
Н
4.1 13
В принципе пентобарбитал может рассматриваться как изомер амо-
амобарбитала. По действию он также схож с ним и отличается меньшей
продолжительностью действия и лучшей переносимостью. Препарат
применяют в качестве успокаивающего, а также как снотворное при
кратковременной бессоннице.
Наиболее часто используемым синонимом препарата является нем-
б\тал.
-93-
Секобарбитал (Secobarbital)
Секобарбитал — 5-аллил-5-A-мегилбутил)барбитуровую кисло-
кислоту D.1.14) также получают по стандартной схеме взаимодействи-
взаимодействием а-аллил-сс-A-метилбутил)-малонового эфира с мочевиной
114]
0?Н3
СНСН2СН2СН3
н2—сн=сн2
I
н
4 1 14
Препарат применяют по тем же показаниям, что и пентобарбитал, —
в качестве успокаивающего, а также как снотворное при кратковремен-
кратковременной бессоннице
Наиболее часто используемыми синонимами являются барбосек,
хинасед и др.
Барбитураты ультракороткого
времени действия
Синтез и свойства метогекситала A.2.15) и тиопентала A.2.10) были
описаны в гл. 1 «Общие анестетики».
О С
СН-С=С-С2Н5
сн3
1 215
1 210
Из рассмотренных выше барбит>ратов наиболее широко в меди-
медицине используются фенобарбитал, амобарбитал и бутабарбитал, а также
метогекситал и гиопентал.
4.2. Бензодиазепины
Производные бензодиазепинов являются основным классом ан-
ксиолитиков или транквилизаторов — соединений для лечения состоя-
-94-
Снотворные средства
ний общего беспокойства, и их синтез и свойства в качестве таковых
б\д\т обсуждены отдельно.
Однако, несмотря на то, что основной клинический эффект исполь-
используемых в медицине бензодиазепинов в принципе качественно одинаков,
определенные бензодиазепины применяются в несколько иных целях,
чем препараты для снятия беспокойства.
В частности, такие представители ряда бензодиазепинов, как флура-
зепам, темазепам и триазолам используются в качестве гипнотиков,
а к.юназепам — в качестве противосудорожного препарата. Более того,
в настоящее время самыми эффективными фармакологическими сред-
сшами, используемыми для лечения нарушений сна, являются флуразе-
пам, темазепам и триазолам.
Однако в малых дозах указанные гипнотики являются седативными
препаратами. Полагают, что основное их действие заключается в устра-
устранении психического напряжения и наступающее при этом успокоение
способствует развитию сна. Механизм действия бензодиазепинов свя-
связывают с их взаимодействием со специальными бензодиазепиновыми
рецепторами, считая, что в результате такого связывания повышается
аффинитет ингибируюшего нейротрансмиттера — ГАМК к соответст-
соответствующим рецепторам, что и усиливает тормозное действие ГАМК.
Рассматриваемые флуразепам, темазепам и триазолам, очевидно,
повышают ингибир>ющий эффект ГАМК на ЦНС.
Триазолам (Triazolam)
Триазолам — 8-хлор-6-B'-хлорфенил)-1-метил-4-Я-з-триазоло[4,3-
а]-[1,4]бензодиазепин D.2.4) получают по схеме, включающей клю-
ключевую стадию классического синтеза бензодиазепинов — взаимо-
взаимодействие о-аминобензофенонов с производными а-аминокислот.
В данном случае взаимодействием 2-амино-2',5-дихлорбензофенона
с этиловым эфиром глицина получают 7-хлор-5-B-хлорфенил)-2,3-
дигидро-1-Я-1,4-бенодиазепин-2-он D.2 1). Взаимодействием по-
последнего с пятисернистым фосфором карбонильную группу транс-
трансформируют в тиокарбонильную с получением 7-хлор-5-B-хлор-
фенил)-2,3-дигидро-1-Я-1,4-бензодиазепин-2-тиона D.2.2). Атом
серы в пол\ченном циклическом тиоамиде, в свою очередь, заме-
замещают взаимодействием с ацетилгидразидом с получением соответ-
соответствующего ацетилгидразона D.2.3), который при нагревании цикли-
з\ется в триазолам D.2.4) [15. 16, 17, 18, 19, 20].
-95-
NH2
,0 H2N-CH2-COOC2H5 HCI
— 1
a
42 1 (\ J
Cl
CH3CONHNH2
NH-C-CH3
250u
423
¦Cl
424
Триазолам — препарат, наиболее часто выписываемый пациентам
при бессоннице,
Однако h нему очень быстро может развиться пристрастие, а также
ряд других побочных эффектов: утренняя бессонница, беспокойство
в дневное время и прочее.
Синонимами препарата являются нормисон, ремстан, ресгорил
и др.
Темазепам (Temazepam)
Темазепам — 7-хлор-1,3-дигидро-3-гидрокси-1-метил-5-фенил-2//-
1,4-бензодиазепин-2-он D.2.7) получают из промежуточного про-
продукта синтеза оксазепама 7-хлор-5-фенил-1,3-дигидро-2//-1.4-
бензодиазепин-2-он-4-оксида E.1.17) путем метилирования амид-
ного атома азота в первом положении бензодиазепинового кольца
диметилсульфатом с получением 1-метил-7-хлор-5-фенил-1,3-дп-
гидро-2Я-1.4-бешодиазепин-2-он-4-оксида D.2.5), который далее
подвергают ацегоксилированию уксусным ангидридом с получени-
получением 1 -метил-3-ацетокси-7-хлор-5-фенил-1,3-дигидро-2//-1,4-беизоди-
азепин-2-она D.2.6). (При этом, очевидно, происходит превраще-
превращение, аналогичное реакции Полоновского.)
Щелочной гидролиз последнего соединения D.2.6), имеющий це-
целью снятие ацетильной группы, приводит к искомому темазепаму
D.2.7) [21, 22. 23.24. 25, 26].
-96-
Снотворные средства
5 1 17
СНз
(CH3OJSO2
425
(СН3СОJО
426
\ "
f—0-C-
СН3
NaOH
427
Гемазепам является умеренно эффективным гипнотиком. По окон-
окончании курса его приема иногда может вновь возникнуть бессонница.
Наиболее часто используемым синонимом препарата является гал-
цион.
Флуразепам (Flurazepam)
Флуразепам — 7-хлор-1-[2-(диэтиламино)этил]-5-B'-фторфенил)-
1,3-дигидро-2//-1,4-бензодиазепин-2-он D.2.14) предложено полу-
получать многостадийным синтезом исходя из 2-амино-5-хлор-2'-
фторбензофеноиа. Взаимодействием последнего с хлорангидридом
бромуксусной кислоты получают 2-(бромацетил)амино-5-хлор-2'-
фторбензофенон D.2.8), реакцией которого с диэтиламином полу-
получают 2-(диэтиламиноацетил)амино-5-хлор-2'-фторбензофенон D.2.9).
Восстановлением обеих карбонильных групп в последнем алюмо-
гидридом лития получают 2-B'-диэтиламино)этиламино-5-хлор-2'-
фторбензгидрол D.2.10). Аминогруппу последнего ацилируют хло-
хлорангидридом фталимидоуксусной кислоты с получением фталими-
допроизводного D.2.11). Снятием защитной фталимидной группы
гидразингидратом получают 2-B'-диэтиламино)этиламиноацетил)-
амино-5-хлор-2'-фторбензгидрол D.2.12). Обработка последнего
бромистоводородной кислотой приводит к внутримолекулярной де-
дегидратации с замыканием в семичленный бензодиазепиновый цикл
7-хлор-1-[2-(диэтиламино)этил]-5-B'-фторфенил)-1,3,4.5-тетрагидро-
2//-1.4-бензодиазепин-2-он D.2.13). Наконец, окислением N4-C5 свя-
-97-
зи последнего 2,3-дихлор-5,6-дициано-1,4-бензохиноном получают
искомый флуразепам D.2.14) [27, 28, 29, 30].
1?
8г-СН2-с-С|
С!-С-СН2 — N Т|
CH2-N(C2H5J
CH2
¦CO-CH2 —
CH2-N(C-H5/2
9Н:
-N—CO-Ch2-NH2
HBr
Флуразепам наиболее хорошо изученный гипнотик. Используется
при трудностях со сном или засыпанием, частых или ранних просыпа-
просыпаниях. Побочные эффекты наблюдаются редко.
Наиболее распространенными синонимами являются далмадорм,
далман, валдорм, фелисон и др.
4.3. Прочие гипнотики и седативные препараты
Еще до появления класса бензодиазепинов ряд эмпирически най-
найденных соединений использовался в медицине в качестве гипнотиков.
Среди них хлоральгидрат. параальдегид, этхловинол, этинамат, глуте-
тимид. метиприлон.
-98-
Снотворные средства
Хлоральгидрат (Chloral Hydrate)
Хлоральгидрат — 2,2,2-трихлор-1,1-этандиол D.3.1) получают либо
хлорированием этанола, либо хлорированием ацетальдегида с по-
последующим присоединением к полученному трихлоруксусному
альдегиду молекулы воды [31].
о
СНз-С-Н
СН3-СН2-ОН)
сь
С13С—С-Н
Н2О
он
С13С-С-ОН
н
431
Седативно-гипнотическое действие хлоральгидрата очевидно сле-
следует объяснять образованием трихлоэтанола, получаемого в результате
его восстановления в тканях. Несмотря на то, что точный механизм дей-
действия хлоральгидрата неизвестен, препарат, очевидно, действует анало-
аналогично этанолу в ЦНС, т. е. повышая проницаемость мембран, что при-
приводит к седации или сну.
Хлоральгидрат может применяться при бессоннице как альтернати-
альтернатива бензодиазепинам.
Синонимами препарата являются аквахлораль, хлорадорм, хлора-
тол. ноктек и др.
Паральдегид (Paraldehyde)
Паральдегид — 2,4,6-триметил-1,3.5-триоксан D.3.2) является при-
примером ацетальдегида, который получают катализируемой кислота-
кислотами полимеризацией ацетальдегида при средних и высоких темпера-
температурах [32, 33].
НзС^О^СНз
CH3
432
Точный механизм действия паральдегида неизвестен, однако, наи-
наиболее вероятно, что действует он сам, а не продукты его биотрансфор-
машш. Показания к применению аналогичны хлоральгидрату.
Синонимами препарата являются эльдальдегид, параль и парааль-
дегид.
-99-
Глава 4
Этхлорвинол (Ethchlorvinol)
Этхлорвинол — 1-хлор-3-этил-1-пентен-4-ин-3-ол D.3.3) получают
конденсацией ацетилена с 1-хлор-1-пентен-3-оном в жидком ам-
аммиаке [34, 35].
С!-СН=СН-С-С2Н6
НС=СН
с=сн
СН=СН-С-С2Н5
433
он
Седативный гипнотик этхлорвинол имеет примерно ту же актив-
активность и токсичность, как и фенобарбитал, однако его гипнотический
эффект достигается и исчезает быстрее. По ряду причин при лечении
бессонницы используется значительно реже бензодиазепинов.
Синонимами препарата являются арвинол, ностел, плацидил и др.
Этинамат (Ethinamate)
Этинамат — карбамат 1-этинилциклогексанопа D.3.4) получают
конденсацией ацетилена с циклогексаноном и последующей транс-
трансформацией полученного карбинола в карбамат путем последова-
последовательного взаимодействия с фосгеном и далее с аммиаком [36, 37].
H2NCOO с=сн
HCSCH
434
Этинамат — гипнотик, который, однако, не имеет существенных
преимуществ по сравнению с барбитуратами и бензодиазепинами и при
лечении бессонницы используется значительно реже.
Синонимами препарата являются валамид. валмад, валамин и др.
Глутетимид (Glutethmide)
Глутетимид — 2-этил-2-фенилглутаримид D.3.6) получают присое-
присоединением (по Михаэлю) 2-фенилбутиронитрила к метнлакрилату
с последующим щелочным гидролизом нитрильной группы в со-
соединении D.3.5) в амидную и последующей кислотной циклизацией
продукта в искомый глутегимид D.3.6) [38, 39, 40. 41. 42].
100-
Снотворные средства
Н2С=СН-СООСН3
Глутетимид — гипнотическое и седативное средство, предназна-
предназначенное для лечения бессонницы. Гипнотический эффект примерно ана-
аналогичен таковому у пентобарбитала. Назначается пациентам, не перено-
переносящим барбитураты. Однако не имеет преимуществ перед
бензодиазепинами и поэтому применяется редко.
Синонимом препарата является дориден.
Метиприлон (Methyprylon)
Метиприлон — 3,3-ДИэтил-5-метил-2.4-пиперидиндион D.3.12)
синтезируют исходя из диэтилацетоуксусного эфира, взаимодейст-
взаимодействием которого с метилформиатом в присутствии натрия получают
4-оксиметилен-2,2-диэгилацетоуксусный эфир D.3.7). Реакцией
с аммиаком последний трансформируется в 4-амииометилен-2,2-
диэтилацетоуксусный эфир D.3.8). Обработкой полученного про-
продукта этилатом натрия осуществляют внутримолекулярное амиди-
рование — циклизацию в 3,3-диэтил-1,2,3,4-тетрагидропиридин-
2,4-дион D.3.9). Восстановлением двойной связи последнего водо-
водородом над палладиевым катализатором получают 3,3-диэтил-
пиперидин-2,4-дион D.3.10), который вновь подвергают формилиро-
ванию в 3.3-диэтил-5-гидроксиметилен-пиперидин-2,4-дион D.3.11)
взаимодействием с метилформиатом в присутствии натрия. Восста-
Восстановлением введенной гидроксиметиленной группы водорода в ме-
тильную группу получают искомый метилприлон D.3.12) [43, 44].
НСООСНз
н5с2
NH3
Na НСООСНя
-101 -
О г- и
Н2 ' Ranay-Ni
СН-
43 11
н
43 12
Как и все рассматриваемые в данной главе препараты, метиприлон
предназначен для лечения бессонницы. Фармакологические эффекты
метиприлона сходны с таковыми у барбитуратов. Однако с введением
в медицинскую практику бензодиазепинов преимущество стало отда-
отдаваться последним.
Синонимами препарата являются ноктар, нолудан и др.
Список литературы
2
3.
4.
5.
6.
7
8.
9.
10.
И,
12.
13.
14.
15.
16.
17.
18
19.
20.
21.
22.
23.
24.
Ger. Pat. 247.952A911).
US Pat. 2.358.072A944).
Chamberlain E. et al.//J. Am. Chem. Soc. 57, 352 A935).
Pinhey J, et al./Tetr. Lett. 21, 965 A980).
Ger. Pat. 537.366A929).
Halpern О et abJ. Am. Pharm. Assoc. 38, 352 A949).
SnyderH et al.,7J. Am. Chem. Soc. 75, 1881 A953).
Brit. Pat. 191.008A922).
US Pat. 1.856.792A932).
VolwilerE.nl. Am. Chem. Soc. 47, 2236 A925).
VolwilerE.'U. Am. Chem. Soc. 52, 1676 A930).
Ger. Pat. 293.163A915).
Brit. Pat. 650.354A948).
US Pat. 1.954.429A934).
Ger. Pat. 2.012.190A970).
US Pat. 3.701.782A972).
US Pat. 3.987.052A976).
US Pat. 3.422.091 A969).
Archer G. et al.//J. Org. Chem. 29, 231 A964).
Hester J, et al..' J. Med. Chem. JA 1078 A971).
Brit. Pat. 1.022.642A962).
Brit. Pat. 1.022.645A962).
Bell S. etal.'J. Org. Chem. 27. 1691 A962).
US Pat. 3.197.467A965).
-102-
Снотворные средства
25. US Pat. 3.340.253 A967).
26. US Pat. 3.374.225 A968).
27. US Pat. 3.567.710A971).
28. US Pat. 3.299.053A967).
29. Belg. Pat. 629.005A963).
30. Ina'ba S. et al./,J. Med. Chem. 8, 815 A965).
31. FavbrotherJ 'Anal Profiles Drag Subs. 2. 85 A973).
32. Kckule F. et al.//Ann. 162, 125 A872).
33. US Pat. 2.864.827A958).
34. US Pat. 2.746.900A956).
35. McLamore W. et al./.'J. Org. Chem. 20, 109 A955).
36 US Pat. 2.816.910A957)
37. Ger. Pat. 1.021.843A953).
38. Ger. Pat. 950.193A951).
39. US Pat. 2.673.205A951).
40. Tagmann A. et al./ZHelv. Chim. Acta. 35- 1541 A952).
41. Salmon-Legagneur R. et al. /Compt. Rend. 234, 1060 A952).
42. Salmon-Legagneur R. etab/Bull. Soc. Chim. France, 1953, 70.
43. US Pat. 2.680.116A954).
44. Ger. Pat. 930.206A953).
Глава 5
Анксиолитши
(транквилизаторы)
Многие заболевания сопровождаются беспокойством, тревожным
состоянием. При этом развивается синдром, характеризующийся ощу-
ощущениями беспомощности и безысходности, мрачными предчувствиями,
астенией. Он может сопровождаться головными болями, повышенным
потоотделением, тошнотой, тахикардией, сухостью во рту и т. д. Беспо-
Беспокойное состояние и тревога могут возникнуть как в результате невроти-
невротических причин, так и иметь соматопсихическую природу, связанную
с развитием патологий при таких заболеваниях, как болезни сердечно-
сердечнососудистой системы, новообразования, гипертония и заболевания ЖКТ.
Препараты, применяемые для устранения беспокойства, напряжения,
тревоги и страха и которые практически не снижают внимание, не дей-
действуют на психомоторную активность пациента, получили название
анксиолитиков или транквилизаторов. Большинство из них обладает
седативным и гипнотическим действием, и в высоких дозах их эффекты
во многом схожи с воздействием барбитуратов. Однако основное пре-
преимущество данной группы перед барбитуратами заключается в значи-
значительно большем значении величины соотношения седативный/гипно-
тический эффекты. Иными словами, соотношение между дозами,
снимающими напряжение, и дозами, вызывающими сон, у анксиолити-
анксиолитиков значительно больше, чем таковое у барбитуратов. Основное приме-
применение транквилизаторов заключается в облегчении таких эмоциональ-
эмоциональных симптомов, как возбуждение, беспокойство, тревога, мышечное
напряжение, повышенная двигательная активность, связанных с психо-
психоневротическими или психосоматическими нарушениями. В качестве
самостоятельных препаратов они мало приемлемы для купирования
острых психотических состояний и используются в этих случаях в соче-
-104-
Анксиолитики
тании с антипсихотическими средствами.
Применяемые в настоящее время анксиолитики в медицине делятся
на 2 группы:
1) бензодиазепины — диазепам, хлордиазепоксид, хлоразепат, га-
лазепам, лоразепам, мидазолам, алпразолам, оксазепам, празе-
пам;
2) прочие анксиолитики, или анксиолитики небензодиазепиновой
структуры, которые представлены мепробаматом, буспироном,
хлормезаноном и гидроксизином.
5.1. Бензодиазепины
До открытия класса бензодиазепинов основными препаратами для
коррекции психоэмоциональных расстройств использовались седатив-
ные и гипнотические препараты и, в частности, фенобарбитал или глу-
тетимид.
Весьма эффективными средствами для лечения невротических со-
состояний оказались бензодиазепины — большая группа соединений, пер-
первый представитель которых — хлордиазепоксид был синтезирован
в 1930-х годах и внедрен в медицинскую практику в конце 1950-х годов.
В последующем в медицинскую практику были внедрены более десятка
других производных бензодиазепинов. Все они проявляют почти сход-
сходную фармакологическую активность и терапевтическую эффективность,
отличаясь лишь количественными показателями.
Анксиолитический эффект бензодиазепинов специфичен и уника-
уникален и отличается от седативных и гипнотических препаратов других
классов.
Основными эффектами бензодиазепинов на ЦНС являются снятие
беспокойства, тревоги, седативный эффект, расслабление скелетной
мускулатуры и снотворное действие.
Они в меньшей степени, чем гипнотики и седативные средства, уг-
угнетают дыхательную систему и в меньшей степени вызывают зависи-
зависимость.
Некоторые представители препаратов ряда бензодиазепинов обла-
обладают несколько иным спектром применения. Флуразепам, триазолам
и темазепам используются в качестве снотворных средств, а карбамазе-
пин — в качестве противосудорожного.
Бензодиазепины с выраженным анксиолитическим действием и от-
отсутствием или слабо выраженным седативно-гипнотическим эффектом
называют дневными транквилизаторами (медазепам).
-105-
Глава 5
С химической точки зрения бензодиазепины формально делятся на
2 главные группы:
1) простые 1,4-бензодиазепины (хлордиазепоксид, диазепам, ло-
разепам);
2) гетероциклические 1,4-бензодиазепины (алпразолам, мидазо-
лам и др.).
Необходимым условием для проявления бензодиазепинами анксио-
литической активности является наличие электроотрицательной группы
в положении С7 бензодиазепиновой системы. Наличие фенильной груп-
группы в положении С5 системы также увеличивает фармакологическую
активность соединений.
Экспериментальные данные позволяют предположить, что меха-
механизм действия бензодиазепинов заключается в стимуляции оензодиазе-
пин-Г4МК-рецепторного комплекса. Следовательно, бензодиазепины,
как класс, потенцируют активность тормозных ГАМК-эргических сис-
систем мозга.
Хотя бензодиазепины непосредственно с ГАМК-рецепторами не
реагируют, возможно, что они связываются со специфическим рецепто-
рецептором на хлоридном ионофоре. Это бензодиазепин-рецепторное взаимо-
взаимодействие, очевидно, вызывает аллостерические изменения ГАМК-
рецепторов, что, в свою очередь, повышает ингибирующую активность
ГАМК, которая выражается увеличением потока хлорид ионов через
ГАМК-активированные ионные каналы.
Основное применение бензодиазепины нашли для симптоматиче-
симптоматического устранения чувства беспокойства, напряжения и раздражительно-
раздражительности, связанных с неврозами, неврозоподобными состояниями, депресси-
депрессией и психосоматическими расстройствами.
Бензодиазепины применяются для премедикации перед проведени-
проведением оперативных вмешательств с целью достижения атараксии пациента,
в качестве вспомогательных средств при лечении эпилепсии, при столб-
столбняке и других патологических состояниях, сопровождающихся гипер-
тон\сом скелетных мышц. Как уже было отмечено, некоторые бензо-
зиачепины применяются в качестве снотворных (флуразепам, триазолам
и гемазепам) и даже противосудорожных средств (карбамазепин).
Диазепам (Diazepam)
Диазепам — 7-хлор-1,3-Дигидро-1-метил-5-фенил-2#-1,4-бензодиа-
зепин-2-он E.1.2), с химической точки зрения является простейшим
из всего ряда рассматриваемых производных 1,4-бензодиазепин-2-
- 106 -
Анксиолитики
онов. Диазепам предложено получать различными способами, ис-
исходящими из 2-амино-5-хлорбензофенона. Первый способ заключа-
заключается в непосредственной циклоконденсации 2-амино-5-хлор-
бензофенона или 2-метиламино-5-хлорбензофенона с гидрохлори-
гидрохлоридом этилового эфира глицина. Амидный атом азота получаемого в
этом варианте 7-хлор-1,3-дигидро-5-фенил-2Я-1,4-бензодиазепин-2-
она E.1.1) метилируют диметилсульфатом, что приводит
к получению диазепама E.1.2).
CH2C 000445
сн3
Второй способ отличается от первого тем, что стадия метилирова-
метилирования азота ос> ществляется до реакции циклоконденсации. С этой целью
исходный 2-амино-5-хлор-бензофенон первоначально тозилируют п-
тол>олсульфохлоридом, и далее натриевую соль полученного тозилата
E.1.3) алкилируют диметилсульфатом. Полученный в результате реак-
реакции 2-(толуолсульфонил)метиламино-5-хлорбензофенон E.1.4) гидро-
лизуют в кислой среде до 2-метиламино-5-хлорбензофенона E.1.5), ко-
который подвергают циклоконденсации реакцией с гидрохлоридом
этилового эфира глицина и получением целевого диазепама E.1.2) [1, 2,
3,4, 5].
TosCI
NH-Tos
(CH3OJSO2
51 3
5 1 5
СН3
H2NCH2COOC2H5
-107-
При третьем способе синтеза исходят из 2-метиламино-5-хлор-
бензофенона E.1 5), который ацилируют хлорангидридом хлоруксусной
кислоты с образованием 2-\лорацетилметиламидо-5-хлорбешофенона
E.1.6). Взаимодействием последнего с уротропином замещают атом
хлора в хлорацетильной части молекулы с получением гексаметилен-
тетраминового производного — 2-аминоацетилметиламидо-5-хлорбен-
зофенона, при гидролизе которого этанольным раствором хлористого
водорода пол\чают диазепам E.1.2) [6, 7].
С1СОСг|2С1
51 5
1 lCH2NN4
2 HCi
5 1 6
Предложен и четвертый способ получения диазепама, исходящий
из 1-метил-3-фенил-5-хлор-2-аминометилиндола E.1.12), окислением
которого хромовым ангидридом получается диазепам. Синтез прово-
проводится исходя из 5-хлоранилина, действием на который азотистой кисло-
кислоты получают диазониевую соль E.1.7). Азосочетанием последней с а-бен-
зилацетоуксусным эфиром в щелочной среде получают 4-хлорфенил-
гидразон этилового эфира фенилпировиноградной кислоты E.1.8),
который в присутствии соляной кислоты по реакции Фишера трансфор-
трансформируется в этиловый эфир 5-хлор-3-фенилиндолил-2-карбоновой ки-
кислоты E.1.9). Алкилируя полученный индол по атому азота диметил-
сульфатом. получают этиловый эфир 1-метил-5-хлор-3-фенилиндолил-
2-карбоновой кислоты E.1.10). Взаимодействием последнего с аммиа-
аммиаком получают соответствующий амид E.1.11), восстановлением которо-
которого алюмогидридом лития получают 1-метил-3-фенил-5-хлор-2-амино-
метилиндол E.1.12). Далее используют практически ценное свойство
хромового ангидрида размыкать индольное кольцо до соответствующе-
соответствующего производного аминобензофенона E.1.13), который в условиях реак-
реакции циклизуется в диазепам [8].
NaNO2 / HCi
¦N2 Cl
CH2-CH-COCH3
COOC2H5
5 1 7
-108-
д н к с политики
СЮ3
сн
5 1 13
Диазепам оказывает анксиолитическое, седативное, снотворное,
центральное миорелаксирующее, противосудорожное действие. Препа-
Препарат подавляет чувство страха, тревоги и напряжения. Его применяют
при нервном напряжении, возбуждении, беспокойстве, нарушениях сна,
нейровегетативных расстройствах, психоневрозах, навязчивых невро-
неврозах, истерических или ипохондрических реакциях, фобиях.
Наиболее часто применяемыми синонимами являются седуксен, ре-
ланиум, вали\м, сибазон, апаурин и многие другие.
Празепсш (Prazepam)
Празепам — 7-хлор-1-(циклопропилметил)-1.3-дигидро-5-фенил-
2#-1,4-бенздиазепин-2-он E,1.18) отличается от диазепама лишь
заместителем при атоме азота в первом положении диазепиновой
системы. Препарат получают по схеме синтеза, очень близкой схеме
синтеза диазепама E.1.2). При первом способе в качестве исходного
используют тот же 2-амино-5-хлорбензофенон, который подвергают
ацилированию хлорангидридом циклопропанкарбоновой кислоты.
Пол\ченный при этом 2-циклопропилкарбониламино-5-хлор-
-109-
Глава 5
бензофенон E.1.14) восстанавливают далее алюмогидридом лития
в 2-циклопропилметиламино-5-хлорбензгидрол E.1.15), и далее по-
полученный продукт вновь окисляют двуокисью марганца в 2-цикло-
пропилметиламино-5-хлорбензофенон E.1.16). Последний ацили-
руют хлорангидридом фтали.мидоуксусной кислоты. Фталимидную
зашит\ в полученном продукте E.1.17) удаляют обработкой гидра-
гидразином, в ходе чего в условиях синтеза происходит внутримолеку-
внутримолекулярная реакция иминообразования, приводящая к получению иско-
искомого празепама E.1.18) [9, 10].
Согласно второй способу синтеза, более простому, исходят из 7-
хлор-5-фенил-2.3-дигидро-1//-1,4-бензодиазепин-2-она E.1.1), который
алкилируют циклопропил-метилбромидом в присутствии амида натрия
в празепам E.1.11) [11, 12].
Br-CH2-<J
51 1
5 1.18 к //
Фармакологические свойства препарата практически повторяют
свойства диазепама, отличаясь лишь большей продолжительностью
действия. Препарат применяют по тем же показаниям, что и диазепам.
¦110-
Анксиолитики
Наиболее распространенным синонимом празепама является цен-
тракс.
Галазепам (Halazepam)
Гатазепам — 7-хлор-1-B',2',2!-трифтор-1-этил)-1,3-дигидро-5-
фенил-2//-1.4-бензодиазепин-2-он E.1.19) также отличается от диа-
диазепама заместителем при атоме азота в первом положении бензо-
диазепиновой системы, который в данном случае представлен
2',2',2'-трифторэтильной группой и может быть получен по любой
из приведенных выше схем [13, 14].
Фармакологические свойства последнего практически повторяют
свойства диазепама, отличаясь меньшей продолжительностью действия.
В основном применяют при беспокойных состояниях.
Наиболее распространенным синонимом является паксипам.
Хлордиазепоксид (Chlordiazepoxid)
Хлордиазепоксид — 7-хлор-2-метиламино-5-фенил-3#-1,4-бензо-
диазепин-4-оксид E.1.22) синтезируют также исходя из 2-амино-
5-хлорбензофенона. Обычным путем — взаимодействием с гидро-
ксиламином получают оксим 2-амино-5-хлорбензофенона E.1.20),
который под действием хлорангидрида хлоруксусной кислоты
в уксусной кислоте легко циклизуется в 6-хлор-2-хлорметил-4-
фенилхиназолин-3-оксид E.1.21). Взаимодействие последнего с
первичными аминами и, в частности, с метиламином приводит
к интересной перегруппировке (с расширением цикла), и продук-
продуктом реакции оказывается 7-хлор-2-метиламино-5-фенил-ЗЯ-1,4-
бензодиазепин-4-оксид E.1.22) — хлордиазепоксид. Аналогичная
перегруппировка с расширением цикла протекает и под действи-
действием щелочей и алкоголятов, однако необходимо отметить, что
с диалкиламинами реакция протекает с образованием ожидаемых
-111 -
Глава 5
продуктов замещения 2-диалкиламинометильных производных
6-хлор-4-фенилхиназолин-3-оксида.
Хлордиазепоксид был первым представителем анксиолитиков бен-
зодиазепинового ряда внедренным в медицинскую практику [15, 16, 17].
NH2Ori
CICH2COC1
NHCH-?
5 1 22
Хлордиазепоксид применяют при лечении невротических состоя-
состояний для уменьшения чувства страха, тревоги, напряженности. Он ока-
оказывает успокаивающее действие на ЦНС, вызывает мышечную релакса-
релаксацию, обладает противосудорожной активностью. Часто применяется
после операционных вмешательств.
Наиболее часто применяемыми синонимами являются элениум
и либриум.
Оксазепам (Oxazepam)
Оксазепам — 7-хлор-1,3-дигидро-3-гидрокси-5-фенил-2/У-бен-
зодиазепин-2-он E.1.25) получают вышеописанным способом,
открытым при синтезе хлордиазепоксида, но с применением в ка-
качестве нуклеофила не первичного амина, а простого неорганиче-
неорганического основания. С этой целью 6-хлор-2-хлорметил-4-фенил-
хиназолин-3-оксид E.1.21) подвергают обработке гидроксидом
натрия с получением 7-хлор-5-фенил-1.2-дигидро-ЗЯ-1.4-бензо-
диазепин-2-он-4-оксида E.1.23). Последний подвергают весьма
любопытной реакции — аиетоксилированию ангидридом уксус-
уксусной кислоты по третьему положению бензодиазепинрвого кольца,
напоминающей реакцию Полоновского с получением 7-хлор-1.3-
дигидро-3-ацетокси-5-фенил-2Я-бензодиазепин-2-она E.1.24). По-
Последу ющим гидролизом ацетильной гр> ппы продукта ползают ок-
- 112-
Анксиолитики
сазепам E.1.25I18. 19, 20,21,24].
i 1 21
NaOH
5 123 LJ
NaOH
5 1 25
Оксазепам по своим фармакологическим свойствам сходен с хло-
диазепоксидом и диазепамом, однако оказывает несколько менее резкое
действие, менее токсичен и проявляет менее выраженный миорелак-
сантный эффект. Часто переносится лучше других транквилизаторов.
Препарат применяют при неврозах, состояниях беспокойства, страха,
напряженности, нарушениях процесса засыпания, психовегетативных
расстройствах.
Наиболее распространенными синонимами являются нозепам и та-
зепам.
Лоразепам (Lorazepam)
Лоразепам — 7-хлор-5-(о-хлорфенил)-1,3-дигидро-3-гидрокси-
2Я-1,4-бензодиазепин-2-он E.1.31) синтезируют по схеме, вклю-
включающей элементы синтеза как хлордиазепоксида, так и оксазепа-
ма, исходя из 2-амино-2',5-дихлорбензофенона. Взаимодействием
последнего с гидроксиламином получают оксим E.1.26), вводя
который в реакцию, с хлорангидридом хлоруксусной кислоты,
в результате гетероциклизации получают 6-хлор-2-хлорметил-4-
B -хлорфенил)хиназолин-3-оксид E.1.27). Реакция последнего
с метиламином, как и в случае с хлордиазепоксидом, приводит
к перегруппировке с расширением цикла с образованием 7-хлор-
2-метиламино-5-B'-хлорфенил)-ЗЯ-1,4-бензодиазепин-4-оксида
E.1.28). Полученный бензодиазепин-4-оксид подвергают ацили-
-113-
Глава
рованию ангидридом укс\сной кислоты по вторичному атому азота
и далее гидролизуют соляной кислотой в 7-\лор-5-B'-\лорфенил)-
1,2-дигидро-ЗЯ-1,4-бензодиазепин-2-он-4-оксид E.1.29). При взаи-
взаимодействии последнего с >ксусным ангидридом происходит реак-
реакция типа перегруппировки Полоновского с получением 3-ацето-
ксилированного бензодиазепина — 7-хлор-1,3-дигидро-3-ацетокси-
5-B'-\лорфенил)-2Я-бензодиазепин-2-она E.1.30), продуктом гид-
гидролиза которого и является лоразепам E.1.31) [18, 25, 26, 27, 28, 29].
nh2oh
CICH2COCI
,NHCH3
(СН3СОJО
2 HCI
ОСОСНз
.N NaOH
Ci
Показания к применению такие же, как и у других транквилизато-
транквилизаторов, а также используется при кардионеврозе, для предоперационной
премедикации и в качестве вспомогательного средства при эндоскопи-
эндоскопических процедурах. Отличается несколько меньшей продолжительно-
продолжительностью действия.
Наиболее распространенными синонимами являются ативан и та-
вор.
Хлоразепат (Clorazepate)
Хлоразепат — 7-хлор-2,3-дигидро-2,2-дигидрокси-5-фенил-1Я-1,4-
бензодиазепин-3-карбоновая кислота E.1 34), применяемая в виде
-114-
Анксиолитики
дикалиевой соли, получается по еще одной, представляющей само-
самостоятельный интерес, схеме синтеза. В качестве исходного соеди-
соединения используется 2-амино-5-хлорбензонитрил, который взаимо-
взаимодействием с фенилмагнийбромидом переводится в имин 2-амино-5-
хлорбензофенона E.1.32). Реакцией последнего с аминомалоновым
эфиром получают продукт гетероциклизации — 7-хлор-1,3-дигид-
ро-3-карбэтокси-5-фенил-2Я-бензодиазепин-2-он E.1.33), при гид-
гидролизе сложноэфирной группы которого спиртовым раствором гид-
роксида калия получается дикалиевая соль E.1 34) — хлоразепат
[30,31,32]
хс
ОС2Н5
COOC2H5
КОН
н 9K
4oh
)—COOK
Препарат относится к гранквилизаторам длительного действия
и применяется по всем показаниям, по которым применяются другие
транквилизаторы, а также в качестве вспомогательного средства при
эпилептических припадках.
Наиболее распространенными синонимами являются транксен, нок-
фан и др
Ллпраюлам (Alprazolam)
Алпразолам — 8-хлор-1-метил-6-фенил-4//-5-триазоло[4.3-а][1,4]бен-
юдназепин E.1 39) является химическим аналогом триазолама
D 2 4) и отличается от него отсутствием атома хлора в о-положении
6-фенильного кольца. Для его синтеза может быть применена
и применяется такая же схема синтеза, как и для синтеза триазола-
триазолама. но исходят из 2-амино-5-хлорбензофенона [33, 34, 35]. Однако
- 115-
Глава 5
предложен и нестандартный подход для получения алпразолама,
исходящий из 2,6-дихлор-4-фенилхинолина, взаимодействием кото-
которого с гидразином получают 6-хлор-2-гидразино-4-фенилхинолин
E.1.35). Кипячение последнего с ортоуксусным эфиром в ксилоле
приводит к гетероциклизации в производное триазола E.1 36). По-
Полученный продукт подвергают окислительному расщеплению с ис-
использованием перйодата натрия и диоксида рутения в системе аце-
ацетон-вода с получением 2-[4-C '-метил- 1,2,4-триазоло)]-5-хлорбензо-
фенона E.1.37). Оксиметилированием последнего формальдегидом
и последующим замещением полученной при этом гидроксильной
группы трехбромистым фосфором дает 2-[4-C'-метил-5'-бромме-
тил-1,2,4-триазоло)]-5-хлорбензофенон E.1.38). Замещением атома
брома на аминогруппу аммиаком и следующей за этой реакцией
спонтанной внутримолекулярной гетероциклизации получают
алпразолам E.1.39) [36, 37, 38].
NH2NH2
СН3
5 1 37
СН2Вг
.О NH3
5 1 38
СН3
5 1 39 / jl
Алпразолам является транквилизатором короткого действия, кото-
который применяют при беспокойных состояниях, панических расстрой-
расстройствах, депрессивном синдроме.
Наиболее распространенным синонимом препарата является кса-
накс.
Как уже было отмечено, среди производных бензодиазепинов най-
найдены препараты с выраженным анксиолнтическим действием и отсутст-
отсутствующим или слабо выраженным седативно-гипнотическим эффектом,
которые были названы дневными транквилизаторами. Представителем
-116-
Анксиолитики
дневных транквилизаторов является медазепам — препарат, отличаю-
отличающийся от диазепама лишь отсутствием карбонильной группы в семи-
членном азепиновом кольце.
Медазепам (Medazepam)
Медазепам — 7-хлор-2,3-дигидро-1-метил-5-фенил-1Я-1,4-бензодиа-
зепин E.1.40) предложено получать разными способами. Первый
способ заключается в восстановлении карбонильной группы в са-
самом диазепаме E.1.2) алюмогидридом лития [39, 40].
51 2
СНз
СНз
LiAIH4
i 1 40
Второй способ получения медазепама заключается в первоначаль-
первоначальном восстановлении алюмогидридом лития карбонильной группы в 7-
хлор-5-фенил-2,3-дигидро-1Я-1,4-бензодиазепин-2-оне E.1.1) — первом
промежуточном продукте при синтезе диазепама, получаемом при цик-
локонденсации 2-амино-5-хлорбензофенона с этиловым эфиром глици-
глицина до 7-хлор-2,3-дигидро-5-фенил-1Я-1,4-бензодиазепина E.1.41) и даль-
дальнейшем метилировании вторичного аминного атома азота последнего
метилйодидом, используя в качестве основания гидрид натрия [41, 42].
51 1
L1AIH4
1 NaH
2 CH3I
Третий способ получения медазепама заключается в новом способе
получения 7-хлор-2,3-Дигидро-5-фенил-1Я-1,4-бензодиазепина E.1.41),
заключающемся в гетероциклизации, происходящей при взаимодейст-
взаимодействии 1-B,5-дихлорфенил)-1-фенилимина с этилендиамином. Исходный
- 117-
Глава 5
1-B,5-дихлорфенил)-1-фенилимин E.1.42) получают взаимодействием
2,5-дихлорбензонитрила с фенилмагнийбромидом [43].
MgBr
5 1 42
5 1 41
5 1 40
Наконец, предложен четвертый способ получения медазепама ис-
исходя из 4-хлор->^-метил-анилина, который вводят во взаимодействие
с этиленимином в присутствии хлористого алюминия с получением
К-D-хлорфенил)-К-метилэтилендиамина E.1.43). Ацилируя последний
бензоил хлоридом получают соответствующий амид E.1.44), который
циклизуют в искомый медазепам E.1.40) с использованием хлорокиси
фосфора [44, 45].
Предложены и разные модификации описанных способов [46, 47].
Медазепам является дневным транквилизатором, оказывает анксио-
литическое, миорелаксирующее и противос>дорожное действие. Препа-
Препарат хстраняет ч>вство тревоги, восстанавливает эмоциональное спокой-
спокойствие и оказывает стабилизирующее воздействие на вегетативную
нервную систем). Медазепам применяют при неврозах, психопатии,
сопровождающейся возбуждением, напряженности, повышенной раз-
- 118-
Анксиолитики
дражительности. бессоннице, функциональных неврозах сердечно-
сердечнососудистой системы.
Синонимами препарата являются нобриум, транквиракс, азепамид
и др
5.2. Анксиолитики небензодиазепиновой
структуры
Мепробсшат (Meprobamate)
Мепробамаг — дикарбамат 2-метил-2-пропил-1,3-пропандиола
(~>,2.2) получают взаимодействием 2-метилвалерианового альдегида
с дв\мя молекулами формальдегида и дальнейшей трансформацией
полученного 2-метил-2-пропилпропан-1,3-диола E.2.1) в дикарба-
дикарбамат п\тем последовательных реакций с фосгеном и аммиаком [48,
49. 50].
с3н7-сч-сно
сэн7-с-сн2-он
СН2-ОН
521
СН3
C3H7-C-CH2-OCONH2
CH2-OCONH2
522
Мепробамат был предложен до введения в .медицинскую практику
бензодиазепинов. Точный механизм действия препарата неизвестен,
однако его эффекты на ЦНС больше похожи на эффекты барбитуратов,
чем бензодиазепинов, но с более коротким временем действия. После
введения в практику бензодиазепинов препарат стал использоваться
значительно реже Мепробамат применяется при лечении беспокойных
состояний, связанных с ежедневными обычными бытовыми стрессами,
в основном, как анксиолитик дневного действия.
Синонимами препарата являются цирпон, экванил, стензол, мепрон,
милта\н. атраксин и др.
Буспирон (Buspirone)
Бчспирон — 8-[4-[4-B-пиримидинил)-1-пиперазинил]бутил]-8-аза-
спиро[4,5]декан-7,9-дион E.2.6) получают взаимодействием 1-B-
пиримндил)-4-D-аминобутил)пиперазинаE.2.4) с 8-оксаспиро[4,5]
декан-7,9-дионом E.2.5). В свою очередь. 1-B-пиримидил)-4-D-
аминобутил)пиперазин E.2.4) получают взаимодействием 1-B-пи-
рнмндил)пиперазина с 4-хлорбутиронитрилом с получением 4-B-
-119-
Глава 5
пиримидил)-1-C-цианопропил)пиперазина E.2.3), который вос-
восстанавливают водородом над никелем Ренея в E.2.4) [51, 52, 53,
54, 55].
' М N
N Н
CI(CH2KCN
/ \
N /
523
1
(CH2bCN
42 ' Re—Ni
& /}—N N—(CH2MNH2
> N] N /
/—\
\ /
М—СН2СН2СН2СН2 —N
Буспирон является весьма специфическим препаратом, который,
возможно, явится представителем нового химического класса анксиоли-
тиков — азаспиронов. Препарат проявляет равную бензодиазепинам
активность в качестве анксиолитика, однако лишен противос> дорожных
и мышечно-расслабляющих свойств, характерных для бензодиазепинов.
Кроме того, он не вызывает зависимости и привыкания.
Механизм его действия выявлен неокончательно. Он не воздейству-
воздействует на ГАМК-рецепторы, что имеет место при использовании бензодиа-
бензодиазепинов. однако имеет большое сродство к серотониновым E-НТ)
и умеренное сродство к дофаминовым (D2) рецепторам. Буспирон эф-
эффективен в качестве анксиолитика. Среди побочных реакций буспирона
встречаются головокружение, сонливость, головные боли, нервозность,
утомляемость, слабость. Препарат предназначен для лечения беспокой-
беспокойных состояний, при которых наблюдается напряжение, мышечные боли,
учащенное сердцебиение, головокружение, страх и т. п., то есть беспо-
беспокойных состояний несколько иного оттенка, чем бытовые, и не совсем
связанных с ежедневными обычными стрессами.
Синонимами препарата являются анизал, аксорен, буспар, буспи-
нен, б>спинол, нарол, травин и др.
Гидроксизин (Hydroxyzine)
Гидроксизин — 2-[2-[4-(л-хлор-а-фенилбензил)-1-пиперазинил]-
этокси]этанол E.2.6) получают алкилированием 1-D-хлорбензгид-
рил)пиперазина 2-B-гидроксиэтокси)этилх;юридом [56. 57, 58. 59,
60,61].
- 120-
Анксиолитики
N-H
I—СН2-СН2-О-СН2-СН2-ОН
CI—(/ V— СН—N N— СН2-СН2-О-СН2-СН2-ОН
5 2.6
Гидроксизин предназначен дня симптоматического лечения беспо-
беспокойства и напряжения, связанного как с неврозами, так и с органиче-
органическими болезненными состояниями. Препарат обладает мышечнорас-
слабляющим, антигистаминным и анальгетическим, местноанестези-
руюшим, противорвотным действием и имеет большую широту
терапевтического действия. Применяют, главным образом, при преме-
дикации и последующей обшей анестезии, в ходе которой препарат по-
тенцир>ет действие меперидина и барбитуратов. Препарат часто приме-
применяют в педиатрии в качестве мягкого седативного средства.
Синонимами препарата являются атаракс, агиракс, дурракс, виста-
рил и др.
Хюрмезапоп (Chlormezanone)
Хлормезанон — 2-(и-хлорфенил)тетрагидро-3-метил-4#-1,3-тиазин-
4-он 1,1-диоксид E.2.8) получают при совместной конденсации
меркаптопропионовой кислоты, метиламина и 4-хлорбензальдегида,
очевидно, через промежуточную стадию образования 4-хлорбен-
зилиденметиламина с получением аминотиоацеталя — 2-(и-хлор-
фенил)-тетрагидро-3-метил-4Я-1,3-тиазин-4-она E.2.7). Окисляя
перманганатом калия атом серы, получают хлормезанон E.2.8) [62,
63].
hS—CH2-Ch2-COGH
-121 -
Глава 5
Хлормезанон улучшает эмоциональное состояние хстраняя >ме-
>меренное беспокойство и напряжение пациента Однако препарат обладает
рядом побочных эффектов и поэтому, не имея особых преимуществ пе-
перед другими анксиолитиками, редко применяется на практике
Синонимами препарата являются транкопал, алинам, флексипирин
и др
Список литературы
1 SternbachL et al //J Org Chem 26 4936A961)
2 US Pat 3 109 843A963)
3 US Pat 3 371 085A968)
4 Gates M J Org Chem 45, 1675A980)
5 hhikura A/ et al //J Org Chem 47, 2456 A982)
6 Ger Pat 2 016 084A970)
7 Ger Pat 2 223 482A972)
8 YamamotoH etal /Chem Ber 101,4245A968)
9 US Pat 3 192 199A965)
10 Fr Pat 1 394 287A965)
11 US Pat 3 192 206A965)
12 InabaS Chem Pharm Bull П, 1263 A969)
13 Steutman M et al '/] Med Chem j_6, 1354 A973)
14 IS Pat 3 429 874A969)
15 US Pat 2 893 992A959)
16 Ger Pat 1 096 363A959)
17 SternbachL et al / J 6rg Chem 26, 1111 A961)
18 US Pat 3 176 009A965)
19 US Pat 3 296 249A967)
20 US Pat 3 109 843A963)
21 Belg Pat 629 227A967)
22 BellS etal 'J Org Chem 27,562A962)
23 BellS etal J Org Chem 27, 1691 A962)
24 BellS etal J Org Chem 33 216A968)
25 Belg Pat 621 819A963)
26 US Pat 3 296 249A967)
T Brit Pat 1 057 492A967)
28 Children 4 etal J Pharm Sci 53,577A964)
29 Children i etal 'J Med Chem П., 457A968)
^0 US Pat 3 516 988A970)
31 Ger Pat 1 518 764A965)
- 122-
AHКСПОЛИТИКИ
42 SchmmJ etal Chim Ther 4, 239 A969)
33 IS Pat 3 987 052A976)
34 Ger Pat 2 012 190A970)
35 Hester J etal /Tetrahedron Letters 1971, 1609
36 Walker 4 et a]//J Med Chem 20, 1694A977)
47 US Pat 3 709 898A972)
38 IS Pat 3 781 289A973)
39 StembachL etal J Org Chem 28, 2456 A963)
40 LSPat 3 109 843A963)
41 Belg Pat 620 773 A963)
42 IS Pat 3 131 П8A964)
43 Ger Pat 1 934 385A969)
44 Ger Pat 1 695 188A967)
45 Ger Pat 1 795 811 A967)
46 InabaS etal "Chem Pharm Bui 20, 1628A972)
47 Mihahc M et al III Heterocycl Chem 14, 941 A977)
48 US Pat 2 724 720A955)
49 Swiss Pat 373 026A963)
50 LudvugB etal/'J Am Chem Soc 73,5779A951)
51 Ger Pat 2 057 845A970)
52 US Pat 3 976 776A976)
53 LSPat 3 907 801 A975)
54 US Pat 3 717 634A973)
55 \\u } etal 'J Med Chem L5, 477 A9"?2)
56 US Pat 2 899 436A959)
57 Ger Pat 1 049 383 A954)
58 Ger Pat 1 061 786A954)
59 Ger Pat 1 068 262A954)
60 Ger Pat 1 072 624 A954)
61 Ger Pat 1 075 116A954)
62 Brit Pat 815 203A977)
63 Surrey A etal' J Am Chem Soc 80, 3469, 3471 A958)
Глава 6
Антипсихотики
(нейролептики)
Антипсихотики — препараты, обладающие определенным седатив-
ным эффектом, улучшающие насгроение и успокаивающие поведение
психотических больных, не вызывающие зависимость, были предложе-
предложены для лечения психотических расстройств (устранение симптоматики
психозов — бреда, галлюцинаций) или шизофренических пациентов.
Препараты этой группы часто называются также нейролептиками.
Раньше для них использовался также термин «большие транквилизато-
транквилизаторы» для того, чтобы отличить их от «малых транквилизаторов» — ан-
ксиолитиков
Эти препараты вызывают эмоциональное спокойствие и весьма эф-
эффективны для лечения пациентов с острыми и хроническими симпто-
симптомами. По с\ществ\, появление в медицинской практике этих препаратов
спасло бесчисленное множество пациентов от необходимости жизни
в закрытых стенах психиатрических клиник.
Первичными показаниями для антипсихотических средств являет-
является симптоматика при следующих расстройствах: шизофрения и ши-
зофреноподобные расстройства, бредовые (параноидные) состояния,
кратковременные психические расстройства, аффективные расстрой-
расстройства с психотической симптоматикой, психотические расстройства, раз-
развивающиеся вследствие основного соматического заболевания.
Должна быть проведена четкая грань между антипсихотиками, ис-
используемыми для лечения острых и хронических психозов, и анксиоли-
тиками. предназначенными для лечения беспокойства и напряжения,
связанного с психоневротическими или с психосоматическими рас-
расстройствами. Антипсихотические препараты обладают значительно бо-
более мощным воздействием на ЦНС, но не являются депрессантами ЦНС
и, как правило, более токсичны Однако даже при длительном примене-
применении они не вызывают зависимости и привыкания — весьма важной про-
проблемы, возникающей при длительном использовании анксиолитиков.
Антипсихотические препараты подразделяются на шесть химиче-
химических групп, а неклассифицируемые препараты рассматриваются как
прочие. Это препараты ряда.
-124-
Антипсихотики
1) фенотиазинов (хлорпромазин, промазин. трифлупромазин,
апегофеназин, флуфеназин, перфеназин. перхлорфеназин,
трифлуоперазин, мезоридазин, тиоридазин);
2) тиоксантенов (хлорпротиксен, тиотиксен);
3) б)тирофенонов (галоперидол, трифлуперидол, дроперидол,
флуанизон);
4) дигидроиндолонов(молиндон);
5) дибензоксазепинов (локсапин) и дибензодиазепинов (клоза-
пин);
6) дифенилбутилпиперидинов(пимозид, флуспирилен и пенфлу-
ридол);
7) прочие, которые включают сульпирид, препараты лития и не-
некоторые другие.
Следует иметь в виду, что, несмотря на наличие количественных
различий, несомненно имеющихся как в одной и той же группе анти-
антипсихотических средств, гак и в различных группах, существенных каче-
качественных различий между их фармакологическим действием нет, т. е.
при применении в терапевтически эквивалентных дозах их клиническая
эффективность практически одинакова. И выбор конкретного антипси-
хогического препарата в каждом конкретном случае в основном базиру-
базируйся на попытках минимизировать побочные эффекты (например, вы-
выбрать препарат с меньшим седативным эффектом для лиц. имеющих
дело с техникой, или препарат с меньшим гипотензивным эффектом для
пациентов в возрасте).
Специфическая этиология психотических расстройств в настоящее
время изучена недостаточно. Предполагается, однако, что первичной
причиной психотического поведения может быть возникновение дисба-
дисбаланса дофаминергических функций в ЦНС. Многие исследователи при-
придерживаются точки зрения, что именно увеличение дофаминовой ак-
активности в специфических областях ЦНС и является причиной
ненормального поведения
Механизм действия нейролептиков недостаточно ясен. Однако при-
принято считать, что они являются антагонистами дофамина и дофамино-
миметиков и их действие определенным образом связано с блокадой
дофаминовых D-рецепторов. что проявляется в виде изменений в пове-
поведенческих реакциях. Более того, не исключено их блокирующее влия-
влияние и на серотониновые рецепторы и М-холинорецепторы. Не исключе-
исключено также, что антипсихотические средства, по-видимому, нарушают
процесс высвобождения и обратного нейронального захвата ряда био-
биогенных аминов
- 125-
Глава 6
Кажется вероятным, что антипсихотические препараты, конкурент-
конкурентно связываясь с дофаминовыми рецепторами, блокируют действие до-
дофамина на соответствующих рецепторных участках, тем самым пони-
понижая психотическую активность. Центральные дофаминовые рецепторы
подразделяются на D,- и D2-, а согласно некоторым источникам, и D3-pe-
цепгоры. Эти рецепторы имеют высокое сродство к дофамину, но отли-
отличаются ч>вствительностью к нейролептикам различных химических
рядов. Например, препараты ряда фенотиазинов являются неселектив-
неселективными конкурентными D|- и Бг-антагонистами. В отличие от фенотиази-
фенотиазинов, антипсихотики ряда бутирофенона, такие как галоперидол, прояв-
проявляют селективное действие только на Dp-рецепторы.
Фармакологическое действие антипсихотических средств очень
сложно. Кроме способности изменять поведение эти препараты имеют
ряд др\гих центральных и периферических эффектов.
Антипсихотики, или нейролептики, применяются для воздействия
на пациента при острых и хронических психозах, как органической
природы, так и индуцированных. Эти препараты применяются для кон-
контроля маниакальной фазы при маниакально-депрессивных психозах —
для снятия беспокойства, страха, возбуждения, связанных с соматиче-
соматическими заболеваниями, для контроля агрессивности, тика и других не-
неадекватных состояний.
6.1. Производные фенотиазинов
Производные фенотиазина являются неселективными, конкурент-
конкурентными Dr и Б2-антагонистами и блокируют активность дофамина на
соответствующих рецепторных участках. Кроме того, их действие вы-
выражается блокадой и серотониновых рецепторов, и а-адренорецепторов,
и холинергических, никотиновых и мускариновых рецепторов.
Фенотиазины проявляют сложный фармакологический спектр дей-
действия и на центральную, и на периферическую нервную систему. Кроме
того они действ\ют на эндокринную систему.
Каждое соединение этого ряда в определенной степени отличается
от другого по своим качественным, но в основном по своим количест-
количественным показателям. Все они действуют на ЦНС, вызывая умеренный
седагивный и противорвотный эффект, действуют на процессы термо-
терморегуляции, скелетную м\ск\латуру, эндокринную систему, потенциру-
потенцируют действие анальгетиков.
В зависимости от типа замещения при атоме азота фенотиазинового
кольца эта грчппа препаратов подразделяется на три подгруппы и,
в частности, на подгруппы фенотиазинов с алифатической боковой це-
-126-
Антипсихотики
пью (хлорпромазин, промазин, трифлупромазин). а также производных
пиперазина (ацетофеназин, флуфеназин, перфеназин, перхлорфеназин,
трифлуоперазин) и пиперидина (мезоридазин, тиоридазин).
Препараты первой подгруппы (с алифатической боковой цепью)
наряд) с выраженным антипсихотическим действием отличаются спо-
способностью вызывать заторможенность, вялость, интеллектуальную за-
заторможенность. Седативное действие этих препаратов превосходит ак-
активность других препаратов фенотиазинового ряда.
Пиперазиновыч производным присуще наличие стимулирующего
компонента.
Препараты пипгридинового ряда обладают более слабой психоти-
психотической активностью, но не имеют седативной компоненты.
Фенотиазины с алифатической боковой цепью и с пиперидиновыми
заместителями имеют больший седативный эффект, чем пиперазиновые
производные.
Весьма существенное влияние на активность этих соединений ока-
оказывает природа заместителя во втором положении фенотиазинового
кольца, в качестве которого предпочтительнее иметь акцепторную
гр> ппу,
Фенотиазины имеют разнообразное применение в медицине. В ос-
основном они используются как антипсихотики. Несмотря на то, что они
не излечивают болезнь, они позволяют уменьшить психотические сим-
симптомы до такой степени, что могут обеспечить больному лучший кон-
контакт с реальностью. Иногда фенотиазины применяются для снятия ост-
острого беспокойства и, в частности, панических реакций вызванных
зависимостью к амфетаминам или диэтиламиду лизергиновой кислоты
(ЛСД). Фенотиазины применяются также для снятия поведенческих
проблем у детей, которые не поддаются лечению другими средствами.
Иногда фенотиазины применяются в предоперационный период, по-
поскольку снимают беспокойство, контролируют рвоту, икот) и понос,
а также вызывают мышечное расслабление.
Промазан (Promazine)
Промазин — 10-C-диметиламинопропил)фенотиазин F.1.1) полу-
получают алкилированием фенотиазина 3-диметиламинопропилхло-
ридом в присутствии амида натрия [1, 2, 3].
СН3
Ij * Ci—CH2-CH2~Ch2-N<
СН2-СН2-СЬ2-н(
СНз
-127-
Глава 6
В психиагрической практике промазин применяют при легких тече-
течениях психомоторного возбуждения \, больных шизофренией, при пара-
параноидных, маниакально-депрессивных состояниях, при неврозах, алко-
алкогольных психозах и др. Иногда применяют в анестезиологической
практике.
Наиболее распространенными синонимами являются кальмизан,
пропазин, талофен, спарин. протактил и др.
Хлорпромазин (Chlorpromazine)
Хлорпромазин — 2-хлор-10-C-диметиламинопропил)фенотиазин
F.1.2) получают по аналогичной схеме, но алкилированием 2-хлор-
фенотиазина 3-диметиламино-пропилхлоридом [4, 5, 6].
СНз
CH2-CH2-CH2-N\
612 СНз
В психиатрической практике хлорпромазин применяют при различ-
различных состояниях психомоторного возбуждения у больных шизофренией,
при хронических параноидных, а также маниакально-депрессивных со-
состояниях, при неврозах, алкогольных психозах и неврозах, сопровож-
сопровождающихся возбуждением, страхом, напряжением, бессонницей. Осо-
Особенностью хлорпромазина, в сравнении с другими нейролептиками,
является выраженный седативный эффект. Иногда применяют в анесте-
анестезиологической практике для потенцирования наркоза. Препарат облада-
обладает также умеренным противовоспалительным действием.
Наиболее распространенными синонимами являются аминазин, ме-
гафен, ларгактил, торазин, промпар и др.
Трифлупромазин (Triflupromazine)
Трифлупромазин — 2-трифторметил-10-C-диметиламино пропил )-
фенотиазин F.1.3) также получают алкилированием 2-трифтор-
метилфенотиазина 3-диметиламино-пропилхлоридом в присутствии
амида натрия [7, 8, 9, 10, 11, 12].
cf3
СНз
Ch2-Ch2-CH2-N(
6 1 3 С|Ч3
- 128-
Антипсихотики
В психиатрической практике трифлупромазин применяют при пси-
психомоторных возбуждениях у больных шизофренией, параноидных со-
состояниях, маниакально-депрессивных состояниях, при неврозах.
Наиболее распространенным синонимом является весприн.
Прохлорперазин (Prochlorperazine)
Прохлорперазин — 2-хлор-10-[3-D-метил-1-пиперазинил)пропил]-
фенотиазин F.1.4) получают алкилированием 2-хлорметилфено-
тиазина D-метил-1-пиперазинил)пропил-3-хлоридом в присутствии
амида натрия или 2-хлор-10-[C-хлорпропил)]фенотиазина 1-метил-
пиперазином [13, 14, 15, 16].
СН2-СН2-СН2— N N-CH3
11 4
Подобно другим пиперазиновым производным фенотиазина про-
прохлорперазин ослабляет психотическую симптоматику и оказывает сти-
стимулирующее действие.
Наиболее распространенными синонимом является метеразин.
Трифлуоперазин (Trifluoperazine)
Трифлуоперазин — 2-трифторметил-10-[3-D-метил-1-пиперази-
нил)пропил]-фенотиазин F.1.5) синтезируют вышеописанным спо-
способом, алкилируя 2-трифторметилфенотиазин 4-метил-1-пиперази-
нилпропилхлоридом [11, 17, 18, 19,20].
СН2-СН2-СН2— N
61 5
N-Cri3
Трифлуоперазин является одним из наиболее активных антипсихо-
антипсихотических препаратов. Нейролептическому эффекту сопутствует уме-
умеренный стимулирующий эффект. Особенностью трифл>операзина явля-
- 129-
Глава 6
ется то, чго больные вместо обычной скованности и слабости, характер-
характерной при применении других производных фенотиазина, становятся бо-
более оживленными. Препарат обладает сильным противорвотным дейст-
действием. Его широко применяют в психиатрии для лечения шизофрении и
других психических заболеваний.
Наиболее распространенными синонимами являются мобадид,
трифтазин, стелазин и кальмазин и др.
Флуфеназин (Fluphenazine)
Флуфеназин — 4-[3-[2-(трифторметил)фенотиазин-10-ил]пропил]-
1-пиперазиноэтанол F.1.8) получают любым из вышеописанных
способов [21. 22, 23, 24, 25, 26, 27]. Алкилируя 2-трифторметилфе-
нотиазин 4-формил-1-пиперазинилпропилхлоридом в присутствии
амида натрия, синтезируют 2-трифторметил-10-[3-D-формил-1-пи-
перазинил)пропил]фенотиазин F.1.6). Далее щелочным гидролизом
удаляют N-формильную группу, получая 2-трифторметил-10-[3-A-
ииперазинил)пропил]фенотиазин F.1.7). Последний алкилируют
ацетатом 2-бромэтанола-1, и дачее кислотным гидролизом снимают
защиттю ацетильную фуппу, пол}чая флуфеназин F.1.8) [27, 28].
СН2-СНг-СН2—N N-ChO
6 1 6
1 вг-сн2-сн2-ососн3
2 Н*
СН2-СН2-СН2—N N-H
61 7
CF3
CH2-CH2-CH2—Nv /J-CH2-CH2-OH
61 8
Флуфеназин является весьма сильным антипсихотическим препара-
препаратом. Нейролептическому эффекту сопутствует и стимулирующий эф-
эффект. Препарат обладает противорвотным действием. Его применяют
в психиатрии для лечения различных форм шизофрении и других пси-
психических заболеваний.
Наиболее распространенными синонимами являются фторфеназин,
модитен, дапотчм, мотивал. пермитил и др.
- 130-
Антипсихотики
Тиоридазин (Thioridazine)
Тиоридазин — 10-[2-( 1 -метил-2-пиперидил)этил]-2-(метилтио)фено-
тиазин F.1.9) синтезируют по аналогичной схеме, алкилируя 2-ме-
тилтиофенотиазин 2-B-хлорэтил)-1-метилпиперидином [29, 30].
CH3S
о.
NaNH2
N СН2СН2С1
СН3
CH3S
По антипсихотической активности тиоридазин уступает аминазину.
Он наиболее эффективен при психических и эмоциональных расстрой-
расстройствах, сопровождающихся страхом, напряжением и возбуждением.
Препарат назначают при различных видах шизофрении, психозах, нев-
неврозах.
Наиболее распространенными синонимами являются сонапакс
и меллерил.
Мезоридазин (Mesoridazine)
Мезоридазин — 10-[2-A-метил-2-пиперидил)этил]-2-(метилсульфи-
нил)фенотиазин F.1.13) также синтезируют по аналогичной схеме,
однако алкилируя окисленную форму 2-метилтиофенотиазина 2-ме-
тилсульфонилфенотиазин 2-B-хлорэтил)-1-метилпиперидином.
С этой целью 2-метилтиофенотиазин первоначально ацилируют ук-
с\сным ангидридом по атому азота с получением 10-ацетил-2-метил-
тиофенотиазина F.1.10). Полученное ацетильное производное датее
окисляют пероксидом водорода в 10-ацетил-2-метилсульфонилфеноти-
а^ин F 1.11). Деацилированием последнего метанольным раствором
поташа получают 2-метилсульфонилфенотиазин F.1.12), который и ал-
килир}ют 2-B-хлорэтил)-1-метилпиперидином в присутствии амида
натрия с получением искомого мезоридазина F.1.13) [31].
<CH-,C0>20
O3S0
-131-
Глава 6
CH3SO'
N CH2CH2Ci
СНз
NaNH,
CH3SO'
Мезоридазин действует аналогично другим фенотиазиновым ней-
нейролептикам и показан при шизофрении, при возникновении поведенче-
поведенческих проблем, при психоневротических проявлениях, при остром и хро-
хроническом алкоголизме.
Синонимами препарата являются лиданил, серенгил и др.
6.2. Производные тиоксантенов
Структурно тиоксантены отличаются от фенотиазинов тем, что
в центральном кольце трициклическои системы атом азота замещен на
углеродный, соединенный с боковой цепью двойной связью. Их фарма-
фармакологическое действие практически сходно с соответствующими фено-
тиазиновыми аналогами. Они имеют тот же механизм действия и анало-
аналогичное влияние на ЦНС. Препараты этого ряда отличаются др>г от
друга количественными показателями.
Хлорпротиксен (Chlorprothixene)
Хлорпротиксен — 2-хлор-9-[A-диметиламино)-3-пропилиден]тио-
ксантен F.2,7) предложено получать исходя из 2-хлортиокхантона
F.2.3). Исходный 2-хлортиоксантон F.2.3) синтезируют исходя из 2-
меркаптобензойной кислоты, взаимодействием которой с 1-бром-4-
хлорбензолом получают 2-D-хлорфенилтио)бензойную кислоту F.2.1),
которую реакцией с пятихлористым фосфором переводят в хлоран-
гидрид F.2.2) и далее с использованием треххлористого алюминия
циклизуют в 2-хлортиоксантон F.2.3) [32]. Альтернативным спосо-
способом получения 2-хлортиоксантона F.2.3) является получение 2-D-
хлорфенилтио)бензойной кислоты F.2.1) взаимодействием 2-йодбен-
зойной кислоты с 4-хлортиофенолом [33]. Полученный 2-хлортио-
2-хлортиоксантон F.2 3) в качестве карбонильного компонента вводят во взаи-
взаимодействие в реакции либо с 3-диметиламинопропилмагнийбромн-
дом [33], либо с аллилмагнийбромидом [34, 35, 36] с получением
соответствующих третичных спиртов F.2.4 или 6.2.5). Дегидратация
первого осуществляется путем ацилирования третичной гидро-
ксильной группы хлорангидридом уксусной кислоты и последую-
- 132 -
Антипсихотики
щим пиролизом образовавшегося ацетата, приводя к искомому
хлорпротиксену F.2.7).
Дегидратация третичного спирта F.2.5) осуществляется в условиях
хлорирования третичной спиртовой группы хлористым тионилом с об-
образованием диена — 2-хлор-9-C-пропен-1-илиден)тиоксантена F.2.6),
присоединение к которому диметиламина при высокой температуре
приводит к получению искомого хлорпротиксена F.2.7).
Н3С 'СНз \ 1 СНзСОС!
2 1°
V
SOCI2
626
-133-
Глава 6
Хлорпротиксен обладает антипсихотическим и седативным дейст-
действием, выраженной противорвотной активностью. Применяют при раз-
различных психозах, шизофрении, реактивных и невротических депресси-
депрессиях с преобладающей тревожной симптоматикой, состояниях возбуж-
возбуждения, связанных со страхом и напряжением. В малых дозах может
применяться как успокаивающее средство при неврозах.
Синонимами хлорпротиксена являются клотиксен и тарасан.
Тиотиксен (Thiothixene)
Гиотиксен — К,^'-диметил-9-[3-D-метил-1-пиперазинил)пропилиден]
тиоксантен-2-сульфонамид F.2.14) синтезируют исходя из 9Я-тио-
ксантена. взаимодействием которого с хлорсульфоновой кислотой по-
получают 9Я-тиоксантен-2-сульфоновую кислоту F.2.8). Последнюю
трансформируют в 2-диметштаминосульфонил-9Я-тиоксантен F.2,9)
путем последовательных реакций с хлористым тионилом и диметила-
мином. Взаимодействием 2-диметиламиносульфонил-9Я-тиоксантена
F.2.У) с бутиллитием и далее с метилацетатом получают 9-ацетил-2-
диметиламиноеульфонил-9Я-тиоксантен F.2.10). Аминометилирова-
нием последнего диметиламином получают 9-B-диметиламинопропи-
ониил)-2-диметиламиносульфонил-9Я-тиоксантен F.2.11). Взаимодей-
Взаимодействием последнего с 1-N-метилпиперазином осуществляют замену
диметиламинной группы в ацильном фрагменте молекулы на N-метил-
шшеразиновую с получением продукта F.2.12). Карбонильную группу
последнего восстанавливают в спиртовую с помощью боргидрида на-
натрия, и далее осу ществляют дегидратацию продукта F.2.13) в искомый
тиотиксен F.2.14) с помощью хлорокиси фосфора [37, 38, 39,40].
5O2N(Ch3)z
- 134 -
Антипсихотики
POCI3
SO2N(CH3J
6 2 14
Препарат проявляет определенное химическое и фармакологиче-
фармакологическое сходство с пиперазиновыми производными фенотиазинового ряда
и применяется при лечении психотических расстройств.
Показания к применению тиотиксена те же, что и для применения
хлорпротиксена.
Синонимами препарата являются орбинамон, наван и др.
6.3. Производные бутирофенонов
Ряд различных соединениях пиперидинового и пиперазинового ря-
рядов замещенных по атому азота и-фторбутирофенониой группой прояв-
проявляют значительную нейролептическую активность (галоперидол, триф-
iy перидол, дроперидол, меторин).
Интерес к производным бутирофенона как в качестве антипсихоти-
антипсихотических средств, так и в анестезиологии весьма значителен. Они прояв-
проявляют фармакологические эффекты и механизм действия, весьма сход-
сходные с фенотиазинами и тиоксантенами, т. е. блокируют дофаминер-
гические рецепторы. Однако они являются более селективными по
отношению к Бгрецепторам.
Трифлуперидол (Trifluperidol)
Трифлуперидол — 4-[4-(а,а,а-трифтор-,и-толил)-4-гидроксипипе-
ридино]-4'-фтор-бутирофенон F.3.3) получают взаимодействием
1-бензил-4-пиперидона C.1.48) с реактивом Гриньяра, приготов-
приготовленным из 1-трифторметил-З-бромбензола и магния, в результате
чего получают 1-бензил-4-гидрокси-4-C~трифторметилфенил)пи-
перидин F.3.1), восстановлением которого водородом в присутст-
присутствии в качестве катализатора палладия на угле снимают бензильную
защиту с получением 4-гидрокси-4-C-трифторметилфенил)пипери-
-135-
Глава 6
дина F.3.2). Алкилированием атома азота последнего со-хлор-4-
фторбутирофенопом получают трифлуперидол F.3.3) [41, 42].
¦CF3
Необходимый для этого 4'-хлор-4-фтор-бутирофенон F.3.4) полу-
получают аиилированием фторбензола хлорангидридом 4-хлормасляной ки-
кислоты.
о
о—с-(Сн2K-С1
А1С|3
)—С -СН2 -СН2 -СН2 -С!
634
Трифлуперидол является мощным антипсихотическим препаратом.
Он усиливает действие снотворных, наркотиков, анальгетиков. Оказы-
Оказывает противосудорожное и противорвотное действие.
Препарат применяют при психозах, сопровождающихся моторным
и психическим возбуждением, при затяжных приступах периодической
шизофрении, при состояниях, сопровождающихся тяжелой депрессией
и бредом, при алкогольных психозах. По способности купировать ма-
маниакальное возбуждение превосходит другие нейролептики.
Синонимами препарата являются триперидол, психоперидол, три-
седил и др.
Галоперидол (Haloperidol)
Галоперидол — 4-[4-(я-хлорфенил)-4-гидроксипиперидино]-4'-
фторбутирофенон F.3.6) пол>чают алкилированием 4-D-хлорфе-
нил)-4-гидроксипиперидина F.3.7) 4'-хлор-4-фторб>тирофеноном
F.3.4). Синтез 4-D-хлорфенил)-4-гидроксипиперидина F.3.7) осу-
осуществляют исходя из 2-D-хлорфенил)пропена, взаимодействием
которого с формальдегидом и хлоридом аммония получают проме-
- 136-
Антипсихотики
жуточный 4-метил-4-D-хлорфенил)-1,3-оксазин F.3.5) очевидно
через стадии постулированные для протекания реакций типа реак-
реакции Принса. Обработка последнего соляной кислотой приводит к по-
ллчению 4-D-хлорфенил)-1,2,3,6-тетрагидропиридина F.3.6) оче-
очевидно через стадию раскрытия гидрированного 1,3-оксазинового
цикла, дегидратации и последующей рециклизациии. Присоедине-
Присоединение к двойной связи полученного 4-D-хлорфенил)-1,2,3,6-тетрагид-
ропиридина F.3.6) бромистого водорода и последующий щелочной
гидролиз образующегося при этом 4-D-хлорфенил)-4-бромпипери-
дина позволяют получить 4-D-хлорфенил)-4-гидроксипиперидин
F.3.7). взаимодействием которого с 4!-хлор-4-фторбутирофеноном
F.3.4) получают целевой галоперидол F.3.6) [41, 42, 43, 44, 45, 46].
CI
634
637
/==\ " f Ч/
F—d Л—С-СН2-СН2-СН2—N Y
^—' ^—' он
638
Галоперидол является одним из наиболее активных современных
нейролептиков. Его высокая антипсихотическая активность сочетается
с >меренным седативным эффектом. Препарат эффективно купирует
психомоторные возбуждения различного рода. Применяют при шизоф-
шизофренических психозах, маниакальных, параноидных бредовых состояни-
состояниях, при депрессиях, при психомоторных возбуждениях различного гене-
за. при бреде и галлюцинациях различного происхождения.
Наиболее распространенными синонимами являются галдол, веза-
ДОЛ, ЛИНТОН И Др.
Дронеридол (Droperidol)
Дроперидол — 1-[1-[3-(и-фторбензоил)пропил]-1,2,3,6-4-пиридил]-
2-беизимидазолинон F.3.11) синтезируют исходя из 1-бензил-З-карб-
этоксипиперидин-4-она C.1.47), который вводят во взаимодействие
-137-
Глава 6
с о-фенилендиамином. Очевидно, первоначально образующееся в
>словиях реакции производное 1,5-бензодиазепина перегруппиро-
перегруппировывается в 1-A -бензил-1,2,3.6-тетрагидро-4-пиридил)-2-бензимида-
золон F.3.9). Дебензилирование последнего водородом над палла-
диевым катализатором в 1-A,2,3,6-тетрагидро-4-пиридил)-2-бенз-
имидазолон F.3.10) и алкилированием последнего 4]-хлор-4-фтор-
бутирофеноном F.3.4) получают искомый дроперидол F.3.11) [47,
48,49].
соос2н5
-СН2—N
4NH2
^-\У~ w~H
Нейролептик дроперидол оказывает антипсихотическое, седатив-
ное, противошоковое, действие. Потенцирует действие средств для нар-
наркоза. В психиатрической практике дроперидол применяют при психо-
психомоторном возбуждении, галлюцинациях. Основное применение
препарат находит в анестезиологии для нейролептанальгезии в комби-
комбинации с фентанилом. Применяют как для премедикации, так и в процес-
процессе хирургических операций, а также в послеоперационном периоде.
Синонимами препарата являются таламонал, дролептан, лептофен,
инновар и др.
Флуанизон (Fluanison)
Флуанизон — 4'-фтор-4-[4-(о-метоксифенил)-1 -пиперазинил]-бути-
рофенон F.3.12) получают взаимодействием 1-B-метоксифенил)-
пиперазина с 4'-хлор-4-фторбутирофеноном F.3.4) [50].
~ С-СН2-СН2-СН2-С
г~\ /=\
Фл\анизон является нейролептиком с седативными свойствами, у ко-
которого антипсихотическое действие выражено относительно слабо. Пре-
Препарат применяют в качестве самостоятельного или дополнительного
- 138-
Антипсихотики
средства при психомоторном возбуждении при острой и хронической
шизофрении, маниакально-депрессивном синдроме.
Синонимами препарата являются седаланд, меторин и др.
6.4. Производные дигидроиндолонов
Производные дигидроиндолонов структурно не принадлежат ни к од-
одному из рассматриваемых выше классов препаратов. Однако механизм их
действия, показания к применению и побочные эффекты весьма сходны
с производными фенотиазинов.
Молиндон (Molindone)
Молиндон — 3-этил-6,7-дигидро-2-метил-5-(морфолиноэтил)-индол-
4E//)-он F.4.3) получают нитрозированием диэтилкетона азотистой
кислотой или метилнитритом в нитрозодиэтилкетон F.4.1). Восста-
Восстановлением последнего цинком в уксусной кислоте в 2-амино-
диэтилкетон в присутствии циклогександиона-1,3 получают 3-этил-
2-метил-4,5.6,7-тетрагидроиндол-4-он F.4.2). Аминометилировани-
ем последнего морфолином и формальдегидом получают молиндон
F.4.3) [51, 52].
н3с.
642
,с2н5
сн3
Zn-СНзСООН
HNO2OI-CH3ONO2
А„^снэ
о
/ СН2О
NOH
О N—СН:
6 4.3
сн3
Молиндон более активный антипсихотик, чем хлорпромазин. Его
седативный эффект выражен слабее. Побочные эффекты также выраже-
выражены слабее, чем у более мощных нейролептиков. Он способствует
уменьшению спонтанных движений и агрессивности и показан для ле-
лечения проявлений психотических нарушений и, в частности, случаев
хронической и острой шизофрении.
Синонимом препарата является мобан.
-139-
Глава 6
6.5. Производные дибензоксазепинов
и дибензодиазепинов
Производные дибензоксазепинов и дибензодиазепинов также
структурно не принадлежат ни к одному из вышеперечисленных клас-
классов препаратов. Однако механизм их действия, показания к применению
и побочные эффекты аналогичны производным фенотиазинов.
Локсапин (Loxapine)
Локсапин — 2-хлор-11-D-метил-1-пиперазинил)дибенз[Ь,Г][1,4]ок-
сазепин F.5.4) синтезируют исходя из 2-D-хлорфенокси)анилина.
Ацилированием последнего хлоругольным эфиром получают N-это-
ксикарбонил-2-D-хлорфенокси)анилин F.5.1), который вводят во
взаимодействие с N-метилпиперазином с получением у рейда F.5.2).
Обработка последнего смесью хлорокиси фосфора и фосфорного
ангидрида получают локсапин F.5.3) [53, 54, 55].
I—\
Н3С-|\1ч ^-Н
С=О
О
N
СНз
6 5.2
СНз
6 53
Локсапин более выраженный активный антипсихотик, чем хлор-
промазин. Его седативный эффект уступает эффекту хлорпромазина.
Показания к применению и побочные эффекты соответствуют таковым
\ производных фенотиазинов. Локсапин используется для лечения про-
проявлений психотических нарушений и, в частности, случаев хронической
и острой шизофрении.
Синонимами препарата являются локсопак и локситан.
- 140
Антипсихотики
Клозапин (Clozapin)
Клозапин — 8-хлор-11-D-метил-1-пиперазинил)-5//-дибензо[Ь,е]-
[1,4]диазепин F.5.7) предложено получать двумя путями. Согласно
первому способу, 4-хлор-2-нитроанилин в присутствии медных
опилок арилируют метиловым эфиром о-хлорбензойной кислоты
с получением соответствующего дифениламина F.5.4). Взаимодей-
Взаимодействием последнего с N-метилпиперазином сложноэфирную группу
в полученном полифункциональном дифениламине трансформиру-
трансформируют в амидную F.5.5). Далее водородом в присутствии никеля Ренея,
восстанавливают нитрогруппу в полученном 4-хлор-2-нитро-2'-карб-
(К'-метилпиперазино)амиде F.5.5) до аминной. Взаимодействием
полученного продукта F.5.6)с хлорокисью фосфора осуществляют
гетероциклизацию в искомый дибензодиазепин — клозапин F.5.7)
[56, 57, 58].
Си
H3C-N N-H
ОСН3
POCI3
Второй способ синтеза клозапина исходит из 8-хлор-10,11-
дигидро-5Я-дибензо-[Ь,е]1,4-диазепин-11-тиона, который алкилируют
по атому серы дибензодиазепинового кольца 4-нитробензилхлоридом в
присутствии /и/?ет-бутилата калия с получением N-метилпроизводного
F.5.8). Взаимодействием последнего с N-метилпиперазином получают
искомый клозапин F.5.7) [59].
-141 -
Глава 6
Клозапин является нейролептиком с выраженным антипсихотиче-
скг/м и седативным действием. Не вызывает выраженного общего угне-
угнетения и экстрапирамидных расстройств. Препарат применяют при ост-
ры\ и хронических формах шизофрении, маниакальных состояниях,
маниакально-депрессивном психозе, психомоторном возбуждении, раз-
различных психотических состояниях.
Синонимами препарата являются лепонекс. ипрокс и др.
6.6. Производные дифенилбутилпиперидинов
Представителями дифенилбутилпиперидинов являются пимозид,
фл\спирилен и пенфлуридол, которые относятся к мощным нейролеп-
нейролептическим препаратам с выраженными антипсихотическими свойствами,
близкими к галоперидол\. Основная особенность этого ряда препара-
препаратов — их пролонгированное действие. Механизм их действия одно-
однозначно не выяснен, однако понятно, что они блокирует дофаминергиче-
скую активность.
Пимозид (Pimozide)
Пимозид — 1-[1-[4,4-бис(я-фторфенил)бутил]-4-пиперидил]-2-бенз-
имндазолинон F.6.5) структурно очень напоминает дроперидол за
исключением наличия двойной связи в пиперидиновом кольце и за-
замене n-фторбутирофенонного радикала при атоме азота пиперидино-
вого кольца на 4,4-бис(«-фторфенил)бутильный. Необходимый для
синтеза пимозида, равно как и флуспирилена и пенфл>ридола, 4,4-бис-
(м-фторфенил)-бчтилхлорид (бромид) F.6.3) получают взаимодей-
С1вием дв>х молей 4-«-фторфенилмагнийбромида с эфиром цикло-
пропанкарбоновой кислоты, в результате чего образуется бис-D-«-
фторфенил)циклопропилкарбинол F.6.1). Обработка последнего
хлористым гионилом (трехбромистым фосфором) приводит к деги-
дегидратации и, естественно, к одновременному раскрытию циклопро-
пильного кольца с образованием 1,1-бис-D-фторфенил)-4-хлор(бром)-
1 -бчтена F.6.2). Восстановление двойной связи последнего водородом
над палладиевым катализатором приводит к получению \,\-бис-D-
фюрфенил)б\тил хлорида (бромида) F.6.3) [60, 61, 62, 63].
-MgBr
СООС2Н5
SOCi2
66 1
-142-
Антипсихотики
Н2 / Pd-C
Собственно синтез пимозида заключается в алкилировании 4-B-
бензимидазолинон) пиперидина F.6.4), получаемого восстановлением
1 -A.2,3,6-тетрагидро-4-пиридил)-2-бензимидазолона F.3.10) водородом
над никелем Ренея, ранее полученным 4.4-бмоD-фторфенил)бутилхло-
ридом F.6.3) в результате чего и образуется пимозид F.6.5).
Н2 ' Ranay-Ni
N-H
664
—СН2-СН2—N /—Nn-:
По спектру фармакологического действия пимозид близок к гало-
иеридол). Его применяют как в стационаре, так и в амбулаторных усло-
условиях для поддерживающей терапии больных, страдающих шизофрени-
шизофренией, параноидными состояниями, психотическими и невротическими
расстройствами с параноидными признаками. При острых психозах не-
нрш оден, так как не обладает психомоторно-седативным действием.
Препарат применяется при лечении пациентов, страдающих синдромом
"(о\ретта. Пимозид имеет ряд побочных эффектов, многие из которых
сходны с таковыми у фенотиазинов.
Синонимом препарата является орап.
-143-
Глава 6
Флуспирилен (Fluspirilen)
Флуспирилен — 8-[4,4-бмс(и-фторфенил)бутил]-1-фенил-1,3,8-
триазаспиро[4,5]декан-4-он F.6.9) получают исходя из 1-бензил-4-
анилино-4-цианопиперидина C.1.64) путем его кислотного гидро-
гидролиза в амид F.6.6) и последующей гетероииклизации с помощью
формамида 4-аминокарбонильной и 4-анилинной функциональных
фупп в имидазолоновый фрагмент, создав, тем самым, искомую
спирогетероциклическую систему — 8-бензил-1-фенид-1,3,8-три-
азаспиро[4,5]декан-4-он F.6.7). Восстановлением водородом с ис-
использованием в качестве катализатора палладия на угле снимают
с последнего защитную N-бензильную группу с получением 1-фе-
нил-1,3,8-триазаспиро[4,5]декан-4-она F.6.8). Алкилируя послед-
последний 1,1-бмс-D-фторфенил)бутил бромидом F.6.3), полччают флус-
флуспирилен F.6.9) [64, 65, 66].
3 1 48
/-у
\\ //-CH?~V_A
NH
666
CONH2 HCONH2
H2SO4
;н2—n
66 7
)сн-снг—ch2-ch2-ci
663
В первую очередь препарат применяют для поддерживающей тера-
терабольных, страдающих хроническими психическими заболеваниями
после лечения в стационаре. Удобен для применения в амбулаторной
практике из-за отс\тствия выраженного гипноседативного эффекта.
пии
- 144-
Антипсихотики
Синонимами препарата являются имап, редептин и др.
Пенфлуридол (Penfluridol)
Пенфлуридол — 4-D-хлор-3-трифторметилфенил)-1-[4,4-5мс-(«-
фторфенил)бутил]-4-пиперидинол F.6.12) синтезируют реакцией
Гриньяра между 1-карбметоксипиперидин-4-оном и 4-хлор-З-
трифторметилфенилмагнийбромидом с получением 1-карбметокси-
D-хлор-3-трифторметилфенил)-4-пиперидинола F.6.10). Щелоч-
Щелочным гидролизом карбметоксильной группы последний превращают
в D-хлор-3-трифторметилфенил)-4-пиперидинол F.6.11), алкилиро-
ванием которого 1.1-?шс-D-фторфенил)бутил бромидом F.6.3) по-
л>чают пенфлуридол F.6.12) [67, 68, 69].
о
Cri3O-C-[
снзо-c-N х
^—' пн
КОН
>СН-СН2—СН2-СН2—N Y
( Х—/ ОН
\ // 66,2
По своему фармакологическому действию препарат близок к пимо-
зиду, однако его действие значительно более длительное, что связано
с медленным метаболизмом препарата. Пенфлуридол показан для под-
поддерживающей терапии в амбулаторных условиях у пациентов, стра-
страдающих шизофренией, а также у пациентов в параноидном, психотиче-
психотическом и невротическом состояниях.
Синонимами препарата являются семап, лонгоперидол и др.
6.7. Прочие нейролептики
Сульпирид (Sulpirid)
Сульпирид — М-[A-этил-2-пирролидинилметил]-5-сульфамоил-0-
анизамид F.7.2) получают исходя из 5-аминосульфосалициловой
кислоты. Метилируя последнюю диметилс>льфаюм, получают 2-
метокси-5-аминос\льфонилбензойную кислоту F.7.1), которою
-145-
Глава 6
трансформируют в амид, используя в качестве аминной компонен-
компоненты 2-аминометил-1-этилпирролидин, а в качестве конденсирующего
средства— карбонил-1,1'-бис-имидазол [70, 71, 72, 73, 74].
и
°
ххосиз
Сульпирид обладает умеренной нейролептической активностью в со-
сочетании с некоторым стимулирующим и тимолептическим эффектом.
Не оказывает седативного действия. Оказывает противорвотное, уме-
умеренное каталептогенное и антисеротониновое действие. Способствует
улучшению кровоснабжения желудка. Ускоряет восстановительные
процессы в тканях. Препарат применяют при шизофрении, депрессии,
мигрени, нарушениях поведенческих функций и язвенной болезни же-
желудка и двенадцатиперстной кишки.
Синонимами препарата являются арминол, догматил, конфидан, эг-
лонил и многие другие.
Препараты лития
Соли лития были предложены в медицине для лечения подагры
и растворения почечных камней. Однако позже было установлено, что
препараты лития способны купировать острое маниакальное возбуждение
у людей и предупреждать аффективные приступы. Механизм действия
препаратов лития выяснен неокончательно, однако ясно, что ионы лития
влияют на транспорт ионов натрия в нервных и мышечных клетках,
вследствие чего ионы лития выступают как антагонисты ионов натрия.
Лития карбонат (Lithium carbonat)
Лития карбонат получают взаимодействием солей лития с содой или
поташом и далее труднорастворимую соль подвергают очистке [75].
2LiCI + Na2CO3= 2NaCI + Li2CO3
Наиболее распространенным препаратом лития является лития кар-
карбонат, который обладает антиманиакальным действием. Полагают, что
литий изменяет транспорт ионов Na в нейронах, влияя на внутрикле-
внутриклеточное содержание катехоламинов, нормализует психическое состоя-
состояние, не вызывая общей заторможенности.
-146-
Ан гипсихотики
Препарат применяют при маниакальных состояниях различного ге-
неза. профилактике и лечении аффективных психозов.
Синонимами препарата являются эскалит, камколит, каболит. лити-
зин и др.
1.
2.
3.
4.
5.
6.
7.
8.
9.
10
11.
12.
13.
14.
15.
16.
17.
18.
19.
20.
21.
22
23.
24.
25.
26.
27.
28.
29.
30.
31.
32
Список литературы
US Pat. 2.519.886A950).
Ger. Pat. 824.944A950).
Wirth ff.//Arzneim.-Forscch. 8, 507 A958).
US Pat. 2.645.640A953).
Ger. Pat. 910.301 A951).
Charpentier B. et al.'/Compt Rend. 235, 59 A952).
Ger. Pat. 1.095.836A956).
US Pat. 2.921.069A960).
Brit. Pat. 813.961 A959)
Duhm B. et al.//Z. Naturforsch. Д, 756 A958).
Craig P. et al.,VJ. Org. Chem. 22, 709 A959).
Yale H. et al.//J. Am. Chem. Soc. 79, 4375 A957).
US Pat. 2.902.484A959).
Brit. Pat. 780.193A957).
Ger. Pat. 1.037.461 A955).
Fr. Pat. 1.167.627A959).
US Pat. 2.921.069A960).
Ger. Pat. 1.095.836A956).
Ger. Pat. 1.165.034A956).
Brit. Pat. 813.861 A959).
US Pat. 3.058.979 A962).
Ger. Pat. 1.095.836A956).
Brit. Pat. 829.246A960).
Brit. Pat. 833.474A960).
US Pat. 3.194.733A965).
Yale H. et al./J. Am. Chem. Soc. 82, 2039 A960).
Anderson E. et al.//Arzneim.-Forsch. \2, 937 A962).
US Pat. 2.766.235A956).
US Pat. 3.239.514A966).
Bourquin J et al.//Helv. Chim. Acta. 4_1, 1072 A958).
US Pat. 3.084.161 A960).
Ger. Pat. 1.044.103 A957).
US Pat. 2.951.082A960).
-147-
Глава 6
34. US Pat. 3.116.291 (,1963).
35. Ger. Pat 1.168.446A959)
36. Ger Pat. 1.418.517A959).
37. Ger. Pat. 1.470.157 A963).
38. US Pat 3.310.553A967).
39. Belg. Pat. 647.066 A964).
40. Muren J et al. 'J. Med. Chem. U, 17 A970).
41. Brit. Pat. 895.309A962).
42. US Pat. 3.438.991 A969).
43. Belg. Pat. 577.977A959).
44. Janssen P et al.VMed. Chem. I, 281 A959).
45. Brit. Pat. 1.141 664A966).
46. US Pat. 4.086.234A975).
47 Brit. Pat. 989.755 A962).
48. US Pat. 3.141.823A964).
49 US Pat. 3.161.645A964).
50. US Pat. 2.997.472 A961).
51. US Pat. 3.491.093A970).
52. Belg. Pat. 670.798 A966).
53. US Pat. 3 412.193A968).
54. US Pat. 3.546.226A970).
55. SchmutzJ etab/Helv. Chun. Acta50, 245 A967).
56. Fr. Pat. 1.334.944A963).
57. US Pat. 3.539.573A970).
58. Brit. Pat. 980.853A961).
59. HunzikerF et al. /Helv. Chim. Acta 50, 1588 A967).
60. Fr. Pat. M 3.695 A963).
61. US Pat. 3.196.157A965).
62. Ger. Pat. 1.470.124A963).
63. Janssen P et aLVArzneim.-Forsch. 18, 261, 279, 282 A968).
64. Belg. Pat. 633.914 A963).
65 US Pat. 3.238.216A966).
66. Ger. Pat. 1.470.125A963).
67. Ger. Pat. 2.040.231 A970).
68. US Pat. 3.575.990A971).
69. SindelarJ. et ab/Coll. Czech. Chem. Commun. 38, 3879 A973).
70. Ger. Pat. 1.595.915A965).
71. Ger. Pat. 1.795.723A965).
72. US Pat. 3.342.826A969).
73. US Pat. 4.077.976A978).
74. Ger. Pat. 2.903.891 A979).
75. Calev M et al.' Inorg. Syn. 1, 1, A939)
-148-
Глава 7
Антидепрессанты
Препараты, применяющиеся для лечения психических расстройств,
сопровождающихся депрессией, называются антидепрессантами Это
препараты, которые могут облегчить множество симптомов, ассоцииро-
ассоциированных с широким набором психосоматических расстройств, известных
как депрессия.
Иными словами, антидепрессанты способны устранить или умень-
уменьшить ряд расстройств со стороны психоэмоциональной сферы, обозна-
обозначаемых в психоневрологической практике как депрессивный синдром.
В свою очередь состояние, характеризуемое термином ^депрессия»,
включает аффективные расстройства, которые часто сопровождаются
рядом др\гих нарушений, включая беспричинную печаль, расстройств
сна, изменения аппетита, различные психомоторные нарушения, потерю
интереса к удовольствиям, ощущение своей бесполезности и довольно
часто суицидальные мысли.
С\ шествует достаточно приемлемая, хотя и не общепринятая, клас-
классификация депрессий, основанная на их этиологии. Выделяют следую-
следующие типы депрессий:
— эндогенные депрессии, характеризующиеся потерей интереса
к удовольствиям, потерей либидо, малой подвижностью, на-
нарушениями сна:
-149-
Глава 7
— невротические, или беспокойные, депрессии, характеризую-
характеризующиеся беспокойством, напряжением, «сверхреактивностью»
по отношению к неожиданностям и потерям, раздражитель-
раздражительностью и беспомощностью;
— ситуационная депрессия, обычно возникающая при воздейст-
воздействии внешних стрессовых факторов;
— маниакально-депрессивные нарушения, характеризующиеся
чередующимися выраженными и неадекватными изменения-
изменениями со стороны настроения.
Общим свойством всех антидепрессантов является их положитель-
положительное влияние на аффективную сфер\ пациента, что сопровождается
>л\чшением настроения и общего эмоционального состояния.
Несмотря на то, что первичные биохимические нарушения, ответст-
ответственные за депрессию и маниакально-депрессивные состояния, остаются
не полностью раскрытыми, некоторые факты позволяют предположить,
чго депрессивные состояния мог\т быть вызваны дефицитом норэпи-
норэпинефрина (норадреналина) и серотонина. Большинство препаратов, при-
применяемых для лечения этих заболеваний, действуют посредством воз-
воздействия на систему биогенных аминов мозга, приводя в действие тот
пли иной механизм, способствующий увеличению их содержания в со-
соответствующих >частках мозга.
С>ществ>ет 4 класса антидепрессантов:
1) трициклические антидепрессанты (имипрамин, тримипрамин
амитриптилин, доксепин, десипрамин, протриптиллин, нор-
триптичлин амоксапин, мапротиллин);
2) антидепрессанты второго поколения, или атипичные антиде-
антидепрессанты, — это разнородная в химическом отношении
группа предложенных в последнее время препаратов (бупро-
пион, тразодон, флуоксетин);
3) ингибиторы моноаминооксидазы (МАО) (фенелзин, изокар-
боксазид, транилципромин);
4) амфетамины и другие стимуляторы ЦНС (декстроамфетамин,
метилфенидат).
Наиболее часто и широко применяемыми препаратами для лечения
эндогенных депрессий являются трициклические антидепрессанты. По
своему клиническом) действию они похожи на фенотиазиновые анти-
психотики. Антидепрессанты второго поколения отличаются от пер-
выл спектром побочных эффектов. Ингибиторы МАО проявляют мень-
-150-
Антидепрессанты
ш)ю клиническую эффективность, чем трициклические антидепрес-
антидепрессанты, и их обычно применяют для лечения острых депрессий, не под-
поддающихся успешному лечению трициклическими антидепрессантами.
Наконец, некоторые стимуляторы ЦНС, большинство из которых явля-
является произвооными амфетамина, используются преимущественно
в сл\чаях \ меренных депрессий, однако их малая эффективность в слу-
случаях осфых депрессий и выраженная способность вызывать привыка-
привыкание ограничивают их применение
При выборе препаратов для фармакотерапии депрессий следует
учитывать как особенности самих препаратов, так и уровень тяжести
и симптоматику заболевания.
7.1. Трициклические антидепрессанты
Наиболее часто используемые препараты — это трициклические
антидепрессанты, получившие свое название исходя из общности их
химического строения, а именно, системы, состоящей из двух бензоль-
бензольных колец, сочлененных с центральным семичленным кольцом, с при-
присоединенной к центральному кольцу диалкиламиноалкильной группой.
В зависимости от заместителей при концевом атоме азота в аминосо-
д-.-ржащей боковой цепи, последние, в свою очередь, подразделяются на
фетичные (имипрамин, амитриптилин, тримипрамин, доксепин) и вто-
вторичные (десипрамин, нортриптилин, протиптилин) амины. Данная клас-
классификация весьма формальна и не основана на наиболее существенных
стр\к(\рных различиях рассматриваемых препаратов, однако она при-
принята в фармакологии.
'! рициклические антидепрессанты химически, фармакологически и то-
токсикологически очень похожи на антипсихотики фенотиазинового ряда.
Механизм действия трициклических депрессантов окончательно не
выяснен, и ни одна из предложенных сегодня гипотез не в состоянии
полностью объяснить их антидепрессантый эффект.
Полагают, что трициклические антидепрессанты ингибируют об-
обратный (нейрональный) захват норэпинефрина (норадреналина) и/или
серотонина пресинаптическими нервными окончаниями, блокируя один
из ведущих механизмов их инактивации, и тем самым увеличивают
концентрацию указанных аминов, потенцируя их эффекты. Следует от-
отметить, что, как правило, вторичные амины — представители трицик-
личееких антидепрессантов проявляют большую активность, блокируя
°оратный нейрональный захват норэпинефрина, в то время как третич-
третичные амины больше влияют на обратный нейрональный захват серото-
серотонина.
-151 -
Глава 7
Не исключено также, что трициклические антидепрессанты блоки-
блокируют пресинаптические ос2-адренорецепторы, увеличивая тем самым
количество высвобождаемого норэпинефрина и/или серотонина.
Трициклические антидепрессанты применяют для облегчения сим-
симптомов депрессии, особенно эндогенного типа, для контроля беспокой-
беспокойства, связанного с депрессивным состоянием, для лечения депрессий
у пациентов с маниакально-депрессивным психозом и т. п.
Третичные амины — представители
три циклических антидепрессантов
Имипрамин (Imipramine)
Имипрамин — 5-[3-(диметиламино)пропил]-10,11-дигидро-5#-ди-
бенз[Ь,1]азепин G.1.1) получают алкилированием 10,11-дигидро-5Я-
дибенз[Ь,г]азепина 3-диметиламинопропилхлоридом в присутствии
амида натрия [1, 2, 3].
CI—СН2 -СН2-СН2-N(
СН3
NaNH2
CH2-CH2-CH2-n(
СН3
СН3
Имипрамин является основным представителем типичных трицик-
лических антидепрессантов. Препарат действует путем блокады меха-
механизма обратного захвата биогенных аминов. Не ингибирует активность
МАО. Имипрамин уменьшает тоску, двигательную заторможенность,
улучшает настроение, повышает психический и общий тон>с организма.
Его применяют при депрессивных состояниях различной этиологии,
сопровождающихся моюрной и идеаторной заторможенностью, при
ночном недержании мочи \ детей, при паркинсонизме.
Основными синонимами препарата являются тофранил, сурпликс,
имизин и мелипрамини др.
Tpu.Hunpa.Him (Trimipramine)
Тримипрамин — 5-[3-(диметиламино)-2-метилпропил]-10,11-дигидро-
5Я-дибенз[Ъ,1]азепин G.1.2) получают совершенно аналогично имип-
рамину, но алкилируя 10,11-дигидро-5Я-дибенз[Ь,1]азепин 3-диметил-
амино-2-мегилпропилхлоридом [4. 5].
-152-
Антидепрессанты
I С
CH2-CH-CH2-N^
712
^
Так же как и имипрамин, его применяют при депрессивных состоя-
состояниях различной этиологии. По эффективности препарат аналогичен
имипрамину.
Синонимом тримипрамина является сурмонтил.
Лмитриптилин (Amitriptyline)
Амитриптилин — 5-C-диметиламинопропилиден)-10,11 -дигидро-
дибензциклогептен G.1.4), который отличается от имипрамина тем,
что атом азота в центральной части трициклической системы заме-
заменен атомом углерода, связанным с боковой цепью двойной связью.
Амитриптилин G.1.4) синтезируют взаимодействием 10,11-дигид-
ро-Н^диметил-5//-дибензо[а,с!]-циклогептен-5-она с 3-диметилами-
нопропилмагнийбромидом с последующей дегидратацией полученно-
полученного третичного спирта G.1.3) соляной кислотой [6, 7, 8, 9, 10, 11].
CIMg-CH2-CH2-CH2-N{
НО Crt2-CH2-CH2-N(
CHj
СН—CH2-CH2-N<
СН3
71 4
СНз
Альтернативным способом синтеза является взаимодействие 10,11-
Дигидро-К,К-диметил-5Я-дибензо[а,с1]-циклогептен-5-она с циклопро-
пилмагний бромидом с получением 10,11-дигидро-К,К-диметил-5Я-
либензо[а.с1]-циклогептен-5-циклопропил-5-ола G.1.5). Взаимодействи-
Взаимодействием последнего с бромистым водородом в уксусной кислоте осуществ-
осуществляют раскрытие циклопропильного кольца с получением 5-C-бромпро-
-153-
Глава 7
пилиден)-10,11-дигидро-5Я-дибензо[а,с1]циклогептена G.1.6). Алкилируя
последним диметиламин, получают амитриптиллин G.1.4) [12, 13J.
hBr /CH3COOH
HN<
СН3
-=-,-РЧ<
Амитриптиллин применяют при тревожно-депрессивных состояни-
состояниях. Он переносится лучше, чем имипрамин.
Наиболее часто встречающимися синонимами являются триптизол
и амиприн.
Доксепин (Doxepin)
Доксепин — A1[16Я]-C-диметиламинопропилиден)-6,11-дигидро-
бенз[Ь.е]оксепин G.1.11) получают по аналогичной схеме взаимо-
взаимодействием 6,11-дигидродибенз-[Ь,е]оксепин-11-она G.1.9) с 3-диме-
тиламинопропилмагнийбромидом с последующей дегидратацией
полученного третичного спирта G.1.10) соляной кислотой [14, 15,
16,17].
CIMg—CHj-CHj-CH2-n{
СЧэ
ch2-ch2-ch2-n(
,снз
сн—ch2-ch2-n(
7 111 °Нз
Исходный 6,11-дигидродибенз[Ь,е]оксепин-11-он G.1.9) синтези-
р;. ют исходя из этилового эфира 2-феноксиметил бензойной кислоты
G.1.7), который легко получают взаимодействием этилового эфира
2-бромметилбензойной кислоты и фенола в присутствии основания.
- 154-
Антидепрессанты
Полученный эфир G.1.5) гидролизуют до 2-феноксиметилбензойной
кислоты G.1.8), которую циклизуют в 6,11-дигидродибенз[Ь,е]оксепин-
11-он G.1.9) действием ангидрида трифторуксусной кислоты.
NaOH
NaOH
Механизм действия доксепина также предположительно связан
с влиянием на адренергическую передачу в ЦНС, в частности, с блока-
блокадой нейронального захвата норэпинефрина. Доксепин применяют при
тревожно-депрессивных и беспокойных состояниях, неврозах, алкого-
алкоголизме, органических заболеваниях ЦНС. психозах.
Наиболее часто встречающимися синонимами являются адапин
и синекван.
Вторичные амины — представители
трициклических антидепрессантов
Дезипрамин (Desipramine)
Дезипрамин — 10,11-дигидро-5-[3-(метиламино)пропил]-5Я-дибенз-
[Ь.х]азепин G.1.13) отличается от имипрамина наличием лишь одной
дополнительной метильнои группы при атоме азота боковой пропи-
ламинной цепи. Предложенные способы синтеза дезипрамина весь-
весьма просты, и разница состоит лишь в способе введения вторичной
метиламинной группы в структуру препарата.
Первый способ синтеза заключается в алкилировании 10,11-
днгидро]-5Я-дибенз[Ь,1]азепина 1-бром-З-хлорпропаном в присутствии
амида натрия в хлорпроизводное G.1.12) и последующем его взаимо-
взаимодействии с метиламином с получением дезипрамина G.1.13) [18, 19, 20].
-155-
Глава 7
Ci—CH2-CH2~CH2-i
CH3NH2
ch2-ch2-ch2-ci
7 1 12
CH2-CH2-CH2-NH—CH3
7 1 13
Второй способ заключается в алкилировании 10,11-дигидро]-5#-ди-
бенз[Ь,1]азепина 3-(К-бензил-К-пропиламино)пРопил хлоридом в при-
присутствии амида натрия и последующим дебензилированием полученно-
полученного продукта G.1.14) путем восстановления водородом над палладиевым
катализатором [21, 22].
сиз
Dl— CH2-CH2-CH2-N\ /=>
Н2/ Pd-C
СН2-СН2-СН2-NH —СНз
7 1 13
Наконец, при третьем способе исходят из имипрамина G.1.1), ко-
который подвергают деметилированию последовательным взаимодейст-
взаимодействием с хлоругольыым эфиром с получением 5-[3-(N-Kap63TOKCH-N-
метил)амиинопропил]-10,П-Дигидро-5Н-дибенз-[Ь,1]азепина G.1.15), ще-
щелочной гидролиз которого приводит к дезипрамин> G.1.13) [23, 24].
CICOOC2HS
Ан тидепрессанты
Дезипрамин применяется при депрессивных состояниях различной
этиологии и, в частности, при эндогенных депрессиях.
Синонимами являются норпрамин и пертофран.
Нортриптилин (Nortriptyline)
Нортриптилин — 5-C-метиламинопропилиден)-10,11-дигидроди-
бензциклогептен G.1.17). Нортриптилин отличается от дезипрамина
геми же признаками, которые отличают амитриптилин от имипра-
имипрамина, а именно: в нортриптилине атом азота в центральной части
трициклической системы дезипрамина заменен атомом углерода,
связанным с боковой цепью двойной связью.
Две предложенные схемы для синтеза нортриптилина основаны на
N-деметилировании амитриптилина G.1.4). Третья схема предполагает
взаимодействие метиламина с 5-C-бромпропилиден)-10,11-дигидро-5Я-
дибенз[а.ё]циклогептеиом G.1.18).
Согласно первому способу, деметилирование осуществляют н\тем
взаимодействия амитриптилина G.1.4) с метилйодидом, что часто при-
приводит к пол>чению четвертичной аммониевой соли G.1.16), взаимодей-
взаимодействие которой с метиламином при относительно высокой температуре
дает искомый нортриптилин G.1.17) [25].
СН31
CH3NH2
7 1 4
СН2 -СН2 -СН2 -N -СНз
СНз
7 1 16
CH2-CH2-CH2-NH— СН3
7 1 17
Во втором способе предусмотрено взаимодействие амитриптилина
G.1.4) с хлоругольным эфиром, приводящее к замещению мет ильной
группы в аминной части молек>ла на этоксикарбонильную G.1.18),
с последующим гидролизом образовавшегося продукта в нортриптилин
G.1.17) [26].
-157-
Глава 7
CICOOC2H5
Согласно третьему способу, нортриптилин получают взаимодей-
взаимодействием метиламина с 5-C-бромпропилиден)-10,11-дигидро-5Я-
дибенз[а,A]циклогептеном G.1.6) [8].
CH3NH2
CH2-CH2-CH2~Br
7 1 6
СН2-СН2-СНг-N Н-СН3
7 1.17
Предложено еще несколько модификаций описанных выше спосо-
способов получения нортриптилина [27, 28, 29, 30, 31, 32].
Нортриптилин — препарат с относительно коротким латентным пе-
периодом действия. Он практически не обладает седативным эффектом.
Его применяют при маниакально-депрессивных психозах, при всех
формах эндогенных депрессий, а также при больших депрессивных сос-
состояниях.
Наиболее распространенными синонимами нортриптилина являют-
являются авентил, нортрилен, мотивал, вивидил и памелор.
Протриптилин (Protriptyline)
Протриптилин — 1М-метил-5Я-дибензо[а,с1]циклогептен-5-пропил-
ампн G.1. 22) отличается от всех описанных выше препаратов тем,
что в положение С|0-Сц центрального семичленного кольца три-
циклического фрагмента молекулы введена двойная связь. В тоже
время из положения С5 исключена свободная электронная пара,
принадлежащая либо атому азота, либо экзоциклической двойной
связи, что несомненно поменяло как архитектуру всей молекулы
в целом, так и расположение в ней фармакофорных участков.
Прогриптилин синтезируют алкилированием 5#-дибензо[а.с1]цик-
логептена 3-(>1-формил-К-метиламино)пропилхлоридом G.1.20), полу-
получаемым, ссмласно приведенной схеме, из соединения G.1.19). Получен-
Полученный пол^продхкп G.1.21) подвергают щелочному гидролизу, что
приводит к получению протриптилина G.1.21) [33. 34, 35, 36, 37, 38].
-158-
Антидепрессанты
ИО-СН2-СН2-СЧ2-МН —СНз
сно
H2NCHO
HO-CH2-CH2-Cri2-N\
7 1 19
SOCI2
сн3
сно
:i—c,h2-ch2-ch2-n <
7 1 го
ch2-ch2-ch2-n(
сно
СНз
Протриптилин является мощным антидепрессантом, механизм дей-
действия которого неясен. Он не является ингибитором МАО и не стиму-
лирчет ЦНС. Препарат начинает действовать намного быстрее и дейст-
действует намного дольше, чем имипрамин или амитриптилин. Протриптилин
не имеет седативных и транквилизирующих свойств. Препарат применяют
в \словилх клиники для лечения глубоких депрессий.
Наиболее распространенными синонимами являются конкордин,
триптил и вивактил,
Мапротилин (Maprotiline)
Мапротилин — ]Ч-метил-9,10-этаноантрацен-9A0Я)-пропиламин
G 1.22) получают реакцией 4т-2 циклоприсоединения 9-C-метил-
аминопропил)антрацена с этиленом [39,40. 41].
н2с =сн2
СН2 -СН2 -СН2 -NH —СНз
CH2-CH2-CH2-NH —СНз
7 1 22
Мапрошлин часто называют тетрациклическим антидепрессантом.
Этот «гибридный» препарат, имеющий как элементы классических три-
циклических антидепрессантов, так и элементы протриптилина, по сво-
своим фармакологическим и клиническим проявлениям больше напомина-
напоминает имипрамин.
- 159-
Глава 7
Препарат нарушает нейрональный захват моноаминов в ЦНС, обла-
обладает умеренной транквилизирующей и чолинолитической активностью.
Значительно повышает настроение, уменьшает чувство страха. Мапро-
тилин применяется при различных формах депрессий, сопровождаю-
сопровождающихся ч)вством страха, раздражительностью.
Синонимом препарата является людиомил.
7.2. Ингибиторы МАО
МАО — это сложная ферментная система, присутствующая прак-
практически во всех органах, которая катализирует дезаминирование или
инактивацию различных природных биогенных аминов и, в частности,
норэпинефрина (норадреналина), эпинефрина (адреналина) и серотони-
на. Ингибирование МАО повышает количество упомянутых, биогенных
аминов в нервных окончаниях. Очевидно, ингибируя их дезаминирова-
дезаминирование. ингибиторы МАО повышают внутриклеточную концентрацию эн-
эндогенных аминов, что, по-видимому, и является причиной их антиде-
прессантного действия.
Препараты, которые образуют стабильные комплексы с МАО и тем
самым ингибируют ее действие, давно применяются в медицине в каче-
качестве ангидепрессантов и называются ингибиторами МАО. (Не исклю-
исключено, что ингибиторы МАО действуют не путем комплексообразова-
ния с ней, а путем образования ковалентных связей, необратимо инак-
тивируя ее.)
С большой осторожностью, с химической точки зрения, эти препа-
препараты можно охарактеризовать как производные гидразина, что одно-
однозначно следует из рассмотрения структур фенелзина и изокарбоксазида
и из параллельного рассмотрения вместе с ними структуры транилами-
на, отвлекшись при этом от символа атомов азота и представив элек-
электронное строение циклопропана.
Механизм антидепрессивного действия этого ряда препаратов веро-
вероятно связан с торможением ими процесса окислительного дезаминиро-
вания нейромедиаторов (норэпинефрина, эпинефрина, дофамина и се-
ротонина). >частвующих в передаче нервного возбуждения в ЦНС.
Существенным недостатком этих препаратов является их высокая
токсичность, связанная с тем, что они ингибируют не только МАО, но
и ряд других неспецифических ферментов.
Ингибиторы МАО применяются для лечения острых эндогенных,
экзогенных и реактивных депрессий, не поддающихся лечению трицнк-
лическпми антидепрессантами, а также для контроля депрессивной фа-
фазы при маниакально-депрессивных психозах.
-160-
Антидепрессанты
Фенелзин (Phenelzine)
Фенелзин — 2-фенилэтилгидразин G.2.1) получают взаимодействи-
взаимодействием 2-фенилэтилбромида с гидразином [42, 43, 44, 45].
-СН2-СН2— Br
H2N-NH2
-CH2-CH2-NH-NH2
721
Фенелзин — ингибитор МАО, который применяют для лечения па-
пациентов с депрессиями, характеризуемыми как атипичные, неэндоген-
неэндогенные или невротические, у которых часто наблюдается смешанные бес-
беспокойство и депрессия или фобии. Фенелзин не является препаратом
первого выбора, поэтому его используют при депрессивных состояниях,
не поддающихся контролю другими лекарственными средствами.
Синонимом препарата является нардил.
Изокарбоксазид (Isocarboxazide)
Изокарбоксазид — 2-бензилгидразид 5-метил-З-изоксазолкарбо-
новой кислоты G.2.6) можно синтезировать исходя из ацетонилаце-
тона, при нитрозировании которого азотистой кислотой получается
5-метил-изоксазол-З-карбоновая кислота G.2.2). Этерификацией
последней получают этиловый эфир 5-метил-изоксазол-З-карбоно-
вой кислоты G.2.3). Синтезированный эфир G.2.3) далее вводят во
взаимодействие с бензилгидразином с получением изокарбоксазида
G.2.6) либо с гидразином с получением гидразида 5-метил-изо-
ксазол-3-карбоновой кислоты G.2.4). Вводя последний в реакцию
с бензальдегидом, получают гидразон G.2.5), который далее вос-
восстанавливают в изокарбоксазид G.2.6) [46, 47].
о о
А А
^СН2 —СН^
rlNO2
п—if
CONHNHj
ц—n
22
с2н5он' н
н3с
СООС2Н5
H2NNH2
Cri2-NHNH2
Глава 7
Изокарбоксазид является мощным ингибитором МАО. Как и фенел-
зин, изокарбоксазид использ>тет при депрессивных состояниях, не под-
поддающихся контролю другими препаратами.
Синонимом препарата является марплан.
Транилципромин (Tranylcypromine)
Транилципромин — (±)-транс-2-фенилциклопропиламин G.2.10)
в отличие от вышеописанных препаратов не является производным
гидразина. Синтез его осуществляют из этилового эфира 2-фенил-
циклопропанкарбоновой кислоты G.2.7), которую получают взаи-
взаимодействием стирола с диазоуксусным эфиром. Эфир 2-фенилцик-
лопропанкарбоновой кислоты G.2.7) гидролизуют щелочью в 2-фе-
нилциклопропанкарбонов>ю кислоту G.2.8), и выделяют транс-
изомер, с которым и продолжают работу. Взаимодействием транс-
изомера кислоты с хлористым тионилом получают хлорангидрид
м/7анс-2-фенилциклопропанкарбоновой кислоты G.2.9), из которого
взаимодействием с азидом натрия получают соответствующий азид
кислоты, перегруппировывающийся в условиях реакции Курциуса
в транилципромин G.2.10) [48, 49].
-сн=сн2
N2CHCOOC2H5
С2Н5ОН / ОН
СООС2Н5
SOCI2
729
7 2 10
Как и вышеописанные препараты, ингибитор МАО транилципро-
транилципромин также используют при депрессивных состояниях, не поддающихся
контролю другими препаратами.
Синонимами препарата являются трансамин, пармодалин, парнат
и др.
- 162-
Антидепрессанты
7.3. Антидепрессанты второго поколения
(атипичные антидепрессанты)
Это ряд химически неоднородных соединений, не классифицируе-
классифицируемых и не относящихся ни к классу трициклических антидепрессантов,
ни к классу ингибиторов МАО, проявляют весьма эффективную анти-
антидепрессивную активность.
Весьма вероятно, что их действие также обусловлено способностью
ингибировать захват норэпинефрина или серотонина. Однако ввиду
разнородности группы возможный механизм действия каждого будет
рассмотрен отдельно.
Амоксапин (Amoxapine)
Амоксапин — 2-хлор-11-A-пиперазинил)-дибенз[Ь,1]оксазепин G.3.2)
является непосредственным аналогом нейролептика локсапина
F.5.3), отличаясь от последнего лишь отсутствием метильной груп-
группы в пиперазиновом фрагменте молекулы. С другой стороны, его
можно отнести и к классу трициклических антидепрессантов, ос-
основное различие которых заключается в месте присоединения боко-
боковой цепи к центральному семичленному кольцу трициклической
системы. Синтез амоксапина, как и локсапина, осуществляют исхо-
исходя из 2-D-хлорбензокси)анилина, который, как и в случае синтеза
локсапина, ацилируют хлоругольным эфиром в F.5.1) и далее
трансформируют в уреид G.3.1) взаимодействием с 1-карбэтокси-
пиперазином. Циклизацией уреида G.3.1) смесью пятиокиси и хло-
рокиси фосфора в дибензоксазепин и последующим щелочным гид-
гидролизом получают амоксапин G.3.2) [50, 51, 52, 53].
Н -N N -СООС2Н5
Р2О5' РОС13
Антидепрессивное действие амоксапина сравнимо с имипрамином
и амитриптилином. Препарат проявляет антагонистическую активность
в отношении дофаминовых (D2) рецепторов.
- 163-
Глава 7
Препарат больше предназначен для облегчения симптомов у па-
пациентов с невротическими или реактивными депрессиями, чем с ати-
атипичными депрессиями. Обладает рядом серьезных побочных дейст-
действий.
Синонимами препарата являются асендин, амоксан, моксадил
и др.
Бупропион (Bupropion)
Бупропион — 1 -C-хлорфенил)-2-[( 1,1 -диметилэтил)амино]-1 -про-
панон G.3.5) синтезируют исходя из 3-хлорбензонитрила, взаимо-
взаимодействием которого с этилмагнийбромидом получают 3-хлорпро-
пиофенон G.3.3). Бромируя последний молекулярным бромом,
получают 3-хлор-а-бромпропиофенон G.3.4), взаимодействием
которого с третбутиламином получают бупропипон G.3 5) [54, 55,
56,57,58].
<\ Я—C-CH-NH-C(CH3K
сн3
Бупропион является а-аминокетоном, структурно родственным ам-
амфетаминам, проявляет уникальную активность, сравнимую с другими
антидепрессантами. Полагают, что бупропион восстанавливает общее
количество циркулирующего в организме норэпинефрина. Это соедине-
соединение слабо ингибирует обратный захват дофамина, не проявляет антихо-
линергической активности и ингибирует МАО.
Его эффективность в качестве антидепрессанта сравнима с тако-
таковой у трициклических антидепрессантов и с ингибитором захвата
серотонина — флуоксетином. Препарат предпочтительно назначают
при больших депрессиях с ослаблением психомоторной деятельно-
деятельности.
Синонимами препарата являются амфебугамон и веллбутрин.
Флуоксетин (Fluoxetin)
Флуоксетин — 3-[и-(трифторметил)-фенокси]-:М-метил-3-фенилпро-
пиламин G.3.6) получают взаимодействием л-трнфторметилфенола
с 3-(хлор)-М-метил-3-фенилпропиламином в присутствии поташа
[59, 60].
Антидепрессанты
-CH-CH2-Ch2-NH-CH3
\ У- CH-CHj-Cri2-NH-CH3
736
Флуоксетин — фенилпропиламин ингибирует обратный нейрональ-
ный захват серотонина, что предположительно, имеет прямое отноше-
отношение к антпдепрессантному действию. Это же соединение не воздейству-
воздействует или мало воздействует на обратный нейрональный захват
норэпинефрина или дофамина. В дополнение препарат не связывается
с холинергическими, гистаминергическими или а-адренергическими
рецепторами, что, полагают, является причиной побочных эффектов
трициклических антидепрессантов.
Эффективность флуоксетина при лечении пациентов с умеренны-
умеренными депрессиями сравнима с эффективностью трициклических антиде-
антидепрессантов. Препарат способствует повышению настроения, устраняет
чувство страха и напряжения. Он не обладает седативным эффектом.
Флуоксетин применяют при депрессиях, а также при булемических
неврозах. Выбор флуоксетина, тем не менее, предпочтителен в случа-
случаях, когда пациенту противопоказаны седативные, гипотензивные и ан-
тихолинергические побочные эффекты, вызываемые другими антиде-
антидепрессантами.
Синонимом препарата является прозак.
Тразодон (Trazodon)
Тразодон — 2-[3-[4-(./и-хлорфенил)-1-11иперазинил]пропил]-5-триа-
золо[4,3-а]пиридин-3B//)-он G.3.8) синтезируют исходя из 2-хлор-
пиридина, взаимодействием которого с семикарбазидом получают
^-триазол-3-он[4,3-а]пиридин G.3.7). Алкилирование последнего 1-
C-хлорпропилL-C-хлорфенил)пиперазином дает тразодон G.3.8)
[61.62].
а—сь2-сн2—к
N—СНг-СНг—N
- 165-
Глава 7
Полагают, что тразодон в терапевтических дозах ингибирует обрат-
обратный нейрональный захват серотонина. Он не является ингибитором
МАО, не является стимулятором ЦНС. Препарат мало воздействует на
обратный нейрональный захват норэпинефрина или дофамина. В до-
дополнение к отмеченному препарат не связывается с холинергическими,
ос-адренергическими рецепторами.
Синонимами препарата являются томбран, прагмарел, дезирел
и др.
7.4. Амфетамины и другие стимуляторы ЦНС
Амфетамины — синтетические симпатомиметические амины явля-
являются мощными стимуляторами ЦНС, и некоторые из них, в частности
декстроамфетамин (8.1.2.2) и метилфенидат (8.1.2.6), иногда применя-
применяются для лечения депрессивных состояний. Они повышают настроение,
стимулируют двигательную активность, бдительность, позволяют луч-
лучше концентрироваться. Однако, в зависимости от дозы и личности па-
пациента, могут вызвать и разную степень эйфории и часто приводят
к зависимости и привыканию.
ОСНз
и аг-СН2~С"СНз
NH2
8 122
Число разрешенных к медицинскому применению амфетаминов
весьма ограничено, и детально их синтез и свойства будут рассмотрены
в гл. 8 «Стимуляторы ЦНС».
1
2.
->
о.
4.
5.
6.
-7
Список литературы
US Pat. 2.554.736A951).
Ger Pat. 829.167A950).
Gaefliger A. et al/'Helv. Chim. Acta. 37, 472 A954).
Fr. Pat. 1.172.014A955).
Jacob R Compt. Rend. 252, 2117 A961).
Brit. Pat. 858.187A959).
Brit. Pat. 858.188A959).
Hoffsommer R. et aU'J. Org. Chem. 27, 4134 A962).
- 166-
Антидепрессанты
9. Hoffsommer R. et al.//J. Org. Chem. 28, 1751 A963).
10. Hoffsommer R. et al./'J. Med. Chem. 8, 555 A965).
11. Belg. Pat. 584.061 A960).
12. US Pat. 3.205.264A965).
13 Ger. Pat. 1.468.138A963).
14. US Pat. 3.420.851 A969).
15. Ger. Pat. 1.232.161A961).
16. Stack R. et al.//Monatsh. 93, 896 A962).
17. Bickelhaupt F. et aLVMonatsh. 95, 485 A964).
18. Fr. Pat. M 796 A960).
19. Brit. Pat. 908.788 A960).
20. Ger. Pat. 1.189.550A960).
21. US Pat. 3.454.698A969).
22. US Pat. 3.454.554A969).
23. Ger. Pat. 1.288.599A962).
24. Ger. Pat. 1.445.800A962).
25. Fr. Pat. 1.345.936A963).
26. Ger. Pat. 1.288.599A962).
27. Ger. Pat. 1.266.755A962).
28. Belg. Pat. 628.904 A963).
29. Ger. Pat. 1.269.614A962).
30. US Pat. 3.281.469A962).
31. US Pat. 3.215.739A960).
32. US Pat. 3.372.196A968).
33. US Pat. 3.244.748A966).
34. US Pat. 3.271.451 A966).
35. Belg. Pat. 617.967A962).
36. Ger. Pat. 1.287.573A963).
37. Ger. Pat. 1.468.212A962).
38. Engelhardt E. et al.//J. Med. Chem. Ц, 325 A968).
39. Ger. Pat. 1.518.691 A965).US Pat. 3.399.201 A968).
40. Wilhelm M et aL'/Helv. Chim. Acta. 52, 1385 A969).
41. US Pat. 3.000.903A961).
42. Votocek .4./Coll. Czech. Chem. Commun. 4, 271 A932).
43. BielJ. etal. /J. Am. Chem. Soc. 81,2805A959).
44. US Pat. 2.908.688A959).
45. Gardner D et al./.'J. Med. Chem. 2, 133 A960).
46. US Pat. 2.997.422A961).
47. US Pat. 4.016.204A977).
-167-
Глава 7
48. Burger A et al/'J. Am. Chem. Soc. 70, 2198 A948).
49. US Pat. 3.663.696A972).
50. SchmuHzJ etal.',Helv. Chim. Acta. 50, 2455 A967).
51. Fr Pat. 1.508.536A968).
52. SchmultzJ et al./ Chim. Ther. 2, 424 A967).
53. Gei. Pat. 2.059.618A970).
54. Ger. Pat. 2.064.934 A970).
55. Can. Pat. 977.778 A970).
56 US Pat. 3.819 706A974).
57. US Pat. 3.885.046A975).
58. Ger. Pat. 2.500.110A975)
59. US Pat. 4.314.081 A982).
60. US Pat 3.381.009A968).
61. Ger. Pat. 1.645.947A966).
Глава 8
Стимуляторы ЦНС
Огромное число физиологически активных веществ оказывает сти-
стимулирующее действие на ЦНС, однако число используемых с этой це-
целью лекарственных препаратов в медицине весьма ограничено.
Собственно стимуляторами ЦНС или психостимуляторами счита-
считаются вещества, повышающие бдительность и понижающие потребность
во сне, т. е. способствующие временному бодрствованию, повышающие
настроение и способность к адекватному восприятию действительности
и внешних раздражителей, уменьшающие чувство усталости и повы-
повышающие физическую и умственную работоспособность. Это препараты,
применяемые по жизненным показаниям.
Некоторые стимуляторы ЦНС, такие как амфетамины и метилфени-
дат, иногда используются для улучшения настроения у пациентов с де-
депрессией. Однако в отличие от антидепрессантов, рассмотренных в гл. 7
«Антидепрессанты», эти соединения лишь повышают планку уровня
возбудимости ЦНС и никак не действуют на депрессию, поэтому следу-
следует различать термины «антидепрессант» и «психостимулятор».
Стимуляторы ЦНС можно классифицировать следующим образом.
Психомоторные стимуляторы — соединения, оказывающие стиму-
стимулирующее влияние преимущественно на функции головного моз-
мозга и активирующие психическую и физическую деятельность ор-
организма. К ним относятся метилксантины (кофеин, теофиллин.
пентоксифиллин); амфетамины (декстроамфетамин, мета.мфета-
мин). а также метилфенидат и пемолин.
Стимуляторы дыхания, или аналептики, — соединения, которые
наряду с определенной активацией психической и физической
деятельности организма возбуждают преимущественно сосудо-
двигательный и дыхательный центры продолговатого мозга (док-
сапрам, алмитрин).
Препараты, уменьшающие аппетит, или аноректики, — лекарст-
лекарственные средства, активирующие психическую и физическую дея-
деятельность организма, но преимущественно и акцентированно
возбуждающие центр насыщения в гипоталамусе (фентермин,
диэтилпропион).
-169-
Глава 8
Иногда с целью повышения умственной работоспособности приме-
применяются и ноотропы — препараты, улучшающие функциональное со-
состояние мозга. Их действие связано с кровоснабжением и метаболизмом
головного мозга.
8.1. Психомоторные стимуляторы
8.1.1. Метилксантины
Кофеин (Caffeine)
Кофеин — 1,3,7-триметилксантин B3.3.6) — наиболее широко ис-
используемый стимулятор ЦНС. Это алкалоид, содержащийся в ли-
листьях чая (Thea sinensis), в семенах кофе (Coffea arabica), в семенах
какао (Theobroma cacao), в семенах кола (Cola acuminata) и других
растениях, синтез которого будет описан в гл. 23 «Препараты для
лечения заболеваний дыхательной системы».
СНз
23 3 6
Чашка кофе может содержать от 50 до 150 мг кофеина, напитки
семейства кола — от 35 до 55 мг. К числу метилксантинов относятся
теофиллин — 1,3-диметилксантин — основной (характерный) алколо-
ид чая и теобромин — 3,7-диметилксантин B3.3.19) — основной алка-
алкалоид какао. В малых дозах кофеин является относительно слабым
психостимулятором и используется для повышения внимания, а также
облегчения головных болей, связанных с расстройствами мозгового
кровообращения.
Кофеин обладает стимулирующим действием на дыхательный и со-
судодвигательный центры, возбуждает центры блуждающих нервов. Он
оказывает прямое стимулирующее влияние на миокард, может в боль-
больших дозах вызвать тахикардию и аритмию.
Кофеин оказывает двоякое действие на уровень артериального дав-
давления (АД). Центральным механизмом — путем возбуждения сосудо-
двигательного центра препарат повышает уровень АД. Прямым воздей-
воздействием на гладкую мускулатуру сосудистой стенки способствует
-170-
Стимуляторы ЦНС
расширению сосудов.
На лиц с нормальным АД препарат практически не действует, одна-
однако при введении его на фоне гипотензии артериальное давление повы-
повышается (нормализуется). Под влиянием кофеина повышается секреция
желез желудка.
Полагают, что стимулирующее действие кофеина связано с его спо-
способностью конкурентно связываться с рецепторами аденозина — фак-
фактора, уменьшающего процессы возбуждения в мозге. Замещение его
кофеином приводит к стимулирующему эффекту, поскольку метилксан-
метилксантины и аденозин вызывают противоположно направленные эффекты.
Согласно другой точке зрения, ингибируя фосфодиэстеразу, кофеин
увеличивает концентрацию циклического аденозинмонофосфата (цАМФ),
рассматриваемого как вторичный медиатор, при помощи которого осу-
осуществляются физиологические эффекты многих биологически активных
веществ. В частности, под влиянием цАМФ усиливаются процессы гли-
когенолиза, стимулируются метаболические процессы в разных органах
и тканях, в том числе и в ЦНС.
Кофеин применяют для стимулирования психической деятельности,
при утомлении, мигрени, гипотензии.
Синонимы препарата не популярны. К ним относятся кафекон,
коффан и некоторые другие.
8.1.2. Амфетамины, а также метилфенидат
и пемолин
Амфетамины являются мощными синтетическими психостимуля-
психостимуляторами с очень большим потенциалом привыкания. Они повышают
бдительность и способность концентрироваться, временно улучшают
настроение и стимулируют двигательную активность. Однако, в зави-
зависимости от дозы и, что очень важно, личности, они могут вызвать раз-
разную степень эйфории, могут повышать АД, способствовать сокраще-
сокращению сфинктера мочевого пузыря и развитию мидриаза. Длительное
применение амфетаминов часто приводит к раздражительности, бес-
бессоннице, потливости. При отмене препаратов может возникнуть де-
депрессия. Попытки выйти из депрессивного состояния с применением
увеличенных доз тех же амфетаминов приводит к привыканию и зави-
зависимости с образованием порочного круга. Применение еще больших
доч препарата вызывает эйфорию, галлюцинации и другие психотиче-
психотические эффекты с симптомами, весьма сходными с клиническими сим-
симптомами параноидной формы шизофрении.
-171 -
Глава 8
Полагают, что механизм действия амфетаминов заключается в их
способности высвобождать из пресинаптических окончаний эпинефрин
(адреналин) и дофамин, стимулирующие соответствующие рецепторы
в ЦНС. Не исключено также, что они уменьшают нейрональный захват
указанных аминов, а также ингибируют их расщепление МАО. Харак-
Характерным для этого ряда соединений является и влияние на дыхательный
центр, на расположенный в гипоталамусе центр насыщения, что приво-
приводит к подавлению чувства голода, позволяя использовать аналоги рас-
рассматриваемых соединений в качестве анорекшков.
Наряду- с ЦН<3*соеяийе»ш*?адздай 1р$фгда влияют йа нервную шс-
тшу. Они опосредованно стимулируют а- и Р-адренорецепторы. Адре-
номиметические свойства этих соединений схожи со свойствами норэ-
пинефрина (норадреналина), однако во много раз уступают ему по
активности.
По химическому строению амфетамины весьма близки к эпинефри-
ну (адреналину) и норэпинефрину (норадреналину), дофамину, отлича-
отличаясь от них отсутствием гидроксильных групп в ароматическом кольце
и алифатической цепи.
амфетамин
эпинефрин
Амфетамины используют при лечении нарколепсии, для повыше-
повышения работоспособности, при утомлении, лечении синдрома отсутствия
внимания у детей, а также при лечении ожирения. Эффекты амфетами-
амфетаминов могут потенцироваться трициклическими антидепрессантами, ин-
ингибиторами МАО, ацетазоламидом, кокаином, фуразолидоном, пропок-
сифеном, бикарбонатом натрия и другими препаратами, подщела-
подщелачивающими мочу. Одновременно антагонистами амфетаминов являются
препараты, подкисляющие мочу, — аскорбиновая и глутаминовая ки-
кислоты, фенотиазины, галоперидол, мефенамин. препараты лития, фрук-
фруктовые соки.
Декстроамфетамин (Dextroamphetamine)
Декстроамфетамин — О-2-амино-1-фенилпропан (8.1.2.2) предло-
предложено получать разными методами. Первый способ заключается
в использовании методики реакции Лейкарта для взаимодействия
метилбензилкетона и формиата аммония с получением формамида
- 172-
Стимуляторы ЦНС
(8.1 2.1), который гидролизуют в 2-амино-1-фенилпропан (8.1.2.2)
соляной кислотой [1]. Аналогичная методика предложена с исполь-
использованием формамида вместо формиата аммония [2].
сн3
Второй способ заключается в моноалкилировании аммиака 2-хлор-
1-фенилпропаном [3].
сн3
-сн2-сн-а
СН3
-CH2-CH-NH2
8 122
Согласно третьему способу, 2-амино-1-фенилпропан (8.1.2.2)
предложено получать реакцией Гофмана из амида а-
бензилпропионовой кислоты [4, 5].
сн3
-CH2-Cri-CONH2
NaOBr
СН3
-CH2-Ch-NH2
8122
Полученный любым из перечисленных методов 2-амино-1-фенил-
пропан (амфетамин) разделяют на изомеры с помощью D-винной кис-
кислоты, выделяя требуемый декстроамфетамин — О-2-амино-1-фенилпро-
пан (8.1.2.2) [6, 7].
Декстроамфетамин является мощным стимулятором нервной сис-
системы, оказывающим свое действие путем высвобождения из пресинап-
пресинаптических нервных окончаний дофамина и норэпинефрина, стимулируя
тем самым центральные дофаминергические и норадренергические ре-
рецепторы. В определенных дозах препарат усиливает процесс возбужде-
возбуждения в ЦНС, уменьшает утомляемость, улучшает настроение и работо-
работоспособность, понижает потребность во сне, уменьшает аппетит.
Декстроамфетамин следует применять с осторожностью и только по
медицинским показаниям при лечении нарколепсии, последствий энце-
энцефалита и других заболеваний, сопровождающихся апатией, сонливо-
сонливостью, астенией, для временного повышения физической и умственной
- 173-
Глава 8
работоспособности, для лечения синдрома отсутствия внимания у де-
детей, а также при лечении ожирения.
Синонимами препарата являются D-амфетамин, дексамфетамин.
дексалон, темподекс, зенидекс и многие другие.
Метамфетамин (Methamphetatnine)
Метамфетамин — (-^)-К-а-диметилфенилэтиламин (8.1.2.3) можно
пол\ чать восстановлением (-)-эфедрина водородом с использовани-
использованием в качестве катализатора палладия на угле [8].
H2/Pd-C /=\ ?Нз
— *¦ d. />— CH2-CH-NHCH3
—CH-NHCH3
8 123
Другим способом получения метамфетамина является восстановле-
восстановление метилбензилкетона водородом в присутствии метиламина [9].
о
;н2-с-сн3
CH3NH2/H2 /=
CH3
л /f—CH2-CH-NriCH3
8 123
Препарат повторяет свойства декстроамфетамина и применяется по
тем же показаниям.
Синонимами препарата являются перитин, филопон, дзоксин, ме-
метам пеке и др.
Метширенидат (Methylphenidat)
Метилфенидат — метиловый эфир а-фенил-2-пиперидилук-
сусной кислоты (8.1.2.6), получают по следующей схеме. Арили-
рованнем бензилцианида 2-хлорпиридином в присутствии осно-
основания получают а-феиил-ос-B-пиридил)ацетонитрил (8.1.2.4).
Сернокислым гидролизом нитрильной группы в кислотную и по-
последующей ее этерификацией метанолом получают метиловый
эфир ос-фенил-а-B-пиридил)пиридилукс>сной кислоты (8.1.2.5).
Пиридинный фрагмент в последнем восстанавливают в пипери-
диновый водородом над платиной с получением метилфенидата
(8.1.2.6) [10, 11, 12].
- 174-
Стимуляторы ЦНС
-CH2-CN
2 СН3ОН / HCI
8 1 2.4
,ОСН3
1125
8 126
Метилфенидат является стимулятором ЦНС сходным с амфетами-
амфетаминами, однако в обычных дозах имеет более выраженное действие на
чметвенную деятельность, чем на физическую или двигательную. В те-
терапевтических дозах он не повышает кровяное давление, скорость ды-
дыхания или скорость работы сердца. Все эти эффекты, а также ряд дру-
других, связанных с общим возбуждением ЦНС (тремор, тахикардия,
гиперпирексия, состояние замешательства), возникают при применении
больших доз. Применяется для лечения средних депрессий и апатичных
состояний, а также в качестве дополнительного средства при лечении
синдрома отсутствия внимания у детей.
Синонимами препарата являются меридил, риталин и др.
Пемолин (Pemolin)
Пемолии — 2-амино-5-фенил-2-оксазолин-4-он (8.1.2.7) получают
конденсацией этилового эфира миндальной кислоты с гуанидином
[13, И].
^ h— CH-COOC2H5
NH
H2N-C-NH2
8 1 2.7
Пемолин — уникальный по структуре стимулятор ЦНС, проявляю-
проявляющий минимум симпатомиметических эффектов, фармакологически по-
повторяет свойства амфетаминов и метилфенидата, но имеет меньший
потенциал к привыканию, чем другие стимуляторы ЦНС. Препарат по-
повышает бдительность и двигательную активность и вызывает слабую
- 175-
______^___________________ Глава 8
эйфорию, что, возможно, связано с увеличением дофаминергических
передач в структурах ЦНС.
Пемолин применяют при нарколепсии и повышенной сонливости,
а также при лечении синдрома отсутствия внимания у детей.
Синонимами препарата являются традон, дельтамин, волитал. фе-
ноксазол, антимеран, цилерт и др.
8.2. Стимуляторы дыхания, или аналептики
Аналептики — препараты, стимулирующие действие на дыхатель-
дыхательный и сосудодвигательныи центры продолговатого мозга.
Аналептики, в первую очередь, используются в качестве антагони-
антагонистов при передозировке депрессантов (гипнотиков, наркотиков). Имея
достаточно малую широту терапевтического действия, даже при не-
небольшой передозировке они могут вызвать стимуляцию других образо-
образований ЦНС, вызывая ряд нежелательных побочных эффектов, таких, как
стимуляция сердечно-сосудистой системы, гиперрефлексия, рвота, су-
судороги.
Доксапрам (Doxapram)
Доксапрам — 1-этил-4-B-морфолиноэтил)-3,3-дифенил-2-пирро-
лидон (8.2.4) получают по следующей схеме. Дифенилацетонитрил
в присутствии амида натрия алкилируют 1-этил-З-хлорпирроли-
дином с получением A-этил-3-пирролидинил)дифенилацетонитрила
(8.2.1). Кислотным гидролизом нитрильной группы получают
A-этил-3-пирролидинил)дифенилуксусную кислоту (8.2.2). Взаи-
Взаимодействие последней с трехбромистым фосфором (хлористым
тионилом, бромистым тионилом, уксусным ангидридом) приво-
приводит к перегруппировке с раскрытием пирролидинового кольца
и последующим замыканием в пирролидиновое с получением 1-
этил-4-B-бромэтил)-3,3-дифенил-2-пирролидона (8.2.3). Замеще-
Замещением атома брома на морфолиновую группу получают доксапрам
(8.2.4) [15, 16, 17, 18].
О
rl2SO4
РВг3
-176-
Стимуляторы ЦНС
СН2-СН2-Вг
СН2-СН2—N О
8.2.4
Доксапрам увеличивает частоту и глубину дыхания. Препарат при-
применяют при постнаркозной депрессии дыхания, при депрессиях дыха-
дыхания вызванных применением лекарств.
Синонимами препарата являются доксаприл, допрам и др.
Ллмитрин (Almitrin)
Алмитрин — 2,4-бис(аллиламино)-6-[4-[бис(«-фторфенил)метил]-1-
пиперазинил]-^-триазин (8.2.6) синтезируют взаимодействием 1-[бис-
(п-фторфенил)метил]пиперазина с цианурил хлоридом с получени-
получением 2,4-дихлор-6-[4-[бис(п-фторфенил)метил]-1-пиперазинил]-5-триа-
зина (8.2.5). Вводя последний в реакцию с аллиламином, получают
алмитрин (8.2.6) [19, 20, 21, 22].
0
/—\
СН — N N-H
CI
h2n-ch2-ch=ch2
СН—N N—(\ N
NH-CH2-CH=CH2
8.2 6
NH-CH2-CH=CHZ
-177-
Глава 8
Алмитрин, как и доксапрам, увеличивает частоту и глубину дыха-
дыхания. Кроме того полагают, что он перераспределяет легочное кровооб-
кровообращение, увеличивая его в альвеолах, что приводит к относительно
лучшей вентиляции легких. Имеет более пролонгированное действие,
чем доксапрам.
Синонимами препарата являются вектарион, дуксил и др.
8.3. Препараты, подавляющие аппетит
(аноректики)
Группа структурно родственных амфетаминам препаратов, подав-
подавляющих аппетит и используемых при терапии ожирения, называется
аноректиками. Соединения данной группы проявляют аналогичный ам-
амфетаминам спектр фармакологического и токсикологического действия
и используются в качестве вспомогательных средств при лечении ожи-
ожирения, осуществляемого при индивидуально составленной программе
ограничения калорийности принимаемой пищи. Ни одно из используе-
используемых веществ не превышает по активности амфетамин, однако меньший
потенциал зависимости делает их применение предпочтительным. Ме-
Механизм действия этих препаратов сходен с таковым амфетаминов. Они
активируют центр насыщения в гипоталамусе, тем самым уменьшая
аппетит. Аноректики могут усиливать эффекты наркотиков, барбитура-
барбитуратов, алкоголя и других депрессантов ЦНС.
Фентермин (Phentermin)
Фентермин — а,ос-диметилфенилэтиламин (8.3.4) отличается от
амфетамина наличием дополнительной метильной группы в сс-по-
ложении к аминогруппе. Синтез препарата осуществляют исходя из
бензальдегида, конденсацией которого с 2-нитропропаном получа-
получают карбинол (8.3.1). Восстановлением нитрогруппы в последнем
получают 2-амино-2-метил-1-фенилпропанол (8.3.2). Взаимодейст-
Взаимодействием с хлористым тионилом гидроксильную группу последнего за-
замешают на атом хлора с получением 2-амино-2-метил-1-фенилпро-
пилхлорида (8.3.3). Восстановлением последнего водородом с исполь-
использованием в качестве катализатора палладий на карбонате кальция
получают фентермин (8.3.4) [23, 24].
СНз
-C-NO2 >
СНз
г—^
-сн-
04
СНз
СНз
H2/Rane>-Ni /=\
СНз
-CH-C-NH2
он СНз
332
-178-
Стимуляторы ЦНС
8 3.3
H2/Pd-CaCO3 /=\
СН3
-CH2-C-NH2
СН3
8.3.4
Действие препарата заключается в активации центра насыщения
в гипоталамусе и уменьшении аппетита, что при ограничении калорий-
калорийности пиши приводит к уменьшению массы тела.
Синонимами препарата являются ионамин, линил, липопилл, тера-
мин и др.
Диэтилпропион (Diethylpropion)
Диэтилпропион — 1-фенил-2-диэтиламинопропанон (8.3.6) полу-
получают бромированием пропиофенона в а-бромпропиофенон (8.3.5)
с последующим замещением атома брома на диэтиламинную груп-
группу [25, 26].
-С-СН2-СН3
Вг2 /=\
-С-СН-СНз
Вг
HN(C2H5J
С У-С-СН-СНз
N(C2H5J
835
8.3 6
Диэтилпропион, в принципе, повторяет все характерные для амфе-
амфетаминов фармакологические свойства и применяется для лечения ожи-
ожирения с ограничением калорийности пищи.
Синонимами препарата являются амфепрамон, анорекс, аписат, ре-
генон, тенуат. тепанил и др.
Список литературы
Бобранский Б. и др./ОКПХ, 14, 410 A941).
Магдисон О. и др./'ЖОХ, Д, 339 A941).
Patrick Т. et al.//J. Am. Chem. Soc. 68, 1009 A946).
WoodruftE. et al./.'J. Am. Chem. Soc. 60, 465 A938).
Buck J. 7J. Am. Chem. Soc. 54, 3661 A932)
Brit. Pat. 508.757A939).
US Pat. 2.276.508A942).
Emde H. /Helv. Chim. Acta. 12, 365 A929).
-179-
Глава 8
9. Ogata A.m. Pharm. Soc. Japan. 45_i, 751 A919).
10. US Pat. 2.507.631 A950).
11. US Pat. 2.957.880A960).
12. Panizzon L./'Helv. Chim. Acta. 27, 1748 A948).
13. US Pat. 2.892.753A959).
14. Traube W. et al./'Ber. 46, 2077 A913).
15. US Pat. 3.192.230A965).
16. US Pat. 3.192.206A965).
17. Belg. Pat. 613.734A962).
18. Lunsford С et al.//J. Med. Chem. 7, 302 A964).
19. Fr. Pat. 2.019.646A969).
20. Ger. Pat, 1.947.332A970).
21. US Pat. 3.647.794A972).
22. Bnt. Pat. 1.256.513A969).
23. US Pat. 2.408.345A946).
24. US Pat. 2.590,079A952).
25. US Pat. 3.001.910A961).
26. Hyde E. et al.//J. Am. Chem. Soc. 50, 2287 A928).
Глава 9
Противоэпилептические
средства
Эпилепсия — хроническое заболевание, проявляющееся пароксиз-
мальными приступами, обусловленными патологическим возбуждением
церебральных нейронов.
Эпилепсия сопровождается различной степенью нарушения созна-
сознания. Существуют судорожные и бессудорожные формы приступов эпи-
эпилепсии, каждая из которых характеризуется своеобразной клинической
картиной. Однако практически для всех разновидностей эпилепсии ха-
характерны определенные изменения в электроэнцефалограммах.
Припадки генерируются в эпилептогенном очаге головного мозга
и могут ограничиваться подрагиванием конечноеieu. Если же судорож-
судорожный разряд начинает распространяться и возбуждение охватывает оба
полушария головонго мозга, то начинаются припадки. Выделяют боль-
большие эпилептические судорожные припадки (grand mal) и малые присту-
приступы эпилепсии (petit mal). Однако в самом общем случае судороги — это
непроизвольные мышечные сокращения, которые могут возникнуть
в результате патологических процессов как внутри, так и вне головного
мозга. Они могут возникнуть под воздействием токсинов, травм, гипер-
гипертермии, при передозировке лекарств или при отмене лекарственной за-
зависимости.
Для лечения эпилепсии применяются различные препараты, в том
числе барбитураты и бензодиазепины, которые используются для сня-
снятия острых судорожных состояний, возникающих и в результате иных,
чем эпилепсия, причин.
Полагают, что в генезисе эпилепсии могут быть задействованы раз-
различные механизмы и на любой из них можно оказать лекарственное
воздействие.
С клинической точки зрения формально противоэпилептические
препараты в основном делятся на 2 категории:
1) эффективные при больших припадках (фенитоин, карбамазе-
пин, фенобарбитал, примидон);
2) эффективные при малых припадках (этосуксимид, ацетазола-
мид. клоназепам. триметадион. вальпроевая кислота).
-181 -
Глава 9
Лечение каждого частного случая эпилепсии производят опреде-
определенными препаратами, начиная с одного наименования, однако впо-
впоследствии для полного конгроля над заболеванием иногда требуется
второй, а нередко и третий, препарат. Частое изменение доз или препа-
препаратов не рекомендуется.
С химической точки зрения противоэпилептические препараты это'
• производные гидантоинов (фенитоин, мефенитоин и этотоин);
• барбитураты (фенобарбитал, мефобарбтал, метабарбтал. а также
примидон);
• сукцинимиды (этосуксимид, метсуксимид, фенсуксимид);
• бензодиазепины (диазепам, хлордиазепоксид. клоназепам, ло-
разепам);
• оксазолидиндионы (триметадион, параметадион);
• вальпроевая кислота, карбамазепин, аиетазоламид.
Механизм действия противоэпилептических средств недостаточно
ясен, поскольку не ясна и этиология эпилепсии. Очевидно, что у раз-
различных препаратов он различен. Одни препараты блокируют натриевые
каналы, другие воздействуют на ГАМК-систему, усиливая ГАМК-
зависимое торможение ЦНС, третьи изменяют внутриклеточное соот-
соотношение концентраций ионов К* и Са2+, четвертые блокируют N-метил-
D-аспартатный (NMDA) рецептор, ответственный за высокочастотные
разряды, возникающие при эпилепсии.
Способы синтеза противоэпилептических препаратов будут рас-
рассмотрены согласно их химической классификации.
9.1. Производные гидантоинов
Механизм действия гидантоинов окончательно не выяснен. Соглас-
Согласно одной из гипотез, гидантоины предупреждают высокочастотную ак-
гивацию эпилептогенного очага, а также способствуют выведению из
нервных клеток ионов Na . что снижает возб>димость нейронов и пре-
препятствует их активации при поступлении к ним импульсов из эпилепто-
эпилептогенного очага.
Фенитоин (Phenytoin)
Фенитоин -- 5,5-дифенилимидазолидин-2,4-дион (9.1.1) предложе-
предложено синтезировать двумя способами. Первый способ предполагает
непосредственное взаимодействие бензила с мочевиной с пол>че-
нием искомого продукта (9.1.1) [1].
- 182-
Противоэпилептические средства
о
H2N-C-NH2
N-H
9 1 1
Второй способ заключается во взаимодействии бензофенона с циа-
цианидом натрия в присутствии карбоната аммония с одновременной цик-
циклизацией полеченного продукта — карбоксиаминонитрила и его пере-
перегруппировкой в условиях реакции в фенитоин (9.1.1) [2].
0*4
По действию на ЦНС фенитоин можно считать отличным антиэпи-
iem ическим препаратом с незначительным седативным эффектом. Да-
Даже в больших дозах он не вызывает гипноза. Предполагается, что фени-
гонн способствует выведению ионов Na^ из нервных клеток, за счет
чего снижается возбудимость нейронов, что препятствует их активации
при пост>плении импульсов из эпилептогенного очага. Кроме того, фе-
Н1поин уменьшает приток ионов Ю в ходе реполяризации. Не исключе-
исключено, что именно в результате перераспределения этих ионных потоков
фенитоин значительно замедляет распределение возбуждения в мозге.
Фенитоин применяют для лечения эпилепсии, главным образом при
больших припадках.
Основными синонимами фенитоина являются дифенин, алепсин,
дилантин и солантил.
Этотоин (Ethotoin)
Этогоин — 3-этил-5-фенилимидазолидин-2,4-дион (9.1.5) получают
способом, примерно аналогичным вышеописанному и заключаю-
заключающемся во взаимодействии оксинитрила, полученного из бензальде-
гица (9.1.2), с мочевиной или гидрокарбонатом аммония с промежу-
промежуточным образованием производного мочевины (9.1.3), который в
кислых условиях циклизуется в 5-фенилгидантоин (9.1.4). Алкили-
рование последнего этилйодидом приводит к этотоину (9.1.5) [3, 4].
-183-
Глава 9
Q^-CH-C
Н2.МСОМН2ОГ N
C2H5i
9 1 4
Этотоин менее активен и менее токсичен, чем фенитоин. Применя-
Применяют по тем же показаниям, что и фенитоин, т. е. для конгроля над боль-
большими и сложными припадками,
Основным синонимом препарата является пеганон.
9.2. Барбитураты
Эффективность барбитуратов в качестве антиэпилептнческих
средств может быть отнесена к их воздействию на возбудимость нейро-
нейронов эпилепто1еннот очага, а также ГАМК-ергическую передачу в ЦНС
путем повышения ингибирующего действия ГАМК. Более того, барон-
бароншу раты могут уменьшать возбуждающие эффекты глутамата в синапсах.
В настоящее время не выяснено, который из этих предполагаемых ме-
механизмов более важен для проявления антиэпилептической активности.
Фенобарбитал (Phenobarbital)
Фенобарбитал — 5-зтил-5-фенилбарбитуровая кислота D.1.4), спо-
способы синтеза которого были уже описаны в гл. 4 «Снотворные
средства (гипнотики и седативные препараты)». Препарат широко
используется как самостоятельно, так и в составе различных комби-
комбинированных лекарственных средств.
2н5„
4 1 4
- 184-
Противоэпилептические средства
Фенобарбитал заметно понижает возбудимость двигательных цен-
центров головного мозга, и поэтому его широко используют при лечении
эпилепсии как при малых, так и при больших припадках, при лечении
хореи и спастических параличей.
Синонимами препарата являются люминал, адонал, седонал и мно-
многие другие.
При эпилепсии применяются также такие барбитураты, как мефо-
барбитал D.1.8) и метарбитал D 1.9), описанные выше.
о с2н5
Примидон (Primidone)
Примидон — 5-этил-5-фенилгексагидропиримидинднон-4,6 (9.2.1)
получают взаимодействием диамида этилфенилмалоновой кисло-
кислоты с формамидом [5, 6]. Альтернативными способами являются
электролитическое восстановление фенобарбитала или каталити-
каталитическое восстановление соответств) ющей 2-тиобарбитуровой кис-
кислоты [7].
О
H-C-NH2
Примидон по химическому строению близок к фенобарбиталу
с тем отличием, чго карбонильная группа в положении С2 заменена на
метиленовую Эта модификация привела к получению препарата
с сильным противосудорожным действием без выраженного снотвор-
снотворного эффекта.
Примидон применяют главным образом при больших припадках.
Основными синонимами являются гексамидин и милепсин.
-185-
Глава 9
9.3. Сукцинимиды
Сукцинимиды — группа препаратов, производных имида янтарной
кислоты, используемых при малых формах эпилепсии в отсутствие
припадков.
Этосуксимид (Ethosuximide)
Этосуксимид — 3-этил-3-метилпирролидин-2,5-дион (9.3.4) полу-
получают исходя из метилэтилкетона и циануксусного эфира, которые
конденсируют по Кновенагелю, и к полученному продукту (9.3.1)
присоединяют циановодород. После кислотного гидролиза и декар-
боксилирования синтезированного динитрила (9.3.2) получают 2-
метил-2-этилянтарную кислоту (9.3.3). Взаимодействием последней
с аммиаком получают диаммониевую соль, при последующем на-
нагревании которой происходит гетероциклизация в этосуксимид
(9.3.4) [8. 9].
н3с
с2н5о
н3с соос2н5
)с=с< _
Н5С2' С =N
HCN
СНз
C2h5-C—Ch-COOC2H5
N=C C=N
9.3.2
СН3
с2н5-с-сн2-соон
соон.
9.3.3
9 3.1
NH-)
СНз
i Ь-с2н5
н
934
Эгосуксимид — противосудорожный препарат, применяющийся
при малых формах эпилепсии.
Выпускается также под названиями аксамид, суксилен, ронтон
и пикнолепсин.
Фенсуксимид (Phensuximide)
Фенсукси.мид — 1-метил-3-фенилпирролидин-2,5-дион (9.3.5) син-
синтезируют взаимодействием фенилянтарной кислоты или ее ангид-
ангидрида с метиламином [10, 11].
и ,>- сн-сн2—соон
соон
CH3NH2
^M-'W
CH3NH2
N
СН3
9 3.5
-186-
Противоэпилептические средства
Фенсуксимид так же, как и этосуксимид является противосудорож-
ным препаратом, применяющимся при малых формах эпилепсии.
Выпускается также под названием милонтин.
9.4. Вальпроевая кислота
Ваяьпроееая кислота (Valproic acid)
Вальпроевая кислота — 2-пропилвалериановая кислота (9.4.3) по-
получается алкилированием циануксусного эфира двумя молями про-
пилбромида с получением дипропилциануксусного эфира (9.4.1).
Гидролизом и декарбоксилированием карбэтоксильной группы по-
получают дипропилаиетонитрил (9.4.2), который гидролизуют в валь-
проевую кислоту (9.4.3) [12, 13, 14, 15].
C2h5C
2 СН3-СН2-СН2—ВГ
C2H5ONa
Cri3 -СН2 -СН2—С-СООС2Н5
СН3-СН2—СН2
94 1
СН3-СН2-СН2\
Vh-c=n
CH3-Cri2-CH2
9.4.2
NaOH
СН3-СН2-СН2\
усн-соон
СН3-СН2-СН2
9.4 3
Вальпроевая кислота и ее соли являются новой группой противо-
эпилептических препаратов, отличающаяся от известных, как по хими-
химической структуре, так и по механизму действия. Предполагается, что
она воздействует на метаболизм ГАМК. Показано, что вальпроевая ки-
кислота повышает уровень ГАМК в мозге путем конкурентного ингибиро-
вания ГАМК трансаминазы и дегидрогеназы янтарного полуальдегида.
Препарат оказывает не только противосудорожное действие, но
и улучшает психическое состояние больных.
Вальпроевая кислота, как и сукцинимиды, используется при эпи-
эпилепсии в отсутствие припадков, а клиническая эффективность ее пре-
превышает таковую сукцинимидов.
Наиболее распространенными синонимами препарата являются де-
папини конвулекс.
-187-
Глава 9
9.5. Карбамазепин
Карбамазепин (Carbamazepine)
Карбамазепин — 5#-дибенз[Ь,1]азепин-5-карбоксамид (9.5.2) синте-
синтезируют взаимодействием 5#-дибенз[Ь,г]азепина с фосгеном с обра-
образованием 5-хлоркарбокси-5#-дибенз[Ь,г]азепина (9.5.1) и последую-
последующим его взаимодействием с аммиаком с получением целевого кар-
бамазепина (9.5.2) [16]. Альтернативным путем синтеза является
непосредственное взаимодействие 5Н-дибенз[Ь,1]азепина с цианатом
калия [17].
косы
Карбамазепин применяют главным образом при больших припад-
припадках При малых припадках недостаточно эффективен. Имеются данные
о ряде серьезных побочных действий.
Синонимом препарата является тегретол.
9.6. Бензодиазепины
Бензодиазепины главным образом используются в медицине в каче-
качестве транквилизаторов. Однако они с успехом применяются и при эпи-
эпилепсии для контроля состояния длительных судорог. Наиболее широко
применяются диазепам E.1.2) и хлордиазепоксид E.1.22), синтез кото-
которых описан в гл. 5 «Анксиолитики (транквилизаторы)».
5 1 2
СНз
5 1 22
NHCH3
Третьим препаратом бензодиазепинового ряда, нашедшим приме-
применение при лечении эпилепсии, является клоназепам.
- 188-
Противоэпилептические средства
Клоназепам (Clonazepam)
Клоназепам — 5-(о-хлорфенил)-1.3-дигидро-7-ни гро-2#-1,4-бензо-
диазепин-2-он (9.6.5) получают по стандартной схеме получения
производных 1,4-бензодиазепинов, но с той разницей, что акцеп-
акцепторную (в данном случае нитро) группу при С7 бензодиазепиновой
системы вводят на последней стадии синтеза. Синтез клоназепама
исходит из 2-\лор-2'-нитробензофенона, который восстанавливают
в 2-хлор-2 -аминобензофенон (9.6.1) водородом над никелем Ренея.
Аминопроизводное ацилируют бромангидридом бромуксусной ки-
кислоты бромацетамид (9.6.2) и далее взаимодействием с аммиаком
переводят в аминоацетамид (9.6.3). Последний под действием пи-
пиридина циклизуют в 5-B-хлорфенил)-2,3-дигидро-1#-1,4-бензодиа-
зепин-2-он (9.6.4). Нитрование полученного продукта в мягких ус-
условиях нитратом калия в серной кислоте приводит к клоназепаму
(9.6.5) [18, 19,20,21,22,23].
!г—СН2-С-Вг
964
HNO3
Препарат оказывает выраженное противосудорожное, а также
центральное миорелаксирующее, анксиолитическое и седативное дей-
действие.
Клоназепам применяют при эпилепсии, сомнамбулизме, различ-
различных формах мышечного гипертонуса, бессоннице (особенно у боль-
больных с органическими поражениями головного мозга), психомоторном
возбуждении.
Синонимами препарата являются клонопин и ривотрил.
- 189-
Глава 9
9. Z Лцетазоламид
А цетазолам ид (A cetazolam ide)
Ацетазоламид — 5-ацетамидо-1,3,4-тиадиазол-2-сульфонамид (9.7.5).
Синтез аиетазоламида основывается на получении 2-амино-5-
меркапто-1,3,4-тиадиазола (9.7 2), который получают взаимодей-
взаимодействием тиоцианата аммония с гидразином с образованием гидра-
зино-К,1\'-бис-(тиомочевины) (9.7.1), которая под действием фос-
фосгена циклизуется в тиазол (9.7.2). Ацилируя последний
ангидридом уксусной кислоты, получают 2-ацетиламино-5-мер-
капто-1.3,4-тиадиазол (9.7.3). Продукт хлорируют в 2-ацетилами-
но-5-меркапто-1,3.4-тиадиазол-5~сульфонилхлорид (9.7.4). кото-
который взаимодействием с аммиаком трансформируют в ацетазол-
ацетазоламид (9.7.5) [24, 25].
:nH,SCN + H2N-NH
s s
H2N -C-NH-NH-C-Nri2
97 1
(CH3CO);O_
*
H2N S SH
972
N N
1 X
СНОСОМ-S Sh
973
N-N
CH3CONH S SO2CL
N N
jl ji
CH3CONH 5 SO2NH2
975
Ацетазоламид применяют при эпилепсии в отсутствие припадков,
а также в сочетании с другими антиэпилептическими препаратами.
Наиболее распространенным синонимом препарата является диа-
мокс.
9,8. Оксазолидины
Эта группа соединений представлена двумя препаратами, которые
применяются только при малых формах эпилепсии в отсутствие при-
припадков.
TpimemaduoH (Trimethadione)
Триметадион — 3.5,5-триметилоксазолидин-2,4-дион (9.8.2) синте-
синтезируют метилированием диметилсульфатом 5.5-триметилоксазо-
лидин-2,4-диона (9.8.1), который, в свою очередь, получают цикло-
конденсацией эфира 2-гидроксиизомасляной кислоты с мочевиной
[26,27,28].
-190-
Противоэпилептические средства
сн3
H3C-C-COOC2ri5
он
?"з
О Uch3 <CH3OJSO2
QH3
H
981
CH3
982
Тримегадион применяют при малых формах эпилепсии, не под-
поддающихся лечению другими препаратами.
Синонимами препарата являются триметин и троксидон.
Параметадион (Paramethadione)
Параметадион — 5-этил-3,5-диметилоксазолидин-2,4-дион (9.8.3),
отличающийся от триметадиона лишь заменой одного метального
радикала на этильный, получают по совершенно аналогичной схеме
исходя не из 2-гидроксиизомасляной кислоты, а из 2-гидрокси-2-
метилмасляной кислоты [29].
СНз
9 [-С2Н5
СНз
983
Параметадион также применяют при малых формах эпилепсии.
Синонимом препарата является парадной.
3.
4
6.
7
S
9.
10
11
12
Список литературы
Biltz H ','Вег. 41, 1391 A908).
US Pat. 2.409 754A946).
Pinner A VBer. 2J, 2325 A888).
US Pat. 2.793.157A946).
US Pat. 2.578.847A951).
Ger. Pat. 843.413A950).
Brit. Pat. 666 D27 A952).
US Pat. 2.993.835A961).
Sircar G et al./'J. Chem. Soc. 1927, 1252.
US Pat. 2.643 258A953).
Long L et al.//J. Am. Chem. Soc. 73. 4895 A951).
Fr. Pat. M 2.442 A962).
-191 -
Глава 9
13. Brit. Pat. 980.279A963).
14. US Pat. 3.325.361A967).
15. WiemannetA. al./'Bull. Soc. Chim. France 1958, 199.
16. US Pat. 2.948.718A960).
17. D.D.R.Pat. 133.052A977).
18. Strenbach L. et al.'/J. Med. Chem. 6, 261 A963).
19. US Pat. 3.116.203A963).
20. US Pat. 3.123.529A964).
21. US Pat. 3.121.114A964).
22. US Pat. 3.203.990A965).
23. US Pat. 3.335.181A967).
24. US Pat, 2.554.816 A951),
25. Robin R et al.'/J. Am. Chem. Soc. 72, 4890A950).
26. US Pat. 2.559.011A951).
27. US Pat. 2.575.692A951).
28. Spiehnan L ;7J. Am. Chem. Soc. 66, 1244 A944).
29. US Pat. 2.575.693 A951).
Глава 10
Средства, применяемые
при паркинсонизме
Паркинсонизм — дегенеративное, медленно прогрессирующее за-
заболевание ЦНС, связанное с поражением базальны.х ганглиев и характе-
характеризующееся четырьмя основными симптомами: замедленностью, ско-
скованностью движений, ригидностью и тремором в покое. Этиология
болезни неизвестна.
Наиболее вероятной причиной перечисленных выше двигательных
нарушений может быть недостаток дофамина, который оказывает тор-
тормозящее влияние на регуляцию функций спинного мозга.
С другой стороны, в регуляции экстрапирамидной системы задейст-
задействованы холинергические нейроны.
Больше века лечение паркинсонизма основывалось на использова-
использовании центральных антихолинергических веществ. Вплоть до недавнего
времени при паркинсонизме использовались различные препараты ал-
алкалоидов белладонны, характерной особенностью которых является
холинолитическое действие, т. е. способность уменьшать чувствитель-
чувствительность к ацетилхолину — медиатору холинергических синапсов.
На сегодняшний день накопилось достаточное количество фактов,
позволяющих утверждать, что паркинсонизм является следствием дис-
дисбаланса между действием дофаминергической и холинергической сис-
систем и что лечение паркинсонизма должно заключаться либо в блокирова-
блокировании избыточной стимуляции холинергической системы, либо в норма-
нормализации функциональной активности дофаминергической системы.
Следовательно, одним из подходов фармакотерапии паркинсонизма
может заключаться в устранении дефицита дофамина. Поскольку сам
дофамин не проникает через гематоэнцефалический барьер, с этой це-
целью использу ют прекурсор дофамина — леводопу либо препараты, вы-
высвобождающие дофамин, либо агонисты дофаминовых рецепторов, ли-
либо ингибиторы инактивации дофамина. С другой стороны, при лечении
паркинсонизма следует применять антихолинергические препараты.
Исходя из вышесказанного, лечение паркинсонизма должно быть
основано на применении 2 групп веществ:
1) средств, стимулирующих дофаминергические системы мозга;
2) средств, ингибирующих холинергические системы мозга.
-193-
Глава 10
10.1. Средства, влияющие на дофалшнергичесние
системы мозга
В медицинской практике применяются четыре типа дофаминерги-
ческих препаратов, которые могут быть охарактеризованы как прекур-
прекурсоры дофамина (леводопы), препараты, высвобождающие дофамин
(амантадин), агонисты дофаминовых рецепторов (бромкриптин), инги-
ингибиторы инактивации дофамина (селегилин).
Прекурсоры дофамина позволяют создать повышенные концентра-
концентрации дофамина. Другая группа — препараты, высвобождающие дофа-
дофамин, были обнаружены случайно при создании противовирусного пре-
препарата амантадина. Препарат может быть полезен пациентам, у которых
имеется депо дофамина. Третья группа — агонисты дофаминовых ре-
рецепторов — является группой вспомогательных препаратов и позволяет
проводить лечение меньшими дозами леводопы. Наконец, четвертый
тип препаратов, который представлен селегилином является ингибито-
ингибитором разновидности моноаминооксидаз (МАО-В) — фермента, обеспе-
обеспечивающего внутриклеточную инактивацию дофамина в пресинаптиче-
ских нервных окончаниях.
Леводопа (Levodopa)
Леводопа — (-)-3-C,4-дигидроксифенил)-Ь-аланин A0.1.1) пред-
представляет собой левовращающий изомер диоксифенилаланина, ис-
используемый в качестве предшественника дофамина. Существует не-
несколько способов получения леводопы, как полусинтетических,
заключающихся в микробиологическом гидроксилировании L-тиро-
зина A0.1.1) [1, 2], так и чисто синтетических.
Окисление L-тирозина, предусматривающее селективное введение
гидроксильной группы в положение Сз бензольного кольца тирозина,
можно осуществить и чисто синтетическим п>тем, применяя в качестве
окислителя смесь перекиси водорода и сульфата двухвалентного железа
в воде при постоянной подаче кислорода [3].
но
\ Н2О2 / FeSO4
/г-сн2-сн-соон * но-<\
NH2
СН2-СН-СООН
NH2
10 1 1
Другой путь синтеза леводопы заключается в ацетилировании тирози-
тирозина ацетилх.вдридом в присутствии хлористого алюминия с последующим
окислительным дезацилированием 3-ацетилтирозина A0.1.2) с использо-
использованием перекиси водорода в растворе гидроокиси натрия [4, 5, 6, 7J.
-194-
Средства, применяемые при паркинсонизме
но—^ А-снг-сн-соон
Nri2
CH3COCL / ALCL3
СН3СО
-i /У-СН2—СН—СООН
Nh2
10 1 2
' NaOH
CH2-CH-COOri
NHZ
Предложены пути синтеза леводопы, исходящие из ванилина [8, 9,
10, 11, 12, 13, 14]. Согласно одному из них, конденсацией ванилина с ги-
дантоином, последующим восстановлением двойной связи в образую-
образующемся продукте A0.1.4) и его гидролизом получают рацемический ди-
гидроксифенилаланин (ДОФА), из которого выделяют леводопу [8].
Ch3O
D.L-Dopa
Леводопу синтезируют также исходя из пипероналя, альдегидную
группу которого восстанавливают водородом над никелем Ренея, полу-
получая пиперониловый спирт, или 3,4-метилендиоксифенилметанол
A0.1.5). Действием хлористого водорода последний переводят 3,4-
метилендиоксифенилметилхлорид A0.1.6). Реакцией этого соединения с
ацетамидомалоновым эфиром получают C,4-метилендиоксифенил-
метил)ацетамидомалоновый эфир A0.1.7). Щелочной гидролиз и час-
частичное декарбоксилирование последнего приводят к получению защи-
защищенного по двум гидроксильным группам и по аминогруппе продукту
A0.1.8), гидролизом амидной группы которого с использованием фер-
фермента такадиастазы непосредственно выделяют исключительно L-3-
C.4-метилендиоксифеннл)аланин A0.1.9). Снятием метилендиоксиза-
шитной группы с помощью бромистого водорода получают леводопу
A0.1.Щ15].
Hg. Raiay— N1
- 195-
Глава 1 О
Ю 1 7
СООС2Н5
сн2-с-соос2н5
NH-COCH3
NaOH
10 1
СН2-СН-СООН
NH-СОСНз
сн2-с н-соон
НВг
10 1 1
10 1 9
Среди многих попыток выправить дефицит дофамина при паркин-
паркинсонизме введение пациенту непосредственного предшественника дофа-
дофамина — леводопы считается весьма логичной терапией, поскольку ле-
водопа проходит через гематоэнцефалический барьер, где превращается
в дофамин, приводя его уровень в норму. Таким образом, леводопа уст-
устраняет или ослабляет проявления паркинсонизма. Леводопа относится
к наиболее эффективным средствам при лечении паркинсонизма, ис-
исключая паркинсонизм, вызванный лекарственными средствами. К сожа-
сожалению, он обладает рядом нежелательных, побочных эффектов.
Наиболее распространенными синонимами являются 1-дофа, мадо-
пар, допар, синемет, лародопа и др.
Лмантадин (Amantadine)
Амантадин — 1-адамантанамин A0.1.12) синтезируют исходя из
адамантана. Последний бромируют в 1-бромадамантан A0.1.10),
который при нагревании со смесью ацетонитрила и серной кислоты
в условиях реакции Риттера трансформируется в 1-ацетиламиноада-
мантан A0.1.11). Гидролиз последнего щелочью приводит к аман-
тадину A0.1 12) [16, 17].
ГМНСОСНз
CM3CN ' ri2SO4
Амантадин является средством, повышающим концентрацию до-
дофамина в синаптической щели путем его высвобождения из нейронов
- 196-
Средства, применяемые при паркинсонизме
и угнетения процесса его обратного захвата. Амантадин — противови-
противовирусный препарат. Свойства облегчать симптомы паркинсонизма были
выявлены у него случайно.
Лечение паркинсонизма комбинацией леводопы, антихолинергиче-
ских препаратов и амантадина дает лучшие результаты, чем при приме-
применении любого из этих препаратов в отдельности.
Синонимами препарата являются мидантан и симметрел.
Бромокриптин (Bromocriptin)
Бромокриптин — 2-бромэргокриптин A0.1.13) является полусинте-
полусинтетическим производным природного алкалоида спорыньи — эргок-
риптина (производного лизергиновой кислоты), который получают
бромированием эргокриптина N-бромсукцинимидом [18, 19].
f^>l О СН(СН3J
СН(СН3J
Бромокриптин — дофаминомиметик, который является агонистом
дофаминовых О2-рецепторов, обладает выраженной антипаркинсониче-
ской активностью. Применяется для лечения всех фаз идиопатического
и постэнцефалического паркинсонизма. Однако он обладает рядом не-
нежелательных, побочных эффектов, вплоть до возникновения психиче-
психических нарушений при длительном применении.
Наиболее распространенными синонимами являются парлодел,
бромэргон и др.
Селегилип (Selegiline)
Селегилин — М-метил-1\т-B-пропинил)-2-.метил-1-фенилэтиламин
A0.1.14) получают алкилированием (-)метамфетамина (8.1.2.3) про-
паргилбромидом [20, 21, 22, 23].
-CH2-CH-NH
сн3
1123
Вг-СН2-С=СН /=\
сн3
-CH2-CH-N-CH2-C5CH
СН3
10 1 14
-197-
Глава 10
Препарат является избирательным ингибитором МАО-В, которая
подавляет процессы инактивации дофамина и способствует повышению
его уровня в головном мозге. Для лечения паркинсонизма препарат
обычно применяют в комбинации с леводопой.
Наиболее распространенными синонимами препарата являются де-
пренил, элдеприл, элдопан и др.
10.2. Анпшхолинергические препараты
(центральные холиноблокаторы)
Первыми препаратами, использованными при лечении паркинсониз-
паркинсонизма, были алкалоиды (атропин и скополамин), и в течение многих лет они
являлись единственными препаратами, используемыми с этой целью.
На сегодняшний день при лечении паркинсонизма эти алкалоиды
применяются крайне редко и практически полностью заменены синте-
синтетическими препаратами, проявляющими центральные антихолинерги-
ческие свойства (центральные холиноблокаторы). Они подавляют стиму-
стимулирующие холинергические влияния путем угнетения холинореиепторов.
Полагают, что на синтез, высвобождение и гидролиз ацетилхолина они не
влияют. Их действие, таким образом, способствует уменьшению или уст-
устранению двигательных нарушений, связанных с поражением экстрапири-
рамидной системы. Они уменьшают ригидность, в несколько меньшей
мере — акинезию, а также мало влияют на тремор.
Терапевтическая ценность этих препаратов относительно невелика, и
они применяются либо в комбинации с леводопой, либо в случаях слабо-
выраженного паркинсонизма, в основном, с целью снятия ригидности.
Вместе с тем они вызывают ряд побочных действий, включая об-
общую слабость головокружение и т. п.
Тригексифенидил (Trihexphenidyl)
Тригексифенидил — 1-циклогексил-1-фенил-3-пиперидинопропан-
1-ол A0.2.2) получают взаимодействием 2-A-пиперидино)про-
пиофенона A0.2.1) с циклогексилмагнийбромидом. Исходный 2-A-
пиперидино)пропиофенон A0.2.1), в свою очередь, получают ами-
нометилированием бензофенона с использованием параформа и пи-
пиперидина [24, 25, 26, 27].
D
H2-CHZ—N \
о
9-СН2-СН2—N \
-198-
Средства, применяемые при паркинсонизме
Тригексифенидил — антипаркинсоническое средство, обладающее
центральным и периферическим антихолинергическим действием, а так-
также прямым релаксирующим действием на гладкие мышцы. Препарат
уменьшает мышечную ригидность и общую скованность и относитель-
относительно мало влияет на тремор. Применяется при паркинсонизме как в виде
монотерапии, так и в комбинации с леводопой.
Наиболее распространенными синонимами являются паркопан.
паркинсан и циклодол.
Проциклидин (Procyclidine)
Проциклидин — 1-циклогексил-1-фенил-3-пиирролидинопропан-
1-ол A0.2.3) получают совершенно аналогичным путем, но исходя
из 2-A-пирролидино)пропиофенона [28, 29, 30, 31, 32].
( \-C-CH2-CH2-V|
— он N—'
10 2 3
По своим фармакологическим свойствам практически не отличается
от тригексифенидила.
Наиболее распространенным синонимом препарата является кемад-
рин.
Бипериден (Biperiden)
Бипериден — 1-E-норборнен-2-ил)-1-фенил-3-пиперидинопропан-
1-ол A0.2.4) также синтезируют по методу получения тригексифени-
тригексифенидила, но взаимодействием 2-A-пиперидино)пропиофенона A0.2.1)
с 5-норборнен-2-илмагнийбромидом [33. 34].
J>
1024
Бипериден повторяет свойства указанных выше препаратов.
Синонимом препарата является акинетон.
- 199-
Глава 1 О
Дифенгидрамин (Diphenhydramine)
Дифенгидрамин — 2-дифенилметокси-КМ-диметиламин A0.2.5)
получают этерификацией 2-диметиламиноэтанола бензгидрилбро-
мидом [35, 36, 37].
СНз
СЧ-Вг
НО-СН2-СН2—N
СНз
сн»
СН— O-CH2-Cri2—N
1025
СНз
Дифенгидрамин также уменьшает мышечную ригидность и об-
общую скованность и относительно мало влияет на тремор. В общем,
трудно отдать предпочтение какому-либо из перечисленных препара-
препаратов.
Синонимами препарата являются бенадрил и бенилин.
Бензтропин (Benztropine)
Бензтропин — 3-дифенилметокси)тропан A0.2.6") получают взаимо-
взаимодействием тропина с дифенилдиазометаном [38].
но
G=N=N
N-СНз
СН—О
1026
¦N-Ch3
Препарат используется для быстрого устранения острых дистониче-
ских реакций при паркинсонизме. Не устраняет тремор.
Синонимом препарата является когентин.
Этопропазин (Ethopropazine)
Этопропазин — 10-B-диэтиламинопропил)фенотиазин A0.2.7) по-
получают алкилированием фенотиазина 1-диэтиламино-2-пропилхло-
ридом в присутствии амида натрия [39, 40].
-200-
Средства, применяемые при паркинсонизме
СНз С2Н5
Cl—CH-CH2-N\
С2Н5
С2Н5
CH3-CH-CH2-N\
10 2 7 С2Н5
Этопропазин — производное фенотиазина с выраженной антихоли-
нергической активностью, который эффективно уменьшает мышечную
ригидность и общую скованность, включая тремор. Применяется как
при паркинсонизме, так и в других случаях экстрапирамидных рас-
расстройств, в том числе и в случаях, вызванных фенотиазиновыми препа-
препаратами.
Синонимами препарата являются парсидол, лизиван, паркин и др.
Список литературы
i
1. Amao S. et al.'/Ann. Sankyo Res. Lab. 23. 249 A971).
2. Sih С J. et al.//J. Am. Chem. Soc. ?1, 6204 A969).
3. Waser E. et al.//Heh. Chim Acta. 4, 657 A921).
4. Bretschneider H et al./, Helv. Chim Acta. 56. 2857A973).
5. Ger. Pat. 2.023.459A970).
6. Ger. Pat. 2.023.460A970).
7. Ger. Pat. 2.023.461 A970).
8. US Pat. 2.605.282A952).
9. US Pat. 4.005.127A977).
10. Ger. Pat 2.223 063A971).
11. Ger. Pat. 2.210.938A972).
12. US Pat. 4.124.533A978).
13. Knowles W. et al.'/J. Am! Chem. Soc. 97, 2567 A975).
14. Vineyard B. et aL/J. Am. Chem. Soc. 99. 5946 A977).
15. Yamada S, et al.//Chem. Pharm. Bull. 10, 680, 688, 693 A963).
16. Stetter H. et al.' Chem. Ber. 93, 226 A960).
17. US Pat. 3.310.469A967).
18. US Pat. 3.752.814A973).
19. Ger. Pat. 1.926.045A969).
20. Ger. Pat. 1.568.277A966).
21. US Pat. 4.564.706A986).
22. Fr. Pat. M 2635 A964).
23. Fowler J.'.l. Org. Chem. 42, 2637 A977).
-201 -
Глава 1 О
24. US Pat. 2.680.115A954).
25. US Pat. 2.716.121 A955).
26. US Pat. 2.682.543A954).
27. Bnt. Pat. 750.156A956).
28. US Pat. 2.682.543A954).
29. US Pat. 2.891.890A959).
30. US Pat. 2.826.590A958).
31. US Pat. 2.842.115A958).
32. Adamson J. et al./'J. Chem. Soc. 1951, 52.
33. US Pat. 2.789.110A957).
34. Ger. Pat. 1.007.067A953).
35. US Pat. 2.421.714A947).
36. US Pat. 2.427.878 A947).
37. US Pat. 2.397.799A946).
38. US Pat. 2.595.405A952).
39. US Pat. 2.526.118A950).
40. US Pat. 2.607.773A952).
Глава 11
А дренергические
(симпатомиметические)
препараты
Адренергические препараты — это природные или синтетические
соединения, частично или полностью повторяющие эффекты норзпи-
нефрина (норадреналина), эпинефрина (адреналина) и дофамина и вы-
вызывающие биологический ответ, сходный с активацией симпатической
нервной системы. Поскольку они воспроизводят стимуляцию симпати-
симпатических нейронов, их также называют симпатомиметиками.
Не поддающаяся усилиям воли, симпатическая нервная система иг-
играет важную роль в регуляции сердечной деятельности, сосудистого
юнуса, функциональной активности гладкой мускулатуры и железисто-
железистого аппарата путем высвобождения в качестве медиаторов из перифери-
периферических нервных окончаний и в синапсах ЦНС эндогенных адренергиче-
ских веществ — катехоламинов.
Эти соединения, в большом количестве выделяются в организме
в периоды физического или эмоционального стресса и играют огром-
огромною роль для адаптации организма к стрессовой ситуации.
В самом организме катехоламины (р-арилэтиламины, имеющие в по-
положениях Сз и С4 ароматического кольца гидроксильные группы) — до-
дофамин, норэпинефрин (норадреналин) и эпинефрин (адреналин) в основ-
основном вырабатываются надпочечниками из общего прекурсора — тирозина,
который в организме, в первую очередь, гидроксилируется в мета-
положение ароматического кольца ферментом тирозингидроксилазой.
Образующийся при этом ДОФА далее декарбоксилируется ферментом L-
декарбоксилазой ароматических кислот с образованием дофамина. Далее
дофамин гидроксилируется ферментом дофамин-р-гидроксилазой с обра-
образованием норэпинефрина (норадреналина). Наконец, концевая первичная
аминная группа метилируется ферментом фенилэтаноламин-К-метил-
трансферазой с образованием эпинефрина (адреналина).
Л— СНг-СН-М~г
СООм
тирозин
ДОФА
дофамин
-203-
Глава 11
CH-CH2-NH2
норэпинефрин
(норадреналин)
¦L )>— CH-CH2-nh-CH3
эпикгфрин
(адреналин)
Адренергические препараты используются ввиду их способности
воздействовать на сердечно-сосудистую систему, вызывать бронхолити-
ческий эффект, стимулировать ЦНС, проявлять мидриатичесское и ано-
рексигенное действие. С другой стороны, именно широкий спектр ак-
активности, обусловленный, очевидно, большим сродством к различным
и не только к адренергическим рецепторам, ограничивает их примене-
применение ввиду ряда нежелательных побочных эффектов.
Адренергические или симпатомиметические препараты составляют
большую группу веществ — препараты прямого действия, которые
непосредственно взаимодействуют с адренергическими рецепторами.
К ним относятся эпинефрин, фенилэфрин и изопротеренол. добутамин,
тербуталин, альбутерол, метапротеренол, изоэтарин, клонидин, нафазо-
лин. оксиметазолин, тетрагидрозолин, ксилометазолин.
Препараты непрямого действия проявляют симпатомиметический
эффект, опосредованно вызывая высвобождение эндогенных катехола-
минов. Симпатомиметическая активность этих препаратов, таким обра-
образом, зависит от наличия в организме катехоламинов. К ним относится
тирамин — соединение, используемое, в основном, в качестве анализа-
анализатора в экспериментальных исследованиях.
Наконец, некоторые препараты имеют двойное действие — прямое
и непрямое. К ним относятся дофамин, эфедрин, фенилпропаноламин,
метараминол, амфетамины.
Первичное взаимодействие между адреномиметиками и эффектор-
ной клеткой осуществляется посредством адренергических рецепторов,
исключительно широко представленных в мозге, в различных органах
и тканях. Строение адренорецепторов неизвестно.
Концепция рецепторов, как известно, основывается на наличии оп-
определенных клеточных структур, которые ответственны за связывание
биологически активных соединений.
Молекулярная структура лиганд — связывающий участок рецептора
определяет специфик\ физиологического ответа организма. Связывание
адренергического агониста, равно как и любого другого препарата, дейст-
действующего путем субсграт-реиепторного взаимодействия, с соответствую-
соответствующим рецептором на поверхности мембраны вызывает каскад биохимнче-
-204-
Адренергические препараты
ских реакций в клетке, в конечном счете приводящих к изменению ее
функционально-метаболического состояния. Лекарство, таким образом,
содержит информационное послание, передаваемое внутрь клетки и со-
соответствующим образом распространяющееся, что и вызывает измери-
измеримые эффекты на уровне ткани или органа. Специфическое связывание
препарата с рецептором активирует определенный биологический про-
процесс, который можег завершиться, регуляцией ионных каналов, секреци-
секрецией желез, изменением ферментной активности и т. д.
Каждый из адренергических препаратов в отдельности выявляет
значительные качественные и количественные различия, как фармако-
динамического. так и фармакокинетического характера, что обеспечи-
обеспечивает разумное их терапевтическое применение.
Постулируют два основных класса рецепторных белков, связываю-
связывающих адренергические препараты, которые исторически были определе-
определены как а- и C-рецепторы и далее были, в свою очередь, разбиты на че-
четыре подтипа адренергических рецепторов -- аь а2; C, и C2.
Несмотря на некоторые исключения, активация агрецеппюров, в об-
общем, приводит к возбуждению, р:-рецепторы — ответственны за релак-
релаксацию тканей. Активация ргремепторов выражается в стимулирующем
эффекте на сердце и почки; активация пресинаптических адренер] иче-
ских агрецепторов, возможно, предполагает механизм обратной связи —
ингибирование нейронального высвобождения норэпинефрина. В то же
время стимуляция постсинаптических агрецепторов, аналогично ееi-ре-
ееi-рецепторам, вызывает возбуждение тканей.
На основе анатомических, фармакологических, биохимических и иных
критериев показано, что агрецепторы присутствуют, главным образом,
в эффекторных органах; а2-рецепторы расположены в адренергических
нейронах, в пресинаптических участках; C,-рецепторы расположены,
преим>шественно, в сердечных и почечных тканях; C2-рецепторы обна-
обнаружены во многих других органах (бронхах, сосудах, матке и др.).
Вариации ответов организма на различные адренергические пре-
препараты основываются на их относительной селективности при взаи-
взаимодействии с различными рецепторами, которые исключительно не-
неравномерно распределены в эффекторных структурах (сердце,
сердечно-сосудистая система, легкие, мозг, периферическая нервная
система и т. д.)
В общем, ответ эффекторного органа на эпинефрин (адреналин)
и или норэпинефрнн (норадреналин) непосредственно определяется
типом адренореиептора. равно как и соотношением а- и C-адрено-
рецепторов.
-205-
Глава 11
Типичное фармакологическое действие адренергических препара-
препаратов заключается в следующем:
— стимуляция работы сердца — повышение частоты и силы
сердечных сокращений;
— вазомоторные воздействия — вазодилатация, вазоконстрик-
иия.
- репчяция эндокринного состояния — модуляция инсулина,
ренина и ряда гормонов;
— регуляция метаболического состояния — усиленный глико-
генолиз в печени и в мышцах, высвобождение жирных кис-
кислот из тканей;
— психомоторное возбуждение — со стороны ЦНС.
Спектр сердечно-сосудистых, дыхательных, гормональных, метабо-
метаболических и нейропсихических ответов, которые могут быть вызваны
адренергическими препаратами, в общем очень похож на многие из
адаптивных реакций организма — на повышенную физическою актив-
активность и физический стресс.
Адренергические препараты с клинической точки зрения формаль-
формально можно классифицировать и нижеприведенным образом, хотя при
тшм некоторые препараты могут одновременно фигурировать в разных
ipynnax:
• эндогенные (эпинефрин, норэпинефрин, дофамин) и синтети-
синтетические катехоламины (изопротеренол, добутамин);
• вазопрессорные амины (метараминол, метоксамин, мефентер-
мин);
• противоотечные (тетрагидрозолин. фенилэфрин. нафазолин,
эфедрин);
• бронхолитики (эфедрин, метапротеренол, изоэтарин, тербута-
лин);
• релаксанты гладкой мускулатуры (ритодрин, арлидин, изо-
ксчприн);
• стимуляторы ЦНС (амфетамины).
С химической точки зрения адренергические препараты имеют
весьма много общего и рассматриваются как замещенные фенилэтила-
мины.
Р а
R4—Л Л-CH-CH-NH-R
R- R]
-206-
Адренергические препараты
Обращают на себя внимание корреляции между структурой симпа-
гомиметиков и проявляемой ими биологической активностью:
1. Симпатомиметическая активность максимальна, когда между
ароматическим кольцом и аминогруппой имеется два атома уг-
углерода.
2. Чем меньше степень замещения при аминогруппе, тем больше
селективность соединения для активации а-адренорецепторов,
и, наоборот, увеличение объема заместителя при первичной
аминогруппе придает большую селективность по отношению
к Р-адренорецепторам.
3. Замещение при ос-углеродиом атоме предупреждает окисли-
окислительную дезактивацию молекулы препарата моноаминооксида-
зой и, таким образом, намного увеличивает продолжительность
его действия. В то же время замещение при а->глеродном атоме
способствует непрямому действию препарата — способность
к высвобождению эндогенных катехоламинов из нейрональных
запасников.
4. Активность препарата в значительной степени зависит от нали-
наличия гидроксильных групп в положениях Cj или С4 ароматиче-
ароматического кольца. Последнее условие необходимо для активации
как а- так и C-адренорецепторов. Соединения с наличием гид-
роксильной группы только при Сз в ароматическом кольце вы-
выявляют высокое соотношение прямой/непрямой агонистической
активности. Соединения с наличием гидроксильной группы
только при С4 в ароматическом кольце, выявляют высокое со-
соотношение непрямой/прямой активности. Фенилэтиламины. не
содержащие гидроксильных групп в ароматическом кольце (не
катехоламины), выявляют больший стимулирующий эффект на
ЦНС. чем катехоламины.
/ /. I. Агонисты прямого действия
Средства, стимулирующие а-
и р-адренорецепторы
Эндогенные и синтетические катехоламины
Три главных эндогенных катехоламина — эпинефрин (адреналин),
норэпинефрин (норадреналин) и дофамин — осуществляют функцио-
функционирование симпатической нервной системы и присутствуют практиче-
практически зо всех частях организма. Кроме того, большое число других лекар-
-207-
Глава 11
ственных средств проявляют свою активность путем модификации дей-
действия одного или более из этих эндогенных веществ таким образом, что
катехоламины оказываются задействованы в проявлении результата
довольно широкого набора лекарств. В медицине применяются и синте-
синтетические симпатомиметики прямого действия, которые широко исполь-
используются при лечении многих патологий. Терапевтические показания
к применению катехоламинов основаны на их сосудосуживающем,
бронхолитическом и сердечностимулирующем действии.
Эпинефрин (Epinephrine)
Эпинефрин — 1_-1-C,4-дигидроксифенил)-2-метиламиноэтанол
A1.1.2) получают как из ткани надпочечников убойного скота [1. 2],
так и синтетическим путем. Синтез эпинефрина осуществляют исхо-
исходя из со-хлор-3,4-дигидроксиацетофенона - - хлорацетилпирокатехи-
на, взаимодействием которого с избытком метиламина получают
и-метиламино-3,4-дигидрокси)ацетофенон A1.1.1). Восстановлением
последнего водородом над никелем Ренея, действием амальгамы
алюминия или электролитическим восстановлением получают D,L-
эпинефрин A1.1.2) [3, 4, 5. 6, 7, 8, 9], который разделяют на изомеры
с использованием (-)винной кислоты [10].
но
1111
но
НО—? V-CH— CH2-NHCh3
11 1 2
Эпинефрин, эндогенный катехоламин, больше известен под офици-
официальным английским названием адреналин. Эпинефрин — мощный аго-
нист, как а- так и р-адренергических рецепторов. Его действие весьма
сложно и зависит не только от сравнительного распределения адренер-
гических рецептивных участков в разных тканях и органах, но также от
дозировки и путей введения. Природный изомер эпинефрнна(-) в 50 раз
более активен, чем (+)изомер.
Препарат прямо и неснецифично активирует как а-, так и Р-адренер-
гические рецепторы. Активация ос-адренорецепторов приводит к сужению
большинства сосудов. Активация ргадренорецепторов увеличивает ско-
-208-
Адренергические препараты
рость работы сердца и силу сокращений сердечной мышцы Активация
ргадренорецепторов приводит к расширению бронхов и сосудов ске-
скелетных мышц. Повышается уровень глюкозы в крови, понижается внут-
риглазное давление.
Несмотря на то, что основное фармакологическое действие отража-
отражается на сердечно-сосудистой и дыхательной системах, полный спектр
ею эффектов указывает его физиологическую значимость в качестве
системного нейрогормона, вовлеченного в активацию большого ряда
защитных функций.
Фактически он является прототипом многих адренергических пре-
препаратов, и поэтому следует несколько подробнее рассмотреть его дей-
действие на отдельные органы системы. Типичная реакция на внутривенное
введение эпинефрина — стремительный подъем преимущественно сис-
систолического АД. Подобное действие эпинефрина возникает благодаря
комбинированному действию, т. е, во-первых, сокращению большинст-
большинства сосудов и, во-вторых, стимуляции миокарда, выражающейся повы-
повышением силы сокращений и частоты работы сердца. Эпинефрин и дру-
другие симпатомиметические препараты с р2-адреноагонистнческими свой-
свойствами ответственны за релаксацию бронхиальной мускулатуры и уси-
усиление бронходилатции. Более того, ос-адренергическая агонистическая
активность эпинефрина проявляется в виде сокращения сосудов легких
и развития противоотечных эффектов.
Препарат применяется при анафилактических, аллергических и дру-
других реакциях гиперчувствительности, в качестве агента, повышающего
АД при гипотензии, в качестве бронхолитика при отеках легких, в каче-
качестве противоотечного средства в ЛОР и офтальмологической практике,
а также с целью усиления и пролонгирования действия местных анесте-
анестетиков.
Эпинефрин используется для купирования приступов бронхиальной
астмы, для выведения из анафилактического шока, при гипергликеми-
ческой коме, аллергических реакциях. Препарат применяют в качестве
местного сосудосуживающего средства и, в частности, в офтальмологии
для понижения внутриглазного давления.
Имеется огромное количество синонимов эпинефрина — аднефрин,
адренат. биоренин, эпринал, гемостатин, ниералин. синдернин и др. Од-
Однако основным синонимом эпинефрина является адреналин.
Норэп инефрин (Norepin eph rin)
Норэпинефрин — Ь-1-C,4-дигидроксифенид)-2-аминоэганол A1.1.4)
предложено получать двумя методами, исходящими из 3,4-дигидро-
ксибензальдегида. Согласно первому способу, взаимодействием
с цианистым водородом указанный альдегид трансформируется
-209-
Глава 11
в циангидрин A1.1.3). который далее восстанавливают в норэии-
нефринA1 1 5) [11, 12].
но
но-
HCN
[Н]
Второй способ заключается в конденсации диацетата того же аль-
альдегида с нитрометаном с получением C,4-диацетоксифенил)-2-нитро-
этаиола A1.1.5). нитрогруппу которого далее подвергают восстановле-
восстановлению, и продукт A1 1.6) гидролизуюг в искомый норэпинефрин A1.1.4)
[4.9.13,14].'
СН3ССЮ
сн3соо
•CH-GH2NO2
[Н]
11 1 5
NaOH
11 1 4
Норэпинефрин — основной нейротрансмиттер. продуцируемый
и высвобождаемый адренергическими нейронами, в литературе также
называе1ся и описывается как (-)норадреналин или левартеренол. Этот
вазопрессорный катехоламин уменьшает и сопротивляемость, и емкость
кровяньк сосудов путем стимулирования а-адренорецепторов и имеет
прямое кардиостимулирующее действие, осуществляемое путем акти-
активации C]-адренорецепторов. Норэпинефрин проявляет значительно
меньшую активность, чем эпинефрин в качестве препарата для расши-
расширения сосудов путем активации р2-адренергических рецепторов. Типич-
Типичной реакцией на внутривенное введение норэпинефрина является по-
повышение как систолического, так и диастолического АД,
Норэпинефрин применяют для усиления сердечных сокращений
и тля повышения АД при резком его понижении, которое может воз-
возникнуть при хирургических вмешательствах и травмах.
Синонимами препарата являются артеренол, левартереиол. левофед
и др.
- 210 -
Адренергические препараты
Средства, стимулирующие преимущественно
Р-адренорецепторы
Изопротеренол (Isoproterenol)
Изопротеренол — 1-C.4-дигидроксифенил)-2-шопропиламино-
этанол A1.1.8) получают по схеме, аналогичной схеме получения
эпинефрина. Взаимодействием со-хлор-3,4-дигидрокси-ацетофенона
(хлорацетилпирокатехола) с изопропиламином получают ю-изопро-
пиламино-3,4-дигидроксиацетофенон A1.1.7), восстановлением
в котором карбонильной группы водородом с использованием
в качестве катализатора палладия на угле получают изопротеренол
A1.1.8) [11, 12].
Я сн3
;-ch2-ci t h2n-ch(
СНз
¦C-CH2-NH-CH\
но-
¦С У-сн-сн2-мн-сн(
сн3
сн3
11 1 8
Изопротеренол является представителем симпатомиметических
препаратов с высокой селективностью к C-адренорецепторам. Как уже
было указано, наличие объемистой шо-пропильной или трет-
бутильной групп при атоме азота C-фенилэтиламинного скелета обычно
придает соединениям большее сродство к C-адренергическим рецептив-
рецептивным участкам, чем к а-адренергическим. Изопротеренол лишен значи-
значительного ос-адренергического агонистического действия. Активация
р\-адренергически\ рецепторов в сердце повышает положительное хро-
нотроиное и ионотропное действие. Периферическое сосудистое сопро-
сопротивление повышается путем вызванного задействованным C2-адре-
нергической системой расширением сосудов, в основном, в скелетной
мускулатуре, но также в почечном и мезентериальном кровообраще-
кровообращении
"ho сложное, объединенное кардиостимулирующее и сосудорасши-
сосудорасширяющее действие выражается значительным повышением сердечного
выброса и ударного объема. В результате активации р\-адреноре-
цепторов усиливается также бронходилатация.
-211 -
Глава 11
Изопротеренол применяют при бронхоспазме. астме, сердечной
блокаде, шоке.
Синонимами препарата являются протеренол, изопренатин, изад-
рин, норизадрин, новодрин и др.
Изоэтарин (Isoetharine)
Изоэтарин — 3,4-дигидрокси-а-[1-(ызо-пропиламино)пропил]бен-
зиловый спирт A1.1.11), отличающийся от изопротеренола наличи-
наличием дополнительного радикала — этильной группы в боковой этила-
минной цепи, получают бромированием 3,4-дибензилоксиб>ти-
рофенона молекулярным бромом с последующим взаимодействием
полученного бромпроизводного A1.1.9) с изопропиламином. Про-
Продукт A1.1.10) подвергают восстановлению водородом с использо-
использованием палладиевого катализатора, при котором одновременно вос-
восстанавливается и карбонильная группа и осуществляется снятие
защитных бензильных групп с получением изоэтарина A1.1.11)
[15].
С6Н5СН2О
с6н5сн2о -
с6н5сн2о
С6Н5СН2О—С V-C-CH — С2Нг
^—' Вг
11 1 9
СНз
СНз
СбН5СН2О
с6н5сн2о
О СНз
-C-CH-NH-CH\
I СНз
с2н5
И,/ Pd-C
ОН СНз
сн-сн-мн-сн{
I См3
С2Н6
Изоэтарин — симпатомиметик прямого действия со сравнительно
низкой селективностью к (Зг-адренорецепторам. Однако вызывает бы-
быстрое успокоение бронхоспазма. по сравнению с более селективными
бронходилата горами.
Применяют при лечении хронических обструктивных заболеваний
верхних дыхательных путей.
Синонимами препарата являются астмалитан и бронкосол.
Тербуталин (Terbutaline)
Терб\ талин — а-[(/и/?е»?-бутиламино)метил ]-3,5-дигидроксибензи-
ловый спирт A1.1.14), принципиально отличающийся от рассмот-
рассмотренных соединений расположением гидроксильных групп в бен-
-212-
Адренергические препараты
зольном кольце, получают бромир>я 3,5-дибензилокснацетофенон
в соответствующий 3,5-дибензилоксибромацетофенон A1.1.12), ко-
который вводят во взаимодействие с М-бензил->^-,>?г/?е7?г-бутиламином
с получением аминокетона A1,1.13). Восстановление последнею
водородом над палладиевым катализатором приводит к терб>тали-
терб>талину A1.1.14) [16, 17. 18].
С6Н5СН2О
<
С6Н5СН2О
с6н5сн2о
с-снз
-сч2
CnHiCHoO 1111?
Вг2
С(СН3Й
СаН5СН2о
С V-C-CH2-Br
CeH5Ch20 11 1 12
H-N
Pd_c
С(СН3)з
НО
но '1 1 14
Тербуталин — синтетический симпагомиметический амин, Являет-
Является одним из наиболее селективных стимуляторов (Зг-адренорецепторов
прямого действия. Стимулирует р2-адренорецепторы гладкой м\ск}ла-
туры бронхов, расслабляя их, и сравнительно мало действ>ет на ргадре-
норецепторы сердца.
Применяют для купирования и профилактики бронхоспазма при
бронхиальной астме, хроническом бронхите, эмфиземе легких и других
бронхолегочных заболеваниях.
Синонимами препарата являются бретин и бриканил.
Метапротеренол (Metaproterenol)
Метапротеренол — а-[(ызопропиламино)метил]-3,5-дигидрокси-
бензиловый спирт A1.1.15) практически является аналогом тербу-
талина, в котором тяре^-б)тиламинная грз'ппа замещена на изо-
пропиламинную. Синтез препарата осуществляется анало1ично
синтезу тербуталина [19, 20. 21].
04
К Ъ— ch-ch2-nh-ch(
СН3
11 1 15
сн3
-213-
Глава 11
Метапротеренол менее селективен, чем тербуталин и альбутерол,
однасо широко используется при лечении хронических обструктивных
заболеваний верхних дыхательных п)тей.
Синонимами препарата являются орсипреналин, метапрел и алю-
пен!.
Фгнилэфрин (Phenyiephrine)
Фепилэфрин — 1-C-гидроксифенил)-2-метиламиноэтанол A1.1.16),
принципиальное отличие которого от эпинефрина заключается в от-
с>тсгвии гидроксильной группы при С4 ароматического кольца, по-
получают по схеме аиатогичной получению эпинефрина, однако
с применением вместо <м-хлор-3,4-дигидроксиацетофенона со-хлор-
3-гидроксиацетофенона [11, 22, 23].
^ /У— СН— Ch2-NHCH3
и 116
Этот синтетический препарат имеет как химическое, так и фарма-
фармакологическое сходство с норэпинефрином. Характерная особенность
фенил зфрина — это отчетливо выраженная селективность по отноше-
отношению к а-адренорецепторам, особенно а,-адренорецепторам. Хотя фени-
лэфрин и усзеличивает сокращаемость сосудов, он практически не явля-
является кардиостимулятором.
Фепилэфрин применяют при гипотензпи, пароксизмальной супра-
вентрик)лярной тахикардии, шоке, а также местно, в частности в виде
носовых капель для снятия отеков.
Синонимами препарата являются алмефрин. дегест. неокседрин,
метаокседрин и многие другие.
Ритодрин (Ritodrine)
Ритодрин — 4-гидрокси-а-[1-[D'-гидроксифенэтил)амино]этил]-
бензилозый спирт A1.1.19) отличается от эпинефрина уже несколь-
несколькими штрихами и находится в рассматриваемом ряду из-за наличия
лишь одной гидроксильной группы в ароматическом кольце фени-
лэтиламинного фрагмента классических симпатомиметиков. Второе
существенное отличие от всего рассматриваемого ряда заключа-
заключается в замене традиционного концевого ызопропил- или трет-
б\ гитаминного фрагмента на «-гидроксифенилэтиламинный. На-
-214-
Адренергические препараты
конец, третье его отличие — наличие метальной группы у а-атома
фенилэтиламинной части симпатомиметиков роднит его с изоэта-
рином.
Препарат синтезируют исходя из 4-бензилоксипропиофенона, под-
ьергая его бромированию в 4-бензилокси-а-бромпропиофенон A1.1.17).
Последний вводят во взаимодействие с 2-D-бензилоксифенил)этила-
мином с получением промежуточного продукта A1.1.18), который далее
повергают дебензилированию водородом с использованием палладиево-
ю катализатора с получением ритодрина A1.1.19) [24, 25].
Н2Гч-СН;-СН2-
СН2СвН5
Ритодрин является селективным стимулятором C2-адренорецеп-
тороь преим) щественно мочеполовой системы. Применяют в качестве
юколитического средства при угрозе преждевременного прерывания
беременности, только в специализированных медучреждениях.
Синонимами препарата являются утопар и препар.
Альбутерол (Albuterol)
Альбутерол — 2-/ире/я-бутиламино-1-D-гидрокси-3-гидроксиметил-
фенил)этанол A1 1.26) принципиально отличается от всех выше-
вышеописанных симпатомиметиков тем, что гидроксильная группа при
Cj ароматического кольца заменена на гидроксиметильную. Пре-
Препарат предложено получать двумя путями. При первом способе
исходят из 4-тидроксиацетофенона, хлорметилированием которо-
которого пол>чают 4-гидрокси-З-гидроксиметилацетофенон A1.1.20).
Последний ацетилируют в диацетилпроизводное A1.1.21) и далее
бромируют в соответствующий бромацетофенон A1.1.22). Его
в;аимодейсгвием с ^г-бензил-Х-/ире/и-бутиламином получают
производное аминоацетофенона A1.1.23), ацетильные гр>ппы
которого гндролизуют соляной кислотой, и полученный при этом
продукт A1,1.24) подвергают восстановлению — вначале боргид-
ридом натрия для трансформации кетонной группы в спиртовую
A1.1.2?), затем водородом над палладиевым катализатором для
-215-
Глава 11
удаления бензильной группы с получением альбутерола A1.1.26)
[26,27,28.29,30].
CH3COONa
CLCri2 CH3COOH 1 СН3СОО-СН2
HCt h=\ ?, (СНзСОЬО >=\ П Er2
но -^ ff—С-СЧ3 »¦ CH3CO0—<\ />— c-ch.,
CH3COO-Cri2
CH3COQ—& Л— С-СН2-Ег
1! 1 22
СЧ2СвН5
С(СНз>з
Ch-jCOQ -СН2
hO-CH2
f=\ и ,СН2С6п5
N
С(СН3)з
^=ч ОН СН2С6Н5 H2'Pd-C
С(СН3)з
11 1 25
НО-СН2
)=\ он
НО—^ V-CH-CH2-NH—С(СН3K
11 1 26
Второй способ синтеза мало отличается от вышеприведенного и
заключается в первоначальном получении 4-гидрокси-З-ацетоксибром-
ацетофенона A1.1.27) п>тем ацилирования метилового эфира салицило-
салициловой кислоты хлорангидридом бромуксусной кислоты. Последний также
вводят во взаимодействие с К-бензил-М-тяре/и-бутиламином, и полу-
полученный продукт A1.1.28) полностью гидрируют алюмогидридом лития
в N-бензилзамешенный альб>терол A1.1.29), бензильную грунп\ кото-
которого также удаляют восстановлением водородом над палладиевым ка-
катализатором в искомый альбутерол A1.1.26) [31J.
)=, О
Q
НОСН2
-СН—СН2 —N
11 1 29
СН2С6Н5 H2/Pd-C
С(СН3Ь
НО-СН2
2-NH—С(СН3)з
11 1 26
-216-
Адренергические препараты
Альбутерол является C2-адренергическим симпатомиметическим
амином со сходными с тербуталином фармакологическими характери-
характеристиками. Почти не оказывает действия на ргадренорецепторы сердца.
Оказывает выраженный бронхолитический эффект, предупреждая или
купируя спазмы бронхов, снижает сопротивление в дыхательных путях,
\ величивает жизненную емкость легких.
Широко используется при острой и хронической бронхиальной ас-
астме и других заболеваниях дыхательных путей, протекающих со спа-
спастическим состоянием бронхов.
Синонимами препарата являются алопрол, вентолин, вольмакс,
сальбутамол, сальб>вент. спреор и др.
Добутамин (Dobutamine)
Добутамин — (±)D-[2D1-гидроксифенил)-1-метилпропил]-3,4-дигид-
роксифенилэтиламин A1.1.31) серьезно отличается по строению от
всех рассмотренных выше препаратов и, главным образом, отсутст-
отсутствием гидроксильной гр\ппы у C-углеродного атома фенилэтила-
минного фрагмента классических симпагомиметиков. Вторым су-
существенным отличием от рассмотренных препаратов является
прис>тствие в качестве концевого аминного фрагмента л-гидрокси-
фенил-иэо-бутиламинного фрагмента.
Препарат пол) чают взаимодействием 3,4-диметоксифенилэтил-2-
амина с 1-D-метоксифенил)-3-б\таноном с одновременным восстанов-
восстановлением образующейся при этом иминной связи и получением продукта
A1.1 30), метоксильные связи которого расщепляют бромистым водо-
водородом, получая добутамин A1.1.31) [32, 33].
сн3о%
сн3
СН3О—^ Л— CH2-CH2-NH-CH-CH2-CH2-<\ /У
11 1 30
-ОСНз
НВг
CHjO
CH3O
CH;-CH2-NH2
СН3О-
-CH2-CH2-C-GH3
Н2/ Pd-C
НО—(ч Л— CH2-CH2-NH-GH-CH2-GH2H\ /У—ОН
11 1 31
-217
Глава 11
Добутамин является препаратом, селективно активирующим
р\-адренорецепторы сердца и одновременно C2-адренорецепторы со-
сосудов и ос.-адренорецепторы миокарда. Механизм ею действия весь-
весьма сложен.
Добутамин применяют в случаях, когда при острой сердечной не-
недостаточности необходимо кратковременно усилить сокращения мио-
миокарда и, в частности, при декомпенсации сердечной деятельности, свя-
связанной с хирургическими вмешательствами на сердце или при его
органических заболеваниях.
Синонимом добутамина является добутрекс.
Средства, стимулирующие
преимущественно а-адреыорецепторы
Описываемые далее адреномиметики прямого действия — а-адре-
нергические агонисты по своему строению резко отличаются от рас-
рассмотренных выше препаратов.
Клонидин (Clonidine)
Клонидин — 2-B,6-дихлорфениламино)имидазолин A1.1.34) синте-
синтезируют исходя из 2,6-дихлоранилина, взаимодействием которого
с гиоцианагом аммония получают М-B.6-дихлорфенил)тиомоче-
вину A1.1.32). Метилированием последней в A1.1.33) дальнейшим
взаимодействием с этилендиамином получают клонидин A1.1.34)
[34.35,36,37.38,39].
<л J— NH-C-NH2
' 1 1 32
11 1 34
Клонидин — селективный а2-адренергический агонист. Клонидин
оказывает выраженное гипотензивное действие, связанное со снижени-
снижением общего периферического сосудистого сопротивления, урежением
частоты сердечных сокращений, уменьшением сердечного выброса.
- 218 -
Адренергические препараты
Механизм действия препарата обусловлен стимуляцией а2-адреноре-
цепгоров тормозных структур головного мозга и уменьшением симпа-
шческой импульсации к сосудам и сердцу.
Препарат понижает системное кровяное давление и скорость рабо-
работы сердца, стимулируя а2-адренорецепторы в определенных частях
ЦНС, и используется в основном в качестве антигипертензивного сред-
средства. Клонидин применяют при различных формах гипертонической
болезни и для купирования гипертонических кризов. Используют также
в офтатьмологической практике при открытоугольной глаукоме.
Синонимами клонидина являются гемитон. катапресан, клофелин.
Противоотечные симпатомиметики
Наиболее популярными препаратами в качестве противоотечных
средств для слизистых оболочек сегодня являются препараты нафазо-
нафазолин. оксиметазолин, тетрагидрозолин и ксилометазолин, являющиеся
производными имидазолина. Это полностью а-адренергические агони-
агонисты, иоторые вызывают осушивающий эффект путем сужения кровяных
сосудов в слизистых.
Для снятия отеков слизистых оболочек в медицине используются
также фенилэфрин и фенилпропаноламин, который является симпато-
миметиком смешанного действия.
Нафазолин (Naphazoline)
Нафазолин — 2-A-нафтилметил)-2-имидазолин A1.1.36) синтези-
синтезируют исходя из A-нафтил)-ацетонитрила, который взаимодействи-
взаимодействием с этанолом переводят в иминоэфир A1.1.35) и далее подвергают
гетероциклизаиии в искомое производное имидазолина A1.1.36)
взаимодействием с этилендиамином [40].
h— СН2-СГч
С2Н5ОН /==> NH
\~ CH2-C-OC2h3
11 1 35
H2NCH2CH2NH2 /==
Нафазолин применяют при острых ринитах, связанных с простудой,
атлергаческими реакциями, острыми и хроническими воспалительными
состояниями, в частности, при воспалениях гайморовых полостей, а так-
также для остановки носовых кровотечений.
Синонимами препарата являются нафтизин, санорин, риназин,
привин.
-219-
Глава 11
Окашетазолин (Oxymetazoline)
Оксиметазолин — 6-от/5еот-бутил-3B-имидазолин-2-илметил)-2,4-
диметилфенол A1 1.39) получают хлормегилированием 6-трет-
б>тил-2,4-диметилфенола и дальнейшей трансформацией полнен-
полненного хлорметилпроизводного A1 1.37) в нитрил A1.1 38). Взаимо-
Взаимодействием последнего с этилендиамином получают оксиметазолин
A1 1 39) [41, 42].
,,,з? СНз
11 1 39
Оксиметазолин применяют по тем же показаниям, что и нафазолин.
в основном при ринитах
Синонимами препарата являются африн и дурамист.
Ксилометазолин (Xylometazoline)
Ксилометазолин — 2-D-от/?сти-бутил-2.6-диметилбензил)-2-имида-
золин A1.1.40) также пол) чают в одну стадию — циклоконденса-
цией 4-/я/5еот-бутил-2,6-диметилбензилцианида с этилендиамином
[43, 44J
11 1 40
Ксиломегазолин применяют при ринитах, ларингитах, син>снтах,
воспалении гайморовой полости, аллергических заболеваниях полости
носа и горла.
Синонимами препарата являются галазолин и отривин
-220-
Адренергические препараты
Тетрагидрозолин (Tetrahydrozoline)
Тетрагидрозолин — 2-A,2.3.4-тетрагидро-1-нафталинил)-2-имида-
золин A1.1.41) получают в одну стадию — гетероциклизацией 1-циа-
ногетралина с этилендиамином [45].
11 1 41
Тетрагидрозолин в основном применяют, в качестве глазных капель
для сужения сосудов, а также местно при небольших воспалениях, > к>сах.
Основными синонимами препарата являются визин и тизин.
11.2, Агонисты непрямого действия
Единственное соединение непрямого действия, находящее практи-
практическое применение только в экспериментах, — это тирамин, который
проявляет симпатомиметический эффект, вызывая высвобождение эн-
эндогенного норэпинефрина. Очень быстро инактивируется МАО. Клини-
Клинического применения практически не имеет.
Тирамин (Tyramine)
Тирамин — 4-B-аминоэтил)фенол A1.2.1) можно синтезировать
различными путями и. в частности, декарбоксилированием тирози-
тирозина [46, 47, 48]. Препарат выделяют также из тканей убойного скота.
но—<\ А— сн2-сн-соон
NH2
но—^ л— CH2-CH2-NH2
112 1
Синонимами препарата являются мидриал, чтерамин и др.
11.3. Агонисты смешанного действия
Практически все обсуждаемые вещества смешанного действия
имеют непрямое действие типа тирамина в дополнение к прямому —
активации адренорецепторов и являются а- и Р-адреномиметиками не-
непрямого (опосредованного) действия.
-221 -
Глава 11
Дофамин (Dopamine)
Дофамин — 2-C,4-дигидроксифенил)-этиламин A1.3.1) в качестве ле-
лекарственного средства получают деметилированием 2-C,4-диметокси-
(ренил)эгиламина A9.4.3) бромистым водородом [49, 50, 51].
СН3О
СН3О—^ Ъ— CH2-CH2-NH2
19 4 3
НВг
НО-А />—CH2-CH2-NH2
11 3 1
Дофамин найден во всех симпатических нейронах и ганглиях и в
ЦНС. Как препарат в дополнение к стимуляции дофаминергических ре-
рецепторов дофамин опосредованно стимулирует и а- и р-адренорецепторы.
Дофамин вызывает также высвобождение эндогенного норэпинефрина.
Механизм действия основан на возбуждающем влиянии на р-адрено-
р-адренорецепторы (в малых и средних дозах) и на а-адренорецеторы (в больших
дозах). Оказывает положительное инотропное действие на сердце;
ул>чшает кровоснабжение; избирательно расширяет почечные и брыже-
брыжеечные кровеносные сосуды; не вызывает снижения артериального дав-
чения: незначительно увеличивает частоту сердечных сокращений.
Дофамин проявляет свое основное действие на сердечно-
сердечнососудистую систему, почки, а также брыжейку. Используется как вре-
временное средство для лечения гипотензии и циркуляторного шока, вы-
вызванного инфарктом миокарда, травмой, отказом почек, эндогенной
септицемией. Главным показанием к применению препарата является
шок различного генеза (кардиогенный, послеоперационный, инфекци-
онно-токсический, анафилактический); тяжелая гипотония; угрожаю-
угрожающая почечная недостаточность.
Синонимом дофамина является интропин.
Эфедрин (Ephedrine)
Эфедрин — 1_-э/ш«г?>о-1-фенил-2-метиламинопропанол-1 A1.3.4)
синтезируют разными путями исходя из бензальдегида. Согласно
первому способу, бензальдегид конденсируют с нитроэтаном с по-
получением 2-метил-2-нитро-1-фенилэтанола A1.3.2), который вос-
восстанавливают до 2-метил-2-амино-1-фенилэтанола A1.3.3), пред-
представляющего собой смесь изомеров, из которой дробной кристал-
кристаллизацией выделяют необходимый 1-изомер. Метилированием послед-
последнего пол> чают эфедрин A1.3.4) [52,53]
-222-
Адренергические препараты
C..H5NO2
& Л— CH-CH-NO2
^ П— CH~CH-NH2
СН3| /=¦
СНз
\ A-CH-Cri-NHCH3
Второй способ синтеза заключается в сбраживании глюкозы кар-
болигазой дрожжей в присутствии оешалъдегида, который при этом
превращается в (-)-1-фенил-2-кетопропанол A1.3.5). Последний восста-
восстанавливают водородом в присутствии метиламина с пол>чением искомо-
искомого эфедрина A1.3.4) [54, 55].
-сно
CH3NH2/H2/R /=\
11 35
сн3
-CH-CH-NHCH3
6н
11 34
Эфедрин — алкалоид, содержащийся в различных видах семейства
зфедровых. и его до сих пор экстрагируют из Ephedra sinica и Ephedra
equisetina^ Ввиду наличия в нем двух асимметрических атомов, сущест-
существует в четырех изомерных формах Псевдоэфедрин (d-изоэфедрин) —
стереоизомер с фармакологическим действием, очень тонко отличаю-
отличающимся от эфедрина Фармакологическое действие эфедрина типично
для некатехоламинных симпатомиметиков смешанного типа. Препарат
стимулирует как а-, так и р-адренорецепторы и одновременно вызывает
высвобождение норэпинефрина из синаптических нейронов. Его сосу-
сосудосуживающая способность примерно в 100 раз уступает таковой
у эпинефрина. однако продолжительность действия примерно в 10 раз
больше. Препарат значительно менее токсичен, чем эпинефрин, что по-
позволяет широко применять го в медицине.
Основное применение препарат находит при бронхиальной астме,
аллергических заболеваниях, в качестве противоотечного для слизистых
оболочек при ринитах, а также в качестве средства, повышающего дав-
давление при оперативных вмешательствах. Применяют местно в офталь-
офтальмологии как сосудосуживающее средство для расширения зрачка.
Синонимами препарата являются эцифин, эфедрол, манадрин, каль-
иидрин и др.
Фенилпропаноламин (Phenyipropanolamine)
Фенилпропаноламин — 0,Ь-э/^от/>о-1-фенил-2-метиламинопропа-
нол-1 A1.3.7) синтезируют из пропиофенона, нитрозируя его до
мзо-нитрозопропиофенона A13.6). Восстановлением последнего
-223-
Глава 11
водородом в соляной кислоте с одновременным использованием
двух катализаторов, палладия на угле и платины на >гле, получают
норэфедрин A1.3.7) [56. 57, 58, 59].
CH3NOj
Pt-C , HCL /=\
З-СН7-СН5
Фармакологическое действие фенилпропаноламина сходно с дейст-
действием эфедрина. Этот симпатомиметик может вызвать временное повы-
повышение давления крови и используется по тем же показаниям, что
и эфедрин, главным образом при простудных заболеваниях в составе
различных комбинированных лекарств. Кроме того, он обладает слабым
центральностимулирующим и анорексигенным действием.
Основным синонимом препарата является норэфедрин.
Метараминол (Metaraminol)
Метараминол — Ь-1-C-гидроксифенил)-2-аминопропан-1-ол A1.3.11)
предложено получать дв\мя путями. Первый способ (синтетиче-
(синтетический) исходит из 3-гидроксипропиофенона. Гидроксильную группч
последнего защищают алкилированием хлористым бензилом с по-
получением 3-бензилоксипропиофенона A1.3.8). Взаимодействием с бу-
тилнитритом последний подвергают нитрозированию в шо-нитро-
зокетон A1.3.9), который восстановлением водородом над никелем
Ренея переводят в 1-C-бензил-оксифенил)-2-аминопропан-1-ол
A1.3.10), защитную бензильную группу последнего удаляют вос-
восстановлением водородом с использованием палладиевого катализа-
катализатора и получением рацемического метараминола A1.3.11). Искомый
L-изомер выделяют с помощью (+)-винной кислоты [60, 61]
C6H5CH2O НО
)=\ ^Н2 H2/Pd-C
4 ^—СН-СН-СНз *" <\ /)—СН-СН-СНз
он —' он
11 3 10 113 11
-224-
Адренергические препараты
Второй способ (полусинтетический) заключается в сбраживании
D-глюкозы в присутствии 3-ацетоксибензальдегида с получением (-)-1-
гидрокси-1-C-гидроксифенил)-ацетона A1.3.12), карбонильную группу
которого восстанавливают водородом над палладиевым катализатором
в присутствии аммиака с получением метараминола A1.3.11) [62, 63, 64,
65].
nh3
NH2
<\ />— СН-СН-СНз
он
11 311
Метараминол — симпатомиметический амин прямого и непрямого
действия, имеющий гемодинамические характеристики, сходные с но-
рэпинефрином. Препарат обладает способностью поднимать как систо-
систолическое, так и диастолическое давление.
Препарат применяют при гипотензивном шоке, с целью поднятия
давления, который может возникнуть при спинномозговой анестезии,
при хирургических осложнениях, при травмах головного мозга.
Синонимами метараминола являются арамин, изофенилэфрин, ме-
тарадин и др.
Амфета.чины (Amphetamines)
Термин амфетамины обычно используется в отношении рацематам
амфетамина, декстроамфетамина (8.1.2.2) и метамфетамина (8.1.2 3).
сн3
-CH2-CH-NH2
8 122
СН3
-CH2-CH-NHCH3
8 123
Как препараты смешанного типа действия амфетамины активируют
адренергические рецепторы и одновременно высвобождают эндогенные
катехоламины, норэпинефрин и дофамин из нейронов мозга и перифе-
периферии. Симпатомиметические свойства на периферии весьма сходны
с таковыми эфедрина. Амфетамин повышает систолическое и диастоли-
диастолическое давление и имеет слабо выраженное бронхолитическое действие.
Эти эффекты более продолжительны, но менее выражены, чем у эпи-
нефрина. Отличительной особенностью амфетаминов является их пси-
психостимулирующая активность. Большие дозы могут вызвать галлюци-
-225
Глава 11
нации, психотическое состояние сходное с параноидальной ш|1зо
френией В качестве симпатомиметика амфетамин иногта применяют
при С1або(ли родовой деятельности
Синонимами амфетамина являются фенамин и бензедрин
Список литераторы
1 lakaminel J Ьос Chem Ind 20,746,A901)
2 AldnchPi Am J Physiol 5, 457, A901)
3 Stoh 4 Ber 37, 4149A904)
4 Payne G Ind Chem 37 523 A961)
5 Loene G I\rzneimittel Forsch 4, 583 A954)
6 Ger Pat 152 814A903)
т Gei Pat 157 300A903)
8 Ger Pat 222 451^908)
9 TullarB J Am Chem Soc 70,2067A948)
10 FlacherDhZ Physiol Chem 58 189 (A908)
11 Ger Pat 723 278A942)
12 US Pat 2 308 232A943)
П US Pat 2 774 789A956)
14 Pratesi et al / J Chem Soc 1959, 4062
15 Ger Pat 638 650A936)
16 Brit Pat 1 199 630A967)
П Belg Pat 704 932A968)
18 US Pat 3 937 838A976)
19 US Pat 3 341 594A967)
20 Ger Pat 1 275 069A960)
21 Belg Pat 611 502A961)
22 US Pat 1 932 347A934)
23 Bergmann M et al ' J Org Chem K>, 84 A951)
24 Belg Pat 660 244A965)
25 US Pat 3 401 944A968)
26 LSPat 3 642 896A972)
27 S Afr Pat 67 05 591 A968)
28 US Pat 3 644 353A972)
29 ColhnD etal J Med Chem 13,674A970)
30 ColhnD etal J Med Chem 14, 89э A971)
31 US Pat 3 70s 233A9^2)
32 Ger Pat 2 317 710A973)
33 LSPat 3 987 200A9^6)
- 99Я -
Адренергические препараты
34 Ger Pat 1 303 141 A961)
35 US Pat 3 202 660A965)
36 US Pat 3 236 857A966)
37 Belg Pat 653 933 A964)
38 Brit Pat 1 016 514A962)
39 Brit Pat 1 034 938A964)
40 US Pat 2 161 938A939)
41 US Pat 3 147 275A964)
42 Ger Pat 1 117 588A961)
43 US Pat 2 868 802A959)
44 Ger Pat 1 049 387A957)
45 US Pat 2 731 471 A956)
46 BargerG J Chem Soc 95, 1127 A909)
47 WaserH Ueh Chim Acta 8,766A925)
48 BuckR J Am Chem Soc 55, 3389A933)
49 BaxelerS Ann 513, 196A934)
50 StiehlH Ъех 69,2640A936)
51 Ger Pat 247 906A909)
^2 Spath E et al / Monatsh 41, 319 A920)
53 Manske sta\"J A.m Chem Soc 51,580, 1906A929)
54 US Pat 1 956 950A934)
55 Ger Pat 469 782A926)
56 \'agai И et al / Arm 470, 157 A929)
5-7 US Pat 3 028 429A962)
58 HmtungW etal//J Am Chem Soc 51,2262A929)
59 Hartungtt etal 'J Am Chem Soc 74,5927A952)
60 Ger Pat 555 404A930)
61 US Pat 1 951 229A934)
62 Ger Pat 571 229A930)
ЬЪ LSPat 1 948 162A934)
64 US Pat 1 995 709A935)
65 Brit Pat 396 951 A932)
Глава 12
Адреноблокирующие
препараты
Термин «адреноблокатор» относится к препаратам, способным кон-
конкурировать с катехоламинами и другими адреномиметиками за связыва-
связывание с адренергически.ми рецепторами и тем самым блокировать эффекты
симпатических нервов, вызванных либо их стимуляцией эндогенными
симпатомиметиками, либо введенными извне экзогенными адренергиче-
скими препаратами. Процесс синтеза норэпинефрина (норадреналина)
в организме истинные адреноблокаторы не затрагивает.
В соответствии с вызываемым в организме ответом адреноблоки-
адреноблокирующие препараты классифицируются как а-адреноблокаторы, р-адре-
ноблокаторы и блокаторы адренергических нейронов.
а-адреноблокаторы вызывают расширение периферических сосу-
сосудов, а некоторые из них расслабляют и гладкую мускулатуру.
В противоположность этому fi-адреноблокаторы мало влияют на
сосудистый тонус. Более того, р-адреноблокаторы предотвращают со-
с>дорасширяющее действие эпинефрина. В таких органах, как сердце,
которые регулируются преимущественно Р-адренорецепторами, р-адре-
р-адреноблокаторы противодействуют возбуждающему действию норэпинеф-
норэпинефрина.
В свою очередь, а- и р-адреноблокаторы подразделяются на се-
селективные и не селективные. Неселективные C-адреноблокаторы
проявляют сродство как к рг. так и к р2-адренорецептивным участ-
участкам. К препаратам этой категории относятся препранолол, надолол,
тимолол и лабеталол (комбинированный а- и р-адреноблокатор). Се-
Селективными ргблокаторами являются ацебутол, атенолол, эсмолол
и метопролол. которые в терапевтических дозах преимущественно
связываются с pi-адренорецептивными участками.
На сегодняшний день еще нет терапевтически полезных селектив-
селективных р2-адреноблокаторов, хотя уже существует ряд экспериментальных
соединений с выраженной р2-адреноблокирующей активностью.
Наиболее широко Р-адреноблокаторы применяют при лечении сте-
стенокардии, гипертонической болезни, тахикардии, аритмии.
-228-
Адреноблокирующие препараты
Совершенно аналогично а-адреноблокаторы также подразделя-
подразделяются на селективные и неселективные. Примерами неселективных
а-адреноблокаторов являются фентоламин и феноксибензамин, а так-
также эргоалкалоиды — эрготамин и эргоновин. Несмотря на то, что их
практическое применение в медицине не связано с их а-блокирующей
способностью, исторически они были первыми исследованными а-адре-
ноблокаторами. Селективные а-адреноблокаторы в терапевтических
дозах выявляют большую степень сродства либо к агадренорецеп-
тивным участкам (празозин, теразозин), либо к осг-адренорецептивным
\ часткам (иохимбин).
В медицинской практике а-адреноблокаторы — препараты, блоки-
блокирующие а.\- и аг-адренорецепторы, — используются сравнительно ред-
редко. Наиболее важным эффектом а-адреноблокаторов является расшире-
расширение периферических сосудов, в связи с чем их применяют при различ-
различных нарушениях периферического кровообращения, при геморра-
геморрагическом и кардиогенном шоке, при котором типичным признаком
является спазм артериол.
Последней группой адреноблокаторов, условно названных блона-
торами адренергических нейронов, являются препараты, подавляющие
синтез, хранение и высвобождение биогенных аминов (норэпинефрина,
дофамина или серотонина) в нервных окончаниях.
К этому ряду препаратов относятся резерпин, гуанадрел, гуанети-
дин и метирозин, и их используют главным образом в качестве антиги-
пертензивных препаратов.
12.1. $-адреноблокаторы
Препараты, проявляющие обратимое конкурентное блокирующее
действие на Р-адренорецептивные участки рецепторной системы и про-
противодействующие эффектам катехоламинов, называются Р-адренобло-
каторами.
Эти препараты селективно уменьшают кардиостимулирующее, со-
сосудорасширяющее, бронхолитическое и метаболическое (гликогеноли-
гическое и липолитическое) действия катехоламинов, высвобождаемых
из адренергических нервных окончаний и надпочечников.
Введение Р-адреноблокаторов в медицину явилось одним из основ-
основных достижений фармакологии сердечно-сосудистой системы. Вначале
эти препараты использовались только при лечении эссенциальной ги-
гипертонии. В настоящее время они используются при лечении стенокар-
стенокардии, аритмиях, мигрени, инфаркте миокарда, глаукоме.
Глава 12
Их эффективность при многих болезнях объясняется конкурентным
блокированием р-адренорецепторов в автономной нервной системе,
в принципе любым из примененных препаратов класса 1-арилокси-З-
аминопропанолов-2, в результате чего понижаются скорость работы
сердца и сила сердечных сокращений, замедляется атриовентрикуляр-
ная проводимость, понижается уровень ренина в плазме, понижается
давление. Центральные эффекты р-адреноблокаторов выявляются и на
уровне сосудодвигательного центра в гипоталамусе, в результате чего
замедляется выход симпатических тонических импульсов.
В основную группу C-ареноблокирующих препаратов включены
пропранолол. метопролол, надолол. атенолол, тимолол, ацебутол, пиндо-
лол, зсмолол и комбинированный а- и р-адреноблокатор — лабеталол.
В химической структуре р-адреноблокаторов много общего. Прак-
Практически все они являются производными 1-арилокси-З-аминопропа-
нола-2. в положении С, которого обязательно наличие замешенной или
незамещенной ароматической или гетероароматической группы, свя-
связанной эфирной связью с трехуглеродной цепью. Радикал R при атоме
азота пропанового фрагмента должен быть представлен либо третичной
бутильной гр\ппой (надолол, тимолол), либо мзо-пропильной группой
(вс.: остальные препараты).
Ar-O-CH2-CH-CH2 —NH-R
ОН
Следует отметить, что замещенная этаноламинная группа в струк-
)\ре р-адреноблокаторов сходна с таковой у многих соединений с аго-
гшстической адренергической активностью (изопротеренол A1.1.9),
альбчтерол A1.1.21) и др.), и поэтому не исключено, что она может
быть ответственной за высокое сродство рассматриваемых адренобло-
каторов к C-адренергическим рецепторам.
Левовращающие изомеры этих препаратов являются гораздо более
мощными адреноблокаторами, чем правовращающие, однако все эти
препараты производятся и используются в виде рацемических смесей.
Рассматриваемые препараты обратимо связываются с Р-адренер-
гическими рецептивными участками и конкурентно предотвращают
активацию этих рецепторов катехоламинами, высвобождаемыми симпа-
симпатической нервной системой или вводимыми извне симпатомиметиками.
Как уже было отмечено, Р-адренорецепторы подразделяются на
C,-адренорецепторы, которые преимущественно находятся в сердеч-
сердечной мышце, и р2-адренореиепторы, находящиеся преимущественно
в бронхиальной и сосудистой мускулатуре. Соответственно, Р-адрено-
-230-
Адреноблокирующие препараты
бдокир\ющие вещества классифицируются по их селективности по
отношению к этим рецепторам.
Соединения, проявляющие примерно равное сродство к рг и Рг-ре-
цеп горам независимо от дозы, классифицируются как неселективные
блокаторы. например, надолол, пропранолол, пиндолол, тимолол и лабе-
1адол (комбинированный а- и Р-адреноблокатор). Препараты, имеющие
в терапевтических дозах большее сродство к р [-рецепторам, чем к р2-ре-
цепторам, например, ацебутол, атенолол, метопролол и эсмолол, называ-
называются селективными или кардиоселективными Р-адреноблокаторами.
Важно отметить, что эта селективность не абсолютна и что она за-
зависит от вводимых доз. При больших дозах селективность нивелируется
и оба подтипа р-адренорецепторов ингибируются в равной мере. В до-
дополнение к блокированию Р-адренорецепторов эти препараты воздейст-
воздействуют на сердечно-сосудистую систему и иным способом.
Пропранолол (Propranolol)
Пропранолол — 1-(шо-пропиламино)-3-A-нафтокси)-2-пропанол
112.1.2) предложено получать двумя путями исходящими из одних и
тех же исходных веществ. Первый способ заключается во взаимо-
взаимодействии 1-нафтола с эпихлоргидрином. Раскрытием эпоксидного
кольца получают 1-хлор-3-A-нафтокси)-2-пропанол A2.1.1), кото-
который далее вводят во взаимодействие с мзопропиламином с получе-
получением пропранолола A2.1.2).
сн3
О-СН2-СН-СН2—NH-CH
Второй способ синтеза, осуществляемый теми же реагентами, но
уже в присутствии основания, заключается в первоначальном получении
3-A-нафюкси)пропиленоксида A2.1.3), дальнейшее взаимодействие ко-
которого с изопропиламином, происходящее с раскрытием эпоксидного
кольца, приводит к получению пропранолола A2.1.2) [1, 2, 3, 4, 5, 6].
о-сн2-
о-снг-сн-енг—nh-си
-231 -
Глава 12
Пропранолол самый старый и наиболее широко используемый не-
неселективный C-адреноблокатор, который является прототипом этого
ряда препаратов. Обладает антиангинальным, гипотензивным и анти-
антиаритмическим действием. Пропранолол — сердечный депрессант, кото-
который действует и на механические, и электрофизиологические свойства
миокарда. Он может блокировать атриовентрикулярную проводимость
и автоматизм потенциалов синусного узла, а также адренергическую
стимуляцию, вызванную катехоламинами, тем не менее препарат пони-
понижает сократимость миокарда, скорость работы сердца, давление крови
и потребность миокарда в кислороде.
Все эти свойства и делают пропранолол и другие Р-адреноблокаторы
полезными антиаритмиками и антиангинальными препаратами.
Пропранолол понижает кровяное давление у большинства пациен-
пациентов с эссенциальной гипертонией. Этот эффект может быть вызван ря-
рядом возможных механизмов. В их числе понижение сердечного выбро-
выброса, ингибирование высвобождения ренина, понижение симпатического
выброса из ЦНС, ингибирование высвобождения норэпинефрина из
симпатических постганглионарных нейронов и т. п.
Однако ни один из предложенных механизмов не объясняет адекват-
адекватно антигипертензивную активность пропранолола и других р-блокаторов.
Пропранолол показан при лечении артериальной гипертонии, сте-
стенокардии, экстрасистолии, суправентрикулярной аритмии, вентрику-
лярной тахикардии, мигрени, гипертрофическом субаортальном стенозе
и феохромоцитоме. Применяется также в послеострой фазе инфаркта
миокарда.
Общепринятыми синонимами препарата являются анаприлин, обзи-
дан, индерал и многие другие.
Метопролод (Metoprolol)
Метопролол — 1-(шо-пропиламино)-3-[4'B-метоксиэтил)фенокси)]-
2-пропанол A2.1.5) получают взаимодействием 4-B-метоксиэтил)-
фенола с эпихлоргидрином в присутствии основания с выделением
1,2-эпокси-3-[4'B-метоксиэтил)фенокси)]пропана A2.1.4), дальней-
дальнейшее взаимодействие которого аналогично описанному выше с изо-
пропиламино.м, происходящему с раскрытием эпоксидного кольца,
приводит к получению метопролола A2.1,5) [7, 8].
сн3о-сн2-сн2-<\
-сн2о
-232-
Адреноблокирующие препараты
CH3O-Ch2-CH2'
12.1.5
СНз
-о-сн2-сн-сн2— nh-ch
ОН СН3
В отличие от пропранолола, блокирующего как рг, так и р2-адре-
норецепторы, метопролол проявляет кардиоселективное действие, т. е.
в терапевтических дозах он блокирует ргадренорецепторы с незначи-
незначительным воздействием на р2-адренорецепторы.
Метопролол применяют при умеренной гипертензии, острых со-
состояниях, инфаркте миокарда, для предупреждения омертвления сер-
сердечно-сосудистых тканей, при стенокардии, тахикардии, экстрасисто-
экстрасистолии, для вторичной профилактики после перенесенного инфаркта.
Наиболее распространенными синонимами препарата являются ло-
прессор, беталок и др.
В медицине широко используются и другие р-адреноблокаторы, ме-
методы синтеза которых мало отличаются от вышеприведенных. Поэтому
далее приводятся лишь их названия, структурные формулы, фармаколо-
фармакологические свойства и синонимы.
Ацебутол (Acebutol)
Ацебутол — 3 '-ацетил-4'-[2-гидрокси-3-(мзо-пропиламино)пропо-
кси]бутиранилид A2.1.6) [9, 10].
сн3со
сн3
о-сн2-сн-сн2 — nh-ch
ОН СН3
121.6
NH-CO-C3H7
Ацебутол — селективный Pi-адреноблокатор. Обладает антианги-
антиангинальным. гипотензивным и антиаритмическим действием. Применяют
при артериальной гипертонии, для профилактики приступов стенокар-
стенокардии, при нарушениях ритма сердца.
Синонимами препарата являются ацебутолол, секторль и др.
Атенолол (Atenolol)
Атенолол — 2-[41[2-гидрокси-3-(юо-пропиламино)пропокси]фенил]-
ацетамид A2.1.7) [П.. 12, 13].
-233-
Глава 1 2
СН3
о-сн2 -сн -сн2 —nh-ch
ОН СНз
12 1 7
CH2-CONH2
Атенолол — селективный ргадреноблокатор. или иначе — карди-
облокатор. Так же как и ацебутол, атенолол обладает антиангинальным,
гипотензивным и антиаритмическим действием. Применяют при арте-
артериальной гипертонии, для профилактики приступов стенокардии, сину-
синусовой тахикардии, наджелудочковых тахиаритмий.
Синонимами препарата являются тенормин, калтен, ибинол и др.
Надолол (Nadolol)
Надолол — 1-(/иреот-бутиламино)-3-[E,6,7,8-тетрагидро-г/мс-6,7-дигид-
рокси-1-нафтил)-окси]-2-пропанол A2,1.8) [14, 15, 16].
<Э-СН2 -СН -СН2 -NH-C(CH3K
6н
12 1 8
Надолол — неселективный р-адреноблокатор пролонгированного
действия. Так же как и рассмотренные выше Р-адреноблокаторы, препа-
pai обладает антиангинальным, гипотензивным и антиаритмическим
действием. Применяют при артериальной гипертонии, для профилакти-
профилактики приступов стенокардии, синусовой тахикардии.
Синонимами препарата являются коргард, солгол, корзид и др.
Пиндолол (Pindolol)
Пиндолол — 1-(индол-4-илокси)-3-(шо-пропиламино)-2-пропанол
A2.1.9) [17, 18].
сн3
о-сн2 -сн -сн2 —nh -сн
' ОН С
12 1 9
-234-
Адреноблокирующие препараты
Пиндолол, как и надолол, является неселективным Р-адренобло-
катором. Препарат обладает антиангинальным, гипотензивным и анти-
антиаритмическим действием. Применяют при артериальной гипертонии,
при стенокардии напряжения (профилактика приступов), наджелудоч-
наджелудочковой тахикардии, тахисистолической форме мерцания предсердий,
наджелудочковой и желудочковой экстрасистолии.
Синонимами препарата являются карвискен, вискен и др.
Тимолол (Timolol)
Тимолол — 1-(от/5еот-бутиламино)-3-[D-морфолино)-1,2,5-тиадиазол-
3-ил)окси]-2-пропанол A2.1.10) [19, 20, 21, 22, 23, 24, 25, 26, 27].
О
W
¦О-СН2 -СН -СН2 -NH -С(СН3)з
ОН
43'
12 1.10
Тимолол — неселективный р-адреноблокатор, предупреждающий
действие катехоламинов. При местном применении в виде глазных ка-
капель понижает внутриглазное давление. Применяют при хронической
открытоугольной глаукоме, вторичной глаукоме, закрытоугольной
глаукоме.
Синонимами препарата являются модукрин, тимакор, тимоптол,
блокадрен, тимолид и др.
Лабетапол (Labetalol)
Лабеталол — 2-гидрокси-5-[1-гидрокси-2-[A-метил-3-фенилпропа-
нол)амино]этил] бензамид A2.1.12) предложено получать N-алки-
лированием ТЧ-бензил-М-D-фенил-2-бутил)амина 5-бромацетилса-
лиииламидом с получением аминокетона A2.1.11), который далее
дебензилируют водородом с использованием палладий-платинового
катализатора на угле в лабеталол A2.1.12) [28, 29, 30].
о
м
H2N-C
Ch2
HN-CH-CH2-CH2
СН3
-235-
Глава 12
8
H2N-C
о ^н2
¦С-СН2 -N—СН -СН2 -СН2
12 111 СНз
/=\ H2'Pd-Pt.C
N—(JH ~CH2-Crl2 —^ ^
Структурно лабеталол отличается or других р-адреноблокаторов
уже хотя бы тем, что является производным этаноламина, а не 1-арил-
окси-З-аминопропанола-2, что не содержит арилоксильной фуппы, что
является производным фенилпропиламина, а не изопропил- или трет-
бутиламина, что аминоэтанольный фрагмент его соединен с ароматиче-
ароматическим фрагментом не эфирной связью. В то же время ароматическая
часть молекулы, в отличие от вышеприведенных типичных структур
Р-адреноблокаторов. достаточно функционализированна и представля-
представляет собой замещенный салициламид. Структурно препарат напоминает
добутамин A1.1.31), однако, в принципе, малые структурные отличия
делают его антагонистом добутамина. В фармакологическом плане он
является селективным конкурентным блокатором аг и неселективным
блокагором Р-адренергических рецепторов, что приводит к снижению
давленая у гипертензивных пациентов.
Показанием для применения лабеталола является лечение эссенци-
альной гипертонии.
Основными синонимами препарата являются трандат, абетол, ами-
пресс, прессалол и др.
12.2. а-адреноблокаторы
Соединения, способные блокировать а-адренергические рецептив-
рецептивные участки, предотвращая действие на них различных агонистов, на-
называются ос-блокаюрами.
Характерной особенностью а-адреноблокаторов является их спо-
способность уменьшать прессорный эффект фармакологических доз эпи-
нефрина (адреналина).
В частности, постсинаптические Oi-блокаторы действуют на а-ре-
цептивные участки, расположенные на сосудистой гладкой мускулату-
мускулатуре, и противодействуют прессорному, сосудосуживающему эффекту
эпинефрина и норэпинефрина. Кроме того, они проявляют прямой рас-
расслабляющий эффект на гладкую мускулатуру, что приводит к перифе-
периферическому расширению сосудов, в итоге приводящее к понижению дав-
давления. Однако они проявляют также кардиостимулируюший эффект.
-236-
Адреноблокирующие препараты
что нередко становится причиной тахикардии.
Пресинапгические ос2-рецептивные участки расположены на симпа-
симпатических нервных окончаниях, и их блокада, очевидно, по механизму
обратной связи повышает выброс эпинефрина из нервных окончаний.
Подобное фармакологическое действие имеет весьма ограниченную
клиническую полезность, однако является ценным лабораторным инст-
инструментом. Представителем селективных а2-адреноблокаторов является
алкалоид иохимбин.
Клинически полезными а-блокаторами являются:
1) долгодействующие неконкурентные антагонисты (фенокси-
бензамин), которые образуют прочные химические связи с а-ре-
цептивными участками, в результате чего блокада а-рецептора
может длиться днями и даже неделями;
2) обратимые конкурентные антагонисты — неселективные
(фентоламин, толазолин) и агселективно действующие (пра-
зозин, тетразозин) — обратимо и конкурентно блокируют
а-рецептивные участки; их действие может продолжаться не-
несколько часов. В то же время, блокада ими а-рецепгоров мо-
может быть прервана и прекращена действием больших доз аго-
ниста, например норэпинефрина;
3) эргоачксшоиды (эрготамин, эргоновин) также проявляют опре-
определенную неселективную ос-адреноблокирующую активность,
однако, в первую очередь, проявляют спазмогенное действие
на гладкую мускулатуру, вызывая сужение сосудов;
4) селективные а~адреноблокаторы, представителем которых
является алкалоид иохимбин, имеют ограниченное клиниче-
клиническое применение.
Долгодействующие неконкурентные
антагонисты
Феноксибензамин (Phenoxybenzamine)
Феноксибензамин — Н-B-хлорэтил)-М-( 1 -метил-2-феноксиэтил)бен-
зиламин A2.2.5) получают взаимодействием фенола с прониленокси-
дом с получением 1-фенокси-2-пропанола A2.2.1), хлорированием ко-
которого хлористым тионилом получают 1-фенокси-2-пропил\лорид
A2.2.2). Взаимодействие последнего с 2-аминоэтанолом приводит
к получению 1-фенокси-2-B-гидроксиэтил)аминопропана A2.2.3).
Алкилированием вторичной аминогруппы последнего получают
-237-
Глава 12
\-B-гидроксиэтил)-Х-( 1 -метил-2-феноксиэтил)бензиламин A2.2.4),
гндроксильную групп> которого хлорируют хлористым тионилом
с получением феноксибензамина A2.2.5) [31].
/У— С-СН2-СН-ОН
12 2 1
ТНз
C-Chj-CH-CI
12 2 t
SOCI2
СН3
<ч A-O-CH2-CH-N-CH2-CH2-CI
12 2 5 9H2
Феноксибензамин является галогеналкиламином, структурно родст-
родственным алкилирующим агентам, используемым в химиотерапии. Меха-
Механизм его долговременной блокады а-адренорецепторов, вероятно, дол-
кен бьпь объяснен их необратимым алкилированием. Скорее всего,
после кратковременного воздействия на а,- и а2-адренорецепторы на-
наступает и\ необратимая блокада. Возможно, Р-хлорэтиламинный фраг-
фрагмент в (каняч организма образует высокореакционноспособныи этиле-
иимониевый ингермедиат, который затем необратимо алкилирует
рецептор. Подобная блокада необратима и называется неравновесной
рецепторной блокадой.
Феноксибензамин применяется при лечении феохромоцитомы, опу-
опухоли мозгового слоя надпочечников, при которой продуцируется боль-
большое количество эпинефрина, что ведет к значительному повышению
давления.
Синонимом препарата является дибензилин.
Обратимые конкурентные антагонисты
Неселективные адреноблокаторы
Толазолин (Tolazoline)
Толазолин — 2-бензил-2-имидазолин A2.2.7) пол\чают гетероцик-
лизацией этилендиамина с этиловым эфиром иминофенил>ксусной
-238-
Адреноблокирующие препараты
кислоты A2.2.6) с получением целевого продукта A2.2.7) [32, 33,
34, 35]. Структура толазолина поразительно напоминает а-адре-
нергпческие агонисгы — противоотечные симпатомиметики.
С2Н5ОН
4 Л-сн2-с-ос2ь5
12 2 6
H2NCH2CH2NH2 /=='
Толазолин слабый, обратимый а-адреноблокатор — препарат, по-
понижающий сопротивление периферических сосудов и повышающий
венознчю наполняемость. Однако он проявляет и р-адреномимети-
ческую активность, заключающуюся в стимуляции работы сердца, ко-
которая выражается в виде тахикардии, и холинергическую активность,
заключающуюся в стимуляции работы ЖКТ, и гистаминоподобную ак-
активность, заключающуюся в стимуляции желудочной секреции.
Препарат показан для лечения устойчивых форм легочной гипер-
тензии > новорожденных, в случаях, когда системная артериальная ок-
сигенация не может быть достигнута обычным путем при тщательней-
тщательнейшем наблюдении профессионалов.
Синонимами препарата являются прискол, прискофен, имидалин
п др
Фенпголапии (Phentolamine)
Фентоламин — 2-[[К-C'-гидроксифенил)-иара-толуидино]метил]-
2-имидазолин A2.2.8) получают алкилированием 3-D-метилани-
лино)фенола 2-хлорметилимидазолином [36, 37].
N-H
N—|
N-1
N-1
1228
СНз
Фентоламин также является производным имидазолина, проявляю-
проявляющим прямое а-адреноблокирующее, мышечнорасслябляющее действие
на гладкчю мускулатуру, а также холиномиметическое, гисгаминное
и симиатомиметическое действие. Химическое варьирование структуры
-239-
Глава 1;
позволяет сделать некоторые из его свойств более выраженными.
К примеру, вышеописанный голазолин — 2-бенил-2-имидазолин,
структурный аналог фентоламина, имеет более выраженное мышечно-
расслябляюшее действие на гладкую мускулатуру, чем сс-адренобло-
кирующее.
Фентоламин свое действие проявляет, конкурируя с катехоламина-
ми за связывание с а-адренорецепторами, и именно поэтому называется
конкурентным блокатором, имеющим большое сродство, но малую ак-
активность к этим рецептивным участкам. Такая субстрат-рецепторная
блокада понижает способность а-адренорецепторов к взаимодействию с
симпатомиметическими аминами и, соответственно, уменьшав] значи-
значимость ответа вызванного эндогенными или экзогенными аминами. Вре-
Время блокады а-адренорецепторов фентоламином значительно меньше,
чем у феноксибензамина.
Фентоламин применяют при расстройствах периферического кро-
кровообращения, в частности при начальных стадиях гангрены, при лече-
лечении грофических язв конечностей, пролежней, отморожений.
Синонимами препарата являются регитин и дибазин.
агселективные адренодлокаторы
Эти препараты являются периферическими коронарорасширяющи-
ми препаратами с а-адреноблокирующей активностью и отличаются
специфичностью только к агадренорецепторам. В отличие ог рассмот-
рассмотренных выше феноксибензамина и фентоламина, они селективно бло-
блокируют а [-рецепторы и имеют малое сродство к сь-адренергическим
рецепторам.
Известно, что норэпинефрин регулирует свое собственное высвобож-
высвобождение из адренергических нервных окончаний по механизму отрицатель-
отрицательной обратной связи посредством а2-рецепторов на постсинаптической
мембране. В то же время нразозин и тетразозин — это единственные из-
известные селективные агадреноблокаторы, которые в терапевтических
дозах не блокируют ai-адренергические рецепторы. Таким образом, при
их применении механизм обратной связи для высвобождения норэпинеф-
рина не включается.
Празозин (Prazosin)
Празозин — 1-D-амино-6,7-диметокси-2-хиназолинил)-4-B-ф\роил)-
пиперазин A2.2.12) синтезируют исходя из 2-амино-4,5-диметокси-
бензойной кислоты, которую действием цианата натрия подвергают
-240-
Адреноблокирующие препараты
гетероциклизации в 2,4-дигидрокси-6,7-диметоксихиназолин A2.2.9).
Замещая гидроксильные группы полученного соединения на атомы
хлора реакцией с хлористым тионилом или смесью хлорокиси фосфо-
фосфора с пягихлористым фосфором, получают 2,4-дихлор-6,7-диметокси-
хиназолин A2.2.10). Последующим взаимодействием с аммиаком атом
хлора при С4 пиримидинового кольца замещают на аминогруппу, что
приводит к получению 4-амино-2-хлор-6.7-димегоксихиназолина
A2.2.11). Введением последнего в реакцию с 1-B-фуроил)пипера-
зином получают празозин A2.2 12) [38, 39, 40, 41, 42, 43, 44, 45,46. 47].
NH2
CH3O' ^^ "n Oh
12 2 9
SOCI2
CH3O
CH3O
СН-,0
СН3О
h-N
\ I? п—п
N-C-A. >'
N-S-JO
122 12
Празозин показан для лечения средней или умеренной гипертензии.
При применении препарата кровяное давление понижается без сущест-
существенных изменений таких показателей работы сердца, как частота со-
сокращений, коронарный поток, сердечный выброс.
Синонимами препарата являются минипресс и минизид.
Тетразозин (Tetrazosin)
Тетразозин — 1-D-амино-6,7-диметокси-2-хиназолинил)-4-B-тетра-
гидроф>роил)-пиперазин A2.2.13) отличается от празозина лишь
тем, что фурильный радикал заменен в нем на тетрагидрофуриль-
ный. Синтез осуществляют по совершенно аналогичной схеме с ис-
использованием вместо 1-B-фуроил)пиперазина 1-B-тетрагидрофу-
роил)пиперазина [48. 49. 50, 51].
-S-O
-241 -
Глава 12
Тетразозин применяют по тем же показаниям, что и празозин, од-
однако он имеет то преим\щество, что его можно принимать один раз
в день,
Синонимами препарата являются геитрин и вазокард.
Эргоалкалоиды
(алкалоиды спорыньи)
Эрготамин. эргоновин и ряд других алкалоидов выделены из спо-
спорыньи, являющейся продуктом грибкового заражения зерна, и в частно-
частности ржи. В ранней истории цивилизации и в средние века потребление
зерна, зараженного спорыньей, оканчивалось гангреной конечностей,
выкидышами, судорогами.
Алкалоиды спорыньи были первыми изученными адреноблокато-
рами. Несмотря на то. что большинство алкалоидов спорыньи проявля-
проявляют ct-адреноблокирующую активность, их фармакология зачастую раз-
различна. Химически эрготамин и эргоновин являются производными
лизергиновой кислоты.
Эрготамин (Ergotamine)
Эрготамин — 3',61,18'-трион,12'-гидрокси-2|-метил-5'-бензил)-
E а)-эрготамамн A2.2.14) получают микробиологическим синте-
синтезом [52].
122 14
Эрготамин в качестве а-адреноблокатора проявляет прямой сосудо-
сосудосуживающий эффект из-за чего и используется в медицине, в частности
для прерывания острых атак головной мигрени. Препарат категорически
противопоказан при хронических заболеваниях ввиду возможных про-
проявлений таких побочных эффектов, как инициирование гангрены.
Синонимами препарата являются синерган, секотамин и др.
-242-
Адреноблокирующие препараты
Эргоновин (Ergonovine)
Эрюновин — 1-гидроксиметилэтиламид лизергиновой кислоты
A2.2 15) получают этерификацией D-лизергиновой кислоты 2-ами-
нопропанолом в диметилформамиде, прямой обработкой реакцион-
реакционной смеси фосгеном [53, 54, 55, 56, 57, 58, 59].
о
.с-он
сн3
H2N-CH-CH2-OH
О СНз
,C-NH-CH-CH2-OH
¦N
СНз
Эргоновин не проявляет значимой а-адреноблокируюшей активно-
активности. Однако, как и эрготамин, применяется в акушерско-гинекологи-
ческой практике, для остановки послеродовых кровотечений.
Вероятнее всего механизмом его действия является прямое спазмо-
генное влияние на матку.
Синонимами препарата являются эргометрин и эрготрен.
Селективные аг-адреноблокаторы
Иохи.ибии (Yohimbine)
Иохимбин — метиловый эфир (±)-2а-гидроксииохимбан-1а-кар-
боновой кислоты A2.2.16). Выделяют из растений ряда Corynanthe
johimbe и Rauwolfia serpentina [60, 61]. Осуществлен также синтез
иохимбина [62, 63, 64, 65, 66].
122 16
Иохимбин — селективный а2~адренергический антагонист. Хими-
Химически сходен с алкалоидом резерпином. Являясь производным индоли-
лалкиламина, селективно блокирует а2-адренергические рецепторы.
На нервных окончаниях он ослабляет механизм отрицательной обрат-
обратной связи высвобождения норэпинефрина. Препарат обладает симпато-
-243-
Глава 12
миметическим эффектом, но может вьивать и симпаголитическое дей-
действие. Очевидно, треб) ются дополнительные исследования, чтобы од-
однозначно обрисовать его фармакологическое действие. В настоящее
время пет четких показаний по его применению.
Синонимами препарата являются коримбин. валимбин и др.
12.3. Блокаторы адренергических нейронов
Блокаторы адренергических нейронов вызывают распад биогенных
аминов в окончаниях нейронов. Эти препараты могут вмешаться в синтез,
хранение и высвобождение норэпинефрина, дофамина и серотонина.
Резерпин (Reserpine)
Резерпин — метиловый эфир 2а,11-диметокси-3-C,4,5-тримет-
оксибензоилокси)-иохимбан-1-карбоновой кислоты A2 3.1). Резер-
Резерпин является одним из алкалоидов, выделяемых из многолетних
к>старников семейства Rauwolfia [67, 68, 69, 70, 71, 72]. Осуществ-
Осуществлен также синтез резерпина [73, 74, 75, 76].
сьцо
ОСНз
1231
Резерпин вызывают распад норэпинефрина, дофамина и серотони-
серотонина в окончаниях нейронов. Он ослабляет вн>триклеточный захват био-
биогенных аминов и уменьшает способность к их хранению в везикулах.
Не исключено, что резерпин действует на мембраны везикул, необра-
необратимо ингибируя АТФ-М§2"-зависимый процесс, ответственный за за-
захват биогенных аминов в межнейрональные везикулы. Распад катехо-
ламинов выражается в уменьшении количеств внутринейронального
серотонина и дофамина.
Резерпин применяется при лечении гипертензии, однако не является
лекарством выбора из-за большого числа побочных реакций. На его ос-
основе имеется много препаратов комбинированных с другими гипертен-
зивными средствами, в частности, с диуретиками.
Резерпин выплскается под множеством названий, из которых можно
выделить серпасил, бринердин, диупрес и др.
-244-
Адреноблокирующие препараты
Гуанетидин (Guanethidine)
Г\анетидин — Р-A-азациклооктил)этилгуанидин A2.3.4) предло-
предложено получать по следующей простой схеме, Азоцин алкилир>ют
хлорацетонитрилом с получением 1-азоцинилацетонитрила A2.3.2),
который восстанавливают алюмогидридом лития в 1-B-амино-
этил)азош1н A2.3.3). Взаимодействием последнего с S-метилтио-
мочевиной получают гуанетидин A2.3.4) [77, 78. 79].
N-H
I—CH2-CN
N — CH2-CN
1232
LiALH4
NH
CH3-S-C-NH2
N —C42-CH2-NH2
1233
Г4!
Nh
—CH2-CH2-NH~C-NH2
1234
Гуанетидин не действует на эффекторные клетки, как это имеет ме-
сго с адреноблокаторами. Он воздействует на конечные разветвления
симпатических периферических нервных волокон и проникает в нейрон
по тому же механизму обратного захвата, который возвращает норэии-
нефрин в окончания нейрона из синаптической области. Внутри нейро-
нейрона гуанетидин аккумулируется и конкурирует за места складирования
в грануле с норэпинефрином. С увеличением концентрации гуанетидина
норэпинефрин замещается им, и, соответственно, в нейроне понижается
количество трансмиттера способного к выбросу. В результате стимуля-
стимуляции нерва может быть выброшен сам гуанетидин, который, однако, сам
не является стимулятором адренергического рецептора. Вдобавок к на-
нарушению наличия запасов катехоламинов в адренергических нервных
окончаниях препарат также воздействует на наличие запасов катехола-
катехоламинов в таких органах, как сердце, селезенка и аорта. Поскольку препа-
препарат не проходит через гематоэнцефалический барьер, то он не действует
на центральные симпатические нейроны.
Гуанетидин применяется при острой гипертензии. когда примене-
применение более общепринятых препаратов оказывается безуспешным. Это
очень сильный и долгодействующий препарат, и часто его действие
продолжается еще 2-3 дня после его применения.
Синонимами препарата являются октадин, исмелин. санотензин и др.
-245-
Глава 12
Гуанадрел (Guanadrel)
Гуанадрел — A.4-диоксиспиро[4,5]дец-2-илметил)гуанидин A2.3.8)
получают, подвергая циклогексанон катализации 3-хлор-1,2-пропан-
диолом с образованием 2-хлормежл-1,4-диоксиспиро[4,5]декана
A2.3.5), которым далее алкилируют фталимид натрия. Полученное
фталимидопроизводное A2.3.6) после щелочного гидразинолиза
трансформир\ется в 2-аминометил-1,4-диоксиспиро[4,5]декан A2.3.7)
и вводится во взаимодействие с S-метилтиомочевиной с получением
искомого гуанадрела A2.3.8) [80, 81, 82].
+ HO-CH2-CH-CH2-CI
6н
CH2-Ci
Na-i
1235
о-
1? 3 6
H-NNH?
ос
CH3-S-C-NH2
ост'
CH2-NH-C-NH2
Гуанадрел — блокатор адренергических нейронов, используемый
при эссенциальной гипертензии. Механизм его действия и побочные
реакции сходны с гуанетидином.
Препарат применяют для лечения гипертензии } пациентов, неадек-
неадекватно реагирующих на гиазидные диуретики. Может быть использован
в качестве дополнительного средства при тиазидном лечении для дос-
достижения оптимального уровня кровяного давления.
Синонимом препарата является гилорел.
Метирозин (Metyrosine)
Метирозин — (-)а-метилтирозин A2.3.11) предложено получать не-
несколькими путями, наиболее простым из которых представляется
синтез, исходящий из 4-метоксибензилацетона. который взаимодей-
взаимодействием с цианистым калием в присутствии карбоната аммония пе-
переводят в гидантоин A2.3.9). Обработкой последнего йодистым во-
водородом снимается защитная метальная гр>ппа в бензольном
кольце и продчкт A2.3.10) гндролизуется гидроокисью бария в ра-
-246-
Адреноблокирующие препараты
цемическую смесь а-метил-О,Ь-тирозина, из которой выделяется
искомый L-изомер A2.3.11) [83].
О KCN / (МЩЬСОз
СН2-С-СН3 •
HI
СНз
Ва(ОНJ
СНз
-СНг-С-СООН
NH2
123 10
12.3 11
Метирозин является метилированным производным тирозина. Пре-
Препарат конк>рентно ингибирует действие тирозиигидроксилазы и гем
:амым понижает образование эпинефрина и норэпинефрина.
Используется для лечения пациентов с феохромоцитомой в случаях,
(огда наблюдается повышение уровня катехоламинов.
Синонимом препарата является демсер.
' Список литературы
1. US Pat. 3.337.628A967).
2. US Pat. 3.520.919A970).
3. Brit. Pat. 994.918A963).
4. Brit. Pat. 994.918A963).
5. Belg. Pat. 640.312A964).
6. Belg. Pat. 640.313A964).
7. US Pat. 3.873.600A975).
8. Ger. Pat. 2.106.209A971).
9. S. Afr. Pat. 68 08.345A969).
10. US Pat. 3.857.952A974).
11. Ger. Pat. 2.007.751 A970).
12. US Pat. 3.663.607A972).
13. US Pat. 3.836.671 A974).
14. Ger. Pat. 2.258.995A973).
15. US Pat. 3.935.267A976).
16. Ger. Pat. 2.421.549A974).
17. Swiss. Pat. 469.002A969).
-247-
Глава 12
Адреноблокирующие препараты
18 Swiss Pat 472 404A969)
19 Ger Pat 1 925 955 A970)
20 Ger Pat 1 925 956A969)
21 LSPat 3 655 663A972)
22 US Pat 3 657 237A972)
23 WassonA etal >J Med Chem 15,651 A972)
24 US Pat 3 718 647A973)
25 US Pat 3 729 469A973)
26 US Pat 3 812 182A974)
27 US Pat 4 145 550A979)
28 Ger Pat 2 032642A971)
29 US Pat 4 012 444A977)
30 Clifton J etal /J Med Chem 25,670A982)
31 LSPat 2 599 000A952)
32 US Pat 2 161 938A939)
33 Ger Pat 615 527A934)
34 Ger Pat 687 196A938)
35 Ger Pat 842 063A945)
36 US Pat 2 503 059A950)
37 UrechE etal Helv Chim Acta 33, 1386A950)
38 US Pat 3 511 836A970)
39 LSPat 3 633 979A972)
40 US Pat 3 663 706A972)
41 Brit Pat 1 156 973A970)
42 Honkanen E et al J Heteroc>cl Chem I7, 79V(i980)
43 US Pat 3 935 213A976)
44 US Pat 4 062 844A977)
45 US Pat 4 138 561 A979)
46 Belg Pat 861 821 A977)
47 Belg Pat 861 822 A97^)
48 US Pat 4 026 894A977)
49 Ger Pat 2 646 186A977)
50 Ger Pat 2 831 112A979)
51 US Pat 4 251 532A981)
52 StollA Helv Chim Acta 28, 1283 A945)
53 Stall 1 etal Heh Chim Acta 26, 956 A943)
54 ITS Pat 2 090 430A937)
55 US Pat 2 447 214A948)
56 US Pat 2 736 728A956)
57 US Pat 2 774 763A956)
58 LSPat 2 809 920A957)
59 US Pat 3 141 88^A964)
60 Hofmann К /Heh Chim Acta 37, 849 A954)
61 BaderF J Am Chem Soc 76, 1695A954)
62 Tamelen Van E et al /80, 5006 A958)
63 LiljegrenD etal 'J Org Chem 27,377A962)
64 Tamelen P an E etal 91,7315A967)
65 WenkertE etal J Am Chem Soc 100,4894A978)
66 Ninomiya I et al / Heterocycles 14, 631 A980)
67 Ger Pat 967 469A954)
68 US Pat 2 752 351 A956)
69 US Pat 2 833 771 A958)
70 US Pat 2 88^489A957)
71 US Pat 2 938 906A960)
72 DorfmanL etal//Helv Chim Acta 37,59A954)
73 Ger Pat 1 088 062A957)
74 Woodward R et al //78, 2023 A956)
75 Pearlman В 7J Am Chem Soc 101, 6404 A979)
76 HenderP etal'J Am Chem Soc 102,6157A980)
77 US Pat 2 928 829 A960)
78 US Pat 3 006 913A961)
79 US Pat 3 055 882A962)
80 Fr Pat 1 522 153A967)
81 S Afr Pat 67 06 328A968)
82 US Pat 3 547 951A970)
83 Stein G etal J Am Chem Soc 77, 700 A955)
84 Potts К /J Chem Soc 1955, 1632
85 SaariA /J Org Chem 32,4074A967)
86 US Pat 2 868 818A959)
-248-
Глава 13
Хол ином иметики
Холиномиметики, или холинергические препараты, — это препара-
препараты, которые вызывают эффекты сходные с реакцией, возникающей при
введении ацетилхолина или стимуляции ганглиев парасимпатической
нервной системы. Эти препараты имитируют действие эндогенно вы-
высвобождаемого ацетилхолина. Известно, что действие ацетилхолина
в определенных органах может быть воспроизведено алкалоидом мус-
карином, в других органах алкалоидом — никотином. На этом основа-
основано подразделение холинорецепторов на так называемые мускариновые
(М-холинорецепторы) и никотиновые (Н-холинорецепторы).
Холинорецепторы разной локализации имеют неодинаковую чувст-
чувствительность к различным препаратам.
Более чем 10 миллиардов нейронов, составляющих нервную систе-
систему человека, сообщаются друг с другом посредством медиаторов.
Ацетилхолин, ряд аминов, определенные аминокислоты и пептиды
и аденозин являются медиаторами в ЦНС. Под упомянутым термином
амины следует подразумевать норэпинефрин. дофамин, серотонин, а так-
также, с весьма большой долей вероятности, гистамин и норэпинефрин.
Медиаторными аминокислотами считают глутаминовую и аспара-
гиновую кислоты, которые возбуждают посгсинаптические мембраны
многих нейронов, а ГАМК и глицин, являющиеся ингибирующими
трансмиттерами. Эндорфины. энкефалины и субстанция Р считаются
пептидергическими трансмиттерами. Имеется много соединений ими-
имитирующих действие указанных медиаторов.
Общепринятым на сегодняшний день считается, что:
-- медиатором постганглионарных парасимпатических нервных
окончаний гладкой мускулатуры, сердечной мышцы и экзок-
ринных желез является ацетилхолин;
— медиатором постганглионарных симпатических нервных
окончаний гладкой мускулатуры, сердечной мышцы и экзок-
ринных желез (за исключением потовых) является норэпи-
норэпинефрин (норадреналин);
— медиатором всех окончаний двигательных нервов является
ацсгилхолин;
-250-
Холиномиметики
— медиа!орами в ЦНС являются ацетилхолин, норэпинефрин,
дофамин, серотонин, гистамин. глчтаминовая и аспарагино-
вая кислоты, ГАМК, глицин, аденозин и ряд пептидов.
Основным медиатором в парасимпатической части автономной
нервной системы, которая иннервирует главным образом ЖКТ, глаз,
сердце, дыхательный факт, секрецию желез, является ацетилхолин.
Весьма небольшое число болезненных состояний можно объяснить
дисфункцией холинергических участков периферической автономной
системы, хотя именно они являются ключевыми для сохранения всех
нормальных функций организма.
Хотя сам ацетилхолин и является веществом, без которого невоз-
невозможно представить нормальное функционирование организма в целом,
два свойства делают его крайне неудобным для применения в качестве
лекарственного средства. Первое— весьма короткое время действия из-
за быстрого его расщепления холинэстеразами и второе, что более важ-
важно, — эго многогранность его действия, ввиду чего становится практи-
практически невозможным сделать его действие узконаправленным, для реше-
решения данной конкретной задачи. Однако ряд производных ацетилхолина
более устойчивы к действию холинэстераз и могут проявить большую
селективность действия.
Таким образом, холиномиметики — это препараты, которые имити-
имитируют действие эндогенно высвобождаемого ацетилхолина.
Классификации этих препаратов основываются на механизме их
действия, которое проявляется либо прямой стимуляцией холинергиче-
ски\ рецепторов эфирами холина или холиномиметическими алкалои-
алкалоидами, либо непрямым путем — ингибированием ацетилхолинэстераз —
ферментов, ответственных за химическую деструкцию ацетилхолина
в месте его действия. Последние, в свою очередь, подразделяются на
обратимые ингибиторы холинэстеразы и необратимые ингибиторы
чолинэстеразы.
13,1. Холиномиметики прямого действия
Холиномиметики прямого действия являются препаратами, дейст-
вующими путем прямой стимуляции холинергических рецепторов. Эти
препараты делятся на препараты, стимулирующие мускариновые (М-хо-
линорецепторы) или никотиновые (Н-холинорецепторы) рецепторы.
Препараты, эффективность которых в первую очередь связана со
стимуляцией мускариновых рецепторов, включают холиновые эфиры,
т. е. сам ацетилхолин и его структурные аналоги — метахолин, карба-
\ол, бетанехол и природные алкалоиды — мускарин и пилокарпин.
-251 -
Глава 13
Препараты [ейсгвие которых основывается на етимч тяцни ннкош
новых рецепторов вктючакя алка юиды — никонш и тобе мш
Холиновые эфиры
Препараты зтою к теса вкчючакм ацеппхочин и его структурные
анало! и метахотнн. бетапехол и карбахоч Несмотря на го чго ¦указан-
¦указанные препараты способны непосредственно сгим\лирова1ь все хочинер-
гичеекие рецепторы их терапевтическая эффективность опосредована
возченствием на чуускариповые рецепторы (подтипы М, и М->) Соедп
нения отчитаются то 1ько прочотжительностью дейстия и, в некоюрои
степени се [ективноетью к рецепторам Ацешлхошн якчяетея протоги
пом всей фуппы Для терапевтическою иепо [ьзования в настоящее
время не преччожено селсктивныч Мг и М2-агонисюв
Ацетилхолин (Acetylcholine)
Ацетихолин — хчорид 2-ацетокси N Ч",\т-тримети пти i аммония
A3 1 2) весьма просто синтезировать раз шчными п\ 1ями Согласно
первоwy способу, 2-хлорланол вводят во взаимодействие с фиме-
гиламнном, и полеченный при этом гидрохлорид N,N,N-TpnvieTHj-
этил-2-эганотамнна (П 1 1), называемый 1акже хочином, ацечн гп-
руют ашидридом или хчорашидридом уксусной кислоты с полу-
получением ацетилхолина (П 1 2) Второй способ зак!ючае!ся во
взаимодеис1вии гриметичамина с окисью этичена с поучением
гидроксида \т Л,1\-триметитэтил-2-этанолам1!на A3 13), который
взаимодействием с ччористым водородом перевочяг в гидрохторид
A3 1 1) и далее ацешлирчют вышеописанным способом Наконец,
третий способ — ацеттхошн чюжно поучать также взаимодей-
взаимодействием ацетата 2-хтор.)танота с тризтиламнном [1. 2 3, 4, \ 6. 7J
С!—СН^.—СН2 —ОН
'СНзKК — СН^-СН^-ОН Ci
13 1 1
CH3CCCi
о
-СИ -СН_,-О-С~СЧ3
1 j " 2
(СН / N +
—СН^-СИ^-СН 04
13 1 3
ChjCCCi
1_ 1 2
-252-
Холиномиметики
О
CI—CH2 -CH2 -O-C-Ch ,
13 1 г
Ацегилхотин предетавпяет собой мо 1ек>ту хотина, ацетилирован-
\л\ю по атомч кис юрода Ввидч натичия высокопо тярной заряженной
аммониевой грмшы ацетлхолин не проходит через линидные мембра-
мембраны По этой причине вводимый извне препарат задерживается во вне-
меючном просфанс!ве и не проникаег через гемаго^нцефалическии
барьер
Ацетилхолин не имеет терапевтической ценности в качестве препа-
препарата для впч фивенного введения из-за многопланового действия и бы-
быстрой инактивации хотинэстеразой Одновременно возможно возникно-
возникновение колтапгоидного состояния, может резко понизиться АД,
оиановшься сердце Однако его применяют в виде i аазных капеть тля
вьмывания мисна во время операций катаракты, [де и проявтяегся ею
преим>шество, способств\ющее бысфомч нослеонерационном\ вос-
сгаиов тению
Синонимом препарата является миохот
Метахо.шн (Methacholine)
Метахотин — хлорид 1-ацетокси-2-(\,\,\г-трпч1еп-п)пропип аммо-
аммония (П 14), или иначе ацетил-Р-мегилхолш. можно полччить лю-
любым in вышеописанных ч1еюдов [8]
сн3
CI
13 1 4
Малое стр>кт\рное изменение наличие метитьной грчппы ч p-\i-
теродного атома хотина выражается в двчх важных изменениях фарма-
коюгическою профиля мо)ек>лы В отчичие от ацети 1холина, метхо-
пин гидротизуется то гько ацетилхотинэстераюй, а скорость его
гндротиза значигепыю меньше. чеч1 ч ацешхолкна 1 1кич1 образом
действие ме!ахотина значшельно продотжитетьнее, чем \ auennxo m-
на Ьо iee юго натичие мети 1ьной фчппы \ р \i теродною аточ!а хот-
па обеспечивает соетинению ботьш\ю селекшвность действия Мега-
хочин непосредственно действчет на мчекариповые рецепюры гча [кои
м\скч 1а1\ры жечез п сердца и очень с табо дейс!гпет на никотиновые
рецепторы авгоночшых ганглиев екетешой чпекч та1чры Огн две осо-
-253-
Глава 1 3
бенности — длительность действия и повышенная селективность —
являются основными различиями в фармакологическом действии мета-
холина и ацетилхолина. Препарат применяется только для диагностики
бронхиальной гиперреактивности.
Синонимом препарата является провохолин.
Карбахол (Carbachol)
Карбахол — хлорид 2-карбамоилокси-М,><т,М-триметилэтил аммо-
аммония A3.1.7) получают взаимодействием 2-хлорэтанола с фосге-
фосгеном с образованием хлоругольного эфира 2-хлорэтанола A3.1.5).
Взаимодействием с аммиаком последний переводят в соответст-
соответствующий амид A3.1.6), и далее взаимодействием с эквимольным
количеством триметиламина получают карбахол A3.1.7) [9, 10,
11, 12, 13].
Cl—СН:-СН:-О-С-С1
13 1 5
Нз -СН2 -O-C-NH2
13 1 6
(CH3KN
(CH3KN — CH2-CH2-O-C-NH2 CI
13 1 7
В отличие от ацетилхолина и метахолина, карбахол содержит вме-
вместо ацетильной карбаминовую функциональную группу, которая не так
чувствительна к гидролизу холинэстеразами. Опытами in vitro показано,
что скорость его гидролиза как минимум вдвое меньше, чем у ацетичо-
лина.
Карбахол — мощный холиновый эфир, стимулирующий как муска-
риновые, так и никотиновые рецепторы, и проявляет все фармакодинами-
ческие свойства ацетилхолина, вызывая вдобавок расширение сосудов,
понижение скорости сердцебиения. Он повышает тон и сокращаемость
гладкой мускулатуры, стимулирует слюнные, глазные и потовые железы,
автономные ганглии и скелетную мускулатуру. По этим причинам он,
подобно ацетилхолину, ограниченно применяется в терапии, за исклю-
исключением офтальмологической практики, и при послеоперационной ато-
атонии кишечника и мочевого пузыря. При закапывании в глаз сужает зра-
зрачок и снижает внутриглазное давление.
Применяют при острой и хронической глаукоме.
Синонимами препарата являются дорил и миостат.
-254-
Холиномиметики
Бетанехол (Betanechol)
Бетанехол — хлорид 2-карбамоилокси-1-(Х,М,К-триметил)пропил
аммония A3.1.8) предложено получать либо последовательным
взаимодействием хлорида 1-(КДт,М-триметиламмоний)пропан-2-ола
с фосгеном и аммиаком, либо совершенно аналогичным синтезу
карбахола путем — последовательным взаимодействием 1-хлор-2-
пропанола с фосгеном, аммиаком и далее с триметиламином с по-
получением бетанехола A3.1.8) [14, 15].
СН3
СН2-СН — О-Н CI '
СОС12
СНз
о
(CH3KN—CH2-CH—O-C-NH2 Cl"
13.1.8
СНз
СН2-СН-ОН
I—СН2-СН— O-C-NH2
(CH3KN
13.1.8
Беганехол является препаратом, в котором скомбинированы сгрук-
т>рные особенности метахолина и карбахола, т.е. препарат содержит
в своей структуре как р-метальную, так и карбаматную функциональ-
функциональные группы и, вполне логично, проявляет фармакологические свойства
обоих препаратов. Он устойчив к гидролизу холинэстеразами и мало
действует на никотиновые рецепторы автономных ганглий и нервно-
мышечных соединений. Бетанехол имеет более селективное действие
на мускариновые рецепторы ЖКТ и мочевого пузыря, чем другие
хсаиновые эфиры.
Терапевтическое применение препарата основано на этом действии,
и его применяют при лечении послеоперационной необстру ктивной
задержки мочи и нейрогенной атонии мочевого пузыря. Ранее он ис-
использовался для лечения желудочно-кишечных заболеваний и болезни
Альцгеймера.
Синонимами препарата являются дувоид, миотонин и урехолин.
Природные мускариновые алкалоиды
Мускарин (Muscarine)
Мускарин — хлорид 2-метил-3-гидрокси-5-(\т.><,М-триметиламмо-
нийметнлентетра-гидрофурана A3.1.14) был впервые выделен из
ядовитых грибов — мухоморов Amanita muscaria Его можно синте-
-255-
Глава 13
зировать раз шчными способами из совершенно раличныч исход-
исходных всщеив [16 17 Is, 19 20 21 22 23 24] и в частное ги ис\оля
из 2^ ушетил ^ карбоксиметилф)рана вводя сю в реакцию К\р
ии\са г е поеледовагечьныч взаимодействием t гидразином и да
чее с азотистой кистоюй в изопропи ювом спирте с поучением
чретана A3 19) кисчотным гидрочизоч которого по i> чают 2 5-
димети i 1H ф)ранон-3 (И 1 10) Ач1ичьным бромированием по
с 1еднего поч\чаюг 2-мети i-5-бромметил 211 фураноп 3 AЭ 1 11) ко
торый вводя! во взаимодействие с димешчамином с поучением
2 мети ь4" диметичачинометил 2//-ф\ранона Ч A3 1 12) Восстанов-
Восстановление посчечнего приводит к почучению 2 метил-3-гидрокси "> чиме-
ти1аминомеишефагидроф\рана A3 1 13) взаимодействием которо-
которого с мористым метичом почлчаюг м\скарин A3 1 14) в виде смеси
егереоиюмерон
xl
Jrf
..... х
Cri CL
СИ 2NTH2 ^ CH,
1 i
М\скарин явтяется природным алкалоидом, встречающимся и ряхе
дикорас г\ тих мукоморов Несмофя на то, чго м\скарин не имеет тера
певтическою значения он пректавпяет интерес из-за выражьнных гок
сическах свойств и поскольк\ исторически он бьп одним из первых
систематически из\ченных хотиномиметических веществ Это сое гние-
гниение чегчо в основу классификации хотинергических м>скариновыч ре-
рецепторов Действие м\скарина сходно с действием аценпхотьиа на
периферические автономные эффеморные органы и атаюпизир\ется
атропином В опичие от ацетилхочииа м\скарин не чейств\ет на нико
тиновые рецепторы
Отрав 1ение фибами требует серьезного мечицинского вмещатеть-
ства. посколькх мчекарпн хорошо абсорбир\ется из АКТ и лоэтом\
может привести к несчастным ечучаяч М>скарин значшечьно ботее
мощен чем аиетитхочип возможно из за большей \сгоГгчивос1и Но
б\ч\чи эфиром он не подвергается гидрочиз\ чолпнэстеразами Геоа-
певтического применения не имеет Отравчение м\скарином чечи с\ ть
фатом атропина
-256-
Холиномиметики
Синонимов соединения практически нет
Пилокарпин (Pilocarpine)
Пилокарпин — 3-этил-4-A-метил-5-им1пазолилметил)тетрагидро-
фуран-2 он A3 1 22) является алкалоидом, почучаемыч из листьев
тропического растения Pilocarpus Jaborandi Его синтез осуществ-
осуществляют несколькими путями [25 26, 27, 28, 29, 30, 31, 32J, наиболее
приемлемым из которых следует считать путь исходящий из 2-этич-
3-карбокси-2-б>тиролактона [25, 26, 27], который с помощью хло-
хлористого тионила превращают в хлорангидрид A3 1 15) и далее вво-
вводят во взаимодействие с диазометаном и этанолом, почучая соот-
соответствующий этиаовый эфир (реакция Арндта—Айстерта), который
гидролиз>юг в кислот) A3 1 16) Полученная кисчота A3 1 16) дей-
действием хлористого тионила вновь переводится в хлорангидрид
A3 1 17) Последняя обрабатывается диазометаном Но на сей раз
промежуточно образующийся кетон обрабатывается хчористым во-
водородом с получением хлоркетона A3 1 18) Взаимодействием по-
последнего с фталимидом калия и последующим удалением фталимид-
ной защитной ф>ппы кислотным гидрочизом получают аминокетон
A3 1 19), который вводят во взаимодействие с подкисленным раство-
раствором тиоцианага калия с получением 3-этил-4-B-меркапто-5 имидазо
лилметил)тетрагидрофуран-2-она A3 1 20) Мягкое окисление послед-
последнею позвочяет >далить меркаптогруппу из продукта A3 1 20) и по-
чучить 3-этил-4-E-имидазолилметил)тетрагидрофуран-2-он A3 1 21)
Алкичирование полученного продукта йодистым метилом приводит
к образованию пилокарпина A3 1 22)
C2H5. СНгСОС!
1 CH2N2
2 HCI
о
131 17
J Г
0*^0^
1 К—
,CH2COC42CI о
2 Н +
131 18
-257-
Глава 13
C2HS CH2COCH2NH2
13.1 19
с2н5
KNCS/H
2
\ N-H
[O]
13.1 20
C2H5
-H
CH3I
13 1 21
13 1.22
Действие пилокарпина состоит в стимуляции мускариновых рецеп-
рецепторов и поэтому при систематическом введении сходно с действием
ацетилхолина. Соединение отличается от ацетилхолина отсутствием
какого-либо воздействия на никотиновые рецепторы, стимулирует ЦНС.
Его эффекты блокируются атропином. Находит также терапевтическое
применение в офтальмологии в качестве миотического средства.
Синонимами являются пилофрин, изоптокаприн, атмокаприн.
Природные никотиновые алкалоиды
Никотин (Nicotine)
Никотин — 1-метил-2-C-пиридил)пирролидин A3.1.27) — алкало-
алкалоид, который выделяют из растений рода Nicotiana {Nicotiana to-
Ъасит, Nicotiana rustica и др.) можно синтезировать разными путя-
путями [33, 34, 35, 36]. В частности, предложено исходить из этилового
эфира никотиновой кислоты, которую конденсируют с N-метилпир-
ролидоном с получением 1-метил-2-никотиноил пирролидона-2
A3.1.23). Кислотный гидролиз последнего приводит к раскрытию
пирролидинового кольца с промежуточным получением кислоты
A3.1.24), которая в условиях реакции декарбоксилируется в у-ами-
нокетон A3.1.25). Карбонильную группу последнего восстанавли-
восстанавливают до спиртовой, и далее образовавшийся продукт A3.1.26) под-
подвергают дегидратации в никотин A3.1.27).
СООС2Н5
C2Hs0Na
~N~ 0
13 1 23
1
Cri3
Н -СН2 -CH2 -N НСЧ3
COOH
-258-
Холиномиметики
СН2 —CH2 -CHj -NHCH3
[Н].
-CH2-CH2-CH2-NHCH3
«?
i
CH3
13 1 27
Никотин интенсивно изучался по разным причинам. Он использо-
использовался в фармакологии в экспериментальных целях для характеристики
холинергических никотиновых рецепторов и для стимулирования
и блокирования автономных ганглиев. На сегодня никотин является
объектом внимания из-за его большого наличия в табаке, что является
фактором риска для возникновения многих заболеваний. Никотин дей-
действует путем взаимодействия с периферическими холинергическими
никотиновыми рецепторами на постсинаптической мембране в авто-
автономных ганглиях и нервно-мышечных соединениях, равно как и нико-
никотиновых рецепторов в ЦНС. В низких дозах, скажем при курении сига-
сигарет, никотин стимулирует рецепторы, вызывая деполяризацию мем-
мембраны и приток ионов Na+ или Са2+. В высоких дозах стимуляция
сопровождается пролонгированной блокадой реполяризации. Это вызы-
вызывает нереагирование рецептора на последующую стимуляцию ацетил-
холином, высвобожденным из преганглионарных холинергических тка-
тканей, в результате чего и блокируется нервная передача. Это явление
характеризуется как деполяризующая ганглиевая блокада.
Единственным терапевтическим применением никотина является
его использование в составе жевательной резинки, в качестве временно-
временного средства при попытках бросить курить.
Синонимом препарата в виде салицилата является эндернол.
Лобелин (Lobeline)
Лобелии — 1-метил-2-(Р-гидрокси-р-фенилэтил)-6-фенацилпипе-
ридин A3.1.33) является основным алкалоидом листьев Lobelia
inflata. Синтез осуществляют конденсацией 2,6-диметилпиридина
с двумя молями бензальдегида с образованием а,а'-дистирилпи-
ридина A3.1.28) [37, 38, 39]. Исчерпывающее бромирование послед-
последнего и далее дегидробромирование полученного тетрабромпроизвод-
ного A3.1.29) приводит к получению а,а'-дифенилэтинилпиридина
A3.1.30). Гидратацией тройных связей продукта A3.1.30) получают
а,а'-дифенацилпиридин A3.1.31). Взаимодействием последнего
с метиловым эфиром и-толуолсульфокислоты получают N-метил-
«ара-толуолсульфонат а,а'-дифенацилпиридиния A3.1.32), который
-259-
Глава 13
осторожно восстанавливают водородом в искомый лобелин A3.1.33)
в условиях одновременного применения платинового и палладиевого
катализаторов. В результате получается продукт в виде рацемической
смеси, из которой, при необходимости, можно выделить левовра-
щающий изомер.
h3C N СНз
¦ - О
„сно
13 1 28
г XX
С6Н5СН—СН N ¦
Вг
13 1 29
Вг
СН—СНС6Н5
Вг
КОН
+ +2
Н2О / Н ' Нд
CeH5C=C" "N* С=ГСС6Н5
53 1 30
с6н5-с-сн2
P-CH3C6H4SO3CH3
¦СН2-С-СбН5
СНз
13 1 32
P-CH3C6H4SO3
Н2/ Pt,
О
ОН
сн2-сн—с6н5
)
СНз
13 1 33
Действие лобелина во многих отношениях сходно с никотином, од-
однако он слабее никотина в 50-100 раз. Он также является первичным
стимулянтом и вторичным депрессантом симпатических ганглиев, пара-
парасимпатических ганглиев и надпочечников и др. Может применяться в ка-
качестве средства против курения.
Синонимами препарата являются лоброн, вентарон, юнилобин, ло-
бетон и др.
13.2. Холиномиметики непрямого действия
Ингибиторы холинэстеразы являются очень важным классом со-
соединений семейства холиномиметиков. Кроме своей терапевтической
значимости, некоторые из них используются в качестве пестицидов
-260-
Холиномиметики
в сельском хозяйстве, а наиболее токсичные — в качестве химических
отравляющих средств. Использование этих веществ основано на изме-
изменениях, которые происходят после инактивации холинэстеразы или
псевдохолинэстеразы (менее специфичного фермента), т. е. эффектов,
наблюдаемых в результате накопления ацетилхолина в нейронально-
эффекторных соединениях. Ингибиторы холинэстеразы классифициру-
классифицируются как на основе их химической структуры, так и на типе их химиче-
химического взаимодействия с ферментом, который определяет их временное
действие.
Имеется 3 больших класса ингибиторов холинэстеразы:
1) карбаматы — физостигмин, неостигмин, пиридостигмин
и ряд инсектицидов типа карбарила;
2) четвертичные амины — эдрофоний, амбеноний и демека-
рий;
3) органофосфаты — изофлурофат, эхотиофат, инсектициды
типа малагиона и паратиона, а также боевые отравляющие
вещества типазомана.
Основываясь на разнице в длительности их ингибирующего эффек-
эффекта, ингибиторы холинэстеразы могут быть классифицированы как об-
обратимые и необратимые ингибиторы.
Обратимыми ингибиторами являются карбаматы и четвертичные
амины. Необратимыми ингибиторами холинэстеразы являются органо-
органофосфаты
Обратимые ингибиторы
холинэстеразы
Обратимые ингибиторы холинэстеразы образуют переходный ком-
комплекс с ферментом аналогично ацетилхолину. Эти соединения находятся
в конкуренции с ацетилхолином за связывание с активными участками
фермента. Химическая структура классических обратимых ингибиторов
(физостигмина и неостигмина) говорит о сходстве с ацетилхолином. Эти
соединения имеют большое сродство к ферменту и их ингибирующее
действие обратимо. Эти ингибиторы отличаются от ацетилхолина тем,
что не так легко расщепляются ферментами. Ферменты реактивируются
намного медленнее, чем происходит последующий гидролиз ацетилхоли-
ацетилхолина. Поэтому фармакологический эффект, вызываемый этими соедине-
соединениями, обратим.
Эдрофоний также является обратимым ингибитором.
-261 -
Глава 13
Карбаматы
Физостигмин (Physostigmine)
Физостигмин — 1,3а.8-триметил-2,3,3а,8а-тетрагидропирроло[2,3-
Ь]-индол-5-ил-М-метилкарбамат A3,2.7) является алкалоидом, вы-
выделяемым из так называемых калабарских бобов — семян ядовито-
ядовитого африканского растения семейства бобовых Physostigma venosum.
Синтетически физостигмин предложено получать разными путями
[40, 41, 42], один из которых исходит из иара-этоксиметиланилина,
который вводят во взаимодействие с бромангидридом ос-бромпро-
пионовой кислоты в присутствии хлористого алюминия с получе-
получением 1,3-диметил-5-этоксииндолин-2-она A3.2.1). Взаимодействи-
Взаимодействием последнего с хлорацетонитрилом в присутствии этилата натрия
получают 1,3-диметил-5-этокси-3-цианометилиндолин-2-он A3.2.2).
Нитрильнлю группу восстанавливают до аминной, которую далее
метилируют с получением 1,3-диметил-5-этокси-3-(Р-метиламино-
этил)индолин-2-она A3.2.3). Карбонильную группу последнего вос-
восстанавливают с получением аминоспирта A3.2.4), дегидратация ко-
которого приводит к получению 1,3а,8-триметил-2,3,3а,8а-тетрагидро-
пирроло[2.3-Ь]-5-этоксииндола A3.2.5). Этоксильная защитная группа
последнего удаляется действием бромистого водорода с получени-
получением соединения с фенольным гидроксилом A3.2.6), которое вводят
во взаимодействие с метилизоцианатом с получением искомого фи-
зостигмина A3.2.7).
1323 СН3
13 2 5 СН3 СН3
N N
i i
13 2 6 СН3 СН3
CH3NCO
CH3NHCOO
N N
13 2 7 СН3 СН3
-262-
Холиномиметики
Физостигмин легко абсорбируется из ЖКТ и других слизистых
оболочек. Попав в кровоток, препарат легко пересекает и гематоэн-
цефалический барьер. Препарат инактивируется холинэстеразой
плазмы. Физостигмин имеет минимальное прямое воздействие на хо-
линергические рецепторы. Из-за способности проникать в ЦНС пре-
препарат применяется в качестве антидота при возникновении в орга-
организме токсических концентраций препаратов с антихолинергичес-
кими свойствами, таких как атропин, ангигистамины, фенотиазины
и трициклические антидепрессанты. Его действие на организм, в об-
общем, сходно с действием ацетилхолина и он применяется по тем же
показаниям в офтальмологии для сужения зрачка и понижения глаз-
глазного давления при глаукоме.
Синонимами препарата являются эзерин и мезитинон.
Неостигмин (Neostigmine)
Неоетигмин — метилсульфонат М,?чт,1\[-триметил-л<еша-(диметил-
карбамоилокси)-фениламмония A3.2.9), который можно рассматри-
рассматривать как упрощенный аналог физостигмина, получают взаимодейст-
взаимодействием 3-диметиламинофенола с диметилкарбамоил хлоридом с полу-
получением диметилкарбамата A3.2.8) и последующим алкилированием
диметилс>льфатом A3.2.9) [43].
<СН3JЧ
132 8
CH3OSQ3
Неостигмин — ингибитор холинэстеразы содержит четвертичный
атом азота и, как следствие, из-за затрудненного прохождения через
гематоэнцефалический барьер проявляет минимальную токсичность,
связанную с ингибированием холинэстеразы в мозге. Наличие в моле-
молекуле четвертичного атома азота приводит и к другому значительному
различию между физостигмином и неостигмином, а именно: неостиг-
неостигмин, кроме ингибирования холинэстеразы, имеет прямой стимулирую-
стимулирующий эффект на холинергические рецепторы. Однако за исключением
этих серьезных различий общее действие неостигмина аналогично дей-
действию физостигмина. Как и другие обратимые ингибиторы холинэсте-
холинэстеразы, неостигмин проявляет мощное антикурареподобное действие. Это
свойство неостигмина используется в анестезиологии для преодоления
паралича скелетной мускулатуры вызванной курареподобными препа-
препаратами.
-263-
Глава 13
Неостигмин в основном применяют при миастении, двигательных
нарушениях после травм мозга, параличах, атрофии зрительного нерва,
при лечении атонии кишечника и мочевого пузыря.
Синонимами препарата являются прозерин, простигмин, стигмосан
и др.
Пиридостигмин (Pyridostigmine)
Пиридостигмин — диметилкарбамат З-гидрокси-1-метил пириди-
ний бромида A3.2.11) синтезируют из 3-гидроксипиридина взаимо-
взаимодействием с диметиламинокарбамоилхлоридом с получением 3-(ди-
метиламинокарбамоил)пиридина A3.2.10). Подвергая последний дей-
действию метилбромида, получают пиридостигмин A3.2.11) [44].
or.
CI—C-N(CH3J
О"
132 10
.О—C-N(CH3J
CH3Br
о
—С-ЩСИзЬ
Качественно фармакологические свойства пиридостигмина анало-
аналогичны свойствам неостигмину.
Синонимом препарата является местинон.
Четвертичные амины
Эдрофоний (Edrophonium)
Эдрофоний — хлорид этил-C-гидроксифенил)диметиламмония
A3.2.13) получают взаимодействием 3-диметиламинофенола
с этилбромидом с образованием бромида этил(.ме/па-гидроксифе-
нил)диметиламмония A3.2.12), атом брома которого обменивают на
хлор, взаимодействием с хлористым серебром с получением эдро-
фония A3.2.13) [45].
С2Н5ВГ
AgCL
сн3
132 12
Фармакологически эдрофоний также схож с неостигмином, однако
он начинает действовать быстрее и действует в течение более короткого
промежутка времени.
Синонимом препарата является тенсилон.
-264-
Холиномиметики
Амбеноний (Ambenonium)
Амбеноний — хлорид [оксалилбис(иминоэтилен)]бис[ор/ио-хлорбен-
зил)диэтиламмония] A3.2.15) получают взаимодействием диэтилок-
салата с двумя молями М,М-диэтилэтилендиамина с получением ок-
салилбис(иминоэтилен)бис>Ш-диэтиламина A3.2.14), который алки-
лируют двумя молями 2-хлорбензилхлорида с получением амбенония
A3.2.15) [46,47,48].
-CH2-CH2-NH2
о о
м
(C2H5JN -СЧ2-СН2—NH NH—CH2-CH2-N(C2H5J
С2Н5-О
0
NH
\О— СНг— N-CH2-CH2— NH NH—CH2-CH2-N—СН2—^ Л
С2Н5 13 2 15 CH
2CI '
Фармакологические свойства амбенония сходны с неостигмином
и пиридостигмином и достигаются путем обратимой инактивации
холинэстеразы.
Синонимом препарата является мителаз.
Демекарий (Demecarium)
Демекарий — гидроксид М,К'-декаметиленбис-[л<е/иа-(К-метилкар-
бамоилокси)-фенилтриметиламмония] A3.2.18) получают взаимо-
взаимодействием двух молей фосгена с 1,10-бг/с-(метиламино)-декано-
(М,Ы'-диметилдекаметилен-1,10-диамином с получением бискарба-
моилхлорида A3.2,16), который переводят в бискарбамоилэфир
A3.2.17) взаимодействием с двумя молями натриевой соли 3-диме-
тиламинофенола. Взаимодействием с метилбромидом последнего
получают демекарий A3.2.18) [49].
(CH3JN .
,-ONa
2 COCI2
СН3 СНз
H-N-(CH2I(I— N-H
СНз СНз
CI— CO-N-(CH2I(j— N-CO-CI
132 16
(CH3JN
СН3 СНз
-CO-N -(CH2)io—N -СО—Ov
13217
,N(CH3J
СН3ВГ
-265-
Глава 13
СН3 СНз
CO-N-(CH2)io— N-CO—
132 18
2 Br"
Демекарий — диссимметричное соединение, содержащее две аммо-
аммонийные и две карбаматные группы. Соединение является обратимым
ингибитором холинэстеразы, но с более продолжительным действием,
чем др) гие. Применяют для сужения зрачка, повышения внутриглазно-
внутриглазного давления при лечении глаукомы, а также для снятия атропинового
мидриаза.
Синонимами препарата являются тосмилен и гуморосол.
Необратимые ингибиторы холинэстеразы
Органофосфаты
Вторым классом ингибиторов холинэстеразы являются фосфорор-
фосфорорганические соединения общей формулы:
RiO О
м
R2O X
Фосфорорганические соединения действуют путем комплексооб-
разования с гидроксильной группой серина в эфирной части холинэ-
стеразных ферментов с образованием ковалентной связи с атомом фос-
фосфора.
В отличие от быстрого гидролиза комплекса ацетилхолина с фер-
ферментом и несколько более замедленного гидролиза комплексов карба-
матов. фосфорнлированный фермент с водой реагирует очень медленно,
приводя, в общем, к необратимому ингибированию работы фермента.
При применении большинства фосфорорганических веществ в организ-
организме должен произойти новый синтез фермента, чтобы восстановить хо-
линэстеразную активность ткани. Несмотря на то, что подобная актив-
активность называется необратимой, некоторые химические соединения,
такие как оксимы, могут восстановить жизнедеятельность фермента.
Однако фосфорилированный фермент может подвергнуться и процессу,
определяемому как старение, при котором органофосфат теряет алкиль-
н\ю групп), образуя более сильную необратимую связь с ферментом,
чю ) же делает фермент не способным к восстановлению оксимами.
-266-
Холиномиметики
Признаки и симптомы острой токсичности, возникающие при вве-
введении фосфорорганических антихолинэстеразных соединений, могут
быть предсказаны с легкостью и объясняются гиперактивностью пара-
парасимпатической нервной системы, нервно-мышечных соединений, авто-
автономных ганглиев и холинергических нервов ЦНС. Смерть возникает по
причине депрессии дыхания, вызванной депрессией ЦНС, паралича
диафрагмы и межреберных мышц из-за аккумуляции избыточного ко-
количества ацетилхолина. Некоторые органофосфаты полезны в качестве
медицинских препаратов, другие — в качестве инсектицидов и потен-
потенциальных химических боевых веществ по причине их высокой токсич-
токсичности.
Изофлурофат (Isoflurophate)
Изофлурофат — ди-шо-пропиловый эфир фторфосфорной кислоты
A3.2.21) получают взаимодействием шо-пропилового спирта с трех-
хлористым фосфором с получением ди-шо-нропилфосфита A3.2.19),
который хлорируют в 13.2.20, и далее действием фтористого натрия
обменивают атом хлора на фтор с получением изофлурофата
A3.2.21) [50].
(CH3i2CHOH
PCL-,
(СН3JСн -О о
W
-О н
132 19
С12 (СН3JСН-О о N.F
—*¦ )р{ —.
(СН3JСН -О CI
13 2 20
13221
Первое различие между изофлурофатом и средствами типа физо-
стигмина заключается в постоянстве (инерционности) действия. Со-
Согласно описанному выше возможному механизму, изофлурофат вызы-
вызывает необратимую инактивацию холинэстераз. Причем инактивируются
как ацетилхолинэстераза, так и «неспецифические» холинэстеразы
плазмы. Однако изофлурофат имеет большее сродство к последним.
Изофлурофат используется для лечения определенных типов глаукомы,
когда миотики кратковременного действия непригодны.
Синонимами препарата являются флороприл, флуостигмин и диф-
л> пил.
Экотиофат (Echothiophate)
Экотиофат— 8-B-триметиламиноэтил)-О,О-диэтилгиофосфат A3.2.23)
получают взаимодействием диэтилхлорфосфорной кислоты с 2-ди-
метиламиноэтилмеркаптаном с получением 8-B-диметиламино-
- 9R7 .
Глава 13
этил)-О,О-диэтилтиофосфата A3.2.22), который алкилируют ме-
тилйодидом с получением экотиофата A3.2.23) [51].
с2ч5-о
)
с2н5-о ci
HS-CH2-CH2-N(CH3J
с2н5-о о
)р{
c2h5-o \s
13 2 22
с2н5-о .0
СН3|
C2Hs-0 NS-CH2-CH2~N(CH3K
13 2 23
Экотиофат является фосфорилтиохолином с фармакологическим
действием, аналогичным таковому изофлурофата, однако спонтанное
восстановление фосфорилированного фермента происходит быстрее,
чем это происходит после применения изофлурофа-фата. Препарат
применяют при различных формах глаукомы.
Синонимами препарата являются эходид и фосфолин йодид.
Другие фосфорорганические
ингибиторы холинэстеразы
В настояшее время получены многие фосфорорганические соедине-
соединения, применяемые в быту и сельском хозяйстве в качестве инсектици-
инсектицидов. Многие из них являются липорастворимыми соединениями, быстро
и полностью адсорбируемыми практически всеми путями, включая ко-
кожу, дыхательный тракт и ЖКТ. Большинство фосфорорганических со-
соединений подвергаются биотрансформации путем гидролиза сложно-
эфирной группировки и выделяются с мочой. Малатион, широко
используемый дома и в саду, малотоксичен для людей, поскольку легко
гидролизуется. Однако его применение основано на том, что у насеко-
насекомых гидролиз протекает значительно медленнее.
Фосфорорганические соединения типа зарин, зоман и табун являются
одними из наиболее токсичных известных химических соединений, при-
применяемых в качестве боевых отравляющих веществ. Они вызывают очень
быстрое старение ферментов, не подвергающееся реактивации. Поэтому
нет соответствующей терапии для лечения этих отравлений.
Лечение интоксикации фосфорорганическими соединениями вклю-
включает искусственное дыхание, введение атропина — антагониста муска-
риновых рецепторов, введение пралидоксима, являющегося реактивато-
ром холинэстеразы.
-268-
Холиномиметики
Нралидоксим (Pralidoxime)
Пралидоксим — 2-пиридинальдоксима метилхлорид A3.2.25) син-
синтезируют взаимодействием пиридин-2-альдегида с гидроксилами-
ном с получением пиридин-2-альдоксима A3.2.24), который далее
вводят во взаимодействие с метилйодидом с получением искомого
пралидоксима A3.2.25) [52, 53, 54, 55].
N^CHO
h2noh
СН31
CH=N-0H
13.2.24
N "CH=N-OH
СН3
13.2.25
Пралидоксим — сильный нуклеофил. Он реактивирует фосфорили-
рованный фермент путем двухстадийной реакции. Первая стадия —
образование комплекса между оксиматионом и фосфорилированным
ферментом. Вторая стадия — восстановление ферментной активно-
активности и образование фосфорилированного оксима. Высокая реактиви-
реактивирующая способность пралидоксима приписывается его способности
сочетаться с отрицательно заряженной группой на поверхности фер-
фермента и высокой степени молекулярного соответствия между оксимом
и фосфорилированной холинэстеразой. Кажется вероятным, что окси-
мы могут реагировать непосредственно с ингибитором, превращая его
в безвредное соединение, а также реактивировать ингибированный
фермент как в крови, так и в тканях. Применяют при отравлениях ор-
ганофосфатами, параличе дыхательных мышц и, вообще, при холинер-
гическом кризисе.
Синонимами препарата являются контратион и протопам.
Глава 13
Список литературы
1. Bayer A Arm. 141235A867).
2. Nothnagel ,V.//Arch. Pharm. 232. 265 A894).
3. Fourneau E. et al, 'Bull. Soc. Chim. France. [4] 15, 544 A914).
4. Ger. Pat. 801.210A948).
5. US Pat. 1.957.443A934).
6. US Pat. 2.012.268 A935).
7. US Pat. 2.013.536A935).
8. US Pat. 2.040.146A936).
9. Ger. Pat. 539.329A930).
10. Ger. Pat. 553.148A930).
11. Ger. Pat. 590.311 A932).
12. Hayworth R. et al.;/J. Chem. Soc. 1947, 176.
13. US Pat. 2.374.367A945).
14. US Pat. 2.322.375A943).
15. US Pat. 1.894.162A933).
16. Kogl H. et al. Rec. Trav. Chim. 76, 109 A957).
17. KuglH etal./ZExpenentia. 13, 137A957).
18. Cox A. etabHelv. Chim. Acta. 4JL 229A958).
19. Matsumoto H. et al.//Tetrahedron. 25, 5889 A969).
20. Stilt W et al./'J. Org. Chem. 45. 3375 A980).
21. Whiting B. et al.//Can. J. Chem. 50, 3322 A972).
22. Mubarak A. et al.//Tetrahedron Letters. 21, 2453 A980).
23. Mubarak A. et al.//J. Chem. Soc. Perkin Trans I, 1982, 809.
24. Pochet S. et al./.'J. Org. Chem. 47, 193 A982).
25. Preobrashemki N. et al./'Ber. 66, 1187 A933).
26. Preobrashenski N. et aL'/Ber. 66, 1536 A933).
27. Preobrashenski /V et al.' Ber. 68, 850 A935).
28. DeGraw V.//Tetrahedron. 28, 967 A972).
29. Link K. et al./ZHelv. Chim. Acta. 55, 1053 A972).
30. howdam A. et al.//Rec. Trav. Chim. 98, 467 A979).
31. Langenbeck ЯО/Angew. Chem. 60, 297 A948).
12. Van Rossum J. et аЬ'Пб, 373 A960).
33. Pinner N. IIBev. 26, 294A893).
34. PictetJ. et al./'Ber. 37, 1225 A904).
35. Craig J.'J. Am. Chem. Soc. 55, 2854 A933).
36 Nakane M. et al.' J. Org. Chem. 43, 3922 A978).
37. Schoppf С, :Ап°е\\. Chem. 50, 786 A937).
38. WielandH et al.'/Arm. 473. 102 A929).
-270-
Холиномиметики
39. Scheuing G. et al./'473, 126 A929).
40. Julian P et al.//J. Am. Chem. Soc. 57, 755 A935).
41. Harley-Mason J. et al.//J. Chem. Soc. 1954, 3651.
42. Wijnberg J. et al.//Tetrahedron. 34, 2399 A978).
43. US Pat. 1.905.990A933).
44. US Pat. 2.572.579A951).
45. US Pat. 2.647.924A953).
46. US Pat. 3.096.373A963).
47. Ger. Pat. 1.024.517A954).
48. Phillips A /'J. Am. Chem. Soc. 73, 5822 A951).
49. US Pat. 2.789.891 A957).
50. US Pat. 2.409.039A946).
51. US Pat. 2.911.430A959).
52. US Pat. 2.816.113A957).
53. US Pat. 3.123.613A964).
54. US Pat. 3.140.289 A964).
55. US Pat. 3.155.674A964).
Глава 14
Антихолинергические
препараты
Антихолинергические препараты — это соединения, проявляющие
конкурентное блокирующее действие на холинергические рецепторы.
Указанная обширная группа препаратов может быть разбита на
3 подгруппы на основе их относительной специфичности к различным
типам холинорецепторов.
Первая группа «классических» антихолинергических средств пред-
представлена антимускариновыми соединениями (атро-
(атропин, пропантелин), которые блокируют действие
ацетилхолина или вводимых холиномиметических
препаратов на мускариновых (М-рецепторных) уча-
участках ЦНС и железистого аппарата, миокарда, глад-
гладкой мускулатуры.
Вторая группа антихолинергических препаратов представлена ганг-
лиоблокаторами (мекамиламин. триметафан), кото-
которые ингибируют холинергическую передач)' как в ав-
автономных парасимпатических, так и в симпатических
ганглиях путем блокирования (никотиновых) Н-ре-
цепторов.
Третья группа антихолинергических препаратов представлена инги-
ингибиторами передачи (тубокурарин, панкуроний), бло-
блокирующими никотиновые Н-рецепторы скелетной мус-
кулатуры, и будет рассмотрена в гл. 15 «Мышечные
релаксанты».
14.1. Антимускариновые препараты
М-чолиноблокаторы являются конкурентными антагонистами аце-
ацетилхолина, а также других М-холиномиметиков в отношении постеи-
наптических М-холинорецепторов.
Парасимпатические холинергические рецепторы локализованы в глад-
гладкой мускулатуре сосудов, бронхов, ЖКТ, мочевого пузыря, сердце, м>с-
к)латуре глаз, большинстве экзокринных железах и в ЦНС.
-272-
Антихолинергические препараты
М-холиноблокаторы проявляют широкий спектр фармакологиче-
фармакологических эффектов и применяются по самым различным показаниям. Они
могут быть использованы:
— с целью вызвать мидриаз или циклоплегию при офтальмоло-
офтальмологических исследованиях;
— при предоперационной подготовке пациента с целью умень-
уменьшения слюноотделения и предотвращения брадикардии:
— для уменьшения секреции ЖКТ в случаях язвы желудка,
спазмов и других желудочно-кишечных заболеваний;
— с целью уменьшения нософарингеальной и бронхиальной
секреции при респираторных и аллергических заболеваниях;
— для предотвращения и облегчения двигательных нарушений;
— для лечения детского энуреза и уменьшения частоты мочеис-
мочеиспускания;
— для облегчения некоторых симптомов паркинсонизма;
— в качестве антидота при передозировке холинергических пре-
препаратов, при отравлениях антихолинэстеразными препаратами,
фосфорорганическими инсектицидами и пестицидами.
Антимускариновые препараты классифицируются как:
• алкалоиды (атропин, гиосциамин, скополамин);
• антихолинергики ряда четвертичных аминов (анизотропии,
клидиний, гликопирролат, гексоциклий, изопропамид, мепен-
золат, метантелин, метскополамин, пропантелин);
• антипаркинсонические препараты ряда третичных аминов
(бензтропин, бензпериден, этопропазин, орфенадрин, процик-
лидин. тригексифенидил);
• спазмолитики ряда третичных аминов (дицикломин, оксибу-
тинин, оксифенциклимин);
• мидриатики ряда третичных аминов (ииклопентолат, тропи-
тропикам ид).
Алкалоиды
Старейшими препаратами этой группы являются различные галено-
вые препараты, выделяемые из красавки (Atropa belladonna), белены
(Hyoscyamus niger) и дурмана [Datura stramonium). Все они получаются
из растений, содержащих L-гиосциамин и несколько меньшие и варьи-
варьируемые количества L-скополамина. В качестве блокатора мускариновых
-273-
Глава 14
рецепторов L-гиосциамин намного активнее, чем D-гиосциамин, как на
периферии, так и в ЦНС. Однако рацемическая смесь D.L-гиосциамина,
более известная как атропин, предпочтительнее для большинства меди-
медицинских целей ввиду большей доступности.
Атропин и его аналог скополамин являются двумя наиболее важ-
важными антимускариновыми препаратами. Эти алкалоиды и родственные
им соединения применяются в офтальмологии и анестезиологии, при
сердечных и желудочно-кишечных заболеваниях, при паркинсонизме.
Большое значение они имеют в качестве антидотов при антихолинэсте-
разных интоксикациях.
Атропин и скополамин являются эфирами троповой кислоты с тро-
пином и скопином соответственно. Скопин отличается от тропина лишь
наличием эфирного кислородного мостика между атомами углерода С6
и С,- тропина.
Описаны подтипы мускариновых рецепторов (М| и Mi), которые
активируются или блокируются различными веществами, однако оба
типа мускариновых рецепторов активируются эндогенным нейротранс-
миттером — аиетилхолином и блокируются атропином или скополами-
ном. Несмотря на то, что атропин и скополамин являются обратимыми
холиноблокирующими агентами, константы их диссоциации с М-рецеп-
юрами в несколько раз меньше, чем у ацетихолина.
Соответственно их действие является более продолжительным
(до нескольких дней).
Неоднократно наблюдалось, что атропин более эффективен при
блокировании эффектов экзогенно вводимого ацетилхолина и других
парасимпатомиметиков, чем при блокировании эффектов, возникающих
после стимуляции волокон парасимпатических и холинергических нер-
нервов. Причиной этого могут быть 2 фактора:
1) ацетихолин высвобождается после нервных импульсов в
области очень близкой к М-рецепторам эффекторных клеток
и, следовательно, действует более эффективно, чем ацетилхо-
лин, поступающий путем циркуляции, и чем парасимпатиче-
парасимпатические вещества, поступающие тем же путем;
2) в определенных органах, таких как мочевой пузырь, постганг-
лионарные парасимпатические волокна в дополнение к аце-
тилхолину, могут высвобождаться и другие нейротрансмитте-
ры, например аденозинтрифосфат, действие которых не бло-
блокируется атропином.
Алкалоиды белладонны имеют весьма широкий фармакологический
спектр. В дополнение к их способности к блокированию М-рецепторов
-274-
Антихолинергические препараты
атропин и скополамин действуют и на другие рецепторы, проявляя со-
соответствующие эффекты. Они могут блокировать никотиновые холи-
нергические рецепторы, однако в дозах значительно выше чем те, кото-
которые применяются в клинике. Атропин проявляет также свойства
местных анестетиков и блокатора гистаминовых (Н|) рецепторов. Атро-
Атропин и скополамин практически полностью абсорбируются из ЖКТ и из
конъюнктивы. Скополамин может абсорбироваться и через кожу.
Атропин (Atropin)
Атропин — В,Ь-8-метил-8-азабицикло[3.2.1]окт-3-иловый эфир ос-гид-
роксиметилфенилуксусной кислоты A4.1.4) можно синтезировать по
обычной схеме синтеза тропановых алкалоидов. Конденсацией ма-
леинового диальдегида с метиламином и ацетондикарбоновой ки-
кислотой получают тропенон A4.1.1), который является основным ис-
исходным веществом как для синтеза атропина, так и для синтеза
скополамина. Карбонильную группу тропинона восстанавливают
с получением тропенола A4.1.2), после чего гидрируют двойную
связь между углеродными атомами С6 и С7 тропанового кольца
с получением тропина A4.1.3). Этерификацией последнего тропо-
троповой кислотой получают искомый атропин A4.1.4) [1, 2, 3. 4, 5, 6].
сн-сно
сн-сно
CH3NH2
о
ноос -сн2 -с -сн2 -соон
CHjCOONa
[И)
Н-О-С-СН-С6Н5
СН2-ОН
СНз
О-С-СН-С6Н5
сн2-он
Атропин применяют при язвенной болезни, пилороспазме, холеци-
холецистите, желчнокаменной болезни, спазмах кишечника и мочевых путей,
бронхиальной астме.
Атропин часто применяется в процессе анестезии в хирургии. Ос-
Основная цель — минимизировать секрецию в бронхах и в носоглотке,
Глава 14
которая может затруднить дыхание. В случаях, когда необходимо до-
дополнительное седативное действие, предпочтителен скополамин.
В офтальмологической практике атропин применяют в диагности-
диагностических целях — для расширения зрачка, и при осгрых воспалительных
заболеваниях и травмах глаза.
Атропин часто применяют при простудных заболеваниях, для вре-
временного осушения носоглотки. В сочетании с другими средствами
атропин применяется как антидот при отравлениях антихолинэстераз-
ными агентами, такими как фосфорорганические инсектициды и нерв-
нервно-паралитические газы. В эгих случаях атропин устраняет или нивели-
нивелирует многие токсические проявления являющиеся результатом действия
высокой концентрации ацетилхолина.
Агропин первый эффективный препарат, предложенный для сим-
симптоматического лечения паркинсонизма. Показано, что в отличие от
гастроинтесгинальных спазмолитиков, разные синтетические вещества,
проходящие через гематоэнцефалический барьер, такие как тригексн-
фенидил, этопропазин, бензтропин, проциклидин, орфенадрин и бипе-
риден, также эффективны при симптоматическом лечении паркинсо-
паркинсонизма. Для его лечения общепризнанным препаратом является
леводопа, однако исследования последних лет указывают на определен-
определенные ограничения при его применении.
Синонимами препарата являются атроптол, атропизол, D,L-rnoc-
циамин и др.
Скополамин (Scopolamine)
Скополамин — Ь-9-метил-3-окса-9-азатрицикло[3.2.1.0/'4]нон-7-
иловый эфир ос-гидроксиметилфенилуксусной кислоты A4.1.6)
можно синтезировать из тропенола A4.1.2) окислением двойной
связи между углеродными атомами С6 и С7 тропанового кольца
с получением эпоксидного производного — скопина A4.1.5). Эте-
рификацией последнего троповой кислотой получают скополамин
A4.1.6) [7, 8].
N
[О]
Н-О-С-СН-С6Н5
сн2-он
он
-С-СН-С5Н5
СН7-ОН
-276-
Антихолинергические препараты
Скополамин применяют практически по тем же показаниям, что
и атропин, но с учетом того, что он оказывает седативный эффект
и уменьшает двигательную активность, рекомендовано его примене-
применение и при симптомах паркинсонизма.
Синонимами препарата являются джосцин, осцин и др.
Антихолинергики ряда
четвертичных аминов
В течение последних десятилетий для клинического использования
при лечении язвы желудка, пилороспазма, гиперперистальтики был
предложен ряд синтетических атропиноподобных веществ с большим
спазмолитическим, но с меньшим антихолинергическим действием
и проявляющих меньше побочных эффектов.
Большинство из этих препаратов действуют по одному из трех ме-
механизмов: мускариновой блокады, прямого подавления активности
гладкой мускулатуры и блокады парасимпатических ганглиев, и ни
один из них не лишен присущих агропину побочных эффектов. Список
этих препаратов включает ряд четвертичных аммониевых солей (про-
пантелин, метскополамин, анизоторопин, мепензолат, изопропамид,
гликопирролат, клидиниум и гексоцицилиум).
Метскополамин (Methscopolamin)
Метскополамин — нитрат 7-C-гидрокси-1-оксо-2-фенилпропокси)-
9,9-диметил-3-окса-9-азонийтрицикло[3.2.1.0.2'4]нонана A4.1.7) по-
получают взаимодействием скополамина A4.1.6) с метилбромидом
(иногда с последующей заменой бромид иона на нитрат ион) взаи-
взаимодействием с нитратом серебра [9, 10].
СИ,
1-СН31
2.AgNO3
CH3-N
14.1.6
О
м
о-с-сн-с6н5
СН2-ОН
NO3
14.1.7
О
II
о-с-сн-с6н5
сн2-он
Метскополамин ингибирует мускариновое действие ацетилхолина
на постганглионарных парасимпатических эффекторных участках. Пре-
Препарат применяют при лечении язвы желудка.
-277-
Глава 14
Синонимами препарата являются памин и сколин.
Анизотропии (Anisotropin)
Анизотропии — метилбромид 2-пропилпентаноилтропиния A4.1.9)
синтезируют ацилированием тропина 04.1.3) хлорангидридом 2-про-
пилвалериановой кислоты с получением эфира A4.1.8) и дальней-
дальнейшим его взаимодействием с метилбромидом с получением анизо-
гропина A4.1.9) [11].
0
CL-C-CH-C3ri7 *"
СэН'
Cri3
N
14 1 8
s
1
{
0-
СН3Вг
0
II
-C-CH-C3H7
с,н7
снз
CH3-N +
л
14 1 9
\
0
Вг"
9
—с-сн-с3н7
с3н?
Анизотропии ингибир>ет секрецию желудочного сока и восстанав-
восстанавливает нормальную работу желудка. Применяют при лечении язвы же-
л\ дка.
Синонимом препарата является вальпин.
Пропантелин (Propantheline)
Пропантелин — Х-метилАт-A-метилэтил)-К-[2-[(9Я-ксантен-9-
илкарбонил)окси]этил]-2-пропанаммония бромид A4.1.11) получа-
получают взаимодействием хлорангидрида ксантен-9-карбоновой кислоты
с 2-ди-шопропиламиноэтанолом с получением эфира A4.1.10), ко-
который взаимодействием с метилбромидом переводят в четвертич-
четвертичную соль — пропантелин A4.1.11) [12, 13].
jf Т И ^ -ch2-ch2-n{
CH(Cri3J
СН3В'
со-о—снг-сьь-м
14 1 10
СН1СН3)г
СН(СН3)г
i +1
СО-О—CH2-CH2-N —СНз
Вг
14 1 11
СН(СНзJ
Фармакологическое действие пропангелина качественно сходно
-278-
Антихолинергические препараты
с атропином. На ЦНС действует слабее атропина. В отличие от атро-
атропина, он больше проявляет ганглиоблокирующее действие, чем анти-
мускариновое. Более того, при передозировке он вызывает нервно-
мышечную курареподобную блокаду. Применяют при лечении язвы
желудка
Синонимами препарата являются норпант, пропантел, робанталин.
Мепензолат (Mepenzolat)
Мепензолат — 3-[(гидроксидифенилацетил)окси]-1,1-диметил пипе-
ридиния бромид A4.1.13) получают путем этерификации бензиловой
кислоты 1-метил-З-хлорпиперидином и последующим взаимодейст-
взаимодействием полученного эфира A4.1.12) с метилбромидом [14, 15].
ас
Ch3
СНз
О"
о—с-с
СНз
Мепензолат ингибирует мускариновое действие ацетилхолина на
постганглионарных парасимпатических эффекторных участках. Приме-
Применяют при лечении язвы желудка, воспалениях кишечника вместе с дру-
другими препаратами.
Синонимами препарата являются кантил и эфторон.
Клидиний (Clidinium)
Клидиний — бромид З-бензилоилокси-1-метилхинуклидиния A4.1.19)
получают взаимодействием 3-гидроксихинуклидина A4.1.17) с хлор-
ангидридом бензиловой кислоты с получением эфира A4.1.18), кото-
который далее алкилируют по атому азота метилбромидом с получением
клидиния A4.1.19) [16].
14 1 18
Синтез самого 3-гидроксихинлклидина A4.1.17) осуществляют ис-
исходя из метилового эфира шо-никотиновой кислоты, которую взаимо-
-279-
Глава 14
действием с этиловым эфиром бром>ксусной кислоты переводят в соль
пиридиния A4.1,14). Восстановлением последней водородом с использо-
использованием платинового катализатора получают 1-карбэтоксиметил-4-карб-
метоксипиперидин A4.1.15), из которого циклизацией по Дикману. ис-
польз>я в качестве основания калий или этила! калия, получают
хинуклидин-3-он A4.1 16). Карбонильную группу последнего восста-
восстанавливают до спиртовой водородом над окисью платины с получением
3-гидроксихин> клидина A4.1.17)
I] * Br-CH.-COOC2H5
COOCHi
СН2-СООС2Н5
14 1 М
Н2 / РЮ
Н2< РЮ
ОН
6
N
I
СН2-СООС2Н,
14 1 15
14.1.16
14.1.17
Клидинин ингибирует мускариновое действие ацетилхолина на по-
стганглионарных парасимпатических эффекторных участках
Препарат применяют при лечении язвы желудка.
Синонимом препарата является кварзан
Гликопирролат (Glycopyrrolate)
Гликопирролат - 3-[(циклопентилгидроксифенилацетил)окси]-1,1-
диметилпирролидиния бромид A4.1.22) получают исходя из мети-
метилового эфира сх-циклопентилманделовой кислоты ( 14.1.20) путем
переэтерификации с использованием в качестве спиртового компо-
компонента З-гидрокси-1-метилпирролидина с получением эфира A4.1.21),
который далее переводят в четвертичную соль взаимодействием с
метилбромидом с получением гликопирролата A4.1.22). Исходный
из метиловый эфир сх-циклопентил-манделовой кислоты A4.1.20)
пол> чают взаимодействием циклопентилмагнийбромида с метило-
метиловым эфиром фенилглиоксиловой кислоты [17, 18]
?, 8
,С-С-О-СНз
MgBr
О
сн.
-280-
Антихолинергические препараты
о он
С1-ЬВг
СН-,
СН3 СНз
¦>4 1 21
14 1 22
Гликопирролат ингибирует секрецию желудочного сока и восста-
восстанавливает нормальною работу желудка. Препарат применяют при лече-
лечении язвы желудка, воспалениях кишечника, а также в качестве предопе-
предоперационного средства для ингибирования избыточной секреции желудка.
Синонимом препарата является робинул.
Изопропамид (Isopropamid)
Изопропамид — C-карбамоил-3,3-дифенилпропил)ди-шо-пропил-
метиламмония йодид A4.1.25) синтезируют алкилированием дифе-
нилацетонитрила ди-изо-пропиламиноэтилхлоридом в присутствии
амида натрия с последующим гидролизом нитрильной группы обра-
образовавшегося соединения A4.1.23) в амид A4.1 24). Алкилированием
последнего метилйодидом получают изопропамид A4.1.25) [19, 20.
21.22].
с
C-CN + CI-CH2-Ch2-N(
' СН(СН3J
> (
| Cri(CH3J
ch2-ch2-n(
14 1 23 СН(СН3J
CH(CH3J
(
C-CONh2
|
chz-ch2-n(
14 1 24 СН(СН3J
СН3Вг
Ch2-CH2-N— СНз Вг
14 1 25 СН(СН3J
Изопропамид ингибирует мускариновое действие ацетилхолина на
постганглионарных парасимпатических эффекторных участках. Приме-
Применяют при лечении язвы желудка, воспалениях кишечника.
Синонимами препарата являются дарбид и мобадид.
-281 -
Глава 14
Гексоциклий (Hexocyclium)
Гексоииклий — метилсульфат 4-(р-циклогексил-р-гидроксифен-
этил)-1,1-пиперазиния A4.1.28) синтезируют, алкилир>я 1-метилпи-
перазин а-бромацетофеноном с получением 4-метил-1-фенаиилпи-
перазина A4.1.26). Вводя последний во взаимодействие с цикло-
гексилмагнийбромидом получают 4-(Р-циклогексил-р-гидрокси-
фенэтил)-1,1-пиперазин A4.1.27), алкилированием которого диме-
тилсульфатом получают гексоциклий [23].
о
,С-СНгВг
+ H-N N-CH3
? Г~\ /—\
;-CH2—N N-CH3 ^ V-MgBr
14 1 26
/Г\ °Н Г~\ (CH3O!2SO2 /Г\ ?н /—х
\/-С-СН2 — N N-CH3 > \/~*9"CH2~N *H(
14 1 28
CH3OSO3
Гексоциклий интибирует мускариновое действие ацетилхолина на
постганглионарных парасимпатических эффекторных участках. Приме-
Применяют при лечении язвы желудка.
Синонимом препарата является трал.
Антипаркинсонические препараты
ряда третичных аминов
При лечении паркинсонизма применяются препараты, проявляю-
проявляющие центральные антихолинергические свойства. Полагают, что на
синтез, высвобождение и гидролиз ацетилхолина они не влияют. Их
лечебная эффективность проявляется в уменьшении или устранении
двигатечьных нар>шений. обусловленных поражением экстрапира-
миднон системы. Они уменьшают ригидность, в несколько меньшей
мере — акинезию и мало влияют на тремор.
Терапевтическая ценность этих препаратов относительно невелика,
и они применяются либо в комбинации с леводопой. либо в случаях
слабовыраженного паркинсонизма. К этим препаратам относятся опи-
описанные в гл. 10 «Средства, применяемые при паркинсонизме» тригек-
сифенидил A0.2.2), проциклидии A0.2.3), бипериден A0.2.4), бензтро-
пинA0.2.6), этопропазин A0.2.7) и др.
-282-
Антихолинергические препараты
9
9
( Vc-ch2-ch2—n
ч—'
О
:н—о
1026
С2Н5
CH3-CH-CH2-N\
10 2 7 С2Н5
Спазмолитики ряда
третичных аминов
Синтетические спазмолитики ряда третичных аминов (дицикломин,
оксиб>тинин, оксифенциклимин) проявляют прямое антиспастическое
действие на гладк>ю мускулатуру и ингибирует мускариноподобное
действие на нее ацетилхолина
Эти препараты проявляют более слабую, чем \ атропина, антихоли-
нергическую активность, однако значительно более выраженное анти-
антиспастическое действие. Их применяют для лечения, так называемого
синдрома раздраженной толстой кишки и при запорах.
Дицикломин (Dicyclomin)
Дицикломин — диэтиламиноэтиловый эфир 1-циклогексилцикло-
гексанкарбоновой кислоты A4.1.32) предложено получать двумя
путями. Согласно первому способу, бензилцианид подвергают ал-
килнрованию 1,5-дибромпентаном с получением 1-циано-1-фенил-
циклогексана A4 1.29). Последний подвергают алкоголиз) с получе-
получением лилового эфира 1-фенил-1-циклогексанкарбоновой кислоты
A4.1.30). которую подвергают переэтерификаиии с использованием
в качестве спиртового компонента 2-диэтиламиноэтанола в присутст-
присутствии натрия с получением 2-диэтиламиноэтилового эфира 1-фенил-
циклогексанкарбоновой кислоты A4.1.31), фенильную группу кото-
которой восстанавливают до циклогексильной водородом над окисью
платины [24, 25].
-283-
Глава 14
+ Er— (Crl2j,-Br
CH2CN
C2H5OH .< H
COOC2H5
HO-CH2-CH2-M(C2H5J
.co-o—сн2 -сн2 -N
CO-0—Ch2 -CH2 -N(C2H5J
Второй способ синтеза дицикломина исходит из цианоциклогекса-
на, который подвергают алкилированию циклогексилбромидом с полу-
получением 1-иианобициклогексана A4.1.33). Последний подвергают алко-
голизу с получением этилового эфира 1-бициклогексанкарбоновой
кислоты A4.1.34), которую подвергают переэтерификации 2-диэтилами-
ноэтанолом в присутствии натрия [25].
6-6
С2Н5ОН •н
.СООСггк
HO-CH2-CH2-N(C2H5J
Дицикломин ингибирует мускариновое действие ацетилхолина на
постганглионарных парасимпатических эффекторных участках. В ком-
комбинации с другими препаратами применяют при лечении язвы желудка
и при коликах у детей, для лечения синдрома раздраженной толстой
кишки.
Синонимами препарата являются антиспас, бентил, дибент, формулекс.
Оксибутинин (Oxybutinin)
Оксибутинин — 4-диэтиламино-2-бутиноловый эфир сс-фенилцик-
логексангликолевой кислоты A4.1.35) получают либо реакцией
Манниха с использованием пропаргилового эфира и-фенил-а-цикло-
гексангликолевой кислоты, параформа и диэтиламина, либо пере-
этерификацией метилового эфира се-фенил-сх-циклогексангликоле-
вой кислоты с использованием 1-ацетокси-4-диэтиламино-2-бутина
в присутствии метилата натрия [26].
-284-
Антихолинергические препараты
\__/-C-COO-Ch2-C=Cri
снго
H-N
от
С00-СН2-С5С—N
О
С-СОО-СНз
он
СН3-СОО-СНг-С=С—N
,с2н5
сгн5
CH3ONa
Оксибутинин предназначен для облегчения неприятных симптомов
при опорожнении кишечника и мочевого пузыря.
Синонимом препарата является дитропан.
Оксифенциклимин (Oxyphencyclimin)
Оксифенциклимин — 1,4,5,6-тетрагидро-1-метил-2-пиримидинме-
таноловый эфир а-фенилциклогексангликолевой кислоты A4.1.37)
получают этерификацией а-фенил-а-циклогексангликолевой кис-
кислоты 2-\лорметил-1-метил-1,4,5,6-тетрагидропиримвдином A4.1.36)
в присутствии йодистого калия. Исходный 2-хлорметил-1-метил-
1,4,5.6-тетрагидропиримидин A4.1.36), в свою очередь, получают
взаимодействием метилового эфира иминохлоруксусной кислоты
с 3-метиламинопропиламином [27, 28. 29].
С1-СН2-С-ОСН3
CH3-NH-CH2-CH2-CHr-NH2
ci—сн2—
14 1 36
-COOH
он
Ch3
\ г- с-соо—сн2
\ г с
ОН
N—л
-О
14 1.37
Окхифенциклимин весьма широко применяют по тем же показани-
показаниям, что и дицикломин и оксибутинин.
Синонимами препарата являются орбигастрил, гастрисед, гастрикс,
дарикон и др.
-285-
Глава 14
Мидриатики ряда
третичных аминов
Анчихолинергические препараты ряда третичных аминов (цикло-
пентолат, тропик-амид) применяются и местно в качестве мидриатиков
с целью вызвать циклопегию и мидриаз. В первую очередь, они исполь-
используются в качестве вспомогательных средств для исследования глаза
и других диагностических процедур до, во время и после офтальмоло-
офтальмологических вмешательств.
Циклопентолат (Cyclopentolat)
Циклопентолат — 2-(диметиламино)этиловый эфир 1-гидрокси-
циклопентан-а-фенилуксусной кислоты A4.1.39) получают этерифи-
кацией а-A-гидроксициклопентил)фенилукс\сной кислоты A4.1.38)
2-диметиламиноэтилхлоридом.
а-A-гидроксициклопентил)фенилуксусную кислот)' A4.1.38) полу-
получают взаимодействием натриевой соли фенилукс>сной кислоты с цик-
лопентаноном в присутствии изопропилмагнийбромида [30],
о
<Q>-0,-COONa + CH,-Cri-Br * (j
CHZ-CH2-N
(—COOH
14 1 38
CH3
•CH-COO—CH2-CH2-N
OH CH3
14 1 39
Циклопентолат— эффективный мидриатик и циклоплегик с очень
быстрым начатом и относительно коротким временем действия. Приме-
Применяется при офтальмоскопии и для вызывания предоперационного мид-
риаза.
Синонимами препарата являются мидрилат, цикложил. цикломид-
рил, пентолайр и др.
Тропикамид (Tropicamid)
Тропикамид — К-D-пиридилмет ид)-\т-этил-р-гидрокси-а-фенилпро-
пионамид A4.1.41) получают взаимодействием О-ацетилпропил-
хлорида с этидD-пиридил-метил)амином с последующим кислотным
гидролизом ацетильной гр>ппы в полученном амиде A4.1.40) [31].
-286-
Антихолинергические препараты
ч-сс
сн2
Ch2—<( N
C2H5
•CH-CO—N
C2H5
Тропикамид, так же как и циклопентолат, применяется при офталь-
офтальмоскопии, для получения предоперационного мидриаза и для тестиро-
тестирования узко\ гольной глаукомы.
Синонимами препарата являются мидрин, мидриацил, мидриафайр,
тропикацил.трипатар и др.
14.2. Ганглиоблокирующие вещества
Ганглиоблокирующие вещества — это соединения, селективно дей-
действ) ющие на нервную передачу в автономных ганглиях. (Теоретически
ганглиблокаторы могут упразднить всю автономную активность орга-
организма.)
Эти препараты классифицир>ют как деполяризующие и антидепо-
тяриз\ющие ганглиоблокаторы.
Деполяризующие ганглиоблокаторы, примером которых может
служить никотин, вначале стимулируют постганглионарные рецепторы,
а затем блокируют последующую активацию рецептора, предотвращая
гем самым реполяризацию постсинап гич ее кой мембраны. Фармаколо-
Фармакологические эффекты никотина очень разнообразны и в большой степени
зависят от дозы, экспозиции, физиологического состояния индивидуу-
индивидуума.
Антидеполяризующие ганглиоблокатиры, к которым относятся кли-
клинически эффективные препараты мекамиламин и триметафан, действуют
как конкурентные антагонисты ацетилхолина на постганглионарных ре-
иептивных \частках Их основное действие заключается в понижении
сое) дистого тонуса, выраженном расширении сосудов и понижении пе-
периферической сопротивляемости. Венозное расширение вызывает застой
крови, соответственно, уменьшение количества возвращаемой крови
в сердце и понижение сердечного выброса. Оба этих эффекта выража-
-287-
Глава 14
ются в виде гипотензии. В то же время ганглиоблокаторы вызывают
ортостатическую гипотензию, что является крайне нежелательным по-
побочным эффектом. Они являются средствами для понижения давления,
однако используются редко из-за большого числа побочных эффектов,
выражающихся в виде тахикардии, мидриаза, пониженной активности
ЖКТ. задержки мочи, сухости во рту и т. п.
В течение 1950-х и в начале 1960-х годов ганглиоблокаторы были
практически единственными веществами, используемыми для лечения
общей гипертензии. В настоящее время они практически заменены бо-
более эффективными средствами и их клиническое применение весьма
незначительно.
Мекамиламин (Mecamylamine)
Мекамиламин — ]Ч,2,3,3-тетраметилнорборнан-2-иламнн A4.2.2)
получают исходя из 2,3,3-триметилнорборнена-2, вводя его в реак-
реакцию Риттера с цианистоводородной кислотой в концентрированной
серной кислоте с получением 2,3,3-триметилнорборнан-2-ил-фор-
миламина A4.2.1), восстановление которого алюмогидридом лития
приводит к мекамиламину A4.2.2) [32, 33].
гхСН2
ЧИ~СНэ
СНэ
+ hcn + h2so4
L1ALH4
В настоящее время мекамиламин — единственный ганглиоблока-
тор, применяемый при общей гипертензии, однако ввиду развития
к нему привыкания и в связи с внедрением в медицинскую практику
многих других антигипертензивных препаратов необходимость в нем
отпала.
Синонимами препарата являются мевазин. инверзин и др.
Триметафан (Trimethaphan)
Триметафан — О-3,4-A,3-дибензил-2-оксоимидазолидино)-1,2-три-
метилентио-фания D-камфорсульфонат A4.2.12) является промежу-
промежуточным продуктом синтеза биотина (витамина Н). Препарат пол\-
чают исходя из фумаровой кислоты, бромирование которой при-
приводит к л<езо-дибромянтарной кислоте A4.2.3). Взаимодействием
последней с бензиламином пол}чают 2.3-бие-(бензиламино)янтар-
-288-
Антихопинергические препараты
ную кислоту A4.2.4), обработкой которой фосгеном получают 1,3-
дибензил-2-оксоимидазолидин-4,5-дикарбоновую кислоту A4.2.5).
Дегидратацией последней получают соответствующее имидазоли-
новое производное янтарного ангидрида A4.2.6). Восстановлением
последнего цинком в уксусной кислоте и последующей обработкой
сероводородом получают 1,3-дибензил-2,5-диоксо-тетрагидротиено-
[3,4]имидазолин A4.2,7), который вводят во взаимодействие с 3-это-
ксипропилмагийбромидом. Полученный карбинол A4.2.8) подвер-
подвергают кислотной дегидратации в A4.2.9), и далее восстанавливают
образовавшуюся при этом двойную связь водородом с использова-
использованием в качестве катализатора никеля Ренея. Расщеплением эфирной
связи в полученном продукте A4.2.10) с помощью бромистого во-
водорода в уксусной кислоте получают бромид 3,4-A,3-дибензил-2-
оксоимидазолидино)-1,2-тримегилентиофания A4.2.11), обработкой
которого D-камфорсульфнатом серебра получают триметафан
(.14.2.12) [34. 35, 36, 37, 38].
,с=с.
НООС h
н-с-с-н
НООС COOh
5-CH2-Nri Nh-CH2-C6H5
НООС COOH
14 2 4
I
ch2-^n-^vn^- сн2-с6н5
ноос/ \оон
О 1 Zoi СЧ3СООН
А.— СН.-СН* 2 H2S/HCI
14 2 5
О
N А
Ch2-C6H5
Вг—Mq— \
-,^N^ СН;~СьН3
\ /
^S CH~CH2-Cri2-O-C2Hs
Н2 Чале/ Ni
«4 2 8
,AN^ ch
M
CH2-CeH5
HBr'
h
СНзСООН
289-
Глава 14
Сг!з СН
СН2-Се«5
S
14212
Триметафан применяют для контролируемого снижения давления
в ходе хирургических вмешательств, для быстрой регутяции при рез-
резких повышениях давления, срочных вмешатечьств при отеке легких,
при ишемической болезни сердца, в случаях, когда другие препараты
не мог>т быть применены
Синонимом препарата является арфонад и др
Список литераторы
1 Ladenburg 4 "Ann 217, 75 A883)
2 WilhtatterR Ber 31, 1537 A898)
3 Willstattet R Ann 326, 23 A903)
4 Schnenker E et al //Ber 99, 2407 A966)
s Robinson J J Chem Soc 111,762A917)
6 Ger Pat 247 455A912)
7 Fodor G et al ,/Chem & Ind 1956. 764
8 Dobo P etal J Chem Soc 1959, 3461
9 US Pat 2 753 288A956)
10 Ger Pat 145 996A902)
11 US Pat 2 962 499A960)
12 US Pat 2 659 732A953)
13 Cusit 4 etal J Org Chem .16. 1921A951)
14 US Pat 2 918 408A959)
15 BielM etal /J Am Chem Soc 77,2250A955)
16 US Pat 2 648 667A955)
17 US Pat 2 956 062A960)
18 HinsfordH etal/'J Med Pharm Chem 2,523A960)
19 Brit Pat 772 921 A955)
20 Ger Pat 1 003 744A955)
21 Janssen P et al Arch Int Pharmacodyn Ther ШЗ, 82 A955)
22 US Pat 2 82^233A958)
-290-
Антихолинергические препараты
23 US Pat 2 907 765A959)
24 US Pat 2 474 796A949)
25 TilfordС etal J Am Chem Soc 69, 2903 A947)
26 Brit Pat 940 540A961)
27 Brit Pat 795 758 A956)
28 Ger Pat 1 058 515A956)
29 Faust T etal 'J Am Chem Soc 81, 2214A959)
30 US Pat 2 554 511A951)
31 US Pat 2 726 245A955)
32 US Pat 2 831 027A958)
33 Stain G etal 7J Am Chem Soc 78, 1514 A956)
34 US Pat 2 489 238A949)
35 US Pat 2 519 720A950)
36 US Pat 3 740 416A973)
37 US Pat 4 130 713A978)
38 LauelleS etal/'J Am Chem Soc JLQO, 1558A978)
Глава 15
Мышечные
релаксанты
Мышечные релаксанты (миорелаксанты) — это большая группа
химических соединений, обладающих способностью расслаблять ске-
скелетные мышцы.
На скелетную мускулатуру можно воздействовать довольно разно-
разнообразной и широкой группой веществ, действующих как на уровне
нервно-мышечных соединений, так и на различных уровнях спинного
мозга и ствола головного мозга.
Некоторые из них, воздействуя на передачу нервных импульсов
в местах нервно-мышечных контактов, способны парализовать скелет-
скелетную мускулатуру и используются преимущественно как вспомогатель-
вспомогательные вещества при анестезии в ходе малых хирургических вмешательств.
С другой стороны, имеются миорелаксанты, которые, действуя либо
на передачу нервных импульсов в нервно-мышечных синапсах или не-
непосредственно на сократительный механизм скелетной мускулатуры,
либо на передачу импульсов на уровне спинного мозга, вызывают раз-
различную степень мышечного расслабления вплоть до полного блокиро-
блокирования скелетной мускулатуры. Последние используются для облегчения
состояния пациента при мышечных спазмах, гиперрефлексии, гиперки-
незах, связанных с воспалением, стрессом и рядом неврологических
заболеваний.
В соответствии с локализацией и механизмом действия миорелак-
миорелаксанты могут быть классифицированы как:
• миорелаксанты периферического действия,
• мышечные релаксанты прямого действия,
• мышечные релаксанты центрального действия.
Активность миорелаксантов периферического действия проявля-
-292-
Мышечные релаксанты
ется в области нервно-мышечных контактов, в результате чего ослабляет-
ослабляется передача от окончаний двигательных нейронов к мембранам клеток
скелетных мышц.
Последние, в свою очередь, включают блокаторы нервно-мышеч-
нервно-мышечной передачи, которые можно подразделить на антиоеполяризующие
препараты (тубокурарин, атракурий, галламин) и деполяризующие пре-
препараты (сукцинилхолин).
Мышечные релаксанты прямого действия непосредственно бло-
блокируют процесс сокращения самих мышечных волокон. Из миотропных
препаратов прямого действия в практической медицине используется
только дантролен.
Широко применяются также мышечные релаксанты центрально-
центрального действия (баклофен, циклобензаприн, карисопродол, метокарбамол,
хлорфенезин, хлорзоксалон, орфенадрин и диазепам), которые подав-
подавляют передачу двигательных импульсов в межнейрональных синапсах
ЦНС.
75.7. Блокаторы нервно-мышечной передачи
Это соединения, блокирующие передачу импульсов от двигатель-
двигательных нервных окончаний к скелетной мускулатуре.
Предполагается, что есть два механизма блокирования передачи
нервных импульсов. Одна группа препаратов, родоначальником и ти-
типичным представителем которой является тубокурарин, называется ан-
тидеполяризующими препаратами. Конкурентно связываясь с соответ-
ств\ющим Н-холинорецепторным участком, они противодействуют
действию ацетилхолина на постсинаптическую мембрану, предотвра-
предотвращая его деполяризующее действие и тем самым исключают возмож-
возможность возбуждения мышечного волокна.
Следует иметь в виду, что из-за очень малой разницы в дозах, вы-
вызывающих необходимое мышечное расслабление и способствующих
развитию паралича скелетной мускулатуры, небольшая передозировка
курареподобных соединений может привести к серьезным нарушениям
со стороны дыхательной функции и резкому понижению давления. Пе-
Передозировку снимают путем введения антихолинэстеразных средств,
которые, блокируя ацетилхолинэстеразу, повышают концентрацию аце-
ацетилхолина в синаптической щели, используют искусственное дыхание
с применением кислорода, а при необходимости — средства, повы-
повышающие АД (левартеренол).
Другая группа препаратов, представителем которой является сук-
сукцинилхолин, называется деполяризующими препаратами. Соединения
-293-
Глава 1 5
>казанной группы вызывают первоначальную активацию (деполяриза-
(деполяризацию) рецептора с последующей его длительной и стойкой блокадой, что
приводит к задержке реполяризаиии, блокированию возможности по-
последующей стимуляции рецептора и в итоге к нар\шению проведения
возбуждения с нерва на мышцу.
В отличие от недеполяризуюших веществ, эти препараты являются
не конкурирующими антагонистами, а, наоборот, более устойчивыми
агоннстами, чем сам ацетилхолин.
Приемлемыми для практики антагонистами деполяризующих
средств в настоящее время медицина не располагает.
Антидеполяризующие
нервно-мышечные блокаторы
Впервые нервно-мышечные блокаторы были выделены из кураре —
экстракта, получаемого из южно-американских растений вида Strych-
nos и Chondodendron Сегодня в качестве антидеполяризующих или
курареподобных препаратов, которые называются также антидеполя-
ризующими, или конкурентными блокаторами, используются синте-
синтетические соединения, а также тубокурарин — алкалоид, выделяемый
из кураре.
Тубокурарин и большинство синтетических курареподобных со-
соединений содержат два или более четвертичных атома азота, располо-
расположенных на расстоянии примерно 1.0 ±0,1 nm друг от друга, что пред-
представляется необходимым условием для связывания этого типа
препаратов с никотиновыми холинорецепторами.
Эти препараты используются при оперативных вмешательствах, ко-
когда требуется релаксация скелетных мышц, в травматологии для репо-
репозиции отломков при вправлении сложных вывихов, при столбняке. Ин-
Интересно, что курареподобные препараты расслабляют мышцы в опре-
определенной последовательности. В первую очередь расслабляется мус-
мускулатура лица, шеи, затем конечностей и туловища. В последнюю
очередь выключаются дыхательные мышцы и диафрагма, что сопрово-
сопровождается остановкой дыхания.
Соединения этой группы включают тубок\рарин, метокарин, гал-
ламин, панкуроний, векуроний и атракурий.
Тубокурарин (Tubocurarine)
Тубокурарин — дихлорид 7',12'-дигидрокси-6,б'-диметокси-2,2,2 .2 -
тетраметилтубокурариния A5.1.1) получают из водных экстрактов
растений родов Chondrodendron [1, 2, 3, 4, 5, 6].
-294-
Мышечные релаксанты
НО ОСНз
сн3о
2CI
15 1 1
Предложены методы синтеза тубокурарина [7. 8].
Тубокурарин применяют, главным образом, в анестезиологии в ка-
качестве миорелаксанта, вызывающего длительное расслабление мускула-
мускулатуры во время операций. Малыми дозами препарата удается вызвать
временное расслабление скелетной мускулатуры без существенного
изменения основных функций организма, что, в частности, используют
при эндотрахеальной интубации или в ортопедии при репозиции облом-
обломков, вправлений сложных вывихов и др.
Основными синонимами препарата являются тубарин, курарин.
Метокурин (Metocurine)
Метокурин — 6,6!7', 12'-тетраметокси-2,2,2',2'-тетраметилтубоку-
12'-тетраметокси-2,2,2',2'-тетраметилтубокурариния дихлорид A5.1.2) получают метилированием двух гидро-
ксильных групп тубокурарина метилхлоридом [9].
15 1 1
СН3С|
СН3О
2 CI
151 2
Метокурин применяют по тем же показаниям, что и тубокура-
тубокурарин.
Синонимом препарата является метубин.
Галламин (Gallamin)
Галла.мин — трийодид 1.2,3-трисB-триэтиламиноэтокси)бензола
A5.1.4) синтезируют исходя из пирогаллола, гидроксильные груп-
-295-
Глава 1 5
пы которого этерифииируются 2-диэтиламиноэтилхлоридом в при-
присутствии амида нагрия. Полученный при этом 1.2,3-грисB-триэтил-
аминоэтокси)бензол A5.1 3) далее алкилируется по всем трем ато-
атомам азота этилйодидом с получением галламина A5.1.4) [10, 11].
1 NaNI-2
2 CL-C42-CH2-C
н2 -сн2 -сы2 -n;C
\- О—CH2-C
C2H6I
О—CH2-CH2-CH2-NlC2H5J
15 1 з
О—CH2-CH2-CH2-N(C2H5K
О—CH2-CH2-CH2-N(C2H5K
15 1 4
Галламин применяют по тем же показаниям, что и тубокурарин.
Синонимом препарата является флакседил.
Панкуроний (Pancuronium)
Панкуроний — 1,1'-(За,17C-диацетокси-5а-андростан-2р,1бр-илен-
)-бмс-A-метилпиперидиния) дибромид A5.1.8) получают исходя из
3,17-бис-(ацетокси)-2,16-5а-андростадиена. Окислением последнего
3-хлорнадбензойной кислотой получают бмс-эпоксисоединение
A5.1.5), взаимодействием которого с пиперидином и дальнейшим
гидролизом выделяют аминокетон A5.1.6). Кегогруппу образовав-
образовавшегося соединения A5.1.6) восстанавливают боргидридом натрия
до спиртовой с получением бмс-аминоспирта A5.1.7), и дальней-
дальнейшим ацетилированием спиртовых групп уксусным ангидридом
и алкилированием обоих атомов азота метилбромидом получают
целевой панк\роний A5.1.8) [12, 13, 14].
-296-
Мышечные релаксанты
QX&XQ
Ox6x^O
1 !СН3СОJО
2 Crt3Br
2Вг
Панкуроний является стероидным соединением, но гормональной
активностью не обладает. Применяется в анестезиологии в качестве
миорелаксанта, вызывающего длительное расслабление мускулатуры,
при хирургических вмешательствах на грудной и брюшной полостях,
в проктологии, офтальмологии, ортопедической практике, а также при
операциях на сердце.
Синонимом препарата является павулон.
Векуроний (Vecuronium)
Векуроний — 1 -[Bр,3а,5а, 16C,17р)-3,17-бис(ацетокси)-2-( 1 -пипе-
ридинил)-андростан-16-ил]-1-метилпиперидиния бромид A5.1.9)
отличается от панкурония лишь тем, что в алкилированное состоя-
состояние — четвертичную соль переводят лишь пиперидиновый замести-
заместитель у Сю стероидного скелета [15, 16].
15 1 9
Вг
Векуроний применяют по тем же показаниям, что и панкуроний.
Синонимом препарата является норкурон.
-297-
Глава 15
Атракурий (Atracurium)
Атракурий — дибензолсульфонат 2,2'-[1,5-пентадиилбис[оксиC-
оксо-3,1-пропандиил)]]бис[1-[C,4-диметоксифенил)метил]-1,2,3,4-
тетрагидро-6.7-диметокси-2-метилизо\инолиния] A5.1.12). Синтез
этого соединения осуществляют исходя из биоакрилового эфира
1,5-пентандиола A5.1.10), получаемого из хлорангидрида акрило-
акриловой кислоты и 1.5-пентандиола. К последнему по реакции Михаэля
присоедиеняют две молекулы вторичного амина — тетрагидропа-
паверина с получением продукта A5.1.11), оба атома азота которого
метилируют метилбензолсульфонатом с получением атракурия
A5.1.12) [17, 18, 19].
сн3о
СН3О
Н2С=СН-С-С|
НО-(СН2M-ОН
о о
Н2С =Cri -С — О-(СН2M-О— С -СН =СН2
СН3О
сн3о
СН3О
о о
N—Н2С-СН-С—О-(СН2M-О—С-СН-СН2 —N
СН3О
ОСН3
so2och3
оснз
ОСНз
СН3О
8 8
-N— НгС-СН-С — О-(СН2M-О—С-СН-СН2 — N
сн3
СН3О
ОСНз
ОСН3
Атракурий применяют по тем же показаниям, что и тубокурарин.
Синонимом препарата является тетракурий.
-298-
Мышечные релаксянтм
Деполяризующие
нервно-мышечные блокаторы
В отличие от недеполяризующих веществ, деполяризующие нервно-
мышечные блокаторы, являются не конкурирующими антагонистами,
а. наоборот, более устойчивыми агонистами, чем ацетилхолин. В прин-
принципе, они отличается от ацетилхолина только большей продолжитель-
продолжительностью действия. Эти препараты взаимодействуют с тем же рецептор-
ным участком, что и ацетилхолин. Но, поскольку эти препараты
инактивируются медленнее, чем ацетилхолин, то и действуют на синап-
синапсе дольше, вызывая более устойчивую деполяризацию. Таким образом,
блокируется процесс реполяризации рецептора, и наступает релаксация
скелетных мышц.
Большое практическое значение в качестве нервно-мышечного бло-
блока гора в медицине имеет сукцинилхолин.
Сукцинилхолин (Succinylcholine)
Сукцинилхолин — дихлорид 2,2'-[A,4-диоксо-1,4-б>тандимл)бис-
(окси)]б«с[^г,К,К-триметилэтиламмония] A5.1.14). который можно
рассматривать как удвоенную молекулу ацетилхолина (диацетилхо-
лин). получают взаимодействием дихлорангидрида янтарной кисло-
кислоты с 2-диметиламиноэтанолом и дальнейшим переводом получен-
полученного оис-B-диметиламиноэтил)сукцината A5.1.13) в четвертичную
соль —сукцинилхолин A5.1.14) [20, 21, 22,23, 24].
2 HO-CH2-CH2-N(CH3>2
CH2-C-O-ch2-CH2-N(CH3J
15 1 13
О
СН2-с-О-СН2-СН2-N(CH3;3
снг-с-о-СНг_СНг_у(СНз)з
15 1 14
2 CI
Сукцинилхолин является единственным терапевтически используе-
используемым деполяризующим нервно-мышечным блокатором. В отличие от
не1еполяризующи\ веществ, сукцинилхолин является не конкурирую-
Глава 15
щим антагонистом, а, наоборот, более устойчивым агонистом, чем аце-
тилхолин. Таким образом, сукцинилхолин отличается от аиетилхолина
только продолжительностью действия и, соответственно, действует
дольше, вызывая более устойчивую деполяризацию. Таким образом
блокируется процесс реполяризации. и наступает мышечное расслабле-
расслабление. При этом мышцы, вызывающие тонкие движения (глазные, голов-
головные лицевые, шейные) наиболее чувствительны и блокируются первы-
первыми, после чего блокируются мышцы конечностей и, наконец, наиболее
устойчивые дыхательные мышцы. Восстановление происходит по окон-
окончании действия препарата.
Терапевтическое использование сукцинилхолина заключается в пре-
предотвращении у пациентов непроизвольных движений. Его применяют
при кратковременных операциях, интубации трахеи и другие эндоско-
эндоскопических процедурах.
Синонимами препарата являются листенон, мидарин, сукострин,
дитилин и др.
15.2. Мышечные релаксанты прямого действия
Единственным препаратом такого типа, получившим широкое при-
признание, является дантролен.
Дантролен (Dantrolen)
Дантролен — 1 -[[[5-D-нитрофенил)-2-фуранил]метилен]амино]-2,4-
имидазолидин-дион A5.2.2) получают взаимодействием 4-нитрофе-
нилдиазоний хлорида с фурфуролом с образованием 5-D-нитро-
фенил)-2-фуранкарбоксальдегида A5.2.1), который далее вводят во
взаимодействие с 1-аминогидантоином с получением соответст-
соответствующего гидразона—дантролена A5.2.2) [25, 26].
CuCLz
H2N
О СНО
-300-
Мышечные релаксанты
Дантролен является препаратом, который вызывает спастическое
сокращение мышц. В отличие от других мышечных релаксантов, он
непосредственно воздействует на сократительный механизм, вмешива-
вмешиваясь в процесс высвобождения ионов Са"+ из саркоплазматической сети.
Это выражается в несогласованности механизма возбуждения-
сокращения скелетной мускулатуры, что в большей степени отражается
на волокнах быстрых, а не медленных мышц.
Дантролен используется для контроля проявлений клинической
спастичности, возникающей в результате серьезных клинических случа-
случаев, таких как ранения, паралич, церебральный паралич и рассеянный
склероз.
Синонимами препарата являются дантрий и данулен.
15.3. Мышечные релаксанты центрального действия
К сожалению, паралич скелетной мускулатуры, достигаемый
применением курареподобных соединений, в большинстве случаев не
является пригодным при общих состояниях спасгичности, сопровож-
сопровождающихся поражениями ЦНС, а также при местных повреждениях
и воспалениях. Конечно, нервно-мышечная блокада облегчает спазм,
однако сопровождается потерей способности произвольным движе-
движениям.
В условиях мышечной спастичности бывают необходимы препа-
препараты, способные снять болевой мышечный спазм без утраты способ-
способности мышцы к произвольным сокращениям и без ухудшения мозго-
мозговой функции.
Многие депрессанты ЦНС вызывают мышечное расслабление. Сре-
Среди них следует отметить алкоголь и барбитураты, которые, однако, не
используются для этой цели, поскольку вызывают значительную седа-
цию и другие эффекты. Поиск селективных ЦНС-активных веществ,
ответственных за возможное достижение мышечного расслабления,
привел к получению ряда интересных соединений, предложенных кли-
клинике, ни одно из которых, однако, не смогло полностью удовлетворить
необходимым требованиям. Тем не менее мышечные релаксанты, дей-
действующие посредством воздействия на ЦНС. широко используются при
лечении растяжений, разрывов, артритов и других мышечных наруше-
нарушениях. В их число входит большая гетерогенная группа химических со-
соединений, которые воздействуют через спинной мозг и подавляют мо-
носинаптические и полисинаптические рефлексы. Среди них баклофен,
циклобензаприн, карисопродол, метокарбамол, хлорфенезин, хлорзок-
салон. орфенадрин и диазепам.
-301 -
Глава 1 5
Бакюфен (Baclofen)
Баклофен — 4-амино-3-D'-хлорфенил)масляную кислоту A5.3.5)
предложено получать двумя методами. Согласно первому способу,
4-хлорбензальдегид конденсируют с двумя молями ацетоуксусного
эфира с получением продукта A5.3.1), который сначала подвергают
щелочному расщеплению с получением 3-D-хлорфенил)глутаровой
кислоты A5.3.2). Дегидратацией последней получают ангидрид
3-D-хлорфенил)глутаровой кислоты A5.3.3) и далее обработкой ам-
аммиаком — соответствующий глутаримид A5.3.4). Действием на по-
последний щелочным раствором галогена (расщепление по Гофману)
получают баклофен A5.3.6) [27, 28].
СОСН3
. СН-СООС2Н5
H
NaOH
СН-СООС2Ч5
СН2-СООН
(СН3СО)гО
NH3
у==. CH2-NH2
сн2-соон
1535
Второй способ синтеза баклофена исходит из этилового эфира
4-хлоркоричной кислоты. Присоединением к ней нитрометана в присут-
присутствии тритона В получают этиловый эфир р-D-хлорфенил)-у-нитро-
масляной кислоты A5.3.6), нитрогруппу которой восстанавливают во-
водородом над никелем Ренея в этиловый эфир Р-D-хлорфенил)-у-амино-
масляной кислоты A5.3.7), который далее гидролизуют в целевой
баклофен A5 3.5) [29].
, . CH2-NH2
СН2-СООС2Н5
-302-
Мышечные релаксанты
Ьаклофен является замещенным аналогом ГАМК. Предполагается,
ч'о его действие состоит во взаимодействии с ГАМК-рецепторами, что
приводит к ингибированию высвобождения возбуждающих ней-
ро;рансмпттеров.
Показан при признаках мышечной спастичности, рассеянном
склерозе и других спинальных расстройствах. Может быть полезен па-
ииен1ам с мышечными спазмами в рез>льтате повреждений спинного
мозга.
Синонимом препарата является лиоресаль.
Цик. гобешаприн (Cyclobenzaprine)
Циклобензаприн — К,К-диметил-3-(дибензо[а^]циклогептен-5-или-
ден)пропиламин A5.3.9) получают взаимодействием 5Я-дибензо[а^]-
циклогептен-5-она с 3-диметиламинопропилмагнийхлоридом и даль-
дальнейшей дегидратацией образующегося карбинола A5 3.S) в кислых
\словиях в циклобензаприн A5.3.9) [30, 31, 32].
+ СНз
CIMg-CH?-CH2-C4;-N(
он3
но снг-сн2~сн2-ц(
¦¦5 3 8 снз
Цпклобензаприн структурно схож с трициклическим антидепрес-
сангами. Действует на уровне ствола головного мозга. Препарат при-
применяют в качестве вспомогательного средства для облегчения мы-
мышечного спазма, связанного с острыми болезненными состояниями
мышц.
Синонимом препарата является флексерил.
Kapucnpodo.i (Carisprodol)
Кариспродол — дикарбамат М-шо-пропил-2-метил-2-пропил-1,3-
пропандиола A5.3.12) получают взаимодействием 2-метил-2-
пропилпропандиола-1.3 с одним молем фосгена с получением хлор-
>гольного эфира A5.3.10), из которого взаимодействием с изопро-
-303-
Глава 15
пила.мином получают карбамат A5.3.11). Вводя последний в реак-
реакцию либо с О-этилуретаном, либо с цианатом натрия, получают ка-
риспродол A5.3.12) [33].
сн3
СзН7-С-СН2-О-н
сн2-о-н
СОС12
сн3
С3Н7-С-СН2-О-СО-С1
СН2-О-Н
H2NCH(CH3J
13.3.10
сн3
С3Н7 -С -СН2 -O-CO-HNCH(CH3J
СН2-0-Н
13,3.11
C2H5OCONH2
or NaCNO
СН3
СзН7-С-СН2-О-СО-НЫСН(СНзJ
CH2-NH2
13 3.12
Кариспродол подавляет межнейрональную деятельность ретику-
ретикулярной формации спинного мозга. Применяют в качестве вспомога-
вспомогательного средства при утрате гибкости скелетной мускулатуры, а также
для облегчения болей, возникающих при этом.
Синонимами препарата являются рела, сома, карисома, санома.
Метокарбамол (Methocarbamol)
Метокарбамол — карбамат 3-B-метоксифенокси)-1,2-пропандиола-1
A5.3.13) синтезируют последовательным действием фосгена и за-
затем аммиака на 3-B-метоксифенокси)пропандиол-1,2 [34, 35].
ОСНч
¦о-сн2-сн-сн2-он
он
1.СОС12
2- NH3 _
OCH3
\\ \~ O-CH2-CH-CH2-OCONH2
он
153.13
Метокарбамол подавляет мультисинаптические пути в спинном
мозге. Применяют для облегчения спазмов и болей в скелетной муску-
мускулатуре, а также при лечении столбняка.
Синонимами препарата являются делаксин, форбаксин, робамол,
робаксин, тресортил.
-304-
Мышечные релаксанты
Хлорфенезин (Chlorphenesin)
Хлорфенезин — 3-D-хлорфенокси)-1,2-пропандиол A5.3.14) синте-
синтезируют аналогично описанному выше метокарбамолу исходя из 3-
D-хлорфенокси)-1,2-пропандиола [36, 37, 38].
O-CH2-CH-Cri2-OCONH2
он
153.14
Хлорфенезин действует по невыясненному механизму. Применяют
для облегчения болей в скелетной мускулатуре.
Синонимами препарата являются маолат и мусил.
Хлорзоксазон (Chlonoxazon)
Хлорзоксазон — 5-хлор-2-бензоксазолинон A5.3.15) получают ре-
реакцией гетероциклизации при взаимодействии 2-амино-4-хлорфе-
нола с фосгеном [39].
15.3.15
Хлорзоксазон подавляет мультисинаптические пути в спинном моз-
мозге. Применяют для облегчения болей в скелетной мускулатуре.
Синонимами препарата являются оксирен и парафлекс.
Глава 15
1.
2.
3,
4.
5.
6.
7.
8.
9.
10.
11.
12.
13.
14.
15.
16.
17.
18.
19.
20.
21.
22.
23.
24.
25.
26.
27.
28.
29.
30.
31.
32.
33.
34.
35.
36.
37.
38.
39.
Список литературы
DutcherJ. et al.//J. Am. Chem. Soc. 68, 419 A946).
DutcherJ. et al.'/J. Am. Chem. Soc. 74, 2221 A952).
US Pat. 2.409.241 A946).
US Pat. 2.600.539A952).
?Vere« A et ai.//J. Chem. Soc. D, 1970, 1020.
Codding P. et al. /J. Chem. Soc. D, 1972, 1174.
Naghaway J. et al.//J. Pharm. Sci. 68, 655 A979).
Bepomm А. и др./.'Доклады АН СССР. 122, 77 A958).
US Pat. 2.581.903A952).
US Pat. 2.544.076A951).
Ger. Pat. 817.756A947).
Bucket W. et ak//Chim. Ther. 2, 186 A967).
Bucket W. et al.//J. Med, Chem. 16, 1116 A973).
JJS Pat. 4.177.190A975).
Bucket W. et al.//J. Med. Chem. 16, 116 A973).
Eur. Pt. Appl. 8824A980).
US Pat. 4.179.507A979).
Ger. Pat. 2.655.833A976).
StenkaleJ. et al./'Eur. J. Med. Chem. 16, 515 A981).
Fusco R. et al./VGazz. Chim. Ital.//79, 129 A949).
Tammelin L. ,'Acta Chem. Scand. 7, 185 A953).
Walker J./'J. Chem. Soc. 1950, 193.
07a«g С et al.'/Org. Prep. Proc. Int. U, 93 A979).
Austrian Pat. 171.411 A952).
US Pat. 3.415.821A968).
Snyder H. et al./'J. Med Chem. JO, 807 A967).
US Pat. 3.471.548A969).
US Pat. 3.634.428A972).
Jap. Pat. 16.692 G0) A970).
Brit. Pat. 858.187A961).
Villani F. et al.'/J. Med. Pharm. Chem. 5, 373 A962).
Wintrop H. et al./'J. Org. Chem. 27, 230 A962).
US Pat. 2.937.119A960).
US Pat. 2.770.649A956).
}'fl/e //. et al.//J. Am. Chem. Soc. 72, 3710 A950).
US Pat. 3.161.567A964).
US Pat. 3.214.336A965).
Brit. Pat. 628.497A948).
US Pat. 2.895.877A959).
Глава 16
Антигистаминные
препараты
Препараты, которые конкурентно блокируют эффекты гистамина на
соответствующих рецепторных участках, называются антигистаминны-
ми препаратами.
Открытие и синтез гистамина явились крупными достижениями
в фармакологии, медицине и иммунологии. Этот природный мощный
биогенный амин широко распространен практически во всех тканях
млекопитающих и вовлечен в разные физиологические процессы. Реак-
Реакция организма на гистамин характеризуется сокращением гладкой мус-
мускулатуры, признаками воспаления, сужением сосудов и симптомами,
характерными для шока. Достоверно известно, что гистамин играет
центральную роль при аллергических реакциях, реакциях гиперчувст-
гиперчувствительности и участвует в механизмах ответов организма на воспали-
воспалительный процесс.
N
4
гистамин
Гистамин синтезируется в тканях путем декарбоксилирования ами-
аминокислоты L-гистидина — процесса, катштизируемого пиридоксаль-
фосфатзависимым ферментом (L-гистидиндекарбоксилазой). Гистамин
может поступать в организм с пищей, а также продуцируясь бактериями
ЖКТ. Однако эти источники не создают дополнительных запасов гис-
гистамина, поскольку в организме экзогенный гистамин легко катаболизи-
руется.
Гистамин распределяется и запасается в тучных клетках большин-
большинства органов, в которых он сохраняется в выделительных цитоплазма-
тически.х гранулах в виде гепарин-протеазных матриц, составляя около
10% от их массы. Гистамин становится физиологически активным
только после высвобождения из гранул.
-306-
-307-
Глава 1 6
Гнетамин обнаружен и в тканевых жидкостях — желудочном соке,
крови, моче. Лишь 2-3 % гистамина выводятся из организма неизме-
неизмененными. В основном, он метаболизируется двумя ферментными путя-
путями, включающими дезаминирование диаминоксидазои и метилирование
гистамин N-метилтрансферазой.
После выделения из тканевых депо гистамин может вызывать ог-
огромное множество физиологических эффектов. Однозначно доказана
ею роль в различных патологических процессах, связанных с острыми
и хроническим аллергическими реакциями, а также реакциями гипер-
гиперчувствительности. Вместе с тем функции эндогенного гистамина
(в проведении нервной передачи, выделении желудочного сока, роста
тканей, их восстановления) остаются не до конца выясненными.
Несмотря на то, что высвобождение эндогенного гистамина может
быть вызвано разными причинами, полагают, однако, что важнейшим
является иммунологический ответ организма. Принято считать, что во
время анафилаксии и аллергии на поверхности тучных клеток и базофи-
лов происходит специфическое взаимодействие иммуноглобулина Е
с антигеном, в результате чего включается каскад биохимических собы-
событий, приводящих к дегрануляции с высвобождением гистамина.
Кроме указанных выше реакций антиген-антитело, которые играют
критическую роль в патогенезе многих аллергических, анафилактиче-
анафилактических реакций и реакций гиперчувствительности, гистамин может быть
выделен из тканевых депо и в результате физических воздействий,
влияния так называемых либерантов гистамина — ряда химических ве-
веществ, различных препаратов и токсинов.
Существует большой класс соединений, которые способны высво-
высвобождать гистамин. Это могут быть ферменты и яды, морфин и d-ту-
бокурарин, полимеры, например декстран. Более того, повреждения тка-
тканей (травмы, укусы, стресс) также могут вызвать высвобождение
гистамина, по всей вероятности, как следствие высвобождения при этом
эндогенного полипептида брадикинина. Действие всех вышеперечис-
вышеперечисленных веществ, как и ряда других, на организм может способствовать
формированию анафилактических реакций.
Высвобождение гистамина блокируется разными ингибиторами
ферментов и другими веществами (никотинамид).
Главное физиологическое действие гистамина проявляется на сер-
сердечно-сосудистой системе, несосудистой гладкой мускулатуре, экзо-
кринных железах и надпочечниках.
Его наиболее важные фармакологические эффекты заключаются
в расширении вен и капилляров, увеличении проницаемости капилля-
капилляров, увеличении скорости работы сердца, сокращении несосудистой
-308-
Антигистаминные препараты
гладкой мускулатуры (сужение бронхов, перистальтики ЖКТ), стиму-
стимуляции секреции желудочного сока, выделении катехоламннов из надпо-
надпочечников.
Фармакологическое действие гистамина опосредуется двумя мем-
мембранными рецепторными связывающими участками, названными Нг
и Нг-репепторами. Нгрецепторы расположены в гладкой мускулатуре
сосудов, бронхиол и ЖКТ, тогда как Н2-рецепторы найдены в стенках
желудка, в миокарде и определенных сосудах.
Поэтому представляется весьма вероятным, что сокращение несо-
несосудистой гладкой мускулатуры является эффектом воздействия на
Н,-рецепторы, а выделение желудочного сока и увеличение частоты
сердцебиений связано с активацией Нг-реиепторов; при этом расшире-
расширение сосудов и повышение проницаемости капилляров являются резуль-
результатом комбинированного воздействия на оба типа рецепторов.
Имеются также специфические различия в распределении рецепто-
рецепторов в различных тканях и у различных животных. Так, если мыши
и крысы достаточно >стойчивы к эффектам гистамина, то организм
морских свинок и человека весьма чувствительны.
Антигисламинные препараты классифицируются как антагонисты
Н|- и Н2-рецепторов и в количественном отношении Нгантагонисты
превалируют. Более того, термин «антигистаминный препарат» больше
ассоциируется именно с Нгантагонистами. Н2-блокаторы проявляют
специфический эффект на гистаминные рецепторные участки, располо-
расположенные в стенке желудка и значительно понижают секрецию соляной
кислоты.
Аллергические заболевания представляют собой сложный набор
нарушений с хроническими и острыми проявлениями, варьирующими
от легких покраснений, сыпи и насморка до сильной, а возможно и фа-
фатальной, анафилаксии. Установлено, что около 10% населения могут
быть подвержены какой-либо форме аллергии. Терапия, направленная
на устранение источника аллергена, не всегда оказывается успешной.
В ряде случаев бывает не выявлен и сам аллерген. Поэтому проводится
симптоматическое лечение с применением Н.-антигистаминных препа-
препаратов.
Сам гистамин в настоящее время не имеет терапевтического значе-
значения и в клинике не применяется, хотя и была попытка его использова-
использования в качестве препарата для лечения ахлоргидрии — отсутствия в же-
желудке соляной кислоты. Он может быть использован в малых дозах
с диагностическими целями, т. е. для стимуляции желудочных желез
для выяснения их способности генерировать соляную кислоту и иногда,
при диагностике феохромоцитомы.
-309-
Глава 1 6
16.1. Нi-антигистаминные препараты
Антигистаминные препараты были открыты в конце 1930-х годов.
К 1950-м годам были предложены высокоэффективные антагонисты
гистамина — трипеленнамин и дифенилгидрамин, которые иницииро-
инициировали широкие исследования в области синтеза этого типа препаратов.
Все эти соединения являются обратимыми, конкурентными антаго-
антагонистами гистамина на Нгрецепторах и не проявляют существенной ак-
активности в отношении Н2-рецепторов. Антагонисты Нгрецепторов в раз-
разной степени блокируют эффекты гистамина в различных органах или
системах и могут обеспечить защиту организма от аллергических или
анафилактических реакций. Сами по себе они не выявляют значитель-
значительной самостоятельной активности, и поэтому в терапевтическом плане
их используют только для блокирования эффектов, возникающих в ре-
результате выделения гистамина. Иначе говоря, их эффекты заметны
только при повышенной гистаминной активности. Более того, эти анти-
антигистаминные препараты только уменьшают высвобождение или мета-
метаболизм гистамина, но никак не влияют на его синтез.
Несмотря на четкие различия в относительной активности этих
препаратов, они имеют сравнимые фармакодинамические свойства
и терапевтическое применение при рассмотрении в качестве единой
гр>ппы препаратов.
Наиболее распространенные Нгантигистаминные препараты струк-
прно напоминают гистамин с участием замещенной этиламинной бо-
боковой цепи, однако они имеют два ароматических кольца и только фор-
формально могут быть представлены общей формулой:
X-C-C-N
,/ I I \
R2
где Аг, и Аг2 являются карбоциклическими или гетероциклическими
ароматическими кольцами, одно или оба из которых могут быть от-
отделены от X атомом )глерода;
X является кислородом, углеродом или азотом;
R: и R2 представляют собой алкильные заместители, обычно ме-
тильные группы.
Блокаторы Н,-гистаминных рецепторов принято группировать со-
согласно их химическому строению:
- 310 -
Антигистаминные препараты
• производные этаноламина (дифенгидрамин, клемастин);
• производные этилендиамина (трипеленнамин, пириламин);
• алкиламины (хлорфенирамин, дексхлорфенирамин, бромфени-
рамин);
• пиперазины (циклизин, меклизин, гидроксизин);
• фенотиазины (прометазин, тримепразин);
• пиперидины (ципрогептадин, дифенилпиралин);
• прочие, не поддающиеся определенной химической классифи-
классификации (терфенадин, астемизол).
Их клиническая эффективность и проявляемые побочные эффекты
значительно отличаются при переходе от группы к группе и от пациента
к нациент>. Эти препараты предотвращают действие как эндогенного,
гак и экзогенного гистамина, однако значительно более эффективны
в отношении первого.
Все они действуют путем конкурентного связывания с Н,-рецеп-
Н,-рецепторами. Их применяют для облегчения симптомов аллергических забо-
заболеваний (аллергических ринитов, других аллергических реакций), для
лечения анафилактических реакций, временного облегчения состояния
бессонницы, в качестве вспомогательной терапии при лечении паркин-
паркинсонизма и эстрапирамидных расстройств антипсихотиками, для облег-
облегчения кашля простудного, аллергического и другого происхождения,
предотвращения и контроля тошноты и рвоты, в качестве вспомога-
вспомогательных препаратов при анальгезии послеоперационных болей и для
предоперационной седации.
Аминоалкильные эфиры
Дифенгидрамин (Diphenhydramine)
Дифенгидрамин — К,М-диметил-B-дифенилметокси)этиламин A6.1.1)
синтезируют простым взаимодействием бензгидрилбромида и 2-ди-
метиламиноэтанола [1, 2, 3].
СН-Вг + HO-CH2-CH2-N(
СНз
сн3
сн-о—ch2-ch2-n(
\ ) 1611
сн3
-311 -
Глава 1 6
Дифенгидрам'ин — один из основных представителей антигиста-
минных препаратов, блокирующих Hj-рецепторы. Кроме антигиста-
минной активности дифенгидрамин оказывает местноанестезирующее
действие, расслабляет гладкую мускулатуру, проявляет седативное
и снотворное действие.
Дифенгидрамин применяют при симптомах аллергии, при лечении
крапивницы, сенной лихорадки, сывороточной болезни и других аллер-
аллергических заболеваний, а также в качестве успокаивающего и снотворно-
снотворного средства, как самостоятельно, так и в сочетании с другими препара-
препаратами.
Синонимами препарата являются димедрол, бенадрил, аллерган,
вальдрен и многие другие.
Дименгидринат (Dimenhydrinate)
Дименгидринат — A6.1.2) является комплексным соединением
1\т,1Ч-диметилB-дифенилметокси)этиламина — дифенгидрамина
с 8-хлортеофиллином.
Блокируя Н|-рецептор, дименгидринат одновременно воздействует
и на рвотный центр [4. 5].
—ch2-ch2-n(
СНз
Cri3
СНз CH3-N
Cl
16 1 2
Дименгидринат применяют для предупреждения и купирования
морской и воздушной болезни, при тошноте и рвоте.
Синонимами препарата являются драмамин, дадалон, эмедил, тра-
велин и др.
Кле.пастин (Clemastine)
Клемастин — 2-[2-[1-D-хлорфенил)-1-фенилэтокси]этил]-1-метил-
пирролидин A6.1.4) получают взаимодействием 1-D-хлорфенил)-1-
фенилэтанола A6.1.3) с 2-B-хлорэтил)-1-метилпирролидином, ис-
используя в качестве основания амид натрия. Исходный 1-D-.\лор-
фенил)-1-фенилэтанол A6.1.3) получают либо взаимодействием
4-хлорбензофенона с метилмагнийхлоридом, либо взаимодействием
4-хлорацетофенона с фенилмагнийбромидом [6, 7, 8].
-312-
днтигистаминные препараты
=0 r CH3MgCi
-MgCI ¦ СНз-С
CI—C
9-CH?/"^N
CH3
-O-CH2~CH2
CH3 СНз
16 1 4
Клемастин применяют при симптомах аллергии, ринитах, отеке
Квинке, анафилактическом шоке, сывороточной болезни, сенной лихо-
лихорадке, аллергических дерматитах и дерматозах, хронической экземе.
Синонимами препарата являются тавегил, мекластин.
Этилендиамины
Трипеленшшин (Tripelennamine)
Трипеленнамин — К-бензил-К',М'-диметил-К-2-пиридилэтилен-
диамин A6.1.6) синтезируют взаимодействием 2-бензиламинопири-
дина A6 1.5) с 2-диметиламино-этилхлоридом в присутствии амида
натрия. 2-бензиламинопиридин, в свою очередь, может быть легко
получен восстановлением основания Шиффа, полученного конден-
конденсацией 2-аминопиридина с бензальдегидом [9, 10, 11].
НСООН
ci—ch2-ch2-n(
СНз
16 1 5
/ГСН2\ /СНз
N— CH2-CH2-N\
СНз
16 1 6
-313-
Глава 16
Препарат уменьшает аллергический ответ организма, вызванный
гистамином. Трипеленнамин применяют при симптомах аллергии, ри-
ринитах, конъюнктивитах, аллергических и анафилактических реакциях.
Синонимами препарата являются пеламин и пирибензамин.
Пириламин (Pyrilamine)
Пириламин — К-D-метоксибензил)-Н',Н|-диметил-К-2-пиридил-
этилендиамин A6.1.7) синтезируют аналогичным путем, но с ис-
использованием 2-D-метоксибензиламино)пиридина [10, 11, 12].
N— CH2-CH2-n(
сн3
СНз
—/ 16 1 7
Пириламин также применяют при симптомах аллергии, ринитах.
Синонимами препарата являются вистосан, антисан и триаминик.
Хлорпирамин (Chlorpyramin)
Хлорпирамин — М-D-хлорбензил)-1Ч',>>1'-диметил->>1-2-пиридил-
этилендиамин A6.1.9) получают несколько иным путем, а именно:
взаимодействием 2-бромпиридина с Ы-D-хлорбензил)-Ы',Ы'-диме-
тилэтилендиамином A6.1.8). К-D-хлорбензил)->^,>^-диметилэти-
лендиамин A6.1.8), в свою очередь, получают конденсацией
4-хлорбензальдегида с >},К-диметилэтилендиамином с после-
последующим восстановлением иминной группы [13, 14, 15, 16, 17, 18,
19].
-сно
Н2 / Raney-Ni
СН3
Ч ,снз
N— Ch2-Ch2-N(
h^ CHi
ia i e
a.
\ CH3
N—CH2-CH2-n(
снз
16 19
-314-
Антигистаминные препараты
Хлорпирамин применяют при аллергических дерматозах, аллерги-
аллергическом рините и конъюнктивите, при медикаментозных аллергиях,
в начальной стадии бронхиальной астмы, при экземе, нейродермите,
контактных дерматитах и токсикодермии. Препарат оказывает также
седативный эффект.
Синонимами препарата являются супрастин, хлортрипеленамин,
синопен.
Алкиламины
Хлорфенирамин (Chlorpheniramine)
Хлорфенирамин — 3-(,иара-хлорфенил)-3-B-пиридил)пропилди-
метиламин A6.1.12) предложено получать двумя путями. Первый
способ исходит из 4-хлорбензилцианида, взаимодействием которого
с 2-хлорпиридином в присутствии амида натрия получают
4-хлорфенилB-пиридил)ацетонитрил A6.1.10). Алкилируя послед-
последний 2-диметиламиноэтилхлоридом в присутствии амида натрия,
синтезируют у-D-хлорфенил)-у-циано-М,Н-диметил-2-пиридилпро-
панамин ( 16.1.11), гидролиз и декарбоксилирование которого при-
приводит к хлорфенирамину A6.1.12) [20].
-CH2-CN
NaNH2
16 1 10
NaNH2 с
ci—ch2-ch2-n(
с
сн3
CHZ-CH,.-N<
СНз
H2SO4
CH —СНг -СНг -N
J
16 1 12
CH3
СНз
Второй способ синтеза исходит из пиридина, который подвергают
алкилированню 4-хлорбензилхлоридом с получением 2-D-хлорбензил)-
пиридина A6.1.13). Алкилируя последний 2-диметиламиноэтилхло-
2-диметиламиноэтилхлоридом в присчтствии амида натрия, получают хлорфенирамин A6.1.12)
121].
-315-
Глава 1 6
-CHj-CI
[Cuj
NaNH2 c
г ci—ch2-ch2-n(
CH3
16 1 13
Хлорфенирамин уменьшает аллергический отвег организма, вы-
вызванный гистамииом. Препарат применяют при симптомах аллергии,
ринитах, а также в составе многочисленных композиций с эфедрином
и псевдоэфедрином, рекомендуемых применять при простудных забо-
заболеваниях, инфекциях верхних дыхательных путей, аллергических ри-
ринитах.
Синонимами препарата являются хлортриметон, гистаспан, трипо-
лон, телдрин.
Дексхлорфенирамин (Dexchlorpheniramine)
Дексхлорфенирамин — О(+)-3-(яо/?а-хлорфенил)-3-B-пиридил)про-
пилдиметиламин получают разделением рацемата, получаемого
в результате синтеза хлорфенирамина A6.1.12) с помощью D-фе-
нилянтарной кислоты [22, 23, 24].
Активность препарата примерно вдвое превышает таковую у хлор-
хлорфенирамина.
Дексхлорфенирамин также применяют при симптомах аллергии,
ринитах, дерматитах.
Синонимом препарата является поларамин.
Бромфенирамин (Brompheniramine)
Бромфенирамин — 3-(яа/?а-бромфенил)-3-B-пиридил)пропилди-
метиламин A6.1.14) является аналогом хлорфенирамина с той раз-
разницей, что атом хлора в бензольном кольце заменен на атом брома.
Соответственно, его синтез осуществляют по аналогичной схеме
[22, 23].
сн3
-Cri— CH2-CH2-n(
¦А. СНз
lj 16 1 14
-316-
Антигистаминные препараты
Бромфенирамин также применяют при симптомах аллергии, ринитах,
дерматитах Активность препарата примерно такая же, как и у хлорфени-
хлорфенирамина.
Синонимами препарата являются диметан, бромбей, спентан. вел-
тан и др.
Пиперазины
Циклизин (Cyclizine)
Циклизин — 1-(дифенилметил)-4-метилпиперазин A6.1.15) полу-
получают алкилированием 1-метилпиперазина бенгидрилбромидом [25,
26].
CH-Br
H-N N-CH3
Циклизин проявляет антигистаминное и антихолинергическое дей-
действие и применяется при рвоте и поносе. Точный механизм его действия
не выяснен
Синонимами препарата являются марезин и мигрил.
Меклизин (Meclizine)
Меклизин — 1-[D-хлорфенил)метил]-4-[C-метилфенил)фенил]-
пиперазин A6.1.16) получают восстановительным аминированием
смеси 3-метилбензальдегида с 1-D-хлорбензгидрил)пиперазином,
с использованием водорода над никелем Ренея [27, 28, 29].
-317-
Меклизин активно воздействует на рвотный центр и применяется
при рвоте и поносе.
Синонимами препарата являются антиверт, боноин, ламин, рокли-
зин. вертол.
Гидроксизин (Hydroxyzine)
Гидроксизин — 2-[2-[4-[D-хлорфенил)фенилметил]-1-пиперази-
нил)этокси]этанол A6.1.17) получают анкетированием 1-D-хлор-
бензгидрил)пиперазина 2-B-гидроксиэтокси)этилхлоридом [30, 31.
32,33,34.35].
N-H
ci~ch2 ~сн2 — о-ч:н2 -сн2 -он
16 1 17
Гидроксизин — антигистаминный препарат с М-холиноблоки-
рующими свойствами и выраженным влиянием на ЦНС. Препарат по-
подавляет подкорковые участки ЦНС, включая лимбическую систему
и ретикулярную формацию. Потенцирует действие наркотических
анальгетиков, проявляет седативный эффект. Применяют в качестве
симптоматического средства при атопическом дерматозе, в качестве
седагивного средства до и после операционных вмешательств, для пре-
предупреждения рвоты и поноса, для купирования ажитации и эмоцио-
эмоциональных расстройств,
Синонимами препарата являются атаракс, дурракс. вистарил.
Фенотиазины
Прометазин (Promethazine)
Промегазин — 10-B-диметиламинопропил)фенотиазин A6.1.18)
пол) чают алкилированием фенотиазина 1-диметиламино-2-пропил-
члоридом [36. 37].
- 318 -
Антигистаминные препараты
/Crt3 NaNH2
CH-CH2-N\ *¦
' сн3
сн3
СН3
Являясь производным фенотиазина, прометазин по строению
и фармакологическим свойствам напоминает хлорпромазин. Препарат
проявляет сильную антигистаминную активность, а также выраженное
действие на ЦНС. Потенцирует действие снотворных и анальгезирую-
ших препаратов.
Прометазин применяют при лечении аллергических заболеваний:
крапивницы, сывороточной болезни, сенной лихорадке, дерматозах,
а также при ревматизме с выраженным аллергическим компонентом,
при аллергических осложнениях, вызванных антибиотиками и другими
лекарственными средствами, для усиления действия анальгетиков и ме-
местных анестетиков.
Синонимами препарата являются аллерган, фенэрган, пипольфен,
протазин и др
Тримепразин (Trimeprazine)
Тримепразин — 10-C-диметиламино-2-метилпропил)фенотиазин
A6.1.19) получают алкилированием фенотиазина 1-диметиламино-
2-метилпропилхлоридом [38].
I
ch2-ch-ch2-n(
сн3
сн3
161.19
Тримепразин применяют при лечении зуда при дерматитах как ал-
аллергического, так и неаллергического происхождения.
Синонимом препарата является темарил.
-319-
Глава 1 6
Пиперидины
Ципрогептадии (Cyproheptadine)
Ципрогептадин — 4-(дибензо[а,с1]циклогептен-5-илиден)-1 -метил-
пиперидин A6,1.21) получают взаимодействием 1-метил-4-магний-
хлорпиперидина с 5//-дибензо[а.о!]циклогептен-5-оном с получени-
получением карбинола A6.1.20), дегидратация которого в кислой среде
приводит к получению ципрогептадина A6.1.21) [39, 40].
MgCl
16 1 20
Ципрогептадин обладает антианафилактической активностью, свя-
5анной со способностью тормозить высвобождение гистамина и других
медиаторов из т\чных клеток Главным образом препарат применяют
для лечения приступов бронхиальной астмы, аллергических бронхитов,
ринитов и аллергических кожных реакций, а также для вспомогательной
терапии при анафилактических реакциях.
Синонимами препарата являются периактин и вимикон.
Терфенадин (Terfenadine)
Терфенадин — а-D-/и/?е»г-бутнлфенил)-4-(гидроксидифенилметил)-
1-шшеридино-бутанол A6.1.24) предложено получать разными пу-
путями. Согласно одному из них, бензил-4-магмийхлорпиперидин
вводят в реакцию с бензофеноном с получением A-бензил-4-пи-
перидил)дифенилкарбинола A6.2.22), который далее подвергают
дебензилированию восстановлением водородом с использованием
в качестве катализатора палладия на угле с получением D-пипе-
ридил)дифенилкарбинола A6.2.22). Последний алкилир>ют либо
1-D-/?г/?е/и-б\тилфенил)-4-хлорбутанолом с получением терфенади-
на A6.1.24), либо алкилирование осуществляют D-т/>ет-бутнлфе-
нил)-3-хлорпропиофеноном с получением продукта A6.1.25), карбо-
нильн>ю группу которого восстанавливают до спиртовой, получая
целевой терфенадин A6.1.24) [41, 42, 43. 44. 45. 46].
-320-
Антигистаминные препараты
MgCl
N
СН2
СбНб
¦ Pd-C
j4>
о
С(СН3)з
C(Cri3)j
(СН2)з—С—<k ft— С(СН3)з
NaBH4
16 1 25
Терфенадин отличается от других антигистаминных препаратов не
только химической структурой, но и гем, что его действие начинается
через 1- 2 ч и продолжается около 12 ч, достигая пика действия через
3 4 ч. Препарат показан для облегчения симптомов, связанных с сезон-
сезонными аллергическими ринитами и конъюнктивитами, при ангионевро-
тическом отеке, кожных аллергических реакциях, а также в составе
комплексной терапии при бронхиальной астме.
Синонимами препарата являются селдан. гистадин, трексил и др.
Астемизол (Astemizole)
Астемизол — 1-[{4-фторфенил)метил]-М-[1-[2-D-метоксифенил)-
этил]-4-пиперидинил]-бензимидазол-2-амин A6.1.31) получают
многостадийным синтезом исхоця из 1-карбэтокси-4-аминопи-
перидина и 2-нитроизотиоцанобензола, при взаимодействии кото-
которых пол\ чается производное тиомочевины A6.1.26). Нитрогруппу
последнего восстанавливают, и далее осуществляют S-метили-
рование продукта, который в условиях реакции подвергается внут-
внутримолекулярной циклизации в производное бензимидазола — N-[1-
[2-D-карбэгокси)]-4-пиперидинил]бензимидазол-2-амин A6.1.28).
Последний алкилируют 4-фторбензилхлоридом в 1-[D-фгорфенил)-
-321 -
Глава 1 6
метил]-К-[1-[2-D-карбэтокси)]-4-пиперидинил]беизимидазол-2-амин
A6.1.29). Карбэтоксильную гр\ппу полученного соединения A6.1 29)
гидролпзуют бромисто-водородной кислотой с получением неза-
незамещенного по атому азота производного пиперидина A6.1.30), ал-
килирование которого 2-D-метоксифенил)этилметансульфонатом
приводит к астемизолу A6.1.31) [47, 48].
О
I—C-N(C2H5J
H2N—( N-
СООС2Н5
"NH-C— NH~< N-COOC2H5
S
16 1 26
,.NH2
H-C— NH—\ I
N-СООСгНг
16 1 27
CH3I /CH3OH
s?^__JH Ч-У CH3O-SO2-O-CH2-CH2-
оснз
-NH< N-H
16 1 31
Астемизол применяют для профилактики и лечения сезонного ост-
острого и хронического аллер! ического ринита, аллергического конъюнк-
конъюнктивита, крапивницы, отека Квинке, других аллергических состояний
и дерматитов.
Синонимами препарата являются гисманал. гистазол др.
-322-
Антигистаминные препараты
Дифенилпиралин (Diphenylpyraline)
Дифенилпиралин — 4-дифенилметокси-1-метилпиперидин A6.1.32)
получают алкилированием 4-гидрокси-1-метилпиперидина бензгид-
рилбромидом [49. 50].
Н-Вг + НО'
:-О-/ N-CH3
16 1 32
Дифеннлпиратин — антигистаминный препарат с антихолинерги-
ческим и седативным действием.
Препарат предназначен для симптоматического лечения сезонных
аллергий и аллергических реакций, а также в качестве вспомогательно-
вспомогательного средства для терапии анафилактических реакций.
Синонимами препарата являются арбид, темпил, гистрил, гисприл
и др.
16.2. Антагонисты Н^-рецепторов
Антагонисты Н2-рецепторов практически полностью блокируют
секрецию соляной кислоты в желудке в ответ на большинство стимулов,
Эги препараты играют огромную роль для лечения язвы желудка, свя-
связанной с гиперсекрецией, поскольку проявляют способность уменьшать
как объем желудочного секрета, так и общую кислотность, и активность
пепсина
Препараты этого ряда применяют для лечения язвы желудка и две-
двенадцатиперстной кишки и при гиперсекреторных состояниях.
Традиционные, или Нгантигистаминные, препараты блокируют
многие эффекты, вызванные гистамином, однако они оказываются не
в состоянии противостоять событиям, опосредованным Н2-рецепто-
рами, в частности, избыточной секреции желудочного сока. В 1977 г.
оьп предложен антагонист Н2-рецеторов — циметидин. революцини-
зировавший лечение язвы желудка. Впоследствии был предложен ра-
""гидин, а позже — уже препараты с минорными структурными
ч фармакологическими различиями — фамотидин и низатидин.
Антак>нисты Нг-рецепторов обратимо и конк>рентно ингибир\ют
действие 'исгамина на ЬЬ-рецепторах. Они являются чистыми антаго-
-323-
¦Глава 16
нистами, поскольку не действуют на Нгрецепторы, [3-адренорецепторы
или мускариновые рецепторы. Более того, они не воздействуют в сколь-
сколько-нибудь значительной мере на синтез, высвобождение и биотранс-
биотрансформацию гистамина.
Структура циметидина представляет собой метилимидазольное
кольцо с серосодержащей боковой цепью с цианогуанидинной группой.
Казалось, что наличие имидазольного кольца в циметидине, имеющееся
и в структуре гистамина. должно являться определяющим в проявлении
Н2-блокирующей активности, однако создание ранитидина, фамотидина
и низатидина. содержащих фурановое и тиазольное кольца вместо ими-
имидазольного, показало неверность высказанного предположения.
Циметидин (Cimetidine)
Цимегидин — 1-циано-2-метил-3-[2-[[5-метилимидазол-4-ил)метил]-
тио]этил]-гуанидин A6.2.5) синтезируют по следующей схеме.
Взаимодействием 2-хлорзцетоуксусного эфира с двумя молями
формамида получают 4-карбэтокси-5-метилимидазол A6.2.1). Вос-
Восстановлением карбэтоксильной группы последнего натрием в жид-
жидком аммиаке получают 4-гидроксиметил-5-метилимидазол A6.2.2).
Гидрохлорид полученного спирта вводят во взаимодействие с гид-
гидрохлоридом 2-меркаптоэтиламина, с получением дигидрохлорида
4-B-аминометил)-тиометил-5-метил-имидазола A6.2.3). Последний
вводят во взаимодействие с 1Ч-цианимидо-8,8-диметилдитиокар-
бонатом с получением производного тиомочевины A6.2.4), которое
взаимодействием с метиламином трансформируют в циметидин
A6.2.5) [51, 52, 53, 54, 55, 56, 57, 58].
и и
сн3'\^-о
2 h2NCHO
«.
,СООС2Н5
Na'NH3
,СН2-ОН
HS-CH2-CH2-NH2
ОС
CH..-S — CH2-Ch2-NH2
CH3-S
CH^ri-
N
Н
16 i 4
-324-
д H т и г истаминные препараты
N-CN
ii
CH2-S—CH2-CH2-NH-C-NH-CH3
1625
Циметидин является представителем первого поколения антигиста-
минных препаратов, блокирующих Н2-рецепторы. Основным фармако-
фармакологическим эффектом циметидина является угнетение секреции желу-
желудочного сока, связанное с блокадой Н2-рецепторов стенок желудка.
Он подавляет продукцию соляной кислоты, как базалытую, так и стиму-
стимулированную пищей, гистамином, гастрином, одновременно понижая
активность пепсина.
Циметидин применяется при лечении язвенной болезни желудка
и двенадцатиперстной кишки и других состояниях, сопровождающихся
повышением кислотности и избыточной секрецией желудочного сока.
Используют для профилактики поражений и кровотечений верхних от-
отделов ЖКТ.
Синонимами препарата являются гагамет, цинамет, беломет.
Ранитидин (Ranitidine)
Ранитндин — К[2-[[[5-димтиламино)метил]-2-фуранил]метил]тио]-
?тил]-М'-метил-2-нитро-1,1-этендиамин A6.2.8) синтезируют исхо-
исходя из фурфурилового спирта, который повергают аминометилиро-
ванию с использованием диметиламина и параформа с получением
5-(диметиламинометил)фурфурилового спирта A6.2.6). Далее взаи-
взаимодействием с гидрохлоридом 2-меркаптоэтиламина получают
продукт замещения гидроксильной группы — 5-диметиламино-
мегил-2-B'-аминоэтил)тиометилфуран A6.2.7). Вводя последний во
взаимодействие с К-метил-1-метилтио-2-нитроэтенамином, полу-
получают ранитидин A6.2.8) [59. 60, 61, 62, 63, 64].
СН2О
(Ch3feNh
II П
О C
"S-CH2-CH2-NHi
"О" Ch2-Oh
16.2.6
-325-
Глава 16
X1L
(C43JN -СЧ2 О CH2-S—CH2-CH2-NH2
CH3S
CH3NH
>CH=CH-NO2
О
16.2.7
(CH3JM -CH2
XX
CH-NO2
-CH2-CH2-NH-C-NHCH3
16.2.8
Ранитидин -- препарат второго поколения блокаторов Н2-рецеп-
торов. Так же как и циметидин, ранитидин подавляет, как базальную,
так и стимулированную пищей, гисгамином, гастрином и ацетилхоли-
ном продукцию соляной кислоты. Одновременно снижает активность
пепсина и применяется при лечении язвенной болезни желудка и двена-
двенадцатиперстной кишки, а также других состояниях, сопровождающихся
повышенной кислотностью ЖКТ.
Синонимами препарата являются зантак, азантак. раниплекс. рани-
дил и др.
Фамотидин (Famotidine)
Фамотидин — 3-[[B-((аминометил)амино-4-тиазолил)метил]тио]-К-
(аминосульфонил)пропанимидамид A6.2.13) синтезируют исходя из
8-B-аминотиазол-4-ил-метил)изотиомечевины A6.2.9), которую
получают взаимодействием 1,3-дихлорацетона с двумя молекулами
тиомочевины, при котором одновременно с образованием шазоль-
ного кольца происходит замещение атома хлора в промежуточно
образующемся 2-амино-5-хлорметилтиазоле. Взаимодействием по-
последнего с 2-хлорпропионитрилом получают 8-B-аминотиазол-4-
ил-метил)-2-цианоэтан A6.2.10), который, в свою очередь, вводят
в реакцию с бензоилизтиоцианатом. Полученное в результате этой
реакции производное бензоилтиомочевины A6.2.11) подвергают
сначала S-метилированию метилйодидом и далее расщеплению ам-
аммиаком до 3-[[B-((аминометил)амино-4-тиазолил)-метил]тио]этил-
цианиида A6.2.12). Последовательным мечанолизом нитрильной
группы и последующим взаимодействием полученного иминоэфира
с сульфонамидом получают фамотидин A6.2.13) [65, 66, 67. 68. 69,
70]".
-326-
Антигистаминные препараты
Cl—CH2-CH2-CN
H2N NN CH2-S-C-NH2
1629
-C-N=C=S
CH2-S — ch2-CH2-CN
16 2 10
-C—NH—C-HN'" ^"N' "CH2-S—CH2—CH2—CN
16.2 11
)
1
2
CH2-CH2-CN
CH3OH / HCI
tNH2!2SO|
H2N
>=
H2N
=ЛАн2
N-SO2-NH
-S — CH2-CH2-C-NH2
Так же как и ранитидин, фамотидин относится к препаратам второ-
второго поколения блокаторов Н2-рецепторов и так же, как и два других вы-
вышеописанных препарата, применяется при лечении язвенной болезни
желудка и двенадцатиперстной кишки и других состояниях, сопровож-
сопровождающихся повышенной кислотностью ЖКТ.
Синонимами препарата являются фамодил, гастридин, пегщид и др.
Низатидин (Nizatidine)
Низатидин — М-[2-[[[2-[(диметиламино)метил]4-тиазолил]метил]-
гио]-этил]-2-нитро-1,1-этендиамин A6.2.15 ). По своему химиче-
ском\ строению низатидин является некоторым гибридом структур
ранитидина и фамотидина, где использованы боковая цепь ранити-
дина и несущий гетероцикл — 2-аминотиазол. Соответственно,
синтез последнего также представляет собой определенную комби-
комбинацию подходов, примененных при получении обоих препаратов
прото типов. Исходным соединением служит 2-(диметиламино-
метил)-4-гидроксиметилтиазол, из которого последовательным
-327-
Глава 16
взаимодействием с гидрохлоридом 2-меркаптоэтиламина и далее
с 1Ч-ме1ил-1~метилтио-2-н1Гтроэтенамином получают искомый низа-
гидин A6.2.15) [71, 72].
HS-CHC-CH2-NH2
„3S)
S ri 2 CH3Nri
CH3JNCH2 '^"N CH--OH
1R2 U
)CH=O-NQ2
(CH3JNCH2 '^N C-S—Cri2-C42-Nri-C-NriCH3
162 15
Так же как и другие вышеописанные препараты, низатидин приме-
применяется при лечении язвенной болезни желудка, двенадцатиперстной
кишки и других состояниях, сопровождающихся повышенной кислот-
кислотностью ЖКТ.
Синонимами препарата являются аксид и пульвулес.
Список ли?ературы
1.
US Pat. 2.397.799A946).
US Pat. 2.421,714A947).
3. US Pat. 2.427.878A947).
4. US Pat. 2.499.058A950).
5. US Pat. 2.534.813A950).
6. Brit. Pat. 942.152A963).
7. Fr. Par. M1313 A961).
8. EbnotherA. et al.'/Helv. Chim. Acta. 59, 2462 A976).
9. US Pat. 2.406v594A946).
10. US Pat. 2.502.151 A950).
11. Huttrer С et al./J. Am. Chem. Soc. 68. 1999 A946).
12. Bovet et al.' С R. Soc. Biol. .138, 99 A944).
13. US Pat. 2.569.314A951).
14. US Pat. 2.607.778A952).
15. Swiss. Pat. 264,754A950).
16. Swiss. Pat. 266,234 A950).
17. Swiss. Pat. 266,235A950).
18. Brit. Pat. 651.596A951).
19. Vaughan J. et al./J. Org. Chem. 14, 228 A949).
20. US Pat 2.567.245A951).
-328-
Антигистаминные препараты
21. US Pat 2.676.964A954).
22. US Pat. 3.061.517A962).
23. US Pat. 3.030.371 A962).
24. Brit. Pat. 834.984 A958).
25. US Pat. 2.630.435A953).
26. BaltzlyR etaUJ. Org. Chem. !4, 775A949).
27. US Pat. 2.709.169A955).
28. Brit. Pat. 705.979 A954).
29. Belg. Pat. 502.889A951).
30. US Pat. 2.899.436A959).
31. Ger. Pat. 1.049.383A953).
32 Ger. Pat. 1.061.786A953).
33. Ger. Pat. 1.068.262A953).
34. Ger. Pat. 1.072.624A953).
35. Ger. Pat. 1.075.116A953).
36. US Pat. 2.530.451 A950).
37. US Pat. 2.607.773A952).
38. US Pat. 2.837.518A958).
39. US Pat. 3.014.911 A961).
40. Engelhardt E. et al,, J. Med. Chem. 8, 829 A965).
41. US Pat. 3.878.217A975).
42. Ger. Pat. 2.303.305A973).
43. Ger. Pat. 2.303.306A973).
44. Ger. Pat. 2.503.362A973).
45. Brit. Pat. 1.412.605A972).
46. Can A et al.//Arzneimittel-Forsch. 32, 1157A982).
47. US Pat. 4.219.559A980).
48. Eur. Pat. Appl. 5318A979).
49. US Pat. 2.479.843A949).
50. Ger. Pat. 934.890A951).
51. US Pat. 3.894.151 A975).
52. US Pat. 3.950.333A976).
53. US Pat. 4.000.302A976).
54. Ger. Pat. 2.320.131 A973).
55. Ger. Pat. 2.344.779 A973).
56. Belg. Pat. 804.144 A974).
57. Kairisalo P. et al.,. Arch. Pharm. (Wienheim). 3J6, 688 A983).
58. Brimblecombe R. et al.'J. Int. Med. Res. 3_, 86 A975).
-329-
Глава 16
59. Ger. Pat. 2.734.070 A977).
60. US Pat. 4.128.658A978).
61. Fr. Pat. 2.384.765A978).
62. US Pat. 4.399.293A978).
63. US Pat. 4.399.294A978).
64. Belg. Pat. 888.747A980).
65. US Pat. 4.283.408A981).
66. Get. Pat. 2.951.675A979).
67. Ger. Pat. 3.008.056 A980).
68. Brit. Pat. 2.052.478 A980).
69. Brit. Pat. 2.055.800 A979).
70. Belg. Pat. 882.071 A980).
71. US Pat. 4.375.547A983).
72. Eur. Pat. Appl. 49618A982).
Глава 17
Кардиотонические
препараты
Препараты, увеличивающие силу сокращений миокарда и тем са-
самым улучшающие его работоспособность и эффективность, называются
кардиотоническими средствами. Это определение традиционно и весьма
долгое время относилось к группе препаратов, называемых сердечными
гликозидами, однако в последнее время клинике предложены новые
кардиотонические препараты (негликозидные кардиотонические сред-
средства, являющиеся ингибиторами фосфодиэстеразы — амринон и мил-
ринон), проявляющие сходные свойства. Кардиотонические средства
иногда называют положительными инотропными препаратами, т. е. ве-
веществами, усиливающими силу мышечных сокращений, в данном слу-
случае — усиливающими силу сокращений миокарда.
Кардиотонические препараты предназначены для лечения сердеч-
сердечной недостаточности.
Сердечная недостаточность — весьма распространенное заболева-
заболевание Оно может быть определено, как неспособность сердца прокачать
достаточное количество крови для снабжения кислородом и питатель-
питательными веществами органы и ткани, что ведет к появлению усталости,
одышки, отеков. Причиной возникновения сердечной недостаточности
чаще всего являются артериальная гипертензия и ишемическая болезнь
сердца. Она может проявляться как в острой форме, в виде резкого сни-
снижения сердечного выброса с симптомами нарушения кровообращения,
так и в хронической форме, выражающейся болями в сердце.
В дополнение к инотропным средствам при лечении сердечной не-
недостаточности применяются также диуретики (гл. 21 «Диуретики»),
которые увеличивают выведение ионов Na* и воды из организма, сни-
снижают объем циркулирующей крови, понижают нагрузку на сердце
и устраняют отеки; сосудорасширяющие средства (вазодилататоры).
которые способствуют уменьшению венозного и артериального давле-
давления, что снижает сосудистый тонус и. соответственно, нагрузку на
сердце и уменьшает его потребность в кислороде. Иногда применяются
и адреномиметики — эпинефрин (адреналин), норэпинефрин (норадре-
-331 -
Г пава 17
налин), изопротеренол, тербу талин, альбутерол, обладающие способно-
способностью увеличивать силу сердечных сокращений и стимулирующие по-
повышение сердечного выброса. Однако они одновременно повышают
скорость сердечного ритма, обладают аритмогенным действием, а также
увеличивают потребность миокарда в кислороде, что нежелательно
и может привести к усилению ишемии. Иногда применяют также дофа-
дофамин и леводоп). Последний в организме, несомненно, превращается
в дофамин, являясь, таким образом, оральной формой дофамина в виде
пролекарства.
Все указанные симпатомиметики ограниченно используются для
кратковременной B4 ч и менее) поддержки сердца.
Оптимальная терапия сердечной недостаточности часто требует од-
одновременного применения двух или более из перечисленных выше
гр\ пп препаратов.
17.1. Сердечные гликозиды
Для лечения сердечной недостаточности широко применяются гли-
гликозиды, выделяемые из листьев различных видов наперстянки Digitalis
lanta (наперстянка шерстистая), Digitalis purpurea (наперстянка пурпу-
пурпуровая) и строфанта Strophantus Kombe (строфанта Комбе), а также ряда
других растений (ландыш, обвойник, олеандр, морозник, желтушник,
дж\т, харг и др.), проявляющие прямое воздействие на миокард и уси-
усиливающие силу его сокращений.
Основным свойством сердечных гликозидов является их избира-
избирательное действие на сердце, причем главным эффектом следует считать
>силение систолы, что создает наиболее экономный режим для работы
сердца: сильные систолические сокращения сменяются периодами от-
отдыха (диастолы), способствующими восстановлению энергетических
ресурсов миокарда.
Общий кардиодинамический эффект сердечных гликозидов доволь-
довольно сложен, поскольку является комбинацией их прямого действия на
миокард и непрямого действия, изменяющего электрофизиологические
свойства сердца (автоматизм, проводимость и возбудимость).
Есть основания предполагать, что сердечные гликозиды, равно как
и другие инотропные вещества, действуют на сокращаемость сердца
п\тем воздействия на процесс переноса ионов Са2^ через мембрану
м но кард но ц ито в. Воздействие на электрическую проводимость клеточ-
клеточных мембран опосредовано изменениями в транспорте ионов Na\ КГ
и Са'+, что является рез>льтатом их непрямого ингибир>юшего дейст-
действия на Na"*-, К*-АТФазу клеточных мембран.
-332-
Кяпдиотонические препараты
Сердечные гликозиды применяются для лечения острой хрониче-
хронической сердечной недостаточности, при определенных видах сердечных
аритмий, кардиогенном шоке. Они рассматриваются в качестве единой
гр\ппы. поскольку имеют сходные фармакологические характеристики.
Они могут иметь один и тот же агликон, но остатки различных Сахаров,
и наоборот. При выборе препарата этого ряда следует учитывать не
только его активность,'' но и быстротч наступления эффекта, что сильно
зависит от физико-химических свойств этого ряда препаратов, которые
принято подразделять на полярные и неполярные. К полярным (гидро-
(гидрофильным) i ликозидам обычно относят строфантин, который применяют
внутривенно и эффект которого наблюдается уже через 5-10 мин после
введения. К неполярным гликозидам относят дигитоксин и дигоксин.
которые применяют в основном перорально или ректатьно и эффект
которых наблюдается через 2—4 ч после приема.
Выбор препарата и способ его введения зависят от показаний. При
острой сердечно-сосудистой недостаточности и внезапной декомпенса-
декомпенсации прибегают к внутривенному введению строфантина или корглюко-
на. При хронической сердечной недостаточности перорально применя-
применяют дигитосин или дигоксин.
То, что обычно экстрагируется из обоих видов Digitalis, представля-
представляет собой уже частично гидролизованные гликознды.
Природными гликозидами, содержащимися в Digitalis purpurea, яв-
являются п\рпуреагликозид А и пурпуреагликозид В, которые под дейст-
действием ферментов расщепляются на дигитоксин и глюкозу или, соответ-
соответственно, гитоксин и глюкозу, а при действии кислот полностью
гидролизуются до агликонов дигитоксигенина и, соответственно, гито-
ксигенина, а также дезоксисахаров дигитозы и глюкозы.
В Digitalis lanta содержатся гликозиды — лантозиды А. В и С.
Лантозид А при щелочном гидролизе отщепляет ацетильную группу
и превращается в пурпуреагликозид А. лантозид В — в пурпуреагли-
пурпуреагликозид В. Стр\ктура двух лантозидов — лантозида В и лантозида С —
отличается лишь гем, что в лантозиде В имеется гидроксильная группа
при С,,, его генина (дитоксигенин), в то время как в генине лантози-
лантозида С (дигокснгенин) имеется дополнительная гидрокеильная группа
и при С,2 генина.
Продукт, который обычно экстрагируется из обоих видов Digitalis.
предешвляет собой >же частично гидролизованные гликозиды — диги-
дигитоксин и дигоксин. Дигоксин выделяют только из Digitalis lanta.
Смесь сердечных гликозидов. выделяемых из семян Strophantus
Kombe. содержит в основном К-строфантин-Р и К-строфантозид.
-333-
Глава 17
К-строфантин-р состоит из агликона строфантидина и сахарного
остатка, состоящего из цимарозо-р-Б-глюкозы. К-строфантозид имеет
сахарный остаток из трех единиц — цимарозо-р-Б-глюкозо-а-В-
глюкозы. Использование термина «строфантин» в общем относится ко
всем гликозидам этого ряда.
Углеводная часть различных сердечных гликозидов может быгь
моно-, ди- , три- и тетрасахаридом, а агликон (генин) — стероидом
с определенными структурными особенностями. Главная роль сахарных
остатков, очевидно, заключается в способствовании растворению гени-
нов.
Для агликонов сердечных гликозидов характерны следующие струк-
структурные особенности: сочленение колец А и В — цис, колец В и С —
транс, колец С и D — цис; в положении 17Р находится бутенолидный
фрагмент. Большинство соединений отосится к 5р ряду. За одним ис-
исключением гидроксильная группа в положении Ся также имеет р-кон-
фигурацию. Физиологически активные соединения обязательно содер-
содержат гидроксильную группу в положении 14р. Группы ОН и СО в по-
положениях 11, 12, 16 и 19, по-видимому, оказывают меньшее влияние на
активность.
Главная роль сахарных остатков, которыми этерифицирована гид-
гидроксильная группа при Сз, очевидно заключается в способствовании
растворению генинов.
Простейшие сердечные генины — дигитоксигенин, гитоксигенин
и строфангидин являются агликонами важнейших гликозидов Digitalis
lanta. Digitalis purpurea и Strophantus Kombe.
дигитоксигенин
гитоксигенин
он
Oh
строфантидин
Цигитоксин (Digitoxin)
Дигиуоксин — Зр,14р-дигидрокси-5р-кард-20B2)енолид-3-триди-
гитоксид A7.1.1) является гликозндом. выделяемым из листьев раз-
различных видов наперстянки. Из 10 кг листьев выделяется около 6 г
дигитоксина [1, 2, 3, 4, 5, 6, 7. 8, 9].
-334-
Кардиотонические препараты
171 1
Дигигоксин применяют при хронической сердечной недостаточно-
недостаточности, тахиаригмической форме мерцания предсердий, пароксизмальной
мерцательной аритмии, пароксизмальной суправентрикулярной тахи-
тахикардии.
Синонимами препарата являются кардигин, кордален, кристодигин,
пуродигини др.
Дигоксин (Digoxin)
Дигоксин — Зр,14р-дигидрокси-5р-кард-20B2)-енолид-3-ригиток-
сид A7.1.2) также является гликозидом, выделяемым из различных
видов наперстянки. От дигитоксина отличается тем, что в положе-
положении С|6 стероидного скелета содержит дополнительную гидро-
гидроксильную группу. Продукт экстрагируют из листьев Digitalis lanta,
Digitalis onentalis или Scrophulanaceae [10, 11, 12. 13, 14, 15, 16].
17 1 2
-335-
Глава 1 7
Дигоксин оказывает сильное систолическое действие и замедляет
сердечный ритм. По сравнению с дигитоксином. быстрее выводится из
организма. Применяют при хронической сердечной недостаточности
при декомпенсированных клапанных пороках сердца, перегрузке мио-
миокарда при артериальной гипертонии, тахикардии желудочковой фиб-
фибрилляции и др>гих аналогичных состояниях.
Синонимами препарата являются цедоксин, ланакордин, ланоксин
и др.
Строфантин (Strophantinum)
Строфантин состоит из смеси гликозидов и, в основном, К-стро-
фантина-р — Зр,5,14-тригидрокси-19-оксо-5р-кард-20B2)-енолид-
З-Б-цимаро-Р-Б-гликозида A7.1.3) и К-строфантозида — 3C,5,14-
тригидрокси-19-оксо-5р-кард-20B2)-енолид-3-Б-цимаро-р-В-глюко-
a-D-гликозида A7.1.4). Препарат, в основном, получают выделени-
выделением из семян Strophantus Kombe [17, 18].
Строфантин применяют при острой сердечно-сосудистой недоста-
недостаточности и, в частности, после инфаркта миокарда, при хронической
сердечной недостаточности, сердечной декомпенсации, суправентрик>-
лярной тахикардии и мерцательной аритмии.
Синонимами препарата являются комбетин, строфопан и др.
17.2. Другие положительные инотропные препараты
Нет никакого сомнения в том, что вышеприведенные гликозиды яв-
являются наиболее ^удовлетворительными инотропным соединениями.
Однако по ряд) причин некоторым пациентам препараты дигиталиса
мопт быть противопоказаны. В качестве инотропного агента интенсив-
интенсивно из\чался теофиллин, однако он оказался непригодным для долговре-
долговременного применения.
-336-
Кардиотонические препараты
В последние годы в качестве иноторпных средств нашли примене-
применение производные ряда бипиридинов — амринон и минринон.
Механизм действия этих препаратов не совсем понятен. Однако
весьма вероятно, что они ингибируют клеточную фосфодиэстеразу мио-
миокарда, что приводит к повышению клеточного уровня цАМФ, который
в свою очередь способствует сокращениям клеток миокарда. Ясно, что
эти препараты не являются агонистами р-адренорецепторов и их эффект
не опосредован ингибированием Na+-, К*-АТФазы. Одновременно они
\величивают поток ионов Са2^ в клетки. Их применяют для кратковре-
кратковременного контроля за пациентами, неадекватно реагирующими на сер-
сердечные гликозиды, диуретики и коронарорасширяющие средства.
Амринон (Amrinone)
Амринон — 3-амино-5-D-пиридинил)-2A//)-пиридинон A7.2.4)
можно синтезировать исходя из пиридин-4-уксусной кислоты,
взаимодействием которой с комплексом диметилформамид — хло-
рокись фосфора получают 2-D-пиридил)-3-диметил-аминоакролеин
A7 2.1). Взаимодействием последнего с амидом циануке^сной ки-
кислоты получают 3-циано-5-D-пиридил)-2AЯ)-пиридинон A7.2.2).
Гидролизом цианогруппы последнего пол>чаюг 3-карбамил-5-D-
пиридил)-2AЯ)-пиридинон A7.2.3). Вводя последний в перегруп-
перегруппировку Гофмана (с применением брома в гидроокиси натрия), по-
л\чают амринон A7.2.4).
' POCh fi—л СнО H2N
^=^ CH-N(CH3J
17 2 1
^Л H
CONH2
Альтернативным путем синтеза, также исходящим из 3-циано-5-D-
пиридцл)-2A//)-пиридинона A7.2.2), является его кислотный гидролиз
до соответствующей кислоты — 3-карбокси-5-D-пиридил)-2AЯ)-
пиридинона A7.2.5), нитрование которого азотной кислотой в присутст-
присутствии серной кислоты приводит к 3-нитро-5-D-пиридил)-2A//)-пириди-
-337-
Глава 17
нону A7.2.6). Восстановлением нитрогруппы последнего водородом
получают искомый амринон A7.2.4) [19. 20].
\=/\
1722
CN
СООН
HNO3 / H2SO4
H2/Pd -С
-*¦ N
NH2
О
1724
3-циано-5-D-пиридил)-2A//)-пиридинон A7.2.2) предложено полу-
получать также конденсацией 2-D-пиридил)малонового диальдегида с ами-
амидом циануксусной кислоты [21].
•О-
сно
сн
сно
H2N
1722
Амринон является производным бипиридина и занял весьма полез-
полезную нишу в арсенале инотропных средств для кратковременного при-
применения в тех случаях, когда организм неадекватно отвечает на глико-
зидные препараты и коронарорасширяющие средства. Препарат уника-
уникален тем, что вызывает расширение сосудов и не вызывает аритмии или
признаков миокардиальной аритмии.
Амринон применяют при кратковременном лечении сердечной
недостаточности, не подвергающейся лечению другими препара-
препаратами.
Синонимами препарата являются инокор и винокарм.
Милринон (Milrinone)
Милринон — 1,6-дигидро-2-метил-6-оксо-C,4'-бипиридин)-5-кар-
бонитрил A7.2.7) является метильным аналогом промежуточного
продукта синтеза амринона A7.2.2).
-338-
Кардиотонические препараты
1727
Милринон обладает всеми свойствами амринона, лучше переносит-
переносится при оральном приеме и является более сильным препаратом, однако
по ряду причин не рекомендован к применению в США.
Синонимом препарата является примакор.
Список литературы
1. Cloetta Й- '/Arch. Exp. Pathol. Pharmacol. Д2, 261 A926).
2. Windaus A. et al.//Ber. 58, 2503 A925).
3. US Pat. 2.449.673 A948)
4. US Pat. 2.557.916A951).
5. US Pat. 2.615.884 A952).
6. Ger. Pat. 646.930A933).
7. Hungarian Pat. 155.252A968).
8. Hungarian Pat. 156.753 A968).
9. Ger. Pat. 2.006.926A969).
10. Smith S '/J. Chem. Soc. 1930. 508.
11. Brit. Pat. 337.091 A929).
12/ Indian Pat. 62.497 A958).
13. Hungarian Pat. 149.778A959).
14. Hungarian Pat, 151.897A964).
15. Hungarian Pat, 156.753A968).
16. Ger. Pat. 2.225.039A972).
П. Ger. Pat. 721.001A937).
18. Ger. Pat, 737.540A937).
19. US Pat. 4.004.012A977).
20. US Pat. 4.072.746A978).
21. Bnt. Pat. 2.070.008A981).
Глава 18
Антиаритмические
препараты
Препараты, применяющиеся для предотвращения и лечения нару-
нарушений нормальной скорости и ритма сокращений сердца, называются
антиаритмическими препаратами.
Аритмии возникают из-за нарушений в образовании электриче-
электрических импульсов и их проводимости в сердце или обеих причин одно-
одновременно.
Ритм сердца регулируется аиетилхолином и норэпинефрином (нор-
адреналином).
В норме ритм сердечной деятельности зависит от активности пейс-
мейкерных клеток (водителей ритма) синоатриального узла. При нару-
нарушении их функции нарушается сердечный ритм, что клинически прояв-
проявляется разной симптоматикой. Аритмия может быть связана и с по-
появлением эктопических очагов, генерирующих импульсы с большей
частотой, чем нормальные водители ритма.
Ритм сокращений сердца зависит от очень многих параметров: со-
состояния водителей ритма и проводящей системы, кровоснабжения мио-
миокарда и других факторов, и, следовательно, аритмии могут возникнуть
в силу различных причин вызванных нарушениями генерирования элек-
электрических импульсов или их проведения. Они могут быть вызваны по-
пороками сердца, ишемией миокарда, электролитными и кислотно-
основными изменениями, нарушениями иннервации сердца, интоксика-
интоксикацией организма и т. п.
Препараты, применяющиеся для лечения аритмий, могут воздейст-
воздействовать на проводящие системы сердца, его возбудимость, автоматизм,
величину эффективного рефрактерного периода, адренергическлю
и холинергическую иннервацию сердца. Соответственно, нарушенный
ритм сердечных сокращений могут восстанавливать соединения самых
различных химических классов.
Как уже было отмечено, аритмии возникают из-за нарушений в об-
образовании электрических импульсов и их проводимости в сердце, осу-
-340-
Антизритмические препараты
шествляемой посредством переноса ионов Хат, К+, Са2* через клеточные
мембраны, или обеих причин одновременно. Поэтому механизм дейст-
действия многих антиаритмических препаратов заключается в блокировании
натриевых или кальциевых ионных каналов миокарда, что пролонгиру-
пролонгирует время, необходимое этим каналам для восстановления после актива-
активации, и что в свою очеред'ь действует на проводящие системы сердца, его
возбчдимосгь, автоматизм и т. п.
Основываясь на тонком понимании механизма возникшей тахикар-
тахикардии, требующей хорошего знания электрофизиологии сердца, и знании
воздействия каждой группы лекарств на данный механизм, в большин-
большинстве случаев можно достаточно точно подобрать конкретный препарат
для конкретного пациента.
Классификация антиаритмических препаратов может быть основана
на разных принципах (например, по месту действия препарата). Это
могут быть вешества, действующие непосредственно на миокард и про-
проводящую систему самого сердца, или вещества, влияющие на эффе-
эфферентную иннервацию сердца. Их можно рассматривать как группы пре-
препаратов, эффективных при наджелудочковых аритмиях или эффек-
эффективных при желудочковых аритмиях.
Однако более или менее общепринятой на сегодняшний день клас-
классификацией препаратов, применяемых для лечения тахиаритмий, явля-
является классификация, основанная на особенностях их воздействия на
электрофизиологические или биохимические процессы в миокарде.
В соответствии с этим ангиаритмические препараты принято под-
подразделять на 4 основные группы. К первой группе относят препараты,
блокирующие натриевые каналы миокарда (хинидин, прокаинмид, ди-
зопирамид, лидокаин, токаинид, фенитоин, мексилетин, флекаинид,
энкаинид). Препараты, блокирующие действие на сердце эндогенных
катехоламинов, которые имеют определенное значение в патогенезе
аритмий, относят ко второй группе антиаритмических препаратов
(пропранолол). К третьей группе относят препараты с не совсем ясным
механизмом действия, которые одновременно оказывают и адренобло-
кирчющее действие и. в определенной степени, влияют на трансмем-
трансмембранный перенос ионов, возбудимость и проводимость и, в итоге, про-
пролонгируют потенциал действия в предсердно-желудочковом пучке
и волокнах Пуркинье (амиодарон, бретилий). Наконец, четвертая
группа антиаритмических препаратов представлена антиангннальными
средствами — блокаторами кальциевых каналов (верапамил).
В свою очередь, основываясь на специфических особенностях
влияния различных веществ в пределах одной группы (в частности, пер-
первой гр>ппы), их подразделяют на подгруппы. Некоторые исследователи
-341 -
Глава 18
придерживаются системы разделения антиаритмических препаратов на
пять групп без деления на подгруппы.
Препараты группы I
За редким исключением, все препараты, относящиеся к данной
группе, являются местными анестетиками, образующими комплексы
с липопротеинами мембран клеток миокарда и тем самым блокирую-
блокирующими проводимость натриевых каналов клеточной мембраны для пото-
потока ионов Na+ внутрь и способствующими выводу ионов К^ из клеток
миокарда, что, в итоге, приводит к слабому подавлению деполяризации
клеток миокарда, сокращению времени их реполяризации и уменьше-
уменьшению скорости проведения возбуждения. Этот ряд препаратов пролонги-
пролонгирует потенциал действия и увеличивает эффективный рефрактерный
период миокарда. В миокарде, главным образом в желудочках, подавля-
подавляется автоматизм эктопических очагов.
Подгруппа IA
Препараты этой подгруппы замедляют скорость проведения воз-
возбуждения, уменьшают возбудимость волокон Пуркинье, подавляют
автомагизм эктопических участков и увеличивают эффективный реф-
рефрактерный период. Они проявляют прямое и опосредованное антихо-
линергическое действие. К этой подгруппе относятся антиаритмиче-
антиаритмические препараты хинидин, прокаинамид, днзопирамид. Препараты этой
подгруппы применяются при лечении нарушений синусового ритма,
пароксизмальной, суправентрикулярной и вентрикулярной аритмии,
профилактики артериальной фибрилляции и преждевременных сокра-
сокращений сердца.
Хинидин (Quinidin)
Хинидин — E-винил-2-хинуклидинил)-F-метокси-4-хинолил)-
метанол A8.1 1) является декстроизомером алкалоида хинина
и является одним из четырех наиболее важных алкалоидов, выде-
выделяемых из коры хинного дерева [1, 2, 3]. Хинидин представляет
собой вторичный спирт, радикалами в котором являются 5-мето-
ксихинолиновое кольцо и 3-винилхинуклидин. Хинидин отличает-
отличается о г хинина только конфигурацией углеродного атома карбо-
карбонильной группы, и его предложно было пол\чать изомеризацией
хинина C7.1.1.47) [4]. Предложены также способы синтеза хинина
[5, 6. 7J.
-342-
Антиари тмические препараты
СН3О
Ch=CH2
СН3О
сн=сн2
Хинидин проявляет все фармакологические свойства хинина, вклю-
включая аинтималярийное, жаропонижающее и др. Хинидин назначают при
разных видах ариший для предотвращения тахикардии и фибрилляции
предсердия и. в частности, для профилактики мерцательной аритмии,
пароксизмальной суправентрикулярной тахикардии, экстрасистолии
и желудочковой тахикардии. Однако он является токсичным препара-
препаратом, и его применяют относительно редко.
Препарат выпускается также под названиями кардиохин, дурахин,
хинидекс и др.
Прокаинамид (Procainamide)
Прокаинамид — 4-амино-М-[2-(диэтиламино)этил]бензамид A8.1.3)
получают взаимодействием хлорангидрида 4-нитробензойной ки-
кислоты с К,К-диетилэгилендиамином с дальнейшим восстановлени-
восстановлением нитрогруппы в полученном 4-нитро-М-[2-(диэтиламино)этил]-
бензамиде A8.1.2) в аминогруппу [8, 9].
с2н5
с2нь
С2Н5
H2N-
/7~\ <
¦г у—со-ин—ch2-ch2-n(
18 1 3
С2Н5
С2Н5
Химическое отличие прокаинамида от прокаина заключается в за-
замене эфирной группы па амидную. Действие прокаинамида качественно
сходно с действием прокаина. Его влияние на работу сердца идентично
влиянию хинидина. Прокаинамид предпочтительнее прокаина в качест-
качестве антиаритмика, поскольку, в отличие от прокаина, он л\чше адсорби-
р>сгся при оральном применении и поскольку труднее гидролизуется
^етеразами плазмы, имеет большую продолжительность действия.
-343-
Глава 18
Прокаинамид предназначен для лечения пароксизмальной пред-
сердной тахикардии, предсердной фибрилляции, преждевременных же-
желудочковых сокращений и желудочковой тахикардии. Для быстрого
достижения терапевтических концентраций парентеральное введение
прокаинамида предпочтительнее хинидина.
Синонимами препарата являются амидопрокаин, кардиоритмин, но-
вокаинамид, пронестил и др.
Дизопирамид (Disopyramid)
Дизопирамид — а-B-диизопропиламиноэтил)-а-фенил-2-пиридин-
ацетамид A8.1.6} получают арилированием бензилцианида 2-хлор-
пиридином в присутствии амида нафия с последующим алкилиро-
ванием полученного а-фенил-а-B-пиридил,>ацетонитрила A8.1.4)
2-ди-мзо-пропиламиноэтилхлоридом с использование амида натрия.
Сернокислый гидролиз полученного нитрила A8.1.5) приводит
к пол\ чению а-B-диизопропиламиноэтил)-а-фенил-2-пиридинаце-
тамида — диизопирамида [10, 11, 12].
-CH2-C=N +
NaNH2
N CI
Ci— CH2-CH2-n(
CH(Cri3J
СН(СНзJ
N=C-C — CH2-CH2-N(
CH(CH3J
CH(CH3J
18 1 5
H2SO4
II I /
H2N -С—С—CH2 -CH2-n(
CH(CH3J
CH(CH3J
Дизопирамид структурно не относится ни к одному из известных
классу антиаритмиков, однако являясь препаратом группы блокаторов
натриевых каналов IA класса, оказывает мембраностабилизируюшее
действие, увеличивает эффективный рефрактерный период и продолжи-
продолжительность потенциала действия в предсердиях и желудочках. Он вызы-
вызывает снижение сократимости и возбудимости миокарда, замедление
проводимости, подавление автоматизма синусового узла. Дизопирамид
показан для предотвращения и восстановления наджелудочковой и же-
344
д н т и а ритмические препараты
тедочковой экстрасистолии и тахикардии с целью предотвращения
мерцания и трепетания предсердий, профилактики аритмий.
Препарат выпускается также под названиями дикорантил, димодан,
напамид, норпас. ритмилен, ритмодан и др.
Подгруппа IB
Препараты подгруппы IB увеличивают электрический порог возбу-
возбудимости желудочков во время диастолы, подавляют автоматизм и диа-
столическую деполяризацию, уменьшают продолжительность рефрак-
рефрактерного периода и отличаются от препаратов подгруппы IA тем, что
если первые блокируют открытые натриевые каналы, то препараты под-
подгруппы IB, в основном, блокируют неактивные натриевые каналы. Это
означает следующее: так как они быстро элиминируют с нормальных,
открытых натриевых каналов, то на здоровые участки миокарда оказы-
оказывают слабое влияние. В зоне ишемии миокарда гипоксия вызывает де-
деполяризацию клеточных мембран, и возникают аритмогенные очаги.
При этом многие натриевые каналы инактивируются и становятся чув-
чувствительными к препаратам этого класса, которые улучшают проводи-
проводимость и уменьшают время реполяризации этих клеток сердца. Препара-
Препараты подгруппы IB мало воздействуют на мышцу предсердий, атриовен-
трикулярную проводимость, сокращаемость миокарда, сердечный
выброс и систолическое артериальное давление. Препараты этой под-
подгруппы — лидокаин, токаинид, мексилетин являются местными анесте-
анестетиками, однако применяются при острых вентрикулярных аритмиях,
таких, которые могут возникнуть при инфаркте миокарда, хирургиче-
хирургических вмешательствах и катетеризации сердца, интоксикациях сердеч-
сердечными гликозидами. Фенитоин, не относящийся к ряду местных анесте-
анестетиков и являющийся противосудорожным средством, ограниченно
применяется только в качестве орального средства, заменяющего лидо-
лидокаин при пароксизмальной тахикардии, вызванной интоксикацией.
Лидокаин (Lidocain)
Лидокаин является 2-диэтиламино-21,61-диметилацетанилидом B.2.3).
Синтез лидокаина описан в гл. 2 «Местные анестетики».
сн3
/—\ ¦¦ /
4 /У— NH—C-CH2-N(
с2н5
сн3
223
С2Н5
-345-
Глава 18
Лидокаин является прототипом антиаритмических препаратов под-
подгруппы IB и наиболее широко применяется для лечения и предотвраще-
предотвращения вентрикулярной эктопической активности прн инфаркте миокарда.
Аналогично прокаинамиду, лидокаин является амидом с местноане-
стезирующим действием. Обычно лидокаин вводится внутривенно для
кратковременной терапии желудочковой экстрасистолии, тахикардии,
особенно в острой фазе инфаркта миокарда, профилактики фибрилля-
фибрилляции желудочков при остром инфаркте миокарда, аритмии по жизнен-
жизненным показаниям и при аритмиях, которые могут возникать при хирур-
хирургических манипуляциях на сердце.
Синонимами препарата являются лидопен, ксилокаин, ксилокард и др.
Токаинид (Tocainid)
Токаинид — 2-амино-2',б'-диметилпропионанилид A8.1.8) получа-
получают взаимодействием 2,6-диметиланилина с бромангидридом 2-бром-
пропионовой кислоты и последующим замещением атома брома
в полученном амиде A8.1.7) на аминогруппу [13, 14, 15, 16].
Br-C-Cri-СНз
¦NH—С-СН-СН3
Вг
18 1?
NH— C-CH-СНэ
NH2
Токаинид применяют для подавления симптомов вентрикулярной
аритмии и тахикардии, при преждевременных сердечных сокращениях.
Синонимом препарата является тонокард.
Мексилепшн (Mexiletin)
Мексилетин — 1-метил-2-B',2'-диметилфенокси)этиламин A8.1.11).
Синтез мексилетина осуществляют взаимодействием натриевой со-
соли 2,6-диметилфенола с хлорацетоном с получением 1-B,6-диме-
тилфенокси)-2-пропанона A8.1.9). Взаимодействием последнего
с гидроксиламином получают соответствующий оке им A8.1.10).
Восстановлением оксиминогруппы в последнем водородом над ни-
никелем Ренея получают мексилетин A8.1.11) [17, 18, 19,20].
CH-s
о
CI—СНо-С-СНз
NH2OH
-346-
Антиаритмические препараты
Н2/ Raney'Ni
СНз
18 1 11
Мексилетин показан при желудочковой экстрасистолии и желудоч-
желудочковой тахикардии, фибрилляции желудочков (в том числе в остром пе-
периоде инфаркта миокарда).
Синонимом препарата является мекситил.
Фенитоин (Phenytoin)
Синтез противосудорожного препарата фенитоина (9.1.1) описан
в гл. 9 «Противоэпилептические средства».
Основные эффекты фенитоина на сердце сходны с таковыми лидо-
каина. По существу, его применение ограничено, и он, в основном,
применяется только в качестве орального средства, заменяющего лидо-
лидокаин при пароксизмальной тахикардии, в частности, вызванной инток-
интоксикацией препаратами дигиталиса.
Синонимами препарата являются дилантин и дифенилан.
Подруппа 1С
Препараты этой подгруппы также являются блокаторами натриевых
каналов. Они в значительной мере подавляют деполяризацию клеток
миокарда и незначительно сокращают время их реполяризации, подав-
подавляют автоматизм синусовых узлов. Эти препараты отличаются от рас-
рассмотренных выше тем, что уменьшают проводимость и увеличивают
рефрактерный период желудочков, В эту подгруппу включены флекаи-
нид и энкаинид. Указанные препараты применяются для предотвраще-
предотвращения и регуляции суправентрикулярной тахикардии и предсердной фиб-
фибрилляции у пациентов с нормальной или близкой к нормальной
желудочковой функцией, желудочковых аритмиях.
-347-
Глава 1 8
Флекаинид (Flecainid)
Флекаинид — М-B-пиперидилметил)-2,5-бис-B,2,2-трифторэто-
кси)бензамид A8.1.14) получают исходя из 2,5-дигидроксибен-
зойной кислоты. Взаимодействием последней с трифторэтилфтор-
метилсульфонаюм осуществляют исчерпывающее 2,2,2-трифтор-
этоксилирование всех трех гидроксильных фупп с получением
2,2,2-трифторэтилового эфира 2,5-бие-B,2,2-трифторэтокси)бензой-
ной кислоты A8.1.12). Взаимодействием последнего с 2-аминоме-
тилпиридином получают соответствующий амид A8.1.13), восста-
восстановлением пиридинового кольца которого водородом получают
флекаинид A8.1.14) [21. 22, 23, 24].
н-о
CF3Ch2-O
H2N-CH2
h It— COO-CH2CF3
O-CH2CF3
CF3Chb-0
(л Л— COO—NH-CH2
O-CH2CF3
jO
Pd-C
CF3CH2 -О
¦COO—М-1-СН2
O-Cri2CF3
О
Химически флекаинид является аналогом прокаинамида, в положе-
положения С2 и С5 бензольного кольца которого введены 2,2,2-трифторэто-
ксильные группы, а боковая диаминоэтильная цепь завершается в пи-
перидиновом кольце
Эти изменения значительно меняют фармакологические свойства
прокаинамида, однако флекаинид сохраняет местноанестезирующие
свойства.
Аналогично другим местным анестетикам, флекаинид применяется
при вентрикулярных аритмиях по жизненным показаниям.
Синонимом препарата является тамбокор.
Энкаинид (Encainid)
Энкаинид — М-B-пиперидилэтил)-4-метокси)бензамид A8.1.15)
получается ацилированием 2-A-метил-2-пиперидилэтил)анилина
хлорангидридом 4-метоксибензойной кислоты. Химическая струк-
структура энкаинида значительно отличается от других местных анесте-
анестетиков и антиаритмиков [25, 26, 27].
-348-
Антиаритмические препараты
осн,
сн3
ОСН3
сн.
18 1 15
Клиническое применение энкаинида в первую очередь связано с на-
наличием серьезной желудочковой тахиаритмии, однако, как и флекаинид,
он бывает достаточно эффективен и при наджелудочковой аритмии
и применяется по жизненным показаниям.
Синонимом препарата является энкаид.
Препараты группы II
Препараты этой группы представляют собой C-адреноблокаторы,
антиаршмическая активность которых связана с устранением действия
не сердце адренергической иннервации и циркулирующего адреналина.
Поскольку все C-блокагоры уменьшают стимулирующие симпатические
нервные импульсы катехоламинов на сердце, уменьшая трансмембран-
трансмембранный перенос ионов Na~, скорость проведения возбуждения, то при этом
уменьшается синусовая скорость и сокращаемость миокарда, подавля-
подавляется автоматизм синусовых узлов и ингибируются и наджелудочковая,
и желудочковая тахиаритмии.
Возможно, чго р-адреноблокаторы регулируют ритм сердца и ус-
успокаивают ишемию также и понижением потребности сердца в кисло-
кислороде.
Их применяют при аритмиях, связанных с нервным стрессом, при
инфаркте миокарда, тиреотоксикозе, сопровождающихся повышением
адренергической активности. Более того, многие антиаритмические
препараты сами могут вызвать аритмию, особенно у пациентов с ише-
мической болезнью сердца. Исключение составляют рассматриваемые
р-адреноблокаторы.
В силу вышеизложенного практически все Р-адреноблокаторы мо-
могут быть применены в качестве антиаритмиков.
Однако в практической медицине группа пока представляется од-
одним препаратом — пропранололом. Появились публикации и по ис-
использованию в качестве антиаритмика атенолола. Противопоказаний
по использованию Р-блокаторов наряду с другими антиаритмиками
не имеется.
-349-
Глава 1 8
Пропранолол (Propranolol)
Синтез пропранолола — 1-изопропиламино-3-A-нафтилокси)пропан-
2-ола A2.1.3) описан в гл. 12 «Адреноблокирующие препараты».
он сн3
o-ch2-ch-ch2-nh-ch(
сн3
121 3
Пропранолол изучен наиболее детально и в эксперименте, и в кли-
клинике. Его применяют при вентрикулярной тахикардии, при аритмиях,
вызванных передозировкой препаратов дигиталиса или возникших в ре-
результате тиреотоксикоза либо избыточной катехоламинной активности.
Несмотря на то, что имеется много C-адреноблокаторов, пропранолол
счюается препаратом первого выбора, хотя другие блокаторы кальцие-
кальциевых блокаторов могут оказаться не менее эффективными.
Пропранолол урежает ритм сердечных сокращений, увеличивает
эффективный рефрактерный период предсердно-желудочкового узла
и угнетает его проводимость, уменьшает автоматизм клеток сердца,
снижает возбудимость и сократимость миокарда. Препарат применяют
при су праве нтрикулярных и желудочковых аритмиях.
Синонимами препарата являются анаприлин, детенсол, индерал,
новапранол и др.
Препараты группы III
Препараты этой группы оказывают антиаритмическое действие, за-
замедляя реполяризацию и увеличивая продолжительность потенциала
действия и эффективного рефрактерного периода во всех отделах серд-
сердца. Препарат этой группы — амиодарон блокирует некоторые ионные
каналы и а- и Р-адренорецепторы сердца. Их используют при неэффек-
неэффективности других антиаритмических средств при желудочковых аритми-
аритмиях, не поддающихся лечению другими препаратами, по жизненным по-
показаниям.
Амиодарон (Amiodarone)
Амиодарон — 2-бутил-3-бензофуранил-4-[2-(диэтиламино)этокси]-
3,5-дийодфенил кетон A8.1.21) получают по следующей схеме.
Бензофуран анилируют ангидридом масляной кислоты в присутст-
присутствии фосфорной кислоты с получением 2-бутироилбензофенона
-350-
Антиаритмические препараты
A8.1.16). Восстановлением карбонильной группы в последнем по
Вольф)—Кижнеру с использованием гидразингидрата получают 2-
бутилбензофуран A8.1.17). Последний ацилируют хлорангидридом
4-метоксибензойной кислоты с получением 2-бутил-3-D-метокси-
бензоил)бензофурана A8.1.18) и далее подвергают деметилирова-
нню гидрохлоридом пиридина с получением 2-бутил-3-D-гидрокси-
бензоил)-бензофурана A8.1.19). Полученный продукт йодируют в
присутствии йодида калия с получением 2-бутил-3-бензофуранил-4-
B-гидрокси-3,5-дийод-фенил) кетона A8.1.20), который далее вво-
вводят во взаимодействие с 2-диэтиламиноэтилхлоридом с получением
амиодарона A8.1.21) [28, 29].
(С3Н7СОJО
Н3РО4
H2NNH2
С3Н7
ОСН3
СН3О
HCI
О С4Нд
18.1 18
Химически амиодарон совершенно отличается от других антиарит-
миков и содержит в качестве заместителя два атома йода и диэтилами-
огганольнхю группу, и, в целом, молекула амиодарона весьма напоми-
т СтР> ктуру тироксиноподобных молекул.
-351 -
Глава 1 8
Антиаритмическое действие амиодарона связано с его способно-
способностью блокировать К+, Na+, Ca2+ каналы и неконкурентно блокировать
а- и Р-адренорецепторы сердца, пролонгировать потенциал действия
и эффективного рефрактерного периода клеток предсердий, атриовен-
трикулярного соединения и желудочков сердца, что сопровождается
снижением автоматизма синусного узла, замедлением атриовентрику-
лярной проводимости.
Клиническое применение амиодарона ограничено из-за его высо-
высокой токсичности, которая заключается в сердечной блокаде, брадикар-
дии (вызванной сердечной недостаточностью), нарушении функций
щитовидной железы, нейропатил, повышенной светочувствительно-
светочувствительности, что значительно ограничивает применение амиодарона. Он пока-
показан только при терапии весьма серьезных тахиаритмий, таких как по-
повторяющаяся желудочковая фибрилляция и гемодинамически неста-
нестабильная желудочковая тахикардия, и только под наблюдением врача
в условиях клиники.
Синонимами препарата являются кордарон, ритмарон и др.
Бретилий (Bretilium)
Бретилий — тозилат К-(о-бромбензил)-К-этил-1чт,К-диметиламмония
A8.1.22) получают взаимодействием о-бромбензилтозилата с этил-
диметиламином [30].
СНз
сн3
СНз
2—N-C2H5
СН3
СНз-
Препарат плохо абсорбир>ется при оральном применении и приме-
применяется только в виде внутривенных или внутримышечных инъекций.
Однако, аналогично многим другим четвертичным аммониевым солям.
препарат инициирует выброс нейрональных катехоламинов, что может
вызвать тахикардию, повысить кровяное давление и т. п.
Бретилий обладает симпатолитическим действием, связанным
с блокированием выделения норэпинефрина (норадреналина) из преси-
наптических нервных окончаний. Препарат имеет и прямое действие
непосредственно на ишемические миоциты. Бретилий — средство неот-
неотложной помощи, который используется в ситуациях желудочковой та-
тахикардии и фибрилляции желудочков, главным образом в остром пе-
периоде инфаркта миокарда, когда применение иных препаратов и про-
-352-
А н т и а ритмические препараты
цедур оказывается безуспешным. Он должен применяться только в слу-
случаях неотложной помощи и требует большой осторожности.
Синонимами препарата являются вретилол, орнид и др.
Препараты группы IV
Препараты этой группы, являясь блокаторами кальциевых каналов,
ингибируют медленный трансмембранный ток ионов Са2+ в клетки про-
проводящей системы сердца в ходе деполяризации, что вызывает замедле-
замедление атриовентрикулярной проводимости и увеличение эффективного
рефрактерного периода атриовентрикулярных узлов, что в итоге приво-
приводит к релаксации гладкой мускулатуры сердца и восстанавливает нор-
нормальный синусовый ритм при суправентрикулярных тахикардиях.
На сегодняшний день группа представлена одним препаратом —
блокатором кальциевых каналов — верапамилом, который, в основном,
используется в качестве антнангинального средства, а также препарата
для контроля за гипертензией.
Верапамил (Verapamil)
Синтез верапамила 5-[C,4-диметоксифенэтил)метиламино]-2-C,4-
диметоксифенил)-изопропилвалеронитрила A9.3.15) будет описан в
гл. 19 «Антиангинальные препараты».
СНз-0
О-СНз
СН3-О—^ V-С-СН2СН2СН2— N-CH2-CH2—^ Ъ— О-СНз
^ V Л-м ГЦ. * '
CEN
сн;
193 15
В качестве антиаритмического средства верапамил применяют и для
лечения суправентрикулярных аритмий, таких как пароксизмальная
предсердная тахикардия, для контроля над фибрилляцией предсердий.
Подавляя вход кальция в клетку, верапамил оказывает отрицательное
инотропное действие, и поэтому его нельзя комбинировать с C-адрено-
блокаторами или хинидином, так как при этом усиливается его отрица-
отрицательный инотропный эффект.
В качестве антиаритмика верапамил в основном применяется при
желудочковых аритмиях, однако в настоящее время он постепенно вы-
вытесняется аденозином.
Синонимами препарата являются изоптин, калан, финоптин, фали-
кард, манидон и многие другие.
-353-
Глава 1 8
Список литературы
1 Turner R, Woodward R , 'The Alkaloids. 3. 1-63 A953).
2. US Pat. 2.878.252A959).
3. Gsr. Pat. 2.156.725A971)
4. Doenng W et al.//J. Am. Chem, Soc. 69, 1700 A949).
5. GutzwillerJ. et al./'J. Am. Chem. Soc. 92, 204 A970).
6. GutzwillerJ. et al.//Helv. Chim. Acta. 56, 1494 A973).
7. GutzwillerJ et al. '/J. Am. Chem. Soc. Ш, 576 A978).
8. BaltzyR et al.//J. Am. Chem. Soc. 64, 2231 A942).
9. Yamazaki M et al., 'J. Pharm. Soc. Japan. 73, 294 A953).
10 US Pat. 3.225.054A962).
11. Ger. Pat. 1.470.2156A962)
12. Adelstein J et al.//J. Med. Chem. 16, 309 A973).
13 Ger. Pat. 2.235 745A972).
14. Brit. Pat. 1.461.602A974).
15. Ger. Pat. 2.400.540 A974).
16 Byrnes E 'J. Med. Chem. 22, 1171 A979).
17. US Pat. 3 954.872A976).
18. US Pat. 3.659.019A972).
19. Fr Pat 1.551.055A968).
20. S.Afr. Pat 69 03.772 A970).
21. US Pat. 3.900.481 A975).
22. US Pat. 3.655.728A972).
23. US Pat. 4.005.209A977).
24. BanittE. et al./'J. Med. Chem. 2Д 821 A977).
25. Ger. Pat. 2.210.154A972).
26. US Pat. 3.931.195A976).
27. Dybtra S et al.//J. Med. Chem. 16, 1015 A973).
28. Fr. Pat. 1.339.389A962).
29. US Pat. 3.248.401A966).
30. US Pat, 3.038.004A962).
Глава 19
Антиангинальные
препараты
Антиангинальными препаратами являются лекарственные средства,
применяемые для купирования и профилактики патологических состоя-
состояний, связанных с коронарной недостаточностью и объединенных тер-
термином «ишемическая болезнь сердца».
К ишемической болезни относятся стенокардия («грудная жаба»)
и инфаркт миокарда.
Стенокардия возникает в результате дисбаланса между потребно-
потребностью и снабжением кислородом ишемической области миокарда. Сле-
Следовательно, теоретически при стенокардии необходимы препараты либо
понижающие потребность миокарда в кислороде, либо улучшающие его
снабжение кислородом. Этого можно достичь либо уменьшением на-
гр\зки на сердце, либо путем снижения системного венозного и артери-
артериального давления (нитраты и нитриты), либо частичным подавлением
адренергической иннервации сердца (C-адреноблокаторы), либо угнете-
угнетением транспорта ионов Са2 в клетки миокарда, поскольк) сокращение
гладких мышц сосудов контролируется концентрацией ионов Са2+
в цитоплазме (блокаторы кальциевых каналов). Фактически результи-
результирующим эффектом перечисленных выше рядов препаратов становится
снижение потребности сердца в кислороде.
Таким образом, основными препаратами, используемыми во время
терапии ишемии миокарда и для облегчения болей при стенокардии,
являются нитраты и нитриты (нитроглицерин, динитрат изосорбида
и тетранитрат пентаэритрита), вещества подавляющие адренергические
системы сердца — C-адреноблокаторы (атенолол, метопролол, пропра-
нолол и надолол) и блокаторы кальциевых каналов (верапамил, дилтиа-
зем, нифедипин и никардипин), а также некоторые более старые препа-
препараты и, в частности, папаверин и дипиридамол.
-355-
Глава 19
19.1. Нитраты и нитриты
Еще более 100 лет назад было замечено, что амилнитрат и нитро-
нитроглицерин облегчают боли при стенокардии, и поскольку нитриты и нит-
нитраты имеют свойство расширять сосуды, умеренно увеличивая кровоток
к миокарду, стало принятым считать, что расширение коронарных сосу-
сосудов облегчает состояние больного стенокардией.
Кажется вероятным, что механизм действия всех рассматриваемых
органических нитратов и нитритов должен быть аналогичен. Они про-
проявляют прямой релаксирующий эффект на сосудистую гладкую муску-
мускулатуру, в результате чего наступает общее расширение сосудов, при
котором доминирует расширение вен, а расширение артерий происхо-
происходит в меньшей степени. В результате уменьшается сосудистое сопро-
сопротивление, что приводит к уменьшению нагрузки на сердце и к сниже-
снижению потребности миокарда в кислороде, и состояние гипоксии
устраняется. Более того полагают, что нитроглицерин и другие нитраты
уменьшают размеры ишемического поражения, что связывают с улуч-
улучшением кровоснабжения миокарда.
Механизм действия нитратов выяснен не до конца. На основании
имеющихся фактов можно с определенной долей вероятности утвер-
утверждать, что в клетках гладкой мускулатуры нитраты трансформируются
в нитриты и затем высвобождают N0. Последний, в свою очередь,
взаимодействует с гунилатциклазой, вызывая повышенный синтез гуа-
нозин 3',5'-монофосфата (циклический GMP). В результате активирует-
активируется GMP-зависмая протеинкиназа, и, как следствие, происходит меньшее
фосфорилирование мышечных белков, а дефосфорилированные мы-
мышечные белки имеют меньшую способность к сокращению, итоговым
результатом чего становится снижение потребности сердца в кислороде.
Таким образом, нитраты расслабляют всю гладкую мускулатуру,
включая систему печени, мочевого пузыря и бронхиол. Однако наибо-
наиболее активная релаксация происходит в кровеносных сосудах.
Тем не менее селективное расширение коронарных сосудов не мо-
может полностью объяснить лечебное действие коронарорасширяющих
средств. При стабильных формах стенокардии ввиду повреждения сосу-
сосудов образуются жесткие сосудистые структуры, не способные к расши-
расширению. Более того, коронарное кровообращение само отвечает на ише-
ишемию расширением сосудов. Не поврежденные атеросклерозом сосуды
увеличивают кровоток к нормальному миокарду путем расширения и,
соответственно, уменьшают поток крови к ишемической области. Это
явление называется «сосудистым воровством» и имеет скорее отрица-
отрицательное, чем положительное значение.
-356-
Антиангинальные препарятк,
В качестве антиангинальных препаратов лекарственные формы
нитратов представлены как быстродействующими препаратами, исполь-
используемыми для снятия острых приступов стенокардии, так и препаратами
пролонгированного действия, которые применяются для предотвраще-
предотвращения приступов стенокардии. Нитроглицерин — глицерилтринитрат и амил-
нитрит являются препаратами с быстрым началом, но с коротким пе-
периодом действия. Другие органические нитраты, используемые для
более пролонгированного действии, представляют из себя тетранитрат
эритрита, динитрат изосорбида и тетранитрат пентаэритрита. Из орга-
органических нитритов в медицине применяется амилнитрит.
В последние 10 лет коронарорасширяющие средства зарекомендо-
зарекомендовали себя как первичные соединения в терапии сердечной недостаточ-
недостаточности.
Нитроглицерин (Nitroglycerine)
Нитроглицерин — 1,2,3-пропантриолтринитрат A9.1.1) получают
нитрованием глицерина азотной кислотой [1, 2, 3].
сн—он
СН2-ОН
CH2-ONO2
СН—ONO2
CH2-ONO2
19 1 1
Препарат вызывает уменьшение нагрузки на сердце за счет расши-
расширения периферических вен, уменьшает потребность миокарда в кисло-
кислороде и способствует перераспределению коронарного кровотока в об-
области миокарда со сниженным кровообращением.
Нитроглицерин применяют преимущественно для купирования ост-
острых и хронических приступов стенокардии, при инфаркте миокарда.
Синонимами препарата являются тринитроглицерин, тринитрол,
тринитрин и многие другие.
Тетранитрат пентаэритрита (Pentaerythriol tetranitrat)
Тетранитрат пентаэритрита — 2,2-бис(гидроксиметил)-1,3-пропан-
диолтетранитрат A9.1.2) также получают реакцией нитрования, но
уже 2,2-бис(гидроксиметил)-1,3-пропандиола — пентаэритрита азот-
азотной кислотой [4].
но-сн2
НО-СН2 СН2-ОН
HNO3 /
д
O2NO-CH2 CH2-ONO2
ОгМО-СН/ CH2-ONO2
19 1 2
-357-
Тетранитрат пенгаэритрита применяют при хронической сердечной
недостаточности. Препарат предупреждает наступление приступов сте-
стенокардии, облегчает их течение
Синонимами препарата являются нитропентон, нитринал, вазокор,
вазолат, пентилан, эриыит и многие другие.
Июсорбиддинитрат (hosorbiddinitrat)
№осорбиддинитрат — 1,4:3,6-диангидросорбит-2.5-динитрат A9.1.4)
получают внутримолекулярной дегидратацией D-сорбита в изосор-
бид A9.1.3) с использованием «я/?а-толуолс>льфокислоты с после-
д)'ющм нитрованием двух гидроксильных групп азотной кислотой
[5, 6, 7J.
снг-он
н-с-он
Oh-C-H
H-C-Oh
н-с-он
СН2-ОН
он
ONO2
О HNO3/H2SO4
19 1 3
он
19 1 4 0N°2
Изосорбиддинитрат также применяют при хронической сердечной
недостаточности, для предупреждения приступов стенокардии. Дейст-
Действует продолжительно.
Синонимами препарата являются изордил, метронитрон, вазкардин
и др.
19.2. Препараты ряда fi-адреноблокаторов
Имея свойство понижать потребность сердца в кислороде, C-адре-
яоблокаторы и, в частности, атенолол, метопролол, пропранолол и на-
долол рекомендуются для лечении хронической стенокардии, которая
часто развивается после перенесенного инфаркта миокарда. Уменьше-
Уменьшение потребности сердца в кислороде C-адреноблокаторами достигается
понижением скорости работы сердца, уменьшением кровяного давления
и сокрашаемостн миокарда. Следует отметить, что острые приступы
стенокардии лучше всего снимаются нитроглицерином. Однако, несо-
несомненно, терапия р-адреноблокаторами комплементарна терапии нитра-
нитратами. Более того, нередко нитраты противодействуют некоторым неже-
нежелательным эффектам C-адреноблокаторов, поэтому наиболее часто
применяется комбинированная терапия нитратами и р-адреноблока-
р-адреноблокаторами.
-358-
Антиангинальные препараты
Пропранолол (Propranolol)
Пропранолол — 1-(шо-пропиламино)-3-A-нафтокси)-2-пропанол
A2.1.2). Синтез препарата описан в гл. 12 «Адреноблокирующие
препараты».
о-сн2-сн-сн2-
ОН
12.1.2
СН3
-NH-CH
СН3
Пропранолол — неселективный Р-адреноблокатор, который дейст-
действует и на механические и электрофизиологические свойства миокарда.
Препарат понижает сократимость миокарда, скорость работы сердца,
давление крови и потребность миокарда в кислороде. Эти свойства де-
делаю i пропранолол и другие р-адреноблокаторы полезными антианги-
нальными препаратами.
Пропранолол показан при лечении гипертонии, стенокардии, супра-
вентрикулярной аритмии, вентрикулярной тахикардии, мигрени, гипер-
гипертрофическом субаортальном стенозе и феохромоцитоме. Применяется
в послеострой фазе инфаркта миокарда.
Общепринятыми синонимами препарата являются анаприлин. обзи-
дан, индерал. новапранол, дефенсол.
Метопролол (Metoprolol)
Метопролол — 1-(мзопропиламино)-3-[4'B-метоксиэтил)фенокси)]-
2-пропанол A2.1.5). Синтез препарата описан в гл. 12.
СН3О-СН2-СН2
СН3
•О-СН2-СН-СН2— NH-CH
ОН СНз
12.1.5
В отличие от пропранолола, блокирующего как рг, так и р2-адре-
норецепторы, метопролол проявляет кардиоселективное действие, т. е.
в терапевтических дозах он блокирует ргадренорецепторы с незначи-
незначительным воздействием на р2-адренорецепторы.
Метопролол применяют при инфаркте миокарда, для предупрежде-
предупреждения омертвления сердечно-сосудистых тканей, при стенокардии.
-359-
Глава 1 9
Наиболее распространенным синонимом препарата является ло-
прессор.
Ацебутол (Acebutol)
Ацео> тол — 3 '-ацетил-4 Ч2-гидрокси-3-(кзо-пропилам1шо)пропокси]-
бутиранилид A2.1.6). Синтез препарата также описан в гл. 12.
сн3
O-Ch2-CH-CH2—NH-Cri
ОН СНз
12 1 6
NH-CO-C3H7
Применяется для профилактики стенокардии.
Синонимом препарата является сектрал.
Атенолол (Atenolol)
Атенолол — 2-[4' [2-гидрокси-3-(мзо-пропиламино)пропокси]фенил]-
ацетамид A2.1.7). Синтез препарата описан в гл. 12.
О-СН2-СН-СН2— NH-CH
ОН
СНз
CH2-CONH2
Препарат применяется для профилактики стенокардии.
Синонимом препарата является тенормин.
Надолол (Nadolol)
Надолол— 1-(/ире/и-бутиламино)-3-[E,6.7,8-тетрагидро-г/кс-6,7-ди-
гидрокси-1-нафтил)-окси]-2-прпанол A2.1.8). Синтез препарата
описан в гл. 12.
O-CH2-CH-CH2-NH-C(CH3K
он
12 1 8
-360-
Антиангинальные препараты
дни.
Препарат применяется для профилактики хронической стенокар-
i.
Синонимом препарата является коргард.
19.3. Блокаторы кальциевых каналов
Эта группа препаратов разрабатывалась в качестве коронарорас-
ширяюших средств и некоторое время использовалась в качестве та-
таковой, пока не было выяснено, что они ингибируют сокращающее
действие кальция на гладкую мускулатуру и сердечную мышцу и ме-
местом их действия являются кальциевые каналы на поверхности клетки,
служащие для проведения ионов Са2+ в клетку. Первоначально их ста-
стали называть антагонистами кальция, однако позже для этого класса
соединений предпочтение было отдано названию блокаторы кальцие-
кальциевых каналов.
Химически блокаторы кальциевых каналов представляют довольно
разнообразную группу соединений, что может свидетельствовать о раз-
разнообразных рецептивных участках как на поверхности клеточной мем-
мембраны, так и внутри нее. Верапамил, который можно рассматривать как
производное бензилцианида, является одним из старейших и до сих пор
активно используемым соединением этого класса. Дилтиазем является
тио-диазепином, а нифедипин и никардипин — производным дигидро-
пирирдина.
Сегодня является очевидным факт, что сокращение гладких мышц
сосудов контролируется концентрацией ионов Са2+ в цитоплазме. Ос-
Основной принцип действия блокаторов кальциевых каналов заключает-
заключается в том. что они нарушают проникновение ионов Са2* в мышечные
клетки сердца и сосудов. Уменьшение поступления ионов Са2~ в клет-
клетки миокарда приводит к уменьшению возможности использования
энергии фосфатных связей для механической работы сердца. В ре-
результате снижаются сила сердечных сокращений и работа сердца, что,
в свою очередь, приводит к уменьшению потребности сердца в кисло-
кислороде.
Предложены два механизма, регулирующих клеточную концен-
концентрацию кальция. Первый из них называется механизмом электромеха-
электромеханического сопряжения. При этом полагают, что вольтажзависимые
кальциевые каналы раскрываются в ответ на деполяризацию мембра-
мембраны, и в результате внеклеточные ионы Са2+ устремляются в клетку.
Второй из предложенных механизмов независим от деполяризации
мембраны. Он предполагает высвобождение ионов Са^~ из саркоплаз-
магической сумочки, что вызывает поток внеклеточных ионов Са2
-361 -
Глава 1 9
в клетку через не связанные с напряжением кальциевые каналы. Неза-
Независимо от механизма проникновения ионов Са2+ в клетку, их повышен-
повышенная концентрация приводит к связыванию с кальмадулином. В свою
очередь Са2+-кальмадулиновый комплекс инициирует фосфорилирова-
ние легких цепей миозина путем активации киназы легких цепей. Взаи-
Взаимодействие фосфорилированных легких цепей миозина с актином
в свою очередь вызывает сокращение гладкой мускулатуры.
Блокаторы катьциевых каналов могут блокировать поток кальция
в клетку по любому из приведенных механизмов. Однако вольтажзави-
симые каналы отвечают на меньшие концентрации кальция, чем воль-
тажнезависимые. Отсюда следует, что соотношение вольтажзависи-
мых'вольтажнезависимых каналов определяет селективность ответов
вен и артерий. В клинически применяемых дозах блокаторы кальциевых
каналов расслабляют гладкую мускулатуру артерий и мало действуют
на вены. Необходимо отметить, что процесс возбуждения-сокращения
в сердечных миоцитах больше зависит от потока внутрь клетки Na^, а не
Са + ионов. Следовательно, в дозах, которые релаксируют гладкую мус-
мускулатуру, блокаторы кальциевых каналов относительно мало влияют на
сокращаемость сердца.
Дилтиазем (Diltiazem)
Дилтиазем — ацетат 5-[2-(диэтиламино)этил]-г/ис-2,3-дигидро-3-гид-
рокси-2-D-метоксифенил)-1,5-бензотиазепин-4EЯ)-она A9.3.10) по-
получают по следующей схеме. Конденсацией в условиях реакции
Дарзана 4-метоксибензальдегида с метилхлорацетатом в присутст-
присутствии метилата натрия получают метиловый эфир 3-D-мето-
ксифенил)глипидиловой кислоты A9.3.5). Раскрытием эпоксидного
цикла последнего взаимодействием с 2-аминотиофенолом получают
метиловый эфир 2-гидрокси-3-B'-аминофенилтио)-3-Dп-метокси-
фенил)пропионовой кислоты A9.3.6). Гидролиз полученного соеди-
соединения щелочью приводит к получению соответствующей кислоты
A9.3.7) в виде рацемической смеси, из которой взаимодействием
с (+)-а-фенилэтиламино.м получают /ярео-(+)-2-гидрокси-3-B'-ами-
нофенилтио)-3-Dп-метоксифенилпропионовую кислоту A9.3.8). Ки-
Кипячение последней в смеси уксусный ангидрид/диметилформа-
мид'пиридин приводит к замыканию тиазепинового цикла и одно-
одновременному ацилированию гидроксильной группы с образованием
(+)-г/мс-2-D-метоксифенил-3-ацетокси-2,3-дигидро-1.5-бензотиазе-
ппн-4-EЯ)-она A9.3.9). Алкилирование последнего 2,2-диметил-
аминоэтил-хлоридом приводит к дилтиазему A9.3.10) [8, 9, 10, 11,
12, 13. 14, 15].
-362-
Антиангинальные препараты
¦СОН + Ci—CH2-СООСНз
СН3О
^sh
"^NHj
\ ^
Л—СН-СН — СООСНз
1935
'СИ-ОН
¦NH- СООСНз
сн-он
соон
ОСНз
ОСОСНз
CICH2CH2N(CH3J
19 3 9
ОСНз
ОСОСНз
19 3 10
СН2
N(CH3J
Дилтиазем уменьшает трансмембранное поступление ионов Са2^
в клетки сердечной мышцы и гладкой мускулатуры сосудов. Вызывает
расширение коронарных и периферических сосудов, увеличивает коро-
коронарный кровоток, предотвращая развитие спазма коронарных артерий,
снижает повышенное АД и уменьшает тахикардию.
Препарат показан при стабильной и нестабильной стенокардии (в том
числе и после инфаркта миокарда), при артериальной гипертонии.
Общепринятыми синонимами препарата являются изоптин, ипро-
вентарил и др.
Верапамил (Verapamil)
Верапамил — 5-[C,4-диметоксифенэтил)метиламино]-2-C,4-диме-
токсифенил)изопропилвалеронитрил A9.3.15) получают по схеме,
исходящей в качестве основного исходного вещества из 3,4-диме-
токсифенилацетонитрила. Сам синтез конечного продукта A9.3.15)
сводится к алкилированию 2-C,4-диметоксифенил)-3-метилбути-
ронитрила A9.3.11) К-[2-C,4-диметоксифенил)-этил]-Ы-3-хлорпро-
пил)-К-метидамином A9.3.14).
-363-
Глава 19
Исходный 2-C,4-диметоксифенил)-3-метилбутиронитрил A9.3.11)
получают алкилированием 3,4-диметоксифенилацетонитрила изопро-
пилхлоридом в присутствии амида натрия. Алкилирующий агент — N-
[2-C,4-диметоксифенил)-этил]-]\т-3-хлорпропил)-1\'-метиламин A9.3.14)
также получают исходя из 3,4-диметоксифенилацетонитрила последо-
последовательным восстановлением в 3,4-диметоксифенилэтиламин A9.3.12)
с последующим метилированием в ^"-метил-М-3,4-диметоксифенилэти-
ламин A9.3.13). Далее полученный М-[2-C,4-диметоксифенил)-этил)-М-
метиламин A9.3.12) алкилируют 1-хлор-З-бромпропаном в искомый N-
[2-C,4-диметоксифенил)-этил]-М-3-хлорпропил)-М-метиламин A9.3.14),
которым и алкилируют 2-C.4-диметоксифенил)-3-метилбутиронитрила
A9.3.11) в конечный продукт—верапамил A9.3.15) [16, 17, 18, 19].
V
СНз-0
Cri3
H2N-CH2-CH2-\\
19 3 12
О-СНз
,О-СНз
H-N-CH2-CH2-\\ А— О-СЧ3
СН3
19313
Cl—CH2-CH2-CH2-N -CH2 -CH2 -<\
CH3
19.3 14
1S3.11
СНз-0
о-сьь
У- С-СН2-СН2-СН2—N-CH
C=N СН3
193 15
Верапамил обладает антиаритмической, антиангинальной и гипо-
гипотензивной активностью. Снижает потребность миокарда в кислороде за
счет снижения сократимости миокарда и урежения частоты сердечных
сокращений. Вызывает расширение коронарных артерий и увеличение
коронарного кровотока. Снижает тонус гладкой мускулатуры, перифе-
периферических артерий и общее периферическое сосудистое сопротивление.
-364-
дмтиангинальные препараты
Оказывает антиаритмическое действие при наджелудочковых аритмиях.
Верапамил применяют для профилактики приступов стенокардии,
артериальной гипертонии, при лечении и профилактике наджелудочко-
наджелудочковых аритмий (пароксизмальная наджелудочковая тахикардия, мерцание
предсердий, трепетание предсердий, экстрасистолия).
Синонимами препарата являются изоптин, калан, финоптин, фали-
кард, манидон и многие другие.
Нифедипин (Nifedipin)
Нифедипин — диметиловый эфир 1,4-дигидро-2,6-диметил-4-B'-
нитрофенил)-3,5-пири-диндикарбоновой кислоты A9.3.16) получа-
получают синтезом Ганча, исходящего из двух молей р-дикарбонильного
соединения — метилового эфира ацетоуксусной кислоты, альдегида
2-нитробензальдегида и аммиака. Последовательность промежу-
промежуточных стадий синтеза точно не установлена [20, 21, 22, 23].
сно
Ch-
NH3
19.3 16
Нифедипин вызывают расслабление гладкой мускулатуры сосудов,
расширяет коронарные и периферические артерии, снижает перифери-
периферическое сопротивление, АД, улучшают снабжение сердца кислородом.
Нифедипин применяют для профилактики приступов стенокардии,
их копирования, при гипертонии, в составе комбинированной терапии
хронической сердечной недостаточности.
Синонимами препарата являются адалат, коринфар, прокардиа, ни-
фекор.
Никардипин (Nicardipine)
Никардипин — 1,4-дигидро-2,6-диметил-4-C-нитрофенил)-метил-2-
| метилфенилметил)-амино]этиловый эфир 3,5-пиридидинкарбоно-
вой кислоты A9.3.17) синтезируют аналогично нифедипину с той
лишь разницей, что в реакции Ганча с о-нитробензальдегидом од-
одновременно используются два разных р-дикарбонильных соедине-
соединения. При этом одно из них в виде енаминной формы ацетоуксусного
зфира одновременно используется и в качестве аминной компонен-
-365-
Глава 19
ты Реакция гетероциклизации ос\ шестляется взаимодействием ме-
метилового эфира Р-аминокротоновой кислоты с 2-метил-2-бензил-
аминоэтиловым эфиром ацетоуксусной кислоты [24, 25, 26, 27].
+ CH3-C=CH — COOCh3
NO, NH2
Никардипин расслабляет гладкую мускулатуру сосудов, снижает
сопротивление коронарных и периферических сосудов, увеличивает
кровоток в сосудах головного мозга, вызывает умеренный и стойкий
гипотензивный эффект, уменьшает потребность миокарда в кислороде.
Препарат применяют при артериачьной гипертонии, при хрониче-
хронической стабильной стенокардии, для профилактики стенокардии и при
нарушениях мозгового кровообращения по ишемическому типу.
Синонимами препарата являются нердипин, карден и др.
19.4. Прочие препараты
Современные препараты, применяющиеся при лечении стенокар-
стенокардии, были описаны выше. Однако имеются весьма старые препараты
и подходы для ее лечения и, в частности, использование папаверина и ди-
пиридамола, которые применяются и сегодня.
Папаверин (Papaverin)
Папаверин — 1-вератрил-6,7-диметоксиизохинолин 19.4.7) предло-
предложено синтезировать исходя из вератрола.
Вератрол подвергают хлорметилированию с получением 3,4-диме-
токсибензилхлорида A9.4.1). Взаимодействием последнего с цианистым
калием получают 3,4-диметоксибензилцианид A9.4.2). Подвергая полу-
полученный 3,4-диметоксибензилцианид восстановлению водородом над
никелем Ренея получают гомовератриламин A9.4.3), а кислотным гид-
гидролизом 3,4-диметоксифенилуксусную кислоту A9.4.4). Взаимодейст-
Взаимодействием полученных соединений синтезируют соответствующий амид
A9.4.5). Циклизацией последнего по Бишлеру—Напиральскому с исполь-
использованием хлорокиси фосфора получают 3,4-дигидропапаверин A9.4.6).
который дегидрируют в искомый папаверин нагреванием в тетралине
при высокой температуре [28, 29, 30, 31].
-366-
Антиангинальные препараты
СЧ2О + HCI
СН3О
СНзО'
194 1
1942
СН3О
I94 3 + 19 44
СН3О.
СН3О
POCI3
ОСНз
1946
ОСНз
ОСНз
1947
ОСН3
Папаверин является алкалоидом сырого опия, однако не относится
к соединениям класса морфина и не обладает анальгетическими свойст-
свойствами. Он является периферическим вазодилатагором и непосредственно
во действует на сосуды. Вызывает расширение коронарных, мозговых,
легочных артерий. Способствует увеличению церебрального кровотока
»1 снижению церебрального сосудистого сопротивления. В терапевтиче-
терапевтических дозах он понижает кровяное давление. В больших дозах может
вызвать аритмию. Несмотря на отсутствие однозначного терапевтиче-
терапевтического эффекта, тем не менее его продолжают широко использовать при
нф\ тениях периферического и мозгового кровообращения и в качестве
коронарорасширяющего средства вообще, а также при спазмах перифе-
периферических сосудов и сосудов головного мозга, бронхов.
Синонимами препарата являются папавин, церебид, миобид, пава-
иен ьазоспан и многие другие.
-367-
Глава 1 9
Дипиридамол (Dipyridamol)
Дипиридамол — 2.2',2",2"'-[D,8-дипиперидинопиримидо[5,4-б]пи-
римидин-2,6-диил)-диимино]-тетраэтанол A9.4.13) синтезирчют ис-
исходя из 5-нитрооротовой кислоты A9.4.8), легко получаемой, в свою
очередь, нитрованием 2,4-дигидрокси-6-метилпиримидина, который
обычно получают конденсацией мочевины с ацетоуксусным эфи-
эфиром. Восстановлением нитрогруппы в 5-нитрооротовой кислоте
различными восстановителями пол\чают 5-аминооротовую кислоту
A9.4.9), которая взаимодействием с мочевиной или с цианатом ка-
калия приводит к получению 2,4,6,8-тетрагидроксипиримидо[5,4-с1]-
пиримидина A9.4.10). Подвергая последний действию смеси хлоро-
киси фосфора и пятихлористого фосфора получают 2.4,6,8-тетра-
\лорпиримидо[5,4-б]пиримидина A9.4.11). Взаимодействием полу-
полученного тетрахлорида с пиперидином замещают атомы хлора при
С.» и С8 гетероиикличской системы пиперидином с получением 2,6.-
дихлорпиримидо-4,8-дипиперидино[5/М]пиримидина A9.4.12). Вво-
Вводя пол>ченный продукт во взаимодействие с диэтаноламином полу-
получают дипиридамол A9.4.13) [32, 33].
„о-Ч
РОС!,/РС[5
О О
HO-CH2-CH2-N'
^н2-снг-он
.N~CH2-C42-OH
Дипиридамол >силивает коронарное кровообращение, улучшает
снабжение миокарда кислородом, потенцирует активность аденозина
и препятствует его метаболизации. Препарат тормозит агрегацию тром-
тромбоцитов, блокирует фосфодиэстеразу, улучшает мнкроциркуляцию и пре-
препятствует образованию тромбов.
Препарат показан при хронической коронарной недостаточности,
профилактики и лечении тромбозов.
Синонимами препарата являются ангинал, курантил, стенокор, тром-
пресантин и многие другие.
-368-
АнтиангинальИые препараты
Список литературы
1. SobreroH. a Arm. 64, 398A847)
2. Williamson К.'/Ann. 92, 305 A854).
3. DiCarlo F.lfDmg Metab. Rev. 4, 1 A975).
4. US Pat. 2.370.437 A945).
5. Goldberg L./IActa. Physiol. Scand. JJ>, 173 A948).
6. KrantzJ. et al./'J. Pharmacol. Exper. Ther. 67, 187 A939).
7. Ger. Pat. 2.623.800A976).
8. Ger. Pat. 1.805.714A968).
9. US Pat. 3.562.257A968).
10. US Pat. 4.416.819A983).
11. US Pat. 4.438.035A984).
12. US Pat. 4.552.695A985).
13. Ger. Pat. 3.415.035A984).
14. Nagao T. et al.'/Chem. Pharrn. Bui. 21, 92 A973).
15. Kugita H. et al.//Chem. Pharm. Bui. 19, 595 A971).
16. US Pat. 3.261.859A966).
17. Belg. Pat. 615.861 A962).
18. Ramuz Я/'Helv. Chim. Acta. 58, 2050 A975).
19. Theodore L. et al.//J. Org. Chem. 52, 1309 A987).
20. US Pat. 3.485.847 A969).
21. US Pat. 3.644.627A972).
22. Brit. Pat. 1.173.862A968).
23. S.Afr. Pat. 68 01.482A968).
24. Belg. Pat. 811.324A974). ¦
25. US Pat. 3.985.758A976).
26. IwanamiM. et al./'/Chem. Pharm. Bui. 27, 1426 A979).
27. Shibanuma T et al.//Chem. Pharm. Bui. 28, 2809 A980).
28. PictetA. et al.//Compt. Rend. 149, 210 A909).
29. PictetA. et al/'Ber. 42, 2943 A909).
30. Браз Г. и др.лЖПХ. 26, 337 A953).
31. Goldberg M.//Chem. Prod. Chem. News. Ц, 371 A954).
32. Brit. Pat. 807.826A956).
33. US Pat. 3.031.450A962).
Глава 20
Гиполипидемические
средства
Препараты, понижающие концентрацию липопротеидов в плазме
п>тем ингибирования их выработки в организме либо путем их вывода
из плазмы, называются гиполипидемическими или противосклеротиче-
скими препаратами.
Атеросклероз — это состояние организма, характеризующееся по-
повышенным содержанием в плазме крови атерогенных липопротеидов,
отложением липидов, в том числе холестерина, в виде сложных эфиров
внутри стенок артериальной системы, выражающееся в постепенном
затруднении кровообращения. Наиболее подходящее название для этой
болезни — липопротеинемия. Клинически это проявляется в виде ише-
мической болезни сердца, инсульта, нарушения мозгового кровообра-
кровообращения, периферической ишемии.
Атеросклероз гораздо более сложное заболевание, чем простая кон-
констатация факта высокой концентрации липопротеидов в крови и суже-
сужения сосудов.
Основной механизм развития атеросклеротического процесса не
совсем ясен. Кажется весьма вероятным, что развитию атеросклероза
предшествуют метаболические нарушения синтеза, транспорта и ути-
утилизации липидов. Липиды. такие как триглицериды и сложные эфиры
холестерина, циркулируют в крови в виде частиц (липопротеидов),
покрытых гидрофильной оболочкой, состоящей из фосфолипидов
и свободного холестерина. Холестерин транспортируется частицами
различного размера, составленными из триглицеридов. эфиров холе-
холестерина и фосфолипидов, каждая из которых играет весьма опреде-
определенную роль.
Липопротеиды разделяют на пять основных типов. Самыми круп-
крупными частицами являются хиломикроны. затем идут линопротеиды
очень низкой плотности (ЛПОНП), липопротеиды промежуточной
плотности (ЛПГТП), липопротеиды низкой плотности (ЛПНП), и, нако-
-370-
Гиполипидемические средства
нец, самыми маленькими являются липопротеиды высокой плотности
(ЛПВП). Разделение вышеперечисленных холестеринсодержащих ком-
комплексов осуществляют с помощью ультрацентрифугирования.
Таким образом, хиломикроны являются самыми крупными частица-
частицами с наименьшей плотностью, которые образуются в клетках эпителия
тонкого кишечника и состоят из экзогенных триглицеридов (жиров),
в отношении которых выполняют транспортные функции, а также эфи-
эфиров холестерина.
ЛПОНП образуются в печени и включают, главным образом, эндо-
эндогенные триглицериды и сложные эфиры холестерина с ненасыщенными
жирными кислотами. В организме они подвергаются липолизу с образо-
образованием короткоживущих ЛППП, содержащих примерно равные количе-
количества триглицеридов и сложных эфиров холестерина. Последние вновь
подвергаются липолизу, переходя в ЛПНП, в которых уже преобладают
сложные эфиры холестерина.
ЛПВП образуются в печени и кишечнике в результате катаболизма
хиломикронов и ЛПОНП и по сравнению с другими липопротеидами
содержат значительно больше сложных эфиров холестерина с ненасы-
ненасыщенными жирными кислотами, а также фосфолипидов и специфических
белков. Однако, в отличие от атерогенных ЛПНП и ЛПОНП, которые
метаболизируясь высвобождают холестерин, который в виде сложных
эфиров отлагается в тканях, хиломикроны и ЛПВП не атерогенны. Су-
Существует прямая связь между концентрацией в плазме и крови ЛПНП
и выраженностью атеросклеротических изменений в средних и крупных
артериях.
Вероятное течение процесса образования атеросклеротических
бляшек, очевидно, кратко можно описать следующим образом. В те-
течение времени, в основном с годами, в определенной точке сосуда, где
по какой-то причине имеется турбулентность потока крови, происхо-
происходит повреждение эндотелия. Тромбоциты начинают притягиваться
к поврежденному участку. Комбинированное действие эндотелиально-
го роста и вызванного тромбоцитами фактора роста привлекает к это-
этому } частку макрофаги, вызывая воспалительную реакцию, приводя-
приводящую к гипертрофии средней мышцы артерии, что сужает сосуд по
всей его длине с образованием бляшки. Эндотелий никогда не восста-
восстанавливается полностью и может явиться участком образования тром-
тромбов в суженном сосуде.
Тактика понижения уровня холестерина в организме в основном за-
заключается либо в выведении его избыточного количества из плазмы,
либо в ингибировании синтеза ЛПНП и ЛПОНП. Соответственно, гипо-
гиполипидемические средства подразделяются на препараты, усиливающие
-371 -
Глава 20
катаболизм и выведение из организма атерогенных липопротеидов
и липидов (колестипол и холестирамин), и средства, препятствующие
образованию атерогенных липопротеидов — фибраты (клофибрат, гем-
фибрознл), природные соединения — статины (ловастатин, мевастатин
и их аналоги), а также пробукол и никотиновая кислота. Кроме того,
иногда применяют препараты, снижающие уровень холестерина в орга-
организме с необъясненными до конца механизмами действия — декстроти-
роксин и неомицин.
Однако, наряду с приведенными выше отрицательными свойствами,
присущими холестерину, следует иметь в виду, что весьма определен-
определенная его часть в организме расходуется и на превращение в адренальные,
половые гормоны и витамин D.
20.1. Препараты, удаляющие желчные кислоты
' Одним из путей катаболизма холестерина в организме является его
трансформация в желчные кислоты, важнейшими из которых являются
холевая, дезоксихолевая. литохолевая и холановая кислоты.
,С ООН
НО'
НО' ~^ ~^ "ОН
холестеринхолевая кислота
.соон
соон
дезоксихолевая
кислота
литохолевая
кислота
холановая
кислота
При связывании желчных кислот и их удалении из организма нару-
нарушается баланс холестерин — желчные кислоты и начинается компенса-
компенсаторное увеличение трансформации холестерина в желчные кислоты,
в результате чего уменьшается содержание самого холестерина. Препа-
Препараты, удаляющие холестерин в виде нерастворимых производных желч-
-372-
Гиполипидемические средства
ных кислот, стимулируют трансформацию организмом холестерина
в желчные кислоты. Результирующим эффектом является общее пони-
понижение количества холестерина в организме.
В настоящее время доступны два препарата, связывающих желчные
кислоты в ЖКТ и выводящих их из организма — колестипол и холести-
холестирамин. Оба являются высокомолекулярными соединениями — анионо-
обменными смолами. Они отличаются друг от друга по химическому
строению, однако имеют один и тот же механизм действия. Будучи не-
нерастворимыми в воде они не абсорбируются из ЖКТ и связывают желч-
желчные кислоты на своих четвертичных аммониевых участках, выделяя их
в связанном с ионообменной смолой виде с фекалиями.
Колестипол (Colestipol)
Колестипол B0.1.1) представляет собой гидрохлорид продукта со-
полимеризации эпихлоргидрина с диэтилентриамином, содержа-
содержащим различное число кватернизованных атомов азота. Точной фор-
формулы продукта сополимеризации нет, но его примерное строение
можно выразить следующим образом B0.1.1) [1, 2, 3, 4J.
h2n-ch2-ch2-NH-снг-снг-nh2
А
I—СН2-СН-СН2
—<МН—СНг—CH2-NH-CH2—CH2-NH-CH2-CH-CH2 — NH—CH2—CH2-NH-CH2-CH2-NH-h ¦ mHCI
он "
Колестипол связывает желчные кислоты, которые выделяются, в свя-
связанном с ионообменной смолой виде. Препарат понижает уровень об-
общего холестерина и холестеринсодержаших ЛПНП в плазме крови, не
изменяя уровень ЛПВП.
Колестипол применяют при гиперхолестеринемии (в том числе при
атеросклерозе и артериальной гипертонии).
Синонимами препарата являются холестабил, холестид, лестид
и др.
Холестирамин (Cholestyramine)
Холестирамин B0.1.2) является сополимером дивинилбензола и сти-
стирола, который подвергают хлорметилированию и вводят во взаимо-
взаимодействие с триэтиламином [5].
-373-
Глава 20
сн=сн2 сн=сн2
сн=сн2
—сн-сн2 —сн-сн2—сн-сн2 —
сн2о/ не:
—сн-сн2-сн—сн2-сн-сн2 —
-си-сн2 — сн-сн2—сн-сн2 —
—сн-сн2—сн-сн2—сн-сн2 —
(CH3KN
ch2ci
-сн-сн2-сн—сн2-сн-сн2—
CH2N(CH3K CI
-сн-сн2-сн—сн2-сн-сн2 —
СН2С1 СН2С1
CH2N(CH3K CH2N(CH3K
сГ сг
20 1 2
Холесгирамин. аналогично колестиполу, связывает желчные кисло-
кислоты, которые выделяются в связанном с ионообменной смолой виде,
и применяется по тем же показаниям.
Синонимами препарата являются колибар, кванталан, квестран и др.
20.2. Препараты, ингибирующие синтез холестерина
К препаратам этого ряда относятся клофибрат и гемфиброзил, отно-
относящиеся к производным феноксикарбоновых кислот — фибраты, про-
5) кол, являющийся замещенным бис-меркапто-фенолом, а также при-
природные соединение — ловастатин, мевастатин и их аналоги. Поскольку
згйствне всех эгих препаратов трудно объяснить единым механизмом,
то они буд>т рассмотрены по отдельности.
Клофибрат (Clofibrate)
Клофибрат — этиловый эфир 2-D-хлорфенокси)-шо-масляной ки-
кислоты B0.2.2) получают этерификацией 2-D-хлорфенокси)-мзо-
масляной кислоты B0.2.1) этиловым спиртом. Последнюю, в свою
очередь, получают одностадийным синтезом взаимодействием 4-хлор-
-374-
Гиполипидемические средства
фенола, ацетона и хлороформа в присутствии щелочи, очевидно, пу-
путем первоначального образования хлорэтона — трпхлор-трет-
б)тилового спирта, который в условиях реакции этерифицируется
в D-хлорфенокси)трихлор-/«ре/и-бутиловый эфир и далее гидроли-
з\ется в искомую кислот)' B0.2.1) [6, 7, 8].
сн3
СНз'
СНС13
NaOh
С2Н5ОН ' Н
"^ /У~о-с-соос2нъ
20 2 2
Это производное арилоксиизомасляной кислоты оказалось наиболее
активным из серии соединений, найденных в начале 1960-х годов и по-
понижающих общую концентрацию липидов и холестерина в плазме.
Конкретный участок воздействия клофибрата неоднозначен. Быстро
и полностью трансформируясь в организме в парахлорфеноксимасля-
н>ю кислоту, он повышает активность липопротеинлипазы, которая
вн\ гри сос\дов повышает скорость превращения определенного коли-
количества ЛПОНП в ЛППП и далее в ЛПНП. Клофибрат непосредственно
уменьшает синтез в печени и распределение ЛПОНП.
Клофибрат понижает и концентрацию триглицеридов в плазме.
В общем, замечено, что клофибрат снижает уровень холестерина на
>-Ю %, а уровень триглицеридов — на 20-25 %. Уровень протеинов
высокой плотности при этом не меняется.
Препарат, в основном, применяют при наличии большого количест-
количества ЛПОНП.
Синонимами препарата являются мисклерон, аколестол, атеросол,
лиситерол, регелан и др.
Гемфиброзил (GemflbrozU)
Гемфиброзил — 2,2-диметил-5-B,5-диметилфенокси)валериановую
кислоту B0.2.4) получают либо гидролизом этилового эфира 2,2-
диметил-5-B.5-диметилфенокси)валериановой кислоты B0.2.3). по-
-375-
Глава 20
лучаемого алкилированием этилового эфира 2,2-диметилвалери-
ановой кислоты 3-B.5-диметилфеноксипропилбромидом-1 в при-
присутствии диизопропиламида лития, либо окислением соответст-
соответствующего альдегида B0.2.4) [9, 10, 11].
—(СН2;з -вг
h-C-COOC2H5
СНз
СНз
СНз
20 2 3
СНз
¦О-(СН2K—С-СОН
СНз
20 2 S
[О]
20 2 4
С химической точки зрения в определенном смысле гемфиброзил
родственен клофибрат) и имеет аналогичное фармакологическое при-
применение. Основное действие гемфиброзила, как и клофибрата, заключа-
заключается в значительном понижении уровня протеинов очень низкой плот-
плотности в плазме. При этом имеет место и небольшое понижение уровня
протеинов низкой плотности и увеличение образование ЛПВП.
Препарат применяют при гиперлипопротеинемиях, не корриги-
корригирующихся специальной диетой и физической нагрузкой
Синонимами препарата являются лопид, иполииид, нормолин
и др.
Пробукол (Probucol)
Пробу кол — бисC,5-ди-/я/?е/я-бутил-4-гидроксифенил)меркаптол
ацетона B0.2.6) получают тиокетализаиией ацетона 2,Ь-т\-трет-
б>1ил-4-меркаптофенолом в присутствии хлористого водорода [12,
13. 14. 15. 16].
,С{СН3)з
HCI
Cri,'
20 2 6
С{СН3)з
-376-
Гиполипидемические средства
Внедренный сравнительно недавно в качестве антигиперхолестере-
мического препарата, пробукол химически отличается от других препа-
препаратов. Он представляет собой орто-т-трет-бутнл, замещенный бис-
меркаптофенол. Механизм действия пробукола неясен. Будучи весьма
липофильным соединением он легко распределяется в жировую ткань,
и в результате около 20 % его максимальной концентрации в крови еще
сохраняется в течение 6 месяцев.
Пробукол понижает уровень общего холестерина, главным образом
за счет ЛПНП, не воздействуя на триглицериды и ЛПОНП. Высказано
предположение, что он ингибирует синтез самого холестерина и усили-
усиливает выведение желчных кислот. При его применении уменьшается
фракция протеинов низкой плотности, однако еще значительнее умень-
уменьшается фракция протеинов большой плотности. С эпидемиологической
точки зрения это вредно, поскольку понижение концентрации протеи-
протеинов большой плотности означает меньшее выведение холестерина из
тканей. Однако в любом случае пробукол снижает уровень холестерина
в плазме на 10-15 %. Более того показано, что пробукол способствует
уменьшению зоны некроза при ишемии миокарда.
Препарат показан при нарушениях липидного обмена, связанных
с повышением уровня холестерина и ЛПНП, когда диета и физические
нагрузки не оказывают достаточного гипохолестеринемического эф-
эффекта.
Синонимами препарата являются бифенабид и лорелко.
Ловастатин (Lovastatin) и Мевастатин (Mevastatin)
Ловастатин — (lS,3R,7S,8S,8aR)-l,2,3,7,8,8a-reKcanmpo-3.7-flHMe-
тил-8-[-[211,4К.)-тетрагидро-4-гидрокси-6-оксо-2//-пиран-2-ил]этал]-
1-нафтенил (8)-2-метилбутират B0.2.7), выделенный из Monascus
rubber [17] и Aspergillus terreus [18], а также (lS,3R,7S,8S,8aR)-
1,2,3,7,8,8а-гексагидро-7-метил-8-[-[2Я, 4К)-тетрагидро-4-гидрокси-
6-оксо-2//-пиран-2-ил]этил]-1-нафтенил (8)-2-метш1бутират B0.2.8),
выделенный из Penicillium citrinum [19, 20], а также из Penicillium
brevicompactum [21].
Ловастатин и мевастатин являются препаратами новой генерации,
внедренными в практику для лечения гиперлипохолистеринемии.
и представляют из себя уникальные соединения, Ловастатин выделен
из грибков Aspergillus terreus. Химически аналогичное соединение —
мевастатин, отличающийся лишь отсутствием метальной группы при
С3 нафталиновой системы, — выделено из грибков Penicihnium
citrinum.
-377-
Глава 20
но.
20 2 7
20 2 8
Эти гиполипидемические средства являются конкурентными инги-
ингибиторами фермента, лимитирующими скорость синтеза холестерина
в печени на стадии левалоновой кислоты.
Препараты считаются наиболее эффективным для снижения уров-
уровня холестерина, триглицеридов, ЛПОНП в плазме и умеренно повы-
повышают содержание ЛПВП. Препараты применяют при гиперлипопро-
теинемиях, не корригирующихся специальной диетой и физической
нагрузкой.
Синонимами ловастатина являются ловалип. мевакор, мевинакор,
сивлор; мевастатина — CS-500, ML-236 В.
Никотиновая кислота (Nicotinic Acid)
Никотиновая кислота — пиридин-3-карбоновая кислота B0.2.9)
в промышленности получается нагреванием под давлением пара-
альдегида — тримера ацетальдегида с аммиаком, приводящим к по-
получению 2-метил-5-этилпиридина, окислением которого азотной
кислотой получают искомый продукт [22. 23, 24, 25].
сн3
NH3
СН3 О СНз
^г^сн2сн3 ЖОз
С ООН
20 2 9
Никотиновая кислота, или витамин РР, в больших дозах понижает
уровень холестерина и триглицеридов в плазме. Несмотря на весьма
проблематичные побочные эффекты, она имеет долгую и \спешную
историю в качестве антигиперлипопротеинемического препарата. При-
Причем в этом плане ее применение не связано с применением в качестве
-378-
Гиполипидемические средства
витамина. Ее действие сводится к понижению выработки протеинов
очень низкой плотности, что очевидно связано с ингибированием липо-
лиза в жировых тканях. Важно отметить, что никотиновая кислота не
воздействует на общий синтез холестерина в организме. Никотиновая
кислота или никотиновая кислота в сочетании с препаратами, удаляю-
удаляющими желчные кислоты, могут снизить уровень холестерина и тригли-
иеридов на 10-30 %.
Препарат применяют при пеллагре (авитаминоз РР), атеросклерозе,
заболеваниях печени, язвенной болезни желудка и двенадцатиперстной
кишки, длительно не заживающих ранах и язвах.
Синонимами препарата являются никонацид, пернивит, энзикол,
ниацнн и др.
20.3. Прочие препараты
Декстротироксин (Dextrothyroxine)
Декстротироксин — О-3,3',5.5'-тетрайодтиронин B5.1.10). Синтез
эгого препарата приведен в гл. 25 «Тиреоидные гормоны и антити-
реоидные препараты».
NH2
25 1 10
Декстротироксин ускоряет распад холестерина и липопротеидов,
активируя катаболизм холестерина в печени, в результате чего холесте-
холестерин более интенсивно трансформируется в желчные кислоты. Снижает
\ровень ЛПНП в плазме и ЛПОНП в жировой ткани.
Препарат рекомендован для лечения гиперлипопротеинемии.
Синонимами препарата являются холоксин, лизолипин, натексин,
травенон и др.
Неомицин (Neomycin)
Неомицин является комплексом аминогликозидных антибиотиков
(неомицин А, неомицин В, неомицин С), вырабатываемых актино-
мицетом Streptomyces fradiae и родственными микроорганизмами
[26, 27, 28. 29, 30].
-379-
Глава 20
К примеру неомицин В явтяется О 2 6 диамино-2,6-дидезокси-ос-В-
пюкопиранозип-A->4)-О-[О-2,6-диамино-2 б-дидезокси-P-L идопира-
нози1A—>3)-Р-В-рибофуранозит-A —»5)]-2-дезокси-В-стрептамином
B0 3 1)
CH2NH2
• /I О..
NH2
20 3 1
Неомицин обладает широким спектром ангибактериального дейст
вия Эффективен как в отношении ряда грампопожительных, так и гра-
мотрицательных микроорганизмов Однако он способен связываться
с холестерином и желчными кислотами В сочетании с другими препа-
препаратами, удаляющими желчные кислоты, или никотиновой кислотой не-
неомицин способен блокировать абсорбцию холестерина и желчных ки-
спот, что значительно понижает уровень холестерина в плазме
Синонимами препарата являются миаиин, неоспорин, эндомиксин,
кортиспорин, тописпорин и др
Список литературы
1 Ger Pat I 927 336A969)
2 Ger Pat 2 053 585A971)
3 US Pat 3 692 895A971)
4 LSPat 3 803 237A974)
5 LSPat 3 383 281A968)
6 US Pat 3 262 850A966)
7 Brit Pat 860 303A961)
-380-
Гиполипидемические средства
8 Julia M etal Bull Soc Chim Fr 1956,777
9 Ger Pat 1 925 423 A969)
10 US Pat 3 674 836A972)
11 US Pat 4 126 637A978)
12 US Pat 3 862 332A975)
13 Ger Pat 1 767 443A968)
14 US Pat 3 576 883A971)
15 Fr Pat 1 561 853A969)
16 NeuworthM et al/;J Med Chem 13,722A970)
17 Endo A I J Antibiot 32, 852 A979)
18 US Pat 4 231 938A980)
19 US Pat 3 983 140A975)
20 Ger Pat 2 524 3^5A976)
21 Brown A etal'J Chem Soc Perkm Trans I, 1976, 1165
22 US Pat 2 905 688A959)
23 US Pat 3 983 140A9^5)
24 Ger Pat 2 256 508 A972)
25 NenzA etal Hydrocarbon Process 47, A1) 139 A968)
26 US Pat 2 799 620A957)
27 US Pat 2 848365A958)
28 US Pat 3 005 815A96П
29 US Pat 3 022 228A962)
30 US Pat 3 108 996A963)
Глава 21
Диуретики
Диуретики — это препараты, увеличивающие выделение из орга-
организма избыточной воды и солей, которые аккумулируется в тканях.
с мочой. '
Избыточное количество внеклеточной жидкости в организме обра-
образуется в результате неспособности почек выводить ионы Na~ с такой
скоростью, чтобы вместе с ними выделилось достаточное количество
воды. Поэтому эффективность диуретика, в первую очередь, зависит от
ею способности выводить из организма ионы Na"\ поскольку этомч
сопутствует выведение осмотически эквивалентного количества воды
из тканевых жидкостей. Исключение составляют диуретики классифи-
классифицируемые как ингибиторы карбонангидразы.
Основное терапевтическое применение диуретиков заключается
в уменьшении общей отечности, коррекции специфического ионного
дисбаланса, уменьшении кровяного давления, уменьшении скорости
образования внутриглазной жидкости, уменьшении давления в легоч-
легочных клиньях.
Дихретики являются препаратами, широко используемыми в меди-
медицине при самых различных патологиях и, в первую очередь, для снятия
отеков, при лечении гипертензии, при сердечной недостаточности, ги-
перкальцийурии. глаукоме и некоторых формах эпилепсии, циррозе
печени, нефрозе.
Принципиальный участок действия диуретиков на выделение отеч-
отечных жидкостей из организма — это нефронные отделы почек. В основ-
основном диуретики >величивают выделение почками воды и солей, путем
подавления реабсорбции некоторых основных ионов (в основном, ионов
Na+ и СТ), однако, в определенной степени, увеличивается также и вы-
выделение ионов К+, Са2", Mg2~ и гидрокарбонат ионов.
Диуретическим эффектом обладает большое количество химически
разнородных соединений. Согласно предполагаемом}, механизм}' дейст-
действия, диуретические препараты классифицируются по 5 группам:
-382-
Диуретики
1) осмотические диуретики (маннитол, глицерин, мочевина,
изосорбид);
2) диуретики, подавляющие активность карбонангидразы (аце-
тазола.мид, метазоламид, дихлорфена.мид);
3) иазиды (хлортиазид, гидрохлортиазид. хлорталидон, индапа-
мид и др.);
4) петельные диуретики (буметанид. этакриновая кислота, фу-
росемид);
5) калийсберегаюшие диуретики (амилорид, спиронолактон,
канренон, триаметерен).
21.1. Осмотические диуретики
Осмотические диуретики являются единственной группой соедине-
соединений, действие которой не связано с взаимодействием с соответствую-
соответствующими рецепторами или прямым блокированием какого-либо почечного
транспортного механизма. Фармакологическая активность этой группы
зависит исключительно от осмотического давления, вызываемого нали-
наличием молекул препарата в растворе. Находясь во внеклеточной жидко-
жидкости, эти соединения вызывают переход внутриклеточных молекул воды
во внеклеточное пространство и препятствуют ее проникновению во
вн\трь клетки. Найдена линейная зависимость между величиной диуре-
диуретического эффекта и концентрацией осмотических диуретических пре-
препаратов.
Наряду с глицерином, мочевиной и изосорбидом, основным и глав-
главным препаратом этой группы является маннитол.
Маннитол (Mannitol)
Маннитол — Б(-)-маннит B1.1.1) получают восстановлением D(-)-
маннозы [1, 2. 3, 4].
сно
но-с-н
но-с-н
h-C-OH
н-с-он
СН2ОН
СН2ОН
но-с-н
но-с-н
н-с-он
н-с-он
СН2ОН
21 1 1
Маннитол -- наиболее употребляемый сегодня препарат из группы
осмотических диуретиков. Повышает осмотическое давление в почеч-
почечных канальцах, вызывая уменьшение реабсорбции воды в нефронах.
-383-
Глава 21
В результате выделяется большое количество свободной воды, усили-
усиливается выведение натрия, как правило без значительного выделения
ионов КГ. Маннитол используется как дополнительное средство для
предотвращения олигурии и анурии. Может быть использован и для
понижения внутриглазного давления в пре- и постоперационном перио-
периоде при офтальмологических процедурах, а также при отеках мозга.
Синонимами препарата являются осмосал, осмитрол, ренитрол и др.
21.2. Диуретики, подавляющие активность
карбонангидразы
Препараты данной группы ингибируют активность карбонангидра-
карбонангидразы — фермента, который катализирует в организме обратимую реакцию
взаимодействия воды с двуокисью углерода с образованием угольной
кислоты. Механизм действия этой группы препаратов недостаточно
ясен. Однако ингибирование активности карбонангидразы приводит
к уменьшению образования угольной кислоты и увеличению выделения
с мочой бикарбонат ионов и ионов Na+ и К7, что в итоге приводит к зна-
значительному усилению процесса выведения воды из организма.
Показаниями к применению ингибиторов карбонангидразы являют-
являются отеки при легочно-сердечной недостаточности, глаукома (открыто-
угольная, вторичная и предоперационная узкоутольная главкома), ма-
малые эпилептические припадки, предменструальное высокое давление
и острая горная болезнь. Полагают, что при глаукоме действие препара-
препаратов, возможно, связано с угнетением карбонангидразы ресничного тела
и уменьшением секреции водянистой жидкости глаза. При лечении ма-
малых форм эпилепсии действие препаратов, возможно, связано с угнете-
угнетением карбонангидразы мозга, в результате чего уменьшается выделение
спинномозговой жидкости.
Из препаратов, подавляющих активность карбонангидразы, на пра-
практике применяются ацетазоламид, метазоламид, дихлорфенамид.
Ацетазоламид (Acetazolamide)
Ацетазоламид — 5-аиетамидо-1,3,4-тиадиазол-2-еульфонамид (9.7.5)
синтезируется по схеме, приведенной в гл. 9 «Противоэпилептиче-
ские средства».
N N
CH3CONH'
975
-384-
Диуретики
Ацетазоламид является ароматическим сульфонамидом, используе-
используемым в качестве ингибитора карбонангидразы. Препарат способствует
выработке щелочной мочи с повышенной концентрацией бикарбонат,
Na* и К+ ионов. Ингибируя карбонангидразу, препарат подавляет реаб-
сорбцию ионов Na* в обмен на ионы W, усиливает выделение бикарбо-
бикарбонат и Na ионов и уменьшает выделение ионов СГ. При этом в почках
удерживаются ионы СГ для покрытия недостатка бикарбонат ионов
и сохранения ионного баланса. Электролитный состав жидкости, выде-
выделяемой почками, у пациентов, принимающих ингибиторы карбонангид-
карбонангидразы, характеризуется повышенным содержанием ионов Na* и К+ и би-
бикарбонат ионов и умеренным увеличением количества воды. Моча
становится щелочной, и концентрация бикарбонат ионов в плазме по-
понижается.
Ацетазоламид — слабый диуретик с ограниченным применением
при отеках, связанных с сердечной недостаточностью, при глаукоме,
малых эпилептических припадках, горной болезни.
Синонимами препарата являются мидамор, модамид, цетазол, диа-
мокс. диакарб и др.
Метазоламид (Methazolamide)
Метазоламид — М-D-метил-2-сульфамоил-1,3,4-тиадиазол-2-ин-5-
илиден)ацетамид B1.2.3) получают из промежуточного продукта
синтеза ацетазоламида — 2-ацетиламино-5-меркапто-1,3,4-тиадиа-
зола (9.7.3). Последний бензилируют бензилхлоридом по меркапто-
группе с получением 2-ацетиламино-5-бензилтио-1,3,4-тиадиазола
B1.2.1), Дальнейшее метилирование продукта йодистым метилом
приводит к образованию М-D-метил-2-бензилтио-1,3,4-тиадиазол-2-
ин-5-илиден)ацетамида B1.2.2). Окислением и одновременным хлори-
хлорированием последнего в водном растворе уксусной кислоты и взаи-
взаимодействием полученного при этом хлорсульфопроизводного с ам-
аммиаком получают B1.2.3) [5, 6, 7].
HjC -C-N
H3C -С—
N-N
-SH
973
21 2 2
СбН5СН2С1
Cl2 / СН3СООН / Н2О
CH3
N-l
2-NH2
21 2 3
-385-
Глава 21
Действие препарата сходно с таковым ацетазоламида, и он приме-
применяется для понижения внутриглазного давления при лечения открыто-
угольной и вторичной глаукомы, перед хирургическим вмешательством
при острой открытоугольной глаукоме.
Синонимом препарата является нептазан и др.
Дихлорфенамид (Dichlorphenamide)
Дихлорфенамид — 4,5-дихлорбензол-1,3-дисульфонамид B1.2.6)
получают довольно простым путем, исходящим из 2-хлорфенола.
2-хлорфенол подвергают сульфохлорированию хлорсульфоновой
кислотой с получением 4-гидрокси-5-хлорбензол-1,3-дисульфохло-
рида B1.2.4). Гидроксильную группу последнего замещают на атом
хлора с использованием пятихлористого фосфора с получением 4,5-
дихлорбензол-1,3-дисульфохлорида B1.2.5), взаимодействием ко-
которого с аммиаком получают искомый дихлорфенамид B1.2.6) [8].
CISO3H
Cl—SO2
PCI5
so2-ci
Cl—SO2
NH3
SO2-CI
21 2 5
21 2 4
H2N-SO2-^\ ft— С!
SO2-NH2
21 2 6
Как и описанные выше препараты, дихлорфенамид применяется для
выведения избыточной воды при повышенном внутриглазном давлении
и применяется для лечения открыгоугольной и вторичной глаукомы,
а также в случаях, когда требуется понизить внутриглазное давление
перед хирургическим вмешательством при острой открытоугольной
глаукоме.
Синонимом препарата является даранид и др.
21.3. Тиазидные диуретики
Наибольшая в количественном отношении группа диуретиков клас-
класса тиазидов структурно родственна антибактериальным препаратам
класса сульфонамидов, однако эти соединения в целом не проявляет
-386-
Диуретики
антибактериальной активности.
Препараты этой группы представляют собой производные бензо-
тиадиазина, как правило замещенные при С7 бензольного кольца
с>льфонамидной группой и атомом хлора или другой электроноакцеп-
торной группой (трифторметильной) при С6. Гидрогенизованное тиа-
диазиновое кольцо бензотиадиазиновой системы допускает введение
разнообразных заместителей в положение С3, что позволило создать
значительное число препаратов и сделать определенные корреляции
межд> структурой и активностью в этом ряду соединений. В частно-
частности установлено, что в большинстве случаев, восстановление двойной
связи при С3-С4 препаратов ряда тиазидов увеличивает их диуретиче-
диуретическую активность.
Точный механизм действия неизвестен, однако качественно тиазид-
тиазидные диуретики действуют одинаково, и их отличия в целом носят коли-
количественный характер.
Участком воздействия тиазидных диуретиков являются дисталь-
ные канальцы нефронов. Препараты этой группы ингибируют реаб-
сорбцию ионов Na и СГ, а также К* и Mg2+ и вызывают усиленное
их выведение из организма вместе с осмотически эквивалентным
количеством воды. Тиазиды эффективны и при ацидозе или алкалозе,
ингибирукп карбонангидразу in vitro и понижают АД у гипертензив-
ных пациентов. Антигипертензивный эффект тиазидов может быть
объяснен их диуретическим действием, т. е. уменьшением объема
циркулирующей крови. Не исключено также, что антигипертензив-
ное действие тиазидов происходит вследствие их спазмолитического
действия на стенки сосудов, возможно, в результате изменения со-
содержания ионов Na+ внутри мышечных волокон. Под действием тиа-
тиазидов меняется и реактивность сосудистой системы, снижаются
прессорные реакции на сосудосуживающие вещества (адреналин
и др.), Большинство побочных действий тиазидов бывает связано с ги-
потензией или с нарушениями электролитного баланса, например
г ипонатриемия, гипокалиемия или гипомагнеземия. Примерно у 1 %
пациентов, пользующихся тиазидными диуретиками, возникает кож-
кожная сыпь. Тиазиды используются для лечения гипертензии либо са-
самостоятельно, либо в сочетании с другими антигипертензивными
препаратами.
На практике наиболее часто применяются гидрохлортиазид, хлор-
тиазид. бентиазид. бендрофлуметиазид, гидрофлуметиазид, политиазид,
трихлометиазид. а также родственные тиазидам, но таковыми не яв-
являющиеся, хлорталидон, метолазон и индапамид.
-387-
Глава 21
Хлортиазид (Chlorthiazide)
Хлортиазид — 1.1-диоксид 6-хлор-2Я-1.2.4-бензотиадиазин-7-суль-
фонамида B1.3.3), как и все тиазидные диуретики, получают при-
примерно по одной и той же схеме. 3-хлоранилии (либо 3-трифторме-
тиланилин) подвергают сульфохлорированию хлорсульфоновой
кислотой с получением 4,6-сульфохлоридо-З-хлоранилина B1.3.1),
взаимодействием которого с аммиаком получают 4,6-сульфонами-
до-3-хлоранилин B1.3.2). Нагревание последнего с формамидом
приводит к пол\чению хлортиазида B1.3.3) [9, 10, 11].
2 C!SO3H
CISO2
2 NH3
21 3 1
H2NSO2
NH2 HCONH2
SO2NH2
21 3 2
21 3 3
Диуретическое действие хлортиазида. как и других препаратов это-
этого ряда, обусловлено уменьшением реабсорбции ионов Na* и С1" почка-
почками при одновременном усиленном их выведении из организма.
Препарат оказывает сильное диуретическое действие как при аци-
ацидозе, так и при алкалозе. Применяют при артериальной гипертонии, при
отечных синдромах различного генеза, застойных явлениях при сердеч-
сердечно-сосудистой недостаточности, нефрозах и нефритах, токсикозах. Осо-
Особенно рекомендуется применение препарата при гипертонической бо-
болезни. В ряде случаев препарат понижает и внутриглазное давление.
Синонимами препарата являются клотрид, диупрес, диурил и др.
Гидрохлортиазид (Hydrochlorthiazide)
Гидрохлортиазид — 1,1-диоксид 6-хлор-3.4-дигидро-2Я-1,2,4-бен-
зотиадиазин-7-сульфонамида B1.3.4) получают либо циклизацией
4,6-с\льфонамидо-3-хлоранилина B1.3.2) с использованием пара-
форма, при котором одновременно происходит восстановление
двойной связи в положении С^-С4. либо препарат получают восста-
восстановлением этой же двойной связи в хлортиазиде B1.3.3) формаль-
формальдегидом. Эго небольшое изменение в структуре повышает актив-
-388-
Диуретики
ность препарата по сравнению с хлортиазидом, улучшает его абсор-
бируемость при оральном применении [12, 13, 14. 15, 16, 17J.
ri2NSC>2 ^^ SO2NH2
21 3 2
СН2О
Гидрохлортиазид является одним из самых широко используемых
препаратов этого ряда и применяется по тем же показаниям, что и хлор-
хлортиазид. Гидрохлортиазид вызывает меньшее ингибирование карбонан-
гидраш, но вызывает в 5-10 раз больший диурез ионов Na+, чем хлор-
хлортиазид, в одной и той же дозе.
Синонимами препарата являются хлорзид, диаква, эсидрикс, гидро-
ди)рил, гидрозид, гипотиазид, новогидразид, урозид и др.
Бендрофлуметиазид (Bendroflumethiazide)
Бендрофлуметиазид — 1,1-диоксид 3-бензил-6-(трифторметил)-3,4-
дигидро-2Я-1,2,4-бензотиадиазин-7-сульфонамида B1.3.6) получа-
получают по совершенно аналогичной схеме получения вышеописанных
препаратов, используя в качестве карбонильного компонента фени-
лукс>сный альдегид или его ацеталь, а в качестве о-аминосуль-
фонамидного компонента 2,4-дисульфонамидо-5-трифторметилани-
лин B1.3.5) [18, 19,20,21].
H2NSO2
21 3 5
21 3 6
Бендрофлуметиазид может применяться по тем же показаниям, что
и вышеописанные препараты, однако в основном он показан в качестве
вспомогательного средства для снятия отеков, связанных с сердечной
недостаточностью, циррозом печени, и при отеках, вызванных приме-
применением кортикостероидов.
Синонимами препарата являются синесалин, доцидразин, тенсио-
норм, апринокс, натуретин и др.
-389-
Глава 21
Политиазид (Polythiazide)
Политиазид — 1,1-диоксид 2-метил-3-B,2,2-трифторэтилтиометил)-
6-хлоро-3,4-дигидро-2Я-1,2,4-бензогиадиазин-7-сульфонамида B1.3.8)
также получают по аналогичной схеме, конденсируя 4-аминосуль-
фонил-5-хлоро-2-метиламиносульфониланилин B1.3.7) с диметил-
ацеталем 2.2,2-трифторэтилтиоацетальдегида [22].
СН3О
СН3О
)CH-CH2-SCH2CF3
21 3 7
^-^NyCH2~SCH2CF3
N-CHj
О
02
21 3 8
Политиазид выявляет более выраженный антигипертензивный эф-
эффект, чем политиазид, и самостоятельно может применяться по тем же
показаниям, что и вышеописанные препараты. Однако его в основном
применяют в составе комбинированных лекарств, предназначенных для
понижения давления, в частности, минизида, представляющего собой
комбинацию празозина и политиазида.
Синонимами препарата являются дренусил, нефрил, ренис и др.
Число диуретиков ряда тиазидов весьма значительно и не исчерпы-
исчерпывается вышеприведенными. К широко используемым препаратам отно-
относятся гидрофлуметазид, трихлорметазид, метилциклотиазид, цикло-
тиазид, бензотиазид, диазоксид и др., методы синтеза которых и фар-
фармакологическое действие которых практически аналогичны вышепри-
вышеприведенным.
Гидрофлуметиазид (Hydroflumethiazid)
Гидрофлуметиазид— 1,1-диоксид 3,4-дигидро-6-трифторметил-2Я-
1,2,4-бензотиадиазин-7-с>льфонамида B1.3.9) [21, 23, 24, 25J.
H2NSO2
21 39
Синонимами препарата являются леодрин, диуритенс, гидренокс,
риосил, ронтил, диукардин, саллрон, салутензин и др.
-390-
Диуретики
Трих.~юрметиазид (Trichlormethiazid)
Трихлорметиазид — 1,1-диоксид 3,4-дигидро-3-(дихлорметил)-6-
\лор-2Я-1,2,4-бензотиадиазин-7-сульфонамида B1.3.10) [26. 27, 28,
29.30,31].
H2NSO2
21.3 10
Синонимами препарата являются эсмарин, эсмалорид, анатран, кар-
вакрон, интромен, санамирон, метагидрин, наква, триазид и др.
Метилциклотиазид (Methylcyclothiazid)
Метилциклотиазид — 1,1-диоксид 3,4-дигидро-3-(хлорметил)-
6-\лор-2Я-1,2.4-бензотиадиазин-7-сульфонамида B1.3.11) [23].
21 3 11
Синонимами препарата являются тиазидил, эндурон и др.
Цикютиазид (Cyclothiazid)
Циклотиазид — 1,1-диоксид 3,4-дигидро-3-E-норборнен-2-ил)-
6-хлор-2Я-1,2.4-бензотиадиазин-7-сульфонамида B1.3.12) [32, 33,
34].
21 3 12
Синонимами препарата являются диампрес, циклотериам, ангидрон
и др.
-391 -
Глава 21
Беттиазид (Benzthiazid)
Бензтиазид — 1,1-диоксид 3,4-дигидро-3-(бензилтиометил)-6-хлор-
2Я-1,2,4-бензотиадиазин-7-сульфонамида B1.3.13) [35, 36, 37].
21 3 13
Синонимами препарата являются дитериам, дитид, регулон, аква-
таг, гидрекс и др.
Диазоксид (Diazoxid)
Диазоксид— 1,1-диоксид 3-метил-7-хлор-2Я-1,2,4~бензотиадиазина
B1.3.14) [38, 39,40].
,N СНз
.. -N-H
С! ^ S
02
21 3 14
Синонимами препарата являются гипертоланум, гиперстат, эуде-
мин, проглицем и др.
Препараты, родственные
тиазидным диуретикам
Диуретические препараты — метолазон, хлорталидон и индапа-
мид— относятся к диуретикам и антигинертензивным препаратам. Хи-
Химически они не относятся к тиазидам, однако являются сульфонамид-
ными производными и имеют, в определенном смысле, структурное
сходство и сходный механизм действия, обычный для тиазидов, за ис-
исключением того, что они не ингибируют карбонангидразу. Поэтому,
чисто формально, они рассматриваются в одной группе с тиазидными
ди>ретиками,
Способность метолазона, хлорталидона и индапамида удалять из
организма отечные жидкости практически одинакова с тиазидными
диуретиками. Эти препараты применяются для снятия отеков, связан-
связанных с печеночными, почечными или сердечными заболеваниями, а так-
также для лечения общей гипертензии либо самостоятельно, либо в соче-
сочетании с другими препаратами.
-392-
Диуретики
Метолазон (Metolazone)
Метолазон — 7-хлоро-1,2,3,4-тетрагидро-2-метил-4-оксо-3-о-толил-
6-хиназолинс>льфонамид B1.3.20) получают исходя из 5-хлор-2-
мегиланилина. Аминофуппу последнего ацилируют хлоругольным
эфиром с получением 5-хлор-К-этоксикарбонил-2-метиланилина
B1.3.15). Далее продукт обычным путем, т.е. последовательным
взаимодействием с хлорс>льфоновой кислотой и аммиаком, транс-
трансформируют в 4-сульфонамидо-5-хлор-М-этоксикарбонил-2-метил-
анилин B1.3.16). Метильную фуппу последнего окисляют перман-
ганатом калия с получением 5-сульфонамидо-4-хлор-М-этокси-
карбонил анграниловой кислоты B1.3.17). Обработкой хлористым
тионилом последняя циклизуется в соответствующий ангидрид
B1.3.18). Действием о-толуидина последний превращается в 2-ами-
но-5-аминосульфонил-4-хлор-о-толуолбензамид B1.3.19). Наконец,
взаимодействием последнего с диметилацеталем уксусного ангид-
ангидрида получают метолазон B1.3.20) [41, 42, 43, 44, 45, 46, 47].
CICOOC2H5
СО i
NH-COOC2H5
соон
21 3 17
H2N-SO2
21 3 18
¦=\ Н3С -СН(ОСН3J
21 3 19
H2N-SO2
21 3 20
Метолазон действует на дистальные канальцы, увеличивая выделе-
выделение воды, ионов Na , К и СГ. Препарат показан для лечения отеков,
вызванных сердечной недостаточностью и почечными нарушениями,
включая нефротический синдром.
Синонимами препарата являются диуло, матеникс, зароксолин.
-393-
Глава 21
Хлорталидон (Chlortalidone)
Хлорталидон — 2-хлор-5-A-гидроксн-3-оксо-1-изоиндолинил)-
бензолсульфамид B1.3.26) предложено получать разными путями,
исходящими из 2'-карбокси-4-хлорбензофенона B1.3.21), который
легко получается при ацилировании хлорбензола фталевым ангид-
ангидридом в присутствии хлористого алюминия. Согласно первому спо-
способу, полученный бензофенон B1.3.21) подвергают нитрованию
азотной кислотой с получением 2'-карбокси-3-нитро-4-хлорбен-
зофенона B1.3.22). Нитрогруппу в полученном соединении восста-
восстанавливают двухлористым оловом до 2'-карбокси-3-амино-4-хлор-
бензофенона B1.3.23). Далее последовательным диазотированием и
взаимодействием с двуокисью серы в присутствии двухлористой
меди получают соответствующий сульфохлорид B1.3.24). Под дей-
действием хлористого тионила последний циклизуется во фталид
B1.3.25), который под действием водного аммиака перегруппиро-
перегруппировывается в производное изоиндолина с одновременным замещени-
замещением атома хлора в судьфогруппе на аминогруппу, в результате чего
получается хлорталидон B1.3.26) [48, 49].
А1С13
HNO3
213 21
SnCl2
1 HNO2
¦ СООН
SO2-CI SOCL2
Второй способ синтеза также исходит из 21-карбокси-4-
члорбензофенона B1.3.21), который при восстановлении цинком в ук-
уксусной кислоте трансформируется в 3-D'-хлорфенил)фталид B1.3.27).
Сульфохлорированием последнего получают соответствующий сульфо-
-394-
Диуретики
21 3 25
Третий способ синтеза, исходящий также из 2'-карбокси-4-хлор-
бензофенона B1.3.21), заключается в непосредственной циклизации
)казанного карбоксибензофенона в 3-D'-хлорфенил)фталимидин B1.3.29).
Последовательным сульфохлорированием и аминированием последнего
получают 2-хлор-5-C-оксо-1-изоиндолинил)-бензолсульфамид B1.3.29),
который различными окислителями, такими как кислород либо пере-
перекись водорода в щелочи, или хромовая кислота, в уксусной кислоте
окисляют в хлорталидон B1.3.26) [51, 52].
CISO3H
2 NH3
21 1 30
SO2-NH2
NaOH / Ог or
Н2СЮ4 / СН3СООН or
NaOH / H2O2
-395-
Глава 21
По активности хлорталидон весьма близок к бензотиадиазиду
B1.3.13) и показан в качестве самостоятельного препарата или в комби-
комбинации с другими антпгипертензивными средствами для понижения АД,
а также в качестве вспомогательного средства для лечения отеков, вы-
вызванных сердечной недостаточностью и почечными нарушениями,
включая нефротический синдром.
Синонимами препарата являются гигротон, новаталидон, уридон
и др.
Индапанид (Indapamide)
Индапамид — 4-хлоро-М-B-метил-1-индолинил)-3-сульфамоил-
бензамид B1.3 33) синтезируют исходя из 2-метилиндолина, нитро-
зированием которого получают 2-метил-1-нитрозоиндрлин B1.3.31).
Восстановление последнего алюмогидридом лития приводит к по-
получению 1-амино-2-метилиндолина B1.3.32). Ацилирование по-
последнего хлорангидридом З-сульфонил-амино-4-хлорбензойной ки-
кислоты приводит к B1 3.33) [53, 54].
сн3 'so2nh2
21 3 33
Индапамид является производным бензолсульфонамидов, и его ме-
механизм действия аналогичен таковому тиазидов. Препарат предназначен
для понижения АД, а также в качестве вспомогательного средства для
лечения отеков, вызванных сердечной недостаточностью.
Синонимом препарата является лозол и др.
21.4. Петельные диуретики
Наиболее мощный диуретический эффект оказывают петельные
диуретики, которые резко ингибируют реабсорбцию ионов Na~ и СГ из
почечных канальцев в корковых и мозговых частях и восходящего уча-
-396-
Диуретики
стка петли нефрона. Как при оральном, так и при внутривенном введе-
введении они вызывают быстрое увеличение выделения из почек ионов Nah
и СГ и увеличение объема выделяемой мочи.
Одновременно с увеличением выделением с мочой ионов Na* и СГ
наблюдается увеличение выделения ионов К, ?Г, Mg2' и Са2+. Кислот-
Кислотность мочи при этом повышается, концентрация ионов аммония падает.
При этом может возникнуть гипохлоремический алкалоз. Наиболее ши-
широко применяемыми петельными диуретиками являются буметанид
(производное моносульфамоил метаниламида), этакриновая кислота
(производное арилоксиуксусной кислоты) и фуросемид (производное
моносульфамоилантраниловой кислоты), которые имеют большую диу-
диуретическую эффективность, чем тиазиды. Буметанид, этакриновая ки-
кислота и фуросемид используются при лечении отеков, связанных с ост-
острой и хронической сердечной недостаточностью, цирроза печени,
нефротическом синдроме и почечных заболеваниях. Они часто приме-
применяются у пациентов, не переносящих тиазиды. Их используют также
при лечении хронической гипертензии как самостоятельно, так и в со-
сочетании с другими антигипертензивными препаратами. Эффективность
и безопасность буметанида и этакриновой кислоты при хронической
[ипертензни не доказана. Петельные диурегики эффективны при лече-
лечении острой гиперкалиемии.
Буметанид (Bumetanide)
Буметанид — 3-бутиламино-4-фенокси-5-сульфамоилбензойную
кислоту B1.4.6) синтезируют исходя из 4-хлорбензойной кислоты.
На первой стадии синтеза ее подвергают сульфохлорированию
хлорсульфоновой кислотой с получением 4-хлор-З-хлорсульфо-
нилбензойной кислоты B1.4.1), которая далее нитруется азотной
кислотой в 4-хлор-3-хлорсульфонил-5-нитробензойную кислоту
B1.4.2). Взаимодействием последней с аммиаком получают 5-ами-
носульфонил-4-хлор-З-нитробензойную кислоту B1.4.3), которая
взаимодействием с фенолятом натрия трансформируется в 5-ами-
носульфонил-З-нитро-5-феноксибензойную кислоту B1.4.4). Вос-
Восстановление нитрогруппы в последней водородом с использовани-
использованием в качестве катализатора палладия на угле получают 3-амино-
5-аминосульфонил-5-феноксибензойную кислоту B1.4.5). Нако-
Наконец взаимодействием последней с бутиловым спиртом в присутст-
присутствии серной кислоты получают искомый буметаннд B1.4.6) [55, 56,
57, 58, 59].
-397-
Глава 21
•соон
H9N
C4H9NH
21 4 5
21 4 6
Буметанид применяют для снятия отеков, связанных с сердечной
недостаточностью, при болезнях печени и почек, включая нефротиче-
ский синдром, при асцитах, гипертензии.
Синонимом препарата является бумекс и др.
Этакриновая кислота (Ethacrynic acid)
Этакриновая кислота — [2,3-дихлоро-4-B-метиленбутирил)фено-
кси]уксусн\ю кислоту B1,4.9) получают исходя из 2,3-дихлор-
феноксиуксусной кислоты. Последнюю ацилируют хлорангидридом
масляной кислоты с получением 4-бутироил-2,3-Дихлорфенокси-
у кеч спой кислоты B1.4.7), которую далее аминометилируют в ус-
условиях реакции Манниха с использованием диметиламина и фор-
формальдегида. Полученный продукт B1.4.8) далее подвергается тер-
термическому расщеплению с образованием ненасыщенного кетона —
зтакриновой кислоты B1.4.9) [60, 61, 62].
2И5-СН;
1
C;h5-
0
-с-с
rl О
С-С-<
СН?
р—л
"У
-О-СН;-СООН
1
Э-СН2 оииг
А1СЬ
> C/Ie-C
t°
Cl Cl
О
и
с2н5-с-с
II
СНг
о-сн2
21 '
-4.
-COOI
G
//
CI
CH2O.iCri3JNH
-i ~~ ^
•о-сн2-соон
21 4 9
с2 )
I С! С] 2148
Эгакриновая кислота является сильным диуретиком, который на-
назначают при отеках, связанных с сердечной недостаточностью, при оте-
-398-
Диуретики
ках почечного происхождения, не поддающихся действию других диу-
диуретиков, при отеках мозга и легких.
Синонимами препарата являются урегит, эдекрин и др.
фуросемид (Furosemide)
Фуросе.мид — 4-хлоро-1ЧГ-фурфурило-сульфамоилантраниловая ки-
кислота B1.4.11) получается довольно-таки простым синтезом, исхо-
исходящим из 2,4-ди.хлорбензойной кислоты, которую последователь-
последовательным взаимодействием с хлорсульфоновой кислотой и аммиаком
переводят в 5-аминосульфонил-4,6-дихлорбензойную кислоту B1.4.10).
Взаимодействие последней с фурфуриламином приводит к фуросе-
миду B1.4.11) [63,64 65,66].
2 мНз ri2N-S°?4.<^COOri
cr-sAc,
21 4 10
21411
Фуросемид — высокоэффективный и быстродействующий диуре-
диуретик, действие которого, как и всех рассмотренных петельных диурети-
диуретиков, связано с блокадой реабсорбции ионов в восходящем колене петли
нефрона. Препарат применяют при отечном синдроме различного гене-
за. при отеках легких, мозга, хронической почечной недостаточности,
некоторых формах гипертонического криза, при отравлениях барбиту-
барбитуратами и другими соединениями, выделяющимися преимущественно
с мочой.
В ряде случаев фуросемид оказывается более эффективным, чем
др) гие диуретики. Кроме диуретического эффекта он также расширяет
периферические сосуды. Часто назначается в комбинации с другими
аи гигипертензивными препаратами.
Синонимами препарата являются лазикс, лазизикс. франил, уросе-
мид и многие другие.
21.5. Калийсберегающие диуретики
Калийсберегающие диуретики отличаются от других диуретиков
тем, что увеличивают выведение из организма ионов Na+ и одновремен-
одновременно \мень01ают выведение ионов К*. В общем, при использовании в ка-
качестве самостоятельных средств, препараты этого класса не являются
мощными диуретиками, и специально их применяют лишь в случаях
гиперкалиемии. В основном их используют в комбинации с другими
диуретиками с целью увеличения диуреза и предупреждения развития
-399-
Глава 21
гипокалиемии. Ввиду совершенно различного строения и наличия спе-
специфических особенностей свойства препаратов этого ряда (спиронолак-
(спиронолактон. гриамтрен и амилорид) б>дут рассмотрены по отдельности.
Спиронолактон (Spironolactone)
Спиронолактон — 7-ацетат у-лактона 17-гидроксп-7-меркато-3-
оксо-17-а-прегн-4-ен-21-карбоновой кислоты B1.5.8). Спиронолак-
Спиронолактон в промышленности получают дв>мя путями, исходящими из
андростенолона — ЗР-гидрокси-5-андростен-П-она. Согласно пер-
первому способу, андростенолон подвергают этинилированию ацети-
ацетиленом по Норману с использованием амида натрия в жидком ам-
аммиаке с получением 17а-этинил-Зр'-,17р'-дигидрокси-5-андростена
B1.5.1). Последовательным взаимодействием последнего с метил-
магнийбромидом и двуокисью углерода получают соответствую-
соответствующую пропиоловую кислоту B1.5.2). Восстановлением тройной свя-
связи в последней водо'родом с использованием в качестве катали-
катализатора палладия на карбонате кальция получают соответствующее
производное акриловой кислоты B1.5.3), которую без выделения
обрабатывают кислотой, что приводит к циклизации в производное
непредельного лактона B1.5.4). Двойную связь в последнем восста-
восстанавливают водородом с использованием в данном случае в качестве
катализатора палладия на угле. Полученный при этом предельный
лактон B1.5.5) подвергают окислению по Оппенауеру, в непредель-
непредельное кетопроизводное — 4-андростен-3,17-дион B1.5.6). В результа-
результате дальнейшего окисления продукта B1.5.6) хлоранилом получают
диенон B1.5.7), присоединением тиоуксусной кислоты к которому
получают искомый спиронолактон B1.5.8) [67, 68, 69, 70, 71].
¦С=С-СООп
CH=CH-COOrt
[HI
-400-
Диуретики
Второй способ синтеза исходит из 4-андростен-3,17-диона B1.5.6),
который подвергают этинилированию пропаргиловым спиртом в при-
присутствии трет-бутшата калия с получением 17р-гидрокси-17а-C-гид-
роксипропинил)-4-андростен-3-он B1.5.9), тройную связь в котором
полностью восстанавливают водородом с использованием в качестве
катализатора комплекса трифенилфосфина с хлористым родием с полу-
получением 17р-гидрокси-17а-C-гидроксипропил)-4-андростен-3-она B1.5.10).
Окислением последнего оксидом шестивалентного хрома в пиридине
полхчают лактон B1.5.6), который аналогично описанному выше окис-
окисляют хлоранилом в B1.5.9) и далее вводят во взаимодействие с тиоук-
тиоуксусной кислотой с получением искомого спиронолактона B1.5.8) [72].
Н-С=С-СНгОН / (СН)зСОК
С=С-СН2ОН
[Н]
21 5 9
21 5 10
: rtf?
*^-4c0CH3
215 6
Спиронолактон является калийсберегающим диуретиком, отли-
отличающимся по механизму действия от других препаратов этого клас-
класса.
Препарат является конкурентным антагонистом альдостерона и его
действие наиболее эффективно, когда уровень циркулирующего в орга-
организме альдостерона высок.
-401 -
Глава 21
?н сосн2он
альдостерон
Альдостерон является минералокортикостероидом, участвующим
в регуляции электролитного баланса в организме. Альдостерон умень-
уменьшает выведение из организма ионов Na+, увеличивая их реабсорбцию,
и увеличивает секрецию ионов Кт в почечных канальцах. Являясь кон-
конкурентным антагонистом альдостерона, стгронолактон, блокирует ре-
рецепторы альдостерона и тем самым повышает выведение с мочой ионов
Na+, СГ и соответствующего эквивалентного количества воды, сохраняя
при этом количество ионов К* в организме.
Спиронолактон используется как индивидуально, так и в сочета-
сочетании с тиазидамн, поскольку уменьшает калийурез, вызванный тиази-
довыми диуретиками. Препарат применяется при отечном синдроме,
вызванном хронической сердечной недостаточностью, циррозе пече-
печени, гиперальдостеронизме, гипокалиемии, вызванной другими диуре-
диуретиками.
Синонимами препарата являются альдактон, верошпирон и др.
Триамтерен (Triamterene)
Триамтерен — 2,4,7-триамино-6-фенилптеридин B1.5.13) получают
по следующей схеме. Взаимодействием гуанидина с динитрилом
малоновой кислоты получают 2,4,6-триаминопиримидин B1.5.11).
Последний подвергают нитрозированию взаимодействием с азоти-
азотистой кислотой, в результате чего получают 5-нитрозо-2,4,6-триами-
нопиримидин B1.5.12), который конденсацией с бензилцианидом
в присутствии метилата натрия пиклиз>ется в триамтерен B1.5.13)
[73, 74, 75, 76].
NH
X
H2N NH2
CH3ONa
H2N
T
HNO2
H2N
ON
„NH2
NH2
21 511
NH2
21 5 12
-402-
Диуретики
C=N
2 CH3ONa
21 5 13
Триамтерен является производным пиразина, ингибирующим реаб-
реабсорбцию ионов Nar без увеличения выделения ионов К". Препарат про-
проявляет примерно такой же результирующий эффект, как и спиронолак-
спиронолактон, однако действ) ет не по механизму конкурентного связывания
с альдостероновыми рецепторами. Его действие не связано с влиянием
на секрецию альдостерона или антагонизма к нему, а является результа-
результатом прямого воздействия на почечные канальцы.
Этот калийсберегающий диуретик вызывает умеренное увеличение
выделения ионов Na~ и бикарбонат ионов в мочу и понижает выделение
ионов К+ и аммония. Мало влияет на объем мочи.
Препарат рекомендуется в сочетании с другими диуретиками для
лечения отеков, вызываемых обычными причинами обусловленных не-
доааточностыо кровообращения, циррозом печени, нефротическим
синдромом.
Синонимами препарата являются диазид, ревитен, птерофен и др.
Амилорид (Amyloride)
Амилорид — 1Ч~амидино-3,5-диамино-6-хлорпиразинкарбоксамид
B1.5.18) синтезируют исходя из 5,6-диаминоурацила, который
взаимодействием с глиоксалем трансформируют в производное пи-
разинопиримидина B1.5.14), и далее действием сильной щелочи
расщепляют с получением З-аминопиразин-2-карбоновой кислоты
B1.5.15). Последнюю этерифицируют в соответствующий метило-
метиловый эфир B1.5.16) и далее последовательно обрабатывают хлори-
хлористым сульфурилом и аммиаком с получением метилового эфира 3,5-
диамино-6-хлорпиразин-2-карбоновой кислоты B1.5.17). Взаимо-
Взаимодействие последней с гуанидином приводит к амилориду B0.5.18)
[77.78. 79,80,81,82].
¦НС
yHO
CHO
О
ОН
NaOh
COOH
21 5 14 ОН
21 5 15
-403-
Глава 21
Диуретики
.N.-COOCH-j
т
'N NH2
SO2CI2
2 NH3
21 5 16
H2N N NH2
21 5 17
NH
Л
21 5 18
Амиторид также является калийсберегающим диуретиком, прояв-
проявляющим умеренную активность Не является антагонистом альдостеро-
на Он ингибир>ет реабсорбцию ионов Na+ и уменьшает выведение ио-
ионов К* Амилорид редко используется индивидуально, а как правило,
в сочетании с тиазичами или петельными диуретиками Испопьзуется,
в основном, в сочетании с тиазидными диуретиками при сердечной не-
недостаточности и гипертензии, особенно в тех сл\чая\, когда необходи-
необходимо предотвращение гипокалиемии
Синонимами препарата являются арумил, диурсан, модамид, фр>-
мит и др
Список литературы
1 US Pat 2.642 462A953)
2 US Pat 2 749 371 A956)
3 US Pat 2 759 024A95)
4 Makkee M et al / Chem Commun 1980, 930
5 Young J etal'J Am Chem Soc 78,4649A956)
6 US Pat 2 783 241A957)
I Pala M ' Farmaco Ed Sci Ц, 650A958)
8 US Pat 2 835 702A958)
9 US Pat 2 809 194 A957)
10 US Pat 2 937 169A960)
II No\elloEH Am Chem Soc 79,2028A957)
12 USPat 3 163 645A964)
13 USPat 3 164 588A965)
14 USPat 3 025 292A962)
15 I SPat 3 043 840A962)
16 Ste\ ens de G et al E\penentid H, 463 A958)
17 Ger Pat 1 163 332 A964)
18 USPat 3 265 573A966)
19 USPat 3 392 168A968)
20 Brit Pat 863 474A961)
21 Holdrege С et al / J Am Chem Soc 81, 4807 A959)
22 USPat 3 009 911 A961)
23 Close W et al / J Am Chem Soc 82, 1132 A960)
)ateR etal'/J Am Chem Soc 82,2042A960)
Novello E et al / J Org Chem 25, 970 A960)
26 Brit Pat 949 373A960)
27 Ger Pat 1 147 233A960)
28 Stevens de G et al '/Expenentta 16, 113 A960)
29 Sherlock M et al / 'Expenenria 16, 184A960)
30 Brit Pat 954 023A960)
31 USPat 3 264 292A960)
42 LSPat 3 275 625A966)
33 Brit Pat 915 236A961)
34 Whitehead С et al Щ Org Chem 26, 2814 A961)
USPat 3 111 517A963)
USPat 3 440 244A969)
Ger Pat 1 137 740A962)
38 USPat 3 345 365A967)
39 USPat 2 986 573A961)
Raffa \ etal Farmaco Ed Sci 17,244A962)
USPat 3 360 518A967)
USPat 3 357 111 A971)
USPat 3 761 480A972)
Ger Pat 1 620 740A966)
Ger Pat 2 131 622A971)
46 Ger Pat 2 035 657 A970)
47 Shelly В etal '/J Med Chem 13, 886A970)
48 USPat 3 055 904A962)
49 Graf IV etal//Helv Chim Acta 42, 1085A959)
50 USPat 4 188 330A980)
51 Eur Pat Appl 51 215A981)
52 Eur Pat Appl 51 217A981)
53 USPat 3 565 911 A971)
54 Fr Pat 2 003 311 A969)
55 Ger Pat 1 964 503A970)
Ger Pat 1 964 504A970)
USPat 3 806 534A974)
USPat 3 634 583A972)
FeitP etal /J Med Chem. J4, 432 A971)
USPat 3 255 241 A966)
Belg Pat 612 755A962)
24
25
35
36
37
40
41
42
43
44
45
56
57
58
59
60
61
-404-
-405-
Глава 21
62 Schultz E et al. 'J. Med. Pharm. Chem. 5, 660 A962).
63. US Pat. 3.058.882A962).
64. Ger. Pat. 1.122.541 A962).
65. Ger. Pat. 1.213.846A970).
66. Sturm K. et al.-Chem. Ber. 99, 328 A966).
67 US Pat. 3.013.012A961).
68. Ger. Pat. 1.121.610A959).
69 US Pat. 3.137.690A964).
Cella J. et al.//J. Org. Chem. 24- П09 A959).
Dodson R et al./'J. Am. Chem. Soc. 81, 1224 A959).
Ger. Pat. 2.327.448A973).
US Pat. 3.081.230A963).
Spickett R. et ab'/J. Chem. Soc. 1954, 2887.
... Pachter 1 Hi. Org. Chem. 28, 1191 A963).
76. OsdeneM et al.'/J. Med. Chem. ]0, 431 A967).
77. US Pat. 3.313.813A967).
78. Belg. Pat. 639.386A963).
79. Brit. Pat. 1.066.855A963).
80. BickingJ et al.,/J. Med. Chem. 8, 638 A965).
81. Cragoe E et al.,' J. Med. Chem. K), 66 A967).
82. Smith R. et al. 'J. Am. Chem. Soc. 101, 191 A979).
70.
71.
72.
73.
74.
75.
Глава 22
Антигипертензивные
препараты
Препараты, применяемые для лечения гипертонической болезни,
а также симптоматических гипертоний, называются ангигипертензив-
ными препаратами.
Гипертензия — синдром, характеризуемый повышенным АД, ко-
которое зависит от множества факторов. В число основных факторов,
определяющих уровень АД, входят параметры работы сердца и сосу-
сосудов, а также объем, вязкость и электролитный состав циркулирующей
крови.
Нормальная величина давления варьирует в зависимости от пола
и возраста. Более того, различные медицинские школы по-разному оп-
определяют само значение этой величины. Этиология 90-95 % случаев
этого заболевания неизвестна, и эти случаи называют первичной или
эссенциальной гипертензией, а их лечение носит паллиативный харак-
характер и направлено на снижение систолического или диастолического
давления и, в общем, достаточно эффективно позволяет контролировать
АД пациента в течение длительного времени. При этом действие анти-
гинертензивных веществ может быть направлено на различные звенья
физиологической системы, регулирующей АД.
Остальные 5-10 % случаев гипертензии возникают по причине сте-
стеноза почечных артерий или сужения аорты, синдрома Кушинга и фео-
хромоцитомы. Гипертензия, возникшая вследствие указанных причин,
называется вторичной гипертензией.
Основными участками, контролирующими АД организма, являются
ЦНС, симпатические ганглии, адренергические нервные окончания,
|Ладкая мускулатура сосудов, почки и артериолы и. наконец, ренин-
ангиотензиновая система.
С целью снижения АД можно воздействовать на гладкую мускула-
т>ру сосудов гидралазином, диазоксидом, миноксидилом, нитропрусси-
дом натрия, диуретиками, блокаторами кальциевых канатов, которые
расслабляют гладкую мускулатуру сосудов и тем самым понижают
и систолическое, и диастолическое давление.
-407-
Глава 22
Па автономные ганглии с целью снижения давления можно воздей-
воздействовать н-\олиноблокаторами (ганглиоблокаторами), мекамиламином
и триметафаном.
С целью снижения АД путем воздействия на адренергическую сис-
систему можно:
— стимулировать а-адренорецепторы (клонидин, гуанабенз, гу-
анфацин, метилдопа), что приведет к уменьшению симпати-
симпатической импульсации к сосудам и сердцу и в итоге уменьшит
сердечный выброс и скорость сердца, а следовательно, сни-
снизит АД;
— блокировать агадренорецепторы (празозин, тетразозин),
наиболее существенным эффектом чего явится расширение
периферических сосудов, что приведет к снижению давле-
давления;
— блокировать Р-адренорецепторы (пропранолол, атенолол, на-
долол и др.), что уменьшит сердечный выброс и перифериче-
периферическое сопротивление сосудов, результатом чего также станет
понижение давления.
С той же целью снижения давления можно воздействовать на
ренин-ангиотензиновую систему ингибиторами ангиотензин-превра-
щающего фермента (АПФ) — каптоприл, эналаприл. Эти препараты
блокирует работу АПФ, результатом чего подавляется образование ан-
гиотензина II и устраняется его сосудосуживающее действие на артери-
артериальные и венозные сосуды. На почки и артериолы с целью снижения
давления можно воздействовать диуретиками. Наконец, с целью сниже-
снижения давления можно воздействовать на гладкую мускулатуру сосудов
блокаторами кальциевых каналов (верапамил, дилтиазем, нифедипин).
Основываясь на механизме действия, антигипертензивные препара-
препараты могут быть разделены на 8 классов:
• диуретики.
• C-адреноблокаторы.
• центрально действующие симпатолитики,
периферически действующие симпатолитики,
блокаторы кальциевых каналов,
миотропные гипотензивные препараты,
ингибиторы АПФ,
активаторы калиевых каналов.
-408-
Антигипертензивные препараты
В зависимости от остроты гипертензии, к лечению антигипертен-
зивными препаратами стратегически приступают в определенном по-
порядке. Разумеется, этот порядок должен быть гибок и должен обеспечи-
обеспечивать альтернативные подходы, но обязательно следует придерживаться
некоторых общих принципов.
В качестве первого шага при слабой гипертензии попытку сниже-
снижения давления начинают с приема диуретиков или C-адреноблокаторов,
или малых доз ингибиторов АПФ. При гипертензии от слабой до уме-
умеренной для лечения рекомендуется использовать Р-адреноблокаторы
или ингибиторы АПФ, или клонидин, гуанабенз, гуанфацин, или метил-
метилдопа, или празозин, тетразозин, или блокаторы кальциевых каналов, или
резерпин. При гипертензии от умеренной до сильной рекомендуется
использовать гидралазин и большие дозы ингибиторов ангиотензин
конвертирующего фермента. При сильной гипертензии используют гуа-
нетидин или гуанадрел, а также миноксидил. Наконец, в неотложных
случаях гипертензии рекомендуется использовать нитропруссид натрия,
диазоксид, триметафан или лабеталол.
Общепринятым принципом антигипертензивной терапии является
одновременное использование нескольких препаратов, воздействующих
на основные участки, контролирующие АД, и в основном предполагает
использование сочетания диуретиков, адреноблокаторов, ингибиторов
АПФ или блокаторов кальциевых каналов.
22.1. Диуретики
Терапия гипертензии предполагает широкое использование диуре-
диуретиков, включая тиазидные диуретики, родственные им метолазон
B1.3.20) и индапамид B1.3.26), петельный диуретик фуросемид
B1.4.11), а также калийсберегаюшие диуретики — спиронолактон
B1.5.8), триаметрен B1.5.13), амилорид B1.5.18).
Молекулярный механизм действия диуретиков в качестве антигипер-
тензивных средств недостаточно ясен, однако применение диуретиков
вызывает значительное увеличение количества воды и электролитов, вы-
выделяемых с мочой, что приводит к уменьшению объема внеклеточной
жидкости и плазмы. А это, в свою очередь, приводит к снижению сердеч-
сердечного выброса, основного параметра, ответственного за снижение АД
и венозного возврата крови. Постепенно сердечный выброс восстанавли-
восстанавливается, но гипотензивный эффект сохраняется, возможно, из-за уменьше-
уменьшения периферического сопротивления сосудов. Не исключено также, что
диуретики каким-то образом снижают сосудистую активность норадре-
налина или других факторов давления в организме.
-409-
Глава 22
Методы синтеза тиазидных диуретиков, применяемых при гипер-
тензии описаны в предыдущей главе.
Тиазидные диуретики
Наиболее широко применяются хлортиазид B1.3.3), гидрохлортиа-
зид B1.3.4), бендрофлуметиазид B1.3.6), политиазид B1.3.8), гидро-
флутиазид B1.3.9), трихлорметазид B1.3.10), метилциклотиазид
B1.3.11). циклотиазид B1.3.12), бензтиазид B1.3.13).
H2NSO2
ri2NSO2
^Ы^СНг-ЭСНгСРз
^N-CH3
Препараты, родственные тиазидам
К этим препаратам относятся метолазон B1.3.20), хяорталидон
B1.3.26), индапамид B1.3.33), а также петельные диуретики буметанид
B1.4.6), этакриновая кислота B1.4.9), фуросемид B1.4.11).
C2h5-C-C—4 Л— 0-СЧ2-СООН
сн2 )—(
Cl CI
21 4 9
-410-
Антигипертензивные првпяп^
Калийсберегающие диуретики
21.58
21.5 13
Р NH
- К
NH >J
21.5 18
Эффекты этих препаратов практически одинаковы. Эту группу пре-
препаратов характеризуют 3 основных побочных эффекта: 1) гиперурице-
мия, 2) гиперглицемия и 3) нарушение электролитного баланса, харак-
характеризуемого гипер калием ией, гипохлоремией и метаболическим
алкалозом.
Фуросемид является более эффективным, однако не самым мощным
антигипертензивным препаратом по сравнению с тиазидами.
22.2. $-адреноблокаторы
Наиболее часто используемыми антиадренергическими препарата-
препаратами при терапии гипертензии являются C-адреноблокаторы. Несмотря на
многолетнее их использование, механизм их действия понят не полно-
полностью. Однозначно ясно лишь то, что они являются конкурентными ан-
антагонистами адреналина и норадреншшна на сердечных Р-адреноре-
цепторах.
Полагают, что так же, как и в случае диуретиков, использование
Р-адреноблокаторов приводит к понижению сердечного выброса. Сни-
Снижается скорость работы сердца и общее периферическое сопротивление
сос\дов.
Так же как и в случае диуретиков, сердечный выброс постепенно
восстанавливается, но гипотензивный эффект сохраняется. Наибольшая
способность понижать давление выявлена у уникального |3-адрено-
блокагора — лабеталола, который сочетает в себе неизбирательное C-адре-
ноблокирующее действие как на Рг, так и на р2-реиепторы с одновре-
одновременной блокадой а |-рецепторов.
В отличие от других адреноблокаторов, лабеталол понижает кро-
кровяное давление больше путем снижения сопротивления перифериче-
периферических сосудов, чем путем подавления функции миокарда. При этом на-
-411 -
Глава 22
ряду со снижением давления практически не изменяется скорость
сердца.
В настоящее время для терапии гипертензии применяются 8 наибо-
наиболее широко используемых в медицине (З-адреноблокаюров, синтез ко-
которых был описан в гл. 12 «Адреноблокирующие препараты», — про-
пранолол A2.1.3), метопролол A2.1.5), ацебутол A2.1.6 ), атенолол
A2.1.7), надолол A2.1.8), пиндолол A2.1.9), тимолол A2.1.10) и лабета-
лол A2.1.12).
снз
О-СИг-СИ-СН2 — NH-CH
ОН 'Ch3
СН3О-СН2-СН2—<\ /Г
-O-CH2-CH-CHj— Nh-CH
СН3СО
СН3
О-СН2-СН-СН2—NH-CH
ОН СНз
121 6
NH-CO-C3H7
СНз
о-сн2-сн-сн2—nh-ch
ОН СН3
-СН-СН2 -Nh -С(СН3K
12 1 i
СН3
о-сн2-сн-сн2— nh-ch
ОН СН3
12 1 9
Ч^-М\ /О-СН2-СН-СН2-МН-С(Сиз)з
N-s'N
НО—^ Л— СН— C42-N— CH-Ch2-CH2—\\
Наиболее часто побочными эффектами при применении C-адре-
ноблокаторов являются чувство усталости, похолодание конечностей,
а также повышение уровня триглицеридов и липопротеидов в крови.
-412-
22.3. Центрально действующие адренергические пре-
препараты (симпатолитики)
Стимуляция а-адренергических рецепторов в определенных участ-
участках ЦНС приводит к гипотензии.
Механизм действия препаратов обусловлен стимуляцией а2-адре-
норецепторов тормозных структур головного мозга. Полагают, что
взаимодействие этих препаратов с а2-адренорецепторами выражается
в угнетении нейронов вазомоторного центра продолговатого мозга
и снижении активности гипоталамуса, что приводит к уменьшению
симпатической импульсации к сосудам и сердцу. В итоге умеренно
\меньшаются сердечный выброс и скорость сердца, и, следовательно,
понижается АД.
Малочисленные клинически полезные антигипертензивные препа-
препараты этого ряда, такие как клонидин, гуанабенз и гуанфацин, очевидно,
действуют одинаково путем воздействия на аг-адренорецепторы.
Метилдопа, рассматриваемая в ряду с перечисленными выше пре-
препаратами, в организме трансформируется в а-метилнорадреналин, ко-
который, стимулируя <х2-адренорецепторы, тормозит симпатическую им-
пульсацию, вызывая понижение АД.
Клонидин (Clonidine)
Синтез препарата A1.1.34) описан в гл. 11 «Адренергические (сим-
патомиметические) препараты».
Клонидин селективный а2-адренергический агонист, который ока-
оказывает выраженное гипотензивное действие, связанное со снижением
общего периферического сосудистого сопротивления, урежением часто-
частоты сердечных сокращений, уменьшением сердечного выброса. В ком-
комбинации с оральными диуретиками клонидин является препаратом вы-
выбора при лечении разных степеней гипертензии
Клонидин применяют при различных формах гипертонической бо-
болезни и для купирования гипертонических кризов. Используют также
в офтальмологической практике при открытоугольной глаукоме.
Синонимами клонидина являются гемитон, катапресан, клофелин.
-414 .
Глава 22
Гуанабенз (Guanabenz)
Гуанабенз — [B,6-дихлорбензилиден)амино]гуанидин B2 3.1) син-
синтезируют в очну стадию взаимодействием 2,6-дихлорбензальдегида
с аминогуанидином [1, 2, 3]
сно
NH
H2N-NH-C-NH2
NH
CH=NH—NH-C-NH2
22 3 1
Гуанабенз а2-адренергический агонист, оказывающий выраженное
гипотензивное действие, связанное со снижением общего перифериче-
периферического сосудистого сопротивления, урежением частоты сердечных со-
сокращений, уменьшением сердечного выброса.
Применяется как самостоятельно, так и в комбинации с оральными
диуретиками при лечении разных степеней гипертензии.
Синонимом препарата является витенсин.
Гуанфацин (Guanfacin)
Г)анфацин — Кт-амидино-2-B,6-дихлорфенил)ацетамид B2.3.2)
также получают весьма простым синтезом — взаимодействием хло-
рангидрида или эфира, 2,6-дихлорфенилуксусной кис-лоты с гуани-
дином [4, 5, 6, 7].
СН2СОС!
NH
и
H2N—C-NH2
NH
и
CH2CO-NH—C-NH2
22 3 2
Г\анфацин действует по тому же механизму, что и клонидин и гуа-
гуанабенз. и применяется по тем же показаниям
Синонимом препарата является эстулик.
Метилдопа (Methyldopa)
Метилдопа — (-)-3-C,4-дигидроксифенил)-2-метилаланин B2.2.5)
предложено получать несколькими методами, отличающимися
лишь небольшими деталями. Один из них исходит из 3,4-димето-
кснфенилацетона. который вводят в реакцию Штреккера—Зелин-
Штреккера—Зелинского с использованием цианида калия и карбоната аммония с по-
-414-
Антигипертензивные
сифеНапIМеТИС/;;;/зТпИСИ ^ В (±>3~
гают ацетилированию по аминогоуппе }' П°СЛедний "одвер-
разделяют с использованиемТ)Z'* рацемиче™уТО смесь
изомер гидролюуют бромистоволоп!еНТ™ламина- Выделенный
иым >Даленисм и мето^ГГаметип, КИСЛ°Т°Й С °Дноврсмсн-
комого (-)-3-C,4-дИГидРок;ифенТГОИ ФУППЬ1 С пол>'чением „С-
CH C-
CH3O
22 3 3
22 3 5
Метилдопа представляет собой а-метилированное производное ле-
водопы, оказывает гипотензивное действие вследствие снижения обще-
общего периферического сосудистого сопротивления и уменьшения работы
сердца. Антигипертензивное действие метилдопы предполагает био-
биотрансформацию метилдопы в метилнорадреналин (метилнорэпинеф-
рин), который действует в качестве «фальшивого нейротрансмиттера».
В настоящее время общепринята точка зрения, согласно которой дейст-
действие метилдопы осуществляется посредством ЦНС. где метилнорэпи-
нефрин. являясь мощным стимулятором а-адренорецепгоров продолго-
продолговатого мозга, тормозит сосудодвигательный центр.
Препарат применяют при артериальной гипертонии, гипертониче-
гипертонических кризах
Синонимами препарата являются альдомет, допегит, мопатил и др.
22.4. Периферически действующие симпатолитики
(а-адреноблокаторы)
Как >же было отмечено (см. гл. 12 «Адреноблокирующие препара-
препараты»), характерной особенностью а-адреноблокаторов является их спо-
способность уменьшать прессорный эффект адреналина (эпинефрина).
В частности, постсинаптические а;-блокаторы действуют на а-рецеп-
Глава 22
тивные участки, расположенные на сосудистой гладкой мускулатуре
и противодействуют прессорному, сосудосуживающему, эффекту адре-
адреналина (эпинефрина) и норадреналина (норэпинефрина). Кроме того,
они проявляют прямой расслабляющий эффект на гладкую мускулату-
мускулатуру, что приводит к периферическому расширению сосудов, в итоге вы-
вызывающему понижение давления. Наверное, наиболее важным эффек-
эффектом а-адреноблокаторов является расширение периферических сосудов.
Однако они проявляют также кардиостимулирующий эффект, что не-
нередко становится причиной тахикардии.
Попытки лечения гипертензии такими препаратами, как фентола-
мин A2.2.1) и феноксибензамин A2.2.6), блокирующими а-адренер-
гические рецепторы, оказались безрезультатными при лечении гипер-
гипертензии как по причине большого числа сопутствующих им побочных
эффектов, 1ак и по причине развития к ним толерантности.
Однако ряд а,-селективных адреноблокаторов и блокаторов адре-
нергических нейронов применяются при лечении гипертензии.
Обратимые конкурентные
ой -селективные адреноблокаторы
Препараты с а-адреноблокирующей активностью, отличающиеся
специфичностью только к агадренорецепторам, представляют собой
периферические коронарорасширяющие средства. Празозин и тетразо-
зин — селективные а,-адреноблокаторы, которые в терапевтических
дозах применяют для понижения АД.
Празозин (Prazosin)
Синтез препарата A2.2.12) описан в гл. 12.
122 12
\ /
Празозин показан для лечения средней или умеренной гипертензии.
При применении препарата кровяное давление понижается без сущест-
существенных изменений таких показателей работы сердца, как скорость, ко-
коронарный поток, сердечный выброс.
Празозин показан при слабой и умеренной гипертензии.
Синонимами препарата являются минипресс и минизид.
-416-
Антигипертензивные
Тетразозин (Tetrazosin)
Синтез препарата A2.2.13) описан в гл. 12.
2 J—|
Тетразозин применяют по тем же показаниям, что и празозин, од-
однако он имеет го преимущество, что его можно принимать один раз
в день.
Синонимами препарата являются геитрин и вазокард.
Блокаторы
адренергических нейронов
Блокаторы адренергических нейронов вызывают распад биогенных
аминов в окончаниях нейронов. Эти препараты могут вмешаться в синтез,
хранение и высвобождение норэпинефрина, дофамина и серотонина.
Резерпин (Reserpine)
Синтез препарата A2.3.1) описан в гл. 12.
сн3о
осн3
12.3 1
Резерпин вызывает распад норэпинефрина, дофамина и серотонина
в окончаниях нейронов. Он ослабляет внутриклеточный захват биоген-
биогенных аминов и уменьшает способность к их хранению в везикулах.
Резерпин применяется при лечении гипертензии, однако не является
лекарством выбора из-за большого числа побочных реакций. Тем не
менее на его основе имеется много комбинированных с другими гипер-
тензивными средствами, в частности, с диуретиками препаратов.
Резерпин выпускается под множеством названий, среди которых
можно выделить его синонимы серпасил, бринердин, диупрес и др.
-417-
Глава 22
Гуапетидин (Guanethidine)
Синтез препарата A2.3.2) описан в гл. 12.
NH
N —CH2-CH2-NH-C-NH2
12 3.4
Гуанетидин не воздействует на эффекторные клетки. Он проникает
в нейрон, где аккумулируется и замещает норэпинефрин. В результате
стимуляции нерва может быть выброшен сам гуанетидин, который, од-
однако, не является стимулятором адренергического рецептора.
Гуанетидин применяется при острой гипертензии, когда примене-
применение более общепринятых препаратов оказывается безуспешным. Это —
мощный долгодействующий антигипертензивный препарат, однако он
действует на кровяное давление пациента исключительно в ортостати-
ческом положении и не действует в лежачем.
Гуанетидин очень сильный и долгодействующий препарат, и часто
его действие продолжается еще 2-3 дня после его отмены.
Синонимами препарата являются октадин, исмелин, санотензин
и др.
Гуанадрел (Guanadrel)
Синтез препарата A2.3.8) описан в гл. 12.
,CH2-NH-C-NH2
NH
123.8
Гуанадрел — блокатор адренергических нейронов, используемый
при эссенциальной гипертензии. Механизм его действия и побочные
реакции сходны с гуанетидином.
Препарат применяют для лечения гипертензии у пациентов, неадек-
неадекватно реагирующих на тиазидные диуретики. Может быть использован
в качестве дополнительного средства при тиазидном лечении для дос-
достижения оптимального уровня кровяного давления.
Синонимом препарата является гилорел.
- 418 -
Антигипертензивные
22.5. Блокаторы кальциевых каналов
В дополнение к применению в качестве антиангинальных и анти-
антиаритмических средств блокаторы кальциевых каналов используются для
лечения слабой и умеренной гипертензии. Эти препараты препятствуют
проникновению в клетки гладких мышц периферических сосудов ионов
Са2 и вызывают расслабление периферических сосудов, что приводит
к снижению АД. В клинически применяемых дозах блокаторы кальцие-
кальциевых каналов расслабляют гладкую мускулатуру артерий и мало дейст-
действуют на вены. В дозах, которые релаксируют гладкую мускулатуру,
блокаторы кальциевых каналов относительно мало влияют на сокра-
сокращаемость сердца.
При антигипертензивной терапии наиболее часто используются
дилтиазем A9.3.10), верапамил A9.3.15) и нифедипинA9.3.16), которые
кажутся равно эффективными препаратами для лечения гипертензии.
Методы их синтеза уже были предложены в гл. 19 «Антиангинальные
препараты».
Дилтиазем (Diltiazem)
Синтез препарата A9.3.10) описан в гл. 19.
ОСНз
ОСОСНо
19 3.10
Дилтиазем уменьшает трансмембранное поступление ионов Са2+
в клетки сердечной мышцы и гладкой мускулатуры сосудов. Вызывает
расширение коронарных и периферических сосудов. Увеличивает коро-
коронарный кровоток, предотвращая развитие спазма коронарных артерий.
Снижает повышенное АД и уменьшает тахикардию.
Препарат показан при стабильной и нестабильной стенокардии
(в том числе и после инфаркта миокарда), при артериальной гиперто-
гипертонии.
-419-
Глава 22
Верапамил (Verapamil)
Синтез препарата A9.3.15) описан в гл. 19.
Л— С-СН2-СН2-СН2—N-CH2-CH2-A.
C=N СН3
О-СНз
O-CH3
193 15
Верапамил обладает антиаритмической, антиангинальной и гипо-
гипотензивной активностью. Снижает потребность миокарда в кислороде
за счет снижения сократимости миокарда и урежения частоты сердеч-
сердечных сокращений. Вызывает расширение коронарных артерий и увели-
увеличение коронарного кровотока. Снижает тонус гладкой мускулатуры,
периферических артерий и общее периферическое сосудистое сопро-
сопротивление. Оказывает антиаритмическое действие при наджелудочко-
вых аритмиях.
Верапамил применяют для профилактики приступов стенокардии,
артериальной гипертонии, при лечении и профилактике наджелудочко-
вых аритмий.
Нифедипин (Nifedipin)
Синтез препарата A9.3.16) описан в гл. 19.
н3с
Н3СООС
сн3
соосн3
NO2
19 3 16
Нифедипин вызывает расслабление гладкой мускулатуры сосу-
сосудов, расширяет коронарные и периферические артерии, снижает пе-
периферическое сопротивление, АД, улучшают снабжение сердца кис-
кислородом.
22.6. Миотропные гипотензивные препараты
Препараты этого класса (гидралазин и нитропруссид натрия) пони-
понижают АД, главным образом, непосредственным спазмолитическим дей-
действием на гладкую мускулатуру артериол, что приводит к понижению
-420-
Антигипертензивные препараты
сопротивления периферических сосудов вызывая их расширение. Диа-
столкческое давление обычно понижается больше, чем систолическое.
Гидралазин (Hydralazin)
Гидралазин — 1-гидразинонафталазин B2.6.4) получают окисли-
окислительным хлорированием фталида с одновременным гидролизом
продукта, в результате чего получают гидроксифталид B2.6.1), ко-
который взаимодействием с гидразином переводят в фталазон B2.6.2).
Подвергая последний действию хлорокиси фосфора, получают
1-хлорфталазин B2.6.3), замещая в котором атом хлора гидразином,
получают искомый гидралазин B2.6.4) [14, 15, 16].
22 6.1
H2NNH2
N-H POCh
22 6 2
H2NNH2
22 6 3
NhNH2
22 6 4
Гидралазин проявляет антигипертензивный эффект путем прямо-
прямого расслабления гладкой мышцы сосудов. Причем препарат воздейст-
воздействует на артериальные сосуды с минимальным действием на венозные.
В результате понижается сопротивление периферических сосудов,
и кровяное давление понижается (диастолическое больше, чем систо-
систолическое).
Препарат существенно не влияет на несосудистую гладкую муску-
мускулатур) или сердечные ткани. Гомеостатические циркуляторные рефлек-
рефлексы остаются нативными, вызванная гипотензия активирует сердечно-
сердечнососудистые рефлексы, выражающиеся в увеличении работы сердца, си-
силы и объема сердечного выброса. Поэтому препарат наиболее эффек-
эффективно используется в сочетании с Р-блокаторами.
Сам по себе гидралазин используется при гипертензии. однако не
является лекарством выбора даже при мягких формах.
Синонимами препарата являются апрессин, гипатол, депрессан
и др.
-421 -
Глава 22
Нитропруссид натрия (Nitroprusside natrii)
Нитропруссид натрия —Na2Fe(CNMNO B2.6.7) получают последо-
последовательными реакциями, включающими взаимодействие ферроциа-
нидэ калия с азотистой кислотой с получением нитропруссида ка-
калия B2.6.5). дальнейшим переводом его в нитропруссид меди
B2 6.6), и далее взаимодействием последнего с карбонатом натрия
получают нитропруссид натрия B2.6.7).
2K4Fe(CNN + 4HNO2 + 2H2SO4 = K2Fe(CNMNO + 2NO + 2(CNJ + 2K2SO4 + 4H2O
22 6 5
K2Fe(CNMNO + CuSO4 = CuFe(CNMNO + K2SO4
22 6 6
CuFe(CNMNO
= Na2Fe(CNMNO + CuCO3
22 6 7
Нитропруссид натрия — мощный, мгновенно действующий внут-
внутривенный препарат, используемый для понижения кровяного давления
при гипер!ен?ивны\ кризах. Гипотензивный эффект вызывается пери-
периферической вазодилатацией в результате прямого воздействия как на
артериальные, так и на венозные сосуды.
Побочные эффекты также наступают очень быстро, однако продол-
продолжаются очень недолго по причине весьма короткого времени полужиз-
полужизни препарата, Нитропруссид натрия биотрансформируется в цианид
и тиоцианат, вследствие чего при передозировке может появиться тио-
циднатная или цианидная интоксикация.
Наличие таких препаратов, как диазоксид и нитропруссид натрия,
значительно увеличило возможность резкого снижения АД в экстрен-
экстренных случаях, которое, однако, должно производиться под постоянным
контролем медицинского персонала.
Синонимами препарата являются ниприд, нипрутон и др.
22.7. Ингибиторы АПФ
Ингибиторы АПФ проявили себя в качестве весьма эффективных
антигипертензивных препаратов, начавших вытеснять C-адренооло-
каторы, особенно при монотерапии гипертензии.
Эти препараты ингибируют АПФ, который осуществляет гидролиз
неактивного ангиотензина I в активный ангиотензин II. являющийся
активным эндогенным вазопрессорным веществом.
-422-
А н т и г и п ертензивные препараты
Ahi иотензин I является прогормоном, который образуется в резуль-
результате действия ренина на пептидный субстрат, вырабатываемый пече-
печенью.
Ренин, в свою очередь, является протеолитическим ферментом,
продуцируемым почками и контролирующим физиологические функ-
функции других органов.
Секреция самого ренина контролируется нервной системой и, воз-
возможно, недавно открытым сердечным пептидным гормоном.
Ангиотензин I относительно неактивен и активируется превраще-
превращением в ангиотензин II АПФ. Рецепторы мембран клеток гладкой муску-
мускулатуры артериол и коры надпочечников (секреция альдостерона) спе-
специфично стимулируются ангиотензином II. В результате повышается
периферическое сопротивление сосудов, повышается скорость работы
сердца, увеличивается сердечный выброс и происходит задержка воды
и ионов Na\ В свою очередь, индуцированное повышение давления
путем обратной связи вызывает уменьшение выделение ренина.
Существует гипотеза, что в основе этиологии эссенциальной гипер-
гипертензии во всех случаях лежит нарушение ренин-ангиотензиновой сис-
системы Однако, несмотря на всю кажущуюся привлекательность этого
предположения, для ее признания в качестве единственной причины
повышения АД еще нет достаточных доказательств.
В то же время, независимо от того, вызвана ли гипертензия повы-
повышением уровня ренина или другими причинами, у гипертоников инги-
ингибиторы АПФ вызывают понижение как систолического, так и диастоли-
ческого АД, и их действие усиливается диуретиками.
Препараты ряда ингибиторов АПФ (каптоприл, эналаприл) являют-
являются эффективными антигипертензивными препаратами, применяющими-
применяющимися для лечения всех типов гипертензии как самостоятельно, так и в ком-
комбинациях с другим препаратами, а также для лечения сердечной
недостаточности.
Каптоприл (Captopril)
Каптоприл — 1-[B8)-3-меркапто-2-метилпропионил]-Ь-пролин
B2.7.4) получают следующими путями: при первом способе —
прямым ацилированием L-пролина хлорангидридом 3-ацетилтио-
2-метилпропмоновой кислоты B2.7.2), получаемого из 3-аце-
тилтио-2-метилпропионовой кислоты B2.7'.1), которую, в свою
«чередь, получают взаимодействием метакриловой и тиоуксусной
кислот. Образовавшийся в результате взаимодействия L-пролина
с хлорангидридом З-ацетилтио-2-метилпропионовой кислоты
1-C-ацетилтио-2-0-метилпропаноил)-Ь-пролин B2.7.3) далее под-
-423-
Глава 22
вер1ают аммонолизу аммиаком с получением искомого капюпри-
ла B2 7 4).
СНз
М2С=С-СООН +
Crk-CO-SH
»¦ CH3-CO-S—н
22
СНч
1
_'С-СН—СООН
7 1
ХООН
;н3-со-ь —н
Cbo-C0-S — 42C-Ch-CG
I
22 'j Ch3
COCH
H-S —42C-CH-CO
22 7 4 Ch3
Второй способ отличается от первого лишь тем, что ацилнрова-
нию члорангидридом З-ацетилгно-2-метилпролионовой кислоты
B2.7.2) подвергают предварительно защищенный по карбоксильной
группе L-пролин - трет-б}1 иловый эфир L-иролина B2.7.6) По-
Последний получают по следующей схеме: L-пролин ацилпруюг хлор-
бенчиловым эфиром с получением N-бешилоксикарбоиил L-пролина
B2.7.7), который вводят во взаимодействие с изобугиленом с целью
получения трет-Ьути:ювого эфира N-бензилоксикарбонил — L-про-
L-пролина B2.7.8). Восстановлением последнею водородом с использова-
использованием в качестве катализатора палладия на угле пол)чаю г трет-
бутиловый эфир L-пролнна B2 7.9). После ацилирования последнего
хлорангидридом B2.7.2) получают аи/?<?«-6\тиловый эфир 1-C-
aцeтил^иo-2-мeт^!л-IIpoпaнoил)-L-пpoлннa B2.7.10), из которого по-
последовательно удаляются защитные группы С помощью трифторук-
сусной кислоты iидролиз\ется сложноэфирная часть молек^(Ы с по-
получением 1-C-ацетилгио-2-ме1Илпропаноил)-Е-пролина B2.7 3). ш
днастереомеров которою после разделения отбираек-я 1-C-
aцeтилтI!O-2-D-мeтил-пpoпaнoил)-L-lIpoлин, и далее аналогично вы-
шеописанном> его подвер!аюг аммонолшч с получением каптоприла
B2 7.4) [17, 18, 19.20.21,22,23]
-424-
Антигипертензизные препараты
^IJ^C
N СООС(СН;)з
I
СНз-CO-S—Н2С -Ch-CO
СНз 22 7 10
22 7 3
Каптоприл является наиболее изученным веществом из ряда инги-
ингибиторов АПФ. предложенным в качестве ангигипергензивного средства.
Препарат блокирует АПФ, в результате чего подавляется образование
ангиотензина II и устраняется его вазоконстрикторное действие на ар-
артериальные и венозные сосуды. При этом снижается общее сосудистое
периферическое напряжение, и уменьшайся АД.
Препарат применяют при гипертонии и хронической сердечной
недостаточности.
Синонимами препарата являются капотен, каприл и др.
Эналапрт (Enalapril)
Энадаприл — (8)-1-[^т-[1-(этоксикарбонил)-3-фенилпропил]-Ь-ала-
нил]-1.-пролин B2.7.12) получают взаимодействием бешиловот
эфира дипептнда I-аланил -L-пролина с этиловым эфиром 3-бен-
зоилакриловой кислоты с образованием продукта B2 7.1). восста-
восстановлением которого водородом с использованием в качестве ката-
катализатора никеля Ренея удаляется защитная беншльная группа
и получае(ся искомый эналаприл B2.7.12) [24]. Предложены и аль-
!ернативные пути синтеза [25, 26. 27, 28, 29].
сн3
•сн=сн-соос2н5
СООСН2С6Н5
CHj
Н2/ Raney-Ni
соосн2с6н5
HN
о
сн2-сн
СООС2НЬ
22 7 12
соон
-425-
1 ак же как и каптоприл, эналаприл селективно подавляет ренин-
аш потензин-альдостеронов\ю систем), ишибнрует АПФ, предотвра-
otaej превращение ангиотензина I в анпютензин II.
Применяют при гипертонии и при хронической сердечной недоста-
недостаточности.
Синонимами препарата являются вазотек, ренитек, наприлен и др.
22.8. Активаторы калиевых каналов
Миноксидил (Minoxidil)
Миноксидил — - 6-амино-1,2-дигидро-1-гидрокси-2-имино-4-пипе-
ридинопиримидин B2.8.5) получают исходя из барбитуровой ки-
кисло гы, взаимодействием которой с хлорокисью фосфора получают
2,4,6-трихлорпиримидин B2.8.1). Действием аммиака последний
переводят в 2,4-диамино-6-хлорпиримидин B2.8.2). Далее получен-
полученный 2,4-диамино-6-хлорпиримидин B2.8.2) вводят в реакцию с 2,4-
дихлорфенолом в присутствии гидроокиси калия с получением 2,4-
лиа.мино-6-B,4-дихлорфеиокси)-пиримидина B2 8.3). Окисляя по-
последний 3-хлор-пербензойной кислотой, получают 2,4-диамино-6-
B.4-дихлорфенокси)пиримидин-3-оксид B2.8.4), 2,4-дихлорфено-
ксильную грипту в котором при высокой температуре замещают на
пиперидиновую с получением миноксидила B2.8.5) [30, 31, 32, 33].
NH.
Cl
22 8 1
NH2
22 8 2
} 0 i
NH,
-С 8';
о
X 2
22 8 5
Мнноксидил — периферический вазодилататор. непосредственно
расслабляющий гладкие мускулатуру сосудов и тем самым понижаю-
•426-
Днтигипертензивные препараты
щий и сие 1 одическое, и диасголическое давление. Его действие связы-
связываю] с активацией калиевых каналов. Открытие калиевых каналов вы-
вызывает гиперполяризацию клеток гладкой мускулатуры, что. в свою
очередь, снижает поступление внутрь клеток ионов Са"~, необходимых
для поддержания сосудистого тонуса. Однако при применении минок-
миноксидила одновременно с гипотензией может возникнуть тахикардия, по-
повышается секреция ренина, а также происходит задержка воды и ионов
\а .
Вследствие серьезных потенциальных побочных действий препарат
показан только при острой гипертензии, не поддающейся лечению дру-
другими препаратами, и обязательно в сочетании с дв\мя другими антиги-
пер!ензивными средствами.
Синонимом препарата является лонитен.
Динзоксид (Diazoxid)
Диазоксид — 7-хлор-3-метнл-2-Я-1,2.4-бепзотиадназин-1,1-диоксид
B1.3.14) пол>чают конденсацией 2-а.миносульфонил-4-хлоранилина
i фиэгилортоацегатом [34, 35, 36].
NH->
(С2Н5О)зССНз
Дпазокснд является недиуретическим производным тиазидов, резко
снижающим кровяное давление путем прямого расслабления гладких
мыши артериол, возможно, в результате активации калиевых каналов
клегок гладкой м)ск)лат_\ры артериол. При эгом препарат мало влияет
на вепознлю систем) и сердце. В дополнение к гипотензивному дейст-
действию диазоксид вызывает резкое повышение уровня глюкозы в крови
вследствие ингибирования высвобождения инсулина из поджелудочной
же 1езы К его неблагоприятным эффектам относят также задержк)
в организме ионов Na и воды, повышение содержания в крови мочевой
кислоты.
Препарат применяется в случаях необходимости Heoiложного сни-
снижения давления при острой гипертензии. При эссенциальнон гипертен-
!ин диазоксид не применяется.
( ннонимом препарата является гиперстат.
-427-
Глава 22
2.
3.
4.
5.
6.
•7
8.
9.
10,
П.
12.
13.
14.
15.
16.
17.
18.
19.
20,
21.
22.
23.
24.
25.
26.
27.
28.
29.
30.
31.
32.
33.
34.
35.
36.
Список ли гературы
Ger. Pat 1.802.364A967).
Байт Т et al. /Experientia. 2_5, 1066A969).
Brit. Pat. 1.019.120A966).
Fr Pat. 1.584.670A969).
US Pat. 3.632 645A972).
Ger. Pat 1.793.483 A968)
Bream J. et al- Aizneimittel-Forsch. 25, 1477A975)
US Pat. 2.868.818A959).
Rnt. Pat. 936.074A960).
Tristram E et al.'/J. Org. Chem. 29, 2053 A964).
US Pat. 3.158.648A964).
Tristram E et al.''J. Org. Chem 29, 1424 A964).
Slates H et al. ,J. Org. Chem. 33, 1209 A968).
US Pat. 2.484.029A949).
Ger. Pat. 848.818A9451.
Druey H. et al.-'Helv. Chim. Acta. 34, 204 A951).
US Pat. 4.046.889A976).
US Pat. 4.105.776A978).
US Pat. 4.154.840 A979).
US Pat. 4.154.935 A979).
Ger. Pat. 2.703.828A977).
Ondetti M etaL/Science. 196, 441 A977).
Nam D et al.' J. Pharm. Sci. 73, 1843 A984).
US Pat. 4.442.030A984).
Patchett A. et al./ Nature. 2_88, 280 A980)
Wyvratt M et al.-"J. Org. Chem. 49, 2816 A984)
US Pat. 4.374.829A983).
US Pat. 4.472.380A984).
Eur. Pat. Appl. 12.401 A979).
US Pat. 3.382 247A968).
US Pat. 3.461.461 A969).
US Pat. 3.644.364A972).
McCallJ et al. J. Org. Chem. 40, 3304 A975).
US Pat. 3.345.365 A967).
US Pat. 2.986.573 A961).
Raffa I et al., Farmaco. Ed. Sci. 17, 244 A962).
Глава 23
Препараты для лечения
заболеваний дыхательной
системы
Заболевания дыхательной системы могут возникнуть в результате
воздействия на нее инфекций, действия чужеродных aiemoB разной
природы, в том числе пыли, химических веществ, курения, переохлаж-
переохлаждения, 1енетических факторов, в результате острых поражений или ре-
реакций (иперчувствительности. Терапия заболеваний дыха(ельной сис-
системы в обшем сводшся к восстановлению соответствующих физио-
физиологических функций. В частости, антибиотики устраняют инфекции,
поразившие респираторный тракт, глюкокортикоиды устраняют его
воспаление, бронходилатагоры (бронхолитики) расслабляют гладкую
\пск>лат\р> бронхиол и раскрывают заблокированные для прохожде-
прохождения воздуха участки и т. и
Особое место среди легочных заболеваний занимает астма, которая
яилиется клиническим синдромом, характеризующимся повышенной
возбудимоегью и сужением дыхательных п>тей и. следовательно, янле-
ниями одышки, затрудненным дыханием и кашлем. Пациенты, cipa-
даюшие астмой, могут проявлять признаки хронического бронхита ипи
эмфиземы легких.
Поскольку в основном молекулярные механизмы этих иаюлошче-
скн\ изменений недостаточно изучены, терапия астмы, легочных забо-
заболеваний и других заболеваний дыхательной системы в основном на-
направлена на предупреждение и устранение сопутствующих mm заболе-
заболеваниям симптомов.
Соответственно, препараты для лечения заболеваний дыха!ельной
системы можно рассматривать как противоотечные препараты сосудо-
сосудосуживающего действия, применяемые как носовые капли, протнвокаш-
левые и отхаркивающие средства, а также как бронхолигики и другие
препараты, применяемые для лечения бронхиальной астмы, 1акие как
У1егнлксантины, антихолннергические препараты, адренергические пре-
препараты, ингибиторы высвобождения медиаторов аллергии и кортико-
стероиды.
-428-
-429-
Глава 23
23.1. Противоотечные сосудосуживающие
препараты
Сосудосуживающие препараты, как правило сс-адреномиметики,
применяются как временные успокаивающие средства при острых ри-
ринитах вирусного или аллергического происхождения, синуситах, евста-
хеигах. При местном применении в виде капель или аэрозолей они су-
сужают артериолы слизистой оболочки носа, приводя к снижению отека,
гиперемии, экссудации
С этой целью часто применяют симпатомиметики с выраженным
противоотечным действием, такие как нафазолин A1.1.36), гетрагидро-
золин A1.1 37), ксилометазолин A1.1.38), оксиметазолип A1.1.40) и др..
синтез и свойства которых были описаны в гл. 11 «Адренергические
(симпатомиметические) препараты»,
11 1 36
11 1 37
(СНз)зС
23.2. Противокашлевые препараты
и отхаркивающие средства
Заболевания дыхательной системы как правило сопровождаются
кашлем — защитным механизмом, посредством которого инородные
вещества, раздражители и слизь выделяются из дыхательного тракта.
Противокашлевые препараты могут действовать на уровне «кашле-
«кашлевого центра» в продолговатом мозге, а также на разлшных участках
грахеобронхиального древа. Препараты, проявляющие противокашле-
вой эффект, делятся на две группы. Это препараты центрального дейст-
действия, наркотические протвокашчевые средства или опиаты, к которым
oiносятся кодеин и гидрокодон, а также разнородная группа препара-
препаратов, проявляющих и центральный, и периферический эффекты, подав-
подавляющие кашель, называемая ненаркотическими противокаи-иевыми
средствами (декстромегорфан, бензонатат).
-430-
Препараты для лечения заболеваний дыхательной системы
Наркотические
противокашлевые средства
Кодеин (Codeine)
Синтез препарата C.1.20) был описан в гл. 3 «Анальгетики».
сн3о
Препарат подавляет кашлевой рефлекс в кашлевом центре в про-
до.поватом мозге, и его используют при остром и хроническом рефлек-
рефлекторном кашле
Гидрокодон (Hydrocodone)
Синтез препарата C.1.27) был описан в гл. 3.
3 1 27
Гидрокодон — мощный противокашлевой препарат, который
широко применяется для подавления кашлевого рефлекса. Он входит
в состав эффективных противокашлевых коммерческих препаратов
в комбинациях с гуайфенезином (энтусс), с гоматропином (гикодан),
с фенилпропаноламином (гикомин), фенилтолоксамином (туссио-
некс) и псевдоэфедрином и гуайфензином (туссенед).
Ненаркотические
противокашлевые средства
Декстрометорфан (Dextrometorphan)
Декстрометорфан — (9а.13а,14а)-3-метокси-17-метилморфинан
B3.2 1) получают исходя из (±)-3-гидрокси-М-метилморфинана пу-
путем замещения фенольнои гидроксильнои группы на метоксильную
-431 -
Глава 23
с использованием фенилтриметиламмоний хлорида и метилага нат-
натрия в метаноле. Полученный рацемический продукт (±)-3-метокси-
N-метилморфинан разделяют на изомеры с помощью D-винной кис-
кислоты с пол\чением декстрометорфана [1,2].
V—N-CH3 CL/ CH3ONa / СН3ОН
СН3О
Препарат обладает выраженным противокашлевь(м эффектом и ми-
минимальным действием на ЦНС, не вызывает привыкания.
Синонимами препарата являются коффекс, робидекс, седатусс и др.
Бензонатат (Benzonatat)
Бензонатат — я-бутиламинобензоат 2,5,8,11,14,17,20,23,26-нона-
октакозан-28-ола B3.2.2) получают переэтерификацией этилового
эфира 4-бутиламинобепзойной кислоты монометиловым эфиром
нонаэтиленгликоля. Препарат является структурным аналогом ме-
местного анестетика тетракаина [3, 4].
C^HgNH-^ у)
hO-lCH2CH2O)g-Ch-,
C4H0NH-
ОС— (СН2СН?О)9-СНЭ
23 2 2
Предполагается, что он действует по двум механизмам: селектив-
селективной анестезией раздраженных рецепторов в легких и одновременным
подавлением кашлевого центра.
Синонимами препарата являются тессалон, венту ссин и др.
Отхаркивающие средства
При вязком сухом секрете бронхиальных желез кашель можно
>меныиить либо рефлекторно, путем увеличения секреции желез слизи-
слизистой оболочки бронхов или путем повышения активности мерцательно-
мерцательного эпителия и \силения сокращения мышц бронхов (гуайфенезин, йоди-
йодистый калий, терпингидрат), либо разжижением секрета муколитиками —
препаратами, уменьшающими вязкость мокроты путем деполимериза-
деполимеризации полисахаридов, входящих в ее состав. Наиболее широко при этом
-432-
Препараты для лечения заболеваний дыхательной системы
применяется ацетилцистеин.
Гуайфенезин (Guaifenesin)
Гуайфенезин — 3-(о-метоксифенокси)-1,2-пропандиол B3.2.3)
предложено получать взаимодействием гваякола с 3-хлорпропан-
1,2-диолом или с глицидолом [5, 6, 7, 8, 9, 10].
¦2-СН-СИ2—ОН
Гуайфенезин способствует выделению секрета из желез слизистой
оболочки бронхов, облегчая кашель при простудных заболеваниях,
бронхитах, бронхиальной астме.
Синонимами препарата являются робитуссин, лотуссин и др.
Ацетилцистеин (Acetylcysteine)
Ацетилцистеин — М-ацетил-Ь-цистеин B3.2.4) получают взаимо-
взаимодействием гидрохлорида L-цистеина с уксусным ангидридом в при-
присутствии ацетата натрия [11, 12, 13].
HS-CH2-CH-COOH
NH2 HCI
(СН3СОJО
CH3COONa
HS-CH2-CH-COOH
CH3COHN
23 2 4
Ацетилцистеин является препаратом, применяющимся при кашле
с целью уменьшения вязкости мокроты.
Синонимами препарата являются флумуцетин, мукомист и др.
23.3. Бронходилататоры (бронхолитики)
Метилксантины
Ксантины принадлежат к семейству соединений, содержащих пури-
новую циклическую систему — одну из наиболее важных гетероцикли-
гетероциклических систем, встречающихся в природе, получаемой сочленением
пиримидинового и имидазольного колец.
Три наиболее известных природных метилксантина это теофиллин,
теобромин и кофеин. Метилксантины проявляют сходный спектр био-
биологической активности.
-433-
Глава 23
Главными источниками этих соединений являются чай, какао и ко-
кофе соответственно. В качестве бронхолитика наибольший интерес пред-
представляет теофиллин.
Теофиллин (Theophyllin)
Теофиллин — 1,3-диметилксантин B3.3.5) содержится в небольшом
количестве в чайных листьях Синтетически его получают методом
Трауое — общим методом, предложенным для получения пурнно-
вых оснований. В данном случае взаимодействием К,К-диметил-
мочевины с циануксусным эфиром в присутствии уксусного ангид-
ангидрида получают цианацетилметилмочевину B3.3.1), которую цикта-
з>ют в 6-амино-1.3-диметилурацил B3.3.2). Полученное соединение
действием азотистой кислоты трансформируют в 5-нитрозо-6-
амино-1,3-диметилурацил B3.3.3). Восстановлением нитрозогруп-
пы в последнем получают 5,6-диамино-1,3-диметилурацил B3.3.4),
последующим взаимодействием которого с формамидом получают
искомый теофиллин B3.3.5) [14, 15, 16, 17].
о
NaOH
СНз-N'
HNO2
[HJ
23 3 3
NH2 HCONH2
CH3
23 3 4
CH3
23 3 5
Механизм действия теофиллина в качестве бронхолитика неизвес-
неизвестен Однако предложено несколько гипотез, основанных на его струк-
структурном сходстве с аденозином и 3',5'-цАМФ,
Аденозин является эндогенным медиатором, который, взаимодей-
взаимодействуя с мембранными рецепторами, может вызывать сокращение
оронхов. Геофиллин же препятствует этому взаимодействию, предот-
предотвращая вызванный этим субстратрецепторным взаимодействием
оронхоспазм.
Полагают, что теофиллин может ингибировать фосфодиэстеразу,
что. в свою очередь, может привести к повышению у ровня клеточного
-434-
Препараты для лечения заболеваний дыхательной системы
циклического аденозинмонофосфата и. следовательно, к расслаблению
гаадкой мускулатуры дыхательных путей. Однако теофиллин не являет-
является мощным ингибитором фосфодиэстеразы и, в принципе, необходимые
для этого концентрации могут быть недостижимы in vivo.
С другой стороны, теофиллин ингибирует обратный захват катехо-
ламинов, что может повысить уровень циклического аденозинмонофос-
аденозинмонофосфата и тем самым вызвать бронхолитический эффект.
Наконец, 1еофиллин является блокатором аденозиновых рецепто-
рецепторов, и именно это его свойство может быть ответственно за его бронхо-
литическое действие.
Несмотря на то, что последний механизм может быть основным
в случае с геофиллином, некоторые ксантины, будучи, в обшем, лишен-
лишенными способности связываться с аденозиновыми рецепторами, выявля-
выявляют такую же, если не большую, бронхолитическую активность, как
у теофиллина.
Теофиллин и другие метилксантины проявляют фармакологический
эффект и на ряд других систем. Конечно, наиболее выраженным их эф-
эффектом является расслабление гладкой мускулатура дыхательных пу-
путей. Однако теофиллин является стимулятором ЦНС, понижает артери-
артериальное кровяное давление, повышает диурез, проявляет кардио-
тоническую активность, оказывает определенное действие на ЖКТ.
Перечисленные эффекты являются наиболее часто встречающимися
побочными действиями при применении теофиллина в качестве брон-
бронхолитика.
Действие на ЦНС прямо зависит от дозы введенного препарата
и может появляться усталостью, беспокойством, тремором и даже кон-
конвульсиями при относительно больших дозах.
На сердечно-сосудистую систему теофиллин действует, проявляя
положительный ионотропный и хронотропный эффекты на сердце, что,
вероятно, могло бы быть вызвано повышенным притоком ионов Са2+,
смодулированным циклическим аденозинмонофосфатом и действием на
специфические сердечные фосфодиэстеразы. В желудочно-кишечной
системе метилксантины одновременно стимулируют секрецию и желу-
желудочной кислоты, и пищеварительных ферментов.
Теофпллин уменьшает сократительную активность гладкой муску-
мускулатуры, расширяет бронхи и кровеносные сосуды, уменьшает легочное
сосудистое сопротивление, стимулирует дыхательный центр, повышает
частот\ и силу сердечных сокращений. Препарат применяют при брон-
бронхиальной астме — для предупреждения приступов и для систематиче-
систематического лечения. Теофиллин применяют также для симптоматического
лечения бронхоспастического синдрома другой этиологии (хронические
-435-
Глава 23
обструктивные заболевания легких, хронический бронхит, эмфизема
jieiKnx).
На его основе создано большое число комбинированных препара-
препаратов, например аминофиллин или эуфиллин (сочетание теофиллина
с этилендиамином). дифиллин, окстрифиллин.
Синонимами теофиллина являются адофиллин. астмофиллин. тео-
цин и многие другие.
Антихолинергические
препараты
Антихолинергические препараты, в частности атропин A4.1.4) или
скополамин A4.1.6), веками использовались и для лечения обструктив-
ных легочных заболеваний. Ингибируя действие ацетилхолина на глад-
гладкую мускулатуру дыхательной системы, такие препараты предотвра-
предотвращают бронхоспазм, возникающий в результате разрядки вагусного
нерва. Однако они воздействуют на многие ткани и системы и. следова-
следовательно, выявляют широкий спектр побочных эффектов. В настоящее
время их редко применяют для лечения кашля, возникшего от опреде-
определенных раздражителей. Однако четвертичное производное атропина —
ипратропий бромид часто используется при хронических бронхитах,
эмфиземе легких и астме.
Ипратропий бромид (Ipratropiwn bromide)
Ипрагропий бромид — За-гидрокси-8-ичопропил-1аЯ,5а//-тропа-
ния бромид B3.3.6) получают взаимодействием N-изопропилнор-
агропина с бромистым метилом [18, 19, 20].
СН3Вг
о-со-сн-сн2он
О-СО-СН-СНгОН
23 3 6
Препарат оказывает бронхолитическое действие за счет уменьше-
уменьшения холинергических влияний на бронхиальную мускулатуру (М-холи-
ноблокирующее действие). Устраняет спазм бронхов. Применяется для
-436-
Препараты для лечения заболеваний дыхательной системы
лечения и профилактики бронхиальной астмы легкой и средней сте-
степени, особенно сопутствующей заболеваниям сердечно-сосудистой
системы.
Синонимами препарата являются атровент, итроп, ипрафен и др.
Ингибиторы высвобождения
медиаторов аллергии
Медиаторы аллергии (гистамин, лейкотриены и др.) участвуют
в формировании бронхоспазма. Блокируя высвобождение медиаторов
аллергии у аллергических субъектов, некоторые препараты, в частности
кромолин, являющийся прототипом препаратов этого типа, блокируют
и ранние и поздние фазы реакции организма в ответ на экспозицию ал-
аллергенов. Эти препараты не имеют бронхорасширяющих свойств, одна-
однако ингибируют вызванный антигенами или другими причинами брон-
бронхоспазм.
Кромолин (Cromolyn)
Кромолин — 5,5 '[2-гидрокситриметилен)диокси)]окс-4-оксо-4#-1-
бензопиран-2-карбоновую кислоту B3.3.9) получают взаимодейст-
взаимодействием 2,6-дигидроксиацетофенона с эпихлоргидрином. при котором
происходит как реакция замещения атома хлора в эпихлоргидрине,
так и раскрытие эпоксидного кольца с образованием бис-продукта
B3.3.7). Циклизацией последнего в бис-хромоновое производное
с помощью диэтилоксалата в B3.3.8) и последующим щелочным
гидролизом сложноэфирных групп продукта получают искомый
кромолин B3.3.9) [21, 22, 23].
о о-н
О О-СН7-СН-СН2— О О СООС2Н5
СН2С1
Oh
О р-СН2-СН-СН;—
О О-СН2-СЧ-СН-
СООС2На
Кромолин стабилизирует мембраны тучных клеток, угнетая высво-
высвобождение из них медиаторов аллергии и активацию эозинофилов, ней-
-437-
грофилов, тромбоцитов и макрофагов, которые участвуют в формиро-
формировании бронхоспаз.ма.
Кромолин отличается от большинства медикаментов, применяемых
при обструктивных заболеваниях дыхательных путей, тем, что исполь-
i) ется только в качестве профилактического средства.
Препарат применяют при бронхиальной астме, а также для профи-
лакшки сеюнных, постоянных и вызываемых физической нагрузкой
приступов астмы и при аллергических ринитах.
Синонимами препарата являются интал, оптикром, аллергоспазмин,
ломупрен и многие другие.
Кортикостероиды
Многие кортикостероиды используются в качестве ингаляционных
средств при бронхиальной астме.
Кортикостероииы не являются бронходилататорами, и принято счи-
считать, что их действие просто сводится к противовоспалительному им-
М) нодепрессивном) эффекту, что весьма положительно сказывается на
течении бронхиальной астмы.
Они широко используются при обструктивных заболеваниях дыха-
дыхательных путей, однако не применяются при острых приступах бронхи-
бронхиальной астмы.
Множество побочных реакций, вызываемых ими при систематиче-
систематическом применении, в определенной степени ограничивает их применение
в качестве средств для лечения бронхиальной астмы.
При обструктивных легочных заболеваниях, в основном использу-
используются преднизолон B7.1.33), метилпреднизолон B7.1.38), дексаметазон
B7,1.51) беклометазон B3.3.10) и флунизолид B3.3.11). Синтез и де-
детальное описание некоторых из них будут приведены в гл. 27 «Кортико-
сгероиды>>.
HO. ЛНО**Х^-ОН
27 < лз
-438-
Препараты для лечения заболеваний дыхательной системы
но.
23 3 10
НО.
23 3 11
Адренергические препараты
(агонисты р2-рецепторов,
симпатомиметики)
Одним из наиболее важных применений симпатомиметиков — аго-
нистов р2-адренорецепторов является лечение обструктивных заболева-
заболеваний дыхательных путей. Весьма вероятно, что эти препараты действуют
путем повышения уровня циклического аденозинмонофосфата, избы-
,'ичное количество которого, очевидно, образуется в результате актива-
активации аденилатциклазы. Результатом действия агонистов р2-адреноре-
цеторов является расслабление гладкой мускулатуры, в данном случае
гладкой мускулатуры бронхов, и, одновременно, ингибирование высво-
оождения аллергогенных медиаторов.
Одними из первых агонистов Р-адренорецепторов, применяемых
ранее и в настоящее время в качестве бронхолитика, являются эпинеф-
рин или адреналин, изопротеренол и, особенно, эфедрин. При лечении
и профилактике обструктивных заболеваний дыхательных путей ис-
используются также и другие агонисты (З-адренорецепторов, такие как
тоэтарин, тербуталин, альбутерол, метапротеренол, а также описывае-
описываемые в настоящем разделе фенотерол B3.3.16), пирбутерол B3.3.22),
прока[ерол B3.3.25).
Сишез и фармакологические свойства первых шести из рассмат-
рассматриваемых препаратов — эпинефрина (адреналина) A1.1.2), изопроте-
репола A1.1.8), альбутерола A1.1.26), тербуталина A1.1.12), метапро-
1еренола A1.1.15), изоэтарина A1.1.11), а также эфедрина A1.3.4) —
были описаны в гл. 11 ^Адренергические (симпатомиметические) пре-
препараты».
Cn-CH^-NH-CHj
On
¦A A-CH-CH2-NH-CH(CH312
он
-439-
Глава 23
но
^ М—C
)—
C4-CH2-NH-C*CH3J3
он
он
11 1 15
сн3
-Ch-CH— NH-CH3
ОН
1134
Фенотерол (Fenoterol)
Фенотерол — 3,5-дигидрокси-а[[(-я-гидрокси-а-метилфенэгил)-
амино]метил]-бензиловый спирт B3,3,16) синтезируют исходя из
3,5-диацетокспацетофенона, бромированием которого получают
3,5-диацетоксибромацетофенон B3.3.12). Последний вводят во
взаимодействие с 2-бензиламино-1-D-метоксифенил)-пропаном
с получением соответствующего третичного амина B3.3.13). Гид-
Гидролизом ацетильных групп в последнем и удалением защитной бен-
зильной гр>ппы восстановлением водородом с использованием
в качестве катализатора палладия на угле получают вторичный
амин B3.3.14). Подвергая последний действию бромистоводород-
ной кислоты расщепляют эфирную связь в бензольном кольце с по-
полз чением фенольного производного B3.3.15). Наконец, восстанов-
восстановлением карбонильной группы в последнем водородом получают
искомый фенотерол B3.3.16) [24, 25, 26].
Вг2
-440-
Препараты для лечения заболеваний дыхательной системы
о н
-C-Ch2—N-CH-CH2—W л
СН3
Н-0 23 3 15
Фенотерол — препарат, избирательно стимулирующий р2-адре-
норецепторы. Препарат расширяет бронхи и кровеносные сосуды, ока-
оказывает выраженное токолитическое действие, уменьшает сократитель-
н>ю активность и понижает тонус матки. Основное применение находит
при преждевременных родах.
Синонимами препарата являются беродуал, беротек, дуовент и др.
Пирбутерол (Pirbuterol)
Пирбугерол — аF)-[[[1.1-диметилэтил]амино]метил]-3-гидрокси-
2.6-пиридиндиметанол B3.3.22) синтезируют исходя из 3-гидро-
ксипиридина, последовательно подвергая его гидроксиметилирова-
нию и далее алкилированию бензилхлоридом по ароматической
гидроксильной группе с получением 3-бензилокси-2,6-бмс-(гидро-
ксиметил)пиридина B3.3.17). Селективным окислением 6-гидро-
ксиметильной группы двуокисью марганца получают 3-бензилокси-
2-гидроксиметилппперидин-6-альдегид B3.3.18). Конденсацией по-
последнего с нитрометаном получают соответств>ющий нитрометил-
карбинол B3.3.19), нитрогрупп> которого восстанавливают до
аминной водородом, с использованием в каестве катализатора ни-
никеля Ренея с получением аминоспирта B3.3.20). Алкилированием
аминогруппы последнего трет-б)тилбромидом получают вторич-
вторичный амин B3.3.21), снятием защитной бензильной группы которого
восстановлением водородом получают пирбутерол B3.3.22) [27, 28,
29.30,31,32,33].
1 НСОН
2 CgHsCri
Ч-С N CHjOH
с
23 3 17
CH/ЭН
(СН3)зСВг
H2N-CH2-Cr- N CHjOh
-441 -
(CH3,3CNH-CH2-C
OH
CH2OH
H2 Pd-C
„XX.
23 3/1
OH
23 3 22
Этот относительно селективный агонист р2-адренорецепторов
стр\кт>рно весьма похож на альб\терот и проявляет сходные с ним
брохошгические свойства Применяется в качестве ингаляционного
средства при печении бронхиальной астмы
Синонимами препарата являются эксирел и максайр
Прокатеро г (Procaterol)
Прокатерол 5-[1 гидрокси-2-[A-метилэти 1)амино]б> гил] 8-гид-
рокси 2AЯ)хинолон B3 3 25) получают ашлированием 8-гидрокси-
2A//)хиноиона хлорангидридом 2-броммасляной кислоты по пято-
пятому положению хинолиновой системы с получением соединения
B3 1 23) Подвергая последнее действию изопропиламина, получа-
получают аминокетон B3 3 24), карбонильную гр>ппу которого восста-
восстанавливают боргидридом натрия с получением прокатерола B3 3 25)
[34 35,36 37,38]
AICI,,
Br О
i ii
C2H5-CH-C
Br
(CH3JCH-NH2
(CH3JCH-NH
О
C2H=-Ch-C
'CH3JCH-NH OH
C2H5-CH-C-H
OH
23 3 24
23 3 25
Гак же hak и пирб} герол прокатерол проявляет сходные с альб>те-
ролом и брохотнтические свойства с несколько большей продолжи-
продолжительностью действия Его рекомендовано применять в качеслве ингаля-
ингаляционного средства при лечении бронхиальной астмы
Синонимами препарата являются онсукил масакин, прокалил, меп-
1ИН И Др
-442-
Препараты для лечения заболеваний дыхательной системы
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
19'
20
21
22
23
24
25
26
27
28
29
30
31
32
13
34
35
16
-> -7
1 /
18
Список литературы
I SPat 2 676 177A954)
SchmderO et al / Heh Chim Acta 34, 2211 A951)
LSPat 2 714 608A955)
US Pat 2 714 609A955)
Brit Pat 628 497A948)
Span Pat 212 920A954)
Ger Pat 3 106 995A982)
I SPat 4 390 732A983)
Marie E J Chem Soc ИЛ, 305 A912)
YaleH etal/J Am Chem Soc 72, 3710 A950)
LSPat 4 091 569A963)
US Pat 3 184 505A965)
Smith H et al J Org Chem 26, 820 A961)
Ger Pat 834 105A949)
Traube W /Ber 33, 3035 A900)
Гринберг А Ж П X 13, 1461 A940)
Гебнер 4 и др//Ж Общ X Н>, 179 A946)
US Pat 3 505 337 A967)
S Afr Pat 67 07 766A970)
Schub W et al // Arzneimittel-Forsch 26. 960 A976)
Bnt Pat 1 144 905A966)
LSPat 3 419 V78 A968)
Baker G et al 'J Med Chem 16, 87 A973)
US Pat 3 341 593A967)
Ger Pat 1 286 047A962)
Belg Pat 640 433A962)
US Pat 3 700 681A972)
US Pat 3 761 173A973)
US Pat 3 772 314A973)
I SPat 3 786 160A974)
US Pat 3 948 919A976)
LSPat 4 031 108A977)
Ger Pat 2 204 195 A972)
Belg Pat 831 841 A975)
LSPat 4 026 897A977)
)oshizah S et al' Chem PharmBul 28, 3441 A980)
\aka\awaK et al//J Med Chem J9, 1138A976)
"loshizakiS etal//J Med Chem 20, 1103A97'')
-443-
Глава 24
А нтикоагулянты,
антиагреганты,
тромболитики, гемостатики
Препараты, препятствующие тромбообразованию и предотвра-
предотвращающие свертывание или образование новых сгустков крови, называ-
называются антикоагучянтами.
Препараты, >меньшающие агрегацию тромбоцитов крови, называ-
называются антиагрегантами
Препараты, чскоряющие лизис уже образованных сгустков крови,
называются ыромбопитшачи, или фибринояитшами
Препараты, способствующие уменьшению и остановке кровотече-
кровотечения, называются гемостатическгши препаратами.
Коагуляционныый и фибринолитический процессы являются очень
важными защитными физиологическими механизмами организма,
и только очень тонко отрегулированное взаимодействие между ними
обеспечивает равновесное гомеостатическое состояние сосудистой сис-
системы.
В нормальных условиях образование микроскопических сгустков
крови часто бывает необходимо для восстановления поврежденной час-
части сосудов. При этом поврежденный сосуд восстанавливается путем
обновления его эндотелиальной поверхности, а образующийся в этом
случае нерастворимый сгусток далее эффективно удаляется фибриноли-
тической системой путем его протеолитического расщепления на рас-
растворимые фрагменты.
Процесс образования сгустков крови и последующего их лизиса
представляет собой очень сложную картину, зависящую от множества
веществ — факторов коагуляции (фибриноген, протромбин, тромбопла-
стин, кальций, ангигемофильный фактор и др). присутствующих
в плазме, клетках крови и в меньшей степени в других тканях.
Процесс агрегации тромбоцитов и его hhi ибирование весьма выра-
выражено рег\лир>ется системой тромбоксан—простациклин. Тромбоксан
А2 усиливает агрегацию, а простациклин (простагландин 12) препягствл-
ет агрегации.
-444-
днтикоагулянты, антиагреганты, тромболитики, гемостатики
Стимуляторами агрегации являются также простагландин Е2, колла-
коллаген сосудистой стенки, тромбин, аденозиндифосфат, серотонин и кате-
чоламины.
Ингибиторами агрегации являются простагландин Еь аденозинмо-
нофосфат, аденозин, метилксантины, антагонисты серотонина. гепарин
и др.
Нарушение эндогенного контроля над коагуляционным и фибрино-
литическим процессами может привести к тяжелым последствиям.
С одной стороны, нелимитируемое инициирование коагуляции мо-
может привести к тромбозам и. соответственно, к ишемии, инфарктам или
смерти. С другой стороны, сбой механизмов коагуляции может привес-
привести к геморрагии. Соответственно, в зависимости от характера наруше-
нарушения, при котором мог>т возникнуть клинические проблемы разной
сложности, оба состояния требуют коррекции. С этой целью применяют
антикоагулянты, антиагреганты, тромболитики и гемостатики.
24.1. Антикоагулянты
Антикоагулянты предотвращают развитие процесса коагуляции
крови. Терапия антикоагулянтами, в первую очередь, направлена на
предотвращение образования тромбов в сосудах, являющегося основной
причиной смерти при тромбоэмболических заболеваниях.
Антикоагулянты подразделяются на антикоагулянты прямого дей-
действия, т е. влияющие на факторы свертывания непосредственно в кро-
крови, и непрямого действия, т. е. влияющие на синтез факторов свертыва-
свертывания крови в печени. С другой стороны, антикоагулянты
классифицируют как парентеральные и орагьные препараты. Единст-
Единственным представителем парентеральных антикоаг>лянтов является ге-
гепарин К оральным антикоаг>дянтам относится ряд производных кума-
кумарина (дикумарол, этилбискумацетат, варфарин, фенпрокумон и ацено-
кумарол) и инданона (фениндион, анизиндион).
Антикоагулянты прямого действия,
или парентеральные антикоагулянты
К первому типу антикоагулянтов прямого действия относится ге-
гепарин.
Гепарин (Heparin)
Гепарин — природный антикоагулянт, образующийся в организме.
Источниками коммерческого гепарина являются слизистая свиного
кишечника и бычьи легкие [1, 2, 3, 4, 5].
-445-
Глава 24
Гепарин является смесью природных сульфатированных мукополи-
сахаридов и, в основном, содержится в гранулах тучных клеток. Осо-
Особенно много гепарина содержится в печени и легких. Лизосомы тучных
клеток содержат протеазы и гликозидазы, которые очевидно разрушают
содержащийся в них гепарин — протеоглюкан, образуя разнообразные
сульфатированные олигосахариды, которые и представляют собой гепа-
гепарин, присутствующий во внеклеточном пространстве, а в виде очищен-
очищенных образцов используемый в клинике. Гепарин активен только при
парентеральном введении. Наиболее часто его применяют внутривенно.
Гепарин - гетерогенная смесь сульфатированных полисахаридов,
построенных из повторяющихся единиц D-глюкозамина, D-глюко-
роновой и L-идуроновой кислот. Собственно коммерческий гепарин
является смесью ряда соединений с разной длиной цепи с молекулярной
массой от 5000 до 30 000. Моносахариды, образующие гепарин, моди-
модифицированы либо N-ацетильными, либо N- или О-сульфатными груп-
группами и соединены гликозидными связями, образуя полимеры типа
24 1,6 с разной длиной цепи. Основными моносахаридами, образующи-
образующими гепарин, являются 6-сульфат 2-дезокси-2-сульфамино a-D-глюкозы
B4 1.1), 2-сульфат a-L-идуроновой кислоты B4.1.2), 2-ацетамидо-2-
дезокси a-D-глюкозы B4.1.3), p-D-глюкороновая кислота B4.1.4) и a-L-
ндуроковая кислота B4.1.5). Эти сахара присутствуют в коммерческом
гепарине в убывающем порядке B4.1.1) > B4.1.2) > B4.1.3) > B4.1.4) >
B4,1.5). Ввиду наличия в молекулах сульфатных и карбоксильных
¦рупп гепарин является сильнокислым соединением, которое частично
нейтрализуется замещением кислых атомов водорода в сульфатных
группах ионами Na~.
ОН
NhSO3
OSO3
24 I 2
CH2OH
NHCOCH3
24 < 3
соо
А °
O4OH
Яон
OH
24 1 4
Oh
24 1 5
—о
24 1 6
oso3
-446-
днтикоагулянты, антиагреганты, тромболитики, гемостатики
Полагают, что гепарин действует путем нейтрализации ряда акти-
активирующих факторов свертывания крови, нарушая переход протромбина
в тромбин.
Гепарин применяют для предотвращения тромбообразования при
инфаркте миокарда, при тромбозах и эмболиях, для поддержания жид-
жидкого состояния крови в аппаратах искусственного кровообращения
и гемодиализа.
Синонимами препарата являются артевен, гепален, лепаран, ликве-
мин, пангеприн, ветрен и многие другие.
Антагонист гепарина
Антагонистом гепарина, использующимся при его передозировках,
является протамин — смесь протеинов, которую выделяют из спермы
рыб. Взаимодействуя с гепарином, он инактивирует его путем образо-
образования нерастворимого комплекса.
К антикоагулянтам прямого действия относится и цитрат нагрия,
который используется для стабилизации крови при ее консервации. По-
Полагают, что его антикоагулянтное действие заключается в связывании
ионов Са2т. необходимых для превращения протромбина в тромбин.
Антикоагулянты непрямого действия,
или энтеральные антикоагулянты
Наиболее широко используемые в клинике энтеральные антикоагу-
антикоагулянты являются структурными производными 4-гидроксикумарина —
соединения, которое был выделено из сладкого клевера и явившегося
причиной фатального геморрагического диатеза у скота в 1920-х годах,
так называемой «болезни сладкого клевера». После выявления того
факта, что именно кумарины способны подавлять синтез протромбина,
были развернуты интенсивные исследования в области синтеза кумари-
новых производных, в результате чего в медицину были внедрены ди-
кумарол (бисгидроксикумарин), этилбискумацетат, варфарин. фенпро-
кумон и аценокумарол.
Их терапевтическое действие зависит от способности подавлять об-
образование в печени ряда функциональных факторов свертывания крови.
Эти факторы описаны как витамин К-зависимые факторы, поскольку их
биосинтез гепатоцитами частично связан с метаболизмом гепатического
витамина К. Оральные антикоагулянты эффективны только in vivo, по-
поскольку принцип их действия заключается в угнетении в печени синтеза
протромбина, проконвертина и других факторов свертывания крови.
И\ иногда условно называют антагонистами витамина К.
-447-
Дикумарол (Dicoumarol)
Дикумарол — 3,з'-метилен-омс-D-гидроксикумарин) B4.1.8) полу-
получают исходя из 4-гидроксикумарина B4.1.7), который, в свою оче-
очередь, получают из метилового эфира салициловой кислоты путем его
циклизации в хромоновое производное с использованием натрия или
метилата натрия либо из о-оксиацетофенона, путем взаимодействия
с диэтилкарбонатом в присутствии этилата натрия. Конденсацией по-
полученного 4-гидроксикумарина в качестве фенольного компонента
с формальдегидом получают дикумарол [6, 7, 8, 9].
C2H6ONa
3 * X
¦он с2н5о-^-сс2н5
24 1 8
Препарат применяют в целях профилактики и лечения тромбозов,
тромбофлебитов, тромбоэмболии, для предупреждения тромбообразо-
вапия в послеоперационном периоде.
Синонимами препарата являются бисгидроксикумарин, дикумол,
кромолин и др.
Этилбискумацетат (Ethyl Biscoumacetate)
Эта1бискумацетат — этиловый эфир ом<?-D-гидрокси-3-кумаринил)-
уксусной кислоты B4.1.9) получают аналогично из 4-гидро-
4-гидроксикумарина, но с использованием вместо формальдегида глиокси-
ловой кислоты, этилглиоксилата или его пол>ацеталя [10, 11, 12, 13].
он
С2Н5О-СН-СООС2Н5
СООС2Н5
он | он
-448-
днтикоагулянты, антиагреганты, тромболитики, гемостатики
Препарат применяют по тем же показаниям, что и дикумарол.
Синонимами препарата являются неодикумарин, этилдикумарол,
тримексан. дикумацил и др.
Варфарин (Warfarin)
Варфарин — 3-(а-ацетонилбензил)-4-гидроксикумарин B4.1.10)
синтезируют по реакции Михаэля присоединением бензальацетона
к 4-гидроксикумарину B4.1.7) в присутствии пиридина [14, 15, 16,
17. 18. 19].
о
-СН=СН—С-СНз
Варфарин показан в качестве антикоагулянта для предотвращения и
лечения глубокого венозного тромбоза и легочной эмболии.
Синонимами препарата являются кумадин, панварфин, софраин,
вар.нерин и др.
А ценокумарол (Acenocoumarol)
Аценокумарол — 3-(а-ацетонил-«-нитробензил)-4-гидроксикума-
рин B4.1.11) получают по схеме, совершенно аналогичной получе-
получению варфарина, но с использованием «-нитробен-зальацетона [20].
о
it
Он СН?~С~СНз
Cri~\
Препарат применяют по тем же показаниям для предотвращения
и лечения тромбозов и легочной эмболии.
Синонимом препарата является синтром.
Фенпроку.нон (Phenprocounwn)
Фенпрок\мон — 3-(а-этилбензил)-4-гидроксикумарин B4.1.14) по-
полз чают ацилированием натриевой соли диэтилового эфира A-
фенилпропил)малоновой кислоты хлорангидрпдом ацетилсалици-
-449-
Глава 24
ловой кислоты с получением соединения B4.1.12), которое под дей-
действием метилата натрия циклиз>ется в 3-(а-этилбензил)-2-карбэто-
кси-4-гидроксикумарин B4.1.13). Щелочным гидролизом последне-
последнего и дальнейшим декарбоксилированием получают фенпрокумон
B4.1.14) [21, 22, 23, 24, 25. 26, 27, 28].
C2H5ONa
С^б4"
о ос2н5
СОСНз
24 1 12
ОН
NaOH
24 1 13
Фенпрокумон применяют по тем же показаниям, что и все описан-
описанные выше препараты.
Синонимами препарата являются маркумар и ликвамар.
Фениндион (Phenindion)
Фениндион — 3-фенилиндан-1,3-дион B4.1.16) предложено полу-
получать двумя путями. Первый способ заключается в конденсации бен-
зальдегида с фталидом в присутствии этилата натрия. Очевидно об-
образующийся при этом фенилметиленфталид B4.1.15) в условиях
реакции перегруппировывается в искомый фениндион B4.1.16).
Второй способ заключается в конденсации фенилуксусной кисло-
кислоты с фталевым ангидридом с образованием и выделением фенилме-
тиленфталица B4.1.15), который далее в присутствии алкоголята
натрия перегруппировывают в фениндион [29].
сно
C2H5ONa
24 1 16
-450-
Антикоагулянты, антиагреганты, тромболитики, гемостатики
СН2СООН
CH3COONa/t°
24 1 15
Аналогично производным кумарина фениндион, соединение класса
индандпонов. действует путем изменения биосинтеза коагулирующих
протеинов в печени.
Препарат применяют в целях профилактики и лечения тромбозов,
фомбофлебитов, тромбоэмболии. Однако вследствие вызываемых им
ряда побочных эффектов, таких как полиурия, полидипсия, тахикардия
и др., редко используется в практической медицине.
Синонимами препарата являются пиндион. биндан, гед>лин, индон,
фенилин,ректадион.
Лнизиндион (Anisindione)
Анизиндион — 3-(«-метоксифенил)индан-1,3-дион B4.2.11) отлича-
е1ся от фениндиона лишь наличием «-метоксилъной группы в фе-
"нильном кольце. Его синтезируют совершенно аналогичными спо-
способами, что и фениндион. но с использованием л-метоксибензаль-
дегнда или w-метоксифенил) ксусной кислоты [30, 31, 32].
¦осн3
24 1 17
Препарат применяют по тем же показаниям, что и фениндион.
Синонимами препарата являются унидон и мирадон.
24.2. Антиагреганты
Ингибиторы агрегации тромбоцитов крови имеют большое практи-
практическое значение и в значительной степени регулируются системой
тромбоксан-простациклин.
Тромбоксан А2 увеличивает, а простациклин (простагландин 12)
препятствует агрегации тромбоцитов крови.
Стимуляторами агрегации являются также простагландин Е2, колла-
'ен сосудистой стенки, тромбин, аденозиндифосфат, серотонин и кате-
-451 -
Глава 24
Ингибиторами агрегации являются также просгагландин Е,, адено-
зинмонофосфат, аденозин, мегилксантины, антагонисты серогонина,
гепарин и др.
Практическое значение в медицине в качестве ингибиторов агрега-
агрегации тромбоцитов крови приобрели такие нестероидные противовоспа-
противовоспалительные жаропонижающие анальгетики, как аспирин, индометанин,
ибупрофен и др., которые, блокируя циклооксигеназу, предотвращают
трансформацию арахидоновой кислоты в тромбоксан А2. Другие инги-
ингибиторы агрегации тромбоцитов крови, такие как коронарорасширяющий
препарат дипиридамол, а также тиклопидин, модулируют активацию
тромбоцитов.
Аспирин (Aspirin)
Синтез и свойства препарата C.2.2) описаны в гл. 3 «Анальгетики».
ссон о
О-С-СНз
3.2.2
Аспирин является ингибитором циклооксигеназы, что выражается
в нарушении синтеза тромооксана А2 и простациклина (простагланди-
на Ь), которые являются функциональными антагонистами. Причем
синтез тромооксана А2 подавляется в большей степени при использо-
использовании аспирина в малых дозах. Применение аспирина уменьшает риск
инфаркта миокарда и повышает выживаемость больных с инфарктом
миокарда. Снижает опасность инсульта при нарушениях мозгового
кровообращения.
Сульфинпиразон (Sulfinpyrazone)
Синтез препарата C.2.8) описан в гл. 3.
328
-452-
Антикоагулянты, антиагреганты, тромболитики, гемостатики
Сульфинпиразон используется в медицине в качестве нестероидно-
нестероидного противовоспалительного жаропонижающего анальгетика, однако
полагают, что он ингибирует циклооксигеназу тромбоцитов. Кроме того
возможно также, что его действие связано и с действием на мембрану
тромбоцитов и уменьшением количества высвобождаемых при этом
аденозиндифосфата и серотонина, способствующих агрегации тромбо-
тромбоцитов.
В огличие от аспирина он не воздействует на лиц, не имеющих
нарушений системы агрегации.
ИнОо.петацин (Indometacin)
Синтез и свойства индометацина C.2.51) описаны в гл. 3.
СН3О.
Индометацин так же, как и аспирин обратимо ингибирует действие
циклооксигеназы, блокируя образования тромбоксана А2.
Дипиридамол (Dipiridamol)
Синтез препарата A9.4.13) был описан гл. 19 «Антиангинальные
препараты».
Г
HO-CH2-CH2-N NV
но-сн2-сн2
194 13
СН2-СН2-ОН
N-CH2-CH2-OH
Дипиридамол известен в качестве коронарорасширяющего средст-
средства, однако он обладает и определенной антиагрегантной активностью.
-453-
Глава 24
Его предложено применять для предупреждения тромбообразования
после протезирования клапанов сердца в сочетании с варфарииом. Ме-
Механизм антиагрегантного действия дипиридамола не совсем ясен, а эф-
эффективность сомнительна.
Тиклопидин (Ticlopidin)
Тиклопидин — 5-(о-хлорбензил)-4,5,б,7-тетрагидротиено[3,2-с]пи-
ридин B4 2 1) предложено получать разными способами [33, 34, 35,
36, 37. 3S. 39]. Первый способ заключается в N-алкилировании
4,5,6,7-тетрагидротиено[3,2-с]пиридина 2-хлорбензил\лоридом.
СН2С1
24 2 1
Согласно второму способу, тиено[3.2-с]пиридин подвергают N-ал-
килированию 2-\лорбензилхлоридом, и полученную таким образом
соль пирндиния B4.2.2) далее восстанавливают боргидридом натрия
до искомого гиклопидина
СН;С1
NaBH4
24 2 1
24 2 2
Наконец, третий способ синтеза заключается в алкилировании
тиофена окисью этилена с получением 2-B1-гидрокси)этилтиофена
B4.2 3), взаимодействием которого с n-толуолсульфохлоридом получа-
101 соответствующий тозилат B4.2.4) Замещением тозильной группы
в последнем с использованием 2-хлорбензиламина получают амин
B4 2.5). который в условиях реакции члорметилирования циклизуется
в искомый гиклопидин B4 2.1).
О • ?\
СН2-СН2-ОН
24 2 3
-S02-CI
-454-
Ан гикоагулянты, антиагреганты, тромболитики, гемостатики
-CH-j-O-SOj-
-См.,
Тиклопидин подавляет агдезию тромбоцитов и обладает антиагре-
ган!ной активностью. Предполагается, что его действие связано с дей-
действием на мембрат тромбоцитов и уменьшением количества высвобо-
высвобождаемых аденозиндифосфата и серотонина, способствующих агрегации
тромбоцитов.
В широкомасштабных клинических испытаниях тиклопидин вы-
выявил ряд преимуществ по сравнению с аспирином.
Синонимами препарата являются тиклид, анагрегал, тиклозан и др.
24.3. Фибринолитики (тромболитики)
Фибринолитики — это соединения, способные растворять уже об-
образовавшиеся тромбы. Принцип их действия заключается либо в акти-
активации-физиологической системы фибринолиза, активируя фибриноли-
тический фермент плазмин (фибринолизин), стимулирующего лизис
и выведение существующих сгустков крови, либо в восполнении недос-
lafomero фибринолизина. (Гепарин и оральные антикоагулянты неэф-
неэффективны в плане уменьшения размера уже существующих фибрино-
tibix сгустков.)
С целью активации эндогенного фибринолитического механизма
обычно вводят активаторы плазминогена. Наиболее часто применяется
такие препараты, как стрептокиназа и урокиназа.
Полагают, что стрептокиназа взаимодействуя с плазминогеном,
вызывает изменение конформации плазминогена, в результате чего
разрывае1ся ряд пептидных связей в плазминогене и образуется плаз-
мин
Считается также, что в отличие от стрептокиназы, урокиназа непо-
непосредственно расщепляет илазминоген в плазмин, который и вызывает
разрушение фибрина и других составляющих сгустков крови.
Однако их применение связано с определенным риском возникно-
возникновения кровотечений из-за возможного разру шения в плазме фибриноге-
фибриногена и др^ гих коагулирующих факторов.
Принципиально новым типом фибринолтиков является активатор
|качевою пдазмино!ена — альтеплаза.
-455-
Глава 24
Стрептокиназа (Streptokinase)
Стрепгокиназа является белком, продуцируемым определенными
штаммами гемолитического стрептококка группы С, и является
первым клинически полезным фибринолитиком [40. 41, 42, 43, 44,
45]. В отличие от дрчгих активаторов плазминогена, стрептокиназа
не является ферментом и сама не расщепляет какие-либо связи
в молек)ле плазминогена. Она создает эквимолекулярное соедине-
соединение с плазминогеном. образуя комплекс стрептокиназа-плазми-
ноген. В плазминогенной части полученного комплекса при этом
возникают определенные конформационные изменения, приводя-
приводящие к разрыв)' некоторых пептидных связей и трансформирующие
этот комплекс в комплекс стептокиназа-плазмин, или свободный
плазмин, которые и расщепляют фибрин.
Препарат имеет время полужизни в плазме 15-30 мин и использует-
используется внутривенно для лечения пациентов с острыми массивными эмбо-
лиями легких и тромбов вен. а также при инфарктах миокарда.
Недавно предложен ряд производных стрептокиназы, в частности
ацетилированных, которые разрабатываются для применения в качестве
фибринолитиков.
Синонимами препарата являются кабикиназа, стрептаза и др.
Урокиназа (Urokinase)
Урокиназа — фермент, экстрагируемый из человеческой мочи или
клеток почек человека [46, 47. 48, 49, 50, 51, 52, 53, 54, 55]. который
непосредственно расщепляет весьма определению пептидную
связь (Arg-560-Val561) в молекуле плазминогена, трансформируя
таким образом его в плазмин.
Показания к применению такие же, как и у стрептокиназы.
Синонимом препарата является аббокиназа и др.
Алыпеплаза (Alteplase)
Альтеплаза является препаратом человеческого активатора тканево-
тканевого плазминогена (t-PA) и представляет собой гликопротеин молеку-
молекулярной массы 68 000, синтезируемый сосудистыми эндотелиальны-
ми клетками.
Молекулы t-PA впервые были выделены из среды культивируемых
клеток меланомы человека [56, 57, 58], но в настоящее время методами
генной инженерии получают также генетически рекомбшгантную фор-
mv rt-PA.
-456-
Антикоагулянты, антиагреганты, тромболитики, гемостатики
Являясь главным эндогенным промотором фибринолиза, t-PA свя-
зывае1ся с фибрином и так же, как и урокиназа, расщепляет пептидную
связь Arg-560 — Val-561 в молекуле фибрин-связанного плазминогена,
превращая последний в активную молекулу плазмина, который вызыва-
вызывает расщепление фибриновых сгустков. Его действие локализуется в тром-
ботических областях, и, соответственно, вероятность возникновения
системного фибринолиза при его применении намного ниже, чем та,
которая может возникнуть при применении стрептокиназы и урокиназы.
Обе формы (t-PA и rt-PA) имеют очень короткое время полураспада
(около 3 мин) и быстро выделяются из организма, в основном, печенью.
Поэтом) они применяются только инфузионным методом. Препарат
можно назначать пациентам, которым противопоказана стрептокиназа
(например, пациентам, недавно перенесшим стрептококковую инфек-
инфекцию).
Синонимом препарата является активаза и др.
24.4. Гемостатики (прокоагулянты)
Гемостатики являются средствами, применяемыми для остановки
кровотечений мест но или при их резорбтивном действии.
' Иногда после травм, хирургических вмешательств, маточных кро-
кровотечений, при циррозе печени, передозировке фибринолитиков и из-за
других причин активность системы фибринолиза в организме может
повыситься настолько, что может стать причиной кровотечений.
Гемостатики, применяемые в настоящее время в медицине дейст-
в)ют либо путем замещения дефицита факторов свертывания (антиге-
мофильный фактор), который получают из человеческой плазмы, либо
повышением концентрации эндогенных факторов свертывания в плазме
(десмопрессин) или ингибированием естественного механизма фибри-
фибринолиза (аминокапроновая кислота, транексамовая кислота).
Системные гемостатики
Аминокапроновая кислота (Aminocaproic Acid)
Аминокапроновая кислота — 6-аминогексановая кислота B4.4.1)
получается гидролизом s-капролактама при высокой температуре
[56, 57,58, 59,60,61.62].
Н2О
H2N-CH2-CH2-CH2-CH2-CH2-COOH
24 4 1
- 457 -
Глава 24
Поскольку связывание плазминогена или плазмина с фибриногеном
или фибрином опосредуется лизиновыми фуппами, имеющимися
в структурах фибрина и фибриногена, аминокапроновая кислота, явля-
являясь структурным аналогом лизина и отличаясь от него отсутствием
лишь одной аминогруппы, выступает в качестве конкурирующего инги-
ингибитора для связывания плазмин(оген)а с фибрином. Аминокапроновая
кислота сдвигает гомеостатический баланс в сторону коагуляции, вос-
восстанавливая при этом активность фибринолитического механизма.
Аминокапроновая кислота, не являясь прокоагулянтом, как таковая
используется при хирургических вмешательствах и различных патоло-
патологических состояниях, сопровождающихся повышением фибринолитиче-
ской активности крови и тканей. Препарат используется для остановки
кровотечений.
Синонимами препарата являются афибрин, капрацид, эпсиламин.
кофламнн и др.
Транексамовая кислота (Tranexamic acid)
Транексамовая кислота — /и/ад«с-4-(аминометил)циклогексанкар-
боновую кислоту B4.4.5) синтезируют исходя из 4-метил-
бензонитрила, окислением метальной группы которого получают
мононитрил терефталевой кислоты B4.4.2). Нитрильную группу
в последнем восстанавливают водородом с использованием в каче-
качестве катализатора никеля Ренея. Бензольное кольцо полученной при
этом 4-аминометилбензойной кислоты B4.4.3) восстанавливают до
циклогексильного водородом с использованием в качестве катали-
катализатора платины с получением изомерной смеси 4-аминометил-
циклогексанкарбоновой кислоты B4.4.4), из натриевых солей кото-
которой кристаллизацией выделяют требуемый /и/?а«с-изомер B4.4.5)
[63, 64, 65, 66, 67, 68].
H2N-CH2—/ У-
соон
24 4 4
Транексамовая кислота также рассматривается в качестве структур-
структурного аналога лизина. Полагают, что она работает по тому же механизму,
-458-
Антикоагулянты, антиагреганты, тромболитики, гемостатики
что и аминокапроновая кислота, однако активнее последней в 6-10 раз.
Препарат ингибирует действие активатора плазмина и плазминогена,
обладает гемостатическим действием. Его применяют при кровотечени-
кровотечениях пли риске кровотечений на фоне усиления фибринолиза (злокачест-
(злокачественные новообразования, послеродовые кровотечения, желудочно-
кишечные кровотечения, гематурия и т. п.)
Синонимами препарата являются угурол, циклокапрон, амкацид.
транекс и др.
Антигемофильный фактор (Antihemophilic Factor)
Антигемофильный фактор — белок, превращающий протромбин
в тромбин и замещающий дефицит эндогенного гемофильного фак-
фактора, получают переработкой человеческой плазмы [69. 70].
Препарат применяют при лечении классической гемофилии А, для
остановки кровотечений.
Синонимами препарата являются гемофил Т, моноклат, криоблин
и др.
Десмопрессип (Desmopressin)
Десмопрессин - - 8-О-аргининвазопрессин-1-C-меркаптопропио-
новая кислота) B4.4.6) является структурным аналогом вазопресси-
на. Препарат получают многостадийным синтезом, методами спе-
специфичными для пептидной химии, и поэтому его синтез здесь не
рассматривается [71, 72, 73, 74].
Mep-Tyr-Phe-Gln-Asn-Cys-Pro-D-Arg-Gly-NH 2
I I
24 4 6
Нарядч с основным использованием препарата в качестве антидиу-
ретнка при лечении диабета его применяют и при лечении классической
гемофилии А.
Синонимом препарата является DDAVP.
Местные прокоагулянты
Тромбин (Thrombin)
Для остановки местных кровотечений часто применяют тромбин —
препарат естественного тромбина, катализирующий превращение
фибриногена в фибрин.
-459-
Глава 24
Тромбин получают из бычьей плазмы [75, 76, 77] и применяет дня
остановки кровотечения из открытых сос>дов, когда невозможно при-
применить другую техник\
Препарат применяют для остановки мелких кровотечений
Синонимом препарата является тромбостат и др
Абсорбирующий жечатин (Gelatine Absorbable)
Абсорбирующий желатин применяется в виде стерильных пченок
г>бок или п>дры для наружного применения Он иногда применяет-
применяется и орально при жетудочных кровотечениях, хотя и весьма ограни-
ограниченно
Синонимами препарата являются гельфоам, гельфипьм и др
Микрофибриллярный коллагеновый гемостат
(Microfibrillar Collagen Hemostat)
Микрофибриллярный коллагеновый гемостат получают из бычьего
колтшена
Ьго испо1ьз\юг при хир>ргических вмешательствах в качестве
вспомогательного средства при кровотечениях когда другие процедуры
неэффективны и непрактичны
Синонимом препарата является авитен и др
Окисленная целлюлоза (Oxidized Cellulose)
Окис пенная целлютоза это хирургическая марля обработанная
диоксидом азота При контакте с тканевыми жидкостями образует
искусственные аустки, обеспечивающие механический гемостаз
Синонимами препарата явтяются новоцел, оксицел, сурджицел
и др
Список литературы
1
2
4
4
5
6
7
8
US
US
US
LS
Brit
US
Brit
Ger
Pat 2
Pat 2
Pat 3
Pat 4
Pat
Pat 3
Pat
Pat
884 358A959)
989 438A961)
016 331 A962)
119 754A978)
1 ^39 332 A976)
419 578A968)
1 144 905A966)
1 543 579A966)
-460-
^Антикоагулянты, антиагреганты, тромболитики, гемостатики
9 Barker G eta] J Med Chem 16,87A973)
10 US Pat 2 482 510A949)
11 US Pat 2 482 511 A949)
12 I SPat 2 482 512A949)
13 Stahmann 4 et al ' J Am Chem Soc 65, 2285 A943)
14 US Pat 2 427 578A947)
Ь I SPat 2 777 859A957)
16 LSPat 2 765 321 A956)
П US Pat 3 077 481 A963)
18 US Pat 3 239 529A966)
19 IVestE etal'/J Am Chem Soc 83,2676A961)
20 US Pat 2 648 682A953)
21 LSPat 2 701 804A955)
22 LSPat 2 872 457A959)
23 LSPat 3 239 529A966)
24 US Pat 2 723 276A955)
2d Junek J et al Monatsh 87,218A956)
26 Schroder H et al /J Am Chem Soc 79,3291A957)
27 PohlLi J Med Chem 18, 513 A975)
28 lalenteE et al 'J Med Chem 21, 141,213A978)
'29 DieckmannJ Ber 47 1439A914)
30 US Pat 2 899 358A959)
31 Koehch Clil Am Chem Soc 58, 1331 A936)
32 HoreauJ et al Bull Soc Chim France 1948,53
33 MaJfrandJ et al''Em- J Med Chem 9 483A974)
34 Ger Pat 2 530 516A975)
ЗЭ LSPat 4 127 580A978)
36 US Pat 4 174 448A979)
37 Ger Pat 2 048 372A971)
38 LSPat 3 758 506A973)
*9 ThuilherG et al //Eur J Med Chem 9,625A974)
40 US Pat 2 666 729A954)
41 US Pat 2 701 227A955)
42 US Pat 3 063 913 A962)
43 US Pat 3 063 914A962)
44 LSPat 3 107 203A963)
45 US Pat 3 138 542A964)
46 I SPat 2 961 482A961)
47 LSPat 2 989 440A961)
48 US Pat 3 081 236A963)
49 US Pat 4 256 158A966)
-461 -
Глава 24
50. US Pat. 4.160.697A979).
51 US Pat. 4.169.764A979).
52. SobelG etal.'/Am. J. Physiol. 171 768A952).
53. White W et al.//Biochemistry. 5, 2160 A966V
54 LesukA et ab/Science 147,880A965).
55. Astrup T et al.//Proc. Soc. Exp. Biol. Med. 81, 675 A952).
56 Astrup T et al.'/Nature. 159, 681 A947).
57. Astrup T et al.//Nature. 170, 929 A952).
58. Tagnon H et aU'Proc. Soc. Exp. Biol. Med. 70, 359 A949).
59. Calm A et al. /J. Am. Chem. Soc. 68, 2729 A946).
60. Eek J.i<Ot%. Syn. Coll. Vol. II, 28 A943).
61. Meyers С et al.AOrg. Syn. Coll. Vol. IV, 39 A963).
62 Garamaise E et al., 'Can. J. Chem. 34, 743 A956).
63. Einhorn A -'Justus Liebigs Ann. Chem. 310, 194 A900).
64. LevineM et al./'J. Org. Chem. 24, 115 A959).
65. Ger. Pat. 1.443.755A964).
66. Bnt. Pat. 1 202.189A969).
67. Bnt. Pat 1.409.938A973).
68. US Pat. 3.499.925A970).
69 HershgoldA et al./'J. Lab. Clin. Med. 77, 185 A971).
70. LegazM et al., 'Methods Enzymol 45B, 83 A976).
71. Fr. Pat. 1.540.536A968).
72. US Pat. 3.497.491 A970).
73. HuguenmR et aL'/Helv. Chim. Acta. 49, 695 (.1966).
74. ZaoralM et al Coll. Czech. Chem. Commun. 32, 1250 A970).
75. Seegers W et al.,/J. Biol. Chem. 126, 91 A938).
76 Seegen W et al, 'J. Biol. Chem. 146. 511 A942).
77 US Pat. 2.398.077A946).
Глава 25
Тиреоидные гормоны
и анпгипгиреоидные препараты
Эндогенные йодсодержащие тиреоидные гормоны — L-тироксин
и L-трийодтиронин продуцируются щитовидной железой, которая по-
посредством двух указанных йодсодержащих гормонов проявляет выра-
выраженный метаболический контроль практически над всеми клетками ор-
организма Путем контролирования скорости окислительных клеточных
процессов ли гормоны участвуют в регуляции роста и развития орга-
организма, в формировании мозга и костной ткани, воздействуют на актив-
активность ЦНС, на сердечно-сосудистую систему, ЖКТ, метаболизм угле-
углеводов, жиров и белков, влияют на репляцию температуры тела,
мышечн\ю активность, водно-электролитный баланс и воспроизводст-
воспроизводство, играя весьма важную роль для нормального физического и умствен-
ногб развития В отличие от многих других гормонов, они воздействуют
не на отдельные органы, а проявляют диффузный эффект на весь орга-
организм в целом.
Сишез. хранение и высвобождение тиреоидных гормонов щито-
щитовидной железой в основном регулируется тиреотропным гормоном,
а йодиды, необходимые для их синтеза, обычно поступают в организм
с пищей.
Болезни, связанные с щитовидной железой, являются результатом
либо избыточного продуцирования тиреоидного гормона — гиперги-
реоиди 1м, либо его недостаточности — гипотиреоидизм. В обоих слу-
случаях результатом может быть зоб.
Основным клиническим применением тиреоидных гормонов явля-
eica течение гипотиреоидизма.
Эта болезнь характеризуется понижением или отсутствием секре-
секреции эндогенных тиреоидных гормонов. При возникновении в детском
возрасте она клинически может быть описана как кретинизм (детский
нтотиреоидпзм), а > взрослых как микседема (взрослый гипотиреои-
дизм). проявляющаяся в снижении умственной и физической работо-
работоспособное ги, угнетении обменных процессов в организме и отеками.
Носкотьк) гиреоидная фчнкция не восстанавливается, клинический эф-
эффект используемых препаратов проявляется лишь в течение применения
-463-
Глава 25
тиреоидных гормонов. Применение тиреоидных гормонов при гипоти-
реоидизме представляет собой заместительную терапию и не вылечива-
вылечивает самое заболевание.
В настоящее время для лечения гипотиреоидизма применяются
очень небольшое число различных препаратов, таких как препараты
щитовидной железы животных, а также синтетические препараты.
Используются тиреоидин — высушенный тиреоид, который гото-
готовится из бычьих, овечьих и свиных тиреоидных желез, а также тирогло-
булин (пролоид) — очищенный экстракт свиных тиреоидных желез,
синтетические препараты — левотироксин и лиотиронин, а также лот-
рикс — смесь синтетических левотироксина и лиотиронина в соотно-
соотношении 4:1.
При гиперфункции щитовидной железы секреция избыточного ко-
количества тиреоидных гормонов приводит к гипертиреоидному состоя-
состоянию (базедова болезнь, зоб). При этом заболевании применяют препара-
препараты, угнетающие продукцию тиреотропного гормона в передней доле
гипофиза (дийодтирозин), в щитовидной железе (пропилтиоурацил, ме-
тилтиоурацил, метимазол, карбимазол), а также препараты, разрушаю-
разрушающие клетки фолликулов щитовидной железы (радиоактивный йод).
25.1. Препараты для лечения гипотиреоидизма
Гипотиреоидизм (микседема) возникает при сбоях работы щито-
щитовидной железы в выработке тиреоидного гормона. Лечение заключается
в замещении этого гормона вышеуказанными препаратами. Предпочти-
Предпочтительно лечение левотироксином, который представляет собой 3.5,3',5'-
тетрайодтиронин. Используются также препарат лиотиронин —
L-3.5,5 -трийодтиронин, а также лотрикс — смесь синтетических ле-
левотироксина и левотиронина в соотношении 4:1. Из препаратов жи-
животного происхождения используют тиреоидин, а также тиреоглобу-
лин (пролоид).
Левотироксин (Levothyroxin)
Левотироксин — 1,-3-[4-D-гидрокси-3,5-дийодо-фенокси)-3,5-дн-
йодфенил]аланин B5.1.10) получают многостадийным синтезом ис-
исходя из 4-гидрокси-3-йодо-5-нитробензальдегида. Взаимодействием
последнего с бензолсульфохлоридом в пиридине получают соответ-
соответствующий бенюлсульфонат B5.1.1), бепзолсульфонильную группу
в котором с легкостью замещают на 4-метоксифенилоксильную
взаимодействием с 4-мегоксифенолом. Полученный 3-йодо-4-D-
-464-
Тиреоидные гормоны и антитиреоидные препараты
меюксифенокси)бензальдегид B5.1.2) далее вводят во взаимодей-
взаимодействие с а-ацетилглицином в присутствии ацетата натрия по типу
реакции Кневенагеля, при которой образующееся идиденовое со-
соединение циклизуется в производное оксазолона B5.1.3). Оксазоло-
новое кольцо последнего размыкают взаимодействием с метилатом
натрия с получением искомого производного кротоновои кислоты
B5.1.4). Нитрогруппу в последнем восстанавливают до аминогруп-
аминогруппы водородом в присутствии в качестве катализатора никеля Ренея,
с получением соответствующего амина, и далее последовательным
диазотированием и замещением диазогруппы на йод получают ме-
т иловый эфир а-ацетамидо-3,5-дийодо-4-D-метоксифенокси)кро-
тоновой кислоты B5.1.6). Далее, подвергая полученное соединение
одновременному воздействию йодистоводородной кислоты и фос-
фосфора в уксусной кислоте, восстанавливают двойную связь в полу-
полученном производном кротоновои кислоты и снимают мегоксильную
защит> с фенольного кольца. При этом одновременно гидролизует-
ся ацетильная группа при атоме азота и получается D,L-3,5-
дийодтпронин B5.1.7). Аминогруппу в последнем вновь защищают
формилированием муравьиной кислоты в присутствии уксусного
ангидрида с получением БХ-М-формил-3,5-дийодтиронина. Разде-
Разделение изомеров в полученном рацемате осуществляют с использо-
использованием бруцина с получением О-(-)-Т\т-формил-3,5-дийодтиронина
Ь-(+)-М-формил-3,5-дийодтиронина B5.1.8). Защитную формаль-
формальную группу в последнем вновь гидролизуют с использованием бро-
мистоводородной кислоты с получением Ь-(-'-)-3,5-дийодтиронина
B5.1.9), который повергают прямому йодированию с использовани-
использованием йода в присутствии йодистого калия в водном метиламине с по-
получением искомого левотироксина [1, 2, 3, 4].
-SO2CI
H-CH2—COOH
-465-
Глава 25
¦СН=С-СООСп3
N4COC-3
-CH=C-COOCh3
1 NaNOj H2SO4
2 Kl i2 tNHizC
CHZ-OI—COOH
Л— СН2-СН-СООН
NHCHO
Racemate
resolution
—CH2-CH-COOH
NH2
l2 / Kl / CH3NH2
л a—CH2-CH-COOH
NH2
25 1 10
Эффекты препарата сильно зависят от доз. В малых дозах левоти-
роксин обладает анаболическим действием. В средних дозах стимули-
стимулирует рост и развитие тканей, метаболизм белков жиров и углеводов,
повышает функциональную активность ЦНС и сердечно-сосудистой
системы, почек и печени. В больших дозах препарат тормозит тирео-
тропную активность гипофиза и угнетает функцию щитовидной железы.
Левотироксин применяют при гипотиреоидизме, микседеме, тирео-
тиреотоксикозах, эритроидных состояниях, кретинизме.
Синонимами препарата являются элтроксин, левоид. нороксин, син-
троид и др.
Лиотиронин (Liothyronine)
Лиотиронин — Ь-3-[4-D-гидрокси-3-йодо-фенокси)-3,5-дийодфе-
нил]аланин B5.1.11) получают по совершенно аналогичной схеме
с использованием при прямом йодировании Ь-(+)-3,5-дийодтиро-
нина B5.1.9) одного эквивалента йода [5, 6, 7, 8, 9].
•сн2-сн-соон
NH2
25 1 11
-466-
Тиреоидные гормоны и антитиреоидные препараты
Лиотиронин обладает всеми свойствами левогироксина, однако он
оказывает более быстрый эффект и меньше связывается с белками кро-
крови. Показания к применению лиотиронина такие же, как у левотирокси-
на — гипотиреозы, эутиреоидный зоб, тиреоидит, однако считается, что
его применение более целесообразно на первой стадии лечения.
Синонимами препарата являются тибон. циномел, тетроксин и др.
25.2. Препараты для лечения гипертиреоидшма
Гипертиреоидизм возникает вследствие избыточного производства
гиреоидныч гормонов по разным причинам. Лечение возникающего при
этом тиреотоксикоза (базедовой болезни) заключается в применении
лекарств, ингибирующих избыточный синтез гормонов, в применении
радиоактивного йода с целью вывода из строя фолликулов шит обидной
железы с избыточной активностью или ее удаления.
Препараты, используемые при гипертиреоидизме можно классифи-
классифицировать как препараты, угнетающие синтез тиреотропного гормона
в передней доле гипофиза, и к которым относятся дийодтирозин и йод,
а также препараты, угнетающие синтез тиреоидных гормонов в щито-
щитовидной железе (пропилтио>рацил, метилтиоурацил, метимазол, карби-
мазол).
Наиболее пригодны в этом плане последние препараты, классифи-
классифицируемые как тиоамиды. Они сходны в химическом отношении и со-
содержат в качестве функциональной гр\ппы остаток тиомочевины —
тионамидную группу. Наиболее предпочтительны пропилтиоурацил
и метимазол, хотя широко используются и метилтиоурацил и карби-
мазол.
Тиоамиды являются восстановителями. Они ингибируют синтез ти-
тиреоидных гормонов путем ингибирования пероксидазной ферментной
системы, катализирующей окисление поступающих в организм с пищей
йодид ионов в йод, необходимый для йодирования производных тиро-
тирозина. Таким образом они уменьшают концентрацию свободного йода,
необходимого для взаимодействия с производными тирозина, а также
мог\т блокировать реакцию окислительного сочетания моно- и дийод-
гирозинов с образованием L-тироксина и L-трийодтиронина
Для лечения тиреотоксикоза иногда применяют препараты, нару-
нарушающие поглощение йода щитовидной железой, и в частности перхло-
перхлорат калия
В некоторых случаях рекомендуется применять препараты радиоак-
радиоактивного йода, например йодотоп — (Nalbl). Последний кумулируется
в щитовидной железе, включается в состав L-тироксина и L-трийод-
-467-
Глава 25
тиронина и в результате последующего радиоактивного распада и вы-
вызываемого вследствие этого слабого Р-нзл>чения разрушает клетки
фолликулов щитовидной железы, что приводит к постепенному умень-
уменьшению секреции тиреоидного гормона.
Дийодтирозин (Diiodothyrosine)
Дийодтирозин — 3,5-дийодтирозин B5.2.1) получают прямым
йодированием тирозина йодом в присутствии йодида натрия в вод-
водном этапамине либо в смеси уксусной и соляной кислот с добавле-
добавлением перекиси водорода [10, 11, 12].
KI
-сн2-сн-соон
NH2
¦сн2-сн-соон
NH2
25 2 1
Дийодтирозин не обладает выраженной гормональной активностью.
Однако он тормозит выработку тиреотропного гормона передней доли
гипофиза, активирующего деятельность щитовидной железы.
Препарат применяют при гипертиреоидных формах эндемического
и спорадического зоба, при диффузном токсическом зобе и других за-
заболеваниях, сопровождающихся тиреотоксикозом.
Синонимами препарата являются дитирин, йодоглобин и др.
Пропилтиоурацил (Propylthiouracil)
Пропилтиоурацил — 6-пропил-2-тио-2,4-AЯ,3//)-пиримидиндион
B5.2.2) получают конденсацией пропиоиилуксусного эфира с тио-
мочевиной в присутствии этилата натрия [13].
он
СзН;
H2NCONH2
C2H5ONa
А
С3Н7 N SH
25 2 2
Препарат обладает выраженным тиреостатическим эффектом и вы-
вызывает уменьшение синтеза тироксина в щитовидной железе. Препятст-
Препятствует процессу йодирования тиреоглобулина, снижает образование актив-
активной формы йода в щитовидной железе, блокирует систему пероксидаз.
-468-
Тиреоидные гормоны и антитиреоидные препараты
Пропилтио>рацил применяют при runepi иреозе, тиреотоксических
кризах, при гиреодектомии.
Синонимами препарата являются пропицил и тиреостат.
Мепииттоурацил (Methylthiouracil)
Мегилтиоурацил — 6-метил-2-тио-2.4-(Ш,3//)-пиримидиндион B5.2.3)
пол_\чают совершенно аналогично конденсацией пропионилуксус-
ного эфира с тиомочевиной в присутствии этилата натрия [14J.
он
25 2 3
Метилтиоурацил применяют по тем же показаниям, что и пропил-
гио\рацил.
Синонимами препарата являются муркаин и метиоцил.
Метимазол (Methimazol)
Метимазол — 1-метил-2-имидазолтиол B5.2.5) получают взаимо-
дейс1вием диэтилацеталя аминоуксусного альдегида с метилизо-
тиоцианатом с последующим гидролизом ацетальной группы обра-
образующегося производного дизамещенной мочевины B5.2 4) раство-
раствором серной кислоты, при которой одновременно происходит реак-
реакция циклизации с образованием имидазольного кольца искомого
мегимазола [15, 16].
Ch3-N=C=S
CH3-NH-C-NH-CH2CH(OC2H5J
25 2 4
h2SO4
Метимазол также нарушает синтез тироксина и трийодтиронина не-
непосредственно в щитовидной железе, и его применяют по тем же пока-
показаниям, что и пропилтиоурацил и метилтиоурацил для лечения гипер-
Ф> нкции щитовидной железы )¦ больных с базедовой болезнью.
Синонимами препарата являются меразолил. тиамазол, метотирин.
гимидазол и др.
-469-
Глава 25
Карб&пазол (Carbimazol)
Карбимазол, — этиловый эфир 3-метил-2-тиоимидазолин-1-карбо-
новой кислоты B5.2.7) получают одновременным взаимодействием
этиленацеталя бромуксусного альдегида с метиламином и изоциа-
натом калия с образованием З-метил-2-имидазолтиона B5.2.6), ко-
который далее подвергают ацилированию по атому азота этиловым
эфиром хлоругольной кислоты с получением искомого продукта
B5.2.7) [17, 18, 19].
С1СООС2Н5
СООС2Н5
сн.
25 2 S
9
СНз
25 2 7
Показания к применению карбимазола такие же, как и у всех пере-
перечисленных выше препаратов.
Синонимами препарата являются карботироид и неомерказол.
Список литературы
1. Nahm H. et al./'Chem. Ber. 96, 1 A963).
2. Chalmers V. et al.//J. Chem. Soc. 1949, 3424.
3. Ger. Pat. 1.067.826A955).
4. Ger. Pat. 1.077.673 A958).
5. US Pat. 2.784.222 A957).
6. US Pat. 2.823.164A958).
7. US Pat. 2.993.928A961).
8. Brit. Pat. 671.070A949).
9. Roche L. et al.'/Bull. Soc. Chim. France. 4, 462 A957).
10. Bernes J, et al./7J. Chem. Soc. 1950, 2824.
11. Jurd L'/J. Am. Chem. Soc. 77, 5747 A955).
12. US Pat. 2.835.700A958).
13. Anderson G. et al./,'J. Am. Chem. Soc. 67, 2197 A945).
14. List R, /Justus Liebigs Ann. Chem. 236, 1 A886).
15. Wohl A. et al/'Ber. 22, 1354vA889).
16. Jones R. et al.,<'J. Am. Chem. Soc. 71, 4000 A949).
17. US Pat. 2.671.088A954).
18. US Pat. 2.815.349A957).
19. Baker J -. J. Chem. Soc. 1958, 2387.
-470-
Глава 26
Инсулин и синтетические
гипогликемические средства
Препараты, применяемые с целью снижения уровня глюкозы в кро-
крови, называются гипогликемическими средствами. Соответственно, ве-
вещества, вызывающие увеличение уровня глюкозы в крови, называются
гипергликемическими средствами.
Изменения в уровне содержания глюкозы в крови могут быть вы-
шаны различными причинами, основной из которых является сахарный
диабет.
Сахарный диабет — метаболическое заболевание, связанное с вы-
высоким уровнем сахара в крови и сопровождаемое также нарушением
метаболизма углеводов, липидов и белков. Наиболее частым биохими-
биохимическим нар\шением при сахарном диабете является кетоацидоз.
При лечении сахарного диабета используются инсулин и другие ги-
попнкемические средства.
В зависимости от состояния организма диабет классифицируется по
двум типам: инсулинзависимый (тип I), при котором абсолютно подав-
подавлена выработки эндогенного инсулина самим организмом, и инсулинне-
зависимый (тип II). возникающий либо по причине недостаточности
выработки самого инсулина, либо ввиду сбоев работы инсулнновых
рецепторов, что часто является результатом др\гих нарушений в орга-
организме и, в частности, ожирения.
26.1. Инсулин
Гормон поджелудочной железы инсулин является специфическим
антидиабетическим средством, особенно при диабете типа I. Человече-
Человеческий ине\лин представляет собой двухцепочечный белок с молекуляр-
молекулярной массой около 6000, состоящий из 51 аминокислоты (цепь А — 21
аминокислота, цепь В — 30 аминокислот), связанной двумя дисульфид-
ными мостиками.
-471 -
Глава 26
Nh2NH2
I I
NH2S S NH2 NH2
olv-Heu-Va'-Glu-GIu-C^s Cys-Thr-Ser-ileu-C/S-Ser-^eu-Tyr-Glu-Leij-Glu-Asp-T/r Cys-Asp-
Pne Val-Asp-Glu-His-Leu-C,s-Gi^-Ser-His--eu-Val-Glu-Aia-Leu-Tyr-Leu-V3l-Cys-Glu-GI/-Arg-Glv-Phe-Phe-Tyr-Thr-Pro-Lys-Thr
Свиной инсулин отличается от человеческого лишь аминокислотой
в положении 30, а бычий — в положениях 8, 10 и 30.
Инсулин был открыт в 1921 г. Он был выделен из поджелудочной
железы млекопитающих [1, 2, 3, 4, 5, 6, 7, 8. 9]. В настоящее время осу-
осуществлен синтез инсулина человека и некоторых животных (свиней
и крупного рогатого скота) [10, 11, 12], а также предложены способы
его получения методами генной инженерии [13, 14, 15, 16].
В организме инсулин синтезируется Р-клетками островков Лангер-
ганса поджелудочной железы. Скорость его образования изменяется
в зависимости от гипа принятой пищи, желудочно-кишечных гормонов
и неиронального контроля. Циркулирующий в организме инсулин имеет
время биологической полужизни около 5 мин. Быстро разлагается фер-
ферментами и выделяется из крови печенью и почками.
Механизм гипогликемического действия инсулина окончательно не
выяснен. Однако принято считать, что инсулин действует, связываясь со
специфическими рецепторами на поверхности инсулпкчувствительных
тканей, таких как скелетные и сердечные мышцы, жировая ткань, лей-
лейкоциты.
Инс\лин понижает содержание сахара в крови путем превращения
глюкозы в гликоген. Применение инсулина при сахарном диабете при-
приводит к снижению уровня сахара в крови и накоплению в тканях глико-
гликогена. Уменьшение глюкозы в крови устраняет гликозурию и. соответст-
соответственно, уменьшает повышенные диурез и жажду, нормализует
\глеводный. белковый и жировой обмен, снимает явления диабетиче-
диабетической комы.
Инсулин эффективен при инсулинзависимом сахарном диабете. По-
Поскольку инсулин разрушается пищеварительными ферментами, способ
его введения исключительно парентеральный. Обычно подкожно, реже
внутримышечно или внутривенно.
Имеются препараты инсулина пролонгированного действия, что
обеспечивает его медленное всасыванием из места введения.
Препараты инсулина понижают уровень глюкозы в крови.
Инсулин применяют при инсулинзависимом и инсулиннезависимом
сахарном диабете.
-472-
Инсулин и синтетические гипогликемические средства
26.2. Синтетические гипогликемические
препараты
Для больных с диабетом типа II, у которых эндогенная секреция ин-
с_\лина в некоторой степени функционирует, предложен ряд весьма эф-
эффективных гипогликемических препаратов.
Шесть наиболее широко применяемых сегодня препаратов подраз-
подразделяются на две группы. Препараты первой генерации —¦ производные
с\льфонилмочевины были наиболее популярны в ранние 1980-е годы
и включают тол бутам ид, ацетогексамид, толазамид и хлорпропамид.
Препараты второй генерации — производные гуанидина, такие как
глибурид и глипизид, вошли в медицинскую практику после 1984 г. Все
они имеют весьма общие химическое строение и механизм действия
и отличаются строением боковой цепи и. соответственно, активностью
и фармакокинетическими особенностями.
Считается, что действие сульфаниламидов заключается в повыше-
повышении секреции инсулина. Предполагается также, что гипогликемический
эффек1 этих препаратов связан и с подавлением высвобождения глюка-
гона — гормона, продуцируемого сх-клетками островков Лангерганса
поджел>дочной железы и, представляющего собой полипептид, состоя-
состоящий из остатков 29 аминокислот. Влияние глюкагона на углеводный
обмен проявляется гипергликемией, что связано с усилением гликоге-
ногенеза (синтез глюкозы из неуглеродных прекурсоров) в печени.
Важной особенностью всех рассматриваемых препаратов является
возможность их перорального применения.
Многие из лекарственных препаратов, применяемых при различных
заболеваниях, являются антагонистами оральных гипогликемических
препаратов (кортикостероиды, тиреоидные гормоны, тиазидные диуре-
диуретики, фуросемид и оральные контрацептивы). В то же время имеются
препараты, потенцирующие их действие (фенилбутазон, клофибрат,
дикумарол и салицилаты).
Толбутамид (Tolbutamid)
Толбутамид — 1-бутил-З-и-толуолсольфонилмочевина B6.2.2) по-
получается в одн) стадию взаимодействием я-толуолсулъфаниламида
(в виде натриевой соли) с бутилизоцианатом [17, 18, 19. 20].
C|H9-N=C=O
СН3—(\ Л— SO2-NH-C-NH-C4H9
26.2 2
-473-
Глава 26
То.чб) гамид является одним из широко применяемых противодиа-
бетических средств. Его действие предположительно связывается со
стимулирчющим действием на Р-клетки поджелудочной железы, вслед-
вследствие чего происходит интенсивное выделение инсулина. Препарат
применяют при сахарном диабете типа II средней тяжести без выражен-
выраженных микрососудистых осложнений.
Синонимами препарата являются мебенол, орамид, орабет, толбу-
тон, б\тамид, растинон и др.
Хлорпропамид (Chlorpropamid)
Хлорпропамид — 1-(«-хлорфенилсульфонил)-3-пропилмочевина
B6.2.3) получается совершенно аналогичным способом — взаимо-
взаимодействием «-хлорбензолсульфаниламида с пропилизоцианатом [21,
22.23,24.25,26].
о
-SO2-NH-C-NH-C3H7
26 2 3
Показания к применению и механизм действия также сходен с та-
таковым для всей рассматриваемой группы соединений, т. е. связан со
с эмуляцией секреции инсулина при наличии функционирующих тка-
тканей поджелудочной железы.
Препарат назначают при инсулиннезависимом сахарном диабете
стабильного течения.
Синонимами препарата являются диабиниз, хлороназ и др.
Ацетогекса.\тд (Acetohexamid)
Ацетогексамид — 1-(и-ацетил фенилсульфонил)-3-циклогексил-
мочевина B6.2.6) также получается по аналогичной схеме — взаи-
взаимодействием «-хлорбензолсульфаниламида с ииклогексилизоциана-
том. Необходимый для этой цели и-ацетилбензолсульфаниламид
получают диазотированием и-аминоацетофенона в присутствии
дв\ окиси серы и хлорида одновалентной серы с получением суль-
фохлорида B6.2.4). который далее взаимодействием с аммиаком
переводят в сульфонамид B6.2.5). Взаимодействием последнего
с циклогексилизоцианатом получают ацетогексамид B6.2.6) [27, 28,
29, 30.31]
-474-
Инсулин и синтетические гипогликемические средства
сг~
СИз-С
SO2-NH
26 2 6
-C-NH—( >
Показания к применению и механизм действия ацетогексамида ана-
аналогичен таковым у всей рассматриваемой группы соединений.
Синонимами препарата являются цикламид, аглирал и др.
То.1аза.нид (Tolazamid)
Голазамид — 1-(гексагидро-Ш-азепин-1-ил)-3-(я-толуилсульфо-
нил)мочевина B6.2.8). Сохраняя структурное сходство с препара-
препаратами первого поколения, толазамид отличается от всех рассмотрен-
рассмотренных выше наличием* семикарбазидной группы вместо остатка
мочевины и азепиновой вместо циклогексильной.
Синтез препарата осуществляют взаимодействием этил-(я-толу-
олсульфонил)карбамата B6.2.7), который, в свою очередь, получают из
«-голуолсульфонамида и этилового эфира хлору гольной кислоты с 1-ами-
ноазепином [32. 33, 34, 35].
I—COOC2h5
Д—SO2-NH-COOC2H5
26 2 7
h— SO2-NH-CO— NH-N
26 2 8
Препарат, гакже являясь производным сульфонилмочевины I гене-
генерации, обладает стимулирующим действием на р-клетки поджелудоч-
поджелудочной железы и тем же спектром действия, что и вся группа рассматри-
рассматриваемых соединений.
Толазамид применяют при инсулиннезависимом сахарном диабете
без выраженных микрососудистых осложнений.
Синонимами препарата являются норглицин, толиназ и др.
-475-
Глава 26
Глибурид (Gliburide)
Глибурид — 1-[4-[2-E-хлоро-2-метоксибензамидо)тшл]-фенил-
сульфонил]-3-циклогексил-мочевина B6.2.11), являясь препаратом
второго поколения, отличается от рассмотренных выше более
сложным строением сульфаниламидной части молекулы, в которую
введена дополнительная фармакофорная группировка.
Синтез препарата осуществляют исходя из хлорангидрида 2-мето-
кси-5-хлорбензойной кислоты, котор\ю трансформируют в амид B6.2.9)
взаимодействием с 2-фенилэтиламином. Последний последовательно
подвергают с>льфохлорированию хлорсульфоновой кислотой и далее
амидированию аммиаком с получением сульфонамида B6.2.10). Полу-
Полученный сульфонамид вводят во взаимодействие с ииклогексилизоциа-
натом с получением искомого глибурида B6.2.11) [36. 37, 38, 39].
н2м-сн2-сн2
¦CC^NH—Ch.-'
Препарат принадлежит к производным сульфонилмочевины II гене-
генерации. Подобно всем рассматриваемым оральным гипогликемическим
препаратам, он является стимулятором р-клеток поджелудочной желе-
железы, а с другой стороны, повышает чувствительность к инсулину и сте-
степень его связывания с клетками-мишенями. Одновременно препарат
отличается лучшей переносимостью. Гипогликемизирующий эффект
наст>пает при значительно меньших дозах, чем при применении препа-
препаратов I генерации.
Препарат применяют при сахарном диабете типа II средней тяжест и
без выраженных микрососудистых осложнений.
Синонимами препарата являются глибенкламид, манинил, дигабен.
даонил и многие другие.
Глипизид (Glipizid)
Глипизид — 1-циклогексил-3-[[я-[2-E-метилпиразинкарбоксамидо)-
этил]фенил]сульфонил]-мочевина B6.2.13) отличается от глибурида
-476-
Инсулин и синтетические гипогликемические средства
строением амидной части молекулы, в которой фрагмент 2-метокси-
5-хлорбензойной кислоты заменен на фрагмент 6-метилпиразин-
карбоновой кислоты, Метод синтеза препарата также альтернативен
вышеприведенному. В данной схеме синтеза сначала 6-метил-
пиразинкарбоновую кислоту взаимодействием с тионилхлоридом
переводят в соответствующий хлорангидрид, который далее под-
подвергают действию 4-B-аминоэтил)бензолсульфонамида с получе-
получением соответствующего амида B6.2.12). Далее полученный суль-
сульфонамид по традиционной схеме вводят во взаимодействие с цпк-
логексилизоцианатом с пол\чением искомого глипизида B6.2.13)
[40.41.42].
.XT
1 SoCi2
2 H2N-C--2-Cr-
О"
N^XO-NH— СН2-СН2—(\ /У-SO2—NH-C-NH
26 2 13
Показания к применению и механизм действия также сходны с та-
таковыми глибурида.
Синонимами препарата являются глибиниз. минидаб, глюкотрол
и др.
Список литературы
Banting F. et al.//J. Lab. Clin. Med. 7, 251 A921-22).
Abel A.i'Vxoc. Nat. Acad. Sci. USA, U- 132 A926).
Lens У..'/Biochim. Biophys. Acta. 2, 76 A948).
SangerF. et al.//Biochem. J. 49, 463 A951).
Sanger F. et al.;,Biochem. J. 53, 353, 366A953).
Ryle A et al. 'Biochem. J. 60, 541 A955).
Sanger F .'/Science. Ш, 1340 A959).
Nicol D. et al. Nature. 187, 483 A960).
Hodgkin D.'Verh. Schweiz. Naturforsch. Ges. i_50, 93 A970).
10. Katsoyannis P. et al. 'J. Am, Chem. Soc. 88. 164, 166 A966).
1.
2.
j.
4.
5.
6.
7.
8.
9.
-477-
Глава 26
11. Kaisoyannis P. et aL Science, 177- 623 A972).
12. KatsovannisP et al. Recent Progr. Horm. Res. 23, 505 A967).
13. Hsiung H. et al./'Nucleic Acid Res. 6, 1371 A979).
14. Hsiung H etal.''Nucleic Acid Res. 7, 2199A979).
15. Hsiung H et al.//Nucleic Acid Res. 8, 5753 A980)
16. Johnson /.//Science. 219, 632 A983).
17. US Pat. 2.968.158A961).
18. Ger. Pat. 974.062 A955).
19. Ger. Pat 1.066.575A959).
20. Brit. Pat. 808.071 A959).
21. US Pat. 3.013.072A961).
22. US Pat. 3.349.124A967).
23. Ruschig H et al."Arzneim. Forsch. 8. 448 A958).
24 Brit. Pat. 853.555A960).
25. Marshall J et al./J. Org. Chem. 23, 927 A958).
26. Bauer et al./J. Org. Chem. 31., 3440 A960).
27. Ger. Pat. 1.177.631 A967).
28. Ger. Pat. 1.135.891A960).
29. US Pat. 3.320.312A967).
30. Brit. Pat. 912.789A962).
31. Marshall J J. Med. Chem. 6, 60 A963).
32. US Pat. 3.063.903A962).
33. Brit. Pat. 887.886A960).
34. Ger. Pat. 1.196.200A961).
35. Wright J et al.' J. Med. Pharm. Chem. 5, 815 A962).
36. Aumuller W. et al.//Arzneim.-Forsch. .16, 1640 A966).
37. Ger. Pat. 1.283.837A967).
38. Ger. Pat. 1.301.812A965).
39. Belg. Pat. 684.652 A966).
40. Ger. Pat. 2.012.138A969).
41. US Pat. 3.669.966A969).
42. Amborgi V. et al.''Arzneim.-Forsch. 2\ 200 A971).
Глава 27
Корт икостер о иды
Термином «кортикостероиды» обозначаются стероидные гормоны.
секретир\емые корой надпочечников. К ним относятся глюкокортикои-
ды (гидрокортизон, 11-дегидрокортикостерон, кортикостерон), минера-
локортикоиды (альдостерон. 11-дезоксикортикостерон, 11-дезокси-17-
оксикортикостерон) и половые стероидные гормоны (андростерон, анд-
ростендион. эстрон, прогестерон). Образование этих гормонов находит-
находится под прямым контролем полипептидного адренокортикотропного
гормона (АКТГ, кортикотропина) вырабатываемого передней долей
гипофиза. Человеческий АКТГ состоит из 39 аминокислот и имеет мо-
молекулярную массу 4500. Он отличается от АКТГ животных аминокис-
аминокислотным составом на участке 29-33.
Глюкокортикоиды являются эндогенными соединениями, влияю-
влияющими на метаболизм углеводов, липидов и протеинов и проявляющих
противовоспалительное, десенсибилизирующее и антиаллергическое
действие. Они являются иммунодепрессантами, а также обладают про-
противошоковым и антитоксическим действием.
Минералокортикоиды являются эндогенными соединениями, воз-
воздействующими на жидкостный и электролитный баланс в организме.
Однако спектр биологических свойств многих кортикостероидов,
как правило, намного шире спектра свойств, присущих как «чистым»
глюкокортикоидам, так и «чистым» минералокортикоидам по опреде-
определению.
Природные стероидные гормоны в организме синтезируются из хо-
холестерина. Стадией, лимитирующей скорость, является окисление боко-
боковой цепи холестерина с образованием прегненолона и изокапронового
альдегида.
Все кортикостероиды являются производными циклопентанофенан-
трена с кетогруппами при С-) и С2о и ненасыщенной связью между С4
и Cs (обозначаемой как Д4), а также обязательным наличием аксиальной
Р-СО-СН2ОН боковой цепи при Ci7. Друг от друга они отличаются при-
приел гствием или наличием кето- или р-гидроксильной групп при Сц,
а также при С,- и/или С)8. Эти отличия определяют главные фармаколо-
i ические свойства этих соединений и их прекурсоров.
-479-
Глава 27
19
Стероиды обратимо связываются в плазме с двумя протеинами:
кортикостероидсвязывающим глобулином, являющимся специфическим
а2-глобулином. и альбумином, который имеет неспецифическую актив-
активность и слабовыраженное сродство к стероидам.
Не связанные с плазмой свободные стероиды проникают в целевые
клетки путем пассивной диффузии и связываются с цитоплазматиче-
ским растворимо-связанным протеином (акцепторным участком), обра-
образуя комплекс стероид—протеин. Последний и проникает в ядро, где
взаимодействует со стероидными рецепторами на хроматине.
Кортикостероиды не вылечивают болезни, но широко используются
при различных состояниях, когда бывает необходимо использовать их
противовоспалительные, иммуносупрессорные и минералокортикоид-
ные свойства. Кроме того, они применяются для заместительной тера-
терапии у пациентов с недостаточностью надпочечников. Кортикостероиды
могут применяться по жизненным показаниям при астме, острых аллер-
аллергических реакциях и отторжении трансплантатов. Эффективны при пе-
инфекционных гранулематозных заболеваниях, таких как саркоцид,
коллагеновые сосудистые заболевания, ревматоидные артриты, лейке-
лейкемии. При лечении ряда дерматологических и офтальмологических забо-
заболеваний стероиды широко применяются в составе лосьонов, мазей
и т. п.
Кортикостероиды являются очень мощными препаратами, и при их
применении практически невозможно избежать побочных реакций. По-
Поэтому их следует применять в самых малых эффективных дозах и очень
короткое время. Рекомендуется их применение не обрывать резко и их
введение прекращать постепенно.
27.1. Глюкокортикоиды
Глюкокортикоиды — это соединения, которые в первую очередь
действуют на метаболизм углеводов, белков и жиров и, в определенной
степени, на электролитный и водный баланс в организме. Фактически
они действуют на все ткани и органы и могут изменять иммунный ответ
-480-
Кортикостероиды
организма на воздействия различного типа. Конечным результатом их
действия является индукция (анаболизм) или подавление (катаболизм)
синтеза протеинов. Они воздействуют на сердечно-сосудистую систему.
ЖКТ. скелетную мускулатуру, кожу и соединительную ткань, кровь
и эндокринную систему. Прямым показанием к их применению является
острая и хроническая недостаточность надпочечников. Их используют
при коллагенозах, ревматоидных артритах, ревматизме, экземе, нейро-
нейродермитах и других кожных заболеваниях, при аллергиях, трансплантации
тканей, бронхиальной астме и многих других заболеваниях.
Связь между химическим строением и биологическим действием
кортикостероидов весьма сложна. Однако ряд обобщений сделать
можно.
Для проявления глюкокортикоидной активности в структуре пре-
гнановой системы очень важно наличие гидроксильных групп в поло-
положениях СпР и Срос. В то же время для проявления адекватной минера-
локортикоидной активности необходимо наличие кислородной функции
при Сц и С|з, или же требуется отсутствие кислородных функций одно-
одновременно и при С,,,'» при С17. В общем, кажется вероятным, что глюко-
кортикоидное связывание с рецепторными участками должно происхо-
происходить с участием СцР-гидроксильной группы и Срр-СО-СН2ОН
бокового фрагмента стероидной системы. Присутствие в молекуле дру-
других объемистых аксиально ориентированных C-заместителей, как пра-
правило, препятствует связыванию стероидной молекулы с рецепторами,
в то время как аналогичные экваториальные «-заместители больших
трудностей не создают.
Основными эндогенными глюкокортикоидами являются гидрокор-
гидрокортизон и кортизон. Получены и применяются многочисленные синтети-
синтетические аналоги природных глюкокортикостероидов, которые оказались
более эффективными и в настоящее время почти полностью заменили
кортизон (преднизолон, преднизон, дексаметазон и др.).
Глюкокортикоиды применяются орально, внутримышечно, внутри-
внутривенно, ингаляционно, в виде мазей, кремов и т. п.
Гидрокортизон (Hydrocortison)
Гидрокортизон — 11р\17а,21-тригидроксипрегн-4-ен-3,20-дион
B7.1.8) предложено получать разными методами из разных исход-
исходных соединений со стероидным скелетом. Согласно первому спосо-
??, гидрокортизон получают исходя из декстропрегненолона.
С этой целью двойную связь между С16 и С|7 декстропрегненолона
подвергают окислению с использованием перекиси водорода в ще-
-481 -
Глава 27
лочи с получением эпоксида B7 1.1). Взаимодействием последнего
с бромистоводородной кислотой осуществляют раскрытие эпоксид-
эпоксидного кольца с получением 16-бром-17-гидроксидекстропрегнено-
лона B7.1.2). Полученное бромпроизводное подвергают деброми-
рованию водородом с использованием в качестве катализатора
палладия на угле, и далее вторичную гидроксильную группу под-
подвергают этерификации муравьиной кислотой в присутствии я-то-
л\олсульфокислоты с получением З-формилокси-17-гидрокси-
декстропрегненолона B7.1.3). Далее полученный З-формилокси-17-
гидроксидекстропрегненолон подвергают бромированию молеку-
молекулярным бромом, в результате чего бромируется и двойная связь
между С4 и С, и ацетильная метильная группа с получением триб-
ромпроизводного B7.1 4). Взаимодействием продукта с йодидом
натрия осуществляют дегалогенирование полученного вицинально-
го дибромида, в ходе которого одновременно происходит и смеще-
смещение двойной связи в положение между углеродными атомами С;
и Сб с получением бромкетона B7.1.5). Взаимодействием последне-
последнего с ацетатом калия и далее с уксусным ангидридом в присутствии
«-толуолсульфокислоты получают диацетат B7.1.6). С учетом того
факта, что в отличие от ацетатов, формиаты легко окисляются
и дают те же продукты, что и соответствующие спирты, получен-
полученный диацетат окисляют по Оппенауэру, используя изопропилат
алюминия и циклогексанон в качестве акцептора водорода. При
этом одновременно происходит изомеризация двойной связи в пер-
первоначальное положение между С4 и С5 с образованием устойчивого
сопряженного винилкетона, и далее ацетильные защиты обеих гид-
роксильных групп гидролизуют с использованием гидроокиси ка-
калия с получением 17-гидрокси-11-дезоксикортикостерона B7.1.7).
Последний подвергают микробиологическому окислению по поло-
положению Си с получением искомого гидрокортизона B7.1.8). Подоб-
Подобными реакциями микробиологического окисления с применением
самых различных микроорганизмов возможно осуществить гидро-
ксилирование стероидов в различные положения, применяя в каче-
качестве исходного легко доступный прогестерон [1, 2, 3. 4, 5].
Ct/
-482-
Кортикостероиды
'¦ ОН ' СЬзСООК
;Со-с-сн,
Ь
-о~ч°
Второй способ, интересный с точки зрения химика-синтетика, по-
получения гидрокортизона заключается в использовании в качестве ис-
исходного вещества прогестерона. На первой стадии синтеза прогестерон
подвергают микробиологическому окислению, аналогичному вышеопи-
вышеописанному, с получением Па-гидроксипрогестерона B7.1.9). Полученную
таким образом гидроксильную группу окисляют оксидом шесгивалент-
ного хрома в уксусной кислоте с получением 11-кетопрогестерона
B7.1.10). Последний вводят в реакцию с диэтилоксалатом в присутст-
присутствии этила!а натрия с получением соответствующего а-кетоэфира в виде
натриевого енолята B7.1.11), который подвергают бромированию двумя
эквивалентами брома с получением дибромкетона B7.1.12). Получен-
Полученный дибромкетон подвергают перегруппировке Фаворского и далее
гидролизуют с получением ненасыщенной кислоты B7.1.13). Затем кар-
карбонильную группу в положении С3 кетализируют с использованием
этиле и гликоля в присутствии «-толуолсульфокислоты. при которой
происходит миграция двойной связи в положение между углеродными
атомами С5 и С6 с образованием кеталя B7.1.14). Полученный продукт
восстанавливают алюмогидридом лития. При этом до спиртовых групп
восстанавливаются как карбоксильная, так и кетогруппа Сц с образова-
образованием диола B7.1.15). Далее последовательно снимается кетальная за-
защита, в ходе чего в кислых условиях двойная связь вновь мигрирует
обратно в первоначальное положение между С4 и С,, и первичная гид-
роксильная группа ацилируется ангидридом уксусной кислоты в пири-
пиридине с получением продукта B7.1.16). Двойную связь в последнем
окисляют с использованием перекиси водорода в присутствии четырех-
окиси осмия в N-метилморфолине с получением ацетата гидрокортизо-
гидрокортизона B7 1.17). Гидролизом ацетильной группы в последнем гидроокисью
калия получают гидрокортизон B7.1.8) [6, 7].
-483-
Глава 27
С СНЬС OCi
OH2OH TosCH
C-COOh
C-CH2-Oh
1 H20 H
2 (CH3COJO i P/
27 1 15
ч<4^ ^
о
Гидрокортизон можно получать, также используя в качестве исход-
исходного ацетат кортизона. С этой целью ацетат кортизона обрабатывают
семикарбазидом. в ходе чего получают дисемикарбазон B7.1.18) в ре-
результате взаимодействия по обеим карбонильным группам при С3 и С20.
Далее карбонильную группу при Си восстанавливают боргидридом ка-
калия до спиртовой, в ходе чего одновременно удаляется ацетильная
группа при гидроксиле у С2, с получением семикарбазона B7.1.19).
Снятием семикарбазидной защиты с помощью азотистой кислоты полу-
получают гидрокортизон B7.1.8).
Гидрокортизон применяется как в виде свободного спирта (речь
идет о гидроксильнон группе при C2i). так и в виде ацетата, с\кцнната,
фосфата [8].
-484-
Кортикостероиды
СН ,-C-Os,
л I с=о
ri-N-C-NH—N
но.
C=N—NH-C-NP2
-он
сн2
Гидрокортизон оказывает противошоковое, противоаллергическое,
противовоспалительное действие. Повышает содержание глюкозы
в крови, увеличивает .выведение калия и уменьшает выделение натрия
из организма. Проявляет антиметаболическое действие и уменьшает
синтез гистамина в организме.
Препараты гидрокортизона применяются при острых воспалениях,
шоке, первичной или вторичной почечной недостаточности, недос1а-
точности надпочечников, при язвенных колитах, ревматоидных, подаг-
подагрических, псориатрических артритах, при коллагеновых и дерматологи-
дерматологических заболеваниях, аллергических состояниях, офтальмологических
и желудочно-кишечных заболеваниях, при заболеваниях дыхательных
п\тей.
Синонимами препарата являются кортеф, гидрокортон и др.
Кортизон (Cortison)
Кортизон — 17а,21-дигидроксипрегн-4-ен-3,11,20-трион B7.1.26)
также предложено получать разными способами из соединений, из-
изначально имеющих стероидный скелет молекулы.
Первый способ, весьма схожий с вышеизложенным методом для
получения гидрокортизона, исходящим из прогестерона, заключается
в том, что прогестерон подвергают микробиологическому окислению
с получением 11а-гидроксипрогестерона B7.1.9). Далее гидроксильную
гр\пп\ окисляют оксидом шесгивалентного хрома в уксусной кислоте
с пол\чением 11-кетопрогестерона B7.1.10). Последний вводят в реак-
реакцию с диэтилоксалатом в присутствии этилата натрия с получением
-485-
Глава 27
соответствующего «-кетоэфира в виде натриевого енолята B7.1.11),
который подвергают бромированию двумя эквивалентами брома с по-
получением дибромкетона B7.1.12). Полученный дибромкетон подверга-
подвергают перегр>ппировке Фаворского, но продукт далее не гидролизуют
и выделяют ненасыщенную кислот> в виде метилового эфира B7.1.20).
Взаимодействием последнего с пирролидином получают диенамин
B7.1.21). который подвергают восстановлению алюмогидридом лития,
в результате чего кетогруппа при Сц трансформируется в гидроксиль-
н\ю. а карбметоксильная — в первичную спиртовую с образованием
соединения B7.1.22). Кислотным гидролизом последнего и дальнейшим
аиегилированием получают ацетат B7.1.23), гидроксильную группу при
Сц в котором окисляют оксидом шестивалентного хрома до кетонной
с получением соединения B7.1.24). Последнее подвергают действию
чегырехокиси осмия, и поллченный при этом осмат окисляют четырех-
окисью марганца в N-метилморфолине с получением ацетата кортизона
B7.1 25). Гидролиз ацетильной группы в последнем бикарбонатом ка-
калия приводит к получению кортизона B7.1.26) [6, 9. 10].
сн3
с=о
СНз
с=о
с-соосн.
с-снг-оч
-486-
Кортикостероиды
?
-сн2-о-с-сн3
Второй способ получения кортизона исходит из ацетата дигидро-
кортизона. Подвергая последний монобромированию молекулярным
бромом получают 4-бромпроизводное ацетата дигидрокортизона
B^.1.27). Подвергая последнее действию семикарбазида, осуществляют
отщепление бромистого водорода, и одновременно получают семикар-
базон по кетогруппе при С3 с образованием прод>кта B7.1.28). Далее
21-О-ацетилкортизон B7.1.29) выделяют из семикарбазона с помощью
лировиноградной кислоты. Гидролизом ацетильной группы в последнем
бикарбонатом калия получают искомый кортизон B7.1.26) [11, 12, 13].
о
СНз-С-О,
сн2
.С=О
'-ОН
27 1 29
КНСОз I СНзОН
27 1 26
-сн2
^С=0
-он
Кортизон применяют при воспалительных процессах, аллергии, не-
недостаточности надпочечников.
Синонимами препарата являются кортизан, корто, адресон, кортад-
рен и др.
Преднизон (Prednison)
Преднизон — 17а,21-дигидроксипрегна-1,4-диен-3,11,20-трион
B7.1.30) отличается от кортизона наличием дополнительной двой-
двойной связи между Cj и С2. Предложены различные пути его синтеза.
В одном из них. как и в случае синтеза кортизона, исходят из ацета-
-487-
Глава 27
та дигидрокортизона. Однако в данном случае последний подвер-
подвергают дибромированию молекулярным бромом с получением 2,4-
дибромпроизводного ацетата дигидрокортизона B7.1.30). Дегид-
робромированием последнего лутидином и дальнейшим гидроли-
гидролизом ацетильной группы бикарбонатом калия получают искомый
преднизон B7.1.31) [14, 15] Преднизон получают также микробио-
микробиологическим дегидрированием кортизона [16, 17].
Br2?1 35
27 1 Л
Преднизон применяется по тем же показаниям, что и кортизон; при
оспачительных процессах, аллергии, недостаточности надпочечников,
чнако он в несколько раз активнее последнего и меньше влияет на ми-
митральный обмен.
Синонимами препарата являются кортансил, декортизил, паракорт и др.
чеднтолон (Prednisolon)
Преднизолон 11 C.17а,21 -тригидроксипрегна-1,4-диен-3,20-дион
B7 1.33). Структурно преднизолон отличается от преднизона тем,
что кетогруппа в положении Сц преднизона заменена гидроксиль-
ной. Синтез преднизолона осуществляют либо микробиологиче-
микробиологическим дегидрированием гидрокортизона по связи Ct-Cz [16. 17, 18,
19]. либо исходя из 21-ацетокси-11K,17а-дигидрокси-5сс-прегнан-
3,20-диона, который подвергают дибромированию молекулярным
бромом в уксусной кислоте в положения С2 и С4, и датее получен-
полученный дибромид B7.1.32) дегидробромируют нагреванием в коллнди-
ie с получением ацетата преднизолона по положению Сг(. Гидролиз
юследнего приводит к образованию преднизолона B7.1.33) [14].
-488-
Кортикостероиды
Преднизолон также оказывает противошоковое, противоаллерги-
противоаллергическое, противовоспалительное, иммуносупрессивное действие. По-
Повышает содержание глюкозы в крови, увеличивает выведение калия
и уменьшает выделение натрия из организма.
Преднизолон применяют по тем же показаниям, что и все кортико-
стероиды: при ревматизме, полиартрите, бронхиальной астме, нейро-
нейродермитах, экземе.
Синонимами препарата являются антизолон, декоргин, кортолон,
прекорталон и многие другие.
Метилпреднтолон (Methylprednisolon)
Метилпреднизолон — 11р,17а,21-тригидрокси-6а-метилпрегиа-1,4-
дяен-3,20-дион B7.1.38) отличатся от преднизолона наличием ме-
тильной группы в положении С6 стероидного скелета молекулы.
Кажущееся весьма простым различие в структуре требует самостоя-
самостоятельного подхода к синтезу. Синтез исходит из гидрокортизона
B7.1.8), карбонильные группы которого первоначально подвергают
кетализации этиленгликолем в присутствии следов кислоты, при
которой двойная связь в положении С4-С5 изомеризуегся положе-
положение С5-Сб с получением диэтиленкеталя B7.1.34). Продукт окисля-
окисляют до эпоксида B7.1.35) с использованием надбензойной кислоты.
Далее полученный эпоксид вводят во взаимодействие с метилмаг-
нийбромидом, и последующим снятием кетальной защиты восста-
восстановлением водородом получают 5-гидрокси-6-метилпроизводное
дигидрокортизона B7.1.36). Полученный р-гидроксикетон дегидра-
дегидратируют с помощью щелочи, и далее образовавшийся ба-метил-
кортизон B7.1.37) подвергают микробиологическому дегидрирова-
дегидрированию по положению С,-Сг с получением искомого метилпредни-
золона B7.1.38) [20, 21,22,23, 24, 25].
с=о
-о-1
-489-
та дигидрокортизона. Однако в данном случае последний подвер-
подвергают дибромированию молекулярным бромом с получением 2,4-
дибромпроизводного ацетата дигидрокортизона B7.1.30). Дегид-
робро.мированием последнего лутидином и дальнейшим гидроли-
гидролизом ацетильной группы бикарбонатом калия получают искомый
преднизон B7.1.31) [14, 15J. Преднизон получают также микробио-
микробиологическим дегидрированием кортизона [16, 17J.
о
Chh-C-0
Г*"*2
с=о
'"'Oh
с=о
-он
Преднизон применяется по тем же показаниям, что и кортизон: при
восп&тительных процессах, аллергии, недостаточности надпочечников,
однако он в несколько раз активнее последнего и меньше влияет на ми-
минеральный обмен.
Синонимами препарата являются кортансил, декоргизил, паракорт и др.
Преднизолон (Prednisolon)
Преднизолон - 11р.17а.21-тригидроксипрегна-1,4-диен-3,20-дион
B7.1.33). Структурно преднизолон отличается от преднизона тем,
что кетогр>ппа в положении С), преднизона заменена гидроксиль-
ной. Синтез преднизолона осуществляют либо микробиологиче-
микробиологическим дегидрированием гидрокортизона по связи Ct~C2 [16. 17, 18,
19]. либо исходя из 21-ацетокси-11р,17одигидрокси-5а-прегнан-
3,20-диона, который подвергают дибромированию молекулярным
бромом в уксусной кислоте в положения С; и С^, и далее получен-
полученный дибромид B7.1.32) дегидробромируют нагреванием в коллиди-
не с получением ацетата преднизолона по положению С2| Гидролиз
последнего приводит к образованию преднизолона B7.1.33) [14].
~, 27 1 3
-488-
Кортикостероиды
Преднизолон также оказывает противошоковое, противоаллерги-
противоаллергическое, противовоспалительное, иммуносупрессивное действие По-
Повышает содержание глюкозы в крови, увеличивает выведение калия
и уменьшает выделение натрия из организма.
Преднизолон применяют по тем же показаниям, что и все кортико-
стероиды: при ревматизме, полиартрите, бронхиальной астме, нейро-
нейродермитах, экземе.
Синонимами препарата являются антизолон, декоргин, кортолон,
прекорталон и многие другие.
Метилпреднизолон (Methylprednisolon)
Метилпреднизолон — 11р,17а,21-тригидрокси-6а-метилпрегна-1,4-
диен-3,20-дион B7.1.38) отличатся от преднизолона наличием ме-
тильной группы в положении Cg стероидного скелета молекулы.
Кажущееся весьма простым различие в структуре требует самостоя-
самостоятельною подхода к синтезу. Синтез исходит из гидрокортизона
B7.1.8), карбонильные группы которого первоначально подвергают
кетализации эгиленгликолем в присутствии следов кислоты, при
которой двойная связь в положении С4-С5 изомеризуется положе-
положение Cs"C6 с получением диэтиленкеталя B7.1.34). Продукт окисля-
окисляют до эпоксида B7.1.35) с использованием надбензойной кислоты.
Далее полученный эпоксид вводят во взаимодействие с метилмаг-
нийбромидом, и последующим снятием кетальной защиты восста-
восстановлением водородом полччают 5-гидрокси-6-метилпроизводное
дигидрокортизона B7.1.36). Полученный Р-гидроксикетон дегидра-
дегидратируют с помощью щелочи, и далее образовавшийся ба-метил-
кортизон B7.1.37) подвергают микробиологическому дегидрирова-
дегидрированию по положению Ci-Ci с получением искомого метилпредни-
золона B7.1.38) [20, 21, 22, 23, 24, 25].
'•Oh 2 Z" H,SOj
2 СизСОСг
y-2
C=O
I 2-138
-489-
Глава 21
Метилпредничолон. являясь аналогом преднизолона, оказывает бо-
более продолжительный эффект, чем преднизолон и кортизон, и практиче-
практически не обладает минералокортикостероидной активностью и лучше пе-
переносится.
Синонимами препарата являются метипред, медронметризон и др.
Дексаметазон (Dexamethason)
Дексаметазон — 9а-фтор-16а-метил-11 р, 17,21 -тригидроксипрегна-
1.4-диен-3,20-дион B7.1.51), или, проше, 9а-фтор-16а-метил-
преднизолон. Характерным отличительным признаком дексамета-
дексаметазона является наличие в его молекуле атома фтора при С9 стероид-
стероидного кольца.Многостадийный синтез дексаметазона осуществляют
исходя из За-ацетокси-16-прегнеи-11,20-диона, взаимодействием
которого с метилмагнийбромидом в присутствии бромида лития
получают За-гидрокси-16а-метилпрегнан-11,20-дион B7.1.39). Да-
Далее осуществляют введение 17сх-гидроксильной группы. С этой це-
целью взаимодействием с уксусным ангидридом в присутствии и-то-
луолсульфокислоты получают З-ацетокси-17-енолацетат B7.1.40),
который эпоксидируют надбензойной кислотой в 27.1.41, и далее
продукт гидролизуют щелочью с получением оксикетона B7.1.42).
Введение второй гидроксильной группы при С21 осуществляют по-
последовательным бромированием метильной группы молекулярным
бромом, обменом атома брома на йод и взаимодействием йодида
с ацетатом калия с получением соответствующего ацетоксикетона
B7.1.43). Гидроксильную групп)' при С-3 в последнем окисляют до
карбонильной оксидом шестивалентного хрома в пиридине с полу-
получением 3,11,20-трикетона B7.1.44), который вновь подвергают бро-
мированию молекулярным бромом, но уже в положение С4. Дегид-
рогалогенирование последнего осуществляют с помощью семикар-
базида, в результате чего образуется ненасыщенный трикетон
B7.1.45). Во избежание образования семикарбазонов но кетогруп-
пам в положениях С3 и С2о конечный продукт обрабатывают пиро-
виноградной кислотой. Далее специально получают семикарбазоны
по кетогруппам в положениях Сз и С2о. и не вступающую в реакцию
образования семикарбазона кетогруппу в положении Си восстанав-
восстанавливают до спиртовой с помощью боргидрида натрия. После снятия
защитных семикарбазонных групп пол\чают 21-О-ацетокси-16р-
метилгидрокортизон B7.1.46). Полученный продукт подвергают де-
дегидратации путем последовательной трансформации в мезилат
и дальнейшим отщеплением метансульфокислоты с использовани-
-490-
Кортикостероиды
ем метансульфохлорида в пиридине. Полученный при этом продукт
содержит двойную связь в положении С9-Сп B7.1.47). Взаимодей-
Взаимодействием последнего с гипобромной кислотой получают бромгидрин
B7.1.48). Действием ацетата калия последний трансформируют
в эпоксид B7.1.49). Далее взаимодействием с фтористоводородной
кислотой осуществляют раскрытие эпоксидного кольца, при кото-
котором образуется фторгидрин B7.1.50). Наконец, микробилогическим
дегидрированием последнего по связи С,-С2 и одновременным де-
ацетилированием получают дексаметазон B7.1.51) [26, 27, 28].
rgb?-
1 ВГ2
3 CH3COCGGH
" - -^си2
27 1 50
НО.
27 1 51
-491 -
Глава 21
Дексаметазон применяют по гем же показаниям, чго и все кортико-
стероиды, однако он проявляет значительно более сильное противовос-
противовоспалительное и противоаллергическое действие.
Препарат применяют при циркуляторном коллапсе (шоке во вре-
время или после хирургической операции), травме, потере крови, ин-
инфаркте миокарда, ожогах. При тяжелых инфекциях — токсемии, со-
сосудистом коллапсе при менингококковой инфекции, септицемии,
дифтерии, брюшном тифе, перитоните. При экстренных аллергиче-
аллергических состояниях — астматическом статусе, отеке гортани, острой
анафилактической реакции на лекарственные препараты, пирогенных
реакциях.
Синонимами препарата являются декакорт, декардан, гексадрол,
новометазон и др
Бепншетазон (Betamethason)
Бетаметазон — 9а-фтор-16C-метил-11 C,17,21-тригидроксипрегна-
1.4-диен-3.20-дион B7.1.49), или, проще, 9а-фтор-1бр-метилпред-
низолон B7.1.52). Как видно из химического названия препарата,
бетаметазон отличается от дексаметазона лишь ориентацией ме-
тильной группы при С|6. Предложенный метод синтеза отличается
от метода рядом деталей и последовательностью осуществления ре-
реакций кроме первой стадии, а именно- введения мегильной группы
в положение С16 стероидного кольца. Синтез бетаметазона, как
и дексаметазона, осуществляют исходя из За-ацетокси-16-прегнен-
11,20-диона, однако метильную группу в положение C|g стероидно-
стероидного кольца вводят не с использованием метилмагнийбромида, а пу-
путем его взаимодействия с диазометаном. с последующим вооста-
новлением двойной связи между углеродными атомами Ci6-Cr
стероидного кольца водородом с использованием в качестве катали-
катализатора палладия на угле, за счет чего и обеспечивается соответст-
соответствующая р-ориентация вводимой метильной группы [29].
но.
-492-
Кортикостероиды
Являясь изомером дексаметазона, бетаметазон в основном приме-
применяется в качестве препарата местного применения при дерматитах, эк-
экземе, а также в качестве средства против зуда.
Синонимами препарата являются бетакорт, целестон, суперкортен
и др
Триамицинолон (Triamicinolon)
Триамицинолон — 9а-фтор-11 C,16а, 17,21 -тетрагидроксипрегна-
1,4-лиен-3,20-дион B7.1.61) по химическому строению триамици-
триамицинолон отличается от дексаметазона тем, что а-метильная группа
при С16 заменена на гидроксильную. Синтез препарата осуществ-
осуществляют исходя из 21-О-ацетата гидрокортизона B7.1.17). С этой це-
целью на первой стадии синтеза обе карбонильные группы исходного
подвергают кегализации с помощью этиленгликоля. Далее гидро-
ксильные группы в полученном дикетале B7.1.53) замещают на
хлор с* помощью хлористого тионила, и продукт подвергают дегид-
рохлорированию с помощью щелочи, в ходе чего шдролизуется
и 21-О-ацетильная группа. Вновь ацетилируя эту гидроксильную
группу, уксусным ангидридом получают триен B7.1.54). Взаимо-
Взаимодействием последнего четырехокисью осмия получают вициналь-
ный диод B7.1.55). Вторичная гидроксильная группа при С|6 по-
последнего подвергается ацетилированию уксусным ангидридом
в пиридине с получением диацетата B7.1.56). Обработкой продукта
N-бромацетамидом в хлорной кислоте получают бромгидрин
B7.1 57). который действием ацетата калия трансформируется
в эпоксид B7.1.58) Раскрытием эпоксидного кольца фтористоводо-
фтористоводородной кислотой получают соответствующее 9-фтор-11-гидрокси
производное B7.1.59). Микробиологическим дегидрированием по-
последнего связь С|-Сг окисляют в двойную с получением ацетата
триамицинолона B7.1.60), гидролизом ацетильных групп которого
получают искомый триамицинолон B7.1.61) [30, 31. 32].
-493-
Глава 27
о
OHj-C-O.
о
ch3-c-cl
он
он
,с=о
-он
"О—С-СНз
о
CH3COISiHBr/ НСЮ4
27 1 66
'О-С-СНз
27 1 58
HF
jS$^;
но.
с=о
¦он
Триамининолон по фармакологическому действию близок к декса-
метазон> и в некоторых случаях лучше переносится.
Синонимами препарата являются ледеркорт, кенакорт, делсолон и др.
27.2. Минералокортикоиды
Минералокортикоиды играют большую роль в регуляции электро-
электролитного и водного баланса особенно в почках, где они способствуют
реабсорбцин ионов Na" и воды из мочи.
Основным эндогенным минералокортикоидом является альдосте-
рон, который, однако, не используется в клинике. Широко применяется
дезоксикортикостерон.
В огличие от глюкокортикоидов. минералокортикоиды действуют
на >глевотный обмен незначительно. Противовоспалительными и анти-
антиаллергическими свойствами не обладают.
Их применяют при хронической недостаточности надпочечников,
а также с целью повышения тонуса и работоспособности мышц.
Корреляции межд\ химической струк1урой и действием минерало-
кортикоидов весьма сложны, однако ряд частных заключений сделать
можно.
-494-
Кортикостероиды
В частности, следует отметить, что поскольку 11-дезокснкорти-
косгерон не проявляет глюкокортикоидной активности, но является
мошным минералокортикоидом и имеет только два потенциально реак-
реакционно-способных заместителя, которые мог>т взаимодействовать с ре-
рецептором, то это взаимодействие должно осуществляться посредством
C-i-кего и или C^P-CO-CHiOH групп. В то же время замечена необхо-
шмость либо одновременного наличия кислородных функций при Сп и
Cis, либо отновреченного отсутствия кислородных функций и при Сп,
и при С г в стр>ктуре прегнановой системы.
Фторирование в положение С9а повышает минералокортикоидную
активность и Сц-гидрокси (гидрокортизон), и Си-дезокси (дезоксикор-
тико<.терон) соединений,
Альдостерон (Aldosteron)
Альдо(. lepon — Пр^Ьдигидроксипрегн^-ен-гДЗДО-трион^Т.г^)
син1елфуют исходя из 21-0-ацетилкортикостерона, взаимодейст-
вие\( кшорого с хлористым нитрозилом в пиридине получают нит-
ри| B7.2.1). Под действием фотохимического облучения последний
грансформир>ется в оксим B7 2.2), гидролиз которого азотистой
кислотой приводит к получению полуацеталя B7.2.3), являющегося
ацетатом искомого альдостерона. Щелочной гидролиз ацетильной
группы последнего приводит к искомому альдостерону B7.2.4) [33].
он
-сн
f
о
О-С-СНз
О-Н
ОН
27 2 3
27 2 4
-495-
Глава 27
По ряду причин альдостерон практически не используется в качест-
качестве терапевтического средства для корректировки электролитных нару-
нарушений при недостаточности надпочечников, с этой целью чаще исполь-
используются дезоксикортикостерон и флудрокортизон.
Дезоксикортикостерон (Desoxycorticosteron)
Дезоксикортикостерон — ацетат 21-гидроксипрегн-4-ен-3,20-диона
B7.2.6) предложено получать различными методами. Первым спо-
способом (простейшим) является йодирование прогестерона по С7, ме-
тильной группе, с последующим взаимодействием полученного
йодпроизводного B7.2.5) с ацетатом калия, что приводит к получе-
получению искомого дезоксикортикостерона в виде ацетата B7.2.6) [34].
Сн3
с=о
r~J ,c=o
¦сн2
с=о
Второй способ синтеза ацетата дезоксикортикостерона B7.2.6) ис-
исходит из 3-гидрокси-5.16-прегнадиен-20-она. Первоначальным актом
синтеза является защита гидроксильной группы при С3. Ее подвергают
форматированию муравьиной кислотой с получением формиата
B7.2.7). Взаимодействием последнего с изопропенилацетатом в присут-
присутствии л-толуолсульфоислоты получают енолацетат B7.2.8). Обработав
полученный енолацетат йодсукцинимидом, который взаимодействует
исключительно по енолацетатной двойной связи, получают йодкетон,
взаимодействие которого с ацетатом калия приводит к образованию
ацетата B7.2.9). Далее двойную связь при С,6-Сг восстанавливают во-
водородом с использованием в качестве катализатора палладия на угле,
и получают продукт B7.2.10). Окислением последнего изопропилатом
алюминия в присутствии циклогексанона получают ацетат дезоксикор-
дезоксикортикостерона B7.2.6) [35, 36].
но1
,с=о
нсоон
о
Н-С-О'
сн3
.с=о
СНз
Н2С=С-ОСОСН3 ¦' TosOH
-496-
Кортикостероиды
CHj-C-Os,
о
Н-С-О'
сч2
с=о
Нг/PJ—С.
о
н-с-о'
СН3-С-О\
сн2
с=о
27 2 10
/ А1[ОСН(СН3J)з
о
СНз-С-СК.
сн2
27 2 6
Дезоксикортикостерон вызывает усиленную реабсорбцию ионов
Na и выброс ионов 10 из почечных канальцев, что приводит к повыше-
повышению гндрофильности тканей. Способствует увеличению объема плазмы
и повышению АД. Повышает тонус и улучшает работоспособность
мышц.
Препара1 применяют при недостаточности функции коры надпо-
надпочечников, миастении, астении, адинамии, обшей мышечной слабости.
Синонимами препарата являются перкортен, докаболин, корти-
грон и др.
Флудрокортизон (Fludrocortison)
Флудрокортизон — 9а-фтор-11р,17а,21-трнгидроксипрегн-4-ен-
3,20-дион B7.2.14) предложено получать из ацетата гидрокортизона
B7.1.17). На первой стадии синтеза осуществляют дегидратацию
молекулы гидрокортизона с помощью хлорокиси фосфора в пири-
пиридине с получением продукта с двойной связью в положении С9-Сц
B7.2.11). Полученную двойную связь эпоксидируют путем перво-
первоначальной трансформации в бромгидрин с использованием N-бром-
ацетамида и дальнейшим дегидробромированим с помощью ацетата
натрия получают 21-О-ацетокси-9с1-11р-эпокси-17а-гидрокси-4-
прегнен-3,20-дион B7.2.12). Раскрытие эпоксидного кольца в по-
последнем, как и в вышеописанных случаях, осуществляют с помо-
помощью фтористоводородной кислоты, в результате чего получается
¦497-
Глава 27
21 О-ацетат флудрокортизона B7 2 13) Гидролизом ацетильной
гр\ппы последнею ацетатом калия пол)чают фл\ трокортизон
B7 2 14I37]
ОИ РОС3 Р
^Н 2 CH3COONa
о
CH3-C-Ov._
но.
с=о
H-Ov.,
с=о
он
27 2 14
Препарат обчадает практически той же активностью что и дезок-
сикоргикостерон, и даже вытесняет поспедний из медицинского при-
применения
Основным синонимом препарата является флоринеф
Список литературы
1
2
3
4
5
6
7
8
9
10
US Pat 2 649 401 A953)
US Pat 2 638 023 A953)
US Pat 2 794 816 A957)
Julian P et al //J Am Chem Soc 72, 5145 A950)
SondheimerF et al "J Am Chem Soc 78, 816A956)
US Pat 2 769 823 A956)
Hogg] etal J Am Chem Soc 77,4436A955)
Olneto E et al "J Am Chem Soc 78, 1736 A956)
US Pat 2 602 769 A952)
Applezw-eig V //Steroid Drugs Vol \, 62 (New-York, Toronto,
London 1962)
11 Applezw eig Л / Steroid Drugs Vol 1, 14 (New-York, Toronto,
London 1962)
12 Kendall E et al ' J Biol Chem 166, 345 A946)
-498-
Кортикостероиды
13 KendallE etal J Biol Chem 173, 271 A948)
14 IS Pat 2 897 216A959)
15 Applezweig N/ Steroid Drugs Vol 1, 66 (New-York, Toronto,
London 1962)
16 LSPat3 134 718A964)
17 WettsteinA etal/'Helv Chim Acta 39,734A956)
18 Ger Pat 1 135 899A960)
19 Mobile A etal J Am Chem Soc 77, 4184 A955)
20 US Pat 2 897 218 A959)
21 SpeeroG etal/'J ChemSoc 78,6213A956)
22 Speero G et al ' J Chem Soc 79, 1515 A957)
23 US Pat 3 053 832A962)
24 US Pat 4 041 055A977)
23 Fried J etal /J Am Chem Soc 81, 1235A959)
26 Arth G etal/ J Am Chem Soc 80,3160A958)
27 Ger Pat 1 113 690A958)
28 ApplezweigN Steroid Drugs Vol 1 72 (New-York, Toronto,
London 1962)
29 US Pat 3 164 618A965)
^0 US Pat 2 789 118A956)
31 Bernstein S et al //J Am Chem Soc 78, 5693 A956)
32 Bernstein S etal /J Am Chem Soc ?1 1689A959)
3^ Barton D etal/'J Am Chem Soc 82 2641 A960)
34 RingoldH etal /J Am Chem Soc 80,250A958)
3^ SondheimerF etal J Am Chem Soc 79,5034A957)
36 Hall \i etal J Am Chem Soc 77, 5665 A955)
37 Fried J et al ' J Am Chem Soc 76, 1455 A954)
38 HirschmannR et al//J Am Chem Soc 78,4956A956)
39 Ger Pat 1 035 133 A956)
40 Ger Pat 1 028 572A957)
41 US Pat 2 894 007 A959)
42 Brit Pat 792 224 A954)
Глава 28
Женские
половые гормоны
Среди многочисленных регуляторов деятельности организма, гор-
гормонов, огромное значение имеют два стероидных гормона: эстрадиол —
женский половой гормон и тестостерон — мужской половой гормон.
Присутствуя в организме в ничтожных количествах, они регулируют
половую дифференциацию и воспроизводство, а также действуют на
ф)нкционирование многих других физиологических систем. Несмотря
на огромное сходство химической структуры, по физиологическому
действию они весьма различны.
эстраОиол
тестостерон
Двумя основными классами женских половых гормонов являются
эстрогены и прогестины, которые образуются в яичниках, в меньших
количествах — корой надпочечников, в период беременности — пла-
плацентой. Совместно они выполняют весьма важные функции по разви-
развитию вторичных женских половых признаков, контроля беременности,
контроля овуляторного и менструального циклов и модуляции большо-
большого числа метаболических процессов.
Одним из наиболее важных областей применения синтетических эс-
эстрогенов и прогестинов является их использование в качестве оральных
контрацептивов. Эти препараты могут представлять собой фиксирован-
фиксированные комбинации, содержащие постоянные количества эстрогена (на-
(например, этинилэстрадиола) и прогестина (например, норэтиндрона).
комбинации, содержащие постоянное количество эстрогена с варьи-
рлюшими дозами прогестина, или же таблетки, состоящие только из
прогестина в постоянной дозе.
-500-
Женек не половые гормоны
28.1. Эстрогены
Эстрогенами называются соединения природного или синтетиче-
синтетического происхождения, координирующие системную регуляцию во вре-
время овуляторного цикла, включая регуляцию репродуктивного тракта,
грудей, слизистых и других тканей. Они также играют важную роль
в развитии некоторых опухолей, и, в частности, эстрогены, равно как
и антиэстрогены, используются также при лечении опухолей гр>ди
и простаты.
Эсфогены — общий термин, используемый для описания соедине-
соединений, обладающих эстрогенной активностью. Однако они, в свою оче-
очередь, могут быть подразделены на две группы: эстрогены, являющиеся
функционализированиы.ми производными стероидной структуры, и со-
соединения, не содержащие стероидного кольца.
Существует три природных человеческих эстрогена: 17Р-эстрадиол,
наиболее мощный эстроген, который трансформируется в более слабый
метаболит эстрон и который, в свою очередь, метаболизируется в эст-
риол.
17Р-эстрадиол — главный эстроген, синтезируемый и выделяемый
нормальными женскими яичниками. Его окисленный аналог — эстрон
в значительно меньшей степени также выделяется пременопаузальными
яичниками. Гормональное действие эстрогенов на целевые ткани осно-
основывается на сложном механизме, включающем их взаимодействие со
специфическими эстрогеновыми цитоплазматическими рецепторами.
После связывания с последними происходит конформационная пере-
перестройка, в результате которой эстроген-рецепторный комплекс прони-
проникает в ядро, где в последствии диссоциирует и возвращается в нативное
состояние.
Эстрогены применяются при недостаточной функции яичников.
Заместительная эстрогональная терапия используется в агонадаль-
ном, менопаузальном и гипоталамическом и аменоррагическом состоя-
состояниях (т. е. в случаях первичного гипогонадизма и гормональной терапии
у постменопаузных женщин). Эстрогены рекомендуются также при
других клинических эндокринных нарушениях, если установлен гипоэ-
строгенизм.
Наиболее широко эстрогены используются в комбинации с прогес-
ншами в составе ряда оральных контрацептивных препаратов. Часто
используются для предупреждения и лечения остеопороза и в качестве
препаратов заместительной терапии для устранения ряда симптомов
при наступлении менопаузы. Эстрогены используются также в качестве
антагонистов андрогена в случаях андрогенчувсгвительных форм рака.
-501 -
Глава 28
Из препаратов стероидной структ>ры в медицине широко приме-
применяют зстрон, эстрадиол, эстриол и этинилэстрадиол.
Из препаратов нестероидной структуры применяют синэстрол. ди-
этилстильоесгрол, хлортрианизен. Для исследовательских целей многие
препараты можно получать из мочи беременных женщин или беремен-
беременных животных. Препаративное же получение часто осуществляют исхо-
исходя из растительных стеринов - — сапонина, эргостерина и стигмастерина
и др. или же из холестерина либо желчных кислот предварительной де-
деструкцией боковой цепи с образованием соответствующих прекурсоров
для дальнейших синтезов.
Осуществлены и полные синтезы всех главных стероидных гормо-
гормонов. В качестве одного из примеров полных синтезов будет приведен
лишь относительно простой синтез эстрона.
Эстрон (Estron)
Эстрон — 3-гидроксиэстра~1.3,5A0)-триен-17-он B8.1.9) был полу-
получен синтетическим путем различными методами. Согласно первому
способу, наиболее простой и одной из первых схем синтеза, проис-
происходит следующее. Конденсацией 3-метоксифенилацетиена с би-
циклогексан-1,5-дионом по Фаворскому был получен соответст-
соответствующий карбинол B8.1.1). Тройная связь последнего была восста-
восстановлена водородом над паллациевым катализатором с получением
третичного спирта B8.1.2), который был далее дегидратирован
в кислых условиях в соединение B8.1.3). Внутримолекулярным ал-
килированием последнего в присутствии безводного хлористого
алюминия был получен тетрациклический кетон B8.1.4), который
конденсацией с бензальдегидом был трансформирован в енон
B8.1.5). Последний был метилирован в Р-положение относительно
кетогр^ппы йодистым метилом в присутствии трегп-бутнлага ка-
калия, и полученное соединение B8.1.6) было подвергнуто озонолизу
с образованием дикарбоновой кислоты B8.1.7). Циклизация по-
последней в производное циклопентанона привело к получению мети-
метилового эфира искомого эстрона B8.1.8), деметилированием феноль-
ного гидроксила в котором бромистоводородной кислотой был
получен искомый эстрон B8.1.9) [1, 2].
-502-
Женские половые гормоны
28 1 9
Второй способ синтеза исходит из доступного андростенолона (ди-
гидроэпиандростерона) B8.1.10), который, в свою очередь, получают из
ацетата дибромхолестерина. Восстановлением двойной связи в андро-
стенолоне водородом с использованием в качестве катализатора палла-
палладия на угле получают кетоспирт B8.1.11), который далее оксидом
шестивалентного хрома окисляют в дикетон B8.1.12). Последний под-
подвергают бромированию молекулярным бромом в уксусной кислоте
с получением днбромида B8.1.13). Продукт подвергают дегидробро-
мированию нагреванием в коллидине с получением диенона B8.1.14).
При нагревании последнего при температуре около 530 °С происходит
отщепление молекулы метана с ароматизацией кольца А и образовани-
образованием искомого эстрона B8.1,9).
СНз
„А.
-503-
Глава 28
Аналогичный подход к синтезу .эстрона продемонстрирован с ис-
использованием в качестве исходного 1,4,6-андростатриен-3.17-диона
B8.1.15), который при нагревании до 600 °С также ароматизируется
с выбросом молекулы мегана с образованием 8,9-дигидроэквиленина.
Двойная связь последнего в положении С6—Cv была восстановлена во-
водородом над папладиевым катализатором с получением искомого эс-
тронаB8.1 9).
HjC
Предложены и другие методы синтеза получения эстрона с исполь-
использованием в качестве исходных других доступных функционализирован-
ных производных стероидов, выделяемых из природных источников
и далее модифицированных [3, 4, 5, 6, 7, 8, 9. 10, 11, 12, 13. 14. 15, 16,
17. 18, 19,20,21,22].
Как уже было отмечено, эсфон является фолликулярным гормоном,
необходимым для развития женского организма от периода полового
созревания до климактерического периода. Препарат применяют при
недостаточности функции яичников, при климактерических или постка-
страционных расстройствах, бесплодии, переношенной беременности,
слабости родовой деятельности, после гинекологических операций.
Синонимами препарата являются фолликулин, кетоксиэстрин, теле-
стрин, бестрон и многие другие.
Эстрадиол (Estradiol)
Эстрадиол — эстра-1,3.5A0)-фиен-3,17Р-диол B8.1.17) проще все-
всего получить восстановлением кетогруппы эстрона различными вос-
восстановителями и. в частности, боргидридом калия [23, 24J.
квн4
18 1 9
28 1 17
-504-
Женские половые гормоны
Альтернативным путем получения эстрадиола является способ, ос-
основанный на использовании ацетата андростенолона (З-ацетокси-5-
андростен-17-она) B8.1.18). Восстановлением кетогруппы последнего
водородом с использованием в качестве катализатора никеля Ренея
и дальнейшим ацилированием образовавшейся гидроксильной группы
хлористым бензоилом получают диэфир B8.1.19). Последний подвер-
подвергают ряду превращений, и, в частности, восстанавливают двойную связь
в положении С5-С6 водородом над платиновым катализатором, далее
подвергают мягкому щелочному гидролизу в метаноле ацетильную за-
защитную группу при С3, окисляют полученную гидроксильную группу
до кетонной. с использованием оксида шестивалентного хрома, и далее
водной щелочью гидролизуют бензоильную защиту гидроксильной
фуппы при С|7 с получением кетоспирта B8.1.20). Последний, анало-
аналогично методам уже описанным при получении эстрона, подвергают
бромированию молекулярным бромом с получением дибромида
B8.1 21). Далее продукт подвергают дегидробромированию нагревани-
нагреванием в коллидине с получением диенона B8.1.22). При нагревании по-
последнего при температуре около 325 °С в тетралине происходит отщеп-
отщепление молекулы метана с ароматизацией кольца А и образованием
искомого эстрадиола B8.1.17) [25, 26]. Эстрадиол получают также дру-
другими методами [27, 28].
Н3С Oh
СН3 N СН:
Нз? О
Эстрадиол образуется в организме женщины вместе с эстроном
и при применении в виде эфиров кислот оказывает сильное и продол-
продолжительное эстрогенное действие. Применяется по тем же показаниям,
что и эстрадиол.
Синонимами препарата являются делэстроген, эстравал, ретестин,
деладиол и др.
-505-
Глава 28
Эстриол (Estriol)
Эстриол — эстра-1,3,5A0)-триен-3.16ос.17C-триол B8.1.25) пред-
предложено получать из метилового эфира эстрона B8.1.8). Исходный
метиловый эфир эстрона взаимодействием с г«о-пропенилаце-
татом в присутствии я-толуолсульфокислоты переводят в соответ-
соответствующий енолацетат B8.1.23). Далее полученный енолацетат
окисляют до эпоксида с применением надбензойной кислоты. Об-
Образовавшийся при этом эпоксид B8.1 24) подвергают восстанов-
восстановлению алюмогидридом лития с получением эстриола B8.1.25) [29,
30,31,32,33].
H3Q
сн3о-
СН3СОО
28 1 8
СН3О'
С-СНз
С6Н5СОООН_
28 1 23
Н3С О-С-СНз
СЧ3О'
28 1 24
LiAIH4
СН3О'
28 1 25
Эстриол значительно менее активен, чем эстрадиол, однако облада-
обладает селективным свойством стимулировать кровоснабжение и восстанов-
восстановление эпителия гениталий. Кроме того, при его применении уменьша-
уменьшаются психические симптомы климактерического синдрома. Применя-
Применяется в период пременопаузы и менопаузы, при атрофии кожи и приз-
признаках дегенерации гениталий и т. п.
Синонимами препарата являются овестин, гормонин и др.
Этинилэстрадиол (Ethinylesradiol)
Этинилэстрадиол — 17а-этинил-1,3,5A0)-эстратриен-3,17Р-диол
B8.1.26) получают либо конденсацией эстрона с ацетиленом в при-
присутствии гидроокиси калия (реакция Фаворского), либо взаимодей-
взаимодействием ацетиленида натрия в жидком аммиаке с эстроном [34, 35.
36].
-506-
Жинские половые гормоны
нс=сн
28 1 9
28 1 26
Фактически этинилэстрадиол отличается по строению от эстрадио-
ла наличием эчинильной группы у Ср. Однако такое различие в строе-
строении приводит к существенному повышению эстрогенной активности
препарата.
Синонимами препарата являются прогинон, бинордин, гестрол, ов-
ранет, оврат и многие другие.
Гексэстрол (Hexestrol)
Гексэстрол — 4,4'-A,2-диэтилэтилен)дифенол B8.1.29) представля-
представляет собой производное а,р-дифенилэтана и является синтетическим
эстрогеном. Гексэстрол получают реакцией димеризации типа реак-
реакции Вюрца 1-бром-1-D-метокси-фенил)пропана B8 1.27) в присут-
присутствии натрия, магния, алюминия или железа. Исходный 1-бром-1-
D-метоксифенил)пропан B8 1.27), в свою очередь, получают при-
присоединением бромистого водорода к 4-метокси-1-пропенилбензолу.
Последующим снятием метоксильных защитных групп с образо-
образовавшегося продукта димеризации B8.1.28) йодистоводородной ки-
кислотой получают гексэстрол B8.1.29) [37, 38, 39, 40. 41,42, 43].
¦нс=нс-сн3
НВг
¦нс-сн2-сн3
Na
28 1 27
СН3О—i У-НС-СН—/ V-ОСНз
с2н5 —
28 1 28
HI
Значительно отличаясь по строению от стероидных эстрогенных
гормонов, препарат проявляет все присущие этим гормонам биологиче-
биологические свойства.
-507-
Глава 28
Гексэстрол применяют по гем же показаниям, что и эстрон. Его
применяют также при раке предстательной железы пли ее гипертрофии
\ мужчин
Синонимами препарата являются, синэстрол, циклоэстрол и др.
Диэтилстилъбестрол (Diethylstilbestrol)
Диэтилстильоесгрол — т/однс-а,р-диэтил-4,4 -сгильбендиол B8.1.34)
предложено получать разными методами. Согласно первому спосо-
способу, дезоксианизоин алкилируют йодистым этилом в присутствии
этилата натрия, и полученный кетон B8.1.30) вводят в реакцию
Гриньяра с этилмагнийбромидом с получением карбинола B8.1.31)
Дегидратацией последнего перегонкой в присутствии и-толуол-
счльфокислоты получают диметиловый эфир стильбестрола B8.1.32),
метальные группы которого снимаются нагреванием при высокой
температуре с гидроокисью калия с образованием диэтилстильбэст-
рола B8.2 33) [44].
C2H5I' C2HsONa
-OCH3
CjHsMgBr
СНзО
Второй способ получения диэтилстильбестрола заключается в сле-
следующем: 4-гидрокси-пропиофенон подвергают пинаконовому восста-
восстановлению с использованием амальгамы натрия, в результате чего полу-
получают соответствующий пиакон B8.1.34). Далее полученный пинакон
подвергают действию соляной кислоты с получением продукта пинако-
линовой перегруппировки — кетона B8.1.35). Кетогрчппу последнего
восстанавливают с использованием натрия в пзоамиловом спирте, и в
результате получают соответствующий карбинол B8.1.36). Полученный
карбинол обрабатывают соляной кислотой, одновременно осуществляя
и дегидратацию, и перегруппировку в диэтилстильбэстрол B8.1.33) [45,
46]
-508-
Женские половые гормоны
-С-С;Н5
/=\н1г?2ЧЬ\
HCI
28 1 36
28 1 33
Диэтилстильбестрол является производным стильбена и отличается
от синестрола наличием двойной связи с трансконфигурацией двух фе-
иильных групп. По эстрогенной активности препарат превосходит
и эстрон. и гексэстрол.
Синонимами препарата являются дистильбен, менопакс, стильфо-
строл, гилостерон, антигестил и очень многие другие.
28.2. Антиэстрогены
Как следует из самого названия, антиэстрогенами являются соеди-
соединения, подавляющие эффекты эстрогенов. Это синтетические вещест-
вещества нестероидной структуры, весьма вероятно, действующие путем
илокады эстрогенных рецепторов, подавляя тем самым эффекты эст-
poieHOB.
Однако в малых дозах, связываясь с теми же рецепторами, они ока-
оказывают умеренный эстрогенный эффект и только в больших дозах ока-
оказывают антизстрогенное действие. Их применяют как препараты, члуч-
шающие ф>нкциональнлю деятельность яичников в основном при
бесплодии у женщин, а также при лечении эстроген-рецептор позитив-
позитивного рака грудной железы. Их применяют также при андрогенной не-
недостаточности и олигоспермии у мужчин.
Основными антиэстрогенными препаратами, применяемыми в ме-
ищинской практике, являются синтетические препараты кломифен
и тамоксифен. относящиеся к ряду диэтилстильбесгрола.
-509-
Кло.чифен (Clomiphen)
Кломифен — 2-[«-B-хлор-1,2-дифенилвинил)фенокси]триэтиламин
B8.2.4) предложено синтезировать из 4-гидроксибензофенона, взаи-
взаимодействием которого с 2-диэтиламиноэтилхлоридом в прису
в
]рин
B8.2.4) предложено синтезировать из 4-гидроксибензофенона, взаи-
взаимодействием которого с 2-диэтиламиноэтилхлоридом в присутст-
присутствии щелочи получают 4-B-диэтиламиноэтокси) бензофеион B8.2.1).
Последний вводят Г
,. „„.vpuiu t z-диэтиламиноэтилхлоридом в прису-..
вии щелочи получают 4-B-диэтиламиноэтокси) бензофенон B8.2.1).
Последний вводят в реакцию Гриньяра с бензилмагнийхлоридом
с получением соответствующего карбинола B8.2.2). Дегидратацией
последнего хлористым водородом получают 2-[я-1,2-дифенил-
винил)феиокси] триэтиламин B8.2.4), винильный атом водорода
которого замещают на атом хлора с использованием N-хлорсук-
ииннмида с получением кломифена B8.2.4) [47, 48].
2\
н5с2/
N-CH2~CH;
^^Х Hci
о
[Л-с
Н5С2/
,N-CH2-CH2—
CI
28 2 4
Кломифен действует путем усиления фолликулярного роста, вызы-
вызывая овуляцию. Основным показанием для применения кломифена явля-
является индукция овуляции у неовулируюших женщин, у которых еще со-
сохраняется некоторая выработка эстрогена. Кломифен используется при
бесплодии для повышения репродуктивное ги женщин-олигоовуляторов.
имеющих три. четыре овуляционных цикла в год, приводя к нормальной
ежемесячной овуляции.
-510-
Женские половые гормоны
Синонимами препарата являются кломнд, серофен, клостильбегит
и лр.
Тамоксифен (Tamoxifen)
Тамоксифен — B)-2-[я-A,2-Дифенил-1-бутенил)фенокси]1\т,М-
диметилэтиламин B8.2.8) предложено синтезировать исходя из
а-эшлдезоксибензоина. Взаимодействием последнего с 4-мето-
ксимагнийбромидом получают соответствующий карбинол
B8.2.5). формальной дегидратацией которого получают производ-
производное стильбена B8.2.6), и дальнейшим нагреванием с гидрохлори-
гидрохлоридом хинидина в качестве деметилнрующего реагента получают
2-[я-A,2-дифенил-1-бутенил)фенол] B8.2.7). Фенольный гидро-
ксил далее алкилируют диметиламиноэтилхлоридом с использо-
использованием в качестве основания этилата натрия с получением смеси
Е и Z изомеров искомого продукта, из которой дробной кристал-
кристаллизацией из петролейного эфира выделяют искомый Z изомер та-
тамоксифена B8.2.8).
н5с2\
N-CH2-CH2-CI
н5с2/
N-CH2-CH2—
с2н5
28 2
Альтернативным путем получения тамоксифена является непосред-
непосредственное введение в реакцию с ос-этилдезоксибензоином в качестве ре-
реактива Гриньяра 4-B-диметиламиноэтокси)фенилмагнийбромида, даль-
дальнейшей дегидратацией образовавшегося карбинола B8.2.9) и после-
последующим разделением смеси Е и Z изомеров [49, 50, 51, 52, 53, 54, 55,
56].
-511 -
Глава 28
/
н«с2
¦=\ НС
н5с2\
н5с2/
N-CH2-CH2—|
с2н6
28 2 8
Тамоксифен является конкурентным ингибитором эстрадиола. Он
используется при паллиативном лечении эстроген-рецептор позитивном
раке грчди. Используется в сочетании с другими химиотерапевтически-
ми средствами.
Синонимами препарата являются нолвадекс, кессар и др.
28.3. Прогестины
Термин «прогестин» объединяет прогестерон и другие природные
или синтетические соединения с аналогичным прогестерону физиоло-
физиологическим действием
Прогестерон является гормоном, вырабатывающимся стероидоген-
ными тканями -— желтым телом и плацентой. Прогестерон подготавли-
подготавливает эндометрий к имплантации яйцеклетки, предупреждает овуляцию,
способствует увеличению железистой ткани молочных желез.
Его структура больше напоминает структуру мужского полового
гормона тестострона, отличаясь от него лишь заместителем при Ср
(ацетильная группа вместо гидроксильной), чем структуру женских по-
половых гормонов — эстрона или эстролов. Прогестерон считается гор-
гормоном беременности, поскольку вырабатывается в течение всего перио-
периода беременности, уменьшает возбудимость и сократимость матки
и одновременно препятствует созреванию новых яйцеклеток. Этот ре-
результат его действия (предотвращение образования яйцеклеток) равно-
равносилен временной стерильности женщины. Обнаружение этою факта
привело к созданию нового метода предохранения от беременности п\-
тем поддержания в организме искусственного гормонального состояния
-512-
Женские половые гормоны
псевдобеременности.
Прогестины применяются при различных нарушениях менструаль-
менструального цикла, при функциональных маточных кровотечениях разного
происхождения, в качестве контрацептивов. Прогестиновая терапия
применяется и при лечении эндометриоза и эндометриальной карцино-
карциноме. Прогестерон не эффективен при оральном применении вследствие
интенсивной метаболизации, поэтому применяется парентеральным
либо трансвагинальным путем.
Получен ряд активных синтетических прогестинов для использова-
использования в качестве оральных контрацептивов и обладающих большей, чем
у прогестерона, активностью и продолжительностью действия. Более
того, сделаны определенные заключения относительно модификации
структуры прогестерона с целью получения новых прогестинов. Пока-
Показано, что прогестерон значительно теряет свою характерную биологиче-
биологическую активность при введении в положение Ср гидроксильной группы.
В то же время этерификация этой гидроксильной группы длинноиепо-
чечной жирной кислотой, такой как капроновая, приводит к образова-
образованию долгодействующего при парентеральном введении прогестина —
капроната окипрогестерона.
Весьма эффективными прогестинами являются С^ этиннльные
производные — линэстренол, норгестрел, норэтиндрон. которые обес-
обеспечивают высокоэффективную контрацепцию.
Прогестерон (Progesteron)
Прогестерон — прегн-4-ен-3,20-дион B8.3.1) получают окислением
прегненолона изопропилатом алюминия в присутствии циклогекса-
нона в качестве акцептора протонов [57, 58, 59, 60, 61, 62, 63]. Сам
прегненолон получают последовательным окислением и дальней-
дальнейшим расщеплением боковой цепи стигмастерина — стерина расти-
растительного происхождения, выделяемого из соевых бобов.
ho1
СНз
,с=о
/ AI[OCH(CH3Jb
Прогестерон применяют в качестве контрацептива, при аменорее,
пременопачзальном синдроме, бесплодии, недонашнванш: беременно-
беременности, ановуляторных маточных кровотечениях.
-513-
Глава 28
Синонимами препарата являются прогестасерт, синергон, цикло-
гест, прогесгол, пролутон и многие другие.
Гидроксипрогестерон (Hydroxyprogesteron)
Гидроксипрогестерон — 17а-гидроксипрегн-4-ен-3,20-дион B8.3.6)
синтезируют исходя из дегидропрегнеиолона B8.3.2). Сам дегидро-
прегненолон получают последовательной деструкцией и окислени-
окислением боковой спирокегальной группы диосгенина-агликона — одного
из сапонинов растительного происхождения, выделенного из
Discorea Двойную связь при Сj6~C17 дегидропрегненолона окисля-
окисляют перекисью водорода в присутствии щелочи до эпоксидной
B8 3.3). Взаимодействием полученного эпоксида с бромистым во-
водородом в уксусной кислоте получают бромгидрин B8.3.4). Гидро-
ксильную группу при С3 стероидной системы формилируют му-
муравьиной кислотой, и далее восстановлением водородом над
палладиевым катализатором удаляют атом брома при С1Ь с получе-
получением продукта B8.3.5). Гидроксильную группу при С,- последнего
ацилируют ангидридом уксусной кислоты или других карбоновых
кислот (например, капроновой) в присутствии w-толуолсульфо-
кислоты, и далее окисляют формильную группу при С3 изопропила-
том алюминия в присутствии циклогексанона, при которой одно-
одновременно происходит изомеризация двойной связи из положения
С5-С6 в положение С4-С5 с получением искомого эфира гидрокси-
прогестерона, в данном случае ацетата B8.3.6), в каком виде они
и применяются в медицинской практике [64, 65]. Предложены
и альтернативные пути синтеза [66, 67, 68. 69, 70, 71, 72].
снэ
,с=о
ОНО—О'
сн3
,с=о
'-Oh
1 (СНзСОJО TsOH
О
28 3 5
, А1[ОСН(СНзЫз
¦514-
Женские половые гормоны
По биологическим свойствам препарат сходен с прогестероном, од-
иаьо ботее стоек в организме и действует медленнее, оказывая пролон-
пролонгированный эффект. Применяют при менструальных расстройствах,
аменорее, угрожающем выкидыше и прочих патологических процессах,
связанных с недостаточностью желтого тела.
Синонимами препарата являются неолютин, сигинон, капростерон
и др.
Медроксипрогестерон (Medroxyprogesteron)
Медроксипрогестерон — 17а-гидрокси-6а-метилпрегн-4-ен-3,20-
дион B8 3.37) отличается от гидроксипрогестерона наличием в по-
положении С6 дополнительной метильной группы, которую вводят
различными методами [73, 74, 75, 76, 77].
сн3
-О-СОСНз
28 3 7
Применяется по тем же показаниям, что и вышеописанные препараты.
Синонимами препарата являются амен, курретаб, провера и др.
Мегестрол (Megestrol)
Мегестрол — ацетат 17а-гидрокси-6а-метилпрегна-4,6-диен-3,20-
диона B8.3.3) является продуктом дегидрирования медроксипроге-
стерона B8.3.7) хлоранилом (тетрахлор-/7-бензохиноном) в присутст-
присутствии я-толуолсульфокислоты, в результате чего образуется дополни-
дополнительная двойная связь в положении Сб-С7, и дальнейшим ацети-
лированием продукта B8.3.8) в искомый мегестрол B8.3.9) уксусным
ангидридом в присутствии и-толуолсульфокислоты [78, 79].
x^l
-515-
Глава 28
Являясь представителем класса прогестинов, препарат применяется
при различных формах рака и, в частности, рака груди, почек и др.
Синонимами препарата являются мегестат, ниагестин, мегейс и др.
Норэтиндрон (Norethindrone)
Норэтиндрон — 17а-этинил-17Р-гидроксиэстр-4-ен-3-он B8.3.12)
получают исходя из 19-нор-4-андростен-3,17-диона B8.3,10), кото-
который, в свою очередь, получают частичным восстановлением литием
в жидком аммиаке ароматической части З-О-метилового эфира эс-
трона и одновременно кетогруппы при Ср в спиртовую, которую
далее окисляют обратно в кетогруппу оксидом шестивалентного
хрома в уксусной кислоте. Сопряженную с двойной связью карбо-
карбонильную группу при С3 далее трансформируют в этиловый эфир
соответствующего енола B8.3.11) с помощью ортомуравьиного
эфира. Продукт далее этинилируют ацетиленом в присутствии трет-
бутилата калия. После гидролиза соляной кислотой образующегося
О-калиевого производного, при котором гидролизуется и енольная
группа, пол> чают норэтиндрон B8.3.12) [80, 81, 82, 83, 84, 85].
СН3О'
1 Li,' NH3
2 СЮз , СНзСООН
Н3С О
28 1 11
28 3 12
Препарат может применяться и в виде эфиров карбоновых кислот
и, в частности, апетата.
Препарат вызывает переход слизистой оболочки матки в секретор-
секреторную фазу, что способствует развитию оплодотворенной яйцеклетки.
Уменьшает возбудимость и сократимость мускулатуры матки. Приме-
Применяется при аменорее, маточных кровотечениях, бесплодии, невынаши-
невынашивании беременности, миоме, мастопатии, раке эндометрия и ряде других
патологий.
- 516 -
Женские половые гормоны
Синонимами препарата являются концеплап.
и многие другие.
норфор. бревинор
Норгестрел (Norgestrel)
Норгестрел — (±I3-этил-17а-этинил-17р-гидроксиэстр-4-ен-3-он
B8.3 13) отличается от норэтиндрона наличием этильной группы при
С|з стероидной системы, и его синтезируют этинилированием 3-ги-
дрокси-18-метил2.5|0-эстрадиен-17-она [86, 87. 88. 89. 90. 91, 92].
с2н6 он
\"С=СН
28 3 13
Наличие этильной группы при С и стероидной системы делает его
менее активным, чем прогестерон, однако сохраняет активность при
оральном приеме, что обеспечивает эффективную контрацепцию.
Синонимами препарата являются ановлар, норлест, миллигинон,
лоэстрин и др.
Этистероп (Ethisteron)
Этистерон — 17-этинил-17-гидроксиандростен-4-ен-3-он B8.3.14)
получают этинилированием андростенолона ацетиленом и после-
последующим окислением гидроксильной группы при С., стероидкой
системы [93. 94].
28 3 14
Этистерон отличается от норэтиндрона наличием двух метильных
группы при С10 и Си стероидной системы. Это делает его менее актив-
активным, чем прогестерон, однако препарат сохраняет активность при
оральном применении, чем обеспечивается высокоэффективная контра-
контрацепция.
Синонимами препарата являются аменореи, оралутон. прегнорал
» др.
-517-
1.
2.
3.
4.
5.
6.
7.
8.
9.
10.
И.
12.
13.
14.
15.
16.
17.
18.
19
20.
21.
22.
23.
24.
25.
26.
27.
28.
29.
30.
31
32
Список литературы
34.
35.
36.
37.
38.
39.
Johnson W et a].//J. Am. Chem. Soc. 72, 1426 A950).
Johnson W. et al./'J. Am. Chem. Soc. 74, 2832 A952).
Anner G et aL'/Helv. Chim. Acta. 31, 2173 A948).
Anner G. et al.//Helv. Chim. Acta. 32, 1957 A949).
,4/ww 6'. et al.//Helv. Chim. Acta. 33, 1379 A950).
Торгов И. и др.//ДАН СССР. 135, 73 A960).
Sih Ch. et al. /J. Am. Chem. Soc. 87, 2765 A965).
KalvodaJ. etal./.'Helv. Chim. Acta. 46, 1361 A963).
Dryden H. et al./786, 742 A964).
MorandP. et al.//Chem. Rev. 68, 85 A968).
Velluz L et al./.Angew. Chem. 72, 725 A960).
Velluz L, et aL /Angew. Chem. 77, 185 A965).
5>«/г/г //. et al./'J.Chem.Soc. 1963. 5072.
Smith H. et al.//Experientia. 19, 177 A963).
Torgovl. et al./'/Tetrahedron Lett. 1963, 1553.
Torgov I. et al.'/Tetrahedron Lett. 1964. 171.
. FieserL, FieserM. //Steroids. New York: Reinhold, 1959. P. 495.
Windholz T. et al./'Angew. Chem. Int. Ed. 3, 353 A964;.
BartlettP. et al.//J. Am. Chem. Soc. 95, 7501 A973).
Danishefsky S. et al.//J. Am. Chem. Soc. 98, 4975 A976).
Kametani T. et al.//J. Am. Chem. Soc. 99, 3461 A977).
Grieco P. et al./'J. Org. Chem. 45, 2247 A980).
US Pat. 2.096.744A937).
Ger. Pat. 698.796A932).
JnhoffenH. etal.'/Ber. 74, 1911 A941).
US Pat. 2.361.847A944).
. Eder V. et al.ABer, 109, 2948 A976).
. Oppolzer W. et al./'-Helv. Chim. Acta. 63, 1703 A980).
GallaherF.iil. Am. Chem. Soc. 76, 2943 A954).
Butenandt.A. et al.'-'Z. Naturforsch. L 82 A946).
Huffmann M. et al.//Science, ,100, 312 A944).
Huffmann M. et al. /J. Am. Chem. Soc. 69, 1835 A947).
US Pat. 1.967.351 A930).
Inhoffen H. et al./Ber. 71, 1024 A938).
Ger. Pat. 702.063 A938).
Ger. Pat. 516.444A937).
Dodds E. et al.//Proc. R. Soc. London, Ser. B218, 253 A940).
Bernstein S. et al./'J. Am. Chem. Soc. 62, 2871 A940).
Bun-Hoi N. etal.'-'J. Org. Chem. J4, 1023 A949).
-518-
Женские половые гормоны
40
41
42
43.
44.
45.
40.
47.
48.
49.
50.
51.
52.
53.
54.
55.
56.
57.
58.
59.
60.
61.
62.
63.
64.
65.
66.
67.
68.
69.
70.
71.
73.
74.
75,
76.
79.
S0.
US Pat. 2.357.985A944).
Brit. Pat. 523.320A938).
Fr. Pat. 855.879A939).
Kharash M. et al.'J. Am. Chem. Soc. 65, 491 A943).
Dodds E. et al .//Nature. 1Ц, 247 A938).
US Pat. 2.421.401 A947).
Ger. Pat. 715.542A939).
US Pat. 2.914.563A959).
Belg. Pat. 782.321 A971).
Brit. Pat. 1.013.907A963).
Brit. Pat. 1.064.629A966).
. Ger. Pat. 1.468.088 A963).
. Bedford G. et aL /Nature. 2J2, ?33 A966).
. US Pat. 4.536.516A985).
. Robertson D. et al./'J. Org. Chem. 47, 2387 A982).
. Miller R. et al.'/J. Org. Chem. 50, 2121 A985).
. Al-Hassan M. et al.//'Synth. Commun. 17, 1247 A987).
. US Pat. 2.379.832A945).
. Oppenauer R./'Rec. Trav. Chim. Pays-Bas Belg. 56, 137 A937).
US Pat. 2.232.438A941).
US Pat. 2.420.489A947).
HeylF. et al.//J. Am. Chem. Soc. 72, 2617 A950).
Slomp G. et al.AJ. Am. Chem. Soc. 65, 491 A943).
Johnson J. et al.//J. Am. Chem. Soc. 93, 4332 A971).
RingoldH. et 1. J. Am. Chem. Soc. 78, 816 A956).
US Pat. 2.802.839A947).
US Pat. 4.041.055 A977).
US Pat. 2.648.662A953).
US Pat. 2.777.843A957).
US Pat. 2.786.857A957).
US Pat. 2.813.060A977).
US Pat. 3.000.883A961).
Cutler F. et а1.Л. Org. Chem. 24, 1629 A959).
US Pat. 3.147.290A964).
Ellis, B. et al.'J. Chem. Soc. 1957, 4092.
US Pat. 3.061.616A96).
Ger. Pat. 1.097.986A957).
Babcock J. et al.' J. Am. Chem. Soc. 80, 2904 A958).
US Pat. 2.891.079A959).
RingoldH. et 1. J. Am. Chem. Soc. 8L. 7312 A959).
US Pat. 2.774.122A956).
-519-
Глава 28
81. US Pat. 2.774.777A956).
82. Djerassi С et al <J. Am. Chem. Soc. 76, 4092 A954).
83 Ringold H et I. J. Am. Chem. Soc. 78, 2477 A956).
84. I'eberwasser H. et al. /Helv. Chim Acta. 34, 344 A963).
85. OnkenD et al. /Die Pharmazie. 25, 3 A970).
86. Bnt. Pat. 1.041.279A961).
87. Bnt. Pat. 1.041.280 A961).
88. Ger. Pat. 2 030.056A970).
89. Buzby G et al./.'J. Med. Chem. 9, 782 A966).
90. Smith H et al.,/J. Chem Soc. 1963, 5072.
91. Smith H et al./ J. Chem Soc. 1964, 4472.
92 Smith H et al.'/Expenentia. 19, 394 A963).
93. US Pat. 2 272 131A942).
94. US Pat. 4 041.055A977).
Глава 29
Мужские половые гормоны
и анаболические стероиды
Термин «андрогены» относится к ряду природных и синтетических
соединений, проявляющих маскулинизирующее и анаболическое дейст-
действие тестостерона — основного физиологического эндогенного андро-
генного i ормона.
Андрогены, или, как часто их определяют, мужские половые гор-
гормоны или анаболические стероиды, и, в частности, тестостерон в муж-
мужском организме вырабатываются мужскими половыми железами. Анд-
Андрогены имеют маскулинизирующий, анаболический и ростостиму-
лирующий эффекты. Под их влиянием развиваются половые органы,
вторичные половые признаки, контролируется сперматогенез. Тестосте-
Тестостерон способствует также синтез) белка в организме (анаболическое дей-
действие), увеличивает реабсорбцию воды и ряда ионов в почках. Физиоло-
Физиологический эффект тестостерона и других андрогенов проявляется на
протяжении всей жизни мужчины, начиная с внутриутробной, в частно-
частности с маскулинизации урогенитального тракта. Мужской организм вы-
вырабатывает ежедневно от 2,5 до 10 мг тестостерона и в наибольшем ко-
количестве ранним утром Андрогены играют весьма важную роль в спер-
сперматогенезе и созревании спермы, в процессе роста мускульной массы,
тембре звучания голоса и т. д. Следует отметить, что женский организм
также вырабатывает андрогены. но в значительно меньшем количестве,
чем \ мужчин. Использование андрогенных стероидов в медицинской
практике показано в качестве заместительной терапии у мужчин при
недостаточной функции мужских половых желез, половом недоразви-
ши. импотенции, климактерических и других нарушениях, а у жен-
женщин — при раке молочной железы и яичников, при климактерических
расстройствах.
Как и все стероидные препараты, андрогены являются фуикштона-
лизированными производными циклопентанофенаитрена.
Ьыло проведено много исследований, имеющих целью создать пре-
препараты с высоким андрогенным и малым анаболическим потенциалом,
однако в большинстве своем они оказались безуспешными. Бхдучи
сгр\кт>рно родственными тестостерону, они проявляют как андроген-
-521 -
Глава 29
н)ю. так и анаболическою активность, что часто используется спорт-
спортсменами для нарашивания массы мышц.
В то же время все используемые в настоящее время анаболики
имеют андрогенную активность.
29.1. Андрогены
В практической медицине в качестве андрогенов широко использу-
используются эфиры тестостерона (пропионат, ципионат и энантат) и синтетиче-
синтетический аналог тестостерона — метилтестостерон.
Андрогенный эффект тестостерона во многих тканях зависит от
степени его превращения в дигидротестостерон ферментом 5-а-редук-
газой в целевых тканях. Считается, что все стероиды, включая тестосте-
тестостерон, проявляют свой эффект путем связывания с соответствующими
рецепторами в целевых тканях. Показано, что сродство к рецепторам
5-а-дигидротестостерона к андрогенным рецепторам примерно в 10 раз
превышает таковое у тестостерона. Показано также, что связывание
андрогенов с соответствующими рецепторами приводит к синтезу в ор-
организме некоторых специфических белков, т. е. их применение всегда
сопровождается и анаболическим действием.
С разными целями были получены многочисленные синтетические
аналоги андрогенов. в том числе и с целью пролонгирования андроген-
ною эффекта, и с целью увеличения абсорбир\емости препаратов при
разных путях введения. Модификации тестостерона включали этерифи-
кацию 17-р-гидроксильной группы и, в частности, получение сложных
эфиров тестостерона метилированием (метил тестостерон, дромстано-
лон), деметилированием (нандролон), введением атомов галогена в сте-
стероидный скелет (флуоксиместерон), заменой циклогексанового кольца
А стероидной структуры на тетрагидропирановое (оксандролон), введе-
введением дополнительного гетероциклического кольца в стероидную струк-
структуру (станозолол).
Андрогены используются при терапии андро! енодефицитных со-
состояний, таких как гипофункция яичек, евнухизм и евнухоидизм, каст-
кастрация, импотенция, климактерические состояния, а также при раке мо-
моточной железы и яичников у женщин до 60 лет.
Тестостерон (Testosteron)
Тестостерон - 17Р-гидроксиандрост-4-ен-3-он B9.1.5) предложено
пол\чагь разными путями из различных исходных соединений,
включая холестерин, но, однако, чаще всего исходят из ацетата анд-
ростеполона. С этой целью кетогр\ппу при СO стероидной системы
-522-
Мужские половые гормоны
ацетат-андростенолон восстанавливают до гидроксильной либо
с помощью боргидрида натрия, либо алюмогидридом лития, либо
водородом над никелем Ренея, но всегда с получением 17Р-гид-
роксисоединения. В рассматриваемом варианте синтеза восстанов-
восстановление боргидридом натрия или водородом над никелем Ренея
приводит к получению ЗР-ацетокси-5-андростен-17Р-ола B9.1.1).
Пол\ченную в результате восстановления гидроксильную групп)'
далее подвергают ацилированию хлористым бензоилом в пиридине
с получением диэфира B9.1.2). После чего с >четом разницы в ки-
кислотной части двух присутствующих в молекуле сложноэфирных
групп, а также давно замеченного факта, что эфиры — производные
17-гидроксигруппы гидролизуются труднее, чем эфиры — произ-
производные 3-гидроксигруппы, селективным гидролизом гидроокисью
калия в этаноле снимается ацетильная защита гидроксильной груп-
группы при Сз, и полученный спирт B9.1.3) окисляется до кетона
B9.1.4) изопропилатом алюминия в присутствии циклогексанона
в качестве акцептора водорода, в ходе которого одновременно про-
происходит изомеризация двойной связи из положения Cs-Q в поло-
положение С4-С5. Дальнейшим гидролизом щелочью сохранившейся
сложноэфирной части молекулы получают искомый тестостерон
B9.1.5) [1, 2, 3, 4, 5, 6]. При необходимости перевода его в соответ-
соответствующий сложный эфир (пропионат, энантат, ципионат и некото-
некоторые другие эфиры тестостерона) далее осуществляют необходимое
ацилирование.
В лечебных целях препараты (эфиры) тестостерона применяется
при половом недоразвитии, функциональных нарушениях в половой
системе, гипертрофии предстательной железы, климактерических рас-
-523-
Глава 29
стройствах у мужчин, некоторых видах бесплодия, ооусловленных на-
нарушением сперматогенеза, посткастрационном синдроме, эндокринной
импотенции. Тестостерон иногда применяют для лечения женщин
с от холями половых органов и молочных желез, при климактериче-
климактерических расстройствах, когда противопоказаны эстрогенные препараты.
При пероральном применении сам тестостерон неактивен, поэтому,
в основном, применяется в виде эфиров карооновых кислот (пропионат,
энантат, ципионат и некоторые другие эфиры тестостерона).
Синонимами препарата являются гистерон, малоген, менопакс, тес-
торал и др.. а синонимами эфиров тестостерона являются андронат, де-
потест, эверон и многие другие.
Метилтестостерон (Methyltestosteron)
Метилтестостерон — 17Р-гидрокси-17а-метиландрост-4-ен-3-он
B9.1.7) также предложено синтезировать из андростенолона, вводя
его во взаимодействие с метилмагниййодидом с получением соот-
соответствующего третичного спирта B9.1.6) и дальнейшим окислением
гидроксильной группы при С3 в кетонную оксидом шестивалентно-
шестивалентного хрома. При этом в условиях реакции происходит одновременная
изомеризацией двойной связи с получением искомого метилтесто-
стерона B9.1.7) [7, 8, 9, 10].
СН3Мд!
Метшпестостерон, являясь синтетическим аналогом тестостерона,
обладает всеми свойствами тестостерона, оказывая стимулирующее
действие на развитие мужских половых органов и вторичных половых
признаков, однако не разрушается ферментами ЖКТ и поэтому может
применяться орально. Применяется по тем же показаниям, что и тесто-
тестостерон при половом недоразвитии, ф\ нкниональных нарушениях в по-
половой сфере, климаксе у мужчин и связанными с этим сосудистыми
нервными расстройствами. Препарат применяют также при дисфунк-
дисфункциональных маточных кровотечениях в преклимактерическом и кли-
климактерическом периодах у женщин, при раке молочной железы и яич-
яичников.
-524-
Мужские половые гормоны
Синонимами препарата являются андрорал, тесторал. оравирон
и др.
29.2. Антагонисты андрогенов
С> шествуют и антагонисты андрогенов — препараты, снижающие
продукцию андрогенов мужскими половыми железами и подавляющие
сперматогенез п>тем блокады рецепторов андрогенов. К ним относятся
ципротерон и флутамид.
Ципротерон (Cyproteron)
Ципротерон — ацетат 6-хлор-17а-гидрокси-1а,2а-метиленпрегна-
4,6-диен-3.20-диона B9.2.14) получают из ацетата 17а-гидрокси-
прогестерона B8.3.36). Дегидрированием последнего хлоранилом
(теграхлор-«-безо\иноном), в результате чего образуется дополни-
дополнительная двойная связь в положении С6-С- B9.2.8). и дальнейшим
дегидрированием двуокисью селена получают соответствующий
дивпннлкетон — 17а-ацетокси-1,4,6-прегна-трпен-3,20-дион B9.2.9).
Подвергая последний воздействию диазометана, осуществляют ре-
реакцию 1,3-диполярного присоединения по С|-Сг двойной связи сте-
стероидной системы с получением производного дигидропиразола
B9.2.10). Последний под действием хлорной кислоты в диоксане
разлагается с выбросом молекулы азота и образованием циклонро-
панового производного B9.1.11). Далее перекисью бензоила селек-
селективно окисляют двойнлю связь в положении С(,-С7, и образовав-
образовавшийся эпоксид B9.2.12) подвергают действию хлористого водорода
в уксусной кислоте, в результате чего происходит образование
хлоргидрина и его последующая дегидратация и одновременно рас-
раскрытие циклопропанового кольца с образованием соединения
B9.2 13). Нагревая последнее с коллпдином, в результате внутри-
внутримолекулярного алкилирования осуществляют циклизацию в цикло-
пропановое кольцо с получением ципротерона B9.2.14) [11, 12].
-525-
Глава 29
>^Ozf°
CICH
Ch3
c=o
"O-COCH3
29 2 13
CH3
C=0
¦"O-COCH3
Cl
29 2 14
Ципротерон применяют для контроля полового влечения у мужчин
в случае сексуальных отклонений, а также при неоперабельной карци-
карциноме предстательной железы. У женщин препарат применяется при гя-
желых случаях андрогенизации, а у детей — при идиопатической преж-
преждевременной половой зрелости.
Синонимами препарата являются ципростат, андрокур, дайан и др.
Флутамид (Flutamid)
Флутамид — 4'-нигро-3|-трифторметилизобутиранилид B9.2.15),
несгероидный антагонист андрогенов, получают ацилированием
4-нитро-З-трифторметиланилина хлорангидридом изомасляной кис-
кислоты [13. 14, 15].
С1-С-СН-СНз
о сн3
¦NH-C-CH-СНз
29 2 15
Флутамид — нестероидный препарат, обладающий антиандроген-
ным действием. Препарат блокирует связывание аидрогенов клетками
тканей-мишеней, препятствуя действию андрогенов Механизм его дей-
действия, возможно, связан также с торможением транспорта дигидроте-
стоегерона. Препарат способствует уменьшению размеров и плотности
предстательной железы и уменьшает количество метастазов при раке
последней, в связи с чем и применяется при паллиативном лечении рака
предстательной железы.
Синонимами препарата являются фугерел, э>лекин и др.
-526-
Мужские половые гормоны
29.3. Анаболики
В реплыате поиска новых андрогенных соединений были получе-
получены очень близкие по структуре тестостерону вещества с более выра-
выраженной, и даже избирательной, анаболической активностью. Их наибо-
iee характерным свойством является способность стимулировать синтез
белка в opiainove, улучшать азотистый обмен, задерживать выделение
из организма азота, серы, фосфора, калия и кальция, в результате чего
чвеличивается масса мышц, развивается костная ткань и улучшается
общее сосшяние организма, улучшается аппетит.
Анаболические стероиды используют при кахексии, астении, после
тучевой ic-раиии, при остеопорозе, для стимуляции регенераторных
процессов
Нандролоп (Nandrolon)
Нандролон — 17Р-гидроксиэстр-4-ен-3-он B9.1.7) получают исходя
из эстрадиола B8.1.17). Фенольную гидроксильную группу послед-
последнею подвергают метилированию диметилсульфатом в присутствии
гидроокиси натрия с получением соответствующего метилового
)фира B9 3 1), и далее ароматическое кольцо восстанавливают ли-
литием в жидком аммиаке с получением эфира енола B9.3.2)
(CH3OJSO2
СН3О'
29 3 1
Li / NH3
он,с
29 3 2
Н3С ОН
29 3 3
1 сдролнз эфира енола смесью соляной и уксусной кислот приводит
к Of/pa юванию кетогруппы и одновременной изомеризации двойной
«-'вязи из положения С5-Сю в положение С4-С5 с получением искомого
н;»н ipo-юна B9.1 3) [16. 17, 18, 19]. При необходимости использования
-527-
Глава 29
в виде эфиров кислот прод)кт ацилируют производными соответст-
соответствующих кислот [20J.
Нандролон способствует созданию мышечной массы юла, чсилива-
ет процесс развития костной ткани.
Основными показаниями к применению нандролона. как и других
анаболических стероидов, являются нарушения белкового анаболизма,
астения, заболевания, сопровождающиеся потерей белка, недостаточ-
недостаточность надпочечников, стероидный диабег, продолжительное неподвиж-
неподвижное состояние.
Синонимами препарата, используемого в виде эфиров кислот, яв-
являются ретаболил. феноболин, э\болин и многие др>м ие.
Флуоксиместерон (Fluoxymesteron)
Флуоксиместерон — 9-фтор-11р,17Р-дигидрокси-17а-метиландросг-
4-ен-З-он B9.3.8) получают исходя и) 11 Р-гидрокси-4-андростен-
3,17-диона, который взаимодействием с пирролидином переводят
в диенамин B9.3.4). Далее подвергают действию метилмагниййодида
с получением после гидролиза 11Р,17р-дигидрокси-17а-метил-
андрост-4-ен-З-она B9.3.5). Дегидратацией последнего путем селек-
селективного тозилирования вторичной гидроксильной фуппы при С,,
и-толуолсульфохлоридом и последующим действием щелочи полу-
получают диен B9 3 6). двойную связь которого при Со-С,, трансформи-
трансформируют в эпоксидную последовательным действием N-бромаиетамида
во влажном растворителе (источник НОВг) и щелочью B9.3.7). Даль-
нейшим действием фтористого водорода осуществляют раскрытие
эпоксидного кольца с получением искомого флуоксиместерона
B9.3.8) [21, 22. 23, 24, 25, 26, 27, 28. 29. 30].
*rfcr
Фчуоксиместерон применяется по тем же показаниям, что и нанд-
нандролон
-528-
Мужские половые гормоны
Синонимами препарата являются ультандрен, галостерин, галоте-
стин и др
Оксандролон (Oxandrolon)
Оксандролон — 17Р-гидрокси-17а-метил-2-окса-5-андростан-3-он
B9.3 10) получают окислением С|-С2 двойной связи 17Р-гидрокси~
17и-мегил-1-андросген-3-она смесью тетра-ацетата свинца и четы-
рехокиси осмия с расщеплением кольца А стероидной системы
и получением альдегидокислоты B9.3.9). При восстановлении аль-
альдегидной группы последнего боргилридом натрия в результате
вн>тримолекулярной циклизации непосредственно образуется лак-
тон B9 3.10), представляющий собой искомый оксандролон [31, 32].
РЬ(СН3СОО)д OsO<_
Оксандролон применяется по тем же показаниям, что и нандролон.
Синонимами препарата являются вазором, анавар и др.
Стинозол (Stanozol)
Станозол —- 17а-метил-5а-андростаио[3,2-с]пиразол-17Р-ол B9.3.13)
получают исходя из продукта восстановления двойной связи при
С4 Cs в метилтестостероне, представляющего собой самостоятель-
самостоятельный интерес в качестве анаболического препарата местанолона
B9 3.11). Местанолон подвергают форматированию этилформиа-
том в присутствии этилата натрия с получением 2-формильного
(оксиметиленового) производного B9.3.12), которое взаимодейст-
взаимодействием с гидразином с легкостью циклизуется в искомый станазол
B9.3 13), представляющий собой конденсированную с пиразолом
стероидную систему [33. 34].
Станозол применяется по тем же показаниям, что и нандролон.
Синонимами препарата являются стромоа, винстрол и др.
-529-
Глава 29
Список литераторы
1. US Pat. 2.308.833A943).
2. US Pat. 2.308.834A943).
3. US Pat. 2.379.832A936).
4. US Pat. 2.387.469A945).
5. US Pat. 2 236.574A941).
6. US Pat. 2.341.110 A939).
7. US Pat. 2.143.453A939).
8. US Pat. 2.374.369A945).
9. US Pat. 2.374.370A945).
10. Ruzicka L. Hely. Chim. Acta. 18, 1487 A935).
11. Ger. Pat. 1.289.991 A965).
12. US Pat. 2.234.093A966).
13. Ger. Pat. 2.130.450A972).
14. Ger. Pat. 2.261.293A973).
15. US Pat. 3.847.988A974).
16. US Pal. 2 698.855A955).
17. US Pat. 2.774.777A956).
18. Wilds A et al.'-'J. Am. Chem. Soc. 75, 5366 A953).
19. Djerassi С et aL 'J. Am Chem. Soc. 76, 4092 A954).
20. US Pat. 2.998.423 A961).
21. US Pat. 2.793.218A957).
22. US Pat. 2.813.881 A957).
23. US Pat. 2.837.517A958).
24. US Pat. 3.029.263A962).
25. Ger. Pat. 1.037.447A955).
26. Heyl W et al.//J. Am. Chem. Soc. 75, 1918 A953).
27. Bernstein S. et al.'/J. Org. Chem. 19, 41 A954).
28. Fried J et al./.'J. Am. Chem. Soc. 75, 2273 A953).
29. Fried J et aL J. Am. Chem. Soc. 76, 1455 A954).
30. HerrM etal.'J. Am. Chem. Soc. 78, 501A956).
31. US Pat. 3.128.823A964).
32. Pappo R. et al./'Tetrahedron Lett. 1962, 365.
33. ClintonR etal. J. Am. Chem. Soc. 81, 1513 A959).
34. Clinton R et al.'/J. Am. Chem. Soc. 83, 1478 A961).
Глава 30
Антинеопластики
Рак — это заболевание, встречающееся у людей и животных, при
котором нарушается структура и нормальное функционирование тканей
организма. Точная этиология большинства видов рака неизвестна. Од-
Однако хорошо известно, что инфекции, факторы окружающей среды
(химические вещества, инородные частицы, радиация), генетические
факторы, могут индуцировать трансформацию нормальной клетки
в неопластическую, т. е. размножающуюся и функционирующую не-
ненормально.
Рак может быть охарактеризован следующими параметрами.
Клетки начинают безудержно размножаться, поскольку нарушают-
нарушаются механизмы контроля роста. Клетки перестают дифференцироваться.
Клетки начинают проявлять инвазивность и приобретают способность
к мегастазированию, т. е. выявляться в тканях, удаленных от места пер-
первоначальной локализации. Клетки начинают усиленный синтез макро-
макромолекул из нуклеозидов и аминокислот.
Лечение рака включает хирургическое вмешательство, радиацию,
иммунотерапию и химиотерапию неопластическими препаратами.
До настоящего времени химиотерапия применяется в качестве дополне-
дополнения к хирургическому вмешательству или радиационной терапии с це-
целью удалить возможные оставшиеся метастатические клетки. Тем не
менее некоторые виды опухолей в настоящее время лечат, в первую
очередь, химиотерапевтическими средствами.
Как уже отмечалось, лечение пациентов больных раком зависит от
успешного удаления или разрушения всех раковых клеток в организме.
В настоящее время даже при наилучшем детектировании, вылечивается
только определенный процент диагностированных пациентов.
Причиной этого является не плохая диагностика, а то что рак часто
распространяется за пределы его локализации, делая лечение местной
формы неадекватным. Итак, хирургическое вмешательство, химиотера-
химиотерапия и обл\чение являются тремя составляющими лечения рака, однако
только химиотерапия эффективно вылечивает системное заболевание.
-531 -
Глава 30
Химиотерапия рака в обшем неспецифична. Под этим подразумева-
подразумевается, что препарат убивает не только раковые клетки, но и нормальные
клетки. Ввиду эгой неспецифичности вырабатываются специальные
стратегии для повышения потенциала уничтожения раковых клеток
и понижения токсичного воздействия на нормальные ткани. Опыт деся-
десятилетий показал, что рост опухолевых клеток происходит значительно
интенсивнее, чем рост клеток той ткани, из которой они образовались.
Парадоксально, однако, что в отличие от ожидаемого нормальные ткани
часто регенерируются быстрее, чем раковые. Поэтому после цитоиш и-
бируюшего эффекта определенных препаратов нормальные ткани после
химиотерапии могут восстанавливаться.
Препараты, применяемые при лечении рака, подразделяются на
шесть групп: антиметаболиты, алкилирующие агенты, антибиотики,
препараты, выделенные из растений, гормоны и группа веществ, кото-
которая не укладывается в вышеперечисленную классификацию и потому
рассматривается в разд. «Прочие».
30.1. Антиметаболиты
Антиметаболиты являются структурными аналогами обычных кле-
клеточных метаболитов, таких как фолиевая кислота, пиримидины и пури-
пурины, которые будучи введены в организм начинают имитировать струк-
структуру обычных метаболитов. Конкурируя с природными пуринами и пи-
римидинами в метаболических схемах, они вмешиваются в синтез
нуклеиновых кислот, включаясь в их состав вместо обычных метаболи-
метаболитов. Это приводит к образованию клеточных продуктов, которые уже
не могут нормально функционировать. Тем самым нарушаются клеточ-
клеточные процессы деления и размножения клеток.
Кроме того, являясь структурными аналогами природных веществ,
антиметаболиты могут действовать не только внедрением в метаболи-
метаболический процесс и образованием «фальшивых» нефункциональных мета-
метаболитов, но и ингибированием каталитических функций определенного
фермента или ферментной системы.
Антиметаболиты подразделяют на три группы: антагонисты фолие-
вой кислоты (метотрексат), производные пурина (меркаптопурин, тио-
гуанидин). производные пиримидина (фторурацил, флоксуридин, цита-
рабин).
30.1.1. Антагонисты фолиевой кислоты
Антагонисты фолиевой кислоты и, в частности, метотрексат дейст-
действуют путем конкурентного связывания с ферментом дигидрофолатре-
¦532-
Антинеопластики
дуктазой вместо фолиевой кислоты. Последняя является общим исход-
исходным соединением для ферментнокатализируемых реакций переноса ме-
тильной фуппы. Фолаты являются переносчиками одноутлеродных
групп (метилирующих групп), необходимых в ходе синтеза пурина
и пиримидинтимидилата и, в частности, для метилирования дезокси
уридин монофосфата в дезокситимидин монофосфат. Сродство дигид-
рофолагредуктазы к антиметаболитам намного больше, чем к обычным
субстратам — фолиевой кислоте и ее восстановленным формам. Из-за
выраженного сродства дигидрофолатредуктазы к метотрексату даже
большие дозы фолиевой кислоты, вводимой с ним одновременно, ока-
оказываются бесполезными для предотвращения эффектов метотрексата.
фолиевая кислота
N CH2-N-4 Л— C-NH—СН
Н — СОО
дигидрофолиевая
кислота
J N СН2— N—<\ /
NH?
СНз'
метотрексат
СООН
I
сн2
-C-NH—СН
СООН
Метотрексат (Methotrexat)
Метогрексат — М-[я-[[B,4-диамино-6-пиеридинил)метил]метил-
амино]-бензоил]-Ь-(±)-глютаминовую кислоту C0.1.1 8) получают
взаимодействием Х-D-метнламинобензоил)глютаМиновой кислоты
C0.1.1.3) с 2-амино-4-гидрокси-6-бромметил-птеридином C0.1.1.7).
Для этой цели >Ц4-метиламинобензоил)глютаминовую кислоту
C0.1.1.3) синтезируют исходя из хлорангидрида 4-нитробензойной
кислоты, которую вводят во взаимодействие с L-глютаминовой ки-
кислотой с получением М-D-нитробензоил)глютаминовой кислоты
C0.1.1.1). нитрогруппу которой восстанавливают до аминогруппы
с использованием водорода над никелем Ренея с получением N-D-
аминобензоил)глютаминовой кислоты C0.1.1.2). Последнюю под-
подвергают восстановительному метилированию с использованием
-533-
Глава 30
формальдегида и водорода с получением М-D-метиламинобензоил)-
глютаминовой кислоты C0.1.1.3J,
Второй фрагмент молекулы метотрексата — 2-амино-4-гидрокси-6-
бромметилтеридин C0.1.1.7) получают исходя из 2,4,6-триаминопи
римндина C0.1.1 4). который легко получается взаимодействием динит-
рила малоповой кислоты с гуанидином. Последний нитрозируют без-
безводной азошстой кислотой в 2,4,6-триамино-5-нитрозопиримидин
C0 1.1 5) и далее восстанавливают боргидридом натрия в 2,4,5,6-тетра-
аминопирнмидин C0 1.16). Действуя на последний 1.2-дибромпро-
пионовым альдегидом, продуктом присоединения брома к акролеин),
пол\чают 2-амино-4-гидрокси-6-бромметилптеридин C0.1.1 7) Алки-
лированием полученным бромидом аминного атома азота в М-D-мети-
ламинооензоил)глютаминовой кислоте C0.1.1.3) синтезируют мето-
трексат C0.1.1.8) [1, 2, 3, 4. 5, 6, 7, 8].
С ООН
сч2
H2N-CH
соон
Н2 Raney-Ni
СООН
СООН
30 1 1 2
СН2О/ 2n-NaOH
301 1 3
СООН
сн?
C-Nh—СН
СООН
NH7
H2n' ~N' "Nh2
30 1 1 4
и
N N
NH2
N
H2N N
n
H2N К NH2
Br
Br—CHo-CH-CHO
301 1 6
NH?
30 1 1 7
-534-
A н т и н eonластики
30 1 . 3
JO 1 1 7
I
CH2-N
NH2
301 1 8
Метотрекса! показан для лечения осфой лимфатической лейкемии,
чориокарциномы, неходжкинской лимфомы, саркомы костей, опухолей
головы, шеи. грлди и легких.
Синонимами препарата являются фармигрексат. ледертрексат, эма-
тексат, макстрекс, фолекс, мексат и др.
30.1,2. Производные пурина
Среди многих синтезированных аналогов пурина меркаптопурин
и тиогуанин оказались наиболее эффективными при химиотерапии рака.
Эти соединения ингибируют синтез пуриновых нуклеотидов, кото-
которые состоят из пуриновых оснований и фосфорилированной рибозы.
Оба соединения должны быть трансформированы в нуклеотиды путем
присоединения фосфорибозильного фрагмента.
Меркаптопурин (Mercaptopurin)
Меркапгопчрин — 6-пуринтиол получают исходя из мочевой ки-
кислоты C0.1.2.5), которую синтезируют из барбитуровой кислоты
C0 1.2.1) Барбитуровая кислота C0.1.2.1) легко получается конден-
конденсацией мочевины с малоновым эфиром и далее нитрозируется азо-
азотистой кислотой. Нитрозопроизводное C0.1.2.2) восстанавливается
водородом, получаемым взаимодействием олова с соляной кисло-
кислотой в амин (урамил) C0.1.2.3) и далее вводится во взаимодействие с
изоциановой кислотой с получением псевдомочевой кислоты
C0 1.2.4). Последняя при нагревании в присутствии соляной кисло-
кислоты циклизчется в мочевую кислоту C0.1 2.5). При действии пяти-
хлорисгого фосфора на мочевую кислоту образуется 2,6,8-три-
хлорплрин C0 1.2.6). Три атома хлора в трихлорпурине сильно
отличаются по отношению к замещению нуклеофилами. Атом хло-
хлора при Сб намного более активен, чем атом хлора в положении Ci,
а последний более активен, чем атом хлора при С8, что позволяет
последовательно манипулировать ими. Взаимодействием 2,6,8-три-
хлорпурина C0.1.2 6) с аммиаком замещается атом хлора при С6
с получением дихлорпроизводного C0.1.2.7), которое далее восста-
-535-
Глава 30
навливается йодистым водородом до гипоксантина C0.1.2.8). Дей-
Действием пентасульфида фосфора последний трансформируется в мер-
каптопурин C0.1.2.9) [9, 10, 11, 12, 13. 14. 15].
н
30 1 2 1
оч
он
SH
hi
30 1
и
п
NSl
н
30 1 28
H
30 1 29
Меркаптопурин в организме превращается в активную форму пре-
препарата — нуклеотид 6-тиоинозин-5-фосфат. Нуклеотид 6-тиоинозин-
5-фосфат методом отрицательной обратной связи ингибирует первый
шаг в синтезе инозин-5-фосфата, препятствуя его превращению в аде-
ниновые или г\аниновые нуклеотиды, необходимые для синтеза ДНК.
Таким образом, меркаптопурин ингибирует синтез и взаимопревраще-
взаимопревращения пуриновых нуклеотидов, что ведет к торможению синтеза ДНК
в пролиферирующих клетках во время клеточного цикла.
Меркаптоплрин применяют при лимфобластомном и миелобла-
стомном лейкозах и лечении нейролейкемии.
Синонимами препарата являются изимпур, классен. пуринэтол и др.
Тиогуанин (Thioguanine)
Тиогланни — 2-аминопурин-6-тиол C0.1.2.12) получают исходя
их 2,8-дихлор-6-гидроксипурина C0.1.2.7), в котором действием
аммиака замешают второй атом хлора при С2 на амииогр>пп\
с получением 2-амино-8-хлор-6-гидрокснпурина C0.1.2.7), кото-
который далее восстанавливается йодистым водородом до 2-амино-
-536-
Антинеопластики
пурин-6-ола C0.1.2.11). Замену гидроксильной группы на мер
каптогруппу в положении С6 осуществляют в/аимодействием
с получением тиогуанина (ЗОЛ 2 12)
он
-
Н
30 1 2 10
н
30 1 2 11
SH
н
30 1 2 12
Тиогуанин в организме конвертируется в активную форму — 6-тио-
гуанин-5-фосфат.
Главный механизм его действия заключается во включении его три-
фосфатной формы в ДНК, замещении гуанинового нуклеотида и инги-
бировании синтеза ДНК.
Меркаптопурин имеет значение при лечении и взрослых, и детей
в качестве препарата поддерживающей терапии. Тиогуанин может
иметь определенное клиническое применение и в комбинации с други-
другими препаратами при острой миелогенной терапии.
Синонимом препарата является ланвис и др.
30.1.3. Производные пиримидина
В качестве потенциальных противораковых препаратов синтезиро-
синтезировано большое число фторированных аналогов пиримидина. Наиболее
глубоко изучены фторурацил и флоксуридин. Возможно, что наиболее
важным механизмом действия фторированных пиримидинов является
ингибирование синтеза тимидилат синтетазы и, таким образом, воздей-
воздействие на процесс выработки ДНК. Это действие сопровождается обра-
образованием активного метаболита, 5-фтордезоксиуридиномонофосфата
как из фторурацила, так и флоксуридина. 5-фтордезоксиуридиномоно-
фосфат образует комплекс с восстановленным фолат 1Ч5,1Чт'0-метилен-
тетрагидрофолатом. Этот комплекс ингибирует тимидилат синтетазу
и понижает метилирование 2-дезоксиуридиновой кислоты для образо-
образования тимидиловой кислоты. Возникающий при этом дефицит тимиди-
на вызывает повреждение и гибель клеток.
Считается также, что трифосфорилированная форма фторирован-
фторированных аналогов пиримидина может быть включена в РНК и воздейство-
воздействовать на синтез протеинов.
-537-
Фторурацил (Fluorouracil)
Фторурацил — 5-фторурацил C0.1.3.3) получают конденсацией
этилового эфира фторуксусной кислоты с этилформиатом в присут-
присутствии этилата калия с получением гидроксиметиленфторуксусного
эфира C0.3.1) и дальнейшей его циклизацией взаимодействием
с S-метил-изо-тиомочевиной в 2-метилтио-4-гидрокси-5-фторпири-
мидин и последующим гидролизом соляной кислотой во фторура-
фторурацил C0.1.3.3) [21, 22]. Альтернативным путем синтеза 5-фторура-
цила является прямое фторирование урацила фтором или трифтор-
метилгипофторидом [23, 24, 25, 26, 27, 28].
F-CH2-COOC2H5 * НСООС2Н5
СгН5ОК
С2Н5ООС.
. SCH3
'V" H2N-C=NH
НО'
3013 1
30 1 3.3
F2 / CF3OF
м
н
30 1 34
Фтор>рацил действует ггутем ингибирования синтеза пиримидинов
и, соответственно, образования ДНК.
Применение фторурацила показано при лечении карциномы го-
головы и шеи, ободочной и прямой кишок, груди, желудка, мочевого
пузыря, поджелудочной железы, при актиничных и солнечных кера-
кератитах.
Синонимами препарата являются эффл\дер.м, флудикс, флуоробла-
стин, арумел, бентон, лифрил и др.
Флоксуридин (Floxuridine)
Флоксуридин — 5-фтор-1-B-дезоксирибофуранозил)-пиримидин-
2,4-1 Ш,ЗЯ)-дион C0.1.3.5) является пиримидиновым нуклеозидом,
получаемым взаимодействием фторурацила C0.1.3.3) с 2-дезокси-
рибофуранозилбромидом в присутствии серебряных или ртутных
солей [29, 30. 31.32, 33].
-538-
Антинеопластики
н-
0*
Вг
N
{
Н
30 1 33
СН2ОН + 2+
' Ag or Hg
H-N
О'
ОН
*f0 СН2ОН
\ / 30 1 3 5
ОН
Флоксуридин используется методом инфузионного введения в пе-
печеночную артерию при метастазах в печени.
Синонимом препарата является FUDR и др.
Цитарабин (Cytarabin)
й,итарабин — 4-амино-1-р-арабинофуранозил-2AЯ)пиримидон
C0.1.3.8) получают исходя из l-p-D-арабинофуранозилурацила пу-
путем предварительного ацилирования гидроксильных групп с полу-
получением триацетилпроизводного C0.1.3.6), дальнейшей заменой кар-
карбонильной группы в положении 4-пиримидинового кольца на
тиокарбонильную с использованием пентасульфида фосфора и, на-
наконец, замещением меркаптогруппы в C0.1.3.7) на аминогруппу
с использованием аммиака и одновременным гидролизом ацетиль-
ацетильных защитных групп с получением цитарабина C0.1.3.8) [34, 35, 36,
37.38].
1 Г2
»-f || NH3'CHjOH j [1
.о сн2он
ОАс
30 1 3 7
.ОН
30' за
Цитарабин так же, как и вышеописанные препараты, действует пу-
путем ингибирования синтеза пиримидинов и, соответственно, образова-
образования ДНК в клетках.
Цитарабин является антиметаболитом эффективным при лечении
лейкемии. Аналогично другим пиримидиновым антиметаболитам цита-
цитарабин должен быть «активирован» путем его первоначальной транс-
трансформации в соответствующий нуклеотид. Активной формой препарата
-539-
Глава 30
является цитарабин трифосфа1 Цитарабин используется при всех видах
лейкемии.
Синонимами препарата являются цитозин, арабинозид. ара-С.
30.2. Ллкилирующие агенты
Алкилирующие агенты — высокореакционоспособные соединения,
способные к образованию ковалентных связей с нуклеофильными уча-
участками (амино-, гидрокси-, сульфгидрил- и карбоксигруппами, азоти-
азотистыми гетероциклами) таких молекул, как нуклеиновые кислоты, фос-
фосфаты, аминокислоты и протеины. Как правило, алкилнрующие препа-
препараты, применяемые в медицине, алкилируют положение N? гуанина.
Однако алкилирование в принципе может происходить и происходит
и по О6 или N3 Панина, по N,, N, или N-. аденина либо по N3 цитозина.
При этом многие составляющие клеток, включая ДНК, РНК, протеины,
компоненты мембран и др., также алкилируются. Однако, согласно ра-
рабочей гипотезе, основной цитотоксический эффект этих соединений
может быть объяснен их способностью к связыванию именно с нуклео-
тидами ДНК. Это приводит к неправильному считыванию информации
с ДНК, и, как правило, клетка погибает из-за вмешательства в реплика-
репликацию ДНК и митоза. Биф> нкциональные алкилирующие агенты имеют
возможность образовывать межцепочечные связи в ДНК вызывая кросс-
связывание двух цепочек ДНК и считаются более цитотоксичными, чем
монофункциональные алкилирующие агенты.
Схематический механизм действия алкилирующих препаратов на
примере самого простого из них — мехлорэтамина можно пояснить
следующей схемой.
ph2-Ch2~CI
'о ?-Crt~-O
rijN'
h-Г
H2N
0
N-CH2-CH2-N-CH2-CH2 — N ГГ^К
nbose—р 2CI р—nbose
-540-
Антинеоппастики
Несмотря на то, что алкилирующие агенты выявляют общий меха-
механизм действия, их клиническое применение варьирует в зависимости от
разницы в фармакокинетике. метаболизме, липидной растворимости,
способности проникать в клеточные мембраны и токсичности. Они мо-
г>т быть классифицированы как азотсодержащие горчичные производ-
производные (мехлорэтамин, хлорамбуцил, мелфалан, циклофосфамид, ифосфа-
мид), производные этиленимина (тиотепа), нитрозомочевины (карму-
стин, ломустин, стрептозоцин), алкулсульфонаты (бусульфан), произ-
производные платины (цисплатин, карбоплатин).
30.2.1. Азотсодержащие горчичные
производные
Мехлорэтамин (Mechlorethamine)
Мехлорэтамин — 6ис-B-хлорэтил)метиламин C0.2,1.2) получают
взаимодействием метиламина с окисью этилена с получением бис-
(,2-гидроксиэтил)метиламина C0.2,1.1). который взаимодействием
с хлористым тионилом трансформируется в искомый мехлорэтамин
[39,40,41].
CH3NH2
CH3-N
СН2-СН2-ОН
SOCI2
CH3-N
СН2-СН2-ОН
302 1 1
CH2-CH2-CI
302 1 2
Мехлорэтамин широко используется внутривенно в комбинации
с другими препаратами при болезни Ходжкина, лимфосаркоме, лейке-
лейкемии, бронхогенной карциноме.
Синонимами препарата являются азотоиприт. хлорэтамин, хлорэта-
зид, мустин и многие другие.
Хлорамбуцил (Chlorambucil)
Хлорамбуцил — 4-[я-[бисB-хлорэтил)амино]фенил]маслян>ю ки-
кислоту C0.2.1.7) получают исходя из ацетанилида и янтарного ан-
ангидрида. На первой стадии синтеза ацетанилид аиилируют ангидри-
ангидридом янтарной кислоты с получением 4-D-ацетаминофенил)-4-
кетомасляной кислоты C0.2.1.3). Кетогруппу в последней восста-
восстанавливают водородом в метаноле растворе с использованием в ка-
качестве катализатора палладия на угле. В результате получают мети-
метиловый эфир 4-D-ацетаминофенил)-масляной кислоты C0.2.1.4).
Обработка последнего щелочью с целью гидролиза как амидной.
-541 -
Глава 30
так и эфирной части молекулы приводит к получению 4-D-
аминофе-нил)масляной кислоты C0.2.1.5), взаимодействие которой
с окисью этилена приводит к получению 4-[я-[бисB-гидро-
нсиэтил)амино]фенил]масляной кислоты C0.2.1.7). Замещением
всех гидроксильных гр>пп в последней с помощью хлорокиси фос-
фосфора и дальнейшей обработкой водой с целью гидролиза до кисло-
кислоты промежуточно образовавшегося хлорангидрида получают хло-
рамбуцил B0 2 1.7) 142, 43, 44, 45, 46].
АЮ!з
СНз-CO-NH-
л а— с-сн2-сн2-соон
H2/Pd-C CH3OH
Ch3-CO-NH-
1СН2)з-СООСН3
30 2 1 4
302 1 5
НО-СН2-СН2 /==ч
N
но-сн2-сн/
РОС13
(СН2}3-СООН
I—СН2-СН2 /=г\
|—СН2-сн/
302 1 7
Хлорамбуцил хорошо адсорбируется при оральном применении.
Использ\ется при хронической лимфатической лейкемии и множест-
множественной миеломе.
Синонимами препарата являются лейкеран, амбохлорин, хлорбутин
и др.
Мелфалан (Melphalan)
Мелфалан Ь-3-[«-[бисB-хлорэтил)амино]фенил]аланин C0.2.1.13)
является структурным аналогом хлорамбуцила, в котором фрагмент
масляной кислоты заменен на фрагмент аминокислоты — аланина.
Синтез препарата осуществляют исходя из L-фенилаланина, нитро-
нитрованием которого азотной кислотой получают 4-нитро-1.-фенил-
аланин C0.2.1.8). Взаимодействием последнего со спиртом в при-
с\тствии хлористого водорода получают хлоргидрат этилового
эфира 4-нитро-1_-фенилаланина C0.2.1.9), аминогруппу в котором
защиашют п\тем перевода во фталимид взаимодействием с янтар-
-542-
Антинеопластики
ным ангидридом C0.2.1.10). Нитрогрупп\ в последнем восстанав-
восстанавливают до аминогруппы водородом с использованием в качестве
катализатора палладия на карбонате кальция. Полученный аромати-
ароматический амин C0.2.1.11) далее вводится во взаимодействие с окисью
этилена с получением бисB-гидоксиэтил)-амино производного
C0.2.1.12). Гидроксильные группы в последнем замещаются на
атомы хлора взаимодействием с хлористым тионилом, после чего
обработкой соляной кислотой снимается фталимидная защита с по-
л>чением мелфалана C0.2.1.13) [47, 48, 49, 50].
к А— СН2-СН-СООН
/^^ С2Н5ОН HCI
O2N—^ Л—CH2-Cri-COOH
NH2
— CH2-CH-COOC2H5
NH2
h2 / Pd-СаСОз
Л—СН2-СН-СООС2Н5 •" Н2№
ио-снг-сн/
1 SOCI2
2 HCI
Нг—СН2 /^Ч
ft—^. Ъ—СН2—СН—СООН
О—СНг-СНг' — NH2
Мелфалан применяется внутривенно и орально для лечения множе-
множественной миеломы, рака груди, шеи, яичников.
Синонимом препарата является алкеран.
Под названием сарколизин, или рацемелфалан, широко применяет-
применяется также рацемическая форма этого препарата — D,L-3-[«-[6hcB-
\лорэтил)амино]фенил]аланин.
Циклофосфалшд (Cyclophosphamide)
Циклофосфамид — 2-[бисB-хлорэтил)амино]тетрагидро-2Я-1,3,2-
оксазафосфорин 2-оксид C0.2.1.15) получают взаимодействием
бисB-хлорэтил)амина с хлорокисью фосфора с получением N,N-
-543-
Глава 30
бисB-хлорэтил)дихлорфосфорамида C0.2.1.14), который дальней-
дальнейшим взаимодействием с 3-аминопропанолом трансформир)ется
в циклофосфамид C0.2.1.15) [51, 52, 53, 54, 55, 56, 57, 58, 591.
СН2-СН2-С|
СН2—Снг—CI
¦n
Ch2-CH2-CI
Характерное химическое строение препарата придает ему избира-
избирательную противоопухолевую активность. Находясь в крови он практи-
практически не активен, однако при проникновении в опухолевые клетки под
действием содержащихся в них относительно больших количеств фос-
фамидаз он разлагается с высвобождением собственно цитостатическо-
го вещества — бисB-хлорэтил)амина. Это означает, чго алкилирующее
действие этого препарата узко направленно именно на опухолевые
клетки. Циклофосфамид является одним из наиболее часто применяе-
применяемых химиотерапевтических средств.
Циклофосфамид применяется и внутривенно, и орально. Использу-
Используется при хронической лимфатической лейкемии, болезни Ходжкина,
лимфомы Буркиттса, множественной миеломе, раке груди, шеи и яич-
яичников и др.
Синонимами препарата являются эндоксан, циклостин, цитоксан,
циклофосфан и др.
Ифосфа.иид (Ifosfamide)
Ифосфамид — 3-B-хлорэтил)-2-[B-хлорэтил)амино]тетрагидро-2#-
1,3,2-оксазафосфорин-2-оксид C0.2.1.17), который можно рассмат-
рассматривать как соединение, изомерное циклофосфамиду C0.2.1.15)
и аналогичное ему по действию, получают взаимодействием N-B-
хлорэтил)-М-C-гидроксипропил)амина с хлорокисью фосфора с по-
получением 3-B-хлорэтил)-2-хлортетрагидро-2//-1,3,2-оксазафосфорин
2-оксида C0.2,1.16), который далее вводят во взаимодействие с N-
B-хлорэтил)амином с получением искомого ифосфамида C0.2.1.17)
[60.61.62].
-544-
Антинеопластики
Ифосфамид — экспериментальный препарат, аналог циклофосфа-
мида.
Синонимами препарата являются голоксан и митоксан.
30.2.2. Производные этиленимина
Этиленимины являются высокореакционноспособными ал кил и-
р)юшими реагентами. Они алкилируют ДНК по положению N7 гуанина
аналогично мехлорэтамину. Этиленимины оказывают цитостатическое
действие и угнетают развитие пролиферирующей, в том числе злокаче-
злокачественной, ткани. Они нарушают обмен нуклеиновых кислот и блокиру-
блокируют митотическое деление ткани.
Их применяют при раке яичников, молочной железы, неоперабель-
неоперабельных опухолях, прочих рецидивах и метастазах. В медицине в основном
применяется триэтилен-фосфортриамид — тиотепа C0.2.2.1), однако
предложены и применяются и другие препараты этого ряда — бензотеф
C0.2.2.2), дипин C0.2.2.3), тиодипин C0.2.2.4), фосфемид C0.2.2.5)
и др.
-Р=О
N N— Р=о
ч—' I
s=p-
N ^N—Р=О
Тиотепа (Thiotepa)
Тиотепа — трисA-азиридинил)фосфина сульфид C0.2.2.1) получа-
получают взаимодействием этиленимина с хлортиоокисью фосфора [63,
64].
3 N-H
Ci
ci—p=s
CI
N
I N—P=S
30 22 1
Триэтилентиофосфорамид используется внутривенно при ранних
стадиях карциномы печени, яичников и груди. Препарат применяют при
хроническом лимфолейкозе, лимфогранулематозе, лимфосаркоматозе.
-545-
Глава 30
Его применяют для уменьшения числа рецидивов и метастазов, при
комплексном лечении различных форм рака.
Синонимами препарата являются теспамин, тилфосфамид, тиофо-
сил и др.
30.2.3. Алкилсульфонаты
Единственным препаратом ряда алкилсульфонатов, нашедшим ме-
медицинское применение, является бусульфан.
Бусульфан (Busulfan)
Бусульфан — 1,4-бутандиолдиметансульфонат C0.2.3.1) получают
взаимодействием бутандиолас метансульфонилхлоридом [65, 66].
СН2-СН2-ОН
сн2-сн2-он
2 СН3—SO2-CI
CH2-CH2-O-SO2-CH3
CH2-CH2-O-SO2-CH3
3023 1
Ьусульфан является бифункциональным алкилирующим агентом,
слабосвязывающимся с ДНК, однако не выявляет способности к кросс-
связыванию Бусульфан избирательно алкилирует положение N7 гуани-
гуанина, а также алкилирует сульфгидрильные группы глутатиона и цистеи-
на. В отличие от других алкилирующих агентов, он мало действует на
лимфоциты и намного меньше проявляет иммуносупрессивные свойст-
свойства Имеет сильные цитотоксические свойства и способность убивать
стволовые клетки. Может применяться орально. Используется в основ-
основном при хронической миелогенной лейкемии и полицитемии. В отличие
от других алкилирующих агентов не увеличивает случаев вторичной
лейкемии.
Синонимами препарата являются цитосульфан, лейкосульфан, мие-
лосан. митостан и др.
30.2.4. Нитрозомочевины
Следующую группу антинеопластических препаратов в клинике
представляют нифозомочевины (ломустин. кармустин, стрептозоцин).
Имеются и др\гие препараты этого ряда (нимустин, семустин и др.).
отличающиеся лишь группой, обозначенной R на нижеприведенной
схеме Пречиодагается. что в организме нитрозомочевины расщепля-
расщепляются на Р-\лорэтанол и на алкилизоцианаты. Образовавшийся р-хлор-
-546-
Антинеопластики
этанол является высокореакционноспособным алкилирующим аген-
агентом, а алкилизоцианаты — карбамоилирующими агентами для про-
протеинов, которые также проявляют определенную цитотоксическую
активность.
Вероятная схема распада в организме нитрозомочевин на возмож-
возможные активные компоненты приводится ниже
R-NH-C-N-CH2-CH2-CI
N=0
R-N=C=O
Cl—CH2-CH2-N=N-OH
Cl—CH2-CH2-OH
Jlo.nyqmuH (Lomustine)
Ломустин — 1-B-хлорэтил)-3-циклогексил-1-нитрозомочевину
C0.2.4.3) получают взаимодействием этаноламина с циклогексили-
зоцианатом. в результате чего образуется 1-B-гидроксиэтил)-3-цик-
логексилмочевина C0.2.4 1). Взаимодействием последней с хлори-
хлористым тионилом гидроксильную группу в нем замещают на атом
хлора с получением 1-B-хлорэта1)-3-циклогексилмочевины C0.2.4.2).
Последнюю нитрозируют в безводных условиях с применением
безводной муравьиной кислоты и нитрита натрия и получают лому-
ломустин C0.2.4.3) [67, 68]
H2N-CH2-CH2-OH
OCN
HO-CH2-CH2-NH-C—NH-/ }
30 24 1
SOCI2
О
:i-ch2-ch2-nh-c—nh—( \
30 24 2
НСООН / NaNO2 О .—.
*¦ CI-CH2-CH2-N—C—NH—( )
O=N ^—'
30 24 3
Как и другие нитрозомочевины. ломустин действует в качестве
агента алкилирующего ДНК, а также ингибирует различные ключевые
ферментативные реакции путем кабамоилирования белков. Ломустин
применяется только орально. Применяется при новообразованиях ЦНС,
опухолях мозга, глотки, гортани, лимфогранулематозе, неходжкинской
лимфоме, раке легких и ЖКТ.
Синонимами препарата являются белустин, CCNU и др.
-547-
Глава 30
Кармустин (Сarm ustine)
Кармустин — 1,3-бисB-хлорэтил)-1-нитрозомочевшга C0.2.4 4) по-
получается нитрозированием 1,3-бисB-хлорэтил)мочевины грехоки-
сью азота [68, 69].
I—СН2-СН2—NH-C-NH—СН2-СНг-С1
N2O3
CI—CHj-СНг—NH-C-N-CH2-CH2-CI
N=O
30 24 4
Механизм действия препарата аналогичен механизму действия ло-
мустина.
Кармустин применяется только внутривенно. Применяется при
неходжкинской лимфоме, множественной миеломе и опухолях
мозга.
Синонимами препарата являются кармубрис, нитрумон, BICNU.
Стрептозоцин (Streptozocine)
Стрептозоцин — 2-дезокси-2-[[(метилнитрозамино)карбонил]-
амино]-О-глюкоза C0.2.4.5) является антибиотиком, выделенным
из продуктов жизнедеятельности Streptomvces achromogenes [70, 71,
72].
рн2он
J—о
НО I и
30 24 5
ОН N=0
NH-C-N-СНз
ii J
О
Несмотря на то, что препарат, являясь антибиотиком лишь фор-
формально, относится к ряд\ нигрозомочевин, отсутствие характерной \ло-
рэчильной гр\ппы придает ем\ свойства отличные от других нитрозо-
соединений. Он проявляет алкилир>ющие (метилирующие свойства),
однако не способен к кросс-связыванию цепей ДНК. Он не обладает
также карбамоилирующей активностью присущей другим нитрозомоче-
винам вследствие происходящей быстрой внутримолекулярной реакции
циклизации гликозилизоцианата, получаемого в ходе трансформаций
в организме стрептозоцина. Однако препарат ингибирует синтез амино-
аминокислот, необходимых для построения белков раковой клеткой.
-548-
Антинеопластики
Стрептозоцин применяется только внутривенно. Назначается, в ос-
основном, при раке поджелудочной железы и при карциноидах.
Синонимом препарата является заносар и др.
30.2.5. Производные платины
Цисплатин (Cisplatin)
Цисплатин -- г/ис-диаминодихлорплатина C0.2.5.1) получается
восстановлением гексахлорплатината калия гидразином до тетра-
хлорплатината калия, взаимодействием которого с аммиаком полу-
получают цисплатин C0 2.5.1) [73, 74, 75, 76, 77].
H2NNH2
K2[RC|4]
NH3/ NH4CI
H3N NH
>рК.
CI' CI
302 5 1
Цисплатин является неорганическим платиносодержащим препара-
препаратом с алкилируюшими свойствами. Вызывает кросс-связывание цепей
ДНК и РНК. В частности показано, что цисплатин, как и другие ал кили-
рующие агенты, связывается преимущественно с положением Nt двух
соседних дезоксигуанилатов в ДНК, что препятствует ее репликации.
Используется только внутривенно Высокоактивен по отношению к кар-
карциноме яичек и яичников, головы, шеи, селезенки легких и др.
Синонимами препарата являются платинол, платибластин, плати-
платине кс, неоплатин и др.
Карбоплатин (Carboplatin)
Карбоплатин — г/ис-диамино-A,1-циклобутандикарбоксилат)пла-
гины-(Н) получают исходя из цисплатина последовательным взаи-
взаимодействием с раствором нитрата серебра и далее с циклобутан-1,1-
дикарбоновой кислотой с получением искомого карбоплатина
C0.2 5.2) [78, 79].
с ci
JC2 5 1
соон
СООг!
CIS—((Nh3JPt(H2O)J(NO3J
H3N.
-549-
Глава 30
Среди большого массива производных платины, карбоплатин явля-
является единственным соединением, вошедшим в медицинскую практику
и от тчаюшимся от цисплатина замещением двух атомов хлора на
фрагмент циклоб>тан-1.1-дикарбоновой кислоты. Подобно цисплатину
карбоплатин также реагир>ет с ДНК с образованием как вн\тренних,
так и внешних кросс-связей. Спектр активности и показания к примене-
применению практически аналогичны цисплатину.
Синонимом препарата является параплатин и др.
30.3. Антибиотики
Ряд антибиотиков обладает выраженными цитостатическими свой-
свойствами, они весьма эффективны при лечении определенных опухолей.
К их числу относятся акгиномицин, антрациклины — даунорубицин
и локсорубицин, блеомицин и др. Некоторые из них, кроме митоксан-
трона, являющегося чисто синтетическим препаратом, получаются мик-
микробиологическим путем, для некоторых разработаны и синтетические
пути синтеза, которые приводятся в литературных источниках. В дан-
данном разделе б) дет рассмотрено лишь их строение и показания к приме-
применению.
Дактиномицины
Дактиномицин (Dactinomycin)
Дактиномицин — 2-амино-1,9-бис-B.9-диизопропил-6.10,13-триметил-
1.48,11,14-пентаоксо-7-окса-3,10.13,17а-тетрааза-5-бицикло[ 14.3.0]-
ноиадецилкарбамоил)-4,6-диметил-ЗЯ-феноксазин-3-он C0.3.1) яв-
является одним из первых антибиотиков, выделенных из культураль-
ной жидкости микроорганизмов рода Streptomyces pan'ulus [80, 81,
82. 83, 84. 85, 86, 87].
Sar §ЭГ
L-Prp L^teva! L~P[° L-Meval
-550-
Антинеопластики
Дактиномицин является хромонопептидом с феноксазиновым коль-
кольцом и двумя циклическими полипептидами, присоединенными по кар-
карбоксильным группам в положениях 2- и 9-феноксазинового кольца.
В общем дактиномицины проявляют ингибирующий эффект как на
грамноложительные, так и на грамотрицательные бактерии, а также на
грибки. Однако дактиномицин проявляет и выраженное неопластиче-
неопластическое действие. Он образует комплекс с ДНК за счет связывания гуанин-
цитозиновых сегментов, в результате чего блокируется ДНК-зависимый
синтез РНК. Другим цитотоксическим эффектом дактиномицина явля-
является вызываемые им нарушения скручивания ДНК. Кроме того, дакти-
дактиномицин ингибирует топоизомеразу II. Может вводиться внутривенно.
Применяется при опухолях Вильмса, саркоме Юинга и Капоши, лим-
фоме и др.
Синонимами препарата являются актиномицин D, космоген и др.
Блеомицины
Блео.йицин (Bleomycin)
Блеомицины — стереоизомеры 6-амино-1Ч-[2-[[4-[[1-[[[2-[4-(амино-
карбонил)[2,4'-битиазол]-2'-ил]этил]амино]карбонил]-2-гидрокси-
пропиламино-2-гидрокси-1,3-диметил-4-оксобутил]амино-1-[[[2-0-
[3-О-(аминокарбонил)-а-В-маннопиранозил-а-Ь-глюкопиранозил]-
окси]-1Я-имидазол-4-илметил]-2-оксоэтил]-2-[1-B,3-Диамино-3-ок-
сопропил)-4-оксо-азетидинил]-5-метил-4-пиримидинкарбоксамидов
C0.3 2).
сн3
СНз ОН СН3 НО-СН
носн2
он
НО OCONH-з
о
II
C-R
30 3 2
-551 -
Глава 30
Блеомицины — комплекс не менее 16 гликопептидных антибиоти-
антибиотиков, полученных из рода Streptomyces verticilus, отличающихся значени-
значением R [88, 89, 90, 91, 92, 93, 94]. Блеомицины проявляют противоопухо-
противоопухолевую, антивирусную и антибактериальную активность. Связываясь
с ДНК. они вызывают нар\ тения в скручивании как одной, гак и дв\х
цепей ДНК. В меньшей степени они ингибируют синтез РНК и белков.
Вводятся внутривенно или внутримышечно. Применяется при лимфо-
мах, карциномах и саркомах.
Синонимами препарата являются бленоксан. блеоцин и др.
Антрациклины
Доксор>бицин и даунорубицин — антибиотики, полученные из
микроорганизмов рода Streptomyces peucetius Стр> ктура этих ан грацик-
линов включает аминосахаридный остаток даунозамии с планарным
нафтаценхиноновым ядром. Доксорубицин отличается or дачнорубици-
на наличием одной гидроксильной фуппой при Ci4. Предложен ряд ме-
механизмов, согласно которым антрациклины проявляют цитотоксич-
ность. Они вызывают расслоение ДНК, участвуют в окислительно-
восстановительных реакциях, хелатируют двухвалентные катионы и вза-
взаимодействуют с клеточными мембранами, изменяя их функции. Приме-
Применяются при острой лейкемии, лимфоме, раке груди и яичников и прочих
солидных опухолях
Доксорубицин (Doxorubicin)
Доксорубицин — 7,8,9,10-тетрагидро-6,7,9.11-тетрагидрокси-9-
гидроксиацетил-4-метокси-5,12-нафтаценхинон-7-C-амино-5-метил-
2,3-дидезокси-Ь-ликсопиранозид) C0.3.3), который выделен из
культуральной жидкости Streptomyces peucetius var caesms [95, 96]
и позже синтезирован [97, 98, 99, 100]
о он
СН3О
но
30 3 3
-552-
Антинеопластики
Доксор\бицин является одним из наиболее эффективных неопла-
стическпх препаратов и. в основном, применяется в комбинациях с дру-
другими препаратами для лечения солидных опухолей.
Препарат применяется при лейкемиях, различных саркомах, прак-
практически при всех видах рака, нейробластоме, лейкозах, лимфомах.
Синонимами препарата являются адриацин, адриабластин и др.
Даунорубицин (Daunorubicin)
Даунорубицин — 9-ацетил-7,8,9,10-тетрагидро-6,7,9,11-тетрагид-
рокси-4-метокси-5.12-нафтаценхинон-7-C-амино-5-метил-2.3-диде-
зокси-Ь-ликсопиранозид) C0.3.4) выделен из культу ральной жидко-
жидкости Streptomyces peucetius [101, 102, 103. 104] и позже был синте-
синтезирован [105, 106, 107, 108].
сн-.о
30 3 4
Механизм действия даунорубицина и показания к применению та-
такие же, как и у доксорубицина.
Синонимами препарата являются даунобластин, рубомицин, церу-
бидин
Митомицин (Mitomycin)
Митомицин — карбамат 6-амино-1,1а,2,8,8а.8Ь.-гексагидро-8-гидро-
ксиметил)-8а-метокси-5-метилазирино[1,2-а]индол-4,7-диона C0.3.6).
,CH2-O-CO-NH2
..ОСН3
-553-
Глава 30
Мигомицин является антибиотиком, выделенным из продуктов
"жизнедеятельности микроорганизмов рода Streptomyces caepitosus,
и содержит хиноновый. уретановый и азиридиновый фрагменты [109,
110, 111, 112, 113, 114], который позже был синтезирован [115, 116].
Он также является алкилирующим агентом и ингибирует синтез
ДНК. Вводится внутривенно в сочетании с другими химиотерапевтиче-
скими препаратами для лечения карциномы поджелудочной железы,
груди, легких простаты головы, шеи и др.
Синонимом препарата является аметицин и др.
30.4. Соединения, выделенные из растений
Винбластин и винкристин являются алкалоидами, полученными из
растений рода баравинок (Vinca rosed). Эти соединения вызывают за-
задержу деления клеток в метафазе и ингиоируют сборку микротуоул и,
соответственно, сбой митотического веретенообразования. Ингибируют
синтез нуклеиновых кислот и белков. Винбластин и винкристин отли-
отличаются лишь заместителем при атоме азота индольного фрагмента мо-
молекул и применяются в комбинации с другими химиотерапевтическими
средствами. В основном применяются при лейкозах, миеломах, сарко-
саркомах, раке различных органов и при лимфоме.
Винбластин (Vinblastine)
Винбластин— [3aR-[3aa,4p,5p,5ap,9CR\5S*,7R',9S*),10bR*.13aa]]-
метил-4-(аиетил-окси)-9-[5-этил-1,4.5,6.7.8,9,10-октагидро-5-гидро-
СН3О'
R = —СООСНз
ксн-9-(метоксикарбоннл)-2//-3,7-метаноазаиикло\ндецино-[5.4-Ь]-
-554-
Антинеопластики
индол-9-ил]-За-этил-За,4,5,5а,6,11,12,13а-октагидро-5-гидрокси-8-
мегокси-6-метил-Ш-индолизино[8,1-сё]-карбазол-5-карбоксилат
C0.4.1) выделяют из Vinca rosea [117. 118, 119, 120].
Винбластин подавляет рост клеток на стадии метафазы, действует
на метаболизм аминокислот, в частности на уровне включения глутами-
новон кислоты в лимоннокислый цикл и превращения в мочевину,
а также ингибирует синтез белка и нуклеиновых кислот.
Винбластин применяется при острой лимфобластной лейкемии, бо-
болезни Ходжкина, неходжкинских лимфомах, нейробластоме, саркоме
и других опухолевых заболеваниях.
Синонимами препарата являются велбан, экзал и др.
Винкристин (Vincristine)
Винкристин — [3aR-[3aa,4p,5p,5ap,9CR*,5S*,7R*,9S*),10bR*,13aa]]-
метил-4-(ацетил-окси)-9-[5-этил-1,4,5,6,7,8,9,10-октагидро-5-гидро-
кси-9-(метоксикарбонил)-2Я-3,7-метаноазациклоундецино-[5,4-Ь]-
индол-9-нл]-За-этил-За,4,5,5а,6,11,12,13а-октагидро-5-гидрокси-8-
меюкси~6-формил-1//-индолизино[8,1-с<3]-карбазол-5-карбоксилат
C0.4.2) также выделяют из Vinca rosea [121, 122, 123]. Предложены
и полу синтетические способы получения препарата [124, 125, 126].
СН3О
сн3
¦ОСОСНз
СООСНз
R = —СООСНз
Механизм действия винкристина и показания к применению такие
же. как и \ вннбластина.
Синонимами препарата являются лейрокристин, онковнн и др.
-555-
Глава 30
Эпиподофиллотоксины
Этопозид и тенипозид являются синтетическими производными
экстракта американского растения мандрагора (майское яблоко). Меха-
Механизм их действия выяснен не однозначно, однако они действуют на
фермент топоизомеразу II, что вызывает нарушения в скручивании
ДНК. Кроме того, препараты ингибируют синтез ДНК и РНК, а также
транспорт нуклеозидов к клеткам. Цитотоксическое действие на нор-
нормальные клетки наблюдается только в очень больших дозах. Препараты
проявляют значительную активность при лимфоме, лейкемии и саркоме
Капоши, при опухолях яичка.
Этопозид (Etoposide)
Этопозид — [5К-Eа,5аР,8аа.9р)]-9-[4,6-0-этшшден-р-0-глюкопи-
ранозил)окси]-5,8.8а,9-тетрагидро-5-D-гидрокси-3.5-диметоксифе-
нид)фуро[3',4':6,7]-нафто[2,3-с1]-1,3-диоксол-6Eа//)-он C0.4.5) по-
получают исходя из 41-дезметилэпиподофиллотоксина. фенольную
группу которого предварительно ацилируют бензиловым эфиром
хлоругольной кислоты с получением 4'-карбобензиллокси-4'-дезме-
тилэпипо-дофиллотоксина C0.4 3). Далее гидроксильную группу
в положении С9 этого соединения эгерифицируют 4,6-О-эгилиден-
2,3-ди-0-ацетил-Р-0-глюкопиранозой в присутствии эфирата трех-
фтористого бора получением соответствующего глюкопиранозида
C0.4.4). Удалением ацетильных групп в глюкопиранозильной части
молекулы с помощью ацетата цинка в метилате натрия, а также сня-
снятием карбобензоксильной защиты, восстановлением водородом с
использованием в качестве катализатора палладия на угле получают
искомый этопозид C0.4.5) [127, 128].
-СНт-О-СО-С!
-556-
Антинеопластики
1 Zn(CH3COOJ/CH3ONa
2 Н2 ' Рй-С
сн2-о
СН3О
Этопозид применяют при герминогенных опухолях, раке яичников,
•желудка и легких, болезни Ходжкина и неходжкинских лимфомах как
при моно-, так и при комбинированной терапии.
Синонимом препарата является вепезид и др.
Тенипозид (Teniposide)
Тенипозид-- [5К-Eа,5ар,8аа,9р)]-9-[4,6-О-B-тиенилметилен)-р-В-
глюкониранозил)окси]-5,8,8а,9-тетрагидро-5-D-гидрокси-3.5-диме-
токсифенил)фуро[3',4::6,7]-нафто[2,3-с1]-1,3-диоксол-6-Eа//)-он
C0.4.9) синтезируют примерно по аналогичной схеме исходя из 41-
бензиллокси-4'-дезметилэпиподофиллотоксина C0.4.6), который
этерифицируют 2,3,4,6-тетра-0-ацетил-р-В-глюкозой в присутствии
эфирата трехфтористого бора с получением гликозида C0.4.7).
1 Zn(CH3CC>O
г -п =«-с
Ацетильные и бензоильные защитные группы в последнем удаляют
последовательным применением ацетата цинка в мет плате натрия
и дальнейшим восстановлением водородом, и получают диол C0.4.8).
Последний далее трансформируется в соответствующий ацеталь 2-фор-
- 557 ¦
Глава 30
милгиофена, являющийся искомым тенипозидом C0.4.9) [128, 129, 130,
131. 132]
^S'"XHO ZiC
сн3о ^ оснз
но
Тенипозид применяют по тем же показаниям, что и этопозид. одна-
однако препарат проявляет активность, превосходящую таковую эгопозида
в 5-10 раз.
Синонимами препарата являются эпиподофиллотоксин, вумон и др.
30.5. Гормональные препараты
Гормональные препараты успешно применяются при комплексном
лечении злокачественных новообразований. Причем опухоли могут
быть как гормонально зависимые, так и гормонально чувствительные.
I ормонально зависимые опухоли регрессируют при исключении гормо-
гормонального воздействия. Следовательно, возможно уменьшить и даже
предотвратить развитие гормоиально зависимых опухолей лекарствами.
В частности, антиэстрогенный препарат тамоксифен предотвращает
стимуляцию эстрогенами опухолевых клеток рака груди. То же касается
и аминоглугетнмида — ингибитора синтеза кортикостероидов надпо-
надпочечниками.
Гормонально чувстительные опухоли могут регрессировать и час-
часто приостанавливают свой рост при введении определенных гормонов.
Основными гормнальночувствительными формами рака являются кар-
карцинома гр\ди, простаты, лимфомы и некоторые виды карциномы.
Гормональными препаратами, ингибирующими рост определенных
человеческих оп\ холей, являются стероиды, включающие андрогены,
эстрогены, прогестины и кортикостероиды. причем использ}ются толь-
только глюкокортнкоиды Более того, ни кортизол, ни кортизон ие исполь-
з\ются при лечении злокачественных новообразований, а используются
преднион. преднизолон, метилпреднизолон и дексаметазон.
-558-
Антинеопластики
1 ормональные препараты не вылечивают рак. однако проявляют
выраженное паллиативное действие, за исключением цитотоксического
действия 1люкокортикоидов на лимфоидные клетки. Речь идет, в част-
частное ги. о нреднизоне, который применяется при лечении лимфомы
и определенных лейкемий при комбинированной терапии. Точный ме-
чаншм действия стероидов до конца не выяснен.
Андрогены
Андрогены — производные тестостерона B9.1.3), метилтестостерон
B9.1 7). фл\оксиместерон B9.3.8), тестолактон C0.5.1) наиболее часто
используются для паллиативного лечения рака груди у постменопау-
зальных женщин, которым показана гормональная терапия. Точный
механизм противоопухолевого эффекта андрогенов неизвестен. Однако
полакают, что андрогены блокируют рост клеток путем ингибирования
транспорта природного гормона роста в клетку. Более того, андрогены
мог\.т ишибировать синтез эстрогенов, вызывая тем самым истощение
'.апасов эстрогенов.
Эстрогены
Эстрогены — эстрон B8.1.9), эстрадиол B8.1.17), этинилэстрадиол
(is 1.2о), диэтилстильбестрол B8 1.33), хлортрианизен C0.5.2) исполь-
использую 1ся дтя паллиативного лечения постменопа\ зального рака фуди,
рака простаты и рака груди у мужчин. Считается весьма вероятным, что
механизм их действия сходен с механизмом действия андрогенов.
-559-
Прогестины
Прогестины — стероидные соединения родственные прогестеро-
н> — капроат гидроксипрогестерона B8.3.6), ацетат медроксипроге-
стерона B8.3.7) и ацетат мегестрола B8.3.9) применяются при паллиа-
паллиативном лечении карциномы груди и почечных опухолях. Прогеспшы
могут иметь прямое местное воздействие на клетки и одновременно
понижать количество лютеинизиру/ющего гормона.
28 3 6
,с=о
о-сосн-
СНз
,c=o
¦¦O-COCH3
c=o
-COC",
Кортико стероиды
Коргикостероиды — синтетические стероидные препараты, полу-
чаемые из природного гормона гидрокортизона, и, в частности, нредни-
зон часто используются при комбинированной терапии для лечения
острой и хронической лимфоцитной лейкемии, ходжкинской и не.ход-
жкинской лимфомах. множествентгой миеломе и раке груди. Кортико-
стероиды оказывают противоопухолевый эффект, связываясь с коргико-
стероидными рецепторами, присутствующими во многих раковых
лимфоидных клетках, что приводит к ингибированию и транспорта
глюкозы, и фосфорилирования, что уменьшает количество энергии, не-
необходимой для митоза и синтеза протеинов, что, соответственно, при-
приводит к лизису клеток.
27 1 31
Негормональные препараты
В дополнение к гормональным препаратам в химиотерапии рака
широко используются также пять других препаратов, не являющихся
стероидами, но имеющих прямое отношение к данном} разделу Ими
-560-
Антинеопластики
являются аминоглутетимид, флугамид, митотан, тамоксифен, лейпро-
лид.
Аминоглутетимид (Aminoglutethimide)
Аминоглутетимид — (±)-2-D-аминофенил)-2-этилгл\ гаримид C0.5.4)
получают двумя путями. Первый способ исходит из глутетимида
D 3 6). нитрованием которого нитрующей смесью пол>чают 2-D-
нитрофенил)-2-этилглутаримид C0.5.3). Восстановлением нитро-
группы в последнем водородом с использованием в качестве ката-
катализатора никеля получают искомый аминоглутетимид C0 5.4).
л Д-МН2
HNO3 H2SO4
Второй способ синтеза исходит из 2-фенилбутиронитрила, нитро-
нитрованием которого в аналогичных условиях получают 2-D-нитрофенил)-
б>тиронитрил C0.5.5). Последний в условиях реакции Михаэля в при-
с>тс1вии гидроокиси бензилтриметиламмония присоединяют к метил-
акрплат), и продукт подвергают кислотному гидролизу смесью
\ ксусной и серной кислот, при котором происходит циклизация в 2-D-
нит-рофенил)-2-этилглутаримид C0.5.3), который аналогично выше-
вышеописанному и восстанавливают водородом в искомый продукт — ами-
аминоглутетимид C0,5.4) [133, 134].
СН2=СН-СООСН3
PhCHjNiCHaB ОН
C-CSN
СН.-СН;-СООСи3
CH3COOH, H2SO4
30 5 3
2Н5
Препарат блокирует трансформацию холестерина в прегненолон и
андрогенов в эстрогены в надпочечниках и тем самым полностью по-
подавляет выработку всех стероидных гормонов. Аминоглутетимид ис-
-561 -
Глава 30
пользуется при паллиативном лечении постменопаузальной карциномы
груди и карциноме простаты.
Синонимами препарата являются ориметен. цитадрен и др.
Флутамид (Flutamide)
Синтез флутамида B9.2.15) описан в гл. 29 «Мужские половые гор-
гормоны и анаболические стероиды».
02N—^ \- NH-C-CH-СНз
F3C 29 2 15
Препарат блокирует связывание андрогенов клетками тканей-
мишеней и препятствует биологическом) действию андрогенов, в том
числе в клетках опухоли предстательной железы.
Используется при карциноме простаты в сочетании с лейпролидом.
Митотан (Mitotane)
Мнтотан — 1,1-дихлор-2-(о-хлорфенил)-этан C0.5.8) получают ал-
килированием хлорбензола 1-B-хлорфенил)-2,2-дихлорэтаном C0.5.7)
в присутствии серной кислоты. Необходимый для этой цели 1-B-
хлорфенил;-2,2-дихлорэтан C0.5.7), в свою очередь, получают
взаимодействием 2-хлофенилмагнийбромида с дихторуксусным аль-
альдегидом [135].
н
он
30 5 7
' h2so4
Митотан — производное инсектицида ДДТ очень быстро понижает
уровень кортикостероидов и их метаболитов в крови и моче и использу-
используется при неоперабельной метастатической карциноме простаты.
Синонимом препарата является лизодрен и др.
Тамоксифен (Tamoxiphen)
Синтез гамоксифена B8.2.8) был описан в гл. 28 «Женские половые
гормоны».
-562-
Антинеопластики
н5с2\
Н5С2
N-CH2-CH2—I
С2Н5
28 2 8
Препарат блокирует рецепторы эстрогенов, тормозя прогрессирова-
ние опухолевого заболевания, стимулируемого эстрогенами.
Тамоксифен используется при паллиативном лечении рака груди
у пре- н постменопач зальных женщин.
Лейпролид (Leuprolide)
Лейпролид — 5-оксо-Ь-пролил-Ь-гистидил-Ь-триптофил-Ь-серил-
]_-1ирозил-О-лейцил-Ь-лейцил-Ь-аргинил-М-этил-1.-пролинамид
C0.5.9) получают синтетическим путем [136. 137, 138, 139].
pyroGlu-His-Trp-Ser-Tyr-D-Leu-Leu-Arg-Pro-NHEt
Нонапепгнд лейпролид является синтетическим аналогом декапеп-
тида — гонадотропин высвобождающего гормона, превосходит по ак-
активности естественный гормон и значительно снижает уровень тесто-
тестостерона и дигидротестостерона у мужчин и эстрогенов у женщин. При
этом имеет место также ингибирование фолликулостимулирующего
гормона и лютеинизирующего гормона.
Лейпролпд используется при раке простаты, когда орхиэктомия или
эстрогенная терапия противопоказаны пациенту.
Синонимом препарата является люпрон.
30.6. Прочие антинеопластические препараты
Рассматриваемые ниже препараты классифицируются как прочие,
поско 1ьк> либо по механизму их действия, либо по принадлежности
к опРе-"№ленном\ химическом) классу их трудно было включить в под-
Рлзделы, изложенные согласно традиционно принятой классификации
антинеоплас гнческих средств.
-563-
Глава 30
Гидрокси-почевина (Hydroxyurea)
Гидромзимочевина C0.6.1) получается взаимодействием иианата
натрия с гидроксиламином. При этом использ\ется гидрохлорид
гидроксиламина и основная ионообменная смола [140, 141].
NaOCN
NH2OH x HCI
amberlit
О
HO-NH-C-NH2
30 6 1
Гидроксимочевина действует путем подавления дегидрофосфатре-
дуктазы — фермента, который восстанавливает рибонуклеотиды в де-
зоксирибонуклеотиды, необходимые для синтеза ДНК.
Препарат резко понижает количество белых кровяных клеток при ост-
острых лейкемиях. Применяется при лейкемиях, меланомах и карциномах.
Синонимами препарата являются литалир, гидреа, онкокарбид и др.
Митоксантрон (Mitoxantrone)
Митоксантрон — 1,4-дигидрокси-5.8-Eмс[[2-[B-гидроксиэтил)ами-
но)эгил]амино]-9,10-антрацендион C0.6.3) структурно родственен
антибиотику доксорубицину. Его синтезируют исходя из дантрона
A,8-дигидроксиантрахинона), который действием азотной кислоты
и далее смесью с>льфида и тиосульфата натрия в щелочи транс-
трансформируется в 1.4,5,8-гетрагидроксиантрахинон C0.6.2). Взаимо-
Взаимодействием последнего с 2-аминоэтиламиноэтанолом в присутствии
хлоранила B,3,5.6-геграхлорбензохннона-1,4) получают искомый
митоксантрон C0.6.3) [142, 143, 144, 145].
/СН2-СН2-ОН
ОН О ОН ОН О ОН HN
¦ ¦ 1 hno, 1 и | " Nv
2 Na2S;Na2SO3/NaOH ^y^y^> 4CH2-CH2-NH2
о он о он Cv
30 6 2
ОН О NH—CH2-CH2-NH-CH2-CH2-OH
ОН О NH—CH2-CH2-NH-CH2-CH2-OH
30 6 3
-564-
штинеопластики
Механизм его действия однозначно не выяснен, однако полагают,
что митоксантрон ф\ нкционирует, связываясь с ДНК и тем самым на-
п\шает процесс скр>чивания цепей Используется внутривенно для ле-
лечения острой нелимфатической лейкемии, рака груди и т п.
Синонимом препарата является новантрон.
Дакардазин (Dacarbazine)
Дакарбазин — 5-C,3-диметил-1-триазено)имидазол-4-кабоксамид
C0 6 5) получают диазотированием 5-аминоимидазол-4-карбокс-
амида азотистой кислотой, в результате чего получае1ся 5-диазоими-
дазол-4-карбоксамид C0.6.4). Взаимодействием последнего с диме-
тиламином получают искомый дакарбазин C0.6.5) [146].
CONH2
N / NaNO2 ' H2SO4
II U *
N *Нг
CONH2
N /
Сх +
^N N2
30 6 4
(CH3JNH
CONh2
Н
30 6 5
CH3
Принято считать дакарбазин пока еще первым, но тем не менее
предегавигелем ряда триазеновых производных Показано, что он явля-
является алкилирующим агентом, причем препарат ингибирует синтез РНК
и протеинов в большей степени, чем ДНК.
Дакарбазин применяется внутривенно при болезни Ходжкина. сар-
саркоме мягких тканей и метастатической меланоме.
Синонимом препарата является дитииен.
Прокарбсиин (Procarbazine)
Прокарбазин — 1-метил-2-(/1-изопропилкарбамоилбензил)-гидразин
C0.6 8) синтезируют исходя из 1,2-бмс-(бензилоксикарбонил)-1-ме-
тилгидразина, который алкилируют метиловым эфиром 4-бромме-
тилбензойной кислоты в присутствии гидрида натрия с получением
1.2-бг<с-(бензилоксикарбонил)-1-метил-2-(«-карбметокси)бензил ги-
гидразина C0.6.6) Гидролизом карбметоксильной группы последнего
гидроокисью натрия, трансформацией полученной карбоксильной
гр\ппы в хлорангидридную, и, наконец, взаимодействием продукта
с изопропиламином получают 1,2-бмс-(бензилоксикарбонил)-1-ме-
гил-2-(/2-изопропилкарбамоил)бензилгидразин C0.6.7). Гидролизом
бензилоксисарбонильных групп в последнем бромистым водородом
в >кс\сной кислоте получают искомый прокарбазин C0.6.8) [147,
148, 149, 150].
-565-
Глава 30
СО-0-СН2С6Ч5
2 SOCb
3 (Crio;:CHNH
NaH C6H6Cbj-O-CO
HBr/ Ch3COOH
Ch3NHNH-CH2
CONHCH(CH3J
30 6.8
Первоначально прокарбазин был синтезирован в качестве ингиби-
ингибитора МАО Однако впоследствии выяснилась его способность высту-
выступать в роли алкилирующего агента и ингибировать синтез ДНК, РНК
и протеинов. Вместе с тем существует точка зрения, согласно которой
прокарбазин накапливается в опухолевых тканях и генерирует в клетках
перекисные и гидроперекисные радикалы, что имитирует эффект иони-
ионизирующей радиации. Препарат используется при злокачественных но-
новообразованиях лимфатических тканей, опухолях мозга, легких, болез-
болезни Ходжкина.
Синонимом препарата является натулан.
Амсакрин (Amsacrine)
Амсакрин — 4-(9-акридиниламино)-3-метоксифенил->4-метансуль-
фонамид C0.6.11) получают сульфонирированием 4-нитро-л<-ани-
зидина метансульфохлоридом с получением сульфонамида C0.6.9),
нифогруппу в котором восстанавливают до аминогруппы водоро-
водородом с получением 4-амино-3-метоксифенил-М-метансульфонамида
C0.6.10). Взаимодействием последнего с 9-хлоракридином получа-
получают амсакрин C0.6.11) [151, 152, 153].
СН3О
O2N—<\ Л— NH-SO2-CH3
30 6 9
-566-
\ т и н е о пласт и. ки
СН3О
NH-<\ V-NH-SO2-CH3
Амсакрин — препарат, проходящий интенсивные испытания при
острой лейкемии и лимфоме. Является циготоксическим препаратом,
связывающимся с ДНК, с выраженной специфичностью к паре адено-
зин-тирозин. тем самым ингибирующим синтез ДНК. Предполагается
его использование при острой лейкемии.
Синонимом препарата является амсидил.
Аспарагиназа (Asparaginase)
Аспарагиназа является ферментом, гидролизующим L-аспарагин до
L-аспарювой кислоты, чем и вызывает истощение запасов L-acna-
рагина, ингибируя тем самым синтез протеинов и нуклеиновых ки-
кислот. Эффективен при острой лимфоцитной лейкемии [154].
Синонимом препарата является элспар.
. Список литературы
1 Seeger D et al. 'J. Am. Chem. Soc. 11, 1753 A949).
2. Piper J. et al., 'J. Heterocycl. Chem. Ц, 279 A974).
3. Chaykowsky M et al."J. Med. Chem. Г7, 1212 A974).
4. Ger. Pat. 2.741.270A977).
5. US Pat. 4.057.548A977).
6. US Pat. 4.067.867A978).
"¦¦ US Pat. 4.080.325A978).
Ь. Ger. Pat. 2.741.383A977).
9. Brit. Pat. 713.286A951).
10. US Pat. 2.721.886A955).
П. US Pat. 2.724.711 A955).
12. US Pat. 2.933.498A960).
13. Elton G et al.' J. Am. Chem. Soc. 74, 411 A952).
14. US Pat. 2.697.709A954).
15 Beaman A. et al.' J. Am. Chem. Soc. 81 4042 A961).
-567-
Глава 30
16.
17.
18.
19.
20.
21.
22
23.
24.
25
26.
27.
28.
29
30.
31.
32.
33.
34.
35.
36.
37.
38.
39.
40.
41.
42.
43.
44.
45.
46.
47.
48.
49.
50.
51.
52.
53.
54.
55.
56.
US Pat. 2.884.697A959).
US Pat. 2.800.473A957).
US Pat. 3.019.224A962).
US Pat. 3.132.144A964).
Elion G et al./'J. Am. Chem. Soc. 77, 1676 A955).
US Pat. 2.802.005A957).
Duschinsky R. et al.'/J. Am. Chem. Soc. 79, 4559 A957).
US Pat. 3 682.917 A972).
US Pat. 3 846.429A974).
US Pat. 3.954.758A976).
Ger. Pat. 2.149.504A971).
Ger. Pat. 2.719.245A977)
Ger. Pat. 2.726.258A978).
Hoffer M. et al. <J. Am. Chem. Soc. 81, 4112 A959).
US Pat. 2.885,396A959).
US Pat. 2.970.139A961).
US Pat. 2.949.451 (I960).
US Pat. 3 041.335A962).
US Pat. 3.116.282 A963).
Roberts W et al.//J. Org. Chem. 32, 816 A967).
Formageot H et al./'Tetrahedron Lett. 1966, 3499.
Messier E et al., J. Org. Chem. 4J, 1828 A976).
Claesen С et al.,' Tetrahedron, 26, 3859 A985).
Prelog V. et al./ Coll. Czech. Chem. Commun. 7, 93 A935).
HanbyE. et al.'/J. Chem. Soc. 1947, 513.
Abrams J et al. J. Soc. Chem. Ind. (London) 68- 280 A949).
Brit. Pat. 727.336A955).
US Pat. 2.944.079A960).
US Pat. 3.043.301 A962).
US Pat. 3.046.301 A962).
Everett A et al.//J. Chem. Soc. 1953, 2390.
US Pat. 3.032.584A962).
US Pat. 3.032.585A962).
BergelL. et al. 'J. Chem. Soc. 1954, 2409.
BergelL. et al. J. Chem. Soc. 1955, 1223.
Ger Pat. 1 057.119A956).
US Pat. 3.018.302A962).
Arnold H. et aL.Naturwiss. 45. 64 A957).
Arnold H. et al/'Nature. 181, 931 A958).
ArnoldH et al. Angew. Chem. 70. 539 A958).
Karle I et al. J. Am. Chem. Soc. 99. 4803 A977).
58.
59.
60.
61.
62.
63.
64.
65.
66.
67.
68.
69.
70.
71.
72.
73.
74.
75.
76.
77.
78.
79.
80.
81.
82.
83.
84.
85
86.
87.
88.
89.
90.
91.
92.
93.
94.
95.
96.
97,
Adamaik D. et al/'Angew. Chem. Int. Ed, 16, 330 A977).
Kawashima T et al. "J. Org. Chem. 43, 111 1 A978).
Sato T. et al/ J. Org. Chem. 48, 98 A983).
Fr. Pat. 1.530.962A968).
US Pat. 3.732.340A973).
Brassfield H. et al./VJ. Am. Chem. Soc. 97, 4143 A975).
US Pat. 2.670.347A954).
Japan Pat. 55 218A955).
Brit Pat. 700.677A950).
US Pat. 2.917.432A959).
Johnston T et al.'/J. Med. Chem. 9, 892 A966).
Johnston T. et al.,/J. Med. Chem. 6, 669 A963).
Ger. Pat. 2.528.365A975).
Vavra J et al.' Antibiot. Arm. 1959-1960, 230.
Ger Pat. 1.090.823A960).
US Pat. 3.027.300A962).
Rosenberg B. et al.,'Nature (London), 222, 385 A969),
Ger. Pat. 2.906.700A979).
Kauffman G et al.//Inorg. Synth. 2, 239 A963).
Ger. Pat. 2.318.020A972).
Ger. Pat. 2.329.485A972).
US Pat. 4.140.707A979).
Harrison R et al.,/Inorg. Chim. Acta. 46, L15 A980).
US Pat. 2.378.876A962).
ManakerJ et al.,', Antibiot. Arm. 1954-55, 853.
Bullock J et al.,7J. Chem. Soc. 1957, 3280.
Brockmann H. et al.,'/J. Chem. Soc. 1964, 384, 435.
Brockmann H. et aL'/Ber. Ш, 1312 A968).
MeienhoferJi/i. Am. Chem. Soc. 92, 3771 A970).
Tanaka T et aL/Bull. Chem. Soc. Japan, 53, 1352 A980).
Nakajima K. et al.//Pept. Chem. 19, 143 A981).
Takita T. et al./'J. Antibiot. 21, 79 A968).
Takita T et al./VJ. Antibiot. 22. 237 A969).
Takita T et al.;/J. Antibiot. 25, 755 A972).
Takita T et al. J. Antibiot. 3J_, 801 A978).
Takita T et al. Tetrahedron, 23, 521 A982).
ioyagi У et al.', J. Am. Chem. Soc. 104, 5537 A982).
Saito S etal. J. Antibiot. 36, 92 A983).
US Pat. 3.590.028A971).
Brit. Pat. 1.161.278A968).
Arcamone F. et al. Ger. Pat. 1.917.874 A969).
-568-
-569-
Глава 30
98. Лгсатопе F. et al.//Tetrahedron Letters, 1969, 1007.
99. Acton E. et al. J. Med, Chem. Ц- 659 A974).
100. US Pat. 4.012.448A977).
101. Gassinelh G. et al/Giorn. Microbiol. U, 167 A963).
102. DiMarco A et al. '.Nature, 20J, 706 A964).
103. US Pat. 4.012.284A977).
104. US Pat. 3.997.662 A976).
105. Marsh P. et aL/Chem. Commun. 1967, 973.
106. Yamaguchi T. et al./'Carbohyd. Res. 59, 343 A977).
107. Wovkulich P. et al.', J. Am. Chem. Soc. ШЗ, 3956 A981).
108. Acton E. et al.'/J. Med. Chem. JJ, 659 A974).
109. Hata T. et al /J. Antibiot. 9A, HI A956).
110. Wakaki S. et al.,, Antibiot. Chemoter. 8, 228 A958).
111. Brit. Pat. 830.874A960).
112. US Pat, 3 660.578A972).
113. US Pat. 3.042.582A972).
114. Lefemine D et. al.'J. Am. Chem. Soc. 84. 3184 A962).
113. Fukuyama T. et al.'Tetrahedron Letters, 1977, 4295.
116. Kislu }.J. Nat. Prod. 42, 549 A979).
117. Svoboda G. et al.-VJ. Parm. Sci. 5±, 707 A962).
118. US Pat. 3.097.137A963).
119. US Pat. 3.225.030A965).
120. US Pat. 4.070.358A978).
121. Belg. Pat. 867.670A978).
122 Fr. Pat. 2.210.392A972).
123. Brit Pat. 1.382.460A972).
124. US Pat. 3.899.493A975).
125. Rahman A. et al.//Tetrahedron Letters. ±976, 2351.
126. Mangeney P et al.'/J. Am. Chem. Soc. 101, 2243 A979).
127. US Pat. 3.524.844A970).
128. Keller-.Juslen С et al./'J. Med. Chem. 14, 936 A971).
129. S.Afr. Pat. 66 07,585A968).
130. US Pat, 3.524.844 A970).
131. Fr. Pat. 1.518.706A966).
132. Fr. Pat. 2.320.104A975).
133 US Pat. 2.848.455A958).
134. Finch N ei al. 'bxperientia, 3L Ю02 A975).
135 Holler В et al/ J. Am. Chem. Soc. 67. 1591 A945).
13b. tier. Pat. 2.446.005 A975).
\Г, US Pat. 4.005.063A977).
-570-
Аитинеопластики
138 Vilchez-Martinez J et al.//Biochem. Biophys. Res. Commun.
5_9. 1226A974).
139 Fujino M. et al. /Biochem. Biophys. Res. Commun. 60, 406
' A974).
140. Hantzsch A.; Aim. 299, 99 A898).
141. US Pat. 2.705.727A955).
142. US Pat. 4.197.249A980).
143. Ger. Pat. 2.835.661 A979).
144. Zee-Cheng R. et al.//J. Med. Chem. 21, 291 A978).
145. Murdock К et al.//J. Med. Chem. 22, 1024 A979).
146. ShealyJ et al.//J. Org. Chem. 27, 2150 A962).
147. US Pat. 3.520.926A970).
148. Brit. Pat. 968.460A962).
149. Zeller P et al./'Experientia. \9, 129 A963).
150. Belg. Pat. 618.638A962).
151. Cain В. etaUJ. Med. Chem. 18, 1110A975).
152. Cain B. et al., ''J. Med. Chem. 20, 987 A977).
153. Denny W et al./'J. Med. Chem. 21, 5 A977).
154. Ho D. et al.', J. Biol. Chem. 245, 3708 A970).
Глава 31
Иммунофармакологические
препараты
Способность организма самостоятельно защищать себя от опреде-
определенных ботезней называется иммунитетом.
Иммунитет к определенным заболеваниям может быть как врож-
врожденным, так и приобретенным. Большинство типов иммунитета либо
приобретается в течение жизни в ответ на заражение различными мик-
микроорганизмами (активно приобретенный иммунитет), либо достигается
специальной, направленной выработкой в организме антител в снвет на
искусственное заражение заранее убитыми или ослабленными микроор-
микроорганизмами (пассивно приобретенный, искусственный, иммунитет), что
обычно достигается вакцинацией.
Иммунизация, или селективное усиление иммунного ответа орга-
организма, является одним из способов борьбы с инфекционными заболева-
заболеваниями путем вакцинации, т. е. выработки антител против конкретных,
специфических патогенов.
Иммунной реакцией несомненно является и воспаление. В этом
плане препараты, описанные в других главах как антигистаминные
средства, НПВС, антисеротониновые препараты и многие другие, мож-
можно формально 1акже отнести к иммунофармакологическим. Однако
в этой главе будут рассмотрены лишь препараты, имеющие прямое дей-
действие только на клетки, обладающие иммунными функциями, такие как
лимфоциты, клетки плазмы и подтипы этих клеток. Следует отметить,
что продукты жизнедеятельности самих- этих клеток, такие как лнмфо-
кины, интерфероны и интерлейкины, сами по себе являются весьма
важными иммунофармакологическими препаратами. Иммунная система
обладает огромным количеством антител, распознающих «свои» и «чу-
«чужие» молекулы Она играет огромную роль при аутоиммунных болез-
болезнях, при реакциях гиперчувствительности организма на определенные
раздражители и при отторжении трансплантатов.
-572-
Иммунофармакологические препараты
Иммунная система жизненно необходима не только для защиты ор-
организма от чужеродных тел как органического и неорганического про-
происхождения, но также от собственных клеток, трансформировавшихся
в ч\жеродные. Она служит также для удаления больных, мертвых или
инородных клеток, а также, по всей вероятности, служит основной за-
зашитой организма от рака, подавляя многие возникающие очаги новооб-
новообразований и часто не дает образоваться метастазам
Различные лекарственные средства способны влиять на специфиче-
специфические иммунные реакции. Они могут как повышать общую сопротивляе-
сопротивляемость организма или его неспецифический иммунитет, так и подавлять
им.му иные реакции организма.
Таким образом, контроль над болезнями иммунологическими сред-
средствами означает либо генерирование в организме необходимого имму-
иммунитета, либо подавление нежелательных иммунных реакций.
Очевидно, чю иммуиофармакологические препараты имеют ог-
огромное шачение при болезнях иммунной системы, при транспланта-
трансплантации органов, при вирусных инфекциях и, в частности, при лечении
СПИДа.
31.1. Иммуностимуляторы
Повышение общей сопротивляемости организма наблюдается под
влиянием ряда известных препаратов — иммуностимуляторов (кофеин,
фенамин, метилурацил), витаминов (ретинол, аскорбиновая кисло!а,
витамины группы В), производных нуклеиновых кислот, а также и спе-
специальных, созданных для этой цели препаратов природного или генно-
инженерного происхождения.
К ним относятся такие протеины, как лимфокины, и в частности ин-
терлейкин-2, являющийся гликопротеином, состоящим из 133 амино-
аминокислот, а также так называемые факторы, стимулирующие колонии
(ФСК) макрофагов или гранулоцитов, вырабатываемые некоторыми
клетками, к которым относится ФСК-мульти или интерлейкин-3; грану-
лоцитоз стимулирующий фактор, являющийся негликозилированным
протеином: макрофагоз стимулирующий фактор, являющийся высоко-
гликозилированным гомодимерным протеином; фактор стимулирую-
стимулирующий и гранулоцитоз и макрофагоз, являющийся мономерным гликопро-
гликопротеином, — все эти факторы стимулируют пролиферацию, диффе-
дифференциацию и функционирование целевых клеток на различных стадиях
развития.
Для этой же цели предложены препараты, названные факторами,
вызывающими некроз опухолей (ФНО-а и ФНО-Р).
-573-
Глава 31
В качестве иммуностимуляторов широко используются и интерфе-
роны — семейство гликопротеинов. вырабатываемых в макрофагах
(сх-ишерфероны). вырабатываемые в макрофагах и фибробластах (Р-ин-
терфероны). вырабатываемые в лимфоцитах (у-итерфероны), назван-
названные так из-за способности взаимодействовать с вирусными РНК и воз-
действоваать на синтез белка, В настоящее время в медицине исполь-
используются коммерчески доступные а-, Р- и у-интерфероны.
В качестве чисто синтетического иммуностимулятора применяется
практически только левамизол, первоначально предложенный в качест-
качестве противоглистного средства и широко применяющийся в качестве
гакового и в настоящее время.
Левамujo.i (Levamizol)
Левамизол — 2.3,5.6-тетрагидро-6-фенилимидазо[2.1-Ь]тиазол C1 1.4)
предложено получать разными путями. Первый способ исходит из
а-бромацетофенона, взаимодействием которого с 2-имино-1,3-тиазо-
лидином получают 3-фенацил-2-имино-1,3-тиазолидин C1.1.1). Под-
Подвергая продукт действию уксусного ангидрида, получают 3-фен-
ацид-2-ацетили\1ино-1,3-тиазолидпн C1.1.2). Кетонную группу в по-
последнем восстанавливают до спиртовой с использованием бор-
гидрида натрия, и образовавшуюся гидроксильную группу в C1.1.3)
замещают на хлор действием хлористого тионила. Кипячением про-
продукта в уксусном ангидриде замыкается нмидазольный цикл с обра-
образованием продукта C1.1.4).
А
- А
~сн,—m^s
6h~ch2-nAs
31 1 3
N-СОСЧз
31 1 4
Второй способ, представляющий несколько иной подход, был реа-
реализован при использовании в качестве исходного вещества окиси сти-
стирола. Взаимодействием последней с 2-имино-1,3-тиазолидином полу-
получают 3-B-фенил-2-гидроксизгил)-2-имино-1,3-тиазолидин C1.1.5).
-574-
Иммунофармакологические препараты
пос1едовагельной обработкой которого хлористым тионилом и далее
укс\сным ангидридом получают искомый левамизол C1.1 4).
Наконец, исходя из той же окиси стирола, предлагается третий
способ получения продукта. Окись стирола вводят во взаимодействие
(Газиридином с получением 2-азиридино-1-фенилэтанола-1 C1.1.6). Об-
Обработкой последнего изотиоцианатом калия или тиомочевиной получа-
получают 3-B-фенил-2-гидроксиэтил)-2-имино-1,3-тиазолидин C1.1.5), после-
девате гьной обработкой которого аналогично вышеописанному хло-
хлористым шонилом и далее уксусным ангидридом получают искомый
левам1потC1.1 4) [1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12].
N~H
?н А
,ХН—СН2—N S
(СНзСО)гО
Левамизол обладает иммуиомодулируюшей активностью. Полага-
Полагают, что npenapai регулирует клеточные механизмы иммунной системы
и механизм его действия может быть связан с активацией и пролифера-
тивным ростом Г-лимфоцитов, увеличением числа моноцитов и актива-
активацией макрофаюв, а также с увеличение подвижности и хемотаксиса
нейтрофильныч гранулоцитов. Левамизол оказывает также антигель-
мин гное действие.
Он повышает общую сопротивляемость организма, восстанавливает
измененные функции Т-лимфоцитов и фагоцитов. Препарат может вы-
выполнять и функции иммуномодулятора, усиливая слабую реакцию кле-
клеточного иммунитета, ослабляет сильную и не действует на нормальную
Реакцию
Левами юл показан при первичных и вторичных иммунодефицит-
ныч состояниях, аутоиммунных заболеваниях, хронических и рециди-
рецидивирующих инфекциях, аденокарциноме толстой кищки, гельминтозах
и Ревматоидном артрите.
Синонимами препарата являются декарис, тетрамизол и др.
-575-
Глава 31
31.2. Иммунодепрессанты
Наряд) с иммуностимуляторами в медицинской практике необхо-
необходимы препараты, подавляющие имм>ногенез, продукцию антител, что
особенно важно при трансплантации различных тканей и органов,
когда организм вырабатывает антитела, вызывающие гибель переса-
пересаженных тканей, а также при лечении некоторых аутоиммунных забо-
заболеваний.
Иммунодепрессивной активностью обладают вещества различных
фармакологических групп — глюкокортикоиды, цитостатики, антибио-
антибиотики (циклоспорин).
Глюкокортикоиды
Многие синтетические производные глюкокортикоидов широко
применяются в качестве иммунодепрессантов. Глюкокортикоиды (кор-
(кортизон, преднизолон, метилпреднизолон, бетамезазон, дексаметазон.
триамицинолон и др.) обычно применяются в сочетании с другими им-
мунодепрессантами. особенно в случаях, сопровождающихся воспале-
воспалениями. Иммунодепрессивное действие глюкокортикоидов связывают
с понижением уровня лимфоцитов, эозинофилов и базофилов в крови,
подавлением распознавания антигена, угнетением фазы пролиферации
лимфоцитов.
Циготоксические препараты
Предположительно любое циготоксическое вещество, разрушаю-
разрушающее костный мозг и лимфоидную ткань, может быть использовано
в качестве иммуносупрессора. Среди этих препаратов наиболее широко,
и главным образом при аутоиммунных заболеваниях, используются
винкристин, меготрексат и цитарбаин. Однако их применение следует
считать экспериментальным. Только метотрексат достаточно обосно-
обоснованно признан в качестве первичного препарата для лечения ревмато-
ревматоидных артритов.
Кроме того, один из серии аналогов меркаптопурииа — азатиоприн,
предложенный в качестве цитотоксического препарата, оказался более
эффективным как иммуносупрессор.
Азатиоприн (Azathioprin)
Азатиоприн — 6-[A-метпл-4-нитроимидазол-5-ил)тио]пурин C1.2.1)
получают гетероарилированием SH-ipynnM 6-меркаптощрина
C0.1.2.9) 5-хлор-1-метил-4-нитроимидазолом в присутствии ацета-
ацетата натрия в качестве слабого основания [13].
-576
O2N
J-CH3
O2N
CH3COONa
N
Cl
i
н
31 2 1
Фактически азатиоприн является пролекарством, поскольку в орга-
организме он превращается в меркаптопурин. Возможно, что именно это
является причиной его преимущества в качестве иммуносупрессора пе-
перед меркаптопурином.
Механизм действия азатиоприна в качестве цитотоксического пре-
препарата не отличается от механизма действия других антиметаболитов.
Азатиоприн является основным препаратом, применяемым при
трансплантациях, особенно при пересадке почки. Сегодня во многих
случаях вместо азатиоприна используют циклоспорин. Однако азатио-
азатиоприн полезен в комбинации с цикоспорином и даже предпочтителен
в определенных случаях.
Синонимами препарата являются азумек, имуран и др.
Циклофосфамид (Cyclophosphatnide)
Синтез и свойства препарата C0.2.1.15) описаны в гл. 30 «Антинео-
пластики».
Ср<-0 СН2-СН2-С
N"H CH2-CH2-C
30 2 1 15
Кроме применения в качестве алкилирующего средства при химио-
химиотерапии рака, циклофосфамид является уникальным препаратом в каче-
качестве имм\носупрессора. Во-первых, он является наиболее мощным из
всех подобных препаратов. Во-вторых, он разрушает пролиферирующие
клетки, а также, по-видимому, алкилирует определенную часть остав-
оставшихся клеток. Наконец, его действие на Т-клетки таково, что несмотря
на общий супрессорный эффект, он может в определенных обстоятель-
обстоятельствах подавлять ответ этих клеток на антигены.
Циклофосфамид успешно применяется при трансплантации костей.
В малых дозах препарат эффективен при аутоиммунных нарушениях.
-577-
Глава 31
Циклоспорин Л (Cyclosporin A)
Циклоспорин А — [R-[R*,R*-(E)J]-m-iKjiH4ecKHfi-(L-anaHH-i-D-ajjaHHji-
Ы-метил-Ь-лейщ1л-\т-метил-1_-лейцил->4-метил-Ь-валил-3-гидрокси-
К,4-диметил-Ь-2-амино-6-октеноил-Ь-а аминобутирил-К-метилгли-
цил-К-метил-Ь-лейцил-Ь-валил-Ы-метил-Ь-лейцин C1.2.2), кото-
который экстрагируются из культуральной жидкости продуктов жизне-
жизнедеятельности гриба Tolypocladiwn inflatum [14, 15. 16, 17] и который
предложено получать синтетическим путем [18, 19].
снэ>
н сн,
9Н
сн2
сн
сн
Cri3
сн2
сн3
CH3-N-CH-C-N-CH-C-N-CH-C-N-CH-C-N-CH2
1 1П " ! 11 " ' 1 II I О II о I
О=С 1и О СН11 О СН О Н ^ О J С=
1 1П
О=С 1и
СН-СН2-СН9
О СН311 О СНз О Н
! !
С=О
N-CH3
но?
н о
II
?, 5
h О,
CH3-N
O=C-CH-N-C-CH-N-C-CH-N-C-CH-N-C-CH
i i iii i
СНз CH3 CH2 СНз СН СН2
6н снз снз дн
СНз СНз ""
сн3
31 2 2
Циклоспорин А является мощным иммуносупрессивным препара-
препаратом, предназначенным для предотвращения отторжения при пересадке
почек, печени или сердца.
С открытием циклоспоринов началась новая эра в развитии имму-
нофармакологии. Циклоспорнны продуцируются мицелиальными гри-
грибами Toiypocladium inflatum, Tricoderma polysporum и Cylindrocarpon
lucidum, выделенными из почв.
Циклоспорин А является первым препаратом, воздействующим на
специфическую линию клеток защитных сил организма. Он подавляет
именно Т-клетки, в отличие обычных цитотоксиков, воздействующих
на все линии клеток одновременно. Циклоспорин А значительно облег-
облегчает «принятие» трансплантатов и повышает возможности для лечения
заболеваний аутоиммунной системы
Все циклоспорины (А, В. С, .. U, V, W) являются олигопептидами,
состоящими из 11 аминокислот, замкнутых в цикл. Все составляющие
являются известными аминокислотами за исключением первой, которая
-578-
Иммунофармакологические препараты
никогда ранее не была выделена из природных источников. Все они
являются L-аминокислотами за исключением аминокислот в положени-
положениях 3 и 8. За счет возникающих водородных связей структура циклоспо-
циклоспорина дос га точно жесткая. Циклоспорины А, В, С, ...U, V, W отличаются
лишь второй аминокислотой.
Осуществлен полный синтез как самого циклоспорина А, так и ряда
других циклоспоринов. Синтезировано также много структурных ана-
аналогов и выявлены некоторые закономерности в плане структура-
активность. Выяснено, что активность препарата обуславливается всей
циклической структурой, а не отдельными ее фрагментами. Вместе
с тем ясно, что структура аминокислоты в положении 1 является важ-
важным фактором, определяющим активность. Несмотря на то, что молеку-
молекула ошосительно велика, циклоспорин проникает через клеточные мем-
мембраны с легкостью. Возможно, что для циклоспорина не существует
соотве1ств\ющих «\знающихл рецепторов. Однако существует цито-
зольный циклоспорин-связывающий белок, известный как цитофилин,
с \шлек>лярной массой около 15 000. Циклофилины обнаружены пре-
им\щес1венно в Т-клетках, однако они найдены и в других тканях,
в частности в мозге и почках. Их точное назначение и функции неиз-
неизвестны. Предполагается, что они контролируют РНК при синтезе лим-
фокинов Поскольку механизм действия циклоспорина все еще интен-
интенсивно исследуется, необходимо отметить, что он не цитотоксичен
в общем смысле этого слова, поскольку не подавляет функции костного
мозга.
Несмотря на то, что циклоспорин применяется не очень давно,
он зарекомендовал себя как препарат номер один при транспланта-
трансплантациях.
Циклоспорин изучается также в качестве средства для лечения ря-
ряда аутоиммунных заболеваний, включая диабет, множественный скле-
склероз, миастению, ревматоидный артрит, псориаз. Препарат оказался
весьма эффективным также и при лечении шистосомиаса, малярии,
филарияза.
Синонимами препарата являются сандиммун и неорал.
Глава 31
Литература
US Pat. 3.274.209 A966).
Raemaekers A. et al.-J. Med. Chem. 9. 545 A966).
Spicer L et al,','J. Org. Chem. .33, 1350 A968).
Raemaekers A et al.'/Tetrahedron Letters. 1967. 1467.
Bullock W et al.'/J. Med. Chem. U, 169 C968).
Ger. Pat. 1.076.651 A966).
Brit. Pat. 1.076.109A965).
US Pat. 3.565.907A971).
US Pal. 3.579.530A971).
US Pat. 3.478.047A969).
US Pat. 4.070.363 A978).
1.
2.
3.
4.
5.
6.
7.
8.
9.
10.
11.
12. US Pat. 4.107.170A978).
13. US Pat. 3.056.785A962).
14. US Pat. 4.IP.118 A978).
15. Ger. Pat. 2.455.559A974).
16. RueggerA. et al.'/Helv. Chim. Acta. 59, 1075 A976).
17. Kobel H. et al/Tiur. J. Appl. Microbiol. Biotechnol. 14, 237 A982).
18. Wenger R i Angew. Chem. 97, 88 A985).
19. Wenger R.. Transplant. Proc. 15D), Suppl. 1, 2230 A983).
20. Eur. Pat. Appl. 34 567 A981).
Глава 32
Антибиотики
Препараты, используемые для лечения инфекционных заболеваний,
называются антибиотиками, противоинфекшгонными средствами, анти-
антимикробными или химиотерапевтаческими препаратами. Несмотря на то.
что все эти термины, в принципе, взаимозаменяемы, тем не менее, пер-
первые три — антибиотики, противоинфекционные средства и антимик-
антимикробные препараты, — в основном, употребляются при описания ле-
лекарств, используемых для лечения инфекционных заболеваний, в то
время как термин «химиотерапевтические препараты» больше ассоции-
ассоциируется с препаратами, применяемыми для лечения рака.
Собственно антибиотиками называются природные соединения,
продуцируемые микроорганизмами и способные ингибировать рост бо-
болезнетворных микробов, бактерий и некоторых простейших микроорга-
микроорганизмов.
Пол) синтетическими антибиотиками считаются продукты частич-
частичного химического видоизменения антибиотиков, выделенных из при-
природных источников.
Таким образом, антибиотиками являются соединения, продуцируе-
продуцируемые микроорганизмами и имеющие способность убивать или ингибиро-
ингибировать рост бактерий и других микроорганизмов. Это определение вносит
определенную разницу между антимикробными препаратами, продуци-
продуцируемыми микроорганизмами, и полностью синтетическими соедине-
соединениями. Это различие носит чисто академический характер, и сегодня
слово антибиотик довольно часто используется для определения анти-
антимикробных препаратов вообще. Следует отметить, что существуют
продуцируемые микроорганизмами соединения с противогрибковым
и противоопухолевым действием, которые также классифицируются как
антибиотики.
581 -
Основной концепцией антимикробного действия является избира-
тетьная токсичность, заключающаяся в том, что рост инфекционного
организма ингибируется или он уничтожается определенным препара-
препаратом без повреждения клеток хозяина. Все используемые в клинической
практике антимикробные препараты являются селективно токсичными
по отношению к микроорганизмам. Высокая избирательная токсичность
антибиотиков на микроорганизмы объясняется особенностями органи-
организации микробных клеток, принципиально отличающихся от клеток мле-
млекопитающих. Природа и степень этой селективности и определяет, яв-
является ли данный антимикробный препарат в общем не токсичным по
отношению к клеткам млекопитающих или же он все-таки проявляет
определенную токсичность и по отношению к определенным тканям
млекопитающих.
Антимикробные препараты проявляют антибактериальный эффект
посредством одного из следующих механизмов:
— ингибирование синтеза клеточных стенок микроорганизмов
ф-лактамные антибиотики, ванкомицин, циклосерин);
— ингибирование синтеза протеинов микроорганизмов (ами-
ногликозиды, эритромицин, клиндамицин, хлорамфеникол
и гетрациклины);
-- ингибнрование синтеза нуклеиновых кислот или их функций
в микроорганизмах (сульфонамиды, триметоприм, метрони-
дазол, хинолоны и рифампин);
— пнгибирование или изменение функций внешних и/или цито-
плазматических мембран микроорганизмов (полимиксин).
Рациональный подход антимикробной терапии инфекций основан
па выделении и идентификации инфицирующего организма и определе-
определении его чувствительности к антимикробному препарату. Наиболее ши-
широко используются in vitro тесты, такие как диффузия в агаре и опреде-
определение минимальной подавляющей концентрации в жидкой среде.
В методе диффузии в агаре бумажный диск, содержащий опреде-
определенное количество антимикробного препарата, помещается на поверх-
поверхность пластики, покрытой агаром, содержащим стандартное количест-
количество бактерий. После инкубации в течение определенного времени
измеряются диаметры чистой зоны вокруг дисков, которые отмечают
отсутствие роста бактерий. Диаметры интерпретируются как чувстви-
чувствительный, промежуточный и резистентный по отношению к кон-
конкретном) препарату после сравнения со стандартом. Недостатком ме-
метода следует считать возможность только качественного определения
-582-
Антибиотики
ингибир)юшей активности.
Качественная чувствительность определяется и методом опреОеле-
ния иинимсньной подавляющей концентрации в жиОкой среде. Наблю-
Наблюдают серию двукратных разбавлений препарата в растворе, содержащим
стандартизованное количество микроорганизмов. Результаты выража-
выражаются индексом минимальной ингибирующеи концентрации (МИК),
являющейся минимальной концентрацией препарата, ингибирующего
видимый рост после инкубации в течение ночи. Минимальная бакте-
бактерицидная концентрация (МБК) определяется по отсутствию бактери-
бактериального роста на агаровых пластинках и реинкубированных в течение
еще одной ночи. Это наименьшая концентрация препарата, уничто-
уничтожающего как минимум 99,9 % бактериального содержимого теста. Дан-
Данные МИК и МБК должны быть скоррелированны с концентрацией пре-
препарата, достигаемой в плазме и других тканях, а также в жидкостях
организма.
Противомикробные препараты могут быть классифицированы как
бакгериосчашческие (например, тетрациклины, сульфонамиды) и как
баюерицндные (например, пенициллины).
Бактериостатнческие препараты ингибируют бактериальный рост,
но не уничтожают эти организмы в клинически достижимых концен-
концентрациях. Следует ожидать, что МБК таких препаратов значительно вы-
выше чем МИК.
Бактерицидные препараты вызывают гибель микробных клеток и их
лизис в кпинически достижимых концентрациях. Для этих препаратов
МБК близка или равна МИК.
Лечение бактериостатиками останавливает бактериальный рост, по-
позволяя таким образом нейтрофилам и другим защитным силам организ-
организма вывести патоген.
В процессе использования антибиотиков по отношению к ним
может наблюдаться резистентность. Резистентность бактерий к анти-
антимикробным препаратам может быть охарактеризована и классифици-
классифицирована по двум признакам: внутренняя и приобретенная резистент-
резистентное гь. Внутренняя резистентность микроорганизма является
генетическим свойством микроорганизма, закодированным в хромо-
хромосомах и распространенным на все линии данного вида микроорганиз-
микроорганизмов. Приобретенная резистентность означает, что данная линия бак-
бактериального вида приобрела способность сопротивляться данному
антимикробному препарату.
Приобретенная резистентность подразумевает изменения в ДНК
оаптерий таким образом, что появляются новые характерные штрихи
нивою фенотипа. Резистентность при этом достигается двумя путями:
-583-
Глава 32
мутацией хромосом в бактериях или приобретением новых участков
ДНК (плазмид), кодирующих функцию резистентности.
Биохимический механизм внутренней и приобретенной резистент-
ности одинаков и может быть объяснен как результат одной из следую-
следующих 4 причин:
1. инактивация или модификация лекарств ферментами бак-
бактерий;
2. образование такого барьера проницаемости, чтобы npenapai
не мог достигнуть целевого участка его действия;
3. изменение самой цели таким образом, чтобы препарат не мог
связаться или воздействовать на нее;
4. выработка измененного метаболического пути, который по-
позволяет миновать действие препарата.
Если организм подвергается одновременному действию двух анти-
антимикробных препаратов, результирующим эффектом может оказаться
аддитивный эффект — синергизм или антагонизм.
Препараты считаются аддитивно действующими, когда активность
лекарств в комбинации равна сумме их независимых активностей. Об-
Общий эффект двух антимикробных препаратов может быть меньше (ан-
(антагонизм) или больше (синергизм) суммарного эффекта. Синергизм
может возникнуть в результате различных механизмов действия, таких
как последовательная блокада общего метаболического пути или повы-
повышения проницаемости бактериальных клеток.
Существует одновременно несколько подходов к классификации
антибиотиков, определяемых, главным образом, профессиональными
интересами исследователей.
Антибиотики, в частности, классифицируются по:
— принципу их биологического происхождения (например, ан-
антибиотики, вырабатываемые определенными микроорганиз-
микроорганизмами);
— механизму их биологического действия (например, антибио-
антибиотики, ингибируюшие синтез клеточной стенки, антибиотики,
нарушающие функции мембран, антибиотики подавляющие
синтез нуклеиновых кислот);
— принципу спектра их биологического действия (например,
противобактериальные антибиотики узкого спектра действия,
активные преимущественно в отношении грамположитель-
ных организмов, противобактернальные антибиотики шнро-
-584-
Антибиотики
кого спектра действия, противотуберкулезные антибиотики,
противогрибковые антибиотики, противооп>холевые анти-
антибиотики и противоамебные антибиотики);
— принципу их химического строения (например, C-лактамные ан-
антибиотики, тетрациклины, аминогликозиды, макролиды и др.).
32.1. р-лактамные антибиотики
C-лактамные антибиотики рассматриваются в виде четырех групп,
которые включают пенициллины, цефалоспорины, монобактамы и кар-
бапенемы. Все они содержат четырехчленное р-лактамное кольцо, не-
необходимое для проявления антибактериальной активности, р-лактамное
кольцо сочленено с пятичленным тиазолидиновым кольцом в пеницил-
линах и с шестичленным дигидротиазиновым кольцом в цефалоспори-
нах. В карбапенемах Р-лактамное кольцо также сочленено с пятичлен-
пятичленным кольцом, однако карбоциклическим. Монобактамы представляют
собой моноциклическую р-лактамную структуру, в которой к атому
азота присоединена боковая сульфогруппа.
0
R-C-NH
\
о*
0
R-C-NH
Ml
IN
j
_u
-CHt
^CH3
С ООН
1
Penicillins
Cephalosponns
но
О
R-C-NH
COOH
SR!
COOH
Carbapenems
J— |j-so3h
Monobactams
-585-
Глава 32
Основным механизмом действия р-лактамных антибиотиков явля-
является ингибирование синтеза клеточных стенок бактерий, что и вызыва-
вызывают их быструю гибель. Первичным актом их действия является включе-
включение работы аутентических ферментов, которые далее разрушают
клеточные стенки и вызывают лизис бактерий.
Клеточная стенка бактерий структура уникальная и не имеет анало-
аналогов в клетках млекопитающих. Клеточная стенка защищает бактериаль-
бактериальную клетку от лизиса, который может произойти из-за разницы осмоти-
осмотических давлений междч цитоплазмой и окружающей средой.
Основной составляющей клеточной стенки бактерий является сме-
смешанный полимер, известный как муреин, или пептидогликан. Пепти-
догликан представляет собой длинные полисахаридные цепи, кросс-
связанные короткими соединяющими пептидами. Полисахаридные цепи
составлены из двух варьируемых аминосахаров -- N-ацетилглюкоз-
амина и N-ацетилмураминовой кислоты. Например, в Staphylococcus
aureus (золотистый стафилококк) тетрапептид, состоящий из L-аланина,
D-глютаминовой кислоты, L-лизина и D-аланина, присоединен к каж-
цой из единиц N-ацетилмураминовой кислоты, образуя боковые цепи
гликановых цепей. Многие из этих тетрапептидов кросс-связаны друг с
другом либо непосредственно, либо короткими пептидными цепями.
В Staphylococcus aureus L-лизин одного из тетрапептидов связан пен-
таглициновой цепью с D-аланином другой. Такая структура придает
определенную жесткость стенкам бактерий. Пептидогликановый слой
грамотрицательных бактерий тоньше, чем грамположительных, и имеет
меньше кросс (поперечных) связей.
Синтез пептидогликана клеточных стенок бактерий может быть
разделен на 3 стадии, согласно тому, где происходит реакция.
Первая стадия происходит в цитоплазме, в результате чего синте-
синтезируется прекурсорная единица — уридиндифосфо-Тч'-ацетимурамил
пентапептид и такой антиботик, как, например, циклосерин — препарат,
который наиболее часто используется при лечении туберкулеза, блоки-
блокирует синтез клеточных стенок именно на этой стадии путем конкурент-
конкурентного ингибирования стадии внедрения аланина в пентапептид.
Реакции, относящиеся ко второй стадии, происходят тогда, когда
прекурсорная единица перемещается вдоль цитоплазматической мем-
мембраны. В первой реакции К-ацетилмурамил-пентапептидный участок
присоединяется (посредством пирофосфатного мостика) к несущему
фосфолипиду, связанному с цитоплазматической мембраной. Затем
присоединяется N-ацетилглюкозамин, образуя дисахарид-пентапептид-
Р-Р-фосфолипид. Затем происходит дальнейшая модификация пента-
-586-
АНТИбИОТИКИ
пептидной цепи, например, присоединение пентаглицина в случае того
же Siaphxlococcus aureus Модифицированный дисахарид последова-
последовательно отщепляется от мембраносвязанного фосфолипида и затем свя-
связывается с наращивающейся частью уже имеющегося пептидогликана.
Эта реакция опосредуется ферментом пептидогликансинтетазой. Ос-
Основные повторяющиеся единицы пептидогликана, таким образом, соби-
собираются, образуя гликопептидные полимеры. Этот процесс может нару-
нарушаться таким антибиотиком, как ванкомицин, который ингибирует
пептидогликансинтетазу.
Третья стадия (конечная) синтеза клеточных стенок происходит
вне стенок цитоплазматической мембраны. При этом линейные глико-
гликопептидные полимеры превращаются в кросс (поперечно) связанные по-
посредством реакции транспептизации. Фермент транспептидаза, являю-
являющийся мембраносвязанным, связывает пентапептидные боковые цепи
путем замещения терминальных D-аланинов.
Как уже было отмечено, C-лактамные антибиотики вмешиваются
в биосинтез основной составляющей клеточной стенки бактерий —
пепгицснликана. Вследствие того, что в клетках человека и других мле-
млекопитающих этот процесс не имеет места, C-лактамные антибиотики
относи 1ельно малотоксичны для человека.
р-лаьтамные антибиотики специфично связываются с рядом белков
цитоплазма!ической мембраны и известных как пенициллинсвязываю-
щие белки (ПСБ). Эти белки являются ферментами, вовлеченными
в реакции транспептизации при расформировании клеточных стенок
в чоте роста и разделения.
К примеру, Escherichia coli имеет шесть ПСБ. ПСБ-la и ПСБ-lb, ко-
которые являются транспептидазами, включенными в синтез пептидогли-
пептидогликана. ПСБ-2 необходимы для поддержания «стержневой» формы бакте-
бактерий Селективное ингибирование этого фермента вызывает выработку
иных, «нестержневых», форм бактерий, которые, в конечном счете,
подвергаются лизису. ПСБ-3 необходимы для формирования перегоро-
перегородок в ходе деления. Селективное ингибирование этого фермента приво-
приводит к образованию неких волокнистых форм бактерий, содержащих
множество единиц стержневой формы, не способных отделиться одна
°| тругой, что в результате также приводит к их гибели. Различные
Р-ламамные антибиотики имеют селективное сродство к одной или
нескольким ПСБ. Инакгивирование определенных (высокомолекуляр-
(высокомолекулярных) [КБ (ПСБ-la. -1Ь, -2 или -3) вызывает гибель клеток. В отличие от
нч\, инактивация низкомолекулярных ПСБ (ПСБ-4, -5 и -6) не является
XIя бактерий.
-587-
Глава 32
Резистентность патогенных микроорганизмов к р-лактамным анти-
антибиотикам может возникнуть по одному или сразу нескольким из ниже-
нижеприведенных механизмов:
— неспособности препарата достигнуть непосредственно места
своего действия;
— изменению функций ПСБ, что выражается в понижении
сродства к препарату;
— инактивации препарата бактериальными ферментами.
Р-лактамные антибиотики должны проникнуть через внешнее по-
покрытие клетки, чтобы достигнуть целевых ПСБ на поверхности мем-
мембраны. В грамположительных бактериях клеточная С1енка является
единственным слоем, покрывающим цитоплазматическую мембрану.
У некоторых их видов с внешней стороны клеточной стенки имеется
также и полисахаридная капсула. Однако ни одна из описанных
структур не может явиться барьером для прохождения таких малень-
маленьких молекул, как |3-лактамы. Поэтому предположение, что причиной
возможной резистентности является неспособность достижения
Р-лактамными антибиотиками целевых ПСБ, вряд ли следует считать
возможным механизмом резистентности для грамположительных
бактерий.
Грамотрицагельные бактерии имеют более сложную структуру
поверхности клетки. Пептидогликановый слой опять-таки является
внешним по отношению к цитоплазматической мембране. Однако
у них кроме нее имеется еще одна полисахаридная внешняя мембрана.
Эта внешняя мембрана, построенная из липополисахаридов и липо-
протеинов, может представлять собой серьезный барьер для прохож-
прохождения гидрофильных молекул. Прохождение через эту мембрану
Р-лактамных антибиотиков возможно только через трансмембранные
каналы — порины, образуемые протеинами. Показано, что р-лак-
р-лактамные антибиотики диффундируют через пориновые каналы и лег-
легкость этого процесса варьирует в зависимости от их размера, заряда
и гидрофильных свойств. Соответственно, предположение считать
возможным механизмом резистентности для грамотрицательных бак-
бактерии неспособность достижения целевых ПСБ р-лактамными анти-
антибиотиками также маловероятно.
Вторым механизмом резистенгности к Р-лактамным антибиотикам
может явиться изменение целевых ПСБ, выражающееся в понижении их
сродства к Р-лактамной молекуле.
-588-
Антибиотики
Наконец, наиболее важным механизмом резистентности
к р-лактамным антибиотикам является выработка бактериями
р-лактамаз. р-лактамазы разрывают C-N-связь в Р-лактамном кольце
антибиотиков. А поскольку ее наличие является абсолютным требо-
требованием для взаимодействия с ПСБ, разрыв Р-лактамного кольца при-
приводит к поте-ре антибактериальной активности.
С) шествует много Р-лактамаз, которые могут быть классифициро-
классифицированы по-разному: типу субстрата, расположению в генах (хромосомы
или плазмиды), месту выработки. Некоторые из этих ферментов прямо
гидролиз) ют пенициллины (пенициллиназы), другие гидролизуют це-
фалоспорины (цефалоспориназы), третьи распространяются на более
широкий спектр субстратов. Некоторые бактерии обладают свойством
инд>цировать синтез р-лактамаз. Синтез Р-лактамаз. который в обыч-
обычном состоянии подавлен, индуцируется в присутствии некоторых
р-лактамных антибиотиков.
Таким образом, р-лактамные антибиотики могут различными пу гя-
ми ингибировать процесс синтеза клеточных стенок бактерий и тем са-
самым вызывать их быструю гибель.
32.1.1. Пенициллины
Пенициллин был открыт в 1928 г. Александром Флемингом, заме-
заметившим, что контаминация плесенью одной из его экспериментальных
культур — стафилококков вызывала лизис бактерий. Поскольку плесень
относилась к роду Penicillium, он назвал эту антибактериальную суб-
субстанцию пенициллин.
Примерно через десятилетие группа исследователей Оксфордского
университета выделила сырую субстанцию, состоящую из нескольких
низкомолекулярных веществ — пенициллинов (F, G, К, О, V, X). Пени-
циллин-G (бензилпенициллин), наиболее активный из них, в 1941 г был
предложен для клинических исследований.
о
R-C—NH
сн3
"соон
пеници.%шн
-589-
Глава 32
Строение радикала R
СНН2~
<?У-о-сн2—
Н0 \Ч /У~СН2
CH3Ch2CH=CH-CH2—
СН3(СН2MСН2 —
СНг^СН-СНг—Э-СНг—
Название пенициллина
Пенициллин-G
Бензилпенициллин
Пенициллин-V
Феноксиметилпеницилпин
Пенициллин-Х
/7-окси бензилпенициллин
Пенициллин-F
2-гентенилпенициллин
Пенициллин-К
п-гептилпенициллин
Пенициллин-0
Аллилмеркаптометилпенициллин
Препараты группы пенициллина эффективны при инфекциях, вы-
вызванных грамположительными бактериями (стрептококками, стафило-
стафилококками, пневмококками и др.), спирохетами и другими патогенными
микроорганизмами. Препараш эгой группы неэффективны в отноше-
отношении вирусов, микобактерий т>берк\леза, фибов и большинства грамот-
рчцательных микроорганизмов.
Получение пенициллина — весьма важная веха в развитии микро-
микробиологии, химии и медицины, знаменующая создание мощной антибио-
антибиотической промышленности и формирование современной биотехнологии.
Были предприняты и осуществлены попытки химического синтеза пе-
пенициллинов, однако эти способы практического значения не приобрели.
Весьма важный прогресс в развитии пенициллинов произошел
в 1959 г. когда пенициллиновое ядро — 6-аминопенициллановая кисло-
га F-АПК), отщепленная от боковой цепи, была выделена из культуры
Penicu'lium chrysogenum
сн3
соон
6-аминопенициллановая кислота
-590-
Антибиотики
Б последующем ацилирование 6-АПК производными различных
Kin. loi привело к созданию большого числа полусинтетических пени-
пенициллинов.
В настоящее время пенициллин (бензилпенициллин, пенициллин-G)
з огромных количествах (десятки тысяч тонн) выпускается микробио-
микробиологической промышленностью. Пенициллин могут вырабатывать мно-
г не анды грибов Pemcilhum, а также некоторые виды грибов Aspergillus
В промышленных условиях получают культуральные жидкости с со-
1ержанием более 30 мг мл пенициллина. Примерно 2/3 выпускаемого
пенициллина используется для получения 6-АПК. При этом, несмотря
на возможность чисто химического дезацилирования, наиболее пер-
перспективным способом получения 6-АПК считается ферментативный
млод гидролиза молекулы бензилпенициллина с участием иммобили-
иммобилизованной пенициллинамидазы — фермента, выделяемого практически
из ьсех пенициллинпродуцирующих фибов. Следует отметить, что сама
6-АПК практически лишена антибиотических свойств. Однако ее аци-
лированием различными производными кислот было получено более
50 000 полусинтетических иенициллинов, из которых в настоящее вре-
время лишь чуть больше 30 применяются в медицине.
При вариациях ацильной части боковой цепи молекулы пеницилли-
пенициллинов отмечены значимые изменения свойств полученных соединений.
Выяснилось, что именно боковая ацильная часть молекулы определяет
антимикробный спектр, чувствительное 1ь к р-лактамазам и определяет
фармакокинетические особенности конкретного пенициллина. Особен-
Особенное 1ыо некоторых полу синтетических пенициллинов (метициллина,
оксациллина. клоксациллина) является их эффективность в отношении
штаммов микроорганизмов (стафилококков), резистентных к бензилпе-
нициллину. Более того, некоторые полусинтетические пенициллины
(ампициллин) активны и в отношении большинства грамотрицательных
микроорганизмов.
С химической точки зрения первым типом полусинтетических пе-
ницн.тлинов, несомненно, следует считать относительно простые пени-
пенициллины производные 6-АПК и ароматических или арилоксикарбоно-
вы\ кислот (бензилпенициллин, феноксиметилпенициллин, метициллин,
нафициллин).
Др\гим типом полусинтетических пенициллинов следует считать
пенициллины — производные гетероилкарбоновых кислот, в которых
боковая ацильная фуппа представлена ароматическим гетероцикличе-
гетероциклическим кольцом (оксациллин. клоксациллин, диклоксациллин).
Следующим типом полусинтетических пенициллинов следует счи-
raib пенициллины, в которых в роли ацильного радикала выступает
-591 -
Глава 32
аминокислота, в основном а-аминофенилуксусная (фенилглишш) или
и-окси-а-аминофенил^ксусная, — соответственно ампициллин и амок-
сициллин.
Наконец четвертым типом замещения в боковой ацильной части
пенициллинов следует считать замещение производными дикарбоновых
кисло г(карбенциллин,тикарциллин).
Все пениииллины используются в качестве натриевых или калие-
калиевых солей.
Бензилпенициллин (Benxylpenicillin)
Бензилпенишшган — [28-Bа,5а,бР)]-3,3-диметил-7-оксо-6-(фе-
нилацетамидо)-4-тиа-1-аза-бицикло[3.2.0]-гептан-2-карбоповую ки-
кислоту C2.1.1.1) получают биотехнологическим способом с исполь-
использованием в качестве продуцента гриба вида Penicillium chiysogenum
и в качестве прекурсора — фенилуксусную кислоту. Для медицин-
медицинского применения используются натриевые или калиевые соли, для
чего экстракт культуральной жидкости обрабатывается водным рас-
раствором соответствующей щелочи, и коммерческим продуктом яв-
являются соответствующие лиофилизованные соли [1. 2. 3, 4, 5].
Предложен и чисто синтетический способ получения бензилпени-
циллина [6, 7],
0
С—NH
)
0
32
Л
1 1 1
,сн3
^СНз
чсоон
Бензилпенициллин, или пенициллин-G. имеет узкий антимикроб-
антимикробный спектр. Он активен по отношению к грамположительным бактери-
бактериям (стафилококк, стрептококк, пневмококк), возбудителю дифтерии,
палочке сибирской язвы. Грамогрицательные бактерии к нему рези-
резистентны. Бензилпенициллин расщепляется желудочной кислотой и раз-
разрушается стафилококковой пенициллиназой.
Бензилпенициллнн является лекарством выбора при инфекциях, вы-
вызванных чувствительными организмами. Последние включают стрепто-
стрептококковые инфекции (за исключением энтерококков), гонококки, менин-
менингококки, не продуцирующие (З-лакгамазу анаэробы. Бензилпенициллип
применяют при крупозной и очаговой пневмонии, гнойных инфекциях
кожи и мягких тканей и слизистых оболочек, перитоните, цистите, си-
сифилисе, дифтерии и других инфекционных заболеваниях.
-592-
Антибиотики
Синонимами препарата являются мегациллин, традоциллин, вицил-
лин. с>грациллин и др.
Фенокашетилпешщиллин (Phenoxymethylpenicillin)
Феноксиметилпенициллин — [28-Bа,5а,бР)]-3,3-диметил-7-оксо-6-
(феноксиацетамидо)-4-тиа-1-азабицикло-[3.2.0]-гептан-2-карбоновую
кислоту C2.1.1.2) также получают биотехнологическим способом
с использованием в качестве продуцента гриба вида Penicillium
chrysogenum, а в качестве прекурсора феноксиуксусной кислоты
[8, 9, 10, 11]. Как и для бензилпенициллина, предложен и синтетиче-
синтетический способ получения феноксиметилпенициллина [6, 12, 13, 14, 15].
о
О-СНз— С—NH
О
7
^•СНз
Гснз
соон
321 1 2
Феноксиметилпенициллин, или пенициллин-V, кислотоустойчив
и используется вместо пенициллина-G при необходимости перорально-
го применения. Активен в отношении грамположительных (стафило-
(стафилококк, стрептококк, пневмококк) и грамотрицательных (менингококк,
гонококк) кокков, спирохет, клостридий, коринебактерий.
Феноксиметилпенициллин применяют при бронхите, пневмонии,
ангине, скарлатине, гонорее, сифилисе, гнойных заболеваниях кожи
и мягких тканей и других инфекционных заболеваниях.
Синонимами препарата являются беромицин, викен, изоциллин,
кристален, феноспен, утициллин и др.
Метициллин (Methicillin)
Метициллин — [25-Bи,5а,6|3)]-3,3-диметил-7-оксо-6-B,6-димето-
ксибензамидо)-4-тиа-1-азабицикло[3.2.0]-гептан-2-карбоновую кисло-
кислоту C2.1.1.3) получают ацилированием 6-АПК хлорангидридом 2,6-ди-
метоксибензойной кислоты в присутствии триэтиламина [15, 16, 17]
осн3
осн3
H2N
ГСНз
соон
соон
32 1 1 3
-593-
Глава 32
Подобно др)гим полусинтетическим пенициллинам. метициллин
оказывает аншбактериальное действие, сходное с бензилпенициллином.
Его основным отличием от бензилпенициллина является то, что он не
инактивируется ферментом пенициллиназой и поэтому эффективен
в отношении возбудителей, продуцирующих этот фермент (стафило-
(стафилококков).
Препарат применяют при инфекциях, вызванных устойчивыми к бен-
зилпенициллин> стафилококками (септицемии, пневмонии, эмпиемы,
остеомиелит, абсцессы, раневые инфекции и др.).
Синонимами препарата являются цинопенил, целбенин, смафциллин
и др.
Нафциллин (Nafcillin)
Нафциллин — [25~Bа,5а,6|3)]-3,3-диметил-7-оксо-6-B-этокси-1-
нафтамидо)-4-тиа-1-азабицикло[3.2.0]-гептан-2-карбоновую кислоту
C2.1.1.4) получают ацилированием 6-АПК хлорангидридом 2-этокси-
1-нафтойной кислоты в присутствии триэтиламина [18. 19, 20].
0
С—NH
Г1Нс А
32
1 1
4
^сн3
vch3
чсоон
Препарат эффективен против грамположительных кокков и стафи-
стафилококков, прод> цирующих пенициллиназу. Применяют по тем же пока-
показаниям, что и метициллин.
Синонимами препарата являются нафцил, наллпен, юнипен и др.
Др_\гим типом полусинтетических пенициллинов, несомненно, сле-
следует считать пенпциллины производные гетероилкарбоновых кислот,
к которых в роли радикала в боковой ацильной группе представлено
ароматическое гетероциклическое кольцо, как правило изоксазольное.
в третьем положении которого, в свою очередь, имеется замещенный
или незамещенный фенильный радикал (оксациллин, клоксациллин,
диклоксациллин). Эти резистентные к пенициллиназе пенициллины (ок-
(оксациллин. клоксациллин, диклоксациллин) активны по отношению к пе-
пенициллин)-G и резистентным стафилококкам. Их антимикробный
спектр ограничивается фамположительными микроорганизмами.
-594-
Антибиотики
Резистентные к пенициллиназе пенициллины являются лекарством
выбора при инфекциях резистентных к пенициллину-G, Staph aureus
или коагулазотрицательным стафилококкам. Они эффективны также
при инфекциях, вызванных неэнтерококковыми видами стрептококков,
включая стрептококки гр>пп А, В, С и G, а также пневмококки.
Оксациллин (Oxacillin)
Оксациллин — [25-Bа,5а,6|3)]-3,3-диметил-7-оксо-6-E-метил-3-
фепил-4-изоксазолкарбоксамидо)-4-тиа-1-азабицикло[3.2.0]-гептан-2-
карбоновую кислоту C2.1.1.10) получают взаимодействием хлоран-
тпдрида 5-метил-3-фенил-4-изоксазолкарбоновой кислоты C2.1.1.9)
с 6-АПК в присутствии бикарбоната натрия. Сам же хлорангидрид
5-метил-3-фенил-4-изоксазолкарбоновой кислоты C2.1.1.9) получают
по следующей схеме.
Взаимодействием бензальдегида с гидроксиламином получают бен-
зальдоксим C2.1.1.5). окисленим которого хлором получают хлоран-
хлорангидрид бензгидроксиминовой кислоты C2.1.1.6). Последний вводят во
взаимодействие с ацето> ксусным эфиром в присутствии этилата натрия
с получением этилового эфира 5-метил-3-фенил-4-изоксазолкарбоновой
кисло1ы C2.1.1 7). Щелочным гидролизом полученного эфира получа-
получают соогвегствчющую кислоту C2.1.1.8), взаимодействием которой
с хлористым тионилом пол>чают требуемый для ацилирования хлоран-
хлорангидрид [21, 22, 23, 24].
-НО * NH2On
-ос2н5
о
С-С!
НгМ
о
соои
-О" СНЗо
rvt
СН3
СООН
32 1 1 10
-595-
Глава 32
По cuehipy антимикробного действия оксациллин аналогичен бен-
зилпенициллину. Однако он сочетает в себе устойчивость к пеницилли-
назе со стойкостью в кислой среде, что позволяет примени ib его не
только внутримышечно, но и перорально. Применяют при инфекциях,
вызванных пенициллиназаобразующими стафилококками, устойчивыми
к бензил- и фепоксиметилпенициллинам (септицемии, пневмонии, абс-
абсцессы, эмпиемы, остеомиелит, инфицированные ожоги, раневые инфек-
инфекции и др.)
Синонимами препарата являются криптоциклин, люципен, опто-
циллин,тотоциллин и др.
Клоксациллин (Cloxacillin)
Клоксациллин — [28-Bа,5а,6C)]-3,3-диметил-7-оксо-6-[E-мегил-3-
@-хлорфенил)-4-изоксазолкарбоксамидо)]-4-тиа-1-азабицикло[3.2.О]-
гептан-2-карбоновую кислоту C2.1.1.11) получают по вышепри-
вышеприведенной схеме исходя и о-хлорбензальдегида [21, 22, 23. 25].
32 1 1 11
По механизму действия и по показаниям препарат аналогичен окса-
циллину
Синонимами препарата являются ампиклокс, орбенин, тотаклокс,
тегапен и др.
Диклокса цилл ин (Dicloxacillin)
Диклоксациллин — [25-Bсс,5а,бР)]-3,3-диметил-7-оксо-6-[E-ме-
тил-3-B,6-дихлорфенил)-4-изоксазолкарбоксамидо)]-4-тиа-1-азаби-
цикло[3.2.0]-тептан-2-карбоновую кислоту C2.1.1.12) также полу-
получают по приведенной выше схеме, используя в качестве исходного
2.6-дихлорбензальдегид [26, 27, 28].
Ci
О С ООН
32 1 1 12
-596-
Антибиотики
По механизму действия, по антибактериальному спектру и по пока-
показаниям препарат существенно не отличается от оксациллина и клокса-
циллина.
Синонимами препарата являются диклоиил, новапен, диклекс
и др.
Следующим типом полусинтетических пенициллинов следует счи-
считать пепнциллины, в которых в роли ацильного радикала выступает
аминокислота, в основном а-аминофенилуксусная или л-окси-а-амино-
фенилуксусная (ампициллин, амоксициллин).
Антимикробный спектр аминопенициллинов сходен с пеницилли-
HOM-G за исключением того, что они воздействуют и на ряд грамотри-
цагельных микроорганизмов. Оба аминопенициллина разрушаются ста-
стафилококковой пенициллиназой.
Ампициллин (Ampicillin)
Ампициллин — [28-[2а,5а,6|3E*)]]-3,3-диметил-7-оксо-6-B-амино-
2-фенилацетамидо)-4-тиа-1-азабицикло[3.2.0]-гептан-2-карбоновую
кислоту C2.1.1.16) предложено получать различными способами,
по сути сводящимися к различным способам защиты аминогруппы
в исходном фенилглицине Первый способ (один из наиболее ши-
широко применяемых) заключается в использовании бензилового эфи-
эфира хлорутольной кислоты (карбобензоксихлорида). Взаимодействи-
Взаимодействием последнего с фенилглицином первоначально получают карбо-
бензоксифенилглицин C2.1.1.13). Обработкой последнего этиловым
эфиром хлоругольной кислоты в присутствии триэтиламина полу-
получают смешанный ангидрид C2.1.1.14) с защищенной аминогруппой,
который с легкостью вступает во взаимодействие с 6-АПК в при-
присутствии бикарбоната натрия с получением натриевой соли N-кар-
бобензокси-защищенного ампициллина C2.1.1.15). Удалением кар-
бобензокси защитной группы гидрогенолизом с использованием
в качестве катализатора палладия на карбонате бария получают ис-
искомый ампициллин C2.1.1.16) [29, 30, 31. 32, 33, 34. 35].
С—G-O-CH-,
-597-
Глава 32
о
II
^-CH-C—NH.
NH2
CH3
сн3
соон
32 1 1 16
Второй способ получения ампициллина аналогичен вышеописан-
вышеописанном) и отличается способом защиты аминогруппы в исходном фенилг-
лииине. С этой целью используется ацетоуксусный эфир, взаимодейст-
взаимодействием которого с натриевой солью фенилглицина пол>чают промежу-
промежуточный аминокротоновый эфир C2.1.1.17). Последовательной транс-
трансформацией последнего в смешанный эфир C2.1.1.18) и последующим
взаимодействием с 6-АПК в присутствии бикарбоната натрия получают
ампициллин C2.1.1.16) в виде натриевой соли [36].
\ /У- CH-COONa
сн3
о
T-CH-COONa С1-С-О-С2Н5>
NH О (C2H5KN
32 1 1 17
¦Cri3
'соон
NaHCO3
Предложен также третий способ прямого ацилирования 6-АПК
хлораш идридом гидрохлорида фенилглицина [37].
^гм НС,
COOh
-598-
Антибиотики
Ампициллин обладает широким спектром действия и эффективен при
инфекциях, вызванных различными чувствительными организмами —
активен в отношении грамположительных и грамотрицательных кокков.
кишечной палочки, сальмонелл, шигелл. энтерококков, листерий, неко-
некоторых штаммов гемофильной палочки. Ампициллин является лекарст-
лекарством выбора при инфекциях вызванных Р-лактамаз отрицательными ви-
видами Н mfluenzae, L. monocytogenes и энтерококков. Препарат
применяют при бронхите, пневмонии, дизентерии, сальмонеллезе, кок-
коклюше, пиелонефрите, эндокардите, сепсисе и т. д.
Синонимами препарата являются амблосин, бинотал, люципен, то-
тапен, амфипен, ампицил, пенберин и многие другие.
Amokchuwuiuh (Amoxycillin)
Амоксициллин — [28-[2а,5а,бР(8*)]]-3.3-диметил-7-оксо-6-[[ами-
но-D-гидроксифенил)-ацетил]амино]-4-тиа-1-азабицикло[3.2.0]-геп-
1ан-2-карбоновую кислоту C2.1.1.21) предложено получать двумя
in 1 ям и. Первый способ, предполагающий енаминовую защиту
аминогруппы 4-гидроксифенилаланина, исходит из натриевой соли
4-1и;1роксифенилаланина, взаимодействием которой с ацетоуксус-
ным эфиром получают енамин — натриевую соль а-D-гидро-
ксифенил)-а-(карбметоксипропен-2-ил-амино)уксусной кислоты
C2 1.1.19). Взаимодействием полученного аминокротоната с этило-
этиловым эфиром хлоругольной кислоты в N-метилморфолине получают
соответствующий смешанный эфир C2.1.1.20), который вводят во
взаимодействие с триметилсилиловым эфиром 6-АПК [38, 39].
CH-COONa
NH;
СН^
<—с-о-с2н5
НО—С \—СН-СООНа
NH О ^°N
О
•СН3
•СН3
COOSi(CH3;
NaHCOj
-599-
Глава 32
Второй способ предполагает непосредственное взаимодействие
хлорангидрида хлоргидрата В-(-)-2-D-гидроксифенил)глицина с триме-
тилсилиловым эфиром 6-АПК [40].
Необходимый для этой цели триметилсилиловый эфир 6-АПК,
в свою очередь, получают взаимодействием триметнлхлорсилилана с
6-АПК в присутствии триэтиламина.
Амоксициллин обладает широким спектром действия аналогичным
ампициллину. Показания к применению такие же. как и у ампициллина.
Синонимами препарата являются амоксикан. амоксил, ларогид, ро-
бамокс. тримокс, вимокс, утимокс и др.
Несомненно, к этой же группе соединений следует ел нести и анало-
аналоги ампициллина, замещенные по аминном> фрагменту фенилглицина
(азлоциллин, мезлоциллин, пиперациллин).
А злоциллин (Azlocillin)
Азлоциллин — B8,511,6К)-3,3-диметил-7-оксо-6-[(К)-2-B-оксо-
имидазолидин-1-карбоксамидо)-2-фенилацетамидо]-4-гиа-1-азаби-
цикло[3.2.0]гептан-2-карбонов\ю кислоту C2.1.1.24) предложено
получать по следующей схеме. 2-имидазолидинон ацилир>ют фос-
фосгеном с получением 1-\лоркарбонил-2-имидазолидинона C2.1.1.22).
Полученный 1-хлоркарбонил-2-имидазолидинон C2.1.1.22) вводят
в реакцию с В(-)-а-фенилглицином с получением Ь'-B-оксоимида-
золидин-1-карбоксамидо)-фенилглицина C2.1.1.23). Взаимодейст-
Взаимодействием последнего с 6-АПК в присутствии чриэтиламина получают
искомый азлоциллин C2.1.1.24) [41, 42, 43].
V_7
Л-с
\ tf VH~COOH
1=0
<Q>_CH-C-GH
NH
32 ' 1 23
\ariCO3
-600-
Антибиотики
соон
2 1 1 24
Азлоциллин активен в отношении грамположительных и грамотри-
цательных аэробных и анаэробных микроорганизмов. Высокоэффекти-
Высокоэффективен в oi ношении синегнойной палочки, включая штаммы, резистентные
к карбенциллин) и аминогликозидам. Разрушается Р-лактамазами.
Применяется при таких бактериальных инфекциях, как пиелонефрит,
уретрит, цистит, эндометрит, холангит, холецистит, сепсис, перитонит,
эндокардит, менингит, пневмония, инфекции кожи и мягких тканей,
инфицированные ожоги и т. д.
Синонимами препарата являются секуропен и азлин.
Мезлоциллин (Mezlocillin)
Мезлоциллин — B8,5К,6К)-3.3-диметил-7-оксо-6-[A1)-2-[3-ме-
1 илсульфонил)-2-оксоимидазолидин-1-карбоксамидо]-2-фенил-
ацетамидо]-4-тиа-1-азабииикло[3.2.0]-гептан-2-карбоновую кис-
лог\ C2.1.1.27) получают ацилированием ампициллина
C2.1.1.16) 3-хлоркарбонил-1-метансульфонил-2-имидазолидино-
ном C2.1.1.26) в присутствии триэтиламина. Необходимый для
этой цели 3-хлоркарбонил-1-метансульфонил-2-имидазолидинон
C2.1.1.26) получают сульфонилированием 2-имидазолидинона ме-
гансульфохлоридом с получением 1-метансульфонил-2-имидазо-
лидинона C2.1.1.25) и последующим его взаимодействием с фосге-
фосгеном [44, 45, 46].
32 1 ! 25
CnsS":-../
-601 -
Глава 32
С ООН
32 1 1 27
Аналогично азлоциллину мезлоциллин применяется при инфекциях
мочеполового тракта, гинекологических инфекциях, интраабдоминаль-
ных инфекциях, инфекциях кожи и дыхательного тракта.
Синонимами препарата являются байпен, мезлин. оптоциллин.
Пиперациллин (Piperacillin)
Пиперациллин — B5,511.б1Я)-3.3-диметил-7-оксо-6-[BК)-2-[D--этил-
2,3-диоксо-1-пиперазинил) формамидо]-2-фенилацетамидо]-4-тиа-1-
азабицикло[3.2.0]-гептан-2-карбонов>ю кислоту C2.1.1,30) также
предложено получать ацилированием ампициллина C2.1.1.16). но
>же 1-хлоркарбонил-4-этилпиперазин-2,3-дионом C2.1.1.29). Необ-
Необходимый для этой цели 1-хлоркарбонил-4-этидпиперазин-2,3-дион
C2.1,1 29) получают взаимодействием N-этил-этилендиамина с ди-
этилоксалатом с образованием 4-этилпиперазин-2,3-диона C2.1.1.28)
и далее ацилированием фосгеном после первоначального силилиро-
вания продукта по атому азота триметилхлорсиланом [47, 48. 49, 50].
s-hb-CHt-CH -NH2
С2Нб—О-С
C2H6-N^yi-H
С ООН
соон
-602-
Антибиотики
Область применения препарата аналогична таковой азлоциллина
и мезлоциллина
Синонимами препарата являются пиприл, пипрацил, авоцин и др.
Наконец четвертым типом замещения в боковой ацильной части
пеништл типов следует считать замещение производными дикарбоновых
кислот (карбенциллин, гикарциллин).
Карбенциллин (Carbencillin)
Карбенциллин — [28-Bи,5а,6р)]-3,3-диметил-7-оксо-6-B-карбокси-2-
фенилацетамидо)-4-тиа-1-азабицикло[3.2.0]-гептан-2-карбонов>ю ки-
кислот) C2.1.1.32) предложено получать прямым ацилированием
6-АПК в присутствии бикарбоната натрия хлорангидридом моно-
бензилового эфира фенилмалоновой кислоты с получением бензи-
лового эфира карбенциллина C2.1.1.31), гидрогенолизом которого
водородом с использованием в качестве катализатора палладия ли-
либо на >гле, либо на карбонате кальция получают искомый продукт
C2.1.L32) [51, 52, 53, 54, 55, 56, 57, 58].
Qr-rJ-№
csh5-ch2-o
о' соон
32 1 1 31
Карбеиц№!лин обладает широким спектром антибактериальной ак-
riBHocni в отношении грамотрииательных и грамположительных мик-
роор|анизмов. Однако применение препарата при инфекциях, вызван-
вызванных грамположительными микроорганизмами, нецелесообразно. Его
при\1еняют при заболеваниях, вызванных грамотрицательными микро-
ор!анизмами. чувствительными к этому антибиотику, — инфекциях
мочевых п\тей, септицемии, эндокардите, менингите, остеомиелите.
перитоните, гнойном отите, раневых инфекциях, инфицированных ожо-
ожогах И Т П.
Синонимами препарата являются кариндапен, пиопен, геопен, гри-
пенин и др
-603-
Глава 32
Тикар ц илл ин (Ticarcillin)
Тикарииллин — [28-Bсх,5а,6|3)]-3,3-диметил-7-оксо-6-[2-карбокси-
2-C-тиенил)ацетамидо]-4-тиа-1-азабицикло[3.2.0]-гентан-2-карбоно-
вую кислоту C2.1.1.34) также предложено получать прямым ацили-
рованием 6-АПК в присутствии гидроокиси натрия, но уже хлоран-
гидридом 3-тиенилмалоновой кислоты C2.1.1.33) с получением
соон
сн-соон
ь
ЗОС12
iri
и '
32 1
СН-СС—И
1 33
J
О
— . 7 ^ _- j .
' I СН3
соон
NaHCO3
II
х s соон
3
о'
>—S
п
32 1
г
*ч
1 34
,сн3
'соон
По антимикробному спектру действия и областям применения ти-
карциллин сходен с карбенциллином.
Синонимами препарата являются бетабактил, тикар, тиметин и др.
Ингибиторы р-лактамазы
Клавулановая кислота и сулбактам
(Clavulanic acid and Sulbactam)
Добавление ингибиторов р-лактамазы, таких как клавулановая ки-
кислота C2.1.1.35) или сулбактам C2.1.1.36), к пенициллинам либо
к аминоиенициллинам широкого спектра действия значительно рас-
расширяет их антимикробный спектр.
Л- N-
СН2ОН
о' соон
32 1 1 36
снз
о соон
32 1 1 36
Клаву лановую кислоту выделяют из Strepiomvces clavuhgerus
[60. 61. 62, 63, 64, 65, 66]. а с\лбактам — сульфон пенициллановой ки-
кислоты, получают из 6-АПК [67, 68, 69]. Оба соединения обладают весь-
весьма слабыми антибактериальными свойствами и действуют, ообразуя
необратимые комплексы с р-лактамазой, которые инакгивируют фер-
фермент, в результате чего р-лакта.мный антибиотик успевает разрушить
-604-
Антибиотики
микроорганизм. В настоящее время применяется ряд комбинированных
препаратов, содержащих различные сочетания антибиотиков и ингиби-
ингибиторов р-лактамазы.
32.1.2. Цвфалоспорины
Из продуктов ферментации гриба Cephalosporium acremonicum был
выделен ряд антибиотиков — цефалоспоринов Р, N, С. Мажорным ком-
компонентом смеси является цефалоспорин С — амид а-аминоадипиновой
и 7-амнноцефалоспорановой кислот.
О
HOOC-CH-(CH2K-C-NH,
NH2
СООН
цефалоспорин С
Химический или ферментативный гидролиз этого соединения по-
позволяет получать большие количества 7-аминоцефалоспорановой ки-
кислоты, ацнлированием аминогруппы которой производными различных
кислот аналогично ряду полусинтетических пенициллинов был создан
ряд полу синтетических р-лактамных цефалоспориновых антибиотиков,
которых в настоящее время насчитывается около 25 000, из которых
около 100 внедрено в медицинскую практику. Причем, в отличие от
пенициллинов. полусинтетические цефалоспорины получают как рас-
расширением спектра различных кислот, которыми ацилируется 7-ами-
ноцефалоспорановая кислота, так и модификациями внутри аминоцефа-
лоспоранового ядра (R| и R2).
H2N
соон
"'-алшноцефалоспорановая
кислота
СООН
полусинтетические
цефалоспорины
Цефалоспориновое ядро состоит из Р-лактамного кольца, сочленен-
сочлененного с шестичленным дигидротиазиновым кольцом. В отличие от пени-
Циллинового ядра цефалоспориновое ядро значительно более устойчиво
-605-
Глава 32
к Р-лактамазам. Более того, оно имеет больше \частков для возможных
модификаций Модификации Rt в аиильной боковой цепи изменяют
антибактериальную активность, тогда как модификации R2 ассоцииру-
ассоциируются с изменениями в фармакокинетике и метаболических параметров
препарата
Радикалы R, в ацильной боковой цепи в принципе не отличаются
или мало отличаются от применяемых в синтезе пенициллинов.
В то же время модификации R2 довольно существенны, и их можно
определить как следующие:
¦сн2-о-осн,
ih с
цефалотин
цеф\роксим
цефепим
цефотаксим
цеоокситин
цеопиром
цефапирин
цефтазидим
R,—С-ЧЧ.
d
о
R,—C-NH
О
R —C-N
Ch3
:00H
0
R,—C-NH
цефаклор
цефалексин
цефтизоксим
цефиксим
цефрадин
иефадроксил
/у
иефазотин
цефамандол
цефтриаксол
цефотетан
цефоперазон
-606-
Антибиотики
NH
О
С ООН
N-N
сн.
och3q
f^-CO-NH—V-f >
соон
цефотетан
моксал актам
цефаклор
Во iee тою, последний из приведенных препаратов — моксалактам
содержит днгидрооксазиновое кольцо вместо общего для всех цефалос-
цорипов дигидротиазинового кольца. Некоторые цефалоспорины со-
содержат дополнительную метоксильную группу в положении С- фраг-
фрагмента амииоцефалоспорановой кислоты (цефотетан. цефаклор).
Цефадоспорины классифицир\тотся по четырем группам или под-
подразделяются на четыре поколения на основе спектра их активности. Со-
Соединения одного поколения отличаются др>г от друга главным образом
фармакокинешческими особенностями, хотя у них могу г быть и разли-
различия по отношению к отдельным микроорганизмам.
Цефалоспорины I поколения
Цефалоспорины II поколения
Цефаюспорины III поколения
(цефалотин. цефалоридин, цефалек-
цефалексин, цефапирин, цефазолин, цефад-
роксил, цефради и др.) обладают
высокой биологической активно-
активностью в отоплении стафилококков,
стрептококков, пневмококков, мно-
многих видов энтеробактерий.
(цефуроксим, цефамандол, цефок-
ситин, цефотетан, цефаклор и др.)
характеризуются высокой активно-
активностью в отношении грамотрпцатель-
ных микроорганизмов, устойчивы
к действию Р-лактамаз. Не оказы-
оказывают заметного действия на энтеро-
энтерококки.
(цефотаксим, цефтизоксим, цефтри-
аксон, цефазидим, цефоперазон и ряд
других) отличаются высокой анти-
антимикробной активностью против эн-
энтеробактерий, в том числе устойчи-
устойчивых к др\гим антибиотикам. Эта
гр\ппа устойчива к действию Р-лак-
-607-
Глава 32
Цефалоспорины IV поколения
тамаз. образуемых грамотрицатель-
грамотрицательными бактериями Однако они уме-
умеренно активны по отношению к ста-
стафилококкам.
(цефепим и цефпиром) активны
в отношении широкого спектра
грамположительных и грамотрнца-
тельных аэробов. Обладают не-
необычно малым сродством к р-лак-
тамазам и способны очень быстро
проникать в периплазматическое
пространство.
Цефалоспорины I поколения
Цефалоспорины I поколения (цефалотин, цефазолин, цефапирии,
цефрадин, цефалексин и цефадроксил) обладают высокой биологиче-
биологической активностью в отношении стафилококков, стрептококков, пневмо-
пневмококков, многих видов энтеробактерий, в том числе Escherichia coli.
Proteus mirabihs. Они гидролизуются многими |3-лактамазами, продуци-
продуцируемыми грамотрицательными бактериями и поэтому имеют относи-
относительно узкий спектр активности по отношению к грамотрицательным
бактериям. Цефалоспорины I поколения являются альтернативой пени-
циллинам для лечения стафилококковых и неэнчерококковых инфекций
> пациентов, не переносящих пенициллин. Они широко используются
при профилактике сердечно сосудистых, ортопедических и прочих хи-
хирургических вмешательствах.
Цефалотин (Cefalothin)
Цефалотин — F11-транс)-3-[(ацетилокси)метил]-8-оксо-7-[B-тие-
нилацегал)амино]-5-тиа-1-азабицикло[4.2.0]окт-2-ен-2-карбоновая
кислота C2.1.2.1) получают прямым взаимодействи.м хлорангидри-
да 2-тиенилуксусной кислоты с 7-аминоцефалоспорановой кисло-
кислотой в присутствии бикарбоната натрия [70, 71, 72, 73, 74].
<r
-608-
Антибиотики
Цефалотин антибиотик с широким спектром антимикробного дей-
действия -- актвен в отношении грамположительных (стафилококки,
стрептококки, пневмококки, палочки дифтерии, сибирской язвы) и гра-
мотрицагельных микроорганизмов (менингококки, гонококки, шигеллы.
спьмонелла, кишечная и гемофильная палочки, клебсиеллы), неэффек-
неэффективен в отношении синегнойной палочки, микобактерий туберкулеза,
анаэробных микроорганизмов.
Цефалотип применяют при бактериальных инфекциях нижних ды-
дыхательных путей, мочевыводящих путей, кожи и мягких тканей, костей
и суставов, сепсисе, перитоните, остеомиелите, мастите, раневых, по-
послеоперационных и прочих инфекций.
Синонимами препарата являются кефлин, сеффин, коаксин и др.
Цефапирин (Cefapirin)
Цефапирии — F11-транс)-3-[(ацетилокси)метил]-8-оксо-7-[[D-
пиридинилтио)ацетил]амино]-5-тиа-1-азабицикло[4.2.0]окт-2-ен-2-
карбоновая кислота C2.1.2.4) получают ацилированием 7-амино-
7-аминоцефалоспорановой кислоты хлорангидридом 4-пиридилтиоуксусной
кислоты C2.1.2.3), получаемого последовательным взаимодействи-
взаимодействием 4-хлорпиридина с меркаптоуксусной кислотой в присутствии
щелочи с образованием 4-пиридилтиоуксусной кислоты C2.1.2.2)
и дальнейшим переводом полученной кислоты в хлорангидрид
взаимодействием с пятихлористым фосфором. Альтернативным
способом получения цефапирина является ацилирование 7-амино-
7-аминоцефалоспорановой кислоты бромангидридом бромуксусной кисло-
кислоты с получением бромацетильного производного C2.1.2.5), который
далее вводят во взаимодействие с 4-меркаптопиридином в присут-
присутствии триэтиламина с получением искомого цефапирина C2.1.2.4)
[75, 76, 77, 78].
/У- ci + hs-ch2-cooh
;н2-о-сосчэ
-609-
Глава 32
J-^-^K,,
Br—cHz-co-er
Br-CH,-CO— C-NH
sh
6
Спектр действия и показания к применению цефапирина такие же,
как и у цефаллотина.
Синонимами препарата являются бристосеф, цефарин. цефатрексил,
цефадил и др.
Цефазолин (Cefazolin)
Цефазолин — FК-транс)-3[[(-5метил-1,3,4-тиадиазол-2-ил)тио]метил]-
8-оксо-7-[AЯ-тетразол-1-илацетил)амино]-5-тиа-1-азабицикло[4.2.0]-
окт-2-ен-2-карбоновую кислоту C2.1.2.7) получают взаимодействи-
взаимодействием 7-аминоцефалоспорановой кислоты со смешанным ангидридом
C2.1.2.6) — результатом взаимодействия тетразолилуксусной ки-
кислоты с пивалиновой (триметилуксусной) кислотой. Дальнейшим
его взаимодействием с 2-меркапто-5-метил-1,3,4-тиадиазолом осу-
осуществляют замещение 3-ацетоксильной группы на меркаптотиадиа-
зольную с получением цефазолина C2.1.2.7) Существенным струк-
структурным отличием данного препарата от рассмотренных ранее
цефалоспоринов I поколения является замена 3-ацетоксиметильной
группы на 1,3,4-тиадиазол-2-илтиометильную [79, 80, 81].
'ог-о-сэс-3
• N-CHj— C-NH
N-N
COOH
32 1 27
-610-
Антибиотики
Спекгр действия цефазолина и показания к применению такие же,
как и\ цефаллотина.
Синонимами препарата являются цефацидал, кефзол, цефамезин.
цефазил. золин, ансеф и многие другие.
Цефалексин (Cefalexin)
1{ефалексин — [6К-[6а,7РA1*)]]-3-метил-8-оксо-7-[(аминофенил-
ацетил)амино]-5-тиа-1-азабицикло[4.2.0]окт-2-ен-2-карбоновую ки-
кислот) C2.1.2,10) в определенной степени можно считать аналогом
ампициллина, поскольку ацильным фрагментом, вводимым в струк-
структуру 7-аминоцефалоспорановой кислоты, как и в случае ампицил-
ампициллина, является фенилглициновый фрагмент. Кроме того, структура
данного препарата, а также ряда других цефалоспоринов, рассмат-
рассматриваемых ниже, несколько упрощена заменой 3-ацетоксиметильной
гр\ппы на метальную. Синтез цефалексина осуществляют исходя
из цефалоглицина C2,1.2.9), который получают взаимодействием
7-аминоцефалоспорановой кислоты со смешенным ангидридом, по-
полученным взаимодействием N-карбобензоксиглицина и изобутило-
вого эфира хлоругольной кислоты в присутствии триэтиламина.
Снятием с полученного продукта C2.1.2.8) N-карбобензокси за-
шнтной группы восстановлением водородом с использованием
в качестве катализатора палладия на угле получают пефалоглицин
C2 1.2.9) в виде внутренней соли. Восстановлением последнего во-
водородом, но уже с использованием в качестве катализатора палла-
палладия на сульфате бария осуществляют деацетоксилирование в треть-
третьем положении 7-аминоцефалоспорановой кислоты с получением
искомого цефалексина C2.1.2.10) [82, 83, 84, 85, 86].
' 'СИ3,2СН-СО-3! . |СгН5)з1ч
-СН-СО—C-NH
nh-cdo
h s
ri; / Pa—Baso4
о Y сн;-о-сосн,
* 2 9 ссон
<\ а—сн-со—c-nh.
NH2
-611 -
Глава 32
Цефалексин имеет широкий спектр антимикробного действия: ак-
гивен в отношении грамположительных и грамотрицательных микроор-
микроорганизмов. Неэффективен в отношении синегнойной палочки, микробак-
микробактерий туберкулеза, анаэробных микроорганизмов. Применяется при
бактериальных инфекциях верхних и нижних дыхательных путей, моче-
выводящих путей, кожи и мягких тканей.
Синонимами препарата являются цепорексин, орацеф, кефлекс. це-
фазал и др.
Цефрадин (Cephradin)
Цефрадин — [611-[6а,7р(К*)]]-3-метил-8-оксо-7-[(амино-1,4-цик-
логексадиен-1-илацетил)амино]-5-тиа-1-азабицикло[4.2.0]окт-2-ен-
2-карбоновая кислота C2.1.2.13) является близким аналогом цефа-
лексина и отличается тем, что фенильный радикал в фенилглицине
частично гидрирован в 1,4-циклогексадиенильный. Синтез препара-
препарата осуществляют исходя из фенилглицина, который частично вос-
восстанавливают литием в жидком аммиаке с получением 1,4-цикло-
гексадиенилглицина C2.1.2.11), аминную группу в последнем
защищают взаимодействием с метиловым эфиром ацетоуксусной
кислоты в присутствии метилата натрия. Полученную при этом
соль C2.1.2.12) трансформируют в смешанный ангидрид взаимо-
взаимодействием с этиловым эфиром хлоругольной кислоты в триэтила-
мине и вводят во взаимодействие с дезацетоксилированной 7-ами-
ноцефалоспорановой кислотой с получением искомого цефрадина
C2.1.2.13) [87, 88. 89].
^ V-сн-
о о
СН3-С-СН2-0-О—СНз ' Cri3ONa
со-он
32 1 2 11
1 C2H5-CO-cl i (C2H5/3N
\ V"?H~co~°Na
\ У~9Н~СО~С"М"
Nrb
о
:о-
32 1 2 1 3
Спектр действия и показания к применению цефрадина такие же,
как и \ цефалексина.
Синонимами препарата являются велосеф, сефрил, цефро и др.
-612-
днтибиотики
Цефадроксил (Cefadroxil)
Цефадроксил —[6R-[6a,7p(R')]]-3-MeTH.i-8-oKco-7-[[aMHHoD-nupo-
ксифенил)ацетил]амино]-5-тиа-1-азабицикло[4.2.0]окт-2-ен-2-карбо-
новую кислоту C2.1.2.14), являющуюся аналогом цефалексина
и отличающуюся лишь наличием гидроксильной группы в четвер-
четвертом положении фенильного кольца фенилглицина, получают по
схеме, аналогичной схеме синтеза цефрадина [90 91 92 93 94 95
96]. ' ' "' '
0~\ V~rH~C0~0Na
СгНз-CO-CI , (С2н5Kм
Цефадроксил имеет широкий спектр антимикробного действия —
активен в отношении грамположительных и грамотрицательных микро-
микроорганизмов. Как и все вышеописанные препараты, действует бактери-
бактерицидно путем нарушения процесса восстановления мембран бактерий.
Синонимами препарата являются бидоцеф, цефадрил, лурасеф.
ультрацеф и др.
Цефалоспорины II поколения
Цефалоспорины II поколения (цефуроксим, цефамандол, цефони-
цид, цефоранид) характеризуются большей, по сравнению с цефалоспо-
ринами I поколения, активностью в отношении грамотрицательных бак-
герий. Они имеют большею р-лактамазную устойчивость и более
широкий спектр активности по отношению к грамотрицательным орга-
организмам, однако не оказывают заметного действия на энтерококки,
Pseudumonas aeruginosa. Кроме того к цефалоспоринам II поколения
относят и цефокситин, получаемый из цефамицина С. цефотетан, полу-
полусинтетическое производное органомицина-G, а также цефаклор). Це-
Цефокситин и цефотетан применяются при смешанных аэробоанаэробных
инфекциях. Их отличительной химической особенностью является на-
наличие дополнигельной метоксильной группы в положении С; фрагмента
ампноцефалоспорановон кислоты, а отличительной химической осо-
оенностью цефаклора является еще и отсутствие характерной для всех
иефалоспоринов замещенной гидроксиметильной группы в положении
*-j фрагмента аминоцефалоспорановой кислоты.
-613-
Глава 32
Цефуроксим (Cefuroxim)
Цеф\роксим — карбамат B)-моно(О-метилоксима) FR,7R)-7-[2-B-
фурил)глиоксиламидо]-3-(гидроксиметил)-8-оксо-5-тиа-1-азабицик-
ло[4.2.0]окт-2-ен-2-карбоновой кислоты C2.1 2 18) получают исхо-
исходя из 2-ацетилфурана Окислением последнего азотистой кислотой
получают 2-фурилглиоксалев\ю кислоту C2.1.2.15), взаимодейст-
взаимодействием которой с О-метилгидроксиламином пол>чают соответствую-
соответствующий оксим — смн-2-метоксимино-2-B-фурил)укс>сную кислоту
(^2.1 2.16). которую далее взаимодействием с хлорангидридом ща-
щавелевой кислоты в диметилформамиде трансформируют в смешан-
смешанный ангидрид и вводят во взаимодействие с бензгидриловым эфи-
эфиром 7-аминоцефалоспорановой кислоты. Полученный продукт
C2 1.2 17) подвергают ферментативному гидролизу в щелочной
среде, при котором не затрагивается бензгидрильиая защита, а гид-
ролиз\егся лишь уксуснокислая часть молекулы в положении С3
фрагмента аминоцефалоспорановой кислоты. Образовавшийся про-
продукт со свободной гидроксиметильной группой C2.1.2.18) подвер-
подвергают действию хлорсульфоизоцианата с промежуточным получени-
получением соо1ветствующего N-хлорсульфонилуретана C2.1.2.19), который
гидролизуется водой до уретана C2.1.2.20). Наконец, снятием бенз-
гидрильной зашиты трифгоруксусной кислотой получают искомый
цеф\роксим C2.1.2.21) [97, 98, 99, 100, 101, 102. 103, 104, 105, 106,
107. 108, 109].
1 Ci—CO-CC-Cl DMF
NaNOj НС
С ООН
32 1 2 16
H2-O-COCH3
COOCh(C6H6>2
н2о сн
СН2-С-СОС
СООСН С„Н. 2
СН3О-^ 3
сосен с
3O-N О
соосн^с6ни
J2 1 ^20
-614-
Антибиотики
CH3O~~N О
чЧ "
У—C-NH.
-N.
CH2-O-CO-NH2
СООН
32 1 2 21
Дрчгим. кажущимся несколько более простым, способом получения
цеф>роксима является прямое ацилирование 7-амино-З-аминокарбо-
нилокСнмегил-З-цефем-4-карбоновой кислоты C2 1.2 22) — продукта,
выделяемого из культуральной жидкости Stretomyces lactamdurans хло-
хлорангидридом смн-2-метоксимино-2-B-фурил)уксусной кислоты, полу-
получаемым взаимодействием соответствующей кислоты с пятихлористым
фосфором [ПО, 111].
PCI5
H;N
COOh
32 1 2 22
CH3O--N
с оон
i2 ' . 1о
32 1 2 21
Цефор\ксим действует бактерицидно. Имеет широкий спектр анти-
антимикробного действия. Устойчив к действию р-лактамаз. Высокоактивен
в отношении грамотрицательных микроорганизмов (кишечная и гемо-
фи'тьная палочки, сальмонеллы, шигеллы, энтеробактер, гонококки).
Активен также в отношении грамположительных микроорганизмов
(стафилококки, стрептококки). Не активен в отношении различных ви-
чоз Pseudomonas, большинства штаммов энтерококков, многих штам-
штаммов Enterobacter cloacae, метициллинрезистентных стафилококков и Listeria
monoevtogenes.
Препарат применяют при бактериальных инфекциях, вызванных
чувствительными к препарату микроорганизмами. Это могут быть аб-
абдоминальные и гинекологические инфекции, сепсис и менингит, эндо-
эндокардит, инфекции мочевыводящих и дыхательных путей, костей, суста-
суставов кожи и мягких тканей. Широко используется при пневмониях,
а также бактериальном менингите у детей, при послеоперационных ин-
инфекционных осложнениях.
Синонимами препарата являются цефтин, зинацеф, к\роксим. ке-
фокс и многие другие.
-615-
Глава 32
Цефамандол (Cefamandol)
Цефамандол — 7-О-манделамидо-3-[[A -метил-1 //-те гразол-5-ил)-
тио]метил]-8-оксо-5-тиа-1-азабицикло[4.2.0]окт-2-ен-2-карбоновую
кислоту C2.1.2.25) получают из 7-аминоцефалоспорановой кисло-
кислоты. Предварительно защитив свободную аминогруппу в 7-аминоце-
фалоспорановой кислоте формилированием муравьиной кислотой
в присутствии укс>сного ангидрида получают 7-формамидоце-
фалоспорановую кислоту C2.1.2.23), ацетоксильную группу в кото-
которой замешают взаимодействием с 1-метил-1,2,3.4-тетразол-5-тио-
лом, и после снятия N-формильной зашиты соляной кислотой
получают 7-амино-3-A-метил-1,2,3.4-тетразол-5-ил)-тиомегил-3-це-
фем-4-карбоновую кислоту C2.1.2.24). Взаимодействием последней
со смешанным ангидридом, полученным из миндальной кислоты
и фосгена нол\чают искомый цефамандол C2.1.2.25) [112, 113, 114,
115, 116, 117, 118, 119].
соси
32 1 2 2"
СООН
32 1 2 24
Фармакологическое действие и показания к применению цефаман-
цефамандола аналогичны таковым цефуроксима и цефамандола.
Синонимами препарата являются мандокеф, кефандол, кефадол
и многие дру[ ие.
Цефошщид (Cefonicid)
Цефоницид — 7-О-манделамидо-3-[[A-сульфометил-1//-тетразол-5-
ил)тио]метил]-8-оксо-5-гиа-1-азабицикло[4.2.0]окт-2-ен-2-карбоно-
вая кислота C2.1.2.26) структурно родственна цефамандолу и отли-
отличайся наличием с\льфогруппы при метильном заместителе тетра-
-616-
Антибиотики
вольного кольца. Препарат получают методами, аналогичными ме-
юдам синтеза цефамандола [120, 121, 122, 123].
О
CH-C-N
СООН
32 1.2 26
CH2-SO3H
Фармакологическое действие, антимикробный спектр и показания к
применению аналогичны таковым цефамандола.
Синонимом препарата является моноцид.
Цефоранид (Ceforanid)
Цефоранид — 7-[2-(а-амино-о-толил)ацетамидо]-3-[[(карбокси-
мстил-1Я-тетразол-5-ил)-тио]метил]-8-оксо-5-тиа-1-азабицикло[4.2.0]-
окт-2-сн-2-карбоновая кислота C2.1.2.27) также структурно родст-
родственна цефамандолу и отличается тем, что ацилирующей кислотой
является о-аминометилфенилуксусная кислота, а также наличием
карбоксильной группы при метильном заместителе тетразольного
кольца. Препарат также получают методами, аналогичными мето-
методам синтеза цефамандола [124. 125, 126, 127, 128].
N-N
о
N
'CH2-
Фармакологическое действие, антимикробный спектр и показания
к применению аналогичны таковым цефамандола.
Синонимом препарата является прецеф.
К препаратам II поколения цефалоспоринов относятся также цефок-
снтин и пефотетан, являющиеся цефамицинами и принципиально отли-
отличающиеся от других цефалоспоринов наличием метоксильной группы
-617-
Глава 32
в положении 7 цефалоспориновой системы, что сильно повышает их
устойчивость по отношению к E-лактамазам.
Цефокситин (Cefoxitin)
Цефокситин — карбамат 3-(гидроксиметил)-8-оксо-7-метокси-7-[B-
тиенилацетил)амино]-5-тиа-1-азабицикло[4.2.0]окт-2-ен-2-карбоно-
вой кислоты C2.1.2.30) предложено получать различными метода-
методами. При первом способе исходят из цефамицина С — 7[J-(D-5-
амино~5-карбоксивалер-амидо)-3-аминокарбонилгидроксиметил-7-ме-
токси-З-цефем-4-карбоновой кислоты, в которой изначально при-
присутствует метоксильная группа при С?, и задача получения искомо-
искомого препарата сводится, собственно, к переамидированию.
СН3О
HOOC-CH-(CH2K-CO-NH
NH2
CH2-O-CO-NH2
СООН
цефамицин С
При втором способе синтез препарата начинают исходя из 7-
аминоцефалоспорановой кислоты, в положение С7 которой необходимо
внедрить метоксильную группу.
В одном из примеров синтеза цефокситина из цефамицина С перво-
первоначально осуществляют защиту свободной аминогруппы с помощью
толуолсульфохлорнда, и продукт выделяют в виде хорошо кристалли-
кристаллизующейся соли с дициклогексиламином C2.1.2.28). Далее с помощью
метилхлорметилового эфира этерифицируется карбонильная группа
в положении 2 цефалоспориновой системы, полученное соединение
C2.1.2.29) подвергается действию 2-B-тиенил)ацетилхлорида и далее
с целью снятия эфирной защиты с карбоксильной функции — действию
раствора хлористого водорода в метаноле с получением искомого це-
цефокситина C2.1.2.30) [129].
-Nrt—|—f" ]
¦ -О-
¦пз? s
C-Cri~iGH24-.CQ-NH-J ^
СООИ
32 1 2 28
-618-
Антибиотики
1 ^у-сн*-со~а
2 HCI i ChjOh
СООН
32 1 2 3C
Третий способ синтеза цефокситина исходит из 7-амино-
цефа-тоспорановой кислоты, а точнее из ее бензгидрилового эфира
C2 1 2.31). который получают предварительным тозилированием ами-
аминогруппы исходной 7-аминоцефалоспорановой кислоты, этерификацией
карбоксильной группы дифенилдиазометаном и последующим снятием
тозильной защиты.
Действием азотистой кислоты полученный продукт диазотируется
с пол) чением дифенилметилового эфира 7-диазоцефалоспорановой ки-
кислоты C2.1.2.32). Последовательным действием на полученное соеди-
соединение азидом триэтиламмония в дихлорметане и далее бромазидом по-
л\чают дифенилметиловый эфир 7-бром-7-азидоцефалоспорановой
кислоты C2.1.2.33). Обработка последнего метанолом в присутствии
борфторида серебра ос> ществляют замещение атома брома, и получают
дифенилметиловый эфир 7-метокси-7-ази-доцефалоспорановой кислоты
C2.1.2.34). Полученный азид восстанавливают водородом в присутст-
присутствии окиси платины в качестве катализатора с получением дифенилмети-
дифенилметилового эфира 7-метокси-7-аминоцефалоспорановой кислоты C2.1.2.35).
А ш пиру я последнюю 2-B-тиенил)ацетилхлоридом, получают дифенил-
дифенилметиловый эфир 7-метокси-7-[2-B-тиенш1)-ацетамидо]цефалоспора-
новой кислоты C2.1.2.36), сложноэфирную часть которой гидролизуют
с помощью трифторуксусной кислоты, и далее полученную кислоту
действием бикарбоната калия переводят в калиевую соль C2.1.2.37).
Полученный продукт далее гидролизуют ферментом ацетилэстеразой
Otrusi до калиевой соли 3-гидроксиметил-7-метокси-7-[2-B-тиенил)-
ацетамидо]-3-цефем-4-карбоновой кислоты C2.1.2.38). Способом уже
ранее описанным, а именно первоначальным действием хлорсульфони-
лизоцианатом и далее гидролизом водой, полученное соединение
C2.1.2 38) трансформируют в искомый цефокситин C2.1.2.20) [130, 131,
132. 133, 134, 135, 136, 137, 138].
-619-
Глава 32
1
Л;"СО- С)
ioccb'Censt?
32-2 34
СОССм{Сен5^
СН,С
CO-NH-U-S
IT
CH3C
2—CO-NH
СН3О
СН?—:CO-NH
-H—{ >
соон
32 1 2 30
Фармакологическое действие, антимикробный спектр и показания
к применению аналогичны таковым цефамандола.
Синонимами препарата являются мефокситин, бетацеф, цефокси-
нол, тифокс.
Цефотетан (Cefotetan)
Цефотетан — 7р-[(карбамоилкарбоксилатометилен)-1,3-дитиетан-2-
ил]-карбоксамидо-7-метокси-3-A-метилтетразол-5-ил)-тиометил-3-
цефем-4-карбоновая кислота C2.1.2.43) получают по следующей
схеме. Вначале осуществляют S-алкилирование тринатриевой соли
4-карбокси-3-гидрокси-5-меркаптоизотиазола C2.1.2.41) ?Р-бром-
ацетамидо-7а-метоксицефалоспорановой кислотой, которую полу-
получают по вышеприведенной схеме C2.1.2.31) —> C2.1.2 37) с той
лишь разницей, что ацилнрование на стадии C2.1.2.35) —> C2.1.2.36)
ос\шествляют не 2-B-тиенил)ацетилхлоридом. а бромангидридом
бромуксчсной кислоты.
Далее при взаимодействии полученного продукта C2.1.2.42) с 1-ме-
1-метил-1.2,3,4-тетразол-5-тиолом в прис>тствии бикарбоната натрия одно-
одновременно с ожидаемым замещением в условиях реакции происходит
-620-
днтибиотики
и перегруппировка с раскрытием изотиазольного кольца и получением
производного карбамоилкарбоксилатометилен-1,3-дитиетана — цефо-
гетена C2.1.2.43) [139, 140].
Вг-СН2—CCh-NH
NaO COONa
i
Фармакологическое действие, антимикробный спектр и показания
к применению цефотетана аналогичны таковым у цефамандола.
Синонимами препарата являются цефотен, апатеф, цепан, дарвилен
и др.
Цефаклор (Cefaclor)
Цефаклор — F11,711)-7-[(]1)-2-амино-2-фенилацетамидо]-3-хлор-
8-оксо-5-тиа-1-азабицикло[4.2.0]окт-2-ен-2 карбоновая кислота
C2.1.2.48) принципиально отличается от рассматриваемых и при-
применяющихся в медицинской практике антибиотиков цефалоспори-
нового ряда всех поколений наличием вместо замещенной метиле-
новой группы в положении 3 цефалоспораиовой кислоты атома
хлора. Синтез препарата осуществляется исходя из наиболее дос-
доступного антибиотика этого ряда — цефалотина C2.1.2.1), карбок-
карбоксильную группу которого защищают этерификацией взаимодейст-
взаимодействием с 4-нитробензилбромидом в триэтиламине с получением
4-нитробензилового эфира 7-B-тиенилацетамидо)-цефалоспорано-
вой кислоты C2.1.2.40). Взаимодействием последней с этилксанто-
тенатом калия замещают ацетоксильную группу в положении 3 це-
фалоспорановой системы, и получают соответствующее S-произ-
водное C2.1.2.41). Восстановлением последнего цинком в мура-
муравьиной кислоте продукт десульфируют, и получают 4-нитробен-
зиловый эфир 3-ЭА-зс>-метилен-7-Bтиенилацетамидо)-цефем-4-кар-
боновой ислоты C2.1.2.42). Э^о-метиленовую группу окисляют
озоном и образовавшееся дикарбонильное производное переводят
-621 -
Глава 32
в енольную форму C2.1.2.43) действием сернистого ангидрида. Да-
Далее гидроксильную группу действием хлористого тионила в диме-
шлфор.мамиде замещают на атом хлора с получением 4-нитро-
бензилового эфира 3-хлор-7-B-тиенилацетамидо)-3-цефем-4-карбо-
новой кислоты C2.1.2.44) Полученный продукт подвергают
дезацилированию действием смеси пиридина с пятихлористым
фосфором в изобутаноле с получением гидрохлорида 4-нитро-
бензплового эфира 7-амино-3-хлор-3-цефем-4-карбоновой кислоты
C2.1.2.45). Последний ацилируют N-защишенным производным
фенилглицина — 1Ч-(отреот-бутоксикарбонил)-В-сх-фенилглицином
в присутствии К-этоксикарбонил-2-этокси-1,2-дигидрохинолина
в тетрагидрофуране с получением продукта C2.1.2.46). Трет-
б>токсикарбонильную защиту последнего удаляют кипячением аце-
тонитриле в присутствии «-толуолсульфокислоты. Наконец, восста-
восстановлением водородом с полученного тозилата C2.1.2.47) снимают
4-нитробензильн\ю защитн>ю группу с использованием цинка
и соляной кислоты в димегилформамиде с получением цефаклора
C2.1.2.48) [141, 142, 143].
ОТ
C0OCH;CeH4NO2
32 1 2 42
1 DMF ' SOCI2
2 HCI
COOCh2C6h4NO2
32 ! 2 43
p<'
COOCH2CeH4NO2
32 1 2 44
COOH
C6H5-CH-NHCOO(CH3K
COOCH2C6H4NO2
TsOH
СООСН2С6Н4ЫО2
32 1 2 46
-622-
Антибиотики
Q-CM-CO-Nh-W-S
TsOH
COOCH2C6H4NO2
32 1 2 47
HCI / Zn
/-CH.CO-NH-r-r-N
NH2 J ¦¦ '
COOH
32 1 2 48
Фармакологическое действие, антимикробный спектр и показания
к применению цефаклора аналогичны таковым у цефамандола.
Синонимами препарата являются панорал, альфатил, дистаклор. па-
нацеф, цеклор и др.
Цефалоспорины III поколения
Цефалоспорины III поколения (цефотаксим, иефтизоксим, цефтри-
аксон. цефтазидим, цефоперазон и моксалактам) отличаются высокой
ашимикробной активностью против энтеробактерий, в том числе ус-
устойчивых к другим антибиотикам. Они относительно более устойчивы
к гитролиз) Р-лактамазами и имеют самый широкий спектр грамотри-
naiejibnofi активности. Для них характерна повышенная антибиотиче-
антибиотическая активность в отношении Escherichia coli, ряда штаммов Proteus
Enterobcter. Вместе с тем они обладают умеренной активностью в от-
отношении стафилококков и используются при полирезистентных гра-
мофицательных инфекциях при лечении бактериального менингита
и гонореи. Следует отметить, что моксалактам содержит дигидроокса-
зиновое кольцо вместо общего для всех цефалоспоринов дигидрот-
иазинового кольца. Таким образом, это не цефалоспорин, не цефамицин
и не пенициллин, однако по спектру фармакологического действия яв-
является соединением, родственным всем трем перечисленным выше ан-
антибиотикам, и классифицируется как цефалоспорин III поколения.
С химической точки зрения их объединяет то, что практически все они
являются производными 7-аминоцефалоспорииовой кислоты, ацилиро-
ванной по аминогруппе 2-B-амино-4-тиазолил)-2-метоксиминоуксусной
кислотой. По фармакологическому действию цефалоспорины III поко-
поколения, в основном, отличаются друг от друга фармакокинетическими
особенностями, а также некоторыми признаками по отношению к Pseu-
dumonas aernginosa и Staphylococcus aureus.
Цефотаксчм (Cefotaxim)
Цефотаксим — а-О-метилоксим ацетата FR.7R) -7-[2-B-амино-4-
1иазолил)глиоксилами-до]-3-(гидроксиметил)-8-оксо-5-тиа-1-азаби-
-623-
Глава 32
цикло[4.2.0]окт-2-ен-2-карбоновой кислоты C2.1.2.56) получают
ацилироваиием 7-аминоцефалоспорановой кислоты в присутствии
диииклогексилкабодиимида 2-B-амино-4-тиазолил)-2-метоксими-
но>кс\сной кислотой, защищенной по аминогруппе тритильной за-
защитой C2.1.2.54) После снятия тритильной зашиты с образовавше-
образовавшегося продукта C2.1.2.55) разбавленной муравьиной кислотой
получают искомый цефотаксим C2.1.2.56). Необходимый для дан-
данного синтеза, а также для синтеза ряда других антибиотиков цефа-
лоспоринового ряда этиловый эфир 2-B-амино-4-тиазолил)-2-мего-
ксиминолкс)сной кислоты получают исходя и ацетоукс\ сного
эфира. Нитрозированием последнего азотистой кислотой получают
изонитрозоацетоуксусный эфир C2.1.2.49), О-метилированием гид-
роксильной гр\ппы которого диметилсульфатом в присутствии по-
поташа пол)чают этиловый эфир 2-ацетил-2-метоксиминоуксусной
кислоты C2.1.2.50). Бромируя полученный метиловый эфир оксима
молекулярным бромом в хлористом метилене в прис>тствии
«-толуолсульфокислоты получают 4-бром-2-метоксиминоацетоук-
сусный эфир C2.1 2.51). Взаимодействием последнего с гиомочеви-
ной по классической схеме получения тиазотов из с-бром-
карбонильных соединений и тиоамидов получают этиловый эфир
2-B-амино-4-тиазолил)-2-мегоксимино) кс>сной кислоты C2.1.2.52)
Взаимодействием последнего с трифенилхлорметаном в присутст-
присутствии триэтиламина осуществляют тритильную защиту аминогруппы
с получением этилового эфира 2-B-тритиламино-4-гиазолил)-2-ме-
токсиминоуксусной кислоты C2.1.2.53). который гидролизу ют
в кислоту C2.1.2.54) с помощью гидроксида натрия. Полученною
кислот) C2.1.2.54), как уже было отмечено, используют для ацили-
рования 7-аминоцефалоспорановой кислоты в присутствии дицик-
логексилкарбодиимида с получением тритилированного цефаток-
сима - - а-О-метилоксима ацетата 7-[2-B-тритиламино-4-тиазолил)-
глиоксиламидо]-3-(гидроксиметил)-8-оксо-5-тиа-1-азабнцикло[4.2.0]-
окт-2-ен-2-карбоновой кислоты C2 1.2.55). Наконец, снятием с син-
синтезированного продукта C2.1.2.55) тритильной зашиты с помощью
разбавленной муравьиной кислоты получают цефотаксим C2.1.2.56)
[144, 145, 146, 147, 148].
NldNO..
C2ri5
NOh
32 • 2 49
О О
N-OCH-
32 I 2 50
В-2
-624-
днтибиотики
ч. c
NH-C[i6H53
Д.
s\
CH-—O-COCri
COQH
32 i 2 55
Цефотаксим обладает широким спектром антимикробного дейст-
действия Действует бактерицидно. Высокоактивен в отношении грамотрица-
тельных микроорганизмов, устойчивых к другим антибиотикам, —
Е Coli, Cuobacier, Proteus mirabilis, Proteus indole, Providencia,
Klebsiella, Serratia. некоторые штаммы Pseudomonas, Haemophilus
mfluenzale Цефотаксим менее активен в отношении стрептококков,
пневмококков, менингококков, гонококков, бактероидов. Устойчив
по отношению к большинству Р-лактамаз грамположительных и грам-
отрицательных микроорганизмов.
Препарат применяют при бактериальных инфекциях тяжелого тече-
течения, вызванных чувствительными к препарату микроорганизмами, —
перитоните, сепсисе, абдоминальных инфекциях, инфекциях органов
малою таза, нижних дыхательных и мочевыводящих путей, костей, сус-
шеов, кожи, мягких тканей, инфицированных ранах и ожогах.
Синонимами препарата являются клафоран, заривиз и др.
Цефтизоксим (Ceftizoxim)
Цефтизоксим — ct-O-метилоксим FR,7R)-7-[2-B-aMnno-4-THa3o-
лил)глиоксиламидо]-8-оксо-5-тиа-1-азабицикло|4.2.0]окт-2-ен-2-кар-
боновая кислоту C2.1.2.64) получают по схеме синтеза приводимой
ниже, которая исходит из 4-нитробензилового эфира З-гидрокси-7-
B-фенилацетамидо)-3-иефем-4-карбоновой кислоты C2 1.2.57), по-
л) чаемой с использованием набора методов, применяемых при син-
синтезе цефаклора C2.1.2.48). Восстановлением двойной связи при
С3-С4 в исходном 4-нитробензиловом эфире 3-гидрокси-7-B-фе-
нилацетамидо)-3-цефем-4-карбоновой кислоты C2.1.2.57) борги
дридом натрия в метаноле пол) чают 4-нитробензиловый эфир
3-гидрокси-7-B-фенилацетамидо)-3-цефем-4-карбоновой кислоты
-625-
Глава 32
C2 1 2.58), гидроксильную группу в котором ацилируют ангидри-
ангидридом \кс>сной кислоты в пиридине с пол)чением ацетата C2.1.2.59).
Действуя на последний триэтиламином. отщепляют молекулу ук-
уксусной кислоты с получением 4-нитробензилового эфира 7-B-фе-
нилацегамидо)-3-цефем-4-карбоновой кислоты C2.1.2.60). Действи-
Действием на последний пятихлористым фосфором в пиридине и после-
д\ющим метанолизом дезацилирую i амидный фрагмент молекулы,
и пол> чают 4-нитробензиловый эфир 7-амино-3-цефем-4-карбо-
новой кислоты C2 1 2.61). Предварительным силилированием ами-
аминогруппы последнего триметилсилилацетамидом и дальнейшим
ацилированием хлорангидридом 2-B-формамидо-4-тиазолил)-2-ме-
токсиминоуксусной кислоты, получаемого взаимодействием с хло-
рокисью фосфора в диметилформамиде непосредственно в услови-
условиях реакции, получают 4-нитробензиловый эфир а-О-метилоксима
7-[2-B-формамамидо-4-тиазолил)глиоксиламидо]-8-оксо-5-тиа-1-аза-
бицикло[4 2.0]окт-2-ен-2-карбоновой кислоты C2 1.2.62). Восста-
Восстановлением последнего водородом с использованием в качестве ка-
татизатора палладия на угле снимают 4-нитробензильную защиту
с карбоксильной группы и получают кислоту C2,1,2 63). Наконец,
гидролизом формамидной части молекулы хлористым водородом
в метаноле получают искомый цефтизоксим C2.1.2.64) [149,150,151].
NaBHj I СНзОН
4. tf—CH2—CO-NH
—CO-Nh—г-
J-
32 1
;_CO-NH-r
0
32 1
,S^ (CH3CO)ZO/P>
COOCH2C6H4NO2
2 58
1 PCI5 / Py
^-S^ 2 CH3OH
2 60
to
N4CHO
К
V—СОСИ
N
OCH3
NH-CHO
А,
¦626-
Днтибиотики
nh-cho
A.
NH2
S N
^Vco-,
N
OCH3
hci / CH3OH
CO-NH-1—{
J
COOH
N
OCH3
COOH
32 1 2 63
32 1 2 64
Цефгизоксим применяют при бактериальных инфекциях нижних
дыхательных путей, инфекциях мочевыводящих п>тей, костей, суста-
суставов, кожи, мягких тканей, абдоминальных инфекциях.
Синонимами препарата являются цефтикс и эпосерин.
Цефтриаксон (Ceftriaxon)
Цеф|риаксон — 7-[[B-амино-4-тиазолил)-2-B)-(метоксимино)аце-
1нл]амино]-8-оксо-3-[[A,2,5,6-тетрагидро-2-метил-5N-диоксо-1,2,4-
триазин-3-нл)тио]метил]-5-тиа-1-азабицикло[4.2.0]окт-2-ен-2-карбо-
новая кислота C2 1.2.72) получают ацилированием 7-амино-З-
\[B ^-дигидро-6-гидрокси-2-\детил-1,2,4-триазин-5-он-3-ил)тио]ме-
пп]-3-цефе\1-4-карбоновой кислоты C2.1 2.70), защищенной по
аминогруппе хлорацетильной группой, хлорангидридом 2-D-тиазо-
1ил)-2-метоксиминоуксусной кислоты, а именно 2-B-хлорацетами-
Д1'-4-гпазолил)-2-метоксиминоацетилхлоридом C2.1.2.67). Послед-
Последний пол>чают исходя из этилового эфира 2-B-амино-4-тиазолил)-2-
маокснминоуксусной кислоты C2.1.2.52), аминную группу которо-
i о защищают ацилированием хлорангидридом хлоруксуснои кисло-
ты s диче гилацет амиде с получением этилового эфира 2-B-хлор-
аиетамидо-4-тиазолил)-2-метоксиминоуксусной кислоты C2.1.2.65).
Гидролизом сложноэфирной части последнего гидроокисью калия
до кислоты C2 1.2 66) и ее дальнейшим взаимодействием с пяти-
\лористым фосфором в присутствии триэтиламина пол>чают 2-B-
^1ораиегамидо-4-тиазолил)-2-метоксиминоацетил\лорид C2.1.2.67).
Параллельно осуществляется синтез 7-амино-3-[[B,5-дигидро-6-
П1 'рокси-2-метил-1,2.4-триазин-5-он-3-ил)тио]метил]-3-цефем-4-кар-
боновой кислоты C2 1.2.70) С этой целью метилгидразин вводится
во в шимодействие с тиоцианатом калия с получением 1-амнно-
1-ме1илпго.мочевины C2.1.2.68), которую вводят в реакцию с диме-
тилоксалаюм в присутствии метилата натрия с получением продук-
продукта геюроциклизации — 2,5-дигидро-6-гидроксн-2-метил-3-мерка-
-627-
Глава 32
пто-1,2,4-триазин-5-она C2.1.2.69). Взаимодействием последнего
с 7-аминоцефалоспорановой кислотой осуществляют замещение
ацетоксильной пруппы последней на 2,5-дигидро-6-гидрокси-2-
метил-1,2,4-триазин-5-он-3-тиольную с получением 7-амино-З-
[[B,5-дигидро-6-гидрокси-2-метил-1,2,4-триазин-5-он-3-Ш1)тио]метил]-
З-цефем-4-карбоновой кислоты C2.1.2.70). которую ацилируют ра-
ранее полученным хлорангидридом C2.1.2.67) в тетрагидрофуране
в присутствии гидроокиси натрия с получением N-хлорацетил-
замещенного производного искомого продукта C2.1.2.71). Снятие
хлорацетильной защиты с последнего осуществляют: последова-
последовательным взаимодействием продукта C2.1.2.71) с тиомочевиной
в присутствии бикарбоната натрия, при котором получают новое
тиазольное производное. Дальнейшим растеплением образовавше-
образовавшегося вторичного гетероароматического амина муравьиной кислотой
получают цефтриаксон C2.1.2.72) [152, 153, 154, 155, 156].
NH-CO-CH2-C!
s <
у-сосс2н5
V 32 i 2 Ь5
Mri-CO-CH;—Cl
y-COOH
1
СИз-NH-'JH; * 'SCN
A.
СООСЬ3 CH3ONa
N-N
-i V°
о
32 1 2 6S
CH3
N-N
COOH
; >-он
32 1 2 70
A
A
-628-
Антибиотики
Препарат обладает широким спектром антимикробного действия,
который включает большинство клинически значимых микроорганиз-
микроорганизмов: грамположительных, грамотрицательных, аэробных и анаэробных,
в том числе синегнойную палочку. Устойчив по отношению к большин-
большинству р-лактамаз грамположительных и грамотрицательных бактерий.
Применяют при перитоните, сепсисе, менингите, холангите, эмпиеме
желчного пузыря, пневмонии, абсцессе легкого, пиелонефрите, инфек-
инфекциях костей, суставов, кожи, мягких тканей, абдоминальных и гинеко-
гинекологических инфекциях, инфицированных ранах и ожогах.
Основным синонимом препарата является ронефин.
Цефтазидим (Ceftazidim)
Цефтазидим — внутренняя соль 1-[[7-[[B-амино-4-тиазол»л)[A-
карбокси-1-метилэтокси)имино]ацетил]амино]-2-карбокси-8-оксо-5-
тиа-1-азабицикло[4.2.0]окт-2-ен-3-ил]метил]пиридин-2-карбоновон
кислоты C2.1.2.82). Как и в случае синтеза цефтриаксона, получе-
получение цефтазидима предусматривает предварительный синтеза двух
составляющих. В качестве цефалоспоринового фрагмента исполь-
используется дигидрохлорид 7-амино-3-A-пиридинометил)цеф-3-ен-кар-
боновой кислоты C2.1.2.80), а ацильной — модифицированная
стр>кт\ра C2.1.2.77), представляющая собой на сей раз не произ-
производное 2-B-амино-4-тиазолил)-2-метоксиминоуксусной кислоты,
а производное 2-B-амино-4-тиазолил)-2-B-/и/?еда-б> токсикарбонил-
2-пропокхимино)уксусной кислоты, которую получают по следую-
следующей схеме. Нитрозированием ацетоуксусного эфира получают изо-
нитрозоацетоуксусный эфир C2.1.2.49), который подвергают хло-
хлорированию хлористым сульфурилом в хлористом метилене с по-
получением 4-хлор-2-гидроксиминоацетоуксусного эфира C2.1.2.73).
Взаимодействием последнего с тимочевиной по классической схеме
получения тиазолов взаимодействия а-галогнкарбонильных соеди-
соединений с тиоамидами получают этиловый эфир B)-2-B-аминотн-
азол-4-ил)-2-гидроксиминоуксусной кислоты C2.1.2.74). Аминную
группу в последнем защищают взаимодействием с трифенилхлор-
метаном в диметилформамиде в присутствии триэтиламина с полу-
получением этилового эфира G)-2-B-тритиламино-тназол-4-ил)-2-гид-
роксиминоуксусной кислоты C2.1.2.75). Гидроксильную ф\пп>
в пол>ченном соединении алкилир\ют дарет-бутиловым эфиром
u-бромизомасляной кислоты в диметилсульфоксиде в присутствии
поташа с получением этилового эфира B)-2-2-(т/7ете-бутокеи-
карбонил-проп-2-оксимино-2-B-тритиламинотиазол-4-ил) уксусной
кислоты C2.1.2.76). Этоксикарбонильую группу в последнем гид-
-629-
Глава 32
ролизуют гидроокисью натрия, и после подкисления реакционной
смеси выделяют соответствующую кислоту C2.1.2.77), которую да-
пее взаимодействием с пятихлористым фосфором переводят в хло-
рангидрид C2.1 2.78) для использования в качестве ацилирующего
реагента
Второй небходимый фрагмент — дихлоргидрат 7-амино-3-A-
пиридинометил)цеф-3-ен-карбоновой кислоты C2.1.2.80) получают из
цефалоридина C2.1.2.79) — цефалоспоринового антибиотика, само-
самостоятельно использующегося в медицине и получающегося в виде внут-
внутренней соли взаимодействием цефалотина C2.1.2.1) с пиридином путем
замещения в нем ацетоксильной группы на пиридиновую. Обрабатывая
цефалоридин сначала триметил-хлорсиланом в присутствии диметила-
нилина и далее пятихлористым фосфором и последующим взаимодей-
взаимодействием с 1,3-бутандиолом, осуществляют дезацилирование, получая
искомую 7-амино-3-A-пиридинометил)цеф-3-ен-карбоновую кислот)
C2.1.2.80). Последнюю ацилируют ранее полученным хлорангидридом
C2.1.2.78) с получением продукта C2,1.2.81), обработкой которого сме-
смесью м)равьиной и соляной кислот снимают обе защитные группы (три-
фенилметильную и /ярет-бутильную) с получением цефтазидина
C2.1.2 82)ввидедигидрохлорида[157, 158, 159, 160, 161, 162].
32 ' 2 73
.1
S^N \С«ИЮС-
У-COCCjH,
^-С1ХХгн
A
Ч-ссо
NH-C С
NaOh^ \ I
IT*-
СН3-С-СОС\СЧ3K
/rcoa
N
' 32<278
-630-
гибиотики
H3N
COOH
32 1 2 80
2CI
, , 2 77 . Зг 1 2 Su
NH2
A
ц
Как и большинство описанных выше антибиотиков цефалоспорино-
цефалоспоринового ряда III поколения, цефтазидим обладает широким спектром анти-
антимикробного действия, который включает большинство клинически зна-
значимых микроорганизмов: грамположительных, грамотрицательных, аэро-
аэробных и анаэробных. Устойчив по отношению к большинству Р-лактамаз
грамположительных и грамотрицательных бактерий.
Препарат применяют при лечении большинства бактериальных ин-
инфекций тяжелого течения.
Синонимами препарата являются фортум, цефтим, стацеф, тази-
цеф.
Цефоперазон (Cefoperazon)
Цефоперазон — F11,711)-7-[A1)-2-D-этил-2.3-диоксо-1-пиперазин-
карбоксамидо)-2-(«-гидроксифенил)ацетамидо]-3-[[A-метил-1#-тет-
разол-5-ил)тио]метил]-8-оксо-5-тиа-1-азабицикло[4.2.0]окт-2-ен-2-
карбоновая кислота C2.1.2.84) получается ацилированием 7-амино-
3-A-метил-1,2.3,4-тетразол-5-ил)-тиометил-3-цефем-4-карбоновой
кислоты C2.1.2.24) смешанным ангидридом, полученным из хлор-
Кольного эфира и а-D-этилпиперазин-2,3-дион-1-карбониламино)-
4-гидроксифенилуксусной кислоты C2.1.2.83), в свою очередь по-
получаемой из 4-этилпиперазин-2,3-дион-1-карбоновой кислоты
C2.1.1 29) и натриевой соли 4-гидроксифенилглицина [163, 164,
165, 166, 167, 168].
-631 -
Глава 32
t ССООСгН5 DMF
H^-Cb-COQNa
8
C2H5-N N-C—HN-CH-CO-NH
COOH
N-N
v
CH3
32 1 2 84
Цефоперазон также обладает широким спектром антимикробного
действия, который включает большинство клинически значимых мик-
микроорганизмов: грамположительных, грамотрицательных, аэробных и ана-
анаэробных. Устойчив па отношению к большинству р.-лактамаз грампо-
грамположительных и грамотрицательных бактерий.
Цефоперазон применяют при бактериальных инфекциях нижних
дыхательных, мочевыводящих и половых путей, инфекциях костей, сус-
суставов, кожи, мягких тканей, абдоминальных и гинекологических ин-
инфекциях.
Синонимами препарата являются цефазон, цефобид, цефобис и мно-
многие другие.
Моксалактам (Moxalactam)
Моксалактам — 7р[2-карбокси-2-D-гидроксифенил)ацетамидо]-7а-
метокси-3-( 1 -метилтетразол-5-ил)-тиометил-1 -окса-детиа-3-цефем-
4-карбоновая кислота C2.1.2.98) получается многостадийным син-
синтезом исходящим из 6-АПК, ацилированием которой бензоилхло-
ридом в присутствии триэтиламина получают 6-бензоилпенициллин
C2 1.2.85). Карбоксильную группу последнего защищают взаимо-
взаимодействием с дифенилдиазометаном и получением 3-дифенил-
метилового эфира 6-бензоилпенициллина C2.1.2.86). Окисление
последнего молекулярным хлором в щелочных условиях получают
S-оксид 3-дифенилметилового эфира 6-бензоилпенициллина
-632-
Антибиотики
C2.1.2.87). При взаимодействии последнего с трифенилфосфином
вместо ожидаемого раскисления сульфоксида в сульфид происхо-
происходит раскрытие тиазинового цикла с выбросом атома серы, одновре-
одновременным его замещением кислородом и последующим образованием
циклического иминоэфира C2.1.2.88). Хлорированием двойной свя-
связи последнего хлором и последующей обработкой полученного ди-
члорпроизводного бикарбонатом натрия получается хлораллильное
производное C2.1.2.89), взаимодействием которого с йодистым ка-
калием получают продукт замещения хлора на йод — йодаллильное
производное C2.1.2.90), и, наконец, гидролизом которого в диме-
тилсульфоксиде в присутствии оксида одновалентной меди полу-
получают соответсвующий аллиловый спирт C2.1.2.91). Нагреванием
последнего в присутствии эфирата трехфтористого бора продукт
рециклизуется с образованием оксазинового кольца и обратной
трансформацией циклического иминоэфира в амидную форму
C2.1.2.92). Подвергая полученный продукт с экзоциклической
двойной связью хлорированию и дальнейшей обработкой продукта
хлорирования 1,7-диазабицикло-[4.5.0]ундец-6-еном в качестве ос-
основания, получают 3-хлорметильное производное C2.1.2.93). Дей-
Действуя на последний «р^да-бутилгипохлоритом, очевидно с целью
получения N-хлорпроизводного, и далее метилатом лития, после
подкисления и обработки тиосульфатом натрия получают дифенил-
дифенилметиловый эфир 7Р-бензоиламидо-7ос-метокси-3-(хлорметилил)-1-
окса-детиа-З-цефем-4-карбоновой кислоты C2.1.2.94). Вводя по-
последний во взаимодействие с натриевой солью 5-меркапто-1-метил -
тетразола, получают дифенилметиловый эфир 7Р-бензоиламидо-7ос-
метокси-3-A-метилтетразол-5-ил)-тиометил -1-окса-детиа-З-цефем-
4-карбоновой кислоты C2.1.2.95). Дебензоилированием последнего
последовательной обработкой пятихлористым фосфором в пириди-
пиридине и далее метанолом и диэтиламином получают дифенилметило-
дифенилметиловый эфир 7Р-амино-7ос-метокси-3-A-метилтетразол-5-ил)-тиометил-
1-окса-детиа-3-цефем-4-карбоновой кислоты C2.1.2.96). Ацилируя
последний смешанным ангидридом, получаемым из монодифенил-
метилового эфира D-гидроксифенил)малоновой кислоты и окса-
лилхлорида в присутствии триэтиламина, получают ди-дифенил-
метиловый эфир по обеим карбоксильным группам искомого
продукта C2.1.2.97). Наконец, снятием указанной дифенилметиль-
ной защиты с обеих карбоксильных групп кипячением с трифторук-
сусной кислотой в толуоле получают искомый моксалактам
C2.1 2.98) [168, 169, 170, 171, 172, 173].
-633-
Глава 32
J-'- Ч
CCOC4(CsH5J
л
ГО'
COOCHtCeHsa
СООСН(СаН5J
сн3
СООСН(С6Н6J
• PC, ?v
2 СН3ОН
(C;Hm2NH Ci—GO-CO-Cl
Как \же было отмечено и как видно из схемы синтеза, моксалактам
содержит дигидрооксазиновое кольцо вместо общего для всех цефалос-
поринов дигидротиазинового кольца, и, таким образом, это соединение
формально не может быть причислено ни к цефалоспоринам, ни к це-
фамицинам, ни к пенициллинам, однако по спектру фармакологическо-
-634-
Антибиотики
го действия оно, являясь соединением, родственным всем трем пере-
перечисленным выше антибиотикам, классифицируется как цефалоспорин
III поколения.
Моксалактам устойчив к действию Р-лактамаз — пенициллиназ
и цефалоспориназ, продуцируемых грамотрицательными и фамполо-
жительными бактериями. Многие штаммы ряда микроорганизмов, об-
обладающие множественной устойчивостью к другим антибиотикам —
пол) синтетическим пенициллинам, цефалоспоринам и аминогликози-
дам, чувствительны к моксалактаму.
Препарат применяют при инфекциях органов дыхания, мочевых пу-
путей, брюшной полости, гинекологических инфекциях, инфекциях кос-
костей, суставов, кожи, мягких тканей, при гонорее.
Синонимами препарата являются латамоксеф, фестамоксин, мокса-
цеф, моксам и многие другие.
Цефалоспорины IV поколения
Цефалоспорины IV поколения (цефепим, цефпиром) обладают еще
более широким спектром действия и активны против большинства
грамположительных и грамотрицательных аэробных и анаэробных мик-
микроорганизмов. По спектру действия они похожи на цефалоспорины III
поколения — цефотаксим и цефтриаксон, химическим гибридом кото-
которых формально они являются, сочетая в себе аминотиазолилметоксии-
миноацетамидо групп) в положении 7 и четвертичный атом азота, вхо-
входящий в гетероциклическую систему в положении 3, что придает их
молекулам свойства цвиттериона, однако они превосходят по активно-
активности препараты III поколения против Pseudomonas aeroginosa, Staphy-
lococcus aureus, в том числе некоторых метициллинорезистентных
штаммов. В терапевтически значимых концентрациях они действуют на
Streptococcus faecalis Препараты активны против Enterobacter cloacae,
Klebsiel/a pneumoniae. Они очень быстро транспортируются в пери-
плазматическое пространство, и к ним практически не обнаружена ре-
зистентность чувствительных штаммов энтеробактерий.
Цефепим (Cefepim)
Цефепим — хлорид {6К-[6а,7C(г)]}-1-[G-{[B-амино-4-тиазолил)-
(метоксимино)ацетил]-амино}-2-карбокси-8-оксо-5-тиа-1-азабицик-
лоГ4.2.0]окт-2-ен-3-ил)метил-1-метил]пирролидиния C2.1.2.99) по-
получают комбинацией методов, описанных для синтеза цефалоспо-
ринов III поколения, и, в частности, цефалоридина C2.1.2.79)
и цефтазидимаC2.1.2 82) [174, 175, 176].
-635-
Глава 32
NH2
3
coo
32 1 2 99
Цефепим применяется при бактериальных инфекциях, вызванных
чувствительными к препарату микроорганизмами, при септицемии, бак-
бактериемии, осложненных инфекциях верхних и нижних отделов мочевы-
делительной системы, пневмонии, абсцессах легкого, эмпиемы плевры,
лихорадке у больных с нейтропенией, инфекционных поражениях кожи
и мягких тканей.
Синонимами препарата являются максипим, цепим, цепимекс и др.
Цефпиром (Cefpirom)
Цефпиром — {611-[6а,7рB)]}-1-[G-{[B-амино-4-тиазолил)-(ме
токсимино)ацетил]амино}-2-карбокси-8-оксо-5-тиа-1-азабицикло-
[4.2.0]окт-2-ен-3-ил)метил-1-метил]пирролидиния хлорид C2.1.2.100)
также получают методами, описанными для синтеза цефалоспори-
нов III поколения, и в частности цефтазидима C2.1.2.82) [177, 178].
NH2
¦CO-NH-i—{
N
ОСН3
32 1 2 100
Препарат устойчив по отношению к широкому спектру р-лактамаз.
Спектр активности аналогичен таковому цефалоспорина III поколения
цефотаксима C2.1.2.56), однако цефпиром более активен по отношению
к некоторым стафилококкам, энтерококкам, а также некоторым энтеро-
-636-
Антибиотики
бактериям.
Синонимами препарата являются цефрон, цедиксен и др.
32.1.3. Пенемы и карбапенемы
Кроме пенициллинов и цефалоспоринов, образуемых мицеллиаль-
нымн грибами, к группе Р-лактамных атибиотиков относятся и веще-
вещества, вырабатываемые стрептомицетами и называемые пенемами. Этот
класс антибиотиков химически сходен с производными пенициллановой
кислоты, однако отличается от них наличием внутрикольцевой, сопря-
сопряженной с карбоксильной группой, двойной связи, что придает им опре-
определенное сходство и с цефалоспорановой кислотой, наличием вместо
дв\х метальных групп во втором положении пятичленного кольца
S-алкильного заместителя в и отсутствием аминогруппы в шестом по-
положении.
Пенемы SCH-29482 (R=CH2CH3) и SCH-34343 (R=CH2CH2OCONH2)
пока еще не нашли применения в медицине.
СН3
НС
о
соон
Представителями другого класса антибиотиков являются карбапе-
карбапенемы, отличающиеся от пенемов отсутствием атома серы в пенемовом
колыю:
• тиенамицин (R = CH2CH2NH2),
• оливановая кислота (R = СН = CHNH2),
• имипенем (R = CH2CH2NHC = NH).
СНз
SR
СООН
Имипенем (Imipenem)
Имипенем — [5К-[5а,6а(К*)]]-6-A-гидроксиэтнл)-3-[[2-[(имино
метил)а.мино]этил]тио]-7-оксо-1-азабицикло[3.2.0]гепт-2-ен-2-карбо-
новая кислота C2.1.3 1) является единственным карбапенемом
ис-
-637-
Глава 32
польз) ющимся в настоящее время в клиниках. Его получают из
(иенамицина, выделенного из Streptomyces cattleya взаимодействи-
взаимодействием с гидрохлоридом метилового эфира иминомуравьиной кислоты
[179, 180, 181. 182].
Ch3
HO~"V_^^-S-Cri—CHo-NH2
0 COOH
нЛосн *
3
CH3
О СООН
321 3 1
NH
Н2 NH H
В отличие от пенициллинов и цефалоспоринов, имеющих боковую
аминоацильную гр\ппу, присоединенную к Р-лактамному кольцу,
в имипенеме имеется гидроксиэтильная боковая цепь. У соединения
наблюдается значительная резистентность к гидролизу Р-лактамазами,
очевидно благодаря отранс-конфигурации боковой цепи, в то время как
> пенициллинов и цефалоспоринов боковая цепь имеет г^мс-конфи-
гурацию.
Имипенем обладает широким спектром антимикробного действия,
который включает большинство клинически значимых микроорганиз-
микроорганизмов: грамположительных. грамотрицательных, аэробных и анаэробных.
Ус/ойчив по отношению к большинству р-лактамаз грамположитель-
грамположительных и гримогриштельных бактерий. Применяют при бактериальных
инфекциях нижних дыхательных, мочевыводящих и половых путей,
инфекциях костей, суставов, кожи, мягких тканей, интраабдоминальных
и гинекологических инфекциях, бактериальных септицемиях, эндокар-
эндокардитах.
Имнпенем подвергается ферментной инактивации в почках. Чтобы
обойти эту проблему, он используется в соотношении 1:1 в комбинации
с циласгатином — натриевой солью [R-[R*.S*-(Z)]]-7-[B-aMHHO-2-
\арбоксиэтил)тио]-2-B,2-диметилциклопропил)карбонил]ами-но]-2-ге-
теновой кислоты C2.1.3.6), которая ингибирует метаболизм имипенема
в почках. Эта комбинация дв>х соединений и применяется в медицине
под названием примаксин.
Циласгпатин (Cilastatin)
Циластатин — (г)-7-[2-амино-2-карбэтоксиэтил)тио]-2-[[B,2-диме-
гилцикло-пропил)карбонил]амино]-2-гептеновую кислоту C2.1.3.6)
получают исходя из этилового эфира 1,3-ди-тиан-2-карбоновой ки-
кислоты (защищенной по альдегидной группе 1,3-пропандитиолом
зтилового эфира глиоксиловой кислоты), который алкилируют 1,5-
-638-
Антибиотики
тибромпентаном в присутствии амида натрия в смеси растворите-
растворителей диметилформамидтолуол с получением этилового эфира
7-бром-2-[2-A,3-дитиано)]гептановой кислоты C2.1.3.2). Окисли-
Окислительный гидролиз последнего N-бромсукцинимидом в смеси рас-
растворителей ацетонитрил-вода приводит к получению этилового
эфира 7-бром-а-кетогептановой кислоты C2.1.3.3). Кислотным гид-
гидролизом последнего бромистым водородом в уксусной кислоте по-
получают 7-бром-а-кетогептановую кислоту C2,1.3.4). Последнюю
вводят во взаимодействие с амидом 2,2-диметилциклопропанкар-
боновой кислоты с получением соответствующего енамида — (Z)-7-
бром-2-B.2-диметилциклопропанкарбоксамидо)-2-гептеновой кис-
кислоты C2.1.3.5). Полученный продукт используют для S-алкили-
рования L-цистеина, в результате чего получают искомый циласта-
циластатин C2.1.3.6) [183, 184].
В—,Сп25-ВГ
в, — Qx
32-
СНз
о JU-ch3
н
;оосги5
fCH;5-Ef
Вг—(С
о
Н СООН
.H2,4^NH-C~
0
сн3
н
Br-(Cri2M-C-CO<X:2H
32 1 3 3
CH2-SH
H2N-C-H
СООН
СНг—S
H2N--C--H
СООН
СНз
СООН
NH-C-H
О Н
32 1 3.6
Циластатин используют при лечении заболеваний, вызванных по-
лирешстентными грамотрицательными микроорганизмами, и серьезных
смешанных инфекциях, включая заражение бактериями Staphylococcus
aureus. Ввиду его мощной активности против анаэробных бактерий
имипенем эффективен при монотерапии интраабдоминальных инфек-
инфекций. Применяется при инфекционных заболеваниях нижних дыхатель-
-639-
Глава 32
ных путей, мочеполового тракта, гинекологических инфекциях, бакте-
бактериальных септицемиях, инфекциях костей, кожи и т. д.
32.1.4. Монобактамы
Некоторые виды микроорганизмов, в частности Chromobacterium
violaceum, в процессе жизнедеятельности могут синтезировать своеоб-
своеобразные Р-лактамные антибиотики, имеющие моноциклические структу-
структуры — монобактамы. Примером таких монобактамов являются нокарди-
цины, в частности нокардицин А.
ноос-сн-сн2-сн2—
он
нокардицин А
Первым полностью синтетическим моноциклическим Р-лактамным
антибиотиком является азтреонам. Антимикробная активность этого
препарата в основном проявляется в отношении широкого спектра
аэробных грамотрицательных бактерий. Он устойчив к р-лактамазам
и не индуцирует их образование. Механизм его действия идентичен
таковому других р-лактамных антибиотиков в отношении грамотрица-
грамотрицательных бактерий. Под влиянием азтреонама инактивируются ПСБ.
Азтреонам (Aztreonam)
Азтреонам — (г)-2[[[B-а.мино-4-тиазолил)[[B8.38)-2-метил-4-оксо-
1-сульфо-3-азетидинил]карбамоил]метилен]амино]окси]-2-метилпро-
пионовую кислоту C2.1.4.9) получают исходя из трет-бутнп-
оксикарбонилтреонина, взаимодействием которого с О-бензиловым
эфиром гидроксиламина в присутствии дициклогексилкарбодиими-
да в качестве дегидратирующего агента с добавлением 1-гидрокси-
бензгриазола получают бензиловый эфир соответствующей гидро-
ксамовой кислоты C2.1.4.1). Подвергая последний действию
трифенилфосфина и диэтилового эфира азодикарбоновон кислоты,
осуществляют циклодегидратацию продукта в C§-транс)~Ы-бенз1и1-
окси-3-ш/?еот-бутилоксикарбониламино-4-метилазетидинон C2.1.4.2).
Дебензилироанием последнего путем восстановления водородом
-640-
днтибиотики
с использованием в качестве катализатора палладия на угле полу-
получают C8-т/?а«с)-М-гидрокси-3-отреот-б\тилоксикарбониламино-4-
метилазетидинон C2.1.4.3). Гидроксильную группу в последнем
убирают восстановлением треххлористым титаном с получением
азетидинона C2.1.4.4). Снятием ягреот-бутилоксикарбонильной за-
защиты с последнего с помощью трифторуксусной кислоты и после-
последующим ацилированием полученного продукта бензиловым эфиром
хлоругольной кислоты получают C8-от/>а«с)-бензилоксикарбонил-
амино-4-метилазетидинон C2.1.4.5). Сульфируя последний ком-
комплексом трехокиси серы с диметилформамидом получают соответ-
соответствующую N-сульфокислоту. Переводом полученной N-сульфо-
кислоты в калиевую соль взаимодействием с гидрофосфатом калия
и, наконец, обменом катиона калия на тетрабутиламмониевый кати-
катион, взаимодействием с сульфатом тетрабутиламмония получают
продукт C2.1.4.6). Восстановлением последнего водородом с ис-
использованием в качестве катализатора палладия на угле получают
З-а.мино-4-метилмонобактамовую кислоту C2.1.4.7). Ацилируя по-
последнюю B)-2-2-(дифенилметилоксикарбонил-проп-2-оксимино-2-
B-амино-тиазол-4-ил) уксусной кислотой в присутствии дицикло-
гексил карбодиимида и 1-гидроксибензтриазола, получают дифе-
нилметиловый эфир искомого азтреонама C2.1.4.8), который гид-
ролизуют до азтреонама C2.1.4.9) с помощью трифторуксусной
кислоты [185, 186, 187].
(Ch3hCO—CO-NH-CH-CH-СНз
соон
H2N-O-CH2
(СН3)зСО—CO-Nh-CH-CH-СНз
CO-NH—О-СН2
iCpH. p C2l-kOCC-N=N~COOC2-l3 чснз)зСО СО Nh CH3
: . „ Vf
O^N^CH2
(CH3KCO-CO-NH С„э ^О^
,CH3,,CO-CO-NH
СНз
С!СООСН2СвН5
о' н
32 1 44
H
32 1 45
2 К2НРОл + ¦
3 (C4HakfJ HSO4
-641 -
Глава 32
NH2
CeH5CH2O-CO— NH
О 'SO3tC4H9LN +
32 1 46
X
Нг / Pd-C
Нг\_/снз
0 SO3H
321 47
СН3-С-СООСН(С6Н6)
сн3
NH2
S—/
V-CO-NH
N
О
у о
СН3~С-СООСН(С6Н5)
СН3
CF3C00H
so3h
32 148
NH2
А,
N
\ СН3
о
so3h
у
CH3-C-COOH
СНз
32 1 49
Полагают, что метильная группа в положении 4 повышает стабиль-
стабильность р-лактамного кольца по отношению к большинству р-лактамаз,
и в то же время препарат не индуцирует образование р-лактамаз, как это
происходит при применении цефалоспоринов и имипенема.
Аминоацильная боковая цепь препарата, аналогичная таковой у це-
фтазидина, ответственна за высокую активность по отношению к гра-
мотрицательным аэробным бактериям. Спектр действия азтреонама
весьма близок к антимикробному спектру аминогликозидов, и в боль-
большинстве случаев он является их потенциальным заменителем.
Азтреонам используют при лечении инфекций мочевыводящих
путей, желчного тракта, остеомиелитов, гонореи, интраабдоминаль-
ных. гинекологических инфекций, при инфекциях костей, кожи
и других, вызванных аэробными грамотрицательными микроорганиз-
микроорганизмами. У пациентов с выявленными или подозреваемыми смешанными
инфекциями он должен быть применен в сочетании с другими препа-
препаратами, такими как клиндамицин, метронидазол. нафциллин или ван-
комицин.
-642-
Днтибиотики
32.2. Макролидные антибиотики
Макролидные антибиотики. использ>емые в настоящее время
в клинике, включают в себя прототип этих соединений — эритромицин,
выделенный из вида Streptomyces erythreus, и два относительно новых
препарата — кларитромицин и азитромицин. Они относятся к группе
антибиотиков, известных под названием макролиды, названных так,
поскольку они содержат макроцикл ическое лактонное кольцо A4-член-
ное в эритромицине и кларитромицине, являющимся по сути 6-мето-
ксиэритромицином, и 15-членное в азитромицине благодаря наличию
в кольце дополнительного атома азота), к которому присоединены ос-
остатки дезоксисахаров.
Известны также макролиды с 12-членным лактонным кольцом, по-
л\чившие название патулолиды, и макролиды с 16-членным лактонным
кольцом, названные изенамицинами.
В группу макролидных антибиотиков, продуцируемых в основном
сгрептомицетами, сегодня входит около 100 соединений.
Макролиды имеют важное клиническое значение. С\ шествуют
прямые показания к их применению, и одновременно они являются аль-
альтернативой пенициллинам у пенициллиналлергичных лиц. Макролиды
на сегодняшний день считаются одними из самых безопасных антибио-
антибиотиков.
Макролиды (эритромицин и др.) ингибируют синтез бактериальных
белков Основные механизмы синтеза протеинов \ человека и у бакте-
бактерий идентичны. Однако имеется существенная разница, позволяющая
конкретному антибиотику проявлять селективную токсичность по от-
отношению к бактерии.
Как известно, первым шагом в синтезе протеинов является транс-
транскрипция генетического кода с ДНК на мессенджерную РНК (мРНК) —
процесс, зависимый от РНК полимеразы (транскриптазы). Участок нук-
леотидов в мРНК отражает порядок нуклеотидов в ДНК и, таким обра-
образом, содержит информацию, определяющую последовательность, в ко-
которой должны быть соединены аминокислоты для образования
соответствующего белка.
Синтез белка происходит на рибосомах, которые можно предста-
представить как некие станки, на которых собираются белки из разных амино-
КИС1ОТ.
Бактерии содержат 80-S рибосом, которые состоят из двух нерав-
неравных составляющих: большой 50-S с>бъединицы и малой 30-S субъеди-
субъединицы. Эти две субъединицы имеют разные функции мРНК связывается
с 30-S субъединицей, в то время как 50-S с\бъединица служит для при-
-643-
Глава 32
соединения аминокислот и участком для поддержания растущей пеп-
пептидной цепи. Эти участки, известные как акцепторные (А) и донорные
(Р) участки, соответственно и находятся очень близко друг к другу.
Аминокислоты доставляются к комплексу рибосома — мРНК
транспортной РНК (тРНК). Для каждой аминокислоты, которая должна
быть включена в синтезируемый белок, существует специфическая
тРНК. Каждая тРНК, в свою очередь, специфична по отношению к од-
одному нуклеотидному участку (нуклеотидному триплету или кодону)
в мРНК. Таким образом, тРНК является двухконцевой молекулой, в ко-
которой один конец специфичен по отношению к одной аминокислоте,
а другой — специфичен к участку из трех нуклеотидов в мРНК. Ами-
ноацильная тРНК связывается с участком А на 50-S субъединице. Рост
пептидной цепи осуществляется переносом и связыванием пептидной
цепи от участка Р на участок А посредством катализа пептидилтрансфе-
разой. После образования пептидной связи происходит сложный про-
процесс «транслокации» тРНК с удлиненной пептидной цепью: она перено-
переносится от участка А к участку Р, и 30-S субъединица передвигается на
один кодон вдоль мРНК. Участок А освобождается и становится гото-
готовым принять другую аминоацильную тРНК, предопределяемую сле-
следующим кодовым триплетом на мРНК. Такой процесс наращивания
продолжается до завершения построения белковой цепи. Макролиды
ингибируют синтез бактериальных белков, связываясь с бактериальной
50-S субъединицей и тем самым предотвращая рост пептидной цепи,
скорее всего, вмешиваясь на стадии транслокации.
В то же время эти препараты не связываются с рибосомами млеко-
млекопитающих, что и является причиной их селективной токсичности. Мак-
Макролиды могут проявлять себя и как бактериостатики, и как бактерициды
в зависимости от концентрации препарата, чувствительности микроор-
микроорганизмов, скорости их роста и, собственно, величины колонии. Анти-
Антибактериальная активность макролидов зависит от кислотности среды.
Большая активность наблюдается в нейтральной и основной средах по
сравнению с кислой. В частности, эритромицин инактивируется в ки-
кислой среде желудка. Макролиды имеют относительно широкий спектр
действия и активны в отношении грамположительных и грамотрица-
тельных микроорганизмов, актиномицетов, микоплазм, спирохет, хла-
мидий, риккетсий, определенных микобактерий и др.
Эритромицин (Erythromycin)
Эритромицин — CR',4S*, 5S*,6R',7R\9R*.llR*,12R*,13S*,14R*)-4-
[B,6-дидезокси-3-С-метил-3-0-метил-а-Ь-рмбо-гексопиранозил)-ок-
си]-14-этил-7,12,13-тригидрокси-3,5,7,9,11,13-гексаметил-6-[[3,4,6-
-644-
днтибиотики
гридезокси-3-(диметиламино)-Р-В-ксшо-гексопиранозил]окси]окса-
циклотетрадекан-2,10-дион C2.2.1), более точно называемый эрит-
эритромицином А, впервые был выделен в 1952 г. из культуральной
жидкости микроорганизмов вида Streptomyces erytherus. В культу-
культуральной жидкости в минорных количествах обнаруживаются также
эритромицины В и С. Эритромицин В отличается от эритромици-
эритромицина А тем, что в положении 12 вместо гидроксильной группы нахо-
находится атома водорода, а эритромицин С отличается от эритромици-
эритромицина А тем, что в положении 3 вместо кладинозы к макроциклу
присоединен остаток другого углевода — микарозы.
В настоящее время эритромицин А производится только микробио-
микробиологическим путем с использованием активных штаммов микроорганиз-
микроорганизмов вида Saccharopolospora erythraea [188, 189, 190, 191].
эритромицин А
эритромицин В
эритромицин С
Как уже было отмечено, эритромицин и другие антибиотики, обсу-
обсуждаемые в этой главе, ингибируют синтез бактериальных белков.
Эритромицин ингибирует синтез протеинов бактерий путем обра-
обратимого связывания с их 50-S рибосомальной субъединицей и тем самым
блокирует образование новых пептидных связей. Эритромицин класси-
классифицируется как бактериостатический антибиотик. Однако он может
проявлять и бактерицидное действие против некоторых видов микробов
при определенных концентрациях.
Бактериальная резистентность к эритромицину может возникать по
Двум возможным механизмам: невозможностью преодоления покрытия
клетки, что в частности имеет место в случае с микроорганизмом
Enierobacteriaceae. или в случае наличия метилированного аденина
в 23-S рибосомальной РНК 50-S субъединицы, что понижает сродство
эритромицина к ней.
-645-
Глава 32
Эритромицин действует на грамположительные (стафилококки,
продуцирующие и не продуцирующие пенициллиназу, стрептококки,
пневмококки, клостридии и некоторые грамотрицательные микроорга-
микроорганизмы — гонококки, бруцеллы, гемофильная и коклюшная палочки,
легионеллы), микоплазмы, хламидии, спирохеты, риккетсии. К эритро-
эритромицину устойчивы кишечная и синегнойная палочки, а также палочки
шигеллы, сальмонеллы и др,
Эритромицин применяют при таких бактериальных инфекциях, как
дифтерия, коклюш, трахома, ангина, скарлатина, отит, синусит, холеци-
холецистит, пневмония,гонорея и др.
Эритромицин является альтернативой пенициллину для лечения
инфекций, вызванных чувствительными организмами. Препарат яв-
является лекарством выбора при ряде пневмоний, дифтерии, энтеритов
и т. п.
Синонимами препарата являются илозон. меромицин, эритропед
и многие другие.
Кларитромицин (Claritromycin)
Кларитромицин — BR*,3S*,4S*, 5R*,6R*,8R*,10R*,llR',12S",13R*)-3-
B,6-дидезокси-3-С-3-О-диметил-а-Ь-/?мбо-гексопиранозилокси-6-ме-
токси-9-оксо-11,12-дигидрокси-2,4,6,8,10,12-гексаметил-5-C,4,6-три-
дезокси-3-диметиламино-C-0-ксшо-гексопиранозилокси)циклопен-
тадекан-13-олид C2.2.2) является полусинтетическим аналогом
эритромицина А, в котором гидроксильная группа при С6 замещена
на метоксильную [192, 193].
СНз
-646-
Антибиотики
Кларитромицин лучше абсорбируется и меньше чем эритромицин
раздражает ЖКТ. Полагают, что его активность в 2^4 раза превосходит
таков\ю у эритромицина по отношению к ряду стрептококков и стафи-
стафилококков и некоторым другим микроорганизмам. Показан для лечения
бактериальных бронхитов, пневмонии, кожных и половых инфекций.
Полакают, что кларитромицин является наиболее активным макролидом
при печении атипичных микобактерий.
Синонимом препарата является биаксин и др.
Лштролшцин (Azitromycin)
Азитромицин — BR*,3S*,4R*, 5R\ ,8R*,10R*,llR*,12S*,13S*,14S*)-3-
[B,6-дидезокси-3-С-3-0-диметил-а-Ь-у9ибо-гексопиранозилокси)-2-
этил-3,4,10-тригидрокси-3,5,6,8,10,12,14-гепта-метил-11 -C,4,6-три-
дезокси-3-диметиламино)-Р-В-/1Си/го-гексопиранозил окси-1-окса-6-
аза-циклопентадекан-15-он C2.2.3) также является макролидным
антибиотиком, получаемым полусинтетическим п\тем [194, 195].
он
32 2 3
Его активность в 2-4 раза меньше чем у эритромицина по отноше-
отношению к ряду стрептококков и стафилококков и некоторым другим мик-
микроорганизмам, однако он активнее других макролидов по отношению
к определенным анаэробным организмам. Подобно другим макроли-
дам азитромицин активен по отношению к патогенам респираторного
тракта и патогенам, передаваемым половым путем. Применяют для
лечения бактериальных бронхитов, пневмонии, кожных и половых
инфекций.
Синонимом препарата является зитромакс и др.
-647-
Глава 32
32.3. Тетрациклины
Тетрациклины представляют собой семейство химически сходных
соединений, которые объединяет наличие четырех сочлененных в гид-
ронафтаценовую систему колец, а разницу в активности определяют
различные заместители базовой структуры.
N(CH3J
.ОН
NH2
ОН О
ОН
Первый антибиотик тетрациклинового ряда — хлортетрациклин,
выделенный из культуральной жидкости жизнедеятельности Strepto-
Streptomyces aureofacines, был введен в медицинскую практику в 1948 г. Впо-
Впоследствии в течение с 1950 по 1972 г. в медицинскую практику были
внедрены еще 6 препаратов тетрациклинового ряда:
• окситетрациклин. выделенный из Streptomyces rimosus,
• тетрациклин (полусинтетический),
• демеклоциклин, выделенный из мутантного вида Streptomyces
aureofacines,
• метациклин (полусинтетический),
• доксициклин (полусинтетический),
• миноциклин (полусинтетический).
Предложены и методы синтеза антибиотиков тетрациклинового ря-
ряда, которые, однако, представляют чисто академический интерес и не
имеют практического значения.
Несмотря на некоторые различия этих препаратов в плане фармако-
кинетических особенностей, их широкий спектр антимикробной актив-
активности во многом очень схож.
Тетрациклины, как и макролиды, ингибируют синтез протеинов
бактерий. Существенным элементом этого процесса является энергоза-
энергозависимый перенос препарата через цитоплазматическую мембрану, что
приводит к их аккумуляции в клетке. В клетке препараты обратимо свя-
связываются с 30-S рибосомальной субъединицей бактерий. Этот процесс
блокирует присоединение аминоацильной тРНК к мРНК 30-S рибосоме,
что и приводит к ингибированию синтеза протеинов. Селективная ток-
токсичность тетрациклинов заключается в различной способности их про-
проникновения в бактериальные клетки и клетки млекопитающих, у кото-
-648-
Антибиотики
рых отс>тств>ет соответствующая система транспорта. Антимикробный
спектр всех тетрациклинов практически одинаков. Отличия проявляют-
проявляются лишь в степени активности по отношению к тем или иным микроор-
микроорганизмам. Тетрациклины активны по отношению к огромному разнооб-
разнообразию микроорганизмов, включая грамположительные, грамотрица-
тельные, аэробные и анаэробные. Они активны в отношении спирохет,
микоплазм, риккетсий, хламид и некоторых протозойных инфекций.
Однако они не активны по отношению к стрептококковым инфекциям,
синегнойной палочке и некоторым другим. Резистентность к тетрацик-
линам проявляется в виде пониженной способности бактерий аккуму-
аккумулировать антибиотик внутри клетки. Этот процесс опосредуется плаз-
мидами. Резистентность по отношению к какому-либо тетрациклину,
как правило, обозначает резистентность и ко всем остальным.
Тетрациклины являются препаратами выбора по отношению к ши-
широком) ряду инфекций, включая хламидиальные, риккециозные и др.
Хлортетрациклин (Chlortetracyclin)
Хлортетрациклин — 7-хлор~4-диметиламино-1,4,4а,5,5а,6,11,12а-
октагидро-3,6,10,12,12а-пентагидрокси-6-метил-1,11-диоксо-2-наф-
таценкарбоксамид C2.3.1) получают биосинтетическим путем в ре-
результате жизнедеятельности микроорганизма актиномицета {Strep-
{Streptomyces aureofaciens) [196, 197, 198, 199, 200, 201].
N(CH3J
NH2
он о
32 3 1
Хлортетрациклин — антибиотик широкого спектра действия, ока-
оказывающий бактериостатический эффект в отношении грамположитель-
грамположительных (стафилококки, в том числе продуцирующие пенициллиназу,
стрептококки, пневмококки, клостридии, листерии, палочка сибирской
язвы) и грамотрицательных (гонококки, коклюшная палочка, кишечная
палочка, энтеробактер, клебсиелла, сальмонелла, шигелла) микроорга-
микроорганизмов, а также риккетсий, хламидий, микоплазм, спирохет. Устойчивы
к препарату синегнойная палочка, протей, серрации. большинство
штаммов Bacteroides fragilis, большинство грибов, мелкие вирусы. Пре-
Препарат применяют при пневмонии, бронхите, эмпиеме легких, ангине,
холецистите, коклюше, эндокардите, эндометрите, кишечных инфекци-
-649-
Глава 32
ях, простатите, сифилисе, гонорее, коклюше, бруцеллезе, остеомиелите,
гнойных инфекциях мягких тканей и других, вызванных чувствитель-
чувствительными к препарату микроорганизмами.
Синонимами препарата являются ауреомицин, биомицин, ксанто-
мицин и др.
Океитетра цикл ни (Oxytetyracyclin)
Окситетрациклин — 4-диметиламино-1,4,4а,5,5а,6,11,12а-октагидро-
3,6,10,12,12а-гексагидрокси-6-метил-1,11 -диоксо-2-нафтаценкарбокс-
амид C2.3.2) получают биосинтетическим путем в результате жизне-
жизнедеятельности актиномицета Sireptomyces rimosus [202, 203, 204, 205].
НСХХНз
ОН N(CH3J
он о он о
32.3.2
По антибактериальному спектру препарат близок к хлортетрацик-
лину. Применяют по тем же показаниям. Относится к тетрациклинам
короткого времени действия.
Синонимами препарата являются тетрамицин, оксимицин и др.
Тетрациклин (Tetracyclin)
Тетрациклин — 4-диметиламино-1,4,4а,5,5а,6,11,12а-октагидро-
3,6,10,12,12а-пентагидрокси-6-метил-1,11 -диоксо-2-нафтаценкарбо-
ксамид C2.3.3) получают восстановлением хлортетрациклина водо-
водородом, используя в качестве катализатора палладий на угле. Однако
его можно получать и микробиологическим путем с использовани-
использованием актиномицета Streptomyces viridifaciens, а также определенного
мутанта Streptomyces aureofaciens [206, 207, 208, 209, 210, 211, 212,
213,214].
С!
N(CH3J
ОН
ОН О
01-
он о
32 3 1
NH2
Н2/ Pd-C
НО
t
N(CH3J
ОН
он о
ОНИ
он о
32 3 3
NH2
-650-
Антибиотики
По антибактериальному спектру окситетрациклин близок к хлор-
тетрациклину. Препарат также относится к тетрациклинам короткого
времени действия, и его применяют по тем же показаниям, что и хлор-
тетрациклин.
Синонимами препарата являются акромицин, бициклин, циклопар,
саркоциклин и многие другие.
Демеклоциклин (Demeclocyclin)
Демеклоциклин — 7-хлор-4-диметиламино-1,4,4а,5,5а,6,11,12а-
октагидро-3,6.10,12,12а-пентагидрокси-1,11 -диоксо-2-нафтаценкар-
боксамид C2.3.4) продуцируется мутантным штаммом Strepiomyces
aureofaciens, у которого нарушен механизм переноса метальных
групп, и, таким образом, демеклоциклин, или деметилхлортетра-
циклин, отличается от хлортетрациклина, окситетрациклина и тет-
тетрациклина отсутствием метильной группы при С6 гидронафтацено-
вой системы. В результате получается антибиотик более ус-
устойчивый к кислотам и щелочам по сравнению с метальными
гомологами [215, 216, 217, 218, 219, 220, 221].
ci он
N(CH3J
он
NH2
он о
32 3.4
По антибактериальному спектру демеклоциклин мало отличается от
всего ряда тетрациклинов, однако время его полураспада несколько
больше, чем у описанных выше антибиотиков с коротким временем
действия, поэтому его относят к тетрациклинам среднего или промежу-
промежуточного времени действия. Применяют демеклоциклин по тем же пока-
показаниям, что и другие антибиотики тетрациклинового ряда.
Синонимами препарата являются ледермицин, биотетрицин, децик-
лян, декломицин.
Метациклин (Methacyclin)
Метациклин — 4-димегиламино-1,4,4а,5,5а,6,11,12а-октагидро-
3,6,10.12,12а-пентагидрокси-6-метилен-1,11-диоксо-2-нафтаценкар-
боксамид C2.3.6) получают исходя из окситетрациклина C2.3.2),
взаимодействием которого с комплексом серный ангидрид — пири-
пиридин в результате реакции окисления и одновременно сульфирова-
-651 -
Глава 32
ния получают промежуточное нафтаценсульфотетрагидрофурано-
вое производное C2.3.5), которое под действием фтористоводород-
фтористоводородной кислоты расщепляется с образованием метациклина C2.3.6)
[222, 223, 224, 225].
Метациклин применяют по тем же показаниям, что и другие анти-
антибиотики тетрациклинового ряда. В некоторых случаях он лучше пере-
переносится, чем другие тетрациклины.
Синонимами препарата являются рондомицин, метамицин, адрами-
цин и др.
Докыщиклин (Doxycyclin)
Доксициклин — 4-диметиламино-1,4,4а,5,5а,6,11,12а-октагидро-
3,5,10,12,12а-пентагидрокси-6-метил-1,11 -диоксо-2-нафтаценкарбо-
ксамид C2.3.7) — препарат, являющийся изомером тетрациклина
и отличающийся от тетрациклина расположением одной гидро-
гидроксильной группы. Формально же доксициклин можно считать ре-
результатом переноса С6-гидроксильной группы тетрациклина в по-
положение С5. Доксициклин предложено получать двумя путями
исходя из окситетрациклина C2.3.2). Первый способ синтеза пред-
предполагает дегидроксилирование окситетрациклина по положению С6
путем восстановления третичной гидроксильной группы водородом
с использованием в качестве катализатора родия на угле [226, 227].
ОН N(CH3J
Н2 / Rh—С
СН3 ОН N(CH3J
„ОН
,NH2
32.3 7
Второй способ имеет аналогию с получением метациклина, а имен-
именно: он предполагает стадию окисления гомоаллильной системы, но
с использованием в качестве окислителя N-хлорсукцинимида, при кото-
-652-
Антибиотики
ром образуется нафтацентетрагидрофурановое производное C2.3.8)
и которое под действием фтористоводородной кислоты расщепляется
с образованием Па-хлор-6-экзомтиленового производного C2.3.9).
Восстановительным дехлорированием последнего тиосульфатом натрия
промежуточно получают метациклин C2.3.6), к метиленовой группе
которого в условиях проведения радикальных реакций осуществляют
присоединение тиофенола с получением производного C2.3.10). По-
Последнее восстанавливают водородом над никелем Ренея в качестве ка-
катализатора, при котором происходит восстановительная десульфуриза-
ция, и получается доксициклин [225, 228, 229, 230].
¦'^j:rz Ч"а -3^/°\г г*
о о
Ь
32 3 8
Доксициклин применяют по тем же показаниям, что и другие анти-
антибиотики тетрациклинового ряда, однако он относится к долгодейст-
в\юшим тетрациклина.м. В некоторых случаях он более активен по от-
отношению к ряду микроорганизмов, лучше переносится, чем другие
тетрациклины.
Синонимами препарата являются азудоксат, кодидоксал, эфтапан,
вибрамицин и др.
Миноциклин (Minocyclin)
Миноциклин — 4.7-био(диметиламино)-1,4,4а,5,5а.6,11,12а-ок-
таги дро-3,10.12,12а-тетра-гидрокси-1,11 -диоксо-2-нафтаценкарбо-
ксамид C2.3.17) получают исходя из 6-деметилтетрациклина
C2.3.11), получаемого в результате жизнедеятельности штамма
Streptomyces aureofaciens, у которого нарушен механизм переноса
метильных групп, или же из обычного штамма того же микроорга-
микроорганизма, но при добавлении в среду для развития данного акгиноми-
цета таких соединений, как этионин, D-норлейцин или D-метионин,
-653-
Глава 32
являющихся антиметаболитами метионина — основного донора ме-
тильных групп при микробиологическом синтезе молекулы тетра-
тетрациклина. Гидрогенолизом упомянутого 6-деметилтетрациклина
132.3.11) водородом с использованием в качестве катализатора пал-
палладия на угле получают 4-диметиламино- 1,4,4а,5,5а,6,11,12а-
октагидро-3,10,12,12а-тетрагидрокси-1,11 -диоксо-2-нафтаценкарбо-
ксамид C2.3 12), который нитруют в положение 9 нитратом калия
в жидкой фтористоводородной кислоте с получением нитросоеди-
нения C2.3.13). Последнее восстанавливают до соответствующего
аминосоединения C2.3.14) водородом над двуокисью платины. По-
Полученный аминофенол C2.3.14) далее нитруют азотной кислотой в
присутствии серной кислоты с получением 7-нитро-9-амино-4-
диметил амино-1,4,4а,5,5а,6,11.12а-октагидро-3,10,12,12а-тетрагидро-
кси-1.11-диоксо-2-нафтаценкарбоксамида C2.3.15). Последний под-
подвергают диазотированию действием бутилнитрита в серной кисло-
кислоте, и полученное диазопроизводное C2.3.16) восстанавливают
водородом с использованием палладия на угле. При этом продукт
деазотируется, и одновременно нитрогруппа восстанавливается до
аминогруппы, которую подвергают исчерпывающему метилирова-
метилированию формальдегидом в миноциклин C2.3.17) [231, 232, 233, 234,
235,236,237].
Oh 4<Ch3)j
С J4 О О
22 С М
^v-Y-x\_/\!/\^Oh HNG3/ ^
ОН О ОН О О
N02
N(CH3J
мн2
он о он о о
32 3 15
C4H9-ONO/
N(CH3J 1 Н2 / Pd-C
он 2 СН2О
,NH2
Ori О ОН О О
32 3 16
N(CH3J
N(CH3J
NH2
ОН
ОН О ОН О О
32 3 17
-654-
днтибиотики
Миноциклин применяют по тем же показаниям, что и другие анти-
бисики те фа цикл и нового ряда. В некоторых случаях он хуже перено-
переносится, чем другие тетрациклины, и, в частности, действует на вестибу-
вестибулярный аппарат. Кроме того, как это следует уже из схемы синтеза, он
значительно дороже других тетрациклинов, получаемых чисто микро-
микробиологическим путем.
Синонимами препарата являются клиноцин, миноцин, вектрин и др.
32.4. Аминогликозиды
Амлногликозиды являются соединениями, содержащими два или
более аминосахаров, связанных гликозидными связями с аминоцикли-
тольным кольцом (агликоном). Шестичленное аминоциклитольное коль-
кольцо является либо стрептидином A,3-дигуанидино-2,4,5,6-тетрагидро-
ксициклогексан), как в стрептомицине, либо 2-дезоксистрептамином
11,3-диамино-4,5,6-тригидроксициклогексан), как во всех других ами-
ног'хикозидах.
H2N
стрептидин
H2N ^ "ОН
2-0аоксистрептамин
2-дезоксистрептаминовые антибиотики могут далее дифференциро-
ва1ься по числ) и типу Сахаров, присоединенных к аминоциклитольно-
м\ кольцу. Так, неомицины, включающие сам неомицин и паромоми-
цин. имеют три сахарных остатка (две аминогексозы и одну неаминную
пентоз\), присоединенные к 2-дезоксистрептамину. Аналоги канамици-
ка (гобрамицин, амикацин) и гентамицина (сисомицин, нетилмицин)
имеют по две аминогексозы, присоединенные к центральному агликону.
Последние два ряда отличаются типом 3-аминогексозы: для ряда кана-
мицинов -- это канозамин. для ряда гентамицинов — это гаросамин.
Вариации внутри самих рядов аминогликозидов обусловлены разницей
в боковых цепях аминосахаров и агликона.
lh 8 применяемых в настоящее время аминогликозидов 5 получены
ш разных видов Sireptomyces
• стрептомицин (выделен из Streptomyces gnseus),
• неомицин (выделен из Streptomyces fradiae),
• паромомицин (выделен из Streptomyces rimosus).
-655-
Глава 32
• канамицин (выделен из Streptomyces kanamyceticus),
• тобрамицин (выделен из Streptomyces tenebrarius).
Гентамицин выделен из Micromonospora purpurea. Он состоит из
смеси примерно равных количеств 3 соединений: гентамицина Сь Cia
и С2. Амикацин и нетилмицин являются полусинтетическими препара-
препаратами. Амикацин получается химической модификацией канамицина.
Нетилмицин является полусинтетическим производным шизомицина,
выделенного из Micromonospora inyoensis.
Аминогликозидные антибиотики являются бактерицидными. Они
ингибируют синтез протеинов и приводят к неправильному считыванию
генетического кода. Общим элементом в процессе, приводящему к ле-
летальном}, исходу бактерий, является активный перенос препарата из
окружающей среды в бактериальную клетку, что приводит к большой
аккумуляции препарата в клетке, намного превосходящей таковую в ее
окружении. Аминогликозиды легко диффундируют сквозь внешнюю
мембрану бактерий и проходят в периплазматическое пространство.
Первичным внутриклеточным участком действия аминогликозидов яв-
является бактериальная рибосома. Очевидно, существует как минимум
2 разных типа рибосомального связывания: один — специфический для
стрептомицина и другой — участвующий в связывании с другими ами-
ногликозидами. Стрептомицин связывается с ЗО-S рибосомальной субъ-
единицей. Другие аминогликозиды связываются к разным участкам как
ЗО-S, так и 50-S рибосомальных субъединиц и не могут конкурировать
со стрептомицином за связывание с ЗО-S рибосомой.
Связывание аминогликозидов с рибосомами проявляется как непо-
непосредственным ингибированием синтеза протеинов, так и неправильным
считыванием генетического кода с матрицы мРНК, что в результате
приводит к внедрению неправильных аминокислот в полипептидные
цепи. Однако ни один из этих эффектов полностью не объясняет бакте-
бактерицидный эффект аминогликозидов. Аминогликозиды являются препа-
препаратами, используемыми преимущественно против аэробных и некото-
некоторых грамотрицательных микроорганизмов, Staphylococcus aureus и ми-
кобактерий. Эти антибиотики не активны по отношению к анаэробным
микроорганизмам.
Бактериальная резистентность по отношению к аминогликозидам
может быть объяснена изменениями в связывающих участках на рибо-
рибосомах, ухудшением внутриклеточного транспорта и дезактивацией пре-
препаратов микробными ферментами.
Стрептомицин связывается со специфическим белком (S^) на 30-S
субъединице рибосомы. Изменение этого белка в результате мутации
-656-
Днтибиотики
делает рибосомы неспособными к связыванию со стрептомицином, что
и придает организму резистентность. Мутационная речистентность
к стрептомицину встречается весьма часто. Гентамицин, тобрамицин,
нетилмицин и амикацин связываются со многими участками на обеих
субъединицах рибосом, и поэтому мутационная резистентность к ним
не носит общего характера.
Второй механизм резистентное™ — это затрудненный транспорт
в клетку, который приводит к резистентности ко всем аминогликозидам.
Этот тип резистентности не носит общего характера среди грамотрица-
грамотрицательных аэробных и некоторых других микроорганизмов. Поскольку
транспорт аминогликозидов через цитоплазматическую мембрану явля-
является кислородзависимым процессом, особенно анаэробные бактерии
всегда проявляют резистентность по отношению к этим бактериям.
Наиболее значимым механизмом резистентности является опосре-
опосредованная плазм идами выработка ферментов, которые фосфорилируют,
аденилируют или ацетилируют специфические амино- или гидроксиль-
ные группы в молекуле аминогликозидов. Эти ферменты не вырабаты-
вырабатываются вне клеток. Они обнаруживаются в периплазматической облас-
области. Как только препарат проникает через внешнюю мембрану и до-
достигает периплазматической области, он подвергается изменению
ферментом. Видоизмененный препарат наряду с неизмененным конку-
рир>ет за проникновение в клетку, но оказывается неспособным связы-
связываться с рибосомами. Как следствие, вторая энергозависимая фаза за-
захвата аминогликозидов ингибируется. Найдено около 20 подобных
ферментов.
В свою очередь аминогликозиды отличаются по своей способности
противостоять ферментной инактивации:
— гентамицин и тобрамицин чувствительны к одним и тем же
ферментам;
— нетилмицин несколько более устойчив к этим модификациям
ферментов;
— амикацин наиболее устойчив к описанным в настоящее время
ферментам:
— гентамицин. тобрамицин, нетилмицин и амикацин эффектив-
эффективны для лечения аэробных инфекций и некоторых грамотри-
грамотрицательных бацилл.
При серьезных инфекциях, вызванных Pseudomonas aeruginosa, эти
препараты используются в комбинации с антибиотиками широкого
спектра действия — пенициллином, цефтазидином, имипенемом или
-657-
Глава 32
азтреонамом. Стрептомицин является лекарством выбора при лечении
туляремии, чумы и бруцеллеза (в комбинации с тетрациклином). Он не
используется для лечения других грамотрицательных бактериальных
инфекций из-за высокой вероятности возникновения резистентности,
которая может развиться благодаря всего лишь одной мутации. Однако
следует особенно отметить, что практически все антибиотики ряда ами-
ногликозидов не метаболизируются в организме, накапливаются в поч-
почках и обладают определенной ото- и нефротоксичностью.
Стрептомицин (Streptomycin)
Стрептомицин — т/?анс-2,4-дигуанидино-3,5,6-тригидроксицикло-
гексил-5-дезокси-2-0-B-дезокси-2-метиламино-а-Ь-глюкопиранозил)-
З-С-гидроксиметил-р-Ь-ликсо-пентофуранозид C2.4.1) выделяют из
культуральной жидкости жизнедеятельности актиномицета Strepto-
myces griseus [238, 239, 240, 241, 242, 243, 244, 245, 246, 247].
NH
H2N-C-HN
NH
NH-C-NH2
OH
H3C
Гсно
OH
Н0^н7-°-
OH
32 4 1
Сфептомицин обладает широким спектром антибактериальной ак-
активности. Эффективен в отношении большинства грамотрицательных
и некоторых грамположительных бактерий; стафилококков, стрепто-
стрептококков, пневмококков, гонококков, менингококков, возбудителей ди-
дизентерии, бруцеллеза, туберкулеза, туляремии, чумы и др.
Препарат применяют при различных заболеваниях, вызванных чув-
чувствительными к нему микроорганизмами, — бактериальном эндокарди-
эндокардите, перитоните, менингите, инфекциях мочевых путей, кишечных ин-
инфекциях, туляремии, чуме, бруцеллезе и т. п.
Синонимами препарата являются стрептан, стрептокол и др.
-658-
Антибиотики
Неомицин (Neomycin)
Неомицин является комплексом антибиотиков (неомицины А, В, С,
D, Е и F), образующихся в результате жизнедеятельности актино-
актиномицета Streptomyces fradiae. Причем неомицин А, называемый так-
также неамином, является 2-дезокси-4-0-B,6-диамино-2,6-дидезокси-
сс-О-глюкопиранозил)-О-стрептамином C2.4.2) и не обнаруживает
антибиотических свойств. В то же время неомицин В — О-2,6-
диамино-2,6-дидезокси-а-В-глюкопиранозилA—>4)-О-[О-2,6-диа-
мино-2.6-дидезокси-р-Ь-идопиранозил-A-»3)-Р-В-/?ибо-фуранозил-
A->5)]-2-дезокси-О-стрептамин C2.4.3), отличающийся от неоми-
цина А наличием второго гликозидного остатка, уже проявляет
мощную антибактериальную активность. Неомицин С C2.4.4) от-
отличается от неомицина В ориентацией аминометильной группы
в неозаминной части молекулы [248, 249, 250, 251, 252, 253, 254
255].
H2N А,
NH2
32 4 3
Неомицин, как и стрептомицин, обладает широким спектром анти-
антибактериальной активности. Эффективен в отношении большинства гра-
грамотрицательных и некоторых грамположительных бактерий, стафило-
стафилококков, пневмококков, гонококков, менингококков, возбудителей
Дизентерии. В отношении стрептококков малоактивен. Антибиотиче-
Антибиотический эффект неомицина в отношении многих видов бактерий выше, чем
> стрептомицина. В то же время чувствительные к неомицину микроор-
микроорганизмы приобретают устойчивость к нему в меньшей степени, чем
к стрептомицину.
Препарат применяют при различных желудочно-кишечных заболе-
заболеваниях, вызванных чувствительными к нему микроорганизмами, в том
-659-
Глава 32
числе и энтеритах, вызванных устойчивыми к другим антибиотикам
микробами. Однако ввиду высокой ото- и нефротоксичности его пред-
предпочитают применять местно при гнойных заболеваниях кожи, инфици-
инфицированных ранах, конъюнктивитах, кератитах и др.
Синонимами препарата являются фармицетин, софрамицин. тутто-
мицин и др.
Паромомицин (Paromomycin)
Паромомицин — 0-2-амино-2-дезокси-сс-В-глюкопиранозилA-»4)-
0-[0-2,6-диамино-2,6-дидезокси-р-Ь-идопиранозил-A->3)-р-0-/?ибо-
фуранозил-A->5)]-2-дезоксиЛ)-стрептамин C2.4.5) с химической
точки зрения отличается от неомицина В лишь заменой 6-ами-
ногруппы в глюкопиранозильной части молекулы на гидроксиль-
ную и выделен из культуральной жидкости жизнедеятельности ак-
тиномицетов Streptomyces rimosus [256, 257, 258].
H2N-C-HN
32 4 1
Антибактериальная активность и показания к применению паромо-
мицина аналогичны таковым неомицина. Кроме того он рекомендуется
при лечении острых и хронических форм кишечного амебиоза.
Синонимами препарата являются аминозидин, катенулин, кресто-
мицин, гидроксимицин, мономицин, зигомицин и др.
Канамицин (Kanamycin)
Канамицин — О-3-амино-3-дезокси-а-В-глюкопиранозил-A->6)-О-
[6-дезокси-6-амино-а-В-глюкопиранозил-A—>4)]-2-дезокси-О-стреп-
тамин C.4.6) выделен из культуральной жидкости жизнедеятельно-
жизнедеятельности актиномицета Streptomyces kanamyceticus, который продуцирует
три антибиотика — канамицин А, В и С [259, 260, 261, 262].
-660-
Антибиотики
NH2
32 4 6
Канамицин А сходен со стрептомицином и неомицинами и обладает
широким спектром антимикробного действия. Активен в отношении
большинства грамположительных, а также грамотрицательных микро-
ор1анизмов (стафилококков, кишечной палочки, клебсиеллы, палочки
Фридлендера, протея, шигеллы, сальмонеллы).
Применяют при лечении сепсиса, менингита, остеомиелита, пери-
перитонита, пневмонии, пиелонефрите, пиелоцистите, раневых инфекциях,
послеоперационных гнойных осложнениях, вызванных чувствительны-
чувствительными к препарату микроорганизмами.
Синонимами препарата являются кармицин, камаксин, резистоми-
цин и многие другие.
Тобраницин (Tobramycin)
Тобрамиции — 0-3-амино-3-дезокси-а-0-глюкопиранозил-A—»6)-
О-[2.6-амино-2,3,6-три-дезокси а-В-/7м6о-глюкопиранозил-A->4)-2-
дезокси-О-стрептамин C.4.7) выделен из культуральной жидкости
жизнедеятельности акгиномииета Streptomyces tenebranus [263, 264,
265, 266, 267, 268, 269, 270].
сн2он
H2NCH2
НО
H2N
32 4 7
-661 -
Глава 32
Гобрамицин высокоактивен в отношении грамотрицательных мик-
роор!анизмов (синегнойной и кишечной палочек, клебсиеллы, серра-
ции. проаиденсии, энтеробактер, протея, сальмонеллы, шигеллы),
а также грам положительных микроорганизмов (стафилококков, в том
числе устойчивых к пенициллину и некоторым цефалоспоринам), неко-
некоторых штаммов стрептококков.
Применяют при бактериальных инфекциях тяжелого течения: пери-
тони re, сепсисе, менингите, остеомиелите, эндокардите, пневмонии,
эмпиеме плевры, абсцессе легкого, гнойных инфекциях кожи и мягких
тканей, инфекциях мочевыводящих путей, вызванных чувствительными
к препарату микроорганизмами.
Синонимами препарата являются небицин, обрацин и др.
Гентамицин (Gentamycin)
Гентамицин — это комплекс антибиотиков, выделенных из культу-
ральной жидкости жизнедеятельности актиномицета Micromono-
spora purpurea, который состоит из смеси примерно равных коли-
количеств 3 соединений: гентамицина Q, С!а и С2 [271, 272, 273. 274,
275,276,277,278].
32 4 8
гентамицин С; (R = R| = СН3)
гентамицин С2 (R = СН3, Ri = Н)
гентамицин С| ^ (R = Ri = Н)
Гмнтамицин обладает широким спектром биологического действия
и высокоактивен в отношении штаммов стафилококков, устойчивых
к пенициллинам и др>гим антибиотикам, многих грамотрицательных
микроорганизмов — синегнойной палочки, клебсиеллы, энтеробактер,
сальмонеллы, шигеллы, протея.
-662-
Антибиотики
Применяют при пиелонефрите цистите, пневмонии, эмпиеме плев-
плевры, перитоните, сепсисе, менингите, гнойных инфекциях кожи и мягких
(каней инфекциях ран, ожогов и прочих, вызванных чувствительными
к npenapaiy микроорганизмами. Гентамицин является препаратом вы-
выбора при бактериальных инфекциях тяжелого течения, вызванных неус-
неустановленным возбчдителем.
Синонимами препарата являются гарамицин, генгацилин, рибоми-
цин и mhoi ие другие.
Амикацин (Amikacin)
Амикацин — О-3-амино~3-дезокси-а-В-глюкопиранозил-A—И)-О-
[б-амино-б-дезокси-а-О-глюкопиранозил-О—>6)]-N -D-амино-Ь-2-ги-
фОксибутирил)-2-дезокси-Ь-стрептамин C.4.10) является полусинте-
полусинтетическим антибиотиком, получаемым из канамицина C.4.6), первич-
первичную аминогрупп) в котором предварительно защищают ацилиро-
ванием К-(бензоилоксикарбонилокси)сукцинимидом в диметилфор-
мамиде, после чего полученный продукт C2.4.9) обрабатывают
эфиром полученным из N-i идроксисукциннмида и бензилоксикарбо-
ниламино-а-Ь-(-)гидроксимасляной кислоты, в результате чего селек-
селективно ацилируется 4-аминогруппа стрептаминовой части молекулы.
Дальнейшим снятием дв}^ бензилоксикарбониламинных защитных
групп традиционным способом, восстановлением водородом с ис-
использованием в качестве катализатора палладия на угле получают ис-
искомый амикацин C2.4.10) [279, 280, 281, 282, 283. 284,285, 286].
о
СН2ОН
-о.
vNH2
но
к
-0-CQ-0—N I C6H5CH2-O-CO—HNCH2 НО
II
о к он
^.н2
H2N
32 4 9
о
I
1 Сг-вСЬ2—О-СО— HNCrir-CHj-CM-COO—N I
п
о
' J^ Pa- С
.он у
НО 1 J О/
но Кбн у\ он
NH-CO-CH-Ch2-CH2—NH2
H2N
32 4 10
-663-
Глава 32
Амикацин высокоэффективен в отношении грамотрицательных
микроорганизмов (синегнойной и кишечной палочек, клебсиеллы, сер-
рации, провиденсии, энтеробактер, протея, сальмонеллы, шигеллы),
а также грамположительных микроорганизмов (стафилококков, в том
числе устойчивых к пенициллину и некоторым цефалоспоринам), неко-
некоторых штаммов стрептококков.
Применяют при бактериальных инфекциях тяжелого течения: пери-
перитоните, сепсисе, менингите, остеомиелите, эндокардите, пневмонии,
эмпиеме плевры, абсцессе легкого, гнойных инфекциях кожи и мягких
тканей, инфекциях мочевыводящих путей, вызванных чувствительными
к препарату микроорганизмами.
Синонимами препарата являются амикин, биклин, новамин и др.
Нетилмицин (Netilmycin)
Нетилмииин — 0-3-дезокси-4-С-метил-3-(метиламино)-р-Ь-араби-
нопиранозилA-»4)-О-[2,6-диамино-2,3,4,6-тетрадезокси-а-О-2тог/е/х)-
гекс-4-енопиранозил-A-»6)-2-дезокси->»|3-этил-Ь-стрептамин C.4.10)
также является полусинтетическим антибиотиком, который полу-
получают в две стадии из др>гого известного антибиотика — сизомици-
на C2.4.11), продуцируемого культурой Micromonospora inyoensis.
На первой стадии синтеза взаимодействием сизомицина с уксусным
альдегидом при весьма определенной кислотности среды (рН 5)
удается селективно получить имин по 3-аминогруппе 2-дезокси-
стрптаминовой части молекулы. Полученный имин далее гидриру-
гидрируется цианоборгидридом натрия до этиламинопроизводного — не-
тилмицина C2.4.12) [287, 288, 290, 291].
H2NCH2
H2N
32 4 11
1 H2SO4, pH 5
2 СНзСНО
3 NaBH3CN
HZNCH2
NHC2H5
32.4 12
Нетилмицин также высокоэффективен в отношении грамотрица-
грамотрицательных микроорганизмов (синегнойной и кишечной палочек, клебси-
-664-
днтибиотики
еллы. серрации, провиденсии, энтерооактер, протея, сальмонеллы, ши-
шигеллы]. а также некоторых грамположительных микроорганизмов (ста-
(стафилококков, некоторых штаммов стрептококков).
Применяют при бактериальных инфекциях тяжелого течения, вы-
вызванных чувствительными к препарату микроорганизмами.
Синонимами препарата являются нетиллин, зетамицин и др.
32.5. Линкозамиды
Линкозамиды — линкомицин и клиндамицин — являются предста-
представителями очень небольшой группы препаратов, представляющих собой
аминокислоту, связанную с аминосахаром.
Линкозамиды связываются с 50-S рибосомальными субъединииами
бактерий и ингибируют синтез протеинов. Они ингибируют также дей-
действие пептидил. Линкозамиды являются бактериостатическими анти-
антибиотиками, однако при достижении определенных концентраций в пла-
плазме они проявляют и бактерицидное действие против некоторых
бактерий. Линкозамиды высокоактивны против анаэробных инфекций,
таких как Рерюсоссш, Peptostreptococcus, Actinomyces, Propionibacerium
и Clostridiumfringens, некоторых видов Peptococcus и Closiridium.
Практически все аэробные грамотрицательные бактерии резистент-
резистентны к линкозамида.м.
Резистентность к линкозамидам может иметь место из-за невоз-
невозможности препаратов проходить через клеточную оболочку бактерий
или изменений в рибосомальных участках связывания.
Наиболее часто линкозамиды используются при лечении ана-
анаэробных инфекций, таких как интраабдоминальные и женские ин-
инфекции.
Линкозамиды являются хорошей альтернативой р-дактамным анти-
антибиотикам для лечения инфекций, вызванных золотистой палочкой или
стрептококками. Полезны при лечении остеомиелитов и септических
артритов ввиду больших концентраций, достигаемых в костях.
Линкомицин (Lincomycin)
Линкомицин — 6,8-дидезокси-6-/ираноA~метил-4-пропил-Ь-2-пир-
ролидинкарбоксамидо)-1-метилтио-В-з/?ши/>о-а-В-га7акУяо-октопи-
ранозид C2.5.1) является первым линкозамидом, нашедшим приме-
применение в клинической практике и который был выделен в 1962 г. из
культуральной жидкости жизнедеятельности актиномицета Strepto-
myces lincolnensis [292, 293, 294, 295].
-665-
Глава 32
но—с—н
I
CO-NH—С—Н
но
¦о
S-CH3
он
32 5 1
Линкомицин оказывает антибактериальное действие в отношении
грамположигельных микроорганизмов (стафилококки, стрептококки,
пневмококки, палочка дифтерии, клостридии). Применяется при бакте-
бактериальных инфекциях тяжелого течения: сепсисе, остеомиелите, септи-
септическом эндокардите, пневмонии, абсцессе легкого, раневых инфекциях,
гнойном менингите. Линкомицин является антибиотиком резерва при
инфекциях, вызванных штаммами стафилококка и другими грамполо-
жительными микроорганизмами, резистентными к пенициллину и дру-
другим антибиотикам.
Синонимами препарата являются линкоцин, мицивин, альбиотик
и др.
Клиндамицин (Clindamycin)
Клиндамицин — метил-[7-хлор-6,7,8-тридезокси-6-/и/?а«с-A-метил-
4-пропил-1-2-пирроллидин-карбоксамидо)-1-тио-Ь-т/>ео-а-В-га/гд-
к/ио-октопиранознд] C2.5.2), который является 7(8)-хлоро-7-дезок-
сипроизводным линкомицина, получают замещением гидроксиль-
ной группы линкомицина C2.5.1) при О обработкой трифе-
нилдихлоридом в ацетонитриле (реактив Райдона), при котором
одновременно происходит и обращение конфигурации при данном
атоме углерода [296, 297, 298, 299, 300, 301, 302, 303].
сн3
сн3
CO-NH—С—Н
Crl3CN Cl2
Oh
\ НТС|
CO-NH—С—И
32 5 2
Orl
1-СН3
Он превосходит базовое соединение линкомицииа по всем положи-
положительным параметрам, включая абсорбцию в ЖКТ, антибактериальную
-666-
Антибиотики
активность и антимикробный спектр.
Синонимами препарата являются клеоцин, клинимицин, далацин и др.
32.6. Хлорамфеникол
Хлорамфеникол — В-/и/?ео-2,2-дихлор-Ы-[р-гидрокси-а-(гидрокси-
метил) л-нитрофенилацетамид C2.6.7) впервые был выделен в 1947 г. из
кчльтуральной жидкости жизнедеятельности актиномицета Streptomyces
venezuelae, однако в настоящее время он производится только синтети-
синтетическим путем. При использовании синтетического рацемата без предва-
предвари гельного разделения на D-mpeo и L-mpeo формы препарат называется
синтомицином. Предложено два основных пути синтеза хлорамфенико-
ла. Первый способ исходит из 4-нитроацетофенона, бромированием
которого молекулярным бромом получают ш-бром-4-нитроацетофенон
C2.6.1). Последний переводят в ю-амино-4-нитроацетофенон C2.6.2)
последовательным получением четвертичной соли с уроторопином и
последующим ее расщеплением до амина хлористым водородом. Полу-
Полученный аминокетон ацилируют ангидридом уксусной кислоты с полу-
получением со-ацетамидо-4-нитроацетофенона C2.6.3), и продукт подверга-
подвергают оксиметилированию параформом с получением а-ацетамидо-р-гид-
рокси-4-нитропропиофенона C2.6.4). Восстановлением карбонильной
группы в последнем изопропилатом алюминия в изопропиловом спирте
получают В,Ь-/ирео-2-ацетамидо-1-D-нитрофенил)-1,3-пропандиол
C2.6.5). гидролизом ацетильной группы в котором соляной кислотой
получают О,Ь-трео-2-амино-1D-нитрофенил)-1,3-пропандиол. Полу-
ченн\ю рацемическую смесь аминов обрабатывают камфор-О-сульфо-
кислотой, полученные энантиомерные соли разделяют, и после щелоч-
щелочного гидролиза отобранной соли получают В(-)-/ирео-2-амино-1-D-
нитрофенил)-1,3-пропандиол C2.6.6). Ацилированием аминогруппы
последнего метиловым эфиром дихлоруксусной кислоты получают ис-
искомый хлорамфеникол C2.6.7) [304, 305, 306, 307, 308, 309, 310, 311,
312].
O2N—<( у—C-CH2-NHCOCH3
32 6 3
(СН2О)п Л-^ ° NhCOCH3 Al[OCH(CH3)d3
•¦ ON—(' Ч—С-СН-СНо-ОН »•
°2N \ у—С-СН-СН2-ОН
32 6 4
-667-
Глава 32
Второй способ синтеза исходит из коричного спирта, взаимодейст-
взаимодействием которого с бромноватистой кислотой получают 2-бром-1-фенил-
1,3-пропандиол C2.6.8). гидрокснльные группы в котором защищают
кетальной защитой взаимодействием с ацетоном с получением 5-бром-
2.2-диметил-4-фенид-1,3-диоксана C2.6.9). Реакцией полученного бро-
бромида с аммиаком получают изомерную смесь D,L-wp<?o-5-a.MHHo-2,2-
диметил-4-фенил-1,3-диоксанов, обработкой которой D-винной кисло-
кислотой, разделением полученных солей и последующим щелочным гидро-
гидролизом отобранной соли получают В-(-)-трео-5-амино-2,2-диметил-4-
фенил-1,3-диоксан C2.6.10). Ацилированием последнего метиловым
эфиром дихлоруксусной кислоты получают О-(-)-трео-5-дихлор-
ацетамидо-2,2-диметил-4-фенил-1,3-диоксан C2.6.11). Далее осуществ-
осуществляют нитрование бензольного кольца, в ходе которого расщепляется
и 1,3-диоксановый цикл с получением динитрата В-(-)-трео-2-дихлор-
ацетамидо-1-D-нитро-фенил)-1,3-пропандиола C2.6.12). Восстанавли-
Восстанавливая нитрогруппы в последнем сульфатом двухвалентного железа полу-
получают искомый хлорамфеникол C2.6.7) [313, 314, 315].
H=Ch-CH2-OH
({ \-CH-Ch-CH2-OH
О
л
9 V
снэ сн3
NH-CCCHC2
NH-COCHCI2
Хлорамфеникол ингибирует синтез протеинов в бактериях и в мень-
меньшей мере в эукаротических клетках. Препарат хорошо диффундирует
в бактериальную клетку, где обратимо связывается с 50-S рибосомаль-
ной субъединицей. Это предотвращает присоединение аминокислотного
окончания тРНК к связывающим участкам 50-S рибосомы Связывание
аминоацильной тРНК с 30-S счбъединицей при этом не нарушается.
Клетки млекопитающих, содержащие 80-S рибосомы, не затрагиваются
хлорамфениколом. Однако препарат ингибирует синтез митохондри-
альных протеинов в клетках млекопитающих, возможно, по причине
сходства митохондриальных и бактериальных рибосом.
-668-
Антибиотики
Хлорамфеникол имеет широкий спектр антимикробной активности,
включающий грамположительные, грамотрицательные, аэробные и ана-
анаэробные бактерии, спирохеты, микошгазмы, хламидии и др. Однако он
может вызвать выраженное угнетение кроветворения, сопровождаю-
сопровождающееся ретикулоцитопенией, гранулоцитопенией, а в тяжелых случаях —
апластической анемией.
Резистентность к хлорамфениколу обычно объясняется наличием
плазмид. определяющих выработку хлорамфеникол ацетилтрансферазы.
Этот фермент ацетилирует препарат, делая его неспособным связывать-
связываться с 50-S субъединицей бактериальной рибосомы.
Хлорамфеникол является потенциально токсичным препаратом и име-
имеет немного показаний к применению. Он является препаратом выбора
для лечения тифозной лихорадки, применяется для лечения абсцесса
мозга. До недавнего времени он являлся лекарством выбора при тера-
терапии бактериальных менингитов у детей (в комбинации с ампицилли-
ампициллином). Однако в настоящее время для этих целей предпочтительнее це-
фалоспорины III поколения. Хлорамфеникол является эффективной
альтернативой при ряде инфекций в тех случаях, когда препараты пер-
первого выбора по той или иной причине не могут быть использованы. Од-
Однако препарат никогда не должен применяться при инфекциях, которые
надежно мог\т быть вылечены другими антимикробными препаратами.
Синонимами препарата являются левомицетин, амнндан. аквамице-
тин, хлормицетин, ортохлор. опулетс, лейкомицин и очень многие другие.
32.7. Прочие антибиотики
Спектиномицин (Spectinomycin)
Спектиномицин — 4а,7,9-тригидрокси-2-метил-6,8-б»с-(метиламино)-
пергидроксипирано-[2,3-Ь]бензодиоксан-4-он C2.7.1). выделенный
из продуктов жизнедеятельности актиномицетов Streptomyces
spectabilis, является аминоциклитольным, но не аминогликозидным
антибиотиком, поскольку не содержит ни аминосахаридтюй части,
ни гликозидной связи [316, 317. 318. 319. 320, 321, 322. 323, 324].
CH3-HN
9 н
н-о1
CH3-HN H
32 7 1
Н
?о
,.СН3
-669-
Глава 32
Аналогично стрептомицину спектиномицин связывается с рибосо-
мальной ЗО-S субъединицей микроорганизмов и ингибирует синтез про-
протеинов, однако при этом не происходит неправильного считывания ге-
генетического кода. Несмотря на широкий спектр активности, спек-
тиномишш используется только при гонококковых инфекциях. Дру-
Другие грамотрицательные бактерии начинают проявлять резистентность
в ходе лечения. Препарат эффективен в отношении большинства штам-
штаммов гонококков, а также ряда других грамотрицательных микроорга-
микроорганизмов.
Применяют для лечения острого гонорейного уретрита и проктита
> мужчин и острого гонорейного проктита у женщин, вызванного чув-
чувствительными к препарату штаммами гонококков.
Синонимами препарата являются актиноспектоцин, спектам, тога-
мицин и др.
Банкомицин (Vancomycin)
Ванкомицин C2.7.2) был выделен в 1956 г. из продуктов жизнедея-
жизнедеятельности актиномнцегов Streptomyces onentahs (в настоящее время
Socardia orientalis). Основываясь на его химическом строении и со-
составе, ванкомицин классифицируется как гликопептидный антибио-
антибиотик. Его молекулярная масса значительно больше, чем у любого
другого из практически применяемых антибиотиков [325, 326, 327,
328,329,330]
он
H2N
нею
NHCH3
32 7 2
-670-
Антибиотики
Ванкомицн ингибирует синтез клеточных стенок бактерий. В отли-
отличие от р-лактамных антибиотиков, которые ингибируют третью стадию
синтеза пептидогликана, ванкомицин действует на второй стадии по-
построения клеточной стенки бактерий. Ванкомицин ингибирует ту реак-
реакцию, в которой повторяющаяся единица клеточной стенки отделяется от
цигоплазматического мембраносвязанного фосфолипида и связывается
с уже существующим пептидогликаном. Препарат также повреждает
протопласты путем воздействия на цитоплазматические мембраны
и щ гем ингибирования синтеза РНК. Ванкомицин активен только в от-
отношении грамположительных бактерий. Он является наиболее мощным
из известных антибиотиков в отношении и Staphylococcus aureus. и Sta-
phylococcus epidermidus, включая метицицлин- и цефалоспоринрези-
стентные штаммы.
Резистентность грамотрицательных организмов, таких как микобак-
терии, грибы, вирусы, простейшие, к ванкомицину возникает из-за
барьера непроницаемости для препарата, обеспечиваемого их внешней
мембраной. Резистентность к ванкомицину среди грамположительных
организмов встречается редко.
Ванкомицин применяют при бактериальных инфекциях тяжелого
течения, вызванных чувствительными к препарату микроорганизмами,
при неэффективности пенициллинов и цефалоспоринов или неперено-
непереносимости их больными при сепсисе, эндокардите, пневмонии, абсцессе
легких, остеомиелите, менингите, энтероколите. Ванкомицин является
лекарством выбора при инфекциях, вызванных метицицлинрезистент-
ными видами Staphylococcus aureus, Staphylococcus epidermidus и дру-
другими коагулазотрицательными стафилококками, при эндокардитах,
дифтеропдных инфекциях, применяется для лечения тяжело больных
пациентов с колитом, вызванным Clostridium difficile.
Синонимом препарата является ванкоцин.
Рифимпицин (Rifampicin)
Рифампицин — 5,6,9,17,19,21-гексагидрокси-23-метокси-2,4,12,16,18,
20,22-гептаметил-8-[К-D-метил-1-пиперазинил)-формимидоил]-2.7-
(эпоксипентадека-1,11,13-триенимино)-нафто-[2,1-Ь]фуран-1,11B//)-
диона-21-ацетат C2.7.8).
Рифампицин является полусинтетическим производным рифампи-
шша В — макролактамного антибиотика — одного из не менее чем пя-
пяти антибиотиков из смеси рифампицинов А, В, С, D и Е, которые назы-
называются рифампишшовым комплексом (введенным в медицинскую
практику в 1968 г.) и продуцируются актиномицетами Streptomyces
-671 -
Глава 32
mediteranei (Nocardia mediteranei). Синтез рифампицина начинается
с того, что водный раствор рифампицина в условиях реакции окисляет-
окисляется в новое производное рифампицин S C2.7.4) с промежуточным обра-
образованием рифампицина О C2.7.3). Восстановлением хиноновой струк-
структуры последнего водородом с использованием в качестве катализатора
палладия на угле получают рифампицин SV C2.7.5). Подвергая полу-
полученный продукт аминометилированию смесью формальдегида и пирро-
лидина, получают 3-пирролидинометилрифампицин SV C2.7.6). Окис-
Окисляя последний тетраацетатом свинца до енамина и последующим
гидролизом водным раствором аскорбиновой кислоты, получают 3-фор-
милрифампицин SV C2.7.7). Вводя последний во взаимодейстие с 1-ами-
но-4-метилпиперазином, получают искомый рифампицин C2.7.8) [331,
332. 333, 334].
--о
С-з 32-5
H2N-N N-CH3
СН3 СН3
СНз
CH=N-N N-CH3
ОН
32 7 8
-672-
Антибиотики
Рифампицин является антибиотиком широкого спектра действия
и отличается от рифампицина SV C2.7.5), также применяемого в меди-
медицине в качестве самостоятельного препарата, большей эффективностью
при приеме внутрь и более широким антибактериальным спектром дей-
действия
Рифампицин проявляет бактерицидный эффект путем ингибирова-
ния синтеза РНК. Препарат ингибирует ДНК-зависимую РНК-поли-
меразу, предотвращая начало развития цепи, а не ее удлинение. Рифам-
Рифампицин не связывается с РНК-полимеразой ядра клеток млекопитающих
и не воздействует на соответствующий синтез РНК. Он может ингиби-
ровать митохондриальный синтез РНК, однако концентрации, требуе-
требуемые для этого, в несколько сот раз превышают таковые, необходимые
для синтеза РНК.
Рнфампицинн высокоактивен в отношении Mycobacterium tubercu-
tuberculosis, в ряду атипичных микобактерий по отношению к Mycobacterium
kansasii. Mycobacterium marinum и к большинству видов Mycobacterium
scrofulaceum и Mycobacterium xenopi. Чувствительность других мико-
микобактерий варьирует. Рифампицин проявляет активность и в отношении
Mycobacterium lepare.
Кроме микобактерий, рифампицин проявляет активность и в отноше-
отношении широкого ряда организмов. Он высокоактивен в отношении Sta-
phyilococcus aureus, неэнтерококковых видов Streptococcus и Listena
monocytogenes. Среди грамотрицательных видов к рифампицину очень
чувствительны Neisseria meningitidis, Haemophilus influenzae и Legionella.
Устойчивы Е coli и Proteus mirabilis. Анаэробные кокки, виды Clost-
ndium и Bacteroids часто оказываются чувствительны к рифампицинч.
Рифампицин является наиболее эффективным лекарством для лече-
лечения легочной и нелегочной форм туберкулеза, включая туберкулезный
менингит. Всегда должен применяться в сочетании с другими препара-
препаратами.
Синонимами препарата являются рифадин, римактан, рифапиам,
римактазид и др.
Полимиксины
Полимиксины являются группой родственных полипептидных ан-
антибиотиков, вырабатываемых спорообразующими почвенными бакте-
бактериями Bacillus polymyxa и Bacillus circulans и отличающихся аминокис-
аминокислотным составом. Было определено пять разных полимиксинов —
полимикснн А, В, С, D и Е, отличающихся аминокислотным составом
и дифференцированных добавочными буквенными обозначениями
-673-
Глава 32
и названиями — полимиксин В (аэроспорин), полимиксин Е (колистин).
Известно, что одни штаммы Bacillus polymyxa в процессе развития обра-
образуют лишь полимиксин А и С, другие синтезируют полимиксин В и D.
Позже был выделен полимиксин М, сульфометильное производное по-
лимиксина Е.
В структуре всех этих антибиотиков присутствует треонин и а,у-ди-
аминомасляная кислота. Особенность группы полимиксинов в том,
что в их составе имеется 4-5 свободных у-аминных групп а,у-диами-
номасляной кислоты, что придает им свойства катионных детерген-
детергентов, способных образовывать комплексы с фосфолипидами клеточ-
клеточных мембран. По антибиотическому действию все полимиксины
сходны.
Полимиксин В (Polymyxine В)
Полимиксин В — 1М-[3-амино-1-[[1-[[3-амино-1-[[6,9,18-трис-B-
аминоэтил)-15-бензил-3-A-гидроксиэтил)-12-изобутил-2,5,8,11,14,
17,20-гептаоксо-1,4,7,10,13,16,19-гептаазациклотрис-21-ил]-карбамо-
ил]-пропил]-карбамоил]-2-гидроксипропил]-карбамоил]-пропил]-6-
метилоктанамид C2.7.9) [335, 336, 337].
H2N
СН3
СН3
NH2
32 7 9
По:ишиксин Е (Polymyxine Е)
Полимиксин Е — М-[3-амино-1-[[1-[[3-амино-1-[[6,9,18-трис-B-
аминоэтил)-3-A-гидроксиэтил)-12,15-диизобутил-2,5,8,11,14,17,20-
гептаоксо-1,4,7,10,13,16,19-гептаазациклотрис-21 -ил]-карбамоил]-
пропил]-карба.моил]-2-гидроксипропил]-карбамоил]-пропил]-6-ме-
тил-октанамид C2.7.10) [338].
-674-
Антибиотики
H2N>
сн3
32 7 10
В принципе, при физиологических рН полимиксины являются кати-
онными пиверхностно-активными соединениями и проявляют свое бак-
бактерицидное действие путем взаимодействия с фосфолипидной компо-
компонентой цитоплазматической мембраны чувствительных бактерий и тем
самым нарушают осмотическую целостность их клеточной мембраны,
способствуя выведению многих компонентов, в том числе ионов К+,
из цитоплазмы в окружающую среду. Детальный биохимический меха-
механизм их действия пока неясен.
Практически все полимиксины исключительно активны против
аэробных грамотрицательных микроорганизмов. В частности, они ак-
активны против Pseudomonas aeruginosa, Escherichia coli, Klebisella
pneumoniae, Enterobacter, Salmonella, Shigella Haemophilus и др. Не дей-
действуют на кокковые аэробные (стафило-, стрепто-, пневмо-, гоно- и ме-
менингококки) и на анаэробные микроорганизмы, а также на большинство
штаммов Proteus, на возбудителей туберкулеза и дифтерии.
Эти препараты применяют при желудочно-кишечных заболеваниях
(колиты, энтероколиты, при острой и хронической дизентерии, при сеп-
сепсисе, менингите, пневмонии, инфекциях мочевых путей и других забо-
заболеваниях, вызванных Pseudomonas aeruginosa, когда другие антибиоти-
антибиотики неэффективны. В виде мазей с успехом используются при лечении
некоторых форм экзем, фурункулов, гидраденитов и других кожных
заболеваний.
Парентеральное применение полимиксинов ограничено ввиду их
неиро- и нефротоксических эффектов. Они не являются лекарствами
выбора для какой-то конкретной инфекции. Однако их применяют при
серьезных, угрожающих жизни инфекциях, например бактеремии, вы-
шанной, как уже было отмечено, некоторыми штаммами Pseudomonas
aeruginosa.
-675-
Глава 32
Бацитрацины
Бацитрацины также являются полипептидными антибиотиками, вы-
выделенными из к>льт>ральной жидкости жизнедеятельности Bacillus
hcheniformis Выделено десять индивидуальных бацитрацинов А, Аь В,
С, D, E, Fb F2, Ft,, G Однако сам препарат, называемый бацитрацин
и применяемый в медицине, является смесью полипептидных антибио-
антибиотиков Все бацитрацины, являясь полипептидами, содержат в своем со-
составе и тиазолиновое кольцо
Бацитрацин A (Bacitracin A)
Бацитрацин А — М-[[2-A-амино-2-метилбутил)-4,5-дигидро-4-тиа-
золил]нарбонил] бацитрацин F C2 7 11) составтяет основную часть
выдетенных фракций [338, 339, 340, 341]
сн3
СНз S'
NH2
Э—Leu—G'u—I leu—Ly s—Orn—I leu
NH-CO \
HOOC-Asp-Asp— His—Phe
NH2
32 7 11
Бацитрацин -- бактерицидный препарат и ингибир>ет образование
линейных пептидогликановых цепей, являющихся основным компонен-
компонентом клеточных стенок бактерий К препарату чувствительно большин-
большинство грамположительных бактерий, включая стафилококки, стрептокок-
стрептококки, а также Clostndium difficile В то же время препарат почти не
действует на грамотрицательные бактерии Наиболее часто препарат
применяется наружно при местном лечении гнойных инфекций глаз
и кожи Показания для внутримышечного введения препарата крайне
ограничены ввиду его нефротоясичности Он может быть использован
как препарат крайнего случая у детей со стафилококковой пневмонией,
с эмпиемой, устойчивой ко всем другим антибиотикам
Антибиотики
Список литературы
1 Fleming A Brit J Exp Pathol Ю, 226 A929)
2 Cletterbuck P et ab Biochem J 26, 1907 A932)
3 Chain Е etal /Lancet 2, 226A940)
4 Abraham E et al //Lancet 2, 177 A941)
5 US Pat 3 024 169A962)
6 LSPat 3 159 617A964)
7 Bachi M et al /J Chem Soc Perkm Trans I, 1980. 11
» US Pat 2 479 295A946)
9 IS Pat 2 479 296A946)
10 US Pat 2 562 410A946)
11 US Pat 2 941995A960)
12 SheehanJ etal /J Am Chem Soc 79, 1262A957)
П SheehanJ etal /J Am Chem Soc 81,3089A959)
14 SheehanJ etal /J Am Chem Soc 84,2983A962)
15 GlombitzaV Ann 673. 166A964)
16 US Pat 2 951 839A960)
17 Doyle F etal 'J Chem Soc 1962. 1457
18 US Pat 3 157 639A964)
19 US Pat 3 248 386A966)
20 Brit Pat 880 400A964)
21 US Pat 2 996 501 A961)
22 Brit Pat 905 778A961)
23 Brit Pat 958 478 A963)
24 Doyle F etal 'Nature 192, 1183A961)
25 DovleF etal /J Chem Soc 1963-5838.
26 USPat 2 239 50-7A966)
27 Bnt Pat 978 299A962)
28 Belg Pat 657 504 A964)
29 Bnt Pat 893 049 A959)
30 Bnt Pat 902 703 A961)
31 USPat 2 985 648A961)
32 Ger Pat 1 139 844A960)
33 Ger Pat 1 545 534 A965)
M IS Pat 2 985 648A961)
35 DoyleF etal J Chem Soc 1962. 1440
36 Bnt Pat 991 586A964)
37 USPat 3 140 282A964)
-677-
Глава 32
38
39
40
41
42
43
44
45
46
47
48
49
DO
51
52
ЭЗ
M
5э
56
57
58
59
60
61
62
63
Ы
65
66
67
68
69
71
и
"'3
^5
76
п%
US Pat A
Brit Pat
Ger Pat
Fr Pat 2
US Pat 3
Ger Pat
Ger Pat
Ger Pat
Ger Pat
Ger Pat
Ger Pat
Brit Pat
US Pat 4
US Pat 3
US Pat 3
US Pat 1
Ger Pat
Ger Pat
Brit Pat
Brit Pat
Belg Pat
Ger Pat
Brit Pat
Ger Pat
Ger Pat
Brit Pat
US Pat 4
US Pat 4
Brown A
Belg Pat
US Pat 4
Volkman
Belg Pat
L S Pat 3
Fi Pat 1
I 128 547A978)
1 339 603A972)
2 611 286A976)
100 682A971)
933 795A976)
2 104 579A971)
2 152 967A971)
2 152 968A971)
2 318 955A973)
2 519 400A975)
2 824 610A978)
1 508 062A97^)
¦087 424A978)
142 673A964)
282 926A966)
492 291 A970)
1 295 558A964)
1 770 225 A968)
1 004 670A964)
1 197 973A967)
646 991 A964)
2 244 556A972)
1 508 977 A975)
2517316A975)
2 560 074A975)
1 543 563 A976)
490 294A984)
490 295A984)
et al J Antibiot 29, 668 A976)
867 859A978)
234 579A980)
R et al '/J Org Chem 47. 3344 A982)
618 663A962)
218 318A965)
384 197A965)
Chau\etteR etal J Am Chem Soc 84,3401 A962)
Ratchffe,
L S Pat 3
L S Pat 3
L S Pat 3
R etal Tetrahedron Lett 1973,4649
422 100A969)
503 967A970)
578 661 A971)
CmstL etal J Med Chem 16,1413A973)
-678-
Антибиотики
79 i SPat 3 516 997A970)
»() S \fr Pat 68 04 514A970)
81 Кит one 4 et al / J Antibiot 23, 131 A970)
82 t SPat 3 507 861 A970)
8; LSPat 3 275 626A966)
84 R,anC etal J Vied Chem 12, 310 A968)
8* Fr Pat 1 524 225A967)
Sb Brit Pat 1 174 335A967)
8" С SPat 3 485 819A969)
88 Gei Pat 1 931 722A969)
89 Dolfini E et al / J Med Chem 14, 117 A971)
90 US Pat 3 489 752A970)
91 LSPat 3 98s 741 A9b8)
42 Brit Pat 1 240 687A968)
93 Brit Pat 1 532 682A977)
94 Gei Pat 2 216 113A972)
9^ LS Pat 3 816 253A974)
% I SPat 4 504 657A985)
97 Brit Pat 1453 049A974)
98 Ger Pat 1 931 722A969)
99 Brit Pat 1 453 049A974)
100 Ger Pat 2 439 880A974)
101 Ger Pat 2 462 376A974)
102 Ger Pat 2 204 060A972}
103 Ger Pat 2 223 375A972)
104 Ger Pat 2 265 234A972)
105 US Pat 3 966 717A976)
106 US Pat 3 971 778A976)
107 LSPat 3 974 153A976)
108 Ger Pat 2 706 413A977)
109 US Pat 4 267 320A981)
110 LSPat 4 075 061 A978)
111 LSPat 4 164 447A976)
112 LSPat 3 641 021 A972)
113 US Pat 3 840 531 A974)
114 US Pat 3 974 153A976)
115 LSPat 3 903 278A975)
116 Ger Pat 2 018 600A970)
II Ger Pat 2 06Э621 A970)
lib Gei Pat 2 730 579A977)
119 Ger Pat 2 312 99^ A973)
-679-
АНТИбИОТИКИ
120 Ger Pat 2 611270A976)
121 US Pat 4 048 311 A977)
122 US Pat 4 093 723A978)
123 US Pat 4 159 373A979)
124 US Pat 4 100 346A978)
125 LSPat 4 172 196A979)
126 LSPat 4 182 863A980)
127 Ger Pat 2 538 804A976)
128 GottstainW c\a\ J Antibiot 29, 1226 A976)
129 Ger Pat 2 456 528A974)
130 Ger Pat 2 318 829A973)
131 Ger Pat 2 365 582A973)
132 Ger Pat 2 129 675A971)
133 Ger Pat 2 143 331 A971)
134 Ger Pat 2 203 653A972)
135 Ger Pat 2 258 278A972)
136 US Pat 3 775 410A973)
137 US Pat 3 843 641 A974)
138 Hiraoka T et al Heterocycles (Japan) 8, 719 A977)
139 Ger Pat 2 824 559A978)
140 ЫапагтМ et al Chem Pharm Bull 28,2629A980)
141 US Pat 3 925 372A975)
142 Ger Pat 2 408 698A974)
143 ChametteR et al '/[ Med Chem 18,403 A975)
144 Ger Pat 2 702 501 A977)
145 Ger Pat 2 708 439A977)
146 Ger Pat 2 256 736A976)
147 US Pat 4 098 888A978)
148 US Pat 4 152 432A979)
149 US Pat 4 427 674A984)
150 US Pat 4 463 002A984)
151 Ger Pat 2 810 922A978)
152 Ger Pat 2 922 036A979)
153 US Pat 4 431 806A984)
154 US Pat 4 327 210A982)
155 Brit Pat 2 022 090A979)
156 Reiner R et al /J Antibiot 33 783A980)
157 Ger Pat 2 921 316A979)
158 US Pat 4 258 041A981)
159 US Pat 4 525 587A985)
160 Bnt Pat 2 025 398A979)
-680-
161 Ger Pat 3 037 102A981)
162 LSPat 4 329 453A982)
163 US Pat 4 110 327A978)
164 Ger Pat 3 519 400A975)
165 Bnt Pat 1 508 062A975)
166 Bnt Pat 2 508 071A976)
167 US Pat 4 410 522A983)
168 Belg Pat 837 682A976)
169 Ger Pat 2 713 370A977)
170 US Pat 4 138 486A979)
171 US Pat 4 180 571 A979)
172 NansadaM etal/'J Med Chem 22,758A979)
171 Nansada M et al //Heterocycles 7, 839 A977)
174 US Pat 4 406 899A983)
175 Ger Pat 3 307 550A983)
176 Naito T et al /'J Antibiot 39, 1092 A986)
177 US Pat 4 609 653A986)
178 SeibertG et al '/Arzneimittel-Forsch 33, 1084A983)
179 US Pat 4 194 047A980)
180 Ger Pat 2 652 679A976)
181 Leanza И etal/'J Med Chem 22, 1435 A979)
182 ShinkaiJ et al//Tetrahedron, 23, 4903 A982)
183 bur Pat Appl 48 301 A982)
184 Eur Pat Appl 48 025A982)
185 Ger Pat 3 104 145A981)
186 Bnt Pat 2 071 650A981)
187 Neth Pat Appl 8 100 571 A981)
188 US Pat 2 653 899A953)
189 US Pat 2 823 203A958)
190 Bnt Pat 1 121 056A957)
191 Ger Pat 2 758 942A977)
192 US Pat 4 331 803A982)
193 Eur Pat Appl 41 355A981)
194 US Pat 4 517 359A985)
195 Belg Pat 892 357A982)
196 US Pat 2 482 055A949)
197 US Pat 2 609 329A949)
198 US Pat 2 899 422A959)
199 US Pat 2 987 449A961)
200 US Pat 3 050 446A962)
201 Duggar В Arm N Y Acad Sci 51., 177A948)
-681 -
Антибиотики
202.
203.
204.
205.
206.
207.
208.
209.
210.
211.
212.
213.
214.
215.
216.
217.
218.
219.
220.
221.
222.
223.
224.
225.
226.
227.
228.
229.
230.
231.
232.
233.
234.
235.
236.
237.
238.
239.
240.
241.
242.
US Pat. 2.516.080A950).
Finlay A. et al.//Science. U\, 85 A950).
Regna P et al./'Ann. N. Y. Acad. Sci. 53, 221 A950).
Regna P. et al.'VJ. Am. Chem. Soc. 73, 4211 A951).
US Pat. 2.699.054A955).
US Pat. 3.005.023A961).
BootheJ et al.'/J. Am. Chem. Soc. 75, 4621 A953).
ConoverL et al.VJ. Am. Chem. Soc. 75, 4622 A953).
US Pat. 2.734.018A956).
US Pat. 2.712.517 A955).
US Pat. 2.886.595A959).
US Pat. 3.019.173A962).
US Pat. 3.301.899 A967).
US Pat. 2.878.289 A959).
US Pat. 3.012.946 A961).
US Pat. 3.019.172 A962).
. US Pat. 3.050.446A962).
US Pat. 3.154.476A963).
Ger. Pat. 1,041.213A957).
McCormicJ. etal./'J. Am. Chem. Soc. 79. 4561 A957).
US Pat. 2.984.686A961).
US Pat. 3.026.354A962).
BlackwoodR. et al/'J. Am. Chem. Soc. 83, 2773 A961).
BlacfoxoodR etal.-'J. Am. Chem. Soc. 85. 3943 A963).
US Pat. 3.019.260A962).
Ger. Pat. 1.082.905A958).
US Pat. 3.200.149A965).
Ger. Pat. 1.793.556A961).
Ger. Pat. 1.298.522 A961).
US Pat. 3.148.212A964).
US Pat. 3.226.436A965).
US Pat. 3.345.410A967).
Ger. Pat. 1.245.942A962).
Church R. et al.//J. Org. Chem. 36, 723 A971).
MartellA. et al.//J. Med. Chem. JO. 44 A967).
Bernardi J. et al.//Farmaco Ed. Sci. 30, 736 A975).
US Pat. 2.449.866A948).
US Pat. 2.765.302A956),
US Pat. 2.868.779A959).
US Pat. 2,493.489A950).
Fried J et al/ J. Biol. Chem. 168, 391 A947).
243.
244.
245.
246.
247.
248.
249.
250.
251.
252
253.
254.
255.
256.
257.
258.
259.
260.
261.
262.
263.
264.
265.
266.
267.
268.
269.
270.
271.
272.
273.
275.
276.
277.
278.
279
280
281
282
283
284
Fried J et al.,7J. Biol. Chem. Г74, 57 A948).
Fried J et al./'J. Am. Chem. Soc. 69, 1549 A947).
Fried J. et al.//J. Am. Chem. Soc. 71, 2452 A949).
Fried J. et al./'J. Am. Chem. Soc. Д, 135 A949).
Peck R. et al.//J. Am. Chem. Soc. 70, 3968 A948).
US Pat. 2.799.620A957).
US Pat. 2.848.365A958).
US Pat. 3.108.996A963).
US Pat. 3.005.815A961).
US Pat. 3.022.228A962).
Waksman S. et al.//Science. 109, 305 A949).
PeckR. et al.//J. Am. Chem. Soc. 71, 2590 A949).
Regna P et al.//J. Am. Chem. Soc. 72, 1045 A950).
US Pat. 2.916.485A959).
US Pat. 2.895.876A959).
Brit. Pat. 880.035A959).
US Pat. 2.931.798A960).
US Pat. 2.936.307A960).
US Pat. 2.967.177A961).
US Pat. 3.032.547A962).
US Pat. 3.691.279 A972).
Ger. Pat. 2.514.985A975).
Ger. Pat. 2.361.115 A973).
Ger. Pat. 2.533.985 A974).
Okutani T. et al./'J. Am. Chem. Soc. 99, 1278 A977).
Tagaki Y et al./'J. Antibiot. 26, 403 A973).
Tanabe T. et al.//Tetrahedron Lett. 1977, 3607 .
Tagaki Y. et al./VBull. Chem. Soc. Japan, 49, 3649 A979).
US Pat. 3.091.572A963).
US Pat. 3.136.704A964).
Weinstein M. et al.//Antimicrob. Ag. Chemoter. 1963, 1.
Maehr H et al.//J. Am. Chem. Soc. 89, 6787 A967).
Nagabushan A. et al.//J. Org. Chem. 40, 2830 A975).
Meyer zu ReckendorfW. et al.//Ber. \Q5, 2546 A972).
ChmielewskiM et al.//Carbohyd. Res. 70, 275 A979).
Kawaguchi H. et al.//J. Antibiot. 25, 695 A972).
. Ger. Pat. 2.234.315A972).
.US Pat. 3.781.269A973).
US Pat. 3.974.137A976).
. Ger. Pat. 2.432.644A974).
.Ger. Pat. 2.716.533A977).
-682-
-683-
Глава 32
285 Ger Pat 2 818 822A978)
286 Ger Pat 2 818 992A978)
287 Ger Pat 2 462 485A974)
288 Ger Pat 2 437 160A974)
289 US Pat 4 029 882A977)
290 US Pat 4 002 742A973)
291 Wright J Chern Commun 1976, 206
292 US Pat 3 086 912A963)
293 US Pat 3 155 580A964)
294 US Pat 3 380 992A968)
295 US Pat 4 091 204A978)
296 US Pat 3 418 414A968)
297 US Pat 3 475 407A969)
298 US Pat 3 509 127A970)
299 US Pat 3 627 887A971)
300 US Pat 3 544 551 A970)
301 US Pat 3 513 155A970)
302 BirkenmeyerH et al /J Med Chem .13 616A970)
303 Magerlein В et al //Antimicrob Ag Chemoter 1966, 727
304 US Pat 2 483 871 A949)
305 US Pat 2 483 884A949)
306 US Pat 2 483 885A949)
307 US Pat 2 483 892A949)
308 US Pat 2 687 434A954)
309 US Pat 2 651 661A953)
310 US Pat 2 786 870A957)
311 LongL etal/J Am Chem Soc 71,2469A949)
312 RebstockM et al//J Am Chem Soc Д, 2458A949)
313 Belg Pat 539 991 A955)
314 Belg Pat 558 378A957)
315 Ger Pat 1 016 718A953)
316 US Pat 3 206 360A965)
317 US Pat 3 234 092A966)
318 US Pat 3 272 706A966)
319 US Pat 3 819 485A974)
320 Mason J et al//Antibiot & Chemoter Ц, 118 A961)
321 Berg} M et al //Antibiot & Chemoter Д, 661 A961)
322 Sinclair A et al'/Antimicrob Ag Chemoter 1961, 503
323 HoeksemaH et al' J Am Chem Soc 84,3212A962)
324 Wiley P et al' J Am Chem Soc 85, 2652 A963)
325 US Pat 3 067 099 A962)
-684-
Антибиотики
Mb Eur Pat Appl 145 484 A984)
327 Williamson M et al//J Am Chem Soc 84, 3212 A962)
328 Marshall F et al //J Med Chem 8, 18A965)
^29 Wenngs W etal /J Chem Soc Perkin Trans I 1972,443
330 Smith К et al '/J Chem Soc Perkin Trans I 1974, 2369
331 US Pat 3 342 810A967)
332 Ger Pat 2 846 321 A978)
333 Ger Pat 1089 513A959)
334 MaggiM et al/'Chemotherapia Д, 285A966)
335 US Pat 2 565 057A951)
336 US Pat 2 595 605A952)
337 US Pat 2 771 397A956)
338 US Pat 2 915 432A959)
339 US Pat 2 498 165A950)
0 US Pat 2 828246A951)
341 Johnson В et al//Science 102.376A945)
342 Anker H et al / J Bactenol 55, 249A948)
Глава 33
Антимикробные препараты
33.1. Сульфонамидные препараты и триметоприм
Сульфонамидные препараты являются группой синтетических ан-
антимикробных препаратов широкого спектра действия в отношении как
грамположительныч, так и грамотрицательных микроорганизмов, вве-
введенных в медицинскую практику еще до открытия пенициллинов.
СЧльфонамидные препараты являются производными сульфанила-
сульфаниламида (w-аминобензолсульфонамида), который является структурным
аналогом и-аминобензойной кислоты — компонента, необходимого
бактериям для синтеза фолиевой кислоты, — предшественника синтеза
пурина, нуклеиновых кислот и, особенно, ДНК.
H2N—^ ))—С-ОН
п-аминобензойная кислота
сульфаниламид
Клетки животных не способны сами синтезировать фолиевую ки-
кислот), и она должна поступать в их организм с пищей.
соон
фо.шевая кислота
Вместе с тем большинство бактерий не способны утилизировать
фолиев\ю кислот) экзогенного происхождения и самостоятельно осу-
осуществляют необходимый для жизнедеятельности синтез фолиевой ки-
кислоты. Эта разница между бактериальными и животными клетками
-686-
днтимикробные препараты
и является причиной избирательной токсичности сульфонамидов.
Сульфаниламид, имея структуру близкую к структуре и-аминобен-
зойной кислоты, конкурирует с н-аминобензойной кислотой за включе-
включение в молекулу фолиевой кислоты и, в итоге, занимая место и-амино-
и-аминобензойной кислоты, «мешает» биосинтез) фолиевой кислоты. В резуль-
результате «введенные в заблуждение» ферменты конструируют «ложную»
молекллу фолиевой кислоты, не способную выполнять жизненные
ф)нкции истинной фолиевой кислоты.
i—NH-CH
6 CH2
CH?
соон
«ложная фолиевая кислота»
Таким образом, с)льфонамиды являются бактериостатическими
препаратами, которые ингибируют рост бактерий путем вмешательства
в микробный синтез фолиевой кислоты. Точнее, сульфонамиды блоки-
блокируют биосинтетический путь синтеза фолиевой кислоты, конкурентно
ингибируя опосредованное ферментом дигидроптероат синтетазой пре-
превращение «-аминобензойной кислоты в фолиевую кислоту, что позволя-
позволяет считать их антиметаболитами.
В настоящее время в медицинской практике применяются различ-
различные с) тьфаниламидные препараты, выбор которых зависит от различ-
различных факторов и, в первую очередь, от типа возбудителя и течения забо-
заболевания, скорости всасывания препарата из ЖКТ и скорости его
выделения, его способности проникать в различные органы и ткани
и т. п.
Сульфонамиды имеют широкий спектр антимикробной активност,
включая Staphylococcus aureus, неэнтерококковые виды Streptococcus,
Lisle da monocytogenes, Nocardia, Neissena. Haemophilius influenzae, эн-
терические грамотрицательные виды Eschrrichia coh и Proteus mirabilis
и некоторые виды анаэробных бактерий. В первую очередь, сульфона-
сульфонамиды используются для лечения неосложненных инфекций мочеполо-
И'чо тракта, при инфекциях, вызванных Nocaria asteroides, стрептокок-
стрептококковых фарингитов, менингококковых заболеваниях, гоксоплазмозов
и тр.
При длительном применении к ним возникает резистентность. Бак-
териатьная резистентность к сульфонамидам может развиться в резуль-
-687-
Глава 33
тате м\таций, выражающихся либо в перепроизводстве л-аминобен-
зойной кислоты, либо в изменениях в самой дигидропротероат синтета-
зе, которая становится менее чувствительной к препаратам. Резистент-
ность может быть также опосредована нлазмидами, кодирующими
выработку дигидропротероат синтетазы или же пониженной проницае-
проницаемостью мембраны бактериальных клеток для препарата.
Четкой классификации сульфаниламидных препаратов в настоящее
время нет. Однако их группируют как системного (резорбтивного дей-
действия) и местного применения. Их подразделяют на короткодейст-
короткодействующие (сульфацетин, сульфадиазин, сульфамеразин, сульфаметазин,
сульфаметизол. сульфизоксазол); средней длительности действия
(сульфаметоксазол, сульфапиридин); долгодействующие (сульфаметок-
сипиридазин, сульфамтер), которые, однако, более не применяются
в качестве самостоятельных препаратов вследствие весьма редких, но,
тем не менее, встречающихся реакций гиперчувствительности. В число
препаратов для местного применения входят препараты для офтальмо-
офтальмологического применения (сульфацетамид, сульфизоксазол), вагинально-
вагинального применения (счльфабензамид, сульфацетамид, сульфатиазол, суль-
сульфизоксазол) и нар>жного применения (мафенид, сульфадиазин серебра).
Наконец, в эту группу входит и сульфасалазин (фталилсульфатиазол) —
препарат, действующий в просвете кишечника, но плохо всасываемый
из ЖКТ.
В химическом отношении, за редкими исключениями (например,
фт&зазол), сульфаниламидные препараты можно представить следую-
следующей простой формулой:
Синтезировано огромное число соединений этого типа, главным
образом, путем взаимодействия 4-ацетиламинобензолсульфохлорида
с различными аминами, преимущественно ароматического и гетероаро-
матического рядов, с последующим снятием защитной ацетильной
грчппы с аминной части молекулы либо взаимодействием 4-амино-
бензолсульфонамида с соответствующими ароматическими или гете-
роароматическими галогенпроизводными. Ввиду простоты исполнения
преимущественно пользуются первым методом. При выведении корре-
корреляции структура-активность было показано, чго свободная «-амино-
«-аминогруппа в бензольном кольце необходима для проявления антибактери-
-688-
Антимикробные препараты
альной активности и может быть замещена только такими группами,
которые позволяют обратную ее трансформацию в свободную амино-
аминогруппу. Наличие дополнительных заместителей в о- и ^-положениях
бензольного кольца снижает активность данного ряда соединений в ка-
качестве антибактериальных средств. Замещение одного из атомов водо-
водорода при атоме азота в сульфонамидной части молекулы приводит
к значительным изменениям и в активности, и в растворимости соеди-
соединений. Более того, природа заместителя при сульфонильном радикале
определяет антимикробную активность и фармакокинетические осо-
особенности каждого отдельно взятого соединения. Таким образом, при
наличии легкодоступного и многотоннажного продукта — 4-аие-
тиламинобензолсульфохлорида, получаемого взаимодействием ацети-
ланнлина с хлорсульфоновой кислотой, или же при наличии 4-ами-
нобензолсульфонамида, получаемого дальнейшим взаимодействием
4-аш иламинобензолсульфохлорида с аммиаком с последующим гидро-
гидролизом задача синтеза новых потенциальных сульфонамидов практиче-
практически сводится к получению новых гетероароматических аминов. Этими
путями получены рассматриваемые ниже наиболее широко применяе-
применяемые сульфонамиды.
Сульфацетин (Sulfacetin)
Сульфацетин — :\'-A-этил-1.2-дигидро-2-оксо-4-пиримидинил)-
сульфаниламид C3.1.5) получают взаимодействием 4-ацетилами-
нобензолсульфохлорида с 1-этилцитозином C3.1.3) с последующим
восстановительным дезацилированием ацетанилидной части моле-
молекулы C3.1.4) с использованием системы цинк-гидроокись натрия
в искомый сульфацетин. 1-этилцитозин C3.1.3), в свою очередь,
получают исходя из 3-этиламинопропионитрила, взаимодействием
которого с циановой кислотой (цианат калия — соляная кислота) на
первом этапе синтеза получают 1-B-цианоэтил)-1-этилмочевину
C3.1.1). Последняя в присутствии метилата натрия легко циклизу-
ется в 1-этил-5,6-дигидроцитозин, который с целью последующего
окисления ординарной связи C5-Q выделяют в виде гидробромида
C3.1.2). Оптимальным окислителем для этой цели оказался бром,
и при использовании в качестве растворителя нитробензола был по-
получен гетероароматический амин — 1-этилцитозин C3.1.3), кото-
который был трансформирован в искомый сульфаиетин описанным вы-
выше путем — взаимодействием с 4-ацетиламинобензолсульфохло-
ридом и последующим снятием защитной ацетильной группы
с аминной части молекулы [1, 2, 3, 4].
-689-
Глава 33
NC—CH;-CH2-NH-C2ri5
О
HjN-C
NC—CH2-CH/
33 1 1
1 CH3ONa
2 HBr
О
N-C2H5
0 N_^
I3-C-NH—4 V-SO2-NH—#" N-C2H5
Л— SO2-NH—V N-C2H5
33 1 5
Препарат эффективен при инфекциях, вызванных стрептококками,
гонококками, пневмококками, гонококками, стафилококками, а также
кишечной палочкой.
Сульфацетин применяют при пневмонии, церебральном менингите,
стафилококковом и стрептококковом сепсисе и других инфекционных
заболеваниях.
Синонимом препарата является реноквид.
Сульфадиазин (Sulfadiazin)
Сульфадиазин — 1Ч'-2-пиримидинилсульфаниламид C3.1.7) синтези-
синтезируют взаимодействием 4-ацтиламинобензолсульфохлорида с 2-ами-
нопиримидином с получением ацетанилидного производного C3.1.6),
последующий гидролиз которого щелочью приводит к получению
искомого с)льфадиазина [5, 6, 7, 8].
CH3-C-NH—& Л— SO2-CI " H2N—<,\ Л
СНз-C-NH—<^ ^—SO2-
зз 1 а
N-=\
H2N—L Ъ~ SO2-NH <\ Ъ
33 1 7
Гак же как и сульфацетин, препарат эффективен при инфекциях,
вызванных стрептококками, гонококками, пневмококками, гонококка-
гонококками, стафилококками, а также кишечной палочкой.
¦690-
Антимикробные препараты
Счльфадиазин применяют при пневмонии, церебральном менинги-
менингите, стафилококковом и стрептококковом сепсисе и других инфекцион-
инфекционных заболеваниях, однако он является препаратом выбора при нокар-
диозе. Ввиду м&пой растворимости и определенной нефротоксичности
препарат не рекомендуют при инфекциях мочеполового тракта.
Синонимами препарата являются ренковид, фламазин, стеринор, тер-
фонил и др.
В виде серебряной соли (сульфадиазин серебра) применяют в каче-
качестве наружного антибактеришгьного средства, в основном для лечения
ожоговых ран. Полагают, что наличие в молекуле препарата иона се-
серебра способствует усилению антимикробного и ранозаживляющего
действия.
Сулыраперазин (Sulfamerazin)
С\льфамеразин — 1\т|~D-метил-2-пиримидинил)сульфаниламид
C3.1.12) также получают описанным выше способом — взаимо-
взаимодействием 4-ацтиламинобензолсульфохлорида с 2-амнно-4-мегил-
пиримидином C3.1.10), который, в свою очередь, получают по тра-
традиционной схеме синтеза производных пиримидина. Конденсацией
ацетоуксусного эфира с гуанидином получают 4-метил-2-амино-
ниримидин-6-он C3.1.8). Взаимодействием последнего с хлороки-
сью фосфора получают 4-метил-2-амино-6-хлорпиримидин C3.1.9).
Далее восстановлением водородом с использованием в качестве ка-
катализатора палладия на угле удаляют атом хлора при С6 пиримиди-
нового кольца, Полученный 4-метил-2-аминопиримидин C3.1.10)
вводят во взаимодействие с 4-ацтиламинобензолсульфохлоридом
с получением ацетанилидного производного C3.1.11), последую-
последующий гидролиз которого щелочью приводит к получению искомого
счльфамеразина [8. 9, 10].
L3
Так же как и все рассматриваемые сульфаниламиды, препарат эф-
эффективен при инфекциях, вызванных стрептококками, гонококками,
-691 -
Глава 33
пневмококками, гонококками, стафилококками, а также кишечной па-
палочкой.
Синонимами препарата являются досульфин, полагин, ромезин и др.
Сульфаметазин (Sulfamethazine)
Сульфаметазин — ?\Г'-D,6-диметил-2-пиримидинил)сульфаниламид
C3.1.13) также предложено получать описанным выше способом —
взаимодействием 4-ацетиламинобензолсульфохлорида с 2-амино-
4.6-диметилпиримидином, который, в свою очередь, получают кон-
конденсацией ацетилацетона с гуанидином и последующим гидроли-
гидролизом ацетиламинной группы щелочью [11, 12, 13, 14, 15].
Г3
33 1 13
Препарат применяют при пневмококковых, стафилококковых и стреп-
стрептококковых инфекциях, а также при сепсисе, гонорее и других инфекци-
инфекционных заболеваниях.
Синонимами препарата являются сульфадимезин, сульфадимидин.
Сульфаметизол (Sulfamethizole)
Сульфаметнзол — М'-E-метил~1,3,4-тиадиазол-2-ил)сульфанила-
мид C3.1.15) предложено получать двумя путями. Согласно перво-
первому способу, 5-амино-2-метил-1,3,4-тиадиазол вводят во взаимодей-
взаимодействие с 4-нитробензхолсульфохлоридом с получением нитропро-
изводного C3.1.14), который восстанавливают с помощью железных
стружек в уксусной кислоте до искомого сульфаметизола.
— гчн-^^-с
N-N
-692-
Антимикробные препапяты
Второй способ получения сульфаметизола заключается во взаимо-
взаимодействии 4-ацетиламинобензолсульфохлорида с тиосемикарбазоном
aueiальдегида последующей окислительной циклизации продукта
C3 1.16) в замещенный 1,3,4-тиадиазол в присутствии феррицианида
калия в щелочи с одновременным снятием защитной ацетильной груп-
группы [ 16. 17].
N-N=Ch-CH3
Препарат обладает антибактериальной активностью в отношении
стрептококков пневмококков, стафилококков, менингококков и гоно-
гонококков, кишечной палочки, возбудителя дизентерии и др. Малотокси-
Малотоксичен. В основном применяют при острых неосложненных инфекциях
мочеполового тракта, вызванных чувствительными микроорганизмами.
Ввиду его быстрого вывода из организма почками, уровень препарата
в плазме остается низким, и поэтому препарат не используется для ле-
лечения инфекций локализованных вне мочеполового тракта. Более пред-
предпочтительным препаратом является сульфизоксазол.
Синонимами препарата являются \росол, руфол, тиосульфил и др.
Сульфизоксазол (Sulfizoxazole)
Сульфизоксазол — 1^'-C,4-диметил-5-изоксазолил)сульфаниламид
C3.1.19) синтезируют, вводя во взаимодействие 4-ацетилами-
нобензолсульфохлорид и 5-амино-3,4-диметилпзокс-азол C3.1.17).
который, в свою очередь, получают гетероциклизацией 2-метнл-
ацетилацетонитрила с гидроксиламином и последующим кислот-
кислотным гидролизом соляной кислотой защитной ацетильной группы
в полученном продукте C3.1.18) [18, 19].
jj. H2NOH
снь
33 1 17
-693-
Глава 33
сн3
о
сн3
CH3
HCI
СНз-C-NH-^ Л—So2 —|
33 1 18
Как и все рассматриваемые сульфаниламиды, препарат эффективен
при инфекциях, вызванных стрептококками, гонококками, пневмокок-
пневмококками, гонококками, стафилококками, а также кишечной палочкой. Од-
Однако после орального применения около 90 % его связывается с протеи-
протеинами плазмы, и препарат распределяется по большинству тканей и
тканевым жидкостям, вследствие чего он является препаратом выбора
для многих системных инфекций.
Синонимами препарата являются гантрисин. фултрексин, сульфа-
зан. сульфолар и др.
Сульфаметоксазол (Sulfamethoxazole)
Сульфаметоксазол — К!-E-метил-3-изоксазолил)сульфаниламид
C3.1.20) получают по совершенно аналогичной схеме, но с исполь-
использованием в качестве гетероциклической компоненты З-амино-5-ме-
тилизоксазола [20].
-SO2—NH
Ьч
33 1 20
Так же как и сульфизоксазол, препарат эффективен при инфекциях,
вызванных стрептококками, гонококками, пневмококками, гонококка-
гонококками, стафилококками, а также кишечной папочкой. В отличие от сульфи-
зоксазола, после орального применения лишь около 70 % его связывает-
связывается с протеинами плазмы, и препарат распределяется по большинству
тканей и тканевым жидкостям. Однако, поскольку его выделение про-
происходит значительно медленнее, чем у сульфизоксазола, он не требует
частого введения и также является препаратом выбора для многих сис-
системных инфекций. Более того, он является составной частью комбини-
комбинированного препарата, называемого бактрим, бисептол и др.. который
будет рассмотрен ниже с фиксированным соотношением с тримето-
примом.
Синонимами препарата являются гантонол, синоми, сульфизоме-
зол и др.
-694-
днтимикробные препараты
О1.1ьфапиридин (Sulfapyridin)
Сульфапиридин — М'-B-пиридил)сульфаниламид C3.1.21) также
пол\ чают по аналогичной схеме исходя из 4-ацетиламинобен-
золсульфохлорид и 2-аминопиридина [21, 22, 23].
Как и все сульфаниламиды, препарат обладает антибактериальной
активностью в отношении стрептококков пневмококков, стафилокок-
стафилококков, менингококков и гонококков, кишечной палочки, возбудителя ди-
дизентерии и др. Является препаратом длительного действия.
Синонимами препарата являются бациллопирин, плюразол, суль-
сульфидин, гиасептол.
Су, гьфасалазин (Sulfasalazin)
С) льфасалазин — 5-[и-[D,6-диметил-2-пиридинил)сульфамоил]-
фенилазо]салициловая кислота C3.1.22) является производным
списанного выше с}лфапиридина и одним из тех немногих сульфа-
сульфаниламидов, в которых свободная аминогруппа в бензольном кольце
модифицирована; получают реакцией азотосочетания диазониевой
соли, полученной взаимодействием сульфапиридина C3.1.21) с азо-
шсгой кислотой, с салициловой кислотой в щелочи [24, 25].
1 NaNO2 2
Препарат обладает антибактери&чьной активностью в отношении
некоторых кокков и кишечной палочки. Одновременно оказывает вы-
выраженный лечебный эффект у больных неспецифическим язвенным ко-
тигом. что объясняется отщеплением в организме 5-аминосалициловой
кислоты и сулфапиридина. обладающих противовоспалительным и ан-
шбактериапьными свойствами. Применяют при язвенном колите, хро-
хроническом ревматоидном артрите и острых, и подострых воспалитель-
воспалительных заболеваниях.
Синонимами препарата являются салазопирин, салазосульфапири-
fSit! И др.
-695-
Гпава 33
Фталилсульфатиазол (Phtalylsulfathiazole)
Фталилсульфатиазол — AЧ4-фталоилсульфаниламидо)-тиазол C3.1.24)
также является одним из тех сульфаниламидов, в которых свобод-
свободная аминогруппа в бензольном кольце модифицирована, чем, оче-
очевидно, и объясняется локализация места их действия. Препарат по-
получают взаимодействием сулфатиазола C3.1.23), синтезируемого по
стандартной схеме исходя из 4-ацетиламинобензолсульфохлорида
и 2-аминотиазола, с фгалевым ангидридом [26, 27].
Как и другие сульфаниламиды, препарат обладает антибактериаль-
антибактериальной активностью в отношении стрептококков, пневмококков, стафило-
стафилококков, менингококков и гонококков, кишечной палочки, возбудителя
дизентерии и др. Фталазол медленно всасывается из ЖКТ, и его основ-
основная масса при пероральном применении задерживается в кишечнике,
где он медленно расщепляется. При этом, как и в случае с сульфасала-
зином, создается высокая концентрация сульфаниламида в кишечнике,
чем и объясняется его большая активность в отношении кишечных ин-
инфекций. Препарат применяют при дизентерии, колитах, гастроэнтеритах
и при оперативных вмешательствах на кишечнике для предупреждения
гнойных осложнений.
Синонимами препарата являются фталазол, энтерозол, сульфазол,
талазол и многие другие.
Сульфадоксин (Sulfadoxin)
Сульфадоксин — 4.5-диметокси-6-сульфаниламидопиримилдин
C3.1.33) синтезируется по стандартной схеме исходя из 4-ацетил-
аминобензолсульфохлорида и 4-амино-5,6-диметоксипиримидина.
Однако любопытен сам синтез 4-амино-5,6-диметоксипиримидина
C3.1.31), исходящий из метилового эфира метоксиуксусной кисло-
кислоты. Взаимодействием последнего с диметнловым эфиром щавеле-
щавелевой кислоты в присутствии метилата натрия синтезируют метокси-
производное C3.1.25), пиролизом которого получают ди.метиловый
эфир метоксималоновой кислоты C3.1.26). Взаимодействием по-
последнего с аммиаком получают диамид метокснмалоновой кислоты
C3.1.27). Гетероцпклизацией последнего взаимодействием с фор-
-696-
Антимикробные препараты
мамидом в присутствии этилата натрия получают 4.6-диокси-5-
мегоксипиримидин C3.1.28), который далее трансформируют
в 4,6-дихлор-5-метоксипиримидин C3.1.28). Подвертя полученный
4,6-дихлор-5-метоксипиримидин C3.1.29) действию аммиака, полу-
получают 4-амино-6-хлор-5-метоксипиримидин C3.1.30), и далее взаи-
взаимодействием полученного соединения с метилатом натрия получа-
получают искомый 5,6-диметокси-5-аминопиримидин C3.1.31). Взаимо-
Взаимодействием последнего с 4-ацетиламинобензолсульфохлоридом и по-
последующим гидролизом ацетильной группы в 33.1.32 получают
сульфадоксин [28, 29, 30, 31].
СНзООС-СОССЬз
СН3ООС-СО—СН-СООСНз
33 • 25
СН3ООС—Cri~CCOCh5
33 - 26
NH2 SH;
33 1 27
33 1 29
По антибактериальному действию препарат аналогичен другим
сульфаниламидам, однако обладает весьма длительным, пролонгиро-
пролонгированным, действием. Время его полужизни составляет от 120 до 200 ч.
Сульфадоксин применяют при инфекционных заболеваниях, вызван-
вызванных чувствительными к сульфаниламидным препаратам микроорга-
микроорганизмами, — инфекциях органов дыхания, желчевыводяших и мочевых
путей гнойных инфекциях различной локализации, при остеомиелите,
синусите и других инфекциях. Применяется в комбинации с противома-
противомалярийными препаратами.
Синонимами препарата являются сульформегоксин, фанасил, фан-
си дар.
Сульфалеп (Sulfalen)
Сульфален — З-метокси-2-сульфаниламидопиразнн C3.1.41) так
же, как и другие сульфаниламиды, синтезируется по стандартной
схеме исходя из 4-ацетиламинобензолсульфохлорида, который вво-
вводят во взаимодействие с З-амнно-2-метоксипиразином, синтез кото-
-697-
Глава 33
рого предложено осуществлять двумя технологически реализуемы-
реализуемыми путями. Первый способ заключается в бромировании 2-ами-
нопиразина с использованием в качестве растворителя уксусной
кислоты с получением 3,5-дибром-2-аминопиразина C3.1.34).
Взаимодействием последнего с метилатом натрия получают 3-мето-
кси-5-бром-2-аминопиразин C3.1.35). Восстановлением водородом
с использованием в качестве катализатора палладия на угле атом
брома продукта в положении С5 замещают на атом водорода с по-
получением З-метокси-2-аминопиразина C3.1.36). Согласно второму
способу, З-метокси-2-аминопиразин C3.1.36) предложено получать
исходя из З-гидроксипиразин-2-карбоксамида. Взаимодействием
последнего с хлорокисью фосфора замещают гидроксильную груп-
группу на хлор, и одновременно подвергают дегидратации карбокса-
мидную группу с получением З-хлор-2-цианопиразина C3.1 37).
Далее взаимодействием с метилатом натрия получают 3-метокси-
2-цианопиразин C3.1.38) Цианогруппу в последнем гидролизуют
щелочью в присутствии перекиси водорода до карбоксамидной
с получением З-метокси-2-карбоксамидопиразина C3.1.39). Полу-
Полученный продукт подвергают перегруппировке Гофмана действием
гипохлорита натрия с получением искомого З-метокси-2-амино-
пиразина C3.1.36). Взаимодействием последнего с 4-ацетиламино-
бензолсульфохлоридом и последующим гидролизом ацетильной
группы щелочью в 33.1.40 получают сульфален [32, 33, 34].
CH3ONa
ri2 Pd—С
or
^C0-N42
^M' '"OH
УСсн
33 1 37
CH3ONa
.CO-NH2
3J 4.
-698-
Антимикробные препараты
Сульфален также является бактериостатическим сульфаниламидом
очень длительного действия с широким спектром антимикробной ак-
активное ги. Применяют по тем же показаниям, что и сульфадоксин. Вре-
Время его полужизни также составляет около 150-200 ч. Препарат в мень-
меньшей степени, чем др>гие сульфаниламиды, связывается с протеинами
плазмы, что обеспечивает его высокую концентрацию в крови в свобо-
свободой форме. Поэтому при профилактическом применении (при хрониче-
хронических заболеваниях легких, ревматизме, болезнях почек и мочевыводя-
ших путей) сульфален можно назначать даже один раз в неделю в один
прием.
Синонимами препарата являются келфизин, сульфаметопиразин,
сульфаметоксипиразин и др.
Сульфаметоксипиридазин (Sulfamethoxypyridazine)
Сульфаметоксипиридазин — \1'-F-метокси-3-пиридазинил)сульфа-
ниламид C3.1.43) получают замещением атома хлора в 6-хлор-3-D-
аминобензолсульфониламидо)пиридазине на метоксигруппу C3.1.42)
с использованием метилага натрия. Исходный же 6-хлор-3-D-ами-
нобензолсульфониламидо)-пиридазин C3.1.42), в свою очередь, по-
получают взаимодействием 4-аминобензолсульфаниламида с легко-
легкодоступным 3,6-дихлорпиридазином [35, 36].
c-Q-c,
Препарат обладает антибактериальной активностью в отношении
некоторых кокков и кишечной палочки. Препарат обладает длительным
действием Применяют для лечения пневмонии, бронхитов, тонзилли-
тонзиллитов, гнойных отитов и менингитов, гнойных инфекций мочеполового
тракта, дизентерии и др.
Синонимами препарата являются сульфапиридазин, суфалекс, рета-
сульфон и многие другие.
Сульфацетамид (Sulfacetamid)
Сульфацетамид — N'-ацетилсульфаниламид C3.1.44) получают ли-
либо прямым алкилированием ацетамида 4-аминобензолсульфохло-
ридом, либо взаимодействием 4-аминобензолс>льфонамида с уксус-
уксусным ангидридом и последующим селективным восстановительным
дезацилированием полученного ацетамида C3.1.45) с использова-
использованием системы цинк-гидроокись натрия [37, 38].
-699-
Глава 33
-SO2-CI
H2N-CO-CH3
(CH3COJO
CH3CONH
33 1 44
V-SO2-NHCOCH3
33 1 45
Препарат обладает антибактериальной активностью в отношении
стрептококков, пневмококков, стафилококков, менингококков и гоно-
гонококков. Применяют для лечения пневмонии, гнойных трахеобронхитов,
инфекций мочеполового тракта, при гонорейных заболеваниях глаз но-
новорожденных и взрослых и др.
Синонимами препарата являются альбуцид, цетамид, пронтамид,
себизон и др
Сульфабензамид (Sulfabenzamid)
Сульфабензамид — М'-бензоилсульфаниламид C3.1.46) получают
аналогично сульфацетамиду [38, 39, 40, 41].
H2N—6 Л—SO2-NHCOC6H5
33 1 46
Применяют по тем же показаниям, в основном в виде мазей, при ва-
вагинальных инфекциях.
Синонимом препарата является сульфабензид.
Мафенид (Maphenid)
Мафенид — «-(аминометил)-бенолсульфамид C3.1.48) — препарат,
структурно несколько отличающийся от всех рассмотренных выше пре-
препаратов тем. что аминогруппа в параположении к с\льфонамидной от-
отдалена от бензольного кольца на одну метиленовую группу. Синтез
препарата осуществляют исходя из ТЧ-бензилацетамида, последователь-
последовательным взаимодействием которого с хлорсульфоновой кислотой и далее
с аммиаком получают 4-ацетамидометил)-бензолс\льфонамид ^33.1.47).
Гидролизом последнего шелочью получают мафенид [42, 43, 44].
-700-
днтимикробные препараты
Ch3CONHCH2-
CH3CONHCH;,—<> у— SO2-Nrt2
33 147
Синонимами препарата являются марфанил, мезудин, амбамид, сеп-
тицид и др.
В настоящее время наиболее широко используются сульфизоксазол,
сульфаметоксазол, сульфадиазин, сульфаметизол и трисульфапирими-
дины (смесь сульфамеразина, сульфаметазина и сульфадиазина). Пер-
Первые два из отмеченных препаратов используются наиболее широко.
Долгодействующий сульфонамид — сульфадиоксин применяется толь-
только в комбинации с пириметамином (антагонистом фолиевой кислоты)
для профилактики и лечения тропической лихорадки.
В комбинации с пириметамином или триметопримом сульфанила-
сульфаниламиды активны в отношении некоторых протозойных инфекций, вклю-
включая Toxoplasma, Plasmodium falciparum и Pneumocystis carinii.
Диаминомиримидины
Диаминомиримидины — триметоприм и пириметамин — являются
антибактериальными синтетическими препаратами, ингибиторами ди-
гидрофолатредуктазы, которые используются как самостоятельно, так
и в комбинации с сульфаниламидами, в частности, с сульфаметоксазо-
лом (котримоксазолом, бактримом, бисептолом, сульфатримом и мно-
многими другими).
Собственно диаминомиримидины (триметоприм, пириметамин)
были предложены в качестве лечебных и профилактических средств
против малярийных инфекций. Показано, что все сильные ингибиторы
яигидрофолатредуктазы могут вывести из строя малярийный паразит
с относительно малыми последствиями на хозяина.
Близкое структурное сходство этих препаратов, а также структур-
структурное сходство между птеридиновым кольцом фолиевой кислоты и диа-
минопиримидиновым фрагментом пириметамина скорее всего является
причиной сродства этих соединений к рецептивному участку дигидро-
фолатредуктазы.
Все эти соединения являются ингибиторами дигидрофолатредук-
тазы в бактериях, плазмодиях и человека. К счастью, они имеют зна-
-701 -
Глава 33
чительно большее сродство к бактериальным и протозойным дигид-
рофолатредуктазам. Пириметамин, jc примеру, ингибирует дигидро-
фолатредуктазу паразита при концентрациях в несколько сотен раз
ниже, чем это требуется для ингибирования дигидрофолатредуктазы
человека. Это и является основой их селективной токсичности. Се*
лективная токсичность может быть повышена при снабжении орга-
организма хозяина фолиевой кислотой, которую паразит не в состоянии
использовать.
Таким образом, триметоприм в организме действует путем вмеша-
вмешательства в действие дигидрофолатредуктазы — фермента, восстанавли-
восстанавливающего дигидрофолиевую кислоту в тетрагидрофолиевую. Эта про-
процесс необходим для биосинтеза живыми организмами пуринов и,
соответственно, ДНК. Восстановление дигидрофолиевой кислоты в тет-
тетрагидрофолиевую у людей также катализируется дигидрофолатредукта-
зой. Однако триметоприм имеет во много тысяч раз больший ингиби-
рующий эффект в отношении бактериальных ферментов, чем в отноше-
отношении аналогичных ферментов млекопитающих, что и является основным
преимуществом триметоприма.
Различные сульфонамиды ингибируют одну из стадий этого био-
биосинтетического пути внедрением вместо n-аминобензойной кислоты
в дигидрофолиевую кислоту сульфаниламида. Последовательная блока-
блокада одного и того же биосинтетического пути двумя препаратами —
сульфаниламидом и триметопримом одновременно — отличается высо-
высокой степенью синергичности по отношению к широкому спектру мик-
микроорганизмов.
В сочетании триметоприма с сульфометоксазолом проявляется
очень сильный его эффект по отношению ко многим микроорганизмам.
Причем оптимальным считается сочетание сульфаметоксазола и триме-
триметоприма 20:1. Это соотношение в плазме достигается применением пре-
препаратов, в которых это соотношение равно 5:1. Конечно, эти соотноше-
соотношения можно широко варьировать, однако наличие триметоприма в смеси
с сульфаниламидом является залогом успеха при лечении.
Триметоприм (Trimethoprim)
Триметоприм — 2,4-диамино-5-C',4',5'-триметоксибензил)пири-
мидин C3.1.51) предложено получать различными путями. Первый
способ синтеза исходит из этилового эфира 3,4,5-триметоксидигид-
рокоричной кислоты, формилированием которой этилформиатом
с использованием в качестве основания натрия получают енол по-
полуальдегида 3',4',5'-триметоксибензилмалонового эфира C3.1.49),
который вводят в реакцию гетероциклизации с гуанидином с полу-
-702-
Антимикробные препараты
чением 2-амино-4-гидрокси-5-C|,4|,5|-гриметоксибензил)пирими~
дина C3.1.50). Последовательным замещением гидроксильной
группы в последнем на хлор с применением хлорокиси фосфора
и далее на аминогруппу с использованием аммиака получают иско-
искомый триметоприм [45, 46, 47].
ПСООС2Н5
СН3О
СН3О
POCI3
H2N
33 1 50
СН3О
33 1 51
Все остальные способы синтеза исходят из 3,4,5-триметоксибенз-
альдегида. Согласно второму способу, конденсируя 3,4,5-тримето-
ксибешальдегид с 3-этокси- или 3-анилинопропионитрилом получают
соответствующее бензилиденовое производное C3.1.52), непосредст-
непосредственное взаимодействие которого с гуанидином приводит к получению
тримеюприма [48, 49, 50, 51].
---W-o
ОС-Н;
(NHC6h5
(NHC6HS)
Согласно третьему способу, триметоприм предложено получать
гакже конденсацией 3.4,5-триметоксибензальдегида с динитрилом ма-
лоновой кислоты по Кневенгелю с получением илиденового производ-
производного C3.1.53), которое частично восстанавливают водородом с исполь-
использованием в качестве катализатора палладия на угле до енамина C3.1.54),
который взаимодействием с гуанидином трансформируется в тримето-
триметоприм [52, 53].
•CH=<
CH3O
GH3O
"h-NH2
-703-
Глава 33
Nh
X
H2N'^NH2
СН3О
33 1 51
Наконец, триметоприм предложено получать четвертым спосо^
бом, предусматривающим в качестве первого шага также конденсацию
по Кневенгелю 3,4,5-триметоксибензальдегида, но уже с эфиром циа-i
нуксусной кислоты с получением илиденового производного C3.1.55).
Двойную связь в последнем восстанавливают водородом над палладием
на угле с получением З'д'р'-триметоксибензилциануксусного эфира
C3.1.56). Вводя последний в реакцию гетероциклизации с гуанидином,
получают искомый триметоприм [54, 55].
;t-3o
4>-
H.2N
N4
CH3>
сн3одх
ch^o
-Nri2
1 POCI3
2 н2; Pd-c
Триметоприм имеет широкий спектр антимикробной активности.
Он в 20- 100 раз более активен в отношении большинства бактериаль-
бактериальных видов, чем сульфаметоксазол. Триметоприм активен по отношению
к таким грамположительным аэробным бактериям, как Staphyiococcus
aureus, Staphyiococcus epidermidis, к различным видам Streptococcus
и Listeria monocytogenes. Против видов Nocardia триметоприм уступает
сульфонамидам.
Триметоприм активен по отношению к таким грамотрицательным
аэробным бактериям, как большинство Е. coli, Enterobacter, Proteus,
Klebsiella, Providencia, Morganella. Serratia marcescens, Citrobacter,
Salmonella, Shigella, Yersinia enterocolitica, чувствительным к тримето-
приму.
Триметоприм активен также по отношению к Legionella,
Acinetobacter, Vibrio, Aeromonas, Pseudomonas maltophila, Pseudomonas
cepacia, однако Pseudomonas aernginosa резистентна по отношению
-704-
днтимикробные препараты
к триметоприму.
Haemophilus influenzae и Haemophilus ducreyi чувствительны к три-
триметоприму. Патогенные Neisseria (менингококки и гонококки) и Branha-
mella catarrhalis умеренно резистентны к триметоприму, однако очень
чувствительны к сочетанию триметоприм-сульфаметоксазол. Анаэробные
бактерии в общем резистентны к триметоприму, в то время как сочетание
триметоприм-сульфаметоксазол воздействует и на них. К этому сочета-
сочетанию чувствительны и все виды Pneumocystis carinii.
Бактериальная резистентность к триметоприму может возникать
по ряду причин: неспособности препарата проникнуть сквозь мем-
мембранную оболочку (Ps. aeruginosa); наличие дигидрофолатредуктазы,
не чувствительной к ингибированию триметопримом; перепроизвод-
перепроизводство дигидрофолатредуктазы и мутации, выражающейся в тиминовой
зависимости, когда организму требуется экзогенный тимин для синте-
синтеза ДНК, т. е. обход метаболической блокады, вызываемой тримето-
триметопримом.
Резистентность к комбинации триметоприм-сульфаметоксазол
всегда ниже чем к любому из этих препаратов, используемых по от-
отдельности.
Эта комбинация препаратов, коммерческими названиями которых
являются котримоксазол, бактрим, бисептол, сульфатрим и многие дру-
другие, применяется при лечении инфекций дыхательных путей, инфекци-
инфекциях мочеполового тракта, желудочных инфекциях, хирургических ин-
инфекциях, энтеритах, менингитах и прочих болезнях.
Пириметамин (Pyrimethamin)
Пириметамин — 2,4-диамино-5-D'-хлорфенил)-6-этилпиримидин
C3.1.60) получают исходя из 4-хлорбензилцианида, конденсацией
которого с метиловым эфиром пропионовой кислоты в присутствии
метилата натрия получают Р-кетонитрил C3.1.58). Взаимодействи-
Взаимодействием последнего с ортомуравьиным эфиром получают метоксимети-
леновое производное C3.1.59), гетероциклизацией которого в пи-
пиримидин с использованием в качестве бинуклеофила гуанидина
получают искомый пириметамин C3.1.60) [55, 56, 57, 58, 59, 60].
-СН2-С=М
о
С2Н5 О-СН3
CH3ONa
С=О НС(ОСН3)з
CEN
-705-
Глава 33
с2н5
\
C-O-Chj
H2N
NH
А
33 1 59
Пириметамин, являясь антагонистом фолиевой кислоты, оказывает
противомикробное действие в отношении возбудителей малярии, обла-
обладает споронтоцидным действием. Препарат эффективен также в отно-
отношении возбудителя токсоплазмоза. Применяется для профилактики ма-
малярии и лечения токсоплазмоза.
33.2. Хинолоны
Хинолоны являются группой структурно сходных антимикробных
препаратов, проявляющих высокую активность против многих микро-
микроорганизмов.
Формально первым представителем нового класса антимикробных
препаратов, называемых препаратами ряда хинолонов, будучи произ-
производным нафтиридина. явилась налидиксовая кислота (невиграмон), ко-
которая была синтезирована в 1962 г. и была предложена для лечения ин-
инфекций мочеполового тракта. Основной спектр ее действия включает
грамотрицательные бактерии. Препарат эффективен также в отношении
кишечной палочки, протея, клебсиелл, шигелл, сальмонелл. В после-
последующие годы был синтезирован и ряд других химически сходных со-
соединений, таких как оксолиновая кислота (собственно производное хи-
нолона) и ииноксацин (производное циннолина), однако все они имели
относительно узкий антимикробный спектр.
.соон
С2Н5
налидиксовая кислота
соон
оксолиновая кислота
циноксацин
Огромный прогресс был достигнут в 1980-х годах, и он был связан с
введением в положение Со молекулы 4-хинолонов атома фтора, а в по-
положение С- — пиперазинового фрагмента. Введение атома фтора в ука-
указанное положение резко увеличило активность препаратов в отношении
грамположитедьных микроорганизмов и расширило их спектр действия,
-706-
Антимикробные препараты
включив в него и грамотрицательные микроорганизмы. Введение пипе-
разипового фрагмента в положении С7 обеспечило активность группы
препаратов и в отношении Pseudomonas aeruginosa. Заместители при
атоме азота хинолоновой структуры и в пиперазиновом кольце могут
варьировать от препарата к препарату.
Все фторхинолоны, применяемые на практике (ципрофлоксаин,
эноксацин, норфлоксацин, офлоксацин), имеют примерно одинаковый
антимикробный спектр действия, включающий большинство аэробных
грамотрицательных и некоторые грамположительные бактерии. Фтор-
Фторхинолоны высокоактивны против большинства энтеробактерий, вклю-
включая Escherichia coli, Enterobacter, Proteus mirabilis, Proteus vulgaris,
Morganella morganii, Providencia, Citobacter и Setratia. Они активны
также в отношении Pseudomonas aeruginosa, включая штаммы, устой-
устойчивые к другим антибактериальным препаратам. К фгорхинолонам чув-
чувствительно большинство штаммов Acinetobacter аэробных грамотрица-
тельных микроорганизмов. Фторхинолоны высоко активны против
большинства грамотрицательных бактериальных патогенов ЖКТ:
Shigella, Salmonella, Yersinia enterocolitica, Aeromonas species и Vibrio
species. Грамотрицательные коккобактерии Haemophilus influenzae,
Haemophiius ducreyi и грамотрицательные кокки Neisseria meningitides,
!\'eisse-ria gonorrhoeae, Moraxella также очень чувствительны к фторхи-
нолонам.
Фторхинолоны активны и в отношении большинства грамположи-
грамположительных бактерий, Staphylococcus aureus, Staphylococcus epidermidus,
хотя применяемые при этом концентрации должны быть несколько вы-
выше чем для грамотрицательных бактериальных патогенов.
Фторхинолоны являются мощными бактерицидными препаратами,
которые изменяют структуру и функции бактериальной ДНК, воздейст-
в\я на активность ферментной ДНК-гиразы (топоизомеразы И). Этот
фермент ответственен за отрицательные суперспиральные скручивания
(отрицательные суперспирали) в ковалентно закрытую циркулярную
ДНК, а также за разрыв и повторное соединение (катенация, декатена-
декатенация) ДНК-витков, замкнутых связями в цепь. ДНК-гираза способна рас-
расположить бактериальную ДНК, имеющую примерную длину в 1300 цт,
скажем в Escherichia coli, внутри клетки размером от 2 до 3 цт. Этот
фермент необходим для репликации, восстановления, транскрипции
определенных оперонов ДНК. ДНК-гираза состоит из двух А и двух В
с>бъединиц. Хинолоны воздействуют непосредственно на работу субъ-
едпницы А.
Как уже было отмечено, препараты этого ряда имеют сходный ан-
шмнкробный спектр, включающий большинство аэробных грамотрица-
-707-
Глава 33
тельных и некоторые грамположительные бактерии. Специфическая
разница в активности этих препаратов отмечается по отношению к не-
некоторым конкретным микроорганизмам, их относительной токсичности,
фармакокинетическим особенностям и т. п. Например ципрофлоксацин
и норфлоксацин имеют сходный антимикробный спектр, однако в зави-
зависимости от типа микроорганизмов норфлоксацин может оказаться сла-
слабее от 2 до 8 раз.
Выявлены два механизма резистентности по отношению к фторхи-
нолонам: изменение субъединицы А ДНК-гиразы и понижение прони-
проницаемости внешней мембраны бактерий. Резистентность опосредуется
хромосомами, а не плазмидами бактерий. Возникновение резистентно-
резистентности во время применения препаратов встречается крайне редко.
Ввиду своих фармакокинетических особенностей (выраженной
биодоступности при пероральном применении, распределения по тка-
тканям и проникновения в них, широкого спектра антибактериальной ак-
активности и др.) фторхинолоны имеют значительный потенциал для ле-
лечения инфекций практически любой анатомической локализации.
Фторхинолоны весьма эффективны при лечении инфекций дыхатель-
дыхательных путей, мочеполового тракта, костей, кожи и мягких тканей и др.
Налидиксовая кислота (Nalidixic Acid)
Налидиксовая кислота — 1-этил-1,4-дигидро-7-метил-4-оксо-1,8-
нафтиридин-3-карбоновая кислота C3.2.4) получают синтезом, пре-
предусматривающим на первой стадии взаимодействие 2-амино-6-
метилпиридина и этоксиметиленмалонового эфира, в результате че-
чего получается продукт замещения C3.2,1), который при нагревании
циклизуется в этиловый эфир 4-гидрокси-7-метил-1,8-нафтиридин-
3-карбоновой кислоты C3.2.2). Гидролизом последнего щелочью
получают соответствующую кислоту C3.2.3). Алкилированием по-
последней этилйодидом в присутствии гидроксида калия получают
налидиксовую кислоту [60, 61. 62. 63, 64].
.COOC2rl5
CH3' ~N' N
33 2 3
СН3N N
с2н5
,3 2 4
-708-
Антимикробные препараты
Налидиксовая кислота действует бактерицидно или бактериостати-
ческн в зависимости от чувствительности микроорганизма и концентра-
концентрации. Препарат эффективен в отношении грамотрицательных микроор-
микроорганизмов: кишечной палочки, сальмонелл, шигелл, протея, палочки
Фридлендера. Применяют при пиелонефрите, цистите, уретрите, про-
простатите, инфекциях ЖКТ.
Синонимами препарата являются нефам, невиграмон, уралгин, уро-
грам, винтрон и многие другие.
Оксолиновая кислота (Oxolinic acid)
Оксолиновая кислота — 5-этил-5,8-дигидро-8-оксо-1-диоксоло[4,5-
g]-xинoлlIH-7-кapбoнoвaя кислота C3.2.9), в принципе, получается
по аналогичной налидиксовой кислоте схеме синтеза, однако исхо-
исходящей в качестве ароматической аминной компоненты не из 2-ами-
но-6-метилпиридина, как в случае налидиксовой кислоты, а из 3,4-
метилендиоксианилина C3.2.6). Последний получают, восстанавли-
восстанавливая водородом 3,4-метилендиокси-1-нитробензол C3.2.5), исполь-
используя в качестве катализатора двуокись платины. Сам 3,4-метилен-
диокси-1-нитробензол C3.2.5), в свою очередь, получают нитрова-
нитрованием 1,2-метилендиоксибензола азотной кислотой. Далее взаимо-
взаимодействием полученного 3,4-метилендиокси-анилина C3.2.6) и эток-
этоксиметиленмалонового эфира получают продукт замещения C3.2.7),
который при нагревании циклизуется в этиловый эфир 4-гидрокси-
6,7-метилендиоксихинолин-З-карбоновой кислоты C3.2.8). Гидро-
Гидролизом последнего щелочью в диметилформамиде и непосредствен-
непосредственной обработкой продукта этилйодидом получают искомую оксоли-
новую кислоту [65, 66, 67].
Как и налидиксовая кислота, препарат эффективен в отношении
грамотрицательных микроорганизхмов и применяется по тем же пока-
показаниям.
-709-
Глава 33
Синонимами препарата являются нидантин, продоксол, околин,
>роксо.( и др.
*
Циноксацин (Cinoxacin, Azolinic acid)
Цнноксацин — 1-этил-1,4-дигидро-4-оксо[1,3]-диоксоло[4,5^]цин-
нолин-3-карбоновая кислота C3.2.14) синтезируется по иной схеме,
которая исходит из 2-амино-4,5-метачендиоксиацетофенона C3.2.10),
получающегося воссоновлением водородом над платиновым ката-
катализатором 4,5-метилендиокси-2-нитроацетофенона. В условиях
диазогирования последнего происходит спонтанная гетероциклиза-
ция s 4-гидрокси-6,7-мегилендиоксициннолин C3.2.11), очевидно
в результате наличия в условиях реакции значительного количества
енольной формы ацетофенона C3.2.10). Полученный шшнолин
C3.2 11) далее подвергают бромированию молекулярным бромом
в присутствии ацетата калия и получают 3~бром-4-гидрокси-6,7-
метилендиоксициннолин C2.2.12). Взаимодействием последнего
с цианидом одновалентной меди в диметилформамиде атом брома
в нем замещают на цианогруппу с получением З-циано-4-гидрокси-
6,7-метилендиоксициннолина C3.2.13). Полученный продукт алки-
лнруют по положению 1 этилйодидом, используя в качестве осно-
основания гидрид натрия, а цианогрупгту гидролизуют до карбоксильной
смесью соляной и уксусной кислот с получением искомого цинок-
сацина [68, 69]
NaNO2 ' НС,
332 11
Вг2 СНзСООК
' CjHg' i NaH D№
2 НС СН3СООН
Препарат эффективен в отношении грамотрицательных микроорга-
микроорганизмов и применяется по тем же показаниям, что и налидиксовая и ок-
солиновые кислоты.
Синонимами препарата являются цинобактин, носсацин, уронорм
И Л р.
- 710 -
Антимикробные препараты
Норфлоксацин (Norfloxacin)
Норфлоксацин — 1-этил~6-фтор-1,4-дигидро-4-оксо-7-A-пипера-
зиннл)-3-хинолинкарбоновая кислота C3.2.18) является первым
представителем из серии фторированных хинолонов и одновре-
одновременно первым препаратом, содержащим пиперазиновый замести-
заместитель из вошедших в медицинскую практику производных хиноло-
хинолонов. Способ его синтеза в принципе не отличается от способа
синтеза предложенного для синтеза налидиксовой и оксолиновой
кислот. Взаимодействием З-хлор-4-фторанилина и этоксиметилен-
малонового эфира, получают продукт замещения C3.2.15), кото-
который при нагревании в дифениловом эфире циклизуется в этило-
этиловый эфир 6-фтор-7-хлор-1,4-дигидро-3-хинолин-4-он-карбоновой
кислоты C3.2.16). Непосредственной обработкой продукта этил-
этилйодидом в присутствии триэтиламина и последующим гидролизом
щелочью получают 1-этил-6-фтор-7-хлор-1.4-дигидро-3-хинолин-
4-он-карбоновую кислоту C3.2.17). Вводя последнюю во взаимо-
взаимодействие с пиперазином, получают норфлоксацин C3.2.18) [70, 71,
72. 73, 74, 75].
C2H6v
О О
-СООС2Н5
Норфлоксацин обладает широким спектром бактерицидного дейст-
действия Высокоактивен в отношении большинства грамотрицательных
и некоторых грамположительных микроорганизмов. К препарату не
чувствительны анаэробные бактерии, малочувствительны энтерококки
и акинетобактер. Препарат применяют при бактериальных инфекциях
мочевыводящих путей, предстательной железы, ЖКТ, гонореи, диареи
путешественников.
Синонимами препарата являются нороксин, баразан, фулграм, ба-
цпдал и др.
-711 -
Глава 33
Ципрофлоксацин (Ciprofloxacin)
Ципрофлоксашш — 1-циклопропил-6-фтор-1,4-дигидро-4~оксо-7-
A-пиперазинил)-3-хинолинкарбоновая кислота C3.2.19) получают
по совершенно аналогичной схеме синтеза с использованием на
стадии ал копирования вместо этилйодида циклопропилбромида [76,
77. 78].
соон
33 2 19
Ципрофлоксацин обладает широким спектром антимикробного дей-
действия. Высокоактивен против грамотрицательных микроорганизмов:
синегнойной, гемофильной и кишечной палочек, шигелл, сальмонелл,
менингококка, гонококка, некоторых разновидностей энтерококков.
Препарат активен также в отношении многих штаммов стафилококков,
кампилобактера, легионелл, микоплазм, хламидий, микобактерий.
К препарату резистентны Ureaplasma urealyticum, Clostridium difficile,
Xocanlia asteroids. Препарат применяют при инфекциях мочевых путей,
дыхательных путей, желчевыводящих путей, инфекциопно-воспали-
тельных заболеваниях брюшной полости и органов малого таза, костей,
суставов, кожи.
Ципрофлоксацин эффективен также при бактериальных простати-
простатитах, неосложненной гонорее, остеомиелитах и легочных инфекциях.
Он эффективен при лечении острых инфекционных диареях, включая
диарею путешественников, и энтеритах. Побочные реакции при его
применении встречаются редко.
Синонимами препарата являются ципроквин, ципролет, ципропан,
ципросан. ципроцинол и многие другие.
Эноксацин (Enoxacin)
Эноксацин — 1-эгил-6-фтор-1,4-дигидро-4-оксо-7-A-пиперазинил)-
1,8-нафтиридин-З-карбоновая кислота C3.2.24) отличается от нор-
флоксацина исключительно тем, что в положении 8 норфлоксацина
атом углерода замещен атомом азота, т. е. препарат принадлежит не
ряду хинолоиов, а ряд> нафтиридинов. Синтез препарата осущест-
осуществляется исходя из 2.6-дихлор-З-нитропиридина, взаимодействием
которого с N-этоксикарбонилпиперазином получают прод\кт заме-
-712-
Антимикробные препараты
щения атома хлора в положении 2 пиридинового кольца C3.2.20).
Последовательным замещением в нем атома хлора в положении С6
на аминогруппу аммиаком, ацилированием полученной аминогруп-
аминогруппы уксусным ангидридом и, наконец, восстановлением нитрогруп-
пы в положении Сз пиридинового кольца водородом получают
6-амино-3-ацетиламино-2-D-этоксикарбонилпиперазинил)пиридин
C3.2.21). С целью введения в положение С3 атома фтора прибегают
к реакции Шимана. С этой целью свободную аминогруппу диазоти-
руют амилнитритом, и полученную диазониевую соль обрабатыва-
обрабатывают борфтористоводородной кислотой. Образовавшийся фторборат
диазония подвергают пиролизу с получением З-фтор-6-ацетилами-
но-2-D-этоксикарбонилпиперазинил)пиридина. Наконец, снятием
ацетильной защиты аминной группы в положении С6 получают
3-фтор-6-амино-2-D-этоксикарбонилпиперазинил)пиридин C3.2.22).
Полученный амин C3.2.22) вводят во взаимодействие с этоксиме-
тиленмалоновым эфиром, в результате чего получается производ-
производное аминометиленмалонового эфира, нагревание которого приводит
к получению этилового эфира 6-фтор-1,4-дигидро-4-оксо-7-D-это-
ксикарбонил-1-пиперазинил)-1,8-нафтиридин-3-карбоновой кисло-
кислоты C3.2.23). Алкилированием последнего этилйодидом и дальней-
дальнейшим гидролизом двух карбэтоксильных групп получают эноксацин
Р9,80,81.82].
:хх-
сгн5оос
' с2нъ.
C;h5O'
2
.cooc,Hs , NjO
В плане антибактериального спектра и области применения энокса-
эноксацин, в принципе, повторяет все свойства норфлоксацина. Однако он
лучше абсорбируется из ЖКТ и имеет более продолжительное время
полу жизни.
Синонимами препарата являются бактидан, флумарк и др.
-713-
Глава 33
Офлоксацин (Ofloxacin)
Офлоксацин — (±) 9-фтор-3-метил-10-D-метил-1-пиперазинил)-7Я-
пиридо-A,2,3-<1е)-1,4-бензоксазин-7-оксо-6-карбоновая кислота
C2.2.30) имеет несколько более усложненную, по сравнению с вы-
вышеописанными препаратами, структур), главная особенность кото-
которой состоит в наличии метилзамещенного оксиэтиленового мостика
между атомом азота и положением Cg хинолоновой системы, а так-
также наличием метильного заместителя в положении С4 пиперазино-
вого кольца. Синтез препарата осуществляют исходя из 2,3,4-
трифторнитробензола, взаимодействием которого с гидроокисью
калия получают 2-гидрокси-3,4-дифторнитробензол C3.2.25). Вводя
последний во взаимодействие с хлорацетоном в присутствии йоди-
йодистого калия и поташа, получают соответствующий эфир гидрокси-
ацетона C3.2.26). Исчерпывающим восстановлением последнего
водородом над никелем Ренея в одну стадию получают искомое
производное дифторбензоксазина C3.2.27), минуя отдельное и, по-
пожалуй, невозможное, да и ненужное, последовательное выделение
амина, далее внутреннего имина и. наконец, целевого продукта.
По уже многократно описанной выше схеме синтезированный вто-
вторичный гетероциклический амин C3.2.27) вводят во взаимодейст-
взаимодействие с этоксиметиленмалоновым эфиром, и полученное аминомети-
лен.малоновое производное C3.2.28) циклизуют в пиридобен-
зоксазиновую систему. Однако, в отличие от ранее описанных
случаев, где данная реакция осуществлялась в высокотемперагур-
ном режиме, в данном случае реакция осуществлялась с примене-
применением полифосфорной кислоты. Полученный при этом этиловый
эфир 9,10-дифтор-3-метил-7#-пиридоA,2,3-de)-l ,4-бензоксазин-7-
оксо-6-карбоновой кислоты подвергают гидролизу до соответст-
соответствующей кислоты C3.2.29). Наконец, вводя последнюю во взаимо-
взаимодействие с N-метилпиперазином, осуществляют замещение атома
фтора в положении С|0 пиридобензоксазиновой системы с получе-
получением офлоксацина C2.2.30) [84, 85, 86].
^•N02 H2 Rd— N
¦714-
Антимикробные препапятм
ХЗСГ
CH3-N N-4
Офлоксацин также обладает широким спектром антимикробного
действия. Высокоактивен против грамотрицательных микроорганизмов:
синегнойной, гемофильной и кишечной палочек, шигелл, сальмонелл,
хламидий. Применяют при инфекциях дыхательных путей, уха, горла,
носа, кожи, мягких тканей, костей, суставов, инфекционно-
воспалительных заболеваниях органов брюшной полости, почек, моче-
выводящих путей, органов малого таза, гениталий, гонореи.
Синонимами препарата являются таривид, флобацин и др.
33.3. Нитрофураны
Некоторые производные нитрофурана обладают выраженной анти-
антимикробной активностью. Все эти соединения характеризуются тем, что
являются производными 5-нитрофурфурола, полученными взаимодей-
взаимодействием с различными соединениями, формально содержащими гидра-
зинн)ю функциональную группу. Нитрофураны эффективны в отно-
отношении грамположительных и грамотрицательных микроорганизмов,
а также трихомонад и лямблий. В низких концентрациях препараты
действуют бактериостатически, в высоких — бактерицидно. Наиболее
эффективны против некоторых штаммов Escherichia coli, Klebsiella,
Enterobacter и Citobacter. Следует отметить, что они бывают эффектив-
эффективны и в отношении некоторых микроорганизмов, устойчивых к антибио-
антибиотикам и сульфонамидам. Наиболее широко используются нитрофура-
зон, фуразолндон, нитрофурантоин. Производные нитрофурана исполь-
з>ют как орально, так и в качестве наружных средств. Препараты этого
ряда аккумулируются в моче и желчи. Скорость абсорбции весьма зави-
зависима от кристаллической формы препарата. Нитрофураны используют-
используются преиму щственно в качестве антисептиков для наружного применения
(нитрофзразон). а также для лечения инфекций мочевыводящих путей
и кишечника. Точный механизм действия этих препаратов не установ-
установки Однако кажется вероятным, что они ингибируют ряд бактериаль-
НЬ1\ ферментных систем, скорее всего путем повреждения их ДНК. По-
•laiajoT, что фермент нитроредуктаза трансформирует эти препараты
-715-
Глава 33
i короткоживчшие промежуточные радикалы, которые взаимодейству-
взаимодействует с ДНК бактерий, нарушая процесс их скручивания. Редко встречаю-
цаяся резистентность может возникнуть в результате мутаций, связан-
тых с потерей активности фермента нитроредуктазы.
Нитрофуразон (Nitrofurazon)
Нитрофуразон — семикарбазон 5-нитрофурфурола C3.3.1) получа-
получают взаимодействием 5-нитрофурфурола с семикарбазидом [87. 88].
O2N
H2N-NH-C-NH2
О
—NH-C-NH2
33 3 1
Нитрофуразон является эффективным препаратом, действующим на
ряд грамположительных и грамотрицательных микроорганизмов (ста-
(стафилококки, стрептококки, дизентерийная палочка, кишечная палочка,
палочка паратифа и др.). Применяется, в основном, наружно для лече-
лечения и предупреждения гнойно-воспалительных процессов и внутрь для
лечения бактериальной дизентерии. Нитрофуразоном орошают раны,
накладывают влажные повязки. Его применяют в виде капель, практи-
практически при всех гнойных процессах, требующих назначения антибакте-
антибактериальных препаратов.
Синонимами препарата являются фурациллин, фурацин, антибио-
птал, ваброцид и др.
Нитрофурантоин (Nitrofurantoin)
Нитрофурантоин — 1-E-нитрофурфурилиденамино)гидантоин C3.3.5)
синтезируют исходя из гидразиноуксусной кислоты C3.3.2), полу-
получаемой взаимодействием хлоруксусной кислоты с гидразином.
Взаимодействием гидразиноуксусной кислоты с иианатом калия
получают семикарбазидоуксусную кислоту C3.3.3), которая при на-
нагревании циклиз^ется в 1-аминоидантоин C3.3.4). Взаимодействи-
Взаимодействием последнего с диацетилацеталем 5-нитрофурфурола получают ис-
искомый нитрофурангоин [89, 90, 91, 92, 93].
Н2.Ч-ЧН-СНг-СООН
33 3 2
,?N-CO
rl2ti
-716-
Антимикробные препараты
СН(О~СОСН3J
33 3 4
33 3 5
Так же как и нитрофуразон, нитрофурантоин является эффектив-
эффективным препаратом, действующим на ряд грамположительных и грамотри-
грамотрицательных микроорганизмов (стафилококки, стрептококки, дизентерий-
дизентерийная палочка, кишечная палочка, палочка паратифа и др.). В основном
препарат применяют при лечении инфекционных заболеваний мочевых
п\тей (пиелиты. пиелонефриты, циститы, уретриты).
Синонимами препарата являются фурадонин, итуран, фенурин,
)ролонг, цистофуран, нитрофурин и многие другие.
Фуразолидон (Furazolidone)
Ф\разолидон — 3-E-нитрофурфурилиден)амино-2-оксазолидинон
C3 7.8) получают исходя из 2-гидразиноэтанола, взаимодействием
которого с диэтилоксалатом получают З-амнно-2-оксазолидон.
Взаимодействием последнего с бензальдегидом пол>чают соответ-
соответствующий гидразон C3 3.7). Очисткой последнего и последующим
взаимодействием с 5-нитрофурфуролом получают фуразолидон [94,
95, 96. 97].
(С2Н5ОЬСО
H2N-NH-CH2-CH2-OH -¦ >
H2N,
NO
33 3 6
О
V_7
33 3 7
33 3 8
Фуразолидон, как и рассмотренные выше производные нитрофура-
на. эффективен против грамположительных и грамотрицательных мик-
микроорганизмов. Однако он обладает и противотрихомонадной акгивно-
-717-
Глава 33
стью и эффективен при лямблиозе. По сравнению с нитрофуразоном
и нитрофурантоином, фуразолидон более активен в отношении грамот-
рицательных микроорганизмов и одновременно менее токсичен. Фура-
Фуразолидон применяют по тем же показаниям, что нитрофуразон и нитро-
фурантоин, как внутрь, так и местно.
Синонимами препарата являются диафурон, фуроксан. итифур, ва-
гинол, медарон и др.
Список литературы
1. US Pat. 3.375.247A968).
2. Ger. Pat. 1.620.140 A966).
3. Neth. Pat. Appl. 6.610.815 A967).
4. Doub L. et al.'/J. Med. Chem. Ц, 242 A970).
5. US Pat. 2.407.966A946).
6. US Pat. 2.407.966A946).
7. Brit. Pat. 557.055 A943).
8. Roblin V et al.//J. Am. Chem. Soc. 62, 2002 A940).
9. US Pat. 2.407.966A946).
10. Sprague G. et al.//J. Am. Chem. Soc. 63, 3028 A941).
11. Brit. Pat. 546.158A942).
12. Brit. Pat. 552.887A943).
13. US Pat. 3.119.818A964).
14. Caldwell et al.//J. Am. Chem. Soc. 63, 2188 A941).
15. Roblin V. et al.'/J. Am. Chem. Soc. 64, 567 A942).
16. US Pat. 2.358.031 A944).
17. US Pat. 2.447.702A948).
18. US Pat. 2.430.094A947).
19. Ger. Pat. 819.855A944).
20. US Pat. 2.888.455A959).
21. US Pat. 2.275.354A942).
22. Brit. Pat. 512.145A939).
23. Winterbottom R.,;J. Am. Chem. Soc. 62, 160 A940).
24. US Pat. 2.396.145A946).
25. Doraswamy G. et al.//J. Indian Chem. Soc. 23 B78 A946).
26. US Pat. 2.324.013 A943).
27. US Pat. 2.324.015A943).
28. US Pat. 3.132.139A964).
29. Belg. Pat. 618.639A962).
30. GntssnerA. et al. Monatsh. Chem. 96, 1676A965).
-718-
Антимикробные препараты
31
32
33
34
35.
36.
38.
39,
40.
41.
42.
43.
44
45.
46.
47.
48.
49.
^0
51.
52.
53
54.
55,
56
57.
58.
59
60.
61.
62.
63.
64.
65.
66,
t j 7.
68
69.
70.
71.
Brctschneider A. et al.//Monatsh. Chem. 96, 1661 A965).
Brit. Pat. 928.151A963).
L'S Pat. 3.098.069A963).
Camerino B. et al.//Gazz. Chim. Ital. 90, 1815 A960).
US Pat. 2.712.012A954).
US Pat. 2.833.761A958).
. US Pat. 2.411.495A946).
Crossley N. et aLv'J. Am. Chem. Soc. 61, 2950 A939).
US Pat. 2.240.496 A941).
Brit. Pat. 541.958A942).
Siebenmatinet M. aL/J. Am. Chem. Soc. 61, 2950 A939).
US Pat. 2.288.531 A942).
Miller G. et al.//J. Am. Chem. Soc. 62, 2099 A940).
Bcrgeim L. et al.//J. Am. Chem. Soc. 66, 1459 A944).
US Pat. 2.909.522A959).
Brit. Pat. 875.562A958).
Ger. Pat. 1.103.931 A958).
US Pat. 3.049.544A962).
Ger. Pat. 1.303.544A960).
Ger. Pat. 1.445.176A960).
Ger. Pat. 1.795.586A974).
. Ger, Pat. 2.443.080A974).
. Brit. Pat. 1.445.254A974).
. Ger. Pat. 2.165.362A970).
, Ger. Pat. 2.258.238 A971).
US Pat. 2.576.939A951).
US Pat. 2.602.794A952).
US Pat. 2.680.740 A954).
RusselR. et al.//J. Am. Chem. Soc. 73, 3763 A951).
Longeman H. et al.//Ber. 87, 435 A954).
US Pat. 3.149.104A964).
Brit. Pat. 1.338.023A971).
Belg, Pat. 612.258A962).
Lesher G et al./'J. Med. Pharm. Chem. 5, 1063 A962).
US Pat. 3.287.458A966).
Ger. Pat. 2.103.805A971).
Kaminsky F. et al.'.'J. Med. Chem. Д. 160 A968).
Ger. Pat. 2.005.104A970).
US Pat. 3.669.965 A972).
US Pat. 4.146.719A979).
Cier. Pat. 2.804.097A979).
-719-
Глава 33
72. Belg. Pat. 863.429A978).
73. Ger. Pat. 2.840.910A979).
74. US Pat. 4.292.317A981).
75. Koga H. et al./'/J. Med. Chem. 23, 1358 A980).
76. Ger. Pat. 2.142.854 A983).
77. US Pat. 4.670.444A981).
78. Grohe K. et al.'/Ann. 1987 29.
79. Eur. Pat. Appl. 9425A980).
80. US Pat. 4.352,803A982).
81. US Pat. 4.359.578 A982).
82. Matsumoto J. et al./.'J. Med. Chem. 27, 292 A984).
83. Eur. Pat. Appl. 47.005 A982).
84. US Pat. 4.382.892A983).
85. Egava H. et al./'Chem. Pharm. Bull. 34, 4098 A986).
86. Atarashi S. et aL<'Chem. Pharm. Bull, 35, 1896 A987).
87. US Pat. 2.416.234A947).
88. US Pat. 2.927.110A960).
89. US Pat. 2.610.181 A950).
90. US Pat. 2.779.786A957).
91. US Pat. 2.898.335A959).
92. US Pat, 2.927.110A960).
93. Swirska A. et al.'/Przem. Chem. Ц, 306 A955).
94. US Pat 2.759.931 A956).
95. US Pat. 2.742.462A956).
96. Brit. Pat. 735.136A955).
97. Gever G. et al./'J. Am. Chem. Soc. 77, 2277 A955).
Глава 34
Антимикобактериальные
препараты
Патогенными организмами, вызывающими весьма серьезные забо-
заболевания у человека, являются микобактерии Mycobacterium tuberculosis,
Mycobacterium avium, Mycobaclerium leprae, Mycobacterium kansasii, My-
Mycobacterium fortuitum-M, Mycobacterium chelonae и некоторые другие.
Характерной особенностью микобактерии является высокое содержание
в них (около 40 % от собственного веса) липидов, главным образом на
внешней стенке бактерий.
Типичные микобактерии вызывают, как правило, туберкулез, ати-
атипичные — некоторые другие заболевания. Микобактерии группы I —
фотохромогены вызывают заболевания, связанные с пигментацией; ми-
микобактерии группы II — скотохромогены вызывают лимфадениты
\ доей; микобактериальные организмы группы III вызывают опреде-
определенные легочные заболевания, и, наконец, микобактерии группы IV
{Mycobacterium fortuitum) вызывают редко встречающиеся легочные
и нелегочные заболевания, не поддающиеся лечению обычным набором
антитуберкулезных препаратов и требующие лечения антибиотиками
широкого спектра. Особняком стоит проказа (лепроз, болезнь Хансена)
вызываемая микроорганизмом Mycobacterium leprae
34.1. Антитуберкулезные препараты
Туберкулез является инфекцией, вызываемой микобактериями
Mvcobacterium tuberculosis, наиболее часто поражающей легкие и харак-
характеризующейся такими симптомами, как острое воспаление, некроз тка-
тканей и часто развитием открытых полостей.
В некоторых случаях патоген проникает в лимфу или кровь, и ин-
инфекция может распространиться и по другим тканям организма. Совре-
Современная терапия туберкулеза весьма эффективна, однако может быть
трудна и длительна. Патоген быстро приобретает резистентность к те-
терапии одним препаратом. Более того, многие штаммы приобрели рези-
сгентность и к ой-, и даже к мультилекарственной терапии, поэтому
антитуберкулезные препараты, как правило, используются в виде ком-
комбинации двух, а иногда и трех препаратов.
-721 -
Глава 34
Препараты, используемые при терапии туберкулеза, весьма отли-
отличаются по активности и токсичности и делятся на 2 группы.
Препараты / группы объединяют лекарственные средства с высшим
уровнем эффективности при относительно низкой токсичности,
В эту группу входят изониазид, этамбутол, пиразинамид. а также анти-
антибиотики — рифампицин и стрептомицин.
Подавляющее большинство пациентов может быть успешно выле-
вылечено этими препаратами. Иногда по причине микробной резистентности
и'или в связи с пациентзависимыми причинами может возникнуть необ-
необходимость в применении препаратов // группы. Сюда включены этио-
намид, антибиотики (циклосерин, капреомииин, канамицин), а также
структурно очень простой препарат и я-аминосалициловая кислота.
Указанные препараты несколько более токсичны, чем препараты I груп-
ппы и имеют определенные ограничения по применению.
Химиотерапия туберкулеза должна включать применение двух или
более эффективных препаратов для предотвращения умножения числа
резистентных мутантов. Лечение должно продолжаться достаточно дол-
долго, чтобы предотвратить рецидив медленно растущих внутриклеточных
организмов.
Препараты I группы
Изониазид (Isoniazid)
Изониазид — гидразид изоникотиновой кислоты C4.1.1) получают
взаимодействием этилового эфира изоникотиновой кислоты с гид-
гидразином [1, 2. 3, 4. 5].
ос2н5
H2N-NH2
34.1 1
Изониазид является гиразидом изоникотиновой кислоты, введен-
введенным в медицинскую практику для лечения туберкулеза в 1953 г. Изо-
Изониазид проявляет бактерицидное действие на Mycobacterium tubercu-
tuberculosis Он ингибир>ет синтез миколиевой кислоты — важной состав-
составляющей микобактериальной клеточной стенки. Миколиевая кислота
присуща только микобактериям, и именно это является причиной селек-
селективной токсичности препарата по отношению к этим микроорганизмам.
Существующие в природе резистентные к изониазиду мутанты встре-
-722-
Антимикобактериальные препапяты
чаются редко, и в спонтанно растущей популяции туберкулезных ба-
бацилл и\ можно наблюдать в соотношении примерно один на 105-10б
организмов. Большие популяции микроорганизмов порядка 109-1010
баиилл в открытых легочных полостях, уже содержат значительное
число резистентных мутантов. Если при лечении применять только изо-
ниазид, то будет наблюдаться увеличение числа м>тантов, которые мо-
могут стать доминантным фенотипом. Переход от чувствительных, в ос-
основном, к нечувствительным микроорганизмам в ходе лечения называ-
называется вторичной, или приобретенной, резистентностью, которая может
возникнуть в течение нескольких недель.
Изониазид является наиболее важным лекарством для лечения ле-
легочной и нелегочной форм туберкулеза. Он активен по отношению как
к внутриклеточным, так и внеклеточным организмам. Для предотвра-
предотвращения вторичной резистентности изониазид должен применяться с дру-
другим эффективным препаратом (обычно рифампином).
Синонимами препарата являются тубазид, андразид, ниазид, пири-
дизип и многие другие.
Эта.нбуто.1 (Ethatnbutol)
Этамбутол — (±)-М.Ы'-этиленбис-B-аминобутан-1-ол) C4.1.4)
предложено получать несколькими путями. Согласно первому спо-
способу, нитропропан подвергают оксиметилированию формальдеги-
формальдегидом, и далее нитрогруппу в полученном 2-нитробутаноле C4.1.2)
восстанавливают водородом до аминогруппы с получением раце-
рацемического (±J-аминобутанола. Применением L(t-) винной кислоты
из рацемата выделяют (+J-аминобутанол C4.1.3). Взаимодействи-
Взаимодействием последнего с 1,2-дихлорэтаном в присутствии гидроокиси на-
грия получают этамбутол D3.1.4) [6, 7, 8, 9, 0, 11, 12, 13, 14, 15].
ch,-Ch2-ch2-no2 -СНг0.
CH3-Cri2-CH-NO2
СН2-ОН
34.12
Н2 ' Raney—Ni
CH3-CH2-CH-NH2
CH2-OH
34 13
CH3-CH2-CH-NH-CH2-CH2-NH-CH-CH2-CH2-CH3
СН2-ОН НО-СН2
34 1.4
Второй способ синтеза заключается в получении (+J-аминобу-
танола C4.1.3) путем восстановления водородом гидрохлорида этилово-
-723-
Глава 34
го эфира L-2-аминомасляной кислоты с одновременным использовани-
использованием в качестве катализаторов никеля Ренея и окиси платины. При этом
однозначно получается чистый (+J-аминобутанол. Взаимодействием
последнего с 1,2-Д1-клорэтаном в присутствии гидроокиси натрия полу-
получают искомый этамбутол C4.1.4) [16, 17].
снз-сн2-сн-соос2н5
NH2
Н2 / Raney-Ni.PtO
CH3-CH2-CH-NH2
CH2-Ori
34 1 3
Третий способ синтеза весьма любопытен и, очевидно, напоминает
реакцию Риттера, которую проводят в присутствии хлора. Способ за-
заключается во взаимодействии 1-бутена и ацетонитрила в присутствии
хлора, в результате чего, очевидно, происходит 1,4-присоединение хло-
хлора к проду кту реакции Риттера с образованием промежуточного дихло-
рида C3.1,5), который гидролизуют водой с получением 1Ч-[1-(хлор-
метил)-пропил]-ацетамида C3.1.6). Кипячением последнего с соляной
кислотой получают рацемический (±J-аминобутанол, из которого вы-
вышеописанным способом с использованием Ц+) винной кислоты выде-
выделяют (тJ-аминобутанол C4.1.3). Взаимодействием последнего с 1,2-ди-
хлорэтаном в присутствии гидроокиси натрия получают искомый этам-
этамбутол C4.1.4) [18, 19, 20, 21].
СНз-СН2-СН-СНг-С1
N=C"CH;
CH3-Ch2-CH-CH2-Ci
-iN-C-СНз
Этамбутол был открыт в 1961 г. Препарат имеет бактериостатиче-
ское действие по отношению к Mycobacterium tuberculosis, однако точ-
точный механизм его действия неизвестен. Препарат ингибирует перенос
микотиновой кислоты в клеточную стенку Mycobacterium smegmatis,
чем и объясняется его избирательная токсичность. Этамбутол активен
только по отношению к микобактериям Mycobacterium tuberculosis,
Mycobacterium kansasii, Mycobacterium scrofulaceum Чувствительность
других микобактерий к этамбутолу весьма различна. Все остальные
бактерии практически резистентны по отношению к нему. Случаи пер-
первичной резистентности к этамбутолу единичны Вторичная резистент-
ность возникает, когда препарат используется самостоятельно без па-
параллельного применения другого эффективного антитуберкулезного
препарата, например изониазида или рифампина. Механизм резистент-
-724-
Антимикобактериальные препараты
ности к препарату неизвестен.
Синонимами этамбутола являются диамбутол, клобутол, гибистал,
пбетол и многие другие.
Пиразинамид (Pyrazinamid)
Пиразинамид — пиразинкарбоксамид C4.1.11) синтезируют исходя
из хиноксалина C4.1.7), который получают взаимодействием о-фе-
нилендиамина с глиоксалем. Окисляя последний перманганатом ка-
калия, получают пиразин-2,3-дикарбоновую кислоту C4.1.8). Декар-
боксилированием последней при нагревании получают пиразин-2-
карбоновую кислоту C4.1.9). Этерификацией полученной кислоты
метанолом в присутствии хлористого водорода и дальнейшим взаи-
взаимодействием полученного эфира C4.1.10) с аммиаком получают
пиразинамид [22. 23, 24, 25, 26, 27, 28].
соон
соон
34 1 8
СООН
СН3ОН / HCI
N-^СООСНз
II
,л
NH3
34 1 9
N
34 1 10
34 1 11
Пиразинамид был синтезированный в 1952 г. Он является азаанало-
юм никотинамида, однако уступает ему по активности Точный меха-
механизм его действия неизвестен, Препарат проявляет гепатотоксичность.
Синонимами препарата являются дексамбутол, миамбутол, эсанбу-
тол. эбутол и др.
Рифампицин (Rifampicin)
Рифампицин — ацетат 5,6,9,17,19,21-гексагидрокси-23-метокси-
2,4,12,16,18,20,22-гептаметил-8-[К-D-метил-1-пиперазинил)-форми-
мидоил]-2,7-(эпоксипентадека-1,11,13-триенимино)-нафто-[2,1-Ь]фу-
ран-1.11B//)диона-21 C2,7.8). Рифампицин является полусинтети-
полусинтетическим производным рифампицина В, продуцируемого актиноми-
цетами Streptomyces mediteranei (Nocardia mediteranei) и введенного
в медицинскую практику в 1968 г. Синтез рифампицина был описан
в гл. 32 «Антибиотики».
-725-
Глава 34
СНз СНз
но.
СНз
/—\
N N
N-СНз
Cri3
32 7 8
Рифампицнн проявляет бактерицидный эффект путем ингибирова-
ння синтеза РНК. Препарат ингибирует ДНК-зависимую РНК полиме-
pd'.y, предотвращая начало развития цепи, а не ее наращивание. Рифам-
Рифампицин не связывается с РНК полимеразой ядра клеток млекопитающих
и не воздействует на соответствующий синтез РНК. Он может ингиби-
ровать митохондриальный синтез РНК, однако концентрации, требуе-
требуемые для этого, в несколько сот раз превышают таковые, необходимые
для синтеза РНК.
Рифампицин высоко активен в отношении Mycobactenum tubercu-
losis, в ряду атипичных микобактерий — по отношению к Mycobacte-
Mycobactenum kamasn, Mycobactenum mannum и к большинству видов Mycobac-
Mycobactenum scrofulaceum и Mycobactenum xenopi Чувствительность других
микобактерий варьирует. Рифампицин проявляет активность и в отно-
отношении Mycobactenum lepare
Кроме микобактерий, рифампицин проявляет активность и в отно-
отношении широкого ряда организмов. Он высокоактивен в отношении
Staphy iococcus aureus, неэнтерококковым видам Streptococcus и Listena
monocytogenes Среди грамотрнцательных видов к рифампишшу очень
чувствительны Neissena memngitidis, Haemophilus influenzae и Legio-
nella Устойчивы E coh и Proteus mirabilis Анаэробные кокки, виды
Clostndium и Bacteroids часто оказываются чувствительны к рифампи-
цин\
Рифампицин является наиболее эффективным лекарством для лече-
лечения легочной и нелегочной форм туберкулеза, включая туберкулезный
менингит Всегда должен применяться в сочетании с другими препара-
препаратами
Синонимами препарата являются рифадин. римактан, рифапиам,
р и мак газ ид и др.
-726-
Антимикобактериальные препараты
Стрептомицин (Streptomycin)
Стрептомицин — /и/?а«с-2,4-дигуанидино-3,5,6-тригидроксицик-
логексил-5-дезокси-2-О-B-дезокси-2-метиламино-сс-Ь-глюкопирано-
зил)-3-С-гидроксиметил-Р-Ь-ликсо-пентофуранозид C2.4.1) выде-
тяют из культуральной жидкости жизнедеятельности актиномицета
Streptomyces gnseus Его синтез был описан в гл. 32 «Антибиотики».
NH
H2N-C-HN
NH
NH-C-NH2
Стрептомицин обладает широким спектром антибактериальной ак-
активности. Является первым клинически эффективным препаратом, при-
примененным для лечения туберкулеза.
Синонимами препарата являются стрептан, стрептокол и др.
Препараты II группы
Этионамид (Etionamid)
Этионамид — 2-(этил)изоникотинтиоамид C4 1.18) — производное
изоникотиновой кислоты получают по следующей схеме. Конден-
Конденсацией диэтилоксалата с метилэтилкетоном в присутствии этилата
натрия получают этиловый эфир пропионилпировиноградной ки-
кислоты C4.1.12). Конденсацией последней с цианацетамидом осуще-
осуществляют гетероциклизацию с получением 3-циано-4-карбэтокси-6-
этил-2-пири-дона C4.1.13), гидролизом которого соляной кислотой
получают 4-карбокси-6-этил-2-пиридон C4.1.14). Взаимодействием
последнего со смесью хлорокиси и пятиокиси фосфора синтезируют
-727-
Глава 34
хлорангидрид 6-этид-2-хлоризоникотиновой кислоты, дальнейшей
обработкой которого этиловым спиртом получают этиловый эфир
6-этил-2-хлоризоникотиновой кислоты C4.1.15). Восстановлением
последней водородом с использованием палладиевого катализатора
убирают атом хлора в положении 2 пиридинового кольца с получе-
получением этилового эфира 6-этил-изоникотиновой кислоты C4.1.15).
Взаимодействием последнего с аммиаком и дальнейшей дегидрата-
дегидратацией полученного при этом амида 6-этилизоиикотиновой кислоты
пятиокисью фосфора получают нитрил 6-этилизоникотиновой ки-
кислоты C4.1 17). Наконец, вводя последний во взаимодействие с се-
сероводородом, получают этионамид [29, 30. 31, 32].
COOC2h6
СООС2Н5
О
с2н5-с-сн3
C2H5ONa
С2Н5
.ОС2Н6
34 1 12
— /х
1 POCb P
2 СН5ОИ
СООС2Н5
COOCtH5 х NH,
C=N
H2S
C2H5
H
34 1 17
S
11
C-NH2
C2H5
H
34 1 18
Этионамид активен по отношению к Mycobacterium tuberculosis
и Mycobacterium leprae, но не оказывает влияния на другие микроорга-
микроорганизмы. Препарат усиливает фагоцитоз в очаге туберкчлезного воспале-
воспаления, что способствует его рассасыванию. Однако препарат часто вызы-
вызывает побочные эффекты, связанные с ЖКТ, и гепатотоксические эффе-
эффекты примерно \ 5 % пациентов.
Синонимами препарата являются трекатил, этим ид, тиомид, т^бер-
мин,тубероид и др.
-728-
Антимикобактериальные препараты
Циклосерин (Cycloserin)
Циклосерин — 4-амино-З-изоксалидинон C4.1.19) может быть по-
получен как биотехнологическим путем в результате жизнедеятельно-
жизнедеятельности актиномицетов Streptomyces garyphalus, Streptomyces orchida-
ceus и Streptomyces lavenduale, так и синтетическим путем, исходя-
исходящим из метилового эфира D-серина, взаимодействием которого
с пятихлористым фосфором замешают гидроксильную группу се-
рина на атом хлора и дальнейшим взаимодействием полученного
продукта C4.1.19) с гидроксиламином осуществляют гетероцикли-
зацию в искомый циклосерин C4 1.20) [33, 34, 35, 36, 37, 38, 39, 40,
41.42].
РС15
сн2-сн-соос2н5
ОН NH2
СН2-СН-СООС2Н5
Cl NH2
34 1 19
NH2-OH
NH2
I
H
34 1 20
Циклосерин обладает широким спектром антибактериального дей-
действия, действуя как на грамположительные, так и на грамотрицателыгые
бактерии, а также на микобактерии туберкулеза, устойчивые к препара-
препаратам I группы. Препарат действует бактерицидно, нарушая синтез кле-
клеточной стенки микобактерии. Принятым объяснением этому является
его химическое сходство с D-аланином, что позволяет ему конкурентно
\i нетать активность ферментов D-аланинрацемазы и D-аланинсинте-
тазы. в результате чего нарушается образование дипептида О-аланил-D-
аланина, необходимого для построения клеточной стенки бактерий.
Циклосерин применяют для лечения пациентов с хроническими форма-
формами туберкулеза, у которых лечение препаратами I группы оказалось
безрезультатным.
Синонимами препарата являются цикловальдин, цикломицин, се-
ромицин и др.
Капреомицин (Capreomycin)
Капреомицин — полипептидный антибиотик C4.1.21), выделенный
из культуральной жидкости продуктов жизнедеятельности
Streptomyces capreolus, представляет собой комплекс из минимум
четырех микробиологически активных составляющих, лишь час-
частично охарактеризованных. Капреомицины IA и IB представлены
ниже.
-729-
Глава 34
NH3
H3N(CH2KCHCH2CONhCH2-CH2-CH
NH
CHNHCONh2
NH —C-CO-MH-C
CO CO
NH
L,N
T
.N
2 HSO4
CH2
CO-CH-NHHCO-CH-NH3
CH2-R
34 1 21
капреомицин IA Л = ОН
капреомицин IB Д = H
Капреомицин имеет выраженное подавляющее действие против
Mycobacterium tuberculosis и Mycobacterium bovis. Большинство, штаммов
Mycobacterium kansasii также чувствительны к капреомииину, однако
другие, нетуберкулезные штаммы, не чувствительны к нему. Препарат
часто используется при необходимости применения парентеральной те-
терапии, путем глубоких внутримышечных инъекций. Капреомицин менее
токсичен, чем канамицин и имеет несколько больший бактериостатиче-
ский эффект.
Синонимами препарата являются канромицин, капастат, огостал и др.
Канамицин (Kanamycin)
Канамицин — О-3-амино-3-дезокси-а-О-глюкопиранозил-A->6)-О-
[6-дезокси-6-амино-а-В-глюкопиранозил-A—>4)]-2-дезокси-О-стреп-
тамин C2.4.6) выделен из культуральной жидкости жизнедеятель-
жизнедеятельности актиномицета Streptomyces kanamyceticus, который продуци-
продуцирует три антибиотика (канамицины А, В и С) и описан в гл. 32.
сн2он
.А—о..
32 4 6
-730-
Антимикобактериальные препараты
Канамицин А сходен со стрептомицином и неомицинами и обладает
широким спектром антимикробного действия. Активен в отношении
большинства грамположительных, а также грамотрииательных микро-
микроорганизмов (стафилококков, кишечной палочки, клебсиеллы, палочки
Фридлендера, протея, шигеллы. сальмонеллы).
Препарат применяют при лечении сепсиса, менингита, остеомиели-
остеомиелита, перитонита, пневмонии, пиелонефрите, пиелоцистите, раневых ин-
инфекциях, послеоперационных гнойных осложнениях, вызванных чувст-
чувствительными к препарату микроорганизмами. Канамицин применяют для
лечения туберкулеза легких и других органов при устойчивости к дру-
другим противотуберкулезным препаратам.
Синонимами препарата являются кармицин, камаксин, резистоми-
цин и многие другие.
п-аминосалициловая кислота (n-aminosalicylic acid)
я-аминосалициловая кислота — 5-амино-2-гидроксибензойная ки-
кислота C4.1.22) получается по реакции Кольбе непосредственным
взаимодействием .w-аминофенола с бикарбонатом калия и с двуоки-
двуокисью углерода при нагревании и небольшом давлении в 5-10 атмо-
атмосфер [43, 44, 45, 46, 47].
H2N
КНСО3
СО2
ОН
34 1.22
«-аминосалициловая кислота является бактериостатиком, ингиби-
рующим большинство туберкулезных микобактерий. По туберкулоста-
тической активности уступает изониазиду и стрептомицину. Препарат
нефро- и гепатотоксичен. Применяется редко.
Синонимом препарата является апацизин.
34.2. Препараты для лечения лепроза
Поврежденная кожа, потеря ею болевой чувствительности и увели-
увеличение нервов являются тремя основными признаками лепроза — забо-
заболевания, вызываемого микобактериями Mycobacterium leprae. Заболева-
Заболевание крайне заразно. Дети и мужчины более чувствительны к болезни,
чем женщины. Инкубационный период может длиться несколько лет.
что затрудняет раннюю диагностику и лечение лепроза, или проказы.
-731 -
Глава 34
Антимикобактериальные препараты
Химиотерапия лепроза до 1982 г заключалась в применении дапсо-
на. который давал хорошие клинические результаты. Однако, вследст-
вследствие возникновения первичной и вторичной резистентности в результате
его долговременного применения, в настоящее время стало обязатель-
обязательным применение определенного сочетания препаратов — лечение дап-
соном сопровождается применением рифампицина и клофазимина. До-
Допускается и применение этионамида.
Дапсон (Dapson)
Дапсон - 4,4-диаминодифенилсульфон 1.34.2 3) пол>чают исходя
либо из 4-\лорнитробензола, либо из натриевой соли 4-ацетами-
добезолсульфоновой кислоты. Взаимодействием 4-хлорнитро-
бензола с сульфидом натрия получают 4,41-динитродифенилтио-
эфир C4.2.1), окислением атома серы в котором дихроматом калия
в серной кислоте получают 4,41-динитродифенилсульфон C4.2.2).
Восстановлением нитрогрупп в последнем двухлористым оловом
в соляной кислоте получают искомый дапсон Предложено также
предварительно осуществлять восстановление нитрогрупп до ами-
аминогрупп, защищать их ацетильной защитой, окислить атом серы до
сульфона дихроматом калия и затем гидролизом убрать защитные
ацетильные группы [48, 49, 50]
34 2 1
SnCL / HCI
NO2
34 2 3
34 2 2
Иной подход к синтезу дапсона осуществлен исходя из 4-ацетами-
добезолсулъфоновой кислоты, взаимодействием которой с 4-хлор-
нитробензолом при высоких температурах получают 4-ацетамидо-41-
нитродифенилсульфон 04.2.4), Восстановлением нитрогрупп в послед-
последнем двухлористым оловом в соляной кислоте и одновременным гид-
гидролизом в условиях реакции ацетильной группы получают искомый
дапсон [51, 52, 53].
-732-
Дапсон, впервые предложенный в 1941 г. обладает как бактерицид-
бактерицидной, так и бактериостатической активностью в отношении Mycobac-
tenum leprae и My cobactermm tuberculosis Предложен также для лече-
лечения больных герпетиоформным дерматитом. Полагают, что механизм
ei о действия заключается в конкурентном ингибировании фермента
днгидропротеатсинтетазы, блокирующей синтез фолиевой кислоты
\ микроорганизма, поскольку его также можно рассматривать в качестве
аналога я-аминобензойной кислоты.
Кюфазимин (Clofazimine)
Клофазимин — 2-(л-хлоранилино)-5-(и-хлорфенил)-3,5-дигидро-3-
(изопропилимино)-феназин C4.2.6) синтезируют, окисляя 2-(и-хлор-
анилино)анилин раствором хлористого железа в воде, что приводит
к получению 2-(и-хлоранилино)-5-(и-хлорфенил)-3,5-дигидро-3-ими-
нофеназина C4.2.5) Взаимодействием последнею с первичными
аминами, в частности с изопропиламином, происходит формальное
замещение атома водорода в иминной части молекулы на алкиль-
ную групп) вводимой аминогруппы, в данном случае не изопро-
пильную, с получением искомого препарата — клофазимина [54,
55, 56].
Клофазимин является замещенным иминофеназнном и впервые был
предложен для лечения лепроза в 1962 г., однако вошел в медицинскую
практику в конце 1980-х годов. Механизм его действия не окончательно
понят, однако есть предположение, что он может ингибировать образо-
образование матриц с ДНК, что приводит к задержке роста микобактерий
Клофазимин проявляе! бактерицидный эффект промежуточный между
дапсоном и рифампицином.
-733-
Глава 34
Список литераторы
1 LSPat 2 596 069A952)
2 LSPat 2 830 994A958)
3 Ger Pat 1 116 667A956) '
4 Meyer H et al / Monatsh Chem 33 393A912)
5 Lrbanski 1 etal '/Rocz Chem 27, 161 A953)
6 I S Pat 3 176 040A965)
7 Belg Pat 600 640A961)
8 Belg Pat 613 545 A962)
9 Wilkinson R etal/J Am Them Soc 83,2212A961)
10 Wilkinson R etal 'i Med Pharm Chem 5,835A962)
11 LiSPat 3 553 257A971)
12 LSPat 3 769 347A973)
P Ger Pat 2 205 269A972)
14 T SPat 3 944 616A976)
1^ Fr Pat 2 351 090A974)
16 Ger Pat 2 446 320A974)
17 Bnt Pat 1 469 014A974)
18 US Pat 3 944 617A976)
19 I SPat 3 944 618A976)
20 LSPat 3 944 619A976)
21 Bnt Pat 1 541290A976)
22 Ger Pat 623 257 A934)
23 But Pat 451 304A939)
24 LSPat 2 149 279A939)
25 LSPat 2 677 641 A954)
26 I SPat 2 780 069A957)
27 HallS etal J 4m Chem Soc 62,664A940)
28 Km, finer 4 etal J Am Chem Soc 74, 3617 A952)
29 Brit Pat 800 251 A957)
30 LibermannS etal Compt Rend Acad Soi 242, 2409 A956)
4 LibermannS etal 'Bull Soc Chim France 1958,687
32 Johnson К etal J \m Chem Soc 117,5009A995)
^ Planner P etal Heh Chim Acta 40, 1531 A957)
^4 Smart J etal Expenentia Ц, 291 A957)
35 US Pat 2 772 280A954)
36 LSPat 2 840 565A958)
3 LSPat 2 773 878A956)
4 LSPat 2 789 983A957)
39 I SPat 2 845 43^A958)
40
41
42
43
44
43
46
US Pat 3 124 590A964)
Bnt Pat 768 007 A957)
Stammer В etal J Am Chem Soc 77,2346A955)
USPdt 2 540 104A951)
US Pat 2 844 625A958)
Ger Pat 50 835A889)
SheehanJil Am Chem Soc 70, 1665A948)
47 ErlenmeyerE etal /Helv Chim Acta 31,988A948)
48 LSPat 2 235 889A945)
49 Fromm E et al Ber 41, 2264 A908)
RaizissG etal /J Am Chem So.. 61,2763A939)
Ferry С et al /Organic Synth 22, 32 A942)
Brit Pat 510 127A938)
US Pat 2 227 400A940)
Bam I etal /Nature, Г9, 1013 A957)
US Pat 2 948 726A960)
Barry P et al J Chem Soc 1958 859
50
51
52
53
54
55
-734-
Глава 35
Противогрибковые
препараты
Грибки, по сравнению с бактериями или вирусами, являются более
сложными организмами. Они имеют рибосомы, компоненты клеточных
стенок, ядерную мембрану, поэтому антибактериальные антибиотики,
как правило, неэффективны против патогенных грибков.
Грибковые инфекции (микозы) встречаются реже чем бактериаль-
бактериальные или вирусные. Однако это утверждение может оказаться неверным
для некоторых географических районов, благоприятных для существо-
существования и роста специфических грибковых патогенов. Некоторые грибко-
грибковые инфекции могут располагаться на поверхности тела и лишь достав-
доставлять локальное беспокойство, другие могут быть системными, угро-
угрожающими жизни. Причем одни и те же микроорганизмы (например,
Candida) могут из поверхностной локализации перейти и на внутренние
органы, приводя к системным заболеваниям с серьезными осложнения-
осложнениями. Грибковые (микотические) инфекции доставляют много беспокой-
беспокойства и, как правило, трудно вылечиваются.
Грибковые инфекции условно делятся на три категории, дермато-
фитные, кожно-слизистые и системные.
Наиболее распространенными являются дерматофитные грибко-
грибковые инфекции, включающие кожу, волосы и ногти. Большинство ин-
инфекций может быть вылечено применением таких наружных средств,
как толнафтаг, ундециленовая кислота, галопрогин, клотримазол и ми-
коназол Для глубоких инфекций, в частности инфекций ложа ногтя,
орально назначают гризеофульвин. В настоящее время в качестве пре-
препарата для лечения хронических дерматофитов широко используется
кетоконазол.
Кожно-сшзистые инфекции, вызываемые в основном грибком
Candida albicans, включают участки влажной кожи и слизистые мем-
мембраны (т. е. ЖКТ. перианальные и вульвовагинальные области). Для их
лечения наружно применяются амфотерицин В, миконазол, клотрича-
зол и нистатин. При хронических инфекциях орально применяется ке-
кетоконазол.
- 736-
Противогрибковые препарата
Системные грибковые заболевания встречаются реже, однако пред-
сив 1ЯЮ1 собой серьезную проблему, поскольку являются хронически-
хроническими по своей природе и трудно поддаются диагностированию и лечению.
В соответствии с вышеописанным противогрибковые препараты
характеризуются как дерматофитные, кожно-слизистые и системные, и,
соответственно, их рассматривают как:
• противогрибковые препараты для лечения системных и по-
поверхностных инфекций,
• противогрибковые препараты для лечения только поверхност-
поверхностных инфекций,
• противогрибковые препараты для лечения только системных
инфекций.
35.1. Противогрибковые препараты для лечения сис-
системных и поверхностных инфекций
К противогрибковым препаратам для лечения как системных, так
и поверхностных инфекций относятся амфотерицин В, нистатин, кето-
кетоконазол и мнконазол
Амфотерицин В (Amphotericin В)
Амфотерицин В — [1RAR*,3S*,5R\6R*,9R*,11R*,15S*,16R*,17R',
lSS*,19E*,21E',23*,25E*",27E*,29E',31E*,33R*,35S',36R',37S*)]-33-[3-
амино-3.6-дидезокси-Р-О-манопиранозил)-окси]-1,3,5.6,9,11,17,37-
октагидрокси-15,16,18-триметил-13-оксо-14,39-диоксабицикло-
[3331 ]-нонатриаконта-19,21,23,25,27,29,31 -гептаен-36-карбоновая
кислота C5.1.1.) является большим полиенновыУ1 антибиотиком,
получаемым из культуральной жидкости жизнедеятельности акти-
ноушцета Streptomyces nodosus [I, 2, 3, 4. 5]
..ОН
СООН
ОН
-737-
Глава 35
Соединение имеет широкий спектр антигрибковой активности,
включая Candida albicans, Leishmania brasiliensis, Mycobacterium leprae,
Histoplasma capsulatum, Blastomyces dermatitidus и Coccidioides immitis.
Имеет фунгистатическую и фунгицидную активность в зависимости
От используемой дозы.
Противогрибковая активность амфотерицина В проявляется по при-
причине его связывания со стеролами, в частности с эргостеролом, в кле-
клеточной мембране чувствительных грибков. Это взаимодействие создает
поры в мембранах и увеличивает проницаемость мембран в отношении
малых молекул, понижая таким образом функцию мембран в качестве
осмотического барьера и делая клетки более чувствительными к разру-
разрушению. Амфотерицин В активен по отношению к растущим клеткам
и клеткам, находящимся в состоянии покоя. Однако соединение невы-
сокоселективно и взаимодействует и с клетками хозяина — млекопи-
млекопитающего.
Несмотря на многие побочные реакции, амфотерицин В остается
первым препаратом для лечения острых, сильных системных грибковых
инфекций. Применяется при генерализованных грибковых инфекциях:
кандидомикозе, аспергиллезе, гистоплазмозе, криптококкозе, кокцидо-
микозе, бластомикозе, легочных микозах.
Синонимами препарата являются амфоциклин, фунгизон, фунгилин
и др.
Нистатин (Nystatin)
Нистатин — стереоизомерные 33-[3-амино-3,6-дидезокси-р-Б-ма-
нопиранозилокси]-1,3,4,7,9,11,17,37-октагидрокси-15,16,18-триме-
тил-13-оксо-14,39-диоксабицикло-C3.3.1)-нонатриаконта-19,21,25,
27,29,31-гексаен-36-карбоновая кислота C5.1.2) [6, 7, 8, 9, 10, 11,
12, 13. 14].
сн3-
35 1.2
,.ОН
СООН
СНз
-738-
Противогрибковые препапят^,
Нистатин был выделен в 1949 г. из продуктов жизнедеятельности
актиномицетов Streptomyces noursei и был первым из найденных анти-
микотических антибиотиков. Это полиеновый антибиотик, структурно
сходный с амфотерицином В. Имеет широкий спектр активности. Ме-
Механизм противогрибкового действия сходен с механизмом действия ам-
амфотерицина В. Применяется для профилактики и лечения кандидных
инфекциий кожи и слизистых мембран. С профилактической целью
применяют для предупреждения и развития кандидомикоза при дли-
длительном лечении препаратами пенициллина и антибиотиками других
групп, особенно при пероральном применении антибиотиков тетрацик-
линового ряда, левомицетина и др.
Синонимами препарата являются биофанал, моронал, ниспорил, фа-
зигин, кандекс и др.
Имидазолы
Для лечения грибковых инфекций оказались весьма пригодными
некоторые производные имидазола. К ним относятся кетоконазол, ми-
коназол, клотримазол, эконазол и бутоконазол и др.
Противогрибковая активность производных имидазолов в настоя-
настоящее время объясняется их способностью селективно повышать прони-
проницаемость мембран грибковых клеток путем вмешательства в биосинтез
стеринов, в частности эргостерина, ингибируя его синтез, и изменением
липидного состава мембраны. Однако, в отличие от амфотерицина В,
производные бензимидазола активны только по отношению к растущим
клеткам. Клетки хозяина при этом не подвергаются действию препара-
препаратов, поскольку для своей жизнедеятельности млекопитающие исполь-
)\ют экзогенные стеролы.
Кетоконазол ((Ketoconazol)
Кетоконазол — г/7Лс-1-ацетил-4-[4-[2-B,4-дихлорфенил)-2-A//-ими-
дазол-1-илметил)-1,3-диоксолан-4-илметил]фенил]пиперазин C5.1.6)
синтезируют исходя из 2.4-дихлорфнацилбромида, кетализацией
которого с помощью глицерина получают г/ис-2-B,4-дихлорфенил)-
2-бромэтил-4-гидроксиметил-1,3-диоксолан C5.1.3). Ацилируя гид-
роксильную группу последнего беизоилхлоридом и далее алкили-
руя полученным соединением имидазол, получают производное
C5.1.4). Далее щелочным гидролизом удаляют бензоильную группу
и взаимодействием с метансульфохлоридом получают мезилат
C5.1.5). Наконец алкилируя последний 1-ацетил-4-D-гидрокси-
фенил)пиперазином, получают кетокеназол [15, 16, 17, 18].
-739-
Глава 35
C-CH2-Br
сн2-он
сн-он
Сг12-ОН
СН2ОН /=\
С-СН2-Вг
соа
IT— N
О
35 1 6
Кетоконазол имеет широкий спектр противогрибковой активности,
включая многие кандидные инфекции. Обладает фунгицидной и фунги-
статической активностью в отношении дерматофтов, дрожжевых гриб-
грибков, диморфных грибков и эумицетов. Активен также в отношении ста-
стафилококков и стрептококков. Эффективен при хронических заболева-
заболеваниях, при лечении грибковых инфекций ЖКТ, половых органов, кожи,
волос и ногтей. Используется и в составе шампуней при лечении и про-
профилактике плесневых микозов, себорейного дерматита, перхоти.
Синонимом препарата является низорал и др
Миконазол (Miconazol)
Миконазол — 1-[2.4-дихлор-р-[B,4-дихлорбензил)окси]фенэтил]-
имидазол C5.1.8) так же, как и кетоконазол, синтезируют исходя из
2,4-дихлорфнацилбромида, взаимодействием которого с имидазо-
лом получают 1-B,4-дихлорбензоилметил)-имидазоло[2,4-дихлоро-
ш-A-имидазолил)ацетофенон] C5.1.6) Восстановлением карбо-
карбонильной группы в последнем боргидридом натрия получают 1-B,4-
ди\лорфенил)-2-A-имидазолил)-этанол C5.1.6), алкилированием
-740-
Противогрибковые препараты
гидроксильной группы которого 2.4-дихлорбензилбромидом с ис-
использованием в качестве основания такого мощного основания, как
гидрид натрия, получают миконазол [19, 20, 21].
О
35 1 6
NaBHj
Br-CH2
35 1 7
Миконазол предназначен в основном для внешнего применения при
кандидных и дерматофитных инфекциях кожи и вагинальном кандидо-
зе. а также при острых внутренних микозах.
Синонимами препарата являются акнидазил, дактар, дермонистар
и др.
35.2. Противогрибковые препараты для лечения
поверхностных инфекций
Гршеофуяьвин (Griseofulvin)
Гризеофульвин — 7-хлоро-2',4,6-триметокси-б'-метилспиро[бензо-
фуран-2(ЗЯ),1 '-[2]-циклогексен]-3',4-дион C5.2.1) — антибиотик,
продуцируемый плесневым грибком Penicillium patulum [22, 23, 24,
25,26,27,28,29].
сн3
СН-.О'
CI снз
35 2 1
Гризеофульвин является противогрибковым средством для лечения
поверхностных инфекций, оказывающим фунгистатическое действие на
-741 -
Глава 35
разные виды дерматофитов (трихофиты, микроспорумы, ахорионы,
эпидермофитоны). Антимикотическая активность объясняется способ-
способностью ингибировать клеточный митоз грибков, вызывая образование
многоядерных дефектных клеток. Спектр антимикотической активности
гризеофульвина включает дерматофитные инфекции кожи, ногтей
и скальпа. Препарат неэффективен в отношении глубоких системных
микотических инфекций. Неэффективен при кандидомикозах. К нему
может развиться резистентность.
Препарат, в основном, применяют при лечении больных, страдаю-
страдающих фавусом, трихофитией и микроспорией волосистой части головы
и гладкой кожи, поражением ногтей, красным эпидермофитоном. Гри-
зеоф)львин применяется только в виде оральных лекарственных форм.
Синонимами препарата являются фульцин, ликудеи, грифульвин
и др.
Имидазолы
Эконазол (Econazol)
Эконазол — 1-[2,4-дихлор-Р-[D-хлорбензил)окси]фенэтил]-имида-
зол C5.2.2) является аналогом миконазола, отличающимся отсутст-
отсутствием одного атома хлора в бензильной части молекулы и синтези-
синтезируемого аналогичным путем лишь с использованием на последней
стадии 4-хлорбензилхлорида вместо 2,4-дихлорбензилбромида [19,
20,21].
С1 35 2 2
Эконазол применяется наружно, только накожно, при лечении ли-
лишаев и кандидозов, вызванных чувствительной к препарату флорой
{Frichophitun rubrum, Trichophiton mentagrophytes, Trichophiton
tonsurans, Microsporum canis, Microsporum audouini, Microsporum
gy-pseum, Candida albicans). При местном применении препарат вызыва-
вызывает гибель грибков в течение 3 дней.
Синонимами препарата являются певарил, экостатин, дермазол и др.
-742-
Противогрибковые препараты
Сулкопазол (Sulconazol)
С\лконазол — 1-[2,4-дихлор-р-[D-хлорбензил)тио]фенэтил]-имида-
зол C5.2.2) является аналогом эконазола, отличающегося от по-
последнего заменой эфирного кислородного мостика, соединяющего
4-хлорбензильную часть молекулы с фенэтилимидазольной, на тио-
эфирный. Соответствующие изменения в синтезе препарата заклю-
заключаются в замещении гидроксильной гуппы в 1-B,4-дихлор-фенил)-
2-A-имидазолил)-этаноле C5.1.6) на атом хлора с использованием
хлористого тионила и последующем взаимодействии полученного
хлорида с 4-хлорбензилмеркаптаном с получением сулконазола
[30.31].
1 soci2
2 hs-ch2-<\ л-ci
35 1
35 2 3
Гак же как и эконазол, сулконазол применяется наружно, только
накожно, по тем же пок-заниям, что и эконазол
Синонимами препарата являются экселдерм, сулкозил и др.
Бутоконазол (Butoconazol)
Бутоконазол — 1-[4-D-хлорфенил)-2-[B,6-дихлорфенил)тио]бу-
тил]-1Я-имидазол C5.2.6) синтезируют исходя из 4-хлорбен-
зилмагний бромида, взаимодействием которого с эпихлоргидрином
получают 4-D'-хлорфенил)-1-хлорбутанол-2 C5.2.4), взаимодейст-
взаимодействием которого с имидазолом в присутствии натрия получают 4-D'-
\лорфенил)-1-AЯ-имидазол-ил)бутанол-2 C5.2.5). Замещая в по-
последнем гидроксильную группу на хлор с использованием хлори-
хлористого тионила и далее взаимодействием с 2,6-дихлортиофенолом
получают бутоконазол [32, 33].
О
¦CH--MgBr
~СН;—С!
:Н2-СН2-СН-СН2-С!
ОН
35 2 4
-743-
Глава 35
-CH2-CH2-CH-Ch2 —N
ОН
1 SOCI2
Бутоконазол является фунгостатиком и его формально можно отне-
отнести к класс} имидазолов, но лишь по признаку наличия в структуре
препарата имидазольного кольца. Полагают, что он, как и миконазол,
эконазол и другие «чистые» представители ряда имидазолов, также ин-
гибирует биосинтез эргостерина в цитоплазматической мембране гриб-
грибков, однако вполне вероятно, что это не есть единственный механизм
его действия. Препарат эффективен при вагинальных инфекциях, вы-
вызванных кандидами разного типа. Применяется в качестве только на-
наружно средства и только вагинально.
Синонимами препарата являются фемстат, листовин и др.
Терконазол (Terconazol)
Терконазол — 1 -[4-[[2-B,4-дихлорфенил)-2-( 1Н-1,2,4-ч риазол-1 -ил-
метил)-1,3-диоксолан-4-ил]метокси]фенил]-4-A-метилэтил)-пипера-
зин C5.2.13) химически весьма напоминает кетоконазол с той лишь
разницей, что вместо имидазольного кольца в структуру препарата
включено триазольное кольцо, а пиперазиновое кольцо вместо аце-
ацетильной замещено изопропильной группой. Синтез препарата осу-
осуществляют исходя из 2,4-дихлорацетофенона, взаимодействием ко-
которого с глицерином в присутствии л-толуолсульфокислоты полу-
получают кеталь — 2-B,4-дихлорфенил)-2-метил-4-гидроксиметил-1,3-
диоксолан C5.2.7). Бромируя последний молекулярным бромом по
метильной группе, и далее ацилированием свободной гидроксиль-
ной группы хлористым бензоилом получают 2-B.4-дихлорфенил)~2-
бромметил-4-бензоилоксиметил-1.3-диоксолан C5.2.8). Взаимодей-
Взаимодействием последнего с 1,2,4-триазолом в прис\тствии натрия и после-
последующим гидролизом защитной бензоильной группы гидроокисью
натрия получают 2-B,4-дихлорфенил)-2-A#-1,2,4-триазол-1 -илметил)-
4-гидроксиметил-1,3-диоксолан C5.2.9). Обработкой последнего
метансульфохлоридом получают мезилатC5.2.10).
г Q-cca
CH-Cri
Ch2-On
-744-
Противогрибковые препараты
N
Н
2- NaOH
СН2-ОН
CH2-OSO2CH3
;h3so2ci
Второй необходимый компонент синтеза — 1-изопропил-4-D-
гидроксифенил)пиперазин C5.2.12) получают исходя из 4-D-метокси-
фенилпиперазина). Восстанавливая последний водородом в присутст-
присутствии ацетона и использ>я в качестве катализатора палладий на угле, по-
получают 1-изопропил-4-D-метоксифенил)пиперазин C5.2.11). Обработ-
Обработкой полученного продукта концентрированной бромистоводородной
кислотой снимают защиту с фенольного гидроксила с получением
1-изопропил-4-D-гидроксифенил)пиперазинаC5.2.12)
CH3 HBr
CH3
h'
CH3
Наконец, взаимодействием мезилата C5.2.10) с полученным 1-изо-
пропил-4-D-гидроксифенил)пиперазином C5.2.12) получают искомый
терконазол [34, 35. 36, 37].
C42-OSO2Cri3
\2*4
Терконазол эффективен для фунгистатического действия на многие
штаммы Candida и дерматофитов. Точный механизм его действия не-
неясен, однако, подобно другим описанным выше азолам, препарат инги-
бирует действие фермента ланостерол 1-деметилазы цитохрома Р-450
чувствительных фибков, вызывая уменьшение количества эргостерина,
необходимого микроорганизму для конструирования мембраны и при-
приобретения соответствующей проницаемости. Препарат применяется
только наружно и только вагинально для лечения вульвовагинальных
кандидозов.
Синонимами препарата являются теразол, теркоспор и др.
-745-
Глава 35
Кютримазол (Clotrimazol)
Клотримазол — 1-(о-хлор-сс,сс-дифенилбензил)имидазол C5.2. 15)
получают взаимодействием 2-хлортрифенилметилхлорида C5.2.14)
с имидазолом в присутствии триэтиламина [38, 39, 40, 41, 42].
л—N
О
CI
CI
35 2 14
352 15
Исходный 2-хлортрифенилметилхлорид предложено получать раз-
различными путями. В частности, хлорированием на свету 2-хлортолуола
получают 2-хлортрихлорметилбензол C5.2.16), взаимодействием кото-
которого с бензолом в присутствии хлористого алюминия получают 2-хлор-
2-хлортрифенилметилхлорид C5.2.14).
сь
А1С13
CI
35 2 14
Альтернативным путем получения 2-хлортрифенилметилхлорида
являйся реакция Гриньяра между 2-хлорбензофеноном и фенилмаг-
нийбромидом и замещением гидроксильной группы в полученном
2-хлортрифенилмегилкарбиноле C5.2.17) на хлор с помощью хлористо-
хлористого тионила.
с-он
-746-
Противогрибковые препараты
И, наконец, взаимодействием пятихлористого фосфора 2-хлор-
2-хлорбензофеноном получают 2'-хлор-1,1-дихлордифенилметан C5.2.18),
алкнлированием последним бензола в присутствии хлористого алюми-
алюминия гакже получают 2-хлортрифенилметил.хлорид C5.2.14).
РС15
А1С13
CI
C-CI
35 2 18
CI
35 2 14
Клотримазол также формально относится к производным имидазола
лишь по признаку наличия в структуре молекулы препарата имидазоль-
ного кольца. Полагают, что он, как и миконазол, эконазол и другие
«чистые» представители ряда имидазолов, также ингибирует биосинтез
эргостерина в цитоплазматической мембране грибков.
По фармакологическому действию клотримазол очень схож с мико-
назолом. Имеет широкий спектр противогрибковой активности. Эффек-
Эффективен в отношении дерматофитов, а также оказывает противомикробное
действие в отношении стрептококков и стафилококков. Эффективен и в
отношении трихомонад. Препарат очень широко применяется для лече-
лечения поверхностных инфекций как накожно, так и вагинально.
Синонимами препарата являются канестен, эмпецид, лотримин, ми-
коспорин и др.
Прочие
Нафтифин (Naftifine)
Нафтифин — (Е)-М-метил-М-C-фенил-2-пропенил)-1-нафталинме-
танамин C5.2.19) получают алкилированием Ы-метил-A-нафтилме-
тил)амина кротилхлоридом в присутствии соды [43,44,45, 46, 47, 48].
Na2CO3
с=с
CI—Си/ Н
СЧ3
-747-
Глава 35
Нафтифин является первым представителем нового класса противо-
противогрибковых препаратов, классифицируемых как аллиламины. и разре-
разрешенного к применению только наружно и только накожно в качестве
препарата с широким спектром действия в отношении дерматофитных
и кандидных инфекций. Согласно первоначально полученным данным,
препарат превосходит по активности эконазол. Более того, препарат не
имеет местнораздражающего действия. Полагают, что фунгицидная
активность препарата основывается на его способности ингибировать
грибковый фермент сквален эпоксидазу и тем самым понижать концен-
концентрацию эргостерола. Соответствующий фермент млекопитающих при
этом ингибируется значительно меньше.
Синонимами препарата являются экзодерил, нафтин и др.
Гаюпрогин (Haloprogin)
Галопрогин — 3-йодо-2-пропинил-2,4,5-трихлорфениловый эфир
C5.2.21) получают замещением на йод смесью йода и йодистого ка-
калия, медного производного 2,4,5-трихлорфенилпропаргилового эфира
C5.2.20), получаемого по стандартной методике из пропаргилбро-
мида и 2,4,5-трихлорфенола в присутствии гидроокиси натрия [49,
50,51].
¦ в,-сн;-==сн -^ с,-0-с-си2-сн=н—-
С! 55 2 20
Галопрогин применяют в качестве наружного средства при умерен-
умеренных дерматофитных инфекциях (опоясывающий лишай), он эффективен
при кожных кандндных инфекциях.
Синонимами препарата являются галотекс, мицилан, миканден и др.
Толнафтат (Tolnaftat)
Толнафтат — О-B-нафтил)-ТЧ-ме1ИЛ-]Чт-C-толил)-тиокарбамат C5.2.23)
получают взаимодействием эквимольных количеств 2-нафтола и тио-
фосгена с получением продукта монозамещения в фосгене C5.2.22),
который далее вводят во взаимодействие с N-метил-З-толуидином
с получением искомого толнафтата [52, 53, 54, 55].
-748-
Противогрибковые препараты
Голнафтат применяют в качестве наружного средства при умерен-
умеренных дерматофитных инфекциях (опоясывающий лишай), он неэффекти-
неэффективен при кандидных инфекциях.
Синонимами препарата являются тинатокс, тонофтал, тимопед, ти-
надерм.тинактин и др.
Ундециленовая кислота (Undecylenic acid)
Ундециленовая кислота — 10-ундеценовая кислота C5 2.24) получа-
получается пиролизом при 400 °С и низком давлении E0мм) оксипроизвод-
ного олеиновой кислоты — рицинолиевой кислоты, глицерид кото-
которой образует главную составляющую касторового масла [56, 57]
j— lCH2l5-CH-CH2-CH = CH— (CHZ)--COOH
он
Ч2С=СН- (CH2)8-COOri
35 2 24
CH3-(CH2M-CH=O
Ундециленовая кислота, равно как и ундециленат цинка весьма эф-
эффективны в качестве наружного средства при умеренных дерматофит-
дерматофитных инфекциях и дрожжевых дерматитах, но неэффективны при опо-
опоясывающем лишае и при кандидных инфекциях.
Синонимами препарата являются бензодем, микоцид, ундетин и др.
Натамицин (Natamycin)
Натамицин — смесь стереоизомерных 22-[C-амино-3,6-дидезокси-
Р-В-маннопиранозил)окси]-1,3,26-тригидроксн-12-метил-10-оксо-6,
11,28-триоксатрицикло[22.3.1.0.5 ']-октакоза-8,14,16,18,20-пентен-
25-карбоновых кислот C5.2.25), как и амфотерицин и нистатин, яв-
является полиеновым антибиотиком и выделяется из продуктов жиз-
жизнедеятельности актиномицетов Streptomyces natalensis [58, 59, 60].
СН3
..ОН
соон
35 2 25
Спектр его активности несколько более узок, чем амфотерпцина и
нистатина, но одновременно препарат и менее токсичен. Особенно вы-
-749-
Глава 35
раженная активность отмечена в отношении некоторых штаммов
Fusarium и Cefalosporium Натамииин является препаратом для лечения
поверхностных грибковых инфекций и применяется только в офтальмо-
офтальмологических целях.
Синонимами препарата являются пимафугин, пимарицин, теннеце-
тин и др.
35.3. Противогрибковые препараты для
лечения системных инфекций
Флуцшпозин (Flucytosin)
Флуцитозин — 5-фторцитозин C5.3.3) предложено получать исходя
из фторурацила C0.1.3.3). При первом способе, подвергая послед-
последний действию хлорокиси фосфора в диметиланилине, получают 2,4-
дихлор-5-фторпиримидин C5.1.1), взаимодействием которого с ам-
аммиаком получают продукт замещения атома хлора в положении 4
пиримидинового кольца — 4-амино-2-хлор-5-фторпиримидин
C5.3.2). Гидролизом хлорвинильного фрагмента в последнем рас-
раствором соляной кислоты получают искомый флуцитозин [61, 62, 63,
64].
HjO/ НС!
h
30 1 3 3
Альтернативным вторым способом синтеза является получение
фл>иитозина из прекурсора фторурацила — из 5-фтор-2-метилтио-
>ранила C0.1.3.2) примерно по аналогичной схеме. Обработкой 5-фтор-
2-метилтио\рацила C0.1.3.2) с пятихлористым фосфором получают
4-хлор-5-фтор-2-метилтиопиримидин C5.3.4), который взаимодействи-
взаимодействием с аммиаком трансформируют в 4-амино-5-фтор-2-метилтиопирими-
дин C5.3.5). Гидролизом метилтиовинильного фрагмента в последнем
действием концентрированной бромистоводороднои кислоты получают
искомый флуцитозин [65, 66, 67].
'Гч
30 1 3 2
Nria
NH2
-750-
Противогрибковые препараты
Флуцитозин является фторированным производным пиримидина.
Ьго спектр активности уже чем у амфотерицина В. Однако он проявляет
синергическое действие при использовании в комбинации с амфотери-
цином В. В чувствительных грибках флуцитозин трансформируется
в 5-фторурацил, который, в свою очередь, превращается в 5-фтордезо-
кси\ридиловую кислоту — ингибитор тимидилат синтетазы и, соответ-
соответственно, синтеза ДНК. В процесс может быть вовлечен и трифосфат
5-фторурацила, вызывающий образование дефектных РНК. Механизм
высокоселективен, поскольку клетки млекопитающих не в состоянии
превращать большие количества флуцитозина в 5-фторурацил.
Флуктозин используется в качестве самостоятельного препарата,
однако, как правило, его используют в комбинации с амфотерицином
для лечения определенных системных грибковых инфекций, в частно-
С1И для лечения подкожных хромобластомикозов. Препарат интенсивно
используется при лечении системных инфекций мочеполовых путей,
вызванных различными штаммами Candida.
Синонимами препарата являются анкобон, анкотил и др.
Список литературы
2.
3.
4.
5.
6.
7.
8.
9.
10.
Gold W. et al /'Antibiot. Ann. 1955-1956, 579.
\ andeputteJ et al.//Antibiot. Ann. 1955-1956, 587.
DutcherJ. et al.//Antibiot. Ann. 1955-1956, 866.
Walters A et al.//J. Am. Chem. Soc. 79, 5076 A957).
US Pat. 2.908.611 A959).
Hazen E. et al./7Science, U2, 423 A950).
Hazen E. et aL'/Proc. Soc. Exp. Biol. Med. 76, 93 A951)
Cohen R. et al./,'Arch. Pediatrics, 69, 414 A952).
US Pat. 2.786.781 A957).
US Pat. 2.797.183A957).
11. US Pat. 2.832.719A958).
12. US Pat. 3.517.100A970).
13. ZelinskiJ. et al/'J. Antibiot. 4J., 1289 A988).
14. Seneca Я./ZAntibiot. Ann. 1955-1956, 697.
15. Ger. Pat. 2.804.096A978).
16. US Pat. 4.144.346A979).
17. US Pat. 4.223.036A980).
18. HeersJ. et al./J. Med. Chem. 22, 1003 A979).
19. Ger. Pat. 1.940.388A970).
20. US Pat. 3.717.655A973).
-751 -
Глава 35
Противогрибковые препараты
21. Godefroi E. et al. /J. Med. Chem. 12, 784 A969).
22. Brit. Pat. 784.618A955).
23. US Pat. 2.900.304A959).
24. US Pat. 3.038.839A962).
25. US Pat. 3.069.328A962).
26. US Pat 3.069.329A962).
27. Oxford A etab/Biochem. 133.240A939).
28. Grove J et al., 'Chem. & Ind. (London), 1951, 219.
29. Grove J et al./J. Chem. Soc. 1952, 3977.
30. Ger. Pat. 2.541.833A976).
31. US Pat. 4.038.409A977).
32. US Pat. 4.078.071A978).
33. Walker К et al.'. J. Med. Chem. 2\, 840 A978).
34. US Pat. 4.144.346A979).
35. US Pat. 4.223.036A980).
36. HeersJ. et ab'J. Med. Chem. 26, 611 A983).
37. HeersJ. et ab/J. Med. Chem. 22, 1003 A979).
38. Ger. Pat. 1.617.481 A967).
39. Ger. Pat. 1.670.976A968).
40. US Pat. 3.660.577A972).
41. US Pat. 3.705.172A972).
42. S.Afr. Pat. 68 05.392A972).
43. Ger. Pat. 2.716.943A977).
44. Ger. Pat. 2.809.211 A978).
45.Belg. Pat. 853.976A977).
46. US Pat. 4.282.251 A981).
47. Span. Pat. 504,432A982).
48. LoibnerH. et ab/Terahedron Letters. 25, 2535 A984).
49. US Pat. 4.038.409A977).
50. Japan Pat. 64 19.791 A964).
51. SekiS. et al. Agr. Biol. Chem. (Tokyo), 27, 150A963).
52. US Pat. 3.334.126A967).
53. Brit. Pat. 967.897A962).
54. Fr. Pat. 1.337.797A963).
55. Noguchi N et al.'/J. Pharm. Soc. Japan, 88, 335 A968).
56. Kraft F>Ber. 10.2034A877).
57. Perkins G. et al. J. Am. Chem. Soc. 49, 1070 A927).
58. Struyk et al./ Antibiot. Ann. 1957-1958, 878.
59. Brit Pat, 844.289 A960).
60. Brit. Pat. 846.933 (I960).
61. US Pat. 3.040.026A962).
62. US Pat. 3.185.690A967).
63. Dunschinsky R. etal.U. Am. Chem. Soc. 79_, 4559 A957).
64. Undheim К et aL'/Acta. Chem. Scand. 23 294 A969)
65. US Pat. 3.945.038A967).
66. US Pat. 2.802.005A957).
67. US Pat. 3.368.938A968).
68. Ger. Pat. 2.716.943 A977). C2)
69. Ger. Pat. 2.809.211 A978).
70. Belg. Pat. 853.976A977).
71. US Pat. 4.282.251A981).
72. Span. Pat. 504.432 A982).
73. LoibnerH. et al.//Terahedxon Letters. 25, 2535 A984).
74. US Pat. 4.038.409A977).
75. Japan Pat. 64 19.791 A964).
76. SekiS et al./,'Agr. Biol. Chem. (Tokyo). 27, 150 A963).
77. US Pat. 3.334.126A967).
78. Brit. Pat. 967.897A962).
79. Fr. Pat. 1.337.797 A963).
80. Noguchi N. et ab'J. Pharm. Soc. Japan, 88, 335 A968).
81. Kraft f,//Ber. 10, 2034 A877).
82. Perkins G et ab'J. Am, Chem. Soc. 49, 1070 A927).
-752-
Глава 36
Противовирусные
препараты
Вирусы служат причиной большего числа болезней, чем любая дру-
другая группа паразитов. Они могут вызвать слепоту, глухоту, паралич,
умственную отсталость, различные врожденные дефекты и, по крайней
мере у некоторых растений и животных, рак. Среди наиболее известных
вирусных заболеваний следует назвать корь, свинку, оспу, ветряную
оспу, грипп, полиомиелит, желтую лихорадку. Имеются подозрения, что
вирусы являются причиной рассеянного склероза, болезни Ходжкина,
болезни Дауна и даже, возможно, шизофрении.
Однако, несмотря на значительный прогресс, достигнутый в облас-
области лечения бактериальных инфекций, достижения химиотерапии вирус-
вирусных заболеваний значительно скромнее. Имеется лишь небольшой на-
набор доступных препаратов для лечения весьма ограниченного числа
вирусных заболеваний.
Вирус — это одна из величайших загадок биологии. Его очень
трудно дифференцировать в качестве объекта, относящегося к живой
или неживой природе. Место вируса, по-видимом}, находится где-то
посередине между молекулой и живым организмом. Одновременно его
можно считать и самым мелким организмом, и самой большой молеку-
молекулой. Большую часть времени у вируса нельзя обнаружить никаких при-
признаков жизни: в таком состоянии он может оставаться годами. Однако
в любой момент он может «воскреснуть»; для этого нужна лишь вос-
восприимчивая клетка, которую вирус мог бы заразить.
Каждый вирус способен заражать только ограниченный ассорти-
ассортимент клеток. Это позволяет разделять их на 3 основные группы:
1) вирусы, поражающие растения;
2) вирусы, поражающие животных, в том числе и человека;
3) вирусы, поражающие одноклеточные организмы (микробы
или бактерии).
Внр\сы являются значительно более простыми организмами, чем
бактерии, и построены из двух веществ — белка и нуклеиновой кисло-
кислоты. Простчю вирусную частицу можно считать единичной нлклеопро-
-754-
Противовирусные препараты
теидной молекулой, образованной из молекулы нуклеиновой кислоты,
химически связанной с объемистой белковой молекулой. Причем бел-
белковая молекула играет роль защитной оболочки. Таким образом, вирус
схематично можно описать как некий нуклеиновокислотный вкладыш,
защищенный белковым покрытием. Вирус может содержать либо РНК,
либо ДНК, но никогда не содержит обе кислоты вместе. Тип нуклеино-
нуклеиновых кислот является основой для одной из классификаций вирусов. Ви-
р\сы являются облигативньши внутриклеточными паразитами, которые
после внедрения в клетку, т. е. после ее инфицирования, используют
многие биохимические системы клетки хозяина. Внедрение в живую
клетку и участие в ее сложных интимных механизмах, как будто он яв-
является частью ее хромосомного аппарата при относительной простоте
собственного строения, с одной стороны, создают огромные трудности
для нахождения избирательно токсичных по отношению к вирусам пре-
препаратов, с другой стороны — делают вирус мощным орудием для ис-
исследований. В частности, в процессе размножения вирусы в основном
используют аппарат биосинтеза клеток организма хозяина, модифици-
модифицируя его определенным образом. Поэтому очень трудно подобрать со-
соединения с клинически полезной противовирусной активностью, кото-
которые не повреждали бы нормальный клеточный метаболизм
неинфицированных клеток хозяина и, тем самым, не оказывали бы на
него токсического действия. Тем не менее имеются определенные про-
противовирусные препараты, обладающие определенной избирательностью
действия в отношении зараженных вирусом клеток и подавляющих реп-
ликативный цикл вирусов.
Несмотря на то, что точный механизм инфицирования весьма спе-
специфичен для каждого типа вирусов, общую схему инфицирования мож-
можно представить следующим образом. Вирус абсорбируется на поверхно-
поверхности клетки хозяина, по всей вероятности путем электростатических
взаимодействий. Не исключено, что многие вирусы присоединяются
к определенным вирус-специфичным рецепторам. Затем вирус проника-
проникает в мембрану клетки хозяина и там высвобождает из белковой оболоч-
оболочки нуклеиновую кислоту, утрачивая при этом свою индивидуальность
как вирус. Далее вирусная нуклеиновая кислота начинает вести себя
так, как будто она представляет собой функциональную часть клетки
хозяина. Начинаются репликация и транскрипция вирусного генома
либо в цитоплазме, либо в ядре клетки хозяина. В результате описанных
событий производится значительное количество вирусной нуклеиновой
кислоты и белка для генерации нового поколения вирионов. При этом
репликационный механизм клетки хозяина полностью выключается, и,
раз начавшись, описанный цикл многократно повторяется.
-755-
Глава 36
Химиотерапия вирусных инфекций достигается 3 различными под-
подходами, включающими:
1) профилактическую иммунизацию;
2) использование эндогенных противовирусных веществ, на-
например интерферона, который, как полагают, связываясь со
специфическими рецепторами на поверхности клеточной
мембраны, инициирует внутри клетки синтез РНК и белков,
проявляющих противовирусный эффект;
3) применением антивирусных препаратов.
Первыми препаратами, предложенными в качестве противовирус-
противовирусных средств, явились йдоксуридин и цитарабин, а также, несколько
позже, вндарабин, названные антивирусными препаратами первого по-
поколения. Они имеют ограниченное клиническое применение из-за низ-
низкого терапевтического индекса (отношения эффективности к токсично-
токсичности). Эти препараты воздействуют непосредственно на репликацию
вирусов, однако ингибируют и определенные функции клеток хозяина.
Позже были предложены амантадин, ацикловир, рибавирин и зидову-
дин. В настоящее время для лечения СПИДа предложен ряд новых пре-
препаратов — рибавирин, амплиген, дидезоксицитидин и фоскарнет.
Исследования в области синтеза противовирусных препаратов
только недавно позволили сделать значительный шаг в области лечения
заболеваний, вызванных вирусом простого герпеса, и совсем недавно
для лечения СПИДа. Эти препараты действуют путем ингибирования
процесса размножения вирусных клеток.
В настоящее время в качестве противовирусных препаратов исполь-
злются амантадин, видарабин, трифлуридин, йдоксуридин, ацикловир,
рибавирин и зидовудин. Анализ механизмов действия существующих
и применяемых противовирусных препаратов позволяет заключить, что
они могут повышать резистентность клетки к вирусу (интерфероны);
\гнетать адсорбцию вируса на клетке, проникновение его в клетку, про-
процесс его «депротеинизации» в клетке (амантадин): они также являются
атиметаболитами, ингибирующими синтез нуклеиновых кислот. Клини-
Клиническая «полезность» этих пиримидиновых и пуриновых препаратов на-
напрямую зависит от их способности селективно блокировать синтез ви-
вирусных нуклеиновых кислот, не затрагивая при этом синтез
нуклеиновых кислот клеток хозяина.
Амантадин (Amantadin)
Амантадин — 1-адамантанамин C6.1.3) получают исходя из ада-
мантана, бромированием которого молекулярным бромом вначале по-
-756-
Противовирусные пр
л\чают 1-бромадамантан C6.1.1). Вводя последний в реакцию Риттера,
получают 1-ацетиламиноадамантан C6.1.2). Гидролизом последнего
гидроксидом натрия получают амантадин [1, 2, 3,4, 5, 6].
Вг2
CH3CN '
NHCOCH3
NH2
36 1 1
Амантадин является первичным амином — производным адамантана.
Влияет на миксовирусы, которые относятся к РНК-содержащим вирусам.
Препарат имеет очень узкий спектр действия и показан только при лече-
лечении и профилактике гриппа А. Используется также при лечении паркин-
паркинсонизма. Точный механизм антивирусного действия амантадина не пол-
полностью понятен. Полагают, что он является блокатором ионных каналов.
Предполагается также, что амантадин ингибирует абсорбцию вирусных
частичек в клетку хозяина, что выражается в сбоях при проникновении
вируса в клетку или ингибировании «процесса раздевания» вируса.
Основное применение — профилактика гриппа типа А2.
Синонимами препарата являются симметрел, вирегит, мантадан
и др.
Ацикловир (Acyclovir)
Ацикловир — 2-амино-1,9-дигидро-9-[B-гидроксиэтокси)метил]-
6//~пурин-6-он C6.1.5). Согласно первому способу, его получают
алкилированием гуанина 1-бензоилокси-2-хлорметоксиэтаном в три-
этиламине. Гидроксильная и аминогруппы гуанина при этом пред-
предварительно защищаются триметилсилильной защитой обработкой
гексаметилдисилазаном. После гидролиза полученного при этом
продукта водой выделяется 9-B-бензоилоксиметоксиметил)гуанин
C6.1.4). Обработкой последнего метанольным раствором аммиака
)лаляют защитную бензоильную группу с гидроксиэтоксиметиль-
ного фрагмента с получением ацикловира.
-757-
Глава 36
он
h2n-j^n
ch2—o-ch2-ch2-oh
36 1 5
Второй способ получения ацикловира исходит из 2,6-дихлор-
пурина, алкилированием которого тем же 1-бензоилокси-2-хлормето-
ксиэтаном, но уже в системе триэтиламин — диметилформамид полу-
получают 2,6-дихлор-9-B-бензоилоксиэтоксиметил)пурин C6.1.6). Обработ-
Обработкой последнего метанольным раствором аммиака замещают оба атома
хлора на аминогруппы, а последующим диазотированием с использова-
использованием нитрита натрия в разбавленной уксусной кислоте, селективно за-
замещают одну из двух аминогрупп, а именно: аминогруппу в положении
С6 пуриновой системы на гидроксильную группу. Наконец, обработкой
продукта метанольным раствором аммиака снимают и бензоильную
защиту с синтезированного 9-B-бензоилоксиэтоксиметил)гуанина C6.1.4)
с получением ацикловира [7, 8, 9, 10, 11].
&?> -
-СО-С-СН2-СН2-О-СНг-С1
он
2 NaNO2/ CHgCOOH
3 Nh3 CH3OH
,хх>
СНг—О-СНг—СН2~О—СО—
СН2 —О-СН2-СН2-ОН
36 1 5
Как видно из химической формулы, ацикловир является нуклеозид-
ным аналогом гуанозина, замещенным в боковой цепи не традицион-
традиционным циклическим сахарным остатком, а 2-гидроксиэтоксиметильной
ациклической боковой цепью.
Ацикловир обладает противовирусной активностью в отношении
вируса простого герпеса типа 1 и 2, вируса опоясывающего лишая, ви-
вируса Эпштейна—Барр и цитомегаловируса.
Механизм противовирусной активности ацикловира заключается
в его трансформации в трифосфат и последующем ингибировании син-
-758-
Противовирусные препараты
геза ДНК-вируса. Его действие высокоселективно. Ацикловир проника-
проникает в инфицированные вирусом клетки и фосфорилируется до монофос-
монофосфата тимидин киназой, индуцированной вирусом герпеса. Неинфи-
цированные клетки не используют ацикловир в качестве субстрата.
Далее монофосфат последовательно трансформируется в дифосфат
и затем в трифосфат, который и является ингибитором вирусной ДНК
полимеразы, а также включается в вирусную ДНК, где действует в про-
процессе обрыва цепей, предотвращая таким образом дальнейшее удлине-
удлинение цепи молекулы ДНК и, соответственно, репликацию ДНК-вируса.
Ацикловир применяется при простом герпесе, при поражении глаз, ге-
гениталий и герпетических поражениях другой локализации, при опоясы-
опоясывающем лишае, ветряной оспе.
Синонимами препарата являются зовиракс, цикловиран, сифивирал
и др.
Видарабин (Vidarabin)
Видарабин — 9-В-арабинофуранозил-6-амино-9-Я-пурин C6.1.10)
получают как микробиологическим путем из культуральной жидко-
жидкости жизнедеятельности актиномицетов Streptomyces antibioticus
NRRL 3238, так и синтетическим путем. Согласно первому способу,
препарат было предложено получать из ацетонида-р-О-кси-
длофуранозид аденина — 9-C',5'-О-изопропилиден-Р-В-ксидло-
фуранозид)аденина, взаимодействием которого с метансульфохло-
ридом был получен мезилат 9-C',5'-О-изопропилиден-2 -О-метан-
сульфонил-Р-О-ксидлофуранозид) аденина C6.1.7). Длительным
кипячением последнего в 90%-й уксусной кислоте с полученного
соединения снимается ацетонильная защитная группа с получением
продукта C6.1.8). Взаимодействие последнего с метилатом натрия
приводит к получению эпоксида — 9-B',3'-ангидро-р-люксо-
фуранозил)аденина C6.1.9). Наконец кипячением полученного
эпоксида с ацетатом или бензоатом натрия в системе диметилфор-
диметилформамид — вода расщепляют эпоксидный цикл с пол>чением соот-
соответствующего дигидроксипроизводного видарабина [12, 13].
-759-
Глава 36
NH2
Nh2
CH3COONa / DMF / H20
CH2OH
I о CH2OH
36 1 9
OH
36 1 10
Второй способ синтеза видарабина, разработанный позже, заклю-
заключается в алкилировании 6-бензамидопурина 2,3,5-три-О-бензил-О-ара-
бинофуранозил хлоридом с использованием натрия в жидком аммиаке.
При этом одновременно происходит и дебснзоилирование по положе-
положению 6 пуриновой системы и де-О-бензилирование гидроксильных групп
фуранозильного фрагмента молекулы с получением видарабина [14].
NHCOC6H5
Н2ОСН2С6Н5
NH3 ' Na
,0 CH2OM
OCri2C6H5
OH
36 1 10
Видарабин (арабинозид аденина) является стереоизомером адено-
зина. Этот аналог пуринового нуклеозида проявляет селективную ак-
активность против вируса герпеса. В его структуре остаток рибозы заме-
замещен арабинозой. Подобно ацикловиру он превращается в моно-, ди-
и трифосфат в инфицированных вирусом клетках, ингибируя таким об-
образом ДНК полимераз> и, соответственно, препятствуя синтезу ДНК-
вируса примерно в 20-40 раз больше, чем у клеток хозяина. С легко-
легкостью метаболизируется в менее активное, но опять-таки противовирус-
противовирусное соединение — арабинозилгипоксантин. С успехом применяется при
герпетическом энцефалите, при осложненном опоясывающем лишае.
Применяется в виде глазных лекарственных форм при герпетическом
кератоконъюнктивите.
Синонимом препарата является Вира-А.
Идоксуридин (Idoxuridin)
Идоксурндин — 5-йод-1-B-дезоксирибофуранозил)пиримидин-2,4-
A#.3//)-дион C6.1.14) получают по следующей схеме. 5-йод\рацил
-760-
Противовирусные препараты
ацилируют >ксусным ангидридом с получением 1-ацетил-5-йодурацила
C6.1.11 ). Обработкой последнего ацетатом двухвалентной ртути полу-
получают 5-йодомономеркурийурацил C6.1.12), взаимодействием которого
с 1-бромдидезокси-П-рибофуранозил-3,5-бис(и-толуолсульфонатом) по-
л\чают дитозильное производное C6.1.13). Гидролизом тозильных за-
защитных групп с помощью гидроксида натрия и дальнейшей обработкой
полученного вещества уксусной кислотой с целью выделения целевого
продукта получают искомый идоксуридин [15, 16, 17, 18, 19].
&
¦З'ОСОСНзЬ
СОСН3
36 1 1'
о
-У
н3
J-
N|^O CH2OTs
OTs
36 1 13
1. NaOH
2 CH3COOH
N О СН2ОН
ОН
36 1 14
Идоксуридин является аналогом тимидина— йодированным произ-
производным дезоксиуридина. Идоксиуридин действует на ДНК-вирусы и не
действует на РНК-вирусы. Основное действие идоксуридина заключа-
заключается в ингибировании репликации ДНК-вируса путем внедрения в сам
вирус. При системном введении этот нуклеозид фосфорилируется как-
вирусной, так и клеточной тимидин киназой в активное трифосфорили-
рованное соединение, которое ингибирует синтез как вирусной, так
и клеточной ДНК. Поскольку препарат затрагивает клетки млекопи-
млекопитающих и, кроме того, обладает тератогенным, мутагенным и иммуно-
счпрессивным действием, его назначение ограничивается только в каче-
качестве препарата для наружного применения. Используется в основном
в офтальмологии при герпетической инфекции глаз (кератитах).
Синонимами препарата являются герплекс, стоксил, идувиран
и др.
-761 -
Глава 36
Трифлуридин (Trifluridin)
Трифлуридин — 5-трифторметил-1-B-дезоксирибоф\ранозил)-
пиримидин-2,4-(Ш.З//)-дион C6.1.22) получают исходя из 5-три-
фторметилурацила. Последний получают по следующей схеме.
В начале из трифторацетона получают оксинитрил C6.1.15), ацети-
лированием которого получают соответствующий трифторацетат
C6.1.16). Пиролиз последнего приводит к трифторметилакрилонит-
рилу C6.1.17). Присоединением к последнему сухого бромистого
водорода в метаноле, в процессе которого происходит и метанолиз
нитрильной группы, получают бромид C6.1.18). Взаимодействием
бромида с мочевиной получают ключевое соединение C6.1.19), при
кислотном гидролизе которого происходит гетероциклизация в ди-
гидропиримидин C6.1.20). Бромированием полученного дигидро-
пиримидина молекулярным бромом и последующим дегидробро-
мированием полученного продукта C6.1.21) нагреванием в диме-
тилформамиде получают 5-трифтор-метилурацил C6.1.22). После-
Последний вводят во взаимодействие с 2-дезокси-О-рибоз-1 -фосфатом
с использованием фермента нуклеозид фосфорилазы, либо обработ-
обработкой гекаметилдисилазаном и далее трихлорметилсиланом получают
2,4-триметилсилилокси-5-трифторметил пиримидин C6.1.23). При-
Применение гексаметилдислазана, который сам и не образует триме-
тилсилиловых эфиров, обусловлено тем, что использование сочета-
сочетания этих двух реагентов приводит к получению оптимальных
выходов тримтилсилиловых эфиров. Взаимодействием полученного
пиримидинового производного с 3,5-бисD-нитробензоатом)-2-дезо-
ксирибофуранозил хлоридом в присутствии ацетата двухвалентной
ртути получают соответствующий дитриметилсилилоксинуклеозид,
обработкой которого водным раствором йодистого калия снимают
защитные группы. Полученный продукт подвергается предвари-
предварительной очистке путем хроматографирования, и далее обработкой
метанольным раствором диизопропиламина, с фуранозильной части
снимается 4-нитро-бензоильная защита с получением искомого
трифлуридина [20, 21, 22, 23].
CF3
Bi-CH;-CnCON^
ОСЗСНэ
зе 1Ч6
-762-
Противовирусные препараты
H2OH
\
—SI(CH3K
CF3
о
ОН
36 1 22
36 1 23
Трифлуридин также является галогенированным производным ти-
мидина и применяется при кератоконъюнктивитах. По действию и об-
области применения аналогичен идоксурдину. Так же как и идоксуридин,
трифлуридин превращается в трифосфат, ингибируя ДНК полимеразу.
Синонимом препарата является вироптик.
Зидовудин (Zidovudin)
Зидовудин — З'-азидо-З'-дезокситимидин C6.1.26) получают исхо-
исходя из 1-B'-дезокси-5]-0-тритил-Р-0-ликсозил)тимина, обработкой
которого метане)льфохлоридом в пиридине получают соответст-
соответствующий мезилат C6.1.24). Замещением мезильной группы на азид-
иую с использованием азида лития в диметилформамиде получают
продукт C6.1.25) с обращенной конфигурацией при Сз фуранозиль-
ного кольца. Кипячением последнего в 80%-й уксусной кислоте
с него удаляется тритильная защита с получением зидовудина [24,
25,26.27,28].
о
°Нз
0
сн2о-сн<свн5)з СНзО5ОгС|
СН2О-СН(С6Н5)з
36 1 24
H-N"^VCH3
0 ^ .0 СН2О-СН(С6Н5K СН3СООН
N^ 0 СН2ОН
36 1 25 N3
36.1.26 N3
-763-
Глава 36
Зидовудин — антиретровирусный препарат, клинически активный
против ВИЧ-1 и предназначен для лечения ВИЧ-инфицированных па-
пациентов
Зидовудин — аналог тимидина, который ингибирует репликацию
вирусов СПИДа. Он также превращается в моно-, ди- и трифосфаты
теми же клеточными ферментами, которые катализуют фосфорилирова-
ние тимидина и тимидиновых нуклеозидов. Далее зидовудин-трифосфат
включается вирусной реверс-транскриптазой в концевой фрагмент рас-
растущей цепи вирусной ДНК и тем самым вызывает обрыв цепи вирусной
ДНК в инфицированных вирусом клетках. Зидовудин был разрешен для
лечения больных СПИДом. Он значительно продлевает жизнь больных,
однако обладает рядом токсических эффектов.
Синонимами препарата являются азидотимидин и ретровир.
Рибавирин (Ribavirin)
Рибавирин — 1-|3-0-рибофуранозил-1Я-1,2.4-триазол-3-карбокс-
амид C6.1.28) получают вводя во взаимодействие метиловый эфир
1,2.4-триазол-З-карбоновой кислоты с О-1,2,3,5-тетраацетил~[3-В-
рибофуранозой с получением метилового эфира 1-0-1,2.3,5-тет-
раацетил-|3-В-рибофуранозил-1,2,4-триазол-3-карбоновой кислоты
C6.1.27), обработкой которого аммиачным раствором метанола
осуществляют одновременно дезацетилирование углеводной части
и амидирование карбалкоксильной части продукта с получением
рибавирина [29, 30, 31, 32, 33, 34, 35. 36, 37].
О
-с
h3CO"-OCt-2 o О-СОСНэ
но oh
36 1 28
Рибавирин является синтетическим аналогом нуклеозидов. Эффек-
Эффективен против многих ДНК- и РНК-вирусов: вирусов гриппа, герпеса.
Механизм его действия не совсем ясен. Однако вполне вероятно, что он
не является одим и тем же для всех вир\сов. Препарат испытывался и на
ряде больных СПИДом с получением различных рез>льтатов.
Синонимом препарата является виразол.
-764-
Противовирусные препараты
Список литературы
1. US Pat. 3.310.469A967).
2. US Pat. 3.152.180A964).
3. Brit. Pat. 925.728A963).
4. Belg. Pat. 646.581 A964).
5. Stetter H. et aL'-Ber. 93, 226 A960).
6. Gerzon K. et al./'/J. Med. Chem. 6. 760 A963).
7. Belg. Pat. 833.006A975).
8. Ger. Pat. 2.539.963A976).
9. USPat. 4.199ю4574A980).
10. Matsumoto H. et al.'/Chem. Pharm. Bull. 36, 1153 A988).
11. Schaeffer H. et al./'/Nature, 272, 583 A978).
12 Reist E. et al.//J. Org. Chem. 27, 3274 A962).
13. Lee W. et al./'J. Am. Chem. Soc. 82, 2648 A960).
14. Reist E. et al./'J. Org. Chem. 29, 3725 A964).
15. Fr. Pat. 1.336.866A962).
16. Brit. Pat. 1.024.156A963).
17. PrusoffW.! Biochim. Biophys. Acta. 32, 295 A959).
18. CheongK. et al./'J. Biol. Chem. 235, 1441 A960).
19. Chang F et al.'/J. Med. Chem. 6, 428 A963).
20. USPat. 3.531.464A970).
21. USPat. 3.201.387A965).
22. Heidelberger С et al.'/J. Am. Chem. Soc. 84, 3597 A962).
23. Heidelberger С et al.'/J. Med. Chem. 7, 1 A964).
24. Lin T.-ShJ'L Med. Chem. 21, 109 A978).
25. Horowitz J. et al./'J. Org. Chem. 27, 3045 A962).
26. Horowitz J. et al.//J. Org. Chem. 29, 2076 A964).
27. Glinski R. et aL/J. Org. Chem. 38, 4299 A973).
28. Chu С et aL'Tetrahedron. 29, 5349 A988).
29. Ger. Pat. 2.220.246 A972).
30. Ger. Pat. 2.441.823A974).
31. Ger. Pat. 2.511.828A975).
32. USPat. 3.976.545A976).
33. USPat. 4.138.547A979).
34. Witkowsb J.,'.L Med. Chem. 15, 1150 A972).
35. WitkowskiJ/J. Carbohyd. Nucl. 5, 363 A978).
36. ho Y. et al./ Tetrahedron Letters. 1979, 2521.
37. Schmidt R etab'Berr. 114,2825A981).
-765-
Г л ава 3 7
Препараты для лечения
протозойных инфекций
Наиболее распространенными протозойными инфекциями, вызы-
вызываемыми патогенными простейшими, являются малярия, лейшманиоз
и трипаносомоз, а также трихомониаз, амебиаз, гиардиоз и токсоплаз-
моз. Все виды протозы являются одноклеточными организмами, при-
приспосабливаемыми к различным условиям намного более гибко, чем бак-
бактерии. Они имеют довольно сложный жизненный цикл и поэтому
существуют во многих формах, которые требуют разных подходов для
лечения больных, зараженных протозойными инфекциями. Протоза —
типичный паразит, который оккупирует клетку хозяина, размножается
в ней и разрушает ее.
Пред> преждение лечение протозойных заболеваний заключается
в контроле над распространением заболеваний, улучшении санитарно-
гигиенических условий жизни, проведении вакцинаций и, собственно,
лечении. Следует иметь в виду, что малярия распространяется комара-
комарами, в частности посредством укуса самцами Anofeles mosquito; лейшма-
лейшманиоз распространяется зараженными песчинками; трипаносомоз рас-
распространяется мухой цеце; амебиаз и гиардиоз распространяются через
пищу и воду, а токсоплазмоз — через мясные продукты и зараженных
кошек.
Для борьбы с протозойными паразитами используется очень много
химиотерапевтических препаратов различного типа.
37.1. Антималярийные препараты
Малярия является наиболее распространенным из заболеваний, вы-
вызываемых протезами. Возбудителями малярии являются плазмодии
-766-
(Plasmoaium falciparum, Plasmodium vivax, Plasmodium malariae и
Plasmodium ovale). Малярийный плазмодий имеет 2 цикла развития —
бесполый, который происходит в органиме зараженного человека (ши-
(шизогония), и половой, происходящий в теле самого комара (спорогония).
При укусе комаром в организм человека попадают спорозиты, обра-
образующиеся в крови комара из мужских и женских гематоцитов. Послед-
Последние внедряются в клетки печени, где образуют первичные тканевые ши-
зонгы, которые растут и делятся, трансформируясь в мерозоиты.
Мерозоиты далее выделяются в кровь человека и проникают в эритро-
эритроциты, где происходит их дальнейшее развитие. При созревании в эрит-
эритроцитах шизоиты вновь делятся и трансформируются в мерозоиты. По-
Последние периодически высвобождаются из оккупированных эритроцит-
ных клеток и поражают новую группу эритроцитов, начиная описанный
процесс вновь. Этот процесс длится 3-4 дня, и момент разрушения
эритроцитов и выхода мерозоитов в кровь проявляется в виде приступа
малярийной лихорадки и называется периэритроцитарной формой ма-
малярии. Однако при заражении плазмодиями Plasmodium vivax, Plasmo-
Plasmodium malariae и Plasmodium ovale возможен и другой ход развития со-
событий, называемый экзоэритроцптарной формой малярии, когда пара-
паразиты, находящиеся в мерозоитной стадии развития, остаются или вновь
внедряются в клетки печени. Это возобновляет эритроцитарный цикл
развития плазмодия и наступление рецидивов. При тропической маля-
малярии параэритроцитарные формы отсутствуют.
Химиотерапия малярии заключается в воздействии на различные
стадии жизненного цикла паразита. Соответственно, антималярийные
препараты подразделяются на 3 группы:
1) воздействующие на эритроцитарную стадию жизненного цик-
цикла,
2) разрушающие экзоэритроцитарную (или геиатическую) ста-
стадию,
3) воздействующие на обе стадии одновременно.
Старейшими препаратами, применяемыми против малярии, являют-
являются хинин и хинидин. В настоящее время для лечения малярии применя-
применяют аминохинолины, такие как хлороквин и его аналоги, преимущест-
преимущественно для воздействия на паразита в ходе эритроцитарной стадии, и
примахин — для воздействия на паразита в экзоэритроцитарной стадии.
В последнее время начали применяться мефлохин и природное соеди-
соединение хингошу, а также различные антибиотики в сочетании с антима-
антималярийными препаратами
-767-
Глава 37
3 7.1.1. Препараты, эффективные против эритро-
цитарной стадии заражения плазмодиями
4-аминохинолины и хинолинметанолы
В эритроцитарной стадии заражения плазмодиями применяются
2 класса препаратов: 1) 4-аминохинолины и 2) хинолинметанолы. 4-ами-
4-аминохинолины (хлороквин, амодиаквин и гидроксихлороквин) являются
синтетическими соединениями. Их наиболее важной структурной ха-
характеристикой является тип заместителя при С7 и С4 хинолинового
кольца. Показана необходимость аминного заместителя при С4 хиноли-
хинолинового кольца, которая может варьировать с сохранением антималярий-
антималярийной активности этого типа соединений в целом, однако необходимым
условием для проявления антималярийной активности является наличие
атома хлора при С7 хинолинового кольца. Прототипом этой группы со-
соединений является хлороквин.
Другая группа препаратов, используемых во время эритроцитарной
стадии малярийной инфекции, представлена хинолинметанолами. Эта
гр>ппа включает мефлохин и хингошу, а также хинные алкалоиды, по-
получаемые из коры хинного дерева, из которых только хинин все еще
продолжает использоваться при лечении малярии.
Хлороквин (Chloroquin)
Хлороквин — 7-хлор-4-D-диэтиламино-1-метилбутиламиио)хино-
лин C7.1.3) получают взаимодействием 4,7-дихлорхинолина
C7.1.1.1) с 4-диэтиламино-1-метилбутиламином C7.1.1.2) при
180 °С [.1,2,3].
з
H2N-CH-(Ch2K-n(
2Н5
С2Н5
9нз С
ш—c4-;ch2K-n(
с2н5
Для осуществления синтеза необходимого для этой цели 4.7-ди-
хлорхинолина C7.1.1.1) предложено несколько способов, исходящих из
3-хлоранилина. Первый способ заключается во взаимодействии 3-хлор-
анплина с этоксиметиленмалоновым эфиром с получением C-хлор-
анилино)метиленмалонового эфира C7.1.1.4), высокотемпературная
гетероциклизация которого приводит к получению этилового эфира
-768-
Препараты для лечения протозойных инфекций
7-хлор-4-гидроксихинолин-3-карбоновой кислоты C7.1.1.5). Гидроли-
Гидролизом последнего гидроокисью натрия получают 7-хлор-4-гидроксихи-
нолин-3-карбоновую кислот) C7.1.1.6), которая нагреванием при 250-
270 °С декарбоксилируется с образованием 7-хлор-4-гидроксихинолина
C7.1.1.7). Обработкой последнего хлорокисью фосфора получают один
из искомых компонентов для синтеза хлороквина — 4,7-дихлорхинолин
C7.1.1.1) [4, 5].
„СИ
С СОН 250°
Второй способ для получения 4,7-дихлорхинолина C7.1.1.1) за-
заключается во взаимодействии 3-хлоранилина с диэтиловым эфиром ща-
велевоуксусной кислоты в присутствии уксусной кислоты с получением
соответствующего имина C7.1.1.8), который при нагревании до 250 °С
гетероциклизуется в этиловый эфир 7-хлор-4-гидроксихинолин-2-кар-
боновой кислоты C7.1.1.9) с примесью 5-хлор-4-гидрокси\инолин-2-
карбоновой кислоты C7.1.1.10). которая отделяется от основного про-
продукта путем кристаллизации из уксусной кислоты. Щелочным гидро-
гидролизом этилового эфира 7-хлор-4-гидроксихинолин-2-карбоновой ки-
кислоты C7.1.1.9) и дальнейшим высокотемпературным декарбоксили-
рованием полученной при этом кислоты C7.1.1.11) получают 7-хлор-
4-гидроксихинолин C7.1.1.7). Взаимодействием последнего с хлор-
окисью фосфора по вышеописанной схеме получают 4,7-дихлор-
4,7-дихлорхинолин C7.1.1.1) [6].
-769-
Глава 37
Наконец, третий способ из предложенных вариантов получения
4,7-дихлор\инолина C7.1.1.1) заключается во взаимодействии 3-хлор-
анилина с этиловым эфиром формилуксусной кислоты с получением
имина C7.1.1.12), который при нагревании непосредственно циклизует-
ся в 7-хлор-4-гидроксихинолин C7.1.1.7), взаимодействием которого
с хлорокисью фосфора по уже неоднократно описанной схеме получают
4.7-дихлорхинолин C7.1.1.1) [7].
Второй компонент, необходимый для синтеза хлороквина, — 4-ди-
э1иламино-1-метилбутиламин C7.1.1.2) также предложено получать
различными путями. Согласно первому способу, алкилированием аце-
тоуксусного эфира 2-диэтиламиноэтилхлоридом получают 2-диэтил-
аминоэтилацетоуксусный эфир C7.1.1.13), кислотным гидролизом ко-
которого соляной кислотой с одновременным декарбоксилированием
получают 1-диэтиламино-4-пентанон C7.1.1.14). Восстановительным
аминированием последнего водородом и аммиаком с использованием
в качестве катализатора никеля Ренея получают 4-диэтиламино-1-
метилбутиламин C7.1.1.2) [8].
о о
сн3
ОС2Н3
С2Н5
с2н5 hci
)ch-ch2-ch2-n( "
o=< с2н= _co
ос2н=
37 1 1 13
СН3-С-СН2-Сг12-СН2-м(
с2н5
Н2 NH3/ |Raney—Ni]
СНз С2Н6
H2N-CH-(CH2K-n(
С2Н5
Вторым способом, предложенным для получения 4-диэтиламино-
1-мегилбутиламина C7.1.1.2), является путь, исходящий из 3-ацетил-
бугиролактона C7.1.1.15), который, в свою очередь, получают взаи-
взаимодействием ацетоуксусного эфира с этиленоксидом. Кислотным
гидролизом сложноэфирной группы в 3-ацетмлбутиролактоне
C7.1.1.15) с одновременным декарбоксилированием получают 1-бром-
-770-
Препараты для лечения протозойных инфекций
4-пентанон C7.1.1.16). Взаимодействием последнего с диэтиламином
получают 1-диэтиламино-4-пентанон C7.1.1.14), восстановительным
аминированием которого водородом и аммиаком с использованием
в качестве катализатора никеля Ренея получают 4-диэтиламино-1-
метилбутиламин C7.1.1.2) [9].
37 1 1 15
Сгз-С-СН2-СН2-СН2—Br
ch3-c-ch2-ch2-ch2-n(
37 1 1 14
С2И5
[Raney-Ni]
.C2H5
C2H5
37 1 1 2
Хлороквин является лекарством выбора для профилактики и ле-
лечения острых форм малярии, вызванной Plasmodium vivax, Plasmodium
malariae, Plasmodium ovale, а также чувствительных форм Plasmodium
J'alciparum Механизм его действия не совсем ясен, однако имеется не-
несколько гипотез, объясняющих его антималярийную активность. Хло-
Хлороквин и его аналоги ингибируют синтез нуклеиновых кислот паразита,
воздействуя на матричную функцию ДНК. Это происходит путем пре-
преимущественного связывания препарата водородными связями с пурино-
выми фрагментами и последующим внедрением молекулы хлороквина
между упорядочненно уложенными парами оснований в спирали ДНК
паразита. Таким образом хлороквин предотвращает транскрипцию
и трансляцию, значительно ограничивая синтез ДНК и РНК паразитом.
Селективная токсичность хлороквина по отношению именно к маля-
малярийным плазмодиям приписывается также способности паразитирован-
ных красных кровяных клеток концентрировать этот препарат в количе-
количествах, примерно в 25 раз превосходящих таковую в нормальных
эритроцитах.
Существует и другая гипотеза. Хлороквин имеет большое сродство
к тканям паразита и концентрируется в его цитоплазме. Как слабое ос-
основание он повышает рН внутриклеточных лизосом и эндосом, а для
заражения паразитами клеток млекопитающих требуется значительно
более кислая среда этих органелл. Как следствие, при применении хло-
роквина ингнбируются рост и развитие паразитов.
Итак, главным качеством хлороквина, которым он превосходит все
другие противомалярийные препараты, является влияние на эритроци-
-771 -
Глава 37
тарные шизонты (гематошизотропное действие). Однако хлороквин об-
обладает и амебицидным действием. У него обнаружены также иммуно-
депрессивные и противоаритмические свойства.
Препарат применяют при всех видах малярии, для химиопрофилак-
тики, а также при внекишечном амебиазе и амебном абсцессе печени.
Синонимами препарата являются нивахин, хингамин, делагил, ре-
зохин, атрохин и др.
Гидроксихлороквин (Hydroxychloroquin)
Гидроксихлороквин — 7-хлор-4-[4-[этилB-гидроксиэтил)амино]-1 -
метилбутиламинохинолин C7.1.1.19) получают по схеме, близкой
к получению хлороквина. Взаимодействием 1-хлор-4-пентанона
с 2-этиламиноэтанолом получают соответствующий аминокетон
C7.1.1.17), который подвергают восстановительному аминирова-
нию в условиях, аналогичных описанным выше, с получением 4-
[этилB-гидроксиэтил)амино]-1-метилбутиламина C7.1.1.18). Вводя
последний во взаимодействие с 4,7-дихлорхинолином C7.1.1.1), по-
получают искомый гидроксихлороквин [10, 11].
h-n(
C
С C
снз-с-сг12-снг-сьг— n(
C
Ci3
СИ-СН-.-СН2-СЧ2
Гидроксихлороквин, как и хлороквин, также применяется для лече-
лечения острых форм малярии, вызванной Plasmodiwn vivax, Plasmodium
malariue, Plasmodium ovale, а также чувствительных форм Plasmodium
falciparum. Он так же эффективен и так же безопасен, как и хлороквин,
однако не имеет явных преимуществ перд ним. Единственным преиму-
преимуществом является несколько лучшая переносимость. Его применение
несколько более ограничено, чем применение хлороквина.
Синонимами препарата являются плаквенил, квенсил, торемонил и др.
Амодиаквин (Amodiaquin)
Амодиаквин — 4-[G-хлор-4-хинолил)амино]-а-диэтиламино-о-
крезол C7.1.1.21) получают взаимодействием 4,7-дихлорхинолина
-772-
C7.1.1.1) с 4-аминофенолом с получением 7-хлор-4-D-гидрокси-
фениламино)хинолина C7.1.1.20), который далее вводят в реакцию
аминометилирования с использованием формальдегида и диэтиламина
с получением амодиаквина [12, 13, 14, 15].
j*|T^t| Ch2C I (C;H5J№
rQ-°
Амодиаквин также является структ>'рным аналогом хлороквина и гид-
роксихлороквина и существенных различий в активности не выявляет.
Поэтом}' его применяют реже, чем описанные выше препараты.
Синонимами препарата являются флавохин и камохин.
Хинин (Quinine)
Хинин — E-викил-2-хинуклидинил)-F-метокси-4-хинолил)метанол
C7.1.1.47) выделяют из коры хинного дерева [16].
СН3О.
Начиная с XVII в. хинная кора применялась в Европе как противо-
противолихорадочное средство, а затем как средство для лечения малярии. Еще
в 1820 г. из коры хинного дерева были выделены два ачкалоида — хи-
хинин и цинхонин, представляющие собой неконденсированные бигете-
роциклы, сочетающие в себе два гетероциклических ядра — хинолина
и хинуклидина. Причем хинин является метоксильным производным
цинхонина и левовращаюшим изомером хинидина. Его каркас состоит
из хинолинового кольца, в положении 4 которого посредством метиле-
нового мостика присоединено хинуклидиновое кольцо. Метоксигруппа
при С6 хинолинового кольца и винильная группа в хинуклидиновом
кольце повышают активность соединения, однако не являются абсо-
-773-
Глава 37
лютно необходимыми для проявления соединениями этого ряда проти-
противомалярийной активности. Хинин приобрел огромное значение как ба-
базовая стр\кт>ра для синтеза многочисленных соединений с противома-
противомалярийной активностью. Синтез препарата весьма сложен и был
осуществлен разными путями, но в принципе сводится к сложноэфир-
ной конденсации эфиров 6-метоксихинолиновой (хининовой) кислоты
C7.1.1.27) и N-бензоилгомомерохинена C7.1.1.42), которые могут быть
получены разными путями, и последующей последовательной обработ-
обработке полученного продукта гипобромидом и этилатом натрия с целью
создания хинуклидинового фрагмента.
Одним из методов получения этилового эфира хининовой кислоты
C7.1.1.27) след>ет считать первый способ, осуществляемый по сле-
следящей схеме. Взаимодействим «-анизидина и ацетоуксусного эфира
в прис)тствии серной кислоты получают 6-метоксилепидин C7.1.1.22),
гидроксильн>ю групп> в котором замешают на атом хлора взаимодей-
взаимодействием со смесью хлорокиси и пятихлористого фосфора с получением
2-хлор-4-метил-6-метоксихинолина C7.1.1.23). Восстановлением по-
последнего водородом с использованием в качестве катализатора палладия
>бирают атом хлора при С2, и получают 4-метил-6-метоксихинолин
C7 1 1 24). Конденсацией последнего с бензальдегидом получают 2-F-
метокси\инолинил-4)-стирол C7.1.1.25), окислением двойной связи
в котором с помощью перманганата калия получают 6-метокси-
хинолинов\ю кислоту — цинхонин C7.1.1.26). которую далее обычным
способом переводят в эфир C7.1.1.27).
о
Вторым способом получения этилового эфира хининовой кислоты
C7.1.1.27) является метод, исходящий из n-N-метилацетанизидина и ди-
этилоксалата. в результате взаимодействия которых получают «-N-ме-
тилацетанизид щавелевоуксусной кислоты C7.1.1.28). Гетероциклиза-
ция последнего в кислых условиях приводит к пол\чению 1Ч-метил-2-
кето-4-карбэтокси-6-метоксихинолина C7.1.1.29), взаимодействием
-774-
Препараты для лечения
которого со смесью хлорокиси и пятихлористого фосфора получают
2-хлор-4-карбэтокси-6-метоксихинолин C7.1.1.30). Восстанавливая по-
последний водородом с использованием в качестве катализатора палладия,
получают искомый этиловый эфир 6-метоксихинолиновой кислоты
C7.1.1.27).
""XX
соос2н*
I
ООСС2,-5
СООС2Н5
СООСо
СН3О.
CH3O.
СООС2Н5
Н2 / Pd
Синтез N-бензоилгомомерохинена C7.1 1.42) осуществляют исходя
ш 7-оксиизохинолина C7.1.1.32). получающегося взаимодействием
аминоацегаля с w-оксибензальдегидом с промежуточным выделением
имина C7 1.1.31). который далее в присутствии серной кислоты цикли-
зуется в исходный 7-оксиизохинолин C7.1.1.32). Полученный 7-окси-
изохинолин аминометилируют смесью формальдегида и пиперидина
с получением 7-окси-8-пиперидинометилизохинолина C7.1,1.33). Вос-
Восстанавливая последний водородом с использованием в качестве катали-
катализатора палладия, удаляют пиперидиновый фрагмент с получением
7-окси-8-метилизохинолина C7.1.1.34), который далее с целью гидри-
гидрирования пиридинового фрагмента вновь восстанавливают водородом, на
сей раз используя в качестве катализатора окись палладия, и получают
7-окси-8-метилтетрагидроизохинолин C7.1.1.35). И-ацилир>я послед-
последний уксусным ангидридом и подвергая продукт дальнейшему гидриро-
гидрированию водородом с использованием в качестве катализатора платины,
получают смесь стереоизомерных 1\"-ацетил-7-окси-8-метилдекагид-
роизохинолинов, из которых выделяется цис-томер C7.1.1.36), и с по-
помощью оксида шестивалентного хрома его окисляют до К-ацетил-7-
кето-8-метилдекагидроизохинолина C7.1.1.37). Взаимодействием по-
последнего с этилнитритом в присутствии этилата натрия расщепляют
метилциклогексаноновый фрагмент с образованим N-ацетил-Ю-окси-
минодигидрогомомерохинена C7.1.1.38), который далее водородом
в присутствии платинового катализатора восстанавливается в амин
-775-
Глава 37
C7.1.1.39). Подвергая последний исчерпывающему метилированию йо-
йодистым метилом, пол>чают четвертичную соль C7.1.1.40), расщеплени-
расщеплением которой концентрированной щелочью при нафевании получают ра-
рацемический гомомерохинен C7.1.1.41). Последовательной этерифи-
кацией и дальнейшим бензоилированием продукта получают этиловый
эфирК-бензоилгомомерохинена C7.1.1.42).
.. О
сгн5о
Г
сне
С2Н5О
H2SC4
сь2о н
о
сн3со
37 1 1 за
ГГ°
ч.
I
СНзСО
осгн5
'сн—сч3
¦сн-сь,
37 1 1 41
=сн2
1 С2Н5ОН / Н
2 C6H5COCI
37 1 1 42
Далее этиловый эфир N-бензоилгомомерохинена C7.1.1.42) в при-
с>тствии этилата натрия конденсируют с этиловым эфиром 6-мето-
ксихинолиновой кислоты C7.1.1.27) с получением производного хино-
токсина C7.1.1 43). Кипячением с соляной кислотой осуществляют
гидролиз карбэтоксильной и бензоильной фупп и одновременно декар-
боксилирование с получением соединения C7.1.1.44). Обработкой по-
последнего гипобромитом натрия получают N-бромпроизводное C7.1.1 45),
-776-
Препараты для лечения протозойных инфекций
взаимодействием которою с этилатом натрия реализуют ключевой мо-
момент данного синтеза — трансформацию пиперидинового производного
в хинукидиновое C7 1.1.46). Восстанавливая кетофуппу в последнем
алюмогидридом лития, получают искомый хинин C7.1.1.47) [17, 18, 19,
20,21,22].
СН3О.
СООСгН5
CO-CH-CH;
сн=сн2
CH3O.
Хинин по типу действия является противомалярийным препаратом,
сходным с хлороквином, однако уступает ему по активности.
Аналогично хлороквину, хинин присоединяется к плазмодиевой
ДНК, вмешиваясь в синтез нуклеиновых кислот и предотвращая их реп-
репликацию и транскрипцию. Хинин подавляет также офомное число
ферментных систем и поэтому характеризуется как общий протоплаз-
мический яд. Этот факт хорошо согласуется с действием хинина на
мембраны, его местноанестезирующим и кардиодепрессивным дейст-
действиями.
При оральном применении хинин эффективно действует в комби-
комбинации с пириметамином, сульфадиазином и'или тетрациклином при
лечении неосложненных случаев хлороквинрезистентных форм
Plasmodxum falciparum. Ввид> многих побочных реакций, его примене-
применение крайне ограничено. Единственным показанием к применению в на-
-777-
Глава 37
стоящее время являются формы малярии, резистентные к синтетиче-
синтетическим препаратам.
Синонимами препарата являются бронхоплльмин, никоприв, хин-
нам и др
Мефлохин (Mefloquin)
Мефлохин — В,Ь-эритро-ос-2-пиперидил-2,8-бис-(трифторметил)-4-
хинолинметанол C7.1.1.53) предложено получать разными путями,
исходящими из 2-трифторметиланилина. Согласно первому спо-
способу, гетероциклизацией продукта взаимодействия 2-трифтор-
2-трифторметиланилина с трифторацетоуксусным эфиром получают 2,8-бис-
(трифторметил)-4-гидроксихинолин C7.1.1.48). Реакцией продукта
с трехбромистым фосфором гидроксильную группу в положении 4
хинолинового кольца замещают на атом брома с получением 2,8-
бг<с-(трифторметил)-4-бромхинолина C7.1.1.49). Далее взаимодей-
взаимодействием последнего с бутиллитием получают литийорганическое
производное — 2,8-бис-(трифторметил)-4-литийхинолин C7.1.1.50).
Реакцией последнего с двуокисью углерода получают 2,8-бис-
(трифторметил)-4-хинолинкарбоновую кислоту C7.1.1.51). Вводя
полученную кислоту во взаимодействие с 2-литнйпиридином, полу-
получают кетон C7.1.1.52). Восстанавливая в последнем одновременно
как кетогруппу, так и пиридиновое кольцо водородом с использова-
использованием в качестве катализатора платины, получают искомый мефло-
мефлохин [23].
37 1 ' 48
-2%
N CF3
37 1 1 SC
СООН
N Li
Н2/ Pt
Второй способ синтеза мефлохина исходит из описанного выше
2,8-сшс-(трифторметил)-4-литийхинолина C7.1.1.50), который вводят во
-778-
Препараты для лечения протозойных инфекций
взаимодействие с 2-формилпиридином с получением а-2-пиридил-2,8-
ш<о(трифторметил)-4-метанолхинолина C7.1.1.54). Пиридильную фуппу
в последнем также восстанавливают аналогично вышеописанному, и в ре-
результате получают искомый мефлохин [24].
н2 / Pto
Наконец, третий способ синтеза мефлохина также исходит из
2-трифторметиланилина, однако в данном случае его вводят во взаимо-
взаимодействие с хлорапьгидратом и гидроксиламином с получением изонит-
розоацетилB-трифторметил)анилида C7.1.1.55), который при нагрева-
нагревании в присутствии серной кислоты циклизуется в 7-трифтормети-
лизатин C7.1.1.56) (рекция Зандмейера). Далее взаимодействием полу-
полученного 7-трифторметилизатина C7.1.1.56) с 1,1,1-трифторацетоном
в присутствии щелочи по реакции Фридландера получают описанную
выше 2,8-бис-(трифторметил)-4-хинолин карбоновую кислоту C7.1.1.51).
Взаимодействием с гидроокисью лития последнюю переводят в литие-
литиевую соль, которую вводят во взаимодействие с реактивом Гриньяра,
полученным из 2-бромпиридина и магния — 2-магнийбромпиридином.
Полученный при этом кетон C7.1.1.52) вновь восстанавливают водоро-
водородом в присутствии платинового катализатора с получением искомого
мефлохина [25].
LlOH
COOh
N МдВг
37 1 1 52
Н2/ Pt
CF3-C-CH3 , NaOH
-779-
Глава 37
Мефлохин является аналогом хинина и отличается от него тем, что
боковая цепь при С4 хинолинового кольца содержит вместо хииуклиди-
нового фрагмента пиперидиновый, а положения С2 и С8 замещены
трифторметильными группами.
Этот антималярийный препарат был создан для лечения и профи-
профилактики хлороквинрезистентных форм малярии, вызванной Plasmodium
falciparum. Клинически не активен против экзоэритроцитарных форм
Plasmodium vivax, однако весьма активен против кровяных шизонтоци-
дов Plasmodium vivax и Plasmodium falciparum и, соответственно, пред-
предназначен для лечения слабых и умеренных форм малярии, вызванной
указанными плазмодиями.
Синонимом препарата является лариам.
Хингошу (Quinghaosu)
Хингошу — октагидро-3,6,9-триметил-3,12-эпокси-12#-пирано-
D,3-ди)-1,2-бензодиоксепин-10-C#)-он C7.1.1.57) выделяют из рас-
растения Artemisia amma [26]. Препарат предложено также синтезиро-
синтезировать [27].
сн3
Хингошу является последним принципиальным открытием в этой
области и является гетероциклическим соединением, не имеющим
в своей структуре атомов азота. Препарат взят из китайской народной
медицины. Его выделяют из растения Artemisia amma. Удивительно, что
соединение, совершенно отличающееся по структуре от описываемых в
настоящей главе, проявляет совершенно одинаковое терапевтическое
действие. Основной интерес к хингошу обусловлен тем, что он активен
в отношении резистентных форм малярии, вызванной Plasmodium
falciparum, и даже его церебральных форм.
Синонимами препарата являются артемизин, артемизинин и др.
-780-
Препараты для лечения протозойных инфекций
37.1.2. Препараты, эффективные против гепати-
ческой (экэоэритроцитарной) стадии зараже-
заражения плазмодиями
8-аминохинолины
Примахин (Primaquin)
Примахин — 8-[D-амино-1-метилбутирил)амино]-6-метоксихино-
лин C7.1.2.4) получают из 6-метокси-8-нитрохинолина C7.1.2.1),
который синтезируют по реакции Скраупа из 4-метокси-2-нитро-
анилина и глицерина в присутствии серной кислоты. Нитрогруппу
в последнем восстанавливают с получением 6-метокси-8-амино-
хинолина C7.1.2.2). Алкшшруя аминогруппу последнего 4-бром-1-
фталимидопентаном, получают 8~[D-фталимидо-1-метилбутирил)-
амино]-6-метоксихинолин C7.1.2.3), гидразинолизом которого с по-
последнего снимается фталимидная защита с получением примахина
[28, 29].
Ch2-CH-Ch3
ОН ОН ОН
N02
371 2 1
СН3О.
NH—CH-(CH2K-N
СН3
37 1 2.3
H2N-NH2 снз0.
NH— CH-(CH2K-NH2
СН3
37 1 24
Перенос боковой цепи из четвертого положения хинолинового
кольца в восьмое полностью меняет спектр активности соединения.
В отличие от 4-замещенных аминохинолинов, примахин практически
не действует на эритроцитарные формы малярийного паразита. Его
активность ограничена тканевыми формами паразита у млекопигаю-
ших и в самих комарах. Это делает примахин особенно ценным препа-
препаратом, позволяющим радикальное излечение и одновременно профи-
профилактику, что обычно не достигалось при использовании эритроцитар-
ных препаратов.
•781 -
Глава 37
Место действия примахина — митохондрии малярийного паразита.
Кажется вероятным, что примахин вмешивается в процессы переноса
электронов, вызывая повреждение митохондриальных ферментных сис-
систем. Это выражается в набухании и вакуолизации митохондрий парази-
паразита. Митохондрии хозяина при этом не затрагиваются.
Примахин является наиболее эффективным и наименее токсичным
препаратом из всего ряда доступных 8-аминохинолинов. Используется
в основном при лечении экзоэритроцитарных форм малярии, вызванной
Plasmodium vivax и Plasmodium ovale. Он действует также на половые
формы плазмодиев, которые при применении препарата гибнут в орга-
организме человека.
Примахин применяется при лечении и профилактике отдаленных
рецидивов трехдневной, четырехдневной и тропической малярии.
Синонимом препарата является авлон и др.
37.1.3. Препараты, эффективные против гепатиче-
ской и эритроцитарноп форм заражения
плазмодиями
Биг\ аниды и диаминопиримидины оказались активными соедине-
соединениями как в отношении экзоэритроцитарных, так и эритроцитарных
форм плазмодий. Хлоргуанид C7.1.2.3) в качестве противомалярийного
препарата был внедрен в медицинскую практику в результате работы
над большой серией производных гуанидина. Предполагается, что
в организме он трансформируется в активное дигидротриазиновое со-
соединение.
Несколько позже в результате интенсивных исследований антиме-
габолитов фолиевой кислоты был предложен пириметамин C3.1.60).
Триметоприм C3.1.51) — результат более поздних исследований. Близ-
Близкое стр>к1\рное сходство этих препаратов с птеридиновым фрагментом
фолиевой кислоты несомненно определяет их сродство к рецептивному
участку дигидрофолатредуктазы.
оигидротриазиновып
метаболит
хлоргуанида
хлоргуанид
пириметамин триметоприм
-782-
Препараты для лечения протозойных инфекций
Все эти соединения являются ингибиторами дигидрофолатредук-
дигидрофолатредуктазы в бактериях, плазмодиях и человека. К счастью, они имеют зна-
значительно большее сродство к бактериальным и протозойным дигид-
рофолатредуктазам. Пириметамин, к примеру, ингибирует пара-
паразитную дигидрофолатредуктазу при уровнях в несколько сотен раз
ниже, чем это требуется для ингибирования дигидрофолатредуктазы
человека. Это и является основой их селективной токсичности. Се-
Селективная токсичность может быть повышена при дополнительном
снабжении организма хозяина фолиевой кислотой, которую паразит
не в состоянии использовать. Собственно первоначально диаминопи-
римидины (триметоприм, пириметамин) были предложены в качестве
лечебных и профилактических средств против малярийных инфекций.
Показано, что все сильные ингибиторы дигидрофолатредуктазы мо-
могут вывести из строя малярийный паразит с относительно малыми
последствиями для хозяина.
Как уже было отмечено, бигуаниды и диамннопиримидины активны
как в отношении экзоэритроцитарных, так и эритроцитарных форм
плазмодий. Каждый из этих препаратов в отдельности может приме-
применяться для профилактики, однако наибольший эффект достигается при
их комбинированном применении с сульфонамидами.
Было показано, что некоторые сульфоны и сульфонамиды могут
представлять интерес в качестве средств для лечения малярии. Экспе-
Экспериментальное изучение выявило выраженный синергизм между суль-
сульфонамидами и хлоргуанидом и пириметамином.
Хлоргуанид (Chloroguanid)
Хлоргуаннд — М|-D-хлорфенил)-М^-изопропилбигуанид C7.1.3.2)
получают исходя из 4-хлоранилина и дицианамида натрия, взаимо-
взаимодействием которых получают D-хлорфенил)-дициандиамид C7.1.3.1).
Вводя последний в реакцию с изопропиламином, получают иско-
искомый хлорнуанид [30, 31, 32].
/=\
—л^ rf— Nh-C-NH-C-NH-CH^
СНз
В условиях in vitro хлоргуанид неактивен, однако в организме он
трансформируется в активное дигидротриазиновое соединение.
Хлоргуанид активен как в отношении экзоэритроцитарных, так
и эритроцитарных форм плазмодий. Препарат наиболее полезен для
-783-
Глава 37
подавляющей терапии. Применяется при профилактике малярии, кото-
которую следует начинать за 2 недели до входа в малярийную зону и про-
продолжать прием в течение 8 недель.
Синонимами препарата являются бигуанид, бигумал, палудрин,
прогуанид и др.
Пириметамин (Pyvimethamin)
Пириметамин — 2,4-диамино-5-D'-хлорфенил)-6-этилпиримидин
C3 1.60), синтез которого был описан в гл. 33 «Антимикробные
препараты».
Этот мощный ингибитор дигидрофолатредуктазы используется для
профилактики и лечения малярии, вызванной плазмодиями Plasmodium
vivax, Plasmodium malanae, Plasmodium ovale, включая Plasmodium fal-
ciparum
Пириметамин, являясь антагоистом фолиевой кислоты, оказывает
противомикробное действие в отношении возбудителей малярии и од-
одновременно обладает споронтоцидным действием. Препарат эффекти-
эффективен также в отношении возбудителя токсоплазмоза. Применяется для
профилактики малярии и лечения токсоплазмоза.
Препарат может применяться только в профилактических целях,
однако вследствие быстрого развития к нему резисгентности, а гакже
с учетом того факта, что наибольший эффект достигается при его ком-
комбинированном применении с сульфадоксином, выпускается также ком-
комбинированный препарат под названием фансидар, содержащий
пириметамин — сульфадоксин в соотношении 1:20.
Комбинация пириметамина, сульфонамида и хинина является пре-
препаратом выбора при острых атаках малярии при ее хлороквинрезист-
нтных формах.
Пириметамин в комбинации с с>льфадназином или трисульфапи-
римидином является препаратом выбора при токсоплазмозе.
Синонимом этого комбинированного препарата является дараприм.
-784-
Препараты для лечения протозойных инфекций
37.1.4. Прочие антималярийные препараты
Малярийный паразит чувствителен ко многим разным группам ле-
лекарств, вследствие чего в зависимости от конкретных случаев исполь-
используются различные комбинации препаратов.
Хинакрин (Quinacrine)
Хинакрин — 6-хлор-9-D-диэтиламино-1-метилбутиламино)-2-мето-
ксиакридин C7.1.4.3) синтезируют исходя из 6,9-дихлор-2-мето-
ксиакридина C7.1.4.2) и уже описанного ранее 4-диэтиламино-1-
метилбутиламина C7.1.1.2). Необходимый для этого синтеза 6,9-ди-
хлор-2-метоксиакридин C7 1.4.2) получают в две стадии. С этой це-
целью первоначальным взаимодействием 2,4-дихлорбензойной кисло-
кислоты и /7-анизидина в присутствии медной пыли и поташа получают 2-
D-метоксианилино)-4-хлорбензойную кислоту C7.1.4.1), которую
реакцией с хлорокисью фосфора переводят в требуемый 6,9-дихлор-
2-метоксиакридин C7.1.4.2) [33, 34, 35. 36, 37, 38].
хоон
,OCh3
С ООН
.ОСНз
РОС13
Cri3 С
NH—CH-(CH2K-n(
.ОСН3 С
Ch3 С2Н5
H2N-CH-(Ch2K-N(
37 1 1 2 °2Н5
Хинакрин — производное акридина, химически и клинически очень
сходное с 4-аминохинолинами. Он являлся основным лекарством для
профилактики и терапии малярии в ходе Второй мировой войны. Сей-
Сейчас он редко используется для лечения малярии, однако применяется
для лечения амебиаза.
Синонимами препарата являются мепакрин. атабрин, акрисуксин
и др.
При лечении устойчивых форм малярии используется также тетра-
тетрациклин в комбинации с пириметамином, сульфонамидами и сульфона-
ми и дапсон, который широко используется при лечении лепроза, как
правило в сочетании с пириметамином.
-785-
Глава 37
37.2. Препараты для лечения амебиаза
Амебиазом считается инфицирование организма протозами
Entamoeba histolytica, которые чаще всего поражают толстый кишечник,
однако могут поражать и легкие, печень, мозг и другие органы. При
поражении ЖКТ болезнь может протекать без клинических симптомов,
с умеренно выраженными клиническими симптомами (диарея, судоро-
судороги, метеоризм), а также с симптомами острой амебной дизентерии, со-
сопровождаемой кровавой диареей, рвотой, лихорадкой и дегидратацией
организма. Присутствие протозойных микроорганизмов Entamoeba
histolytica в других органах может вызвать некроз печени, амебный ге-
гепатит, абсцесс легких. Описаны случаи поражения сердца (вызывающие
перикардит) и мозга (приводящие к абсцессу мозга).
Микроорганизм передается от одного лица к другому посредством
амебных цист — формы существования амеб, в которых протоза имеет
наибольшую сопротивляемость воздействию извне. Цисты не повреж-
повреждаются желудочным соком, поэтому проходят в кишечник, где могут
развиться в трофозоиты, которые поражают слизистую кишечника, аб-
абсорбируются и могут далее проникать в другие органы. Entamoeba
histolytica является причиной амебиаза имеет довольно сложный жиз-
жизненный цикл в организме хозяина. Выделяемые в неизмененном виде
цисты являются источником для новых заражений. Имеется много пре-
препаратов, применяемых для лечения амебиаза. Однако ни один из них не
может считаться совершенно эффективным, поскольку этот микроорга-
микроорганизм очень резистентен.
Препараты, применяемые при лечении амебиаза, могут быть оха-
охарактеризованы по принципу их основного места действия. Например,
некоторые препараты (йодохинол, дилоксанид, паромомицин) активны
только против амеб, локализованных в просвете кишечника, и приме-
применяются при лечении асимптомных или умеренных формах амебиаза.
Др\1ие (эметин, хлороквин) активны против амеб, локализованных
в стенке кишечника и других тканях и применяются при амебной дизен-
дизентерии и гепатических абсцессах. Третьи (метронидазол, тинидазол) ак-
активны против амеб как кишечной, так и внекишечной локализации.
Йодохинол (Iodoquinol)
Йодохинол — 5,7-дийод-8-хинолинол C7.2.2) получают йодирова-
йодированием 8-оксихинолина C7.2.1) смесью йодид калия/йодат калия. Ис-
Исходный 8-ОКС1ГХННОЛИН C7.2.1) получают исходя из 2-аминофенола
и глицерина в присутствии серной кислоты и нитробензола (синтез
Скрачпа) [39,40].
-786-
Препараты для лечения протозойных инфекций
сн2-сн-сч2
он он он
H2SO4
37 2 2
Йодохинол является амебоцидом, применяемым против Entamoeba
histolytica, и активен как против цист, так и против трофозоитов, лока-
локализованных в просвете кишечника; считается препаратом выбора при
лечении асимптомных или умеренных форм амебиаза. Механизм дейст-
действия препарата неизвестен.
Йодохинол применяется при заболеваниях кишечным амебиазом
средней тяжести.
Синонимами препарата являются дихинол, йодоксин, дийодоквин,
амебаквин и др.
Дилоксанид (Diloxanide)
Дилоксанид — 2,2-дихлор->7-D-фуроилоксифенил)-№метилаце-
тамид C7.2.4) получают ацилированием 2,2-дихлор-М-D-гидрокси-
фенил)-М-метилацетамида C7.2.3) хлорангидридом-2-фуранкарбо-
новой кислоты. Сам 2.2-дихлор-М-D-гидроксифенил)-]\т'-метилаце-
тамид C7.2.3) получают N-ацилированием 4-гидрокси-К-метилани-
лина либо хлорангидридом дихлоруксусной кислоты, либо весьма
оригинальным способом — с использованием циангидрина хлораля
[41,42,43].
if ?riV=\
CI2CH-C— N—(\ //—ОН
I CljCH-C-CN I "• С1зС-С-ОН
Дилоксанид также активен против цист и против трофозоитов, ло-
локализованных в просвете кишечника, и применяется при лечении носи-
-787-
Глава 37
телей Entamoeba histolytka, а также асимптомных или умеренных форм
амебиаза. В стадии перехода к трофозоитам препарат менее активен,
чем йодохинол.
Синонимом препарата является фурамид.
Паромомицин (Paromomycin)
Паромомицин C2.4.5) был описан гл. 32 «Антибиотики».
Препарат рекомендуется при лечении острых и хронических форм
кишечного амебиаза, а также при лечении кишечных бактерий
Salmonella и Shigella.
СН2ОН
А—о
NH2
ОН
32 4 5
Синонимами препарата являются аминозидин, катенулин, кресто-
мицин, гидроксимицин, мономицин, зигомииин и др.
Эметин (Emetine)
Эметин — З-этил-2.3,4,6,7,11Ь-гексагидро-9Л0-диметокси-2-( 1,2,3,
4-тетрагидро-6,7-диметокси-1-нзохинолилметил)-1//-бензо[а]хино-
лизин C7.2.8) является природным соединением. Традиционно ал-
алкалоид эметин извлекался из растения ипекакуанна (Бразильский
корень) и использовался в качестве основного средства для лечения
амебиаза, лейшманиоза, дизентерии. Предложены различные пути
синтеза эметина, каждый из которых исходит из гомовератрилами-
на — 2-C,4-диметоксифенил)этиламина [44, 45, 46, 47, 48].
-788-
Препараты для лечения протозойных инфекций
При совместном каталитическом гидрировании этилового эфира
р-(ос -циано)пропилглутаровой кислоты и гомовератриламина водоро-
водородом происходит реакция восстановительного аминирования с выбросом
аммиака и промежуточным образованием вторичного амина C7.2.5),
который в условиях реакции подвергается внутримолекулярной цикли-
циклизации с получением 1-[2-C,4-диметоксифенил)-этил]-4-карбэтоксиме-
тил-6-этилпиперидона-2 C7.2.6). Взаимодействием полученного лакта-
ма с хлорокисью фосфора осуществляют гегероциклизацию последнего
в производное бензохинолизина C7.2.7). Дальнейшим взаимодействием
продукта с гомовератриламином получают соответствующий амид. По-
Последний действием хлорокиси фосфора циклизуют в изохинолиновое
производное, пиридиновое кольцо в котором далее гидрируют водоро-
водородом до рацемической смеси продуктов, из которой выделяют искомый
эметин.
CH3CL^
сн3сГ^
1.
2.
-и—i
Tl
COOC2H6
СНзСк^
сн3о^-
POCI3
H2 /РГО
I 1
> NH2
сн3о.
СН3О
37 2 7
СН3О
СН3О
С2Н6
37 2 8
Препарат обладает прямым амебицидным эффектом против трофо-
зоитов Entamoeba histolytica в тканях и не активен против цист, как
в просвете и стенке кишечника, так и в других органах. Механизм дей-
действия эметина заключается в блокировании синтеза протеинов в эука-
риотических, но не прокариотических клетках, ингибируя процесс по-
-789-
Глава 37
строения полипептидной цепи. Причем синтез протеинов ингибируется
в клетках паразитов и млекопитающих, но не в бактериях.
В качестве средства для лечения амебиаза эметин в настоящее вре-
время применяется лишь в случаях резистентности к другим препаратам.
Синонимами препарата являются ипецин и метилцефалин.
Хюроквин (Chloroquin)
Синтез и свойства хлороквина C7.1.1.3) описаны в настоящей главе
в разд. 37.1.
Из
NH—CH-(CHJ3-N(
С2Н5
с2н6
Хлороквин широко применяется также при лечении амебиаза.
Метронидазол (Metronidazole)
Метронидазол — 2-метил-5-нитроимидазол-1 -этанол C7.2.10) по-
получают нитрованием 2-метилимидазола с получением 2-метил-5-
нитроимилазола C7.2. 9), который дальнейшим взаимодействием
с 2-хлорэтанолом или этиленоксидом с легкостью трансформирует-
трансформируется в искомый метронидазол [49, 50].
N
4N03
сн3'
н
37 2 9
¦N02
С!—СН2-СН2-ОН
N-л
U vL
|
Cri2-Cri2—ОН
Э7 2 10
Метронидазол является синтетическим противопротозойным пре-
препаратом, впервые внедренным в медицинскую практику в 1960 г. Пре-
Препарат подавляет развитие трихомонад, гиардий, амеб, лямблий, бакте-
бактероидов, фузобактерий и некоторых других. Эффективен в отношении
облигатных анаэробных бактерий. Неактивен в отношении аэробных
микроорганизмов.
Метронидазол с легкостью проникает через клеточные оболочки
как аэробных, так и анаэробных бактерий. Далее активация и действие
препарата треб\ют протекания определенных восстановительных про-
-790-
Препараты для лечения протозойных инфекций
цессов, которые имеют место в анаэробных организмах и некоторых
бактериях в анаэробных условиях. При этом нитрогруппа препарата
подвергается восстановлению белками с низким редокс потенциалом.
Эта реакция понижает концентрацию неизмененного метронидазола
и вызывает градиент, позволяющий большему количеству препарата
проникнуть в бактерию. Некий нестабильный и неидентифицированный
промежуточный продукт восстановления метронидазола взаимодейст-
взаимодействует с бактериальной ДНК, вызывая гибель протозойного паразита. Ме-
Механизм резистентности к метронидазолу выяснен неокончательно. Мет-
Метронидазол проявляет высокую бактерицидную активность по отно-
отношению к большинству анаэробов {Protococcus, Peptostreptococcus,
Clostridium Bacteroides и Fusobacterium), а также некоторых неспорооб-
разуюших грамположительных организмов (Actinomyces, Eubacterium,
Bifidobacterium, Propionibacterium). Неактивен по отношению к аэроб-
аэробным инфекциям. Высокоактивен против анаэробных протозойных ин-
инфекций, включая Trichomonas vaginalis, Entamoeba histolytica, Giardia
lamblia и Balantidium coli.
Метронидазол является лекарством выбора при амебиазах, ваги-
вагинальном трихомониазе и трихомонадном уретрите у мужчин, лямблио-
зе, амебной дизентерии, анаэробных инфекциях, вызванных чувстви-
чувствительными к препарату микроорганизмами.
Синонимами препарата являются флагил, протостат, трихопол
и вагимид.
Тинидазол (Tinldazol)
Тинидазол — 1-2-(этилсульфонил)этил-2-метил-5-нитроимидазол
C7.2.12) получают также из 2-метил-5-нитроимидазола C7.2.9), ко-
который взаимодействием с 2-этоксисульфонил л-толуолсульфонатом
C7.2.11) трансформируется в искомый тинидазол. Необходимый
для этой цели 2-этоксисульфонил-л-толуолсульфонат C7.2.11),
в свою очередь, поддается тоизилированием 2-этилсульфонилэта-
нола я-толуолсульфохлоридом [51, 52. 53].
ТУ-
%—зо2-сьЭ"СИ;—он
CH3'^N N°2
I
C2H5—SO2-CH2-CH2
37 2 12
-791 -
Глава 37
По механизму действия и по показаниям к применению тинидазол
очень похож на метронидазол. Эффективен также в отношении амеб,
трихомонад, лямблий, при остром язвенном гингивите, послеопераци-
послеоперационных анаэробных инфекциях. Его применяют для лечения практически
всех протозойных инфекций.
Синонимами препарата являются тинапорт, тинимед и тинисан.
37.3. Препараты для лечения лейшманиоза
Группа трипаносомных протозойных паразитов рода Leishmania вы-
вызывает ряд болезней, известных как лейшманиоз. Болезнь в основном
распросгранена в тропиках и субтропиках и переносится специфиче-
специфическими кровососущими насекомыми. Различают кожный лейшманиоз
(возбудитель Leishmania tropica) и висцеральный лейшманиоз (возбуди-
(возбудитель Leishmania donovam). При местном лечении кожного лейшманиоза
применяют акрихин и мономицин.
При лечении висцерального лейшманиоза (калаазар) широко при-
применяют препарат пятивалентной сурьмы — стибиоглюконат натрия
Следует отметить, что органические соли трехвалентной сурьмы (ли-
(литиевая соль антимониляблочной кислоты — антиомалин, производное
арилсульфоновой кислоты — антимосан, производное л-аминофе-
нилстилбоновой кислоты - (либамин и др.) долгое время являлись тра-
традиционными и эффективными препаратами для лечения лейшманиоза.
Недавно было показано, что соли пятивалентной сурьмы более удобны
для применения. Полагают, однако, что в организме пятивалентная
сурьма восстанавливается до трехвалентной. Для печения лейшманиоза
применяются гакже амфотерицин В. метронидазол и пентамидин.
Стибиоглюконат натрия (Sodium Stibogluconate)
Стибиоглюконат натрия — тринатриевую соль 2,4:2',4'-0-(окси-
дисгибилидин)-8Ь,8Ь -диоксида-О-глюконовой кислоты C7.3.1) по-
получают действием глюконовой кислоты на свежеосажденную сурь-
сурьмяную кислоту и нейтрализацией полученного раствора гидро-
гидроокисью натрия, после чего искомый продукт — стибиоглюконат
натрия - - осаждают спиртом [54]. Стибиоглюконаг натрия является
препаратом выбора для лечения лейшманиоза. Полагают, что он ин-
гибирует гликолитический фермент (фосфофр>ктокиназ>). \часг-
в\ющий в цикле Кребса, происходящем в ор[анизме паразиюв рода
Leishmania в результате чего паразитический микроорганизм пере-
перестает вырабатывать необходимую для своею существования энер-
энергию и погибает.
-792-
Препараты для лечения протозойных инфекций
н
сн-о-н
сн-о-н
2 СН-О-Н
сн-о-н
сн-о-н
соон
HSb(OHN
NaOH
н
сн-о-н
сн-о-н
н
н-о-сн
н-о-сн
9Н~°\ он о" о-сн
CH-O-;Sb-O-Sb^O-CH
сн-о о-сн
соо'
оос
3Na
37 3 1
Синонимом препарата является солюсурмин и др.
37.4. Препараты для лечения трипаносомоза
Трипаносомиаз — болезнь, больше известная под названием сонная
болезнь, выражается хроническим сном, головными болями, нарушени-
нарушением координации движений, апатией, потерей интеллекта и, при отсутст-
отсутствии лечения, смертью. В Африке трипаносомиаз переносится мухой
цеце, инфицированной трипаносомами {Trypanosoma gambience и Try-
panosoma rhodesience). В Южной Америке болезнь также переносится
кровососущими насекомыми. Известна группа диамидиновых соедине-
соединений, активных против трипаносом. Наиболее широко используемым для
этой цели соединением является пентамидин. Нередко применяют ни-
футрифокс и более старый препарат — сурамин.
Пентамидин (Pentamidine)
Пентамидин — 4,41-(пентметилендиокси)дибензамидин C7.4.2) по-
получают взаимодействием 4-гидроксибензонитрила с 1,5-дибром-
пентаном в присутствии гидроксида натрия с получением 1,5-бис-
D-цианофенокси)пентана C7.4.1). Последовательным взаимодейст-
взаимодействием последнего со спиртовым раствором хлористого водорода
с промежуточным получением иминоэфира и далее со спиртовым
раствором аммиака получают искомый пентамидин [55, 56, 57]
C2H5OH
-793-
Глава 37
NH2-C-
-О— (СН2)б—О
37 4 2
-C-NH?
Препарат уничтожает микроорганизмы, которые вызывают трипа-
трипаносомоз и лейшманиоз. Полагают, что пентамидин может действовать
либо путем ингибирования процесса окислительного фосфорилирова-
ния, либо путем ингибирования процесса метаболизма глюкозы, либо
ингибированием активности дигидрофолатредуктазы, либо взаимодей-
взаимодействия с ДНК или нуклеотидами паразита.
Синонимами препарата являются ломидин, небупент и др.
Нифуртимокс (Nifurtimox)
Нифуртимокс — 1,1-диоксид-4-[E-нитрофурилиден)амино]-3-ме-
тилтиоморфолин C7.4.7) получают по следующей схеме синтеза.
Взаимодействием 2-меркаптоэтанола с пропиленоксидом в присут-
присутствии гидроокиси калия получают B-гидроксиэтил)-B-гидрокси-
пропилсульфид C7.4.3), внутримолекулярной дегидратацией кото-
которого с помощью бисульфата калия получают 2-метил-1,4-окситиан
C7.4.4). Окислением последнего пероксидом водорода получают
2-метил-1,4-окситиан-4,4-диоксид C7.4.5), который при взаимодей-
взаимодействии с гидразином трансформируется в 4-амино-З-метилтетра-
гидро-1,4-тиазин-1,1 -диоксид C7.4.6). Вводя последний во взаимо-
взаимодействие с 5-нитрофурфуролом, получают соответствующий гидра-
зон — искомый нифутримокс [58, 59].
НО—Cri2—CH2—ЗН
НО-СН2-си2
hO-CH-CH2
CH3
V
J-*
h2n-n
СНз
^
37 4 6
t—N SO'
Н СНз
37 4 7
-794-
Препараты для лечения протозойных инфекций
Нифуртимокс является препаратом выбора при острой форме юж-
южно-американской формы трипаносомоза — болезни Чагаса. Полагают,
чго препарат действует путем образования реакционноспособных ради-
радикалов (супероксид, гидропероксид, гидроксил) в паразитах, что приво-
приводит к потере паразитом каталазы и глутатион пероксидазы и повыше-
повышению у последнего чувствительности к пероксиду водорода, что нару-
нарушает его нормальную жизнедеятельность.
Синонимом препарата является лампит и др.
Сурамин (Suramin)
Сурамин — гексанатриевая соль [8,8'-карбонил-Eгд?-[имино-3,1-
фениленкарбонилимино-4-метил-3,1-фенилен]карбонилимино]-бис-
1,3,5-нафталинтрисульфоновой кислоты C7.4.13) может быть полу-
получена взаимодействием 1-аминонафталин-3,6,8-трис>льфоновой ки-
кислоты с хлорангидридом 4-метил-З-нитробензойной кислоты с по-
получением нитробензоильного производного C7.4.8). Нитрогруппу
в последнем восстанавливают активированным железом в амино-
производное C7.4.9), которое ацилируют .м-нитробензоилхлоридом
с получением нового нитропроизводного — .м-нитробензоил-D-ме-
тил-3-аминобензоил)-1-аминонафталин-3,6,8-трисульфоновой ки-
кислоты C7.4.10). Последний вновь восстанавливают в амин C7.4.11)
гем же способом. Взаимодействием полученного продукта с фосге-
фосгеном получают [8,8'-карбонил-бш>[имино-3,1-фениленкарбонили-
мино-4-метил-3,1-фенилен]карбонилимино]-бмс-1,3,5-нафталинтри-
с>льфоновую кислоту C7.4.12), обработкой которой гидроксидом
натрия получают сурамин [60, 61, 62, 63].
HO3S
-O»S 3? 4 S
-795-
Глава 37
HO3S
HO3S'
HO3S
NH2
COCI2
HO3S
¦3O3H
SO3H
NaO3S
UaO3:
Nh —С—NH
SO3Na
SO3Na
SOjNa
Сурамин — очень старый препарат, полученный в 1920-х годах при
исследованиях некоторых ядов и красителей (трипановый красный
и гол\ бой, афридол фиолетовый) в качестве препаратов с трипаносоми-
цидной активностью. Точный механизм действия препарата не выяснен.
Однако полагают, что сурамин абсорбируется в трипаносомах, где, воз-
возможно, обратимо связывается с белками. В настоящее время препарат
используется редко при лечении ранних форм сонной болезни.
Синонимами препарата являются антрипол, натримин, германии и др.
37.5. Препараты для лечения других
протозопных инфекций
Протозойной инфекцией считается также лямблиоз, который выле-
вылечивается хинакрином. Иногда в случаях лямблиоза применяют метро-
нидазол и фуразолидон. Другой распространенной протозойной инфек-
инфекцией является трихомониаз, для лечения которого применяют описан-
описанные выше метропидазол и тинидазол. Лечение токсоплазмоза осущест-
осуществляют сульфаниламидами ихлоридином.
-796-
Препараты для лечения протозойных инфекций
Список литературы
1. US Pat. 2.233.970A941).
2. Ger. Pat. 683.692A937).
3. Drake К. et al.//J. Am. Chem. Soc. 68, 1214 A946).
4. Price С et aL'/J. Am. Chem. Soc. 68, 1204 A946).
5. Ger. Pat. (DDR). 53.065A966).
6. Surrey A. et al.//J. Am. Chem. Soc. 68, 113 A946).
7. US Pat. 2.478.125A949).
8. Ger. Pat. 486.079A924).
9. ElderfieldR. et al./, J. Am. Chem. Soc. 68, 1579 A946).
10. US Pat. 2.546.658A951).
11. Surrey A. et al.'/J Am. Chem. Soc. 72, 1814 A950).
12. US Pat. 2.474.819A949).
13. US Pat. 2.474.821 A949).
14. Burckhalter G. et al.-VJ. Am. Chem. Soc. 70, 1363 A948).
15. Natarajan M. et al./VArzneimittel-Forsch. 22, 1230 A972).
16. Jucker H. et al./ZUlmann's Enzyklopadie der Technischen Chemie.
3,213A953).
17. Woodward R. et al.//J. Am. Chem. Soc. 66, 849 A944).
18. Woodward R. et al.//J. Am. Chem. Soc. 67, 860 A945).
19. Taylor et al.//J. Am. Chem. Soc. 94, 6218 A972).
20. Gutzwiller et al./J. Am. Chem. Soc. 100, 576 A978).
21. Grethe G. et al.//J. Am. Chem. Soc. Ш0, 589 A978).
22. Imanishi T. et al. ,Chem. Pharm. Bull. 30, 1925 A982).
23. OhnmachtC et al., 'J. Med. Chem. 14., 926 A971).
24. Ger. Pat. 2.940.443A979).
25. Ger. Pat. 2.806.909A978).
26. Jing-Ming L. et al.A'Acta Chim. Sinica. 37, 129 A979).
27. Schmid G. et al.'/J. Am. Chem. Soc. Ш5, 624 A983).
28. Elderfield R. et al./'J. Am. Chem. Soc. 68. 1524 A946).
29. Elderfield R. et aLVJ. Am. Chem. Soc. 77, 4816 A955).
30. CurdR et ab'J. Chem. Soc. 1946, 729.
31. CurdR. etaLJ. Chem. Soc. 1948, 1630.
32. Ainly H. et al. J. Chem. Soc. 1949, 98.
33 Ger. Pat. 553.072A934).
34. Ger. Pat. 571.499A934).
35. US Pat. 2.113.357A938).
36. US Pat. 1.782.727 A930).
37. US Pat. 1.889.704A932).
38. Wingler A. /Angew. Chem. 6_L 49 A949).
-797-
Глава 37
39 Ger. Pat. 411.050A925).
40. PapeschJ'J. Am. Chem. Soc. 58. 1314A936)
41. Bnt. Pat. 767.148A954).
42. Bnt Pat 786.806A955).
43. US Pat. 2.912.438A959).
44. Евстигнеева Р и др./.'ДАН СССР, 75, 539 A950).
45. Tamelen Van E et al.//J. Am. Chem. Soc. ?1, 7359 A969).
46. Kametam T et aL/'J. Chem. Soc. Perkm. Trans. T, 1979, 1211.
47. TakanoS et al,/J. Org. Chem. 43. 4169 A978).
48. Fujii T etal.'/Tetrahedron. 36, 1539A980).
49. US Pat. 2.944.061 A960).
50. Cossar К et al.//Arznemiittel-Forsch. 16, 23 A966).
51. US Pat. 2.376.311 A968).
52. Ger. Pat. 1.745.780A967).
53. Miller M et al.,<J. Med. Chem. 13, 849 A970).
54. BoseJ et al.//lndian. J. Pharm. Д, 155 A949).
55. Bnt. Pat. 507.565A939).
56. US Pat. 2.394.003A946).
57. Ashley J et al.'J. Chem. Soc. 1942, 103.
58. Ger. Pat. 1.170 957A964).
59. US Pat. 3.262.930A966).
60. Bnt. Pat. 224,849 A923).
61. DresselJ >',']. Chem. Ed. 38, 620 A961).
62 Fourneau E et al.'/Compt. Rend. 178, 675 A924).
63 Heymann 5,,'Angew. Chem. 37, 585 A924).
Глава 38
А нтигельм интные
препараты
Гельминтные инфекции представляют большую проблему для жиз-
жизни миллионов людей на Земле, особенно в тропиках и субтропиках.
В зависимости от типа и локализации возбудителя гельминтоз может
протекать бессимптомно или же явиться причиной анемии, поражения
кровеносных сосудов, печени, глаз. Различают кишечные и внекишеч-
ные гельминтозы. Возбудители классифицируются как круглые черви
(нематоды) и плоские черви, к которым причисляют ленточных червей
(цестоды) и сосальщиков (трематоды). Большинство нематодных ин-
фекиий локализуется в кишечном тракте, однако некоторые из них мо-
могут проникать в иные органы, включая сердце, печень, легкие, мышцы
и др., из которых их удаление значительно сложнее. Цестодные инфек-
инфекции обычно локализуются в ЖКТ, но известны случаи их проникнове-
проникновения в циркуляционную систему. Трематоды вызывают хроническое
инфицирование, называемое шистосомоз. при котором поражаются кро-
кровеносные сосуды и нарушаются функции и структуры различных орга-
органов печени, кишечника, мочеполового тракта.
Антигельминтные препараты предназначены для искоренения гель-
гельминтов и выведения их из организма хозяина, и их подразделяют на:
— средства, нарушающие нервно-мышечнчю координацию гель-
гельминтов;
— средства, действующие на энергетические процессы гельмин-
гельминтов, в частности на метаболизм глюкозы;
— средства, действующие на ферментную систему гельминтов,
кладку и высиживание яиц гельминтами и т. п.
Большинство антигельминтных препаратов предназначены для воз-
воздействия на определенных гельминтов. Исторически в качестве лекар-
лекарственных средств при гельминтозах применяли галогензамещенные уг-
углеводороды, фенол и родственные им соединения: сульфаниламиды,
производные хинолина, нафтохинона, фенотиазина, ряд природных со-
-799-
Глава 38
единений, выделенных из листьев полыни и папоротника, эфирных ма-
масел (производных шшена). алкалоидов (ареколиновой группы), алка-
алкалоидов ряда эметина и многие другие. Однако в настоящее время эссен-
циальными препаратами для лечения гельминтоза являются
нижеописанные лекарственные средства.
Мебендазол (Mebendazol)
Мебендазол — метил-[5-(бензоил)-1//-бензимидазол-2-ил]карбамат
C8.1.5) является производным бензимидазола. который получают
п\тем взаимодействия 3,4-диаминобензофенона C8.1.3) с N-мето-
ксикарбонил-Б-метилтиомочевиной C8.1.4) [1, 2].
CH3S4
C=N-COOCH3
38 1 4
Необходимые реагенты получают следующим способом. Нитрова-
Нитрованием 4-хлорбензофенона азотной кислотой при температуре ниже 5 °С
пол>чают 4-хлор-З-нитробензофенон C8.1.1), атом хлора в котором за-
замешают на аминогруппу нагреванием до 125 °С с раствором аммиака
в метаноле с получением 4-амино-З-нитробензофенона C8.1.2). Восста-
Восстановлением нитрогруппы в последнем водородом с использованием
в качестве катализатора палладия на угле получают 3,4-диамино-
бензофенон C8.1.3).
Второй реагент — М-метоксикарбонил-З-метилтиомочевину C8.1.4)
получают взаимодействием метилового эфира хлоругольной кислоты
с S-метилтиомочевиной.
ch3sn
C=N-H
H2N'
I—СООСНз
CH3S\
#C=N-COOCH3
31 1 4
-800-
Антигельминтные препараты
Точный механизм действия мебендазола окончательно не выяснен,
но кажется вероятным, что он вызывает необратимое ингибирование
захвата и утилизации глюкозы организмом паразита, тормозит образо-
образование в их организме аденозинтрифосфата, вызывая тем самым глико-
геновое истощение и последующую гибель паразитов.
Мебендазол применяется для лечения энтеробиоза, аскаридоза, ан-
килостомидоза, стронголоидоза, трихоцефалеза, трикуриаза. аскаридоза,
трихострондиоза. анциклостомиаза и смешанных генльминтозов. Его
применение в течение 3 дней 2 раза в день в дозах по 100 мг вызывает
полное излечение от 90 до 100 % пациентов.
Синонимами препарата являются вермокс, мебутар, панфуган
и многие др\гие.
Альбендазол (Albendazol)
Альбендазол — метил-[5-(пропилтио)-1Я-бензимидазол-2-ил]карба-
мат C8.1.8) также получают гетероциклизацией производного фе-
нилеидиамина в производное бензимидазола. С этой целью 3-хлор-
6-нитроацетанилид вводят во взаимодействие с пропилмеркаптаном
с получением З-пропилтио-6-нитроацетанилида C8.1.6). Восста-
Восстановлением нитрогруппы в последнем водородом также с применени-
применением в качестве катализатора палладия на угле получают 4-(про-
пилтио)-о-фенилендиамин C8.1.7). Взаимодействием полученного
производного о-фенилендиамина с цианамидом и далее с метиловым
эфиром хлоругольной кислоты получают искомый альбендазол [3].
c3h7sh
Н2 / Pd-C
C3H7S ^-^ NH-СОСНз
38 1 6
C3H7S
38 1 7
1 H2NCN
2 CICOOCH3
C3H7S
38 1 8
NH-еооеНз
Производное бензимидазола — альбендазол — препарат широкого
антигельминтного спектра. Проявляет антигельминтный эффект против
чувствительных цестод и нематод путем блокирования процесса захвата
глюкозы паразитами, выражающееся истощением запасов гликогена
-801 -
Глава 38
и последующего понижения уровня аденозинтрифосфата, вследствие
чего паразиты обездвиживаются н погибают. Препарат применяется при
заражении Acaris lumbricoides, Ancylostoma duodenale, Necaior ameri-
canus, Enterobius vermicularis и Trichuris irichiura
Синонимом препарата является СКФ 62979 и др.
Тиабендазол (Thiabendazol)
Тиабендазол — 2-D'-тиазолил)бензимидазол C8.1.9) также полу-
получают аналогичным путем — гетероциклизацией, происходящей при
взаимодействии о-фенилендиамина с 1.3-гиазол-4-карбоновой кис-
кислотой [4, 5, 6].
ноос
38 1 9
Тиабендазол — антигельминтный препарат широкого спектра дей-
действия. Хотя детальный механизм его действия выяснен неокончательно,
кажется очевидным, что его действие опосредовано ингибированием
специфического для гельминтов фермента— фумаратредуктазы.
Тиабендазол активен по отношению к большинству нематодных
инфекций, включая Angyostrongylus cantonesis, Strongyloides stercoralis,
Trichinella spiralis, Toxocara canis, Toxocara cati, Ancylostoma caninum,
Ancxlostoma braziliense, Ancylostoma duodenale, Dracunculus medinesis,
Capillaria philippinesis, а также при лечении Acaris cantonesis и Shisto-
soma stercoralis.
Синонимами препарата являются минтезол, минзолум и др.
Ниридазол (Niridazol)
Ниридазол — 1-E-нитро-2-тиазолил)-2-имидазолидинон C8.1.11)
получают взаимодействием 2-амино-5-нитротиазола с 2-хлорэтил-
изоцианатом с получением дизамешенной мочевины C8.1.10), на-
нагреванием которой осуществляют внутримолекулярную реакцию
алкилирования с образованием искомого имидазолидинонового
производного — ниридазола [7, 8, 9, 10, 11].
Г\гл
-802-
Антигельминтные препараты
Ниридазол проявляет шистосомицидное и амебицидное действия.
Механизм действия неясен. Кажется вероятным предположение, что,
концентрируясь в организме паразита, он вызывает ингибирование ак-
активации фосфорилазы, выражающейся в истощении запасов гликогена,
а также ингибирует сперматогенез паразитов, воздействует на продук-
продукцию яиц.
Показан для лечения болезней, вызванных Dracunculus meddinesis,
а также Shistosoma Haematobium и Shistosoma mansoni. Относится к третич-
третичным препаратам и используется только в отсутствие препаратов выбора.
Синонимом препарата является амбилар и др.
Пиперазин (Piperazin)
Пиперазин C8.1.12) является многотоннажным продуктом органи-
органического синтеза, который получают исходя из этаноламина путем на-
нагревания последнего в среде аммиака при температуре 150-220 °С
и давлении 100-250 атмосфер. Применяют в виде солей, как прави-
правило в виде адипината [12, 13].
H2N-CH2-CH2-OH
NH3
I \
H-N N-H
38 1.12
Пиперазии является альтернативным препаратом и применяется для
лечения при заражении различными видами нематод, в частности при
энтеробиозе и аскаридозе. Препарат вызывает паралич нематод, блоки-
блокируя ацетилхолиновую передачу. Это вызывает отлипание паразитов от
слизистых стенок и выделение их из организма. Аскаридоз требует ле-
лечения в течение двух дней, энтеробиоз — семи.
Синонимами препарата являются таснон, увилон, антепар, бексин
и многие другие.
Диэтилкарбаназин (Diethylcarbamazine)
Дютилкарбамазин — ^',^>-диэтйл-4-метил-1 -пипераэинкарбоксамид
C8.1.13) получают ацилированием 1-метилпиперазина диэтилкар-
бамоилхлоридом [14, 15. 16].
^v О
°\ II
N-C-CI
H-N N-CH3
С2Н5
Г
N-C—-N N-CH3
38 1 13
-803-
Глава 38
Диэтилкарбамазин является производным пиперазина. Механизм
его действия выяснен не полностью. Однако весьма вероятно, что он
вызывает понижение мышечной активности и даже паралич у гель-
гельминтов. Препарат вызывает быстрое исчезновение паразитов вида
Brugia malayi, Loa loa и Wuchereria bancrofti, а также применяется
при заболеваниях, вызванных Onchocerca volvulus и Mansonella strep-
tocerca.
Синонимами препарата являются гетразан. нотезин, баносид и др.
Празиквантел ((Praziquantel)
Празиквантел — 2-(цнклогекснлкарбонил)-1,2,3,6.7,11Ь-гекагидро-
4//-пиразино[2,1-а]изохинолин-4-он C8.1.15) представляет собой
производное пиразинохинолина, который предложено получать
двумя путями [17, 18, 19]. Согласно первому способу, 1-амино-
метил-1,2,3,4-тетрагидроизохинолин алкилируют хлоруксусной ки-
кислотой, и далее полученный амин ацилируют хлорангидридом цик-
циклогексанкабоновой кислоты с получением 1-AЧт-карбоксиметил-1Ч-
циклогексилкарбониламинометил)-1,2,3,4-тетра-гидро-изохинолина
C8.1.14), нагреванием которого при 150 °С получают искомый пра-
зиквангел.
СЮи2СООН
2 < >—СООЧ
о
соон
Второй способ синтеза исходит из изохинолина, взаимодействием
которого со смесью хлорангидрид циклогексанкабоновой кислоты'циа-
кислоты'цианистый калий получают дигидропроизводное изохинолина C8.1.16),
восстановлением которого водородом над никелем Ренея получают
прод>кт восстановления (переамидирования) — амид-1-(М-циклогек-
силкарбониламинометил)-1.2,3,4-тетрагидроизохинолин C8.1.17). Аии-
лированием последнего хлорангидридом хлоруксусной кислоты полу-
получают хлорацегильное производное C8.1.18), при нагревании которого
в присутствии диэтиламина в результате внутримолекулярного алкили-
рования получается искомый продукт — празиквантел.
-804-
Антигельминтные препараты
/ V—СООН ' KCN
(CZH5JNH
38 1 18
38 1 15
Празиквантел — антигельминтный препарат широкого спектра дей-
действия. Кажется вероятным, что он воздействует на клеточную мембрану
шистосом путем повышения проницаемости и следовательно потока
в нее ионов Са2 с последующим параличом мышц паразита. В резуль-
результате присоски паразита перестают действовать, и он выводится из орга-
организма хозяина. Препарат показан при лечении всех форм шистосомоза
у людей. Является лекарством выбора при лечении Shistosoma mansoni,
Shistosoma haematobium, Shistosoma japonicum, а также Shistosoma inter-
calatum и Shistosoma mekongi.
Синонимами препарата являются дронцит, билтрицид, цезол.
Пирантел (Pyrantel)
Пирантел — 1,4,5.6-тетрагидро-1-метил-2-[/и/?анс-2-B-тиенил)ви-
нил]-пиримидин C8.1.22) — производное тетрагидропиримидина,
получают исходя из 3-B-тиенил)-акрилонитрила C8.1.19, который
пол>чают по реакции Кновенагеля конденсацией фурфурола с циа-
нуксусной кислотой. Кислотным гидролизом последнего получают
3-B-тиенил)акриламид C8.1.20). Вводя последний во взаимодейст-
взаимодействие с пропансульфоном, получают иминоэфир A8.1.21), взаимодей-
взаимодействием которого с N-метил-триметилендиамином получают иско-
искомый пирантел [20, 21, 22, 23].
-805-
Глава 38
сн3
HN-CH2-CH2—CH2-NH2
О-СН2-СН2-СН2—S03n
Пирантел является высокоэффективным ангигельминтным средст-
средством при энтеробиозе, аскаридозе, анкилостомидозе и некаторозе. Анти-
гельминтный эффект проявляется в виде мощного холиномимегическо-
го воздействия на мышечные клетки нематод путем связывания с их
холинергическими рецепторами, что приводит к ингибированию ней-
ромышечной передачи в организме паразитов, сокращению их мускула-
мускулатуры, и. в результате, к выделению гельминтов из ЖКТ хозяина. Вы-
Вылечивает 85-100% случаев аскаридоза и 90-100% случаев энтеро-
биоза. Является лекарством выбора при заражениях Enterobius vermi-
cularis, Acaris lumbricoides, а также Ancylostoma duodenale, Necator
amencanus.
Синонимами препарата являются гелмекс, комбантрин, антиминт
и др.
Левамизол (Levamisol)
Левамизол — (-)-2,3,5,6-теграгидро-6-фенилимидазо[2,1-Ь]тиазол
C8.1.27) является производным имидазотиазола и является L-
изомером DL-тетрамизола (±)-2.3,5,6-тетрагидро-6-фенилимидазо
[2,1-Ь]тиазола A8.1.26), который предложено получать различными
способами. Первый способ исходит из а-бромацетофенона, взаимо-
взаимодействием которого с 2-имино-1,3-тиазолидином получают продукт
N-аткилирования 1-фенацил-2-имино-1,3-тиазолидин C8.1.23).
Ацилированием продукта уксусным ангидридом получают 2-аце-
тилиминопроизводное C8.1.24). Восстановление кетонной карбо-
карбонильной группы в последнем боргидридом натрия приводит к полу-
получению ключевого продукта синтеза— 1-B-фенил-2-гирокси-этил)-
2-ацетилимино-1,3-тиа-золидина C8.1.25). Замещением в послед-
последнем гидроксильнои группы на хлор с помощью хлористого тионила
и последующей обработкой продукта уксусным ангидридом осуще-
сгвляют реакцию гетероциклизашш в рацемическую смесь (±)-2,
3.5.6-тетрагидро-6-фенилимидазо[2,1-Ь]тиазолов C8.1.26), называ-
называемую гакже гетрамизолом. Обработкой последней D-10-камфорсуль-
фокислотой выделяют искомый L-изомер —левамизол [24, 25].
-806-
Антигельминтные препараты
а
"-"
-6
N-СОСНз
он И 1 sooi2
38 1,27
Следующие способы получения левамизола отличаются лишь мето-
методами получения 1-B-фенил-2-гироксиэтил)-2-имино-1,3-тиазолидина
C8.1.28). Второй способ исходит из взаимодействия окиси стирола с 2-
имино-1,3-тиазолидином и последующей обработкой полученного про-
продукта C8.1.28) хлористым тионилом и далее уксусным ангидридом, что
приводит к получению тетрамизола [25].
NH
1 SOCI2
2 (СН3СО)гО
38 1 28
38 1 26
Третий способ заключается в первоначальном взаимодействии
окиси стирола с этиленимином с получением М-B-фенил-2-
1 идроксиэтил)этиленимина C8.1.29), взаимодействием которого с тио-
цианатом качия или с тиомочевиной получают 1-B-фенил-2-
гироксиэтил)-2-имино-1,3-тиазолидин C8.1.28). Далее уже описанным
выше путем (обработкой продукта сначата хлористым тионилом, а за-
затем уксусным ангидридом) получают тетрамизол [26, 27, 28, 29, 30, 31].
N--l KSCN or H^CSNHj
1 SOOI2
Y_}S 2 (СНзСОJО_
-807-
Глава 38
Принципиальным отличием четвертого способа получения тетра-
мизола от вышеописанных заключается в осуществлении реакции гете-
роциклизации в присутствии гидроокиси натрия вместо уксусного ан-
ангидрида, что делает более понятным возможный механизм реализуемой
гетероциклизации. В предлагаемом методе 1-B-фенил-2-гироксиэтил)-
2-имино-1,3-тиазолидин C8.1.28) получают путем взаимодействия оки-
окиси стирола с этаноламином, дапьнейшим замещением гидроксильной
группы на хлор в полученном производном диэтаноламина C8.1.30)
хлористым тионилом, частичным кислотным гидролизом образующего-
образующегося при этом дихлорида C8.1.31) до первичного хлорида C8.1.32) и, на-
наконец, взаимодействием последнего с тиомочевиной получают 1-B-фе-
нил-2-гирокснэтил)-2-имино-1,3-тиазолидин C8.1.28). Взаимодействием
последнего с хлорсульфоновой кислотой получают 1-B-фенил-2-хлор-
этил)-2-имино-1,3-тиазолидин C8.1.33), который циклизуется в искомый
тетрамизол при обработке щелочью [32, 33, 34, 35, 36].
H2N-CH2-CH2-OH
SOCI2
за.1 зо
CI
CH-CH2-KH-Crl2-CH2-C!
Н2О / HCI
ri2N-C-NH2
38 1 ;
CISO3H
38 1 33
NaOH
38 1 26
Наконец, предложен еще и пятый способ получения 1-B-фенил-2-
гироксиэгил)-2-имино-1,3-тиазолидина C8.1.28), заключающийся во
взаимодействии 2-амино-1-фенилэтанола с 2-бромэтилизотиоцианатом,
приводящим непосредственно к образованию ключевого 1-B-фенил-2-
гироксиэтил)-2-имино-1.3-тиазолидина C8.1.28), который трансформи-
р_\ют в тетрамизол последовательным взаимодействием с хлористым
тионилом и далее с уксусным ангидридом [37].
-808-
Антигельминтные препараты
он
36 1 28
Левамизол является препаратом выбора при аскаридозе. Многочис-
Многочисленные исследования указывают на то, что однократный прием дозы
левамизола вылечивает от 90 до 100 % пациентов с аскаридозом, в част-
частности зараженных Ancylostoma duodenale. Препарат менее эффективен
при анкилостомидозе и стронгилоидозе. Однако препарат не эффекти-
эффективен при заражении Necator americanus. Кажется вероятным, что препа-
препарат оказывает ганглиостимулирующий эффект на ткани паразита как
в парасимпатических, так и в симпатических участках. Более того пред-
предполагается, что препарат оказывает иммуномодулирующий эффект на
организм хозяина.
Синонимами препарата являются декарис, соласкил, эргамизол,
трамизол, иммунол и др.
Никлозамид (Niclosamid)
Никлозамид — 2',5-дихлор-4'-ни1росалициланилид C8.1.34) полу-
получают взаимодействием 5-хлорсалициловой кислоты с 2-хлор-4-
нитроанилином в присутствии треххлористого фосфора [38, 39, 40].
H2N
ОН
РС13
NO2
38 1 34
Никлозамид является производным салициламида и является эф-
эффективным антигельминтным препаратом. Его действие заключается
в ингибировании митохондриального окислительного фосфорилиро-
вания как у млекопитающих, так и у паразитов. Одновременно он ин-
гибирует захват глюкозы и кислорода паразитом. В терапевтических
дозах практически не проявляет фармакологических эффектов на ор-
организм хозяина.
Никлозамид эффективен против кишечных цестод, таких как
Diphvllobothnum latum, Taenia saginata. Taenia solium, Dipilidium
caninum, Hymenolepis diminuta и Hymenolepis diminuta, но эффективен
-809-
Глава 38
против нематод. Препарат эффективен при одноразовом применении
в количестве 2 г.
Синонимами препарата являются иомесан, иклоцид, тредемин и др.
Бефениум (Bephenium)
Бефениум — З-гидрокси-2-нафтоат бензилдиметилB-феноксиэтил)-
аммония C8.1.37) получают взаимодействием натриевой соли 3-ги-
дрокси-2-нафтойной кислоты с хлоридом бензилдиметилB-фено-
ксиэтил)аммония C8.1.36). Последний, в свою очередь, получают
из хлористого бензила и М-B-феноксиэтил)диметиламина C8.1.35),
который синтезируют взаимодействием фенолята натрия с 2-диме-
тиламиноэтилхлоридом [41,42].
С!—Chj-Chb-N
/СН3
-О—СН?—СН?— N
/снэ
СН3
<\ /У— о—ch2-ch2-n-ch2—V у
сн3
COON a
CI
38 1 36
Ch3
/=\ +T
h— 0—CH2-CH2-N-CH2
CH3
38 1 37
Препарат проявляет антигельминтное действие, действуя в качестве
чолинергического агониста и вызывая паралич мускулатуры паразитов,
что способствует их удалению из кишечника. Применяют при лечении
аскаридоза, анкилосюмидоза, энтеробиоза. трихостронгилоидоза, три-
хоцефалеза. Однократное применение дозы бефениума вылечивает от
80 до 100 % пациентов, зараженных Ancylostoma duodenale Менее эф-
эффективен по отношению к Necator americanus.
Синонимом препарата является аклопар и др.
-810-
Антигельминтные препараты
Битионол (Bithionol)
Битионол — 2,2'-тиобисD,6-дихлорфенол) C8.1.38) получают
взаимодействием 2,4-дихлорфенола, растворенного в четыреххло-
ристом углероде с однохлористой серой в присутствии хлористого
алюминия [43, 44].
S2CI2 / А1С13
CI
38 1 38
Битионол представляет собой бмс-дихлорфенол и структурно схож
с гексахлорофеном. Является антигельминтным препаратом выбора для
лечения при заражении человека Fasciola hepatica, а также альтернати-
альтернативой препарату празиквантел, применяемому для лечения легочного
и церебрального парагонимиаза.
Точный механизм действия неясен, однако кажется вероятным, что он
ингибирует окислительное фосфорилирование в Paeagonumus westermani.
Синонимами препарата являются актамер, битин, превенол и др.
Список литературы
1. Ger. Pat. 2.029.637A970).
2. US Pat. 3.657.267A972).
3. US Pat. 3.915.986A975).
4. US Pat. 3.017.415 A962).
5. US Pat. 3.262.939A966).
6. US Pat. 3.274.208A966).
7. Brit. Pat. 986.562 A963).
8. Ger. Pat. 2.033.611 A970).
9. Ger. Pat. 2.117.050A971).
10. Belg. Pat. 632.989A963).
11. Lambert С et aL/Experientia. 20, 452 A964).
12. US Pat. 2.799.617A957).
13. Brit. Pat. 767.826A957).
14. US Pat. 2.467.893A949).
15. US Pat. 2.467.895A949).
16. KushnerA et al.-'J. Org. Chem. U, 151 A948).
-811 -
Глава 38
„
18
19
20
21
22
23
24
25
26
27
28
29
30
31
32
33
34
35
36
37
38
39
40
41
42
43
44
Ger Pat
LSPat 4
Frehel D
Belg Pat
LSPat 3
2 362 539A977)
Oil 411 A977)
etal /Heterocycles 20, 1731 A983)
658 987A965)
^02 661 A970)
S 4fr Pat 68 00 516A968)
Austin Л
US Pat 3
et al //Nature 212, 1273 A966)
274 209A966)
Rae\maekers 4 et al /J Med Chem 9, 545 A966)
Ger Pat
L S Pat 3
US Pat 3
Bnt Pat
Bnt Pat
Bnt Pat
Ger Pat
Ger Pat
US Pat 3
US Pat 4
US Pat 4
Ger Pat
US Pat 3
US Pat 3
Brit Pat
US Pat 2
Ger Pat
Ger Pat
LSPat 2
1 795 651A966)
679 725A972)
4^8 047 A969)
1 076 109A965)
1 131 799A966)
1 131 800A966)
2 233 481 A972)
2 264 911A9-72)
855 234A974)
070 363A978)
107 170A978)
2 034 081 A970)
079 297A963)
113 067A963)
824 345A959)
918 401 A959)
1 117 600A961)
^83 055A933)
849 494A958)
Указатель лекарственных препаратов
BICNU
CCNU
CS-500
DDAVP
0,Ь-гиосциамин
D-амфетамин
FUDR
ML-236 В
и-аминосалициловая
1-дофа
Аббокиназа
Абетол
Авентил
Авлон
Агиракс
Аглирал
Адалат
Адапин
Адомал
Адофиллин
Адрамицин
Адреналин
Адресон
Адриабластин
Адриацин
Адрокаин
Азантак
Азатиоприн
Азепамид
Азидотимидин
Азитромицин
Азлин
Азлоциллин
Азолид
Азотоиприт
Азтреонам
Азудоксат
Азумек
548
547
378
459
276
174
539
378
кислота 731
196
456
236
158
782
121
475
365
155
63
436
652
204
487
553
553
22
326
576
119
764
647
601
600
64
541
640
653
577
Аквамицетин
Акватаг
Аквахлораль
Акинетон
Аклопар
Акнидазил
Аколестот
Акрисуксин
Акромицин
Аксид
Аксорен
Актамер
Активаза
Актиномицин D
Актол
Акутус
Алговерин
Алепсин
Алинам
Алкеран
Аллерган
Аллергоспазмин
Алмефрин
Алмитрин
Алопрол
Алпразолам
Алревмат
Алфента
Альбендазол
Альбиотик
Альбутерол
Альбуцид
Альдактон
Альдомет
Альдостерон
Альтеплаза
Апьфатил
Альфентанил
669
392
99
199
810
741
375
785
651
328
120
811
457
551
69
40
64
189
122
543
312
438
214
177
217
115
73
53
801
666
215
700
402
415
495
456
623
51
-813-
Указатель лекарственных препаратов
Алюпент
Аман гадин
Амоамиа
Амбеноний
Амбтар
Амбпосин
Амбохюрин
Амебаквин
Амен
Аменореи
Аметицин
Амидопрокаин
Амикацин
\микин
Амиторид
Аминазин
нминдан
Аминоп\тетимид
А^ИНОЗИДИН
Аминокапроновая кислота
Амиодарон
Амипре< с
Амитал
Амитриптилин
Амкацид
Амобарбитат
Амо 1иаквин
Амоксан
Амоксапин
Лмоксикан
Амоксит
Амоксищшин
Ампиклокс
Ампицит
\мпиципин
Амринон
Амсакрин
Амсщит
Амфеб\ гамон
Амфепрамон
Амфипен
214
196
701
265
803
599
542
787
515
517
554
344
663
664
403
128
669
561
660
457
350
236
92
153
459
91
¦772
164
163
600
600
599
596
599
597
ЗЗ7
566
567
164
179
599
Амфогерицин В
Амфоцикпин
Анавар
Анагрегал
Анальгин
Анаприлин
Анатран
Ангидрон
Ангинал
Андразид
Андрокур
Андронат
Андрорал
Анестезин
Анестокаин
А низал
Анизиндион
Анизотропии
Анкобон
Анкотил
Ановлар
Анорекс
Ансеф
Антепар
Антибиоптал
Антиверт
Антигемофильный фактор
Ант и гест ил
Антизолон
Антимеран
Антиминт
Антисан
Антиспас
Антрипот
Антчран
Апатеф
Апаурин
Апацизин
Аписат
Апотекс
Апрессин
737
738
529
455
66
232
391
391
368
723
526
524
525
30
26
120
451
278
751
751
517
179
611
803
716
318
459
509
489
176
806
314
284
796
65
621
109
731
179
71
421
-814-
Указатель лекарственных препаратов
Апрннокс
Арабинозид
Арамин
Ара-С
Лрвинот
Арлеф
Арминол
Артевен
Артемизин
Артемизиним
Артеренол
Арумил
Арфонад
Асендин
Аспарагиназа
Аспирин
Астемизол
Астмалитан
Атабрин
Атаракс
Атеноло1
Атеросол
'Чтиван
Агмокаприн
Атраксин
Атрак\рий
Атровент
Атропизол
Атропин
Атроптот
Атрохин
А>реомицин
Афибрин
Африн
Ацеб>тол
Аценок\мароч
Ацетазотамид
Ацетаминофен
Ацетилсалициловая кисчота
Ацетитхолин
Ацегипцистеин
389
540
225
540
100
68
146
447
780
780
210
404
290
164
567
62
321
212
785
121
233
375
114
258
119
298
437
276
275
276
772
650
458
220
233
449
384
67
62
252
433
АцеЮ1ексамид
Лцетосал
Ацикловир
Байпен
Баклофен
Бактидан
Баносид
Баразан
Барбамил
Барбифенал
Барбосек
Бацидал
Бациллопирин
Бацитрацин
Бексин
Бел)стин
Бенадрил
Бендрофчуметиазид
Бензедрин
Бензилпенициллин
Бензодем
Бензокаин
Бензоната!
Бензтиазид
Бензтропин
Бенилин
Бентил
Бентон
Беродуал
Беромицин
Беротек
Бестрон
Бетабактит
Бетакорт
Беталок
Бетаметазон
Бетанехол
Бетацеф
Бефениум
Биаксин
Бигуанид
474
62
757
602
302
713
804
711
92
91
94
711
695
676
803
547
200
389
226
592
749
29
432
392
200
200
284
538
441
593
441
504
604
493
233
492
255
620
810
647
784
-815-
Указатель лекарственных препаратов
Ьигу мал
Бидоцеф
Биклин
Билтрицид
Биндан
Бинордин
Бинотал
Биомицин
Биотетрицин
Биофанал
Ьипериден
Бисгидроксику марин
Битин
Битнонол
Бифенабид
Бицик шн
Бленоксан
Блеомицин
Блеоцин
Бпокадрен
Блоке
Боноин
Бревинор
Брек
Бретилий
Бретин
Бриканил
Бринердин
Бристосеф
Бромбей
Бромкриптин
Бромфенирамин
Бромэргон
Бронкосол
Ьронхопутьмии
Бруфен
Бумекс
Бу метан ид
Бупивакаин
Бупренекс
Бупренорфин
784
613
664
805
451
507
599
650
651
739
199
448
811
811
377
651
552
551
552
235
49
318
517
49
352
213
213
244
610
317
194
316
197
212
778
71
398
397
27
59
5»
Бупропион
Буспар
Буспинен
Б\спинол
Буспирон
Бусульфан
Бу габарбитал
Бутазолидин
Бутамид
Бутизон
Бут ил каин
Бутоконазо i
Ваброцид
Вагимид
Вагинот
Вазкардин
Вазокард
Вазокор
Вазолат
Вазором
Вазоспан
Вазотек
Валамид
Вачамин
Валнорм
Валимбин
Валиум
Валмад
Вальдрен
Вальпин
Вальпроевая кислота
Ванкоцин
Варнерин
Варфарин
Везадол
Вектарион
Вектрин
Векуроний
Велбан
Вечлбутрин
Велосеф
164
120
120
120
119
546
92
64
474
92
23
743
716
791
718
358
242
358
358
529
367
426
100
100
98
244
109
100
312
278
187
671
449
449
137
178
6э5
297
555
164
612
-816-
Указатель лекарственных препаратов
Велтан
Вентотин
Венту ссин
Вепезид
Верапамип
Вермокс
Верошпирон
Вертот
Весприн
Ветрен
Вибрамицин
Вивактил
Вивидит
Видарабин
Визин
Викен
Викодин
Вимикон
Вимокс
Винбластин
Винкристин
Винокарм
Винстрол
Винтрон
Вира-А
Виразол
Вирегит
Вироптик
Вистарил
Вистосан
Витенсин
Бициллин
Волитал
Вопьмакс
Вольтарен
Вретилоп
By мои
Галазепам
Галазолин
Г алдо1
Галпамин
317
217
432
557
353
801
402
318
129
447
653
159
158
759
221
593
43
320
600
554
555
338
529
709
760
764
757
763
121
314
414
593
176
217
74
353
558
111
220
137
294
Галоперидол
Галопрогин
Галостерин
Галотан
Галотекс
Галотестин
Галцион
Гантонол
Гантрисин
Гарамицин
Гастридин
Гастрикс
Гастрисед
Гедулин
Геитрин
Гексадрол
Гексамидин
Гексоциклий
Гексэстрол
Гелмекс
Гемитон
Гемонил
Гемофил Т
Гемфиброзил
Гентамицин
Гентацилин
Геопен
Гепален
Гепарин
Германии
Героин
Герплекс
Гестрол
Гетр азан
Гигротон
Гидралазин
Гидреа
Гидре кс
Гидренокс
Гидродиурш
Гидрозит
136
748
529
7
748
529
97
694
694
663
327
285
285
451
242
492
185
282
507
806
219
91
459
375
662
663
603
447
445
796
40
761
507
804
396
421
564
392
390
389
389
-817-
Указатель лекарственных препаратов
Гидрокодон
Гидроксизин
Гидроксимицин
Гидроксимочевина
Гндроксипрогестерон
Гидроксихвдроквин
Гидроморфон
Гидрофл) ме гиазид
Гидрохлортиазид
Гиюрел
Гипатсл
Гиперстат
Гипертоланум
Гипнамил
Гипномидат
Гипнотал
Гипотиазид
Гисманат
Гисприл
Гистадин
Гистазо i
Гистаспан
Гистерон
Гистрит
Гчибенкпамид
Глибиниз
Глибурид
Гтикопирроаат
Гтипизид
Глчтетимид
I люкотрот
Голоксан
Гормонин
Гризеофч тьвин
Грипенин
Гриф\львин
Г\анабенз
Гчаначрел
Гуанетидин
1уанфацин
Гчморосот
43
120
660
564
514
772
41
390
388
246
421
427
392
92
13
90
389
322
323
321
322
316
524
323
476
477
476
280
476
100
417
545
506
741
603
742
414
246
245
414
266
Гуайфенезин
Дадалон
Дайан
Дактар
Дактиномицин
Далацин
Далмадорм
Далман
Дантрий
Дантролен
Дану лен
Даонит
Дапотум
Дапсон
Даранид
Дараприм
Дарбид
Дарвипен
Дарикон
Даунобластин
Дачнорубицин
Дегест
Дезипрамин
Дезирел
Дезоксикортикостерон
Декакорт
Де кардан
Декарис
Декломицин
Декортизил
Декортин
Дексалон
Дексамбутол
Дексаметазон
Дексамфетамин
Дексикам
Декстроам фетам и н
Декстрометорфан
Декстротироксин
Дексхчорфенирамин
Депагит
433
312
526
741
550
667
98
98
301
300
301
476
130
732
386
784
281
621
285
553
553
214
155
166
496
492
492
575
651
488
489
174
725
490
174
81
7 72
431
379
316
772
- 818 -
Указатель лекарственных препаратов
Де тадиол
Делаксин
Делсолон
Дельтам и н
Делэстроген
Демекарий
Демектоцик1ин
Демерол
Демсер
Депакин
Депотест
Депрениi
Депрессан
Дерм азол
Дермонистар
Дермопласт
Десмопрессин
Дег\ссин
Дециитин
Джосцин
Дзоксин
Диабиниз
Диазепам
Диазид
Диазоксид
Диакарб
Диаква
Диамбутол
Диамокс
Диаф}рон
Дибазин
Дибензилин
Дибент
Дигабен
Дигитоксин
Дигоксин
Дизопирамид
ДиЙОДОкВИН
Дийодтирозин
Диклекс
Дикчоксацилтин
505
304
494
176
505
265
651
46
247
187
524
198
421
742
741
30
459
43
651
277
174
474
106
403
392
385
389
725
190
718
240
238
284
476
334
335
344
787
468
597
596
Дикпофенак
Диклоцил
Дикодид
Дикорантит
Дикумарол
Дикумацил
Дик) мол
Дилантин
Дилаудид
Дилоксанид
Дилтиазем
Димедрол
Дименгидринат
Диметан
Димодан
Дипиридамол
Дипирон
Диссенте
Диета
Диетаклор
Дистильбен
Дитериам
Дитид
Дитилин
Дитирин
Дитицен
Дитропан
Диукардин
Диуло
Диупрес
Диурил
Диуритенс
Диурсан
Дифенгидрамин
Дифенилан
Дифенилпиралин
Дифенин
Дифеноксилат
Дифлу нисал
Дифлупил
Дихинол
73
597
43
345
448
449
448
183
41
787
362
312
312
317
345
368
66
49
72
623
509
392
392
300
468
565
285
390
393
244
388
390
404
200
347
323
183
49
63
267
787
-819-
Указатель лекарственных препаратов
Диморфенамид
Дициьломин
Диэтиткарбамазин
Диэтичпропнон
Диэтилоитьбестроч
Доб>тамин
Добутрекс
Догматил
Доксапрам
Доксаприл
Доксепин
Доксициклин
Доксор\биции
Долантин
Долобид
Долофин
Допар
Допегит
Допрам
Дориден
Дорип
Дос> тьфин
Дофамин
Доцидразин
Драмамин
Дрен)сил
Дролептан
Дроморан
Дронцит
Дроперидол
Дувоид
Д\ксит
Д\овент
Дурамист
Д>ранест
Дурасеф
Дурачин
Дчрракс
Закись азота
Заносар
Зантак
386
283
803
179
508
217
218
146
176
177
154
652
552
46
63
46
196
415
177
101
254
692
222
389
312
390
138
45
805
137
255
178
441
220
28
613
343
121
10
549
326
Заривиз
Зароксо шн
Зенидекс
Зетамицин
Зигомицин
Зидовудин
Зинацеф
Зигромакс
Зовиракс
Ибинол
Ибупрофен
Иб>фен
Идоксуридин
Идувиран
Изадрин
Изимпур
Изокарбоксазид
Изоксикам
Изониазид
Изопреналин
Изопропамид
Изопротеренол
Изоптин
Изоптокаприн
Изордил
Изосорбиддинитрат
Изофениаэфрин
Изофлуран
Изофлурофат
Изоциишн
Изоэтарин
ИкЛОЦИД
Ичозон
Имап
Имбарал
Имидалин
Имизин
Имипенем
Имипрамин
Имм> нол
Имоди\ м
625
393
174
665
660
763
615
647
759
234
69
71
760
761
212
536
161
81
722
212
281
211
353
258
358
358
225
8
267
593
272
810
646
145
79
239
152
637
152
809
49
-820-
Указатель лекарственных препаратов
Имплетот
Имуран
Инверзин
Индон
Индапамид
Индацид
Индерал
Индометацин
Инновар
Инокор
Интал
Интравал
Интромен
Интропин
Иомесан
Ионамин
Иохимбин
Ипецин
Иполипид
Ипратропий бромид
Ипрафен
Ипрокс
Исмелин
Итифур
Итроп
Ит^ран
Ифосфамид
Йодопобин
Йодоксин
Йодохинол
Кабикиназа
Каболит
Калан
Калтен
Кальмизан
Кальцидрин
Камаксин
Камколит
Камохин
Канамицин
Кандекс
22
577
288
451
396
11
232
75
138
338
438
14
391
222
810
179
243
790
376
436
437
142
245
718
437
717
544
468
787
786
456
147
^53
234
128
223
661
147
773
660
739
Канестен
Кантил
Капастат
Капотен
Капрацид
Капреомицин
Каприл
Капромицин
Капростерон
Каптоприл
Карбамазепин
Карбенцичлин
Карбимазол
Карбокаин
Карбоплатин
Карботироид
Карвакрон
Карвискен
Карден
Кардигин
Кардиоритмин
Кардиохин
Кариндапен
Карисома
Кариспродол
Кармицин
Карм>брис
Кармустин
Катапресан
Кате ну айн
Кванталан
Кварзан
Квенсил
Квестран
Келфизин
Кемадрин
Кенакорт
Кессар
Кетааар
Кеталгин
Кетам и н
747
279
730
425
458
729
425
730
515
423
188
603
470
27
549
470
391
235
366
335
344
343
603
304
303
661
548
548
219
660
374
280
772
3"?4
699
199
494
512
11
73
11
-821 -
Кетанест
Кетоконазо!
Кеюксиэстрин
Кеюпрофен
Кефаки
Кефанцот
Кефзол
Кефлин
Кефокс
кис юта
Кааритромииин
Классен
Клафоран
Кпемастин
Ктеоцин
Ктидиний
Клиндамицин
Клинимицин
Ктиноцин
Клоб\тот
Клозапин
Кломид
Кчомифен
Клоназепам
Клонидин
К юнопин
ит
Ктотиксен
К ютрпд
Клотримазот
Клофазимин
Клофетнн
Клофибрат
Коаксин
Когентин
Коцеин
Кодидоксал
Кодит
Кокаин
11
739
504
72
616
616
6i:
612
609
61S
604
646
536
625
312
667
279
666
667
655
725
141
596
511
510
189
218
189
511
134
388
746
733
219
374
609
200
39
653
40
23
-822-
Колестипоч
Колибар
Комбетин
Комбантрин
Конвулекс
Конкордин
Контратион
Конфидан
Концеппан
Коргард
Кордален
Кордарон
Корзид
Коримбин
Коринфар
Кортадрен
Кортансил
Кортизан
Кортизон
Кортиспорин
Кортитрон
Корто
Кортолон
Космоген
Кофламин
Коффекс
Крестомицин
Криобчин
Криптоциклин
Кристален
Кристодигин
Кромолин
Ксанакс
Ксантомицин
Ксилокаин
Ксичокарт
Ксилометаюгшн
Ксичонесл
Кумадин
Курантич
К\рарин
373
374
336
806
187
159
269
146
э17
234
335
3^2
234
244
365
487
488
487
485
380
497
487
489
551
458
432
660
459
596
593
335
437
116
650
26
346
220
29
449
368
295
К>рретаб
Лабе га. юл
Лазизикс
Лазикс
Ламин
Лампит
Лаг^вис
Ларгактщ
Лариам
Чародопа
Ларотид
Латамоксеф
Левам изол
Левартеренол
1еводопа
Леводроморан
Левоид
Левомицетин
1еворфанот
Левотироксин
1евофед
Тедеркорт
Ледермицин
Ле 1ертрексат
Лейкераи
Лейкомицин
Лейкос> льфан
Лейпротиэ
Лейрокристин
Леодрин
Лепаран
Лепонекс
Лепрофен
Лептофен
Лестид
Либричм
Лиданил
Лидокаин
Лидопен
615
515
235
399
399
318
795
537
336
128
780
196
600
635
574
210
194
45
466
669
43
464
210
494
651
535
542
669
546
563
555
390
447
142
51
138
373
112
132
25
346
Лизиван
Лизодрен
Лизочипин
Ликвамар
Ликвемин
Ликуден
Линил
Линкомиции
Линкоцин
Линтон
Лиоресаль
Лиотиронин
Липопилл
Лиситерол
Листенон
Лисговин
Литалир
Литизин
Лития карбонат
Лифрил
Лобелии
Ловалип
Ловастатин
Лозол
Локсапин
Локситан
Локсопак
Ломидин
ЛОМОТ11П
Ломупрен
Ломустин
Лонгоперидот
Лонитен
Лоперамид
Лопид
Лопрессор
Лоразепам
Лорелко
Лотримин
Лот\ссин
Лот\стат
201
562
379
450
447
742
179
665
666
137
303
466
179
375
300
744
564
147
146
538
259
378
377
396
140
140
140
794
50
438
547
145
427
48
376
233
из
377
747
433
93
-823-
Указатель лекарственных препаратов
Лоэстрин
ЛЮТИОМИТ
Пюмин&1
Люпрон
Люципен
Мадопар
Максайр
Максипим
Макстрекс
Малоген
Манадрин
Мандокеф
Манидон
Манинип
Маннито 1
Мантадан
Мао чат
Мапротилин
Марезин
Маркаин
Марку мар
Марплан
Марфанил
Матеникс
Мафенид
Мебендазот
Мебенот
Мебутар
Мевазин
Мевакор
Мевастатин
Мевинакор
Мегафен
Мегацитшн
Мегейс
Мегестат
Мегестрол
Медазепам
Медарон
Медроксипрогестерон
Медронметризон
517
160
90
563
596
196
442
636
535
524
223
616
353
4"'6
383
757
305
759
317
28
4зО
162
701
393
''ОО
800
474
801
288
378
377
378
128
593
Мб
S16
57 <>
117
718
575
490
Мезитинон
Мезтин
Мезлоциллин
Мезоридазин
Мезудин
Мекамиламин
Мекдастин
Меклизин
Меклофенамовая кислота
Мексат
Мексилетин
Мекситил
Мелипрамин
Мел каин
Меллерич
Мечфалан
Менопакс
Мепакрин
Мепензолат
Меперидин
Мепивакаин
Мепробамат
Мепрон
Мептин
Меразолил
Меридич
Меркапто пурин
Меро\гицин
Местинон
Метабарбитат
Метагидрин
Метадон
Метазоламид
Мегамизол натрия
Метамишш
Мешмпекс
Метамфетамин
Метаоксе 1рин
Me гапрел
Метапротерено i
Метарадин
263
602
601
131
701
288
313
317
68
535
346
347
152
22
131
542
509
785
279
46
26
119
119
442
469
Р5
535
646
264
91
391
45
385
65
652
174
Г4
214
214
213
25S
-824-
Указатель лекарственных препаратов
Метараминот
Метарбитал
Метахолин
Метациктин
Метеразин
Метилдопа
Метилпреднизоюн
Мети ттестостерон
Метилтио\рацил
Метилфенидат
Мегилфенобарбитад
Метилцефалин
Метилцяклотиазид
Метимазот
Метиндот
Метиоцш
Мегипред
Метиприлон
Метирозин
Мети цил чин
Метогекситал
Метокарбамол
Метокарин
Метокспфлуран
Метокурин
Метотазон
Метопропот
Меторин
Метотирин
Метотрексат
Метронидазол
Метронитрон
Метскопотамин
Метубин
Мефенамовая киспота
Мефенон
Мефюхин
Мефобарбитал
Мефокситин
Мехторэтамин
Миамбч гот
224
91
253
651
129
414
489
524
469
174
91
790
391
469
77
469
490
101
246
593
14
304
294
9
295
393
232
139
469
533
790
358
277
295
68
46
778
90
620
541
725
Миацин
Мигрил
Мидамор
Мидантан
Мидарин
Мидриал
Мидриафайр
Мидриацил
Мидрилат
Мидрин
Миелосан
Миканден
Миконазол
Микоспорин
Микоцид
Милепсин
Мичлигинон
Мипонтин
Милринон
Милта> н
Минидаб
Минизид
Минипресс
МиНОкСИДИЛ
Миноциклин
Миноцин
Минтезол
Миобид
Миостат
Миотонин
Миохол
Мискперон
Мите таз
Митоксан
Митоксантрон
Митомицин
Митостан
Митотан
Мицивин
Мицилан
Млаксикам
380
317
385
197
300
221
287
287
286
287
546
748
740
747
749
185
517
187
338
119
477
241
241
426
653
655
802
367
254
255
253
375
265
545
564
553
546
562
666
748
81
-825-
Указатель лекарственных препаратов
Мобадид 130
Мобан 139
Мовенс 69
Модамид 385
Модитен 130
Моду крин 235
Моксаднл 164
Моксалактам 632
Моксам 635
Моксацеф 635
Молиндон 139
Моноклат 459
Мономицин 660
Моноцид 617
Мопатил 415
Моронал 739
Морфин 36
Мотивал 130
Мотрин 71
Мтиоцил 469
Мукомист 433
Муркаин 469
Мусил 305
Мускарин 255
Мустин 541
Наван 135
Надолол 234
Наква 391
Налбуфин 56
Налидиксовая кислота 708
Наллпен 594
Налоксон 59
Налорфин 54
Натотрекс 60
Налтрексон 60
Налфон 72
Нандролон 527
Напамид 345
Наприлен 426
Напроксен 71
Напросин 71
Нарднл 161
Наркан 55
Нарол 120
Натамицин 749
Натексин 379
Натримин 796
Натулан 566
Натуретин 389
Нафазолин 219
Нафтизин 219
Нафтин 748
Нафтифин 747
Нафцил 594
Нафциллин 594
Небицин 662
Небупент 794
Невиграмон 709
Неграм 709
Нембутал 93
Неодикумарин 449
Неокседрин 214
Неолютин 515
Неомерказол 470
Неомицин 379
Неоплатин 549
Неорал 579
Неоспорин 380
Неостигмин 263
Нептазаи 386
Нердипин 366
Нескаин 23
Нетиллин 665
Нетилмицин 664
Нефлуан 26
Нефр'ил 390
Ниагестин 516
Ниазид 723
Ниацин 379
Нивахин 772
Нидантин 710
Низатидин 327
-826-
Указатель лекарственных препаратов
Низорал 740
Никардипин 365
Никлозамид 809
Никонацид 379
Никоприв 778
Никотин 258
Никотиновая кислота 378
Ниприд 422
Нипрутон 422
Н иридазол 802
Ниспорил 739
Нистатин 738
Нитринал 358
Нитроглицерин 357
Нитропентон 358
Нитропруссид натрия 422
Нитрофуразон 716
Нитрофурантоин 716
Нитрофурин 717
Нитрумон 548
Нифедипин 365
Нифекор 365
Нифлу.миковая кислота 69
Нифлурил 69
Нифуртимокс 794
Нобриум 119
Новамин 664
Новантрон 565
Новапен 597
Новаталидон 396
Новогидразид 389
Новодрин 212
Новокаин 22
Новокаи намид 344
Новометазон 492
Нозепам 113
Ноктар 102
Ноктек 99
Ноктран 115
Ноладол 63
Нолвадекс 512
Нолудан 102
Норадреналин 204
Норгестрел 577
Норглицин 475
Норизадрин 212
Норку рон 297
Норлест 517
Нормисон 96
Нормолин 376
Нороксин 466
Норпант 279
Норпас 345
Норпрамин 157
Нортрилен 158
Нортриптилин 757
Норфлоксацин 777
Норфор 517
Норэпинефрин 209
Норэтиндрон 575
Норэфедрин 224
Ностел 100
Нотезин 804
Нубаин 57
Нуморфан 42
Обзидан 232
Обрацин 662
Овестин 506
Овранет 507
Оврат 507
Огостал 730
Околин 710
Оксазепам 112
Оксандролон 529
Оксациллин 594
Оксибутинин 284
Оксикодон 42
Оксикон 43
Оксиметазолин 220
Оксимицин 650
Оксиморфон 41
Оксирен 305
-827-
Указатель лекарственных препаратов
Окситетрациклин 650
Оксифенци кл им ин 285
Оксолиновая кислота 709
Октади н 245
Онковин 555
Онкокарбид 564
Онсу кил 442
Оптикром 438
Оптоциллин 596
Опулетс 669
Орабет 474
Оравирон 525
Оралутон 517
Орам ид 474
Орап 143
Орацеф 612
Орбенин 596
Орбигастрил 285
Орбинамон 135
Ориметен 562
Орнид 353
Орсипреналин 214
Ортохл ор 669
Осмитрол 384
Осмосал 384
Осцин 277
Отривин 220
Офлоксацин 714
Павацен 367
Павулон 297
Паксипам 111
Палудрин 784
Памелор 158
Памин 278
Панацеф 623
Панварфин 449
Пангеприн 447
Панкуроний 296
Панорал 623
Панфутан 801
Папаверин 366
Папавин 367
Параальдегид 99
Парацетамол 67
Парадной 191
Паракорт 488
Параль 99
Паральдегид 99
Параметадион 7 97
Параплатин 550
Парафлекс 305
Паркемед 68
Паркин 201
Паркинсан 199
Паркопан 199
Парлодел 197
Пармодалин 162
Парнат 162
Паромом ицин 660
Парсидол 201
Певарил 742
Пеганон 184
Пеламин 314
Пемолин 175
Пенберин 599
Пентазоцин 55
Пентамидин 793
Пентилан 358
Пентобарбитал 93
Пентолайр 286
П е нто тал 14
Пентран 10
Пенфлуридол 145
Пепцид 327
Периактин 320
Перитин 174
Перкдан 43
Перкортен 497
Пермитил 130
Пернивит 379
Пертофран 157
Петиднн 46
-828-
Указатель лекарственных препаратов
Пилокарпин 257
Пилофрин 258
Пимарицин 750
Пимафутин 750
Пимозид 142
Пиндион ...451
Пиндолол ...234
Пиопен 603
Пиперазин 803
Пиперациллин 602
Пипольфен 319
Пипрацил 603
Пиприл 603
Пиразинамид 725
П ирантел 805
Пирбутерол 441
Пирибензамин 314
Пиридизин 723
Пиридостигмин 264
Пириламин 314
Пириметамин 705
Пироксикам 79
Плаквенил 772
Платибл астин 549
Платинекс 549
Платинол 549
Плацидил 100
Плюразол 695
Полагин 692
Поларамин 316
Полимиксин В 674
Полимиксин Е 674
Политиазид 390
Понстан 68
Понстел 68
Прагмарел 166
Празепам 109
Празиквантел 804
Празозин 240
Пралидоксим 269
Превенол 811
Прегнорал 517
Преднизолон 488
Преднизон 487
Прекорталон 489
Препар 215
Прессалол 236
Прецеф 617
Привин 219
Прилокаин 29
Примахин 781
Примидон 185
Прискол 239
Прискофен 239
Пробукол 376
Провера 515
Провохолин 254
Прогестасерт 514
Прогестерон 575
Прогестол 514
Прогинон 507
Проглицем 392
Прогуанид 784
Продоксол 710
Прозак 165
Прозерин 264
Прокадил 442
Прокаин ...21
Прокаинамид 343
Прокарбазин 565
Прокардиа .365
Прокатерол 442
Проладон 43
Пролутон 514
Промазин 127
Промедол 46
Прометазин 318
Промпар 128
Пронестил 344
Пронтамид 700
Пропазин 128
Пропаксен 71
-829-
Пропантел
Пропан гелин
Пропи птиочраци т
Пропицит
Пронранотсп
Простигмин
Протазин
Протактил
Прогеренол
Прслопам
Протостат
Протриптилин
Профчндол
Прохторперазин
Процимидин
Псичоперидот
Птерофен
П\ тьв\ тес
ГКринэтол
Пчролшин
Равонат
Раниди i
Раниплекс
Рант и №н
Распшон
Peaceк
Ребчiен
Ревтен
Ре, eian
Регенон
Регитин
Pe:v юн
Ретепгин
Резерпин
Резистомицин
Рсочин
Рента <,ион
Реи
Ре шни\ м
Ремстан
Рент
Указатель лекарственных
279
278
468
469
231
264
319
128
212
269
791
158
93
729
199
136
403
328
536
335
14
326
326
325
474
50
71
403
375
179
240
392
145
244
661
4з1
304
109
96
Ренитек
Ренитрол
Ренковид
Ресторит
Регабо 1ил
Ретасульфон
Ретестин
Ретровир
Ре> профен
Рибавирин
Рибомицин
Ривотрит
Римактазид
Римактан
Риназин
Риосит
Риталин
Ритмарон
Ритмиаен
Ритмодан
Ршодрин
Рифадин
Рифампицин
Рифапиам
Робаксил
Робамокс
Робамот
Робанталин
Робидекс
Робину1
Робитуссин
Ромизин
Роксен
РокСИКОДОН
Ромазал
Ромезин
Рондомицин
Ронти i
Роцефин
Р\бомицин
Pvvlaцид
426
384
691
96
528
699
505
764
73
764
663
189
673
673
219
390
175
352
345
345
214
673
677
67?
304
600
304
279
4^2
281
433
318
81
43
68
692
652
390
629
553
77
Р\фот
Салазопирин
Салазосу чьфапиридин
Сал> рон
Салутензин
Сальб\вент
Сальб\тамот
Санамирон
Сандиммчн
С анома
Санорин
Санотензин
Сарг^оциктин
Себизои
Седалант
Сед) ксен
Секобарбитал
С екотачшн
Секторль
С ектрат
Сек)ропен
Сепдан
С еаеги1ин
Семап
Серентит
Серомицин
Серофен
Серпасиi
Сефрит
Сеффин
Сибазон
Сив1ор
Сигинон
Симметрел
Синекван
Синемет
Синерган
Синергон
С инесалин
Си ном и
693
695
695
390
390
217
217
391
579
304
219
243
651
700
139
432
109
94
242
233
360
601
321
797
145
132
729
511
244
612
609
109
378
515
197
757
196
242
514
389
694
Синопен
Синтроид
Синтром
Снгострол
Сифивирал
Сколин
Скопотамин
Сотантил
Сопаскил
Сотгол
Солюсчрмин
Сома
Сонапакс
Софраин
Софрамицин
Спарин
С пектином и ци н
Спентан
CnnponoiakTOH
Спреор
Станозот
Стафциллин
Стацеф
Стелазин
Стензол
Стенокор
Стеринор
Сгибиоглюконат нафия
Стигмосан
Стильфострол
СтокСИТ
Стрептаза
Стрептан
Стрептозоцин
Стрептокиназа
Стрептокоi
Стрептомицин
Стромба
Строфантин
Строфопан
Счграцилтин
-830-
466
449
508
759
278
276
183
809
234
793
304
131
449
660
128
669
317
400
217
529
594
631
130
119
368
691
792
264
509
761
456
727
548
456
658
658
529
336
336
593
831 -
Указатель лекарственных npenaf
СЧкострин
Счкцини !\отин
Сулбактам
Сулиндак
С>лкозил
С\лконазол
С)льпирид
С>льфабензамид
С>льфадиазин
Сульфадимезин
Сульфадимидин
С>льфадоксин
С)льфазан
Сульфизсжсазот
Сульфазол
Сульфален
Су чьфамеразин
С) льфаметазин
Сульфаметизол
С\ тьфаметоксазоа
С\ тьфаметоксипиразин
Cv тьфамегоксипиридазин
С) льфаметопиразин
Сутьфапириддзин
Счльфапиридин
С)льфасалазин
Су чьфаиетамид
С>тьфацетин
Сульфидин
С>льфизомезол
Сульфинпиразон
Счльфолар
С> тьформетоксин
Слперкортен
С\прастин
С\проп
С>рамин
Сурмонтит
С>рпликс
С>фалекс
С\фента
299
604
78
1\Ъ
743
145
700
690
692
692
696
694
693
696
697
691
692
692
694
699
699
699
699
695
695
699
689
695
694
64
694
697
493
315
79
795
153
152
699
54
С^фентант
Тавегит
TdBop
Гагамет
Тазспам
Тазицеф
Тайленол
Галазол
Таламоиал
Тал б\ тал
Талвин
Галофен
Тамбокор
Тамоксифен
Тарасан
Таривид
Таснон
Тегапен
Тегретол
Телдрин
Телестрин
Темазепам
Гемарил
Темподекс
Тенипозид
Геннецетин
Тенормин
Тенсилон
1енсиоиорм
Генуат
Теофиллин
Теоцин
Тепанит
Теразол
Терамин
Терб> талин
Терконазот
Геркоспор
Терфенадин
Теспамин
Тессалон
53
313
114
325
113
631
67
696
138
92
60
128
348
511
134
715
803
596
188
316
504
96
319
174
557
750
234
264
389
179
434
436
179
745
179
212
44
745
320
546
432
-832-
Указатель лекарственных
препаратов
Тесторал
Тестостерон
Тетрагидрозотин
Тегразозин
Тетракаин
Тетракурий
Тетрамизол
Тетрамицин
Тетранитрат пентаэритрита
Тетрациклин
Тетроксин
Тиабендазол
Тиазидил
1 иамазол
Тиасептот
Тибистал
Тибон
Тизин
Тикар
Тикарциллин
Тиклид
Тикюзан
ТИЮ1ОПИДИН
Тилфосфамид
Тимакор
Тиметин
Тимидазол
Тимолид
Тимолол
Тимопед
Тимоптол
Тинадерм
Тинактин
Тинапорт
Тинатокс
Тинидазот
Тинимед
Тинисан
Гиог)анин
Тиомид
Тиопентал
524
522
221
241
23
298
575
650
357
650
467
802
391
469
695
725
467
147
604
604
455
455
454
546
235
604
469
235
235
749
235
749
749
792
749
797
792
792
536
728
13
Тиоридазин
Тиосульфил
Тиотепа
Тиотиксен
Тиофосил
Тирамин
Тиреостат
Тифокс
Тобрамицин
Токаинид
Толазамид
Толазолин
Толиназ
Толбутамид
То л б) тон
Толектин
Толмекс
Толметин
Толнафтат
Томоран
Тонокард
Тонофтал
Тописпорин
Торазин
1оремонил
Тосмилен
Тотаклокс
Тотапен
Тотоциллин
Тофранил
Травелин
Травенон
Травин
Традон
Традоциллин
Тразодон
Трал
Трамизот
Грандат
Транекс
Транексамовая кислота
131
693
545
134
546
227
469
620
661
346
475
238
475
4-73
474
78
78
77
748
166
346
749
380
128
772
266
596
599
596
152
312
379
120
176
593
765
282
809
236
4S9
458
-833-
Указатель лекарственных препаратов
Трани щипромин
Транквиракс
Транкопач
Транксен
Трансамин
Трапанал
Тредемин
Трекатип
Трексан
Трексил
Тресортил
Триази ч
Триазочам
Триаминик
Триамициночон
Триамтерен
Тригексифенидип
Гримексан
Тримеперитин
Тримеиразин
Триметадион
Триметафан
Триметин
Тримегоприм
Тримипрамин
Тримокс
Тринитрин
Тринитро!тицерин
Тринитрот
Трипатар
Трипе 1енна\шн
Триперидоп
Триполон
Триптизот
Трипти1
Триседи 1
Трифл\перидот
1 рифл\ промазин
Трифтчриаин
Трнфтзин
Tpnvnopweiиазид
162
119
122
115
162
14
810
728
60
321
304
391
95
314
493
402
198
449
47
319
190
288
191
702
152
600
357
357
357
28"?
313
136
316
154
159
136
135
128
762
130
391
Трихопот
IрОКСИДОН
Тромбин
Громбосгат
Тромпресантин
Тропикамид
Тропикацит
Тубазид
Т> барин
Т>бермин
Тубероид
Тубетол
Т>бокурарин
Туттомицин
Увилон
Углрот
Учьтандрен
Упьтрацеф
Ундециленовая кислота
Ундетин
Унидон
Уралгин
Урегит
Урехогшн
Уридон
Урограм
Урозид
Урокииаза
Уролонг
Уронорм
Уросемид
Уросот
Утерамин
Утимокс
\тициллин
Утопар
Фазигин
Фаликард
Фамотидин
Фамодил
Фанасит
791
191
459
460
368
286
287
723
295
728
728
725
294
660
803
459
529
613
749
749
451
709
399
255
396
709
389
456
111
710
693
221
600
593
215
739
353
326
327
697
-834-
Указатель лекарственных препаратов
Фансидар
Фармитрексат
Фармицетин
Фармотал
Фас rv м
Фечден
Фетисон
Фемстат
Фенамин
Фенелзин
Фенемал
Фениндион
Фенилб\тазон
Фенилин
Фенилпропаноламин
Фенилэфрин
Фенитоин
Фенклофенак
Фенобарбитал
Феноботин
Феноксазот
Феноксибензамин
Феноксиметилпенициллин
Феноспен
Фенотерот
Фенпрокчмон
Фенопрофен
Фенс\ксимид
Фентанест
Фентанит
Фентермин
Фентоламин
Фенурин
Фенэрган
Фестамоксин
Физептон
Физостигмин
Филопон
Финоптин
Фтавохин
Ф тип
697
535
660
14
73
81
98
744
226
161
90
450
64
451
223
214
347
74
89
528
176
237
593
593
440
449
71
186
51
50
178
239
717
319
635
46
262
174
353
773
791
Фпакседил
Фламазин
Флекаинид
Флексерил
Флексипирин
Флексокчтан
Фленак
Фтобацин
Фтоксикам
Флоксуридин
Флоринеф
Флороприл
Флумарк
Фл\нир
Флуоксетин
Флу оксиместерон
Флуспирипен ,
Фл\ гам ид
Фл>фенамовая кистота
ФЛ) ЦИТОЗИН
Флуанизон
Ф1\ДИКС
Флудрокортизо н
Флумуцетин
Флуоробластин
Флуостигмин
Флуразепам
Фл\феназин
Фо1екс
Ф01ЛИк>ЛИН
Форан
Форбаксин
Форенол
Форм\ леке
Фортрал
Фортум
Фосфопин йодид
Франил
Фру мил
Фталазол
Фталилсульфатиазот
296
691
348
303
122
68
74
715
81
538
498
267
713
69
164
528
144
526
67
750
138
538
497
433
538
267
97
130
535
504
9
304
69
284
56
631
268
399
404
696
696
-835-
Указатель лекарственных препар
атов
Фторотан
Фторурацил
Фторфеназин
Фугерел
Ф>лграм
Футтрексин
Фучьцнн
Фунгизон
Фунгилин
Фурадонин
Фуразолидон
Фурамид
Фурацигпин
Ф\рацин
Фуроксан
Фуросемид
Хинакрин
Хинасед
Хингамин
Хингош>
Хинидекс
Хинидин
Хинин
Хиннам
Хчорадорм
Хпоразепат
Хлоральгидраг
Хлорамбу цил
Хпорамфеникол
Хлоратол
Хлорб\тин
Хторгуанид
Хюрдиазепом-ид
Хюрзид
Хлорзоксазон
Хлормезанон
Хчормицетин
Хтороквин
Хлороназ
Хлорпирамии
Хлорпрокаин
8
538
130
526
711
694
742
738
738
717
717
788
716
716
718
399
785
94
772
~80
343
342
773
778
99
114
99
541
667
99
542
783
111
389
305
121
669
768
474
314
22
Хлорпромазин
Хлорпропамид
Хлорпрогиксен
Хлорталидон
Хлортетрацимин
Хюртиазид
Хтортриметон
Хчортрипеленамин
Хлорфенезин
Хлорфенирамин
Хторэтазид
Хлорэтамин
Холестабит
Холес гид
Холестирамин
Холоксин
Цедиксен
Цедоксин
Цезоч
Цеклор
Цечбенип
Целестон
Цешракс
Цепан
Цепим
Цепимекс
Цепорексин
Церебид
Церубидин
Цетазот
Цетамид
Цетосал
Цефадил
Цефацрил
Цефадроксил
Цефазал
Цефазочин
Цефазон
Цефамор
Цефалексин
Цефалотин
128
474
132
394
649
388
316
315
305
315
541
541
373
373
3~>3
379
637
336
805
623
S94
493
111
621
636
636
612
367
553
385
700
62
610
613
613
612
610
632
621
611
608
-836-
Указатель лекарственных
препаратов
Цефамандол
Цефапирин
Цефарин
Цефатрексил
Цефацидал
Цефепим
Цефобид
Цефобис
Цефоксинот
Цефокситин
Цефоницид
Цефоперазон
Цефоранид
Цефотаксим
Цефотен
Цефотетан
Цефпиром
Цефрадин
Цефро
Цефрон
Цефтазидим
Цефтизоксим
Цефтикс
Цефтим
Цефтин
Цефтриаксон
Цефуроксим
Циклам ид
Циклизин
Цикюбензаприн
Циклова^льдин
Цикловиран
Циклогест
Циклодол
ЦикЛОЖИЛ
Циктокапрон
Циклометикаин
Цимомидрил
ЦикТОМИциН
Циклопар
Циклопенточат
616
609
610
610
611
635
632
632
620
618
616
631
617
623
621
620
636
612
612
637
629
625
627
631
615
627
614
475
317
303
729
759
514
199
286
459
30
286
729
651
286
-837-
Циклосерин
Циклоспорин А
Цик юсгин
Циклотериам
Циклотиазид
Циклофосфам ид
Циклофосфан
Цикпоэстрол
Циластатин
Цилерт
Циметидин
Цинамет
Цинобактин
Циноьсацин
Циномел
Цинопенит
Ципрогептадин
Ципроквин
Ципролег
Ципропан
Ципросан
Ципростат
Ципротерон
Ципрофлоксацин
Ципроцинол
Цирпон
Цисплатин
Цистофуран
Цитадрен
Цитанест
Цитарабин
Цитозин
Цитоксан
Цитосульфан
Эбутол
Эверон
Эглонил
Эдекрин
Эдрофоннй
Эзерин
Экванил
729
578
544
391
391
543
544
508
638
176
324
325
710
710
467
594
320
712
712
712
712
526
525
712
712
119
549
111
562
29
539
540
544
546
725
524
146
399
264
263
119
Указатель лекарственных препаратов
Экзал
Экзсперит
Эконазоп
Экостатин
Экотиофат
Эксе тдерм
Эксирет
Эчдеприл
Элдопан
Этентм
Э 7спар
Этгроясин
Эльдальдегид
Эматексат
Эмедил
Эмегин
Эмпецид
Эналаприт
Эндиэмалчм
Эндоксан
Эндомиксии
Энд\рон
Этико 1
Энкаид
Энкаинид
Эноксацин
Энгерозол
Энп,рен
Энфенемал
Энфт\ран
Эпинефрин
Эпиподофил ютоксин
Эпосерин
Элси 1а\шн
Эргамизол
Эртметрин
Эргоновин
Эрготамин
Эрготрен
Эрпнит
Эритромицин
555
748
742
742
267
743
442
198
198
112
567
466
99
535
312
788
747
425
91
544
380
391
379
349
348
712
696
65
91
8
208
558
627
458
809
243
243
242
243
358
644
Эритропед
Эсанбутол
Эсидрикс
Эскалит
Эсмалорид
Эсмарин
Эстравал
Эстрадиол
Эстраду рин
Эстриол
Эстрон
Эстулик
Этакриновая кислота
Этамб>тот
Этидокаин
Этилбискумацетат
Эгилдик>марол
Этимид
Этинамат
Этинитасградиол
Этионамид
Этистерон
Этомидат
Этопозид
Этопропазин
Этотоин
Этран
Этхлорвинол
Эуболин
Эудемин
Эулекин
Эутаген
Эуфиллин
Эфедрин
Эфедрот
Эфтапан
Эфторон
Эффлчдерм
Эходид
Эцифин
Юнипен
646
725
389
147
391
391
505
504
27
506
502
414
398
723
28
448
449
728
100
506
727
517
12
556
200
183
8
100
528
392
526
43
436
222
223
653
279
538
268
223
594
-838-
Содержание
От автора 3
Список сокращений 5
Глава 1 Общие анестетики 6
1 1 Ингаляционные анестетики 6
1 2 Неингаляционные анестетики 10
Глава 2 Местные анестетики 17
2 1 Местные анестетики ряда аминоэфиров 21
2 2 Местные анестетики ряда аминоамидов 25
2 3 Поверхностные анестетики 29
Гтава 3 Анальгетики 32
3 1 Опиоидные анальгетики 33
3 2 Нестероидные противовоспалительные средства,
ичи жаропонижающие анальгетики 61
Глава 4 Снотворные средства (гипнотики и седативные
препараты) 86
4 1 Барбитураты 87
4 2 Бензодиазепины 94
4 3 Прочие гипнотики и седативные препараты 98
Глава 5 Анксиолитики (транквилизаторы) 104
5 1 Бензодиазепины 105
5 2 Анксиолитики небензодиазепиновой структуры 119
Глава 6 Антипсихотики (нейролептики) 124
6 1 Производные фенотиазинов 126
6 2 Производные тиоксантенов 132
6 3 Производные бутирофеноиов 135
6 4 Производные дигидроиндолонов 139
6 5 Производные дибеюоксазепинов и дибензо-
диазепинов 140
6 6 Производные дифенилбутилпиперидинов 142
6 7 Прочие нейролептики 145
Глава 7 Антидепрессанты 149
7 1 Трицикшиеские антидепрессанты 151
7 2 Ингибиторы МАО 160
7 3 Антидепрессанты второго покотения (атипичные
антидепрессанты) 163
7 4 Амфетамины и другие стимуляторы ЦНС 166
-839-
Глава 8. Стимуляторы ЦНС
Г) 1 *—¦
Содержания
S.1
8.2.
169
Психомоторные стимуляторы
8.1.1. Метилксантины
8.1.2. Амфетамины, а также метилфенидат
и пемолин
Стимуляторы дыхании в»" ——¦—
70
170
171
яторы дыхания, или зналептики 176
3-г.. ¦ 178
8.3. Препараты, подавляющие аппетит (аноректики)
Глава 9. Противоэпилептические средства 181
9.1. Производные гидантоинов 182
9.2. Барбитураты 184
9.3. Сукцинимиды 186
9.4. Вальпроевая кислота 187
9.5. Карбамазелин 188
9.6. Бензодиазепины 188
9.7. Ацетазоламид 190
9.8. Оксазолидины 190
Глава 10. Средства, применяемые при паркинсонизме
10.1. Средства, влияющие на дофаминергические
системы мозга
10.2. Ангихолинергические препараты (центральные
холиноблокаторы)
Глава 11. Адренергические (еимпатомиметические)
препараты 203
11.1. Агонисты прямого действия 207
11.2. Агонисты непрямого действия '•""
11.3. Агонпгтм ™«^" -
193
194
198
рямого д
Агонисты смешанного
действия
221
221
Глава 12. Адреноблокирующие препараты 22S
12.1. Р-адреноблокаторы
12.7 «-см *
-а
дреноблокаторы,
229
„Уш 236
12.3. Блокаторы адренергических нейронов 244
Глава 13. Холиномимегики 250
13.1. Холиномиметики прямого действия
13.2. Холиномиметики непрямого действия
Глава 14. Антихолинергические препараты
14.1. Антим)'скаоиновмр ™»™
251
260
._ 272
.; скариновые препараты , ""'""
14.2. Ганглиоблокирующие вещества
272
287
Глава 15. Мышечные релаксанты 292
15.1. Блокаторы нервно-мышечной передачи 293
-840-
Содержание
15.2. Мышечные релаксанты прямого действия 300
15.3. Мышечные релаксанты центрального действия 301
Глава 16. Антиг истаминные препараты 307
16.1. Н.-антигистаминные препараты 310
16.2. Антагонисты Нг-рецепторов 323
Глава 17. Кардиотонические препараты 331
17.1. Сердечные гликозиды 332
17.2. Другие положительные инотропные препараты 336
Глава 18. Антиаритмические препараты 340
Глава 19. Антиангинальные препараты 355
19,1. Нитраты и нитриты 356
19.2. Препараты ряда Р-адреноблокаторов 358
19.3. Блокаторы кальциевых каналов 361
19.4. Прочие препараты 366
Глава 20. Гиполипидемические средства 370
20.1. Препараты, удаляющие желчные кислоты 372
20.2. Препараты, ингибирующие синтез холестерина 374
20.3. Прочие препараты 379
Глава 21. Диуретики 382
21.1. Осмотические диуретики 383
21.2. Диуретики, подавляющие активность
карбонангидразы 384
21.3 Тиазидные диуретики >. 386
21.4. Петельные диуретики 396
21.5, Калийсберегающие диуретики. 399
Глава 22. Антигипертензивные препараты 407
22.1. Диуретики 409
22.2. Р-адреноблокаторы 411
22.3. Центрально действующие адренергические препараты
(симпатолитики) ». 413
22.4. Периферически действующие симпатолтики
(ос-адреноблокаторы) 415
22.5. Блокаторы кальциевых каналов 419
22.6. Миотропные гипотензивные препараты 420
22.7. Ингибиторы АПФ 422
22.8. Активаторы калиевых каналов 426
Глава 23. Препараты для лечения заболеваний дыхательной
системы 429
-841 -
Содержание
23 1 Противоотечные сосудосуживающие препараты 430
23 2 Противокашлевые препараты и отхаркивающие
среде гва 430
23 3 Бронходилататоры (бронхолитики) 433
Глава 24 Антикоаг>лянгы, антиагреганты, тромбочитики
гемостатики 444
24 1 Антикоаг> чянты 445
24 2 Антиагреганты 451
24 3 Фибриночитики (тромболитики) 455
24 4 Гемостатики (прокоагулянты) 457
Глава 25 Тиреоидные гормоны и антитиреоидные препараты 463
25 1 Препараты для лечения гипотиреоидизма 464
25 2 Препараты для лечения гипертиреоидизма 467
Г чава 26 Инс> тин и синтетические гипогликемические
средства 471
26 1 Инс>1ин 471
26 2 Синтетические гипогчикемические препараты 473
Гчава 27 Кор гикостероиды 479
27^f Гчюкокортикоиды 480
27 2 Минералокортикоиды 494
Глава 28 Женские половые гормоны 500
28 1 Эстрогены 501
28 1 Антизстрогены ^09
28^ Про1естины 512
Глава 29 Мужские почовые гормоны и анабочические
стероиды 521
29 1 Андрогены 522
29 2 <\нта1 онисгы андрогенов 525
29 3 Анаболики 527
Г тава 30 Антинеопчастики 531
30 1 Антнметабочиты 532
30 1 1 Антагонисты фолиевой кисчоты 532
30 1 2 Производные пурина 535
30 1 3 Производные пиримидина ^37
30 2 Аткитир>ющие а!енты 540
30 2 1 Азотсодержащие горчичные производные 541
30 2 2 Производные этиченимина ^45
30 2 3 Ачкилс\льфеначы э46
-842-
Содержание
30 2 4 Нитрозомочевины 546
30 2 5 Производные платины 549
30 3 Антибиотики 5э0
30 4 Соединения выделенные из растений 554
30 5 Гормональные препараты 558
30 6 Прочие антинеопчастические препараты S63
Глава 31 Имм\ нофармакологические препараты 572
31 1 Иммуностим\ чяторы 573
312 Иммунодепрессанты 576
Г лава 32 Антибиотики , 581
32 1 C-лактамные антибиотики 585
32 1 1 Пеницилчины 589
32 1 2 Цефалоспорины 605
32 1 3 Пенемы и карбапенемы 637
32 1 4 Монобактамы 640
32 2 Макролидные антибиотики 643
32 3 Тетрацикчины 648
32 4 Аминопикозиды 655
32 5 Линкозамиды 665
32 6 Хчорамфеникол 667
32 7 Прочие антибиотики 669
Гчава 33 Антимикробные препараты 686
33 1 Сульфонамидные препараты и гриметоприм 686
33 2 Хиночоны 706
33 3 Нигрофчраны 715
Глава 34 Антимикобактериальные препараты 721
34 1 Антигуберкучезные препараты 721
34 2 Препараты для течения чепроза 731
Г ыва Зэ Противогрибковые препараты 736
Зэ 1 Противогрибковые препараты для лечения системных
и поверхностных инфекций 737
3i 2 Противогрибковые препараты для чечения поверхност-
поверхностных инфекций 741
35 3 Противогрибковые препараты дчя чечения системных
инфекций 750
Гчава 36 Противовирусные препараты 754
Гтава 3"" Препарачы дчя чечения протозойных инфекций 766
" 1 Антимгыярийные препараты 766
-843-
Содержание
37.1.1. Препараты, эффективные противэритроцитар-
ной стадии заражения плазмодиями 768
37.1.2. Препараты, эффективные против гепатическей
(экзоэритроцитарнои) стадии заражения плазмо-
плазмодиями 781
37.1.3. Препараты эффективные против гепатическои
и эритроцитарной форм заражения плазмоди-
плазмодиями 782
37.1.4. Прочие антималярийные препараты 785
37.2. Препараты для лечения амебиаза 786
37.3. Препараты для лечения лейшманиоза 792
37.4. Препараты для лечения трипаносомоза 793
37.5. Препараты для лечения других протозойных
инфекций 796
Глава 38. Антигельминтные препараты 799
Указатель лекарственных препаратов 813
Р.С. Вартанян
Синтез основных
лекарственных средств
Руководитель научно-информационного отдела,
кандидат мед. наук А.С. Макарян
Главный редактор, канд. мед. наук Д.Д. Проценко
Зам. главного редактора С.А. Зайцева
Ответственный за выпуск ЕД. Броун
Компьютерная верстка Е.Б. Родина
Дизайн обложки С. С. Филиппов
Изд. лиц. №064889 от 24.12.96. Подписано в печать 15.01.2004.
Формат 60x90/16. Бумага офсетная. Гарнитура «Times New Roman»
Объем 53 печ. л. Тираж 1000 экз.
ООО «Медицинское информационное агентство».
119048, Москва, М. Трубецкая ул., д. 8
(ММА им. И.М. Сеченова).
Тел./факс 245-86-20, 242-91-10
E-mail: miapubl@mail.ru http://www.medagency.ro
Интернет-магазин: www.medkniga.ru
ISEN 5-89481-2I8-6
7958941812181