Автор: Габриелян О.С.
Теги: воспитание обучение образование химия методика преподавания учебных предметов в общеобразовательной школе учебное пособие
ISBN: 5—7107—2146—8
Год: 1998
Текст
О. С. Габриелян
химия
Методическое
пособие
классы
Москва
Издательский дом «Дрофа»
1998
УДК 372.8:54
ББК 74.262.4
Г12
Габриелян О. С.
Г12 Химия. 8—9 классы: Методическое пособие. —
М.: Дрофа, 1998. — 128 с.
ISBN 5—7107—2146—8
Методическое пособие адресовано учителям, работающим
по новым учебникам «Химия—8» и «Химия—9», созданным
заслуженным учителем РФ О. С. Габриеляном. Оба учебника
одобрены Федеральным экспертным советом и включены в
перечень учебников, рекомендованных Министерством обще-
го и профессионального образования РФ.
Пособие содержит примерное тематическое планирование
программного материала 8 и 9 классов и методические реко-
мендации к новым и наиболее трудным темам курса.
УДК 372.8:54
. ББК 74.262.4
ISBN 5—7107—2146—8
© «Дрофа», 1998
© О. С. Габриелян, 1998
Предисловие
Предлагаемый курс построен на основе концентри-
ческой концепции химического образования для ос-
новной школы и завершается в 9 классе темой «Орга-
ническая химия». Важнейшей его особенностью яв-
ляется стремление автора сохранить высокий теоре-
тический уровень, присущий русской средней школе
и признанный во всем мире, и соответствие тенден-
ции перехода общеобразовательной школы к основно-
му 9-летнему образованию. Это достигается путем вы-
членения укрупненной дидактической единицы, в ро-
ли которой выступает основополагающее понятие
«химический элемент и формы его существования
(свободные атомы, простые и сложные вещества)»,
следование строгой логике принципа развивающего
обучения, положенного в основу построения курса, и
освобождение его от избытка конкретного материала.
Другой особенностью курса является то, что весь
теоретический материал рассматривается на первом
году обучения, что позволяет учащимся более осо-
знанно изучать фактический материал — химию эле-
ментов и их соединений. Наряду с этим такое построе-
ние курса дает возможность развивать полученные
первоначально теоретические сведения на богатом
фактическом материале химии элементов.
Программа составлена с учетом реализации меж-
предметных связей с курсом физики 7 класса, где
изучаются основные сведения о строении атомов, и
3
биологии 9 класса, где ученики знакомятся с химиче-
ской организацией клетки и процессами обмена ве-
ществ.
Ведущими идеями предлагаемого курса являются:
— материальное единство веществ природы, их ге-
нетическая связь;
— причинно-следственные связи между составом,
строением, свойствами и применением веществ;
— познаваемость закономерностей протекания хи-
мических реакций;
— объясняющая и прогнозирующая роль теорети-
ческих знаний для фактологического материала хи-
мии элементов;
— представление о химическом соединении как
о звене в непрерывной цепи превращений веществ, об
участии веществ в круговороте химических элемен-
тов и в химической эволюции;
— объективность и познаваемость — основа разра-
ботки принципов управления химическими превра-
щениями веществ, экологически безопасных спосо-
бов их производства и мероприятий по охране окру-
жающей среды от загрязнения;
— взаимосвязанность науки и практики: практи-
ка — движущая сила развития науки, а успехи прак-
тики — результаты развития науки;
— гуманистический характер химической науки и
химизации народного хозяйства, их направленность
на решение глобальных проблем современности.
Основное содержание курса химии 8 класса состав-
ляют сведения о химическом элементе и формах его
существования — атомах, изотопах, ионах, простых
веществах и их важнейших соединениях, о строении
вещества (типы химических связей и виды кристал-
лических решеток), закономерностях протекания ре-
акций и их классификации.
Основное содержание курса химии 9 класса сво-
дится к изучению отдельных, наиболее практически
ценных веществ. Курс заканчивается знакомством с
органическими соединениями, в основе отбора кото-
рых лежит идея генетического развития органиче-
4
ских веществ от углеводородов до биополимеров (бел-
ков и углеводов).
Введенный в курс химический эксперимент пре-
следует цель сформировать у учащихся практические
навыки в проведении основных химических опера-
ций, приобщить их к самостоятельной химической
работе, обучить безопасному и экологически грамот-
ному обращению с веществами в быту и на производ-
стве.
Практические работы сгруппированы в блоки —
химические практикумы, которые служат не только
средством закрепления знаний, но также способом
контроля за качеством их сформированности. По сво-
ему усмотрению, а также исходя из возможностей
школьного кабинета химии, учитель может изменить
структуру представленного в программе практикума,
например, увеличить число лабораторных работ за
счет сокращения демонстрационных опытов, что ре-
комендуется при небольшой наполняемости классов.
Данное пособие содержит также методические ре-
комендации к проведению уроков по наиболее слож-
ным разделам курса — «Расчеты по химическим фор-
мулам и уравнениям», по отдельным работам в соот-
ветствии с новыми приемами в методике преподава-
ния химии и выполнения школьного химического
эксперимента (группирование практических работ в
практикумы, в том числе и по методике отдельных
нетрадиционных работ) и по новой для основной шко-
лы теме «Органическая химия».
Важнейшей особенностью курса является выделе-
ние специального времени (14—15 часов) на реализа-
цию регионального компонента в обучении химии,
которая осуществляется через модули определенного
содержания. В пособии предлагаются программы мо-
дулей «Химия и экология» и «Химия в сельском хо-
зяйстве» (рекомендуется для сельских школ), но в ка-
ждой конкретной школе учитель может использовать
и свой собственный модуль, наиболее характерно от-
ражающий региональный компонент. В качестве до-
полнительного средства его реализации могут быть и
5
предусмотрены экскурсии на местные производства и
учреждения, связанные с химией.
Распределение времени по темам является ориен-
тировочным, и учитель может изменять его по своему
усмотрению.
Тема-модуль «Химия и экология» разработана до-1
центом Калужского педагогического института ।
Н. И. Савиткиным и зав. кабинетом химии Калуж-
ского областного института усовершенствования учи-
телей Т. К. Толкачевой, которые приняли деятельное
участие в работе над первым изданием учебника «Хи-
мия-8», за что им низкий поклон и глубокая благо-
дарность.
Аналогичные чувства автор испытывает к учите-
лям г. Калуги и области зд бескорыстную и действен-
ную многолетнюю проверку всего курса и ценные за-
мечания по его улучшению.
Искреннюю признательность и благодарность ав-
тор выражает также методистам Г. В. Бронзовой
(г. Зеленоград), В. Н. Перемановой и Г. Г. Лысовой
(г. Москва), С. Ф. Шеверевой (г. Смоленск), Л. И. Ла-
гуновой (г. Тверь) и всем учителям, принявшим ак-
тивное участие в апробации и совершенствовании
данного курса.
Примерное
тематическое планирование
уроков химии в 8 классе
Как было указано в предисловии, предлагаемый
курс химии построен, исходя из укрупненной дидак-
тической единицы— «химический элемент», кото-
рый может существовать в виде атомов, образовывать
простые вещества и входить в состав сложных. Поэто-
му за введением в курс химии (первые шесть уроков)
следуют три темы, которые дают сведения о внутрен-
нем строении и составе химических веществ: «Атомы
химических элементов», «Простые вещества», «Со-
единения химических элементов». Логическим за-
вершением изучения строения и состава веществ яв-
ляется четвертая тема «Изменения, происходящие с
веществами». Первая часть курса химии 8 класса за-
вершается практикумом, цель которого — привить
учащимся навыки работы в химическом кабинете
(лаборатории).
Вторая часть курса химии 8 класса представляет
собой развитие и углубление представлений о хими-
ческих взаимодействиях. Чтобы охарактеризовать
химическую реакцию, важно знать ее закономерно-
сти, и об этом следующая тема — «Скорость химиче-
ских реакций. Химическое равновесие». Большинст-
во химических реакций происходит в растворах, и по-
этому курс химии 8 класса заканчивается темой
«Растворение. Растворы. Свойства растворов электро-
литов».
7
В последующем, втором практикуме учащимся
предлагается самостоятельно выполнить серию опы-
тов, демонстрирующих типичные реакции для основ-
ных классов неорганических веществ.
В заключение курса 8 класса дается классифика-
ция химических реакций по различным признакам и
изучаются окислительно-восстановительные процес-
сы.
Данная программа освобождена от избытка кон-
кретного материала, так как в основу ее положен раз-
вивающий принцип.
Для усиления идей гуманизации и гуманитариза-
ции в завершение курса предусматривается тема
«Шеренга великих химиков», в которой повторение
основного материала химии 8 класса (важнейшие по-
нятия, законы и теории) проводится через знакомство
с жизнью и деятельностью выдающихся ученых-
химиков.
Разумеется, предлагаемое тематическое планиро-
вание уроков химии является ориентировочным и на
его основе учитель может разработать свой вариант,
наиболее отвечающий особенностям конкретного
класса и методического предпочтения учителя.
Планирование курса химии 8 класса составлено из
расчета 3 часов занятий в неделю (всего 102 часа, из
них 11 часов — резервное время).
Задание на дом (параграф и упраж- нения по 1 учебнику) Введение. Предмет химии (6 часов) §1, упр. 3, 4, 5 §2, упр. 1—5
Экспериментальная часть (демонстрация химических продуктов, демонстрацион- ные опыты, решение задач) Коллекции предметов — физических тел и изделий из простых и сложных веществ (алюминия и стекла) i Взаимодействие соляной А хм v шрашириш, HU.’iyi- нение «известковой воды»
Изучаемые вопросы СО Что изучает химия. Про- стые и сложные вещества. Свойства веществ. Химический элемент. Формы существова- ния химического элемента Химические явления (реак- ции), отличие их от физических явлений. Достижения химии и их правильное использование. Экологические проблемы химии
Тема урока СО Предмет химии. Вещества Превращения ве- щсигд. хи«нх> лшпин пгх- ШеЙ жизни
№ т-Н 1-М СО
9
Продолжение
1 2 3 4 5
3 Краткие сведения по истории развития химии. Основоположники отече- ственной химии Возникновение и развитие химии. Роль отечественных ученых в становлении химиче- ской науки. Основные законы химии §3, упр. 1, 5
4 Периодическая систе- ма химических элементов Д. И. Менделеева Структура периодической системы (таблицы): периоды и группы. Периодическая табли- ца как справочное пособие о свойствах химических элемен- тов §4 (с. 14—15, упр. 1—4)
5 Знаки химических эле- ментов Обозначения химических элементов, их названия, проис- хождение названий §4 (до кон- ца)
6 Химические форму- лы. Относительные атом- ная и молекулярная мас- сы Химическая формула, за- пись и чтение формул. Индексы и коэффициенты. Масса атомов и молекул. От- носительная атомная масса. От- носительная молекулярная масса §5, упр. 1—5
Тема 1. Атомы химических элементов (10 часов)
1 Основные сведения о строении атомов Доказательства сложного строения атомов. Опыты Резер- форда. Планетарная модель атома. Состав атомных ядер: протоны, нейтроны. Взаимо- связь понятий: протон, ней- трон, относительная атомная масса §6, упр. 1, 3
2 Изменение числа про- тонов в атомном ядре — образование новых хими- ческих элементов. Изме- нение числа нейтронов в атомном ядре — образова- ние изотопов Современное определение понятия «химический эле- мент». Изотопы как разновид- ность атомов одного и того же химического элемента §7, упр. 1—4
3 Электроны. Строение электронных оболочек атомов Электронная оболочка ато- ма, электронные слои, энерге- тические уровни. Строение электронной оболочки атомов элементов малых йериодов. За- вершенный и незавершенный электронные слои. Орбиталь, электронные формулы атомов 1 §8, упр. 1—5
Продолжение
1 2 3 4 5
4 Периодическая систе- ма химических элемен- тов, строение атомов и свойства элементов Физический смысл порядко- вого номера элемента, номера группы, номера периода. Изме- нение свойств химических эле- ментов в периодах и группах §9, с. 34—36, упр. 1
5 Изменение числа элек- тронов на внешнем энерге- тическом уровне атома — образование положитель- ных и отрицательных ио- нов. Ионная химическая связь Ионы. Понятие об ионной связи. Схемы образования ион- ных соединений §9 (до кон- ца), упр. 2, 3
6 Взаимодействие ато- мов элементов-неметал- лов между собой — обра- зование молекул простых веществ. Ковалентная хи- мическая связь Схема образования двух- атомных молекул (Н2, Cl2, S2, N2). Структурные формулы. Кратность химической связи §10, упр. 1—4
7 Взаимодействие ато- мов элементов-неметал- лов между собой — обра- зование молекул соедине- ний. Электроотрицательность (ЭО). Ковалентная хими- ческая связь неполярная и полярная Схема образования молекул соединений (НС1, Н2О, NH3 и др.). Понятие об ЭО и ковалент- ной полярной химической свя- зи § и, упр. 1—4
8 Взаимодействие ато- мов металлов между собой — образование ме- таллической химической связи Понятие о металлической связи. Строение кристаллов на- трия §12, упр. 1—3
9 Обобщение и система- тизация знаний об эле- ментах металлов и неме- таллов, о видах химиче- ской связи Решение задач и упражне- ний. Подготовка к контрольной работе
10 Контрольная работа № 1
Продолжение
1 2 з 4 5
Тема 2. Простые вещества (9 часов)
1 Простые вещества- металлы Положение металлов в пе- риодической системе элемен- тов. Металлическая связь (по- вторение). . Физические свойст- ва металлов Коллекция металлов: Fe, Al, Са, Mg, Na, К, Hg (послед- ние два металла — в запаян- ных ампулах) §13, упр. 1, 3, 4
2 Простые вещества- неметаллы Ковалентная связь (повторе- ние). Физические свойства не- металлов. Химические форму- лы. Расчет относительной моле- кулярной массы Коллекция неметаллов: Н2, О2 (в газометре), S, Р, угля активированного, брома (в ам- пуле) §14, с. 50—51, упр. 3, 4
3 Аллотропия Понятие аллотропии на при- мере модификаций элемента кислорода. Аллотропия фосфо- ра, олова. Относительность по- нятия «металлические и неме- таллические свойства» Получение и ознакомление со свойствами белого и красно- го фосфора, белого и серого олова §14, с. 51 и до кон- ца, упр. 4
4 Количество вещества Количество вещества и его единицы: моль, ммоль, кмоль. Постоянная Авогадро Некоторые простые веще- ства и соединения количест- вом в 1 моль, 1 ммоль, 1 кмоль §15, с. 54—55, упр. 1—2
5 Молярная масса веще- ства Расчет молярных масс по химической формуле. Милли- молярная и киломолярная мас- сы. Выполнение упражнений с использованием характеристик ХА, га, гаг, М Решение задач с использо- ванием постоянной Авогадро, количества вещества, массы и молярной массы §15, с. 55 и до кон- ца, упр. 3, 4
6 Молярный объем газо- образных веществ Понятие о молярном объеме газов, миллимолярном и кило- молярном объеме их Модель молярного объема газов §16, упр. 1—2
7 Урок-упражнение Решение задач и упражне- ний с использованием характе- ристик: количество вещества, молярная масса, молярный объем газов, постоянная Аво- гадро
8 Обобщение и система- тизация знаний по теме «Простые вещества» Решение задач и упражне- ний, подготовка к контрольной работе
9 Контрольная работа №2
Продолжение
1 2 з 4 5
Тема 3. Соединения химических элементов (15 часов)
1 Степень окисления Понятие о степени окисле- ния. Определение степени окис- ления атомов элементов в би- нарных соединениях §17, с. 59—62, упр. 1
2 Бинарные соединения металлов и неметаллов: оксиды, хлориды, суль- фиды и др. Составление формул бинар- ных соединений, общий способ построения их названий Образцы хлоридов, суль- фидов, оксидов металлов §17, с. 62 и до кон- ца, упр. 2
3 Важнейшие классы бинарных соединений — оксиды и летучие водо- родные соединения Составление формул, их на- звания. Расчеты по формулам. Характеристика важнейших соединений. Представители их Образцы оксидов неметал- лов Р2О5, СО2, SiO2, Н2О и во- дородных соединений НС! и NH3 (газы и растворы) §18, упр. 1—6
4 Основания Состав, названия и класси- фикация оснований. Расчеты по формулам оснований. Пред- ставители (NaOH, КОН, Са(ОН)2). Индикаторы и качествен- ные реакции Образцы щелочей (твердых и в растворе) и нерастворимых оснований. Изменение окраски инди- каторов У §19, упр. 1—6
5 Кислоты Состав, названия и класси- фикация кислот. Расчеты по формулам кислот. Характери- стика представителей кислот (H2SO4, Н2СО3, Н28О3 и др.) Образцы кислот: НС1,1 HNO3, Н3РО4 и других неорга- нических и органических кис- лот. Правило разбавления H2SO4 Изменение окраски инди- каторов §20, ' упр. 1—5
6-7 Соли Состав и названия солей. Растворимость солей. Характе- ристика представителей солей (NaCl, СаСО3, Са3(РО4)2) Образцы солей §21, упр. 1—3
8 Урок-упражнение Классификация сложных веществ, определение принад- лежности соединейий к различ- ным классам по их формулам. Составление формул по назва- ниям и названий по формулам. Расчеты по формулам соедине- ний
Продолжение
00 1 2 3 4 5
9 Кристаллические ре- шетки Аморфные и кристалличе- ские вещества. Типы кристал- лических решеток; связь типов кристаллических решеток с ви- дом химической связи; харак- терные свойства веществ с опре- деленным типом кристалличе- ской решетки. Закон постоян- ства состава Модели кристаллических решеток хлорида натрия, ал- маза, графита, металлов. Модели кристаллических ре- шеток СО2 и иода. Возгонка бензойной кислоты или наф- талина §22, упр. 1,4, 5
10 Чистые вещества и смеси Понятие о чистом веществе и смеси, их отличиях. Примеры жидких, твердых и газообраз- ных смесей, разделение смесей и очистка веществ Взрыв смеси водорода с воздухом. Различные образцы смесей. Способы разделения смесей, в том числе и с помо- щью делительной воронки. Дистилляция воды §23, упр. 1, 2, 4
11-12 Массовая и объемная доли компонентов смеси, в том числе и доля приме- сей Понятие о доле компонента смеси. Вычисление доли компо- нента в смеси и расчет массы или объема вещества в смеси по его доле §24, упр. 1—3
". , J 13 Количественные рас- четы, связанные с поня- тием «доля» (Ю И ф) Решение задач и упражне- ний на расчет доли (массовой или объемной) и нахождение массы (объема) компонента смеси §24, 1 упр. 4—7
14 Обобщение и система- тизация знаний по теме «Соединения химиче- ских элементов» Решение задач и упражне- ний. Подготовка к контрольной работе
15 Контрольная работа №3
Тема 4. Изменения, происходящие с веществами (12 часов)
1 Физические явления Физические и химические явления (повторение). Способы очистки веществ, основанные на физических явлениях: дис- тилляция (перегонка), кристал- лизация и выпаривание, фильт- рование, возгонка (сублима- ция), отстаивание смесей. Очистка питьевой воды. Пе- регонка нефти Плавление парафина, воз- гонка иода или бензойной ки- слоты. Диффузия душистых веществ с поверхности горя- чей лампочки накаливания. Сравнение скорости испаре- ния капель воды и спирта с фильтровальной бумаги §25, упр. 2—4
Продолжение
1 2 3 4 5
2— 3 Химические реакции Признаки протекания хи- мических реакций. Реакции го- рения. Экзо- и эндотермические реакции Горение магния; взаимо- действие НС1 с мрамором; по- лучение Си(ОН)2 и последую- щее растворение его в кисло- те; взаимодействие CuCl2 с Fe; помутнение известковой воды §26, упр. 1—5
о 4 / Закон сохранения мас- сы веществ. Химические уравнения Количественная сторона хи- мических реакций в свете уче- ния об атомах и молекулах. Роль М. В. Ломоносова и Д. Дальтона в открытии и утверждении за- кона сохранения массы ве- ществ. Химическое уравнение как условная запись химической реакции. Составление уравне- ний химических реакций Опыт, подтверждающий закон сохранения массы ве- ществ в результате химиче- ских реакций §27, с. 97—98, Упр. 1 1 1
5 Реакции разложения Сущность реакции разложе- ния. Составление уравнений ре- акций, проведенных учителем на уроке Электролиз воды; разложе- ние нитратов калия или на- трия, перманганата калия, азотной кислоты, гидроксида §27 (реакции разложе- ния)
6 Реакции соединения Сущность реакции соедине- ния. Составление уравнений ре- акций, проведенных учителем на уроке Осуществление переходов: a) S * SO2 * * H2SO3; б)Р > р2о5 ♦ ♦ Н3РО4; в)Са — * СаО » > Са(ОН)2 §27 (реакции соедине- ния)
ЬО 7 Реакции замещения Сущность реакции замеще- ния. Составление уравнений ре- акций, проведенных учителем иа уроке Взаимодействие щелочных металлов с водой. Взаимодействие цинка и алюминия с растворами соля- ной и серной кислот. Взаимодействие металлов (Fe, Al, Zn) с растворами солей (CuCl2, AgNO3) §27 (ре- акции за меще- ния)
8 Реакции обмена Сущность реакции обмена. Составление уравнений реак- ций, проведенных учителем на уроке. Условия течения реак- ций между растворами кислот щелочей и солей до конца Взаимодействие растворов щелочей, окрашенных фенол- фталеином, с растворами кис лот. Взаимодействие H2SO4 ВаС12, НС1 с AgNO3, NaOH Fe2(SO4)3 и другими солями §27 (реак- ции об- мена), упр. 3, 4
1 о я Продолжение
9-10 Расчеты по химиче- ским уравнениям Нахождение количества ве- щества, массы и объема продук- та реакции по количеству, мас- се и объему исходного вещест- ва. Те же расчеты, но с использованием долей (исход- ное вещество дано в виде рас- твора заданной концентрации или содержит определенную до- лю примесей) 4 5 §28, задачи 1—5
11 Обобщение и система- тизация знаний по теме «Изменения, происходя- щие с веществами» Решение задач и упражне- ний. Подготовка к контрольной работе 1 t
12 । Контрольная работа №4
Тема 5. Простейшие операции с веществом. Химический практикум (7 часов)
1 Правила по технике безопасности при работе в химическом кабинете. Приемы обращения с на- гревательными прибора- ми и лабораторным обору- дованием Глава 5. Работа № 1
2 Наблюдения за изме- нениями, происходящи- ми с горящей свечой, и их описание Работа №2
3 Анализ почвы и воды Работа №3
4 Признаки химических реакций Работа № 4
5 Получение водорода и изучение его свойств Работа №5
6 Получение кислорода и изучение его свойств Работа №6
Продолжение
1 2 3 4 5
7 Приготовление раство- ра сахара и определение массовой доли сахара в растворе Работа № 7
Тема 6. Скорость химических реакций. Химическое равновесие (7 часов)
1 1 Скорость химических реакций Понятие о скорости химиче- ских реакций. Единицы скоро- сти химических реакций. Гомо- генные и гетерогенные процес- сы. Зависимость скорости реакции от площади соприкос- новения реагирующих веществ Взаимодействие гранул и порошка цинка с соляной ки- слотой §29, упр. 1—5
2 Зависимость скорости химических реакций от природы реагирующих веществ, концентрации и температуры Зависимость Vp от а) природы реагирующих ве- ществ; б) температуры; в) концентрации реагирую- щих веществ. Закон действующих масс. Правило Вант-Гоффа Взаимодействие Zn, Mg, Fe cHCl. Взаимодействие раствора H2SO4 с раствором тиосульфа- та натрия различной концен- трации. Взаимодействие цинка с H2SO4 и тиосульфата натрия с H2SO4 при разных температу- §30, упр. 1—6
3 Катализ и катализато- ры Понятие о катализе, катали- заторах и ингибиторах. Фер- менты как биологические ката- лизаторы белковой природы Разложение пероксида во- дорода в присутствии МпО2; | горение сахара в присутствии свежего сигаретного пепла §31, ( упр. 1—5
4 Обратимые и необра- тимые реакции Понятие об обратимости хи- мических реакций. Условия протекания необратимых реак- ций. Правило Бертолле Примеры необратимых ре- акций, протекающих в рас- творах с образованием газа, осадка или Н20, а также реак- ций горения. Примеры обратимых реак- ций §32, упр.1—4
5 Химическое равнове- сие Понятие о химическом рав- новесии как характеристике об- ратимых реакций. Динамиче- ский характер химического равновесия. Принцип Ле Шате- лье. Способы смещения хими- ческого равновесия Смещение равновесия хи- мической реакции, протекаю- щей между роданидом аммо- ния и хлоридом железа (III) §33, упр. 1—5
6-7 Обобщение и система- тизация знаний по теме «Скорость химических реакций. Химическое равновесие» Решение задач и упражне- ний. Контроль знаний по теме
Продолжение
1 2 з 4 5
Тема 7. Растворение. Растворы. Свойства растворов электролитов (21 час) «
1 Растворение как физи- ко-химический процесс Растворы. Гидраты. Кри- сталлогидраты. Тепловые явле- ния при растворении Растворение безводного сульфата меди (II) в воде. §34, с. 135— 138
2 Растворимость. Типы растворов Кривые растворимости. На- сыщенные, ненасыщенные и пересыщенные растворы. Коли- чественные оценки растворимо- сти веществ Растворимость веществ при разных температурах. Мгновенная кристаллизация пересыщенного раствора глау- беровой соли §34, с. 138— 140, упр. 1—7
3-4 Электролитическая диссоциация Электролиты и неэлектро- литы. Механизм диссоциации веществ с разным типом связи. Степень электролитической диссоциации. Сильные и сла- бые электролиты Испытание веществ и их растворов на электропровод- ность. Зависимость степени электролитической диссоциа- ции уксусной кислоты от раз- бавления §35, упр. 1—6
5 Теория электролити- ческой диссоциации Основные положения тео- рии электролитической диссо- циации. Ионы. Свойства ионов. Классификация ионов по соста- ву (простые и сложные), по за- ряду (катионы и анионы), по наличию водной оболочки (гид- ратированные и негидратиро- ванные). Определение кислот, оснований, солей с позиций тео- рии электролитической диссо- циации Движение окрашенных ионов в электрическом поле §36, упр. 1—5
6 Ионные реакции уравнения Реакции обмена, идущие до конца. Молекулярные, полные и сокращенные ионные уравне- ния реакции. Реакции нейтра- лизации Примеры щих до конца реакций, иду- §37, упр. 1—5
Продолжение
N 00 1 2 3 4 3
7-8 ' Кислоты, классифика- ция и свойства Диссоциация кислот, клас- сификация кислот по различ- ным признакам. Взаимодейст- вие кислот с металлами, усло- вия течения этих реакций. Электрохимический ряд на- пряжений металлов. Взаимо- действие кислот с оксидами ме- таллов и основаниями. Реакции нейтрализации. Вза- имодействие кислот с солями. Использование таблицы рас- творимости веществ в воде для характеристики химических свойств кислот Реакции, характерные для кислот (на примере НС1, H2SO4) §38, упр. 1—6
9-10 Основания, классифи- кация и свойства Диссоциация растворимых оснований. Классификация ос- нований по различным призна- кам. Взаимодействие раствори- мых оснований с кислотами, оксидами неметаллов, солями. Разложение нерастворимых ос- нований Реакции, характерные для щелочей и нерастворимых оснований §39, упр. 1—5
11-12 Оксиды, классифика- ция и свойства Несолеобразующие и соле- образующие оксиды. Кислот- ные и основные оксиды. Типич- ные реакции основных и ки- слотных оксидов Изучение ных оксидов и кислотных мере СО2 свойств основ- на примере СаО оксидов на при- §40, упр. 1—5
13-14 Соли, классификация и свойства Средние, кислые, основные соли. Взаимодействие солей с кислотами, щелочами, солями, металлами. Электрохимиче- ский ряд напряжений металлов (повторение). Взаимодействие солей с металлами, особенности этих реакций и взаимодействие солей с солями (работа с табл, растворимости). Взаимодейст- вие солей с кислотами и щело- чами (повт.) Изучение свойств солей химических §41, упр. 1—5
15 Генетическая связь между классами неорга- нических веществ Понятие о генетической свя- зи и генетических рядах метал- лов и неметаллов Осуществление переходов: а) Р ► Р2О5 > * П3РО4 * Са3(РО4)2, б) Са ► СаО ► ► Са(ОН)2 > Са3(РО4)2 §42, упр. 1—5
Продолжение
1 2 3 4 5
16 Обобщение и система- тизация знаний по теме ♦ Растворение. Растворы. Свойства растворов элек- тролитов» Решение расчетных задач и упражнений. Подготовка к кон- трольной работе
17 Контрольная работа №5
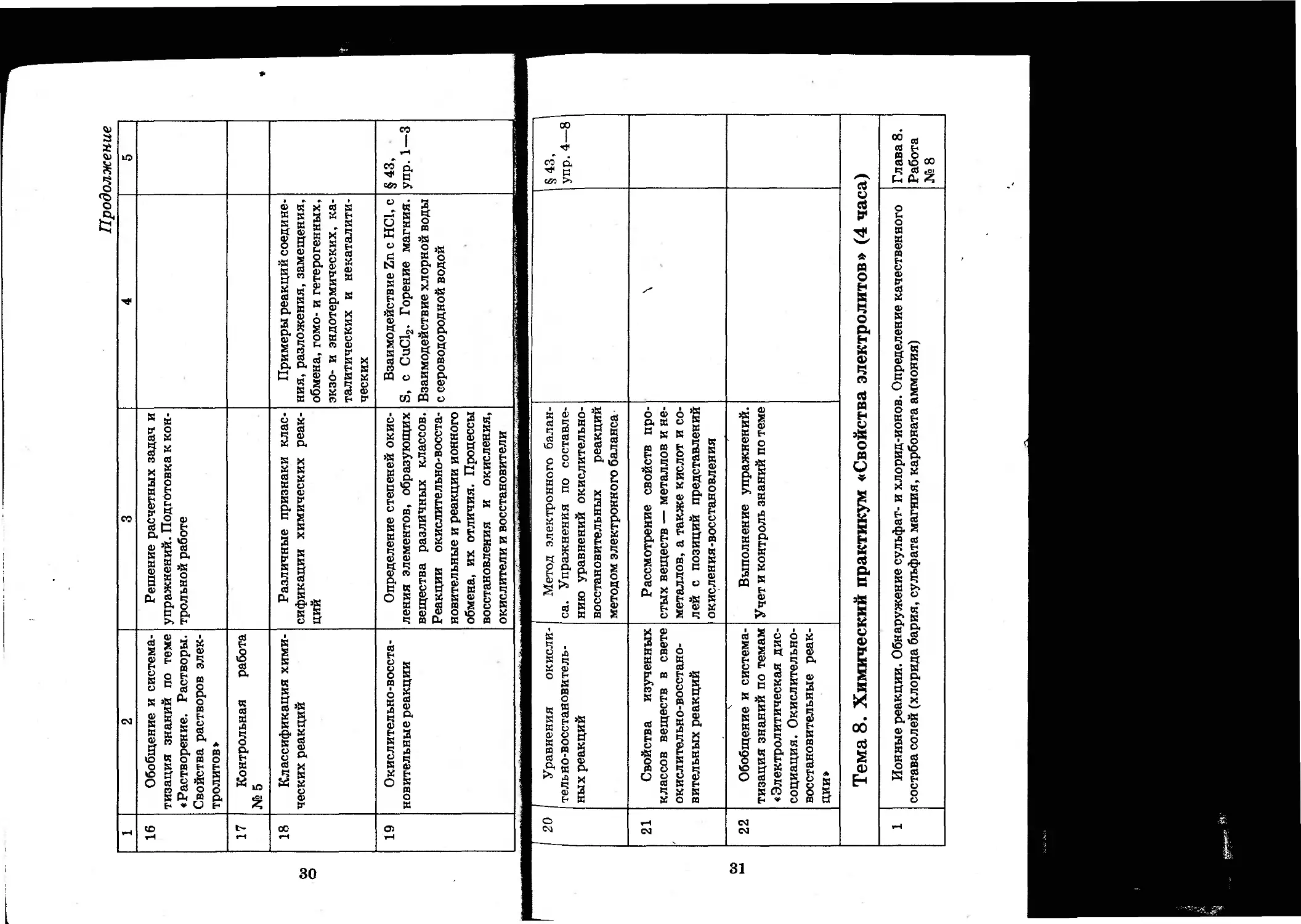
18 Классификация хими- ческих реакций Различные признаки клас- сификации химических реак- ций Примеры реакций соедине- ния, разложения, замещения, обмена, гомо- и гетерогенных, экзо- и эндотермических, ка- талитических и некаталити- ческих
19 Окислительно-восста- новительные реакции Определение степеней окис- ления элементов, образующих вещества различных классов. Реакции окислительно-восста- новительные и реакции ионного обмена, их отличия. Процессы восстановления и окисления, окислители и восстановители Взаимодействие Zn с НС1, с S, с СиС12. Горение магния. Взаимодействие хлорной воды с сероводородной водой §43, упр. 1—3
20 Уравнения окисли- тельно-восстановитель- ных реакций Метод электронного балан- са. Упражнения по составле- нию уравнений окислительно- восстановительных реакций методом электронного баланса §43, упр. 4—8
21 Свойства изученных классов веществ в свете окислительно-восстано- вительных реакций Рассмотрение свойств про- стых веществ — металлов и не- металлов, а также кислот и со- лей с позиций представлений окисления-восстановления
22 Обобщение и система- тизация знаний по темам ♦Электролитическая дис- социация. Окислительно- восстановительные реак- ции» Выполнение упражнений. Учет и контроль знаний по теме
Тема 8. Химический практикум «Свойства электролитов» (4 часа)
1 Ионные реакции. Обнаружение сульфат- и хлорид-ионов. Определение качественного состава солей (хлорида бария, сульфата магния, карбоната аммония) Глава 8. Работа №8
IO Работа №9 Работа № 10 Работа № 11 । Тема 9. Шеренга великих химиков (6 часов) Глава 9 Тема 10. Учебные экскурсии (3 часа)
со С.4 Реакции ионного обмена, идущие до конца. Проведение серии реакций, сопровождаю- щихся образованием осадка, газа, слабого электролита (воды) Свойства кислот, оснований, оксидов и солей Решение экспериментальных задач Повторение материала курса химии 8 класса — основных понятий, законов и теорий путем знакомства с деятельностью ученых, осуществивших их открытие. Посещение местных промышленных предприятий, аптек, агрохимических лаборато- рий Резервное время —11ч _ . ... ... , . ,
п — со
32
Примерное
тематическое планирование
уроков химии в 9 классе
Курс 9 класса начинается с введения, рассчитанно-
го на 5 часов. В нем обобщаются основные вопросы из
учебного материала 8 класса, а также даются новые
понятия — о переходных элементах и амфотерности.
На последующих уроках рассматриваются общие
свойства классов химических элементов — металлов
и неметаллов. Затем в обобщенном плане разбирают-
ся свойства отдельных групп химических элементов:
щелочных и щелочноземельных металлов и галоге-
нов. Далее рассматриваются свойства отдельных важ-
ных в народнохозяйственном отношении веществ.
При изучении химии классов, групп и отдельных хи-
мических элементов повторяются, обобщаются и раз-
виваются полученные в 8 классе основные понятия,
законы и теории базового курса.
Курс 9 класса, построенный по концентрической
концепции, завершается ознакомлением с органиче-
скими веществами.
Региональный компонент, включенный в базовый
курс, реализуется с помощью специальных тем-моду-
лей «Химия и экология» (12—13 часов), «Химия в
сельском хозяйстве» (для сельских школ). Однако в
каждой конкретной школе учитель может использо-
вать и другой модуль, наиболее характерно отража-
ющий региональный компонент.
Разумеется, предлагаемое планирование является
ориентировочным и учитель может разработать свой
3 19S5
33
«
ф
•О
И
«
о
ф
И
«
PD
и Я «
к;
s ?
СО
я
ф
л о
о
рэ
о
о
я
ф
W
й
ф
S
»
м
»
§
§
S
» _.
~ 3
и
о
Ф
to
>4
№
S
X
сл
>4
S
►3
ф
я
»
3
в
s
н
я
й
«
S
•о
§
»
s
£ »
3
I
о
я
1:
§
S
3
ф
*з
!
сл
о
й
ф
»
2
д
3
Й5
СО
л
I
о
д
я
S
st
о
S
Д
О
1 №? Тема урока Изучаемые вопросы Экспериментальная часть (демонстрация химических продуктов, демонстрационные опыты) Задание иа дом (пара- граф и упражне- ния по учебнику)
1 2 3 4 5
Введение. Общая характеристика химических элементов (5 часов)
1 Характеристика хи- мического элемента на основании его положе- ния в периодической системе Д. И. Менде- леева Строение атома. Характер простого вещества; сравнение свойств простого вещества со свойствами простых веществ, об- разованных соседними по перио- ду элементами; аналогично для соседей по подгруппе. Состав и характер высшего гидроксида; состав летучего водородного со- единения (для неметалла). Генетические ряды металла и неметалла. Предсказания Д. И. Менде- леева о существовании герма- ния, скандия и франция Получение и изучение характерных свойств основ- ного и кислотного оксидов, оснований и кислот на при- мерах MgO и S02, Mg(OH)2 и h2so4 §1, упр. 1—4
Продолжение
1 2 * 3 4 5
2 Амфотерные окси- ды и гидроксиды Понятие о переходных эле- ментах. Амфотерность. Генети- ческий ряд переходного элемен- та. Зависимость свойств оксидов и гидроксидов переходных эле- ментов от степени окисления (для хрома). 1) Получение и изучение свойств амфотерного гидро- ксида Zn(OH)2 2) Изучение свойств гид- роксидов хрома §2, упр. 1—4
со <я 3 Периодический за- кон и периодическая система химических элементов Д. И. Менде- леева Открытие Д. И. Менделее- вым периодического закона. Фи- зический смысл порядкового но- мера и номеров периода, груп- пы. Закономерности изменения свойств элементов и образуемых ими веществ в пределах перио- дов и групп §3, упр. 1—5
4 Урок-упражнение: описание свойств эле- ментов на основании их положения в пе- риодической системе Оксиды, основания, кислоты: их состав, классификация и свойства с позиции теории элек- тролитической диссоциации. Расчет выхода продукта реакции Упр. 7—10 к§2
5 Повторение свойств классов соединений Характеристика свойств ос- новных классов неорганических соединений в свете теории элек- тролитической диссоциации и окислительно-восстановитель- ных реакций Получение и изучение свойств Fe(OH)3, NaOH, CuSO4
Тема 1. Металлы (21 час)
1 Век медный, брон- зовый, железный Значение металлов в разви- тии человеческой цивилизации. Бронза и художественное литье. Сплавы чёрные и цветные Образцы изделий из ме- таллов, коллекции §4, упр. 1—6
2 Положение метал- лов в периодической системе Д. И. Менде- леева Щелочные и щелочноземель- ные металлы — элементы I и II группы. Особенности строения атомов металлов и характерное свойство металлов — восстано- вительная способность. Деление элементов на металлы и неметал- лы §5, упр. 1—3
Продолжение
1 2 3 4 5
3 Физические свой- ства металлов Металлическая связь и ме- таллическая кристаллическая решетка (повторение). Физиче- ские свойства металлов: пла- стичность, электро- и теплопро- водность, металлический блеск, плотность, твердость и др. Ме- таллы черные и цветные. Драго- ценные металлы (Au, Pt, Ag, Ir) Коллекция образцов ме- таллов §6, упр. 1—5
4 Сплавы Сплавы как системы метал- лов с другими металлами и неме- таллами. Особенности свойств сплавов. Классификация спла- вов. Черные сплавы — чугун и сталь. Цветные сплавы — брон- за, латунь, дюралюминий, мель- хиор. Свойства сплавов. Коллекция сплавов §7. упр. 1—3
3 Химические свой- ства металлов Взаимодействие металлов с кислородом, неметаллами, во- дой Горение Na, Са, А1 в ки- слороде. Взаимодействие Na и Са с водой. Взаимодейст- вие А1 с. Ьь Fe с S, _ ...., §8, с. 34—35, упр. 1, 3,
6 Химические свой- ства металлов и элек- трохимический ряд на- пряжений металлов Особенности взаимодействия металлов с растворами кислот и солей. Использование таблицы растворимости для прогнозиро- вания этих свойств Взаимодействие Zn с HCl\ и H2SO4 (р); Fe с CuSO4 §8, с. 35 и до кон- ца, упр. 2, 6, 7, 8
7 Получение метал- лов Металлы в природе. Руды ме- таллов. Пиро-, гидро- и электро- металлургия, микробиологиче- ская металлургия Коллекция образцов руд черных и цветных металлов. Восстановление металлов из оксидов углем, водородом §9, упр. 1—6
8 Коррозия металлов Понятие о коррозии металлов и сплавов. Последствия от корро- зии. Химическая и электрохи- мическая коррозия. Способы за- щиты от коррозии: защитные по- крытия, легирующие добавки, ингибиторы коррозии, протек- торная защита Демонстрация результа- тов заблаговременно зало- женного опыта по коррозии металлов и защиты их от коррозии §10, упр. 1—6
1 2 3 4 5
9 Щелочные металлы Строение атомов щелочных металлов. Свойства щелочных металлов (сравнительная харак- теристика): взаимодействие их с водородом, хлором, серой, во- дой; особенности взаймодейст- вия с кислородом (пероксид на- трия и оксид лития) Взаимодействие Li и Na с водой, взаимодействие Li и Na с хлором, серой §И. с. 44—45, упр. 1—2
10 Соединения щелоч- ных металлов Оксиды: строение (ионная связь и кристаллическая решет- ка — повторение), их основной ха- рактер и получение. Гидроксиды (ионный характер связи и решет- ки), свойства с позиций теории электрической диссоциации (по- вторение). Получение и примене- ние NaOH и КОН. Соли (ионный характер связи и решетки). Сода (техническая и пищевая), поташ, глауберова соль, поваренная соль. Биологическая роль ионов Na+ и К . Открытие щелочных метал- лов (историческая справка) Ознакомление с химиче- скими свойствами Li2O. Оз- накомление с химическими свойствами NaOH и КОН. Коллекция образцов природ- ных соединений щелочных металлов §11, с. 45 и до конца, упр. 3 (по желанию), 4, 5
11 Бериллий, магний и щелочноземельные металлы Сравнительная характери- стика строения атомов. Сравни- тельная характеристика физиче- ских и химических свойств бе- риллия, магния и щелочноземельных металлов: взаимодействие с кислородом, хлором, серой, водой, оксидами металлов Горение магния. Взаимо- действие Са с Cl2, S, водой §12, 1 с. 50—52, упр. 1, 6, 9
12 Соединения берил- лия, магния и щелоч- ноземельных метал- лов: оксиды и гидро- ксиды Оксиды: их строение и основ- ные свойства, получение, приме- нение СаО (негашеной извести) и MgO. Гидроксиды, их строение, свойства, получение и примене- ние. Разновидности Са(ОН)2 (из- вестковая вода, известковое мо- локо, пушонка) Изучение свойств нега- шеной и гашеной извести §12, с. 52—53, упр. 5, 8
13 Соли магния и ще- лочноземельных ме- таллов Сульфиды (фосфоры), галоге- ниды, карбонаты, сульфаты, фос- фаты. Карбонат кальция в приро- де (мел, мрамор, известняк). Биологическая роль кальция и магния. Открытие щелочных металлов (историческая справ- ка). Коллекция природных соединений кальция §12, с. 53 и до конца, упр. 2,4, 9; упр. 7 (по желанию)
Продолжение
N3 1 2 3 4 5
14 Алюминий Строение атома алюминия и сравнение его с бором. Алюминий — простое веще- ство (металлическая связь и решетка — повторение). Физи- ческие свойства алюминия и его применение. Химические свойства алюми- ния: взаимодействие с кислоро- дом, неметаллами, кислотами, щелочами, солями. Алюминотермия Коллекции изделий из алюминия и сплавов алюми- ния. Горение алюминия. Взаимодействие алюми- ния с иодом. Демонстрация механиче- ской прочности оксидной пленки. Взаимодействие алюми- ния с растворами кислот, со- лей и щелочей §13, с.57—60, упр. 3, 4, 7
15 Амфотерный ха- рактер оксида и гидро- ксида алюминия Амфотерность. Получение и свойства А1(0Н)3 Получение и изучение свойств А1(0Н)3 §13, с. 59, упр. 1, 2, 5
16 Соединения алю- миния Алюминий в природе. Алю- мосиликаты. Бокситы. Глино- зем. Корунд и его разновидности (наждак, рубин, сапфир). Соли алюминия: хлорид и сульфат. Открытие алюминия. Коллекция образцов природных соединений алюминия §13, с. 60 и до конца, упр. 6, упр. 8(по желанию)
17 Железо Строение атома железа, сте- пени его окисления. Железо — простое вещество, физические свойства и техническое значе- ние. Химические свойства желе- за: взаимодействие с хлором, се- рой, кислородом, растворами ки- слот и солей, водяными парами. Железо в природе: оксидные и сульфидные руды Горение железа в хлоре. Опыты, показывающие отношение железа к конц. H2SO4 и HNO3. Взаимодействие железа с серой, растворами кислот и солей. Коллекция образцов руд железа §14, с. 63—65, упр. 4, 5, 6
18 Генетический ряд Ре2+ Соединения железа со степе- нью окисления +2: Fe ► » FeCl2 ► > Fe(OH)2 > FeO > Fe. Основный характер оксида и гидроксида железа(П). Качест- „ 2+ венная реакция на ионы Fe Получение Fe(OH)2 и до- казательство его основного характера, окисление в Fe(OH)3. Качественная реакция на Fe2+ §14, с. 65—66, упр. 2 (а), 8 (по жела- нию)
44
1 2 3 4 5
19 Генетический ряд Fe3+ Соединения железа со сте- пенью окисления +3: Fe * ♦ FeCl3 ♦ Fe(OH)3 ♦ * Fe2O3 * Fe. Качественные реакции на Fe3+. Соли железа(1П): хлорид и сульфат. Биологическая роль железа Получение Fe(OH)3 и изу- чение его свойств. Качественные реакции Fe3+ § 14, с. 66 и до конца, упр. 1, 2 (б, в), 7
20 Обобщение и систе- матизация знаний по теме «Металлы» Решение задач и упражне- ний, подготовка к контрольной работе
21 Контрольная работа № 1
Тема 2. Химический практикум I. Свойства металлов и их соединений (4 часа)
1 Определение выхода продукта реакции Работа № 1
2 Практическое осуществление химических превращений Работа № 2 I
3 Экспериментальные задачи по распознаванию и получению веществ Работа Xs 3
4 Качественные реакции на ионы металлов Работа № 4
Тема 3. Неметаллы (26 часов)
1 Неметаллы: атомы и простые вещества. Кислород, озон, воздух Положение неметаллов в пе- риодической системе элементов, особенности строения их атомов. Электроотрицательность как ме- ра неметалличности, ряд ЭО. Ал- лотропия. Физические свойства неметаллов. Относительность понятий «металл» и «неметалл». Кислород и озон. Состав воздуха Коллекция образцов не- металлов в различных агре- гатных состояниях. Образцы аллотропных модификаций О, S, Р. Получение озона §15, упр. 1—6
2 Химические эле- менты в клетках жи- вых организмов Макро- и микроэлементы. Роль микроэлементов в жизне- деятельности растений, живот- ных и человека. Витамины. Гор- моны Образцы витаминных препаратов и гормонов; ил- люстрации рисунков жи- вотных и человека с авита- минозами и гормональными нарушениями §16, упр. 1—6
1 2 3 4 ииилжение 5
3 Галогены Строение атомов галогенов, их степени окисления. Строение молекул галогенов. Свойства га- логенов. Закономерности в изме- нении физических и химических свойств галогенов от фтора к иоду. Открытие галогенов. Образцы галогенов — простых веществ. Взаимодействие их с на- трием, алюминием. Вытеснение хлором бро- ма или иода из растворов их солей § 17, упр. 1—8
4 Соединения галоге- нов. Получение галоге- нов Галогеноводороды. Хлоро- водород и соляная кислота. Фто- риды, хлориды, бромиды, иоди- ды. Природные соединения гало- генов. Получение галогенов Образцы галогеноводоро- дов (газы и растворы). Получение и изучение свойства НС1. Образцы природных со- единений галогенов §18, упр. 1—7, §19, с. 87, упр. 1—3
5 Биологическое зна- чение и применение га- логенов и их соедине- ний Биологическая роль фтора, хлора, брома и иода. Их значе- ние в промышленности, сель- ском хозяйстве, быту Образцы зубной пасты; изделия из тефлона; про- мышленные продукты на ос- нове хлора (пластмасса, ле- карства, ядохимикаты и др.); образцы фотобумаги и плен- ки; препараты иода § 19, с. 87 и до конца, упр. 1—7
6 Кислород Кислород в природе — в атмо- сфере, литосфере, гидросфере. Химические свойства кислорода: взаимодействие с простыми веще- ствами (металлами и неметалла- ми), сложными веществами (уг- леводородами, сероводородом). Горение и медленное окисление. Дыхание и фотосинтез. Получе- ние и применение кислорода Получение кислорода разложением КМпО4 и Н2О2; собирание й распознавание кислорода; Горение S, Р, Fe, Li, Na, Al в кислороде; горение СН4 иН28 §20, упр. 1—6, 7 и 8 (по желанию)
7 Сера Строение атома серы. Алло- тропия. Физические свойства ромбической серы. Химические свойства серы Получение пластической серы. Взаимодействие серы с металлами, водородом и ки- слородом §21, с. 96—98, упр. 2, 6
8 Сера в природе. Применение серы. Се- роводород и сульфиды Сера в природе: самородная, сульфидная и сульфатная. Применение серы. Биологи- ческое значение серы. Сероводород: физические свойства, физиологические ас- пекты действия, горение, восста- новительная способность. Сульфиды; растворимые и не- растворимые Образцы природных со- единений серы. Образцы соединений се- ры, применяемых в народ- ном хозяйстве. Получение и изучение свойств H2S. Качественная ог- реакция на S §21, с. 98 и до кон- ца, упр. 1, 3,4, 5; §22, с. 100—101
Продолжение
00 1 2 3 4 5
9 Оксиды cepu(IV) и (VI). Сернистая кисло- та и ее соли Получение и свойства оксидов серы (IV) и (VI) как кислотных оксидов. Реакция 2SOZ + + О2 «к - '* 2SO3, условия смеще- ния равновесия вправо. Сернистая кислота, сульфи- ты, гидросульфиты Получение SO2 при горе- нии серы и по реакции меди с КОНЦ. H2SO4. Взаимодействие SO2 с во- дой и щелочью. Обесцвечивание красок с помощью SO2. Качественная реакция на so!" О §22,с.101, упр. 1,2,5, 6
10 Серная кислота Характеристика свойств сер- ной кислоты с позиций электро- литической диссоциации и окис- лительно-восстановительных ре- акций. Сравнение свойств кон- центрированной и разбавленной серной кислоты. Применение серной кислоты. Производство серной кисло- ты: сырье, стадии производст- венного процесса, аппаратура. Разбавление концентри- рованной HZSO4. Взаимодействие H2SO4 (конц.) с медью, органиче- скими веществами (сахаром, целлюлозой). Изучение свойств разбав- ленной H2SO4. Качественная реакция на SO* . Модели аппаратов для производства H,SO. §22, до конца, упр. 3, 4, 8
1985
11 Соли серной кисло- ты Сульфаты и гидросульфаты. Реактив на серную кислоту и ее соли Образцы сульфатов, при- меняемых в народном хозяй- стве. Распознавание сульфатов §22, с. 102 упр. 7
12 Азот Строение атомов азота. Строение молекулы азота. Физи- ческие и химические свойства азота. Биологическое значение азо- та Корни культур бобовых растений с клубеньками §23, упр. 1—5
13 Аммиак Строение молекулы аммиака. Водородная связь. Физические свойства, полу- чение, собирание, распознава- ние. Водный аммиак. Химические свойства аммиа- ка: образование иона аммония по донорно-акцепторному механиз- му, NH3 — сильнейший восста- новитель Модель колонны синтеза аммиака. Получение, собирание и распознавания аммиака. Растворение аммиака в воде. Взаимодействие аммиака с хлороводородом §24, упр. 1—6
Продолжение
1 2 3 4 5
14 Соли аммония Состав, получение, физиче- ские и химические свойства со- лей аммония. Применение солей аммония в народном хозяйстве Образцы солей аммония, в том числе в составе удобре- ний. Качественная реакция на NH4 §25. упр. 1—5
15 Кислородные со- единения азота Оксиды азота. Азотная ки- слота, ее свойства: взаимодейст- вие конц. и разб. HNO3 с медью. Применение азотной кислоты в промышленности Взаимодействие разб. и конц. HNO3 с медью. Горение скипидара в азотной кислоте. Разложение нитрата ка- лия §26, с. 118—120, упр. 1—5
16 Соли азотистой и азотной кислот. Азот- ные удобрения Нитраты и их свойства (раз- ложение при нагревании). Про- блема повышенного содержания нитратов и нитритов в сельско- хозяйственной продукции. Азот- ные удобрения Образцы нитратов и нит- ритов. Коллекция азотных удоб- рений. Качественное обнаруже- ние NO3 hNO2 ; - — - §26, с. 120 и до конца, упр. 6, 7
17 Фосфор Строение атома фосфора. Ал- лотропия: красный и белый фос- фор. Химические свойства фосфо- ра. Получение белого фосфо- ра из красного. Воспламенение белого фосфора §27, с. 122—123, упр. 1—3
18 Соединения фора фос- Оксид фосфора(У) и ортофос- форная кислота. Фосфаты, ди- гидро- и гидрофосфаты. Фосфор в природе. Биологи- ческое значение фосфора. При- менение фосфора. Открытие фос- фора Получение Р2О5 при горе- нии фосфора. Растворение Р2О5 в в°Де< Изучение свойств Н3РО4 как слабого электролита. Качественная реакция на ро®-. Образцы природных со- единений фосфора, коллек- ция фосфорных удобрений §27, с. 123 и до конца, упр. 4—7
Продолжение
1 2 3 4 5
19 Углерод Строение атома углерода. Ал- лотропия: алмаз и графит. Аморфный углерод и его сорта: кокс, сажа, древесный уголь. Адсорбция и ее практическое значение. Химические свойства углеро- да. Биологическое значение уг- лерода. Углерод — основной эле- мент живой природы Модели кристалличе- ских решеток алмаза и гра- фита. Адсорбция активирован- ным углем растворенных или газообразных веществ. Горение угля в кислоро- де. Восстановление меди из ее оксида углем §28, упр. 1—8
20 Оксиды углерода (П) и (IV) Физические и химические свойства оксидов углерода. По- лучение и применение СО и СО2, их биологическое значение Получение, собирание и распознавание СО2. Изучение свойств СО2 как кислотного оксида §29, с. 134—136, упр. 1—5
21 Угольная кислота и ее соли Карбонаты и гидрокарбона- ты. Жесткость воды. Качествен- ная реакция на соли угольной кислоты Коллекция карбонатов. Качественная реакция на со|”. Переход карбоната каль- ция в гидрокарбонат и обрат- но § 29, с. 136 и до конца, упр. 6—8
22 Кремний Строение атома, сравнение его свойств со свойствами атома углерода. Кристаллический кремний, сравнение его свойств с углеро- дом. Кремний в природе: кремне- зем и минералы на его основе, силикаты, алюмосиликаты. Соединения кремния: оксид, силициды, силан, кремниевая кислота, силикаты. Силикагель. Биологическое значение кремния Коллекция природных соединений кремния §30, с. 138—141, упр. 1—4
23 Силикатная про- мышленность Производство стекла, фарфо- ра, цемента Коллекция изделий из стекла, фарфора, керамики и цемента §30, с. 141 и до конца, упр. 5, 6
24 Обобщение и систе- матизация знаний по теме «Неметаллы» Решение задач и упражне- ний, подготовка к контрольной работе
25 Контрольная рабо- та по теме «Неметал- лы»
Продолжение
СП
1 2 з 4 5
Тема 4. Химический практикум II. Свойства соединений неметаллов (5 часов)
1 Получение соляной кислоты и изучение ее свойств Работа № 5
2 Экспериментальные задачи по теме «Подгруппа кислорода» Работа № 6
3 Получение аммиака и изучение его свойств Работа № 7
4 Экспериментальные задачи по теме «Подгруппа азота» Работа № 8
5 Получение оксида углерода (IV) и изучение его свойств. Распознавание карбонатов Работа № 9
Тема 5. Органические вещества (19 часов)
1 Предмет органиче- ской химии. Теория строения органических соединений А. М. Бутле- рова Органическая химия — хи- мия соединений углерода. Веще- ства органические и неорганиче- ские. Причины многообразия углеродных соединений. Природ- ные и синтетические органиче- ские вещества. Основные положения теории строения А. М. Бутлерова. Валентность и степень окис- ления. Структурные формулы. Значение органической хи- мии Образцы природных и синтетических веществ §31, упр. 1—6
2 Предельные углево- дороды Представители предельных углеводородов — метан, этан, пропан,бутан. Изомерия, изомеры. Гомологический ряд, гомоло- ги. Гомологический ряд предель- ных углеводородов. Номенкла- тура. Свойства предельных углево- дородов (на примере метана): го- рение, замещение водорода на галоген, термическое расщепле- ние. Реакции дегидрирования Шаростержневая и мас- штабная модели молекул ал- канов. Горение метана и других углеводородов, обнаружение продуктов горения. Отношение к бромной во- де и раствору перманганата калия §32, упр. 1,2,4, 5
3-4 Непредельные угле- водороды. Этилен и его гомологи Гомологический ряд непре- дельных углеводородов: общая формула, изомерия и номенкла- тура. Двойная связь. Свойства непредельных угле- водородов (на примере этилена): горение, реакции присоедине- ния водорода, галогена, галоге- новодорода, воды. Модели молекул этилена. Получение этилена. Горение этилена. Взаимодействие этилена с бромной водой ц раствором перманганата калия §33, упр. 1—6
Продолжение
1 2 3 4 5
3-4 Реакции полимеризации, по- лимеры, мономеры. Реакции гидратации. Качественные реак- ции на двойную связь
5 Непредельные угле- водороды. Ацетилен Тройная связь. Получение ацетилена и его свойства: реакции горения, при- соединения галогенов, воды (ре- акция Кучерова). Полимериза- ция винилхлорида Получение ацетилена из карбида кальция. Горение ацетилена. Взаимодействие ацетиле- на с растворами брома и пер- манганата калия. Изделия из поливинил- хлорида §34, упр. 1—6
6 Ароматические уг- леводороды. Бензол Бензол как простейшее аро-. матическое соединение. Строе- ние молекулы бензола. Физические и химические свойства бензола: реакции заме- щения бромом, нитрование, при- соединение хлора. Пестициды, их виды. Применение бензола Растворение в бензоле жиров. Коллекция пестицидов §35, упр. 1, 3, 5
7 Спирты Функциональная гидро- ксильная группа —ОН. Атом- ность спиртов. Одноатомные спирты. Мети- ловый и этиловый спирты, их физические и химические свой- ства, физиологическое действие. Двухатомные спирты. Эти- ленгликоль. Трехатомные спирты. Глице- рин Образцы метанола, эта- нола, этиленгликоля, глице- рина. Качественная реакция на многоатомные спирты. Окисление спиртов в аль- дегиды §36, упр.1,2,4, 5
8 Альдегиды Функциональная альдегид- ов ная группа —Q. Ъ Муравьиный альдегид (фор- мальдегид). Уксусный альдегид (ацеталь- дегид). Качественная реакция на альдегиды Образцы формальдегида и ацетальдегида. Формалин. Реакция «серебряного зеркала» §37, упр. 1—3, 6
Продолжение
1 2 3 4 5
9 Предельные одноос- новные карбоновые ки- слоты Ацетаты. Жирные кислоты. Функциональная карбок- сильная группа — СООН. Муравьиная кислота. Уксус- ная кислота Формиаты. Ацетаты Взаимодействие уксус- ной кислоты с металлами, оксидом металла, основани- ем и солью (карбонатом) §38, с. 176—178, упр. 1, 5
сл 00 10 Сложные эфиры Реакция этерификации. Слож- ные эфиры в природе, примене- ние их Получение сложных эфи- ров: синтез этилового эфира уксусной кислоты § 38, с. 178 и до конца, упр. 2,3,4, 6
11 Жиры Жиры как сложные эфиры трехатомного спирта глицерина и жирных кислот. Животные и растительные жиры. Омыление жиров. Мыла Образцы твердых и жид- ких жиров. Растворимость жиров §39, упр. 1—5
12 Аминокислоты Аминокислоты как соедине- ния с двойственной функцией: сочетание карбоксильной груп- пы —СООН и аминогруппы — NH2. Амфотерность амино- кислот: их взаимодействие с ки- слотами и щелочами. Биологическое значение ами- нокислот Доказательство наличия функциональных групп в растворах аминокислот §40, с.183—184, упр. 1
13 Белки Белки как продукты поли- конденсации аминокислот. Пеп- тидная связь. Полипептиды. Состав и строение белков. Распознавание белков. Биологическая роль белков Цветные реакции белков. Растворение и осаждение белков. Денатурация белков §40, с. 184 и до конца, упр. 2—5
14 Углеводы Состав углеводов. Моносаха- риды, дисахариды, полисахари- ды. Сахароза. Крахмал и целлю- лоза. Биологическая роль угле- водов Образцы углеводов. Взаимодействие крахмала с иодом. Гидролиз крахмала и целлюлозы §41, с. 191—192, 194 и до конца, упр. 3, 5, 6
Продолжение
1 2 3 4 5
15 Глюкоза Состав глюкозы. Содержание ее в природных продуктах, физические и химические свой- ства, применение. Фруктоза как изомер глюко- зы. Значение и биологическая роль глюкозы Реакция «серебряного зеркала », взаимодействие глюкозы с гидроксидом ме- диа!) §41, с. 192—194, упр. 1, 2, 4
16 Полимеры Полимеры — высокомолеку- лярные соединения. Природные и синтетические полимеры. Реакции полимеризации и поликонденсации. Структура полимеров. Пластмассы и волокна Коллекция пластмасс и волокон, каучуков и биопо- лимеров §42, упр. 1—5
17-18 Обобщение и систе- матизация знаний по органической химии Генетическая связь между классами органических веществ, пример цепочки переходов от предельного углеводорода к по- липептиду
19 Контрольная работа
Тема 6. Химический практикум III. Свойства органических веществ (4 часа)
1 Получение этилена и изучение его свойств Работа № 10
2 Экспериментальные задачи по распознаванию и получению веществ Работа №11
3 Распознавание пластмасс Работа № 12
4 Распознавание волокон Работа №13
Темы-модули
1 Химия и экология (13 часов)
2 Химические вещества в сельском хозяйстве (13 часов) (рекомендуется для сельских школ)
Методические рекомендации
к урокам по решению расчетных задач
по химическим формулам
и уравнениям
Урок
«Количество вещества. Моль»
Предлагаемый вариант дифференцированного под-
хода к изучению такого важнейшего понятия, как
♦моль», представляет собой попытку трехуровневого
обучения восьмиклассников на основе базового учеб-
ного материала.
Обучение на I уровне требует от учащихся кон-
кретно-образного мышления. Учитель выделяет 2—3
основных понятия или формулы и ♦отрабатывает» их
многократно, используя игровые формы или путем
решения несложных упражнений. С помощью такого
методического приема изучаются зависимости между
массой вещества, его молярной массой и количеством
вещества, т. е. зависимости, которые отражаются хи-
мической формулой и непосредственно вытекающи-
ми из нее количественными характеристиками. По-
нятие о постоянной Авогадро (величина высокой сте-
пени абстрактности) на I уровне обучения вводится
лишь в ознакомительном плане, как вспомогательное
к понятию ♦моль», да и само понятие »моль» связы-
вается прежде всего с более конкретным понятием
♦ масса вещества».
Развитие понятий на этом уровне может быть пред-
ставлено в такой последовательности:
масса вещества---► молярная масса---» моль
62
При обучении на II уровне, который характеризу-
ется равным вкладом конкретного и абстрактного,
понятие «постоянная Авогадро» выступает в одном
ряду с понятиями «моль» и «молярная масса».
Связующим здесь является более конкретное
понятие— «масса вещества».
Ученики на этом уровне обучения должны уметь
определять массу вещества по известному числу час-
тиц.
Обучение на III уровне, где развивается абстракт-
ный уровень мышления школьников, основано на
первичности понятия «постоянная Авогадро», и по-
нятие «моль» прежде всего связывается именно с
ним, а не с массой вещества, которая в свою очередь
выступает как производное от них. Развитие понятий
на Ш уровне обучения может быть представлено в та-
кой последовательности:
постоянная Авогадро-----> моль-----► молярная
масса----» масса вещества
При обучении на Ш уровне широко используются
моделирование, прогнозирование, умозаключение.
Таким образом, содержание и методы обучения на
этом уроке для разных уровней обучения различают-
ся соотношением абстрактного и конкретного как в
плане отбора понятий, так и по глубине их отработки
на уроке.
Цели урока
I уровень. Дать понятие о количестве вещества
и единице его измерения — моль. Сформировать
представление о молярной массе вещества и научить
учащихся переходить от понятия «относительная мо-
лекулярная масса вещества» к понятию «молярная
масса вещества». Научить пользоваться ими при
определении массы вещества по известному его коли-
честву и наоборот.
II уровень. Аналогичные цели, что и для пер-
вого уровня, с введением понятия «постоянная Аво-
63
гадро». Научить школьников пользоваться этим пс
нятиём для определения числа частиц по известном
числу частиц и наоборот.
III уровень. Аналогичные цели, что и для пе
вого и второго уровней, но с применением таких пр
изводных единиц количества вещества, как кил
моль, миллимоль. Расширить представление о пост
янной Авогадро применительно к этим единицл
количества вещества. Продемонстрировать решеш
более сложных задач.
Таким образом, в целях уроков заложено и их с
держание, которое развивается по принципу наращ!
вания понятий и углубления представлений о них.
Уровни обучения различаются и степенью прим
нимости понятий. Если на I уровне достаточно, чтоб
учащиеся научились находить массу вещества по ei
количеству (и наоборот), то на II уровне не менее ваг
но научить их оперировать количеством вещества
массой для вычисления молярной и относительнс
молекулярной массы вещества. Если на I уровне тол
ко вводится понятие о постоянной Авогадро, то i
П уровне эта величина применяется для решени
задач.
Еще более усложнено содержание урока III уровн.
где понятия «моль», «миллимоль», «киломоль» и
пользуются в расчетах, аналогично, как и число ча
тиц вещества, содержащихся в них.
Методические подходы к обучению на I уровне
Для учащихся классов I уровня, вероятно, больп
подойдет вариант объяснения в соответствии с ист
рией становления понятий в химии.
Например, учитель может начать урок с вопрос
♦ Что изучает химия?» (вещества, свойства и превр
щения веществ) и продолжить беседу: «Ав чем изм
рить вещество? Температура измеряется в градуса
путь — в м, км; масса в г, мг, кг. Какие бы вы предл
жили единицы вещества?» Как правило, учени»
предлагают измерять его числом молекул или в ед
ницах массы.
64
На примере реакции
2Н2 + 02 = 2Н2О
вводится понятие «моль». Учитель задает вопрос:
«Как нужно отмерить водород и кислород, чтобы они
полностью прореагировали и образовали воду? » Уче-
ники предлагают взять на одну молекулу кислорода
две молекулы водорода. Но технически выполнить
это невозможно из-за малого размера молекул. Как
быть? А если взять столько граммов водорода, сколь-
ко весят 2 его молекулы, т. е. массой 4 г. Соответ-
ственно кислорода взять 32 г, т. е. какова его молеку-
лярная масса. Тогда поставленное вначале условие
будет соблюдено — все молекулы водорода и все моле-
кулы кислорода прореагируют друг с другом и обра-
зуют воду. Поэтому, обобщает учитель, вещество ре-
шили измерять единицей, в которой как бы соедини-
лись две величины — число молекул и масса
вещества. Такая единица называется моль (п). Чтобы
отмерить 1 моль вещества, нужно взять столько грам-
мов его, какова относительная молекулярная масса
вещества:
1 моль Н2 весит 2 г (Мг (Н2) = 2)
1 моль О2 весит 32 г (Мг (О2) = 32)
1 моль Н2О весит 18 г (Мг (Н2О) =18)
А сколько реальных частиц-молекул содержится в
1 моль любого вещества? Очевидно, что одинаковое
число. Оно называется постоянной Авогадро.
После этого учитель может дать определение поня-
тия «моль»: моль — количество вещества, которое со-
держит число атомов или молекул, равное числу
Авогадро (6 • 1023).
Количество вещества обозначается буквой п («эн»)
или v («ню»).
Масса 1 моль называется молярной массой, обо-
значается буквой М.
Молярная масса измеряется в г/моль и равна отн<»
сительной молекулярной массе вещества, например;
М(Н2О) =18 г/моль.
Если известна масса вещества т, то, рассчитав ег$
молярную массу М, можно найти количество вещест,
ва п: <
Очевидно, что справедлива и производная формула:
т = М • п
Для закрепления материала учитель может пред,
л ожить устный счет:
а) сколько граммов весит 2 моль воды; j
б) какое количество кислорода содержится в 3 г во-
дорода? , i
или решить задачи. <
Ниже предлагаются задачи, ход и запись их реше,
ния, на примере которых учащиеся осваивают поня*
тия «массавещества», «количество вещества». >
1. Какова масса 1,5 моль оксида углерода (IV)CO2?
Решение
п(СО2) =1,5 моль т = М • п М/СО2) = 12 +16 • 2 = = 44 Af(CO2) = 44 г/моль
т (СО2) = ? ти(СО2) = = 44 (г/моль) -1,5 (моль) = 66 г Ответ: т(СО2) = 66 г
2. Какое количество серной кислоты содержится в
294 г ее?
66
Решение
т (H2SO4) = 294 г т п м М r(H2SO4) = 1-2 + 32 + + 16 • 4 = 98 M(H2SO4) = 98 г/моль
n(H2SO4) = ? n(H2S()4) = = 294 (г): 98 (г/моль) = = 3 моль Ответ: n(H2SO4) = 3 моль
В качестве итогов урока учащимся предлагается
записать в тетрадях основные определения и некото-
рые выводы.
1) Количество вещества измеряется в молях п.
2) 1 моль любого вещества содержит число моле-
23
кул его, равное постоянной Авогадро Na (6 • 10 ).
3) Чтобы измерить 1 моль вещества, нужно взять
столько граммов его, какова его относительная моле-
кулярная масса Мг.
4) Масса 1 моль вещества называется молярной мас-
сой М, она измеряется в г/моль и численно равна Мг.
Задачи на дом
1. Какое количество оксида серы(У1) содержится в
96 г его?
2. Сколько весят 0,25 моль едкого натра — NaOH?
Методические подходы к обучению на II уровне
Методика обучения на II уровне хорошо отработа-
на и описана в многочисленных пособиях. Остано-
вимся лишь на заданиях следующего типа.
23
3. Известно, что 1,55-10 молекул одного из окси-
дов серы весят 16 г. Требуется найти относительную
молекулярную массу этого оксида и записать его фор-
мулу.
Решение
W= 1,5-1023
m = 16 г
1,5 1023 „
n =-------5^- = 0,25 моль
6 1023
Af = ?
M=-
n
М=бГ^^=64г/МОЛЬ
N
П Nt
M/SOJ = 32 + 16- x = 64
x = 2
Ответ: M/SO2) = 64; формула оксида серы — SO2. 1
Отметим, что на этом уровне органически сочетает-;-
ся конкретное и абстрактное в учебном материале, <
«работают» обратные логические действия: от числа 1
молекул и количества вещества учащиеся переходят.'
к молярной массе.
При формировании понятия «моль» учитель мо-.|
жет использовать методические приемы, которые!
описаны ниже для III уровня обучения, и в ознакоми-1
тельном плане ввести понятия «миллимоль» и «кило-1
моль». 1
Методические подходы к обучению на III уровне |
Для объяснения учебного материала учитель мо-1
жет воспользоваться традиционной методикой, опи-1
санной в пособиях последних лет для учителей. Е
можно дополнить, используя по аналогии прием пе-|
рехода к производным единицам количества вещест-1
ва от основной — моль. Это можно сделать, исходя из 3
хорошо знакомого учащимся понятия «масса»: |
«В чем измеряется масса?» — в граммах. 3
♦А в тысячу раз большая единица массы?» — ки-1
лограмм. J
«Ав тысячу раз меньшая единица массы?» — мил-1
лиграмм. j
Соответственно молярная масса вещества будет!
иметь единицы г/моль, кг/кмоль, мг/ммоль.
68
Аналогично можно рассмотреть и определение
23
числа молекул в 1 моль — 6-10 , в миллимоль —
6 • Ю20 и в 1 киломоль — 6 • 1026.
Эти объяснения можно свести в следующую табли-
цу-
Некоторые физико-химические величины
и единицы их измерения
Величина и ее обозна- чение Единицы величины
основная в 1000 раз большая в 1000 раз меньшая
Масса т г кг мг
Количест- во веще- ства п моль кмоль ммоль
Моляр- ная масса М г/моль кг/кмоль мг/ммоль
Число мо- лекул в единице количест- ва веще- ства — постоян- ная Аво- гадро Аа 6-1023 в 1 моль 6 • ю26 в 1 кмоль 6 • ю20 в 1 ммоль
Объем га- за V Z 3. Л (дм ) 3 м 1 3. мл (мм )
Моляр- ный объем газа Vm л/моль (22,4л/моль при нор- мальных условиях) з , м /кмоль (22,4 м3/кмоль при нормаль- ных условиях) мл/ммоль (22,4мл/ммоль при нормаль- ных условиях)
Примечание: последние две графы можно ос-
тавить пустыми и заполнить их после изучения поня-
тия «молярный объем» газообразных веществ.
69
При отработке понятий, рассматриваемых на уро-
ке, можно использовать устный счет (упражнения,
аналогичные таковым для I уровня), например сле-
дующие.
4. Сколько молекул кислорода содержится в
2 моль его? Какую массу будет иметь это количество
кислорода?
5. Какую массу имеют 5 киломоль водорода?
Сколько молекул водорода содержится в этом его
количестве?
6. Сколько весит 3 • 1О20 молекул воды?
Если ученики затруднятся сразу дать ответ на это
устное упражнение, то можно сначала задать такие
вопросы: Какова формула водорода (кислорода, во-
ды)? Какова его относительная молекулярная масса?
Молярная? Киломолярная? Миллимолярная?
Для закрепления знаний учащихся по теме «Коли-
чество вещества. Моль» рекомендуем учителям про-
демонстрировать ход решения следующих задач.
7. Какую массу имеют 9 • 1026 молекул серной ки-
слоты H2SO4?
Предлагаемые ход и запись решения:
MH2so4) = = 9 • 1026 (моле- кул) т = М • п Mr(H2SO4) = 1 • 2 + 32 + + 16 • 4 = 98 M(H2SO4) = 98 кг/кмоль
m(H2SO4) = ? N 9 • 1026
"(IW) ’ ““
= 1,5 (кмоль) Ответ: m(H2SO4) = = 98 кг/кмоль • 1,5 кмоль = = 147 кг
При объяснении хода решения задачи важно обра-
тить внимание учащихся на выбор и соотношение
единиц измерения.
70
8. Какова масса одной молекулы глюкозы
С6Н12О6?
Решение
Формула глюкозы С6Н2О6 несет следующую ин-
формацию:
1) принадлежность — сложное вещество;
2) качественный состав вещества — построено из
атомов трех элементов: углерода, водорода и кисло-
рода;
3) количественный состав вещества — число ато-
мов каждого элемента в молекуле, и соответственно
можно рассчитать их массовую долю w;
4) относительная молекулярная масса глюкозы
Мг = 12 6 + 1 • 12 + 16 • 6 = 180;
5) молярная масса глюкозы М = 180 г/моль;
6) 1 молекула глюкозы весит:
180 ОП 1 л-23
----== = 30•10 г
6 10
Ответ: т (молекулы С6Н12О6) = 30-10 23 г
Цикл уроков
«Химические расчеты, связанные
с оперированием долей как количественно]
характеристикой вещества»
Цели уроков
1. На основе известного из курса математики нон.
тия «часть от целого» сформировать универсальн»
расчетное понятие «доля».
2. Отнести понятие «доля» к химическим вещее
вам и рассмотреть такие его разновидности, как дол
химического элемента в веществе, доля (объемш
или массовая) компонента в смеси (растворе, газовс
смеси), доля примеси (как частного случая компоне
та смеси), выход продукта реакции от теоретичес»
возможного.
Ниже предлагаются задачи разной степени услоз
ненности и ход их решения, на примере которых уч
щиеся смогут освоить подходы и принципы расчет»
по химическим формулам и уравнениям с использ
ванием фундаментальных понятий и законов химии
Урок
«Расчеты с оперированием долей
химического элемента в веществе
по химическим формулам»
В начале урока учитель напоминает, как находить
часть от целого, например, разрезает яблоко на четы-
ре части, берет одну дольку и спрашивает: «Какую
часть я взял? » Очевиден ответ: «Одну четвертую». За-
тем учитель спрашивает: «А если я взял две дольки? »
Ученики, конечно, ответят: «Две четвертых, или по-
ловину, от целого яблока».
Далее учитель на примерах разъясняет, как произ-
водить химические расчеты, основанные на такой
важной характеристике как доля химического эле-
мента в соединении.
Задача 1. Какова массовая доля калия, азота и ки-
слорода в калийной селитре? (Если ученики не знают
формулу этого вещества, учитель записывает ее.)
Решение
1. Определяем относительную молекулярную мас-
су вещества:
Mr(KNO3) = 39 + 14 + 16 • 3 = 101
2. Находим массовые доли элементов в калийной
селитре:
a) ir(K) = = 0,3802, или 38,02%
б) w(N) = = 0,1380, или 13,80%
в) ia(O) = 48,18%
Здесь важно показать практическое значение мас-
совой доли химического элемента для определения
массы его соединения. Это демонстрирует приведен-
ный ниже пример, который условно также относится
к рассматриваемому типу задач.
Задача 2. Массовая доля белка в организме челове-
ка составляет 17% от массы его тела. В свою очередь,
73
массовая доля азота в белке равна 16%. Найдите мас-
су азота в организме человека массой 80 кг.
Решение
1. Определяем массу белка в организме:
т(белка) = /п(организма) • отбелка)
т(белка) = 80 • 0,17 = 13,6 кг
2. Аналогично определяем массу азота:
m(N) = т(белка) • u>(N)
m(N) = 13,6 • 0,16 = 2,176 кг
При расчетах по химическим формулам важно по-
казать их практическое значение для определения
массы продукта по массе сырья, без использования
уравнений химических реакций.
Задача 3. Сколько килограммов серной кислоты
H2SO4 может быть получено из 400 кг серы?
Решение
1 кмоль серы S образует 1 кмоль H2SO4
или 32 кг S---* 98 кг H2SO4
а 400 кг---* х кг H2SO4
Отсюда х = = 122>5 кг (H2SO4)
Можно предложить более сложную задачу, также
основанную на законе сохранения массы веществ.
Задача 4. Сколько килограммов серной кислоты
H2SO4 может быть получено из 1800 кг колчедана,
имеющего формулу FeS2?
Решение
Из формул H2SO4 и FeS2 видно, что из 2 кмоль FeS2
образуется 2 кмоль H2SO4
1 кмоль FeS2--» 2 кмоль H2SO4
или 120 кг FeS2--* 196 кг H2SO4,
а 180 кг FeS2-* х кг H2SO4
Отсюда х = —г™— = 245 кг (H2SO4)
74
Хорошо подготовленным ученикам можно предло-
жить задачи, в которых значение массовой доли хи-
мического элемента используется для вывода форму-
лы вещества.
Задача 5. Определите формулу соединения серы с
кислородом, если известно, что массовая доля серы в
нем равна 40%.
Решение
Находим относительную молекулярную массу со-
единения:
u>(S) = = 0,4
Г
Отсюда М = = 80
U ,о
Определяем формулу оксида:
Mr(SOx) = 32 + 16 • х = 80
х = 3, следовательно, формула оксида — SO3
Для закрепления материала урока учащиеся само-
стоятельно решают ряд задач.
Задача 6. Сколько граммов мяса должен содер-
жать суточный рацион человека, если суточная норма
потребления белка составляет 100 г, а содержание
белка в мясе равно 18% ?
Задача 7. Массовая доля костей в организме чело-
века составляет 20% от общей его массы. В свою оче-
редь, на долю фосфата кальция, входящего в состав
костей, приходится также 20% от массы костей.
Сколько килограммов фосфата кальция содержится в
организме человека массой 70 кг? Сколько килограм-
мов фосфора содержится, если формула фосфата
кальция Са3(РО4)2?
Задача 8. В организме человека в среднем содер-
жится 5 л крови, плотность которой составляет
1,050 г/мл. Сколько граммов железа содержится в
крови человека, если массовая доля гемоглобина со-
ставляет 12%, а массовая доля железа в гемоглобине
составляет 5% ?
75
Урок
«Расчеты параметров состава смесей
(растворов)
с использованием долей компонента»
В начале урока учитель напоминает об основных
параметрах, выражающих состав смесей веществ 5
(растворов):
1) массовая доля
^=т(вещества)
т (смеси) '
2) объемная доля
^вещества) 000/
У(смеси) '
Производные формулы ребята выведут сами:
1) масса вещества
т(вещества) = т(смеси) • w
, . пг(вещества)
т(смеси) = ———------
2) объем вещества I
^(вещества) — Р(смеси) • <р
. У(вешества)
У( смеси) = ----
Предлагаем примеры типовых задач.
Задача 9. Сколько граммов сахара и сколько мил-;
лилитров воды нужно взять, чтобы приготовить 250
12% -ного раствора его?
Решение
1. Определяем массу сахара:
т(сах.) = т(р-ра) • w = 250 (г) • 0,12 = 30 г
2. Находим объем воды:
а) т(Н20) = т(р-ра) - т(сах.) = 250 (г) - 30 (г)
= 220 г
76
га v/n гл m<H2°) 200 (г) onn
б) V(H2O) = = :-- . = 200 мл
z ' р(Н2О) 1 (г/мл)
Решение задачи удобно записать в такой форме:
zn(p-pa) = 250 г пг(сах.) = = тп(р-ра) • w /п(сах.) = 250 • 0,12 = = 30 г
щ(сах.) = 0,12 т(Н20) = = т(р-ра) - - /п(сах.) т(Н20) = 250 - 30 = = 220 г
/и(сах.) = ? Р(Н2О) = ? /п(Н90) W»" р(Н2О) У(Н2О)=?20 = = 220 мл
Задача 10. Слили два раствора калийной селитры:
160 г 5%-ного и 140 г 20%-кого. Какова массовая до-
ля калийной селитры в полученном растворе?
Решение
1. Определяем общую массу полученного раствора:
т(р-ра общ.) = т(5%-ного р-ра) + ?п(20%-ного
р-ра) = 160 (г) + 140 (г) = 300 г
2. Находим массу калийной селитры в полученном
растворе:
m(KN03 в 5%-ном р-ре) = 160 • 0,05 = 8 г
m(KN03 в 20%-ном р-ре) = 140 • 0,02 = 28 г
m(KN03 общ.) = 8 (г) + 28 (г) = 36 г
3. Вычислим массовую долю KNO3 в полученном
растворе:
т(ККО3общ.) _ 36(г)
т(р-ра общ.) ЗОО(г)
= 0,12т или 12%
Далее разбираются несколько усложненные зада-
чи с использованием плотности раствора. В этих рас-
четах ученики оперируют формулами:
77
Р = (г/мл), m = V-p, V — :
Задача U.K 200 мл 20%-ного раствора гидрокси- J
да натрия NaOH (р = 1,25 г/мл) прибавили 20 г твер-J
дого NaOH. Какова массовая доля NaOH в получен-j
ном растворе?
Решение
1. Определяем общую массу полученного раствора: 1
а) т( 20%-ного р-ра) = Р(20%-ного р-ра) • р =д
= 200 (мл) х 1,25 (г/мл) = 250 г
б) тп(р-ра общ.) = т(20% -ного р-ра) + m(NaOH) =1
= 250 + 20 = 270 г 1
2. Определяем общую массу NaOH в полученном!
растворе: д
a) m(NaOH в 20% -ном р-ре) = 250 (г) • 0,2 = 50 г J
б) m(NaOH общ.) = 50 + 20 = 70 г
3. Находим массовую долю NaOH в полученном]
растворе:
m(NaOH) 70 „ оео/
и> = —4---г2 = = 0,26, или 26% 1
zn(p-pa) 270 I;
Для ребят с высоким уровнем абстрактного мыш-Я
ления и овладевших навыками химических расчетов I
можно предложить задачи, в которых необходимо ис-1
пользование таких характеристик, как молярный]
объем газов, количество вещества, молярная масса. Я
Задача 12. В 650 мл 5% -ного раствора соляной ки-Д
слоты НС1 (р = 1,2 г/мл) растворили еще 33,6 л газо-Я
образного хлороводорода. Какой стала массовая доля!
НС1 в полученном растворе? Я
Решение - |
1. Определяем общую массу полученного раствора!
как сумму масс раствора и газообразного вещества:
тп(общ. р-ра) = тп(5%-ного р-ра) + тп(газ. НС1) J
а) ти(5%-ного р-ра) = V • р = 650 (мл) • 1,2 (г/мл)
= 780 г !
78
б) массу газообразного НС1 вычисляем по формуле
ти(газ. НС1) = ЛГ(НС1) (г/моль) • п (моль)
Af(HCl) = 1 + 35,5 = 36,5 г/моль
Количество вещества п находим по объему хлоро-
водорода, используя значение молярного объема газа
V-
т
~ _ V _ 33,6(л) . , -
п vm 22,4(л/моль) ’5 МОЛЬ
Отсюда тп(газ. НС1) = 36,5 (г/моль) • 1,5 (моль) =
= 54,75 г
в) /п(общ. р-ра) = 780 + 54,75 = 834, 75 г
2. Определяем общую массу НС1 в полученном рас-
творе:
тп(НС1 общ.) = тп(НС1 в 5%-ном р-ре) + тп(НС1 газ.)
а) тп(НС1 в 5%-ном р-ре) = /п(5%-ного р-ра) х
х щ(НС1 в 5%-ном р-ре) = 780 • 0,05 = 39 г
б) ти(НС1 общ.) = 39 + 54,75 = 93,75 г
3. Находим массовую долю НС1 в полученном рас-
творе:
= т(НС1 общ.) = 93, 75
W zn(p-pa общ.) 834,75
Следующей ступенью усложнения будут задачи,
в которых производится расчет по формуле соли, со-
держащей кристаллизационную воду, т. е. по форму-
ле кристаллогидрата. Эти задачи можно предложить
для индивидуального домашнего задания сильным
учащимся.
Задача 13. В 500 мл 12%-ного раствора сульфата
меди(П) CuSO4 (р = 1,5 г/мл) растворили 500 г медно-
го купороса CuSO4 • 5Н2О. Какой стала массовая доля
сульфата меди(П) в полученном растворе?
Решение
1. Определяем массу полученного раствора:
тп(р-ра общ.) = тп(12% -ного р-ра) + m(CuSO4 • 5Н2О)
79
творе соли:
zn(CuSO4 в 12%-ном р-ре) = /п(12%-ного р-ра) х
х u>(CuSO4 в 12%-ном р-ре)
т = 750 • 0,12 = 90 г 1
3. Находим массу CuSO4 в 500 г медного купороса. J
Для этого сначала рассчитываем молярную массу 1
CuSO4 • 5Н2О:
M(CuSO4 • 5Н2О) - 64 + 32 + 16 • 4 + 5(1 • 2 + 16) = 1
= 160 + 90 = 250 г/моль
Отсюда следует, что в 250 г CuSO4 5Н2О содержит- 3
ся 160 г CuSO4, тогда в 500 г содержится 320 г CuSO4. /
4. Общая масса CuSO4 в полученном растворе равна: 1
/n(CuSO4 общ.) = 90 + 320 = 410 г
5. Находим массовую долю CuSO4 в полученном |
растворе:
m(CuS04o6iq.)
/п(р-ра общ.)
= 0,33, или 33%
Для школьного тура химической олимпиады мож- ;
но предложить задачи, по условиям которых в исход-
ных растворах проводятся химические реакции с об- J
разованием газообразных продуктов и нужно опреде- ’
лить параметры состава вновь полученных растворов.
Задача 14. Требуется найти массовую долю гидро-i
ксида натрия в растворе, который был получен в ре- j
зультате растворения 69 г Na в 460 мл 15%-ного рас-3
твора гидроксида натрия (р = 1,5 г/мл).
80
Решение
1. Записываем уравнение химической реакции,
которая происходит при растворении натрия в исход-
ном водном растворе:
2Na + 2Н2О = 2NaOH + Н2|
Отсюда следует, что общая масса полученного рас-
твора составит:
/п(р-ра общ.) = т( 15%-ного р-ра) + m(Na) - m(H2)
а) т( 15%-ного р-ра) = V- р = 460 (мл) • 1,5 (г/мл) =
= 690 г
б) Массу выделяемого водорода находим, исходя из
уравнения реакции
69 г хг
2Na + 2Н2О = 2NaOH + Н12
2 23 г 2 г
(Молярная масса Na и Н2 соответственно равна
23 г/моль и 2 г/моль.)
69 х 69 2 о гтт ч
2Тз-2:Х"-«-"3г<Н^
в) /п(р-ра общ.) = 690 + 69 - 3 = 756 г
2. Определяем общую массу NaOH в полученном
растворе:
m(NaOH общ.) = m(NaOH в 15%-ном р-ре) +
+ m(NaOH, образованном в результате реакции)
a) m(NaOH в 15%-ном р-ре) = т( 15%-ного р-ра) х
х ir(NaOH в 15%-ном р-ре) = 690 • 0,15 = 103,5 г
б) m(NaOH, образованного в результате реакции)
найдем по уравнению реакции:
69 г х г
2Na + 2Н2О = 2NaOH + Н2
2 23 г 2 40 г
(Молярная масса NaOH равна 23 + 16 + 1 = 40 г/моль.)
69 х 80 69 -
2~23 = Г4б; Х “ ~46~ = 120 Г <Nfl0H)
в) m(NaOH общ.) = 103,5 + 120 = 223,5 г
6 1985
3. Находим массовую долю NaOH в получена
растворе:
= т(ЫаОНобщ-) _ 223, 5
т(р-раобщ.) 756 г
Задачи
для самостоятельного решения
15. В 160мл 20%-ного раствора серной кислот
H2SO4 (р = 1,15 г/мл) растворили еще 42 г H2SO4. К
кой стала массовая доля H2SO4 в полученном ра
творе?
16. Из 320 г 5%-ного раствора гидроксида натри
NaOH выпарили 120 г воды. Какой стала массовая д
ля NaOH в растворе?
Для сильных ребят предлагается дополнител
ное задание: ♦ Сколько молекул воды выпарили?»
17. В 180 мл воды растворили 11,2 л хлороводор
да. Требуется найти массовую долю НС1 в полученно
растворе.
Для сильных ребят: «Сколько молекул Н2О
сколько молекул НС1 содержится в полученно
растворе?» •
Кроме того, для сильных ребят можно предл<
жить задачи.
18. В 880 мл 2%-ного раствора сернистой кислот:
H2SO3 (р = 1,1 г/мл) растворили 33,6 л оксида сер:
(IV). Какой стала массовая доля H2SO3 в полученно,
растворе?
19. В 620 мл 10%-ного раствора карбоната натри,
Na2CO3 (р = 1,5 г/мл) растворили еще 588 г кристал-
лической соды Na2CO3 • ЮН2О. Какой стала массовая'
доля карбоната натрия в полученном растворе?’
Сколько молекул воды содержится в нем?
20. В 240г 5%-ного раствора гидроксида лития
LiOH растворили еще 49 г лития. Какой стала массо-'
вая доля LiOH в полученном растворе? Сколько моле-
кул водорода при этом выделилось?
82
Урок
«Расчеты с использованием понятия
«массовая доля примеси»
При формировании понятия «массовая доля ком-
понента смеси» мы не рекомендуем раздельное пред-
ставление разновидностей этого понятия — «массо-
вая доля растворенного вещества» и «массовая доля
примесей». Учащиеся должны четко усвоить, что ес-
ли речь идет о растворах, то масса вещества в нем на-
ходится по формуле:
/п(вещества) = тп(раствора) • w,
а если в задаче говорится о примеси, то масса вещест-
ва в смеси определяется по формуле:
тп(вещества) = /п(смеси) • и>,
при этом вначале по известной доле примеси рассчи-
тывается массовая доля вещества в смеси
w = 100% - w(примеси в %)
Например, чтобы найти массу вещества в смеси
его, где ш(примеси) = 20%, нужно задать такой во-
прос: «Если в смеси содержится 20% примесей, то
сколько там чистого вещества?» Они без затруднений
определят, что чистого вещества будет 80%, т. е.
о>(в-ва) = 0,8.
Рассмотрим типичные задачи на заданную тему.
Задача 21. Какой объем водорода образуется при
растворении в соляной кислоте 325 кг цинка, содер-
жащего 20% примесей?
На этом примере мы рекомендуем учителям отра-
ботать с учащимися алгоритм решения расчетных за-
дач с использованием уравнений химических реак-
ций. Ход решения таких задач можно разделить на
пять шагов:
1) составляют уравнение химической реакции
(т. е. обязательно уравнивают — расставляют коэф-
фициенты);
2) над соответствующими формулами в уравнении
записывают количественную характеристику веще-
ства с единицами измерения, которая известна Или ее
можно рассчитать, исходя из условия задачи, и иско-
мую величину (х) также с единицами ее измерения;
3) под этими формулами записывают соответст-
вующие количественные величины, задаваемые са-
мим уравнением, также с единицами уравнения;
4) составляют и решают пропорцию;
5) оформляют ответ.
Решение
1. Составляем уравнение реакции:
Zn + 2НС1 = ZnCI2 + Н2
Будет очень полезно, если на начальных этапах ре-
бята научатся читать химическое уравнение, напри-
мер, так: «Из уравнения реакции видно, что при взаи-
модействии 1 киломоль цинка расходуется 2 кило-
моль соляной кислоты и при этом образуется
1 киломоль хлорида цинка и 1 киломоль водорода».
2. Над формулами веществ записываем массу цин-
ка, вступившего в реакцию, — ее предварительно
рассчитываем, исходя из условия задачи, и искомую
величину, которую требуется определись.
m(Zn) = т(образца) • u>(Zn)
u>(Zn) = 1 - о’(примеси) = 1 - 0,2 = 0,8
m(Zn) = 325 • 0,8 = 260 кг
260 кг х м3
Zn + 2HCI = ZnCl + Н2
Здесь важно обратить внимание на то, что масса в
задаче дана в кг, поэтому расчеты следует вести с ис-
пользованием количества вещества в киломолях,
с з ~ ~
а объема газов — в м , т. е. через киломолярныи объ-
ем, равный 22,4 м3/кмоль.
3. Под формулой цинка записываем соответствен-
но массу 1 киломоль его, а под формулой водорода —
объем 1 киломоль его:
84
260 кг v * * * * х м
Zn + 2HCI = ZnCl2 + Н2
65 кг 22, 4м3
M(Zn) = 65 кг/моль.
4. Составляем и решаем пропорцию:
260 х 260 22,4 оп с з . __.
-xz- = 5^-7 х = —= 89,6 м (водорода)
DO 4 00
5. Записываем ответ:
У(Н2) = 89,6 м3
Аналогично усвоению учащимися понятия «массо-
вая доля вещества в смеси* формируется и понятие
«объемная доля компонента в смеси». Предлагаем
учителям разобрать на уроке решение типовых задач
с этой разновидностью понятия «доля».
Задача 22. В состав воздуха входит 21% кислорода
и 78% азота по объему. Рассчитайте, сколько грам-
мов кислорода содержится в 125 л воздуха при нор-
мальных условиях.
Решение
1. Находим объем кислорода, содержащийся в
125 л воздуха:
Р(О2) = Р(возд.) • ф
У(02) = 125 (л) • 0,21 = 26,25 л
2. Определяем количество кислорода (число моль)
в данном объеме газа:
v Г(Ог) 26, 25(л) , , -
п(О9) = т, = оо ' = 1,17 моль
' 2 Vm 22,4(л/моль)
3. Рассчитаем массу кислорода в 125 л воздуха:
т(О2) = М(О2) • п
ЛГ(О2) = 16 • 2 = 32 г/моль
тп(О2) = 32 (г/моль) *1,17 (моль) = 37,44 г
85
Для того чтобы показать взаимосвязь между мае-<
совой и объемной долями, можно предложить на этом
уроке комбинированные задачи.
Задача 23. Какой объем воздуха потребуется для
сжигания 320 кг серы, содержащей 25% примесей?
Решение
1. Составляем уравнение химической реакции:
S + О2 = SO2
2. Рассчитаем массу чистой серы, вступающей в ре-
акцию:
u>(S) = 1 - и>(примеси) = 1 - 0,25 = 0,75
m(S) = т(смеси) • w = 320 (кг) • 0,75 = 240 кг
Искомую величину будем находить по кислороду,
прореагировавшему с серой. Следовательно, можем
записать
з
240 кг 1 м
S + о2 =so2
22,4 м3
3. Под формулой серы записываем массу 1 кило-
моль ее, а под формулой кислорода объем 1 киломоль
его:
240 кг 3 X м
S + о2 =so2
32 кг 22,4 м3
4. Составляем и решаем пропорцию:
240 _ х _ 22, 4 240 _ . _с з .
32 22,4 ’ Х 32 М
По объемной доле кислорода находим необходи-
мый объем воздуха, учитывая, что в воздухе содер-
жится 21% О2:
з
У(возд.)= Ц^р=840м3
V,
з
5. Запишем ответ: Р(возд.) = 840 м
86
Задачи
для самостоятельного решения
24. Сколько граммов магния, содержащего 12%
примесей, потребуется для реакции с соляной кис-
лотой — HCI для получения 67,2 л водорода?
25. Найти массу кислорода, содержащуюся в 660 м3
воздуха, зная, что объемная доля кислорода в воздухе
составляет 21%.
26. Какой объем воздуха потребуется для сжига-
ния 270 мг алюминия, содержащего 40% негорючих
примесей?
Дополнительное задание
для сильных учащихся
Сколько молекул кислорода вступит в реакцию и
какое количество оксида алюминия при этом образу-
ется?
27. Сколько граммов угля, содержащего 20% при-
месей, сожгли, если при реакции потребовалось 212 л
воздуха?
Дополнительное задание
для сильных учащихся
Сколько молекул оксида углерода(1У) образова-
лось при этом?
Обобщающий урок
«Расчеты по химическим
формулам и уравнениям
с использованием понятия «доля»
В соответствии с учебной программой этому заклвд
чительному уроку по теме, посвященной решение
химических расчетных задач, предшествует практИ;
ческое занятие: «Определение выхода продукта реек
ции от теоретически возможного». Поэтому в начал»
этого урока учитель повторяет с учащимися понятна
«выход продукта реакции». Ученики должны запой
нить и усвоить основную формулу для расчета выхода
продукта реакции W как доли от его массы или объе-
ма от теоретически возможной величины:
w = m (Продукт) ирод у кт) Я
т(теор.) К(теор.) ' iUU/o) Я
Для отработки понятия «доля выхода» продукте
реакции можно предложить решение'на уроке слей
дующих задач. Я
Задача 28. Какой объем воздуха потребуется дляЯ
сжигания 620 мг фосфора, содержащего 40% приме I
сей? Какова масса полученного при этом оксида фос I
фора(У), если его выход составляет 80% от теоретиче-1
ски возможного? 1
Решение 1
1. Составляем уравнение химической реакции: I
4Р + 5О2 = 2Р2О5 1
2. Расставляем известные и неизвестные величины ]
над формулами в уравнении реакции. Известной ве-
личиной является масса чистого фосфора, которую >
находим, исходя из условия реакции:
ш(Р) = т(исх. вещество) • ir(P)
HP) = Ю0% - 40% = 60%, или 0,4 1
m(P) = 620 • 0,6 = 372 мг J
88
Неизвестными величинами являются объем про-
реагировавшего кислорода (х мл 02) и масса образуе-
мого оксида Р2О5 (х мг Р2О5) — теоретически возмож-
ная величина.
3. Под формулами веществ записываем
а) массу 4 ммоль фосфора:
М(Р) = 31 мг/ммоль;
/п(4Р) = 31 (мг/ммоль) • 4 (ммоль) = 124 мг
б) объем 5 ммоль кислорода:
V(5O2) = 22,4 (мл/ммоль) • 5 (ммоль) = 112 мл
в) массу 2 ммоль Р2О5:
М(Р2О5) = 31-2 + 16*5 = 142 мг/ммоль
тп(2Р2О6) = 142 (мг/ммоль) • 2 (моль) = 284 мг
Итак, записываем
372 мг х мл х мг
4Р + 5О2 = 2P2Os
124 мг 11,2 мл 284 мг
4. Составляем и решаем пропорции:
. 372 х 112-372 оо„ .
а) 124 112’ Х 124 336мл(О2)
Отсюда находим объем воздуха:
... ч Г(О2) 336(мл)
= ф(О^ - -б^Г" ~ 1680 мл
,. 372 х 372 284 о,о
б) 124 284’ Х 124 852 МГ
Отсюда рассчитываем массу продукта от теорети-
чески возможного:
zn(P2O5) = /п(теор.) • W ~ 852 мг • 0,8 = 681,6 мг
5. Записываем ответ: У(возд.) = 1680 мл; /п(Р2О5) =
= 681,6 мг
89
Рекомендуется разобрать ход решения и обратных
задач, в частности, рассчитать выход продукта реак-
ции по его фактической массе или объему или найти
массу вещества-реагента по известному выходу про-
дукта реакции.
Задача 29. При растворении в воде 230 г натрия,
содержащего 25% примесей, получено 78 л водорода.
Сколько это составляет процентов от теоретически
возможного?
Если ученики еще не знают, как взаимодействует
натрий с водой, им нужно будет дать уравнение хими-
ческой реакции:
2Na + 2Н2О = 2NaOH + Н2
Задача 30. Сколько килограммов магния сожгли,
если при этом было получено 120 кг оксида магния,
что составляет 75% от тео'ретически возможного?
Для сильных и средних ребят эту задачу можно до- :
полнить заданием: какой объем воздуха потребуется
для сжигания этой массы магния?
В завершение урока для сильных и средних ребят
можно предложить решение задачи, когда одно из
реагирующих веществ дано в избытке.
Задача 31. Какой объем углекислого газа может
быть получен при взаимодействии 250 г известняка
(карбоната кальция СаСО3), содержащего 20% при-
месей, с 730 г 30%-ного раствора соляной кислоты
HCI, если выход СО2 составляет 75% от теоретически
возможного?
Решение
1. Записываем уравнение реакции
СаСО3 + 2НС1 = СаС12 + Н2О + СО2
2. Расставляем известные и неизвестные величи-
ны. Для этого сначала рассчитываем количества про-
реагировавших карбоната кальция и соляной кисло-
ты (число моль).
а) Определим массу чистого СаСО3 по его массовой
доле (1 - 0,2 = 0,8):
90
m(CaCO3) = 250 (г) • 0,8 = 200 г
т(СаСОч)
"<СаС°з)=лдс^соГ)
М(СаСО3) = 40 + 12 + 16-3 = 100 г/моль
1
п(СаСО3) = ; = 2 моль
' 100(г/моль)
б) Аналогично находим количество НС1 по массо-
вой доле ее в растворе:
zn(HCl) = 730(г) • 0,3 = 219 г
М(НС1) = 1 + 35,5 = 36,5 г/моль
п(НС1) = t19(r) ч = 6 моль
' 9 36,5(г/моль)
Теперь можем записать
2 моль 6 моль х л
СаСО3 + 2HCI - СаС12 + СО2 + Н2О
3. Под формулами веществ укажем их количества
t J и объемы, заданные химическим уравнением:
2 моль 6 моль х л
Н СаСО3 + 2НС1 = СаС12 + СО2 + Н2О
1 моль 2 моль 22,4 л
J Далее определяем, какой реагент находится в из-
c. бытке. Для этого потребуется рассуждение типа: «Из
; уравнения химической реакции видно, что на 1 моль
; СаСО3 приходится 2 моль НС1. Следовательно, на
! 2 моль СаСО3 потребуется 4 моль НС1. А в условии за-
!:! дачи дано 6 моль НС1, т. е. соляная кислота взята в
I избытке. Можно сказать, что СаСО3 полностью про-
t реагирует с кислотой.
Очевидно, что расчет продукта реакции должен
г проводиться по реагенту, который полностью прореа-
| гирует с реагентом в избытке.
I 91
В обсуждаемой задаче количество продукта реак
ции — углекислого газа находим по количеству про.
реагировавшего СаСО3.
4. Составляем и решаем пропорцию:
1=2Г4; х = 44,8л(СО2)
Находим выход СО2 от теоретически возможного:
У(СО2) = 44,8 (л) • 0,75 = 33,6 л
5. Записываем ответ: V(CO2) = 33,6 л
Задачи
для самостоятельного решения
32. Какой объем воздуха потребуется для сжига
ния 120 граммов угля, содержащего 10% примесей'
Сколько граммов оксида углерода(1У) при этом обра
зуется, если его выход составляет 82% от теоретиче*
ски возможного?
Дополнительное задание
для сильных ребят
Сколько молекул кислорода вступило в реакцию I
сколько молекул азота находилось в качестве приме
сей в необходимом для сжигания угля объеме воздуха
33. Какой объем водорода образуется при взаимо
действии 120 г магния, содержащего 25% примесей
с 730 г 25%-ной соляной кислоты, если выход водоро
да составляет 90% от теоретически возможного?
Методические рекомендации
к проведению работ
химического практикума
Практическая работа
«Наблюдение за горящей свечой»
Цель работы
Заложить практические основы важнейшего мето-
да познания химических явлений — наблюдения и
умения описывать его.
Научить школьников применять на практике изу-
ченные на предыдущем занятии приборы и оборудо-
вание.
В ходе самостоятельной работы школьники долж-
ны отметить существенные отличия физических и хи-
мических явлений.
На примере реакции горения свечи проиллюстри-
ровать зависимость хода реакции от условий ее прове-
дения.
Обучить простейшим приемам проведения качест-
венных реакций на примере обнаружения продуктов
горения свечи.
К этому занятию ребята должны принести свечу
или огарок, кусочек жести (можно крышку от стек-
лянных банок) — для внесения в зону темного конуса
пламени свечи и обнаружения копоти, резиновую
грушу (ее можно заменить на небольшую пластмассо-
вую бутылочку, в пробку которой плотно вставлена
стеклянная трубка) — для продувания воздуха в пла-
мя свечи.
В ходе обсуждения работы после ее выполнения бу-
дет весьма показательным выразить наблюдаемые
93
химические явления с помощью уравнений. При это»
учитель сначала обращает внимание на химически!
состав свечей — парафиновые, предельные углеводо
роды и на примере ряда таких углеводородов (жид
ких и твердых) предлагает записать уравнения на
блюдаемых реакций горения:
С7Н16 + 02
Гептан
CgHie + О2 "
Октан
C17H36 + ^2
Гептадекан
Практическая работа
« Анализ почвы и воды»
Цель работы
Закрепить у школьников умение наблюдать за яв-
лениями, описывать их и делать соответствующие
выводы.
Продолжить формирование умений и навыков в
работе с использованием лабораторного оборудования
для проведения химического эксперимента.
Научить выполнять операции в простейших спосо-
бах разделения смесей: отстаивание, фильтрование,
выпаривание.
Обучить практике элементарного анализа на при-
мере оценки качества воды (определение ее прозрач-
ности и запаха).
Научить ребят делать практические выводы из
проведенного анализа.
Этот урок можно рассматривать как практическую
иллюстрацию межпредметных связей химии с други-
ми дисциплинами, и прежде всего с биологией.
Аналогичный анализ ребята выполняли на уроках
природоведения и ботаники, когда изучали состав
почвы и доказывали, что в ее состав входят вода, воз-
дух, песок, глина, органические вещества (перегной)
и минеральные соли.
Операцию по выжиганию органических веществ
из почвы на этом занятии. рекомендуется не про-
водить — кабинет заполнится дымом и неприятным
запахом. Будет лучше, если в начале занятия учитель
напомнит, как определяется наличие перегноя в поч-
ве, и сам проведет прокаливание ее образца до появле-
ния дыма. Весь последующий анализ ребята проводят
с образцами прокаленной почвы (можно и не выжи-
гать почву — на общий анализ наличие органики не
скажется).
Первая часть работы — анализ почвы — является
аналогом ставшему классическим в школьном обуче-
нии практическому занятию «Очистка поваренной
95
соли»: те же операции отстаивания, фильтрования и
выпаривания смесей. Однако предлагаемая здесь ра-
бота несет большую дидактическую нагрузку: уча-
щиеся на практике выявляют межпредметные связи.
К тому же она имеет большое прикладное значение.
На основании этой работы делаются выводы о том,
как взаимосвязаны состав почвы и ее плодородие. Бу-
дет очень полезно связать плодородие почвы с прави-
лами выращивания комнатных растений, с подкорм-
кой растений на дачных и приусадебных или фермер-
ских участках.
В заключение этой части работы учитель может по-
казать значение почвы как категории нравственной:
в Японии почву продают чуть ли не квадратными сан-
тиметрами, в Западной Европе плодородный слой
почвы при промышленном и гражданском строитель-
стве бережно срезают и свозят в специальные банки,
в Голландии не было большей трагедии для народа,
когда фашисты в годы мировой войны вывозили из
страны рукотворно созданную на протяжении многих
десятилетий почву в Германию. А что у нас? Ведь Рос-
сия обладает самыми большими в мире запасами чер-
нозема, и эти запасы быстро сокращаются из-за без-
думного и бездушного обращения с ними. Земле ну-
жен чуткий и бережный хозяин.
Вторая часть урока — анализ воды — может быть
проведена в плане сравнения качества водопроводной
(колодезной), речной или прудовой (озерной) и дис-
тиллированной воды.
В заключение этой части практической работы бу-
дет важно показать, как можно улучшить качество
питьевой воды. На этом занятии можно повторно рас-
смотреть свойства воды и связать проблему охраны
вод с запасами пресной воды на Земле.
96
Практическая работа
«Приготовление раствора сахара
и расчет его массовой доли в растворе»
Цель работы
Закрепить важнейшие химические понятия: отно-
сительная молекулярная масса, количество вещест-
ва, молярная масса, моль, постоянная Авогадро, мас-
совая доля растворенного вещества.
Обучить таким важным лабораторным операциям,
как взвешивание, отбор проб твердых и жидких ве-
ществ, приготовление растворов.
Отработать «на практике» химические расчеты с
использованием указанных выше физико-химиче-
ских характеристик.
Предлагаемая практическая работа отличается це-
лым рядом особенностей от традиционной по теме
«Приготовление раствора вещества с заранее задан-
ной массовой долей».
Представление этой темы в иной форме обусловле-
но следующими причинами.
1. Традиционная работа не является новой для уча-
щихся 8 класса, они выполняли ее в курсе природове-
дения.
2. С принципом вычисления массовой доли компо-
нента в смеси как «части от целого» учащиеся позна-
комились на уроках математики, поэтому от прямой
задачи нахождения массы растворяемого вещества по
массовой доле, что требуется для приготовления рас-
твора, мы перешли к обратной — нахождение массо-
вой доли вещества по его массе и массе растворителя.
3. Работа усложнена в ее расчетной части, так как
ставит задачу нахождения количества вещества по
массе и числа молекул вещества по количеству, т. е.
абстрактные понятия «число молекул», «число Аво-
гадро» и вновь сформированное понятие «количество
вещества» в этой работе получают свое конкретное во-
площение.
4. Выбор вещества для выполнения этой практичеД
ской работы — сахарозы С12Н22ОП продиктован дву4
мя причинами: а) сделать более сложным расчет по
формуле (С12Н22ОП) относительной молекулярной
массы и затем молярной массы этого вещества; б) ре-
бята могут выпить приготовленный раствор, что по-
требуется для определения числа глотков, соответст-
вующего объему раствора, с целью последующего рас-
чета числа молекул в одном глотке раствора.
5. Предлагаемая модификация работы таит боль-s
шие возможности для .дифференциации заданий;^
Так, ребятам со слабым уровнем практических и расй
четных умений и навыков можно предложить в каче-.
стве итогового задания нахождение количества сахаД
ра в полученном растворе. J
Ребятам со средним уровнем сформированное™^
расчетных и практических умений и навыков можна
предложить рассчитать число молекул в растворе илш
в одном глотке. $
Ребятам с высоким уровнем абстрактного мышле-d
ния можно усложнить расчетную часть введением зай
нимательного задания типа: «Сколько стоит 1 молей
кула сахара? » Предварительно учитель должен спро-
сить у ребят, знают ли они цену сахара на текущий
день, — насколько они осведомлены о стоимости ос-1
новных продуктов питания в магазинах и на рынкет
(воспитательный, момент)* Задание можно еще боД
лее усложнить, если предложить ребятам на III уров-1
не обучения рассчитать «цену» одного глотка приго-|
товленного сладкого раствора. Если ребятам I и
II уровней это будет интересно, то по желанию им
можно дать усложненное задание на дом.
Ниже дается описание расчетной части работы. Ре-
комендуем учителям ориентироваться на этот вари-
ант при подготовке к данному практическому заня-
тию.
1. Расчет массовой доли сахара в приготовленном,
растворе.
98
Предположим, что кусочек сахара массой 5 г рас-
творили в 100 мл воды. Масса полученного раствора
будет равна:
/п(р-ра) = m(H20) + т(сахара)
/п(Н2О) = 100 (мл) • 1 (г/мл) = 100 г
т(р-ра) = 100 + 5 = 105 г
Отсюда находим массовую долю сахара в растворе:
= т(сахара) = 5 = 0 047б 4 76%
т(р-ра) 105
2. Расчет числа молекул сахара в одном глотке рас-
твора.
Сначала рассчитаем число молекул сахара N, кото-
рое содержится в 105 г 4,76%-ного раствора, пользу-
ясь формулой
N = NA-n
Ход этого расчета следующий:
MXC12H22On) = 12 • 12 + 1 • 22 + 16 • 11 = 342
М(С12Н22ОП) = 324 г/моль
п = £ = ,.9/5(.г)—г = 0,01143 моль
М 342(г/моль)
N = Na • п = 6 • 1023 • 0,01143 = 0,06858 • 1023 моле-
кул.
3. Если ученик, выпив приготовленный раствор са-
хара, сделал 20 глотков, то, следовательно, число мо-
лекул в одном глотке составит:
0,06858 1023 п „олог. 1 г.23
N = —-----------= 0,03429 • 10 молекул
Z5U
7*
99
Практическая работа по теме
«Определение выхода продукта реакции
от теоретически возможного»
Цель работы
Показать универсальный характер понятия «до-
ля», продемонстрировав еще один пример выражения
через долю количественной характеристики — выхо-
да продукта реакции на опыте по получению газооб-
разного вещества.
Закрепить практические навыки в работе с хими-
ческими веществами и лабораторным оборудованием
(взвешивание, отбор проб газов, сборка и работа с
прибором для получения газов).
Отработать умения производить расчеты по хими-
ческим формулам и уравнениям с использованием ха-
рактеристик «молярная масса», «молярный объем га-
зов», «объемная (массовая) доля вещества от теорети-
чески возможного».
Предлагаемая работа является новой для школь-
ного практикума. Необходимость ее проведения про-
диктована стремлением обеспечить целостный под-
ход к формированию очень важного химического по-
нятия «доля» и ее различных модификаций.
В химическом практикуме учебника 9 класса
предлагаются две работы такой направленности.
Здесь только дадим некоторые рекомендации для
учителя по выполнению этих работ.
Для проведения экспериментальной части этих ра-
бот необходимо следующее оборудование: прибор для
получения и собирания газов, эксикатор, мерный ци-
линдр или градуированная мерная пробирка емко-
стью 20—50 мл. Учитель может предварительно про-
демонстрировать получение и собирание водорода с
использованием аппарата Киппа.
В качестве реагентов рекомендуются 5—10%-ный
раствор соляной кислоты и крупный цинковый поро-
шок (навеска 0,07—0,08 г на опыт). Если в наборе ре-
активов в химическом кабине нет цинкового порош-
100
ка, его нужно приготовить заранее из гранул (с помо-
щью крупного напильника). Использование мелкой
цинковой пыли нежелательно, поскольку в этом слу-
чае скорость реакции будет высокой и в результате
достигается очень малый практический выход водо-
рода.
Оптимальную скорость реакции можно обеспечить,
также подбором соответственно размерам цинковых
частиц концентрации кислоты.
Для дифференцированного подхода к выполнению
этой практической работы у учителя имеются боль-
шие возможности.
Так, ребята со слабым уровнем сформированности
практических умений и навыков и высокой степенью
конкретного мышления могут ограничиться выпол-
нением работы с навеской чистого цинка.
Для ребят среднего и высокого уровня сформиро-
ванности практических умений и навыков работу
можно усложнить, если к порошку цинка добавить
порошок меди, при этом должна быть указана массо-
вая доля примеси меди в смеси. Например, в навеске
образца цинка 0,8175 г, содержащей 25% примеси
меди, массу чистого цинка учащиеся должны будут
найти, используя такой алгоритм рассуждений и рас-
четов: 1) если массовая доля примеси составляет
25%, то массовая доля чистого цинка будет равна
100% - 25% = 75%, т. е. ir(Zn) = 0,75; 2) если масса
образца равна 0,8175 г, то масса цинка может быть
найдена по формуле:
zn(Zn) = т( смеси) • u>(Zn)
m(Zn) = 0,8175 (г) • 0,75 = 0,6538 (г)
Для тех учеников, кто закончит практическую ра-
боту и ее оформление досрочно, учитель может пред-
ложить дополнительное задание опять-таки с исполь-
зованием характеристики «массовая доля растворен-
ного вещества в растворе», например, определить
массу 5% -ного раствора соляной кислоты, необходи-
мой для растворения выданной навески цинка.
101
Методические рекомендации
к изучению темы
«Органические вещества»
Органическая химия — раздел химии, охватываю-
щий огромный фактический материал. Главная цель
школьного курса химии (9 класс) состоит в том, что-
бы ввести учащихся в мир органической химии, нау- '
чить их ориентироваться во множестве органических
веществ и органических превращений.
Поэтому перед учителем стоит задача, не углубля- ’
ясь в рассмотрение основ и методов органической хи- ,
мии, свойств и реакций индивидуальных веществ, j
дать общие представления о классах органических со-
единений и, рассказывая об их многообразии, пока-
зать их взаимосвязь и преемственность. Учитель дол-
жен отразить уникальную способность атомов углеро-
да соединяться друг с другом с образованием
разнообразных по строению, но внутренне взаимосвя-
занных соединений.
Такой подход поможет учащимся без лишнего ме-
ханического запоминания, а путем логических за-
ключений осознать генетическую связь органических
веществ.
Очень важно на уроках показать истоки органиче-
ской химии, ее неразрывную связь с живой природой
и жизнедеятельностью человека. Именно подобный
подход должен быть положен в основу изложения
учебного материала. Ниже даются краткие рекомен-
дации по постановке уроков для каждой темы школь-
ного курса органической химии.
102
Урок 1
Предмет органической химии
На этом уроке учитель вводит учащихся в мир ор-
ганической химии, обращая их внимание на исклю-
чительное многообразие органических веществ и их
роль в живой природе и в жизни человека.
Приступая к изложению основ органической хи-
мии как научной дисциплины, учитель знакомит ре-
бят с жизнедеятельностью основоположника теории
строения органических веществ А. М. Бутлеровым.
При объяснении понятия «валентность», высту-
пающего в органической химии в качестве аналога
понятия «степень окисления», важно подчеркнуть,
что для веществ немолекулярного строения (а их доля
среди неорганических веществ существенно больше)
применимо понятие «степень окисления», а для ве-
ществ молекулярного строения, составляющих боль-
шинство органических веществ, применимо понятие
«валентность».
Одна из основных задач этого урока — дать пред-
ставления о структурных формулах как средстве гра-
фического изображения строения органических ве-
ществ. Эти представления учитель развивает на при-
мерах метана СН4, этана С2Н5, пропана С3Н8,
подтверждая их демонстрацией шаростержневых мо-
делей молекул этих веществ.
Обобщая эту часть урока, полезно сравнить валент-
ность и степень окисления, например:
азот N2, степень окисления 0, валентность — три:
№N
этан С2Н6, степень окисления углерода 3, валент-
Н Н
I I
ность — четыре: Н—С—С—Н
Н Н
пероксид водорода Н2О2, степень окисления кислоро-
да -1, валентность — два: Н—О—О—Н.
103
Урок 2
Предельные углеводороды
На этом уроке учащиеся знакомятся с первым
классом органических веществ — предельными угле-
водородами, которые можно рассматривать как родо-
начальную группу в генетической цепи органических
соединений. Учитель демонстрирует (на моделях)
способность атомов углерода соединяться друг с дру-
гом с образованием цепей — линейных и разветвлен-
ных и далее переходит к формированию важнейших в
органической химии понятий «изомерия», «изоме-
ры», «гомологический ряд», «гомолог».
На примерах предельных углеводородов — мета-
на, этана, пропана учащиеся продолжают осваивать
запись структурных формул.
104
Уроки 3—4
Непредельные углеводороды.
Этилен и его гомологи
В начале урока учитель может провести неболь-
шую фронтальную беседу в форме вопросов из уже
пройденного материала:
1. Какие вещества называются углеводородами?
2. Какие химические связи реализуются в предель-
ных углеводородах? Почему их так называют?
3. Какие свойства метана и этана лежат в основе их
применения?
4. Где в природе встречаются углеводороды?
5. Как физические свойства углеводородов зависят
от их состава?
6. Какая общая формула предельных углеводоро-
дов ряда метана?
7. Что такое изомерия?
8. Как объяснить причины многообразия углерод-
ных соединений?
Учитель показывает формулы отдельных углево-
дородов и их радикалов, записанные на небольших
плакатах, и предлагает учащимся назвать их.
Такая беседа позволяет закрепить понятия «гомо-
логический ряд», «гомологи», «изомеры», а также
развивает навыки у учеников «работать» со структур-
ными формулами.
Последующее рассмотрение непредельных углево-
дородов ведется на примере этилена. Для объяснения
образования двойной связи в его молекуле не реко-
мендуется привлекать теорию гибридизации, поэто-
му и различия между ст- и к-связями здесь давать не
нужно.
Качественное обнаружение кратных связей в моле-
кулах органических веществ учащиеся должны про-
вести опытным путем, для чего им предлагается лабо-
раторная работа по получению и распознаванию этого
углеводорода.
105
В конце урока учитель знакомит ребят с областями
применения этилена и рассматривает реакцию поли-
меризации, гидратации и окисления этилена раство-
ром КМпО4.
При таком подходе формируется представление о
генетической цепочке веществ:
Алкан (этан)--► реакция дегидрирования--► Алкен
(этилен) ---> реакция дегидратации -----* Алканол
(этанол) ---> реакция окисления и гидратации ---->
----* Алкандиол (этиленгликоль)
которая потребуется для логического перехода к сле-
дующему классу органических веществ — спиртов.
106
Урок 5
Ацетилен
Этот урок строится по плану, аналогичному плану
урока по изучению этилена. Здесь важно отметить ге-
нетическую связь:
Алкен (этилен) --* реакция дегидратации ---*
----> Алкин (ацетилен)
Как генетическую основу перехода к классу аренов
учитель может рассмотреть реакцию тримеризации
ацетилена с образованием бензола.
107
Урок 6
Ароматические углеводороды
Учитель может начать этот урок с беседы в форме
вопросов по пройденному материалу.
1. Чем отличаются предельные углеводороды от
непредельных?
2. Как качественным путем можно установить не-
предельный характер органических веществ?
3. Как получить этилен и ацетилен? Каковы облас-
ти применения их? Какие свойства этих веществ ле-
жат в основе их применения?
5. Какими формулами записываются этилен, аце-
тилен, этан, этил? Предложите записать уравнения
реакции горения этилена и полимеризации его.
6. Какими свойствами обладает полиэтилен и ка-
кое применение находят его свойства?
Затем учитель переходит к рассмотрению нового^
класса углеводородов — ароматических углеводоро-'
дов на примере бензола. На основе реакции присоеди-
нения хлора к бензолу учитель знакомит учащихся cj
инсектицидами, представляющими практически важ-;
ную группу веществ, объединенных общим назва-
нием — ядохимикаты, или пестициды. Будет очень'
полезно продемонстрировать учащимся коллекции^,
пестицидов и обратить внимание ребят на правила
техники безопасности при использовании их на прак-
тике.
108
Урок 7
Спирты
В начале урока учитель может провести небольшой
химический диктант, в котором учащиеся должны
записать формулы называемых им веществ или, на-
оборот, по формуле дать название вещества. Предла-
гаем следующие варианты этого задания:
1) пропан 1)С2Н6
2) этил 2)С2Н5-
3) этилен 3) (—СН2—СН2—)
4) ацетилен 4)С6Н6
5) метил 5) СН3— СН-СН3
СН3 о
6) гексахлоран 6) СпН2п + 2
Далее полезно будет задать ребятам следующие во-
просы и упражнения:
1. Как опытным путем можно отличить этан от
этилена? Этилен от ацетилена?
2. Какие свойства бензола лежат в основе его при-
менения?
3. К какой группе веществ относят гексахлоран?
Какие еще вещества этой группы вы знаете?
4. Какие правила техники безопасности следует со-
блюдать при использовании пестицидов?
5. Попробуйте, применив свои знания по биологии,
дать объяснения названиям отдельных групп веществ
из разряда пестицидов: «инсектициды», «фунгици-
ды», «гербициды», «бактериоциды», «зооциды».
Затем учитель переходит непосредственно к теме
«Спирты». При ознакомлении учащихся со свойства-
ми метилового и этилового спиртов особо следует ос-
тановиться на их физиологическом действии.
109
При описании структур двухатомного спирта эти.
ленгликоля и трехатомного спирта глицерина нужно
научить ребят выводить формулу того и другого спир-
та, исходя из четырехвалентности углерода в органи-
ческих соединениях и атомности спиртов.
В качестве важнейшего звена в генетическом ряду
органических веществ, связывающего спирты и сле-
дующий класс веществ — альдегиды, рассматривает-1
ся реакция окисления этанола на медном катализато-1
ре в уксусный альдегид. |
110
Урок 8
Альдегиды
Урок можно начать с фронтального опроса уча-
щихся по предыдущей теме, посвященной спиртам.
1. Какую формулу имеет а) метиловый спирт,
б) этиловый спирт, в) этиленгликоль, г) глицерин?
2. Что общего и каково отличие в составах этило-
вого спирта, этиленгликоля и глицерина?
3. Где применяются знакомые вам одноатомные и
многоатомные спирты?
4. Что такое антифриз?. Каково его значение?
Второй вариант урока может заключаться в том,
что учитель предлагает ребятам еще раз провести ла-
бораторный опыт по окислению спирта в альдегид на
медном катализаторе. Таким путем осуществляется
логический переход к новой теме, и в основу этого пе-
рехода закладывается генетическая связь между
спиртами и альдегидами. В этом случае учащиеся
должны записать уравнение химической реакции.
Составление этого уравнения не должно вызвать у ре-
бят затруднений, так как они знают формулы этило-
вого спирта и уксусного альдегида и понятие «окисле-
ние».
Будет важно напомнить и еще одну генетическую
связь, а именно между алкинами и альдегидами на
примере реакции гидратации ацетилена— реакции
Кучерова.
При проведении урока по второму варианту учи-
тель ведет фронтальную беседу в ходе выполнения
учащимися лабораторной работы.
Урок заканчивается проведением качественных
реакций на альдегиды, на основе которых осуществ-
ляется логический переход к новому классу органи-
ческих веществ — к карбоновым кислотам.
111
Уроки 9—10
Предельные одноосновные
карбоновые кислоты. Сложные эфиры
Повторив отличительные признаки альдегидов
как класса органических веществ — состав и способ-
ность их окисляться в соответствующие кислоты,
учитель переходит к знакомству с представителями
предельных одноосновных карбоновых кислот. На
этом уроке учащимся предлагается самим записать
уравнения реакций, характеризующие свойства ки-
слот (на примере уксусной кислоты): а) взаимодейст-
вие с металлами; б) взаимодействие с оксидами ме-
таллов; в) взаимодействие с основаниями; г) взаимо-
действие с солями; взаимодействие со спиртами с
образованием сложных эфиров.
Лабораторный практикум должен закрепить пред-
ложенную систему свойств кислот.
Можно дать названия солей: муравьиной кисло-
ты — формиаты, уксусной кислоты — ацетаты,
и предложить ученикам записать формулы, напри-
мер, ацетата алюминия и формиата меди(П).
112
Урок 11
Жиры
Урок можно начать с химического диктанта, в ко-
тором учащиеся должны будут по предложенным
учителем формулам написать названия веществ и, на-
оборот, формулы веществ по их названиям. Возмож-
ный вариант такого диктанта:
дать названия
по формулам
А)
1) Н—. или
ОН
НСООН
2) СН3ОН
3) Н—
Н
или СН2 ==О
4) (СН3СОО)2Са
написать формулы
по названиям
1) уксусный альдегид
2) остаток уксусной кис-
лоты
3) соль муравьиной кис-
лоты и цинка — форми-
ат цинка
4) формальдегид
5) R—
О —R
5) сложный эфир
Переход к новой теме «Жиры» можно осуществить
с помощью беседы, включающей следующие вопро-
сы:
1. Как из альдегида получить кислоту?
2. Какими свойствами обладает уксусная кислота?
3. Какое свойство уксусной кислоты, отличающее
ее от неорганических кислот, вы узнали на прошлом
уроке? Как называется эта реакция?
8
1985
113
4. Какое определение вы можете дать сложным
эфирам?
5. Может ли давать сложные эфиры трехатомный
спирт глицерин?
Таким путем учитель подходит к представлению о
жирах как о разновидности сложных эфиров и при
активном участии учеников дает определение этому
классу веществ. Далее учитель рассматривает класси-
фикацию жиров по признаку их происхожде-
ния.
Жиры — это сложные эфиры трехатомного спирта
глицерина и жирных карбоновых кислот
Животные жиры
(говяжий, бараний
свиной)
а) содержат остатки
предельных кислот
б) как правило, твердые
(исключение рыбий жир)
Растительные жиры,
или масла
(подсолнечное,
оливковое, касторовое)
а) содержат остатки
непредельных кислот
б) как правило, жидкие
(исключение
кокосовое масло)
«гидрирование жидких жиров»
114
Урок 12
Аминокислоты
В рамках этой темы учитель должен развить пред-
ставление об амфотерности как универсальном свой-
стве для неорганических и органических соединений.
Здесь важно подвести учащихся к выводу об амфотер-
ности аминокислот:
VII —ги—тпы
определяет
основные
свойства
определяет
кислотные
свойства
При этом рекомендуется провести параллель меж-
ду аммиаком и аминокислотами (ведь в предложен-
ном школьном курсе нет аминов): рассмотреть донор-
но-акцепторный механизм присоединения к молеку-
ле аммиака и к аминогруппе аминокислоты катиона
водорода, что обусловливает основные свойства обоих
веществ. Понимание обусловленности кислотных
свойств аминокислот затруднений у учащихся не вы-
зывает.
Вторую важную параллель учитель проводит,
сравнивая свойства амфотерных гидроксидов
Zn(OH)2 или А1(0Н)3 со свойствами аминокислот.
8*
115
Урок 13
Белки
На этом уроке завершается формирование представ-
лений об основополагающей генетической цепочке:
Алкан----* Алкен------► Спирт----* Альдегид----»
Кислота-----* Аминокислота---* Полипептид
Исходя из амфотерности аминокислот учитель пе-
реходит к рассмотрению полипептидов — белков и
далее к характеристике белковой индивидуальности
живых организмов на Земле, т. е. к знакомству с пер-
вичной структурой белков.
Характеристику трех структур белковых молекул
можно представить в форме следующей таблицы:
Струк- тура бел- ковой молеку- лы Характеристика структуры Тип связи, определяю- щий структуру Графическое отображение
Первич- ная — линей- ная Порядок чередо- вания аминокис- лот в полипеп- тидной цепи — линейная струк- тура Пептидная связь —NH—СО— Ill
Вторич- ная — спирале- видная Закручивание полипептидной линейной цепи в спираль — спи- ралевидная структура Внутримоле- кулярная во- дородная связь CO...HN CO...HN
Третич- ная — глобу- лярная Упаковка вто- ричной спирали в клубок — клуб- ковидная струк- тура Дисульфид- ные и соле- вые связи
116
На основе рассмотрения взаимодействия амино-
кислот друг с другом, в результате чего формируются
белки, учитель еще раз демонстрирует реакции поли-
конденсации.
На этом уроке важно показать белковую индивиду-
альность живых организмов, которая, в частности,
проявляется в том, что а) является причиной оттор-
жения трансплантантов — пересаженных органов,
б) лежит в основе иммунитета — невосприимчивости
к чужеродному белку, например к белку болезнетвор-
ных микробов. Это позволит учителю, максимально
привлекая межпредметные связи с курсом биологии,
рассмотреть биологические функции белков в орга-
низме: структурную, ферментативную, защитную,
транспортную, запасающую и т. д.
Уроки 14—15
Углеводы
При освоении этой темы продолжается формирова-
ние представлений о веществах с двойственной функ-
цией (пример глюкозы), развивается умение сравни-
вать строение и свойства веществ на основе выявле-
ния признаков их сходства и различия (пример
целлюлоза и крахмал).
Урок начинается с объяснения этимологии поня-
тия «углеводы», и далее учитель рассматривает клас-
сификацию углеводов по критерию гидролиза (необ-
ходимо будет напомнить, что означает процесс «гид-
ролиз»).
При изучении моносахаридов на примере глюкозы
учащиеся с помощью эксперимента закрепляют пред-
ставления о двойственной функции глюкозы. На при-
мере глюкозы и фруктозы закрепляется еще одно
важнейшее понятие органической химии — изоме-
рия.
При изучении полисахаридов на примере крахма-
ла и целлюлозы будет полезным предложить учащим-
ся провести сравнение строения и свойств этих угле-
водов. Это задание можно оформить, например, в ви-
де таблицы.
Сравнение строения и свойств
крахмала и целлюлозы
№ Крахмал Целлюлоза
Признаки сходства
1 Оба вещества — углеводы
2 Оба вещества — полисахариды
3 Состав обоих веществ выражается одинаковой-фор- мулой
4 Оба вещества в результате гидролиза образуют глю- козу
118
№ Крахмал Целлюлоза
5 Оба углевода имеют растительное происхождение
Признаки различия
1 Полимер линейной и раз- ветвленной структуры Полимер только линей- ной структуры
Степень полимеризации крахмала меньше таковой у целлюлозы
2 Подвергается ступенчато- му ферментативному гид- ролизу Не подвергается фермен- тативному гидролизу
3 Синеет при действии иода (качественная реакция) Не дает синего окраши- вания с иодом
4 Запасающая функция в растительной клетке Строительная функция в растительной клетке
Программы тем-модулей
Химия и экология (13 часов)
Основные экологические понятия: среда обитания,
экологические факторы, биосфера, биоэлементы, че-
ловек и биосфера. Уровни экологических проблем:
локальный, региональный, глобальный. Взаимосвязь
экологии и химии. Связь понятий «химический эле-
мент», «вещество», «химическая реакция» с экологи-
ческими понятиями.
Природные и антропогенные источники веществ-
загрязнителей окружающей среды. Воздействие
вредных веществ на человека: общетоксическое, раз-
дражающее, аллергическое, с отдаленными последст-
виями (канцерогенное, мутагенное). Нормирование
загрязнений окружающей среды, понятия и крите-
рии нормирования: летальная доза (ЛД), летальная
концентрация (ЛК), предельно допустимая концен-
трация (ПДК), предельно допустимые выбросы
(ПДВ), временно допустимые концентрации (ВДК).
Основные источники загрязнения атмосферы и совре-
менные способы очистки выбросов (абсорбция, ад-
сорбция, конденсация, катализ). Источники загряз-
нения гидросферы и современные способы очистки
сточных вод (физические, химические, биологиче-
ские). Источники загрязнения гидросферы и совре-
менные способы очистки сточных воды (физические,
химические, биологические). Источники загрязне-
120
ния литосферы, проблема городских и промышлен-
ных свалок и пути ее решения.
Химические элементы и их соединения в биосфе-
ре. Биохимические циклы элементов. Биологическая
роль и круговороты важнейших неметаллических
элементов в биосфере — кислорода, серы, азота, фос-
фора, углерода. Биоэлементы-металлы — магний,
кальций, железо, калий, натрий, их роль в жизнедея-
тельности организмов. Антропогенные источники тя-
желых металлов — меди, ртути, свинца и других, их
воздействие на организм и биохимические циклы.
Органические вещества в жизни растений, животных
и человека, их хемокоммуникационная роль. Взаи-
модействие растений и животных посредством орга-
нических веществ (красители, пахучие вещества, фе-
ромоны). Токсичность и пути воздействия некоторых
органических веществ (спирты, фенолы, альдегиды,
анилин, полициклические углеводороды) на орга-
низм человека. Нефть, уголь и охрана окружающей
среды. Решение задач, упражнений и заданий с эко-
логическим содержанием.
Демонстрационные образцы сточных
вод различных предприятий, гальванических шла-
ков, твердых остатков в циклонах и электрофильт-
рах. Коллекция веществ-коагулянтов, катализато-
ров, обезвреживающих выбросы в атмосферу. Влия-
ние оксида серы(ГУ) на растения; действие нефти и
нефтепродуктов на растения; влияние синтетиче-
ских, моющих средств на водную экосистему.
Лабораторные опыты. Извлечение ионов
меди из промывных вод гальванических ванн медне-
ния методом цементации. Очистка воды от аммиака
ионообменным способом. Качественные реакции на
нитрат-, нитрит- и фосфат-ионы. Обнаружение серы и
азота в органических соединениях. Качественные ре-
акции на ионы тяжелых металлов — свинца, цинка,
меди и др.
121
Практикум к теме-модулю (4 часа).
1. Воздействие табачного дыма на организм человека.
2. Моделирование процесса образования кислотных
дождей. 3. Количественное определение остаточного
хлора в воде. 4. Очистка от нефти и синтетических ма-
сел и смол.
122
Химические вещества в сельском хозяйстве
(13 часов) (рекомендуется для сельских школ)
Основные направления химизации сельского хо-
зяйства.
Растения и почва. Минеральное питание растений.
Понятие о почвенном поглощающем комплексе.
Удобрения и их классификация. Органические
удобрения: сапропель, торф, навоз и др. Минераль-
ные удобрения, их классификация. Важнейшие ка-
лийные, азотные, фосфорные удобрения. Микроудоб-
рения. Проблемы выращивания экологически чистой
сельскохозяйственной продукции.
Химические средства защиты растений. Пестици-
ды, их классификация, важнейшие представители.
Техника безопасности при использовании пестицидов
в сельском хозяйстве.
Стимуляторы роста и плодоношения растений.
Использование веществ в кормовых рационах жи-
вотных.
Химическая мелиорация почв. Известкование.
Гипсование.
Химизация сельского хозяйства и пути решения
продовольственной проблемы.
Защита окружающей среды от химических ве-
ществ, применяемых в сельском хозяйстве.
Демонстрационные образцы. Коллек-
ции органических и минеральных удобрений. Образ-
цы микроудобрений. Коллекции пестицидов. Кол-
лекции стимуляторов роста и плодоношения расте-
ний. Ознакомление с некоторыми минеральными
удобрениями (хлорид и фосфат аммония).
Лабораторные опыты. 1. Влияние мине-
ральных удобрений на рост и развитие растений.
2. Ознакомление с образцами различных удобрений и
пестицидов. 3. Сравнение действия различных удоб-
рений на содержание нитратов и нитритов в плодах и
овощах.
123
Практикум к теме-модулю (4 часа).
1. Распознавание минеральных удобрений. 2. Качест-
венное определение нитритов и нитратов в сельскохо-
зяйственных продуктах. 3. Определение кислотности
почвы и расчет норм внесения извести. 4. Определе-
ние содержания азота, калия или фосфора в почве и
расчет норм внесения удобрений (по указанию учи-
теля).
Оглавление
Предисловие ............................. 3
Примерное тематическое планирование уроков
химии в 8 классе....................... 7
Примерное тематическое планирование уроков
химии в 9 классе.......................33
Методические рекомендации к урокам
по решению расчетных задач по химическим
формулам и уравнениям..................62
Методические рекомендации к проведению
работ химического практикума...........93
Методические рекомендации к изучению
темы «Органические вещества»..........102
Программы тем-модулей....................120
Учебное издание
Габриелян Олег Сергеевич
ХИМИЯ
8—9 классы
Методическое пособие
Ответственный редактор Н. В. Стрелецкая
Оформление Д. С. Иванов
Художественный редактор Д. С. Иванов
Компьютерная верстка С. Л. Мамедова
Технический редактор В. Ф. Козлова
Корректор Н. С. Соболева
Отпечатано с готовых диапозитивов.
Изд. лиц. №061622 от 07.10.97.
Подписано в печать 11.06.98. Формат 84х 108 ‘ /32.
Бумага газетная. Гарнитура "Школьная”. Печать высокая.
Усл. печ. л. 6,72. Тираж 5000 экз. Заказ № 1985.
Издательский дом "Дрофа”. 127018, Москва, Сущевский вал, 49.
По вопросам приобретения продукции
Издательского дома "Дрофа" обращаться по адресу:
127018, Москва, Сущевский вал, 49.
Тел.: (095) 289-03-25,218-16-37,289-03-66,218-54-09.
ГУП "Облтипография "Печатный двор".
432061, г. Ульяновск, ул. Пушкарева, 27.
S
Учительская страничка
Уважаемый учитель химии!
Издательский дом «Дрофа» предлагает вашему вниманию
программно-методические, дидактические и справочные ма-
териалы по химии. Эти пособия разработаны в соответствии с
современными образовательными стандартами и школьными
программами, структурно соответствуют действующим учеб-
никам.
Контрольные и проверочные работы
«Химия. Контрольные и проверочные работы». 8—9 классы.
«Химия. Контрольные и проверочные работы». 10—11 классы.
Тесты
«Химия. Тесты». 8—9 классы.
«Химия. Тесты». 10—11 классы.
Практикумы
S-S Wfi.
«химия. Школьный практикум». 10—11 классы.
Прогоаммно-методические материалы
«Химия. Программно-методические материалы». 8—11 классы.
Книги серии «Предметы в формулах и таблицах»
«Химия в формулах». 8—11 классы.
«Химия в таблицах». 8—11 классы.
Справочники
«Химия. Краткий справочник школьника». 8—11 классы.
«Химия. Большой учебный справочник для школьников
старших классов и поступающих в вузы».
Эти и многие другие книги Издательского дома «Дрофа»
можно приобрести во всех регионах России и странах
СНГ по минимальным издательским ценам
Телефоны отдела реализации ИД «Дрофа»:
(095) 289-03-25, 218-16-37, 218-55-09.
Адрес: 127018, Москва, Сущевский вал, 49.
Кроме того, вы можете
заказать и получить учебную литературу Издательского дома «Дрофа» по
почте наложенным платежом. Текущие цены и правила оформления заказа
регулярно публикуются в «Учительской газете», приложениях к газете
«Первое сентября», других педагогических изданиях. Для получения
| каталога «Книга—почтой» заявки присылайте по адресу: 117168, Москва,
J ул. Кржижановского, 14, корп. 1, «Книга-Сервис».
-приобрести любое количество книг Издательского дома «Дрофа»
| в оптово-розничном магазине издательства — Торговом доме «Школьник»
I по адресу: Москва, ул. Большие Каменщики (м. «Таганская»), д. 6/1А.
>- Телефоны для справок: (095) 912-15-16,911-70-24.
Оперативная информация об издательстве в глобальной сети Интернет —
по адресу http://www.drofa.ru. E-mail: weimaster@drofa.msk.ru