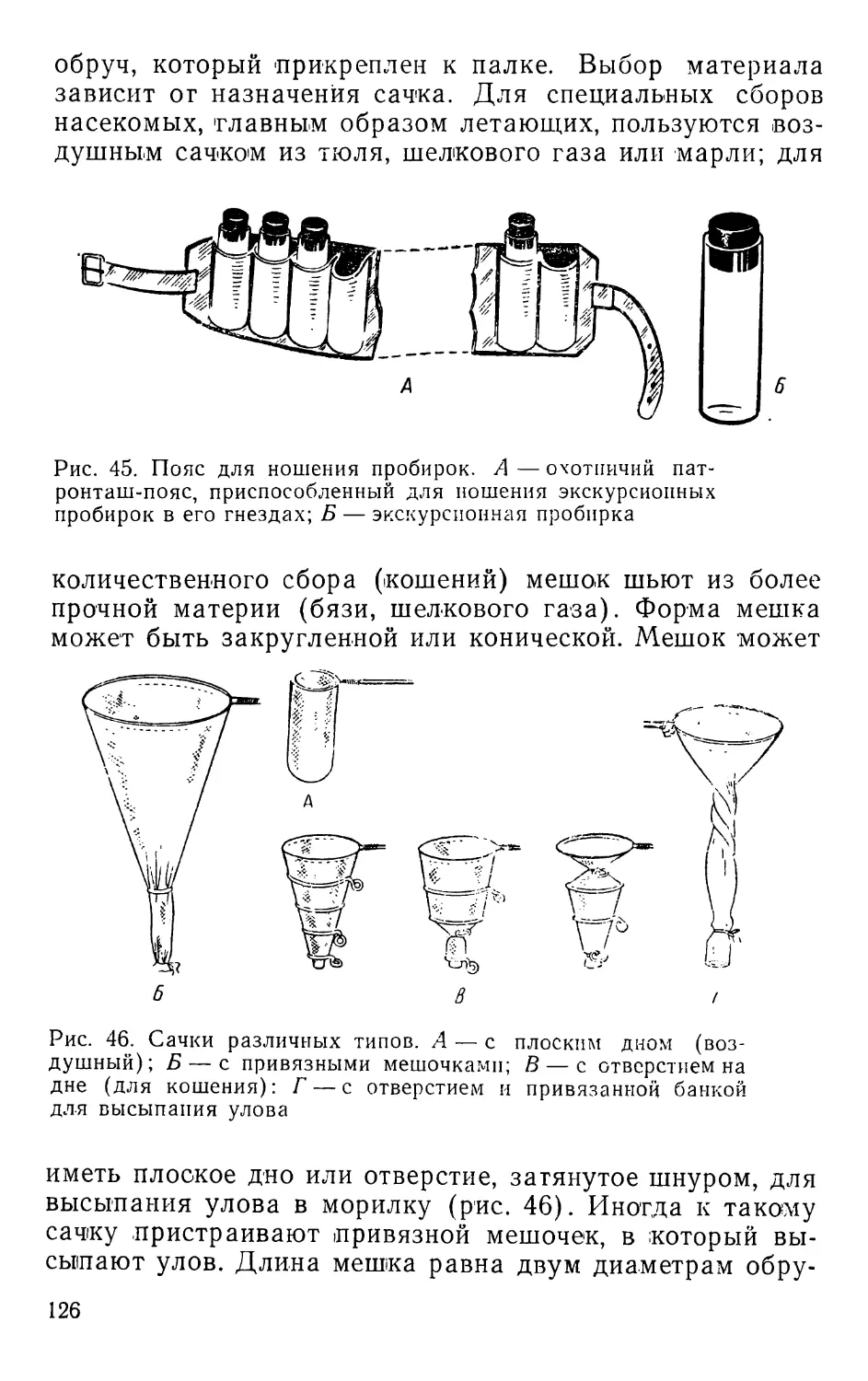
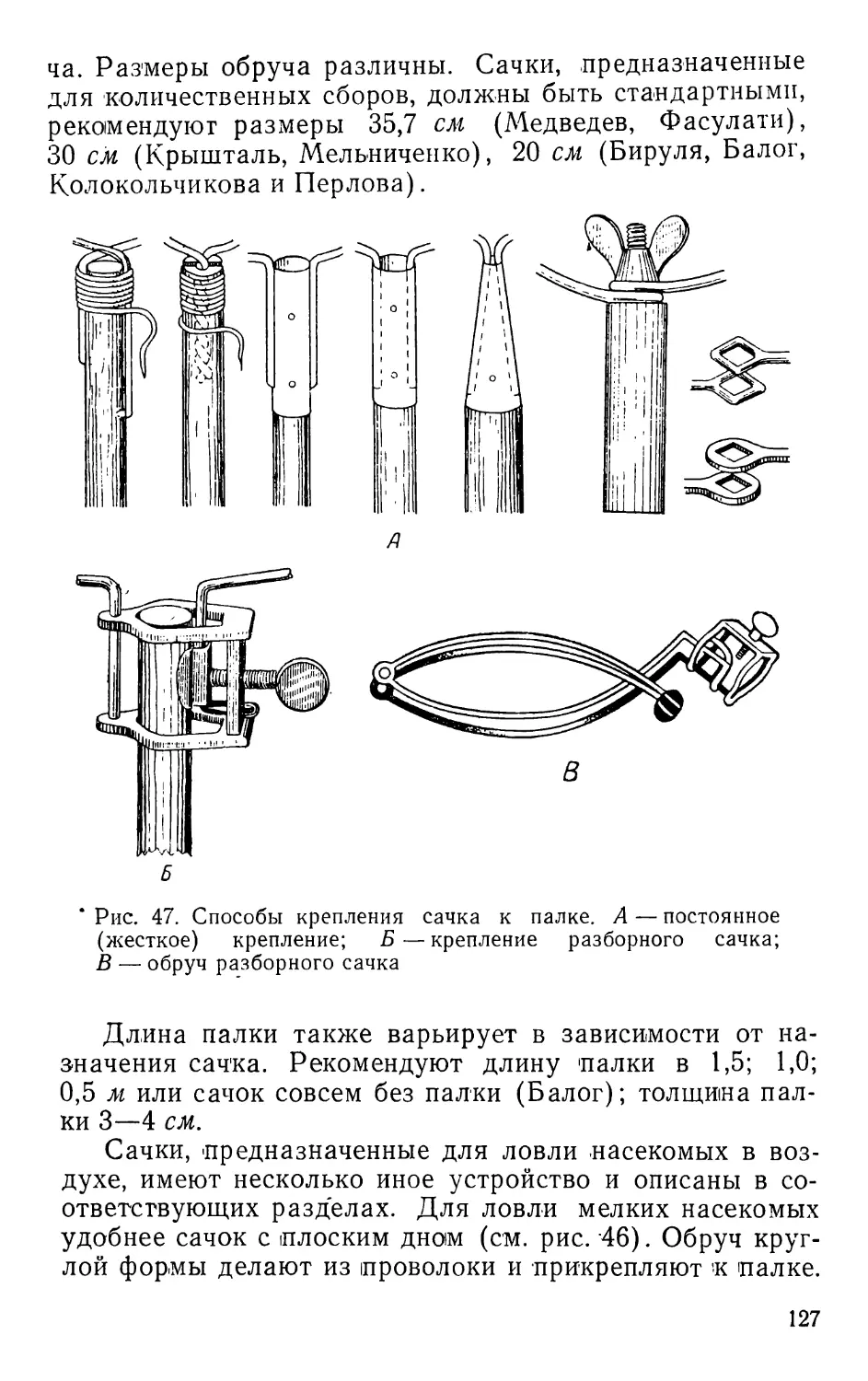
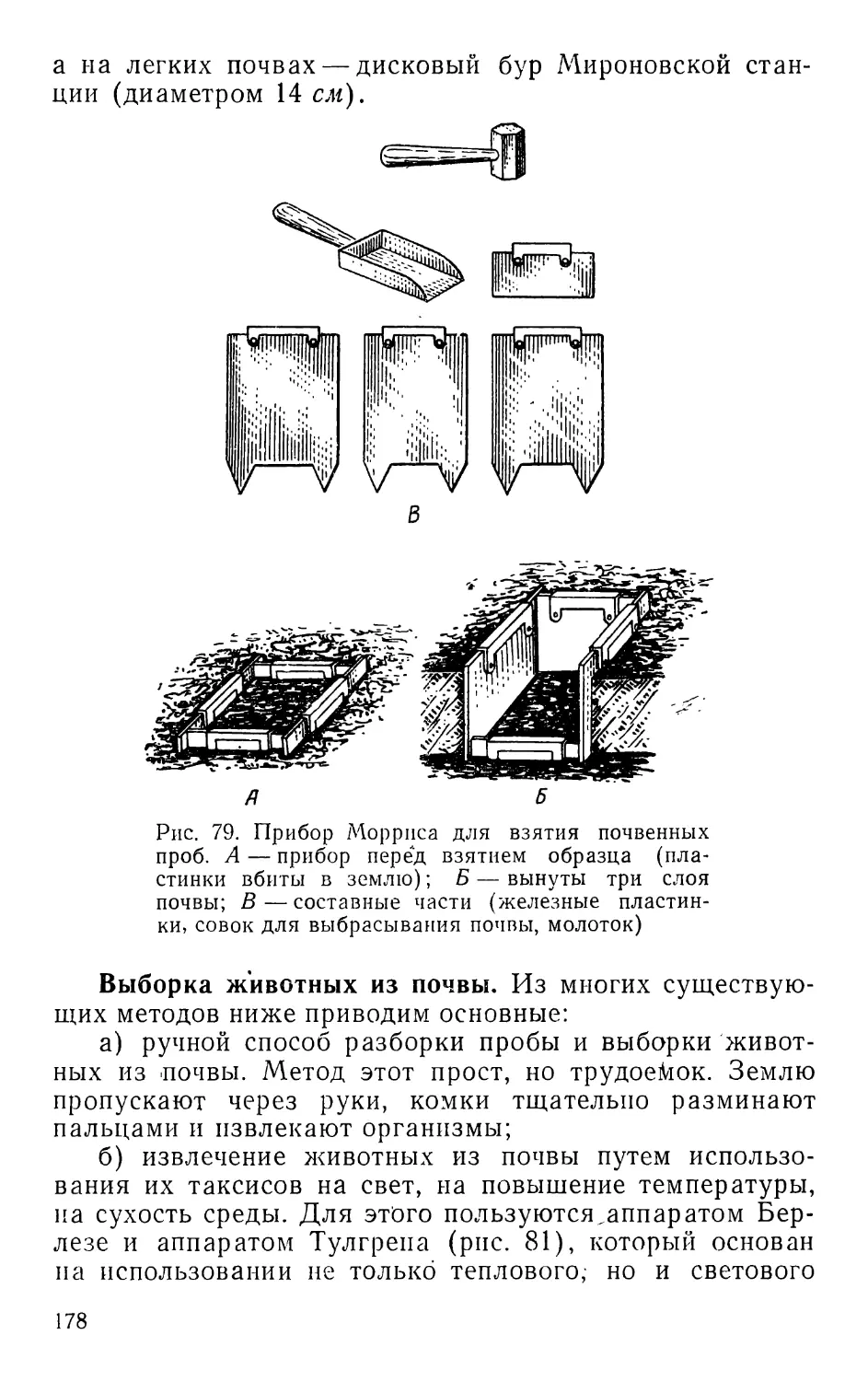
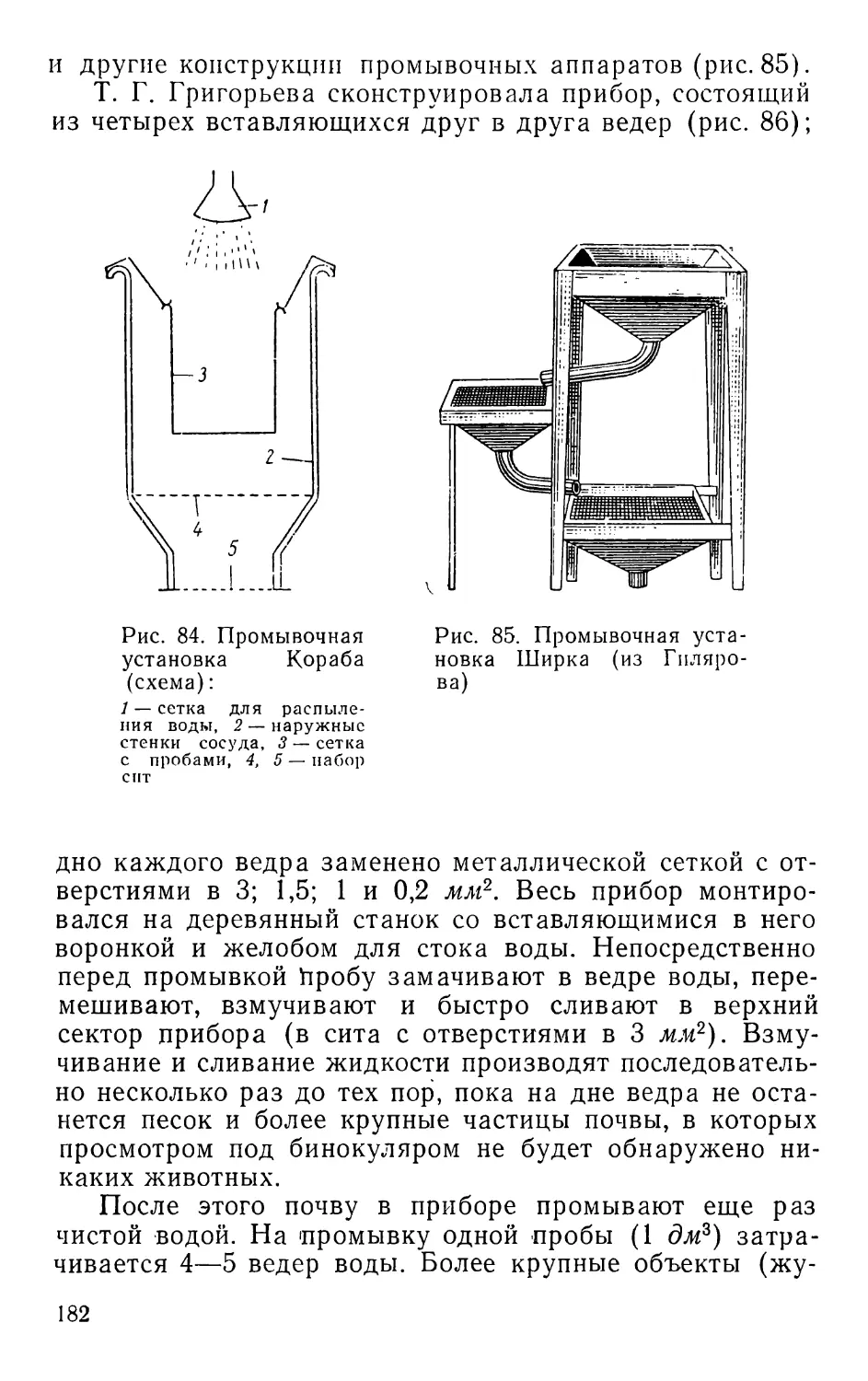
Текст
к. к. ФАСУЛАТИ
Полевое изучение
наземных
беспозвоночных
ИЗДАНИЕ ВТОРОЕ, ДОПОЛНЕННОЕ
И ПЕРЕРАБОТАННОЕ
Допущено Министерством высшего и среднего
специального образования СССР в качестве учебного
пособия для студентов биологических специальностей
университетов
ИЗДАТЕЛЬСТВО «ВЫСШАЯ ШКОЛА» МОСКВА— 1971
592
Ф26
Фасулати К. К.
Полевое изучение наземных беспозво-
ночных. Изд. 2. Учебп. пособие для универ-
ситетов. М., «Высшая школа», 1971.
424 с. с илл.
В книге рассматриваются различные ме-
тоды проведения полевых исследований био-
ценозов, природных комплексов и отдельных
групп беспозвоночных. Освещается методика
и способы изучения отдельных элементов
абиотической и биотической среды. Приво-
дятся общие приемы и способы сбора, фикси-
рования, обработки и хранения материала.
Описываются приборы и материалы. Разби-
раются методы изучения и учета комплек-
сов почвенной фауны и отдельных групп
беспозвоночных. Рассматривается методика
изучения и учета опылителей, энтомофагов,
комплексов вредителей и отдельных групп
наземных беспозвоночных; описаны методы
изучения и учет кровососов и других члени-
стоногих— паразитов животных, обитателей
гнезд и нор, комплексов некрофагов и коп-
рофагов.
2—10—6
66—71
ИЗ ПРЕДИСЛОВИЯ К ПЕРВОМУ ИЗДАНИЮ
Полевое изучение беспозвоночных, как и всякое на-
\чное исследование, предполагает сбор большого коли-
чества материала, хорошо документированных фактов,
|»с| которых невозможен анализ, немыслимы обобщения.
II ш гомологии, паразитологии, почвенной зоологии по-
леные исследования дали возможность не только на-
i\o.iniь материал для теоретических построений, но так-
/hr и решить ряд практических вопросов, непосредствен-
на связанных с растениеводством, ветеринарией и
мс/ищи ной.
II полевых исследованиях большое значение имеет
выбор методики, которая зачастую решает успех дела.
II связи с этим становится понятной та потребность в
пособиях, которая ощущается в настоящее время.
Предлагаемое пособие является первым опытом све-
чения методических материалов по этой чрезвычайно
ра пюобразной группе животных. Пособие написано на
основе опыта преподавания данного курса в Ужгородс-
ком государственном университете и проведения поле-
вых практических работ со студентами. В нем автор стре-
мился познакомить студентов с методиками исследова-
iiiiii. используемых для работы в поле по изучению жизни
наемных беспозвоночных (без эндопаразитов), глав-
ным образом насекомых.
Автор
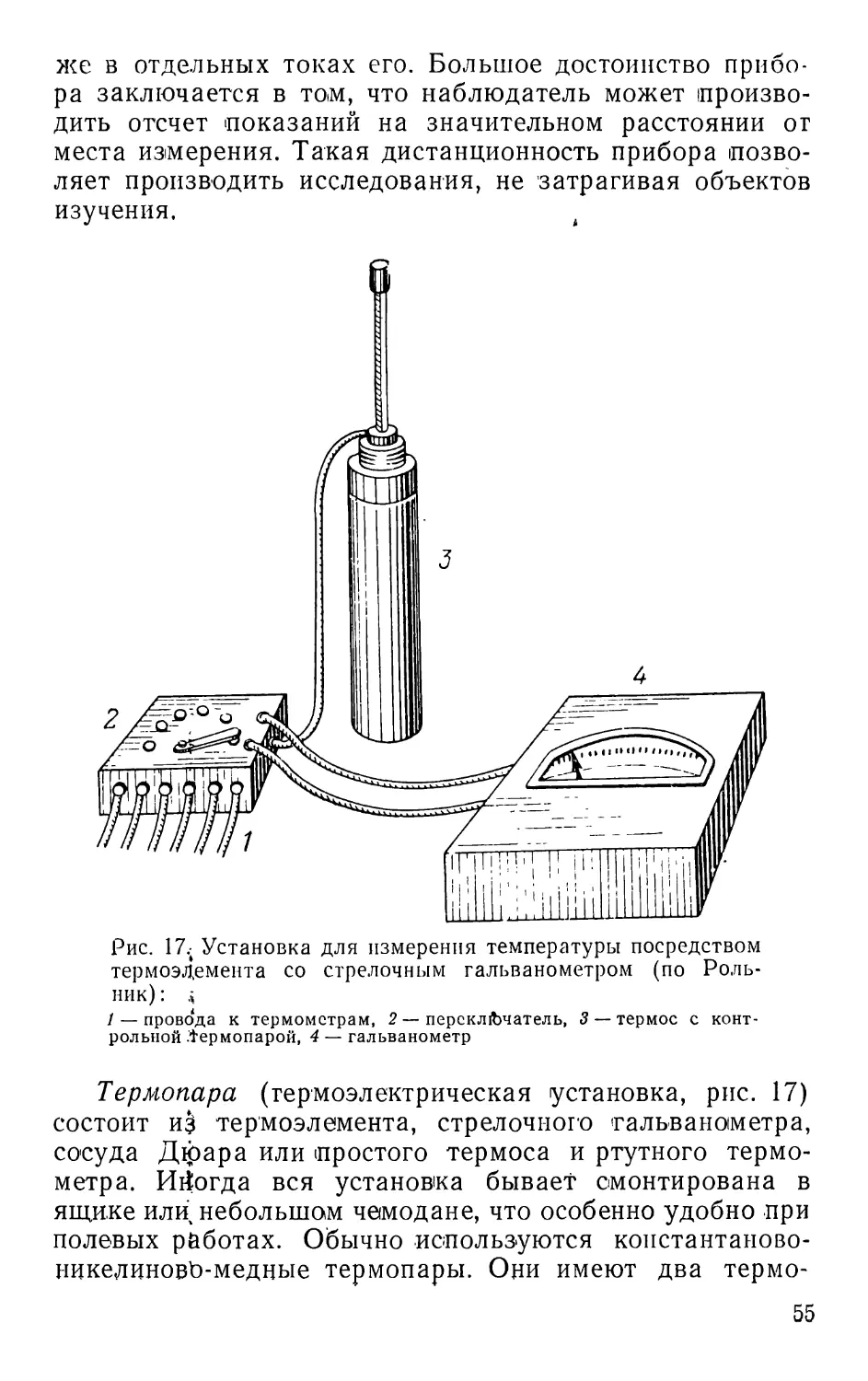
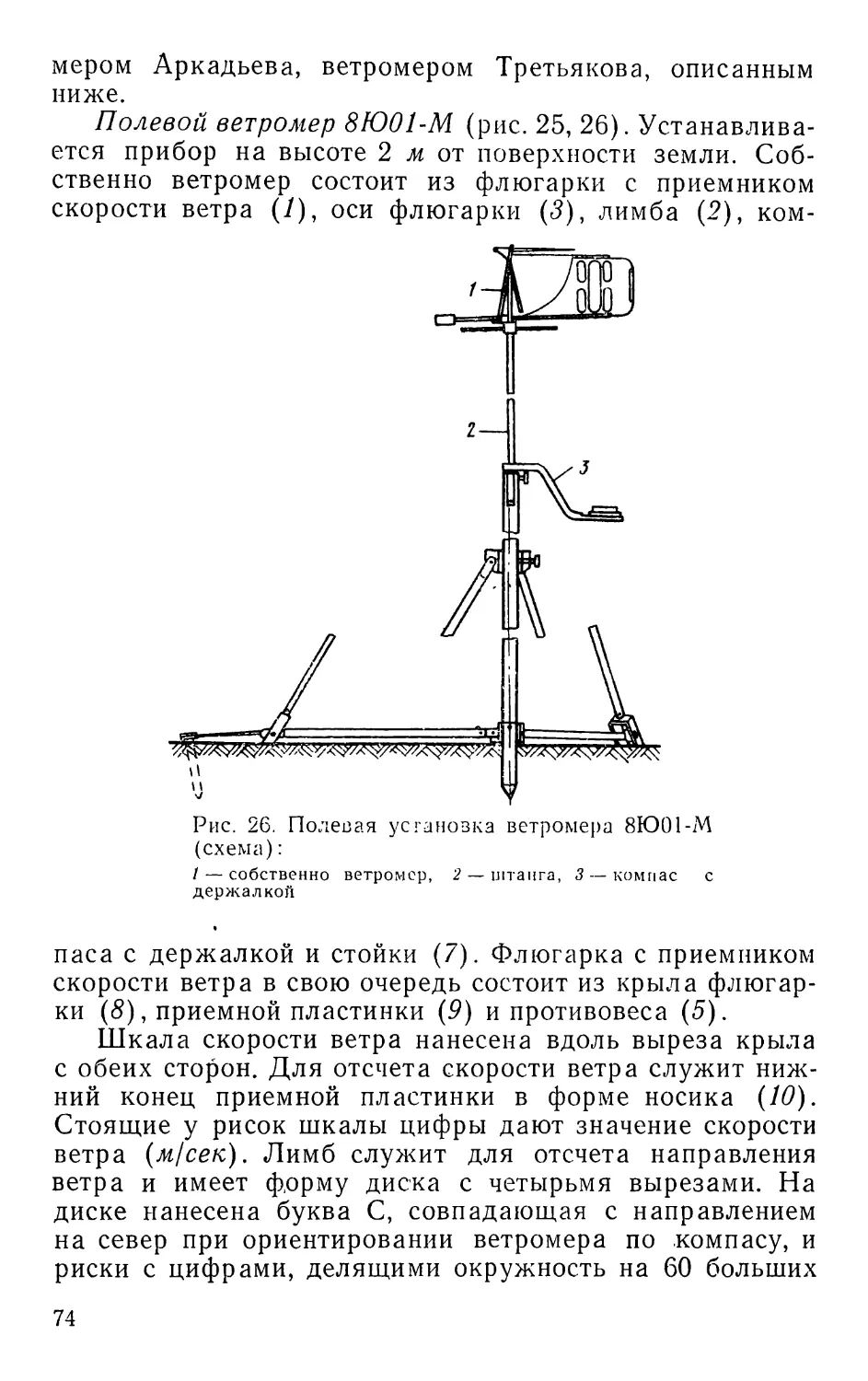
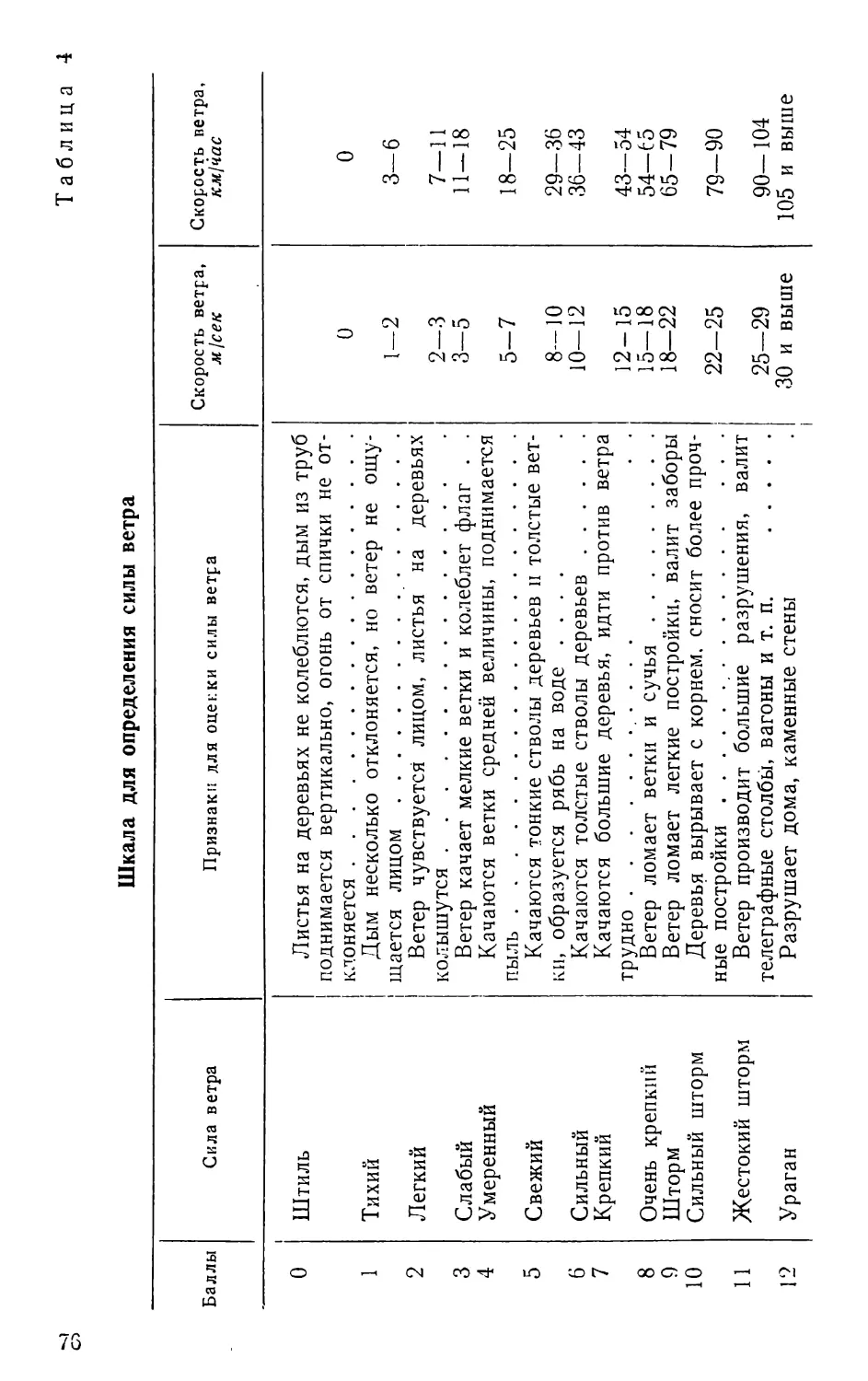
ПРЕДИСЛОВИЕ КО ВТОРОМУ ИЗДАНИЮ
С момента выхода первого издания (1961 г.) прошло
/К’сять лет. Книга давно разошлась. Многочисленные
i.iiipocbi и пожелания, поступающие в адрес автора,
3
свидетельствует о большой необходимости в таком по-
собит
За последний период в связи с общим развитием на-
уки накоплены новые данные и по методике полевых
исследований. Немало методических работ появилось и
в отечественной литературе. Все этй достижения, а так-
же пожелания читателей учтены при подготовке второго
издания.
Книга подверглась значительной переработке: изме-
нена структура изложения материала, обновлена общая
часть, упорядочен раздел «Сбор и изучение беспозвоноч-
ных»; этот же раздел и большинство других пополнены
новыми данными, введены новые главы и рисунки.
Автор выражает признательность тем лицам, чьими
добрыми советами и ценными замечаниями он пользовал-
ся при подготовке работы к печати. Особенно признате-
лен С. И. Медведеву, прочитавшему рукопись и сделав-
шему ряд ценных замечаний, 3. Л. Аникиной, оказавшей
помощь в подготовке рукописи к печати, в подборе и
выполнении фотографий и части рисунков.
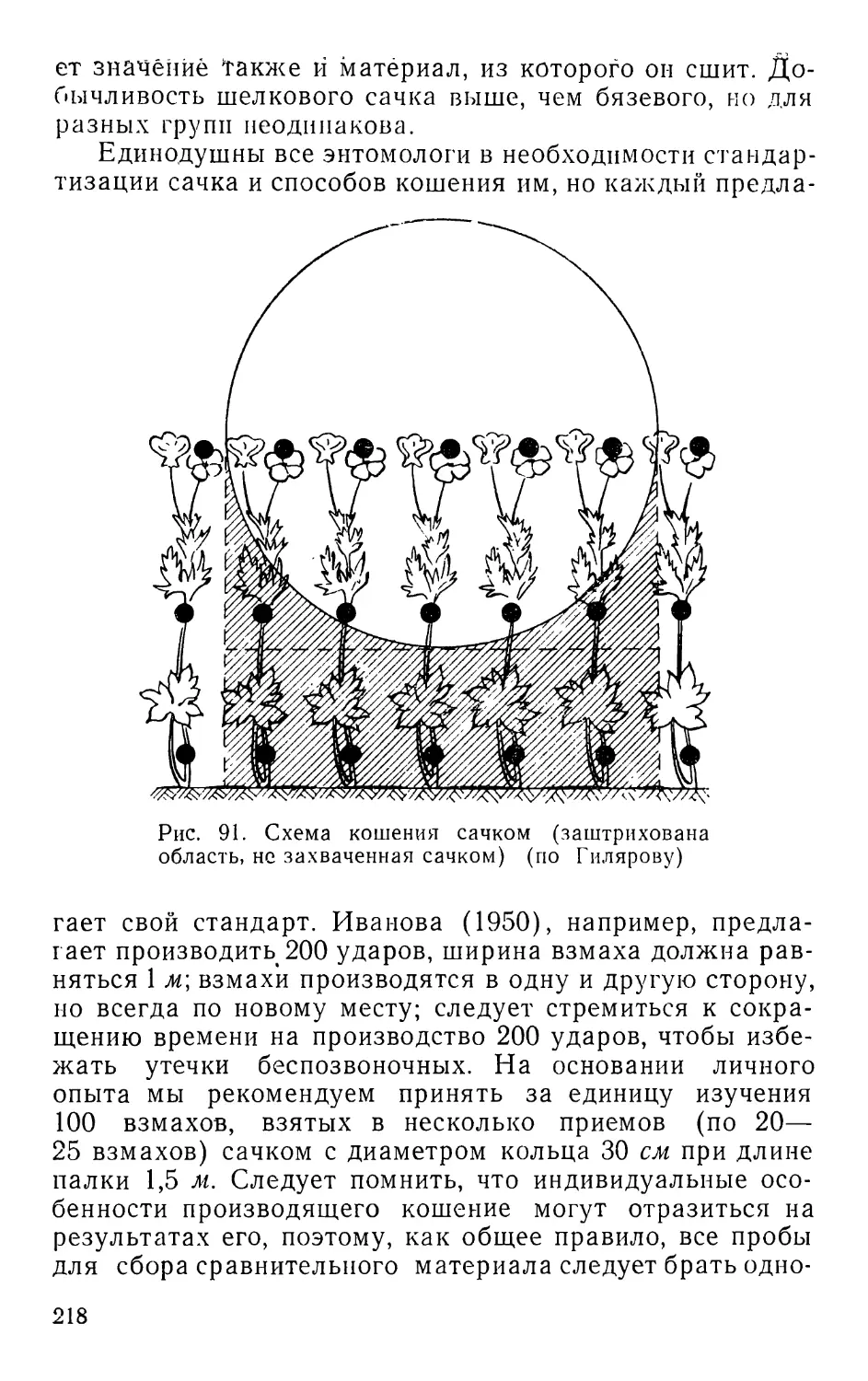
Автор
ОБЩИЕ ЗАДАЧИ И ОСНОВНЫЕ ПРИНЦИПЫ
Нашу планету заселяют около полутора миллионов
видов животных, более миллиона из них составляют
беспозвоночные. Сотни тысяч видов последних — назем-
ные животные. Своей деятельностью они не могут не
влиять на природу, а следовательно, и на экономику че-
ловека. Несмотря на интенсивное накопление материала,
по многим группам беспозвоночных наши сведения отры-
вочны, далеко не полны, а во многих случаях они утрати-
ли свою первоначальную ценность, устарели. Без знания
видового состава животных той или иной территории,
биологических особенностей отдельных видов, роли их в
биоценозах, хозяйственного значения мы не можем го-
ворить ни об охране и использовании полезных, ни о
борьбе с вредными животными или ограничении их чис-
ленности и снижении вреда до хозяйственно неощутимых
размеров. Таким образом, необходимость всемерного
изучения животного мира не вызывает сомнений. Осо-
бенно необходимо проводить исследования там, где мы
собираемся, осваивать территорию для новых отраслей
хозяйства, или там, где имеется угроза появления того
или иного, важного в хозяйственном либо в эпидемиоло-
гическом отношении вида. Важно изучение беспозвоноч-
ных животных и как метода диагностики почв, и как фак-
тора, играющего важную роль в почвообразовательных
процессах, в опылении, пищевом рационе позвоночных
и т. п.
Следует иметь в виду и огромное мировоззренческое и
познавательное значение полевых зоологических исследо-
ваний, учебную и методическую ценность таких работ.
Поэтому очень важно проводить их в качестве учебных
занятий при подготовке специалистов биологов.
5
Все организмы, в том числе и наземные беспозвоноч-
ные, живут в определенной среде, подвергаясь влиянию
ее различных факторов, приспосабливаются к определен-
ным условиям и в свою очередь как обратная связь
влияют на них. Каждое животное, таким образом, может
быть изучено только в связи с условиями его существо-
вания. В этом единстве организма и условии его жизни
заключается один из основных принципов современной
биологии.
Наземные беспозвоночные живут в различных усло-
виях: на поверхности земли и в почве, на растениях и
внутри их тканей, на животных и продуктах их жизне-
деятельности и т. п. Уже одно это заставляет применять
дифференцированную методику учета интересующих нас
животных, разнообразные приемы поиска и разные спо-
собы сбора их. Наличие в индивидуальном развитии чле-
нистоногих отдельных фаз, отличающихся степенью
активности, своеобразием экологии и образа жизни, пе-
риодичностью жизненных процессов, а также особенно-
стями трофических связей, требует дифференцированного
подхода к изучению этих явлений. Обычно живущие в
сходных условиях организмы объединяют в экологичес-
кие группы и для изучения их применяют сходные прие-
мы и методы.
При сборе научной информации по беспозвоночным,
кроме знания последних, важно уметь ориентироваться
в обстановке и правильно разбираться в экологических
особенностях изучаемой местности. Следует помнить, что
многие беспозвоночные тесно связаны с растениями, жи-
вотными, почвенным покровом и различными другими
физико-географическими условиями и что только ком-
плексное изучение всех этих элементов среды дает воз-
можность правильно подойти к решению многих биоло-
гических вопросов, лучше понять закономерности разви-
тия фауны, биоценозов. Особенно необходимо учитывать
экологические условия при изучении образа жизни видов
и проявлений жизненных функций тех или иных организ-
мов изучаемой группы в различных средах.
Необходимо стремиться к тому, чтобы как можно
шире и полнее исследовать природные комплексы, обра-
щать внимание на обследование всех компонентов био-
ценоза; изучать каждое животное круглый год, начиная
с весны; обращать внимание на сезонную смену явлений
6
П органическом мире — фенологию; учитывать измене-
ния сроков развития животных в зависимости от высоты
местности; наконец, собирать сведения о зимовке живот-
ных. При таком подходе любой полученный результат
нолевых исследований есть известное научное достиже-
ние, если этот результат является выводом законченных,
планомерно проведенных наблюдений.
Общие требования, предъявляемые ко всем полевым
исследованиям, следующие:
собирать нужно богатый и обширный фактический
материал, он должен быть не большим, а достаточным;
изучать все стороны жизни животного;
добывать сравнимые данные (применять единую ме-
тодику) ;
точно документировать материал;
Приступая к изучению того или иного объекта, необ-
ходимо определять объем, содержание и характер пред-
полагаемого исследования, составить план, разработать
методику и позаботиться о материально-техническом
оборудовании.
НАПРАВЛЕНИЯ, СОДЕРЖАНИЕ И ПЛАНИРОВАНИЕ
ПОЛЕВЫХ ИССЛЕДОВАНИЙ
Задачи, стоящие перед зоологами, многогранны и
мпогоплановы; решаются они на разных уровнях, раз-
личными путями и методами. Многие из них могут быть
выполнены только в полевых условиях.
Жизненные процессы, протекающие в органической
природе, изучаются на разных уровнях — молекулярном,
клеточном, организменном, популяционном, видовом,
биоценологическом и т. д. Изучение таких вопросов, как
экология организма, эволюция и изменчивость, и его
функция выполняется на организменном уровне и осу-
ществляется главным образом в полевых условиях. В по-
левых же условиях на популяционном и видовом уров-
нях изучается сходство и различие видов, объединенных
в таксоны разного ранга, распространение их и измене-
ние численности популяций в зависимости от экологи-
ческих условий. Принципиально новым является биоце-
пологический уровень изучения жизненных явлений в
природе, предметом которого уже будут сообщества ор-
7
ганизмов растительных и животных, их связи между
собой и взаимоотношения с окружающей средой.
Планирование любого исследования включает сос-
тавление программы по каждой подлежащей изучению
теме; определение путей и методики выполнения; подбор
необходимого оборудования.
РАЗРАБОТКА ПРОГРАММЫ ИССЛЕДОВАНИЯ
Программа исследования раскрывает содержание те-
мы, конкретизирует задачи, определяет объем, основные
направления и различные аспекты работы, выделяет ос-
новные ведущие вопросы, намечает маршруты (места),
время и объекты исследования, кроме того, программа
включает методику выполнения работы.
Составление программы — важный творческий про-
цесс работы над темой. Оно является началом работы
над избранным вопросом, начальным этапом выполнения
темы. Работа над программой предполагает серьезное
изучение литературы и может быть облегчена знакомст-
вом с уже выполненными в этом плане работами.
Предложить здесь единую, сколько-нибудь разрабо-
танную программу исследования, естественно, не пред-
ставляется возможным. Ее составляет сам исследователь.
Можно говорить лишь о типовых программах (схемах).
На основе таких типовых программ исследователь
или руководитель, исходя из поставленных задач, цели,
темы и объекта исследования с учетом обстоятельств и
имеющихся возможностей составляет реальную (инди-
видуальную) программу исследования.
Ниже приводим типовые программы по основным
группам и направлениям, выполнение которых предпо-
лагает полевые исследования.
Эколого-фаунистические исследования
Эколого-фаунистические, особенно фаунистические,
исследования проводят везде, это первый этап изучения
природы. Такие систематические работы в течение нес-
кольких лет в избранной зоне позволят собрать полные
коллекции, установить видовой состав той или иной
8
। руины животных и уловить изменения как в составе, так
и и экологии изучаемых животных за ряд лет. Регуляр-
ные наблюдения позволят выяснить зависимость изме-
нений от климата, развития растительности и колебаний
других условий среды. Полученные данные послужат
основой для выяснения значения вида и помогут в раз-
работке путей проведения хозяйственных мероприятий.
Такой эколого-фаунистический обзор основных групп
животных какого-либо ландшафта или природного рай-
она представляет первый, но один из наиболее важных
и ответственных этапов познания животного мира изу-
чаемой местности. Данные подобного рода могут служить
основой нового цикла: экологических, генетических, био-
целогических исследований.
В эколого-фаунистических исследованиях в отличие от
чисто фаунистических (определение видового состава
животных) главный упор делается на установление ос-
новных особенностей среды обитания и связанных с ней
изменений в образе жизни изучаемых животных. Из со-
поставления таких данных и вытекают закономерности
и экологическом распределении и географическом рас-
пространении видов.
Выяснение важнейшего элемента такого характера
исследования — изучение видового состава на первый
взгляд очень простого — сопряжено с известными труд-
ностями. Необходимо охватить все сезоны, исследовать
все пункты и в итоге выяснить систематическое положение
вида—определить и систематизировать весь собранный
материал. К этой трудоемкой работе часто привлекаются
другие лица или специальные сборщики, а работу по
определению видов обычно проводят специалисты-систе-
матики, но основную работу (тему в целом) все же вы-
полняет сам исследователь. Одновременно с выяснением
видового состава следует накапливать материал по второ-
му этапу — изучению экологических особенностей жи-
вотных, пользуясь сравнительно-экологическим методом.
Как уже отмечалось, нельзя составить единую прог-
рамму для всех случаев и местностей, равно как и для
всех групп беспозвоночных. Она, безусловно, будет
варьировать в зависимости от конкретных задач, объекта
и от характера местности. Общие вопросы, подлежащие
изучению и включенные в типовую программу, следую-
щие.
9
Видовой состав животных (встречаемость, числен-
ность, степень обычности вида). Доминирующие виды.
Изменение видового состава и численности каждого
вида по годам; сезонные изменения видового состава
(преобладание тех или иных фаз развития). Анализ
фаунистических комплексов; происхождение отдельных
фаунистических элементов, ареалы.
Экологический анализ среды обитания. Принадлеж-
ность района к той или иной зоне. Явления вертикальной
зональности (в горных местностях). Условия обитания
животных (рельеф, почвы, гидрографическая сеть и бо-
лота, климат и микроклимат). Основные растительные
группировки и их распределение в зависимости от релье-
фа, характера почв. Оценка растительных группировок
как мест обитания, питания и размножения животных.
Для эктопаразитов и кровососов следует выяснить эко-
логию хозяина (прокормителя или хранителя) и роль
его в цикле развития паразита.
Подразделение района, выделение биотопов и групп
их. Выделение экотопов в зависимости от рельефа, почв,
растительности и климата. Значение их в жизни живот-
ных. Защитные и кормовые условия местообитания для
отдельных фаз насекомых и их изменения по сезонам и
годам, по зонам и средам. Основные и второстепенные
обитатели экотопов. Связь животного с различными эко-
топами. Явление ярусности (в лесу, в почве).
Основные черты экологии важнейших видов живот-
ных. Анализ фауны по жизненным формам — типы пита-
ния, передвижения, типы приспособления к температуре,
влажности, свету, субстрату, к отдельным биоценозам.
Хозяйственная оценка. Выяснение роли видов в при-
роде, биоценозах и определение практического значения
их в жизни человека.
Выводы (теоретические и практические). Перспекти-
вы и пути дальнейших исследований, определение наибо-
лее важных вопросов. Предложения об использовании
местной фауны, обогащение ее новыми полезными вида-
ми или устранение вредных, о мерах регулирования чис-
ленности популяций, Вероятные изменения животного
мира под влиянием дальнейшего хозяйственного освое-
ния района.
Приведенная краткая схема эколого-фаунистического
обзора должна служить общей основой для изучения
10
условий жизни животного в исследуемой местности й
характеристики его значения для человека. Важную
часть работы составляет анализ среды обитания. Он
тол жен показать ту обстановку, в которой протекает
жить различных беспозвоночных, прямое значение ее
условий для жизни вида животного. Поэтому не следу-
ет механически переносить в экологические работы дан-
ные о характере условий среды (почвенные, климатичес-
кие), нс относящиеся к данным биотопам.
При разработке программы для облегчения работы
желательно ознакомиться с имеющимися эколого-фау-
нистическими работами.
Монографическое изучение
Монографические исследования предполагают всесто-
роннее и полное изучение какого-либо вида, группы.
Такне исследования представляют большой теоретичес-
кий и практический интерес, но иметь такие данные по
всем видам наземных беспозвоночных животных — зада-
ча почти невыполнимая, поэтому монографическому ис-
следованию подвергают наиболее важные в научном и
практическом отношении виды. Так, в разное время изу-
чались всесторонне свекловичный долгоносик, колорадс-
кий жук, кровяная тля и многие другие вредители. Ниже
приводим схему программы таких исследований.
Общая часть. Систематическое положение вида, его
название — научное (латинское), книжное русское или
других национальностей, на языке которых пишется ра-
бота, н народное; важнейшие синонимы.
История изучения вида (обзор литературных данных
о виде вообще и роли его в частности). Причина поста-
новки данного исследования.
Морфология и экология. Взрослые насекомые. Под-
робное морфологическое и анатомическое описание сам-
цов н самок; сезонные изменения формы и окраски. Вре-
мя н место отрождения насекомого и зависимость этого
явления от экологических условий. Лёт (проявление, на-
чало, максимум и прекращение). Местообитание, харак-
теристика стаций; поведение вида в разные часы суток;
способность образовывать скопления, колонии, общины.
Влияние температуры, света, влажности и других усло-
вий на жизнь и поведение вида. Пища и способы пита-
11
ния, дополнительное питание взрослых насекомых.
Размножение—созревание половых продуктов, связь
этого явления с дополнительным питанием, спаривание,
партеногенез и место его в циклах развития. Откладка
яиц — количество отложенных за день, за неделю, за
все время и другие детали. Продолжительность жизни
половозрелых самки и самца.
Яйцо и яйцекладка. Описание (размер, форма). Тип
яйцеклетки. Расположение яиц по отношению к кормо-
вому растению или вообще к субстрату. Эмбриональное
развитие. Продолжительность развития зародыша (инку-
бационный период), выход личинки. Явления диапаузы.
Личинка. Морфологическое описание всех возрастов.
Число линек; образ жизни личинки в различные периоды
развития; поведение, способы передвижения, характер
питания (кормовые растения), интенсивность роста.
Продолжительность фазы личинки. Окукливание, образо-
вание коконов, пупариев. Продолжительность фазы
пронимфы.
Куколка (и нимфа) — их типы и описание; жизнь ним-
фы, место залегания куколки, продолжительность перио-
да покоя; различные явления, связанные с фазой ку-
колки.
Полный цикл развития. Продолжительность и число
генераций; диапауза, зимующие стадии и фазы. Феноло-
гические данные. Календарь развития.
Географическое распространение и экологическое
распределение. Связь этих явлений с геологическими
(историческими), с почвенными, геоботаническими, био-
ценотическими условиями среды обитания.
Хозяйственное значение изучаемого вида. Характер
повреждения растений личинкой и взрослыми насекомы-
ми. Другие имеющие практическое значение особенности
образа жизни. Сравнительная оценка повреждений и
деятельности вида на разных растениях, в различных
местах и разных видов на данном растении. Физиологи-
ческая реакция растения на повреждения и экологиче-
ские адаптации вида. Способы самозащиты растения.
Продолжительность вредной деятельности вредителя
(суточная, месячная, годовая). Вредоносность и ее пе-
риодичность. Учет вреда, нанесенного беспозвоночными.
Враги и болезни вида (вредителя). Уничтожение вида
позвоночными (устанавливается наблюдением и анали-
12
зом содержимого желудков птиц, рептилий и др.) и хищ-
ными Членистоногими. Паразиты вредителя из насеко-
мых и Других беспозвоночных и болезни насекомых изу-
чаются по специальной программе (см. Изучение энто-
мофагов стр. 234).
Обоснование мер освоения. Борьба с вредными вида-
ми или использование полезных форм. Выяснение наибо-
лее уязвимых моментов в жизни вида, связанных с ана-
томо-физиологическими и экологическими особенностями
его и условиями, в которых протекает жизнь вида. Обзор
существующих способов борьбы с вредными видами и
анализ их с научной и хозяйственной точек зрения. Борь-
ба с вредителями в данной местности, ее результаты.
Формулирование рекомендаций.
По аналогичной схеме монографически изучают и по-
лезные виды: из опылителей, хищников, паразитов. В
этих случаях вместо вреда анализируют полезную роль
насекомого и способы их использования. Вместо изучения
наиболее уязвимых биологических моментов принимают-
ся во внимание ограничивающие факторы и выявляются
способы их устранения (см. соответствующие разделы).
Монографически изучают и целые группы беспозво-
ночных, но всесторонний охват отряда или семейства не
означает, что рассматриваемые виды изучены моно-
графически.
Изучение экологии отдельного вида (аутэкология)
Экология отдельного вида (популяции) или группы
видов обширного в видовом отношении класса насекомых
всегда имеет свои особенности. Отсюда разнообразие
отношений видов к ф.акторам среды. Неодинаково отно-
сятся разные виды и к результатам воздействия человека
на природу. Все это определяет и различное хозяйствен-
ное значение их. Предлагать единую программу для изу-
чения экологии любых видов животных невозможно,
ибо беспозвоночные, связанные с растениями, отличают-
ся своей экологией от таковых, связанных с животным
организмом. Живущие в почве и приспособленные к этой
среде организмы могут быть изучены по иному варианту
программы, чем насекомые, обитающие на кроне деревь-
ев или паразитирующие в других насекомых. Ниже при-
13
водим лишь самую общую схему типовой программы
экологических исследований на примере насекомых. В
связи с резко выраженной сезонностью и с наличием раз-
ных фаз развития у этих видов программу исследования
можно строить или по сезонам, или по фазам развития,
но она ни в коем случае не должна ограничиваться толь-
ко одной какой-нибудь фазой или одним сезоном. Типо-
вая программа изучения экологии включает следующие
вопросы.
Название вида (кроме научного, желательно дать и
местное название).
Распределение по территории и характерные стации.
Появление (начало и конец лета), кладка яиц и
другие стороны цикла развития (связь с факторами сре-
ды). Календарь жизни вида.
Питание личинки. Кормовые растения, прокормители
(для кровососов). Пищевая специализация. Избиртель-
ность питания у олиго- и полифагов. Дополнительное пи-
тание имаго.
Экология размножения (гамогенез, партеногенез).
Развитие отдельных стадий и фаз в зависимости от раз-
личных факторов.
Темпы размножения. Массовое размножение и коле-
бания численности популяций вида. Наличие естествен-
ных врагов, болезней и других ограничивающих факторов.
Миграция в пространстве (циклическая, связанная со
сменой кормового растения, и массовая — передвижение
гусениц на окукливание или концентрация имаго на
зимовку).
Миграция во времени (диапауза и другие сходные яв-
ления (эстивация, спячка) в зависимости от экологичес-
ких условий).,
Экологический стандарт вида (пластичность и спо-
собность вида приспособляться к новым условиям). За-
селение новых территорий, приспособление к новому
кормовому растению, смена стаций.
Связь с растениями. Типы питания и пищевой специ-
ализации, характеристика наносимых повреждений. Ре-
акция растений на повреждения.
Учет вреда и хозяйственная оценка вида. Вредонос-
ность, значение вида. Прогнозы и сигнализация.
Обоснование мер хозяйственного освоения. Способы
борьбы (для вредителя). Сбор сведений о применяющих-
14
ся мерах, анализ их с учетом экологических особенностей
вида и местных условий; испытание или разработка но-
вых методов, которые должны лечь в основу при построе-
нии системы мероприятий по ограничению численности
популяции, снижению вредной деятельности вида и лик-
видации вреда.
Для полезных видов — разработка путей их исполь-
зования. Сбор сведений о хищниках и роли паразитов на
их хозяевах; экологическая оценка и выяснение значения
их как ф.актора, влияющего на численность вредителя.
В отдельных случаях можно решать частные задачи,
требующие более детального изучения одного какого-ни-
будь экологического вопроса (вредоносность, циклы раз-
вития) или группы таких вопросов, как отношение жи-
вотного к факторам окружающей среды — температуре,
влажности, солнечной радиации и т. п. В некоторых
случаях можно концентрировать внимание на изучение
численности популяций — экологии массового размноже-
ния вредителя. Наконец, можно изучать такие вопросы,
как антофилия и опыление, энтомофагия и паразитизм.
Программу необходимо уточнять в зависимости от задач
круг вопросов может меняться. Исследования не обяза-
тельно должны следовать приведенному выше порядку.
Частные вопросы программы изучения экологии отдель-
ных видов (групп), а также методика этих исследований
изложены в соответствующих разделах настоящего ру-
ководства.
Биоценологические исследования
При биоценологических исследованиях в отличие от
наблюдений экологических мы имеем дело с комплексом
животных, приуроченных к характерным для них экото-
нам и различным образом связанных между собой, с
растениями и условиями неживой природы. Таким обра-
зом, при изучении биоценозов мы изучаем взаимоотно-
шения (связи), поэтому приходится иметь дело не только
с зоологическими объектами, но и с другими компонен-
тами, это значительно усложняет получение необходимой
информации. Биоценологические исследования являются
комплексными, в них должны принимать участие как
зоологи разных профилей, так и ботаники, микробиологи
15
и почвоведы. Чтобы не выходить за рамки данногд руко-
водства, все построения будут ограничены в основном
изучением беспозвоночных как компонента биоценозов.
Биоценологические исследования включают такие
вопросы: изучение почвенных и наземных беспозвоноч-
ных как компонентов лесных и полевых биоценозов; изу-
чение биоценотических связей и отношений; закономер-
ности формирования биоценозов и многие другие.
Существовавшие программы были далеки от совер-
шенства, но они на ранних этапах становления сыграли
определенную положительную роль в развитии биоцено-
логических исследований.
В последнее время появился ряд теоретических трудов
по биоценологии, которые знаменуют новый этап в раз-
витии этой науки. На новом уровне освещаются принци-
пы и методы исследований; разработана методика ком-
плексных биоценологических исследований. В этом плане
заслуживает упоминания сборник «Программа и мето-
дика биогеоценологических исследований» (1967), в ко-
тором приводится программа и по изучению беспозво-
ночных как компонента биоценоза, разработанная
М. С. Гиляровым.
С учетом новейших данных и личного опыта можно
рекомендовать три типа программ биоценологических
исследований.
А. Изучение беспозвоночных как
компонентов биоценоза
Анализ условий обитания беспозвоночных изучаемого
биоценоза. Место биоценоза в ландшафтной зоне, в изу-
чаемом районе; характеристика условий обитания живот-
ных данного района. Рельеф, роль различных экспозиций
склонов; микрорельеф. Почвенно-грунтовые условия как
место обитания, развития и укрытия в некоторые небла-
гоприятные периоды года. Растительные группировки как
место обитания или как кормовая база; фитоценологи-
ческая характеристика. Микроклимат разных горизонтов
почвы, в которых живут беспозвоночные, различных
ярусов растительности и различных растительных груп-
пировок; микроклимат периода прохождения различных
фаз развития беспозвоночных. Минимальные и макси-
16
мальнйе температуры, влажность и чрезмерная сухость.
Кормовые ресурсы для различных групп интересую-
щих нас; животных. Сезонный аспект кормовых растений.
Изменение условий обитания деятельностью челове-
ка (рубки, лесонасаждения, сельскохозяйственное освое-
ние территории и др.).
Состав и структура животной части' биоценоза. Ос-
новные виды (ядро), предоминанты и подчиненные виды.
Состав, количественные показатели: обилие, встречае-
мость, доминирование. Изменение состава и численности
но сезонам, годам, их причины. Степень устойчивости
состава, верность, экологические ниши, занимаемые каж-
дым видом в биоценозе. Анализ состава по жизненным
формам. Связи, ценотические системы. Границы био-
ценоза.
Биотопы, их место и классификация. Выделение на
изучаемой территории биотопов и экологическая оценка
их: распределение, защитные особенности и кормовые
ресурсы. Генетические и биоценотические связи между
биотопами. Экологическая классификация биотопов.
Сравнительная (количественная и качественная) харак-
теристика животного населения биотопа. Сукцессия био-
ценоза.
Внутривидовые и межвидовые отношения. Стаи, кули-
ги, скопления гусениц, массовое появление имаго, канни-
бализм. Межвидовые отношения. Совместное обитание
видов, использование чужих жилищ, паразиты, хищники.
Влияние животных на растительность и зависимость их
от последних.
Трофические связи. Значение растительных и живот-
ных кормов. Обеспеченность кормами по сезонам. Типы
связей на почве питания; хищничество, паразитизм, кон-
куренция, взаимопомощь и т. п. Влияние урожайности
кормов на численность потребителей. Характер влияния
иа растительность и животный мир в процессе питания.
Различные трофические приспособления у растений и жи-
вотных, возникшие в процессе эволюции.
Суточный и сезонный циклы. Смена экологических
условий в течение суток, по сезонам, в течение года.
Особенности суточных изменений в разных биотопах.
Дневные, сумеречные беспозвоночные. Суточные измене-
ния активности. Миграции и влияние погоды на них. Мес-
та скопления в недеятельное время. Сезонные явления
17
в жизни растений и животных. Фенологические времена
года, календарь природы. Устойчивость сроков сезонных
явлений по годам в зависимости от метеорологических
условий. \
История и изменение биоценоза. Прошлое района,
условия возникновения и формирования биоценоза.
Влияние хозяйственной деятельности человека на состоя-
ние и развитие биоценоза. Реконструкция природы и фор-
мирование новых биоценозов.
По иной программе проводятся комплексные исследо-
вания биоценозов естественных ландшафтов и биоцено-
тических комплексов возделываемых участков (поля,
огорода, сада и т. п.).
Б. Комплексное изучение биоценозов
в естественных зональных ландшафтах
Фаунистическая и экологическая характеристика жи-
вотного мира избранного ландшафта. Почвенная фауна,
ее состав, экология и биология важнейших компонентов.
Позвоночные, их роль и значение в избранном ландшаф-
те. Насекомые и клещи-энтомофаги и их связи с вредя-
щими видами. Насекомые и клещи-фитофаги, детрито-
фаги и опылители и их связи с растительностью. Коле-
бания численности наиболее значительных видов, роль
условий существования и энтомофагов в регуляции их
численности.
Формы ценотических связей растений и животных
в изучаемых сообществах (питание, размножение, защи-
та, охота, опыление и т. п.).
Процессы накопления и трансформации вещества и
энергии'.
Хозяйственная оценка изучаемого ландшафта. Пути
рационального использования его биологической продук-
тивности. Ценные для человека компоненты сообщества
и возможности их использования в качестве источника
биологического сырья.'Вредные компоненты ценоза (вре-
дители растений, паразиты животных и человека, пере-
1 Выполняется физиологами растении, биохимиками и микробио-
логами.
1S
носчийи заболеваний и т.п.), их зависимость от особен-
ностей! биоценоза и возможности ограничения вредящей
деятельности. Полезные компоненты и пути освоения их
для нужд человека.
В. Комплексное изучение
би о ц е н о т и че с к и х группировок,
созданных деятельностью
человека
Ценотическая характеристика искусственных сооб-
ществ (полей, хлебных злаков, технических культур,
фруктовых садов, полезащитных полос и т. п.). Эколо-
гическая оценка развивающихся культурных растений
и влияние на них бактерий, грибов, вирусов. Состав и
значение животного населения и фаунистических элемен-
тов на изучаемых полях, связь животных с культурными
растениями и иными компонентами биоценотических
группировок. Условия проявления вредной и полезной
деятельности насекомых и клещей. Пути ограничения
вредных и использования полезных видов (паразитов,
хищников, опылителей).
Изменения, происходящие в ландшафте под влия-
нием хозяйственной деятельности человека. Влияние
неумеренного использования инсектицидов и фунгицидов
против сельскохозяйственных и лесных вредителей. Оцен-
ка эпидемиологической (паразитарной, бактериальной
и вирусной) ситуации в связи с развивающимся живот-
новодством. Возможные вредные влияния, связанные с
деятельностью человека.
Методы повышения продуктивности изучаемых куль-
тур. Улучшение экологических условий. Мероприятия,
ограничивающие численность и деятельность вредителей
п стимулирующие полезную деятельность части энтомо-
комплекса.
К биоценологической группе исследований также от-
носятся работы по изучению биоценотических группиро-
вок, отдельных синузий, комплексов (комплекс энтомофа-
гов, комплекс опылителей, комплекс обитателей нор и
гнезд, комплекс насекомых, населяющих отдельные по-
роды деревьев) и др. Вопросы эти обсуждаются в со-
ответствующих местах книги.
19
РАЗРАБОТКА, ВЫБОР И ОБОСНОВАНИЕ
МЕТОДИКИ ИССЛЕДОВАНИЯ
I
I
Методика — совокупность приемов и способов, кото-
рыми пользуются для максимально эффективного реше-
ния поставленных задач и успешного выполнения прог-
раммы. Методика, как и вообще метод, в большинстве
случаев, как указывалось, вытекает из направления,
уровня и содержания исследований (из программы),
зависит от путей разрешения вопроса, от принципиальных
установок и, наконец, от материально-технических воз-
можностей. Выбор способов и приемов получения науч-
ной информации в значительной мере определяется и
качественной спецификой самого биологического объек-
та. Вот почему при планировании, после того как состав-
лена программа и определены аспекты и направления,
разрабатывают и уточняют конкретную (частную) ме-
тодику— устанавливают наиболее целесообразный и эф-
фективный путь осуществления намеченной работы и
подбирают нужное для этого материально-техническое
оснащение. Разработка методики, таким образом, явля-
ется основным и обязательным элементом планирования.
Необходимо как можно больше разнообразить и обнов-
лять способы и приемы работы. Нельзя забывать, что
как методика, так и технические средства совершенст-
вуются, поэтому обязательна творческая проверка ме-
тодики, включение новых приемов и разработка новых
принципов и путей.
Оборудование и рабочий план
Оборудование. Применение современных научных
методов для выполнения поставленной задачи на долж-
ном уровне возможно только при наличии соответствую-
щего оборудования и полевого снаряжения. Материаль-
но-техническое оснащение полевой работы зависит от
программы исследования и определяется применяемой
(избранной) методикой, кроме того, зависит от техничес-
ких средств и материальных возможностей. Нет нужды
перечислять и характеризовать оборудование для каждо-
го типа работ. Необходимое при тех или иных исследо-
ваниях оборудование и оснащение охарактеризовано в
20
соответствующих разделах (см. ниже) и при описаний
методики изучения отдельных вопросов. Здесь можно
ограничиться лишь общими требованиями, предъявляе-
мыми к нему. Оборудование должно обеспечить высокую
эффективность в работе и правильность результатов,
должно быть доступным и удобным в обращении и в ре-
монте, (в случае поломки) портативным, прочным и
легким.
Рабочий план. После того как разработана програм-
ма, определено направление, продумана методика, по-
добрано оборудование, необходимо составить рабочий
план, в котором следует указать продолжительность и
общий срок выполнения исследований, сроки и сезоны
проведения отдельных мероприятий. В рабочем (кален-
дарном) плане предусматривают очередность выполне-
ния тех или иных работ с указанием методики. Равно-
мерно распределяют работу на все месяцы года. При
возможности предусматривается перенесение части рабо-
ты по камеральной обработке на зимний сезон или на
период, когда по сезонным или иным условиям нельзя
выполнять полевую работу.
Обзор применяемых в полевых исследованиях
методов и приемов
Различают два типа, проводимых на разных уровнях
изучения, полевых исследований — экспедиционный и
стационарный. Отличаясь внешне друг от друга степенью
постоянства и длительностью времени пребывания иссле-
дователя на одном месте, указанные типы не имеют рез-
кой грани, так как даже при дальних экспедициях про-
водят стационарные исследования, а при стационарных
работах для получения сравнительного материала совер-
шают экскурсии в пределах района. Правильнее разли-
чать типы исследования по применяемой методике.
Экспедиционное исследование с кратковременным
пребыванием на одном месте имеет целью проведение в
одних случаях рекогносцировочных, в других — более
широких исследований на протяжении сравнительно не-
большого отрезка времени. Это маршрутный (экспеди-
ционный) или, как его еще называют, походный метод
получения информаций. Широко применяется он при фау-
21
Мистических, эколого-фаунйстическйх, зоогеографическйх
и других исследованиях. При этом широком охвате мож-
но составить представление об общих закономерностях
распространения животных, в том числе и насекомых, в
пространстве и во времени, можно собрать серийный ма-
териал и сведения о составе и экологическом распростра-
нении видов. Однако при маршрутных исследованиях мы
не получим возможности систематически наблюдать жи-
вотных в месте их обитания, не получим полных данных
по экологии и вообще биологии того или иного вида
животного. Кроме того, при походной, экспедиционной
работе много времени тратится непроизводительно на
переходы и часто бывает исключена возможность полной
обработки материала.
Стационарные работы проводятся в одном, строго
определенном месте. При этом тот или иной вопрос
исследуется регулярно и последовательно длительное
время. Наблюдения в природе, постановка экспериментов
и сбор материала чередуются с его обработкой. При
стационарных исследованиях экологические работы мо-
гут проводиться беспрерывно круглый год. Такие иссле-
дования в отличие от маршрутных позволяют полно и
детально изучить экологию вида или группы их на фоне
сезонного изменения условий существования.
Обычно при полевых работах стационарные исследо-
вания фактически комбинируются с маршрутными.
При полевых исследованиях применяют комплекс
приемов и методов. Основой всякого биологического
исследования и исходным пунктом научного пути, по
которому оно движется, является наблюдение. Широко
пользуются наблюдением и при полевых исследованиях.
Известны различные уровни наблюдений. Различают
наблюдения непосредственные — визуальные и наблюде-
ния инструментальные, осуществляемые с помощью спе-
циальных приспособлений. Кроме того, бывают наблюде-
ния прямые — простые и косвенные—более сложные.
Нередко в полевых исследованиях, особенно в экологи-
ческих и биоценологических работах, применяют слож-
ное наблюдение — эксперимент (изолируют и исследуют
отдельное явление в чистом виде). Экспериментальный
метод предполагает активное вмешательство человека
в процессы природы и целенаправленное испытание ис-
следуемых объектов. В ряде случаев наблюдения совер-
22
шснствуются применением современной аппаратуры.
Явления природы фиксируют техническими средствами
(фотография, фото-, киносъемки, звукозапись, хрономет-
раж) и как бы сохраняют эти явления для повторных
наблюдений и сравнений в лабораторных условиях, это
расширяет наши возможности, кроме того, позволяет
сделать более доказательной полученную наблюдениями
в природе информацию. Таким образом, наблюдения—>
основа биологических знаний, а наблюдательность—важ-
ное личное вооружение зоолога, ведущего исследования.
Для обработки таких материалов наблюдения применя-
ют математические методы. Данные наблюдений фикси-
руют в количественных показателях.
На основе обработки материалов наблюдений (в ши-
роком понимании) проводится' описание. Научное опи-
сание тесно сопряжено с элементами сравнения, сопос-
тавления и отбора фактов, чем достигается упорядочение,
систематизация и обобщение данных. Сравнение как ме-
тод дает возможность познать явления во всей полноте,
но, кроме того, сравнение — один из приемов доказатель-
ства полученного знания. Сравнение как метод приме-
няется во всех науках и значение его хорошо выражено
в словах И. П. Павлова: «Изучайте, сопоставляйте, на-
копляйте факты... пытайтесь проникнуть в тайну их воз-
никновения.,..». Только путем сопоставления и анализа
полученных сравнительных данных можно определить
условия существования вида и действительно глубоко
познать жизнь животных. В полевой экологии очень ве-
лико значение сравнительных наблюдений и эксперимен-
тов, без них не обходится ни одно экологическое иссле-
дование. В полевых исследованиях широко пользуются
сравнительно-географическим и сравнительно-экологи-
ческим методом. Последний широко применяется и в
прикладной энтомологии.
Ведение дневника и другие способы
фиксации исследований
Все наблюдения и все факты необходимо фиксиро-
вать точно и своевременно. Только тогда они обретают
научную ценность. Следует помнить, что даже важный
факт или редкая находка без должной паспортизации
23
может совершенно обесцениться. Никогда не стоит по-
лагаться на память. Следует записывать только те фак-
ты, которые наблюдал сам. Если приведенные факты
записаны со слов, то необходимо указать фамилию,
должность и другие данные о лице, давшем сведения
или материал. Записывать необходимо разборчиво, изла-
гать факты кратко, точно и ясно. При несоблюдении этих
правил, хотя бы частично, записи теряют свою досто-
верность или становятся малоубедительными.
Не следует пренебрегать и технической стороной
ведения записей. Записи во время экскурсии по ходу
работы производятся графитным (обычным или цанго-
вым) карандашом в записной книжке на одной стороне
листа, затем дома, на базе или на привале обязательно
переносятся в дневник. Это делают вечером или в другие
свободные от наблюдений или экскурсий часы; можно
также использовать свободные часы и дни во время
наступившей ненастной погоды. Вообще же для оформ-
ления дневника не следует жалеть время. В поле записи
делают в специальных полевых книжках (в клетку)
формата почтовой открытки. Такую книжку можно хра-
нить в кармане, лучше привязав ее во избежание потери
шнурком к сумке или петле куртки. Вести дневник лучше
в общей тетради в клетку, в плотном переплете. Записи
следует делать разборчиво, так как дневником постоянно
будут пользоваться многие специалисты. Все страницы
в дневнике должны быть пронумерованы и на каждой
странице должна быть проставлена дата.
Иногда для записи данных полевых исследований
используют специально заготовленные бланки по той или
иной форме (по конкретному вопросу темы исследова-
ния). При полевых исследованиях остается только за-
полнить их1. Это конкретизирует записи, организует
внимание, упрощает работу, однако ни в коем случае
не исключает необходимости ведения дневника. Напро-
тив, в связи с конкретизацией наблюдений в виде лако-
ничных или цифровых записей необходимо уточнять,
объяснять или комментировать некоторые явления. В
этих случаях в дневнике обязательны ссылки на карточ-
ки, к которым относятся записи. Кроме того, в дневнике
1 Формы карточек приведены в соответствующих разделах по-
собия.
24
должны повторяться сведения, занесенные в бланк.
Преимущества карточек в простоте обработки записей.
Карточки можно подобрать по любому признаку: по био-
топам, по видам, по сезонам, по явлениям, по времени
суток и т. д. Вместо карточек можно вести полевой жур-
нал по специальной форме. Применяется журнал при
экспедиционных работах, экспериментальных исследова-
ниях и при ведении фенологических и других постоянных
наблюдениях.
Записи в дневнике могут быть хронологическими или
тематическими (например, повидовыми), что зависит от
программы, темы работ и методики исследования. Упо-
мянутые выше карточки, предполагающие тематическое
ведение записей, отличаются меньшей документаль-
ностью и имеют ограниченное применение. В этих случа-
ях записи в дневнике следует делать в хронологическом
порядке. Хронологические записи — наиболее распростра-
ненный тип ведения дневника, они более документальны,
здесь исключены или почти исключены пропуски, неточ-
ности, чего нельзя сказать о записях по темам или видам.
В дневник, кроме записей и цифровых данных, реко-
мендуется заносить и зарисовки, планы, топографические
съемки. Часто схематические зарисовки (например, рас-
положение яиц в кладке, место локализации на растении
кладок, личинок или имаго, схема ходов, характер пов-
реждений, морфологические особенности личинки, кукол-
ки и т. д.) имеют большее значение, чем словесное описа-
ние. Такие зарисовки, схемы, картограммы особенно
важны при экологических работах. Хорошо делать схе-
матические наброски ландшафтов, биотопов, стаций тех
или иных видов. Даже схематическая карта (план)
распределения биотопов поможет разобраться в опреде-
лении границ биоценозов, облегчит изучение стаций, не
говоря уже о том, что она с успехом может быть исполь-
зована для иллюстрации при оформлении работы.
Кроме ведения записей и зарисовок, многие предметы
и явления можно фотографировать. Хорошо сделанный
и правильно этикетированный снимок — такой же науч-
ный документ, как и дневник, коллекционный материал
или полевая карточка. Особенно ценны при полевых эко-
логических работах фотоснимки, характеризующие ста-
ции того или иного животного (рис. 1), макрофотографии
отдельных видов в их связях с растением или другими
25
Рис. 1. Ландшафт (образец съемки)
условиями (рис. 2). Такие фотографии заменят длинное
изложение, описание и дадут более отчетливое и конкрет-
ное представление об исследуемом объекте и материале.
При фотографировании необходимо аккуратно регистри-
ровать каждый снимок в дневнике или в специальной
книжке для последующей точной этикетировки. Жела-
тельно делать и цветные снимки.
Богатый и ценный материал по убедительности и пол-
ноте дает киносъемка. Она служит незаменимым сред-
ством иллюстрации и научной документации. Но неизме-
римо большее значение в наше время приобретает
киносъемка как особый метод исследования. Изучение,
например, таких вопросов, как поведение и жизнедеятель-
ность организмов, достигается использованием,современ-
ных технических средств, как киносъемка, ультразвуко-
запись, автоматический хронометраж.
Киносъемки служат основой для изучения поведения
и составления этограмм типичных форм инстинктивного
поведения животных («танцы» пчел, стадные отношения,
защитные позы и реакции, кладка яиц, прием пищи
и т. п.).
26
Рис. 2. Гусеница на листьях дуба (обра-
зец съемки)
Имеется много фото- и кинокамер, которые с успехом
могут быть использованы для научных целей. Описание
техники научной фотографии и киносъемки при полевых
исследованиях можно найти в ряде специальных руко-
водств.
ИЗУЧЕНИЕ ФАКТОРОВ СРЕДЫ
ОБЩИЕ ЗАМЕЧАНИЯ
Средой для животных является определенная терри-
тория с характерными особенностями рельефа, почвен-
ного (покрова, с особыми свойствами атмосферы, микро-
климата, а также с определенным растительным
и животным миром.
Без учета указанных элементов, образующих единый
взаимообусловленный комплекс внешних факторов,
нельзя познать жизнь интересующих нас организмов.
Знание образа жизни животных предполагает изучение
общих условий существования организмов, изучение той
обстановки, в которой живет и развивается вид или
комплекс видов животных и которая определяет специ-
фику жизненных процессов.
Каждый исследователь, изучающий живые объекты,
никогда не обходится и не может обходиться без дол-
жного описания условий отдельных участков арены жиз-
ни, особенно тех, которые прямо или косвенно воздей-
ствуют на рост, развитие, размножение, распространение
и выживание вида.
Для правильного решения подлежащего исследова-
нию экологического вопроса необходимо точно понимать
явления, строго разграничивать термины, обозначающие
эти явления, четко представлять себе то или иное поня-
тие. В этом отношении нет, к сожалению, еще единого
взгляда. Некоторые научные понятия и термины, обозна-
чающие арену жизни, еще не установились или еще не-
достаточно разработаны. Поэтому автор излагает эти
положения в такой интерпретации, которая, по его мне-
нию, является наиболее приемлемой для учебных целей
и удобной для пользования. Интересующиеся иными
точками зрения могут ознакомиться с ними в специаль-
ной литературе.
28
Рис. 3. Характерные биотопы в ландшафтах Карпат
Основная единица подразделения -среды (арены жиз-
ни) — биотоп. Биотоп — более или менее однородный
участок ‘пространства на достаточно обширной террито-
рии, к которому приурочен определенный комплекс рас-
тительных и животных организмов. Он является сос-
тавным элементом ландшафтов в географической зоне.
Биотоп не только участок среды, он в то же время и
место существования приспособленного к нему комплек-
са группировок, это —жилое место. Поэтому он опреде-
ляется не только физико-географическими особенностя-
ми, но и характером на-селения. В тех или иных зонах
и ландшафтах можно выделить различные биотопы.
Различают биотопы горных лесов, долин рек, степей
и т. д. Таким образом, термин биотоп употребляется для
обозначения не одного определенного участка, а всех
сходных мест, в которых подобные группировки живот-
ных встречаются или могут встречаться.
Совокупность условий биотопа, которые могут вли-
ять на организм, составляет биотопические факторы.
К последним приспосабливаются животные и растения.
29
Описывая биотопы следует обращать внимание на
такие особенности, как: а) высота над уровнем моря,
которая обусловливает вертикально-зональное распреде-
ление экологических элементов среды; б) рельеф, являю-
щийся причиной многих микроусловий; в) почва как
важный комплексный фактор для многих обитающих в
ней организмов. На этом основании почвенные условия
рассматривают как самостоятельный эдафический фак-
тор; мы их лишь для удобства рассмотрим в составе
биотопических факторов.
Биотопы в сочетании с условиями определенных кли-
матических зон и под влиянием конкретного метеороло-
гического режима образуют качественно новые жилые
места — экотопы (по Станчинскому). Эти участки с
определенными физико-географическими и климатиче-
скими особенностями — экотопы— и находящиеся во
взаимодействии с ним растительные и животные группи-
ровки организмов образуют биоценозы.
Эколог, изучающий те или иные группировки живот-
ных или биоценозы, практически имеет дело с конкрет-
ными биотопами в определенном климате, т. е. с экото-
пом. Часто выделяют участки пространства преимуще-
ственно по принципу их хозяйственного использования.
Для их обозначения употребляют название угодье. Раз-
личают такие угодья: выпасы, овраги, обочины арыков,
пахотные земли, заливные луга, сенокосные луга и т. д.,
в которых создаются специфические условия и к кото-
рым приурочены животные и растения. Это — культур-
ные экотопы (рис. 4).
Изучая экологию какого-либо вида животного, мы
непременно должны изучать и фактически изучаем одно-
родную обстановку, условия, в которых обитает популя-
ция данного, вида. Все эти 'места жизни популяции в
пределах ареала вида составляют участки обитания или
стацию вида. Стация может выделяться и характеризо-
ваться всегда только с учетом изучаемых видов живот-
ных. Можно различать, например, стации малярийного
комара, стации клеща, стации итальянской саранчи
и т. д. Без указания объекта изучения (вида животного)
понятие теряет свое содержание. Стация каждой попу-
ляции вида имеет свои границы в пределах ареала вида.
В одних случаях они будут совпадать с границами эко-
топа, а иных — могут охватывать несколько экотопов,
30
Рис. 4. Экотопы антропогенного ландшафта
Рис. 5. Стации отдельных видов
и, напротив, в ряде случаев в экотоне может быть нес-
колько стаций изучаемого вида.
Стации вида в различных ландшафтно-географиче-
ских зонах ареала могут быть неодинаковыми. Так, со-
гласно правилу смены стаций, разработанному Г. Я. Бей-
Биенко, виды с широким ареалом в южных его частях
занимают более увлажненные и затененные стации, где
не так сказывается воздействие южного солнца. В север-
Рис. 6. Диаграмма зональной смены стаций (по Бей-
Биенко)
ных же частях ареала стациями тех же видов являются
более освещенные, хорошо прогреваемые участки (скло-
ны холмов, открытые места) (рис. 6).
Но, кроме смены стаций, наблюдается изменение эко-
логического стандарта и вид занимает стацию с иными,
чем в других зонах; свойствами. Это 'следует иметь ib ви-
ду при экологических исследованиях.
Виды, характеризующиеся высокой подвижностью,
а также те, которые имеют в своем развитии несколько
активных фаз, занимают несколько совершенно отлича-
ющихся одна от другой стаций. Личинки могут быть
в почве, имаго — на кустарниках или деревьях (хрущи).
У кровососов (комаров) личинка ведет водный образ
жизни, самка питается на теплокровных животных,
а стациями имаго являются жилища человека, хозяйст-
венные помещения. Стации могут определяться релье-
фом, почвой, растительным покровом, микроклиматом,
гидрохимическими и другими показателями. Внешне ка-
32
Рис. 7. Стации различных видов на склоне горы
жущиеся однородными стации в действительности могут
значительно отличаться своими микроклиматическими
условиями. Это обнаруживают по наличию популяции
того или иного вида, являющегося индикатором
микроусловий.
Для обозначения не какой-либо одной определенной
стации, а -вообще мест, в которых вид встречается или
может встречаться, пользуются термином «местооби-
тание».
Популяция — совокупность особей (население) одно-
го вида животных какой-либо обособленной части аре-
ала ic более или менее одинаковыми экологическими
свойствами (с учетом возрастных особенностей). Состав
11 о п ул яции опр ед ел яется истор ически сложившим и ся
взаимоотношениями вида и условий среды в -разных
частях ареала. У некоторых животных в ограниченном
н определенном участке обитания могут возникать спе-
цифические популяции. У видов, имеющих ареал с мно-
жеством характерных особенностей среды, встречается
большое мноообразие популяций. Другие виды на сра-
внительно большом однородном пространстве образуют
2—1867
33
оолее или менее однородное 'население, одну популяцию,
хотя генетически она может быть неоднородной. Непра-
вильно называть популяцией все животное население
участка.
Биоценоз — комплекс растительных и животных ор-
ганизмО|В какого-либо определенного биотопа (экотопа),
обеспечивающий нормальный круговорот веществ. В ре-
альности биоценоза в настоящее время никто не сомне-
вается, однако в понимании его нет единства *. Нет
и установившегося, общепринятого определения этого
понятия.
Но в любом случае при изучении биоценоза как ком-
плекса (сообщества) и как фактора 'Среды для лучшего
его понимания должны быть в определении подчеркну-
ты следующие характеризующие биоценоз моменты.
1. В биоценоз входят растения и животные; 'видовой
состав входящих в биоценоз организмов и их 'взаимоот-
ношения имеют комплексный характер. Основным усло-
вием существования биоценоза является наличие для
организмов — компонентов биоценоза — возможностей
удовлетворять свои требования к условиям жизни.
2. Биоценоз возникает исторически и формируется
из комплекса организмов, их взаимоотношений, образу-
ющих ценотические системы.
3. Возникает и формируется биоценоз обязательно
в определенных биотопах и в конкретном климате и раз-
вивается в соответствующих экотопах. В каждом био-
ценозе существуют ведущие компоненты, которые ока-
зывают решающее 'влияние на формирование и разви-
тие всего биоценоза.
4. Биоценоз развивается и изменяется в связи с из-
менением условий экотопа (биотопа и климата) и под
влиянием различных других причин, в том числе и дея-
тельности человека; развивается он также в связи с эво-
люцией 1ВИДО1В и под влиянием противоречий в разнооб-
разных внутривидовых и межвидовых отношениях, что
в свою очередь также стоит и связи с изменением эко-
топа.
1 См. литературу: Буковский (1935), Зернов (1949), Кашкаров
(1944), Крышталь (1955), Мебиус (1877), Наумов (1955), Павлов-
ский (1950), Поляков и Шумаков (1955), Арнольди (1951), Бей-Би-
енко (1966), Гиляров (1965, 1966) и др.
34
Ь. Для естественных биоценозов характерно саморегу-
лирование.
<>. Деятельность человека изменяет биотоп 'И климат,
а имеете с ними и биоценоз, следовательно, утрачивает-
<я саморегулирование. В этих случаях на месте старого
биоценоза возможно формирование нового биоценоза
<плчала в виде биоценотических группировок, которое
проходит под постоянным воздействием антропогенных
факторов. В таких случаях новый, культурный биоценоз,
л и шейный свойств целого, существует до тех пор, пока
щТк’твуют указанные факторы. Такие группировки ре-
ципируются человеком.
11а основании сказанного можно было бы дать сле-
нующее определение биоценоза. Биоценоз — исторически
сложившийся комплекс организмов (составляющих це-
иогпческие системы), локализованный в определенном
жогопе, способный развиваться вместе с развитием вхо-
дящих в него видов (под влиянием противоречий видо-
вых отношений), изменяющихся в связи с изменением
жотоиа (условий существования).
Различают биоценоз естественный, дикий — истори-
чески сложившийся первичный биоценоз (биоценозы
горных долин, луга, опушки леса и т. д.) и искусствен-
ный, культурный — вторичный биоценоз (биоценозы са-
цов, виноградников и других искусственных насажде-
нии). В культурных экотонах из осколков разрушенных
диких биоценозов и имигрантов из уцелевших создаются
временные новые группировки — биоценотические, сос-
।являющие определенный этап становления биоценозов
(Фасулати, 1947).
Группировки в культурных экотопах рекомендуют
напивать агробиоценозами (Бей-Биенко, 1957, Гиляров,
IЧ()3, 1968). Так как эти группировки временные и состо-
ит из отдельных синузий (консорций) и в своем сущест-
вовании регулируются деятельностью человека, подход
к их изучению должен быть иным, чем при изучении
сложившихся биоценозов. Биоценологическое изучение
ж гомокомплексов культурных биотопов, в том числе и
посевов, имеет первостепенное значение и в последнее
время привлекает внимание многих экологов, однако
методика еще не установилась.
Наряду с накоплением научной информации, позво-
ляющей судить о некоторых закономерностях формиро-
35
Рис. 8. График закрытости горизонта
(по Щербань)
Рис. 9. Лиственный лес, поляна
тиши. разрабатывается теория вторичных биоценозов
и м<*।(i/uiка их изучения. В основном применяется срав-
ни н^ишо-экологический метод, как и при изучении есте-
• Шеиных биоценозов. Принципиально новым и доступ-
ным является постановка полевого опыта, эксперимента.
Чля выделения характерных биотопов в полевых ус-
KiiiiiHX следует описать все элементы, которые его обра-
зин.
Ниже мы подробно рассматриваем отдельные факто-
ры среды. Для удобства приводим их в той последова-
H’.’ibiiocTH, в которой их легче характеризовать.
АБИОТИЧЕСКИЕ ФАКТОРЫ
Биотопические факторы. Высота и рельеф
Высота над уровнем моря, рельеф й физико-химиче-
< кие особенности верхнего слоя земли, как известно,
<»к.11ывают прямое влияние на организмы. Кроме того,
к’пствуя косвенно, они имеют большое значение для
формирования микроклимата и других микроусловий.
Иги факторы при экологических исследованиях обяза-
ir'ihiio должны учитываться.
Высота. Высота местности определяет атмосферное
/1лплсиие, температурные и другие абиотические усло-
вия, влияющие на жизнедеятельность организмов, поэ-
юму, описывая биотопы, особенно в горной местности,
следует определять и высоту. Это делается при помощи
анероида или специального прибора — альтиметра.
В крайнем случае можно пользоваться топографически-
ми картами, на которых приведены основные высоты.
Рельеф. Особое внимание следует обратить на рель-
еф. В зависимости от рельефа формируется и микрокли-
мат, который служит причиной многих особенностей
среды, включая характер и направление ветров. Боль-
ниц' влияние рельеф оказывает на температуру воздуха
в солнечную погоду, что обусловлено неодинаковым на-
। реваиием склонов разной крутизны и экспозиции, а так-
же1 (‘током и подъемом воздуха по склонам (см. радиа-
цию, стр. 83). При описании рельефа следует отметить
такие важные элементы, как равнины (уклон не свыше
0.5°), холмы (высота до 200 л/), горы (свыше 200 м над
37
уровнем моря). Описывают направление и характер ок-
ружающих возвышенностей, направление и характер
долин, их ширину, поперечный и продольный профиль, на-
Рис. 10. Схематическое изображение плана долины
р. Уж (ориг.)
личие крупных поворотов или сужений долины. Отмеча-
ют выходы долин второго порядка и балок. Все эти дан-
ные заносят в виде схемы в дневник (рис. 10, И). Если
вблизи изучаемого участка имеются море, озера, реки
или другие водоемы, определяют расстояние до них, их
размеры и все это заносят на карту.
Если биотопы расположены на склоне, отмечают ха-
рактер последнего: склон в долину, открытый склон к
38
Ц.4П равнине. Определяют экспозицию и крутизну
। hiii.i; различают склоны: пологие (уклон 2—7°), пока-
ii.ir (уклон 7—15°), крутые (уклон 15—40°), обрывистые
..... свыше 40°) склоны (рис. 12). При описании био-
ник hi на высоких местах указывают характер возвышен-
но» in (холм, отдельная гора, гребень). Отмечают высоту
Рис. 12. Различные элементы рельефа (объяснения в
н’ксте)
пал дном долины или равнины, характер самой верши-
ны если вершина плоская, указывают размеры плос-
кой части, ее форму (округлая, вытянутая, в каком на-
правлении). Все эти данные заносят на план.
Во всех биотопах отмечают характер поверхности и
особенности ее строения: трещиноватость, промоины от
Ю/кдя, протоптанные скотом выбоины и дорожки, камни
н щебень на поверхности, поросшие мхом и лишайни-
ком выходы, присутствие солей на солончаках и т. д.
Почва как фактор среды
Почва представляет собой чрезвычайно сложный
комплекс переплетающихся между собой факторов. Поэ-
। <»му выделить какой-нибудь из них (как и при изучении
климата) бывает иногда очень трудно. Все же это при-
едятся делать для понимания почвы как экологиче-
« кого фактора. Для организмов имеют значение как
физические свойства и химический состав почвы, так и
биология ее.
Физические свойства почвы имеют нередко первосте-
пенное значение для обитающих в ней и на ней живот-
ных. Замечено, например, что роющие позвоночные жи-
вотные избегают грубых, особенно щебневатых почв. В
1ЛКИХ почвах отсутствуют или малочисленны и беспоз-
воночные: земляные черви, личинки жуков и др. В рых-
,39
лой, богатой перегноем почве обитает большое обилие
видов животных. Имеет значение и химизм почвы. На-
пример, больше моллюсков как по числу видов, так и по
количеству особей на известковых почвах. Характер
жизни в почве зависит от свойств самого субстрата. Су-
щественные же процессы почвообразования происходят
при непременном участии организмов. Вот почему по
комплексу почвообитающих беспозвоночных, обусловли-
вающих в значительной мере тот или иной тип почвооб-
разовательного процесса, лучше всего определить, как
указывает Гиляров (1967), гидротермический режим и в
целом весь режим почвы.
Почву можно изучать морфологически, химически,
генетически, но существо ее составляет жизнь, протека-
ющая в ней (Петров, 1954). Чтобы сохранить почву как
живое тело, при изучении ее следует рассматривать от-
дельные элементы лишь как условия жизни организмов,
биоценозов и как компоненты последнего1.
Физические свойства почвы. При изучении экологии
животных, их вертикального и горизонтального распре-
деления, а также приуроченности к различным биотопам
следует изучать среду и прежде всего обращать внима-
ние на такие физические свойства почвы и ее горизон-
тов, как влажность, связность, плотность (твердость),
пластичность. Значение каждого из них огромно. От
влажности, например, зависит наличие дождевых чер-
вей, глубина их обитания; связность влияет на продви-
жение организмов в почве; пластичность имеет значение
для прокладывания и заделки нор. Сведения о физичес-
ких свойствах почвы нужны при исследованиях залега-
ния личинок на окукливание, развития почвенных живот-
ных и других вопросов.
Влажность. Степень увлажнения почвы зависит от
уровня состояния грунтовых вод, от механического сос-
тава ее и от других причин. Существует очень много спо-
собов инструментального и визуального определения
влажности почвы. Инструментальный метод осуществля-
ется двумя способами.
1. По образцу (пробе), взятому из слоя почвы, с по-
следующей обработкой в лаборатории; метод трудоем-
кий, но достигается большая точность.
1 Изучение влияния организмов на свойства почвы см.
стр. 267, 271.
40
? Непосредственно в природе: в слое почвы, с по-
ннцыо прибора, рабочая часть (датчик) которого уста-
п.1 нливается в определенной точке. Преимущества мето-
i.i, во-первых, в том, что он дает возможность просле-
।и 11. последовательные изменения влагосодержания
и*i'ihi.i в месте наблюдений; во-вторых, для таких наблю-
iciihh нужна небольшая площадь; кроме того, эти иссле-
|'>н.111пя менее трудоемки — заключаются* они только в
• >п чсте по прибору и нахождении значений по таблице.
В полевой обстановке определяют еще визуально —
прямыми наблюдениями — по следующей шкале (по
Р.чмепскому, с изменениями):
Валл 1. Почва сухая, не холодит руки; песок сыплет-
• >i. глина высохла в крепкие комки; высыхая на воздухе,
ini'i।п не светлеет.
Валл 2. Почва свежая, слегка холодит руки и очень
<лабо светлеет при высыхании; песок обнаруживает сла-
|>\к> связность, глина—лишь следы способности скаты-
ши вся, прижатая к почве фильтровальная бумага не
намокает.
Валл 3. Почва влажная, заметно холодит, значитель-
но светлеет, высыхая, увлажняет придавленную к почве
фильтровальную бумагу; песок легко формуется, глины
н суглинки скатываются, но «колбаска» легко трес-
кается.
Валл 4. Почва сырая, еще не лоснится, но уже при
высыхании сильно светлеет; на ощупь холодная и сырая;
приложенная обыкновенная бумага промокает; на за-
пыленной руке дает темный отпечаток.
Валл 5. Почва мокрая, блестит, лоснится от покрыва-
ющей ее пленки воды; обнаруживается текучесть, почва
не скатывается, а больше размазывается.
В последнее время предложена другая шкала визу-
ального определения влажности почвы (С. А. Вериго и
Л. Л. Разумова, 1964), которая применяется на гидро-
метеостанциях. Основана на принципе увеличения силы
сцепления между почвенными частицами по мере умень-
шения содержания влаги. Определяют влажность по
следующим пяти градациям:
текучее состояние — сцепление между частицами
отсутствует;
липкое состояние, что совпадает с максимальной вла-
। оемкостью;
41
мягкопластичпое состояние — капилляры освобожда-
ются от воды, сила сцепления возрастает, почва переста-
ет быть липкой;
твердопластичное состояние — влага остается только
в капиллярах, сцеплепие увеличивается, утрачивается
мягкопластичность;
твердое или сухое состояние — сухая почва откалы-
вается глыбами или рассыпается.
Связность. Чем легче по механическому составу, чем
рыхлее и чем влажнее почва, тем меньше ее связность.
Чаще всего связность определяют при копании лопатой
по нижеследующим признакам (по Красюку):
малосвязная (легкая) почва — к лопате при копании
не пристает и с лопаты сбрасывается рыхлыми пластами;
средней связности (среднетяжелая) почва — к лопате
прилипает, но сравнительно легко отделяется от нее;
очень связная (тяжелая) почва — при копании силь-
но прилипает к лопате и с трудом очищается с нее.
Плотность (твердость) определяют также при копа-
нии по следующим признакам:
очень твердая почва — представляет собой чрезвы-
чайно компактную массу, почти не поддающуюся копа-
нию лопатой;
почва средней твердости — лопата входит в почву с
некоторым усилием, в несколько приемов, но все же зна-
чительно легче, чем в первом случае, из ямы почву вы-
брасывают целыми пластами;
рыхлая почва — лопата входит сразу на весь штык и
при выбрасывании из ямы почва легко рассыпается.
Пластичность (скатываемость) определяют пробой
руками. Для этого кусочек почвы сильно увлажняют
почти до состояния текучести (размазываемости), затем
между ладонями скатывают из нее шарик, который за-
тем раскатывают в возможно более тонкую «колбаску».
Легкие почвы скатываются только в шарик и развали-
ваются при попытке раскатать их в проволочку. Чем тя-
желее почва, тем в более тонкую проволочку она ска-
тывается. Такая проволочка прочна, не трескается при
сгибании в кольцо и с трудом раздавливается.
Структура почвы. От структуры зависит та или иная
пористость (скважность) почвы, а также ее водные и
воздушные свойства. Структура почвы обусловливает
оптимальные для жизни растений и животных физичес-
42
кие свойства; от структуры, например, зависит развитие
филлоксеры корневой формы и распространение ее.
< ipyicrypa почвы влияет на эффективность внесенных
фумигантов. Определение структуры крайне необходимо
при изучении эдафических факторов. Образцы почвы
• шрсделяют визуально по следующим признакам:
зернистая структура — типичные зерна темного цвета
< блестящей поверхностью, в сухом состоянии легко от-
еляются друг от друга, а, будучи связаны тонким ко-
решком, образуют «бусы»;
орсховатая структура — типичные орешки, более или
менее правильно ограниченные, иногда распадаются на
более мелкие частицы (свойственна верхним горизонтам
серых лесных почв, глубоким горизонтам выщелоченных
•к'рпоземов и др.);
'•толбчатая структура—-многогранные столбики с за-
кругленной головкой; распадаются на более мелкие час-
III ореховатые и призмовидные (уплотненный горизонт
солонцов);
плитчатая структура — характерна для верхних гори-
loiiTOB подзолистых и бурых почв некоторых солонцов и
солодей. Сильно подзолистым суглинистым почвам свой-
ственна нежная листоватая структура; в глубокой части
последняя переходит в пластинчатую и плитчатую струк-
туры;
чешуйчатая структура — свойственна самым поверх-
ностным горизонтам бурых почв, солонцов, а также на-
блюдается на поверхности некоторых почв, которые под-
вергались вспашке на зябь.
Механический состав почвы. Механический состав
почвы определяет ее термический режим. Глинистые и
суглинистые почвы характеризуются большой теплоем-
костью, что влияет в свою очередь на влагоемкость. Та-
кт' почвы не пропускают воду и способствуют ее испаре-
нию. При полевых исследованиях выделяют следующие
механические разности почв:
глинистые почвы (глины)—почвенная масса с боль-
шим трудом растирается на ладони, под лупой представ-
ляет собой однородный порошок без песчинок или с ми-
нимальным их количеством, в сухом состоянии очень
твердая, образует крепкие комья, борозда от ножа дает
узкую мелкую и блестящую черту, во влажном состоя-
нии очень вязка, пластична и при скатывании образует
43
тонкую длинную «колбаску» толщиной в 2—2,5 мм, она
сгибается в кольцо, не разрываясь;
суглинистые почвы (суглинки)—в растертом состоя-
нии под лупой среди глинистых частиц видны песчинки.
В сухом виде почва довольно плотна; во влажном —
пластична, дает шарик, но «колбаска» разваливается
при сгибании, бороздка от ножа получается матовая и
широкая;
супесчаные почвы — растираются без труда, преобла-
дают хорошо различимые простым глазом песчаные ча-
стицы; ссыхается в непрочные комки, под ножом ощу-
щается характерный хруст и края бороздки крошатся, в
«колбаски» не скатывается;
песчаные почвы — почва состоит почти исключитель-
но из песчинок, в сухом состоянии сыпучая, но во влаж-
ном— текучая масса.
Химический состав почвы. От химического состава
почвы обычно зависит распределение почвенной фауны.
При полевых исследованих определяют:
реакцию почвы — определяют при помощи лакмусо-
вой бумажки, которую зажимают между комками све-
жевыкопаыной почвы, лучше класть одновременно си-
нюю и красную бумажки;
наличие карбонатов — определяют действием 5- или
10%-ным раствором соляной кислоты, вызывающей
вскипание; кислоту капают на почву или подпочву. Сле-
дует различать интенсивность реакции (бурное вскипа-
ние, вскипание, вспучивание), распределение вскипания
по горизонтам (сплошное, местное, прерывистое) и глу-
бину, с которой почва начинает вскипать;
наличке сернокислых солей — для этого сульфаты
извлекают из испытываемой почвы разведенной -соля-
ной кислотой, а вытяжку испытывают несколькими
каплями раствора хлористого бария;
присутствие в почве солей закиси железа —опреде-
ляют путем обработки почвы слабой соляной кислотой
и прибавления к вытяжке 1—2 капель раствора крас-
ной кровяной соли (дает зеленовато-синее окраши-
вание) ;
содержание в почве нормальной соды — к отфильт-
рованной водой вытяжке из почвы добавляют несколь-
ко капель спиртового раствора фенолфталеина (появ-
ляется вишнево-красная окраска).
44
Климатические факторы
Климат представляет собой элемент географической
< рсды. Климатообразующие (Процессы протекают при
постоянном взаимодействии друг с другом в определен-
ных географических условиях. Они определяются мете-
орологическими условиями. Совокупность метеорологи-
ческих элементов в данной местности в какой-то про-
межуток времени составляет погоду. Состояние и
последовательная смена погодных явлений обозначает-
( я как режим погоды, па который действуют и который
определяют такие географические элементы, как обще-
циркуляционные процессы, происходящие в атмосфере,
। (’(Графическая широта, высота над уровнем моря, фор-
ма рельефа, близость океанов и морей и т. д.
Климат — это среднее состояние погоды, находяще-
еся в зависимости от факторов космического и плане-
тарного масштаба. Научные данные, характеризующие
климат того или иного места, обозначаются средними
величинами, которые получаются на основе анализа
результатов многолетних наблюдений, проводимых на
специальных метеорологических станциях. Для сравне-
ния климата разных районов или небольших участков
пользуются различными подразделениями его. Выделя-
ют микроклимат, мезоклимат (местный климат), эко-
клпмат, фитоклимат, микроклимат.
Следует отметить, что эти названия (микроклимат,
♦ коклимат, фитоклцмат) не соответствуют смысловому
значению слова «климат», по существу здесь учитывает-
ся фактический режим метеорологических условий (по-
шла) среди растений и вообще в ограниченном прост-
ранстве, фиксируемых как в момент наблюдений, таки
выраженных в обобщенных характеристиках за сутки,
декаду, сезон. Эти метеорологические условия складыва-
ются под влиянием различных факторов, действие кото-
рых неравнозначно, наиболее сильно влияние деятель-
ности человека.
Макроклимат — режим верхних слоев воздуха.
Он является общим для обширных пространств земной
поверхности. Различия в макроклимате обнаруживаем
лишь между пунктами, расположенными на расстоянии
более сотни километров. Макроклимат может характе-
ризовать особенности географических ландшафтов, но
45
не может дать представления о конкретных условиях
места обитания животного.
Местный климат (мезоклимат) — климат определен-
ной территории несколько меньшего масштаба, клима-
тообразующими факторами здесь будут мезорельеф,
растительные массивы и пр. Различают местный кли-
мат леса, поляны, долины. Образуют местный климат
также осуществляемые на больших пространствах мели-
оративные мероприятия — осушение, полезащитные ле-
сонасаждения. Местный климат существенно отличает-
ся от климата окружающего пространства. Точки, меж-
ду которыми сравнивают показатели местного клима-
та, находятся обычно на расстоянии десятков, сотен
метров. Некоторые экологи определяют его как эко-
климат (ср. Кашкаров, .1945); ботаники — как фи-
токлимат.
Микроклимат — метеорологический режим наземного
слоя воздуха (15—20 см) или мелких участков поверхнос-
ти земли (микрорельеф, характер растительности),’или
же различных полостей (дупла, норы), или же различных
частей кроны дерева и яруса леса. В этих микроклимати-
ческих условиях обычно живут и различные беспозво-
ночные животные. Эти микроусловия наиболее подвер-
жены изменениям, возникшим под влиянием деятельно-
сти человека, так как известно, .например, что вспашкой,
уплотнением и оголением почвы, изменением травостоя
меняется и микроклимат. Имеем дело с микроклиматом
и на грядках, и на посевах, огородах, различаем микро-
климат канавы, межи, участков поля и т. п.
Часто нам -приходится иметь дело с комплексом ми-
кроклиматов: та'к, на 'картофельном поле, до смыкания
ботвы, на открытых участках и на участках, затененных
листьями 'картофеля, микроклимат будет различным (Са-
пожкова, 1950). На посевах хлопка, кукурузы мы наблю-
даем подобную же картину. Меняется микроклимат в
течение сезона и на виноградниках, в садах.
Микроклимат верхних слоев почвы и прилегающего к
ней воздуха находится в непосредственной зависимости
от местных особенностей почвы и растительного покрова,
поэтому отличается исключительной изменчивостью. Ми-
кроклимат, как отчасти и местный климат, вследствие
иных более мелких масштабов не может определяться
средними данными сети метеорологических станций. Поэ-
46
। < >му для изучения его разработаны и широко (применяют-
ся специальные методы исследования.
Конкретное состояние атмосферы, обусловленное фи-
-.|1чески1ми процессами, происходящими в ней под влияни-
ем притока солнечной энергии, при взаимодействии с по-
верхностью земли составляет погоду. Погоду характери-
зуют такие метеорологические элементы: температура и
влажность воздуха, облачность, видимость (прозрачность
атмосферы), осадки, ветер, метели, грозы, туманы, а так-
же испарение с поверхности почвы и водоемов; солнечная
радиация, тепловое излучение земли и атмосфера. В 'каж-
дой изучаемой местности ежедневно при учете метеоро-
логических элементов мы имеем дело с показателями
погодных явлений — с погодой этого дня и данного места.
Метеорологические условия среды по отношению к
организмам являются климатическим фактором. Клима-
тический фактор по сравнению с другими факторами
внешней среды играет доминирующую роль в жизни ор-
ганизмов. Он может влиять на организм как непосред-
ственно, так и через другие факторы.
Исследователь, как правило, располагает только поде-
кадными и месячными средними данными сети метеоро-
логических станций. К тому же эти данные приурочены к
определенным географическим пунктам и дают представ-
ления лишь об условиях этого района.
Метеорологические элементы, обобщенные и приуро-
ченные к календарным периодам, как об этом не раз от-
мечалось в экологической литературе (ср. Кашкаров),
чалски от конкретного хода погодных явлений в разные
юды и особенно в разных географических пунктах. Для
»колота важно по значение каждого такого элемента в
отдельности, а наличие и характер связи между ними, их
совместное воздействие на организм. Так, совершенно
очевидно, что осадки одинаковой силы, выпавшие в ус-
ловиях различных температур и влажности воздуха, име-
ют для растений и животных дадеко не одинаковое зна-
чение.
Общеизвестна и связь температуры и влажности. На-
лл), следовательно, рассматривать метеорологические эле-
менты в их конкретных, наблюдаемых в действительности
сочетаниях. При этом нельзя ограничиваться установле-
нием некоторой средней картины климатических условий,
гак как при экологических работах, как признают мно-
47
гие экологи, не меньшее значение имеет выявление сте-
пени неустойчивости 'климата, характер 'колебаний погод-
ных явлений из года в год и также крайние (максималь-
ные и минимальные) показатели этих явлений.
Обычно для характеристики макроклимата, отчасти и
мезоклимага, пользуются данными стационарных метео-
рологических станций, которые изучают метеорологичес-
кие условия типичной для изучаемого района местности.
Но данные стационарных наблюдений на метеорологи-
ческих станциях, характеризующие лишь условия на вы-
соте 2 м и более обширного района, как уже указывалось
выше, не могут удовлетворить эколога. Такие данные мо-
гут служить лишь для сравнений характера погоды в
разных местах и для общей характеристики метеорологи-
ческих явлений.
При экологических исследованиях в полевой экспеди-
ционной обстановке следует пользоваться походным на-
бором метеорологических приборов. Такие приборы могут
служить для изучения микроклимата различных биотопов
и отдельных местообитаний животных и применяются
как в экспедиционных условиях, так и при полустацио-
нарных исследованиях на базах и биостанциях. Этими
приборами пользуются для выяснения микроусловий при
изучении биоценозов, динамики численности отдельных
видов в них, а также при изучении важнейших видов,
биологии развития интересующих нас животных и т. п.
Температура. Общие замечания. Температура
как экологический фактор оказывает огромное влияние
на развитие организмов, притом различное на разные фа-
зы развития последних. При понижении температуры жи-
зненные процессы в организме животных протекают ме-
нее интенсивно и могут совсем прекратиться. Темпера-
тура, ниже которой невозможны метаболические
процессы и развитие неизменно прекращается, может
быть представлена низкими градиентами. Высокая тем-
пература выше определенной границы тоже может ока-
заться губительной.
Каждый вид животного имеет определенный темпера-
турный оптимум, при котором его жизненные процессы
идут наиболее интенсивно. При понижении или повыше-
нии температуры они замедляются или даже останавли-
ваются. Например, гусеницы озимой совки, располагаю-
щиеся в почве на глубине 10—25 см, не выносят темпера-
48
гуры ниже — 11°С. Для начала весеннего вылета совки
необходима средняя температура воздуха не ниже
|- 12°С, а для .массового вылета-Н7°С. Откладка яиц
возможна при +18°С. Весенний вылет бабочек лугового
мотылька начинается тогда, когда средняя декадная тем-
пература воздуха достигает + 15°С.
В зависимости от температуры изменяется и поведе-
ние животных. Происходят массовые миграции жуков
(долгоносиков) на полях; осы зарываются в землю, где
температура значительно ниже температуры поверхности
н более постоянная. Влияет температура также и на
распространение животных. Температура, действуя как
ограничивающий фактор, оказывает прямое влияние на
организмы, она в значительной мере определяет появле-
ние и распределение вредителей в различных «зонах жиз-
ни» и в различных биотопах. Температура оказывает
влияние также и на внутренних паразитов — понижен-
ная температура подавляет развитие плазмодия у кома-
ров, не влияя на самих насекомых.
Таким образом, есть температуры, ниже и выше кото-
рых развитие останавливается. Эти температурные преде-
лы называют нижними и верхними порогами развития,
ческим нулем. Разность между фактической температу-
рой среды и температурой нижнего порога получила на-
Нижний порог развития иногда еще называют биологи-
звапие эффективной температуры. Для прохождения
каждой стадии развития насекомого требуется определен-
ная сумма эффективных температур, которая определя-
ется по формуле:
Y = n(t — х),
где п — число дней развития;
/ — температура, при которой совершалось раз-
витие;
х — температура порога развития;
t — х — эффективная температура.
Величина порога может быть различной для разных
фаз онтогенеза и даже в пределах одной фазы, что, не-
сомненно, носит адаптивный характер (Горышин, 1966).
Так, перезимовавшие куколки хлопковой совки имеют
очень высокий порог развития (+ 18°С), благодаря чему
вылет бабочек задерживается до появления генеративных
органов у кормовых растений.
49
В значительной мере температурой определяется
распределение организмов по разным слоям в воде, в
почве и по ярусам на растительности. От температуры
зависит и продолжительность развития насекомых в лю-
бой фазе их. Например, гусеница капустной моли при
температуре 20,6°С развивается 11—15 дней; при 24°С —
8—11 дней и при 26,1°С — 6—9 дней. Фаза куколки у лу-
гового мотылька продолжается при 12°С —37—62 дня,
при 17,5°С — 33—37 дней, при 22°С —13—15 дней.
Температура влияет на морфологию, биологию и вы-
живание организмов и, наконец, может оказать влияние
на образование новых наследственных морфологических
изменений, а длительное воздействие этого фактора при-
водит к образованию соответствующих жизненных форм,
иначе говоря, температура играет большую роль в про-
цессе формообразования (видообразования) и в завоева-
нии видом новых мест обитания.
Измерение температуры и описание
приборов. Для измерения температуры в полевой об-
становке служат термометры таких типов: максималь-
ный, минимальный, срочный почвенный, срочный на по-
верхности почвы, срочный воздушный, пращ-термометр,
термопара, термограф, электротермомегр (рис. 13).
Максимальный термометр служит для определения
наибольшей, максимальной, температуры за данный изу-
чаемый промежуток времени от последнего измерения.
Основное достоинство этого термометра — автоматич-
ность регистрации наивысшей температуры. В ртутных
максимальных термометрах капиллярная трубка вблизи
резервуара сужена. Когда температура повышается, не-
которое количество ртути выходит через сужение в ка-
пилляр; когда же опа понижается, ртуть из капилляра не
опускается. Более удаленный от резервуара конец отде-
ленной части ртутного столбика показывает самую высо-
кую температуру за время после последней установки
термометра. Для того чтобы подготовить максимальный
термометр к следующему наблюдению, его после отсчета
снимают со стойки и встряхивают до тех пор, пока ртуть
не покажет температуру, близкую к показанию сухого
термометра психрометра. В каждый из сроков наблюде-
ний отсчитывают по максимальному термометру и запи-
сывают не только максимальную температуру, но и по-
казания термометра после встряхивания. Максимальные
50
термометры обыкновенно бывают разделены на градусы
11 полуградусы, а десятые доли отсчитывают на глаз.
Минимальный термометр (рис. 14) служит для реги-
страции еамой низкой температуры за изучаемый проме-
жуток времени. В трубке его, в спируово'м столбике, на-
ходится стеклянный штифтик с головками на обоих кон-
11
Рис. 13. Типы термометров:
/, 2 — психрометрические термометры, 3 — термометр-пращ, 4 — комнатный,
!> технический угловой, 6 — максимальный, 7 — минимальный термометр
цах. Этот штифтик не выходит из спирта, поэтому, когда
спиртовой столбик укорачивается при понижении темпе-
ратуры и конец его приходит в соприкосновение с голов-
кой штифтика, последний под влиянием спирта сдвигает-
ся в сторону уменьшения показаний; когда спиртовой стол-
бик удлиняется вследствие повышения температуры, то
при горизонтальном положении термометра штифтик
остается на месте. Следовательно, конец штифтика, бо-
лее удаленный от резервуара (вилки), показывает наибо-
лее низкую, -минимальную, температуру в период, про-
51
Шедший со времени последней установки термометра.
Этот термометр при наблюдениях в отличие от макси-
мального всегда кладут в .горизонтальном положении.
Перед установкой наклоняют термометр резервуаром
кверху, штифтик приводят в соприкосновение с поверх-
ностью спирта в трубке; в таком положении его и уста-
навливают.
Рис. 14. Полевая установка минимального и максимального
термометров
Случается, что часть спирта в минимальном термомет-
ре отделяется и скопляется в верхнем конце трубки или
столбик спирта разбивается на несколько частей. Чтобы
исправить инструмент в этом случае, следует взять его за
верхний конец трубки и, держа ее резервуаром от себя,
делать сильные взмахи до тех пор, пока весь спирт не
соединится -в один столбик. Если при этом штифтик заст-
рянет в нижней части трубки, следует повернуть термо-
метр вертикально резервуаром кверху и осторожно по-
стукивать им по ладони руки, по книге и т. п. до тех пор,
пока штифтик не освободится.
В каждый срок наблюдений отсчитывают по мини-
мальному термометру не только самую низкую темпера-
туру, т. е. показания штифтика, но и показания спирто-
вого столбика в приборе. Отсчитывая показания мини-
мального термометра, следует держать глаза прямо про-
тив конца штифтика или конца стол»бика спирта. Так как
минимальные термометры обычно бывают разделены на
полуградусы, десятые доли градуса определяют на глаз.
52
Регистрация минимальных и максимальных темпера-
тур является обязательной частью полевых исследований
и имеет, как отмечалось, большое значение в экологи-
ческих работах.
Рис. 15. Термограф:
Сверху общий вид (по Мальченко), внизу термочувствительная пла-
стинка и записывающее приспособление (по Кедроливанскому)
Термометры (минимальный и максимальный) удобно
(а для минимального и обязательно) устанавливать го-
ризонтально на защищенном от прямого действия солнца
месте. Хорошо затенить зонтом, доской, деревом или спе-
циальной защитой, не изменяя при этом движения и силы
ветра. Способ установки приборов показан на рисунке 14.
53
Термограф (рис. 15) самопишущий прибор, которым
пользуются для исследования изменения температуры во
времени. Это самый совершенный 'прием регистрации из-
менения температуры среды, что в экологических рабо-
тах может иметь большое значение, но он не дает точных
абсолютных показаний, поэтому не может полностью за-
менить термометры. Термограф перед работой необходи-
мо выверить по точному термометру и при каждой записи
Рис. 16. Термоэлектрический прибор для опреде-
ления температуры в норах и щелях (по Стрель-
никову) :
/ — конец термопары в эбонитовой капсуле, 2 — термос
с холодным термоспаем, 3 — гальванометр
производить контрольные определения температуры с по-
мощью выверенного термометра, отмечая результаты
проверки на ленте. Применяется прибор на стационарах.
При отсчетах каждый раз следует делать метку на
ленте. Для получения такой отметки следует, открыв
крышку прибора, осторожно приподнять кверху стрелку
с пером или изменить положение стрелки другим спосо-
бом (легким постукиванием пальцем по крышке прибора
ит. д.).
Для экологических исследований термограф, если он
работает безотказно, представляет большой интерес. Но
из-за громоздкости и большого затенения создает свой
микроклимат и никак не может быть использован для на-
блюдений среди травостоя. При экспедиционных работах
термографы вследствие своих значительных размеров не
всегда могут быть применены.
Термоэлемент (рис. 16) служит для измерения темпе-
ратуры при микроклиматических исследованиях. Прибор
этот позволяет определять температуру в самых неболь-
ших по объему средах, убежищах, в теле животных и да-
54
же в отдельных токах его. Большое достоинство прибо-
ра заключается в том, что наблюдатель может произво-
дить отсчет показаний на значительном расстоянии от
места измерения. Такая дистанционность прибора позво-
ляет производить исследования, не затрагивая объектов
изучения. t
О
Рис. 17/ Установка для измерения температуры посредством
термоэлемента со стрелочным гальванометром (по Роль-
ник) :
/ — провода к термометрам, 2 — переключатель, 3 — термос с конт-
рольной .Фермопарой, 4 — гальванометр
Термопара (термоэлектрическая установка, рис. 17)
состоит и$ термоэлемента, стрелочного гальванометра,
сосуда Дюара или простого термоса и ртутного термо-
метра. Иногда вся установка бывает смонтирована в
ящике или небольшом чемодане, что особенно удобно при
полевых работах. Обычно используются коистантаново-
никелиновЪ-медные термопары. Они имеют два термо-
55
епая — один из них находится при постоянной темпера-
туре (0°С), для чего помещается в термос со льдом или
холодной водой, второй — в измеряемую среду. При оди-
наковой температуре обоих термоспаев гальванометр не
реагирует. Но как только изменяется температура одного
из термоспаев в зависимости от характера изменений
температуры, гальванометр дает пропорциональное от-
клонение в ту или иную сторону.
В полевых условиях лучше всего применять стрелоч-
ный гальванометр, так как он хотя и менее чувствителен,
но удобен вследствие своей портативности (Калабухов).
Зеркальный гальванометр более чувствительный, поэтому
при стационарных работах ему следует отдавать пред-
почтение. При отсчетах гальванометр должен стоять
горизонтально. Перед измерением нужно опускать его
стрелку, а потом снова закреплять ее посредством спе-
циального арретира. В настоящее время имеется удоб-
ный зеркальный гальванометр экспериментальных мас-
терских Арктического института, которым рекомендуют
(Н. И. Калабухов) пользоваться в полевых условиях.
Термопара широко применяется при экологических
наблюдениях. Пользуясь термопарой, можно получить
данные, которые позволят глубже проникнуть во многие
явления природы. В настоящее время существуют раз-
личные модификации этого прибора, значительно упро-
щающие пользование им.
Пращевый термометр (см. рис. 13). Для измерения
температуры воздуха удобнее всего пользоваться пра-
щевым термометром. Небольшой его размер и сравни-
тельно большая прочность (он сделан из небьющегося
стекла) делает этот термометр незаменимым. Для опре-
деления температуры воздуха термометр берут за при-
вязанный к йему шнурок и быстро вращают над головой.
Не успев подвергнуться прямому действию солнечных
лучей, он покажет действительную температуру воздуха.
Температуру воздуха можно отсчитывать и по сухому
термометру аспирационного психометра (см. вентиля-
ционный психометр Ассмана), а при отсутствии пос-
леднего— по показаниям максимального термометра
после встряхивания; но эти данные будут менее точными.
Почвенные термометры. Температура почвы имеет
большое значение при изучении комплекса почвенных
организмов — эдафона, растительности, при изучении
56
биологии отдельных видов почвенных животных, эколо-
гии вредителей и т. д. Для измерения пользуются раз-
личными почвенными термометрами.
Наиболее удобны и портативны термометры Савино-
ва. Резервуар такого коленчатого термометра зарывают
в землю на нужную глубину (рис. 18) так, чтобы на
Рис. 18. Почвенные
термометры Савинова.
А — установка термо-
метра (ориг.); Б —
доска для установки
почвенных термомет-
ров (по Кедроливан-
скому)
поверхность выходила только трубка со шкалой отсчета.
По ней мы и отсчитываем температуру почвы. Недостат-
ком этого прибора являются неизбежные нарушения
почвенного и растительного покрова в процессе установ-
ки термометров, что не может не отразиться на последую-
щих показаниях приборов.
Существует новая конструкция почвенных термомет-
ров— прямые термометры — которая упрощает как изго-
товление их, так и пользование ими. Точность же пока-
заний прибора этой конструкции не ниже первых. Для
того чтобы установить такие термометры, в почве проби-
57
Ьают отверстие до заданной глубины при помощи метал-
лического стержня того же диаметра, что и термометры.
Устанавливают термометр в отверстие, сделанное под
углом в 60°, пользуясь специальной доской (рис. 18. Б).
Для измерения температуры на не-
больших глубинах можно пользоваться
I I срочными термометрами: обычным с цп-
Н линдрическим резервуаром, термометром-
j пращом (без оправы), термометром-ат-
: гаше и при маршрутных исследованиях
: (до глубины 0,5 м) термометром-щупом.
; Термометр-щуп Иванова (АМ-6) (рис.
: 19) представляет собой деревянную штап-
£ гу, в конец которой вделан термометр
3 небольшого размера (типа термометра-
праща). На резервуар термометра надет
-—2 металлический колпачок, наполненный
гудроном, предохраняющий термометр
от повреждений и придающий ему боль-
; шую инертность. Щуп вводят в скважину,
пробитую деревянным или металлическим
стержнем, имеющим такое же сечение,
- — ч как и щуп. Можно пользоваться для из-
1—3 мерения температуры почвы также обыч-
V ными (коленчатым и прямым) термомет-
Рис. 19. Поч- рами. Их так же, как и указанные выше,
венный тер-
мометр-щуп:
1 — жидкост-
ный толуоло-
вый термо-
метр, 2 — оп-
рава для тер-
мометра, 3 —
металлический
конусообраз-
ный наконеч-
ник, 4 — теп-
лоизолирую-
щий текстоли-
товый пере-
ходник, 5 —
ручка
вводят в скважины, сделанные при помо-
щи деревянного или металлического
стержня.
Температуру поверхности почвы от-
считываем обыкновенными термометра-
ми. В этом случае термометр кладут го-
ризонтально так, чтобы резервуар со
ртутью только наполовину был заделав
в землю. Отсчеты делают обычным спо-
собом. Температуру поверхностных слоев
почвы под снежным покровом, в том чис-
ле и в узле кущения растений на полях
озимых культур, а также самого снежно-
го покрова при эпизодических и круглосуточных наблю-
дениях измеряют обычными срочными термометрами.
С помощью описанных выше приборов можно прово-
дить важные и интересные в научном отношении наблю-
58
дения, детально исследовать экоклимат отдельных ста-
ций животных, микроклимат различных биотопов.
При полевых исследованиях особенности микрокли-
мата того или иного травостоя оценивают посредством
сравнения с микроклиматом оголенной поверхности поч-
вы, обычно с черным паром. Последний служит стандар-
том, подобно тому как пользуются контролем в опытах.
Только сравнение со стандартом дает ^возможность со-
поставлять результаты наблюдения над микроклиматом
различных как естественных, так и культурных экотопов.
Почвенный электротермометр. Одной из применяю-
щихся конструкций электрических термометров такого
типа есть термометр сопротивления системы Третьякова.
Он представляет собой приемник из медной проволоки
диаметром 0,05 мм с сопротивлением 50 ом, помещенный
в стеклянную герметизированную трубку диаметром
около 6 мм. Термометр работает по схеме неуравновешен-
ного мостика. Отклонения гальванометра проградуиро-
ваны в градусах Цельсия. С помощью переключателя
производится последовательное подключение к гальвано-
метру датчиков, расположенных на разных глубинах.
Прибор работает от батареи сухих элементов напряжени-
ем в 2—4,5 в. С помощью соответствующего регулиро-
вочного реостата силу тока в приборе устанавливают по
красной черте на шкале гальванометра.
Прибор достаточно дистанционный, так как вся изме-
рительная часть находится в помещении. В этом их
достоинство; поэтому они незаменимы не только зимой,
но и летом, когда наблюдатель при непосредственных
отсчетах показателей термометров на месте наблюдения
может сильно повреждать травянистую растительность
и тем самым искажать тепловой режим (Сапожнико-
ва, 1950).
Влажность. Некоторые животные очень чувствитель-
ны к содержанию влаги в их среде обитания. Например,
личинки гороховой зерновки (Bruchus pisorum) живут за
счет той влаги, которая содержится в бобах. У озимой
совки и лугового мотылька развитие яиц у самок не про-
исходит, и они остаются бесплодными, если погода за-
сушливая, воздух недостаточно влажен и не хватает
нектара для дополнительного питания. Для окукливания
кукурузного мотылька необходима вода, которую пере-
зимовавшие гусеницы даже заглатывают. Шелковичные
59
черви могут развиваться, если относительная влажность
в помещении бывает не менее 65—70%. Установлено, что
наиболее благоприятные условия для марокканской са-
ранчи создаются там, где весной выпадает примерно
100 мм или немного более осадков. Осадки, а не темпе-
ратура, служат определяющим фактором численности
этого вида.
Некоторые беспозвоночные при недостатке влажности
могут впадать в так называемое анабиотическое состоя-
ние— личинки пшеничной нематоды даже высыхают и
снова оживают, когда вновь попадают во влажную среду.
Подобное явление при высыхании наблюдается и у ти-
хоходок. Наземные моллюски закупоривают раковину
выделяемой слизью и становятся недеятельными. Сухость
почвы заставляет земляных червей продвигаться в более
глубокий и влажный горизонт почвы. Влажность оказы-
вает большое влияние на смертность и продолжитель-
ность жизни насекомых. Это — важный критерий вы-
живаемости.
Влажность действует всегда вместе с температурой,
причем эффект одного фактора изменяется другим. В
сухой атмосфере при высокой температуре испарение
идет быстрее, тем самым сильнее охлаждается тело
животного. В атмосфере же влажной и жаркой проис-
ходит перегрев до температуры воздуха, так как испаре-
ние не происходит в достаточной степени.
Для определения относительной влажности пользу-
ются различными психрометрами.
Вентиляционный психрометр Ассмана (рис. 20). Этот
прибор довольно прочен, удобен для пользования и пе-
ревозки или переноски при экспедициях и экскурсиях.
Главное его. преимущество состоит в том, что им можно
пользоваться без метеорологической будки или другой
добавочной защиты. Применяется при изучении микро-
условий какого-нибудь определенного экотопа. Венти-
ляционный психрометр — пока единственный прибор,
пригодный для наблюдений над влажностью нижних сло-
ев воздуха.
Конструкция психрометра исключает влияние ветра
на его показания и делает прибор очень удобным и для
полевых исследований (Горышин, 1966). Однако этот
прибор засасывает и перемешивает воздух целого слоя,
забирая его из более низких и более высоких уровней;
60
таким образом он дает некоторую осредненную величину.
Поэтому вентиляционный психрометр не дает возмож-
ности изучить влажность определенного уровня и не
Рис. 20. Вентиляционный психрометр Ассмана:
Л 2 — ртутные термометры, 3 — ключ заводного ме-
ханизма, 4 — металлические планки для защиты тер-
мометров, 5 — прорезы для выброса воздуха из вен-
тилятора, 6—аспирационная головка, 7 — стержень
для подвешивания прибора, 8 — колпак, закрываю-
щий заводной механизм и вентилятор (аспирацион-
ную головку), 9 — щиток для защиты вентилятора от
сильного ветра, 10 — резиновая груша с пипеткой,
// — воздухопроводная трубка, 12 — трубчатая защи-
та для резервуаров термометров
совсем пригоден для измерений влажности среди расте-
ний и в приземном слое воздуха.
Психрометр Ассмана состоит из двух одинаковых
термометров, закрепленных в металлическую оправу,
представляющую собой трубки. Резервуары термометров
61
Таблица 1
Психрометрическая таблица для определения относительной
влажности воздуха по психрометру Ассмана при атмосферном давлении 755 лш
Психрометрическая разница, °C
°C 1 2 3 4 5 6 7 8 9 10 и 12 13 14 15 16 17 18
. Относительная'влажность в процентах
5 86 72 58 45 32 19 6
6 86 73 60 47 35 23 10
7 87 74 61 49 37 26 14
8 87 75 63 51 40 29 18 6
9 88 76 64 53 42 31 21 11
10 88 76 65 54 44 34 24 14 5
11 88 77 66 56 46 36 26 17 8
12 89 78 68 57 48 38 29 20 11
13 89 79 69 59 49 40 31 23 14 6
14 90 79 70 60 51 42 33 25 16 9
15 90 80 71 61 52 44 36 27 20 12
16 90 81 71 63 54 46 37 30 22 15 8
17 90 81 72 64 55 47 39 32 24 17 10
18 91 82 73 65 56 49 41 34 27 20 13
19 91 82 74 66 58 50 43 36 29 22 15
20 91 83 74 66 59 52 44 37 30 21 18
21 91 83 75 67 60 53 46 39 32 26 20 14
22 92 84 76 68 61 54 47 40 34 28 22 16
23 92 84 76 69 62 55 48 42 36 30 24 18 13
24 92 84 77 70 63 56 49 43 37 31 26 20 15
25 92 84 77 70 63 57 50 44 38 33 27 22 17
26 92 85 77 71 64 58 52 46 40 34 29 24 19 14
27 92 85 78 71 65 58 52 47 41 36 30 25 21 16
28 93 85 78 72 65 59 53 48 42 37 32 27 22 18 13
29 93 86 79 72 66 60 54 49 43 38 33 28 24 19 15 И
30 93 86 79’ 73 67 61 55 50 44 39 34 30 25 21 17 13
31 93 86 80 73 67 62 56 50 45 40 36 31 27 22 18 14 10
32 93 86 80 74 68 62 57 51 46 41 37 32 28 24 20 16 12
33 93 87 80 74 69 63 58 52 47 42 38 33 29 25 21 17 14 10
34 93 87 81 75 69 64 58 53 48 43 39 34 30 26 22 19 15 12
35 93 87 81 75 69 64 59 54 49 44 40 36 31 27 24 20 16 13
36 94 87 81 75 70 65 59 55 50 45 41 37 32 29 25 21 18 14
37 94 87 81 76 70 65 60 55 51 46 42 38 34 30 26 22 19 16
38 94 88 82 76 71 66 61 56 51 47 43 39 35 31 27 24 20 17
39 94 88 82 77 71 66 61 56 52 47 43 39 35 31 28 25 21 18
40 94 88 82 77 71 67 62 57 53 48 44 40 36 33 29 25 23 19
62
для предохранения от Нагревания солнцем заключены
в трубочки, через которые засасывается воздух особым
вентилятором (аспиратором), приводимым в движение
часовым механизмом. Резервуар одного термометра об-
тянут батистом. Для
наблюдений прибор
подвешивают на метал-
лический держатель, а
резервуар термометра,
обтянутый батистом,
смачивают при помощи
пипетки дистиллиро-
ванной или дождевой
водой, после чего клю-
чом заводят аспиратор;
через 3—4 мин отсчи-
тывают температуру по
сухому и смоченному
термометрам. Влаж-
ность воздуха опреде-
ляется по разности по- _
казаний термометров
по специальной табли-
це или по графику, при-
ложенному к прибору.
Прибор нельзя
класть горизонтально.
Батист в случае за-
грязнения следует сме-
нить. В зимнее время
Рис. 21. Полевая установка психро-
метра Августа. От прямого действия
солнца термометры защищены дощеч-
кой (ориг.)
при низких температу-
рах определения влаж-
ности по психрометру
ненадежны. Для вы-
числения относитель-
ной влажности по показаниям психрометра Ассмана
пользуются специальной психрометрической таблицей
(табл. 1).
Стационарный психрометр Августа (рис. 21) состоит
из двух совершенно одинаковых термометров, резервуар
одного из них обтянут лоскутом батиста. Чтобы поддер-
живать обтянутый батистом резервуар термометра пос-
тоянно влажным, конец лоскутка погружен в стаканчик
63
с Дождевой водой. Термометр с сухим резервуаром по-
казывает температуру воздуха. Из показаний же обоих
термометров, сухого и смоченного, определяют влажность
воздуха. Следует обращать внимание на то, чтобы ста-
канчик под смоченным термометром был всегда наполнен
водой. Воду наливают тотчас же после наблюдений, во
всяком случае не менее чем за 10—15 мин до очередного
наблюдения. В теплое время воду нужно менять чаще,
а если вода не дистиллированная, то чаще менять и
батист.
Батистовый лоскуток, охватывающий шарик термо-
метра, должен быть всегда мягким и влажным, если он
перестанет всасывать воду из стаканчика, его надо заме-
нить новым. В теплое летнее время батист нужно менять
не реже, чем через каждые две недели. Важно, чтобы
батист смачивался совершенно чистой водой, лучше всего
дистиллированной, при крайней необходимости — дож-
девой, но в этом случае воду необходимо профильтро-
вать, и только в условиях полного отсутствия возможнос-
ти пользоваться указанной водой можно употреблять
профильтрованную кипяченую питьевую воду, но при
этом необходимо чаще менять батист, так как он пропи-
тывается солями. Основным недостатком приборов этого
типа является зависимость показаний смоченного термо-
метра от скорости ветра.
При отсутствии ветра затрудняется испарение воды,
что приводит к искажению показания прибора. Поэтому
применяется психрометр при стационарных исследовани-
ях в открытых и продуваемых местах, защищенных от
прямого действия солнечных лучей и ветра, а также в
помещениях. В полевых условиях прибор устанавливает-
ся па различных высотах в зависимости от поставленной
задачи. Для защиты от прямых солнечных лучей поль-
зуются щитом (рис. 21).
Отсчеты по обоим термометрам психрометра даются
в градусах с точностью до десятых долей. При работе с
психрометром необходимо учитывать следующее: при
отсчете показаний термометра наблюдатель должен ста-
новиться так, чтобы его глаз находился на одной высоте
с концом ртутного столбика, нельзя приближать к при-
бору голову, руки, фонарь и т. д. Психрометр устанавли-
вают, как указано на рисунке. Вычисление влажности
воздуха (абсолютной и относительной) производится на
64
Таблица 2
Психрометрическая таблица для определения относительной
влажности воздуха по психрометру Августа при
атмосферном давлении 755 мм и скорости ветра = 0,8 л в 1 о? к
5 84 68 53 38 24
6 85 70 55 41 27 13
7 85 71 57 43 30 16
8 86 72 59 46 34 21 8
9 87 73 61 48 36 25 13
10 87 74 62 50 39 28 16
11 87 75 63 52 41 30 19 8
12' 88 76 65 54 43 33 22 13
13 89 77 66 56 45 35 25 16
14 89 78 67 57 47 37 28 18 9
15 89 79 68 58 49 39 30 21 13
16 89 79 69 59 50 41 32 24 15
17 90 80 70 61 52 43 34 26 18 10
18 90 80 71 62 53 44 36 28 20 13
19 90 81 72 63 54 46 38 30 23 16
20 91 81 72 64 55 47 40 32 25 18 11
21 91 82 74 65 57 49 41 34 27 20 14
22 91 82 74 66 58 50 43 36 29 22 16
23 91 83 74 66 59 52 44 38 31 25 18 12
24 91 83 75 67 60 53 46 39 32 25 20 14
25 92 83 76 68 61 54 47 40 34 28 22 16 11
26 92 84 76 69 62 55 48 42 36 30 24 18 13
27 92 84 77 69 63 56 49 43 37 31 26 20 15
28 92 85 77 70 63 57 51 45 39 33 27 22 17 12
29 92 85 78 71 64 58 52 46 40 34 29 24 19 14
30 92 85 78 71 65 59 53 47 41 36 30 25 21 16 11
31 92 85 79 72 65 59 53 48 42 37 32 27 22 17 13
32 93 86 79 72 65 60 54 49 43 38 33 28 24 19 14 11
33 93 86 79 73 67 61 55 50 44 39 34 30 25 21 16 12
34 93 86 80 73 67 62 56 51 45 41 36 31 27 22 18 13
35 93 86 80 74 68 62 57 46 42 37 32 28 24 19 15 11
36 93 87 81 75 69 63 57 52 47 43 38 33 29 25 20 17 13
37 93 87 81 75 69 64 58 53 48 44 39 35 31 27 23 19 15 12
38 93 87 81 75 70 64 59 54 49 44 40 36 31 27 23 19 16 12
39 94 87 82 76 70 65 59 55 50 45 41 37 33 29 24 21 17 14
40 94 88 82 76 70 65 60 56 51 46 42 38 34 30 25 22 18 15
3-1867
65
основании записей показаний сухого и смоченного термо-
метров психрометра Августа по разности температур,
пользуясь готовыми психрометрическими таблицами
(табл. 2).
Существует более практичный метод для измерения
влажности в малых пространствах. Заключается он в ис-
пользовании маленьких кусочков специальной тонкой
бумаги, смоченной в растворе какой-либо соли кобальта.
Окраска кусочков меняется при изменении относитель-
ной влажности окружающего воздуха. Для экологичес-
ких исследований рекомендуют использовать тиоцианат
кобальта. Бумагу смачивают стандартным способом,
сушат и помещают в серию воздушных сред заданной
влажности, создаваемой растворами серной кислоты или
едкого кали. Спустя 30 мин бумажки быстро заливают
жидким парафином и помещают между куском стекла
и белой подложкой. При исследовании влажности среды
их сравнивают со стандартными образцами. Метод поз-
воляет вести определение с точностью до 2% (Solomon,
1945, 1951, 1957).
Имеются модели психрометров, в которых вместо
термометров применены термопары, термобатареи или
термометры сопротивления (термисторы), что ускоряет
процесс измерения влажности.
Обычно учитывается относительная влажность возду-
ха, однако во многих случаях обнаруживается зависи-
мость экологических процессов от дефицита насыщения,
характеризующего испаряющую силу воздуха (эвапори-
цию). Интенсивность испарения измеряется эвапори-
метрами (см.).
Испаряемость. Испаряемость имеет большое значение
для транспирации растений и животных. Определяется
испаряемость количеством испарившейся воды в единицу
времени с единицы поверхности.
Для наблюдений над количеством испаряющейся во-
ды на метеорологических станциях употребляют эвапори-
метры (испарители).
Испаритель (эвапориметр) Бильда представляет со-
бой чашечные весы, отсчитывающие испарение за еди-
ницу времени в миллиметрах. Пользуются им следующим
образом. Наливают в чашку прибора дистиллированной
или в крайнем случае питьевой прокипяченой воды до
тех пор, пока стрелка не поднимется до деления «0»
66
(нуль). Это показание записывают. От испарения коли-
чество воды уменьшается, стрелка падает. Записав пока-
затель ее в очередной срок наблюдений, можно устано-
вить разницу, которая и показывает испаряемость в мил-
лиметрах. После отсчетов прибор необходимо долить
водой, записать показание и оставить до следующего
срока. Для предохранения воды в испарителе от птиц и
собак применяют защиту из сетки.
После дождя испаритель следует осмотреть, измерить
(взвесить) воду в контрольной чашке и внести поправку
на дождь. В экспедиционных условиях этим прибором
пользоваться трудно.
Для измерения испарения воды с поверхности поч-
вы наиболее употребительны испаритель системы Попова
(рис. 22) и почвенный испаритель Рыкачева (рис. 23).
Рис. 22. Испаритель Попова. А — схема установки; Б — дета-
ли прибора:
/ — струг для взятия почвенного образца, 2 — внутренний цилиндр ис-
парителя, 3 — внешний цилиндр, 4 — водосборный сосуд
Испаритель Попова состоит из двух, плотно входящих
один в другой цилиндрических сосудов. Внешний ци-
линдр (футляр) вставляют в почву; на дно его ставят
водосборный сосуд. Дно внутреннего сосуда сделано из
проволочной сетки. В этот цилиндр помещают почвенный
монолит высотой 25 см и сечением 500 см2. Монолит вы-
резывают особым стругом. Величину испарения опреде-
ляют по разности веса монолита в два последовательных
срока наблюдений. При помощи этого прибора можно
измерить также количество воды, просочившейся через
почвенный монолит. Испаритель Рыкачева устроен го-
раздо проще. Принцип действия виден на рисунке.
При работе в полевых условиях метеорологические
приборы устанавливают в тех биотопах, где проводятся
исследования. Приборы, требующие неподвижной уста-
новки, размещают тотчас же по приходе на место иссле-
дований. Другие же устанавливают по мере надобности.
Приборы устанавливают в открытом месте, но так,
чтобы они были защищены от прямого действия ветра
Рис. 23. Почвенный испаритель Рыка-
чева (по Кедроливапскому)
и непосредственного влияния солнечных лучей. Для это-
го, если предстоит исследовать температуру травостоя,
в землю вбивают специально приготовленные два ко-
лышка с развилками (сучьями), на эти развилки, обра-
зующие как бы гнезда, устанавливают максимальный
и минимальный термометры. Можно также из колышков
сделать козлы и установить термометры на этих под-
ставках (см. рис. 12). Для аспирационного психрометра
Ассмана не требуется специальной установки. Психро-
1^етр же Августа требует в полевых условиях специаль-
ных приспособлений: его термометры необходимо укреп-
лять в специально приготовленные из досок гнезда (см.
рис. 21). От прямого действия солнца эти термометры
защищены щитом, зонтом, дощечкой или специальной
защитой Виткевича. Установка и размещение приборов
при изучении условий поля представлены на рис, 38.
Изучение влажности почвы изложено в соответствую*
щем разделе.
Атмосферные осадки. Осадки —один из важных фак-
торов среды. Влияние их может быть прямым и косвен-
68
ным. Отсутствие осадков или небольшое количество их
в иные годы вызывает гибель как растительности, так и
связанных с ней животных. В свою очередь и сильные
ливни уничтожают многих насекомых. Осадки обусловли-
вают и влажность воздуха. Периодические засухи, выз-
ванные недостатком осадков, являются причиной разви-
тия летоспящих форм. В том, что осадки имеют большое
значение, нет никакого сомнения, но, к сожалению, пор-
тативных приборов для измерения осадков пока еще нет.
Поэтому исследователю остается только пользоваться
данными стационарных установок — дождемерных стан-
ций.
Попавшие в дождемер осадки для измерения выли-
вают в специальный измерительный стакан, на который
нанесены деления, показывающие толщину слоя воды
(в миллиметрах), выпавшей на горизонтальную поверх-
ность среза дождемера.
Записи количества, продолжительности и интенсив-
ности осадков можно получить на стационарах при по-
мощи самописцев.
В поле же, на экскурсии, если исследователя застал
дождь, ему приходится определить осадки описательно,
на глаз. Характер дождя, интенсивность, продолжитель-
ность, глубина промоченного слоя земли, образование
луж, стоков и т.' д. Но такие визуальные наблюдения
дают лишь общее представление об изменениях режима
погоды.
Ветер (направление и скорость). Ветер также оказы-
вает большое влияние на органическую природу. Он
участвует в формировании метеорологических условий
в приземном слое воздуха, среди растений. Действие
ветра здесь проявляется в зависимости от подстилающей
поверхности (микрорельефа, растительности, почвы и
др.).
Если даже самостоятельное действие ветра бывает
незначительным, то в соединении с температурой и влаЖ’
ностью он играет большую роль. Так, движение воздуш-
ных масс имеет значение в процессах испарения воды с
поверхности почвы и растениями. Увеличению испарения
способствует вызванная ветром непрерывная смена воз-
духа. Сильные зимние морозы, например, и летние засу-
хи во многом обязаны своим происхождением и этому
фактору.
«о
Известно прямое влияние ветра на распространение
насекомых и их расселение. Гусеницы непарного шелко-
пряда переносятся ветром — это почти единственное их
средство расселяться в новые биотопы. При сильном
ветре хрущи падают с дерева. Имеется обширная лите-
ратура о переносе ветром тлей и других насекомых, что
важно для выяснения характера расселения их и пере-
носа ими возбудителей заболеваний. Ветер определяет
направление летающих насекомых. Воздушные течения
играют роль в распространении семян растений и т. д..
Ветру как фактору приписывают решающую роль в фор-
мировании нелетающих ф.орм насекомых на океаничес-
ких островах. Ветер — причина скопления насекомых в
укромных местах. От ветра прячутся многие насекомые
в лесу, в травяном покрове и в других укрытиях.
При характеристике ветра необходимо определить
основные его показатели: скорость, с которой воздушные
массы перемещаются, и направление воздушных течений.
Важно при полевых исследованиях иметь в виду, что
названные особенности ветра зависят от многих других
элементов среды. Растительный покров, образуя шеро-
ховатую поверхность, значительно уменьшает скорость
ветра в приземном слое. Например, скорость его над
пшеничным полем (по данным Г. В. Белухиной) в 2—3
раза меньше, чем в верхних слоях, отмечаемых флюгером.
В лесу вследствие завихрения направление ветра на по-
ляне может быть противоположным основному направле-
нию потока воздуха. Влияние могут оказывать также
постройки, рельеф и т. п. Для определения направления
и скорости ветра служат соответствующие приборы.
Флюгер Вилида. Этот прибор применяют на всех
стационарных метеорологических пунктах. Скорость вет-
ра определяется по показаниям флюгерной доски — по-
казателя силы ветра. Для перевода показаний флюгера
на скорость ветра, выраженную количеством метров в
секунду, надлежит пользоваться табл. 3.
Числа, найденные с помощью приведенной таблицы,
отмечают в книжках рядом с номерами штифтов в скоб-
ках. В сводную таблицу скорость ветра, выраженную
числом метров в секунду, переносят в одну графу с от-
меткой направления, причем отметка направления ветра
должна быть поставлена впереди показателя скорости
ветра (СВ-5, ЮЗ-2, или соответственно: 7VE-5, SU/-2).
70
Таблица 3
Определение скорости ветра
Номер штифтов, где колеблется дощечка Скорость ветра в м}сек
легкая досга (200 г) тяжелая доска (f00 г)
0-1 1 2
1 2 4
1-2 3 6
2 4 8
2-3 5 10
3 6 12
3-3 7 14
4 8 16
4—5 9 18
5 10 90
5—6 12 24
6 14 28
6-7 17 34
7 20 40
Так наблюдают за ветром при макроклиматических
исследованиях. Но эти данные не отражают того движе-
ния воздуха, которое в действительности имеет место в
конкретных условиях жизни изучаемых животных (сад,
лес, поле, балки, горы). Здесь будет свой режим, который
и представляет интерес для нас. Для изучения этого ре-
жима служат специальные приборы.
Ручной анемометр Фусса (рис. 24). Для определения
скорости ветра в походных условиях этот анемометр
чрезвычайно удобен, им можно производить наблюдения
при изучении микроклимата любых микроусловий. Для
производства наблюдений прибор нужно держать в руке,
но можно и ввинтить его в деревянный шест и поднять
для исследования на желаемую высоту. Необходимо
следить за тем, чтобы анемометр стоял вертикально, так
как наклон прибора сказывается на результатах его
показаний.
Перед началом наблюдений арретируют стрелки
(выключают счетчик) и записывают их показания (луч-
ше поставить на «О»), затем выставляют анемометр на
ветер и дают прибору свободно вращаться в течение 1—
71
2 мин, пока он не достигнет полной скорости вращения.
По истечении этого срока при помощи арретира вклю-
чают счетчик анемометра и одновременно с этим пускают
в ход секундомер или замечают показание секундной
стрелки ручных часов. По истечении 2 мин одновременно
Рис. 24. Ручной анемо-
метр Фусса
И напротив, как только в
вину с той же скоростью,
выключают счетчик и секун-
домер и снова записывают
показания счетчика. По раз-
нице показания счетчика до
и после наблюдений узнают,
сколько прошла стрелка
счетчика за указанный срок
(2 мин); для грубых отсче-
тов полученное число деле-
ний счетчика в 1 сек дает
скорость ветра, выраженную
числом метров в секунду.
Для получения более точных
величин скорости ветра
пользуются поверочным сви-
детельством, в котором сооб-
щается переводной коэффи-
циент для перевода показа-
ний счетчика данного анемо-
метра на скорость ветра, вы-
раженную метрами в секун-
ду. Поверочное свидетельст-
во всегда прилагается к при-
бору.
Необходимо помнить, что
ручной анемометр дает пра-
вильные показания до тех
пор, пока направление ветра
горизонтально и совпадает
с плоскостью крестовины.
*тер начинает дуть на кресто-
но под острым углом, кресто-
вина замедляет скорость вращения и дает искаженные
показания, а при движении ветра под углом 70° кресто-
вина перестает вращаться. Следовательно, ручной анемо-
метр неприменим в тех местах, где направление движе-
ния воздушных масс отличается от горизонтального (на
склонах гор, вблизи деревьев, построек).
72
Направление ветра при пользовании анемометром и
ветромером определяют по компасу. Название ветра
дается по названию той стороны горизонта, откуда он
дует, и отмечается в румбах. Румб — одна из шестнад-
Рис. 25. Полевой ветромер 8Ю01-ЛЕ
1— приемник скорости, 2—лимб, 3 — ось флюгарки, 4—приемная пла-
стинка, 5 — противовес, 6 — рычаг, 7 - стойка, 8—крыло флюгарки,
9 — уравнительная пластина, 10 — носик пластины
цати равных частей, на которые делят окружность гори-
зонта. Установив по компасу страны света, нетрудно оп-
ределить и румбы направления ветра. Записывают
согласно принятым обозначениям:
N — северный С
S — южный . . Ю
Е — восточный В
W — западный ... 3
NE — северо-восточный СВ
NW — северо-западный СЗ
SE — юго-восточный ЮВ
SW — юго-западный ЮЗ
Кроме перечисленных, различают еще промежуточ-
ные румбы. Например: ССЗ — северо-северо-западный;
ЮЮВ — юго-юго-восточный и т. д. В случае необходи-
мости указанные приборы могут быть заменены ветро-
73
мером Аркадьева, ветромером Третьякова, описанным
ниже.
Полевой ветромер 8Ю01-М (рис. 25, 26). Устанавлива-
ется прибор на высоте 2 м от поверхности земли. Соб-
ственно ветромер состоит из флюгарки с приемником
скорости ветра (/), оси флюгарки (3), лимба (2), ком-
Рис. 26. Полевая установка ветромера 8Ю01-М
(схема):
/ — собственно ветромер, 2 — штанга, 3 — компас с
держалкой
паса с держалкой и стойки (7). Флюгарка с приемником
скорости ветра в свою очередь состоит из крыла флюгар-
ки (8), приемной пластинки (9) и противовеса (5).
Шкала скорости ветра нанесена вдоль выреза крыла
с обеих сторон. Для отсчета скорости ветра служит ниж-
ний конец приемной пластинки в форме носика (/3).
Стоящие у рисок шкалы цифры дают значение скорости
ветра (м/сек). Лимб служит для отсчета направления
ветра и имеет форму диска с четырьмя вырезами. На
диске нанесена буква С, совпадающая с направлением
на север при ориентировании ветромера по компасу, и
риски с цифрами, делящими окружность на 60 больших
74
делений угломера. Лимб надевается на ось цифрами
книзу. В качестве указателя при отсчете по лимбу нап-
равления ветра используется рычаг противовеса (6),
имеющий для удобства отсчета с нижней стороны паз,
закрашенный белой краской.
Быстро взглядывая на шкалу направлений, а затем
на шкалу скоростей, производят отсчеты направления
(с точностью до 0,5 деления) и скорости (с точностью
до 0,5 м!сек) ветра. В течение 5 мин необходимо сделать
десять отсчетов направления и десять отсчетов скорости
ветра. Полученные цифры складывают и сумму делят на
число отсчетов (/0), получая среднее значение направ-
ления и скорости ветра за 5 мин.
В полевых условиях при отсутствии приборов силу
ветра определяют визуально по условным шкалам и по
условным знакам, пользуясь стандартной методикой.
Можно пользоваться для этого шкалой Бофорта (табл. 4)
или ее упрощенной модификацией по шестибалльной сис-
теме. Существует подробная 12-балльная шкала и упро-
щенная 6-балльная. На основе их составлены различные
модификации шкалы. Приводим комбинированную 12-
балльную шкалу для определения скорости ветра.
Облачность. Облачность оказывает влияние на интен-
сивность радиации, уменьшая ее силу, поэтому является
важным климатообразующим элементом среды. Опреде-
лить облачность — это значит зафиксировать, какая
именно часть небесного свода закрыта облаками, сколь-
ко часов или дней было закрыто солнце, указать харак-
тер облаков. Специальных приборов для этого нет,
определяется облачность визуально. Интенсивность об-
лачности отмечается по балльной системе в зависимости
от того, какая часть небесного свода закрыта облаками.
Если облаками покрыто все небо, ставится отметка «10»,
если половина — «5».
Отметки «1», «2», «3», «4» и т. д. означают, что 1, 2, 3,
4 и т. д. десятых частей небесного свода покрыты обла-
ками. Безоблачное небо отмечается отметкой «0» (нуль).
Известно, что облака бывают разных- типов. Если они
очень тонки, то к цифре облачности прибавляется пока-
затель «0», если же они очень густы, то прибавляется
показатель «3». Так, например, 5° показывает, что пять
десятых частей неба покрыты очень тонкими облаками,
З2 — три десятых части неба покрыты густыми облаками,
75
о
Таблица 4
Шкала для определения силы ветра
Баллы Сила ветра Признаки для оценки силы ветра Скорость ветра, м!се к Скорость ветра, км}час
0 Штиль Листья на деревьях не колеблются, дым из труб поднимается вертикально, огонь от спички не от-
клоняется 0 0
1 Тихий Дым несколько отклоняется, но ветер не ощу- 1-2
щается лицом 3-6
2 Легкий Ветер чувствуется лицом, листья на деревьях колышутся 2-3 7-11
3 Слабый Ветер качает мелкие ветки и колеблет флаг . . 3—5 11—18
4 Умеренный Качаются ветки средней величины, поднимается
пыль 5-7 18-25
5 6 Свежий Качаются тонкие стволы деревьев и толстые вет- ки, образуется рябь на воде .... 8-10 29-36
Сильный Качаются толстые стволы деревьев 10—12 36-43
7 Крепкий Качаются большие деревья, идти против ветра трудно 12-15 43-54
8 Очень крепкий Ветер ломает ветки и сучья 15—18 54—65
9 Шторм Ветер ломает легкие постройки, валит заборы 18—22 65-79
10 Сильный шторм Деревья вырывает с корнем, сносит более проч- ные постройки , 22-25 79-90
11 Жестокий шторм Ветер производит большие разрушения, валит телеграфные столбы, вагоны и т. п. 25-29 90-104
12 Ураган Разрушает дома, каменные стены 30 и выше 105 и выше
a 63 —шесть десятых частей неба покрыты очень густыми
облаками. Необходимо, чтобы в случае безоблачного
неба в записную книжку всегда записывалась в соответ-
ствующую строку отметка «О» (нуль), так как отсутствие
ее означает, что наблюдение было пропущено.
Наблюдения над облачностью следует производить
на открытом месте, дающем возможность обозревать
весь небесный свод. В ночное время количество облаков
определяют по звездам. Если наблюдатель затрудняется
определить облачность хотя бы приблизительно, реко-
мендуется при оценке се ставить вопросительный
знак (?).
В конце месяца все числа, выражающие облачность,
складывают, и полученную сумму делят на число дней
месяца (месяц здесь равен количеству дней наблюдений).
Дни, в которые были сделаны не все три срочных
наблюдения, в расчет также не принимаются. Среднеме-
сячные величины вычисляются с точностью до одной
десятой.
Свет. Свет составляет одну из важных особенностей
среды и служит необходимым условием развития и за-
метным внешним регулятором многих экологических и
физиологических реакций растительных и животных
организмов.
Св,ет влияет на активность, характер распространения
и пространственное размещение животных, особенно на-
секомых. Сезонный и суточный цикл развития многих
беспозвоночных зависит от изменений освещенности. Из-
вестна, например, зависимость от света продолжитель-
ности сроков диапаузы у многих насекомых. Свет служит
своеобразным сигналом, вызывающим физиологические
реакции на воздействие других факторов. Ответом на
сигналы служат сложные условные и безусловные реф-
лексы. Установлено, что действует на насекомых не свет
сам по себе, а ритмическое чередование света и темноты
и особенно изменение ритмичности освещения.
Режим освещения оказывается иногда более мощным
внешним фактором, нежели температура и даже пища.
Доказано (Данилевский, 1950), что, меняя режим осве-
щения, можно в любое время года вызвать у некоторых
насекомых диапаузу. Но видимая часть света — это, как
известно, лишь ограниченная область широкого спектра
электромагнитных колебаний, являющихся лучистой
77
энергией в широком смысле, спектральный состав его
следующий:
Спектор мяк
Фиолетовый
Синий
Голубой
Зеленый . . .
Желто-зеленый
Желтый . .
Оранжевый
Красный
390—450
450—480
480—510
510—550
550—575
575—585
585—620
620—800
Свет с длиной волны короче 390 ммк называется
ультрафиолетовым, а с длиной волны более 800 ммк—
инфракрасным. Чувствительность органов зрения жи-
вотных к свету и его физиологически вредное действие
изменяется в зависимости от длины волны. Так, многие
насекомые не реагируют на красный свет, видимый для
человека, но различают ультрафиолетовые лучи и реаги-
руют на них.
На организм, таким образом, влияют, кроме видимого
света, и невидимые лучи спектра — ультрафиолетовые
лучи.
В экологической практике для измерения освещен-
ности применяют люксметры и фотометры.
Люксметр — переносного типа фотометр (рис. 27).
Представляет собой визуальный прибор, в котором наб-
людения ведутся с помощью глаза и, естественно, огра-
ничены видимой частью спектра. Люксметр состоит из
небольшого деревянного ящика. На выдвижную планку,
которая находится внизу, насаживается белая пластинка
из обожженного фарфора. Внутри ящика находится лам-
па, которая йитается током от аккумуляторов, смонтиро-
ванных внутри люксметра. Лампа дает свет определен-
ной яркости и служит для сравнения. Внутри люксметра
имеется также наклонная пластинка сравнения — экран.
Свет от лампы падает на экран, являющийся одним из
полей сравнения. Отраженный от экрана световой пучок,
отразившись далее от зеркал, падает через окуляр в глаз
наблюдателя. Белая пластинка, видимая через окуляр,
и свободная от амальгамы часть зеркала служат вторым
полем сравнения. Наблюдение производится через оку-
ляр, в котором видна пластинка сравнения. При изме-
рениях пластинка должна быть помещена в то место, где
78
следует измерять освещенность. Для определения пос-
ледней нужно уравнять яркости видимых через окуляр
обеих половинок пластинки, служащих полями сравне-
ния. Это достигается изменением угла наклона отража-
теля при помощи вращения кнопки, расположенной
Рис. 27. Люксметр. А — общий вид (по Новикову);
Б —схема устройства (по Кедроливанскому):
/ — лампа, 2 — экран. 3, 4, 5 — зеркала, 6 — окуляр, 7 — фарфо-
ровая пластинка, 8, 9 — светофильтры, фильтры
сбоку ящика. Когда мы достигнем при вращении совер-
шенно равномерного освещения пластинок сравнения,
тогда отсчитываем на шкале у кнопки регулятора по
стрелке, прикрепленной к ней, величину освещения в
люксах.
При слишком малой или, наоборот, чрезмерно боль-
шой яркости света для получения равномерного освеще-
79
ния пластинки сравнения применяют светофильтры,
которыми закрывают соответственно лампочку или на-
ружный свет. В этих случаях следует в показания внести
поправку на светофильтр. На фильтрах обычно обозна-
чена их кратность.
Фотометр (люксметр) с селеновым фотоэлементом
(рис. 28). Этот объективный прибор, не будучи связан с
глазом, позволяет исследовать влияние инфракрасных
Рис. 28. Фотометр:
/ — соленовый фотоэлемент, 2 — гальванометр (по Нови-
кову)
и ультрафиолетовых областей спектра на жизнь живот-
ных. Основой его является круглая пластинка (около
10 см2), покрытая специальным лаком, с ней соединен
фотоэлемент. Под действием света в элементе возбуж-
дается ток, отклоняющий стрелку гальванометра, пока-
зания которого обозначают освещенность в люксах.
Степень отклонения стрелки зависит от яркости све-
та. Если освещение особенно сильное, применяют све-
тофильтры. В этих случаях нужно вносить соответствую-
щую поправку. Фотоэлемент дает относительные пока-
затели, тем не менее полученные с его помощью
результаты измерений отличаются постоянством, пос-
кольку не зависят от индивидуальных особенностей глаз
наблюдателя. В большинстве случаев измерение яркости
освещения посредством фотоэлементов является единст-
венно возможным.
Люксметр типа Ю-16 (рис. 29) предназначен для
измерения освещенности, создаваемой естественным
80
дневным светом, лампами накаливания, люминесцентны-
ми лампами, с непосредственным отсчетом по шкале в
люксах. Принцип действия этого люксметра также осно-
ван на явлении фотоэлектрического эффекта. При осве-
щении поверхности фотоэлемента в замкнутой цепи,
состоящей из фотоэлемента и магнитоэлектрического
измерителя, возникает ток, который отклоняет подвиж-
ную часть измерителя.
Рис. 29. Люксметр Ю-16:
/ — измеритель, 2—поглотитель к фотоэлементу, 3 - фото-
элемент
Измеритель люксметра представляет собой магнито-
электрический стрелочный прибор с подвижной частью
на растяжках. Светоприемник люксметра состоит из се-
ленового фотоэлемента, заключенного в пластмассовый
корпус, снабженный ручкой, и двужильного гибкого про-
вода, служащего для подключения фотоэлемента к из-
мерителю. На корпус фотоэлемента надевается поглоти-
тель, который позволяет расширить основные пределы
и шсрения в 100 раз. Поглотитель состоит из металличес-
кой рамки, в которую вставлены два молочно-нейтраль-
ных оргстекла и металлическая решетка между ними.
Прежде чем приступить к работе с прибором,-необхо-
димо измеритель расположить горизонтально и прове-
рить, находится ли стрелка на пулевом делении шкалы.
81
После фотоэлемент подключается к измерител^б с соб-
людением полярности, указанной на зажимав, и под
требуемым углом вносится в место измерения освещен-
ности. Измерения внутри помещения следует начинать
при положении переключателя на пределе «600 лк». При
малых отклонениях стрелок рекомендуется переходить
на меньший предел измерения. Измерение естественной
освещенности внутри помещений вблизи светопроемов
и снаружи следует производить с поглотителем. Перек-’
лючатель при этом должен быть установлен в пределе
«500 лк». При отклонении стрелки прибора менее 10 де-
лений переключатель переводится на меньшие градусы.
При понижении освещенности до значения менее 500 лк
переключатель надо перевести на предел «500 лк» и снять
поглотитель.
Измеряемая величина освещенности будет равна
отсчитанному числу делений, умноженному на цену де-
ления и в случае необходимости на поправочный коэф-
фициент k\ для ламп дневного света & = 0,9, для ламп
белого света k= 1,1, при измерении естественной освещен-
ности k = 0,8. Цена деления равна пределу измерения,
деленному на число делений шкалы прибора. При ис-
пользовании поглотителя полученную от умножения ве-
личину нужно умножить еще на коэффициент, равный 100.
Для относительной оценки освещенности можно
пользоваться экспонометром ФЭД (являющимся тем же
фотоэлементом), употребляемым фотографами для опре-
деления экспозиции. Удобство экспонометра заключает-
ся в том, что не нужен отдельный гальванометр, так как
он смонтирован вместе с прибором. Хорошие результаты
дает этот прибор при работе на ярком свету. Недостат-
ком яляется то, что экспонометры отличаются малой
чувствительностью к небольшим яркостям света, а так-
же то, что шкала прибора градуирована в единицах
времени. Однако прибор легко переградуировать в
люксы.
В настоящее время сконструирован прибор с селено-
вым фотоэлементом, в котором применяются светофильт-
ры, пропускающие и не пропускающие ультрафиолетовые
лучи.
Для учета состава света данного источника, т. е. для
определения его спектра, применяют специальные спек-
троскопы и спектрофотометры различных конструкций.
82
Солнечная радиация. Энергия, излучаемая солнцем
и пронищающая в нашу атмосферу, кроме светового эф-
фекта, им'еет и тепловую радиацию. Она оказывает влия-
ние на развитие растительности, определяет в большей
Рис. 30. Актинометр Араго — Деви —
Калитина (по Кедроливанскому)
мере температуру воды и почвы, силу испарения на по-
верхности Земли и количество атмосферной влаги.
Основные виды радиации следующие: прямая солнеч-
ная; рассеявшая; суммарная и отраженная.
1. Прямая радиация — поток солнечных лучей, непо-
средственно падающих на поверхность земли. Зависит
опа от высоты солнца, времени года, состояния атмос-
феры.
2. Рассеянная радиация — та часть солнечной радиа-
ции, которая поступает после отражения от облаков, пы-
ли, снежных кристаллов, а также от гор, деревьев и пр.
83
3. Суммарная радиация, или инсоляция,общий
приход прямой, рассеянной и отраженной солнечных ра-
диаций сверху на горизонтальную поверхность. /
4. Отраженная радиация — солнечная радиация, ПО’
ступающая после отражения различных предметов.
В экологических исследованиях по существу необхо-
дим учет радиационного баланса, определяемого излуче-
нием, поглощением и отражением радиации и представ-
ляющего самую существенную часть теплового баланса
деятельной поверхности, который создает условия обес-
печенности биологических процессов теплом и светом.
Интенсивность суммарной радиации выражается в кало-
риях, получаемых на 1 см2 поверхности в единицу време-
ни (кал!см2 мин).
Для приближенных измерений солнечной радиации
пользуются актинометром.
Актинометр Араго — Деви — Кдлитина (рис. 30).
Принцип его конструкции основам на различном погло-
щении тепловой радиации черной и посеребренной (или
белой) поверхностями. Состоит прибор из двух точных
термометров, впаянных в стеклянные трубки с шариками,
окружающими резервуары термометров. Воздух из обо-
лочек выкачан и поэтому резервуары не могут нагревать-
ся от соприкосновения с воздухом, а нагреваются только
от инсоляции и теряют тепло лучеиспусканием. Шарик
одного термометра оставлен блестящим, а другого—за-
чернен. При одинаковом воздействии инсоляции на оба
термометра показания зачерненного термометра будут
выше, чем блестящего, и разность температур приблизи-
тельно пропорциональна солнечной радиации. При оп-
ределении интенсивности радиации актинометром этого
типа его закрепляют шариками вверх и через 10—15 мин
отсчитывают температуру. Разность показаний светлого
и черного термометров умножают на коэффициент дан-
ного прибора.
5 = Л(/ч-/6),
где S— солнечная радиация;
А — переводный множитель в калориях (значение
его указывается в прилагаемом к прибору про-
верочном свидетельстве);
/ч— показания зачерненного термометра;
/б — показания светлого термометра;
84
Величину А можно определить из уравнения
А S .
/ц /б
Исходя из того что интенсивность солнечной радиации
следует определять на единицу площади, Калитин приме-
нил термометры не с шарообразными резервуарами, а
уплощенными с одной стороны.
Актинометр термоэлектрический АТ-50 (рис. 31) пред-
назначается для измерения прямой солнечной радиации.
При измерении прибор соединяется со стрелочным галь-
ванометром типа ГСА-1 (рис. 31). Принцип действия ак-
тинометра основан на поглощении солнечной радиации
н превращении тепловой энергии в электрическую зачер-
ненным приемником с термоэлектрической батареей, на-
ходящихся в трубке (рис. 32, /). Трубка закрывается
съемной крышкой (рис. 32, 2), которая служит для опре-
деления' места нуля и защищает приемник от загрязне-
ния. Для установки актинометра и нацеливания его на
солнце служит параллактический штатив, монтирован-
Рпс. 31. Рабочая установка актинометра АТ-50 (слева) и
гальванометр ГСЛ-1 (справа)
85
пый на стойке, укрепленной на основание футляра. На
основании имеется три целика (рис. 32, 3), которые слу-
жат для установки прибора по географической широте
места.
На месте наблюдения актинометр устанавливается
так, чтобы север находился в направлении от стойки к
Рис. 32. Актинометр термоэлектрический АТ-50 (схе-
ма) :
/ — трубка, 2 — съемная крышка, 3 — целик для ориентиров-
ки по* меридиану, 4 — рукоятка, 5 — отверстие, 6 — кольцо,
7 —точка совмещения кольца, — кольцо, 9 — шкала с гра-
дусами, 10 — провода для соединения с гальванометром,
// — кожух, закрывающий термобатареи, /2 — закрепляющая
гайка
целикам. Актинометр нацеливают на солнце. Для этого
с него снимают крышку и путем вращения рукоятки (4)
и поворота трубки вокруг горизонтальной оси устанавли-
вают ее в такое положение, чтобы зайчик от луча, про-
шедшего в отверстие (5) на кольце (6), совместился с
точкой (7) на другом кольце (8). Провода актинометра
присоединяют к клемам гальванометра ( + ) и (с) при
освобожденном арретире. Крышка актинометра при этом
должна быть снята и актинометр нацелен на солнце. Ес-
ли стрелка гальванометра отклоняется влево за нуль
шкалы, то провода меняют местами.
86
Наблюдения начинают с того, что с актинометра сни-
мают крышку и нацеливают его на солнце, а через 2 мин
закрывают крышкой и, выждав время, соответствующее
его инерции (приблизительно 14—25 сек), отсчитывают
место нуля гальванометра (Hi). Затем снимают крышку
с трубки актинометра и точно нацеливают его на солнце.
Через 15 сек по гальванометру производится пять отсче-
тов Р1Р2Р3Р4Р5 с интервалом между ними в 10—15 сек.
По окончании серии отсчетов актинометр закрывают
крышкой и через 15 сек снова производят отсчет нулевого
положения нуля стрелки гальванометра по формуле
Hi 4- Н2
п =--------.
2
Затем подсчитывают среднюю величину:
р __ Pi + Р2 + Рз + Р^ + Р5
В полученную величину вводят поправку гальвано-
метра :
Рпспр — Р 4" А-
Окончательный результат будет иметь вид:
S = K(P^-H),
где S— напряжение солнечной радиации в калориях на
1 см2 поверхности, перпендикулярной к направ-
лению солнечных лучей;
К — переводной^ множитель данного гальванометра
(см. свидетельство, прилагаемое к гальваномет-
ру).
Чтобы определить интенсивность солнечной радиации,
падающей на единиц^ горизонтальной поверхности, надо
5 умножить на синус высоты солнца, измеренной в мо-
мент наблюдения:
T!SZ :fc='S sin h.
При актинометрии применяются также термоэлемен-
ты. Актинометры такого типа называются пиранометрами
(рис. 33). В этих приборах на круге укреплены термопа-
ры. Общая поверхность термопар покрыта черной и белой
краской в шахматном порядке. Термопары сверху накры-
87
ты стеклянным колпачком, предохраняющим их от сопри-
косновения с воздухом. Неудобство актинометра-термо-
элемента заключается в необходимости пользоваться для
измерения гальванометром.
Рис. 33. Пиранометр Янишевского. А — общий вид; Б — схема
соединения термоэлементов; В — схема зачернения термоэлемен-
тов (по Кедроливанскому)
Физиологическое и патологическое влияние на орга-
низмы оказывает и атмосферное электричество, но оно
мало изучено. Известно, что насекомые (тли) погибают
после сплошного дождя лишь в том случае, если дождь
сопровождается сильной грозой. Тли погибают также
после грозы при отсутствии дождя. На основании этого
предполагают, что гибель насекомых вызывается элек-
трическими разрядами. Этот вопрос требует дальнейшего
изучения.
О методике исследований местного климата
и микроклимата
При характеристике местного климата следует всегда
помнить, что метеорологические явления изучаются не
сами по себе, а как элемент среды обитания, как фактор
88
для животных организмов. Выясняют, какие метеороло-
гические элементы, в какие сезоны года, время суток, на
какой высоте в воздухе или глубине почвы оказывают
решающее влияние на интересующий нас объект. При
микроклиматических исследованиях выясняют условия
среды, окружающие, например, мелкое безпозвоночное,
обитающее в зарослях травы или близ* поверхности
почвы.
Нужно рассматривать не изолированные физические
явления атмосферы, а взаимную связь, взаимную обу-
словленность этих явлений с прочими элементами ланд-
шафта. Особенности ландшафта описывают с точки
зрения влияния их на изучаемый элемент микроклимата.
Одновременно с метеорологическими ведут наблюдения
за животными, устанавливают корелляцию биологиче-
ских явлений с явлениями физико-географическими и
климатическими.
Важно для сохранения постоянства поправок пользо-
ваться во всей серии наблюдений одним и тем же прибо-
ром или по крайней мере приборами одной и той же
конструкции. Во избежание нарушения во время наблю-
дений растительного покрова следует отдавать предпо-
чтение дистанционным приборам.
Такими качествами обладают некоторые самопишу-
щие приборы. Удобны также недавно выпущенные дис-
танционные метеорологические станции, регистрирующие
силу и направление ветра, влажность и температуру воз-
духа.
Изучение местного климата (мезоклимата). В прак-
тике экологических исследований для изучения местного
климата применяют различные методы наблюдений. По
способу их проведения они бывают стационарные и по-
ходные. С походными наблюдениями иногда непосредст-
венно связаны и стационарные. Эти последние вместе с
походными объединяются под понятием «съемка».
Анемометрическая съемка имеет своей задачей дать
характеристику движения воздуха. Формирование мест-
ных ветров самым тесным образом связано с условиями
рельефа местности — оно зависит от наличия'балок и во-
доемов, от характера растительности, в том числе спе-
циальных лесных насаждений (рис. 34) и от различных
сооружений (рис. 35). При этих съемках пользуются все-
ми имеющимися в распоряжении климатологов специаль-
89
ними приборами: ручным анемометром, ветрометром
и др.
В отличие от общей анемометрической съемки, кото-
рая проводится полустационарно метеорологическими
Рис. 34. Движение воздуха по лесной поляне (слева) и в
полосе прореживания (справа) (по Рудневу)
станциями, частная анемометрическая съемка произво-
дится единовременно, применяется в экспедиционных ис-
следованиях и пригодна для экологических работ.
Термометрическая съемка осуществляется также при
помощи стационарных и походных наблюдений. Произ-
Рйс. 35. Влияние лесных полос на скорость
ветра в 3—4 ч дня при высоте деревьев
10—12 м (по Мельниченко)
водится она для определения таких местных особенностей
режима температуры, как характеристика морозоопас-
ности территории. Такие наблюдения имеют сезонный
характер, их производят в то время года, когда морозо-
опасность местности представляет практический интерес.
Оценка морозоопасности имеет значение не только для
90
сельского и других отраслей народного хозяйства, но и
для понимания некоторых сторон жизни насекомых и
других беспозвоночных.
Рис. 36. Распределение основных элементов мик-
роклимата в системе лесных полезащитных полос
(по Мельниченко)
Наблюдения над температурой производятся большей
частью на участках, представляющих непосредственный
интерес (сад, виноградник, хлопковое поле, чайная план-
Рис. 37. Количественное распределение насекомых
разных экологических типов в системе лесных по-
лезащитных полос в летнее время (по Мельни-
ченко)
тация, огород и т. д.), вне зависимости от типичности их
для окружающих территорий (рис. 36, 37). Организаци-
онным центром таких наблюдений может быть опытная
станция, опорный пункт или метеостанция.
91
Рис. 38. Полевое изучение микроклимата. Установка при-
боров (по Махотину)
Основные стационарные наблюдения производят на
высоте 1,5—2 м в будках нормального образца или уп-
рощенных систем. Но можно проводить и дополнитель-
ные наблюдения в самом приземном слое и на поверхно-
сти почвы. Дополнением к сети стационарных пунктов
наблюдений служат и походные наблюдения над темпе-
ратурой в определенных точках специально выбранного
маршрута. Такие данные дадут возможность полнее оха-
рактеризовать изменения температуры между стационар-
ными пунктами.
В зависимости от задач и характера исследовании
термометрические съемки могут быть пешеходными,
верховыми и автомобильными. Последние не могут часто
применяться, но незаменимы при рекогносцировочные
обследованиях.
Наблюдения над температурой при походных иссле-
дованиях производятся с помощью аспирационного пси-
хрометра. В крайнем случае последний может быть заме-
нен пращ-термометром. Измерения производятся в осно-
вном на высоте 150 см, но следует обязательно проводить
дополнительные наблюдения в приземном слое воздуха
на высоте 20 см или на высоте травостоя (рис. 38).
92
Характеристика физико-географических факторов яв-
ляется обязательной частью при изучении местного кли-
мата и микроклимата, так как они (рельеф, раститель-
ность, почвенный покров, близость водоемов, застройка
территории и пр.) определяют микроклиматические осо-
бенности изучаемой местности. Характеристика микро-
климатических факторов может быть описательной, когда
дают сжатое описание или заполняют графы таблиц, и
графической, когда данные исследований изображают в
виде схемы, профиля, плана, карты, фотографии и т. д.
При изучении особенностей влияния растительности
на климат следует учитывать, в какой мере, затеняя поч-
ву, растения влияют на нагрев почвы днем и охлаждение
ночью; как влияет растительный покров на движение вет-
ра. Необходимо выяснить интенсивность транспирации
растений с точки зрения расхода влаги и тепла на эти
процессы. При изучении температуры почвы исчерпываю-
ще характеризуются также растительный покров и влаж-
ность, влияющие на исследуемые явления.
Известно, что многие растения, приспосабливаясь к
тому или иному микрокомплексу условий, образуют свое-
образные экологические формы. По присутствию их мы
можем иногда судить и о характере тех или иных микро-
условий. Растения, таким образом, могут быть использо-
ваны как своеобразный климатический фитоиндикатор.
Фитоиндикатор особенно широко можно использовать в
экспедиционных условиях и в тех случаях, когда нет ме-
теорологических данных, при агроклиматическом райони-
ровании, при освоении новых территорий. Наличие расте-
ний, так или иначе реагирующих на особенности климата,
например погибающих при сильных морозах, указывает
на отсутствие в изучаемой местности губительных низких
температур. Этот метод был использован Агрометинсти-
тутом при районировании субтропической зоны. Специ-
альная группировка фитоиндикаторов субтропического
климата была проведена Романовским (табл. 5).
Изучение микроклимата. В зависимости от специфи-
ческих особенностей местных почв и растительного по-
крова микроклимат верхних слоев земли и прилегающей
к ней части воздуха отличается исключительной пестро-
той (Сапожникова). Большую изменчивость мы можем
наблюдать на любом экотопе — на лугу, огороде, в поле
и в саду.
93
Таблица 5
Фитоклиматические индикаторы, характеризующие основные
три зоны в субтропиках СССР
Наименование
Фитоиндикаторы
Средние темпера-
туры из абсолют-
ных годовых
минимумов
Зона цитрусовых
Зона чая или маслины
Крайняя граница суб-
тропической зоны
Все виды цитрусовых,
пальмы (притчардия, фи-
никовая, кокосовая), эв-
калипт, австралийские
акации, агавы, драцены,
тунг, олеандр в виде де-
рева или высокого куста
Лавр благородный,
камфорный, пальма ха-
меропс, камелия, земля-
ничное дерево, олеандр
в виде низкого куста . .
Инжир в виде дерева,
японская хурма, гранат-
ник, кипарис
От —2 до —6
От —7 до —8
От —9 до —11
Имеет место непосредственное нагревание различных
тел солнцем — поверхность предметов, находящихся под
лучами солнца, оказывается теплее, чем воздушные мас-
сы под ними. Влияет на микроклимат и рельеф. Так, хо-
лодный воздух по ночам скапливается в низинных местах
и долинах. В зависимости от рельефа местности локаль-
ными являются заморозки.
Известную пестроту микроклимата мы вызываем са-
ми, нарушая почвенный покров, растительность в процес-
се наблюдений. Например, установлено, что ненарушен-
ный! травостой дает во всех случаях (в опытах) более
низкую температуру, чем вытоптанная площадка.
Суточное колебание температуры внутри бревен го-
раздо меньше, чем снаружи, на открытом воздухе. Из-
меняется температура и в зависимости от движения воз-
духа на открытых и закрытых участках. Например, при
прочих равных условиях, среди массива густого траво-
стоя, где обмен воздуха ограничен, получали температуру
более высокую, чем на открытых участках черного пара
(контроль).
94
Оценивают особенности микроклимата исследуемых
участков путем сопоставления их с микроклиматом чер-
ного пара. Как указывалось, черный пар и вообще ого-
ленная поверхность почвы является стандартом для
сравнения. При выделении участков для изучения микро-
климата культурных полей необходимо учитывать агро-
технику, принятую в данном производстве. Выделенные
Рис. 39. Изменение температуры воздуха по мере удаления от
края пшеничного поля (по Сапожниковой)
участки должны находиться недалеко от контроля (чер-
ного пара) и иметь прочие равные условия. Размеры их
определяются характером окружающей местности. Чем
разнообразнее условия изучаемой территории, тем боль-
ший участок нужно брать. Имеет значение и расположе-
ние участка, оно во многих случаях играет решающую
роль в формировании микроклимата. Температура возду-
ха внутри травостоя и над ним уменьшается по мере про-
движения от края поля к середине (рис. 39).
На точность данных влияет также величина участка,
малые размеры площадки черного пара искажают тепло-
вой режим почвы. Для того чтобы результаты не искажа-
лись большой пестротой микроусловий, отсчеты рекомен-
дуется производить на всех площадках в нескольких пов-
торностях (хотя бы в трех). При наблюдениях над
температурой воздуха на различных высотах нужно поль-
зоваться одним и тем же прибором. Рекомендуется поль-
зоваться психрометром, который последовательно нес-
колько раз перемещают снизу вверх, сверху вниз и опять
снизу вверх. Для увеличения точности микроклиматиче-
95
ских наблюдений нужно увеличить число повторных ис-
следований и отсчетов.
При постановке микроклиматических исследований в
воздушной среде большее значение имеет правильный
выбор высоты для воздуха, а для почвы — глубины на-
блюдений. Высота или глубина избирается исходя из за-
дач исследования. Например, при изучении расселения
животных, приборы устанавливают на границе их рас-
пространения. При изучении экологии вредителей прибо-
ры рекомендуют устанавливать на высоте (глубине)
наибольшего скопления их.
Для изучения температуры и влажности воздуха наи-
более распространенными высотами наблюдений над ого-
ленной поверхностью или над поверхностью с небольшим
травостоем являются 20 и 150 см. Это обосновано тео-
ретически отделом сельскохозяйственной метеорологии
Всесоюзного института растениеводства и подтверждено
большим практическим материалом. Эти высоты прини-
мают за стандарт и с ними сравнивают все остальные
наблюдения.
Что касается выбора высоты среди травостоя, то в
этом случае наблюдения приурочивают к тем высотам,
где можно ожидать перелома в ходе изучаемого метеоро-
логического элемента, причем верхней точкой остается
высота 150 см. Обычно перелом вертикального распреде-
ления температуры воздуха наблюдается у поверхности
травостоя. В этих случаях дополнительно берут пробу и
на высоте 5 см.
Что касается температуры почвы, то ее измеряют в
этих случаях на глубинах 5 и 15 см, но полезно иметь
данные и для 10 и 20 см.
Сроки наблюдений зависят от характера исследова-
ний. При систематических наблюдениях ограничиваются
2—4 сроками. Эпизодически проводят круглосуточные
наблюдения через каждый час или два в течение круглых
суток. Мы проводили наблюдения через 2 ч и получали
ценные результаты. В дневные часы сроки наблюдений
целесообразно приурочить к 12—13 ч, так как наиболь-
ший градиент наблюдается именно в этот период. Это
совпадает с общеметеорологическим сроком. Выбор сро-
ка ночных наблюдений не стандартизирован, но наиболее
удобным временем следует считать 1 ч ночи, что также
совпадает с общеметеорологическим сроком.
96
В тех случаях, когда интерес представляют минималь-
ные температуры, их следует измерять перед восходом
солнца.
БИОТИЧЕСКИЕ ФАКТОРЫ
Растения как фактор и как компонент биоценоза
Высшие растения. Растения определяют ландшафт,
они входят как обязательный элемент (компонент) в сос-
тав почти всех биоценозов и составляют энергетическую
базу для их животных компонентов. Для большего коли-
чества животных фитофагов высшие растения, а из низ-
ших— высшие грибы служат пищей, а часто убежищем
и местом развития. На растениях и в их тканях проводят
жизнь и заканчивают свой цикл развития многие скрыто-
живущие насекомые и другие беспозвоночные (короеды,
усачи, древоточцы, клещи, нематоды и др.). В трещинах
коры, под корой, в дуплах создается комплекс микроусло-
вий, благоприятный для развития многих мелких беспоз-
воночных. Растения служат местом обитания и для хищ-
ников (кокцинеллид, кожеедов, жужелиц и др.), которые
здесь охотятся за другими животными, а многие энтомо-
фаги здесь дополнительно питаются. На растениях или в
их стеблях устраивают свои гнезда и заготовляют в них
живой корм для будущего потомства некоторые осы.
Опад растений образует мертвый покров, в котором
находят приют и проводят зимовку многие насекомые,
пауки, многоножки, моллюски, черви и другие беспозво-
ночные.
Вместе с тем растения оказывают и отрицательное
влияние на животных, выделяя яды, эфирные масла, фи-
тонциды и вообще вещества, убивающие или отпугиваю-
щие насекомых.
Растения влияют также на структуру почвы своими
разветвленными корнями или мертвыми остатками. Та-
ким образом, растения — элемент среды, биотический
фактор, от которого зависит жизнь многих животных, он
влияет как непосредственно, так и через почву. Поэтому
при зоологических исследованиях, особенно при экологи-
ческих и биоценологических, приходится всегда иметь де-
ло и с растениями.
Эколога могут интересовать не только роль и значение
растений в жизни животных, но и прямое или косвенное
4—1867 97
влияние последних на растения, а также на растительный
покров в целом (рис. 40). Этому вопросу пос-вящен почти
весь раздел «Изучение беспозвоночных поверхности зем-
Рис. 40. Колония тлей на ветке дерева (ориг.)
ли и растительного покрова». Известно, что многие насе-
комые являются опылителями (рис. 41). В этом случае
при изучении таких насекомых нас неизбежно должна ин-
Рис. 41. Питание нектаром цветов
тересовать и биология растений, и биология опылителей
(см. стр. 226). Насекомые, с одной стороны, могут быть
переносчиками семян растений, а с другой — носителями
98
и переносчиками возбудителей и болезней культурных и
диких растений (вирусов, грибов, фитопатогенных бакте-
рий и т. д.), являясь причиной их гибели.
Многие беспозвоночные — фитофаги, поедая растения,
в том числе и культурные, наносят им повреждения, на-
рушают их функции, чем часто причиняют хозяйству
большой ущерб. Таким образом, растение, служащее кор’
мом, субстратом или убежищем насекомым или другим
беспозвоночным животным, угнетается или уничтожается
последними. Растения по-разному реагируют на это.
Обычно в природе животные, влияя на растительный
покров, изменяют тем самым условия среды. И в этом
случае для того, чтобы определить величину и характер
взаимного воздействия насекомого и растения, нужно
помимо животного, знать и биологию растения.
Таким образом, растением мы интересуемся при изу-
ченйи и биоценозов, и трофических отношений насекомых,
при изучении вредителей — экологии отдельных видов
животных, при изучении опылителей, при выяснении ха-
рактера периодических явлений в природе — фенологии,
при изучении факторов среды, когда растение служит
эдификатором, при изучении биоклимата, когда растени-
ем пользуются как своеобразным индикатором, а фазы
его развития служат фенологическим сигналом.
При изучении растительности и растительных компо-
нентов как элементов внешней среды и как биотического
фактора для животных необходимо вести учет и система-
тические наблюдения за растительностью и отдельными
ее видами. Для этого следует выбрать постоянные пло-
щадки во всех основных экологических вариантах, разме-
ры в зависимости от задач наблюдения могут быть раз-
ными.
Для изучения фенологии, продуктивности раститель-
ного (травянистого покрова) достаточен размер площад-
ки в 1 м2. Для стационарного изучения смены раститель-
ности при исследовании биоценозов какого-либо района
берется площадка в 100 м2. Каждую площадку, точно
зафиксированную на листе бумаги и в плане стационар-
ных пунктов, подробно описывают в основные сезоны
(середине лета, весны и осени). Кроме стометровых пло-
щадок, для более детальной характеристики раститель-
ности при эколого-биоценологических исследованиях ис-
4*
99
пользуют площадки в 1 л/2. В любом случае площадка
описывается.
При стационарных биоценологических и эколого-фау-
нистических исследованиях наблюдения над изменениями
в фазах развития растений ведутся через пятидневку
или декаду. На каждом участке, кроме общебиологиче-
ских наблюдений, нужно отмечать явления, определяю-
щие фазу развития отдельных растений. Устанавливают
фазу не по отдельным растениям, а по среднему состоя-
нию большинства особей данного вида (см. «Фенологиче-
ские наблюдения»).
Описание производят ежедневно в полевом журнале
(дневнике) исследований или описывают фитоценозы на
отдельных бланках.
Форма бланка (сокращенная)
1. Номер описания (в журнале указать место участ-
ка) .
2. Дата производства описания.
3. Наименование ассоциаций или групп ассоциаций.
4. Географическое положение.
5. Название урочища.
6. Топографическое положение участка.
7. Микрорельеф.
8. Почвенно-грунтовые условия.
9. Размеры пробной площадки.
10. Распространение данной ассоциации в обследуе-
мом массиве.
И. Физиономическое описание растительного по-
крова. Необходимо указать наиболее резко бросающееся
в глаза отличие данного биоценоза от соседних.
12. Плотность растительного покрова. Определяется
числом особей (побегов) на единицу площадки. При мар-
шрутных исследованиях можно ограничиться следующи-
ми определениями: плотный, разреженный, редкий, очень
редкий растительный покров.
13. Ярусность — указывается количество ярусов.
14. Флористический (видовой) состав биоценоза.
Включить в список следует все растения, так как мало-
распространенные виды могут оказаться хорошим инди-
100
катором какой-нибудь особенности в экологической об-
становке или кормовым растением для насекомых.
15. Количественные отношения между видами:
а) обилие — относительное количество экземпляров
каждого вида; определить, какой вид представлен боль-
шим количеством экземпляров, какой меньшим; для
оценки можно пользоваться следующей шкалой (по
Друде)
Обильно (об) . 6 (soc)
Рассеянно (рс) . 5 (сор3)
Разбросанно (рб) 4 (сор2)
Изредка (изр) . 3 (сор1)
Редко (р) . . . 2 (sol)
Единично (ед) 1 (sp)
Для видов, представленных всего одним экземпляром,
прибавляют еще один показатель 7 (шг)=0; возможно
обозначение рб — рс или 4—5 при колебании между дву-
мя баллами; для каждого яруса оценку производят
отдельно;
б) степень проективного покрытия; выражается в
процентах покрытия. При глазомерном определении мож-
но пользоваться такими градациями:
80—100% — полное или почти полное,
60—80% — покрытие приблизительно на 3/4,
40—60% — покрытие приблизительно на У2,
20—40% — покрытие на У4.
Можно пользоваться цифровыми обозначениями по-
крытия по шкале Гульт — Сернандера:
5 —• покрыто больше ’/2 м2 пробного участка
4 —• покрыто от У4 до У2 » »
3 — покрыто от У8 до У4 » »
2 —• покрыто от У1б до У8 » »
1 — покрыто меньше у16 » »
в) встречаемость — выражается в процентах возмож-
ного нахождения данного вида или группы видов1; при
зоологических работах (в условиях экспедиции) встреча-
емость не определяется;
1 Отношение в процентах числа проб, в которых обнаружены
объекты, к общему количеству взятых проб.
101
г) вес определяется путем взятия пробного укоса с
площадки определенной величины. Проводится при ра-
ботах, имеющих целью выяснить влияние животных на
пастбище;
ж) жизненность; при маршрутном исследовании от-
мечается для тех видов, которые явно уклоняются от об-
щего уровня своей угнетенностью или ненормально пыш-
ным развитием.
16. Фенологические фазы. Обязательны фенологиче-
ские наблюдения: а) для доминирующих растений;
/7
Рис. 42. Снаряжение для сбора расте-
ний. А—сетка для сушки растений;
Б — ботанизирка; В — копалка
б) для осо’бей, важных с точки зрения изучаемого про-
цесса; в) для видов растений, фенологическое состояние
которых представляет интерес «показателя» специфиче-
ских экологических условий или сигнала (см. «Изучение
периодичности явлений»).
Из изложенного следует, что зоолог всегда прямо или
косвенно имеет дело с растениями, ему, кроме животных,
в той или иной мере нужно изучать и растения, много раз
описывать их, но сделать описание это, не будучи специа-
102
листом-ботаником, трудно. Для облегчения работы при
описании растительности в полевых условиях, вместо на-
учных названий растений, можно ограничиваться услов-
ными обозначениями или нумерацией, а для точного оп-
ределения растений собирают образцы; гербаризируют и
с соответствующими записями доставляют в лаборато-
рию. Иметь дело с растениями, а следовательно, и соби-
рать их зоологу приходится при различных исследовани-
ях: при изучении типов и характера повреждений (скеле-
тированные листья, мины, галлы), при изучении
кормовых растений насекомых и других беспозвоночных,
при описании пробных площадок, при изучении почвен-
ной фауны и при многих других исследованиях.
Для сбора растений необходимо пользоваться суще-
ствующими правилами и способами. Нужно иметь папку,
ботанизирку, лопатку, пресс для сушки растений (рис.
42) и бумагу (можно газетную). В зависимости от задач,
поставленных исследованием, может меняться и методи-
ка. Так собирают растения с участков, где ведут феноло-
гические наблюдения, по фазам, причем каждый раз
отмечают дату, номер площадки и номер или условное
название растений (если точное не известно). Очень важ-
но иметь образцы всех фаз развития растения, но цве-
тущей— обязательно, так как достоверное определение
растения возможно только по цветущей фазе.
При изучении вредителей следует собирать растения
с типичными повреждениями; при изучении почвенной
фауны нужно собирать корни для анализа повреждений;
при изучении пищи млекопитающих — остатки растений
у нор, погрызенные растения (пеньки) и т. п. Наконец,
желательно при экологических работах собирать флори-
стический гербарий местности. Такой гербарий послужит
для справок при определении растений по нецветущим
фазам или по отдельным вегетативным органам и их ос-
таткам.
Методика и техника сбора растений.
Растения следует собирать в сухую погоду. Выбирают
лучшие растения и собирают из каждого вида по не-
сколько экземпляров. На этикетках записывают дату, но-
мер площадки, тему исследования, условное название
растения, сделав ссылку на номер дневника.
Собранные растения (молодые проростки, цветущие
формы или отдельные вегетативные части и поврежден-
103
ные органы) кладут в отдельные листы бумаги и перено-
сят в папку или ботанизирку.
По окончании экскурсии (можно и сразу) собранные
растения определяют и делают соответствующие исправ-
ления в дневнике и в этикетках, а условные обозначения
заменяют точными названиями. Для сохранения образ-
цов собранные растения необходимо разложить на листы
бумаги и сдавить в сетке.
Время от времени растения нужно перекладывать на
сухие листы, причем чем сочнее растения, тем чаще сле-
дует перекладывать их, а когда они высохнут, перенести
во внутрь вдвое сложенного листа бумаги вместе с эти-
кеткой.
Иногда при учете растений с площадки, на которой де-
лают количественный и качественный учет насекомых,
приходится брать всю растительность (например, с
0,25 м2). Для этого необходимо все растения срезать или
выкопать, а потом распределить их по видам, подсчитать,
сколько получилось каждого вида, связать растения од-
ного вида в снопик, а все снопики (все виды), собранные
с одной площадки, перенести в ботанизирку, банку или
мешочек и доставить (с этикеткой) в лабораторию. В ла-
боратории весь этот материал сразу анализируется или
засушивается для дальнейшей обработки. Все снопики с
одной площадки необходимо высушивать и сохранять
вместе. Конечно, этот способ применим только там, где
нет возможности собирать гербарий и нет возможности
сразу же на месте определить растения по цветущим эк-
земплярам.
Собранные же корни и другие вегетативные части, а
также образцы повреждений необходимо перенести в
папки, банки или пробирки (в зависимости от характера
или размера объекта), в таком виде доставить в лабора-
торию для анализа. Образцы растений с минами сушат
как обычный гербарий, кладут вместе с этикеткой в кон-
верты или в пакеты из целлофана и в таком виде сохра-
няют для последующего определения и изучения.
Сочные растения и корни для длительного хранения
консервируют в 2 %-ном формалине (1 часть продажного
формалина на 19 частей воды). Подробно о сборе и хра-
нении растений см. специальную литературу.
Низшие растения. Низшие растения и другие микро-
организмы, в том числе грибы и бактерии, как показали
104
исследования многих биологов, играют большую роль в
жизни беспозвоночных, главным образом насекомых.
Одни являются симбионтами (простейшие), другие вы-
зывают различные заболевания (-рис. 43). Известны за-
болевания, вызываемые грибами: белой мюскардиной,
видами родов Empusa, Entomophtord и др. У пустынной
саранчи и у пруса массовое заболевание вызывает Em-
pusa gryli Now. Сумчатый гриб Cardyceps clavata Ell. Ev.
вызывает заболевание акациевого червеца и т. д. Бакте-
рии также являются причиной различных заболеваний:
Bact. melolonthae вызывает заболевание у майско-
го жука. Из клопа-че-
репашки В. И. Посте-
ловым выделена споровая
палочка Bacillus euryga-
steris Pos. Во Франции из
кукурузного мотылька,
мельничной огневки и во-
щинной моли выделены
культуры: Вас. canaden-
sis, Вас. pyrenei, Вас. gal-
leriae и др. Кроме того,
многие заболевания у
пчел, шелкопряда и др.
вызываются представите-
лями микроспоридий (No-
sema, Perezid) из простей-
ших. Вирусы вызывают
полиэдренную болезнь че-
шуекрылых.
Для учета возбудите-
лей болезней при изуче-
нии численности насеко-
Рис. 43. Мертвые гусеницы,
погибшие от фляшерии
мых в популяциях следует выявлять погибших насеко-
мых, имеющих признаки заболеваний. Особенно это сле-
дует делать при массовом заболевании, когда гибель
превышает 50%. Собранный для изучения материал не-
обходимо зафиксировать. Для сбора материала берут не-
сколько образцов насекомых (всех фаз развития, имею-
щихся в данный период) с различной степенью заболева-
ния и поступают с ними одним из указанных способов.
1. Для микробиологических исследований надрезают
покровы больного насекомого, наносят на предметное
105
стекло вытекающую жидкость и приготовляют мазки.
Если содержимое сухое, нужно, нажимая телом насеко-
мого на стекло, сделать мазок (на препарат не должно
попасть содержимое кишечника). Препарат высушивают
на воздухе, завертывая в бумагу с этикеткой и хранят до
их исследования.
2. Для гистологических исследований собранных
мертвых насекомых фиксируют в одной из следующих
жидкостей: а) в смеси спирта с формалином (70 мл 96°
спирта, 26 .мл воды и 4 мл 40 %-ного формалина); б) в су-
лемовом фиксаторе (100 мл насыщенного раствора суле-
мы с 5 мл ледяной уксусной кислоты). Объект с фиксато-
ром нагревают до 37—45° С и оставляют в нем на 6—12 ч,
после чего обрабатывают 70° спиртом с йодом (окраска
крепкого чая). После фиксации материал сохраняют в
70° спирте или в фиксаторе Буэна (15 мл насыщенного
раствора пикриновой кислоты, 5 мл 40 %-ного формалина
и 3 мл ледяной уксусной кислоты). Объект оставляют в
фиксаторе на 12—24 ч, после чего перекладывают в 70°
спирт, в котором он может оставаться до дальнейшей об-
работки.
3. Собирают погибших от болезней насекомых, кладут
их между слоями ваты или фильтровальной бумаги, пере-
носят в коробки (или банки) и сохраняют (с этикеткой)
до обработки. В фиксированном виде материал может
храниться неограниченное время. Для обработки мате-
риала можно пользоваться методом, описанным в книгах
Евлаховой и Швецовой (1954), Наумова (1937), Роски-
на (1951).
Животные как биотический фактор
Животные, опыляющие или поедающие растения, об-
разующие галлы или влияющие на ускорение разложения
опавшей листвы в лесах, являются важным фактором в
жизни растений, в существовании растительных группи-
ровок и формировании почвенных условий.
Изучение характера связей и величины влияния жи-
вотного как фактора — один из коренных вопросов эколо-
гии животных. Ему посвящены многие разделы данного
руководства.
Кроме связи изучаемых организмов с растениями и
влияния на них, многие беспозвоночные живут за счет
106
Рис. 44. Хищник, нападающий на
жертву
других животных, чем влияют на последних и ограничи-
вают численность их в биоценозах (рис. 44).
Своеобразные взаимоотношения со средой наблюдаем
и у паразитических беспозвоночных. Для паразитов, как
указывает Е. Н. Пав-
ловский, существует
среда первого и второ-
го порядка. Средой
первого порядка будет
организм хозяина, сре-
дой второго порядка —
внешняя среда. Посе-
ляясь на животном, па-
разиты находят там
временный или посто-
янный источник пита-
ния.
> Многие паразитиче-
ские насекомые: клещи,
нематоды, живущие за
счет других видов на-
секомых или же дру-
гих беспозвоночных —
в ажнейший биотичес-
кий фактор. Точно так
же для паразитическо-
го насекомого хозяин
является необходимым
условием его существо-
вания. При изучении
как паразита, так и его
хозяина (особенно вре-
дителя сельского хо-
зяйства) эти взаимоот-
ношения необходимо учитывать. Интересные связи обра-
зуют кровососы, временно нападающие на животных и
человека, сохраняя при этом дополнительное питание на
растениях. Подобные явления наблюдаем и среди насе-
комых хищников (см. Изучение энтомофагов-хищни-
ков).
Многие животные, в том числе и некоторые беспозво-
ночные, устраивая норы, гнезда и т. п., создают подходя-
щие условия для жизни ряда других видов членистоногих.
107
В этом случае для последних названные животные также
являются необходимым условием существования. Насе-
комые, живущие в норах, гнездах, а так же живущие на
других животных, образуют специфические жизненные
формы (см. «Изучение ф.ауны нор и гнезд млекопитаю-
щих и птиц»).
Особые приспособления наблюдаем у насекомых,
пользующихся для своего развития мертвыми остатками
(трупом) животного. Эти насекомые образуют биологиче-
ские формы «мертвоедов», что также необходимо учиты-
вать при изучении насекомых, (см. Изучение комплекса
некрофагов «мертвоедов»). К специфическим биотиче-
ским отношениям следует отнести и связи многих беспоз-
воночных (главным образом насекомых) с отбросами
других животных, здесь они находят нужные условия
существования, что также следует упитывать. Эти вопро-
сы рассматриваются в разделе «Изучение комплекса на-
возников».
Насекомые и другие беспозвоночные в борьбе за су-
ществование вступают в конкурентные отношения. Эти
последние обязательно должны являться предметом вни-
мания эколога при изучении различных групп животных.
ИЗУЧЕНИЕ БИОКЛИМАТА
Изучение периодических явлений
Жизненные процессы многих организмов, как и мно-
гие явления природы, подвержены законам периодичнос-
ти. Так, например, с наступлением весны — как только
сходит снеговой покров — начинают зеленеть луга, поля,
леса, в пробудившихся растениях обнаруживается дви-
жение сока, затем развиваются почки, растения цветут,
плодоносят и, наконец, прекращают вегетацию. После
некоторого зимнего покоя весной снова начинается тот
же цикл. С растениями, как уже упоминалось, связаны
многие животные, для которых растения являются тро-
фической базой и условием их существования — от них
зависит развитие многих животных. Животные эти, как
и все организмы, также подвержены законам периодич-
ности, так, некоторые птицы прилетают в более северные
широты, кладут яйца, выводят птенцов, а осенью улета-
108
ют на места зимовки. Лягушки с весны пробуждаются от
зимней спячки, мечут икру, из которой затем развиваются
головастики и т. д. Пробуждаются от зимнего покоя на-
секомые, из перезимовавших кукулок появляются взрос-
лые насекомые, они откладывают яйца, сами погибают,
а из яиц отрождаются личинки, которые после периода
питания и роста окукливаются, и куколки остаются зи-
мовать.
Сезонные явления в растительном и животном мире
дают наглядную картину совместного влияния различных
элементов погоды на развитие растения и животных. Все
эти сезонные или периодические явления называются фе-
нологическими, а наблюдения их — фенологическими на-
блюдениями. Система знаний о сезонном развитии орга-
нической природы, обусловленном сменой времени года,
называется фенологией.
Подобно тому как на метеорологических станциях при
помощи специальных приборов мы регистрируем темпе-
ратуру, влажность, силу света и т. д., при фенологических
наблюдениях изучают явления, которые позволяют су-
дить о характере и совокупном действии этих факторов.
Отдельные фазы в жизни растений, а в ряде случаев и
животных могут проходить только тогда, когда накопится
достаточная сумма тепла и имеются нужные условия
влажности почвы, а для животных — и нужные для пита-
ния растения. Таким образом, смена времен года в повсе-
дневной жизни нами определяется не наступлением той
или другой температуры воздуха, не интенсивностью сол-
нечной радиации, а результатом совокупного действия
их — последовательностью прохождения различных фе-
нологических явлений (прилет грачей, жаворонков, за-
цветание различных растений ит. д.). Вот-почему данные
фенологических наблюдений дают представление о ха-
рактере биоклимата района. Поэтому наряду с метеоро-
логическими данными, а иногда и вместо них мы пользу-
емся результатами фенологических наблюдений. По пе-
риодическим наблюдениям хорошо выраженные сезоны
можно разделить на отдельные фенологические периоды.
Можно, например, определить природную периодизацию
явлений для данной местности, т. е. составить так назы-
ваемый фенологический календарь, указывающий на по-
следовательность наступления тех или иных фенологиче-
ских явлений.
109
Хотя, как показывают многолетние наблюдения, фено-
логические сроки в отдельные годы изменяются (растя-
гиваются или сокращаются), но последовательность их
остается постоянной (черемуха, например, всегда зацве-
тает раньше сирени).
Климатические и физико-географические различия
местности определяют сроки появления насекомых и во-
обще животных в разные времена сезона. Эти различия
часто зависят от широтного, долготного положения изу-
чаемого пункта. Такую зависимость фенологических дат
от географического положения предложено выразить в
виде биоклиматического закона (Гопкинс), согласно ко-
торому каждое периодическое явление в живой природе
наступает на четыре дня позже на каждый градус широ-
ты по направлению на север и на 5° долготы по направ-
лению на восток, а также на каждые 133 м высоты над
уровнем моря. Хотя правило это не универсально, поло-
жения его ограничены небольшим пространством уме-
ренных стран северного полушария, но известная законо-
мерность, подобная вышеуказанной, действительно на-
блюдается в природе и может иметь место в средней
части северной Европы.
Фенологические наблюдения, как и составленные на
материалах многолетних наблюдений фенологические
календари, могут быть полезны для определения сезон-
ных явлений, например, для установления сроков посева
различных культурных растений, сроков выставления
пчел, сроков проведения мероприятий по борьбе с теми
или иными вредителями. Сюда можно отнести также на-
блюдения над сроками проведения различных сельскохо-
зяйственных работ (начало полевых работ, сроки весен-
ней и осенней пахоты, время посева, сроки сенокоса,
уборки и т. д..).
Таким образом, фенологические данные характери-
зуют природные условия — биоклимат.
Важное практическое значение биоклиматических на-
блюдений определяется тем, что они дают возможность
установить: ход развития и смену фаз каждого отдельно-
го вида организмов, постоянство последовательности
фаз развития различных их видов в данной местности,
связь между метеорологическими факторами и временем
прохождения отдельных фаз данным организмом, нако-
нец, они позволяют судить о биоклимате района.
ПО
Данные фенологии используют экологи, биогеографы,
метеорологи, климатологи, работники сельского хозяйст-
ва, лесоводы и медики.
На основании общих фенологических данных состав-
ляют биоклиматические карты, а на основании послед-
них— фенологические календари. Вще Н. А. Северцов
писал: «Гораздо удобнее определять время периодиче-
ских явлений животной жизни по их отношению к другим
явлениям природы, составляющим их физические усло-
вия. Отношение между периодическими изменениями
внешних условий и перодическими явлениями животной
жизни есть отношение постоянное, основанное на причин-
ной связи». Народ издавна приурочивал многие земле-
дельческие работы к наступлению того или иного явления
в природе. Интересно отметить, что в России вопросам
фенологии придавал значение Петр Первый. Он обязал
всех генерал-губернаторов сообщать фенологические све-
дения.
Различают такие типы фенологических наблюдений:
1. Общие, для выяснения биоклимата.
2. Детальные, для изучения экологии организма.
3. Агроклиматические, для определения сроков прове-
дения сельскохозяйственных работ.
Общие фенологические (биоклиматические) наблюдения
Общие (биоклиматические) наблюдения имеют целью
изучить природную ритмичность, прохождение метеоро-
логических явлений, пользуясь таким чувствительным
«прибором», каким являются живые организмы. Прово-
дятся они на специально выделенных участках над оп-
ределенным составом животных и растений, связывая это
с метеорологическими наблюдениями.
Но для систематических наблюдений, для получения
сравнимых материалов, для определения годового хо-
да изменений погоды, а значит и для- составления харак-
теристики биоклимата данной местности (района, облас-
ти) следует ограничиться определенными видами расте-
ний и животных. Лучше, чем растение, никто и ничто не
отражает общих свойств климата и почвы данного места.
Наблюдения можно вести над различными объектами,
но строго определенными для всех местностей. Гидроме-
111
теорологический комитет для систематических наблюде-
ний рекомендует такие объекты:
Растения
Лещина Береза пушистая
Мать-и-мачеха Береза бородавчатая
Пролеска двулистная Ветреница дубравная
Пролеска сибирская Ветреница лютиковая
Калужница Акация желтая
Клен остролистный Акация белая
Одуванчик Дикий цикорий
Черемуха Бузина черная
Рябина Синяк
Каштан конский Липа мелколистная
Сирень
Животные
Суслик Летучие Скворец Ласточка Щука Водяная
мыши деревен- лягушка
Дикие гуси ская Пчела
Жаворонок Стриж Майский
полевой башенный жук
Журавли Кукушка Жук-кузька
Аист Соловей Крушинница
Грач Перепел Пауки-летуны
Наблюдения следует вести за отдельными фазами
развития растений и животных, когда порисходят хорошо
видимые изменения в росте и развитии. У растений они
проявляются в образовании листьев, стеблей, цветочных
бутонов, плодов и т. д.; у насекомых — в размножении
или кладке яиц, появлении личинок, куколок и лёте има-
го. При всех фенологических наблюдениях следует отме-
чать эти легко заметные, наиболее резко выраженные
моменты (табл. 6).
Чтобы наблюдения имели научную ценность, нужно
записывать только те явления, которые наблюдал сам
исследователь. Следить только за теми видами и теми
моментами их развития, которые указаны в программе
исследования. Все наблюдения следует вести в опреде-
ленных, точно обозначенных участках, типичных для
изучаемого района и содержащих в себе по возможности
все нужные объекты для наблюдения. Площадки, выб-
ранные для наблюдений, описывают по следующей схе-
ме: общий характер местности (ровная, холмистая, до-
лина реки и т. д.); местоположение участка (на склоне,
112
Таблица 6
Фенологические явления у растений и животных, за которыми
следует вести наблюдения
Шифр Для растений * Для животных
1 Растение распускает почки или начинает оживать Первое появление единичных насекомых или других живот- ных, появление первых стай пе- релетных птиц
15 Образуются бутоны —
2 Расцветают первые цветы (цветет не более 10% всех растений вида) Первое пение, крик птиц или кваканье лягушек
25 Массовое цветение Массовое появление насеко- мых или других животных. Стаи птиц массой перелетают или пролетают с юга. Массовое по- явление зимних птиц
3 Цветение заканчивается (цве- тет не более 10% всех расте- ний вида) Птицы начали вить гнезда, лягушки и рыбы начали метать икру
4 Лист начинает развиваться Деревья покрыты зеленой дымкой В гнездах вывелись птенцы, в ульях появились личинки
5 Листья выросли до нормаль- ной величины Первый вылет молодых птиц из гнезд. Начало роения у пчел
6 Плоды начинают созревать Птицы перестали петь, не слышно лягушек
7 Плоды созрели, отпадают или высыпают семена Птицы начали собираться в стаи
8 Листья начали желтеть Начало отлета перелетных птиц на юг или зимующих на север. Замечены первые оди- ночные стаи
85 Массовое пожелтение листь- ев —
9 Начало листопада Массовый отлет перелетных птиц на юг или зимующих на север.
96 Массовый листопад Насекомые и другие живот- ные появляются только в теп- лую погоду
0 Наблюдений не было Наблюдений не было
на холме и т. д.); освещенность и прогреваемость пло-
щадки солнцем; почва; характер растительности (луг,
лес, болото, степь и т. д.).
Изучение фенологии отдельных видов животных
Основная задача всякого фенологического наблюде-
ния по вредным насекомым — выяснить сроки появления
и развития каждой фазы (подсчитать количество яиц,
личинок, куколок). Эти явления нельзя познать без
одновременного изучения и фенологии растений, кото-
рыми питаются беспозвоночные, и других растений, осо-
бенно многолетних, а также без учета метеорологических
и других значительных периодических явлений, ибо важ-
ной задачей является установление связей фенологии
изучаемых животных с периодическими явлениями в
окружающей его природе, в первую очередь с явления-
ми, от которых в той или иной степени зависит их суще-
ствование и развитие.
Нужно стараться сопоставить сроки появления из-
бранного для изучения животного, например вредителя,
со сроками других более заметных явлений. Замечено,
например, что лёт лугового мотылька совпадает (на юге)
с началом цветения белой акации. Лёт белой американс-
кой бабочки в Закарпатье совпадает с началом цветения
яблони. Гусеницы златогузки покидают зимние гнезда во
время распускания листовых почек дуба. Такое совпаде-
ние в сроках нескольких фенологических явлений исполь-
зуют в качестве фенологических сигналов. Одно явление
предупреждает, что одновременно или вскоре начнется
другое важное для нас фенологическое явление. При пол-
ных фенологических наблюдениях следует стремиться
выявлять фенологические сигналы. Сроки развития рас-
тительноядных насекомых тесно связаны со сроками раз-
вития растений, за счет которых они питаются. Такое
совпадение в сроках фенологических явлений можно ис-
пользовать для уточнения времени возможного появления
вредных насекомых и для наблюдений за причиняемыми
им повреждениями.
При изучении фенологии насекомого (вредителя) не-
обходимо учитывать и фенологию возделываемых куль-
тур, и сроки проведения сельскохозяйственных работ.
114
Фенологические фазы развития растений
В литературе по фенологии .приводится ряд условных
(в виде значков) обозначений фаз развития. Такие услов-
ные значки хороши для составления фенограмм, фено-
карт, но для полевых записей фенологических явлений
они менее удобны. Предпочтительны буквенные или ци-
фровые обозначения. Ниже приводится шкала таких по-
казателей и характеристика фаз, которые следует от-
мечать.
I фаза. Всходы—появление первых листочков
(Всх-1).
II фаза. Кущение или развитие розетки: начало (Л-1),
массовое (Л-2), конец (Л-3).
III фаза. Выход в трубку или стеблевание: начало
(Ст-1), массовое (Ст-2), конец (Ст-3).
IV фаза. Цветение: начало (Цв-0-1), максимальное
(Цв-2-4), конец (Цв-5).
У'фаза. Плодоношение: начало (Пл-0-1), максималь-
ное (Пл-2), конец (Пл-3).
VI фаза. Обсеменение: начало (06-1), массовое
(06-2),конец (Об-З).
VII фаза. Засыхание, сухие листья (СЛ).
VIII фаза. Осеннее отрастание и осенние всходы: на-
чало (Ол-1), массовое (Ол-2), конец (Ол-3).
Результаты наблюдений за изучаемый период записы-
вают по следующей форме (табл. 7).
При наблюдениях в природе по общепринятой про-
грамме следует руководствоваться основными принципа-
ми, выработанными практикой учета, периодических яв-
лений, которые могут быть сформулированы в виде общих
требований. Обязательно производить точные записи как
самого явления, так и даты и точные названия объектов,
с которыми имеем дело. Наблюдения должны быть регу-
лярными в течение ряда лет. Независимо от программы
исследования важные явления в жизни беспозвоночных
(массовое появление вредителей, скопление паразитов,
резкое уменьшение численности) и их сроки не должны
оставаться не отмеченными.
Для выяснения сроков появления и развития вредных
насекомых, для вскрытия закономерностей их фенологии
нужны, как справедливо указывает Б. В. Добровольский,
115
Таблица 7
Таблица смены фаз развития растений за год
Год
Место наблюдений.
№ участка-
Название ви юв I фаза- вс ходы II фаза- кущение или разви- тие розетки III фаза- выход в трубку или стеб- левание IV фаза- цветение V фаза— плодоно- шение VI фаза- обсеме- нение VII фаза- засыхание VIII фаза— осеннее отрастание или осен- ние всходы
1 1 2 3 1 2 3 1 2 3 4 5 1 2 3 1 2 3 1 1 2 3
•
массовые наблюдения в различных местах, нужны мас-
совые фенологические материалы.
Наблюдения за сельскохозяйственными
к у л ь 'г у р а м и к
Эти наблюдения включают изучение периодических
явлений в жизни .культурных растений. Знание сроков
прохождения последовательных фаз развития культур-
ных растений или вредных насекомых используется со-
ответственно для прогнозов появления плодов и семян
или появления вредителей и позволяет планировать сель-
скохозяйственные работы. Ту же цель преследует выяв-
ление местных природных уже упомянутых фенологичес-
ких сигналов, указывающих наилучшие сроки посева,
проведения борьбы с вредителями.
Данные последовательной смены фаз развития —фе-
нологический спектр — дают возможность использовать
эти явления при подборе древесных и кустарниковых по-
род при озеленении населенных пунктов для создания
беспрерывно цветущего парка, в выборе медоносов для
цветочного конвейера, кормовой базы для пчел и энтомо-
фагов, при разработке календаря по борьбе с вредителя-
ми и т. д.
Нужны эти данные (фенологический спектр) при изу-
чении вредителей, животного населения культурных по-
лей, формирования биоценозов, они дают возможность
установить закономерность прохождения отдельных фаз
в результате действия внешних условий. Наконец, они ха-
рактеризуют биоклимат.
Наблюдение каждой сельскохозяйственной культуры
производят на специально выделенной для этой цели пло-
щадке (типичной для окружающей местности). Она
должна обеспечить общие условия как в естественно-ге-
ографическом отношении, так и в отношении характера
применяющейся агротехники.
Выбрав площадку, следует описать ее по такой схеме.
1. Общий рельеф местности, где расположена намечен-
ная для наблюдений площадка (ровная, холмистая, до-
лина речки, низина и т. д.).
2. Почва поля.
117
3. Как далеко от намеченного поля речка, озеро, пруд,
болото и т. п.
4. Глубина грунтовых вод в колодцах.
5. Нет ли вблизи лесов, указать расстояние от них.
6. Как почва воспринимает влагу: задерживается ли
вода на поверхности, трескается ли земля, когда высыха-
ет или образует корку и др.
7. Застаивается ли вода в поле и бывают ли от этого
вымокания.
8. Севооборот, принятый в окрестности изучаемого
района.
9. Чем было занято поле в прошлом году. Место поля
в севообороте.
Для получения сравнимых данных необходимо на-
блюдать над определенными фазами у специально вы-
бранных для этой цели растений. Для сельскохозяйствен-
ных культур, за которыми ведут наблюдения, следует от-
мечать и другие фазы (табл. 8, 9, 10).
Пояснение к отдельным фазам. Для свеклы появление
первой пары листочков (2-я фаза) будет тогда, когда на
растении показывается первая пара настоящих листоч-
ков, а не семядольных.
На начало роста озими весной указывают не зазеле-
невшие поля, а появление на всходах молодых побегов
(начало отрастания и кущения озими).
За наступление фазы цветения у злаков условно сле-
дует считать появление пыльников на поверхности коло-
са. Молочная спелость — когда зерно достигло уже своего
обычного размера, но еще мягкое, так что при раздавли-
вании между пальцами выступает белое молоко. Воско-
вая спелость — период, когда зерно стало желтым, но все
же еще мягкое, так что разрезается ногтем.
Временем наступления той или иной фазы условно счи-
тают тот день, когда это явление наблюдается у 10%
всех растений в поле.
При записях отдельных фаз следует записывать так-
же состояние посевов по следующей пятибалльной сис-
теме: 1 —плохое состояние, 2 — ниже среднего, 3 — сред-
нее, удовлетворительное, 4 — выше среднего, 5 — хоро-
шее. Указывается и высота растений.
Если культурам вредит какой-нибудь грибок или на-
секомое, нужно точно указать дату их появления, а также
размеры повреждения (среднее в процентах от общего
118
Таблица 8
Полевые культуры и их фазы развития, над которыми проводят наблюдения
1 Шифр фазы 1 Рожь, пшеница, (озимая и яровая), овес, ячмень, просо, кукуруза Гречиха Подсолнечник Картофель Горох Свекла сахарная
0 Посев Посев Посев Посадка Посев Посев
1 Всходы Всходы Всходы Всходы Всходы Появились проростки на большей части поля
2 —~ — — — — Появилась первая па- ра настоящих листочков (не семядольных)
3 Кустится —। — — — 3-я пара листиков
4 Озимь весной начала расти — — — — —
5 Колосится или выбрасывает сул- таны (у кукурузы) — — — 5-я пара листиков
6 Цветение Цветение Цветение Цветение Цветение —
7 Зерно налилось, настала молочная спелость Появление пер- вых почерневших зерен Отцветание, мелкие цветки осыпаются Отцветание Появ пение гервых стручков Нижние листья начи- нают желтеть
8 9 Наступила вос- ковая спелость — Уборка у рожая —
Таблица 9
Овощные культуры с указанием фаз, над которыми проводят фенологические наблюдения
Ши фр фазы Огурцы, дыни, арбузы, тыква, кабачки Томаты, баклажаны, перец Капуста Лук
1 Всходы Всходы Всходы Всходы
2 Первый настоящий лист Первый настоящий лист Первый настоящий лист Появление третьего пе- ра
3 Третий настоящий лист Третий настоящий лист Третий настоящий лист —
4 Образование бутонов (у огурцов не регистри- руется) Образование боковых побегов. Образование со- цветид Начало завивания ко- чана Увядание крайних перьев
5 Цветение Цветение — Увядание крайних перьев (из севка)
6 Отцветание первых женских цветков (нача- ло увеличения завязей) Отцветание первых цветков (начало увели- чения завязей) — Увядание всей ботвы (у севка)
7 Съемная спелость Съемная спелость Техническая спелость Съемная спелость
Таблица 10
Плодовые культуры с указанием фаз, над которыми проводят фенологические наблюдения
Шифр фазы Яблоня, груша и другие семечковые; слива, вишня, и другие косточковые; крыжовник и другие ягодные Виноград Цитрусовые Грецкий орэх, лещина
1 Начало сокодвижения
2 Набухание цветочных почек Набухание почек — Набухание почек
3 Распускание цветоч- ных и листовых почек Распускание почек Распускание почек Распускание почек
4 Развертывание первых листьев Развертывание первого листа Развертывание первых молодых листьев Развертывание первых листьев
5 Образование соцветий (у малины) Развертывание третье- го листа Образование бутонов —
6 Цветение (начало и конец) Цветение (начало и конец) Цветение (начало и конец) Цветение (начало и ко- нец)
7 Созревание Созревание Наступление периода летнего покоя Созревание плодов
8 — Техническая спелость Начало вторичного ро- ста побегов —
9 Осеннее расцвечивание листьев Осеннее расцвечивание листьев Съемная спелость пло- дов Осеннее расцвечивание листьев
10 Конец листопада Листопад Осенняя приостановка роста Конец вегетации
И Опадение завязей и не- зрелых плодов, оконча- ние роста побега у шел- ковицы; завертывание пятого и десятого листьев. Дополнительное вызре- вание лозы
числа 'Кустов или стеблей на площади 0,25 ж2), для насе-
комых обозначают и фазы их развития (яйцо, куколка,
имаго).
Следует отмечать проведенные работы по подкормке,
прополке. Также следует записывать и сведения о сор-
няках и вообще о всех условиях, влияющих на нормаль-
ное развитие культур, а следовательно, и на животных, и
на весь биоценоз в целом
СБОР И ИЗУЧЕНИЕ БЕСПОЗВОНОЧНЫХ
ОБЩИЕ МЕТОДИЧЕСКИЕ ПРЕДПОСЫЛКИ
Всякое исследование животных — фаунистическое,
экологическое, биоценологическое, морфологическое или
производственное — предполагает сбор разнообразного
материала, который служит основным документом или
объектом для анализа.
Сбор фактического научного материала должен отли-
чаться от любительского коллекционирования. Для це-
ленаправленного подхода к сбору материала необходимо
предварительно ознакомиться с особенностями образа
жизни изучаемой группы животных и с теми экологичес-
кими условиями, в которых животных легче находить,
наблюдать и удобнее всего добывать. При массовых ис-
следованиях в природе приходится собирать не только то,
что сразу бросается в глаза, и не только животных, явно
вредящих или заведомо полезных, но и прочих беспозво-
ночных, попадающих в места исследования, поскольку
среди них могут оказаться виды, важные для целей ис-
следования, или виды с еще не известным значением для
хозяйства человека.
Научные сборы, коллекции дают возможность систе-
матизировать животных, решить важные вопросы биоло-
гии и географического распространения. В процессе же
сбора материала при полевых работах накапливаются
экологические и вообще биологические сведения, полез-
ные в научном и практическом отношении.
При сборе материала и выборе для этого наиболее
целесообразной методики и приемов сбора необходимо
учитывать ряд особенностей, которыми характеризуется
123
большинство беспозвоночных, в том числе и обширная
группа насекомых. Нелишне напомнить, что для большин-
ства указанных животных характерен полный метамор-
фоз, т. е. развитие с превращением. В течение года любое
насекомое (можно найти в фазе яйца, личинки, куколки
(у некоторых нимф) или имаго.
Развитие насекомого от яйца до имаго обозначается
как генерация. Многие насекомые успевают за год пройти
только один раз все фазы —они имеют одну генерацию
(непарный шелкопряд, боярышница и др.). Это моноволь-
тинные формы. Другие дают несколько генераций в год
(тли и др.) — это поливольтинные формы.
Имеются насекомые, у которых развитие проходит
медленно, генерация длится несколько лет (майский
жук —3—5 лет, щелкуны —4—7 лет). Меняется в тече-
ние года и характер активной деятельности. На, зиму
многие виды (их личинки и имаго) забираются в почву,
под кору деревьев, в щели и другие укромные убежища.
Иные зимуют в фазе куколок или яиц.
Некоторые беспозвоночные, в том числе и насекомые,
ведут скрытый образ жизни. Обнаружить их можно лишь
по результатам жизнедеятельности — по повреждениям,
галлам, минам, ходам, которые хорошо выделяются на
растениях, а также по экскрементам, паутине, гнездам.
Поэтому вместо живых объектов в этих случаях собира-
ют следы их жизнедеятельности, которые будут единст-
венным фактическим материалом, документирующим на-
хождение вида.
Для получения наиболее ценных в научном отношении
сборов, кроме знания особенностей жизни животных,
важно и умение хорошо разбираться в ландшафтах, знать
почвы и растительность. Для того, чтобы сборы имели на-
учную ценность, необходимо производить их, придержи-
ваясь общепринятой методики, технических приемов,
пользуясь разнообразными приспособлениями.
Сбор свободноживущих беспозвоночных обычно про-
водят на различных частях растений, деревьев. Собирают
их в почве, на земле, под камнями, поваленными деревь-
ями, в лесной подстилке, во мху, на траве и вообще во
всех местах, где они могут укрыться. Для сбора хищни-
ков и «мертвоедов», например, осматривают трупы раз-
личных животных. Многих насекомых находят в помете
животных. В сырых местах встречаются хищные насеко-
124
мые (жужелицы, стафилины), а также мокрицы, много-
ножки, дождевые черви; в известковых местах — назем-
ные (моллюски. На земле, нагретой солнцем, бегают чер-
нотелки, долгоносики, жужелицы; на траве, на стеблях и
листьях можно найти листоедов, долгоносиков, клопов;
на цветах — трипсов, перепончатокрылых, мух, усачей,
пыльцеедов; коре деревьев — клопов, 'муравьев, жуков,
мух, бабочек; на стволах, ветвях— червецов,, щитовок,
тлей, клещей и т. д. В земле, в лесной подстилке, в гнию-
щем дереве, кроме насекомых и их личинок, находим чер-
вей, моллюсков, мокриц, пауков, многоножек. Используя
обыкновение некоторых видов скопляться в определен-
ных местах, для сбора применяют различные приманки.
Описание их и специальные способы сбора отдельных
групп приводятся в соответствующих разделах.
Наиболее простой и распространенный способ сбора
большинства беспозвоночных — ручной. При этом в за-
висимости от объекта, обстановки, среды пользуются пин-
цетами различной формы, ловчей пробиркой, смоченной в
спирте кисточкой (для сбора мелких насекомых). Произ-
водят сбор насекомых механическими способами: при
помощи эксгаустера, сачка, сетки и т. п., а также пове-
денческими — при помощи различных приманок, ловушек,
эклекторбв. Способ сбора зависит от особенностей биоло-
гического объекта. Так, для сбора моллюсков необходим
иной способ лова, чем, скажем, для лова трипсов или
кровососов. Например, мокрецов можно собирать про-
биркой, а при наличии оборудования — светоловушкой
со всасывающим аппаратом. Способ лова зависит и от
задач и характера исследования. Так, обычно ручной
сбор коллекционного материала производят при фауни-
стических, морфологических, систематических исследова-
ниях, а учет насекомых при биоценологических и других
работах осуществляют специальными приборами.
ПРИБОРЫ И ПРИСПОСОБЛЕНИЯ ДЛЯ СБОРА НАСЕКОМЫХ
И ДРУГИХ БЕСПОЗВОНОЧНЫХ
Сачки. Универсальным сачком пользуются для сбора
насекомых, реже пауков, клещей. Он представляет собой
мешок из плотной материи, мельничного шелкового газа,
капрона, тюля или марли, навешенный на металлический
125
обруч, который прикреплен к палке. Выбор материала
зависит от назначения сачка. Для специальных сборов
насекомых, главным образом летающих, пользуются воз-
душным сачком из тюля, шелкового газа или марли; для
Рис. 45. Пояс для ношения пробирок. /1—охотничий пат-
ронташ-пояс, приспособленный для ношения экскурсионных
пробирок в его гнездах; Б — экскурсионная пробирка
количественного сбора (кошений) мешок шьют из более
прочной материи (бязи, шелкового газа). Форма мешка
может быть закругленной или конической. Мешок может
Рис. 46. Сачки различных типов. А — с плоским дном (воз-
душный); Б — с привязными мешочками; В — с отверстием на
дне (для кошения): Г — с отверстием и привязанной банкой
для высыпапия улова
иметь плоское дно или отверстие, затянутое шнуром, для
высыпания улова в морилку (рис. 46). Иногда к такому
сачку пристраивают привязной мешочек, в который вы-
сыпают улов. Длина мешка равна двум диаметрам обру-
126
ча. Размеры обруча различны. Сачки, предназначенные
для количественных сборов, должны быть стандартными,
рекомендуют размеры 35,7 см (Медведев, Фасулати),
30 см (Крышталь, Мельниченко), 20 см (Бируля, Балог,
Колокольчикова и Перлова).
Рис. 47. Способы крепления сачка к палке. А — постоянное
(жесткое) крепление; Б—крепление разборного сачка;
В — обруч разборного сачка
Длина палки также варьирует в зависимости от на-
значения сачка. Рекомендуют длину палки в 1,5; 1,0;
0,5 м или сачок совсем без палки (Балог); толщина пал-
ки 3—4 см.
Сачки, предназначенные для ловли насекомых в воз-
духе, имеют несколько иное устройство и описаны в со-
ответствующих разделах. Для ловли мелких насекомых
удобнее сачок с плоским дном (см. рис. 46). Обруч круг-
лой формы делают из проволоки и прикрепляют к палке.
127
Чтобы сделать сачок портативным, обруч делают склад-
ным, но такие сачки непрочны и для кошений менее при-
годны. Имеется несколько способов /крепления обруча
(рис. 47).
Рис. 48. Способы пользования сач-
ком
Эксгаустеры (аспи-
раторы). Эксгаустер —
прибор для сбора мел-
ких насекомых, пред-
ставляющий собой про-
бирку или широкогор-
лую банку с корковой
пробкой или широкую
стеклянную трубку, за-
крытую с обоих концов
пробками. В * пробку
вставляют две тонкие
(0,5 см) стеклянные
трубочки, на одну из
них натягивают рези-
новую трубку с мунд-
штуком на конце.
Мундштук берут в рот
(или используют рези-
новую «грушу»), отвер-
стие свободной трубки
приближают к мелко-
му насекомому и через
резиновую трубку втя-
гивают воздух. Насеко-
мое током воздуха втя-
гивается и переносится
в широкую трубку
(пробирку или банку).
Эксгаустеры бывают
различные (рис. 49).
Биоценометры. Для количественного учета беспозво-
ночных на поверхности земли в травостоях, на кустарни-
ках и на других подобных объектах используют биоцено-
метры. Биоценометры бывают разных систем, но все они
устроены по одному принципу. Определенный участок
земли в 1 или 0,25 м2 накрывают прибором, затем из него
выбирают всех животных, подсчитывают их и пересчиты-
вают на определенную площадь.
128
Впервые в СССР применил биоцеиометр Догель. За
последнее время в нашей стране и за рубежом сконстру-
ированы -и применяются их различные модификации.
Приведем описание некоторых из них. Способы примене-
ния описаны в разделе «Учет насекомых травы ...».
Рис. 49. Эксгаустеры
Биоценомётр Баскиной и Фридман (рис. 50) представ-
ляет квадратный железный ящик (высота каждой сторо-
ны 10 см) с двумя ручками. Нижний край ящика заост-
рен, а верхний загнут наружу для надевания мешка. Ме-
шок сшит из плотной материи по размеру ящика. Перед
началом работы с прибором мешок надевают на ящик и
завязывают. Биоценометр берут за ручки и поднимают
вверх на вытянутых руках и быстро опускают на землю,
5—1867
129
Рис. 50. Биоценометры. Слева — Бас-
киной и Фридман; справа — Станчин-
ского
тод дает большую утечку, которая,
затем землю вокруг подкапывают лопатой, площадку
земли 'поднимают и быстро проталкивают в мешок.
Мешок снимают с рамы и сразу же завязывают. Дальней-
шую работу проводят так же, как и при пользовании дру-
гими сборами. Рассматриваемый биоценометр по устрой-
ству почти тождествен с биоценометром Догеля. Очевид-
но, эти авторы использовали его модель, но значительно
изменен прием взя-
тия пробы. По
В. А. Догелю, квад-
рат дерна с землей
подрывают, но не
проталкивают в ме-
шок, а наклоняют
над листом белой бу-
маги. Мешок с рамы
снимают и выбирают
летающих насеко-
мых. Срезанные рас-
тения и всех извле-
ченных насекомых
также помещают в
банки для последую-
щего анализа в ла-
боратории. Этот ме-
ло признанию самого
автора, равна 10—15% всего населения площадки.
Биоценометр американский (цилиндрический) пред-
ставляет собой цилиндр с закрытым верхом, диаметром в
25,2 см, покрывающий площадь в 0,1 м2, или цилиндр
диаметром -в 54,3 см, покрывающий 0,25 м2 земли. Ниж-
няя его часть состоит из железного кольца с заостренным
нижним краем. Прибор вгоняется в землю на глубину
7 см. В верхней части цилиндра есть маленькое отверстие,
через которое вводится летучий яд (хлороформ), ане-
стезирующий насекомых. Через некоторое время их соби-
рают и подсчитывают. Собирают также для анализа все
растения. Почву берут послойно, так же послойно анали-
зируют и учитывают пробы.
Пользоваться биоценометром рекомендуют в часы
наименьшей температуры во избежание утечки подвиж-
ных насекомых. Этим прибором пользовался в последнее
130
время Балог (1953) для изучения фауны почвы в
Венгрии.
Биоценометр Станчинского (ом. рис. 50). Прибор со-
стоит из железной рамы, сторона которой равна 50 см, с
заостренным нижним краем и отогнутыми под прямым
углом тремя верхними краями. На раму устанавливают
деревянный ящик высотой в 75 см со стенками из оцин-
кованной сетки. В одной из боковых стенок имеются два
отверстия — верхнее и нижнее, закрывающиеся выдвиж-
ными дверцами. В эти отверстия перед началом работы
вместо дверец вдвигают рамки с рукавами. Все пять ра-
мок ящика скрепляют между собой крючками. Ящик лег-
ко может быть разобран, что облегчает переноску. При
набрасывании биоценометра на него надевают' чехол из
черной материи, что, по принципу фотоэклектора, дает
возможность поймать всех насекомых, двигающихся на
свет., Затем сбрасывают чехол, просовывают руку через
отверстие с выдвижными рамками и выбирают в пробир-
ки менее подвижных животных. Выбрав всех двигающих-
ся насекомых, снимают ящик и продолжают поиски ос-
тавшихся мелких и малоподвижных беспозвоночных. За-
тем снимают и учитывают растения. При специальных
исследованиях берут и почву для отмывки корней или
выборки из почвы насекомых.
Биоценометр описанного типа очень громоздок и им
трудно пользоваться по принципу фотоэклектора. Однако
в руководимых В. В. Станчинским в Аскании-Нова рабо-
тах С. И. Медведев, а затем и автор этого пособия поль-
зовались этим биоценометром без упомянутой железной
рамы и без чехла. Насекомых выбирали руками, к дви-
жущимся насекомым подносили банку (морилку), в ко-
торую они и попадали.
Биоценометр с мешком (Конакова и Онисимовой)
(рис. 51). Основой его также служит квадратная рама,
сделанная из котельного железа. Длина каждой стороны
по внутреннему краю —50 см, высота —10 см. Нижний
край рамы остро отточен. Верхний отогнут наружу кан-
том шириной около 1 см, снаружи прикреплены ручки.
Площадь, покрытая такой рамой, равна 0,25 м2. Вторая
часть биоценометра — мешок высотой около 170 см (в
зависимости от роста исследователя), без дна, а в диа-
метре немного шире рамы. Нижняя половина мешка сши-
та из полотна или бязи, верхняя — из марли. Нижний
5*
131
Рис. 51. Биоценометр Конакова и
Онисимовой
край мешка, снабженный резинкой, надевают на верх-
нюю часть рамы, выше ручек, под кантом. Затем мешок
перевязывают шнуром посередине, где полотно сшито с
марлей. В таком виде биоценометр набрасывают на пло-
щадку. Исследователь просовывает на верхнюю часть
мешка голову и руки, резина затягивает его на уровне
груди или пояса, затем отвязывают шнурок, перехваты-
вающий мешок, и ис-
следователь оказы-
вается в биоцено-
метре.
Перед началом
работы берут с со-
бой в боковые кар-
маны или в специ-
альные сумки необ-
ходимый инстру-
мент: ножницы, кис-
точку, эксгаустер,
морилку, пробирки
пустые и со спиртом.
Здесь, внутри меш-
ка, насекомых и
других животных со-
бирают в банки, а
мусор н сухие растительные остатки складывают в ме-
шочки, которые затем переносят в лабораторию для ана-
лиза. По окончании работы осматривают одежду, на
которой могли остаться насекомые. На взятие одной
пробы затрачивают от 15 мин до 4 ч в зависимости от
биоценоза (обилия насекомых и характера травостоя).
Авторы биоценометра проверяли прибор в различных
условиях и рекомендуют его для массового исследования
биоценозов. Недостаток его — в том, что им очень труд-
но пользоваться в дождливую и сырую погоду.
Своеобразным биоценометром, служащим для коли-
чественного учета кровососов, является учетный колокол
системы Мончадского и Радзивиловской (рис. 52). Состо-
ит этот прибор из матерчатого колокола, натянутого на
проволочный или деревянный каркас. Общая высота чех-
ла 190 см, высота цилиндра 150 см, конуса 40 см, диа-
метр 150 см. Сверху и снизу, на расстоянии 10—15 см от
верхнего и нижнего краев нашиты две полосы бязи ши*
132
риной 6—8 см. В эти нашивки бязи вставляются два об-
руча из толстой проволоки (5—8 мм), которые поддер-
живают форму цилиндра и предотвращают опускание
стенок чехла. Кольца могут быть разборные. Нижнее
кольцо (обруч) делается из более толстой проволоки,
чтобы своей тяжестью обеспечивать быстрое опускание
колокола. В середи- д
не, к вершине кону-
сообразного купола,
прикреплен деревян-
ный круг диаметром
10—15 см. В середи-
ну его с наружной
стороны вделывают
металлическое коль-
цо, служащее для
прикрепления верев-
ки или стального
троса, на который
подвешивается при-
бор. Принцип дейст-
вия этого прибора
заключается в быст-
ром накрывании ко-
локолом собравших-
ся на приманку на-
секомых. Приманкой
служит человек или
животное. Модифи-
кацией этого колоко-
Рис. 52. Ловчий колокол Мончадско-
го и Радзивиловской (слева); ловчая
пробирка с коническим дном, вдаю-
щимся в середину (с отверстием)
(справа)
ла служит полог.
Эклекторы. Принцип действия эклекторов основан на
использовании фототаксиса, гигротаксиса или термотак-
сиса насекомых. Соответственно бывают фото-, гигро- и
термоэклекторы. Фотоэклектором пользуются для облег-
чения выборки насекомых из трухи, подстилки, из почвы
и т. п., а также для учета насекомых, выходящих из поч-
вы и т. д. В зависимости от целей й объектов исследова-
ний применяют фотоэклекторы различных систем, опи-
санных ниже.
Фотоэклектор Плигинского (рис. 53, В) служит для
выборки членистоногих из трухи, подстилки и т. д. Прин-
цип действия ясен из рисунка. Этот эклектор в простей-
133
шем виде применяется как составная часть многих при-
боров.
Применяются также фотоэклекторы ящичный (рис.
53, Д), металлический (рис. 53, Б).
Рис. 53. Фотоэклекторы. А — ящичный (по Рамбусеку);
Б — металлический (из Якобсона); В — фотоэклектор
Плигинского (из Кашкарова)
Фотоэклектор Пермской биостанции (по Баскиной и
Фридман, рис. 54) состоит из железного обруча в 3,5 см
Рис. 54. Полевой фото-
эклектор (по Баскиной
и Фридман):
L — банки с фиксатором, 2 —
железный ‘ каркас, 3'— обруч
с.отверстиями, 4 — ручка
шириной с заостренным нижним
краем. Диаметр кольца 35,7 см,
площадь, прикрываемая прибо-
ром, равна 1000 см2 (0,1 ж2). Под
углом в 45° к кольцу приделана
ручка для насаживания длиной
около 1,5 м деревянной палки.
Стенки обруча, приблизительно
на половине его ширины, имеют
отверстия для навязывания меш-
ка. Мешок конической формы
имеет проволочный каркас, кото-
рый придает ему устойчивое по-
ложение. Мешок сделан из двух
слоев материи (черной и крас-
ной), что лучше обеспечивает не-
проницаемость света внутрь ко-
нуса. В верхней части мешка сбо-
ку прорезано круглое отверстие,
в которое вшит из той же черной
,134
материи короткий рукав с оборочкой. К рукаву привязы-
вают широкогорлую банку (морилку), оборку откидыва-
ют назад, чтобы не закрывать морилку.
Этим прибором в солнечный день накрывают иссле-
дуемую площадку. Железный обруч вследствие своей тя-
жести плотно прилегает к земле, и ни одно насекомое
уже не может уйти. Держат прибор 5Д мин, так что все
Рис. 55. Полевые фотоэклекторы Пол-
тавской опытной станции
летающие формы успевают за это время влететь в мо-
рилку.
Фотоэклектор Полтавской сельскохозяйственной опыт-
ной станции (рис. 55). Этот прибор представляет собой
легкий ящик без дна, с железной рамой внизу, который
врезается немного в землю. Фотоэклектор закрывает и
затемняет исследуемую площадь. На одной стороне в
этот ящик вставлена банка—морилка, в которую на
свет вылезают насекомые, обладающие положительным
фототропизмом.
Полевой количественный фотоэклектор этой же стан-
ции представляет собой фанерный ящик без дна, снаб-
женный на нижних краях полосками из толстого кро-
вельного железа шириной в 5 см. Сверху прибор накрыт
двускатной крышей с выдающимися несколько вперед
козырьками. Передняя часть фотоэклектора, под козырь-
ком,. в верхней части имеет выступ, выдающийся вперед,
затянутый полотном. На вершине выступа к остову при-
креплена небольшая дощечка с прорезанными в ней
круглыми отверстиями, куда вставляется банка или боль-
шая пробирка. Высота фотоэклектора может быть раз-
личной в зависимости от высоты травостоя, не превышая,
однако, 50 см. Площадь, прикрываемая прибором, варь-
ирует от 0,25 до 4 м2, чаще всего она бывает 1 м2. Для
предохранения фанеры от нагревания, что может отра-
135
зиться на продвижении насекомых к свету, крышу затя-
гивают двойным слоем материи, сверху белой, а снизу
темной. Если прибором быстро накрыть площадку (ост-
рые края при этом врезываются в землю), то насекомые
в темном ящике устремляются к передней полотняной
стенке и через круглое отверстие попадают в банку.
Этим прибором пользуются для вылавливания хлеб-
ных мух, земляных блошек, тлей, трипсов и др. Оставляя
Рис. 56. Термоэклек-
тор в разрезе (из
Рихтера)
Рис. 57. Керосиновый
термоэклектор (по Вы-
соцкой)
прибор длительное время на одном месте, можно наблю-
дать выход насекомых из почвы. Можно установить даты
начала и конца вылета многих насекомых. Прибор удо-
бен при стационарных исследованиях, проводимых в те-
чение длительного времени.
Термоэклекторы (аппарат Берлеза, аппарат Тулгре-
на и др.) бывают разного типа (рис. 56). Широкое при-
менение нашли электрические термоэклекторы для учета
насекомых лесной подстилки, для выборки животных из
почвы (см. стр. 178), для изучения фауны нор и гнезд
(стр. 327), для определения зараженности клещами зер-
на, муки и других продуктов. Различают термоэклекторы
одинарные, трехгнездные и многогнездныё, но принцип
действия у всех один, он заключается в совместном воз-
действии температуры и света на обитателей исследуемо-
136
го субстрата. Тепловой и световой таксис заставляют
членистоногих переходить из хорошо освещенных и на-
гретых слоев субстрата вниз, откуда они через сетку эк-
лектора скатываются по наклонной поверхности воронки
в сосуд с фиксатором, которым может быть 70° спирт.
Рис. 58. Многокамерный термоэклектор (по
Гилярову)
Нередко используют воду. Часто применяют комбиниро-
ванный прибор термогигрофотоэклектор (см. рис. 81).
Керосиновый термоэклектор (рис. 57) применяется в
экспедиционных условиях, где нет электрической сети.
Известно описание многих типов (Старк, Чернышов,
Гинзбург и др.). В улучшенной конструкции, предложен-
ной Высоцкой, обогревающая часть камеры полностью
отделена от резервуара, где помещается исследуемый ма-
териал. Тепло поступает в резервуар от источника по
трубе сверху. В качестве нагревателя применяется керо-
газ. Бывают одно-, двух-, трех- и четырехкамерные эклек-
137
торы этого типа, которые обогреваются одним керогазом
(рис. 58).
Имеется еще термоэклектор Иоффа, где источником
тепла служит горячая
вода. Этот прибор представляет
собой небольшой металлический
шкаф с железными полочками и с
полой задней стенкой, в которую
наливают горячую воду. Дно име-
ет воронкообразное отверстие, к
которому прикрепляют банку с
Фиксирующей жидкостью (рис.
116).
Фонари и другие источники
света. Для лова ночных насеко-
мых, осмотра ночью стволов, при-
манок используют различные ис-
точники света. Пользуются с этой
целью электрическими фонарями
с батареей или работающих от
осветительной сети, керосиновы-
ми лампами или фонарями типа
«летучая мышь» или ацетилено-
выми (карбидными) лампами
(рис. 59).
При пользовании источником
света для привлечения ночных на-
секомых ф.онарь ставят на возвы-
шенное место, а под него рассти-
лают белое полотно, часть кото-
Рис 59 Фона и рого УкРепляют вертикально на
ис. □ . онари стенку или дерево. Можно фона-
ри повесить на белую стенку.
Прилетающих на свет насекомых ловят пинцетом и пере-
носят в морилку. Если пинцетом не успевают собирать
всех прилетающих насекомых, их накрывают стаканчи-
ками, а затем собирают в морилку. Прилетающих к
фонарю насекомых можно собрать также сачком.
При пользовании фонарями для осмотра ночью при-
манок, ловчих деревьев следует пользоваться не сильны-
ми источниками света; удобны для этого карманные эле-
ктрические фонари.
Светоловушки. Для сбора жуков, бабочек, перепонча-
токрылых, привлекаемых светом, используют специаль-
138
ные приборы — светоловушки. Источником света в таких
приборах служит лампа в 500 пли 1000 вт, подключенная
к местной электрической сети. В полевых условиях поль-
зуются походной электростанцией типа КИНАП или ак-
кумуляторами автомашины. Источником света для ло-
Рис. 60. Светоловушка Саха-
рова
Рис. 61. Коническая
светоловушка с увио-
левыми стеклами (по
Мазохину-Поршня-
кову)
вушек могут быть и лампы ПРК (см. ниже). Светоло-
вушки бывают различных конструкций.
Светоловушка Н. Л. Сахарова (рис. 60). Простейший
прибор, состоит из электрической лампы в 500—2000 вт
и металлического абажура-рефлектора, под которым
подвешивается на трех проволоках конусообразная цин-
ковая воронка, обращенная узким концом вниз, раструб
воронки частично охватывает нижнюю часть лампы (диа-
метр раструба 72 см). К узкому концу воронки (диаметр
6—10 см) при помощи полотняного или резинового со-
единения подвешивается обыкновенная широкогорлая
стеклянная банка, наполненная до половины 90—95°
139
спиртом. Кроме спирта, в качестве яда используют также
цианистый калий, цианистый натрий, керосин, денатурат
или бензин.
Насекомые, привлеченные светом, с силой ударяются
о стенки абажура или стекло лампы, скатываются в во-
ронку и через узкий ее конец попадают в банку с ядом.
Весь прибор подвешен тросом при помощи блока к теле-
графному столбу или дереву, что дает возможность под-
нимать его на любую высоту. Для того чтобы фонарь не
раскачивался ветром, его удерживают на двух парал-
лельных проволоках (тросах) или укрепляют проволо-
кой, идущей от низа конуса, пользуясь блоком. Ловушка
может служить и для определения вертикального рас-
пределения насекомых в ночное время, при этом уста-
навливают ее на разные исследуемые высоты. Ловушки
ставят на всю ночь, материал из них выбирают каждое
утро и разбирают, как обычно. На следующую ночь ло-
вушку заправляют и ставят вновь, так повторяют в тече-
ние всего сезона исследования. Светоловушка — одно из
эффективных приспособлений для сбора насекомых.
Хороший эффект (по Мазохину-Поршнякову) дает
коническая светоловушка с увиолевыми стеклами
(рис. 61).
Лампы и светоловушки с ультрафиолетовыми лучами.
Там, где лов обычной лампой оказывается безрезультат-
ным, используют ультрафиолетовые лучи, которые, как
показывает опыт многих авторов, привлекают большое
количество насекомых. Источником ультрафиолетовых
лучей служат ртутные лампы ПРК. Их устанавливают
на открытом месте, вблизи стены дома или около специ-
ально натянутого экрана из полотна. Во время работы
глаза исследователя должны быть защищены специаль-
ными очками. Насекомые прилетают с расстояния 400—
500 м. Численность насекомых, собирающихся у источни-
ка ультрафиолетового излучения, зависит от многих ус-
ловий: от погоды, характера рельефа и т. п. Массовый
лет насекомых наблюдается только в тихие теплые и осо-
бенно пасмурные ночи.
Коническая светоловушка с использованием ультра-
фиолетовых лучей (рис. 62) —наиболее простой тип тако-
го аппарата. Вместо обычных электрических ламп нака-
ливания источником света служат ртутные лампы ПРК.
Такая ловушка описана Г. А. Мазохиным-Поршняковым
140
Рпс. 62. Коническая свето-
ловушка с использованием
ультрафиолетовых лучей
(1958, 1965). По свидетельству автора, она отличается
высокой эффективностью.
Ловушка всасывающего типа, состоит из металличес-
кого корпуса цилиндрической формы диаметром 30—
40 см, ртутной лампы в сетке или футляре и защитного
колпака (рис. 63).
Внутри корпуса имеется
небольшой мотор с трехло-
пастным винтом. Мощность
мотора 70—100 вт с 2000
оборотов. Защитный колпак
укрепляется на двух или
трех кронштейнах, на кото-
рых при помощи растяжек
крепится сетка с лампой. На
корпусе имеются петли для
укрепления ловушки во вре-
мя работы и электрическое
распределительное устройст-
во. Оно имеет клеммы для
независимого подключения к
сети лампы и мотора и вы-
ключатели к ним. Приемный
цилиндр можно сделать из
металлической сетки с ячей-
ками в 1 мм2 или иного раз-
мера или же сшить из мар-
ли мешок соответствующего
размера, который надевают
на корпус ловушки. В нем
будут скапливаться пойман-
ные насекомые. Ловушки всасывающего типа удобны для
учета численности мелких двукрылых и чешуекрылых,
хотя часть их повреждается лопастями воздушного вин-
та, особенно крупные формы бабочек. Кроме того, под-
бирая тот или иной размер ячеек приемной камеры, мож-
но собирать только крупные формы и оставлять-на сво-
боде мелкие.
Ловушка с электрическим убивающим устройством.
Здесь вместо улавливающего аппарата имеется специ-
альная металлическая решетка, связанная с источником
тока высокого напряжения (800 в). Подлетая к лампе и
натыкаясь на решетку, насекомые получают электричес-
141
кий удар и погибают. Можно ловить и крупные, и мелкие
формы насекомых, прилетающих на свет. Но ловушки
такого типа малопригодны по следующим причинам. Они
сложно устроены, относительно дорога стоимость их из-
Рис. 63. Светоловушка всасывающего типа
(по Мазохину-Поршнякову)
Д — общий вид; Б — схема устройства:
/ — защитный колпак, 2 — сетка, 3 — ртутная лампа.
4 — укрепление лампы, 5 — кронштейны, 6 — растяжки
для укрепления лампы, 7 — электромотор, 8 — трех-
лопастный винт, 9 — электрические распределитель-
ные устройства, 10 — цилиндрический корпус, // —
приемная камера из сетки, 12—петли, в которые
вставляются ножки
готовления, необходима специальная изоляция для пре-
дупреждения контакта ловушки с человеком и животны-
ми, при массовом прилете насекомых происходит засоре-
ние решетки.
Ловушки и приманки, основанные на хемотаксисе.
Насекомых можно привлекать на запах различных орга-
нических веществ как животного, так и растительного
происхождения, а также специфических веществ, выделя-
142
на
емых самими насекомыми. На этой особенности основа-
ны различные ловушки.
Корытца с бродящей патокой. Это — четырехугольные
ящики из оцинкованного железа от 6 до 10 см глубиной,
площадью 30X50 см. Корытца устанавливают горизон-
колышках, вбитых в землю, в
местах лета совок. В корытце
наливают бродящую патоку
(не бродящая патока
привлекает насекомых)
ким расчетом, чтобы до
тально на высоту 1 м
Рис. 64. Паточная са-
моловка. Установка
прибора для сбора
насекомых
плохо
с та-
верх-
Рис. 65. Ловчее дере-
во
него края корытца оставалось не меньше 2 см. Исполь-
зуются корытца для ловли бабочек. Однако бабочки, до-
бытые таким способом, не всегда пригодны для качест-
венного определения и могут служить только для коли-
чественного учета их. Для того чтобы с бабочек не сбива-
лись чешуйки, их следует быстро умертвить, для этого в
патоку нужно добавить никотина или анабазин-сульфата
(1 г препарата на одно корытце).
Используя способность насекомых прилетать на за-
пахи, сконструирована специальная ловушка. К обычной
светоловушке вместо источника света ставят щит, покры-
143
тый войл/ком, пропитанным патокой. По такому прин-
ципу построена ловушка В. Н. Щеголева (рис. 64). Насе-
комые, привлеченные запахом патоки, падают в конус
прибора, оттуда — в банку с фиксирующей жидкостью.
Рис. 66. Выкладка ловчих деревьев
Ловчие деревья и ветви используют для вылова лес-
ных вредителей и для определения их численности. Эти
своеобразные приманки рассчитаны на то, чтобы короеды
или усачи отложили в них яйца. Потомство после опре-
деления видового состава уничтожают (см. стр. 259). Лов-
чие деревья выкладывают или в виде поваленных целых
144
стволов (хлыстов), очищенных от ветвей (рис. 66), или
в виде стоячих, но частично окоренных стволов (рис. 65),
или в виде древесных вершин, вкопанных основанием в
почву (рис. 99).
Ловчие ямы (рис. 67) используют главным образом
для сбора жужелиц и других обитающих в траве насе-
Рис. 67. Типы ловчих ям. А — общий вид;
Б — схема
комых. Они представляют собой прямоугольные ямы
(60X50 см) глубиной 30—35 см, на дно которых кла-
дут траву, камни и т. п. Для привлечения жужелиц
используют как приманку слегка раздавленных ули-
ток. Устраивают ловчие ямы и кучи для привлечения
короедов.
Модификации ловчих ям — ловушки Барбера-Гейле-
ра служат для вылавливания насекомых и других беспоз-
воночных, ползающих по поверхности почвы. Стакан
емкостью от 500 до 1000 мл с отогнутыми под прямым уг-
лом краями вкапывают в землю так, чтобы кромка ста-
кана была на уровне поверхности почвы. В стакан нали-
вают один из фиксаторов — этиленгликоль, метиленгли-
коль или же 4%-ный формалин. В почве стакан может
находиться от ранней весны до поздней осени; осматри-
вают и опорожняют его один раз в неделю, а при необ-
ходимости (массовая инвазия и т. п.) и чаще. Ловушки
145
размещают в зависимости от задач исследования, но так,
чтобы максимально охватить обследуемый участок. Су-
ществуют ловушки и других типов (рис. 67, 68).
Лужи смерти — небольшие водоемы с залитой
нефтью поверхностью, применяют для сбора слепней
(см. стр. 361).
Рис. 68. Полиэтиленовые ловушки. А — привя-
занная к палочке; Б — с марлевым верхом на
каркасе
Волокуши служат для сбора клещей. Это простое при-
способление состоит из полоски материи, прикрепленной
к палке, и служит для сбора клещей. Их волокут по тра-
ве, при этом клещи присасываются к материи.
Модификацией их являются флажки, экран и пропаш-
ник (стр. 343).
146
Липучки (липкие ленты, листы, щиты) применяют для
лова мелких насекомых. Имеются липучки разного изго-
товления:
плоскость намазывается глицерином или жиром (при-
меняется для ловли галлиц);
листы восковой бумаги намазыва*ют с обеих сторон
касторовым маслом — ловят москитов и других двукры-
лых;
листы намазывают специальной смесью (2 части кас-
торового масла, 4 части размельченной канифоли); смесь
нагревают на огне, пока не растворится канифоль, и в
подогретом виде намазывают на лист бумаги. Можно из-
готовить клей и такого состава — 450 г смолы, 55 г льня-
ного масла и 55 г патоки.
Указанными липучками пользуются для ловли блох,
мелких двукрылых, клещей.
Ловчие пояса делаются из рогожи, соломы, бумаги и
используются для сбора насекомых, передвигающихся по
стволам деревьев.
Желтые ловчие чашки Мерике представляют собой
эмалированные чашки (миски) диаметром примерно
22 см с краями высотой 5 см. Для этой же цели можно
использовать соответствующих размеров фотографичес-
кие ванночки и другую подходящую посуду. Дно чашки и
стенки до половины высоты покрываются яркой желтой
краской. В чашку наливают воду или раствор инсектици-
да на уровень окраски. Привлеченные желтым цветом
тли, двукрылые, перепончатокрылые и другие насекомые
попадают в чашку, откуда по истечении определенного
промежутка времени осторожно извлекаются пинцетом
или мягкой кисточкой.
Для вылова тлей предлагается усовершенствованный
вариант метода «желтых чашек» (Эвене, Медлер, 1966).
Желтые квадратные кюветы (30X30X7,5 см) помещают
на коричневые пирамидообразные подставки высотой
в 60 см.
Ловля на самку. Опытами доказано, что запах самки
может привлекать самцов того же вида насекомых на
расстоянии до 4 км, у некоторых даже до 8 км. Это ре-
зультат действия половых аттрактантов, выделяемых
самкой и имеющих запах, который способны восприни-
мать только самцы того же вида. Таким путем пользу-
ются, например, для ловли самцов многих ночных бабо-
147
чек. Неоплодотворенную самку сажают в небольшой
марлевый садочек, который помещают в большой садок
с марлевыми или из проволочной сетки стенками, сделан-
ными в виде направленных внутрь верший с отверстиями
на середине. Самцы залетают в такой садок, но вы-
Рис. 69. Приспособления для сбора живых
насекомых. А—сетчатый садок; Б — дере-
вянные ящики (по Богданову-Катькову);
В—садок для сохранения комаров; Г —
банка с сетчатой крышкой
летать оттуда не могут. Таким же образом можно соби-
рать самцов хрущей и некоторых других насекомых. Пу-
тем экстрагирования ароматические вещества, привлека-
ющие самцов, могут быть выделены из тела самки и
использованы в качестве приманки.
Этот способ применяют при обследованиях, когда важ-
но установить наличие вида, начало лёта насекомого,
для выявления очагов вредителей.
148
Пользуются и другими приманками: иа приманочные
посевы нектароносов (мята, табак, подсолнечник, горчи-
ца, зонтичные) привлекаются в ночное время различные
бабочки (совки, огневки, пяденицы) и другие питающие-
ся нектаром насекомые. В ямах, в которые насыпан на-
Рис. 70. Морилки
воз, ловят медведок. В кучах зеленых растений или клуб-
ней, засыпанных землей, ловят некоторых чернотелок,
щелкунов, серого свекловичного долгоносика. Под зары-
тыми листьями свеклы, лопуха и т. п. ловят гусениц со-
вок. В ловчих' канавах собирают крупных долгоносиков,
чернотелок, пластинчатоусых и др.
Для сбора и временного хранения живых объек-
тов служат различные приспособления (рис. 69).
149
УМЕРЩВЛЕНИЕ, ФИКСИРОВАНИЕ, МОНТИРОВАНИЕ И
ХРАНЕНИЕ НАСЕКОМЫХ И ДРУГИХ БЕСПОЗВОНОЧНЫХ
Морилки. Насекомых, собранных одним из указанным
выше способов, переносят для умерщвления в банки или
морилки. Существуют разные способы замаривания на-
секомых. Можно пользоваться простейшим способом —
морить насекомых сухим паром. Для этого в небольшую
жестяную банку кладут насекомых, плотно закрывают
крышкой и опускают ее до половины в кипяток на 3—
5 мин. В результате все насекомые в банке погибнут. Не
рекомендуется при этом сажать вместе с другими и на-
секомых с сильными челюстями, они попортят остальных.
Но обычно пользуются морилками с анестезирующи-
ми веществами. Принцип их действия следующий. В лю-
бой сосуд кладут анестезирующее вещество, впускают
туда насекомых и закрывают корковой пробкой. Через
некоторое время насекомые погибают.
Посудой для морилки может служить любая широко-
горлая банка или широкая пробирка, закрываемая кор-
ковой пробкой, пропитанной парафином. Лучше, конеч-
но, иметь банку с ровными стенками типа цилиндричес-
кого стакана. Пробку привязывают к горловине банки,
чтобы при открывании пробку не приходилось держать
в руке. В банку бросают ленточки фильтровальной бу-
маги для поглощения влаги, выделяемой насекомыми.
Ленточки заготовляют заблаговременно и используют их
по мере надобности (см. рис. 70).
Анестезирующие вещества. Для умерщвления беспоз-
воночных применяют различные вещества: цианистый
калий, серный эфир, хлороформ, уксусный эфир, четы-
реххлористый углерод, дихлорэтан, пары спирта, бензи-
на, бензол, табачный дым. Вещество должно быстро уби-
вать насекомых: после умерщвления объекты должны
оставаться эластичными (неломкими). Ниже приведены
наиболее отвечающие этим требованиям анестезаторы.
Цианистый калий быстро действует, долго держится
в морилке. Заряжают им морилку так: на дно кладут не-
много этого вещества и заливают его гипсом; пары циа-
нистого калия проходят через поры затвердевшего гипса,
наполняют полость банки и действуют на помещенных
насекомых. Способ удобный и безупречный в смысле со-
хранности насекомых, но небезопасный. При пользова-
150
нии цианистым калием следует остерегаться большого
скопления паров в помещении, не нужно оставлять мо-
рилки открытыми. Диль (1958) предложил такой способ
изготовления морилки. На дно сосуда насыпают слой
опилок, внутрь его помещают кусочек цианистого калия,
сверху насыпают слой 3—4 мм гипса, утрамбовывают и
на гладкую поверхность его кладут шайбу из войлока
или фетра. Шайбу смачивают несколькими каплями воды
и сосуд хорошо просушивают. На долгоносиков и особен-
но чернотелок яд этот действует медленно.
Хлороформ действует хорошо. Безопасен. Смоченный
хлороформом комок ваты бросают в банку, куда потом
переносят для замаривания насекомых. Действует не бо-
лее часа, поэтому морилку с хлороформом необходимо
заряжать несколько раз в день. Чаще всего поступают
так. В банку с притертой пробкой укладывают на ее
высоты кусочки нарезанной резиновой трубки и налива-
ют хлороформ так, чтобы он покрыл резиновые кусочки,
а затем закрывают пробкой. На другой день часть про-
питанных хлороформом кусочков резины переносят в ши-
рокогорлую банку, прикрывают куском бумаги и морил-
ка готова.
Серный эфир действует быстро, но летуч и огнеопасен.
Для серного эфира морилки несколько видоизменяют: в
пробку продевают вниз отверстием короткую широкую
пробирку с расширенным дном или стеклянную колбоч-
ку, которая наполняется ватой, пропитанной ядом.
Уксусный эфир менее летуч, не огнеопасен, действует
медленнее двух предыдущих, но насекомые сохраняют
в нем гибкость длительное время. Лучше всего приме-
нять его в смеси с хлороформом (в равных количествах).
Такая смесь действует довольно быстро и не сушит насе-
комых.
Бензин используют как и серный эфир. Недостаток
его — насекомые» быстро затвердевают. Действует мед-
леннее предыдущих. Огнеопасен.
Дихлорэтан — бесцветная жидкость с запахом хлоро-
форма, используется, как и последний, но действует зна-
чительно хуже. Огнеопасен.
Бабочек обычно умерщвляют легким сдавливанием
грудки с помощью большого и указательного пальцев.
Фиксирующие и консервирующие жидкости. Спир7
употребляют для консервирования личинок и куколок.
151
Крепость спирта зависит от объекта, который фиксируют
(от 50 до 96°). Но спирт обесцвечивает неметаллические
краски, кроме того, он вызывает загрубевание сочлене-
ний, слипание и выпадение волосков и чешуек у обрабо-
танных им насекомых. Для приготовления спирта нужной
крепости пользуются упрощенным способом. Берут столь-
ко объемных единиц спирта, сколько градусов должно
быть в готовом спирте, и доливают дистиллированной во-
дой до объема, содержащего столько единиц, сколько
градусов в исходном спирте. Например, для приготовле-
ния 50° спирта из 95° — надо взять 50 см3 спирта и долить
водой так, чтобы общий объем получился 95 см3.
Формалин хуже спирта, насекомые сильно твердеют и
становятся хрупкими, ломкими, но сохраняют окраску.
Употребляют слабые растворы — продажный 40%-ный
формалин следует разбавить в 15—25 раз.
Для хранения отдельных групп членистоногих поль-
зуются специальными фиксаторами. Например, для гу-
боногих — это жидкость Кёнике или жидкость Фолкма-
новой. Описаны они в специальных разделах (стр. 203).
Для специального фиксирования энтомологического ма-
териала рекомендуют (Хань Юань-фа, 1966) и такую
фиксирующую смесь. Берется 1 часть фенола, 1 часть
уксусной кислоты и 8 частей дистиллированной воды.
Мелкие объекты (тли и др.) помещаются в эту смесь
живыми, крупные (гусеницы, личинки) предварительно
ошпариваются кипятком. Цвет, форма и мягкость объ-
ектов не меняются и спустя год после фиксации.
Предложен фиксатор (Мержеевская, 1965) для гусе-
ниц, позволяющий сохранить окраску тела в течение 5—
6 месяцев, а рисунок из темных тонов — в течение 5 лет
и более. Для приготовления фиксирующей жидкости бе-
рут 2 части салициловой кислоты и растворяют в 100 мл
96° спирта, 1 часть поваренной соли растворяют в 100 мл
дистиллированной воды; растворы смешивают и хранят
в темной посуде. Через сутки фиксатор готов к употреб-
лению.
РАЗВЕДЕНИЕ И ВОСПИТАНИЕ БЕСПОЗВОНОЧНЫХ
Для содержания и воспитания насекомых применяют
специальные, различной конструкции садки (рис. 71),
152
барьеры, модели и т. п. (рис. 72, 73). Методика обсуж-
дается в соответствующих разделах. Клещей и некоторых
насекомых можно содержать открыто, используя барьер
из политетрафторэтилена, который не токсичен для насе-
Рис. 71. Садки для разведения насекомых и других
беспозвоночных. А — воздушные; Б — стеклянный
для наблюдения почвенных насекомых; В — устрой-
ство для искусственного разведения насекомых, раз-
вивающихся па растениях
комых, обладает термопластическими свойствами и не
разрушается при действии света. Пленка из политетра-
фторэтилена обладает низким коэффициентом трения, а
при необходимости легко может быть смыта водой (Гол-
леман, Элтон, 1965).
153
Пауков можно содержать па изолированных водой
возвышенностях (стопках), как показано на рис. 110.
Улиток содержат в террариумах или в садках с мхом
Рис. 72. Садок для экспери-
ментальных работ по пря-
мокрылым
на дне, в качестве корма мож-
но использовать капусту, соч-
ную траву.
Червей содержат и разво-
дят в специальных ящиках (см.
стр. 197, 198.
Рис. 73. Садок . для содер-
жания хищных жужелиц
ХРАНЕНИЕ МАТЕРИАЛА
Для хранения сухих насекомых пользуются ватными
матрасиками (ватниками). Из белой гигроскопической
ваты готовят слои по размеру коробки (обычно 22 X
Х13 см), кладут их в бумажные пакетики, края которых
отворачивают на верх слоя и прикрывают вату сверху
(рис. 74). На вату сверху насекомых помещают вкла-
дыш — лист бумаги, вырезанный по размеру ватника. На
таких ватниках, уложенных в коробки, и хранится со-
бранный материал.
Умерщвленных насекомых, собранных разными спосо-
бами для различных целей, перекладывают пинцетом
непосредственно на слой ваты, материал количественных
сборов, взятых кошением, высыпают на лист бумаги или
на стекло, под которое подложена наполовину черная и
белая бумага. Пинцетом или птичьим пером отделяют
насекомых от мусора, распределяют их по группам, затем
переносят на ватник. Укладывают насекомых ножками
вниз, одинаковых насекомых кладут рядом, крупных от-
154
деляют от мелких. Собранных в разных местах или в
разное время насекомых также раскладывают отдельно.
Ниткой или проведенной пером чернильной линией на
Рис. 74. Хранение насекомых. А — укладка
насекомых на ватный матрасик в бумажной
обвертке и образец этикетки; Б — бумаж-
ные пакетики для хранения бабочек
вате разграничивают один слой от другого или же одну
группу от другой. На листе бумаги (вкладыше) повторя-
ют все сделанные на ватнике границы. На верхней сто-
роне левого клапана пишут номер, фамилию сборщика
и другие сведения. Эти же данные записывают и на
вкладыше. В каждую клетку его заносят необходимые
сведения об их сборах.
155
Ватные сборы хранят в деревянных или картонных
коробках, на дно которых насыпан нафталин. Следует
отдавать предпочтение деревянным, так как они прочны
(что важно при полевых работах), долговечны и удобны
для транспортировки. Картонные коробки менее прак-
тичны. Металлические или пластмассовые ящики не го-
дятся для хранения ватного материала.
Рис. 75. Влажные камеры для размачивания
насекомых
Умерщвленных бабочек можно помещать в треуголь-
ные пакетики и^ плотной бумаги, на внутренней стороне
загнутого края записываются нужные сведения (рис. 74).
Пакетики хранятся также в специальных ящиках.
Хранение нематод, моллюсков, пауков, клещей, личи-
нок насекомых имеет свои особенности и описано в спе-
циальных разделах.
Подготовка насекомых к монтированию. Для размяг-
чения сухих насекомых пользуются камерами (рис. 75),
их легко приготовить в любом месте. Для этого берут глу-
бокую тарелку или кювету, насыпают на дно промытый
и прокаленный речной песок, затем увлажняют его про-
156
кипяченной водой до насыщения. На песок кладут бу-
мажную подстилку, а на нее помещают насекомых (мож-
но вместе со слоем ваты).
Для размягчения перед расправлением высушенных
бабочек, стрекоз и других насекомых рекомендуют (Jur-
Рис. 76. Расправление и наколка насекомых
zitza, 1961) применять 70° спирт. Для этого смоченный
спиртом ватный тампон кладут на 2—3 мин на грудь
насекомого. Размягчение тела, например, стрекоз Zygop-
tera гарантирует сохранение их собственной окраски.
Насекомых, предназначенных для коллекций, расправ-
ляют и накалывают (рис. 76, 77).
Этикетировка. Весь собранный разными методами
фактический материал, включая фотографии, зарисовки
и всякие наблюдения, приобретает подлинную научную
157
ценность, как уже отмечено, только при условии точной
его паспортизации. Это значит, что каждый объект дол-
жен иметь свою этикетку. Вот почему этикетировка явля-
ется важным элементом полевого исследования.
Рис. 77. Способ наколки насекомых (места
прикола указаны точкой)
В зависимости от уровня изучения, аспекта исследо-
вания, характера изучаемого объекта и техники сбора
способы этикетировки могут различаться, но общим оста-
ется принцип; этикетка должна содержать все данные,
необходимые для последующей полной и точной харак-
теристики материала и условий.
158
Если для характеристики мест наблюдений таким пас-
портом является описание участка, а для характеристики
наблюдаемых явлений — запись, то для фактического и
коллекционного материала — сборы насекомых и других
беспозвоночных, образцы жизнедеятельности животных
(повреждения, экскременты и т. п.), гербарные образцы,
а также фотоснимки и зарисовки, необходима правильно
оформленная этикетка. Без этикетки нет научного мате-
риала.
Этикетировка зоологических объектов должна быть
полной. Особенно это важно в наше время, когда накоп-
ленный материал может быть использован при различ-
ных уровнях изучения жизненных явлений разными спе-
циалистами. Совершенно недопустимо пользоваться шиф-
рованными этикетками, что иногда еще имеет место.
Традиционные фаунистические сборы обычно снабжа-
лись краткой этикеткой с указанием пункта, даты сбора
и фамилии сборщика. Такая этикетка в известной мере
удовлетворяла фаунистов, систематиков на первоначаль-
ном этапе инвентаризации животных. На современном же
этапе развития науки, когда биологические явления изу-
чаются на различных уровнях (популяционном и биоцено-
тическом и т. п.), такая этикетка не дает нужной инфор-
мации. Требуется совершенствование — количество сведе-
ний должно быть увеличено. Изучаемый объект следует
снабдить двумя этикетками (а иногда и тремя): обычной
(традиционной) и подробной (экологической), где дают-
ся нужные сведения об условиях среды, кормовом расте-
нии или хозяине паразита, деятельности и т. д.
Этикеткой для энтомологических сборов, хранящихся
на ватных слоях, служит вкладыш—лист бумаги, кото-
рый помещают сверху насекомых. В такую этикетку, по-
мимо данных о месте и дате сбора, заносятся подробно
все экологические сведения, что важно и крайне необ-
ходимо делать при биоценологических исследованиях.
Насекомые, монтируемые на булавки, снабжаются, как
уже было сказано, двумя этикетками. Этикетку пишут
тушью на специальных прямоугольниках (18x8 жж) из
плотной бумаги.
Материал, хранящийся в консервирующей жидкости,
снабжается этикеткой, написанной графитным каранда-
шом на обычной бумаге или тушью на кальке (перга-
ментной бумаге), причем на этикетке указывается и
159
способ фиксирования, а при необходимости и первона-
чальная окраска фиксируемого объекта. Этикетки, напи-
санные тушью, рекомендуется перед опусканием в спирт
подогреть над пламенем, а еще лучше смазать раст-
вором целлоидина в ацетоне.
Микроскопические препараты снабжаются также дву-
мя этикетками, написанными тушью и прикрепленными
справа и слева покровного стекла. Специальные требо-
вания к этикетировке отдельных сборов оговариваются
в соответствующих разделах данного руководства.
ОБРАБОТКА МАТЕРИАЛА (ОСНОВНЫЕ ТЕРМИНЫ, ПОНЯТИЯ
И ИХ ОПРЕДЕЛЕНИЕ)
Обработка материала преследует различные цели в
зависимости от уровня и задач исследования. Обычно она
сводится к научному описанию, определению, выяснению
закономерностей, получению сравнимых величин и обоб-
щению их. В ряде случаев материал подвергается мате-
матической обработке.
На современном этапе развития биологических наук,
когда объем фактического материала увеличивается
чрезвычайно быстро, особенно важно, чтобы каждый но-
вый научный термин или специальное понятие имели со-
вершенно точную формулировку, четкое смысловое со-
держание и свои показатели или правила применения.
В экологии и биоценологии мы встречаемся с поня-
тиями и показателями, характеризующими сущность яв-
лений (колебания численности, количественные показа-
тели в биоценозах и т. п.). Фаунистика и зоогеография
оперируют понятиями, отражающими количественное со-
отношение и распределение фаунистических элементов,
общность последних и т. п.
Качественная определенность употребляемых катего-
рий до сих пор остается запутанной; существуют все еще
разногласия в представлениях отдельных авторов. Науч-
ная литература изобилует терминологией и специальной
фразеологией, которыми подчас трудно пользоваться. Не-
редко одно и то же явление или смысл отдельного поня-
тия определяется множеством терминов. А в ряде случаев
отдельные термины употребляются в разных значениях,
что обесценивает его качественную определенность и
160
усложняет понимание существа исследуемых явлений и
закономерностей. Необходимо, как об этом не раз ука-
зывалось в литературе (В. Н. Беклемишев), добиться
унификации и упорядочения. Особенно важно и актуаль-
но это в методических руководствах.
Ниже приводим (по многим авторам) основные кате-
гории и трактовки, используемые авторам предлагаемого
пособия в учебной и научной работе. Дается рекоменду-
емый термин, в скобках указаны синонимы.
Количество, Употребляется в широком смысле для
характеристики показателей при количественном учете.
Оно может означать и количество особей, и биомассу, и
степень доминирования. В более конкретном виде как
термин не употребляется, вместо этого пользуются поня-
тием численность.
Численность (общее число особей). Общее число осо-
бей составляющих популяцию или вообще какую-либо
единицу населения. Понятие употребляется для общей
количественной характеристики, например численность
кладок кольчатого шелкопряда на яблоне, численность
микропопуляции блохи (Neopsylla setosa) в данной норе
суслика. Общее число особей меняется по сезонам в за-
висимости от количества генераций и от фазы развития.
Изменение численности на протяжении сезона — это се-
зонный (годовой) ход или колебание численности. Часто
для отражения изменений говорят динамика численнос-
ти, но это понятие не отражает существа явления и от
употребления его в этом смысле, видимо, следует отка-
заться.
Плотность (массовость, обилие, густота населения, за-
раженность— в паразитологии)—среднее число особей
данного вида в пересчете на единицу учета. Единицей
учета может быть площадь, объем или вес какого-либо
субстрата, или же организм хозяина (для паразита). Про-
ба или учет может относиться к единице времени (чело-
веко-флаго-ч*ас, ловушко-сутки), когда учитывают флаж-
ком клещей или пользуются ловушками, к единице при-
мененных операций (взмахи сачком) и т. д.
При учете на единице площади, объема или веса по-
лучаем абсолютные величины; во всех других учетах,
единицами которых служат время или число проведен-
ных операций, получаем относительные величины. Опре-
деляется плотность средним количеством, которое при-
6—1867
161
ходится на единицу измерения (учета). При определении
плотности обязательно принимаются во внимание и те
пробы, в которых не оказалось ни одной особи данного
вида
V = —,
п
где V — плотность;
k — сумма всех особей вида во всех пробах;
п — количество взятых проб; по этой формуле
вычисляют и на единицу веса.
Плотность является одним из основных показателей
по учету компонентов биоценоза. На основании этих дан-
ных (плотности) вычисляются многие другие показате-
ли. Абсолютная плотность — общее количество особей
определенного вида на 1 ж2 почвы, на одно растение или
животное.
Встречаемость (частота, индекс встречаемости, коэф-
фициент попадания, для паразитов пораженность, про-
цент заклещевения, экстенсивность инвазии) — показа-
тель относительного числа проб, в которых представлен
данный вид, к общему числу исследованных проб, выра-
женный в процентах:
п-100
где п — пробы, в которых обнаружен вид;
'N — общее число взятых проб.
Число особей при определении встречаемости в расчет
не принимается. Для эктопаразитов определяют процент
зараженности (пораженности) —процент хозяев, на ко-
торых найден паразит.
При сравнении встречаемости вида в пробах, взятых
в различных биоценозах, а не в одном и том же био-
топе, пользуются понятием «постоянство».
Доминирование (преобладание, относительное оби-
лие) — определяется отношением (в процентах) числа
особей данного вида к общему числу особей всех видов.
Доминирование имеет биологическое значение в приме-
нении к растениям, к паразитам, почвенным животным,
вредителям. Доминирование — вспомогательная величи-
на, служащая для сравнения численного соотношения
близких видов, но не заменяет понятия встречаемость и
162
плотность. Иначе: доминирование — доля, которую со-
ставляет плотность данного вида по отношению к сум-
марной плотности всех сравниваемых между собой видов
в населении изучаемого биотопа. Сумма показателей до-
минирования всех сравниваемых видов равна 100%'. Фор-
мула 4
Ы00
где К — сумма особей всех видов во всех пробах;
k — сумма особей данного вида.
Общность (индекс общности, сходство) видового со-
става — показатель, определяющий сходство видового
состава между двумя комплексами населения, например,
между микропопуляциями двух гнезд или между населе-
нием двух лесосек, или же между эктопаразитами двух
видов грызунов. Различают общность фауны и населе-
ния/Общность, или сходство по встречаемости, — отно-
шение числа общих видов двух сравниваемых единиц
среды к суммарному числу видов, учтенных в этих еди-
ницах, выраженное в процентах:
0_ а‘100
— А
где а — общие виды;
А —суммарное число видов двух сравниваемых еди-
ниц;
О — общность.
Верность — показатель того, насколько прочно вид
связан с данной ассоциацией, с данным биотопом или
биоценотической группировкой. Верность служит не
только показателем регулярного присутствия вида в дан-
ной ассоциации, но и отсутствия его в других ассоциаци-
ях. Верность — степень приуроченности вида или популя-
ции к исследуемым единицам среды. Показатель верно-
сти (по встречаемости)—доля, которую составляет
встречаемость данного вида по отношению к сумме его
индексов встречаемости во всех типах сравниваемых еди-
ниц. Может быть верность также по плотности
6*
163
где В — верность;
р—встречаемость данного вида;
Р — сумма индексов встречаемости.
Верность может быть рассмотрена так же как сте-
пень участия различных единиц среды в размещении дан-
ного вида, выраженная в процентах. Сумма индексов
верности для какого-либо вида в отношении совокупности
всех сравниваемых единиц среды равна 100%.
Коэффициент размножения — отношение абсолютной
плотности популяции вредителя на исследуемой террито-
рии в текущем году к абсолютной плотности популяций
в предыдущем году. Если этот коэффициент равен еди-
нице, то численность популяции в текущем году остается
на уровне прошлого года. При значении коэффициента
больше или меньше единицы численность популяции со-
ответственно возрастает или уменьшается по сравнению
с предыдущим годом.
Специфичность. В паразитологии — степень преодоле-
ния паразитом защитных свойств организма хозяина; у
растений — образование специализированных форм; у
насекомых — образование приуроченных к данному виду
растения или хозяина форм. Часто специфичность реали-
зуется в форме встречаемости (Быховский).
Преферентные виды — виды с широким экологическим
потенциалом. Они (например, насекомые полифаги) мо-
гут встречаться иа многих видах растений, но предпоч-
тение отдают одному или нескольким видам.
Значение (важность) вида — степень влияния изуча-
емого вида на биоценоз. Иначе — степень необходимости
для заполнения экологической ниши, или же степень
значимости для хозяйства.
Роль — функция организма в биоценозе (фитофаг,
зоофаг и т. д.)‘. Роль определяет жизненную форму, ме-
сто, занимаемое видом среди компонентов биоценоза.
ИЗУЧЕНИЕ ПОЧВЕННОЙ ФАУНЫ
ОБЩИЕ ЗАМЕЧАНИЯ
Понятие почвы неотделимо от живущих в ней живых
организмов. В почве обитает постоянно или временно
множество видов животных. Количество особей различ-
ных видов на 1 м2 сильно колеблется. Более крупные бес-
позвоночные (черви, многоножки, жуки и их личинки
и др.) исчисляются десятками и сотнями; мелкие члени-
стоногие (клещи, ногохвостки)—тысячами и сотнями
тысяч; нематод содержится до миллиона на 1 м2, а про-
стейших насчитывают тысячи в 1 г почвы. С почвой, как
указывают энтомологи (ср. Крышталь, 1955), в той или
иной мере связано до 90% всех известных насекомых.
Характер, количество видов и число особей каждого вида
обитающих в почве беспозвоночных находится в тесной
связи как с географическим положением, так и с почвен-
ными условиями данной местности.
Почва в свою очередь находится под влиянием живых
организмов. Многими учеными установлена ведущая роль
организмов, в том числе и животных, живущих в почве,
в ее формировании. Комплекс растительных и животных
организмов оказывает огромное влияние на различные
процессы почвообразования — накопление гумуса и его
изменения, увеличение плодородия и т. п. В буково-дубо-
вом лесу, как указывает М. Ткаченко (1939), все почвен-
ные беспозвоночные перерабатывают около 2/з сухого ве-
щества — продуктов годового опада. Процессы выветри-
вания происходят при непременном участии организмов.
Подробно же эти вопросы освещены в научной литера-
туре (Гиляров, 1949; Зражевский, 1957).
Распределены животные вфочве далеко не равномер-
165
но. Каждая, даже незначительная, группа имеет свои
биологические особенности, свои формы реакции на внеш-
ние факторы, а следовательно, и свой характер распрост-
ранения. Этим объясняется то, что в разных местах
состав фауны неоднороден. Но несмотря на такую при-
уроченность животных к определенным условиям, сущест-
вует некоторая центральная группа почвенной фауны,
встречающаяся почти повсюду; во всех пунктах и во
всех почвах. Например, различные виды круглых и коль-
чатых червей, членистоногие (отдельные их фазы) и про-
стейшие.
Жгутиковые (Flagellatd) являются самыми многочис-
ленными животными из почвенной протистофауны, за
ними следует Amoeba и в меньшем количестве встреча-
ются Ciliata. В 1 кг почвы содержится до полутора мил-
лионов простейших (по В. Р. Вильямсу).
Известно (по Фридериксу) приблизительно 250 видов
простейших в почве, хотя некоторые из них не являются
постоянными почвенными обитателями. Специфических
почвенных форм простейших, таких, которые не встреча-
лись бы в пресных водах, не наблюдается (кроме
Amoeba terricola).
Количество простейших в почве не остается хотя бы
приблизительно постоянным, оно изменяется непрерывно
изо дня в день. Это зависит от различных причин: от ко-
личества органических веществ в почве, т. е. энергетиче-
ского материала, при изменении которого изменяется
как общее число особей, так и видовой состав простей-
ших; от времени года — весной и осенью численность
форм бывает высокая, летом и зимой — низкая; от аэра-
ции, сильно влияющей на количество протистофауны
почвы.
Разнообразна и деятельность протистофауны почвы.
Активные формы Protozoa в почве вредны для бактерий,
они уменьшают количество последних, питаясь ими.
Только немногие из почвенных организмов ограниче-
ны одним типом деятельности, большинство же из них
(по Рэсселю) способно изменить свою деятельность с пе-
ременой условий. Это можно установить лишь при изуче-
нии самих почв. Существуют разные точки зрения и на
роль протистофауны в почве. Есть указания, например,
что амебы понижают плодородие почв (Вильямс), хотя
это положение, как уже этом упоминалось, не многи-
166
ми современными авторами признается. Эти и подобные
вопросы также можно разрешить лишь специальными
исследованиями.
Рэссель и Хетчинсоп (1909) в результате изучения
почвы путем ее частичной стерилизации пришли к выво-
ду, что простейшие составляют нормальную часть поч-
венного населения, влияющего на рост растений. Заслу-
живают внимания в этом отношении также работы
А. А. Бродского и его сотрудников; некоторые интерес-
ные сведения приводит В. К. Эглитис (1954). По этим
данным в почве обитает большое число представителей
круглых и кольчатых червей; в Латвии их около 560 ви-
дов. Многочисленные членистоногие, особенно насеко-
мые, представлены значительным числом видов, образу-
ющим различные экологические группы.
В почве Латвии, по В. К- Эглитису, насчитывается дэ
9000 видов насекомых. Роль этих животных, как показа-
ли многие исследователи, огромна (ср. Гиляров и др.).
Все эти вопросы должны быть предметом изучения, а
взаимоотношения организма и условий его существова-
ния — руководящей идеей при изучении почвенной фа-
уны.
ТИПЫ ПОЧВЕННО-ЭКОЛОГИЧЕСКИХ ИССЛЕДОВАНИЙ
Единого метода учета всех групп, обитающих в поч-
ве беспозвоночных, нет и быть не может. Методика оп-
ределяется характером изучаемых объектов (их разме-
ром, численностью и т. п.), условиями почв (среды), вре-
менем суток и года и, как уже указывалось в общей
части, задачами исследования.
При общем обследовании учитывают в количествен-
ном и качественном отношении всех или по крайней мере
большинство обитателей данного участка независимо от
его величины. Такой полный учет почвенной фауны ставит
задачу дать возможно более точное представление об
абсолютном количестве разных элементов, образующих
животный мир в данной местности (Догель). Исследова-
ния этого типа проводят при исследованиях какой-ни-
будь небольшой территории или участка с неизвестной
фауной, при изучении биоценозов и при других подобных
работах. Вообще такие комплексные исследования не-
многочислены, хотя представляют немалый научный и
167
производственный интерес. Общее исследование какого-
либо участка в широком понимании представляет боль-
шие трудности, так как приходится пользоваться разны-
ми методами, различным оборудованием, поэтому общее
обследование проводится только при специальных комп-
лексных работах.
Частное или специальное обследование — целевое об-
следование— ставит задачу выяснить наличие и количе-
ственную группировку какого-либо одного вида или ог-
раниченной группы видов животных. Типичным приме-
ром может служить обследование на зараженность
луговым мотыльком, кубышками саранчи, почвенными
нематодами и т. д. Частное обследование осуществляется
методами:
а) грубо ориентировочными;
б) детальными, когда выясняется плотность, обилие
и численность (применяемая для фаунистических и эко-
логических целей и оперативных рекогносцировок);
в) специальными, когда исследование имеет целью
выяснить пригодность участка земли для хозяйственного
использования; пользуются ими и для составления прог-
ноза появления отдельных вредителей; также и при
экспериментальных работах с почвенной фауной и т. д.
или для диагностики почв.
Практически, по характеру объектов различают изу-
чение отдельно микрофауны и мезофауны.
МЕТОДЫ ИЗУЧЕНИЯ МИКРОФАУНЫ
К почвенной микрофауне относятся простейшие (про-
тистофауна), нематоды, коловратки, тихоходки, клещи
и другие мелкие формы. Численность мелких форм все-
гда выше, чем более крупных, это определяет и специ-
фичность применяющейся методики.
Протистофауна. Для изучения протистофауны поль-
зуются различными методами.
1. Наиболее упрощенный способ следующий. Из про-
бы изучаемого участка берут комки земли, разбавляют
их дистиллированной или профильтрованной водой и
рассматривают под микроскопом. Можно использовать
микроаквариум: это дает лучшие результаты, но все же
метод не вполне удовлетворяет требованиям качественно-
го и количественного учета.
16Я
2. Метод непосредственного обнаружения простейших
в почве (Мартин и Левин, 1915). Растирают почву в рас-
творе пикриновой кислоты и затем собирают плавающие'
на поверхности организмы и исследуют их. Метод кро-
потливый и малоэффективный. Коффман, улучшивший
этот метод, рекомендует пробу почвы смешать с водой до
тестообразного состояния, тщательно взболтать и иссле-
довать отстоящуюся сверху жидкость. При изучении про-
тистофауны почв М. П. Божко (1937) в стерильных усло-
виях разводила 15 г почвы в 20 см2* дистиллированной
воды, в тот же день брала пипеткой вытяжку и просмат-
ривала под микроскопом. Результаты получались не
вполне удовлетворительные. Такую оценку дает этому
методу и В. К. Эглитис (1954). Метод не может служить
для количественного учета.
3. Метод воронки для качественного анализа почвен-
ных организмов (Догель с сотрудниками, 1923). Почвен-
ную..пробу, взятую с глубины 10—12 см, помещают в
большую воронку и сквозь нее фильтруют стерилизован-
ную воду. Фильтрат затем исследуют на протистофауну.
Следует иметь в виду, что в фильтрате остается незначи-
тельное число простейших. (Этот метод имеет ограничен-
ное применение, так как нельзя добиться точного качест-
венного анализа и количественного учета).
4. Метод культур (разведение), рекомендованный
Кэтлером, применяется наиболее часто. В модифициро-
ванном виде этот метод заключается в следующем: 1 г
почвы разводят в 9 г питательного сенного отвара). Из
этого разведения 1 г раствора (со взвесью) переносят в
новые 9 частей сенного отвара. Получится второе разве-
дение. Так можно получить третье, четвертое разведение
и т. д. Дают простейшим размножиться до получения до-
статочной плотности. Срок этот при 24—25° С может
быть от 6 до 25 дней. Затем под микроскопом устанавли-
вают количество простейших в 1 г исследуемой почвы
(путем определенного пересчета). Можно разведение
производить, перенося навеску в стерильную воду. По-
том по 1 см? взвеси каждого разведения помещают на
питательный агар в чашки Петри и оставляют при тем-
пературе 18—20° С. Культуры просматривают раз в не-
делю в течение месяца. Простейшие могут находиться в
инци'стировашюм состоянии. Для определения инцисти-
рованных форм другую навеску обрабатывают 2%-ной
169
соляной кислотой, которая убивает простейших и не дей-
ствует на цисты. Этот метод слишком громоздок,, мало-
доступен и поэтому не всегда удовлетворяет зоологов. В
то же время М. П. Божко пользовалась этим методом
для изучения протистофауны каштановых почв степи и
получила хорошие результаты.
5. Метод «почвенных капсулек» (Бродский, 1937).
Берут стеклянные капсюльки (пробирки) диаметром
0,7—0,8 см и длиной 3—3,5 см, наполняют их стерильным
сенным экстрактом и зарывают в землю на глубину 15слг
по 3—5 шт. в одно гнездо. Через 3—5 дней извлекают их
из земли и изучают. Проба из 3—5 капсулек обеспечи-
вает полную картину качественного состава и дает пред-
ставление о количественном распределении протистофа-
уны в почве. При частном изучении протистофауны
дифференцируют свойства жидкости, используемой в кап-
сульках. Метод «почвенных капсулек» позволяет выяс-
нить характер «гнездового» распределения простейших
в почве. При нем относительно мало затрачивается силы
и можно производить количественный учет протистофау-
ны сразу же по извлечении капсулек из почвы.
Количественный учет проводят прямым счетом при
помощи окулярной сетки (см. ниже), одна ячея которой
тщательно измеряется. Просчитывают число организмов
в 5 ячеях по двум диагоналям и выводят среднее из этих
десяти подсчетов. Для облегчения вычисления А. Л. Брод-
ский рекомендует пользоваться таким покровным стек-
лом, в котором площадь одной ячеи содержится число
раз, выражаемое единицей с нулями. Так, например, в
приводимых подсчетах стекло имело 22 лиг2, что в 1000 раз
превышало площадь одной ячеи окулярной сетки, равной
0,022 мм2.
На предметное стекло помещают определенный объ-
ем жидкости с подлежащими подсчету организмами, на-
пример 0,01 см\ т. ё. 0,01 а. Жидкость берут мерной
пипеткой или, для большего удобства, специальной пипет-
кой с пометками, позволяющими набирать 0,01 см3. Про-
стейшие, содержащиеся в этом объеме жидкости, умерщ-
вляются парами осмиевой кислоты, чтобы устранить их
подвижность. Исходя из площади ячеек окулярной сетки,
площади покровного стекла, объема испытуемой культу-
ры, Бродский предложил эмпирическую формулу
У = (X X 22 X ЮО) : (10 X 0,022)
170
или
Y = 10 000Х,
где У— общее число организмов, заключенных в испы-
тываемом объеме жидкости;
X — число организмов, обнаруженных в 10 полях
окулярной сеточки. 4
При большой численности животных, а также для со-
хранения изучаемых организмов живыми и подвижными
А. Л. Бродский предложил проводить количественный
учет способом «линднеровских запятых». Этот способ
подсчета доступен каждому и заключается в следую-
щем. Покровное стекло смазывают с одной стороны тон-
ким слоем вазелина, излишки которого удаляют при по-
мощи папиросной бумаги, затем стекло проводят над
пламенем, чтобы сохранить только тонкий слой жира.
Погружая стерильное чертежное перышко в испыту-
емую жидкость, наносят на покрытую жиром поверх-
ность покровного стекла от 10 до 20 «запятых». Покров-
ное стекло опрокидывают покрытой «запятыми» поверх-
ностью вниз над микроаквариумом или на два
капилляра или обрезка обыкновенного покровного
стекла. Исходя из того что 150 «запятых» равны 0,01 см3,
составляется эмпирическая формула.
У=1^001Т е у= 1500.
10
где У— число организмов в 10 «запятых». Автор, пред-
ложивший этот метод, дает ему высокую оценку.
Результаты учета микрофауны любым из методов за-
носят в дневник или на карточку по определенной форме.
Учет почвенной микрофауны
Название местности-------------------Хозяйство -------------------•
Угодье (биотоп). ------------------Характер почвы —---------------
Структура почвы ------------------Влажность почвы-----------------
pH почвы----------Способ взятия почвенного образа ----------------
№ Название организма Количество № Название организма Количество
I II III I 1 II 1 III
1 1 1 1
171
Нематоды и коловратки. Для изучения почвенных не-
матод и коловраток В. К. Эглитис (1954) пользовался
однограммовыми пробами. В такой пробе почти всегда
имеется достаточное для учета количество нематод. На-
званный автор находил в среднем 12,5 нематоды в 1 г
почвы, в абсолютных цифрах — от 0 до 207 штук. Эффек-
тивность указанного метода зависит от многих причин,
главная из них — плотность населения. Установлено, что
однограммовый метод дает хорошие результаты только
при исследовании почв с богатой фауной. В почвах же
бедных, например в сыпучих песках, без высшей расти-
тельности, где нематод мало, такой объем пробы не мо-
жет считаться достаточным. В таких случаях пробу ре-
комендуется увеличить до 50—100 г. Увеличенной пробой
следует пользоваться в тех случаях, когда нужно выявить
более редкие виды, а также при изучении цист.
Вместе с нематодами можно учитывать коловраток,
тихоходок, но в этих случаях пробы следует увеличивать,
так как эти группы распределены неравномерно и встре-
чаются в почве значительно реже, чем нематоды. Эгли-
тис приводит такое соотношение отдельных групп в поч-
ве: в пробе, где найдено 8800 нематод, коловраток было
65, а тихоходок — 4.
Анализ однограммовых проб можно проводить путем
прямого просмотра в небольшом количестве воды под
бинокуляром с 40-кратным увеличением. Но в целях эко-
номии времени рекомендуется пользоваться вороночным
способом, который почти наполовину сокращает время,
затрачиваемое на анализ. Этот метод (по Эглитису) за-
ключается в следующем. На кусочек (3X3 см) мелкой
металлической сетки с отверстиями в 1X1 мм кладут
пробу земли в 1 г и осторожно погружают в наполненную
водой воронку, на нижний конец которой надета рези-
новая трубка *с зажимом. Нематоды покидают почву и
проникают в трубку, скопляясь над зажимом. Через 2—
3 дня проводят анализ накопившихся здесь нематод.
Пользуются обычным, указанным выше способом, про-
сматривая материал под бинокуляром в проходящем
свете. Выявленные нематоды препаровальной иглой пе-
реносят в каплю воды на предметное стекло. В дальней-
шем, рассматривается материал при более сильном уве-
личении, сортируют его. Так поступают и при учете дру-
гих мелких, редко встречающихся беспозвоночных.
172
Учет мелких животных в почве — дело довольно
сложное и нелегкое, а между тем такие исследования
имеют большое практическое значение. Число нематод
в почве чрезвычайно велико. По данным Кобба, на 1 га
их приходится от 300 млн. до 2 млрд., по Ваксману — до
11 млрд., по А. Л. Бродскому (в Средней Азии) — до
14 млрд. Эта фауна по характеру питания распадается
на следующие биологические группы:‘потребители дет-
рита, потребители микрофлоры, хищники, полупаразиты
растений, паразиты растений, полупаразиты животных,
паразиты животных. Вследствие своей многочисленности
нематоды оказывают большое влияние на строение
почвы — изменяют капиллярную пористость, участвуют в
процессе минерализации, регулируют плотность микро-
флоры и микрофауны, а главное, поражают корневую
систему многих сельскохозяйственных растений.
Методику учета почвенных нематод впервые разрабо-
тал Кобб. Метод его сводится к следующему: берут про-
бу земли в 1 кг, равную 1 дм3, т. е. составляющую пло-
щадь в 0,000001 га, переносят ее в ящик или мешок и
сохраняют до обработки. Проба благодаря выносливости
нематод может сохраняться долгое время. Пробы следу-
ет брать послойно: из слоя до глубины 20 см для про-
мывки берут 10 см3, из слоев ниже 20 см, но не глубже
50 см — по 25 см3, а еще ниже — по 100 см3.
Большие объемы почвы брать нецелесообразно, так
как в верхних горизонтах нематод очень много, что очень
затрудняет количественный подсчет и качественный
анализ.
Можно извлекать нематод из земли методом декан-
тации, для чего землю тщательно размешивают с водой
и дают смеси отстояться. Частицы земли осядут на дно,
а нематоды останутся на поверхности. Воду сливают в
другой сосуд, а осадок снова декантируют. Нематод вы-
лавливают с поверхности слитой воды сеткой из мель-
чайшего газа и переносят в соответствующую посуду.
Часто пользуются набором сит (рис. 78). Для механиза-
ции извлечения нематод применяют аппарат Морриса, но
это дает незначительное облегчение. Значительно облег-
чает работу вороночный метод.
Метод приманок Буанакке. Предложен для учета
свекловичных нематод. Свекловичные семена (1—2 см3)
завязывают в шелковый газ, привязывают этот мешочек
173
к палочке и вместе с последней зарывают на нужную глу-
бину в исследуемую почву, где семена
прорастают. Прорастающие семена силь-
нее всего привлекают нематод, поэтому,
в случае присутствия нематод, они про-
никают в корешки, где могут быть обна-
---г.--1 ружены в них обычными способами.
Учет нематод при помощи пробирок-
ловушек. Разработал метод А. Л. Брод-
ский (1937). Этот метод дает возможность
сравнительно легко собрать нематод с
изучаемой площади. Основан он на том
экологическом ф.акте, что нематоды рас-
пространены в горизонте глубиной при-
мерно до 15 см и имеют гнездовое распре-
деление. Почвенные нематоды влаголю-
бивы и легко собираются в пробирки-ло-
вушки, наполненные водой. Пользуются
этим методом следующим образом: про-
Рис. 78. Набор бирки диаметром 6 мм и длиной 25 мм
сит для из- наполняют ватой, смоченной речной про-
влечения нема- фильтрованной водой (наибольшее чис-
тод. Л -общий ло нематод собирается в ловушки при
нейтральной' реакции), и закладывают
в количестве 4—8 шт. на 1 дм2 почвы.
Пробирки вводят в почву опытного участка на глубину
15 см и оставляют на 4—5 дней. В такие ловушки нема-
тоды попадают в большом количестве, активно пе-
редвигаясь в вертикальном и горизонтальном направле-
ниях.
Для извлечения нематод из ловушек применяют ме-
тод, основанный на принципе, применяемом при извле-
чении нематод из растений. Вынув из пробирки вату,
переносят в банку или пробирку с водой, нематоды поки-
дают вату и скопляются на дне сосуда. Можно пользо-
ваться и вороночным методом.
Учет цист свекловичной нематоды. Чаще всего для
учета нематод изучают их цисты. Осенью самки свекло-
вичной нематоды цистируются в земле и циста бывает
переполнена яйцами. Цисты имеют эллиптическую фор-
му, 1,3 мм длиной, 0,5—0,8 мм толщиной.
Берут для пробы 1 дм2, (что равно 1 кг) земли с глу-
бины 10—30 см, так как в этом слое нематоды наиболее
распространены. Пробу нужно брать небольшими пор-
циями в 10—30 местах так, чтобы всего было 1 дм3 поч-
вы. Если пробу берут на свекловичных полях, то следует
брать ее и в рядах, и в междурядьях. Пробу нужно брать
лопатой или почвенным буром. Взятую пробу (1 кг или
1 дм3 земли) сохраняют до обработки.* Путем анализа
устанавливают количество жизнеспособных цист в опре-
деленном объеме (или единице веса) почвы.
Обработка почвы методом флотации. Высыпав пробу
в банку, наполненную до 3/4 водой, размешивают ее де-
ревянной мешалкой так, чтобы не осталось комков. Если
одновременно изучают несколько проб в нескольких
банках, то нельзя пользоваться общей мешалкой во избе-
жание переноса цист из одной банки в другую. Дают
смеси немного отстояться. Земля осядет на дно, а цисты
всплывуют на поверхность. Собирают цисты с поверхно-
стней подсчитывают. Для более точного учета ъболтан-
ную воду следует процедить через систему сит с таким
расчетом, чтобы последнее сито задерживало цисты. Под-
счетами устанавливают количество цист на единицу пло-
щади (объема).
Цисты нематод очень крепки, даже пустые они сохра-
няются в почве довольно долго. Поэтому для точного уче-
та следует в пробе отделить живых и здоровых от боль-
ных и пустых. Для этого цисты кладут на предметное
стекло, надавливают другим стеклом и рассматривают
под малым увеличением микроскопа. В живых ясно вид-
ны яйца, а в больных — споры грибков. Путем подсчета
устанавливают процент живых.
Тихоходки (Tardigrada). Тихоходки — мелкие (от 0,1
до 1,0 мм) организмы, преимущественно наземные фор-
мы. Они заселяют заросли мхов и лишайников, встре-
чаются и в почве. Питаются содержимым клеток этих, а
иногда и высших растений. Во мху Маркус (Marcus,
1930) находил до 22 тыс. особей на 1 г сухого мха, а во-
обще в благоприятных условиях тихоходки размножают-
ся в больших количествах — до сотен тысяч на 1 м2. К
почвам относятся неодинаково и в общем здесь встре-
чаются редко. В Латвийской ССР Эглитис, пользуясь
вороночным методом, в почвах, взятых в лесу, находил
19 экземпляров на 10 г почвы (преимущественно из ро-
дов Macrobiotus и Diphascon), в то время как на дерно-
во-карбоиатпых пахотных почвах тихоходки не были
175
найдены. В целом тихоходки — это эврибионтная и ши-
роко распространенная группа. Среди них есть немало
космополитов, но отдельные виды имеют ограниченный
ареал. Предпочитают влажные, но периодически пересы-
хающие места. Тихоходки способны высыхать и значи-
тельное время пребывать в состоянии анабиоза. Периоди-
ческое обсыхание субстрата — физиологически необходи-
мое условие. Высохшие организмы могут сохранить свою
жизнеспособность несколько месяцев, даже лет. В этом
состоянии они могут выносить исключительно низкую
температуру (до —271,8° С), а в течение 20 месяцев вы-
держивать —190° С. Кратковременно они могут перено-
сить и очень высокие температуры (до 100° С). В высох-
шем состоянии тихоходки разносятся ветром. Но не-
смотря на это, не везде их можно обнаружить.
Видимо, решающим фактором является характер влаж-
ности субстрата.
Откладывают они от 1 до 30 шт. яиц, которые также
способны переносить высыхание субстрата. Они могут до
7 раз высыхать и вновь оживать.
Методика сбора и учета. Методика определяется био-
логическими особенностями. Для изучения тихоходок, во
всех средах их обитания берут пробы субстрата для по-
следующего извлечения и изучения их. Собирают мох
(подушечки) на деревьях, почве, на камнях, крышах до-
мов и тому подобных местах. Проба снабжается этикет-
кой и подушечки переносят в пакетики, которые сохра-
няют в коробках до обработки. Таким же методом соби-
рают лишайники, соскабливая их с субстрата, и также
с этикеткой хранят в пакетах или коробках в сухом ме-
сте. Для изучения живущих в почве видов берут пробы
земли в жестяные или стеклянные банки, как при изуче-
нии нематод и коловраток. Для обработки сборов сухой
материал (мох, лишайники) увлажняют, дают возмож-
ность тардиградам выйти из анабиотического состояния
и в таком виде изучают. Почвенные пробы обрабатывают
вороночным методом, как нематод и коловраток (см.
стр. 172).
ИЗУЧЕНИЕ ПОЧВЕННОЙ МЕЗОФАУНЫ
Общий обзор методов и описание приборов
Черви, моллюски, мокрицы, а также личинки, кукол-
ки и даже яйца многих насекомых составляют главную
176
часть обитателей почвы. В определенные периоды и се-
зоны они заселяют различные ее слои. Для изучения
биологии живущих в земле беспозвоночных или их от-
дельных фаз применяют специальные методы. Количест-
венный учет осуществляют методом раскопок.
Все работы по количественному учету почвенной
мезофауны можно свести к таким основным моментам:
а) техника взятия почвенной пробы;
б) выборка животных из почвы;
в) фиксация и определение;
г) оценка типичности полученных величин населе-
ния;
д) математическая обработка—доведение до сред-
них величин на единицу площади.
Способы взятия почвенной пробы. Простой способ
взятия почвенных проб — ямы. Отмеряют площадку
соответствующего размера (0,5X0,5 м), почву подкапы-
вают и послойно вынимают для анализа (см. «Методика
и техника почвенных раскопок»). Для предотвращения
осыпания стенок ямы применяют специальные приспо-
собления. Кинг (1929) применил металлическую форму
в виде цилиндра, Джонс (1937)—квадратную. Такие
формы с отточенными нижними краями вдавливают или
забивают в почву. Моррис применил четыре пластинки
(три длинных, одна короткая), их вбивают в почву и так
отгораживают квадрат, из которого выбирают почву для
исследования (рис. 79). Взятые пробы выбирают и ис-
следуют. Размеры ям в зависимости от условий и целей
исследования бывают различными. Для учета мелких
объектов наиболее удобны размеры 10X10X10 см. Для
учета таких организмов Эглитис пользовался пробой в
0,5 л (0,5 дм3). При обследовании полей с вегетирую-
щими растениями рекомендуют брать пробу буром, что
обеспечивает соблюдение нужного размера проб (рис.
80). Применяют бур Пятницкого, вырезывающий 0,01 м2
на глубине 30 см. Такой бур вводится в почву враще-
нием при легком надавливании на рукоятку. Извлечен-
ную буром почвенную пробу переносят в мешок. В один
мешок можно поместить 10—15 проб. Применение бура
повышает точность средних данных, так как небольшие
пробы на обследуемых полях берут на многих участках
с разными микроусловиями. На тяжелых грунтах пред-
ложили использовать бур Розанова (диаметром 11 см),
177
а на легких почвах — дисковый бур Мироновской стан-
ции (диаметром 14 см).
Рис. 79. Прибор Морриса для взятия почвенных
проб. А — прибор перёд взятием образца (пла-
стинки вбиты в землю); Б — вынуты три слоя
почвы; В — составные части (железные пластин-
ки, совок для выбрасывания почвы, молоток)
Выборка животных из почвы. Из многих существую-
щих методов ниже приводим основные:
а) ручной способ разборки пробы и выборки живот-
ных из почвы. Метод этот прост, но трудоемок. Землю
пропускают через руки, комки тщательно разминают
пальцами и извлекают организмы;
б) извлечение животных из почвы путем использо-
вания их таксисов на свет, на повышение температуры,
па сухость среды. Для этого пользуются,аппаратом Бер-
лезе и аппаратом Тулгрепа (рис. 81), который основан
на использовании не только теплового, но и светового
178
таксисов. При пользовании этими аппа-
ратами почву или подстилку помещают
на сетку или в воронку и подвергают ее
действию повышенных температур или
света, или того и другого вместе. Живот-
ные устремляются вниз через стенку в во-
ронку и сваливаются в фиксирующую
жидкость.
В. К. Эглитис (1954) пользовался при-
бором, состоящим из десяти одинаковых
эклекторов (термогигрофотоэлектромет-
ров), что давало возможность за корот-
кий срок проанализировать большое ко-
личество проб.
Для такого учета в специальные алю-
миниевые бюксы берут пробы объемом
0,5 л, что соответствует площади 0,01 м2
и толщине слоя в 5 см. Такой объем про-
бы оказался наиболее удобным и приме-
ним он в большинстве случаев. В луговых
и полевых почвах обычно попадает 100—
считает возможным, при обсле-
лесных почв и вообще почв,
животными, сократить объем
Рис. 80. Бур
для взя-
тия почвен-
ных проб
жестяной во-
200 особей, в лесных—свыше 500. Поэто-
му автор
довании
богатых
пробы.
Прибор (эклектор) состоит из длинной
ронки с крутым склоном стенок. Внутри воронки укреп-
лены узкие подставки, на которые помещается сетка с
ячейками 2X2 мм. На конце воронки посредством рези-
новой трубки прикреплена пробирка диаметром в 12 мм
с консервирующей жидкостью (70° спирт). Над воронкой
помещается рефлектор с осветительной лампой в 55 вт.
Между лампочкой и почвой, положенной на сетку эклек-
тора, должно быть расстояние 10 см. Животные нахо-
дятся в пробе в течение одних суток. Под влиянием
постепенного повышения температуры и вызванного
этим высыхания поверхности почвы животные устремля-
ются в нижние слои и в конце концов через марлю и
сетку попадают в воронку и по ее стенкам скатываются
в пробирку. Энхитреиды не успевают уйти из высохшей
почвы и погибают. Материал, собранный в пробирке,
сортируется под бинокуляром при 18-кратном увеличе-
нии;
179
в) просеивание почвы через сита и решета ручным
способом либо с применением механизированных и мо-
торизированных снт (рис. 82);
г) промывка почвы через сита и системы сит. Для
этого служит прибор Морриса (1921—1922) (рис. 83).
Через сита постоянным током воды промывают образцы
Рис. 81. Термогигрофотоэклектор (аппа-
рат Тулгрена). А—общий вид; Б — раз-
рез (схема):
1 — цилиндр, 2 — сетка для материала исследо-
вания, 3 — воронка, 4 — банка с фиксатором
до окончательного удаления частиц из почвы. Ориги-
нальную установку применил Кораб (приводится по
Иванову, 1931) (рис. 84). Принцип работы заключается
в следующем. Струей воды, вытекающей из крана с рас-
пылительной сеткой, вымываются из помещенного в ме-
таллический сосуд образца почвы имеющиеся в ней
животные и всплывающий в воде мусор. Животные ор-
ганизмы и мусор задерживаются системой металличес-
ких сит. Е. С. Кирьянова (1930) промывала почвенные
образцы объемом до 1 дм3 через сито из мельничного
газа № 14 с последующим просмотром промывного ос-
татка под малым увеличением бинокуляра. Существуют
180
Б
Рис. 82. Прибор для
промывки почвы. А —
общий вид; Б — во-
рончатое сито для
промывки почвы
Рис. 83. Аппарат для просеивания и разделения
насекомых из почвенных проб (по Моррису, из
Фридерикса). А — общий вид; Б — схема:
/ — сеточка душа, 2 — выступающий край первого сита,
3—кольцеобразный кантик для поддержки сита, 4 — во-
ронки, 5 — сита, 6 — трубка для стока воды, 7 —трубка,
приводящая воду
и другие конструкции промывочных аппаратов (рис. 85).
Т. Г. Григорьева сконструировала прибор, состоящий
из четырех вставляющихся друг в друга ведер (рис. 86);
Рис. 85. Промывочная уста-
новка Ширка (из Гиляро-
ва)
Рис. 84. Промывочная
установка Кораба
(схема):
1 — сетка для распыле-
ния воды, 2 — наружные
стенки сосуда, 3 — сетка
с пробами, 4, 5 — набор
епт
дно каждого ведра заменено металлической сеткой с от-
верстиями в 3; 1,5; 1 и 0,2 мм2. Весь прибор монтиро-
вался на деревянный станок со вставляющимися в него
воронкой и желобом для стока воды. Непосредственно
перед промывкой hpo6y замачивают в ведре воды, пере-
мешивают, взмучивают и быстро сливают в верхний
сектор прибора (в сита с отверстиями в 3 мм2). Взму-
чивание и сливание жидкости производят последователь-
но несколько раз до тех пор, пока на дне ведра не оста-
нется песок и более крупные частицы почвы, в которых
просмотром под бинокуляром не будет обнаружено ни-
каких животных.
После этого почву в приборе промывают еще раз
чистой водой. На промывку одной пробы (1 для3) затра-
чивается 4—5 ведер воды. Более крупные объекты (жу-
182
А
Рис. 86. Прибор Григорье-
вой для промывки почвен-
ных образцов. А—общий
вид; Б —деталь ведра с ук-
репленной сеткой
ки-чернотелки, жужелицы) задерживаются на трех верх-
них ситах, их выбирают .с помощью пинцета и переносят
в спирт. Последнюю фракцию промывают через мельнич-
ный газ № 17 (для удаления мути), после чего фикси-
руют 4%'-ным раствором
формалина;
д) метод флотации осно-
ван на том, что животные
всплывают при замачива-
нии почвы в жидкостях.
Флотацию применил впер-
вые В. М. Брянцев (1926).
Он разбавлял почву водой
в стеклянной ванночке и
кистью вылавливал всплы-
вавших животных. Подкла-
дывая под ванночку попере-
менно белую и черную бума-
гу, можно менять фон, что
облегчает выборку. Приме-
нение флотации дает воз-
можность использовать тех-
ническую силу вместо квали-
фицированных работников.
Даниэльс (1933) применил
флотацию при экстракции
личинок и куколок карто-
фельной блошки. К. Гранкина
метод для конопляной блошки и др. По ее утверждению,
проба в 0,25 м2 может быть проанализирована за 30—
45 мин.
Для подсчета всплывающих на поверхность воды
животных Форд (1935) предлагает способ, который
предупреждает возможность пропусков отдельных орга-
низмов и ускоряет систематизацию собранного материа-
ла. Вода и плавающие в ней организмы сливаются в во-
ронку с фильтром, предварительна разграфленном на
квадратики со стороной в 3 мм. Осевший на дно осадок
заливают водой и сливают в тот же фильтр. Это проде-
лывают несколько раз. Осадок оставляют для отдель-
ного просмотра, а фильтр разворачивают и помещают
в чашку Петри с эфиром. Минут через 10 все организмы
умирают, тогда фильтр с животными помещают па плас-
(1938) использовала этот
183
тинку стекла и просматривают под бинокуляром, при-
чем просматривают каждый квадратик фильтра. Живот-
ных выбирают иглой и тут же систематизируют и запи-
сывают в таблицу.
Леделл (1938) предложил новый метод флотации —
обработку почвы крепким сульфатом магния (MgS,O4)
с удельным весом 1,11. Этим достигается ускорение про-
цесса флотации — большее число объектов легко всплы-
вает на поверхность. Образцы почвы 7,5X10,0X22,5 см
предварительно просматривают для извлечения крупных
экземпляров, после чего почву замачивают раствором
магнезии и тщательно размешивают в специальном ап-
парате для дальнейшей обработки.
МЕТОДИКА И ТЕХНИКА ПОЧВЕННЫХ РАСКОПОК
При обследовании выбор места и число пробных ям
может быть различным, в зависимости от поставленных
задач. Чем больше будет ям, тем точнее можно опре-
делить степень зараженности почвы. Если почва зара-
жена слабо, то ям должно быть выкопано больше. По су-
ществующим инструкциям для массовых обследований
фауны почвы в условиях вспаханного поля рекомендует-
ся на площади до 10 га копать не меньше четырех полу-
метровых ям; на массивах от 10 до 50 га — 8 ям, на пло-
щади от 15 до 100 га— 12 ям и далее на каждые 50 га
по три добавочные ямы. Ямы должны быть так размеще-
ны, чтобы взятая проба отражала среднее состояние ус-
ловий обследуемого участка. Образцы должны быть взя-
ты со всех вариантов рельефа и почвы. Это особенно
важно в тех случаях, когда мы имеем дело с сильно
развитым рельефом и большой пестротой почвенного и
растительного покрова. Для того чтобы избежать слу-
чайностей, следует брать не отдельные ямы, а группы их
по 4—5 ям на расстоянии 2—3 м одна от другой
(рис. 87).
При копании ям надо обращать внимание на повреж-
дения корневой системы травянистой растительности и
древесных пород. Если корни окажутся поврежденными,
следует собирать образцы их для последующего анализа,
а повреждения крупных корней зарисовывать. Размеры
184
ям могут быть различными и зависят от многих обстоя-
тельств: от типа обследования, задач, поставленных
перед исследователем, методики и от технических воз-
можностей. Моррис применял размеры 10X10 см. Такие
размеры рекомендуют при изучении мелких беспозво-
ночных, но они малы и не дают должных результатов,
при изучении мезофауны. Наиболее распространены
размеры ям — 0,25 м2
(0,5x0,5ж). Ими поль-
зуются при научных
исследованиях и при
производственных об-
следованиях. Для по-
следних роют иногда
ямы 0,5 м2 (0,5Х1,0л/).
Хотя такой размер ям
может несколько об-
легчить работу, но точ-
ность от этого страда-
ет. Лучше, конечно,
пробу в 1 м2 брать в
четырех местах (по
0,25 м2), чем в двух (по
0,5 м2) и еще хуже —
в одном месте.
Для изучения личи-
нок кравчика, зарыва-
ющихся на глубину
75—80 см, яму следует копать глубиной не менее 80—
90 см. Личинки некоторых хрущей зарываются еще глуб-
же. Время раскопок и характер их также имеет значение
для выбора глубины ям. Установлены некоторые стандар-
ты глубины для каждого слоя. А. В. Знаменский (1927)
рекомендует такие глубины: первый слой — 5 см, вто-
рой— 10 см, третий — 15—20 и т. д. или первый слой —
0—5 см, второй — 5—20, третий — 20—40 см. Но и эти
варианты глубин страдают искусственностью, так как
глубина не всегда соответствует экологическим особенно-
стям организмов.
В. Н. Старк (1930) рекомендует подходить к этому
экологически: изучить сначала почвенные горизонты, а
потом брать пробы по этим установленным горизонтам.
В качестве критерия рекомендуется использовать влаж-
185
ность почвы. Если трудно сразу установить глубину го-
ризонтов, то можно снимать почву малыми слоями от
1 до 5 см с учетом условий влажности, что дает возмож-
ность установить действительное распределение насеко-
мых в различных горизонтах. Но нельзя придавать ре-
шающее значение какому-либо одному фактору, напри-
мер влажности; имеют значение и такие особенности
почвы, как кислотность, температура, аэрация, механи-
ческая структура, а также распространение корневой
системы (Бродский) и др. Наконец, имеет значение се-
зон, когда проводится обследование. Известно, например,
что насекомые и многие другие беспозвоночные осенью
уходят на зимовку на большую глубину, следовательно,
в этот период ямы нужно копать глубокие.
Обработка и фиксирование материала
Редко приходится обрабатывать материал параллель-
но с раскопками. В большинстве случаев его обрабаты-
вают позже — в более удобной обстановке, поэтому все
сборы необходимо зафиксировать и подробно этикети-
ровать. Рекомендуется такая форма этикетки (сок-
ращенно):
№-----Место ----------Время--------Характер местности--------------
Собранный материал фиксируют кипятком — способ
быстрой фиксации — или применяют медленную фикса-
цию в хромовой смеси: формалина (40%) —80 частей по
объему, раствора хромовой кислоты в воде (1%) —180
частей, уксусной кислоты (ледяной) — 10 частей. В этой
186
смеси прекрасно фиксируются личинки долгоносиков,
мух и др. В хромовой смеси материал нужно держать
несколько дней (но не более месяца), затем промыть и
перенести в консервирующую жидкость. Личинки круп-
ных насекомых (пластинчатоусых) в этой смеси фикси-
руются плохо. Для них лучше применять кипяток. В
сосуд, где находятся личинки, наливают кипяток, варят
2—3 мин на медленном огне, после чего дают остыть.
Затем личинок помещают в 96° спирт, а через несколько
дней переносят их в спирт меньшей крепости (70°) и в
нем сохраняют. Спирт можно заменить смесью Мак-Гре-
гора (10 см3 неразведенного формалина, 10 см3 дистил-
лированной воды и 2 см3 глицерина). При фиксации на
теле крупных мягких личинок рекомендуется сделать
несколько наколов иглой, что ускоряет пропитку тканей
фиксирующей жидкостью. Хорошо фиксируются личин-
ки и без нагревания жидкостью следующего состава:
концёнтрированный формалин — 5—6 частей , этиловый
спирт (96°) — 15 частей, ледяная уксусная кисло-
та— 2 части, дистиллированная вода — 30 частей. Через
10 дней личинок следует перенести в 80° спирт, который
спустя несколько дней следует сменить. Для фиксации
мелких мягких личинок лучше пользоваться жидкостью
такого состава: спирт — 96° — 750 частей, серный эфир —
250 частей, ледяная уксусная кислота — 30 частей, фор-
малин 40%-ный — 3 части. Хранить личинок нужно в про-
бирках в темном шкафу, так как свет обесцвечивает и
размягчает фиксированных в спирте личинок. В каждой
пробирке обязательно должна быть этикетка, которая
пишется на кальке или плотной бумаге графитным ка-
рандашом или тушью. Этикетки, написанные тушью,
рекомендуется перед опусканием в спирт подогреть над
пламенем, а лучше смазать раствором целлоидина в
ацетоне.
Для сохранения материала применяют консервацию
сухую или в жидкостях. Сухая консервация состоит в
следующем: личинку насекомого помещают в посуду или
коробку и засыпают мелко толченной солью. Этот способ
не всегда дает хорошие результаты и поэтому имеют
ограниченное применение.
Для консервирования в жидкости чаще всего поль-
зуются 2—5%-ным формалином или 70° спиртом. В слу-
чае отсутствия указанных консервирующих веществ
187
можно консервировать 3%-ным раствором карболовой
кислоты или 5%-ным раствором салициловой кислоты
в обычной водке. Можно пользоваться, наконец, только
одной водкой. Применение той или иной консервирую-
щей жидкости зависит в большей мере от характера
фиксируемого объекта.
Имеет широкое применение сухая фиксация формы
и окраски личинок. Просто высушенные личинки теряют
свою форму, изменяют окраску, темнеют, сморщиваются
б
Рис. 88. Приспособление для выдува-
ния гусениц. А — прибор из лампово-
го стекла; Б — приборчик из жести
не перестанут выдавливаться
и делаются негодными
для демонстрации. По-
этому рекомендуют
(Гиляров) личинок
проволочников, ложно-
проволочников, а так-
же личинок пластинча-
тоусых и усачей фикси-
ровать следующим спо-
собом. Препаровальной
иглой делают прокол в
анальное отверстие ли-
чинки, кладут ее на
лист фильтровальной
бумаги и, нажимая
стеклянной палочкой в
направлении от головы
к «хвосту», выдавлива-
ют все внутренности.
Выдавливание продол-
жают катанием стек-
лянной палочки по
шкурке личинки, пока
остатки внутренностей.
После выдавливания кожу личинки надевают на пре-
паровальную иглу местом прокола и так подсушивают
над пламенем спиртовки или в горячем воздухе от спе-
циального прибора (рис. 88). При нагревании образую-
щимися внутри шкурки парами личинка распрямляется
и приобретает естественную форму. Не следует слишком
интенсивно нагревать, ибо при перегреве, от сильного
давления паров, личинка может чрезмерно раздуться и
изменить свои размеры и форму. Нужно следить также
и за тем, чтобы у личинки не обгорели ножки. Высушен-
188
ная таким образом личинка полностью сохраняет и фор-
му, и окраску.
Личинок 'пластинчатоусых после выдавливания ре-
комендуется не сушить, а заполнять парафином (Гиля-
ров, 1937). После двукратного или трехкратного выдав-
ливания их 2—3 раза промывают уксусной кислотой
для того, чтобы свернулись оставшиеся возле хитино-
вого покрова белки, внутри шкурку промывают из пи-
петки 5—6 раз спиртом возрастающих крепостей, от
70 до 96° или абсолютным. После этого шкурку про-
мывают еще 2—3 раза хлороформом, а затем надувают,
придав ей естественную форму. Далее в нее наливают
насыщенный раствор парафина в хлороформе. Так как
хлороформ испаряется, его испарение нужно ускорить
продуванием через длинную тонкую соломинку. Проце-
дуру наливания раствора ('парафина в хлороформе) и
просушивание нужно повторить несколько раз, пока на
внутренней стороне шкурки не образуется слой парафи-
на, удерживающий форму шкурки. После этого при по-
мощи пипетки с «грушей» шкурку дополняют расплав-
ленным парафином. К парафину желательно добавить
порошок мела. Когда парафин внутри шкурки застынет,
нагретым шпателем сглаживают в месте надреза края
шкурки и освобождают личинку снаружи от пристав-
шего парафина. В таком виде экспонат может хра-
нится долго.
Для сохранения формы и окраски животных П. И.
Савинский рекомендует пользоваться таким методом.
Объект после умерщвления его эфиром помещают на
бумагу и расправляют, придавая нужную форму. По-
верхность высушивают до полной сухости. На 3А— 2/з
всей поверхности объекта накладывают формовой
слой — расплавленную смесь канифоли (4 части) и па-
рафина (1 часть) так, чтобы этот слой (примерно в
2 мм) прикреплял объект со всех сторон к бумаге. Для
прочности при фиксировании крупных объектов накла-
дывают еще слой гипса в 2—3 мм.
Для сохранения при фиксации густых щетинок вмес-
то названного фомовочного слоя объекты опудривают
толченой канифолью и сразу опрыскивают из пульве-
ризатора концентрированным раствором канифоли в
спирте. При этом способе расположение щетинок и
форма их не нарушаются. У гусениц (непарный шел-
189
копряд и др.) форхиа и расположение щетинок, если
они густые и длинные, хорошо фиксируются при нало-
жении обычного формового слоя (канифоль+парафин).
После того как формовой слой станет твердым, препа-
ровальными ножницами разрезают непокрытую формо-
вым слоем поверхность и удаляют внутренности, не
допуская отделения поверхности объекта от формового
слоя. У гусениц большая часть внутренностей может
быть оставлена. Для фиксации окраски и удаления
воды из тканей внутрь тела животного насыпают пова-
ренную соль. Отсыревшую в теле соль заменяют сухой,
п объект высушивают в сушильном шкафу при невы-
сокой температуре.
После полного высыхания объект освобождают от
формового слоя, для чего его помещают в бензин. Осво-
божденный объект пропитывают и покрывают парафи-
ном в сушильном шкафу при температуре около 70°,
после этого всю поверхность объекта покрывают да-
марным лаком. Для прочности изнутри накладывают
слой гипса со столярным клеем. Такие препараты хра-
нятся очень долго без изменения. Окраска сохраняется
лучше, чем при других способах фиксации.
Сбор и учет беспозвоночных при помощи
почвенных раскопок
Для выяснения качественного и количественного
состава животных почвы, перегнивших листьев и травы,
а также подземных частей растений пользуются в зави-
симости от поставленных задач различными методами.
Наиболее распространен учет почвенной мезофауны
методом раскопок (рис. 89, 90).
На подлежащей обследованию площадке выбирают
наиболее типичные, как было указано выше, точки и
закладывают на них пробные ямы. Наиболее широко
распространены размеры ям 0,25 м2 — длина стороны
0,5 му а глубина — в зависимости от условий и задач
исследования. Четыре такие ямы, взятые на данной
территории, дают пробу 1 м2, и население этих четырех
ям будет характеризовать таковое 1 м2. Так как все
пробы (ямы) должны вместе охватить средние типичные
190
условия, необходимо учесть все разности обследуемой
площади (см. стр. 184).
Выбрав одним из указанных выше методов площад-
ку, работу 'проводят одним из следующих способов:
а) раскапывают яму, тщательно пёребпрая послой-
но руками всю землю, выбирают из нее всех животных
Рис. 89. Взятие почвенного образца островком
(рис. 90) или же помещают землю в мешочки и сохра-
няют до анализа;
б) отмеренную площадку обкапывают со всех сто-
рон на заданную глубину (рис. 89), снимают послойно
почву и анализируют ее или же подрезают лопатой,
переносят пробу в мешочки для последующей разборки
в лаборатории. Осмотр земли в обоих случаях произво-
дят на листе белой бумаги или дикта, но при этом
землю с каждого слоя нужно собирать в отдельные ме-
шочки, последние завязывают и снабжают подробной
этикеткой (этикетку лучше положить в середину). В
таком виде пробу можно сохранять несколько дней.
191
Для выборки можно применить один из описанных
выше механических методов.
Раскопку производят по слоям: вначале выбирают
верхний слой — 5 см или верхний сухой слой, затем
снимают второй слой — 5—10 см, третий и т. д. Всех
обнаруженных в этих слоях животных переносят в от-
дельные банки или пробирки. Личинок фиксируют в
Рис. 90. Вид почвенной пробы (по Линдеману)
спирте, формалине и снабжают этикеткой с указанием
слоя, а в дневник заносят соответствующие данные о
месте взятия пробы и об условиях почвы. Если вид
животного определить трудно, то в дневнике записы-
вают предварительное (условное) название и указывают
номер пробирки, где материал сохраняется. После уста-
новления точного названия в дневнике делают сответст-
вующие исправления.
Такая выборка насекомых или других беспозвоноч-
ных различных слоев дает возможность сделать выводы
о вертикальном распределении почвенных животных. В
дневнике следует описать почву с указанием условий
увлажнения, температурных и других свойств. Так,
при изучении сезонного распределения животных необ-
ходимо брать пробы в различные сроки, сезоны и т. д.
При изучении влияния агротехники следует брать
пробы на различных полях севооборота. В таких слу-
192
чаях раскопки приходится проводить по особой програм-
ме, через определенные промежутки времени, это дает
возможность накопить данные, по которым можно будет
установить изменение фауны в зависимости от деятель-
ности человека. При изучении вертикального распреде-
ления и вертикальных миграций почвенной фауны необ-
ходимо учитывать то обстоятельство/ что некоторые
представители почвенных животных могут уходить на
большую глубину (1—2 м).
Сбор и учет беспозвоночных за плугом
Большое количество насекомых, живущих в почве,
при обработке ее плугом выбрасывается на поверхность
земли. Их можно собирать в борозде во время весен-
ней вспашки и учитывать. Особенно эффективен этот
метоД при сборе личинок и куколок хрущей и других
пластинчатоусых, личинок щелкунов, крупных видов
долгоносиков, личинок некоторых групп мух. При сбо-
ре насекомых нужно следить, чтобы расстояние между
плугом и сборщиком не было слишком большим, так
как насекомых могут склевывать птицы.
За многолемешным тракторным плугом следует рас-
ставить сборщиков так, чтобы каждый из них -собирал
насекомых на определенном участке прохождения трак-
тора. Пробы при таком сборе анализируют отдельно,
чтобы установить, в какой мере изменяется видовой
состав животных на разных участках поля. Количест-
венный учет насекомых при сборе их за плугом явля-
ется неполным, но дает представление о заселенности
различных полей теми или иными видами. Учет за
плугом, по А. Ф. Крышталю, проводят так: поле разби-
вают на 10 участков и в -каждом из них после прохож-
дения плуга собирают насекомых на отрезках в 10 м.
В сумме получают количество собранных насекомых на
участке в 100 пог. м.
Другой способ учета, описанный А. И. Ильинским
(1951), состоит в следующем. С помощью плуга в на-
меченной стации проводят борозду. Непосредственно за
плугом справа и слева от борозды идут два рабочих,
которые собирают всех вывернутых на поверхность
7—1867
193
насекомых и складывают их в ведро с водой. При теп-
лой погоде число сборщиков должно быть увеличено,
так как быстро двигающиеся насекомые могут снова
зарыться в землю. В каждом участке того или иного
угодья обследуют борозду длиной в 100 м. Ее проводят
по диагонали участка, намеченному для обследования.
Материал с каждой борозды собирают отдельно.
Недостаток описанного метода — его невысокая точ-
ность, так как при вспашке выворачивается лишь часть
обитающих в земле насекомых; более точные резуль-
таты можно получить на песчаных почвах. Можно
повысить точность учета плужного метода путем уста-
новления переводного коэффициента. Для этого, по
А. И. Ильинскому, собирают и определяют насекомых
с борозды в 1 м. Далее на этих же участках тщательно
и полностью просматривают всю перевернутую плугом
почву. Затем лопатой раскрывают нетронутую почву
дна борозды до глубины нижнего уровня залегания
беспозвоночных (при этом выкопанные ямы не расши-
ряют за пределы стенок борозды и границ учитываемого
отрезка 1 ж) и выбирают насекомых.
Переводной коэффициент для каждого насекомого
устанавливают делением его суммарного числа, най-
денного при полном просмотре почвы, на число пред-
варительно собранных насекомых на перевернутом плас-
те борозды. Переводные коэффициенты можно устано-
вить для отдельных фаз и возрастов. Само собой
разумеется, что переводные коэффициенты не могут
быть постоянными и общими, их устанавливают для
каждого участка отдельно.
Установление переводных коэффициентов в каждом
отдельном случае позволит пользоваться полученными
данными, как данными детального обследования. Досто-
инством этого метода является быстрота и нетрудоем-
кость работы; кроме того, он позволяет быстро выявить
заселенность почвы беспозвоночыми одновременно на
значительной площади. Исходя из этого следует поль-
зоваться таким методом для рекогносцировочных обсле-
дований при подготовке почвы для закладки питомни-
ков, а также под другие культуры, если эта вспашка
совпадает с периодами, когда основная масса насекомых
(вредителей) располагается в пахотном горизонте
почвы.
194
Учет населения подстилки
Остатки растений, покрывающие поверхность земли,
образуют подстилку. Особенно много такого мертвого
покрова в лесу, где он состоит главным образом из
листьев, хвои, травы и т. п. По данным А. И. Зражевс-
кого, в насаждениях дуба и клена на 1 га приходится
иногда до 8,6 т подстилки, а количество годичного опа-
да равно 3,5—3,8 т на 1 га. Мертвый покров имеет
богатую фауну. В нем зимуют или прячутся во время
засухи многие наземные беспозвоночные: нематоды, кле-
щи, низшие насекомые Collembola (ногохвостики), ли-
чинки галлиц Cecidomyidae, а также клопы черепашки,
блошки и др.
Для учета населения подстилки берут пробы следую-
щим образом: отмеряют 1 или 2 ж2 подстилки, отграни-
чивают, снимают весь покров и укладывают в плотные
мешки (бязевые, полиэтиленовые) или в плотно закры-
вающиеся банки; пробу сохраняют до обработки.
При обработке подстилку небольшими порциями раз-
бирают на белом поле стекла на столе. Для быстрого
анализа можно пользоваться фотоэклектором или аппа-
ратом Тулгрена. Результаты анализа пробы заносят в
дневник. Подобным же образом производят и учет на-
селения во мху, в торфе.
Сбор и учет беспозвоночных в наносах
Во время весеннего разлива рек на поверхность воды
на лугах всплывает наряду с остатками растений и
большое количество насекомых. Подробные сведения об
этом изложены в работе А. Ф. Крышталя (1956). В пер-
вую очередь всплывают насекомые, которые зимуют на
поверхности земли в подстилке. Течением воды и вет-
ром все эти растительные остатки вместе с насекомыми
сбиваются в кустарниках и среди деревьев, образуя
наносы, в которых нередко можно обнаружить множество
насекомых. Собирать насекомых следует тогда, когда
температура еще низкая и вода держится на опреде-
ленном уровне. Спадает вода уже при сравнительно
высоких температурах и насекомые тогда активно вы-
бираются из наносов.
7* 195
Пробы лучше брать из мелких растительных остат-
ков. Отобранные пробы переносят в бязевые мешочки.
Такие пробы можно сохранять 10—15 дней, но нужно
их держать влажными и при низкой температуре. Вы-
борка насекомых из взятых проб производится, как и
при обследовании подстила. При небольших размерах
пробы насекомых выбирают вручную, пользуясь лупой
для нахождения мелких видов. В других случаях, когда
проба большая и нужна быстрая обработка, выборку
производят термоэклектором.
Весь собранный материал обрабатывают, как и при
обследовании подстила. Результаты подсчетов, взвеши-
ваний заносят на карточку, а материал фиксируют и
монтируют обычным способом.
Учет беспозвоночных на поверхности почвы
и в верхних ее слоях
Отмечают площадку размером 2X2 м, забивают на
углах этого участка четыре колышка, натягивают верев-
ку, затем разбивают участок на четыре равных квадрата
и собирают всех беспозвоночных. Для такого обследова-
ния на одну площадку затрачивают до часа времени. По-
добным методом пользуются в прикладной энтомологии.
Особенно удобно им пользоваться весной, когда растения
малы или их вовсе нет.
Модификация этого метода (по Лигнау) сводится
к следующему. На землю выбранного участка наклады-
вают раму (1 м2) и подсчитывают всех насекомых в ней.
Часто учитывают только отдельные виды (чернотелки,
свекловичный долгоносик и т. п.). Насекомых, выходя-
щих из земли, учитывают по количеству отверстий на
поверхности почвы.
Беспозвоночых выбирают из земли ручным способом
или промывают почву и кладут их в банки или коробки,
не слишко.м маленькие, чтобы насекомые находились
там среди насыпанной земли. Иногда выбирают лишь
определенные группы животных изучаемой поверхности.
Можно ловить насекомых и на приманки. Для многих
ночных насекомых хорошей приманкой служит овсяная
мука. Хаббел (1956) предложил следующий метод
массового сбора ночных насекомых. В сумерках высы-
196
пают на почву тонким слоем дорожку из овсяной муки.
С наступлением темноты освещают дорожку фонарем
и собирают привлеченных мукой насекомых.
Быстро бегающих по ’поверхности земли или зары-
вающихся в щели, норы и другие укрытия насекомых
рекомендуется собирать следующим образом. Выкапы-
вают ямы, зарывают в них ведра и кладут на дно ведра
приманку; для хищников последней служат раздавлен-
ные улитки. Насекомые ночью попадают также в ловчие
ямы. Учет беспозвоночных на поверхности проводят и с
помощью различных ловушек. Методика такого учета
приведена в соответствующих разделах. Материал, соб-
ранный любым из этих методов, необходимо этикетиро-
вать.
СПЕЦИАЛЬНОЕ ИЗУЧЕНИЕ И УЧЕТ ОТДЕЛЬНЫХ ГРУПП
БЕСПОЗВОНОЧНЫХ, ЖИВУЩИХ В ПОЧВЕ
Дождевые черви
Дождевые черви — один из постоянных обитателей
почвы. Количество их сильно варьирует, достигая в
наиболее благоприятных условиях 900—1000 штук на
1 ж2, в среднем колеблется от нескольких десятков до
2—3 сотен.
Для сбора червей нужно иметь длинный пинцет,
крепкий нож, совок и лопату. Собранных червей поме-
щают в мешочки, сшитые из плотной материи, или в
стеклянные банки вместе с землей или мхом. В банках
в жаркую погоду черви быстро гибнут. Лучше пользо-
ваться мешочками, но нужно следить, чтобы в них не
высохла земля.
Собирают червей в старом навозе, опавших листьях,
гниющей соломе, под камнями, около хозяйственных по-
мещений, животноводческих ферм и других подобных
местах. Но большинство видов червей живет в земле
и раскопки — лучший способ добывания их отсюда. Из
влажной почвы Эванс (1948) рекомендует извлекать чер-
вей, пользуясь химическим методом выгонки. Для этого
применяют раствор марганцевокислого калия, действую-
щего раздражающе на кожные покровы червей. Этим
раствором поливают участок, с которого после выбирают
197
червей. По свидетельству Зражевского (1957), этот метод
не всегда дает хорошие результаты.
Для фиксирования червей пользуются 5%-ным раст-
вором формалина. Наиболее удобен для обычных це-
лей фиксатор следующего состава: 5 частей 40%-ного
формалина, 1 часть глицерина, 94 части воды. Для
гистологических целей лучший фиксатор — жидкость
Ценкера (сулемы кристаллической 5 г, двухромокисло-
го калия 2,5 г, сернокислого натрия 1 г, воды дистил-
лированной 100 см3).
При пользовании жидкостью Ценкера следует фик-
сировать только передние отрезки червей, примерно до
двадцатого сегмента, так как именно здесь располага-
ется половая система и другие органы, важные при опи-
сании и определении червей. Фиксация продолжается
от получаса до нескольких часов в зависимости от раз-
мера объекта. Затем промывают сутки в проточной воде
и в 70° спирте; для удаления сулемы объект помещают
в слабый раствор йода в 70° спирте. Объект хранят в
70° спирте до изготовления срезов.
В эспедиционных условиях умерщвлять и фиксиро*
вать червей рекомендуется следующим образом (по
Малевичу). Отмытых от земли и слизи червей по 5—6
штук одновременно бросают в ванночку со слабым раст-
вором формалина (1—2%), где черви погибают. Пока
они еще шевелятся, их нужно все время переворачивать
пинцетом и ополаскивать, освобождая от слизи и прис-
тавшей земли. Когда черви перестают двигаться, их
переносят в чистую ванночку, обтирают ваткой от слизи,
расправляют до естественных размеров и дают немного
обсохнуть, после чего увлажняют 5%-ным раствором
формалина. Минут через 10—15, когда черви затверде-
ют, их вкладывают в пробирки и заливают 5%-ным
раствором формалина с глицерином. Можно вместо
формалина заливать 70—80° спиртом, но его нужно
потом 3 раза менять.
Для содержания и разведения червей (на корм для
цыплят, для использования в садоводстве, а также в
научных и учебных целях) используют следующие
методы.
В первом случае — для получения корма — выращи-
вают червей по методу Исаковой-Кео (из описания
А. Б. Рабинович, 1953). В ямы (3,5X2X1 м) послойно
198
насыпают свежий конский навоз (30 см). землю (30 см).
навоз (20 см), мягкую траву, затем навоз и траву прик-
рывают еще одним слоем земли (20 см), так заполняют
яму. В специальные ямки, сделанные на верхнем слое,
насыпают корм (смоченные отруби, картофельные
очистки и другие кухонные отбросы, листья и т. п.),
впускают червей (100—150 шт. на 1 м2) или их коконы.
Сверху накрывают щитами или матами.
Ящичный способ культур, по Баррету (из О. В. Чс-
кановский, 1960), предназначен для массового разведения
червей в целях использования их в садоводстве. В изме-
ненном виде этот метод может применяться и для на-
учных, и учебных целей. Деревянные ящики (36X40X12)
с 6—8 отверстиями в 2—3 см на дне наполняют компос-
том (1 часть конского или коровьего навоза, 1 часть
просеянной земли, 1 часть торфяного мха). Компост сме-
шивается в почти сухом состоянии в особых ящиках и
перед укладкой в ящики смачивается. На компост в ящи-
ки кладут червей из расчета по 500 штук и прикрыва-
ют слоем (2—3 см) земли. Можно заряжать и яйце-
выми коконами червей. Сверху ящики прикрывают меш-
ковиной или рогожей. Ящики, если их много, укладывают
в стеллажи по 4—10 штук. Между ящиками оставляют
промежутки для доступа воздуха. Стеллажи с ящиками
должны быть защищены от прямых лучей солнца и тем-
пература почвы в них не должна превышать 15—17° С.
Наземные моллюски
Наземные моллюски связаны с особенностями ланд-
шафта— с характером тех или иных биотопов, с релье-
фом и высотой над уровнем моря, с особенностями
химического состава почвы, растительности и с условия-
ми микроклимата. Распространение наземных моллюс-
ков определяется главным образом степенью увлажнен-
ности местообитания, достаточным количеством и ка-
чеством пищи (они в основном растительноядны) и с
наличием соединений кальция, необходимых для пост-
роения раковины. Активность в течение суток и по сезо-
нам также зависит от особенностей погоды.
Все эти особенности образа жизни определяют мето-
дику и своеобразный подход к сбору, наблюдениям п
199
Исследованию этих животных. Известно, что моллюски
обитают в укромных местах — подстилке, щелях скал;
встречаются они и под камнями, под корой, под свален-
ными деревьями, в гнилых -пнях, где имеется свой мик-
роклимат. Наконец, крупные формы встречаются на
кустарниках и траве.
Голые слизни обитают на земле, используют трещины
в почве в качестве убежищ. Их можно поэтому чаще
всего находить в толще земли на глубине 20—30 см.
Слизни наносят большой вред сельскохозяйственным
растениям. Разработанные приманочные способы борь-
бы с ними (Березина) могут быть использованы и для
учета этих моллюсков.
Улитки обитают во влажных садах и парках на рас-
тениях, на земле под сухими ветками и листьями. Мно-
гие из них способны выдерживать большие колебания
климатических условий.
Крупных моллюсков, обычно живущих на кустах и
деревьях, собирают вручную; мелких, обитающих на
траве или полукустарниках и на земле, — прокашива-
нием сачком по траве.
Почвенные моллюски живут в рыхлой земле, трухе,
подстилке, в осыпях. В поле их и следует собирать не-
посредственно в этих субстратах, перебирая землю и
труху руками. Для более полных сборов всех обитаю-
щих в пробе моллюсков рекомендуют взять в специ-
альные мешочки немного почвы, подстилки и другого
подобного материала, вложить этикетку и доставить в
лабораторию для тщательного разбора и изучения.
Собирают моллюсков и при количественном учете
почвенной фауны вместе с другими беспозвоночными.
Для количественного учета крупных видов, живущих в
траве или прос’то на земле, пробу берут с учетной пло-
щадки в 4 jw2, иногда берут четыре таких площадки в
разных микроусловиях биотопа, что вместе составляет
площадку в 16 ж2. Для учета мелких форм, живущих
в рыхлой почве, подстилке или трухе, пробу берут с пло-
щадки в 0,25 ж2, как и вообще при почвенных раскопках.
Таких площадок — ям берут 4 в каждом биотопе, что
составит пробу в 1 м2.
Из взятых проб в полевых условиях моллюсков вы-
бирают из почвы или растительных остатков (трухи),
подсчитывают, этикетируют отдельно каждый вид и
200
затем фиксируют. Для удобства выборки мелких мол-
люсков рекомендуется просеивать всю пробу через сис-
тему из 2—3 сит.
Важно при количественных исследованиях знать чис-
ло живых экземпляров в пробе. Это легко сделать на
крупных видах. Мелких же определяют» так: помещают
их в чашку Петри на обильно смоченный лист фильтро-
вальной бумаги и покрывают другой половиной чашки
Петри. Через некоторое время моллюски начнут дви-
гаться. Отмачивать следует не более 4—6 часов. Проя-
вивших жизнедеятельность моллюсков тотчас же сле-
дует отобрать, сосчитать и записать, в противном слу-
чае от избытка влаги они могут погибнуть и тогда
сложится неверное представление о количестве живых
форм.
Для учета моллюсков на кустах, полукустарниках
и на деревьях или непосредственно под ними подсчиты-
вают' число моллюсков на нескольких кустах или полу-
кустарниках и на площади, занимаемой проекцией этих
растений. Одновременно подсчитывают число растений
каждого вида, растущих на данной площади (4, 16,
25 jw2). Подробно описана методика у Акрамовского
(1949). Полученные данные обрабатывают вариацион-
но-статистическим методом.
Голых слизней, обитающих на земле под листьями,
кусками коры и т. п., использующих в качестве убежищ
п трещины в почве, следует собирать на глубине 20--
30 см. Здесь чаще всего можно их находить. Слизни
вредят сельскохозяйственным растениям. Разработан-
ные приманочные способы борьбы с моллюсками могут
быть использованы и для сбора и учета их. Разбрасы-
вают в природных очагах (сырой луг, лес, парк) листья
лопуха, капусты или куски толстой коры. Лучше при-
манки разбрасывать после дождя, вечером, а утром
производить выборку слизней. В этикетках следует дать
характеристику микростаций, указать высоту (в горис-
той местности).
Моллюсков, взятых в различных условиях на кустах,
в траве или земле складывают в отдельные банки, ко-
робки или пробирки и фиксируют на месте. Для того
чтобы не повредилась раковина, их перекладывают ва-
той, мхом, листьями и в таком виде с этикеткой перено-
сят в лабораторию. В зависимости от задач исследова-
201
ния часть моллюсков доставляют живыми в лаборато-
рию для последующего изучения.
Слизней и других моллюсков, раковина которых не
может покрыть все мягкие части, фиксируют и сохра-
няют в спирте. Для того, чтобы моллюски при умерщ-
влении не втянули ногу в раковину, их предварительно
помещают в сосуд с охлажденной кипяченой водой; со-
суд плотно закрывают так, чтобы под крышкой или под
пробкой не оставалось воздуха. Приблизительно через
сутки-двое моллюски гибнут от поступления в ткани
большого количества воды. Далее такое животное фик-
сируют 54° спиртом, который через 3—4 дня заме-
няют 70°.
Можно умерщвлять моллюсков и выдерживая их в те-
чение суток в 0,1 %-ном водном растворе хлоралгидрата с
последующим перенесением в 0,5%-ный. После этого фик-
сируют указанным выше способом.
Моллюсков с хорошо развитой раковиной можно со-
хранять в сухом виде. Мелких моллюсков и моллюсков с
узким устьем тщательно просушивают на воздухе. Нужно
следить за тем, чтобы устье было свободно от слизи.
У крупных форм раковины освобождают от мякоти, для
этого их опускают на короткое время в крутой кипяток,
затем охлаждают, пинцетом вынимают мягкие части, про-
мывают раковину водой и просушивают. Доставленных в
лабораторию живых моллюсков, предназначенных для
наблюдений и дальнейших исследований их жизни, поме-
щают в специальные садки с влажной землей или торфом.
Кормят их капустой, морковью и другими растениями.
Более подробные сведения можно почерпнуть из работ
Акрамовского (1949), Лихарева и Раммельмейер (1952),
Лихарева (1962) и др. Эти работы служат и пособием для
определения моллюсков.
Мокрицы
Эти небольшие немногочисленные наземные предста-
вители равноногих ракообразных (Isopoda) встречаются
в лесах под поваленными деревьями и кучами дров, а в
населенных местах — в подвалах, сараях. Живут у осно-
вания стволов деревьев, в старых гнилых пнях, под кам-
нями, мхом, в лесной подстилке. Они здесь играют суще-
202
ственнуто роль в начальных этапах процесса разложения
растительных остатков.
Мокрицы — обитатели сырых затененных мест. Все
эти особенности определяют способ сбора и изучения их.
Собирают мокриц во всех указанных местах их обитания.
Следует иметь в виду, что некоторые мокрицы, живущие
в подстиле, обладают криптическими свойствами и могут
быть приняты за какой-нибудь другой предмет. Мокриц
пинцетом переносят в банку, куда вкладывают и этикет-
ку. Количественный учет живущих в земле видов прово-
дят обычными методами при общих учетах почвенных
животных. Собранный материал фиксируют в 70° спирте
или 3%-ном формалине. Можно сохранять мокриц и в
сухом виде в ватных слоях.
Многоножки
Многоножки держатся большей частью на земле под
камнями или в самом поверхностном слое почвы, а также
под корой старых пней. Однако не все группы многоножек
имеют одинаковый образ жизни. Широко распространен-
ные представители многоножек — симфилы встречаются
в почвах преимущественно пахотных, различных по меха-
ническому составу; не обнаруживают они заметной зави-
симости от реакции и влажности почвы.
Двупарноногие (Diplopoda) в основном сапрофаги.
Основными стациями этой группы являются леса. Поло-
жительная роль их заключается в том, что они влияют на
разрушение растительных остатков. Встречаются они и на
культурных полях — свекловичных и морковных планта-
циях, на посевах фасоли, в плодопитомниках и ягодниках,
в садах и оранжереях. Многопоясник (Polyzonium) встре-
чается в сырых местах в лесу, в парках, можно найти
свернувшиеся экземпляры их в углублениях и щелях поч-
вы. Некоторые Polydesmidae могут встречаться и в
ручьях.
Губоногие (Chilopoda) ведут хищнический образ жиз-
ни. к ним относятся Lithobiidae и Geophilidae. Обитают
губоногие под камнями, в трухлявой древесине, часто на
деревьях и кустарниках. Они хорошо переносят недоста-
ток влаги в почве и легко выдерживают суровый климат
с коротким периодом вегетации.
203
Во всех этих местах обитания и следует собирать мно-
гоножек. Небольшой лопатой или ботанической копалкой
раздвигают подстилку или разрыхляют почву в лесу, пар-
ках и садах, поднимают камни и собирают выявленных
представителей изучаемой группы. В гнилой древесине
многоножек удобнее собирать, пользуясь для ее разрых-
ления долотом. Можно использовать также специальные
ловушки; на пни и деревья накладывают клеевые ловчие
кольца, собирают волокушами. Рекомендуется собирать
весь материал, особенно при сборе губоногих, так как от-
дельные виды этой группы трудно различимы без специ-
ального микроскопического исследования.
Количественный учет многоножек проводят обычными
методами, принятыми для учета почвенных беспозвоноч-
ных. Можно учитывать многоножек и при общих количе-
ственных сборах, почвенных раскопках и т. д.
При сборе многоножек важно учитывать их биологи-
ческие особенности. Раздраженные и освещенные много-
ножки ведут себя по-разному: малоподвижные двупарно-
ногие скручиваются в спираль или кружочек и в таком
состоянии их легко собирать; губоногие, особенно
Lithobiomorpha, очень юркие, они сразу же прячутся в
щели или укрытия. Поэтому при сборе губоногих нужно
быть наготове: в левой руке держать пробирку, а правой
ловить животных, стараясь ухватить пинцетом их за пе-
реднюю часть тела не задевая заднюю, так как при при-
косновении к анальным конечностям животное легко от-
ламывает их.
Лучше всего собирать многоножек живыми и опреде-
лять сразу же после экскурсии, предварительно заморив
их хлороформом. Чаще всего материал фиксируют на мес-
те сбора. В этих случаях каждый экземпляр Lithobiidae
рекомендуется, помещать в отдельную маленькую про-
бирку, так как в фиксаторе у этих многоножек легко от-
рываются анальные конечности, имеющие большое сис-
тематическое значение. Других же (Geophilidae,
Cryptops, а также всех Diplopoda) можно фиксировать по
несколько штук и вместе.
Собранных многоножек обычно фиксируют в 70° спир-
те, но заспиртованные объекты сильно обезвоживаются,
твердеют, хитин становится хрупким, окраска меняется,
это затрудняет дальнейшую обработку материала. Для
фиксирования губоногих пользуются жидкостью Кёнике
204
(5 частей глицерина, 2 частц ледяной уксусной кислоты,
3 части воды). Однако в этом фиксаторе многоножки де-
лаются очень мягкими, некоторое части деформируются,
а окраска меняется на красную. Более удобна жидкость
Фолкмановой, состоящая из комбинации указанных двух
фиксаторов в следующих соотношениях: ледяной уксус-
ной кислоты 1 часть, глицерина 2 части, спирта 90 или 100°
3 части, воды 4 части. В этом фиксаторе животные не те-
ряют упругости, хитин не твердеет, форма не изменяется
и довольно хорошо сохраняется окраска. При фиксации
материала для более длительного хранения следует изме-
нить соотношение спирта и воды соответственно 4 : 3 или
5:2.
Сразу же по возвращении с экскурсии необходимо
сменить фиксатор, так как он загрязняется остатками
субстрата и защитными выделениями многоножек. Опре-
деляют материал под водой или фиксатором в чашке Пет-
ри или на часовом стекле. При определении пользуются
бинокуляром.
Для определения многих групп многоножек нужно го-
товить препараты тех или иных органов.
При изучении Julidae из двупарноногих необходимо
прибегать к особым методам препарирования самцов.
Необходимо предварительно 5—10 мин вымачивать ма-
териал в воде с несколькими каплями НС1. Можно соля-
ную кислоту заменить уксусной, но в этом случае мате-
риал нужно кипятить 3—5 мин в слабом растворе ее. Под
действием кислоты хитин становится мягким и объект
легко поддается дальнейшей обработке. Кратковременное
действие кислоты не влияет на окраску животных.
Затем приступают к изготовлению препаратов. Препа-
рируют сначала гоноподы, затем первые две пары конеч-
ностей, гнатохилярий и, наконец, тельсон. Отпрепариро-
ванные части промывают в воде, переносят кисточкой
через спирты, помещают в ксилол, а затем заключают в
канадский бальзам. Перед заключением гонопод в баль-
зам их следует тщательно расправить под микроскопом.
Приготовленные препараты снабжают этикеткой, а ос-
тавшиеся части тела расправляют в воде и переносят в
80° спирт.
Из губоногих следует препарировать только Geophi-
lomorpha. У них отделяют ротовые части и приготовляют
из них препарат. Поступают так: под водой или фиксато-
205
ром, острыми иглами, под ринокуляром отделяют ного-
челюсти, а потом вынимают ротовые части. Рекомендует-
ся препараты подкрасить плазматической краской
(слабым эозином или светлой зеленью). После окраски
препарат расправляют под микроскопом, переводят через
спирты возрастающей крепости, помещают в ксилол и за-
ключают в бальзам. Препарат снабжают этикеткой. Каж-
дую препарированную особь предварительно описывают,
зарисовывают голову и первый туловищный сегмент ла-
терально, дорзалыю и вентрально.
Почвенные клещи
Клещи, обитающие в почве и широко распространен-
ные во многих ландшафтных зонах, очень разнообразны
в биологическом отношении и многочисленны по количест-
ву видов и числу особей в популяциях. Одни живут в поч-
ве временно, являясь паразитами наземных животных,
другие — постоянно обитают в почвенной фауне, находя
здесь нужные для жизни и развития условия. Наиболее
обширной группой из всех клещей и всех членистоногих
почвы являются панцирные клещи — Oribatide. Места
обитания их — почва, лесная подстилка, пни и дупла де-
ревьев, мхи и лишайники, гнезда птиц и норы позвоночных.
В некоторых из названных стаций орибатеи составляют
до 80% всего населения беспозвоночных. На одном квад-
ратном метре площади насчитывалось 37 870 особей (Бу-
ланова-Захваткина, 1967). Орибатиды не требовательны
к внешним условиям, могут жить в сухой почве в жарких
районах и под слоем снега в зимний период. Они легко
переносят похолодание, непродолжительные затопления
водой — при весенних и летних разливах. Панцирные
клещи способны быстро впадать в оцепенение, но также
быстро могут переходить в активное состояние.
Распространены орибатиды на разных глубинах — от
50 до 250 см. В пахотных почвах состав клещей менее
разнообразен. Для значительной части видов наиболее
подходящими стациями служат леса, преимущественно
лиственные. В общем эти клещи предпочитают почвы за-
тененные и влажные, но лучше переносят высокую темпе-
ратуру (25° С) в сухом воздухе, чем во влажном. Боль-
шинство клещей — сапрофаги, но есть среди лесных видов
206
и микофаги, а среди живущих на пастбищах — копро-
фаги. х
Разнообразие экологических\групп, различный образ
жизни исключают возможность применения единой мето-
дики сбора и учета клещей. При всех типах изучения кле-
щей собирают в типичных для вида местах обитания. При
сборах эколого-фаунистического характера — для выяс-
нения видового состава и распределения отдельных ви-
дов по биотопам — тщательно подбирают участки сбора
в различных местах с учетом микроусловий, характера
растительных ассоциаций и рельефа.
При экологических, особенно биоценологических,
работах проводится количественный учет — берутся
стандартные пробы. Чаще всего такой пробой служит
почвенный образец 1 дм3, который берут специальным
прибором (см. выше), а в некоторых случаях и в опреде-
ленное время суток. Е. М. Буланова-Захваткина пользо-
зовалась прибором, позволяющим брать почвенный мо-
нолит в 1 дм3; Эглитис брал пробу 0,5 л земли в банки
или железные коробки.
При необходимости учета распределения клещей по
горизонтам взятый монолит разделяют по слоям, поме-
щают в коробки, банки или плотные мешочки, переносят
в лабораторию и хранят во влажном состоянии до обра-
ботки, снабдив пробу этикеткой.
Выборку клещей осуществляют одним из следующих
способов.
Ручной способ. Кусочки почвы (мха) помещают в
чашки Петри и разбирают под лупой препаровальной иг-
лой. Так по частям разбирают всю пробу.
Флотация. Кусочки пробы переносят в воду. Клещи
при этом всплывают на поверхность, здесь их собирают
кисточкой.
Выгонка клещей при помощи аппарата Тулгрена
(стр. 136). При этом пробу рекомендуется держать в ап-
парате 4—5 суток. Для ускорения выгонки клещей при
большом числе проб берется несколько таких аппаратов,
размещенных на одной стойке. Пробирка или банка, под-
ставленная под узким отверстием воронки, заливается
фиксатором.
Фиксируют орибатид обычно в 70° спирте, но приме-
няют и другие фиксаторы: 1. Жидкость Кёнике (5 частей
глицерина, 2 части крепкой уксусной кислоты и 3 части
207
воды) мацерирует и расправляет клещей. 2. Жидкость
Удеманса (87 частей 70°/спирта, 8 частей крепкой уксус-
ной кислоты и 5 чаете}! глицерина) просветляют и рас-
правляют клещей. 3. ^Жидкость Карнау (6 частей абсо-
лютного спирта, 3 цДсти хлороформа и 1 часть ледяной
уксусной кислоты) применяется при гистологическом
изучении. 4. Молочная кислота используется как фикса-
тор, но*в ней можно и сохранять материал.
Изготовляют микроскопические препараты так же как
и для других групп членистоногих (стр. 293, 338, 355).
Но для просветления твердого панцыря клещей проводят
через 15%-ный раствор едкого кали или молочную
кислоту.
Лабораторное разведение. Орибатей разводят для вы-
яснения питания, жизненных циклов, характера размно-
жения и других специальных вопросов. Для массового
содержания пользуются цветочными горшками и бюкса-
ми, куда клещей переносят вместе с субстратом. Для ин-
дивидуального разведения пользуются камерами разных
типов. Обычно на предметном стекле прикрепляют вос-
ковой кружок диаметром 15 мм, высотой 5 мм, сверху
прикрывают батистом или тонким мельничным газом.
Камеры и бюксы помещают в эксикаторы, где поддер-
живается влажность 100%. Пищей служит субстрат, но
Буланова-Захваткина успешно культивировала клещей
рода Galutnna и Oppia nitens на ломтиках картофеля.
Подробные сведения можно почерпнуть в приведенной
специальной литературе.
Низшие бескрылые насекомые
Первичнобескрылые являются наиболее многочис-
ленной группой насекомых почвы. В районе Канева их
находили в почве до 70 000 особей на 1 м2 (Крышталь,
1956). К первичнобескрылым насекомым относятся сле-
дующие отряды: ногохвостки, бессяжковые, двухвостки и
щетинкохвостые. За редким исключением, они обитают в
почве и лесной подстилке.
Ногохвостки (Collembola) — мелкие, чрезвычайно
распространенные насекомые. Они представляют доми-
нирующую группу среди насекомых почвы. Соотношение
их легко видеть из таких данных: из общего числа насе-
комых, находимых в почвенных пробах, 97%, составляют
208
ногохвостки. В альпийских почвах Францель (1936) на-
считывал ногохвосток около 45Q00 экземпляров на 1 м2.
В условиях Латвийской ССР в 1 м2 почвы В. К. Эглитис
(1954) выловил 143 000 экземпляров насекомых, из них
140 000 приходилось на долю ногохвосток, остальные от-
носились к другим группам. В посевах Многолетних трав
число ногохвосток доходило до 59 000 (в среднем 39 850).
Пищей ногохвосткам (по Беккеру) служат водоросли,
грибы, бактерии, разлагающиеся части различных орга-
низмов. Некоторые питаются тканями высших растений.
Отмечено свыше 20 видов вредных ногохвосток (Щего-
лев) .
Отдельные виды (Hypogastrura socialist часто встре-
чаются на снегу. В Латвийской ССР массовое появление
этого вида Эглитис наблюдал в 1952 г. В том же 1952 г.
мы наблюдали ногохвосток зимой в Карпатах. Появле-
ние на снегу объясняют (Мельниченко, 1935) положи-
тельным гелиотропизмом у зимних форм насекомых.
Насекомые эти имеют нежное тело, быстро двигаются,
что в значительной мере затрудняет их сбор.
Собирают ногохвосток разными способами. С расте-
ний собирают энтомологическим сачком или мягкой кис-
точкой, смоченной в спирте. Лучшие результаты дает сбор
с помощью эксгаустеров и фототермоэклекторов. Приме-
няют обычный эклектор, которым пользуются для извле-
чения беспозвоночных из почвы. Лампу сначала поме-
щают подальше от объекта и постепенно приближают к
последнему, чтобы предотвратить субстрат от очень быст-
рого высыхания и дать возможность насекомым постепен-
но переместиться с поверхности в более глубокие слои.
Длительность экспозиции колеблется от нескольких ча-
сов до нескольких суток и зависит от размеров пробы и
степени увлажненности почвы. Под воронку ставят про-
бирку с 70° спиртом. При пользовании эксгаустером, для
предохранения ногохвосток от повреждений, в последний
помещают пробирку со спиртом.
Наиболее простым и удобным в полевых условиях яв-
ляется метод флотации. В широкогорлую бутылку нали-
вают до половины воды. Постепенно высыпают в нее ис-
следуемую пробу почвы. Бутылку вращают, наклоняют,
затем доливают воду до горлышка и насекомые всплы-
вают на поверхность. С небольшой площади в горлышке
легко собрать их эксгаустером или сеточкой соответст-
209
вующего размера. Эту процедуру повторяют до тех пор,
пока не будут извлечен^! все насекомые.
Консервируют и сохраняют ногохвосток в 70° спирте
(100 мл 95° спирта +39 мл воды). Пробирки плотно за-
крывают ватным тампоном так, чтобы между ним и спир-
том не оставалось пузырьков воздуха.
Бессяжковые (Protura). Мелкие (0,5—1,5 лш) насеко-
мые, известно около 80 видов, встречаются во всех кон-
тинентах. В почвах Средней Азии в окрестностях Таш-
кента (Кирьянова, 1936) этих представителей обнаружено
на виноградниках 90 экземпляров, на целине 360 эк-
земпляров, на хлопковом поле 1040 особей на 1 м2. Живут
в различных горизонтах, встречаются на глубине до
100—НО см. В буковых лесах окрестностей Вены находи-
ли (Шаллер, 1949) 17 особей в 1 дм3 пробы. Роль их как
компонентов почвенной фауны еще не изучена. Живут в
хвойных и лиственных лесах, под корнями, под отстаю-
щей корой старых пней, под мхом — в местах, богатых
органическими остатками и с достаточной влажностью.
Встречаются в верхних слоях почвы (до 8 см); на ее по-
верхность не выходят. Зимуют в почве и подстилке или
под мхом. Этих мелких насекомых собирают во всех мес-
тах их обитания с помощью кисточки, смоченной в спир-
те, и переносят в пробирку с 90° спиртом. Массовый сбор
проводят следующим образом. Берут пробы в 1 дм3 земли
или лесной подстилки в различных местах и помещают их
в эклекторы, где насекомые извлекаются автоматически.
Применяют эклекторы типа Берлезе — Тулгрена. По мере
высыхания материала насекомые опускаются вниз и па-
дают в соответствующие сборники-пробирки с 90° спир-
том.
Точное определение возможно только по микропрепа-
ратам. Для изготовления такого препарата материал из
спирта переносят на короткое время (на 10 мин) в воду
на часовое стекло, потом доливают несколько капель
10%-ной КОН. Через полчаса пипеткой переносят на но-
вое стекло с водой, где оставляют на 10—15 мин. Затем
переносят на предметное стекло, накрывают покровным
стеклом и обычным способом (см. выше) заключают в
желатин или в канадский бальзам.
Двухвостки (Diplura). Многочисленная в видовом от-
ношении, но малоизученная группа. В почве встречаются
в большом количестве. В. К. Эгдитис указывает, что в па-
210
хотном поле в Латвии находили до 2400 особей на 1 м2.
Живут эти насекомые в укрытиях (в почве, под камня-
ми, мхом, под опадом, в пнях). Биология их изучена сла-
бо. Проявляют себя как троглобионты, нигде не встре-
чаются, кроме своего логовища. Некоторые Campodea
живут на растениях.
Собирают кисточкой, смоченной в спирте. Учитывая,
что эти насекомые стараются укрыться от света, нужно
смоченную кисточку и пробирку со спиртом всегда иметь
наготове. Подняв камень или другой предмет, кисточкой
ловят насекомых. В спирте у них могут отламываться
щетинки и конечности, поэтому рекомендуется в каждую
пробирку класть насекомых одного вида, чтобы можно
было определить, какому виду принадлежат отломанные
части. При массовых сборах пользуются эклектором (см.
выше). Для определения приготовляют микропрепарат,
как указано выше (см. стр. 210).
Щетинкохвостые (Thysanura) представлены двумя
резко отличающимися строением, образом жизни и осо-
бенностями экологии группами — Machilidae и Lepismi-
dae. Некоторые представители первой группы живут в
горах высотой до 2400 м над уровнем моря. Днем насе-
комые прячутся под камнями и другими предметами.
Собирают их при помощи пробирки. Пустой пробиркой
накрывают насекомое и стряхивают его в пробирку, в
которую затем наливают фиксатор или просто закрывают
пробирку пробкой, и хранят объекты живыми до исследо-
вания. Для воспитания пользуются банкой, в которую по-
мещают небольшие камни, куски коры, покрытые лишай-
ником. Время от времени опрыскивают водой, а потом
меняют куски коры на свежую с кормом. Собранных на-
секомых консервируют в 90° спирте. Рассматривают под
лупой объекты в спирте.
ИЗУЧЕНИЕ БЕСПОЗВОНОЧНЫХ
ПОВЕРХНОСТИ ЗЕМЛИ
И РАСТИТЕЛЬНОГО ПОКРОВА
ОБЩИЕ ЗАМЕЧАНИЯ
Беспозвоночные, а также их личинки, живущие или
питающиеся на поверхности земли, в травостое, на де-
ревьях и в их тканях или за счет других животных (хищ-
ники и паразиты), представляют большое разнообразие
жизненных форм с различными экологическими связями
в сообществе и образуют различные биоценотические
группировки. Изучение их возможно при выполнении раз-
личных типов исследований на разных уровнях с приме-
нением самой разнообразной методики. Общими програм-
мными моментами, выполняемыми поэтапно, можно счи-
тать следующие.
1. Изучение видового состава беспозвоночных вместе
с основными видами растительного покрова, прежде все-
го эдификаторами. Сбор материала осуществляется мар-
шрутными и стационарными методами. Производится
массовый сбор фактического материала, включая имаго
и другие фазы развития; собираются образцы жизнедея-
тельности беспозвоночных (повреждения, экскременты,
характер ходов, галлы, мины и т. п.); учитываются перио-
дические явления; выясняются жизненные циклы. Нако-
нец, выясняется поедание их позвоночными животными.
2. Количественный учет беспозвоночных, изучение из-
менения численности под влиянием различных факторов,
изучение обратных связей — влияния животных на смену
растительных компонентов биоценозов и на свойства поч-
вы. В комбинации с другими методами и типами исследо-
212
Ванйя количественный учет проводится также при выяс-
нении структуры и состава биоценоза и других биоцено-
тических группировок, при изучении суточной и сезонной
миграции, при изучении связей отдельных видов насеко-
мых с растениями — главнейшими образователями рас-
тительного покрова, при изучении услцвий, влияющих на
периодическую продуктивность и круговорот веществ в
биоценозах. Количественный учет дает возможность вы-
яснить соотношение вредной и полезной деятельности жи-
вотных, поэтому имеет практический интерес.
3. Изучение циклов развития отдельных видов членис-
тоногих и фенологических явлений в их жизни.
Исследования рекомендуется начинать с фитофагов.
Прежде всего это массовые компоненты всякого сообще-
ства, деятельность которых прямо отражается на первич-
ной продуктивности растительной массы — определяюще-
го звена в сообществе. Кроме того, на фитофагах как мас-
совых видах хорошо изучать хищников и паразитов, жи-
вущих- в них или за их счет. Для удобства ниже будем
рассматривать население отдельно травяного покрова и
древесной растительности.
УЧЕТ НАСЕЛЕНИЯ ТРАВЯНОГО ПОКРОВА
К биотопам с травяным покровом, образующим мно-
жество микроусловий, относятся естественные комплексы
растительных сообществ (степи, луга), травяной ярус в
лесах, а также созданные деятельностью человека вто-
ричные биоценотические группировки (посевы на полях).
Характер животного населения названных растительных
группировок складывается из связанных с отдельными
видами растений насекомых — фитофагов, из привлечен-
ных сюда биотическими и микроклиматическими условия-
ми различных беспозвоночных — полифагов, из парази-
тов и хищников, связанных с комплексом фитофагов,
детрито- и копрофагов. Виды этого комплекса беспозво-
ночных, таким образом, являются компонентами биоце-
нозов и составляют различные экологические группы.
Все это определяет методику изучения.
Учет населения травяного покрова любого типа про-
водят фотоэклектором, биоценометром, всасывающими
аппаратами, кошением сачком и непосредственными ви-
зуальными наблюдениями и подсчетами.
213
Выборка и учет насекомых при помощи
фотоэклектора
Метод учета фотоэклектором основан на принципе ис-
пользования положительного фототаксиса у насекомых.
Но не все насекомые положительно реагируют на свет
и не все положительно фототаксичные формы могут под-
няться и попасть в банку, следовательно, метод имеет ог-
раниченное применение. Хорошие результаты применяя
фотоэклектор получают при количественном учете отдель-
ных групп насекомых, при учете, например, выхода насе-
комых из зимовки (прибор ставят до начала выхода и
снимают в конце) и при учете влияния агротехнических
мероприятий на вредителей. Может также применяться
в комбинации с другими методами при биоценологиче-
ских исследованиях.
Учет проводят следующим образом. Выбирают пло-
щадку на подлежащей изучению территории. Берут фото-
эклектор в вытянутые руки, осторожно подходят к ис-
следуемому месту (лучше против солнца) и опускают
прибор на избранную площадку. Если применяют фото-
эклектор с ручкой, то издали, осторожно, идя против
солнца, набрасывают его на изучаемый участок и остав-
ляют на некоторое время. Во время этого перерыва от-
мечают состояние погоды, и данные заносят в дневник.
Описывают также кратко растительный покров вокруг
площадки по методике, указанной в разделе «Изучение
растительности». Фотоэклектор можно держать на иссле-
дуемом участке от нескольких минут до нескольких часов.
Можно даже оставлять его на ночь. Рекомендуют также
(Полтавская опытная станция) ставить фотоэклектор в
поле с вечера или ночью, когда насекомые мало подвиж-
ны. Это даст возможность учесть почти без потерь всех
насекомых. Собранных в банку насекомых разбирают,
как обычно, подсчитывают и записывают в карточку сле-
дующей формы.
Карточка учета насекомых фотоэклектором
№-----Название биоценоза------------------ Дата-------------
Система фотоэклектора------------------Размеры -------------
Время закладки---------------- Время снятия-----------------
Характер метеорологических условий —------------------------
Характер растительного покрова ------—----------------------
214
Название насекомых Количеств о Название насекомых Количество
Учет беспозвоночных при помощи биоценометра
Для учета животных пользуются одним из описанных
выше типов биоценометра (см. стр. 128). Приводим
описание работы с биоценометром Станчинского \
Собранный биоценометр берут за края верхней плос-
кости или за ручки, поднимают на вытянутых руках вверх
и опускают (накладывают) на выбранный для изучения
участок. Опущенный биоценометр прикрывает и изолиру-
ет определенный участок земли. Прибор прижимают
плотно к земле и приступают к выборке насекомых. Сни-
мают боковые дверцы и вдвигают раму с рукавом (см.
рис. 50), просовывают руку и начинают сбор. Сначала
вылавливают из биоценометра летающих насекомых. Для
этого подносят банку (морилку) к насекомым, сидящим
па растениях или на стенках биоценометра * («заморен-
ные» насекомые падают в морилку), затем снимают верх-
нюю раму, не перенося прибора, собирают спрятавших-
ся насекомых с растений и с поверхности земли. Бегаю-
щих насекомых (жуков и др.) ловят руками или пинцетом,
мелких — смоченной спиртом кисточкой или эксгаустером
и переносят в пробирку со спиртом.
После того как все быстробегающие животные соб-
раны, обрезают вокруг биоценометра землю, удаляют
биоценометр и продолжают обследовать изучаемую пло-
щадку. Сначала срезают траву и переносят ее в банки
или в мешочки для детального .последующего анализа в
лаборатории; собирают насекомых, обнаруженных у кор-
ней, в отдельные пробирки; выкапывают дернину и пере-
носят ее также в банку или мешочек для детального изу-
чения. Перебирают землю на этой площадке на глубине
10 см, собирают обнаруженных животных, фиксируют их
и снабжают этикеткой. Так изучают второй, третий и пос-
ледующие слои. Обнаруженных насекомых учитывают по
каждому слою отдельно (см. «Изучение почвенной фау-
1 При пользовании другими биоценометрами следует руковод-
ствоваться замечаниями, приведенными при описании этих приборов.
215
ны»). После обработки материала все данные заносят в
дневник или на карточку по следующей форме.
№-----Название биоценоза---------------------Дата------------
Время взятия пробы--------Характер растительного покрова-----
--------------------Метеорологические условия----------------
Способ взятия пробы—---------------
Количество
Название
животных
на расте- на гозерх-
ниях ности
зсмл I
в земле
на корнях
Примечание
2 3
Выборка и сбор насекомых при помощи
всасывающих аппаратов
Джонсон, Саутвуд и Энгуэлл (1955) предложили для
сбора насекомых в травяном покрове аппарат, в основу
которого положен ручной электрический пылесос, соеди-
ненный с металлическим барабаном (длиной 25 и диамет-
ром 14 см), внутри которого укреплен мешочек из нейло-
лона для сбора животных. От крышки барабана отходит
гибкая трубка, снабженная каучуковым наконечником.
Вес аппарата 7 кг. При сборе насекомых металлический
цилиндр (высотой 30 и диаметром 30 см) ставят в траву,
аппарат пускают в ход, а сопло трубки передвигают
внутри цилиндра во все стороны. Процедура продолжает-
ся 2 мин, и после двухминутного перерыва ее повторяют.
Этим способм достигается богатый вылов обитателей рас-
тительности (до 66,7—100%) из разных систематических
групп.
Для сбора мелких насекомых с деревьев Кеннард и
Спенсер (1955) рекомендуют аппарат, состоящий из руч-
ного пылесоса и длинной гибкой трубки, заканчивающей-
ся воронкой. С его помощью можно собирать насекомых
с деревьев высотой 7 it и более.
Для ускорения и облегчения сбора насекомых (крово-
сосов) под колоколом Мончадского, для выборки живых
насекомых и клещей из субстрата и т. п. предлагается
216
йсйдЛЬзовать всасывающий коллектор автомашины типа
ГАЗ-51, ГАЗ-63, а при необходимости и ГАЗ-69 (Алек-
сеев, 1962). Трубка комароловки присоединяется к шлан-
гу, соединенному со всасывающим коллектором автома-
шины (для ГАЗ-61 и ГАЗ-63 — через патрубок стекло-
очистителя), что значительно ускоряет и неизмеримо об-
легчает процесс сбора насекомых. В трубке комароловки
должно быть широкое конусообразное углубление, затя-
нутое марлей, в противном случае отверстие будет быстро
забито притянутыми насекомыми. Всасывающий коллек-
тор можно использовать и для выборки блох из субстра-
та. Насекомых собирают в конические колбы. Чтобы из-
бежать попадания пыли в коллектор, между ним и колбой
монтируется промежуточная емкость, на дно которой на-
лито небольшое количество автола, хорошо поглощающе-
го частицы пыли.
Учет населения травы методом кошения
энтомологическим сачком
Метод кошения сачком как метод количественного
учета наиболее старый и вследствие своей простоты наи-
более распространенный. Кошение в сочетании с другими
методами позволяет выяснить видовой состав членисто-
ногих, суточную и сезонную динамику, отношение насе-
комых к различным факторам среды. Видовой состав на-
секомых, собранных кошением в определенных стациях,
значительно обширнее, чем в сборах биоценоматром
(рис. 91).
Существуют сачки различных систем, имеются различ-
ные приспособления к ним, а при учете применяется раз-
личное количество взмахов. Колокольчикова и Перлова
(1954) считают, что относительная добычливость сачка
повышается при уменьшении количества взмахов, и реко-
мендуют делать 25 взмахов. Это особенно относится к
активным формам. Для малоактивных форм количество
взмахов сачком не влияет на точность учета. Бируля
(1957) считает усталость сборщика главной причиной
уменьшения добычливости. Он рекомендует уменьшить
количество взмахов или брать пробу в несколько прие-
мов. Подтверждается вывод о том, что большая высота и
густота травостоя уменьшает добычливость сачка. Име-
217
ет значение Также й материал, из которого он сшит. До-
бычливость шелкового сачка выше, чем бязевого, но для
разных групп неодинакова.
Единодушны все энтомологи в необходимости стандар-
тизации сачка и способов кошения им, но каждый предла-
Рис. 91. Схема кошения сачком (заштрихована
область, не захваченная сачком) (по Гилярову)
гает свой стандарт. Иванова (1950), например, предла-
гает производить 200 ударов, ширина взмаха должна рав-
няться 1 м\ взмахи производятся в одну и другую сторону,
но всегда по новому месту; следует стремиться к сокра-
щению времени на производство 200 ударов, чтобы избе-
жать утечки беспозвоночных. На основании личного
опыта мы рекомендуем принять за единицу изучения
100 взмахов, взятых в несколько приемов (по 20—
25 взмахов) сачком с диаметром кольца 30 см при длине
палки 1,5 м. Следует помнить, что индивидуальные осо-
бенности производящего кошение могут отразиться на
результатах его, поэтому, как общее правило, все пробы
для сбора сравнительного материала следует брать одно-
218
му человеку и одним типом сачка. При специальных ис-
следованиях, например для изучения суточной миграции
кошения производить через каждые 1—2 часа.
Метод кошения энтомологическим сачком для количе-
ственного анализа можно считать универсальным, но он
имеет ряд недостатков. Прежде всего он* является отно-
сительным, так как не обеспечивает вылавливания всего
животного населения обследуемой растительной группи-
Рис. 92. Подготовка к выборке насекомых из сач-
ка. А — после кошения; Б — засыпка пробы в
банку
ровки, хотя, по словам Шелфорда, сборы кошением и
биоценометром при некоторых условиях оказываются
сходными. По Смиту (1928), сбор 50 ударами сачка диа-
метром кольца в 30 см при кошении соответствует числу
животных на пробной площадке в 1 ж2. С другой стороны,
этот метод мало применим к некоторым видам животных.
В отношении некоторых групп животных нужно приме-
нять для сравнения и другие методы. Например, для пше-
ничного трипса (взрослых и личинок) —метод подсчета
на одном колосе или на 10 колосьях (см. стр. 307), для
вредной черепашки и хлебных жуков наиболее точным
методом количественного учета следует считать метод
подсчета на единицу площади.
Техника работы. Выбирают типичный для данной
местности участок, становятся так, чтобы при кошении
219
при изучении комплексов насекомых, экологии и при изу-
чении вредителей (или энтомофагов) и опылителей. При
этом выявляется видовой состав населения и количествен-
ное соотношение между видами, а также характер связи
с растениями того или иного вида. Методика учета насе-
ления травянистых растений разработана и впервые при-
менена А. П. Владимирским в 1921 —1922 гг. В настоящее
время разработаны и небезуспешно применяются (в част-
ности, и автором пособия) различные модификации, ко-
торые описаны ниже.
Метод стационарного учета (по Владимирскому, с
изменениями) сводится к следующему. Намечают нес-
колько экземпляров растений. Систематически, через оп-
ределенные промежутки времени осторожно подходят к
растению и тщательно осматривают его, точно регистри-
руя все выявленные виды. Осмотр проводят строго по
частям, начиная сверху. Осматривают сначала цветки,
верхние листья, затем веточки и так лист за листом, ве-
точка за веточкой до самой земли. Осматривать растение
следует со всех сторон, не прикасаясь к нему. Желатель-
но зарисовать некоторые положения насекомых на рас-
тении в полевую книжку и обязательно зарисовать схему
растения. Насекомые с растения не снимать — дать им
возможность естественно развиться. Наблюдая и записы-
вая результаты изо дня в день, мы получаем возможность
изучать естественное развитие и изменение фауны во вре-
мени. Пользование этим методом требует хорошего зна-
ния фауны района. Нужно отметить, что мелкие вреди-
тели, а также скрытоживущие остаются при таких наблю-
дениях вне поля зрения исследователя. Поэтому метод
применим только при изучении открытоживущих, хорошо
заметных на растении насекомых.
При другой модификации метода растение осторожно
срезают ножницами по частям до самого корня и быстро
переносят в банку или мешок из плотной материи, причем
банку каждый раз плотно закрывают бумагой. Но при
этом способе трудно добиться точных результатов, так
как насекомые слетают с растения или падают.
Для того чтобы уменьшить утечку насекомых с изу-
чаемого растения, рекомендуют натянуть на растение
мешок из плотной белой материи до самого корня, сре-
зать растение и затянуть края мешка. Растение, таким
образом, вместе с обитаемыми на нем насекомыми будет
.222
заключено в мешок. Добытый материал снабжают эти-
кеткой и доставляют в лабораторию для анализа и изуче-
ния. Этим способом, при некоторой осторожности, можно
получить точные данные, так как почти ни одно насекомое
не ускользает. Этот метод применим для, изучения мало-
подвижных и скрытоживущих насекомых и дает более
или менее точные данные. Недостаток его в том, что,
пользуясь им, мы не имеем возможности длительно сле-
дить за судьбой насекомых именно данного растения.
Кроме того, трудно выяснить и роль насекомых на изу-
чаемом растении. Указанными выше методами изучалось
население листьев, плодов и других частей растения мно-
гими авторами (Владимирский, Калинникова, Устинов
и др.).
Мы пользовались комбинацией этих двух методов и
получили хорошие результаты. Нами изучались разные
растения и в разное время. Приведем этот вариант.
Осматривают растение на расстоянии (можно пользо-
ваться биноклем), замеченных насекомых записывают в
полевую книжку с указанием их количества и деятельно-
сти, потом, приблизившись, осматривают листья, ветки,
пользуясь лупой, и каждый раз записывают насекомых.
Так постепенно осматривают все растения и записывают
все данные. Осмотрев одно растение, переходят ко второ-
му, третьему и т. д. Прямыми наблюдениями определяют
и деятельность выявленных насекомых. Затем берут ос-
мотренные растения для лабораторного анализа и выяв-
ления скрытоживущих насекомых. Для этого растение
срезают и переносят в банку или мешок из плотной ма-
терии, как указано выше, снабжают этикеткой, завязы-
вают и доставляют в лабораторию или на базу для
анализа.
Анализ растения. Для анализа берут обычно специ-
альные пробы, например, при изучении вредителей.
В этих случаях для выяснения количества и характера
связей на изучаемом участке берут пробу в 100 растений
(по 25 из 4 мест) и переносят в лабораторию.
Растения, собранные при разных (специальных) ис-
следованиях или доставленные для детального изучения,
в лаборатории вскрывают и подвергают тщательному
анализу. Подсчитывают стебли, осматривают каждую
ветку, обнаруженные крупные виды животных снимают и
фиксируют. Собрав с поверхности хорошо видимых насе-
223
комых, на бсёХ стеблях раскрывают или отрывают
листья, чтобы обнаружить личинок (или пупарии), рас-
полагающихся за влагалищем листа. После этого скаль-
пелем разрезают растение вдоль и вскрывают его, с по-
мощью лупы осматривают кусочки и собирают скрытожи-
вущих беспозвоночных, а также личинок, куколок и яйца
насекомых. Обнаруженных насекомых и клещей осто-
рожно извлекают и подсчитывают, вычисляют процент
повреждений: подсчитываются стебли, включая и прида-
точные (у злаков), результаты записывают в дневник или
карточку. Не поддающихся точному определению личинок
помещают в садки для воспитания и выведения из них
имаго или фиксируют их в 70° спирте и в таком виде сох-
раняют до дальнейшего определения. Каждую пробу ана-
лизируют, отдельно фиксируют, записывают и сохраняют.
Для воспитания личинок существует много способов.
Таленхорст (1955) предложил небольшой портативный
прибор, который состоит из склянки объемом 100 мл, на-
полненной водой. На склянке укрепляют деревянный
круглый брусок с отверстием в центре, соответствующим
диаметру горлышка склянки. Отверстие прикрывают лис-
том фильтровальной бумаги и через него пропускают ве-
точку кормового растения. Сверху на брусок одевают
цилиндр, открытый с обоих концов, высотой 10 см, диа-
метром 6 см. Верхнее отверстие цилиндра прикрывают
марлей, прихваченной толстой резинкой.
Анализом листьев и стеблей широко пользуются в
прикладной энтомологии. Результат учета населения
растений заносят в дневник или на карточку по следую-
щей форме.
Карточка анализа растений
№-----Название биоценоза-----------------Время-----------
Дата ------------------ Характеристика образца-----------
Название растения-------------- Цель анализа ------------
Название насекомых Фаза Количе- ство На какой части растений Характер связи Частота встречае- мости Примеча- ние
224
Учет насекомых культурных полей
в период уборки урожая
Современная техника уборки урожая дает возмож-
ность использовать ее для учета насекомь/х. Метод пред-
ложен Г. Я. Бей-Биенко.
Учет насекомых при уборке лобогрейкой. Для учета
насекомых пользуются зерноулавливателем — приспособ-
лением, устраняющим потери зерна. Тщательно очистив
зерноулавливатель от зерна и примесей, в том числе и от
насекомых, необходимо прогнать лобогрейку с нормаль-
ной скоростью на 60 м при ширине захвата 1,75 ж, при
этом площадь скошенной пшеницы будет равна 100 ж2.
После остановки лобогрейки содержимое зерноулавлива-
теля перекладывают в мешочки, замаривают в морилках
и доставляют в лабораторию для анализа. Выделяют из
зерна всех насекомых и прочих беспозвоночных (круп-
ных— обычным путем, мелких — при помощи бинокуля-
ра). Обязательно нужно выбирать как взрослых насеко-
мых, так и их личинок, куколок и яйца.
Учет насекомых при уборке комбайном. Во время ра-
боты комбайна берут в бункере из разных мест и разной
глубины несколько килограммов зерна. Пробу взвешива-
ют и переносят в лабораторию для анализа. Разбирают
пробу способом, указанным в предыдущем случае, без
замаривания, так как все активные формы здесь будут
убиты. В шнеке, где зерно еще не отделено от примесей,
берут пробу во время остановки комбайна таким же спо-
собом, как и в бункере. Пробу очищают и взвешивают.
Вес зерна позволит определить площадь, с которой было
получено данное количество зерна, если известен урожай
с гектара. Учет не точный, но дает возможность су-
дить о роли этих машин в уничтожении тех или иных
вредителей. Это не относится к раздельному способу
уборки.
Сравнивая пробу, взятую в шнеке, с пробой, взятой в
бункере комбайна, можно определить количество насеко-
мых, уничтожаемых комбайном. Определяя при уборке
урожая количество насекомых с каждого поля отдельно,
можно составить картину плотности популяции в раз-
ных полях севооборота. Результат учета заносят на кар-
точку.
8—1867
225
Карточка учета насекомых при уборке
Район
Хозяйство
Культура
(характеристика полей севооборота) -------------------------------
Способ взятия пробы--------------------------------------—
t
Е
Название
животных
Количество
Приме-
чание
2
I поле II поле III поле IV поле
УЧЕТ И ИЗУЧЕНИЕ НАСЕКОМЫХ — ОПЫЛИТЕЛЕЙ
РАСТЕНИЙ
Посетителями цветов являются представители многих
отрядов насекомых (рис. 93). Многие из них — опылите-
ли, а некоторые насекомые, имея на теле длинные волос-
ки, хорошо удерживающие пыльцу, способствуют пере-
крестному опылению растений. Ряд насекомых питается
Рис. 93. Насекомые-опылители
пыльцой и другими частями цветка, но для многих видов
антофилов нектар является основной пищей. Многим па-
разитическим перепончатокрылым и двукрылым нектар
служит дополнительным питанием, обеспечивающим до-
зревание половых продуктов и удлинение-жизни имаго.
226
Пчелиные
Среди насекомых, играющих большую роль в опыле-
нии многих диких и культурных растений, пчелиные за-
нимают первое место. Они встречаются повсюду, где есть
цветущие растения. Даже в степи с относительно бедной
растительностью нами выявлено на 35 видах растений бо-
лее 90 видов пчел.
Многие виды пчелиных связаны ^определенными рас-
тениями, отдельные группы которых в разных микроусло-
виях вегетируют не одновременно и цветение растений
происходит в растянутые сроки. Сроки цветения кормо-
вых растений и определяют период активной деятель-
ности специализированных пчелиных.
Кроме узких олигофагов, имеется немало видов, пи-
тающихся на цветах многих растений. Переходя с одного
вида растения на другой, по мере начала их цветения, эти
насекомые могут быть активными довольно продолжи-
тельное время. Энтомофильные растения могут иметь ог-
раниченное число опылителей строго определенных видов,
но большая часть растений посещается и опыляется мно-
жеством видов пчелиных. Кроме пчелиных, опылителями
выступают представители многих других отрядов (см.
ниже).
Наблюдения над опылителями показали, что виды ан-
тофильных насекомых отличаются разными сроками по-
явления и неодинаковой продолжительностью лета. Раз-
лична активность этих насекомых и в течение суток, а
также различен состав опылителей на отдельных видах
растений. Все это необходимо учитывать при выборе пу-
тей, способов и приемов изучения.
Исследование опылителей предполагает проведение
таких работ: выявить видовой состав их на различных ви-
дах растений; выяснить растение, цветки которого посе-
щает один и тот же вид насекомого; определить частоту,
с которой насекомое данного вида посещает цветки
разных видов растений; установить время наибольшей ак-
тивности опылителей в течение дня.
Сбор опылителей. Насекомых-опылителей проще всего
собирать на цветках чистых посевов или зарослей рас-
тений кошением сачком и другими способами, применяе-
мыми для сбора различных насекомых. Это дает воз-
можность на протяжении короткого времени собрать не-
8*
227
мало видов насекомых, среди которых будут и опылители
данной культуры, и установить соотношение отдельных
групп; если учет производили кошением сачком, то можно
подсчитать и количество насекомых на определенное чис-
ло взмахов. Но при этом методе не всегда можно устано-
вить, все ли опылители в момент кошения посещали рас-
тение и являются ли они опылителями того растения, на
котором проводили кошение. В связи с этим рекомендуют
собирать насекомых-опылителей с отдельных цветков с
помощью небольших сачков из марли или газа (диаметр
кольца такого сачка равен 12—15 см, длина палки —
30—50 см). С каждого вида растений насекомых собира-
ют в отдельную морилку и снабжают этикеткой.
С отдельных цветков собирают пчел также небольшим
сачком, но можно ловить на цветках и пробиркой. Пос-
ледней накрывают насекомое, берут левой рукой цветок
за цветоножку и проталкивают им пчелу в перевернутую
пробирку, пчела падает на дно, пробирку закрывают
пробкой, а цветок отбрасывают.
Мелких опылителей Новицкий (1956) рекомендует со-
бирать с помощью эксгаустера. Затем насекомых из
сачка или эксгаустера пересыпают в специальный мешок,
подвешенный к поясу. На месте заморенный в мешке или
эксгаустере материал рекомендуется просеять через два
сита с ячеей разного диаметра, чтобы отделить более
крупные формы. Мелких перепончатокрылых рекомен-
дуется размещать в бумажные гильзы или целлофановые
трубочки с соответствующими этикетками, а затем все это
укладывается в коробку.
Учет опылителей разными методами. Описано много
методов. Приводим три способа (по В. В. Попову с изме-
нениями) .
1. Посредине поля с помощью колышков и шпагата вы-
деляют учетную полосу площадью в 100 м2 (1 м ширины
и 100 м длины). Наблюдатель, продвигаясь вдоль такой
полосы, должен подсчитывать на ней пчелиных или дру-
гих опылителей. Учет проводят 3 раза в день в точно ус-
тановленные часы не менее 3 раз в неделю.
2. Учет проводят на метровых учетных площадках
3 раза в день, по 15 мин на каждой площадке, не менее
3 раза в неделю. Для этого на поле выделяют 6—8 участ-
ков по 1 м2 каждый. Размещение площадок зависит от
конфигурации поля и состояния травостоя.
228
3. Маршрутный метод. Он наиболее рационален при
учете таких крупных опылителей, как шмели. При этом
способе наблюдатель в течение 30 мин в определенные
часы дня двигается по площадке в 500 м2 и учитывает
всех замеченных опылителей. Такие учеты рекомендует-
ся проводить в течение всего весенне-летнего периода
через каждые 2—3 дня в часы утреннего (6—11 ч) и ве-
чернего (15—18 ч) максимума лета шмелей.
Для учета опылителей кок-сагыза М. С. Гиляров и
Ф. Н. Правдин (1943) пользовались методикой, которая
с успехом может быть применена и к другим растениям.
На выделенной посреди исследуемого поля учетной пло-
щадке в 100 м2 вечером, накануне учета, отмечают 200
еще не цветущих, но готовых раскрыться корзинок иссле-
дуемых растений. Ежедневно, в течение всего периода
цветения этих корзинок, через каждый час, проходя вдоль
рядов по площадке, подсчитывают на цветущих корзин-
ках всех посетителей, имеющих значение в перекрестном
опылении. Это дает возможность определить представи-
телей более крупных групп. Параллельно ежедневно про-
водят массовые сборы посетителей цветков морилкой.
По ним определяют соотношение родов и видов внутри
каждой группы.
За каждый день наблюдения суммируют итоги под-
счетов и высчитывают среднее количество посетителей за
одно наблюдение. Такой пересчет важен для получения
сравнимых данных. Обязательно также ежедневно опре-
делять количество цветущих корзинок на учетной пло-
щадке и, пересчитав, определить среднее количество
посетителей на тысячу цветущих корзинок в одно наблю-
дение. Чтобы выяснить эффективность посещения опыли-
телей на отмеченных 200 цветущих в период наблюдения
корзинках, во избежание разлета и потери семян на кор-
зинки надевают бязевые колпаки. Этот метод позволяет
учитывать всех посетителей цветущих растений. Известно,
например, что, кроме пчелиных, опылителями являются
двукрылые, жуки и другие насекомые. Их также следует
учитывать при изучении комплекса опылителей.
Для определения интенсивности посещения в послед-
нее время большинство исследователей применяет такой
метод (ср. Крышталь, 1955). На поле или на дереве вы-
бирают несколько (4—5) цветков с таким расчетом, что-
бы все они были в поле зрения. На протяжении опреде-
229
ленного времени (30—60 мин) следят за этими цветками
и учитывают всех насекомых, которые их посещают. Та-
кие подсчеты повторяют несколько раз и высчитывают
среднее количество опылителей на один цветок на протя-
жении часа. Для облегчения учета пользуются специаль-
но изготовленными пометками. Можно использовать для
этого разноцветные палочки или использовать зерно раз-
ных видов бобовых и злаковых растений. Для каждого
вида опылителей назначается отдельная пометка. Если
во время учета намеченный цветок посещается каким-ни-
будь опылителем, соответствующую пометку откладыва-
ют в определенное место. В конце наблюдений подсчиты-
вают отложенные пометки и узнают, сколько раз и какие
виды посетили данный цветок. Таким способом можно
получить довольно точные данные, а если такие подсчеты
проводить в разное время дня и в разные периоды цве-
тения растения, можно установить также ход лёта опыли-
телей.
Для выяснения фауны опылителей на посеве озимого
рапса в ГДР применяли желтые чашки с водой, диамет-
ром 24 см и высотой 6,5 см (Леймар, 1961). С помощью
этого метода с 19 апреля по 24 июня 1960 г., кроме пара-
зитических перепончатокрылых, было собрано 24 вида
пчелиных, из которых половина приходилась на долю
представителей рода Andrena.
Изучая повторность посещения одним пчелиным ка-
кого-нибудь цветка, мы можем определить коэффициент
полезной работы. Такие наблюдения ведутся с начала
цветения культуры и по возможности регулярно. Посе-
щенные и вскрытые пчелиными в присутствии наблюда-
теля цветки частично изолируют марлевыми мешочками
и оставляют до образования завязей. Изолированные
цветки осматривают через 8—10 дней после изоляции.
По отношению количества завязей к числу изолирован-
ных цветков (в процентах) определяют коэффициент по-
лезной деятельности опылителя. Для выяснения вида рас-
тений, которые посещают пчелы, часто пользуются анали-
зом пыльцы, снятой с ног и волосков пчел.
Количественный учет проводят также кошением стан-
дартным сачком. Так выявляют все виды пчелиных (и
скрытые в цветке, и мелкие виды) и других насекомых,
которые обычно при иных способах учета остаются неза-
меченными. Рекомендуется брать пробу в сто взмахов, но
230
брать их следует частями по 10—20 взмахов. Собирая
сачком, нужно делать взмахи, слегка задевая верхушки
растений.
Сбор опылителей необходимо проводить регулярно, не
реже, чем через 3 дня на протяжении всего периода цве-
тения данного растения или изучаемой культуры. Лучше
проводить сборы в определенные часы — утром, днем и
вечером при хорошей погоде. Пойманных одним из ука-
занных способов насекомых умерщвляют в морилке с
эфиром или хлороформом. Нужно следить, чтобы морил-
ка была сухая и чистая, во влажной морилке у пчели-
ных смачиваются и слипаются волоски.
Собранных при наблюдениях, а также при количест-
венных учетах насекомых умерщвляют индивидуально и
хранят на отдельных слоях ваты так, чтобы они не заде-
вали друг друга. Все сведения о каждом экземпляре за-
писывают на вкладыше ватника и в дневнике: место и да-
та сбора, время (от — до), растение, на котором произ-
водился сбор, или номер гербарного листа, краткие
сведения о погоде, количество собранных экземпляров.
Часть собранного материала следует наколоть на энто-
мологические булавки с тем, чтобы легче было определять
насекомых. В этих случаях поступают так же, как и при
накалывании других насекомых.
Двукрылые и другие группы насекомых-опылителей
Наряду с перепончатокрылыми постоянными посети-
телями и опылителями цветов являются многие виды дву-
крылых, во взрослой фазе питающиеся нектаром цветков.
Эти двукрылые (слепни, ежемухи, толкунчики, болыпего-
ловки, львинки и др.), как и пчелы, имеют на теле длин-
ные волоски, хорошо удерживающие пыльцу, что способ-
ствует опылению растения.
У слепней самцы питаются только нектаром или саха-
ристыми выделениями сосущих насекомых, а самки име-
ют двойственный характер питания — они наряду с
кровью (стр. 361) сосут нектар или сахаристые выделе-
ния тлей, червецов и листоблошек.
Особо важная роль принадлежит тем двукрылым, ко-
торые, кроме нектара, питаются также и пыльцой цвет-
ков. К ним относятся насекомые семейства Syrphidae и
231
Bombyliidae, а также некоторые виды Muscidae. Наи-
большее значение среди указанных двукрылых имеют
сирфиды (журчалки), которые как опылители уступают
только перепончатокрылым. Дополнительное питание
этих мух пыльцой и нектаром начинается сразу после вы-
хода из куколки (ранней весной), что необходимо для со-
зревания половых продуктов. Сирфиды обладают боль-
шой подвижностью, постоянно перелетают с цветка на
цветок; питаясь пыльцой, мухи соприкасаются с тычин-
ками и пестиками и производят перекрестное опыление.
Лет взрослых сирфид не прекращается вплоть до наступ-
ления заморозков. Во время дождя и ветра мухи пря-
чутся в заросли под листьями или сидят на стеблях рас-
тений. Как правило, сирфиды посещают открытые цветки
с доступным нектаром или пыльцой (сложноцветные, лю-
тиковые, зонтичные, крестоцветные, розоцветные, ворсян-
ковые, норичниковые и др.) и занимают важное место
среди опылителей плодовых деревьев и многих овощных
культур, например лука.
Количественный учет производится так же, как ука-
зано для пчел.
Лучшим методом сбора взрослых сирфид, как и дру-
гих мух, является сбор энтомологическим сачком, коше-
ние сачком по траве, на желтые чашки Мерике (стр. 147),
и, наконец, взрослых насекомых можно выводить из ли-
чинок, выкормкой их в специальных садках или сосудах.
Личинок для этого собирают в различных местах их оби-
тания. Выделяют следующие экологические группы ли-
чинок: а) водные личинки, живущие в иле; б) личинки,
обитающие в навозе или в иле; в) водные личинки,
встречающиеся в дуплах с водой и во влажной трухе;
г) личинки, живущие в бродячем соке растений деревьев;
д) личинки-фитофаги, обитающие в растительных тка-
нях; е) личинки-сожители общественных перепончато-
крылых; ж) хищные личинки, живущие открыто в коло-
ниях тлей и червецов или в галлах.
Обнаруженных в указанных местах личинок сохраня-
ют для выведения имаго или фиксируют опусканием на
несколько минут в очень горячую (но не кипящую) воду
с последующим перенесением в 80° спирт (Сое 1953;
Bankowska, 1963).
Для умерщвления имаго обычно пользуются цианис-
тыми морилками. Кроме того, рекомендуют применять
232
серный газ или небольшое количество этилацетата, нане-
сенного на фильтровальную бумагу. Серный газ позволя-
ет сохранить яркость желтых полос на брюшке у мух.
Насекомых следует накалывать сразу после замарива-
ния.
Роль двукрылых и других в опылении устанавливается
просмотром насекомого под бинокуляром. При этом фик-
сируется наличие пыльцы на волосках или отмечается от-
сутствие ее. Затем производится вскрытие и просмотр
содержимого зоба и кишечника. Жидкость зоба выдав-
ливается на кусочек фильтровальной бумаги для после-
дующего анализа на наличие сахаров.
Содержание сахаров в жидкости зоба устанавливается
при помощи жидкости Феллинга. В пробирке или в тигель-
ке кипятят небольшое количество жидкости Феллинга и
бросают туда кусочек фильтровальной бумаги, пропитан-
ной содержимым зоба. При наличии в последнем сахаров
в растворе выпадает красный осадок закиси меди и бума-
га окрашивается в красный цвет. Так как сахара сохра-
няются в фильтровальной бумаге в сухом виде очень дол-
го, то указанные исследования можно проводить и зи-
мой, в лабораторных условиях.
Из других опылителей растений можно назвать куз-
печиковых. Питаясь пыльцой, они часто находятся на
цветах, но иметь точное представление о составе пищи
насекомого можно только на основании анализа содер-
жимого его зоба и кишечника. Встречаются на цветах и
питаются их пыльцой многие виды жуков, что может
быть установлено полевыми наблюдениями и вскрытием
насекомых. Например, бронзовка золотистая, оленка,
многие малашки, некоторые мягкотелки, пыльцееды и др.
Кокцинеллиды в отличие от других актофильных жуков
питаются пыльцой и в фазе личинки (Гринфельд, 1962).
Для оценки эффективности работы жуков можно при-
нять количество цветов, посещаемых данными насекомы-
ми за одну минуту. На участке с одной культурой следу-
ет обращать внимание на количественное соотношение
жуков и других насекомых. Кошение сачком при этом
не может дать точной картины, так как не все группы на-
секомых в одинаковой мере могут попадать в сачок.
Сетчатокрылые наряду с поедаемой животной пищей
питаются пыльцой цветков. Следствием этого является,
очевидно, возникновение у них резервуаров.
233
Широко известными посетителями цветков являются
трипсы (стр. 307). Установить и проследить питание трип-
сов пыльцой позволяет бинокуляр с большим увеличением
(34—68 раз). Для наблюдения обычно берутся цветки
открытого типа.
К антофилам относятся и многочисленные чешуекры-
лые. Они приспособились к питанию нектаром, чему спо-
собствует длинный хоботок. Посещая цветы, бабочки, не-
сомненно, также способствуют опылению. Их учитывают
прямым наблюдением на цветках (см. стр. 311).
ИЗУЧЕНИЕ ЭНТОМОФАГОВ (ПАРАЗИТОВ И ХИЩНИКОВ)
В каждом биоценозе важнейшим регулятором числен-
ности отдельных компонентов являются хищники и мно-
гочисленные паразиты из членистоногих, червей и прос-
тейших. Известно множество примеров, когда вспышки
массовых размножений вредителей сельского хозяйства
подавлялись деятельностью паразитов и хищников.
Хищники имеются во многих отрядах насекомых и
клещей. Питаясь различными беспозвоночными, хищники
влияют на их численность. Некоторые из хищников, на-
пример жужелицы, поедают, кроме насекомых, червей и
слизней. Кокцинеллиды пожирают тлей, щитовок, черве-
цов; личинки златоглазки (Chrysopd) и скорпионицы
(Рапогра)—тлей и других насекомых; клопы из сем.
Miridae, Anthocoridae, Nabidae высасывают яйца насеко-
мых, a Perillus biocidata (сем. Pentatomidae) уничтожает
яйца и личинок колорадского жука. Многие хищники вы-
сасывают гемолимфу личинок разных насекомых; осы и
муравьи истребл-яют гусениц совок, пядениц; мухи-ктыри
(сем. Asilidae) во взрослой фазе нападают на плодожор-
ку, яблоневую моль и других насекомых и высасывают
свою добычу; жуки пестрянки (Trichodes apiarius из
сем. Cleridae) поедают короедов.
Паразиты представлены огромным числом видов и
распространены в природе чрезвычайно широко. Они жи-
вут внутри или на поверхности многих животных и, пита-
ясь за счет тканей их тела, вызывают физиологические
изменения-, нередко приводящие к гибели хозяина. Любое
насекомое, за редким исключением, может быть хозяином
паразита, а некоторые — могут быть основным хозяином
234
нескольких или множества видов паразитов. На-
пример, в яйцах и гусенице озимой совки паразитирует
около 100 видов, а некоторые виды бабочек имеют и более
сотни видов паразитов.
Паразиты характеризуются большей специфичностью,
чем хищники, и значение их в уничтожении вредных насе-
комых чрезвычайно велико. По данным Хазе (1924), в ок-
рестностях Берлина наблюдался, например, массовый лет
капустной совки (Barathra brasstcae), но отродившихся
гусениц было ничтожно малое количество, так как свыше
80% яиц оказалось зараженными яйцеедом (Trichogratn-
та evanescens). В Средней Азии паразитирующий на ко-
робочном черве наездник Симонова (Habrobracon simo-
novi) губит иногда до 90% вредителя (Яхонтов). Жуки-
нарывники (род Milabris), жуки шпанки (род Epicautd)
и мухи жужжалы (сем. Bombilidae),живущие за счет яиц
саранчовых, в некоторые годы уничтожают вредителей
почти полностью еще в фазе яйца. Вредная черепашка
иногда бывает сильно заражена мухами-ф.азиями (сем.
Tachinidae), а яйца — яйцеедами (Scelionidae) из пере-
пончатокрылых.
Для ограничения или подавления вредителей (для био-
логической борьбы) используют местных энтомофагов или
завозят хищников и паразитов из других стран. В том и
другом случае для обоснования планируемых мероприя-
тий нужны полевые обследования, в первом случае — для
выявления новых более эффективных паразитов из мест-
ной фауны, во втором—для выяснения возможности за-
воза, а также для изучения вопроса, в какой степени
прижились завезенные энтомофаги, наконец, для биоло-
гических особенностей и факторов, определяющих эффек-
тивность паразитов.
Изучение энтомофагов — важная проблема. Эти ис-
следования направлены на решение ряда важных вопро-
сов, а именно: выявить видовой состав хищников и пара-
зитов; разработать методы массового размножения их в
природе; изучить методы и способы использования вы-
веденных в искусственных условиях энтомофагов, выяс-
нить роль их в борьбе с вредителями.
Выявление видового состава местных энтомофагов не
отличается по существу от изучения вообще насекомых
в природе и сводится к таким приемам: вылавливание в
природе; выведение в садках; выявление зараженности
235
паразитами — вскрытие и анализ насекомых — хозяев;
определение эффективности энтомофагов в ограничении
численности вредителей.
Поиски и сбор паразитов в природе
Ловить паразитов следует в стациях их хозяев в яс-
ную безветренную теплую погоду; собирают на растениях
при питании, перед яйцекладкой и в период вылета. Наи-
более простой и эффективный способ сбора — кошение
капроновым или шелковым сачком по цветущим растени-
ям. Учитывая малые размеры и нежность тела паразитов,
чтобы избежать повреждений, не следует делать много
взмахов. Обкашивают и отдельные растения. Все кошения
производят после того, когда трава уже обсохла от вы-
павших осадков и ночной росы. Освободив сачок от рас-
тительных частей, выбирают из него сначала крупных
паразитов — наездников, тахин, а затем при помощи экс-
гаустера выбирают мелких насекомых: хальцид, телено-
мусов, браконид и др.
Следует иметь в виду, что при кошении попадают и
очень мелкие яйцееды из сем. Scelionidae, размер кото-
рых не превышает 1 мм. В полевых условиях выбрать их
бывает не просто. В этих случаях содержимое сачка пе-
реносят в банки, замаривают и уже в лаборатории с по-
мощью лупы выбирают всех паразитов.
Можно собирать паразитов и непосредственно с рас-
тений, на которых они дополнительно питаются. Чтобы
своей тенью не отпугивать насекомых, к растению сле-
дует подходить, направляясь против солнца. Мелких па-
разитических .насекомых в природе собирают эксгаусте-
ром, иногда — пробиркой, накрывая ею насекомое на
субстрате. Ловить паразитов можно и на приманки, в
светоловушки. Из мест укрытий насекомых можно извле-
кать фотоэлектором. Для этого следует собирать листья,
листовую подстилку, головки зонтичных и сложноцвет-
ных, сухие стебли трав, паутинные гнезда, кору. Особен-
но хорошие результаты при этом способе получают вес-
ной и осенью.
Пользуясь указанной методикой, выявляют кормовые
растения, на которых проходит дополнительное питание
паразитов. Это позволит при необходимости управлять
236
деятельностью паразитов путем подсева трав. Для учета
паразитов, прилетающих на нектароносы, можно пользо-
ваться липкими листами (липучками) (см. стр. 147).
Собранных с растений или выбранных из сачка и сня-
тых с липких листов насекомых сортируют по группам в
отдельные пробирки, где и замаривают.
Пробирки, в которые собирают или переносят из экс-
гаустера насекомых, необходимо время от времени ме-
нять или же чаще выбирать насекомых из них. Для этого
поворачивают пробирку дном к солнечной стороне, па-
разиты при этом направятся на свет ко дну, в это время
вынимают пробку и помещают в пробирку кусочек ваты,
смоченной эфиром, после чего пробирку закрывают проб-
кой. Заморенных насекомых выбирают и раскладывают
на вату как обычно.
Мелких наездников, браконид, яйцеедов (Scelioni-
dae), хальцид можно хранить в пробирочках с 70° спир-
том; крупных — тахин, наездников — следует хранить на
вате, в сухом виде, в коробках из плотного материала.
Представителей каждого отряда кладут на отдельные
ватные слои.
Указанные приемы позволяют изучить фауну парази-
тов данной местности, но добытый этим способом мате-
риал до некоторой степени бывает обезличенным. Он мо-
жет служить лишь для ориентировки и рекогнисцировки,
а для получения более полных экологических данных
следует пользоваться иными, изложенными ниже, спосо-
бами.
Для получения более конкретных сведений о степени
зараженности насекомых личинками паразитов, а также
чтобы обнаружить наличие паразитов на ранних этапах
их развития, пользуются методом вскрытия насекомых —
хозяев. Эти данные могут быть использованы при прогно-
зах ожидаемого размножения вредителя, для решения
вопроса о целесообразности проведения химической
борьбы. Метод сравнительно простой и менее трудоем-
кий, но требует искусных рук, навыков и умения разби-
раться в патологии насекомых. При систематическом
проведении подобных вскрытий хозяина можно просле-
дить продолжительность развития отдельных фаз пара-
зита. Вскрывают насекомых (имаго, личинок, куколок),
погибших или попавших в ловушки и приманки. При
вскрытии можно найти личинок различных паразитичес-
237
ких мух и перепончатокрылых. Вскрывая зараженных
хозяев и анализируя их остатки, выясняют (по методике
Шеверева), является ли паразит первичным или вторич-
ным. Вскрытием личинок можно решить некоторые част-
ные вопросы биологии паразита, выяснить зараженность
(при экспериментальных работах), но полностью выя-
вить фауну того или иного насекомого нельзя. Поэтому
применим метод только в экологических работах.
Вскрывать насекомых обычно рекомендуется (ср.
Тряпицын, 1965) в физиологическом растворе (0,75%-ный
раствор поваренной соли) в чашках Петри или плоских
ванночках со слоем воска толщиной около 1 см. Умерщ-
вленное насекомое прикалывают ко дну ванночки, в ко-
торую наливают физиологический раствор, мелких насе-
комых можно вскрывать и на предметных стеклах с
углублениями. При вскрытии взрослых клопов отрезают
ножницами надкрылья, подрезают края брюшка с боков,
препаровальными иглами вскрывают брюшко и извле-
кают оттуда яйца и личинок паразитических мух и фик-
сируют их в 70—75° спирте. Гусениц для вскрытия за-
крепляют с помощью двух булавок (голову и конец
брюшка) на восковом дне ванночки, несколько растянув
тело гусеницы в длину. Неглубоким погружением не-
больших ножниц делают разрез, раздвигают стенки тела
и кишечник сдвигается в сторону. Мелких гусениц мож-
но вскрывать на предметном стекле в небольшой капле
воды или раствора.
Тщательный просмотр под бинокуляром или препаро-
вальной лупой (10х) содержимого внутренностей гусениц
даст возможность обнаружить личинок мелких парази-
тов первых возрастов (1 —1,5 мм). Подобным образом
вскрывают и куколок, но, кроме продольного разреза,
делают также Цоперечный разрез в головной части.
При изучении видового состава и биологических осо-
бенностей пользуются методом выведения паразитов.
Этот метод требует знаний естественных условий жизни
хозяина, что важно для имитирования этих условий в
лаборатории. Кроме того, нужно уметь отличать парази-
та от сверхпаразита, который может вывестись из пара-
зита. Вторичные паразиты отрождаются обычно позже
первичных. Появляясь в большом количестве, они могут
почти полностью уничтожить первичных паразитов. Из
хозяина, собранного после того, как лет первичных пара-
238
зитов уже кончился, вылетают только вторичные, кото-
рых нередко ошибочно принимают за первичных. Только
детальными биологическими исследованиями можно точ-
но установить, является ли данный паразит первичным
или вторичным. Для получения большого количества
паразитов, что необходимо для полного лх определения,
следует производить массовый сбор зараженных насе-
комых.
Несколько легче выводить паразитов из разных фаз
насекомых (яйца, личинки, куколки или имаго), если
пробы в природе брать, когда паразиты уже успели прой-
ти через начальные фазы развития. Для выяснения вида
хозяина (жертвы) и уточнения истинных пищевых свя-
зей паразитов энтомологи применяют метод индивиду-
ального выведения — зараженных насекомых отсажива-
ют в отдельные пробирки.
Каждая фаза насекомого-хозяина имеет своих специ-
фичных паразитов, поэтому последних следует выводить
отдельно из яиц, личинок, куколок или имаго. Для того
чтобы выявить фазы развития самого паразита, при вы-
ведении следует собирать и фиксировать последователь-
но яйца, личинки, куколки, но при любых условиях обя-
зательно иметь и взрослую форму паразита, так как
достоверное определение возможно только по имаго. Вы-
деленных паразитов фиксируют вместе с хозяином.
Паразитов лучше всего выводить, пользуясь фото-
эклекторами различной конструкции. Паразиты стремят-
ся к свету и заползают в пробирку фотоэклектора, отку-
да их извлекают и переносят в спирт или морилку. Ящи-
ки эклектора иногда заменяют мешками из темной
материи.
Большинство паразитических мух окукливается в поч-
ве, поэтому в банках, пробирках (садках), где воспиты-
ваются зараженные мухами насекомые, необходимо
держать влажный песок или почву. Паразитические му-
хи предпочитают повышенную влажность, поэтому ват-
ная пробка, пробирки или марля, которой затянута бан-
ка, должны быть умеренно смочены водой.
Следует всегда помнить, что взрослые насекомые мно-
гих паразитических форм как дополнительное питание
используют нектар различных цветов и сок растений. По-
этому паразиты в определенный период жизни посещают
цветы, на которых и можно вести учет их. Для полноты
239
сведений о биологии паразитов важно изучить и сами
кормовые растения, выяснить их видовой состав, условия
и места произрастания, сроки цветения и т. п.
Собирать паразитов, следует в течение всего года. Не-
которые паразиты (их личинки) зимуют в хозяине, поэто-
му нужно знать и место зимовки последнего. Другие на
зиму оставляют хозяина и зимуют (в фазе имаго) непо-
средственно в природе. При изучении паразитов и их ро-
ли следует обязательно учитывать и паразитических не-
матод-мермитид (Mermithidae) (см. стр. 284).
Паразитов следует изучать и описывать по следую-
щей схеме. Место нахождения паразита в разные периоды
года. В каких хозяевах (на каких фазах развития) пара-
зитирует и какое оказывает влияние на хозяина. Имеют-
ся ли естественные враги, какие. Особенности поведения
(разные детали). Дополнительное питание имаго (кор-
мовые растения). Условия спаривания и откладки яиц,
развития личинки, куколки. Время появления отдельных
фаз и связь цикла развития с циклом развития хозяина,
корреляция лёта паразита со сроками цветения кормово-
го растения. Сезонная и суточная активность.
Массовый систематический сбор дает возможность
установить видовой состав паразитов важнейших вреди-
телей, а также собрать материал для изучения колебания
их численности и характеристики других экологических
особенностей.
Зараженность вредителя паразитами на разных фа-
зах онтогенеза хозяина, как и видовой состав, могут
быть изучены только путем выведения паразита из раз-
ных фаз развития хозяина.
При взятии проб для выведения паразитов необходи-
мо учесть их экологию; необходимо помнить, что многие
паразитические насекомые светолюбивы, поэтому про-
цент зараженности хозяина на пробах, взятых на опушке
леса, будет значительно выше, чем в пробах, собранных
в глубине леса. Состав паразитов зависит и от плотнос-
ти вредителей (хозяина) на единице площади.
Лабораторное разведение паразитов
Для разведения паразитов могут быть использованы
обыкновенные сажалки (садки), стенки которых затяну-
240
ты тканью. В таких сажалках паразиты легко размножа-
ются. Металлические садки непригодны, так как, ползая
по их стенке, наездники обламывают коготки на лапках
и от этого гибнут. Наиболее удобны для воспитания па-
разитов садки Шевырева с тюлевыми стенками
(рис. 94, А). Еще лучше делать садки из шелкового газа
или капрона. Для массового разведения паразитов из
вредителей служат садки Фиске (рис. 94, 5), которыми
пользуются американцы. Это деревянный плотно закры-
Рис. 94. Садки для паразитов. А — садок Шевыре-
ва; Б — садок Фиске
вающийся ящик, в одной из стенок которого проделано
одно или несколько отверстий, в которые вставлены кол-
бы или пробирки.
Собирают насекомых, подлежащих обследованию на
паразитов, и, распределив их по фазам развития, поме-
щают в отдельные садки. В каждом садке проба должна
содержать не менее 200 экземпляров. Время от времени
пробу осматривают и отмечают появившихся паразитов.
Выведенных паразитов кормят сахарным сиропом или
сильно разбавленным пчелиным медом.
Выведение паразитов из личинок. Чаще всего бывают
зараженными личинки. Для выведения следует собирать
гусениц бабочек, ложногусениц пилильщиков, открыто
живущих личинок жуков и переносить в садки, стараясь
не повредить их. Каждый вид личинок, равно как и со-
бранных па новом месте таких же личинок, помещают в
отдельные садки. Личинок содержат в условиях, близких
к природным, и регулярно их кормят свежим, взятым в
241
природе кормом. Садки следует осматривать ежедневно
и регулярно выбирать вышедших паразитов. В случае
надобности их фиксируют, снабжают этикеткой и сохра-
няют отдельно. Данные заносят на карточку по следую-
щей форме.
Учет паразитов, выведенных из личинок
Насекомое-------------------- Фаза развития------------------
Место -----------------Время -----------------Где и при каких
обстоятельствах собрано-------------------------------------
Фамилия сборщика-----------------------
№ п.п. Куда помещено Количе- ство Выход хозяина Выход паразитов
время количе- ство время количе- ство
Виды паразитов----------
Всего посажено личинок--------------------
Оказалось зараженными---------------------
Процент зараженности ---------------------
Среднее количество в одном хозяине -------
Определил --------------
На основании полученных данных выясняют процент
зараженности, обилие и видовой состав паразитов вреди-
телей.
Выведение паразитов из яиц. Этот прием довольно
прост. Трудности заключаются лишь в нахождении яиц
в природе, так как многие насекомые откладывают яйца
в земле, в тканях растений, и обнаружить их бывает
трудно. Кладку яиц вместе с субстратом (листьями, ко-
рой и т. д.) переносят в пробирку или баночку, завязыва-
ют сеткой из шелкового газа или закрывают банку
пробкой с отверстием, затянутым такой же сеткой. Можно
в крайнем случае закрывать неплотным ватным тампо-
ном. Пробирки закладывают в гнезда специальных коло-
дочек дном к источнику света. Паразиты будут скоплять-
ся здесь и их легко заметить.
242
Можно для разведения использовать цилиндры без
дна. Используют также стекла от фонаря «летучая
мышь» или другие ламповые стекла. Такие цилиндры
ставят на слегка увлажненный песок, а противополож-
ный их конец затягивают сеткой. На поверхность песка
под банкой на кусок фильтровальной бумаги кладут яй-
ца, предназначенные для выведения из них паразитов.
Яйца хрущей, щелкунов, долгоносиков, отложенные в
почве, промывают из земли и содержат в чашках Петри
на увлажненной фильтровальной бумаге. Можно дер-
жать и в пробирках.
Весь собранный одним из описанных способов матери-
ал для выведения паразитов из яиц нужно держать в по-
мещениях с рассеянным светом и умеренной влажно-
стью. Вышедших паразитов собирают и поступают с ни-
ми, как указано выше.
Разводят паразитов для использования их в биологи-
ческой борьбе с вредителями одним из описанных ниже
способов.
Выращивание трихограмм (по Хазе). Трихограмма
Trichogratnma evanescens развивается очень быстро,
иногда за 2—3 дня, но сроки ее развития в природе не
всегда совпадают со сроками развития вредителя — ее
хозяина. Поэтому отродившееся поколение погибает, не
имея возможности пристроить потомство; таким образом,
заражение этим паразитом хозяина носит случайный ха-
рактер, влияние его на вредителя ограничено. При на-
личии хозяина паразит, как отмечалось, быстро размно-
жается. Лабораторное разведение и основано именно па
учете этой особенности яйцееда.
Приспособлением для выращивания трихограмм слу-
жит стеклянная трубка длиной в 10—12 см, шириной
1,5 см, причем верхний ее конец вытянут так, что обра-
зует тонкий согнутый набок носик с отверстием около
0,5—0,75 мм. Снизу трубка плотно закрыта пробкой. На
поверхность пробки помещают зараженные трихограм-
мой яйца вредителя (их нетрудно отличить от здоровых,
так как они быстро чернеют), из которых вскоре должны
отродиться яйцееды.
На носик прибора надо надеть пробку с высверлен-
ным углублением (ямкой). После этого прибор до поло-
вины его высоты нижним концом погрузить в песок; от-
родившиеся яйцееды полетят на свет и будут скопляться
243
в верхнем загнутом конце трубки (рис. 95). Если снять
пробку (колпачок) с носика, то яйцееды могут выйти, но
диаметр отверстия даст им возможность выходить только
поодиночке. Таким путем
паразитов и высаживают
выпускают нужное количество
их
на новые партии подлежа-
щих заражению яиц.
Трихограмма как по-
лифаг легко поражает
яйца кладовой моли. Это
насекомое и используют
как хозяина при массовом
разведении трихограмм.
Содержать их нужно при
температуре 1—2° С и от-
носительной влажности
90%.
Выращивание афели-
нуса (A phelinus mali).
Паразитирует на кровя-
ной тле, хорошо акклима-
тизируется. Поэтому его
можно использовать для
борьбы с кровяной тлей,
способен размножать-
партеногенетически,
обеспечивает
развития и
Б
в
Рис. 95. Приспособление для выве-
дения паразитов (по Хазе, из Фри-
дерикса). А, Б — сосуды с крыш-
ками, к которым прикрепляют
яйцекладки; В — пробирка с вы-
тянутым концом, помещенная в
песок (внизу пробка, на которую
помещают объект; вверху пробка,
которую надевают на конец про-
бирки)
Он
ся
что
ту-
чнело поколений
тяжении года.
Откладывая в
тлю по одному яйцу, афе-
линус может заразить от
60 до 140 тлей.’ У нас в стране он дает от 4 до 10 поколе-
ний в год. Завезен к нам в 1930 г. (Мейер и Теленга).
В производственных условиях паразита изучали в
Крыму. Взятые осенью ветви деревьев с кровяной тлей,
зараженной афелинусом, вешали на каждое пятое дере-
во или в расфасованном виде ветви развозили по райо-
нам и развешивали на 6—7 деревьях каждого гектара,
преимущественно с северной стороны во избежание ран-
него вылета паразитов.
Для лабораторного разведения осенью до опрыскива-
ния срезают с дерева веточки с тлями, зараженными афе-
быстро-
большое
на про-
каждую
244
линусом, переносят в ящики или банки и сохраняют в
сухом холодном помещении (сарае), защитив от мышей.
Ранней весной переносят эти ветки в садки из сетки или
в мешки с эклектором (рис. 96) и выносят на солнце;
через некоторое время в них выводятся паразиты. Для
получения паразитов зимой следует перенести ветки из
холодного помещения в
теплую светлую комна-
ту. Здесь из заражен-
ных тлей быстро выве-
дутся паразиты, кото-
рых нужно кормить са-
харным сиропом или
разведенным пчели-
ным медом.
При разведении па-
разитов для биологиче-
ской борьбы рекомен-
дуют собирать вреди-
телей руками. Собран-
ный материал склады-
вают в садки или со-
суд, который завязыва- Рис. 96. Мешок для разведения па-
ЮТ капроновой сеткой. разитов (по Рушке)
Развившиеся перепон-
чатокрылые легко проходят через сетку и улетают, а ба-
бочки и другие крупные насекомые, вышедшие из здоро-
вых куколок или дичиног. задерживаются и погибают.
Яйца, отложенные бабочками в садок уничтожают.
Изучение энтомофагов-хищников
Энтомофаги-хищники из различных отрядов отли-
чаются своими биологическими особенностями.
Концинеллиды-афидофаги репродуцируют исключи-
тельно на тлях и, несмотря на значительную полифагию,
отличаются определенной пищевой избирательностью.
Например, жуки Coccinella 1-punctata предпочитают в
некоторых местах колонии тлей Aphis fabae. Определен-
ные различия отмечены и в выборе яруса растений. Не-
которые (Coccinella 1-punctata, Semiadalia 11-notata)
245
размножаются на тлях, заселяющих низкие растения
(О—50 см). Другие виды Harmonia A-punctata, Adonia
variegata можно часто встретить в колониях тлей на кус-
тах (0,5—2 м). И, наконец, некоторые виды Adonia Ы-
punctata, Synharmonia conglobata питаются в основном
в колониях тлей, заселяющих деревья (выше 2 м).
Сирфиды, (Syrphidae) — афидофаги. Откладывают яй-
ца в колонии тлей (или рядом) на кустах, деревьях и
травах. Факторами, определяющими выбор места яйце-
кладки, являются местообитание и вертикальное положе-
ние колонии, а также время года. Например, такие виды,
как Syrphus nitidicollis, S. ochrosttoma, можно найти в ко-
лониях тлей только весной или рано летом. Есть сирфи-
ды, откладывающие яйца в скрученные листья, а также
в галлы. Это надо иметь в виду при поисках личинок
этой группы афидофагов. Следует также учитывать, что
одни их представители — полифаги, другие — хищничают
на тлях только одного рода или даже вида.
Этикетировка, хранение материала
Мелких (менее 3 мм длиной) перепончатокрылых,
яйца, личинок и куколок всех насекомых, а также гал-
лиц хранят в 70—75° спирте в плотно закупоренных ват-
ными тампонами небольших пробирках. В пробирках
не должны образоваться пузырьки воздуха. Все пробир-
ки помещаются в одну банку с фиксатором. В спирте
сохраняется форма тела; на таком материале удобно
изучать строение брюшка, полового аппарата. Но в
спирте объекты выцветают, может произойти мацерация
тканей от частичных высыханий.
Мелкие виды (1—2 мм) —хальциды из сем. Tricho-
grammatidae, Mymaridae, Aphelinidae и некоторых En-
cyrtidae и Eulophlidae, а также галлиц совершенно необ-
ходимо помещать в спирт свежими, даже живыми. Более
крупных паразитов из перепончатокрылых хранят в су-
хих чистых пробирках, отделяя их от вложенной сверху
этикетки ватным тампоном так, чтобы ндсекомые не ло-
мались при встряхивании. Только более крупных (3—
4 мм) паразитов допустимо хранить на ватниках.
246
При монтировке наклеивают насекомых на правый
бок, вперед головой или спинкой вперед и головой влево.
Крупных — ихневмонид, браконид и хальцид (Leucospi-
dae), а также мух, хищных жуков после увлажнения на-
калывают на булавки.
Изготовление микроскопических препаратов
Для определения многих паразитических и хищных
насекомых часто бывает необходимым изготовление
микроскопических препаратов. Препарат может быть то-
тальным (из мелких насекомых), но может быть приго-
товлен из любой части тела насекомого. Чаще всего изго-
товляют препарат из усиков, мандибул, щупиков, крыль-
ев и гениталий. Самый обычный способ — заключение
объекта в канадский бальзам при обязательном условии
полного обезвоживания объекта путем проведения его
через спирты — до абсолютного (обычно объект из 75°
спирта переносят непосредственно в абсолютный спирт).
Мелких насекомых (афелинид, трихограмматид, отдель-
ные части энциртид, проктотрупид и т. п.) можно обезво-
живать прямо на предметном стекле, на которое поме-
щают пипеткой каплю абсолютного спирта и в нее пере-
носят объект.
Крупные объекты обезвоживают и просветляют гвоз-
дичным маслом в тигильке, затем переносят на предмет-
ное стекло и заключают в канадский бальзам (по схеме:
спирты — гвоздичное масло — канадский бальзам — по-
крывное стекло).
Тело насекомого при необходимости очищают, выдер-
живают в 5—20 %-ном водном растворе КОН или недол-
го кипятят в 5—10 %-ном растворе КОН с последующей
промывкой.
Расчленение насекомых для изготовления препаратов
отдельных частей допустимо только при наличии серии
экземпляров. Усики и крылья можно отделять от смон-
тированных сухих экземпляров и сразу переносить в
гвоздичное масло.
Можно готовить препарат и другим способом. Объ-
ект из спирта после промывки переносят в жидкость
Берлезе (см. стр. 338). Мелких насекомых помещают в
.247
нее живыми. Такие препараты долго сохнут, поэтому ре-
комендуется окантовать края покровного стекла асфаль-
товым лаком и сушить при комнатной температуре.
УЧЕТ НАСЕКОМЫХ И ДРУГИХ БЕСПОЗВОНОЧНЫХ,
ЖИВУЩИХ НА ДЕРЕВЬЯХ
Методика учета населения деревьев довольно слож-
на и разработана еще недостаточно. В практике прихо-
дится иметь дело с частичным учетом, с его элементами.
Учитывают беспозвоночных определенного дерева, от-
дельных его частей или же различные экологические
группы животного населения. Так, пользуясь соответст-
вующей методикой, описанной ниже, поэтапно учитывают
население коры и старых ветвей, население кроны, насе-
ление листьев и т. д.
Обследование кроны в период вегетации дерева
Выбирают модельные деревья в лесу или саду,
выявляют присутствие на них по возможности всех насе-
комых. Пользуются разнообразными способами: осма-
тривают крону, отряхивают деревья, обкашивают ветки
сачком, используют всасывающие аппараты, учитывают
по экскрементам и т. д.
Осмотр деревьев. Для обследования населения де-
ревьев выбирают небольшие экземпляры, так как на них
удобнее наблюдать сидящих спокойно жуков или других
насекомых. Жуков хорошо можно рассмотреть в бинокль.
Затем, внешне осмотрев ветви и листья, следует
осторожно поднимать и поворачивать ветви, осматривая
одну за другой, пока не осмотрят все дерево. Обнаружен-
ных животных подсчитывают и данные записывают в
дневник. По Собранным образцам уточняют вид.
Определяют процент деревьев, заселенных данным
видом, среднее количество особей, встреченных на дереве
в доступной для осмотра части. Следует выяснить, какую
функцию выполняет насекомое на дереве. Необходимо
обращать внимание и на количество копулирующих на-
секомых. Все сведения о насекомых и характере их дей-
ствий заносят на карточку или в дневник.
Отряхивание деревьев. Положив под дерево кусок
клеенки или какой-нибудь материн, натянутой на рамку
или лист дикта, встряхивают дерево просто рукой, а бо-
248
лее толстое — палкой (ударить несколько раз по стволу
и по большим ветвям). При сборе с небольших деревьев
и кустарников наилучшие результаты дает стряхивание
на полотно (3X3 или 4X4 м) из бязи с разрезом до
центра. Осторожно подвести такое полотно под дерево
или куст, затем сильно встряхнуть руками или колотушей.
Потревоженные насекомые падают на полотно.
Отряхивать следует утром до жары или в пасмурную
погоду, когда насекомые малоактивны. Упавших насеко-
мых собирают в банки или морилки для учета. После оп-
ределения всех насекомых в дневнике следует сделать
нужные дополнения и исправления, а данные занести в
карточку с указанием количества каждого вида, его дея-
тельности, числа и т. д.
Сбор при помощи пылесоса. Кеннард и Спенсер
(1955) рекомендуют для сбора мелких насекомых с де-
ревьев аппарат, состоящий из ручного пылесоса и длин-
ной гибкой трубки, заканчивающейся воронкой. С его
помощью можно собрать насекомых с деревьев высотой
7 м и более.
Кошение сачком. Энергичными движениями водят
сачком по ветвям дерева или кустарника и насекомые по-
падают в него. Количество ударов при качественных сбо-
рах не устанавливается. Нужно стремиться к тому, чтобы
собрать по возможности все виды насекомых. Для срав-
нительно-экологических сборов и для количественного
учета отдельных групп можно установить определенное
количество ударов, например делают 100 взмахов. На-
клонив ветку, руками можно стряхнуть обитателей ее в
мешок сачка.
Обработка материала. Обнаруженниых при помощи
всех указанных приемов насекомых фиксируют одним из
ранее описанных методов, регистрируют в дневниках,
снабжают этикеткой и сохраняют до окончательной обра-
ботки. Личинок и куколок сохраняют живыми для изуче-
ния биологии и выявления паразитов.
Обрабатывают материал следующим образом. Опре-
деляют видовой состав населения дерева; количественное
соотношение видов и полов в популяциях насекомых; вы-
ясняют характер связи насекомого с данным растением,
роль и значение его; выясняют паразитов у изучаемых
насекомых. Результаты обработки заносят в дневник или
карточку.
249
Учет населения деревьев
Название леса, сада, лесничества------------------Дата ---------
Экологические условия------------------Метод учета--------------
Метеорологические условия---------------------------------------
Характер растительного покрова-----:----------------------------
Название дерева-----------------Размер----------Возраст---------
№ п.п. Название насекомых Количество Характер связи с растением
при встря- хивании при осмотре в кошении сачком при анали- зе отдель- ных веток
Учет повреждений листвы на деревьях
Осматривают дерево и знакомятся с характером пов-
реждений листьев (скелетирование, вырезы, мины, гал-
лы), стволов, ветвей, цветков, плодов и др., а также и
со следами жизнедеятельности животных организмов
(экскременты, паутина и т. д.).
На каждом исследованном дереве подсчитывают или
собирают на нескольких ветках на разных высотах опре-
деленное количество листьев и вычисляют процент листь-
ев с галлами, минами или другими повреждениями.
Собранный материал переносят в банки, пакетики,
пробирки и сохраняют обычным способом до обработки
и точного определения. Обработка материала заключает-
ся в изучении видового состава, биологии развития вре-
дителей, в установлении связи животного с растением,
в выяснении характера вреда, в выявлении паразитов
этих насекомых.
Для определения вида насекомых по повреждениям и
пораженным частям пользуются определителями повреж-
дений. Если же насекомое трудно определить по повреж-
дениям и личинкам, а взрослых форм не найдено или ког-
да есть необходимость изучить некоторые вопросы биоло-
гии вида, нужно поместить галлы или другие повреждения
с личинками, куколками или яйцами в садки и вывести
из них взрослых насекомых, по которым можно опреде-
250
лить их, и одновременно изучать некоторые стороны цик-
ла развития. Таким же образом следует отсадить партию
яиц, личинок, куколок в садки для выведения из них па-
разитов (см. стр. 242).
Насекомых можно учитывать и другим путем. Среза-
ют с дерева на разных высотах и экспозициях ветки и
сбрасывают на подстеленное под дерево полотнище. Так
учитывают неподвижных насекомых (щитовки) и более
крупных и более неподвижных представителей — гусениц
и жуков. Для учета колоний тлей или щитовок пользу-
ются оценкой размеров колоний по баллам, не подсчи-
тывая всех особей. Массовых вредителей (гусениц не-
парного шелкопряда) учитывают по следам жизнедея-
тельности насекомого, по количеству выделяемых
экскрементов. Метод представляет интерес для сравни-
тельного учета. Результаты учета заносят в дневник или
карточку.
Карточка учета вредителей на дереве
Название местности
Название леса, сада---------'
Общая характеристика экологических условий----------------------
Дата---------------------Название дерева------------------------
1 № п.п. I Название животного Фаза вре- дителя Название части растения 1 Характер поврежде- ния 1 Характер связи Выве- денные пара- зиты Приме- чание
Учет галлообразующих и минирующих насекомых
и других обитателей кроны
Многие растительноядные беспозвоночные, в част-
ности, нематоды, клещи, личинки многих насекомых: гал-
лицы (Cecidomyidae), орехотворки (Cynipidae), толсто-
ножки (Eurytonidae), некоторые долгоносики (Tychius),
златки (Sphenoptera), отдельные виды пилильщиков и
многие другие, питаясь соками растений, вызывают па-
толого-анатомическое и физиологическое изменение тка-
ней растения, проявляющееся в образовании галлов.
Личинки других производят анатомические измене-
251
ния тем, что прокладывают в листьях ходы (мины). Бы-
вают повреждения и другого характера.
Учет галлов. Для учета собирают галлы вручную на
нижних частях кроны и при помощи секатора — в сред-
ней и верхней частях. Иногда ограничиваются лишь под-
счетом на 1000 листьев (побегов), взятых в разных час-
тях кроны. На травянистых растениях для учета берут
определенное количество растений (100, 1000) и подсчи-
тывают процент с галлами. Таким путем мы можем уста-
новить наличие, встречаемость и обилие галлов. Эти
данные дадут возможность вычислить коэффициент об-
щности между отдельными объектами.
По галлам в большинстве случаев обнаруживают в
природе галлообразователя и по ним определяют многие
распространенные виды. Но для достоверного определе-
ния насекомого из галлов выводят взрослые формы.
Следует помнить, что галл — удобная среда обитания для
многих видов, не являющихся галлообразоваДелями. Для
выведения имаго следует выбирать галлы давно образо-
вавшиеся, в которых личинки уже заканчивают свое раз-
витие. Галлы с молодыми личинками рекомендуют ос-
тавлять на растениях и собирать через несколько дней,
когда будут личинки старших возрастов.
Галлы берут вместе с растением, на котором они най-
дены. Ни в коем случае не рекомендуется отрывать гал-
лы от растений, так как это исключает возможность точ-
ного определения растения и ценность сборов значитель-
но снижается. В тех случаях когда в одну ботанизирку
собирают несколько видов растений, каждый из образцов
заворачивают отдельно в плотную бумагу или целлофан,
чтобы личинки не расползались; сборы обязательно снаб-
жают этикеткой.
Выведение галлиц. Собранный и разложенный в
пакетики массовый материал, предназначенный для вы-
ведения из него галлообразователя, необходимо предо-
хранять от высыхания: ставить растения в банку с водой,
а промежутки в горловине заполнять ватой, чтобы вы-
ползающие из галлов по стеблям личинки не утонули в
воде, а затем помещать их под колпак в теплое место.
Ниже приводим способ выведения ймаго галлиц.
Галлы тех галлиц, личинки которых развиваются в
земле, Е. В. Домбровская (1934) рекомендует поместить
в ламповое стекло, поставленное вертикально на лист
252
плотной бумаги. Верх стекла накрывают бумагой. Вы-
шедшие личинки будут передвигаться по стеклу и падать
на бумагу. Эту бумагу с личинками затем осторожно вы-
нимают и стряхивают в банку с увлажненным песком.
После этого банку завязывают материей или закрывают
пробкой. *
Часть галлов нужно перенести в 70° спирт и сохранить
для гистологического изучения.
После окукливания следует ежедневно следить за вы-
ходом галлиц. Через день после вылета галлиц банку от-
крывают и помещают туда анестезирующее вещество, в
крайнем случае впускают клуб табачного дыма. Умер-
щвленных таким образом насекомых переносят на чашки
или на стекло для дальнейшей обработки. Если галлицы,
взятые для выведения, принадлежат к зимующим видам,
банку в зимнее время следует держать в холодном поме-
щении.
Хранение материала и изготовление препаратов.
Только что выведенных иЛи пойманных галлиц кон-
сервируют одним из следующих способов: 1) в 70° спир-
те, но при этом способе объект затвердевает и делается
ломким; 2) в жидкости Кёнике — 5 частей глицерина,
2 части ледяной уксусной кислоты, 3 части воды. В этом
составе материал сохраняет гибкость.
В тех случаях, когда материал нужно изучать сразу,
из отродившихся галлиц приготовляют временные ми-
кроскопические препараты. Описав цвет, характер волос-
ков и другие внешние признаки, галлицу для детального
изучения кладут на предметное стекло, увлажнив ее при
этом спиртом с прибавлением глицерина, затем расправ-
ляют крылья и гениталии и накрывают покровным стек-
лом.
Для длительного хранения материала изготовляют
постоянные препараты. Насекомых нужно перевести че-
рез спирты (начиная с 70° до абсолютного), а при первом
способе фиксирования сразу перенести в 80° спирт. В
каждом спирте держать по несколько часов, а в абсолют-
ном можно оставить объекты на ночь. Затем из абсолют-
ного спирта объект следует перенести в гвоздичное масло
и держать часов шесть до просветления. Поместить на
предметное стекло, промыть каплями ксилола, удаляя
последний фильтровальной бумагой.
Расправив иголкой крылья, ножки и т. д., придают
253
насекомому соответствующее положение, заливают кап-
лей канадского бальзама и накрывают покровным стек-
лом. В сухом состоянии, в виде ватных сборов или на-
колки на булавки, сохранять материал не рекомендуется.
Личинки, куколки и яйца можно консервировать всеми
вышеперечисленными способами.
Для определения нужно сохранить галлы в виде гер-
бария повреждений одним из следующих способов:
а) растения с галлами закладывают в бумагу и прес-
суют обычным для гербаризации способом;
б) растения закладывают в бумагу без прессовки;
при этом галлы лучше сохраняют форму, но листья скру-
чиваются, что затрудняет определение растений. Способ
удобен в случаях, когда вид растения хорошо известен;
в) растения с галлами засушивают в горячем песке.
Способ трудный, но дает хорошие результаты. Этот спо-
соб применяют тогда, когда из собранных объектов нуж-
но изготовить демонстрационный материал;
г) спрессовывают только неповрежденные части и
листья, а галлы оставляют нетронутыми.
По аналогичной методике изучают и другие группы
галлообразователей.
Учет мин. Минируют листья представители многих
групп насекомых. Мины имеют вид пятен или извитых
полосок, которые хорошо выделяются на листке своей бе-
лой или черной окраской. Внутри мины заметны экскре-
менты личинки в виде темных зернышек, палочек или ни-
тей. На хвоинках мины имеют вид полосок.
Собирают мины вручную; на деревьях и кустарниках
для учета берут одни только листья. На травянистых рас-
тениях с небольшими листьями лучше брать часть стеб-
ля с листьями. Учет производят прямым подсчетом во
взятой пробе (1000 листьев) листьев с минами.
Для определения минеров нужно собрать серийную
коллекцию поврежденных листьев. Собранные листья
засушивают обычным способом и хранят в конвертах или
пакетиках. В один пакет кладут листья, собранные в дан-
ном биотопе только с одного рода (вида) растения. Обя-
зательно на этикетках указывают его научное название.
Для получения минеров их выводят из мин, создав
для этого условия, близкие к естественным. Можно изо-
лировать на растущем растении ветку с минами марле-
выми или капроновыми колпачками.
254
Учет по экскрементам. Листогрызущих насекомых
кроны (гусениц непарного и кольчатого шелкопрядов, лис-
товерток и т. д.) можно учитывать по экскрементам. Для
этого под обследуемым модельным деревом расчищают
поверхность почвы, подстилают полотнище или листы
светлой бумаги (размером 1—2 м2) или же подкладыва-
ют ящик (корыто) определенного размера, можно ис-
пользовать и таз, а также часто применяемые лесовода-
ми, смазанные липким веществом дощечки (40X40 см),
укрепляемые горизонтально на столбиках нужной высо-
ты. Указанные предметы оставляют под деревом на опре-
деленное время, в них скопляются экскременты с наме-
ченной части растения или со всей кроны. Подсчитав или
лучше взвесив экскременты, полученные с учетной пло-
щади, нетрудно пересчитать количество экскрементов
на всю крону. Установив опытным путем среднее коли-
чество экскрементов, выделяемых одной гусеницей за со-
ответствующий отрезок времени, определяют количество
гусениц на дереве.
Учет поврежденности. Деятельность растительнояд-
ных беспозвоночных в биоценозах имеет самые различ-
ные последствия. Так, питание листогрызущих насекомых
во время массовых вспышек приводит к изменению:
а) микроклиматических условий (изменяется освещен-
ность под пологом леса, что влияет на температуру поч-
вы, воздуха, стволов деревьев, на влажность воздуха и
почвы); б) свойств почвы в связи с изменением состоя-
ния опада; в) состояния древостоя и подроста, подлеска
и травостоя. Характеристика этих изменений должна
входить обязательным элементом в программу исследо-
ваний наряду с учетом прямых повреждений. На послед-
нем моменте остановимся более подробно.
Характер повреждений определяется как составом
вредителей, так и составом насаждений. В первую оче-
редь обычно производят учет повреждений листьев, по-
скольку уменьшение фотосинтезирующей поверхности
последних непосредственно сказывается на первичной
продуктивности фитоценоза. Степень объедания листвы
определяют по пятибальной шкале:
1
2
3
4
5
балл — следы повреждений — листья
балла — слабое повреждение — »
» — среднее » »
» — сильное » »
» — полное » »
объедены до 5%
» на 5—25%
» 25—50%
» 50—75%
» 75—100%
255
При характеристике поврежденности растений тлями
учитывается степень заселения растения этими насекомы-
ми по четырехбальной шкале:
О балла — тли на растении отсутствуют
1 балл — присутствуют отдельные тли
2 балла — единичные экземпляры тлей заселяют 50% листьев
3 » —колонии тлей занимают более 50% листьев
Чтобы вычислить среднюю поврежденность растений,
надо балл поврежденности умножить на количество рас-
тений данной степени поврежденности. Произведение
складывают и сумму делят на общее количество расте-
ний, частное и будет соответствовать показателю сред-
ней поврежденности растений. Ниже приводим пример
расчета средней поврежденности растений.
С оценкой 1 балл повреждено 12 растений (12X1 = 12)
» 2 балла » 15 » (15X2 = 30)
» 3 » » 48 » (48X3=144)
» 4 » » 17 » (17X4 = 68)
» 5 баллов » 8 » (8X5 = 40)
Всего 100 294
Средняя поврежденность равна 294: 100 = 2,94 балла
Сбор и изучение насекомых коры и ствола
Насекомые в известные периоды своей жизни ищут
укромные места: одни прячутся от света или непогоды,
другие забираются для размножения (откладки яиц),
третьи собираются на зимовку. Одни из них опускаются
с кроны дерева на землю, другие поднимаются на дере-
во. Эту особенность и используют для учета насекомых
в определенные .периоды. Применим этот способ для изу-
чения долгоносиков, бабочек и многих других. Для этого
необходимо наметить заблаговременно в изучаемом саду
или лесу деревья, выделив наиболее характерные, и в
строго определенные сроки провести учет.
Количественный учет населения коры и ствола. Подо-
брав учетные деревья, накладывают без выбора прово-
лочную раму площадью 10X10 см на поверхность коры
в различных местах ствола на различной высоте и раз-
лично ориентированных к странам света. Выбирают и
учитывают население 1 дм- площадки. Для точного уче-
256
та мелких объектов кору срезают с дерева и помещают
в стеклянную банку с плотной пробкой или в мешочек,
затем материал исследуют в лабораторных условиях ли-
бо тщательно разбирают в саду на листе бумаги, поль-
зуясь лупой или бинокуляром.
Карафиат (1955) предложил следующий метод для
учета тлей на коре деревьев. Пробные Ьлощадки на коре
дерева, заселенные тлями, покрывают садками из метал-
лической сетки. Нижнюю часть садков у ствола окружа-
ют легкой тканью, предохраняющей от заползания хищ-
ников; для предотвращения залетов мелких хищников
через сетку садка последнюю обрабатывают препарата-
ми ДДТ. Пробные подопытные площадки не закрывают
совсем или положенные па них садки продырявливают,
а в окружающей их ткани проделывают отверстия.
Учеты проводят путем фотографирования подопытных
площадок через определенные промежутки времени с
последующим сопоставлением количества тлей, их воз-
растов и т. п. Более точные данные можно получить при
учете сидящих на площадке тлей через учетную сетку
(разбитую на квадратные сантиметры) с помощью би-
нокуляра. Результаты в увеличенном виде наносят на
бумагу в виде условных символов, указывающих возраст
тли и т. д., и затем сопоставляют через определенные про-
межутки времени. Лучшие результаты можно получить
при комбинации обоих методов.
Учет при помощи ловчих колец. Осенью на стволы де-
ревьев накладывают ловчие кольца (пояса), сделанные
из соломы или рогожи (рис. 97). Стремясь к месту зимов-
ки, насекомые осенью забиваются в эти укрытия. С иа-
Рис. 97. Ловчие пояса на деревьях
9—1867
257
ступлением первых морозов, когда активное движение
насекомых прекращается, ловчие кольца снимают и ана-
лизируют их содержимое. Количество обнаруженных
насекомых дает представление о количестве экземпля-
ров, зимующих на одном дереве, после чего нетрудно
определить, сколько их на деревьях определенного участ-
ка. Ловчими кольцами пользуются и в другое время — в
летние месяцы для учета численности отдельных вреди-
телей или для учета отдельных видов, передвигающихся
по стволу к почве или в крону.
Обрабатывают материал следующим образом. Часть
снятых ловчих колец предварительно кладут в большие
банки с эфиром и умерщвляют находящихся в них насе-
комых, затем заморенный материал перекладывают па
лист белой бумаги и разбирают; сначала выделяют все
виды насекомых, различные их фазы, подсчитывают, как
обычно, и раскладывают в коробки с ватными слоями
или в банки с фиксатором, снабдив этикетками с указа-
нием где, когда и каким методом собрано.
Другую часть колец переносят в энтомологические
садки для выведения из находящихся в них преимаги-
нальных фаз взрослых насекомых или их паразитов. Со-
держать насекомых следует в таких условиях, в каких
они жили в природе (при осенних сборах оставляют са-
док в саду (лесу), но после первых морозов переносят в
лабораторию и получают «выводки» зимой, что значи-
тельно облегчит работу.
При снятии ловчих колец весной содержимое их сразу
кладут в садок и переносят в лабораторию для выведе-
ния взрослых форм и паразитов. Результаты анализа
ловчих колец заносят на карточку.
Карточка для анализа ловчих колец
Название насаждений---------Дата наложения колец--------
Способ наложения колец----------------------------------
Название дерева и его характеристика--------------------
Дата уборки колец---------------------Сколько проб (колец)
анализировано ------------------------------------------
№ Название Количество Сведения о выведенных паразитах
п.п. насекомых яиц личинок куколок взрослых
1 1
258
Изучение насекомых, живущих в коре
и древесине
При изучении короедов и других скрытоживущих жу-
ков обязательны массовые сборы материала. Для этого
сборы должны быть максимально эффективными. Ниже
описываются различные приспособления для получения
такого материала.
Выведение короедов из обрубков. Выпиливают из об-
следуемого поваленного дерева обрубки, смазывают их
края парафином или смолой для предотвращения высы-
хания и помещают в обыкновенный холщовый мешок так,
чтобы он неплотно облегал обрубки, так как короеды
иногда прогрызают ткань. Наиболее удобная величина
мешка 70 см, но можно использовать мешки и других
размеров — от 60 до 150 см, при этом они должны быть
на ГО—15 см больше обрубков. Вместе с обрубком поме-
щают в мешок и этикетку с подробными сведениями о
пробе. Мешок подвешивают в прохладном неотапливае-
мом помещении — в сарае, амбаре, подвале. Для выведе-
ния жуков из небольших обрубков вместо мешка лучше
пользоваться стеклянными банками, которые сверху об-
вязываются марлей. Содержимое мешка и банки время
от времени вытряхивают на лист белой бумаги, сортиру-
ют его, насекомых замаривают и переносят на ватник
(или монтируют). Одновременно здесь же учитывают и
вылетевших паразитов, которые вывелись из живущих в
обрубках насекомых. Для облегчения сбора и экономии
времени применяют механический метод: в отверстие
мешка вставляют обыкновенную банку или фотоэклектор
Плигииского. Насекомые, устремляясь к свету, попадают
в банку или в морилку фотоэклектора. При таком спосо-
бе можно собрать и редкие виды, находящиеся в лесу
единично. Но следует иметь в риду, что обрубки в мешках
в лабораторной обстановке быстро сохнут и короеды
некоторых видов не успевают завершить свое раз-
витие.
Выведение короедов в лесу (по Старку). 1. Выведение
в мешках. Этим способом пользуются при наблюдениях
над дополнительным питанием жуков. Часть ствола или
ветвей обтягивают мешком на металлическом каркасе с
9:
259
таким расчетом, чтобы мешок не прилегал плотно к по-
верхности дерева. Периодически осматривают мешок и
собирают вылетевших
насекомых.
2. Выведение в де-
ревянных ящиках.
Ящики могут быть раз-
ной величины, но не
менее метра в длину.
Изготовляют их из
плотно подогнанных
досок. Изнутри ящики
покрывают черной ма-
товой краской. Для до-
ступа воздуха внутрь в
одну из боковых сте-
нок желательно вста-
вить небольшую плот-
но прилегающую раму,
Рис. 98. Ящик для выведения ко- обтянутую сеткой. В
роедов (по Старку) передней стенке ящика
проделывают отверстие
для пробирки, колбы или специально для этого приспо-
собленного фотоэклектора Плигинского (рис. 98). Места
срезов на обрубках протирают парафином, смолой или
каким-либо иным плохо пропускающим влагу составом
для предотвращения от высыхания. Обрубки переносят в
ящик (рис. 98).
Для выведения некоторых видов жуков, требующих
большой увлажненности, на дно ящика насыпают до 2 см
речного песка, прокаленного и смоченного кипяченой во-
дой. Можно вместо песка использовать гигроскопическую
вату или мох. Периодически осматривают фотоэклектор
ящика и выбирают насекомых. Собранный материал
фиксируют, сушат и сохраняют обычным способом.
3. Сбор на ловчие кучи и ямы (рис. 99 Л, Б). Этим
методом пользуются непосредственно в лесу на стацио-
нарных пунктах. Свежесрубленные ветви стоячих деревь-
ев складывают в кучи высотой в 1 м при диаметре 1 м.
Нагребают немного листьев и все это перемешивают.
Такие кучи привлекают короедов, поэтому время от вре-
мени осматривают ветви, просеивают подстилку, находя-
щуюся под этой кучей, и собирают жуков. Можно пользо-
260
ваться ловчими ямами Громана (рис. 99 В, Г), которые
дают лучшие результаты. При специальных исследовани-
ях пользуются ловчими деревьями, которые дают воз-
можность экспериментировать.
и
Рис. 99. Приспособление для лова короедов (по Старку). А — ловчая
куча из свежей коры и кольев; Б — ловчая ветвь, зарытая вершиной
в почву; В — ямы Громана на глинистых почвах; Г — то же, на сы-
рых почвах
4. Сбор световым самоловом. Короеды охотно летят
на свет. Пользуясь этой особенностью, летом их можно
ловить световым самоловом Сахарова, рассчитанным на
лов ночных насекомых.
5. Выведение паразитов из короедов проводится по
методике, изложенной выше (см. стр. 234).
Фиксирование и обработка. Насекомых замаривают
и сохраняют на вате в сухом виде как обычно (см.
стр. 150), но можно пользоваться и другим методом. Коро-
едов собирают в пробирки, которые наполняют доверху
спиртом, снабжают этикеткой, закрывают ватными там-
понами и помещают в банку с 75° спиртом. По прибытии
на место постоянной работы или на базу пробирки сле-
•дует переложить в банку с притертой пробкой и так хра-
нить до обработки (рис. 100).
261
рают личинок и
Рис. 100. Хра-
нение пробирок
со сборами в
лабораторных
условиях
Изучение личинок и куколок. Личинки и куколки ко-
роедов, как и другие стволовые вредители, исследованы
совершенно недостаточно, хотя с ними часто приходится
сталкиваться при решении практических вопросов. Соби-
куколок для морфологического и анато-
мического описания, для изучения си-
стематического положения, для выяс-
нения деталей онтогенеза, а также для
выведения из них паразитов, изучения
экологии вида и составления прогно-
зов.
Собранных личинок обливают ки-
пятком (не варить!) и помещают в96°
спирт вместе с этикеткой. Через 10—15
дней личинок переносят в спирт мень-
шей крепости, где их и сохраняют (рис.
100). Спирт можно заменить смесью,
состоящей из 75 частей 96° спирта и 25
частей глицерина или 99 частей 75°
спирта и 1 части ледяной уксусной кис-
лоты.
Молодые нежные личинки после ки-
пятка лучше помещать в раствор Мак-
Грегора (10 см3 неразведенного фор-
малина, 10 см3 5 %-ной буры, добавить до 100 см3 дистил-
лированной воды и 2 см3 глицерина).
Можно сохранять личинок в глицерине или в глице-
рин-желатине, куда их переносят из кипятка. Наконец,
сохраняют их в насыщенном растворе обыкновенной по-
варенной соли (обдав личинок кипятком, переносят их в
раствор соли, где и сохраняют) или помещают в кипя-
щий раствор поваренной соли (не кипятить!), дают ос-
тыть вместе с раствором и в таком виде хранят. Иногда
проводят и сухую засолку личинок (стр. 186).
Изучение ходов* и повреждений. В тех случаях, когда
невозможно взять образцы ходов из-за большого веса об-
рубков, нужно сфотографировать их или снять с них ко-
пии (рис. 101). А. И. Ильинский рекомендует снимать
копии ходов так: очищают ходы, сглаживают неровности
и, удалив сучки, накладывают на приготовленную поверх-
ность белую бумагу (лучше восковку), на нее копиро-
вальную бумагу изнанкой наружу и прикалывают по
краям кнопками или булавками. Протирают всю поверх-
262
a
Рис. 101. Ходы короедов (общий вид) и устройство
ходов. Внизу — схема заселения дубовых пней (по
Рефесу):
а — заселение пня, не давшего поросли на сплошной лесо-
секе, в первом году после рубки; б — заселение ни я под
пологом леса в первом году после рубки
ность копировальной бумаги гладкой палочкой. Когда из-
нанка копировальной бумаги посветлеет и на ней начнут
обозначаться контуры ходов, копия готова. С такого от-
печатка на восковке можно получить фотокопию, исполь-
зуя восковку как негатив.
Изучение циклов развития беспозвоночных
и фенологии
Изучение жизненных циклов насекомых, причинной
зависимости жизненных явлений от окружающих условий
и периодических явлений входит обязательной составной
частью в комплексные исследования рассматриваемых
многочисленных беспозвоночных, являющихся важным
компонентом природных и культурных биоценозов. Фено-
логические наблюдения за насекомыми, помимо общебио-
логцческого значения, представляют чрезвычайно боль-
шой практический интерес, так как объектами изучения
обычно служат вредители сельскохозяйственных расте-
ний, насекомые-опылители, переносчики болезней челове-
ка и домашних животных и т. п.
Основная задача фенологических наблюдений — от-
метить все моменты жизни насекомого.
1. Стадия, время и место зимовки.
2. Время весеннего появления, массовый лет. Допол-
нительное питание.
3. Созревание яичников самок, начало и массовое.
4. Откладки яиц, начало, массовая откладка и конец
ее. Количество яиц. Характеристика места яйцекладки.
5. Начало отмирания зимовавших особей, конец отми-
рания.
6. Начало выхода личинок из яиц, массовый выход.
7. Линька и переход личинок во второй, третий и т. д.
возрасты.
8. Окукливание, начало и массовое окукливание. Ме-
сто окукливания.
9. Начало выхода взрослых насекомых нового поко-
ления, массовый выход.
10. Начало ухода насекомых на зимовку, массовый
уход.
Эти явления нельзя познать без одновременного из-
учения и фенологии растений, с которыми тесно связано
264
в своем развитии большинство насекомых, а также без
учета метеорологических и других значительных перио-
дических явлений.
Знание этих зависимостей позволяет обосновать про-
гнозы появления и развития вредных насекомых, дает
возможность наметить лучшие сроки борьбы с вреди-
телями. Так, установлено, что сроки развития яблонного
цветоеда (который в фазе яйца, личинки и куколки нахо-
дится в бутонах яблони) связаны со сроками цветения
кормового растения, а действию ядов подвержены только
взрослые жуки этого вида в период их весеннего допол-
нительного питания и яйцекладки.
Весенний вылет бабочки плодожорки обычно совпа-
дает с периодом осыпания избыточной завязи яблони, по-
явление майских жуков — с распусканием листьев бере-
зы (подробно см. «Изучение биоклимата»).
Фенологические наблюдения обычно ведутся на не-
скольких разнородных биотопах (в поле, саду, лесу
и т. д.) не реже одного раза в три дня. Для наблюдения
лучше выбрать типичные для данной местности постоян-
ные участки и вести здесь наблюдения регулярно, иногда
на протяжении нескольких лет, что позволит значительно
полнее и точнее выявить сроки появления и развития ис-
следуемого объекта, составить фенологический кален-
дарь. Наблюдения упрощаются, если вид насекомого уже
известен. При наблюдении за вредителями производят
тщательный осмотр растений, живущих на них насеко-
мых стряхивают. Рекомендуется делать записи сразу же
на месте наблюдений, которые затем переносятся в спе-
циальный журнал с указанием места наблюдений. Ни-
же приведена форма записей в журнал.
Числа месяца
Вид насекомого
2 3 4 5 6 7 8 9 10 и т. л.
Для обработки материалов и возможности сравни-
тельного изучения фенологии вида в различных местах
его обитания и размножения важно пользоваться единой
методикой. Б. В. Добровольским разработаны обозначе-
265
ния, используя которые можно дать графическое изобра-
жение хода развития насекомого, вставляя в календарную'
решетку значки, соответствующие фазам развития. Так.
составляют фенодиаграммы (рис. 102). Применяют так-
ф Куколка б коконе
• Яйцо
Личинка l одозначе-
—наем возраста
Миграция личинок
Куколка б колыбельке
Ф Взрослое насекомое /К
б колыбельке
взрослое насекомое б гт-гт1
\~Г) недеятельном состоянии
(___) Личинка б недеятельном [(—)|
' ' состоянии 4
Период нанесения бреда
— Сроки проведения борьбы
ф Нимфа Щ
ф Кокониробание ©
• Куколка @
же и другие способы графического изображения цикла
развития насекомых. При первичных записях наблюде-
ний в природе, как уже отмечалось, целесообразно поль-
зоваться цифровыми или буквенными обозначениями,
что исключает путаницу, и делает записи более досто-
верными.
Часто бывает важно установить соотношение полов,
состояние гонад самок взрослых особей. Для этого не ре-
же одного раза в пять дней в условиях стационара отби-
206
рают 16 экземпляров насекомых и, вскрывая самок, уста-
навливают состояние половых продуктов. В соответствии
с результатами анализа самок делят на такие группы:
самки, вступившие в начальную фазу развития, — в
яичниках отчленяются зачатки яиц;
развитые — в яичниках имеются развитые яйца;
окончившие откладку — яичники пустые.
Для наблюдений над развитием насекомых в почве
следует брать почвенные пробы один раз в 5 дней, но не
реже одного раза в 15 дней по способу, указанному выше.
На основании обработки полученных данных за ряд
лет составляют фенодиаграммы по каждому виду.
Беспозвоночные как фактор разложения
растительных остатков
Беспозвоночные животные являются основными аген-
тами механического раздробления растительных остат-
ков, это размельчение сочетается с воздействием на суб-
страт пищеварительных соков животного и с обогащени-
ем выброшенных экскрементов азотсодержащими про-
дуктами белкового обмена (Гиляров, 1939, 1951,
1964, 1967). Особенно большое значение имеют
беспозвоночные в жизни леса, где в силу естественных
причин и в результате хозяйственной деятельности чело-
века накапливаются и подвергаются разрушению значи-
тельные скопления древесины (ветровальные, бурелом-
ные, ослабленные, усыхающие деревья, пни, порубочные
остатки древесины на лесосеках и т. д.). Вслед за механи-
ческим размельчением растительного субстрата беспоз-
вочными наступает период резкой активизации деятель-
ности грибов и бактерий в выброшенных животными экс-
крементах. Поэтому роль беспозвоночных в процессах
гумификации можно уподобить роли катализатора в хи-
мических процессах (Мамаев, 1961).
Достаточно сказать, что при благоприятных условиях
беспозвоночные перерабатывают до 100% коры и до 80%
древесины, ускоряя тем самым круговорот органического
вещества в природе.
Наиболее обычными ксилобионтами являются корое-
ды, усачи, златки, пластинчатоусые жуки, некоторые му-
хи, муравьи, дождевые черви и энхитреиды. Причем ос-
267
новными агентами механического размельчения являются
личинки насекомых, в то время как основными гумифика-
торами—дождевые черви, энхитреиды и другие живот-
ные, перерабатывающие древесную труху, образовав-
шуюся в результате деятельности личинок насекомых.
Разрушение коры начинается видами семейства
короедов Ipidae. Короедов сменяют личинки усачей
(Cerambycidae), златок (Buprestidae), мух (Asilidae, Ху-
lophagidae). Ходы, образующиеся в результате деятельно-
сти личинок, впоследствии используются муравьями La-
sius, Myrmica для постройки гнезд. Там, где муравьи от-
сутствуют, переработку древесины продолжают личинки
подкорников (Pyrochroa, Schizotus и др.). И, наконец, в
массе появляются дождевые черви, энхитреиды, много-
ножки, мокрицы, моллюски.
Разрушение древесины начинается с поселения уса-
чей, златок, рогохвостов. Следом за ними идут личинки
рогачей, пластинчатоусых и двукрылых. Последними по-
являются муравьи, энхитреиды, моллюски, многоножки
и дождевые черви.
При полевых исследованиях выясняют, на каких ста-
диях разрушения древесных остатков происходит заселе-
ние их той или иной группой беспозвоночных ксилобион-
тов, какие морфологические изменения коры и древесины
сопровождает это заселение, с какой скоростью осуществ-
ляется процесс разрушения.
Осмотр древесных объектов рекомендуется (Криво-
шеина, Мамаев, 1968) начинать с отслоения коры и ис-
следования ее по всей толщине. Затем топором отделяют
куски древесины и тщательно просматривают их. Засе-
ленный участок древесины распиливают на имеющие пра-
вильную геометрическую форму отрезки длиной 20 см.
Каждый из них разбирают вручную. Затем, определив
объем отрезка, пересчитывают количество обнаруженных
беспозвоночных на 1 дм3 древесины или соответственно
на 1 дм2 коры.
Кроме осмотра стволов и пней, следует просматривать
лежащие на земле мелкие ветки или куски коры, на ко-
торых также могут развиваться отдельные группы беспоз-
воночных.
Обнаруженных личинок фиксируют здесь же, в поле-
вых условиях в 70%’-ном спирте или 5%-ном форма-
лине.
268
На базе или в лаборатории крупных личинок извлека-
ют из спирта и на несколько минут помещают в нагретую
до кипения, но не кипящую воду, затем переносят в спирт
и снабжают постоянной этикеткой, в которой указывают
место сбора, породу дерева, зону ствола, дату сбора. Все
данные, касающиеся сбора, заносятся в4дневник. Этикет-
ка и соответствующая ей запись в дневнике должны иметь
один и тот же порядковый номер.
Если удается обнаружить большую серию личинок
какого-либо вида, то часть их можно взять для воспита-
ния до имагинальной фазы. Для этого личинок вместе с
куском древесины помещают в широкую плоскодонную
пробирку и затыкают ее ватной пробкой. Молодых личи-
нок лучше поместить с достаточно большим количеством-
субстрата в полиэтиленовые мешки, плотно завязав их
веревкой. Когда личинки подрастут, их можно перенести
в пробирки.
Хищных личинок содержат поодиночке и подкармли-
вают теми же насекомыми, которыми они питаются в ес-
тественных условиях.
Если сбор материала проводился осенью, куски коры
или древесины помещают в полиэтиленовые пакеты и
хранят при температуре — 5° С в течение 1,5—2 месяцев
для перехода в состояние диапаузы.
Для выявления роли беспозвоночных животных в раз-
ложении растительных остатков можно рекомендовать
методику, разработанную Г. Ф. Курчевой (1960). В ее
опытах показано, что если внесением нафталина в субст-
рат отпугнуть беспозвоночных, то из-за отсутствия произ-
водимого ими механического разрушения субстрата при
участии одних только микроорганизмов гумификация лес-
ной подстилки замедляется в несколько раз. Для провер-
ки этогое берут растительные остатки, подсушивают до
воздушно-сухого состояния, взвешивают и помещают на
ранее намеченные участки площадью в 1 м2 каждая. Пос-
ле этого площадки накрывают рамками (с высотой сте-
нок 15 см), затянутыми капроновой сеткой с размером
ячеек 2X2 см. Сетка предохраняет растительные остатки
от ветра и других воздействий. Половину площадок об-
рабатывают нафталином, нанося его тонким слоем на
растительные остатки. Так как нафталин испаряется, его
периодически подсыпают вновь. Другая половина пло-
щадок не обрабатывается нафталином и служит конт-
269
ролем. В конце опыта растительные остатки собирают со
всех площадок, вновь доводят до воздушно-сухого состоя-
ния и взвешивают, определяя потерю веса в контроле и
в опыте.
Существует и другой способ устранения беспозвоноч-
ных от участия в процессе разложения (Heath, Edwards,
Arnold, 1964), по Гилярову (1966).
Растительные остатки (лесной опад и т. п.) помещают
в мешочки (10x7 см) из капроновой сетки. Размеры
ячеек сетки можно подбирать так, чтобы внутрь мешоч-
ков могли проникнуть только определенные группы бес-
позвоночных животных. Так, например, сетка с ячейками
0,5 мм дает доступ к растительным остаткам клещам, но-
гохвосткам и другим мелким почвенным беспозвоночным.
Мешочки помещают на поверхность почвы, прикрывая
опадом, или закапывают в почву на глубину 2—3 см. Для
сравнения хода разложения в конце опыта учитывают
как изменение веса, так и изменение площади раститель-
ных остатков. Для получения последнепгпоказателя рас-
тительному материалу перед опытом лутае придать оп-
ределенную форму, например диска диаметром 2,5 см,
что достигается с помощью коркового бура. Измерение
площади дисков в ходе опыта можно производить элект-
рофотометром. В лабораторию мешочки следует перено-
сить в полиэтиленовых мешках, чтобы предохранить рас-
тительные остатки от высыхания. Участие беспозвоночных
в разложении древесины определяют по весовому соот-
ношению. Количество древесины (в граммах сухого ве-
щества), перерабатываемой беспозвоночными животны-
ми определенного вида, высчитывают по формуле, пред-
ложенной Б. М. Мамаевым (1961). Высчитывается
С
коэффициент усвоения по отношению-------
„ Р% — Р1 *
где С — сухой вес древесины (в граммах), переработан-
ный беспозвоночными за определенный период;
Pi — вес беспозвоночных в начале эксперимента;
Р2 — конечный их вес.
Эксперимент по коэффициенту усвояемости проводят
в природных условиях. Зная коэффициент усвояемости,
определяют участие беспозвоночных в разложении древе-
сины по формуле
NMC
х-р^р,’
270
где Af— среднее число беспозвоночных данного вида;
7И — усредненный максимальный вес.
Изучение влияния беспозвоночных на физические
и химические свойства почвы
Воздействие беспозвоночных на почву разносторонне.
Они изменяют ее химический состав, влияют на минера-
логический состав и физические свойства, ускоряя или
изменяя процесс почвообразования.
Рис. 103. Копролиты червей
Роль почвообитающих беспозвоночных после класси-
ческих работ Дарвина изучали многие исследователи (см.
литературу).
Полевое исследование этой стороны жизнедеятель-
ности беспозвоночных предполагает применение комби-
нированных методик (сочетание полевых с лабораторны-
ми). Принцип сводится к следующему. Берут пробы
(образцы) почвы, подвергшейся воздействию беспозво-
ночных, и отдельно образцы не подвергшейся воздействию
почвы; анализ образцов проводят по бычиым, применяе-
мым в почвоведении методикам.
Известно, что дождевые черви накапливают в кишеч-
нике кальций в виде биогенного кальцита, который по-
ступает в почву с копролитами и тем обогащает ее каль-
цием, оказывая нейтрализующее действие на кислые
почвы. Для учета в полевых условиях выделяют площад-
ки в 1 л/2 в разных местах, очищают от выбросов и других
предметов и регулярно в течение определенного времени
(месяца, сезона) собирают выбросы и взвешивают
(рис. 103). Сделав соответствующие вычисления, полу-
271
чают количество копролитов на 1 га за срок исследова-
ния (лучше брать сезон).
Учитывая, что червь пропускает через свой кишечник
землю в количестве, равном весу его тела, можно изучить
влияние червей на перемешивание почвы и изменение
физических свойств ее.
Рис. 104. Влияние червей на плодородие почвы
(слева — сосуд с червями, справа — без чер-
вей) (по Зражевскому)
Почвенно-зоологическими пробами выявляют количе-
ство червей (по видам) на 1 ж2. Освободив кишечник
червя, определяют средний вес одной особи. Зная про-
должительность деятельности в году (в днях), вычисляют
продуктивность червей в данном месте. При весе червя
в 1 г, при 100 экземплярах на 1 / и при 180 днях про-
272
дуктивность будет 18 кг на 1 ж2, что равно 180 т на 1 га
(по Чекановской, 1960).
Влияние на структурообразование изучают по мето-
дике, описанной Соколовым (1956). Берут сосуды с сетча-
тым дном (размеры в зависимости от особенностей изу-
чаемых объектов), заполняют почвой, взятой из гумусо-
вого горизонта, растертую и просеянную через сито
(используют фракции почв 0,5 мм или 0,!э—1 мм) /Кореш-
ки и другие растительные остатки после просеивания при-
мешивают к почве. Почву в сосудах уплотняют. В поло-
вину сосудов вносят испытуемых животных (червей),
другая половина служит контролем. Сосуды зарывают в
землю так, чтобы земля сосуда через сетчатое дно имела
капиллярную связь с почвой, а поверхность содержимого
сосуда совпадала с поверхностью нетронутой почвы, в ко-
торую закапывают сосуд. В нужных случаях (когда чер-
ви скапливаются на поверхности) в сосуды на поверх-
ность почвы следует вносить листья, труху и другой раз-
лагающийся растительный материал.
Влияние на водопрочность изучают методом слива —
количеством воды, необходимым для размыва почвы на
отдельные частицы. Анализ структурных элементов на во-
допрочность в лабораторных условиях проводится по ме-
тоду Пономаревой (1950).
Изучение влияния животных на водопроницаемость
почвы проводится в зависимости от величины животных.
Дождевых червей и других крупных животных изучают
по методике, описанной в литературе (ср. Гиляров, 1966).
Изучение беспозвоночных зимой
Насекомые и другие беспозвоночные в зимний период
находятся обычно в недеятельном состоянии, к тому же
за редким исключением в одной какой-нибудь фазе.
В этом заключается сложность их изучения.
Насекомые зимуют в имагинальной фазе или в фазе
личинки, куколки или даже яйца. Зимовки большинства
беспозвоночных в природных условиях вообще изучены
недостаточно и поэтому для получения новых данных тре-
буются систематические наблюдения в течение всего года.
Для полного представления о жизни животного на протя-
жении года и для решения ряда вопросов из жизни вида
273
следует обязательно проводить зимние исследования, со-
четая их с весенне-летними и осенними. Любые данные о
животных, даже самый незначительный на первый взгляд
факт, но точно установленный, проверенный и докумен-
тированный, может оказаться ценным материалом для
изучения зимующих беспозвоночных животных.
Зимой создаются для животных своеобразные условия.
Для одних они благоприятны, для других губительны.
Основные специфические условия зимы следующие: низ-
кая температура, замерзший грунт, замерзшие растения
и все влажные среды в почве и на ней и наличие снеж-
ного покрова, который в ряде случаев служит своеобраз-
ным покровом, защищающим нижележащий субстрат от
сильного охлаждения (промерзания); частая облачность
и недостаточная интенсивность солнечного освещения.
Наконец, стоит указать на резкие изменения температуры
и интенсивности солнечного излучения, которые приводят
к резким колебаниям погодных явлений — оттепель чере-
дуется с морозами, что сказывается тем или иным обра-
зом на жизни многих животных организмов.
Зимой прекращается вегетация растений, служащих
пищей для животных. Сами же животные в подавляющем
большинстве также прекращают активную деятельность.
Но некоторые насекомые, как и другие беспозвоночные,
приспосабливаются к этим специфическим условиям на-
столько, что для многих зимующих фаз низкая темпера-
тура становится необходимым условием развития. Напри-
мер, у боярышницы и ряда других бабочек гусеницы уже
в конце июня прекращают питание, у них наступает диа-
пауза, и лишь следующей весной, после того как они под-
вергнутся охлаждению, могут снова перейти к активной
жизни. Насекомце, зимующие во взрослой фазе, также
нуждаются в охлаждении в этот период. Так у саранчи,
не подвергшейся действию низких температур, не пол-
ностью развиваются половые органы. По Н. А. Холодков-
скому, для хермесов также обязательно охлаждение в
фазе взрослого насекомого.
Как приспособление к низкой температуре, у насеко-
мых к зиме происходит физиологическая перестройка.
Это начинается с осенним похолоданием. Сильно понижа-
ется газообмен, сокращается количество воды в теле; за
счет частичного уменьшения жировых запасов увеличива-
ется количество гликогена, К моменту наступления зим-
274
них холодов в организме насекомого имеются достаточ-
ные жировые и углеводные резервы. Чем меньше в орга-
низме воды и чем больше в нем жира и гликогена, тем
более низкие температуры животное может переносить.
Большинство видов беспозвоночных находится в не-
деятельном состоянии и лишь немногие аз них появляют-
ся на поверхности снежного покрова. Все это следует
иметь в виду при выборе методики и составлении плана
проведения зимних наблюдений.
Места зимовки беспозвоночных. В саду — в почве или
на деревьях — зимуют личинки многих насекомых,
важных в хозяйственном отношении (листоблошек, раз-
личных тлей, жуков и т. д.). В лесу на стволах деревьев
обычно до высоты 1 —1,5 м в густом войлоке из волосков
можно найти кладку яиц непарного шелкопряда, на вет-
ках деревьев — кольца кладок яиц кольчатого шелкопря-
да, чехлики моли. На кронах деревьев — в гнездах из
скрученных листьев — мы. находим множество гусениц
златогузки, боярышницы. Под корой деревьев и пней, в
подстилке скопляются на зимовку мухи, клопы, божьи ко-
ровки. На заборах можно встретить куколок капустни-
цы или других бабочек.
Под корой пней, под листвой находятся в недеятель-
ном состоянии личинки, куколки, а иногда и различные
взрослые насекомые, пауки, мокрицы, многоножки и др.
В хвойных и смешанных лесах, в стволах деревьев, в тре-
щинах коры и под сухой корой старых елей и сосен встре-
чаются зимующие сосновые клопы (Aradus cinnamo-
meus), в еловых шишках зимуют гусеницы листовертки,
клопы (Gastrodes abietum), некоторые мелкие жуки и но-
гохвостики (Collembola).
Насекомые забираются на зимовку в сараи, погреба,
ледники, здесь можно найти различных мух, комаров
(Culex, Anopheles).
Могут встречаться зимой в укрытиях среди растений
и бабочки крапивницы, лимонницы и совки (Scoliopteryx
libatrix). На стволах деревьев можно встретить дубового
коконопряда (Gastropacha quercifolia). Все зимующие
взрослые насекомые неподвижны. Они сидят на различ-
ных субстратах, в углах, на стенах и потолке помещений.
В сырых подвалах и других помещениях в развивающих-
ся здесь плесени и других грибах встречаются мелкие ко-
марики из сем. Fungivoridae. Могут попадаться сенокос-
275
Цы и пауки в паутине. Регулярный осмотр помещений
через определенные промежутки времени дает ценный ма-
териал для решения различных теоретических и практи-
ческих вопросов. В частности можно решить вопрос о ха-
рактере и ’Состоянии зимовки самок комаров, что важно
для прогнозов, борьбы и профилактики.
Обитают насекомые зимой также и на снегу. Здесь
можно найти наибольшее количество видов насекомых
(Chionea) и пауков. В еловом лесу на снегу даже при
низкой температуре (—12° С) встречаются пауки Liny-
phia, которые спускаются на паутинках с дерева на снеж-
ный покров и часто зарываются в снег. При раскапыва-
нии снега можно найти их в большом количестве. Под
Москвой собрано за три года на снегу около 300 экземп-
ляров пауков, относящихся к 49 видам (Райков и Рим-
ский-Корсаков). Беспозвоночные выходят на поверхность
снега через щели вокруг стволов деревьев, около пней,
веток, лежащих на земле, вдоль стен каких-нибудь по-
строек и т. п., где, как известно, снег быстрее оттаивает.
Часто находят на снегу комаров Trichocera, различных
пауков. Бывают иногда в массе ногохвостки Collembola,
появление которых на поверхности снега обусловлено их
фототаксичностью (Мельниченко), которая, следователь-
но, зависит от степени освещенности биотопа солнцем.
Температура же окружающей среды лишь регулирует
движение насекомых. Для этих видов относительная
влажность 96—100% является оптимальным условием
жизнедеятельности.
Часто зимой можно встретить различные виды насеко-
мых в активном состоянии. Эти членистоногие ползают
по снегу, четко выделяясь на белом фоне. Иногда насеко-
мых находят в состоянии глубокого оцепенения, что бы-
вает в тех случаях, когда после оттепели сразу наступает
мороз. Этих насекомых следует также собирать, как и
живых. Они дадут представление о видовом составе оби-
тателей снега. У таких видов, как Chionea (бескрылые
комары) и некоторых Fungivoridae (грибные комары),
происходит на снегу копуляция.
Некоторые виды из указанных насекомых активны и
в самое жаркое время года (различные клопы, жуки, ли-
стоеды, стафилины). Специфичными зимними формами
являются лишь немногие представители Chionea, Boreus
(из скорпионовых мух), пауки. На снегу встречаются ча-
276
Сто й личиночные формы, например, снежные черви (ли-
чинки Cantharis), последние вместе со снежными блоха-
ми (^ojiHypogastrura) из ногохвостов иногда появляются
массами. В Карпатах такое явление довольно обычно.
В Закарпатье в иные годы мы находили их в массе,.
В горах на снежных вершинах или на сохранившихся
участках снега насекомых можно найти и в летнее время.
Это главным образом различные хищные жуки (Coccinel-
lidae, Cantharidae, Staphylinidae), некоторые клопы. За-
летают сюда, очевидно, привлекаемые белым цветом суб-
страта различные листоеды, двукрылые и даже бабочки.
Изучая животных в зимнее время, мы можем выяс-
нить, Bi каком состоянии, в каких фазах и где живут те
или иные виды наземных и почвенных обитателей; оста-
ются ли зимой животные на своих местах (внутри расте-
ний, под корой, в подстилке и т. п.) или уходят; как со-
вершается эта миграция и когда; выявить активные зи-
мой виды или отдельные их фазы и изучить особенности
их жизнедеятельности.
Общие задачи исследования должны включать сле-
дующие методические вопросы: 1) способы нахождения
и методы сбора зимующих в природе беспозвоночных;
2) проведение биологических наблюдений за жизнью бес-
позвоночных в природе и лабораторных условиях; 3) спо-
собы и приемы обработки собранного материала.
Находят и собирают животных в солнечную погоду,
когда наступает оттепель. Около деревьев можно найти
ногохвосток и других беспозвоночных; между кустарни-
ками— бархатисто-черных «снежных червей», собирают
их обычным пинцетом, кисточкой, смоченной в спирте; в
саду — гнезда бабочек собирают с деревьев вручную, вы-
резав их ножницами или ножом. Из-под снега в лесной
подстилке насекомых собирают обычным способом (см.
«Учет населения лесной подстилки»). Собранных живот-
ных, относящихся к различным систематическим груп-
пам, фиксируют одним из приведенных для данной груп-
пы способов и обязательно этикетируют.
Количественный учет зимнего населения плодового де-
рева. Метод, предложенный В. Л. Пятаковой, состоит в
следующем: срезают с нескольких деревьев в разных ме-
стах сада некоторое количество побегов, общая длина ко-
торых должна быть примерно 60—80 м. Каждый побег
в отдельности осматривают, причем однолетние и двулет-
277
нИё отдельно. Подсчитывают количество побегов, опре-
деляют средний годичный прирост (количество метров
делится на количество срезанных побегов). Затем под-
считывают общее число однолетних побегов на тех же
деревьях. Зная средний прирост, выводят суммарную
длину вето?; всего дерева (в зимнее время определение
количества побегов на дереве не представляет большого
труда). Подсчитывают количество вредителей, найденных
при анализе, и, определив приблизительную суммарную
длину одно- и двулетних побегов на дереве, можно вы-
вести соответствующее среднее количество вредителей,
населяющих все дерево. Результаты учета записывают
на карточку по следующей форме.
Карточка учета зимнего населения плодового дерева
Название дерева
Местонахождение сада-------------
№ п.п. Название вредителя Количество особей на 100 м побегов Процент заселенных ветвей Примечание
однолетних двулетних однолетних двулетних
Этот метод применяют для специального учета зи-
мующих на деревьях насекомых: червецов, тлей, листо-
верток, чехлоносок (Coleophoridae), яблоневой моли,
пядениц (яйца) и других беспозвоночных, для составле-
ния прогнозов весеннего появления вредителей.
УЧЕТ И ИЗУЧЕНИЕ ОТДЕЛЬНЫХ ГРУПП
БЕСПОЗВОНОЧНЫХ
Нематоды, связанные с растениями
Паразитами растений являются нематоды, которые'
находятся внутри здоровых или уже заболевших, но еще
не отмерших частях растений. Часто на один вид растения
нападает целый ряд видов нематод. Например, на кар-
тофеле паразитируют 25 видов, на ржи — 19, на пше
нице—13, на клевере—15, на свекле—17, на люцер
не — 9ит. д. (Кирьянова).
278
В отмерших растениях имеется всегда богатая фауна
нематод, являющихся уже не паразитами, а сапрозоями.
Такие нематоды поселяются в растении вторично,,
вследствие их заболевания, но не являются причиной
заболевания. Нематод — паразитов растений — в таких
отмерших тканях может и не быть. Нормально они ж\т-
вут в живых свежих тканях и при заболевании послед-
них нематоды покидают растение и уходят* в почву. Та-
ким образом, если имеется заболевшее (умирающее))
растение, паразитических нематод следует искать в.
оставшихся живых тканях или в прилегающих к ним жи-
вых растениях, а также в почве.
Сбор и обработка нематод. Собирают корешки и тка-
ни живых растений и перекладывают в воронку с водой
или делают из них отжим — для этого раздавливают
ткань между пальцами или разрывают растение каким-
нибудь тупым стеклянным предметом в некотором ко-
личестве воды; эту воду вместе с получившейся мутью
сливают щ банку и фиксируют в одном из доступных
фиксаторов.
Фиксация формалином. Нематод перед фиксирова-
нием следует анестезировать одним из описанных спо-
собов.
1. Банку с нематодами или с отмытыми раститель-
ными остатками ставят в водяную баню и подогревают
приблизительно до 50° С так, чтобы она стала теплой на
ощупь, в такой воде нематоды приходят в состояние оце-
пенения и вытягиваются. Затем наливают в жидкость,
продажного формалина !/2о—V25 части находящейся в;
пробе воды, получается 4%-ный раствор. В таком виде1
сохраняют до обработки.
2. Добавляют к воде (в банку с отмытыми остатка-
ми) хлоралгидрата 1%. Через полчаса-час наступит
оцепенение и вытягивание нематод. Затем фиксируют в
4%-ном формалине, как указано выше. Перед обработ-
кой, как и при длительном хранении, материал промы-
вают водой, положив его на фильтр из мельничной сетки
или пропускной бумаги. Затем путем прибавления креп-
кого спирта доводят до 70° и в таком виде сохраняют.
Фиксация спиртом. Отбирают нематод в чашку с воз-
можно меньшим количеством воды, нагревают в про-
бирке 70° спирт до кипения и быстро вливают в чашку
р нематодами. Следят за тем, чтобы нематоды, сразу по-
?79
Рис. 105. Воронка для
выделения нематод из
небольших проб и из
корней
пали в горячую жидкость. Этот способ фиксирования
пригоден для целей изучения систематики, морфологии,
анатомии и гистологии.
Фиксация формалином с солью. Применяют смесь из
5%-ного формалина и 1%-ной поваренной соли. Смесь
применяют в горячем и холодном виде и используют для
фиксации тканевых паразитов. Нематоды в этой жидко-
сти не сжимаются и не скручивают-
ся. Если на растениях имеются хо-
рошо выраженные болезненные яв-
ления— галлы, скрученные листья,
утолщение стеблей, — такие расте-
ния фиксируют целиком, как уже
было указано, и сохраняют для изу-
чения. Наряду с фиксацией целого
растения делают также отжим и
фиксируют его в отдельной пробир-
ке. Параллельно с фиксацией необ-
ходимо, кроме того, и засушить
часть таких растений обычным бо-
таническим способом, как уже об
этом упоминалось выше.
Изучение нематод в живом виде.
1. Тонкие корешки или их кусочки
отмывают от земли, зажимают между предметными стек-
лами и рассматривают в проходящем свете под малым
увеличением микроскопа. Нематоды, особенно их личин-
ки, подвижны и хорошо видны. Однако этот метод труд-
ноприменим в полевых условиях.
2. Растение отмывают от земли и опускают в воронку
с водой так, чтобы корни были полностью погружены
(рис. 105). Воронку ставят в банку с водой. Под носик
воронки подставляют погруженную в банку с водой про-
бирку. Носик воронки можно закрыть пробкой или одеть
на него резиновую трубку с зажимом (рис. 106). Дер-
жать растение в таком виде несколько дней (1—3 дня).
Нематоды выходят из корней, попадают в воду и ско-
пляются на дне пробирки, в носике воронки или в рези-
новой трубке. Через 2—3 дня открывают зажим или
пробку и выбирают нематод в пробирку или банку. За-
тем их обрабатывают одним из указанных способов.
Изучение в окрашенном виде. В специальных иссле-
дованиях, а именно, при количественном учете числа
280
нематод, проникших в корнй, прибегают к окрашивании!
Отмытые корни опускают в раствор йода в йодистом
калии (йода — 1%-ного, йодистого калия—10%-ного),
несколько капель на литр воды, и дают постоять 10—
15 мин. За это время йод успевает проникнуть в глубь
тканей корешка и окрасить нематод. Растительные ткани
окрашиваются слабо, нематоды же окрашиваются ин-
Рис. 106. Воронки для выгонки нематод из стеблей и
корней (из Гилярова)
тенсивнее и становятся хорошо заметными. Нематод
можно окрашивать и в разведенной в 10—100 раз
жидкости Флеминга. Смесь Флеминга состоит из хромо-
вой кислоты 1%-ной— 70 частей, осмиевой 2 %-ной —
20 частей и уксусной кислоты—10 частей. Составные
части смешивают перед употреблением. Корни погру-
жают в эту жидкость и выдерживают в ней приблизи-
тельно одни сутки. За это время личинки и нематоды
успевают окраситься осмиевой кислотой в черный цвет
и становятся хоршо заметными. Перед рассматрива-
нием, для увеличения прозрачности объекта, корни сле-
дует поместить в глицерин или молочную кислоту. Этот
способ применяют только в том случае, если необходим
точный учет личинок в корешках. Во всех других слу-
чаях можно изучать нематод в корешках живыми.
Специальное обследование нематод. Стеблевая нема-
тода картофеля живет только в живых тканях. Поражает
281
преимущественно клубни, но может поселяться и в над-
земных органах — стеблях и листьях. Повышенная влаж-
ность способствует более сильному развитию нематодной
болезни картофеля. Заражение клубней происходит ча-
ще всего осенью, а проявляется обычно в период хране-
ния, особенно к весне, когда температура в хранилище
повышается.
В начале поражения на клубнях появляются слабо
заметные пятна свинцово-серого цвета (их может быть
несколько), которые просвечивают из-под целой кожуры
или кожура трескается и образуются очаги. В дальней-
шем ткань меняет свою консистенцию, а кожура утол-
щается, дает трещины, разрывается и легко отстает от
клубпя. По этому признаку легче всего отличать пора-
женные нематодой клубни.
Для выявления и учета стеблевой нематоды неболь-
шую часть поврежденной мякоти клубня следует отде-
лить и поместить в пробирку, наполненную сырой во-
дой. Через некоторое время нематоды выходят из ткани,
их легко заметить, так как они начинают двигаться в
воде.
Картофельная нематода (Heterodera rostochiensis)
поражает корни, иногда и молодые клубни картофеля,
и является самым опасным вредителем этой культуры;
в Англии, например, потери от повреждений этой нема-
тоды доходят до 2 млн. фунтов стерлингов в год. Сохра-
няется в почве до десяти лет и распространяется с клуб-
нями, почвой и почвообрабатывающим инвентарем. Для
того чтобы предотвратить распространение вредителя,
проводятся специальные обследования, при которых ру-
ководствуются , следующими данными. Самки-цисты
сильно увеличены, достигают размеров мелкого зерна до
1 мм, белого или бурого цвета, формой похожи на пу-
зырь, наполненный яйцами, головной конец (шейка)
самки вытянут, червеобразной формы. Самец червеоб-
разный, бесцветный, находится в почве. Самки нематод
прикрепляются головной частью к корешкам и высасы-
вают соки. Пораженный куст отстает в росте, листья
скручиваются и вянут, на корешках появляются боро-
давчатости, клубней образуется мало и, как правило,
они мелкие. По этим признакам при обследовании опре-
деляют пораженные кусты. Кусты картофеля, слабо
пораженные картофельной нематодой, не имеют внеш-
282
Рис. 107. Воронки Кирх-
нера для выделения из
почвы цист нематод
р. Heterodera (iu — шнур
для удаления пробки)
них признаков поражения. Обнаружив очаг поражений
нематодами, приступают к детальному обследованию
участка. Для этого проходят участок по диагонали и бе-
рут в разных его местах определенное количество кустов
(с 1 га примерно 60 проб), у которых просматривают
корневую систему.
Обследование на выявле-
ние очагов картофельной нема-
тоды проводится одним из сле-
дующих рекомендованных спо-
собов:
1. Просмотр корней карто-
феля и томатов во время веге-
тации. Выкапывают подозре-
ваемые растения картофеля и
тщательно осматривают все
корешки.- и клубни. При обна-
ружении самок картофельной
нематоды пораженные части
растений помещают в 70° спирт
или 5%-ный раствор формали-
на с соответствующей этикет-
кой. Обследование целесооб-
разно проводить в период цве-
тения картофеля, когда нема-
тоды довольно прочно прикреп-
лены к корешкам и хорошо выделяются своей светлой и
яркой окраской.
2. Отбор и анализ почвенных проб. Пробы берут в
зависимости от местных условий в период с 15 июля по
5 сентября. Оптимальный размер пробы — 250—300 см3.
Выборку почвы производят буром диаметром 5,5—0,2 см,
С каждых 100 м2 отбирают 4—6 проб, с каждых 300 м2 —
7—9 проб, с каждых 500 м2—10—12 проб. На больших
площадях берут 25—30 проб: Взятая проба просушивает-
ся на воздухе или в термостате, освобождается от круп-
ных примесей' через сито с диаметром ячеек 2—3 мм.
После этого берут навеску 100 см3 для анализа. При
сильном заражении достаточна навеска в 50 см3. Выде-
ление цист производят с помощью воронки Кирхнера
(рис. 107), способом бумажных полос и фиксируют в 70°
спирте или 5%-ном формалине. Этот способ позволяет
производить обследование в любое время года, не только
283
на территории плантации, но .и на любых участках, не
занятых картофелем. Метод дает возможность опреде-
лить границы выявленных очагов и интенсивность зара-
жения почвы, выяснить зависимость последнего от агро-
техники, обнаружить нематод в почве и при очень слабом
Заражении, что не удается сделать при осмотре растений.
Недостаток метода — невозможность получения резуль-
татов в момент обследования в поле, так как для мас-
совых анализов нужна лаборатория и соответствующий
штат работников (Боровкова, 1963).
Паразитические нематоды — мермитиды
Семейство мерммтид из класса нематод охватывает
большое число видов, паразитирующих у насекомых и яв-
ляющихся таким образом вместе с паразитическими и
хищными членистоногими фактором, ограничивающим
численность последних в природе. Роль мермитид, как и
методика изучения, обсуждаются в многочисленных ра-
ботах П. А. Положенцева и его учеников. Подробно ме-
тодика описана в работе П. А. Положенцева и А. К. Ар-
тюховского (1963).
Тело нематод имеет обычно белую, а иногда — желто-
вато-коричневую окраску. Размеры их колеблются от до-
лей миллиметра до нескольких сантиметров. Взрослые
особи живут в почве или воде, здесь же линяют, копули-
руют, откладывают яйца. Самки рода Mermis отклады-
вают яйца в отличие от остальных мермитид на поверх-
ность травянистой растительности и кустарников, куда
они взбираются во время дождливой погоды или обиль-
ной росы. Заражение насекомых происходит двояко: либо
насекомые заглатывают яйца гельминтов вместе с расти-
тельной пищей, либо личинки мермитид проникаю!
внутрь насекомого активным путем, через анальное от-
верстие или рот. Развитие паразита продолжается в теле
хозяина.
Сбор мермитид. Мермитид находят в свободном со-
стоянии в почве или воде, или собирают из насекомого
хозяина. Пользуются каждым из указанных способов н
зависимости от целей и задач, поставленных перед иссле-
дователем. Для изучения плотности и экологического рас-
284
пределения населения в почве (воде) пользуются почвен-
ными (водными) сборами.
Сбор из насекомых используют для выявления видо-
вого состава, определения степени зараженности насеко-
мых червями, изучения
яснения хозяйствен-
ного значения.
Почвенные мер-
митиды обычно
встречаются сверну-
тыми в клубочки
или в виде обвив-
шихся вокруг кореш-
ков нитей. Учитыва-
ют их методом поч-
венных раскопок
(см. стр. 184). Вы-
борка из почвы про-
изводится вручную.
Обнаруженные эк-
земпляры мермитид
переносятся в стек-
лянные банки, напо-
ловину наполненные
увлажненной поч-
вой. Обнаруженных
в этих же пробах на-
секомых подвергают
вскрытию или выве-
дению из них нема-
тод. В дальнейшем
поступают, как и при
изучении паразитов
их роли в жизни последних и вы-
6
Рис. 108. Мермитиды насекомых. А —
момент выхода мермитид из саран-
чи (Dociostaurus maroccanus) (по
Положенцеву); Б — личинки мерми-
тид в полости тела насекомых (по
Артюховскому)
насекомых.
Для сбора мермитид из насекомых находят очаг па-
разитических червей, для чего производят выборочный
микроанализ насекомых из различных стаций. Поражен-
ных насекомых определяют визуально по таким показате-
лям: деформация тела, просвечивание через кутикулу
у личинок пластинчатоусых и гусениц бабочек, пятна на
теле, задержка в развитии личинок, изменение поведе-
ния. При вскрытии полости тела насекомого мермитиды
вываливаются и их легко заметить. По типу гельминтоло-
285
гических вскрытий исследуют отдельные органы, покровы,
сосуды, гемолимфу, жировое тело, трахеи и т. д. Каждый
орган вскрывают иглами и рассматривают между двумя
предметными стеклами под бинокуляром, а некоторые
части (нервную систему) —под микроскопом.
Выведение и воспитание мермитид. Несколько экземп-
ляров насекомых, предназначенных для выведения мер-
митид, помещают в садок, на дне которого имеется вы-
движной ящик с увлажненным стерилизованным песком.
Последний анализируется каждые 2—3 суток на присут-
ствие нематод.
Фиксация мермитид, приготовление препаратов. Луч-
шим фиксатором для мермитид является жидкость Бар-
богалло (100 мл воды, 30 мл 40 %-ного формалина, 8 ча-
стей поваренной соли). В этой изотонической среде мер-
митиды не сморщиваются (что обычно наблюдается при
фиксировании в спирте) и не теряют окраску. Для прида-
ния телу естественной формы живых мермитид приводят
в состояние теплового оцепенения подогреванием пробир-
ки с жидкостью, в которой находятся мермитиды, до 40° С,
или анестезируют прибавлением к жидкости хлоралгид-
рата.
В полевых условиях мермитид помещают в пробирку
с 1—2%-ным формалином и встряхивают ее 2—3 мин,
мермитиды раскручиваются и фиксируются в распрям-
ленном состоянии. Можно добиться того же эффекта, ес-
ли мермитид до фиксации выдержать некоторое время
в воде, где они расслабляются и потом хорошо фикси-
руются расправленными. Мертвых нематод в воде дер-
жать не рекомендуется. Материал, долго хранившийся
фиксированным, не поддается расправлению, поэтому
мермитид перед расправлением необходимо размягчить.
С этой целью червей 18—24 ч держат в специальной сме-
си (35 мл 50° спирта и такое же количество молочной кис-
лоты).
Паукй
Пауки — одна из наиболее многочисленных и распро-
страненных групп членистоногих. Изучены они недоста-
точно хорошо, некоторые виды мало известны, хотя
встречаются повсеместно. Живут они на деревьях (листь-
ях), под отставшей корой, в земле, в хозяйственных по-
стройках и в жилищах человека. У многих видов пауков
286
Очень развита возрастная изменчивость и половой димор-
физм. Самка сильно отличается от самца размерами, ок-
раской, внешним видом. При полевых исследованиях и
при сборе материала это все следут иметь в виду.
Особое внимание необходимо уделить этикетирова-
нию, так как оно поможет потом при обработке сборов
разобраться в сомнительных случаях. Если в одном гнез-
де найдены два паука, даже если они и разные па вид,
Рис. 109. Приспособление для количественного учета пауков
(по Бэер)
их помещают в одну пробирку и снабжают соответству-
ющими записями: «найдены в одном гнезде» или «пой-
маны во время спаривания» и т. д.
Пауков в большом количестве можно собирать при
количественных сборах, проводимых в связи с изучением;
биоценозов, хотя при сборе сачком такой материал силь-
но портится. Можно и следует проводить специальные*
исследования этих членистоногих биоценометром (рис..
109). Найти пауков можно в самых разнообразных усло-
виях: в пещерах, домах, в темных подвалах, на чердаках,
на травянистых растениях и деревьях, причем на самых
различных их частях. Пауки, селящиеся на коре, обычно
по окраске подходят под окраску субстрата, живущие на
листьях напоминают пятна (повреждения) последних.
Встречаются пауки и под корой сухих деревьев, наконец,
много бывает их на цветах, где они подстерегают приле-
тающих за нектаром насекомых. Многие пауки, как вид-
но из изложенного, обладают обычно криптическими
свойствами и заметить их бывает не всегда легко. Лишь
287
при тщательном осмотре можно обнаружить их на ниж-
ней стороне листа. Некоторые пауки держатся сбоку по-
строенных ими тенет и выходят на паутину, когда в нее
попадает жертва. Живут многие пауки и в земле, но толь-
ко в строго определенных зонах и биотопах — в полын-
ных «степях, песках, на солонцах.
Многие пауки вследствие сильно развитой заботы о
потомстве не разлучаются со своими яйцевыми коконами
до тех пор, пока из яиц не выйдут молодые паучки, а
иногда и потомство свое носят при себе некоторое время
после их вылупливапия. Это также следует учитывать
при их исследовании.
Пауков собирают различными способами: их загоня-
ют или стряхивают в банку со спиртом или переносят
туда пинцетом, схватив их за головогрудь; мелких ловят
обычно в банки, которые подставляются под листья, па
которых живут пауки. Спасаясь от опасности, пауки
быстро спускаются и сами попадают в банку. Паутинные
пауки, как указывалось, обычно держатся около своих
сетей, поэтому, заметив тенета, нужно поискать около
паутины строителей и хозяев сетей.
Фиксируют и сохраняют пауков в 70—75° спирте и по
возможности мелкие экземпляры отдельно от крупных.
Не рекомендуется помещать в одну банку слишком много
пауков, так как толстое и нежное брюшко их очень легко
загнивает. Пауки должны занимать не более 2/3 посуды,
остальную часть должен занимать спирт. После экскур-
сии спирт следует сменить. К этому нужно прибегать и
тогда, когда спирт изменяет окраску.
1. Можно сохранять пауков и в сухом виде на булав-
ках, подобно тому как хранятся насекомые. Для того
чтобы мясистое'брюшко при этом не сморщилось, пауков
вынимают из спирта или из морилки и отрезают у них
брюшко. В середину головогруди сверху вкалывают бу-
лавку, которую втыкают в пробку или торф, расправляют
пауку ноги и дают ему высохнуть. Отрезанное брюшко
кладут на продырявленный булавками лист бумаги и
быстро проводят последней над лампой или горячей пли-
той. Брюшко сначала сморщивается, но потом воздушные
мешки внутри него раздуваются и растягивают стенки
брюшка. Нужно следить за тем, чтобы они от излишнего
раздувания не лопнули. После просушки брюшко прикле-
ивают при помощи узкой картонки снизу к высохшей
288
грудке. У пауков, обработанных таким образом, хорошо
сохраняется внешний облик и окраска.
2. Для сохранения естественной формы и расположе-
ния внутренних органов при просветлении пауков реко-
мендуют использовать смесь бензилбензоата с моноэти-
ленгликолевым эфиром (Peters Werner, 4961). При этом
для изучения слюнных желез смесь берется в пропорции
Рис. НО. Приспособление для лабораторного содержания пауков
17:3, при просветлении corpora pedunculata—16:4, при
выявлении внутреннего скелета головы — 14:6.
3. Большое систематическое значение у пауков имеет
половой аппарат самки, по которому определяют мелкие
формы, различают близкие виды. Для этого бывает необ-
ходимым готовить постоянные микропрепараты. Для
приготовления такого препарата выделяют половой аппа-
рат самки и переносят на предметное стекло, затем про-
водят через спирты и заключают в канадский бальзам.
4. Для изучения постэмбрионального развития — воз-
растных изменений собирают коконы с яйцами, помеща-
ют их, не замаривая, в отдельные банки для выведения
из них пауков. Отродившихся паучков кормят тлями
через определенные промежутки времени (можно после
каждой линьки); по одному или по нескольку экземпля-
ров помещают в пробирки со спиртом, снабжают этикет-
кой с указанием времени отсадки и закрывают ватным
тампоном. Так поступают со всеми стадиями до взрослой
10—1867 289
ниях или их ветвях. Больше всего клещей бывает в искус-
ственных насаждениях и на культурных растениях. Имеет
значение и возраст насаждений — больше клещей на мо-
лодых посадках. Играет роль и рельеф местности — на
открытых высоких ветреных местах клещи, как правило,
не наблюдаются.
Все указанное следует иметь в виду при разработке
методики обследования. Каждое обследование надо про-
водить в нескольких повторностях и несколько раз в те-
чение года. В зимнее время клещей и их яйца можно
найти под чешуйками коры и в ее трещинах. Но наиболее
благоприятным временем сбора следует считать первую
половину лета. В это время численность их довольно ве-
лика и признаки жизнедеятельности на растениях быва-
ют уже хорошо заметными.
Собирают клещей следующим образом. При сильном
поражении растений собирают по пять—двадцать листь-
ев или небольше ветки в специальные пакеты (18Х
ХЗО см) из пергаментной бумаги или восковки, перено-
сят в лабораторию и в тот же день (или не позднее чем
через 2—3 дня) разбирают собранный материал. При
выборке поступают так: сначала стряхивают клещей с
листьев и веток на лист белой бумаги, оставшихся на
растениях клещей выбирают кисточкой, пользуясь би-
нокуляром или препаровальной лупой. Собранных кле-
щей фиксируют, как указано ниже.
При слабом заражении применяют метод отряхивания
растений. Берут диктовую дощечку или плотный картон
размером чуть больше листа писчей бумаги, прикреплен-
ной к нему. Подставив дощечку под ветку, встряхивают
последнюю резким ударом, клещи падают на плоскость,
где их легко заметить на белом фоне. Отряхивание повто-
ряют пока не будет собрано нужное количество клещей.
Прежде чем перейти к следующему растению, нужно за-
менить бумагу или протереть ее, чтобы не попадали в
пробирку клещи разных сборов. Указанный метод позво-
ляет выявлять самые слабые заражения и сравнительно
быстро обследовать большую площадь. Но этим методом
можно пользоваться лишь в тихую, безветренную погода
(Рекк, 1952).
Иногда количественный учет проводят методом отпе-
чаток. Клещей стряхивают с ветки на лист белой бумаги.
Живые клещи хорошо держатся на поверхности бумаги,
292
поэтому, наклонив бумагу, можно стряхнуть мертвых на
другой лист. Бумагу с живыми клещами накрывают
другим листом и прокатывают его карандашом. То же
проделывают и с мертвыми клещами. По пятнам, остав-
шимся при раздавливании, ведут подсчет клещей.
Собранных одним из изложенных методов клещей пе-
реносят вместе с этикетками в пробирки с фиксирующей
жидкостью, где их хранят до приготовления препаратов.
Консервирующей жидкостью служит спирт-ректификат
70—85°; для кратковременного хранения лучше приме-
нять смесь: спирт-ректификат (70°) —87 частей, глицерин
очищенный 5 частей, уксусная кислота ледяная — 8 час-
тей.
Для точного определения клещей необходимо изгото-
вить препараты. При этом лучше брать живых клещей,
но можно пользоваться и законсервированными. Фикси-
рование и просветление проводят жидкостью Фора.
Каплю этой жидкости наносят на предметное стекло, в
неёу при помощи иглы помещают законсервированных или
лучше живых клещей. Каплю покрывают покровным
стеклом (жидкости должно быть столько, сколько нужно
для заполнения пространства под покровным стеклом).
После изготовления препарата наклеивают этикетки.
Препараты кладут для сушки в горизонтальном положе-
нии. Для ускорения сушки их можно выдерживать 5—
10 дней в термостате при 30—35° С. Через 20—40 дней
постоянные препараты заливают по краям покровного
стекла лаком или эмалевой краской, после чего они могут
храниться десятки лет.
Состав жидкости Фора: дистиллированная вода —
10 см3, гуммиарабик сухой — 6 г, хлоралгидрат—10 г,
глицерин очищенный — 6 г. Гуммиарабик можно заме-
нить камедью вишни или черешни, что дает несколько
худшие результаты. Лучшим заменителем гуммиарабика
является камедь серебристой акации (Acacia dealbata),
культивируемой на Черноморском побережье Кавказа.
Прямокрылые, уховертки, тараканы
Прямокрылые. Прямокрылых можно собирать при эко-
логических исследованиях — при количественном и каче-
ственном учете фауны ландшафта, биоценозов. Но для
293
изучения фауны, систематики, изменчивости, биоло-
гии развития и других вопросов проводят специальные
сборы.
В зависимости от задач исследования сбор проводят
сачком или насекомых ловят на свет. Способы и техника
сборов сачком были описаны выше. На свет прямокрылых
(сверчков и др.) лучше всего ловить на таком возвышен-
ном месте, откуда, свет мог бы распространяться повсю-
ду. Если поставить лампу на подоконнике какого-нибудь
помещения за закрытым окном, то проникающий через
окно свет привлекает насекомых, и их без труда можно
ловить на стекле окна руками, банкой или сачком.
Для получения более полноценного коллекционного
материала можно воспитать взрослых насекомых из ли-
чинок. Последних ловить сравнительно легко, ибо они,
как известно, не обладают чуткостью взрослых и, кроме
того, не могут еще пользоваться своими недоразвитыми
крыльями. О воспитании и сохранении личинок будет
сказано ниже.
Некоторые саранчовые обладают инстинктом стадно-
сти. Интересные наблюдения можно сделать в период их
подготовки к перелетам и в момент лета. Пустынная са-
ранча Schistocerca gregarid) совершает большие пере-
леты. Для изучения миграций стай Сейер (1956) приме-
нял фотографирование. Он помещал камеру на землю
объективом вверх и получал снимки летящих особей,
показывающие направления полета, а также плотность
стай.
Собранный материал сохраняют для обработки одним
из нижеизложенных методов.
Сохранение в сухом виде. Собранных сачком или дру-
гим способом прямокрылых переносят в морилку, заря-
женную цианистым калием, эфиром или хлороформом.
Морилку следует предохранять от сырости и загрязнения
несколькими полосками фильтровальной бумаги. После
умерщвления прямокрылых следует перенести для сушки
на слой ваты, которую необходимо брать с собой на эк-
скурсии. Перед сушкой у крупных экземпляров нужно
удалить внутренности. Для этого ножницами осторожно
делают разрез по плейриту — тонкой перепонке — вдоль
дыхалец, не разделяя, однако, первого и последних двух
сегментов брюшка, содержащих важные для определе-
ния органы. Во избежание повреждений нужнб разрезать
294
четыре средних кольца и удалить главные органы, содер-
жащие много жидкости (жевательный желудок, среднюю
кишку, зоб). Ножницами отрезают зоб от пищевода и
среднюю кишку от задней, стараясь не повредить задне-
грудь и половые органы; у полозрелых самок удаляют
яйца. Удалив главные opiaHbi, извлекают оставшуюся
жидкость фильтровальной бумагой, йабивают пустое
пространство комочками ваты и придают брюшку естест-
венную форму. Затем накалывают на булавку или после
просушки укладывают на ватные слои в ящик (см. ниже).
Весь материал по прямокрылым перед укладкой в ящик
непременно надо проветрить и просушить одним из сле-
дующих способов:
ватники с разложенными на них насекомыми уклады-
вают в сетки, легко пропускающие воздух, выставляют :.а
сквозняк и держат при жаркой сухой погоде 2—3 дня;
раскладывают прямокрылых на лист бумаги, покры-
вают другим листом с проделанными на нем дырочками
для свободного доступа воздуха и образования сквозня-
ка; так держат несколько дней;
насыпают в ящик, коробку или банку немного мелко-
го чистого песка, укладывают на него насекомых, засы-
пают сверху песком и выставляют на солнце; при такой
сушке сохраняется естественный цвет прямокрылых;
этот способ особенно хорош в тех случаях, когда собран-
ный материал предполагают использовать для монтиро-
вания демонстрационных коллекций.
При укладке на слой ваты нужно загнуть ножки и от-
тянуть длинные усики назад вдоль спинки, чтобы они не
занимали лишнего места и не ломались при перевозках.
Слои ваты снабжают этикеткой и сохраняют в специаль-
ных коробках. Следует помнить, что Для предохранения
сборов от порчи ватники нужно пересыпать нафтали-
ном.
Для сохранения некоторых прямокрылых предлагает-
ся такая методика (Рентц, 1962). Перед умерщвлением
в течение нескольких дней насекомых полностью лишают
пищи, а затем умерщвляют горячей водой, формалином
или в морилке с KCN, после чего переводят на 24 ч снача-
ла в 70° спирт, а затем в 95°, а после этого помещают на
24 ч в этиловый спирт. Затем вынутых насекомых сушат
над лампочкой 100 вт до полного высыхания, затем на-
калывают и этикетируют. Для уменьшения обесцвечива-
295
ния насекомых рекомендуется накрыть полупрозрачными
пластинками.
Сохранение в спирте. При больших сборах желатель-
но сохранять часть собранного материала в спирте; такой
материал иногда необходим для изучения половых при-
датков, имеющих большое значение при определении
насекомых. Насекомых помещают в 50° спирт (не следу-
ет сразу помещать в спирт большой крепости, так как
материал может испортиться). По приходе домой или на
базу еще раз перекладывают их в 50° спирт дней на 5—
6 и только после этого переносят в 70—75° спирт для
постоянного хранения. Материал следует снабдить эти-
кеткой.
Разведение прямокрылых. Личинок можно легко отли-
чить от взрослых: задние крылья у них всегда прикрыва-
ют передние, у взрослых же крылья имеют обратное по-
ложение. Собранных личинок сажают в коробку или
ящик, предназначенные для ловли живых насекомых (см.
рис. 69). Ящик плотно закрывают крышкой. На одном
конце такого ящика имеется окошко, затянутое сеткой,
через него проникает в ящик свет, на другом — отверстие,
закрывающееся клапаном, в которое и опускают живых
личинок. Коробки могут быть и других конструкций. Ли-
чинки в ящике постоянно находятся на освещенном
конце, возле окошка. Оки всегда стремятся к свету,
поэтому и не пытаются выпрыгнуть из ящика при
впускании через отверстие новых личинок.
Пойманных личинок переносят в приготовленный для
них садок (ящик) для воспитания (рис. 71, 72). Дно та-
кого садка выстилают дерном с сочной растительностью.
При воспитании кузнечиков в садок ставят банку с водой,
в которой держат различные растения (лучше всего ветви
ивы или акации)'С тлями, туда же впускают живых мух
и тараканов, которыми охотно питаются кузнечики. Са-
ранчовым дают в корм зеленые растения. Садок с насе-
комыми нужно держать на свежем воздухе или в комна-
те, но при открытом окне. При воспитании личинок мож-
но получить многие виды, которых в природе не удалось
бы поймать.
Уховертки. Немногочисленная, но широко распростра-
ненная группа. Уховертки живут во влажных местах,
иногда поселяются в домах. Многоядны, питаются живот-
ными остатками, иногда нападают на мелких насекомых,
296
пауков, червей; некоторые питаются живыми растениями,
повреждая плоды и ягоды. Ввиду скрытного образа жиз-
ни они редко попадают в сачок и их приходится ловить
руками. Днем они обитают под камнями, корой, опавшей
листвой. Нередко попадаются в скрученных листоверткой
листьях, в гнездах других насекомых, в ходах насекомых
в древесине.
Тараканы. Обитают в основном в тропиках. В нашей
фауне они немногочисленны. Некоторые виды приспо-
собились к обитанию в жилищах человека. Эти синантро-
пы распространены везде. В природных условиях тарака-
ны встречаются в горах, на лесных полянах, в низинах,
в садах и парках. Ловят их сачком, руками или свето-
ловушками.
Недавно пойманных насекомых (прямокрылые, ко-
жистокрылые, таракановые) после умерщвления накалы-
вают на энтомологические булавки без предварительного
размачивания, сухие экземпляры перед накалыванием
размачивают (в предназначенных для этой цели влажных
камерах, которые легко можно приготовить в каждой ла-
боратории. (В банку, кристаллизатор или эксикатор на-
сыпают мелкий чистый песок, насквозь смочив его про-
кипяченной водой.) Для предохранения насекомых от
плесени нужно положить на песок кусочек тимола, кам-
форы или же добавить в воду несколько капель раствора
карболовой кислоты. Песок накрывают листом фильтро-
вальной бумаги. Насекомых раскладывают на слой песка,
накрывают крышей и оставляют в банке около суток или
дольше, смотря по их величине. Когда насекомые раз-
мякнут, их накалывают на энтомологические булавки.
Прямокрылых прокалывают в заднюю часть перед-
неспинки, справа от срединной линии. Крупные экземпля-
ры нужно поднимать на булавке выше, чем на одну треть,
так как тело занимает много места. Затем необходимо
расправить ножки, чтобы они не торчали, а задние длин-
ные голени согнуть, приподняв их к бедрам. Очень часто
для определения пользуются жилкованием крыльев, для
чего обязательно расправляют правую сторону крыльев
при помощи расправилки (см. рис. 76). Таракановых и
уховерток нужно прокалывать в правое надкрылье, чтобы
булавка снизу прошла между первой и второй парой ног.
Материал, сохраняемый в спирте, также может быть
использован для коллекций. Таких насекомых перед на-
297
калыванием кладут дня на два в воду, меняя последнюю
2—3 раза, после этого высушивают их на фильтровальной
бумаге и накалывают на булавки. После накалывания
каждый экземпляр снабжают этикеткой размером 20X
ХЗ мм с подробными данными (местность, время, фами-
лия собирателя).
Тли
Тли всегда представлены несколькими активными фа-
зами: личинками, бескрылыми и крылатыми самками,
самцами. Живут обычно колониями, но могут встречать-
ся и одиночно. Размножаются в основном партеногенети-
чески, в течение года наблюдается чередование партено-
генеза и гамогенеза, образуя сложные циклы развития.
В результате сложного развития отдельные поколения
приурочены к различным органам и даже к разным ви-
дам растений. Например, одна форма тлей живет на кор-
нях злаков, другая — на деревьях. Питаются тли соком
растений, который они добывают при помощи хоботка.
Многие виды тлей приурочены к определенным растени-
ям-хозяевам и даже к определенным его частям (орга-
нам), но существуют и многоядные виды.
Тлей можно обнаружить как на деревьях, так и на
самых различных травянистых растениях; живут они на
листьях, стеблях и корнях. Следует иметь в виду, что
большинство обитающих на корнях форм является лишь
отдельными поколениями тлей, живущих на надземных
частях других видов растений. Среди тлей есть много
опасных вредителей (филлоксера, кровяная тля и др.).
Собирают тлей во всех стациях их обитания и на всех
кормовых растениях. Одиночных тлей, как и колонии их,
собирают в пробирки, стряхивая с ветки, или переносят
колонию вместе с веткой или листом. Если колонии тлей
будут обнаружены на каком-нибудь растении, следует
описать, как располагается колония, на каких частях
растения тли сидят, обратить внимание и на их скучен-
ность, присутствие крылатых и бескрылых особей. Опи-
сать их цвет. Отметить наличие муравьев !.
Собранных насекомых помещают в пробирки, куда
вставляют и кусочки веток или листьев с этикеткой и хра-
1 Следует иметь в виду, что при приближении к колонии крыла-
тые формы улетают, а бескрылые взрослые падают.
298
нят до прихода на базу, где материал обрабатывают тем
или иным уже известным способом.
Лабораторное разведение тлей. Для определения вида
обязательно нужны крылатые самки, но их не всегда мож-
но найти, поэтому приходится выводить их в лаборатор-
ных условиях. Для этого колонии тлей* вместе с частью
растения помещают в большую стеклянную пробирку, за-
крывают ватным тампоном и оставляют до тех пор, пока
не появятся крылатые особи. Одновременно следят за
выведением из тлей паразитов. Для выведения тлей ис-
пользуют специальные садки.
Галловых тлей извлекают из галлов после созревания
последних. Осматривают растения и отмечают изменения,
происшедшие в результате жизнедеятельности тлей: де-
формирование листьев, побегов, черенков. Все эта данные
нужно записать в дневник под соответствующим номером
и занести эти краткие сведения на этикетку.
Для изучения живущих на корнях тлей нужно подко-
пать лопатой или совочком растение так, чтобы его легко
было вытащить со всеми корнями. Корни следует пере-
нести на лист белой бумаги, осторожно очистить от земли
и собрать с них насекомых.
Тлей можно собирать специально или попутно при
количественном учете насекомых. Если проводить сачком
по траве или веткам, тли окажутся в сачке, но будет
неизвестно, с какого растения тли попали в сачок. Поэ-
тому одновременно с кошениями необходимо осматривать
и растения — отмечать, на каких именно растениях сиде-
ли насекомые и как с ними связаны.
Фиксирование. Собранных или выведенных в лабора-
тории тлей для дальнейшего изучения фиксируют — по-
мещают в 70° спирт. Сушить тлей нельзя; нельзя также
свежих тлей класть в 3—5%-ный формалин, так как в
нем они могут сморщиться. После 70—75° спирта тлей
можно перенести через несколько дней в 3—5%-ный рас-
твор формалина. При таком способе фиксации сохра-
няется окраска тлей и галлов. В крайнем случае тлей
можно помещать в крепкий раствор поваренной соли. На
этикетках следует, кроме прочих данных, отметить цвет
тлей, так как при фиксировании они меняют окраску, из-
меняется и характер восковых выделений. Различные
деформации растений (галлы и пр.) лучше всего сохра-
299
нять в 2—4%-ном формалине, в котором части растений
не твердеют.
Изготовление тотальных препаратов. Точно опреде-
лить тлей можно лишь по специально приготовленным
препаратам. Препараты тлей изготовляют и сохраняют
в глицерине, глицерин-желатине или в канадском баль-
заме. По А. К. Мордвилко, часть тлей из пробирки пере-
кладывают на часовое стекло, отбирают пинцетом наибо-
лее пригодных для препарата, переносят в пробирку с
небольшим количеством 96° спирта и оставляют на не-
сколько часов или на ночь, при этом спирт полезно за-
менить новым. Затем 96° спирт сливают и приливают
смесь 96° спирта и ксилола поровну с прибавлением не-
большого количества карболовой кислоты. Через час
тлей помещают в чистый карбол-ксилол для просвет-
ления.
После 96° спирта можно перенести объекты прямо в
карбол-ксилол или чистый ксилол, но нежные насекомые
при этом могут сморщиться. Когда объекты в карбол-кси-
лоле просветлеют, их перекладывают на часовые стекла
и помещают на предметный столик лупы или микроско-
па. В то же время на Предметное стекло переносят две
капли негустого канадского бальзама, в который осто-
рожно переносят объекты, расправляют их и накрывают
покровным стеклом на ножках из стеклянных нитей. Объ-
екты можно переводить и через гвоздичное масло. Для
этого, слив 86° спирт, наливают в пробирку либо чистого
гвоздичного масла, либо сперва масло, смешанное с 96°
спиртом, а потом, через несколько часов, слив масло-
спирт, приливают чистого масла. Когда объекты просвет-
леют, их переносят в канадский бальзам.
О. И. Ион рекомендует следующий способ. Объект
вываривают, если нужно, в щелочи, обычным способом
промывают в ^оде, затем погружают на 3 мин в ледяную
уксусную кислбту, из нее переносят на предметное стек-
ло в каплю указанной ниже гуммиарабиковой смеси Фо-
ра (в 25 см3 дистиллированной воды растворяют 20 г
гуммиарабика и прибавляют в раствор 25 г хлоралгидра-
та, 0,25 г тимола и 10 г глицерина). Состав сохраняется
долго и препараты в нем не портятся. Покрыв эту каплю
предметным стеклом, получаем готовый препарат. Для
заделки отдельных частей тела (усиков, гениталий) вме-
сто предметного стекла можно употреблять небольшие
300
пластинки из целлулоида или предметное стекло. Целлу-
лоид берут толстый (из пленок для рентгеновских сним-
ков).
Пашек (1955) приводит обзор методов изготовления
препаратов и предлагает свой быстрый метод. Фиксиро-
ванных тлей помещают на предметной стекло и под би-
нокуляром у мелких экземпляров вскрывают брюшко,
крупные виды перерезывают глазными ножницами
по фронтальной линии до анального отверстия
вдоль стигм. Получают две половины тела — дор-
зальную и вентральную. Приготовленный материал
переносят в раствор КОН, кипятят некоторое вре-
мя (чтобы щелочь не «выстрелила», прибавляют зер-
нышко песка). После этого быстро выливают содержи-
мое в чашку с дистиллированной водой, и объект пере-
носят в смесь (дистиллированной воды — 20 частей,
хлоралгидрата — 60 частей, гуммиарабика — 15 частей,
глюкозы — 3 части, ледяной уксусной кислоты — 5 час-
тей). Расправляют ножки, усики у разрезанных тлей и
монтируют отдельно обе половинки тела, накрывают по-
кровным стеклом и сушат. Этим методом можно очень
быстро приготовить неплохой препарат.
Объект можно в любой момент вынуть из этого со-
става и промыть, для чего препарат погружают в холод-
ную воду, и состав легко растворится в ней. Образцы
повреждений нужно фиксировать в 2—4%-ном форма-
лине.
Новая модификация методики изготовления препара-
тов тлей на гуммиарабиковой смеси описана и рекомен-
дована советскими афидологами (В. А. Мамонтова-Солу-
ха, И. А. Черкасова, 1967).
Кокциды (червецы и щитовки)
Кокциды представляют своеобразную группу, отлича-
ющуюся рядом биологических особенностей. Самки кок-
цид во взрослом состоянии, а также их личинки старших
возрастов мало подвижны или вовсе не подвижны. Кок-
циды— насекомые небольших размеров, ведут скрытый
образ жизни. Окраска у них часто покровительственная,
и поэтому эти насекомые бывают мало заметными. Все
это требует своеобразных методов учета, отличных от об-
щепринятых.
301
Для того чтобы находить кокцид и успешно их соби-
рать,' необходимо знать их биологические особенности,
характер связи с растениями, а также уметь различать
по внешнему виду.
В группу кокцид входят (по Борхсениусу) щитовки и
червецы. Из щитовок сем. Diaspidae — самое специали-
зированное. Самки безногие с редуцированными усика-
ми, задние сегменты брюшка (4 или 5), сливаясь, обра-
зуют пигидий. Тело покрыто щитком. Личинки самок
второго возраста и нимфы самцов также покрыты щит-
ками. В группу червецов входит целый ряд семейств,
формы и размеры которых сильно варьируют. Разнооб-
разен и восковой покров их.
Живут кокциды главным образом на древесных и ку-
старниковых породах на коре и корнях, реже на листьях
и плодах. Кокциды сильно вредят лесному и сельскому
хозяйству. Для нахождения этих насекомых следует вни-
мательно осмотреть все растения и все части последних.
Кокцид следует искать в щелях, трещинах коры, веток
и ствола, в различных пятнах на листьях и плодах, в на-
ростах поврежденных частей. Нахождению червецов (по
Н. С. Борхсениусу) помогают муравьи. Эти своеобразные
«индикаторы» почти безошибочно показывают, какую
часть растения нужно обследовать, какую щель следует
осмотреть.
Щитовок находят.по изменениям ствола, вызванным
их деятельностью. Муравьи щитовок не посещают. Кали-
форнийская щитовка вызывает растрескивание коры пло-
довых деревьев. Продольные и поперечные трещины,
усиленные наростами, хорошо заметны на культурных
породах (сливах, яблонях). По этим образованиям и по
сухим верхушечным веткам легко находить пораженные
деревья, а следовательно, и щитовок. Находят их и по
пятнам на листьях и плодах. В лесах их больше бывает
на опушках, здесь их и следует искать. Собирают щито-
вок круглый год (в этом одно из удобств исследования),
но лучший срок обследования леса и сада — июнь, июль,
а травяной растительности — май, июнь, июль. Специ-
альные обследования проводят в строго определенные
сроки, изучение калифорнийской щитовки, например,
проводят в период созревания яблок, на которых легко
можно обнаружить щитовок по красным пятнам на
плодах.
302
Сбор и хранение. Кокцид (кроме тех, которые имеют
твердую спинную поверхность) снимают с веток и поме-
щают в пробирки с 70° спиртом (ректификат). Разные
виды и сборы, проведенные с разных растений, следует
класть в отдельные пробирки с соответствующими эти-
кетками. Параллельно некоторых червецов, имеющих
восковые покровы, нужно собирать в сухом виде. Щито-
вок и ложнощитовок снимают вместе с корой или веткой
(срезают ветки сенатором или садовым ножом), раскла-
дывают на слой ваты, снабжают этикеткой, просушивают
и хранят в коробках на ватных слоях. На дно коробки
под ватники необходимо посыпать нафталин для предо-
хранения от кожеедов и молей. Спиртовый материал
снабжают этикеткой, написанной тушью, сухой —
этикеткой, написанной простым карандашом. В этикетке
указывают место сбора, название растения (или номер
гербария к этому сбору), часть растения или отдельный
орган, на котором собраны кокциды, дату сбора, фами-
лию сборщика. Указывают также, имеется ли спиртовой
сбор к сухому материалу, или наоборот. Для спиртового
материала указывают цвет тела червецов.
Приготовление препаратов. Кокцид определяют по
взрослым самкам. Для этого изготовляют тотальные пре-
параты. Приведем наиболее удобный способ изготовле-
ния их (по Борхсениусу).
Червецы. Фиксируют в 70° спирте не менее 2 ч. Затем
при помощи глазных ножниц, энтомологических копий
или булавок (под бинокуляром) разрезают червецов
вдоль дорзальной или вентральной поверхности, в перед-
нем и в заднем концах тела. Разрезанных насекомых
опускают в тигель с 8%-ным раствором едкого кали или
едкого натра на 12—18 ч, затем подогревают до 80—90°
в течение 10—30 мин, не доводя до кипения. Просветлен-
ных насекомых вынимают из щелочи и промывают в ди-
стиллированной или кипяченой воде, начисто очищают
от внутренностей при помощи копий и тонкой кисточки.
Очищенных насекомых промывают в воде в течение су-
ток; в течение дня меняют воду 8 раз, в последней воде
оставляют на ночь.
Промытых насекомых опускают па 10—15 мин в 70°
спирт, затем окрашивают в растворе фуксина. Сильно
склеротизированных насекомых окрашивают в течение
1—5 мин, слабо склеротизированных — от 2—3 до 24 ч.
303
Красить следует так, чтобы железы, а также все сильно
склеротизированные части тела выделялись на более
светло окрашенном фоне слабо склеротизированных тка-
ней. Из краски насекомых переносят в 70° спирт на 15—
20 мин, в 90° на 15—20 мин и в 96° или абсолютный
спирт на тот же срок. Из 96° спирта объекты переносят
в гвоздичное или бергамотовое масло на 30—60 мин или
из абсолютного спирта в карбол-ксилол на тот же срок.
Потом переносят на предметное стекло, расправляют
так, чтобы не было складок, покрывают каплей канад-
ского бальзама и покровным стеклом.
Щитовки. Самок вынимают из-под щитка и опускают
в фарфоровый тигель с 8%-ным раствором едкого кали,
или едкого натра на 12—18 ч. Просветленных насекомых
вынимают из щелочи и опускают в дистиллированную или
кипяченую воду, непросветлившихся подогревают в раст-
воре едкого кали или едкого натра до 80—90° (не доводя
до кипения) до просветления. Если самки наполнены
яйцами, то во время прогревания необходимо надрезать
головную часть тела щитовки и осторожно, не повредив
пигидия, выдавить внутренности. Просветленных щито-
вок промывают в воде и обрабатывают в дальнейшем
так же, как червецов.
Обзор методов многих авторов и модифицированную
методику приготовления препаратов кокцид приводит
Э. Ф. Косаржевская (1968).
Выявление калифорнийской щитовки. Калифорний-
ская щитовка — опасный карантинный вредитель плодо-
вых деревьев. Для выявления вредителя на больших мас-
сивах осматривают каждое пятое дерево, т. е. не менее
20% всех деревьев, на участках с площадью менее 3 га
осматривают от 25 до 50%, а на приусадебных участ-
ках — все деревья. Лучше проводить обследования в пе-
риод от начала созревания плодов и до конца, уборки
урожая. При обследовании следует осматривать стволы,
2—3 скелетные ветки, 10—20 побегов, а также листья и
плоды. Обязательно осматривают плоды и падалицу в
садах и, кроме того, плоды на заготовительных пунктах.
Интенсивность заражения определяют на глаз по
шкале: первая степень — единичные особи от 2 до 5; вто-
рая степень — колонии численностью до 20 особей;
третья степень — колония имеет характер небольших
скоплений; имеются начальные стадии растрескивания;
304
четвертая степень — ствол и скелетные ветви сплошь по-
крыты щитовками. При обследовании во всех случаях
обнаружения щитовок обязательно брать образцы. Об-
разцы (ветки 8—10 см длиной, срезы коры размером
2—3 см) должны храниться на слоях ваты или в конвер-
тах. Все сборы снабжают подробными/- этикетками, где
указывают район, название хозяйства, вид растения, зара-
женную площадь, характер и степень зараженности, коли-
чество взятых образцов, дату, фамилию обследователя.
Полужесткокрылые и цикады
Биологическая особенность клопов и цикад — их не-
полный метаморфоз, одинаковая экология всех стадий;
нимфы всех возрастов и имаго активно питаются, со-
сут,, одинаково влияют на растения, но рядом биоло-
гических особенностей нимфы отличаются от имаго. У
многих видов клопов способы питания нимф и имаго
различны — нимфы бывают фитофагами, имаго стано-
вятся зоофагами. Это определяет методы, которыми
пользуются для изучения экологии того или иного вида.
Встречаются нимфы или имаго в основном в одних и
тех же стациях, поэтому их легко собирать, пользуясь
обычными способами лова. Основные из них: обкашива-
ние, стряхивание, поиски на стволах и под лишайниками,
под корой и у корней. Можно воспользоваться сборами
кошений, производимых при общих количественных уче-
тах, в которые обычно попадает много клопов. Сачком
специально собирают клопов и ночью. Этот способ дает
возможность добыть полужесткокрылых, ведущих ноч-
ной образ жизни и поэтому ускользающих от наблюда-
теля днем. Сачком косят по траве, кустам и деревьям.
Кроме того, насекомых можно стряхивать в сачок с
веток.
Ловят полужесткокрылых и на свет. Мерер (1956) со-
общает о производившихся в Нидерландах уловах насто-
ящих полужесткокрылых с помощью видоизмененной
световой ловушки Робинзона. Было собрано 978 экзем-
пляров (46 видов) из сем. Corixidae, Saldidae, Anthocori-
dae, Miridae, Pentatomidae. Указывается, что такими ме-
тодами можно получить данные динамики лета по меся-
цам представителей тех или иных семейств. Можно
305
получить данные об уловах в различные сроки при раз-
личных температурных условиях. Описываемым способом
можно пользоваться и при изучении кормовых растений
клопов.
Кроме того, названных насекомых можно собирать
вручную: скрытноживущих полужесткокрылых собирают
на стволах, под лишайниками, под сухой корой деревьев,
в лесной подстилке, в щелях. Много их бывает на травя-
нистых и кустарниковых растениях. Встречаются они и
на земле среди травы. Следует иметь в виду, что некото-
рые виды зимуют в фазе имаго в лесах и кустарниках
под опавшими листьями. Для учета таких видов следует
брать пробы лесного подстила и другого мусора и вы-
бирать из них клопов. Выбирают насекомых из сачка
и с растения пробирками; это сохраняет объекты непо-
врежденными, тогда как при пользовании пинцетом или
пальцами насекомых можно раздавить или повредить их
конечности.
Большой интерес представляют нимфы клопов. Изу-
чение их значительно облегчено разработкой методики
определения клопов по их личинкам (Пучкова, Пучков,
1956).
Для изучения цикла развития и получения имаго со-
бранных нимф содержат в специальных садках с необ-
ходимыми для них условиями.
Трофические отношения устанавливаются непосредст-
венными наблюдениями. Кошением по одному виду рас-
тения можно получить ориентировочные данные о видах
насекомых и их кормовых связях. Можно установить пи-
тание по результатам деятельности — по нанесенным
растению уколам и другим повреждениям. У сосущих
клопов, сидящих на траве, часто можно видеть на хобот-
ке капельку сока; это хороший критерий оценки трофи-
ческих связей.
Такие роды, как Arma, Nabis, Anthocoris, и ряд
других групп клопов могут питаться другими видами
насекомых и клещей (как имаго, так и личинками). Сре-
ди скоплений последних и следует искать клопов-хищни-
ков. Характерным внешним указателем на питание по-
лужесткокрылых является прокол, проделываемый хо-
ботком. При длительном наблюдении за таким клопом
можно заметить, как жертва, если это личинка, изменяет
свою форму, истощается и погибает.
306
Трипсы
Трипсы очень мелкие, довольно многочисленные на-
секомые. Они высасывают соки растений, среди них име-
ются и хищники. Одной из экологических особенностей
трипсов является то, что представители их водятся по-
всеместно и встречаются на растениях и различных пред-
метах. Собирают их на цветках, на листьях, под опавшей
корой и листьями деревьев, во мху, в дерне, в стогах сена
и соломы, в кучах хвороста, в растительных отбросах, в
почве. Можно и следует собирать их не только летом, но
и в любое время года, даже зимой. Для этого в специ-
альные мешочки или банки берут субстрат, в котором
трипсы могут обитать, и из него в лаборатории извле-
кают насекомых.
При сборе с растений соцветия или колосья лучше
собирать в мешочки (20X30 см), сшитые из плотного
легкого материала. Не следует класть вместе растения
разных видов. Для количественного учета в каждый ме-
шочек помещают определенное количество растений,- на-
пример 100 головок клевера или 50 колосьев пшеницы.
Пробы через сутки высыпают на лист бумаги и соби-
рают трипсов с помощью мягкой кисточки, смоченной
спиртом, глицерином или ксилолом. Насекомых опускают
в пробирки с 96—98° спиртом с добавлением глицерина
(на 1 л спирта 20 г глицерина). Пробирки, закрытые ват-
ными тампонами и с соответствующими этикетками, по-
мещают в банку со спиртом той же крепости и плотно
закрывают. Не рекомендуют использовать для хранения
формалин.
Для сбора насекомых можно использовать бумажные
конверты, особенно при проведении количественных уче-
тов, когда бывает необходимость брать целые растения.
Очень удобные и простые способы извлечения трипсов из
различного субстрата предлагает Н. П. Дядечко (1964).
Так, из частей растений трипсов можно собрать при по-
мощи простого фотоэклектора — картонной коробки, в
одну из стенок которой вставляется пробирка. С по-
мощью этого прибора можно также учитывать отрожда-
ющихся из яиц личинок.
Для вылова трипсов, обитающих под отставшей ко-
рой, в лишайниках, пнях, мху, лесной подстилке мешок
с пробой привязывают к стакану, в который положен слой
307
увлажненной ваты. Все это помещается возле отопитель-
ной системы или на копфорке водяной бани. При подсы-
хании пробы трипсы переползают на стенки, откуда их
легко собрать кисточкой. Из почвы трипсов извлекают,
помещая пробу в сосуд с водой. По мере всплывания на-
секомых их вылавливают кисточкой.
Трипсов собирают обычно сачком, достаточно произ-
вести несколько взмахов по цветущим растениям, как в
сачок попадает множество трипсов; можно делать специ-
альные кошения, можно воспользоваться кошениями,
проведенными при общем изучении населения травостоя
или отдельных растений. В этом случае трипсы также
могут быть учтены.
Из сачка, банки, коры, листьев и другого субстрата
трипсов извлекают кисточкой, смоченной спиртом.
Но учет трипсов путем кошения мало пригоден, так
как значительная масса насекомых мнется, портится,
кроме того, как показали исследования (Дядечко, 1964),
при кошении на цветущей растительности в сачок попа-
дает только 25—30% насекомых, на злаковых в начале
колошения—2—3%, в период цветения 7—10% насе-
комых.
Для сбора летающих трипсов можно применять раз-
личные ловушки. В качестве последних используют стек-
ла, смазанные вазелином, автолом или клеем, устанавли-
вая их на разной высоте па шестах; можно применить
водяные ловушки, представляющие собой плоские сосу-
ды с 10%-ным раствором соли; засасывающие ловушки
и светоловушки.
Для изготовления постоянных препаратов поступают
так же, как и с пухоедами, блохами (см. стр. 348, 350).
Жуки
Жуки составляют один из многочисленных и широко
распространенных отрядов насекомых. Большое разно-
образие и повсеместное их распространение привели к
образованию у этих насекомых с полным превращением
множества экологических групп, отличающихся рядом
существенных признаков и требующих особых приемов
изучения. Известны, например, хищники, рыскающие по
поверхности земли (жужелицы, стафилины), охотящиеся
308
за жертвой на растениях (коровки, кожееды), живущие
на трупах (мертвоеды) и обитающие на продуктах жиз-
недеятельности животных (навозники и др.). Многие жу-
ки (имаго) живут на растениях и питаются вегетативны-
ми и генеративными частями — листьями, цветками, пло-
дами (хрущи, хлебные жуки, листоеды, долгоносики
и др.), личинки их ведут другой образ жизни. Например,
личинки многих усачей, златок, короедов связаны со
стволами деревьев. Личинки хрущей и щелкунов обита-
ют в почве, тогда как развитие ранних фаз листоедов
протекает на листьях растений.
Хотя для всех жуков характерно развитие с полным
превращением, но биология их неодинакова. Различный
образ жизни, разные сроки развития, неодинаковый ха-
рактер питания, многообразие приспособлений для до-
бывания пищи отличают многие группы одну от другой.
Все.эти особенности биологии жуков требуют от исследо-
вателя применения дифференцированного подхода — спе-
циальных методов изучения.
Для сбора бегающих насекомых, в том числе и хищ-
ников, применяют ловушки в виде ям или вкопанных ба-
нок, ведер, в которые кладут приманку. Для ловли жу-
желиц рекомендуют дорожки из овсяной муки, которые
привлекают в ночное время жуков. Здесь на дорожке
их и ловят. Для воспитания жужелиц пользуются садка-
ми (рис. 73). Многие жуки привлекаются сильным ис-
точником света. Прилетают многие из них на ультра-
фиолетовый свет. Для их сбора используют, как было
указано, различные световые ловушки. Мертвоедов ло-
вят на приманки, которыми могут быть трупы животных.
Приспособленных к органическим остаткам животных
ищут в отбросах. Жуков многих семейств, живущих от-
крыто на растениях, собирают сачком. Немало жуков
обитает в земле и лесной подстилке, их добывают при
обычных количественных учетах почвенной фауны. Для
решения ряда частных вопросов можно брать и специаль-
ные пробы по определенной методике. Извлекают и вы-
бирают жуков вручную, отмывкой, флотацией и, нако-
нец, при помощи эклекторов.
Многие скрытоживущие жуки требуют применения
особой методики сбора (см. «Насекомые, живущие в ко-
ре и древесине», стр. 259). В тех же случаях, когда по
тем или иным причинам затруднителен сбор в природе
309
взрослых жуков, их выводят из куколок в лабораторных
условиях.
Собранных всеми описанными способами жуков по-
мещают в морилки, через несколько часов умерщвленных
насекомых переносят на ватники для длительного хране-
ния или сразу накалывают на булавки. В том и другом
случае их обязательно этикетируют.
Рис. 111. Проволочные клетки для живущих в почве ли-
чинок (по Бургесу)
Сетчатокрылые и верблюдки
Представители сетчатокрылых и верблюдок — хищ-
ники, ведут активный образ жизни, хорошо реагируют
на свет. Эти особенности и следует учитывать при выбо-
ре методов сбора. Добывают сетчатокрылых воздушным
сачком, попадаются они и в количественных сборах. Ли-
чинки хризоп из сетчатокрылых живут на растениях —
в колониях тлей. Они также попадаются при кошении
сачком, но лучше ловить их эксгаустером на поверхности
листьев, кисточкой и т. п. Личинки муравьиного льва
(Myrmeleori) живут в песке или в распыленной сухой
земле, устраивая ловчие воронки, по ним их легко нахо-
дят, там и ловят. Личинки верблюдок часто встречаются
в ходах короедов. Изучают сетчатокрылых и верблюдок
и как энтомофагов (стр. 245).
Собранные одним из указанных способов взрослые
насекомые хранятся в сухом виде, на вате. При необхо-
310
димости монтирования их сразу после замаривания рас-
правляют, накалывают на булавки, снабжают соответст-
вующей этикеткой и хранят в специальных коробках.
При некоторых исследованиях для лучшего сохранения
естественной окраски (например, цвета глаз у хризоп)
часть материала следует хранить в фиксирующих жид-
костях.
Чешуекрылые (бабочки)
Бабочки — самая богатая и распространенная группа
насекомых. Они обитают почти везде, где есть растения,
служащие кормом для их гусениц, и условия для завер-
шения цикла развития.
Бабочки как насекомые с полным превращением в
своем развитии имеют покоющуюся фазу — куколку,
следовательно, некоторое время они находятся в недея-
тельном состоянии.
За редким исключением бабочки не имеют дополни-
тельного питания. Активная жизнь — питание, рост и на-
копление живой массы — происходит в фазе гусеницы на
многих растениях или на растениях определенного вида.
Распространение этих насекомых в значительной мере
определяется распространением кормовых растений. Ба-
бочки, как правило, летают недалеко от кормовых расте-
ний, на которые откладывают яйца, но нередко их мож-
но встретить и на значительном расстоянии от возмож-
ных мест кладки яиц, обитания и питания их гусениц.
Бабочки по-разному реагируют на факторы внешней
среды. Некоторые активны днем, другие на рассвете и
в сумерки или даже ночью. Одних привлекает свет,
другие прилетают на запах цветов (для дополнительно-
го питания). В зависимости от этого определяются мето-
дика и техника лова.
Гусеницы одних бабочек (боярышница, златогузка)
живут на растениях открыто, питаясь листьями, других
(плодожорка) —в плодах, третьих (минеры, моли, дре-
воточцы) — в тканях растения. Кроме того, гусеницы
многих бабочек (совки) живут в земле или других укры-
тых местах.
Куколки живут в почве (совки), на дереве, на различ-
ных сооружениях и т. п.
Длительность развития бабочек также довольно раз-
311
нообразна: одни имеют годовой цикл развития, другие —
несколько генераций в год; одни зимуют в фазе бабочки
(крапивница Vanessa urticae, лимонница Gonepteryx
rhamni), другие — в фазе гусеницы (боярышница, озимая
совка) или куколки (американская бабочка и некоторые
совки) и, наконец, в фазе яйца (некоторые листовертки,
кольчатый шелкопряд и Др.).
Среди чешуекрылых имеются как специализирован-
ные монофаги, так и полифаги. Многие из них наносят
большой вред сельскому хозяйству.
Такое многообразие в образе жизни бабочек значи-
тельно усложняет и методы, которыми пользуются для
их изучения.
Бабочек обычно ловят сачком. Наиболее удобен воз-
душный сачок из прозрачного газа — сквозь него хорошо
видна бабочка и, зная ее положение в сетке, можно осто-
рожно, не повредив ее, перенести в морилку или умерт-
вить, сдавив грудь пальцами. Для количественного учета
насекомых бабочек также ловят сачком при кошениях.
Пользуются фотоэклекторами, ловчими поясами на де-
ревьях. Но для специального изучения бабочек этого
материала совершенно недостаточно, не говоря уже о
том, что такой материал мало пригоден для коллекциони-
рования.
Лов на приманку и в ловушки. Большинство бабочек
активно только в определенные часы суток, в другое
время их трудно обнаружить. Добывать их можно лишь
ловушками или ловить при помощи различных прима-
нок. Приманкой для совок служит специальная смесь:
сахар или мед, смешанный с пивом и несколькими капля-
ми грушевой эссенции. Этой смесью смазывают на 7—
10 см в ширину стволы ряда больших деревьев на опушке
леса. Сюда прилетают привлеченные сладкой приманкой
многие совки, которых здесь же и ловят.
С наступлением сумерек, подойдя к такому дереву с
фонарем, достаточно просто пальцем столкнуть с него
слетевшихся бабочек в подготовленные морилки. Этот
способ дает неодинаковые результаты в разное время
года. Особенно много попадает бабочек на приманку
ранней весной до цветения растений. Успех ловли зави-
сит также от погоды. Самой благоприятной считается
душная погода перед грозой, неблагоприятной — лунные
ночи.
312
Можно также пользоваться самоловкой Щеголева.
Это широкий металлический колпак, под которым поме-
щена вертикальная рама с натянутым на нее войлоком.
Войлок пропитывается бродящей патокой или перебро-
дившей смесью пива с медом/ Под рамой помещают
большую воронку, на узкий конец которой прикрепляют
ловчую банку со спиртом. Прилетевшие к ловушке на
запах бабочки высасывают патоку из войлока и, насосав-
шись, скатываются в банку.
В производственных условиях применяют и корытца
с бродящей патокой. Их устанавливают на подставках
на высоте 1 м от земли. Бабочки слетаются на запах и
падают в корытце с жидкостью. Собранные таким спосо-
бом бабочки обычно оказываются поврежденными и не
подходят для коллекционирования. Такой материал ис-
пользуют для качественного или количественного учета,
выяснения видового состава и экологии видов.
Лов при помощи света. Бабочки, которые не облада-
ют хеморецепторами, не реагируют на запах и не приле-
тают на приманку, но они охотно летят на сильный источ-
ник света, где их и ловят. Для этого ночью на открытом
месте на белую подстилку (скатерть или клеенку) ставят
ярко светящийся фонарь или защищенную от ветра ке-
росиновую лампу. Вскоре к источнику света слетаются
ночные бабочки и садятся на белую подстилку, где их
легко можно собрать. С увеличением силы света увели-
чивается и его притягательная способность. Учитывая
это, можно использовать электрический фонарь, подве-
шенный в саду, в сквере и около него собирать летаю-
щих вокруг бабочек. Этим способом удается иногда до-
быть очень редких бабочек, важных в экологическом и
фаунистическом отношении. Но метод этот применим
лишь для ограниченной группы.
Иные способы добывания бабочек. Аромат некоторых
растений, распускающихся и пахнущих только ночью,
привлекает бражников, некоторых совок. Здесь этих ба-
бочек можно ловить в сумерках просто руками или мо-
рилкой.
Для ловли дневных бабочек лучшее время — от 10 до
2 ч дня. В это время все растения и в поле, и в лесу ки-
шат самыми разнообразными бабочками, виды которых
меняются в зависимости от биотопа. Например, на цве-
313
тущем клевере всегда можно найти бабочек Pieris, Colias
и ряд других.
Умерщвление и сохранение бабочек. Пойманных сач-
ком или руками дневных бабочек умерщвляют, сдавли-
вая пальцами грудь. Этот способ нельзя применять к ноч-
ным видам, особенно к бражникам и шелкопрядам, так
как при этом могут быть стерты волоски с груди. Этих
бабочек рекомендуют замаривать в специальной морил-
ке. Таковой может служить любая широкогорлая банка,
куда нужно вложить комок ваты, смоченной серным эфи-
ром или хлороформом. В банку (морилку) следует бро-
сить несколько полосок фильтровальной бумаги, она впи-
тывает влагу, выделяемую бабочками в предсмертной
агонии, и предохраняет их от порчи.
Фиксирование и препаровка. Умерщвленных бабочек
лучше сразу же наколоть на булавки и расправить или
хотя бы только наколоть. Если же по условиям работы
препаровку приходится отложить, то бабочек нужно со-
хранять в слое ваты в коробке. Разложив на один слог!
ваты нерасправленных бабочек, прикрывают вату листом
бумаги; заполняют новый слой ваты и так до тех пор,
пока не будут разложены все бабочки (стр. 154). Днев-
ных бабочек можно хранить в пакетиках (рис. 74), запас
которых следует иметь с собой на экскурсии. Пакетики
кладут так, чтобы они не давили друг на друга, но и не
болтались. Лучше всего делать пакетики из целлофана.
Для хранения при коллекционировании бабочек и
других насекомых, предложен хлоркрезоловый метод
(Norman Tindal, 1961): на дно пластмассовой коробки с
основанием 12X1'2 см и высотой 4 см кладут чайную
ложку хлоркрезола. Свежеумерщвленных насекомых рас-
кладывают на ткань или вату, сверху кладут этикетку,
затем ткань и новый слой насекомых, пока коробка не
наполнится. Через сутки ее заклеивают клейкой лентой и
хранят в темноте.’Преимущество этого метода заключа-
ется в том, что насекомые остаются гибкими и пригод-
ными для немедленного расправления без размачивания
в течение года после их сбора.
Обработка материала. Одним из элементов ее явля-
ется расправление и накалывание насекомых на булавки.
Чем свежее материал, тем лучше удается это сделать.
Поэтому накалывать бабочек нужно по возможности сра-
зу после замаривания.
314
Если приходится иметь дело с сухим материалом, хра-
нящимся на ватнике или в пакетиках, то его нужно раз-
мочить во влажных камерах (см. рис. 75). Во влажной
камере оставляют насекомых на 1—2 суток, а более
крупные экземпляры и на 3—4 сутки. За это время они
размягчаются настолько,' что их можно накалывать и
расправлять почти так же, как и свежих.
Можно сухой материал размягчать rto методу Jurzitza
(стр. 157), на грудь насекомого кладут на 2—3 мин смо-
ченный в 70° спирте ватный тампон.
Для накалывания берут бабочку указательным и
большим пальцами левой руки за грудку под крыльями,
правой рукой прокалывают ее булавкой насквозь перпен-
дикулярно к поверхности тела (см. рис. 76). Затем при-
ступают к расправлению. Для расправления пользуются
расправилками. Наколотую бабочку помещают в жело-
бок расправилки так, чтобы крылья при расправлении
ложились на поверхность дощечки. Если брюшко искрив-
лено, и в желобок не укладывается, его нужно обколоть
кругом булавками, но не втыкать булавки в1 брюшко. На
правую дощечку расправилки, выше правого верхнего
крыла бабочки, прикалывают полоску бумаги, заготов-
ленную заранее, придерживая противоположный конец
ее левой рукой.
Иглой или булавкой продвигают крыло вперед так,
чтобы задний край переднего крыла был перпендикуля-
рен к. оси тела бабочки. Затем прижав его полоской, туго
ее натягивают и закрепляют с другого конца булавкой.
Повторяют то же самое и с крыльями левой стороны,
восстанавливая в то же время симметрию крыльев на
обеих сторонах. Если бабочка большая, накрывают по-
лосками бумаги и другие части тела, расправляют ноги
и усики.
Свежая бабочка высыхает в течение 5—10 дней, пред-
варительно размягченная — в 1—2 дня. Когда бабочка
находится на расправилке, ее следует снабдить времен-
ной этикеткой. Расправленную и высушенную бабочку
переносят в коробку и снабжают постоянной этикеткой
с соответствующими данными.
Коробку с бабочками необходимо предохранять от
прямого попадания солнечных лучей. Если крышка ко-
робки стеклянная, ее следует накрыть темной материей.
315
Для предохранения же от хищников нужно положить в
коробку нафталин, завернутый в кусочек марли.
Гусениц фиксируют обычным способом, как и других
личинок (см. стр. 186). Для сохранения формы, мягкости
и окраски тела гусениц рекомендуют пользоваться спе-
циальным фиксатором Хань Юань-фа (стр. 152). Кроме
того, гусениц можно фиксировать в жидкости, предло-
женной Мержеевской (стр. 152), в которой окраска со-
храняется 5—6 месяцев, а рисунок темных тонов — более
5 лет.
Перепончатокрылые
Говорить о единой методике изучения перепончато-
крылых трудно и почти невозможно, так как эти насеко-
мые образуют ряд резко отличающихся образом жизни
и экологией групп, и изучение их ведется различными
путями.
Пчелиные и другие близкие группы характером пи-
тания связаны с цветами высших растений. Среди этих
насекомых имеются и одиночные, и общественные фор-
мы. Гнездятся обычно в норах, дуплах и других полостях,
или же устраивают гнезда на поверхности различных
предметов.
Методика изучения этой группы как опылителей изло-
жена в разделе, посвященном изучению насекомых —
опылителей растений (стр. 226).
Собирают пчелиных сачком, ловят пробиркой, попа-
дают они и в количественных сборах. Для систематичес-
ких и фаунистических целей следует при сборке соблюдать
такие требования. Следить за тем, чтобы волоски на теле
насекомого не слеплялись вследствие увлажнения. Для
этого в морилки вкладывают полоски фильтровальной
бумаги, которые впитывают выделяемую насекомым вла-
гу. Заморенных насекомых желательно сразу наколоть
на булавки. Эти требования относятся и к другим груп-
пам.
Пилильщики и рогохвосты. Эти насекомые — фитофа-
ги, живут на растениях (деревьях), где они откладывают
яйца, а некоторые и дополнительно питаются на расте-
ниях. Их можно ловить сачком, как и других, живущих
открыто на растениях насекомых.
316
Личинки (ложногусеницы) пилильщиков ведут иной
образ жизни. Живущих открыто на растениях личинок
пилильщиков собирают вручную, как и гусениц бабочек;
скрытоживущих в древесине личинок рогохвостов добы-
вают как стволовых насекомых (стр. 259).
Паразитические перепончатокрылые. Браконид, ихне-
вмонид, хальцид и других ловят на цветах воздушным
сачком, попадают они и в количественных сборах, соби*
рают их и специально при изучении их как паразитов;
методика изложена в разделе «Изучение энтомофагов».
Муравьи. Муравьи живут большими семьями, коло-
ниями. Как полиморфные формы образуют несколько
каст, что и следует иметь в виду при изучении видового
состава этих насекомых. Собирая их, необходимо стре-
миться к тому, чтобы пробы имели представителей всех
имеющихся в семье форм, причем собирают их непосред-
ственно в колониях, ибо лишь в таком случае можно
собрать все формы, относящиеся к одному виду, хотя
известны случаи пребывания в гнездах муравьев других
видов. Имеются виды рабовладельцы, в колониях кото-
рых могут быть и представители других видов. Нужно
также иметь в виду и то, что без крылатых форм трудно
определить самок. Уже одно это обстоятельство застав-
ляет собирать представителей всех каст. Конечно, если
во время экскурсии и экспедиции нет возможности про-
изводить поиски всех каст, то собирают и одиночные эк-
земпляры рабочих муравьев, но самостоятельная цен-
ность такого материала весьма ограничена.
Сбор материала. Местом сбора муравьев обычно яв-
ляется гнездо, поэтому с поисков последнего и следует
начинать. Гнезда бывают различных типов: подземные,
надземные, в пнях, под камнями (рис. 112, 113). Гнезда,
не имеющие надземных сооружений, обычно находят по
единичным муравьям, несущим добычу в нору. Находят
их также по скученности отдельных муравьев, по нагро-
мождениям древесной муки, на пнях и, наконец, под кам-
нями. Муравьиные кучи (гнезда) состоят из рыхлых ма-
териалов, поэтому раскапывают их в нужных случаях
лопатой, совком (кэпалкой) (рис. 42, В).
Учет гнезд муравьев. Количественный учет муравьев
представляет значительные трудности. Н. И. Нефедов
(1939) применил метод площадок. На обследованной
территории по профилю отбирают площадки в 100 м2 на
317
равном расстоянии друг от друга. Описывают раститель-
ность, затем по частям тщательно осматривают каждую
стометровую площадку. Подсчитывают найденные гнез-
да. Так учитывают количество гнезд на определенной
площади.
Рис. 112. Купол муравейника в дубовом лесу
Два метода учета гнезд муравьев рода Formica опи-
сывает В. Ф. Добрачев (1966). По первому методу на
площади 100 га закладывают 10 пробных площадок раз-
мером 100X100 м и ведут на них сплошной пересчет
гнезд. По второму маршрутному методу на площади
318
100 га прокладывают 10 маршрутов, каждый длиной
500 м и шириной 25 м в среднеполнотных и 15 м в высо-
кополнотных насаждениях. Независимо от метода учета
обнаруженные гнезда наносятся на план, нумеруются
и описываются.
Учет количества особей в одном гнезде (к этому при-
бегают в крайних случаях) проводят разными способами.
В небольших гнездах проводят полный учет, а в больших
Рис. 113. Заселение пня лесными муравьями
определяют объем кучи гнезда, выбирают лишь часть
(определенный объем), подсчитывают муравьев и путем
пересчета выясняют количество их во всем гнезде.
Для учета количества особей в одном гнезде нужно
произвести подсчет их в нескольких муравейниках, а по-
том вывести среднее на одно гнездо. Лучшее время для
такого учета — поздняя осень, когда все особи находятся
в муравейнике. Гнездовой материал забирают в плотные
мешки. Для выборки насекомых можно воспользоваться
термоэклектором, при отсутствии последнего пробу за-
маривают и отдельными порциями просматривают и вы-
бирают из них муравьев вручную. Подсчитав число му-
равьев в гнезде, можно высчитать возможное их количе-
ство на определенную площадь.
319
Учет добычи. Для изучения муравьев, кроме количе-
ства особей в гнезде, следует учесть и их деятельность.
Для учета приносимой муравьями добычи предложен
(Шовен Chauvin, 1966) метод автоматического сбора, с
помощью которого можно определить как количество
добычи, так и ее видовой состав в разнос время суток и
в разные периоды. Вокруг муравейника укрепляется кар-
тонная ограда высотой 25 см и диаметром около 2 м.
Ограда пропитывается мазутом, обладающим отпугива-
ющими свойствами для муравьев. В ограде на высоте
10—15 см делают два отверстия и сквозь каждое про-
пускают по дощечке. У одной из них конец находится
около муравейника, по ней муравьи могут только выхо-
дить наружу. Конец другой дощечки лежит на земле за
пределами ограды, по ней муравьи могут только вхо-
дить. Под входной дощечкой внутри ограды помещается
деревянный ящик с мелкими отверстиями в стенках и с
металлической гладкой воронкой сверху. Приползающие
муравьи проваливаются в воронку, оставляют в воронке
свою добычу, а сами выходят через боковые отверстия в
стенках ящика.
Выведение муравьев. Иногда в гнезде вполне зрелых
крылатых форм не бывает, в таких случаях их следует
выводить в лаборатории. Выбирают муравьев с гнездо-
вым материалом и куколками (куколки крылатых самок
по размерам больше других) из гнезда, перекладывают
их в обыкновенную банку, завязанную мелкой металли-
ческой сеткой. Муравьям дают пищу в виде сахарного
сиропа в вате. Время от времени дают маленькие кусочки
мяса или несколько полураздавленных насекомых. Из
гнезд следует брать как можно больше экземпляров (до
3—4 десятков каждой касты с колоний, живущих в раз-
ных экологических условиях).
При изучении же полиморфизма муравьев необходи-
мо брать не по выбору, а в виде средней пробы: вначале
гнездовой материал перемешивают, а потом берут часть
в банку. Для изучения биологии можно пользоваться и
искусственными гнездами (рис. 114). Собранных или вы-
веденных в лаборатории муравьев помещают непосред-
ственно в спирт (75—70°); спирт можно заменить смесью
из 5 см3 крепкой уксусной кислоты, 35 см3 абсолютного
спирта и 60 см3 раствора сулемы (1 : 500) в воде.
320
Муравьев в зависимости от размеров нужно ловить
пинцетом, небольшой кистью, смоченной спиртом, а так-
же эксгаустером и переносить их сразу в спирт.
Пробирки не следует загружать большим количест-
вом муравьев, так как они могут деформироваться. В
пробирку можно помещать несколько проб, отделяя их
ватными тампонами, но при этом каждую пробу следует
Рис. 114. Формикарий
снабдить отдельной этикеткой. Пробирки (трубочки) с
собранными насекомыми можно поместить в общую бан-
ку со спиртом (см. рис. 100). Муравьев, помещенных в
спирт, сохраняют до их изучения или препаровки для
коллекций. В целях точного определения часто необходи-
мо препарировать отдельные органы. Это удобно делать
на спиртовом материале. Если нужно сохранить некото-
рые части, из отдельных органов готовят постоянные
препараты и заключают в канадский бальзам, переводя
предварительно их, как обычно, через спирты и гвоздич-
ное масло.
Можно сохранять муравьев сухими. В этих случаях
заморенных муравьев из морилок переносят на ватники,
снабжают этикетками и хранят до обработки.
При отсутствии спиртового материала для препаров-
ки можно пользоваться также сухими насекомыми; для
этого сухой материал нужно проварить в небольшом ко-
личестве дистиллированной воды в течение небольшого
времени. Для изготовления постоянных коллекций сухих
муравьев следует наклеивать их на картонки, ни в коем
случае не накалывать.
11—1867 321
Двукрылые
Нет и не может быть единой методики изучения и уче-
та этой многочисленной группы насекомых со множест-
вом биологических форм. Способы лова должны быть
дифференцированы в зависимости от биологических
особенностей объекта изучения.
Мухи и некоторые другие кровососы, связанные с жи-
вотными и человеком, изучаются по специальной мето-
дике, описанной в другом разделе (см. стр. 357).
Журчалки (Syrphidae) и другие двукрылые, связан-
ные с цветами, отличаются от других групп образом жиз-
ни. Сведения по методике изучения их как антофилов
приведены в разделе, посвященном насекомым-опылите-
лям (стр. 231). Личинки многих сирфид являются хищ-
никами, живут в колониях тлей. Эта группа, как и тахи-
ны, личинки которых паразитируют в теле насекомых,
изучается по особой методике (см. Изучение энтомофа-
гов).
Злаковые мухи — своеобразный комплекс фитофа-
гов— концентрируются на различных растениях. Соби-
рают их воздушным сачком, попадаются и в количест-
венных учетах. Выбирают этих мух эксгаустером, кис-
точкой. Собранный материал после замаривания хранят
на ватнике или в монтированном (наколотом) виде в
коллекциях. Часть материала хранится в спирте.
Личинок, куколок (пупарии), живущих в почве или
другом субстрате, добывают при раскопках почвы, при
анализе подстилки, промывке почвенных образцов и т. п.
Фиксируют и хранят их, как и других личинок и почвен-
ных беспозвоночных (стр. 186).
Своеобразны в биологическом отношении галлицы
(Itonidae). Этих мелких двукрылых добывать в приро-
де довольно трудно, что объясняется биологией и мелки-
ми их размерами. Можно собирать их кошением, ловить
на свет, в местах их скопления ловить на липучки
(стр. 147). В этих случаях во избежание быстрого высы-
хания прилипших галлиц сразу следует перенести в
спирт.
Но для получения ценного материала рекомендуется
выводить их из галлов (стр. 250). Подробные сведения
по этому вопросу можно найти в специальной литерату-
ре (Мамаев, 1962).
ИЗУЧЕНИЕ ЧЛЕНИСТОНОГИХ, СВЯЗАННЫХ
С ТЕПЛОКРОВНЫМИ животными
И ЧЕЛОВЕКОМ
ИЗУЧЕНИЕ ФАУНЫ НОР И ГНЕЗД МЛЕКОПИТАЮЩИХ
Й ПТИЦ
Многие млекопитающие и птицы, защищаясь от не-
благоприятных условий внешней среды и от врагов, поль-
зуются различными укрытиями или роют себе норы, ло-
говища и другие убежища, а также строят гнезда, где
высиживают яйца или выкармливают потомство.
В сооружаемых позвоночными постройках создается
особый микроклимат. Последний характеризуется относи-
тельно большей устойчивостью, резко уменьшаются ко-
лебания температуры в течение суток и по сезонам. Ко-
лебания эти во много раз меньше, чем на открытом воз-
духе, а на глубине 1,5—2 м температура становится
устойчивой, как в термостате. Высока и постоянна в но-
рах и влажность. Для изучения микроклимата пользуют-
ся искусственными норами (рис. 115).
Устойчивый микроклимат гнезда, наличие в нем ос-
татков пищи и, наконец, обитание здесь теплокровного
животного — хозяина гнезда привлекает многих члени-
стоногих. Некоторые обитатели нор настолько приспосо-
бились к таким условиям, что вне этой стации жить не
могут. Чем сложнее и глубже нора, тем богаче население
ее. В колониях песчанок, в окрестностях Ашхабада, най-
дено до 200 видов сожителей из числа двукрылых, жуков,
блох, перепончатокрылых, многоножек, клещей и других
животных.
11*
323
В гнездах малого суслика (Citellus pygmaetis) на
территории Западного Казахстана обнаружено 22 вида
клещей и пауков, 20 видов насекомых, по одному виду
ракообразных и многоножек (Медведев, 1962).
Все убежища и гнезда теплокровных животных пред-
ставляют своеобразные биотопы и служат стациями мно-
Рис 115. Изучение микроклимата гнезда (по Раллю)
гих переносчиков трансмиссивных заболеваний животных
и человека. Такие богатые разнообразными беспозвоноч-
ными биотопы не могут оставаться вне внимания иссле-
дователей. Всякое изучение обитающих на позвоночных
животных эктопаразитов предполагает исследование и
самих обитателей нор и гнезд.
Основным фактором,, влияющим на появление, изме-
нение и исчезновение обитателей гнезд, является их хо-
зяин и его образ жизни (размножение, кормление, выси-
живание, спячка). Фауна покинутых гнезд резко отли-
чается от фауны обитаемых гнезд. Другим важным
фактором являются микроклиматические условия среды.
При изучении обитателей гнезда в цепи паразитологиче-
ских исследований надо обязательно учитывать все ука-
занные условия. Для получения полноценных сравнимых
324
данных следует пользоваться единой методикой сбора и
изучения этих членистоногих.
При изучении фауны гнезд нужно вести качественный
и количественный учет всех его обитателей. Качественное
исследование позволяет нам учитывать видовой состав
эктопаразитов, связанных с гнездом.* Количественный
учет дает возможность делать ценные сравнительно-эко-
логические выводы на основе полных количественных
сборов, проведенных по единой и объективной методике.
Наблюдения необходимо вести систематически в те-
чение суток и в течение всего года, ибо лишь при таких
условиях можно установить основные закономерности
жизненных циклов паразитов и выяснить их роль в жиз-
ни хозяина.
При паразитологических исследованиях важно уметь
определить хозяина гнезда по косвенным материалам
(остаткам пищи, свежим экскрементам, отдельным во-
лоскам), так как пребывание животного в гнезде не
всегда является верным показателем того, что гнездо
(нора) принадлежит ему.
Раскопка нор. Выясняют обитаемость норы, затем за-
крывают все выходные отверстия и приступают к рас-
копке. Сняв лопатой или совком вокруг норы горизон-
тальный пласт земли, тщательно и аккуратно собирают
обычными методами всех крупных насекомых, которые
обитают близ входа. Снимают со стенок камеры слой
земли, затем вынимают гнездо целиком вместе с окру-
жающей землей и кладут его в мешок из плотной белой
материи или в банку с притертой пробкой. Банку обтя-
гивают материей и завязывают. Снимают со стенок по-
лости, где находилось гнездо, особенно под ним землю,
и переносят в тот же мешок или в ту же посуду, куда
помещено гнездо. В банку или мешок вместе с гнездовым
материалом вкладывают этикетку с данными о характе-
ре гнезда, с датой и т. д. Пробу (мешок или банку) пе-
реносят в лабораторию и сохраняют для анализа.
Во время раскопок может иметь место переход неко-
торых активных членистоногих (блох, клещей) в другие
норы. Для учета их рекомендуется (по Петрищевой) раз-
вешивать около нор свернутые в трубку липкие листы
бумаги или пользоваться различного рода ловушками,
а для блох — специальными ящиками с водой (Тифлов
и Потапов).
325
Если удается поймать животное — хозяина гнезда, то
с него необходимо собрать насекомых и клещей как
можно скорее после его поимки и умерщвления. В тех
случаях, когда осмотр животного оставляют до возвра-
щения в лабораторию, трупы переносят в мешочки из
плотной ткани.
Переносить зверька в мешок следует так, чтобы бло-
хи не успели уйти.
Разборка материала. Пользуются разными методами.
Наиболее простой из них — ручной. Таз, кювету или раз-
ложенный лист белой материи или бумаги накрывают
стеклом, вынимают из банки часть пробы, тщательно при
хорошем освещении осматривают, выбирают в первую
очередь блох и проворных мелких жуков (стафилинид).
При известном навыке это можно делать так быстро, что
ни одно хорошо видимое простым глазом насекомое или
другое членистоногое не уйдет. Мелких животных —
клещей, блох — ловят кисточкой, мягким пинцетом или
выбирают эксгаустером.
Ручной сбор материалов трудоемок и недостаточно
объективен, поэтому он применяется только для сбора
крупных видов или определенных представителей, а не
для полного учета всех обитателей гнезда. Более эффек-
тивно в последнем случае использование различного ро-
да термо-гигро-фото-эклекторов — электрических, керо-
синовых и пр., широко применяемых для учета населения
лесной подстилки и другого субстрата.
Для зарядки эклектора открывают верхнюю крышку
и осторожно выкладывают из мешочка на сетку прине-
сенный материал, тут же кладут и вывернутый мешочек,
Перед тем как выложить материал, под воронку внизу
ставят сухую чашку Петри. После того как загрузка эк-
лектора закончилась, принимают из-под воронки чашку
Петри, заменяют банкой с фиксатором, а все то, что ус-
пело попасть в чашку Петри, высыпают в эклектор.
Включают свет. Прогрев гнездового материала в элект-
рическом термоэклекторе летом должен длиться не более
2—2,5 ч (применяется лампочка не более 75 вт); для
влажных гнезд требуется на .час больше. Расстояние
между лампочкой и гнездом в резервуаре должно быть
не менее 10—12 см. При анализе гнезд большого объема
гнездовой материал закладывают в эклектор частями,
баночку с фиксатором при этом не меняют, а в случае
326
надобности лишь доливают фиксатор, так как последний
испаряется.
В качестве жидкости для сбора членистоногих под
эклекторами лучше использовать слабые растворы фун-
гицидов, так как из-за ядовитых паров при употреблении
обычных фиксаторов уменьшается вых^д членистоногих,
а в дистиллированной воде животные быстро покрыва-
ются плесенью.
Наиболее универсален керосиновый термоэклектор
(см. стр. 137). Применяется в экспедиционных условиях,
где нет электрической сети. Известно описание многих
типов керосиновых эклекторов (Старк, Чернышев, Гин-
збург и др.), но у всех имеется один и тот же недостаток,
заключающийся в том, что резервуар их расположен
очень близко к обогревающей части. Эклектор нагрева-
ется неравномерно, что губительно действует на некото-
рых обитателей исследуемого субстрата.
Чтобы избежать этого и предотвратить перемещения
обитателей в разные направления внутри субстрата и
устранить нежелательные действия аппарата. С. О, Вы-
соцкая (1953) видоизменила конструкцию керосинового
термоэклектора. В новой конструкции, в которой устрой-
ство камеры не имеет существенных отличий от других
приборов, обогревающая часть камеры полностью отде-
лена от резервуара, где помещается исследуемый мате-
риал. Тепло (в приборе Высоцкий) поступает в резервуар
от источника по трубе сверху. В качестве нагревателя
применяется керогаз. Вследствие полного сгорания в нем
керосина он экономен, к тому же он не дает запаха. Тер-
моэклекторы этой конструкции бывают одно-, двух-, трех-
и четырехкамерные. Такой одинарный керосиновый тер-
моэклектор изображен на рисунке 57. Многокамерным
одновременно можно обрабатывать четыре гнезда, что
значительно ускоряет работу. Керосиновый термоэклек-
тор может быть использован везде и во все сезоны года.
Термоэклектор (по Иоффу), источником тепла служит
кипяток (рис. 116).
При пользовании эклекторами любого типа следует
придерживаться таких правил. Гнездо перед помещением
его в эклектор необходимо бегло большими порциями
просмотреть и выбрать очень крупных его обитателей
(больших жуков), которые не могут пройти через сетку
и своими движениями могут вызвать осыпание мусора
327
через сетку в фиксирующую жидкость. Крупных насеко-
мых, извлеченных вручную из гнездового материала, пе-
реносят в морилку. На них часто бывает множество мел-
ких клещей из подотрядов Parasitiformes, Sarcoptifor-
mes, поэтому они должны быть тщательно осмотрены под
лупой. Клещей с каждого обитателя отдельно переносят
в пробирку с 7(Г
спиртом (с этикет-
кой).
Для проверки,
все ли обитатели
гнезда извлечены,
здесь же гнездовой
материал небольши-
ми порциями скла-
дывают в кювету
или на лист белой
бумаги и подверга-
ют дополнительному
ручному разбору.
Указанные эклекто-
Рис. 116. Схема термоэклектора
Иоффа (по Иванову). А — вид
сбоку; Б — вид сверху:
1 — резервуар для горячей воды, 2 —
палки, на которых помещают материал
для исследования, 3 — отверстие, через
которое насекомые падают в банку с
фиксатором (4), 5 — стеклянная дверца
ры могут быть ис-
пользованы для сбо-
ра эктопаразитов не-
посредственно с гры-
зуна, если послед-
ний не потребуется
для других исследо-
ваний.
После разбора гнезда необходимо тщательно вымыть
руки, промыть все инструменты и посуду спиртом или
горячей водой и протереть их чистым полотенцем. Раз-
борку производят по группам. Мелких насекомых соби-
рают в отдельную пробирку, затыкают ее ватой и поме-
щают в морилку; крупных насекомых (жуков, мух, кло-
пов, прямокрылых) переносят непосредственно в
морилку и анестезируют обычным способом. Всех осталь-
ных беспозвоночных — червей, пауков, клещей и др., а
также отдельные ф,азы насекомых (личинки, яйца и т.д.),
если их собирают для фаунистического изучения,
помещают в 70° спирт.
Если в гнезде обнаружены неизвестные личинки или
куколки, их отделяют и сохраняют до выведения из них
328
имаго. Для этого помещают выявленных личинок и ку-
колок в небольшой порции гнездового материала в гли-
няные горшки, завязывают сверху плотной марлей или
сеткой и ставят в темное сырое место. Весь уход за ни-
ми заключается в том, чтобы поддерживать землю в
умеренно влажном теплом состоянии. 4
Умерщвленных насекомых раскладывают на слой ва-
ты и снабжают подробными этикетками, а пробирки с
заспиртованным материалом переносят в банки, напол-
ненные спиртом (см. рис. 100).
При изучении гнезд в дуплах приходится прибегать
к разрубке дерева, что возможно лишь в местах массо-
вой рубки леса; такие гнезда представляют большой ин-
терес. Заслуживает внимания также фауна гнезд, рас-
положенных внутри глубоких нор, вырытых птицами
(щурками, удодами и др.) по краям обрывов и крутых
оврагов. Результаты анализа гнезд и нор заносят на кар-
точку.
Обязательно нужно учитывать и тех животных, на
которых паразитов не оказалось, и те гнезда, где пара-
зиты не были обнаружены. На основе анализа данных
всего количества обследованых животных или их нор и
гнезд можно вычислить процент зараженных эктопара-
зитами животных (встречаемости) и среднее число пара1
зитов на одно животное (индекс обилия).
Карточка учета населения гнезда
№-----Название места.-----------Название хозяина---------
Дата ----------Характер гнезда (зимнее, летнее, покинутое)-
---------------------Характеристика---------------------
Метод сбора----------Фамилия----------------------------
№ п.п. Название животного В какой части гнезда Количе- ство Характер связи Примечание
кто определил где хра- нится материал
1
ИЗУЧЕНИЕ И СБОР ЭКТОПАРАЗИТОВ ЖИВОТНЫХ
При изучении паразитов животных и человека необ-
ходимо прежде всего выяснить видовой состав — пара-
329
зитарное население вида, изучить характер взаимоотно-
шений паразита с организмом хозяина и окружающей
средой как непосредственно, так и через хозяина.
Для выяснения паразитофауны животных какой-ни-
будь малоизученной местности Е. Н. Павловский реко-
мендует обследовать представителей всех известных
здесь видов позвоночных животных в различной эколо-
гической обстановке и выявить обитающих на них чле-
нистоногих. Для выяснения фауны, точнее комплекса па-
разитов, предложен метод полных паразитологических
анализов. При помощи этого метода накоплен большой
фаунистический материал, выявлен состав паразитов
многих животных в разных зонах.
Но по одной лишь регистрации паразитофауны нельзя
судить ни об условиях интенсивности заражения, ни об
эволюции паразитов. А между тем данные о чрезвычай-
но широком распространении паразитизма как формы
жизни представляют большой научный и практический
интерес. Поэтому наряду с фаунистическим изучением
необходимо проводить и экологическое. Методику эколо-
гического изучения паразитов впервые применили
Е. Н. Павловский и В. А. Догель. В. А. Догель
(с сотрудниками) установил зависимость паразито-
фауны не только от биологических особенностей
хозяина, по и от его экологии. Стало известно,
что на состав паразитофауны влияет возраст, пища
и сезонное поведение хозяина. Установлена также
зависимость состава паразитофауны от особенностей
различных факторов среды, в которой протекает
жизнь хозяина и с которой на определенных стадиях
развития связаны и паразиты. К таким факторам, влия-
ющим на паразитофауну того или иного животного, отно-
сится географическое положение района, микроклимат,
биотическая среда. Объектом исследования (по Догелю),
таким образом, служит хозяин с его взаимоотношениями
со средой и вся его паразитофауна, взятая в целом.
Е. Н. Павловский выдвинул и развил учение об орга-
низме как среде обитания для других организмов (1931,
1937), о природной очаговости трансмиссивных болезней
(1940, 1944), об экологическом подходе к изучению про-
блемы переносчиков, паразитоценоза в целом, отсюда и
комплексный подход к решению паразитологических воп-
росов.
ззо
В данном руководстве будет рассмотрена только ме-
тодика изучения эктопаразитов. Эндопаразитов мы ка-
саться не будем, так как эти специальные исследования
не входят в нашу задачу.
Общие методы сбора эктопаразитов
Наружные паразиты — эктопаразиты — представле-
ны разными группами с различной биологией. Некоторые
из этих эктопаразитов живут свободно в природе и лишь
короткое время питаются на теле животных и человека:
самки комаров, москитов (Phlebotomus), мокрецов, мо-
шек, самцы и самки слепней и др. Эта совокупность ле-
тающих кровососов получила название «гнус». Личинки
этих двукрылых живут в разнообразных средах и не яв-
ляются паразитами. Временными паразитами могут быть
также клещи, для разных видов которых число приемов
пищи строго определенно; питаются кровью и личинки
многих клещей.
Среди эктопаразитов есть и такие, которые не только
питаются, но и живут исключительно на теле хозяина.
Это постоянные эктопаразиты, например, пухоеды (Ма1-
lophaga), вши (Anoplura), перьевые клещи и некоторые
другие. Паразиты эти находятся постоянно на хозяине,
яйца свои прикрепляют к перьям или волосам, тут же
они и развиваются, а дейтонимфы перьевых клещей да-
же проникают под кожу хозяина.
Эктопаразиты большей частью являются перенос-
чиками возбудителей паразитарных и инфекционных бо-
лезней (блохи — переносчики чумы, клещи — переносчи-
ки вируса клещевого энцефалита, клещевого возвратного
тифа). Изучение отдельных групп беспозвоночных (блох,
клещей) приведено в соответствующих разделах.
Собирают эктопаразитов с животных следующим об-
разом. Пойманное животное умерщвляют: птиц — уколом
в мозг, мелких грызунов — сдавливанием пальцами груд-
ной клетки. Можно применять анестезирование хлоро-
формом или эфиром, но в этих случаях умерщвляются и
паразиты, что усложняет их выборку, поэтому этим спо-
собом следует пользоваться лишь в особых случаях.
Обследуют животное на эктопаразитов. Сначала со-
бирают с него наружных паразитов, постоянных или вре-
331
менных, присосавшихся к телу животного на некоторый
срок (клещей и др.). Иногда наружные паразиты связа-
ны с хозяином слабо, например, взрослые блохи быстро
передвигаются в шерсти животного и легко с него убе-
гают. Для того чтобы собрать и сохранить всех наруж-
ных паразитов изучаемого животного, следует собирать
их по возможности тотчас же после поимки животного
Рис. 117. Приспособ-
ление для сбора экто-
паразитов с грызунов
(ориг.)
одним из приведенных ниже спо-
собов.
1. Животное помещают в
плотно закрывающуюся коробку,
банку или завязывающийся ме-
шок из плотной белой материи,
предварительно закрыв ранки
(если животное убито ранением)
и анальное отверстие комочками
ваты. В таком виде животное до-
ставляют в лабораторию для де-
тального анализа. Если позволя-
ют время, материалы, оборудова-
ние и прочие условия или если
животное невозможно перенести
в лабораторию вследствие боль-
ших его размеров или по другим
причинам, паразитов следует со-
бирать с него на месте. Для этого
труп кладут в таз или на белую
материю, покрытую полиэтилено-
вой пленкой, и приступают к сбо-
ру. Раздвигая слегка пинцетом
шерсть или раздувая ее, собирают активно передвигаю-
щихся блох палочкой или кисточкой, смоченными спир-
том, бензином или хлороформом. Можно собирать вы-
чесыванием частым гребешком или зубной щеточкой.
Этим способом пользуются и в тех случаях, когда жи-
вотное для специальных целей умерщвлено хлороформом
или серным эфиром и вместе с хозяином умерщвлены и
паразиты.
2. С грызунов, выгнанных из нор вливанием в них
воды, сбор производят на месте. Обследуют, как об этом
было сказано (см. «Изучение фауны нор и гнезд»), стен-
ки нор, гнезд и т. д., так как блохи могут убегать с мок-
рых, хотя и живых животных.
332
Доставленный в лабораторию труп животного кладут
в воронку подходящих размеров, под которую ставят
банку с водой или с консервирующей жидкостью. Между
трупом и воронкой должно оставаться пространство, что-
бы блохи могли скатываться вниз и падать в банку
(рис. 117). Если убитое животное крупных размеров, то
его рекомендуется подвесить над тазом и собрать отпав-
ших с него в таз эктопаразитов.
Клещей с трупа собирают пинцетом, следя, чтобы не
оторвался хоботок. Если клещи крепко присосались, то
их следует сначала смазать вазелином или другим ка-
ким-либо жиром, а потом осторожно снимают. В этом
случае клещи даже сами покидают хозяина.
3. С птиц собирают паразитов так. Умерщвленную од-
ним из указанных выше способов птицу после взвешива-
ния и измерения кладут в таз или на белую клеенку и
приступают к анализу. Прежде всего осматривают банку,
в которой птица умерщвлена, и собирают оставшихся
там паразитов. Затем осматривают птицу, снимают и
подсчитывают паразитов с маховых перьев одной сторо-
ны тела. Выдергивают затем несколько перьев с одной
стороны и помещают для детального их анализа в хими-
ческую пробирку или банку со спиртом. После этого при-
ступают к детальному осмотру всего оперения на нали-
чие пухоедов (Mallophaga) и их яиц. Кладут птицу на
эмалированную или обыкновенную белую тарелку, на фо-
не которой пухоеды хорошо выделяются, выщипывают
большую часть перьев с тела и собирают паразитов.
Даже при внимательном осмотре могут ускользать кле-
щи Siringobidae, живущие внутри основания перьев. Ма-
териал, собранный с изучаемых животных, кладут в ча-
совые стекла с 70° спиртом или в мелкие пробирки и
снабжают этикетками. Пробирки затем переносят в ма-
териальные банки со спиртом. Следует сразу рассорти-
ровать клещей, блох и власоедов и разложить в отдель-
ные пробирки, банки.
Затем осматривают покровы, нет ли мест с выпавшей
шерстью или с наслоением ороговевших частей эпидер-
миса. Если такие места обнаружены, следует снимать с
них корочки и помещать в 70° спирт.
Сведения о методах изучения отдельных групп пара-
зитических членистоногих подробно изложены в соответ-
ствующих разделах данного пособия.
333
Свободноживущие клещи
Многие клещи — паразиты. Одни паразитируют на
животных, другие — на растениях; одни паразитируют в
течение всей жизни, другие — в одной из фаз своего раз-
вития. Постоянные паразиты всю жизнь проводят или
на одном животном, или по мере своего развития перехо-
дят на другое животное.
По характеру питания клещи образуют много эколо-
гических групп, которые имеют различное значение. Сре-
ди этих членистоногих есть сапрозойные, которые часто
встречаются в местах, богатых растительными остатка-
ми. Эти виды питаются грибами, тканями растений; есть
среди них также хищники. Но наиболее многочисленны
паразитические виды. Клещи, живущие в почве и распро-
страненные в различных ландшафтных зонах, очень раз-
нообразны в биологическом отношении и многочисленны
по количеству видов и числу особей. Их описание см. на
стр. 206.
Сбор наземных клещей производится: для фаунисти-
ческого изучения; для установления заклещевения паст-
бищ; для изучения биологии их развития и смены хозяев;
для изучения вредителей растений. Добывают материал
при эколого-биоценологических работах, при специаль-
ных паразитологических исследованиях и при изучении
паразитоценозов. В зависимости от группы изучаемых
клещей и от целей исследования применяются и различ-
ные методы сбора.
Свободноживущие гамазовые клещи обитают в разно-
образных местах. В лесу и в садах их можно найти под
отставшей корой деревьев, в трухлявых пнях, на грибах-
трутовиках, в лесной подстилке, во мхах и лишайниках,
неглубоко в почве. Много их бывает по обочинам канав,
на влажных лугах, под камнями. Некоторые из них —
сапрофаги — питаются разлагающимися органическими
остатками. Но основная масса свободноживущих кле-
щей— хищники. Они нападают даже на паутинных кле-
щей, живущих на различных растениях, поэтому их часто
можно видеть на листьях растений. В этом отношении
хищные клещи полезны. Много их бывает в логовищах,
норах и гнездах различных зверей и птиц, в пещерах,
траншеях, погребах. Здесь они нападают на различных
членистоногих — на паутинных и других клещей, а также
334
на насекомых. Некоторые виды клещей приурочены ис-
ключительно к муравейникам и термитникам. Отдельные
виды приурочены к гнездам шмелей и ульям домашних
пчел. Но большинство составляют паразитические
формы.
Часто, иногда в большом количестве можно видеть
клещей на различных насекомых — мухах, жуках, шме-
лях, прямокрылых; найдены они на пауках и многонож-
ках. С указанными членистоногими клещи часто рассе-
ляются, не причиняя им большого вреда. Живут
представители этого отряда и в жилищах человека, в
складских помещениях, сараях. Много клещей концен-
трируется осенью в норах грызунов, где их привлекает
обилие пищи и тепла. Но перезимовывают клещи лишь
немногих видов.
Методы сбора клещей зависят от особенностей биоло-
гии вида. Свободноживущих (сапрозойных и хищных)
клещей собирают в местах их обитания вместе с субстра-
том— гнездовым материалом, трухой, почвой, подстил-
кой. В этих случаях пробу переносят в мешочек, снабжа-
ют этикеткой и доставляют в лабораторию. В лаборато-
рии клещей выбирают из материала с помощью уже
описанных выше термоэклекторов. Так собирают и других
мирмекофильных клещей. Интересный материал можно
собрать в курятниках, на сеновалах, под камнями, в тру-
хе дупел, под корой, в ходах короедов. Клещей собирают
также с жуков, шмелей, пчел, мух и других насекомых
при помощи кисточки, смоченной в спирте. С растений
собирают гамазовых клещей отряхиванием их на белую
плоскость по методике, которой пользуются для сбора
паутинных и плоских клещей (см. «Паутинные и другие
растительноядные клещи»).
Паразитические гамазовые клещи
Паразитические клещи встречаются на самых различ-
ных животных: на членистоногих — насекомых, много-
ножках, пауках; на рептилиях и птицах; на млекопитаю-
щих— грызунах, насекомоядных, мелких хищниках,
летучих мышах и др. На хозяине они пребывают для кро-
вососания сравнительно короткий срок — всего от не-
335
Изготовление микроскопических препаратов (по Бре-
гетовой). Из пробирок со спиртом клещей переносят на
чистые стекла или в стеклянные солонки с дистиллиро-
ванной водой, споласкивают несколько минут, затем пи-
петкой осторожно отсасывают воду, а на стекло налива-
ют 5 или 10%-ный раствор едкого кали и едкого натра,,
покрывают кусочком стекла или другим часовым стеклом
и оставляют для мацерации на 10—12 ч. Затем клещей
промывают дистиллированной водой, а после этого за-
ключают в гуммиарабиковую смесь.
Приготовление гуммиарабиковой смеси. В состав гум-
миарабиковой смеси (жидкость Фора — Берлезе) вхо-
дит: вода дистиллированная — 50 частей, хлоралгидрат —
200, глицерин очищенный — 20, гуммиарабик сухой —
30 частей. Гуммиарабик высыпают в воду и ставят на
несколько часов в термостат при температуре 50—60°
затем добавляют глицерин и хлоралгидрат и держат 2—
3 дня. Когда гуммиарабик растворится, смесь фильтру-
ют через тряпочку. Фильтровать нужно при температуре-
50—60° С. Мелких клещей, а также нимф, как и мелких
насекомых, заключают в смесь без мацерации.
Можно делать глицерин-желатиновые препараты.
Приготовление глицерин-желатиновой смеси. В 10 мл
дистиллированной воды (для заделки клещей берется
20 мл), к которой предварительно прибавляют кристалл
тимола или камфоры, переносят 12 г чистого желатина
и растворяют на ледяной бане или в термостате. Затем
в смесь прибавляют 8 г глицерина и 100 г хлоралгидра-
та. Тщательно перемешивают и снова ставят в водяную
баню или в термостат до полного растворения хлорал-
гидрата. Для освобождения смеси от хлопьев и других
частиц ее фильтруют через стеклянную вату (лучше в
термостате).
Заключение'в глицерин-желатин. Клещей после маце-
рации (а мелких без мацерации) переносят на предмет-
ное стекло в каплю расплавленной глицерин-желатино-
вой смеси и покрывают покровным стеклом. Последнее
слегка надавливают, чтобы жидкость распределилась
равномерно. Во избежание сплющивания объекта под
покровное стекло подкладывают «ножки» из отрезков по-
кровного стекла, оттянутых капилляров трубок и т. п.
После затвердевания среды края покровных стекол обя-
зательно обводят (кантуют) канадским бальзамом, кле-
338
ем БФ-2 или расплавленной менделеевской замазкой.
Хранить этот препарат следует при температуре не выше
30° С. Такие препараты не стойки и годятся только для
временного пользования.
Более устойчивы бальзамовые препараты, но они ма-
ло пригодны, так как в них очень сильно просветляется
хитин, отчего границы хитиновых щиткбв на теле клеща
становятся трудно различимыми.
На одно предметное стекло можно поместить несколь-
ко клещей, если видовой состав заведомо однородный.
Часть клещей при этом кладут вверх спинной стороной,,
а часть — брюшной. Сбоку на теле тонко отточенной пре-
паровальной иглой, лучше энтомологической булавкой,
делают прокол. Готовые препараты кладут в горизон-
тальном положении в термостат или в теплое место на
срок от двух дней до двух недель (при температуре
60° С) для просветления и подсушивания. Каждый пре-
парат снабжают двумя этикетками, на одной пишут наз-
вание клеща, фамилию определившего; на другой — наз-
вание хозяина, географический пункт, дату и номер. Хра-
нить препараты следует в горизонтальном положении.
Иксодовые клещи
Иксодовые клещи встречаются в различных ланд-
шафтных зонах, но наибольшее разнообразие отмечают в
южных районах. В пределах своего ареала вид может
заселять различные стации. Иксодовые клещи нападают
на своего хозяина и присасываются к его телу на время
питания; откладка же яиц, линька личинок и нимф, а
также зимовка происходят во внешней среде.
Изучение иксодовых (пастбищных) клещей имеет,
кроме теоретического, большое практическое значение:
часть клещей является паразитами человека, домашних
животных и птиц. Кроме того, многие из известных ви-
дов— переносчики гемоспоридиозных и других трансмис-
сивных заболеваний сельскохозяйственных животных п
человека. Естественно, возникает необходимость изба-
виться от действия этих клещей. Для активной ликвида-
ции очагов и успешного проведения профилактических
мероприятий нужно знать видовой состав клещей, рас-
пределение их в природе, развитие и круг тех животных,
12*
339
на которых прокармливается интересующее нас членис-
тоногое.
Пастбищные клещи обычно встречаются на крупных
млекопитающих (домашних животных) и на мелких
зверьках (мышах, полевках, летучих мышах, ежах),
очень часто встречаются на птицах и рептилиях. Клещи
быстро бегают по телу животного, а некоторые сидят
неподвижно, присосавшись у углов рта, на губах и чаще
всего на ушах. У многих домашних животных присосав-
шихся клещей можно найти на любой части тела. Таким
образом, источники питания, а также места обитания,
определяющие жизнедеятельность интересующих нас
клещей, весьма разнообразны.
Сбор иксодовых клещей с диких животных. Отлавли-
вают на обследуемой территории зверьков — мелких и
средних — ловят мышеловками и крысоловками, круп-
ных— капканами. Приманкой может быть соленое сви-
ное сало, хлеб с подсолнечным маслом. Кроме того,
зверьков и мелких птиц отстреливают. Ловят животных
также живоловками.
Все орудия лова следует расставлять в местах обита-
ния животных вечером после захода солнца, а рассмат-
ривать утром, как можно раньше, иначе клещи могут
уйти с мертвого хозяина.
Добытых животных кладут вместе с временной эти-
кеткой в отдельные полотняные или полиэтиленовые ме-
шочки, которые крепко завязывают и доставляют в лабо-
раторию для анализа. Живых животных, перед тем как
вынуть из мешочка, умерщвляют. Методом прямого сбо-
ра выбирают находящихся на животных клещей, а при
полном паразитологическом анализе или изучении пара-
зитоценоза — й других эктопаразитов. Собирают сначала
свободно ползающих по телу хозяина клещей и перено-
сят в фиксирующую жидкость. Затем укладывают живот-
ное в посуду соответствующих размеров с обмазанными
вазелином краями (обычно в таз или белую эмалирован-
ную фотографическую кювету размером 20X30 см и
больше) или на подстеленную белую материю.
Клещи быстро покидают животное, поэтому осмотр
трупа должен быть произведен в возможно короткий
срок. Когда труп остынет, клещи обычно отделяются от
кожи животного, начинают ползать по его телу или же
собираются группами на дне и в выдающихся углах со-
340
«суда. Выбирают их оттуда смоченной фиксатором кисточ-
кой или пинцетом. Собранных клещей переносят в посуду
с фиксатором (плоскодонные пробирки соответствующего
размера). Способ этот очень удобен при большом коли-
честве материала и массовом заклещевении. При незна-
чительном же количестве паразитов их можно собирать
с живого животного в зависимости от его величины, пин-
цетом или пальцами, раздвигая волосяной покров хозяи-
на на наименее защищенных участках тела. Мелких
зверьков вычесывают зубной щеткой или частым греб-
нем, а также выбирают всех эктопаразитов пинцетом или
препаровальной иглой. В дневнике или карточке отме-
чают локализацию паразитов.
Осмотр птиц производят в тазу или в глубокой кюве-
те. Птиц следует ощипывать или тщательно перебирать
пёро пинцетом. Следует осмотреть места у хвоста между
перьями. Нужно иметь в виду, что присосавшихся кле-
щей трудно снимать, можно оторвать хоботок, поэтому
клещей нужно сначала смазать вазелином, маслом,'керо-
сином или бензином. Ослабленные таким образом клещи
снимаются легко. Личиночные фазы рекомендуется сни-.
мать соскабливанием кожи хозяина скальпелем.
Сбор с домашних животных. При обследовании за-
клещевения домашних животных основным приемом слу-
жит прямой сбор клещей со скота, находящегося на об-
следуемой территории. Это позволяет получить более
полное представление о составе и численности популяций
клещей значительной территории, с которой клещи на-
падают на пасущийся скот.
Некоторые виды клещей избирательно нападают на
животных определенного вида. Учитывая это, следует
обязательно обследовать сельскохозяйственных живот-
ных всех без исключения видов (пород). Животных сле-
дует периодически осматривать как в поле, так и по воз-
вращении их с пастбищ, несколько раз за лето, на протя-
жении всего сезона активности изучаемых клещей, осо-
бенно после пастьбы на лесных выгонах.
В тех случаях, когда поголовье скота большое, учет
производят на 15—20 головах из каждых ста. Необходи-
мо указать степень заклещевения. У млекопитающих
осматривать нужно особенно тщательно уши, морду, мес-
та около глаз, пах, вымя. На домашних животных при-
сасываются преимущественно половозрелые формы кле-
341
щей. Собирать их следует вручную и осторожно, чтобы
избежать повреждений.
Клещей с мертвых и убитых на бойне животных иног-
да, в зависимости от задач исследования, снимают вмес-
те с мясом — вырезают кусок кожи, снимают клещей и*
фиксируют.
Результаты учета заносят в дневник или в соответст-
вующую учетную карточку.
Сборы с каждого отдельного хозяина помещают в от-
дельную посуду (банку, пробирку) с 70—75° спиртом и
снабжают соответствующей этикеткой со ссылкой на но-
мер карточки.
Карточка учета заклещевения животных
№ учета
1. Место обследования:
а) географический пункт;
б) общий облик местности (климат, растительность, животное на-
селение) ;
в) характер близлежащих угодий.
2. Вид и порода обследуемого животного
а) где поймано, убито или наблюдалось животное.
3. Дата-----------------Фамилия обследователя-------------------
4. Характеристика заклещевения
+ слабое заклещевение (единичные экземпляры}
от 10 до 25;
+ + среднее — от 25 до 100 клещей;
+ + + сильное — от 100 до 500 клещей;
+ + + + очень сильное — более 500 — почти сплошь кле-
щами.
Для обозначения фаз развития пользуются такими
условными обозначениями:
LL — личинки (три пары ног, размер до 0,7 мм, цвет
бледно-желтый, половое отверстие отсутствует;
342
NN— нимфа (четыре пары ног, половое отверстие отсут-
ствует, размер до 1,2 мм);
$ —имагинальные формы (самки и самцы).
Полевой сбор клещей. Самцы и самки иксодовых кле-
щей питаются на крупных хозяевах. Насосавшись, самки
покидают хозяина и некоторое время находятся в лесной
подстилке, в трещинах почвы, под мусором и в других по-
добных местах (откуда их можно извлечь пинцетом), где
через некоторое время приступают к обкладке яиц. Яйца
откладывают кучками, до 3000 штук. Плодовитость сам-
ки зависит от степени насыщения кровью. Личинки при-
сасываются на мелких животных — полевках, мышах, бу-
рундуках, белках, зайцах, птицах — на рябчиках, глуха-
Рис. 118. Волокуша для сбора клещей
рях и др. Могут присасываться личинки и к скоту.
Процесс сосания крови длится 3—6 дней, в это время
личинки сильно увеличиваются в размерах и становятся
свинцово-серыми. Затем они покидают хозяина и даль-
нейшая их жизнь протекает в лесной подстилке и прочих
местах обитания; здесь они линяют и превращаются в
нимф. Нимфы нападают на тех же хозяев, что и личинки,
сосут кровь 4—5 суток, затем отваливаются, через неко-
торое время во внешней среде линяют и превращаются
в самцов и самок.
Клещи в общей сложности на хозяевах проводят не
более 15—25 дней. Остальное время они могут находить-
ся во внешней среде: в жилье человека, курятниках, гнез-
дах птиц (особенно голубей), логове летучих мышей, но-
рах различных грызунов, в стойлах, на местах водопоя
и пастбищах домашних животных, в летовках, куда при-
343
гоняют скот на ночь. Выбрав определенные места на
указанных выше стациях, производят ручной сбор на раз-
личных участках. Обследуют эти места несколько раз в.
сезон. Лучшим временем для сбора клещей в природных,
условиях является время их наибольшей активности —
утренние часы, после того как спадет роса, и вечерние
(с 19 до 20 ч). Мелких клещей собирают просеиванием
трухи птичьих гнезд, нор, логовищ. Можно использовать,
термоэклектор или отпугивающие вещества — репеллен-
ты (нафталин, дезинсекталь и т. п.) (Галузо, 1946).
При массовых рекогносцировочных обследованиях и
при обследовании больших площадей пользуются специ-
альными волокушами из марли размером 0,5x9 м (по<
способу Нутталя) или из шерстяной материи размером
1X1,5 ж, лучше со следами пота коровы или лошади,
(рис. 118). Один конец волокуши берут в руки, а к дру-
гому прикрепляют груз. Такую волокушу следует прота-
щить 500 шагов. На нее с травы переходят голодные
клещи и прикрепляются к ткани. Через каждые 100 ша-
гов волокушу осматривают и выбирают обнаруженных
представителей названных эктопаразитов.
Для сбора клещей на лесных участках, - в степных,
угодьях с высоким травостоем, в кустарниковых зарос-
лях и в других местах, где невозможно протащить
волокушу, Г. В. Сердюкова предложила пропашник
(рис. 119). Состоит он из четырехугольника размером
40X50 см, сделанного из фанеры и обтянутого мягкой
тканью. К одному из его углов прикрепляют ручку дли-
ной 50—70 см.
Пропашником с силой проводят сквозь растительный,
покров, касаясь земли узким краем прибора. Для полу-
чения сравнимых данных о численности клещей на раз-
личных участках пропашник также протаскивают на
определенное расстояние (в шагах), после чего снимают
клещей.
Для определения вертикального распределения кле-
щей по ярусам растительности предложен экран (Поме-
ранцев, Сердюкова). Изготовляют из реек раму (200 X
Х75 см), скрепляют поперечными распорками и обтяги-
вают белой бязью, на которую наносят шкалу в виде по-
перечных полос с промежутками по 25 см, полосы нуме-
руют. Вертикально поставленный экран протаскивают
вдвоем сквозь заросли. Периодически его осматривают^
344
Снимают клещей и отмечают высоту их расположения на
экране (рис. 120). С экраном работают вдвоем. Осматри-
вают его через каждые 5 мин. Обнаруженных клещей
снимают и отмечают высоту, на которой они сидят. Не-
которые виды клещей Hyolomma собирают руками, так
как они не вылавливаются указанными способами.
Существуют и другие приемы. Ползающих на поверх-
ности почвы клещей собирают так называемым ловчим
Рис. 119. Приспособление
для сбора клещей (пропаш-
ник)
Рис. 120. Экран для
сбора клещей
столиком. Привлекают клещей естественным хозяином —
пользуются ловчим животным, которое предварительно^
полностью освобождают от клещей.
На небольших участках клещей вылавливают флаж-
ками из кусков марли или другой мягкой материи разме-
ром около 80X60 см, прикрепленным к палке. Ими мед-
ленно обкашивают траву и кустарники, проводят по вет-
вям деревьев. Флажок через каждые 25—50 шагов-
осматривают и собирают попавших на него клещей. Пос-
ледних переносят в пробирку с соответствующей эти-
кеткой.
Наиболее удобен метод обкашивания растений энто-
мологическим сачком, так как в сачок попадают обе сво-
бодноживущие фазы. Обкашивание пробных площадок
определенных размеров в разное время года в одном и
345
том же месте или учет каким-либо другим способом по-
зволяет выявить изменение клещевой фауны местности
как по фазам метаморфоза, так и по количеству экземп-
ляров. Сачок при учете осматривают не только изнутри,
но и снаружи. Других наземных клещей собирают в раз-
личных местах — их стациях: под камнями и под корой
сухих и гнилых пней, в кучах щепок, в лесной подстилке,
во мху, в птичьих гнездах, в траве, соломе и т. п.
Для фиксации иксодовых клещей, в целях изучения
из систематики и внешней морфологии используют сле-
дующие составы:
1) клещей помещают в 70° спирт и смесь равных объ-
емов его с 5%-ным формалином; при работе с этим фик-
сатором клещи поджимают под себя ноги, а это затруд-
няет дальнейшее определение и обработку материала
(изготовление препаратов);
2) клещей предварительно фиксируют в горячей воде
(70—80° С), а через 30 мин перекладывают в 60—70°
спирт или же обливают горячим спиртом;
3) фиксируют следующим составом (модификации
Шпрингольц — Шмидт); глицерина — 5 частей, уксус-
ной кислоты — 2 части, хлороформа—1 часть, воды дис-
тиллированной— 2 части. В этой жидкости клещи фик-
сируются с расправленными ногами, сохраняется их гиб-
кость и в то же время умеренно просветляется препарат;
4) для сухопутных клещей более пригодной смесью
следует считать: спирта 70° — 87 частей, глицерина — 6
частей, уксусной кислоты — 8 частей; формалина следу-
ет избегать;
5) для сохранения окраски применяют консервирую-
щую жидкость следующего состава: глицерина — 5 час-
тей, уксусной кислоты — 2 части, дистиллированной во-
ды — 3 части;'
6) Нуттал рекомендует брать 25—30° спирт с несколь-
кими каплями серного эфира, а через 1—2 суток перено-
сить в 60° спирт. Пробирки или банки закрывают пробка-
ми и в таком виде сохраняют.
Тотальные препараты изготовляют следующим обра-
зом: после обезвоживания объект помещают в насыщен-
ный раствор карболовой кислоты в ксилоле, просветляют
в гвоздичном или мятном масле и заключают в бальзам.
Для изучения клещей сем. Ixodidae их разводят в лабо-
ратории.
«346
\ Перьевые клещи
Перьевые 'клещи мелкие (0,4—0,5 мм в длину) чле-
нистоногие, обитают главным образом на маховых и ру-
левых перьях птиц. Дейтонимфы некоторых видов ведут
эндопаразитическую жизнь — мигрируют под кожу, где
разрушают ткань. Собирают перьевых клещей с птиц.
Ищут их на маховых, верхних кроющих перьях крыла,
на перьях крылышка и на рулевых перьях, а также в
полостях их очинов. Осматривать птицу следует сразу
же после ее смерти и не позже, чем через 30—60 мин, так
как клещи быстро меняют места локализации на хозяине.
Перья выдергивают и просматривают с помощью лупы,
бинокуляра или микроскопа. Сначала осматривают махо-
вые перья по порядку, начиная с вершины крыла, затем
большие верхние кроющие, далее перья крылышка, ру-
левые хвоста, остальные перья хвоста, крупные контур-
ные перья тела и остальные перья тела. При осмотре
мертвой птицы ее держат над белым или черным фоном.
Живых птиц осматривают в том же порядке, при этом
птицу заворачивают в мешочек, выставляя из него только
ту часть, которую осматривают. Обнаруженных клещей
собирают смоченной кисточкой пли тупой препароваль-
ной иглой и переносят в пробирку с фиксирующей жид-
костью.
Из гнезд перьевых клещей собирают так: гнезда сни-
мают, помещают в мешочки и переносят в лабораторию,
где либо осматривают каждую часть (предмет), либо
пользуются термоэклектором, как и при изучении гнезд.
Клещей собирают в пылевых и песчаных «ваннах» птиц,
пользуясь таким способом: обертывают сжатую в кулак
кисть руки марлей, просовывают в ямку, где «купалась»
птица. Через 5 мин осматривают поверхность марли на
руке и собирают приставших к ней клещей.
Учет перьевых клещей. Подсчитывают количество кле-
щей на перьях одного крыла птицы, причем подсчитыва-
ют клещей не на всем пере, а на отдельных, строго опре-
деленных его участках.
Консервируют перьевых клещей в 70° спирте, но луч-
шим фиксатором является жидкость Удемса (87 частей
70° спирта, 8 частей крепкой уксусной кислоты и 5 частей
глицерина). Но для постоянного хранения фиксирован-
ных этой смесью объектов рекомендуют смесь спирта и
347
глицерина либо 70° спирт. Можно применять для фиксаж
ции и жидкость Карнуа (стр. 365).
Приготосление постоянных микроскопических препа-
ратов. Рекомендуют применять гуммиарабиковую смесь
(Фора — Берлезе) (стр. 338). Можно гуммиарабик заме*
нить вишневым клеем (Захваткин, 1941). На каплю по-
догретой смеси, нанесенной на стекло, кладут выбранное
перо с клещами. Через минуту на объект наносят вторую
каплю подогретой смеси, которая заполняет все проме-
жутки между бородками и заключает клещей. Накрыва-
ют покровным стеклом с небольшим грузом.
Можно заделать клеща в жидкий канадский бальзам
без предварительного обезвоживания. Техника та же, что
и при применении смеси Фора, только без подогревания
бальзама. Для приготовления препаратов из предвари-
тельно фиксированных клещей пользуются той же гум-
миарабиковой смесью, только объекты, подлежащие за-
ключению в эту смесь, предварительно должны быть
отмыты в воде. Применяют для приготовления препара-
тов и смесь глицерин-желатина, куда клещей помещают
непосредственно из консервирующей жидкости, иногда
клещей приходится предварительно просветлять в молоч-
ной кислоте. Края покровных стекол в глицерин-желати-
новых препаратах обязательно должны быть обмазаны
канадским бальзамом или дамар-лаком.
Пухоеды
Пухоеды Mallophaga — большей частью мелкие бес-
крылые насекомые, внешне напоминающие вшей, одни из
них постоянные наружные паразиты птиц (пухоеды),
представители других паразитируют на млекопитающих
(власоеды). Все фазы развития (яйцо, личинка, взрослое
насекомое) проводят на теле своего хозяина. Ротовой ап-
парат у них грызущего типа, что позволяет питаться
перьями, пухом, волосом, ‘ омертвевшим эпидермисом,
иногда жировыми выделениями кожи, выступившей из
царапин кровью, лимфой. В отличие от других паразитов
пухоеды не сосут кровь. У зараженных животных наблю-
дается ощущение зуда, спутанность волос, взъерошен-
ность перьев, выпадение полос (перьев). Эти постоянные
паразиты, как и вообще эктопаразиты, при охлаждении
убитого животного покидают его, выползая на поверх-
ность перьев или волосяного покрова. Учитывая подвиж-
348
кость некоторых видов пухоедов, и возможность их бы-
стро покидать труп хозяина, перед сбором рекомендуется
рпылить тело пиретрумом или другим безвредным инсек-
тицидом.
Пухоедов .и власоедов во всех фазах их развития со-
бирают .на сельскохозяйственных животных вычесывани-
ем частым гребнем из волосяного покрбва над сосудом,
откуда потом паразитов легко собрать со дна и стенок
смоченной кисточкой. Или мелких диких животных уби-
вают и сразу кладут в кисет из плотной материи, смочен-
ной несколькими каплями бензина или хлороформа, а
дальше поступают, как указано выше (выбирают). С жи-
вотных с короткими прямыми волосами паразитов можно
собирать, пользуясь следующим приемом: скальпелем
(тупым концом), линейкой или другим предметом с за-
остренным краем проводят против шерсти, раздвигают
волосы и просматривают обнажающуюся кожу.
Можно пользоваться методом, вызывающим мигра-
цию власоедов и пухоедов с основания волос на вершину,
где их легко собрать. Для этого: а) можно слегка про-
греть волосяной покров электрической лампой; б) при-
кладывать к поверхности покровов кисть руки; в) слегка
увлажнить покровы слабым раствором креолина или
лизола.
Сбор с птицы производят начиная с головы, последо-
вательно перебирая, таким образом, перья на шее, спине,
груди, животе, бедрах, осматривают -все оперение птицы.
При сборе с убитой птицы перья можно выдергивать.
Если нет возможности произвести полное обследование
всего покрова, то берут отдельные перья из разных
участков тела и просматривают все перо. Обнаруженных
паразитов (взрослых и личинок) собирают рукой в рези-
новой перчатке или кистью, смоченной спиртом. Чтобы
паразиты не расползались, свежеубитое животное обра-
батывают инсектицидом. Яйца срезают вместе с перьями
и волосами.
Для облегчения работы предложен метод сбора при
помощи специального прибора (Савельева, 1957). Прибор
представляет собой раму, сделанную из полосового же-
леза, в нижней части которой имеются два крючка, за-
гнутые кверху, расположенные на различной высоте.
В верхней части рама имеет два зажима. К установлен-
ной вертикально раме прикрепляют лист белой жести,
349
изогнутый в нижней части в желобок. В верхнем левом й
нижнем правом углах листа жести делают по два pacnoi
ложенных близко друг от друга отверстия диаметром в
1 см. Лист жести сверху покрывают листом белой бумаги
с глянцевой поверхностью. Соответственно отверстиям в
листе жести проделывают отверстия в листе бумаги. Че-
рез отверстия пропускают тесьму или шпагат в виде пе-
тель, которыми захватывают голову и ноги птицы. Слева
под желобок помещают электрическую лампочку, кото-
рая нагревает нижнюю часть прибора. Справа под жело-
бок ставят сосуд с консервирующей жидкостью, в кото-
рую скатываются паразиты.
Собранных насекомых переносят в 70° спирт, в край-
нем случае можно перенести з 3—5%-ный раствор фор-
малина. Пухоедов, снятых с разных хозяев, следует фик-
сировать и хранить в отдельных пробирках. При фауни-
стических обследованиях можно собирать в общую
пробирку, но в обоих случаях на этикетке следует воз-
можно точней указывать место локализации. В остальном
поступают, как и вообще со спиртовым материалом (см.
«Изучение эктопаразитов животных»).
Для приготовления тотального препарата, служащего
для определения, поступают так: пухоедов, зафиксиро-
ванных в 70° спирте, слегка прокалывают в край брюшка
острой препаровальной иглой, споласкивают в свежем
70° спирте, переводят через 96° спирт в гвоздичное масло
или ксилол и заключают в бальзам. Если объекты сохра-
нялись в формалине, их сначала промывают в воде, затем
проводят через спирты, просветляют и заключают в
бальзам.
Блохи
Живут блохи в норах и гнездах животных, в жилищах
человека, паразитируют на млекопитающих и человеке.
Яйца откладывают в мусор, в засоренные щели, в гнездо-
вую подстилку и т. д. Отродившиеся из яиц безногие бе-
лого цвета личинки питаются растительными остатками,
кровяными испражнениями блох. Личинки после много-
кратных линек превращаются в куколок, а затем во взрос-
лых насекомых. Срок развития зависит от температуры
и влажности среды. В среднем человеческая блоха живет
свыше 500 дней; собачья — свыше 230 дней; сусличья бло-
350
ха (в лабораторных условиях) до 1725 дней. По образу
жизни различают две экологические группы: блохи гнез-
да и блохи шерсти. Поэтому собирать их следует как на
самих животных, так и в природе — в местах обитания
последних (гнезда, норы, логовища, жилые помещения).
Блох собирают при изучении фаунц гнезд, нор, а так-
же при обследовании животных на эктопаразитов. Со-
бирают их, кроме того, и при специальных исследованиях
насекомых — хранителей и переносчиков трансмиссивных
заболеваний, при проведении работ по выявлению, изуче-
Рис. 121. Скребок-выгребалка конструкции П. И. Ши-
рановича. А—общий вид скребка; Б—деталь скреб-
ка (продольный разрез подвижной чашки)
нию и ликвидации природных очагов инфекций. Исследу-
ют блох и на зараженность их микробами — возбудите-
лями инфекций.
Способы лова варьируют в зависимости от задач и
характера исследований, от величины хозяев (при сборе
•с животных) и от характера биотопа при сборе в природе.
Для извлечения блох из нор закладывают в устье но-
ры ватный тампон на 12 ч, после чего обычным способом
блох снимают с ваты и учитывают. Пользуются также
клеевыми трубками (Траут, Колпаков).
Применяли метод выгребания субстрата из первого
колена наклонных нор грызунов (Пофф, Тифлов, Колпа-
кова, Флегонтова). Для выгребания мусора из нор
П. И. Ширанович предложил специальный скребок-вы-
гребалку (рис. 121). Это приспособление (скребок-вы-
гребалка) имеет вид небольшой тяпки с полудиском ди-
аметром 3—5 см и с ручкой 80—100 см. Инструмент
вводят в нору и выгребают поочередно сначала из устья
351
норы, а затем также поочередно из следующих участков,
норы. Выгребание продолжают до полного извлечения
блох из норы. Мусор переносят в таз и тут же просматри-
вают. Блох и личинок, равно как и других эктопаразитов,
выбирают пинцетом или кисточкой. Можно брать и паль-
цами с резиновыми напальчниками и переносить в пробир-
ку. Из таза блох собирают и бросают в ту же пробирку.
Этот способ применим для обследования любых нор.
Значительно лучшие результаты дает рекомендован-
ный Иоффом «ленточный метод» — берут ленту из белой
фланели или другой ворсистой ткани шириной 3—5 см
и длиной 1 —1,5 м. К одному концу ленты привязывают
шнур длиной до 1 м, а в другой конец вшивают груз'
(дробь) весом до 150 г.
Для обследования наклонных нор рекомендуют при-
менять резиновый упругий шланг, который обшивают
ворсистой тканью (И. X. Иванов и Г.Н. Тер-Вартанов).
Шланг вводят в нору на полную глубину первого колена,,
несколько секунд двигают им, а затем вытаскивают. Блох
со шланга собирают указанными выше способами и пере-
носят в пробирки. В каждую нору шланг опускают до*
трех раз.
Для сбора блох из нор Б. Е. Лебедев предложил про-
стой прибор «экскаватор», работающий по принципу
бура. Прибор опускают в нору, делают несколько оборо-
тов вокруг оси. Захваченную землю переносят в тазик и
просматривают или анализируют пробу способом, приме-
няемым при изучении фауны почвы, нор, гнезд.
Выбирают блох из гнезда или гнездового мусора и
при помощи термоэклекторов. Термоэклектор Поффа, ко-
торым чаще всего пользуются, представляет собой не-
большой металлический шкаф с полой задней стенкой и
с железными полочками. В полость задней стенки налита
горячая вода, дно-имеет воронкообразное отверстие, к ко-
торому прикрепляют банку с фиксирующей жидкостью.
От нагревания блохи убегают и по воронке скатываются
в банку (см. рис. 116). Пользуются для выборки блох
также керосиновым термоэклектором и электрическим
ф,ототермоэклектором. Описание их устройства и действия
дано в разделе «Изучение фауны гнезд и нор».
Из гнезда блох можно собирать вручную. В этих слу-
чаях гнездо переносят в ванночку с высокими бортиками
и разбирают по частям. Мертвых блох и их коконы ив
352
земли и гнездового материала выбирают применением
метода флотации. Мусор смешивают небольшими порция-
ми с водой, блохи и коконы с некоторыми мелкими рас-
тительными частицами всплывают на поверхность, отку-
да их можно собирать.
С животных блох вычесывают. Чтобы предотвратить
разбегание насекомых, животных, например собак, пред-
варительно моют теплой водой, к которой добавляют 6—
8 столовых ложек керосина на ведро воды, а затем выче-
сывают частым гребнем. Можно применить протирание
1%-ным раствором гексахлорана в бензине или 0,25%-
ным раствором гексахлорана в креолине. С мелких жи-
вотных блох можно изгнать парами керосина (модифика-
ция способа Павловского). Животное помещают в
жестяную банку или эксикатор соответствующего разме-
ра. Стенки смазывают керосином, прикрывают неплотно
крышкой, тоже смазанной керосином. Через 15—20 мин
блохи выпрыгивают. В жилищах, заселенных блохами,
рекомендуется ставить на пол тарелку с водой или жид-
ким маслом, в которую попадают прыгающие блохи.
Ночью на тарелку необходимо ставить маленькую лампу
(ночник).
При сборе блох следует соблюдать правила предосто-
рожности. Руки, инструменты и посуду сразу же по
окончании работы необходимо тщательно вымыть. Ме-
шочки прокипятить или выстирать.
Консервирование. 1. Собранных блох переносят в кон-
сервирующие жидкости, которыми могут быть 50—700,
спирт или водный раствор формалина (1 часть продаж-
ного формалина на 10 частей воды), но последний менее
желателен; формалин ухудшает заделку блох в препарат,
но им можно консервировать блох для фаунистических
целей.
2. Для микроскопического исследования блох умерщ-
вляют смесью из 97 частей 20° спирта и 3 частей эфира,
что обеспечивает фиксацию ножек в расправленном со-
стоянии; однако хранить материал в этом случае необхо-
димо в 50—70° спирте.
3. Умерщвляют блох также в обычной морилке, после
чего раскладывают, как и вообще всех насекомых, на
слой ваты, высушивают, перекладывают в коробку и со-
храняют обычным способом. Разложенных на слое ваты
353
насекомых сверху следует прикрыть листом белой бума-
ги и на ней написать нужные сведения.
При любых способах консервирования необходимо
-собирать всех встречающихся блох. Собранных с одного
экземпляра хозяина эктопаразитов положить в отдель-
ную посуду: в пробирку, пузырек, баночку или на от-
дельный слой ваты, если блохи собраны в сухом виде.
К каждому сбору прикладывать этикетку (паспорт):
где, когда и кем сняты блохи.
В случае если хозяин не может быть точно определен
-на месте, следует взять его целиком (если он небольшого
-размера) и поместить в 70° спирт или формалин (1 часть
на 8 частей воды) или же снять с него шкуру вместе с че-
репом, необходимым для определения, высушить ее или
поместить в спирт или формалин. Следует отметить хотя
<бы приблизительный возраст хозяина, так как с возрастом
меняется количество паразитов.
Выведение взрослых блох. Личинки блох — безногие,
червеобразные, белого цвета — живут, как указывалось,
в логове хозяина, в мусоре. Так их и следует собирать.
Взрослые личинки хорошо видны простым глазом — дли-
на их около 4 мм. Рассматривают мусор гнезда через
лупу и отделяют куколок (они неподвижны). Часть об-
наруженных личинок и куколок для консервирования пе-
реносят в 70° спирте, приложив этикетку.
Для выведения взрослых блох из личинок и куколок
берут их вместе с мусором и помещают в коробку, окле-
енную изнутри белой бумагой и закрывающуюся стеклян-
ной крышкой. Гнездовой материал время от времени сма-
чивают водой. Для добывания птичьих блох покинутое
птицами гнездо кладут в увлажненную коробку или бан-
ку и оттуда периодически выбирают отродившихся блох.
Учитывая бЛох в гнездах грызунов, преимущественно
•сусликов, можно выяснить следующее:
1) изменение численности блох в гнезде по временам
года, в зависимости от активной жизни хозяев, от темпе-
ратуры и влажности нор и т. д.; летом количество блох в
гнезде значительно превышает количество блох, взятых
с сусликов, пойманных на свободе или вылавливаемых из
нор водой;
2) поведение блох в шерсти хозяина после выхода его
из норы (покидают ли хозяина или держатся на нем);
3) что делается с блохами гнезда, хозяин которого по-
354
гиб (уходят ли они из опустевшего гнезда или погибают'
от голода);
4) приуроченность блох к гнезду или его хозяину в*
связи с состоянием их органов зрения (зрячая сусликовая
блоха Ceratophyllus tesquorum встречается в одинаковой
мере как на взрослых особях, так и в их гнездах; блох-и-
же с рудиментарными глазами — Ctenophthalmus pulex
и Neopsylla setosa — держатся преимущественно в гнез-
дах).
При изучении птичьих блох выясняют условия разви-
тия последних в покинутых гнездах: как долго они со-
храняются и при каких условиях переселяются в новые
гнезда.
Изготовление препаратов. Определять блох лучше
всего на прозрачных препаратах, рассматривая их под
микроскопом. Препараты можно изготовить одним из сле-
дующих способов.
1. Блох, вынутых из спирта, осушить фильтровальной
бумагой и проколоть острой иглой грудь или хитин брюш-
ка. Перенести в чистую крепкую карболовую кислоту и
оставить в таком виде на сутки. Когда объект станет проз-
рачным, блох на несколько минут перенести в гвоздичное
масло, после чего поместить на предметное стекло и за-
ключить в канадский бальзам (.нужно обязательно рас-
править у блох ножки).
2. Блох и их личинок можно обезвоживать также в
спиртах возрастающей крепости (70, 95 и 100°) с после-
дующим перенесением в гвоздичное масло или ксилол.
Для того чтобы канадский бальзам проник внутрь те-
ла, необходимо проколоть хитиновый покров иглой (в
спирте). В противном случае препараты вскоре чернеют,
теряют прозрачность и становятся непригодными для ис-
следования. Исправить почерневший препарат можно
следующим образом: растворить бальзам ксилолом, пе-
ренести блоху снова в 100° спирт, где. сделать еще раз
прокол хитина иглой и снова перенести в гвоздичное
масло, ксилол и заключить в бальзам.
3. Способ Дампфа. Дать блохам умереть в пробирке
от голода и сухости. Кишечник очистится от крови, блоха
станет более прозрачной, но брюшко быстро сморщива-
ется, это затрудняет рассматривание деталей. Блоху пере-
носят на предметное стекло, наливают крепкого раствора
едкого кали или натоа и кладут сверху покровное стекло
355
с небольшим грузом для сдавливания объекта (кусочек
свинца, гальку). Степень действия щелочи проверяют под
микроскопом. Когда объект станет прозрачным, препарат
промывают водой с уксусной кислотой и после проведе-
ния через спирты (50, 65, 70, 85, 96°) переносят в гвоздич-
ное масло и какандский бальзам. Такие препараты отли-
чаются большой прозрачностью, и в этом их положитель-
ная сторона.
Недостатком только что описанного метода является
то, что тело деформируется, а при высыхании блох брюш-
ко их часто очень укорачивается. Поэтому не рекоменду-
ется обрабатывать блох едкими щелочами, делая исклю-
чение лишь для очень темнопигментированных видов,
выдерживая их не более суток в холодном 5—7%-ном
растворе едкой щелочи.
4. Способ Вагнера. Вынимают блоху из спирта, про-
калывают иглой и переносят в абсолютный спирт на нес-
колько часов. Затем погружают на сутки в гвоздичное
масло и заделывают в канадский бальзам.
5. Для заделки блох и особенно их личинок может
быть применена также гуммиарабиковая среда Фора,
употребляемая для заделки мелких клещей. Метод этот
прост. Заделка в жидкости производится без всякой пред-
варительной обработки объектов — живых или зафикси-
рованных в 50—70° спирте. Однако многие систематиче-
ские признаки в этих препаратах хуже различимы, чем
в бальзаме.
6. Использование сухих блох для препаратов. Блох
вымачивают в растворе перекиси водорода. Сморщенное
брюшко от этого расправляется, что дает возможность
изготовить препарат по одному из выше указанных спосо-
бов. Можно пользоваться и таким способом. Сухих блох
бросают в кипящую воду (не кипятить) и оставить до
охлаждения или мацерирования их в течение нескольких
дней в воде (И. Г. Иофф). Получаются хорошие резуль-
таты. Способ этот позволяет использовать для препара-
тов сухой материал. В дальнейшем обезвоживают в спир-
тах, просветляют и заключают в бальзам.
7. И. Иофф и В. Тифлов (1954) рекомендуют следую-
щую стандартную технику приготовления просветленных
тотальных препаратов блох. В маленькой пробирке блоху
проводят через ряд жидкостей (причем жидкости меня-
ют, а блоха остается в той же пробирке): наливают раст-
356
вор едкой щелочи NaOH или КОН — 7%чный — держат
одни сутки; щелочь тщательно отмывают водой, сменяя
ее несколько раз; воду сменяют последовательно спирта-
ми возрастающей крепости 50, 70, 95° и абсолютным), в
которых держат объект около 1 ч, но можно оставить на
сутки и больше. Абсолютный спирт сменяют ксилолом, а
потом гвоздичным маслом; в этих средах держат от 1 ч
до суток. После этого объект заделывают в бальзам, не
особенно густой, с добавлением ксилола.
На предметном стекле чертежным пером пишут эти-
кетку особыми чернилами: 20%-ный водный раствор та-
нина, насыщенный раствор фуксина, поровну. Надпись
можно закрепить, покрыв лаком из органического стекла,
растворенного в хлороформе (4—5%).
Определять живых блох лучше всего в трубке с оття-
нутым капилляром под микроскопом; фиксированных —
в 50° спирте или в спирте с глицерином.
СБОР И ИЗУЧЕНИЕ ЛЕТАЮЩИХ КРОВОСОСОВ,
СИНАНТРОПНЫХ И ДРУГИХ ДВУКРЫЛЫХ НАСЕКОМЫХ
В группу летающих кровососов (гнуса) входят, как
указывалось, комары, мокрецы, мошка, москиты и слеп-
ни. Жизнь этих насекомых протекает в условиях с повы-
шенной влажностью, а размножение и развитие личинок
происходит в небольших водоемах. Этим обусловлено
распространение названных насекомых по различным
зонам СССР. Больше всего их в тундре и тайге, очень
мало в степной и полупустынной зонах, где они распро-
странены в основном в долинах больших .рек.
Летающие кровососы как эктопаразиты имеют боль-
шое значение. В местах своего распространения они силь-
но беспокоят людей, домашних и диких животных. Мно-
гие из них — переносчики возбудителей опасных болезней
(малярии, энцефалита и т. д.).
Не все кровососы встречаются на животных и челове-
ке в одно и то же время. Слепни и комары, например, бы-
вают на животных короткое время, мошки держатся
несколько дольше, а некоторые мокрецы находятся в шер-
сти животных целыми часами, где они не только сосут
кровь, но и спариваются. Неодинаково и время нападе-
ния: слепни (самки) нападают днем при температуре
357
15—16° С, но не выше 40° С, с мая до августа—сентября.
Дождевки предпочитают пасмурную погоду и особенна
агрессивны перед дождем; москиты — перед заходом
солнца; мокрецы активны вечером и ночью, а также с во-
сходом солнца, в ветреную погоду их не бывает. Поэтому
следует пользоваться разными (Приемами для сбора и
учета этих двукрылых насекомых.
Наиболее простой метод сбора и относительного уче-
та кровососов—’вылавливание их сачком. Для этого
пользуются как плотными сачками, приспособленными
для кошения по траве, так и воздушными — марлевыми,
шелковыми, капроновыми.
Кошением с помощью сачка вылавливают насекомых,,
сидящих на траве. Можно воспользоваться сборами, по-
лученными кошением при общем количественном учете
энтомофауны. Но для специального учета двукрылых,
следует проводить кошения отдельно. Принимая во вни-
мание то, что при большом количестве взмахов комары и
другие насекомые в сачках очень часто портятся, реко-
мендуют сначала делать по десять взмахов, пойманных
кровососов выбирать и снова делать столько же взмахов.
В каждой стации берут 10 таких проб, что в сумме со-
ставит пробу в сто взмахов. Это и есть единица измере-
ния при количественном учете.
Н. Г. Олсуфьев (1939) предложил другой способ отно-
сительного учета. Он рекомендует вылавливать летающих
кровососов взмахами сачком в воздухе, стоя на одном
месте. Для каждого учета рекомендуется делать сто та-
ких взмахов со средней скоростью один взмах в секунду.
Видовой состав и численность кровососов подвержены
сильным изменениям на протяжении суток. Учитывая это,
рекомендуют проводить в каждый сезон регулярный учет
хотя бы раз в декаду. Собранный таким способом мате-
риал позволит установить динамику лёта двукрылых в
тех или иных их стациях. Обработка такого материала,
накопленного за ряд лет, даст возможность установить
колебание численности той или иной группы по годам.
Можно, пользуясь данными количественных учетов, вы-
яснить роль различных факторов среды в изменении плот-
ности популяций.
Метод этот, как упоминалось, относительный, поэ-
тому он не лишен недостатков. В сачок не всегда попада-
ет одинаковое количество экземпляров — это зависит от
358
многих случайных причин. Как правило, кошение не обес-
печивает абсолютного количественного учета.
Методы количественного учета. Одним из распростра-
ненных методов количественного учета этих двукрылых
является вылавливание кровососов на себе или на живот-
ном. В течение определенного промежутка времени (вре-
мя в зависимости от активности нападения может быть
5, 10 или 20 мин) вылавливают всех кровососов, севших
на человека. Ловят кровососов эксгаустером или накры-
вают их ловчей пробиркой с коническим отверстием на
одной стороне. Абсолютное количество насекомых, соб-
ранных при разных сроках учета, для сравнимости отно-
сят к 1 мин (ср. Рубцов).
Регулярный сбор в разные часы суток, через каждые
5—10 дней, в течение всего теплого периода и в разных
стациях дает возможность собрать представителей всех
видов, выяснить соотношение между видами и установить
суточные или сезонные колебания. Кроме того, такой
сбор материала позволит решить ряд других важных
экологических вопросов.
Следует иметь в виду, что не все кровососы в одина-
ковой мере избирают человека и не каждого человека.
Многие выбирают для нападения различных животных
и даже птиц. Следует помнить и ту особенность, что дея-
тельность насекомых усиливается в ночное время; рас-
сматриваемый же метод не позволяет собирать их ночью.
В этих случаях пользуются учетом путем подсчета коли-
чества уколов, нанесенных кровососом человеку, но при
этом методе не всегда есть возможность установить вид
двукрылого.
Лучшие результаты можно получить, собирая насеко-
мых не на себе, а на другом человеке эксгаустером.
Учет проводится также при помощи учетного колоко-
ла Мончадского и Радзивиловской (рис. 52, описание
см. стр. 132).
Пользуются этим прибором для количественного уче-
та, когда нападающих кровососов бывает много и один
человек не может собрать всех садящихся на него насе-
комых. Колокол поднимают на подъемном приспособле-
нии на высоту до 2 м. Для установки прибора — подве-
шивания колокола — в землю закапывают столб, к кото-
рому прикрепляют поперечную перекладину. В лесу
можно воспользоваться подходящими ветвями дерева.
.359
к перекладине или ветви прикрепляют металлическое
кольцо, через которое пропускают трос или веревку, кон-
цом последнего и осуществляется подъем и опускание
колокола. Площадку, где предполагается вести учет, под-
готавливают так: тщательно очищают от растений по-
верхность земли, которую должен накрывать прибор, вы-
равнивают и утрамбовывают ее, чтобы устранить воз-
можность скрыться от учета многим кровососам.
Под поднятым колоколом помещается человек или
животное, служащее приманкой. После 5-минутной экс-
позиции сидящего неподвижно собирателя или наблюда-
теля колокол опускается. Собиратель (человек, находя-
щийся под колоколом) вылавливает при помощи эксгау-
стера всех насекомых, оказавшихся под колоколом.
Работают с прибором два человека, один находится внут-
ри, другой — вне колокола, он поднимает и опускает ко-
локол. При некоторой сноровке один человек может вы-
ловить за 10—15 мин 200—300 комаров, а мошек и мокре-
цов и того больше.
Замечено, что мокрецы охотно садятся на темную
шероховатую поверхность, на темную одежду и другие
предметы и хорошо на ней видны. Этими особенностями
воспользовался Хилл (1947) для количественного учета
этих мелких кровососов. Предложенный им метод заклю-
чается в следующем: кусок черной материи определенно-
го размера, например 50x50 см (0,25 ж2), расстилают
на кусты или другие предметы на высоте 1,0—1,5 м над
землей. В течение определенного времени (20—60 мин)
вылавливают всех садящихся на материю насекомых.
Для получения сравнимых данных этим способом
сборы следует проводить в одно и то же время — в тихую
погоду, незадолго до захода солнца, когда мокрецы бы-
вают особенно активны. Систематический количествен-
ный учет, проведенный в каком-нибудь одном пункте, да-
ет возможность решить ряд экологических вопросов. На
животных кровососов собирают непосредственно с по-
верхности тела. Представителей разных групп (слепней,
комаров, мошек, мокрецов) собирают отдельно, так как
разные группы держатся на животных определенное вре-
мя, сидят неодинаково долго и имеют различную биоло-
гию. Все это заставляет дифференцировать методику
учета.
Слепней и мух-кровососок накрывают морилками, ко-
360
маров и часть мошек вылавливают при помощи эксгау-
стеров (аспираторов), мокрецов и мошек, сидящих на
шерсти животных, вылавливают, проводя пробирками
против шерсти. Кровососов у птиц собирают пинцетом.
Слепни
Слепни — влаголюбивые насекомые, стациями их яв-
ляются заросшие кустарником или тростником места око-
ло водоемов, опушки леса, лесные поляны, поймы рек
и т. п. Большое число самок слепней энергично нападают
на крупный рогатый скот и лошадей, реже на людей, по-
этому лучше ловить их с животных. Самцы (и частично
самки) питаются на цветах (стр. 231), там и следует их
ловить.
Для учета слепней К. В. Скуфьин (1951) предложил
пользоваться чучелом. Метод основан на том, что для
отыскания пищи кровососы пользуются главным образом
зрением. Чучелоподобное приспособление, напоминаю-
щее лошадь или корову, состоит из деревянного каркаса,
который монтируют на четырех палках (ножках), а свер-
ху покрывают темной грубошерстной тканью. Такой ма-
кет выставляют в местах активного лёта слепней и дру-
гих кровососов. Прилетевших слепней при помощи бинок-
ля на расстоянии 25—30 м под-
считывают. Такой подсчет длится
20 мин. Количество подсчитанных
слепней относятся к этому отрез-
ку времени. Подсчет числа поса-
док ведется на одной стороне чу-
чела двумя лицами, которые раз-
деляют между собой площадь
этой стороны еще пополам.
К чучелу приспосабливается
специальная ловушка. Большин-
ство летающих слепней, стараясь
сесть на нижнюю часть чучела,
попадает в ловушку-самолов. Ло-
вушкой пользуются для круглосу-
Рис.' 122. Ловушка
для двукрылых (му-
холовка)
точного количественного учета.
Ее ставят возле чучела, насеко-
мые, летящие на чучело, попада-
ют в ловушку.
13—1867
361
Основой такой ловушки (по Скуфьину) служит кар-
кас из проволоки размером 35x35x50 см. Снизу при-
крепляют остов воронки, каркас обшивают марлей или
другой подобной материей. Сверху или сбоку прикрепля-
ют матерчатый рукав, через который насекомых вытря-
хивают из ловушки в пробирку. Такой ловушкой, только
с более мелкой сеткой, пользуются и для круглосуточной
ловли и для учета мошек (рис. 122).
Слепней, кроме того, ловят при помощи «луж смерти»
(Порчинский, 1915). «Лужи смерти» — небольшие водое-
мы, поверхность которых залита нефтью или керосином.
В жаркое время слепни прилетают к водоему напиться,
соприкасаясь при этом с пленкой нефти или керосина,
они прилипают к ней и быстро погибают. Погибших слеп-
ней собирают, промывают в серном эфире или хлорофор-
ме и высушивают на фильтровальной бумаге. Отмытые
и высушенные слепни сохраняют те же качества, что и
собранные другим способом.
Этот довольно простой и доступный метод дает воз-
можность собрать массовый материал для изучения ви-
дового состава и вместе с тем позволяет вести наблюде-
ния за интенсивностью и продолжительностью лёта от-
дельных видов названных групп.
Пойманных насекомых умерщвляют в морилке, высы-
пают в бумажный пакетик, снабжают этикеткой и кладут
в сумку. В дальнейшем их перекладывают на ватные
матрасики. Для исследования слепней на зараженность
(там, где имеются соответствующие показания) пойман-
ных слепней перемещают в садок (20X20X20 см), уст-
роенный из проволоки и обтянутый марлей (см. рис. 69, В),
снабжают соответствующей этикеткой. В один садок
можно помещать не более 100 слепней. Держат садок в
тени, время от времени слегка увлажняя слабо подсаха-
ренный пресной водой (недистиллированной).
Мошки
Самки некоторых видов — гематофаги. В течение сво-
ей жизни (около месяца) кровососущие самки произво-
дят несколько кладок (Рубцов, 1956).
Мошки, как известно, встречаются около всех проточ-
ных водоемов — мест выплода; там их и следует искать.
362
Наилучшим временем для сбора полноценного материа-
ла по мошкам является кратковременный период в цик-
ле их развития — период окукливания, который в различ-
ных районах нашей страны имеет свои сроки. На севере
окукливание (по Рубцову) проходит в июне — августе;
в средней полосе европейской части СССР и Сибири — с
ранней весны до поздней осени; на юге в зависимости от
высоты над уровнем моря, в предгорьях — с весны до осе-
ни, а в высокогорьях — в летние месяцы, как и на севере.
Этими сроками целесообразно и ограничить сбор мате-
риала. Для установления точных сроков развития — ка-
лендаря жизни — в каждой отдельной местности нужны
обязательно для изучения развития водные фазы (яйца,
личинки, куколки).
Взрослых, летающих обычно днем, мошек собирают,
как и других летающих кровососов, различными спосо-
бами— на себе или на животных при помощи учетного
колокола (стр. 359), ловушкой Скуфьина (рис. 122) и дру-
гими указанными ранее способами и пользуются теми
же описанными выше инструментами и материалами —
сачком, эксгаустером, морилкой, пробирками и другими
приспособлениями.
Количественный учет проводят указанными выше ме-
тодами, которыми пользуются для учета других кровосо-
сов. Более подробные сведения о методах сбора интере-
сующих нас насекомых можно найти в работах
И. А. Рубцова (1956).
Иногда для различных целей приходится содержать
мошек живыми. Это нужно при изучении их систематики,
биологии, в частности при изучении их как переносчиков
специфических заболеваний. Выводят мошек также и для
получения самцов, так как точное и надежное определе-
ние возможно только по мужским особям.
Собранный в водоеме субстрат с куколками (трава,
камни) переносят в банки с крышками или в эксикаторы.
Если нужно выводить массовый материал и субстрата
много, его раскладывают на окне, защищенном от попа-
дания прямых солнечных лучей, держат его влажным, но
избегают излишней сырости, следует избегать и подсыха-
ния, для чего следует прикрывать бумагой. Вылетевшие
через 1—2 дня мошки скопляются на стеклах окна (бла-
годаря положительному фототаксису), где, не отрываясь,
держатся до наступления темноты. При сборе насекомых
13*
363
со стекла пользуются их способностью падать при при-
косновении к ним. К насекомому снизу подносят пробир-
ку и оно само падает в нее. Так в одну пробирку можно
собрать несколько насекомых. Можно собирать мошек с
окон и из стеклянных банок при помощи эксгаустера.
Воспитание личинок представляет большие трудности.
Взрослых мошек содержат в специальных садках и кор-
мят сахаром, дают им для питья воду.
Мошек, собранных различными способами в разное
время, как и выведенных из куколок, замаривают в мо-
рилке, переносят на вату и хранят, как обычно. Можно
хранить их и в жидкостях. Для этого мошек переносят
в 70° спирт или в 2—4%-ный формалин в мелкие пробир-
ки, которые закрывают ватными тампонами и ставят дном
вниз в материальные банки, в которые налит соответст-
венно спирт или формалин так, чтобы пробирки находи-
лись в жидкости.
Для приготовления микроскопических препаратов из
личинок и имаго их вываривают в 8—10%-ном растворе
едкого кали (КОН) (см. Рубцов). Перед опусканием ли-
чинки в раствор КОН у нее отрезают ректальные придат-
ки и переносят на предметное стекло в бальзам, где бу-
дут препарировать и другие части личинки, и сохраняют
ее до обработки вместе с личинкой. Личинку (после от-
деления ректальных придатков) и куколку самки погру-
жают в едкий кали целиком. У куколок самцов для мик-
роскопического препарата отделяют лишь задний конец
их тела. То же относится и ко взрослым насекомым —
са.мцам.
По окончании вываривания препарат промывают в
воде 10—15 мин, после промывки производят препариро-
вание (расчленение на части). Расчлененные части про-
водят через спирты (70°, 96° и абсолютный), в каждом
спирте держат 3—5 мин. Из спирта детали переносят в
гвоздичное масло на 10 мин, после этого помещают на
предметное стекло в канадский бальзам и накрывают
покровным стеклом. Для изготовления временных препа-
ратов пользуются глицерином. Перед опусканием в гли-
церин объект проводят через смесь глицерина с водой в
равных объемах. Вместо канадского бальзама можно
пользоваться гуммиарабиковыми смесями (смешивается
40 частей гуммиарабика с 20 частями глицерина, 50 ча-
стями хлоралгидрата и 50 частями дистиллированной во-
364
ды). При изготовлении препаратов с гуммиарабиком нет
надобности проводить объекты через спирты и гвоздич-
ное масло.
Для изготовления микропрепаратов из внутренних ор=
ганов фиксатором может быть жидкость Карнуа. Это
смесь из 60 частей абсолютного спирта, 30 частей хлоро-
форма и 10 частей ледяной уксусной кислоты. Фиксируют
5—30 мин. Фиксированный объект выдерживают в 96°
спирте, который меняют несколько раз. Если постоянные
препараты не изготовляют, то для хранения фиксирован-
ный материал можно перенести в 70° спирт.
Мокрецы
Эта группа очень мелких кровососов имеет широкое
распространение. Они встречаются в тропиках и субтро-
пиках, много их и в лесотундре. Местами они появляются
массами. Из 18 родов мокрецов (Heleidae) представите-
ли трех родов Culicoides, Leptoconops, Lasiohelea являют-
ся (по Гуцевичу) кровососами, самки которых нападают
на человека и животных. Мокрецов, как и других крово-
сосов, собирают различными методами. Наиболее про-
стой и доступный метод — это лов их на добыче — на лю-
дях и домашних животных, причем лучшие результаты
дают сборы на животных.
Основная масса мокрецов в природе обитает в травя-
нистой растительности. При общеэнтомологических сбо-
рах кошением по траве в сачок попадает немало и мокре-
цов. Этот материал, безусловно, может быть использо-
ван, но им ни в коем случае нельзя ограничиться. Сачком
пользуются и для сбора летающих около животных и во-
круг* человека мокрецов. При этом пользуются сачком из
легкого материала с небольшим диаметром кольца (20—
25 см).
Во время роения мокрецов в один взмах сачка попа-
дают тысячи особей (Гуцевич). Такой материал, если
удается собрать, представляет большую ценность. Мокре-
цов привлекает свет. Основываясь на положительном фо-
тотаксисе этих двукрылых, используют для их лова раз-
личные световые ловушки. Ловят мокрецов и на липучку
(липкую бумагу) как и москитов.
Для количественного учета мокрецов, как и других
365
кровососов, пользуются учетным колоколом. Собирают
их и на куски черной материи. Для учета мокрецов поль-
зуются также всасывающей ловушкой с 'источником
ультрафиолетовых лучей (рис. 63). Жоголев (1958) при-
менял модификацию такой ловушки, где в качестве вса-
сывающей части использован пылесос. Количественный
учет следует проводить систематически и длительное вре-
мя. Только такой массовый материал дает возможность
делать теоретические выводы о численности их, о влия-
нии внешних условий на активность мокрецов и выводы
о сроках их массового лета или времени наибольшей ак-
тивности.
Выведение. Для некоторых биологических исследова-
ний мокрецов можно выводить из куколок, что даст воз-
можность получить самцов. Наличие самцов облегчает
определение, так как по строению их гипопигия — при-
датков 9-го сегмента брюшка — распознаются виды мо-
крецов.
Личинки и куколки живут в воде и в почве. Во влаж-
ной земле они держатся у самой поверхности — на глуби-
не 3—5 см. Для отыскания в этом субстрате личинок и
куколок берут пробу лесной подстилки, гниющей расти-
тельности, влажный материал дупел и других укромных
мест, исследуют почву из сырых, заболоченных мест
и т. д. Взятые и доставленные в лабораторию пробы про-
мывают в воде, процеживают через систему сит с отвер-
стиями 5, 1,5 и 0,3 мм и производят подсчет.
Выловленных личинок переносят в банку или пробир-
ку и-фиксируют или же отсаживают для выведения
имаго.
Живущих в почве мокрецов учитывают так же, как и
других представителей почвенной фауны. В местах, где
можно ожидать наличие куколок, рекомендуется (Петри-
щева) «изолировать субстрат» колпаком. Окрылившие-
ся мокрецы по выходе из земли оказываются под колпа-
ком, где их и вылавливают.
Личинок и куколок, живущих в воде, собирают сле-
дующим способом. Берут негустым сачком со дна водое-
ма ил, переносят в материальную банку, взбалтывают и
ставят, на подоконник. Личинки скопляются около осве-
щенных стенок банки, там их и вылавливают, а куколки
всплывают на поверхность воды, где их также легко
собрать. '
366
Из личинок» а еще лучше из куколок, в лаборатории
выводят взрослых мокрецов. Для этого куколок рассажи-
вают в пробирки, впускают в них по несколько капель
воды и опускают стебелек какого-нибудь растения, по ко-
торому куколки могли бы выползать из воды перед окры-
лением, и закрывают пробирки ватными тампонами.
Собранных тем или иным способом мокрецов в случае
надобности сохраняют живыми, содержат их в пробир-
ках, в которые кладут ватный тампон, смоченный раство-
ром сахара. Если нет необходимости сохранять мокрецов
живыми, их фиксируют одним из следующих способов.
Для изучения мокрецов на зараженность, а также для
анатомических исследований только что умерщвленных
эфиром или хлороформом насекомых переносят в каплю
физиологического раствора (0,75%-пого раствора хлори-
стого натрия). Для длительного хранения материала на-
секомых фиксируют специальным фиксатором, например
жидкостями Карнуа (стр. 365) или Буэна (стр. 106).
Для определения видов добытый одним из указанных
методов материал сохраняют в сухом виде обычным спо-
собом— на ватниках. Ватники с этикетками складывают
в коробки, на дно которых кладут нафталин. Часть мате-
риала накалывают на булавки (минуции). Накалывать
можно только свежих, не высохших насекомых. Сухой
материал требует размачивания. Мелкие двукрылые на-
клеиваются бочком груди на конец треугольного кусочка
плотной бумаги, который в широкой части прикалывает-
ся энтомологической булавкой. Капля клея наносится
сбоку в заднем отделе груди. Ноги располагаются впе-
ред, крылья — над бумагой. При пользовании минуцией
тело прокалывается в задней часта груди сбоку.
Тотальный микроскопический препарат можно гото-
вить из спиртового материала обычным способом. Для
обезвоживания их проводят через спирты, просветляют
в карбол-ксилоле и заключают в бальзам.
Москиты
Мелкие (1,3—2,5 мм) двукрылые насекомые, относя-
щиеся к роду Phlebotomus, обитают в тропиках и субтро-
пиках. Распределение в различных зонах СССР и вопро-
сы методики приведены в работе П. А. Петрищевой
367
(1946). Эта группа кровососов живет в разнообразных
биотопах. Москиты в отличие от других кровососов не
имеют связи с водой. В дневное время они бывают в но-
рах грызунов, в хлевах, в жилых помещениях, где сидят
спокойно на верхней части стен и на потолке. На чело-
века и животных нападают при заходе солнца.
В жилых домах или в других хорошо освещенных по-
мещениях москитов собирают вручную, при помощи про-
бирок. Сбор производят также при помощи липучек (ли-
сты восковой бумаги, смазанные с обеих сторон касторо-
вым маслом). При помощи липучек вылавливаются мос-
киты также в норах.
При количественных учетах на липучках или липких
щитах определенных размеров, через определенное время
(2—3 дня) собирают и подсчитывают пойманных моски-
тов. С липучек москитов снимают мягкой кисточкой, смо-
ченной 96° спиртом.
Размножаются они в норах и гнездах диких живот-
ных и птиц, под полом — в норах мышей и крыс, в птич-
никах, в щелях фундаментов построек и в других местах,
где имеются разлагающиеся органические вещества и не-
обходимая влажность. Развитие москитов может проис-
ходить только при высокой температуре. Выловленных
одним из указанных методов москитов фиксируют обыч-
ным способом в жидкостях (70° спирт) или сразу после
затаривания накалывают на ммнуции.
Для сбора и учета личинок и куколок москитов берут
определенное количество почвы — 0,5 кг или 1 кг. Из
этой пробы методом флотации извлекают личинок и ку-
колок. Для этого пробу помещают в банку с насыщен-
ным раствором соли, взбалтывают и размешивают. Ли-
чинки всплывают на поверхность, там их и вылавливают.
Фиксируют и хранят так же, как и других мелких дву-
крылых (мошек и мокрецов).
Комары
Кроме малярийного комара Anopheles maculipennis,
известного как хозяина малярийного плазмодия и как ис-
точника заболевания людей малярией, существует много
видов этого и других родов сем. Culicidae. Многие из них,
кроме того, являются механическими переносчиками воз-
будителей болезней.
368
Взрослые комары держатся обычно вблизи мест вы-
плода и не улетают далеко. Считают, что они редко отле-
тают от водоемов дальше 1—2 км. Вертикально подни-
маются не выше 12—20 м. По образу жизни комары —
ночные насекомые. Днем они прячутся в темных местах,
забираются в хлевы, щели, ямы, в дупла деревьев. На
ночь они вылетают, а с рассветом опять забираются в
свои убежища.
Сбор и учет комаров не представляет больших труд-
ностей. Методика разработана Е. Н. Павловским, моди-
фицирована многими энтомологами. В природе можно их
ловить на цветках, на'животных (лошадях). Днем, когда
они сидят в своих убежищах, их легко отыскать и соб-
рать— в это время они вялы и находятся в пассивном со-
стоянии. Ловят их сачком, пробирками. Самцов часто
можно поймать кошением по траве и кустам вблизи ме-
ста их выплода. В сумерках или в лесу у влажных мест
ком,аров-самок можно ловить на приманку — на себе —
методом, которым пользуются для сборов других крово-
сосов. Малярийных комаров можно собирать и зимой.
Под осень самцы и неоплодотворенные самки погибают.
Остаются на зимовку оплодотворенные, но не отложив-
шие яйца самки. Они выбирают для зимовки укрытия, за-
щищенные от резких колебаний температуры (погреба,
подвалы), здесь они скопляются в углах и впадают в оце-
пененное состояние. Они могут перенести без вреда для
себя пониженные температуры, иногда до —30° С доволь-
но длительное время.
Весной, когда солнце достаточно прогревает водоемы,
самки вылетают и через 10—15 дней приступают к первой
кладке яиц. Исходя из указанных особенностей образа
жизни комаров, их можно ловить круглый год: зимой —
в их убежищах; летом — в природных стациях.
Собирают комаров, как указывалось, кошением сач-
ком на растительности в открытой природе (в лесу, на
опушках, в поле, на огороде, у берега речки, болота). Но
материал, собранный кошением, часто портится, стира-
ются чешуйки, ломаются концы лапок вместе с коготка-
ми, что затрудняет.определение. Хорошо сохраняются ко-
мары при сборе их непосредственно в пробирки. Маля-
рийных комаров ловят простыми ловушками. Собранных
таким способом комаров лучше приносить домой в про-
бирках живыми. В дальнейшем поступают с ними в за-
369
висимости от задач исследования одним из описа!к1Ь1х:
выше способов.
Сборы, проводимые в теченйе ряда лет, представляют*
большую ценность. В результате таких- планомерных сбо-
ров можно составить фенологический’календарь комаров..
Собранных насекомых переносят в‘ мюрилку и умерщ-
вляют одним из доступных способов. В Морилке держат*
минут 5—10. Заморенных насекомых укладывают на ват-
ники, снабжают этикеткой и в таком виде сохраняют до
обработки. Часть насекомых накалывают на булавки.
Для этого лучше использовать свежеумерщвленных ко-
маров. Определяют комаров в сухом виде, в таком мате-
риале сохраняются чешуйки па крыльях. Жилкование
крыльев тоже изучается на сухих экземлярах. Часть сбо-
рой консервируется в 70° спирте или в растворе форма-
лина. Из спиртового материала изготовляют препараты!
гениталей (гипопигий), имеющих важное значение при1
определении самцов комаров.
Комаров можно выводить и из личинок, и куколок,
что дает возможность установить принадлежность личин-
ки добытому виду комара. Это предусматривает содер-
жание их в специальных садках.
СИНАНТРОПНЫЕ МУХИ И ДРУГИЕ ДВУКРЫЛЫЕ
Синантропные насекомые связаны, в той или иной ме-
ре, с человеком, его жилищем и пищей, с домашними жи-
вотными и продуктами жизнедеятельности человека и
животных. Синантропные виды имеются среди многих
семейств насекомых.
Степень и характер связи этих мух с человеком раз-
личны. Одни связаны непосредственно с человеком и его
пищей. В имагиналыюй фазе эти мухи нападают или не-
посредственно на человека для'питания потом и выделе-
ниями, или на пищу человека. Яйца мухи откладывают в
фекалии домашних животных и человека, в гниющие
фрукты, овощи и на другой разлагающийся субстрат рас-
тительного происхождения. Личинки живут там же. Дру-
гие мухи связаны с человеком лишь через домашних жи-
вотных. Они бывают лишь там, где имеется скот — пре-
имущественно на пастбищах. В населенных пунктах эти
мухи обычно не встречаются. Есть мухи (например, жи-
галка), которые обитают как в животноводческих поме*
370
щёниях, так и в жилище человека. Имаго питаются
кровью или выделениями животных. Развиваются в наво-
зе или помете. И, наконец, третьи связаны с человеком
черед его жилище. Эти мухи непосредственно ни с чело-
веком, ни с животными не связаны. В жилищах они на-
ходят лишь убежища для зимовки (мух а-пол ления).
По характеру питания различают такие группы (Дер-
бенова — Ухова):
1. Афаги — во взрослом состоянии не принимают пш
щи (оводы), личинка связана с человеком.
2. Нектарофаги — во взрослом состоянии питаются
нектаром или соками растений (вольфартова муха).
3. Копрофаги — основное питание навоз или же ис-
пользуют пищу человека, кухонные отбросы, а в некото-
рых случаях и растительные соки.
4. Гематофаги — питаются кровью животных и чело-
века, пользуясь сверлящим аппаратом (осенняя жигал-
ка!. Некоторые не способны самостоятельно сверлить и
пользуются выступающей кровью на ранах или на уко-
лах, нанесенных другими мухами. Могут питаться также
потом и выделениями глаз, носа и т. in. и, наконец, по-
метом.
5. Полифаги — питаются разнообразными вещества-
ми— экскрементами, выделениями животных и человека,
отбросами и растительными соками (комнатная муха, па-
дальная муха).
Наряду с разлагающимися остатками синантропные
мухи используют для питания также свежие пищевые
продукты белкового и углеводного происхождения. Их
привлекают запахи бродящих сахаристых веществ — си-
ропы, квас, пиво, привлекают их и изделия кондитерской
промышленности, а также фрукты, ягоды, овощи. Для не-
которых синантропных мух (Calliphooridae) соки, выде-
ляемые растениями, являются излюбленной пищей.
Условия существования отдельных видов и групп
варьируют. Отличаются они и особенностями биологии.
Все это должно быть учтено при изучении синантропных
мух.
Сбор и учет синантропных мух
Сбор мух. Главные места сбора синантропных мух —
жилые помещения, помещения, где содержится скот (са-
371
рай, стойла) и птица, предприятия по переработке пище-
вых продуктов, базары, места около мусорных ящиков,
уборные, навозные кучи, пастбища, полевые станы, ово-
щехранилища и т. п.
Мух ловят марлевыми сачками, имеющими диаметр
10—15 см, и палку длиной 50 см, которыми или накрыва-
вают субстрат, или же производят над ним кошения. Ло-
вят различными ловушками, липучками. Пользуются
также пробирками или банками, которыми накрывают
мух. С цветков собирают сачком обычным способом (ко-
шением). Можно использовать материал из проб, взятых
при общих энтомологических сборах.
Синантропных мух можно собирать также при истре-
бительных мероприятиях с использованием ядовитых ве-
ществ. От попадания этих веществ в кишечник или от
контакта с инсектицидами мухи гибнут. Их собирают и
изучают. В качестве инсектицида используется форма-
лин, фтористый и кремнефтористый натрий. Можно поль-
зоваться в качестве инсектицида и хлорофосом, но к это-
му яду мухи быстро привыкают.
Количественный учет. Учет численности окрыленных
мух проводится для определения видового состава и ко-
личественного соотношения разных видов синантропных
мух, для установления календаря жизни — фенологиче-
ских дат появления (весной) и исчезновения (осенью)
мух, для выяснения сезонного изменения численности,
для определения зараженности данной местности мухами
и определения эффективности применяемых мероприя-
тий. Учет проводится как в разного типа помещениях —
столовых, магазинах, пекарнях, общежитиях, квартирах,
так и на открытом воздухе — около мусороприемников,
навозных куч, сараев.
Учет мух вне помещений необходимо вести весь се-
зон: следует ‘начинать весной, когда максимальная тем-
пература воздуха достигает +10—12° С, и кончать
осенью, когда температурный максимум опустится ниже
+ 12° С. Количественный учет проводят ловушками-мухо-
ловками (см. рис. 122): в помещениях пользуются стек-
лянными, на открытом воздухе — сетчатыми. За единицу
учета принята 24-часовая экспозиция — мухоловко-сутки.
Повторяют такой учет в зависимости от задач и места
исследования через 5, 10 и 20 дней. В качестве показате-
ля численности взрослых мух берут количество мух одно-
372
го^ вида, пойманных в данной местности, в среднем на
одцн отлов в одну мухоловку (мухоловко-сутки).
Предложено несколько видов ловушек для вылова
мух\ Большая часть их устроена по принципу верши. Для
обивки стенок ловушки пользуются сеткой с отверстиями
не более 2x2 мм. Устройство этой ловушки такое же,
как и ловушки Скуфьина (см. выше). Под ловушку про-
тив верши (конуса) в посуду с низкими краями ставят
приманку, которой служит молоко, хлебный квас, пиво
с кусочками хлеба, патока, разведенный мед, фрукты,
посыпанный сахаром хлеб, мясо, навоз, трупы мелких по-
звоночных и т. п. Приманка, применяемая в мухоловках,
должна быть стандартной. Мухи, наевшись, поднимают-
ся вверх и попадают в ловушку. Систематический лов
этим методом дает ценный материал для решения ряда
вопросов — проследить изменение видового состава в за-
висимости от условий окружающей среды и сезона; сде-
лать заключения о количественном объеме популяции
мух в одном и том же пункте или в различных местно-
стях в течение определенного времени в зависимости от
различных условий и, наконец, выяснить эффективность
действия применяемых мер борьбы.
Для учета мух в помещениях пользуются также лип-
кими листами — липучкой. Ее можно приобрести в аптеке
или приготовить самим по такому рецепту: 2 части касто-
рового масла, 4 части размельченной канифоли. Эту
смесь подогревают на огне, пока не расплавится кани-
фоль. В подогретом виде клей намазывают на лист бума-
ги. Имеются и другие рецепты: смола — 450 г, льняное
масло — 55 г, патока — 55 г.
Липкие листы должны быть определенного размера.
Такие стандартные липучки развешивают во многих точ-
ках, только при этом условии результаты будут правиль-
ными. Время от времени листы просматривают, подсчи-
тывают и собирают прилипших на них мух. Пересчет де-
лается на ловушко-сутки или липучко-сутки. Выясняют
индекс количества.
Количественный учет мух проводят также сачком.
В этих случаях делается Определенное количество взма-
хов над субстратом, цветками, стандартным сачком. Та-
кой относительный учет дает возможность изучить состав
и трофические отношения'.
Применяется также метод подсчета мух на приманки.
373
Приманку расставляют в подлежащих обследованию ме-
стах и подсчитывают число мух, севших на приманку в
течение минуты, затем мух сгоняют и снова повторяют
минутный подсчет. Так проводят 5—10 подсчетов и/вы-
считывают среднее число из этих подсчетов. /
При проведении количественных учетов важно /пра-
вильно выбрать место проведения учета, сроки и повтор-
ность взятия проб. '
Фиксирование. Собранных одним из описанных спо-
собов мух умерщвляют обычным способом — в морилках.
В качестве анестезирующего средства лучше пользовать-
ся смесью равных частей хлороформа и уксусного эфира.
Насекомых, попавших в липучки, если встретится необ-
ходимость сохранить их в научной коллекции, обрабаты-
вают так: клей от них отмывают хлороформом или сер-
ным эфиром, мух просушивают на фильтровальной бу-
маге и сохраняют обычным способом на ватниках или
наколотыми на булавки.
Сбор личинок,и куколок не представляет трудностей.
Из субстрата (навоза, отбросов, гниющих веществ, мяса
и т. д.) собирают личинок тонким пинцетом. Фиксируют
личинок в 70° спирте. Лучше предварительно их опустить
в кипяток или обработать горячим спиртом. Для точного
определения и диагностики приходится выводить взрос-
лых из личинок или куколок. Для этого собранных личи-
нок (или куколок) переносят в банки. На дно такой бан-
ки насыпают земли (2—3 см), банку сверху затягивают
марлей. В банке для субстрата необходимо поддержи-
вать определенный режим температуры (соответствую-
щий температуре гниющего субстрата) и влажности.
Учет численности личинок. Этот учет проводится глав-
ным образом для выявления мест выплода мух и провер-
ки эффективности истребительных мероприятий и сани-
тарного состояния. Берется проба субстрата определен-
ного объема или веса в местах (выплода мух, а потом
ведется подсчет. Результат заносят в соответствующую
карточку. Точность зависит от числа взятых проб и от
выбора места для проб (важно обеспечить средние усло-
вия и по возможности охватите разные субстраты).
Для выяснения календаря жизни следует фиксиро-
вать такие данные: 1) время появления мух в активном
состоянии; 2) дата появления первых мух в природе;
3) дата первых кладок яиц; 4) дата появления первых
374
яминок; 5) дата исчезновения мух в природе; 6) дата
исчезновения активных мух в помещениях. Одновремен-
но отмечают среднесуточную и максимальную температу-
ру на открытом воздухе и среднюю температуру в поме-
щении в период исчезновения активных мух осенью.
Оводы ‘
Взрослые оводы ведут свободный образ жизни и вст-
речаются сравнительно редко, чаще их можно видеть
около пасущихся животных. Как афаги, они на живот-
ных не бывают, но будущее потомство обеспечивают кор-
мом, пристраивая яйца (или личинок) на теле или в
ноздри животных; тут в соответствующих условиях в ко-
же или же в желудке или носовой полости) проходит их
развитие.
Метод изучения этих насекомых имеет свои специфи-
ческие особенности. Поймать взрослых оводов в приро-
де— дело нелегкое. Для получения достоверного мате-
риала взрослых оводов приходится выводить из личинок
и куколок. Иногда удается поймать имаго сачком, делая
взмахи около животных, куда оводы могут прилететь для
откладки яиц. Иногда они случайно попадают в сачок
при сборе других насекомых. Пойманных или выведен-
ных в лаборатории насекомых замаривают одним из ука-
занных выше способов и сохраняют, наколов на булавки
или разложив на ватники.
Имаго приходится выводить из личинок и куколок.
Личинки I и II возроста желудочных оводов (Gasterophi-
lidae) могут быть найдены в кишечном тракте хозяина
при забое пли их собирают, когда они выпадают на зем-
лю. Личинок краснохвостого овода извлекают из прямой
кишки хозяина или собирают в свежеотложенных экскре-
ментах. Личинок полостного овода (Oestridae) извлека-
ют рукой из глотки животного (северного оленя, верб-
люда).
Для получения взрослых форм часть извлеченных ли-
чинок помещают в садки с влажным песком и выводят
из них взрослых насекомых. Время от времени следует
просматривать песок, если появятся куколки, часть их
фиксируют, а остальных держат для выведения имаго.
Личинок I возраста держат в 70° спирте. Личинок II
и Ш — в 70° спирте или 10%-ном формалине. Полезно
375
перед помещением их в спирт обдать кипятком. Матери-
ал необходимо этикетировать. у
По месту локализации личинок овбдов делят на такие
основные группы: кожные, желудочные и полостные
оводы. I
Кожные оводы (Hypodermatidae) паразитируют в
крупном рогатом скоте. Распространение и экология не-
которых видов этой группы изучены недостаточно; По-
этому всякий правильно собранный материал' представ-
ляет определенный интерес.
Взрослых собирают сачком, так как в благоприятную
погоду они обычно летают в затененных участках между
ног и под брюхом крупного рогатого скота и лошадей,
откладывают яйца, из которых развиваются личинки.
Яйца свои самка прикрепляет к шерсти животного в ко-
личестве до 800 штук. Чаще всего на ногах. Развившиеся
личинки локализуются в кожном покрове.
В местах локализации личинок образуются желваки,
кожа становится тонкой и, наконец, по окончании разви-
тия личинка проделывает отверстия, через которые она
выходит из кожи хозяина и падает на землю, где личин-
ка и окукливается. Перед выходом и в момент выхода
личинок из кожи животного их можно выдавливать из
желвака или собирать пинцетом.
Личинок III возраста можно получить и таким спосо-
бом: на тело животного, в коже которого прощупывают-
ся личинки, накладывают ловушки — марлевые мешочки.
Накладывают ловушки на желваки, приклеивают их смо-
лой или иным способом. Вышедшие из кожи личинки по-
падают в ловушки, из которых личинки извлекаются по
окончании выхода. Часть собранных личинок фиксируют
70° спиртом или в 5%-ном формалине. Часть отсаживают
в почвенные садки для выведения взрослых оводов.
Ведут учет зараженности для выяснения динамики
развития кожных оводов в условиях определенного кли-
мата. Выясняют наличие благоприятных условий разви-
тия оводов: весной на животных подсчитывают желваки.
Так проводят сравнительный учет на зараженность жи-
вотных оводами.
Желудочные оводы (Gasterophilidae). Эта группа
представлена видами рода Gastrophilis. Известные в Со-
ветском Союзе виды — большой конский овод G_. intesti-
nalis, кишечный конский овод G. veterinus, восточный же-
376
лубочный G. ресогит и краснохвостый конский £вод
G. \aemorrhoidalis имеют более или менее сходный образ
жи^ни. Окрыленные формы ведут свободный образ жиз-
ни, личинки их паразитируют в желудке, вызывая гастро-
филезы. Эти оводы бывают активны в тихую теплую сол-
нечною погоду.
Они не садятся на животных, а самки на лету откла-
дывают яйца на их шерсть. Самка большого конского
овода откладывает яйца чаще всего в шерсть передних
ног. Вылупившиеся из яиц личинки с шерсти попадают в
ротовую полость хозяина и после сложных процессов по-
ступают в желудок, где прикрепляются к его стенкам.
Развитие личинки на этом заканчивается. Личинки крас-
нохвостого овода закрепляются в прямой кишке около
анального отверстия лошади и через 45 дней выпадают
на землю.
Сбор желудочных оводов можно производить сачком
около животных в затененных местах. Личинок следует
собирать в свежих экскрементах лошадей. Кроме того,
их можно извлекать из прямой кишки хозяина (красно-
хвостый овод). Собранных личинок фиксируют обычным
способом (см. выше), а часть помещают в почвенные сад-
ки для выведения имаго (см. Кожные оводы).
Полостные оводы (Oestridae). Эти оводы отличаются
своеобразной биологией. Окрыленные оводы садятся для
отдыха на различные возвышающиеся над землей пред-
меты, столбы, заборы, на освещенные стороны стен ов-
чарен, хлевов. Здесь они находят места в углублениях,
щелях. Самки этих живородящих насекомых подлетают
к ноздрям животных (лошади, овцы, оленя, верблюда),
а иногда и к глазу человека и с силой выбрасывают из
яйцеклада отродившихся личинок. Дальнейшее развитие
их происходит у животных в различных полостях — в но-
совой, в лобных пазухах и в других местах. Оттуда за-
кончившие развитие личинки освобождаются, попадают
в почву, где и превращаются в куколок и имаго.
Исходя из биологических особенностей полостных
оводов, собирать их рекомендуют около животных, у пе-
редней их части. По утрам их можно собирать возле по-
мещений или других мест их скоплений руками, так как
в это время они бывают неподвижны.
Рекомендуют (Порчинский) устраивать на пастбищах
специальные щиты, на которых утром и вечером, в нача-
377
ле и в конце лета можно собирать этих насекомых, ^ля
количественного учета собранных в определенное время
на щите насекомых подсчитывают. Окрыленных овбдов
следует умерщвлять в морилках, пользуясь обычными
анестезирующими ядами— хлороформом, эфиром или
смесью хлороформа и уксусной кислоты. Затем их укла-
дывают на ватники, снабдив этикетками со всеми необ-
ходимыми данными. Личинок собирать трудно, их извле-
кают руками из глотки животного.
Сбор и выведение имаго из куколок проводят описан-
ными выше способами.
ИЗУЧЕНИЕ КОМПЛЕКСА НЕКРОФАГОВ (МЕРТВОЕДОВ)
Животные оказывают влияние на жизнь беспозвоноч-
ных и после своей смерти. Трупы и вообще мертвые ос-
татки различных животных образуют своебразную орга-
ническую среду, к которой приспособлены и в которой
живут — размножаются и развиваются различные бес-
позвоночные, своеобразный комплекс, именуемый мерт-
воедами. Животные таким образом и после своей смерти
могут служить фактором среды обитания для беспозво-
ночных, которые в свою очередь обеспечивают разложе-
ние трупа.
В экологическую группу некрофагов входят жуки —
могильщики — Necrophorus, мертвоеды — Silpha, карапу-
зики — Histeridae, саприны — Saprinus, кожееды — Der-
mestidae, троке — Тгох, и некоторые уже упоминавшиеся
синантропные мухи: синяя мясная муха — Calliphora
erythrocephala, падальная муха — Lucilia, серая муха —
Sarcophaga и др. Комплекс может быть очень богатым.
Так, в трупе лйсицы английским ученым было обнаруже-
но 87 видов жуков из 10 семейств.
У всех этих насекомых удивительно развито чувство
обоняния, которым они безошибочно находят труп. Све-
жий труп первыми посещают комнатная — Musca dome-
stica> домовая — Muscina stabulans и синяя мясная му-
ха — Calliphora erythrocephola, так как они иногда откла-
дывают яйца на свежее мясо. Эти мухи еще не являются
типичными трупными посетителями. Позже на запах тру-
па прилетают падальные мухи: серая — Sarcophaga sar-
narla и зеленая люцилия — Lucllia caesar, которые тоже
378
откладывают яйца. Через несколько дней из отложенных
яиц в трупе появляется множество «червей» — личинок
этих двукрылых, которые вызывают дальнейшее разру-
шение и способствуют высыханию трупа. Сюда, на труп,
прилетают уже привлекаемые личинками мух блестящие
хищные жуки-карапузики — Histeridae и другие хищни-'
ки-охотники, которые питаются уже ‘ личинками мух.
Сравнительно рано, почти одновременно с мухами, при-
влекаемые запахом трупа прилетают и жуки-могильщи-
ки— Necrophorus. Они, повинуясь инстинкту заботы о по-
томстве, сразу приступают к закапыванию в землю тру-
пов мелких животных — создают запасы пищи для своего
будущего потомства (здесь жуки откладывают яйца).
Несколько позднее сюда прилетают быстроногие с
длинным вытянутым брюшком и парой коротких надкры-
лий стафилины Staphylinidae, некоторые из них питаются
на трупе так же, как и другие мертвоеды. Когда исчезает
злрвоние и остатки трупа — мышцы и сухожилия подсы-
хают, можно встретить жуков-мертвоедов — Silpha, их
легко обнаружить, пошевелив труп палкой или припод-
няв его пинцетом. Эти жуки обгладывают твердые остат-
ки трупа.
Среди этих групп насекомых, в основном связанных с
мертвыми остатками, имеются и растительноядные насе-
комые и виды, живущие в навозе (см. ниже). Последни-
ми на животных остатках появляются жуки — кожееды
(Dermestidae), они заканчивают разрушение тканей и
очищают кости. Вместе с кожеедами может встретиться
и троке—Тгох, который живет и питается на костях, ко-
пытах, рогах, но может жить и в песке. На подсохшем
трупе появляются часто и трупные клещи.
Изучение этого комплекса сопряжено с известными
трудностями. Обнаружить труп в природе — дело случая,
к тому же он не всегда бывает в таком состоянии, когда
можно собрать весь комплекс и наблюдать нужных нам
насекомых, поэтому методика будет отличаться некото-
рыми особенностями по сравнению с методикой изучения
других комплексов животных.
Для наблюдения за «мертвоедами» и для получения
необходимого материала приходится искусственно созда-
вать условия, при которых могут появиться нужные для
исследования насекомые. С этой целью пользуются при-
манкой: выкладывают трупы различных мелких млеко-
379
питающих (мышевидных грызунов, кротов, зайцев, До-
шек), рептилий, земноводных и даже рыб. Одновременно
следует выложить в различные микроуслювия несколько
трупов (рис. 123). В зависимости от возможностей реко-
мендуют в некоторых случаях в качестве приманки рас-
кладывать отдельные части тела животных (внутренно-
сти, бараньи головы, куски шкуры).
Рис. 123. Приманки для мертвоедов
Учитывая, что разные виды «мертвоедов» предпочита-
ют разные трупы (одни — трупы более крупных живот-
ных, другие — преимущественно птиц или гадов), а так-
же исходя из того, что на мелких трупах .процесс
разложения совершается в более короткий срок, следует
в качестве приманки брать трупы различных животных.
На трупах больших животных особенно отчетливо можно
наблюдать постепенную смену количественного и видово-
го состава насекомых, что дает возможность решить ряд
экологических вопросов.
В местах, где помещают приманку, землю следует
очистить от растений и дерна. На приготовленную углуб-
380
ленную очищенную площадку кладут труп или части его.
По соседству с приманкой следует положить различные
предметы (куски рогожи, бумагу, тряпки, кору), так как
мелкие мертвоеды прячутся под лежащие на земле ук-
рытия.
При таких опытах, само собой разумеется, следует
заботиться об охране трупов от растаскивания хищни-
ками. Для этого в отдельных случаях прибегают к раз-
личного рода ограждениям из проволочной сетки. Лучше
всего в таких случаях подвешивать труп на проволоке
высоко над землей — на дереве или на специальном ше-
сте. Можно сетку, ящик и другую посуду с приманкой
привесить к стенке нежилого помещения. На разложен-
ных трупах-приманках в зависимости от задач исследо-
вания проводят по этапам наблюдения и собирают насе-
комых.
Сбор материала производят обычными способами,
используя нужные приспособления. Наиболее чутких и
подвижных насекомых (мух и стафилин), которые мо-
ментально улетают при попытке приблизиться к ним, сле-
дует ловить сачком, делая им энергичные взмахи в воз-
духе над трупом.
Для сбора мертвоедов (Silpha) палкой переворачива-
ют труп и сдвигают его с места. Под ним на земле можно
обнаружить целую колонию этих жуков. Потревоженные,
они поджимают ноги и сидят непод1вмжно. Тут же можно
найти и их личинок, похожих на мокриц. Если труп не-
большого размера, его приподнимают пинцетом и встря-
хивают над сачком. Пинцетом же собирают оставшихся
на трупе или на земле мертвоедов. Там же собирают и
других обитателей. Жуков-могильщиков (Necrophorus),
зарывшихся в землю, собирают, несколько разрыхлив
субстрат. Тут же могут находиться пупарии окукливших-
ся мух.
Ста филины (Staphylinidae), .кроме трупов, обитают
еще под камнями, в навозе, в грибах, под корой деревьев,
а также в муравьиных кучах, в норах грызунов, в гнез-
дах птиц. Там и следует их искать при изучении смены
стадий видом. Ловят их пинцетом. Карапузиков (Histe-
ridae) можно собирать, кроме того, в коровьем помете
(см. ниже).
Кожееды (Dermestidae) (жуки и личинки) питаются
различными остатками животного происхождения, жи-
381
йут, как мы видели, на трупных остатках, но могут оби-
тать и в других местах. Нападают они на зоологические
коллекции, где происходит развитие личинок, некоторые
виды нападают на кладки различных насекомых (злато-
гузок, непарного шелкопряда), а также па куколок мно-
гих видов и полностью их уничтожают. Здесь их можно
собирать обычными способами.
Собранный разными способами материал фиксиру-
ют, этикетируют и сохраняют каждую группу способами,
изложенными в соответствующих разделах.
Для изучения личинок мух при систематических рабо-
тах и для наблюдения за их развитием пинцетом извле-
кают их из жидкой массы, переносят в пробирку или в
стеклянную банку вместе с частью пищевого субстрата и
доставляют в лабораторию. Найденные пупарии мух пе-
реносят в банки без субстрата и завязывают марлей,
доставляют в лабораторию, где из них выводят имаго.
Для изучения биологии жуков-могильщиков собирают
живыми, помещают в большой сосуд (таз, ящик), напол-
ненный песком, и прикрывают проволочным колпаком.
На песок кладут труп мыши, воробья и т. п.
На опытном участке и в лаборатории можно изучать
важные вопросы из жизни и развития названных насе-
комых.
ИЗУЧЕНИЕ КОМПЛЕКСА КОПРОФАГОВ (НАВОЗНИКОВ)
Отбросы крупных животных, состоящие из органиче-
ских веществ, представляют отличный питательный ма-
териал для множества насекомых и ряда других мелких
беспозвоночных.’Повсюду, где пасется скот — на выго-
нах, по дорогам — и где имеются навозные кучи, можно
найти и их всевозможных обитателей. Эти последние на-
ходят здесь корм, место развития потомства и удобное
убежище.
Своими специфическими свойствами навоз привлекает
большое количество беспозвоночных. Прилетают сюда
различные двукрылые, в том числе и синантропные мухи
(стр. 357). Заселяют эти кучи многие жуки, среди кото-
рых нередко бывают и хищники: жужелицы, кокцинеллы,
стафилины. Собираются сюда муравьи и, наконец, клещи,
дождевые черви и голые слизни.
382
Среди большого числа посетителей навоза имеется не-
мало случайных видов, но есть определенное количество
и весьма типичных, приуроченных к этому субстрату ви*
дов. Они и составляют экологическую группу копрофагов.
Сюда относятся прежде всего навозные жуки и навозные
МуХ1И._
{ Население’куч помета животных непостоянно, оно
изменяется в зависимости от свежести (возраста кучи).
Обитатели свежего помета будут отличаться от обитате-
лей полежавшего и высохшего навоза.
Свежая куча еще теплого коровьего помета привлека-
ет различных мух. Эти первые посетители, привлекаемые,
очевидно, запахом субстрата, слетаются с больших рас-
стояний. Посещают свежие навозные кучи такие мухи:
зеленая коровница — Orthellia cornicina, полевая му-
ха— Musca corvina, блестящая навозница — Geosargus,
крупная блестящая черная навозница — Mesembrina
meridiana. Они тут же откладывают яйца, из которых
уже через одни-двое суток появляются личинки.
После мух слетаются жуки афодии Aphodius, которые
дня через два откладывают яйца, а через неделю появ-
ляются и личинки этих жуков. Подросшие к этому вре-
мени личинки мух привлекают новых посетителей, но уже
из комплекса «мертвоедов» — жуков-карапузиков Hister,
интенсивно истребляющих мушиное потомство (личи-
нок). Подобную роль играют здесь и некоторые стафили-
ны из рода Philortthus, которые также охотятся на личи-
нок мух.
Уцелевшая часть личинок кокопируется в земле и не-
дели через три от начала существования кучи начинает-
ся вылет мух, которые вскоре разлетаются.
Высохшие кучи бывают значительно беднее, нет здесь
уже мух, но еще могут встретиться личинки навозни-
ков— Aphodius. Подсохший навоз образует новую среду.
Через некоторое время он заселяется кожеедами, появля-
ются кокцинеллы, долгоносики, щелкуны, жужелицы,
иногда муравьи, последние вытесняют всех других обита-
телей и устраивают здесь свою колонию. В большинстве
случаев наблюдается заселение помета какой-нибудь
группой беспозвоночных, заполняющей всю кучу. Так, в
некоторых местах преобладают мухи и нет жуков, и на-
оборот, в ряде случаев куча переполнена одним видом,
например геотрупами — Geotrupes или афодиями Apho-
383
dius, иногда они встречаются вместе и лишь преобладает
тот или другой вид. На население влияет влажность на-
воза, оно значительно богаче в сухое время, чем в период
дождей. Дожди неблагопрятно влияют и на развитие
мух. Но в период осадков хорошо развиваются дождевые
черви — Allolobophora foetida и голые слизни.
В кучах конского навоза жизнь протекает иначе. С
ним связана конская навозница — Cypsela equina, кото-
рая не посещает экскрементов крупного рогатого скота,
но нет здесь обыкновенной навозной мухи — зеленой ко-
ровницы — Orthellia cornicina.
На совершенно свежие фекалии слетаются и облепля-
ют их со всех сторон маленькие мушки — конская навоз-
ница, конская личинкоедка — Polietes albolineata\ хищ-
ные личинки последней уничтожают личинок других мух.
Из жуков типичны геотрупы — Geatrupes, которые зары-
вают конский навоз в землю для предохранения его от
высыхания и используют его в качестве пищи для своих
личинок.
От биологических особенностей населения навозных
куч зависят и наиболее эффективные методы сбора и изу-
чения этих насекомых. Необходимо в хорошую теплую
погоду выбрать и наметить кучи помета разного возраста,
от самых свежих до старых, высохших и исследовать по
мере их заселения. Сначала осматривают кучи снаружи.
Мух наблюдают с помощью большой лупы, а затем отпу-
гивают их взмахом сачка; ловят их в воздухе. Затем рас-
капывают палочкой или лопатой кучи, рассматривают
ходы и собирают обнаруженных насекомых. Исследовав
нижние слои кучи, разрыхляют землю под ней и извлека-
ют насекомых.
Для учета вс.его комплекса обитателей (в тот или
иной период) можно пользоваться биоценометром, опи-
санным выше, например, биоценометром Станчинского
(стр. 131). Прибором накрывают кучу навоза со всеми
ее обитателями, собирают и учитывают их как обычно.
Такой учет, производимый регулярно, дает возможность
судить о динамике заселения кучи насекомыми.
Собирают насекомых из кала пинцетом, для выбора
мелких насекомых можно применять промывание водой
через решето. С собранными мухами поступают так же,
как и с синантропными мухами. Жуков фиксируют и со-
храняют обычным способом.
ЗАКЛЮЧЕНИЕ
Характер и 'Содержание полевых исследований опре-
деляются уровнем и задачами изучения беспозвоночных
и реализуются в конкретной программе. Поэтому состав-
ление программы исследований — обязательный элемент
планирования и начало работы над темой. Программа
включает и разработку основных приемов и способов, при
помощи которых она выполняется, — методику исследо-
ваний. Рабочий план уточняет время и места проведения
отдельных этапов работы.
При любых зоологических исследованиях следует .из-
учать и элементы среды, являющиеся условиями жизни,
местом обитания и ареной деятельности многих видов.
Изучение их — один из этапов исследования. Особенно
важно изучать почву, метеорологические условия (микро-
климат, биоклимат), растительность и животный мир как
факторов среды для отдельных видов и как компонентов
биоценоза.
Изучение самих беспозвоночных животных состоит из
различных элементов. Сбор и учет осуществляется ком-
плексом разнообразных приемов с применением различ-
ных приборов и приспособлений. Единых методов сбора
и учета нет, как нет и универсальных приборов. Выбор
их определяется биологическими особенностями изучае-
мого объекта и задачами (программой) исследования.
При любых способах сбора, фиксации и хранения ма-
териала обязательна этикетировка. Характер ее может
варьировать в зависимости от объектов и задач исследо-
вания, но принципы едины для всех исследований, они
сводятся к следующему: этикетка должна быть лаконич-
ной, но содержать достаточное количество информации.
Своеобразие почвы как среды обитания и обусловлен-
ное этим разнообразие форм и биологических особенно-
385
стей живущих в ней беспозвоночных определяют и мето-
ды изучения этого комплекса животных. Методика, прие-
мы, а также описание приборов рассматриваются здесь
подробно отдельным разделом.
Состав и биологические особенности животных по-
верхности земли, растительного покрова и наземных со-
обществ разнообразны как в видовом отношении, так и
по количеству и характеру жизненных форм. Одновре-
менное изучение отдельных элементов связано с извест-
ными трудностями. Поэтому в книге предусмотрены
приемы изучения отдельных элементов по этапам. Особое
значение приобретает изучение биоценозов, изучение жи-
вотных как компонентов биоценозов и биоценотических
группировок. Успех изучения зависит от методики, кото-
рая уточняется и совершенствуется в связи с расшире-
нием наших знаний о данном предмете. Изучение биоти-
ческих группировок тесно переплетается с изучением
численности и деятельности отдельных компонентов, что
имеет особо 'важное значение. Выделяются вопросы изу-
чения комплексов вредителей, насекомых-опылителей,
энтомофагов (паразитов, хищников): выявление местных
паразитов, выведение, привлечение и расселение парази-
тов, разведение для практических целей.
Членистоногие, связанные с теплокровными животны-
ми и человеком, составляющие сложный комплекс крово-
сосущих и хищных животных и имеющие различные мес-
та обитания, изучаются иной совокупностью приемов,
методик. Комплекс включает методику сбора и учета
беспозвоночных — обитателей нор и гнезд, сбор и изуче-
ние эктопаразитов животных, и частные методики от-
дельных групп кровососов и эктопаразитов.
Особенностью экологических комплексов некрофагов
и копрофагов является их временный характер, связь с
различными биотопами и с наличием позвоночных живот-
ных. Это определяет и сборный характер приемов их изу-
чения.
Описанные в книге приборы, направления и методи-
ки исследования не исчерпывают всего многообразия
возможностей. Приведены лишь проверенные типовые и
распространенные, которыми рекомендуется пользовать-
ся или разработать по их принципу нужные модифика-
ции, а может быть и принципиально новые методики и
поиборы, проверить и внедрить их. '
ЛИТЕРАТУРА
Общие вопросы
Арнольди К. В., Арнольди Л. В. О биоценозе как одном
из основных понятий экологии, его структуре и объеме. Зоол. журн.,
т. 42, вып. 2, 1963.
А/рнольди Л. В. Краткие методические указания по изучению
консортивных связей насекомых при биокомплексных исследованиях.
В кн. Программно-методич. записки по биокомпл. и геобот. изучению
степей и пустынь Центрального Казахстана. Изд-во АН СССР, 1960.
Арнольди Л. В. Зообиологические исследования в степях Ка-
захстана и некоторые общие проблемы биоценологии. Журн. общ.
биол., т. 26, № 3, 1965.
Бей-Биенко Г. Я. К теории формирования агробиоценозов:
некоторые закономерности изменения фауны насекомых и других
беспозвоночных при освоении целинных земель. III Совещ. Всесоюзн.
энтом. общ., ч. 1, 1957.
Бей-Биенко Г. Я. Смена стаций наземных организмов как
экологический принцип. Вопросы экологии, т. 4, 1962.
Бей-Биенко Г. Я. Смена местообитаний наземными организ-
мами как биологический принцип. Журн. общ. биол., т. 27, № 1, 1966.
Бей-Биенко Г. Я. Общая энтомология. Изд-во «Высшая
школа», 1966.
Беклемишев В. Н. Основные понятия биоценологии в их
применении к животным компонентам наземных сообществ. Труды по
защите раст., т. 1, вып. 3, 1931.
Берг Л. С. Климат и жизнь. М., 1947.
Бескровный М. А. Практикум по экологии животных, ч. 1.
Харьков, 1953.
Буковский В. К. К критике основных проблем и понятий
биоценологии. Вопросы экологии и биоценологии, вып. 2. Л.—М.,
1935.
Викторов Г. А. Содержание понятия «биоценоз» в современ-
ной экологии. Вопросы экологии, т. 4, 1962.
Викторов Г. А. Биоценоз и вопросы численности насекомых.
Журн. общ. биол., т. 21, № 6, 1960.
Воронцов А. И. Биологические основы защиты леса. Изд-во
«Высшая школа», 1963.
Гептнер В. Г. Общая зоогеография. М., 1936.
387
Гиляров М. С. Особенности почвы как среды обитания и ее
значение в эволюции насекомых. М.—Л., Изд-во АН СССР, 1949.
Гиляров М. С. Современное представление о вторичных био-
ценозах. Пятое совещ. Всесоюзн. энтом. общ., 1963.
Гиляров М. С. Почвенные животные как компоненты биоце-
ноза. Журн. общ. биол., т. 26, № 3, 1965.
Гиляров М. С. Зоологический метод диагностики почв. Изд-во
«Наука», 1965.
Гиляров М. С. Биосфера, биоценозы и защита растений. За-
щита растений, № 7, 1968.
Григорьева Т. Г. О некоторых общих закономерностях фор-
мирования агробиоценозов и о принципах защиты растений на целин-
ных землях. Журн. общ. биол., т. 21, № 6, 1960.
Г о р ы ш и н В. И. Техническое оснащение экологических иссле-
дований в экологии. Изд-во ЛГУ, 1956.
Данилевский А. С. Фотопериодизм и сезонное развитие на-
секомых. Изд-во ЛГУ, 1961.
Догель В. А. Курс общей паразитологии. М., 1941.
Догель В. А. Количественное изучение наземной фауны. Рус-
ский зоол. журн., т. 4, 1924.
Докучаев В. В. Учение о зонах природы. М., 1948.
Евлахова А. А. и Швецова О. И. Наставление по изуче-
нию болезней насекомых и применению микробиологического метода
защиты растений. М.—Л., Изд-во АН СССР, 1953.
К а л а б у х о в Н. И. Методика экспериментальных исследова-
ний по экологии наземных позвоночных. М., 1951.
Кашкаров Д. Н. Основы экологии животных. М., 1945.
К а шк аров Д. Н. иСтанчинский В. В. Курс биологии
позвоночных. М., 1929.
Кожанчиков И. В. Методы исследования экологии насеко-
мых. Изд-во «Высшая школа», 1961.
К р ы ш т а л ь А. Ф. Состояние и задачи разработки экологиче-
ской терминологии. Третья Экол. конф. Тезисы докл., ч. IV. Киев,
1954.
Макфедьен Э. Экология насекомых. Изд-во «Мир», 1965.
Медведев С. И. Принципы эколого-фаунистического райони-
рования. Третья эколог, конф. Тезисы докл., т. 1, 1954.
Медведев С. И. Особенности распространения некоторых
экологических форм насекомых в различных ландшафтно-географи-
ческих зонах Украины. Зоол. журн., т. 33, вып. 6, 1954.
Медведев С. И. К вопросу о структуре биоценоза. Четвертый
Всесоюзн. съезд энтом. общ., т. 1, 1959.
Методика полевых геоботанических исследований. М.—Л., Изд.
Ботанич. ин-та АН СССР, 1938.
Наумов Н. П. Экология животных. М., 1955, 2-е изд., 1963.
Новиков Г. А. Полевые исследования по экологии наземных
позвоночных. М., 1953.
Основы лесной биогеоценологии. Под ред. В. Н. Сукачева и
Н. В. Дылиса. Изд-во «Наука», 1964.
Павловский Е. Н. Руководство по паразитологии человека.
М., 1948.
Павловский Е. Н. Мичуринская биология и задачи зоологи-
ческих исследований. Зоол. журн., т. 27, вып. 6, 1948.
Павловский' Е. Н. Научная помощь зоологов и паразитоло-
388
гов в устройстве полезащитных полос. Зоол. журн., т. 28, вып. 2, 1949.
Передельский А. А., Богатырев И. О. Сигнальный ме-
тод определения по сборам насекомых мест с повышенной радиоак-
тивностью. Четвертый съезд Всесоюзн. энтом. общ., т. 1, 1959.
Поляков И. Я. и Шумаков Е. М. Сущность экологии, ее
терминов и понятий с позиций мичуринской биологии. Третья Эколог,
конф. Тезисы докл., ч. IV. Киев, 1954.
Поспелов В. П. иЕвлахова А. А. Инструкция для иссле-
дования болезней насекомых. Л., Изд. ВИЗР, 1937.
Поспелов В. Н. (ред.). Энтомология, 1935.
Предварительные программы стационарных комплексных био-
.геоценотических исследований. Землеведение, нов. серия, т. 3 (48),
1950.
Программа и методика биогеоценологических исследований. Под
ред. В. Н. Сукачева и Н. В. Дылиса. Изд-во «Наука», 1966.
Программно-методические записки по биокомплексному изучению
степей и пустынь Центрального Казахстана. Изд-во АН СССР, 1960.
Программы и наставления для наблюдений и собирания коллек-
ций по естественной истории, 4-е изд., Спб., 1896.
Раменский Л. Г. Введение в комплексное почвенно-геобота-
ническое исследование земель, 1938.
Р а ф е с П. М. Кормовые связи лесных насекомых. Чтения памя-
ти И. А. Холодковского. Изд-во «Наука», 1964.
Ра фес П. М. Роль и значение растительноядных насекомых в
лесу. Изд-во «Наука», 1968.
Рулье К. Ф. Жизнь животных по отношению к внешним усло-
виям. Публ. лекц. проф. Моск, ун-та. М., 1952.
Рэссель Э. Д. Почвенные условия и рост растений, 1936.
Справочник путешественника и краеведа. Под ред. С. В. Обруче-
ва, т. 1. М., 1949.
Станчинский В. В. Задачи, содержание, организация и ме-
тоды комплексных исследований в госзаповедниках. Научн. методич.
зап. Комит. по заповеди., вып. 1, 1938.
Станчинский В. В. Экологическое направление в изучении
природных комплексов — ландшафтов. Научн. метод, зап. Комит. по
заповеди., вып. 3, 1939.
Структура и функционально-биогеоценотическая роль животного
населения суши. Материалы совещ., 1967.
Сукачев В. Н., 3 о н н С. В. Методические указания к изуче-
нию типов леса. Изд-во АН СССР, 1961.
Сукачев В. Н. Основные современные проблемы биогеоцено-
логии. Журн. общ. биол., т. 26, № 3, 1965.
Ф р и д е р и к с К. Экологические основы прикладной зоологии
и энтомологии, 1932.
Холодковский Н. А. Курс энтомологии теоретической и
прикладной, тт. I—III. Л., 1927—1931.
Щеголев В. Н. (ред.) Сельскохозяйственная энтомология.
М.—Л., 1955.
Фауна СССР (Сводки и определители по различным группам на-
земных беспозвоночных). Изд-во АН СССР.
Яхонтов В. В. Экология насекомых. Изд-во «Высшая школа»,
1964.
Определители по фауне СССР, издаваемые Зоологическим инсти-
тутом АН СССР.
389
Определитель насекомых европейской части СССР. Под ред.
Бей-Биенко (в 5 т.).
Изучение климатических факторов и микроклимата
Алисов Б. П., 3 е м ц о в а А. И. Полевые микроклиматиче-
ские исследования и их связь с наблюдениями сетевых метеорологи-
ческих станций. Сб.: Методы географических исследований. М.»
Географгиз, 1960.
Архипова Е. П., Глебова М. Гольцберг И. А.»
Романова Е. Н., Микроклиматические наблюдения в совхозах и
колхозах. Л., Гидрометеоиздат, 1962.
Бескровный М. А. Практикум по экологии животных, ч. 1.
Харьков, 1953.
Большаков А. Ф. О формах движения влаги в почвах степ-
ного типа. Почвоведение, № 7, 1946.
Будаговский А. И. Некоторые задачи и методы изучения
водного и теплового режимов сельскохозяйственных полей. Изд-во
АН СССР, сер. геогр., № 6, 1958.
Будаговский А. И. Испарение почвенной влаги. Изд-во
«Наука», 1964.
В е р и г о С. А., Р а з у м о в а Л. А. Почвенная, влага и ее зна-
чение в сельскохозяйственном производстве. Гидрометеоиздат, 1963.
Гейер Р. Климат приземного слоя воздуха. Сельхозгиз, 1931.
Гольцберг И. А. Микроклимат и его значение в сельском хо-
зяйстве. Л., Гидрометеоиздат, 1957.
Гольцберг И. А. (ред.) Микроклимат холмистого рельефа
и его влияние на сельскохозяйственные культуры. Л., Гидрометеоиз-
дат, 1962.
Данилевский А. С. иГейспиц К. Ф. Влияние суточной
периодичности освещения на сезонную цикличность насекомых. Докл.
АН СССР, т. IX, № 2, 1948.
Жарков С. Н. Метеорологические наблюдения в школе. ГИЗ,
1928.
Ишерская Е. В. Особенности микроклимата степной полосы
Саратовской области. Сб.: Вопросы климата и погоды Нижнего По-
волжья, вып. 3. Изд-во Саратов, ун-та, 1967.
К а л а бу хов Н. И. Методика экспериментальных исследований
по экологии наземных позвоночных. М., 1951.
Кедроливанский В. Н. Методика метеорологических на-
блюдений, 1946.
Кедроливанский В. Н. и С'тернзат М. С. Метеороло-
гические приборы. Л., 1953.
Кладо Т. Н. Климат, его значение и методы изучения. Л., 1949.
Ко ж а нч и ко в И. В. Экспериментально-экологические методы
в энтомологии. Изд. ВАСХНИЛ, 1937.
К ож а нчико в И. В. Дыхание насекомых при температуре ни-
же 0. Докл. АН СССР, т. III, № 8, 1935.
К о ж а н ч и к о в И. В. Черты влияния отрицательной темпера-
туры на эмбриональное развитие насекомых. Журн. общ. биол., т. X,
№ 1, 1949.
Колобов Н. В. Метеорологические приборы. М.—Л., 1932.
Кондратьев К. Я., Логинова 3. А. О прямых методах
390
определения температуры подстилающей поверхности. Вестник ЛГУ,
№ 22, серия физики и химии, вып. 4, 1956.
Кондратьев К. Я- Актинометрия. ГИМИЗ, 1965.
Короткевич В. Н. Обзор работ по изучению микроклимата.
Тр. Гл. геофпз. обсерв., вып. 6, 1936.
Коростелев Н. А. К методике микроклиматических исследо-
ваний. Вестник единой гидрометслужбы, № 7, 1937.
Костин С. И. К методике изучения влияния лесных защитных
полос на микроклимат. Научн. зап. Воронежск. лес. хоз. ин-та, т. IX,
1946. '
Кучеров Н. В., Стернз ат М. С. Приборы для исследова-
ния метеорологического режима в приземном слое атмосферы. Сб.:
Соврем, проблемы метеорологии приземн. слоя воздуха. Л., ГИМИЗ,
1958.
Лсвошин В. К. Рельеф и микроклимат в садоводстве По-
волжья. Тр. Саратовского с.-х. ин-та, вып. 10, 1957.
Лю идеи горд Г. Влияние климата и почвы на жизнь расте-
ний. М., 1937.
Мельниченко А. Н. Полезащитные полосы и размножение
животных, полезных и вредных для сельского хозяйства. Изд. Моск,
общ. исп. природы, 1949.
Мищенко 3. А. О температуре деятельной поверхности в мик-
роклиматических исследованиях. Тр. ГГО, Вып. 180, 1965.
Мйщенко *3. А. Тепловой баланс и температура растений.
Тр. ГГО, вып. 190, 1966.
Мончадский А. С. О типах реакции насекомых на измене-
ние температуры, окружающей среды. Изв. АН СССР, Сер. биол.,
№ 2, 1949.
Мурашев С. И. и Кузнецова 3. И. Руководство по изу-
чению снегового режима в лесах. Тр. Всесоюз. ин-та лес. хоз., вып. 4,
1939.
Нефедов Н. И. К методике проведения экологических экскур-
сий. Сталингр. обл. ин-т усоверш. учит. Сталинград, Облкнигоиздат,
1948.
Палечек А. И. Опыт определения микроклимата в экскурси-
онной обстановке. Тр. Биол. н.-и. ин-та при Пермск. гос. ун-те, т. I,
вып. 4, 1928.
Пивоварова 3. И., Гуляев Б. И. Актинометрические на-
блюдения в лесу. Тр. ГГО, вып. 86, 1958.
Преображенский С. М. Климатологические работы в за-
поведниках. Научн.-метод, зап. Гл. упр. по заповеди., вып. 9, 1947.
Рихтер Г. Д. Роль снежного покрова в физико-географиче-
ском процессе. Тр. Инет, геогр. АН СССР, т. XI, 1948.
Руководство метеорологическим станциям II разряда. Изд. 6,
1940.
Сапожникова А. С. Микроклимат и местный климат. Гид-
рометеоиздат, Л., 1950.
Сахаров Н. Л., К изучению холодостойкости насекомых.
Журн. опытн. агрономии Юго-Востока, т. VI, вып. 2, 1928.
Стрельников И. Действие солнечной радиации на темпера-
туру тела некоторых пойкилотермных животных. Изв. инет. им. Лес-
гафта, № 17—Л 8, 1934.
Стрельников И. Д. Значение солнечной радиации в эколо-
гии высокогорных рептилий. Зоол. журн., т. 23, вып. 5, 1944.
391
Стрельников И. Д. Изучение микроклимата нор грызунов.
Сб. Всесоюз. ин-та защ. раст., № 4, 1932.
Сукачев В. Н. Биогеоценология и фитоценология. Докл. АН
СССР, т. 13, № 6, 1945.
Тверской П. Н. (ред.) Курс метеорологии (Физика атмос-
феры). Л., 1951.
Темникова Н. С. О методах изучения микроклимата. Метео-
рология и гидрология, № 5, 1959.
Т о л ь с к и й А. П. Определение температур лесных древесных
насаждений. Сб. тр. Поволж. лесотехн, ин-та, № 1, 1941.
Фигуровский И. В. Агрометеорология. Баку, 1932.
Формозов А. Н. Особый тип климатограмм для целей эколо-
гических исследований. Уч. зап. МГУ, т. 11, 1934.
Чудновский А. Ф., Розен шток Ю. Л. Автоматическая
регистрация испарения сельскохозяйственного поля. Сб. трудов по
агроном, физике, вып. 8, 1960.
Шаронов В. В. (ред.) Таблицы для расчета природной осве-
щенности. М.—Л., Изд-во АН СССР, 1945.
Шмидт П. Ю. Анабиоз. Из-во АН СССР, 1948.
Щербань М. I. Деяю питания теори м!крокл!мату та мето-
дики М1крокл1матичных досл!джень. В1сник КДУ, cepin геологи та
географп, № 8, 1967.
Щербань М. И. Микроклиматология. Изд. Киевск. ун-та,
1968.
Щ е р б и н о в с к и й Н. С. Местная природа и сельское хозяй-
ство Москвы. Изд-во «Новая деревня», 1926.
Янишевский Ю. Д. Методические указания по фитоактино-
метрическим наблюдениям. Руков. по агрометеорология, набл. и
исслед., вып. 3, 1940.
Янишевский Ю. Д. Актинометрические приборы и методы
наблюдении. ГИМИЗ, 1957.
Агроклиматические и фенологические наблюдения
Бейдеман И. Н. Методика фенологических наблюдений при
геоботанических исследованиях. М.—Л., 1954.
Данилевский А. С. Фотопериодизм и сезонное развитие
насекомых. Изд-во ЛГУ, 1961.
Данилевский А. С. и Гейспиц К. Ф. Влияние суточной
периодичности освещения на сезонную цикличность насекомых. Докл.
АН СССР, т. IX, №2, 1948.
Добровольский Б В. О единой системе фенологических
обозначений. Защита растений от вредителей и болезней, № 4, 1957.
Добровольский Б. В. Вредные жуки, Ростов-на-Дону,
1951.
Добровольский Б. В. Фенология насекомых-вредителей
сельского хозяйства. Изд-во «Высшая школа», 1961.
Добровольский Б. В. Комплексное исследование феноло-
гии растений и насекомых. В кн.: Морфология растений. Изд-во МГУ,
т. I, 1961.
Долгошев В. И. Индикаторы выставки пчел. В кн.: Кален-
дарь природы СССР, кн. 2. М., Изд. МОИП, 1949.
392
Забиров Ш. М. Условия, регулирующие сезонные циклы раз-
вития свекловичной (Pegomyia hjosciami) и капустной (Hylcmyia
brassicae) мух. Энтомологии, обозр., т. 40, вып. 2, 1961.
3 Дановский И. А. Наблюдение периодических явлений при-
роды, М., 1928.
Кайгородов Д. Н. Наглядное изображение времени цвете-
ния, облиствения, опадания листьев, а также созревания и сбора се-
мян и плодов у древесных и кустарниковых растений. СПб., 1907.
Календарь русской природы, кн. I. М., 1948.
Календарь природы СССР, кн. II. М., Изд. М(УИП, 1949.
К а п п е р В. Г. Об организации ежегодных систематических на-
блюдений над плодоношением древесных пород. Тр. по лесн. опытн.
делу, вып. 8, 1930.
Н а р ч у к Э. П. Краткая программа фенологических наблюде-
ний. Географ^ общ., фенол, сектор, 1961.
Палий В. Ф. Методика фенологических и фаунистических ис-
следований насекомых, 1966.
Попов А. Г. и Шапраевский В. Б. Инструкция и про-
грамма к ведению основных фенологических наблюдений, 1939.
Попов Н. В. Фенологические наблюдения в школе. Учпедгиз,
1950.
Райков Б. Е. и Римский-Корсаков М. Н. Зоологиче-
ские экскурсии, изд. 5. М.—Л., Учпедгиз, 1948.
Руденко А. И. Краткое руководство к определению фаз раз-
вития главнейших хлебных злаков. Изд. Урал. обл. зем. упр. Сверд-
ловск, 1926.
Руденко А. И. Определение фаз развития сельскохозяйствен-
ных растений, 1950.
Руднев Г. В. Агрометеорология. Л. Гидрометеоиздат, 1964.
Руководство по производству агрометеорологических наблюде-
ний, 43-е изд. Л., 1951.
Святский Д. Спутник краеведа — любителя природы. Спра-
вочная книга краеведа, естественника и фенолога. Л., 1926.
С е в е р ц о в И. А. Периодические явления в жизни зверей,
птиц и гад Воронежской губернии. М., 1950.
Шубин В. Я. Вредители сельскохозяйственных культур сред-
ней полосы европейской части СССР, их появление и движение в за-
висимости от сезонных явлений. В кн.: Календарь природы СССР,
кн. 2, М., Изд. МОИП, 1949.
Щербиновский Н. С. Сезонные явления в природе, 3-е изд.,
1954.
Як провадити загальш спостережения над смьськогосподарськи-
ми культурами. Укрмет, КиТв, 1929.
Изучение почвы и растительности
Алехин В. В. Методика полевого изучения растительности и
флоры. М., 1938.
Аринушкина Е. В. Руководство по химическому анализу
почв. Изд-во МГУ, 1962.
Безсонов А. И. Исследование почв в поле, 1931.
Берг Л. С. Географические зоны Советского Союза, т. I. М.,
Географгиз, 1947, т. II, 1952.
14—1867
393
Болотов А. Т. Избранные сочинения по агрономии, плодо-
водству, ботанике. М., 1952.
Большаков А. Ф. О формах движения влаги в почвах степ-
ного типа. Почвоведение, № 7, 1946.
В а д ющ и н а А. Ф., Корчагина 3. А. Методы исследова-
ния физических свойств почв и грунтов. Изд-во «Высшая школа»,
1961.
Вильямс В. Р. Почвоведение с основами земледелия. Сель-
хозгиз, 1946.
Гиляров М. С. Особенности почвы как среды обитания и
ее значение в эволюции насекомых. Изд-во АН СССР, 1949.
Гросгейм А. А. Программа и методика работ на геоботани-
ческих стационарных пунктах. Тр. по геобот. обслед. пастб. Азер-
байджана, сер. С, вып. 5. Баку, 1931.
Домрачева Е. А. Физико-механический и химический анализ
почвы. Л., СХГИЗ, 1939.
Захаров С. А. Краткий курс практических занятий по почво-
ведению. М.—Л., ГИЗ, 1930.
3 о н н С. В., Б а з и л е в и ч Н. И. Изучение почвы как компо-
нентов беогеоценоза. В кн.: Программа и методика беогеоценологи-
ческих иссл. Изд-во «Наука», 1966.
Ковригин С. А. Лесное почвоведение (гл. XXII. Исследова-
ние почв в поле). Гослесбумиздат, 1949.
Корбасников М. Н. Барометрическое нивелирование. Прак-
тическое пособие для определения относительных и абсолютных вы-
сот с помощью анероидов. Для географов, геологов, геоморфологов,
почвоведов и ботаников. Л., 1938.
Красильников П. К. К вопросу о методике изучения кор-
невых систем древесных пород при экспедиционных геоботанических
исследованиях. Ботанич. журн., т. 36, вып. 1, 1950.
Красюк А. А. Почвы и их исследование в природе. М.—Л.,
1929.
Лавренко Е. М. К методике изучения подземных частей фи-
тоценозов. Ботанич. журн., т. 32, вып. 6, 1947.
Люнденгорд Г. Влияние климата и почвы на жизнь расте-
ний. М., 1937.
Мищенко 3. А. Тепловой баланс и температура растений.
Тр. ГГО, вып. 190, 1966.
Нестеров В. Г. Методика изучения естественного возобнов-
ления лесов. Красноярск, 1948.
Петров Б. Ф. Изучение почв. Сб.: «Справочник путешествен-
ника и краеведа», т. II. М., Географгиз, 1950.
Работы о в Т. А. Жизненный цикл многолетних травянистых
растений в луговых ценозах. Тр. Бот. ин-та АН СССР, сер. III, Гео-
ботаника, вып. 6, 1950.
Раменский В. Г. Введение в комплексное почвенно-геобота-
ническое исследование земель, 1938.
Роде А. А. Методы изучения водного режима почв. Изд-во
АН СССР, 1960.
Садовников И. Ф. Руководство к производству почвенных
исследований, 1946.
Сукачев В. Н. Дендрология с основами геоботаники, 1938
Сукачев В. Н. Руководство к изучению типов леса, изд. 3,
1931.
394
Сукачев В. И. Биоценология и фитоценология. Докл. АН
СССР, № 6, 1945.
Сукачев В. Н. О соотношении понятий географический ланд-
шафт и биогеоценоз. Вопросы географии, № 16, 1949.
Сукачев В. Н., Лавренко Е. М., Ларин И. В. (ред.).
Краткое руководство для геоботанических исследований в связи с
полезащитным лесоразведением и созданием устойчивой кормовой
базы на юге европейской части СССР. Изд-во АН СССР, 1952.
Сукачев В. Н. О некоторых современных проблемах изуче-
ния растительного покрова. Ботанич. журн., № 41, вып. 4, 1956.
Утенкова А. П. Процесс минерализации листьев дуба и со-
путствующих пород. Тр. Воронеж, ун-та, № 36, 1956.
Ш а л ы т М. С. Подземная часть некоторых луговых, степных и
пустынных растений и фитоценозов. Тр. Бот. ин-та АН СССР, сер. III.
Геоботаника, вып. 6, 1950.
Шапошникова Л. К. Условные знаки для лесных карт
СССР. М., Изд-во АН СССР, 1951.
Шиголев А. А., Шиманюк А. Н. Сезонное развитие при-
роды европейской части СССР. Госиздат геогр. лит-ры, 1949.
Щукин И. С. Геоморфологические исследования. Сб.: «Спра-
вочник путешественника и краеведа», т. 2, 1950.
Почвенная фауна
Архангельский Н. Прибор для механического отделения
вредителей из почвы путем отмучивания. Сборник ВИЗР, № 6, 1933.
Беклемишев В. иЧетыркина И. К биологии половодья.
Вопросы экологии и биоценологии, сб. 2, 1935.
Бельский И. Б. и Кузьмин Н. А. Обследование почвы на
залегание вредных насекомых. Советская агрономия^ № 12, 1947.
Березина В. М. Размещение почвенной энтомофауны на пес-
чаных и каштановых почвах камышинского лесомелиоративного уча-
стка. Итоги н.-и. работ Всесоюз. ин-та защиты раст., ч. 1, 1936.
Березина В. М. Комбинированные приманки для борьбы с
жуками-чернотелками. Лесное хозяйство, № 5, 1949.
Богдан о в-Катьков Н. П. Энтомологические экскурсии
на огороды и бахчи, 1933.
Божко М. П. Протистофауна каштановых грунпв посушливо-
го степу Аскашя-Нова. Пращ наук. доел, зоолого-бюл iH-ту, IV.
Харк1в, 1937.
Божко М. П. Tardigrada европейской части СССР. Тр. Харь-
ковск. унив. Юбилейный сборник, 1936.
Божко М. П. Перни вщомосп про фауну Tardigrada в доли-
ni р. Дшця i ii розподм за бютопами. Пращ н.-д. зоологобюлог.
1нст. XDy, т. 4, 1937.
Боровкова А. М. Обследование площадей на выявление
картофельной нематоды посредством отбора и анализа почвенных
проб. Методы исследования нематод растений, почвы и насекомых.
Изд-во АН СССР, 1963.
Бродский А. Л. Исследования по фауне почв. Ташкент, Изд.
Комитета наук УзССР, 1937.
Бродский А. Л. и Бродский К. А. Материалы к позна-
нию фауны почв Средней Азии. Изв. ин-та почвовед, и геоботаники
Ср.-Аз. ун-та, вып. 3, 1927.
14* 395
Брянцев В. М. К методике исследования состава почвенной
энтомофауны. Защита растений, т. III, № 4—5, 1926.
Буланова-Захваткина Е. М. Сбор и исследование пан-
цирных клещей. Изд-во АН СССР, 1952.
Буланова-Захваткина Е. М. Панцирные клещи-ориба-
тиды. Изд-во «Высшая школа», 1967.
Галахов П. Н. Динамика сезонного перемещения личинок
щелкуна в почве и эффективность различных мер борьбы с ним.
Докл. Всесоюз. акад. с.-х. наук им. В. И. Ленина, вып. 1, 1950.
Гиляров М. С. Сухая фиксация формы и окраски личинок
почвенных вредителей. Защита растений, № 15, 1937.
Гиляров М. С. Полевой метод оценки сравнительной привле-
кательности различных культур для живущих в почве вредителей.
Защита растений, № 15, 1937.
Гиляров М. С. Почвенные вредители и обработка почвы, За-
щита растений, № 14, 1937.
Гиляров М. С. Факторы, определяющие вредность почвенных
вредителей и их значение для культуры каучука. Защита растений,
№ 13, 1937.
Гиляров М. С. Методы количественного учета почвенной
фауны. Почвоведение, № 4, 1941.
Гиляров М. С. Особенности почвы как среды обитания и ее
значение в эволюции насекомых. М.—Л., Изд-во АН СССР, 1949.
Гиляров М. С. (ред.) Определитель обитающих в почве ли-
чинок насекомых. Изд-во «Наука», 1964.
Гиляров М. С. Исследование почвенной фауны и некоторые
наблюдения над насекомыми при геоботанических исследованиях.
В кн.: Полевая геоботаника, т. III. Изд-во «Наука», 1965.
Гиляров М. С. Зоологический метод диагностики почв. Изд-во
«Наука», 1965.
Гранкина К. Промывка почвы как способ учета мелких поч-
венных насекомых. Защита растений, № 9, 1936.
Григорьева Т. Г. Приманочный метод борьбы с щелкунами
в комплексе мероприятий по борьбе с их личинками-проволочниками.
Тр. научн.-произв. конф, по сельскому хозяйству Карело-Финск.
ССР. Петрозаводск, 1946.
Григорьева Т. Г. К методике учета почвенной фауны. За-
щита растений, № 17, 1938.
Гусев В. И. и Антонюк С. И. К вопросу о способе перед-
вижения личинок пластинчатоусых жуков в почве. Энтомологиче-
ское обозрение 35, № 1, 1956.
Дарвин Ч. Образование растительного слоя деятельностью
дождевых червей, 1939.
Д и м о Н. А. Земляные черви в почвах Средней Азии. Почвове-
дение, № 4, 1938.
Д и м о Н. А. Роль и значение термитов в жизни почв и грунтов
Туркестана, Русское почвоведение, № 6—7, 1916.
Д л у с с к и й Г. М. Методы количественного учета почвообитаю-
щих муравьев. Зоолог, журн., № 44, вып. 5, 1965.
Добрачев В. Ф. Методы учета гнезд муравьев рода Formica
в лесном хозяйстве. Изв. высш, учебн. завед. Лесной журн., № 4,
1966.
Добровольский В. К. К методике изучения почвенных вре-
дителей. Защита растений № 1, 1935.
'396
Догель В. А. Современное состояние вопроса о почвенных
простейших. Изв. Гос. ин-та опыт, агрон., т. IV, № 3, 1926.
Догель В., Раммельмейер Е. и Стрелков А. К ме-
тодике наблюдений над почвенными Protozoa. Тр. Отд. с.-х. микро-
биол., т. II, 1923.
Дигул ьс к ая 3. А. Особенности населения муравьев основ-
ных типов ландшафтов котловины Тувы и Южн. Хакассии. В кн.:
Структура и функционально-биогеоценотическая роль животного на-
селения суши. Материалы совещания, 1967.
Захваткин А. А. Тироглифоидные клещи СССР. Фауна
СССР, т. VI, вып. 1, Изд-во АН СССР, 1941.
Знаменский А. В. Пособие для производства обследования
энтомофауны почвы. ЦУП ВСНХ СССР, 1927.
Зражевский А. И. Дождевые черви как фактор плодородия
лесных почв. Киев, Изд-во АН УССР, 1957.
I в а н о в С. П. Методи кьльккного облшу наземно! фауни,
Харк1в, 1930.
Иванов С. П. [и др.]. Руководство к обследованию вредной
энтомофауны почвы. Тр. Всесоюз. н.-и. ин-та сахарной промышлен.
Киев1—Полтава, ВНИС, 1937.
Ильинский А. И. Определитель яйцекладок, личинок и ку-
колок насекомых, вредных в лесном хозяйстве. М., Гослестехиздат,
1948.
Ильинский А. И. Долгоносики — вредители полезащитных
питомников и посадок. Лесное хозяйство, № 8, 1949.
Ильинский А. И. Обследование заселенности почвы вредны-
ми насекомыми при защитном лесоразведении. Гослесбумиздат,
1951.
'Карпачевский Л. О., Перель Т. С. Участие дождевых
червей в разложении лесной подстилки. В кн.: Структура и функцио-
нально-биогеоценотическая роль животного населения суши. Мате-
риалы совещ., 1967.
Кирьянова Е. С. К вопросу о вертикальном и горизонталь-
ном распределении фауны беспозвоночных в почвах окрестностей
Ташкента. Тр. ЗИН АН СССР, т. 3, 1936.
Кирьянова Е. С. Сбор и изучение галловой и других рас-
тениеядных нематод. М.—Л., Изд-во АН СССР, 1950.
Космачевский А. С. Влияние влажности почвы на личинок
хрущей. Докл. АН СССР, т. 10, № 6, 1943.
Космачевский А. С. Методика воспитания почвенных насе-
комых. Вторая Экологии, конф. Тезисы докл., ч. 3, 1950.
К р а л л ь Э. Л. Некоторые методы выделения фитонематод из
почвы. Методы исследования нематод растений, почвы и насекомых.
Изд-во АН СССР, 1963.
Кривошеина Н. П., Мамаев Б. М. Определитель личи-
нок двукрылых насекомых — обитателей древесины. Изд-во «Наука»,
1967.
К р ы ш т а л ь О. П. Ентомолопчн! екскурси в середнш школ!,
Кшв, 1955.
Кришталь А. Ф. К изучению динамики энтомофауны почв и
подстилки в связи с половодьем в условиях долины среднего течения
р. Днепра. Зоолог, журн., т. 34, вып. 1, 1955.
Кришталь О. П. Ентомофауна грунту та шдстилки в дрдищ
середньо! течи р. Дншра. Вид. КДУ, 1956.
397
Кудрин А. И. К вопросу о применении земляных ловушек
для изучения распределения и взаимодействия элементов энтомофау-
ны на поверхности почвы. Тр. Всесоюзн. энтом. о-ва, т. 50, 1965.
Курчева Г. Ф. Роль почвенных животных в разложении ду-
бового опада. Почвоведение, № 4, 1960.
Линдеман И. В. Руководство для наблюдений и полевого
обследования вредителей сахарной свеклы. Изд. НИС, 1930.
Лихарев И. М. и Е. С. Раммель мейер. Наземные мол-
люски фауны СССР. Изд-во АН СССР, 1952.
Лихарев И. М. Клаузилииды (Clausilliidae). Фауна СССР,
т. III, вып. 4, 1962.
Лобанова Н. А. Обследование посевов картофеля на выяв-
ление очагов картофельной нематоды. Методы исследования нематод
растений, почв и насекомых. Изд-во АН СССР, 1963.
Малевич И. И. Собирание и изучение дождевых червей, 1950.
Мамаев Б. М. Зоологическая оценка стадий естественного
разрушения древесины. Изд-во АН СССР, сер. биол., № 4, 1960.
Мамаев Б. М. Деятельность крупных беспозвоночных — один
из основных факторов естеств. разрушения древесины. Pedobiologia
1, 1961.
Матекин П. В. Фауна наземных моллюсков Нижнего По-
волжья и ее значение для представления об истории современных
лесов района. Зоолог, журн., т. 29, вып. 10, 1950.
Медведев С. И. Личинки пластинчатоусых жуков фауны
СССР, 1953.
Николюк В. Влияние корневой системы хлопчатника на поч-
венных простейших. Доклады АН УзССР, 1949.
Островский Н. М. Влияние влажности почвы на числен-
ность и развитие амбарных клещей. Итоги н.-и. работ Всесоюзн.
ин-та защиты растений, ч. 1, 1936.
Перель Т. С., Карпачевский Л. О., Егоров С. В.
Роль дождевых червей в формировании подстилки и гумусового го-
ризонта лесных почв. Pedobiologia Bd. 6, Н 3/4, 1966.
Положенцев П. А. Об изучении червей, паразитирующих в
насекомых СССР. Бюлл. Моск. общ. испыт. прир., т. 6, № 1, 1957.
Положенцев П. А. К методике сбора и изучения мермитид.
Всесоюзн. совещ. по почвенной зоологии. Тез. докл. Изд-во АН
СССР, 1958.
Положенцев П. А., Артюховский А. К. К методике
изучения мермитид (Mermithidae, Nematoda). Методы исследования
нематод растений, почвы и насекомых. Изд-во АН СССР, 1963.
Положенцев П. А., Негробов В. Н. О насекомых —
хозяевах паразитических червей. Вредные и полезные насекомые.
Изд. Воронежск. ун-та, 1967.
Пономарева С. И. Роль дождевых червей в создании проч-
ной структуры’ в травопольных севооборотах. Почвоведение, № 8,
1950.
Пономарева С. И. Влияние жизнедеятельности дождевых
червей на создание устойчивой структуры дерново-подзолистой поч-
вы. Тр. Почв, ин-та им. В. В. Докучаева, № 41, 1953.
Потемкина В. А. К методике содержания клещей-орибатид
в лабораторных условиях. Зоолог, журн., № 38, вып. 2, 1959.
Принц Я. И. [и др.]. Влияние кислотности почвы на распреде-
ление в ней личинок хрущей майского, июньского, мраморного хлеб-
398
ного жука и проволочника Agriotes obscurus. Итоги н.-и. работ Все-
союзн. ин-та защиты растений, ч. 1, 1936.
Принц Я. И. К методике экологических исследований. Защита
растений, № 3, 1935.
Рабинович А. Б. Разведение дождевых червей. Птицеводст-
во, № 6, 1953.
Р эсс ель. Почвенные условия и рост растений, М., 1936.
Рубцов И. А. К рационализации методики обследования пло-
щадей, занятых одиночными саранчовыми. Тр. по защите раст.
Восточн. Сибири, вып. 2(4).
Савинский П. И. Метод сохранения формы и жизненной
окраски гусениц, личинок насекомых, рыб и других объектов при
высушивании. Зоолог, журн., т. 32, вып. 6, 1953.
Сент-Иллер К. К. Наблюдение над фауной почвы окрест-
ностей города Воронежа. Тр. Ворон, гос. ун-та, т. 10, вып. 3. Воро-
неж, 1938.
Ситникова Л. Г. Жизненные циклы некоторых панцирных кле-
щей и методы их культивирования. Зоолог, журн., т. 38, вып. 2, 1959.
Соколов А. А. Значение дождевых червей в почвообразова-
нии. Изд. АН Каз. ССР, 1956.
С к а р б и л о вич Т. С. Методика изучения и техника сбора ма-
териала по вредным нематодам растений. Сб. работ по нематодам
с.-х. растений. Сельхозгиз, 1939.
Старк В. Н. Методы изучения и обследования энтомофауны
почвы лесных насаждений. I. Значение генетических горизонтов
почвы. Защита растений от вредителей, т. 6, № 5—6, 1930.
Тулаганов А. Т. Растениеядные и почвенные нематоды Узбе-
кистана. Ташкент, Изд-во АН УзССР, 1949.
Филатова 3. А. Класс тихоходок (Tardigrada). Руководство
по зоологии, т. III. Изд-во «Сов. Наука», 1951.
Филипьев И. Н. Инструкция для собирания свободноживу-
щих нематод. Петр. агр. ин-т н.-и. отд. энтом. ст., сер. В, № 3, 1922.
Филипьев И. Н. Нематоды вредные и полезные в сельском
хозяйстве. М.—Л., Сельхозгиз. 1934.
Фридерикс К- Экологические основы прикладной зоологии
и энтомологии, 1932.
Чекановская О. В. Дождевые черви и почвообразование.
Изд-во АН СССР, 1960.
Чернова Н. М. Динамика численности коллембол в компос-
тах из листового опада. Зоолог, журн., т. 42, вып. 9, 1963.
Ч е т ы р к и н а И. А. Почвенно-зоологический профиль пойм
левого берега реки Камы. Изв. биол. н.-и. ин-та, т. 5, вып. 2, Пермь,
1926.
Шиперович В. Я- Фауна почв и древостоев в различных
типах леса заповедника «Бузулукский бор». Зоолог, журн., т. 18,
вып. 2, 1939.
Щеголев В. Н. [и др.]. Насекомые, вредящие полевым куль-
турам. Сельхозгиз, 1937.
Эглитис В. К- Почвенная фауна Латвийской ССР. Рига,
Изд-во АН Латв. ССР, 1954.
В е г 1 е s е A. Appacchio per raccogliere presto piccole artropodi,
Redia V. 2, 1905.
Cutler D. W. A method for estimating the number of active
Protozoa in the Soil. Journ. agric. Sci, vol. 10, 1920.
399
Daniel A flotation method for determining abundance of potato
flea beetle laryae. Journ. Econ. Ent., XXVI, 1933.
Franz H. Bodenzoologie als Grundlage der Bodenpflege. Berlin,
1950.
FranceR. Das Edaphon. Stuttgart, 1921.
Gray P. H. Apparatus for rapid sorting of small insects. Ento-
mologist, 88, 1955.
Holdhaus K. Die Siebetechnik zum Aufsammeln der Terrikol-
fauna. Zeitsh. wiss. Insectenbiol. B. 6. 1910.
King К. M. The valua of quantitative methos in the investiga-
tion of field crop insects. Vortz. Ent. Intern. Kongr., 1928.
L a d e 11 W. K. A new apparatus for separating insects and other
Arthropodes form the Soil. Ann. Appl. Biol. 23, 1936.
L о z e к V. Klic ceskoslovenskych mekkysu. Bratislava, 1956.
M a e 1 zer D. A. Value of the pF scale for water in an ecological
study of an insect living in Soil. Nature, 178, 1956.
Martin С. H. and Lewin K. R. Journ. agric. Sci., vol. 1, 1915.
Morris H. M. The insect and other invertebrata fauna of arable
land at Rothemsted. Ann. Appl. Biol., vol. 9, 1922.
Morris H. M. One Method of Separating insects and other
Arthropodes from Soil. Bull, ent Reser., vol. 13, 1922.
Matteson Q. W. Flotation technique for extracting eggs of
Diabrotica spp. and other organisms, from Soil. j. Econ. Entomol., 59,
1, 1966.
Read D. S. An apparatus for removing puparia and larve from
Soil. Ganad. j. Agric. Sci., 36, N 3, 1956.
Sankey John. Zoology in the field. Biol and Human Affairs.
28, 1, 1962.
Seinhorst J. W. Modifications of the olutriation method foi
extracting nematodes from soil. Nematodologica, 8, 2, 1966.
Stach J. Owady bezskrzydle (Apterygota). Fauna sladkowodno
Polski, 18. Warszawa, 1951.
Tu 11 gren Alb. Ein sehr einfacher Anschloseapparat fur terricole
Tierformen. Zeit. angew. Ent., IV, 1917.
Turnock W. J. A trap for insects emerging from the soil. Canad
Entomologist, 89, N 10, 1957.
W a e d e Monfred. Uber die Anwendung eines Erbohrers fur
Ermittlung der Tiefenlage von Insecten im Boden. Nachrichtenbl.
Dtsch. Pflanzenschutzdienst (BRD), 13. N 6, 1961.
Изучение наземной фауны
Авдеева Е. А. и Овчинникова А. А. Руководство по
учету вредителей и болезней плодовых культур. Северная и средняя
зоны СССР. М.—Л., 1934.
Алексеев А. Н. Использование всасывающего коллектора
автомашины для сбора насекомых в полевых условиях. Мед. пара-
зитол. и паразитарные болезни, т. 31, № 2, 1962.
Алпатов В. В. Экология как направление краеведческой ра-
боты.-Краеведение, № 1, 1923.
‘Андреев С. В., Б у б н о в Г. М., Мартенс Б. К., Мол-
чанова В. А. Автоматическая ловушка. Защита растений от вре-
дителей и болезней, № 9, 1962.
400
Аристов М. Т. Руководство по учету вредителей плодового
сада для наблюдательных пунктов службы учета, 1934.
Артюховский А. К. Мермитиды, паразитирующие во вред-
ных для леса чешуекрылых Воронежской области. Сб. работ аспи-
рантов Воронежск. лесохоз. ин-та, 1955.
Баскина В. и Фридман Г. Статистическое исследование
животного населения двух сообществ Камской поймы. Тр. Биол.
н.-и. ин-та и биолог, станции при Пермском гос. ун-те, т. 1, вып.
2—3. Пермь, 1926.
Бегляров Г. А., Танский В. И. О метоДах изучения неко-
торых мелких растениеобитающих членистоногих. Четвертый съезд
Всесоюз. энтомолог, об-ва, ч. 1, 1959.
Бей-Биенко Г. Я. Руководство по учету саранчовых. Л.,
Изд-во УСУ ОБВ, 1932.
Бей-Биенко Г. Я. К вопросу о значении уборочных машин
в борьбе с вредными насекомыми. Защита растений, № 17, 1938.
Беклемишев В. Н. Основные понятия биоценологии в при-
ложении к животным компонентам наземных сообществ. Тр. по за-
щите раст., т. 1, вып. 2, Л., 1941.
Б и р у л я Н. Б. Материалы к познанию метода энтомологиче-
ского кошения. III Совещ. Всесоюзн. энтом. об-ва, ч. 1, М.—Л., 1957.
Бируля М. Б. К обоснованию предмета зооценологии с по-
мощью физико-географич. критерия. В кн.: Структура и функциб-
нальн^-биогеоценот. роль животного населения суши. Матер, совещ.,
1967.
Богданов-Катьков Н. Н. Энтомологические экскурсии
на огороды и бахчи, 1933.
Богуш П. П. Применение световых самоловок как метод изу-
чения динамики численности насекомых. Энтомол. обозр., т. 31,
№ 3—4, 1951.
Владимирский Н. Опыт работы на экскурсионной станции.
(Из практики экскурсионной биологич. станции Рыбинск, н. об-ва).
Естествознание в школе, № 3—4, 1923.
Владимирский А. П. Результаты колич. учета фауны от-
дельных растений. I. Колич. учет фауны, обитающей на листьях де-
ревьев. Тр. Лен. общ. естествоисп., т. IV, вып. 2, 1925.
Владимирский А. П. Количественный учет фауны плодов.
Тр. II съезда зоологич. анат. и гистол., 1925.
Владимирский А. П. Результаты количественного учета
фауны отдельных растений. Тр. Всерос. съезда зоол., 1922.
Владимирский А. П. Результаты количественного учета
фауны отдельных растений. II. Колич. учет фауны, обитающей на
травянистых растениях. III. Колич. учет фауны цветов. Тр. Петергоф-
ского ест.-научн. ин-та, № 3, Т926.
Владимирский А. П. Велико ли количество животных в
окружающей нас природе. Естествознание в школе, № 5—6, 1923.
Воронцов А. И., Иерусалимов Е. М., Мозолев-
с к а я Е. Г. Роль листогрызущих насекомых в лесных биоценозах.
Журн. общей биол., т. 27, вып. 6, 1966.
Второв П. П. О первичной обработке результатов количест-
венных учетов животного населения. В кн.: Структура и функц.-
биогеоц. роль животного населения суши. Материалы совещ., 1967.
Гиляров М. С. Изучение беспозвоночных животных как ком-
401
понента биоценоза. В кн.: Программа и методика биоценологических
исследований. Изд-во «Наука», 1966.
Головьянко 3. С. К методике учета зараженности сосны
короедами. Тр. по лков, доев. спр. на Украшь кн. IV, 1926.
Горностаев Г. Н. Конструкция ловушек с источниками све-
та для ночных насекомых. Вестник МГУ, №4, 1961.
Горы шин В. И. (1956) СМ; 1.
Гринфельд Э. К. Питание цветочных мух Syrphidae и их
роль в опылении растений. Зоолог, журн., т. 34, 1955.
Гринфельд Э. К. Происхождение антофилии у насекомых.
Изд-во ЛГУ, 1962.
Гудощикова В. Суточная миграция животных в комплексе
ассоциации. Тр. биолог, ин-та и биолог, станции при Пермском гос.
ун-те, т. 1, вып. 4, 1928.
Гусев В. И. и Р и м с к и й - К о р с а к о в М. Н. Определитель
повреждений лесных и декоративных деревьев и кустарников евро-
пейской части СССР. М.—Л., 1934; 3-е изд. 1951.
Догель В. А. Энтомологическая экскурсия в Старый Петер-
гоф. Естествознание в школе, № 3, 1925.
Догель В. А. Количественный анализ фауны лугов в Петер-
гофе. Исследования по качественному анализу наземной фауны. Рус-
ский зоол. журн., т. IV, вып. 1—2, 1924.
Домбровская Е. В. Инструкция по сбору и исследованию
галлиц (Cecidomyidae) и вызванных ими повреждений. Изд-во АН
СССР, 1934.
Драховская М. Прогноз и защита растений. Сельхозиздат,
1962.
Ж а нтиев Р. Д., Ч е р н ы ш е в В. Б. О лете жуков Coleoptera
на свет ртутнокварцевой лампы. Энтомол. обозр., т. 39, вып. 3, 1960.
Захваткин А. О. распространение хлебных клещей в поле-
вых условиях. Зоол. журн., т. 15, вып. 4, 1936.
Знаменский А. В. Инструкция для наблюдений за вредите-
лями полеводства. Полтавская с.-х. оп. ст. Энтомол. отд. Бюллет.
№ 4. Полтава, 1926.
Зубарева С. П. Статистическая оценка количественного энто-
мологического кошения. Изв. биол. н.-и. ин-та и биол. ст. при Перм-
ском гос. ун-те, т. 7, вып. 2. Пермь, 1930.
I в а н о в С. П. Методи ктльккного облжу наземно! фауни,
XapKiB, 1930.
Ильинская Л. Л. О выживании амбарных клещей в поле в
зимний период. Защита растений, № 4, 1935.
Ильинский ,А. И. Эксгаустер усовершенствованного типа.
Защита растений, № 15, 1937.
Ильинский А. И. Определитель вредителей леса, 1962.
Ильинский А. И. Надзор, учет и* прогноз массовых размно-
жений хвое-листогрызущих насекомых. Изд-во «Лесная промышлен-
ность», 1965.
Ион О. И. Инструкция для собирания трипсов. Изд-во Дет-
скосельск. энтомол. станции. Л., 1924.
Ион О. И. Пузыреногие (Thysanoptera). Л., 1928.
Калинникова Т. Материалы по количественному учету
фауны плодовых деревьев. Тр. Ленингр. общ. естественен., т. 4,
вып. 2, 1927.
Караваев В. Мурашки Укра’ши, ч. 1, 1934; ч. 2, 1936.
402
Кириченко А. Н. Инструкция для собирания полужестко-
крылых Hemiptera-Heteroptera и исследования местных фаун. Петро-
град, 1923.
Кириченко А. Н. Методы сбора настоящих полужесткокры-
лых и изучения местных фаун. М.—Л., Изд-во АН СССР, 1957.
Кирьянова Е. С. Сбор и изучение галловой и других расте-
ниеядных нематод. М.—Л., Изд-во АН СССР, 1950.
Ключ к о 3. Ф., Францевич Л. И. Сбор насекомых на све-
товые ловушки. Вопросы экологии, т. IV, 1962.
Ковров Б. Г., М о н ч а д'с к и й А. С. О возможности приме-
нения поляризованного света для привлечения насекомых. Энтомол.
обозр., т. 42, 1963.
Кож а нчико в И. В. Методы исследования экологии насеко-
мых. Изд-во «Высшая школа», 1961.
Ко л окол ьч и ко в а Т. А., Перлова Н. Д. Сравнительная
оценка различных способов количественного учета насекомых травя-
нистых ассоциаций. Третья эколог, конференция. Тезисы, ч. 1, 1954.
Конаков Н. П. Методика и техника количественного учета
энтомофауны. Вопр. экол. и биоценологии, вып. 4, 1939.
Конаков Н. и Онисимова 3. Биоценометр для учета
фауны насекомых травяного покрова. Защита растений, № 3, 1936.
Кособуцкий М. И. К вопросу о методике количественного
учета при изучении экологии вредных насекомых, болезней и сорня-
ков. 'Вопросы эколог, и биоценол., вып. 3, 1936.
Коротнев Н. И. К вопросу об усовершенствовании техники
кошения сачком. «Ком. д. исслед. фауны Москв. губ.» (Днев. зоол.
отд. имп. общ. люл. естеств.), т. III, № 6, 1905.
Коротнев Н. И. Жуки. Практическое руководство к научно-
му собиранию и воспитанию жуков и составлению коллекций. М.,
1914.
К р е н ь А. И. К вопросу о биоценозах мохового болота. Тр.
Центр, лес. гос. запов., II, 1937.
Кришталь О. П. Ентомолопчш екскурсп в середнш школ!.
Кшв, 1955.
Кудрин А. И. К вопросу о применении земляных ловушек
для изучения распределения и взаимодействия элементов энтомо-
фауны на поверхности почвы. Тр. Всесоюзн. энтомол. общ. т. 50, 1965.
Кулик М. Е. Электросветильники. Защита растений от вреди-
телей и болезней, № 5, 1960.
Курочкин А. А. К вопросу о наблюдениях за опылителями
красного клевера. Опытная пасека, № 1, 1929.
Лавров С. Д. Бабочки и гусеницы. Практическое руководство
к научному собиранию и составлению коллекций чешуекрылых. Тр.
Зап.-Сиб. отд. русск. географ, об-ва, вып. 1. Омск, 1922. *
Ламперт К. Атлас бабочек и гусениц Европы и отчасти Рус-
ско-Азиатских владений, 1913.
Лебедев А. Г. Матер1али до вивчения бюценозу листяного
л!су. Зб1рник праць вщдьлу екологп наземних тварин, ч. 1, 1933,
№ 2, 1935; № 3, 1937.
Лебедев А. Г. До шзнання фауни й екологп комах-запилю-
вач!в квпкових рослин. 36ipH. праць в!дд!лу екол. назем, тв., ч. 1,
1933.
Лебедев А. Г. Про законом!рну залежшсть м!ж бджолами i
рослинами. 36ipH. праць вщ. екологп наземних твар, ч. 1, 1933.
403
Лиги а у В. Г. К методике количественного изучения наземной
фауны. Тр. III съезда зоол., анат. и гист., 1928.
Линдеман М. И. Руководство для наблюдений и полевого
обследования вредителей сахарной свеклы. Изд. НИС, 1930.
Лукьянович Ф. К. Значение и задачи изучения кормовых
отношений у растительноядных насекомых. Защита растений, № 17,
1938.
Любищев А. А. К методике количественного учета и райони-
рования насекомых. Фрунзе. Изд. АН Киргиз. ССР, 1958.
Любищев А. А. Задачи экологического изучения сельскохо-
зяйственных вредителей Киргизии. Тр. биол. ин-та Киргиз, филиала
АН СССР, т. 1, 1947.
Мазохин - По рш няков Г. А. Массовое привлечение насе-
комых на ультрафиолетовое излучение. Докл. АН СССР, т. 102, № 4,
1955.
Мазохин-Поршняков Г. А. Ночной лов насекомых на
свет ртутной лампы и перспективы использования его в прикладной
энтомологии. Зоол. журн., т. 35, вып. 2, 1956.
Мазохин-Поршняков Г. А. Применение ультрафиолето-
вых лучей в борьбе с майским жуком. Зоол. журн., т. 35, вып. 9,
1956.
Мазохин-Поршняков Г. А. Сравнение привлекающего
действия лучей различного спектрального состава на насекомых.
Энтом. обозр., 35, вып. 4, 1956.
Мазохин-Поршняков Г. А. Устройство и использование
ловушек для насекомых с излучателями ультрафиолета. Эйтомол.
обозр., т. 37, вып. 2, 1958.
Мазохин-Поршняков Г. А. Методы и современное со-
стояние изучения цветового зрения насекомых. Энтомол. обозр., т. 43,
1964.
Мазохин-Поршняков Г. А. Зрение насекомых. Изд-во
«Наука», 1965.
Малевич И. И. Летняя учебно-полевая практика по зоологии
беспозвоночных. Учпедгиз, 1952.
Малышев С. И. Наставление к собиранию и изучению гнезд
пчел и некоторых других перепончатокрылых. Изд-во АН СССР,
1931.
Махотин А. А. Температурный режим поля и поведение вред-
ной черепашки. В кн.: Вредная черепашка, вып. 1, 1947.
Мержеевская О. И. Новый фиксатор для гусениц. Зоол.
журн., т. 44, вып. 2, 1965.
Миноранский В. А., Обут Л. М., Чудаков С. М., Фо-
м и ч е в А. И. О методике энтомологического кошения сачком.
В кн.: Структура и функционально-биоценотическая роль животного
населения суши. Материалы совещания, 1967.
Мордвилко А. К. Кормовые растения тлей СССР и сопре-
дельных стран. Тр. по прикл. энтомол., ГИОА, 14, 1929.
Мордвилко А. К. Тли; циклы поколений и их эволюция.
Природа, 11, 1935.
Мордвилко А. К., Штейгель Ф. Р. и Шульц К- Ин-
струкция для собирания и сохранения тлей, червецов, листовых блох
и алейродид. Наставления для собирания зоологических коллекций,
издаваемые Зоол. музеем АН Спб, 1914.
404
Мухин В. А. Заметки о методике энтомологического кошения.
Уч. зап. Волгогр. госпединст., вып. 13, 1961.
Новак К. Чашки Мэрике. Вопросы экологии, т. IV, 1962.
Олигер И. М., Сисолетина Л. Е. К методике количест-
венного учета наземных беспозвоночных. В кн.: Структура и функ-
ционально-биогеоценотич. роль животного населения суши, 1967.
Олсуфьев Г. В. Собирание насекомых. Изд-во «Мысль»,
1922.
Определитель насекомых по повреждениям культурных растений.
Под ред. В. Н. Щеголева. М—Л., 1952.
Павлович С. А. Составление коллекций по естествознанию,
1936.
Палий В. Ф. О количественных показателях при обработке
фаунистических материалов. Зоол. журн. т. 40, вып. 1, 1961.
Парфентьев В. А. Пути и способы попадания вредителей в
полезащитные лесные полосы. Итоги н.-и. работ Всесоюзн. ин-та
защиты растений, ч. 1, 1936.
Попов В. В. Сбор и изучение опылителей сельскохозяйствен-
ных культур и других растений. М.—Л., Изд-во АН СССР, 1950.
Попов П. В. Краткий определитель главнейших вредителей
масличных растений. Саратов, 1928.
Попов П. В. Определитель вредителей хлопчатника по повре-
ждениям и вредящим формам, Ташкент, 1931.
Прогноз появления и учет вредителей сельскохозяйственных
культур. Изд. МСХ СССР, 1958.
Пучкова Л. В. Статистичний анал!з к!льк!сного косшня 1
деяких шших метод!в облжу комах. Пращ 1нст. Зоол. АН УРСР,
т. 17, 1961.
Пя.такова В. Л. К вопросу об учете зимнего населения пло-
дового дерева. Захист рослин, 1927—1928.
Радзиевская С. Б. К вопросу о зимовках божьих коровок
и борьбе с хлопковыми тлями. Вопр. эколог, и биоцен., вып. 4, 1935.
Райков Б. Е. и Римский-Корсаков М. Н. Зоологиче-
ские экскурсии. Учпедгиз, 1956.
Руденская Л. В., Демченко Е. П. Методика определе-
ния интенсивности дыхания беспозвоночных в чашках Конвея. В кн.:
Структура и функционально-биогеоцеыотическая роль животного на-
селения суши. 1967.
Руднев Д. Ф. Методы обследования и учета зараженности
насаждений сосновой совкой Panolis flammea Schill. 36ipH. праць
вщдму екологп наземн. твар., № 2, 1935.
Сахаров Н. Л. и Струков В. К вопросу изучения ночной
энтомофауны и в частности бабочек сем. Noctuidae. Опытная агроно-
мия Юго-Востока, т. 6, вып. 2, 1927.
Семенов А. Е. Усовершенствование полевого фотоэклектора.
Докл. ВАСХНИЛ им. Ленина, № 10, 1939.
С ку гр а вы В. Земляные ловушки. Вопр. экологии, т. 4, 1962.
Соболев А. С. Практикум по сельскохозяйственной энтомо-
логии. М., 1961.
Станчинский В. В. К методике количественного изучения
биоценозов травянистых ассоциаций. Экология и биоценология, 1 (Ь),
1931.
Старк В. Н. Методы исследования вредителей леса из мира
насекомых. Краеведение, т. 1, № 1, 1926.
405
Старк В. Н. Инструкция по собиранию и изучению короедов
АН СССР, 1936.
Старк В. Н. Руководство по учету повреждений леса. Изд. 2.
1932.
Старк Н. К. Враги леса. М.—Л., 1931.
Степанцев И. Н., Кособуцкий М. Н. и Л ю б и-
щев А. А. Методика энтомо-фитопатологического учета. Ташкент,
СоюзНИХИ, 1936.
Талицкий В. И. Таблица для определения повреждений ку-
курузы. М., 1932.
Т а л ь м а н П. Н., К а т а ев О. А. Методы лесоэкологических
обследований. Учебное пособие для студентов лесхозфак., 1964.
Терсков И. А., Коломиец М. Г. Световые ловушки и их
использование в защите растений. Изд-во «Наука», 1966.
Троицкий Н. Н. и Щеголев В. П. Определитель повреж-
дений культурных растений. М.—Л., 1934.
Троицкий В. Н. К методике учета повреждений хлебных
злаков. Защита растений, т. 1, № 3—4, 1925.
Ульяновский В. Ю. Метод количественной характеристики
явлений в природе на экскурсиях. Естествознание в школе, № 3—4,
1923.
Устинов А. А. Население листьев плодовых деревьев.
(Опыт количественного учета). BicH. сад. виногр. та городн., III,
1927.
Уст! нов О. Еколопчне i кьльюсне вивчення наземно! фауни,
В!сник природознавства, № 2, 1928.
Фабр Ж. А. Инстинкт и нравы насекомых, 1898.
Федосимов О. Ф. К методике учета наземной энтомофауны.
Тр. н.-и. ин-та защ. раст. Казахск. акад. с.-х. наук, т. 6, 1961.
Филипьев И. Н. Нематоды, вредные и полезные в сельском
хозяйстве, 1934.
Фридерикс К. Экологические основы прикладной зоологии
и энтомологии, 1932.
Холодковский Н. А. Курс энтомологии теоретической и
прикладной, тт. I—III. Л., 1927—1931.
Чернов Ю. И. О некоторых терминах и понятиях, применя-
емых в исследованиях продуктивности естественных систем. В кн.:
Структура и функционально-биогеоценотическая роль животного на-
селения суши. Материалы совещания, 1967.
Чернышев В. В. Сравнение лёта насекомых на свет ртутно-
кварцевой лампы и на чистое ультрафиолетовое излучение этой же
лампы. Энтомолог, обозр. 40, вып. 3, 1961.
Чернышев П. К. Метод учета численности насекомых на по-
лях и в садах. Тр. н.-и. ин-та защиты растений. Казахск. акад. с.-х.
наук, т. 6, 1961.
Шнитников В. Н. Наставление к собиранию паукообразных,
изд. 3. Изд-во АН СССР, 1931.
Amanshauser Н. Leuchten mit Ultra-Licht. Z. Weiner Ento-
mol. Ges., 1956 67, N 1.
Balogh. J. A zooconologia alapjai (Grundzuge der zooziinolo-
gie, Budapest, 1953.
Balogh J. und L о k s a J. Untersuchungen uber die zoozenose
des Luzernenfeldes. Acta zoologca Academiae Scientiarum Hungaricae,
m. II, fasc. 1—3. Budapest, 1956.
406
Bahkowska Regina. Muchovki-Diptera, Syrphidae. Kluze do
oznaczariia owadow Polski. Cz. XXVII. Warszawa, 1963.
В eflese A. Entomologia agraria. Fierenze, 19 lb.
C a v г о E. Piege a coleopteres carabiques. Bull. Soc. entomol.
Nord France, N 88, 4, 1956.
Chauvin Remy. Un procede, pour recolter automatquement les
proies que les Formica polyctena rapportent an nid. Insectes sociaux,
13. N 1, 1966.
Blum Murray S., Woodring J. Porter. Preservation of
insect larvae by vacuum dehydration. J. Kansas Entomol. Soc., 36, N 2,
1963.
Diehl Ed. Uber die Technik des Einfziillens von Cyankaligasern.
Entomol. Z. 68. N 2, 1958.
Frost S. W. Response of insects to black white light. Journ.
Econ. Entom., 47, 2, 1954.
Fust B. Sammeltage in Kols (Osttirol) I. VI bis 30. II (1954)
Entom. Zeitschr., 66, 12, 1956.
Ford E. B. Moths. The new naturalist. London, 1955.
George K. S. A method for trapping samples of small flying
insects. Plant. Pathol. 6. N 4, 1957.
Glick P. A. and J. P. Hollingswerth-Response of moths of the
pink bollworm and other cotton insects to certain ultraviolet and visible
radiation. Journ. Econ. Entom., 47, 1, 1954.
Q.>e i s 11 i n g e r N. J., Taylor D. W. A method of demonstra-
ting the form of larval galleries of wood-boring insects. Proc. Entomol.
Soc. Brit. Columbia, 59, 1962.
Gerney Ashley B., Kramer James P., Steyskal
Geoge C. Some techniques for the preparation, study, and storage
in microvials of insect genitalia. Ann. Entomol. Soc. America, 57, N 2,
1964.
Harris P., Mohyuddin A. I. The bioassay of insect feeding
tokens. Canad. Entomologist, 97, N 8, 1965.
Hogue Charles L. A field-note form for general insect
collecting. Ann. Entomologist., 97, Soc. America, 59, N I, 1966.
Holleman H. C., Elton E. T. G. Fluon barriers for confining
non-flying insects in open icotainers. Entomol. ber., 25, N 9, 1965.
J u i 1 let J. A. A comparison of four types of traps used for
capturing flying insects. Canad. G. Zool., 41, N 2, 1963.
Jurzitza Gerhard. Die Verwendung von 70° Alkohol zum
Aufweichen von Insekten. Entomol. z., 71, N 10, 1961.
Kennard Alan. On battery-powered mercury vapour light.
Entomol. Rec. and J. Variation, 74 N 2, 1962.
Kaczmarek M., Kaczmarek W. О metodice badane zooce-
notycznych w zakreise zbiorow ilosciowych naziemnej fauny bezcrgow-
cow. Ecol. Polska, 1956, В 2, N 2.
К a 1 о о s t i a n G. H. A. magnetically Suspended insect cage.
J. Econ. Entomol., 48, N 6, 1955.
К a r a f i a t H. Neue Wege der Populationsanalise an rindenbe-
wohnenden Arthropoden. Nachrichtenbl. Dtsch. Pflanzenschutzdienst.,
1955, 7, N 8.
Kennard W. C., Spencer J. L. A mechanical insect collor
with high maneuverability. J. Econ. Entomol., 48, N 4, 1955.
Kessel Edward L. An improved method of mounting small
and medium-sized Diptera. Wasmann. J. Biol., 20, N 1, 1962.
407
Kaszab Z., S о 6 s. A, As allatok gyi’ytesc. Condolat. Budapest,
Lee. L. W. G. Method and apparatus for tropping wingedf insects.
. M e г к 1 M. E. and T. R. Pfrimmer, Light trap investigations at
Stoneville, Miss, and Tallulah, La, during 1954. Journ. Econ. Entom.,
48, 6, 1955.
Meurer J. J. Waarnemingen von Wantzen (Hemip.-Het.) met
behulp. von un vanglajnp. Entumol. ber., 16, N 4, 1956.
Miller Fr. Zemedelska entomologie. Praha.
M о e r i с к e V. Uber das Verhalten phytophager Insekten wahrend
des Befallsflugs unter dem EinfluB von weifien Flachen. Zeitschr. Pflan-
cenkr., 62, 8—9, 1955.
Munchberg Paul. Uber ein neuzeitliches und einfaches
Verfahren zur Markierung von Jnsekten. Nachrichtenbl. Bayer.
EntomoL, 14, N 7—8, 1965.
Musgrave A. Collecting and preserving insects and their
allies. Austral. Museum Mag., 1955, 11, N 12; 1956, 12, N 1.
Nicholls C. F., Maybee G. E. An improved container for
shipping live insects. Canad. Entomologist, 93, N 3, 1961.
Niezgodzinski Piotr. Metodyka zbierania, konserwowania
i hodowli owadow. Polskie pismo entomol., 24, Supl. N 3.
Nippe B. Gefriertrocknung — eine neue Methode zur Prepara-
tion der Raupen. Nachrichtenbl. Bayer. Entomol., 12, N 5, 1963.
Pfrimmer T. R. Response of insects to three soures of black
light. Journ. Econ. Entom., 48, 5, 1955.
Richards I. R. Photoelectric cell observations of insects in
flight. Nature, 175, N 44—46, 1955.
Riley George B. A. modified sweep-not for small insects.
Bull. Brooklyn Entomol. Soc., 52, N 4, 1957.
Roberts Richard B. A cage to contain small insects during
pollination studies. J. Econ. Entomol., 55, N 2, 1962.
Robinson H. S. and P. J. M. Robinson. The observed be-
havior of Lepidoptera in flight in the vicinity of light soures. Entomol.
Gaz, I, 1950.
Sayer H. A. photographie method-for the study of insect migra-
tion. Nature, 177, 1956.
Shell Robert. A method of preserving the collors of the Cassi-
dinae (Coleoptera: Chrysomelidae). Proc. Entomol. Soc. Wash., 66,
N 1, 1964.
Shelford V. E. Laboratory and Field ecology. Baltimore, 1930.
Skuhravy Vaclov. Fallenfang und Markierung zum Studium
der Laufrafer (Coleoptera, Carabidae). Beitr. Entomol., 6, N 3, 1956.
Taylor L. R. The absolute efficiency of insect suction traps. Ann.
AppL BioL, 50, N 3, 1962.
T e у 1 о r J. G., D e а у H. О. and Orem M. T. Some engineering
aspects of electric traps for insects, journ. Amer. Soc. Agr. Engin., 39,
9, 1951.
Thelenhorst W. Ein handlicher Insecten-Zuchbehalter.
Z. pflanzenkrankh, 62, N 10, 1955.
Tindale Norman R. The chlorcresol method for field collec-
ting. J. Lepidop. Soc., 15, N 3, 1961.
Weber G. Insectenfanglampen fur den Warndienst. Zeitschr.
Pflanzenkrankh, 63, 9, 1956.
408
W 6 о d r i n g J. P., Blum M. S. Freeze-drying of spiders and
immatura insects. Ann. Entomol. Soc. America, 56, N 2, 1963.
Weight W. S. Suggested method of recarding the occurence and
distribution of insects Entomol. gaz. 7, N 12, 1956.
Vi leek Fr. Technika zoologickuch sviceni. Bratislava SPN, 1955.
Von Roland Bansch. Vergleichende Untersuchungen zur
Biologie und zum Beutefangverhalten aphidivorer Coccinelliden, Chry-
sopiden und Syrphiden. Zoologische Jahrbiicher, JBand 91, Heft 2, 1964.
Изучение отдельных групп беспозвоночных
Пауки
Шнитников В. Н. Наставление к собиранию паукообразных.
Изд-во АН СССР, 1931.
Многоножки
Folkmanova В. Chilopoda Republiky Ceskovenske. Dil. I.
Chilopoda Cech., 1928.
Растительноядные и почвенные клещи
Бондаренко Н. В. Паутинный клещик и борьба с ним в пар-
никах и теплицах. Изд-во АН СССР, 1952.
Буланова-Захваткина Е. М. Сбор и исследование пан-
цирных клещей. Изд-во АН СССР, 1952.
Буланова-Захваткина Е. М. Панцирцые клещи-ориба-
тиды. Изд-во «Высшая школа», 1967.
Захваткин А. А. Тироглифоидные клещи СССР. Фауна
СССР, т. VI, вып. 1, АН СССР; 1941.
Р е к к Г. Ф. Клещи, вредящие культурным растениям. Тбилиси,
1947.
Р е к к Г. Ф. К установлению возрастных различий у паутинных
клещей (Tetranichidae, Acarina). Сообщ. АН ГрузССР, т. X, № 7,
1949.
Р е к к Г. Ф. Сбор и определение паутинных п плоских клещей
вредящих древесной растительности. Изд-во АН СССР, 1952.
Прямокрылые, тараканы и уховертки
Б е й - Б и е н к о Г. Я- Руководство по учету саранчовых. Л.,
Изд-во УСУ ОБВ, 1932.
Бей-Биенко Г. Я. Кузнечиковые. Фауна СССР, т. 2, вып. 2.
Изд-во АН СССР, 1954.
Бей-Биенко Г. Я. Насекомые кожистокрылые. Фауна СССР,
№ 5. М.—Л., 1936.
Бей-Биенко Г. Я. Насекомые таракановые. Фауна СССР,
новая серия, № 40, М.—Л., 1950.
Бей-Биенко Г. Я. и Мищенко Л. А. Саранчовые фауны
СССР. ч. I и II. Изд-во АН СССР, 1951.
Берман Д. И. К методике количественных учетов прямокры-
лых и цикад. В кн.: Структура и функционально-биогеоненотич. роль
животного населения суши. Материалы совещания, 1967.
Зимин Л. С. Кубышки саранчовых. Изд-во АН СССР, 1954.
409
Кириченко А. Материалы по биологии и экологии п^уса в
степной полосе Украины. Одесса, 1926. |
Рубцов И. К рационализации методики обследования площа-
дей, занятых одиночными саранчовыми. Тр. защиты растений Вост.
Сибири, 2(4), 1935.
Шпет Г. И. Определение числа личиночных возрастов у насе-
комых вариационно-статистическим методом. Защита растений, № 1,
1935.
Тли
Мамонтова-Солуха В. А., Черкасова И. А. Методика
изготовления препаратов тлей на гуммиарабиковой смеси. Вестник
зоологии, 6, 1967.
Мордвилко А. К. Видообразование у тлей. Энтомол. обозр.
25, 1933.
Мордвилко А. К- Кормовые растения тлей СССР.
Мордвилко А. К. Злаковые тли. Изв. Петрогр. Стазра, 1924.
Невский В. Тли Средней Азии. Ташкент, 1929.
Шапошников Г. X. Подотряд Aphidinea — Тли. Определи-
тель насекомых европейской части СССР, т. 1, 1964.
Achremowicz Jerzy. Nowa metoda preparowania mszyc.
BinL Inst ochrony rosl. N 19, 1963.
P a s e k Vladislav. Vosky nasych lesnych drevin (Homoplera —
Aphidoidea), Bratislava, 1956.
Кокциды
Борхсениус H. С. Определитель кокцид (Coccidae), вредя-
щих культурным растениям и лесу, 1937.
Борхсениус Н. С. Насекомые хоботные. Мучнистые червецы
(сем. Pseudococcidae). Фауна СССР, т. 7, 1949.
Борхсениус Н. С. Сбор и изучение червецов и щитовок.
М.—Л., Изд-во АН СССР, 1950.
Борхсениус Н. С. Червецы и щитовки СССР (Coccoidae).
Изд-во АН СССР, 1950.
Борхсениус Н. С. Практический определитель кокцид куль-
турных растений и лесных пород СССР. Изд-во АН СССР, 1963.
Данциг Е. М. Подотряд Coccinea — Кокциды или червецы
и щитовки. Определитель насекомых европейской частй СССР, т. 1,
1964.
Косаржевская Э. Ф. Методика приготовленйя препаратов
кокцид (Homoptera, Coccoidea) для целей их определения. Энтомол.
обозр., т. 47, № 1, 1968.
Краткая инструкция по обследованию плодовых насаждений на
выявление калифорнийской щитовки. Гос. исп. по карант. с.-х.’ раст.
по Молдавск. ССР. Кишинев, МСХ МССР, 1955.
Клопы и цикады
Емельянов А. Ф. Подотряд Cicadinea — Цикадовые. Опре-
делитель насекомых европейской части СССР, ч. 1, 1964.
Кер ж н 6 р И. М. и Я че веки й Т. Л. Отряд Hemiptera — по-
лужесткокрылые пли клопы. Определитель европейской части СССР,
ч. 1, 1964.
410
Кириченко А. Н. Настоящие полужесткокрылые европейской
части СССР. Изд-во АН СССР, 1951.
Кириченко А. Н. Методы сбора настоящих полужесткокры-
лых и изучения местных фаун. М.—Л., Изд-во АН СССР, 1957.
Пучков В. Г. и Пучкова Л. В. Яйца и личинки полужест-
кокрылых — вредителей с.-х. культур. Тр. Всес. энтомол общ., т. 45,
1956.^
Трипсы, или бахромчатокрылые
Дядечко Н. П. К методике определения вредности трипсов.
Вопросы экологии, т. IV, 1962.
Дядечко Н П. Трипсы, или бахромчатокрылые насекомые
европейской части СССР. Изд-во «Урожай», 1964.
Ион О. Инструкция для собирания трипсов. Изд-во Детско-
сельск. энтомол. станции. Л., 1924.
И о н О. Пузыреногие (Thysanoptera), Л., 1928.
Танский В. И. Методика количественного учета трипсов.
Knechtel Wilhelm К. Okologisch-phaenologische Forschun-
gen fiber Thysanopteren. Zur Kenntnis der Thysanopterenfauna der
Karpathen (Thysanoptera). Beit. Entomol., 13, N 3—4, 1963.
f' Жуки
Спесивцев П. H. Определитель короедов. Под ред. М. Н.
Римского-Корсакова, 1931.
Старк В. Н. Инструкция по собиранию и изучению короедов.
АН СССР, 1936.
Фауна СССР. Насекомые жесткокрылые, т. 5, вып. 3; т. 10,
вып. 3; т. 13, вып. 2; т. 18, вып. 8; т. 21, ч. 1; т. 22, ч. 2; т. 26, вып. 1;
т. 27, вып. 2; 1936—1968 (изд. продолжается).
Ш е в ы р е в И. Я- Загадки короедов, 1910.
Ш и п е р о в и ч В. Я. Генерация у короедов и методика опреде-
ления числа генераций по наблюдениям в Парголовском уч.-оп. лес-
ничестве. Прир. и хоз. уч.-оп. лесничества Ленинградск. лесн. ин-та,
1928.
Якобсон Г. Г. Жуки России и Зап. Европы. Спб., 1905—1915.
Якобсон Г. Г. Определитель жуков. М.—Л., 1932.
Яцентовский А. Определитель короедов по повреждениям,
1930.
Галлицы
Домбровская Е. В. О фауне Cecidomyidae, Каменной степи
Воронежской обл. Тр. Зоол. ин-та АН СССР, т. 3, 1936.
Домбровская Е. В. Инструкция по сбору и исследованию
галлиц Cecidomyidae и вызываемых ими повреждений. Изд-во АН
СССР, 1934.
Бабочки
Герасимов А. М. Насекомые — чешуекрылые. Гусеницы.
Фауна СССР, т. 1, вып. 2, 1951.
411
Лавров С. Д. Бабочки и гусеницы. Практическое руководство
к научному собиранию и составлению коллекций чешуекрылых. Тр.
Зап.-Сиб. отд. русск. географ, об-ва, вып. 1. Омск, 1922.
Лавров С. Д. Наши гусеницы. Экскурсионный определитель
главнейших родов и некоторых видов гусениц европейской части
СССР и отчасти Сибири. М., 1936.
Ламперт К. Атлас бабочек и гусениц Европы. Перевод
Н. А. Холодковского и Н. Я. Кузнецова. Спб., 1913.
Методические указания по выявлению и ликвидации очагов аме-
риканской белой бабочки при их обнаружении. М., Изд. МСХ и за-
готовок СССР, 1953.
Тычка А. Маленький атлас бабочек. Прага, 1960.
D ar ge Ph. Photographie des lepidopteres. Quelques conseils aux
debutants. Alexanor. 3. N 7, 1954.
Patocka Jan. Husenice na dubech v CSR. Bratislava, 1954.
См. также общую литературу.
Насекомые-опылители
Алпатов В. В., Андреева М. [и др.]. Опыление красного
клевера, М., 1933.
Гиляров М. С. Опыление кок-сагыза (Taraxacum kok-saghyz
Rod.) в плантационных условиях. Докл. АН СССР, т. 30, № 9, 1941.
Гиляров М. С. и Правдин Ф. Н. Экология опыления кок-
сагыза. Изв. АН СССР, серия биол., № 6, 1943.
Журавлев А. А. Опыляют ли пчелы люцерну? Пчеловодство,
№ 6, 1950.
Конаков Н. П. и Писарева Ю. Н. Баланс шмелей в свя-
зи с общим балансом опылителей в окрестностях Воронежа за ряд
лет. Тр. Воронежск. гос. ун-та, т. 10, вып. 3, 1938.
Малышев С. И. О выборе материала для изучения инстинкта.
Изд-во АН СССР, № 1, 1946.
Малышев С. И. Наставление к собиранию и изучению гнезд
пчел и некоторых других перепончатокрылых. Изд-во АН СССР.
1931.
Мельниченко А. Н. Шмели — опылители клевера и возмож-
ности управления их жизнедеятельностью в хозяйственных целях.
Бюлл. Моск. общ. исп. природы., отд. биол. III, 6, 1948.
Мельниченко А. Н. Полезащитные лесные полосы и раз-
множение животных, полезных и вредных для сельского хозяйства.
М., Изд. Моск. общ. исп.’ прир., 1949.
Определитель насекомых европейской части СССР. Под ред.
С. Тарбинского и Н. Плавилыцикова, 1948.
Попов В. В. Сбор и изучение опылителей сельскохозяйствен-
ных культур и других растений. Изд-во АН СССР, 1950.
Попов В. В. Перепончатокрылые — Hymenoptera. Животный
мир СССР, т. HI. М.—Л., 1950; т. IV, 1954.
Попов В. В. Фауна пчелиных и ее распределение в средней
части трассы Государств, лесной полосы гора Вишневая — Каспий-
ское море. Тр. Зоол. ин-та АН СССР, т. 11, 1952.
Попов В. В. О фауне пчелиных Hymenoptera, Apoidea южной
части Западно-Казахстанской области. Тр. Зоол. ин-та АН СССР,
т. 16, 1954.
412
Энтомофаги
Белановский И. Д. Тахины Украинской ССР. ч. 1, 1951.
Изд-во АН УССР, ч. II, 1953.
Б i л а и о в с ь к и й. 1. D. Бюлопчш методи боротьби з шюдливи-
ми комахами. 36ip'H. праць в!д. екологп наземних тварин, №2,1935.
Д и р ш В. М. Опыт использования Trichogramma evanescens
против яблонной плодожорки в Крыму. Защита растений, № 15,
1937.
Евлахова А. А. и Швецова О. И. Наставление по изуче-
нию болезней насекомых и применению микробиологического метода
защиты растений. М.—Л., Изд-во АН СССР, 1953.
Зимин Г. С. Трихограммирование посевов кукурузы для борь-
бы с кукурузным мотыльком. Защита растений, № 1, 1935.
Зорин Н. В. О методике искусственного размножения яйце-
едов Trichogramma evanescens. Защита раст., т. 4, № 2, 1927.
К и в и т О. Акклиматизация паразита кровяной тли Aphelinus
mali Hald. в Северо-Кавказском крае. Защита растений, № 8, 1939.
К р ы ш т а л ь О. П. К изучению динамики энтомофауны почв и
подстилки в связи с половодьем в условиях долины среднего тече-
ния р. Днепра. Зоол. журн. т. 34, вып. 1, 1959.
^Тебедянская М. Г. [и др.]. Яйцеед Trichogramma eva-
nescens и возможности его эксплуатации в борьбе с вредными насе-
комыми. Защита растений, № 9, 1938.
Лозинский В. А., Романова Ю. С., Смирнова М. П.
Биологический метод борьбы с кольчатым шелкопрядом в лесное
хозяйстве. Гослесбумиздат, 1962.
Мейер Н. Ф. Список тем, рекомендуемых для научно-иссле-
довательских работ республиканских, областных, районных лабора-
торий биометода. Защита растений, № 17, 1938.
Мейер Н. Ф. Биологический метод борьбы с вредными насе-
комыми. М.—Л., 1937.
Мейер Н. Ф. Биологический метод борьбы с вредными насе-
комыми и результаты его применения в СССР. Зоолог, журн., т. XVII,
вып. 5, 1938.
Мейер Н. Ф. Определитель паразитических перепончатокры-
лых сем. Ichneumonidae, вып. 1, 1933; вып. 2, 1933; вып. 3, 1934;
вып. 4, 1935; вып. 5, 1936; вып. 6, 1936.
Никольская М. Н. Хальциды. Семейство Chalcidae и
Leucospidae, Фауна СССР, т. 7, вып. 5. I960..
П о л о ж е н ц е в П. А., Н е г р о б о в В. Н. О насекомых — хо-
зяевах паразитических червей. Вредные и полезные насекомые. Изд.
Воронежск. ун-та, 1967.
П о л о ж е н ц е в П. А. Об изучении червей, паразитирующих в
насекомых СССР. Бюлл. Моск. общ. испыт. прир., т. 6, вып. 1, 1957.
Поспелов В. П. и Евлахова А. А. Инструкция для ис-
следования болезней насекомых. Л., Изд. ВИЗР, 1937.
Принц Я. И. и Г у т и е в а Ф. П. Испытание биологического
метода борьбы Trichogramma evanescens против гроздевой листо-
вертки. Защита растений, № 9, 1935.
Рубцов И. А. Биологический метод борьбы с вредными насе-
комыми. М.—Л., 1948.
Рубцов М. А. Сбор и выведение паразитов вредных насеко-
мых. Изд-во АН СССР, 1950.
413
Рывкин Б. В. Биологический метод борьбы с вредными насе-
комыми в лесу. Гослесбумиздат, 1952.
Соболь П. Ф. Биологический метод борьбы с сельскохозяйст-
венными вредителями. Полевые испытания яйцееда, М.—Л., 1937.
Старк В. Н. Использование сколий для борьбы с хрущами.
Вест. защ. раст., № 1—2, 1940.
Теленга Н. А. Биологический метод борьбы с вредными на-
секомыми, 1948.
Теленга Н. А. и Вогунова М. В. Главнейшие хищники
червецов и тлей Уссурийской части Дальневосточного края и пути
их использования. Защита растений, № 10, 1936.
Теленга Н. А. иЩепитильникова В. А. Руководство
по размножению и применению трихограммы для борьбы с вредите-
лями сельскохозяйственных культур. Изд-во АН СССР, 1949.
Теленга Н. А. Насекомые перепончатокрылые сем. Braconidae.
Фауна СССР, т. 5, вып. 2, 1936; т. 5, вып. 3, 1941; т. 5, вып. 4, 1955.
Теленга Н. А. и Щепетильникова В. А. Руководство
по размножению и применению трихограммы для борьбы с вредите-
лями сельскохозяйственных культур. Изд-во АН СССР, 1949.
Тряпицын В. А., Шапиро В. А., Щепетильнико-
ва В. А. Паразиты и хищники вредители сельскохозяйственных
культур. Изд-во «Колос», 1965.
Чугунин Я. В. Результаты внедрения в производство пара-
зита кровяной тли Aphelinus mali в Крыму. Защита растений, № 8,
1936.
Чумакова Б. М. Калифорнийская щитовка и ее паразиты в
условиях Дальнего Востока. Энтомол. обозр., т. 43, вып. 3, 1964.
Шевырев И. Паразиты и сверхпаразиты из мира насекомых,
Спб.» 1912.
Щепетильникова В. А. Проблема биологического метода
защиты растений. Тр. ВИЗР, 17, 1963.
Hagen К. S., Т a s s a n R. L. A method of providing artificial
diets to Chrysopa larvae. J. Econ. Entomol., 58, N 5, 1965.
Nicholls C. F., Berube J. A. C. An expandable cage for
feeding tests of coccinellid pre dators of aphids j. Econ. Entomol., 58,
N 6, 1965.
Зимние исследования
Андреев И. И. и Птушенко Е. С. Зоология. Зимние зоо-
логические экскурсии в природу. Учебно-методическое пособие для
студентов-заочников педагогических и учительских институтов, 1949.
Болдырев В. О собирании насекомых на снегу. Русск. энтом.
обозр., 11, 1911.
Б р э м А. Жизнь животных, т. IX. Общ. польза, 1895.
Всесвятский В. (ред.). Осенние и зимние экскурсии в при-
роду (сборн. статей). М., Изд. «Работн. проев.», 1927.
Грезе Н. Пауки, собранные на снегу. Изд. Моск, энтом. общ.,
1, 1915.
Г р о в е К. О зимних экскурсиях. Материалы по вопросам пре-
подавания естествознания. М., 1894.
Золотницкий Н. Ф. Сборы насекомых на снегу. В мастер-
ской природы, № 2, 1919.
Мельниченко А. О периодическом появлении Collembola
на снегу. Вопросы экологии и биоценологии, 1935.
414
Полянский И. И. Сезонные явления в природе. Л., Учпед-
гиз, 1937.
Пятакова В. Л. К вопросу об учете зимнего населения пло-
дового дерева. Захист рослин, 1927—1928.
Радзиевская С. Б. К вопросу о зимовках божьих коровок и
борьбе с хлопковыми тлями. Вопр. эколог, и биоцен., вып. 4, 1935.
Райков В. Е. и Римский-Корсаков М. Н. Зоологиче-
ские экскурсии. Учпедгиз, 1956. *
Р и м с к и й - К о р с а к о в М. Н. Зимние зоологические экскур-
сии. Естествознание в школе, V, 1922.
Холодковский Н. А. Биологические очерки. ГИЗ, 1923.
Шмидт П. Ю. Анабиоз, 1935.
Symes Н. Notes on the treatment of hibernatin larvae. Entomol.
Rec. and J. Variation, 69, N 10, 1957.
Изучение фауны гнезд и нор
Бычков В. А. Стафилиниды, живущие в гнездах грызунов,
в роли естественных врагов блох. Энтомолог, обозр., т. 25, 1933.
Власов Я- П. О нахождении в окрестностях Ашхабада моски-
тов в норах грызунов толстой песчанки Rhombomus opimus и тонко-
палого суслика Spermophilopsis leptodactylus Hich. Паразитологии,
сбо^н. ЗИН АН СССР, т. 3, 1933.
Власов Я. П. Нора как своеобразный биотоп в окрестностях
Ашхабада. Проблемы паразитологии и фауны Туркестана. Под ред.
Павловского, 1937.
Власов Я. П. К биологии Reduvius chrystophi и некоторых
других видов. Энтомолог, обозр., т. 25, 1933.
Власов Я. П. Паукообразные из нор окрестностей Ашхабада.
Пробл. паразитол. и фауны Туркестана, 1937.
Власов Я. П. и Мирам Э. Ф. Жуки из нор окрестностей
Ашхабада. Там же.
Власов Я- П. и К и р и ч е н к о А. Н. Hemiptera — Heteropte-
га из нор в окрестностях Ашхабада. Там же.
Власов Я. П. и И о ф ф И. Г. Блохи из нор окрестностей
Ашхабада. Там же.
Власов Я. П. и Штакельберг А. А. К диптерофауне
нор позвоночных окрестностей Ашхабада. Там же.
Высоцкая С. О. Методы сбора обитателей гнезд грызунов.
М.—Л., Изд-во АН СССР, 1953.
Высоцкая С. О. Об одном из возможных путей происхож-
дения эктопаразитизма. Докл. АН СССР, т. 54, № 3, 1949.
Дубинин В. Б. Обитатели нор млекопитающих Южно-Казах-
станской области и их значение для человека. Изв. АН КазССР,
№ 33(4), 1946.
И о ф ф И. О выбирании блох из нор грызунов. Лаборат. прак-
тика, 5, 1929.
И о ф ф И. и Т и ф л о в В. О двух недавно изданных пособиях
для определения блох. Вести, микроб., эпидем. и паразитол. т. 15,
вып. 3—4, 1936 (1937).
И о ф ф И. Очередные задачи изучения фауны и экологии блох.
Медиц. паразитол. и параз. болезни. 18, 2, 1949.
И о ф ф И. и Т и ф л о в В. Е. Определитель афанпптера
Suctoria — Aphaniptcra Юго-Востока СССР, 1954.
415
Кириченко А. Н. Гнезда птиц как биотоп настоящих полу-
жесткокрылых (Hemiptera — Heteroptera). Энтомологическое обозре-
ние, т. 30, вып. 3—4, 1949.
Киршенблат Я. Д. К вопросу о происхождении некоторых
видов нидиколов (обитателей гнезд). Докл. АН СССР, т. 11, вып. 3—
4, 1936.
Киршенблат Я. Д. Фауна гнезд млекопитающих и птиц.
Вопросы экологии и биоценологии, вып. 3, 1936.
Коротнев Н. И. Фауна гнезд и нор и способы ее исследова-
ния. М., 1922.
Колпакова С. Миграция блох из нор полуденных песчанок.
Эктопаразиты, 2, 1950.
Кузенков В. Наблюдения над сезонными колебаниями коли-
чества и видового состава блох на сусликах в активный период их
жизни. Тр. Рост. н.-и. гос. противочумн. ин-та, 2, 1941.
Кузякин А. П. Условия обитания животных в дуплах деревь-
ев. Вопр. экол. и биоценол., вып. 3, 1936.
Латышев Н. И. и Крюкова А. П. Эпидемиология кож-
ного лейшманиоза в условиях песчаной степи. 1-е совещ. по пара-
зитол. пробл. Тезисы докл. Изд. ЗИН АН СССР, 1939.
Медведев С. И. Новый вид сверчка, живущего в норах
суслика в Припонтийских степях. Русск. энтомол. обозр., т. 25, 1933.
Медведев С. И. Энтомологическая фауна нор суслика
(Citellus pygmaeus Mart.) в степях Южной Украины. Энтом. обозр.,
1—2, 1947.
Микулин М. А. Методические указания по организации пара-
зитологической работы в эпидотрядах. Ср.-Азиатск. н.-и. ин-т в
г. Алма-Ата, 1951.
Новиков Г. А. Полевые исследования по экологии наземных
позвоночных. Изд-во «Советская наука», 1953.
Петрищева П. А. Эктопаразиты — переносчики болезней че-
ловека из нор дикообраза. Вопр. краевой общ. эксперимент, парази-
тол. и медиц. зоол., 7, 1951.
Попов В. М. Программа и методика паразитологической рабо-
ты на туляремийной станции. Томск, 1949.
Р а л л ь Ю. М. К методике изучения микроклимата гнезда сус-
лика. Вести, микробиол., эпидем. и паразитол., т. 11, вып. 1, 1932.
Р а л л ь Ю. М. Тепловые условия в норах песчаных грызунов
и методика их изучения. Зоол. журн. т. 16, вып. 1, 1939.
Р а л л ь Ю. М. Методика полевого изучения грызунов и борь-
ба с ними. Ростов-на-Дону, 1947.
Семенов Тянь-Шаньский А. и Медведев С. И. Три
новых вида жуков-навозников из южно-русских степей, Русск. энто-
мол. обозр., т. 21, вып. 3—4, 1927.
Стрельников И. Д. Изучение микроклимата в норах гры-
зунов. Сб. ВИЗР, № 4, 1932.
Стрельников И. Д. Значение гнезда в тепловом режиме
грызунов. Втор. экол. конф. Тезисы, ч. II. Киев, 1950.
Тагильцев А. А. Термоэклекторы для отбора нидиколов из
гнезд. Мед. паразитол. и паразитарн. болезни, № 3, 1947.
ITT и р а н о в и ч П. Временная инструкция по сбору и исследова-
нию эктопаразитов. Изд. Ростов, гос. н.-и. противочумн. ин-та, 1949.
Ширанович П. И., Миронов П. Н. и Фомичева А. С.
416
Методы сбора бескрылых паразитов из нор грызунов. М.—Л., Изд-во
АН СССР, 1950.
Ф л его нто в а А. А. Жуки-стафилины как регуляторы числен-
ности блох в норах суслика (Citellus pygmaeus Pall.). Вести, микро-
биол. эпидем. и паразитол., № 16(1—2), 1937.
Е d ney Е. An apparatus for handling smal living insects. Bulletin
ent. research, 37, 1946.
Estrade F. Technique et appareil * pour la copture
des puces dans les poussieres et debris cereales. Bull. soc. path, exoth,
27, 1934.
Nicholson H., Vetter M. A lethol trap for capturing small
mammals with their ectoparasites. Journ. of parasitol., 36, 1950.
Наружные паразиты животных и человека
А г р и н с к и й Н. И. Насекомые и клещи, вредящие сельскохо-
зяйственным животным. М., Изд. с.-х. лит. 1962.
Беклемишев В. Н. Популяция и микропопуляция парази-
тов, и нидиколов. Зоол. журн., т. 38, вып. 8, 1958.
Засух ин Д. и Колпаков С. О методах учета эктопарази-
тов. Вести, микробиол., эпидем. и паразитол., т. XIII, № 2, 1934.
I в а н о в С. П. Методи юльккного облжу наземно! фауни,
XapKiB, 1930.
Лабораторный практикум медицинской паразитологии. Под ред.
Е. И. Павловского. Медгиз, 1959.
Луги на В. А. Полевая лаборатория энтомолога в чемодане.
Мед. паразитол. и паразит, болезн., т. 30, в. 5, 1961.
Павловский Е. Н. Руководство к практической паразито-
логии человека. Л., Госиздат, 1934.
Павловский Е. Н. Практикум медицинской паразитологии.
Огиз, 1935.
Павловский Е. Н. Методы изучения наружных паразитов,
возбудителей заразных болезней домашних животных. Сельхозгиз,
1931.
Павловский Е. Н. Насекомые и клещи — переносчики филь-
трующихся вирусов. Природа, № 12, 1935.
Павловский Е. Н. Курс паразитологии человека, 1934.
Павловский Е. Н. Биоценологические исследования приме-
нительно к паразитологическим проблемам борьбы с пироплазмозом
с.-х. животных, с паразитарными болезнями человека. Изд-во АН
СССР, ОМЕН, серия биологич., № 4, 1937.
Павловский Е. Н. Организмы как среда обитания. Приро-
да, № 1, 1934.
Павловский Е. Н. Природная очаговость трансмиссивных
болезней и проблема — организм как среда обитания паразитоцено-
зов. Л., 1952.
Померанцев В. К. О паразитических адаптациях у 1хо-
doidea (Acarina). Изв. АН СССР, серия биол., № 4, 1936.
Маркевич А. П. (ред.). Методы изучения паразитологиче-
ской ситуации и борьба с паразитозами сельскохозяйственных жи-
вотных. Киев, Изд. АН СССР, 1957.
417
Клещи
Алфеев Н. Н. О распространении клеща Ixodes ricinus в
районе Череменецкого озера и наблюдения над его биологией и эко-
логией. Вредители животноводства. Изд-во АН СССР, 1935.
Брегетова Н. Г. Сбор и изучение гамазовых клещей. М.—Л.,
Изд-во АН СССР, 1952.
Брегетова Н. Г. Гамазовые клещи. Изд-во АН СССР, 1956.
О л е н е в Н. Паразитические клещи Ixodoidea фауны СССР.
Изд-во АН СССР, 1931.
Павловский Е. Н. Изучение динамики клещей в природе
как обоснование мер борьбы с ними. Вредители животноводства.
Изд-во АН СССР, 1935.
Павловский Е. Н. Наставления к собиранию и исследова-
нию клещей Ixodoidea. Изд-во АН СССР, 1928.
Поспелова-Штром М. В. Биологические наблюдения над
клещом Hyolomma jakimovi в лабораторных условиях. Вредители
животноводства. Изд-во АН СССР, 1935.
Поспелова-Штром М. В. Клещи-орнитодорины и их эпи-
демиологическое значение. Изд-во АН СССР, 1953.
Сердюкова Г. В. Наставление для сбора иксодовых клещей
в районах их северного распространения в СССР. Изд-во АН СССР,
1952.
Шпрингольц-Шмидт А. И. Эктопаразиты некоторых ви-
дов дальневосточных оленей. Вести. Д.-В. фил. АН СССР, 1937.
Шпрингольц-Шмидт А. И. К познанию экологии и систе-
матики клещей Дальнего Востока. Вредители животноводства. Изд-во
АН СССР, 1935.
Блохи, пухоеды и eiuu
Благовещенский Д. И. Пухоеды, ч. 1, Фауна СССР, т. 1,
вып. 1, 1959.
Вагнер Ю. Аналитические таблицы для определения блох,
живущих на Muridae. Параз. сборн. АН СССР, т. 1, 1930.
И о ф ф И. Г. Вопросы экологии блох в связи с их эпидемиоло-
гическим значением. Пятигорск, 1941.
Иофф И. Г. и Тифлов В. Е. К фауне и экологии блох
лесостепи. Параз. сборн. АН СССР, т. 1, 1930.
Иофф И. Г. и Тифлов В. Е. Пособие для определения
блох. Саратов, 1938. .
Иофф И. Г. и Тифлов В. Е. Определитель афаниптера
(Suctoria—Aphaniptera) Юго-Востока СССР. Ставрополь, 1954.
Павловский Е. Н. Наставление к собиранию и исследова-
нию блох. Изд-во АН СССР, 1927.
Павловский Е. Н. Руководство по паразитологии человека
с учением о переносчиках трансмиссивных болезней, II, 1948.
Павловский Е. Н. Вши и власоеды. В кн.: Лабораторный
практикум медиц. паразитол. Медгиз, 1959.
Савельева К. В. Пухоеды сельскохозяйственных птиц Став-
ропольского плато (автореферат), 1957.
Тарбинский С. [и др.]. Определитель насекомых. Л., 1927.
Тифлов В. и Потапов В. О миграции блох суслика Citel-
lus pygmaeus. Вестник микроб, эпидем. и паразит., т. 16, вып. 3—4,
1937 (1939).
418
Шир а но вич П. И., М и р о н о в Н. П. и Фомичев А. С.
Методы сбора бескрылых паразитов из нор грызунов. Л.—М., Изд-во
АН СССР, 1950.
См. также предыдущую литературу.
Кровососущие двукрылые
Беклемишев В. Н. (ред.) Учебник медицинской энтомоло-
гии. ч. 1. М., 1949.
Березанцев Ю. А. Темный колпак для учета гнуса. Медиц.
паразитол. и паразитарные болезни, № 1, 1959.
Бреев К. А. О применении ловушек ультрафиолетового све-
та для определения видового состава и численности популяции ко-
маров. Паразитол. сб.» т. 18, 1958.
Бреев К. А. Влияние различных источников света на числен-
ность и видовой состав кровососущих комаров (Diptera, Culicidae),
собираемых в световые ловушки. Энтомол. обозр., т. 4, 1963.
Гребельский С. Г. Вылов кровососущих мошек Simulidae
ловушкой с ультрафиолетовым излучением. Тр. Вост.-Сиб. филиала
АН СССР, вып. 36, 1961.
у ц е в и ч А. В. Комары — семейство Culicidae. В кн.: Лаборат.
практикум мед. паразитологии. Медгиз, 1959.
Гуцевич А. В. Мокрецы. Кровососущие двукрылые семейства
Heleidae. М.—Л., Изд-во АН СССР, 1956.
Гуцевич А. В. К фауне мокрецов Culicoides лесной зоны.
Паразитол. сборы. ЗИН АН СССР, т. 14, 1952.
Гуцевич А. В. Кровососущие мокрецы (Diptera, Heleidae),
М., 1960.
Латышев Н. И. и Крюкова А. П. Эпидемиология кожно-
го лейшманиоза в условиях песчаной степи. 1-е Совещ. по паразитол.
пробл., тезисы докл. Изд. ЗИН АН СССР, 1939.
Мончадский А. С. иРадзивиловская 3. А. Новый
метод количественного учета активности нападения кровососов. Па-
разитол. сборн. ЗИН АН СССР, т. IX, 1948.
Мончадский А. С. Летающие кровососущие двукрылые
(гнус). Способы защиты и методы исследования. Изд-во АН СССР,
1952.
Мулярская Л. В. Биоценозы птичьих гнезд. Тр. АН Тадж.
ССР 13 1953
Олсуфьев Н. Г. Слепни. Фауна СССР, т. 7, вып. 2, 1937.
Олсуфьев Н. Г. Слепни — семейство Tabanidae. В кн.: Ла-
борат. практикум медиц. паразитол. Медгиз, 1959.
Павловский Е. Н. Наставление к собиранию, исследованию
и сохранению комаров (Culicidae), 1927.
Павловский Е. Н. Методы изучения кровососущих комаров.
Изд-во АН СССР, 1935.
Павловский Е. Н. Динамика кровососущих двукрылых, ме-
тоды и значение их изучения. Изд-во АН СССР, серия биол., № 2—3,
1946.
Перфильев П. П. Москиты — род Phlebotomus. В кн.: Ла-
борат. практикум медиц. паразит. Медгиз, 1959.
Петрищева П. А. Распространение и места выплода моски-
тов (Phlebotomus) в различных ландшафтных зонах Средней Азии
419
и Крыма. 1-е Совещ. по паразитол. пробл., тез. докл. Изд. ЗИН АН
СССР, 1939.
Петрищева П. А. Полевые методы изучения москитов и про-
тивомоскитные мероприятия. М., Медгиз, 1954.
Погодина Е. А. и Сафьянов В. М. Испытание метода
отлова кровососущих двукрылых при помощи ртутной лампы ПРК-4,
Зоол. журн., т. 36, вып. 4, 1957.
Полещук В. Садок для мух. Защита растений от вред, и
болезней, № 12, 1966.
Рубцов И. А. Методы изучения мошек. М.—Л., Изд-во АН
СССР, 1956.
Рубцов И. А. Об изменении активности кровососущих мошек
в связи с гонотрофическим циклом. Тр. ЗИН АН СССР, т. 21, 1955.
С к у ф ь и н К. В. К экологии слепней Воронежской области.
Зоол. журн., т. 28, в. 2, 1949.
Скуфьин К- В. Опыт применения чучелообразной ловушки
для слепней. Зоол. журн., т. 30, в. 1, 1951.
Ч и н а е в П. П. Методы количественного учета кровососущих
комаров (Diptera, Culicidae). Энтомол. обозр., т. 38, вып. 4, 1959.
Штакельберг А. А. Кровососущие комары. Фауна СССР,
Насекомые двукрылые, т. III, № 6, 4, 1937.
Штакельберг А. А. Синантропные двукрылые фауны СССР.
М.—Л., Изд-во АН СССР, 1956.
Щербина В. П. Портативная светоловушка ПСЛ-1 для сбо-
ра кровососущих летающих насекомых. Зоол. журн., т. 43, вып. 10,
1964.
Комплексы «навозники» и «мертвоеды»
Богданов Е. А. Биологические наблюдения над копрофагами
Петровского-Разумовского под Москвою. Зап. имп. АН, сер. VIII,
т. IV, № 3, 1896.
Говард В. Комнатная муха, 1924.
Гринфельд Э. К. Наблюдения над распространением жуже-
лиц и мертвоедов по биотопам. Энтомол. обозр., т. XXX, № 1—2,
1948.
Мончадский А. С. Летающие кровососущие двукрылые —
гнус. Л., Изд-во АН СССР, 1952.
Павловский Е. Н. Мухи. М., Изд. НКЗО, 1921.
Порчинский И. А. Исследования по двукрыл дм насекомым
России. Тр. Русск. энтом. общ., т. XXVI, 1892.
Райков Б. Е. и Римский-Корсаков М. Н. Зоологиче-
ские экскурсии, Л., 1956.
Фабр Ж. А. Инстинкт и нравы насекомых, т. II, изд.
А. Ф. Маркса, 1905.
Фабр Ж. А. Жизнь насекомых. М., 1926.
См. также литературу по отдельным группам.
СОДЕРЖАНИЕ
Стр.
Из предисловия к первому изданию........................... 3
Предисловие ко второму изданию ............................ 3
Общие задачи и основные принципы........................... 5
Направления, содержание и планирование полевых иссле-
дований ............................................. 7
Разработка программы исследования...................... 8
* Эколого-фаунистические исследования................... 8
Монографическое изучение...........................11
Изучение экологии отдельного вида (аутэкология) . . 13
Биоцепологические исследования.....................15
Разработка, выбор и обоснование методики исследования ' 20
Оборудование и рабочий план.............. . . . . 20
Обзор применяемых в полевых исследованиях мето-
дов и приемов......................................21
Ведение дневника и другие способы фиксации иссле-
дований . ........................................ 23
Изучение факторов среды...................................28
Общие замечания..................................... 28
Абиотические факторы .................................37
Биотопические факторы. Высота и рельеф.............37
Почва как фактор среды.............................39
Физические свойства почвы (40). Структура поч-
вы (42). Механический состав почвы (43). Хими-
ческий состав почвы (44)
Климатические факторы.................................45
Температура (48). Влажность (59). Испаряемость
(66). Атмосферные осадки (|68). Ветер (направле-
ние и скорость) (69). Облачность (75). Свет (77).
Солнечная радиация (83)
О методике исследования местного климата и микро-
климата ..........................................°°
Изучение местного климата (мезоклимата) (89).
Изучение микроклимата (93)
Биотические факторы ...................................97
Растения как фактор и как компонент биоценоза . . 97
Высшие растения (97). Низшие растения (104).
Животные как биотический фактор ........ . 196
Изучение биоклимата .............................. . . 198
421
Стр.
Изучение периодических явлений .................... 108
Общие фенологические (биоклиматические) наблю-
дения ..............................................111
Изучение фенологии отдельных видов животных . .114
Фенологические фазы развития растений (115)
Наблюдения за сельскохозяйственными куль-
турами (117)
Сбор и изучение беспозвоночных.............................123
Общие методические предпосылки.........................123
Приборы и приспособления для сбора насекомых и дру-
гих беспозвоночных................................... 125
Сачки (125). Эксгаустеры (128). Биоценометры
(128). Эклекторы (133). Фонари и другие источ-
ники света (138). Светоловушки (138). Лампы и
светоловушки с ультрафиолетовыми лучами (140).
Ловушки и приманки, основанные на хемотаксисе
(142). Ловчие деревья (144). Ловчие ямы
(145). Лужи смерти (146). Волокуши (146). Ли-
пучки (147). Ловчие пояса (147). Желтые ловчие
чашки Мерике (147). Ловля на самку (147)
Умерщвление, фиксирование, монтирование, хранение на-
секомых и других беспозвоночных.................... 150
Морилки (150). Анестезирующие вещества (150).
Фиксирующие и консервирующие жидкости (151)
Разведение и воспитание беспозвоночных ............. 152
Хранение материала...................................154
Подготовка насекомых к монтированию (156).
Этикетировка (157)
Обработка материала (основные термины, понятия и их
определение) ....................................... 160
Изучение почвенной фауны.................................165
Общие замечания.................................... 165
Типы почвенно-экологических исследований ...... . 167
Методы изучения микрофауны...........................168
Протистофауна (168). Нематоды и коловратки
(172). Тихоходки (175)
Изучение почвенной мезофауны.........................176
Общий обзор методов и описание приборов ........ 176
Способы взятия почвенной пробы (177). Выборка жи-
вотных из почвы (178)
Методика и техника почвенных раскопок................184
Обработка и фиксирование материала ............. 186
Сбор и учет беспозвоночных при помощи почвенных
раскопок....................................... 190
Сбор и учет беспозвоночных за плугом.............193
Учет населения подстилки....................... . 195
Сбор и учет беспозвоночных в наносах.............195
Учет беспозвоночных на поверхности почвы и в верх-
них ее слоях ....................................196
Специальное изучение и учет отдельных групп беспозво-
ночных, живущих в почве..............................197
Дождевые черви ..................................197
Наземные моллюски.............................. 199
422
Стр.
Мокрицы..........................................202
Многоножки.......................................203
Почвенные клещи..................................206
Низшие бескрылые насекомые.......................208
Изучение беспозвоночных поверхности земли и растительного
покрова...................................*..............212
Общие замечания......................................212
Учет населения травяного покрова.............. . . . 213
Выборка и учет насекомых при помощи фотоэклектора 214
Учет беспозвоночных при помощи биоценометра . . .215
Выборка и сбор насекомых при помощи всасывающих
аппаратов........................................216
Учет населения травы методом кошения энтомологи-
ческим сачком....................................217
Учет и анализ населения отдельного растения .... 221
Учет насекомых культурных полей в период уборки
урожая...........................................225
Учет и изучение насекомых — опылителей растений . . . 226
Пчелиные ........................................227
Двукрылые и другие группы насекомых-опылителей 231
Изучение эптомофагов (паразитов и хищников)..........234
Поиски и сбор паразитов в природе................236
Лабораторное разведение паразитов .............. 240
Выведение паразитов из личинок (241). Выведение
паразитов из яиц (242). Выращивание трихограмм
(243). Выращивание афелинуса (244)
Изучение энтомофапов-хищников....................245
Этикетировка, хранение материала ............... 246
Изготовление микроскопических препаратов .... 247
Учет насекомых и других беспозвоночных, живущих на
деревьях............................................ 248
Учет повреждений листвы на деревьях..............250
Учет галлообразующих и минирующих насекомых и
других обитателей кроны.........................251
Сбор и изучение насекомых коры и ствола .... 256
Изучение насекомых, живущих в коре и древесине . . 259
Изучение циклов развития беспозвоночных и фено-
логии . . . . ।. ............. । ......г.. . . 264
Беспозвоночные как фактор разложения растительных
остатков........................................ 267
Изучение влияния беспозвоночных на физические и
химические свойства почвы........................271
Изучение беспозвоночных зимой........................273
Учет и изучение отдельных групп беспозвоночных .... 278
Нематоды, связанные с растениями ................278
Паразитические нематоды — мермитиды .............284
Пауки......................._....................286
Паутинные и другие растительноядные клещи . . . 290
Прямокрылые, уховертки, тараканы.................293
Тли..............................................298
Кокциды (червецы и щитовки)......................301
Полужесткокрылые и цикады........................305
423
Трипсы . . 307
Жуки........................................... 308
Сетчатокрылые и верблюдки.......................310
Чешуекрылые (бабочки)...........................311
Перепончатокрылые...............................316
Двукрылые.......................................322
Изучение членистоногих, связанных с теплокровными живот-
ными и человеком.................................... . . 323
Изучение фауны нор и гнезд млекопитающих и птиц . . 323
Изучение и сбор эктопаразитов животных .............329
Общие методы сбора эктопаразитов................331
Свободноживущие клещи ..........................334
Паразитические гамазовые клещи .................335
Иксодовые клещи.................................339
Перьевые клещи .................................347
Пухоеды.........................................348
Блохи......................................... 350
Сбор и изучение летающих кровососов, синантропных и
других двукрылых насекомых..........................357
Слепни........................................ 361
Мошки......................................... 362
Мокрецы ....................................... 365
Москиты.........................................367
Комары..........................................368
Синантропные мухи и другие двукрылые................370
Сбор и учет синантропных мух................... 371
Оводы...........................................375
Изучение комплекса некрофагов (мертвоедов).........378
Изучение комплекса копрофагов (навозников)..........382
Заключение.............................................385
Литература........................................... 387
Кирилл Ксенофонтович Фасулати
ПОЛЕВОЕ ИЗУЧЕНИЕ НАЗЕМНЫХ БЕСПОЗВОНОЧНЫХ
Редактор В. С. Капышева. Художественный редактор Н. В. Красовитова.
Технический редактор С. П. Передерий. Корректор В. С. Кикоть.
Сдано в набор 23/IX 1970 г. Подп. к печати 4/Ш 1971 г.
Формат 84Х 1О8’/з2 Объем 13,25 печ. л. 22,26 усл. п. л. Уч.-изд. л. 21,88
Изд. № Е—189 Тираж 7000 экз. Цена 88 коп.
План выпуска литературы издательства «Высшая школа»
(вузы и техникумы) на 1971 год. Позиция № 66.
Москва, К-51, Неглинная ул., д. 29/14,
Издательство «Высшая школа»
Московская типография № 8 Главполиграфпрома
Комитета по печати пои Совете Министров СССР.
Хохловский пер., 7. Зак. 1867