Автор: Медведев С.С. Шарова Е.И
Теги: физиология растений ботаника растения биология
ISBN: 978-5-288-05018-3
Год: 2011
Текст
ФИЗИОЛОГИЯ
РАСТЕНИИ
БИОЛОГИЯ РАЗВИТИЯ РАСТЕНИЙ
С. С. Медведев, Е. II. Шарова
БИОЛОГИЯ
РАЗБИТИЯ РАСТЕНИЙ
НАЧАЛА БИОЛОГИИ РАЗВИТИЯ РАСТЕНИЙ.
ФИТОГОРМОНЫ
л.
ФИЗИОЛОГИЯ
РАСТЕНИЙ
САНКТ-ПЕТЕРБУРГСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
С. С. Медведев, Е. И. Шарова
БИОЛОГИЯ
РАЗВИТИЯ РАСТЕНИЙ
ТОМ1
НАЧАЛА БИОЛОГИИ РАЗВИТИЯ РАСТЕНИЙ.
ФИТОГОРМОНЫ
УДК 581.14
ББК 28.53
М42
Рецензенты: каф. ботаники Российского гос. педагогического ун-та им. А. И. Герцена (зав.
кафедрой проф. Г. А. Воробейков), д-р биол. наук И. Е. Мошков (зам. дирек-
тора Института физиологии растений им. К. А. Тимирязева РАН), д-р биол.
наук Г. В. Новикова (вед. науч, сотрудник Института физиологии растений
им. К. А. Тимирязева РАН)
Печатается по постановлению
Редакционно-издательского совета
биолого-почвенного факультета
С.-Петербургского государственного университета
Медведев С. С., Шарова Е. И.
М42 Биология развития растений. В 2-х т. Том 1. Начала биологии развития рас-
тений. Фитогормоны: Учебник. — СПб.: Изд-во С.-Петерб. }гн-та, 2011. —253 с.
ISBN 978-5-288-05018-3
ISBN 978-5-288-05019-0 (т. I)
В книге отражено современное состояние знаний в области биологии развития растений.
В первой части тома рассмотрены основные принципы и механизмы морфогенеза, вопросы
полярности и симметрии растений, ритмичности их развития, донорно-акцепторные взаи-
мосвязи, влияние факторов внешней среды, приведены сведения о генетическом и эпигене-
тическом контроле развития — направлениях, занимающих центральное положение в иссле-
дованиях морфогенеза растений. Во второй части представлены концепция фитогормонов,
история их открытия, физиологическая роль, химическое строение и метаболизм, содержа-
ние и транспорт в растении, рецепция и передача гормональных сигналов.
Учебник предназначен для студентов и аспирантов биологических факультетов универ-
ситетов. педагогических и сельскохозяйственных вузов, а также для специалистов, работа-
ющих в области биологии растений.
ББК 28.53
Издание подготовлено при финансовой поддержке
исследовательского гранта РФФИ 08-04-00566а
©
С. С. Медведев,
Е. И. Шарова, 2009
ISBN 978-5-288-05018-3
ISBN 978-5-288-05019-0 (т. 1)
С.-Петербургский
государственный
университет, 2011
©
ОГЛАВЛЕНИЕ
Список сокращений............................................................... 5
Введение........................................................................ 6
Часть 1. Начала биологии развития растений
Глава 1. Генетический контроль развития......................................... 9
1.1. Гены-регуляторы развития растений...................................... 10
1.2. Транскрипционные факторы............................................... 12
Глава 2. Эпигенетические механизмы морфогенеза растений........................ 18
2.1. Особенности организации ядерного генома растений........................ —
2.2. Эпигенетические механизмы регуляции экспрессии генов................... 19
2.3. Участие малых РНК в регуляции развития................................. 24
Глава 3. Полярность............................................................ 30
3.1. Факторы индукции полярности............................................ 32
3.2. Физиологическое проявление полярности.................................. 34
3.2.1. Полярность растительной клетки.................................... 35
3.2.2. Полярность растительных органов и тканей.......................... 43
3.3. Полярность в процессах роста и морфогенеза............................. 50
Глава 4. Факторы внешней среды и морфогенез................................... 55
4.1. Свет................................................................... 56
4.2. Температура............................................................ 57
4.3. Вода................................................................... 59
4.4. Кислород............................................................... 60
Глава 5. Корреляции в ходе роста и морфогенеза................................. 63
5.1. Донорно-акцепторные взаимосвязи......................................... —
5.2. Апикальное доминирование............................................... 65
5.3. Позиционная информация................................................. 67
Глава 6. Биоритмы в развитии растений.......................................... 69
Часть 2. Фитогормоны
Глава 7. Концепция фитогормонов................................................ 80
7.1. Методология изучения функций фитогормонов.............................. 82
7.2. Критерии гормональной регуляции........................................ 84
7.3. Функции фитогормонов................................................... 88
Глава 8. Ауксины............................................................... 91
8.1. Метаболизм ауксина...................................................... —
8.1.1. Биосинтез ауксина................................................. 93
8.1.2. Образование конъюгатов и окисление ауксина....................... 101
8.1.3. Способы регуляции содержания ауксина в развивающихся органах растений. 108
8.2. Транспорт ауксина..................................................... 109
8.3. Механизм действия ауксина............................................. 118
3
8.4. Физиологическая роль ауксина.......................................... 123
Глава 9. Гиббереллины......................................................... 125
9.1. Метаболизм гиббереллинов.............................................. 126
9.2. Механизм проведения гиббереллинового сигнала.......................... 134
9.3. Физиологическая активность гиббереллинов.............................. 143
Глава 10. Цитокинины.......................................................... 149
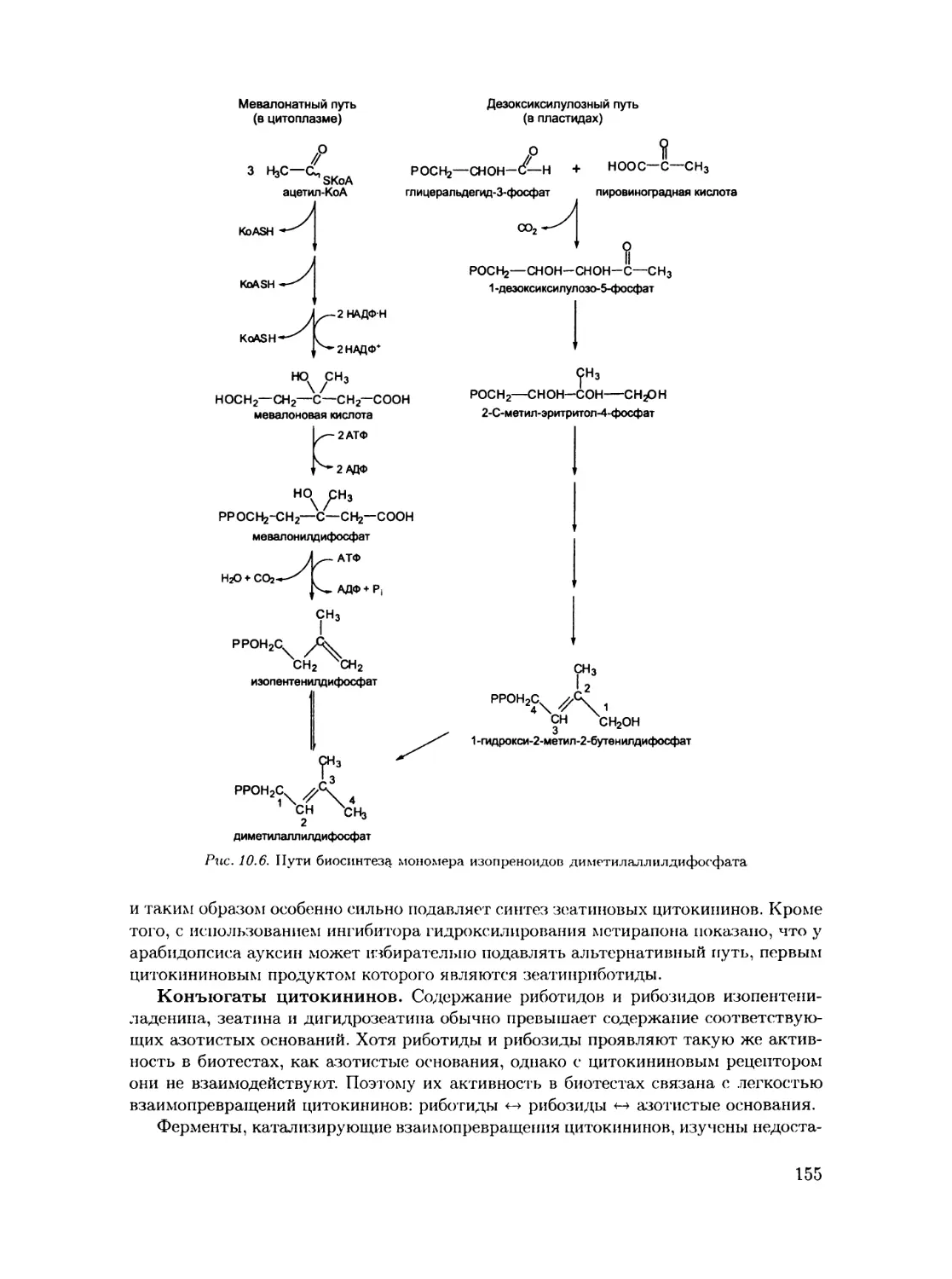
10.1. Метаболизм цитокининов............................................. 150
10.2. Механизм действия цитокининов........................................ 158
10.3. Физиологическое действие цитокининов................................. 163
Глава 11. Абсцизовая кислота.................................................. 167
11.1. Метаболизм абсцизовой кислоты........................................ 168
11.2. Механизм действия абсцизовой кислоты................................. 173
11.3. Физиологическая роль абсцизовой кислоты в растении................... 182
Глава 12. Этилен.............................................................. 188
12.1. Метаболизм этилена................................................... 189
12.2. Механизм действия этилена............................................ 194
12.3. Физиологическая роль этилена в растениях.....,....................... 197
Глава 13. Врассиностероиды.................................................... 202
13.1. Метаболизм брассиностероидов........................................... —
13.2. Механизм действия брассиностероидов.................................. 206
13.3. Физиологическая роль брассиностероидов............................... 210
Глава 14. Жасмонаты........................................................... 214
14.1. Метаболизм жасмонатов.................................................. —
14.2. Механизм действия жасмоновой кислоты................................. 220
14.3. Физиологическая роль жасмонатов..•................................... 222
Глава 15. Салициловая кислота................................................. 228
15.1. Метаболизм салициловой кислоты......................................... —
15.2. Механизм действия салициловой кислоты при патогенезе................. 230
15.3. Физиологическая активность салициловой кислоты в растениях........... 232
Глава 16. Пептидные фитогормоны............................................... 238
16.1. Системны............................................................... —
16.2. Фитосульфокины....................................................... 240
16.3. Цистеин-богатые пептиды S-локуса крестоцветных....................... 241
16.4. Сигнальный пептид CLV3............................................... 241
16.5. Факторы быстрого подщелачивания...................................... 242
16.6. Сигнальный пептид ENOD40............................................... —
Заключение.................................................................... 244
Рекомендуемая литература...................................................... 246
Предметный указатель.......................................................... 248
СПИСОК СОКРАЩЕНИЙ
Л БК - абсцизовая кислота
АДФ — аденозиндифосфорная кислота
А МФ — аденозшшонофосфорная кислота
АТФ -- аденозинтрифосфорная кислота
А ЦК — аминоциклопропанкарбоновая кислота
БАП — бензиламинопурин
ВС — брассиностероиды
БЭП — биоэлектрический потенциал(ы)
В ГМ — вирус табачной мозаики
ГА 1-125 — гиббереллины
ГДФ — гуанозиндифосфорная кислота
ГК — гибберелловая кислота
ГТФ — гуанозинтрифосфорная кислота
ДКС — дальний красный свет (730 нм)
Ж К - жасмоновая кислота
ИСУ - индуцируемая системная устойчивость
ИУК — индол-3-уксусная кислота
ИФз — инозитол-1,4,5-трисфосфат
КоА — коэнзим А
КС — красный свет (660 нм)
МеЖ — метил жасмонат
мРНК — матричная (информационная) РНК
НАД — никотинамидадениндинуклеотид окисленный
НАД Н — никотинамидадениндинуклеотид восстановленный
НАДФ * — никотинамидадениндинуклеотидфосфат окисленный
НАДФ Н — никотинамидадениндинуклеотидфосфат восстановленный
рРНК — рибосомальная РНК
РУ БИСКО - рибулозобисфосфаткарбоксилаза/оксигеназа
СВЧ — реакция сверхчувствительности
СК — салициловая кислота
СИУ — системный приобретенный иммунитет
тРНК — транспортная РНК
ТФ — транскрипционный фактор
УДФ — уридиндифосфорная кислота
Ф — фитохром
цАДФР - циклическая АДФ-рибоза
цАМФ — циклическая АМФ
Ага — арабиноза
Gal - - галактоза
Glc — глюкоза
Inos — инозитол
Pi — фосфат
PPi — пирофосфат
ВВЕДЕНИЕ
Центральная проблема биологии развития —это вопрос о том, каким образом
многократное деление всего лишь одной клетки приводит к формированию организ-
ма, обладающего системами органов и тканей, образованных клетками, не похожи-
ми друг на друга. Ответом на этот вопрос является дифференциальная экспрессия
генов в клетках, составляющих ткани и органы. Именно дифференциальная актив-
ность генома служит основой и структурных, и функциональных различий между
разными клетками одного и того же организма, то есть клеточной дифференциров-
ки. В процессе развития потенциал конкретного генотипа реализуется в зависимости
от условий среды, в результате чего формируется определенный фенотип.
Развитие любого организма, в том числе растения, включает такие процессы, как
рост и дифференцировка. Рост представляет собой одно из наиболее легко обнару-
живаемых проявлений жизнедеятельности растений, так как при этом увеличива-
ются размеры их органов и тканей. Таким образом, под термином «рост» следует
понимать процесс необратимых количественных изменений, которые происходят во
время развития организма, органа, ткани или клетки. Рост любого многоклеточного
растения включает такие процессы, как увеличение числа клеток за счет их деления,
а также увеличение размеров клеток путем растяжения. В апикальных участках
побегов и корней наиболее интенсивное деление клеток происходит в меристемах, а
зона наиболее быстрого увеличения размеров клеток находится в нескольких мил-
лиметрах от апекса. В органах с детерминированным ростом, например в листьях и
плодах, эти два процесса разделены во времени: на ранних этапах развития преоб-
ладает клеточное деление, а затем наступает фаза, в которой деление прекращается
и начинается увеличение размеров клеток путем их растяжения.
Термин «развитие» используют для обозначения и количественных, и качествен-
ных изменений в структуре и функциональной активности растения в ходе онтоге-
неза. О дифференцировке же говорят, если в ходе развития растительного организма
возникают преимущественно качественные различия у первоначально однородных
структур. Дифференцировка может осуществляться на клеточном, тканевом и орга-
низменном уровнях. В последнем случае речь идет о морфогенезе, то есть процессе
формообразования, который связан с закладкой, ростом и развитием специализи-
рованных органов растения.
Онтогенезом называют процесс индивидуального развития организма, сопро-
вождающийся последовательной сменой его возрастных этапов. У растительных
организмов выделяют четыре этапа онтогенеза: эмбриональный — от зиготы до со-
зревания семени, вегетативный — от прорастания семени до начала образования
репродуктивных органов, генеративный — от закладки и формирования репродук-
6
«Детки», развившиеся из отдельных
маргинальных клеток листа Bryophyllum
daigremontianum (по: Батыгина и др., 2006)
тивных органов до образования плодов и семян и, наконец, сенильный — от момента
потери способности к цветению до отмирания.
Этапность онтогенеза — это морфологическая и функциональная расчлени-
мость онтогенеза, проявляющаяся в поэтапном (дискретном) изменении характера
роста, дифференцировки и функциональной активности организма. Однако отдель-
ные этапы онтогенеза не изолированы друг от друга, а представляют собой после-
довательно переходящие друг в друга периоды развития, в основе которых лежат
постепенные изменения организма и его отдельных частей в течение всей жизни
растения.
Наиболее важные отличия растений
от животных организмов касаются осо-
бенностей их роста и развития. Можно
выделить по крайней мере три принци-
пиальных различия.
, растения, в отличие от
большинства животных организмов,
способны размножаться неполовым, ве-
гетативным путем. Вегетативное раз-
множение—это бесполое воспроизведе-
ние растений за счет обособления частей
материнского организма. Оно основано
на регенерации, то есть способности рас-
тения восстанавливать целый организм
из отдельных частей тела и даже из от-
дельной вегетативной клетки. В резуль-
тате появляются генетически однород-
ные группы особей — клоны. Например,
у каланхое и бриофиллума отдельные
клетки, расположенные по краю листа,
способны формировать маленькие рас-
теньица—«детки» (рис.).
Во-вторых, у растений при повре-
ждении очень высока способность к ре-
генерации за счет клеток меристемати-
ческих тканей, а также путем дедиффе-
ренцировки некоторых клеФок в меристематические, образования каллусных тканей
и формирования новых очагов деления и роста. Свойство клетки реализовать при
определенных условиях имеющуюся у нее генетическую информацию и дать начало
целому организму называется тотипотентностью. В отличие от клеток животных
организмов, соматические клетки растения, обладая тотипотентностью, сравнитель-
но легко могут пойти по пути де дифференцировки, формирования каллуса и нового
организма.
В-третьих, растения «в погоне» за питательными веществами вынуждены расти
и формировать органы на протяжении всей жизни. Для них особенно важно функ-
ционирование апикальных меристем верхушки побега и корня, в которых постоянно
идут процессы деления клеток. У большинства животных органогенез охватывает
сравнительно небольшой отрезок времени — они перестают расти, как только дости-
гают половозрелости.
7
Основной тип роста, обеспечивающий наращивание массы растения,—это рост
растяжением за счет увеличения размеров вакуоли, разрыхления и новообразова-
ния элементов клеточной стенки. Этот процесс является специфической особенно-
стью именно растительных клеток. При этом цитоплазма с ядром и органеллами
сохраняется лишь в виде тонкого пристеночного слоя. Активное увеличение раз-
меров растительных клеток связано с поглощением воды, которое обеспечивается
накоплением осмотически активных веществ в вакуоли.
Первый том учебника «Биология развития растений» состоит из двух частей.
В первой части рассмотрены основные принципы и механизмы морфогенеза расте-
ний - генетический и эпигенетический контроль развития, полярность и симметрия,
биоритмы, донорно-акцепторные взаимосвязи, позиционная информация, влияние
факторов среды на морфогенез растений. Вторая часть посвящена современным
представлениям об основных гормонах растительных организмов — ауксинах, гиббе-
реллинах, цитокининах, абсцизовой кислоте, этилене, пептидных гормонах, брасси-
ностероидах, жасмоновой и салициловой кислотах. Описаны история их открытия,
физиологическая роль, химическое строение и метаболизм, содержание и транспорт
в растении, рецепция и передача гормональных сигналов, взаимодействие фито гор-
монов в растении.
Часть 1
НАЧАЛА БИОЛОГИИ РАЗВИТИЯ РАСТЕНИЙ
У растительных организмов можно выделить несколько основных элементов
морфогенеза и определяющих его факторов. Геном, который является основной
матрицей — носителем информации о том, как растению пройти путь от семени до
семени. Для выполнения этой функции генома служат так называемые гены-пе-
реключатели развития. Эпигенетические факторы развития, к которым относят-
ся различные типы микроРНК, а также ферменты, участвующие в модификации
ДНК и хроматина. Полярность клеток и тканей основа для пространственной раз-
метки активности морфогенетических факторов в растительном организме и, как
следствие, дифференциальной активности генома. Факторы внешней среды — тем-
пература, свет, вода и минеральные элементы -определяют этапность онтогенеза
и влияют па фенотипическое проявление конкретного генотипа растения. Донорно-
акцепторные отношения -для каждого этапа развития растительного организма
характерны различные акцепторы, к которым от донорных участков передвигаются
органические и минеральные соединения. Позиционная информация, то есть место-
положение клетки в ткани или органе, определяет ее дифференцировку и будущую
специализацию. Поведение каждой клетки тщательно координируется с поведением
соседних клеток в течение всего жизненного цикла растительного организма. Фи-
тогормоны — интегральные химические сигналы, отражающие состояние окружа-
ющей клетку среды. Ауксин и его полярные потоки служат основой для разметки
плана строения и формирования органов растения, ауксин и цитокинины регулиру-
ют пролиферацию клеток, гиббереллины являются одними из основных факторов
регуляции цветения, абсцизовая кислота контролирует процессы покоя, а этилен —
созревания и старения растений.
Реализация генетической программы развития каждого растительного организ-
ма осуществляется при постоянно изменяющихся условиях внешней среды. Поэто-
му для растения определяющее значение имеет согласованность во взаимодействии
внешних и внутренних факторов, участвующих в регулировании процессов роста и
развития каждой клетки и целого растительного организма.
Глава 1
ГЕНЕТИЧЕСКИЙ КОНТРОЛЬ РАЗВИТИЯ
Носителем информации о том, как сформировать определенные органы и ткани и
пройти путь от семени до семени, является геном. В морфогенезе участвует большое
количество регуляторных генов. Их дифференциальная экспрессия в определенных
9
клетках и на определенных этанах развития обеспечивает последовательное форми-
рований тканей и органов растения.
В настоящее время уже идентифицированы ключевые гены, которые контроли-
руют процессы эмбриогенеза, старения и фотоморфогенеза, регулируют функци-
онирование апикальных, латеральных и флоралыгых меристем, отвечают за фор-
мирование корня, листьев и сосудов. Наиболее хорошо изучена экспрессия генов,
регулирующих развитие цветков. На основе имеющейся в настоящее время гене-
тической информации, математического аппарата и компьютерных программ ста-
ло возможным построение так называемых генетических регуляторных сетей (gene
regulatory network GRN), которые позволяют оценить весь спектр взаимодействий
между различными регуляторными генами в процессе дифференцировки клеток и
формирования органов растения. Отдельные элементы этих сетей способны на раз-
ных этапах развития контролировать несколько процессов, поэтому мутации, за-
трагивающие разные участки одного регуляторного гена, могут отличаться своим
фенотипическим проявлением.
Для объяснения механизма возникновения различий между клетками, содержа-
щими одинаковую генетическую информацию, были предложены две модели, ко-
торые в 1920- 1930-х гг. были сформулированы американским ученым Т. Морганом
и немецким - Р. Гольдшмидтом. Т. Морган полагал, что в клетках, расположенных
в различных частях зародыша, на разных стадиях его развития функционируют
различные гены. Активация же разных генов в разных клетках обусловлена разли-
чиями в химическом составе цитоплазмы в различных частях зародыша, которые
возникают в ходе его развития. Таким образом, но Т. Моргану, специализация клет-
ки является результатом дифференциальной активности генов, а регуляция диффе-
ренцировки осуществляется на транскрипционном уровне. Р. Гольдшмидт считал,
что все гены работают во всех клетках одинаково, однако их продукты, попадая в
цитоплазму с различным составом, функционируют по-разному. Таким образом, по
Р. Гольдшмидту, специализация клеток определяе гея дифференциальным функци-
онированием генных продуктов, то есть осуществляется на уровнях трансляции и
посттрансляционных модификаций. Оказалось, что каждая из предложенных моде-
лей может быть использована для понимания принципов клеточной дифференци-
ровки, однако различные механизмы, которые лежат в их основе (дифференциаль-
ная активность генов или дифференциальное функционирование генных продук-
тов), по-видимому, реализуются или на разных этапах развития, или в различных
тканях.
1.1. Гены-регуляторы развития растений
Подсчитано, что высшие растения могут содержать от 25000 до 50000 генов.
Треть из них экспрессируется во всех органах растительного организма (хотя и на
разном уровне), продукты второй трети присутствуют лишь в некоторых органах, а
остальные гены экспрессируются только в каком-то одном органе. Анализ экспрес-
сии 8300 генов арабндонсиса, проведенный в 2001 г. группой американских исследо-
вателей под руководством Т. Жу, показал, что 64 гена специфически экспрессиру-
ются только в корнях, 94 - в листьях, 3 - в цветоносах, а 36 в цветках растений.
В составе генов, которые экспрессируются только в определенных органах, были
найдены орган-специфические промоторы, обеспечивающие орган-специфичсскую
экспрессию генов, причем в определенное время. Орган-специфические промоторы
10
выявлены, например, в составе генов семян одно- и двудольных растений, которые
кодируют такие белки как лектины, ингибиторы трипсина, глютелин, проламин и
зеин. Таким образом, органы растения различаются экспрессией специфического
набора генов и белков.
Становление различных тканей и органов является результатом дифференци-
альной и каскадной активации генов, осуществляющих расшифровку и реализацию
позиционной информации (см. главу 5). Гены, детерминирующие процессы роста и
дифференцировки, часто называют генами-регуляторами (переключателями) раз-
вития. Они кодируют особые белки - транскрипционные факторы, контролирую-
щие программы формирования органов и тканей растения. Иногда эти гены также
называют гомеозисными. Мутации в гомеозисных генах могут вызвать трансформа-
цию одной части тела в другую. Гомеозисными мутантами называются те, у которых
па месте нормального органа развивается орган другого типа. Например, у дрозо-
филы при мутации antennapedia формируется антенна вместо ноги. Гомологичные
генам дрозофилы гомеозисные гены идентифицированы и у других животных. У
растительных организмов также известны процессы, которые контролируются го-
меозисными генами: филлотаксис, развитие цветков и соцветий. У растений наи-
более хорошо изучено функционирование двух типов генов-регуляторов развития:
гомеобокс-содержащих и генов с MADS-боксом.
Экспрессия генов-регуляторов развития контролируется рядом внутренних и
внешних факторов. К внутренним факторам, влияющим на их активность, отно-
сятся гормоны, сахароза и некоторые минеральные элементы, к внешним темпе-
ратура и свет. В регуляции процессов дифференцировки и развития важная роль
принадлежит генам, содержащим промоторы, чувствительные и специфичные к фи-
тогормонам и к таким факторам внешней среды как свет и температура. В составе
промоторов очень многих генов, активность которых регулируется фитогормона-
ми, выявлены транскрипционные элементы, определяющие гормональную специ-
фичность ростовых реакций растений (см. часть II).
Гомеобокс-содержащие гены. Гомеобокс-содержащие гены определяются по
наличию характерной последовательности ДНК из приблизительно 180 пар нуклео-
тидов (гомеобокса), кодирующей гомеодомен консервативный участок ряда транс-
крипционных факторов. Эта нуклеотидная последовательность типична для генов
каскадного типа регуляции развития.
Первым клонированным геном растений, кодирующим гомеодомен-содсржащий
белок, был KNOTTED! (KN1) кукурузы. Мутация knotted! у кукурузы приводит
к тому, что ген KN1 начинает экспрессироваться в несоответствующее время и не в
том месте. У мутантов knl вокруг уже дифференцированных клеток листа появля-
ются группы клеток, которые еще продолжают делиться. Группы делящихся клеток,
расположенные вдоль сосудистых элементов но всей листовой пластинке, образуют
гак называемые узлы (knots). Все эти изменения вызывают резкие нарушения об-
щего плана деления клеток и развития листа (рис. 1.1, а). Позднее было обнаружено
целое семейство генов, подобных KN!, названное KNOX (KNOTTED 1-like НОМЕ-
ОВОХ). Сверхэкспрессия генов семейства KNOX также искажает развитие листа
(рис. 1.1,6, в).
Среди KNOX-гонок растений наиболее детально исследована большая группа,
участвующая в регуляции деятельности апикальной меристемы побегов и развитии
листьев: KN! и RSI (rough sheath 1) кукурузы; KNAT! (KNOTTEDAiko for Ara-
bidopsis thalianal), KNAT2 (KNOTTED-Yike for Arabidopsis thaliana2) и STM (shoot
11
Рис. 1.1. Фенотипические проявления мутации knotted! в листе кукурузы (а) и сверх-
экспрессии генов KNOX в листьях арабидопсиса (б) и табака (в) (по: Hake,
Ori, 2002). Нормальные листья представлены справа (б и в)
meristemless) арабидопсиса; HvKN0X3 (Hordeurn vulgare KN0X3) ячменя и OSHI
(Oryza sativa H0ME0B0X1) риса. Гены KN1, STM и их функциональные аналоги
отвечают за поддержание деления клеток меристем, репрессируя их дальнейшую
дифференцировку. Эти гены экспрессируются в апикальных меристемах побегов, а
также во флоральных меристемах.
Гены, содержащие MADS-бокс. Термин «MADS-бокс» образован начальны*
ми буквами четырех генов: МСМ1 дрожжей, AG арабидопсиса, DEF львиного зева и
SRF млекопитающих. К генам, содержащим MADS-бокс, относятся, в частности, AG
(AGAMOUS), DEF (DEFICIENS) API (APETALA1) и АРЗ (APETALA3), TFL1
(TERMINAL FLOWER1), PI (PISTILLATA). Гены этого типа регулируют флори-
генез и определяют судьбу клеток в семяпочке; их экспрессия выявлена в зароды-
ше, корнях и листьях. К генам, содержащим MADS-бокс, относится большинство
гомеозисных генов растений, в частности гены идентичности органов цветка. Воз-
никновение новых органов в процессе прогрессивной эволюции растений, например
семяпочек и семян, сопровождалось появлением новых подсемейств именно MADS-
бокс генов.
1.2. Транскрипционные факторы
У эукариотических организмов транскрипция генов, кодирующих белки, проис-
ходит с помощью РНК-полимеразы II. Этот фермент обладает способностью специ-
фически распознавать промоторные области, являющиеся обязательными элемента-
ми ядерных генов. В составе промотора обычно имеется АТ-богатая нуклеотидная
последовательность, называемая ТАТА-боксом, которая служит местом присоеди-
нения РНК-полимеразного комплекса. Для конститутивной экспрессии ряда генов
вполне достаточным условием является наличие ТАТА-бокса, однако активность
очень многих ядерных генов не может быть обеспечена только им и требует при-
сутствия в промоторной области других вспомогательных элементов. Эти допол-
нительные нуклеотидные последовательности, которые называют транскрипцион-
12
ними элементами, играют очень важную роль в регуляции транскрипции. Именно
транскрипционные элементы являются мишенями, которые специфически распозна-
ются ДНК-связывающими белками, называемыми транскрипционными факторами
(ТФ). Эти регуляторные белки, связываясь с транскрипционными элементами, вы-
зывают активацию (или подавление) работы РНК-полимеразного комплекса и экс-
прессию соответствующих генов.
У арабидопсиса в регуляции процесса транскрипции участвует до 15% белков.
Одни из них обеспечивают доступность хроматина для транскрипции (например,
ацетилазы и деацетилазы гистонов), другие белки (транскрипционные факторы)
специфически связываются с цис-элементами соответствующих генов, оказывая
непосредственное влияние на процесс транскрипции, третьи являются кофакторами
и влияют на транскрипцию путем белок-белковых взаимодействий с соответству-
ющими транскрипционными факторами. В процессе клеточной дифференцировки
именно появление нового ТФ является сигналом для активации (или подавления)
транскрипции генов на определенной стадии морфогенеза и синтеза необходимых
генных продуктов.
Транскрипционный фактор — это белок, который после перемещения в ядро
клетки регулирует транскрипцию, специфически взаимодействуя с ДНК либо с дру-
гим белком, который может образовывать комплекс белок -ДНК. Один и тот же
регуляторный белок на разных этапах развития способен взаимодействовать с раз-
личными генами. Эукариотические ТФ обычно состоят из двух функциональных
доменов: ДНК-связывающего и активирующего транскрипцию. ДНК-связывающий
домен отвечает за связывание ТФ с нуклеотидной последовательностью-мишенью,
тогда как активирующий домен ТФ принимает участие в белок-белковых взаимодей-
ствиях с другими белковыми факторами (адаптерами, активаторами, вспомогатель-
ными белками). Некоторые ТФ обладают энзиматической активностью и способны
осуществлять ферментативные модификации белковых факторов и ДНК.
Взаимодействуя с дискретными участками ДНК, транскрипционные факторы
образуют сложный промотор. В районе промотора, прилегающем к сайту инициа-
ции транскрипции, обнаружены участки с характерными нуклеотидными последо-
вательностями, которые могут взаимодействовать с РНК-полимеразой и другими
белками-регуляторами транскрипции. Транскрипционные факторы обеспечивают
снижение (репрессоры) или повышение (активаторы) константы связывания РНК-
полимеразы с регуляторными последовательностями регулируемого гена. Именно
ТФ отвечают за селективность и специфичность генной регуляции в различных
клетках и тканях растительного организма.
У арабидопсиса выявлено более 1600 транскрипционных факторов, содержащих
специфические ДНК-связывающие домены и способных активировать или подав-
лять транскрипцию. Количество же транскриптов, формирование которых контро-
лируется транскрипционными факторами, много больше и составляет более 28000.
У растений выявлены практически все типы транскрипционных факторов, функ-
ционирующих у животных и дрожжей. Активность транскрипционных факторов
может регулироваться их димеризацией с другими белками и посттрансляционны-
ми модификациями. У арабидопсиса выявлено более 40 типов бел ков-регуляторов
транскрипции, которые обычно классифицируют по строению ДНК-связывающих
доменов.
Гомеодомен-содержащие белки. Характерной особенностью этого семейства
ТФ является наличие последовательности из 60 аминокислотных остатков, которую
13
называют гомеодоменом (HD). Гомеодомен способен распознавать небольшие нук-
леотидные последовательности (например ТССТ, GATC и др.) и контролировать
таким образом экспрессию определенных генов. Участие гомеодомен-содержащих
белков в контроле гомеозисных процессов, подобно тому, как это происходит у дро-
зофилы, у высших растений пока установить не удалось.
Гомеодомен-содержащие белки растений регулируют функционирование апи-
кальной меристемы побегов, формирование листа, стебля и сосудов, развитие корня,
программированную гибель клеток, избегание тени. У арабидопсиса выявлено около
90 белков этого типа. К ним относятся, в частности, АТНВ-2 {Arabidopsis thaliana
HOMEBOX-2), АТНВ-8, АТНВ-13, BEL1 (BELLI), GL2 (GLABRA2), KNAT1, LD
(LUMINIDEPENDENCE), PHB (PHABULOSA), PHV (PHAVOLUTA), STM (shoot
meristemless), WUS (WUSCHEL).
Выделяют 6 классов гомеодомен-содержащих белков (рис. 1.2): HD-ZIP
(homeodomain-leucine zipper), HD-PHD (homeodomain associated to a finger domain
and leucine zipper), WUS (WUSCHEL), HD-KNOX (homeodomain KNOX), HD-BELL
(homeodomain-bcll domain) и HD-ZF (homeodomain-zink finger).
HD-ZIP
HD-PHD
Leu
zip
START
Leu PHD
zip finger
IMEZZZZZZZMD
Leu
zip
wus ЕИ1
HD-KNOX СЗЗНЖЖШ
--------------------J I
MEINOX ELK
HD-BELL 1_.____________Ж_____ЖИ__________1
HD-ZF
Zn
finger
HD
Рис. 1.2. Расположение гомеодоменов (HD) в полипептидных цепях различных тран-
скрипционных факторов у арабидопсиса (по: Riechmann, 2002)
Помимо гомеодомена эти белки могут содержать лейциновую молнию (leucine
zipper), Zn- и PHD-пальцы (fingers), которые обеспечивают возможность связыва-
ния с ДНК. В состав гомеодомен-содержащих белков могут также входить доме-
ны (ELK, MEINOX), принимающие участие в белок-белковых взаимодействиях. У
некоторых белков в дополнение к гомеодомену и лейциновой молнии имеется так-
же стерол-связывающий домен START (steroidogenic acute regulatory protein-related
lipid transfer domain).
MADS-белки. Мишенями MADS-белков являются гены, в промоторной об-
ласти которых имеется специфическая 10-нуклеотидная последовательность-
CC(AT)gGG, называемая CArG-боксом. В состав всех MADS-белков входит специ-
14
фический, состоящий из 56 аминокислот, ДНК-связывающий домен, который обес-
печивает распознавание этой последовательности. MADS-белки способны формиро-
вать гетеродимеры, различающиеся по способности связываться с ДНК и по тран-
скрипционной активности. Более чем у половины MADS-белков имеется К-домен
(keratin-like), который обеспечивает белок-белковые взаимодействия и возможность
для димеризации (рис. 1.3).
MVRRKIK IKRiENATTR Q V TFSKRRGG LLKK A HDl SV LCDAEVAVil FSSKGKLFQF
MARGKIO IKRIENQTNR Q V TYSKRRNGLFKK А Н ELSV LCDAKVSHM ISS7QKLHEY
MGRGKIE IKRIEN ANSR QVTFSKRHAG LLKKAHELSV UCDA.EVAVIV FSKSGKLFEF
MGRGKI Е 1KRIEN-TNR QVTFSKRRNG LLKKAHELSV LCD AEVALI I FSSRGKLFEF
CRM1
DEFICIENS
AGL-15
консенсус
Рис. 1.3. Аминокислотный состав MADS-доменов у транскрипционных факторов CRM1 папорот-
ника (Cei'atopteris), DEFICIENS львиного зева (Antirrhinum) и AGL-15 арабидопсиса (Ага-
bidopsis)
Это семейство транскрипционных факторов у арабидопсиса включает более
100 белков, к которым относятся AGAMOUS (AG), APETALA1 (API) АРЕТА L АЗ
(АРЗ), PISTILLATA (PL), CAL (cauliflower), FLC (flowering locus С), FUL (FRUIT-
FULL), SEP1 (SEPALLATA1), SEP2 (SEPALLATA2), SEP3 (SEPALLATA3), SHP1
(SHATTER PROOF1), SHP2 (SHATTER PROOF2), SOC1 (suppressor of CONSTANS
overexpression), SVP (short vegetative phase). MADS-белки регулируют формирова-
ния цветков и плодов, принимают участие в регуляции развитая корня и семян.
Некоторые из этих белков способны контролировать гомеозисные процессы.
АР2/ЕНЕ-семейство (A PETAL А2/ethylene response factor) транскрипционных
факторов у арабидопсиса включает около 150 белков, которые участвую? в регу-
ляции развития цветков и семян, а также в передаче этиленового сигнала. ДНК-
связывающий участок этих белков, называемый АР-доменом, содержит два по-
втора из 68 аминокислотных остатков. Именно АР-домен способен распознавать
нуклеотидную последовательность GCC-бокс в промоторах генов, контролируе-
мых АР2/ERF-белками. К генагл, которые кодируют этот тип ТФ, относятся АР2
(APETALA2), ANT (AINTEGUMENTA) и ERF1 (ethylene response factor 1).
MYB-белки (myeloblastosis) относятся к самому многочисленному чипу ТФ
растений. Это семейство ТФ у арабидопсиса включает около 200 белков, контро-
лирующих такие процессы как развитие корня, паттернирование листа, формиро-
вание трихом, клеточный цикл, циркадные ритмы, передачу фитохромного сигна-
ла. ДНК-связывающий домен MYB-белков содержит от одного до трех повторов
из приблизительно 50 аминокислот. Этот тип ТФ специфически взаимодейству-
ет с генами, содержащими (С/Т)ААС(С/Т)С-нуклеотидные последовательности. К
MYB-семейству транскрипционных факторов относятся белки ALP (altered phloem
development), AS1 (asymmetric leaves 1), AtMYB2, AtMYB4. CCA (circadian clock
associated), CPC (CAPRICE), LHY (late elongated hypocotyl), TT2 (transparent testa
2), WER (WEREWOLF), GL1 (GLABRA1).
bHLH-белки (basic helix-loop-helix) относятся к транскрипционным факторам с
15
основным доменом типа «спираль-пстля-спираль». Их ДНК-связывающий участок
из 9-11 положительно заряженных аминокислот обеспечивает распознавание спе-
цифической нуклеотидной последовательности, называе^мой Е-боксом, в то время
как HLH-домен обеспечивает возможность для гомо- и гетеродимеризации белка и
взаимодействие с ДНК.
В это семейство ТФ входит около 140 белков арабидопсиса, включая такие белки
арабидопсиса как GL3 (GLABRA3), SPT (SPATULA) и ТТ8 (transparent testa 8).
Белки bHLH участвуют в регуляции развития корней, трихом и плодолистиков, в
передаче фитохромного сигнала, а также в формировании устьиц.
bZIP-белки (basic leucine zipper) - семейство транскрипционных факторов с ос-
новным ДНК-связывающим доменом типа «лейциновая застежка-молния». В этом
домене остатки лейцина расположены через каждые шесть аминокислотных остат-
ков на равном расстоянии друг от друга и оказываются на одной стороне а-спирали
через каждые два витка. Такие домены не связываются с ДНК, но обеспечива-
ют димеризацию содержащих их транскрипционных факторов путем взаимопро-
никновения лейциновых а-спиралей, которые переплетаются друг с другом, как в
застежке-молнии. В результате в димере появляются две правильно расположен-
ные друг относительно друга полипептидные цепи, составленные преимуществен-
но из основных аминокислотных остатков, которые образуют ДНК-связывающий
центр фактора транскрипции. Этот домен обеспечивает специфическое связывание
с такими нуклеотидными последовательностями как CCACGTCA, CCACGTGG
и TGACGTAA. bZIP-белки участвуют в регуляции ответных реакций растений на
АБК и гиббереллины, контролируют синтез гиббсрелинов, фотоморфогенез, раз-
витие цветка и листа. У арабидопсиса выявлено около 80 bZIP-белков, например
ABI5(ABA-insensitive 5) и HY5 (long hypocotyls 5).
NАС-белки контролируют развитие меристем и формирование органов, а так-
же участвуют в передаче ауксинового сигнала. К N АС-типу относятся ТФ AN АС
(Arabidopsis NAC), NAM (no apical meristem), CUP (CUPULIFORMIS), CUC1 (cup-
shaped cotyledon 1), CUC2 (cup-shaped cotyledon 2) и CUC3 (CUP-shaped cotyledon
3), VND (vascular-related NAC-domain). Регуляция уровня NAC-белков может осу-
ществляться двумя путями: 1) убиквитин-зависимым протеолизом, 2) микроРНК-
зависимым расщеплением их мРНК.
ARF-семейство (auxin response factor) транскрипционных факторов включает
более 20 белков, участвующих в передаче ауксинового сигнала, эмбриогенезе, регу-
ляции формирования цветков и сосудов. Все ARF на N-конце молекулы содержат
ДНК-связывающий домен (DBD, DNA-binding domain). Ряд ARF содержат активи-
рующий домен (AD, activation domain), а в составе других имеется репрессирующий
домен (RD, repression domain). С-конец большинства ARF включает два домена (III
и IV) для димеризации (их также называют CTD-домены — С-terminal domains).
ARF-белки специфически связываются с TGTCTC-последовательностями ауксин-
регулируемых генов и функционируют вместе с репрессором этих генов Aux/IAA
(auxin/IAA).
C2H2(Zn) -белки относятся к транскрипционным факторам, содержащим «цин-
ковые пальцы». Они отвечают за процессы эмбриогенеза, регулируют развитие цвет-
ков, побегов и семян, контролируют время цветения и формирование клубеньков. К
этому семейству ТФ, которое насчитывает более сотни белков, относятся такие, как
EMF2 (embryonic flower 2), FIS2 (fertilization independent seed 2), RHL41 (roothairless
41), SUP (SUPERMAN), VRN2 (VERNALIZATION2).
16
GRAS-семейство ТФ включает более 30 белков арабидопсиса, участвующих в
регуляции развития корня и побегов, в ответных реакциях на гиббереллины, в пе-
редаче фитохромного сигнала. К ним относятся такие белки, как GAI (gibberellic
acid insensitive), РАТ1 (phytochrome A signal transduction), RGA1 (repressor of GAI),
SCR (SCARECROW), SHR (short root).
GARP -семейство транскрипционных факторов включает более 50 белков, ко-
торые участвуют в передаче цитокининового сигнала (например, ARR1 и ARR.2 —
Arabidopsis response regulator) и формировании дорсовентральной симметрии листа
(например, KAN1 и KAN2 - KANADY).
ССААТ-семейство факторов транскрипции специфически связываются с
ССААТ-боксом посредством ДНК-связывающего домена bZIP-типа. Они участву-
ют в регуляции эмбриогенеза и включают более 30 белков, к которым относится,
например, LEC1 (leafy cotyledon 1).
С2С2^п)-белки отвечают за процессы прорастания семян, циркадные рит-
мы, регуляцию времени цветения, дорсовентральную симметрию. К C2C2(Zn)-ce-
мейству транскрипционных факторов относятся СО-подобные белки (CONSTANS-
like), а также белки YABBY-типа, в частности CRC (crabs claw), FIL (filamentous
flower) и INO (inner no outer).
АВ13/УР1-белки контролируют эмбриогенез, развитие и прорастание семени,
передачу сигнала от АБК, дифференцировку пластид. К этому типу ТФ отно-
сятся ABI3 (ABA-insensitives 3), FUS3 (FUSCA3), LEC2 (leafy cotyledon 2), VP1
(VIVIPAROUS 1).
Белки WRKY относят к классу белков, содержащих «цинковые пальцы», и
сходны с этилен-зависимыми факторами транскрипции, например с ER.F1 (ethy-
lene response factor 1). Большинство этих белков содержат так называемые WRKY-
домены, состоящие из 60 аминокислотных остатков, в которые входит очень кон-
сервативная последовательность аминокислот WRKYGQK на N-конце молекулы.
Этот тип регуляторов транскрипции имеет важное значение для устойчивости рас-
тений к патогенам и абиотическим стрессовым воздействиям, которая формируется
с участием таких гормонов, как салициловая, жасмоновая и абсцизовая кислоты.
Помимо этого WRKY-белки участвуют в регуляции развития и прорастания семе-
ни, контролируемых гиббереллинами, а также процесса старения. В растениях риса
выявлено около сотни генов, кодирующих транскрипционные факторы этого типа.
Глава 2
ЭПИГЕНЕТИЧЕСКИЕ МЕХАНИЗМЫ
МОРФОГЕНЕЗА РАСТЕНИЙ
Ранее, рассматривая основы генетической регуляции развития растений, мы опи-
сали сложную систему факторов транскрипции, с помощью которых в клетках
может тонко и быстро изменяться характер генной экспрессии. Такая регуляция
транскрипции генов происходит по классической схеме, описанной Ф. Жакобом и
Ж. Моно около полувека назад для прокариотов. Однако у эукариотов важные ас-
пекты развития находятся также и под эпигенетическим контролем. Эпигенетика
изучает стабильные, передаваемые в длинном ряду делений соматических клеток и
даже в ряду половых поколений изменения уровня экспрессии генов, не связанные
с изменениями последовательности нуклеотидов в ДНК. Широкое распространение
эпигенетических явлений у эукариотов, в частности у растений, обусловлено особен-
ностями организации их ядерного генома.
2.1. Особенности организации ядерного генома растений
В среднем диплоидные ядра растений содержат 10-12 г ДНК, что соответствует
примерно одному миллиарду пар нуклеотидов. Этого количества ДНК достаточно
для кодирования сотен тысяч различных белков. Вместе с тем данные генетиче-
ских исследований на растениях показывают, что число функциональных генов,
кодирующих белки, составляет несколько десятков тысяч, то есть в среднем 10%
от потенциально возможного их количества. Представляется также удивительным,
что близкие виды растений сильно различаются по содержанию ДНК. Так, клетки
конских бобов имеют в семь раз больше ДНК в гаплоидном наборе хромосом, чем
близкородственный вид вика посевная. Разгадка этих несоответствий состоит в том,
что в геноме эукариотов значительная часть последовательностей ДНК представле-
на множеством (до 1 млн) копий определенных, зачастую простых последователь-
ностей, большая часть которых не несет информации о структуре белков. Даже у
арабидопсиса - растения с очень маленьким геномом частые повторы составляют
около 15% ДНК.
Частые повторы могут быть расположены кластерами или диффузно. Наибо-
лее крупные блоки повторов находятся в центромерных и теломерных областях
хромосом. Они транскрипционно неактивны и выполняют структурно-механиче-
ские функции. Некоторые из часто повторяющихся последовательностей, а именно
18
транспозоны и ретроэлементы, способны независимо реплицироваться и встраи-
ваться в различные части генома, что может приводить к мутациям. Доля транс-
позонов и ретроэлехментов особенно велика у растений с крупными геномами. На-
пример, у кукурузы она составляет 83%. Предполагается, что эти мигрирующие
по геному повторы служат для поддержания высокого генетического разнообразия,
необходимого для адаптивной эволюции.
ДНК эукариотов, в отличие от ДНК прокариотов, входит в состав хроматина,
базовый структурный элемент которого представлен нуклеосомой. Нуклеосома со-
стоит из участка двойной спирали ДНК длиной 146 пар нуклеотидов, делающего
1,75 оборота вокруг белкового октамера, построенного из гистонов (по две молеку-
лы НЗ, Н4, Н2А и Н2В). Соседние нуклеосомы соединены линкерными участками
ДНК длиной 20-40 пар нуклеотидов. Благодаря взаимодействию линкерных участ-
ков с гистоном Н1 образуется так называемая «30 нм фибрилла», представляющая
собой нуклеомерный уровень организации хроматина.
Более высокие уровни упаковки ДНК возникают при у час тии белков цитоскеле-
та, которыми богата нуклеоплазма. С помощью этих белков формируются сложные
петли интерфазного хрохматина, а во время деления клеток достигается очень плот-
ная конденсация метафазных хроматид.
Интерфазный хроматин в цитологическом плане делят на гетеро- и эухрохматин.
Гетерохроматин, в отличие от эухроматина, интенсивно окрашивается щелочными
красителями. Он транскрипционно неактивен и во время интерфазы находится в
конденсированHOxM состоянии. Гетерохроматин формирует хромоцентры, из которых
в виде петель выходят участки некондснсированного, активно транскрибируемого
эухроматина. Частые повторы ДНК упакованы в гетерохроматин и таким образом
транскрипционно заглушены.
2.2. Эпигенетические механизмы регуляции экспрессии генов
Один из наиболее известных эпигенетических феноменов, описанный Б. Мак-
Клинток на кукурузе более 40 лет назад, — это циклическая активность транспо-
зонов. Он состоит в тОхМ. что в ряду поколений происходит периодическое освобож-
дение транспозонов от гетерохроматинового подавления их активности. В послед-
ние десятилетия в связи с широким распространением генной инженерии большое
внимание исследователей привлекает эпигенетическое явление постепенного замол-
кания трансгенов в ряду поколений. Еще одним известным явлением наследования
изменений в хроматине являются парамутации, проявляющиеся в том, что репрес-
сированное состояние одного гена передается на гомологичные ему последователь-
ности ДНК.
К эпигенетическим явлениям относится также геномный импринтинг, под кото-
рым понимают дифференциальную экспрессию гена в зависимости от его родитель-
ского происхождения. Например, у арабидопсиса перед оплодотворением в женском
гаметофите наблюдается эпигенетическая активация нескольких генов (МЕА, FWA,
РНЕ), которые в вегетативных тканях обоих родителей находятся в подавленном со-
стоянии. По отцовской линии они передаются в репрессированном состоянии.
Как наиболее яркий пример эпигенетической регуляции индивидуального разви-
тия растений можно рассматривать репрессию у арабидопсиса гена FLC (flowering
locus С), который кодирует ингибирующий цветение фактор транскрипции. Репрес-
сия этого гена происходит в процессе вернализации, или яровизации, которая необ-
19
ходима многим растениям умеренных широт для индукции цветения. Вернализация
достигается воздействием на растения в течение нескольких дней, недель или меся-
цев низкой положительной температуры на той или иной стадии их вегетативного
развития. Например, цветение арабидопсиса значительно ускоряется, если замочен-
ные семена в течение двух-трех дней выдерживать при 2°С. Происходящая в этих
условиях репрессия ингибирующего цветение гена FLC сохраняется на всю жизнь
растения независимо от того, при какой температуре оно в дальнейшем выращива-
ется.
Модификация ДНК. Эпигенетические механизмы регуляции экспрессии ге-
нов в основном реализуются посредством стойких модификаций хроматина в тех
участках, где эти гены расположены. Эпигенетическая регуляция активности генов
главным образом проявляется в их долгосрочной репрессии. Известно значительно
меньше примеров стойкого повышения уровня генной экспрессии, поэтому наиболее
изучены именно механизмы эпигенетической репрессии, а не активации генов. Тран-
скрипционное подавление генов достигается посредством ремоделирования хрома-
тина, метилирования ДНК и метилирования гистонов.
Хроматин-ремоделирующий комплекс участвует в АТФ-зависимом скольжении
гистоновых октамеров, составляющих ядро нуклеосом, вдоль цепи ДНК. Таким об-
разом достигается реорганизация нуклеосомной структуры хроматина. Нарушение
работы хроматин-ремоделирующего комплекса у ddml (decreased DNA methylation
1) и moml (morphcus molecule 1) мутантов арабидопсиса по двум АТФазпым субъ-
единицам (DDM1 и М0М1) приводит к нарушению образования хромоцентров, к
реактивации заглушенных транспозонов, ретротранспозонов и трансгенов и, в то же
время, к глушению ряда генов, активных у нормальных растений.
Поскольку линкерная ДНК более доступна для транскрипции, чем нуклеосом-
ная, уровень транскрипции многих генов может быть изменен самим фактом пе-
ремещения гистоновых октамеров вдоль молекулы ДНК. Однако это не главная
причина глушения генов. Гораздо важнее то, что работа хроматин-ремоделирую-
щего комплекса необходима для дальнейших модификаций хроматина, главной из
которых является метилирование ДНК — важнейшая детерминанта эпигенетики.
Поэтому у ddml мутантов в целом резко снижен уровень метилирования ДНК, но
при этом метилируются и репрессируются некоторые гены, псметилированные и
активные у нормальных растений.
Метилированию подвергаются остатки цитозина в положении 5. У животных по-
добная модификация может происходить только в CG последовательности. У расте-
ний 5-мстилцитозин обнаружен также в CNG последовательностях, где N — любой
нуклеотид, и в СХХ последовательностях, где X - любой нуклеотид, кроме гуано-
зинфосфата.
Наиболее густому метилированию подвергаются частые повторы, причем уро-
вень их метилирования коррелирует со степенью их репрессии. Замолкапие транс-
гепов также связано с их густым метилированием но цитозину. Есть ряд приме-
ров метилирования эндогенных генов, кодирующих белки, включая факторы тран-
скрипции. Например, геномный импринтинг часто достигается посредством избира-
тельного метилирования или деметилирования генов. Обычно репрессированные в
вегетативных тканях арабидопсиса гены ME А и ЕИ64 метилированы в области про-
моторов. Реактивация этих генов в эндосперме, где экспрессируются гены, имеющие
материнское происхождение, связана с их деметилированием в женском гаметофите
перед оплодотворением.
20
Гены PHABULOSA и PHAVOLUTA. кодирующие факторы транскрипции класса
HD-ZIP, также содержат 5-метилцитозин. Эти гены участвуют в становлении дорсо-
вентральной симметрии листа. Их экспрессия подавляется только на абаксиальной
стороне листового примордия (будущей нижней стороне листа).
У арабидопсиса известно десять ДНК-метилтрансфераз, среди которых наибо-
лее изучена МЕТ1, метилирующая цитозин в CG последовательности, и уникальная
для растений СМТЗ, метилирующая цитозин в других положениях. Метилирование
ДНК —довольно устойчивая модификация, и деметилирование происходит редко.
Оно достигается при участии ДНК-гликозилаз, удаляющих метилированный цито-
зин. Активность МЕТ1 тесно связана с функционированием хроматин-рсмоделиру-
ющего комплекса и нарушена у мутанта ddml. Активность СМТЗ зависит от метили-
рования гистонов, представляющего собой еще один очень важный эпигенетический
механизм регуляции экспрессии генов.
Модификация гистонов. Гистоны в составе нуклеосомы имеют обращенные
наружу N-концы полипептидов, которые могут подвергаться многочисленным моди-
фикациям. Эти модификации очень сильно влияют на уровень транскрипции генов,
находящихся в контакте с модифицированными гистонами. Некоторые из этих моди-
фикаций, такие как фосфорилирование и, в меньшей степени, ацетилирование, носят
динамичный характер. Они могут довольно быстро возникать и исчезать. Наиболее
статичный характер носит метилирование гистонов. Таким образом, метилирова-
ние гистонов может рассматриваться как эпигенетическая метка, хотя с помощью
специальных гистон-деметилаз оно все-таки может сниматься. Фосфорилированию
подвергаются остатки оксиаминокислот: серина (S) и треонина (Т). Ацетилирова-
ние и метилирование в основном происходят по 6-аминогруппе остатков лизина (К),
причем к одному остатку лизина может присоединяться до трех метильных групп.
К остаткам лизина посредством изопептидной связи может также присоединяться
белок убиквитин. Кроме того могут метилироваться некоторые остатки аргинина
(R).
На рис. 2.1 представлены модификации, которым подвержены N-концы гистонов.
Гистон НЗ может обратимо фосфорилироваться по S10 и S28, ацетилироваться по
К9, К14, К18 и К23, метилироваться по R2, К4, К9, К14, R17, К18, К23, R26, К27 и
КЗб. Гистон Н4 может фосфорилироваться по S1, ацетилироваться по К5, К8, К12,
К16 и К20, метилироваться по R3 и К20. Гистон Н2А подвержен фосфорилированию
по S1, ацетилированию по К5 и К9, убиквитинированию по К119, а Н2В может
ацетилироваться по К5, К12, К15, К20 и убиквитинироваться по К120.
Разные модификации N-концов гистонов могут влиять друг на друга. Очевидно,
что если остаток лизина ацетилирован, то он может быть прометилирован только
после деацетилирования. Кроме того, наблюдается влияние друг на друга модифи-
каций, затрагивающих различные сайты гистонов. Например, фосфорилирование
H3S10 и метилирование НЗК4 подаляют метилирование НЗК9.
Перечисленные выше модификации по-разному влияют на экспрессию генов.
Фосфорилирование и ацетилирование гистонов приводят к активации транскрип-
ции. Эффект этих модификаций объясняется главным образом тем, что они умень-
шают положительный заряд гистонов, благодаря которому гистоны взаимодейству-
ют с кислой ДНК.
Влияние метилирования гистонов на транскрипцию генов зависит от того, где
оно происходит. Так, диметилирование по НЗК9 (НЗК9те2) связано с очень силь-
ным гетерохроматиновым подавлением генов, а ди- и триметилирование по НЗК27
21
[м]
NhL-ARTKQTARKSTGGKAPRKQLATKAARKSAPATGGVKK----S
2 4 9 10 14 1718 23 26 27 28
nh4-sgrgkggkglgkggakrhrkvlrdniq
1 3 5 8 12 16 20
Рис. 2.1. Модификации N-концовых участков гистонов, входящих в состав нуклеосо-
мы (по: Lusser. 2002):
М - метилирование, Л — ацетилирование, Р — фосфорилирование, LJ -- убиквитиниро-
вание
(НЗК27те2 и НЗК27те3) связано главным образом с репрессией генов, расположен-
ных в эухроматине.
Метилирование НЗ по расположенному в четвертом положении остатку лизина
(НЗК4те2), напротив, приводит к активации генов. Разнонаправленность влияний
метилирования гистонов на транскрипцию генов объясняется тем, что метилирова-
ние изменяет транскрипцию не само по себе, а привлекая ингибиторы и активаторы
транскрипции. Предполагается, что характер метилирования гистонов представля-
ет собой «гистоновый код», который прочитывается другими белками с помощью
специальных доменов. Так, подавление транскрипции генов посредством НЗК9те2
и НЗК27те3 модификаций связано с тем, что эти модификации узнаются белками,
имеющими так называемый хромодомен. У арабидопсиса хромодомен обнаружен
у метилтрансферазы СМТЗ, метилирующей ДНК по цитозину, и у ингибиторно-
го, способствующего плотной упаковке хроматина белка LHP1 (like heterochromatin
protein 1).
Многие гистон-метилтрансферазы, контролирующие метилирование гистонов,
хорошо изучены. У арабидопсиса их насчитывается 29. К ним относится KYP, ко-
торая метилирует НЗК9 в ходе образования гетерохроматина. Она работает только
в тех участках ДНК, где с помощью МЕТ1 прометилировап цитозин в CG после-
довательностях, поэтому у мутантов metl резко снижено содержание НЗК9те2 и
НЗК9те3. Гистон-метилтрансферазы, относящиеся к Trithorax группе (Trx-G), вы-
зывают очень стойкое метилирование НЗК4, которое приводит к длительной акти-
вации генов эпигенетического характера.
Важную роль в длительной репрессии уникальных последовательностей ДНК
в эухроматине играют гистон-метилтрансферазы Poly comb группы (PcG). С их
22
IWWWJ
Ремоделирование
хроматина
DDM1
Метилирование CGI МЕТ1
Деацетил ирование
гистонов
HDAC
Метилирование
гистонов по НЗК9
I LHP1 Метилирование CNG I смтз
и СХХ сайтов 1
Рис. 2.2. Формирование плотно упакованного, нетранскрибируемого хроматина у
арабидопсиса (по: Lusser, 2002): О - ацетилированные гистоны, А — мети-
лированные гистоны. ★ метилированные CG сайты, другие метили-
рованные сайты ДНК
23
помощью происходит образование НЗК27те3, НЗК27те2 и, возможно, НЗК9те2.
У арабидопсиса к PcG генам относятся CLF, ME A, SWN, FIE, VRN1, VRN2. Му-
тации в PcG генах вызывают гомеозисные преобразования. Так, мутанты elf и sum
формируют бесцветную каллусную массу. Очевидно, что избирательное и длитель-
ное подавление транскрипции генов с участием PcG гистон-метилтрасфераз имеет
чрезвычайно важное значение для дифференциации клеток. Действие PcG в основ-
ном направлено на факторы транскрипции. У растений наиболее яркой демонстра-
цией активности PcG белков может служить репрессия MADS-домен-содержащих
факторов транскрипции FLC и AGAMOUS. Метилирование гистонов (НЗК27те2,
НЗК27те3, НЗК9те2) в окружении гена FLC, кодирующего ингибитор цветения,
происходит в процессе вернализации с помощью VRN1 и VRN2. В глушении
AGAMOUS, который экспрессируется только в процессе формирования генератив-
ных частей цветка, участвует CLF.
Таким образом, хроматиновая репрессия генов происходит благодаря коорди-
нированной работе нескольких белковых комплексов, модифицирующих хроматин.
При образовании гетерохроматина они предположительно работают в следующей
последовательности (рис. 2.2). Вначале хроматин-ремоделирующий комплекс опре-
деленным образом размещает нуклеосомы вдоль ДНК. Это помогает МЕТ1 най-
ти доступ к CG сайтам и прометилировать их по цитозину. Затем гистон-деа-
цетилазные комплексы (HDAC), в состав которых входят белки, связывающие-
ся с метилированными CG сайтами, деацетилируют специфические остатки ли-
зина у НЗ и Н4, что позволяет гистон-метилтрансферазе KYP прометилировать
НЗК9. Сайты НЗК9те2, в свою очередь, привлекают содержащие хромодомен ДНК-
метилтрансферазу СМТЗ и репрессорный белок LHP1, что приводит к дальнейшему
метилированию ДНК и уплотнению хроматина.
2.3. Участие малых РНК в регуляции развития
Открытие целого мира малых РНК (small RNAs, sRNAs), регулирующих экс-
прессию генов, произошло в конце 1990-х гг., а в 2006 г. авторам этого открытия
Э. Фаеру и К. Мелло была присуждена Нобелевская премия. При изучении подавле-
ния генной экспрессии с помощью антисмысловой РНК у нематоды Caenorhabditis
elegans был обнаружен поразительный феномен, который вначале поставил иссле-
дователей в тупик. Оказалось, что подавление экспрессии гена можно вызвать не
только введением в клетки антисмысловой РНК, но и с помощью смысловой РНК.
Однако в десятки и сотни раз более эффективным было введение смеси смысловой
и антисмысловой РНК, иными словами введение двухцепочечной РНК.
В дальнейшем выяснилось, что сама по себе двухцепочечная РНК инертна и
не способна к дальнейшему спариванию оснований по Уотсону-Крику. Однако опа
может выступать триггером РНК-интерференции благодаря тому, что в клетках ра-
ботает мощный и высокоспецифичный механизм процессинга двухцепочечных РНК
с превращением их в высокоактивные короткие одноцепочечные sPHK длиной 20-
24 нуклеотида. Эти sPHK и являются агентами РНК-интерференции, необходимой
как для метилирования ДНК и гистонов, так и для устойчивой посттранскрипци-
онной репрессии генов, передаваемой при клеточном делении как метастабильное
состояние цитоплазмы. Малые РНК делятся на две большие группы: микро-РНК
(miRNAs) и малые интерферирующие РНК (short interfering RNAs, siRNAs). Они
значительно отличаются друг от друга по своему генезису и по характеру действия.
24
Микро-РНК растений. Микро-РНК закодированы на собственных генах и
транскрибируются с помощью РНК-полимеразы II в длинные, состоящие пример-
но из одной тысячи нуклеотидов первичные транскрипты (pri-miPHK), которые,
подобно кодирующим белки мРНК, кэпированы и полиаденилированы (рис. 2.3).
Первичные транскрипты кодирующих miPHK генов имеют в своей средней части
характерную структуру «шпильки», состоящей из «стебелька» и «головки».
mi РНК
ДНкЬ
7mG-
Дуплекс
ra-si РНК
•тотг—МАА
ra-si РНК
Днк
Первичный
транскрипт
Метилирование
ДНК
Двухцепочечная
РНК
Y Полимераза?
Ядро
Цитоплазма
AGO4
ШПТП---АААА
Рис. 2.3. Процессинг miPHK и ra-siPHK и их действие на транскрипционном и посттранскрипци-
онном уровнях (по: Vazques, 2006)
В ядре происходит разрезание pri-miPHK с помощью белка DCL1 (Dicer like 1),
содержащего два домена с активностью РНКазы III. Разрезание осуществляется
в два этапа. Сначала происходит вырезание из первичного транскрипта «шпиль-
ки», включающей обычно более ста нуклеотидов и обозначаемой как pre-miPHK
(рис. 2.4). Затем из области «стебелька» pre-miPHK вырезается короткий двухцепо-
чечный фрагмент длиной 20-22 нуклеотида. Для правильного созревания miPHK
кроме DCL1 требуется также белок HYL1, узнающий двухцепочечные РНК, и белок
HEN1, который метилирует 2'-ОН-группы З'-концевых остатков рибозы у двухцепо-
чечных РНК.
Дуплекс miPHK обычно переносится в цитоплазму и вступает во взаимодействие
с белком AGO1, обладающим активностью РНКазы Н. Для взаимодействия дуплек-
са miPHK с AGO1 важны фосфодиэфирные связи, которыми соединены на обоих
25
Петля из 40
нуклеотидов
A U
U I
U
UA-U‘
и G
A-U
A U
G U
U-A
G-C
U-AAA.
А
С G
C-GAA0
U-A
U-A
A-U
А С
C-G
U-A
A-U
G-C
C-G
U-A
A-U
С А
U-A
U-A
G-C
G-C
С U
G-C
A-U
C-G
G-C
G А
A-U
G-C
G-C
U-A
C-G
G-C
C-G
U С
5' 3
miR162
Арабидопсис
и
и
,и
G U
C-G
G G
A-U
G-C
G-C
A-U
С и
C-G
U и
U
A G
G-C
U-A
C-G
G-C
С СА
G-C
G G
U-A
G С
U-A
U-A
С С
C-G
G-C
U
C-G
C-G
C-G
U-A
U-A
С и
С с
C-G
U-A
A-U
G-C
C-G
U-A
A-U
U-A
U-A
U-A
G-C
G-C
и и
G-C
A-U
C-G
G-C
С А
G U
G-C
G-C
U-A
C-G
С
G
5'
U
и
3'
miR162
Рис
A U
A U
G U
G U
C-G
GU
aug
U-A
A-U
U-A
A-U
U-A
G G
U-A
G U
C-G
GU
UG
А%
А rU
a-ug
C-G
A-U
C-G
C' U
A-U
C-G
U-A
C-G
U U
C-G
A-U
c-Qau
a-uag
U-A
A-U
UG
A G
U-A
A-U
C-G
U-A
C-G
G U
AU
U-A
C-G
uA’uu
и C
A U
cG-cu
U-A
GU
C-G
A-U
C-G
G-C
G-C
agca
CG-CU
A-U
A-U
agca
G-C
G-C
U-A
A-U
G-C
5 3'
miR164
Арабидопсис
СС
U А
C-G
G-C
A Cjj
U ии
C-G
V
C-G
С U
U G
C-G
C-G
и
C-G
C-G
U-A
U-A
С'%
и ии
U-A
C-Q
U-A
лисАЛ
CUAC-G
U-A
U-A
G-C
AU U
UA °
АС-в
G-C
иАс
A-U
C-G
G-C
U-A
G-C
C-G
A-U
C-G
G G
G-U
G-C
A-U
С С
G-C
A-U
A-U
G-C
A-U
G-C
G-C
и и
G-C
С С
G-C
5' 3
miR164
Рис
Рис. 24. Предполагаемые вторичные структуры рге-ппРНК, являющихся предше-
ственниками микро-РНК miR162 и miR.164 из арабидопсиса и риса (по:
Barakat et al., 2007). Нуклеотидные последовательности miR.162 и 164 по-
казаны фигурными скобками
26
концах дуплекса 5'-концевой нуклеотид одной цепи и второй с З'-конца нуклеотид
другой цепи. Белок AGO1 гидролизует одну из цепей дуплекса и прочно соединя-
ется с другой цепью. В комплексе с AGO1 зрелая одноцепочечная miPHK способна
вызывать избирательный гидролиз РНК, а в комплексе с AGO4 - влиять на мети-
лирование хроматина в комплементарных ей участках ДНК. Всего у арабидопсиса
имеется десять гомологичных AGO1 белков.
Малые интерферирующие РНК растений. В отличие от miPHK непосред-
ственными предшественниками siPHK являются полностью комплементарные длин-
ные двухцепочечные РНК, которые в большинстве случаев образуются в результате
активности РНК-зависимых РНК-полимераз (RDR), направленной на одноцепочеч-
ные РНК экзогенного и эндогенного происхождения. Типичные мРНК недоступны
для РНК-зависимых РНК-полимераз благодаря их копированию и полиаденилиро-
ванию. РНК-зависимые РНК-полимеразы могут собирать вторую цепь на одноце-
почечной РНК вироидов, на продуктах транскрипции вирусной ДНК и трансге-
нов. Эндогенными субстратами RDR могут быть транскрипты повторов (рис. 2.3).
В результате процессинга двухцепочечных РНК, собранных на транскриптах повто-
ров, возникают га-siPHK (repeat-associated siRNAs). Вторая цепь может собираться
также на транскриптах особых генов, кодирующих ta-siPHK (trans-acting siRNAs).
Кроме того, двухцепочечные РНК могут появляться в клетках и без участия РНК-
зависимых РНК-полимераз, а благодаря тому, что в геноме имеется до 20% генов,
последовательности которых частично перекрываются в антисмысловой ориента-
ции. В результате транскрипты этих генов частично комплементарны друг другу
и спариваются. Малые siPHK, образующиеся таким путем, обозначаются как nat-
siPHK (natural antisense transcript derived siRNAs).
Процессинг siPHK (рис. 2.3) сходен с процессингом miPHK, и в нем участву-
ют те же белки или их гомологи: DCL2, DCL3, HYL1, HEN1, AGO1, AGO4 и
другие. Двухцепочечные РНК разрезаются па 20 24-нуклсотидные двухцепочеч-
ные фрагменты, которые на обоих концах имеют фосфодиэфирную связь между
5'-концевым нуклеотидом и вторым с З'-конца нуклеотидом комплементарной цепи,
а также метилированные 2'-ОН-гругп1ы З'-копцевых остатков рибозы. Далее дуп-
лексы siPHK взаимодействуют с AGO, в результате чего одна цепь дуплекса гидро-
лизуется, а вторая остается прочно связанной с AGO 1/4 и может служить агентом
РНК-интерференции.
РНК-интерференция, осуществляемая с помощью малых РНК, может вызвать
избирательную репрессию генов как на транскрипционном, так и на посттранскрип-
ционном уровнях, причем РНК-зависимая репрессия генов часто носит длительный!
характер. Первые данные о том, что РНК-интерференция важна для метилирова-
ния ДНК у растений, были получены пятнадцать лет назад при изучении действия
вироидов. Оказалось, что вироид, представляющий собой одноцепочечную кольце-
вую РНК без белковой капсулы, вызывает метилирование ДНК в гомологичных ему
участках генома табака. Экспрессия трансгенов также может приводить к метили-
рованию и глушению гомологичных генов. Это глушение опосредовано действием
siPHK и не наблюдается, если нарушен механизм их образования.
Накопилось немало фактов, доказывающих, что метилирование эндогенных ге-
нов и образование гетерохроматина также направляется малыми РНК. Так, у мутан-
тов по AGO1 и DCL1 нарушен процесс образования гетерохроматина. У арабидопси-
са метилирование ретротранспозона AtSNl происходит с помощью определенной га-
siPHK и нарушается у мутанта по AGO4- Ген арабидопсиса FWA, метилированный
27
в природных условиях, после его реинтродукции в растения путем бактериальной
трансформации реметилируется при участии siPHK, и этот процесс подавляется
при нарушении функций DCL3 и РНК-зависимой РНК-полимеразы. Метилирование
ДНК генов PHAVOLUTA и PHABULOSA у арабидопсиса происходит при участии
miR165 и miR166. Механизм, посредством которого малые РНК вызывают метили-
рование ДНК и глушение транскрипции генов, остается малоизученным. Возможно,
РНК-зависимое метилирование ДНК опосредовано РНК-зависимым метилировани-
ем гистонов. Неясно также, взаимодействуют ли малые РНК непосредственно с ком-
плементарными им участками ДНК или с их нарождающимися транскриптами.
Значительно лучше изучен механизм РНК-зависимой репрессии генов на пост-
транскрипционном уровне. Она может осуществляться посредством гидролиза
мРНК, имеющих комплементарные малым РНК последовательности. Этот про-
цесс происходит следующим образом. Малая РНК в комплексе с AGO1 садится на
комплементарный ей участок мРНК (рис. 2.3) и таким образом создает фрагмент
двухцепочечной РНК. Затем благодаря РНКазной активности AGO, направленной
на двухцепочечную РНК, происходит разрыв мРНК в середине комплементарного
участка (между 10- и 11-м нуклеотидами sPHK).
У животных miPHK существенно отличаются от siPHK по характеру действия
на мРНК: под влиянием miPHK происходит не гидролиз, а подавление трансля-
ции мРНК. Механизм подавления трансляции менее понятен, чем механизм раз-
рыва мРНК. По-видимому, подавляется элонгация или терминация трансляции, но
не ее инициация, так как miPHK животных присоединяются обычно к З'-концевому
нетранслируемому участку мРНК. У растений miPHK, подобно siPHK, обычно при-
соединяется к своей мишени в кодирующей части и разрывает ее.
Роль малых РНК в регуляции развития растений. Малые РНК жизненно
необходимы растениям. Об этом свидетельствуют летальные эффекты нулевых му-
таций арабидопсиса по AGO1 и DCL1 — генам, участвующим в созревании малых
РНК. Гибель зародышей происходит уже на стадии глобулы.
Содержание siPHK в клетках значительно более высокое, чем miPHK. Главная
роль siPHK состоит в защите от чужеродных РНК и ДНК. Устойчивость растений к
вирусам в большинстве случаев связана не с развитием реакции сверхчувствитель-
ности, но с высокоспецифичным разрывом вирусной РНК при участии siPHK. Эти
малые РНК являются также основными агентами замолкания трансгенов. Кроме
того, siPHK, как уже отмечалось, участвуют в репрессии повторов ДНК, в первую
очередь транспозонов и ретротранспозонов. Действие siPHK, за исключением ta-
siPHK, направлено на те последовательности, на которых они синтезированы, что
существенно отличает их от miPHK, синтезирующихся на собственных генах.
В каждом растении, по-видимому, содержатся сотни различных микро-РНК. Их
строение эволюционно консервативно, и наблюдается высокая степень гомологии
miPHK цветковых с miPHK хвойных, папоротников и мхов. Микро-РНК могут пе-
редаваться по симпласту от клетки к клетке, а также передвигаться по флоэме на
большие расстояния.
У арабидопсиса почти 70% всех известных микро-РНК имеют своей мишенью
факторы транскрипции (табл. 2.1), при том что только 6% генов арабидопсиса ко-
дируют факторы транскрипции. Хорошо изучена репрессия посредством семейства
miR165 и miR166 генов PHABULOSA, PHAVOLUTA и REVOLUTA, кодирующих
факторы транскрипции семейства HD-ZIP, которые важны для становления дорсо-
вентральной симметрии листа. Репрессия достигается посредством разрыва мРНК.
28
Таблица 2.1. Мишени некоторых микро-РНК у арабидопсиса
Семейство микро-РНК Мишени микро-РНК
Семейство белков Конкретные гены Функции генов
miR159/JAW MYB факторы транскрипции TCP факторы транскрипции MYB33, MYB65, ТСР2, ТСРЗ, ТСР4, TCP 10, TCP23 Эмбриогенез, развитие листа
miR160 ARP факторы транскрипции ARF10, ARF16, ARF 17 Ауксиновая сигнализация, развитие корня
miR162 Dicer-подобные белки DC LI Процессинг малых РНК
miR164 NAC факторы транскрипции CUC1, CUC2, NAC1 Определение границ органов в меристеме, разделение ор- ганов, определение числа ле- пестков
miR165/166 HD-ZIP факторы транскрипции PHB, PHV, REV Дорсовентральная симметрия листа
miR168 ARGONAUTE AGO1 Процессинг и активность малых РНК
miR172 Факторы транскрипции, по- добные APETALA2 AP2, TOE1, TOE2, TOES Идентификация органов цветка, время цветения
miR173 miR390 ta-siPHK TAS1, TAS2, TASS Избирательное глушение генов »
miR395 АТФ-сульфурилаза APS3 Регуляция усвоения сульфатов
miR398 Медь-содержащая суперок- сиддисмутаза, субъединица V цитохром-с-оксидазы CSDl, CSD2, At3gl56J0 Регуляция окислительного стресса
miR399 Убиквитин-конъюгирующие белки E2-UBC Регуляция избирательного гидролиза белков в условиях стресса
В генах PHABULOSA и PHAVOLUTA кроме того происходит метилирование ДНК.
Другим ярким примером участия микро-РНК в регуляции развития растений может
служить репрессия посредством miR172 флорального гена APETALA2 в приморди-
ях плодолистиков и тычинок.
Микро-РНК играют важную роль в ауксиновой сигнализации, так как их ми-
шенями являются цитоплазматический рецептор ауксина TIR1 и ауксин-зависимые
факторы транскрипции ARF.
Некоторые микро-РНК регулируют сам процесс образования малых РНК, раз-
рывая мРНК, кодирующие DCL1 и AGO1, и снижая тем самым синтез малых РНК.
Другие микро-РНК, напротив, способствуют синтезу малых РНК. Так, ряд микро-
РНК выполняет роль затравки для РНК-зависимой РНК полимеразы в процессе
сборки двухцепочечной РНК, необходимой для образования siPHK.
Обнаружены микро-РНК, нацеленные на мРНК ферментов (лакказы, цито-
хром-с-оксидазы, АТФ-сульфурилазы), а также на мРНК белков, ассоциированных
с избирательной убиквитин-зависимой деградацией белков в цитоплазме и нуклео-
плазме. Содержание некоторых микро-РНК в клетках резко возрастает в условиях
стресса, например при засухе, охлаждении, механических воздействиях, под дей-
ствием ультрафиолетового облучения.
Глава 3
ПОЛЯРНОСТЬ
В любом многоклеточном организме, в том числе и растительном, жизнедеятель-
ность отдельных органов, тканей и клеток должна быть скоординирована таким об-
разом, чтобы обеспечить функционирование организма как целого. Только в этом
случае возможно эффективное отправление различных физиологических функций
организма, его адекватная реакция на разнообразные раздражители и полная ре-
ализация в онтогенезе морфогенетической программы. Одним из наиболее суще-
ственных элехментов целостности организма, и в первую очередь у высших растений,
является полярность, то есть осевая, или аксиальная (от англ, axis — ось), органи-
зация их тела в пространстве. Полярность можно определить как существование
функционально значимых асимметричных структур, образующихся в ответ на дей-
ствие векторизованных стимулов (внешних или внутренних).
Помимо аксиальной выделяют также и другие формы полярности. Дорсовен-
тральная полярност,ь, например, выражается в различиях между верхней и ниж-
ней сторонами листьев. У структур, обладающих радиальной симметрией, может
проявляться радиальная полярность. Однако чаще всего термин «полярность» ис-
пользуется для обозначения осевой полярности.
Осевая симметрия является той основой, на которой создается специфическая
трехмерная структура организма, осуществляется ориентации растения в простран-
стве, обеспечивается координация его функций и адекватная реакция на различные
раздражители. Благодаря аксиальности не происходит образования бесформенной
массы живого вещества, но закладываются в определенном порядке и взаимодей-
ствуют ткани и органы. Процессы поляризации клеток и тканей при морфогенезе
имеют определяющее значение, поскольку возникающие при этом градиенты мор-
фогенетических факторов являются основой для дифференциальной активности ге-
нома в разных клетках и тканях на различных этапах развития растений. Именно
полярность является тем инструментом, с помощью которого осуществляется раз-
метка (паттернирование) формирующихся органов и тканей растения.
Оси полярности появляются уже на стадии зиготы, прослеживаются у зародыша
и «векторизуют» рост на протяжении всего дальнейшего развития растительного
организма. Однако реальные процессы, лежащие в основе полярной организации, а
также особенности взаимодействия клеток, тканей и органов в ходе формирования
осевой симметрии у высших растений пока еще изучены очень слабо.
Учение о полярности являлось исходным пунктом при попытках многих иссле-
дователей понять принципы дифференциации. Первым исследователем, высказав-
шимся в пользу большого значения полярности для развивающегося яйца, был эм-
30
бриолог К. Бэр. В ботаническую литературу термин «полярность» впервые ввел
X. Фехтинг, который в 1878 г. начал изучать полярные свойства высших растений.
Он считал, что явление полярности в целом растении является результатом поля-
ризованное™ составляющих его отдельных клеток. Детальный анализ возможных
принципов, лежащих в основе полярной организации растительных организмов, был
сделан Э. Синнотом в 1960 г. Под полярностью он понимал специфическую ориен-
тацию активности и морфогенеза растения в пространстве.
Особенно продуктивной для понимания процессов дифференцировки и развития
оказалась теория Ч. Чайлда, опубликованная в 1941 г., основой которой являются
представления об осевом физиологическом градиенте. Ч. Чайлд полагал, что фи-
зиологическая активность различных частей организма неодинакова и закономерно
изменяется в направлении его морфологических осей. Если взять главную морфо-
логическую ось организма, то на одном ее конце обнаруживается максимальная
физиологическая активность, а на другом - минимальная; их разделяют активно-
сти промежуточного значения. В понятие физиологической активности (и, соответ-
ственно, градиентов) Ч. Чайлд включал любые типы обмена веществ и целый ряд,
как он выражался, «физиологических констант», таких как концентрации веществ,
осмотическое давление, оводненность, проницаемость. Ч. Чайлд считал, что именно
физиологический осевой градиент обеспечивает целостность и взаимосвязь между
отдельными частями организма, является основной причиной дифференцировки. В
процессе развития яйца, например, факторы внешней среды будут неодинаково вли-
ять на его различные участки и, вызывая различную реакцию вдоль физиологиче-
ской оси, способствовать первым этапам развития. При этом под влиянием внешних
факторов возникающие вдоль оси чисто количественные различия обмена веществ
переходят в различия качественного порядка. Например, в процессе развития имею-
щей форму шара яйцеклетки бурой водоросли Fucus возникает выпячивание опреде-
ленного участка, который затем удлиняется. Первое деление яйцеклетки происходит
в плоскости, перпендикулярной оси, по которой происходит удлинение. Клетка с вы-
ростом становится ризоидом, другая -- дает начало таллому. Таким образом, с точки
зрения Ч. Чайлда, в процессе развития наиболее существенное значение имеют фи-
зиологические градиенты, а также характер внешних воздействий.
В ряде случаев идея о целостности организма может быть проанализирована с
точки зрения теории (или концепции) поля. Целостность означает несводимое™
рассматриваемого явления к составляющим его элементам. Если целостность яв-
ляется чем-то большим, нежели сумма слагающих ее элементов, можно говорить
об органической целостности явления, или, по выражению Л. Берталанфи, «кон-
стелляции органической материи». Впервые попытку применить понятие поля для
биологии осуществил А. Г. Гурвич в 1944 г., который, занимаясь эмбриологией, при-
шел к выводу о несводимое™ актов развития к элементарным процессахМ. Теория
Ч. Чайлда в этом плане представляет частный случай теории поля и является одной
из его разновидностей, поскольку градиенты Ч. Чайлда во многом соответствуют
градиентам математической теории поля.
В дальнейшем, однако, применить теорию векторного поля для решения проблем
морфогенеза оказалось очень сложным. Лишь для небольшого количества биоло-
гических объектов и моделей удалось свести процессы морфогенеза к задачам по
кинематике и динамике, поскольку большинство эмбриологов использовали только
теорию векторного поля либо такого поля, о природе потенциалов которого ничего
не известно.
31
3.1. Факторы индукции полярности
Поляризацию можно индуцировать как с помощью физических, так и химиче-
ских воздействий, которыми могут быть факторы внешней среды, а также сигналы
и процессы, возникающие в самом организме. Отличительной особенностью поля-
ризующих воздействий является их векторный, направленный характер. При этом
необходимо учитывать, что в процессах роста и дифференцировки принципиальное
значение имеют не только количественные параметры поляризующего фактора, но
также его адекватность конкретному растительному объекту.
Свет. К наиболее важным факторам, влияющим на процессы роста и развития
растенийГ^относится свет: его направление, качественные и количественные характе-
ристики. Векторное воздействие света имеет большое значение при фототропизме,
фотоморфогенезе, а также индукции дифференцировки зигот у некоторых водорос-
лей.
В ходе жизнедеятельности растительного организма, особенно на ранних эта-
пах его развития, вероятно, происходит формирование аксиальных световых гради-
ентов вдоль надземной части и корневой системы, поскольку растительные клет-
ки и ткани могут служить световодами. При этом вследствие интенсивного по-
глощения тканями надземной части высокоэнергетической части спектра корне-
вая система нередко оказывается под воздействием красного или дальнего красного
света.
При сравнении грави- и фототропической реакций у зеленых и этиолированных
растений оказалось, что при этиоляции доминирующей становится гравитропиче-
ская реакция. При зеленении проростков, несмотря на возрастание их способности
к гравитропизму, фототропическая реакция возрастает в еще большей степени, при-
чем настолько, что фотостимуляция может подавить или даже обратить гравитро-
пический изгиб.
У спор хвоща и других низших растений свет детерминирует плоскость первого
клеточного деления. Первичная клеточная стенка образуется под прямым углом к
падающему свету.
Сила тяжести. Наиболее выраженным поляризованным внешним фактором
является гравитация, поскольку направление и величина гравитационного стиму-
ла в каждой конкретной точке пространства практически не изменяется в течение
всего развития растительного организма. Поэтому естественно, что растения сфор-
мировали тонкие механизмы, благодаря которым они могут контролировать и кор-
ректировать положение своего тела относительно вектора силы тяжести, создавая
новые оси полярности.
Растительные организмы способны реагировать на чрезвычайно слабые грави-
тационные воздействия. При изменении положения растения в пространстве только
на один градус или при воздействии на него гипогравитации порядка IO-3—10-4 g
уже спустя 1-2 мин регистрируются гравитропические изгибы.
Участие силы тяжести в процессах роста и дифференцировки обычно анализи-
руют, применяя такие методические приемы как клиностатирование и центрифу-
гирование, а также выращивание растений в космосе в условиях микрогравитации.
В работе К. Номура и А. Комамайна (1985) было выявлено, что центрифугирова-
ние (при 1000 g в течение 5 мин) индуцирует соматический эмбриогенез в культу-
ре клеток моркови. Первое клеточное деление было неравным: одна из дочерних
клеток была обогащена цитоплазмой, а другая имела крупную вакуоль. Последу-
32
ющие деления проходили в основном в клетках, обогащенных цитоплазмой. Об-
наруженная полярность сохранялась до глобулярной стадии. При проращивании
семян гороха в условиях длительных перегрузок (от 1 до 1000 g) рост эпикоти-
ля и корневой системы замедляется; угнетается также и формирование боковых
корней.
В корнях проростков кукурузы, выращенных в условиях гипогравитации на
борту биоспутника Космос-1667, пролиферация и дифференцировка клеток коры
осуществлялась быстрее, чем в условиях Земли. В исследованиях, выполненных
на отечественных космических аппаратах (Салют-7, Космос-1129, Космос-1514 и
др.), в американской космической лаборатории Spacelabll, а также в немецкой
космической лаборатории Mission D-2, установлено, что гипогравитация приводит
к замедлению темпов роста и развития растений. При длительном культивирова-
нии наблюдаются значительные ультраструктурные изменения в клетках. Однако
несмотря на эти изменения ряд культур (в первую очередь арабидопсис) проходи-
ли весь цикл развития нормально и давали семена, способные к прорастанию на
Земле.
Совместное влияние света и гравитации. В нормальных условиях расти-
тельные организмы находятся под воздействием сразу нескольких поляризующих
факторов внешней среды, поэтому возникает вопрос о том, как происходит взаимо-
действие между этими факторами в процессе роста и развития растений. У травяни-
стых растений расположение листьев в пространстве определяется гравитационным
полем Земли, поэтому обычно морфологически верхняя сторона листа обращена к
вершине растения и к свету, но в соответствии с вектором силы тяжести. При пе-
ремещении растения вершиной вниз и создании таких условий, когда стебель не
может изогнуться вверх, листья его поворачиваются на 180°, располагаясь вновь в
соответствии с земным притяжением.
Дж. Кисс с коллегами (2003) изучали совместное влияние гравитации и света на
рост корней арабидопсиса. Было установлено, что доминирующей ростовой реакци-
ей корней является гравитропизм. Тем не менее, фототропическая реакция также
имеет место. При освещении синим светом (468 нм) корни проявляли отрицательную
фототропическую реакцию, красный же свет (660 нм) индуцировал положительный
фототропизм.
Электрическое поле. Все растительные организмы постоянно находятся под
воздействием электрического поля атмосферы. Поскольку воздух является хорошим
диэлектриком и содержит мало носителей электрических зарядов, плотность тока,
определяемая электрическим полем атмосферы, невелика и составляет в среднем
3 • 10"10А • см-2. Так как корневая система растений расположена во влажной почве,
по ним должен протекать электрический ток, различный по величине и направле-
нию, поскольку атмосфера может иметь как положительный, так и отрицательный
заряд. Экранирование растений от внешних электрических полей при помещении их
под сетку Фарадея приводит к замедлению ростовых процессов. Электрическое поле
атмосферы является, по-видимому, необходимым фактором для жизнедеятельности
растительных организмов, а его изменение сказывается на основных процессах об-
мена веществ.
Магнитное поле. При изучении роли магнитных полей в жизнедеятельности
растений оказалось, что значительное ослабление геомагнитного поля существенно
снижает скорость ростовых процессов. Так, помещение растений ячменя в сверх-
слабое магнитное поле (в 4000 раз слабее магнитного поля Земли) вызывает рез-
33
кое торможение развития. В то же время магнитные поля высокой напряженности
(1000-25000 эрстед) также подавляют ростовые процессы. При этом магнитные поля
низкой напряженности стимулируют рост, особенно корневой системы. Существен-
ное значение имеет ориентация (особенно корневой системы) относительно вектора
магнитного поля. Установлено, что ориентированные по вектору магнитного по-
ля корни растут быстрее, особенно по направлению к южному магнитному полюсу
(Земли или магнита).
Ионные градиенты. Очень эффективным способом индукции поляризации
клеток является локальная обработка некоторыми ионами, в первую очередь такими
как Са2+, К+ и Н+. Например, наложение искусственного градиента Са2+, созда-
ваемого путем односторонней обработки кальциевым ионофором А23187, служило
причиной направленного роста ризоидов Fucus и Pelvetia в сторону более высокой
концентрации этого катиона. У клеток с полярным типом роста в аксиальном на-
правлении формируются в первую очередь полярные потоки ионов Са2+, вероятно,
благодаря асимметрии в распределении кальциевых каналов и помп на противопо-
ложных сторонах клетки.
3.2. Физиологическое проявление полярности
Если взять черенки ивы и поместить их во влажную атмосферу, то адвентивные
корни будут развиваться на морфологически нижнем, а почки — на верхнем конце,
даже если черенки перевернуть (рис. 3.1). Если такой побег разрезать поперек на
Рис. 3.1. Черенок ивы, посаженный
нормально (а) и нижним концом вверх (б)
более короткие черенки, у каждого из них со-
храняется та же полярность при формирова-
нии корней и побегов. Таким образом, несмот-
ря на то, что черенки ивы не имеют каких-
либо морфологических различий между верх-
ними и нижними концами, видно, что они об-
ладают отчетливой физиологической поляр-
ностью.
У растений при формировании физиоло-
гической оси полярности наиболее существен-
ное значение имеют процесс активного ба-
зипетального транспорта фитогормона аук-
сина, градиенты биоэлектрических потенци-
алов, градиенты и полярные потоки ионов
кальция, а также функционирование элемен-
тов цитоскелета. Практически любые вектор-
ные воздействия внешней среды индуцируют
полярные потоки ионов Са2+ и формируют
градиенты этого катиона в клетках и тка-
нях растительного организма. Именно пото-
ки кальция несут первичную информацию о возникающем векторе поляризации и
как бы задают пространственную разметку (паттерн) будущему направлению ак-
тивности обменных процессов и морфогенеза. При этом в первую очередь изменяет-
ся ионная проницаемость клеточных мембран, формируется специфическая систе-
ма ионных электрических токов, появляется, как удачно выразился А. Голдсуорси
(1986), «электрический компас», который позволяет сориентировать в пространстве
34
процессы роста и морфогенеза. Дальнейшая реализация этой позиционной инфор-
мации связана с изменениями в активности и ориентации элементов цитоскелета и
гормонального статуса растения.
3.2.1. Полярность растительной клетки
Возможные механизмы поляризации на уровне растительной клетки были пред-
ложены Ф.-В. Бентрапом (1984) и Э. Шнеффом (1986). Основу поляризации рас-
тительных клеток они связывали с формированием аксиальных градиентов био-
электрических потенциалов (БЭП) за счет изменения мембранной проницаемости,
в первую очередь к ионам Са2+, К+, С1~ и Н+. Полярный рост клеток, напри-
мер верхушечный рост пыльцевой трубки или корневого волоска, характеризуется
сфокусированным в направлении роста цитозольным градиентом ионов Са2+, поля-
ризацией актинового цитоскелета, апикальным транспортом мембранных везикул
с их последующим экзоцитозом (рис. 3.2). В процессе формирования оси симмет-
рии растительных клеток также участвуют мономерные ГТФ-связывающие белки,
Направление циклоза
Мембранные потоки
Актиновые филаменты
Фрагменты актина
Рис. 3.2. Движение ионов и цитоплазмы в растущей пыльцевой трубке (по: Holdaway-
Clarke, Hepler, 2003)
фосфоинозитиды, активные формы кислорода и Са2+-зависимые протеинкиназы.
Интегральная поляризация клетки также может быть вызвана локальными контак-
тами с другой клеткой, внеклеточным веществом или субстратом.
Электрическая поляризация растительной клетки. Формирование элек-
трофизиологической оси полярности будущего растения происходит на самых ран-
них этапах его развития. Уже через 30 мин после оплодотворения у зиготы бурой
водоросли Fucus происходит «электрическая» поляризация клетки. В этот момент
появляется трансцитоплазматический ток, входящий в область будущего ризоида
и выходящий с противоположной стороны, где будет формироваться таллом. Наи-
большая плотность тока регистрируется при этом в области наиболее интенсивно
растущего ризоидального полюса (рис. 3.3). Аксиальные градиенты БЭП также за-
регистрированы вдоль прорастающей пыльцы, растущего корневого волоска и кон-
чика корня, у развивающихся эмбриоидов. В процессе дифференцировки клетки на
35
Рис. 3.3. Распределение силовых линий электрического тока вокруг’:
а — прорастающей зиготы фукуса, б — прорастающей пыль-
цы лилии, в — корня и корневого волоска (по: Bentrup, 1984)
генерацию сети электрических токов расходуется до 1% общего содержания АТФ.
Наиболее важную роль в понимании процессов поляризации клеток сыграло от-
крытие трансклеточных ионных потоков. У растительных клеток, характеризую-
щихся полярным типом роста (зиготы водорослей, прорастающей пыльцы, корневых
волосков, ризоидов и т.п.), одной из наиболее ранних реакций в процессе диффе-
ренцировки является возникновение электрических токов, входящих в растущие и
выходящих из закончивших рост участков клетки.
Вероятным механизмом инициации трансцеллюлярного электрического тока при
поляризующих воздействиях является в первую очередь локальное изменение каль-
циевой проницаемости плазмалеммы. Л. Джаффи с коллегами разработали поло-
жение о центральной роли ионов Са2+ как поляризующего клетки агента при дей-
ствии различных внешних стимулов. При изучении дифференцировки зигот Fucus
они пришли к заключению, что под действием односторонне направленного фактора
(гравитация, свет и др.) происходит локальное увеличение кальциевой проницаемо-
сти плазмалеммы, приводящее к деполяризации мембранного потенциала на буду-
щем ризоидальном полюсе зиготы. Локальное изменение мембранного потенциала
вызывает электрическую поляризацию клетки и, как следствие, латеральную диф-
фузию в плазмалемме заряженных белковых молекул. Предполагается, что вслед-
ствие поляризации клетки может происходить перераспределение каналов таким об-
разом, что Са2+-каналы концентрируются на положительно заряженном ризоидаль-
ном полюсе, а К+-каналы — на отрицательном талломическом полюсе. Это приведет
к вхождению Са2+-тока в области ризоида и выходу К+-тока на противоположном
конце клетки. Локализованный таким образом ионный ток и возникающая при этом
эндогенная электрическая поляризация клетки приводят к появлению ионных гра-
диентов в цитоплазме, становлению и закреплению полярности клетки. Входящие
ионы Са2+ индуцируют локальную секреторную активность клетки, в этом участке
увеличивается площадь плазмалеммы и начинает образовываться ризоид. Когда же
36
зигота делится перпендикулярно главной оси, то ядра дочерних клеток попадают
в цитоплазму, находящуюся в различном функциональном состоянии, вследствие
чего в них начинают реализовываться разные генетические программы.
Очень убедительное подтверждение гипотезы Л. Джаффи с сотр. (1974) было по-
лучено в экспериментах Э. Пирсона с соавторами (1994, 1996), которым с помощью
Са2+-селективного вибрирующего микроэлектрода удалось зарегистрировать Са2+-
токи величиной от 1,4 до 14,0 пмоль • см-2-с-1 вокруг прорастающего пыльцевого
зерна и пыльцевой трубки лилии. На ранних этапах прорастания входящий Са2+-ток
регистрировался в районе пыльцевой поры. Растущая пыльцевая трубка характери-
зовалась специфическим профилем Са2+-тока, максимальное вхождение которого
наблюдалось в области интенсивно растущего апекса, что, вероятно, и формирует
внутриклеточный градиент ионов Са2+. Э. Пирсон с коллегами полагают, что по-
ступление ионов кальция в пыльцевую трубку осуществляется через Са2+-каналы,
локализованные главным образом в апикальной части плазматической мембраны.
Полярные (по)токи и градиенты ионов Са2+ в растительной клетке.
Градиент ионов Са2+ от верхушки к основанию, вероятно, является абсолютно необ-
ходимым условием функционирования клеток с верхушечным типом роста. В клет-
ках с полярным типом роста (пыльцевые трубки, корневые волоски, гифы грибов)
с помощью флуоресцентных зондов удается зарегистрировать градиент концентра-
ции ионов Са2+, снижающийся от верхушки к ее основанию. При этом наиболее
интенсивно растущие апикальные участки клеток характеризуются более высоким
содержанием цитозольного кальция.
Нарушение внутриклеточных градиентов кальция путем обработки хелаторами,
экзогенным кальцием или кальциевым ионофором А23187 останавливает верхушеч-
ный рост и в ряде случаев вызывает дисперсное распределение органелл в исходно
полярных структурах клетки. Инъекция хелатирующих агентов в пыльцевые труб-
ки лилии блокирует рост в длину и нарушает кальциевый градиент.
Наиболее эффективно способность ионов Са2+ модулировать активность актин-
связывающих белков, фосфолипаз и протеинкиназ проявляется в регуляции роста
пыльцевой трубки. Структурной основой для сигнальной трансдукции при этом яв-
ляется цитоскелет, который обеспечивает взаимосвязь между внешними стимулами,
рецептируемыми на уровне плазмалеммы, и ответными внутриклеточными процес-
сами. Наличие апикального осциллирующего Са2+-градиента и локального входа
ионов Са2+ в верхушку являются главными отличительными особенностями расту-
щей пыльцевой трубки (см. рис. 3.2; 3.4). Изменению направления ее роста предше-
ствует повышение уровня'Са2+, выявляемое
на той стороне, куда она впоследствии повер-
нется.
Способность к генерации градиента цито-
зольного кальция также является основой для
поляризации зиготы фукуса. Яйцеклетки фу-
куса не имеют выраженной клеточной асим-
X |1Са 1цит
-100нМ
20 мкм
Осциллирующий
поток ионов Са2+,
Л-20 пмоль/см2 с
Рис. 3-4- Градиент концентрации ионов
Са2+ в цитоплазме растущей пыльце-
вой трубки (по: Holdaway-Clarke, Hep-
ler, 2003). Стрелками показан вход Са2+;
затемнение указывает на высокий уро-
вень Са2+ в апикальной части пыльцевой
трубки
метрии — их органеллы не ориентированы, а
короткие нити F-актина равномерно располо-
жены по периметру клетки в кортикальном
слое. Основой последующих структурных из-
менений после оплодотворения, в первую оче-
редь, является локальное увеличение уровня
37
ионов Са2+ в цитоплазме, которое регистрируется сразу же в месте проникновения
спермия через плазмалемму яйцеклетки.
Осуществить непосредственное измерение аксиального градиента ионизирован-
ного кальция удалось Э. Пирсону с коллегами (1994) в пыльцевых зернах и пыль-
цевых трубках лилии при микроинъекции флуоресцентного Са2+-зонда фура-2-
декстрана. Если в апикальной зоне пыльцевой трубки концентрация ионов Са2-1"
составляла около 3,0 мкмоль/л, то на расстоянии 20 мкм от апекса 0,2 мкмоль/л.
В пыльцевом зерне кальциевый градиент достигает максимума перед появлением
пыльцевой трубки, для которой характерен собственный градиент ионов Са2+, воз-
растающий от основания к кончику. При этом в пыльцевой трубке одновременно с
кальциевым был зарегистрирован также и градиент внутриклеточных мембранных
образований, пик которого отставал от Са2+-градиента на несколько микрометров.
Предполагают, что поступление ионов кальция в пыльцевую трубку осуществля-
ется через Са2+-каналы, локализованные в апикальной части плазматической мем-
браны. Было выявлено также, что градиент цитоплазматического кальция осцил-
лирует и перемещается вслед за растущим апексом пыльцевой трубки. Концентра-
ция кальция в цитоплазме осциллировала с такой же частотой, как и скорость ро-
ста пыльцевой трубки. Во всех экспериментах, где индуцировалось нарушение гра-
диента цитоплазматического кальция, наблюдалось прекращение роста пыльцевой
трубки.
С помощью рентгеноструктурного микроанализа созревших неопыленных завя-
зей пшеницы показан относительно высокий уровень кальция в клетках синергид.
Возможно, сверхоптимальные уровни кальция в синергидах могут регулировать
правильную ориентацию пыльцевой трубки, образуя градиенты ионов Са2+ вблизи
синергид. Помимо этого высокая концентрация кальция задерживает рост пыль-
цевой трубки и способствует разрыву ее кончика в синергиде для высвобождения
спермиев вблизи яйцеклетки.
По-видимому, именно градиенты ионов Са2+ несут первичную информацию о
возникающем векторе поляризации. Вслед за возникновением градиента ионов каль-
ция в клетке формируется градиент Са2+-связывающих белков-сенсоров и Са2+-
зависимых протеинкиназ, что приводит к пространственной неоднородности актив-
ности многочисленных ферментов. Таким путем может происходить становление
вторичных градиентов, например секреторных и метаболических. И, наконец, чув-
ствительные к изменению активности ионов Са2+ элементы цитоскелета завершают
структурную поляризацию клетки.
ROP-белки. Известно, что контроль за такими актин-зависимыми процессами
как становление клеточной полярности, клеточный морфогенез и движение эукарио-
тических организмов может осуществлять IIho-семейство ГТФаз. У растений иден-
тифицирован новый тип Шю ГТФаз - ROP-ГТФазы (Rho of plants). У арабидопсиса
выявлено около сотни генов, которые кодируют ROP-белки.
Наибольший прогресс в понимании роли ROP-белков связан с исследованиями
механизма роста пыльцевых трубок и корневых волосков (рис. 3.5). Иммунофлуо-
ресценция и конфокальная микроскопия показали, что ROP1 ГТФаза экспрессиру-
ется в пыльце и пыльцевой трубке. ROP-белок локализован в кортикальном реги-
оне апекса пыльцевой трубки и на периферии генеративной клетки. Кортикальный
ROP-белок в апексе образует градиент с понижением концентрации от верхушки
к основанию. Этот белок, по-видимому, ассоциирован с плазмалеммой, участвует
в формировании аксиального градиента ионизированного кальция и коптролиру-
38
ет конфигурацию актинового цитоскелета. Полученные результаты указывают, что
апикальная ROP-ГТФаза вовлекается в сигнальный механизм, который контроли-
рует актин-зависимый полярный рост пыльцевой трубки с участием ионов Са2+ и
фосфоинозитидов.
Рис. 3.5. Важнейшие для поляризованного роста корневых волосков и
пыльцевых трубок белки, связанные: с плазматической мембраной
(ПМ) —ROP1, ROP2, ROP4, RAC5, RIC4, RAC10, сетью транс-
Гольджи (СТГ) - RABA4B, RABF1, ARF1, FYVE, RABUB, муль-
тивезикулярными телами (МВТ) — RABF2A. RAB5, FYVE и с Голь-
джи—ARF1; FYVE — пептид, связанный с фосфатидилинозитол-
4,5-бисфосфатом (по: Samaj et al., 2006). Показаны два способа эк-
зоцитоза: 1) везикулы сливаются с плазмалеммой только в узком
участке, образуя на короткое время (менее 6 мс) пору, через которую
выходит содержимое везикулы; 2) везикулы полностью сливаются с
плазмалеммой
Еще одной очень важной функцией ROP-белков является регуляция поляр-
ной локализации белков-переносчиков ауксина в плазматической мембране и, та-
ким образом, контроль процесса полярного транспорта ИУК в растительных
тканях.
Фосфоинозитиды. Очень важным элементом регуляции полярного роста рас-
тительных клеток являются мембранные липиды фосфоинозитиды и их производ-
ные. В апикальной части плазматической мембраны растущей пыльцевой труб-
ки и корневых волосков регистрируется повышенный уровень фосфоинозитидов
(фосфатидилинозитол-4,5-бисфосфатов) и ферментов, активность которых приво-
дит к гидролизу этих фосфолипидов (фосфолипазы D и С) и появлению таких
вторичных посредников как инозитол-1,4,5-трисфосфат. диацилглицерол и фосфа-
тидная кислота. Мутации, которые приводят к повреждению белков, ответственных
за транспорт фосфоинозитидов, нарушают также полярную организацию сети фиб-
риллярного актина, полярность везикулярной секреции, аксиальный градиент цито-
зольного кальция и, как следствие, полярный рост клетки. Таким образом, фосфо-
39
инозитиды необходимы практически для всех процессов, обеспечивающих регуля-
цию полярного роста растительной клетки.
Цитоскелет. Ось симметрии зародыша и взрослого организма определяется
ориентацией основной оси поляризованной яйцеклетки. Главным носителем про-
странственной информации о будущем развитии яйцеклетки служит ее цитоархи-
тектоника, особенно кортикальный слой, ассоциированный с плазматической мем-
браной.
В зиготе Fucus микротрубочки и актиновые филаменты вначале распределены
симметрично. По мере поляризации зиготы и перед первым ее делением актиновые
филаменты концентрируются в основном в апикальном кортексе, где они участвуют
в удлинении будущей «ризоидальной» клетки. Микротрубочки при этом определя-
ют положение ядра и плоскость деления клетки. Цитоскелет (наряду с ионами Са2+
и электрическими градиентами) играет важную роль в процессе прорастания пыль-
цевого зерна и полярного роста пыльцевой трубки. Полярное распределение ионных
каналов, детерминирующее направление полярного роста, во многом предопределя-
ется ориентацией цитоскелета (рис. 3.6).
Рис. 3.6. Поляризация и закрепление оси симметрии у Fucus (по: Kropf et al., 1999):
а — оплодотворение: пучок кортикального F-актина образуется в месте проникнове-
ния спермия, Са2 -каналы равномерно распределены в плазмалемме, а микротрубочки
радиально симметрично расходятся от поверхности ядра яйцеклетки; б — фотополяриза-
ция: через 3 ч после оплодотворения зигота формирует клеточную стенку и начинает
секретировать слизь, равномерно покрывающую поверхность клеточной стенки; сборка
F-актина происходит в новом ризоидалыюм полюсе (в полусфере, удаленной от источ-
ника света); в — закрепление оси: приблизительно через 4 ч после оплодотворения ось
симметрии закрепляется, так как молекулы и процессы (включая Са2 ^-каналы, цито-
зольный кальций, слизь) локализуются на ризоидальном полюсе; на более поздней стадии
в клеточной стенке ризоидального полюса откладывается серосодержащий полисахарид
фукан F2
Практически во всех растительных клетках существуют белки, способные сши-
вать отдельные элементы цитоскелета не только между собой, но также и с мем-
бранными структурами. В цитоплазматическом матриксе тонкие филаменты мо-
гут быть организованы в трехмерную сеть, связывающую органеллы и ассоцииро-
ванную с плазматической мембраной и кортикальными микротрубочками. Поэтому
при анализе механизмов поляризации растительной клетки необходимо обязательно
учитывать взаимодействие элементов цитоскелета с плазмалеммой и эндомембра-
нами. Относительная стабильность и лабильность мембранно-скелетного комплекса
обеспечивает двойственность выполняемых им функций — поддержание/изменение
формы и взаимного расположения компонентов клетки. Именно эта особенность ар-
хитектоники позволяет эффективно контролировать процессы поляризации клетки.
40
Анализ действия цитохалазинов, нарушающих структуру и функции актиновых
филаментов, на дифференцировку зигот Fucus и Pelvetia показывает, что фибрил-
лярному актину принадлежит ключевая роль в процессах поляризации клетки, в
поддержании осевой анизотропии ее морфогенеза. Комплекс актина с актинсвязы-
вающими белками осуществляет механохимическую фиксацию содержимого цито-
плазмы, в том числе и носителей морфогенетической информации, что может ока-
зывать определяющее влияние на пространственную детерминацию дифференци-
альной активности генома не только в процессе эмбриогенеза, но также и в ходе
дальнейшего развития организма. Обработка цитохалазином, подавляя полимери-
зацию и функционирование актиновых филаментов, нарушает нормальную ориен-
тацию кортикального цитоскелета и вызывает появление неестественных форм у
водоросли Pelvetia wrightii. В первую очередь нарушается поляризация яйцеклетки
и зародыша. Обработка цитохалазинами при этом полностью, но обратимо подав-
ляет электрофизиологическую поляризацию зиготы.
Участие микротрубочек в становлении клеточной полярности показано во мно-
гих исследованиях при использовании колхицина - алкалоида, который в микро-
молярных концентрациях, связываясь с тубулином, блокирует его полимеризацию.
При более высоких концентрациях колхицина (свыше 1 ммоль/л) микротрубочки де-
полимеризуются. Обработка колхицином нарушает полярность формирования кле-
ток корневых волосков у трихобластов Gibesis gemiculata и Tradescantia fluminensis.
Наиболее важными факторами, влияющими на организацию кортикальных мик-
ротрубочек, являются ионы Са2+ и Н+, гормоны и градиенты биоэлектрических
потенциалов. Слабые электрические поля и механическое давление вызывают пе-
реориентацию кортикальных микротрубочек, направление которых уже после 6 ч
воздействия становилось перпендикулярным приложенному полю. Ионы Са2+ и Н+
участвуют в регуляции процессов сборки (и разборки) актиновых филаментов и
тубулина.
Кальций-зависимое функционирование цитоскелета у растительных организмов
выявлено в таких процессах как движение хлоропластов и жгутиков, в циклозе, при
клеточном делении, в ходе полярного роста клеток. Некоторые исследователи пола-
гают, что ионы Са2+ необходимы для полярного роста, например роста пыльцевой
трубки, именно потому, что контролируют работу цитоскелета. Однако структура
цитоскелета может регулироваться не только ионами кальция, но также pH и таким
вторичным посредником как инозитол-(1,4,5)-трисфосфат.
Д. Кропф с коллегами (1995) показали, что на ранних этапах развития зиготы
Pelvetia в зоне возникающего ризоида pH на 0,1 единицы сдвинут в кислую область
по сравнению с другими участками клетки. На стадии двух клеток градиент pH в
цитозоле возрастает еще на 0,3-0,4 единицы. Этот градиент pH почти накладывает-
ся на градиент ионов Са2-1- и хорошо коррелирует со скоростью роста возникающего
ризоида. Градиенты pH участвуют в поляризации клетки, вероятно, за счет локаль-
ного контроля процессов сборки (разборки) элементов цитоскелета. Установлено,
что фибриллярный актин стабилизируется при высоком содержании ионов Н+, в то
время как микротрубочки более стабильны при низкой концентрации ионов Н+ и
Са2+.
Ориентация и активность цитоскелета у растений зависит также и от гормо-
нального статуса. В эпидермальных клетках междоузлий карликовых растений го-
роха преобладает продольная ориентация микротрубочек, которые располагаются
параллельно главной оси клетки. Обработка гибберелловой кислотой стимулиро-
41
вала растяжение интернодальных клеток, при этом расположение микротрубочек в
них было поперечным. Сходные результаты были получены на гиббереллиновых (с/5)
мутантах кукурузы. У нормальных растений в эпидермальных клетках мезокотиля
микротрубочки были ориентированы в поперечном направлении. У мутантных d5
растений с сильно укороченным мезокотилем микротрубочки в клетках эпидермиса
были ориентированы в продольном направлении и/или располагались беспорядоч-
но. При обработке проростков мутанта (15 гибберелловой кислотой нормальный рост
мезокотиля восстанавливался, при этом микротрубочки в клетках эпидермиса в зоне
растяжения приобретали поперечную ориентацию.
Обработка гиббереллинами индуцирует поперечное (относительно продольной
оси) расположение микротрубочек и таким образом влияет также на ориентацию
целлюлозных фибрилл клеточной стенки. Гиббереллин-индуцируемое удлинение
клеток сопровождалось повышением уровня тубулиновых транскриптов в междо-
узлиях овса, что свидетельствует об экспрессии гена, кодирующего синтез тубулина
в процессе растяжения клеток.
Элементы флоэмы, ксилемы и трахеид ориентируются, как правило, параллель-
но потоку ауксина. Предполагается, что полярный транспорт ауксина способен ин-
дуцировать поперечную ориентацию микротрубочек по отношению к главной оси
клетки, что является причиной поперечного расположения целлюлозных микрофиб-
рилл и, как следствие, аксиальной ориентации клеток.
С помощью сканирующей электронной микроскопии исследовали переориента-
цию микротрубочек и микрофибрилл целлюлозы в наружных эпидермальных кле-
точных стенках колеоптилей кукурузы в процессе ауксин-индуцированного роста.
Было показано, что обеднение эндогенным ауксином приводит к увеличению доли
микротрубочек и микрофибрилл целлюлозы, ориентированных параллельно глав-
ной оси клетки. Усиление роста под действием экзогенного ауксина уже через 30-
60 мин сопровождалось увеличением числа микротрубочек и микрофибрилл, ори-
ентированных в поперечном направлении. В работе К. Такесу и X. Шибаоки (1999)
было установлено, что ауксин индуцирует поперечную ориентацию микро трубочек
у эпикотилей фасоли адзуки Phaseolus azuki даже в анаэробных условиях, когда их
рост практически остановлен. Эти результаты свидетельствуют о том, что действие
ИУК на ориентацию тубулинового цитоскелета не опосредовано действием ауксина
на рост. Вероятно, поэтому обработка колхицином практически не сказывается на
рост-активирующем эффекте ауксина. Таким образом, регуляция ауксином роста
растительных клеток, по-видимому, не сопряжена с его влиянием на ориентацию
микротрубочек. Для объяснения полученных результатов появились два предполо-
жения: во-первых, самые начальные этапы активации роста ауксином не связаны с
переориентацией микротрубочек; во-вторых, в действии ауксина на растяжение кле-
ток имеет место как колхицин-зависимый, так и колхицин-независимый процессы.
На первых этапах ИУК индуцирует расщепление компонентов клеточной стенки, а
на более поздних — вызывает переориентацию микротрубочек. Последний эффект,
возможно, требует специфической мРНК, синтез которой индуцируется гибберел-
линами.
Изменение ориентации микротрубочек происходит и при регуляции роста дру-
гими фитогормонами. Так, обработка кинетином меняла расположение микротру-
бочек и микрофибрилл целлюлозы с поперечного на продольное. Обработка абс-
цизовой кислотой также индуцировала продольное расположение микротрубочек.
Водный стресс, который индуцировал повышение уровня абсцизовой кислоты и
42
ингибировал рост, сопровождался переориентацией микротрубочек с поперечно-
го на продольное. Газообразный гормон этилен также вызывал изменение ори-
ентации микротрубочек с поперечного на продольное уже через 30 мин после
обработки.
Морфология индивидуального растения зависит от формы его клеток, в свою
очередь определяющейся направлением растяжения. Растяжение клеток в опреде-
ленном направлении регулируется свойствами клеточной стенки, в частности ори-
ентацией целлюлозных микрофибрилл. Известно, что микротрубочки могут участ-
вовать в формировании синтезирующихся микрофибрилл целлюлозы и задавать
направление их ориентации и локализации. Согласованная ориентация микротрубо-
чек, расположенных в кортикальном слое, задающая направление синтезируемым
de novo целлюлозным фибриллам, характерна для многих растительных клеток
различного типа и формы. Это явление наблюдается при формировании не толь-
ко первичной, но и вторичной клеточной стенки, в частности при отложении до-
полнительных слоев в процессе образования утолщений в определенных участках
элементов ксилемы.
3.2.2. Полярность мстительных органов и тканей
Полярность в организации растений легче всего обнаруживается по морфоло-
гическим различиям. Для растительных организмов характерно наличие хорошо
развитой оси. несущей латеральные органы, такие как побеги, листья, цветки и
боковые корни. Вдоль этой оси возникают различия: на одном конце главной оси
формируется корневая система, на другом - побег. Поэтому морфологически осе-
вое строение и полярная организация растения и его отдельных органов очевидны.
Однако конкретные физиологические процессы, лежащие в основе формирования
осей симметрии растительных организмов, пока еще нс понятны.
Градиенты биоэлектрических потенциалов. Сравнительно простое и еди-
нообразное (по сравнению с животными) распределение процессов роста и обмена
веществ по их интенсивности между основными органами и тканями растительного
организма обусловливает существование четко выраженных метаболических гра-
диентов, которые, в свою очередь, являются причиной возникновения градиентов
биоэлектрических потенциалов (ЕЭП). Электрические градиенты метаболического
происхождения регистрируются вдоль корня, листа, побега и всего организма. Воз-
можно, что эти градиенты от-
ражают различия в интенсивно-
сти процессов роста, фотосин-
теза, дыхательного обмена, ион-
ного транспорта, а также меж-
ду потенциалами покоя клеток.
На рис. 3.7 представлен про-
филь БЭП, снятого с поверх-
ности кончика корня кукуру-
зы. Можно видеть, что поверх-
ность зоны растяжения элек-
троотрицательна, а меристема и
зона корневых волосков заряже-
ны положительно.
Рис. 3.7. Профиль БЭП вдоль кончика корня проростка
кукурузы (по: Fensoni. 1959)
43
Стрессовые воздействия, угнетающие рост и развитие растений (например за-
суха, пониженная температура, клиностатирование, гипогравитация в условиях ор-
битальной космической станции), вызывают снижение аксиальных градиентов био-
электрических потенциалов. Если же восстановить исходную электрическую поляр-
ность путем пропускания слабого электрического тока, то различия в ростовых про-
цессах между контрольным и опытным вариантами нивелируются.
Еще в 1901 г. Т. И. Вяземским было показано, что между различными участками
поверхности листа венериной мухоловки регистрируются разности электрических
потенциалов в 16-75 мВ. Листья мухоловки, обработанные кипящей водой, такими
градиентами не обладали. Во многих работах отмечается, что апикальные части ор-
ганов, а также ткани с максимальной физиологической активностью (камбий, зона
растяжения корня), как правило, электроотрицательны. Например, у вертикально
ориентированных корней ячменя был зарегистрирован электрический ток, выходя-
щий из зоны корневых волосков и входящий в зону растяжения (см. рис. 3.2), то есть
как раз в наиболее интенсивно растущую часть корневой системы, которая заряже-
на отрицательно. Искусственное электрическое изолирование зон, между которыми
регистрируются электрические токи, вызывает значительное снижение скорости ро-
стовых процессов.
Сканируя электрическое поле с помощью вибрирующего электрода, удалось за-
регистрировать электрические токи, связанные с образованием первичных корней у
пшеницы, овса, фасоли, лилии и арахиса и придаточных корней у картофеля. При
этом в зонах растяжения и меристемах регистрировались входящие электрические
токи, а в зоне закончивших рост клеток — выходящие. В растениях гороха около
кончиков корней зарегистрированы электрические токи порядка 1 мкА/см2, входя-
щие в зону растяжения и меристему, и порядка 0,1 мкА/см2, выходящие из зоны
корневых волосков. (Напомним, что направлением электрического тока считается
направление упорядоченного движения положительно заряженных частиц.)
Еще одним методическим приемом, позволяющим обнаружить существование в
клетках и тканях градиентов биоэлектрических потенциалов, является применение
катионных и анионных красителей. Д. Б. Вахмистров и И. Ф. Злотникова (1990) при
изучении распределения красителей в корнях кукурузы, редиса и нарцисса уста-
новили, что катионные красители поглощались кончиками корневых волосков, а
анионные —их основаниями.
С. Броули с коллегами (1984) измеряли биоэлектрические потенциалы дифферен-
цирующихся эмбриоидов дикой моркови. Уже на стадии глобулы вокруг зародыша
было зарегистрировано электрическое поле со специфическим рисунком силовых
линий, который сохранялся на протяжении всего развития эмбриона. Наибольшая
плотность входящего тока регистрировалась в зонах формирующихся семядолей.
Максимум выходящего тока был приурочен к области закладки апикальной мери-
стемы корня. При этом плотность электрического тока в вышеуказанных зонах на
каждой повой стадии развития зародыша возрастала.
Таким образом, в процессе дифференцировки зиготы и зародыша, ризогенеза
и гравитропической реакции возникают электрические токи и формируется специ-
фический рисунок силовых линий. Этот «электрический» рисунок может служить
интегральной характеристикой процессов поляризации в ходе роста и формирова-
ния органов и тканей растения.
Полярный транспорт ИУК. Решающее значение в процессах поляризации
и дифференцировки клеток и тканей имеет содержание и полярный транспорт в
44
растении ауксина (рис. 3.8). Градиенты концентрации ИУК, создавая позиционную
информацию, действуют как мощнейший морфогенетический фактор, а процесс ак-
тивного полярного передвижения этого гормона в базальном направлении являет-
ся основным фактором, обеспечивающим форми-
рование осей симметрии у высших растений. На
распределение в тканях ИУК способны влиять эн-
догенные градиенты биоэлектрических потенциа-
лов, контролируя в первую очередь работу систе-
мы полярного транспорта этого гормона. Меха-
низм образования градиентов ИУК вдоль осевых
органов растений является не только результатом
процесса его активного полярного транспорта, но
также зависит от образования связанных форм
ИУК и активности ферментов, участвующих в ее
катаболизме.
Градиенты ИУК можно зарегистрировать как
вдоль надземной части, так и вдоль корневой си-
стемы растений. При этом как в стебле, так и в
корне максимум содержания свободного ауксина
наблюдался в апикальных зонах. При анализе, на-
пример, распределения ауксина в отдельных ча-
стях этиолированного гипокотиля фасоли оказа-
ние. 3.8. Полярный транспорт аук-
сина у щюростка арабидопсиса (по:
Muday, Delong, 2001). Стрелками по-
казано направление транспорта
лось, что наибольшее количество ИУК в расчете на сырой вес содержится в апи-
кальной части гипокотиля и постепенно снижается по мере удаления от крючка в
сторону зоны растяжения. Содержание ИУК значительно выше в апексах фасоли,
чем в листьях. Более подробно механизмы мембранного и дальнего транспорта аук-
сина будут рассмотрены во второй части этого тома.
Цитокинины. Градиенты содержания в тканях растений цитокининов, как и
других фитогормонов, зависят от целого ряда процессов, в первую очередь их син-
теза, транспорта по сосудам, диффузии и катаболизма. Цитокинины в основнохМ
синтезируются в корневой системе растений и с пасокой передвигаются вверх. В ра-
ботах О. Н. Кулаевой (1973) было показано, что все воздействия, которые приводят
к нарушению роста корней и их нормальной жизнедеятельности, уменьшают подачу
цитокининов с пасокой.
Известно, что растения рода Bryophyllum способны образовывать соматические
зародыши - «детки», которые закладываются в вырезах листовой пластинки (см.
рис. Введения). Интересен тот факт, что они развиваются и растут с различной
скоростью: наибольшая скорость роста характерна для тех, которые формируются
в апикальной части листа. К.Слаби и Дж. Себанск (1984) при анализе содержания
цитокининов в листовой пластинке Bryophyllum crenatum обнаружили аксиальный
градиент этих фитогормонов: их содержание возрастало от основания к апикальной
части листа.
У злаков наибольшее количество цитокининов содержится во флаговом листе
по сравнению с другими листьями. Через неделю после опыления максимум ци-
токининовой активности перемещается к формирующимся зерновкам. При анали-
зе распределения транс-зеатин-рибозида и транс-зеатина в стебле обнаруживает-
ся четкий градиент убывания концентрации цитокининов от верхних междоузлий
к нижним. При этом в каждом междоузлии наибольшее количество цитокининов
45
регистрировалось в верхней части междоузлия, а наименьшее -- у его основания.
Гиббереллины. В большинстве исследований не удается обнаружить поляр-
ность в передвижении гиббереллинов по растениям. Однако в опытах В. Хартунга и
И. Филлипса (1974) при анализе транспорта 14С-гибберелловой кислоты (ГК) оказа-
лось, что в отрезках молодых междоузлий гороха передвижение фитогормона идет
преимущественно акропетально, а в уже закончивших рост ГК транспортируется в
обоих направлениях, причем с одинаковой скоростью.
Предполагается, что в надземной части растений синтезируются в основном
неактивные формы гиббереллинов, такие как ГК 19 и TK-jo- Превращение их в основ-
ные физиологически активные формы ГК1 и ГК3 происходит в корневой системе,
откуда последние с пасокой транспортируются в надземную часть. Действитель-
но, при инъекции ГК-jo в ось проростка кукурузы незначительные количества этой
формы гиббереллина обнаруживаются в корневой системе. Показано, что меченая
ГКз транспортируется в растущие плоды; из плодов метка передвигается в моло-
дые листья и корни в форме ГКр Причем в закончившие рост листья из плодов
поступает в два раза меньше гиббереллина, чем в молодые. Следовательно, мож-
но предположить, что в растении физиологически активные формы гиббереллинов
транспортируются именно в растущие зоны.
Абсцизовая кислота. Для АБК в растительном организме, по-видимому, су-
ществуют два пути транспорта: передвижение из листьев в корпи (вероятно, по
флоэме) и обратный транспорт в листья по ксилеме. При нанесении 14С-АБК па
зрелые листья Vida faba метка распространялась как в направлении корневой си-
стемы, так и в вышележащие зоны: верхушки побегов, апикальные почки, молодые
растущие листья. При этом 80% метки распространялось базипетально, а 20% — ак-
ропетально. Вероятно, поэтому в ряде случаев, например в растениях Chenopodium
polyspermum, удается обнаруживать апикально-базальный градиент распределения
этого фитогормона.
В. Хартунг и Р. Бел (1975) при изучении транспорта абсцизовой кислоты в кор-
нях фасоли обнаружили, что 2-14С-АБК передвигалась как в базипетальном, так
и в акропетальном направлениях, то есть в корневой системе, по-видимому, также
существует два пути дальнего транспорта АБК: акропетальный поток, локализован-
ный в стели (вероятно, во флоэме), и базипетальное передвижение АБК по клеткам
коры. Однако при анализе дальнего транспорта 2-14С-АБК в отрезках корней (ме-
тодом агаровых блоков) полярности передвижения этого фитогормона обнаружено
не было, поскольку распределение метки вдоль корня было одинаковым и при апи-
кальном, и при базальном нанесении гормона.
В опытах С. Прохазки и др. (1978, 1985), выполненных на растениях гороха, был
обнаружен интенсивный приток 14С-АБК из корней в надземные органы. При этом
обработка апикальной части гороха ауксином усиливала процесс акропетального
перемещения и накопления в тканях ,4С-АБК.
С.Хоремапс с коллегами (1986) изучали аксиальные градиенты АБК и ИУК в
гипокотилях этиолированных проростков бобов. Было установлено, что при расчете
на сырой вес уровень фитогормонов максимален в клетках верхней, более моло-
дой части гипокотиля и постепенно снижается к базальной части гипокотиля, со-
стоящей из клеток с меньшей скоростью растяжения или уже закончивших рост.
Однако при пересчете содержания фитогормонов на единицу массы белка направ-
ление градиента их концентрации вдоль гипокотиля окажется противоположным.
Поэтому при оценке физиологической роли фитогормона для конкретного расти-
46
тельного объекта необходимо обязательно учитывать способ расчета его содержания
в ткани.
Этилен. Асимметрия в аксиальном распределении этилена играет важную роль
в процессе прорастания двудольных, у которых верхняя часть стебля имеет фор-
му петли или крючка. Крючок предназначен для защиты от повреждений нежных
апикальных тканей побега при прохождении через почву. Анализ распределения
эндогенного этилена в этиолированных проростках гороха показал, что максималь-
ное содержание его приходится на эпикотильный крючок, что является одной из
причин сохранения изгиба апикальной петли. В тканях узлов этилена значитель-
но больше, чем в тканях междоузлий, причем наблюдается снижение содержания
этилена (как в узлах, так и в междоузлиях) в нижних метамерах по сравнению
с верхними.
Будучи низкомолекулярным газообразным соединением, этилен может переме-
щаться в тканях путем пассивной диффузии, однако чаще всего он действует на те
же клетки и ткани, в которых образуется. Место синтеза и место действия в этом
случае не разделены, что устраняет необходимость транспорта гормона. Дж. Ширл
с соавторами (1989) обнаружил у этиолированных проростков гороха самую вы-
сокую интенсивность образования этилена в апикальных листочках и крючке -
50 нл-г-1-ч-1 и 33 нлг-1-ч-1, соответственно. В нижележащих участках стеб-
ля скорость выделения этилена снижалась: до 14 12 нл-г-1 • ч-1 - в участках под
крючком, до 3 нл • г-1 • ч-1 — в верхнем узле и до 1,5 нл • г-1 • ч-1 — в нижележащих
зонах.
Дж. Тейлор с коллегами (1988)
изучали содержание в различных зо-
нах проростков гороха аминоцикло-
пропанкарбоновой кислоты (АЦК),
являющейся непосредственным пред-
шественником этилена. Оказалось,
что максимальное содержание АЦК
наблюдалось в апикальных листоч-
ках (643 нг/г сырой массы), в крючке
содержание АЦК составляло 113 нг/г,
а в субапикальной зоне —49 нг/г.
Наибольшая способность превращать
экзогенную АЦК в этилен в отрез-
ках эпикотилей гороха была харак-
терна для клеток крючка. АЦК и ее
конъюгат малонил-АЦК интенсивно
синтезируются при поранении стеб-
лей вблизи поверхности срезов и пе-
редвигаются базипетально.
Полярные потоки ионов Са2+.
Помимо полярного транспорта ИУК
в растительных тканях имеет место
также процесс активного полярного
перемещения ионов Са2+. Полярные
потоки и формирующиеся на их ос-
нове градиенты ионов Са2+ являются
Рис. 3.9. Полярный транспорт 4оСа в отрезках меж-
доузлий гороха (а) и колеоптилей кукурузы (б). По-
казано распределение метки, имп/мин, вдоль каж-
дого отрезка через 60 мин после ее нанесения
существенным элементом в индукции поляр-
47
ности растительных клеток и тканей. В растении существует два пути дальнего
транспорта ионов кальция: один из них связан с транспирационным потоком, вто-
рой является результатом процесса активного полярного передвижения этого кати-
она. У осевых органов полярные потоки кальция регистрируются в акропетальном
направлении при их нормальной ориентации (рис. 3.9) и в поперечном — при грави-
стимуляции, то есть при перемещении органа из вертикального в горизонтальное
положение (табл. 3.1). Видно, что после гравистимуляции колеоптилей кукурузы
Таблица 3.1. Распределение 14С-ИУК и 45Са в ходе
гравитропической реакции у отрезков
колеоптилей кукурузы
Части отрезков 14С-ИУК, 60 мин гравистимуляции 45Са, 10 мин гравистимуляции
Верхняя половина 100% 165%
Нижняя половина 130% 100%
уже через 10 мин появляется полярный поток кальция, направленный вверх, и толь-
ко через 60 мин регистрируется поток 14С-ИУК в противоположном направлении.
У вертикально ориентированных отрезков осевых органов транспорт ионов
Са2+строго пол ярен. При нанесении метки 45 Са на базальный конец отрезка
ионы кальция передвигались в акропетальном направлении со средней скоростью
19,0 ± 1,0 мм/ч у отрезков междоузлий гороха и 15,6 ± 0,8 мм/ч у колеоптилей
кукурузы. В том случае, когда метка наносилась на апикальный конец отрезка,
ионы Са2+ в базипетальном направ-
Рис.3.10. Выделение ионов Са2+ из апикального и
базального участков гипокотилей подсолнечника (по:
de Guzman, de la Fuente, 1984)
лении практически не передвига-
лись (рис. 3.9). Радиоактивность об-
наруживалась в основном в апи-
кальном сегменте, который непо-
средственно контактировал с агаро-
вым блоком, содержащим 45Са.
В работах К. Гузмана и Р. Фуэн-
те, а также И. В. Марковой с соав-
торами (1996, 2002) полярные по-
токи ионов Са2+ были выявлены
с помощью ионоселективных каль-
циевых электродов в гипокотилях
подсолнечника (рис. 3.10), колеопти-
лях кукурузы и цветоносах ара-
бидопсиса. Формирование полярных
потоков ионов Са2+ в растительных
тканях, по-видимому, происходит за
счет согласованного функциониро-
вания Са2+-каналов и Са2+-АТФаз.
Следует отметить, что скорость по-
лярного акропетального транспор-
та ионов кальция в осевых органах
растений сопоставима со скоростью
противонаправленного перемещения
48
ИУК. Предполагается, что эти два полярных потока (Са2+ и ИУК) сопряжены.
Инициация морфогенеза у растений, по-видимому, начинается с формирования
полярных потоков ионов Са2+, которые создают электрическую ось полярности и
влияют на распределение в тканях фитогормонов. Полярный поток кальция, ко-
торый ориентирован параллельно вектору силы тяжести (или другому поляризу-
ющему воздействию), вероятно, способен задавать и корректировать направление
потока ауксина, обеспечивая формирование осей полярности, направления роста и
дифференцировки.
Градиенты роста. На протяжении всего жизненного цикла практически у всех
растительных организмов можно зарегистрировать четко выраженные градиенты
скорости роста. Например, скорость роста листьев пшеницы характеризуется убы-
вающим градиентом от основания к верхушке. У гипокотилей Phaseolus aureus об-
наружен крутой аксиальный градиент скорости роста, которая была наивысшей у
отрезков, примыкающих к подсемядольному колену, и постепенно снижалась по на-
правлению к основанию проростка. Причем если у отрезков с исходно максимальной
скоростью роста реакция на ауксин была сильной, но непродолжительной, то обра-
ботка ауксином медленно растущих базальных отрезков вызывала более слабое, но
продолжительное усиление роста. Аналогичные градиенты скоростей роста в акси-
альном направлении были показаны у эпикотилей гороха.
Различия в скоростях ростовых процессов и ответной реакции на ИУК у расту-
щих и уже закончивших рост клеток, по-видимому, связаны с наличием градиента
активности ионных насосов. В работе В. Петерса и Г. Фелле (1999) анализировалась
скорость растяжения локальных участков и характер распределения поверхностно-
го pH вдоль корня кукурузы. Оказалось, что участок с максимальной скоростью
растяжения клеток, находящийся на расстоянии 4 мм от апекса, имеет более «кис-
лую» поверхность, чем соседние участки зоны растяжения клеток (2 8 мм от апекса)
(рис. 3.11).
Рис. 3.11. Скорость роста отдельных участков кончика
корня (а) и pH (б) на их поверхности (по: Peters,
Felle, 1999)
Последовательность перехода клеток к митозу зависит от их размеров и положе-
ния относительно главной оси органа. В. Б. Ивановым (1974) показано, что клетка
вступает в митоз только после достижения определенного размера. В корне, напри-
49
мер, из пары сестринских клеток апикальная клетка раньше переходит к митозу,
чем базальная. Это вызвано тем, что материнская клетка делится неравномерно, и
апикальная дочерняя клетка всегда крупнее, чем базальная.
Градиенты цветения. Многим исследователям удалось зарегистрировать так
называемые градиенты цветения, ориентированные параллельно главной оси рас-
тения. Так, наличие хорошо выраженного градиента цветения продемонстрировано
М.Нома с соавторами (1984) на культуре эксплантов табака, взятых из различных
участков растения. На эксплаптах, полученных из цветоносов, образовывались толь-
ко цветковые почки. Если экспланты получали из несущих соцветия верхних частей
стебля, формировались как цветковые, так и вегетативные ночки. Из нижних меж-
доузлий возникали только вегетативные почки.
3.3. Полярность в процессах роста и морфогенеза
Эволюция стратегии жизни прикрепленных к субстрату растительных организ-
мов, в результате которой они адаптировались к векторизованным факторам среды,
определяется прежде всего развитием систем полярноети, формирующих позицион-
ную информацию для успешного прохождения онтогенеза. Комбинация процессов,
отвечающих за физиологическую полярность, обеспечила механизмы интеграции
внешних сигналов и генетических программ для координации процессов роста и
развития многоклеточных организмов.
У растений, как и у животных, оси симметрии и осевые структуры возникают на
самых ранних стадиях развития. Полярным или асимметричным обозначают такое
состояние живого объекта, когда два его конца или поверхности различаются. От-
сутствие успеха в получении индуцированного морфогенеза для ряда растительных
объектов часто кроется в том, что в эксперименте не всегда удается создать опреде-
ленный эндогенный баланс фитогормонов в конкретном участке ткани, который в
первую очередь зависит от физиологических градиентов, возникающих в процессе
дифференцировки в естественных условиях.
При прохождении жизненного цикла различные клетки в ткани оказываются в
разных условиях. По мере увеличения расстояния от верхушки побега в клетках
происходит изменение состава и соотношения фитогормонов. Соотношение аукси-
нов, цитокининов и гиббереллинов при этом становится менее благоприятным для
индукции деления и более соответствует условиям для растяжения клеток.
Следует отметить, что выяснение принципов формирования и взаимодействия
элементов поляризации в организме растения позволяет понять не только механиз-
мы морфогенеза и полярного роста, но также тропизмов, регенерации, апикального
доминирования, аттрагирующего эффекта фитогормонов, донорно-акцепторных от-
ношений.
Дифференцировка сосудов. В процессах формирования ксилемных и флоэм-
ных элементов, характеризующихся выраженной аксиальной организацией, наибо-
лее важное значение имеет гормональный статус, концентрация ионов Са2+, а так-
же цитоскелет. Известно, что низкое содержание ионов Са2+ в среде, присутствие
ингибиторов кальмодулина (хлорпромазин, трифторперазин), а также блокаторов
Са2+-каналов (дигидропиридины, La3+) подавляют процесс ксилогенеза.
Ведущая роль в формировании сосудов, по-видимому, принадлежит ауксину.
Дифференцировка сосудов и другие проявления полярности, включая деление и
растяжение клеток, индуцируются и ориентируются потоком сигналов, основным
50
из которых является ауксин. Новые сосудистые ткани формируются прямо под раз-
вивающимися почками и молодыми листьями, которые являются источником ИУК.
При изучении влияния ауксина па дифференцировку флоэмных и ксилемных
элементов в корнеплоде репы М. Герсани (1987) было обнаружено, что локальное
нанесение ИУК индуцирует (в месте обработки) формирование сосудов в течение
двух суток. В экспериментах М. Герсани и Ц. Сакса (1984), изменяя направление
транспорта ИУК (посредством фигурного иссечения ткани), удавалось влиять на на-
правление и интенсивность формирования сосудов у гипокотилей фасоли (рис. 3.12).
Таким образом, именно ауксин, образующийся в молодых листьях и передвигающий-
ся в стебель, может быть сигналом для формирования сосудистой системы.
Поскольку ИУК-индуцируемая дифференциров-
ка сосудистых элементов подавлялась трийодбензой-
ной кислотой (ТИБК), можно полагать, что для ини-
циации морфогенеза важен не только определенный
уровень ауксина, но также процесс его полярного
транспорта. Именно базипетальный транспорт аук-
сина задаст вектор, ориентирующий развитие сосу-
дов в вертикальном направлении. В процессе диффе-
ренцировки камбия в элементы флоэмы или ксилемы
определяющее значение имеет латеральный градиент
концентрации ИУК и сахарозы. При этом дифферен-
цировка флоэмы происходила в направлении низких
величин отношения концентраций ИУК/сахароза, а
ксилемы — в направлении высоких.
Эмбриогенез. В представлениях о полярности
одним из основных является вопрос о том, являет-
ся ли полярность врожденным свойством или же она
формируется на каком-либо этапе онтогенеза. У рас-
тений, как и у животных, структуры аксиальных ор-
ганов и соответствующие им оси симметрии реги-
стрируются на самых ранних этапах развития. Ак-
сиальное развитие спор, зигот, эмбрионов и семян во
многом определяется полярностью материнского ор-
ганизма.
Ф.Уорринг и И.Филлиппс (1984) полагают, что
физиологическая полярность является «врожден-
ным» свойством всех тканей и органов, по крайней
мере, у высших растений. Уже на самых первых эта-
Рис.3.12. Влияние локальной об-
работки и изменения направле-
ния транспорта (хирургическим
путем) ИУК на направление и ин-
тенсивность формирования сосу-
дов у гипокотилей фасоли (по:
M.Gersani, Т. Sachs, 1984)
пах формирования зиготы в организме высшего растения яйцеклетка каким-либо
образом поляризована. Эта «наведенная» полярность есть результат влияния поля-
ризованных тканей материнского растения, окружающих яйцеклетку.
У большинства растений наблюдается полярный характер распределения клеток
в зародышевом мешке вдоль микропиле-халазальной оси. Яйцеклетка и синерги-
ды располагаются вблизи микропиле, а клетки-антиподы находятся у халазального
полюса, поэтому уже в зародышевом мешке яйцеклетка может быть поляризована
вдоль оси микропиле-халаза. Поляризация является основой дифференцировки и на
всех последующих этапах эмбриогенеза. В зиготах многих видов растений удалось
обнаружить асимметричность распределения пластид, митохондрий и эндоплазма-
51
тического ретикулума в аксиальном направлении. Поэтому при поперечном делении
поляризованной зиготы образующиеся клетки зародыша имеют цитоплазму с раз-
личным составом. Показано, например, что у эмбриоида хлопчатника апикальная
клетка содержит больше пластид и митохондрий, а базальная клетка — вакуолей.
Представления о биполярности зародыша сформировались в связи с тем, что
основные работы вначале были выполнены на таких традиционных объектах как
пшеница, кукуруза, пастушья сумка. Однако некоторые растения (лотос, орхидные,
растения-паразиты и др.) в процессе эволюции утратили первичную биполярность
зародыша и перешли к монополярности, когда апексы побега и корня формируются
на одном полюсе.
Наиболее удобным объектом для анализа механизмов, лежащих в основе про-
цесса дифференцировки и формирования клеточной полярности, являются зиго-
ты водорослей, таких как Fucus и Pelvetia (рис. 3.13). По образному выражению
В.В. Исаевой (1994), оплодотворенное яйцо служит своеобразным «Ноевым ковче-
гом», переносящим от поколения к поколению всю необходимую для развития ор-
ганизма генетическую и эпигенетическую информацию, который снабжен и картой
(осевой координатной системой дифференцировки), и биологическими часами, ос-
нованными на иерархии биоритмов.
Рис. 3.13. Поляризованная зигота (а) и 3-4-х клеточные зародыши (б) Fucus (по:
Belanger, Quatrano, 2000)
Неоплодотворенные яйцеклетки водорослей радиально симметричны. После
оплодотворения зигота опускается на твердый субстрат и через 12-24 ч при нормаль-
ных условиях на ее нижней стороне образуется ризоидальный выступ (рис. 3.13). В
индукции дифференцировки первым шагом служит возникновение асимметрии, ко-
торая может быть инициирована градиентами какого-либо из факторов окружаю-
щей среды — механическим раздражением, светом, гравитацией, температурой, хи-
мическими соединениями.
Первое деление происходит в плоскости, перпендикулярной оси выступа. Воз-
никающие при этом две дочерние клетки (ризоидальная и талломическая) сильно
различаются по строению и дальнейшему развитию. Первое деление зиготы опре-
деляет постоянную ось полярности в системе, первоначально полностью лишенной
полярности.
Полярность зигот можно индуцировать экспериментально с помощью односто-
52
роннего освещения, центрифугирования, создания градиентов ауксина и некоторых
ионов (К+,Н+,Са2+), а также электрическими воздействиями. Способность к поля-
ризации в определенной степени видоспецифична. Так, для зигот морской водоросли
Fucus, прорастающих на сравнительно небольшой глубине, важным фактором по-
ляризации является свет, тогда как в яйцеклетках Cystosira barbata, родственной
Fucus, но развивающейся в темноте, ризоид возникает в месте проникновения спер-
матозоида.
Поляризация, и в первую очередь возникновение градиентов биоэлектрических
потенциалов, играет важную роль на дальнейших этапах роста и развития расти-
тельного организма, например в процессе закладки органов зародыша. В работе
С. Броули с коллегами (1984), как уже упоминалось выше, было установлено, что
каждый этап эмбриогенеза характеризуется электрическим полем со специфическим
рисунком силовых линий.
В аналогичных исследованиях, выполненных на каллусе табака и суспензионной
культуре клеток моркови, помимо электрического градиента между формирующи-
мися семядолями и корнем было показано появление градиента апопластного pH
вдоль эмбриона. Оба градиента необходимы для нормального развития зародыша.
Таким образом, уже на самых ранних стадиях развития, в процессе дифференциров-
ки зиготы и зародыша, возникают так называемые эмбриональные электрические
токи, формируется специфический рисунок силовых линий, указывающий на точки
с максимальной скоростью роста и зоны закладки будущих органов растения.
Еще одним необходимым элементом регуляции эмбриогенеза является кальций.
В работе П.Овервурде и Г. Граймса (1994) изучалась роль ионов Са2+ в сомати-
ческом эмбриогенезе растений моркови. Было установлено, что для формирова-
ния эмбриоидов необходимо присутствие кальция в среде в концентрации не ниже
200 мкмоль/л. Обработка блокаторами Са2+-каналов верапамилом и нифедипи-
ном, а также кальциевым ионофором А23187 угнетала развитие эмбриоидов. То есть
для эмбриогенеза необходимо поддержание определенного градиента концентрации
ионов Са2+ на плазматической мембране клеток.
Тропизмы. Изучение так называемых ростовых движений, или тропизмов, яв-
ляется наиболее адекватным и эффективным приемом, позволяющим расшифро-
вать всю последовательность событий, разворачивающихся в растительном орга-
низме в ответ на действие поляризующего фактора.
Выделяют рецепцию (перцепцию) сигнала, трансакцию его через систему вто-
ричных посредников, возникновение градиентов морфогенов, поляризацию клеток
и тканей, реализацию позиционной информации на уровне генома и, наконец, инте-
гральную ответную реакцию- полярный рост клеток и тканей.
Наиболее яркой демонстрацией способности высших растений к полярному росту
является ^равитропическая реакция, поскольку наиболее поляризованным внешним
фактором является гравитация. Направление и величина гравитационного стимула
практически не изменяется в течение всей истории развития растения (и фило-, и
онтогенеза). Поэтому растительные организмы сформировали тонкие механизмы,
с помощью которых способны постоянно корректировать положение своего тела в
пространстве. Практически каждое растение способно «оценивать» свое положение
относительно вектора силы тяжести и при необходимости корректировать его за
счет поляризованного роста. Уже на самых ранних стадиях гравитропической реак-
ции регистрируется электрическая поляризация, формируются полярные потоки и
градиенты ауксина и кальция. Практически череЗ 10 мин после изменения положе-
53
ния в пространстве растительного органа формируется новая физиологическая ось
симметрии в соответствии с направлением вектора силы тяжести. Более подробно
тропизмы, эмбриогенез и формирование сосудов рассмотрены во II томе учебника.
В заключение следует особо отметить, что главным фактором полярной органи-
зации роста, морфогенеза и тропизмов служит процесс полярного транспорта ИУК,
который корректируется полярными потоками ионов Са2+. Ионы Са2+ участвуют в
формировании полярных потоков других ионов, создавая электрическую ось поляр-
ности клеток, и принимают непосредственное участие в регуляции гравитропизма и
других процессов морфогенеза. При этом ионы Са2+, вероятно в качестве триггера,
могут работать как при запуске полярного роста, так и при его поддержании. С
другой стороны, действуя на полярный транспорт ауксина, кальций может влиять
на распределение этого гормона и таким образом участвовать в регуляции росто-
вых процессов. Можно допустить, что полярные потоки ионов Са2+, формирующи-
еся при изменении положения растения в пространстве (рост апексов, нутационные
движения и т.п.), а также под действием некоторых других факторов, влияют на
процесс полярного транспорта ИУК, изменяя, прежде всего, его направление. В
результате будет происходить поляризация ростовых процессов и будут формиро-
ваться новые оси полярности клеток и тканей растительного организма.
Глава 4
ФАКТОРЫ ВНЕШНЕЙ СРЕДЫ И МОРФОГЕНЕЗ
Жизненный цикл растения включает стадии гаметофита и спорофита, каждая
яз которых характеризуется уникальной пространственно-временной программой.
Благодаря прикрепленному образу жизни растения часто подвергаются стрессовым
воздействиям. Это требует комплексной и высокоупорядоченной системы ответных
реакций на такие факторы как избыточная или недостаточная освещенность, жара,
холод, гипоксия, засуха, повреждения. Растения способны очень быстро реагировать
на сигналы, поступающие из окружающей среды, и, адаптируясь к ним, корректи-
ровать программу своего развития.
В ответных реакциях растений на повреждающие факторы выделяют элемен-
ты неспецифической устойчивости (включающиеся в самых различных стрессовых
ситуациях) и специфические процессы, инициируемые в растении только опреде-
ленным типом стрессовых воздействий. Некоторые стрессовые факторы, например
высокая или низкая температура воздуха, могут действовать в течение нескольких
часов, другие — оказывают на растение неблагоприятное влияние в течение несколь-
ких дней, недель (затопление) или месяцев (дефицит или избыток некоторых ми-
неральных элементов). Именно устойчивость к неблагоприятным условиям среды
определяет границы ареала и характер распределения различных видов растений
по климатическим зонам.
Для эффективного выращивания большинства культурных растений важна не
только их потенциальная продуктивность, но также способность противостоять раз-
личным стрессовым ситуациям и адаптироваться к ним. При этом важную роль
играет акклиматизация растений, то есть увеличение их устойчивости к стрессово-
му фактору путем закаливания, или серии подпороговых стрессовых воздействий.
Процесс акклиматизации связан с экспрессией определенных генов и появлением
таких генных продуктов, активность которых повышает устойчивость растения к
стрессовому воздействию.
Акклиматизацию не следует понимать как адаптацию, которая определяется как
генетически детерминированный уровень устойчивости определенных видов расте-
ний и, как правило, является результатом процесса отбора в течение многих по-
колений. Адаптация - -это совокупность морфологических, физиологических и хи-
мических приспособительных реакций, обеспечивающих возможность выживания и
полноценного развития определенного вида растений при действии неблагоприят-
ных условий среды.
Традиционно изучение роли факторов внешней среды в физиологии растения
было связано с проблемами экологии, стресса, устойчивости и адаптации. Однако в
55
параметрах окружающей среды также заключена очень важная морфогенетическая
информация, которая позволяет растениям успешно проходить весь свой жизненный
цикл.
4.1. Свет
Растительные организмы способны использовать свет не только как источник
энергии, но и как эффективный фактор, с помощью которого осуществляется регу-
ляция процессов роста и развития. Характер ответных реакций зависит от длины
волны света, интенсивности и направленности светового потока, продолжительности
и периодичности освещения.
Для растений очень важно сформировать семена при наиболее благоприятных
для этого климатических условиях, поэтому большинство видов, ориентируясь на
условия внешней среды, способно переходиты от вегетативного роста к цветению
только в определенное время года. Наиболее важным фактором, который влияет на
переход растительного организма к генеративному этапу развития, является фото-
период, то есть продолжительность светлого времени суток. Для многих видов рас-
тений фотопериод является важнейшим фактором, влияющим на процессы роста,
развития и особенно цветения растений. Это явление было названо фотопериодиз-
мом.
Растения, у которых цветение индуцируется «коротким днем», называют корот-
кодневными. В том случае, когда зацветанию благоприятствует «длинный день»,
растения называют длиннодневными. Виды, у которых длина дня не оказывает су-
щественного влияния на цветение, называют нейтральными (к длине дня). У длин-
нодневных растений зацветание наблюдается при продолжительности светового пе-
риода от 11 до 24 ч в сутки, у короткодневных — при длине дня от 6 до 15 ч.
В основе фототропизма лежит способность растения оценивать направление све-
тового потока (то есть градиент освещенности) и изгибаться в направлении источ-
ника света. Термин фотоморфогенез объединяет процессы, которые не зависят от
направления и периодичности освещения, а определяются длиной волны и интен-
сивностью светового потока. Наиболее важное значение при этом имеют красная и
синяя области солнечного спектра.
Растения, выросшие в полной темноте, называются этиолированными. Они име-
ют бледно-желтую окраску (из-за отсутствия хлорофилла), отличаются сильно вы-
тянутым побегом, недоразвитием механических тканей, листовых пластинок, устьиц
и хлоропластов. Для этиолированных проростков двудольных растений характер-
но наличие гипокотильного (или эпикотильного) крючка, который при прорастании
пробивает слой почвы и предохраняет меристему побега от механических повре-
ждений почвенными частицами. Именно благодаря процессам, происходящим при
этиоляции, побег быстро выносится из почвы к свету.
Красный свет действует как сигнал, который индуцирует переключение програм-
мы этиоляции на программу роста растения на свету. Для деэтиоляции необходимо
изменение паттерна экспрессии генов, контролирующих рост клеток в темноте и на
свету. Освещение этиолированных растений приводит к снижению скорости роста
стебля, распрямлению гипокотильного крючка у двудольных растений, инициации
формирования хлоропластов и синтеза фотосинтетических пигментов. Помимо де-
этиоляции к реакциям, контролируемым красным светом, относятся прорастание
семян некоторых видов растений, рост клеток растяжением, закладка листовых
56
примордиев и развитие листа, закладка цветочных почек, цветение и некоторые
другие.
В основе многих реакций фотоморфогенсза лежат обратимые превращения хро-
мопротеина — фитохрома (Ф). Данный белок обладает уникальным свойством: он
изменяет максимум поглощения при освещении красным светом (КС) и дальним
красным светом (ДКС) за счет способности к фотопревращению. Этот хромопроте-
ин может находиться в двух спектральных формах, имеющих разные максимумы
поглощения, — Фк и Фдк- При освещении красным светом фитохром превращает-
ся в Фдк-форму с максимумом поглощения 730 нм. Освещение ДКС возвращает
фитохром в Фк-форму с максимумом поглощения 660 нм.
Основная функция фитохрома заключается в оценке баланса красного и даль-
него красного света при естественном освещении, который, как известно, сильно
изменяется в сумерках, под пологом леса и в почве. В этиолированных растениях
фитохром обычно присутствует в Фк-форме, а при облучении красным светом он
превращается Фдк-форму. Физиологически активной является Фдк-форма фито-
хрома. Благодаря фотопревращениям фитохрома растения получают информацию
об изменении световых условий в окружающей среде и приспосабливаются к ним.
Именно фитохром позволяет проростку, пробивающемуся из затененных условий в
почве, постепенно готовиться к тем условиям освещенности, которые будут на по-
верхности.
Фитохром и его фотопревращения являются основой суточных ритмов — пери-
одических изменений интенсивности различных метаболических процессов (фото-
синтеза, дыхания, транспирации и др.) в ходе естественной смены световых и тем-
новых периодов в течение суток (утро и вечер). Различная реакция светолюбивых и
теневыносливых растений на условия затенения также определяется соотношением
красной и дальней красной форм фитохрома в тканях растений.
В растительных организмах выявлен ряд процессов, которые специфически кон-
тролируются синим светом. К таким процессам относятся угнетение роста гипо-
котилей и стеблей в длину, фототропизм, движение устьиц, ранние этапы синте-
за хлорофилла и каротиноидов, движение листьев за солнцем, фототаксис хло-
ропластов, Восприятие синего света в растительных клетках осуществляют два
типа фоторецепторов: криптохромы и фототропины. Следует отметить, что ре-
цепторы синего света криптохромы могут также принимать участие в регуля-
ции ряда светозависимых процессов (деэтиоляции, фотопериодизма), контролиру-
емых фитохромами. Более подробно процессы фотоморфогенеза рассмотрены во
II томе учебника.
4.2. Температура
Важным фактором, контролирующим этапность онтогенеза у растений умерен-
ных и высоких широт, являются низкие положительные температуры. Их воздей-
ствие в течение определенного времени, называемое яровизацией (или вернализаци-
ей), необходимо для формирования флорального стимула у озимых форм растений
и способствует последующему ускорению их развития и зацветания. Растения, не
нуждающиеся в яровизации, называют яровыми. Для яровизации необходимыми
условиями являются: наличие делящихся клеток (в зародыше, апикальных мери-
стемах, молодых листьях) и холодовая обработка в диапазоне температур от 11 до
+5°С в течение 1-3 мес. Для растений южных широт эти температуры могут пре-
57
вышать 4-10°С. В некоторых случаях эффект низких положительных температур
может имитироваться рядом других воздействий.
В природных условиях температурный фактор, как правило, не является поля-
ризованным, чем принципиально отличается от света или гравитации. Однако суще-
ствуют данные, согласно которым температура среды может влиять на становление
полярности организма. Очевидно, что морфогенетические программы не являют-
ся жестко детерминированными, что дает возможность организму развиваться по
различным сценариям. Выбор пути развития в конкретных условиях в ряде случа-
ев зависит от температуры. Известно, что морфогенез молодых растений каштана
четко контролируется температурой: при постоянно высоких температурах (-Ь25°С)
каштан растет как кустарник, в то время как при низких (от 4-4 до Ч-12°С)-- он
типичное дерево. Только повышение температуры инициирует образование прида-
точных почек в эксплантах луковиц Lilium speciosum.
Реакции на температуру, как и на свет, у растений могут быть и качественными,
и количественными. Обычно с повышением температуры скорости химических про-
цессов в растении постепенно возрастают, достигают некоторого максимума, а затем
снижаются. Морфогенетические процессы, например прорастание семян или преры-
вание покоя почек, часто регулируются по принципу «все или ничего». В послед-
нем случае для низкотемпературной индукции требуется непрерывное воздействие
в течение некоторого минимального времени, что напоминает фотопериодическую
индукцию, при которой также необходимы определенные периоды темноты.
В процессе развития иногда возникают ситуации, когда решающее значение име-
ет градиент температуры между корневой системой и надземной частью растения.
У сортового картофеля (в отличие от короткодневного дикорастущего) длина дня
не препятствует клубнеобразованию, и он дает хорошие урожаи даже за Поляр-
ным кругом при незаходящем солнце. В такой ситуации важную роль играет тем-
пература почвы. Поскольку по происхождению картофель является высокогорным
растением, он успешнее всего развивается при пониженных температурах почвы.
Повышение температуры почвы выше (4 22)-(4 25)°С уже подавляет клубнеобразо-
вание. Ингибирование клубнеобразовапия при повышении температуры может быть
связано с гиббереллиновым обменом (синтезом этого гормона и его транспортом по
растению).
Большинство видов тропических и субтропических растений не выдерживают
не только заморозков, но даже низких положительных температур. Такие расте-
ния как кукуруза, фасоль, рис, томаты, огурцы и хлопок останавливаются в росте
при температуре от 410 до 415°С и повреждаются, если температура падает ниже
4Т0°С. Холодостойкость теплолюбивых растений можно повысить предпосевным
закаливанием. В процессе закаливания изменяется гормональный баланс растения,
происходит торможение ростовых процессов, возрастает количество ненасыщенных
жирных кислот, включаются механизмы защиты клеток от обезвоживания и замер-
зания.
У морозостойких растений при действии низких температур усиливается гидро-
лиз крахмала и накопление в цитоплазме растворимых сахаров. У озимых форм
пшеницы и многих других видов растений функцию криопротектора выполняет са-
хароза, накапливающаяся в больших концентрациях. В качестве антифризов могут
также выступать и другие растворимые сахара: рафиноза, фруктозиды, сорбит или
маннит, которые накапливаются в клеточных стенках растений и предотвращают
образование кристаллов льда. Наиболее чувствительны к морозу корни, корневища,
58
клубни и луковицы большинства растений, которые повреждаются при температуре
ниже (—10)-(—15)°С. Покоящиеся почки древесных растений способны выдержи-
вать морозы до (—25)-(—30)°С.
Важная роль в адаптации растений к низким температурам принадлежит фито-
гормону АБК. Устойчивость многих растений к заморозкам может быть повышена
не только закаливанием, но также обработкой их АБК. При воздействии низких
положительных температур и (или) при уменьшении светового периода концентра-
ция этого гормона в растительных тканях резко возрастает. Мутанты арабидопсиса,
нечувствительные к АБК (аЫ-1) или с нарушенным синтезом АБК (aba-1), не могут
приспособиться к заморозкам. Активность многих генов, которые экспрессируются
при низкой температуре или водном дефиците, может быть индуцирована обработ-
кой АБК. Белки, кодируемые этими генами, появляются при охлаждении тканей и
имеют высокую степень гомологии с семейством белков RAB/LEA/DHN (responsive
го АВА/ late embryo abundant /dehydrin). Эти белки синтезируются при созрева-
нии семян, водном дефиците и обработке растений АБК. Считается, что именно эта
группа белков обеспечивает защиту клетки при обезвоживании и заморозках, ста-
билизируя другие белки и клеточные мембраны. LEA-белки очень гидрофильны,
способны прочно удерживать воду и сохраняют свою структуру при резких колеба-
ниях температуры.
4.3. Вода
Недостаток воды в растительных тканях возникает тогда, когда расход начина-
ет превышать поступление. Водный дефицит вызывает значительные нарушения в
первую очередь процессов роста и фотосинтеза. Во время засухи наряду с обезвожи-
ванием происходит перегрев растений, поэтому засуха является наиболее жестким
стрессовым воздействием. При резком наступлении засушливого периода растения,
как правило, сбрасывают часть листьев. Если водный дефицит развивается посте-
пенно, то растительному организму лучше удается приспособиться к недостатку
воды, заранее замедлив темпы ростовых процессов.
У растений имеется несколько адаптивных стратегий, с помощью которых им
удается переживать засушливые периоды. Одни виды приспособились функциони-
ровать в условиях дефицита воды в организме (ксерофиты). Другие способны на-
капливать и удерживать воду, поддерживая таким образом необходимую степень
гидратации своих клеток и .органов (например, суккуленты). К третьей группе от-
носят растения, которые «избегают» засухи за счет организации своего жизненного
цикла таким образом, чтобы вегетировать в период достаточного обеспечения водой
(эфемероиды, эфемеры).
Ксерофиты -это засухоустойчивые растения, произрастающие в местах с недо-
статочным увлажнением и хорошо выраженным засушливым периодом. У таких
растений выработались различные приспособления, позволяющие им выжить в су-
хом воздухе и при недостатке воды в почве. Обычно это низкорослые растения с
мощно развитой корневой системой. При этом нередко масса корней в десятки раз
превышает массу надземных побегов. Все защитные приспособления ксерофитов
направлены на снижение транспирации.
Это достигается разными способами. У одних растений на листьях имеется сереб-
ристо-белое опушение, которое отражает солнечные лучи и защищает от перегрева
и излишней транспирации. При этом в густом опушении задерживаются водяные
59
пары и повышается влажность воздуха. У других видов поверхность листовой пла-
стинки может быть покрыта толстым слоем воскового налета. Третьи растения име-
ют узкие, расположенные вертикально листья. В полуденный зной солнечные лучи
скользят вдоль таких листьев и не перегревают их. У ковылей при засухе лист спо-
собен сворачиваться в трубочку, создавая влажную камеру, в которую открываются
устьица. И, наконец, некоторые ксерофиты, например пустынные саксаулы, вообще
лишены листьев.
Стеблевые суккуленты, например кактусы, имеют сочный толстый стебель и
превратившиеся в колючки листья. У них стебли похожи на бочки, в которых на-
капливается влага, а затем экономно расходуется на протяжении засушливого пе-
риода. Листовые суккуленты (алоэ, агавы), напротив, обладают жестким стеблем и
мясистыми листьями.
Многие виды растений резко ускоряют свой рост весной, когда в почве накап-
ливается большое количество влаги. При этом растения или запасают воду для за-
вершения репродуктивного этапа развития (эфемероиды), или быстро завершают
свой жизненный цикл — эфемеры. Такой тип роста и развития растений называют
детерминированным, поскольку он определяется периодами дождей или засухи.
Эфемероиды — это многолетние травянистые растения с непродолжительной
осенне-весенней вегетацией. Длительность вегетации эфемероидов аридных обла-
стей, например различных видов тюльпанов, — 2-3 месяца. Засушливую часть года
эфемероиды находятся в покоящемся состоянии в виде семян, луковиц, клубней или
корневищ.
Мезофитами называют растения, живущие в условиях нормального среднего
увлажнения. У таких растений обычно сочные и достаточно крупные листья с плос-
кими пластинками и большим количеством устьиц. В условиях нормальной обеспе-
ченности водой у растений-мезофитов, произрастающих, например, на северо-западе
России, вегетация и цветение продолжаются весь летний период. Такой тип развития
растений называют недетерминированным,. Мезофиты не имеют особых приспособ-
лений для снижения испарения воды, поэтому не выдерживают длительной засухи,
но способны пережить кратковременный водный дефицит.
Одной из самых ранних реакций растительных организмов на водный дефицит
является синтез фитогормона абсцизовой кислоты, которая вызывает закрывание
устьиц и таким образом снижает потерю воды при транспирации (см. также главу
11). Недостаток воды инициирует рост корней в направлении более влажных участ-
ков почвы при условии, что в растущие кончики корней поступает необходимое
количество фотоассимилятов. В этом случае возникает конкуренция за ассимиля-
ты между растущими корнями и формирующимися плодами. В условиях водного
дефицита активируется синтез низкомолекулярных осмотически активных веществ
(моно- и олигосахаридов, аминокислот, в первую очередь пролина, бетаинов, много-
атомных спиртов) и различных стрессовых белков, таких как осмотин, дегидрины.
4.4. Кислород
Корневая система растений обычно получает кислород прямо из почвы. В хоро-
шо дренированных почвах О2 способен диффундировать на глубину до нескольких
метров, поэтому содержание кислорода в газовой фазе почвы практически такое
же, как во влажном воздухе. Однако при затоплении и заболачивании корни ис-
пытывают недостаток кислорода, тем более что скорость его диффузии в водной
60
среде невелика. При этом кислород также необходим для дыхания различным дру-
гим почвенным организмам. Гипоксия резко угнетает рост и развитие многих видов
растений, однако некоторые из них (например рис, ива) очень устойчивы к дефициту
кислорода.
Корни, находящиеся в условиях аноксии или гипоксии, утрачивают способность
к эффективному поглощению элементов минерального питания и воды и снабжению
ими надземных органов растения. При этом может наблюдаться временное снижение
водного потенциала и завядание, которое быстро прекращается, так как вскоре про-
исходит закрывание устьиц, что предотвращает потерю воды за счет транспирации.
Однако у некоторых видов растений (горох, томаты) аноксия вызывает закрывание
устьиц сразу же, без снижения водного потенциала тканей. Это объясняется тем,
что при затоплении, как и при дефиците воды, активируется синтез фитогормона
АБК и транспорт его в молодые листья как из корневой системы, так и из старых
подвядших листьев.
Гипоксия индуцирует синтез в корнях предшественника этилена — аминоцикло-
пропанкарбоновой кислоты, которая по ксилеме передвигается в надземную часть,
где с участием кислорода превращается в этилен (см. главу 12). Именно повышение
концентрации этилена является причиной эпинастии — опускания листовых пла-
стинок вниз. Эпинастия наблюдается при попадании корневой системы растения в
анаэробные условия.
а
б
Рис. 4-1- Влияние гипоксии на структуру корня кукурузы (по: Drew et al., 2000):
а — нормальная аэрация питательного раствора; б — пеаэрируемый раствор. Кс — со-
суды ксилемы, Эн — эндодерма, Кр - клетки коры, Вп — воздушные полости, Эп — эпи-
дерма
Водные растения очень хорошо приспособились к постоянному дефициту кис-
лорода в корневой системе. Даже если в воду немного погружены и побеги, они
не испытывают видимых признаков стресса. У некоторых видов водных растений,
например у водяной лилии Nymphoides peltata. при погружении в воду начинает вы-
деляться этилен, который стимулирует интенсивный рост клеток молодых череш-
ков. В результате листья очень быстро оказываются на поверхности воды в воздухе.
Сходным путем осуществляется регуляция роста междоузлий растений риса при их
затоплении.
61
В стеблях и корнях водных растений, а также растений, присгкгоблнкых к усло-
виям затопления, за счет ткани, которая называется аэренхимой формируется си-
стема межклеточных воздушных полостей, пронизывающая праггггсм все расте-
ние (рис. 4.1). По этим воздушным ходам обеспечивается перелвмженве воздуха от
устьиц до клеток корней. Благодаря такому строению стебли водных растений зна-
чительно легче, чем наземных. Такая же система воздушных полостей образуется
(независимо от внешних воздействий) в растениях риса, что позволяет его корням
функционировать в анаэробных условиях на глубине 50 см и более. В корнях ри-
са и других растений, хорошо выдерживающих условия затопления, имеются так-
же структурные барьеры, представленные суберинизированными (опробковевшими)
и лигнифицированными клетками, которые препятствуют диффузии кислорода из
тканей корпя в почву.
Глава 5
КОРРЕЛЯЦИИ В ХОДЕ РОСТА И МОРФОГЕНЕЗА
Процессы роста различных органов и тканей растительного организма протека-
ют не независимо, а тесно взаимосвязаны. В результате деятельности апикальных
меристем постоянно увеличиваются длина стебля и масса корневой системы. Их тол-
щина и прочность возрастают благодаря активности камбия и перицикла. Влияние
одних частей организма на скорость и характер роста других называют корреляци-
ями.
Самый простой тип корреляций связан с питанием. Побеги, снабжая корни асси-
милятами, стимулируют рост корневой системы. В свою очередь, растения с более
мощной корневой системой поглощают больше питательных веществ и имеют более
развитую систему побегов. С возрастанием массы побегов увеличивается и корне-
вая система. Листья за счет синтезируемых в них ассимилятов стимулируют рост и
развитие собственных пазушных почек.
При коррелятивном торможении из-за конкуренции за питательные вещества
один орган подавляет другой. С увеличением количества развивающихся плодов
(например у томатов) их размер уменьшается. Нередко рост листьев усиливается
при удалении соцветий, пазушных побегов или других листьев. Рост вегетативных
органов подавляется при формировании цветков, плодов и семян.
Однако взаимоотношения растущих частей растений нельзя объяснить толь-
ко конкуренцией за питательные вещества. Коррелятивные взаимодействия очень
часто определяются количественным соотношением фитогормонов. Именно гормо-
нальная система растений играет главную роль в определении интенсивности роста
и направления морфогенеза клеток и тканей растений. Механизм гормональных
корреляций носит более сложный характер и будет рассмотрен далее.
5.1. Донорно-акцепторные взаимосвязи
Ткани и органы растения, к которым направлен постоянный поток органических
и минеральных соединений, называются акцепторными (зоны интенсивного роста,
репродуктивные органы), а те зоны, из которых происходит перемещение питатель-
ных веществ, называют донорными (листья). Молодые листья являются акцептора-
ми ассимилятов, поступающих из зрелых и активно фотосинтезирующих листьев-
доноров. Донорно-акцепторные отношения играют очень важную роль в процессах
роста и развития таких органов как листья и боковые корни, цветки, плоды и семе-
на, клубни и луковицы. В течение онтогенеза происходит постоянная смена тканей-
доноров и тканей-акцепторов.
63
Сихачакр с коллегами (1983) производили прививки между зя^амп батата:
клубнеобразующим Ipomoea batatas и не способным образовывать к_т.€«и Ipomoea
aquatica. Было обнаружено, что источником фактора клубнеобрахэваям в растени-
ях I. batatas являются листовые пластинки, однако прививка ллгтовых пластинок
от клубнеобразующего вида I. batatas на I. aquatica еще не достаточна д»тя формиро-
вания клубней. Только в том случае, когда на I. aquatica прививали гса*_»временно и
листовые пластинки, и фрагменты корней с апексами от /. batatas, наблюдали фор-
мирование клубней. Таким образом, для клубнеобразования необходимо наличие
листовой пластинки, обеспечивающей синтез фактора клубнеобразования. и корней
как его акцептора.
Интересными в этой работе оказались опыты, в которых исследовали влияние
ориентации фрагментов стебля I. aquatica с уже принявшимися прививками листьев
и корней I. batatas. Оказалось, что у таких прививок последующая вставка кусочка
стебля или черешка I. aquatica с нормальной полярностью не препятствует процессу
клубнеобразования. Когда же вставка помещается так, что полярность ткани ме-
няется на противоположную, клубнеобразования не наблюдается, а рост привоя и
подвоя нарушается. Более того, если вырезать кусочек стебля у нормального клуб-
необразующего вида батата и перевернуть его, клубни образовываться не будут.
Следовательно, для процесса клубнеобразования важным является не только обес-
печенность растений специфическим фактором клубнеобразования, но также нали-
чие полярно организованной системы транспорта этого фактора.
Активность донорных или акцепторных участков в растении зависит от гормо-
нального статуса ткани и определяется процессами синтеза, транспорта, конъюга-
ции и катаболизма фитогормонов. В формирующихся плодах, клубнях и клубеньках
(у бобовых) наблюдается возрастание концентрации эндогенных ауксина и цитоки-
нинов. Гормоны, синтезируемые в молодых развивающихся тканях, играют также
важную роль в формировании сосудов, связывающих эти ткани с другими частями
растительного организма.
Фитогормоны могут усиливать поступление ассимилятов практически во все ор-
ганы растения, а именно: в верхушки стеблей, корни, молодые распускающиеся
листья, репродуктивные органы, молодые растущие плоды, а также запасающие
органы. Именно уровень фитогормонов определяет «запрос» па ассимиляты и на
фотосинтетическую активность листьев. Фитогормоны способны оказывать прямое
воздействие на функционирование листа, влиять на активность практически всех
процессов и в световой, и в темновой стадиях фотосинтеза.
Распускающиеся почки являются акцепторами ассимилятов, которые поступают
из зрелых, активно фотосинтезирующих листьев. Аттрагирующая способность раз-
вивающихся почек обусловлена высоким содержанием в них таких гормонов как аук-
сины и цитокинины. Выявлено, что при нанесении кинетина (синтетического цито-
кинина) на лист усиливается передвижение органических и неорганических веществ
к обработанному участку. На рис. 5.1 показан классический эксперимент К. Мотеса,
доказывающий аттрагирующее действие цитокининов на передвижение 14С-глицина
в листьях конских бобов Faba bona. Хорошо видно, как метка (14С-глицин) переме-
щается в половину листа, обработанную гормоном.
В лаборатории В. В. Полевого изучался аттрагирующий эффект фитогормона
ауксина. На апикальную часть отрезка колеоптиля кукурузы наносили ИУК, а ос-
нование отрезка погружали в раствор 14С-ацетата или 14С-урацила. Было показано,
что обработка ауксином стимулирует передвижение меченых соединений к апикачь-
64
Рис. 5.1. Влияние кинетина на передвижение 14С-глицина в
листьях конских бобов (по: Mothes, 1963).
Стрелками отмечены места нанесения раствора 14С-глицина
ной части отрезка. Обнаруженный в колеоптилях кукурузы аттрагирующий эффект
ауксина не был опосредован транспирацией и ростом клеток.
Нанесение на апикальный участок декапитированных стеблей фасоли кинетина
или ИУК также вызывает усиление транспорта ассимилятов к местам обработки
фитогормонами. Таким образом, к числу главных факторов, регулирующих потоки
питательных веществ от зон доноров к акцепторам, относятся фито гормоны ауксины
и цитокинины. Более детально роль фитогормонов в регуляции роста и развития
органов-акцепторов рассмотрены в II томе учебника.
5.2. Апикальное доминирование
Известно, что апикальная меристема побега делится и дифференцируется гораз-
до интенсивнее, чем меристемы пазушных почек. В результате наблюдается более
активный рост и дифференцировка апикальной почки и подавление развития лежа-
щих ниже пазушных почек. Это явление было названо апикальным доминированием
или коррелятивным ингибированием почек.
Степень доминирования апикальной почки над боковыми варьирует у разных
растений. У некоторых видов, например у подсолнечника, доминирование полное
и распространяется на всю длину стебля. У других видов, в частности томатов,
доминирующий эффект апикальной почки слабее, и растения похожи на куст. У
многих растений (ясень, явор) доминирование верхушки побега ослабевает по мере
старения. Вначале у них интенсивно растет только основной побег, а в последующие
годы наблюдается активное ветвление и усиленное развитие боковых побегов. У
ряда однолетних растений эффект апикального доминирования снижается к концу
вегетационного периода и/или после формирования цветка.
Причина подавления апикальной почкой развития боковых почек и побегов за-
ключается в разном снабжении их ауксином. Для апикальной почки главного побега
характерно наиболее высокое содержание ИУК, что является основой для форми-
рования мощного проводящего пучка и максимального аттрагирующего эффекта.
Именно полярный базипетальный поток ИУК, синтезируемой в апикальной части
растения, лежит в основе явления апикального доминирования (рис. 5.2). Показано,
например, что обработка экзогенной ИУК листьев или апексов хризантемы при-
водила к угнетению развития цветочных почек, задерживала зацветание, снижала
процент раскрывшихся цветков.
65
Рис. 5.2. Снятие эффекта апикального доминирования посредством декапитации
главного побега и возникновение нового доминантного побега из пробудив-
шихся боковых почек (по: Leyser, 2005).
Стрелками показаны потоки ауксина из молодых листьев доминирующего побега
Удаление апикальной почки или ингибирование полярного транспорта ИУК, на-
пример трийодбензойной кислотой (ТИБК), снимает эффект апикального домини-
рования. Это вызывает резкую активацию роста пазушных побегов и ветвления
растений. Показано, что ингибитор полярного транспорта ТИБК активирует рост
стеблей и боковых побегов люцерны и, следовательно, снимает эффект апикально-
го доминирования. ТИБК, нанесенная с ланолиновой пастой на стебель томатов,
также снимает апикальное доминирование, вызывая рост боковых побегов и обра-
зование цветочных кистей. В результате обработки ТИБК образуется значитель-
но больше соцветий. Аналогичный эффект оказывает обработка надземной части
растений другими ингибиторами полярного транспорта ауксина, в результате че-
го, например, хможет пробуждаться и трогаться в рост до 50-65% боковых почек и
возрастать количество бобов у растений сои.
Важную роль в явлении апикального доминирования также играют цитокинины.
В ряде случаев оно может быть снято обработкой цитокининами, которые стиму-
лируют рост пазушных почек стебля. Дж. Хасси (1976) анализировал возможность
устранения апикального доминирования у однодольных растений. Проростки, полу-
ченные из адвентивных почек на кусочках стебля, листа или на луковичных чешуях,
культивировали in vitro на среде с добавлением различных количеств цитокинина
(бензиламинопурина, Б АП). Для видов семейства Iridaceae 0,12 мг/л Б АП было
достаточно, чтобы вызвать появление боковых побегов и подавить образование лу-
ковиц. Для видов из семейства Liliaceae и Amaryllidaceae требовались более высокие
концентрации Б АП (до 2-4 мг/л) для подавления верхушечного доминирования и
образования боковых побегов.
Следует отметить, что ИУК, поступающая из верхушки побега, синтезируется
не только в главном стебле, но также и в апексах боковых побегов и необходима не
только для роста главного стебля, но также и для развития боковых побегов. Поэто-
му ауксин, образующийся в апексе главного побега, вероятно, может содействовать
66
его доминированию лишь в силу донорно-акцепторных взаимосвязей между орга-
нами.
В работе П. Гудвина и С. Морриса (1979) было обнаружено, что удаление 2 мм
верхушки корня гороха тормозит рост растяжением клеток первичного корня в два
раза, но не влияет на общее количество боковых корней. Обработка ауксинами ИУК
и НУК повышает количество латеральных корней, тогда как АВК, Б АП и гиббе-
релловая кислота подавляли их образование. Таким образом, ауксин, производимый
верхушкой побега, угнетая рост боковых почек стебля, стимулирует закладку лате-
ральных корней. Цитокинины, которые производятся в верхушке корня, угнетают
инициацию боковых корней, но стимулируют рост боковых почек стебля.
5.3. Позиционная информация
Позиционной информацией называют систему распределения в пространстве
неких сигналов, которые обусловливают специализацию (дифференцировку) клеток
и тканей растительного организма. Концепция «позиционной информации» была
предложена Л. Вольпертом (1969, 1978, 1989), который полагал, что развитие каж-
дой клетки определяется разницей в концентрациях (градиентом) неких веществ —
морфогенов. По Вольперту, в ходе дифференцировки судьба каждой клетки опре-
деляется ее «позицией» среди других клеток в ткани или органе. Вольперт считал,
что каждая клетка способна «химически оценить» свое месторасположение и, в за-
висимости от этого, «определить» свою специализацию и диффенцироваться.
На ранних этапах эмбриогенеза позиционная информация задается матерински-
ми факторами детерминации. Например, у животных организмов определенная ло-
кализация морфогенетических детерминант в яйце создается под контролем генома
в ходе оогенеза и окончательно устанавливается к началу дробления. Поскольку бел-
ковый синтез раннего зародыша обеспечивается в основном «материнской» инфор-
мационной РНК, именно характер ее пространственного распределения, по-видимо-
му, способен детерминировать наиболее ранние этапы морфогенеза. Генетический
анализ этих ранних детерминант полярности у дрозофилы и нематоды Caenorhab-
ditis elegans привел к идентификации генов материнского эффекта, которые опре-
деляют осн тела эмбриона или непосредственно участвуют в их создании.
Развитие многоклеточного организма из оплодотворенной яйцеклетки требует
возникновения различий между отдельными клетками, то есть их дифференциров-
ки. Становление асимметрии, в развивающемся организме обусловлено, как мини-
мум, двумя процессами. Во-первых, локализацией различных детерминант в опре-
деленных частях цитоплазмы яйцеклетки, что приводит к появлению клеток с раз-
личными потенциями. Во-вторых, индуктивными событиями, которые требуют экс-
траклеточных стимулов, заставляющих клетки с одинаковыми потенциями идти
различными путями развития.
Клетки в многоклеточном организме находятся в тесном контакте и постоянно
обмениваются между собой продуктами жизнедеятельности. Очень важным факто-
ром, определяющим направление роста и развития клетки, является ее местопо-
ложение в ткани или органе. Это было хорошо показано тонкими экспериментами
сотрудников группы Б.Шереса (1995) в Нидерландах. С помощью лазера они по-
следовательно повреждали (удаляли) клетки-инициал и в меристеме корня и следи-
ли за судьбой клеток, которые из этих инициалей обычно образуются. Оказалось,
что при удалении, например, кортикально-эндодермальных инициалей производи-
67
мая ими совокупность клеток коры и эндодермы не исчезает. Клетки перицикла,
смежные с поврежденными кортикальными инициал ями, заниыатн место удаленной
инициал и и начинали выполнять ее функции, производя клетки коры и эндодермы.
Эти эксперименты показывают, что именно позиционные сигналы определяют
путь развития растительной клетки, то есть место клетки в ткани и ее окруже-
ние (позиционная информация) могут играть более важную роль при определении
направления дифференцировки, чем тип инициали, из которой клетка произошла.
Глава 6
БИОРИТМЫ В РАЗВИТИИ РАСТЕНИЙ
Биоритм — это цепь повторяющихся в организме в определенной последователь-
ности событий, для однократного осуществления которых (то есть для прохождения
одного цикла) необходимо одно и то же время. В качестве события можно рассмат-
ривать любой процесс или явление - определенную скорость фотосинтеза, дыхания
или роста, определенное расположение листа, определенный уровень устьичной про-
водимости или генной экспрессии, а также этап развития: клубнеобразование, цве-
тение, опадение листьев. Если событие имеет количественное выражение, то можно
дать математическое описание биоритма. В математическом смысле, ритм - это ко-
лебание некой величины S во времени t, где каждое значение S повторяется неогра-
ниченное число раз (п) через одинаковые промежутки времени Т:
S(t + пТ) = S(t).
Величина S может совершать прямоугольные, синусоидальные, пилообразные
или иной формы колебания во времени. У растений наиболее распространены сину-
соидальные, или гармонические, ритмы. Эти периодические колебания математиче-
ски описываются следующей формулой:
S = Asi.n(2ivt/Т 4- фо),
где А — амплитуда колебательного процесса, под которой понимают половину раз-
маха колебаний между минимальным и максимальным значениями ритмически из-
меняющейся величины; Т — период, или промежуток времени до первого повторения
значения колеблющейся величины (обычно Т измеряется как промежуток времени
между ближайшими максимумами или ближайшими минимумами колеблющейся
величины); фо— начальная фаза колебания, характеризующая колеблющуюся ве-
личину в начальный момент времени.
У растений много ритмических процессов. Особенно хорошо изучены те, кото-
рые происходят с суточной периодичностью- движения устьиц и листьев, измене-
ния скорости роста междоузлий, интенсивности дыхания и фотосинтеза. Эти рит-
мы называются экзогенными, так как они связаны с внешним суточным ритмом
освещенности, влажности, температуры. Однако почти 300 лет назад французский
академик Де Меран показал, что в основе суточного (24-часового) ритма движения
листьев мимозы лежит эндогенный ритм с периодом около 24 ч, выявляемый в неиз-
менных условиях среды. Позднее были обнаружены тысячи различных эндогенных
ритмов.
69
По длительности эндогенные ритмы делят на циркадные (околосуточные), цир-
канные (окологодичные), ультрадианные (с периодом значительно короче 24 ч) и
инфрадианные (с периодом значительно длиннее 24 ч). Наиболее нзуюны циркад-
ные ритмы. Так, у растений в условиях постоянной освещенности и температуры с
периодичностью 22-30 ч открываются и закрываются устьица, опускаются и подни-
маются листья, фосфорилируются и дефосфорилируются белки 1 например ФЭП-
карбоксилаза у каланхоэ), изменяются уровень экспрессии генов, скорость роста
междоузлий и расположение в клетках хлоропластов, раскрываются и закрываются
лепестки цветков. Фотопериодизм цветения растений также основан на циркадных
ритмах (рис. 6.1).
Движение
Рис. 6.1 Некоторые циркадные ритмы растений (по: Barak et al., 2000)
Модельной системой для изучения биоритмов растений многие годы служил су-
точный ритм движения листьев ряда бобовых. Используя эту модель, Э. Бюнпинг
пришел к ряду выводов общетеоретического плана, легших в основу биоритмоло-
гии. Хотя движение листьев происходит в условиях смены дня и ночи с периодом
24 ч, оно носит проспективный характер: растение начинает опускать листья задол-
го до рассвета, а поднимать — задолго до захода солнца, то есть растение как будто
предвидит, что скоро взойдет солнце или наступят сумерки. Говоря математиче-
ским языком, соблюдается определенное отставание по фазе ритма освещенности от
биоритма. Объясняется это тем, что экзогенный 24-часовой ритм движения листьев
базируется на эндогенном циркадном ритме с периодом 22-28 ч, который можно
наблюдать в условиях неизменной освещенности.
Для того чтобы иметь адаптивное значение, эндогенный ритм должен настра-
иваться на внешний ритм и подчиняться ему (рис. 6.2). Процесс подчинения внут-
реннего ритма внешнему, например периодической смене дня и ночи, называется
70
захватыванием ритхма (rhythm entrainment). «Незахваченпый» эндогенный ритм, ко-
торый проявляется при постоянных условиях среды, называется свободнотекущим
(free-running rhythm).
Эндогенные ритмы могут быть
разделены на подневольные и са-
моподдерживающиеся (автоколе-
бательные). Подневольные ритмы
не имеют механизма автогенерации
и основаны на периодических из-
менениях внутренней среды вслед-
Внешний ритм Свет/темнота
Центральный осциллятор
ствие протекания самоподдержива-
ющихся ритмов. Таким образом,
в организме существует иерархия
биоритмов, на вершине которой на-
ходится центральный осциллятор,
или пейсмейкер. Он состоит из
тех эндогенных автоколебательных
процессов, которые контролируют
подневольные ритмы. Нарушение
Подневольные
ритмы
Рис. 6.2. Компоненты циркадной системы (по: Barak et
al., 2000)
ритмичности центрального осцил-
лятора приводит к исчезновению
большинства эндогенных ритмов.
Считается, что у растений имеются также автоколебательные процессы, не вхо-
дящие в иерархию биоритмов, синхронизация которых с другими ритмически-
ми процессами достигается только посредством ритмических изменений внешней
среды.
Концептуальная модель циркадной системы выглядит следующим образом (см.
рис. 6.2). В центре всех осцилляций лежит центральный осциллятор (или комплекс
осцилляторов), который генерирует и поддерживает околосуточный ритм, а так-
же вызывает целый спектр подневольных эндогенных ритмов. Центральный осцил-
лятор настраивается по фазе и периоду внешним ритмом смены дня и ночи. Эта
настройка происходит с участием фоторецепторов: фитохромов и криптохромов.
У животных многолетние попытки найти центральный осциллятор и понять ме-
ханизм его работы в последние десятилетия увенчались успехом. Было обнаружено,
что у млекопитающих циркадный ритм генерируется в супрахиазменных ядрах ги-
поталамуса, у птиц — в эпифизе, а у насекомых - в боковых нейронах, расположен-
ных между центральным мозгом и зрительными долями. Генерация ритма происхо-
дит посредством синтеза белков, которые ингибируют экспрессию генов, кодирую-
щих эти белки. Таким образом, в основе биоритма лежит отрицательная обратная
связь, причем связь замедленная, что обеспечивается пространственной разобщен-
ностью транскрипции и трансляции: транскрипты генов должны транспортировать-
ся в цитоплазму, а транслированные с них белки должны вернуться в ядро, чтобы
повлиять на экспрессию генов. Участвующие в генерации циркадного ритма белки
неустойчивы, и время их жизни регулируется фосфорилированием. Стабильность
ритма, в согласии с теоретической хронобиологией, обеспечивается несколькими вза-
имозависимыми отрицательными и положительными обратными связями.
У дрозофилы центральный циркадный осциллятор устроен следующим образом
(рис. 6.3). Приблизительно в полдень активируется транскрипция генов PER и TIM
71
Рис. 6.3. Модель центрального циркадного осциллято-
ра дрозофилы (по: Young, 2000)
Рис. 6.^. Модель центрального циркадного
осциллятора нейроспоры (по: Barak et al., 2000)
фактором транскрипции, представ-
ленным белковым димером dclock/
cycle. Белок PER накапливается
очень медленно, так как в мономер-
ной форме быстро фосфорилиру-
ется и подвергается распаду в ци-
топлазме. Светолабильный белок
TIM накапливается только после
захода солнца. Димеризация PER
и TIM приводит к стабилизации
PER. Около полуночи комплекс
PER/TIM входит в ядро. В яд-
ре комплекс диссоциирует. Белок
PER, освобождаясь из комплекса с
TIM и действуя как ингибитор ак-
тивности димера dclock/cycle, по-
давляет экспрессию генов PER и
TIM. Одновременно он увеличи-
вает экспрессию гена dclock, так
как комплекс dclock/cycle выпол-
няет роль негативного регулятора
экспрессии гена dclock, a PER сни-
мает эту репрессию. В силу неста-
бильности мономерного PER его
действие постепенно заканчивает-
ся, и экспрессия генов PER и TIM
снова возрастает. Аналогичным об-
разом устроен циркадный осцилля-
тор млекопитающих и птиц.
Принципиальное сходство с автоколебателем дрозофилы имеет и хорошо изучен-
ный циркадный осциллятор плесневого гриба нейроспоры (рис. 6.4). Исследование
мутанта frq (frequency) с укороченным до 15-16 ч циркадным ритмом спорообразова-
ния привело к обнаружению гена FRQ, экспрессирующегося в циркадном ритме. В
дальнейшем была изучена петля негативной обратной связи, которая обеспечивает
эту ритмичность. Белки WC-1 и WC-2 образуют димер, который транспортируется
в ядро и выполняет роль фактора транскрипции гена FRQ. Транскрипт гена FRQ
транспортируется в цитоплазму, где в результате его трансляции образуется белок
FRQ. Этот белок транспортируется в ядро, подавляет активность фактора тран-
скрипции WC-1/WC-2 и тем самым репрессирует экспрессию гена FRQ. Кроме того
белок FRQ в цитоплазме ускоряет трансляцию мРНК WC-1. Схема усложнена так-
же тем, что белок FRQ фосфорилируется, что приводит к его быстрой деградации.
Если мутация затрагивает процесс фосфорилирования этого белка, то скорость его
распада замедляется, а циркадный ритм экспрессии гена FRQ удлиняется до 30 ч.
Поиски центрального генетического осциллятора у растений ведутся давно и в
последние годы благодаря применению новых методов стали более продуктивны-
ми. Недавно с использованием микрочипов ДНК было обнаружено, что примерно
6% генов Arabidopsis thaliana имеют при постоянном освещении циркадный ритм
экспрессии. Рассмотрим наиболее яркие примеры этой ритмичности (рис. 6.5).
72
Гены СС4 / и LH}\ ассоциированные
с циркадным осциллятором
Закат
Гены свстособирающих
антенн {САВ),
биосинтеза хлорофилла,
фиксации углекислоты,
фотодыхания
Гены сахарозного
метаболизма и
транспорта сахаров
Гены роста растяжением
клеток, кодирующие
ферменты биосинтеза ауксина,
переносчики ауксина,
экспансины. аквапорины
Рис. 6.5. Циркадные ритмы экспрессии генов у Arabidopsis thaliana (no: Staiger, 2002)
Утром максимально экспрессированы многие гены, кодирующие белки, которые
участвуют в фотосинтезе. Среди них наиболее четкий ритм с большой амплитудой
имеют гены белков светособирающих антенн (LHC, или САВ). Полагают, что ритм
синтеза этих белков — один из важнейших циркадных ритмов растений, так как их
жизнь целиком зависит от энергии света. Апобелки САВ функционируют только
вместе с хлорофиллом и в его отсутствие быстро распадаются, поэтому их синтез
в естественных условиях поддерживается синтезом хлорофилла. Циркадный ритм
экспрессии генов, участвующих в биосинтезе хлорофилла, совпадает по фазе с рит-
мом экспрессии генов САВ. На рассвете также возрастает количество транскриптов
генов, кодирующих РУБИСКО и активазу РУБИСКО, необходимые для фотосин-
тетической фиксации СО2. Кроме того, на рассвете наблюдается пик экспрессии
генов, кодирующих ферменты фотодыхания, а также генов каталазы, участвующей
в детоксикации образующегося в процессе фотодыхания Н2О2. По своей амплитуде
циркадный ритм экспрессии генов каталазы такой же мощный, как ритм экспрессии
генов САВ.
Во второй половине дня. накапливаются транскрипты, с которых транслируются
белки, вовлеченные в метаболизм, запасание и транспорт фотоассимилятов. К ним
относятся, например, гексозные транспортеры, переносящие сахара через клеточные
мембраны.
ВечерохМ экспрессируются гены, обеспечивающие рост растений, который, как из-
вестно, в основном происходит ночью. Это гены, кодирующие ферменты биосинтеза
ауксина, поэтому количество ауксина в листьях А. thaliana изменяется в циркадном
ритме и достигает максимума в начале ночи. В это же время наблюдается макси-
мальное количество белков PIN (pin-formed), обеспечивающих полярный транспорт
ауксина. Ауксин регулирует растяжение клеток растений, основанное на осмотиче-
ском поступлении в них воды. Вода входит в клетки через образованные аквапо-
ринами каналы в мембранах. Экспрессия генов аквапоринов имеет пик в вечерние
часы. Для необратимого растяжения клеточных стенок под напором гидростатиче-
ского тургорного давления нужны экспансины белки, размягчающие клеточные
73
стенки. Транскрипты экспансиновых генов также накапливаются в циркадном рит-
ме с максимумом в вечерние часы.
В середине ночи возрастает содержание транскриптов генов, обеспечивающих
образование нового материала клеточных стенок. Ближе к рассвету наблюдается
пик экспрессии генов, которые кодируют белки, участвующие в биосинтезе протек-
торов от ультрафиолетового (УФ) излучения. Это прежде всего гены ферментов
фенилпропаноидного пути биосинтеза фенольных соединений.
Значительная часть описанных выше эндогенных ритмов экспрессии генов, без-
условно, относится к категории подневольных ритмов. Для того чтобы определить
генетические компоненты центрального осциллятора, исследователи искали мута-
ции, затрагивающие большое количество ритмов экспрессии генов. Для поиска та-
ких мутаций были использованы трансгенные растения арабидопсиса с генетической
конструкцией саЬ2::1ис, построенной из промотора гена С АВ, который экспрессиру-
ется в четком циркадном ритме с максимумом в часы рассвета, и ген а-репортера
люциферазы (LUC) из жгутиковой водоросли Gonyaulax polyedra. Такие трансген-
ные растения в присутствии люциферина (субстрата люциферазы) обнаруживали
циркадный ритм желто-зеленого свечения.
После мутагенеза у этих растений легко выявлялись мутанты с нарушенным цир-
кадным ритмом экспрессии люциферазы под контролем С А В-промотора. Вначале
был обнаружен ген ТОС1 (timing of CAB expression), мутация в котором приводила
к укорочению периода циркадного ритма С АВ (от 23,5 до 21 ч). Также укорачи-
вались циркадные ритмы роста гипокотиля, устьичной проводимости и движения
листьев, нарушался фотопериодизм цветения арабидопсиса. Таким образом, было
показано, что ТОС1 контролирует много циркадных ритмов. Кроме того, белок
ТОС1 регулирует периодическую экспрессию гена ТОС1 с максимумом в вечерние
часы.
У арабидопсиса были также обнаружены циркадные гены LHY (late elongated
hypocotyl) и CCA 1 (circadian clock associated), которые кодируют белки, относящи-
еся к МУВ-факторам транскрипции. Данные гены экспрессируются в циркадном
Свет, 660 нм
PhyB
PhyB/PIF3
Рис. 6.6. Механизм автоколебатель-
ной экспрессии циркадных генов
CCAln LHY и ее настройки светом
ритме с максимумом в часы рассвета, причем
синтезирующиеся белки LHY и ССА1 подавля-
ют экспрессию кодирующих их генов (рис. б.б).
Это подавление было обнаружено с использова-
нием трансгенных растений, содержащих две ге-
нетических конструкции. Первая конструкция со-
стояла из структурного гена LHY или ССА /, по-
ставленного под контроль конститутивного про-
мотора 35S CaMV. Вторая конструкция состо-
яла из промотора гена LHY или CCA 1 и ге-
на-репортера /3-глюкуронидазы (GUS) Е. coli. У
таких растений происходило накопление белков
LHY или ССА1 и резко снижался синтез GUS
по сравнению с растениями, содержащими толь-
ко одну GUS-конструкцию. Кроме того, было об-
наружено, что гены LHY и ССА1 связаны перекрестной репрессией транскрип-
ции (рис. б.б). Таким образом, ритм транскрипции этих генов генерируется по-
средством механизма саморепрессии и перекрестной репрессии транскрипции ге-
нов белками, которые они кодируют. Регуляция транскрипции генов LHY и ССА1
74
происходит в соответствии с классической моделью осцилля горной репрессии,
предложенной в 1961 г. Ф. Жакобом и Ж. Моно для объяснения механизма рит-
мической экспрессии генов и ритмического накопления продуктов этих генов.
Постоянная сверхэкспрессия LHY и ССА1 под контролем конститутивного про-
мотора 35S CaMV приводит к исчезновению многих циркадных ритмов арабидопси-
са. Установлено также, что экспрессия генов LHY и ССА1 регулируется продуктом
гена GI (gigantca) и у мутанта gi она резко снижена. Показано, что ССА1 связыва-
ется с промотором С АВ и таким образом регулирует циркадную экспрессию С А В.
Кроме того, известно, что активность ССА1 регулируется фосфорилированием при
участии специфической протеинкиназы СК2. В фосфорилированной форме ССА1
имеет большее сродство к ДНК.
Есть данные о том, каким образом может происходить настройка эндогенно-
го ритма экспрессии CCA1/LHY с помощью внешнего ритма освещенности (см.
рис. 6.6). Фитохром В (Phy В), активированный красным светом, перемещается в
ядро, где соединяется с P1F3 — фактором транскрипции класса bHLH. После этого
происходит присоединение этого димера к промоторам генов CCA 1/LHY и актива-
ция экспрессии этих генов, поэтому транскрипты ССА1 и LHY накапливаются на
рассвете. Обнаружен также ген ELF3, продукт которого необходим для настройки
ритма экспрессии ССА1 и LHY светом по фазе.
Известно, что растения способны определять продолжительность светлого и тем-
ного периода суток. На этой способности основан фотопериодизм прорастания се-
мян и цветения растений. Способность определять продолжительность дня и но-
чи, в свою очередь, основана на эндогенных циркадных ритмах. К этому выводу7
Э. Бюннинг пришел более полувека назад, когда обнаружил, что только те сорта
сои, у которых четко выражен циркадный ритм движения листьев, являются обли-
гатными короткодневными растениями, зацветающими строго в условиях короткого
дня. Цветение сортов со слабо выраженным движением листьев в меньшей степени
зависит от продолжительности дня и ночи. У циркадных мутантов факультативно
длиннодневного арабидопсиса (ccal. Ihy, tocl. elf3) фотопериодизм цветения утра-
чен, то есть это растение становится нейтралыюдневным. При этом цветение может
наступить раньше или позже, чем у растений дикого типа, в соответствии с чем
мутации, нарушающие фотопериодизм цветения, делят на две категории.
Предложено две теоретические модели, объясняющие каким образом организм
может воспринимать длину дня, основываясь на собственном эндогенном циркадном
ритме. Согласно одноосцилляторной модели Э. Бюннинга, в осггове фотопериодиз-
ма лежит эндогенный циркадный ритм клеточной активности, состоящий из двух
полуциклов (рис. 6.7). В течение одного полу цикла организм требует света (фото-
фил ьный полуцикл, или фаза разрядки осциллятора), а в течение другого - тем-
ноты (скотофильный полуцикл, или фаза зарядки осциллятора). Эффект длинного
дня возникает, когда внешний фотопериод заходит в скотофильный полуцикл эгг-
догенного ритма, а эффект короткого дня — когда темновая часть внешнего ритма
освещенности заходит в фотофи л ьный полу цикл.
По двухосцилляторной модели, предложенной В. П. Тыщенко для объяснения
продолжительности диапаузы в развитии насекомых, в фотопериодизме принимают
участие два циркадных осциллятора (рис. 6.8). Первый осциллятор настраивается
по наступлению светлого периода суток, а второй — по наступлению темноты. Вос-
приятие длины дня основано на том, насколько эти осцилляторы сдвинуты но фазе.
Известно, что у животных центральный генетический осциллятор работает в
75
Двенадцатичасовой день
Короткий день
Длинный день
Рис. 6.7. Одноосцилляторная модель восприятия фотопериода
(по: Бюнинг, 1961)
Рис. 6.8. Двухосцилляторная модель восприятия фото-
периода (по: Тыщенко, 1966).
1 первый осциллятор; 2 — второй осциллятор
76
клетках определенных зон мозга. У растений попытки локализовать центральный
осциллятор в каком-либо органе не принесли успеха. Возможно, каждая клетка рас-
тения генерирует циркадный ритм, что позволяет в условиях эксперимента доби-
ваться нарушения синхронности циркадных ритмов. Например, с помощью вспы-
шек яркого света можно независимо настроить ритм движения устьиц различных
листьев одного растения. Синхронизация же эндогенных ритмов различных частей
растения происходит благодаря именно ритмическим изменениям внешней среды.
Наряду с иерархией циркадных ритмов, контролируемых центральным осцил-
лятором, в состав которого у арабидопсиса входят гены ССА1 и LHY, у растений,
как уже отмечалось, могут существовать независимые от центрального осциллятора
циркадные ритмы экспрессии генов. Например, ритм экспрессии гена нитратредук-
тазы имеет сложный механизм самоподдержания, предположительно автономный
от центрального осциллятора.
Нитратредуктаза лимитирует скорость ассимиляции нитратного азота, состоя-
щей из следующей цепи химических превращений: NO3 —* NO2 —> NH3 —* амид-
ный азот глутамина. Фермент активен только на свету, и в основе этого суточного
ритма лежит циркадный ритм, включающий элементы регуляции, приведенные на
рис. 6.9. Настройка ритма светом происходит благодаря активации экспрессии гена
нитратредуктазы при освещении. В результате активности синтезирующегося фер-
мента происходит накопление
глутамина, который подавля-
ет экспрессию гена нитрат-
редуктазы. Это подавление
быстро снижает активность
фермента, так как нитратре-
дуктаза имеет короткое вре-
мя жизни. Кроме того, ско-
рость распада фермента воз-
растает в темноте благода-
ря фосфорилированию, по-
следующему связыванию с
14-3-3 адаптерным белком и
направлению на гидролиз в
НР-(14-3-3)
Рис. 6.9. Нитратный осциллятор у высших растений (по: Lillo
et al., 2001). HP — нитратредуктаза, HP — кодирующий ее ген
протеасому.
Кроме циркадных ритмов у растений, как и у других организмов, существует
большое количество ультрадианных ритмов, с коротким периодом. Скорость многих
биохимических реакций испытывает колебания с периодом от нескольких секунд до
нескольких минут. Эти колебания так же, как и циркадные ритмы, основаны на
существовании петель отрицательной и положительной обратной связи.
Наиболее известный метаболический автоколебатель — гликолитический осцил-
лятор. Принцип его работы детально изучен па примере спиртового брожения у
дрожжей и описан в учебниках по биоритмологии. Основным элементом гликоли-
тического осциллятора является периодичность образования фруктозо-1,6-бис-фос-
фата из фруктозо-6-фосфата:
фруктозо-6-фосфат 4- АТФ —> фруктозо-1,6-бис-фосфат + АДФ.
Это превращение катализирует фосфофруктокиназа — аллостерический фер-
мент, активность которого увеличивается продуктами реакции. Предположим, что
в какой-то момент этих продуктов станет мало. Тогда скорость реакции снизит-
77
ся, что вызовет накопление фруктозо-6-фосфата. Накопление субстрата приведет
к увеличению скорости реакции по закону действия масс. В результате возрастет
содержание продуктов реакции, что посредством аллостерической положительной
обратной связи приведет к дальнейшему увеличению скорости реакции, а это, в
свою очередь, вызовет снижение концентрации субстрата и постепенное замедление
процесса.
К числу хорошо изученных ультрадианных осцилляций относятся колебания
мембранного потенциала и концентрации ионизированного кальция в цитозоле, ос-
нованные на петлях отрицательной и положительной обратной связи, регулирую-
щих активность ионных каналов и насосов мембран. Так, кальциевые осцилляции,
возникающие под действием АБК в замыкающих клетках устьиц, обусловлены со-
гласованной работой Н+/Са2-,"-антипортеров, кальциевых каналов, кальциевых и
протонных помп.
Часть 2
ФИТОГОРМОНЫ
Растительные организмы состоят из большого числа различных клеток, тканей
и органов и поэтому им необходима система, которая обеспечивала бы координацию
функционирования их отдельных частей, а также регулирование на уровне цело-
го растения. Взаимодействие между отдельными клетками в растении может осу-
ществляться с помощью гидравлических сил, электрических сигналов и химических
веществ, выполняющих функции гормонов.
Впервые идея о гормональной (химической) регуляции ростовых процессов в рас-
тениях была высказана Ч. Дарвином в 1880 г. на основе анализа ростовых движений
(тропизмов) в его книге «Способность к движению у растений» («The Power of Move-
ments in Plants»). В дальнейшем учение о гормональной регуляции роста и морфоге-
неза растений получило развитие в трудах выдающихся отечественных и зарубеж-
ных физиологов: Д. Н. Нелюбова, Н. Г. Холодного, Ф.Вента, Ф. Кегля, К.Тиманна,
Ф. Скуга, М. X. Чайлахяна, О. Н. Кулаевой. В. В. Полевого, Г. С. Муромцева и ряда
других исследователей.
Было установлено, что с помощью фитогормонов в растении осуществляется
координация взаимодействия клеток, тканей и органов, регуляция функций и обес-
печение целостности организма, запуск физиологических и морфогенетических про-
грамм. Фитогормонам принадлежит важная роль в ответных реакциях растения на
разные внешние воздействия.
Становление гормональной системы регуляции можно представить следующим
образом. Вначале вещества—предшественники гормонов - появлялись как побоч-
ные продукты метаболизма, образующиеся в малых количествах, но обладающие
сильным физиологическим действием. Благодаря особым свойствам их молекул,
обусловленным их строением, эти «протогормоны» стали оказывать значительное
влияние на жизнедеятельность растения, организуя взаимодействие клеток и участ-
вуя в адаптации к изменениям внешней среды. Дальнейшая эволюция шла по пути
отбора наиболее активных аналогов из данного класса соединений посредством со-
вершенствования систем их синтеза, транспорта и инактивации. Параллельно эво-
люционировала также способность клеток реагировать на конкретные гормоны, то
есть система их рецепции и передачи сигнала на исполнительные механизмы.
В настоящее время классическими фитогормонами признаются: ауксин, цито-
кинины, гиббереллины, абсцизовая кислота и этилен. Многие исследователи отно-
сят к фитогормонам брассиностероиды, жасмонаты, салициловую кислоту, а также
ряд пептидов. Необходимо подчеркнуть, что очень редко фитогормоны функцио-
нируют независимо друг от друга. Даже если клетки обработать одним фитогор-
моном, наблюдаемый эффект будет определяться не только им. но и зависеть от
его взаимодействия с другими эндогенными фитогормонами. Взаимодействие фи-
79
тогормонов в организме растения может осуществляться как в процессе их синтеза,
транспорта и катаболизма, так и на уровне механизма их действия, тем более что
некоторые элементы рецепции и передачи сигнала для ряда фитогормонов могут
быть общими.
Глава 7
КОНЦЕПЦИЯ ФИТОГОРМОНОВ
Термин «гормон» происходит от греческого слова «Ьогшаб», что означает «по-
буждаю к действию». Этот термин был предложен в 1905 г. английским физиологом
Э. Старлингом для обозначения вещества, в дальнейшем оказавшегося полипепти-
дом секретином, которое при пищеварении вырабатывается слизистой оболочкой
тонких кишок, транспортируется по крови к поджелудочной железе и усиливает ее
внешнесекреторную функцию. Спустя всего четыре года, в 1909 г., термин «гор-
мон» был применен немецким ботаником Г. Фиттингом к содержащемуся в пыльце
орхидных химическому регулятору (ауксину, как выяснилось впоследствии), бла-
годаря которому даже при обработке рыльца пестика прокипяченным экстрактом
пыльцы происходит разрастание завязи.
Концепция фитогормона первоначально была сформулирована по аналогии с
концепцией гормонов млекопитающих и включала три фундаментальных элемен-
та: 1) синтез гормона в одном органе, 2) транспорт гормона по сосудистой системе,
3) действие гормона на другой орган. Очевидно, что эта схема эффективна только
в том случае, если реакция на гормон определяется его концентрацией.
В течение многих десятилетий исследования были сконцентрированы на поиске
химического сигнала, транспортируемого из апексов побегов и корней в зону рас-
тяжения, где он вызывает фото- и гравитропические ростовые изгибы. Результаты
этих работ вполне отвечали концепции «классического гормона». Однако в даль-
нейшем обнаружилось, что фитогормоны не имеют определенного места синтеза. К
тому же, каждый фитогормон может регулировать множество морфогенетических
и физиологических процессов, то есть фитогормоны не имеют и строго определен-
ного локуса действия. Кроме того, они способны проявлять активность там, где
они синтезируются, и реакция на гормон довольно часто определяется изменением
чувствительности клеток к гормону, а не изменением его концентрации.
Параллельно складывалось представление о морфогенетической роли фитогор-
монов. Идея о существовании у растений органообразующих веществ была высказа-
на в 19 в. Юлиусом Саксом и развита в начале 20 в. Фрицем Вентом. По Ф. Венту,
морфогенетические явления вызываются определенным балансом специфических
веществ-регуляторов (фитогормонов, как можно уточнить теперь). Одним из немно-
гочисленных, хотя и очень ярких, подтверждений этой гипотезы является процесс
закладки апексов побегов или корней в культуре каллуса, зависящий от соотноше-
ния ауксина и цитокинина. В большинстве же случаев так и не удалось соотнести
баланс фитогормонов с тем или иным этапом развития. Один и тот же морфогене-
тический эффект зачастую может быть достигнут при разном соотношении количе-
ства тех или иных фитогормонов. Гораздо менее уязвимо для критики современное
представление о том, что характер клеточной дифференцировки определяется кон-
центрационными градиентами и продолжительностью поступления гормонального
сигнала, а не просто балансом фитогормонов в тканях.
80
За многолетнюю историю изучения фитогормонов было дано немало обобщаю-
щих определений этих веществ. Многие из них фактически были вариациями опре-
деления, предложенного К. Тиманном в 1948 г.: «Фитогормон — это органическое ве-
щество, в микроколичествах контролирующее рост и другие физиологические функ-
ции в местах, удаленных от места его синтеза». Сходное определение было дано в
1982 г. В. В. Полевым: «Фитогормоны —это органические эндогенные соединения, с
помощью которых осуществляется взаимодействие клеток, тканей и органов и ко-
торые в малых количествах необходимы для запуска и регуляции физиологических
программ». Более полное определение было предложено Д. А. Сабининым (1963):
«Во-первых, вещества этого рода должны обладать способностью в небольших ко-
личествах вызывать прохождение не только отдельных химических процессов, как
это имеет место при действии ферментов, а и физиологических процессов, протека-
ющих на основе целой цепи физических и химических изменений. Во-вторых, фи-
тогормоны должны образовываться в растительном организме, будучи продуктом
обмена веществ организма. В-третьих, они должны действовать и в иных частях
организма, чем те, где они вырабатываются».
Следует отметить, что долгое время стратегия исследований фитогормонов опре-
делялась известной «формулой» Ф.Вента— «без ростовых веществ нет роста», по-
скольку физиологическая роль фитогормонов в растениях ранее часто сводилась
исследователями только к регулированию процессов роста и морфогенеза. Поэто-
му фитогормоны стали называть ростовыми гормонами, регуляторами роста или
ростовыми веществами. Однако по мере изучения различных аспектов действия
фитогормонов постепенно выявилось, что их функции не ограничиваются только
регуляцией роста. Стало очевидным, что они являются мощным инструментом, с
помощью которого происходит управление практически всем метаболизмом расте-
ния в онтогенезе. Фитогормоны принимают участие в процессах формирования по-
ла, старения и перехода к стадии покоя, в транспорте веществ, в передаче сигналов
об изменении параметров внешней среды и адаптации к стрессовым воздействиям,
в регуляции процессов синтеза органических соединений и их распада.
В 1980 -1990-е гг. благодаря новым знаниям о механизмах морфогенеза растений,
о метаболизме и функциях фитогормонов представление об этих веществах утрати-
ло свою чарующую простоту. Назревшая необходимость смены парадигмы получи-
ла отражение в том определении, которое в 1987 г. дал фитогормонам А. Леопольд:
«Гормоны растений —это то, что физиологи называют гормонами».
Благодаря достижениям молекулярной биологии в настоящее время хорошо из-
вестно, что развитие растений, как и животных, происходит согласно генетиче-
ским программам координированной экспрессии генов, которыми управляют гены-
регуляторы развития. Эти гены кодируют факторы транскрипции, способные дири-
жировать целым «оркестром генов». Однако механизмы морфогенеза растений все-
таки существенно отличаются от механизмов морфогенеза животных. У растений
судьба каждой клетки не детерминирована так жестко, как у животных. Иными
словами, развитие растений является пластическим, а не канализированным, как
у животных. Для развивающейся клетки растений открыто несколько альтернатив.
Какая из них избирается, зависит от условий внешней и внутренней среды. Эти усло-
вия могут влиять на экспрессию самих генов-регуляторов развития, а также на экс-
прессию многих генов из «оркестра», контролируемого каждым геном регулятором
развития.
Высокая степень зависимости экспрессии генов растений от факторов внешней
81
и внутренней среды объясняет необыкновенную пластичность, значительное разно-
образие формы и размеров растений, которое может быть достигнуто при одном
и том же генотипе. Среди внешних факторов развития важнейшими для растений
являются свет, гравитация, температура и влажность, а среди внутренних много-
численные химические и физические сигналы, которые клетки генерируют и кото-
рыми они обмениваются. Фитогормоны можно рассматривать как интегральные
химические сигналы, отражающие состояние внутренней среды растительного
организма, регулирующие рост и развитие растений.
7.1. Методология изучения функций фитогормонов
Наиболее простой и издавна используемый прием состоит в обработке растений
фитогормонами. Это так называемый метод «spray and pray». Фактически впервые
он был использован задолго до открытия фитогормонов Д. Н. Нелюбовым, описав-
шим действие содержавшегося в светильном газе этилена на развитие проростка
гороха. Применение этого метода, в частности, позволило установить роль гиббе-
реллинов и абсцизовой кислоты в физиологическом покое семян, роль этилена в
созревании плодов. Опрыскивание растений фитогормонами и их аналогами прочно
вошло в практику сельского хозяйства. Однако, применяя этот метод в фундамен-
тальных исследованиях, следует учитывать, что растения сами синтезируют необ-
ходимые им фитогормоны в количестве, оптимальном для нормального развития.
Поэтому экзогенная обработка может оказаться сверхоптимальной и иметь отравля-
ющее влияние на растение, что хорошо известно на примере гербицидного действия
ауксина или эффекта «цитокининовых корней».
Другой традиционный прием состоит в изучении последствий удаления органа
или части органа, служащего источником фитогормона. Законность данного подхо-
да обоснована тем, что ткани растений сильно отличаются по способности синте-
зировать фитогормоны. Применяя данный прием, следует учитывать, что удаление
органа всегда вызывает раневую реакцию. Кроме того, было бы слишком упрощен-
ным рассматривать органы растений только как источники фитогормонов. Вызваны
ли изменения в развитии растения после удаления органа теми фитогормонами, ко-
торые в этом органе синтезировались, можно проверить, заменив удаленный орган
мазком ланолиновой пасты или агаровым кубиком с фитогормонами. Подобные экс-
перименты привели к открытию ауксина. Изучение физиологических эффектов фи-
тогормонов на отрезках растений представляет собой модификацию данного метода.
Например, в течение многих десятилетий исследования механизма ИУК-зависимого
растяжения клеток проводили на субапикальных отрезках колеоптилей злаков. Так
как рост колеоптилей зависит от поступающего из верхушки ауксина, субапикаль-
ные отрезки практически не удлиняются, пока в среду их инкубации не добавлена
ИУК.
С развитием методов количественного анализа фитогормонов появилась возмож-
ность определять изменение их концентрации в отдельных частях растения в ходе
его роста и дифференцировки. Данный метод позволил установить некоторые вза-
имосвязи количества и соотношения разных фитогормонов с процессами развития.
Так, например, было показано, что созревание многих плодов сопровождается мно-
гократным (в 100-1000 раз) усилением биосинтеза этилена, что при пробуждении
пазушных почек в них возрастает количество ауксина и цитокинина, что переход
семян в состояние покоя связан с накоплением в них абсцизовой кислоты.
82
Продуктивность данного подхода снижена гем, что не все присутствующее в тка-
ни количество фитогормопа проявляет биологическую активность. Гормон и его ре-
цептор могут быть пространственно разобщены на уровне ткани и на уровне клетки.
Поэтому концентрация фитогормона в активном сайте может резко отличаться от
его средней концентрации в клетке или в органе. Использование методов генной ин-
женерии позволяет определить транскрипционно активную концентрацию гормона.
Например, если в растения ввести химерный ген-репортер, в котором структурный
ген фермента /3-глюкуронидазы Е. coli поставлен под контроль ауксин-чувствитель-
ного промотора генов SA UR, то при достижении транскрипционно активного уровня
ауксина в клетках будет накапливаться /3-глюкуронидаза, легко идентифицируемая
с помощью цветной гистохимической реакции.
Функции фитогорхмонов можно изучать, используя ингибиторы их синтеза,
транспорта и действия. Так, биосинтез этилена можно подавить аминоэтоксивинил-
глицином (на стадии образования аминоциклопропанкарбоновой кислоты) и солями
кобальта (на стадии окисления аминоциклопропанкарбоновой кислоты), а его био-
логическую активность — солями серебра. Синтез жасмоновой кислоты из липидно-
го предшественника ингибируется салицил гидроксамовой кислотой (на стадии ли-
поксигеназной реакции) и аспирином (на стадии аллен-оксид-циклазной реакции).
Многие ретарданты подавляют биосинтез гиббереллинов, например широко исполь-
зуемый в сельском хозяйстве хлорхолинхлорид, ингибирующий реакцию циклиза-
ции геранилгеранилдифосфата в копалилдифосфат. Для изучения функций ауксина
часто применяются ингибиторы его полярного транспорта: трийодбензойная и наф-
тил фталамовая кислоты.
Большой прогресс в понимании роли фитогормонов в процессах развития был
достигнут благодаря получению и изучению мутантов по биосинтезу фитогормонов
и по чувствительности к ним. Мутанты, синтезирующие мало какого-либо гормо-
на (underproduction mutants), в терминах генетики микроорганизмов называются
гормональными ауксотрофами. Они, в отличие от прототрофов, для нормального
развития нуждаются в добавках фитогормона извне. Для скрининга мутантов с по-
ниженной чувствительностью к фитогормопам (insensitive mutants) используется их
устойчивость к высоким концентрациям экзогенного фитогормона, токсичным для
растений дикого типа. В отличие от мутантов по биосинтезу фитогормонов мутанты
по чувствительности к ним не могут быть «вылечены» добавлением фитогормона
извне. Обнаружены также мутанты, у которых постоянно активированы компонен-
ты пути трансдукции гормонального сигнала (constant response mutants). Они вы-
глядят так, словно в их тканях очень высокая концентрация фитогормопа, хотя на
самом деле она нормальная. Также известны мутанты, синтезирующие избыточное
количество фитогормонов (overproduction mutants).
Для изучения роли фитогормонов широко используются трансгенные растения с
измененным гормональным статусом. Например, генетическая трансформация рас-
тений с помощью Т-ДНК из Ti-плазмиды (рТг) Agrobacterium tum.efaci.ens, содер-
жащей гены ферментов биосинтеза ауксина и цитокинина, приведет к накоплению
этих фитогормонов в клетках.
Вектор трансформации Т-ДНК pTi A. tumefaciens можно использовать для того,
чтобы переносить в геном растения также гены, которых нет в плазмиде агробак-
терии. Например, если растения трансформировать геном псевдомонады, кодирую-
щим дезаминазу аминоциклопропанкарбоновой кислоты, то это приведет к сниже-
нию биосинтеза этилена на 90-97%. Трансформация растений геном псевдомонады,
83
кодирующим синтетазу конъюгата ИУК с лизином, приводит к снижению содержа-
ния ИУК в десятки раз в результате образования негидролизуемого индол-3-ацетил-
лизина.
Увеличения биосинтеза фитогормонов можно достигнуть, поставив гены, ко-
дирующие соответствующие ферменты, под контроль конститутивного промотора
35S РНК из вируса мозаики цветной капусты (35S CaMV). Например, ген син-
тазы аминоциклопропанкарбоновой кислоты под контролем 35S CaMV экспрес-
сируется в растениях постоянно, и это приводит к увеличению синтеза этилена
в сотни раз.
Широкие возможности для изучения функций фитогормонов дает использова-
ние антисмысловых генов, с помощью которых можно избирательно подавлять экс-
прессию генов. С антисмысловых генов транскрибируется антисмысловая мРНК,
комплементарная нормальной «смысловой» мРНК соответствующего гена. Взаимо-
действие этих мРНК приводит к умолканию гена.
7.2. Критерии гормональной регуляции
Впервые систему критериев, которым должна отвечать гормональная регуляция
развития и функционирования растений, предложил в 1959 г. У. Джекобс. Она по-
лучила известность под названием правил ПЕСИГС (PESIGS, Parallelism-Excision-
Substitution-Isolation-Generality-Specificity). Согласно этим правилам, для обоснова-
ния, например, тезиса «ауксин регулирует рост клеток растяжением» требуется до-
казать следующее:
1) скорость растяжения клеток в растениях зависит от концентрации ИУК;
2) удаление источника ауксина (например верхушки колеоптиля) приводит к тор-
можению растяжения клеток;
3) замена удаленной верхушки содержащим ауксин кубиком агар-агара восста-
навливает скорость растяжения клеток;
4) ауксин влияет на растяжение не только клеток в какой-то части целого рас-
тения, но и клеток изолированных кусочков ткани и даже отдельных клеток в сус-
пензионных культурах;
5) ауксин вызывает растяжение клеток не только колеоптилей овса, например,
но и колеоптилей других злаков, а также междоузлий многих растений;
6) действие ауксина специфично, то есть процесс растяжения клеток проявляет
высокую и избирательную чувствительность к ауксину.
В 1987 г. М. Джексон с учетом накопившихся знаний следующим образом модер-
низировал предложенную У. Джекобсом систему критериев.
1. Критерий корреляции требует, чтобы наблюдался параллелизм между измене-
ниями концентрации фитогормона и изменениями интенсивности предположитель-
но контролируемого фитогормоном процесса. При построении кривых доза-ответ,
используемых в биотестах на фитогормоны, линейная зависимость достигается толь-
ко в полулогарифмической шкале. Например, удлинение отрезков мезокотилей и ко-
леоптилей злаков приблизительно пропорционально логарифму концентрации ИУК
в среде в диапазоне от 10-8 до 10-6 моль/л (рис. 7.1).
Таким образом, в соответствии с характером зависимости доза-ответ существен-
ных изменений интенсивности ответа можно ожидать только при изменении кон-
центрации гормона в десять и более раз. Однако столь значительные изменения
эндогенной концентрации гормонов наблюдаются редко. Например, концентрация
84
ИУК в верхней части быстро растущего в темноте мезокотиля кукурузы составляет
приблизительно 10-7 моль/л. При освещении проростка красным светом мезокотиль
через 3 ч практически перестает удлиняться, хотя концентрация ауксина снижается
только вдвое, что согласно полученной с ис-
пользованием экзогенной ИУК кривой доза-
ответ (рис. 7.1) должно уменьшить скорость
роста только на 30-40%.
Резкие изменения концентрации гормо-
нов в растениях зарегистрированы лишь в
немногих случаях. Так, в условиях почвен-
ной засухи содержание АБК в ксилемном со-
ке за 4-8 ч возрастает в 10-50 раз, а после
полива растений оно так же быстро возвра-
щается к норме. Синтез этилена может в те-
чение нескольких часов усиливаться в десят-
ки и сотни раз, как это происходит в клет-
ИУК, моль/л
Рис. 7.1. Зависимость удлинения отрезков
мезокотилей этиолированных проростков
кукурузы от концентрации ИУК в среде
инкубации (по: Briggs, 1967)
ках раневого среза, в созревающих плодах
при климактерическом подъеме дыхания, а
также в растениях, обработанных высокими
концентрациями ауксинов.
Отсутствие во многих случаях ожидае-
мой пропорциональности между количеством фитогормона и интенсивностью кон-
тролируемого им процесса может быть связано с несовершенством методов анализа
фитогормонов. Современные методы позволяют определять содержание фитогор-
монов в нескольких миллиграммах растительного материала, включающих тысячи
клеток. Между тем, не только разные клетки, но и разные компартменты одной
клетки могут существенно различаться по концентрации фитогормонов (например
значительные количества ИУК и АБК находятся в хлоропластах).
Корреляция между концентрацией эндогенного гормона и интенсивностью кон-
тролируемого им процесса может также не регистрироваться из-за того, что многие
широко используемые методы анализа фитогормонов не позволяют оценить содер-
жание отдельных веществ, но только суммарное содержание группы родственных
соединений. Классическим примером подобной ошибки является отсутствие корре-
ляции между количеством определяемых с помощью биопроб гиббереллинов и дли-
ной междоузлий у гороха с различными аллелями гена LENGTH. Этот ген кодирует
3/3-гидроксилазу, катализирующую превращение неактивного гиббереллина ГА20 в
активный ГА1. У растений с аллелями 1е-1 и 1е-2 активность фермента снижена,
поэтому они содержат много ГА20 и мало ГАр Однако биопробы на гиббереллины
обычно не различают ГА20 иГА1, так как используемые для биопроб растения легко
превращают ГА20 в ГАр Посредством хроматографического разделения и иденти-
фикации ГА1 удается продемонстрировать линейную зависимость между длиной
междоузлий гороха с разными аллелями гена LENGTH и логарифмом концентра-
ции ГА1 (рис. 7.2).
2. Критерий воспроизведения означает, что посредством экспериментального
увеличения эндогенной концентрации гормона до уровня, наблюдаемого перед нача-
лом определенной физиологической реакции, эта реакция должна воспроизводится,
если она действительно контролируется данным гормоном.
85
Эндо1енный ГА|, нг/растение
Рис. 7.2. Зависимость длины междоузлий пророст-
ков гороха от содержания ГЛ1, полученная с ис-
пользованием растений с различными аллелями
гена LENGTH: Le, le-1, le-2 (no: Ross et al., 1989)
3. Критерий лишения восстановле-
ния M. Джексона соответствует крите-
риям удаления и замены У. Джекобса
с тем лишь различием, что в эти
действия вкладывается более широкий
смысл. Лишать растение гормона мож-
но не только физически, например, по-
средством декапитации проростка или
удаления корневого чехлика. но и гене-
тически, получая гормон-дефицитные
мутанты и трансгенные растения.
4. Для удовлетворения критерию
химической специфичности физиоло-
гическая реакция должна проявлять
избирательную и высокую чувстви-
тельность к фитогормону.
5. Критерий связи с более высоки-
ми уровнями организации требует до-
казать, что гормональная реакция на-
блюдается не только в лабораторных,
но и в природных условиях, в биоценозах. Так, в 1901 г. Д. Н. Нелюбов в ходе ла-
бораторных экспериментов показал, что содержавшийся в светильном газе этилен
влияет на развитие растений гороха. Но вырабатывают ли растения, выращиваемые
в поле, этилен, причем в таком количестве, чтобы он мог повлиять на характер их
развития? Подобный вопрос встает при изучении гормональных эффектов на кор-
нях, поскольку такие исследования почти всегда проводятся в гидропонной куль-
туре. Ведь корни, растущие в почве, не похожи на корни, растущие в питательном
растворе, и могут реагировать на гормоны иначе.
6. Для удовлетворения критерию связи с более низкими уровнями организации
необходимо понять молекулярный механизм действия гормона.
7. Критерий универсальности гормональной реакции требует, чтобы эта реакция
наблюдалась у растений различных видов. Например, если бы ауксин стимулировал
удлинение колеоптилей только овса, но не других злаков, то это могло бы указывать
на связь наблюдаемого эффекта с какими-то особенностями вторичного метаболиз-
ма. Данный критерий, конечно, не абсолютен. Так. если системин обнаруживается
только у растений семейства пасленовых, то это не означает, что он не может счи-
таться фитогормоном. По существу, данный критерий указывает па необходимость
проследить эволюционное становление гормональной реакции.
Рассмотренные выше системы критериев гормонального действия, хотя и вклю-
чают требование высокой чувствительности исследуемого процесса к фитогормопу,
все-таки больше апеллируют к доказательству различными способами взаимосвязи
между количеством гормона и интенсивностью предположительно контролируемо-
го им процесса. Между тем реакция на гормон может регулироваться изменением
не только концентрации гормона, но и чувствительности к нему. Эго представление
возникло фактически одновременно с открытием фитогормонов, когда К. Тиманн,
изучая явление апикального доминирования, проанализировав действие ауксина на
различные органы растений и показал, что у них сильно различаются кривые кон-
центрационной зависимости ростовой реакции (рис. 7.3).
86
Рис. 7.3. Зависимость роста различных ор-
ганов растений от концентрации ИУК (по:
Thimann, 1948):
а корень, б - почка, в - стебель; ( + )
ускорение роста, ( - ) — угнетение роста
Теория гормонального контроля тропиз-
мов Холодного-Вента также опирается на
представление о различной чувствительно-
сти органов растений к ауксину. Если осевой
орган ориентирован горизонтально, то в его
нижней части скапливается ауксин, но у по-
бегов это приводит к ускорению роста ниж-
ней стороны, а у корней — к торможению.
Чувствительность клеток к гормону мо-
жет изменяться в онтогенезе растения. На-
пример, известно, что в ответ на ауксин
происходит стимуляция мембранной Н+-
АТФазы, что приводит к гиперполяризации
плазмалеммы. У листьев вегетирующих и
цветущих растений табака оптимальная кон-
центрация ауксина в этой реакции составля-
ет 10 мкмоль/л, но во время индукции цвете-
ния чувствительность к ауксину возрастает,
и максимальная гиперполяризация наблю-
дается уже при концентрации 10 нмоль/л.
Изменение чувствительности к гормону может происходить довольно быстро.
Рис. 7.4. Кривые доза-ответ, иллюстрирующие возможность увеличения интенсив-
ности ответа (R) в результате увеличения концентрации фитогормона (а),
чувствительности к фитогормону (б), а также одновременного увеличения
концентрации фитогормона и чувствительности к нему (в) (по: Weyers et
al., 1995)
87
Так, у субапикальных отрезков колеоптилей кукурузы в течение первых 3 -4 ч по-
сле нарезания чувствительность к ауксину существенно возрастает, после чего она
начинает снижаться. Через 16-20 ч отрезки очень слабо реагируют усилением роста
на добавление ауксина.
Есть также яркие примеры изменения чувствительности к этилену. Бутоны цвет-
ков и растущие плоды не реагируют на этилен, тогда как раскрывшиеся цветки отве-
чают на этилен быстрым завяданием, а достигшие окончательного размера плоды —
быстрым созреванием.
Изменение чувствительности клеток к гормону может быть вызвано:
1) изменением количества рецепторов гормона; 2) изменением сродства рецепторов
к гормону; 3) изменением последующей цепи событий. Например, снижение росто-
вой реакции на ауксин при старении колеоптилей кукурузы связано в основном с
потерей клеточными стенками способности растягиваться, а не с изменениями пер-
вичных мембранных реакций на гормон.
Таким образом, гормональная реакция может контролироваться как изменением
концентрации фитогормона, так и изменением чувствительности к нему (рис. 7.4).
Для того чтобы определить, какое место занимает гормональная регуляция в
иерархии факторов, контролирующих тот или иной процесс, Дж. Вейере и Н. Патер-
сон (2001) предложили сравнивать тангенсы максимальных углов наклона кривых
доза-ответ (d7?/d/^[H], где R — величина реакции, [Н| — концентрация фитогормо-
на). Они показывают, в какое максимальное количество раз возрастает величина
реакции при изменении концентрации гормона (или другого фактора) в 10 раз.
7.3. Функции фитогормонов
Роль фитогормонов в регуляции различных морфогенетических и физиологи-
ческих процессов может выражаться по-разному. Дж. Вейере и Н. Патерсон (2001)
выделили 12 функций фитогормонов в растениях.
1. Дистанционная сигнализация. Гормон, транспортируясь от места синтеза к ме-
сту действия, осуществляет функциональную взаимосвязь различных клеток, тка-
ней и органов.
2. Функция разрешающего фактора. Гормон служит стационарным сигналом и
может присутствовать в ткани или органе в постоянной концентрации. При этом
реакция клеток на гормон будет контролироваться посредством изменения чувстви-
тельности к гормону, которое может быть онтогенетическим (происходящим в про-
цессе развития клеток) и метаболическим (вызванным изменением условий). Хоро-
шо известно, что в зоне роста междоузлий торможение роста клеток происходит
значительно быстрее, чем снижается концентрация ауксина. Например, у этиолиро-
ванных проростков кукурузы удлинение клеток в мезокотиле практически прекра-
щается в участке, расположенном ниже узла более чем на 1 см. При этом концентра-
ция ИУК снижается не столь значительно. Она составляет 10“7 моль/л в верхнем
быстро растущем односантиметровом участке и 0,5-10“7 моль/л в расположенном
под ним нерастущем односантиметровом участке. Очевидно, что базипетальное тор-
можение роста клеток мезокотиля связано не столько с изменением концентрации
ауксина, сколько с онтогенетическим снижением чувствительности к нему.
3. Интеграция различных воздействий. Гормон запускает какой-то один физио-
логический процесс, суммируя действие различных стимулов, независимо влияю-
щих на его содержание или на чувствительность к нему. Например, выход семян
88
из состояния физиологического покоя непосредственно зависит от баланса гиббе-
реллинов и абсцизовой кислоты, а также от чувствительности клеток зародыша к
этим гормонам. Изменения температуры, влажности, освещенности, фотопериода
выводят семена из состояния физиологического покоя, влияя на содержание этих
фитогормонов и чувствительность к ним клеток (рис. 7.5, а).
4. Координация различных ответных реакций. Изменение содержания гормона в
ответ на внешний сигнал может вызвать целый спектр реакций, тем самым обеспечи-
вая их участие в одном и том же процессе. Например, повышение содержания АБК
при водном стрессе приводит к закрыванию устьиц, синтезу осмолитов, изменению
ионного транспорта на мембранах клетки, увеличению мембранной гидравлической
проводимости (рис. 7.5,6).
5. Увеличение продолжительности сигнала. Гормональный сигнал может суще-
ствовать намного дольше, чем внешний сигнал, вызвавший изменение содержания
фитогормона. Примером может служить сложная и длительная цепь изменений кон-
центраций гормонов у пасленовых в ответ на погрыз, приводящая к длительному
системному увеличению устойчивости растений к насекомым-вредителям.
а
Рис. 7.5. Примеры действия гормонов в качестве интеграторов раз-
личных воздействий (а) и координаторов различных ответ-
ных реакций (б)
6. Пространственно-временная синхронизация. Гормон должен действовать про-
должительное время и в обширной области, чтобы обеспечить синхронизацию раз-
вития органов одного или даже разных растений. Ярким примером этой гормональ-
ной функции служит одновременное созревание плодов, обусловленное действием
этилена, выделяемого в больших количествах теми отдельными плодами, которые
созрели раньше других. Достигаемая при этом синхронизация созревания плодов
отвечает английской поговорке «one rotten apple in the barrel» (букв, «одно гнилое
яблоко в бочке»).
7. Доминирующий контроль. Эта функция проявляется в реакциях, контролиру-
емых многими факторами. Примером может служить реакция закрывания устьиц.
Устьичная проводимость регулируется светом, СО2 и АБК. В условиях хорошего
водоснабжения устьица в основном настраиваются на оптимальный фотосинтез, од-
нако в условиях водного дефицита возрастает их чувствительность к АБК, и гормон
становится главным контролером устьичной проводимости.
8. Регуляция гомеостаза. Гормон может по механизму обратной связи поддержи-
вать оптимальную скорость процесса. Например, осцилляции скорости растяжения
клеток побегов, очевидно, связаны с волнообразным базипетальным транспортом
ауксина.
89
9. Восприятие окружающей среды. Выделяя гормон, растения могут «прощупы-
вать» среду и адекватно реагировать на ее состояние. Например, пока проросток
гороха находится в почве, вырабатываемый им этилен накапливается вокруг него,
так как скорость диффузии этилена в плотной почве низкая. Как только проро-
сток выходит из почвы, скорость диффузии этилена возрастает, и его концентрация
вокруг проростка снижается. В результате выпрямляется надсемядольное колено.
Зигота фукуса «прощупывает» среду с помощью ауксина. Выделяемый зиготой аук-
син накапливается на стороне, примыкающей к грунту, так как там ниже скорость
его диффузии, и способствует образованию ризоидального выступа.
10. Перераспределение ресурсов растения. Гормональное влияние обычно силь-
нее проявляется в неблагоприятных условиях. В этих условиях гормон включает
наиболее важную для выживания реакцию. Например, ауксин сильнее влияет на
фототропические изгибы этиолированных проростков, чем зеленых растений. Апи-
кальное доминирование, связанное с транспортом ауксина из верхушки побега, силь-
нее проявляется при недостатке освещенности и минерального питания.
11. Передача сигнала между растениями. Эту роль выполняют гормоны, диф-
фундирующие в воздух и в почву, например этилен, метиловые эфиры жасмоновой
и салициловой кислот.
12. Регуляция биологического времени. Гормоны изменяют скорость развития
растений. Они могут остановить развитие и перевести растение в состояние покоя,
могут замедлить или ускорить старение.
Гормон может выполнять одну или несколько перечисленных выше функций.
Например, ауксин способен выполнять функцию дистанционного сигнала, разреша-
ющего фактора, регулятора гомеостаза, сенсора окружающей среды, а также может
перераспределять ресурсы растения.
Глава 8
АУКСИНЫ
История открытия ауксинов восходит к 1880 г., когда Чарльз Дарвин и его сын
Фрэнсис, анализируя фототропическую реакцию проростков канареечника Канар-
ского Phalaris canariensis, показали, что свет воспринимается верхушкой колеопти-
ля, а фототропический изгиб наблюдается в его нижней части. На этом основании
они сделали вывод, что причиной ростового изгиба (при одностороннем освещении)
является «некоторый стимул, который перемещается из верхней части (колеоптиля)
в нижнюю, заставляя ее изгибаться». Только через 50 лет голландскому исследовате-
лю Ф. Венту удалось подтвердить, что верхушки колеоптилей злаков действительно
образуют значительные количества вещества, контролирующего рост нижележащих
зон. В 1935 г. Ф. Кегль идентифицировал это вещество как индол-3-уксусную кисло-
ту (ИУК). Поскольку это вещество стимулировало рост за счет растяжения клеток,
Кегль назвал его ауксином (от греч. auxein — увеличиваться, расти).
8.1. Метаболизм ауксина
Самый распространенный природный ауксин — индол-3-уксусная кислота
(рис. 8.1). Она синтезируется во всех растениях, включая водоросли. У бобовых и
индол-3-уксусная кислота
(ИУК)
индол-3-маслянная кислота 4-хлор-индол-З-уксусная кислота
(ИМК) (4-С1-ИУК)
2,4-дихлорфеноксиуксусная кислота
(2,4-Д)
Рис. 8.1. Природные и синтетические ауксины
нафтил-1-уксусная кислота
(1-НУК)
фенилуксусная кислота
91
д
04-----1-----i-----т-----1-----г
0 2 4 б 8 10
Дни после замачивания семян
92
сосны также имеется другой очень активный ауксин 4-С1-ИУК, который, подобно
ИУК, вызывает закладку корней и ингибирование их роста, выработку этилена, эпи-
настию листьев, партенокарпию, а также ускоряет растяжение клеток у отсеченных
субапикальных отрезков колеоптилей. В некоторых биопробах 4-С1-ИУК оказыва-
ется в 10-100 раз активнее ИУК (то есть вызывает эффекты в гораздо более низких
концентрациях). Так, именно 4-С1-ИУК синтезируется в развивающихся семенах го-
роха и вызывает быстрый рост стручков.
Современные методы позволяют определять содержание ИУК в субмиллиграм-
мовых навесках растительного материала и таким образом изучать изменения ее
концентрации в зонах роста и морфогенеза, например в зонах деления и растяжения
клеток корня, в различных участках развивающейся листовой пластинки и черешка.
Содержание ауксина варьирует от 5-10 до 500 900 нг/г сырой массы и укладыва-
ется в концентрационный диапазон 10“8-10~5 моль/л. Наиболее богаты ауксином
молодые, быстро растущие органы растений, в которых обычно наблюдаются кру-
тые градиенты концентрации ИУК. Например, в стволе сосны концентрация ауксина
максимальна в зоне камбия (рис. 8.2, а), а в зоне развивающихся трахеид (толщи-
ной 300-400 мкм) происходит многократное снижение концентрации ИУК. Градиент
концентрации ауксина с максимумом в зоне деления клеток обнаружен у первичного
корня проростка арабидопсиса (рис. 8.2, б). В растущих листьях табака наблюдается
продольный градиент концентрации ИУК с максимумом в черешке и в основании
пластинки листа, где продолжаются деления клеток и экспрессируется участвую-
щий в регуляции клеточного цикла ген циклина CYC1 (рис. 8.2, в).
Очень большие изменения содержания ИУК происходят в процессе эмбриогенеза.
Так, в неоплодотворенной яйцеклетке моркови (рис. 8.2, г) уровень ауксина доволь-
но низкий — 26 нг/г сырой массы. На глобулярной стадии развития концентрация
ауксина становится в 20-30 раз выше исходной, а на поздней глобулярной/ранней
сердцевидной стадии — в 80 раз выше исходной. Затем концентрация ауксина быстро
снижается и на стадии Торпедо возвращается к исходному значению.
Значительные изменения содержания ИУК происходят во время прорастания
семян. Например, в семенах сосны после двух дней набухания содержание свобод-
ной ИУК увеличивается от 20 до 100 нг/г сырой массы, а затем быстро снижается
(рис. 8.2, д).
Изменения содержания ИУК четко выражены в процессе развития таких органов
с ограниченным ростом как листья и плоды. Так, ее концентрация уменьшается от
250 нг/г сырой массы у совсем молодых листьев арабидопсиса массой 0,1 мг до 80 нг
у листьев массой 1 мг, в которых уже почти прекратились деления клеток, и до 25 нг
у листьев массой 10 мг (рис. 8.2, с).
8.1.1. Биосинтез ауксина
Для изучения биосинтеза ИУК применяют несколько подходов.
1. При использовании изотопного разбавления растения выращивают на интер-
медиате, меченом тяжелым нерадиоактивным изотопом, и анализируют степень обо-
Рис. 8.2. Содержание ИУК в разных тканях и органах растений.
а — зона образования нового годичного кольца сосны (по: Uggla et al., 1998): Ф — флоэма, К — камбий,
РТ — развивающиеся трахеиды, 3T — зрелые трахеиды; б — кончик первичного корня проростка араби-
допсиса (по: Liung et al., 2002); в — развивающийся лист табака (по: Liung et al., 2002): 1 — окрашенный
лист, несущий конструкцию CYC1-1::GUS; г — развивающийся эмбрион моркови (по: Ribnicky et al., 2001);
д — прорастающие семена сосны (по: Liung et al., 2002); е — развивающийся лист арабидопсиса (по: Liung
et al., 2001)
93
гащения им тех или иных соединений. Для идентификации микроколичеств меченых
продуктов биохимических превращений используют газожидкостную хроматогра-
фию в сочетании с масс-спектрометрическим анализом хроматографических фрак-
ций. Цепи метаболических превращений выстраивают, исходя из того, что пред-
шественник должен быть более обогащен изотопом, чеАм его производное. Напри-
мер, если при выращивании растений на растворе, содержащем 30% тяжелой воды
(2Н2О), индол-3-уксусная кислота спустя 10-20 ч накапливает больше дейтерия, чем
триптофан, то это свидетельствует о том, что она синтезируется не из триптофана.
Очевидно, что с использованиехМ только этого подхода нельзя точно определить ме-
таболический путь, и удовлетворяющий условию изотопного разбавления вывод о
том, что триптофан синтезируется из ауксина, безусловно, неверен.
2. Получение и исследование мутантов по биосинтезу ауксина позволяет выявить
ферменты, участвующие в биосинтезе ИУК, и изучить активность этих ферментов
in vitro.
3. Исследование трансгенных растений, у которых ускорены или заторможены
отдельные биохимические реакции, дает информацию о способах регуляции биосин-
теза ИУК.
4. Определение активности интермедиатов в биопробах на ауксин позволяет
определить, насколько эффективно они превращаются в ИУК.
Триптофан-зависимый синтез ИУК. Давно известно, что многие расте-
ния и растительные экстракты способны превращать меченый триптофан в ИУК.
В значительной степени эта способность обусловлена присутствием эпифитных бак-
терий, у которых активен индол-3-ацетамидный путь синтеза ауксина из трипто-
фана (рис. 8.3). Монооксигеназа семейства цитохрома Р450 катализирует окисление
триптофана в индол-3-ацетамид, который гидролизуется с образованием ИУК при
участии амидогидролазы, имеющейся не только у бактерий, но и у растений. Таким
образом, чтобы растения обрели возможность синтезировать ИУК по этому пути,
достаточно трансформировать их геном триптофан-монооксигеназы (iaaM). Подоб-
ную трансформацию в природных условиях осуществляют агробактерии Agrobac-
terium tumefaciens и A. rhizogenes, что приводит к опухолевому разрастанию тканей
вследствие высокого содержания в них ауксина.
Путь от триптофана к ИУК может проходить через индол-3-пировиноградную
кислоту и индол-3-ацетальдегид (рис. 8.3). Эти соединения идентифицированы у
многих растений. Мутанты арабидопсиса swJfsuperrootsl) и sur2, синтезирую-
щие избыточное количество ауксина, имеют повышенное содержание индол-3-
ацетальдегида. Индол-З-пировиноградпая кислота включает больше метки из 2Н2О,
чем ИУК, поэтому она может быть предшественником ИУК. Для превращения трип-
тофана в ИУК по этому пути необходимы три фермента: триптофан-аминотранс-
фераза, индол-3-пиру ват-декарбоксил аза и индол-3-ацетальдегид-оксидаза. До сих
пор выделена и изучена только индол-3-ацетальдегид-оксидаза, представляющая со-
бой локализованный в цитоплазме растворимый флавин-содержащий фермент. Ак-
тивность этого фермента существенно увеличена у мутанта арабидопсиса surl со
сверхпродукцией ИУК.
Путь от триптофана к ИУК может начинаться с его окисления в индол-3-
ацетальдоксим (рис. 8.3) при участии НАДФ • Н-зависимых монооксигеназ семейства
цитохрома Р450. В геноме арабидопсиса закодировано семь ферментов (CYP79),
способных окислять аминокислоты до соответствующих альдоксимов, из которых
два (CYP79B2 и CYP79B3) окисляют триптофан. Двойной мутант арабидопсиса по
94
Рис. 8.3. Синтез ИУК из триптофана
CYP79B2/B3 имеет сниженный уровень ИУК, а сверхэкспрессия этих генов вызы-
вает сверхпродукцию ИУК. Сведения о локализации этих ферментов противоре-
чивы. В составе CYP79B2/B3 имеется транзитный пептид, направляющий белки в
хлоропласты. Тем не менее превращение триптофана в индол-3-ацетальдоксим наи-
более активно осуществляется микросомальными фракциями. Это дает основание
считать, что CYP79B2/B3, подобно большинству монооксигеназ семейства цитохро-
ма Р450, связаны с мембранами эндоплазматической сети. Монооксигеназы CYP79
характерны для крестоцветных, у которых альдоксимы являются промежуточны-
ми соединениями в биосинтезе глюкозинолатов. В геноме риса CYP79B2/B3 отсут-
ствуют.
Пути превращения индол-3-ацетальдоксима в ИУК изучены слабо. Индол-
3-ацетальдоксим -химически неустойчивое соединение, которое может снонтан-
95
но или при участии неидентифицированных ферментов превращаться в индол-3-
ацетальдегид либо в индол-3-ацетонитрил. У злаков, крестоцветных и банановых
накапливаются значительные количества индол-3-ацетонитрила. У 7-дневных про-
ростков арабидопсиса его в 100 раз больше, чем ИУК. Однако методом изотопно-
го разбавления показано, что метка из триптофана сильнее обогащает ИУК, чем
индол-3-ацетонитрил, поэтому он может быть продуктом гидролиза глюкозинола-
тов крестоцветных, а не продуктом окисления триптофана (рис. 8.3). Содержание
индол-3-ацетонитрила обычно изменяется параллельно с изменением содержания
глюкозинолатов. Например, у растений арабидопсиса со сверхпродукцией CYP79B2
накапливаются глюкозинолаты и индол-3-ацетонитрил, а мутанты surl и sur2 име-
ют мало глюкозинолатов и индол-3-ацетонитрила.
Превращение индол-3-ацетонитрила в ИУК происходит с помощью нитрилаз,
субклеточная локализация которых неизвестна. Распространение нитрилаз ограни-
чено семействами злаковых, крестоцветных и банановых. Проростки арабидопсиса,
в отличие от проростков табака, легко гидролизуют индол-3-ацетонитрил в ИУК,
поэтому индол-3-ацетонитрил в высоких концентрациях, подобно ауксину, ингиби-
рует рост проростков арабидопсиса, но не действует на рост проростков табака. Тем
не менее даже у арабидопсиса не удалось повлиять на синтез ИУК, изменяя уровень
экспрессии генов нитрилаз.
Путь от триптофана к ИУК может проходить через триптамин (рис. 8.3). Трип-
тамин образуется из триптофана под действием триптофан-декарбоксилазы — ши-
роко распространенного цитоплазматического фермента. Обычно у растений очень
мало триптамина, однако сверхэкспрессия триптофан-декарбоксилазы приводит к
его накоплению. У арабидопсиса при этом происходит снижение содержания глю-
козинолатов, обусловленное ингибирующим действием триптамина па CYP83B1 —
ключевой фермент глюкозинолатного метаболического пути. Интермедиатом пре-
вращения триптамина в ИУК является ипдол-3-ацетальдоксим. Вначале трипта-
мин гидроксилируется под действием растворимой цитоплазматической флавино-
вой монооксигеназы (YUCCA у арабидопсиса и риса) с образованием N-гидрокси-
триптамина. Сверхэкспрессия YUCCA приводит к увеличению синтеза ИУК. Далее
N-гидрокси-триптамин окисляется до индол-3-ацетальдоксима, который превраща-
ется в ИУК посредством рассмотренных выше химических реакций. Несмотря на
то, что сверхэкспрессия YUCCA увеличивает содержание индол-3-ацетальдоксима,
являющегося общим предшественником ИУК и глюкозинолатов, увеличения синте-
за глюкозинолатов у таких трансгенных растений не происходит. Это объясняется
тем, что N-гидрокси-триптамин, как и триптамин, ингибирует активность фермента
CYP83B1, катализирующего первую реакцию биосинтеза глюкозинолатов.
Регуляция биосинтеза ауксина посредством глюкозинолатной петли.
Долгое время не удавалось получить мутантов с нарушенным ауксиновым гомеоста-
зом. Только в конце 20 в. были получены мутанты арабидопсиса surl и sur2, которые
синтезируют избыточное количество ИУК. Оба мутанта имеют сниженный уровень
глюкозинолатов. Глюкозинолаты — вторичные вещества крестоцветных растений,
которые синтезируются из аминокислот и отвечают формуле:
R - СН2 - С = NOSO3H
SGlc
где R —остаток декарбоксилированной аминокислоты.
96
Эти вещества гидрофильны и накапливаются в вакуолях. Известно более
120 глюкозинолатов; у арабидопсина их не менее 23. Они синтезируются из трип-
тофана, фенилаланина и метионина. Индол-З-ацетальдоксим — общий предшествен-
ник ИУК и индольных глюкозинолатов арабидопсиса, поэтому торможение синтеза
глюкозинолатов ведет к существенному увеличению синтеза ИУК.
Первая химическая реакция на пути синтеза индольных глюкозинолатов состо-
ит в окислении индол-3-ацетальдоксима до его N-оксида (рис. 8.4). Эту реакцию ка-
тализирует цитоплазматическая монооксигеназа CYP83B1 из семейства цитохрома
Р450. N-оксид индол-3-ацетальдоксима — нестабильное вещество, к которому спон-
танно присоединяется остаток цистеина, в результате чего образуется S-цистеил-
тиогидроксимат. Далее при участии фермента C-S-лиазы происходит удаление ал-
кильной группы цистеина в виде пирувата и NH3, и S-цистеил-тиогидроксимат пре-
вращается в тиогидроксимат, который глюкозилируется по SH-группе и превраща-
ется в десульфоглюкозинолат. В результате последующей реакции сульфатирования
происходит превращение десульфоглюкозинолата в глюкозинолат. Этот индольный
глюкозинолат называется глюкобрассицином.
Найден MYB фактор транскрипции ATR1, регулирующий синтез глюкозинола-
тов. Он стимулирует их образование, активируя экспрессию CYP79B2, CYP79B3,
CYP83B1 и генов биосинтеза триптофана, а накапливающиеся глюкозинолаты по-
давляют экспрессию ATR1. Сверхэкспрессия ATR1 в 10 раз увеличивает накопление
глюкобрассицина и удваивает количество ИУК. Ауксин также стимулирует биосин-
тез глюкобрассицина, повышая экспрессию генов CYP83B1 и глюкозилтрансфера-
зы, катализирующей гликозилирование тиогидроксимата.
Под действием /^-глюкозидазы мирозиназы происходит гидролиз тиоглюкозид-
ной связи, в результате которого глюкозинолаты превращаются в нестабильные
О-сульфат-тиогидроксиматы, спонтанно превращающиеся в нитрилы, изотиоциана-
ты, тиоцианаты и некоторые другие вещества. Глюкобрассицин под действием миро-
зиназы превращается в индол-3-ацетонитрил, который далее может под действием
нитрилазы превращаться в ИУК.
Мутанты арабидопсиса по гену CYP83B1 (sur2, mtl) и по гену, кодирующему
C-S-лиазу (surl), имеют фенотип, характерный для растений с высоким содержа-
нием ауксина: у них длинные гипокотили, много боковых и придаточных корней,
усилено апикальное доминирование и поэтому формируется только один цветонос,
наблюдается эпинастия семядолей и листьев. Сверхэкспрессия CYP83B1 приводит
к фенотипу «низкого ауксина». У таких растений короткие гипокотили, много ли-
стьев в розетке, снижено апикальное доминирование и поэтому образуется до 10
цветоносов (рис. 8.5).
Триптофан-независимый синтез ИУК. Существуют довольно веские до-
казательства синтеза ауксина из метаболических предшественников триптофана.
Метаболическая ветвь, ведущая к триптофану, начинается с реакции превращения
хоризмовой в антраниловую кислоту под действием антранилат-синтазы (рис. 8.6).
Антранилат далее превращается в №(5'-фосфорибозил)-антраниловую кислоту под
действием антранилатфосфорибозил-трансферазы. Затем в результате последова-
тельных реакций изомеризации (перегруппировки Амадори) и декарбоксилирова-
ния образуется индол-3-глицерофосфат, который под действием триптофан-синтазы
а превращается в индол. Наконец, триптофан-синтаза (3 катализирует образование
триптофана из индола. Все реакции биосинтеза триптофана протекают в строме
хлоропластов.
97
co
00
ch2-ch=noh
индол-3-ацетальдоксим
ch2-c=noh
SCys
S-цистеилтиогидроксимат
C-S-лиаза
(surf)
пируват, NH3
NH
индол-3-ацетонитрил
Glc,H2SO4,S h2o
CH2-C=N \ ) f
мирозиназа
PAP PAPS
---jr-CH2-C=NOSO3H
4i5tX^4NH SGIc сульфотрансфераза
индольный глюкозинолат
глюкобрассицин
NH
десульфоглюкозинолат
ИУК
CH2-C=NOH
SGIc глюкозилтрансфераза
NH
ch2-c—noh
SH
тио гидрокси мат
нитрилаза
СН2-СООН
индол-3-уксусная кислота
Рис. 8.4- Биосинтез индольных глюкозинолатов — предшественников ИУК: PAPS — З'-фосфоаденозил-б'-фосфосульфат;
РАР — З'-фосфоаденози л-5'-фосфат
a
Рис. 8.5. Влияние уровня экспрессии CYP83B1 на фенотип проростков арабидопсиса
недельного возраста (а) и цветущих растений 6-недельного возраста (б) (по:
Bak et al., 2001):
1 — растения дикого типа; 2 — мутант mtl; 3 — трансгенные растения, сверхэкспрес-
сирующие ген CYP83B1
99
о
о
хоризмовая кислота
Gin Glu, пируват
СООН
NH2
фосфорибоз ил-
пирофосфат пирофосфат
антрани лат-си нтаза
(trp5) т
।----- ,—| антраниловая кислота
триптофан J
фосфорибозил-
трансфераза (trp1)
N-(5 '-фосфорибозил >
антранилиновая кислота
индол-3-уксусная кислота оксидаза индол-3-ацетальдегид
Рис. 8.6. Биосинтез ИУК из предшественников триптофана
Самое раннее предположение о возможности синтеза ИУК из интермедиатов био-
синтеза триптофана было высказано в 1960-е гг. на основании результатов тестиро-
вания способности различных индольных соединений вызывать, подобно ауксину,
удлинение отрезков колеоптилей овса. Оказалось, что индол, но не триптофан, про-
являет активность в этой биопробе на ауксин. Значительно позднее были описаны
примеры более интенсивного включения метки из 15N-антранилата в ИУК, чем в
триптофан. У арабидопсиса дейтерий из 2НзО довольно эффективно включается
в ИУК, указывая на ее активный синтез, а метка из 2Н5-триптофана переходит в
ИУК лишь в малой степени. Кроме того, испытание действия различных индоль-
ных соединений и их аналогов на синтез триптофана и ИУК в эндосперме кукурузы
на стадии молочной спелости позволило выявить ряд соединений (например индоль-
ный аналог индазол), которые подавляли синтез триптофана, ингибируя триптофан-
синтазу /3, но при этом очень слабо действовали на синтез ИУК.
О возможности синтеза ИУК из предшественников триптофана ярко свидетель-
ствует характер изменений ауксинового метаболизма у мутантов по биосинтезу
триптофана. Так, у мутантов арабидопсиса по триптофан-синтазе a (trp3) и по трип-
тофан-синтазе (3 (trp2) был сильно подавлен синтез триптофана, но при этом было
в десятки раз увеличено содержание амидных и эфирных конъюгатов ИУК. Хотя
содержание ИУК у мутантов trp2 и trp3 не изменялось, но накопление конъюгатов
ИУК свидетельствовало о ее возросшем синтезе.
Синтез триптофана регулируется по механизму обратной связи, посредством ал-
лостерического ингибирования триптофаном антранилат-синтазы. У мутанта ара-
бидопсиса trp5 этот механизм нарушен из-за мутации в аллостерическом центре
фермента, и поэтому растения накапливают много триптофана. Мутант trp5 име-
ет нормальный уровень ИУК, но накопление в нем конъюгатов ИУК указывает на
возросший синтез ауксина. Таким образом, исследование мутантов trp2/3/5 пока-
зало, что увеличение содержания предшественников триптофана приводит к более
интенсивному синтезу ИУК.
До сих пор не выделен ни один фермент на пути превращения предшествен-
ников триптофана в ИУК. Ауксиновая ветвь, по-видимому, начинается от индол-3-
глицерофосфата или от индола. Интермедиатами этого пути могут быть индол-3-
ацетонитрил либо индол-3-ацетальдегид (рис. 8.6).
8.1.2. Образование конъюгатов и окисление ауксина
Конъюгирование ИУК. От 90 до 99% ИУК в растениях находится в конъюги-
рованной форме. Конъюгация ИУК происходит посредством присоединения углево-
дов и их производных или аминокислот и пептидов к се карбоксильной группе, что
приводит, соответственно, к образованию эфирных или амидных конъюгатов. Зна-
чительно реже встречаются конъюгаты, в которых присоединение углеводов (глю-
козы) к ИУК осуществляется через индольный азот.
Низкомолекулярные эфирные и амидные конъюгаты ИУК, подобно ИУК, хоро-
шо растворимы в 70-80% спиртах: метаноле, этаноле и пропаноле, тогда как высо-
комолекулярные конъюгаты в спирте не растворяются. Среди спирторастворимых
конъюгатов ИУК наиболее распространены эфирные конъюгаты с глюкозой и мио-
инозитом, амидные конъюгаты с аспарагиновой и глутаминовой кислотами. Высо-
комолекулярные конъюгаты ИУК с полисахаридами, пептидами и нуклеиновыми
кислотами остаются малоизученными.
101
сн2-соон
индол-3-ацетил-инозитил-арабиноза
индол-3-ацетил-инозитил-галактоза
Рис. 8.7. Синтез и гидролиз конъюгатов ИУК в эндосперме кукурузы
102
Состав конъюгатов зависит от вида растения и стадии его развития. В процессе
прогрессивной эволюции обогащался спектр конъюгатов и увеличивалось их про-
центное содержание в тканях. Детально исследованный состав конъюгатов зерновок
кукурузы и процесс их биосинтеза в эндосперме кукурузы на стадии молочной спе-
лости показан на рис. 8.7. Практически весь ауксин в зерновках находится в форме
эфирных конъюгатов: высокомолекулярных конъюгатов с глюканами (50%) и низ-
комолекулярных конъюгатов с инозитил-арабинозой и инозитил-галактозой. Синтез
этих конъюгатов начинается с образования индол-3-ацетил-глюкозы. Катализирую-
щая эту реакцию глюкозилтрансфераза (iaaglu) выделена из эндосперма кукурузы
и из листьев арабидопсиса. В семенах сосны также в основном содержатся эфирные
конъюгаты ИУК, тогда как в семенах бобовых накапливаются амидные конъюгаты
ИУК с аминокислотами, пептидами и белками. В семенах арабидопсиса 99% ИУК
находится в конъюгированной форме: 78% составляют высокомолекулярные амид-
ные конъюгаты с полипептидами и белками, 17% — спирторастворимые амидные
конъюгаты, 4% — спирторастворимые эфирные конъюгаты (рис. 8.8).
Спирторастворимые эфирные
Рис. 8.8. Относительное содержание ИУК и ее конъюгатов в семенах араби-
допсиса (по: Liung et al., 2002)
Конъюгаты ИУК не имеют биологической активности и могут рассматриваться,
в зависимости от возможности их гидролиза в тканях растений, либо как запас-
ные формы ауксина, либо как формы его необратимой инактивации. Кроме того,
конъюгаты могут служить транспортной формой ауксина. Например, при прораста-
нии зерновок кукурузы индол-3-ацетил-инозит транспортируется в развивающийся
зародыш в 400 раз быстрее ИУК. Конъюгаты также могут защищать ИУК от окис-
лительного декарбоксилирования, катализируемого пероксидазами.
При прорастании семян происходит гидролиз эфирных и амидных конъюгатов
ИУК. В этом процессе участвуют широко распространенные гидролазы индол-3-
103
ацетил-глюкозы. Многие растения на вегетативной стадии развития утрачивают
способность гидролизовать амидные конъюгаты ИУК с аспарагиновой и глутамино-
вой кислотами. Так, индол-3-ацетил-аспартат не оказывает гормонального действия
на проростки арабидопсиса, так как не может быть ими гидролизован. В то же время
этот конъюгат ускоряет рост отрезков колеоптилей овса и гипокотилей сои, которые
могут его гидролизовать.
Посредством скрининга мутантов арабидопсиса, рост корней которых не подав-
ляется амидными конъюгатами ИУК, были обнаружены: амидогидролаза, специ-
фичная к индол-3-ацетил-аланину (мутант iar3), и амидогидролаза, специфичная
к индол-3-ацетил-лейцину и индол-3-ацетил-фенилаланину (мутант ilrl). Судя по
первичной структуре, эти ферменты локализованы в полости эндоплазматической
сети. Кроме того, был выделен трансмембранный белок, похожий на металлотранс-
портер (мутант iarl, устойчивый к и н до л-3-ацетил-ал ан и ну). Предполагается, что
IAR1 нужен для транспортировки в полость эндоплазматической сети Мп2+, яв-
ляющегося кофактором амидогидролаз, или для выведения из эндоплазматической
сети Zn2+ и Сп2+, ингибирующих амидогидролазы.
Спектр конъюгатов ИУК в вегетативных тканях растений наиболее полно изу-
чен у арабидопсиса. До 90% ИУК в растениях находится в конъюгированной форме,
в основном в форме высокомолекулярных амидных конъюгатов с пептидами и бел-
ками. Среди низкомолекулярных конъюгатов преобладает индол-3-ацетил-аспартат,
который у вегетирующих растений арабидопсиса не гидролизуется (рис. 8.9). Обра-
зование индол-3-ацетил-глутамата также является способом необратимой конъюга-
ции ИУК. Кроме того, в вегетативных тканях в небольшом количестве содержат-
ся индол-3-ацетил-глюкоза, индол-3-ацетил-лейцин (преимущественно в корнях) и
и идол-3-ацетил-аланин (преимущественно в надземной части). Эти конъюгаты мо-
гут быть гидролизованы с освобождением ИУК.
В качестве эффективного способа обратимой инактивации ИУК можно рассмат-
ривать образование индол-3-масляной кислоты (ИМК). Это соединение обнаружено
у многих растений. У арабидопсиса содержание ИМК сопоставимо с содержани-
ем ИУК. ИМК синтезируется из ИУК при участии связанной с мембранами эндо-
плазматической сети ИМК-синтетазы. Для протекания реакции необходимы АТФ и
ацетил-КоА. Предполагается, что механизм удлинения боковой цепи ИУК гомологи-
чен механизму удлинения жирных кислот. Индол-З-масляная кислота присутствует
в тканях не только в свободной форме, но и в форме легкогидролизуемых эфирных
конъюгатов. Многие растения способны превращать ИМК в ИУК. Это превраще-
ние осуществляется в пероксисомах комплексом ферментов /3-окисления жирных
кислот.
Окисление ИУК. Уже в 1930-е гг. было известно, что отрезки стеблей и ко-
леоптилей способны быстро окислять содержащуюся в среде инкубации ИУК по
декарбоксилирующему пути. При этом в среде инкубации накапливаются индол-
3-метанол, индол-3-альдегид, индол-3-карбоновая кислота, а также оксиндол-3-
метилен, оксиндол-3-метил и оксиндол-3-метанол (рис. 8.10). Это окисление ката-
лизируют секреторные гваякол-пероксидазы, локализованные в клеточных стенках
и вакуолях растений. Препарат пероксидазы хрена может окислять ИУК с помо-
щью О2 без кофакторов, однако скорость окисления многократно возрастает в при-
сутствии Мп2+ и монофенолов, например 2,4-дихлорфенола (рис. 8.11). Природны-
ми активаторами ИУК-оксидазной активности пероксидаз являются такие моно-
фенолы как р-кумаровая и феруловая кислоты, а ингибиторами р-дифенолы и
104
сн2-сн2-сн2-соон
NH
индол-3-масляная кислота (ИМК)
ИУК
СООН
О СООН
// I
ch2-c-nh-ch
(СН2)2
СООН
индол-3-ацетил-глутамат
индол-3-ацетил-аспартат
Рис. 8.9. Синтез и гидролиз низкомолекулярных конъюгатов ИУК в вегетативных
тканях арабидопсиса
СООН
индол-3-альдегид индол-3-карбоновая кислота
оксиндол-3-метанол
окси ндол-3-мети лен
оксиндол-3-метил
Рис. 8.10. Продукты окислительного декарбоксилирования ИУК пероксидазами
105
он
2.4-дихлорфенол
р-кумаровая кислота
феруловая кислота
кофейная кислота
Рис. 8.11. Фенольные кофакторы (а. б, в) и ингибитор (г) ИУК-оксидазной
активности пероксидаз
о-дифенолы, например кофейная кислота. Оксидазы, декарбоксилирующие ИУК,
локализованы в клеточных стенках и легко вымываются из срезов растительной
ткани в среду инкубации.
Несмотря на высокую ИУК-оксидазную активность пероксидаз, существуют
обоснованные сомнения относительно активности этого окислительного пути у непо-
врежденных растений по отношению к эндогенной ИУК, поскольку продукты де-
карбоксилирования ИУК обнаруживаются только в области срезов растительной
ткани. Другим аргументом против существования этого пути в интактных расте-
ниях являются результаты опытов с трансгенным табаком и томатом, у которых
сверхэкспрессия пероксидаз или подавление их экспрессии посредством антисенс-
технологии мало влияли на содержание ИУК в тканях. Еще одним аргументом
против участия пероксидаз в окислении эндогенной ИУК является подавление экс-
прессии ряда пероксидазных генов ауксином. Если бы пероксидазы регулировали
уровень ИУК посредством ее окисления, то следовало бы ожидать, что ИУК бу-
дет активировать, а не подавлять экспрессию пероксидазных генов. Есть сведения
о том, что в кончиках корней редьки может происходить окислительное декарбок-
силирование ИУК, так как там обнаружены продукты этой реакции. Показано, что
это окисление может осуществляться под действием медь-содержащего фермента
аскорбатокси дазы.
Возможно окисление ИУК по индольному кольцу, не затрагивающее боковую
цепь уксусной кислоты. Продукты такого окисления накапливаются в тканях рас-
тений в значительных количествах. Прежде всего, образуется много оксиндол-3-
уксусной кислоты (рис. 8.12). У кукурузы в эндосперме при прорастании и в про-
ростках ее примерно столько же, сколько ИУК. Пути этого окисления и его ко-
нечные продукты различны у разных растений (рис. 8.12). Например, у кукурузы
кроме оксиндол-3-уксусной кислоты может накапливаться 7-гидрокси-оксиндол-З-
уксусная кислота и ее глюкозид. У мггогих растений окисление индольного кольца
ИУК происходит только в форме индол-3-ацетил-аспартата. Таким образом, конъ-
югация не только не препятствует окислению (как при декарбоксилировании ИУК-
оксидазой), но, напротив, является его предпосылкой. У арабидопсиса поглощен-
ная через корни 1-14С-ИУК окисляется до оксиндол-3-уксусной кислоты и затем
образует конъюгат с глюкозой, а индол-3-ацетил-аспартат окисляется до оксиндол-
3-ацетил-аспартата. Ферменты, окисляющие ИУК до оксиндол-3-уксусной кислоты,
у кукурузы связаны с эндоплазматической сетью.
106
•сн2~соон
-сн2-с
О
>0
II-VI
оксиндол-3-уксусная кислота
оксиндол-3-ацетил-глюкоза
О СООН
CH2-Cz-NH—СН
СН2
СООН
ОН
7-гидрокси-оксиндол-З-уксусная кислота
ицдол-3-ацетил-аспартат
II-V
глюкозид 7-гидрокси-оксиндол-З-уксусной кислоты
СООН
оксиндол-3-ацетил-аспартат
оксиндол-3-уксусная кислота
глюкозид диоксиндол-3-ацетил-аспартата
Рис. 8.12. Окисление ИУК в тканях различных растений.
I — кукурузы, II — кормовых бобов. III - томата, IV — осины, V — арабидопсиса, VI — сосны
N-целлобиозил-оксиндол-З-ацетил-аспартат
О СООН
// ।
-C-NH-CH
I
сн2
СООН
107
8.1.3. Способы регуляции содержания ауксина
в развивающихся, органах растений
Метаболизм ИУК в целом включает сложные процессы синтеза, конъюгации и
окисления. Он в значительной степени видоспецифичен и изменяется при разви-
тии растений. На рис. 8.13 представлена схема метаболизма ИУК у арабидопсиса.
В процессе развития изменяется активность различных частей этой схемы. Так, у
арабидопсиса, как и у других растений, при прорастании семян ИУК образуется
в результате гидролиза запасных эфирных и амидных конъюгатов. Только через
несколько дней проростки начинают синтезировать ИУК de novo. Вначале активи-
руется триптофан-зависимый синтез, который интенсивен также в стрессовых усло-
виях и на тех этапах развития, когда необходимо многократно увеличить содержа-
ние ИУК, например на первых этапах эмбриогенеза. В ходе дальнейшего развития
арабидопсиса метка из 2Н2О включается в ауксин эффективнее, чем метка из pHs]-
триптофана, то есть преобладающим становится синтез ИУК из предшественников
триптофана. Конъюгаты и продукты окисления ИУК появляются в тканях вскоре
после начала синтеза ИУК. Гомеостаз ИУК регулируется балансом процессов ее син-
теза и окисления (у водорослей и печеночных мхов) или балансом процессов синтеза
и конъюгации (у сосудистых растений).
индол-З-ацетил-аспартат
оксиндол-3-ацетил-глюкоза
оксиндол-3-ацетил-аспартат
Рис. 8.13. Метаболизм ИУК в тканях арабидопсиса. ATR1 -фактор транскрипции
Большую роль в регуляции содержания ИУК у крестоцветных, и в том чис-
ле у арабидопсиса, играет глюкозинолатная петля, в которую отводится индол-
3-ацетальдоксим — общий ггредшественник ИУК и индольных глюкозинолатов
(рис. 8.13). Косвенные данные, полученные с использованием ингибитора транспор-
та ауксина, свидетельствуют о том, что ауксин регулирует свой синтез по механизму
обратной связи. В образовании ИУК участвуют несколько компартментов клетки:
пластиды, цитоплазма, эндоплазматическая сеть, пероксисомы, вакуоль, поэтому
можно предполагать, что метаболизм ИУК может регулироваться и на уровне мем-
бранного транспорта предшественников и конъюгатов ИУК.
108
В течение более полувека со времени открытия ауксина господствовало представ-
ление о том, что место синтеза ауксина и место его действия пространственно разде-
лены, как у классических гормонов животных организмов. Например, известно, что
растяжение клеток стеблей зависит от ауксина, поступающего из верхушки побега, а
рост плодов — от ауксина, который из семян поступает в ткани околоплодника. Од-
нако с течением времени накапливалось все больше данных, свидетельствующих о
том, что ауксин часто выступает в роли морфогена и, создавая в местах своего синте-
за концентрационное поле, контролирует в нем процессы роста и дифференцировки
клеток. Высокой способностью к биосинтезу ИУК обладают листовые примордии,
молодые растущие листья, развивающиеся зародыши, запасающие ткани семян.
До недавнего времени считалось, что ауксин не синтезируется в корнях, и их фор-
мирование целиком зависит от ауксина, поступающего из надземной части растения.
В настоящее время способность корней синтезировать ИУК не вызывает сомнений.
Корни арабидопсиса накапливают значительные количества ауксина. Особенно мно-
го ИУК в меристемах главного, боковых и придаточных корней. В корнях интакт-
ных растений арабидопсиса метка из 2НгО интенсивно переходит в ИУК даже в
условиях, когда поступление ауксина из надземной части перекрыто с помощью ин-
гибитора его полярного транспорта, и, следовательно, новосинтезированный ауксин
может быть только корневого происхождения. В меристемах корня арабидопсиса
сильно экспрессированы CYP79B2/B3 и гены нитрилаз, а в кончике корня риса —
ген участвующей в биосинтезе ИУК флавиновой монооксигеназы YUCCA.
Поддержание необходимого уровня ауксина в клетках и тканях растительного
организма обеспечивается за счет процессов его синтеза, транспорта, образования
конъюгатов с различными соединениями, компартментации в клеточных органел-
лах, ферментативного и неферментативного распада. Следует особо подчеркнуть,
что для ауксинового обмена характерна множественность метаболических путей и
генов, которые контролируют ферменты, участвующие в этих процессах. Все это
резко повышает надежность системы, отвечающей за регулирование концентрации
этого фитогормона в клетках и тканях растения. Важным фактором регуляции
уровня ауксина в тканях растений является его полярный транспорт, который мы
рассмотрим далее.
8.2. Транспорт ауксина
Со времени своего открытия ауксин рассматривался в свете двух теоретических
концепций, заимствованных из биологии животных: концепции гормона и концеп-
ции морфогена. Место действия классического гормона дистанцировано от места
его синтеза, и эффективность гормональной регуляции основана на высокой ско-
рости транспорта гормона на большие расстояния. В теории развития под морфо-
геном понимается вещество, за счет медленной диффузии которого из места син-
теза создается концентрационный градиент в небольших морфогенетических зо-
нах (100-1000 мкм). Так как же транспортируется ауксин: как гормон или как
морфоген?
Исследования, проведенные в 1970-е гг. Д. Моррисом с сотрудниками с использо-
ванием 14С-ИУК, показали, что в интактных растениях гороха ауксин может пере-
мещаться в разных направлениях со скоростью флоэмного транспорта (5 20 см/ч).
У. Джекобс, изучая в течение многих десятилетий транспорт ауксина в вегетирую-
щих растениях колеуса, в частности, доказал, что в зрелых междоузлиях ауксин
109
транспортируется только вниз, к корням, тогда как в молодых междоузлиях до
одной трети меченого ауксина транспортируется вверх, к развивающимся частям
побега. О существовании флоэмного транспорта ауксина свидетельствует также от-
носительно высокая концентрация ИУК (10-7 моль/л) во флоэмном соке клещеви-
ны. Р. Бандурски и его сотрудники в 1970 1980-е гг. подробно изучили флоэмный
транспорт ауксина в прорастающих зерновках кукурузы, где гормон запасается пре-
имущественно в виде конъюгата с инозитом. При прорастании этот конъюгат быстро
перемещается акропетально в развивающийся колеоптиль.
Существование флоэмного транспорта ауксина можно доказать также логиче-
ским способом. У крупных растений, например у деревьев, молодые части побегов,
в которых в основном синтезируется ауксин, находятся на расстоянии метров от
корней. Закладка же новых боковых корней зависит от поступающего сверху аук-
сина. Понятно, что связь между развитием побега и корня, в поддержании которой
участвует ауксин, не может базироваться на простой диффузии ауксина со скоро-
стью нескольких миллиметров в час и даже на направленном перемещении из клетки
в клетку. Достаточно высокую скорость базипетального транспорта ауксина может
обеспечить только движение по ситовидным трубкам.
Наряду с быстрым перемещением по флоэме ауксин может медленно переме-
щаться от клетки к клетке в одном направлении. Это перемещение получило назва-
ние полярного транспорта ауксина. В 1930-е гг. была разработана методика для изу-
чения полярного транспорта ауксина, которая успешно применялась на протяжении
многих десятилетий (рис. 8.14). Изучение транспорта проводится на отрезках осевых
органов растений длиной 5—10 мм: черешка листа, междоузлия, колеоптиля, гипо-
котиля или корня. Отрезок устанавливается вертикально между двумя агаровыми
блоками — донорным и акцепторным, расположение которых может быть различ-
ным (рис. 8.14: 1-3). Донорный блок содержит 14С-ИУК. В течение нескольких часов
во влажной камере регистрируется динамика увеличения радиоактивности акцеп-
торного блока. Поскольку в процессе транспорта ауксин может метаболизироваться,
Б 2
А Акцепторный
[_] блок
—q Акцепторный
д] блок
! 3
Б I Акцепторный
L2J блок
Рис. 8.14. Методика определения скорости и интенсивности полярного транс-
порта ИУК:
1 — ИУК подается на апикальный конец (Л) отрезка стебля; 2 - ИУК подает-
ся на базальный конец (Б) отрезка стебля, ориентированного базальным концом
вверх; 3 —ИУК подается на базальный конец (Б) отрезка стебля в нормальной
ориентации; чем выше радиоактивность блока, тем он темнее
110
то для более точной характеристики транспортного процесса требуется хроматогра-
фически разделить и идентифицировать радиоактивные вещества, поступившие в
акцепторный блок.
В подобных экспериментах обычно регистрируется линейное увеличение радио-
активности акцепторного блока на протяжении нескольких часов (рис. 8.15). Если
полученную прямую экстраполировать до пересечения с осью абсцисс, то точка пере-
сечения будет соответствовать времени, за которое первые порции 14С-ИУК прохо-
дят всю длину отрезка и достигают акцепторного блока. Опираясь на эту величину,
можно рассчитать скорость транспорта ауксина. Тангенс угла наклона полученной
прямой соответствует интенсивности транспорта, зависящей не только от его скоро-
сти, но и от того, сколько рядов клеток в нем участвует, а также от того, насколько
интенсивно ауксин окисляется или конъюгируется в процессе транспорта. Линии,
представленные на рис. 8.15, характеризуют транспорт ауксина в черешках листьев
колеуса разного возраста. Очевидно, что в черешке молодого листа транспорт проис-
ходит интенсивнее, чем в черешке старого листа, причем различия в интенсивности
обусловлены в основном тем, насколько быстро протекает процесс конъюгирования
ауксина с аспартатом.
Рис. 8.15. Динамика транспорта 14С-ИУК через отрезки черешков мо-
лодого (а) и старого (б) листьев колеуса (по: Jacobs, 1998)
Результаты, полученные с использованием описанной выше методики, доказали
четкую полярность транспорта ауксина. Главный активный поток ауксина и в по-
бегах, и в корнях направлен сверху вниз, то есть в побегах ауксин перемещается
базипетально (к основанию побега), а в корнях акролетально, (к верхушке корня).
Скорость полярного транспорта составляет от 0,5 до 2 см/ч, что значительно выше
скорости простой диффузии, но значительно ниже скорости флоэмного транспорта.
Скорость полярного транспорта ИУК изменяется даже на небольших расстояниях.
Например, у этиолированного проростка кукурузы она в верхней части колеоптиля
составляет 2 см/ч, а у мезокотильного узла падает до 1,2 см/ч. Особенно низкая
111
скорость транспорта ИУК (0,2 -0,5 см/ч) регистрируется в узлах побегов, а также в
кончиках корней.
Полярный транспорт ауксина — активный процесс, идущий с затратой метабо-
лической энергии. Он тормозится в условиях гипоксии, в присутствии ингибиторов
дыхания и синтеза белка. Обнаружены специфические неконкурентные ингибиторы
полярного транспорта ауксина: нафтилфталамовая кислота, 2,3,5-трийодбензойная
кислота, морфактин (рис. 8.16). Они тормозят выход ауксина из клеток в суспен-
зионных культурах и из отсеченных отрезков стеблей. Применение этих ингибито-
ров снижает фото- и гравитропические реакции растений, из-за чего ингибиторы
транспорта ауксина иногда называют фитотропинами. Кроме того, они нарушают
развитие растений. Природными фитотропинами являются фенилуксусная кисло-
та (слабый ауксин) и некоторые флавоноиды, например кверцетин. Мутант араби-
допсиса, не синтезирующий флавоноиды, быстрее транспортирует ауксин и имеет
ярко выраженные тропические реакции.
нафтилфталамовая
кислота (НФК)
2,3,5-трийод бензойная
кислота (ТИБК)
сн2-соон
фенилуксусная
кислота
9-гид роксифлуоренкарбо-
новая кислота (флуоренол, флавонид кверцетин
морфактин)
Рис. S. 16. Ингибиторы полярного транспорта ауксина
Полярный транспорт ауксина происходит путем направленного, опосредованного
апопластом перехода ауксина из клетки в клетку в вертикальных рядах клеток.
Основной базипетальный транспорт осуществляется по клеткам камбия, флоэмной
и ксилемной паренхимы.
В 1974-1975 гг. П. Рубери, А. Шелдрейк и Дж. Рейвен сформулировали хемиос-
мотическую гипотезу транспорта ауксина, которая в своей основе сохранила акту-
альность до настоящего времени (рис. 8.17). Гипотеза базируется на амфифильных
свойствах ИУК: липофильность молекуле придает гидрофобное индольное кольцо,
а гидрофильность — способная к диссоциации ацетильная группа. Индол-З-уксусная
кислота имеет рКа 4,75. Следовательно, при pH 4,75 она диссоциирована наполо-
вину, при pH 5,75 —на 90%, а при pH 6,75 —на 99%. В недиссоциировапном состо-
янии молекула значительно более липофильна, чем в диссоциированном, и легко
112
проходит через мембрану. Это
утверждение базируется не толь-
ко на том, что коэффициент рас-
пределения молекул ИУК меж-
ду органическим растворителем
и водой возрастает при сниже-
нии pH, но также и на сильной
зависимости от pH скорости по-
ступления ИУК в клетки расте-
ний. В кислых клеточных стен-
ках (pH 5,5-6,0) 10-15% молекул
ИУК не диссоциировано и мо-
жет поглощаться клетками. В ци-
топлазме при pH 7,0-7,3 мень-
ше 1% молекул ауксина остает-
ся в иедиссоциированном состоя-
нии. Так как несущие электриче-
ский заряд диссоциированные мо-
лекулы ИУК не могут проникнуть
через мембраны, то в цитоплазме
ауксин оказывается в ловушке, и
его выход из клеток может про-
исходить только с помощью спе-
циального анионного переносчи-
ка. Авторы хемиосмотической ги-
потезы предположили, что поляр-
ный транспорт ауксина обеспечи-
вается полярным расположением
этого переносчика. Для базипе-
тального транспорта выход аукси-
на из клеток должен происходить
с базального конца, для акропе-
тального — с апикального.
Концентрационная зависи-
мость скорости поглощения 14 С-
ИУК клетками суспензионных
культур не имеет насыщения, по-
Рис. 8.17. Межклеточный транспорт ИУК по хемиосмо-
тическому механизму (по: Jones, 1998).
AUX1 — белок, транспортирующий ИУК в клетку,
PIN — белок, транспортирующий ИУК из клетки; стрелка-
ми указано направление транспорта
этому в течение длительного вре-
мени считалось, что для входа ауксина в клетки не нужен специальный переносчик.
Позднее все-таки удалось обнаружить насыщаемый компонент поглощения ауксина,
и в 1996 г. М. Беннет и его сотрудники описали мутант арабидопсиса auxl (auxin
resistant 1), который имеет сниженную геотропическую реакцию корней и слабо по-
глощает ИУК корнями.
Клонирование мутировавшего гена выявило интегральный мембранный белок,
похожий на пермеазы аминокислот. Белок AUX1 арабидопсиса (AtAUXl) состоит
из 485 аминокислотных остатков и имеет молекулярную массу 54 кД. Предполага-
ется, что AUX1 транспортирует вместе с ауксином протон и таким образом исполь-
зует энергию мембранного градиента pH. Поэтому происходящее при поглощении
113
ауксина подкисление цитоплазмы может объясняться не только слабокислотными
свойствами молекулы ИУК, но и котранспортом протонов.
Долгое время считалось, что вход ауксина в клетки не поляризован. Однако
недавно с использованием флуоресцентных антител было показано, что AUX1 рас-
пределен в плазматической мембране клеток нс равномерно, но имеет полярную
локализацию. В корнях арабидопсиса AUX1 находится в верхней (анатомически ба-
зальной) части клеток протофлоэмы, тем самым способствуя разгрузке ауксина,
поступающего по флоэме в корни. В клетках латеральной части корневого чехлика
и в эпидермальных клетках кончика корня AUX1, напротив, расположен внизу (в
анатомически апикальной части клеток). Таким образом, AUX1 способствует дви-
жению ауксина вниз по стеле корня и вверх по клеткам эпидермиса кончика корня.
Давно известно, что полярный транспорт
ауксина лимитируется не входом, а требую-
щим больших энергетических затрат выхо-
дом ауксина из клеток, который и подавля-
ют фитотропины. В 1998 г. сразу четыре ла-
боратории опубликовали результаты клониро-
вания переносчиков, транспортирующих ИУК
из клеток. У арабидопсиса это семейство бел-
ков было обозначено как PIN (pin-formed), так
как у мутантов по этим белкам формирова-
лись шпилькообразные побеги без листьев и
цветков (рис. 8.18). Кроме того, мутанты бы-
ли нечувствительны к фито тропинам и слабо
реагировали на гравистимуляцию. Белок At-
PIN1 состоит из 622 аминокислотных остатков
и имеет молекулярную массу 69 кД. Это инте-
гральный мембранный белок, полинептидная
цепь которого 12 раз пересекает плазматиче-
Рис. 8.18. Мутант pini арабидопсиса по СКУЮ мембрану. Трансмембранные участки со-
транспорту ауксина браны в два гидрофобных домена (но 6 участ-
ков в каждом домене), разделенных цитоплаз-
матическим гидрофильным доменом. Белок AtPIN2 на 64% идентичен AtPINl.
У него 10 трансмембранных участков, собранных в два домена, и он имеет зна-
чительное топологическое сходство с AtPINl.
Визуализация белков семейства PIN с помощью антител, меченных флуоресци-
рующими веществами, в сочетании с определением содержания ауксина в клетках
с помощью генетической конструкции DR5::GUS, имеющей ауксин-чувствительный
промотор DR5, позволили получить убедительные доказательства в пользу хемиос-
мотической гипотезы полярного транспорта ауксина. Во-первых, оказалось, что PIN,
как правило, находится только на одной из четырех сторон клетки, а, во-вторых, в
различных тканях и органах растений расположение PIN четко соответствует на-
правлению градиента ауксина.
Благодаря различной локализации белков семейства PIN возможен полярный
транспорт ауксина не только сверху вниз, но и в других направлениях. Например, в
кончиках корней локализованные в нижней части клеток стели P1N1, P1N4 и PIN7
направляют ауксин вниз по стели, а локализованный в верхней части клеток ко-
ры и эпидермиса P1N2 направляет ауксин наверх. Таким образом, направление по-
114
Рис.8.19. Полярные потоки аукси-
на в кончике корня арабидопси-
са, контролируемые белками-пере-
носчиками PIN1, PIN2. PIN3, PIN4
и PIN7 (по: Dhonukshe et al., 2005).
Стрелками указаны направления
транспорта ИУК
токов ауксина в кончике корня имеет форму пере-
вернутого зонтика (рис. 8.17 и 8.19). Переносчики
PINT, P1N4 и PIN7 формируют сложный узор пото-
ков ауксина в развивающихся зародышах. Различ-
ная локализация P1N1 в клетках туники и корпу-
са определяет направление потоков ауксина в апи-
кальной меристеме побега. Переносчик PIN3 спосо-
бен перераспределять потоки ауксина в латераль-
ном направлении. Он играет важную роль не толь-
ко в гравитропических реакциях, но и в росте нор-
мально ориентированных растений. Например, фо-
тоингибирование роста побегов в значительной сте-
пени связано со снижением латерального потока
ауксина и, как следствие, с уменьшением концен-
трации ауксина в клетках эпидермиса и коры, ко-
торые посредством тканевого натяжения контроли-
руют рост междоузлий.
В транспорте ауксина из клеток также участву-
ют фосфогликопротеипы PGP1 и PGP19, которые
интегрированы в мембрану и имеют по два АТФ-
связывающих домена. Таким образом, они относят-
ся к семейству ABC-транспортеров (ATP-binding
cassette).
Посредством полярного транспорта создаются
высокая концентрация и градиенты ауксина там,
где происходит морфогенез (апикальные меристе-
мы побега и корня, развивающиеся зародыши), что
дает основание рассматривать ауксин как морфо-
ген. С другой стороны, ауксин, безусловно, не мо-
жет считаться классическим морфогеном из теории самоорганизующихся систем,
так как градиент его концентрации возникает отнюдь не спонтанно, но благодаря
контролю расположения переносчиков ауксина в клеточных мембранах. Этот кон-
троль еще очень слабо изучен, однако уже известные факты показывают, насколько
он сложен.
Локализация переносчиков семейства PIN зависит от степени фосфорилирова-
ния белков. Мутант арабидопсиса rcnl, у которого повреждена серин-треониновая
протеинфосфатаза, быстрее транспортирует ауксин в корнях и побегах. Соответ-
ственно, мутант pid (pinoid), у которого мутирован ген, кодирующий специфическую
протеинкиназу, имеет подавленный полярный транспорт ауксина, что придает ему
фенотипическое сходство с pinl. Выход ауксина из клеток можно также подавить с
помощью ингибиторов протеинкиназ.
При изучении механизма нарушения транспорта ауксина у pid оказалось, что в
результате мутации происходит изменение ориентации белков P1N1 в апексе побега.
В норме PIN1 расположены в апикальной части клеток наружного слоя туники и
эпидермы листовых примордиев. У мутанта pid переносчик ауксина PIN1 меняет
ориентацию на противоположную и оказывается в нижней части клеток. Таким об-
разом, поток ауксина у мутанта направляется не наверх, в меристему побега, а вниз.
В результате верхушечная меристема оказывается обедненной ауксином, как и у му-
115
танта pinl, и не может сформировать примордии частей цветка и листья. Органоге-
нез у pid можно вызвать локальным нанесением ИУК на верхушку шпильковидного
побега.
Посредством сверхэкспрессии гена PID под контролем конститутивного промо-
тора 35S CaMV и эктопической экспрессии под контролем тканеспецифичных и ин-
дуцибельных промоторов удалось показать, что продукты гена PID могут влиять
на локализацию не только PIN1, но и других переносчиков ауксина этого семей-
ства. Трансгенные растения, несущие генную конструкцию 35S::PID, отличались
необычно высокой экспрессией PID в кончиках корней. В результате сверхэкспрес-
сии PID белки PIN, которые были локализованы в нижней части клеток корня,
меняют ориентацию на противоположную, то есть перемещаются в верхнюю часть
клеток. Такая переориентация переносчиков ауксина приводит к тому, что ауксин
активно отводится от кончика корня, содержание ауксина в апикальной меристеме
корня снижается в 2-3 раза, деление клеток прекращается и происходит их оконча-
тельная дифференцировка. Таким образом, сверхэкспрессия PID вызывает коллапс
апикальной меристемы корня.
Несмотря на обилие экспериментальных данных, касающихся PID, до сих пор
не предложено механизма действия этой протеинкиназы на полярный транспорт
ауксина, который удовлетворял бы всей имеющейся информации о PID. Многие
обнаруженные последствия изменения уровня экспрессии PID можно объяснить с
помощью модели, представленной Дж. Фримлом и соавторами (2004).
Согласно этой модели, в процессе локализации переносчиков PIN протеипкина-
за PID выполняет роль бинарного переключателя. В субоптимальной концентрации
PID направляет PIN в нижнюю часть клетки, а в сверхоптимальной — в верхнюю.
Возможно, что посредством дифференциальной экспрессии PID растения и могут
поддерживать разнонаправленные потоки ауксина даже в соседних рядах клеток,
как это наблюдается в кончиках корней и побегов. Общая картина явления услож-
няется также тем, что PID относится к генам первичного ответа на ауксин, то есть
Рис. 8.20. Циркуляция белков-переносчиков ауксина PIN1
между' плазмалеммой (а) и эндосомой (б), визуализирован-
ная с помощью флуоресцентных антител (по: Geldner et al.,
2001)
под действием ауксина уровень
экспрессии PID быстро уве-
личивается. По-видимому, из-
менение концентрации ауксина
может приводить к изменению
направления его транспорта.
Полярный транспорт аукси-
на подавляется грибным токси-
ном брефельдином А, ингиби-
рующим везикулярную секре-
цию. К. Пальме и его сотруд-
ники (2001), исследуя действие
этого ингибитора, обнаружили,
что PIN 1 постоянно циркулиру-
ет между плазматической мем-
браной и эндосомой - внутри-
клеточным компартментом, с
которым сливаются покрытые
клатрином эндоцитозные везикулы (рис. 8.20). Брефельдин А не препятствует ин-
тернализации (то есть погружению внутрь клетки) P1N1, но делает невозможным
116
его возвращение в плазматическую мембрану. Оказалось, что фитотропины также
подавляют процесс циркуляции переносчиков семейства PIN. Это заставило изме-
нить существовавшее десятилетиями представление о том, что фитотропины взаи-
модействуют с белком, который ассоциирован в мембране с переносчиком, транс-
портирующим ИУК из клетки. Хотя механизм действия фитотропинов остается
неизвестным, в настоящее время специфическое ингибирование фитотропинами по-
лярного транспорта ауксина связывают с сильной зависимостью этого процесса от
циркуляции переносящих белки PIN транспортных везикул, которую фитотропины
подавляют.
Переориентация PIN с помощью протеинкиназы PID происходит именно в про-
цессе везикулярной секреции. Об этом свидетельствует неспособность PID изменить
ориентацию PIN в присутствии ингибиторов везикулярной секреции. Несущие PIN
везикулы направляются к определенной стороне плазмалеммы по актиновым мик-
рофиламентам. Известно, что у животных направление этого транспорта может ре-
гулироваться степенью фосфорилирования специфических ассоциированных с мем-
бранами актин-связывающих белков. Возможно, что и у растений, как у животных,
направление транспорта везикул регулируется посредством фосфорилирования ка-
ких-то актин-связывающих примембранных белков.
Нарушение процесса везикулярной секреции, подобное тому, которое вызывает
брефельдин А, наблюдается у мутанта арабидопсиса дпот. Мутация затрагивает
структуру белкового фактора обмена гуаниновых нуклеотидов, связанного с малой
ГТФазой ARF-типа. Белок GNOM нужен для сборки белкового покрытия СОР-типа
на транспортных везикулах — процесса, необходимого для отпочковывания везикул
от материнской эндомембраны и для отбора их содержимого. Мутация дпот приво-
дит к нарушению полярного транспорта ауксина. В результате зародыши не могут
сформировать ось полярности и гибнут на ранних стадиях развития.
Полярный транспорт ауксина подавляется также цитохалазином D, разрушаю-
щим актиновые микрофиламенты. В присутствии цитохалазина D PIN1 оказывается
равномерно размещенным по всем сторонам клетки. Предполагается, что актино-
вый цитоскелет нужен либо для удержания переносчика ИУК в определенной части
плазмалеммы, либо для направления содержащих переносчик везикул в определен-
ную часть плазмалеммы.
Известно несколько маршрутов циркуляции переносчиков ИУК. Так, например,
PIN2 циркулирует между плазмалеммой и мультивезикулярными телами, тогда как
PIN3, подобно PIN1, направляется из плазмалеммы в эндосому. Кроме того, попу-
ляция молекул PIN2, но не PINT, в процессе циркуляции в значительной степени
разрушается протеасомой. Поэтому подавление активности протеасомы приводит к
накоплению в клетках полиубиквитинированных молекул PIN2. Переносчик AUX1
также подвергается рециклизации.
Циркуляция белков с полярной локализацией в плазматической мембране пред-
ставляет собой универсальное явление, характерное также для клеток млекопитаю-
щих и дрожжей. Возможно, что необходимость в процессе циркуляции вновь и вновь
определять локализацию белков обеспечивает высокую чувствительность процессов,
контролирующих полярность клеток, к изменениям внешней и внутренней среды.
Большая часть ауксина, синтезируемого в зрелых листьях, распределяется по
растению не посредством полярного транспорта, а по флоэме. Скорость такого типа
транспорта ауксина гораздо выше, чем скорость его полярных потоков. По флоэме
также перемещаются и связанные формы ИУК. Процессы полярного и флоэмного
117
транспорта ауксина осуществляются независимо друг от друга. Тем не менее, есть
основания предполагать, что флоэмный пул ИУК может поступать в систему актив-
ного транспорта ауксина и затехМ передвигаться по системе полярного транспорта,
однако возможность обратного перехода пока не доказана.
8.3. Механизм действия ауксина
Несмотря на множественность эффектов ИУК, первичные реакции, которые этот
гормон вызывает при взаимодействии с клетками-мишенями, практически во всех
случаях одинаковы и начинаются со связывания ауксина с рецептором. Последую-
щий ответ зависит от двух факторов: во-первых, от специализации клетки, опреде-
ляемой набором генов, которые экспрессируются в момент воздействия гормона, и,
во-вторых, от концентрации других сигнальных молекул. Одни клетки в ответ на
ауксин начнут расти растяжением, другие станут дифференцироваться и формиро-
вать сосуды, третьи -делиться и образовывать примордии боковых корней.
Мембранный механизм действия ауксина. В 1970 г. Д. Рейл и Р. Клиланд, а
в 1971 г. А. Хагер с коллегами на основании сходства действия на рост кислых буфер-
ных растворов (эффект «кислого роста») и ауксина высказали предположение, что
в механизме действия ИУК функции вторичного посредника могут выполнять ионы
Н+. Согласно их представлениям, ауксин индуцирует работу АТФазной протонной
помпы в клеточной мембране, в результате чего происходит подкисление фазы кле-
точных стенок, активация гидролитических ферментов и размягчение клеточной
стенки за счет гидролиза се полимеров. Включение Н+-помпы инициирует (в режи-
ме вторичного активного транспорта) поток осмотически активных веществ и воды
в вакуоль. Это приводит к увеличению размеров вакуоли и растяжению клетки.
Первые экспериментальные подтверждения способности ауксина индуциро-
вать транспорт ионов Н+ из растительных клеток были получены Р. Клиландом,
А. Хагером и В. В. Полевым в течение 1971-1973 гг. Они показали, что первичными
реакциями, вызываемыми ИУК, являются активация локализованной в плазмалем-
мс Н+-помпы и гиперполяризация мембранного потенциала. Многие исследователи
предпринимали попытки получить прямой эффект ИУК на Н+-АТФазу плазмалем-
мы; иногда эти попытки были успешными, но чаще нет.
Позже выяснилось, что более ранним эффектом, индуцируемым ИУК, является
активация анионных и кальциевых каналов плазмалеммы (рис. 8.21). Находящийся
в апопласте ауксин, вероятно, вначале активирует анионные каналы плазмалеммы,
что приводит вследствие выхода С1“ к деполяризации мембраны и активации по-
тенциал-зависимых Са2+-каналов. При этом одновременно активируются и рецеп-
тор-управляемые Са2+-канагы плазмалеммы. Увеличение содержания ионов Са2+
в цитоплазме активирует Са2+-зависимые К+-каналы, индуцирует выход из клетки
ионов К+ и гиперполяризацию плазмалеммы. Возрастание концентрации ионов К+
снаружи клетки активирует Н+-АТФазу, которая выкачивая из клетки ионы Н+
и генерирует на плазмалемме электрохимический градиент ионов водорода, служа-
щий источнике хм энергии для поступления ионов К+ в цитоплазму. Таким образом,
ИУК, по-видимому, стимулирует секрецию протонов не прямо, а через последова-
тельную активацию анионных, кальциевых и Са2+-зависимых К+-каналов плазма-
леммы.
Известный американский физиолог растений А. Теолоджист выделяет четыре
методических подхода, которые последовательно применялись при исследовании
118
Рис. 8.21. Мембранный механизм /действия ПУК.
ИМ — плазмалсмма, R-Ca24 -канал - рецеитор-управляемый Са2 1 -канал. Л -
канал — анионный канал, У-Са2 + -канал потенциал-зависимый Са24-канал,
К^-канал — Са24-активируемый К4-канал выходящего направления, К ^-ка-
нал — К 4-канал входящего направления
механизма действия ауксина: физиолого-биохимический анализ (с 1930-х гг.), ис-
пользование технологии рекомбинантных ДНК (с 1980 г.), углубленное изучение
модельного растения Arabidopsis thaliana (с 1985 г.) и применение инструментария
функциональной геномики (с 1990 г.). Современные методы включают: инсерцион-
ный мутагенез генов, определяющих первичные эффекты ауксина: физиолого-фе-
нотипический анализ полученных мутаций; сравнительный анализ глобального пат-
терна экспрессии генов у дикого типа и мутантов; анализ транскриптома и протеома
при различной силе гормонального сигнала; построение молекулярно-генетических
моделей трансдукции сигнала.
С использованием вышеупомянутого методического арсенала удалось уста-
новить, что наиболее ранние (первичные) реакции на ауксин проявляются на
уровне генома. Показано, что ИУК-индуцируемая транскрипция развивается быст-
рее (через 1-2 мин), чем ИУК-индуцируемая секреция ионов Н+ (через 10 мин).
Гены первичного ответа на ауксин. Конечным пунктом ауксинового сиг-
нала является геном. Установлено, что экзогенная ИУК может оказывать влияние
на экспрессию ряда генов уже через 2-3 мин. Такая высокая скорость активации
генов возможна только в том случае, когда имеются соответствующие транскрип-
ционные факторы. Гены, экспрессия которых стимулируется предсущсствующими
факторами транскрипции, называют генами первичного ответа, или ранними ге-
нами. Такое определение подразумевает, что весь набор белков, необходимый для
ИУК-индуцируемой экспрессии генов, присутствует в клетке в момент воздействия
гормона. Именно поэтому быстрая транскрипция генов не блокируется ингибиторОхМ
синтеза белков циклогексимидом. Время, необходимое для экспрессии ранних генов,
варьирует от нескольких минут до нескольких часов.
Гены первичного ответа на гормоны выполняют, как минимум, три функции. Во-
первых, они кодируют белки, регулирующие транскрипцию генов вторичного отве-
та (так называемых поздних генов), необходимых для формирования длительных
ответных реакций на гормон. Так как для поздних генов необходим синтез белков
de novo, их транскрипция снижается при обработке ингибиторами синтеза белка.
Во-вторых, ранние гены вовлекаются в процессы межклеточных взаимодействий.
И, наконец, в-третьих, обнаружена группа генов первичного ответа, которая связа-
на с процессами адаптации к стрессовым воздействиям. Выявлены десятки генов,
119
экспрессия которых активируется или подавляется при воздействии ИУК. Среди
них имеются гены первичного и вторичного ответа.
К наиболее хорошо изученным генам первичного ответа, экспрессия которых ин-
дуцируется ауксином, относятся гены семейства Aux/IAA. К генам, экспрессия кото-
рых изменяется уже через 2-15 мин после воздействия ауксина, относятся Auxl-б и
Аих9-Ц арабидопсиса, а также гены PS-IAA4, PS-IAA5 и PS-IAA6 (Pisum sativum-
IAA) гороха. К ранним ИУК-регулируемым генам относится семейство небольших
генов SAUR (small auxin upregulated-RNA), выделенных и клонированных у сои,
вигны, гороха и арабидопсиса. Хорошо исследованы также ранние ауксип-зависи-
мые гены семейства GH (glycinia hypocotyl) - GH2, GH3, GHJ, найденные у сои и
арабидопсиса.
В промоторной зоне генов первичного ответа найдены специфические консерва-
тивные последовательности нуклеотидов, называемые ауксин-отвечающими элемен-
тами (auxin response elements, AuxREs), с которыми связываются ИУК-зависимые
факторы транскрипции. В промоторной зоне гена GH3, например, идентифициро-
ван консервативный ауксипотвечающий элемент, состоящий из шести нуклеотидов
(5'-TGTCTC-3').
В ауксин-регулируемой транскрипции участвуют два семейства белков: ARF
(auxin response factor) и Aux/IAA белки (рис. 8.22). Белки ARF содержат ДНК-
связывающий домен, а также домены, обеспечивающие гомо- и гетеродимеризацию.
Узнавая на AuxRE сайты TGTCTC, ARF прямо связываются с ДНК и димеризу-
ются с последующей сборкой комплекса ДНК-РНК-полимераза II. У арабидопсиса
обнаружено 23 ARF, пять из которых функционируют как активаторы транскрип-
ции, в то время как остальные действуют как репрессоры.
ARF
Гомо- и гетеродимеризация
Связывание с ДНК
Aux/IAA
II III IV
Гомо-
димеризация
Гомо- и гетеродимеризация
Рис. 8.22. Строение белков ARF и Aux/IAA, участвующих в трансдукции ауксино-
вого сигнала (по: Leyser, 2002):
I -IV — функциональные домены
Белки Aux/IAA не имеют ДНК-связывающего домена, но обладают доменом,
обеспечивающим димеризацию и связывание с ARF. После связывания белков
Aux/IAA с ARF, происходит блокирование сборки прединициационного комплек-
са транскрипции на ДНК. У арабидопсиса найдено 29 белков Aux/IAA, которые
препятствуют ARF регулировать экспрессию ауксин-зависимых генов.
Рецепция и трансдукция ауксинового сигнала. Каким образом ауксино-
вый сигнал воспринимается клеткой и доходит до «нужных» генов? Первым ре-
альным кандидатом на роль рецептора ауксина был полипептид с молекулярной
120
массой ~22 кД, формирующий гомодимер и локализованный большей частью в эн-
доплазматическом ретикулуме. Этот белок получил название АВР1 (auxin-binding
protein 1). У кукурузы белки типа АВР1 кодируются пятью генами, а у арабидопси-
са—только одним. По своей структуре АВР1 — это гидрофильный гликопротеин с
сигнальной последовательностью на С-конце (KDEL: лиз-асп-глу-лей), характерной
для белков эндоплазматического ретикулума. С помощью кристаллографического
анализа выявлена даже трехмерная структура связывающего ауксины «кармана»
на АВР1. Однако реальная связь между АВР1 и ауксин-зависимой активацией генов
пока не установлена.
Лишь недавно удалось найти «основной» рецептор ауксина и проследить всю
цепь событий от связывания гормона до включения генов первичного ответа. В май-
ском номере журнала «Nature» за 2005 г. сразу две научные группы (С. Кепински
с коллегами из Великобритании и М. Эстель с коллегами из США) сообщили об
открытии нового рецептора ауксина. Одновременно в двух лабораториях было
установлено, что непосредственными рецепторами ауксина являются белки F-бокса
убиквитин-лигазного комплекса, в частности, TIR1 (transport inhibitor response 1).
Авторы показали, что TIR1 «узнает» и связывает in vitro Aux/IAA — репрессор аук-
синового сигнала, причем это связывание происходит только в присутствии актив-
ных ауксинов, но не их неактивных аналогов.
Для того, чтобы понять механизм передачи ауксинового сигнала, необходимо
проанализировать процессы внутриклеточного распада белков. Избирательная де-
градация белков в цитоплазме и нуклеоплазме происходит в протеасомах. Белки-ми-
шени, подлежащие деградации, метятся присоединением низкомолекулярного белка
убиквитина, а затем расщепляются в 26S протеасоме. Этот процесс требует работы,
как минимум, трех ферментов: убиквитин-активирующего фермента (Е1), убикви-
тин-конъюгирующего фермента (Е2) и убиквитин протеин-лигазы (ЕЗ). С помощью
убиквитин/268 протеасомного пути обеспечивается селективный протеолиз повреж-
денных и регуляторных короткоживущих белков.
За избирательное мечение белков убиквитином отвечает так называемый убик-
витин-протеин-лигазный комплекс SCF-типа (SKPl-cullin-F-box). У растений араби-
допсиса SCF-комплекс имеет консервативную структуру, включающую такие белки
как ASK 1/2 (Arabidopsis Skp-likel/2), CUL1 (куллин), RBX1 (ring-boxl), а также
белки F-бокса. Димер RBX1-куллин катализирует передачу активированного убик-
витина на белок-мишень. За специфичность выявления мишени отвечают белки
F-бокса, в частности белок TIR1.
На рис. 8.23 показан протеасомный механизм расщепления белка-репрессора аук-
синового сигнала —Aux/IAA. При низком уровне ауксина репрессор Aux/IAA фор-
мирует гетеродимер с ИУК-зависимым фактором транскрипции ARF, что блокиру-
ет экспрессию ауксин-зависимых генов. При повышении концентрации ИУК белок
F-бокса TIR1 метит ауксиновый репрессор Aux/IAA для убиквитинирования и по-
следующего протеолиза. После снятия репрессии гомодимеры или мономеры ARF
обеспечивают трансляцию ИУК-регулируемых генов.
Для окончательного доказательства рецепторной роли TIR1 соответствующий
ген арабидопсиса экспрессировали в гетерологичных системах: клетках насекомых
и яйцеклетках лягушки. Экстракты клеток, экспрессирующих TIR1, приобретали
способность образовывать TIR1-Aux/IAA комплекс (в присутствии ауксина), а так-
же специфически связывать радиоактивно меченую ИУК. Рассчитанная константа
диссоциации комплекса TIRl-ИУК оказалась, по данным разных лабораторий, в
121
Низкий уровень ИУК
Aux/IAA
Протеолиз Aux/IAA
Рис. 8.23. Схема гидролиза белка-репрессора ауксинового сигнала Aux/IAA (по:
Berleth et al., 2004):
ARF — ИУК-зависимый фактор транскрипции. U - убиквитин, Е1 — убиквитин-акти-
вирующий фермент, Е2 — убиквитин-конъюгирующий фермент, ЕЗ-- убиквитин-лигаза,
состоящая из белков: RBXI (белок RING-бокса), CUL1 (куллин), ASK 1/2 (Skp-подобный
белок арабидопсиса), TIR1 (рецептор ауксина), 26S — протеасома
пределах от 25 до 85 нмоль/л. Среди ряда аналогов природный ауксин ИУК имел
наибольшее сродство к рецептору.
В то же время инактивация гена TIR1 слабо отражалась на фенотипе соответ-
ствующих мутантов арабидопсиса, поэтому было предположено, что у арабидопсиса
существует не один белок, а целое семейство белков F-бокса — рецепторов ауксина.
Действительно, оказалось, что ряд гомологичных TIR1 белков, названных AFB-
белками (Arabidopsis F-box), также участвуют в рецепции ИУК. Эти белки локали-
зованы в основном в ядре, но отчасти и в цитоплазме. У мутантов по нескольким
генам рецепторов ауксинов наблюдаются характерные дефекты развития: замедля-
ется удлинение гипокотиля, ослабляются тропизмы, нарушается образование апи-
кального крючка. В корневой системе перестают формироваться боковые корни и
корневые волоски.
Таким образом, ряд белков F-бокса — компонентов убиквитин-лигазного ком-
плекса — являются внутриклеточными рецепторами ауксина. В присутствии аукси-
на они вызывают избирательную деградацию Aux/IAA репрессоров и тем самым
запускают процесс транскрипции генов первичного ответа на ауксин.
Следует отметить, что после открытия внутриклеточных рецепторов ауксина, от-
вечающих за процессы ауксин-регулирусмой транскрипции, исследование функций
ауксин-связывающего белка АВР1 продолжае г оставаться в поле интересов физио-
логов растений. Оказалось, что вновь открытые внутриклеточные рецепторы аук-
сина не способны обеспечить проведение всех сигналов, индуцируемых ауксином в
клетках растений. Показано, что ряд быстрых ауксин-зависимых реакций, таких
122
как изменение ионной проницаемости мембран или набухание протопластов, могут
быть элиминированы с помощью антител к АВР1. Различаются и ряды активности
ауксинов для двух его рецепторов: у TIR выше сродство к ИУК, а АВР1 активнее
связывается с 1-НУК. Многие исследователи полагают, что белок АВР1 может вы-
полнять функции рецептора ауксина, отвечающего за ряд мембранных эффектов
ИУК и воспринимающего гормон с наружной стороны плазмалеммы.
8.4. Физиологическая роль ауксина
ИУК является одним из основных гормонов высших растений и вызывает са-
мые разнообразные физиологические эффекты. Ауксин активирует деление и рас-
тяжение клеток, необходим для формирования сосудов и боковых корней, облада-
ет аттрагирующим эффектом (способностью притягивать питательные вещества).
Поступление ИУК в ткани околоплодника — необходимое условие для инициации
и формирования плода. Ауксин играет ключевую роль в ростовых движениях —
тропизмах и настиях, а также в регуляции роста клеток листа растяжением. Поляр-
ный транспорт ИУК обусловливает явление апикального доминирования, то есть
тормозящего влияния апикальной почки на рост пазушных почек, и обеспечивает
разметку и дифференцировку тканей в ходе онто- и морфогенеза.
ИУК присутствует практически во всех тканях растительного организма. В наи-
больших количествах этот фитогормон содержится в молодых почках и листьях,
цветках, камбии, проводящей системе, семенах. Синтез ИУК наиболее активно идет
в апикальных меристемах побегов, молодых листьях и развивающихся плодах. На
ювенильных этапах развития основным источником ИУК (как, вероятно, и других
фитогормонов) являются эндосперм и семядоли, которые обеспечивают гормонами
формирующуюся корневую систему и надземную часть растений.
Известный американский физиолог растений Р. Клиланд считает, что специфи-
ческие особенности ИУК, отличающие ее от других фитогормонов, хможно опи-
сать пятью эффектами: «1) индукция удлинения изолированных колеоптилей или
отрезков стебля, 2) индукция деления клеток в каллусной культуре в присут-
ствии цитокинина, 3) стимуляция образования боковых корней у стеблевых че-
ренков, 4) индукция роста партенокарпических плодов и 5) индукция образования
этилена».
Наиболее хорошо изученный эффект ауксина — активация роста растяжением
клеток колеоптилей и побегов. Этот эффект лучше проявляется в тканях, выросших
в темноте и наблюдается при обработке ИУК в концентрации 10-8—10-6 моль/л.
Более высокие концентрации ауксина вызывают торможение роста, которое в ряде
случаев может быть связано с активацией синтеза этилена. Следует также отметить,
что в тех концентрациях ауксина, при которых стимулируется рост побегов, сильно
подавляется рост корней.
Еще в 1934 г. Ф. Вснт установил, что обработка ауксином базальной части стебле-
вых черенков стимулирует корнеобразование. Этот эффект очень часто использует-
ся в современном растениеводстве и позволяет добиться укоренения таких черенков
(в частности, многих видов древесных растений), которые в обычных условиях не
укореняются.
Обработка цветков ряда видов растений БУК может приводить к завязыванию
плодов даже без опыления. К таким видам относятся томаты, перец, табак, ост-
ролист, инжир и ежевика. Плоды, завязавшиеся у этих видов путем гормональной
123
обработки без оплодотворения яйцеклетки, лишены семян. Таким образом, с помо-
щью ауксина можно вызвать партенокарпию, или девственное плодоношение.
Каким образом обеспечивается регуляция ауксином такого разнообразия процес-
сов роста и морфогенеза? Выше (глава 7) уже было указано на ряд факторов, кото-
рые могут быть причиной поливалентности в действии одного фитогормона. Наибо-
лее важным из них является компетентность тканей — то есть способность реаги-
ровать на фитогормон только тех клеток, у которых имеется достаточно рецепторов.
Чувствительность клеток к ИУК зависит от ее концентрации, сродства рецепторов к
ауксину, уровня других фитогормонов, сопряженности процессов рецепции и транс-
дукции гормонального сигнала с конкретными процессами роста и развития.
Глава 9
ГИББЕРЕЛЛИНЫ
Растения риса часто поражаются грибом-аскомицетом, половая форма которого
носит название Gibberella fujikuroi, а конидиальная — Fusarium moniliforme. Пора-
женные этим грибом молодые растения усиленно вытягиваются и полегают из-за
недостаточной жесткости стебля. Эта болезнь в Японии получила название «ба-
кане» («глупые ростки» — foolish seedlings).
В 1912 г. японский ботаник Савада высказал предположение, что симптомы это-
го заболевания обусловлены действием химического соединения, выделяемого гри-
бом. В 1926 г. его ученик Куросава установил, что активное вытягивание стебля
и полегание здоровых растений риса можно вызвать химическим веществом, со-
держащимся в культуральной жидкости, где выращивался гриб Gibberella fujikuroi.
В 1938 г. японские исследователи из Токийского университета Ябута и Сумики вы-
делили из культуральной жидкости два соединения, оказывавших сильное влияние
на рост в длину проростков риса, которые они назвали гиббереллинами А и В.
Из-за Второй мировой войны эти работы были прерваны и долгое время оста-
вались неизвестными для западных исследователей. Лишь в середине 1950-х годов,
когда две группы ученых из Великобритании и США обнаружили японские статьи
о гиббереллинах, эти работы были продолжены. Из фильтрата культуральной жид-
кости гриба Gibberella fujikuroi было выделено вещество, которое получило название
гибберелловая кислота. Ее структурную формулу установили в 1954 г. английские
биохимики Б. Кросс и Ф. Куртис. Приблизительно в то же время сотрудники Токий-
ского университета Такахаши и Тамура из комплекса гиббереллинов А выделили три
вида гиббереллинов — Ai, А 2 и Аз- Гиббереллин Аз оказался идентичен гибберелло-
вой кислоте, полученной английскими биохимиками Б. Кроссом и Ф. Куртисом.
В культуральных жидкостях грибов можно найти практически весь спектр гиб-
береллинов, однако доминирующей почти всегда является гибберелловая кислота
(ГК). Вскоре гиббереллины были обнаружены и в самих грибах, и в тканях незара-
женных растений. В 1956 г. М. Рэдли в Англии, а также К. Вэст и Б. Финни в США
обнаружили вещества со свойствами гиббереллинов в семенах высших растений.
Дальнейшее развитие исследований гиббереллинов как фитогормонов определи-
ло открытие, сделанное в 1956 г. американским физиологом А. Лангом. Он уста-
новил, что ряд розеточных растений, которым для зацветания необходимы низкие
положительные температуры и длиннодневный световой период, формируют цвето-
нос и цветки в неиндуктивных условиях, если их обработать гиббереллином. Таким
образом, А. Ланг впервые показал, что гиббереллины, как и условия среды, могут
оказывать влияние на развитие растительного организма.
125
Открытие А. Лангом уникальных свойств гиббереллинов явилось мощным ар-
гументом в поддержку гормональной теории цветения, выдвинутой отечественным
ученым М. X. Чайлахяном. Еще в 1937 г. М. X. Чайлахян высказал гипотезу, соглас-
но которой растения обладают гормональным комплексом цветения - «флориге-
I ном», который, формируясь при наличии соответствующих внешних условий, пе-
’ реключает вегетативный этап развития растений на генеративный. После открытия
А. Лангом гормональных свойств гиббереллинов М. X. Чайлахян выдвинул предпо-
ложение о том, что именно гиббереллины являются определяющим элементом фло-
ригена. Концепция флоригена явилась очень продуктивной основой, позволившей
в дальнейшем подойти к расшифровке общих принципов и конкретных механизмов
формирования органов генеративного развития растений.
Первый «растительный» гиббереллин, который оказался идентичным гиббе-
реллину ГА1, полученному ранее из гриба G.fujikuroi, был выделен в 1958 г.
Дж. МакМилланом из незрелых семян фасоли Phaseolus coccineus. Поскольку со-
держание гиббереллинов в растениях невелико (от нанограммов до нескольких мик-
рограммов в 1 г биомассы), для получения ГА1 Дж. МакМиллану с сотрудниками
пришлось использовать несколько килограммов семян.
Начиная с 1970-х гг., основным способом идентификации гиббереллинов в очи-
щенных препаратах растительных тканей является комбинированный метод газовой
хроматографии и масс-спектрометрии (GC-MC). Для выделения из растений гиббе-
реллинов чаще всего используют незрелые семена, в которых их уровень наиболее
высок.
В связи с большим количеством гиббереллинов их стали обозначать буквами ГА
(в англоязычной литературе GA) или просто А с цифрой справа внизу - порядко-
вым номером, который присваивается каждому новому соединению. Согласно этой
номенклатуре, например, наиболее активные формы гиббереллинов обозначаются
как Ai (ГА1), А4 (ГА4) и Аз (ГА3). Гиббереллин ГА3 (Аз) называют гибберелловой
кислотой.
Наличие гиббереллинов показано для 128 видов растений, 7 видов грибов и 7
видов бактерий. В растениях наиболее широко распространенным гиббереллином
является ГА1 (выявлен у 86 видов). Гиббереллин ГА4 найден у 54, а гибберелловая
кислота (ГАз) у 45 видов высших растений. В грибах выявлено 27 видов гибберел-
линов; у бактерий обнаружены, в основном, только физиологически активные (для
растений) формы ГА], ГА3, ГА4.
Для экзогенной обработки растений обычно применяют гибберелловую кислоту
(ГК). Однако реакция растений на отдельные гиббереллины может быть видоспеци-
фичной. В частности, многие растения из семейства тыквенных Cucurbitaccae слабо
реагируют на воздействие ГК, но очень чувствительны к гиббереллинам ГА4 и ГА7.
Из девяти гиббереллинов (ГА]— ГА9) только ГА7 индуцировал цветение смолевки
Silene armeria в условиях короткого дня. Поэтому необходимо обязательно учиты-
вать специфичность отдельных гиббереллинов в отношении определенных видов
растений.
9.1. Метаболизм гиббереллинов
Гиббереллины — это дитерпеноиды, имеющие энт-гиббереллановый скелет из
четырех колец с карбоксильными группами в положениях 7 и 19 (рис. 9.1). У расте-
ний и грибов найдено уже более 125 таких соединений. Общим предшественником
126
энл>гиббереллан
ГА3
Рис. 9.1. Биологически активные гиббереллины (ГА], ГАз, ГЛ4 и ГА7) — химические
производные э?<т-гиббереллана — и их общий метаболический предшествен-
ник альдегид ГА 12
всех гиббереллинов является альдегид ГА]2, посредством окисления которого и воз-
никает богатый спектр этих соединений. Альдегид ГА 12 подвергается следующим
окислительным преобразованиям:
1) С-7 альдегидная группа у всех гиббереллинов окисляется до карбоксильной
группы;
2) С-20 метильная группа окисляется до спиртовой, альдегидной или карбок-
сильной, а также исключается из молекулы в виде СО2, что приводит к превраще-
нию С2о-гиббереллинов в С19-гиббереллины;
3) происходит гидроксилирование колец в положениях 1, 2, 3, И, 12, 13, 15;
4) происходит десатурация связей 1- 2 или 2- 3, а также эпоксидация двойной
связи в положении 2-3.
Из всего многообразия гиббереллинов только четыре (ГА1, ГАз, ГА4 и ГА7) ак-
тивны в классических биопробах на гиббереллины. Они возвращают нормальные
размеры карликовым мутантам гороха, стимулируют секрецию а-амилазы из эндо-
сперма ячменя, в условиях короткого дня вызывают выход в стрелку длишюдневных
розеточных растений, таких как шпинат и смолевка. Тем не менее нельзя исключить,
что другие гиббереллины являются нс только предшественниками или метаболита-
ми активных гиббереллинов, но и выполняют особые функции в регуляции роста
и развития растений. Сравнив формулы альдегида ГА12 и биологически активных
гиббереллинов (рис. 9.1), можно понять, что для их образования необходимо окис-
ление С-20 метильной группы и исключение С-20 с образованием 7-лактона между
С-19 и С-10, а также гидроксилирование кольца А в положении С-3.
Фитопатогснные грибы, например Gibberella fujikuroi, накапливают в основном
ГАз, тогда как у растений этот гиббереллин, а также ГА7, тоже содержащий двой-
ную связь, встречаются довольно редко и в небольших количествах. У большинства
растений преобладают ГА] и ГАд. В 1 г растительной ткани в среднем содержит-
ся несколько нанограммов гиббереллинов. Особенно богаты гиббереллинами как в
количественном, так и в качественном отношении формирующиеся семена. Среди
вегетативных тканей растений самым высоким содержанием гиббереллинов отлича-
ются молодые листья и междоузлия.
Биосинтез гиббереллинов. Элементарным структурным блоком гибберелли-
нов, как и всех изопреноидных соединений, является изопрен в форме своих произ-
водных: изопентенилдифосфата и диметилаллилдифосфата, которые синтезируют-
ся в цитоплазме по мевалонатному пути либо в пластидах по дезоксиксилулозному
пути (см. гл. 10). Дитерпен геранилгеранилдифосфат синтезируется в пластидах из
диметилаллилдифосфата и трех молекул изопентенилдифосфата (рис. 9.2). Соеди-
нение Сб-изопреновых блоков происходит в порядке «голова к хвосту». Интермеди-
атами синтеза дитерпенов являются монотерпен геранилдифосфат и сесквитерпен
фарнезилдифосфат.
5
4
"голова" "Хвост"
изомераза
5
"голова" -хвост"
копал ил-
дифосфат-
синтаза
РР,
энт-каурен-
синтаза
энт-каурен копалилдифосфат
Рис. 9.2. Реакции синтеза дитерпена геранил геранилдифосфата и его циклизации в
энт-каурен
Дитерпен геранилгеранилдифосфат — общий предшественник гиббереллинов,
каротиноидов и спирта фитола, входящего в состав хлорофиллов. Путь, ведущий
к гиббереллинам, начинается с двухэтапной циклизации геранилгеранилдифосфата
(рис. 9.2), которая осуществляется в пропластидах при участии ферментов семей-
ства терпеновых циклаз. Вначале под действием копалилдифосфат-синтазы замы-
каются кольца А и В. Затем под действием энт-каурен-синтазы продукт этой цик-
лизации копалилдифосфат превращается в э?*т-каурен — один из стереоизомеров
каурена. Многие синтетические ретарданты, например хлорхолинхлорид, подавля-
ют синтез гиббереллинов на стадии циклизации геранилгеранилдифосфата.
Далее энт-каурен окисляется в положении С-19 и С-7, в результате чего обра-
зуется альдегид ГА12 (рис. 9.3). Вначале при участии каурен-оксидазы происходит
окисление метильной группы в положении С-19 до спиртовой (энт-кауренол), альде-
гидной (энт-кауреналь) и, наконец, карбоксильной (эшп-кауреновая кислота). Ло-
128
эмп-каурен энлт-кауремол
альдегид ГА,2 энл?-7-гидроксикауреновая кислота
Рис. 9.3. Окисление энт-каурена до альдегида ГЛ 12
энт-кауреновая кислота
кализация каурен-оксидазы точно не установлена, но есть основания полагать, что
этот фермент связан с поверхностью наружной мембраны оболочки хлоропластов.
Затем энт-кау реновая кислота гидроксилируется в положении С-7 кольца В при
участии оксидазы энт-кауреновой кислоты. Последующее гидроксилирование в по-
ложении С-6 приводит к спонтанному сужению кольца В и образованию альдегида
ГА 12- Оксидаза энт-кауреновой кислоты связана с мембранами эндоплазматической
сети.
Таким образом, для превращения в альдегид ГА 12 высокогидрофобный энт-
каурен должен быть транспортирован из пластид в цитоплазму. Каурен-оксидаза
и оксидаза знт-кауреновой кислоты относятся к монооксигеназам семейства ци-
тохрома Р450. Окисление субстрата молекулярным кислородом сопряжено у этих
ферментов с окислением косубстрата НАДФ • Н и образованием воды.
Синтез гиббереллинов вплоть до образования альдегида ГА12 происходит одина-
ково у всех организмов. Дальнейшие преобразования могут осуществляться различ-
ными путями. Так, для многих фитопатогенных грибов, например Giberella fujicuroi,
характерно раннее 3,/3-гидроксилирование (рис. 9.4) с превращением альдегида ГА12
в альдегид ГА14. Затем происходит окисление альдегида до ГА14, который подвер-
гается С-20 окислению, последовательно превращаясь в ГА37, ГАзб и, наконец, в
биологически активный С 19-гиббереллин ГА4. Далее в результате десатурации свя-
зи 1-2 и 13,/3-гидроксилирования образуется ГА3 — основной активный гиббереллин
G. fujicuroi. Кроме того, в небольших количествах синтезируется ГА1 как продукт
13,/3-гидроксилирования ГА4. Все реакции этого пути катализируются связанными
с эндомембранами монооксигеназами семейства цитохрома Р450, использующими
НАДФ-Н в качестве косубстрата.
У растений обычно вначале происходит окисление альдегида ГА12 до ГА12 при
участии монооксигеназы семейства цитохрома Р450 (рис. 9.5). Дальнейшее окисле-
ние ГА12 может осуществляться по пути раннего 13,/3-гидроксилирования, приво-
дящему к образованию активного гиббереллина ГА1, и по пути, в котором 13,/3-
гидроксилирования не происходит, приводящему к образованию активного гиббе-
129
соонсно
альдегид ГА„
НО” \
СООН СН0
альдегид ГА14
Рис. 9.4- Биосинтез биологически активных гиббереллинов из альдегида ГЛ 12 у фи-
топатогенного гриба Gibberella fujikuroi
реллина ГА4. Растения различаются по соотношению ГА4/ГА1 в результате преоб-
ладания того или иного пути биосинтеза гиббереллинов. Например, у риса, гороха
и салата количественно преобладает ГА1, а у арабидопсиса и огурца — ГАд.
Гидроксилирование в положении С-13, приводящее к превращению ГА12 в ГА53,
так же как и окисление альдегидной группы в положении С-7, происходит при уча-
стии монооксигеназ семейства цитохрома Р450. Все остальные реакции окисления
ГА12 и ГА53 катализируются диоксигеназами. Эти растворимые цитоплазматиче-
ские ферменты содержат негемовое железо. Для окисления субстрата с помощью
О2 этим ферментам в качестве косубстрата необходима а-кетоглутаровая кислота,
которая в процессе реакции окисляется до янтарной кислоты.
Под действием С-20 оксидаз происходит окисление С-20 вплоть до его исключе-
ния в виде СО2. На этом пути метильная группа вначале окисляется до спиртовой.
Гиббереллины ГА15 и РА44, содержащие в положении С-20 группу -СН2ОН, мо-
гут существовать как в форме свободных спиртов, или открытых лактонов, так и
в форме J-лактонов. Лактоны представляют собой внутримолекулярные сложные
эфиры, которые у гиббереллинов образуются в результате взаимодействия карбок-
сильной группы в положении С-19 и спиртовой группы, находящейся по отношению
к ней в (^-положении (С-20) или в 7-положении (С-10). Гиббереллины ГА15 и ГА44
в форме tf-лактонов малодоступны для дальнейшего окисления С-20-оксидазой. В
форме открытого лактона спиртовая группа в положении С-20 окисляется до альде-
гидной, дальнейшее окисление которой приводит к выделению СО2 и образованию
7-лактона, соединяющего С-19 и С-10 (рис. 9.5).
В качестве побочного продукта окисления альдегидной группы образуются три-
130
Рис. 9.5. Пути биосинтеза гиббереллинов из альдегида ГЛ12 у растений
карбоновые кислоты (ГА25 из ГА24, ГА17 из ГА19). Эти вещества не могут быть пре-
вращены в биологически активные гиббереллины. Обычно их очень мало. Исклю-
чение составляют семена тыквы, в которых накапливаются такие трикарбоновые
гиббереллины как ГА13, ГА 17, ГА25 и ГА43. Таким образом, в результате активности
С-20-оксидаз происходит не только постепенное окисление С-20, но и превращение
Сго-гиббереллинов в С 19-гиббереллины ГА9 и ГА20 (рис. 9.5).
Последний этап на пути синтеза биологически активных гиббереллинов состоит в
3,/3-гидроксилировании, приводящем к превращению ГА20 в ГАца ГА9 в ГАд. Эти ре-
акции катализируют 3,/3-гидроксилазы. Благодаря наличию у 3,/3-гидроксилаз так-
же и десатуразной активности в процессе окисления С 19-гиббереллинов ГА9 и ГА20
в небольших количествах, в качестве побочных продуктов, образуются ГА7 и ГАз,
соответственно (рис. 9.5). Гидроксилирование в положении С-2, которое осуществ-
ляется под действием 2,/3-гидроксилаз, приводит к необратимой инактивации гиббе-
131
реллинов. Такому гидроксилированию могут подвергаться не только активные гиб-
береллины, но и их метаболические предшественники. Диоксигеназы, катализирую-
щие С-2-гидроксилирование, наиболее активны по отношению к С 19-гиббереллинам,
но могут окислять и С2о-гиббереллины.
Регуляция биосинтеза гиббереллинов прежде всего осуществляется самими гиб-
береллинами по механизму отрицательной обратной связи. При обработке растений
ГА] происходит снижение активности С-20-оксидазы, а также 3,Д гидроксилазы и
2,/?-гидроксил азы. У мутантов с подавленной активностью 3,Д гидрокси л азы (dwarf1
кукурузы, 1е гороха) происходит накопление С 19-гиббереллина ГА20 и снижение со-
держания Сго-гиббереллина ГА 19. Таким образом, у этих мутантов со сниженным
уровнем активного гиббереллина ГА1 стимулируется С-20-окисление.
Изучение мутантов по чувствительности к гиббереллинам доказало, что нега-
тивная обратная связь между содержанием активных гиббереллинов и скоростью
их биосинтеза достигается на уровне трансдукции гиббереллинового сигнала. По-
этому у гиббереллин-нечувствительных мутантов, например у dwarf8 кукурузы и
gai арабидопсиса, этот механизм обратной связи не работает. В результате они на-
капливают ГА1 в десятки раз больше, чем растения с нормальной чувствительно-
стью к гиббереллинам. Синтез гиббереллинов у этих мутантов ускоряется на стадии
С-20 окисления, поэтому нечувствительные к гиббереллинам мутанты кроме ГА1
накапливают С 19-гиббереллин ГА20 и имеют мало С2о-гиббсреллина ГА19. Сверх-
чувствительные к гиббереллинам мутанты, например slender ячменя и la cry3 горо-
ха, накапливают С2о-гиббереллины и имеют мало С 19-гиббереллинов, так как у них
усилено подавление активности С-20-оксидаз по механизму обратной связи.
ГА29 ГАд
Рис. 9.6. Действие ИУК на синтез гиб-
береллинов в проростках гороха
Фитогормон ауксин ускоряет биосинтез
гиббереллинов. Механизм его действия наи-
более полно изучен на проростках гороха
(рис. 9.6). Действие ИУК проявляется прежде
всего в увеличении активности С-20-оксидаз,
что приводит к возрастанию содержания С 19-
гиббереллина ГА20 и снижению содержания
Сго-гиббереллина ГА19. Кроме того, ИУК уве-
личивает активность 3,/?-гидроксил азы, превра-
щающей ГА2о в ГА1, и ингибирует активность
2, Д гидроксил аз, необратимо инактивирующих
гиббереллины, превращая ГА20 в ГА29, а ГА1 в
ГАд.
Конъюгация гиббереллинов. Регуляция уровня активных гиббереллинов мо-
жет также достигаться за счет их конъюгации с глюкозой. Известны конъюгаты
двух типов: 1) глюкозиды, которые образуются при посредстве -ОН группы в поло-
жениях 2, 3, 11 или 13 (рис. 9.7), и 2) глюкозные эфиры, образующиеся в результате
присоединения остатка глюкозы к -СООН группе в положении С-7. Все конъюга-
ты неактивны, однако могут быть гидролизованы при участии Дглюкозидаз, что
наблюдается при прорастании семян.
Катаболизм гиббереллинов. Изменение уровня гиббереллинов в тканях рас-
тений может происходить за счет их катаболизма под действием 2, Д гидроксилаз
(см. рис. 9.5). Вначале осуществляется гидроксилирование кольца А в положении
С-2, затем гидроксильная группа окисляется до кетонной и, наконец, наблюдается
десатурация связи 1-10, сопровождающаяся раскрытием 7-лактона. Механизм де-
132
Рис. 9.7. Конъюгаты гиббереллинов с глюкозой
глюкозный эфир ГАд
сатурации энт-гибберелланового скелета, отличающегося высокой метаболической
устойчивостью, изучен недостаточно. Эффективность катаболических процессов в
регуляции уровня свободных гиббереллинов доказывается, в частности, тем, что у
мутантов с нарушенной функцией 2,/3-гидроксилаз, например у sin гороха, содер-
жание ГА1 многократно возрастает.
Регуляция метаболизма гиббереллинов в процессе развития растений и
под действием внешних факторов. Наиболее изучены изменения метаболизма
гиббереллинов во время светозависимых реакций, таких как прорастание мелких се-
мян, деэтиоляция проростков, вытягивание побегов при затенении, выход в стрелку
длиннодневных розеточных растений, клубнеобразование у короткодневных сортов
картофеля.
Многие мелкие семена, например семена салата и арабидопсиса, плохо прораста-
ют в темноте. Чтобы индуцировать их прорастание, достаточно короткого импульса
красного света, который можно заменить обработкой гиббереллинами. Анализ со-
держания гиббереллинов показал, что светозависимому прорастанию семян салата
предшествует значительное накопление ГА1 в результате возрастания активности
3,/3-гидроксилазы. У арабидопсиса активация светом 3,/3-гидроксилазы приводит к
накоплению ГА4.
Процесс деэтиоляции наиболее полно изучен у проростков гороха, при освещении
которых уже через 2 ч снижается содержание ГА1 в результате подавления актив-
ности 3,/3-гидроксилазы и стимуляции активности 2,/3-гидроксилазы. Вытягивание
междоузлий при затенении («реакция избегания тени») вегетирующих растений го-
роха, капусты и лотоса связано с многократным возрастанием содержания в побегах
ГА1 и ГА3. Поскольку при этом также происходит накопление ГА20, то, следова-
тельно, ускорение биосинтеза активных гиббереллинов при затенении происходит
на стадии С-20 окисления.
Фотопериодизм цветения многих растений и клубнеобразования картофеля, то
есть зависимость этих процессов от продолжительности светлого и темного перио-
да суток, достигается при участии гиббереллинов. Особенно ярко проявляется роль
гиббереллинов в индукции цветения облигатно длиннодневных растений. Она изуче-
на на примере реакции выхода в стрелку розеточных растений шпината и смолевки.
У этих растений в условиях индуктивного длинного дня в листьях многократно воз-
растало содержание С 19-гиббереллинов ГА20 и ГА1 за счет активации С-20-оксидаз.
У арабидопсиса, цветение которого лишь факультативно зависит от длины дня,
выходу в стрелку предшествует увеличение ГА1 и ГАд в листьях на 40%. Гибберел-
лины также участвуют в процессе вернализации — индукции раннего цветения под
133
воздействием низких положительных температур. У ярутки в ходе вернализации в
верхушках побегов возрастает скорость окисления каурена и кауреновой кислоты
связанными с мембранами монооксигеназами.
У сортов картофеля Solanum tuberosum ssp. andigena в условиях длинного дня не
формируются клубни. В этих условиях в результате активации С-20 окисления в ли-
стьях синтезируется много ГА], который транспортируется в столоны и ингибирует
клубнеобразован ие.
9.2. Механизм проведения гиббереллинового сигнала
Для анализа механизма передачи гиббереллинового сигнала обычно применяют
следующие методические подходы:
1) использование клеток алейронового слоя зерновок злаков;
2) использование мутантов с измененными ответными реакциями на гибберел-
лины;
3) получение и использование трансгенных растений, в которых происходит или
сверхэкспрессия гиббереллин-зависимых генов-мишеней, или их замолкание. Этот
подход удалось осуществить в отношении таких генов как PH0R1 (photoperiod-
responsive 1) у картофеля, KNOX (KNOTTED-like НОМЕОВОХ) у табака, а также
RGA1 (repressor of gal), AGL20 (AGAMOUS-like 20) и SUPERMAN у арабидопсиса.
Действие гиббереллинов на алейроновый слой эндосперма злаков. Ос-
новным объектом в физиологических и молекулярно-генетических исследованиях
механизма действия гиббереллинов служит изолированный алейроновый слой кле-
ток эндосперма злаков. Главной моделью, которую используют для выяснения моле-
кулярного механизма действия гиббереллинов, является процесс синтеза и секреции
алейроновым слоем а-амилазы — фермента, расщепляющего крахмал.
Алейроновый слой составляют клетки, окружающие крахмалистый эндосперм и
содержащие алейроновые зерна с белками (рис. 9.8). В ходе прорастания зерновки и
на ранних этапах развития проростка под действием гиббереллинов происходит ак-
тивация ферментов, которые гидролизуют крахмал и запасные белки эндосперма.
В результате образуется много растворимых сахаров и аминокислот, перемещаю-
щихся к зародышу.
Следует особо отметить, что ГК стимулирует синтез и секрецию только
СЕ-амилазы. Другие гидролазы (например рибонуклеаза, /3-1,3-глюканаза) синтези-
руются в алейроновом слое независимо от гиббереллина, который контролирует
только процесс их секреции клетками алейронового слоя в эндосперм. Эти фак-
ты свидетельствуют о том, что процессы синтеза гидролитических ферментов и их
секреции регулируются независимо друг от друга.
Гидролиз крахмала осуществляется а- и /3-амилазами. Продуктом гидролиза
СЕ-амилазы являются олигосахариды, состоящие из остатков глюкозы; /3-амилаза
расщепляет эти олигосахариды до дисахарида мальтозы, которая под действием
мальтазы превращается в глюкозу. Фермент а-амилаза секретируется в крахмали-
стый эндосперм как алейроновым слоем клеток, так и щитком (семядолей зародыша
злаков, которая граничит с эндоспермом зерновки). На рис. 9.8 приведена вероят-
ная последовательность процессов, регулируемых гиббереллином в ходе прораста-
ния зерновки ячменя.
Получены убедительные доказательства того, что именно ГК обеспечивает ре-
гуляцию экспрессии гена а-амилазы. В промоторной зоне гена о-амилазы ря-
134
Рис. 9.8. Последовательность процессов, регулируемых гиббереллинами в ходе прорастания семян
ячменя (по: Jones, McMillan, 1984): гиббереллины, синтезируемые в колеоптиле и щитке за-
родыша (1), транспортируются в крахмалистый эндосперм и далее в алейроновый слой зер-
новки (2); в клетках алейронового слоя под влиянием гиббереллинов индуцируется синтез
Q-амилазы и других гидролаз, секретирующихся в эндосперм (3); крахмал и другие макро-
молекулы расщепляются до растворимых олигомеров (4), которые поглощаются щитком (5)
и поступают в зародыш. На фотографии показаны клетки алейронового слоя, содержащие
белковые тела и окруженные толстыми клеточными стенками
135
Гиббереллин-отвечающий
элемент
\__________________
днк::::________м
Пиримидиновый ТААСААА- ТАТССАС-
бокс бокс бокс
I_____________________I
Гиббереллин-регулируемый
ген а-амилазы
ТАТА
Начало
транскрипции
комплекс
Рис. 9.9. Строение промоторной зоны гена а-амилазы (по: Jacobsen et al., 1995)
да злаков выделена консервативная последовательность из 200-300 пар нуклео-
тидов, которая обеспечивает специфичность к ГК и необходима для регуля-
ции гиббереллинами экспрессии гена а-амилазы (рис. 9.9). Этот участок называ-
ют гиббереллин-регулируемым комплексом — GARC (gibberellic acid response com-
plex). В него входят три специфические нуклеотидные последовательности (бокса),
необходимые для гиббереллинового ответа - пиримидиновый бокс, ТААСААА- и
ТАТССАС-последовательности. За чувствительность гена а-амилазы к ГК отвечает
ТААСААА-бокс, который получил название гиббереллин-отвечающего элемента -
GARE (gibberellic acid response element). GARE самостоятельно может обеспечи-
вать чувствительность гена а-амилазы к ГК. Два других бокса — пиримидиновый
и ТАТССАС — также необходимы для полноценного ответа на гиббереллин. Эти
Часы после обработки ГК
Рис. 9.10. Динамика образования MYB-мРНК (а) и
мРНК а-амилазы (б) под влиянием ГК (по: Gubler
et al., 1995)
три бокса, объединенные в GARC,
и являются мишенью соответствую-
щих факторов транскрипции, образу-
ющихся в ответ на гиббереллин. Необ-
ходимо отметить, что процессы экс-
прессии генов, везикулярной секре-
ции и отмирания клеток в алейроно-
вом слое зерновок злаков контроли-
руются парой фитогормонов — гиббе-
реллином и абсцизовой кислотой.
Одним из ранних генов, акти-
вируемых гиббереллинами, являет-
ся ген MYB, кодирующий ДНК-
связывающие белки, которые отно-
сятся к семейству MYB-белков. Эти
факторы транскрипции регулируют
процессы роста и развития у на-
секомых, дрожжей и растений. На
рис. 9.10 показано влияние ГК на
транскрипцию генов, кодирующих
MYB-белок и а-амилазу. Можно видеть, что процесс образования транскриптов
МУВ-гена значительно опережает синтез мРНК а-амилазы, поэтому предполага-
ется, что именно MYB-белок является тем транскрипционным фактором, который
связывается с промотором гена а-амилазы и запускает синтез этого фермента. Ме-
стом взаимодействия MYB-белка с промоторной частью гена а-амилазы является
GARC-последовательность нуклеотидов (см. рис. 9.9).
136
Следует отметить, что MYB-белки участвуют в регуляции экспрессии и других
генов, контролируемых ГК, например генов, кодирующих ряд ферментов синтеза
антоцианов. К числу таких ферментов относятся халконсинтаза, халконизомераза
и дегидрофлавонол-4-редуктаза. Однако пока не получены доказательства участия
продуктов MYB-генов в регуляции удлинения стебля и цветения - самых характер-
ных эффектов, вызываемых гиббереллинами в растениях.
Участие ионов Са2+ в передаче гиббереллинового сигнала. Важным эле-
ментом проведения гиббереллинового сигнала являются ионы Са2+. Через 1-4 ч по-
сле обработки ГК концентрация ионов Са2+ в цитоплазме клеток алейронового слоя
возрастает. Полагают, что ионы Са2+ и кальций-связывающий белок кальмодулин
участвуют в гиббереллин-индуцируемой секреции а-амилазы и других гидролаз.
В 1996 г. С. Гилрой предположил, что ГК-индуцируемая экспрессия гена а-амилазы
не зависит от ионов Са2+, в то время как ГК-активируемая секреция а-амилазы
осуществляется кальций-зависимым путем.
На рис. 9.11 представлен механизм регуляции синтеза а-амилазы в клетках
алейронового слоя ячменя гиббереллином. Гиббереллины, образующиеся в заро-
дыше, связываются с рецепторами, находящимися на поверхности плазматической
мембраны клеток алейронового слоя (1). Комплекс ГК-рецептор взаимодейству-
ет с G-белком (2), от которого далее гиббереллиновый сигнал передается дву-
мя путями. В кальций-независимом пути (3) происходит образование еще одного
ГК-активируемого сигнального посредника (4), который связывается с белком-ре-
прессором (5) и инактивирует его. Инактивация репрессора позволяет экспресси-
роваться гену MYB (6). На образующихся транскриптах происходит синтез ГК-
зависимого MYB-белка (7), который связывается с промотором гена а-амилазы (8)
и активирует образование а-амилазных мРНК (9). Белки а-амилазы синтезируются
на шероховатом эндоплазматическом ретикулуме (10) и секретируются в пузырьках
аппарата Гольджи в эндосперм (11). Са2+-кальмодулин-зависимый путь передачи
сигнала (12) необходим для активации гиббереллином процесса секреции клетками
алейронового слоя а-амилазы и других ферментов.
Мутанты с повреждением ответных реакций на гиббереллин. Как уже
упоминалось выше, весьма эффективным способом выявления возможных рецепто-
ров ГК и механизма передачи гиббереллинового сигнала является изучение мутан-
тов, у которых повреждена система ответных реакций на обработку этим гормоном.
В процессе скрининга было выделено два основных типа таких мутантов: нечувстви-
тельные к ГК карлики и растения с сильно удлиненными и утонченными побегами
из-за так называемой slender-мутации. К ним относятся мутанты арабидопсиса spy
(spindly), pkl (pickle), gai (GA-insensitive), rga (repressor of gal-3), rgl (RGA-like) и
их ортологи у кукурузы dS (dwarf8), риса slrl (slender ricel) и ячменя slnl (slender
barley 1), а также ряд других (табл. 9.1).
При клонировании гена GAI оказалось, что его продуктом является фактор
транскрипции, который в отсутствие гормона функционирует как репрессор на пути
трансдукции гиббереллинового сигнала. Гиббереллин снимает эту репрессию, одна-
ко при повреждении гена GAI могут появляться не только ГК-нечувствительные
карлики, но и ГК-нечувствительные великаны.
У ГК-нечувствительного карлика мутация gai затрагивает только ту часть гена,
которая отвечает за взаимодействие с гиббереллином. Из-за повреждения участка
связывания с гормоном белок GAI продолжает работать как репрессор даже в при-
сутствии ГК — растение превращается в ГК-нечувствительного карлика. Если же
137
а-амилаза
i
Гидролиз крахмала в эндосперме
Рис. 9.11. Регуляция синтеза a-амилазы в клетках алейронового слоя ячменя гиббереллином
(по: Gilroy, 1996)
138
Таблица 9.1. Мутанты с повреждением ответных реакций
на гиббереллины (по: Thomas, Sun, 2004)
Мутант Фенотип Роль аллели дикого типа в гиббереллиновой сигнализации Кодируемый белок
gai-1 ГК-нечувствительный карлик Негативный регулятор Фактор транскрипции
gai-t6 ГК-независимый рост Негативный регулятор Фактор транскрипции
gar2-l ГК-независимый рост Не ясна 7
гда ГК-независимый рост Негативный регулятор Фактор транскрипции
shi ГК-нечувствительный карлик Негативный регулятор Белок RING-finger
slyl ГК-нечувствительный карлик Позитивный регулятор F-бокс-белок
spy ГК-независимый рост Негативный регулятор Гомолог N-ацетилглюкозо- аминтрансферазы
повреждения затрагивают участки, отвечающие за саму репрессию, то белок GAI
перестает функционировать как репрессор и теряет способность подавлять тран-
скрипцию; растение при этом превращается в ГК-нечувствительного великана.
Из числа s/ender-мутантов особого внимания заслуживает spy (spindly) мутант
арабидопсиса. Продукт гена SPY также является белком-репрессором, который в
отсутствие гормона подавляет процессы, запускаемые ГК. Предполагается, что бе-
лок, кодируемый геном SPY, представляет собой особую N-ацетилглюкозаминтранс-
феразу — фермент, катализирующий реакцию гликозилирования белков. Эта реак-
ция может приводить к потере активности белков или блокировать их фосфорили-
рование. Влияние ГК заключается в снятии репрессирующего эффекта SPY-белка.
Таким образом, GAI- и SPY-белки функционируют как репрессоры гиббереллино-
вого ответа. Присутствие гиббереллина снимает эту репрессию. Известны и другие
ГК-регулируемые гены, кодирующие и репрессоры (объединяющиеся под названием
DELLA-белки), и активаторы гиббереллинового сигнала.
DELLA-белки — репрессоры гиббереллинового сигнала. У арабидопси-
са найдено 5 генов, которые кодируют DELLA-белки — GAI, RGA, RCL1, RCL2 и
RCL3. У риса их ортологом является белок SLR1. у ячменя -SLN1, у кукурузы -
D8. DELLA-белки были также найдены у винограда и пшеницы. DELLA-белки
VHYNP NLS
II IM м
DELLA Poly S/T LZ1 LZ2
DELLA -домен GRAS -домен
Рис. 9.12. Консервативные домены репрессоров гиббереллино-
вого сигнала DELLA-белков
относятся к GRAS-семейству транскрипционных факторов (см. гл. 1) и, как все бел-
ки этого семейства, имеют консервативный GRAS-домен (рис. 9.12). Он расположен
в С-концевой части белка и включает три характерных аминокислотных мотива:
сигнал ядерной локализации белка (NLS) и две лейциновые молнии (LZ1 и LZ2).
139
Рост и морфогенез
Рис. 9.13. Белки-репрессоры DELLA - ин-
теграторы гормональных сигналов у расте-
ний (по: Alvey, Harberd, 2005)
N-концевая часть представлена уникальным
DELL А-доменом, включающим три консер-
вативные последовательности аминокислот:
DELLA (асп-глу-лей-лей-ала), VHYNP (вал-
гис-тир-асн-про) и Poly S/Т (последователь-
ность, обогащенная остатками серина и трео-
нина).
Имеются сведения о том, что DELLA-
белки способны выполнять интегрирующие
функции в процессах, контролируемых не
только гиббереллинами, но также аукси-
ном, этиленом и рядом других факторов
(рис. 9.13).
Ядерные белки DELLA являются кон-
сервативными репрессорами процесса транс-
дукции гиббереллинового сигнала. Обработ-
ка гиббереллином индуцирует снятие этой
репрессии за счет фосфорилирования и по-
следующего протеолиза DELLA-белков в
SCFSLY1/GID2 убиквитин-лигазном комплек-
се (рис. 9.14). Подробное описание процессов убиквитинирования и деградации бел-
ков в протеасомах дано ранее (см. с. 125).
ГК
26S Протеасома
Деградация
Рост и
дифференцировка
Рис. 9.Ц. Разрушение DELLA-белков под действием гиббереллина в протеа-
соме (по Alvey, Harberd, 2005)
Выявлены белки F-бокса, которые являются посредниками этой деградации
как часть убиквитин-лигазного комплекса. У арабидопсиса таким белком являет-
ся SLY1 (SLEEPY), а у pnca-GID2 (GA-INSENSITIVE DWARF2) (рис. 9.15). По-
теря функций этих белков у мутанта арабидопсиса slyl приводит к появлению
ГК-нечувствительного карлика и накоплению больших количеств одного из DELLA-
белков— RGA. Установлено, что белки F-бокса SLY1 и GID2 способны специфично
взаимодействовать с DELLA-белками и метить их для протеолиза.
140
Таким образом, по-видимому, именно белки SLY1/GID2 осуществляют включе-
ние DELLA-белков в SCFSLY1/GID2 убиквитин-лигазный комплекс для последующей
деградации в 26S протеасоме. После расщепления DELLA-белков происходит акти-
вация процессов, контролируемых гиббереллином.
Еще одним элементом гиббереллинового сигнального пути является негативный
регулятор SPY (SPINDLY), который активирует DELLA-белки (рис. 9.15). Очень
важным последующим компонентом в гиббереллиновом сигнальном каскаде яв-
ляется транскрипционный фактор MYB, который активирует экспрессию гена ci-
ами л азы. Экспрессия MYB приводит к активации таких ГК-контролируемых про-
цессов как прорастание семян, закладка органов цветка и цветение (рис. 9.15).
ГК
+
Рецептор
I
1
i della I
Эмбриогенез Прорастание Удлинение Цветение
семян стебля
Формирование
органов цветка
Рис. 9.15. Транскрипционные факторы (в овалах) и другие
белки, участвующие в передаче гиббереллинового
сигнала (по: Fleet, Sun, 2005). Стрелки и Т-бары
указывают, соответственно, активацию и подавле-
ние
Гиббереллины контролируют работу генов индукции цветения SOC1 (suppres-
sor of CONSTANS overexpression) и LFY (LEAFY), индуцируют экспрессию генов
идентичности органов цветка Pl (PISTILLATA), АРЗ (APETALA3) и AG (AGA-
MOUS). ГК повышает уровень экспрессии гена LUE1 (LUCIFERASE SUPER-
EXPRESSOR1), контролирующего удлинение стебля, а также гена PKL (PICKLE),
отвечающего за пролиферацию клеток при эмбриогенезе (рис. 9.15). Потеря функ-
ции гена LUE1 приводит к нарушению ориентации микротрубочек и торможению
роста стебля в длину. Продукты гена PKL подавляют экспрессию таких генов эм-
бриогенеза как LEC1 и LEC2 (leafy cotyledon) и FUS3 (FUSCA3).
Рецепция и трансдукция гиббереллинового сигнала. Рецептор гибберел-
лина впервые был обнаружен Уегучи-Танака с коллегами (2005) у растений риса.
Им удалось выделить и охарактеризовать новый ГК-нечувствительный карликовый
мутант риса gidl. Оказалось, что ген GID1 кодирует белок, схожий с гормон-чув-
141
ствительными липазами. Флуоресцентная метка комплекса белка GID1 с зеленым
флуоресцентным белком GFP регистрировалась преимущественно в ядре.
Рекомбинантный белок глутатион-S-транфераза (GST)-GIDl имел высокое срод-
ство только к активным гиббереллинам и связывал меченый 3Н-ГА4, в то время как
мутация по локусу GST-GID1, соответствующая трем аллелям gidl, приводила к
потере способности высокоаффинного связывания гиббереллина. Константа диссо-
циации для ГА4 составила около 10-7 моль/л. Сверхэкспрессия GID1 у растений ри-
са вызывала повышенную чувствительность к ГК. Для окончательного доказатель-
ства рецепторной роли GID1 соответствующий ген был экспрессирован в дрожжевой
дигибридной системе. Экстракты гетерологичных клеток, экспрессирующих GID1,
приобретали способность образовывать комплекс GID1-SLR1 только в присутствии
гиббереллина. Напомним, что SLR1 у риса является DEL LA-бел ком - репрессором
гиббереллинового сигнала. Совокупность приведенных выше результатов убеждает
в том, что белок GID1 является цитоплазматическим рецептором гиббереллинов у
растений риса.
Вскоре аналогичный рецептор гиббереллинов был выявлен Накайямой с колле-
гами (2006) у арабидопсиса. Было клонировано три гена, кодирующих рецепторы
гиббереллинов (AtGIDla, AtGIDlb и AtGIDlc), каждый из которых являлся орто-
логом гена OsGIDl. Белки, кодируемые этими генами, связывали различные гиббе-
реллины, но наибольшее сродство имели к ГК4. Константа диссоциации комплекса
GA4-AtGIDlb в диапазоне pH от 6,4 до 7,5 составила 340"8 моль л. Гены, коди-
рующие рецепторы гиббереллина, экспрессировались во всех органах арабидопсиса.
Инсерционпые мутанты по генам AtGIDla и AtGIDlc не вызывали заметных фе-
нотипических изменений, что говорит об избыточности рецепторов гиббереллина у
арабидопсиса в отличие от растений риса.
Введение каждого из трех генов (AtGIDla, AtGIDlb и AtGIDlc), кодирующих
рецепторы гиббереллина у арабидопсиса, в мутанты риса gidl возвращало их нор-
мальный фенотип, то есть все три рецептора гиббереллинов - AtGIDla, AtGIDlb
и AtGIDlc, по-видимому, способны выполнять рецепторные функции не только в
арабидопсисе, но и в других растительных организмах.
Схема, иллюстрирующая рецепцию и трансдукцию гиббереллинового сигнала с
участием белков-рецепторов (GID1) и белков-репрессоров (DELLA), приведена на
рис. 9.16. Внутриклеточными рецепторами гиббереллина в растениях риса и араби-
Подаалеиие роста и
морфогенеза
Рис. 9.16. Рецепция и трансдукция гиббереллинового сигнала в растениях риса с участием белка-
рецептора GID1 и белка-реп рессора DELLA (по: Jiang, Fu, 2007)
142
допсиса являются белки OsGIDl, AtGIDla, AtGIDlb и AtGIDlc, которые входят
в состав F-бокса протеасомного комплекса. В присутствии гиббереллина эти белки-
рецепторы способны узнавать, связывать и вызывать избирательную деградацию (в
SCF-протеасомном пути) репрессоров гиббереллинового сигнала DELLA-белков,
что, в конечном итоге, приводит к запуску процесса транскрипции генов первичного
ответа на гиббереллин.
Хотелось бы обратить особое внимание на то обстоятельство, что механизмы
трансдукции ауксинового и гиббереллиного сигналов однотипны. На первом этапе
передачи и ауксинового, и гиббереллинового сигналов происходит связывание гор-
мона белками-рецепторами — TIR1 или GID1, соответственно. Связывание гормона
с рецептором вызывает его конформационные изменения. Белки-рецепторы аукси-
на и гиббереллина (и TIR1, и GID1) входят в F-бокс, которой является частью ЕЗ
убиквитин-лигазного SCF комплекса. Центральным событием в обоих сигнальных
каскадах (ауксиновом и гиббереллиновом) является прямое лиганд-зависимое вза-
имодействие гормональных рецепторов (T1R1 или G1D1) и репрессоров (Aux/IAA
или DELLA). Изменение конформационных свойств рецептора (под действием гор-
монов) позволяют ему или прямо взаимодействовать с белками-репрессорами гормо-
нального сигнала, или сформировать тройной комплекс: ИУК-TIRl-Aux/IAA или
ГК-GIDl-DELLA. И в первом, и во втором случае происходит убиквитинирование
репрессоров (Aux/IAA и DELLA), их последующий протеолиз в SCF-протеасомном
пути, снятие репрессии и запуск транскрипции генов первичного ответа на фитогор-
моны (рис. 9.16). Следует отметить, что такой тип трансдукции сигналов не встре-
чается в клетках животных.
9.3. Физиологическая активность гиббереллинов
Влияние на рост растений. Наиболее характерным эффектом, который гиб-
береллины вызывают в растениях, является удлинение их стебля (рис. 9.17). Цито-
логическая основа этого явления -- активация деления клеток, усиление их растя-
жения или оба эти процесса вместе. С другой стороны, гиббереллины оказывают
слабое влияние на рост клеток в корневой системе.
Усиление роста стебля под влиянием гиббереллинов делает растения гигантами.
Например, конопля и табак, обработанные гиббереллином, вырастали в длину до
5 -6 метров (!). Длина клеток междоузлий овса и гипокотилей салата после обработ-
ки гиббереллинами возрастает в 3-5 раз. Вызываемая гиббереллинами активация
роста проявляется не только в вытягивании междоузлий. Возрастает также количе-
ство междоузлий, усиливаются образование и рост боковых побегов, увеличиваются
длина и число цветоносов. Ауксины, в отличие от гиббереллинов, практически не
влияют на рост интактных растений.
Особенно эффектные ответные реакции получены при изучении роста мутан-
тов-карликов и розеточных форм растений, обрабатываемых гиббереллином. На
рис. 9.18 приведены данные Б. Финни (1985), который изучал действие гибберел-
лина ГА1 па рост карликовых мутантов кукурузы. Обработка ГА1 не влияла на
рост нормальных растений, но резко стимулировала удлинение стебля карлика, у
которого был нарушен гиббереллиновый обмен. Аналогичное действие гиббереллин
оказывает на карликовые растения гороха (рис. 9.19). Еще более впечатляющий эф-
фект наблюдается при обработке гиббереллином длиннодпевпых растений капусты,
143
Рис. 9.17. Влияние гибберелловой кислоты (ГК) на рост
междоузлий риса (по: Sauter, Kende, 1992)
которые в условиях короткого
дня находятся в розеточной фор-
ме. Гиббереллин индуцирует об-
разование гигантского цветущего
побега (рис. 9.20).
Анализ действия гибберел-
лина на митотическую актив-
ность в субапикальной зоне цен-
трального цилиндра розеточных
растений Samolus parviflorus и
Chrysanthemum morifolium пока-
зал, что обработка гибберелли-
ном вызывает усиление деления
и растяжения клеток. Антигиб-
береллиновый ретардант роста
АМО 1618 сильно снижал мито-
тическую активность, но усили-
вал рост в толщину. Было выска-
зано предположение, что гиббе-
реллины регулируют клеточный
цикл на этапе перехода от фазы
G‘2 к митозу.
Г иббереллины стимулируют
деление клеток камбия и растя-
жение клеток интсркалярных ме-
ристем. В последнем случае это
приводит к вытягиванию междо-
узлий у злаков (рис. 9.17). Обра-
ботка ГК стимулирует также об-
разование столонов у топинамбу-
ра, но подавляет заложение и рост клубней у топинамбура и картофеля.
В то же время гиббереллины не оказывают влияния (или вызывают слабый эф-
фект) на рост отсеченных междоузлий или колеоптилей, сильно реагирующих на об-
работку ауксином. Гиббереллин-индуцированный рост изолированных частей расте-
ний (например отрезков стебля) может наблюдаться только при наличии меристем,
то есть удлинение отрезков побега или высечек листа под влиянием гиббереллина
наблюдается исключительно в тех случаях, когда в тканях имеются клетки, способ-
ные к делению.
Гиббереллины и цветение растений. В отличие от других фитогормонов
только гиббереллины могут функционировать как индукторы цветения у многих
видов растений. Обработка экзогенными гиббереллинами не только значительно
ускоряет цветение двулетников и древесных растений, но также вызывает переход от
вегетативного этапа развития к генеративному при неблагоприятных для цветения
фотопериоде и температурных условиях.
Еще Ю. Сакс в 1880 г. высказал предположение, что изменение внешних условий
может приводить к появлению в растениях некоего фактора цветения. Как уже упо-
миналось, впервые индукцию гиббереллином цветения у длиннодневного растения
Samolus parviflorus в условиях короткого дня обнаружил А. Ланг в 1956 г. Позднее
144
было установлено, что такая же ре-
акция свойственна и некоторым дру-
гим облигатно длиннодневным рас-
тениям: Rudbeckia spp., Nicotiana Sil-
vestris, Spinaceae oleracea, Raphanus
и др. Сходный эффект гиббереллин
оказывает на растения, которым для
цветения необходим вначале длинный
день, а потом короткий (длиннокорот-
кодневные) или наоборот — вначале
короткий, а затем длинный день (ко-
роткодлиннодневные). Обработка гиб-
береллином заменяет таким растени-
ям длиннодневный фотопериод, но не
короткодневный.
Однако далеко не все длинноднев-
ные растения реагируют зацветани-
ем на обработку гиббереллином. Экзо-
генный гиббереллин обычно не влия-
ет на цветение облигатно короткоднев-
ных видов растений в условиях длин-
ного дня, но встречаются исключе-
ния и из этого правила. 1ак, обработ-
ка гиббереллином в условиях длинно-
го дня инициировала заложение цве-
точных почек у короткодневных рас-
тений Impatiens balsamina и Zinnia
Рис. 9. IS. Действие гиббереллина ГА1 на рост нор-
мальных (контроль) и мутантных растений (кар-
лик) кукурузы (по: Phinney, 1985)
elegans.
В процессе долгих поисков соеди-
нений, способных вызвать в растени-
ях эффект обработки низкими поло-
жительными температурами, оказалось, что только гиббереллины могут заменить
потребность ряда растений в яровизации. Впервые этот эффект гиббереллина был
обнаружен А. Лангом (1956) в условиях длинного дня у неяровизированного двух-
летника белены черной Hyoscyamus niger. В дальнейшем формирование цветков
в первый год вегетации под влиянием гиббереллина было показано А. Лангом
(1965) и М.X.Чайлахяном (1969, 1970) для других двухлетников- моркови, пет-
рушки, репы, капусты и др. При этом оказалось, что гиббереллин был эффекти-
вен только в условиях длинного дня; на коротком дне этот гормон индуцировал
только формирование побегов, но не генеративных органов. Однако были выяв-
лены растения (Geum urbanum, Saxifraga rotundifolia, Althaea rosea и др.), нуж-
давшиеся в яровизации, но у которых обработка гиббереллином не индуцировала
цветение.
У растений, развитие которых контролируется как фотопериодом, так и опреде-
ленной температурой, гиббереллин может вызывать эффекты, индуцируемые или
длиннодневным фотопериодом, или воздействием низкими положительными тем-
пературами. Однако обработка гиббереллином не способна заменить одновременно
эти два фактора.
145
Рис. 9.19. Действие гиббереллина (справа) на рост
карликовых растений гороха (по: Lang, 1964)
Детерминация пола. М. X. Чай-
лахян и В. Н. Хрянин (1982) показали,
что гиббереллины оказывают влияние
на выраженность пола некоторых ви-
дов растений. У однодомных сортов
конопли В К подавляет образование
женских цветков и усиливает обра-
зование мужских. У растений семей-
ства Cucurbitасеае количество муж-
ских цветков тем больше, чем вы-
ше уровень эндогенных гибберелли-
нов. Обработка таких растений ве-
ществами, подавляющими синтез гиб-
береллинов, например хлорхолинхло-
ридбм, снижает количество мужских
цветков на растении. Однако известны
примеры, когда гиббереллины вызы-
вали противоположный эффект. Так,
обработка ГК растений кукурузы Zea
mays, клещевины Ricinus communis,
хмеля Humulus lupulus и перца Capsicum аппиит снижала число мужских цветков
и повышала количество женских.
Регуляция развития семян и плодов. Еще одним специфичным эффектом,
который вызывает экзогенная обработка гиббереллинами, является угнетение раз-
вития семян в плодах, формирующихся после оплодотворения. При этом происходит
уменьшение и массы, и количества семян, но активируются процессы завязывания
и развития плодов. Причем у винограда гиббереллин подавляет развитие семян не
только у семенных, но и у малосемянных сортов, которые имеют недоразвитые се-
мена с мягкой оболочкой. Этот эффект проявляется особенно четко, если обработка
растений произведена во время цветения.
Действие гиббереллина на величину плодов зависит от наличия и количества
семян. У многосемянных сортов винограда размер ягод под влиянием гибберелли-
на изменяется мало; малосемянные ягоды под влиянием гиббереллина становятся
крупнее. Среди бессемянных сортов винограда наибольшее увеличение размеров
ягод гиббереллин вызывает у не имеющих семян кишмишных сортов. Чем слабее
развиты семена, тем сильнее ягоды реагируют на обработку гиббереллином уве-
личением размеров. Как стимулятор роста ягод винограда гиббереллин наиболее
эффективен во время цветения или через несколько дней после него.
Образование партенокарпических (бессемянных) ягод под влиянием гибберелли-
на особенно легко происходит у сортов винограда с функционально женским типом
цветка, имеющих стерильную пыльцу и нуждающихся в перекрестном опылении.
При изолировании соцветий (и невозможности опыления) ягоды у таких сортов не
завязываются. Партенокарпия, индуцированная обработкой соцветий гибберелли-
ном, часто применяется на практике: при затрудненном перекрестном опылении у
таких сортов винограда именно обработка гиббереллином позволяет значительно
повысить урожайность благодаря образованию партенокарпических ягод. Наиболее
распространенной является обработка гиббереллином соцветий кишмишных сортов
винограда в период его массового цветения.
146
Формирование партенокарпических пло-
дов при обработке гиббереллином выявлено
и у других растений: томатов, семечковых
и косточковых, цитрусовых, перца, манго
и др. Для образования и последующего ро-
ста таких плодов достаточно однократного
воздействия гиббереллином. Увеличение в
разхмерах партенокарпических плодов проис-
ходит только за счет роста клеток растяже-
нием, но не делением. Интересно, что глу-
шение (silencing) гена, кодирующего инги-
битор гиббереллинового сигнала DELLA, за
счет использования антисмысловой последо-
вательности этого гена индуцирует партено-
карпию томатов.
В США гиббереллин используется в
больших масштабах для обработки цитру-
совых. Он увеличивает эффективность за-
кладки плодов мандаринов, способствует за-
держке созревания апельсинов и грейпфру-
тов, повышает прочность кожицы апельси-
нов, тормозит созревание и значительно уве-
личивает сроки хранения лимонов и лаймов.
Регуляция покоя растений. Семена
многих растений после созревания находят-
ся в состоянии покоя и не прорастают даже
при помещении их в благоприятные условия.
Это состояние характерно также для почек
большинства деревьев и кустарников, клуб-
ней и луковиц.
Состояние покоя многих семян может
быть преодолено обработкой гибберелловой
кислотой. Однако следует отметить, что эк-
зогенный гиббереллин стимулирует прорас-
тание только тех семян, которые характе-
ризуются неглубоким покоем и приобрета-
ют способность к прорастанию под влиянием
Рис. 9.20. Влияние гиббереллина (справа)
па рост розеточных растений капусты (по:
Wittner, Bukovac, 1978)
освещения или непродолжительной стратификации. Гиббереллин не действует на
семена, находящиеся в состоянии глубокого покоя, который может быть преодолен
длительной стратификацией.
Г. С. Муромцев с сотрудниками (1973) показали, что в ходе стратификации семян,
а также перед прорастанием семян и клубней происходит резкое повышение уровня
гиббереллинов. В клубнях картофеля, в частности, перед прорастанием содержание
гиббереллинов возрастает в 20-30 раз.
В ходе прорастании семян гиббереллины контролируют, по крайней мере, три
процесса: рост зародыша, размягчение слоев эндосперма, окружающих зародыш, и
мобилизацию запасных питательных веществ эндосперма. Поэтому в пивоварении
для ускорения получения солода ячмень обрабатывают ГК. Использование гиббе-
147
реллина при производстве солода основано на его способности повышать фермента-
тивную активность прорастающего зерна, при этом продолжительность солодора-
щения удается сократить на 2-3 суток.
Обработка гиббереллином покоящихся почек, клубней и луковиц нередко способ-
ствует их пробуждению и может заменить низкие положительные температуры или
длиннодневный фотопериод, необходимые для выхода из покоя. Вызываемый гиб-
береллином эффект будет зависеть от времени обработки. Неглубокий покой почек
деревьев и кустарников, а также глазков картофеля гиббереллин прерывает легко.
Однако из состояния глубокого покоя вывести эти органы с помощью гиббереллина
обычно не удается. В условиях короткого дня в результате обработки гибберелли-
ном удавалось «пробудить» почки Camelia japonica, Quercus borealis и Pinus elliot-
tii. Г. С. Муромцеву с сотрудниками (1973) удалось подобрать условия стимуляции
гиббереллином прорастания свежеубранных клубней картофеля, что позволяет по-
лучать по два урожая картофеля в год.
Глава 10
ЦИТОКИНИНЫ
В течение 1913-1923-х гг. австрийский ботаник Г. Габер л ан дт и его сотрудники
изучали формирование каллусов и заживление раневых поверхностей в тканях клуб-
ней картофеля и топинамбура. Было установлено, что в этом процессе участвуют
два фактора, один из которых («лептогормон») поступает из проводящих тканей,
а другой («раневой гормон») —из самих поврежденных клеток. Был сделан вывод,
что эти два фактора возвращают клетки паренхимы клубней в меристематическое
состояние и побуждают их к делению. Г. Габерландт считал, что эти два вещества
участвуют и в других процессах, связанных с клеточным делением.
Более 10 лет, начиная с 1940 г., в лаборатории Ф.Скуга Висконсинского уни-
верситета США велись интенсивные поиски соединений, способных инициировать
и поддерживать пролиферацию клеток изолированной сердцевинной ткани стебля
табака. И только в 1955 г. его сотрудникам К. Миллеру, М. Залтце и Ф. Стронгу
из автоклавированных препаратов ДНК молок сельди удалось выделить в чи-
стом виде фактор клеточного деления. Это вещество было идентифицировано как
6-фурфуриламинопурин. Благодаря способности индуцировать митозы и деление
клеток оно получило название кинетин. Стимулирующий эффект кинетина на деле-
ние клеток табака наблюдался только в присутствии ауксина. Позднее выяснилось,
что кинетин не встречается в растениях и, следовательно, нс является фитогормо-
ном. Кинетин слабо растворим в воде и хорошо - в этиловом спирте, серном эфире,
а также растворах щелочей и кислот. Он оказался очень устойчив к нагреванию,
действию щелочей и кислот. Еще одним синтетическим стимулятором, имеющим
сходный с кинетином эффект и часто используемым в научных исследованиях, яв-
ляется 6-бензиламинопурин — Б АП.
Цитокинины получили свое название из-за способности стимулировать цитоки-
нез (клеточное деление). Факторы, индуцирующие деление клеток, были найдены
в кокосовом молоке, экстрактах дрожжей, солоде. Первый природный цитокинин —
6-(4-гидрокси-3-метил-транс-2-бутениламино)пурин был выделен в 1964 г. новозе-
ландцем Д. Летамом и его сотрудниками из незрелых зерновок кукурузы Zea mays.
Этот цитокинин получил название зеатин. Для того чтобы выделить 1 мг зеатина
и установить его структуру было переработано 70 кг (!) семян кукурузы на стадии
молочной спелости, когда семена содержат наибольшее количество цитокининов.
Вскоре было установлено, что цитокинины синтезируются и выполняют гормональ-
ные функции у всех высших растений, папоротников и мхов.
Цитокинины обнаружены также у морских (Gymnodinium splendens, Cricosphaera
149
spp, Laminaria digitata, Hypnea musciformis) и пресноводных (Volvox cartcri) водо-
рослей, некоторых бактерий (Сorynebacterium fascians. Agrobacterium tumefaciens,
Rhizobium japonicum) и грибов (Rhizopogon roseolas, Suillus pinetipes), в опухоле-
вой ткани корончатых галлов, возникающих, например, при поражении растений
бактерией Agrobacterium tumefaciens. Цитокинины (зеатин и изопентениладснин)
обнаружены также в культуральных жидкостях клубеньковых бактерий Rhizobium
japonicum и Rhizobium leguminosarum. Продуцирование цитокининов ризобиями, ве-
роятно, играет важную роль в индукции делений клеток коры корня в процессе
формировании клубеньков.
К специфическим эффектам, которые вызывают только цитокинины, относятся:
индукция деления клеток каллуса в присутствии ауксина, стимулирование образо-
вания побегов в каллусной культуре на фоне низкой концентрации ИУК, задержка
старения листьев, активация роста растяжением у семядолей.
10.1. Метаболизм цитокининов
Растения содержат около двух десятков цитокининов, проявляющих активность
в биотестах. Все природные цитокинины являются производными пуринового осно-
вания аденина, у которого в положении N6 имеется заместитель, представленный
изопреноидной или ароматической группой. В растениях содержатся следующие пу-
риновые основания с цитокининовой активностью: изопентениладснин, транс-зеа-
тин, дис-зеатин, дигидрозеатин (рис. 10.1). У некоторых растений, например у то-
полей, обнаружен Б АП (6-бензиламинопурин), который до недавнего времени рас-
сматривался как синтетический цитокинин, а также гидрокси-производное БАП.
В следовых количествах в тканях присутствует кинетин. Растения содержат также
рибозиды и риботиды (главным образом, монофосфаты) цитокининовых оснований,
причем в количествах, значительно превышающих содержание свободных азотистых
оснований. Из всех этих соединений активно взаимодействуют с мембранными ре-
цепторами цитокининов только транс-зеатин, изопентениладснин, дигидрозеатин,
БАП и кинетин.
Кроме того, цитокинины входят в состав тРНК. Они имеются у тех тРНК, кото-
рые прочитывают кодоны уридин-Х-Х, то есть кодоны, кодирующие цистеин, серин,
лейцин, фенилаланин, тирозин и триптофан. Модификации подвергается аденозин,
который примыкает к антикодону с 3' конца (рис. 10.2). В этом положении благодаря
соответствующей модификации оказывается рибозид изопептениладепина, цис- или
транс-зеатина, а также их 2-метилтиопроизводные. До сих пор неясно, проявляют
ли эти группы активность в составе тРНК или только после ее гидролиза. Очень
много цитокининов в лейциновых и тирозиновых тРНК микроорганизмов. У расте-
ний основным цитокининовым продуктом в гидролизатах тРНК является рибозид
ц?/с-зеатина.
Наиболее богаты цитокининами делящиеся клетки растений. В них содержание
этих гормонов может достигать 500 1000 нг/г сырой массы, тогда как в среднем
оно составляет 5-50 нг/г сырой массы. Особенно много цитокининов в меристемах
боковых корней, в камбии, в зародышах на ранних стадиях их развития. В молодых
листьях с делящимися клетками концентрация цитокининов в десятки раз выше,
чем в листьях, достигших окончательного размера (рис. 10.3).
Цитокинины быстро обмениваются в тканях растений, и их содержание может за
короткое время изменяться в несколько раз, как в процессе развития, так и в резуль-
150
СН3
н2сч
HNZ сн снз
Азотистые основания
дигидрозеатин
цис-зеатин
иэопентениладенин транс-зеатин
Рибозиды
Риботиды
РОН2С 0
нт-"" ГН
он он
РРРОН2С
H1 ' " ГН
он он
рибозид-5'-фосфат рибозид-5'-дифосфат рибозид-5'-трифосфат
Рис. 10.1. Природные цитокинины: R — изопреноидная или ароматическая боковая цепь
а
б
кодон мРНК
Рис. 10.2. Цитокинины в составе тРНК:
а — локализация цитокининов в тРНК, б — модифицированный остаток аденина: R — изопреноидная
цепь (изопентенил; 4-гидроксиизопентенил. цис-изомер; 4-гидроксиизопентенил. транс-изомер)
151
Рис. 10.3. Снижение концентрации риботида (а) и рибозида (б) зеатина в
листьях табака в ходе развития (по: Nordstrom et al., 2004)
тате изменения внешних условий. Например, выход семян из состояния физиологи-
ческого покоя под действием низких положительных температур (стратификация)
у многих растений сопряжен со значительным повышением уровня цитокининов.
В течение первых нескольких дней после опыления в семяпочках в сотни раз повы-
шается концентрация цитокининов, а затем быстро снижается.
Пробуждение пазушных почек при декапитации проростков гороха связано с
многократным возрастанием содержания цитокининов в верхних узлах побега, кото-
рое наблюдается уже через 3-6 ч после удаления верхушки побега. Уровень цитоки-
нинов существенно изменяется в ходе клеточного цикла, достигая максимума в кон-
це синтетического периода интерфазы и во время митоза. Наиболее сильным внеш-
ним фактором, регулирующим содержание цитокининов, является уровень азотно-
го питания. При обильном азотном питании происходит накопление цитокининов в
корнях, увеличение их концентрации в ксилемном соке и в листьях.
Биосинтез цитокининов. В 1980-е гг. из Agrobacterium tumefaciens - бактерии,
образующей корончатые галлы, — был клонирован ген аденилат-изопентенилтранс-
феразы (IPT). Продукт этого гена катализирует синтез изонентениладенозин-5'-
монофосфата из АМФ и диметилаллилдифосфата (рис. 10.4). Позднее из бактерии
были выделены гены, кодирующие тРНК-изопентенилтрансферазы (тРНК-1РТ),
катализирующие изопентенилирование аденинового нуклеотида в составе тРНК
(рис. 10.4). Однако у растений подобные гены не удавалось найти так долго, что
в конце 1990-х гг. даже появилась гипотеза о том, что растения сами не способны
синтезировать цитокинины и получают их от эпифитных микроорганизмов. За по-
следнее десятилетие удалось обнаружить изопентенилтрансферазы (IPT) у целого
ряда растений. Так, арабидопсис имеет девять IPT, причем две из них (АНРТ2 и
АНРТ9), судя по их активности in vitro, являются тРНК-IPT. Гены IPT экспресси-
руются не только в корнях, но и в побегах растений.
Изучение активности AtIPTI и AtlPT4 in vitro показало, что эти ферменты в
качестве субстрата предпочитают АТФ и АДФ, но не АМФ, как бактериальные фер-
менты. Поскольку в клетке содержание АТФ примерно в 100 раз превышает содер-
жание АМФ, скорость синтеза цитокининов лимитируется только активностью изо-
пентенилтрансфераз. Продуктом активности этих ферментов являются изопенте-
нил аденилаты: изопентенил аденозин-5'-трифосфат, изопентенил аденозин-5'-дифос-
фат, изопентениладенозин-5'-монофосфат (рис. 10.5). Гидролиз фосфатных групп
изопентениладенилатов происходит с участием фосфатаз, а отщепление рибозы — за
счет активности рибогидролазы. Гидроксилирование изопентенильной группы осу-
152
Рис. 10.4- Биосинтез цитокининов у бактерий под действием аденилат-
изопентенилтрансфераз (IPT) (а) и тРНК-изопентенилтрансфераз
(tPHK-IPT) (б)
ществляют монооксигеназы семейства цитохрома Р450 (CYP735A1/2/3), связанные
с эндомембранами. Для реакции в качестве косубстрата необходим НАДФ • Н.
Методом изотопного разбавления, а также с использованием метирапона — ин-
гибитора гидроксилаз семейства цитохрома Р450, подавляющего превращение изо-
пентениладенина и его производных в транс-зеатин и его производные, — было по-
казано существование альтернативного пути биосинтеза цитокининов. Предполага-
ется, что первая реакция на этом пути состоит в переносе на аденилаты 1-гидрокси-
2-метил-2-бутенилдифосфата — гидроксилированного производного изопентенилди-
фосфата (рис. 10.5). Фермент, катализирующий эту реакцию, пока выделен только
из бактерий. Предполагается, что альтернативный путь синтеза цитокининов более
характерен для листьев, чем для корней, так как процентное содержание зеатино-
вых цитокининов в листьях обычно выше, чем в корнях.
Веский аргумент в пользу существования альтернативного пути синтеза цито-
кининов и его преимущественного функционирования в листьях дают новые пред-
ставления о механизмах синтеза изопреноидов. Давно известен мевалонатный путь
синтеза (рис. 10.6), в котором из ацетил-КоА синтезируется изопентенилдифосфат,
легко изомеризующийся в диметилаллилдифосфат. Реакции этого пути протекают
в цитоплазме. В конце 1990-х гг. был обнаружен альтернативный путь биосинтеза
изопреноидов из пировиноградной кислоты и глицеральдегид-3-фосфата. Промежу-
точными продуктами на этом пути являются 1-дезоксиксилулозо-5-фосфат и 2-С-
метил-эритритол-4-фосфат (рис. 10.6). Поэтому этот путь также называют дезок-
сиксилулозным, или 2-метилэритритольным путем. Первое изопреноидное соедине-
ние, синтезирующееся па этом пути, -- 1-гидрокси-2-метил-2-бутенилдифосфат, ко-
торый может использоваться для биосинтеза зеатиновых цитокининов. Реакции аль-
тернативного пути протекают в пластидах, поэтому более благоприятные условия
для протекания изопентениладенилат-независимого синтеза зеатиновых цитокини-
нов складываются в листьях с развитыми хлоропластами.
153
изопентениладенозин изоггенгениладенин
Рис. 10.5. Биосинтез цитокининов у растений
Самым мощным внешним фактором, регулирующим биосинтез цитокининов в
корнях, является уровень азотного питания. Так, при выращивании кукурузы на бо-
гатых нитратами растворах в корнях происходит накопление изопентениладенозин-
5'-монофосфата, в ксилемном соке увеличивается концентрация зеатинрибозида, а
в листьях — зеатина.
Появилось немало сведений о том, что ауксин подавляет биосинтез цитокини-
нов, особенно в надземной части растения. Ингибирующий эффект ИУК детально
изучен в условиях снятия апикального доминирования у проростков гороха. Спустя
несколько часов после удаления верхушки побега (декапитации) начинается про-
буждение верхних пазушных почек. Оно вызвано тем, что в верхних узлах уже
через 1-2 ч после декапитации увеличивается экспрессия генов IPT, а спустя 6 ч су-
щественно возрастает содержание изопентениладенозинфосфата и других цитоки-
нинов. Если на место удаленной верхушки положить пропитанный раствором ИУК
агаровый кубик, то происходит подавление экспрессии генов IPT, и пазушные почки
не просыпаются. Ауксин также ингибирует гидроксилазу изопентенильной группы
154
Мевалонатный путь
(в цитоплазме)
/?
3 ^“^SKOA
ацетил-КоА
Ко ASH
KoASH
Дезоксиксилулозный путь
(в пластидах)
РОСН2—СНОН—(^-Н + НООС С СН3
глицеральдегид-3-фосфат пировиноградная кислота
РОСНг—СНОН-СНОН-С—СН3
1 *деэоксиксилулозо-5-фосфат
НО\ /СНз
носн2—сн2—с—СН2—СООН
мевалоновая кислота
^-2АТФ
^*2 АДФ
<fH3
РОСН2—СНОН-СОН-------СН/)Н
2-С-метил-эритритол-4-фосфат
НО\ ^Н3
РРОСН2-СН2—С—СНг—СООН
мевалонилдифосфат
Н2О + СО2
СН3
изопентенилдифосфат
К1
1 -гидрокси-2-метил-2-бутенилдифосфат
диметил аллилдифосфат
Рис. 10.6. Пути биосинтеза мономера изопреноидов диметилаллилдифосфата
и таким образом особенно сильно подавляет синтез зеатиновых цитокининов. Кроме
того, с использованием ингибитора гидроксилирования метирапона показано, что у
арабидопсиса ауксин может избирательно подавлять альтернативный путь, первым
цитокининовым продуктом которого являются зеатинриботиды.
Конъюгаты цитокининов. Содержание риботидов и рибозидов изопентени-
ладенипа, зеатина и дигидрозеатина обычно превышает содержание соответствую-
щих азотистых оснований. Хотя риботиды и рибозиды проявляют такую же актив-
ность в биотестах, как азотистые основания, однако с цитокининовым рецептором
они не взаимодействуют. Поэтому их активность в биотестах связана с легкостью
взаимопревращений цитокининов: риботиды <-> рибозиды азотистые основания.
Ферменты, катализирующие взаимопревращения цитокининов, изучены недоста-
155
точно. У растений обнаружены рибогидролазы, проявляющие различную специфич-
ность к рибозидным конъюгатам транс-зеатина, цис-зеатина, дигидрозеатина и изо-
пентениладенина. Обнаружен мутант арабидопсиса сут, устойчивый к цитокинин-
рибозидам, у которого вдвое снижена рибогидролазная активность по отношению
к изопентениладенин-рибозиду. Гидролиз рибозидов и риботидов необходим также
для мембранного транспорта цитокининов, так как выделенный из клеточных мем-
бран арабидопсиса цитокининовый транспортер AtPUP переносит только свободные
цитокининовые основания.
У растений хорошо изучена активность аденин-фосфорибозилтрансферазы, осу-
ществляющей превращение аденина в АМФ. Предполагается, что подобный фер-
мент может катализировать образование цитокинин-риботидов.
В тканях растений имеется цис-зеатин, его рибозиды и риботиды, причем в ко-
личествах, сопоставимых с количеством транс-зеатина и его производных. Под дей-
ствием изомеразы малоактивный цис-зеатин может превращаться в транс-зеатин,
поэтому цис-зеатин можно рассматривать как запасную форму цитокининов.
В значительных количествах в тканях растений содержатся конъюгаты цитоки-
ниновых оснований и их рибозидов с глюкозой (рис. 10.7). Присоединение остатка
глюкозы может происходить через ОН-группу зеатина и ди гидрозеатин а с образова-
нием 0-глюкозидов. N-глюкозиды образуются посредством присоединения остатка
глюкозы к атому азота пуринового кольца в положении 7, 9 и, реже, 3.
О-глкжозид /ттранс-зеатина
9-М-глюкозид /пранс-зеатина
7-N-глюкозид изопентениладенина
СООН
аланилзеатин (люпиновая кислота)
Рис. 10.7. Конъюгаты цитокининов с глюкозой и аланином
Образование О-глюкозидов происходит при участии О-глюкозил трансферазы;
в качестве донора глюкозы служит УДФ-глюкоза. У растений изучены
0-глюкозилтрансферазы, различающиеся по специфичности к транс-, цис-зеатину,
156
дигидрозеатину и их рибозидам. Сверхэкспрессия гена зеатин-О-глюкозилтрансфе-
разы (ZOG7) у табака приводит к увеличению содержания зеатин-О-глюкозида
в 30-70 раз. У ряда растений охарактеризована активность цитокинин-7-/?-
глюкозилтрансферазы. 0-глюкозиды зеатина и дигидрозеатина проявляют высо-
кую активность в биопробах, так как легко могут быть гидролизованы с помощью
специфических (3-глюкозидаз. N-конъюгаты неактивны.
В семенах люпина накапливается люпиновая и дигидролюпиновая кислоты, ко-
торые являются конъюгатами аланина с зеатином и дигидрозеатином, соответствен-
но (рис. 10.7). Эти неактивные стабильные конъюгаты синтезируются при участии
9-цитокинин-ал анин-синтазы.
Окисление цитокининов. Главный этап окислительного распада цитокини-
нов состоит в отщеплении боковой цепи у N6 аденина под действием цитокининде-
гидрогеназы. Активность этого фермента убывает в следующем субстратном ряду:
изопентениладснин > транс-зеатин > цис-зеатин > рибозиды зеатина и изопентени-
ладенина. Фермент не проявляет активности по отношению к цитокинин-риботидам,
ди гидрозеатину и его производным, бензиламинопурину, глюкозидам цитокининов.
Ферменты, окисляющие цитокинины с насыщенной алифатической или ароматиче-
ской боковой цепью, в растениях пока не найдены.
Цитокининдегидрогеназа была обнаружена около 40 лет назад в культуре каллу-
са из сердцевины стебля табака и названа цитокининоксидазой, так как некоторые
особенности активности роднили ее с медь-содержащими аминооксидазами, переда-
ющими электроны от окисляемого субстрата на О2 с образованием Н2О2. Однако
позднее выяснилось, что этому ферменту не нужен кислород, и пероксид водоро-
да в ходе реакции не образуется. Активность фермента многократно возрастает в
присутствии органических акцепторов электронов, в качестве которых в организме
могут выступать убихиноны.
Предполагается, что реакция протекает по следующему пути (рис. 10.8). Цито-
кинин, например изопентениладснин, спонтанно изомеризуется в соответствующий
кетимин. Затем при посредстве ФАД происходит дегидрогенирование субстрата и
восстановление акцептора электронов. При этом образуется неустойчивый интер-
медиат (альдамин), который гидролизуется с образованием аденина и З-метил-2-
бутеналя.
Цитокининдегидрогеназы — это флавиновые ферменты, содержащие ФАД, ко-
валентно связанный с полипептидом. Они гликозилированы и имеют молекуляр-
ную массу 56-65 кД. У арабидопсиса семь цитокининдегидрогеназ, из которых
четыре имеют N-сигнальный пептид и поэтому должны секретироваться. Дей-
изолентениладенин
4 3 2 У®
н3с-с=-сн—с^н
СН3
З-метил-2-бутеналь
Рис. 10.8. Механизм окисления цитокининов цитокининдегидрогеназой (на примере изопентенил-
аденина):
А — акцептор электронов
157
ствительно, при культивировании каллуса табака в культуральной среде обнару-
живается значительная цитокининоксидазная активность. Два фермента имеют
N-последовательность, близкую по составу к тем, которые адресуют белки в мито-
хондрии. Один фермент не имеет направляющего сигнала и, по-видимому, остается
в цитозоле.
Активность цитокининдегидрогеназ наибольшая в тех тканях, которые богаты
цитокининами: в меристемах корней, камбии, развивающихся зародышах, молодых
листьях. Корни в целом содержат значительно больше этого фермента, чем побеги.
Параллельное изменение активности цитокининдегидрогеназ и содержания цитоки-
нинов связано с тем, что цитокинины стимулируют синтез этих ферментов. Тем не
менее, в ряде случаев наблюдается диспропорция активности цитокин ин дегидро-
геназ и содержания цитокининов. Так. уменьшение содержания цитокининов под
действием ауксина отчасти связано с тем, что ауксин увеличивает активность ци-
токининдегидрогеназ. Сильный гормональный эффект дифенилмочевины и тиди-
азурона (синтетических цитокининов) объясняется не только тем, что они взаимо-
действуют с цитокининовым рецептором, но также и накоплением в их присутствии
природных цитокининов в тканях рас гений из-за ингибиторного действия этих про-
изводных фенилмочевины на активность цитокининдегидрогеназ.
Посредством конститутивной экспрессии цитокининдегидрогеназ у арабидопсиса
можно снизить содержание цитокинина на 30 -70% и наблюдать «синдром низкого
цитокинина», а именно: сокращение размера апикальной меристемы побега, сокра-
щение числа и размеров листьев, значительное уменьшение количества клеток в
листьях, укорочение междоузлий, увеличение размера корневой меристемы, толщи-
ны корней, степени их ветвления и массы.
10.2. Механизм действия цитокининов
Некоторые бактерии и грибы, ассоциированные с растениями, способны синтези-
ровать большие количества фитогормонов, в том числе и цитокининов. При зараже-
нии растений этими микроорганизмами индуцируются процессы дедифферепциров-
ки и деления клеток. Например, инфицирование стеблей бактерией Agrohacterium
tumefaciens вызывает опухолевый рост клеток и образование корончатых галлов.
Вирулентные штаммы этой бактерии содержат большую плазмиду, известную как
Ti-плазмида, которая несет ряд генов, повышающих способность бактерии выжи-
вать в определенных условиях. Часть Ti-плазмиды, известная как Т-ДНК, вклю-
чается в геном клетки хозяина. Эта Т-ДНК содержит ген IPT. необходимый для
синтеза цитокининов.
Трансгенные растения, содержащие ген IPT A. tumefaciens и характеризующие-
ся очень высоким уровнем цитокининов, часто используют как модель для выявле-
ния процессов, регулируемых этим гормоном в растительных организмах. У таких
растений сверхпродуцентов цитокининов наблюдается низкорослость, подавлен
эффект апикального доминирования (то есть формируется много боковых побе-
гов), подавлено корнеобразование, задерживаются процессы старения, образуется
больше листьев, которые из-за активации синтеза хлорофилла имеют более зеле-
ную окраску. При этом также активируется формирование хлоропластов, их рост и
деление.
Хорошим инструментом для анализа молекулярных процессов, контролируемых
фитогормонами, являются мутации в генах, продукты которых необходимы для
158
синтеза, метаболизма или механизма действия фитогормонов. Описано более сот-
ни генов, экспрессия которых контролируется цитокининами. Часть из них отно-
сится к генам первичного ответа, другие экспрессируются позже. Наиболее хорошо
изученным ферментом, синтез которого индуцируется цитокининами, является нит-
ратредуктаза. Полагают, что цитокинины регулируют активность этого фермента,
контролируя транскрипцию нитратредуктазного гена.
Различают два основных типа цитокининовых мутаций. К первому типу отно-
сятся мутанты, у которых содержание гормона низкое и соответственно ослаблена
функция, за которую он отвечает. Обработка цитокининами этих мутантов может
восстановить нормальный фенотип растения. Такие мутации связаны с нарушения-
ми в генетическом контроле процессов синтеза цитокининов, а также их распада или
инактивации. У второго типа цитокининовых мутантов нарушены процессы рецеп-
ции и передачи гормонального сигнала, поэтому обработка экзогенным гормоном не
оказывает на них влияния.
Рецепторы цитокининов. В 2001 г. Т. Иноуи с коллегами был получен мутант
арабидопсиса crel (cytokinin response 1), который не реагировал на цитокинины.
Оказалось, что расположенный во второй хромосоме ген CRE1 кодирует рецептор
цитокининов, гомологичный двухкомпонентным гистидинкиназам гибридного типа.
Этот белок-рецептор локализован в плазмалемме и имеет гистидипкиназный домен
и домен связывания с гормоном (Кр = 4,5 • 10-9 моль/л). Следует отметить, что
у арабидопсиса гистидинкиназа участвует также? в рецепции этилена, красного све-
та, изменении осмотического давления. Взаимодействие цитокининов с рецептором
инициирует гистидинкиназную активность CRE1.
Идентификацию других рецепторов и последующих элементов передачи цито-
кининового сигнала (фосфотрансмиттеров и регуляторов ответа) ускорило полное
секвенирование генома арабидопсиса. И. Хвангом, Дж. Шином и X. Ямадой с колле-
гами (2001) было выявлено еще два гена: А НК 2 и АН КЗ (arabidopsis histidine kinase),
которые (как и ген CRE1) кодируют гистидинкиназы, являющиеся рецепторами ци-
токининов. Таким образом, у арабидопсиса функции рецепторов цитокининов вы-
полняют как минимум три белка, обладающие гистидинкиназной активностью,—
CRE1/AHK4, АНК2 и АНКЗ. В 2007 г. в клубеньках лотоса был обнаружен еще
один рецептор цитокининов, который был назван LHK1 (lotus histidine kinasel).
Выявленные к настоящеАму времени рецепторы цитокининов имеют сходное пер-
вичное строение: так называемый CHASE-домен, два или три трансмембранных до-
мена на N-конце белковой молекулы, гистидипкиназный домен и два принимающих
домена (рис. 10.9). Экстраклеточный CHASE-домен, осуществляющий распознава-
ние и связывание цитокинина, содержит около 270 аминокислотных остатков.
Строение CHASE- до мена (cyclases/histidine-kinase-assosiated sensory extracellu-
lar) сходно с доменами других рецепторных белков из прокариот и низших эука-
риот. CHASE-домен присутствует в составе многих мембранных белков-рецепторов,
которые распознают сходные с цитокининами производные аденина или некоторые
пептиды. Предполагается, что С HASE-домен «попал» в растения в результате ла-
терального переноса от цианобактерий.
У арабидопсиса CHASE-домен специфичен для цитокининовых рецепторов
CRE1/AHK4, АНК2 и АНКЗ (рис. 10.9). Связывание цитокининов с рецепторами
происходит именно в CHASE-домене, экспонированном во внеклеточное простран-
ство. Прямые доказательства связывания цитокининов CHASE-доменом были по-
лучены Т. Шмюллингом (2005), которому удалось клонировать разные фрагменты
159
тм
тм
НК
RLD
RD
Рис. 10.9. Строение рецепторов (АНК2, АНКЗ, CRE1/AIIK4) и других белков, участ-
вующих в передаче цитокининового сигнала (по: Heyl, Schmulling, 2003):
АНК--двухкомпонентные гистидинкиназы — интегральные белки плазматической
мембраны, рецепторы цитокининов; АНР — переносчик остатка фосфорной кислоты,
фосфотрансмиттер; ARR —белки, участвующие в передаче цитокининового сигнала;
CHASE — домен распознавания и связывания цитокининов; НК — гистидиикиназпый до-
мен; GARP — ДНК-связывающий домен; NLS - домен, отвечающий за локализацию бел-
ка в ядре; RD и RLD — принимающие домены; ТМ — трансмембранный домен; Н и D —
остатки гистина и аспарагиновой кислоты, соответственно
рецепторного белка. Оказалось, что только фрагменты, включающие CHASE-домен,
были способны специфически связывать цитокинин.
Воспринимающие и передающие цитокининовый сигнал белки относятся к так
называемой двухкомпонентной системе трансдукции сигнала бактериального типа;
гены этих белков структурно охарактеризованы и клонированы, что позволяет в
настоящее время проводить детальные исследования биологических функций про-
дуктов этих генов in planta.
Важной частью работ по исследованию рецепции гормонов является биохими-
ческий анализ гормон-рецепторного взаимодействия, который часто служит окон-
чательным подтверждением права того или иного регуляторного белка называться
рецептором. До сих пор в случае рецепторов цитокининов такой анализ был в какой-
то мере выполнен лишь для рецептора AHK4/CRE1. Этот пробел был в значитель-
ной степени восполнен в работе Г. А. Романова с коллегами (2006). Ими была дана
детальная характеристика гормон-связывающих свойств рецепторов AHK4/CRE1
и АНКЗ. Как и ожидалось, оба рецептора связывали цитокинины специфично,
обратимо и с высоким сродством, хотя при этом между рецепторами выявились
явные различия в лигандной специфичности и других особенностях связывания.
В частности АНКЗ, в отличие от рецептора АНК4, имел гораздо большее сродство
к irans-зеатину по сравнению с изопентенил аденином и его рибозидом.
Белки, участвующие в передаче цитокининового сигнала. Помимо трех
рецепторов (АНК4, АНК2 и АНКЗ) в сигнальный каскад, осуществляющий передачу
цитокининового сигнала, входят еще три типа белков: 1) гистидин-содержащие бел-
160
ки-переносчики фосфата, фосфотрансмиттеры (arabidopsis histidine phosphotrans-
mitter protein, АНР); 2) регуляторы ответа типа В (arabidopsis В-type response reg-
ulator, ARR B-type); 3) регуляторы ответа типа A (arabidopsis А-type response regu-
lator, ARR А-type) (рис. 10.9).
Небольшие белки фосфотрансмиттеры (127-157 аминокислотных остатков,
~12 кД) отличает наличие специфической консервативной аминокислотной последо-
вательности — XHQXKGSSXS (X-His-Gln-X-Lys-Gly-Ser-Ser-X-Ser). У арабидопсиса
найдено 5 таких переносчиков фосфата (АНР1, АНР2, АНРЗ, АНР4, АНР5).
Белки ARR В-типа представляют собой связывающиеся с ДНК и локализован-
ные в ядре факторы транскрипции, которые под действием цитокининов фосфо-
рилируются и активируют (или блокируют) транскрипцию ряда генов первичного
ответа. Среди этих генов значительную долю составляют гены, кодирующие белки,
участвующие в регуляции транскрипции и внутриклеточной сигнализации. Некото-
рые из этих генов кодируют белки-регуляторы ответа типа A (ARR А). Белки ARR
В-типа вовлечены в ранние этапы передачи цитокининового сигнала и имеют на
С-конце ДНК-связывающий домен GARP (Golden2, ARR, Psrl), который имеет го-
мологию с MYB-семейством факторов транскрипции (рис. 10.9). Белки ARR В-типа
распознают на ДНК последовательность нуклеотидов 5'— (A/G) GAT (Т/С) - 3'.
ARR A-типа функционируют на втором этапе ответных реакций на цитокини-
ны (через 10 мин и более). С помощью белков ARR A-типа осуществляется реа-
лизация «глобальных» физиологических программ, инициируемых цитокининами.
Белки ARR A-типа не имеют ДНК-связывающего домена и, будучи фосфорилиро-
ванными, могут также подавлять первичный цитокининовый сигнал (по принципу
отрицательной обратной связи), влияя на активность фосфотрансмиттеров или на
регуляторы ответа типа В.
Ряд ARR функционируют также как медиаторы при передаче других сигналов,
в частности, таких как свет и этилен. У арабидопсиса выявлено 11 белков типа ARR
В (ARR1, ARR2, ARR10, ARR11, ARR12, ARR13, ARR14, ARR18, ARR19, ARR20
и ARR21), а также 11 регуляторов ответа типа ARR A (ARR3, ARR4, ARR5, ARR6,
ARR7, ARR8, ARR9, ARR15, ARR16, ARR17 и ARR22).
Рецепция и трансдукция цитокининового сигнала. При связывании цито-
кинина с рецептором происходит формирование димера и автофосфорилирование
рецепторной гистидинкиназы по остатку гистидина (рис. 10.10). После этого про-
исходит внутримолекулярная «переброска» фосфата на остаток аспартата белка-
рецептора. Далее этот «активный» фосфат передается на остаток гистидина фосфо-
трансмиттеров, которые транспортируют фосфат от рецепторов через цитоплазму
в ядро на регуляторы ответа типа В и типа А, фосфорилируют их и таким образом
модулируют транскрипционную активность ARR-белков.
Т. Шмюллингом (2005) было проанализировано прямое взаимодействие четырех
семейств сигнальных белков (сенсорных гистидинкиназ, фосфотрансмиттеров, ре-
гуляторов ответа А- и В-типа) в трансдукции цитокининового сигнала. Было вы-
явлено множественное, но специфическое взаимодействие между белками различ-
ных семейств, большей частью между фосфотрансмиттерами и белками остальных
трех семейств. В целом были подтверждены 26 ранее описанных взаимодействий
и обнаружено более 40 новых. Таким образом, при проведении всего лишь одно-
го гормонального сигнала в растительной клетке имеет место 66 белок-белковых
взаимодействий!
Какую роль в передаче цитокининового сигнала играют эти четыре семейства
161
пм
,снрн
vv
Модуляция ответов на цитокинины,
ауксины, свет, стрессовые факторы,
уровень минеральных элементов
Рис. 10.10. Передача цитокининового сигнала путем последовательного фосфорилирования гисти-
дина и аспартата (по: Heyl, Schmulling, 2003):
ARR — белки, участвующие в передаче цитокининового сигнала; ЛИР гистидин-содержащий белок-
переносчик остатка фосфорной кислоты; Н и D - остатки гистина и аспарагиновой кислоты, соответ-
ственно; ПМ — плазматическая мембрана
162
близких по структуре белков? Взаимозаменяемы ли они внутри одного семейства
или выполняют какие-либо специфические функции? Дж. Кибером (2005) были по-
лучены и исследованы инсерционные мутанты с выключенными генами указанных
выше 4 семейств белков, участвующих в передаче цитокининового сигнала. Вы-
ключение единичных генов-регуляторов ответа типа А не сказывалось на фенотипе
растения. Однако мутанты, у которых было выключено большинство генов ARR-A,
проявляли гиперчувствительность к цитокининам.
Сходная картина наблюдалась и при выключении генов фосфотрансмиттеров.
Блокирование сразу трех генов - АНР2, АНРЗ и АНР4 не сказывалось на фено-
типе растений. При блокировании четырех генов (АНР1, АНР2, АНРЗ и АНР4)
чувствительность к цитокининам снижалась. Блокирование всех пяти генов фосфо-
трансмиттеров (АНР1. АНР2, АНРЗ, АНР4 и АНР5) резко подавляло рост первич-
ного корня и вызывало другие дефекты развития. У такого мутанта цитокинины
не вызывали индукции генов первичного ответа. Однако вторичная экспрессия у
данного мутанта только одного гена АНР5 практически восстанавливала исходный
фенотип. Эти результаты указывают на особую роль переносчика фосфата АНР5 в
трансдукции цитокининового сигнала, хотя экспрессия АНР5, в отличие от осталь-
ных фосфотрапсмиттеров, не индуцируется цитокининами.
Мутанты с выключенными генами рецепторов цитокининов имели меньший раз-
мер, меньшее количество семян в стручке, однако сами семена были крупнее, что
соответствовало и большему размеру зародыша. Мутанты, у которых были выклю-
чены все три гена, кодирующие рецепторы цитокининов, переставали отвечать на
гормон экспрессией генов первичного ответа, то есть становились полностью ци-
токинин-нечувствительными. Однако при этом развивались растеньица, близкие к
нормальному плану строения, хотя и крохотные по размеру. Вероятно, в отсутствие
цитокининов клетка использует какие-то иные способы поддержания активности
цитокинин-чувствительпых генов на минимально необходимом уровне. Не исключе-
но, что в этом могут участвовать некоторые другие двухкомпонентные гистидин-
киназы.
10.3. Физиологическое действие цитокининов
Установлено, что цитокинины (в присутствии ауксинов) индуцируют деление
клеток, активируют рост семядолей двудольных растений, вызывают образование
побегов в культуре каллусной ткани. Обработка цитокининами предотвращает рас-
пад хлорофилла и клеточных органелл у изолированных листьев, задерживает про-
цессы старения, способствует образованию и функционированию апикальных ме-
ристем и развитию цветков, снимает эффект апикального доминирования, вызы-
ваемый ауксинами. Цитокинины обладают аттрагирующим эффектом, то есть они
повышают способность клеток аккумулировать питательные вещества за счет их
транспорта из других тканей. Цитокинины участвуют в формировании и развитии
клубней, являются посредниками в регуляции светом процессов развития растений,
регулируют выход семян и клубней некоторых растений из состояния физиологи-
ческого покоя и их прорастание. С помощью цитокининов удается прервать покой
спящих почек древесных растений. Характер ответных реакций растений на цито-
кинины зависит от концентрации гормона и от специфики растительного объекта.
Цитокинины участвуют в регуляции роста, развития и обмена веществ расти-
тельного организма во взаимодействии с другими фитогормонами. Очень часто в
163
экспериментах, связанных с выяснением механизма или физиологической роли фи-
тогормонов, применяют экзогенную обработку гормонами. В этом случае необхо-
димо обязательно учитывать, что ответная реакция будет зависеть не только от
концентрации экзогенно применяемого фитогормона, но также и от его эндогенного
уровня в тканях растений и соотношения с другими гормонами. Поэтому наиболее
четкие физиологические эффекты, специфичные для цитокининов, выявляются в
тех тканях и органах, в которых цитокинины не синтезируются.
Несмотря на то, что цитокинины могут влиять на многие процессы в растении,
наиболее существенным для роста и развития является их способность вместе с
ауксинами контролировать процессы деления клеток. Установлено, что цитокинины
стимулируют репликацию ДНК и активируют деление клеток, регулируя переходы
из фазы Gi в S и из G2 в фазу митоза.
Одним из главных факторов, определяющих форму растительного организма,
является апикальное доминирование верхушечной почки, которая подавляет разви-
тие боковых почек и формирование побегов. Доминирующий эффект апикальной
почки связан с повышенным уровнехМ ауксина в ней и аттрагирующим эффектом
этого гормона. Многочисленные опыты с 32Р-фосфатом и 14С-сахарозой показали,
что питательные вещества передвигаются и накапливаются в зонах с повышенным
уровнем ауксина, в том числе и в апикальных почках побегов. Важную роль в явле-
нии апикального доминирования играют также и цитокинины. У многих растений
обработка цитокининами (или их сверхпродукция у трансгенных растений) устраня-
ет эффект апикального доминирования и активирует рост боковых почек, поэтому
подавление роста боковых почек можно объяснить недостатком в них цитокининов.
Участие цитокининов в регуляции роста плодов подтверждается опытами, в ко-
торых показано присутствие этих фитогормонов в молодых плодах яблони, банана
и томатов на стадии активного клеточного деления в них.
Важным свойством цитокининов и ауксинов является способность регулировать
процессы морфогенеза у недифференцированных тканей. Сразу же после открытия
кинетина было обнаружено, что каллусная культура табака формирует корни или
побеги в зависимости от соотношения ауксинов и цитокининов в среде. Результаты
этого классического опыта, поставленного Ф.Скугом и К. Миллером, приведены на
рис. 10.11. Для образования корней из каллуса табака необходимо 2 мг/л ИУК и
0,02 мг/л кинетина. При возрастании концентрации кинетина до 0,2 мг/л наблюда-
ется интенсивное развитие только каллусной ткани (без дифференцировки). Даль-
нейшее повышение содержания цитокининов в инкубационной среде до 0,5- 1,0 мг/л
Рис. 10.11. Регуляция роста и органогенеза ауксином и цитокинином в каллусной культуре табака
(по: Skoog, Miller, 1965)
164
индуцирует побегообразование. У протонемы мха цитокинины при повышенных кон-
центрациях способствуют развитию гаметофора.
К.Мотес с коллегами установили, что обработка цитокининами предотвращает
распад хлорофилла, разрушение органелл и старение изолированных листьев. Эти
исследования также показали, что цитокинины повышают аттрагирующую способ-
ность клеток. Аттрагирующий эффект цитокининов выражается в том, что при на-
несении гормона на участок листа усиливается передвижение органических и неор-
ганических веществ к обработанному участку. Именно высокое содержание и аттра-
гирующие свойства цитокининов обеспечивают паразитическим растениям, напри-
мер Cuscuta reflexce, постоянный приток питательных веществ из тканей растения-
хозяина.
При помещении срезанных листьев в воду они быстро желтеют и стареют из-
за разрушения хлорофилла и белков. Обработка изолированных листьев цитоки-
нинами задерживает процессы старения и стимулирует синтез хлорофилла. Цито-
кинины активируют также синтез и других пигментов, например бетацианинов, у
растений рода Amaranthus. Стимулирующий эффект цитокининов на синтез одного
из бетацианинов — амарантина настолько специфичен, что положен в основу часто
применяемого биотеста для определения уровня цитокининов в тканях растений.
Хорошим примером, иллюстрирующим задержку старения листьев цитокининами,
служат «зеленые островки», появляющиеся осенью на желтеющих листьях неко-
торых древесных растений (в частности, у клена и березы). Замедление распада
хлорофилла в этих зеленых участках листа связано с повышенным содержанием
цитокининов, которые выделяют насекомые-фитофаги и патогенные грибы. Цито-
кинины обнаружены в слюнных железах личинок насекомых рода Stigmella, а также
в выделениях патогенных грибов рода Uromyces.
В лаборатории Т. Шмюллинга значительная часть исследований по выявлению
физиологической роли цитокининов выполнена с применением трансгенных расте-
ний, у которых либо был усилен распад цитокининов путем суперэкспрессии генов
цитокинин оксидаз/дегидрогеназ (СКХ-генов), либо была подавлена передача цито-
кининового сигнала за счет «выключения» тех или иных рецепторов цитокининов.
Установлено, что дефицит цитокининов по-разному сказывается на росте побе-
га и корня. Побег таких трансформантов растет медленнее, в то время как рост
корней активируется. Это позволяет рассматривать цитокинины как положитель-
ный регулятор роста побега, но отрицательный регулятор роста корня. Тем самым
синтезируемые в корне цитокинины во многом определяют общую архитектонику
растения, поддерживая оптимальный баланс между объемом надземной и подзем-
ной частей растения.
Получение трансгенных растений с разной степенью подавления процесса пере-
дачи цитокининового сигнала позволило выявить (или подтвердить) ряд специфич-
ных для цитокининов функций в растении. Цитокинины оказались важны для роста
побега, удлинения гипокотиля, роста и старения листьев, длительности пластохро-
на, роста корня, общей архитектоники растения, а также размера семян. При этом
отдельные рецепторы цитокининов играли доминирующую роль в осуществлении
тех или иных функций этих гормонов. Например, передача сигнала через рецептор
АНКЗ определяла задержку старения листьев. Скорость прорастания семян больше
зависела от рецептора АНК2.
В работах Хванга с коллегами (2005) было установлено, что из трех цитокини-
новых рецепторов арабидопсиса только мутация или суперэкспрессия АНКЗ влияла
165
на продолжительность жизни листа. Корейские исследователи показали, что ак-
тивированный рецептор АНКЗ специфически передает свой фосфат на регулятор
ответа ARR2. Согласно их данным, фосфорилированный ARR2 подвергается быст-
рой деградации на протеасоме, и именно индуцированное цитокинином снижение
содержания белка ARR2 в клетках приводит к задержке старения и увеличению
срока жизни листа.
В регуляции процессов роста и развития растений необходимо участие и взаимо-
действие нескольких фитогормонов. Определяющее значение при этом имеет тандем
ауксины —цитокинины. Именно эта пара гормонов действует синергично, стимули-
руя пролиферацию клеток, но антагонистично при регуляции роста боковых почек
побега и боковых корней. Боковые корни у арабидопсиса образуются из небольшо-
го числа клеток перицикла, соседствующих с так называемым полюсом ксилемы.
Ауксин стимулирует эти клетки к завершению цикла, то есть к делению, и вызыва-
ет необходимую дифференцировку клеток для формирования зачатка корня. Бло-
кирование полярного транспорта ауксина с помощью пафтилфталамовой кислоты
полностью подавляет развитие боковых корней. Известно, что в транспорте ауксина
в клетки арабидопсиса участвует белок-переносчик AUX1, а также подобный ему
белок LAX3 (like AUX1 3). Именно их экспрессия оказалась важной для инициа-
ции корней. Ауксин стимулирует экспрессию LAX3, но не в инициальных клетках
перицикла, а в соседствующих с ними клетках эпидермиса. Эти клетки также ак-
кумулируют ИУК и облегчают прорастание корешка, в частности путем экспрес-
сии ферментов деградации клеточной стенки. Цитокинины же, наоборот, подавля-
ют формирование боковых корней, нарушают их нормальную организацию, рост
и развитие корневого зачатка. Имеются сведения, что этот угнетающий эффект,
возможно, связан со способностью цитокининов подавлять экспрессию и изменять
паттерн PIN-белков, отвечающих за полярность транспорта ИУК. Таким образом,
процесс образования боковых корней в растениях арабидопсиса определяется взаи-
модействием в системе ауксины-цитокинины.
Глава 11
АБСЦИЗОВАЯ КИСЛОТА
Наблюдения за процессами развития растений привели исследователей к выводу,
что помимо гормонов-активаторов (ауксины, гиббереллины и цитокинины), в расти-
тельном организме должны существовать вещества, ответственные за торможение
ростовых процессов.
В 1949 г. Т. Хемберг из покоящихся почек ясеня Fraxinus excelsior получил эфир-
ный экстракт, который вызывал торможение роста колеоптилей овса Avena sativa.
Выяснение химической природы этого ингибитора стало возможным, когда для раз-
деления веществ стали применять хроматографию на бумаге. В 1953 г. Т. Беннет-
Кларку и Н. Кеффорду удалось выделить это вещество хроматографически.
В 1961 г. Б. Лью и X. Карнс из зрелых коробочек хлопчатника Gossypium hir-
sutum получили в кристаллическом виде вещество, ускоряющее опадение листьев,
которое они назвали абсцизином (abscission — отнятие, ампутация). Аналогичная ра-
бота в 1963 г. была проделана группой Ф. Эддикота. Для получения 9 мг вещества,
которое они назвали абсцизином II, было переработано 225 кг коробочек хлопчатни-
ка. Этим же исследователям удалось установить эмпирическую формулу абсцизина
II — С15Н20О4, а также ряд его химических и физиологических характеристик.
В это же время Ф. Уоринг с коллегами из листьев березы Betula pubescens и
явора Acer pseudoplatanus выделили ингибитор, который вызывал покой почек. По-
лученное вещество было названо ими дормином (dormancy - покой). Позже в ре-
зультате совместной работы групп Ф. Уоринга и Дж. Корнфорта (1965) выяснилось,
что дормин явора по своим физико-химическим характеристикам полностью иден-
тичен абсцизину. Молекулярная структура абсцизина (дормина) была предложена
в 1965 г. К.Окумой с соавторами, а несколькими месяцами позже Дж. Корпфорт с
коллегами подтвердил ее с помощью химического синтеза. Во избежание возможных
недоразумений с названием открытого вещества группы Ф. Эддикота, Ф. Уоринга
и Дж. Корнфорта в 1967 г. встретились и дали ему название абсцизовая кислота
(АБК).
К наиболее важным процессам, которые контролирует в растениях АБК, отно-
сятся: регуляция покоя семян и почек, ранние этапы онтогенеза (развитие семян и
проростков), закрывание устьиц, ответные реакции растений на такие стрессовые
воздействия как засуха и засоление.
167
11.1. Метаболизм абсцизовой кислоты
Гормон АБК представлен одним химическим соединением терпеноидной приро-
ды (рис. 11.1), которое имеет несколько стереоизомерных форм. Во-первых, это два
зеркально симметричных энантиомера, имеющих разную оптическую активность:
S(+)-ABK вращает плоскость поляризованного света вправо, a R(-)-ABK — влево.
Оба энантиомера обладают гормональной активностью, однако растения синтези-
руют только S(+)-ABK. Во-вторых, АБК проявляет геометрическую изомерию от-
носительно двойных связей в положении 2 и 4. У природной АБК двойная связь
в положении 4 всегда имеет транс-конфигурацию. Двойная связь в положении 2
обычно имеет i^c-конфигурацию, но под действием изомеразы может приобретать
транс-конфигурацию. Биологически активна только i^uc-АБК, поэтому образова-
ние транс-АБК можно рассматривать как способ инактивации гормона.
SpHu/c-ABK
Рис. 11.1. Стереоизомеры абсцизовой кислоты
3(+)-транс-АБК
Абсцизовую кислоту синтезируют все растения, цианобактерии, а также мно-
гие фитопатогенные, микоризные и сапрофитные грибы. Содержание АБК в тка-
нях растений в среднем составляет 10-50 нг/г сырой массы. Особенно богаты этим
фитогормоном созревающие семена и плоды, покоящиеся почки, старые листья. В
условиях засухи и засоления концентрация АБК в тканях растений возрастает в
десятки раз.
Биосинтез АБК. Абсцизовая кислота образуется во всех органах растений, но
преимущественным местом ее синтеза являются листья и кончики корней, отку-
да она по сосудистым пучкам транспортируется акро- и базипетально. Много АБК
синтезируют созревающие семена на стадии обезвоживания и перехода в состоя-
ние покоя. Абсцизовая кислота может синтезироваться прямым путем, в результате
циклизации сесквитерпена фарнезилдифосфата, и непрямым путем, в результате
окислительного разрыва эпоксикаротиноидов (рис. 11.2). Прямым путем синтези-
руют АБК грибы, а также, по-видимому, красные водоросли, жгутиковые и ци-
анобактерии, не имеющие виолаксантина и зеаксантина. Представление о том, что
все высшие растения синтезируют АБК из каротиноидов, вначале опиралось на сле-
дующие доказательства: 1) мутанты по биосинтезу каротиноидов, например многие
«живородки» кукурузы, у которых зерновки прорастают прямо в початке, имеют
дефицит АБК; 2) ингибиторы биосинтеза каротиноидов, например флуридон, ин-
гибирующий фитоин-десатуразу, подавляют и синтез АБК; 3) атом кислорода из
18С>2 включается в каротиноиды раньше, чем в АБК. Позднее были клонированы
ферменты, катализирующие реакции окисления каротиноидов до АБК.
Каротиноиды находятся только в мембранах тилакоидов, поэтому ранние эта-
пы биосинтеза АБК, как в зеленых, так и в незеленых частях растений, протека-
ют в пластидах. Абсцизовая кислота синтезируется из ксантофиллов - кислородсо-
держащих желтых каротиноидов, которые циркулируют в ксантофилльном цикле
168
Рис. 11.2. Образование АБК из каротиноидов
169
(рис. 11.2). В этом цикле, играющем существенную роль в регуляции работы све-
тособирающих антенн хлоропластов, совершаются взаимопревращения зеаксанти-
на, антераксантина и виолаксантина. В условиях высокой освещенности происходит
превращение виолаксантина, собирающего солнечную энергию, в зеаксантин, ее рас-
сеивающий. Эту реакцию катализирует виол аксантин-деэпоксидаза, используя для
восстановления виолаксантина аскорбиновую кислоту.
Обратный процесс окисления зеаксантина в виолаксантин происходи!' при уча-
стии зеаксантин-эпоксидазы. Эта мембранная ФАД-содержащая монооксигена-
за один атом из О2 внедряет в субстрат, а второй превращает в Н2О, окис-
ляя косубстрат -восстановленный ферредоксин. В результате эпоксидации одного
^-иононового кольца зеаксантин превращается в антераксантин. Последующая эпок-
сидация второго /3-иононового кольца приводит к превращению антераксантина в
виолаксантин.
Гены зеаксантин-эпоксидазы сильно экспрессированы в листьях, но значительно
в меньшей степени — в незеленых тканях. В листьях наблюдается суточный ритм
экспрессии генов зеаксантин-эпоксидазы с максимумом в середине дня. Как пра-
вило, отсутствует корреляция между уровнем экспрессии этих генов в листьях и
скоростью синтеза АБК. Очевидно, что из-за высокого содержания виолаксантина в
листьях зеаксантин-эпоксидаза не контролирует синтез АБК в клетках листа. В то
же время, в незеленых тканях, например в корнях и семенах, наблюдается прямая
зависимость скорости синтеза АБК от активности зеаксантин-эпоксидазы.
Следующий этап на пути синтеза АБК состоит в изомеризации виолаксантина
под действием изомераз, которые до сих пор не удалось выделить. В результате
изомеризации 7'-двойной связи, сопровождающейся раскрытием эпоксидного коль-
ца, происходит превращение виолаксантина в неоксантин (рис. 11.2). Изомеризация
9-двойной связи приводит к превращению полного транс-изомера виолаксантина в
9-цис-виолаксантин, а неоксантина - в 9-цис-неоксантин.
Затем при участии Fe2+-содержащих диоксигеназ 9-цис-эпоксикаротиноидов
происходит окислительный разрыв двойной связи в положении 11, в результате ко-
торого С4о-цепь каротиноида распадается на С15- и С25-альдегиды. С15-альдегид —
это ксантоксин, предшественник АБК. Диоксигеназа 9-цис-эпоксикаротиноидов ло-
кализована в пластидах, причем разные изоферменты (у арабидопсиса их пять) в
разной степени связаны с мембранами тилакоидов, в которых находился субстрат
этого фермента.
Ксантоксин транспортируется из пластид в цитоплазму, где подвергается даль-
нейшему окислению. Растительные экстракты в присутствии НАД(Ф)+ быстро
окисляют ксантоксин в АБК. Известно три способа этого превращения. Главный
путь начинается с окисления ксантоксина до абсцизового альдегида при участии
короткоцепочечной дегидрогеназы. В этой реакции превращение 4'-гидроксилыюй
группы в кетогруппу сопровождается раскрытием эпоксидного кольца с образова-
нием аллилового спирта. Затем абсцизовый альдегид окисляется до АБК с помощью
оксидазы абсцизового альдегида, которая содержит молибденовый кофермент фла-
виновой природы. Фермент активен только тогда, когда молибденовый кофермент
сульфурилирован под действием специальной сульфуразы (рис. 11.3). Мутанты, де-
фектные по сульфуразе молибденового кофермента (abal табака, аЬаЗ арабидопси-
са, flacca и sitiens томата), имеют низкий уровень АБК.
Растения могут превращать в АБК не только ксантоксин и абсцизовый альде-
гид, но и ксантоксиновую кислоту. Однако этот процесс малоактивный. Ксантокси-
170
о о
Рис. 11.3. Сульфурилирование молибденового кофермента оксидазы абсцизового альдегида
(по: Seo, Koshiba, 2002)
новая кислота образуется из ксантоксина под действием альдегидоксидазы и затем
окисляется в АБК с помощью короткоцепочечвой дегидрогеназы. Третий путь об-
разования АБК из ксантоксина был выявлен при изучении мутантов томата flacca и
sitiens, неспособных превращать абсцизовый альдегид в АБК. Эти мутанты накап-
ливают абсцизовый спирт, который, как выяснилось в опытах in vitro, может прямо
превращаться в АБК (см. рис. 11.2).
Конъюгация АБК. Наиболее распространен сложный эфир АБК с глюкозой
(рис. 11.4). В значительно меньших количествах в растениях содержится 1'-0-глю-
козид АБК. Поскольку быстрое накопление АБК в условиях почвенной засухи и
быстрое снижение ее уровня после полива растений не сопровождаются столь же
значительными изменениями количества конъюгатов, долгое время считалось, что
конъюгация с глюкозой приводит к необратимой инактивации гормона. Однако в по-
следние годы у арабидопсиса была клонирована (3-глюкозидаза глюкозного эфира
АБК (AtBGl). Активность AtBGl возрастает в условиях засоления и засухи, когда
происходит накопление свободной АБК. Мутант atbgl имеет мало АБК. Сверхэкс-
прессия AtBGl приводит к повышению уровня АБК в тканях арабидопсиса. Белок
AtBGl локализован в полости эндоплазматической сети, а глюкозные эфиры АБК
находятся в основном в вакуоли и клеточной стенке и поэтому должны каким-то
образом транспортироваться через мембраны.
Рис. 11.4. Конъюгаты АБК с глюкозой
Катаболизм АБК. Наиболее распространенный путь окисления АБК начина-
ется с гидроксилирования в положении 8', приводящего к образованию 8'-гидрокси-
АБК (рис. 11.5). Эту реакцию катализирует связанная с мембранами эндоплазма-
тической сети монооксигеназа семейства цитохрома Р450. Затем 8'-гидрокси-АБК,
по-видимому спонтанно, циклизуется с образованием фазеевой кислоты. Фазеевая
кислота и 8'-гидрокси-АБК обладают гормональной активностью в некоторых био-
171
4'-О-глюкозид дигидрофазеевой кислоты
Рис. 11.5. Пути катаболизма АБК
пробах на АБК. Восстановление кетогруппы до спиртовой под действием редукта-
зы приводит к образованию дигидрофазеевой кислоты, полностью лишенной гормо-
нальной активности.
Кроме дигидрофазеевой кислоты в тканях растений накапливается ее 4'-0-глю-
козид. Абсцизовая кислота может также гидроксилироваться в положении 7' и пре-
вращаться в 7'-гидрокси-АБК, имеющую небольшую гормональную активность. На-
конец, инактивация АБК может достигаться восстановлением кетогруппы до спир-
товой с образованием 1',4'-диолов АБК.
Регуляция метаболизма АБК в процессе развития и под действием
внешних факторов. Механизмы регуляции уровня свободной АБК изучены в
условиях резких изменений водного статуса растений, а также в процессе созревания
и обезвоживания семян. Хорошо известно, что АБК интенсивно метаболизируется,
поэтому ее уровень в растительных тканях поддерживается балансом быстро про-
текающих реакций биосинтеза и инактивации. Основной способ инактивации АБК
состоит в ее окислении до фазеевой кислоты.
Поскольку АБК образуется из каротиноидов, подавление биосинтеза каротинои-
дов в результате мутаций или применения ингибиторов приводит к снижению уров-
ня АБК. Однако в нормальных условиях содержание ксантофиллов, в том числе
виолаксантина, в зеленых тканях настолько превышает содержание АБК, что ско-
рость синтеза каротиноидов не лимитирует синтез АБК. Как уже отмечалось ранее,
активность зеаксантин-эпоксидазы влияет на синтез АБК только в незеленых ча-
стях растения. Например, значительное увеличение экспрессии генов зеаксантин-
эпоксидазы наблюдается в кончиках корней в условиях засухи, а также в семенах
на стадии созревания, когда происходит накопление АБК.
172
Изменение активности диоксигеназы 9-цглс-эпоксикаротиноидов представляет со-
бой важнейший способ регуляции содержания АБК во всех тканях растений. Экс-
прессия генов этого фермента значительно возрастает в листьях и корнях в усло-
виях засухи. Она возрастает у двудольных под действием высоких концентраций
ИУК. Реакция на ИУК опосредована вызываемым ею синтезом этилена. Сверхэкс-
прессия кодирующего эту диоксигеназу гена AtNCED3 у арабидопсиса приводит к
накоплению АБК в листьях и других частях растения. В развивающихся семенах
арабидопсиса в период накопления АБК сильно экспрессированы гены AtNCED3,
AtNCED5, AtNCED6 и AtNCED9,
Скорость превращения ксантоксина в АБК обычно высока и мало меняется при
обезвоживании. Тем не менее, регуляция биосинтеза АБК в листьях происходит и
на этом этапе. Так, мутант арабидопсиса ааоЗ, у которого нарушен ген, кодирую-
щий сульфуразу молибденового кофермента альдегидоксидазы, не может поднять
уровень АБК в листьях в условиях засухи и быстро завядает. Экспрессия A tAA ОЗ
в листьях индуцируется обезвоживанием. Таким образом, биосинтез АБК в зеленых
частях растения регулируется на стадии разрыва эпоксикаротиноидов и окисления
абсцизового альдегида, а в незеленых -- на стадии эпокеидации зеаксантина и раз-
рыва эпоксикаротиноидов.
Уровень свободной АБК также регулируется скоростью ее катаболизма. На сус-
пензионной культуре кукурузы показано, что АБК вызывает увеличение активности
8'-гидроксилазы, окисляющей АБК до фазеевой кислоты. Очевидно, что этот ме-
ханизм регуляции направлен на поддержание уровня АБК. Однако существует и
другой механизм регуляции активности 8'-гидроксилазы, который приводит к сни-
жению активности этого фермента в условиях засухи, несмотря на накопление АБК.
Наконец, регуляция уровня свободной АБК может достигаться посредством об-
разования и гидролиза конъюгатов с глюкозой. Так, в условиях засоления и засухи
у арабидопсиса возрастает активность /3-глюкозидазы, гидролизующей глюкозный
эфир АБК. Причем активация /3-глюкозидазы происходит не столько за счет воз-
растания экспрессии гена, кодирующего этот фермент, сколько в результате про-
исходящей в условиях осмотического стресса полимеризации фермента, то есть на
посттрансляционном уровне.
11.2. Механизм действия абсцизовой кислоты
Система трансдукции АБК-сигнала включает рецепторы, транспортные мем-
бранные белки (ионные каналы и транспортные АТФазы), вторичные посредники
(ионы Са2+, инозитол-1,4,5-трисфосфат, циклическая АДФ-рибоза, фосфатидная
кислота), белки, осуществляющие фосфорилирование (дефосфорилирование), тран-
скрипционные факторы и АБК-регулируемые гены. Генетический анализ физиоло-
гических процессов, контролируемых АБК (прорастания семян, покоя, осмотиче-
ского стресса, транспирации), позволил выделить ряд АБК-дефицитных мутантов,
у которых удалось выявить гены и генные продукты, принимающие участие в рецеп-
ции и трансдукции АБК-сигнала, а также в регуляции АБК-зависимых процессов.
Рецепция АБК-сигнала. Основной моделью для выяснения молекулярного
механизма действия АБК являются мутанты, у которых нарушена чувствитель-
ность к гормону из-за повреждения системы рецепции или ответных реакций на
АБК. Мутантов, нечувствительных к АБК, отбирают по способности развиваться
на средах с избыточной концентрацией этого гормона (в 10 раз выше нормы). От-
173
личительной особенностью таких мутантов является то, что обработка их АБК не
приводит к восстановлению дикого фенотипа.
К настоящему времени выявлены три связывающие АБК белка — вероят-
ные рецепторы АБК: 1) FCA (flowering time control protein A) — ядерный PHK-
связывающий белок; 2) ABAR/CHLH (abcisic acid receptor/H-субъсдиница Mg-
хелатазы) — белок, локализованный в пластидах; 3) GCR2 (G-protein-coupled recep-
tor 2) -белок, локализованный в плазматической мембране.
Ген FCA, контролирующий автономный путь регуляции времени цветения ара-
бидопсиса, был выделен Р. МакНайтом с коллегами в 1997 г. Было установлено, что
этот ген кодирует ядерный белок FCA, содержащий два РНК-связывающих домена
(на N-конце) и триптофан-триптофан (WW) белок-связывающий домен (на С-конце
молекулы). Позднее, в 2006 г., Ф. Разем с коллегами показали, что белок FCA спо-
собен выполнять функции рецептора и связывать АБК с высокой аффинностью
(Ко — 19 нмоль/л) и стереоспецифичностью. АБК-связывающий сайт находится на
С-конце белковой молекулы и частично перекрывает, но не включает WW-домеп.
Белок FCA является позитивным регулятором цветения. В условиях, благопри-
ятных для цветения, с WW-доменом FCA связывается белок FY (flowering locus Y).
Именно взаимодействие FCA-FY является ключевым фактором, регулирующим цве-
тение. Формирование комплекса FCA-FY препятствует накоплению мРНК репрессо-
ра цветения FLC (flowering locus С). Белок-ингибитор FLC относится к MADS-бокс
содержащим факторам транскрипции.
В присутствии АБК происходит диссоциация комплекса FCA-FY и образование
комплекса FCA-АБК, что уже не препятствует синтезу ингибитора FLC и приводит
к подавлению цветения. Ф. Разем с коллегами делают вывод о том, что FCA явля-
ется тем рецептором АБК, который участвует в АБК-опосредованном метаболизме
РНК и контролирует время цветения арабидопсиса. Выяснилось также, что FCA
участвует в АБК-зависимой регуляции роста боковых корней арабидопсиса. При
этом, однако, пока нет сведений о том, что рецепторный белок FCA может прини-
мать участие в других ответных реакциях растений на АБК, например таких, как
прорастание семян и закрывание устьиц.
В 2002 г. К. Занг с коллегами из эпидермиса листьев конских бобов Vicia faba
выделили белок с молекулярной массой 42 кД, который специфически связывал 3Н-
АБК с Ке>=21 нмоль/л. Предобработка протопластов замыкающих клеток устьиц
моноклональными антителами против этого белка значительно снижала специфи-
ческий для АБК эффект — индукцию активности фосфолипазы D. На основании
полученных результатов авторы пришли к выводу о том, что белок 42 кДа может
выполнять АБК-рецепторные функции в ряде клеток и тканей растительного ор-
ганизма. Доказательства рецепторных функций этого белка К. Зангу удалось полу-
чить в 2006 г. вместе с группой исследователей из пекинского сельскохозяйственного
университета — Й. Шен с коллегами (2006). Они установили, что выделенный из ли-
стьев конских бобов АБК-связывающий белок ABAR (abscisic acid receptor) являет-
ся Н-субъединицей Mg-протопорфирин-ТХ-хелатазы (CHLH). Фермент Mg-хелатаза,
который катализирует включение Mg в протопорфирин-IX, состоит из трех субъеди-
ниц: CHLD, СНЫ, CHLH.
Было выявлено, что субъединица CHLH кодируется ядерным геномом, локали-
зуется на внешней мембране хлоропласта и, помимо проявления ферментативной
активности, связывает (+)АБК и играет ключевую роль в передаче сигнала от пла-
стид к ядру. На растениях арабидопсиса было показано, что белок ABAR/CHLH
174
способен специфично (Кd -32 нмоль/л) связывать АБК. Это связывание опосре-
дует сигнал АБК при регуляции таких процессов как прорастание семян, ранние
этапы роста проростка и движение устьиц, что указывает на рецепторную функцию
ABAR/CHLH. Доказательством рецепторных функций является также тот факт,
что подавление экспрессии ABAR снижает число АБК-связывающих сайтов и при-
водит к АБК-нечувствительности. С другой стороны, при сверхэкспрессии ABAR
наблюдается сверхчувствительность арабидопсиса к АБК и повышение числа АБК-
связывающих сайтов. Было установлено также, что ABAR/CHLH экспрессируется
не только в зеленых, но также и в незеленых тканях (корнях, семенах), что ука-
зывает на то, что этот белок может выполнять рецепторные функции нс только в
листьях, но и других органах.
Имеется только одна работа, выполненная К. Лью с коллегами в 2007 г., в кото-
рой указывается, что роль мембранного рецептора АБК (локализованного в плаз-
матической мембране) может выполнять белок GCR2 (G-protein-coupled receptor 2).
Предполагается, что этот белок относится к типу мембранных рецепторов, функци-
онирование которых сопряжено с G-белками. К. Лью с коллегами (2007) считают,
что после связывания АБК со своим рецептором GCR2 дальнейшая передача гор-
монального сигнала осуществляется через а-субъединицу (GPA1) гетеротри мерного
G-белка. Однако в работе Я. Гао с соавторами (2007) были получены результаты, ко-
торые ставят под сомнение утверждение о том, что белок GCR2 может выполнять
функции сопряженного с G-белком мембранного рецептора АБК, поэтому вопрос о
мембранном рецепторе АБК пока еще остается открытым.
Таким образом, связывающие АБК белки обнаружены не только в плазмати-
ческой мембране, но также в ядре и на внешней мембране хлоропластов. Однако
рецепторные функции пока не доказаны ни для одного из этих белков.
АБК-регулируемые гены. АБК регулирует экспрессию многих генов в ходе
созревания семян, а также в стрессовых условиях (перегрев, низкие температуры,
засоление). С помощью микрочипов фрагментов ДНК в геноме арабидопсиса вы-
явлено более 800 генов, экспрессия которых повышается под действием АБК более
чем в три раза. Из них около 100 генов кодируют транскрипционные факторы, а 60
генов -киназы, принимающие участие в трансдукции АБК-сигнала.
Характерной чертой генов, регулируемых АБК, является наличие в промотор-
ной области нуклеотидной последовательности, называемой ABRC (АВА response
complex). Это АБК-регулируемый комплекс, который является мишенью соответ-
ствующих факторов транскрипции, образующихся в ответ на АБК. Чувствитель-
ность этого комплекса к АБК определяется ABRE (ABA-response element) -- АБК-
отвечающим элементом. Наиболее хорошо изученным АБК-регулируемым ком-
плексом является GARC гена а-амилазы ячменя, который активируется гибберел-
линами, но репрессируется в ответ на АБК (см. главу 9).
Транскрипционные факторы, которые специфически связываются с ABRE, на-
зывают ABF (ABRE binding factors). Фактор транскрипции ABF1 специфически
индуцируется АБК и холодом, ABF2 и ABF3 синтезируются в ответ на АБК и засо-
ление, а появление ABF4 стимулируется в ответ на АБК, засоление, холод и засуху.
АБК-регулируемые факторы транскрипции условно делят на два тина: 1) ABF, от-
носящиеся к bZIP-типу, и 2) другие факторы транскрипции, которые не относятся
к bZIP-типу (табл.11.1). Второй тип транскрипционных факторов представлен, в
частности, AIYB/M YС-бел ками.
Основным элементом ABRE, с которым взаимодействуют АБК-регулируемые
175
факторы транскрипции, является последовательность нуклеотидов PyACGTGGC,
называемая G-боксом, или G-ABRE. Впервые G-ABRE был выявлен в промоторах
гена ЕМ (embryo maturation) пшеницы и гена RAB16A (responsive to АВА) риса.
Однако для индукции АБК-зависимых генов необходимо, чтобы в промоторе при-
сутствовал не только G-ABRE, но и так называемый фактор сопряжения. В качестве
фактора сопряжения может выступать и сам G-ABRE, а также СЕ1, СЕЗ (coupling
element) и мотив III. Именно с G-боксом могут специфично связываться факторы
транскрипции, например bZIP-типа (см. табл. 11.1). Однако встречаются промоторы,
которые имеют в своем составе G-бокс, но не реагируют на АБК. Известны также
АБК-регулируемые гены, в составе промоторов которых нет G-ABRE и фактора
сопряжения.
Таблица 11.1. АБК-регулируемые факторы транскрипции
Название Тип Функции
ABF1 bZIP Способствует устойчивости к холоду
ABF2, ABF3 bZIP Способствует устойчивости к засолению
ABF4 bZIP Способствует устойчивости к холоду, засолению и засухе
AtMYC/RD22BPl MYC Регулятор RD22
AtMYB2 MYB Регулятор RD22
CBF1-CBF4, DREB1A- DREB1D AP2 Факторы, связывающие С- повторы и DRF, участвуют в реакции на холод
ANAC019 NAC Способствует устойчивости к засухе
ANAC055 NAC Способствует устойчивости к засухе
ANAC072/RD26 NAC Регулирует реакции на АБК и стрессоры
ATHB5 HD-ZIP Позитивный регулятор реак- ции на АБК
SCOF-1 Цинковые пальцы Способствует устойчивости к холоду
AZF2 Цинковые пальцы Репрессор транскрипции, способствует устойчивости к засухе
STZ Цинковые пальцы Способствует устойчивости к холоду, засолению и засухе
АБК-индуцируемые гены делят на 8 групп в соответствии с их функциями. Эти
гены участвуют в следующих процессах: 1) рост и деление клеток, 2) защитные ре-
акции, 3) межклеточные взаимодействия и проведение сигналов, 4) биогенез кле-
точных органелл, 5) обмен веществ и энергии, 6) синтез и адресация белков,
7) транскрипция, 8) мембранный транспорт.
Трансдукция АБК-сигнала. Сложности в расшифровке механизма трансдук-
ции АБК-сигнала связаны с тем, что его передача происходит не линейным путем,
а осуществляется через очень сложную сигнальную сеть. Взаимосвязи между раз-
личными сигнальными путями могут осуществляться, как минимум, двумя путями:
или один сигнальный путь влияет на уровень сигнального элемента в другом сиг-
нальном пути, или различные сигнальные пути сходятся в каком-то общем, узловом
176
сигнальном компоненте, являющимся связующим звеном нескольких сигнальных
путей. Если процесс передачи АБК-сигнала осуществляется вторым способом, то
возникают большие трудности с расшифровкой процессов, контролируемых именно
АБК, которые начинаются после узлового сигнального компонента.
Одними из таких узловых компонентов, на которых сходятся различные сигналь-
ные пути, могут быть промоторы генов, в том числе и АБК-регулируемых. Основой
для выявления специфичности участия в проведении АБК-сигнала могут служить
их ф/с-регуляторные элементы. Одним из наиболее хорошо изученных элементов
АБК-сигнализации являются ABRE, которые служат мишенью соответствующих
факторов транскрипции, образующихся в ответ на АБК. Особенность генов, в со-
став которых входят ABRE, заключается в способности реагировать не только на
АБК, но и на другие сигналы. В семенах арабидопсиса ABRE синергично взаимо-
действует с элементом под названием RY, который усиливает транскрипцию генов,
специфичных для семян (рис. 11.6).
Как уже упоминалось, типичный ABRE содержит G-бокс, который распознает-
ся факторами транскрипции, относящимися к bZlP-типу. Одним из таких факторов
транскрипции является белок ABI5 (abscisic acid insensitive 5). В семенах араби-
допсиса ABI5 bZIP фактор транскрипции специфически связывается с ABRE и
активирует АБК-зависимую транскрипцию. Установлено также, что белок ABI3,
который активирует RY-опосредованную экспрессию, тоже взаимодействует с ABI5
(рис. 11.6).
Способ передачи сигнала, по-видимому, в значительной степени определяется ви-
дом процесса, который контролируется АБК. Так, в сигнальном каскаде, с помощью
которого АБК тормозит прорастание семян, участвуют три элемента: фосфатидная
кислота (ФК), фосфатидатфосфатаза (ФФ) и ген А ВЦ (abscisic acid insensitive 4),
кодирующий транскрипционный фактор типа АР2. На рис. 11.7 показан механизм
передачи АБК-сигнала на ген А ВЦ. Как сигнальная молекула липидной природы
Сигнал 1 Сигнал 2 Сигнал 3
Экспрессия генов
Рис. 11.6. Передача сигналов с участием АБК-регулируемых
факторов транскрипции (ABI5, ABI3) и АБК-зависимого
цис-регуляторного элемента (ABRE) (по: Nambara, Marion-
Poll, 2003)
ABI4
Прорастание семян
Рис. 11.7. Передача АБК-сигна-
ла в ходе подавления прорас-
тания семян арабидопсиса (по:
Katagiri et al., 2005).
ФК — фосфатидная кислота;
ФФ — фосфатидатфосфатаза;
ABI4 — АБК-зависимый фактор
транскрипции
177
ФК является тем триггером, который запускает процессы, контролируемые АБК.
Фосфатидатфосфатаза, расщепляющая ФК на диацилглицерол и фосфат, функци-
онирует как негативный регулятор, препятствующий передаче сигнала на ген А ВЦ-
Роль циклической АДФ-рибозы в трансдукции АБК-сигнала. Хорошо
известно, что трансдукция АБК-сигнала может осуществляться через изменение
концентрации ионов Са2+ в цитоплазме. В процессе высвобождения ионов Са2+ из
внутриклеточных компартментов важная роль принадлежит одному из вторичных
посредников — циклической АДФ-рибозе (цАДФР). Этот циклический нуклеотид,
впервые выделенный в 1989 г. К. Ли с коллегами из яиц морского ежа, синтезиру-
ется из НАД с помощью фермента АДФ-рибозилциклазы. В работе Ж. Санчеса с
коллегами (2004) было показано, что активность фермента АДФ-рибозилциклазы
у арабидопсиса быстро индуцируется АБК. Более того, у трансгенных растений
арабидопсиса с повышенной экспрессией гена, кодирующего АДФ-рибозилциклазу,
наблюдали не только повышение содержания цАДФР, но также повышенный уро-
вень экспрессии таких АБК-зависимых генов как KIN2, RD22, RD29a и COR47
(cold-responsive 47). Ранее И. By с коллегами (1997) на трансгенных растениях то-
матов, трансформированных конструкциями, содержащими два АБК-зависимых ге-
на— RD29a-GUS и KIN2-GUS, также было показано, что обработка цАДФР акти-
вирует экспрессию генов RD29a и KIN2.
Ж. Санчес с коллегами (2004) обнаружил, что цАДФР регулирует экспрессию
до 28% АБК-зависимых генов арабидопсиса. Исходя из полученных результатов
делается вывод, что одним из самых ранних АБК-зависимых сигнальных событий
является активация АДФ-рибозилциклазы и синтез цАДФР, который является клю-
чевым элементом в трансдукции АБК-сигнала и поэтому играет очень важную роль
в АБК-зависимых молекулярных и физиологических процессах.
Механизм закрывания устьиц под действием АБК. Одной из самых ран-
них реакций при водном стрессе является резкое повышение уровня АБК. инду-
цирующее закрывание устьиц, что снижает потери воды за счет транспирации и
защищает растение от засухи.
В системе передачи сигналов у растительных организмов основными компонен-
тами являются ионные каналы совместно с системой вторичных посредников и сиг-
нальных белков. В процессе закрывания замыкающих клеток устьиц принимают
участие рецепторы АБК, протеипкиназы и протеинфосфатазы, ионные каналы плаз-
малеммы и тонопласта, вторичные посредники (инозитол-1,4,5-трисфосфат, фосфа-
тидная кислота, Н2О2, NO. цАДФР и ионы Са2+), а также ферменты, участвующие
в их образовании (фосфолипаза С, фосфолипаза I), НАДФ • Н-оксидаза, нитратре-
дуктаза и АДФ-рибозилциклаза). Несмотря на то, что функции многих элементов
в системе передачи сигнала изучены достаточно хорошо, роль некоторых из них.
например Н2О2 и NO, пока еще не понятна.
Закрывание устьиц под действием АБК происходит в результате падения тур-
гора в замыкающих клетках за счет выхода ионов К+, сахарозы, анионов, а так-
же превращения яблочной кислоты в осмотически неактивный крахмал. Движения
замыкающих клеток устьиц в ответ на обработку абсцизовой кислотой являются
наиболее ярким примером активации целого каскада ионных каналов в ходе транс-
дукции гормонального сигнала у высших растений. В этом процессе принимают
участие анионные, кальциевые и калиевые каналы плазматической мембраны и то-
нопласта.
В плазмалемме замыкающих клеток устьиц функционируют два типа анион-
178
ных каналов: медленные S-типа (slow) и быстрые R-типа (rapid). Оба типа каналов
активируются при деполяризации мембранного потенциала. При активации ани-
онных каналов S-типа наблюдается долговременное (в течение нескольких минут)
падение мембранного потенциала. Активация анионных каналов R-типа приводит к
кратковременной деполяризации плазмалеммы. А. Грабов с коллегами (1997) уста-
новили, что обработка АБК активирует именно медленные каналы S-типа. Поэтому
центральным звеном механизма регуляции закрывания устьиц, вероятно, следует
считать активацию АБК анионных каналов S-типа, поскольку только они способ-
ны обеспечивать длительную и устойчивую деполяризацию мембраны, необходи-
мую для включения К+ut-каналов и выхода ионов К+ из замыкающих клеток. Это
подтверждается еще и тем, что угнетающий эффект блокаторов анионных каналов
S-типа на АБК-индуцируемое закрывание устьиц выражен в гораздо большей сте-
пени, чем блокирование работы Са2+-каналов. Недавно М. Рольфсемой с коллегами
(2004) было показано, что деполяризация мембраны, индуцированная АБК в замы-
кающих клетках устьиц Vicia faba, коррелировала с активацией анионных каналов
и S-, и R-типа. Авторы считают, что основой деполяризации плазмалеммы клеток
устьиц является активация под действием АБК обоих типов анионных каналов.
Механизм осморегуляции в замыкающих клетках устьиц невозможно понять без
рассмотрения роли в этом процессе вакуоли, поскольку она занимает до 90% объе-
ма клетки. В процессе движения устьиц ионы К+ и анионы пересекают не только
плазмапемму, но и тонопласт. Основной путь выхода ионов К+ из вакуоли — высо-
коселективные К+-каналы тонопласта (VK-каналы), которые активируются, когда
концентрация ионов Са2+ в цитоплазме повышается до 1 мкмоль/л. При снижении
содержания ионов Са2+ в цитоплазме поток ионов К+ из вакуоли в цитоплазму
обеспечивается быстрыми FV-каналами (fast vacuolar) тонопласта.
Повышение концентрации ионов Са2+ в цитоплазме в ответ на обработку АБК
является результатом их транспорта в цитоплазму из апопласта через потенциалза-
висимые Са2+-каналы плазмалеммы, а из вакуоли — через Са2+-каналы тонопласта
(рис. 11.8).
Рис. 11.8. Механизм закрывания устьиц под влиянием АБК (по: Schroeder, 2001):
а —участие ионных каналов, б — участие вторичных посредников
Дж. Алленом и Д. Сандерсом (1997) в вакуолярной мембране идентифицирова-
179
но четыре типа кальциевых каналов, которые могут активироваться при обработке
АБК. Два из них являются лиганд-управляемыми, два других — потенциал-зависи-
мы. К лиганд-управляемым Са2+-каналам тонопласта относятся каналы, активи-
руемые такими вторичными посредниками как инозитол-1,4,5-трисфосфат (ИФз) и
цАДФР. При микроинъекциях ИФз и цАДФР в замыкающие клетки происходи-
ло повышение уровня цитозольного кальция, что указывает на функционирование
ИФз- и цАДФР-зависимых Са2-,--каналов на тонопласте устьиц.
К Са2+-каналам, которые активируются при деполяризации, относятся медлен-
ные вакуолярные, или SV-каналы (slowly activating vacuolar). Они активируются
при изменении мембранного потенциала тонопласта от (—30)-(—50) мВ до (+10)-
(+30) мВ при концентрациях Сац^т выше 0,5 -5,0 мкмоль/л. SV-каналы неселек-
тивны для катионов и проницаемы для Са2+, Ва2+ и Mg2+, а также (в меньшей
степени) для К+, Na+, Rb+ и Cs+. Предполагается, что именно за счет активации
Са2+-зависимых SV-каналов тонопласта может происходить процесс так называе-
мого Са2+-индуцированного высвобождения ионов Са2+ (CICR, Ca2+-induced Са2+
release) из вакуоли.
Са2+-проницаемые каналы тонопласта, активируемые гиперполяризацией, име-
ют более высокую проницаемость для двухвалентных катионов и обеспечивают при
передаче сигналов значительный поток ионов Са2+ из вакуоли в цитоплазму. Эти ка-
налы открываются в диапазоне значений мембранного потенциала тонопласта (от
-20 мВ до -80 мВ). Они идентифицированы Дж. Алленом и Д. Сандерсом (1994,
1997) в замыкающих клетках устьиц конских бобов.
Самым ранним ответом замыкающих клеток на обработку АБК является по-
вышение (через 2 с) содержания ионов Са2+ в цитозоле за счет активации Са2+-
каналов плазмалеммы (рис. 11.8, а). Практически одновременно активируется син-
тез вторичных посредников (ИФз и цАДФ-рибозы), которые активируют лиганд-
зависимые Са2+-каналы тонопласта и высвобождение ионов Са2+ из вакуоли (рис.
11.8,6). В работе М. МакЭнша (1997) с коллегами было показано, что изменение
содержания цитозольного кальция в ответ на АБК происходит в осциллирующем
режиме. Колебания концентрации Са2+ от 400 до 700 нмоль/л регистрируются в
течение почти 60 мин после воздействия гормоном и распространяются по клетке в
виде кальциевой волны.
Возрастание концентрации кальция в цитоплазме сопровождается активацией
анионных каналов и длительной деполяризацией плазмалеммы, вызванной выходом
анионов из замыкающих клеток. В результате деполяризации мембраны и повыше-
ния концентрации ионов Са2+ в цитоплазме происходит закрывание К^-каналов,
ингибирование Н+-АТФазы и открывание К+иГканалов плазмалеммы, через кото-
рые калий выходит из замыкающих клеток. Инициируемый АБК поток ионов калия
из клеток сопровождается также подщелачиванием цитоплазмы. Итогом всех этих
событий является падение тургорного давления и закрывание устьиц.
Взаимодействие АБК- и углеводного сигналов. Движение замыкающих
клеток устьиц является одним из наиболее тонких и сложных механизмов, с помо-
щью которого осуществляется поступление СО2 в ткани мезофилла листа, испарение
воды и терморегуляция растения. Ширина открытия устьичной щели (ее апперту-
ра) определяется световыми условиями, оводненностью тканей и интенсивностью
образования фотоассимилятов. Сигналы, индуцируемые в клетках растений светом,
углеводами и фитогормоном АБК, контролируют не только закрывание устьиц, но
также и метаболизм запасных соединений. Высокая концентрация сахаров оказыва-
180
ет угнетающий эффект на экспрессию ряда фотосинтетических генов и активирует
экспрессию генов, ответственных за синтез таких запасных соединений как крах-
мал. С другой стороны, при снижении уровня углеводов активируется экспрессия
фотосинтетических генов и усиливается расщепление запасных соединений.
В опытах П. Леон и Дж. Шин (2003) было установлено, что глюкоза и АБК в вы-
соких концентрациях синергически угнетают ростовые процессы, но стимулируют
их в низких концентрациях. Прорастание семян тормозится на средах, содержащих
высокую концентрацию сахаров (глюкозы или сахарозы). Формирующиеся пророст-
ки не зеленеют или, если и формируют настоящие листья, останавливаются в росте.
Этот эффект часто используют для выявления мутантов, нечувствительных к вы-
сокому уровню сахаров. Например, мутант gin (glucose-insensitive) устойчив к 6%-
ному раствору глюкозы, а мутант sis (sugar-insensitive) выдерживает высокую кон-
центрацию (300 ммоль/л) сахарозы в среде выращивания. Неожиданно оказалось,
что 4 мутанта арабидопсиса, устойчивые к высоким концентрациям сахаров - gin6,
sis5, sun6 (sucrose-uncoupled 6) и isi3 (impared sucrose induction 3), являются алле-
лями аЫ4, у которого была нарушена чувствительность к АБК.
На основе детального анализа этих мутантов был сделан вывод о том, что в
ответных реакциях растительных клеток на сахара важную роль играет АБК и
зависимый от нее транскрипционный фактор — ABI4. Анализ промотора гена RBCS,
кодирующего малую субъединицу РУБИСКО, а также гена АрЬЗ (ADP-glucose
pyrophosphorylase), кодирующего большую субъединицу фермента, участвующего
в синтезе крахмала, показал, что оба эти гена прямо контролируются фактором
транскрипции ABI4 (рис. 11.9).
В промоторах генов малой субъединицы РУБИСКО RBCS был найден чувстви-
а
EZ
Ls3si
Рис. 11.9. Регуляция экспрессии углевод-зависимого ге-
на АрЬЗ и гена RBCS, кодирующего малую
субъединицу РУБИСКО, фактором транскрип-
ции ABI4 (по: Rook et al., 2006):
а — индукция экспрессии гена АрЬЗ происходит после
связывания факторов транскрипции X и У с S3S1-6okcom,
a ABI4 с CEl-элементом; б — индукция экспрессии гена
RBCS происходит после связывания GBF с G-боксом; в -
связывание ABI4 с CEl-элементом приводит к подавлению
экспрессии гена RBCS', S3S1 - чувствительный к сахаро-
зе бокс; СЕ 1 — сопрягающий элемент; G-box — АБК-зави-
симый цис-элемент; GBF — фактор, связывающийся с G-
боксом
181
тельный к свету элемент, называемый СМ А 5 (conserved modular arrangement 5).
Оказалось, что этот светозависимый элемент способен реагировать не только на
свет, но также на сахара и АБК. При этом было выявлено, что, во-первых, сахара
и АБК подавляют активность СМ А 5, и, во-вторых, эта негативная регуляция (и
сахарами, и АБК) осуществляется через фактор транскрипции.
С другой стороны, известно, что сахара, в свою очередь, способны влиять на уро-
вень АБК и чувствительность клеток к этому фитогормону. Показано, что глюкоза
может контролировать не только гены биосинтеза АБК, но также гены трансдукции
АБК-сигнала.
Генетический и фенотипический анализы мутантов арабидопсиса, проведенные в
работе П. Леон и Дж. Шин (2003), указывают на очень сложный и до конца еще не
понятый характер взаимодействия между’ гормональными и углеводными путями
передачи сигналов в клетках растений. Установлено, что центральную роль в этих
взаимодействиях играют транскрипционные факторы ABI4 и ABI5, которые, по-
видимому, функционируют как интеграторы различных сигнальных путей.
11.3. Физиологическая роль абсцизовой кислоты в растении
АБК принимает участие в регуляции таких процессов как созревание зародыша,
поддержание покоя, прорастание семян, деление и растяжение клеток, ответные ре-
акции на стрессовые воздействия. Следует отметить, что несмотря на свое название
абсцизовая кислота (abscission -- отделение) не способна прямо контролировать про-
цессы отделения органов. Присутствие АБК в высоких концентрациях в отделенных
листьях и плодах является отражением участия этого фитогормона в процессах ста-
рения и (или) в стрессовых реакциях, предшествующих опадению органов.
Ростовые процессы. Растущие ткани или органы растения обычно отвеча-
ют на обработку АБК обратимым торможением роста, которое может частично
сниматься другими гормонами. Абсцизовая кислота тормозит рост клеток делени-
ем и растяжением, при этом она выступает как антагонист ИУК, цитокининов и
гиббереллинов. Обработка АБК тормозит ауксин-стимулируемый рост растяжени-
ем клеток колеоптилей, подавляет способность гиббереллинов индуцировать синтез
а-амилазы, устраняет эффект задержки старения цитокининами. АБК подавляет
экспрессию генов, активирующихся при прорастании сеАмян. Торможение роста, вы-
зываемое АБК, сопровождается подавлением синтетических процессов и ускорением
старения тканей.
Однако известны примеры и стимулирующего влияния АБК на ростовые про-
цессы. Так, обработка АБК стимулирует удлинение гипокотиля огурца, образование
отделительного слоя в черешке листа, а также формирование корней у стеблевых
черенков маша, огурца и фасоли. Показано, что АБК вместе с ИУК контролируют
процесс формирования боковых корней.
Обычно АБК рассматривают как ингибитор роста, однако для молодых, интен-
сивно растущих тканей характерен высокий уровень этого гормона. Установлено,
что у АБК-дефицитных мутантов арабидопсиса aba наблюдается задержка роста по
сравнению с растениями дикого типа, как предполагается, из-за потери способно-
сти регулировать транспирацию и поддерживать необходимый тургор замыкающих
клеток устьиц. Обработка экзогенной АБК мутантов aba восстанавливала исходный
габитус растений.
182
Следует отметить, что обработка ауксином в высоких концентрациях или его
сверхпродукция в трансгенных растениях стимулируют синтез этилена путем акти-
вации синтазы аминоциклопропанкарбоновой кислоты. Повышение синтеза этилена,
в свою очередь, является триггером активации синтеза АБК, которая индуцирует
угнетение роста и старение.
Регуляция покоя. АБК играет ведущую роль в регулировании покоя, посколь-
ку является ингибитором прорастания семян, клубней и почек. Явление покоя имеет
очень большое значение для растений, так как позволяет им переждать неблагопри-
ятные условия среды. В жизненном цикле двулетних и многолетних растений состо-
яние покоя характерно для почек, семян и таких запасающих органов как клубни,
корнеплоды и луковицы. У однолетних растений в состояние покоя переходят семе-
на.
Различают покой физиологический и вынужденный. Причиной вынужденного
покоя являются факторы внешней среды, которые препятствуют прорастанию се-
мян. Физиологический покой зависит от физиологического состояния растения и
определяется соотношением гормонов ингибиторов и активаторов. Переход растений
от активного роста к физиологическому покою и наоборот определяется балансом
эндогенных ингибиторов (АБК) и активаторов роста (гиббереллины, цитокинины).
Переход в состояние покоя клубней, почек или семян сопровождается значительным
увеличением содержания АБК. Выход из этого состояния связан с уменьшением со-
держания АБК и повышением уровня гиббереллинов и (или) цитокининов.
Покой семян определяется физиологическим состоянием зародыша и (или) се-
менной кожуры, которая содержит соответствующие ингибиторы и непроницаема
для воды и газов. В окружающих семя тканях отмечается наиболее высокое содер-
жание АБК. Семена могут сохранять жизнеспособность в состоянии покоя доволь-
но длительное время. Выделен ряд мутантов с нарушением покоя семян, которые
прорастают прямо на материнском растении. К таким мутантам, называемым жи-
вородящими, относят vp2 — vp9 (viviparous) у кукурузы и aba (abscisic acid) у араби-
допсиса. Их характерной особенностью является низкое содержание АБК в тканях.
Процесс развития семян обычно делится на два этапа. На первом этапе, кото-
рый характеризуется интенсивным делением клеток, формируются зародыш и эн-
досперм. В этот период содержание АБК в тканях обычно очень низкое. После того,
как зародыш завершает свое развитие, происходит переключение клеток от роста
делением к росту растяжением и накоплению в семени запасных соединений. В этот
момент именно АБК останавливает деление клеток на этапе Gi-S, а также обеспечи-
вает регулирование транспорта сахаров, аминокислот, белков и синтез их запасных
форм.
На втором этапе происходит резкое обезвоживание семян (теряется до 90% воды).
Скорость метаболических процессов постепенно замедляется, и семена переходят в
состояние покоя. Содержание АБК между этими двумя стадиями обычно достигает
максимального значения. В работе Д. Уолтона (1977) было показано, что при созре-
вании семян ясеня американского содержание АБК в каждом семени возрастает в
среднем до 11 нг. После стратификации (перед прорастанием) уровень АБК снижа-
ется до 3,3 нг. Сходные изменения наблюдались и в семенах пшеницы, в которых по
мере их созревания исходный уровень АБК повышался в 40 раз (до 4 6 нг в среднем
в расчете на одно семя).
АБК накапливается в формирующихся семенах двумя путями: она поступает из
материнского растения по флоэме или синтезируется в тканях зародыша и семе-
183
ни. Большая часть АБК на этапе созревания зародыша синтезируется и поступает
из тканей материнского растения, а меньшая часть АБК синтезируется в клетках
зародыша и эндосперма.
Для выхода семян из покоя необходимы благоприятные внешние условия (опре-
деленные влажность, температурный и световой режимы). Обязательным условием
при этом является изменение параметров не одного, а нескольких факторов внешней
среды.
Накопление АБК у древесных растений является необходимым фактором для
переживания холода в зимний период. Это достигается за счет торможения росто-
вых процессов и образования чешуек, которые закрывают меристематические ткани.
Процесс перехода почек к состоянию покоя или роста регулируется соотношением
в тканях концентраций АБК и гиббереллинов. В покоящихся почках концентрация
АБК становится особенно высокой с приближением осенних холодов. В течение зи-
мы содержание АБК постепенно снижается вплоть до весеннего прорастания почек.
Это свойственно, например, черной смородине, буку и березе.
Регуляция водного режима. Одной из самых ранних реакций растительных
организмов на водный дефицит является синтез абсцизовой кислоты, которая вы-
зывает закрывание устьиц и снижает потерю воды при транспирации.
На рис. 11.10 приведена динамика водного потенциала, устьичного сопротивле-
ния и содержания АБК в листьях кукурузы при водном стрессе. Хорошо видно, что
падение водного потенциала листа сопровождается увеличением концентрации АБК
Рис. 11.10. Динамика водного потенциала, устьичного сопротивления
и содержания АБК в листьях кукурузы в ответ на водный
стресс (по: Beardsell, Cohen, 1975). Стрелками показан мо-
мент полива растений
184
и устьичного сопротивления. У. Шур с коллегами (1992) изучали влияние водного
стресса на содержание АБК в сосудах ксилемы. Они установили, что если расте-
ния подсолнечника хорошо обеспечены водой, то концентрация АБК в ксилемном
соке колеблется от 1 до 15 нмоль/л; при водном дефиците она становится больше
3 мкмоль/л.
Таким образом, при возникновении в почве водного дефицита активируется син-
тез АБК в корнях и повышается ее содержание в ксилеме. Это служит растению
сигналом, который приводит к закрыванию устьиц и снижению транспирации. Од-
новременно наблюдается ускорение развития корневой системы и замедление росто-
вых процессов в надземной части растений.
Очень важной функцией АБК является активация синтеза специальных белков,
которые способствуют повышению устойчивости зародыша к высыханию. Выявлено,
что на последних этапах развития семян с участием АБК активируется экспрессия
гена ЕМ (embryo maturation), относящегося к семейству ЕЕА-генов, которые коди-
руют так называемые LEA-белки, накапливающиеся в семенах при высыхании, а в
вегетативных тканях —при таких стрессовых воздействиях как засуха и замороз-
ки. Предполагается, что LEA-белки обеспечивают защиту клетки от потери воды,
а также поддерживают структуру белков и мембран за счет способности прочно
связывать воду и предотвращать образование кристаллов льда.
Адаптация к стрессовым воздействиям. АБК нередко называют стрессовым
гормоном, поскольку её концентрация сильно изменяется при водном дефиците, а
также при засолении и резких колебаниях температуры. До 70% генетического по-
тенциала основных сельскохозяйственных культур может не реализовываться при
выращивании растений в условиях засухи, засоления, высоких или низких темпе-
ратур. Адаптивные возможности растений способен повышать фитогормон АБК,
который регулирует экспрессию многих генов, участвующих в адаптации к стрессо-
вым воздействиям.
Уже идентифицировано несколько АБК/стресс-индуцируемых генов и их регу-
ляторных элементов. Установлено, что ABF/ABRB, относящиеся к bZIP-семейству
транскрипционных факторов, способны регулировать экспрессию стресс-индуциру-
емых генов путем взаимодействия с цис-элементами — G-ABRE и СЕЗ/мотивом III.
Однако для многих других АБК-зависимых факторов транскрипции, которые при-
нимают участие в ответных реакциях на стрессовые воздействия, их цис-элементы
пока еще не установлены.
Экспрессия многих АБК-регулируемых генов индуцируется не только этим фи-
тогормоном, но также непосредственно рядом стрессовых факторов. Так, 63% АБК-
регулируемых генов индуцируется также засухой, 54% - засолением, а 47% — как
засухой, так и засолением. Экспрессия около 10% АБК-регулируемых генов инду-
цируется холодом.
Изучение промоторов стресс-индуцируемых генов, экспрессирующихся в ответ
на различные стрессовые сигналы, позволило установить нуклеотидные последова-
тельности, специфичные ко всем этим сигналам. Наиболее хорошо изучен ген RD29,
который активируется при осмотическом шоке, охлаждении, водном дефиците и об-
работке АБК. В промоторной области этого гена выявлены нуклеотидные последо-
вательности, которые позволяют отвечать и на АБК (ABRE), и на осмотический
шок (DRE).
Следует помнить, что в ответных реакциях на такие стрессы как засуха, за-
соление и охлаждение помимо АБК-зависимого пути адаптации имеются также и
185
АБК-независимые пути, поэтому АБК можно рассматривать только как часть этой
взаимосвязанной сигнальной сети.
LEA-белки. Активность многих генов и белков, которые экспрессируются при
водном дефиците или при низкой температуре, может быть индуцирована обработ-
кой АБК. При изучении этих генов обнаружилось, что белки, появляющиеся при за-
сухе, охлаждении или засолении тканей, имеют высокую степень гомологии с семей-
ством белков RAB/LEA/DHN (responsive to АВА, late embryo abundant и dehydrin).
Принадлежащие к этому семейству белки синтезируются у растений, животных и
микроорганизмов, обитающих в условиях дефицита воды, а также в созревающих
семенах. Синтез таких белков коррелирует с устойчивостью организмов к обезво-
живанию.
Выделяют б типов LEA-белков, которые различаются функционально и по кон-
сервативным аминокислотным последовательностям. Эти белки очень гидрофиль-
ны, сохраняют свою структуру при резких колебаниях температуры и способны
очень прочно удерживать воду. Именно эта группа белков стабилизирует другие
белки и клеточные мембраны и обеспечивает таким путем защиту клетки при замо-
розках и обезвоживании.
Только 4% от всех LEA-белков продуцируются в ходе поздних этапов эмбрио-
генеза. Максимум же экспрессии генов LEA наблюдается при резком обезвожива-
нии и последующем отделении листьев. Уровень LEA-белков повышается также при
обезвоживании семян, пыльцы и вегетативных органов растений засушливых мест
обитания. Синтез LEA-белков индуцируется при охлаждении, осмотическом стрессе
и при экзогенной обработке АБК.
Адаптация к низким температурам. Очень важную роль АБК играет в
адаптации растений к низким температурам. Устойчивость многих растений к за-
морозкам может быть повышена не только закаливанием, но также обработкой их
АБК. При воздействии низких положительных температур и (или) при уменьше-
нии светового периода (то есть в условиях яровизации) концентрация АБК в рас-
тительных тканях резко возрастает. Мутанты арабидопсиса, нечувствительные к
АБК (абИ) или с нарушенным синтезом АБК (aba-1), не могут приспособиться к
заморозкам и не закаливаются.
Хорошо известно, что для предотвращения замерзания в растительных клетках и
тканях функционирует система антифризов, представленная различными белками,
углеводами и гликопротеинами. Криопротекторы, синтезирующиеся в раститель-
ных клетках при понижении температуры, предотвращают или резко замедляют
рост кристаллов льда. Именно АБК в период перехода семян к покою обеспечивает
регулирование транспорта, синтез и накопление соединений, которые при действии
низких температур способны выполнять функции криопротекторов.
Адаптация к аноксии. Хорошо известно, что корни, находящиеся в условиях
недостатка кислорода, утрачивают способность к эффективному поглощению ми-
неральных элементов и воды. При этом может наблюдаться временное снижение
водного потенциала и завядание растений, которое быстро прекращается, так как
вскоре происходит закрывание устьиц. Это объясняется тем, что при затоплении,
как и при дефиците воды, активируется синтез АБК и транспорт ее в молодые ли-
стья из корневой системы и из старых подвядших листьев.
Адаптация к биотическим стрессовым воздействиям. Вместе с другими
фитогормонами АБК принимает участие в системе защитных реакций в ответ на
фитопатогены. За несколькими исключениями, АБК является негативным регулято-
186
ром устойчивости растений к патогенам. Этот негативный эффект является частью
сигнальной сети, в которой АБК функционирует наряду с салициловой и жасмоно-
вой кислотами, а также этиленом.
Известно, что абиотические стрессовые воздействия снижают защитные реак-
ции растений на патогены. Ключевым фактором в подавлении этой устойчивости,
по-видимому, является АБК. В работе X. Коги с коллегами (2004) было показано,
что чувствительность растений риса к патогену Magnaporthe grisea снижалась при
обработке АБК и последующем охлаждении. При подавлении синтеза АБК расте-
ния риса, подвергнутые холодовому шоку, адаптировались к воздействию патогена
Magnaporthe grisea так же, как и контрольные. Г1 аким образом, именно повышение
уровня АБК, индуцируемое абиотическим фактором, является причиной ослабле-
ния способности растения противостоять патогену. Еще одним доказательством это-
го положения является способность ряда патогенных грибов продуцировать АБК.
Тем не менее имеются примеры повышения защитной реакции растений на пато-
гены под действием АБК. Так, если растения озимой ржи Secale cereale при комнат-
ной температуре обработать АБК (или салициловой кислотой), начинают синтези-
роваться PR-белки (pathogenesis related), которые предотвращают развитие грибной
инфекции «снежная плесень». Показано также, что АБК может повышать устой-
чивость растительных клеток к патогенам, стимулируя отложение каллозы в меж-
клетниках.
Известно, что в ответных реакциях растений на повреждающие факторы име-
ются элементы неспецифической устойчивости (включающиеся в самых различных
стрессовых ситуациях) и специфические процессы, инициируемые только определен-
ным типом стрессовых воздействий. Участие АБК в адаптации растений к стрессо-
вым воздействиям, вероятно, в большей степени связано с элементами неспецифиче-
ской устойчивости. Можно предположить также, что именно АБК играет ключевую
роль в явлении кросс-адаптации, то есть повышении устойчивости растительного
организма к различным типам стрессов под воздействием только одного из небла-
гоприятных факторов.
Глава 12
ЭТИЛЕН
Впервые участие этилена в регуляции роста растений установил сотрудник ка-
федры физиологии растений Санкт-Петербургского университета Д. Н. Нелюбов в
1901 г. Исходной точкой исследований Д. Н. Нелюбова послужили хорошо известные
и уже описанные в литературе явления: в лабораторных условиях в условиях темно-
ты многие растения (проростки гороха, вики, чечевицы и ряд других) приобретали
ненормальный вид —рост стеблей в длину сильно замедлялся, они утолщались и
начинали расти горизонтально. Впервые это явление было описано немецким фи-
зиологом Ю. Визнером в 1878 г.
Основная цель исследований Д. Н. Нелюбова, которая была поставлена его учи-
телем академиком А. С. Фаминциным, заключалась в изучении влияния условий
внешней среды на ростовые движения проростков. Д. Н. Нелюбову необходимо было
выявить причины, из-за которых растения не могли нормально расти и развиваться
в лабораторных условиях.
Д. Н. Нелюбов обстоятельно исследовал зависимость направления роста стеблей
от температуры, света, влажности, газового состава и пришел к выводу, что стеб-
ли начинают переходить к горизонтальному росту только в том случае, когда к
чистому воздуху добавляется светильный газ. Следует отметить, что в те годы в
лабораторном воздухе всегда имелось небольшое количество светильного газа. По-
сле этого он стал изучать воздействие на растения составных частей светильного
газа — сероводорода, ацетилена, бензола, ксилола, нафталина и этилена.
Было проведено огромное число опытов, из которых стало ясно, что только эти-
лен и ацетилен обладают способностью в очень низких концентрациях вызывать
«тройной эффект» — горизонтальный рост, замедление роста в длину и утолщение
стебля. Помимо гороха этот эффект наблюдался на других видах растений - вике,
бобах, душистом горошке, настурции, куколе, картофеле.
Таким образом, Д. Н. Нелюбову впервые удалось установить, что причина на-
рушений роста растений в лабораторных условиях связана с наличием этилена и
ацетилена в составе светильного газа. Кроме того, Д. Н. Нелюбов обнаружил новое
явление в физиологии растительного организма — стремление стеблей к горизон-
тальному росту под влиянием этилена.
В последующих исследованиях он попытался выяснить причины, приводящие к
изменению направления роста стебля под действием этилена. На основании серии
экспериментов по клиностатированию (растения не изгибались под влиянием этиле-
на) и гравистимуляции (этиленовый изгиб образовывался в направлении наклона)
188
Д. Н. Нелюбов пришел к выводу, что «этилен индуцирует качественные изменения
геотропических свойств стебля».
В атмосфере этилена проростки продолжают расти горизонтально в течение дли-
тельного времени. Если же вывести их из этого положения (то есть подвергнуть
гравистимуляции), они возвращаются к нему вновь. Таким образом, у этих рас-
тений способность к гравитропической реакции сохраняется, но она, как говорил
Д. Н. Нелюбов, «трансверсирована».
Все эти данные Д.Н. Нелюбов впервые изложил в 1901 г. на 11-м съезде русских
естествоиспытателей и врачей (С.-Петербург) в докладе «Об изменении геотропи-
ческих свойств стеблей под влиянием некоторых газов», в котором он сообщил, что
«... мы встречаемся с совершенно новым влиянием газов ацетилена и этилена, они
как будто заставляют стебли принимать горизонтальное направление; это свойство
до сих пор не известное в физиологии растений, с которым я не могу примириться,
к которому я не могу привыкнуть, хотя уже не один год вижу его постоянное прояв-
ление». Поэтому именно 1901 г. считается годом открытия гормональных функций
газа этилена.
Исследования Д. Н. Нелюбова послужили мощным толчком к открытию других
фитогормонов и практическому использованию регуляторов роста и развития рас-
тений. Обработка этиленом стала применяться для ускорения созревания плодов, а
ингибиторы его синтеза - для задержки старения цветов.
Первое упоминание о том, что этилен является естественным продуктом расти-
тельных тканей, было сделано в 1910 г. X. Касинсом. Он писал, что летучие вы-
деления спелых апельсинов способны индуцировать преждевременное созревание
бананов, которые хранятся вместе с ними.
В 1924 г. Ф. Денни показал, что преждевременного созревания апельсинов, ба-
нанов и других плодов можно добиться обработкой этиленом. В 1934 г. Р. Гэйн с
коллегами идентифицировали этилен химически как нормальный продукт метабо-
лизма растений (он содержался в газообразных продуктах метаболизма яблок) и,
исходя из его физиологических эффектов, впервые назвали его гормоном.
В дальнейшем выяснилось, что этилен способны синтезировать не только плоды,
но также листья, цветки, облиственные стебли, корни и семена. Тем не менее, долгое
время этилен не относили к гормонам, считая, что вызываемые им эффекты опо-
средованы ауксином. Интерес к этилену как гормону возник вновь только в 1959 г.
после того, как С. Бург и К. Тиманн стали использовать для его анализа газовую
хроматографию.
12.1. Метаболизм этилена
Этилен синтезируют все растения, за исключением водорослей, а также грибы,
например Mucor heminalis, Penicillium corylophillum, Р. digitatus, Neurospora crassa,
Saccharomyces cerevisiae, Candida vartiovaatia, и некоторые бактерии (Anacystis nidu-
lans, Pseudomonas solanacearum, Escherichia coli). Скорость образования этилена в
тканях растений в среднем составляет 5-50 нл/ч- (г сырой массы), а содержание —
0,1-2,0 нл/г сырой массы. Много этилена накапливается в опадающих листьях и
цветках, в узлах побегов. Очень высоким содержанием этилена отличаются созре-
вающие плоды. Например, в яблоках его концентрация достигает 2500 нл/г сырой
массы. В местах механических повреждений растения синтезируют «раневой эти-
лен».
189
Биосинтез этилена. В живых организмах этилен может синтезироваться из
ацетальдегида, этилового спирта и из жирных кислот в процессе их перекисного
окисления. Однако у покрытосеменных и хвойных растений этилен образуется почти
исключительно из аминоциклопропанкарбоновой кислоты (АЦК), которая, в свою
очередь, синтезируется из активированного метионина (рис. 12.1). Любопытно, что
папоротники, хвощи и мхи, имея достаточное количество АЦК, не могут превращать
ее в этилен и используют для синтеза этилена какой-то другой, пока неизвестный
путь.
СОО"
НС — NH3
сн2
сн2
NH:
адено )u.i-
мепиюиин -
cuumenut ш
сн3 - $
сн3—s —сн2 —сн2 —сн —СОО" / \
метионин А1Ф ррн+рц
R —СО—СОО"
сн2
Аленин
R— С— СОО
NH3
[Цикл Янга|
СН3 — S — СН2 -- СН2 — СО — СОО"
а- кето-г-метилтиомасляная
ж кислота
нсоо_<
2-нро;.
S- аденозилметионин
снэ—S—СН2 г
|/°\
К )—Аденин
о о
н н
5'- метилтиоаденозин
\
CH,-S - СН2 снэ—S —сн2
I О °р°зн"
О о
н н
5-метилтиорибоэо- лДф
1-фосфат
а _ Аденин
О
О О
н н
5-метмл тиорибоза
АЦК-сишиам
Л ЦК оксидам
1/2 О2 СО2
н2с=сн2
этилен
аминоциклопропан- +
карбоновая кислота hcn
(АЦК)
н
Рис. 12.1. Биосинтез этилена и метиониновый цикл
Образование этилена из метионина происходит в результате трех последователь-
ных реакций. Процесс начинается с активации метионина посредством его взаи-
модействия с АТФ и превращения в S-аденозил метионин. Реакция катализируется
аденозилметионин-синтетазой. Поскольку до 80% метионина в клетках находится в
форме S-аденозилметионина, эта реакция не лимитирует биосинтез этилена. Несмот-
ря на то, что образование этилена мало зависит от активности аденозилметионин-
синтетазы, оно зависит от содержания свободного метионина в клетках, которое, в
свою очередь, определяется содержанием в растениях серы. Кроме того, содержа-
ние свободного метионина возрастает в тканях при старении и стрессе в результате
гидролиза денатурированных белков. Количество S-аденозилметионина, доступного
для синтеза этилена, зависит не только от уровня метионина, но и от того, насколько
интенсивно S-аденозилмстионин используется для всевозможных процессов метили-
рования, а также для синтеза полиаминов.
190
Вторая реакция на пути синтеза этилена - это образование АЦК из S-адено-
зилметионина под действием АЦК-синтазы. Обычно в лабораторных условиях для
подавления этой реакции используют аминоэтоксивинилглицин. По структуре АЦК-
синтаза сродни трансаминазам и нуждается в пиридоксальфосфатс в качестве ко-
фактора. Это короткоживущий индуцибельный фермент, активность которого на-
ходится под хмногофакторным контролем и в основном определяет скорость синтеза
этилена.
У арабидопсиса имеется девять генов, кодирующих АЦК-синтазу, причем экс-
прессия различных генов регулируется по-разному. Транскрипция одних генов очень
сильно возрастает под действием высоких концентраций ауксина, других — пози-
тивно или негативно регулируется самим этиленом. Кроме того, активность АЦК-
синтазы контролируется на посттрансляционном уровне. Давно известно, что вре-
мя жизни этого фермента может существенно изменяться в разных условиях. На-
пример, АЦК-синтаза из срезов зеленых плодов томата имеет период полурас-
пада продолжительностью 40 мин, а из зрелых плодов 2 ч. Цитокинины уве-
личивают активность АЦК-синтазы посредством посттрансляционных механизмов
регуляции.
При изучении механизма активации АЦК-синтаз в суспензионной культуре тома-
та под действием грибного элиситора - вещества, вызывающего защитные реакции
растения на контакт с патогенным грибом - было показано, что активация дости-
гается на посттрансляционном уровне путем фосфорилирования фермента, так как
она не наблюдается в присутствии ингибиторов протеинкиназ (К-252а и стауроспо-
рина). Ингибиторы протеинфосфатаз (окадаевая кислота и каликулии А) вызывают
активацию фермента и без элиситора.
Более углубленное понимание роли фосфорилирования в регуляции активности
АЦК-синтаз было достигнуто в результате изучения мутантов арабидопсиса etol.
eto2 и eto3 (ethylene overproduccrs), вырабатывающих в десятки раз больше эти-
лена, чем растения дикого типа. Ген ЕТО1 кодирует адапторный белок, который
обеспечивает присоединение убиквитинлигазы к С-концевому домену АЦК-синтазы,
что приводит к убиквитинированию фермента и его последующей деградации 26S
протеасомой (рис. 12.2). Кроме того, ЕТО1 непосредственно снижает удельную ак-
тивность фермента. Дефект ЕТО1 у мутанта etol делает невозможным взаимодей-
ствие ЕТО1 с АЦК-синтазой. Поэтому время жизни АЦК-синтазы увеличивается,
что приводит к накоплению фермента и увеличению его активности.
В С-концевом домене АЦК-синтазы имеются 1-4 консервативных остатка сери-
на, которые могут фосфорилироваться под действием митоген-активируемых про-
теинкиназ (МАРК) и Са2+-активируемых протеин к иназ. Фосфорилирование пре-
пятствует взаимодействию АЦК-синтаз с ЕТО1 и тем самым продлевает ферменту
жизнь. У мутантов арабидопсиса eto2 и eto3 сверхпродукция этилена вызвана тем,
что АЦК-синтазы из-за мутаций в С-концевом домене утрачивают способность вза-
имодействовать с ЕТО1.
Третья реакция на пути превращения метионина в этилен состоит в окислении
АЦК при участии АЦК-оксидазы. Реакцию можно подавить солями кобальта (10-
100 мкмоль/л). Высечки растительной ткани очень активно превращают АЦК в
этилен, однако при их гомогенизации активность утрачивается. Таким образом, для
проявления АЦК-оксидазной активности нужны живые клетки. Добиться активно-
сти фермента in vitro удалось только после того, как была установлена его диоксиге-
назная природа. Активность диоксигеназ зависит от присутствия Fe2^ и косубстра-
191
ЕТ01
ЕТ01 |
АЦК-синтаза дефосфорилированная
(нестабильный фермент)
убиквитин (Ub)
протеин-
киназа
протеин- 1
фосфатаза
I ЕТО1|
Г
иь
АЦК-синтаза фосфорилированная
(стабильный фермент)
протеасома 26S
гидролизованный фермент
Рис. 12.2. Механизм посттрансляционной регуляции активности АЦК-синтаз
у арабидопсиса
та, как правило, а-кетоглутаровой кислоты. В качестве косубстрата АЦК-оксидазы
используют восстановленную аскорбиновую кислоту, поэтому при добавлении Fe2+
и аскорбиновой кислоты растительные экстракты эффективно превращают АЦК в
этилен.
АЦК-оксидазы в основном локализованы в клеточной стенке, а также в цитозо-
ле, тогда как аскорбатом наиболее богаты хлоропласты, в которых его концентра-
ция достигает десятков миллимолей. В цитозоле аскорбата значительно меньше и
совсем мало его (до 0,1-0,4 ммоль/л) в анопласте. Причем если внутри клетки необ-
ходимый ферменту восстановленный аскорбат составляет 80-90%, то в апопласте —
только 30-40%. Поддержание пула восстановленного аскорбата в клеточной стен-
ке происходит при участии плазматической мембраны: во-первых, посредством его
импорта из цитоплазмы в обмен на дегидроаскорбат и, во-вторых, посредством вос-
становления дегидроаскорбата в клеточной стенке за счет электронов, поставляемых
локализованной в плазмалемме петлей редокс-цепи. В процессе гомогенизации рас-
тительной ткани происходит окисление аскорбата. В связи с этим АЦК-оксидазную
активность можно наблюдать только при добавлении в реакционную среду восста-
новленного аскорбата.
Кроме Fe2+ и аскорбата АЦК-оксидаза нуждается в СО2. В отсутствие СО2
фермент неактивен. При повышении концентрации СО2 от 0,03 до 4% активность
фермента возрастает в 10 раз. Изучение зависимости скорости АЦК-оксидазной ре-
акции от концентрации АЦК при разных концентрациях СО2 показало, что СО2
в высоких концентрациях существенно увеличивает не только максимальную ско-
рость реакции, но и константу Михаэлиса (Кт). Это означает, что стимулирующий
192
эффект СО2 проявляется только при сравнительно высоких концентрациях АЦК
(выше 50 мкмоль/л). Так как концентрация АЦК в растительных тканях обыч-
но составляет 5-25 мкмоль/л, то при высоких концентрациях СО2 скорость АЦК-
оксидазной реакции in situ существенно не возрастает и даже, возможно, снижается.
Кроме того, СО2 в высоких концентрациях вызывает смещение pHopt фермента в
кислую сторону: от pH 7,4 до pH 6,7. Этот сдвиг рНор^ должен приводить к уве-
личению активности локализованного в клеточной стенке фермента, так как pH в
апопласте варьирует в пределах 5,5-6,5.
Максимальная скорость окисления АЦК in vitro достигается в среде, содержа-
щей 1-10 ммоль/л АЦК, 20-30 ммоль/л аскорбиновой кислоты, 50-100 мкмоль/л
Fe2+ и 10-20% СО2. Таким образом, in vivo не только концентрация аскорбата, но и
концентрация АЦК в сотни раз ниже оптимальной, и активность АЦК-оксидазы в
основном определяется содержанием АЦК, которое, в свою очередь, зависит от ско-
рости ее синтеза, окисления, а также от скорости образования инертного конъюгата
АЦК с малоновой кислотой (см. рис. 12.1).
В процессе окисления АЦК образуется токсичная синильная кислота HCN. Ее
детоксикация достигается взаимодействием с /?-аланином, приводящим к образова-
нию Дцианоаланина.
Метиониновый цикл. Для синтеза этилена расходуется метионин, содержа-
ние которого в клетках ограничено. Поэтому важную роль в поддержании био-
синтеза этилена играет процесс регенерации метионина из 5'-метилтиоаденози-
на, образующегося из S-аденозилметионина в результате реакции, катализируе-
мой АЦК-синтазой (см. рис. 12.1). Для восстановления метионина требуется АТФ
и аммонийный азот, который в трансаминазной реакции отдают аспарагиновая
или глутаминовая кислоты, превращаясь, соответственно, в щавелевоуксусную или
а-кетоглутаровую кислоты.
Катаболизм этилена. Этилен легко диффундирует по тканям растений и уле-
тучивается в атмосферу. Поэтому снижение скорости синтеза быстро приводит к
снижению содержания этилена в тканях, и растениям нет необходимости иметь спе-
циальную систему его удаления. Тем не менее, при высоких концентрациях этилена
наблюдается его окисление до СО2, этиленоксида и этиленгликоля.
Регуляция биосинтеза этилена в процессе развития и под действием
стрессоров. Синтез этилена ускоряется в процессе прорастания семян, образо-
вания корневых волосков и отделительного слоя в основании черешков и цвето-
ножек, при созревании плодов, старении листьев и цветков. Синтез этилена так-
же активируется в условиях стресса, особенно при механических повреждениях и
нагрузках.
Зачастую ускорение синтеза этилена бывает опосредовано ауксином. Гербицид-
ный эффект, который ауксин в миллимолярных концентрациях оказывает на дву-
дольные растения, в значительной степени связан с быстрой индукцией (через 1-2 ч)
массированного синтеза этилена, приводящего, в частности, к эпинастии листьев.
Хотя в экспериментальных условиях биосинтез этилена можно регулировать на лю-
бом этапе, в природе скорость биосинтеза этилена в растениях обычно определяется
активностью АЦК-синтазы, которая регулируется как на уровне транскрипции ге-
нов, так и посредством посттрансляционных механизмов.
193
12.2. Механизм действия этилена
В настоящее время удалось расшифровать почти всю цепочку проведения эти-
ленового сигнала в растительной клетке, а этиленовый рецептор является наиболее
хорошо изученным рецептором в растениях. Несмотря на множественность эффек-
тов, вызываемых в растениях этиленом, воздействие этого гормона на клетку осу-
ществляется по общей схеме: связывание с рецептором, передача сигнала одним или
несколькими сигнальными путями, ответная реакция.
Этилен-регулируемые гены. Одним из наиболее ранних эффектов этилена
является активация экспрессии различных генов. В первую очередь начинают экс-
прессироваться гены, участвующие в биосинтезе этилена и регулирующие созрева-
ние плодов; повышается количество транскриптов генов, кодирующих такие фер-
менты как целлюлаза, хитиназа, /3— 1,3-глюканаза и пероксидаза, а также белки,
участвующие в патогенезе при формировании реакции сверхчувствительности.
У многих генов, экспрессия которых активируется этиленом, в промоторной зоне
выявлена консервативная нуклеотидная последовательность, содержащая два GCC-
бокса, которую называют этилен-чувствительным элементОхМ ERE (ethylene response
element). Наличие ERE является необходимым и достаточным условием для транс-
крипционного контроля гена этиленом. У табака, например, обнаружено 4 белка,
которые связываются с ERE. Эти белки называют ERF (ethylene response factor)
или EREBPs (ethylene response elements binding proteins). Гены, кодирующие ERF,
являются генами первичного ответа на этилен. Они кодируют транскрипционные
факторы, регулирующие активность генов вторичного ответа, которые контролиру-
ют формирование физиологических реакций на этот гормон.
Для поиска мутаций, связанных с процессами проведения этиленового сигнала,
чаще всего используют «тройной ответ» растения на обработку этиленом, который у
арабидопсиса включает угнетение роста гипокотиля в длину и его разрастание в ши-
рину, торможение удлинения корня, увеличение апикального «крючка». Именно на
этих эффектах (или их отсутствии) был основан поиск мутантных растений. Удалось
выделить два типа этиленовых мутантов: мутанты, у которых снижена способность
отвечать на обработку этиленом (этилен-устойчивые, или этилен-нсчувствительные
мутанты), и мутанты, которые демонстрируют этиленовую реакцию даже в отсут-
ствие гормона (мутанты с конститутивным ответом на этилен, то есть с постоянной
гормональной реакцией).
К последним относится мутант арабидопсиса ctrl (constitutive triple responsel).
Кодируемый геном CTR1 белок является одним из ключевых элементов в систе.ме
рецепции и трансдукции этиленового сигнала. Тог факт, что мутация Ctrl вызывает
активацию ростовых реакций этиленового типа, свидетельствует о том, что CTR1-
белок у растений дикого типа функционирует как репрессор передачи этиленового
сигнала.
Рецепторы этилена. Первым мутантом, не реагирующим на обработку эти-
леном, был etrl. При клонировании К. Чанг с коллегами (1993) гена ETR1 ока-
залось, что кодируемый им белок гомологичен известному бактериальному рецеп-
тору -двухкомпонентной гистидинкиназе. Следует отметить, что ETRl-белок был
первьш примером эукариотических рецепторов гистидин киназного типа, которые
вскоре были найдены в дрожжах и животных организмах.
В работе Ш. Чиуоча с соавторами (2005) при анализе процессов покоя и прораста-
ния семян арабидопсиса было показано, что мутация ctrl приводит к блокированию
194
передачи не только этиленового сигнала, но также вызывает изменение метаболизма
других фитогормонов ИУК, цитокининов, АБК и гиббереллинов. Авторы счита-
ют, что это вызвано нарушением процесса передачи этиленового сигнала.
Рецептор этилена функционирует как гомодимер, состоящий из трансмембран-
ных белков, соединенных дисульфидными связями. Каждый мономер включает сен-
сорный элемент — собственно гистидинкиназу, способную к автофосфорилированию
по остатку гистидина, и регуляторный элемент, содержащий остаток аспарагиновой
кислоты, на которую переносится фосфатная группа (рис. 12.3). Местом связывания
гормона является N-терминальный участок этиленового рецептора, который содер-
жит три пересекающих плазмалемму гидрофобных домена и ион(ы) меди.
ETR1 ШОНн ngfgKd~>
ERS1 -Д|Е<3>-|Н NGFG|-
ETR2 ШОТ <ЭКА>
ERS2 ЦН-<7>Н 1~
EIN4 адм^онн
Рис. 12.3. Мембранные белки-рецепторы этилена
(по: Schaller, Kieber, 2002):
черные прямоугольники--трансмембранные до
мены; серые прямоугольники сигнальные последова-
тельности; ромбами показаны GAE-домены; Н - фос-
форилируемый остаток гистидина. D — остаток аспа-
рагиновой кислоты; NGFG — консервативная последо-
вател ь нос гь г исти д и н к и н аз ы
У арабидопсиса рецепторы этилена представлены пятью белками: ETR1 и ETR2
(ethylene receptor 1 и 2), EIN4 (ethylene-insensitive 4), ERS1 и ERS2 (ethylene response
sensor 1 и 2) (рис. 12.3). Семейство этиленовых рецепторов имеет перекрывающие-
ся функции. Повреждение одного или двух генов, кодирующих синтез рецепторов,
вызывает незначительный эффект. Если же инактивируются три или четыре рецеп-
тора, дефекты в способности клеток отвечать на этилен становятся весьма замет-
ными. Относительно большое число этиленовых рецепторов позволяет расширить
диапазон эффективных концентраций этилена и поддерживать сигнал более дли-
тельное время, тем более что паттерн экспрессии генов, кодирующих различные
рецепторы, на разных этапах онтогенеза растения различен. В отсутствие этилена
его рецепторы подавляют процессы, контролируемые этим гормоном.
Трансдукция этиленового сигнала. Непосредственное участие в ингибиро-
вании этилен-стимулируемых реакций принимает белок CTR1. являющийся одним
из ключевых сигнальных элементов МАР-киназного модуля, который следует сразу
после рецептора и выполняет функции МАРККК. CTR1 представляет собой се-
рин/треониновую протеинкиназу — фермент, относящийся к семейству Raf-киназ,
участвующих в передаче гормональных сигналов у животных организмов. Субстра-
том фосфорилирования для CTR1-киназы является киназа МАР-киназы (МАРКЕ),
которая в свою очередь фосфорилирует MAP-киназу (МАРК).
Возможный механизм функционирования MAP-киназного модуля в процессе пе-
редачи этиленового сигнала у растений Medicago и Arabidopsis показан на рис. 12.4.
В отсутствие этилена его рецепторы ггроявляют функции гистидинкиназ и фосфо-
рилируют белок CTRl-киназу. Фосфорилированная CTRl-киназа является репрес-
сором МАРКЕ из Medicago (SIMKK), что приводит к блокированию этиленового
сигнала.
Под воздействием внешних стимулов, таких как затопление, инфицирование па-
тогенами или поранение, а также при созревании плодов, старении или повышении
концентрации ауксина активируются ферменты синтеза этилена — АЦК-синтаза и
195
Этилен
ETR1 ERS1 ETR2 EIN4 ERS2 Рецепторы
] Гены первичного ответа на этилен
Гены вторичного ответа на этилен
Рис. 124. Проведение этиленового сигнала (по: Сагеп, Chang, 2003):
EIN2 — трансмембранный белок, участвующий в передаче этиленового сигнала; EIN3
и ERF1 — этилен-зависимые факторы транскрипции; PERE — первичный этилен-отвечаю-
щий элемент в промоторе генов первичного ответа на этилен; GCC — специфический бокс
в промоторе генов вторичного ответа на этилен
АЦК-оксидаза. В результате всех этих процессов содержание этилена в тканях воз-
растает.
Этилен связывается с рецептором, локализованным в плазмалемме, с участием
ионов меди в качестве кофактора. Предполагается, что при связывании с гормоном
происходит инактивация рецептора. Отсутствие позитивного регуляторного сигнала
от рецептора приводит начальный элемент в сигнальной цепи — CTRl-киназу — в
неактивное состояние. В результате SIMKK становится активной и в свою очередь
активирует MAP-киназы (SIMK и ММКЗ из Medicago или их ортологи МРКб и
МРК13 из Arabidopsis).
На следующем этапе активируется белок EIN2 (ethylene-insensitive 2), который
может работать как мембранная пора или канал. Предполагается, что EIN2 распо-
ложен после киназного каскада. Известно, что EIN2 имеет значительную гомологию
с переносчиком двухвалентных катионов (Nramp) у животных организмов.
Следующим элементом сигнального пути служит ядерный белок E1N3. При ак-
тивации этиленом фактор транскрипции EIN3 формирует димер, который способен
196
связываться с «первичным этилен-отвечающим элементом» (PERE) в промотор-
ной части генов первичного ответа, например таких как ERF1 (ethylene response
factor 1). Ген ERF1 кодирует этилен-специфичный фактор транскрипции ERF1, ко-
торый связываются с бСС-боксом генов вторичного ответа и инициируют их тран-
скрипцию.
12.3. Физиологическая роль этилена в растениях
Спектр физиологических процессов, контролируемых в растении этиленом,
очень широк и включает созревание плодов, старение тканей, опадение плодов и
листьев, подавление роста клеток растяжением, развитие цветков, эпинастию, об-
разование корневых волосков и ускорение прорастания семян (рис. 12.5). Этилен
участвует в ответных реакциях растительных организмов на различные стрессовые
воздействия - резкие колебания температуры, анаэробиоз, засуха, механические по-
вреждения, повреждения патогенами. Обычно этилен рассматривают как ингиби-
тор роста, однако имеются факты, указывающие на то, что этот фитогормон может
стимулировать ростовые процессы. Оказываемый этиленом эффект зависит от кон-
центрации и от растительного объекта.
Этилен
Старение и
опадение
листьев
Созревание
плодов
i Формирование
V/ корневых I
SftF волосков М
Воздух
Воздух
Подавление \
растяжения I
ф клеток в
Воздух
Воздух
Ответная реакция
на патогены
Этилен
Тройной ответ
проростков
Рис. 12.5. Процессы, контролируемые в растениях этиленом (по: John-
son, Ecker, 1998)
«Тройной ответ». Наиболее хорошо изученной физиологической реакцией рас-
тений на этилен является «тройной ответ», то есть замедление роста стебля в длину,
его утолщение и горизонтальный рост (рис. 12.6). Такой тип ответных реакций пока-
зан для всех двудольных растений, а также для колеоптилей и мезокотилей злаков.
197
Рис. 12.6. Действие этилена на рост проростков гороха (по: Нелюбов, 1901)
Замедление удлинения стебля под действием этилена происходит из-за его утолще-
ния, вызванного изодиаметрическим ростом клеток. При этом число клеток и их
конечный объем не отличаются у растений, обработанных и не обработанных эти-
леном. Замедление роста стебля в длину под действием этилена, вероятно, связано
со снижением уровня гиббереллина.
При воздействии этилена меняется направление роста клетки с продольного на
поперечное. Этот эффект объясняется тем, что этилен изменяет (на 90°) ориента-
цию микротрубочек кортикального слоя цитоплазмы и целлюлозных микрофибрилл
в клеточной стенке, которые обычно ориентируются поперек продольной оси растя-
гивающейся клетки и определяют направление растяжения растительных клеток.
Гравитропизм. Нарушение вертикальной ориентации осевых органов растений
является стрессовой ситуацией для организма. Вероятно, поэтому при грависти-
муляции активируется синтез стрессового гормона этилена, а ингибиторы синтеза
этилена (Со2+, аминоэтоксивинилглицин) и его действия (СО2, Ag+) подавляют
гравитропическую реакцию.
В качестве эффективного и специфического ингибитора фермента, участвующе-
го в синтезе этилена из его предшественника АЦК, можно использовать салицилат,
являющийся эндогенным фенольным соединением. В наших опытах было показа-
но, что обработка как нативных проростков, так и отрезков колеоптилей кукурузы
салициловой кислотой угнетала гравитропическую реакцию. Внесение в среду инку-
бации совместно с салицилатом этиленпродуцента этрела снимала угнетающий эф-
фект этого фенольного соединения. Таким образом, можно полагать, что подавление
гравитронизма салициловой кислотой опосредовано подавлением при этом индуци-
рованного гравистимуляцией синтеза этилена. Следовательно, активация синтеза
этилена является одним из необходимых, вероятно, ранних звеньев гравитропиче-
ской реакции.
Формирование гипокотильного крючка. Важную роль этилен выполняет в
процессе прорастания семян двудольных растений. Верхняя часть формирующегося
побега этиолированных проростков двудольных растений имеет форму крючка из-
за того, что растяжение клеток в его верхней части идет интенсивнее, чем в ниж-
198
ней. Такая форма облегчает продвижение проростка через почву и защищает от
повреждения его нежную апикальную меристему. Процесс формирования крючка
и поддержания его за счет асимметричного роста контролируется этиленом. Интен-
сивность синтеза этилена максимальна в зоне изгиба и возрастает при механическом
раздражении крючка в процессе его продвижения и трения о почвенные частицы.
Как только этиолированный проросток выходит из почвы на свет, содержание эти-
лена снижается, и крючок распрямляется. Процесс формирования крючка является
следствием различий в скоростях деления и растяжения клеток гипокотиля. Пред-
полагается, что причина дифференциального роста клеток гипокотильного крючка
заключается в различной чувствительности клеток к гиббереллину.
Прорастание семян. У многих видов растений в семенах перед прорастанием
резко возрастает содержание этилена. Установлено, что экзогенная обработка эти-
леном способствует прекращению покоя, ускоряет прорастание семян злаков и раз-
витие почек у древесных растений, активирует рост клубней и луковиц. У многих
видов растений обработка этилен-продуцентами, например этефоном, стимулирует
прорастание семян, находящихся в состоянии физиологического пли вынужденно-
го покоя. При этом этилен может проявлять стимулирующий эффект сам по себе,
аддитивно или синергически с другими факторами, активирующими прорастание
семян.
Эпинастия. Еще одной функцией этилена является индукция эпинастии, то есть
опускания листьев в результате того, что скорость роста клеток на верхней стороне
черешка выше, чем на нижней. Эпинастия может также индуцироваться высокими
концентрациями ИУК, однако этот эффект объясняется активацией синтеза этилена
под действием ауксина. Эппнастические движения листьев наблюдаются также при
затоплении. Механизм этого процесса заключается в следующем: в корневой системе
при анаэробных условиях активируется синтез АЦК, которая с ксилемным потоком
поступает в надземную часть растения, где уже в аэробных условиях быстро пре-
вращается в этилен, индуцирующий эпинастию. Однако не все растения способны
совершать эпинастические движения в ответ на обработку этиленом.
Ускорение созревания. В обиходе термин «созревшие плоды» предполагает их
готовность к употреблению в пищу. Для растения же созревание означает готовность
семян и плодов к распространению. В ходе созревания плодов происходит расщеп-
ление элементов клеточных стенок, гидролиз крахмала, исчезновение органических
кислот и фенольных соединений (включая таннины) и накопление сахаров. Этилен
ускоряет эти процессы, и поэтому его часто называют гормоном созревания.
Усиление дыхания. Одной из характерных особенностей некоторых фруктов,
быстрее созревающих при обработке этиленом, является усиление дыхания перед
созреванием, называемое климактерическим. У таких плодов за усилением дыхания
следует резкая активация синтеза этилена. Этот процесс идет в автокаталитическом
режиме, так как обработка плодов этиленом активирует его синтез и вызывает еще
большее повышение содержания этого гормона в тканях при созревании. Примерами
климактерических плодов являются яблоки, груши, сливы, бананы, авокадо, манго,
персики, томаты. Если же в процессе созревания интенсивность дыхания в тканях
нс изменяется, такие плоды называются неклимактерическими. К ним относятся
цитрусовые, виноград, вишня, ананас, клубника и некоторые другие.
Ускорение старения. Еще одним специфически ускоряемым этиленом процес-
сом является старение листьев. Другой тип фитогормонов цитокинины тормо-
зят этот процесс, поэтому старение листьев зависит от соотношения концентраций
199
этилена и цитокининов. У этиленовых мутантов etrl и ein, которые ие реагируют
на обработку этим гормоном, задерживаются процессы распада хлорофилла и дру-
гих компонентов хлоропластов, а общая продолжительность жизни возрастает на
30%. Предполагается, что механизм действия этилена связан не с индукцией про-
граммы старения, а, вероятнее всего, с повышением скорости процессов старения
растительного организма. Необходимо отметить, что кроме этилена и цитокининов
в регуляции старения листа принимают участие АБК и ИУК. Помимо листьев эти-
лен также ускоряет старение цветков и плодолистиков. Если же цветки обработать
ингибиторами синтеза или действия этилена, их цветение будет происходить более
длительное время.
Цветение и регуляция пола. На практике для ускорения цветения, например
ананаса Ananas comosus и манго Mangifera indica, применяют обработку этиленом.
В результате через 6-12 ч индуцируется почти 100%-ное зацветание растений. Об-
работка этиленом также способна влиять на пол цветков у однодомных растений,
стимулируя, например у огурцов Cucumis sativus, образование большего числа жен-
ских цветков.
Опадение листьев. Этилен является основным регулятором опадения ли-
стьев — процесса активного отделения листа от ветви без повреждения ее живых
тканей. Опадение листьев обусловлено образованием зоны отделения у основания
черешка, вдоль которой лист отделяется от ветви. Отделительная зона может так-
же формироваться перед опадением цветков и плодов. В зоне отделения образуется
два слоя клеток: отделительный слой, по которому происходит разлом, и защит-
ный слой, который предохраняет обнажающуюся при опадении листа поверхность
от высыхания и внедрения патогенов.
Процесс опадения листьев определяется соотношением в тканях двух гормонов —
этилена и ауксина — и происходит следующим образом. На ранних этапах развития
листа ауксин активно синтезируется и транспортируется из листовой пластинки че-
рез черешок в другие части растения, блокируя чувствительность отделительной
зоны к этилену. При этом важна не столько концентрация ИУК, сколько ее гра-
диент вдоль листа, поскольку чувствительность клеток черешка к этилену опре-
деляется главным образом параметрами аксиального транспорта ауксина. По мере
старения листа содержание этилена возрастает, а интенсивность транспорта и гра-
диент концентрации ИУК снижаются, что повышает чувствительность клеток-ми-
шеней зоны отделения к этилену. На этом этапе начинают экспрессироваться гены,
кодирующие ферменты, расщепляющие полисахариды и белки клеточной стенки.
В клетках отделительного слоя синтезируются гидролитические ферменты целлю-
лаза и пектиназа, которые в везикулах аппарата Гольджи секретируются в апопласт
и разрушают клеточную стенку. Клетки отделительного слоя разделяются, под тя-
жестью листа сосуды разрываются, и лист отделяется от дерева. Следует отметить,
что в высоких концентрациях ауксин также может стимулировать опадение листьев,
поскольку при этом сильно активируется синтез этилена.
Формирование аэренхимы. В стеблях и корнях водных растений, а также
растений, приспособленных к условиям затопления, за счет ткани, которая назы-
вается аэренхимой, формируется система межклеточных воздушных полостей, про-
низывающая практически все растение и обеспечивающая передвижение кислорода
и других газов от устьиц до клеток корней. Благодаря такому строению стебли
водных растений значительно легче, чем наземных. Такая же система воздушных
полостей образуется (независимо от внешних воздействий) в растениях риса, что
200
позволяет его корням функционировать в анаэробных условиях на глубине 50 см
и более.
В корнях наземных растений в условиях дефицита кислорода также может фор-
мироваться аэренхима (см. рис. 4.1). Этот процесс контролируется этиленом и иона-
ми Са2+. Этилен индуцирует изменения концентрации ионизированного кальция в
цитоплазме клеток-мишеней, что запускает механизм программируемой гибели кле-
ток коры корня и образование системы воздушных межклеточных полостей. При
этом не происходит разрушения клеток центрального цилиндра и эпидермы.
Защита растений от патогенов. Этилен способен включать ряд элементов в
системе защиты растений от патогенов: синтез ферментов, разрушающих клеточ-
ную стенку грибов (хитиназ и /?-1,3-глюканаз), и фитоалексинов. Этилену также
принадлежит важная роль в формировании системного приобретенного иммуни-
тета растений. Это было убедительно показано в работе М. Верберне с соавторами
(2003) на этилен-нечувствительных мутантах табака tetr. Этими исследователями из
Лейденского университета Нидерландов было показано, что повреждение в системе
рецепции и трансдукции этиленового сигнала приводит к нарушению образования
сигнальных молекул, являющихся триггером образования салициловой кислоты —
основного элемента системного иммунитета растений.
Глава 13
БРАССИНОСТЕРОИДЫ
У растений вещество стероидной природы, дбладающее рост-стимулирующим
эффектом, в чистом виде впервые было получено из липидной фракции пыльцы
рапса М. Гроувом с коллегами в 1979 г. Этот первый стероидный фитогормон по-
лучил название брассинолида. Брассинолид имеет структурное сходство с такими
стероидными гормонами животных как тестостерон и экдизон. В настоящее время
в растительных организмах выявлено много схожих с брассинолидом веществ, на-
зываемых брассиностероидами (БС), которые синтезируются главным образом из
кампестерола. БС выделены из покрыто- и голосеменных растений, папоротников,
мхов и зеленых водорослей. Больше всего БС содержится в пыльце и незрелых семе-
нах. В молодых растущих тканях их больше, чем в старых. В таблице 13.1 показано
содержание БС в различных видах растений.
13.1. Метаболизм брассиностероидов
Брассиностероиды представляют собой гидроксилированные производные фито-
стеринов. Эти фитогормоны в концентрации 10"9 — 10-6 моль/л нужны для роста
побегов и пыльцевой трубки, для ксилогенеза, репродуктивного развития и многих
других процессов. В настоящее время известно более 70 свободных БС. Брасси-
нолид—самый активный и широко распространенный брассиностероид (рис. 13.1).
В значительных количествах также встречается кастастерон, активность которого
в стандартных биотестах составляет 20% активности брассинолида. Разнообразие
БС достигается вариациями степени окисленности колец А и В, длины и степени
окисленности боковой цепи, а также эпимеризацией в положениях С-2, С-3 и С-24
(рис. 13.1).
Кольцо А может быть гидроксилировано только в положении С-3 либо в
положениях С-2 и С-3. Кроме того, существуют стереоизомеры, различающие-
ся конфигурацией заместителей у С-2 и С-3. Брассинолид представляет собой
2а,3а-эпимер. Значительно менее активен его 2б1,3/3-дигидроксиэпимер, называемый
3-эпибрассинолидом. Наиболее активны БС, имеющие лактонную группу в кольце
В. Однако БС с кетогруппой в положении С-6, например кастастерон, также имеют
значительную гормональную активность.
В зависимости от длины боковой цепи различают С27--» С28- и С29-
брассиностероиды (рис. 13.1). Боковая цепь может быть окислена только в положе-
нии С-22. Такие БС малоактивны. Брассиностероиды с высокой активностью гид-
роксилированы в положениях С-22 и С-23. Распространенной модификацией, незна-
чительно влияющей на биологическую активность, является изменение положения
202
Таблица 13.1. Содержание брассиностероидов (нг/г сырой массы)
в растительных тканях (по: Fujioka, 1999)
Виды растений Ткани Содержание
Arabidopsis thaliana Побеги, семена, стручки 0,11-5,4
Brassica napus Пыльца > 100
Brassica campestris Семена, листья кочана 0,00013- 0,094
Raphanus sativus Семена 0,3-0,8
Helianthus annuus Пыльца 25-106
Vida faba Пыльца, семена 5-628
Pisum sativum Семена, побеги 0,164-3,13
Lycopersicon csculentum. I Гобеги 0,029-1,69
Pinus thunbergii Пыльца 89
Cupressus arizonica Пыльца 1,0- 6400
Catharanthus roseus Культура клеток 0,047-4,5
Equisetum arvense Стробил 0,152-0,349
Hydrodictyon reticulatum Зеленая водоросль 0,3-0,4
Oryza sativa Побеги 0,0084-0,0136
Zea mays Побеги 2,0 120
Lilium elegans Пыльца 1,0-50
Typha latifolia Пыльца 68
метильной группы при С-24. У брассинолида опа находится в а-конфигурации
(рис. 13.1). Гормон, у которого эта группа находится в /3-конфигурации, называ-
ется 24-эпибрассинолидом. Кроме того, в боковой цепи может быть десатурирована
связь С-24-С-28.
Рис. 13.1. Наиболее распространенные вариации строения кольца А, кольца В и бо-
ковой цепи у брассиностероидов
Биосинтез БС. Брассиностероиды синтезируются из фитостеринов. Биосин-
тетическим предшественником редко встречающихся Сгэ-брассипостероидов, по-
видимому, является ситостерол — наиболее распространенный фитостерин, кото-
рый составляет 50-80% суммарных стеринов растений, а предшественником столь
же редких Сзт-брассиностероидов — холестерин. Самые распространенные С28-
брассиностероиды синтезируются из кампестсрола (рис. 13.2).
Первая реакция на пути превращения кампестсрола в брассинолид состоит в
восстановлении двойной связи в положении С-5- С-6 при участии НАДФ • Н-за-
203
о
Рис. 13.2. Биосинтез брассинолида из фитостерина кампестерола
204
висимой редуктазы. Дефект гена, кодирующего этот фермент, у мутанта араби-
допсиса det2 приводит к сильным нарушениям развития, которые можно испра-
вить с помощью брассинолида и его предшественников. Продукт этой реакции
кампестанол может превращаться в брассинолид по пути раннего или позднего
С-б-окисления.
Наиболее хорошо изучен путь раннего С-б-окисления. На этом пути кампестанол
сначала превращается в 6-гидроксикампестанол и б-оксокампестанол (рис. 13.2). За-
тем в результате последовательного гидроксилирования боковой цепи в положениях
С-22 и С-23 происходит образование тистерона, который обладает небольшой гор-
мональной активностью, составляющей примерно 1% от активности брассинолида.
Известно, что С-23-гидроксилаза относится к монооксигеназам семейства цитохро-
ма Р450. Ее нарушение у мутанта арабидопсиса cpd приводит к дефектам развития,
которые можно устранить с помощью тистерона и брассинолида, но не с помощью
катастерона. Далее происходит эпимеризация гидроксильной группы в положении
С-3, в результате которой образуется тифастерол с более высокой гормональной
активностью. Последующее С-2-а-гидроксилирование приводит к синтезу кастасте-
рона, активность которого составляет 20% активности брассинолида. Кастастероп
превращается в брассинолид в результате дальнейшего окисления кольца В с обра-
зованием лактона.
Рис. 13.3. Основные модификации, приводящие к частичной или полной инактивации брассиносте-
роидов
205
Окисление и конъюгация брассиностероидов. Окисление брассинолида
приводит к постепенному снижению и полной утрате его биологической активно-
сти (рис. 13.3). Так, гормональная активность исчезает при гидроксилировании в
положении С-26, которое осуществляется с помощью монооксигеназы CYP72B1 се-
мейства цитохрома Р450. Этой инактивации подвергается не только брассинолид,
но и его биосинтетические предшественники, например кастастерон.
Другое преобразование, снижающее гормональную активность, состоит в дегид-
рогенировании молекулы в положениях С-3 и С-23 с превращением спиртовых групп
в кетонные. 23-Дегидробрассинолид в наибольших количествах содержится в пыль-
це японского кедра (Cryptomeria japonica) и поэтому получил название криптолида.
В тканях растений обнаружен 26-норбрассинолид, у которого отсутствует С-26,
и 28-норкастастерон, не имеющий С-28. Эти соединения обладают более низкой ак-
тивностью, чем соответствующие им брассинолид и кастастерон.
Распространенный способ инактивации брассиностероидов состоит в эпимериза-
ции в положениях С-2 и С-3, в результате которой из брассинолида образуется 2- или
3-эпибрассинолид с /3-конфигурацией гидроксильной группы. 24-Эпибрассинолид,
имеющий /3-конфигурацию метильной группы у С-24, сохраняет высокую биологи-
ческую активность. Эпимеры с /3-конфигурацией гидроксильных групп у С-2 и С-3
часто образуют конъюгаты с глюкозой и жирными кислотами: лауриновой, мири-
стиновой и пальмитиновой. Кроме того, брассинолид может быть гликозилирован в
положении С-23. По-видимому, эти конъюгаты служат запасной формой брассино-
стероидов и могут быть гидролизованы.
13.2. Механизм действия брассиностероидов
Выявлено два типа брассиностероидных мутантов. К первому типу относятся
мутанты, у которых нарушены различные этапы синтеза, например два фотомор-
фогенстических мутанта арабидопсиса: det2 (de-etiolated) и cpd (constitutive photo-
morphogenesis dwarfism). У этих мутантов в условиях темноты не проявляется яв-
ление этиоляции - растения имеют развернутые семядоли, не вытянутый, а корот-
кий побег и дифференцированные хлоропласты (синтез хлорофилла, как известно,
без света невозможен). Обработка таких мутантов экзогенными БС восстанавливает
нормальный фенотип растения.
Генетический анализ мутантов с нарушением этиоляции показал, что мутации за-
трагивают гены DET2 и CPD, кодирующие ферменты синтеза брассиностероидов.
Мутация det2 затрагивает ген, который кодирует один из ключевых ферментов ме-
таболизма стероидов - кампестерол-5-редуктазу, катализирующую восстановление
кампестсрола в кампестанол. Мутация cpd блокирует гидроксилирование С-23 в мо-
лекуле катастеропа и превращение его в тистерон. Поэтому обработка мутантов
det2 и cpd экзогенными брассиностероидами восстанавливает нормальный фенотип
растений. Изучение плейотропных эффектов мутаций det2 и cpd, у арабидопсиса
показало, что брассиностероиды играют важную роль в регуляции таких с вето- и
гормон-регулируемых процессов как экспрессия светорегулируемых генов, рост кле-
ток растяжением, старение листьев, индукция цветения.
Второй тип брассиностероидных мутантов связан с нарушением процессов ре-
цепции и (или) передачи гормонального сигнала, поэтому обработка экзогенным
гормоном не оказывает на них влияния. Вначале удалось получить только два БС-
нечувствительных мутанта: bril (brassinosteroid insensitive 1) и bin2 (brassinosteroid
206
insensitive 2), с использованием которых были идентифицированы белок-рецептор
брассиностероидов BRI1 и белок BIN2 — негативный регулятор процессов, завися-
щих от состояния рецептора BRI1.
Рецепторный комплекс брассиностероидов. Оказалось, что ген BRI1 коди-
рует рецептор-подобную киназу с лейцин-богатыми повторами — LRR-RLK (leucine
rich repeat receptor-like kinase). Белок BRU состоит из N-концевого сигнального пеп-
тида, лейциновой молнии, двух пар остатков цистеина и 25 лейцин-богатых повторов
(LRR), разделенных (между 21 и 22 повторами) «островком» из 70 остатков амино-
кислот (рис. 13.4). Трансмембранный домен и внутриклеточный Сер/Тре киназный
домен расположены после лейциновых повторов. В восприятии брассинолида участ-
вуют LRR и трансмембранный домен BRI1.
ВАК1
[Сигнальный
Iпептид
Лейциновая I Пара остатков
молния I цистеина
Трансмембранный
домен
iLRR
Островок
иэ70АК
Рис. 13.4. Рецепторный комплекс для брассиностероидов, состоящий из двух рецепторо-
подобных киназ с лейцин-богатыми повторами LRR (по: Li, 2003)
С помощью зеленого флюоресцирующего белка было показано, что рецептор БС
BRI1 локализован в плазматической мембране и экспрессируется во всех тканях
растительного организма. Установлено, что BRI1 обладает способностью связывать
только биологически активные формы БС. Связывание БС со своим рецептором
происходит прямо на поверхности клетки. Следует отметить, что у животных, в от-
личие от растений, большинство стероидных гормонов распознаются рецепторами,
которые локализованы в ядре.
Позднее выяснилось, что рецепторный комплекс для брассиностероидов состоит
не из одной, а из двух киназ: BRI1 и ассоциированной с ней ВАК 1-киназы (BRI1-
associated receptor kinasei). Я. Ли (2003) было показано, что ВАК1, как и BRI1 (см.
рис. 13.4), содержит лейцин-богатые повторы (LRR), локализована в плазматиче-
ской мембране и экспрессируется во всех тканях арабидопсиса.
В передаче БС-сигнала от BRI1 выявлено два белка: TTL и TRIP1. Белок TTL
(transthyretin-like), являющийся субстратом для BR11-киназы, имеет сходство в пер-
вичной структуре с белками, связывающими тиреоидный гормон животных. По-
казано, что киназный домен BRI1 in vitro способен фосфорилировать белок TTL.
Сверхэкспрессия гена TTL приводит к появлению фенотипа, похожего на слабо вы-
раженную мутацию bril, то есть TTL проявляет свойство негативного регулятора
БС-сигнала. Это подтверждается также тем, что мутанты ttl более чувствительны
к БС по сравнению с растениями дикого типа.
Белок TRIP1 (TGF-/3-receptor interacting protein; TGF - transforming growth fac-
tor), являющийся у арабидопсиса аналогом белка TRIP1 млекопитающих, в расте-
ниях участвует в передаче БС-сигнала. Тот факт, что BRI1 (но не ВАК1) способен
фосфорилировать TRIP1 in vitro, указывает на то, что TRIP1 является еще одним
субстратом для БС-рецепторной киназы BRI1.
207
Третьим элементом, который может регулировать распространение сигнала от
BRI1, является белок-ингибитор ВКИ (BRJl kinase inhibitor!). Было обнаружено,
что сверхэкспрессия гена ВКИ ведет к появлению нечувствительных к БС карли-
ков, в то время как РНК-опосредованное подавление экспрессии гена ВКИ приво-
дит к фенотипу «длинного гипокотиля». Предполагается, что ВК11 препятствует
образованию комплекса ВШ1-ВАС1 в отсутствие БС.
BIN2
8ES1 BZR1
Рис. 13.5. Передача брассиностероидного сигнала (по: Johnson, Ingrain, 2005):
а —неактивное состояние рецепторного комплекса, б — рецепция БС-сигнала и передача его в ядро,
в — протеолитическое разрушение рецепторного комплекса. Р — остаток фосфорной кислоты
Ключевым событием в ходе рецепции и трансдукции БС-сигнала является ге-
теродимеризация между двумя этими рецепторными киназами. Связывание брас-
синолида приводит к образованию димера BRI1-BAC1 и последующей актива-
ции этих рецепторных киназ посредством трансфосфорилирования (рис. 13.5). По-
сле рецепции и передачи БС-сигнала происходит удаление рецепторного ком-
плекса из плазматической мембраны эндоцитозом, сопровождающееся его про-
теолизом.
Трансдукция БС-сигнала. Ключевым сигнальным элементом в ходе транс-
дукции БС-сигнала является белок BIN2, который следует после рецепторного
комплекса. Ген BIN2 кодирует цитоплазматическую протеинкиназу, гомологичную
SHAGGY-киназе дрозофилы и GSK-3 (glycogen synthase kinase-З) млекопитающих.
Этот ген оказался гомологом двух изолированных ранее генов — ASK (arabidop-
sis SHAGGY-like kinase) and UCU1 (ultracurvatal). С использованием дигибридного
биотеста па дрожжах было показано, что BIN2 взаимодействует с двумя ядерны-
ми белками - BES1 (BRIl-ethyl methane sulphonate-suppressorl) и BZR1 (brassina-
sole resistantl), которые функционируют как позитивные регуляторы БС-сигнала
(рис. 13.5). Показано, что BZR1 и BES1 обладают способностью прямо связывать-
ся с ДНК и контролировать экспрессию БС-зависимых генов. В промоторах ряда
БС-чувствительных генов выявлены специфические нуклеотидные последователь-
ности—так называемые БС-отвечающие элементы (BRRE - BR-response element).
208
Для BZR1 это CGTG(T/C)G, а для BES1—Е-бокс (CANNTG). Одним из генов,
содержащих три Е-бокса, является БС/ИУК-индуцируемый ген SAUR-AC1.
Рассмотрим возможный механизм рецепции и трансдукции БС-сигнала
(рис. 13.5). Ключевым событием, запускаемым БС, является фосфорилирование се-
рин/треонинового остатка в каталитическом домене BRI1, которое происходит после
гетеродимеризации двух рецепторных киназ (BR11-BAK1). Дальнейшая передача
БС-сигнала из цитозоля в ядро осуществляется белками BES1 и BZR1.
В отсутствие брассиностероидов белки BZR1 и BES1 фосфорилируются киназой
BIN2, что делает их мишенями для деградации в убиквитин-зависимом 26S про-
теасомном пути. При связывании же брассиностероидов с рецептором происходит
фосфорилирование киназных доменов BRI1 и ВАК1. Это приводит к подавлению
негативного регулятора BIN2.
Белки BES1 и BZR1 перемещаются в ядро, где дефосфорилируются се-
рин/треониновой фосфатазой BSU1 (bril suppressor 1) и приобретают способность
связываться с ДНК и функционировать как активатор и репрессор (соответствен-
но) БС-зависимых генов. Выявлены десятки генов, чувствительных к БС, которые
контролируют биосинтез элементов клеточной стенки и цитоскелета, синтез гор-
монов и их сигналинг (в особенности ауксина). Мишенью для БС может являться
также вакуолярная Н+-АТФаза.
Повреждение
патогенами
Синтез клеточной стенки
Ростовые ответы
Защитные реакции
Рис. 13.6. Взаимодействие БС с системином (по: Wang, Не, 2004)
Взаимодействие БС с системином. У томата обнаружена необычная вза-
имосвязь между реакциями на БС и механическое повреждение. Биохимическими
методами было показано, что SR160 — рецептор системина (пептидного гормона, об-
разующегося у растений семейства пасленовых в ответ на атаку фитофагами), похож
на рецептор БС. Фенотипический анализ мутации по гену ABS1 (altered brassinolide
sensitivityl), кодирующему SR160, подтвердил, что SR160 является ортологом BRI1.
Поэтому можно сделать вывод о том, что мембранный белок BRI1/SR160 выполняет
функции рецептора для двух типов гормонов —БС и системина (рис. 13.6). Однако
до сих пор остается открытым вопрос о том, как два таких разных лиганда (стероид
и пептид) могут взаимодействовать с одним и тем же рецептором.
209
13.3. Физиологическая роль брассиностероидов
Брассиностероиды (БС) необходимы для нормального роста, развития и плодо-
ношения растений. Растения, у которых имеются нарушения в синтезе БС или в
системе рецепции и трандукции БС-сигнала, обычно выглядят как темно-зеленые
а б в
карлики с эпинастическими листья-
ми. Это хорошо видно на рис. 13.7,
где приведены фотографии 16-дневных
проростков арабидопсиса дикого типа
и брассинолид-дефицитных мутантов
det2 и dim. У этих мутантов наблюдает-
ся нарушение развития, снижение или
полное отсутствие фертильности.
‘ Влияние на рост растений. Од-
ной из особенностей БС, отличающей
их от других фитогормонов, являет-
ся способность стимулировать ростовые
Рис. 13.7. Брассинолид-дефицитные мутанты процессы в очень низких концентраци-
арабидопсиса: ях (10“6--10“12 моль/л). Имеются убе-
а - растения дикого типа, б — dd2, в — dim
дителыгые доказательства участия ЬС
в регуляции важнейших этапов развития. Ряд ростовых эффектов показан на
рис. 13.8. Однако обработка БС не всегда вызывает положительный эффект в биоте-
стах, характерных для ИУК, гиббереллинов и цитокининов. Для выявления актив-
ности БС часто используют биотест на изменение угла отклонения листовой пла-
стинки риса от влагалища листа. Этот очень чувствительный биотест позволяет
оценивать уровень БС в диапазоне концентраций от 0,1 до 0,0001 мг/л.
Наиболее специфичный для БС эффект заключается в активации роста второго
междоузлия фасоли или гороха. Ни ауксины, ни цитокинины не вызывают тако-
го эффекта, а гиббереллины активируют удлинение междоузлий фасоли только в
очень высокой концентрации. Еще более чувствительным традиционным биотестом
на БС является рост эпикотилей маша. На этом объекте стимулирующий эффект
БС проявляется в концентрации 10“10 моль/л и ниже. В дальнейшем оказалось, что
стимулирующее действие БС на ростовые процессы связано с активацией не только
растяжения, но и деления клеток.
Установлено, что БС стимулируют деление клеток в присутствии ауксина и ци-
токинина в культуре паренхимных клеток Helianthus tuberosum и протопластов, вы-
деленных из тканей китайской капусты и петунии. Стимулирующий эффект БС на
деление клеток объясняют способностью БС влиять на работу цикл ина D3, регули-
рующего (совместно с цитокининами) клеточный цикл на этапе Gi-S.
Действие БС на рост клеток растяжением может быть связано с изменением
свойств клеточных стенок. Показано, что обработка БС активирует экспрессию
ряда генов, которые кодируют ферменты, участвующие в биосинтезе и модифи-
кации полимеров клеточной стенки, например ксилоглюкан эндотранс-гликозида-
зы/гидроксилазы, экспансины, экстенсины, арабиногалактановые белки.
Брассиностероиды могут также влиять на направление растяжения клетки и ее
форму через регуляцию ориентации микротрубочек. Показано, что обработка брас-
синолидом вызывает переориентацию кортикальных микротрубочек и индуцирует
экспрессию [3-тубулина.
210
Прорастание семян
® Недостаток
гиббереллинов
• +БС о
О ® ---------, © X
® Недостаток
гиббереллинов
Развитие проростков в темноте
б
Гипокотиль
Первичный
корень
WT WT WT bril
Контроль БС БС БС
(нМ) (мкМ) (мкМ)
Рис. 13.8. Действие брассиностероидов (БС) на растения ара-
бидопсиса (по: Haurbrick, Assmann. 2006):
а — экзогенная обработка брассиностероидами ( ьБС) стиму-
лирует прорастание гиббереллин-дефицитных семян арабидопси-
са; б—в низких концентрациях БС стимулируют удлинение ги-
покотиля и первичного корня арабидопсиса дикого типа (WT); в
более высоких концентрациях БС и АБК подавляют рост гипоко-
тиля и первичного корня, причем корни БС-мутантов (Ьгп2, bril)
обладают сверхчувствительностью к АБК
WT
АБК
(мкМ)
t
Ып2
АБК
(мкМ)
Анализ мутанта арабидопсиса det3 показал, что важную роль в индукции рос-
товых ответов БС играет вакуолярная Н+-АТФаза. У этого деэтиолированного му-
танта снижена реакция на БС, и добавление брассинолида не восстанавливает спо-
собное ть гипокотиля удлиняться в темноте. Оказалось, что ген DET3 кодирует субъ-
единицу 3 вакуолярной Н+-АТФазы. Следует отметить, что у БС-мутанта det3 (как
у sas и gpal) нарушены устьичные движения, что указывает на возможное участие
БС в регуляции работы замыкающих клеток устьиц.
Брассиностероиды участвуют в регуляции ростовых процессов, вероятно, во вза-
имодействии с другими фитогормонами. Выявлено, что БС и гиббереллины оказы-
вают аддитивное действие на рост гипокотилей огурца, особенно чувствительных к
брассинолиду. Выявлен сильный синергический эффект ИУК и брассинолида, кото-
рый проявлялся только в том случае, когда растения предварительно обрабатыва-
лись БС. а затем ИУК. Если же обработка растений шла в иной последовательности,
синергизма не наблюдалось. Ингибитор транспорта ауксина 2,3,5-трийодбензойная
кислота устраняла этот синергический эффект. Совместная обработка гипокотилей
арабидопсиса брассинолидом и гибберелловой кислотой (или брассшюлидом и аук-
сином) вызывала синергичный рост-стимул ирующий эффект.
Регуляция процессов развития. Хорошо известно, что в регуляции диффе-
ренцировки сосудов принимают участие такие гормоны как ИУК и цитокинины.
Однако на двух модельных объектах — эксплантах Helianthus tuberosum и изоли-
рованных клетках мезофилла Zinnia elegans, которые наиболее часто используются
для изучения процессов ксилемогенеза, удалось выявить, что и БС (в наномолярных
концентрациях) также обладают способностью активировать процесс дифференци-
ровки трахеальных элементов. В работе X. Фукуды (1997), выполненной на Zinnia,
удалось выявить, что БС способны регулировать экспрессию ряда генов, контроли-
рующих формирование ксилемы.
211
Получены доказательства, что БС, как и гиббереллины, обладают способностью
регулировать выход семян из физиологического покоя, контролируемый АБК. Было
обнаружено, что обработка БС устраняет торможение прорастания, наблюдаемое у
мутантов с нарушением синтеза гиббереллинов или чувствительности к ним. Обра-
ботка АБК вызывает более сильное торможение прорастания семян и роста корней
у брассиностероидных мутантов det2 and bril, чем у растений дикого типа. Таким
образом, БС необходимы для снятия АБК-зависимого покоя семян.
И, наконец, следует отметить, что не только этилен, но и БС, по-видимому, уско-
ряют процессы старения. Замечено, что если обычные растения арабидопсиса дико-
го типа начинают стареть в среднем через 60 суток от начала прорастания, то БС-
мутанты остаются зелеными и формируют новые цветки даже через 100 суток от
начала развития. Старение задерживается тем больше, чем ниже фертильность, и
стерильные БС-мутанты подобные bril развиваются очень медленно.
Роль БС в процессах фотоморфогенеза. Известно, что программа фото-
морфогенеза включается сразу после выхода проростка из почвы на свет. Освеще-
ние инициирует экспрессию светорегулируемых генов, активность которых в темно-
те подавлена специальными белками, являющимися ингибиторами процессов фото-
морфогенеза. Известно более 10 генов, кодирующих такие ингибиторы. Брассино-
стероиды влияют на активность ряда генов, экспрессия которых индуцируется при
попадании этиолированных проростков на свет.
Очень интересные в этом плане результаты получили в 2000-2001 гг. Нагата
с коллегами при использовании ингибитора синтеза БС — брассиназола. После об-
работки брассиназолом этиолированные проростки арабидопсиса приобретали вид
растений, растущих на свету: формировали широкие семядоли, короткий гипоко-
тиль, истинные листья. В семядолях таких проростков начиналось формирование
пластид и повышался уровень РУБИСКО, поэтому полагают, что БС выполняют
функцию репрессора светозависимых генов морфогенеза. Следует отметить, что ис-
пользование брассиназола, а также нечувствительного к нему мутанта bzr оказа-
лось очень эффективным для выяснения механизма трансдукции гормонального
сигнала.
Роль БС в адаптации к стрессовым воздействиям. Установлено, что БС в
низких концентрациях оказывают влияние не только на процессы роста и развития
растений, но повышают также их устойчивость к таким стрессовым воздействиям
как резкие колебания температуры, засуха, засоление, аноксия и воздействие пато-
генных грибов и бактерий. Поэтому брассиностероиды рассматриваются как одна
из наиболее перспективных групп фитогормонов для растениеводства, поскольку их
можно применять в ничтожных количествах как для регулирования процессов роста
и развития, так и для защиты растений. При использовании в сельском хозяйстве
наиболее эффективны комбинации брассиностероидов с другими фитогормонами --
ГК, АБК, этиленом, цитокининами.
Оригинальная идея относительно роли БС в устойчивости растений к фитопато-
генам была высказана группой японских исследователей — X. Накашитой с коллега-
ми (2003). Они считают, что в растениях, в дополнение к уже известным системам
защитных реакций на патогены, существует опосредованная стероидными гормона-
ми устойчивость к патогенам.
Пока трудно сказать, какие конкретные функции выполняют БС в системе за-
щитных реакций клетки на абиотические и биотические стрессовые воздействия. Не
исключено, что защитные эффекты БС на абиотические стрессовые воздействия мо-
212
гут быть опосредованы белками теплового шока. В работе С. Даубхаделя с коллега-
ми (2002) выявлено, что обработка растений рапса 24-эпибрассинолидом индуцирует
синтез и накопление белков теплового шока.
Подводя итог, хотелось бы обратить внимание на парадоксальную ситуацию, ко-
торая в настоящее время складывается в изучении БС. Исследования, посвященные
расшифровке молекулярного механизма рецепции и трансдукции гормона, значи-
тельно опережают работы, связанные с выяснением роли БС в клетках, тканях и
органах растения. То есть, мы уже значительно продвинулись в выяснении строения
рецепторов БС, механизма передачи сигнала по клетке, генов, которые контроли-
руются БС, однако мы пока еще очень мало знаем о конкретных функциях этой
группы фитогормонов в растении.
Глава 14
ЖАСМОНАТЫ
Жасмонаты относительно недавно стали рассматриваться как класс фитогормо-
нов. Впервые метиловый эфир жасмоновой кислоты (МеЖ) был выделен Е. Демоле
с коллегами (1962) из эфирного масла Jasminum grandiflorum как основной липид-
ный компонент аромата жасмина. Свободная жасмоновая кислота (ЖК) впервые
была найдена Д. Альдриджем с коллегами (1971) в культуральной жидкости гриба
Botryodiplodia theobromae.
Жасмоновая кислота (ЖК) контролирует устойчивость растений к патогенам и
насекомым-фитофагам, к осмотическому стрессу и засухе, к повреждению ультра-
фиолетом и озоном, к поранению и элиситорам. Классический эффект жасмопатов
состоит в индукции в условиях биотического стресса экспрессии генов, кодирующих
ингибиторы протеиназ и ферменты биосинтеза вторичных соединений (алкалоидов,
фитоалексинов). Жасмонаты индуцируют старение и подавляют прорастание се-
мян, контролируют развитие пыльцы и растрескивание пыльников, участвуют в
регуляции формирования клубней и луковиц, роста корня и созревания плодов.
ЖК подавляет экспрессию ряда ядерных и хлоропластных генов, продукты ко-
торых необходимы для фотосинтеза, что приводит к снижению содержания хлоро-
филла и хлорозу. Содержание ЖК в тканях растений резко возрастает при таких
механических раздражениях как снижение тургорного давления в условиях дефици-
та воды, движения усиков, взаимодействие корневых волосков с частицами почвы.
14.1. Метаболизм жасмонатов
Все растения, включая водоросли, синтезируют жасмонаты. Эти соединения так-
же обнаружены у грибов. Гормональную активность проявляет 3(R),7(S)?^uc( t )-
жасмоновая кислота (ЖК), ( н)-7-изо-жасмонил-Е-изолейцип ее биосинтетический!
предшественник 9(8),13(8)-12-оксо-фитодиеновая кислота, динор-оксо-фитодиено-
вая кислота, глюкозный и метиловый эфиры ЖК, а также образующаяся при гид-
роксилировании ЖК тубероновая кислота и ее глюкозид (рис. 14.1). Небольшую гор-
мональную активность проявляет 3(К),7(К)-трсшс(-)-жасмоновая кислота- транс(-
)-эпимер ЖК. Биологически неактивны амидные конъюгаты ЖК и ее гидроксили-
рованных производных с тирозином и триптофаном.
Концентрация жасмонатов в тканях растений обычно составляет 10-100 нг/г сы-
рой массы, но в условиях стресса она может возрастать до 3 мкг/г сырой массы.
214
Биологически активные соединения
динор-оксо-фитодиеновая
кислота
глюкозид тубероновой кислоты
3(R).7(R)-mpaHC(-)-
жасмоновая кислота
Неактивные и малоактивные соединения
амидный конъюгат ЖК
с тирозином
Рис. Ц.1. Жасмонаты растений
амидный конъюгат ЖК
с триптофаном
Молодые, развивающиеся части растений содержат больше жасмонатов, чем закон-
чившие рост. Очень низкая концентрация жасмонатов отмечена в клетках, поддер-
живаемых в суспензионной культуре (0,11 нг/г сырой массы).
Биосинтез жасмонатов. Жасмонаты синтезируются в разных тканях расте-
ний в результате перекисного окисления линоленовой кислоты. Процесс начинается
в хлоропластах и заканчивается в пероксисомах. В вегетативных клетках линолено-
вая кислота находится в свободной, деэтерифицированной форме и в составе мем-
бранных липидов. Наиболее богаты линоленовой кислотой галактолипиды тилако-
идных мембран хлоропластов: моногалактозилдиацилглицеролы и ди галактоз и л дп-
аци л глицеролы. Кроме того, значительное количество линоленовой кислоты входит
в состав фосфатидилхолинов эндомембран и плазматической мембраны.
Линоленовая кислота образуется в результате десатурации входящей в состав
липидов линолевой кислоты под действием и-З-десатуразы жирных кислот. Двой-
ная связь формируется в положении 3, считая от tu-конца жирнокислотной цепи
(рис. 14.2). Уровни этерифицированной и свободной линоленовой кислот в десятки и
215
ХЛОРОПЛАСТ
линолевая кислота в составе
мембранного липида
линоленовая кислота в составе
мембранного липида
липаза
свободная линоленовая кислота
13-гидропероксилиноленовая кислота
\/°х /
С=С-^ аллен-оксид
13 12 11
12,13-эпоксилиноленовая кислота
9(8),13(5)-12-оксо-фитодиеновая кислота
НАДФ Н -к
НАДФ+<Г
редуктаза
ПЕРОКСИСОМА
Рис. Ц.2. Биосинтез жасмоновой кислоты
216
сотни раз превышают концентрацию ЖК. Тем не менее, активность о;-3-десату разы
жирных кислот влияет на синтез ЖК. Так, уменьшение активности этого фермента
в листьях картофеля посредством антисенс-технологии снижает индукцию в ответ
на «погрыз» генов, кодирующих ингибиторы протеиназ. Кроме того, в условиях
стресса обычно наблюдается увеличение содержания линоленовой кислоты в клет-
ках.
Так как жасмонаты по структуре и по характеру биосинтеза близки к накапли-
вающимся при травмах простеноидам млекопитающих, исследователи используют
обширную информацию о биосинтезе простеноидов с целью восполнить недостаток
знаний о биосинтезе ЖК. Простагландины и лейкотриены в основном синтезируют-
ся из арахидоновой кислоты--Сго-триеновой жирной кислоты, входящей в состав
мембранных фосфолипидов. В отличие от линоленовой кислоты свободная арахидо-
новая кислота присутствует в клетках только в очень низкой концентрации. Поэтому
одним из ключевых этапов биосинтеза простеноидов является освобождение арахи-
доновой кислоты из фосфолипидов с помощью Са2 "^-зависимой фосфолипазы Аз-
У растений до сих пор не найдена липаза, участвующая в биосинтезе ЖК. Наибо-
лее вероятно, что линоленовая кислота, которая превращается в ЖК, выделяется из
галактолипидов хлоропластов под действием галактолипаз. Подтверждением этому
служит ускоренный распад галактолипидов при механических повреждениях рас-
тений.
Следующий этап синтеза жасмонатов состоит в окислении линоленовой кисло-
ты под действием липоксигеназ (рис. 14.2). Реакция ингибируется салици л гидро-
ксамовой кислотой. Ферменты проявляют наибольшую активность по отношению к
свободным жирным кислотам, но могут также окислять жирные кислоты в соста-
ве липидов. Липоксигеназы — растворимые диоксигеназы, содержащие негеминовое
железо (Fe2+). В клетках присутствует много различных липоксигеназ, которые пре-
имущественно находятся в цитозоле. Кроме того, эти ферменты обнаружены в хло-
ропластах, митохондриях и вакуолях. Липоксигеназы окисляют полиненасыщенные
жирные кислоты, в составе которых есть 1,4-пентадиеновый мотив. Главные суб-
страты липоксигеназ в клетках растений — линолевая и линоленовая кислоты. Вна-
чале фермент катализирует удаление атома водорода у С-11, что приводит к диок-
сигенированию С-9 или С-13 (рис. 14.3). Таким образом, 9--цш?,12-^ис-пентадиеновая
группа превращается в 9-гидроперокси-10-транс, 12-цис- либо в 13-гидроперокси,
9-^ис,11-транс-пентадиеновую группу (рис. 14.3).
В зависимости от того, к какому атому углерода присоединяется кислород в про-
цессе липоксигеназной реакции, ферменты классифицируются на 9-липоксигеназы
и 13-липоксигеназы. В биосинтез жасмонатов вовлечены 13-липоксигеназы хло-
ропластов. Их активность возрастает при стрессе и под действием жасмона-
тов. У трансгенных растений картофеля со сниженной 13-липоксигеназной ак-
тивностью при механических повреждениях резко снижена индукция генов, ко-
дирующих ингибиторы протеиназ. Образующаяся под действием липоксигеназы
13-гидропероксилиноленовая кислота нестабильна и токсична, как и другие гидро-
пероксиды жирных кислот. Она быстро превращается в альдегиды и оксокислоты
жирного ряда. Однако часть молекул 13-гидропероксилиноленовой кислоты пре-
образуется в хлоропластах в 12,13-эпоксилиноленовую кислоту (см. рис. 14.2). Эту
реакцию катализирует аллен-оксид-синтаза, относящаяся к СУР74А-семейству ци-
тохрома Р450. В отличие от типичных монооксигеназ, содержащих цитохром Р450,
аллен-оксид-синтаза имеет низкое сродство к СО и не использует О2 для преобразо-
217
13(5) 12(4) Ю(2) 9(1)
,СН=СН /СН=СН
\н2
11(3)
9-цис, 12-цис-фрагмент
,СН=СН г /СН=СН
Хсн
депротонированный по С-11 фрагмент
13-гидроперокси-9-цис, 11-транс-фрагмент
ООН
I
,СН=СН ^CH-CIH
\н
9-гидроперокси-10-транс, 12-цис-фрагмент
Рис. 14.3. Окисление липоксигеназами 1,4-пентадиенового фрагмента в составе ли-
ноленовой кислоты
вания субстрата. Фермент локализован в хлоропластах, где он связан с мембраной
оболочки. Сверхэкспрессия аллен-оксид-синтазы у трансгенных растений картофеля
вызывает накопление жасмонатов. Активность фермента возрастает при механиче-
ских повреждениях и под действием жасмонатов.
12,13-Эпоксилиноленовая кислота - короткоживущий интермедиат, продолжи-
тельность периода полураспада которого в водной среде при 0°С составляет 20 с.
Этот интермедиат быстро и неэнзиматически преобразуется в кетолы и раце-
мическую смесь ф/с-12-оксо-фитодиеновых кислот. Фермент аллен-оксид-цикла-
за осуществляет стереоспецифическую циклизацию 12,13-эпоксилиноленовой кис-
лоты в 9(8),13(8)-12-оксо-фитодиеновую кислоту (см. рис. 14.2). В значительно
меньшем количестве в этой реакции образуется ее зеркально симметричный энан-
тиомер: 9(В),13(В)-12-оксо-фитодиеновая кислота. В силу нестабильности аллен-
оксида линоленовой кислоты его эффективное использование для стереоспеци-
фического синтеза 12-оксо-фитодиеновой кислоты предполагает существование
в хлоропластах комплекса двух ферментов: аллсн-оксид-синтазы и аллсн-оксид-
циклазы.
12-Оксо-фитодиеновая кислота - активный Cig-жасмонат, который покидает
хлоропласты и может включать каскад реакций, приводящих к экспрессии ряда ге-
нов. Активный Сш-жасмонат — динор-оксо-фитодиеновая кислота образуется не
из С]8-оксо-фитодиеновой кислоты, а посредством окисления и циклизации гекса-
декатриеновых кислот хлоропластов. Реакции синтеза ЖК из 12-оксо-фитодиено-
вой кислоты протекают в пероксисомах (рис. 14.2). Транспорт 12-оксо-фитодиеновой
кислоты в пероксисомы у арабидопсиса происходит с помощью АВС-транспортера
CTS1, поэтому у мутанта ctsl синтезируется мало ЖК. В пероксисомах под дей-
218
о
10,11 -дигидро-12-оксо-
фитодионовая кислота
KoASH, АТФ
АМФ, РР,
ацил-КоА-синтетаза
2-еноил-КоА
ацил-КоА
гидратаза/дегидрогеназа
3 гидроксиаилл-КоА
КоА-гиоэфир Ctfi-
циклолентановой кислоты
КоА-гиоэфир ЖК
ЖК
Рис. Ц.4. /3-окисление 10,11-дигидро-12-оксо-фитодиеновой кислоты
219
ствием НАДФ-Н-зависимой редуктазы 12-оксо-фитодиеновая кислота превращается
в 10,11-дигидро-12-оксо-фитодиеновую кислоту, которая далее проходит три цикла
уб-окисления жирных кислот и превращается в ЖК.
Для вступления в цикл /3-окисления требуется активация 10,11-дигидро-12-оксо-
фитодиеновой кислоты посредством этерификации коэнзимом А (рис. 14.4). Реак-
ция осуществляется при участии ацил-КоА-синтетазы. Цикл /3-окисления включа-
ет: 1) десатурацию связи 2-3 под действием ФАД-зависимой ацил-КоА-окспдазы;
2) гидратацию образовавшегося 2-еноил-КоА до 3-гидроксиацил-КоА и дегидри-
рование до 3-кетоацил-КоА под действием полифункциональной НАД+-зависимой
гидратазы/дегидрогеназы; 3) расщепление 3-кетоацил-КоА на ацетил-КоА и КоА-
производное жирной кислоты, укороченной на два метиленовых звена, под действи-
ем 3-кето-тиолазы. После прохождения трех циклов /3-окисления происходит гидро-
лиз эфира ЖК с коэнзимом А с помощью тиоэстеразы. Растения, дефектные по фер-
ментам /3-окисления жирных кислот, имеют низкий уровень ЖК. Например, тор-
можение синтеза ЖК наблюдается у трансгенных растений, имеющих сниженную
активность ацил-КоА-оксидазы. Поранение индуцирует синтез ацил-КоА-оксидазы.
Инактивация жасмонатов. Синтезированная из линоленовой кислоты биоло-
гически активная цис(+)-ЖК постепенно неэнзиматически преобразуется в термо-
динамически стабильный малоактивный транс(-)-эпимер (см. рис. 14.1). В состоя-
нии термодинамического равновесия соотношение транс^-)- и цис(-+ )-эпимеров со-
ставляет 9:1. Время жизни ф/с(-Н)-эпимера зависит от pH. При pH 6 период полурас-
пада ^ис(+)-эпимера составляет 400 дней. Отклонение от pH 6 как в щелочную, так
и в кислотную сторону вызывает значительное укорочение жизни активного эпиме-
ра. Так, при pH 7 период его полураспада составляет три дня, а при pH 9 — только
8 ч. Таким образом, неэнзиматическая эпимеризация, скорость которой зависит от
pH, приводит к инактивации ЖК.
Другой способ необратимой инактивации состоит в образовании инертных конъ-
югатов ЖК с аминокислотами (см. рис. 14.1). Кроме того, ЖК может инактивиро-
ваться посредством гидроксилирования в положении С-11 и восстановления кето-
группы до спиртовой.
14.2. Механизм действия жасмоновой кислоты
В растениях, которые реагируют на стрессовые воздействия повышением синтеза
ЖК, активируется синтез таких защитных белков как вегетативные запасные белки
(VSP — vegetative storage proteins), тионины (Thi2.1 — thionins) и дефензины (PDF —
plant defensin). ЖК также повышает транскрипцию генов, кодирующих ферменты
синтеза жасмонатов-- DAD, LOX2, AOS, OPR3 и JMT.
Для анализа механизма трансдукции жасмонатного сигнала обычно применя-
ют два типа мутантов с измененными ответными реакциями на ЖК. К первому
типу относятся жасмонат-нечувствительные мутанты арабидопсиса jarl (jasmonic
acid resistant 1), coil (coronatine insensitive 1), jinl (jasmonate insensitive 1), jin4
(jasmonate insensitive 4). Второй тип мутантов включает растения с конститутивной
или повышенной реакцией на ЖК. К этому типу относятся такие мутанты араби-
допсиса как cetl (constitutively express the thionin gene), cexl (constitutively express
the J A inducible gene 1), cevl (constitutively express the vegetative storage protein 1).
Большинство элементов жасмонатного сигнального пути были выявлены именно
благодаря использованию соответствующих мутантов.
220
У мутанта cevl (с конститутивной реакцией на ЖК) был выявлен повышенный
синтез 12-оксо-фитодиеновой кислоты, ЖК и этилена, а также конститутивная экс-
прессия генов, кодирующих такие защитные белки как VSP, Thi2.1, PDF1.2 и СШ-В
(chitinase). Вероятно, поэтому cevl мутанты обладают повышенной устойчивостью к
патогенам и насекомым-фитофагам. К. Эллис с коллегами (2002) показано, что cevl
функционирует на ранних этапах ответных реакций на стрессовые воздействия в
качестве негативного регулятора жасмонатного и этиленового сигналов.
Очень интересным оказался мутант coil, устойчивый к бактериальному токси-
ну коронатину и метилжасмонату (коронатин является структурным аналогом ЖК
и имитирует ее действие). Оказалось, что СОИ необходим практически для всех
процессов, контролируемых ЖК. В мутантах coil не экспрессируются жасмонат-
индуцируемые гены, которые кодируют такие защитные белки как AtVSP, Thi2.1 и
PDF1.2. Растения, мутантные по гену СОИ, отличаются мужской стерильностью и
повышенной чувствительностью к насекомым и патогенам. Интересно, что локаль-
ная инфекция бактерией Pseudomonas syringae, которая продуцирует коронатин,
приводит к системной экспрессии генов, кодирующих ингибиторы протеаз COI1-
зависимым путем без активации синтеза ЖК в неинфицированных листьях.
Ген СОИ кодирует один из 694 белков F-бокса арабидопсиса и очень тесно взаи-
модействует с геном TIR1, контролирующим передачу ауксинового сигнала. Белок
СОИ (66 кД) является компонентом SCFcon комплекса, который функционирует,
как ЕЗ-тип убиквитин-лигаз. Именно этот комплекс, как уже упоминалось ранее
(см. с. 125), обеспечивает избирательное мечение (полиубиквитинирование) белков-
мишеней для протеолитической деградации в 26S протеасоме. SCFco/1-комплекс
является ядром жасмонатного сигнального пути. В его состав, помимо белков
F-бокса (SKP1, RBX1 и куллина), входит белок СОИ, который отвечает за спе-
цифичность полиубиквитинирования белков, участвующих в трансдукции жасмо-
натного сигнала.
Установлено, что под действием ЖК происходит активация SCFco/1-комплекса,
который метит регуляторные белки для их последующего протеолиза. Возможными
мишенями для полиубиквитинирования являются белки-репрессоры JAZ, подавля-
ющие активность факторов транскрипции жасмонат-зависимых генов. После про-
теолиза этих репрессоров снимается ингибирование жасмонат-зависимых факторов
транскрипции и запускается транскрипция генов, контролируемых ЖК (рис. 14.5).
Одним из таких факторов транскрипции является AtMYC2, который кодируется
геном JIN1/JA11, локализован в ядре и относится к типу bZIP транскрипционных
факторов. В промоторной зоне жасмонат-ипдуцибельных генов выделена специфи-
ческая нуклеотидная последовательность (CACGTG-бокс), с которой связываются
транскрипционные факторы bZIP-типа.
Экспрессия AtMYC2 быстро повышается СОП-зависимым способом в ответ на
ЖК. При этом следует иметь в виду, что AtMYC2 повышает экспрессию генов (VSP
и LOX), активируемых поранением и обработкой ЖК, по может снижать экспрессию
ряда генов, связанных с патогенезом (PR1 и PDF 1.2).
Еще одним хорошо изученным регулятором в жасмонатном сигнальном пути
является транскрипционный фактор ORCA3 (octadecanoid-responsive catharanthus
AP2/ERF-domain transcription factor). Показано, что ORC АЗ специфично связы-
ваются с жасмонат- и элиситор-отвечающими элементами (JERE — jasmonate- and
elicitor responsive element) генов, регулируемых ЖК. Функции такого регулятора
также может выполнять и деацетилаза гистонов. В трансдукции жасмонатного сиг-
221
Биотический/абиотический стресс
СК
'' [npri]
, - WRKY70 |
PR1
Стресс-индуцируемые гены
Рис. Ц.5. Сигнальная сеть ответных реакций на стрессовые воздействия, включающая жасмо-
новую кислоту (ЖК). этилен (ЭТ), салициловую кислоту (СК) и абсцизовую кислоту
(АБК) (по: Lorenzo, Solano, 2005)
нала участвует белок JAR1, относящийся к суперссхмейству люцифераз светляков,
которые формируют ацил-аденилаты и таким образом активируют карбоксильные
группы разнообразных соединений для их последующей модификации.
Следует особо отметить, что в регуляции работы жасмонат-индуцибсльных ге-
нов (VSP, Lox. Thi2.1) могут принимать участие транскрипционные факторы,
участвующие также в трансдукции этиленового (ERF1) и салицилатного сигна-
лов (WRKY70). В свою очередь, индуцируемый жасмонатом фактор транскрипции
AtMYC2 может влиять на экспрессию генов, контролируемых этиленом (PDF 1.2,
b-CHI, HEL) и салициловой кислотой (PR1) (рис. 14.5). Более того, несмотря на то,
что убиквитин-лигазный комплекс SCFc<9/1 является основным регулятором про-
цессов, контролируемых ЖК, его активность может изменяться при участии генов
убиквитин-протеасомного пути (например AXR1, SGTlb/JAIJ, CSN), которые так-
же вовлечены в регуляцию активности других SCF комплексов.
14.3. Физиологическая роль жасмонатов
Участие в реакции сверхчувствительности. Наиболее важной функцией
ЖК является ее участие в ответных реакциях при повреждении растений патоге-
нами и насекомыми. Поврежденные ткани отличаются очень высокой концентраци-
ей этого фитогормона, что резко повышает устойчивость растений к вредителям.
Повышение содержания жасмоната активирует экспрессию целого каскада генов,
которые кодируют белки, формирующие механические барьеры в клеточной стенке
на пути инфекции, и ферменты, участвующие в синтезе токсичных для патогенов
соединений.
Одним из самых эффективных способов защиты растительных организмов от
222
повреждения является реакция сверхчувствительности (СВ1!), то есть быстрая ло-
кальная гибель инфицированных растительных клеток вместе с патогеном, что в
конечном счете обеспечивает устойчивость всего растения. Реакция СВ1! запуска-
ется путем контакта растения с патогеном. В том случае, когда несколько расти-
тельных клеток быстро распознают патоген и погибают вместе с ним, выживает
целый организм. Если же клеткам долгое время не удается идентифицировать при-
роду патогена и выработать адекватные меры защиты, растение погибает. Поэтому
самым важным этапом во взаимодействии растения с патогеном является процесс
распознавания паразита, поскольку растения обычно чувствительны к атаке только
определенных видов патогенов, но устойчивы к другим. Специфичность взаимодей-
ствия определяется белковыми продуктами генов устойчивости (71-генов) растения-
хозяина и генов авирулентности (avr-генов) патогена. Каждому гену авирулентпо-
сти патогена соответствует свой ген устойчивости растения.
Успех в выживании зависит прежде всего от того, насколько быстро расте-
ние распознает продукты avr-генов патогена. Ими являются вещества, называемые
элиситорами (elicitc — вызывать) и способные индуцировать реакцию СВЧ. К ним
относятся белки, пептиды, липиды и полисахаридные фрагменты клеточных сте-
нок патогена. Различают специфические и неспецифическпе элиситоры: специфиче-
ские контролируются avr-генами и характерны только для определенных патогенов,
неспецифические имеются у различных типов патогенов.
Элиситоры, как правило, способны индуцировать реакцию СВЧ без непосред-
ственного контакта растительных клеток с патогеном. После взаимодействия эли-
ситоров с рецепторами растительной клетки запускается каскад процессов, резуль-
татом которого является синтез соединений, токсичных и для патогена, и для рас-
тительной клетки.
В первые минуты заражения происходит резкое увеличение концентрации ионов
Са2+ в цитоплазме за счет потока через Са2+-каналы и активация различных Са2+-
связывающих белков. Одной из таких мишеней является находящийся в плазмалем-
ме мультиферментный комплекс НАДФ-Н-оксидазы, который активируется за счет
Са2+-зависимого фосфорилирования и катализирует образование супероксидного
анион-радикала — на поверхности клетки. Затем О*- энзиматически и неэнзи-
матически быстро превращается в другие активные формы кислорода: пероксид во-
дорода (Н2О2), гидропероксильный радикал (НО£), гидроксильный радикал (*ОН).
Наиболее активные формы кислорода (НО* и ОН*) способны индуцировать цеп-
ные реакции, приводящие к образованию большого количества свободных радика-
лов, вызывающих перекисное окисление липидов, нарушение целостности мембран,
инактивацию ферментов и разрушение нуклеиновых кислот. В ходе реакции СВЧ
все эти процессы завершаются появлением некротических пятен, гибелью части кле-
ток растения-хозяина и патогена.
Образование больших количеств пероксида водорода является причиной акти-
вации синтеза фитогормонов — жасмоновой и салициловой кислот. Концентрация
жасмоновой кислоты в растительных тканях резко возрастает при повреждении
патогенами или при воздействии элиситоров. Синтез жасмонатов запускается так-
же при поранении растения, например в процессе поедания растений фитофагами.
Синтез ЖК и метилжасмоната (МеЖ) может индуцировать большая группа
соединений и стимулов: препараты из клеточных стенок дрожжей и Lactobacillus,
производные клеточной стенки грибов хитозаны, циклические пептиды-антибиоти-
ки (полимиксин В, бацитрацин, колистин), полипептид системип, а также механи-
223
ческие повреждения и стимулы, засуха, обработка АБК и тяжелыми металлами.
При всех вышеперечисленных воздействиях наблюдается очень быстрое (5 -45 мин)
многократное возрастание уровня ЖК. Ускорению синтеза ЖК предшествует появ-
ление специфических мРНК и белков и вторичных метаболитов, то есть жасмонаты
могут функционировать, как индукторы вторичного метаболизма растений. При
этом обработка жасмонатами индуцирует синтез вторичных метаболитов, обеспечи-
вающих растениям защиту от патогенов.
Жасмоновая кислота активирует экспрессию ряда генов, продукты которых поз-
воляют растениям адаптироваться к патогенам и механическим повреждениям. К
их числу относятся токсичные для патогенов низкомолекулярные цистеин-богатые
белки тионины и полипептиды дефензины, ферменты, участвующие в синтезе фи-
тоалексинов (большой группы метаболитов вторичного происхождения, которые
подавляют развитие патогена), гидроксипролин-богатые белки клеточной стенки
экстенсины. Поэтому обработка растений жасмоновой кислотой резко повышает
их устойчивость к повреждениям. Жасмоновая кислота, как и салицилат, явля-
ется также одним из факторов индукции иммунитета растений к повторным зара-
жениям.
Участие в формировании устойчивости растений к фитофагам. Несмот-
ря на то, что в ходе биологической эволюции цветковые растения и насекомые по-
явились независимо, они во многом взаимодействовали друг с другом и поэтому
эволюционировали совместно. Привлекая ряд насекомых-опылителей, растения в
то же время страдают от того, что многие насекомые на них кормятся.
Для защиты от фитофагов растения располагают широким набором веществ вто-
ричного происхождения, которые делают их для насекомых несъедобными. Важ-
ным компонентом защитных реакций растений являются также ингибиторы фер-
ментов, участвующих в процессах переваривания пищи насекомыми. У большин-
ства бобовых имеется ингибитор а-амилазы — фермента, расщепляющего крахмал.
Другие виды растений синтезируют защитные белки — лектины, которые, связыва-
ясь с углеводами и гликопротеидами, делают образовавшиеся комплексы непере-
вариваемыми.
Наиболее изученными факторами растений, вызывающими несварение у насе-
комых-фитофагов, являются ингибиторы протеолитических ферментов (протеаз),
расщепляющих белки в процессе пищеварения. У насекомых, которые питаются рас-
тениями, содержащими ингибиторы протеаз, резко падают темпы роста и развития.
В то же время в их пищеварительном тракте происходит накопление непереваренной
пищи, что активирует чувствительные к растяжению механорецепторы и вызывает
у насекомого чувство насыщения. Ингибиторы протеаз обычно не присутствуют в
растениях, а появляются в ответ на повреждение.
Еще в 1990 г. Э. Фармер и К. Райан обнаружили, что обработка МеЖ способна
активировать экспрессию генов, отвечающих за синтез ингибиторов протеаз. При-
менение непосредственных предшественников ЖК, таких как линоленовая кисло-
та, 13(8)-гидропероксилиноленовая кислота и 12-оксо-фитодиеновая кислота, также
приводило к накоплению в растительных тканях ингибиторов протеаз. Подобные же
эффекты вызывали механические повреждения растений фитофагами. На рис. 14.6
показана динамика накопления ЖК в растениях арабидопсиса при повреждении,
вызываемом личинками Bradysia impatiens. Уже через 30 мин после повреждения
уровень ЖК возрастал почти в 20 раз. Активации синтеза ЖК является ключевым
событием, которое позволяет растениям быстро сформировать систему защитных
224
800
Рис. 14-6. Динамика накопления ЖК в растениях арабидопсиса при
повреждении личинками Bradysia impatiens (по: McConn et
al., 1997):
1 — поврежденные растения; 2 — неповрежденные растения
реакций от поедания насекомыми. М.МакКонном с коллегами (1997) было выявле-
но, что тройная мутация (fad3-2 - fad7-2 - fad8), вызывающая снижение содержа-
ния линоленовой кислоты (предшественника жасмонатов), приводила к тому, что
80% мутантов арабидопсиса погибали при повреждении личинками Bradysia im-
patiens. Обработка этих мутантов ЖК снижала их повреждаемость до 12%. Эти
эксперименты четко указывают на то, что именно ЖК является одним из наиболее
важных элементов в системе защиты растений от насекомых-фитофагов.
В дальнейших исследованиях выяснилось, что экспрессия генов, кодирующих
ингибиторы протеаз, контролируется двумя фитогормонами: пептидом системином
и жасмоновой кислотой. У томатов системин включается в системную регуляцию
более 20 генов, контролирующих устойчивость к повреждению фитофагами, пато-
генами, поранению, а также к ряду абиотических стрессовых воздействий. Регуля-
ция экспрессии некоторых «защитных» генов системином может осуществляться не
только вместе с жасмоновой кислотой, но также и совместно с АБК и этиленом.
Образование пептидного гормона системина из его предшественника просистеми-
на является самой ранней реакцией растений на механические повреждения (в том
числе и фитофагами). Системин взаимодействует со своим рецептором SR160 (см.
главу 16), локализованным в клеточной мембране, и вызывает активацию октаде-
каноидного пути синтеза, однако вопрос о механизме этой активации пока остается
открытым.
Образование ЖК в ответ на поранение происходит главным образом в сосуди-
стых тканях листа, где локализовано большинство ферментов, принимающих уча-
стие в синтезе жасмонатов. Жасмонат транспортируется в неповрежденные участки
по флоэме, а метилжасмонат как летучее соединение - по воздуху. Следует отме-
тить, что экзогенный МеЖ очень быстро связывается растительными клетками и
расщепляется эстеразами до свободной жасмоновой кислоты. Повышение ее содер-
225
жания, инициируемое системином, активирует экспрессию генов, которые кодируют
синтез ингибиторов протеолитических ферментов, расщепляющих белки в процессе
пищеварения насекомых.
Следует отметить, что на синтез ЖК могут оказывать влияние также другие гор-
моны и факторы. АБК, этилен, Н2О2, ультрафиолет, олигогалактурониды и конъ-
югаты жирных кислот активируют синтез ЖК и экспрессию ЖК-индуцируемых
генов, в то время как салициловая кислота и NO подавляют образование ЖК.
Участие в процессах морфогенеза. Морфогенез растений, то есть процессы
формирования растительных органов и тканей, контролируется частотой и направ-
лением клеточных делений, а также направлением растяжения клеток. Установлено,
что ЖК и ее метиловый эфир могут регулировать и деление клеток, и направле-
ние их растяжения, определяя таким образом форму будущих органов и тканей
растительного организма. Показано, что жасмонаты участвуют в регуляции таких
процессов морфогенеза как созревание плодов и рост корня, тигмоморфогепез уси-
ков и производство жизнеспособной пыльцы, формирование и функционирование
арбускулярной микоризы, эмбриогенез, клубнеобразование и формирование луко-
виц.
Установлено, что ЖК и ее метиловый эфир индуцируют образование клубней у
картофеля Solanum tuberosum, ямса Dioscorea bulbifera, артишока Helianthus tubero-
sum и батата Ipomea batatas. Следует отметить, что процесс клубнеобразования ре-
гулируется несколькими фитогормонами и контролируется фотопериодом. Корот-
кодневный фотопериод стимулирует этот процесс, в то время как на «длинном дне»
клубнеобразование подавляется. Предпосылкой для формирования клубней явля-
ется падение уровня гиббереллинов. Жасмонаты тормозят удлинение столонов и
индуцируют утолщение их субапикальной области. Цитокинины, накапливающиеся
в утолщенной части, стимулируют этот процесс за счет активации деления клеток.
АБК, уровень которой постепенно возрастает в формирующихся клубнях, контро-
лирует в дальнейшем их покой.
В работе Я. Кода (1997), выполненной на растениях картофеля показано, что
ЖК и ее метиловый эфир стимулируют процесс клубнеобразования за счет ак-
тивации растяжения клеток формирующихся клубней. Такая активация связана с
увеличением осмотического давления в клетках клубней картофеля благодаря на-
коплению сахарозы, а также с увеличением растяжимости клеточных стенок. При
растяжении клеток в процессе клубнеобразования, индуцированного ЖК, проис-
ходит переориентация кортикальных микротрубочек с поперечного на продольное
(рис. 14.7). Такая переориентация приводит к изменению ориентации микрофибрилл
целлюлозы и направления растяжения клеток с продольного на поперечное и, соот-
ветственно, к образованию утолщения в субапикальной части столона и формиро-
ванию клубня. Однако следует также учитывать, что эффекты, которые оказывает
ЖК на процесс клубнеобразования, могут быть опосредованы повышением при этом
уровня цитокининов или снижением содержания гиббереллинов.
Жасмонаты, вероятно, играют важную роль в регуляции симбиотических вза-
имоотношений между растением-хозяином и клубеньковыми бактериями. Установ-
лено, что ЖК подавляет формирование клубеньков на корнях бобовых растений.
Этот угнетающий эффект объясняется в первую очередь способностью ЖК нару-
шать симбиотические взаимоотношения между ризобиями и растением-хозяином.
Известно, что в процессе формирования клубеньков Nod-факторы клубеньковых
бактерий индуцируют специфические осцилляции ионов Са2+ в цитоплазме корне-
226
Стадии
развития
Расположение
кортикальных
микротрубочек
в субапикальной
части
формирующегося
клубня
Направление
растяжения
Рис. Ц-7. Изменение ориентации кортикальных микротрубочек в ходе формирова-
ния клубня и растяжения клеток клубня, индуцируемся? обработкой жас-
моновой кислотой (по: Koda, 1997)
вых волосков бобовых. Д. Эрхард с коллегами (1996) показал, что в клетках корне-
вого волоска люцерны Medicago sativa после инокуляции Rhizobium (или обработки
Nod-фактором) возникали ритмичные колебания ионизированного кальция (с ча-
стотой около 90 с и амплитутой 400-500 нмоль/л). которые продолжались до тех
пор, пока не начиналось формирование клубенька. При этом у мутантов люцерны
dmil и dmi2, характеризующихся пониженной способностью к образованию клу-
беньков, Са2+-осцилляций в ответ на Nod-факторы или не наблюдалось, или они
были очень слабыми. В экспериментах Дж. Сана с соавторами (2006) было показано,
что обработка ЖК растений люцерны Medicago ti'uncatula приводила к уменьшению
частоты и постепенному затуханию осцилляций ионизированного кальция, индуци-
руемых в корневых волосках соответствующими Nod-факторами. Поэтому можно
предположить, что наиболее важную роль в процессе трансдукции жасмонатного
сигнала, ингибирующего формирование клубеньков в корнях бобовых растений, иг-
рает Са2+-сигнальная система.
Глава 15
САЛИЦИЛОВАЯ КИСЛОТА
Салициловая кислота (СК) относится к фитОгормонам, которые обеспечивают
растению устойчивость к повреждению различными патогенами. Синтез СК игра-
ет ключевую роль в реакции сверхчувствительности, а также в пролонгированной
системной устойчивости растений к широкому кругу инфекций. Еще одной очень
специфической особенностью СК является ее способность активировать циан не-
устойчивое дыхание растений, приводящее к выделению тепла.
15.1. Метаболизм салициловой кислоты
Биосинтез. Салициловая кислота в микромолярных концентрациях обнаруже-
на в листьях, корнях, цветках и плодах многих растений. В листьях риса ее содер-
жание особенно высокое и достигает 30 мкг/г сырой массы. При поражении рас-
тений патогенными микроорганизмами возрастает синтез СК, она накапливается в
клетках и посредством индукции синтеза особых белков участвует в обретении рас-
тением местной и системной устойчивости к патогену. Наиболее углубленные иссле-
дования синтеза СК в течение долгих лет проводились с использованием меченых
предшественников на растениях табака, пораженных вирусом табачной мозаики, и
на растениях томата, инфицированных Agrobacterium tumefaciens. В течение послед-
него десятилетия посредством скрининга мутантов арабидопсиса с низкой устойчи-
востью к грибным и бактериальным патогенам был обнаружен ранее неизвестный
путь биосинтеза СК.
В листьях многих растений, инфицированных патогенами, 14С из фенилаланина
и коричной кислоты быстро переходит в СК. При этом у табака и риса интермеди-
атом в этом превращении выступает бензойная кислота, а у томатов и примулы —
орто-кумаровая кислота.
Таким образом, вначале под действием фенилаланин-аммиак-лиазы происходит
превращение фенилаланина в коричную кислоту (рис. 15.1). Затем коричная кислота
декарбоксилируется, превращаясь в бензойную кислоту. Для этого в растительный
экстракт необходимо добавлять АТФ и КоА. Это дает основание предполагать, что
декарбоксилирование коричной кислоты протекает по механизму /3-окисления жир-
ных кислот, хотя до сих пор не выделены участвующие в этой реакции ферменты и
неизвестна их локализация. Превращение бензойной кислоты в СК происходит под
действием 2-гидроксилазы. В листьях табака, пораженных вирусом табачной моза-
ики, активность этого фермента возрастает в 10 раз. У томатов, примулы и ряда
228
других растений коричная кислота сначала гидроксилируется в положении 2, пре-
вращаясь в орто-кумаровую кислоту, и затем декарбоксилируется (рис. 15.1). Ни
один из ферментов, участвующих в этих превращениях, которые можно проследить
с помощью меченых предшественников, пока не выделен.
о-кумаровая кислота
Рис. 15.1. Биосинтез салициловой кислоты (по: Metraux, 2002)
У арабидопсиса получен мутант sid2 (salicylic-acid-induction deficient 2), не спо-
собный при инфицировании патогенами накапливать СК в результате наруше-
ния гена, кодирующего изохоризмат-синтазу. Экспрессия этого гена существен-
но возрастает при инфекции. Таким образом, у арабидопсиса СК синтезируется
из хоризмовой кислоты — предшественника индольных и фенольных соединений
(рис. 15.1).
Конъюгирование. В концентрациях выше 0,1 ммоль/л СК токсична для расте-
ний, поэтому ускорение синтеза и накопление СК при патогенезе должно сопровож-
даться ее детоксикацией. Эффективный способ снижения концентрации СК состоит
в ее метилировании, которое приводит к образованию выделяющегося в атмосфе-
ру летучего эфира (рис. 15.2). Метиловый эфир СК также служит сигналом тревоги
для соседних растений и может при гидролизе освобождать биологически активную
СК. Пораженные вирусом растения табака выделяют в атмосферу значительные ко-
личества метилового эфира СК. Другой способ детоксикации, который наблюдается
у многих растений, в том числе и у табака, состоит в образовании 2-O-/3-глюкозида
СК. Многие растения также содержат глюкозный эфир СК, хотя и в значительно
229
2-О-З-глюкозид
салициловой кислоты
глюкозный эфир
салициловой кислоты
Рис. 15.2. Конъюгаты салициловой кислоты
метиловый эфир
салициловой кислоты
меньших количествах, чем 2-0-0-глюкозид. У некоторых растений, например вино-
града, обнаружен амидный конъюгат СК с аспарагиновой кислотой.
Окислительный катаболизм. Салициловая кислота может гидроксилировать-
ся в положении 3 и 5, превращаясь, соответственно, в 2.3- и 2,5-дигидроксибен-
зойную кислоту. Она также может декарбоксилироваться. причем у табака 2-0-0-
глкжозид СК декарбоксилируется быстрее, чем свободная СК.
15.2. Механизм действия салициловой кислоты при патогенезе
Основным белком, с помощью которого осуществляется передача сигнала от
салициловой кислоты, является NPR1 (non-expressor of PR1). Сверхэкспрессия ге-
на NPR1 (его также называют NIM1 - - non-inducible immunity 1) резко повышает
устойчивость растений арабидопсиса и риса к патогенам. Белок NPR1 содержит
домен, который обеспечивает белок-белковые взаимодействия и дальнейшую транс-
дукцию салицилатного сигнала в геном. Обработка растительных клеток СК инду-
цирует перемещение NPR1 в ядро и активацию последующих событий, контролиру-
емых салициловой кислотой.
Помимо NPR1 в салицилатнОхМ сигнальном пути также участвуют ДНК-
связывающие белки bZIP-типа — TGA. Эти белки связываются со специфической
нуклеотидной последовательностью — TGACG, которая имеется в промоторе сали-
цилат-зависимых генов (в частности, у SAR-генов). Однако для активации экспрес-
сии PR /-генов недостаточно связывания только TGA-белков с этими салицилат-
отвечающими промоторными элементами. Для инициации работы салицилат-зави-
симых генов необходимо, чтобы сформировался белок-белковый комплекс NPR1-
TGA, который осуществляет уже непосредственную регуляцию функционирования
PR-генов (рис. 15.3).
Белки NPR.1 в цитоплазме неинфицированных клеток находятся в окисленном
и неактивном состоянии. При воздействии патогена активируется синтез СК, что
приводит к изменению редокс-статуса клетки и переходу белков NPR1 в восстанов-
ленное состояние (рис. 15.3). Будучи восстановленными, NPR1 приобретают способ-
ность передвигаться в ядро, взаимодействовать с факторами транскрипции TGA и,
таким образом, запускать экспрессию PR-генов.
Следует отметить, что при повышении уровня салициловой кислоты в расти-
тельных тканях активная, то есть восстановленная, форма белка NPR1 ингибиру-
ет передачу жасмонатного сигнала. Механизм действия жасмоновой кислоты за-
ключается в том, что в отсутствие салицилата индуцируется протеолиз ингибито-
ра жасмонатного сигнала. Салицилат-зависимый белок NPR1 подавляет этот про-
теолиз (рис. 15.4). В результате происходит накопление ингибитора жасмонатного
сигнала и подавление экспрессии генов, которые регулируются жасмоновой кис-
230
Патоген
Рис. 15.3. Салицилатный сигнальный путь (по: Pieterse, Van Loon, 2004):
NPR1 — белок, участвующий в передаче сигнала от СК; TGA — ДНК-связывающий белок bZIP-типа;
TGACG — специфическая нуклеотидная последовательность (бокс) для салицилат-зависимых генов;
PR 1 — гены, которые кодируют PR-белки, принимающие участие в формировании устойчивости к па-
тогенам
Патоген
I
Накопление СК
Механическое повреждение
I
Накопление ЖК
( J
1 1
Протеолиз репрессора
ЖК-сигнала
Цитоплазма
Рис. 15.4- Влияние салициловой кислоты (СК) на передачу жасмонатного сигнала (по: Pieterse,
Van Loon, 2004):
NPR1-белок. участвующий в передаче сигнала от СК; TGA — ДНК-связывающпй белок bZIP-
типа; TGACG — специфическая нуклеотидная последовательность (бокс) для салицилат-зависимых ге-
нов; SCFr 0/1 -убиквитин-лигазный комплекс протеасомы. Стрелками показана активация процесса,
барами — подавление
Ядро
231
лотой. Таким образом, повышение уровня СК в растительных тканях приводит
к накоплению белка NPR1 и блокированию процессов, индуцируемых жасмоновой
кислотой.
15.3. Физиологическая активность салициловой кислоты в растениях
Наиболее важную роль салициловая кислота играет в системе защитных реакций
при повреждении растений фитопатогенами. И салициловая, и жасмоновая кисло-
ты (см. главу 14) принимают участие в реализации и регуляции одного из главных
механизмов устойчивости растений к патогенам -- реакции сверхчувствительности
(СВЧ), то есть быстрой локальной гибели инфицированных растительных клеток
вместе с патогеном, что обеспечивает устойчивость всего растительного организ-
ма. Это происходит за счет того, что на самых начальных этапах реакции СВЧ
происходит окислительный взрыв - образуется большое количество активных форм
кислорода (Н2О2, *ОН2 и ОН*). Они способны индуцировать цепные реакции, при-
водящие к образованию свободных радикалов, вызывающих перекисное окисление
липидов, нарушение целостности мембран, инактивацию ферментов и разрушение
нуклеиновых кислот. Реакция СВЧ завершается появлением некротических пятен,
гибелью патогена и части клеток растения-хозяина.
Именно образование больших количеств пероксида водорода в СВЧ-реакции яв-
ляется причиной активации синтеза фитогормонов — салициловой и жасмоновой
Рис. 15.5. Изменение содержания салициловой
кислоты (СК) при инфицировании вирусом табач-
ной мозаики:
1 — свободная форма СК; 2 — связанная фор-
ма СК
кислот. Повышение содержания сали-
циловой кислоты усиливает реакцию
СВЧ, поскольку салицилат являет-
ся ингибитором каталазы — фермента,
расщепляющего пероксид водорода. В
итоге пероксид водорода, активируя
синтез салициловой кислоты, способ-
ствует еще большему накоплению ак-
тивных форм кислорода и таким обра-
зом вызывает усиление СВЧ-реакции.
Наиболее высокий уровень СК об-
наруживается внутри и вокруг некро-
тических пятен, которые формируют-
ся, например, на листьях табака при
повреждении вирусом табачной мозаи-
ки (ВТМ). На рис. 15.5 можно видеть,
что после инфицирования растений та-
бака ВТМ вначале происходит резкое
повышение содержания свободной СК,
а через 10-15 ч от начала инфициро-
вания свободная СК переходит в свя-
занное состояние. То есть по мере затухания реакции СВЧ салициловая кислота
переводится в связанную форму, взаимодействуя с глюкозой и образуя гликозиды.
Параллельно с увеличением уровня СК происходит возрастание содержания мети-
лового эфира СК как в инокулированных, так и в неинокулированных ВТМ листьях
табака.
Участие СК в СВЧ-реакции также подтверждают эксперименты, показываю-
232
щие, что при экзогенной обработке СК и ее аналогами — 2,6-дихлоризоникотиновой
кислотой или бензотиадиазолом (рис. 15.6) ~ повышается устойчивость растений к
патогенам и активируется синтез специфичных для СВЧ-реакции PR-белков, к ко-
торым относятся хитиназы, /3-1,3-гл юканазы, цистеин-богатые белки и ряд других.
Однако растения риса не отзываются на экзогенную обработку СК, поскольку в
них ее эндогенный уровень на два порядка выше, чем в растениях табака и араби-
допсиса.
Салициловая
кислота
Дихлоризоникотиновая
ксилота
О
Метиловый эфир
бензо-(1,2, 3)-тиодиазол-
7-карботиокислоты
Рис. 15.6. Вещества, индуцирующие системный иммунитет растений
Следует отметить, что синтез салициловой кислоты и образование ее конъюгатов
являются ключевыми элементами не только в СВЧ-реакции, но и в формировании
системного приобретенного иммунитета растения. Таким образом, у растений в ходе
СВЧ-реакции происходит также формирование иммунитета к повторным зараже-
ниям.
Роль салициловой кислоты в приобретенном иммунитете растений.
При инфицировании растения в каком-либо одном месте очень часто происходит
формирование устойчивости к последующему нападению во всех тканях и органах.
Это явление было названо системной приобретенной устойчивостью (СПУ, или
SAR —systemic acquiered resistance), или системным приобретенным иммуните-
том. Важным свойством системного иммунитета является быстрота его появления.
При повторном заражении некротические пятна появляются гораздо быстрее, чем
при первичном.
Иммунитет развивается в течение нескольких дней и проявляется в повышен-
ной устойчивости всего растения к повторному заражению широким набором ви-
дов патогенов (грибы, бактерии, вирусы) и насекомых-фитофагов. Таким образом,
особенностью приобретенного иммунитета (в отличие от реакции СВЧ) является
его неспецифичность в отношении патогена. Длительность такого иммунитета — от
нескольких недель после первичного заражения до нескольких месяцев.
Системная приобретенная устойчивость является результатом повышения содер-
жания определенных защитных соединений, таких как фитоалексины, лигнин, хи-
тиназа и ряд других гидролитических ферментов. Внешне процесс формирования
приобретенного иммунитета проявляется в возникновении некрозов (рис. 15.7).
В регуляции процессов системной устойчивости среди фитогормонов наиболее
важное значение имеют салициловая и жасмоновая кислоты, а также их метиловые
233
Рис. 15.7. Некротические пятна на листьях таба-
ка, инокулированных вирусом табачной мозаики,
свидетельствующие о развитии системного имму-
нитета растения
эфиры, которые, являясь летучими со-
единениями, способны передавать ин-
формацию о заражении по воздуху не
только к другим органам, но и к сосед-
ним неповрежденным растениям.
Ключевая роль в формировании
СПУ растений принадлежит именно
салициловой кислоте. Образование са-
лицилата предшествует системной им-
мунизации растения. Экзогенная об-
работка салициловой кислотой и ее
аналогами вызывает формирование си-
стемной устойчивости растения, а му-
тантные растения, не накапливающие
салицилат, не способны к иммуниза-
ции. Заражение растений несовмести-
мыми патогенами индуцирует накопле-
ние салициловой кислоты как в инфицированных, так и в неинфицированных тка-
нях. Избыток салицилата, образовавшийся при заражении, переводится в форму
конъюгатов с глюкозой, которые при вторичном поражении гидролизуются до сво-
бодной салициловой кислоты.
Впервые на возможность взаимосвязи меж/iy салициловой кислотой и СПУ ука-
зал в 1983 г. Л. Ван Лун. Он предположил, что этилен-индуцируемое накопление
PR-белков в растениях опосредовано синтезом «некоего ароматического соедине-
ния, имитирующего эффект салициловой кислоты». Но только в 1990 г. в работах
двух лабораторий независимо друг от друга было постулировано, что СК может
служить эндогенным сигналом для СПУ. Основанием для такого предположения
послужили эксперименты, в которых было показано, что уровень СК локально и
системно возрастает в инфицированных растениях табака и огурца.
Способность экзогенной СК снижать симптомы заболевания, вызываемого ВТМ
в растениях табака, и индуцировать накопление в них PR-белков впервые обна-
ружил в 1979 г. Р. Уайт. Вскоре защитный эффект СК был выявлен у растений,
поврежденными грибными и бактериальными патогенами.
Очень убедительные доказательства участия СК в СПУ были получены с исполь-
зованием растений табака и арабидопсиса, трансформированных геном NahG, ко-
торый кодирует гидроксилазу бактерий, катализирующую превращение СК в неак-
тивный (для СПУ) катехол. Как и ожидалось, сверхэкспрессия гидроксилазы сали-
цилата привела к резкому снижению уровня салициловой кислоты; при этом после
инфицирования не происходило формирование СПУ.
Еще одним веским доказательством не только локального, но и системного уча-
стия СК в СПУ являются эксперименты У. Молдерса с соавторами (1996) с исполь-
зованием меченой 14С-СК. Было выявлено, что меченый гормон быстро распростра-
няется от места нанесения вирусной инфекции к другим тканям растений огурца.
При повышении концентрации салициловой кислоты в растительной ткани ин-
дуцируется локальный синтез фитоалексинов, подавляющих развитие патогена, и
стимулируются процессы, способствующие укреплению клеточных стенок. Сали-
циловая кислота активирует экспрессию специфичных для системной приобретен-
ной устойчивости SAR-генов. Продуктами многих SAR-генов являются вышеупомя-
234
нутые PR-белки, образующиеся в реакции сверхчувствительности (СВЧ). Помимо
PR-белков при системной иммунизации растения также синтезируются белки, не
связанные с СВЧ-реакцией, например сериновые протеазы, которые являются ин-
гибиторами протеаз насекомых-фитофагов. Таким образом, происходит формиро-
вание устойчивости не только к повторному заражению патогенами, но также и к
фитофагам.
Роль фитогормонов в системной приобретенной устойчивости и инду-
цируемой системной устойчивости растений. Выше было сказано, что в ответ
на инфицирование патогенами (как авирулентными, так и ограниченным кругом
вирулентных) в растениях может развиваться иммунная реакция, называемая си-
стемной приобретенной устойчивостью. Именно синтез салициловой кислоты, ин-
дуцированный патогенами, является специфической характеристикой этого типа
устойчивости, поэтому СПУ развивается при инфицировании только теми пато-
генами, которые индуцируют основные салицилат-зависимые защитные реакции.
К таким патогенам относится, например, ВТМ. Этот тип индуцируемой устойчиво-
сти сопровождается локальным и системным накоплением PR-белков. Однако вновь
синтезируемые PR-белки могут быть как эффективны, так и неэффективны против
индуцирующих их патогенов.
У растений встречается еще один тип защитных реакций, индуцируемых пато-
генами, который называют индуцируемой системной устойчивостью (ИСУ, или
ISR — induced systemic resistance). Этот тип защиты растительных организмов на-
блюдается при инокуляции отдельными штаммами ризобактерий. ИСУ не требует
для своей реализации салициловой кислоты, а регулируется такими фитогормонами
как жасмоновая кислота и этилен. ИСУ эффективна против тех патогенов, которые
индуцируют жасмонат- и этилен-зависимыс защитные механизмы. К таким патоге-
нам относится, например, гриб Alternaria brassicicola, растением-хозяином которого
является арабидопсис. Этот тип индуцированной устойчивости не связан с индукци-
ей PR-белков. Интересно отметить, что для реализации ИСУ, как и СПУ, необходим
белок NPR1 (рис. 15.8).
Ряд патогенов, например Pseudomonas syringае pv tomato, способны индуциро-
вать в растениях арабидопсиса комбинацию защитных реакций, в которых участву-
ют и салицилат-, и жасмонат-, и этилен-зависимыс защитные механизмы. Против
таких патогенов одновременно включаются механизмы и СПУ, и ИСУ. В резуль-
тате индукции обоих типов защитных реакций в одном и том же растении резко
повышается его способность противостоять патогенезу.
Роль салициловой кислоты в цианид-устойчивом дыхании растений.
Одним из специфических свойств СК является ее способность активировать альтер-
нативное цианид-устойчивое дыхание растений, в результате которого происходит
выделение энергии в виде тепла. Впервые способность СК повышать температуру
растительных тканей была выявлена И. Раскиным с коллегами (1987) у Arum lilies.
Известно, что завершающий этап почти всех окислительных процессов заклю-
чается в переносе электронов от окисляемого субстрата на кислород. Этот процесс
катализируется дыхательнььми ферментами, которые называют терминальными ок-
сидазами. У растительных клеток к таким ферментам относятся не только цитохро-
моксидаза, но и альтернативная оксидаза, локализованная на внутренней мембране
митохондрий. Терминальные оксидазы являются главными компонентами акцептор-
ного участка дыхательной электрон-транспортной цепи, от которых зависит общая
эффективность дыхания.
235
Ризобактерии
Патогены
ИСУ
Экспрессия генов первич-
ного ответа на патогены
Рис. 15.8. Роль фитогормонов в формировании системной при-
обретенной устойчивости (СПУ) и индуцируемой
системной устойчивости (ИСУ) (по: Van Loon et al.,
2006):
PR —белки, участвующие в защите от патогенов; NPR1 — бе-
лок, участвующий в передаче сигнала от СК
Если к животным тканям добавить 1 ммоль/л раствор цианида, дыхание практи-
чески полностью остановится, поскольку будет подавлена работа цитохромоксида-
зы — терминальной оксидазы, передающей электроны на кислород. Однако у боль-
шинства растительных клеток при этом поглощение кислорода не прекратится, а
только замедлится (в среднем от 10 до 25%). У некоторых растительных тканей
уровень цианид-устойчивого дыхания может достигать даже 100%.
Такая особенность дыхания растений объясняется тем, что на внутренней мем-
бране растительных митохондрий функционирует альтернативная цианид-устойчи-
вая оксидаза, которая обеспечивает передачу электронов от убихинона на кислород
с образованием ЩО. Этот процесс специфически угнетается рядом соединений, к
которым относится, например, салицил гидроксамовая кислота.
Альтернативная оксидаза представляет собой интегральный мембранный белок,
состоящий из двух идентичных субъединиц, молекулярная масса каждой из которых
колеблется от 35,5 до 37 кД. Регулирование активности этого фермента осуществля-
ется путем образования (димерная форма) или расщепления (мономерная форма)
дисульфидного мостика между мономерами.
Когда в электрон-транспортной цепи митохондрий электроны от убихинона с
помощью альтернативной оксидазы сразу переносятся на кислород, пропускается
два участка (комплексы III и IV), на которых была бы возможна генерация энер-
гии (вначале в виде протонного градиента, а затем и АТФ). Поэтому происходит
рассеивание энергии в виде тепла.
У многих цветков перед образованием пыльцы наблюдается быстрое повы-
шение активности этого фермента. Это приводит к резкому возрастанию тем-
пературы тканей цветка, которая, например у Sauromatum guttatum, достигает
25°С. Одновременно активируется синтез салициловой кислоты, а также определен-
236
Рис. 15.9. Влияние салициловой кислоты (СК) на температуру
тканей цветка Arum lilies'.
1 — контроль; 2 — СК в концентрации 1,5 мкмоль/л; 3 — СК в
концентрации 15 мкмоль/л; 4 — СК в концентрации 150 мкмоль/л
ных аминов и индольных соединений, служащих аттрактантами для насекомых-
опылителей. Такие условия могут поддерживаться до 7 ч. Повышение температуры
характерно для соцветий и цветков других видов ароидных (Агасеае) - Arum таси-
latum, Sympocarpus foetidus и Victoria regia. На рис. 15.9 можно видеть, как через 4 ч
после экзогенной обработки СК в концентрации 1,5, 15 и 150 мкмоль/л температу-
ра тканей цветка у Arum lilies повышается, соответственно, на 3, 8 и 9°С. Однако у
большинства растительных организмов уровень цианид-устойчивого дыхания неве-
лик, поэтому его роль для растений пока еще не ясна.
Глава 16
ПЕПТИДНЫЕ ФИТОГОРМОНЫ
До обнаружения Г. Пирсом с коллегами в 1991 г. пептидного фигогорхмона си-
стемина считалось, что межклеточные взаимодействия у растений осуществляют-
ся только с помощью мелких органических молекул. Сейчас уже известны десятки
различных сигнальных молекул пептидной природы, по, возможно, их значитель-
но больше. В геноме арабидопсиса найдено 174 гена, которые предположительно
кодируют мембранные рецепторы-киназы с лейцинбогатыми повторами. Белки, со-
держащие домены с лейциновыми повторами, как правило, вовлечены в белок-бел-
ковые взаимодействия, поэтому лигандами для подобных рецепторов-киназ долж-
ны служить белки или пептиды. Так как лиганды для большинства содержащих
лейцинбогатые повторы рецепторов-киназ пока не найдены, эти рецепторы иногда
называют рецепторами-сиротами (orphan receptors).
При изучении пептидных фитогормонов исследователи часто обращают взгляд
на хорошо изученные и многочисленные пептидные гормоны животных в попыт-
ках найти параллелизм. Пептидные гормоны животных делят на две большие кате-
гории: 1) эндокринные гормоны и 2) прикрепленные к мембранам факторы роста.
И те, и другие синтезируются в секреторном пути в виде высокомолекулярных пред-
шественников. Процессинг эндокринных гормонов происходит при участии конвер-
таз семейства субтилизина, локализованных в дистальных отделах аппарата Гольд-
жи и в секреторных везикулах. Эти эндопептидазы обычно гидролизуют пептидную
связь, следующую за двумя расположенными рядом остатками аргинина.
Большинство известных пептидных фитогормонов также синтезируются в сек-
реторном пути в виде высокомолекулярных предшественников. Как и у животных,
хмолекула предшественника может содержать одну или несколько молекул сигналь-
ного пептида либо молекулы разных сигнальных пептидов. У предшественников
некоторых растительных сигнальных пептидов в точке процессингового гидролиза
цепи имеются сдвоенные остатки аргинина.
16.1. Системин
В листьях томата при их поедании гусеницами формируется раневой сигнал,
который вызывает синтез и накопление ингибиторов трипсина не только в повре-
жденных листьях, но и в листьях, удаленных от места атаки растения насекомыми.
Ингибиторы трипсина ухудшают пищеварение у гусениц и таким образом позволяют
238
растению противостоять нападению. Двадцати летние поиски сигнала, приводяще-
го к выработке системной устойчивости растений к растительноядным насекомым,
завершились открытием в 1991 г. пептидного гормона системина. Из 30 кг поеден-
ных гусеницами листьев томата выделили 200 -300 пг системина. В одном растении
содержится 10“ 1о-10”14 моля этого пептида.
Системин состоит из 18 аминокислотных остатков, расположенных в следую-
щей последовательности: Ala-Val-Gln-Ser-Lys-Pro-Pro-Ser-Lys-Arg-Asp-Pro-Pro-Lys-
Met-Gln-Thr-Asp. Эта пептидная цепь может быть представлена в виде палиндрома:
xxQxBPPxB|BxPPBxQxx, где Q -Gin, Р —Pro, В щелочная аминокислота (Lys
или Arg), х —любая другая аминокислота. Методом ядерпого магнитного резонанса
было установлено, что в центральной части этот пептид имеет конфорхмацию поли-
пролиновой спирали II типа.
Системин томата образуется из просистеминау состоящего из 196 аминокислот-
ных остатков. Соответствующий системину фрагмент расположен на С-конце мо-
лекулы просистемина (от 179 до 196-го аминокислотного остатка). Просистемип не
имеет секреторного N-пептида, поэтому непонятно, как системин попадает в ано-
пласт. Экспрессия гена, кодирующего просистемин, в ответ на погрыз происходит
преимущественно в паренхимных клетках сосудистых пучков листьев. Системин
быстро выходит в апопласт, откуда загружается во флоэму. По флоэме системин
транспортируется на большие расстояния со скоростью 3 см/ч.
Ингибиторы трипсина накапливаются в ответ на погрыз в клетках мезофил-
ла. Их накопление можно также вызвать погружением черенков томата в раствор,
содержащий системин. Трансгенные растения томата, содержащие системиновый
ген в антисмысловой ориентации, не накапливают ингибиторов трипсина и под-
вержены поеданию гусеницами, а растения, конститутивно экспрессирующие си-
стеминовый ген, накапливают много ингибиторов трипсина и не поедаются гусе-
ницами.
Рецепция системина происходит с помощью расположенного в плазматической
мембране белка-рецептора массой 160 кД, содержащего богатые лейцином повто-
ры. В результате рецепции включается MAP-киназный каскад, который приводит к
освобождению из мембран линоленовой кислоты и ее превращению в жасмоновую
кислоту. Именно жасмоновая кислота вызывает экспрессию генов, кодирующих ин-
гибиторы трипсина.
Накопление ингибиторов трипсина в ответ на погрыз происходит не только у
томата, но и у многих других растений. Системины, выделенные из листьев кар-
тофеля, паслена черного и перца овощного, гомологичны системину томата и от-
личаются от него только по 2- 3 аминокислотным остаткам, а соответствующие им
просистемины на 73-88% идентичны по первичной структуре. Системин томата вы-
зывает у этих растений синтез ингибиторов трипсина. В свою очередь системины
картофеля, паслена черного и перца овощного активны по отношению к растениям
томата. Однако системин томата не действует на растения табака, для которых, тем
не менее, очень характерен системный защитный ответ на погрыз.
Для облегчения поиска табачных системинов была использована тест-система,
основанная на способности системина томата вызывать быстрое? подщелачивание
среды в суспензионной культуре клеток томата. Хотя системин томата не подщела-
чивает среду в суспензионной культуре клеток табака, из табака удалось выделить
два пептида, активные не только в отношении клеток табака, но и клеток тома-
та. Табачные системины, как и томатный, состоят из 18 аминокислотных остатков,
239
но они не гомологичны системину томата. Системины табака в отличие от томат-
ного системина гликозилированы и содержат 3-4 остатка оксинролина. Деглико-
зилирование приводит к утрате биологической активности. Оба системина табака
образуются в результате процессинга одной молекулы просистемина, состоящей из
165 аминокислотных остатков. Табачный просистемин в отличие от томатного имеет
секреторный N-пептид, направляющий белки в клеточную стенку. Табачные систе-
мины вызывают у растений томата системную защитную реакцию, что позволило
предположить присутствие у томатов системинов, гомологичных табачным. Такие
системины действительно были недавно обнаружены.
16.2. Фитосульфокины
Давно известно, что скорость деления клеток в суспензионных культурах зависит
от плотности культуры и резко снижается при сильном разбавлении, например при
плотности 300 клеток/мл. Скорость деления клеток в культуре низкой плотности,
приготовленной на свежей среде, можно увеличить добавлением «кондиционирован-
ной среды», отобранной из быстро растущей суспензионной культуры высокой плот-
ности. Многолетний поиск содержащихся в кондиционированной среде митогенов
увенчался в 1992 г. открытием пептидных гормонов фитосульфокинов. Вначале они
были выделены из суспензионной культуры клеток аспарагуса, затем из культуры
клеток риса, моркови, циннии и ряда других растений. а-Фитосульфокин представ-
ляет собой пентапептид Туг(30зН)-Пе-Туг(80зН)-ТЬг-С1п, а Дфитосульфокин —
тетрапептид, который образуется из а-фитосульфокина в результате катализиру-
емого карбоксипептидазой удаления С-концевого остатка глутамина: Туг(БОзН)-
Пе-Туг(30зН)-ТЬг. Оба остатка тирозина сульфатированы по гидроксильной
группе.
Фитосульфокины образуются из белковых предшественников. У риса он состоит
из 89 аминокислотных остатков и имеет N-пептид, направляющий этот белок в сек-
реторный путь. У С-конца (от 80 до 84-го аминокислотного остатка) расположена
последовательность, соответствующая а-фитосульфокину. Сульфатирование тиро-
зина происходит в аппарате Гольджи при участии тирозилпротеинсульфотрансфе-
раз. Фитосульфокины в концентрации 10“9-10“8 моль/л значительно увеличивают
скорость деления клеток в разбавленных суспензионных культурах. Из интактных
растений фитосульфокины до сих пор не выделены, однако высокий уровень экс-
прессии кодирующего фитосульфокин гена в апикальных меристемах побегов и кор-
ней риса позволяет предполагать, что эти сигнальные пептиды регулируют деление
клеток и в природных условиях.
Рецепция фитосульфокинов происходит с помощью комплекса из двух гликози-
лированных белков массой 120 и 160 кД, расположенных в плазматической мем-
бране. Механизм действия этих сигнальных пептидов на деление клеток не из-
вестен. Фитосульфокины также стимулируют дифференцировку суспензии клеток
мезофилла циннии в трахейные элементы и соматический эмбриогенез в культуре
клеток моркови, поэтому можно предполагать, что функции фитосульфокинов в
растениях не ограничены их митогенной активностью.
240
16.3. Цистеин-богатые пептиды S-локуса крестоцветных
У перекрестноопыляемых растений рода Brassica гены, препятствующие само-
опылению, находятся в S-локусе. Это многоаллельные доминантные гены, которые
кодируют цистеин-богатые рецепторы-киназы и связанные с ними гликопротеины и
Сосочек рыльца
пестика
1 Фосфори-
* пирование
белков
• - SCR (пистеип-богатый
пептид S-локуса)
- 1ликопрогеин
S-локуса
экспрессируются в сосочках рыльца пестика.
Мужской детерминант пыльцевой самонесовместимости представлен цисте-
ин-богатыми пептидами (SCR —S-locus cystein-rich), состоящими из 47-60 амино-
кислотных остатков и содержащими 8 консервативных остатков цистеина. Цистеин-
богатые пептиды синтезируются в пыльниках клетками тапетума из предшествен-
ников, содержащих секреторный N-пептид. Из клеток тапетума SCR транспорти-
руются в экзину пыльцевого зерна. При попадании пыльцевого зерна на рыльце
пестика эти пептиды диффундируют к рецепторным белкам, находящимся в плаз-
матической мембране клеток сосочков.
Рецепторы-киназы S-локуса име-
ют находящийся в апопласте
N-концевой цистеин-богатый домен,
посредством которого они взаимо-
действуют с SCR. С помощью транс-
мембранного домена они пересека-
ют мембрану, на цитоплазматиче-
ской стороне которой у этих рецепто-
ров расположен С-концевой Ser/Thr-
киназный домен. В рецепторный
комплекс также входят гликопро-
теины S-локуса, не имеющие про-
теинкиназного домена. В результа-
те взаимодействия SCR с рецепто-
ром включается каскад фосфорили-
рования белков, что в итоге при-
- рецептор-кипаза
S-локуса
А к напор ин
водит к активации аквапоринов и
обезвоживанию поверхности сосоч-
ков (рис. 16.1). Таким образом, пыль-
ца отторгается, так как не может на-
бухнуть.
Рис. 16.1. Взаимодействие компонентов S-локуса в
процессе реакции пыльцевой самонесовместимости у
Brassica (по: Ryan et al., 2002)
16.4. Сигнальный пептид CLV3
В апикальных меристемах побегов обнаружены мигрирующие сигнальные пеп-
тиды, участвующие в поддержании баланса между делением и дифференцировкой
клеток и таким образом контролирующие размер апикальных меристем. Мутации в
генах, которые кодируют эти пептиды или белки, участвующие в их рецепции, при-
водят к булавовидному разрастанию апикальных меристем. Поэтому компоненты
данной сигнальной системы обозначаются как CLAVATA, или CLV (от лат. clava-
tum — булава).
Крупный (105 кД) белок CLV1 пересекает плазматическую мембрану. Его экс-
траклеточный домен гликозилирован и содержит 21 повтор, богатый остатками лей-
цина, а внутриклеточный С-домен обладает Ser-киназной активностью. С белком
241
CLV1 посредством дисульфидных мостиков связан белок CLV2 (80 кД), имеющий
экстраклеточный домен с повторами, богатыми остатками лейцина, но у него отсут-
ствует внутриклеточный протеинкиназный домен. Гены CLV1 и CLV2 экспресси-
руются во внутренних слоях центральной зоны апикальной меристемы побега.
Рис. 16.2. Рецепция сигнального пептида CLV3 (по: Ryan et al.. 2002)
Ген CLV3 кодирует полипептиды, состоящие из 78 аминокислотных остатков,
которые являются лигандами для рецептора CLV1. Сигнальные пептиды CLV3 син-
тезируются в клетках верхних (наружных) слоев центральной зоны в виде содер-
жащих секреторный N-пептид предшественников, а затем транспортируются в ни-
жележащие слои центральной зоны, где взаимодействуют со своими рецепторами
(рис. 16.2). В результате этого взаимодействия включаются каскады фосфорилиро-
вания белков, приводящие к изменению экспрессии генов.
16.5. Факторы быстрого подщелачивания
Пептиды, которые подобно системину вызывают быстрое и сильное подщелачи-
вание среды в суспензионных культурах клеток, но при этом не индуцируют синтез
ингибиторов трипсина, были впервые выделены из листьев табака и обозначены
как RALF (rapid alkalinization factor). Позднее из листьев томата, люцерны и ара-
бидопсиса были изолированы пептиды, высокогомологичные RALF табака. У ара-
бидопсиса обнаружено девять генов, кодирующих RALF. Эти сигнальные пептиды
синтезируются в виде предшественников, имеющих секреторный N-пептид и пару
расположенных рядом остатков аргинина, за которыми происходит процессинговый
протеолиз. У табака препептид состоит из 115 аминокислотных остатков. Последова-
тельность RALF из 49 аминокислотных остатков находится на С-конце препептида.
Функции RALF точно не установлены. Так как выделенный из листьев томата
RALF в микромолярной концентрации подавляет деление клеток корней томата и
арабидопсиса, предполагают, что эти мигрирующие по апопласту сигнальные пеп-
тиды нужны для регуляции деления клеток.
16.6. Сигнальный пептид ENOD40
Экспрессия гена ENOD40 связана с образованием клубеньков у бобовых. У иеин-
фицированных корней ENOD40 экспрессируется в клетках перицикла, соседствую-
щих с лучами протоксилемы (рис. 16.3). Проникновение Rhizobium приводит к экс-
242
прессии ENOD40 в области коры, включающей место проникновения бактероида.
Экспрессия ENOD40 активирует деление клеток коры.
Рис. 16.3. Активация экспрессии ENOD40 при инфицировании корней бобовых
клубеньковыми бактериями (по: Lindsey et al., 2002). Области экспрессии
ENOD^O заштрихованы
Особенность транскрипта ENOD40 состоит в наличии у него двух сайтов ини-
циации трансляции ORF (open reading frame), что позволяет транслировать какой-
либо из двух или оба участка мРНК, кодирующих сигнальные пептиды. Один из
кодируемых ENOD40 пептидов имеет в своем составе 12-13 аминокислотных остат-
ков, другой 24 -27. У синтезированных пептидов нет секреторного сигнала, и они
не подвергаются процессингу. Известно, что они взаимодействуют с субъединицей
сахарозосинтазы - фермента, расщепляющего сахарозу с использованием УДФ на
УДФ-глюкозу и фруктозу. Поэтому предполагается, что эти пептидные сигналы,
действуя внутри клеток, способствуют поступлению в клетки корней сахарозы, ко-
торая, как известно, стимулирует деление клеток корней.
ЗАКЛЮЧЕНИЕ
Сверхзадачей существования любого живого организма является прохождение
пути от яйца до яйца, от семени до семени, от споры до споры. Именно продол-
жение себя в последующих поколениях составляет главную стратегию существова-
ния и отличает живое от неживого. Информация о том, как пройти этот путь (то
есть о процессе индивидуального развития), закодирована в геноме и реализуется
с помощью сотен белков — транскрипционных факторов. В основе и структурных,
и функциональных различий между клетками одного и того же организма лежит
дифференциальная активность отдельных генов. В морфогенезе участвует большое
количество регуляторных генов, дифференциальная экспрессия которых в опреде-
ленных клетках и на определенных этапах развития обеспечивает этапность онтоге-
неза, дифференцировку клеток, последовательное формирование тканей и органов
растения. Дифференциальная активность генома и дифференцировка клеток и тка-
ней растения базируются на процессах поляризации и возникающих при этом гра-
диентах морфогенетических факторов — гормонов, микроРНК, Са2+-связывающих
белков-сенсоров.
Реализация генетической программы развития организма осуществляется при
постоянно изменяющихся условиях внешней среды, поэтому она находится не только
под контролем генома, но также регулируется рядом внутренних и внешних факто-
ров. К внутренним факторам, влияющим на процессы роста и развития, относятся
прежде всего фитогормоны, а к внешним — температура, свет, вода, минеральные
элементы и др. Именно факторы внешней среды играют определяющую роль в фе-
нотипическом проявлении конкретного генотипа растения.
В последние годы получение новых знаний в биологических исследованиях идет
главным образом за счет использования методов молекулярной биологии и генетики.
Мы стали свидетелями стремительного роста знаний о биологических процессах и
возникновения новых направлений на стыках наук. Одними из таких интенсивно
развивающихся направлений являются клеточная и генная инженерия растений,
биология клетки, биоинформатика, системная биология.
В 2000 году произошло ключевое событие в биологии растений: был полностью
расшифрован геном резуховидки (резушки) Таля (Arabidopsis thaliana L.). За про-
шедшие 6 лет секвенированы геномы риса, люцерны и тополя. Завершается рас-
шифровка геномов кукурузы, пшеницы, ячменя, винограда, лотоса, томатов. По-
явилась возможность одновременно анализировать совокупность всех мРНК (тран-
скриптом) и белков (протеом), которые определяют функциональную специфику
клетки, свойственны ткани или органу на определенном этапе онтогенеза и зави-
сят от условий среды. Стремительно совершенствуются методы анализа метаболо-
ма — совокупности всех метаболитов клетки, ткани или органа. В настоящее время
244
появляются сотни статей в области протеомики и метаболомики растений. После
получения информации об отдельных молекулах, составляющих протеом и метабо-
лом клетки, следующим шагом будет составление целостной структурной и функ-
циональной картины клеточных процессов. В этом случае обязательно возникнет
проблема понимания принципов управления физиологией клетки и механизмов ее
ответных реакций на внешние и внутренние раздражители.
После появления информации о полных сиквенсах геномов возникла новая на-
ука — геномика, которая изучает нуклеотидный состав генома, принципы функци-
онирования отдельных генов и их комплексов, а также эволюцию генома. Задачи
геномики заключаются в выявлении того, как клетки в многоклеточном организ-
ме, имея идентичный набор генов, образуют такое разнообразие тканей и органов
с узкой функциональной и структурной специализацией. Биология переходит в так
называемый пост-геномный период развития (post-genomics world of science).
В пост-геномный период доминируют исследования, которые начинаются с секве-
нирования генома и белков, а завершаются выявлением функций отдельных генов,
белков и метаболитов, а также их эволюционного происхождения. Центром всех
этих исследований служит информация о сиквенсе генома. Именно эта информа-
ция дает основу для анализа происходящих в организме процессов на самых разных
уровнях: биохимическом, генетическом, регуляторном, клеточном, организменном и
эволюционном.
Первый том учебника «Биология развития растений» посвящен анализу общих
принципов и механизмов, лежащих в основе процессов роста и развития раститель-
ных организмов. В нем проанализированы генетический и эпигенетический уров-
ни регуляции развития, биоритмы, донорно-акцепторные взаимосвязи, полярность,
роль фитогормонов и внешних факторов среды в регуляции морфогенеза растений.
Во втором томе даны современные представления о ростовых процессах — де-
лении и растяжении клеток, тропизмах и настиях; подробно рассмотрены эмбрио-
нальное развитие и состояние покоя, старение и фотоморфогенез, детально описаны
процессы формирования вегетативных и генеративных органов растения, а также
программируемая гибель клеток растений.
РЕКОМЕНДУЕМАЯ ЛИТЕРАТУРА
Алехина Н.Д., Балнокин Ю. В., Гавриленко В. Ф., Жигалова Г. В.. Мейчик Н. Р., Носов А. В.,
Полесская О. Г., Харитоношвгьлгь Е. В., Чуб В. В.. Батыгина Т. Б., Васильева В. Е. Физиология
растений / Под ред. И. П. Ермакова. М.: Академия, 2005. 635 с.
Батыгина Т. Б., Васильева В. Е. Размножение растений. СПб.: Изд-во С.-Петерб. ун-та, 2002.
230 с.
Бутенко Р. Г. Экспериментальный морфогенез и дифференциация в культуре клеток растений.
35-е Тимирязевское чтение. М.: Наука, 1975. 51 с.
Васильев А. Е., Воронин Н. С.. Еленевский А. Г., Серебрякова Т. И. Ботаника. Анатомия и
морфология растений. М.: Просвещение, 1978. 480с.
Гамалей Ю. В. Флоэма листа. Развитие структуры и функций в связи с эволюцией цветковых
растений. Л.: Наука, 1990. 144с.
Гамалей Ю. В. Транспортная система сосудистых растений. СПб.: Изд-во С.-Петерб. ун-та,
2004. 424 с.
Гамбург К. 3. Биохимия ауксина и его действие на клетки растений. Новосибирск: Наука, 1976.
272 с.
Гэлстон А., Девис П., Сэттер Р. Жизнь зеленого растения. М.: Мир, 1983. 549с.
Горшкова Т. А. Растительная клеточная стенка как динамичная система. М.: Наука, 2007. 429 с.
Дёрфлинг К. Гормоны растений. М.: Мир, 1985. 303 с.
Дондуа А. К. Биология развития. Т. 2. Клеточные и молекулярные аспекты индивидуального
развития. СПб.: Изд-во С.-Петерб. ун-та, 2005. 238с.
Ежова Т. А., Лебедева О. В., Огаркова О. А.. Пенин А. А., Солдатова О. II., Шестаков С. В.
Arabidopsis thaliana - модельный объект генетики растений. М.: МАКС Пресс, 2003. 219с.
Зитте П., Вайлер Э. В., Кадерайт И. В., Брезински А., Кёрнер К. Ботаника. Том 2. Физио-
логия растений. На основе учебника Э. Страсбургера и др. / Под ред. В. В. Чуба. М.: Академия,
2006. 421 с.
Иванов В. Б. Клеточные основы роста растений. 14.: Наука. 1974. 223с.
Исаева В. В. Клетки в морфогенезе. М.: Наука, 1994. 224с.
Кефели В. И. Рост растений. М.: Колос, 1984. 175с.
Кефели В. И., Коф Э. М., Власов 11. В., Кислин Е. 11. Природный регулятор роста — абсцизовая
кислота. М.: Наука, 1994. 184с.
Кордюм Е.Л.. Сытник К. М.. Беляевская Н.А. и др. Современные проблемы космической
клеточной фитобиологии. Серия «Проблемы космической биологии». Т. 73. М.: Наука, 1994. 293с.
Кузнецов Вл. В., Дмитриева Г. А. Физиология растений. М. Высшая школа. 2006. 742 с.
Кулаева О. Н. Цитокинины, их структура и функция. М.: Наука, 1973. 264 с.
Кулаева О. И. Гормональная регуляция физиологических процессов у растений на уровне син-
теза РНК и белка. 41-е Тимирязевское чтение. М.: Наука, 1982. 83с.
Курсонов А. Л. Транспорт ассимилятов в растениях. М.: Наука, 1976. 646с.
Лутова, Л. А. Биотехнология высших растений. СПб.: Изд-во С.-Петерб. ун-та, 2003. 227с.
Лутова Л. А.. Проворов И. А., Тиходеев О. Н. и др. Генетика развития растений. СПб.: Наука,
2000. 539 с.
Медведев С. С. Физиологические основы полярности растений. СПб.: Кольна. 1996. 159с.
Медведев С. С. Электрофизиология растений. СПб.: Изд-во С.-Петерб. ун-та, 1998. 179с.
Медведев С. С. Физиология растений. СПб.: Изд-во С.-Петерб. ун-та, 2004. 335с.
Меркис А. И. Ауксин и рост растений. Вильнюс: Мокслас, 1982. 200с.
Меркис А. И. Сила тяжести в процессах роста растений. Серия «Проблемы космической био-
логии». Т. 68. М.: Наука, 1990. 185с.
246
Мокроносов А. Т. Фотосинтетическая функция и целостность растительного организма. 42-е
Тимирязевское чтение. М.: Наука, 1983. 64 с.
Муромцев Г. С., Агнистикова В. Н. Гиббереллины. М.: Наука, 1984. 207с.
Новикова Г. В., Степанченко Н. С., Носов А. В.. Мошков И. Е. В начале пути: восприятие АБК
и передача ее сигнала у растений // Физиол. растений. 2009. Т. 56, №6. С. 806 823.
Полевой В. В. Фитогормоны Л.: Изд-во Ленингр. ун-та, 1982. 249с.
Полевой В. В., Саламатова Т. С. Физиология роста и развития растений. Л.: Изд-во Ленингр.
ун-та, 1991. 239 с.
Полевой В. В. Физиология растений. М.: Высшая школа, 1989. 464 с.
Романов Г. А. Рецепторы фитогормонов // Физиол. раст. 2002. Т. 49, К«1. С. 615 625.
Романов Г. А. Как цитокинины действуют на клетку // Физиол. раст. 2009. Т. 56. К02. С.295-
319.
Сабинин Д. А. Физиология развития растений. М.: Изд-во АН СССР, 1963. 196 с.
Саламатова Т. С. Физиология растительной клетки. Л.: Изд-во Ленингр. ун-та, 1983. 232с.
Сингер М., Берг П. Гены и геномы: В 2 т. М.: Мир, 1998. 373с, 391с.
Синнот Э. Морфогенез растений. М.: ИЛ, 1963. 603 с.
Тарчевский И. А. Сигнальные системы клеток растений. М.: Наука, 2002. 294 с.
Уинфри А. Т. Время по биологическим часам. М.: Мир, 1990. 208с.
Уоринг Ф., Филлипс И. Рост растений и дифференцировка. М.: Мир, 1984. 512с.
Усманов И.Ю., Рахманкулова 3. Ф., Кулагин А. Ю. Экологическая физиология растений. М.:
Логос, 2001. 223 с.
Чайлахян М.Х. Регуляция цветения высших растений. М.: Наука, 1988. 560с.
Чайлахян М.Х., Хрянин В. Н. Пол растений и его гормональная регуляция. М.: Наука, 1982.
173 с.
Чиркова Т. В. Физиологические основы устойчивости растений. СПб.: 14зд-во С.-Петерб. ун-та,
2002. 240 с.
Шакирова Ф. М. Неспецифическая устойчивость растений к стрессовым факторам и ее регу-
ляция. Уфа: Гилем, 2001. 159 с.
Шарова Е. И. Клеточная стенка растений. СПб.: Изд-во С.-Петерб. ун-та, 2004. 156с.
Шевелуха В. С. Рост растений и его регуляция в онтогенезе. М.: Колос, 1992. 593 с.
Эзау К. Анатомия семенных растений: В 2 т. М.: Мир, 1980. 558с.
Эмбриология цветковых растений: В 3 т. / Под ред. Т. Б. Батыгиной. СПб: Мир и семья, 1995-
1997.
Biochemistry and Molecular Biology of Plants / Eds. by В. B. Buchanan, W. Gruissem, R. L. Jones.
American Society of Plant Physiologists, 2000. 1408 p.
Plant Hormone Signaling / Ed. P. Hedden, S.G. Thomas. Blackwell Publishing Ltd., 2006. 348 p.
Polarity in Plants I Eds. by K. Lindsey. Blackwell Publishing Ltd., 2004. 346 p.
Taiz L., Zeiger E. Plant Physiology. Sunderland. Massachussetts: Sinauer Associates Inc. Publishers,
1998. 791 p.
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
АБК, см. абсцизовая кислота
Абсцизовая кислота (АБК) 46, 167-187
— катаболизм 171, 172
— конъюгация 171
— механизм действия 173-182
---АБК-регулируемые гены 175-176
---взаимодействие АБК и углеводного сиг-
нала 180-182
---механизм закрывания устьиц под дей-
ствием АБК 178-180
---рецепция 173-175
---трансдукция АБК-сигнала 176-178
---роль цАДФ-рибозы в трансдукции
АБК-сигнала 178
---синтез 168-171
— функции 182-187
---адаптация к стрессам 185-187
---к аноксии 61, 186
---к низким температурам 59, 186
---к патогенам 186
---LEA-белки 59, 185, 186
---регуляция водного режима 60, 85, 89,
184, 185
---регуляция покоя 89, 183
---регуляция ростовых процессов 42, 182,
183
Абсцизовый альдегид 169-171
Абсцизовый спирт 169, 171
Адаптация 55
— к аноксии 61, 62
— к гипоксии 61, 62
— к низким температурам 57-159
— к обезвоживанию 59-60
Аденилат- изопентен и лтрансфераза, см. изо-
пентенилтрансфераза
Акклиматизация 55
Активные формы кислорода 35, 223, 232
Актиновые филаменты 35, 37-41, 117
Алейроновый слой 134-138
а-Амилаза 127, 134-138, 224
Аминоциклопропанкарбоновая кислота
(АЦК) 47, 61, 83, 190, 191, 193
Аноксия, см. адаптация
Антераксантин 169, 170
Апикальное доминирование 65-67, 163, 164
Аттрагируюгций эффект 64, 65, 164, 165
Н+-АТФаза 87, 118, 119, 179, 180, 209, 211
Ауксин (индол-3-уксусная кислота) 45, 91-
124
— конъюгаты 101-105, 108, ПО
— механизм действия 118-123
---гены первичного ответа 119, 120
---мембранный 87, 118, 119
---рецепция 120 123
---трансдукция сигнала 120-123
— переносчики (мембранные)
---фосфогликопротеины (PGP) 115
---AUX1 (auxin resistant 1) 113, 114, 115
---PIN (pin-formed) 114-117
-окисление 104-108
— полярный транспорт 34, 39, 42, 44, 45, 48,
51, 54, 65, 66, 109-118
— синтез 93-101, 108, 109
-функции 42, 51-64, 84, 85, 87, 88, 123, 124
АЦК, см. аминоциклопропанкарбоновая
кислота
АЦК-оксидаза 190-193
АЦК-синтаза 84, 190-193
Аэренхима 62, 200, 201
6-Бензиламинопурин (БАП) 66, 149
Бензойная кислота 228, 229
Биоритмы (биологические часы) 69-78
— экзогенные 69
— эндогенные 69
---подневольные 71, 74
---самоподдерживающиеся (автоколеба-
тельные) 71-72, 74, 75, 77
Биоэлектрический потенциал, см. градиен-
ты
Брассинолид 202-206
Брассиностероиды 202-213
— биосинтез 205-203
— механизм действия 206-209
---взаимодействие с системином 209
---рецепторный комплекс 207
---трансдукция сигнала 208
— окисление и конъюгация 205, 206
— функции 210
---адаптация к стрессовым воздействиям
212
---влияние на рост 210
248
---регуляция процессов развития 211
---регуляция фотоморфогенеза 212
Вегетативное размножение 7
Вернализация 19, 20, 24, 57, 133, 145
Виолаксантин 168-170, 172
Виолаксинтин-деэпоксидаза 169, 170
Вторичные посредники
-G-белки 137, 138, 175
— кальмодулин 50, 137, 138
-кальций 34-39, 118, 119, 137, 139, 178, 179
— инозитол-1,4,5-трисфосфат (ИФз) 39 41,
178-180
— МАР-киназы 191, 195, 196
— фосфатидная кислота 39, 177, 178
— циклическая АДФ-рибоза (цАДФР) 178-
180
ГА, см. гиббереллины
Ген (ы)
— АБК-регулируемые 175, 176
— авирулентности, avr 224
— ауксин-регулируемые 16, 29, 119-122
— вторичного ответа (поздние) 119
— гиббереллин-регулируемые 134, 136, 137
— гомеозисные 11, 12
— дифференциальная активность 6, 9-11
— жасмонат-индуцибельные 220-222
— первичного ответа (ранние) 119
— «переключатели» (регуляторы) развития
9-12, 81
— светорегулируемые 212
— содержащие гомеобокс 11, 12
---MADS-бокс 11, 12, 14, 15, 24
— устойчивости к патогенам (7?) 223, 224
— циркадные 71-75
— этилен-регулируемые 194
Генетическая регуляторная сеть 10
Геном 9, 18
Геномика 245
Геномный импринтинг 19, 20
Геранил геранилдифосфат 128
Гетерохроматин, см. хроматин
Гиббереллины 46, 125-148
— классификация 126, 127
— механизм действия 134-143
---действие на алейроновый слой эндоспер-
ма злаков 134, 135
---мутанты с повреждением ответных ре-
акций на гиббереллин 132, 137, 139
---рецепция и трансдукция гиббереллино-
вого сигнала 141-143
---участие ионов Са2+ 137
---DELLA-белки — репрессоры гибберел-
линового сигнала 139-142
— катаболизм 132
— конъюгация 132, 133
-синтез 128-132
— функции 143
---влияние на рост 42, 85, 86, 143
---детерминация пола 146
--регуляция покоя растений 147, 148
--регуляция развития семян и плодов 146,
147
--регуляция цветения 144, 145
Гибберелловая кислота, см. гиббереллины
Гипоксия, см. адаптация
Гистидинкиназы рецепторные 159-162, 195,
194, 195
Гистоны 19, 21-24
-ацетилирование 13, 21-24
— метилирование 20-24, 28
- фосфорилирование 21, 22
Гистон-метилтрансфераза 22-24
Глюкобрассицин, см. глюкозинолаты
Глюкозинолаты 96-98, 108
Гомеобокс 11, 12
Гомеодомен 11-14
Гомеозисные мутанты 11, 12, 14
Гормональная система 79
Гравитропизм 32, 33, 44, 53, 80, 112, 115, 198
Градиенты 30, 31, 41, 43
— гормонов 44 -47, 53
— биоэлектрических потенциалов (БЭП) 35,
43, 44, 53
-ионов Са 34, 35, 37-39, 47-49, 53
— роста 49
— температурные 58
- цветения 50
Дедифференцировка 7
Деление клеток, см. рост
Детерминация пола 146
Детки 7, 45
Дефензины 220, 224
Деэтиоляция 56, 57, 133
Дигидрозеатин, сМ. цитокинины
Дигидроэеатинриботид, см. цитокинины
Дигидрофазеевая кислота 172
Диметилаллилдифосфат 128, 153-155
Динор-оксо-фитодиеновая кислота, см. жас-
монаты
Диоксигеназы 130, 132, 133, 169, 191
Дифференцировка 6, 10, 31, 36, 44, 50, 52, 67
Длиннодневные растения 56, 127, 133, 143-
145
ДНК ядерная 9, 18, 19
— метилирование 20-25, 27-29
— модификация 20
— частые повторы 18, 20, 27
ДНК-метилтрансфераза 2124
Донорно-акцепторные отношения (взаимо-
связи) 9, 63-65
Дормин 167
Жасмонаты 214-227
— биосинтез 214-220
— инактивация 220
— механизм действия 220-222
— участие в процессах морфогенеза 226, 227
— участие в реакции сверхчувствительности
222-224
249
— участие в формировании устойчивости к
фитофагам 224- 226
— формы 214, 215
Жасмоновая кислота, см. жасмонаты
Замыкающие клетки устьиц, см. устьица
Зародыш 44, 52, 53, 67, 92
Защита растений 185-187, 201, 212. 222, 232-
236
---иммунитет приобретенный 233-236
---от патогенов 201, 212, 222, 232
---реакция сверхчувствительности 223, 232
---от фитофагов 224, 225
Зеаксантин 168-170
Зеаксантин-эпоксидаза 169, 170, 172
Зеатин, см. цитокинины
Зеатинрибозид, см. цитокинины
Зеатинриботид, см. цитокинины
Зигота 32, 35-37, 40, 41, 44, 51-53
Изопентениладенип, см. цитокинины
Изопентениладенинрибозид, см. цитокини-
ны
Изопентениладенинриботид, см. цитокини-
ны
Изопентенилдифосфат 128, 153, 155
Изопентен и лтрансфераза 152-154, 158
— аденилат-изопентени лтрансфераза 152 -
154
— тРНК-изопентенилтрансфераза 152, 153
ИМК, см. индол-3-масляная кислота
Иммунитет приобретенный (системный)
233-236
Ингибиторы протеаз 101, 108, 224, 226, 238,
239
Индол-З-ацетальдегид 94-96, 100, 108
Индол-З-ацетальдоксим 94-98, 101, 108
Индол-З-ацетонитрил 95, 96, 98, 100, 101, 108
Индол-3-глицерофосфат 97, 100, 101, 108
Индол-З-масляная кислота (ИМК) 91, 104,
108
Индол-З-пировиноградная кислота 94, 100,
108
Индол-З-уксусная кислота, см. ауксин
4-С1-индол-3-уксусная кислота, см. 4-С1-
ИУК
Инозитол-1,4,5-трисфосфат, см. вторичные
посредники
Ионные каналы 118, 119, 179
---анионные 118, 119, 178, 179
---калиевые 36, 118, 119, 179, 180
---кальциевые, см. кальций
ИУК, см. ауксины
4-С1-ИУК 92
Каллус 7, 80, 164
Кальмодулин. см. вторичные посредники
Кальций 39
— полярные потоки 34, 36, 37, 47, 54
---в клетке 37-39
---в растении 47, 48, 54
— мембранный транспорт 119, 179
---каналы 34, 36-38, 48, 53,118, 119, 179, 180
функции 38, 50, 53, 54, 137, 138
Кальций-зависимые протеинкиназы 35, 38,
191
Кальций-связывающие белки-сенсоры 38
Камбий 44, 51, 92, 93, 144
Каротиноиды 168 173
Кауреноксидаза 128, 129
Кинетин (6-фурфуриламинопурин) 42. 64,
65, 149, 164
Кислород
-дефицит, см. адаптация
Клоны 7
Клубни 58. 64, 133, 134, 147, 226, 227
Клубеньки 226, 227, 242, 243
Компетентность тканей, см. чувствитель-
ность
Копалилдифосфат 128
Копал илдифосфат-синтаза 128
Корневые волоски 35 39, 43, 44
Коронатин 221
Короткодневные растения 56, 75, 133, 145
Корреляции (в ходе роста и морфогенеза)
63-68
Криопротекторы (антифризы) 58, 186
Криптохром 57
Ксантоксин 169-171
Ксантоксиновая кислота 169-171
Ксантофилльный цикл 168-170
Ксерофиты 59
Ксилема 42, 50, 51, 61, 85, 92, 93, 211
Кумаровая кислота 104, 106, 228, 229
Линоленовая кислота 215-217, 225
Липоксигеназы 216 218
Лист 14, 28, 44, 45, 60, 92, 93
опадение 167, 200
-старение 200
Луковицы 58, 60, 142
Малые РНК, см. РНК
Мезофиты 62
Меристемы (а) 6, 7, 12, 14, 44, 115, 116. 144,
241, 242
Метаболом 244
Метилжасмонат 214, 215, 221, 223
Метилсалицилат 229, 230
Метиониновый цикл 190-193
МикроРНК, см. РНК
Микротрубочки 40-43, 210,226, 227
Микрофибриллы целлюлозные 42, 43, 198
Микрофиламенты, см. актиновые филамен-
ты
Монооксигеназы 94-98, 109, 129, 130, 153,
170, 205, 206, 217
Морфоген 67, 80, 109. 115
Морфогенез 6, 115, 164
НАДФ • Н-оксидаза 178, 223
Неоксантин 169
250
Нитратредуктаза 77
Нитрилаза 95-98, 100, 109
Нуклеосома 19, 22, 24
Озимые растения 57
Окислительный взрыв 232
12-оксо-фитодиеновая кислота 214-216, 218
Онтогенез 6
--этаппость 7
Партенокарпия 124, 146, 147
Патогены 187, 201, 222-224, 232, 233
Пейсмейкер, см. центральный осциллятор
Пептидные фитогормоны 238-243
— системин 209, 225, 238-240
— факторы быстрого подщелачивания 242
— фитосульфокины 240
— цистеин-богатые пептиды S-локуса кресто-
цветных 241
-CLV3 241, 242
- ENOD40 242, 243
Позиционная информация 9, 11, 35, 45
Покой 147, 167, 183
— вынужденный 183
— семян 183
-физиологический 89, 148, 183, 212
Полярность 9, 30-54
— аксиальная 30
- дорсовентральная 17, 21, 28-30
— клеточная 35-43
— органов и тканей 43-50
— радиальная 30
- факторы индукции 32 -34
-физиологическое проявление 34-50
Протеинкиназы 35, 37. 75, 115, 116, 178, 195,
196, 207-209
Протеасома 121, 122, 140-143, 191, 192, 209,
221, 231
Протеом 244
Протонные насосы (помпы), см Н^-АТФаза
Пыльцевая трубка 35-40
Развитие 6, 60, 81
Растяжение клеток, см. рост
Регенерация 7
Ретроэлементы 19, 20, 28
Рецепторы АБК 173-175
— ауксина 120-123
--АВР1 121
- - TIR1 121-123
— брассиностероидов 207, 208
— гиббереллинов 141-143
— красного света (фитохромы) 57
— синего света 57
--криптохромы 57
--фототропины 57
— пептидных гормонов 209, 239-242
— цитокининов 159, 160
— этилена 194, 195
Ризоид 35, 36, 40, 41, 52, 57
Ритмы суточные 57
РНК
— малые 24 -29
---интерференция 24, 27
---интерферирующие (short interfering
RNAs, siRNAs) 24, 26-28
---микро (miRNAs) 24 29
---мишени 28, 29
-тРНК 150-153
Рост 6
- делением 6, 41, 92, 93, 144, 147, 149, 210,
240, 242
— полярный 35-37, 39, 41, 53, 54
- растяжением 6, 8, 44, 49, 92, 93. 144, 147,
210
Салициловая кислота 228-237
-биосинтез 228
- коньюгирование 229, 230
- механизм действия при патогенезе 230-232
- окислительный катаболизм 230
— функции 232
---защита от патогенов 232
---приобретенный иммунитет растений
233-236
---участие в морфогенезе 226, 227
---цианид-устойчивое дыхание 235 237
Салицилат, см. салициловая кислота
Сахароза 51, 58, 181, 243
Сверхчувствительность 223, 232. 233
Семена 183, 199
— обезвоживание 183. 185
- покой 183, 184
— прорастание 92, 93, 133, 147, 199
Системин. см. пептидные фитогормоны
Созревание плодов 89, 199
Специализация клетки 10, 67
Старение 165, 200
Суккуленты 60
Таллом 35, 36, 52
Температура 57 59
- низкие положительные 57-59
ТИБК, 2,3,5-трииодбензойная кислота 51,
66, 83, 112, 21L
Тионины 220, 224
Тотипотентность 7
Транскриптом 119, 244
Транскрипционные факторы 11-17, 28, 29,
175, 176
Транспирация 59-61, 178-180, 184
— регуляция АБК 178-180, 184
2,3.5-трииодбензойная кислота, см. ТИБК
Транспозоны 19, 20, 28
Триптамин 95, 96, 108
— N-гидрокси-триптамин 95, 96, 108
Триптофан-аминотрансфераза 94, 95
Триптофан-монооксигеназа 94, 95
Триптофан-декарбоксилаза 95. 96
Триптофан-синтаза 97, 100, 101
Тропизмы 53
Тубулин, см. микротрубочки
251
Убиквитинирование 21, 22, 121, 140-143, 191,
192, 209, 221, 231
Устойчивость
— к заморозкам 58, 59, 186
— к засухе 59, 60, 185, 186
— к недостатку кислорода 60-62, 185
— к патогенам 222-224, 233-235
— к фитофагам 212, 224-226, 238, 239
— к холоду 57, 60, 184, 185
Устьице (а) 60, 61, 178-180, 184, 185, 211
Фазеевая кислота 171, 172
Факторы внешней среды 9, 55
— вода 59
— кислород 60-62
— свет 56, 57
— температура 57-59
Фенилаланинаммиак-лиаза 228, 229
Фитоалексины 233
Фитосульфокины, см. пептидные гормоны
Фитотропины 112, 117
Фитофаги 224, 225
Фитохром 57, 75
Флориген 126
Флоэма 28, 42, 50, 51, 92, 93, ПО
Фосфатидная кислота, см. вторичные по-
средники
Фосфоинозитиды 35, 39
Фосфолипазы 37, 39, 174, 178
Фотоморфогенез 32, 56, 212
Фотопериодизм 56, 57, 70, 75, 76, 133, 145,
148
Фототропизм 32, 33, 57, 80, 91, 112
Фототропины 57
6-фурфуриламинопурин, см. кинетин
Хроматин 9, 19, 23
— гетерохроматин 19, 21, 24, 27
— модификация (ремоделирование) 20, 21,
23, 24
— эухроматин 19, 22
Цветение 56, 57, 174
— индукция 56, 57, 125, 143
Целостность 30, 31
Центральный осциллятор 71, 72, 74, 77
Цианид-устойчивое дыхание, см. салицило-
вая кислота
Циклическая АДФ-рибоза, см. вторичные
посредники
Цитокинины 45, 149-166
— биосинтез 152-155
---цитокининсинтаза, см. изопентенил-
трансфераза
— конъюгаты 151, 155-157
---рибозиды 150-152
---риботиды 150-152
— окисление 157, 158
---цитокининдегидрогеназа 157, 158
— механизм действия 158-163
---белки, участвующие в передаче цитоки-
нинового сигнала 160, 161
---рецепция и трансдукция цитокининово-
го сигнала 161-163
-рецепторы 159, 160 163
— формы 150, 151
— функции 163-166
---аттрагирующий эффект 64, 164, 165
---влияние на рост 163, 164
---задержка старения 165
---снятие апикального доминирования 66,
67, 164, 165
Цитоскелет 34, 35, 37-43, 50, 118
Чувствительность 86-88, 124
Щиток 134, 135
Элиситоры 191, 223
Эмбриогенез, см. этапы развития
Эндосперм 20, 134, 135
Энт-кауреновая кислота 128, 129
Энт- каурен 128, 129
Энт-каурен-синтаза 128
Эпигенетика 18-29
Эпигенетические факторы развития 9, 18-29
Эпинастия, см. этилен
Этапы развития (онтогенеза) 6
— вегетативный б
— генеративный 6
— сенильный 7
— эмбриогенез 6, 32, 44, 51, 53, 67, 92, 93
Этилен 43, 47, 83, 188-201
— катаболизм 193
— механизм действия 194-197
---рецепторы 194, 195
---трансдукция этиленового сигнала 195-
197
---этилен-регулируемые гены 194
— синтез 190-193
— функции 197-201
---участие в гравитропизме 198
---защита от патогенов 201
---регуляция опадения листьев 200
---тройной ответ 188, 197
---формирование гипокотильного крючка
47, 198, 199
---усиление дыхания 199
---ускорение созревания 89, 199
---ускорение старения 199, 200
---формирование аэренхимы 200, 201
---эпинастия 61, 199
Этиоляция 32, 56
Эухроматин, см. хроматин
Эфемероиды 60
Эфемеры 60
Яйцеклетка 30, 31, 37, 38. 40, 41, 51-53, 67,
92, 93
Яровизация, см. вернализация
Яровые растения 57
CLV3, см. Пептидные фитогормоны
252
ENOD40, см. пептидные фитогормоны
LEA-белки 185, 186
MAP-киназы, см. Вторичные посредники
IPT, см. изопентен и лтрансфераза
ROP-белки 38, 39
S-аденозилметионин 190
Учебное издание
Сергей Семенович Медведев, Елена Игоревна Шарова
БИОЛОГИЯ РАЗВИТИЯ РАСТЕНИЙ
Том 1
НАЧАЛА БИОЛОГИИ РАЗВИТИЯ РАСТЕНИЙ.
ФИТОГОРМОНЫ
Редактор Е. В. Гуреева-Преобраэ(сенская
Обложка художника Е. А. Соловьевой
Корректор Е. А. Стерлина
Верстка Е. М. Воронковой
Подписано в печать 25.06.2010. Формат 70x100 Vie- Бумага офсетная.
Печать офсетная. Усл. печ. л. 20,64. Тираж 600 экз. Заказ №276
Издательство СПбГУ.
199004, С.-Петербург, В.О., 6-я линия, 11/21
Тел./факс (812) 328-44-22
E-mail: editor@unipress.ru
www.unipress.ru
По вопросам реализации обращаться по адресу:
С.-Петербург, В. О., 6-я линия, д. 11/21, к. 21
Телефоны: 328-77-63, 325-31-76
E-mail: izdat-spbgu@mail.ru
Типография Издательства СПбГУ.
199061, С.-Петербург, Средний пр., 41
ФИЗИОЛОГИЯ
РАСТЕНИИ
С. С. Медведев, Е. И. Шарова
БИОЛОГИЯ
РАЗВИТИЯ РАСТЕНИЙ
НАЧАЛА БИОЛОГИИ РАЗВИТИЯ
РАСТЕНИЙ. ФИТОГОРМОНЫ
...Центральная проблема био-
логии развития — это вопрос о
том, каким образом многократ-
ное деление всего лишь одной
клетки приводит к формирова-
нию организма, обладающего си-
стемами органов и тканей, обра-
зованных клетками, не похожими
друг на друга. Ответом на этот во-
прос является дифференциаль-
ная экспрессия генов в клетках,
составляющих ткани и органы.
Именно дифференциальная ак-
тивность генома служит основой
и структурных, и функциональных
различий между разными клетка-
ми одного и того же организма.
В процессе развития потенциал
конкретного генотипа реализует-
ся в зависимости от условий сре-
ды, в результате чего формирует-
ся определенный фенотип.
На первой стороне обложки — О. В. То-
ме. Сборник ботанических иллюстраций
«Флора Германии». 1885. На четвертой
стороне обложки — О. В. Томе. Фраг-
мент иллюстрации из «Флора Герма-
нии». 1885.
"" Необходимость в таком учебнике назрела давно. На протяжении
20 лет едва ли не единственным учебным пособием для студентов и
аспирантов, специализирующихся по физиологии и биохимии расте
ний, была изданная на русском языке книга Ф. Ф. Уоринга «Рост расте-
ний и дифференцировка» (М., Мир, 1984). За последнее время в науке
о биологии растений произошли изменения, приведшие к накоплению
принципиально новых знаний о росте и развитии, генетике, биохимии
и молекулярной биологии растений, без которых сейчас невозможна
серьезная профессиональная подготовка новых научных кадров
И. Е Мошков, ИФРим. К. А. Тимирязева
Впервые в таком объеме в учебное пособие вошли современные
данные о фитогормонах в биохимическом и молекулярно-биологиче-
ском контекстах. Эта книга может дать новые точки роста для будущих
исследований в этой области.
Г В. Новикова. ИФР им. К. А. Тимирязеве