Автор: Рослый И.М. Водолажская М.Г.
Теги: прикладная микробиология общая патология биохимия биохимический анализ
ISBN: 978-5-9986-0021-0
Год: 2010
Текст
И.М. Рослый
М.Г. Водолажская
ПРАВИЛА ЧТЕНИЯ
БИОХИМИЧЕСКОГО
АНАЛИЗА
МЕДИЦИНСКОЕ
ИНФОРМАЦИОННОЕ
АГЕНТСТВО
И.М. Рослый, MX. Вололажекая
Правила чтения
биохимического анализа
Медицинское информационное агентство
Москва
2010
УДК 579.61
ББК 52.5
Р74
Рослый И.М., Водо.іяжская М.Г.
Р74 Правила чтения биохимического анализа: Руководство для
врача. М.: ООО «Издательство «Медицинское информационное
агентство», 2010. 96 с.: ил.
ISBN 978-5-9986-0021-0
Руководство предназначено врачу любой специальности. Изуче¬
ние медицинской биохимии читателю предложено начать с отбора и
врачебного осмысления той информации из фундаментальной био¬
химии, которая необходима врачу для практического использования
в конкретной ситуации с конкретным пациентом. Одновременно
эта информация должна дать ориентиры на глубинное (вплоть до
молекулярного уровня) понимание патологии с учетом основных
биохимических процессов, которые более известны в теории как па¬
клене шческис механизмы И редко упоминаются (хотя непременно
должны упоминаться) в практике врача.
Семнадцать правил чтения биохимического анализа представ¬
лены в biuc текста, цветных иллюстрированных схем, кратких фор¬
мул и комментариев, что делает медицинский курс доходчивым для
широкого круга читателей: студентов медицинских университетов,
академий, факультетов, врачей, научных сотрудников, абитуриентов.
Книга адаптирована для любознательного человека, который интере¬
суется собственным организмом, хочет иметь современные научные
представления о самом себе.
Руководство подготовлено в проблемной научно исследова¬
тельской лаборатории биомедицины (зав. д-р биол. наук, проф.
М.Г. Водолажская) Ставропольского государственного университета
доктором медицинских наук, профессором Игорем Михайловичем
Рослым и доктором биологических наук, профессором Маргаритой
Геннадиевной Водолажской.
УДК 579.61
ББК 52.5
ISBN 978-5-9986-0021-0 *- Рослый им . Водолажская М.Г., 2010
£ Оформление ООО «Издательство «Меди¬
цинское информационное агентство», 2010
Кее права защищены. Никакая часть данной
книги не может быть воспроизведена в какой-
либо форме 6е і письменного разрешен ия вла¬
дельцев авторских прав
Содержание
Сокращения 4
Предисловие (обращение к врачу) 5
Правило 1. Введение в медицинскую биохимию 7
Правило 2. Ферменты крови дли биохимического анализа 15
Правило 3. ЛОТ и переаминированис 19
11равило 4. АЛТ. Ппкжозо-аланиновый шунт 22
Правило 5. биологический смысл работы
двух транса миназ: ACT и.ATT 29
Правило 6. ПТ фермент мембранного транспорта
аминокислот 34
Правило 7.11сказатель «общего белка» крови 39
І Ірапило 8. Строение белков как иллюстрация
их сгруктурно-функнионалыюй роли
в формировании живых систем 41
Правило 9. Альбумины, мочевина и креатинин - показатели
катаболизма 47
Правило 10. Роль аминокислот в обеспечении церебральных
процессов при нормальной активност и
головного мозга 51
Правило 11. Что важно знать врачу о холестерине 60
Правило 12. Щелочная фосфатаза 66
Правило 13. Тактатдегидрогеназа 68
Правило 14. Креатинфоефокиназа 71
Правило 15. Энергетический обмен 73
Правило 16. Алгоритм биохимического анализа,
производимого врачом 79
Правило 17. Интеграция метаболических и тзимологических
показателей («энзимо-метаболический веер») 85
Литература 88
Указатель иллюстраций 93
Сокращения
АДФ аденозиндифосфат, аденоэиішифосфорная кислота
АЛА - аланин
ДЛТ аланинтрансаминаза
АСП - аспарагиновая кислота
ACT ас і іартатт рансам и нала
АСТ/АЛТ - соотношение ак і ивности аспартатгрансамииазы
к активности аланинтрансамипани
АТФ - аденозинтрифосфат, аденозинтрифосфорная кислота
Ацетил-коЛ - ацетилкоэнзим-А
ГАШ - глюкозо-аланиновый шунт
ГИД - гидроксибутиратлепшрогсиала
ГГТ - га м ма гл юта м илтрансфераза
или гаммаглютамилтранспеи і идаза
КФК крсати нфосфокина за
«ІДГ - лакгатдегидрогеиаза
ЛК - лимонная кислота
ME - международная сд и 11 и ua
НАД - никотинамидадениндинуклеотид
ПВК иировиноградная кислоіа
СДГ - сукнииатдегмдрогсиаза
ЦТК цикл трикарбоновых кислот, никл Кребса,
никл лимонной кислоты
ФАД - флавинадениішинуклеотид
Ф К - фс юфорная кислота
ЩУК ща вел о воуксус ная кислота
ЩФ - щелочная фосфатаза
4
Предисловие (обращение к врачу)
Ни у кого не вызывает сомнений, что клиническое мышление
врача должно быть совершенным. Для этого его ніщо упорно фор¬
мировать и одним из серьезных препятствий к данном направлении
является неспособность адекватно оценить результаты биохими
ческого анализа крови, других биологических жидкостей и тканей.
Врачи признаны особенно глубоко разбираться в метаболическом,
физиологическом смысле биохимических изменений, протекающих
к организме больного. Врач должен овладевать искусством чтения
биохимического анализа по всей молскулярно-организменной вер¬
тикали, от молекулы до любой сложной формы поведения человека,
а не замыкаться на одном или нескольких показателях, укладывая их
в прокрустово ложе общепринятого шаблона. Этому же метабол и
ческой оценке результатов биохимического анализа крови - необхо¬
димо УЧИТЬСЯ постоянно.
Врачу необходимо грамотно и корректно заказать, оценить
и использовать в практике, прежде вест, доступные биохимичес¬
кие показатели. Этому можно научиться, подразумевая важнейший
нрипшш биологии принцип функциональной целесообразности.
Применительно к биохимии это означает следующее: в популяр¬
ном медицинском термине «энзимодиагностика» энзимам или фер¬
ментам отказано в праве на автономное (мскдиническое, физиоло¬
гическое) существование, несмотря на их биологическую природу.
Складывается впечатление, что ферментам уготовлена всего лишь
вспомогательная ролі» в диагностике (инфаркта, цирроза, гепатита
и т.д.). И поэтому часто встречающиеся в литературе названия ста¬
тей, книг, диссертаций типа «Клинико-биохимические параллели...»
лишь подчеркивают бессмысленность таких сравнений, гак как па¬
раллели никогда не пересекаются. Смысловая скупость нормирова¬
ния биохимических показателей -зачастую вводит п заблуждение как
5
врачей, так и пациентов. Ведь только факт, обласканный мыслью,
может быть предложен дли і фактического использования. Постав¬
ленные «галочки» в результатах биохимического анализа напротив
показателей, отличающихся от «нормы*, чаще всего вызывают не¬
обоснованную тревогу за снос здоровье и будущее, порождают ятро¬
генные заболевания, гипердиагностику, либо, наоборот, приводя т к
недосмотру серьезной симптоматики. Этому же способствует разроз¬
ненная оценка отдельных биохимических показателей без глубинно¬
го (на уровне обмена вещее і в, в целостном организме и в конкретных
условиях окружающей среды) понимания их функциональной взаи¬
мосвязи. без понимания единства всех биохимических процессов,
работы органов, систем, высших психических функций.
Задача настоящего руководства - внести определенный (в дан¬
ном случае, метаболический) смысл в оценку- биохимических пока¬
зателей, которые каждый день доступны врачу. Эта книга написана
для тех, кто хочет не только прочесть, но также понять, осмыслить,
исследовать и вступить в научную полемику по всем предлагаемым
клинико-биохимическим аспектам, а главное - реально помочь па¬
циенту, нс навредив, нс напугав, вылечив больного или сохранив здо¬
ровье здорового, как и подобает квалифицированному врачу.
Правило 1. Введение в медицинскую
биохимию
Медицинская биохимия - это дисциплина, изучающая биохими¬
ческие механизмы, необходимые врачу для понимания нормальных,
предиатологических и патологических процессов, лежащих в основе
поддержания гомеостаза, отклонения от гомеостаза, развития пато¬
генетических процессов, а также для формирования навыков и при¬
емов диагностики.
Предметом изучения медицинской биохимии является организм
человека— основные механизмы его жизнедеятельности (метабо¬
лизм, дыхание, кровообращение, выделение, репродукция, единство,
целостность, системность, саморегуляция), рассматриваемые в кате¬
гориях биохимических процессов, т.е. на молекулярном уровне.
Целью медицинской биохимии является формирование пред¬
ставлений врача о биохимических принципах функционирования
целостного организма человека в различных условиях, формирова¬
ния донозодогических состояний, механизмах развития заболева¬
ний, диагностики.
Задачи курса медицинской биохимии:
1) формирование у врача фундаментального биохимической) пред¬
ставления о функционировании живот организма;
2) обучение врача смысловому анализу основных биохимических
показателей организма дня оценки его физиологического, доно-
зологичсского и патологического ста туса;
.3) обучение врача отбору минимально необходимых, информатив¬
ных и приоритетных биохимических показателей для характерис¬
тики конкретного состояния обследуемых и больных людей;
4) формирование клинического мышления на основе познания ос¬
новных физиологических и общебиологических закономерностей.
7
Правило
Весь предлагаемый материал курса лекций подчинен обшей ина¬
че - отбору и изложению только той информации из фундаменталь¬
ной биохимии, которая будет необходима врачу дли практического
использования и поможет сформировать нужное отношение к пред¬
мету ион названием биохимия. Одновременно эта информация долж¬
на дать ориент иры на понимание патологии как таковой с учетом ос¬
новных биохимических процессов, которые более ИЗВЄС1НМ в теории
как патогенетические механизмы и редко упоминаются (а должны!)
в практ ике врача-биохимика.
Ведь в соответствии с Государственным образовательным стан¬
дартом высшего профессионального образования для специальности
040800 — Медицинская биохимия, квалификационная характеристика
врача-биохи пика включает:
- проведение научно-исследовательской работы для внедрения в
медицинскую практику достижений медико-биологических наук,
биохимии и молекулярной биологии, для педагогической рабоїм
в медицинских вузах;
- применение на практике знаний биохимических основ вирусоло¬
гии. бактериологии, аллергологии, иммунологии, генетики, ос¬
нов судебно-медицинской экспертизы.
Врач-биохимик, изучив медицинскую биохимию, должен знать:
- теоретические и методические основы фундаментальных наук
(биологии, математики, физики, химии, биохимии), и на этом
фундаменте осваивать клинический аспект биохимических про¬
цессов орі анизма человека;
- качественные и количественные биохимические различия между
здоровьем и болезнью, этиологию, патогенез и клинику наиболее
часто встречающихся заболеваний, принципы их профилактики,
лечения, обшис закономерности нарушений функций систем, а
также различия между нарушениями и напряжением адаптивных
реакций.
Врач-биохимик, изучив медицинскую биохимию, должен уметь:
- в целях изучения природы и механизмов патологических процес¬
сов и донозологичсских состояний формулировать задачу иссле¬
дования, адекватно задаче выбирать объект и использовать совре¬
менные биохимические методы исследования;
- применять следующие технологии научного исследования и ди¬
дактическом поиска:
а) создават ь и пополнять базу данных с учетом снерхинформа-
тивности и многоуровневой смысловой структуры огромного
числа параметров современного оборудования;
8
Правило
б) формировать базу знаний, в результате чего выявлять из
большого числа показателей и фактов наиболее информатив¬
ные биохимические критерии и маркеры конкретных нозоло¬
гических форм;
в) вырабатывать алгоритм знаний, который позволит врачу-
биохимику действовать системно, экономично (в том числе, во
времени), последовательно, квалифицированно и эффективно.
- производить смысловой анализ избранных и заказанных в ла¬
боратории биохимических показателей организма человека для
медицинской оценки его физиологического, донозологического
и патологическою статуса.
Анализ вышеприведенных общих положений позволяет сформу¬
лировать ряд сутубо профессиональных аспектов, составляющих ос¬
нову идеологии медицинской биохимии.
Идеология предмета медицинской биохимии
Использование биохимической информации в современной кли¬
нической практике требуется для: проведения массовогодоклини¬
ческого обследования, постановки диагноза и дифференциальной
диагностики, контроля эффективности лечения, прогноза течения
заболевания и критерия его излеченности.
Даже специалист в области молекулярной биологии А. Корнберг,
лауреат Нобелевской премии, выступая на с везде Американской ас¬
социации по клинической химии, подчеркивал, что «любое явление в
организме здорового и больного человека для полного его понимания
должно опираться на биохимический уровень». За рубежом препода¬
вание клинической биохимии начинают уже при изучении курса об¬
щей химии. Каждая глава руководства закапчивается разделом «кли¬
нические корреляции», в которых приводятся примеры из истории
болезни с разбором биохимической закономерности. Клиническая
биохимия позволяет интегрировать фундаментальные сведения по
биохимии человека и различные варианты применения лих знаний
в практической медицине.
Биохимия имеет три информативных языка:
1) формульный, или статическая биохимия;
2) метаболический, или динамическая биохимия;
3) смысловой, т.с. физиологическое объяснение процессов.
Одновременно сохраняется необходимость иллюстрировать мо-
лскулярно-организмеипую вертикаль. Более того, химия органи¬
ческих веществ должна опираться на необходимость иллюстрации
трех К любого органического вещества: конституции, конформа¬
9
Правило
1
ции и конфигурации. Так, например, Бутлеровское изображение
углеводов в линейном киле бессмысленно, так как оно не иллюст¬
рирует многообразие структурновариативных комбинаций для спе¬
цифического взаимодействия в иммуноглобулинах и рецепторах. Из
D-глюкозы и D-галактозы можно построить 56 изомеров, из 3 гек¬
соз - 4896 изомеров, а 4 гексозы дают 374 784 изомера па все случаи
специфического взаимодействия. Фактически здесь замена формулы
должна сопровождаться заменой смысла и это должно быть базовым
принципом изучения биохимии. В метаболизме динамическая био¬
химия должна быть подчинена иллюстрации взаимосвязи в узловых
точках, т.е. пересечении метаболических путей. Не нужно ориенти¬
роваться исключительно на запоминание реакций (хотя и это важно),
а можно использовать их как справочный ознакомительный матери¬
ал при ответе на принципиальные вопросы по регуляции, патогенезу
и физиологическому смыслу процесса. Основное внимание необхо¬
димо концентрировать на узловых местах метаболизма.
В настоящее время сложился большой разрыв между фундамен¬
тальной (молекулярной) и клинической биохимией. Это связано с тем,
что существует «многоэтажность» дисциплины от молекулярного до
оріанизмениоіо уровня. Авторы традиционных учебников застряли на
самом нижнем «атомарно-молекулярном» уровне и движения вверх нет.
Наиболее продуктивным уровнем изучения биохимии следует счи¬
тать характеристику адаптационного синдрома на примере биохими¬
ческих показателей, учитывая общность его основных проявлений-
лихорадкаи интоксикация. Последовательное гьпроцессовслемуюшая:
глюкокортикоиды, глюконеогенез, аминокислоты как основной суб¬
страт, трансаминироваиис при участии АЛТ и ACT, а уровень глюкозы
в крови как основной количественный признак синдрома.
Выход на сближение между фундаментальной и клинической
биохимией должен проходить, в первую очередь, через биохимичес¬
кий анализ с тщательной подготовкой к его восприятию по следую¬
щим позициям:
1) понятие уровня биохимическою исследования (их 5);
2) метаболическая взаимосвязь показателей (триглицериды, жир¬
ные кислоты и глюкоза, глюкоза и ACT);
3) понятие алгоритма заказа и понятие алгоритма оценки биохими¬
ческих показателей:
4) функциональная роль каждоїо параметра (щелочная фосфатаза -
это не только холестаз и поражение костей, но также и важней¬
ший показатель трансмембранных процессов, роуляции выхода
10
Правило
глюкозы в кровь, создание фосфатно-буферных систем, а также
блокада свертывающей системы у долго лежащих больных при
травме и инфекции). Вводится понятие показателя метаболичес¬
кой) (белок, мочевина, глюком, креатинин) и энзимологическо¬
го типа.
Подробно и і щательно необходимо изучи гь биохимическую суть
основных синдромов:
1) лихорадочного - в нем биоэнергетика клетки, тканевое дыха¬
ние. транспортные системы крови, никл Кребса, КФК-система
и т.д.;
2) интоксикационного— в нем субстраты эндо- и экзотоксико-
за. барьеры зашиты: белковый, эритроцитарный, мембранный,
внутриклеточный и г.д. а также микросомалыюе окисление;
3) тромбогеморрагического - в нем каскадный механизм усиления
реакций, полный и ограниченный протеолиз, денатурация бел¬
ков и неконтролируемое свертывание и т.д.;
4) нефротического - в нем протеинемия, механизмы се контроля,
выход белков и аминокислот из клетки и т.д.;
5) ликворно-гинертензиоиного и цереброкардиального - в нем по¬
нятие барьеров и трансмембранных систем, единство гемодина¬
мических и биохимических параметров, понятие биохимических
констант и г.д.
Поэтому изложение биохимии должно быть:
1) дедуктивным: обтис поняіия — синдромы — паю- и саногснети-
чсские механизмы - физиологические проявления — молекуляр¬
ные причины;
2) алгоритмизированным (на примере глюконеогенеза - синтеза
глюкозы - можно показать всю горизонталь процесса): фермент-
субстратные прекращения с конечным результатом (повышение
глюкозы в крови) и вертикаль — межорганные взаимоотношения
на фоне гипер- и гипогликемии:
3) предметно-наглядным: как взаимосвязь обменов (белковою, уг¬
леводною и ли і питою) т рансформируется в динамику биохими¬
ческих показателей.
Ввести в предмет понятие уровней биохимическою исследова¬
ния крови:
1) ориентировочный - как внешний ват бального;
2) конституционально-метаболический — сопоставление биохими¬
ческих показателей с внешним видом, типом конституции и жа¬
лобами больною;
11
Пранило
3) деталыю-энзимологичсский - максимальное подключение фермен¬
тов с целью разграничения цитолиза и адаптивной ферментемии;
4) лабораторно-функциональный - сопоставление с клинико-ин-
сгрумецтальными методами дня подтверждения или исключения
диагноза (ЭКГ, ЭХО КГ, УЗИ и т.д.);
5) поисково-диагностический: например, мочевая кислота — подаг¬
ра, мочевина - почечная паюлогия и т.д.
Необходимо исключить эклектическую мешанину фактов с не¬
нужной легализацией. Псі смысла механически, без понимания
сути, заучивать химические формулы и комментировать анатомо-
физиологические связи. В звездном небе фактов надо искать свои
созвездия, или более обстоятельно изучать известные без ненужного
на Пластовы ва пня лавин информации.
Должен соблюдаться главный принцип обучения - развитие ло¬
гического мышления на фоне расширения информации с постоян¬
ной коррекцией фундаментальных представлений (сути предмета,
темы, раздела). Для отого нужно провести графологическое (граф
логической структуры) разделение всех тем на главные и подчинен¬
но-второстепенные. Одновременно необходимо ин ісгрироватьс фи¬
зиологами. например, транспортную (их тема) и антиоксидантную
(наша тема) функцию зриіроиита. Сейчас ото искусственно разде-
ленная область, а без единого понимания се не объяснить состояние
эритропа, изменение гематокрита, ускорение СОЭ и т.д.
Нужна теснейшая профессиональная связь с клиницистами, сов¬
местный поиск примеров, состояний, проблем и конкретных боль¬
ных для иллюстрации биохимических основ патої сиеза.
В процессе и зучения биохимии необходимо обращаться к неко¬
торым обшим понятиям пропедевтики внутренних болезней, но без
легализации. Обя зательны примеры клинические, гак как у будущих
врачей есть к ним специфический интерес, который называется про¬
фессиональной мотивацией.
Выделяются следующие фундаментальные разделы для освоения
узких медицинских дисциплин:
1. Внутренние болезни — лихорадка, интоксикация, головная боль.
2. Медиаторные взаимосвязи и рецепторные структуры клеток в
психиатрии.
3. Анестезиология и реаниматология — молекулярные механизмы
шока, отека мозт а, синдрома полиорганной недос таточное і и.
4. Офтальмология - биохимический сое гав слезной жидкост и.
12
Правило
5. Травматология и ортопедия — биохимия костной ткани.
(>. Оториноларингология - бронхиальный секрсг, негазообмеиная
функция легких и т.д.
Биохимический и лабораторно-клинический анализ должен быть
на первом месте и как вершина айсберга обозначать место и роль
биохимических сведений в полном о нем представлении. Биохими¬
ческий анализ складывается из изучения и оценки различных видов
обмена веществ в организме:
1) белкового;
2) липидного;
3) углеводно-метаболического;
4) энзимологических корреляций,
и подразумевает определенный алгоритм действий, обучение
которому' является основной задачей дидактического процесса.
Необходимо уделить много внимания парадоксальной (сопос¬
тавление с гемодинамикой и кровообращением), оптоіенетической
(проблема зрелости и предрасположенности), адаптивной (молеку¬
лярно-клеточная трансформация обмена веществ), саноіснетичес-
кой (целесообразность изменения показателей и отношение врача
к этому) ферментемии. Ферментемия - это не обязательно цитолиз,
а прежде всего - адаптивный механизм.
Особый раздел должен быть посвяшсн эритропу и крови как
интегрирующей, а не только разбавляющей и уравнивающей среде.
Крові, переносчик кислорода, углекислого таза, витаминов, мета¬
болитов и, главное, важнейший барьер дезингосикапии.
Для всех медицинских специальностей, а тем более дня будущего
врача-биохимика. необходимо освоение следующих разделов:
1) основные параметры биохимического анализа;
2) экзотические параметры биохи мического анализа;
3) изменения биохимических параметров мод влиянием гормональ¬
ной терапии;
4) алгоритм отбора биохимических показателей:
5) алгоритм оценки биохимических показателей.
И менно биохимический анализ должен бы і ь ориентиром для от¬
бора необходимой биохимической информации.
Алгоритм анализа энзимологических показателей предполагает:
1) выделение одно- и разнонаправленных сдвигов;
2) начало анализа с общей ЛДГ, так как она позволяет подойти
к оценке эритрона в сочетании с гемаюкритом и СОЭ;
13
■ Правило
3) оценку КФК проводить с учетом ее молекулярно-энергегической
роли и в совокупности с сердечными отклонениями;
4) определить «печеночный» или «сердечный» тип изменений по
коэффициенту дс Ритиса и этим самым также установить цент¬
ральный или периферический тип сдвигов метаболизма;
5) провести анализ метаболических изменений;
6) оценить индикаторную роль ITT как показатель эндотоксикоза
или детоксицирующей системы; .
7) использовать ЩФ как органно-меїаболический (глюкозиый го¬
меостат) показатель.
В связи с этим конечным результатом прохождения курса клини¬
ческой (медицинской) биохимии должно быть:
1. Создание развернутой энзимологической характеристики основ¬
ных клинических синдромов при различных видах патологии с
использованием семи наиболее доступных и распространенных
ферментов.
2. Установление метаболического и патогенетического смысла фер-
ментемии.
3. Изучение роди энзимологических сдвигов в крови дія поддержа¬
ния важнейших метаболических констант.
4. Создание алгоритма оценки биохимических показателей крови
при анализе состояния организма.
5. Создание прогностической шкалы ферментемии при различных
видах патологии.
6. Изучение метаболической сущности эндотоксикоза при различ¬
ных патологиях.
Правило 2. Ферменты крови
для биохимического анализа
При назначении анализов для лабораторного исследования сы¬
воротки крови или спинномозговой жидкости врач в случае необхо¬
димости может заказать определение активности ферментов крови
в лаборатории любой больницы или лабораторного центра. Дія по¬
становки диагноза (в комплексе с другой информацией) часто впол¬
не достаточно семи основных ферментов, определяемых в крови. Это
так называемая великолепная семерка, отбор в которую из гемато-
энзимного множества производился самой природой (табл. 1). Имен¬
но природа, еще в условиях физиолоз ической нормы, позаботилась
о том. чтобы те семь фермен тов крови послужили добрую службу
медицине, если в организме вдруг произойдет отклонение от гомеос¬
таза, т.с. отклонение от генетически запрограммированного состоя¬
ния. Ведь в клиническом отношении ферменты, о которых идет речь,
особенно важны: как для выяснения этиологии и патогенеза забо¬
левания. так и дня суждения об общем состоянии больною, а также
и здорового человека. Ведь в большинстве случаев мы переболевасм,
даже не замечая этою, благодаря иммунной, эндокринной и нервно-
гуморальной системам. В орган из менпоіі вертикали они подчинены
высшим отделам нервной системы, но обязаны и силу своей автоно¬
мии выполнять специфическую, а точнее нормализующую гомеостаз
функцию. И именно ферментам принадлежит при этом важнейшая,
а если быть еще более точным - гомсокинетическая роль.
Термин «омеостаз» в принципе не совсем верен, ибо стаз обес¬
печивается восстановлением, т.с. гомеокииезом. Любое же движение
в метаболическом или функциональном плане невозможно без дви¬
гателей реакции (это слишком мелко но смыслу!) метаболизма. Ге¬
ниальный Клод Бернар сказал: «Постоянство внутренней среды есть
условие свободной и независимой жизни». Впрочем, динамическое
15
11 равило
постоянство состава и свойств внутренней среды организма (опре¬
деление гомеостаза) содержит диалектическое противоречие и єдин¬
ої во, свойственное любому живому и неживому явлению.
Семерку ферментов крови можно встретить практически на лю¬
бом бланке общепринятого у законенного анализа (табл. 1).
Таблица 1
Семь ферментов крови, обязательных для биохимического анализа
Сокращенное
название фермента
Активность фермента
п норме, ME*/-1
Полное название
фермента
ACT
30
Лспаргаттрансямипаза
(ас партитам и но транс-
ферата)
АЛТ
20
Алани і ггранеаминаза
(аланинаминогрансфе-
paiaj
АСТ/ДЛ Г
1,5
Коэффициент де Ри-
тиса (соотношение ак-
тивности асиартаттран
саминазы к активности
алани нтрансаминазы)
ШФ
100
Щелочная фосфатаза
ГГТ
20
Гаммаглютамилтранс-
ферата (іаммаглюта-
милтрансисптидаза -
ГГТП)
ЛДГ
250
Лактатдстидрогеиаза
Г БД
200
1 идроксибу гиратдеї ил
рогеназа (она же ЛДП
и ЛДГ2).
КФК
0-20
Крса типфосфокина за
* ME международная одиниця для намерения активности фермента
в 1 зі крови или другой биолої ической жидкости.
Такие бланки, как правило, во вклеенном виде размещают в ис¬
тории болезни. Во вклеенном, но, увы, в незаполненном, а точнее,
в не до конца заполненном виде. Практика показывает, что врачи
редко назначают определение всех семи энзимных позиций, хотя не¬
пременно должны это делать. Без них (включая все семь ферментов!)
Правило
невозможно получить полное и завершенное представление о со¬
стоянии метаболизма больного и здорового субъекта, подобно тому,
как невозможно профессионально и с аккомпанементом исполнить
музыкальное произведение без всех семи лот. Гармония прочтения
физиологическою либо патологического процесса будет нарушена,
лиши мы себя хотя бы одного, но существенного промежуточного
звена в логической цени, а тем более — начального или завершающе¬
го этапа.
Порой ферменты, о которых идет речь, именуют и «зловещей се¬
меркой», так как их синхронное звучание в определенной тональнос¬
ти в прямом смысле слова вешает зло - указывает на неблагоприят¬
ный прогноз.
Наша задача разобраться в символике, которую несет биохими¬
ческий ферментный анализ крови, перевести ее на метаболический
язык физиолога, чтобы потом, вооружившись знаниями, квалифи¬
цированно, а не механически применять навыки практического вра¬
ча. Иначе говоря; из минимально возможного и доступного миниму¬
ма извлечь максимум полезной информации.
Подчеркнем, что в табл. 1 приведены довольно жесткие кон¬
станты нормальной активности каждого фермента. В отличие от
этого, во многих пособиях и справочниках можно встретить более
динамичный норматив с широким диапазоном значений, что, по
существу, является ошибкой, фактом, не соответствующим реаль¬
ной действительности, неопровержимые доказательства чему будут
приведены ниже. Ошибки эти связаны с тем, что «так называемая
норма» определялась у произвольно взятого контингента, который
субъективно считал себя здоровой группой, и поэтому туда, естес¬
твенно, попадали лица, адаптированные к начинающейся пато¬
логии, те, кто обращает мало внимания на свое здоровье и живет
но законам внутренней прочности. Любые вариации в активности
семи ферментов, любое отклонение от указанных в табл. 1 величин
представляют собой процессы, которые клиницистам еще предсто-
и г научиться читать, понимать, использовать в лечебной практике.
Каковы же эти процессы?
Начнем с того, что для простоты понимания и единообразия про¬
чтения биохимического анализа желательно иметь величины актив¬
ности ферментов крови в одних и гсх же международно принятых
единицах измерения в МF на 1 л (М Е/л).
Кроме того, следует помнить, что ферменты в своей молекуле
имеют активный центр, к которому присоединяется субстрат (рис. 1).
17
Правило
Рис. 1. Схема взаимодействия субстрата с активным центром
фермента
Субстрат сферически соответствует активному центру и времен¬
но с ним соединяется. Происходит это чрезвычайно быстро. I Ipouecc
молниеносен и. как ядернмс реакции, трудно фиксируем для изуче
ния. После взаимодействия (реакции) из субсірата образуется про¬
дукт. Фермент же при этом не изменяется.
Теперь перейдем к изучению метаболического смысла отельных
ферментов «великолепной семерки».
Правило 3. ACT и переаминировдние
Аенартатгрансаминаза (ACT), или аспартатаминотрансфераза,
способствует образованию шавслеиоуксусной кислоты (ЩУК) из
аминокислоты аспартата (АСП) путем переаминирования - переноса
аминогруппы от ЛСП к ЩУК вместо кислородной «руины (рис. 2).
Рис. 2. Роль ACT в переаминировании аспарагиновой аминокислоты
(АСП) и щавелевоуксусной кетокислоіьі (ЩУК)
При этом сама АСП становится ЩУК, так как теряет аминогруп¬
пу. Процесс протекает как к прямом, так и обратном направлении.
Другое его название транса минирование.
ЩУК. как известно, фактически (и судя по названию) происхо¬
дит от двух аминокислот - уксусной и щавелевой.
Уксусная кислота (СНЗ СООН) имеет «лишний» атом кодорода,
полученный из молекулы воды после гидролиза ШУК. А щавелевая
кислота, в свою очередь, обладает «лишней» гидроксильной группой
(0=СОН-СОН~0). появившейся из той же молекулы воды вслед¬
ствие того же гидролиза ЩУК. Таким образом, атом водорода из
леи
ш соон
щук
СООН
19
11ранило
молекулы волы (11,0 или Н-ОН). необходимой дли гидролиза, идет
к уксусной кислоте, а гидроксильная группа - к щавелевой кислоте.
Если вернуться к схеме рис. 2 и дополнить его информацией из
рис. 3. то становится ясно: что, во-первых, АСИ представляет собой
результат многоступенчатого метаболизма белков, а ЩУК, аналогич¬
но, результат многоступенчатого метаболизма углеводов; во-вторых,
что данное взаимообратное превращение иллюстрирует перекачку
белков в углеводы и наш но своеобразной воронке. Объединяет же
белково-углеводный обмен ACT (совместно с АЛТ, конечно).
Интенсивность этого процесса (переаминирования, или транс-
аминирования) зависит отдиамст ра «воронки», а точнее, от диамет¬
ра прогиба образно представляемых нами сообщающихся сосудов,
т.е., в конечном итоге, - от активности ACT. Чем активность фер¬
мента меньше (к примеру. 15 МЕ/л), тем медленнее протекает пере¬
качка белков в углеводы и назад но сравнению с 70 М Н/л. В данном
случае «воронка шире», переаминирование протекает интенсивнее
(рис. 3).
леи ЩУК
СХХНІ СООН
» і
он, си,
Рис. 3. Зависимость интенсивности взаимного превращения белков
в углеводы от активности ACT (от «ширины воронки»)
Для переноса аминогруппы (NH,) в составе трансаминаз необхо¬
дим витамин В6 (пиридоксальфосфат или пиридоксаминофосфат).
20
Правило
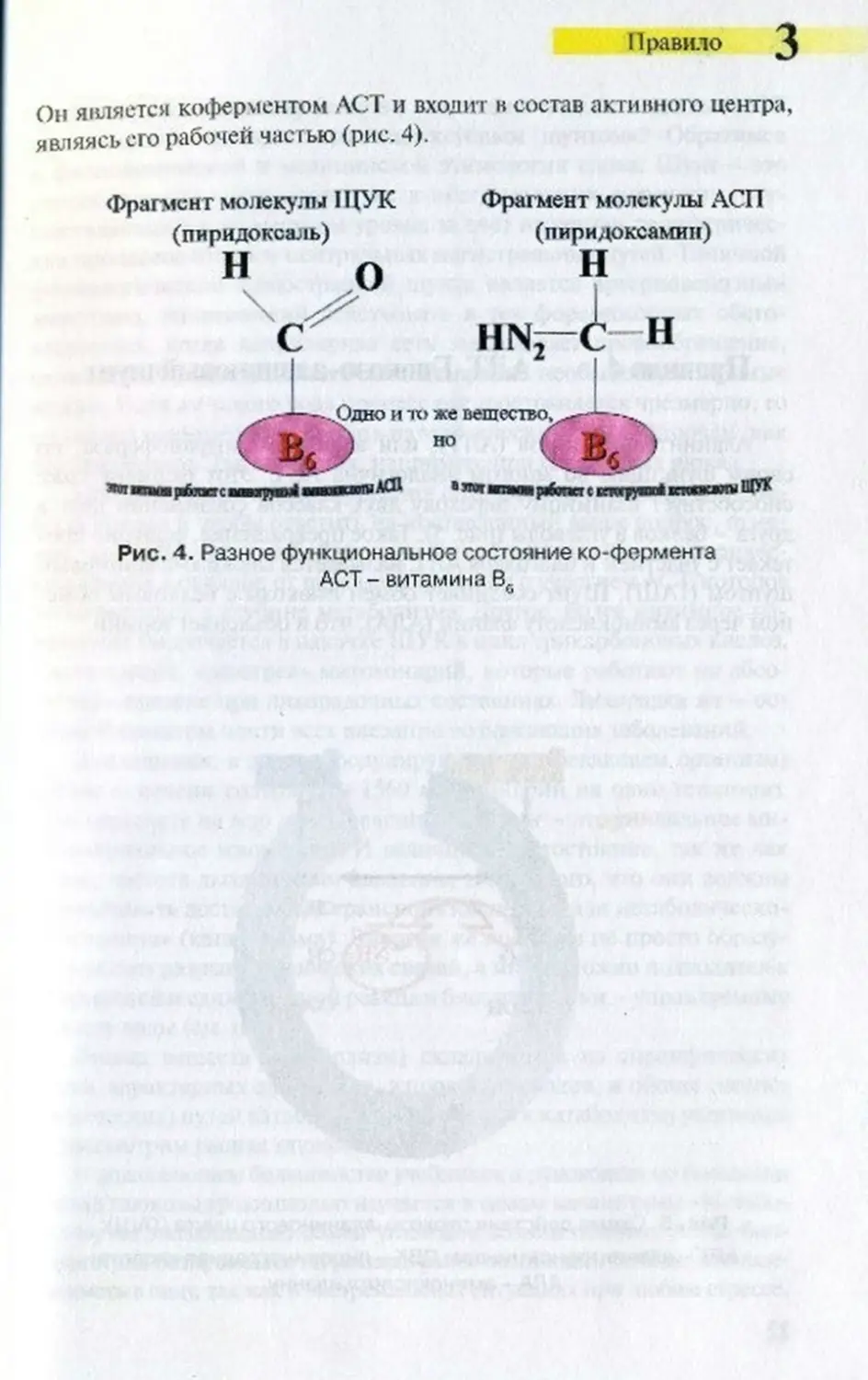
Он является коферментом ACT и входит в состав активного центра,
являясь его рабочей частью (рис. 4).
Фрагмент молекулы II ГУК фрагмент молекулы АСП
(пнридоксаль) (пиридоксамин)
Рис. 4. Разное функциональное состояние ко-ферменга
ACT - витамина Вс
Правцю 4. АЛТ. І лкжозо-аланиновьій шуігг
Аланин-ірансаминаза (АЛТ), или аланинаминотранефераза, по
своим функциям во многом аналогична ACT. Эют фермент тоже
способствует взаимному переходу двух классов соединений друг в
друга белков в углеводы (рис. 5). Такое превращение, если оно про¬
текает с участием и благодаря АЛТ. называется глюкозо-аланиновым
шунтом (ГАШ). Шунт соединяет обмен глюкозы с белковым обме¬
ном через аминокислоту аланин (АЛА), что и объясняем термин.
Рис. 5. Схема действия ілюкозо-аланинової о шунта (ГАШ):
АЛТ - аланинтрансаминаза; ПВК - пировиноградная кислота;
АЛА - аминокислота аланин
22
Правило
Почему же перекачка белков в углеводы и назад с помошыо ACT
нс именуется «аспартат-щавелевоуксусным шунтом»? Обратимся
к физиологической и медицинской этимологии слова. Шунт— это
способ защиты всего организма в экстремальных ситуациях, осу¬
ществляющийся на местном уровне за счет изоляции периферичес¬
ких процессов в пользу центральных магистра.іьньїх путей. Типичной
физиологической иллюстрацией шунта является артериовенозный
анастомоз, начинающий действовать в тех форсмажорных обсто¬
ятельствах. когда капиллярная есть задерживает кровообращение,
отнимает энер| ию, в данный момент крайне необходимую на иные
нужды. Если же такого рода процесс распространяется чрезмерно, то
он (шунт) начинает приобретать патологический смыл. Впрочем, как
все чрезмерное. Так случается, например, при сосудистых шоках.
Понятие шунта и шунтирования сохранилось и в биохимии. За¬
бої ая вперед и чтобы оіветить на поставленный выше вопрос, отмс¬
тим, что ГАШ, как и любой шунт, действует именно на периферичес¬
ком уровне в отличие 01 переаминиронания с участием ACT, которое
разыгрывается в глубине метаболизма. Другое, более интимное на¬
значение заключается к накачке ЩУК в цикл трикарбоновых кислот,
иначе говоря, «разогрев» митохондрий, которые работают на абсо¬
лютом пределе при лихорадочных состояниях. Лихорадка же - ос¬
новной симптом почти всех внезапно возникающих заболеваний.
Для справки: в онергопродуцируютцем (согревающем организм)
органе печени содержится 1560 митохондрий на один гспатоцит.
При пересчете на всю массу печени - 1,5—2 кг - это уникальное ми¬
тохондриальное множество. И величина эта постоянна, гак же как
пульс, частота дыхания или давление, в силу тот, что они должны
обеспечивать достаточный транспорт кислорода для метаболическо¬
го «горения» (катаболизма). Энергия же при этом не просто образу-
еіся за счет разрыва химических связей, а многосложно подводится к
главнейшей и единственной реакции биознсріетики - управляемому
синтезу воды (см. ниже).
Распад веществ (катаболизм) складывается из специфических
путей, характерных ятя белков, жиров и углеводов, и общих (неспс-
цифических) путей катаболизма. Обратимся к катаболизму углеводов
и рассмотрим распад глюкозы (рис. 6).
В подавляющем большинстве учебников и руководст в по биохимии
Распад глюкозы традиционно изучается в самом начале темы «Метабо¬
лизм», но эволюционно обмен углеводов возник позднее. А вся био¬
энергетика базировалась на распаде ранее возникших белков. Это важ¬
но иметь в виду, так как в экстремальных ситуациях при любом стрессе.
23
Правило
ОДгОб
s
І
спа*фиескнй путь
распад» глокозы в побочном
сочетании с ГАИ]
2ПВК (СЛ
общий неспецн-
фжсскнй путь
распада глюкозы
(С2) потеря
атома углерода от ПВК за счстдскарбокпотроваинн.
Это - игипьный этап образования выдыхаемого
углекислого газа в процессе тканевого дыхания.
8 1
а
8
&
О 1
Пі
: Г
1 J
Водород
8 і
і
II
II
S i
„ж
щ второй общий
™,K03MV.iV.w',inS'lI),
переаминирование с участием ACT.
Вода
КШИ*
третій общий неспеинфнчсский пуп.
распада глюкозы
• итог всего метаболизма углеводов
Рис. 6. Обобщенная схема метаболизма углеводов
в юм числе при инфекции, травме, алкоголизме, организм переходит
па более древний способ энергоснабжения. И первой при этом, подоб¬
но «шагреневой коже», начинает трапіться именно белковая мазрица
организма, что, на первый взгляд, нецелесообразно для обычных усло¬
вий. но абсолютно необходимо дня экстремального выживания.
Специфическим для глюкозы путем распада является гликолиз
начальный этап метаболизма углеводов. В результате десяти реакций
гликолиза образуется пирониноградная кислота (I ІВК), или пируват.
На стадии ее образования заканчивается специфический для глюко¬
зы путь метаболизма. И начинаются обшиє, нсснеиифическис пути.
Их гри: 1-й, 2-іі и 3-й (рис. 6).
24
Прамило
Первый общий неспецифический путь .метаболизма углеводов — это
окислительное дскарбоксилирование ПВК. Неспеиифичность дан¬
ного биохимического направления объясняется тем, что ПВК может
метаболизировать подобным обра юм, будучи производной нс только
от углеводов, но также от белков и жиров. Рассмотрим два послед¬
них источника происхождения. Белки (прежде всего, аминокислота
АЛА). В организме АЛА больше, чем других аминокислот, именно
потому, ЧТо АЛА- источник ПВК. К примеру, в крови присутствует
свободно плавающий АЛА в количестве около 40 г, а также запако¬
ванный в эритроциты как буфер. Жиры как источники ПВК пред¬
ставляют собой глицерин.
Молекула ПВК- облалателырехатомовуглерода (СН£ОСООН).
На начальном этапе декарбоксилирования один атом углерода «теря¬
ется» в виде углекислого газа (СО,). Именно этим отщеплением объ¬
ясняется «нехватка» атома углерода в молекуле ацетилкоэшима А
(Ацс г ил-КоА) окончательного продукта окислительного декарбок-
силирования ПВК (рис. 6). На этом интересном моменте мы подхо¬
дим к понятию «тканевое дыхание». Ведь упомяну тая молекула СО,
представляет собой ни что иное, как первую порцию образующегося
выдыхаемого углекислого газа!
Но вернемся к продукту окислительного декарбокеилирования
ПВК - аиетид-КоА. Эго вещество не случайно считают «дровами»
иди «углем» дія метаболического «когда». Ацстил-КоА, действи гель-
но, буквально сгорает в цикле Кребса.
Второй общий неспецифический путь метаболизма углеводов - это
никл Кребса I. или цикл три карбоновых кислот (ЦТК), в котором
в результате сгорания ацсгил-КоА образуется ешс две молекулы
углекислого газа. При этом происходит и четыре дегидрирования.
Иначе говоря, образуется водород (рис. 6,7). По существу. I ('ГК - это
энергетическая тонка организма, ацетил-КоА (как уже было сказа-
мо) - «дрова» для нее. Образование водорода в ней имеет колоссаль¬
ное значение, гак как он отправляется в дыхательную цепь.
бустий общий неспецифический путь метаболизма углеводов — это
Дыхательная цепь, он же - цепь переноса электронов, он же цепь
•каневого дыхания. В разных учебниках можно встретить любой из
ЭТИХ синонимичных терминов.
В дыхательной цепи образовавшийся в цикле Кребса I водо¬
род идет на встречу с кислородом вдыхаемого воздуха, в результате
чего, конечно, образуется вода - итог всего метаболизма углеводов
(рис. 6, 7). За сутки в состоянии относительного покоя в дыха гель-
ной цепи синтезируется 0,5 л воды.
25
Правило
Лцсім 1-КО-ЦПИМ Л
Рис. 7. Биохимический итог цикла Кребса
В неживой природе тоже существует процесс синтеза волы, из-
вестный под названием «реакции гремучего газа». Она протекает
е взрывом из-їл своей высочайшей теплоемкосіи:
2Н. + О, = 2Н,0 -+ 56 к кал ?
Такой гремуч сети и быстротечности синтеза воды способствуют
условии: I) сухость (отсутствие влажности); 2) чрезвычайно высокая
температура.
Важно, что вся биознері епіка дышащих кислородом сущест в ос¬
нована на этой реакции. Вдыхательной цепи (in vivo) происходит тот
же самый син тез воды, но менее бурный и драматичный, не гремучий,
так как он является управляемым, а значит, замедленным. И этому
снова способствуют два условия, зеркально противоположных тем,
что были в неживой природе: I) высокая влажность, даже сырость;
2) оптимальная температура +37 “С.
В принципе, процесс сгорания или катаболизма углеводов можно
свести к следующей реакции:
С,,Н12Оь- 60. -> 6С0, + 6Н,0 + 686 ккал Т
В многоступенчатом специфическом пути распада углеводов —
гликолизе - участвуют десять ферментов (рис. 6), к действию кото¬
рых может подключаїься и АЛТдля работы с ПВК к качестве альтер¬
нативною пути метаболизма. AJ1T не подключится, если в организме
26
Правило
относительное спокойствие: достаточное количество глюкозы и гли-
когена Ситуация же с подключением АЛТ (ГАШ) может возникнуть
при необходимости для организма поддерживать уровень глюкозы в
крови в экстремальных патологических состояниях. Именно на на¬
чальном этане катаболизма глюкозы, входе гликолиза может сраба¬
тывать и IAUI. поэтому он и называется «шунтом», ведь его функ¬
ционирование осуществляется «поверхностно», на биохимической
периферии. В отличие от этого персаминирование с учааием ACT
протекает ілубже. Вслед за гликолизом наступает окислительное дс-
карбоксилирование (1-й общий путь катаболизма углеводов), в кото¬
ром участвуют три фермента, а лишь затем - никл Кребса (2-й общий
путь). И только здесь, в цикле трикарбоновых кислот (цикле Кребса)
наряду' с остальными девяз ью ферментами вступает в свои права ACT.
объединяя трансамшшрованием углеводный и белковый обмены со
значительно большей интенсивностью, чем при действии ПАШ.
Далее, вдыхательной цени, где происходит итоговое обра ювание
СО, и Н,0 (рис. 7), вдыхаемый кислород из легких проходит через:
1) эритроциты;
2) гемоглобин;
3) эндотелий;
4) рыхлую соедините.!ьную ткань и попадает в митохондрии.
Переводя описанные процессы на метаболический язык, можно
обобщенно констатировать, что живой организм, в том числе орга¬
низм человека, дышит митохондриями. Так как именно в митохонд¬
риях синтезируется вода как итог углеводного метаболизма.
Важнейшим компонентом метаболизма углеводов является глю-
конеогенсз — образование глюкозы из неуглсводистых компонентов,
т.е. производство повой (нео. new) глюкозы. Его биохимическое мес¬
то находится «в районе» ГАШ (рис. 8).
Глюконеогенез представляет собой многоступенчатый переход
белковых комплексов в аминокислоты (например, в АЛА), затем -
действие ГАШ (образование ПВК). а затем преобразование ПВК
в глюкозу. Каждый из названных процессов является обратимым, но
глюконеогенез протекает именно в таком направлении.
і АШ и глюконеогенез в целом - более оперативный и мощный спо¬
соб синтеза необходимой глюкозы и поддержания ее уровня в крови и в
м°згс, по сравнению с каким бы го ни было другим путем образования
сахара. Но подобного рода мобильность прекращается на уровне 1-го
общего пути метаболизма углеводов- на переходе ПВК в ацетил-КоА,
1j,k как процесс «ПВК —► ацетил-КоА* является необратимым.
27
Рис. 8. Функциональные соотношения глюконеогєнєза, глюкозо-
аланинового шунта и трансаминирования с ACT:
АЛТ - аланинтраксаминаза; ACT - аспартаттрансаминаза
В соответствии с этим реакция персами нирования с ACT протекает
на более глубинном, клеточном уровне, а следовательно, оказывается
более отдаленной от глюкозы (и гораздо более интенсивной в от по¬
тении перекачки белков в углеводы и назад). Как уже было сказано,
переаминирование происходит в НТК (рис. 8) и представляет собой
образование ЩУК один из основных субстратов этого цикла, ею
центральный метаболит. Со ЩУК начинается ЦТ К (или цикл Кребса).
Без ЩУК цикл не состоится. Иными словами, без ЩУК метаболичес¬
ки й котел не будет запущен. Если же ЦТК состоялся, то конечным его ]
соединением оказывается лимонная кислота (ЛК):
ЩУК-* ацетил-КоА->ЛК
Отсюда видно, что интенсивность сгорания ацетил-КоА в цикле 1
Кребса напрямую зависит от концентрации ЩУК, а значит, от ин¬
тенсивности псрсаминиронания с участием ACT. В этом случае новы- I
шенная активность ACT выступает маркером «разогрева» митохондрий
(интенсификации конечных путей катаболизма), а вовсе нс «призна¬
ком поражения сердца*, как это было приня ю считать ранее.
Правило 5. Биологический смысл работы
двух транеаминаз: ACT и АЛТ
Для рассмотрения физиологического смысла работы двух транс*
аминаз необходимо вернуться к понятии» глюкозо-аланиноного
шута (ГАШ) и напомнить себе о том, что он является своеобразной
метаболической периферией. Это означает, что в ГАШ заключена
возможность организма мобильно ♦уйти* от сжигания углеводов,
если таковое уже началось, и вернуться к анаболизму, т.е. к глюконео-
генезу. Такой довольно легкий взаимный возврат от растраты к на¬
коплению, от катаболизма к анаболизму сплошь и рядом происходит
как в нормальных, так и в патологических условиях.
Пройдя через 1-й обший путь углеводною обмена - окисли гель-
нос декарбоксилирование ІІВК- живой организм вступает в цикл
Кребса, іде происходят глубинные катаболические процессы. Здесь
наибольшей биологической важностью обладает биохимическое пре¬
вращение АСП в 1ЦУК с участием ACT, т.е. интенсификация ♦ топки»
в никле Кребса, происходящее за счет увеличения количества ЩУК.
ACT активирует пикт Кребса, так как благодаря се рабоїе происходит
поставка ЩУК. крайне необходимой для запуска всего метаболичес¬
кого котла.
Поэтому ACT служит универсальным показателем интенсивнос¬
ти катаболизма на конечных ею этапах или критерием стимуляции
митохондрий. Ведь цикл Кребса протекает именно в митохондриях.
В огличие от лого ІАШ и гликолиз происходят в цитозоле. Для
облегченною проникновения вновь образовавшейся ЩУК в мемб¬
рану митохондрии существует челночный механизм. В нем участвуют
АСП и малат. поэтому механизм так и называется «аспартат-малат-
ный*. АСП проникает в митохондрии и там начинает превращаться
н ЩУК, конечно, благодаря переаминироваиию с участием ACT.
Иными словами, АСП - это транспортировщик ЩУК. ее дорожная
29
Правило
упаковка. Ведь сама молекула ЩУК не может попасть к мембрану мі
тохондрии, потому что мембрана для этой кислоты непроницаема.
Возникаеі вопрос, зачем природе необходимо было создала!
подобные «неудобства» и осложнения? 11о смысл столь изб и рате J ц
ной проницаемости митохондриальной мембраны в данном с луча!
заключается в і ом, чтобы воспрепятствовать не столько входу, сколь]
ко выходу ЩУК и з митохондрии. Нели бы препятствий не было,
молекула ЩУК свободно входила и выхолила бы из органоида. 11<
ЩУК нужнее внутри этой биоэнергетической клеточной субсгаї
нии. Она там крайне необходима для цикла Кребса, для «топки»
для работы метаболического котла. Поэтому природа позаботилась
о том. чтобы не терять пенное топливо, а. наоборот, придержать сі
в печи.
Становится ясно, почему повышенный уровень активности АС
в крови (оі меченный в результатах биохимического анализа больно
го) является при знаком следующих процессов:
1) активации митохондрий;
2) усиления катаболизма;
3) стимуляции трансмембранного переноса;
4) разоірева организма, в том числе лихорадочного процесса;
5) контроля над ферментами ЦТК.
ACT единственный фермент, который взаимодействует со все¬
ми другими ферментами этого цикла. ACT - прожорливое животно
и маркер катабодически-митохондриальных процессов. Преобразо¬
вание ДСП в ЩУК - процесс обратимы». 11о направление
ACT
АСП -> ЩУК
преобладает в митохондриях, а обратный процесс АСП <- ЩУК)
(с участием гого же фермента ACT) доминирует вне митохондрий,
в крови, чтобы дать возможность образования ДСП - посредника]
ДЛЯ трансмембранного, траисмитохондриалиного переноса ЩУК]
в метаболическую топку.
Кроме того, АСП родственен крови. Это обычная и привычная
для внутренней среды организма аминокислота. ЩУК же более «чу¬
жеродна» крови, она может сбить pH с константного уровня.
Кроме того, присутствие аминогруппы (из молекулы АСП) внут¬
ри митохондрий крайне нежелательно, так как это чревато засоре¬
нием важнейшей энергетической станции клетки при случайном дез¬
аминировании аммиаком.
В отличие от этого роль АЛТ в ГАШ, в основном, заключается
в перекачке белков н углеводы и назад, а не пропуск углеводов
30
Правило
вниз* для сжигания в цикле Кребса. Впрочем, в особых экстре¬
мальных ситуациях, например при голодании, лихорадке или
алкогольном психозе, ГАШ иногда, н качестве исключения нсе-
•гаки пропускает углеводы «вниз*, в цикл Кребса. Цикл при этом
счужит своеобразной втягивающей воронком для углеводов. В
побом случае, ГАШ работает на глюкоіу и над ним главенствует
гтюкоза - объективный признак здоровья и жизни. Именно глю-
консогенсз, осуществляющийся через ГАШ. поддерживал жиз¬
ни заключенных в концентрационных лагерях, піші последние
белки в глюкозу. Несчастные люди при этом истощались, но не
умирали.
По существу, АЛТ и ACT находятся в реиинрокныхсоотношениях.
При этом АЛТ в большей мере отображает уровень анаболизма. АС Г
наоборот. - интенсивность катаболизма, а совокупность сопряженных
актинносчей ♦АЛТ ACT* предегашіяет собой в упрошенном виде
обший маркер всею обмена веществ (метаболизма). Соответственно,
в случае интенсивного роста, в процессе гипертрофии скелетной мус¬
кулатуры, при ожирении или во время беременности в данной паре
преобладает активность АЛТ. И наоборот, во время интенсивных мы¬
шечных нагрузок, голодания, лихорадки, при старении или на фоне
кахексии доминирует активность другой грансаминазы ACT.
Для суждения о соотношении ката- и анаболизма в клинике
вычисляют коэффициент де Рптиса — ACT/.АЛТ. Его нормальная
величина для взрослою человека в условиях покоя равняется 1,5
(табл. 1). Это означает, что уровень активности ACT превышает
таковой у АЛТ в 1,5 раза. Иными словами, в здоровом организме
катаболизм слегка преобладает над анаболизмом. Активно живу¬
щий организм (вне беременности, роста либо реконвалесиеппии)
все-таки немного больше тратит, чем приобретает. Видимо этим и
объясняется существующая у человека довольно мощная потреб¬
ность в экономии сил, в элементарном отдыхе, предохраняющем
его от истощения.
Повышение величины коэффициента де Ритиса указывает на
усиление процессов катаболизма. К примеру; активность ACM равна
АЛТ - 10. Тогда АСТ/АЛТ составляет величину 6,5. В этом случае,
организм «горит». Так бывает при іяжельїх лихорадочных состояниях
-''ибо на фоне алкогольного делирия. Если же ACT — 10, АЛТ S0,
•^СТ/АЛТ — 0,12, то происходит явное выздоровление, организм вос¬
станавливается после интенсивных трат, преобладают анаболические
Процессы.
Рассмотрим конкретный клинический пример.
31
Правило
Больной С-ов Е.В., история болезни № .311, ЗО лет. Поступні
во 2-ю Клиническую инфекционную больницу г. Москвы. Заболел
14.01.05 после злоупотреблением алкоголем (пил водку).
Динамика его показателей представлена в габл. 2.
Таблица 2
Динамика биохимических показателей больного алкоголизмом
Показатель
Дата-
Клинико-ла-
бораторлыс
синдромы
18.01.05
20.01.05
27.01.05
ACT.
МВ/л
507
310
99
«Тушение» ми¬
тохондрий
АЛТ МВ/л
222
227
130
Активность
ГАШ
АСТ/АЛТ
2,28
1,36
0,76
Соотношение
капі- и анабо¬
лизма
Глюкоза,
ммоль/л
5,4
4,1
Компенсатор¬
ный уровень
Холестерин,
ммоль/л
5,7
4,1
Дефицит
ацетил-КоА
ЩФ, VI С/л
690
755
567
Избыточный
фонд фосфа гов
Обший
белок, т/л
82
74
68
Выжигание
белков
организма
Мочевина,
ммоль/л
12.4
5,12
3,4
Дефицит’
аминогрупп
Креатинин,
мкмоль/л
94
87
72
Консервация
креатина
Билирубин,
мкмоль/л
28
22
20
Токсический
гемолиз
С момента поступления: лейкоцитоз 7.8 тыс. в мкл, п/я 20%,
с/я - 61%, лимфоциты — 10%, моноциты - 9%, СОЭ - 24 мм/ч.
Из данного анализа видно, что с момента поступления в клинику
глкжонеогенез был интенсифицирован для повышения уровня глю¬
козы до минимально допустимых значений (5,4 ммоль/л) и гипогли¬
кемического уровня (4.1 ммоль/л).
32
Правило
Эти изменения происходили на фоне сверхактивации митохои-
іриґі (при посуплений в стационар - 507 МЕ/л) с последующим
резким тушением, но бел нормализации (99 МЕ/л). «Горение» мито¬
хондрий требовало усиления ГЛШ, что хорошо иллюстрируется ди¬
намикой АЛТ (от 222 до 130 МЕ/л). а также отношением трансами-
иаз. когда вначале они имеют катаболический смысл (коэффициент
ле рлтиса 2,28), а в последствии - анаболический (0.76). Этот пример
показывает, что помимо абсолютных значений обязательно необхо¬
димо рассчит ывать соотношение активностей трансаминаз, которое
раскрывает истинный характер изменений.
Правило 6. ГГТ — фермент мембранного
транспорта аминокислот
Весьма распространенное мнение о том, что основным и опера]
тинным источником глюкозы для любых жизненных проявлением]
служит гликоген печени, является ошибочным. На самом деле гли-
когенолиз включается, пожалуй, лишь при стрессе па фоне резкоі
активизации сим патоадреналовой системы, и действие его расщ
страняегся не больше чем па 1,5-2,0 ч. В основном же, и н норме,
и при патологии, и при напряженной «шатании глюкоза поступав
и кровь с помошью глкжонеогенеза.
Интенсификация же глкжонеогенеза возможна лишь при опти¬
мальном поступлении необходимого для этого субстрата - амино¬
кислот.
В организме существует 5 белковых (аминокислотных) пулов или j
«источников»:
1) ближайшим и еамым доступным дтя метаболизма ііулом являют¬
ся аминокислоты крови. Поэтому они называются свободными;
2) за ними (по значимости и востребованности) следуют аминокис¬
лоты клеток;
3) затем аминокислоты межклеточного вещества — рыхлой соеди¬
нительной ткани (коллагена и эластина);
4) аминокислоты мышц:
5) аминокислот остальных органов, в том числе головного мозга.
В обычных условиях человек между приемами пищи может обой- j
тись кровяным пулом. Но если прием нищи откладывается и этот]
период затяги кается, то подключается клеточный пул. Этим под¬
ключением и занимается гомми-гдютамшнпрансфераш (ГГТ). Она
выполняет транспортую функцию. Транспортирует ГГТ именно те
аминокислоты, которые, закончившись водном пуле, заимствуют#
дія глкжонеогенеза из другот пула, затем - из третьего, затем из
четвертого, и, наконец, - из пятого.
34
Правило
Дело в том. что аминокислоты проникают в ткани против і-ради-
ента концентрации, для чего нужен активный іранспорт. Роль актив-
1)01Х) транспортировщика играет ГГТ. Эго происходит при минималь¬
ном (но в то же время нормальном, табл. I) уровне се активности,
равном 20 VlF./л, Любое повышение данного уровня свидетельствует
об эпизодическом или постоянном заимствовании аминокислот из
клеточных пулов. «Общепринятая норма» до НМ) МЕ/л (что можно
встретить в других руководствах) на самом деле указывает па физио¬
логический или патологический дефицит аминокислот в целом ор¬
ганизме. Уровни активности ГГТ вплоть до гигантских значений (до
КИЮ М£/л) говорят о мощном заимствовании аминокислот из тка¬
ней для дальнейшего глюконеогенеза чере і АЛТ.
Так, например, при синдроме выжигания собственных белков
на фоне длительной алкоголизации повышение ГГТ является мар¬
кером адаптации к алкогольному стрессору. У больного чрезвычай¬
но активно заимствуются белки из собственных аминокислотных
пулов. Чем выше активность ГГТ, тем лучше алкоголик переноси г
токсикоз, ведь си) адаптивные способности выше. Образно выража¬
ясь. высокая активность ГГТ — это широкие ворота в собственные
белковые резервы.
Существует понятие онтогенетической ферментемии. Ее ил¬
люстрацией может служить возрастная динамика ГГТ. При рожде¬
нии уровень ГГТ составляет онтогенетический максимум, равный
НМ) МЕ/л. Это объяснимо необходимостью обеспечения интенси¬
фикации белкового метаболизма для роста и развития. К моменту
полового созревания уровень активности Г ГТ снижается до мини¬
мальною- 20 МЕ/л. Полому низкие значения активности ГГТ
У 5-12-летних детей можно рассматривать как признак их ohtojv-
нетической незрелости.
Кроме того, ГГТ может являться маркером малигпизации (пе¬
рехода нормальной ткани в опухоль), а также аллергизайми, что по
смыслу не противоречит вышесказанному, так как опухоль является
ловушкой аминокислот, способной довести органи зма до кахексии.
Лллсргизации - это не что иное, как накопление производных
гис тидина в эозииофилах и серотонина в тучных клетках, что также,
собственно, и представляет собой мощное перемещение аминокис-
л°т между клетками.
Т относится к глютиі ионовой антиоксидантной системе. Не
Ро.н, резко возрасіаст при любом стрессе. ГГТ хорошо индуцируема,
1,е* ІУТКРЬіта для внешних воздействий, а также алкоголъно-наркоти
"-скц-медикаменюзно зависима.
35
) Правило
Таким образом, I ГТ является:
- аминокислотным насосом (транспортирует аминокислоты через
мембраны в клетки, обеспечивает адекватный уровень общего
белка в плазме);
- маркером малишизации;
- маркером интоксикации (утилизирует потенциально гоксичные
аминокислоты и з плазмы);
маркером аллергизашш;
- маркером онтогенетической зрелости;
- аптиісннмм компонентом;
- модулятором активности других ферментов;
- антиоксидантом (глутатион);
- активатором глюконеогенсза в условиях недостаточности инсу¬
лина;
- маркером регенерации и онкогенеза.
Наиболее выразительно ферментемия (сверхпормаїьнос повы¬
шение уровня активности фермента н крови) по ГГТ выявляется при
алкоголизме, гена і игах, а также инфекционном мононуклеозе (ИМ).
В клинической практике Вы можете встретиться и с такой си¬
туацией (табл. I). Из таблицы видно, что активность ACT к среднем
повышена в пять, АЛТ - в девять, активность ЩФ в три. а ГГТ пре¬
вышает нормальные показатели в 8,5 раз. Значительный разброс ак¬
тивности ферментов в «цитоплазматической* (ACT .АЛТ) и в «мемб¬
ранной'» (ЩФ, ПТ) парах заставляет по-иному оценивать их роль.
Таблица 3
Среднестатистическая характеристика активности ферментов
у больных инфекционным мононуклеозом
ACT, МЕ/л
АЛТ, МЕ/л
ЩФ, МЕ/л
ГГГ, МЕ/л
Среднее
149,9
186,5
335.1
85,3
Интервал
567
859
929
711
Минимум
8
4
21
2
Максимум
575
863
950
713
«Идеальная»
норма
30
20
100
10
Несмотря на высокую ферментемию преимущественно печеноч¬
ных ферментов, дополнительными методами обследования наголо-
Пранило
пій печени (УЗИ) не было вы явлено, что не удивительно, учитывая
•ІИ ІМИСЗ и возраст больных. В спязи с этим необходимо объясни гь не
только высокие уровни активности, но и их значительный разброс.
13 го же время «печеночный» коэффициент де Ритися является по¬
казателем усиления аминокислот ГАШ при лихорадочном синдроме.
Энергетическим субстратом лихорадки является н первую очередь
глюкоза, а точнее аиетил- КоА и субстраты цикла трикарбоновых кис¬
лої. которые легко образуются из аминокислот (ЛМ К) и жиров. ГИГ
необходим дія поддержания адекватного уровня глюкозы в услови¬
ях лихорадки и интоксикации. О его значительной интенсификации
свидетельствует нс только низкий коэффициент де Ритиса. но и вы¬
сокая активное і ь АЛТ. Гормоиад ьной основой стресса при инфекции
является стсровдоіенез, который активирует ГИГ. ГНГ начинается с
пируката или ЩУК, образующихся из аланина и аспартата иод дей¬
ствием соответственно /VI Г и ACT. Именно глюкокортикоиды сти¬
мулируют 7-кратно образование АЛТ с периодом иолужизни 84 ч
и одновременной задержкой ее распада. Координированно с АЛТ
увеличивается синтез аргиназы (конечный фермеш цикла синтеза
мочевины) с периодом полураспада 96 ч, что предполагает эффектив¬
ную нейтрализацию образующегося аммиака после использования
АМК. Признаком его активации является повышение уровня актив¬
ности АЛТ' что установлено экспериментально и находит клиничес¬
кое подтверждение.
С точки зрения классической теории регуляции метаболи зма ко¬
нечной его целью является поддержание энергетического гомеостаза,
что реализуется через интенсификацию ГНГ, с потреблением необхо¬
димых субстратов при помощи ЩФ и ГГГ (табл. 3). С учетом роли
ферментов в метаболизме и их локализации по отношению к ЦТК
(онсріетический котел организма) в качестве стержневого показа¬
теля для оценки нами была выбрана активность ГГГ регулирующей
поток субстратов чере з мембрану. Фермент обеспечивает энерпт зави¬
симый транспорт АМК в клегки (35 и\% в сыворотке и 520 мг% втка-
НЯХК поддержание уровня общего белка н крови в норме и патологии,
л также разрешение дисиротеиисмии. ГГТ- ключевой фермент в сис¬
теме детоксикации и стабилизации пула АМК, дисбаланс которых
является важнейшим механизмом токсикоза. Именно ПТ является
наиболее стабильным показателем, и рост а о активности наблюдает¬
ся в ситуациях, когда недостаточно роста акт явности трапсаминаз.
Из классической биохимии известно, что существуют различные
гипы интенсивности обмена веществ— «быстрый» и «медленный»
37
Пранило
метаболизм. Это обусловливает разные метаболические сдвиги при
лихорадочном синдроме, т.е. «быстрый* метаболизм требует одних
механизмов, а ♦медленный* других, что частично объясняет вари¬
ативность показателей. Одновременно существуют 4 уровня регуля¬
ции метаболизма:
1) субстратный:
2) модификапионный (на уровне структуры ферментов);
3) белковый (через изоформы ферментов и іеном);
4) гормональный (синтез и распад). Молекулярная модификация
ЩФ связана с гликозилированием, а это влияет на взаимо¬
действие се с мембранами при гормональной регуляции. Все
это вместе и объясняет многообразие клиники, основанной на
различных механизмах адаптации на уровне метаболизма.
Правило 7. Показатель «общего белка»
крови
Термин клинической биохимии «общий белок* крови пред¬
ставляет собой сумму всех белков, находящихся в крови на момент
анализа. В норме он должен равняться 100 г/л. Хотя в большинстве
справочников предлагается стандартный норматив - 65 85 г/л. Но
в этом «нормативе* заведомо содержится непонимание очевидного:
количество всех белков, находящихся в крови на момент анализа. -
жесткая генетическая константа. В норме она не может иметь столь
явный индивидуальный разброс. Почему?
Дадим на этот вопрос сугубо биологический ответ. В организме
тотально синтезируется около 100 000 белков. Обший белок, как вер¬
шина этого айсберга, енилетельсівует о іенетико-физиологическом
благополучии.
В крови можно определи 1Ь около 100 белков. Весь геном
(примерно 8 іьісяч генов) представляет собой отрезок ДНК, ко¬
торый мысленно можно «вытянуть* во весь росі человека и даже
больше. Его длина — 2 м. Гены упакованы в 46 хромосом и дают
с этой ДНК информацию обо всех реально синтезирующихся
100 000 белков.
В разных клеіках работает разное число генов. Самая примитив¬
ная клетка эритроцит - не имеет ядра, а значит, не имеет и генов.
Но ее предшественник ретикулонит располагает 8-ю генами. Самос
большое количество функционирующих генов - в нервных клет¬
ках: 1560 генов в одном нейроне. (В клетке печени - гепатоиите —
ЗОО генов, в почечной клетке - 800 генов.) Чем больше генов, тем
больше требуется аминокислот и белков. Поэтому у нервной системы
сила. отсасывающая аминокислоты, не сравнима ни с каким другим
живым функциональным аппаратом. Ее можно сравнить с самым
мощным пылесосом! В связи с этим потенциально в фи шологичес-
39
Правило
ком отношении в целостном организме всегда существует нехвагк
аминокислот, и особенно этот дефицит ощущает мозг.
Движение аминокислот к мол у напоминает движение электро
поездов в час пик. В онтогенезе в процессе жизнедеятельности МО}
развивается. И чем интенсивнее протекает cm развитие, тем больша
у него потребность в аминокислотах. Ведь серое вещество, синаи
сы — это не что иное, как аминокислоты и белки. В организме взрос
лого человека уровень белка в физиологических условиях не може
претерпевать резких колебаний. В белке всегда сеть хоть нобольшо
дефицит.
Образование одной пептидной связи (для соединения белков из
аминокислот) требует около 15 молекул АТФ - это очень энсргосм
кий процесс. Исчезновение из крови 1 і белка означает потерю 30 г
белка в тканях. Если из крови уйдет 2 г белка, то из тканей исчсзне
тоже в два paw больше 60 г белка, 3 г повлекут за собой потер'
90 г, 4 г - 120 г и т.д. Поэтому еше раз подчеркнем, что «общий белок
крови* в норме не может иметь значительный разброс значений, если
человек: а) хорошо питается, б) нс болеет, в) созрел, является взрос¬
лым. В этом случае величина «общего белка крови» жестко генети¬
чески детерминирована.
Оісюда следует, что если у двух больных при прочих равных усло¬
виях уровень общего белка различен, то эк» чате веет следует рас¬
сматривать как признак благополучия в'одном случае и как признак
резкого неблагополучия - в другом. Лучше же имеїь высокое зпаче-1
ние «общею белка», чем низкое. Например, число 85 лучше, чем 65,
так как 65 — указывает на дефицит:
— иммунной еисісмьі;
— системы комплемента;
— бактерицид ной белковой системы;
системы транспорта жиров.
Правило 8. Строение белков как
иллюстрация их структурно-
функциональной роли
в формировании живых систем
Любой из нас б конечном итоге БОЛЬНО или невольно приходит
(либо подходит) к одному из определений жизни. Первый вариант
определения: «Жизнь есть способ существовании белковых тел»
(Ф. Энгельс). Второй вариант: «Жизнь есть искусство делать кыводы
на основании недостаточных предпосылок» (Ф. Бушеляр). Задачей
настоящей статьи является поиск путей к согласованию этих двух по¬
нятий. Начнем с первого.
В 1871 г. немецкий физиолог Р. Пфлюгер утверждал, что основ¬
ным носителем жизненных функции является про і оплата, а н ней,
в свою очередь, — так называемый «живой белок», который отличает¬
ся от «мертвою» способностью к саморазложению. Он также допус¬
кал, что «мертвый» белок используется в процессе питания растений
и животных.
Известный химик К. Шорлеммср познакомил своего друга,
Ф- Энгельса, с трудами Р. Пфдюгера, из которых Энгельс и заимство¬
вал представление о тождестве «живою» белка и жизни. С этою мо¬
мента началось, и продолжается но сей день, интенсивное изучение
структуры белка.
Первичная структура белка является нижним этажом формиро¬
вании белковых молекул. Следующий уровень организации предпо¬
лагает вариативное взаимоотношение альфа-спирали, бета-структу-
ры и беспорядочного клубка (рис. 9).
На уровне третичной структуры в дополнение к простым ХИМИ¬
ЧЕСКИМ связям (пептидной, водородной, дисульфидпой И Т.Д.) тре¬
буется стерическое соответствие, или иначе - комплемептарность.
41
8
11 ранило
1 Іослсді icc свойство в сочетании с компак і ностыо и растворимоегьи
формирует новое качество — нативность. На следующем уровне oi
ганизации (четвертичная структура) происходит формирование нг
молекулярных комплексов, или олигомерных структур. В дальне!
тем организация биологических структур требует взаимодеистві
с липидами, обеспечивающими образование мембранных структу
и органоидов. И далее создаются клетки, ткани, органы, организм!
сообщества, популяции, нации.-любые живые субстраты вселен но]
(рис. 9).
Неотъемлемой стороной организации живых систем являет
ся функция - свойство структуры специфически взаимодействовм
с другой структурой.
Такое взаимодействие обеспечивается наличием в общем плаї
строения белков специфических участ ков (активные центры фермой-]
тов, рецепторные -зоны, т.е. фрагменты специфического узнавания)!
Именно этим функциональным элементам должно быть уделено осо]
бое внимание при изучении молекулярно-биологических дисципли
и в любой исследовательской дея гельности, так как они формируют]
ся при участии витаминов, коферментов, металлов, нуклеотидов
т.д. Особое внимание к активным центрам, рецепторам должно быт*
обращено потому', что они модифицируют, меняют, комллексируь
интеїрируют, иными словами, создают-различные варианты взаимо¬
действия с субстратами, гормоиамй, другими белками. Эю означает
что под действием условий внешней среды, лекарств, токсинов и ха¬
рактера питания они меняют свои свойства. При усложнении струк]
туры белков (на этапе формирования тканей) количество и вариант
специфического взаимодействия резко увеличиваются, и усложлешК
функций означает нс что иное, как усложнение взаимодействий.
Даже на уровне специфических контактов выделяется доминиру-1
ющий тип межклеточного взаимодействия, наиболее иллюстратив¬
ным из которых являются нексусы или плотные контакты. Это позво-j
лист конкретную ткань в нормальном или патологическим состояли
рассматривать не как сумму клеток, а как интегративное клеточж
ноле, способное реагировать одномоментно и синергично в ответ на]
эндо- или экзогенный стимул.
Многообразие структур, а значит, и многообразие функций]
достигается взаимодействием с другими классами соединений]
(лигандами), к которым относятся нуклеиновые кислоты, угле¬
воды, липиды, металлы, гем, фосфор, стероиды. После взаимо-]
действия с перечисленными веществами образуются органоиды,
42
Уровни
структуры
Тип связи
Варианты
структуры
Свойства
структуры
Лиганды
Примеры
сложных
белков
Функция
БЕЛКИ
Гг*‘Аул«мс«э.
фм6рм***риье te/FM
- ;*стр*ТгТ*.
tJTj&M
К*СЮТоі
УгтаоАЫ
С*++*фВ**ОСМЬ
}
Рис. 9. Граф логической структуры по теме «Белки»
11 ранило
характеристиками которых являются: I) специфическая функі
2) сложный состав и структура; 3) определенный набор ферма
не только как индикатор органоидов, но и признак, обсслечш
ший функцию.
Например, нуклеиновые кислоты образуют с белками ядер
вещество хроматин, рибосомы и информосомы.
Липиды образуют с белками мембранные структуры и лииог
теины крови.
Металлы образуют с белками транспортные или резервные
мы белков, а также ферменты.
Гем образует с белками гемоглобин, миоглобин и систему
тохромон.
Углеводы формируют с белками соединительно-1 кашiwe
разовании (гиалуроноваи и хондроитипсерная кислоты). Наиб
употребительны углеводы в зоне широчайших взаимосвязей cneij
фического узнавания (в иммунной системе, в процессе гормоно-|
цен горного взаимодействия).
В каждом случае для взаимодействия белка с лигандами oi о
их партнеров іребуетея особый тип связи (рис. 9). В н у ю icon рот
дах - :яо взаимодейст вие отрицательно заряженною фосфорною і
гатка нуклеиновой кислої ы с положительно заряженными остатка
аргинина, лизина и оксилизина в белках (гистонах). В липопрогс
нач гидрофобное взаимодействие между радикалами аминокисл
и жирнокислотными остатками, в металлопротсинах - координац(
онпые ионные связи, в гемонротеинах— координационные связи,
гликопротсинах- сложноэфирные связи. Перечисленные связи
ля клея доминирующими во взаимодействиях белков с определен»!
ми типами лигандов, однако возможны и их комбинации в дополі
ние к важнейшему свойству белков - комплементарное™.
В рибосоме, которая состоит из нуклеиновых кислот и coni
рибосомных белков, помимо ионного взаимодействие между IIOJK
жителько заряженными остатками лизина, оксилизина и аргингп
белков и отрицательно заряженными остатками (|к>сфорной кисти
ты, необходима высокая концен і рация ионов двухвапентної о маті
для образования металлических мостиков.
Такой краї кий обзор показывай, что многообра же взаимосвязи
абсолютно со всеми возможными классами соединений витаминов і
металлов обеспечивает многообразие связей специфическою xapal
гора, иначе говоря, многообразие функций (рис. 9).
На уровне каждой структуры можно выделить характерные сі
пифические связи между более элементарными компонентами. ДЛ
44
Правило
8
ицокания первичной структуры это- пептидная связь. Для
р л0и^1Нця вторичной структуры - водородная связь, которая
Р-Рс, важнейшей упаковочной силой. Для формирования тре-
»ВОЙ структуры - межрадикальное взаимодействие различной
Імичсской Природы, а на уровне четвертичной структуры такое
не пифическое взаимодействие дополняется важнейшим систсмо-
■ ратующим свойством, которое называется комплемснтарностьн».
ос ісшее начинается к третичной структуре, а завершается на уров-
е целою организма в виде: черепной коробки, суставных поверх-
осте'й глазницы, турецкого седла, грудной клетки и других самых
азнообразных анатомических структур. Это и есть важнейшее пра-
ило формирования живых систем, которое можно обозначить как
диистно в многообразии.
И одной из высших форм многообразия количественного и ка-
сственного взаимодействия является центральная нервная система
цНС) с обилием вариантов синаптических связей и межмедиатор-
юго равновесия. Следует напомнить, что это возможно благодаря
целому ряду генетических характеристик. Несмотря на небольшую
физическую хінну ДНК-диплоидного набора хромосом - около 2 м
этой урожайной юрритории считывается информация о ста тысячах
телков, большинство из которых функционирует в ЦНС. Они спеии-
ически распределены между различными тканями, где используют¬
ся свои участ ки генома.
Исторически изучение человеческого организма шло по пути:
органы -> ткани > клетки -» молекулы. И это движение ВНИЗ (био¬
логический лифт) продолжалось до самого дна, которое выстлано
белком. Начало изучению его положил Якоб Беккари в 1728 г., вы¬
делив первый белок - клейковину из пшеничной муки. После уста¬
новления структуры белка началось движение вверх к целому орга¬
низму в исследовании структурно-функциональных проблем живых
систем. Несмотря на сбои объективной) (методический уровень)
и субъективно! о (понимание проблемы) характера, взгляд вверх стал
доминировать. Многообразное сочетание аминокислот в первичной
структуре, которая обеспечивает специфичность, вариативность
11 прочность белковых молекул. Мы носим на голове в виде пучка
колос фибриллярные белки, прочность которых достаточно извсс-
|,,а- А конский волос остается одной из самых прочных лесок для
Рыоной ловли. В первичной структуре и .заложено все многообразие
Бриантов остальных белковых структур. Одним из современнейших
достижений молекулярной биологии является возможность точного
прогнозирования всех видов структуры белка на основании амино¬
45
8
Правило
кислотной последовательности. Но следует помнить, «по три а\ц
кислоты в пентиле дадут шесть различных комбинаций, а увеличь
аминокислот в пептиде до двадцати (лаже если они присутствуї
нокраї но) дает практически бесконечное множество комбинаии]
Первичная структура белка или его специфичность являї
важнейшей его характеристикой. Наряду с молекулярной мае
и аминокислотным составом (вспомогательные показатели) она і
жит его исчерпывающей характеристикой. В среднем белок солеї
300-350 аминокислотных остатков.
Уже на уровне строения отдельных аминокислот угадывается:
несообразност ь формирования примитивных живых систем на ос|
ве создания важнейшего свойства белка - компактности. Komi и
ность или оптимальная упаковка белка собственно и обеспечит
его высокую плотность, которая равна плотности олова! Вое приз
белка в нашем воображении, как правило, сводится к рыхлой ст
нистой массе яичного происхождения, что абсолютно не COOTT
твует его истинному физико-химическому состоянию. 11а самом,
белок жесткий и прочный (подобно волосам на голове), линейн
и твердый (как хрящи и кости), эластичный и быстро сжимаем]
(как сгусток крови).
Для построения вторичной структуры белка наибатес прелпоч
тельны аминокислоты с коротким радикалом: глицин, аланин и
производные. Удлинение радикала аминокислот означает неполна
ванне их не столько для построения структур, сколько для создан
особых функциональных элементов (связей) или, как исходный
териал.для синтеза гормонов и медиаторов.
Второе определение жизни Ф. Бушеляра ориентирует наснаоцеї
ку высшей нервной дея і ел ьности как конеч ного резул ьтата движет
эволюции ог простого (построения белка) к сложному (ПСИХИ1
Этапы формирования структуры живых систем по существу и он
чают организацию высших функций. Движение в направлении вве
(но молекул мрпо-организменной вертикали) является олповремені
средст вом отбора информации в обучении и анализом фактической
материала, а т акже об вменением главнейшей задачи биологическс
науки - расшифровки механизмов онтогенеза и дифференциров»
Па -пом пути достигается совершенство высших систем и форми]
еюи патология любого свойства и качества.
Правило 9. Альбумины, мочевина
и креатинин — показатели
катаболизма
Основными белками крови являются альбумины. Его норматив в
многочисленных биохимических справочниках составляет 35-50 г/л.
Но на самом деле данный показатель, как и вышеописанный «общий
белок» крови, является гораздо более стабильной величиной, тоже
относя і вейся к жестким биологическим константам.
Константності, альбуминов крови объясняется тем, чго они со¬
ставляют 60% от общего белка. Любое отклонение от этих 60% вверх
или вниз является тяжелейшим биологическим и мелишнтским син¬
дромом под названием белок-альбуминовая диссоциация.
Сам по себе (без соотношения с общим белком) уровень альбуми¬
нов в крови свидетельствует о:
- белково-синтетической функции печени (нарушенной либо нор¬
мальной);
- соотношении ана- и катаболизма (анаболизм преобладает мри
повышенном уровне альбуминов, а катаболизм - при понижен¬
ном);
~ состоянии антитоксического барьера;
- состоянии липидного обмена, гак как альбумин является буфе¬
ром со взаимопревращениях липопротеинов крови;
~ степени токсикоза любого існеза;
онкотическом давлении крови.
Значения альбумина ниже 35 г/л являются критическими и опас-
!_,Ь1МИ: могут возникнуть серьезные осложнения, поэтому врачу стоит
°1,тк 'Рспогу (не подавая вида больному). К сожалению, из перечня
обязательных биохимических анализов в больничных стационарах
ЭТЧ)1 параметр исчез. Более того, инфузионная терапия (внутривен-
47
Правило
мое введение больших объемов расі пора, содержащего даже cjj
альбумины, например, коллоиды и кристаллоиды) проводится
предварительного учета уровня собственных альбуминов и дру
белков, чю, но существу, недопустимо. Ведь содержание альбумиї
коененно характеризуют фармакокинетику, т.е. траекюрию «дви
пия» препарата но организму н быстроту его выведения.
Определение альбумина бс і выявления уровня общего белка ;п
логично измерению диастолического давления без систолически
(и наоборот). В эюм заключается пока еще не до конца расшиф*
ванный глубинный физиологический смысл. Вероятно, оба НОУ
зателя (белковый и артериальный) функционально связаны. Ош
тическое давление как составная часть обшет кровяного даодеї
детерминируется уровнем альбумина.
В соотношении же е общим белком крови из двух вариантов
лок-альбуминоных диссоциаций худшей для прогноза состоин
больною и развития возможных осложнений следует считать:
высокий уровень общего белки (например, 88 г/л)
при таком уровне альбуминов (например. 32 г/л)
по сравнению с вариантом:
низкий уровень общего белка (например, 62 г/л)
при высоком уровне альбуминов (например, 48 г/л)
Цифра 48 лучше 32, но тоже довольно неблаюприятна. Заш
<•32 г/л » хуже, так как у этого пациента:
1) сниженабелок-синтегическая функция печени;
2) дефективен важнейший антитоксический барьер - альбумиї
вый (втом числе, антитоксичность по отношению кжирным ки<
лотам);
3) недостаточна общая транспортная функция организма (перен<
витаминов, металлов, гормонов, лекарств, жирных кислот и т.д.
4) реальна угроза развития отеков.
В случае же записи <-48 г/л» перечисленные 4 механизма нс и<
ключены, но менее вероятны.
Снижение же и общего уровня бедка, и альбумина не в иод
пои мере характеризует степень катаболизма, гак как для этой
необходимо тать уровень конечного распада белка, г.е. уровеї
мочевины.
В медицине традиционно принято следить за понышепнем у рові
мочевины при угрозе уремии разного існсза. Однако не менее опасны
является вариаш снижения уровня мочевины, так как аммиак, обезі
реживаюпінися в цикле Кребса 2 или в арпшиновом цикле (не путат
48
ом ,рикар5оновых кислот!), крайне необходим для синтеза нук-
С U,\obmn кислот, а именно - ДЛЯ синтеза мар нуклеотидов.
"ЄИ1 Каждая пара нуклеиновых кислот (НК) требует три (а ото - мно-
, мо,,ек>лы аммиака. Соответственно, две пары НК нуждаются
r*°6 ці мо іекудах NH3, три лары - в 9 молекулах и т.д. Поэтому пол¬
ный синтез НК не возможен без достаточного количества аммиака.
\ резкое снижение уровня мочевины (особенно, при алкоголизме,
копа величина этого показателя падает до нуля) должно вызывать
особую тревогу' врача, так как в этом случае затрагивается не только
популяция белка, но и ядерное вешссі во (6 X і О23 пар нуклеотидов) на
системном и организме ином уровне.
Падение уровня мочевины даже более опасно, чем его подъем,
при котором есть некая степень свободы: избыток мочевины свиде¬
тельствует о достаточности двух важнейших составляющих синтеза
белка - фонда белка и аминогрупп. Ведьпуклеиновые кислоты опре¬
деляют всю белковую матрицу организма.
Именно поэтому белковая дистрофия у алкоголиков означает
системную десрадацию всего ядерно-генетичеекого потенциала.
Для того чтобы корректно интерпретировать ферментемию
(она практически нс бывает нитолитической. а лишь - адаптив¬
ной). уровень ферментов необходимо сопоставлять с рядом мета¬
болических параметров: уровнем общего белка, мочевины, альбу¬
минов, т.е. знать определенный алгоритм анализа биохимических
показателей крови, который позволяет выявлять не только сте¬
пень дисгармонии в соотношении анаболизма и катаболизма, но
и определять глубину нарушений при любой патологии и любом
функциональном состоянии.
lime одним важным показателем катаболизма, паря,ту с альбуми¬
ном и мочевиной, является креатинин. По сути, альбумин и мочеви¬
на выступают в роли биохимических «заказчиков» уровня креати¬
нина. Креатинин содержится із крови в микромольных количествах
<на литр), в отличие от мочевины, которая измеряется С МИЛЛИМО¬
ЛЯХ (на литр), т.е. креатинина в крови на 2-3 порядка меньше, чем
мочевины. На это колоссальное количественное различие никто из
клиницистов не обращает внимания, теряя тем самым понимание
важнейшего физиологического значения уровня креатинина.
А между тем концентрация креатинина в крови сопоставима
с ^Р(,внем юрмонов- она мала, но чрезвычайно эффективна. Это
‘иачает. что креатинин, подобно гормонам, обладает высокой био-
логнческой активностью, в отличие от мочевины. Уровень креатини-
а’ н ноРме равный 60-80 мкмоль/л (или 0,5-1.5 мг%), очень сгаби-
49
Правило
лен, т.е. является жесткой физиологической константой. Колее т
сю нормальная концентрация абсолютно идентична концентр-
его биохимического предшественника - креатина (60-80 mkvioj
или 0,5—1,5 мг%). В определенном смысле креатинин - ото ваг
сервированная форма креатина, который является фосфат-извл
ющим субстратом из митохондрий при участии креатинфосфоки
зы (КФК). Поэтому-то содержание креатина столь стабильно,
определяет валовый (на весь организм) выход макроэргических
фатов их всего митохондриальною поля.
Переход макроэршческого фосфата в форму АТФ из митохо
рий (а в сутки ее образуется 70 кг!) иллюстрирует закон еохранеї
энергии на уровне организма. Есть аксиома: чем ниже уровень к
атина, тем меньше будет извлечено макроэргических фосфата
митохондрий. Креатинин легко и быстро, без ферментов, лишь
небольших сдвигах pH образуется из креатина (простой цикли
ей). Его снижение указывает, во-первых, на торможение управляє,
го т еплообмена, а во-вторых, на дефицит двух незаменимых ами
кислот - аргинина и метионина, из которых он образуется сонмсс
с глицином.
Правило 10. Роль аминокислот
в обеспечении церебральных
процессов при нормальной
активности головного мозга
В различных учебниках по биохимии (а их насчитывается более
тридцати, отечественного и импортного производства) приводятся
многочисленные классификации и характеристики аминокислот. Од¬
нако, как нам кажется, в процессе изучения клинической биохимии
должен существовать единый принцип классификации, основанный
на усложнении строения аминокислот в зависимости от размера их
радикала и особенностей его функционального элемента. Компакт¬
ность структуры предполагает и обеспечивает оптимальность, а для
нервной системы - уникальность высшей психической функции.
Добелковый уровень аминокислот к центральной нервной сис¬
теме (UHC) исчерпывающе многообразен и. по сути, представляет
собой богатый арсенал, дающий организму возможность широкого
выбора адекват ного поведенческого ответа. 'Зга мысль проиллюст ри¬
рована нами на схеме (рис. 10).
Избранный критерий представляется нам основным потому, что
построение живых систем происходило по принципу «от простого -
к сложному». Экспериментально доказано, что в первичном бульо-
,,е (копія создавалась жизнь) возникали простейшие аминокислоты,
наиболее известной из которых является глицин.
По своему фундаментальному значению отнесение глицина вес
1о лишь к аминокислоте в какой-то мере недостаточно и даже нс
корректно. Будучи уникальным раствори гелем для биомолекул и
вездесущим фактором жидких сред организма, глицин препятствует
преждевременной денатурации белков, обеспечивая их стабильную
растворимость. Вода как растворитель находится в организме в двух
51
10 Правило
Рис. 10. Схема усложнения аминокислот в зависимости
от размера их радикала
состояниях - свободном и связанном. Глинин же привносит во;
и другим жидким средам дополнительный «привкус», придавая нс
вое своеобразное свойство - резкое усиление растворимости любой
рода веществ.
Глинин является исходным компонентом синтеза гема. Чтс
бы количественно представить значение глицина для синтеза гем
(т.е. оритропоэза), необходимо знать, что один эритроцит содержи
340 млн молекул гемоглобина! Это и есть переход из области маї
ромира в микромир. Для синтеза одной молекулы ісма гребуєте
8 молекул глицина. Иначе говоря, для построения одного эритрс
цита необходимо (340 000 000 х 8 = 2 720 000 000) молекул глиии-)
на. Количество глииина, требуемое для нягилитрового кроветвої
пня. трудно себе представить. Достаточно сказать, что в стандартної
строчной букве «о* помещается 150 штук эритроцитов. А все фибрил-j
лирные белки (коллаген, эластин, волосы, мышцы) на треть cocio-j
ят из глицина. Дальнейшие многочисленные синтезы (нуклеинов»
кислот, пуриновых оснований, глутатиона, креатина и т.д.) требуї
участия глицина. В свободном виде глицин содержится в организ»
в количестве 40 г. Видимо не случайно природа наделила его сладким
52
Правило 10
oTicvja и произошло его название: glycos - сладкий (греч.).
вкусом. - стартовый или «нулевой» уровень в построении
фактически?
аминокислот, а значит, и белков (рис. 10).
Ус южнение структуры означает не что иное, как усложнение
пни И о ряду одноосновных карбоновых кислот (формирую¬
щих их углеродный скелет) обозначается следующий, по сути, нуле-
пой уровень формирования разнообразных аминокислот.
К лк в гене і икс существует постулат «один ген — один белок», так
и в нейрохимии срабатывает правило «один фермент - один новый
субстрат (или новый функциональный элемент)». Известна важней¬
шая роль для функционирования мозга гамма-аминомасляной кис¬
лоты (ГАМК), однако этот медиатор или ключевой метаболит ЦНС
представляется клиницистам неким экзотическим соединением. Тем
не менее, его можно считать обычным результатом дс карбоксил иро-
плния глутаминовой кислоты. Иными словами, глутамат это ГАМК
с дополнительной карбоксильной іруттпой. И этот пример указывает
на избыточность субстратной основы и простоту важнейшего медиа¬
тора ЦНС. 1см более что по своей химической структуре он мало чем
отличается от глицина лишь немного большим размером углерод¬
ного скелета:
Ч/^'-СН.-СОО- +Н/І-Щ - СН2 -щ-соо-
Глицин ГАМК
Неудивительно, что такое структурное сходство обеспечива¬
ет и функциональную общность двух медиаторов - их способность
потенцировать растворимость других веществ. (О подобном досто¬
инстве глицина уже было сказано выше.) Головной мозг «пропитан»
ГА\1К ничуть не меньше, чем глицином. И в этом, разумеется, кроет¬
ся физиологическая целесообразное! ь — ведь ГАМК является факто¬
рам. тотально оптимизирующим нейрохимические процессы к ЦНС.
Лосіаточно привести в качестве примера анксиолитические свойства
1 AM К, лежащие в основе нротивотревожного дейст вия других меди¬
аторов (мелатонина) и целого ряда фармакологических препаратов.
ротшюположпые же — анкеиогенные - эффекты нередко явлмют-
См результатом ингибирования ГАМКергичсских процессов, кото¬
рые, в случае их генерализации, приводят к реакции общемозговой
активации (arousal). Электрознцефалографически это состояние, как
Ранило, выражается в виде ирритации церебральных структур раз¬
личного уровня.
53
10 Правило
Известно, что электрическая активность мозга создасі иске
представление о функциональном состоянии психики. Одним щ
важнейших механизмов формирования высшей нервной деятельно
ти является адекватный энергетический и аминокислотный обмены]
гак как нервная система является основным эли гарным потребителем!
аминокислотного пула. К предшествующем разделе настоящей стать»
основное внимание было обращено на структурную роль аминокис¬
лот, которая, трансформируясь в третичную структуру, обеспечивает
высокую контактность с любым классом соединений. Без третичной
структуры белка невозможно свободное взаимодействие с любым»
і ииами .штатов, формирование синап і ичсских образований, нейро
глиальных метаболических взаимосвязей, а самое главное обеспе-]
чепие предшественниками широкого спектра медиаторов, большин¬
ство из которых собст венно и являются аминокислотами. Н последнее
время в литературе многообразие функций часто объясняется много¬
образием аминокислотного и пептидного пула в ЦНС.
И действительно, нормальная электрическая активность голо¬
вного мозга но существу предполагает нормальный метаболизм. важ¬
нейшей характеристикой которого является специфический амино¬
кислотный состав. Доминирующая роль аминокислотного обмен»
свя зана и с тем, что липиды грсбуют сложных транспортных систем,
а углеводный обмен метаболически громоздок. Ом поддержива¬
ется при различных физиологических и даже некоторых патологи¬
ческих состояниях. Аминокислотный фонд мозга человека соста»
ляег в среднем 34 мкмоль на I г ткани, ч то значительно превышает
их содержание как в пла зме крови, так и спинномозговой жидкости
(ликворе). Достигается это благодаря энерго-зависимому транспорту!
аминокислот прот ив і радиста концентраций. Если в плазме кои-]
центрамия свободных аминокислот составляет 35 50 мг%, то в клет¬
ке это количество оказывается на порядок выше. Та же закогюмср-j
нос і ь чарак і ерна и для I (НС.
Косвенным показателем состояния белкового обмена является I
аминокислотный состав ликвора — одной из необходимых изолиру¬
ющих сред I (НС. Напомним, что у взрослого человека обший объем
ликвора составляет около 140 мл. Из этого количества 25—35 мл махо-1
дится всистеме мозговых желудочках и примерно столько же - в по¬
ясничном расширении. Скорость продукции ликвора колеблется от
0.4 до 0,6% от его обще їх) объема в минуту. У человека за сутки секрс-
тируется около 500 мл ликвора (приблизительно столько же образует¬
ся и эндогенной воды, необходимой для поддержания биоэнергетики
в нормальных условиях!). Общая площадь поверхности чорнотіліюго
54
І Іравило 10
v чеіовека составляет 200 см'. Это означает, что возмож-
эпи'гсл!1я^^^ рассоренными веществами между нервной іканью и
ноегь о ^ ЛИ\,итирована недостатком поверхности соприкоснове-
ликкої: к попью и ликвором локализуется на уровне хори-
И11Я карьер между крепью и ликвором
ОИЛНОІ о эпителия, а не кровеносных сосудов.
кропи они
другие тка-
При повышении концентрации аминокислот в плазме крс
шикают в головной мозг в меньшем количестве, чем вдруг
?lf>°что подчеркивает физиологическое значение жесткой констант¬
ное! п их состава для UHC. Их высокое поглощение в большинстве
счучаев коррелировало с «незаменимостью» аминокислот, за исклю¬
чением тирозина. Последний, как известно, необходим для магист¬
рат ьн о го синтеза моноаминов мозга, обладающих жестким физиоло¬
гическим эффектом.
Ликвор отличается от сыворотки крови высоким содержанием
глютаминовой, аспарагиновой, N-ацетиласиарагиновой, у-ами-
номасляной кислот и глутамина, а также их интенсивным метабо¬
лизмом. По сути же в ликворе есть всего две аминокислоты: аспа-
рагиновая и глутаминовая, а остальные три «отставлены» на один
метаболический «шаг». К структурной простоіе добавляется мета¬
болическая осторожность движения. Ведь еше по і вилле ровекому
второму закону эстетики: «Природа не терпит резких переходов».
Все просто, степенно, величаво. Только л о движение видится скорее
мысленно, чем реально.
Эти аминокислоты составляют 15% фонда всех свободных ами¬
нокислот. причем ГАМК и N-аиет идаспарагиновая кислота (N-ЛДК)
локализованы почти исключительно и нервной ткани. Высокие кон¬
центрации дикарбоновых аминокислот и глютамина обнаружены
в мозге всех изученных вилов животных. Такая прелпоч і ительная
избирательность для аминокислот с гидрофильным радикалом объ¬
ясняется. во-первых, необходимое!мо быть хорошо растворимыми
в средах мозга, во-вторых, при участии глутаминовой кислоты про¬
исходит обезвреживание (связывание) аммиака дія последующего
•ранаюрта в печень и синтеза мочевины. Это и есть основной ме¬
ханизм обезвреживания аммиака. Глутаминовая кислота является
предшественником а-кетоглутароной и стимулирует тканевое ды¬
хание. В-третьих, подобная избирательность объясняется участием
а^-параї и новой кислоты в биоэнергетике мозга: цикле трикарбоно-
»ьіч кислот (ЦТК) и челночном механизме для транспорта протонов
п МИг0хонДРиях. Высокое содержание дикарбоновых аминокислот
сое їдке белков мозга также служит временным и дополнительным
Папизмом обезвреживания аммиака.
55
10 Правило
Таким образом, уникальный аминокислотный состав лихі
и белком мозга с избытком дикарбоновых аминокислот позволі
предположить разные механизмы обезвреживания аммиака с опт
мальной для физиодої ических условий интенсивностью. Такой а\ц
нокислотный состав объясняет возможность нескольких уровз
нейтралі изаиии аммиака.
Этот важнейший механизм детоксикации аммония связан с в!
сокой чувствительностью мозга, при накоплении которого іювре)
стся U1IC. Повышение аммиака в мозге до концентрации 0.6 мм<
сопровождается судорогами. Системное введение солей аммония в{
зывает конвульсии и увеличение содержания глутамина в мозге. П|
серьезных повреждениях печени повышается концентрация амм<
ния и глутамина в ликворе с развитием комы. Симптомы печенотгн<
комы смягчаются введением глутамата.
Фермент, синтезирующий глутамин из глутаминовой кислот
в результате следующей реакции:
NH. і АТФ
Глутаминовая кислота > Глутамин + ДТФ + Ф + НО
Глутаминсинтетаза находится в мозге в более высокой концені
трации, чем в других тканях, и составляет 0.2% от общего белі
мозга. Фермент подавляется глицином и аланином и имеет болі
шой запас энзимологической прочносіи, гак как при физиологи]
чееккх концентрациях аммония в мозге (0,16 ммоль) існетичесі
заданный максимум активности составляет 0,39 ммоль. Т.с. феї
мент работает в режиме полу-насыщения. Дезаминирование гл
та мина катані изируется глутаминазой. наиболее активной в митс
хондриях нейронов. Однако в целом активность этого фермент^
крайне невеликії. Через мембраны лучше проникает глутамин, чеі
глутамат, и поэтому глутамипаза участвует в превращении туда]
мина крови ко внутриклеточный глутамат. Глутамин также являет
ся главным предшественником и ГАМК. Фактически, через глутг
миназу обеспечивается частичный гранспорт в нейроны глутамат
и IАМ К, выполняющие функцию передатчиков нервного имнуль]
са. Именно поэтому сформулирована концепция о сущее гвованиі
глутаминового цикла.
Функцию стимуляции тканевого дыхания выполняет и аспараги¬
новая кислота, коюрая при участии асцартаттрансаминазм образу*
стартовый субстрат для ЦІ К - щавелевоуксуепую кислоту (ЩУК)]
Такая высокая концентрация субстратов, обслуживающих IJTK, ука¬
зывает на большой запас прочности биоэнергетических систем.
56
Правило 10
5 ,„чиwe органеллы клеток головного мозга контролируют уро-
^ L'n но кислот, накапливая их против градиента концентрации,
^'^обеспечивается сбалансированным функционированием іемато-
Э1° Ігаического барьера и мембранным транспортом. Сушестнуют
>И!1С‘ (ы активного транспорта аминокислот не только в мол . но и из
сис w ^ ^ они - энергозависимые. Известно 8 классов трансиорт-
ныхсистем аминокислот, между которыми существуют конкурент¬
ные взаимоотношения.
Транспорт аминокислот не только энергозависим, но и Na-зави-
сим ца пего влияют температура и pH среды. Конкурентные іранс-
портные взаимоотношения иірают существенную роль и в патоло¬
гии. Ключевым ферментом для фанепорта аминокислот является
• глутамилтранспептидаза (ГГГП) и фипептида глутатиона. Фунда¬
ментальное значение глутатиона для обмена обеспечиваемся доступ¬
ными для его синтеза аминокислотами - глутаминовой кислотой и
глицином. Аминокислоты аккумулируются мозгом. Формируя пул
свободных аминокислот, который быстро истощается. Имеющееся
количество аминокислот для синтеза белков мозга, нейроиептидов и
нейро медиаторо в используется к течение 30 мин и поэтому требуется
постоянная активная подпитка из внемозговых источников.
Приведем пример длительной алкоголизации в качестве своеоб¬
разной модели белковой дистрофии по типу активации энергетичес¬
кого обмена через все ми тохондриальное ноле организма.
Продолжительная алкогольная ишоксикация при активации
глюконеогепеза требует большого количества субстратов, которы¬
ми являются гликогенные аминокислоты (аспарагиновая, аланин).
В этих условиях дія поддержания требуемого уровня сахара в крови
начинают использоваться аминокислотный и белковый пул всего
организма, и мозг оказывается в самой невыгодной ситуации в силу
т°го, что аминокислотный обмен в нем крайне интенсивен даже
ь нормальных условиях. (Это является его органной особенностью.)
Поэтому хроническая алкоголизация является основой интеллекту¬
ально-личностной деградации в начале и основанием дня белковой
Дистрофии в последующем. Электроэнцсфалофафически это выра-
жается (в зависимости от сталии алкоголизма и степени алкогольной
интоксикации) либо в формировании пик-вол новых комплексов
11 медленно-волновой активности, либо в ослаблении общею элск-
^Ро гене за головного мозга. И то. и другое свидетельствует о ДИС¬
ФУНКЦИИ мезодиэпцефальных и подкорковых структур, основанной
лам инокиол о m о м голоде организма в целом и, в первую очередь,
’ ^ диэнцсфальной области функционируют практически все
57
10 Правило
известные нейромедиаторы (норадреналин, дофамин, серотонин
ацетилхолін, ГАМК) производные аминокислот. Многие из mj
специфически участвуют в патогенезе формирования алкогольной
зависимости. j
Отсутствие в литературе данных о болезнях, вызванных пару шея
ние.м транспорта аминокислот в мозг, связано с тем, что эти болезнШ
приводят к детальному исходу, а в патофизиологические задачи но!
лобного рода анализ, видимо, не входит. Дефекты транспорта ими!
нокислот в другие ткани имеют неврологические последствия и col
ответственно искажают нормальную ллектро мшефадоірамму (ЭЭГЦ
В митохондриях мозга 90% глутамата подвергается переаминиро!
ванию с образованием аспартата при участии ACT, которая является
наиболее мощной трансаминазой головного мозга.
В мозге существует два изофермента: митохондриальный (обес-1
печивает функционирование НТК) и цитоплазматический (onpe-j
деляет интенсивность глюконеогепеза в качестве дополнительной
«подпитки* мозга глюкозой). Экспериментально изолированные из]
IЩС митохондрии быстро поглощают глутамат и мадат. освобождая]
аепартат и а-кетоглутарат. Фермент г луга минсинтстаза локализован в!
глиальных клетках, и лишь небольшая часть представлена в нервных
окончаниях. Дезаминирование глутамина глутаминазой происходит
в митохондриях, но активность его крайне низка, (лутамин болея
проницаем для биологических мембран, чем глу тамат. И это служит
основанием для предположения участия глутамнназы в транспорте
глутамата внутрь клетки.
Глутамин является главным предшественником глутамата и
ГАМК, выполняющих медиаторную функцию, и это служи т основа¬
нием для концепции о существовании глутан и нового цикла. Гдутл
мин служит глиалыю-нейрональным переносчиком глутамага. Глу¬
тамат же участвует в синтезе белков мозга и биологически активных
пептидов и составляет от 8 до 10% общих аминокислотных оста? ков в
Глутамаї составная часи, малых и средних регуляторных неп-;
тидов мозга (глутатион и ряд у-глутамильных дипеп і идов).
Введение глутамата в различные отделы мозга приводит или к су¬
дорожной активности, или к распространяющейся депрессии даже
при низких концентрациях. Глутамин не вызывает такого эффекта.]
Внутривенное введение глутамата вызывает гибель клеток в опреде¬
ленных районах ЦНС, где менее развит гемато-энцефалический ба¬
рьер (ГЭБ), например в желудочках мозга. Это опасно и для незрелых
нейронов. Повышенная чувствительность к глутамату натрия, кото-'
белковых гидроли затах мозга.
58
Правило 10
.lu-MMi в китайской кухне, известен как «синдром Китай-
Ы1 ||0Н*. Глутамат как медиатор выделяется н сииаптиче-
кИХ ,кс 1П|» ..го концентрация повышается до 1 ммоля. Захват из
кую щель, L,v
. обеспечивается астроцитами, которые и синтезируют глутамин,
звестны два источника глутамата - из глюкозы и у-кегоглутарата и
нитина и аргинина.
фундаментальность и избирательность определенных вилов оо-
ена и специфических метаболических путей объясняется основным
^ (назначением органа. Дія нервной системы подчиненность ами-
окислитного обмена основным биологическим задачам связана со
іедуюіцими обетоя ісльства.м и:
формированием многочисленных связей структурао-фушатио-
нального межклеточного уровня:
координированием биоэнергетических запросов и субстратной
обеспеченности;
необходимостью иметь достаточный выбор и поток аминокислот
для образования бесчисленных медиаторов;
использованием при распаде аминокислот конечных продуктов
для специфических транспортных систем.
Все эти особенности белкового обмена реализуются н виде опре¬
деленной функциональной активности головного мозга, отражаю¬
щейся на динамике церебральных биопотенциалов - электроэнцефа¬
лограммы. В пользу такою заключения свидетельствуют отдельные
клинически и экспериментально установленные факты.
Правило 11. Что важно знать врачу
о холестерине
В основе строение молекулы холестерина лежит ІІИІСІОіІСІІТа
пергидрофенантрен. «Силуэт* этой молекулы изображен на рис. 1
Полную и подробную ее формулу можно обнаружить н любом уч-*
пике по биохимии. Паша же задача состоит и том, чтобы объясни
смысл «зрительного образа» холестерина, с тем. чтобы после это
читателю прояснилась основная функция и клиническая значимім;
уровня холестерина, определяемого у больного.
Итак, в структуре холестерина содержится 30 атомов угле
да. Синтез холестерина начинается с ацетил-КоЛ, в котором все
60
Правило 11
vнеродных атома. Те. лам синтеза одной молекулы холестс-
Обуется 15 молекул ацетил-Ко-А. Для двух молекул холес-
ри ина _ 30 молекул ацетил-КоА, для трех - 45 молекул и т.д.
Основное топливо для цикла Кребса (I), которое необходимо для
содержания биоэнергетики, становится крайне дефицитным в
М- [ониях лихорадки любого генеза. По сути, лихорадочный про¬
цесс - это почти всегда инфекционная патология, для которой
требуется колоссальное напряжение иммунной системы. Учиты¬
вая, что каждая живая клетка содержит в своей мембране до 30%
холестерина, становится ясно, что при лихорадке возникает неже¬
лательная конкуренция за субстрат анетил-КоА— между «топ¬
кой» (митохондриями) и системами, требующими формирования
клеточною пула (лимфоцитов, моноцитов, эритроцитов и лейко¬
цитов). Синтез одной молекулы холестерина - чрезвычайно энер¬
гоемкий процесс, узкое место всей биоэнергетики. Поэтому мощ¬
ное энергопотребление автоматически подразумевает снижение
способности организма к формированию клеток. А эго означает
подавление иммунитета, снижение кроветворной способности ор¬
ганизма, недостаточность лейкоцитарной реакции, а также всех
репаративных процессов и др.
Даже человеку, далекому от медицины, знакомо угрожающее
понятие «холестериновые бляшки». Они образуются на эндотелии
крупных кровеносных сосудов вследствие нарушения обмена ве¬
ществ- инфильтрации (одною из вариантов дистрофии) внутрен¬
ней оболочки артерий холестерином и его производными. Это - па¬
тологический процесс, т ипичный для атеросклероза, когда с кровью
приносятся, а затем поступают в клетку свойственные ей вещества,
но в значительно большем, чем в норме, количестве. Опасность за¬
ключается к том, что в месте прикрепления бляшки (состоящей из
производных холестерина - холестеридов, фибринозных отложений,
Других застрявших там клеток) артерия теряет свою эластичность, что
может привей и к разрыву сосуда, несущею кровь к жизненно важ-
НомУ органу. Но еше до разрыва это может привести к тромбозу (за¬
купорке сосуда) и эмболии (отрыву тромба и миграции его по всему
кровяному руслу). Чаше такого рода явления встречается у пожилых
•|к>дей, особенно у лиц, пересдающих и ведущих малоподвижный об¬
раз ЖИЗНИ.
Помимо этого, холестерин является биохимическим предшест¬
венником глюкокорт и кон, го в и минсралокортикоидон, желчных кио-
■|(>Г' *СНСКИХ и мужских половых гормонов и т.д. Поэтому-то к мо¬
лодо^ возрасте вероятность холестериновой инфильтрации крупных
61
11 Правило
артерий низка - ведь холестерин идет на бурное производство щ
вых тормонов, и ему «некоіда» отклепываться н виде бляшек,
надпочечников (тоже прои зводящая стероидные гормоны) не по
анатомически мала, что ее негде разместить в организме, а поп
что синтез стероидов - крайне дорогое удовольствие. Стероиды -
своего рола анатомическая валюта. Вот почему при инфекнион
патологии, а не только при атеросклерозе и заболеваниях серде
сосудистой системы, врачу необходимо следить за уровнем ход
рина у больного. Ведь этот показатель свидетельствует о еосто:
фонда важнейшего субстрата, необходимого как для пост рое'
мембран любых клегок. так и для обеспечения щдогенного мет
личеекого ответа на стресс при помощи гормонов стресса — глюк
минералокортикоидов.
Уровень холестерина в норме составляет 5—6 ммоль/л, не б
ше, но и не меньше. Или 120 -160 мг%. Сумма из двух с.тагае
«концентрация холестерина» и «содержание глюкозы» в крови -
жесткая биологическая константа. У здоровых людей она ра
10 ммоль/л. В условиях же мощнейшего энергодефицита (нанрим
при алкоюлизме или длительной лихорадке) срабатывает реиипр
ноет», (сопряженность) лих двух слагаемых: снижение содержа
глюкозы приводит к повышению уровня холестерина, или ааобо
но при соблюдении константной десятки.
В традиционной клинической практике повышенное виима
уделяется лишь высоким значениям холестерина, прежде всего, г
за опасения атеросклероза. А дефицитное содержание холосте
лаже нс рассматривается, более того, считается прогностически Гм
гоириятным фактором. На самом же деле, низкий холестерин не
нее опасен и указывает на серьезные нарушения в обмене веществ
Например, вы получаете анализ крови следующих больных (табл. 4
Суммарный уровень холестерина и глюкозы в крови первых шс
ти больных (№.\г 1.2.3.4,5,6) снижен, он меньше 10. У больных №
N9 2 и .\у 3 снижение произошло за счет глюкозы: она ниже норм
(ниже 5,0 ммоль/л), а холестерин - в пределах нормальных зна
(5,0-5,3 ммоль/л). Д у больных №4. >65 и .Vd6 низкое суммарное:
чепие преимущественно связано с пониженным уровнем холсстери
па (2,9-3,7 ммоль/л в сравнении с нормой 5-6 ммоль/л).
И только у больных № 7, js|b 8 и JSb 9 получена та «десяіка
(10,4 ммоль/л) в результате суммирования содержания холестсри
на и глюкозы. Из анализа их крови видно, что оба этих показатсд:
в отдельносі и тоже находятся в пределах нормы.
тче нм
ое зна
62
Таблица 4
Пример наборов биохимическою анализа крови 9 больных
Номер
больной»
ACT
AJIT
Кооф. ле
Рнінса
ITT
Моче-
кииа
Обший белок/
альбумин
Холее-
гернн
1лн>ко<а
Холестерин 1
+ глюкоза
Креаги-
иин
1
447
297
1,51
зоо
4,05
60/41
5,3
3,5
8.8
79
2
114
56
2,01
204
3.55
66/40
5,3
3.2
8.5
70
3
1%
137
1,43
435
2.27
62/43
5.0
3,7
8,7
72
4
319
168
1,78
249
4.14
74/47
3,7
4,5
8,2
77
5
266
93
2,86
681
3.96
89/36
3,1
4.5
7.6
58
6
193
77
2.5
377
2.67
80/33
2,9
6,1
8,7
64
7
191
100
1.91
191
4,72
62/35
5,4
5,0
10.4
71
S
165
143
1,15
350
1,01
72/43
5,4
5,0
10,4
71
9
125
85
1.47
95
4,82
77/47
5.4
5.0
10.4
79
Таблица 4
Лифферениироіючпмй подход к анализ) биохимических показателей
Номер
больного
ACT
AJIT
Козф. де
Ритиса
ггг
Моче¬
вина
Общий
белок/
альбумин
Холесте¬
рин
Глюко¬
за
Холес¬
терин +
Глюкоза
Креатинин
Больные, «дефицитные* но глюкозе
1
447
297
1.51
300
4,05
60/41
5.3
3,5
8.8
79
2
ЇМ
56
2,01
204
3.5.5
66/40
5,3
3,2
8.5
70
3
196
137
1,43
435
2.27
62/43
5,0
3.7
8,7
72
Вольные, «ДСфиШ1Л1Ые» по холестерину
4
319
168
1.78
249
4,14
74/47
3,7
4,5
8,2
77
5
266
93
2.86
681
3,96
89/36
3,1
4,5
7.6
58
6
193
77
2 5
377
2,67
80/33
2,9
6.1
8.7
64
Вольные с нормальними показате.тями глюкозы и холестерина
7
191
100
1,91
191
4.72
62/35
5,4
5,0
10,4
71
8
165
143
1,15
350
1,01
72/43
5.4
5,0
10,4
71
9
125
85
1,47
95
4,82
77/47
5,4
5,0
10.4
79
Правило
им образом, выявились три группы больных.
,1' , н1Пцо из разделенной на три части табл., клинически почти
тковые» больные существенно различаются по своим биохи-
*°чсским показателям. Первые трое больных (№№ 1 -3) характе-
М,1'лкяся выраженной гипогликемией, что означает необходимость
рИ *' еиия терапии с целью повышения (нормализации) уровня глю¬
козы внутривенное введение глюкозы вместе с инсулином. В данном
ст\чае. гипогликемия является одним из звеньев всей патогенетиче¬
ской цепи конкретною заболевания. (Любою заболевания, поэтому
в тайном примере мы умышленно не приводим диагноз. Ведь здесь
сы имеем дело с песпенифическим стрессовым состоянием, вероят¬
но, в фазе напряжения.)
В горой тройке бол ьных (AfeNy 4 6) с гигюхолесгсринемисй требу¬
ется: 1) дополнительное исследование в виде подробною клиничес¬
кою анализа кроки с лейкоцитарной формулой, так как это состояние
должно сопровождаться снижением лимфоцитов и других лейкоци¬
тов, а также эритроцитов; 2) внимательное отслеживание симптомов
пшокортицизма недостатка юмонов стресса, продуцируемых ко¬
рой надпочечных желез, как показателя фазы истощения.
И только третья группа больных (№№ 7-9) нс является объектом
большой тревоги по наиболее приоритетным биохимическим пока¬
зателям в силу достаточности уровня глюкозы и холестерина в оп¬
тимальном сочетании (10.4 ммоль/л). Хотя следует помнить, что эти
пациент ы остаются больными, но патогенез и> заболевания отличен
от такового у первых двух групп. Нс исключено, что они пребывают
в фазе резистентности но отношению к стрессовому фактору вы¬
звавшему болезнь. Поэтому больные >й№ 7—9 наиболее адаптирова¬
ны и прогностически их состояние более благоприятно.
Следовательно, патогенетические механизмы это не что иное, как
адаптивные биохимические сдвиги. Как правило, стрессор (нёспеаи-
Фическое воздействие) это и есть болезнетворный фактор. Но лишь
Н:‘ «ладил истощения (после шока, напряжения и резистентности) он
вызывает истинно специфическое воздействие, т.е. поражение.
Ч Тоби следовать заповеди «Лечить не болезнь, а больного», необ-
*«аимо знать вес опенки патогенеза заболевания, которые у каждо-
10 °°лы10го сугубо индивидуальны. А это видно из биохимического
анализа крови, который необходимо уметь читать и комментировать.
а»..аий Фермент может послужить дополнительной информацией
' м исчерпывающею представления о состоянии больною. Так, све-
с НІ1Я активности щелочной фосфатазы (ЩФ) расширяют пред¬
ание о патогенезе заболевания.
65
Правило 12. Щелочная фосфатаза
Щелочная фосфатаза (ЩФ) отшепляет фосфорнокислый ос
ток от любых соединений, им располагающих: от глицерофосфата,
глюкозо-6-фосфата и т.д. Это - неспенифичный фермент.
Нормальная активность ЩФ равняется 100 МЕ/л. Обычно п
нято считать, что повышение активности ЩФ «есть признак ход
таза, указывающего на воспаление желчного пузыря, наличие в н
камней, другой причины задержки и остановки движения желчи
Весь материал настоящей лекции послужит опровержению зтої
традиционного, но отнюдь не соответствующего действительносп
поверхностного и узкого представления, сложившеюся, очевидне
вследствие недостатка информации по данному' вопросу1; имевшему
ся на определенном (и весьма давнем) этапе развития клиническо
биохимии. Современный же уровень развития ДИСЦИПЛИНЫ ПО30
ляет оценивать не только отдельные биохимические показатели, н(
также анализировать их комбинации, переводя биохимические сдвп
ги на язык метаболизма, обобщенно двигаясь но молекулярно-орп
низменной вертикали, а значит — лечить не отдельный симптом и н
болезнь, а больного.
Судите сами. ЩФ в больших количествах представлена в костно
ткани. Поэтому считается, что у детей и у беременных (в растушй
организмах) уровень данного фермента повышен. Ведь их опорно
двигательный аппарат стремительно укрупняется. По на самом деле
если расшифровывать роль фермента ЩФ. не привязывая ее к наго
логии. то она сводится к следующему:
- ЩФ повышает уровень фосфатов в крови;
- способствует закислению крови (этому препятствует фосфатні
буферная система крови);
- будучи мембранным ферментом (как и ГГТ). ШФ выпускав
глюкозу из тканей путем отщепления фосфорнокислого остатка
А тот, в свою очередь, регулирует уровень глюкозы в крови.
Правило 12
Так осуществляется один из механизмов поддержания уровня
' „^.пп Поэтому величина активности ШФ довольно стабиль-
сахара крннш. j
ja ,,ей юрко следят буферные системы. И если, несмотря на это,
Н' снь ШФ все же резко отклоняется от нормального в сторону по¬
вышения, то последствия вряд ли можно назвать «холссіазом». На¬
ступает тотальный сдвиг в гомеостазе:
_ изменяется pH крови;
меняется уровень глюкозы и целого ряда других констант;
повышается фосфатно-энергетический потенциал на уровне все¬
го организма, так как в сутки образуется 70 кі ЛІ Ф и с помощью
свободного фосфата реализуется закон сохранения энергии на
уровне целого организма.
Именно пол ому ШФ постоянно присутствует в крови от момен¬
та рождения в довольно ограниченных (узких) диапазонах активнос¬
ти, напоминая буферные системы.
Перечисленные особенности, по сути, отменяют нелепое пред¬
ставление о том, что повышенная активность ШФ является призна¬
ком холестаза. На самом деле это не так.
Правило 13. Лактатдегідрогеназа
Обшая активность .чакгаїдсі и.фогеназы (ЛДГ) состакли
250 МЕ/л и складывается из фракции - разных изоформ. Отсюда су
шествует понятие «шофермент». И «)(]к:рмси1ы кагали шрукп одну
акцию, но имеют различное строение (своеобразные биохимичес
синонимы). ЛДГ бывает в виде пяти изоформ ЛДІЛДГ3ЛД1 ,ЛД
ЛДГГ- каждая из которых состоит из четырех субъединиц (рис. 12
Почки
ЛДГ,
м:
м
м
м„
лдг,
:л
Мышцы
лдг4
н
и
м
—Sin
Ml
Г
Г-Т Z
н
м
[»
m£j&і
м
Печеш.
Ґ
Мозг
Рис. 12. Изоформы лактатдегідрогенази (ЛДГ):
Н - сердце (heart): М - мышцы (muscle):
ГБД -1 идроксибутирлтдогидрогеназа
68
Правило 13
ПЦГ активна исключительно в сердце, а ЛДГ5 - в мышцах. <)с-
п ные'же изоформы менее оріаноспспифичнм, но и определенной
1<L ■’ увязаны с почками, печенью и головным мозгом.
МС ч ія нормальной работы сердца в нем всегда должен присутство-
^ть кислород, тогда как для скелетных мышц это необязательно,
их возможен и анаэробный (бескислородный) распад. Почему не
в сердив?
Реакция превращения нировипоградпой кислоты (ГГВК) и мо¬
точную с участием ЛДГ$ (рис. 13) называется нируватлегидрогенези-
рование, а сам фермент (ЛДГ.) в этом случае именуется «пируват-1 ид-
рогеназа». Обратный процесс катализируется тем же с]«рмеіітом, но
теперь его «официальное» название- лактатдегидрогеназа. Сточки
•зрения ортодоксального химика данный термин неверен, но принят.
Оба взаимообратных процесса равновесны и представляют собой
единую саморегулирующуюся систему, поддерживающую конкрет¬
ные процентные соотношения каждого компонент. Но меняется
субстрат, и равновесие поддерживается «в другую сторону». *в поль¬
зу» продукта реакции (рис. 13).
енз енз
, лдг, ОІІАД -К
ШЯЕЯШШ
с=о htoeff)
ЛДГ 5 (-НАД’Нл)
. ;
соон соон
~1№ ~9<М
ПИК Лактат (МК)
Рис- Равновесная саморегулирующаяся система превращения
мировиної радной кислоты (ПВК) в молочную (МК)
К сердце же организму нельзя допустить образования молоч-
сГ? Кислогы’ иначе произойдет контрактура миокарда и остановка
*ЇЛІіа‘ 3а,о в скелетных мышцах вполне допустимо. Ведь там МК.
69
ІЗ 11 рани, іо
образуясь в анаэробных условиях при физической нагрузке, зат
постепенно поступает в печень. Это - цикл Кори. От М К огщепл
стоя два атома водорода, идет прекращение МК в ПВК с участи
ЛДГ,, схематично изображенное на рис. 13. Часть пирувата, к сно
очередь, идет по 1-му. 2-му и общему пути катаболизма глюкоз
в цикле Кребса I. а часть расходуется на образование глюкозы ч
рез глюконеогенез. Возможно также превращение ПВК в алани
(а затем в белки) в ГАШ.
Па приведенном примере видно, насколько крепки организме
ные функциональные взаимосвязи между веществами, соединени
ями, их превращениями и физиологическими процессами. Все
объединяет организм в живую саморазвивающуюся систему, еозда
его целостность, формирует единство и содружественный ответ все
компонентов на постоянно меняющиеся условия окружающей сре
ды. Это и есть метаболизм.
Правило 14. Креатинфосфокиназа
Креатинфосфокинаэа (КФК) катализирует реакцию превраще¬
ния креатина в крсатинфосфат (рис. 14).
Рис. 14. Метаболическая роль креатинфосфокиназы (КФК).
Извлечение макроэргического фосфата (-Ф) из митохондрий
Метаболический смысл действия фермент и процесса в целом
состоит в облегчении выхода из митохондрий макро эрги ческою
Ф‘>сфата, т.е. фосфата с богатейшим энергетическим потенциалом,
необходимым для здоровой и активной жизни. Это происходит при
участии креатина. Адснозипдифосфорная кислота (.АДФ) остается
внутри митохондрий. Молекула АДФ огромна и ее пребывание «сна¬
ружи», в ци топлазме, вне митохондрии нецелесообразно. Это потом,
а дыхательной цени, она вернется — ресинтезируется в аленозинтри-
Фосфат (дтф);
Q
.АДФ + ФК <-> АТФ
10 ккал
71
14 Правило
10 ккал - большая энергетическая величина! Поэтому вмс<
содержание КФК в крови, определяемое у паписта мри анализе щ
биохимических проб. - ото. как правило, хороший знак.
Врач должен помнить закономерность: чем больше в крови КФ{
тем интенсивнее работа митохондрии, тем лучше стимулировано ТІ
некое дыхание, тем мощнее реализуется биоэнергетика всею opraj
низма. Поэтому чем больше мы работаем, напрягаемся, нервничаем
тем выше в нашей крови концентрация л ого энзима. КФК один j
самых лабильных ферментов. Его «нормой» счи тается величина от]
до 20 М Е/л. по в норме же она может возрастать до 5000 М Е/л и болі
ше. «Ноль» КФК это абсолютный покой, нирвана. Но при есте«
венной активности человека уровень фермента может иодпиматт
от нуля до заоблачных высот, и это вовсе не будет указывать на «и<
раженис сердца» (как ошибочно записано во многих руководствах)]
а лишь свидетельствует о нормальной адат явной реакции органи:
ма на изменившиеся психофизические условия. В пике спортивне
тренировки содержание КФК в крови чрезвычайно высокое. Бонк
юю. уровень КФК служит показателем тренированное і и организм
чем он выше, тем выше спортивная тренированность. Как этообьж
нястся (кроме того, что уже сказано в настоящей лекции)?
Фермент КФК является прекрасным мембраиопротектором, о
защищает мембраны живых клеток. Образование и накопление к*
тинфосфата - еще один механизм защит ы мембран, способ нарабої
ки необходимого организму эндогенного лекарства. Поэтому гипе|
ферментемии но КФК (повышенное содержание фермента КФК в]
крови) благоприятный признак. Он указывает на начавшийся п|
цесс восстановления клеточных мембран, поврежденных болезни
творным фактором. КФК упорядочивает строение оболочки клетки]
после альтерации (повреждения). В ответ на альтерацию в организме
происходи! интенсивный выброс КФК, способствующий образова¬
нию крсатинфосфата, дающего энергию на выздоровление либо m
поддержание высокой (нормальной) активности.
Следовательно, если в биохимической пробе пациента обнаружен
высокий уровень КФК (практически любой конкретной величины),
то это указывает не на поражение чего-либо, а, прежде всего, на нор¬
мальную реакцию адаптации либо на интенсивное выздоровление.
Высокая активності, КФК — сакогенетическое, зашишо-комиенса*
торное явление.
Правило 15. Энергетический обмен
Для того чтобы хорошо разобраться в вопросах энергообчена. не¬
обходимо усвоить 5 положений:
1. Главная реакция энергетического обмена синтез волы (рис. 15).
Врачу-биохимику важно знать происхождение основных компо¬
нентов синтеза воды - кислорода и водорода.
2. Кислород поступает в энергообмем из окружающей среды с вды¬
хаемым воздухом. Водород же берется из никла Кребса I в резуль¬
тате дс1 идрирования субстрата. Каждая из четырех молекул во¬
дорода должна встретиться с кислородом дія образования 11,0.
Само название «водо-рол» говорит о том, что это - вещество,
рождающее воду, и подчеркивает значимость синте за воды.
3. Зисрі етичсский эффект (или стой мость) одной молекулы воды -
56 ккал. Эти килокалории распределяю!ся так: 30 ккал расходу¬
ются на синтез АТФ, а 26 ккал — ла образование тепла (рис. 15).
4. Способ синтеза воды - перенос протонов и электронов в дыха¬
тельной цепи. Нед», атом водорода, посуш, представляет собой
пару: «Один прогон + один электрон». Атом водорода - самый
элементарный из всех атомов (рис. 15).
5- Полная дыхательная цепь состоит из комплексов, в состав ко¬
торых входят белки и следующие коферченты: НАД: ФАД: уби¬
енной (коэнзим Q); система цитохромов (b, с, cl, а, аЗ). Буквы
обозначают различные по своим окислительно-восстановитель¬
ным свойствам шп охромы. Пару иитохрочов - а и аЗ - называют
также цитохромоксидазой. потому что они окисляют кислород
(присоединяют к нему два электрона). Эту- же дыхательную цепі,
можно образно представить себе как «спуск по лестнице» с одно¬
го ЭЛСКфОННОГО уровня на другой с выделением энергии. Если к
началу и к концу такою «лестничного пути» приложить напря¬
жение. it) движение электронов приобретет конкретное направ-
73
*
її
ф
5
Ю
В
5.
ф
і
0
і,
= ІЛ
О
S
Q.
і
fz
І
?
з
Правило 15
пение. Из курса физики известно, что направленное движение
электронов есть не 4-ю иное, как электрический ток. При этом
иеличина напряжения всей дыхательной цени составляет 1,24 В.
По всей длине электрической (дыхательной) цепи на каждом эта¬
пе выделяется энергия, суммарная величина которой и составля¬
ет 56 ккал. И только в трех местах - между НАД и ФАД, между b
и с 1. между а и аЗ - выделяется количество энергии, достаточное
дня синтеза АТФ, те.
10 ккал
АДФ - ФК -» АТФ I Ql
Эти три участка называются местом сопряжения окисления (пе¬
реноса электронов) и фосфорилирования (синтеза АТФ). Поэтому
синтез АТФ, сопряженный с окислением или переносом электронов
вдыхательной цепи, представляет собой окисли тельное фосфорили¬
рование с поглощением энергии
АТФ <-> АДФ + ФК
Если реакция направлена «влево» (->), то происходит выделе¬
ние энергии (Q Т) в размере 10 ккал. Если же реакция направлена
«вправо» (<—), то она сопровождается, наоборот, поглощением энер¬
гии (QI) в размере 10 ккал. Величина «10 ккал» - разменная монета.
В тех трех местах (между: НАД и ФАД, b и сЗ, а и аЗ) синтезируется
три молекулы АТФ, в каждом месте - по одной молекуле. При этом
затрачивается 10 ккал х 3 = 30 ккал. Эти-то 30 ккал и идут на синтез
АТФ, а остальные 26 ккал (56 - 30 = 26) расходуются на тепло.
Остается подчеркнуть, что вышеописанные процессы характер¬
ны лая нормы и для состояния функционального покоя.
Итак, запомните два термина и осознайте их смысловое значение
(рис. 15):
J- Свободное дыхание.
2- Окислительное фосфорилирование.
Свободное дыхание - ото перенос протонов и электронов в ды¬
хательной цепи с выделением 56 ккал без синтеза АТФ. Вся знері ия
ИАет на образование тепла, отсюда термин «свободное дыхание».
Окислительное <1юсфори>шровапие — это дыхание, сопряженное с
синтезам АТФ, когда часть энергии (а именно, 30 ккал) идет па се об¬
разование.
(Имейте в виду, что биологическое окисление и тканевое дыха-
Иие - ГУГО одно и то же.)
Отсюда различают два класса соединений: ингибиторы и разоб-
ид,пел и тканевоіч) дыхания.
75
15 Правило
Ингибиторы, соединяясь с каким-то компонентом дыхателык
цепи, тем самым прерывают цепь, что означает гибель для органи зи
І Іодобньїе процессы происходят, например, при отравлении угарны
газом, солями синильной кислоты, которые соединяются С UHTOXJ
мами а и аЗ на самом завершающем этапе дыхательной цепи. Циіі]
ниды иніибируюі (даже блокируют, сильно и необратимо тормоз»
перенос электронов либо синтез вольт, потому что они ннгибируї
ци гохромоксидазу. Цитохромы а и аЗ окисляются кислородом, огеї
да и название фермента «цитохромоксидаза».
Разобшитсли же не мешают синтезу воды, нс мешают- встречу
кислорода с водородом, но мешаюі синтезу АТФ, и, следовательж
разобщают дна процесса: окисление (перенос протонов и эдск гропої
и синтез АТФ. В норме оба этих фактора должны быть сопряжены^
Л при дейст вии разобщителей вся энергия идет лишь на свободи
дыхание (окисление). Известен лишь один эндогенный разобі
гель тироксин.
При лихорадке резко повышается потребность в энергии. кисл<
роде, водороде. Откуда все это берется? Кислород - из учащенном
дыхания лихорадящего больного, водород - из никла Кребса. Чт
же касается энергии, то все 56 к кал расходуются на обеспечение ли¬
хорадки. поэтому у таких больных отмечается чрезмерная слабой
Кроме тот, при лихорадке либо во время других экстремальных си¬
туаций (когда повышается онсріетичсский запрос) запускается сук-
нинагпмй шунт.
Сукцинатным шунтом называют укороченный вариант тканевой
дыхания, укороченную дыхательную непь. «Укорочепносты* достиг,
ется за счет выключения первою комплекса - НАД. Электроны пос¬
тілки сразу на ФАЛ и при этом теряется одно меси»синтеза АТФ (н<
этапе между НАД и ФАЛ). Іоіда оказывается, что вместо нормально¬
го: *56 ккал - 30 ккал (на АТФ) = 20 ккал (на свободное тепло)»,
при работе сукцинатного шунта происходит следующее изменение:
*56 ккал — 20 ккал (на АТФ) = 30 ккал (на свободное тепло)». В месі
іреч молекул АТФ образуется две. На свободное тепло выделяется на
J0 ккал больше (не 20. а 30), поэтому лихорадочные больные - го¬
рячие на ощупь. Так происходит перераспределение энергии. Коль
скоро на АТФ идет меньше ккал тепла, чем в норме, m такое пере¬
распределение представляет собой холостой неэкономный ХОД шер¬
пи ичсского обмена.
Итак, существует многоуровневый способ поддержания и нара¬
ботки тепла. Такая биохимическая многоэтажность подобна иерар¬
хической организации нервного цен іра физиологической функции.
76
Правило 15
її нс только подобна, но, по сути, составляет молекулярную основу
„оою процесса, всю молскулярно-организмснную вертикаль.
Отсюда можно заключить, что при лихорадке увеличение геп-
•1(,продукции может достигаться: I) подачей большого количества
кислорода; 2) подачей дополнительного количества субстрата (аце-
,цлкоэнзима-А в топку цикла Кребса) с целью достижения больше¬
го производства атомов водорода для синтеза воды; 3) укорочением
дыхательной цепи через сукцинатный шунт, который автоматически
требует запуска ГАШ. Ведь источник углеводов па фоне лихорадочно¬
го процесса отсутствует, жиры не используются, поэтому единствен¬
ное. что остается - трата белка для подлержания адекватного уровня
глюкозы в крови, а также адекват ного снабжения цикла Кребса.
Для лучшего восприятия описанных процессов и для формиро¬
вания клинического, медико-биохимическою и физиологического
мышления врача рассмотрим детальнее работу сукнина того шунта.
В цикле Кребса есть реакция, которую катал изирует фермент сук-
иинатдепшрогеназа (СДГ), отщепляющий два атома водорода (2Н)
<ут молекулы янтарной кислоты (ЯК или сук і пшата). «В честь» него,
собственно, и назван шутгт;
СДГ
Я К -> ФАД112 + ФУМАРОВАЯ КИСЛОТ А
Это означает, что два атома водорода попадают в дыхательную
цепь (при лихорадке и. і и других экстремальных состояниях цепь идет
по укороченному варианту) с наработ кой большого количества теп¬
ла, но меньшого количества АТФ.
На рис. 16 показано перераспределение энергии в цикле Кребса:
ни этапе ФАД «56 ккал - 20 ккал - 36 ккал».
Но из четырех дегидрирований (из 4 высвободившихся атомов
водорода) в трех случаях работает не ФАД, а НАД. Путь с НАД всег¬
да дает нс две, а три молекулы АТФ. что видно из простого расчета:
56 ккал - 30 ккал = 26 ккал. Вычитаемое «30» складывается, как уже
было сказано выше, из трех порций энергии по 10 ккал каждая, рас¬
ходуемой именно па синтез АТФ. Если же всю биоэнергетику пере¬
ключить на ФАД (а этой делает сукцинатный шунт!), ю, например,
при лихорадке каждое дегидрирование (а оно приравнивается по
смыслу к синтезу эндогенной воды) означает перераспределение об
•него фонда реакции образования энергии в пользу теплопродукции,
а нс в пользу синтеза АТФ.
Поэтому если представить себе лихорадочного больного, интен¬
сивно работающего физически (что затруднительно, но житейски
15 Правило
такие случаи не исключены), то для элементарной результативности
его деятельности придется потратить объективно больше усилии, чем
здоровому человеку.
Следовательно, при лихорадке либо в каких-то других напряжен¬
ных экстремальных состояниях укороченный обменный процесс,
обеспечивающийся рабо і ой сукцинагного шунта, энергетически на¬
много дороже нормального теплообмена.
Правило 16. Алгоритм биохимического
анализа, производимого врачом
Когда врач получает из лаборатории полный биохимический
анализ, то он должен уметь его прочесть, т.с. проанализировать
с точки фения особенностей метаболизма конкретного больного,
а не при помощи шаблона общепринятых нормативов. И уж ко¬
нечно нс спешить ставить диагноз о «поражении на основе эи-
зимодиагностики». Нс забывайте, что наличие и вариативность
ферментов в крови создано природой отнюдь нс для обозначения
зоны поражения, и не для постановки диагноза врачом, а, преж¬
де всего, для поддержания здоровья человека, для сохранения его
гомеостаза, обеспечения наилучшей адаптации к условиям сущес¬
твования, создания оптимальных условий для развития. Иными
словами, фермептемия биологически целесообразна именно бла¬
годаря своей функциональной вариативности. Поэтому врачу-
биохимику необходимо знать классификации ферментемий. Вна¬
чале рассмотрим классификацию ферментемий по клиническим
характеристикам.
Ферментемий
1. Онтогенетическая
2. Парадоксальная
3. Индуцированная
4. Управляемая
5. Синдромальная
6. Банальная
7. Функциональная
К. Саногенстическая
9. Аферментсмия
10. .Адаптивная
79
16 Правило
Онтогенетическая ферментемия означает более высокие уро
ни активности ферментов к момент рождения и их постепенное
снижение к наступлению половой зрелости. Это относится нрак
тически ко всем ферментам, но особенно выразиісльно иллюс
трируется возрастной динамикой по ЩФ и ГГТ. Несоответствие
уровня активности ферментов возрастному нормативу (указанных
в справочниках по биохимическим показателям) может указывать
на: онтогенетическую незрелость, более низкие адаптивные спо¬
собности организма, повышенную чуветвиїельность к патоген¬
ным факторам. Например, активность ПТ при рождении - око¬
ло 100 МЕ/л, а к 18 годам - около 20 МЕ/л. Активность ЩФ при
рождении - около 400 МЕ/л. а к 18 годам - около 100 Ml-/л. Это
означает, что транспорт аминокислот в ткани через мембрану кле¬
ток у детей больше, чем у взрослых. А более высокая активность
ЩФ означает более свободный и мощный фосфатный (энергети¬
ческий) потенциал организма.
Парадоксальная ферментемия означает повышение активности
фермен 1ов при клиническом улучшении состояния больного. Ее «па¬
радокс* заключается в том. что традиционное представление о фер-
ментемии как непременном маркере повреждения «парадоксально
противоречит» позитивным клиническим сдвигам. На самом же деле
никакого парадокса нет, так как повышение активности ферментов
имеет всего лишь адаптивное значение. Причиной такого биохими¬
ческого явления служит улучшение кровообращения на периферии,
когда восстановление оптимального кровотока происходит на уров¬
не капиллярного ложа и поступление крови на периферию сочета¬
ется с оптимальным возвратом метаболитов из гканей. Фактически
парадоксальную ферментсмию можно рассматриват ь как индикатор
физиологической стабилизации кровообращении и отражение сис¬
темности наблюдаемых явлений, т.е. зависимости изменения био¬
химических показателей су г состояния важнейших физиологических
функции организма.
Индуцированная ферментемия связана с активацией і с ном и для
усиления синтеза соответствующих ферментов или торможеїшя их
распада. Стимуляторами синтеза ферментов могут быть лекарст ва,
наркотики, алкоголь и другие химические вещества, индуцирующие
синтез ДНК. а значит, ипдунируюшие изменение количества моле¬
кул ферментов (и сторону увеличения либо уменьшения).
Управляемая фермен геми я означает повышение активное! и фер¬
ментов в крони в ответ на различные виды патогенетической терапии.
80
Правило 16
Так. например, применение гипербарической оксигенации (ГБО) уп¬
равляет уровнем активности ACT, повышая сто.
С'инлромальная ферментемия является важнейшей характерис¬
тикой целою ряда синдромов (интоксикационного, лихорадочного,
цереброкардиального). К примеру, повышение ликворного давления
и спазм сосудов на периферии обязательно сопровождается повыше¬
нием активности сердечной КФК. Различные виды интоксикации
часто сопровождаются повышением ГГТ, а тахикардия при лихорадке
сочетается с повышением КФК.
Банальная ферментемия. Только этот вид ферментемии и явля¬
ется истинным признаком цитолиза, когда в ответ на действие иато-
і енного фактора (токсины, бактерии, вирусы и яды) происходи т раз¬
рушение клеток по типу местного и тотального некроза, и при этом в
крови повышаются одновременно и одноуровменно разные опреде¬
ляемые ферменты.
Функциональная ферментемия обычно проявляется в результате
интенсивной работы, вследствие интенсивного тренировочною про¬
месса, иного сверхнапряжения, т.е. при стрессе. Серия интенсивных
тренировок обычно сопровождается значительным повышением
КФК.
Саногенетнческая ферментемия означает повышение активности
ферментов при выздоровлении и восстановлении физиологических
констант. Самої енстичсский характер ферментемии направлен на
восстановление гомеостаза за счет гомеокииеза, при котором именно
ферментам и отводится главная роль.
Аферментемня обычно означает стадии атрофических процессов
как результат эндогенною и экзогенною голодания, а также связана
с серьезными отклонениями в онтогенезе. Поэтому нужно помнить,
что приближение уровня активности ферментов к нулевым значени¬
ям должно быть причиной особой тревоги, а не радоват ь врача (как
>то традиционно принято в лабораторной диагностике). Справочные
нормативы, а также іе. «нормы-», что указываются в бланках результа¬
тов биохимических анализов, типа «от 0 до 40* — ію существу абсурд¬
ны. так как ноль означает полное отсутствие активности фермента,
созданного природой дія здоровья и адаптации.
Адаптивная ферментемия это след адаптации к многократным
воздействиям различных факторов. Этот вид ферментемии отражает
приспособление организма на стадии резистентности (по Г. Селье),
генетически закрепляется. Эпизодические повышения активности
81
16 Правило
ферментов могут сохраняться длительное время, а иногда и на всю
жизнь.
Классификация фермситемий по клиническим характеристикам,
приведенная выше, должна быть дополнена функциональными осо¬
бенностями каждого из анализируемых ферментов:
ЛДГ
Маркер эритроцитарного пула
Компонент буферной системы
Реіулятор углеводных потоков
Маркер анаэробною токсикоза
ГБД
Фермент стресса
Компонент буферной системы
Маркер липидного токсикоза
КФК
Продуцент мембраноиротектора
Индикатор биоэнергетических сдвигов
Стимулятор агрегации тромбоцитов
Компонент фосфатной буферной системы
Индикатор фосфолипазного цитолиза
ACT
И11 тегратор метаболизма
Маркер центральной зоны катаболизма
Индикатор пол-механизма цитолиза
АЛТ ' І
Компонент глкжозо-алан и нового шунта
Маркер периферической зоны катаболизма
АСТ/АЛТ
І Іоказа гель адаптации метаболических потоков
ЩФ
Маркер онтогенетической зрелости
Компонент фосфатной буферной системы
Регулятор трансмембранных потоков
Индикатор выхода цитрата из костей
ITT
Маркер малигнизапии
Маркер интоксикации
Маркер аллергизаіі и и
Маркер онтогенетической зрелости
82
Правило 16
Аминокислотный насос клетки
Антигенный компонент
Следует помнить, ч і о все ферменты обеспечивают метаболичес¬
кие потоки. Это означает, что каждому из ферментов отведено соот¬
ветствующее место в конкретном метаболическом пути (гликолиз,
протеолиз, синтез и распад жирных кислот и ілі.). Уровень активнос¬
ти фермента отражает долю его участия, а значит, и интенсивность
того пути метаболизма, к которому он от носится.
Существует еле,чующая закономерность: чем большее количество
молекул фермента, тем выше его активность, а значит, выше интен¬
сивность метаболического пути. Синтез ферментов, в свою очередь,
является результатом целого ряда этапов реализации існстичсской
информации, которые приведены ниже.
Этапы реализации генетической информации:
1. Репликация.
2. Транскрипция.
3. І Іроцессинт.
4. Прохождение через ядерііыс мембраны.
5. Трансляция.
6. Секреция в каналы лишила зматичеекого ретику.иума.
7. Поспрансляционные модификации и упаковка в аппарате
Гольджи .
8. Комплементарные взаимодействия (физиологические аффекты).
9. Деградация белка.
Отсюда видно, что снижение уровня активности ферменти мо¬
жет быть результатом нарушения любого из этапов реализации гене¬
тической информации. Результат видно, а ист инную причину' врачу
еще предстоит распознать. Для этого необходимо строгое соблюде¬
ние технологии биохимического анализа.
Технология биохимического анализа
1. Информационный вал как фактор лабораторной среды
2. Основной принцип анализа: ба за данных, база знаний, алюри і м
знаний
3. Анализ ошибочных попыток:
а) преждевременная статистика;
б) отсутствие типирования;
в) пренебрежение метаболической сущностью показателей;
г) отсутствие характерного для патологии алгори і ма;
д) переоценка значения «нормы»:
с) недооценка крови как информационной среды.
83
16 Правило
4. Показатели:
а) стандартные;
б) реиипрокные;
к) фундаментальные;
г) выключающие;
д) вспомо гател ьн ы е.
5. Этимологические синонимы:
а) ACT — катаболическая, м итохондриал ьная, термої сі и іая;
б) АЛТ - анаболическая, глюконеогенная. стресс-инауііированнам;
в) ГІТ- мембран іранспоріная, 11 ос та іе і я юшая, ком неї ісаторі іая;
г) ШФ - буферная, энергетическая, фосфатизвлекаюш.ая.
Правило 17. Интеграция метаболических
и энзимологических показателей
(«энзимо-метаболический веер»)
Ферментативные и другие биохимические показатели тесно сня-
таны с метаболизмом и, но сути, отражают сю общую направлен¬
ность, а также оттенки и частности. Следовательно, по результатам
нескольких анализов крови можно судить об обмене вещест в боль-
НОІ о как на уровне целостного организма, так и па уровне отдельною
физиологического (и патолої ического) процесса.
Заключение врача будет тем подробнее, чем больше биохимичес¬
ких показателей взято для оценки. Всю их совокупность можно об¬
разно представить в виде энзимо-метаболического веера (рис. 17).
Если принять, чю каждая лопасть (или сектор) веера — это сим¬
вол уровня активности отдельною фермента, то становится ясно,
что «удерживающим» их основанием (или конечной метаболической
целью) является константное соотношение концентрация глюкозы
и холестерина, равное десяти. При этом сами холестерин и глюкоза
могут варьировать, лишь бы удерживалась дорогостоящая десятка.
Ведь это - одни из наиболее энергетически дорогих для организма
субстратов.
Сектора веера могут расходиться строго индивидуально, но обя¬
зательно сочетанно с другими секторами (рис. 17). «Сектор» ACT —
зю параметр знерістических затрат (катаболизма), который очень
вариат ивен как в норме, так и при патологии. Его колебания субъек¬
тивно не улавливаются, а лишь регистрируются биохимически, ко¬
личественно. Активность АЛТ показатель, подчиненный ACT. Он
отражает противоположные — анаболические механизмы. Поэтому
при развертывании веера его ширина обеспечивается либо за счет
ACT (тогда этот показатель представлен уже несколькими сектора-
85
17 Правило
Рис. 17. Веер форм физиологических (адаптивных) закономерностей
ферментемии (Рослый И.М., Водолажская М.Г., 2005)
ми), либо за счет АЛТ. Но может быть ситуация, когда оба этих про¬
цесса (ката- и анаболизм) протекают слишком ин існсивно — лопасти
веера расширяются и но ACT. и по АЛТ. Это наблюдается, например,
при инфекционной лихорадке, алкогольном термогенезс чаше па
стадии перехода от осірой фазы к периоду восстановления. В любом
случае такое соотношение указывает на затянувшуюся компенсацию,
когда организм с большим трудом справляется с боле шью. Тогда на
помощь обоим ферментам приходит ГГТ. F,e активность свидетель¬
ствует об уровне снабжения субстратами больного либо здорового
организма. Если пока:шель ПТ высок, то происходит интенсивное
заимствование аминокислот из тканей. Веер при этом расширяется
за счеі сектора «ГГТ».
Результатом же суммарной траты аминокислот является уровень
мочевины и крови. При закрытом веере это - четвертая лопасть. При
развернутом же почт любое количество. Чем больше тратиіся
собственно і каневыхаминокислот (об этом сулим по ГI Г), тем боль¬
ше отщепляется в кровь аминоірупп от углеродного скелета каждой
аминокислоты. Эги аминогруппы нейтрализуются, гак как они опас¬
ны для ор!анизма (токсины!). Осуществляется дан пая нейтрализация
путем синтеза мочевины:
2N11, + С()2 -> H.N-CO-NH,
86
Правило 17
Повыше ние уровня мочевины указывает на усиление использова¬
ния аминокислот ;ия синтеза глюкозы, холестерина (деся іка), а так¬
же для термогенеза (ЛСГ). Подчеркнем, что по ГГТ судят о заимство¬
вании аминокислот из собсгвенных тканевых резервов организма, а
по мочевине — об интенсивности их использования. Остается не про¬
комментированной промежуточная стадия данного фрагмента ами¬
нокислотного обмена — нахождение аминокислот в крови н свобод¬
ном состоянии. Их практически всегда не хватает. О степени лого
дефицита свидетельствует уровень общего белка. Его снижение гово¬
рит о неблагополучии орпшизма в целом — дефицит по аминокисло¬
там чрезмерен и опасен.
Такие колебания ферментов и метаболитов не могут быть беспре¬
дельными (развертывание веера оіраничено, ибо он можег сломать¬
ся). И единственным сдерживающим фактором является уровень
креатинина, который жестко константен и мало меняется у больных.
Креатинин колеблется в предельно узком диапазоне и является пока¬
за гелем интенсивности термогенеза (катаболизма), о котором врач,
имея биохимические показатели, судит, прежде всего, по ACT, сс же
активность связна с АЛТ, ГГТ, мочевиной, глюкозой и холестерином
(рис. 17). Но ACT играет роль * печки» (как и митохондрии), а креа¬
тинин - роль «поддувала*. Мочевина же оказывается «пеплом», со¬
жженных в I П К «дров» аминокислот. Этим самым иллюстрируется
физиологическое равновесие в любых условиях, в том числе патоло¬
гических, основанное на жестких метаболических связях.
Троица энзимологических потоков — ACT. АЛТ, ГГТ (плюс мо¬
чевина) - обеспечивает аїрессивньїн катаболизм, неустойчивое рав¬
новесие и компенсаторный анаболизм за счет ГНГ с достижением
парной (глюкоза и холестерин) константы. Фактически в любом со¬
стоянии мы можем иметь четкое представление о статусе организма
после любого стресса, в том числе болезни. Семь основных биохи¬
мических показателей дружно и сопряженно подтверждают дока¬
занную нами аксиому: константность метаболических показателей
обеспечивается вариативностью этимологических сдвигов. Весь веер
биохимических показателей должен стать объективным критерием
физиологического состояния, а не нссндоиллюстрацией абстрактной
нормы. В анализ должна входить оценка данных но принципу: база
данных переходит в базу знаний и далее алгоритм знаний с точным
объективным заключением с выходом на клиническое прогнозиро¬
вание: тяжесть состояния, исход заболевания, скорость развития на
тологического процесса, влияние іерании. адекватная оценка веду¬
щих синдромов.
87
Литература
1. Абрамов С.В., Росши И.М., Белова Е.Г., Еремушкина Я.М.
Метаболические основы биохимических сдвигов в плаз¬
ме крови // Современные достижения фундаментальных
наук в решении актуальных проблем медицины: Материалы
научно-практической конференции. — Астрахань, 2004,
С. 60-65.
2. Агаджанян НА. Адаптационная физиология - философия
медицины. Программа I Съезда физиологов СНГ «Физиоло¬
гия и здоровье человека» / Под рел. Р.И. Сепиашізили. М.:
Медицина; Здоровье, 2005. - С. 7.
3. Лрушаняи Э.В. Участие эпифиза в антистрессовой заши¬
те мозга // Успехи физиол. наук. - 1996. Т. 27. - Х° 3. -
С. 31-50.
4. Арушанян Э.Б., Арушанян Л. Г. Хронобиологичсские доказа¬
тельства анксиолитических свойств энифи тарною гормона
мелатонина // Материалы Всероссийской науч. конф. с меж-
дунар. участием «Актуальные проблемы экспериментальной
и клинич. фармакод.». 2—5 июня, 1999. - СПб., 1999. - С. 17.
5. Видалажская А/-/- Влияние потребления алкоголя на состоя¬
ние катехолачинергической системы и адаптивное поведение
(экспериментальное исследование): Автореф. лис. ... канд.
биол. наук. М., 1993. — 24 с.
6. Воробьев Л.В.. Черняховский С.И. Физиологические основы
нормализации иммунного статуса// Научные труды 1 съезда
физиологов СНГ. Сочи, Дагомыс, 19—23 сентября 2005. Т. 1,
Хз 295. - С. 108.
7. Држееецкая И.А., Водолажская М.Г. Возрастная динамика ка-
тсхоламннергической системы потомков, получавших алко¬
голь но время беременности // Рел. журнала Фармакология
Литература
и токсикология. - М., 1991. - 12 с. - Библиогр.: 9 назв. -
Рус. - ДЕП в ВИНИТИ 05.02.91, .\ь 581-В91.
8. Иванов В. Г. Шаміш Л.И. Путь к синтезу белка. - Л.: Химия.
1982. 176 с.
9. Коган Б.М. Состояние кагехоламиновой нейромедиации
мри алкоголизме: Днгореф. лис. ... докт. биол. наук. — М..
1988. - 48 с.
10. Кожечкии С.Н., Свидерская Н.Е., Коштоянц О.Х., Середе
нин С.Б. ЭЭГ крыс мри острой алкогольной интоксикации.
Отведение от 24 точек. Многопараметрический анализ //
Российский физиологический журнал им. И.М. Сечено¬
ва. - 2004. - Т. 90. № 8 (Ч. 2). - С. 438.
11. Кузнецова К.И., Горбачевская Н.Л., Байкова В.Н., Иванов А.В.
СвязьЭЭГ с биохимическими показателями у детей с лимфоб¬
ластными опухолями // Российский физиологический журнал
им. И М. Сеченова. - 2004. - Т. 90. - № 8 (Ч. 2). С. 441.
12. Ленинджер А. Биохимия. Молекулярные основы структуры и
функции клетки / Пер. с ашл. - М.: Мир, 1974. 957 с.
13. ЛюбаревА.Е., Курганов Б. И. Молекулярная биология. —1987 —
Т. 21. Вып. 5.-С. 1286-1296.
14. Марри Р., ГреннерД., Мейес И., Нодули В. Биохимия человека:
В 2 т. / Пер с англ. М.: Мир, 1993. 752 с.
15. Нейрофизиологические исследования в клинике / Пол рсд.
проф. Г.А. Щекутьева. — М.: Ли і идор, 2001. - 232 с.
16. Нейрохимия / Под рсд. И.П. Ашмарина. - М.: Изд-во Инсти¬
тута Биомедицинской химии РАМН, 1996. -470 с.
17. Оганесян Г.А., Карманова И.Г., Аристакесян Е.А. и др. Науч
мыс груды 1-го съезда физиологов СНГ. Сочи, Дагомыс. 19-
23 сентября 2005. - Под рсд. Р.И. Сешіамівили. - Т. 1. — М.:
Медицина: Здоровье, 2005. - С. 158.
18. Пальцев М.А., Иванов А.А. Межклеточные взаимодействия. -
М.: Медицина. 1995. 224 с.
19. Попов Б.М. Естествознание и проблема белка. — М.: Высшая
школа, 1989. 416 с.
20. Рослый Н.М., Абрамов С.В. Надмолекулярная организация
и функции креатинфосфокина зной системы і І Успехи фи-
зиолог ических наук. 2008. - Т. 36. № 3. — С. 65—72.
21. Рослый И М., Абрамов С.В. Биохимические показатели крови
при физиологической беременности // Вопросы гинеколо¬
гии, акушерства и перипаталогии. - 2005. — Т. 4. - № 2.
С. 7-14.
89
Литература
22. Рослый И.М., Абрамов С.В. Гипотеза: адаптивное значение
ферментамии // Патологическая физиология и эксперимен¬
тальная терапия. — 2003. - № 4. С. 5—9.
23. Рослый И.М., Абрамов С. В. Агаронов И.Р.. Шшшко Т.А., IНу¬
лик Ю.А. БИОХИМИЯ И АЛКОГОЛИЗМ (111): Длительная
алкоголизация как механизм развития белковой дистро¬
фии //Вопросы наркологии. —2004. -№4. — С. 75- 81.
24. Росши И.М., Абрамов С.В. Ахметов Р.Р., Рынейскан Е.С., Рых-
лщкии П.З., Шуляк Ю.А. БИОХИМИЯ И АЛКОГОЛИЗМ
(II): биохимические показатели при іяжелом алкогольном
абстинентном синдроме // Вопросы наркологии. — 2004. -
№ 3. - С. 69-78.
25. Рослый И. А/.. Абрамов С. В. Особенности биохимической адап¬
тации при вирусных гепатитах//Эпидемиология и инфекци¬
онные болезни. — 2003. -№4. - С. 45-48.
26. Рослый И.М., Абрамов С.В. Принципы оценки энзимологиче¬
ских показателей крови больных инфекционной патологи¬
ей (1) // Инфекционные болезни. — 2003. - Т. 1. — N° 1. -
С. 58-64.
27. Рослый ИМ., Абрамов С.В. Сравнительная энзимологическая
и метаболическая характеристика сыворотки крови и ликво¬
ра при менинткокковых и пневмококковых менингитах //
Эпидемиология и инфекционные болезни. 2004. -№ 6. -
С. 27 34.
28. Рослый И.М., Абрамов С.В., Агароиов В.Р., Иванов А. В., Шуляк
Ю.А. БИОХИМИЯ И АЛКОГОЛИЗМ (I): метаболические
процессы при алкоголизме// Вопросы наркологии. - 2004. —
№2. -С. 70-79.
29. Рослый И.М.. Абрамов С. В., Ага[юное В.Р., Рожкова Е. С, Шуляк
Ю.А. БИОХИМИЯ И АЛКОГОЛИЗМ (IV): типовые клини¬
ко-биохимические синдромы при хронической алкогольной
интоксикации // Вопросы наркологии. 2004. — No 5. -
С. 46-56.
30. Рослый ИМ.. Абрамов С.В., Белова Е.Г. Принципы оценки эн¬
зимологических показателей крови больных инфекционной
патологией (111): способ метаболического анализа биохими¬
ческих показателей на примере инфекционного моноиук-
леоза // Инфекционные болезни. — 2004. Т. 2. - N2 2. -
С. 13-І?.
31. Рослый И.А/., Абрамов С.В., Белова Е.Р., Еремушкина ЯМ.
Принципы оценки энзимологических показателей кро-
90
Литература
ви больных инфекционной патологией (II): синдром ин¬
токсикации // Инфекционные болезни. — 2004. - Т. 2. -
№1. - С. 12-19.
32. Рослый И.At., Абрамов С.В., Водолаокская М.Г. Биология и
медицина: приоритет фундаментального знания иди клини¬
ческого мышления // Сборник трудов научной конференции
«Актуальные вопросы клинической медицины». МГМСУ
НИМСИ. - М., 2005. -С. 137-139.
33. Рослый И.М., Абрамов С.В., Водолаокская М.Г. Научные труды
1-го съезда физиологов СНГ. Сочи, Дагомыс, 19—23 сентяб¬
ря 2005 / Под ред. Р.И. Сепиашвили. - Т. 1. — М.: Медицина;
Здоровье, 2005. С. 13.
34. Рослый И.At., Абрамов С.В., Водолажская М.Г., Шуляк Ю.А.
БИОХИМИЯ И АЛКОГОЛИЗМ (VI): биохимические по¬
казатели плазмы крови в оценке метаболическою статуса
больных алкоголизмом // Вопросы наркологии. — 2005. -
№ 1. - С. 59-67.
35. Рослый И.At., Абрамов С.В., Кускова Т.К. Принципы оценки
энзимологических показателей крови больных инфекцион¬
ной патологией (IV): об информативной ценности кардиоспе-
цифических ферментов при инфекционном мононуклеозе //
Инфекционные болезни. -2004. - Т. 2. N?4. — С. 13 17.
36. Рослый И.At., Абрамов С.В., Малеев В.В. и др. Принципы оцен¬
ки энзимологических показателей крови больных инфекци¬
онной патологией (V): биохимические показатели крови при
астраханской риккетсиозной л ихорадке у детей//Инфекцион¬
ные болезни. — 2005. - Т. 3. - № 2. —С. 45—50.
37. Росши It.At., Абрамов С.В., Покровский В.И. Ферментемия
адаптивный механизм или маркер цитолиза? // Вестник
РАМН. - 2002. 8. - С. 3-9.
38. Рослый И М., Абрамов С.В.. Шипико Т.А. и др. БИОХИМИЯ
И АЛКОГОД ИЗМ (V): развитие белковой дистрофии и пато¬
генез алкоголизма//Вопросы наркологии. -2004. — № 6. -
С. 59-66.
39. Росили И.М., Водолажская М.Г. Принципы изучения кли¬
нической биохимии при подготовке врачей-биохимикон в
системе университетского образования // Вес гни к Ставро¬
польского государственного университета. — 2005. — N: 4. —
С. 21 29.
40. Рослый Н.М.. Абрамов С.В., Водолажская М.Г.. Шуляк Ю.А.
Биохимические показатели плазмы крови в оценке метабо-
91
Литература
лических особенностей патогенеза алкоголизма // Вестник
Ставропольского государственного университета. - 2005. —
М-4. -С. 30-37.
41. Рослый ИМ, Водолажский Г. И. Молекулярная биология: кон¬
спекты лекций. - Ставрополь: Идл-воСГУ. 2006. - 41 с.
42. Рослый И. М., Шуляк Ю Л. Прак і плеская биохимия. М.: Бор¬
гес, 2004.- 167 с.
43. Роуз С. Устройство памяти. От молекул к сознанию / Пер.
с англ. - М.: Мир, 1995. - 384 с.
Указатель иллюстраций
Рисунок 1. Схема взаимодействия субстрата с активным центром
фермента
Рисунок 2. Роль ЛОТ в переаминировамии аспарагиновой ами¬
нокислоты (АСП) и щавелевоуксусиой кстокислогы
(ЩУК)
Рисунок 3. Зависимость интенсивности взаимного превращения
белков в углеводы от активности ACT (от «ширины во¬
ронки*)
Рисунок 4. Разное функциональное состояние ко-фермента ACT
витамина В,
Рисунок 5. Схема действия глюкозо-алан и нового шунта (ГАШ)
Рисунок 6. Обобщенная схема меіаболизма углеводов
Рисунок 7. Биохимический итог цикла Кребса
Рисунок 8. Функциональные соотношения глюконеогенеза, глю-
козо-аланинового шунта и трансаминировапии с ACT
Рисунок 9. Граф логической структуры по теме «Белки*
Рисунок 10. Схема усложнения аминокислот в зависимости от раз¬
Рисунок 11.
Рисунок 12.
Рисунок 13.
Рисунок 14.
Рисунок 15.
Рисунок 16.
Рисунок 17.
мера их радикала
Схема молекулярной структуры холестерина
Изоформы лактат дегидрогеназы (-ІДГ)
Равновесная саморегулирующаяся система превра¬
щения нировинограднои кислоты (ПВК) в молочную
(МК)
Метаболическая роль крсаі инфосфокинаты (КФК).
Извлечение макроэргического фосфата (~Ф) из мито¬
хондрий
Граф Онергообмеи*
Перераспределение энергии в цикле Кребса
Веер форм физиологических (адаптивных) закономер¬
ностей ферментемии
93
Учебное изделие
Рослый Игорь Михайлович,
Водолажская Марі ирита Геннадьевна
Правила чтения биохимического анализа
Учебное пособие
Санитарно-эпидемиологическое заключение
№ 77.99.60.953.Д.008014.07.09 от 08.07.2009 г.
Подписано к печать ??.??.2008. Формат 60x90/16
Бумага офсетная. Гарнитура «NewtonC». Печать офсетная.
Объем 6 печ. л. Тираж 1500 экз. Заказ № В-1927.
ООО «Издательство «Медицинское информационное агентство -
119048, Москва, ул. Усачева, д. 62, стр. 1. оф. 6
Тел.: 8 (499) 245-45-55
E-mail: тіариЬІФгл ail.ru http://www.medagency.ru
Интернет-магазин: www.medkniga.ru
Отпечатано в ОАО ПИК «Идея-Пресс»
420066, г. Казань, ул. Докабристов. д. 2
ISBN 978-Ь-9986-0021-0
9