Автор: Жуков А.П. Малахов А.И.
Теги: металлургия металловедение обработка металлов металлы коррозия металлов высшая школа
Год: 1978
Текст
А Н МАЛАХОВ • АП ЖУКОВ
основы
МЕТАЛЛОВЕДЕНИЯ
И ТЕОРИИ
Н0РР03ИИ
| А. И. МАЛАХОВ I , А. П. ЖУКОВ
ОСНОВЫ
МЕТАЛЛОВЕДЕНИЯ
И ТЕОРИИ
КОРРОЗИИ
Допущено
Управлением кадров и учебных заведений
Министерства автомобильной промышленности СССР
в качестве учебника
для машиностроительных техникумов
по специальности 0807
«Электрохимические покрытия»
МОСКВА «ВЫСШАЯ ШКОЛА» 1978
ББК 34.2 + 34.66
М18
УДК 669.017 + 620.19(075)
Рецензенты: доц. Н. X. Андреев (CJAHKHH) и преподава-
тель Горьковского автомеханического техникума Е. Н. Бочка-
рева.
Малахов А. И.|, Жуков А. П.
Ml8 Основы металловедения и теории коррозии:
Учебник для машиностроительных техникумов.—
М.: Высш, школа, 1978. — 192 с., ил.
35 к.
В книге рассмотрены общие вопросы основ металловедения и кор-
розии металлов. Дано описание физико-механических, химических и
технологических свойств широко применяемых металлов и сплавов.
Большое внимание уделено коррозии и коррозионной стойкости основ-
ных металлических материалов и методам их защиты, описаны корро-
зионно-стойкие неметаллические материалы. Прн рассмотрении конст-
рукционных материалов указаны области их применения.
м
20503—299
-----------222—78
001(01)—78
ББК 34.2+34.66
6П3.4+6П4.52
Афанасий Иванович. Малахов
Александр Петрович Жуков
ОСНОВЫ МЕТАЛЛОВЕДЕНИЯ
И ТЕОРИИ КОРРОЗИИ
Редактор В. Н. Бораненкова
Художник А. И. Шавард
Художественный редактор Т. М. Скворцова
Технический редактор А. К- Нестерова
Корректор С. К. Марченко
ИБ № 1042
Подп. в печать 24.04.78.
Гарнитура литературная,
л. 10,03 уч.-изд. л.
___ ____ ______ Цена 35 коп
Издательство «Высшая школа», Москва, К-51, Неглинная ул., д. 29/14
Московская типография № 8 Союзполнграфпрома
Изд.' № ХИМ—584
Формат 84ХЮ8’/з2
Печать высокая.
Тираж 40 000 экз.
Сдано в набор 18.11.77
Бум. тип. № 3.
Объем 10,08 усл. печ.
Зак. № 3504.
прн Государственном комитете Совета Министров СССР
по делам издательств, полиграфии н книжной торговли.
Хохловский пер., 7.
©Издательство «Высшая школа», .1978 г.
ПРЕДИСЛОВИЕ
Развитие народного хозяйства в значительной степе-
ни определяется производством металлов и сплавов.
В современной технике применяются материалы с высо-
кой прочностью, коррозионной стойкостью, электро- и
теплостойкостью. Правильный выбор материала и его
рациональное использование зависят от знания свойств
металлов и сплавов. Металловедение изучает связь меж-
ду строением и свойствами металлов и сплавов в зави-
симости от химического состава, технологии получения
и обработки.
Зарождение металловедения связано с именами П. П.
Аносова и Д. К. Чернова, работы которых оказали огром-
ное влияние на последующее развитие металловедения.
Большую роль в развитии металловедения сыграли ра-
боты Д. И. Менделеева, Н. С. Курнакова, Р. Аустена,
Ф. Осмонда, А. А. Байкова, А. М. Бочвара, А. Л. Бабо-
шина, С. С. Штейнберга, А. А. Бочвара, Н. Т. Гудцова,
Г. В. Курдюмова, и др.
XXV съезд КПСС наметил большую программу в об-
ласти производства конструкционных материалов. Так,
к концу десятой пятилетки производство стали составит
160—170 млн. т., производство алюминия, меди, никеля
возрастет в 1,2—1,3 раза, титана—в 1,4 раза.
Металлы и сплавы под действием внешней среды раз-
рушаются, поэтому применение их в технике требует
знания как теории коррозии металлов под влиянием раз-
личных факторов, так и мер и способов борьбы с этими
явлениями. Несмотря'на то что средства, затрачиваемые
на борьбу с коррозией, огромны, ежегодно теряется
большое количество металла.
Одной из первоочередных задач снижения потерь ме-
таллов и сплавов от коррозии является внедрение в ма-
шиностроение новых .металлических материалов (титана,
тантала и др.), обладающих стойкостью против воздей-
ствия агрессивных сред.
3
Настоящая книга является- первой попыткой изло-
жить два очень больших и важных вопроса — основы ме-
талловедения и коррозии металлов. В ней кратко рас-
смотрены строение металлов и сплавов, методы исследо-
вания их структуры и свойств, основы термической и
химико-термической обработки, а также вопросы, связан-
ные с изучением коррозии металлов и сплавов и методы
их защиты от коррозии, описаны металлические и неме-
таллические материалы, применяемые в технике и в
быту.
Учебник состоит из четырех разделов: I и IV напи-
саны проф. А. И. Малаховым} ; П и III — асе. А. П. Жу-
ковым.
Раздел первый
ОСНОВЫ МЕТАЛЛОВЕДЕНИЯ
Металловедение — наука, изучающая строение, свой-
ства металлов и сплавов в зависимости от их состава,
теплового, химического и механического воздействия. Ме-
талловедение базируется на таких науках, как химия,
физика, кристаллография, оказывая большое влияние на
развитие инженерных дисциплин.
Металловедение условно можно подразделить на тео-
ретическое и практическое. Теоретическое металловеде-
ние изучает природу металлов и сплавов, законы, по кото-
рым изменяются свойства и строение сплавов в зависи-
мости от состава, а также от теплового, химического или
механического воздействий.
Практическое металловедение дает возможность вы-
бирать металлы или сплавы для определенных целей,
основываясь на их физических, химических, механиче-
ских и технологических свойствах.
Глава I
СТРОЕНИЕ И КРИСТАЛЛИЗАЦИЯ МЕТАЛЛОВ
1. Строение металлов
Из 106 элементов периодической системы Д. И. Мен-
делеева 82 элемента относятся к металлам. Металлы и
сплавы — это твёрдые кристаллические вещества.
Характерной особенностью кристаллического состоя-
ния вещества является правильное, закономерное распо-
ложение атомов (рис. 1) в пространстве. У металлов и
сплавов атомы в кристалле расположены в строго опре-
деленном порядке и образуют так называемую простран-
ственную решетку, в узлах которой находятся положи-
тельно заряженные ионы, а между ними перемещаются
свободные электроны.
5
Металлы легко вступают во взаимодействие е неме-
таллами, отдавая валентные электроны. Это объясняет-
ся тем, что у металлов все валентные электроны непроч-
но связаны с ядром и количество их невелико. Эти же
свойства .металла лежат и в ос-
Рис. 1. Расположение
атомов в кристалло-
графической плоскости
нове электропроводности, так как
электроны, заряженные отрица-
тельно, создают ничтожную раз-
ность потенциалов, что обеспечи-
вает их перемещение к положи-
тельно .заряженному полюсу и
тем самым появлению электриче-
ского тока. Таким образом, сла-
бая связь валентных электронов
с ядром определяет физические и
химические свойства металлов.
Металлы, как правило, хоро-
шо проводят электричество и теп-
лоту, обладают характерным ме-
таллическим блеском, непрозрач-
ны, пластичны. Такими же свойствами обладают и ме-
таллические сплавы—более сложные вещества, состоя-
щие из нескольких элементов как 'металлов, так и не-
металлов.
Все 'металлы условно подразде-
ляют на черные и цветные. К чер-
ным 'металлам относят железо и
сплавы на основе железа. К цвет-
ным металлам относят медь, никель,
цинк, свинец, алюминий, магний, ти-
тан и др.
Расположение атомов в кристал-
ле условно можно изображать раз-
личными схемами, но чаще всего в
виде пространственных, так назы- рис_ 2. Простая куби-
ваемых элементарных кристаллине- ческая элементарная
скид ячеек, многократным повторе- решетка
нием которых можно воспроизвести
пространственную кристаллическую .решетку. Расстоя-
ние между атомами в кристаллической решетке называ-
ют параметрами решетки и обозначают а и с. Они изме-
ряются в ангстремах А (1А = 10-8 см). Простейшей эле-
ментарной кристаллической решеткой является простая
кубич^цкая рещетка с параметром а (рис. 2). Для ме-
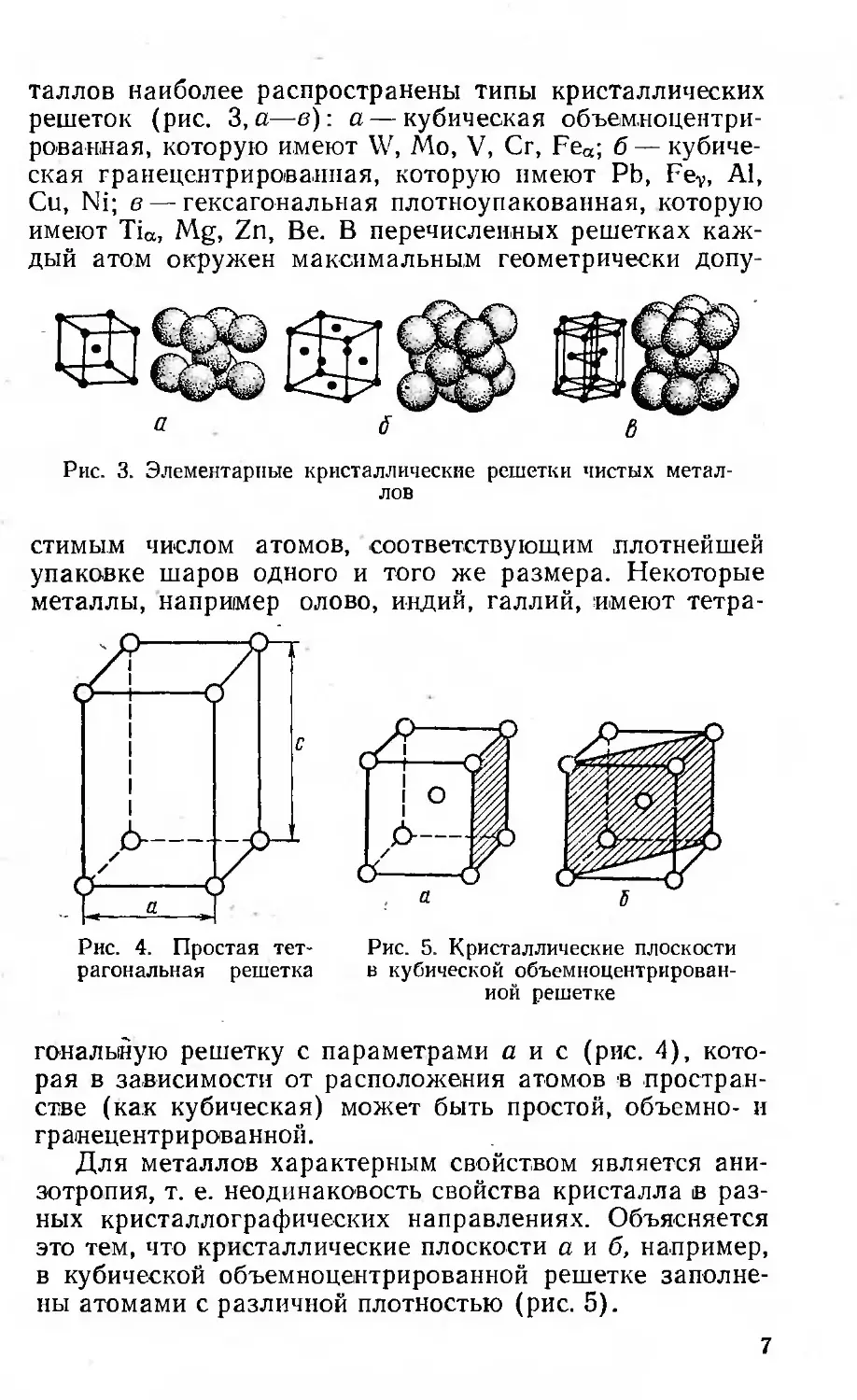
таллов наиболее распространены типы кристаллических
решеток (рис. 3, а—в): а — кубическая объемноцентри-
рованная, которую имеют W, Mo, V, Сг, Fea; б — кубиче-
ская гранецентрированпая, которую имеют Pb, Fev, Al,
Си, Ni; в — гексагональная плотноупакованная, которую
имеют Tia, Mg, Zn, Be. В перечисленных решетках каж-
дый атом окружен максимальным геометрически допу-
Рис. 3. Элементарные кристаллические решетки чистых метал-
лов
стимым числом атомов, соответствующим плотнейшей
упаковке шаров одного и того же размера. Некоторые
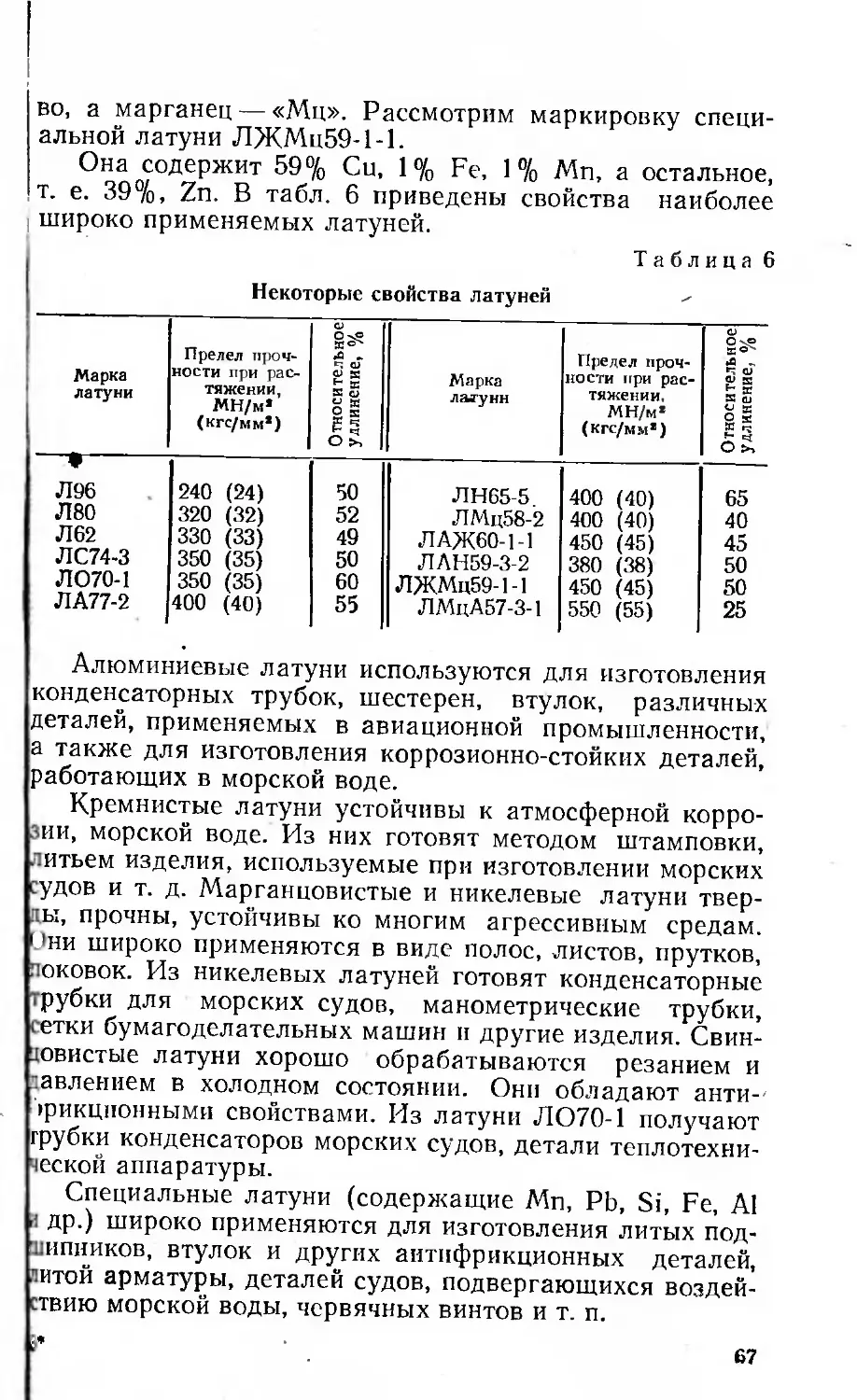
металлы, например олово, индий, галлий, имеют тетра-
Рис. 4. Простая тет-
рагональная решетка
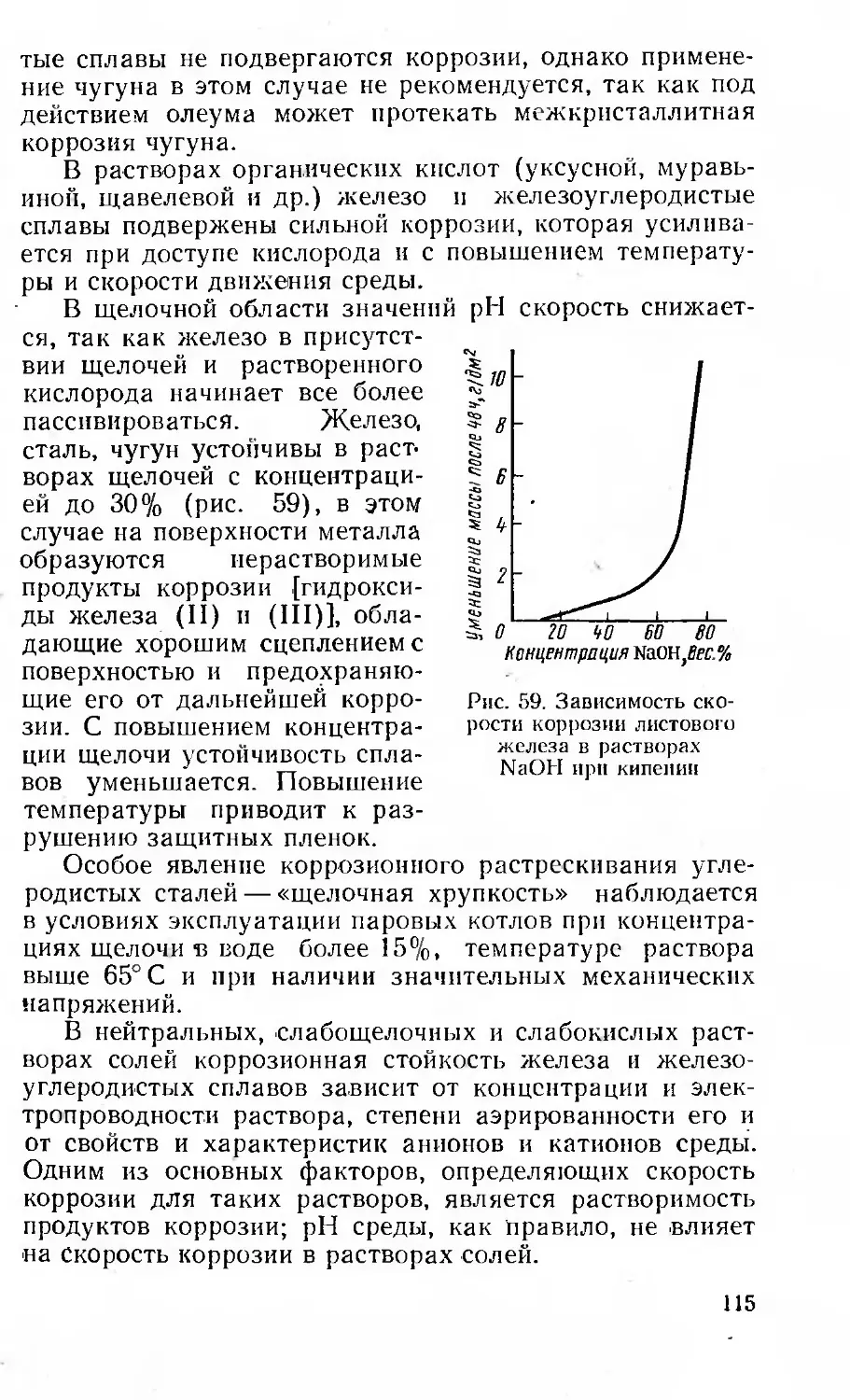
Рис. 5. Кристаллические плоскости
в кубической объемноцентрирован-
иой решетке
тональную решетку с параметрами а и с (рис. 4), кото-
рая в зависимости от расположения атомов в простран-
стве (как кубическая) может быть простой, объемно- и
гранецентрированной.
Для металлов характерным свойством является ани-
зотропия, т. е. неодинаковость свойства кристалла в раз-
ных кристаллографических направлениях. Объясняется
это тем, что кристаллические плоскости а и б, например,
в кубической объемноцентрированной решетке заполне-
ны атомами с различной плотностью (рис. 5).
7
2. Построение кривых охлаждения
Рис. 6. Схема определения тем-
пературы плавления металла
Для определения температуры плавления металла
или сплава, выяснения процессов кристаллизации при-
меняют термический метод анализа. В огнеупорный ти-
гель 5 (рис. 6), содержащий расплавленный металл 4,
погружают термопару 3 (две сваренные с одного конца
проволоки из разных металлов), свободные концы кото-
рой присоединяют к галь-
ванометру 2. При нагре-
вании сваренного конца
термопары, т. е. при раз-
нице температур горяче-
го спая и двух холодных
концов, в ней возникает
э.д.с., ток которой пропор-
ционален температуре ме-
талла, и стрелка гальва-
нометра, отклоняясь, бу-
дет показывать темпера-
туру металла по градуи-
рованной шкале 1 гальванометра. Если охлаждать рас-
плавленный металл и измерять по гальванометру тем-
пературу, записывая ее изменение через определенные
промежутки времени, можно получить данные, по кото-
рым строят кривые охлаждения металла в координатах
температура — время.
Если в металле при определенной температуре про-
исходит какое-либо превращение, то такая температу-
ра называется критической точкой.
3. Кристаллизация металлов
Металлы в зависимости от условий (температуры, дав-
ления) могут находиться в трех состояниях: газообраз-
ном, жидком п твердом. Химически чистые металлы при
нагревании переходят в жидкое состояние при строго оп-
ределенной температуре, называемой температурой плав-
ления, а из жидкого — в газообразное (парообразное)
при температуре, называемой температурой кипения.
Температуры плавления металлов различны и колеблют-
ся от —38,9° С (для ртути) до 4-3410° С (для вольфра-
ма).
8
Образование кристаллической решетки происходит
при переходе металла из жидкого состояния в твердое.
В идеальных условиях в результате такого перехода ато-
мы располагаются по геометрически правильной схеме,
на определенном расстоянии друг от друга, образуя кри-
сталлическую решетку. Например, очень медленным ох-
лаждением при кристаллизации (пли другими метода-
ми) можно получать монокристаллы (единичные
кристаллы) массой до 200 г и более, которые приме-
няются в полупроводниковой и других отраслях тех-
ники.
Превращение металла из
жидкого состояния в твердое
при охлаждении происходит
плавно (рис. 7, кривая 2), но
при достижении температуры
кристаллизации Ts появляется
горизонтальная площадка, ко-
торая связана с выделяющейся
скрытой теплотой кристалли-
зации, компенсирующей отвод
теплоты. При дальнейшем ох-
лаждении металл переходит в
Время
Рис. 7. Кривые охлаждения
расплавов веществ:
I — аморфного: 2 — кристалличе-
ского (теоретически); 3 — кри-
сталлического (реально)
твердое состояние и темпера-
тура его снова плавно понижается. Но реальный про-
цесс кристаллизации несколько сложнее (рис. 7, кривая
3), так как жидкий металл, непрерывно охлаждаясь до
температуры переохлаждения Т„ (охлаждение жидко-
сти ниже температуры кристаллизации), может нахо-
диться в жидком состоянии ниже теоретической тем-
пературы кристаллизации Ts. При температуре 7’,, ме-
талл переходит в твердое состояние. Разница температур
Ts—Тп, которая достигает до 50° С, называется сте-
пенью переохлаждения.
Процесс кристаллизации жидкого металла состоит из
двух стадий: а) образования зародышей, или центров
кристаллизации; б) роста кристаллов. Предложено не-
сколько схем, объясняющих процесс кристаллизации
жидкого металла, одна из них приведена на рис. 8. Из
рис. 8, б следует, что за короткий промежуток времени
(несколько секунд) происходит появление новых цент-
ров кристаллизации и быстрый их рост. При свободном
развитии процесса кристаллизации вначале образуется
первичная ось, а затем вторичные оси и осн высших по-
9
рядков (рис. 9). Кристаллы приобретают древовидную,
называемую дендритной, форму (рис. 10).
В реальных условиях процесс кристаллизации с са-
Рис. 8. Последовательные этапы процесса кристаллизации ме-
талла
образования
Рис. 9. Схема
осей кристаллизации:
а — первичная ось; в — вторич-
ные оси; с — оси высших поряд-
ков
мого начала идет быстро, но
’при взаимном столкновении
растущих кристаллов он за-
медляется. Пока кристалл
окружен жидкостью, он име-
ет правильную форму, но
при столкновении кристал-
лов между собой происхо-
дит их срастание и правиль-
ная форма роста их наруша-
ется, поэтому образуются
кристаллы неправильной
формы, которые принято на-
зывать зернами или кристаллитами (рис. 8, е). На про-
цесс кристаллизации помимо переохлаждения влияют
скорость и направление отвода теплоты, наличие при-
месей, служащих центрами кристаллизации* и др. При-
чем в направлении отвода теплоты кристалл растет зна-
чительно быстрее, чем в других направлениях. Все это
приводит к образованию неправильной формы кристал-
10
лов (рис. 11). Для более четкого уяснения реального
процесса кристаллизации- рассмотрим процесс получе-
ния слитка стали.
Стальные слитки получают в металлических излож-
ницах или на установках непрерывной разливки. В из-
ложнице сталь не может затвердевать одновременно во
всем объеме, так как это связано с неравномерной ско-
ростью отвода теплоты. Поэтому процесс кристаллиза-
ции стали начинается с холодных (относительно темпе-
ратуры расплавленной стали) стенок и дна изложницы,
а затем уже распространяется внутрь жидкого металла.
Плотность твердой стали несколько выше расплавлен-
Рис. 10. Схема образования Рис. 11. Схема расположе-
дендритов ния дендритов в наружных
частях слитка или отливки
ной, поэтому в слитке в верхней части вследствие умень-
шения объема стали образуется усадочная раковина.
Химический состав стали в различных зонах зерна
(кристаллита) будет неоднородным, так как оси расту-
щего кристалла, образовавшиеся позднее, будут содер-
жать больше легкоплавких элементов, которые затверде-
вают позднее. Неоднородность химического состава внут-
ри кристаллита называется внутрикристаллической лик-
вацией.
Различие химического состава по зонам слитка или
отливки называется зональной ликвацией, которая тер-
мической обработкой не устраняется в отличие от внут-
рикристаллической. Как правило, сплавы, подверженные
зональной ликвации, не используются для получения
отливок.
11
Таким образом, при соприкосновении расплавленно-
го металла со стенками изложницы в первоначальный мо-
мент образуются мелкие разноориентированные зерна 1
(рис. 12). Так как скорость затвердевания слитка умень-
шается, то кристаллиты растут, ориентируясь по направ-
лению отвода теплоты, в результате чего образуется зо-
на 2 слитка, представляющая ориентированные столбча-
тые или древовидные кристаллиты. Внутреннюю ч^сть
слитка 3 составляют неориентиро-
ванные, крупные равновесные кри-
сталлиты. В результате кристалли-
зации полученный слиток имеет в
верхней части усадочную раковину
1 5, вблизи которой располагаются
2 мелкие газовые раковины 4. Такой
слиток из-за указанных дефектов
3 применять для получения изделий
нельзя, поэтому верхнюю и нижнюю
часть его (20—25% металла по мас-
се) отрезают и направляют на пере-
плав.
Недостатки, возникающие при
разливке стали в изложницы, устра-
няются при получении слитков на
слитка спокойной ста- установках непрерывной разливки
ли стали.
4. Аллотропия металлов
Атомы большинства элементов образуют устойчивые,
строго определенные кристаллические решетки. Но ряд
металлов в твердом состоянии при различных темпера-
турах имеет различное строение кристаллической решет-
ки, т. е. может перестраиваться из одной кристалличе-
ской системы в другую. Процесс перехода при нагрева-
нии (охлаждении) одного вида кристаллической решет-
ки металла в другую или изменение параметра решетки
называют аллотропическим или полиморфным превра-
щением, а кристаллические формы одного и того же эле-
мента называют полиморфными или аллотропическими
модификациями. Аллотропические формы элемента при-
нято обозначать греческими буквами: а, р, у, 6 и т. д.
Превращение одной аллотропической формы в другую
12
при нагревании металла сопровождается поглощением
теплоты и происходит при постоянной температуре.
Аллотропические модификации имеют железо, ко-
бальт, олово, марганец, титан, никель, цирконий и неко-
торые другие металлы. Для примера рассмотрим алло-
тропические превращения железа. На рис. 13 показана
кривая нагревания железа. Критические точки перехода
одной модификации железа в
принято обозначать Ас с
цифрой (Ас3, Дс4), а при ох-
лаждении — Ar (Ar3, Ari).
Индексы 3, 4 указывают на
аллотропические превраще-
ния, индекс 1 оставлен для
обозначения превращения
на диаграмме состояния
Fe—РезС, а индекс 2 — для
обозначения магнитного
превращения. Железо пла-
вится при 1539° С и в твер-
дом состоянии имеет следу-
другую при нагревании
Рис. 13. Кривая нагревания хи-
мически чистого железа
ющие кристаллические формы решетки:
от 1539 до
1401° С — кубическую объемноцентрированную решетку
с параметром 2,93 А, это так называемое 6-железо (ча-
ще обозначаемое как высокотемпературное а-железо).
Растворимость углерода в 6-железе мала и составляет
до 0,08%- При 1401—910°С железо имеет кубическую
гранецентрированную решетку с параметром решетки
3,66 А, так называемое у-железо. В у-железе в зависи-
мости от температуры растворяется от 0,8 до 2,14% уг-
лерода. Оно немагнитно. При 910—768° С железо имеет
кубическую объемноцентрированную решетку с парамет-
ром решетки 2,9 А, оно также немагнитно и называется
а-немагнитным железом, раньше его называли р-желе-
зом. Железо ниже 768° С имеет кубическую объемно-
центрированную решетку с параметром 2,87 А, называе-
мую а-магнитным железом. Максимальная раствори-
мость углерода в a-железе при 727° С составляет всего
0,02%, а при комнатной температуре — 0,006%.
При аллотропическом превращении всегда наблюда-
ется изменение объема металла, что приводит в некото-
рых случаях к нежелательным результатам, например,
при аллотропических превращениях олова. Олово имеет
две аллотропнйе модификации: a-Sn (серое олово), ус-
13
тойчивое при температуре ниже 18° С, и p-Sn (белое оло-
во), устойчивое при температуре выше 18° С. При пере-^
ходе p-Sn->a-Sn (процесс идет очень медленно, но уси- •
ливается при охлаждении) происходит превращение
тетрагональной объемноцентрированной решетки в pe-j
шетку алмаза, резко увеличивается объем (примерно на
25%) и белое олово превращается в серый порошок
(«оловянная чума»). Но белое олово способно к переох-
лаждению, поэтому оно может длительное время сохра-
няться при температуре ниже 18° С, однако опасность
«оловянной чумы» велика при нахождении олова при
температуре ниже нуля.
5. Методы изучения строения металлов
В настоящее время имеется много разнообразных
методов определения строения металлов и сплавов.
Расположение атомов в кристаллической решетке ус-
танавливают с помощью рентгеновских лучей, т. е. ме-
тодом рентгеноструктурного аналйза.. Определение раз-
меров, форм и взаимного расположения кристаллитов
осуществляется металлографическими методами, осно-
ванными на том, что все металлы и сплавы для видимого
света являются непрозрачными телами. Для этой цели
используют изломы или шлифы.
Определение структуры металлов и сплавов прово-
дится при помощи макро- и микроанализа. Макроанализ
(макроскопический анализ)—-это определение строения
металла или сплава (макростроения) невооруженным
глазом или с помощью лупы (увеличение до 30 раз).
Этим методом выявляют пороки в отливках, волокнистое
строение ковочно-штампованных, прокатанных деталях;
их неоднородность, распределение вредной примеси серы
и т. д.
Микроанализ (микроскопический анализ) проводят с
помощью металлографических микроскопов, использова-
ние которых позволяет определить тип структурных со-
ставляющих, их форму, величину, расположение, нали-
чие неметаллических и других включений, дефектов
и т. д. Применяемые металлографические микроскопы
позволяют обнаружить частицы до 0,2 мкм (увеличение
до 2000 раз, а с применением электронного микроскопа
увеличение достигает до 100 тыс. и больше раз).
14
Глава II
ОСНОВНЫЕ СВОЙСТВА МЕТАЛЛОВ
И ИХ ОПРЕДЕЛЕНИЕ
1. Свойства металлов
Все свойства металлов и сплавов можно разделить
на четыре группы: физические, химические, технологиче-
ские и механические.
К физическим свойствам металлов и сплавов относят-
ся цвет, г/лотность, плавкость, электро- и теплопровод-
ность, теплоемкость, магнитные и другие свойства.
Плотность металлов имеет большое значение для вы-
бора .материалов при проектировании машин, аппаратов.
Использование легких металлов и сплавов (алюминие-
вые, магниевые, титановые, бериллиевые) снижает об-
щую массу аппарата, сооружения, что особенно важно в
таких отраслях, как авиапромышленность, ракетострое-
ние, автомобильное и тракторное машиностроение.
. "Плавкость металлов определяется температурой их
плавления. Легкоплавкие металлы и сплавы использу-
ют для отливки типографических матриц, изготовления
подшипников и др.
Металлы с высокой электропроводностью (медь, алю-
миний) используют для устройства линий электропере-
дач; сплавы, обладающие высоким электросопротивле-
нием,— для ламп накаливания и нагревательных прибо-
ров и др. Металлы и сплавы, обладающие магнитными
свойствами, применяют при изготовлении динамомашин,
электродвигателей, трансформаторов; для изготовления
приборов связи: телефонных, телеграфных и других ви-
дов аппаратов и машин.
Металлы и сплавы, обладающие высокой теплопро-
водностью, равномерно нагреваются прн горячей обра-
ботке, их легко сваривать и паять. Их широко применя-
ют для изготовления теплообменных аппаратов.
Коэффициент линейного расширения — величина, на
которую изменяются линейные размеры тела при измене-
нии температуры. Этот коэффициент должен учитывать-
ся при конструировании аппаратуры. Детали, изготовлен-
ные из металлов с разным коэффициентом линейного
расширения и соединенные между собой, могут разру-
шаться или дать изгиб при нагревании. Сплавы, имею-
15
щне очень малый коэффициент линейного расширения,
используются при изготовлении точных приборов.
К химическим свойствам металлов .и сплавов относят-
ся их окисляемость, растворимость, коррозионная стой-
кость.
К технологическим—-жидкотекучесть, ковкость, сва-
риваемость, обрабатываемость режущим инструментом.
Технологические свойства металлов и сплавов имеют ис-
ключительное значение при выполнении тех или иных
операций в производстве и, в частности, при выборе при-
емов и методов получения деталей машин.
Ковкость — способность металлов и сплавов подвер-
гаться обработке давлением. Это свойство металлов и
сплавов связано с их пластической деформацией, особен-
но при нагревании. С ковкостью связаны такие важней-
шие виды обработки, как прокатка, прессование, волоче-
ние, ковка и штамповка.
Жидкотекучесть — способность металлов и сплавов
легко растекаться и заполнять полностью литейную фор-
му. Медь даже при перегреве расплава густа и не расте-
кается, поэтому из нее нельзя готовить изделия методом
литья, тогда как сплавы ее (бронзы m латуни) и многие
другие металлы (чугун, сталь, магниев.ые и алюминие-
вые сплавы) достаточно жидкотекучи.
Свариваемость — способность металлов и сплавов
давать прочные неразъемные соединения изготовленных
из них деталей. Сварку применяют для изготовления
сварных конструкций взамен литых, клепанных, восста-
новления поломанных деталей, исправления брака литья
и т. д. Сварные конструкции легче, прочнее и дешевле
клепанных.
Металлы и сплавы подвергаются обработке резанием.
Это свойство широко используется в технике, несмотря
на большие отходы (стружка) металлов. Объясняется
это тем, что получить обработкой резанием нужную фор-
му, точные размеры и чистоту поверхности детали на-
много рациональнее по сравнению с другими мето-
дами.
Механические свойства металлов и сплавов характе-
ризуют их прочностное, пластическое и вязкое состоя-
ния.
Прочность — способность металла или сплава сопро-
тивляться действию прилагаемых внешних сил, не раз-
рушаясь. При конструировании учитывают это свойство,
16
гак как по нему определяются допускаемые напряже-
ния и ведется расчет аппаратуры. Чем прочнее металл
или сплав, тем меньше размер детали, ее масса и тем
меньше расход металла на ее изготовление.
Вязкость — способность металла оказывать сопротив-
ление ударным .нагрузкам. Пластичность — свойство ме-
талла деформироваться без разрушения при приложении
внешних сил. Пластичность и вязкость не влияют на мас-
су изготовляемых изделий, но при малой пластичности и
вязкости изделие при высоких .прочностных свойствах
(Становится хрупким и при случайных перегрузках (при
ударном приложении нагрузок) будет разрушаться. При
понижении прочностных свойств изделия повышаются
его пластичность и вязкость. Следовательно, при опре-
деленной прочности изделие должно обладать необходи-
мой (минимумом) пластичностью и вязкостью. На меха-
нические свойства металлов и сплавов влияют химиче-
ский состав, структура и факторы, связанные с
•эксплуатацией изделий.
Упругость — свойство металла восстанавливать свою
: форму после действия приложенных внешних сил. Твер-
дость— способность одного тела противостоять проник-
новению в него другого тела, более твердого.
Таким образом, металлы (сплавы), используемые в
качестве конструкционных, должны обладать определен-
ными свойствами и выбор металла или сплава для изго-
товления изделия зависит от всего комплекса этих
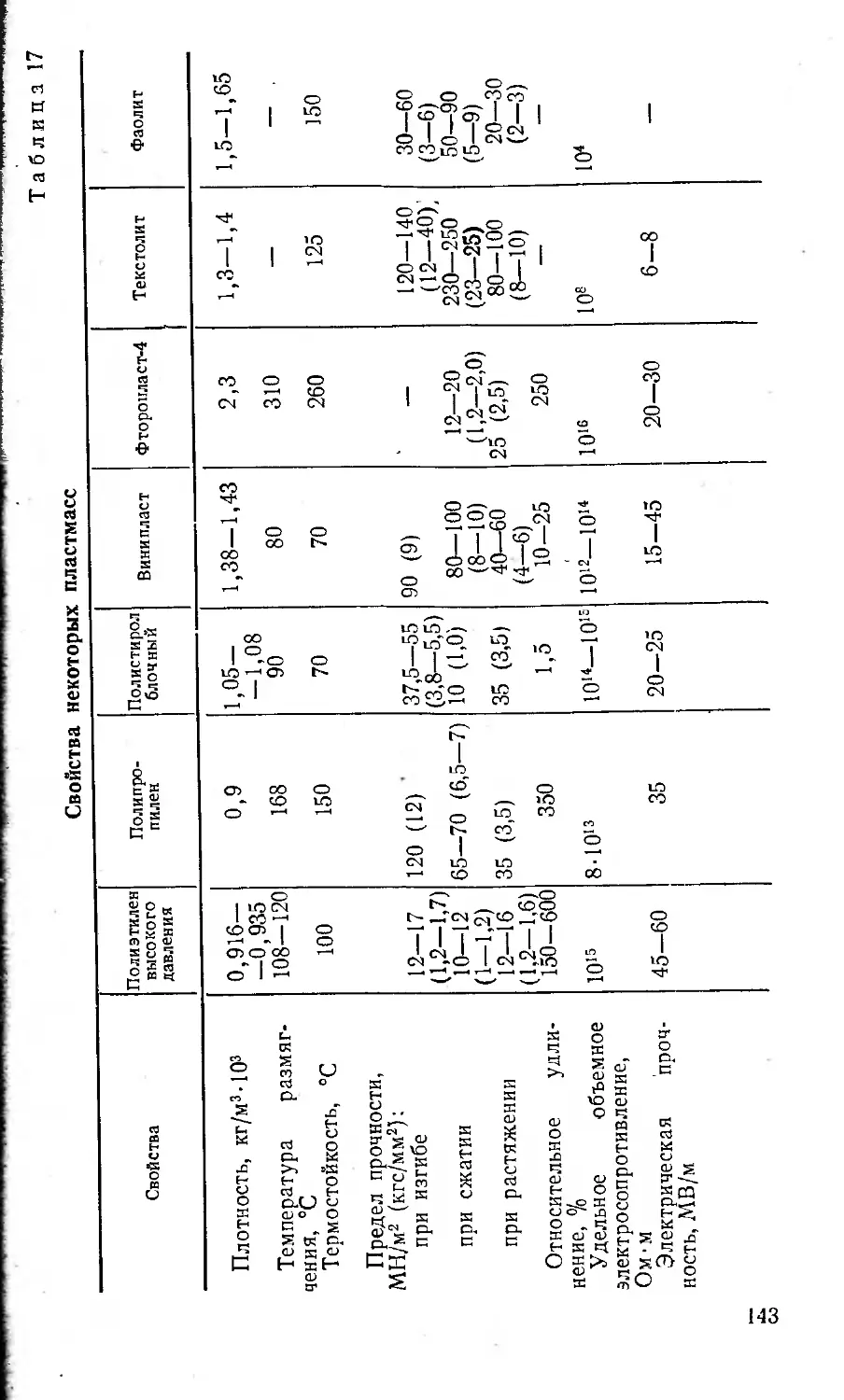
свойств. В табл. 1 приведены некоторые свойства наи-
более широко применяемых металлов.
Таблица 1
Металл Плотность, 1 Кг/м3 и о Е T. кип.. °C Предел прочности, МН/м2 (кгс/мм2) Относительное удлинение, % Твердость по Бринел- лю Коэффи- циент ли- нейного расширения Х.10»
Алюминий 2700 660 2500 80—110 (8-11) 40 20-30 23,1
Железо 7860 1539 2880 300(30) 21—55 50—70 11,5
Магний 1740 651 1100 170—200 (17—20) 10—12 251-301 25,7
Медь 8930 1083 2600 220(22) 60 35 16,5
Титан 4500 1665 3260 300—550 (30—55) 20-30 100 7,2
17
2. Определение свойств металлов
Пластическая деформация и рекристаллизация. При:
приложении к металлу или сплаву нагрузки он подверга-1
ется деформации, которая может быть упругой, т. е. ис-1
чезающей после снятия нагрузки, и сохраняющейся —:
пластичной или остаточ-
ной. Пластическая дефор-
мация связана со сдвигом
части кристаллитов по от-
ношению к другой его
части по плоскостям
скольжения. Упругая де-
формация прямо пропор-
циональна напряжению.
ИМ-4Р:
I — рычаг; 2, 3 — зажимы; 4 — винт;
5 — электродвигатель; 6г 12 — зубчатые
колеса; 7 — маятник; 8 — стрелка; 9 —
перо; 10 — шкала; 11 — диаграммный
барабан
Рис. 14. Образцы для статиче-
ских испытаний металлов и
сплавов:
I — круглый; 2 — плоский; /о — рас-
четная длина; Ц— рабочая длина;
а — головка образца
Рассмотрим поведение образца металла при испы-
тании его на растяжение. Для этих испытаний готовят-
ся круглые или плоские (для листовых материалов) об-
разцы из испытуемого металла (рис. 14) стандартных
размеров: диаметр рабочей части 20 мм, рабочая длина
образца 200 мм. Для испытаний можно применять образ-
цы и других размеров. Испытания проводятся на раз-
рывных машинах различного типа. На рис. 15 приведен
общий вид и кинематическая схема разрывной машины
типа ИМ-4Р.
Машина состоит из нагружающего и силоизмеряю-
щего механизмов. Испытуемый образец закрепляется го-
ловками в зажимах, после чего приводятся в действие
18
рабочие механизмы машины и перо автоматически запи-
сывает на бумаге диаграмму в координатах нагрузка —
деформация, где по оси ординат отложена нагрузка Р,
а по оси абсцисс — удлинение образца Д/. Рассмотрим
диаграмму растяжения мягкой стали (рис. 16), получен-
ную при постепенном увеличении растягивающего уси-
лия вплоть до разрыва испытуемого образца. Зная при-
Р и площадь поперечного
Рис. 16. Диаграмма растяже-
ния мягкой стали
лагаемую нагрузку (усилие)
сечения Fo, можно опреде-
лить напряжение о в любой
точке диаграммы, т. е. о=
— P/Fo. Анализ диаграммы
показывает, что участок ОА
является отрезком прямой
линии и характеризует жест-
кость металла. Удлинение
образца до точки А строго
пропорционально усилию.
Такое изменение дефор-
мации (удлинения) металла
от приложенного усилия на-
зывается законом пропорциональности или законом Гу-
ка, а наибольшее напряжение, которое выдерживает об- •
разец без отклонения от этого закона,— пределом про-
порциональности Опц, который определяется по уравне-
нию
сиц — Р пц/^О-
Точка А соответствует моменту появления пластической
деформации и при дальнейшей нагрузке образца до точ-
ки В .нарушается закон пропорциональности и на диа-
грамме появляется криволинейный участок. Возникаю-
щие деформации образца от точки А до В являются
упругими, если они полностью исчезают при снятии на-
грузки. Условное напряжение, соответствующее появле-
нию первых признаков оставшейся после снятия нагрузки
образца деформации, 0,05% (или еще меньше) от перво-
начальной длины образца, называется пределом упруго-
CTU Оуп"
ауп = Р ytJFo •
Для стали предел упругости принимается равным пре-
делу пропорциональности, что видно из диаграммы (точ-
ки А и В близки друг к другу). В точке С образец начи-
19
нает удлиняться без увеличения нагрузки. Минимальное,
напряжение, при котором происходит такое удлинение1
образца, называется физическим пределом текучести:
aT = p.clF0. I
Большинство металлов .и, в частности, средне- и высоко-
углеродистые стали не обнаруживают горизонтального
участка на диаграмме растяжения, и поэтому для таких
материалов определяется условный предел текучести
Оо,2:
°о.2 = PqoIF о,
где 0,2 — остаточное удлинение, равное 0,2% от перво-
начальной длины образца; Р0;2— нагрузка, соответст-
вующая условному пределу текучести.
Максимальная нагрузка, которую может выдержи-
вать образец без разрушения, приложена в точке D. На-
пряжение, соответствующее наибольшей нагрузке и
предшествующее разрушению образца, называется пре-
делом прочности при растяжении или временным сопро-
тивлением разрыву ов:
° в = PbIFq
Истинное сопротивление разрыву SK определяется по
уравнению
sk = PkJFk<
где Рк— нагрузка в момент разрыва образца; FK — пло-
щадь поперечного сечения образца в шейке после раз-
рыва.
Из диаграммы видно, что до точки D удлинение Д/i
образца (соответственно и сужение его поперечного се-
чения) происходит по всей длине его рабочей части рав-
номерно, но по достижении точки D удлинение сосредо-
тачивается в месте наименьшего сопротивления и даль-
нейшее удлинение Д/2 образца протекает за счет того
места, где образуются шейка и разрыв его при нагруз-
ке Рк-
Пластичность металлов характеризуется относитель-
ным удлинением 6 и сужением площади поперечного се-
чения ф, которые выражаются в процентах и определя-
ются по уравнению
8 = Z/f~z° ion и ф = — 100,
lo Fq
20
где lK — длина образца после разрыва, мм; 10 — расчет-
ная длина образца, мм; FK — площадь поперечного сече-
ния образца после разрыва, мм2; Fo— первоначальная
площадь его поперечного сечения, мм2.
У ряда металлов относительное удлинение и относи-
тельное сужение близки к нулю. Такие металлы являют-
ся хрупкими, тогда как у пластичных металлов эти ха-
рактеристики велики (десятки процентов).
Пластическую деформацию металлов и сплавов учи-
тывают при выборе материала для изготовления изде-
лий и, в частности, при получении проволоки, операциях
гибки, вытяжки, высадки, штамповки и т. д. Пластиче-
ская деформация обеспечивает конструктивную проч-
ность металлических конструкций, аппаратов и других
изделий. Если же металл не способен к пластической
деформации, то он склонен к так называемым хрупким
разрушениям, т. е. к разрушениям, происходящим при
пониженных .напряжениях.
В результате пластической деформации происходит
упрочнение металла, которое получило название накле-
па или нагартовки, при этом пластичность металла рез-
ко падает. При большой деформации в результате про-
цессов скольжения зерна меняют свою форму, вытягива-
ясь в направлении действующих сил, происходит
дробление зерен, кристаллическая решетка искажается,
структура металла находится в неустойчивом, напряжен-
ном состоянии. Для снятия наклепа изделия нагревают
при определенной температуре, при этом атомы металла
приобретают способность к перемещениям, что ведет к
устранению искажений кристаллической решетки, обра-
зованию новых центров кристаллизации и росту кристал-
литов. При этом прочность металла понижается, а пла-
стические свойства повышаются. Такой процесс называ-
ется рекристаллизацией.
Между абсолютной температурой рекристаллизации
Трек и абсолютной температурой плавления Тпл сущест-
вует простая зависимость Т^—а- Тпл, где коэффициент
а определяется степенью чистоты металла.
Для химически Чистых металлов а равно от 0,1 до
0,2, металлов технической чистоты 0,Зч-0,4, а для спла-
вов а может достигать величины, равной 0,8. Так, при
нагревании изделия, находящегося в стадии наклепа
выше Грек, ему возвращают пластичность. Если пласти-
ческую деформацию металла проводят при температуре
1
выше Трею то достигнутое в процессе деформирования
упрочнение (наклеп) устраняется при рекристаллизации,
протекающей при этих температурах. Такой вид обра-
ботки называется горячей обработкой давлением в отли-
чие от холодной, когда обработка давлением проводит-
ся при температуре ниже Трек-
Для некоторых металлов Трек ниже комнатной (для
свинца —30°С, олова —70°С), поэтому при пластиче-
ской деформации при комнатной температуре (-|-20°С)
. образовавшийся наклеп после
у обработки будет самопроиз-
Q вольно устраняться. Поэтому
деформация таких металлов,
как свинец и олово, при ком-
натной температуре будет яв-
ляться для них горячей обра-
боткой давлением. Для такого
d металла, как вольфрам (тем-
г* ~ пература рекристаллизации
Рис. 17. Схема определе- 1200°С), обработка давлением
ния твердости по Бринел- даже при 1000—1100° С явля-
ется холодной пластической
деформацией.
Поэтому холодную и горячую обработку давлением
следует различать в зависимости qt отношения темпера-
туры деформации к температуре рекристаллизации.
Определение твердости. При определении твердости
применяемые приборы несложны по устройству и просты
в обращении, не требуется изготовления образцов для
испытаний (можно испытывать заготовки изделия). Для
определения твердости (вдавливание, царапание, упру-
гая отдача, магнитный метод) наиболее широко приме-
няются методы, основанные на способности тела (метал-
ла) противостоять проникновению в него другого более
твердого тела.
По методу Бринелля твердость определяют вдавлива-
нием в изделие закаленного стального шарика опреде-
ленного диаметра (10; 5; 2,5 мм) (рис. 17). Число твер-
дости по Бринеллю НВ характеризуется отношением
нагрузки, действующей на шарик, к поверхности отпе-
чатка:
Р
НБ=-
(О_У/)2_Д2)
22
где Р — нагрузка на шарик, Н (кгс); F — поверхность от-
печатка, мм2; D — диаметр вдавливаемого шарика, мм;
d — диаметр отпечатка, мм.
Для определения твердости применяют рычажные
(рис. 18) и гидравлические прессы. Образец, установлен-
।
Рис. 18. Схема пресса Бринелля
ный на столике 1 при помощи винта 9, прижимают к ша-
рику 2 так, чтобы сжать пружину 3. Затем при помощи
, электродвигателя приводится в движение эксцентрик 7,
при вращении которого шатун 6 опускается и грузы 8
создают давление через систему рычагов 4 и 5. Эксцент-
рик, вращаясь, поднимает шатун и таким образом сни-
мается давление'грузов с образца. При нахождении ша-
23
при испытании алюминия
Рис. 19. Определение твер-
дости алмазным конусом
туна в верхнем положении автоматически происходит
отключение электродвигателя. Затем освобождают обра-
зец, определяют с помощью специальной лупы диаметр
отпечатка, по которому .вычисляют твердость по приве-
денной формуле, что требует много времени. В практике
пользуются специальной таблицей, в которой каждому
диаметру отпечатка соответствует число твердости НВ.
Диаметр шарика и нагрузку устанавливают в зависимо-
сти от испытываемого металла, твердости и толщины
его. При испытании стали и чугуна Р=30О2 [например,
0 = 10 мм, Р=30 000 Н (3000 кгс)]; при .испытании меди
Р= 10D2 [например, 0 = 10 мм, 0=10 000 Н (1000 кгс)[;
0=2,5D2 [например, 0 = 10 мм,
0 =2500 Н (250 кгс)]. По ме-
тоду Бринелля нельзя испыты-
вать металлы с твердостью .вы-
ше НВ 450, так как шарик бу-
дет деформироваться и резуль-
тат получится неправильным.
Для многих материалов, оп-
ределив твердость НВ, можно
найти предел прочности ав,
так как твердость и прочность связаны простым отноше-
нием: ов=/СНВ, где А— величина, зависящая от мате-
риала, например, для мягкой стали К = 0,34, литой стали
А=0,3—0,4, меди и ее сплавов /С=0,55 и т. д.
По методу Роквелла твердость определяют вдавлива-
нием в изделие стального шарика диаметром 1,59 мм при
твердости определяемого металла не более 2200 МН/м2
(220 кгс/м2) [нагрузка 1000 Н (100 кгс)] или алмазного
конуса с углом 120° при испытании более твердых мате-
риалов [нагрузка 1500 Н (150 кгс)] и при испытании
сверхтвердых сплавов [нагрузка 600 Н (60 кгс)]. Вдав-
ливание в образец шарика или .конуса на приборе про-
исходит под действием двух нагрузок: предварительной
Ро, равной всегда 100 Н (10 кгс), и основной, Р\ при вдав-
ливании шарика силой 900 Н (90 кгс) (шкала В), силой
1400 Н (140 кгс) (шкала С) и 500 Н (50 кгс) (шкала А).
Общая нагрузка Р (рис. 19) является суммой этих на-
грузок: P=P0+Pi.
В зависимости от того, применяют стальной шарик
или алмазный конус и нагрузки, при которых проводят
испытание (т. е. по какой шкале — В, С или А), число
твердости обозначают HRB, HRC, HRA.
24
Определение твердости проводят на приборе Роквел-
ла (рис. 20). Установленный на столике 2 образец, вра-
- щением маховика 1 доводят до соприкосновения его со
стальным шариком или алмазным конусом 3. Затем про-
должают вращение маховика до тех пор, пока малая
стрелка 4 на циферблате дойдет до красной точки, а боль-
шая стрелка циферблата установится при этом в верти-
кальном положении. Этим создается предварительная
нагрузка 100 Н (10 кгс). Далее на образец при помощи
определения твердости
рукоятки 5 прилагается основ-
ная нагрузка. По окончании
определения (вдавливание
длится 5—6 с) снимается ос-
новная нагрузка обратным по-
воротом рукоятки 5 и по пока-
заниям большой стрелки ци-
ферблата определяется твер-
дость, которая является услов-
ной величиной, характеризую-
щей разность глубин отпечат-
ков. Для перевода значений
твердости по Роквеллу в зна-
чения твердости по Бринеллю
пользуются переводной табли-
. ней.
Метод испытания вдавлива-
нием алмазной пирамиды (ме-
тод Виккерса) используется для
деталей малой толщины и тонких поверхностных слоев,
имеющих высокую твердость. При испытании в металл
вдавливают четырехгранную пирамиду (с углом при
вершине 136°) под нагрузкой от 50 Н (5 кгс) до 1000 Н
(100 кгс). Величину диагонали отпечатка определяют с
помощью микроскопа, укрепленного на приборе, и по
полученным показаниям определяют число твердости,
обозначаемое HV, по формуле
HV -- P/F,
где Р — нагрузка на пирамиду, Н (кгс); F — площадь
отпечатка, мм2.
Обычно для определения числа твердости HV по ве-
личине диагонали отпечатка пользуются специальными
таблицами.
25
Определение вязкости. При работе машины, механиз-
ма и т. д. детали испытывают ударные нагрузки, поэто-
му металлы, применяемые для их изготовления, подвер-
гают (кроме статических испытаний) динамическим ис-
пытаниям. Объясняется это тем, что некоторые металлы
обладают высокими показателями статической прочно-
сти, могут легко разрушаться даже при малых ударных
нагрузках, например изделия из чугуна.
Для динамических испытаний готовят образцы квад-
ратного сечения, ослабленные в середине поперечным
надрезом (рис. 21,о). Такой образец помещается на опо-
ры маятникового копра так,
чтобы удар бойка маятника
приходился с противополож-
ной стороны надреза (рис.
21, б). Маятник, падая с вы-
соты Н и ударяя по образцу,
разрушает его, после чего
поднимается на некоторую
высоту h. Отклонения маят-
ника фиксируются на шкале
копра. Работу разрушения
о s
Рис. 21. Определение вяз-
кости
Дн[Дж/(кгс-м)], затраченную на излом образца, опреде-
ляют по формуле
Лн = Р(Н-Л), ,
где Р-—вес маятника, Н (кгс), а ударную вязкость
аа — по формуле
ак = AJF,
где F — площадь поперечного сечения образца в месте
надреза, см2.
Определение выносливости. Выносливость (уста-
лость) —способность металла сопротивляться разруше-
нию (усталости) от периодически повторяющегося дейст-
вия сил. При переменном воздействии сил (переменных
деформациях и напряжениях) могут образовываться ми-
кротрещины и трещины, которые концентрируются в ме-
стах больших напряжений. Но разрушение металла не
произойдет, если напряжение будет меньше определен-
ного значения. Наибольшее напряжение, которое при пе-
ременном действии сил не вызывает образования тре-
щин, называется пределом выносливости. Его определя-
ют на специальных машинах, испытанием изгибом при
вращении, растяжений, сжатии, кручении. Предел вынос-
26
ливости для конструкционной стали обычно составляет
10 млн. циклов, а для цветных металлов 20 млн. циклов.
Кроме названных методов применяют испытания на
срез, кручение, сжатие, изгиб, свариваемость, загиб, осад-
ку, выдавливание, обжатие и др.
Глава III
ОСНОВЫ ТЕОРИИ СПЛАВОВ
1. Основные сведения о сплавах
В связи с отсутствием у большинства чистых метал-
лов технически полезных свойств в технике наибольшее
применение находят их сплавы. Сплав — вещество, со-
держащее два и более компонентов. Сплав, состоящий из
металлических элементов и обладающий металлически-
ми свойствами, называется металлическим сплавом.
Сплавы в настоящее время получают несколькими спо-
собами, например, взаимодействием элементов в жидком
состоянии (сплавлением); спеканием и диффузией в твер-
дом состоянии; осаждением нескольких элементов на ка-
тоде при электролизе водных растворов. По количеству
компонентов, содержащихся в сплаве, их делят на двой-
ные, тройные и т. д. Вещества, входящие в состав сплава,
при затвердевании могут находиться в виде отдельных
частиц, зерен обоих компонентов (механическая смесь),
или в виде образующихся химических соединений (хими-
ческое соединение), или взаимно растворяющихся друг в
друге компонентов (твердые растворы).
Сплавы типа механической смеси образуются из ве-
ществ, не растворяющихся и не вступающих в химическое
взаимодействие между собой в твердом состоянии с об-
разованием соединений. Такие сплавы состоят из смеси
кристаллитов веществ, сохраняющих свои кристалличе-
ские решетки. Свойства сплава будут определяться соот-
ношением компонентов, входящих в его состав. Чем боль-
ше компонентов входит в состав сплава, тем его свойства
ближе к свойствам чистого компонента.
Сплавы типа химического соединения образуются при
взаимодействии между собой компонентов, входящих в
состав сплава, причем содержание компонентов должно
быть строго определенным.^ Они имеют рещетку, отдцч-
87
ную от кристаллических решеток компонентов, поэтому
обладают и другими механическими, физическими и хи-
мическими свойствами.
Сплавы типа твердых растворов бывают трех видов:
твердые растворы замещения, твердые растворы внедре-
ния и твердые растворы вычитания.
Твердые растворы замещения образуются в тех слу-
чаях, когда атомы растворяемого вещества замещают в
кристаллической решетке атомы растворителя (рис. 22,
а). Это возможно в том случае, когда компоненты имеют
одинаковую решетку, размеры их атомов должны мало
Рис. 22. Схема распределения атомов в решетках твердых раство-
ров
отличаться друг от друга (не более 15%). Размеры ато-
мов растворяемого вещества влияют нй параметры ре-
шетки, увеличивая ее, если диаметр атома больше, или
уменьшая ее, если он меньше. Атомы растворяемого ве-
щества могут занимать в кристаллической решетке раст-
ворителя строго определенное положение (упорядочен-
ные твердые растворы) или располагаться в произволь-
ном порядке (неупорядоченные твердые растворы).
Образование твердых растворов внедрения (рис.
22, б) происходит при растворении атомов растворяемого
элемента в кристаллической решетке растворителя, т. е.
когда атомы растворенного элемента внедряются в ре-
шетку растворителя в промежутках между атомами рас-
творителя. Это возможно только в том случае, когда ато-
мы растворяемого элемента по размерам невелики, т. е.
когда отношение диаметра атома растворяемого элемен-
та к диаметру атома растворителя меньше 0,59. Как пра-
вило, твердое растворы внедрения образуются с неметал-
лами, причем параметры кристаллической решетки всег-
да увеличивается.
Твердые растворы вычитания (рис. 22, в) могут обра-
зовываться только в сплавах, содержащих химические
соединения, когда избыточные атомы ‘ одного из компо-
нентов занимают строго определенное положение в кри-
сталлической решетке, а места, которые должны быть
заняты атомами другого компонента, остаются частично
свободными, например в решетках карбидов TiC, WC
(места, принадлежащие углероду, остаются свободны-
ми). Растворы вычитания часто встречаются в полупро-
водниковых соединениях.
Помимо указанных типов сплавов металлы образуют
электронные соединения и фазы внедрения. Электронные
соединения характеризуются определенным соотношени-
ем числа валентных электронов к общему числу атомов
в химическом соединении, например, в соединении CuZn3
указанное отношение будет равно 7/4. Каждому такому
соотношению соответствует определенная кристалличе-
ская решетка, например, отношению 3/2— решетка гра-
нецентрированного куба; 21/1з — сложная кубическая ре-
шетка; 7/4— гексагональная плотноупакованная решетка.
Сплавы меди с цинком, меди с оловом, меди с кремнием,
железа с алюминием и т. д. содержат в своем составу
электронные соединения. Фазы внедрения могут образо-
вывать атомы железа, хрома, вольфрама, молибдена с
элементами, имеющими малый атомный диаметр, напри-
мер водородом, углеродом, азотом, бором. Они имеют
свою кристаллическую решетку, отличающуюся от реше-
ток обоих фаз. Фазы внедрения могут быть трех типов:
МеХ (WC, VC, TiN и др.); Ме2Х (W2C, Fe2N и др.);
Ме4Х (Fe4N и др.).
Состояние сплава в зависимости от концентрации и
температуры изображают графически. Такое изображе-
ние состояния сплава получило название диаграмм
состояния. Так как диаграмма состояния показывает ус-
тойчивое состояние системы (совокупность фаз, находя-
щихся в равновесии), то она является диаграммой равно-
весия фаз, существующих при данных условиях. Состои-
те сплава, изображенного на диаграмме, относится к
равновесным условиям без учета перегрева или переох-
лаждения. чего в действительности быть не может. Сле-
довательно, рассматриваемые. диаграммы состояния
представляют собой теоретический случай. Математиче-
ское, описание общих закономерностей существования ус-
тойчивых фаз, отвечающих условиям равновесия, было
29
Дано Гиббсом, именуемое правилом фаз, которое уста
навливает количественную зависимость между стелены
свободы системы С, количеством фаз Ф и врмпонентов К
Компонентами К называют вещества, составляющи
систему, способные переходить из одной фазы в другук
т. е. если мы имеем химически чистый элемент, то о:
представляет собой однокомпонентную систему. Однс
компонентной системой является и химическое соедине
ние, не разлагающееся на составные части в интервал
температур изучаемой системы.
Фазой Ф называют однородную часть системы едина
кового агрегатного состояния и состава, отделенную о
других фаз системы поверхностью раздела, переход кото
рой резко изменяет химический состав или структуру ве
щества. Например, расплавленный металл является одно
фазной системой, а механическая смесь — двухфазно!
и т. д.
Под числом степеней свободы системы понимают чис
ло факторов (температура, давление, концентрация), ко
торые можно изменять без изменения числа фаз в систе
ме. Математическое выражение правила фаз можно за
писать в следующем виде:
С = К — Ф+2,
т. е. число степеней свободы равновесной системы, на ко
торую влияют температура и давление, равно числу не
зависимых компонентов системы, минус число фаз, плю<
два. Давление при равновесии не оказывает влияния нг
процессы превращения в сплавах, поэтому при изученш
систем под атмосферным давлением можно пользовать
ся правилом фаз в следующем виде: j
С — К— Ф + 1.
Рассмотрим применение правила фаз для некоторы
систем. Допустим, мы имеем однокомпонентную систем
(К=1) в расплавленном состоянии (Ф = 1). Требуете
определить число степеней свободы:
С = К—Ф + 1 = 1 — 1 4-1 = 1.
Таким образом, для металла в жидком состоянии числ!
степеней свободы равно единице, а это означает, чт
30
можно изменять только температуру расплава, не изме-
няя агрегатного состояния системы.
При кристаллизации металла число фаз равно двум
(жидкая и твердая), а число степеней свободы будет
равно нулю (С = 1—2+1=0). Это значит, что нельзя ме-
нять температуру и концентрацию системы без наруше-
ния равновесия и изменения числа фаз до тех пор, пока
не пропадет одна из фаз и система не превратится в од-
нофазную.
Диаграммы состояния показывают изменение состоя-
ния сплавов от температуры и концентрации при посто-
янном давлении. Для двухкомионентной системы по оси
абсцисс откладывают концентрацию, равную для обоих
компонентов 100%, а по оси ординат — температуру. Их
строят по данным термического анализа, т. е. сначала-
строятся кривые охлаждения температура — время, по
которым определяют температуры превращений по оста-
новкам и перегибам на этих кривых. Кривые охлажде-
ния строятся для нескольких составов сплава. Зная тем-
пературы кристаллизации двух компонентов, остановки
температур и перегибы на кривых температура — время,
строится диаграмма состояния двухкомпонентного спла-
ва температура — состав. Например, на основании терми-
ческого анализа получили кривые охлаждения сплавов
системы 100% компонента А и 100% компонента В
(рис. 23) в координатах температура — время для спла-
вов I, II, 111. На основании полученных данных построим
диаграмму состояния сплавов А—В (рис. 24).
31
2. Диаграмма состояния сплавов
Диаграмма состояния сплавов для случая нераствори-
мости компонентов в твердом состоянии. Диаграмма со-
стояния сплавов РЬ—Sb (рис. 25) представляет собой
систему, в которой компоненты нерастворимы в твердом
состоянии, а образуют механическую смесь двух видов
кристаллитов, одновременно кристаллизующихся из жид-
кости. На оси ординат отложена температура, а на оси
абсцисс — концентрация. С левой стороны диаграммы
откладывается 100% компонента РЬ, а с правой сторо-
Рис. 25. Диаграмма состояния сис-
темы сплавов свинца и сурьмы
ны — 100% компонента
Sb. Концентрация сурьмы
отсчитывается слева на-
право, а концентрация
свинца — справа налево.
Так как сумма концентра-
ции двух компонентов
равна 100%, то на ось
абсцисс наносят только
концентрацию сурьмы, а
концентрацию свинца оп-
ределяют по разности.
Из рисунка видно, что
температура начала затвердевания сплавов различного
состава нс одинакова, а окончание затвердевания харак-
теризуется определенной температурой 246° С для всей
данной системы сплавов и что сплав, содержащий 13%
Sb и 87% РЬ, имеет одну критическую точку В, в кото-
рой он полностью затвердевает. Линия СВА, соединяю-
щая точки начала затвердевания сплавов, называется
линией ликвидуса («ликвед» по-латыни — жидкий), а
линия DBE, ниже которой все сплавы находятся в твер-
дом состоянии, называется линией солидуса («солид»
по-латыни — твердый).
Рассмотрим ход кристаллизации для сплавов трех
концентраций: 5; 13 и 40% Sb. В точке В при содержа-
нии 13% Sb и 87% РЬ (/ = 246°С) происходит одновре-
менно кристаллизация РЬ и Sb с образованием механи-
ческой смеси этих кристаллов. Сплав указанного соста-
ва называется эвтектическим («эвтектика» по-гречески —
легкоплавкая). Сплавы, содержащие менее 13% Sb, на-
зываются доэвтектическими, а содержащие более 13%,—
заэвтектическими. Сплав, содержащий 5% Sb, до линии
32
Aat находится в жидком состоянии, ниже линии Aai из
жидкого расплава выкристаллизовывается компонент РЬ.
По мере охлаждения количество жидкого расплава
уменьшается, а твердого свинца увеличивается. Посколь-
ку из расплава выделяется РЬ, концентрация жидкого
расплава становится беднее свинцом и богаче Sb. При
дальнейшем охлаждении (при 246° С) концентрация
сурьмы в жидком расплаве становится равной 13% и
жидкий расплав кристаллизуется, образуя механическую
смесь (эвтектику), состоящую из РЬ и Sb. Так как до
кристаллизации эвтектики выделялись кристаллы свин-
Рис. 26. Диаграмма состояния сплавов
медь — никель
ца, структура данного сплава после окончательного за-
твердевания будет: свинец+эвтектика (свинец-1-сурьма).
Аналогично идет процесс затвердевания заэвтектиче-
ских сплавов. Сплав, содержащий 40% Sb, выше линии
ВС находится в жидком состоянии. При охлаждении ни-
же линии ВС из жидкого раствора выпадает Sb и при
246° С происходит кристаллизация всего оставшегося
жидкого расплава эвтектического состава. Так как до
кристаллизации эвтектики выделялись кристаллы сурь-
мы, структура после окончательного затвердевания бу-'
дет: сурьма + эвтектика (свинец-1-сурьма).
Диаграмма состояния сплавов для случая неограни-
ченной растворимости компонентов в твердом состоянии.
На рис. 26 приведена диаграмма состояния сплавов
медь — никель.
На этой диаграмме верхняя линия — это линия лик-
видуса, а нижняя — линия солидуса.
Рассмотрим процесс кристаллизации сплава /—I со-
става 50% Cu+50% Ni (рис. 26). При температуре (л
начинается кристаллизация и образуются первые кри-
2—3504
33
сталлы. На диаграмме состояния состав твердой части
сплава (состав кристаллов, которые могут находиться в
равновесии с жидкостью) при данной температуре пока-
зывает линия солидуса. Следовательно, первые образо-
вавшиеся кристаллы будут иметь состав точки М. При
дальнейшем охлаждении, когда сплав достигнет, напри-
мер, температуры Л, в равновесии с жидкостью уже мо-
гут быть только кристаллы состава точки Л.
Каким же образом ранее образовавшиеся кристаллы
состава точки М превращаются в кристаллы состава
точки Л? Ведь в кристаллах состава М больше никеля,
чем в кристаллах состава Л, следовательно, кристаллы
состава М обогащаются медью. Этот процесс происходит
за счет диффузии атомов меди в уже имеющиеся, т. е.
возникшие до этой температуры, кристаллы. При доста-
точной выдержке или медленном охлаждении при Л ус-
тановится равновесие кристаллов состава точки Л и жид-
кого сплава. Но в кристаллах состава точки Л никеля
больше, чем в сплаве, следовательно, жидкая часть
сплава должна быть беднее никелем. При этой темпе-
ратуре состав жидкой части сплава определяется лини-
ей ликвидуса, т. е. точкой N.
При дальнейшем охлаждении, когда сплав достигнет
температуры /2 и установится равновесие, сплав будет
состоять из кристаллов состава точки К и жидкой части
сплава состава точки Р.
Таким образом, чем ниже температура, тем больше
кристаллов твердого раствора и они по составу ближе к
исходному (т. е. в данном случае 50% Си и 50% Ni).
Наконец, при достижении температуры tc сплав полно-
стью затвердеет и будет состоять из однородных кристал-
лов твердого раствора. Так будет идти процесс при ус-
ловии очень медленного охлаждения, когда состав кри-
сталлов успевает полностью выравняться.
При ускоренном охлаждении (в реальных условиях
охлаждения) состав кристаллов, не получается однород-
ным. Неоднородность состава внутри кристалла называ-
ется внутрикристаллитной ликвацией, а так как такая не-
однородность связана с дендритным характером кри-
сталлизации, то эту неоднородность по составу называют
также дендритной ликвацией.
Если сплав с такой структурой нагреть до температу-
ры, близкой к линии солидуса, и длительное время вы-
держать, то структура становится более однородной.
34
Диаграмма состояния сплавов для случая ограничен-
ной растворимости компонентов в твердом состоянии. Ха-
рактерной особенностью таких диаграмм является нали-
чие при температурах ниже линии солидуса (т. е. для
твердого состояния) линии (или линий) ограниченной
растворимости. Один из видов такой диаграммы состоя-
ния показан на рис. 27.
Линия KCD — линия ликвидуса; линия KECF — ли-
ния солидуса; линия SE показывает изменение раство-
римости компонента В в ком
нии. В данном случае с .по-
нижением температуры раст-
воримость уменьшается.
Рассмотрим процессы,
.происходящие при охлажде-
нии сплава I—I (рис. 27).
До температуры точки 1
сплав жидкий. При темпера-
туре точки 1 начинается кри-
сталлизация и образуются
кристаллы твердого раство-
ра В в А (обозначим их а).
Образование кристаллов
происходит до температуры
точки 2. В точке 2 сплав
А в твердом состоя-
Рис. 27. Диаграмма состоя-
ния сплавов для случая
ограниченной растворимости
компонентов в твердом со-
стоянии
имеет структуру кристаллов
а. При температуре точки 3 линия сплава пересекает ли-
нию SE и при этой температуре из кристаллов твердого
раствора а начинают выделяться кристаллы компонен-
та В, называемые вторичными (Вц). С понижением тем-
пературы от точки 3 до точки 4 растворимость компонен-
та В в компоненте А становится все меньше и меньше
и из твердого раствора а выделяется все большее коли-
чество кристаллов компонента В. Таким образом, после
полного охлаждения сплав будет иметь структуру твер-
дого раствора а и вторичных кристаллов компонента В
(Вп).
В сплавах, лежащих по составу правее точки Е, т. е.
на линии ECF, образуется-эвтектика, но она представля-
ет смесь не кристаллов А и В, а кристаллов твердого
раствора а и кристаллов компонента В.
Диаграмма состояния сплавов для случая образова-
ния компонентами химического соединения. Рассмотрим
диаграмму состояния сплавов магний — кальций. Из
2
35
рис. 28 видно, что между компонентами образуется хи-
мическое соединение Mg4Ca3, которое можно рассматри-
вать как третий новый компонент, поэтому эту диаграм-
му можно рассматривать как диаграмму, состоящую из
двух систем: Mg — Mg4Ca3 и Mg4Ca3 — Са. Для системы
Mg — Mg4Ca3 линия АВС — линия ликвидуса, а линия
FBG — солидуса. В области,
Рис. 28. Диаграмма состояния
системы сплавов магния и каль-
ция
ограниченной площадью
ABF, наряду с расплавом
содержится магний, а в
области BCG — химичес-
кое соединение Mg4Ca3. В
точке В выпадает эвтек-
тика, состоящая из крис-
таллитов Mg и Mg4Ca3.
Доэвтектические сплавы
состоят из смеси кристал-
литов магния и эвтектики,
а заэвтектические — из
смеси эвтектики и Mg4Ca3.
Для системы Mg4Ca3 —
Са линией ликвидуса яв-
ляется линия CDE, а со-
лидуса — HN. В точке D образуется эвтектика, состоя-
щая из кристаллитов Mg4Ca3 и Са. Доэвтектические
сплавы этой системы состоят из Mg4Ca3 и эвтектики
Mg4Ca3 и Са, а заэвтектические — из эвтектики и каль-
ция. Из диаграмм состояния видно, что состав и темпе-
ратуры плавления эвтектик этих сплавов различны.
3. Связь между свойствами сплавов
и типом диаграммы состояния
Диаграммы состав — свойства разработаны Н. С. Кур-
наковым и С. Ф. Жемчужным. Для наглядности рассмот-
рим изменение твердости НВ, электропроводности Е от
состава сплава, содержащего два компонента А и В
(рис. 29).
В сплавах типа механической смеси свойства (твер-
дость, электропроводность и т. д.) изменяются в зависи-
мости от состава линейно (рис. 29, а).
В сплавах твердого раствора свойства изменяются в
зависимости от состава по определенным зависимостям,
например, твердость при возрастании концентрации
компонента В (рис. 29, б) вначале растет, а затем пада-
36
ет, тогда как электропроводность вначале падает, а за-
тем возрастает.
В сплавах типа химического соединения свойства
('рис. 29, в) выражаются ломаными линиями, и в точке,
отвечающей химическому соединению, наблюдается мак-
симум (для твердости) или минимум (для электропро-
водности). Из рис. 29 видно, что механические (твер-
Рис. 29. Диаграмма состав — свойства
дость) и физические (электропроводность) свойства
зависят от структуры сплава. По этим диаграммам мож-
но определять и технологические свойства сплавов, что
облегчает выбор материала для изготовления изделий.
Глава IV
ЖЕЛЕЗОУГЛЕРОДИСТЫЕ СПЛАВЫ
К сплавам железо — углерод относятся стали, чугуны
и ферросплавы, занимающие по масштабам производства
первое место, а по многообразию применения самое ши-
рокое распространение в технике. Чистое железо имеет
две аллотропические модификации — а и у (см. аллотро-
пические превращения железа). Чистое железо со мно-
гими элементами образует как химические соединения,
так и твердые растворы. Например, с углеродом оно об-
разует химическое соединение цементит FesC, в котором
37
содержится 6,67% С. Цементит обладает высокой твердо-
стью (НВ 800) и очень малой пластичностью.
Железо растворяет углерод с образованием твердых
растворов. В зависимости от модификации железа рас-
творимость углерода различна. Так, в у-железе макси-
мальная растворимость углерода при 1147° С составля-
ет 2,14%, а минимальная растворимость при 727° С —
0,8%. Твердый раствор углерода в y-Fe называется аус-
тенитом по имени английского ученого Р. Аустена. Аус-
тенит пластичен, твердость его НВ 160—200. В ct-Fe рас-
творимость углерода намного ниже. Так, максимальная
растворимость углерода при 727° С составляет всего
0,02%, а минимальная — 0,006% при комнатной темпе-
ратуре. Твердый раствор углерода в a-Fe называется
ферритом (от лат. слова ferrum — железо). Феррит име-
ет низкую твердость (НВ 80) и высокую пластичность.
1. Диаграмма состояния железо — цементит
Сплавы железо — углерод выше 6,67% С не применя-
ются как конструкционные материалы, поэтому рассмот-
рим только диаграмму состояния сплавов железо — це-
Рис. 30. Диаграмма состояния системы Fe — Fe3C
38
ментцт (рис. 30). Для упрощения диаграммы состояния
железо — цементит структурные изменения, связанные с
существованием б-железа в области температур выше
1401° С, не будут рассматриваться.
На диаграмме точка А отвечает т. пл. чистого железа
1539° С, в точке D т. пл. цементита около 1600° С. Об-
ласть выше линии ACD (линия ликвидуса) характеризу-
ется жидким состоянием сплава. Полное затвердевание
сплавов происходит по линии солидуса АЕСВ. Ниже ли-
нии АС до линии АЕС из жидкого расплава (Ж) выделя-
ются кристаллы аустенита (А). В области АСЕ сплав со-
стоит из жидкого раствора (Ж) и аустенита (А). Ниже
линии CD до линии СВ из жидкого расплава выпадают
кристаллы цементита, называемого первичным (Дг), и
в области DCB находится смесь жидкого раствора (Ж)
и цементита (Дг). При содержании углерода в сплаве,
равном 4,3% и 1147° С, в точке С одновременно крис-
таллизуется аустенит и цементит, образуя механическую
смесь (эвтектику), называемую ледебуритом (Л). Во
всех сплавах, содержащих от 2,14 до 6,67% углерода —
чугунах, присутствует ледебурит. Сплавы, лежащие ле-
вее точки Е, относятся к группе сталей.
Превращения в твердом состоянии в сплавах системы
Fe — Fe3C связаны с переходом железа из одной моди-
фикации в другую и изменением растворимости углерода
в железе в результате этого перехода.
В области диаграммы AESG находится аустенит. При
снижении температуры ниже линии GS (критическая
точка Аз) из аустенита выделяется феррит (Ф), а ниже
линии ES — цементит, называемый вторичным (Цц).
В области диаграммы GSP сплавы состоят из феррита и
аустенита, а в области ниже линии SE (критическая точ-
ка Аст) — из цементита и аустенита. Сплавы, содержа-
щие от 2,14 до 4,3% углерода, при температурах от 1147
до 727° С состоят из аустенита, цементита и ледебурита,
а содержащие углерода более 4,3% —из цементита и
ледебурита.
При 727°С (линия PSK, критическая точка AJ аусте-
нит распадается с образованием механической смеси
феррита и цементита, которая называется перлитом (П).
Ниже 727° С железоуглеродистые сплавы имеют следую-
щие -структуры.
Стали, содержащие от 0,02 до 0,8% С феррит+пер-
лит,— доэвтектоидные стали; 0,8% С перлит — эвтекто-
39
йдная сталь; от 0,8 до 2,14% цементит+перлит — заэВ-
тсктоидные стали.
Белые чугуны, содержащие от 2,14 до 4,3% С пер-
лит-]- вторичный цементитЧ-ледебурит, — доэвтектиче-
ские чугуны; 4,3% С ледебурит — эвтектический чугун;
от 4,3 до 6,67% С цементит первичный+ледебурит — за-
эвтектические чугуны.
Линия PQ показывает, что с понижением температу-
ры растворимость углерода в феррите уменьшается от
0,02% при 727° С до 0,006% при комнатной температуре.
При охлаждении ниже 727° С из феррита выделяется из-
быточный углерод в виде цементита, называемого третич-
ным. В ннзкоуглеродистых сталях в условиях медленного
охлаждения третичный цементит выделяется по грани-
цам зерен феррита, что уменьшает пластические свойст-
ва, особенно способность к холодной штамповке листо-
вой стали.
Сплавы, содержащие =С0,02% С, называют техниче-
ским железом.
В практике диаграммой состояния железо — углерод
пользуются не только для получения заданных (первона-
чальных пли конечных) структур в сплаве, но и для оп-
ределения теплового режима при термической обработке,
температуры нагревания металла при обработке давле-
нием (прокатке, ковке, штамповке), а также для оп-
ределения температурных пределов при этих опера-
циях.
2. Влияние на сталь углерода, постоянных примесей
и легирующих элементов
Углерод оказывает основное влияние на свойства
стали. С увеличением содержания углерода в стали по-
вышаются твердость и прочность, уменьшаются пластич-
ность и вязкость.
В углеродистой стали кроме железа и углерода содер-
жатся еще постоянные примеси таких элементов,
как сера, фосфор, кремний, марганец.
Сера и фосфор являются вредными примесями. До-
пускаемое их содержание в зависимости от качества ста-
ли должно быть не более 0,05% каждого. Сера не рас-
творяется в железе, а образует с ним сульфид железа,
который с железом образует эвтектику Fe — FeS с т. пл.
988° С. Эта эвтектика при затвердевании стали распо-
40
лагается вокруг зерен в виде легкоплавкой оболочки, и
при горячей обработке (ковке, прокатке и т. п.) такие
оболочки расплавляются, теряется связь между зернами,
образуются трещины. Это явление получило название
красноломкости стали. Фосфор, растворяясь в феррите,
резко снижает его пластичность, вызывает внутрикри-
сталлическую ликвацию, способствует росту зерна, что
приводит к хрупкости изделий при обычной температуре
(хладноломкость). Кремний (до 0,5%) и марганец (до
0,8%) практически не оказывают влияния на свойства
стали.
Легированными сталями называют стали, содержа-
щие в своем составе специально введенные легирующие
элементы, такие, как никель, хром, молибден, титан, ва-
надий, вольфрам и др., или в которых содержится повы-
шенное (более 0,5—1,0%) количество кремния или мар-
ганца. Введение легирующих элементов в сталь повыша-
ет механические свойства или придает им специальные
свойства, например жаростойкость, жаропрочность, кис-
лотостойкость и др.
Легирующие элементы при введении в сталь мвгут
образовывать с железом твердые растворы, растворяться
в цементите [например, (Fe, Cr)sC] или образовывать
самостоятельные химические соединения с углеродом
(специальные карбиды), например VC, * СГ7С3
и др.
Легированные стали по структуре в условиях равно-
весия делят на следующие классы: перлитный, ледебу-
ритный, ферритный, аустенитный, а по структуре, полу-
чаемой после охлаждения на воздухе, на перддтный,
мартенситный, аустенитный, карбидный.
3. Чугуны
Чугуны — железоуглеродистые сплавы, содержа-
щие более 2,14% углерода. В зависимости от состояния
углерода, входящего в состав сплавов, чугуны подразде-
ляют на белые и серые. Чугуны, у которых углерод нахо-
дится в связанном состоянии в виде цементита Fe3C, на-’
зываются белыми. Такие чугуны тверды, хрупки, не под-
даются механической обработке. В серых чугунах угле-
род полностью или частично содержится в свободном
состоянии в форме пластинчатого графита.
41
По назначению чугуны подразделяются на передель-
ные (белые) и машиностроительные. Передельные чугу-
ны в основном используются для получения стали и в не-
больших количествах — для получения ковкого чугуна.
К машиностроительным чугунам относят серый, ковкий и
высокопрочный чугуны.
Присутствие углерода в виде графита в машиностро-
ительных чугунах разобщает сталистую структуру и рез-
ко снижает механические и пластические свойства. Од-
нако наличие графита дает и ряд преимуществ чугунам
перед сталью. Они легко обрабатываются резанием, так
как образующаяся стружка легко ломается, обладают
хорошими антифрикционными свойствами, мало чувстви-
тельны к дефектам поверх-
ности, надрезам и т. п. Кро-
ме того, чугуны имеют более-
низкую температуру плавле-
ния, высокую жидкотеку-
честь и хорошую заполняе-
мость форм металлом по
сравнению со сталями. Поэ-
тому машиностроительные
чугуны широко применяются
для изготовления деталей
машин, не испытывающих
значительных растягиваю-
Рис. 31. Микрошлиф серого чу-
гуна (Х150):
/ — перлит; 2 — пластинчатый гра-
фит
щих и ударных нагру-
зок.
Серым чугуном называ-
ют чугун, излом которого
имеет серый цвет. Объясня-
ется это тем, что структура
металлической основы и
серого чугуна состоит из
фитовых включений, имеющих форму пластин (рис. 31).
Содержание углерода в сером чугуне, применяемом в ка-
честве машиностроительного, колеблется от 2,8 до 3,8%
(до 0,8% С находится в связанном состоянии, а осталь-
ное— в форме графита). Кремний в чугуне содержится
в широких пределах: от 0,5 до 5%. Он влияет на струк-
туру и свойства чугуна и усиливает процесс графитиза-
ции. Содержание марганца в серых чугунах колеблется
от 0,8 до 1,2%. Марганец в отличие от кремния препят-
ствует процессу графитизации. Сера, присутствующая в
чугунах (от 0,08 до 0,12%), снижает жидкотекучесть и
42
Механические свойства. Присутствие фосфора (до 0,3%)
улучшает жидкотекучесть чугуна. Объясняется это тем,
что фосфор образует легкоплавкую эвтектику (950°С),
состоящую из аустенита и фосфида железа (Fe3P), а
твердые участки фосфидной эвтектики повышают твер-
дость и износоустойчивость.
По структуре серые чугуны подразделяют на три
группы:
1. Ферритный чугун, состоящий из феррита и гра-
фита.
2. Ферритно-перлитный чугун, состоящий из феррита,
перлита и графита.
3. Перлитный чугун, состоящий из перлита и гра-
фита.
Маркируется серый чугун буквами СЧ с добавлением
двух чисел: первое число указывает предел прочности при
растяжении, а второе — предел прочности при изгибе.
Например, марка СЧ 15-32 показывает, что чугун имеет
ов=150 МН/м2 (15 кгс/мм2) и оИзг=320 МН/м2
(32 кгс/мм2).
• Высокопрочным чугуном называется чугун, в кото-
ром графит имеет шаровидную форму в виде глобулей.
Из всех видов графита наиболее благоприятен шаровид-
ный, так как он меньше ослабляет металлическую основу
и поэтому лучше сохраняет присущие ей свойства (проч-
ность и пластичность). Шаровидная форма графита по-
лучается модифицированием жидкого серого чугуна пе-
ред заливкой в формы магнием, церием. Высокопрочный
чугун обозначается ВЧ с добавлением двух чисел; пер-
вое число указывает предел прочности при растяжении,
а второе — относительное удлинение. Например, марка
ВЧ 100-4 показывает, что чугун имеет ов=1 000 МН/м2
(100 кгс/мм2) и 6=4%. Металлическая основа высоко-
прочных чугунов такая же, как и серых, — ферритная,
ферритно-перлитная, перлитная.
Ковкий чугун — условное название мягкого и вязкого
чугуна. Он не подвергается ковке, но имеет по сравнению
с серым чугуном более высокую пластичность. Углерод
в ковком чугуне находится в виде включений графита ок-
ругленной (хлопьевидной) формы.
Ковкий-чугун получается в процессе отжига отливок,
изготовленных из белых чугунов. Изделия из белых чу-
гунов помещают в печь, нагревают до 950—1000° С и вы-
держивают длительное время при этой температуре для
43
разложения первичного цементита FegC с выделением
графита отжига. Затем изделия охлаждают до темпера-
туры ниже критической (740—720° С) и выдерживают
при этой температуре для разложения цементита эвтек-
тического. Ковкий чугун может быть трех видов: феррит-
ный, состоящий из феррита и углерода отжига (рис.
32, а), перлитный — из перлита и углерода отжига
(рис. 32,6) и ферритно-перлитный — из феррита, перли-
та и углерода отжига.
Ковкий чугун обозначают буквами КЧ и числами.
Первое число указывает предел прочности при растяже-
нии, а второе — относительное удлинение. Например,
марка КЧ 45-6 показывает, что чугун имеет ов =
= 450 МН/м2 (45 кгс/мм2) и б = 6%-
Рис. 32. Микрошлиф ковкого чугуна (Х150):
а — ферритный; б — перлитный
Ковкий чугун является более дешевым материалом по
сравнению со сталью и используется для изготовления
изделий, применяемых в автомобильной, тракторной про-
мышленности, сельскохозяйственном машиностроении,
вагоно-, станкостроении и т. д.
Легированные чугуны — чугуны, легированные хро-
мом, алюминием, кремнием, никелем и другими, элемен-
тами с целью улучшения их свойств. Легирование чугу-
нов повышает их стойкость в щелочах, кислотах и
других агрессивных средах, а также их жаростой-
кость.
44
Глава V
ТЕРМИЧЕСКАЯ И ХИМИКО-ТЕРМИЧЕСКАЯ ОБРАБОТКА
Термическая обработка — совокупность операций на-
грева, выдержки и охлаждения (рис. 33) изделий из ме-
таллов и сплавов с целью изменения их структуры и
свойств. Ее подразделяют на отжиг, нормализацию, за-
калку и отпуск. Химико-термическая обработка основана
на диффузионном насыщении поверхности изделий рядом
элементов.
1. Термическая обработка стали
Изделия, получаемые из стали, подвергаются всем ви-
дам термической обработки.
Рис. 33. Диаграмма тер-
мической обработки ста-
ли
Рис. 34. Диаграмма различных
видов отжига и нормализации:
1 — диффузионного; 2 — нормализа-
ции: 3 — полного; 4 — рекристалли-
зационного
Отжиг стали. Отжиг применяется для устранения
внутренних напряжений и внутрикристаллической лик-
вации, снижения твердости, повышения пластичности и
вязкости и т. д. Основными видами отжига являются
диффузионный, полный, неполный и рекристаллизацион-
ный. Температура нагрева изделий при проведении от-
жига различна (рис. 34). Отжиг изделий'состоит в мед-
ленном нагреве их в печи, выдержке при определенной
температуре и медленном охлаждении вместе с печью.
Диффузионный отжиг проводят с целью устранения
химической неоднородности зерен (внутрикристалличе-
ской ликвации), особенно в изделиях из легированных
сталей, стальных фасонных отливках и в слитках. Тем-
пература нагрева должна быть на 200—300° С выше тем-
пературы аллотропического превращения, например,
стальные слитки нагревают до 1100—И15° С, выдержи-
45
вают йх в печи в течение ~ 12 ч и медленно охлаждают
до 200е С. Полное время диффузионного отжига состав-
ляет 80—100 ч.
Полный отжиг основан на фазовой перекристаллиза-
ции, приводящей к измельчению зерна стали. Он приме-
няется для улучшения структуры стали, понижения ее
твердости. При полном отжиге устраняется волокнистая
структура, полученная в процессе прокатки или ковки,
происходит снятие внутренних напряжений, что приво-
дит к повышению пластично'сти изделий и облегчает по-
лучение изделий штамповкой, резанием.
Полному отжигу подвергают доэвтектоидные стали.
Температура нагрева на 30—50° С выше точки Ас3. При
нагреве из исходной структуры феррит+перлит образу-
ется аустенит, характеризующийся мелким зерном, и по-
этому при охлаждении зерна образующейся ферритно-
перлитной структуры получаются тоже мелкими.
Неполный отжиг характеризуется нагревом стали до
температуры на 20—30° С выше точки Аст и применяется
для заэвтектоидных сталей с целью превращения пла-
стинчатого перлита и сетки цементита в структуру зер-
нистого перлита, обладающего по сравнению со сталью
с пластинчатым перлитом большей пластичностью и луч-
шей обрабатываемостью резанием. Так как получается
зернистая (сфероидальная) форма цементита, такой от-
жиг называют сфероидизацией.
Рекристаллизационный отжиг применяется для уст-
ранения внутренних напряжений, снижения твердости,
получения равновесной структуры из обломков кристал-
литов, образовавшихся при холодной деформации. От-
жигу подвергают изделия, полученные при холодной об-
работке, например волочением (проволока), прокаткой
(листы, ленты), находящиеся в стадии наклепа (пони-
женная пластичность изделий, но высокая твердость). От-
жиг проводят нагреванием изделий в печи до температур,
близких к точке ДС] (650-—700°С), с последующим мед-
ленным охлаждением их вместе с печью.
В результате рекристаллизации из деформированных
зерен образуются новые мелкие, равноосные зерна. Из-
делия после отжига обладают более высокой пластич-
ностью, но меньшей твердостью.
Нормализация стали. Это процесс термической обра-
ботки, состоящий в нагреве доэвтектоидных сталей вы-
ше точки Ас3, а заэвтектоидных сталей выше точки Аст
46
на 50—60° С, выдержке их при данной температуре с по-
следующим охлаждением на воздухе. Применяют норма-
лизацию для улучшения структуры, механических
свойств и обрабатываемости сталей. Процессы измель-
чения зерна аналогичны процессам при отжиге. Изделия
после нормализации приобретают повышенную твердость
по сравнению с отжигом в связи с образованием перлита
боЛее тонкого строения. Нормализация (как более произ-
водительный процесс) для улучшения свойств изделий из
низкоуглеродистых сталей применяется чаще, чем пол-
ный отжиг. Изделия из высокоуглеродистых и легирован-
ных сталей подвергают нор-
мализации в том случае,
когда требуется устранить
цементитную сетку, образу-
ющуюся при охлаждении в
результате выделения вто-
. ричного цементита по грани-
цам зерен.
Закалка стали. Это тер-
мическая обработка, заклю-
чающаяся в нагреве стали
выше критических точек
превращения, выдержке их
Рис. 35. Диаграмма закалки и
отпуска стали:
/ — закалка; 2 — отпуск
при этой температуре и быстром охлаждении. В резуль-
тате этого процесса твердость изделий резко повышает-
ся. При закалке температура нагрева зависит от содер-
жания углерода в стали. Так, изделия, изготовленные из
доэвтектоидных сталей, нагревают на 30—50° С выше
точки Ас3 для перевода ферритно-перлитной структуры
в аустенитную, а из заэвтектоидных сталей — на 30—
50° С выше точки Act (рис. 35).
Качество закаленных изделий зависит от температу-
ры нагрева, времени выдержки изделий в печи и скоро-
сти охлаждения. Правильный выбор этих параметров
обеспечивает получение изделий без закалочных дефек-
тов. Охлаждение проводят с применением различных за-
калочных сред: воды, масла, расплавленных солей, рас-
творов солей, кислот и щелочей, воздуха. Если принять
охлаждающую способность воды при 20° за единицу, то
относительная охлаждающая способность 10%-ного вод-
ного раствора поваренной соли составит 1,23, масла 0,20,
спокойного воздуха 0,03 и т. д. Тонкостенные изделия ох-
лаждают в расплавах солей (изотермическая закалка),
47
что устраняет коробление их и исключает появление за-
калочных дефектов (трещин, микротрещин).
В зависимости от скорости охлаждения при.закалке
образуются три структуры: мартенсит, троостит и сорбит.
Мартенсит* получают при скорости охлаждения
180—200 град/с (рис. 36, а). Он представляет собой пере-
сыщенный твердый раствор углерода в a-Fe. Это про-
дукт начальной стадии распада аустенита, когда углерод
при высокой скорости охлаждения не успевает выделить-
ся в виде цементита Fe3C при переходе y-Fe в a-Fe, и
поэтому углерод остается в кристаллической решетке
Рис. 36. Закалочные структуры (Х375):
а — мартенсит; б — троостит и мартенсит; в — сорбит
a-Fe в виде пересыщенного раствора. Мартенсит закалки
имеет неравновесную структуру, тетрагональную решет-
ку, игольчатое строение, высокую твердость и характери-
зуется наличием внутренних напряжений. Твердость мар-
тенсита НВ 500—650. Мартенсит имеет самую низкую
плотность по сравнению с другими структурами, неустой-
чив при нагревании, переходя в другие структуры.
Троостит ** является продуктом распада аустенита
при скорости охлаждения 80—100 град/с (рис. 36,6).
Троостит представляет собой механическую смесь ферри-
та и цементита высокой дисперсности, так как при такой
скорости охлаждения аустенит при переходе y-Fe в a-Fe
распадается с образованием феррита и цементита, но
рост зерна этих структур затруднен. Твердость троости-
та НВ 400.
Сорбит*** — продукт распада'аустенита при скоро-
сти охлаждения 50 град/с. Так же, как и троостит, явля-
* Назван в честь немецкого металловеда Мартенса,
** Назван в честь французского химика Трооста.
*** Назван в честь английского ученого Сорби,
48
ется смесью феррита и цементита (рис. 36, в), но зерна
феррита и цементита в сорбпте ~ в 10 раз крупнее, чем
в троостите-, так как при меньшей скорости охлаждения
зерно успевает расти. Структура сорбита более вязкая,
пластичная, но менее твердая (НВ ~ 300) по сравнению
с трооститом и мартенситом.
Выбирая охлаждающие среды, следует учитывать
закаливаемость и прокаливаемость данной стали. Зака-
ливаемость — способность стали к повышению твердости
при закалке (определяется содержанием углерода в ста-
ли). Прокаливаемость — способность стали воспринимать
закалку на определенную глубину ( глубина слоя с мар-
тенситной или троосто-мартенситной структурой).
Поверхностную закалку применяют в том случае, ког-
да необходимо повысить износостойкость, твердость по-
верхности изделий при сохранении менее твердой серд-
цевины. Применяют ее и в тех случаях, когда требуется
повысить твердость поверхности в ее отдельных частях,
например зубья шестерен, шейки коленчатого вала
и т. д. Нагрев поверхности под закалку осуществляют то-
ками высокой частоты и реже пламенем газовой го-
релки.
Нагрев токами высокой частоты является наиболее
производительным и прогрессивным способом нагрева;
можно закаливать детали разнообразных конфигураций
и полностью автоматизировать процесс закалки.
От неправильного проведения закалки в деталях мо-
гут возникнуть различного рода дефекты: недогрев, пе-
регрев, перетяг, закалочные трещины, окисление и обез-
углероживание, коробление, пятнистая закалка.
Отпуск закаленной стали. Структуры, получаемые при
закалке стали, неравновесны, тверды (особенно мартен-
сит), имеют внутренние напряжения, поэтому изделия
сразу после закалки применяться не могут. Для устране-
ния этих недостатков необходимо проводить отпуск. Это
процесс термической обработки, состоящий в медленном
нагревании изделий до температуры ниже фазового пре-
вращения, т. е. ниже точки Aci с последующим охлаж-
дением обычно на воздухе. В результате такой обработки
снимаются частично или полностью внутренние напряже-
ния, образуется более равновесная структура, пластин-
чатая форма цементита превращается в глобулярную,
что улучшает механические свойства (при одинаковом
значении предела прочности сталь с зернистой структу-
49
рой обладает большей вязкостью по сравнению со сталью
с пластинчатой структурой).
В зависимости от температуры нагрева закаленной
стали отпуск бывает низкий, средний и высокий. Низкий
отпуск (до 250° С) проводят с целью получения мартен-
сита отпуска и снятия части внутренних напряжений при
сохранении твердости. Этому виду отпуска подвергают
большинство деталей, мерительный и режущий инстру-
мент. Средний отпуск (350—500рС) проводят с целью
получения троостита отпуска. Такая структура обеспечи-
вает высокий предел упругости и несколько повышает
вязкость. Средний отпуск применяют при изготовлении
пружин, рессор, кузнечных штампов, пресс-форм и т. д.
Высокий отпуск (500—650° С) проводят для получения
структуры сорбита отпуска, что обеспечивает лучшее со-
отношение между прочностными и пластическими свойст-
вами, поэтому его используют для отпуска многих дета-
лей, например осей автомобилей, шатунов двигателей,
т. е. изделий, подвергающихся воздействию высоких на-
пряжений. Для обеспечения равномерного нагрева приме-
няются электропечи (шахтного типа) с циркуляцией на-
гретого воздуха при помощи вентилятора.
2. Химико-термическая обработка стали
Химико-термическая обработка — процесс тепловой
обработки изделий в активных средах с целью изменения
химического состава, структуры и свойств поверхностных
слоев. Ее проводят для повышения твердости, износо-
стойкости и коррозионной стойкости изделий. К процес-
сам химико-термической обработки относятся цемента-
ция, азотирование, цианирование (нитроцементация) и
диффузионная металлизация.
Цементация. Это насыщение углеродом поверхности
изделий из низкоуглеродистых сталей (до 0,25%), в ре-
зультате чего изделия становятся двухслойными — по-
верхность науглероживается до 0,8—1% С, а сердцевина
остается ненауглероженной. Изделия после цементации
подвергают отжигу или нормализации для измельчения
зерна с последующей закалкой и низким отпуском, при
этом сердцевина не принимает закалку, остается пла-
стичной и может работать в условиях динамических на-
грузок, а поверхность становится твердой (закалка на
мартенсит). Толщина слоя чаще всего 0.5—2 мм. Цемен-
50
тацию проводят с использованием как твердого, так и
газового карбюризатора.
При цементации с использованием твердого карбюри-
затора изделия укладываются в специальные ящики и
засыпаются карбюризатором, состоящим из 70—80%
древесного угля и 20—30% карбонатов (ВаСО3, СаСОз,
Na2CO3), после чего герметически закрытые ящики уста-
навливают в печи на определенное время и нагревают до
900—950° С. В процессе нагревания происходят следую-
щие реакции: углерод угля взаимодействует с кислоро-
дом воздуха, находящимся в ящике, с образованием ок-
сида углерода (II):
2С + О2 = 2СО
Карбонаты при высокой температуре диссоциируют
по схеме _.-_j
МеСО3> МеО + СО2
а СО2 окисляет углерод древесного угля, поэтому кон-
центрация СО в газовой камере возрастает. Оксид угле-
рода (II), соприкасаясь с поверхностью изделия, распа-
дается с выделением атомарного углерода:
2СО = СО-2 4" Сатом
который диффундирует в сталь, растворяясь в у-фазе:
Сатом -> = Се7 (С) аустенит
Газовую цементацию применяют при массовом произ-
водстве изделий. Ее проводят в герметических камерах
В качестве цементирующих газов используют оксид угле-
рода (II) и углеводороды: метан, пропан.
При 900—950° С газообразные продукты разлагаются
с выделением атомарного углерода, который диффунди-
рует в поверхностный слой, например:
СЩ—>- 2Н2 + Сатом
2СО —СО2 + Сатом
Газовая цементация имеет ряд преимуществ перед
цементацией в твердых карбюризаторах, в частности,
сокращается длительность процесса, возрастает пропу-
скная способность оборудования, улучшаются условия
труда, возможна автоматизация управления процессом.
Наиболее распространенной термической обработкой
цементованных деталей является закалка от 800—850° С
с последующим отпуском при 150—200° С. При газовой
цементации деталей широкое распространение получила
51
непосредственная закалка из цементационной печи с
предварительным подстуживанием до 800—840° С (для
уменьшения коробления).
Глубина проникновения углерода в поверхностный
слой изделий зависит от температуры и времени нагрева-
ния (рис. 37).
Азотирование. Это — насыщение поверхностных слоев
стали азотом. Оно основано на образовании в поверхно-
стном слое твердого раствора азота в железе, нитридов
время, ч
Рис. 37. Влияние температуры
и времени выдержки изделий
в печи на глубину цементации
(карбюризатор: уголь+ВаСО3):
I — 980° С; 2 — 900° С; 3 — 845° С
(химических соединений)
железа и легирующих эле-
ментов с азотом. Азотирова-
ние осуществляют для по-
вышения твердости, износо-
стойкости и коррозионной
стойкости изделий.
Азотированию подверга-
ют изделия из углеродистых,
но чаще легированных ста-
лей с низким содержанием
Сг, Al, Mo, W, V. Процесс
азотирования проводят в
герметических камерах при 500—600° С в присутствии
аммиака. Аммиак разлагается с выделением атомарно-
го азота:
NH3 ЗН 4" Гратом
и диффундирует в сталь. Азотирование — процесс дли-
тельный и составляет (при 500—520° С) 25—90 ч для
насыщения поверхности изделия на глубину 0,3—0,6 мм.
Для ускорения процесса азотирования применяют двух-
ступенчатый режим — при 500—520° С (15—20 ч) и при
550—570° С (20—25 ч). Твердость азотированного слоя
HV 1000—1200. После азотирования изделия могут сразу
использоваться при сборке машин й аппаратов. Для по-
вышения устойчивости против коррозии детали, изготов-
ленные из низко- и среднеуглеродистых сталей, подвер-
гают антикоррозионному азотированию при 600—700° С
с выдержкой от 30 мин до 6—10 ч.
Цианирование (нитроцементация). Это процесс со-
вместного насыщения поверхности стали углеродом и
азотом для повышения твердости и износостойкости по-
верхностного слоя. Цианирование проводят в жидких
средах (цианирование) и газовых средах (нитроцемен-
52
тация), наиболее часто при 820—870° С. Цианирование
проводят путем нагрева изделий в расплавах цианидов
(NaCN, KCN, Ca(CN)2 и др.) и нейтральных солей
(NaCl, ВаС12, Na2CO3 и др.). Цианиды при плавлении
разлагаются с выделением азота и углерода, которые
диффундируют в поверхность изделий. Чем выше темпе'
ратура расплава и время пребывания изделий в распла-
ве, тем глубже цианированный слой. Недостатком циани-
рования является ядовитость цианистых солей.
- Нитроцементацию осуществляют в герметических ка-
мерах с использованием цементующего газа, к которому
добавляют 2—10% аммиака. После цианирования (нит-
роцементации) проводят закалку и низкий отпуск. Твер-
дость цианированного слоя после термической обработки
HRC 58—62, а структура — мелкокристаллический мар-
тенсит.
Диффузионная металлизация. Это процесс насыщения
стали алюминием, хромом, кремнием, бором и др. с целью
упрочнения или придания особых физико-химических
свойств поверхностному слою изделия.
Наиболее распространенными способами являются
алитирование, хромирование, силицирование.
Алитирование — процесс насыщения поверхности из-
делий из стали алюминием. Для алитирования применя-
ют порошкообразные алитирующие смеси (порошок алю-
миния или смесь состава: 45% ферроалюминия, 2% хло-
рида аммония, 53% оксида алюминия).
При порошковом методе изделия укладывают в ящи-
ки, засыпают алитирующей смесью, герметично закрыва-
ют и нагревают в печи при 900—1000° С в течение 4—
25 ч. В процессе нагрева хлорид аммония разлагается
(NH4C1 = NH3+HC1) с выделением хлороводорода, кото-
рый с алюминием образует легколетучий хлорид алюми-
ния (2А1-?6НС1 = 2А1С13+ЗН2), разлагающийся при со-
прикосновении с поверхностью изделий с выделением
атомарного алюминия, диффундирующего в поверхност-
ный слой изделия. Диффузионный слой, состоящий из
твердого раствора алюминия в железе и химического со-
единения типа Fe„Alm, имеет высокую твердость, хруп-
кость. Такие изделия из-за хрупкости применять нельзя,
поэтому они подвергаются термической обработке. При
этом выравнивается концентрация алюминия в поверх-
ностном слое. Концентрация и глубина проникновения
алюминия в поверхностный слой зависят от температуры
53
Hfifpeba и Ёремейй йыдержкй и колеблЮтсй от 0,02 ДО
1 мм.
Газовое алитирование проводят в среде летучих со-
единений алюминия в герметически закрытых камерах.
1 Алитированию подвергают детали газогенераторов,
реторты, муфты, котельную арматуру, чехлы термопар и
другие с целью повышения окалиностойкости (до 900° С).
Хромирование — процесс насыщения поверхности из-
делий из стали хромом. Процессы хромирования анало-
гичны процессам алитирования, но осуществляются при
более высокой температуре (1000—1050° С) в течение
20—25 ч. После хромирования поверхностный слой изде-
лий приобретает повышенную износостойкость, твердость
(HV 1200—1300), окалиностойкость (до 800° С).
Хромированию подвергают различные детали: клапа-
ны компрессоров, втулки насосов, матрицы для холодной
высадки и др.
Силицирование — процесс насыщения поверхности из-
делий из стали кремнием. Оно проводится как с исполь-
зованием порошков, содержащих кремний и другие до-
бавки (подобно алитированию), так и в газовой среде,
в ретортах, при разложении паров хлорида кремния
(SiCh) при 950—1050° С. Глубина проникновения в по-
верхностный слой изделия выделяющегося кремния со-
ставляет от 0,8 до 1,0 мм.
Силицированные изделия устойчивы к растворам
азотной, серной и соляной кислот. Они обладают повы-
шенной твердостью (HV 200—300) и износостойкостью.
Поэтому силицированию подвергают кислотопроводы,
детали тракторов, автомобилей, насосов для перекачки
кислот и арматуру, применяемую в химической, нефте-
химической и других отраслях промышленности.
Глава VI
УГЛЕРОДИСТЫЕ И ЛЕГИРОВАННЫЕ СТАЛИ
По применению стали делят на конструкционные, ин-
струментальные и с особыми свойствами.
1. Конструкционные стали
К конструкционным сталям, из которых изготовляют
самые разнообразные конструкции, детали машин для
различных отраслей промышленности, предъявляют тре-
54
бования высоких механических свойств, технологично-
сти в обработке и дешевизны.
Углеродистые конструкционные стали обыкновенного
качества. Эти стали подразделяют на три группы: А, Б
и В. Стали группы А поставляются промышленностью
по механическим свойствам; группы Б — по химическому
составу; группы В — по химическому составу и механиче-
ским свойствам. Стали обыкновенного качества маркиру-
ются буквами «Ст» и цифрой от 0 до 6.
Для обозначения степени раскисления к обозначению
марки стали после номера марки добавляют индексы:
кп — кипящая, пс — полуспокойная, сп — спокойная, на-
пример, СтЗкп, СтЗпс, СтЗсп, БСтЗсп, ВСтЗсп. Чем боль-
ше номер, тем выше прочность (для стали группы А),
(табл. 2), больше углерода (для стали группы Б). Стали
группы А термической обработке не подвергают, а групп
Б и В подвергают.
Таблица 2
Механические свойства углеродистой стали обыкновенного качества
Марка стали Предел прочности при растяжении, МН/м* (кгс/мм’) Относительное удлинение, %, для толщины до 20 мм
Ст. 0 Не менее 310 (31) 23
Ст. 1 310—420 (31—42) 34-35
Ст. 2 330—440 (33—44) 32-33
Ст. 3 370—490 (37—49) 26—27
Ст. 4 410—540 (41—54) 24-25
Ст. 5 500—640 (50—64) 20
Ст. 6 Не менее 600 (60) 15
Углеродистые стали обыкновенного качества (всех
трех групп) предназначаются для изготовления различ-
ных металлоконструкций, а также слабонагруженных
деталей машин.
Углеродистые и легированные конструкционные каче-
ственные стали. Эти стали поставляются по химическому
составу и механическим свойствам. Углеродистые качест-
венные конструкционные стали маркируют цифрами 08,
10, 15, 20, 25. 85, которые характеризуют среднее со-
держание углерода в сотых долях процента. Эти стали
содержат фосфора не более 0,035% и серы не более
0,040%, кремния (для большинства марок) 0,17—0,37%,
а марганца до 0,8%. Выпускаются также качественные
55
стали с повышенным содержанием марганца (до 1,2%);
в этих случаях они маркируются буквой Г: 60Г, 65Г, 70Г.
В табл. 3 приводятся свойства некоторых углеродистых
качественных сталей.
Таблица 3
Некоторые свойства углеродистых качественных сталей
Марка стали Предел прочности при растяжении, МН/м* (кгс/мм*), не менее Твердость по Бринеллю, не более Относительное удлинение, %, не менее
10 340 (34) — 31
25 460 (46) — 23
45 610 (61) 197 16
60 690 (69) 229 10
75 1100 (НО) 241 7
85 1150 (115) 255 6
Легирующие элементы, входящие в состав стали, при-
нято обозначать следующими буквами: А — азот, Б — нио-
бий, В —вольфрам, Г — марганец, Д — медь, Е — селен,
М — молибден, Н — никель, Р — бор, С — кремний, Т —
титан, Ф — ванадий, Ю — алюминий, К — кобальт, X —
хром, Ц—цирконий.
Для обозначения легированных сталей принято опре-
деленное сочетание цифр и букв. В конструкционных ле-
гированных сталях первые две цифры указывают среднее
содержание углерода в сотых долях процента, буквы —
легирующий элемент, а цифры, стоящие за буквами, —
содержание элемента в процентах. Если после буквы
отсутствует цифра, то содержание данного элемента в
стали равно приблизительно 1%. Например, марка стали
55С2 обозначает кремнистую сталь, содержащую в сред-
нем 0,55% углерода и 2% кремния.
Для высококачественных сталей, более чистых по со-
держанию серы и фосфора, в конце обозначения марки
ставят букву А. Например, сталь ЗОХГС — качественная,
а ЗОХГСА — высококачественная.
Конструкционные цементуемые углеродистые и леги-
рованные стали. Для цементируемых изделий применяют
стали с содержанием 0,1—0,25% С. Детали небольших
размеров, работающие на износ при малых нагрузках,
когда прочность сердцевины не влияет на эксплуатацион-
ные свойства, изготовляют из углеродистых сталей марок
10, 15, 20. Крупные и тяжело нагруженные детали, в ко-
56
торых йеобходимо иметь кроме ЁЫсокой твердости по-
верхности прочную сердцевину, изготовляют из легиро-
ванных сталей марок 12Х2Н4А, 18ХГТ, 18Х2Н4ВА и др.
После цементации, закалки и низкого отпуска твердость
поверхности HRC 60—64, а сердцевины HRC 30—40.
Конструкционные улучшаемые углеродистые и легиро-
ванные стали. Улучшаемыми сталями называют средне-
углеродистые стали (0,3—0,5% С), подвергаемые закал-
ке и высокому отпуску (550—650° С). Углеродистые стали
марок 40, 45 применяют для изготовления деталей не-
больших сечений и испытывающих небольшие напряже-
ния. Легированные стали марок 45Х, ЗОХГС, 40ХНМ и
других благодаря их высокой прочности и достаточно
хорошей прокаливаемости применяют для изготовления
деталей крупного сечения или работающих при высоких
нагрузках.
Для получения высокой поверхностной твердости де-
тали закаливают токами высокой частоты (коленчатые
валы, зубчатые колеса и др.).
Рессорно-пружинные стали. Основным требованием,
предъявляемым к этим сталям, являются высокий пре-
дел упругости и выносливости. Указанным условиям
удовлетворяют углеродистые стали (например, марок
65; 85) и стали, легированные такими элементами, как
Si, Мп, Сг, W, V (стали марок 60С2, 65Г, 50ХФА,
65С2ВА и др.). Специфическим в термической обработке
рессорных листов и пружин является применение после
закалки отпуска при 400—450° С.
Шарикоподшипниковые стали. Основной сталью для
изготовления колец, шариков и роликов является сталь
ШХ15 (0,95—1,05% С; 1,30—1,65% Сг). Термическая об-
работка подшипниковой стали — отжиг (НВ 187—207),
закалка в масле от 830—860° С и отпуск при 150—200° С
(HRC 62—65).
2. Инструментальные стали
Инструментальные стали применяют для изготовле-
ния трех основных групп инструмента — режущего, изме-
рительного и штампов.
Углеродистые и легированные стали для режущего
инструмента.
Углеродистые стали применяют марок У7
(У7А), У8 (У8А), ..., У13 (У13А). Эти цифры характе-
57
ризуют среднее содержание углерода в десятых долях
процента. В них содержится серы до 0,03% и фосфора до
0,05%. Если марки сталей имеют на конце букву А, на-
пример У8А, то это означает, что сталь содержит серы
до 0,02% и фосфора до 0,03%.
Стали У7 и У8 применяют для инструмента ударно-
режущего (например, зубила) и деревообрабатывающе-
го (топоры, сверла, ножи, пилы и др.). Сталь У9 — для
ножовочных полотен и деревообрабатывающего инстру-
мента (сверла, фрезы, ножи и др.). Стали У10 и У12 —
для различного металлорежущего инструмента (сверла,
метчики, развертки, фрезы и др.), напильников. Сталь
У13 — для бритвенных ножей, напильников.
Углеродистую инструментальную сталь закаливают <
в воде, но инструмент прокаливается на небольшую глу- f
бину — диаметром до 10—12 мм. Отпуск проводят при :
разных температурах (160—240° С) в зависимости от ин-
струмента и требуемой твердости (например, зубила
HRC 56—58, метчики, развертки HRC 60—64). Тепло-
стойкость, т. е. способность рабочей кромки инструмента
сохранять в эксплуатации (при нагреве) структуру и
свойства, необходимые для резания, у углеродистых ста-
лей низкая — до 200° С.
Легированные стали, например, марок X
(0,95—1,10% С; 1,30—1,65% Сг); 9ХС (0,85—0,95% С;
0,95—1,25% Сг; 1,20—1,60% Si); ХВГ (0,90—1,05% С;
0,90—1,20% Сг; 1,20—1,60% W; 0,80—1,10% Мп) по
сравнению с углеродистыми сталями имеют следующие 1
преимущества: большую прокаливаемость (например, ;
сталь ХВГ прокаливается до 45 мм) и, следовательно,
возможность применения для инструмента большего се-
чения; возможность закалки в масле, в горячих средах,
меньшая деформация инструмента; более высокие режу-
щие свойства; более высокую теплостойкость (например,
для стали 9ХС до 250°С). Из легированных сталей изго-
товляют сверла, фрезы, метчики, плашки, протяжки
и т. п.
Быстрорежущие стали широко применяют для
изготовления разнообразного режущего инструмента, ра-
ботающего при высоких скоростях резания, в тяжелых
условиях. Эти стали являются сложнолегированными, i
обозначаются буквой Р (режущие), следующая за ней I
цифра указывает содержание главного легирующего эле-
мента — вольфрама, а некоторые другие элементы не t
58
обозначаются. Например, сталь Р18 (0,7—0,8% С; 3,8—
4,4% Сг; 17,5—19% W; 1,0—1,4% V; 0,5—1,0% Мо);
Р6М5 (0,8—0,88% С; 3,8—4,4% Сг; 5,5—6,5% W; 1,7—
2,1% V; 5,0—5,5% Мо).
Основное преимущество быстрорежущих сталей по
сравнению с другими сталями — это высокая теплостой-
кость— до 600—620° С. Термическая обработка инстру-
мента из быстрорежущей стали — закалка в масле от
температуры 1270—1290° С (для стали Р18) и 1210—
1230° С (для стали Р6М5) и многократный (чаще трех-
кратный) отпуск при 550—570° С.
Инструментальные твердые сплавы обла-
дают наибольшей теплостойкостью (до 800—-1000° С) и
твердостью (до HRA 90). Их получают прессованием и
спеканием (при 1400° С) порошков карбида вольфрама,
карбида титана и кобальта (пластичная связка). Для
обработки чугуна и цветных металлов применяют спла-
вы группы ВК, например сталь марки ВК2 (98% WC и
2% Со), а для обработки стали — сплавы группы ТК,
например Т15К6 (79% WC, 15% TiC и 6% Со). Механи-
ческой и термической обработке эти сплавы не подверга-
ют, только шлифуют.
Стали для измерительного инструмента. Измеритель-
ный инструмент (калибры, плитки) изготовляют из ста-
лей У10, X, ХВГ и др.; закаливают и для стабилизации
структуры (сохранения размеров инструмента в течение
длительного времени) подвергают низкому отпуску при
120—140° С в течение 12—60 ч. Твердость после термиче-
ской обработки HRC 62—65.
Штамповые стали делят на стали для инструментов
холодного и горячего деформирования.
Стали для инструмента холодного де-
формировани я — это У10, У11, У12 — для штампов
небольших размеров (диаметром до 25 мм) простой
формы, работающих в легких условиях; стали X, ХВГ —
для штампов диаметром до 100 мм более сложной фор-
мы и для более тяжелых условий работы; сталь Х12Ф1 —
цля штампов; работающих в условиях сильного износа
и давления. Штампы подвергают термической обработке
(закалке и отпуску) на твердость HRC 60—62.
Стали для инструмента горячего дефор-
мирования. Штампы, деформирующие металл в го-
рячем состоянии, работают .в более сложных условиях,
одвергаясь воздействию сложных напряжений, перио-
59
дическому нагреву и охлаждению рабочей поверхности,
истирающему действию горячего металла. Поэтому стали
для таких штампов должны иметь высокие механические
свойства, сохраняющиеся и при повышенных температу-
рах, быть стойкими против образования трещин «разга-
ра», образующихся при циклических нагревах поверх-
ности, глубоко прокаливаться (до 200—300 мм). Такими
сталями являются стали марок 5ХНМ, 5ХНВ (для моло-
товых штампов), ЗХ2В8Ф, 4Х5В2ФС (для высадочных
штампов, пресс-форм для литья под давлением).
Глава VII
ЦВЕТНЫЕ МЕТАЛЛЫ И СПЛАВЫ
1. Алюминий и его сплавы
Алюминий обладает малой плотностью 2700 кг/м3
(2,7 г/см3), низкой температурой плавления (660°С),
высокой пластичностью, тепло- и электропроводностью.
Алюминий легко поддается прокатке, ковке, волочению
и т. д. Обладая высокой теплопроводностью и элект-
ропроводностью, он способен заменить медь при изготов-
лении проводов и других изделий, применяемых в элект-
ронной промышленности, и для изготовления теплооб-
менной аппаратуры. Алюминий в зависимости от содер-
жания примесей выпускается трех видов: особой чисто-
ты (99,999% А1), высокой чистоты (от 99,995—99,95% А1)
и технической чистоты (от 99,85—99,5% А1). Основными
примесями в алюминии являются кремний, железо и ;
медь. Железо в алюминии не растворяется и образует 1
AI3Fe, тогда как растворимость кремния при эвтектиче-
ской температуре равна 1,65%, но при низкой темпера-
туре растворимость его очень мала. Присутствие одно-
временно в алюминии железа и кремния приводит к об-
разованию химических соединений железа, кремния и
алюминия. Медь растворяется в алюминии и образует
химические соединения, например СнА12.
Чистый алюминий применяется мало, так как он име-
ет малую прочность (50—80 МН/м2 (5—8 кгс/мм)] и твер-
дость (НВ 20—30). В основном он идет для получения
алюминиевых сплавов. Алюминий со многими элемента-
ми образует сплавы, которые подразделяются на дефор-
60
мируемые (для полуфабрикатов и изделий обработкой
давлением) и литейные (для фасонных отливок).
К деформируемым сплавам алюминия относятся спла-
вы систем А1—Мп, А1—Mg, Al—Си—Mg—Мп,
Al—Си—Si, Al—Си—Mg—Ti и др.
Сплавы системы А1—Мп, А1—Mg обладают низкими
пластическими и прочностными свойствами. Они не
упрочняются при термической обработке. Из таких спла-
вов получают изделия штамповкой. Наиболее часто при-
меняются алюминиевые сплавы системы А1—Си—Mg—
Мп под названием дуралюмины (Д) (табл. 4).
Табл и'ц а 4
Химический состав (%) и механические свойства
наиболее распространенных дуралюминов после закалки
и старения
Марка сплавов Основные компоненты* Предел проч- ности при рас- тяжении, МН/м* (кгс/мм*) Относи- тельное уд- линение, %
Си Mg Мп
Д1 3,8—4,8 0,4—0,8 0,4—0,8 410 (41) 15
Д16 3,8—4,9 1,2—1,8 0,3—0,9 520 (52) 11
Д20 6,0—7,0 до 0,2Ti 0,4—0,8 400 (40) 12
* А1 — основа.
Дуралюмины обладают достаточно высокими механи-
ческими свойствами, особенно после закалки (~500°С),
охлаждения в воде с последующим старением.
Изделия из дуралюмпна подвергаются отжигу, закал-
ке и старению. Отжиг проводят при 300° С, в результате
чего структура сплава состоит из твердого а-раствора и
упрочняющих включений (CuA12, Mg2Si и др.) и нераст-
воримых в алюминии фаз. Закалку изделий из дуралю-
мина проводят в воде от 495—505° С. Структура изделий
после закалки состоит из перенасыщенного а-раствора
и включений, нерастворимых в твердом растворе при
нагревании фаз. После закалки изделия подвергаются
естественному старению, которое заканчивается в тече-
ние 5 суток, или искусственному старению (при нагреве).
Старение — процесс распада пересыщенного твердого
раствора, образующегося в процессе закалки, Если
старение (выдержка) закаленных сплавов происхо-
дит в естественных условиях и вызывает опреде-
61
ленные изменения структуры и свойств, например повы-
шение прочностных характеристик, то такой вид старения
называют естественным. Нагрев закаленных сплавов до
100—200° С и выдержка их в печи в течение некоторого
времени называется искусственным старением. При
старении происходит тонкое измельчение структуры
сплавов, что связано с их упрочнением. Из дуралю-
минов готовят, например, большое количество деталей,
используемых в самолетостроении (детали каркаса,
стойки, штангоуты и др.). Дуралюмины широко исполь-
зуются в общем машиностроении, вагоностроении, авто-
мобильной и других отраслях промышленности. Они
достаточно жаропрочны, например, изделия из дуралю-
мина Д16 могут работать длительное время при 150° С;
из Д20 — при 300° С.
Более высокие механические свойства по сравнению
с дуралюмином имеет алюминиевый сплав с цинком В95
(1,4—2% Си; 1,8—2,8% Mg; 0,2—0,6% Мп; 5—7% Zn;
0,1—0,25 Сг). После закалки от 465—475°С в воде и ис-
кусственного старения при 120—140° С сплав В95 имеет
следующие механические свойства: ов = 600 МН/м2
(60 кгс/мм2), 6 = 8%.
К деформируемым сплавам относятся и так называе-
мые ковочные сплавы марок АД4, АД4-1, АК6, АД-8
и др., в состав которых кроме указанных в табл. 4 ком-
понентов входят Fe, Si, Ni и др. Эти сплавы обладают
высокими пластическими свойствами при нагревании. Из
них готовят слитки, поковки, штамповки крупных разме-
ров и сложной формы. Из сплавов этой группы получают
лопатки компрессоров, крыльчатки, диски и кольца тур-
бореактивных и турбовинтовых двигателей и другие де-
тали (сплавы АК.4-1, АД4), подмоторные рамы, детали
самолетов (АД8). Эти изделия могут работать при 200—
250° С.
К литейным алюминиевым сплавам (АЛ) относятся
сплавы системы А1—Mg, Al—Si, Al—Си (табл. 5).
Литейные алюминиевые сплавы подвергаются от-
жигу, закалке и старению. С целью измельчения зерна
и повышения свойств изделий в состав этих сплавов вво-
дят модифицирующие добавки: Ti, Zr, V, В и др. Режимы
отжига, закалки и старения зависят от химического со- ।
става сплава и использования литых изделий.
Наиболее распространенными литейными сплавами с I
повышенным содержанием кремния (от 4 до 13%) явля-
62
Таблица 5
Химический состав (%) и свойства* некоторых литейных сплавов
Марка * Основные компоненты** Предел прочности при растяжении, МН/м’ (кгс/мм*) Относительное удлинение, % Твердость по Бринеллю
Mg SI Мп Си
АЛ8 9,5-11,5 — — — 290 (29) 9 60
АЛ27 9,5-11,5 — — Ti, Be, Zr до 0,20 320 (32) 12 75
АЛ22 10,5—13,0 0,8-1,3 — Ti, Be до 0,15 180—230 (18—23) 1-1,5 90
АЛ4 0,17-0,3 8,0-10,5 0,2-0,5 — 150—240 (15—24) 1,5-3 50-70
АЛ19 — — 0,6-1,0 4,5—5,3 (0,15—0,35 Ti) 300—340 (30—34) 4-8 70-90
АЛ20 0,7-1,2 1,5-2,0 0,15-0,30 3,5—4,5 (0,05—0,1 Ti) 160—250 (16—25) 1 65
АЛЗО 0,8—1,3 11,0-13,0 — 0,8—1,5 (0,8—1,3 Ni) 200 (20) 0,5 90
* Указаны после термообработки.
*’ А1 — основа.
ются силумины. Благодаря высоким литейным свойст-
вам их используют для получения отливок сложной
формы, не требующих высоких прочностных свойств.
Изделия с высокими механическими свойствами готовят
с применением силуминов с пониженным содержанием
кремния (4—10%) с добавкой их в состав меди, магния,
марганца.
На основе тонкоизмельчснного алюминия — алюми-
ниевой пудры, содержащей оксид алюминия, получают
теплостойкий материал САП (спеченная алюминиевая
пудра). Это легкий 2700 кг/м3 (2,7 г/см3), прочный и кор-
розионно-стойкий .материал, хорошо обрабатываемый
давлением, резанием и т. п. САП сохраняет достаточную
прочность выше 350° С, тогда как все другие алюминие-
вые сплавы легко разупрочняются. При 500° С прочность
САП равна прочности алюминия при 20° С. Изделия из
САП выдерживают кратковременный нагрев их до
1000° С.
Технология получения САП состоит из следующих
стадий: 1) получение алюминиевой пудры с содержанием
от 6 до 22% А12О3 (это одна из самых ответственных и
трудоемких операций); 2) брикетирование пудры (без
нагревания); 3) спекание брикетов под давлением 500—
800 МН/м2 и при 450—500° С; получение из спеченных
брикетов полуфабрикатов прессованием или прессова-
нием с последующей прокаткой. Свойства САП зависят
от содержания в пудре А12О3. Чем меньше оксида алю-
миния в пудре, тем выше пластические свойства и ниже
прочностные. В зависимости от содержания в пудре А12О3
предел прочности при растяжении меняется от 300 до
460 МН/м2 (30—46 кгс/мм2), а относительное удлине-
ние— от 1,5 до 8%.
САП используется в ряде случаев вместо теплостой-
ких или нержавеющих сталей, например, для облицовки
летательных аппаратов, изготовления деталей различ-
ных приборов, химического и лабораторного обо£удова-
ния, изделий, применяемых в атомной технике, и т. п.
2. Магний и его сплавы
Магний относится' к легким и легкоплавким элемен-
там: плотность его 1740 кг/м3 (1,7 г/см3), а т. пл. 651°С.
Это химически активный элемент, стружки- и опилки
магния легко воспламеняются при нагреве. Магний легко
64
обрабатывается резанием, но имеет низкие механические
свойства [ов —80—ПО МН/м2 (8-11 кгс/мм2), 6 = 6%],
поэтому как конструкционный материал не находит при-
менения, а служит основой для получения сплавов, при-
меняемых в технике, особенно там, где вес конструкции
имеет решающее значение (ракето-, самолете-, приборо-
строение). Это объясняется тем, что удельная прочность
магниевых сплавов в 4,5 раза выше, чем у алюминиевых,
в 2 раза выше, чем у высокопрочного чугуна. Магниевые
сплавы способны гасить ударные и вибрационные нагруз-
ки, но они имеют низкую термостойкость (100—150° и
только некоторые из них до 200—350° С и кратковремен-
но при 350—400° С).
В настоящее время применяется большое количество
магниевых сплавов, содержащих алюминий, цинк, марга-
нец, торий, цирконий, бериллий, РЗМ (редкоземельные
металлы). Наибольшее применение находят сплавы си-
стем: Mg—-Al—Zn, Mg—Zn—Zr, Mg—Zn—Zr—P3M.
Указанные элементы частично растворимы в магнии, мно-
гие из них образуют химические соединения, например
MgsAU. Магниевые сплавы подразделяются на литейные
(МЛ) и деформируемые (МА).
Деформируемые сплавы подвергаются ковке, штам-
повке, прессованию, прокатке, поэтому из них делают
прутки, полосы, профили, трубы, листы, поковки и др.
Из сплавов магния изготовляют перегородки, трубы, про-
фили для сварных конструкций, кузовы, бензобаки и
детали спортивных автомобилей, крупногабаритные на-
груженные детали.
Литейные магниевые сплавы имеют высокие литей-
ные свойства, поэтому из них делают изделия литьем в
кокилп (металлические формы) под давлением и в сырые
песчаные формы. Особенно широко применяется сплав
МЛ5, в котором сочетаются высокие литейные и прочно-
стные свойства, что позволяет из него готовить детали
летательных аппаратов, колес, корпуса агрегатов, мас-
лопомпы и др. Сплавы магния также используются для
изготовления изделий, применяемых в автомобильной и
тракторной промышленности (картеры двигателей, короб-
ки передач, детали автомобильных колес и др.). Сплавы
магния с РЗМ и цирконием (МЛ 12 и МЛ 15) использу-
ются для изготовления изделий, работающих при 250—
350° С и кратковременно при 350—400° С. Кроме того,
магниевые сплавы применяются при изготовлении дета-
3—3504
65
лей приборов, фотоаппаратов, киноаппаратуры, оптиче-
ских и счетно-решающих приборов и т. п., потребность в
которых непрерывно возрастает.
Изделия магниевых сплавов подвергаются рекристал-
лизационному отжигу (~350°С), закалке и старению.
Используя эти операции, можно резко повысить их проч-
ностные свойства, например, предел прочности у дефор-
мируемых сплавов повышается на 10—30%, а у литейных
на 30—60%.
3. Медь и ее сплавы
Медь — металл, обладающий высокой пластичностью,
электро- и теплопроводностью. Плотность меди
8,9-103 кг/м3 (8,9 г/см3), а т. пл. 1083°С. Предел прочно-
сти при растяжении горячедеформированной меди
250 МН/м2 (25 кгс/мм2), при относительном удлинении
40—50%. Чистая медь в основном используется в элект-
ропромышленности и в установках передачи теплоты, в
том числе и в химической промышленности. Около 50%
меди применяется для получения сплавов, из которых
наибольшее применение находят латуни и бронзы, имею-
щие более высокую прочность, чем чистая медь, низкий
коэффициент трения и они более устойчивы к коррозии.
Латуни — медные сплавы, содержащие до 45% цинка.
Такие латуни называются простыми. При комнатной тем-
пературе они состоят либо из одних а- кристаллов (твер-
дый раствор цинка в меди), либо из смеси а- и (3-кристал-
лов (бета.— твердый раствор на основе соединения
CuZn). Латуни, содержащие до 35% Zn, пластичны, бо-
лее прочны по сравнению с медью, хорошо обрабатыва-
ются давлением в холодном и горячем состоянии. Они
поставляются в виде прутков, ленты, полосы, проволоки.
Простые латуни маркируют буквой «Л» и цифрой, указы-
вающей содержание меди в сплаве, например, Л80 со-
держит 80% меди и 20% цинка. Из простых латуней
наиболее широко применяются Л96, Л90, Л85, Л80, Л70.
и др.
Латуни, содержащие кроме цинка другие элементы,
называются специальными, из которых широкое приме-
нение находят сплавы, содержащие свинец, марганец,
никель, железо, кобальт, алюминий и др.
Элементы, входящие в состав специальных латуней,
маркируются первой русской буквой, например, О — оло-
66
во, а марганец — «Мц». Рассмотрим маркировку специ-
альной латуни ЛЖМц59-1-1.
Она содержит 59°/о Си, 1% Fe, 1% Мп, а остальное,
т. е. 39%, Zn. В табл. 6 приведены свойства наиболее
широко применяемых латуней.
Таблица 6
Некоторые свойства латуней
—
Ох® «О' ОхО
Предел проч- Предел проч- tfi
Марка пости при рас- (У s Марка ности при рас- <U s
латуни тяжении, МН/м1 S О у к лагунн тяжении. МН/м* S OJ й Е £ s
(кгс/мм1) н 5 (кгс/мм1)
О >, О S
•
Л 96 240 (24) 50 ЛН65 5 400 (40) 65
Л80 320 (32) 52 ЛМ.Ц58-2 400 (40) 40
Л 62 330 (33) 49 ЛАЖ60-Ы 450 (45) 45
ЛС74-3 350 (35) 50 ЛАН59-3-2 380 (38) 50
Л070-1 350 (35) 60 ЛЖМц59-1-1 450 (45) 50
ЛА77-2 400 (40) 55 ЛМцА57-3-1 550 (55) 25
Алюминиевые латуни используются для изготовления
конденсаторных трубок, шестерен, втулок, различных
деталей, применяемых в авиационной промышленности,
а также для изготовления коррозионно-стойких деталей,
работающих в морской воде.
Кремнистые латуни устойчивы к атмосферной корро-
зии, морской воде. Из них готовят методом штамповки,
литьем изделия, используемые при изготовлении морских
судов и т. д. Марганцовистые и никелевые латуни твер-
ды, прочны, устойчивы ко многим агрессивным средам.
Они широко применяются в виде полос, листов, прутков,
поковок. Из никелевых латуней готовят конденсаторные
трубки для морских судов, манометрические трубки,
сетки бумагоделательных машин и другие изделия. Свин-
Ювистые латуни хорошо обрабатываются резанием и
савлением в холодном состоянии. Они обладают анти-
>рикцпонными свойствами. Из латуни JIO70-1 получают
грубки конденсаторов морских судов, детали теплотехни-
ческой аппаратуры.
Специальные латуни (содержащие Мп, Pb, Si, Fe, Al
а др.) широко применяются для изготовления литых под-
шипников, втулок и других антифрикционных деталей,
литой арматуры, деталей судов, подвергающихся воздей-
ствию морской воды, червячных винтов и т. п.
67
Бронзы — сплавы меди, содержащие олово. В настоя-
щее время бронзой называют и безоловянистые сплавы
меди, т. е. сплавы, содержащие медь и любой элемент,
кроме цинка. Оловянистые бронзы применяются редко
из-за дефицитности и высокой стоимости олова, поэтому
применяются бронзы, где олово частично заменено свин-
цом, фосфором, никелем и другими элементами. Мар-
кировка элементов, входящих в состав бронз, анало-
гична маркировке элементов в латунях, например,
Бр.ОЦС 5-5-5. Она содержит в среднем 5% Sn, 5% Zn,
5% Pb, а остальное количество составляет медь (85%
Си). В табл. 7 приводятся свойства некоторых бронз.
Таблица 7
Некоторые свойства бронз в отожженном состоянии
Марка бронзы Предел прочности при рас- тяжении, МН/м* (кгс/мм*) Относительное удлинение, %
Бр.ОЦЮ-2 250—350 (25—35) 10—20
Бр.ОЦС5-5-5 150—250 (15—25) 10—15
Бр.А7 600 (60) 10
Бр.АМц9-2 450 (45) 20—40
Бр.АЖН 10-4-4 650 (65) 5
Бр.Б2
После закалки при 800° С 500 (50) 30
После закалки и старе- 1300 (130) 2-4
нии при 325° С
Бр.А5 380 (38) 65
Бр.АЖ9-4 500—600 (50—60) 40
Наибольшее применение находят алюминиевые, крем-
нистые, марганцовистые, свинцовистые и бериллиевые
бронзы. Оловянистые бронзы устойчивы к атмосферной
коррозии, в сухом и влажном водяном паре, в пресной и
морской воде, в сухих газах без нагревания. Они имеют
высокие механические и технологические свойства, по-
этому их используют для получения сложных по конфи-'
гурации отливок. Они обладают антифрикционными свой-
ствами. 1
Алюминиевые бронзы имеют более высокие механи-
ческие свойства по сравнению с оловянистыми. Механиче-1
ские и коррозионные свойства этих бронз повышаются!
при введении в их состав железа, никеля, марганца. !
Бериллиевые бронзы электро- и теплопроводны, твер-
ды, износо- и коррозионно-стойки, имеют высокие меха-
нические свойства особенно после закалки и отпуска!
68 |
Поэтому., их используют для изготовления пружин, мем-
бран, пружинящих контактов и т. д.
Изделия из кремнистых бронз получают методом
литья, так как они обладают высокими литейными свой-
ствами.
Марганцовистые бронзы прочны, коррозионно-стойки,
способны сохранять свои свойства при повышенных тем-
пературах, поэтому применяют их для изготовления из-
делий, работающих при нагревании.
Специальные бронзы, содержащие олово, никель, мар-
ганец, свинец и другие элементы, широко используются
для изготовления арматуры, работающей в пресной и
морской воде, маслах и слабых коррозионных средах, в
парах воды, изготовления лент, полос, проволоки для
пружин, трубок различного назначения, антифрикцион-
ных деталей, различного вида фасонных отливок, полу-
чаемых литьем под давлением, в кокиль и сырые песча-
ные формы. Изделия из меди и ее сплавов (латуни и
многие бронзы), полученные после деформации в холод-
ном состоянии, подвергаются только рекристаллизацион-
ному отжигу, который проводят при 500—700° С. Объяс-
няется это тем, что латуни и многие бронзы не имеют
фазовых превращений. Алюминиевые бронзы (AI до
Ю°/о) с добавкой железа и никеля подвергают закалке
и отпуску. После закалки изделия имеют структуру
игольчатого типа, а после отпуска образуется мелкая
механическая смесь фаз, что резко повышает свойства
изделий. Особенно резко улучшаются свойства изделий,
полученных из бериллиевых бронз, после закалки (зака-
ливают в воде от 750° С) и отпуска (при 320° С в течение
2 ч). Так, ов изделий после закалки составляет всего
540 МН/м2 (54 кгс/мм2), а после отпуска —1100—
1200 МН/м2 (110—120 кгс/мм2).
Кроме латуней и бронз на основе меди получают
медноникелевые сплавы типа мельхиор (30% Ni, 1%> Fe,
1% Мп), копель (42,5—44% Ni, до 1% Мп), константан
(39—41% Ni, 1—2% Мп), манганин (2,5—35% Ni, 11,5—
13,5% Мп) и др., широко применяемые для изготовления
деталей точной механики, медицинского инструмента,
реостатов, термопар, нагревательных приборов, монет,
столовой посуды и т. д.
Раздел второй
ОСНОВЫ ТЕОРИИ КОРРОЗИИ МЕТАЛЛОВ
Глава VIII
КЛАССИФИКАЦИЯ И ВИДЫ КОРРОЗИОННЫХ ПРОЦЕССОВ
1. Введение в теорию коррозии металлов
Металлы и металлические сплавы являются наиболее
важными конструкционными материалами для большин-
ства отраслей народного хозяйства. Но изделия из метал-
лов и сплавов под действием различных физико-химиче-
ских и биологических факторов разрушаются. Такое раз-
рушение изделий под действием внешней среды получило
название коррозии (от лат. слова — corrodere, что озна-
чает разъедать), а среда, в которой происходит этот про-
цесс, называется коррозионной или агрессивной. В ре-
зультате взаимодействия металла и коррозионной среды
образуются химические соединения, называемые продук-
тами коррозии.
Разрушение металлов и сплавов происходит в резуль-
тате химического (химическая коррозия), электрохими-
ческого (электрохимическая коррозия) и механического
воздействия внешней среды. Механическое разрушение
(истирание и т. п.) аппаратуры, изготовленной из метал-
лов и сплавов, называется эрозией. Процессы коррозии и
эрозии при эксплуатации аппаратуры могут протекать
одновременно, например, при работе насосов, мешалок
и т. п.
Способность металлов сопротивляться коррозионному
воздействию внешней среды называют коррозионной
стойкостью.
Основная причина коррозии металлов и сплавов —
их термодинамическая неустойчивость. Термодинамика
дает нам информацию о возможности самопроизвольно-
го протекания коррозионного процесса при данных внеш-
них условиях. Термодинамическая стабильность химиче-
70
ского соединения определяется знаком и величиной из-
менения изобарного потенциала G (при его образовании
из простых веществ). Пусть G\ относится к исходным
веществам, Сг— к продуктам реакции, т.е. AG = G2—Gb
и если Gi>G2 и AG>0, то соответствующее соединение
стабильно.
Термодинамические потенциалы используются для
количественной оценки движущей силы процесса. Инфор-
мацию о скорости возможного коррозионного процесса
и о в'лиянии различных факторов на коррозию металлов
дает кинетика.
Коррозионные процессы протекают, как правило, на
границе раздела фаз при взаимодействии твердого веще-
ства с газом или жидкостью, т. е. взаимодействие про-
исходит по гетерогенному механизму. Простейшую схему
гетерогенного процесса можно представить в виде сле-
дующих основных стадий:
а) транспортировка реагирующих веществ к поверх-
ности раздела фаз;
б) химическое взаимодействие;
в) отвод продуктов реакции из реакционной зоны.
Любая из стадий схемы может состоять из элементар-
ных процессов, протекающих последовательно, парал-
лельно, сопряженно. Скорость коррозии определяется
скоростью процессов самой медленной стадии. Поэтому
исследование кинетики начинают с установления лимити-
рующей (самой медленной) стадии реакции.
2. Классификация коррозионных процессов
Коррозионные процессы различают:
а) по механизму реакций взаимодействия металла со
средой;
б) по виду коррозионной среды;
в) по виду (геометрическому характеру) коррозион-
ных разрушений на поверхности или в объеме металла;
г) по характеру дополнительных воздействий, кото-
рым подвергается металл одновременно с действием кор-
розионной среды.
По механизму реакции взаимодействия различают
два типа коррозии металлов: химическую и электрохими-
ческую. Особо выделяют биологическую коррозию, иду-
щую под влиянием продуктов жизнедеятельности бакте-
рий и других микроорганизмов, и радиационную корро-
71
зию, протекающую под воздействием радиоактивного
излучения.
По виду агрессивной среды, принимающей участие в
процессе разрушения металлов, различают газовую, ат-
мосферную, в растворах электролитов, подземную, кор-
розию в жидкостях-неэлектролитах и др.
По характеру изменения поверхности металла или
степени изменения физико-механических свойств его не-
зависимо от того, какое происходило взаимодействие со
средой, коррозионные разрушения подразделяются на
следующие виды (рис. 38).
Рис. 38. Виды коррозионных разрушений:
а — равномерная коррозия; б — неравномерная коррозия; в — коррозия пят-
нами; г — коррозия язвами; д — коррозия точками; е — подповерхностная
коррозия; ж — межкристаллитная коррозия; з — структурно-избирательная
коррозия
1. Если коррозией охвачена вся поверхность металла,
такой вид разрушения называют общей или сплошной
коррозией. Сплошную коррозию делят на равномерную и
неравномерную в зависимости от того, одинакова глубина
коррозионного разрушения на всех участках металличе-
ской поверхности или нет. Сплошная коррозия — наиме-
нее опасный вид коррозии, так как материал, из которого
выполнен аппарат или отдельный его узел, незначитель-
но теряет свои свойства (около 5%).
2. При местной коррозии происходит разрушение от-
дельных участков поверхности металла. Местная корро-
зия имеет неодинаковую степень разрушения. Наиболее
характерными видами местной коррозии являются кор-
розия в виде пятен, язв, точечная и подповерхностная,
межкристаллитная и транскристалл'итная.
Коррозия в виде пятен — разрушение отдельных уча-
стков поверхности металла в виде пятен на сравнительно
небольшую глубину (например, коррозия латуни в мор-
ской воде).
72
Коррозия в виде язв мало отличается от коррозии в
виде пятен, но разрушения сосредоточены па ограничен-
ных участках с большой глубиной проникновения в слой
металла (например, коррозия стали в грунте).
Точечная коррозия (питтинг) связана с разрушением
металла в виде отдельных точечных поражений, перера-
стающих в сквозные (коррозия нержавеющей стали в
морской воде).
Подповерхностная коррозия начинается с поверхно-
сти и, как правило, в тех случаях, когда защитные по-
крытия (пленки, лаки и т. п.) разрушены на отдельных
участках. Поэтому металл разрушается преимуществен-
но под поверхностью, и продукты коррозии оказываются
сосредоточенными внутри металла. Обнаружить начало
такого коррозионного разрушения можно только при мик-
роскопическом обследовании. Подповерхностная корро-
зия часто вызывает вспучивание и расслоение ме-
талла.
Наиболее опасные виды местной коррозии — это меж-
кристаллитная коррозия, которая, не разрушая зерен
металла, продвигается вглубь по их менее стойким гра-
ницам, и транскристаллитная, рассекающая металл тре-
щиной прямо через зерна. Эти виды коррозии опасны
тем, что, не изменяя внешнего вида конструкции, они
приводят к быстрой потере металлом прочности и плас-
тичности. Местная коррозия является более опасной, чем
сплошная коррозия, так как может значительно снизить
прочностные свойства стенки аппарата (трубопровода,
резервуара) и даже разрушить их.
3. Специфический характер носит избирательная кор-
розия, которой подвержены сплавы, содержащие несколь-
ко структурных составляющих, и сплавы типа твердых
растворов. В первом случае коррозия называется струк-
турно-избирательной, а во втором — компонентно-изби-
рательной. Пример структурно-избирательной корро-
зии — графитизация серого чугуна под действием олеума,
когда вследствие растворения ферритных и перлитных
составляющих образуется относительно мягкая масса
графитного скелета без изменения формы. Пример ком-
понентно-избирательной коррозии — процесс обесцинко-
вания латуни, приводящий к обеднению сплава цинком
и образованию на поверхности губчатого медного осадка.
Среди видов коррозии, различающихся по характеру
дополнительных воздействий, можно выделить:
73
1. Коррозию под действием напряжений — коррозию
металла, развивающуюся в зойе действия механических
напряжений.
2. Коррозию при трении (коррозионная эрозия) — раз-
рушение металла при одновременном воздействии кор-
розионной среды и сил трения.
3. Кавитационную коррозию — разрушение металла
под одновременным коррозионным и ударным воздейст-
вием агрессивной среды (коррозия лопастей гребных
винтов).
Глава IX
ХИМИЧЕСКАЯ КОРРОЗИЯ
Химическая коррозия — процесс разрушения метал-
лов под действием внешней среды, не сопровождаемый
образованием электрического тока. К химической корро-
зии относятся:
а) коррозия в жидкостях-неэлектролитах (например,
в безводных органических растворителях, в расплавлен-
ной сере и т. п.);
б) газовая коррозия — коррозия при контакте метал-
ла с сухими газами при высоких температурах (напри-
мер, коррозия двигателей внутреннего сгорания, мате-
риалов камер сгорания, реактивных сопл под действием
газовых продуктов горения топлива).
1. Коррозия металлов в жидкостях-неэлектролитах
К жидкостям-неэлектролитам, т. е. к неэлектропро-
водным жидким средам, относятся жидкости органиче-
ского происхождения — спирты, бензол, фенол, хлоро-
форм, тетрахлорид углерода, нефть, керосин, бензин и
т. д., а также ряд жидкостей неорганического происхож-
дения — расплавленная сера, жидкий бром и др. В чис-
том виде органические растворители и входящие в состав
нефти и жидких топлив углеводороды не реагируют с
металлами, но в присутствии даже незначительного
количества примесей процессы взаимодействия резко ин-
тенсифицируются. Ускоряют коррозионные процессы со-
держащиеся в нефти серусодержащие соединения (серо-
водород, меркаптаны, а также элементарная сера). По-
74
добное действие оказывают на металлы серусодержащие
соединения, растворенные в фенолах.
Повышение температуры среды, наличие растворен-
ного в жидкости кислорода приводят к усилению процес-
са коррозии. Присутствие в жидких неэлектролитах вла-
ги обеспечивает интенсивное протекание процесса кор-
розии по электрохимическому механизму. Например, при
содержании в тетрахлориде углерода следов воды ско-
рость коррозии резко возрастает
СС14 + Н2О -> СС13ОН + НС1
что связано с образованием агрессивных продуктов при
гидролизе.
Жидкий бром уже при обычных температурах энер-
гично реагирует с металлами, вызывая их коррозию. Он
заметно разрушает алюминий, углеродистые стали, ти-
тан, в меньшей степени — никель й незначительно — же-
лезо. Наиболее устойчивы к брому серебро, платина, сви-
нец, тантал. Сера в расплавленном состоянии реагирует
практически со всеми металлами, заметно разрушая оло-
во, свинец, медь, меньше — углеродистые стали и титан
и незначительно — алюминий.
Защиту металлических конструкций, работающих в
среде жидкостей-неэлектролитов, ведут либо подбором
устойчивых в данной среде металлических конструкци-
онных материалов (например, применение высокохроми-
стых сталей для оформления процессов каталитического
и термического крекинга нефти), либо нанесением спе-
циальных защитных покрытий (в частности, покрытия
алюминием для работы в среде неэлектролитов, содер-
жащих соединения серы).
2. Газовая коррозия
Газовая коррозия — наиболее распространенный в
практических условиях вид химической коррозии. Это
процесс разрушения металлов и сплавов в результате
химического взаимодействия с газами при высоких тем-
пературах. Газовая коррозия наблюдается при работе
металлических конструкций, контактных и других аппа-
ратов, арматуры обжиговых и нагревательных печей, де-
талей двигателей внутреннего сгорания, при термической
обработке, горячей прокатке, ковке и др. Причина газо-
вой коррозии металлов — их термодинамическая неустой-
75
чивость в данной газовой среде при определенных внеш-
них условиях (температуре и давлении).
Самый распространенный случай газовой коррозии —
это процесс взаимодействия металла с кислородом, по-
этому рассмотрим основные закономерности этого ва-
рианта на примере реакции:
Me J- I/2O2 МеО
Направление химической реакции окисления метал-
лов определяется парциальным давлением кислорода в
газовой смеси (роа) и давлением диссоциации паров ок-
сида при данной температуре (рмео). Рассмотрим воз-
можные пути протекания этой химической реакции:
а) роа —рмео, т. е. парциальное давление кислорода
Роа и давление диссоциации оксида рмео равны; реакция
находится в равновесии;
б) ро, >РмеО, реакция сдвинута в сторону образова-
ния оксида;
в) РО2 <рмео, реакция протекает в обратном направ-
лении; оксид будет диссоциировать на чистый металл и
кислород.
Если процесс окисления происходит на воздухе, то
/?оа можно считать постоянной (при атмосферном давле-
нии роа~0,02 МН/м2). Таким образом, зная давление
диссоциации оксида металла и парциальное давление
кислорода в газовой смеси, можно определить темпера-
турные границы термодинамической вероятности данно-
го процесса.
Скорость процесса газовой коррозии зависит от ряда
факторов: природы металла (состава сплава), характера
газовой среды, температуры среды, от свойств образую-
щихся продуктов коррозии, времени контакта газовой
среды с объектом воздействия.
От свойств и характера образовавшейся на поверх-
ности металла оксидной пленки (пленки из продуктов
коррозии) зависит процесс коррозии. Механизм образо-
вания подобной пленки можно представить следующим
образом:
1. Адсорбция молекул кислорода поверхностью метал-
ла, соприкасающейся с атмосферой.
2. Химическое взаимодействие металла и газа с обра-
зованием химического соединения.
В результате такого взаимодействия образуется сна-
чала мономолекулярный, а затем полимолекулярный
76
слой оксидов. В дальнейшем атомы кислорода диффун-
дируют через образовавшийся слой оксида, одновремен-
но с этим в противоположном направлении в него диф-
фундируют ионы металла. Реагируя с кислородом, ионы
металла образуют оксид, что приводит к появлению но-
вых слоев пленки, т. е. к ее утолщению. По мере утол-
щения пленки процесс диффузии будет затрудняться.
Возникающая пленка будет тормозить дальнейшее раз-
витие коррозионного процесса только в том случае, когда
она будет обладать защитными свойствами. В связи с
этим важно знать свойства образующихся пленок, меха-
низм и законы их роста, отношение пленок к влиянию
различных внешних факторов (температуре, pH среды,
давлению и др.). Толщина образовавшихся пленок обус-
ловливается видом металла, параметрами среды и рядом
других факторов. Различают три группы пленок, обра-
зующихся на металле, в зависимости от их толщины:
1) тонкие (невидимые), толщина которых менее
400 А;
2) средние (дающие цвета побежалости), толщина
которых от 400 до 5 000 А;
3) толстые (видимые), толщина их более 5 000 А.
Чтобы оксидная пленка обладала защитными свойст-
вами, она должна удовлетворять следующим требова-
ниям: быть сплошной, беспористой;' иметь хорошее сцеп-
ление е металлом; иметь коэффициент термического рас-
ширения, близкий к величине этой характеристики для
металла; быть химически инертной по отношению к дан-
ной- агрессивной среде; обладать твердостью и износо-
стойкостью. Если образующаяся оксидная пленка пори-
стая, рыхлая и обладает плохим сцеплением с металлом,
то даже при условии ее инертности к данной агрессивной
среде она не будет выполнять роль защитной.
Основным требованием к образующейся оксидной
пленке является условие сплошности, которое определя-
ется соотношением между объемом образованного окси-
да (Е’мео) и окисляемого металла (Еме) и формулиру-
ется так: молекулярный объем оксидной пленки должен
быть больше атомного объема металла. В этом случае
можно ожидать образования сплошных пленок. Соотно-
шение объемов оксида и металла, на котором образуется
пленка, легко подсчитать. Объем 1 г-атома металла ра-
вен: Е’ме= А/^ме, где А — атомная масса металла; с?ме—
плотность металла.
77
Объем грамм-молекулы полученного оксида равен:
^MeO=Af/nZ), где М— молекулярная масса оксида; п —
число атомов металла в оксиде; D — плотность оксида.
В том случае, когда объем пленки меньше, чем объем
металла, израсходованного на ее образование, т. е.
^МеО
——= ---------< 1, образующаяся пленка не сплошная.
име nDA
Такие пленки не обладают защитными свойствами, по-
этому металл подвергается дальнейшей коррозии. Если
> 1, то в этом случае пленка сплошная и может
обладать защитными свойствами.
Выполнение условий сплошности пленки всегда яв-
ляется необходимым, но в ряде случаев недостаточным
условием. В реальных условиях у пленок с Емео/УмеЗ>1
может и не быть высоких защитных свойств, как, напри-
мер, у МоО3 или WO3. Поэтому ориентировочно считают,
что если соблюдается условие 1,0< Емео/Еме<2,5—
пленка сплошная, защитная; а при Емео/Еме>2,5 плен-
ка может быть незащитной, так как в процессе роста ее
могут возникать напряжения, разрушающие пленку, на-
рушающие ее сплошность. Могут быть и другие причины
разрушения образовавшейся пленки: недостаточная пла-
стичность пленки, летучесть образовавшегося оксида, из-
менение кристаллической структуры пленки. Данная за-
кономерность может быть применима и к другим видам
пленок из продуктов коррозии на поверхности металла.
Законы роста оксидных пленок на поверхности метал-
лов. Процессы газовой коррозии — это многостадийные
гетерогенные процессы, протекающие на границе раздела
фаз металл — газовая среда. В процессе взаимодействия
металла, с газообразными веществами, который сопро-
вождается образованием пористой оксидной пленки на
поверхности металла, можно выделить следующие после-
довательно протекающие стадии:
а) транспортировка газообразных веществ к поверх-
ности раздела фаз;
б) адсорбция газа на поверхности металла;
в) химическое взаимодействие;
г) отвод (десорбция, возгонка) продуктов коррозии
из зоны взаимодействия (в некоторых случаях).
При образовании незащитной пленки (пористой) наи-
более медленной (лимитирующей) стадией процесса
78
является химическое взаимодействие (рис. 39). Скорость
роста пленки для этого случая будет величиной постоян-
ной— толщина пленки пропорциональна времени окис-
dy
ления: —- = k, где у — толщина пленки; т — время
dt
окисления металла, k—константа скорости химической
реакции.
Интегрируя данное уравнение, получим, что толщина
пленки прямо пропорциональна времени: £/=/jT+const.
В большинстве случаев значение const мало или равно
нулю, т. е. y=kx. Указанный линейный закон роста ок-
Рис. 39. Схема процесса об-
разования пористой- оксид-
ной пленки на поверхности
металла
Рис. 40. Коррозия магния
в атмосфере кислорода при
различных температурах
сидных пленок наблюдается при окислении щелочных и
щелочноземельных металлов (рис. 40).
При образовании на поверхности металла защитной
(сплошной, непористой) пленки схему процесса (рис. 41)
можно разбить на следующие отдельные стадии:
а) переход металла в форме ионов и электронов из
металлической фазы в оксид:
Me (тв) Ме"+ + пе~
б) перемещение ионов металла и электронов в слое
оксида;
в) транспортировка кислорода к поверхности раздела
оксидная пленка — газ;
г) адсорбция кислорода на поверхности оксидной
пленки;
д) ионизация адсорбированного кислорода;
е) перемещение ионов кислорода в слое оксида;
79
ж) химическое взаимодействие с образованием ок-
сида.
В зависимости от внешних условий, толщины и каче-
ства образующейся оксидной пленки скорость процесса
определяется скоростью одной нз этих стадий. При обыч-
ных температурах реакция окисления протекает по за-
конам химической кинетики. С увеличением температуры
скорость химической реакции быстро увеличивается, а
диффузии возрастает очень медленно, в результате чего
при высоких температурах скорость коррозии начинает
подчиняться законам диффузии. Диффузионный харак-
Рис. 41. Схема процесса об-
разования защитной пленки
на поверхности металла
Рис. 42. Окисление меди на
воздухе при 800° С
тер процесса проявляется тем резче, чем толще пленка
и чем .она качественнее.
Следовательно, чем выше защитные свойства пленки,
тем меньше скорость ее роста. Поэтому скорость роста
пленки обратно пропорциональна толщине ее, т. е.
dy____k_
dx у
Интегрируя данное уравнение, получим параболиче-
скую зависимость
1/2 = + const или >Z/2 — kT + const.
Из уравнения Следует, что скорость роста пленки в
этом случае лимитируется только стадией диффузии и
пропорциональна ] т, т. е. скорость коррозии умень-
шается во времени (рис. 42).
Иногда рост пленок идет с сильным затуханием, не
соответствующим зависимости у = 1\х. Этим процессам
80
соответствует логарифмический закон роста пленки:
у\ = k IgT 4- const.
Такая зависимость наблюдается, например, для окисле-
ния меди при температурах ниже 100° С, тантала до
150° С, алюминия, никеля, цинка до 300° С. Но окисление
многих металлов (Fe, Al, Ti, Си, Mg, Zn, Та, Мо и др.)
в зависимости от внешних условий (температуры, состава
газа, времени контакта) происходит по разным законам).
Влияние температуры и состава среды на скорость
газовой коррозии. С повышением температуры скорость
газовой коррозии практически во всех случаях повыша-
ется (табл. 8).
Таблица 8
Скорость газовой коррозии металлов в некоторых средах,
г/м2-сут (по Гатфильду)
Металл * Ч Атмосфера, °C
о2 Н2О (пар) со2 SO2
700 000 700 900 700 900 700 900
Fe 511 1243 622 575 587 1133 354 5000
Сг 4,7 22,0 0,5 12,0 2,7 13,0 1,6 32,0
Ni 9,6 28,0 0,3 14,0 3,9 36,0 923 837
Со 37,0 931,0 8,0 259 27,0 443 598 1633
Си 120 439 33,0 153 65,0 123 1.3 2,0
W 412 3762 21,0 1792 139,0 139 470 290
Зависимость скорости коррозии от температуры выра-
жается уравнением
Приведенное соотношение может быть осложнено или
нарушено, если с изменением температуры изменяется
структура или свойства металла или образующейся на
нем пленки.
Рассмотрим некоторые наиболее частные случаи га-
зовой коррозии.
Газовая коррозия железа, стали, чугуна и других ме-
таллов и сплавов. Среди других примеров газовой кор-
81
розни представляет интерес окисление железа, железо-
углеродистой стали и чугуна. При нагревании выше
600° С железо и углеродистая сталь покрываются плен-
кой — окалиной, имеющей сложное строение. Толщина
слоя различных оксидов зависит от температуры, време-
ни коррозии и состава газовой среды. Наиболее близкий
к железу слой оксида железа (II) обладает лучшими за-
щитными свойствами. Остальные слои имеют поры и тре-
щины и легко отслаиваются. В стали наряду с окислени-
ем железа происходит взаимодействие карбида железа
с кислородом воздуха и кислородсодержащими вещест-
вами:
Fe3C 4- О2 3Fe 4- СО2
Fe3C 4- CO2^±3Fe 4-2СО
Fe3C 4- H2O 3Fe 4- CO 4- H2
В результате поверхностный слой обедняется углеро-
дом, что приводит к изменению структуры сплава и
ухудшает его механические и антикоррозионные свойст-
ва. Содержание примесей марганца, серы, фосфора не
•оказывает заметного влияния на коррозию стадуи
Сталь и чугун обезуглероживаются также в среде
водорода с образованием метана:
Fe3C 4- 2Н2 3Fe 4- CH,
Этот вид газовой коррозии, называемый водородной,
наблюдается при взаимодействии водорода с железоуг-
леродистыми сплавами при высоких температурах и дав-
лениях, например в колоннах синтеза аммиака (процесс
синтеза аммиака ведут при 450—550° С и давлении 25—
100 МН/м2). Для предупреждения обезуглероживания
стали при высоких температурах применяют легирован-
ные стали. В качестве легирующих добавок вводят эле-
менты, способные образовывать карбиды, более стойкие
по отношению к водороду, чем цементит Fe3C.
Карбонильная коррозия — процесс разрушения ме-
таллов при взаимодействии их с оксидом углерода (II),
который при высоких давлениях и температурах, как, на-
пример, в процессах получения синтетических спиртов
(метилового, бутилового и др.), может образовывать с
@2
металлами легко возгоняющиеся карбонилы:
Me + nCO^t Me (CO)„
Для железа реакция идет с образованием яентакар-
бонила железа:
Fe 4- 5 (СО) Fe (СО)5
Пентакарбонил железа Fe(CO)s— жидкость, кипя-
щая при 102° С, пары ее полностью диссоциируют на Fe
и СО при давлении 0,1 МН/м2 и температуре выше 140° С.
При карбонильной коррозии происходит разрушение
поверхностного слоя металла и разрыхление его на глу-
• бину до 5 мм. В качестве предупредительных мер в со-
став стали вводят легирующие добавки. Однако необхо-
димо заметить, что никель при взаимодействии с оксидом
углерода (II) образует легкокипящий тетракарбонил ни-
келя Ni (СО) 4-
Не подвержены карбонильной коррозии хромистые
Рис. 43. Зависимость скорости
коррозии металлов от температу-
ры в атмосфере сухого хлора:
/ — алюминий; 2— серый чугун; 3—
медь; 4— сталь углеродистая; 5 —же-
лезо Армко; 6 — сталь 10XI8H10T; 7 —
никель
стали с содержанием 30%
Сг, хромоникелевые стали
(23% Сг и 20% Ni) и
марганцовистые бронзы
при температуре до 700° С
и давлении до 35 МН/м2.
Коррозии под действи-
ем хлора и хлороводорода
подвержены практически
все металлы и сплавы.
Образующиеся в резуль-
тате такого взаимодейст-
вия хлориды металлов ти-
па МеСЬ или МеС13 пла-
вятся или разлагаются
при повышении темпера-
• туры. Реакция взаимодействия Me+CU^MeCIs носит
экзотермический характер, и поскольку при этом ско-
рость отвода теплоты может быть ниже скорости реак-
ции, то металлы в токе хлора горят, вот почему этот вид
коррозии принципиально отличается от воздействия дру-
гих газовых сред (рис. 43).
Наиболее стойкие по отношению к хлору и хлорово-
дороду никель, хромоникелевые стали, свинец. Объясня-
ется это тем, что взаимодействие этих металлов с хлором
не сопровождается экзотермическим эффектом и обра-
зующиеся пленки обладают защитными свойствами.
83
Глава X
ЭЛЕКТРОХИМИЧЕСКАЯ КОРРОЗИЯ
4
1. Механизм электрохимической коррозии
Чтобы протекала электрохимическая коррозия, необ-
ходим контакт металла с раствором электролита. В вод-
ной среде механизм процесса электрохимической корро-
зии подобен процессу, происходящему в элементе батареи
для карманного фонаря. Такой элемент (рис. 44) состоит
цинк корродирует
Рис. 44. Принци-
пиальная схема су-
хого элемента:
из двух электродов: угольного — като-
да и цинкового — анода, разделенных
электролитом. Электрическая энергия
образуется за счет химических реак-
ций, протекающих на каждом электро-
де. На катоде — химическое восстанов-
ление, а на аноде — окисление, при
этом цинк превращается в ионы Zn2+.
Чтобы такие процессы протекали и
гальванический элемент начал рабо-
тать, необходимо замкнуть цепь. Одна-
ко растворение цинка возможно и в
разомкнутой цепи, в этом случае роль
катода выполняют мельчайшие приме-
си, находящиеся в цинке. Такие эле-
1 — угольная пласти-
на; 2 — цинк; 3 — рас-
твор электролита
менты называют микрокоррозионными.
Они играют основную роль в процессе
электрохимической коррозии.
Поверхность любого металла состоит из микроэлек-
тродов, короткозамкнутых через сам металл. Микрокор-
розионные элементы начинают функционировать при кон-
такте металла с электролитом, что приводит со временем
к коррозионному разрушению металла. Таким образом,
коррозионный процесс возникает и протекает-в резуль-
тате работы множества короткозамкнутых гальваниче-
ских микроэлементов. Причины образования микропар
самые разнообразные: неоднородность металлической
фазы, жидкой фазы и физических условий. Среди причин,
вызывающих неоднородность металлической фазы, сле-
дует отметить неоднородность самого металла, состава
защитных пленок на металле и внутренних напряжений
в металле.
Во время работы микрогальванического элемента од-
новременно протекают два электродных процесса:
84
1. Анодный — процесс перехода ионов металла в рас-
твор с оставлением соответствующего количества элек-
тронов на поверхности металла:
Ме+е- + пН2О^± Ме+пН2О + е~
Примерами таких процессов могут
окисления:
Zn^:Zn2+ +2е-
служить реакции
Al тГ АР+ + Зе—
Fe2+ Fe3+ + е~
2. Катодный процесс —
ассимиляция избыточных
электронов атомами или мо-
лекулами электролита •(де-
поляризаторами), которые
при этом восстанавливают-
ся. Примерами катодных
процессов являются реак-
ции восстановления:
Н+^±1/2Н2 —е-
Сц2+ Си — 2е—
Fe3+Fe2+— е—
Рис. 45. Принципиальная
схема электрохимическо-
го коррозионного процес-
са:
D — катодный деполяризатор
Оба указанных процесса протекают сопряженно и за-
медление одного из них приводит к торможению другого.
Как видно из приведенных примеров реакций, разруше-
ние (коррозия) металлов обычно происходит на аноде.
Принципиальная схема электрохимического разрушения
металла приведена на рис. 45.
2. Электродные потенциалы
При погружении металла в раствор электролита меж-
ду поверхностью металла и электролитом возникает оп-
ределенная разность потенциалов, что связано с образо-
ванием двойного электрического слоя, т. е. несимметрич-
ного распределения заряженных частиц у границ раздела
фаз. Рассмотрит явление на границе раздела фаз ме-
талл— электролит (рис. 46). В случае, если энергия
гидратации ионов достаточна для разрыва связи между
ион-атомами металла и электронами и ион-атомы пере-
85
ходят в раствор, на Поверхности металла остается экви-
валентное число электронов, которые сообщают поверх-
ности металла отрицательный заряд. В дальнейшем эти
отрицательные заряды притягивают катионы металла из
раствора. В результате на границе раздела металл —
электролит возникает двойной электрический слой, что
и вызывает появление некоторой разницы потенциалов
между металлом и раствором электролита (рис. 46, а).
Возможен и другой вари-
ант формирования двойного
электрического слоя на гра-
нице раздела металл — эле-
ктролит. В этом случае (рис.
46, б) на поверхности метал-
ла могут разряжаться кати-
оны из раствора электроли-
та (энергия связи в кристал-
лической решетке больше
энергии гидратации). В ре-
зультате поверхность метал-
ла приобретает положитель-
ный заряд, который образу-
раствора.
mH,0
Ф металл
электролит
электролит
б
a
Рис. 46. Схема образования
двойного электрического слоя:
а — при переходе иона атома ме-
талла в раствор; б — при переходе
катиона из раствора иа металл
Рис. Водородный
электрод сравнения
ет двойной слой с анионами
Величины электродных потенциалов оказывают боль-
шое влияние на характер коррозионного процесса, т. е.
необходимо знать значения этих потенциалов и действи-
тельную разность потенциалов между металлом и рас-
твором электролита. В настоящее время нет эксперимен-
тальных способов измерения и теоретических методов
расчета абсолютных значений
электродных потенциалов, поэто-
му измеряют относительные зна-
чения потенциалов, используя для
этого так называемые электроды
сравнения. За основной электрод
сравнения принят стандартный
водородный электрод (рис. 47),
представляющий собой электрод
из платинированной (черненой)
платины 1, погруженный в раст-
вор кислоты 2 с активностью ио-
нов Н+, равной 1 г-ион/л.
Через раствор продувается’во-
дород под давлением, пузырьки
86
которого адсорбируются на платине и образуют специ-
фичную «водородную» пластинку, которая аналогично
металлам обменивает с раствором положительные ионы.
За величину стандартного электродного потенциала при-
нимают э.д.с., возникающую в цепи «водородный элект-
род»— металл, погруженный в раствор своей соли с ак-
тивностью одноименных ионов, равной единице. Так оп-
ределяют значения стандартных электродных потенциа-
лов металлов, находящихся в равновесии с собственными
ионами (равновесные, или обратимые, потенциалы)
(табл. 9).
Таблица 9
Стандартные электродные потенциалы некоторых металлов
в водных растворах при 25° С
Электродный процесс Потенциал, В Электродный процесс Потенциал, В
Li^Li++e~ —3,05 1п^1п3 + +3е~ —0,342
к^к+ —2,93 TWT1 + +е- —0,336
Сач^Са2 г +2е~ —2,87 Соз=±Со2+ 4-2е— -0,277
Na=i±Na + +е— —2,71 Ni^Ni2+ +2е~ —0,250
Mg^Mg2 + +2е~ -2,37 Mo=i±Mo3+ 4-Зе— —0,200
Веч±Ве2 + +2е~ — 1,85 Sn=^Sn2+ +2е- -0,136
U,-U3+ 4-Зе- — 1,80 РЬ=^РЬ2 + +2е- —0,126
HfeHf4+ +4е- — 1,70 Fe=^Fe3+ +3е~ —0,036
А1ч±А13 + +3е- -1,66 И2^±2Н+ +2е- —0,000
Ti^Ti2 + +2е- —1,63 Cu^Cu2+ +2е~ +0,337
Zr^Zr4 + +4е- —1,53 Cu^Cu+ -f-e~ +0,521
Мп^Мп2 + +2е- -1,18 2Hg^Hg22 + +2e- +0,789
Nb^Nb3+ +3е- —1,10 Hg^Hg2 + +2е- +0,854
Zns^Zn2 + +2е~~ —0,763 Pd^Pd2+ +2е- +0,987
Сг^Сг3+ +3е~ —0,74 Ag^Ag+ +е- +0,899
Ga^Ga’-f +3е~ —0,53 Pt=-:Pt2+ 4-2е- + 1,200
Fe^Fe2 + +2е~ —0,440 Au5=*Au3+ +3е— + 1,50
Cd^Cd2+ +2е~ —0,403 Аизз: Аи + +е~ +1,68
Равновесный электродный потенциал зависит от природы
металла и растворителя, температуры электролита, ак-
тивности ионов металла. Значение такого потенциала
можно рассчитать по уравнению Нернста: *
RT
Е = Е° + ——- In а „ п,
nF Мея+
где Е° — стандартный потенциал металла, В; R — моляр-
ная газовая постоянная; Т — абсолютная температу-
87
ра, К; ti— степень окисления иона металла; F — посто-
янная Фарадея; аме"+ —активность ионов металла
в г-ион/л.
Подставив в приведенное уравнение значения всех
констант при 25°С (/? = 8,314 Дж (град-моль), Т=
=298,2 К и F=96 500) и перейдя от натуральных лога-
рифмов к десятичным, получим
0,059
Е = £0,4-----1g а . .
П Ме+
Электродные потенциалы металлов, у которых в про-
цессе обмена участвуют не только собственные, но и
другие ионы и атомы, называются неравновесными или
необратимыми. В практических условиях при коррозии
металлов устанавливаются неравновесные электродные
потенциалы и уравнение Нернста в этом случае неприме-
нимо, поэтому значения неравновесных потенциалов оп-
ределяются экспериментально.
3. Поляризация, деполяризация
Некоторые металлы, например магний, алюминий, с
термодинамической точки зрения коррозионно-нестойки,
но на практике в определенных условиях они корроди-
руют медленно и могут применяться в качестве конструк-
ционных материалов. Чтобы правильно оценивать влия-
ние различных факторов на скорость коррозии, необхо-
димо иметь данные о равновесном состоянии системы и
учитывать то, что при протекании тока через электрод
равновесное состояние его нарушается. Протекание элек-
трического тока при работе коррозионного микроэлемен-
та обусловлено начальной разностью потенциалов ка-
тода и анода, потенциал этого электрода изменяется в
зависимости от величины и направления внешнего тока.
В момент замыкания микрогальванической цепи зна-
чение коррозионного тока по закону Ома равно:
/иач - R ,
где Ек° и Еа°—начальные потенциалы анода и катода
(до замыкания цепи); 7? — омическое сопротивление си-
стемы.
88
Величина коррозионного тока после замыкания цепи
быстро падает и через определенное время становится
постоянной. Так как величина омического сопротивления
в этом случае мала и постоянна, то уменьшение силы кор-
розионного тока можно объяснить только смешением на-
чальных значении потенциалов, т. е. уменьшением их
разности (рис. 48). Такое изменение потенциалов в ре-
зультате протекания тока называется поляризацией, а
вещества, уменьшающие поляризацию, называются депо-
ляризаторами. Уменьшение поля-
ризуемости электродов называет-
ся деполяризацией.
Чтобы изучить скорость и ха-
рактер электродных процессов,
измеряют потенциал электрода в
зависимости от плотности про-
ходящего через него тока, полу-
чая при этом анодные или катод- ' время
ные поляризационные кривые.
Графики такой функциональной
связи широко используют при
изучении процессов электрохими-
ческой коррозии.
Анодная поляризация. В зави-
симости от причин, вызывающих
анодную поляризацию, различа-
ют три основных случая. Концен-
трационная поляризация. Этот
Рис. 48. Зависимость из-
менения разности потен-
циалов элемента после
замыкания гальваниче-
ской пары:
£к°. Ек — потенциал катода
до и после замыкания; £а°,
ЕЛ — потенциал а иода до и
после замыкания; UDt U —
разность потенциалов до и
после замыкания
вид анодной поляризации вызывается небольшой скоро-
стью диффузии ионов металла в растворе электролита,
из-за чего образуется повышенная концентрация ионов
в прианодной зоне.
Перенапряжение ионизации металла. Если при про-
текании анодного процесса
. Ме+е' 4- Ме+ + лН2О + е~
выход ионов металла в раствор не поспевает за отводом
электронов, потенциал металла сдвигается в положи-
тельную - сторону.
Анодная пассивность, которая заключается в образова-
нии пассивных пленок на поверхности металла. Анодный
процесс из-за наступления явления анодной пассивности
резко тормозится. Этим можно объяснить достаточно
высокую коррозионную стойкость алюминия и нержа-
89
веющих сталей в растворах азотной кислоты и в аэриро-
ванных растворах солей. Защитные фазовые пленки на
аноде могут образовываться как результат отложения на’
поверхности металла труднорастворимых соединений это-
го металла.
Катодная поляризация. Эта поляризация обусловли-
вается перенапряжением катодной реакции, т. е. замед-
ленностью процесса D+ne~^Dner\ концентрационной
поляризацией, т. е. недостаточной скоростью подвода или
отвода начальных либо конечных продуктов реакции на
катоде. Возможны следующие основные виды катодной
деполяризации:
а) деполяризация нонами;
б) разряд катионов (ионов водорода или благород-
ных металлов):
Н+ +е-^-Н-> 1/2Н2
Ag+ + е~ -> Ag
в) восстановление нейтральных молекул:
О2 + 4е- +'2Н2О -> 4ОН-
С12 +2е-->2С1-
4. Коррозия металлов
с водородной деполяризацией
Наиболее частые случаи коррозии в практике — это
процессы, протекающие в растворах неокислительных
кислот с выделением водорода — водородная деполяри-
зация, или в нейтральных растворах солей. Иногда оба
этих процесса могут протекать параллельно.
Водородная деполяризация термодинамически воз-
можна в тех случаях, когда равновесный потенциал ме-
талла отрицательнее водородного в данных условиях.
В нейтральном растворе с pH 7, Z=25°C и =1,013Х
ХЮ5 Н/м2 (1 атм). равновесный потенциал водородного
электрода легко подсчитать по формуле Нернста:
Е = £0 + 2,3 1g - = 0 + 0,059 1gан+ = 0,059 (-7) =
= — 0,414 В.
Процесс разряда ионов водорода на катоде представ-
ляют в виде схемы, состоящей из нескольких стадий: ,
SO
1. Диффузия и миграция гидратированных ионов во-
юрода к катоду:
Н+-Н2О = (Н3О)+
2. Дегидратация ионов водорода:
(Н3О)+Н+4-Н2О
3. Вхождение иона водорода в состав двойного слоя.
4. Разряд иона водорода:
Н+ + е-^надс
5. Рекомбинация атомов водорода в молекулу:
Нале + Надс = Н2
6. Образование и отрыв пузырьков из молекул водо-
рода от поверхности катода.
5. Коррозия металлов
с кислородной деполяризацией
Если для протекания коррозионного процесса с водо-
родной деполяризацией нет условий или при наличии в
растворе кислорода, основную роль в качестве деполя-
ризующей реакции играет процесс восстановления (иони-
! циц) кислорода на катоде, т. е. процесс кислородной
г.еполяризации.
Термодинамическую возможность процесса кислород-
ной деполяризации можно также рассчитать по формуле
Нернста, так как процесс возможен только в тех случаях,
когда равновесный потенциал металла отрицательнее
равновесного потенциала кислородного электрода в дан-
ных условиях.
Процесс кислородной деполяризации протекает в не-
сколько стадий, как любая электрохимическая гетеро-
генная реакция.
Для кислых растворов процесс кислородной деполя-
ризации можно представить в виде реакции
О2 4- 4Н+ + 4е~'->'2Н2О
Для нейтральных и щелочных сред суммарная реак-
ция кислородной деполяризации описывается следую-
щим образом:
О2 4- 2HjO 4- 4е- -<4ОН-
ei
С кислородной деполяризацией протекают следующие
виды электрохимической коррозии: атмосферная, в воде
(пресной, морской), в нейтральных растворах солей, в
аэрированных растворах слабых органических кислот;
грунтовая (почвенная), в расплавах солей и др.
Анодная и катодная реакции металла классифици-
руются как первичные процессы коррозии, а продукты
коррозии называются первичными продуктами коррозии.
В процессе электрохимической коррозии возможно
протекание вторичных процессов: взаимодействие первич-
ных продуктов коррозии друг с другом, с электролитом,
с растворимыми в нем газами с образованием вто-
ричных продуктов коррозии. Наибольший интерес пред-
ставляет образование пленок труднорастворимых соеди-
нений (например, гидроксидов, фосфатов и др.). В общем
случае слаборастворимые вторичные продукты коррози!
затрудняют доступ электролита к поверхности металла
и тем самым снижают скорость электрохимической кор-
розии.
6. Влияние внутренних и внешних факторов
на скорость коррозии
К внутренним факторам, определяющим скорость и
характер электрохимической коррозии, относятся состо-
яние поверхности, химический состав и структура метал-
ла и т. д. Неоднородность поверхности металла является
одной из причин местной коррозии. Тщательная, тонкая
обработка поверхности (шлифовка, полировка) повыша-
ет коррозионную стойкость металлов, способствуя обра-
зованию более однородной сплошной оксидной пленк
на поверхности металла. При грубой обработке исти
ная поверхность контакта металла с агрессивной средо». г
увеличивается, что усиливает коррозию.
Внешние факторы, влияющие на скорость коррозии
металлов, определяются природой и свойствами корро-
зионной среды и ее параметрами (температура, давле-
ние, скорость движения раствора электролита и т. д.) .
Влияние pH среды.- Концентрация ионов водорода т;
растворе электролита определяет скорость электрохи-
мической коррозии металлов. Для благородных метал-
лов (серебра, золота, платины) характерна высокая кор-
розионная стойкость в кислых, нейтральных и щелочньп
средах, т. е. скорость коррозии для этих металлов не за
92
висит от pH среды (рис. 49,а). К металлам малостой-
ким в кислых средах относятся железо, магний, медь,
марганец (рис. 49,6). При невысоких значениях pH ско-
рость их разрушения велика: легко выделяется водород,
продукты, образующиеся в результате коррозии, раство-
римы. При pH от 4,0 до 8,5 скорость коррозии этих ме-
таллов не зависит от pH, так как в этих условиях не ме-
няется растворимость кислорода, основного катодного
деполяризатора. В щелочных средах (рН>10), если
Рис. 49. Зависимость скорости коррозии металлов от pH
среды
рассматривать зависимость k=f (pH) для железа, про-
исходит образование нерастворимых гидроксидов, и ско-
рость' коррозии резко падает. При очень высоких кон-
центрациях гидроксид-ионов (рН>14) образуются раст-
воримые ферриты и гипоферриты железа, скорость кор-
розии при этом возрастает.
Цинк, алюминий, олово, свинец устойчивы в нейтраль-
ных средах, но разрушаются в щелочных и кислых сре-
дах (рис. 49, в). Неустойчивость этих металлов в кислых
и щелочных средах объясняется их амфотерностью, т. е.
растворимостью оксидов этих металлов в кислотах и ще-
лочах. К металлам, устойчивым в кислых, но нестойким
в щелочных средах, относятся молибден, тантал, воль-
фрам (рис. 49,г). К металлам, малостойким в кислых
средах, но устойчивым в щелочных, относятся никель,
кадмий (рис. 49,6). Для каждого металла имеется опре-
93
деленное значение pH раствора электролита, при кото-
ром скорость коррозии минимальна, например, для алю-
миния— 7,0; свинца — 8,0; олова — 9,0; цинка—10,0;
железа — 14,0.
Влияние температуры на скорость коррозии. Измене-
ние температуры внешней среды значительно влияет на
скорость коррозии, так как увеличивается скорость диф-
фузии, растворимость продуктов коррозии, величина пе-
ренапряжения на электродах. При повышении темпера-
туры среды скорость электрохимической коррозии, как
Рис. 50. Зависимость коррозии
углеродистой стали от тсмпера-
правило, возрастает (рис.
50, а). В этом случае за-
висимость скорости кор-
розии k от температуры
Т К выражается уравне-
нием следующего вида:
k = Ае RT ,
где А — константа; е —
туры основание натуральных
логарифмов;. Q — величи-
на энергии активации; R — молярная газовая постоянная.
После логарифмирования уравнение носит линейный
характер:
Q
In k = In А —--
RT
Такой вид зависимости справедлив для скорости корро-
зии неблагородных металлов в минеральных кислотах
(рис. 50,6), т. е. в процессах, протекающих с водород-
ной деполяризацией. Возможны исключения из указан-
ного правила, что -связано с появлением защитных
свойств у продуктов коррозии или уменьшением раство-
римости кислорода в электролите с повышением темпе-
ратуры в открытых системах.
Влияние давления на скорость коррозии. Основная
причина влияния давления на скорость электрохимиче-
ской коррозии — изменение растворимости газа, участ-
вующего в этом процессе. Поэтому при увеличении дав-
ления увеличивается скорость коррозионных процессов,
идущих с кислородной деполяризацией, и давление не
влияет на процессы, идущие с водородной деполяризаци-
94
Рис. 51. Обобщенная кри-
вая зависимости скорости
коррозии металла от ско-
рости движения электро-
лита
ей. Повышение давления и температуры увеличивает
скорость коррозии (карбонильная коррозия углеродис-
тых сталей).
Влияние скорости движения электролита на скорость
коррозии. Каждый прибор, аппарат и т. п. работает в ус-
ловиях, когда раствор электролита перемещается пли
перемешивается. При перемещении электролитов, не име-
ющих в своем составе значительных количеств агрессив-
ных ионов, зависимость скорости коррозии от скорости
потока жидкости можно представить кривой (рис. 51) с
тремя характерными участка-
ми: 1 —с увеличением скоро-
сти движения раствора элект-
ролита скорость коррозии уве-
личивается, так как увеличива-
ется скорость диффузии кисло-
рода к поверхности контакта
металл — электролит; 2 — ско-
рость коррозии уменьшается,
так как на поверхности метал-
ла образуется защитная оксид-
ная пленка; 3 — скорость кор-
розии резко возрастает из-за
механического удаления защитной пленки (эрозии) дви-
жущимся потоком электролита.
Скорость движения электролита значительнее влия-
ет на процесс коррозии, протекающий с кислородной де-
поляризацией, чем с водородной. Если при движении
электролита на отдельных участках поверхности метал-
ла чередуется низкое и высокое давление, то наблюдает-
ся усиленное разрушение не только защитных пленок, ио
и металлической поверхности. Это явление называют ка-
витационной эрозией. Такой вид разрушения характерен
для втулок цилиндров дизелей со стороны, охлаждаемой
водой, гребных винтов, лопастей гидравлических турбин.
Разрушения, вызванные кавитационной эрозией, прояв-
ляются в виде трещин, углублений, раковин. Агрессив-
ность среды благоприятствует разрушению металла ка-
витационной эрозией.
Влияние состава нейтральных растворов. С повыше-
нием концентрации раствора скорость коррозии вначале
растет, а затем падает. Такая зависимость является ти-
пичной для процессов коррозии металлов в нейтральных
растворах солей (рис. 52). Поскольку процесс коррозии
95
в этом случае зависит от кислородной деполяризации,
повышение скорости коррозии нельзя объяснить только
влиянием растворенного кислорода, так как раствори-
мость кислорода снижается при повышении концентра-
ции соли в растворе. Наличие восходящей ветви на ука-
занной зависимости связано с увеличением электропро-
водности раствора и соответствующей активизацией
анодного процесса. При повышении концентрации соли
в растворе выше 3% NaCl, дальнейшее понижение раст-
воримости кислорода становится превалирующим факто-
ром, и скорость коррозии снижается.
Концентрация мас.1,%(и?массе)
Рис. 52. Влияние концентрации
нейтрального раствора соли NaCl
на скорость коррозии железа при
18° С
Рис. 53. Влияние приро-
ды аниона солей галоге-
новодородпых кислот иа
скорость коррозии метал-
лов
Растворы солей других щелочных металлов (напри-
мер, КС1, LiCl, Na2SO4, KI, NaBr) влияют .на скорость
коррозии аналогичным образом. Растворы солей щелоч-
ноземельных металлов несколько менее коррозионно-ак- '
тивны, чем соли щелочных металлов.
На процесс коррозии большинства металлов в раст-
ворах солей существенно влияет природа аниона соли
(рис. 53). Растворы этих солей не способствуют образо-
ванию защитной нерастворимой пленки на поверхности
металлов (исключая ионы СГ- для молибдена и ионы F-
для магния). Наиболее агрессивными являются раство-
ры, содержащие фторнд-ионы, и замыкают группу раст-
воры, содержащие нодид-ионы.
Растворы солей, обладающих окислительными свой-
ствами, повышают скорость электрохимической корро-
зии металлов, если эти растворы являются катодными
деполяризаторами (коррозия железа в растворах гипо-
96
хлоритов). Однако, если эти растворы оказывают пасси-
вирующее влияние на металл, скорость коррозии при до-
стижении определенной концентрации раствора резко
снижается (коррозия железа в растворах нитратов).
7. Атмосферная коррозия
Атмосферной коррозией называют разрушение
металлов и сплавов .в атмосфере и в средах влажных га-
зов в результате электрохимических и химических про-
цессов. Преобладающее значение при атмосферной кор-
розии имеют электрохимические гетерогенные процессы,
которые протекают в тонких слоях влаги, сконденсиро-
вавшейся на поверхности металла.
При атмосферной коррозии гетерогенный электрохи-
мический процесс часто сопровождается кислородной де-
поляризацией, но в условиях промышленной атмосферы,
содержащей различные агрессивные газы, коррозионный
процесс может протекать и за счет водородной деполяри-
зации. На скорость процесса атмосферной коррозии вли-
яют характер атмосферы, продолжительность воздейст-
вия, состав металла и состояние его поверхности. Влаж-
ность, температура и степень загрязнения атмосферы
сильно влияют па качество и состав образующихся на
поверхности металла .пленок влаги, причем в таких слоях
становится возможным возникновение концентрационной
поляризации.
Наиболее агрессивны среды, сильно загрязненные
промышленными отходами — газами СО2, SO2, МО2, NH3,
НС1, частицами солей, угольной пылью; менее активны
чистые и сухие континентальные атмосферы. О влиянии
состава атмосферы на скорость коррозии можно судить
и по следующим данным: ,в сельской атмосфере скорость
коррозии стали составляет 100—250 г/м2-год, а в про-
мышленной атмосфере 450—550 г/м2-год; для цинка —
соответственно 7—20 и 40—80 г/м2-год.
В зависимости от влажности атмосферы различают
несколько видов атмосферной коррозии: мокрую, влаж-
ную и сухую коррозию.
Мокрая атмосферная коррозия наблюдается при ка-
пельной конденсации влаги на поверхности металла при
относительной влажности воздуха, равной 100%. К этому
виду коррозии относят разрушения металлических конст-
рукций под воздействием дождя, снега, тумана и др.
4—3504
97
Влажная атмосферная коррозия возникает при влаж-
ности в атмосфере ниже 100% и сопровождается адсорб-
ционной, капиллярной и химической конденсацией на по-
верхности металла. Адсорбционная конденсация — это
процесс, образования тончайшего слоя молекул воды, свя-
занных с поверхностью металла адсорбционными сила-
ми. В зависимости от состояния металлической поверхно-
сти па ней при влажности немного ниже 100% может
адсорбироваться слой влаги в несколько десятков моле-
кулярных слоев. Основные этапы процесса конденсации:
образование мономолекулярного адсорбционного слоя
пленки из молекул воды, затем при понижении темпера-
туры происходит осаждение мельчайших капелек воды,
в дальнейшем капельки водяного пара образуют сплош-
ную пленку по всей поверхности металла. В случае ше-
роховатой или запыленной поверхности образуется моле-
кулярный слой воды. Химическая конденсация влаги (хе-
мосорбция воды) — это процесс дальнейшего развития
адсорбционной конденсации. Для этого процесса харак-
терно образование гидроксидов. Капиллярная конденса-
ция преимущественно проходит в зазорах, щелях
и пр.
Сухая атмосферная коррозия проходит при относи-
тельной влажности ниже 60%. т. е. под действием кисло-
рода воздуха. При этом процессе наблюдается лишь по-
тускнение поверхности металла вследствие образования
пленки из продуктов коррозии. Процесс разрушения в
случае сухой атмосферной коррозии подобен химическо-
му процессу роста оксидных пленок на поверхности ме-
талла; Пленка на металле в условиях сухой атмосфер-
ной коррозии растет очень медленно, рост ее быстро
прекращается, однако сухая атмосферная коррозия при
появлении на металлической поверхности тончайших
пленок влаги переходит во влажную атмосферную корро-
зию, а при попадании брызг — в мокрую атмосферную
коррозию.
На скорость атмосферной коррозии оказывают влия-
ние свойства образующихся продуктов коррозии, в част-
ности, их гигроскопичность. Так, гигроскопичные про-
дукты коррозии меди и никеля в атмосфере, загрязнен-
ной сернистыми газами, способствуют интенсивному по-
глощению влаги поверхностью металла и дальнейшему
усилению коррозии. Негигроскопичные продукты корро-
зии алюминия хорошо предохраняют металл от дальней-
98
шего разрушения даже при наличии в атмосфере оксида
серы (IV).
При работе аппаратуры в атмосфере следует учиты-
вать контакт двух металлов, обладающих различными
значениями электродных потенциалов. На основе иссле-
дований механизма контактной коррозии рекомендованы
следующие количественные критерии контакта металлов:
допустимыми контактами являются такие, при которых
скорость коррозии анода составляет 0 -50 г/м2-год; от-
носительно допустимыми — при скорости 50—150 г/
/м2-год; контакты не допустимы, если скорость коррозии
превышает 150 г/м2-год.
Все металлы разделены на пять групп: I группа —
магний; II — цинк, алюминий, кадмий; III — железо, уг-
леродистые стали, свинец, олово; IV — никель, хром, хро-
мистые стали, хромоникелевые стали; V — медноникеле-
вые сплавы, медь, серебро. Допустимым считается кон-
такт металлов, входящих в одну и ту же группу. Метал-
лы каждой последующей группы усиливают коррозию
металлов предыдущей группы. Внутри группы металлы
подвергаются коррозии, находясь в контакте с.металла-
ми, расположенными в группе за ними.
Меры по защите металлов от атмосферной коррозии
могут быть различными и зависят от конструктивных и
эксплуатационных особенностей машин и аппаратов, но
основная задача этих мер сводится к торможению анод-
ного или катодного процесса.
8. Коррозия металлов в почве
Коррозия металлических конструкций в почвах и грун-
тах называется подземной коррозией, которой подверже-
ны трубопроводы (газовые, нефтяные, водные), резер-
вуары, сваи, опоры и другие конструкции. Наличие в поч-
вах и грунтах влаги определяет электрохимический
характер подземной коррозии. Процесс разрушения при
этом часто протекает в условиях недостаточной аэрации,
в результате чего характер разрушений местный (в виде
язв).
Агрессивные свойства любого грунта (почвы) опреде-
ляются такими характеристиками, как пористость, влаж-
ность, аэрация, pH грунта (почвы), электропроводность,
наличие растворенных солей. Различают высококоррозн-
4* 99
онные грунты, среднекоррозпонные и грунты, практиче-
ски инертные в коррозионном отношении.
Обычно трудно выделить влияние на скорость под-
земной коррозии какой-либо одной из характеристик
грунта в отдельности. Пористые грунты способны сохра-
нять влагу в течение долгого времени, к тому же порис-
тость грунта создает благоприятные условия для их аэ-
рации. Скорость коррозии в пористых и влажных грун-
тах, как правило, в первый момент повышается. В даль-
нейшем зависимость между скоростью коррозии и порис-
тостью почвы осложняется, так как продукты коррозии,
образовавшиеся в аэрированных грунтах, могут иметь
более высокие защитные свойства, чем продукты, образо-
вавшиеся в неаэрнрованных. Аэрация может влиять на
коррозионный процесс не только за счет прямого воздей-
ствия кислорода на образование пленок, но и различны-
ми косвенными путями, например, уменьшая концентра-
ции некоторых присутствующих в почвах органических
деполяризаторов.
Влажность грунта определяет скорость подземной
коррозии. Повышение влажности грунтов до 20% вызы-
вает уменьшение омического сопротивления возникаю-
щих коррозионных элементов, что вызывает увеличение
коррозии. Максимальная скорость коррозии отмечается
при влажности 15—25%. При дальнейшем увеличении
влажности грунта происходит насыщение грунта водой,
образуется сплошной слой, затрудняющий доступ кисло-
рода к металлу и приводящий к уменьшению скорости
процесса.
На скорость коррозии влияет pH почвы. Коррозия
особенно велика в торфянистых, болотистых грунтах
(рН«3). Черноземы, содержащие в своем составе орга-
нические кислоты, относительно высоко агрессивны к
стали, меди, цинку, свинцу. Одна из наиболее агрессив-
ных почв — подзол. Скорость коррозии стали в таких
почвах в 5 раз выше, чем в других грунтах.
Заметное влияние на развитие процесса подземной
коррозии оказывают микроорганизмы и продукты их жиз-
недеятельности. Этот вид коррозии имеет особое назва-
ние— биокоррозия. Роль микроорганизмов и продуктов
их жизнедеятельности в коррозионных процессах может
быть различной, они могут воздействовать на катодные
пли анодные электрохимические процессы, изменять фи-
зико-химические характеристики почвы, разрушать за-
100
L
1
щитные покрытия. Биокоррозия может развиваться и
протекать в аэробных или анаэробных условиях *. Напри-
мер, биокоррозйя под действием серобактерий, протека-
ющая в аэробных условиях. В процессе своей жизнедея-
тельности они окисляют сероводород сначала в серу, за-
тем -и серную кислоту по следующей схеме:
2H2S + О2 = 2Н2О + S2
S + 2Н2О +ЗО2 = 2H2SO4
Разрушающее влияние серной кислоты на многие
конструкционные материалы хорошо известно. В ана-
эробных почвенных условиях микроорганизмы могут вы-
рабатывать сероводород, углекислоту, углеводороды и
другие химические соединения, влияя тем самым на ход
и скорость процесса подземной коррозии.
Методы защиты конструкций от воздействия подзем-
ной коррозии разнообразны. Это защитные покрытия,
электрохимическая защита, подбор коррозионно-стойких
материалов для подземных сооружений. В особо жестких
условиях применяют комбинированные методы защиты,
например, все современные подземные трубопроводы и
резервуары предохраняют от коррозии с помощью ка-
тодной защиты в сочетании с армированными покрытия-
ми на основе каменноугольной смолы.
9. Коррозия металлов и сплавов в морской воде
Агрессивность морской воды обусловлена содержани-
ем кислорода и наличием в ней хлоридов металлов, пре-
пятствующих образованию эффективных защитных пле-
нок. Коррозионные потери сплавов системы Fe— Св мор-
ской воде составляют 1—3 г/м2-сут в зависимости от
температуры, концентрации воды ,и географического рай-
она. Оценку коррозионной стойкости некоторых важней-
ших металлов и сплавов можно дать согласно значениям
их электродного (стационарного) потенциала в морской
воде (табл. 10).
* Аэробы — микроорганизмы, способные жить и развиваться
только при наличии свободного кислорода.
Анаэробы — микроорганизмы, способные жить и развиваться при
отсутствии свободного кислорода и получающие энергию для жизне-
деятельности расщеплением органических и неорганических веществ.
101
Т а б ли ц а 10
Значения электродных (стационарных) потенциалов (Ен)
для некоторых металлов и сплавов в морской воде
(по данным Томашова и Черновой)
Металл ЕН. в Металл ЕН, в
Магний — 1,45 Никель (активное со- -0,12
Цинк —0,80 стояние) —0,10
Алюминии —0,53 Бронза (5—10% А1)
Дур алюминий -0,50 Медь —0,08
Железо —0,50 Нержавеющая сталь (10X13 пассивное состоя- +0,03
Углеродистая сталь —0,40 ние) +0,05 +0,10
Серый чугун —0,36 Никель (пассивное со- стояние) Нержавеющая сталь
Нержавеющая сталь (20X13, 08X17 актив- —0,32 (08X17 пассивное состо- яние)
пое состояние)
Нержавеющая сталь (12Х18Н9 активное состояние) —0,30 Нержавеющая сталь (12Х18Н9 пассивное со- стояние) +0,20
Нержавеющая сталь (10Х18Н12М2Т актив- —0,30 Серебро +0,124- 10,20
ное состояние)
Свинец —0,30 Титан +0,15-=- 0,20
Латунь (40% Zn) —0,20 Платина +0,40
10. Коррозия металлов и сплавов
под действием блуждающих токов
Блуждающими токами называются токи, ответвляю-
щиеся от своего пути. Попадая в металлические конст-
рукции, расположенные в грунте, они вызывают корро-
зию. Источником возникновения блуждающих токов в
почве служат рельсовые пути трамвайных и электриче-
ских железных дорог, в которых рельсы выполняют роль
обратного провода для тока, электросварочные аппара-
ты, работающие от постоянного тока, установки катод-
ной защиты, электролизеры, установки для гальванопо-
крытии. Коррозия под действием блуждающих токов осо-
бенно опасна в тех случаях, когда этот ток постоянный.
Принципиальная схема возникновения блуждающих то-
ков и протекающей при этом коррозии приведена на
рис. 54.
102
Воздушный приВод
__________ / б)
^U|UUUUlJn^
рОЛЬС' Q
тру6а>
\кагподнпя '.нейтраль- анодная
i \ная зона зона
|л и шиинил yicm при/ID-
ЗОНО. \ная зона
Рис. 54. Принципиальная схема
коррозии металлов под дей-
ствием блуждающих токов
При движении электропоезда по рельсам ток посту-
пает от положительного полюса источника тока в кон-
тактный воздушный провод и возвращается по рельсам
обратно к отрицательному полюсу источника тока. Прак-
тически всегда рельсы имеют контакт с влажной почвой,
которая, несмотря на значительное электросопротнвле-
. ние, является параллельным проводником. В этом слу-
чае часть тока ответвляется и переходит в почвы. Ответ-
вляющая часть тока стремится к подземным металличе-
ским конструкциям (в частности, к трубопроводам), ко-
торые имеют меньшее сопро-
тивление, чем почва.
При прохождении блуж-
дающего тока по участку
трубопровода можно выде-
лить три зоны.
1. Катодную зону — уча-
сток входа блуждающих то-
ков в трубопровод. Зона в
коррозионном отношении бе-
зопасна.
2. Нейтральную зону —
участок протекания блуж-
дающего тока по трубопро-
воду. Зона также безопасна
в коррозионном отношении.
3. Анодную зону — участок выхода блуждающих то-
ков из трубопровода в грунт. Это участок интенсивной
коррозии, которая проявляется в виде глубоких язв и
сквозных разрушений, на этом участке чугунные трубо-
проводы подвергаются графитизации.
Для конструкций из амфотерных металлов, таких,
как алюминий, цинк, свинец, олово, корродирующих в
кислых, щелочных средах, опасны катодные зоны, так как
при накоплении щелочи на катодном участке в резуль-
тате электролиза амфотерные металлы разрушаются.
Величина силы блуждающих токов вблизи путей элек-
трических железных дорог достигает значений 200—
300 А. Для подземных трубопроводов характерны блуж-
дающие токи силой в 10—20 А. О разрушительных спо-
собностях таких токов можно судить по таким данным:
ток силой в 1 А за год разрушает 9 кг железа, 11 кг цин-
ка и меди, 34 кг свинца, 3 кг алюминия. Радиус зоны
действия блуждающих токов достигает нескольких де-
103
сятков километров, увеличивая этим опасность такого
вида коррозии. Защита металлических конструкции от
действия блуждающих электрических токов осуществля-
ется различными способами. Основные из них: изоляция
металлических конструкций, находящихся в грунте, спе-
циальная дренажная защита и др.
Глава XI
ПАССИВНОСТЬ МЕТАЛЛОВ И СПЛАВОВ
Для некоторых металлов, таких, как железо, хром,
никель, тнтан, цирконий, алюминий и ряд других, ско-
рость коррозии в растворах сильных окислителей значи-
тельно меньше, чем в растворах более слабых. Резкое
Концентрация С ,%
Рис. 55. Зависимость скоро-
сти коррозии железа от кон-
центрации раствора азотной
кислоты (20° С)
уменьшение скорости коррозии
(на несколько порядков) в
сильных окислителях называет-
ся пассивацией, а состояние
металла пассивным. Это состо-
яние относительно коррозион-
ной стойкости металла или
сплава вызвано преимущест-
венным торможением анодной
реакции ионизации металла в
определенной области потенци-
алов. .Способность металлов к
пассивации различная; так,
никель пассивируется легче
железа. При легировании ме-
таллов легко пассивирующими-
ся металлами они могут пере-
дать им свою склонность к пас-
сивации. Тормозить анодную реакцию способны окисли-
тельные среды /аэрированные растворы электролитов,
водные растворы HNO3 (рис. 55), К2СГ2О7, KMnO-i,
KCIO3 и др.].
Возникновение пассивного состояния зависит от при-
роды металла, его свойств, характера агрессивной сре-
ды, концентрации раствора электролита, температуры,
скорости движения раствора и ряда других факторов,
104
т. е. для создания пассивного состояния необходимо из-
менить некоторые внешние условия агрессивной среды.
Пассивность определяет коррозионную стойкость в ес-
тественных условиях многих металлических конструкци-
онных материалов, среди них хром, алюминий, нержаве-
ющие стали.
Средн факторов, способствующих нарушению пассив-
ного состояния металла, основными являются восстано-
вительные процессы, механическое повреждение пассив-
ного слоя, повышение температуры раствора, действие
таких активных ионов, как Cl~, SO4ОН-.
В зависимости от характера пассиватора и активато-
ра в-растворе и соотношения между их концентрациями
возможны периодические переходы поверхности металла
из пассивного состояния в активное и наоборот.
С точки зрения термодинамической пассивный металл
не является более благородным, нежели активный, а за-
медление коррозионного процесса происходит благодаря
образованию на поверхности фазовых или адсорбцион-
ных слоев, тормозящих анодный процесс. Пассивное со-
стояние поверхности металла выражается в смещении
электродного потенциала металла в положительную сто-
рону. Например, железо в активном состоянии имеет по-
тенциал (—0,4-?-к-0,58) В, а в пассивном состоянии —
около +1,0 В.
Механизм процесса пассивирования очень сложен и
недостаточно изучен. Предложено несколько теорий,
объясняющих пассивность металла и сплавов. Согласно
пленочной теории пассивности торможение процесса кор-
розии металла наступает в результате образования на
поверхности металла .защитной пленки. Эта теория свя-
зывает возникновение пассивного состояния металлов с.
образованием тончайшего, часто невидимого защитного
оксидного или другого слоя из соединений металла.
Несмотря на широкую распространенность пленочной
теории пассивного состояния, все же большее число яв-
лений, наблюдаемых при пассивации, не может быть объ-
яснено только защитным эффектом образующейся
пленки.
По адсорбционной теории пассивности механизм за-
щиты металлов состоит в насыщении валентностей по-
верхностных атомов металла путем образования химиче-
ских связей с адсорбирующимися атомами кислорода.
Этот так называемый химический вариант адсорбцион-
105
нои теории пассивации предполагает образование неак-
тивного поверхностного слоя металла, связанного с ато-
мами кислорода.
По другому/, электрохимическому, варианту адсорб-
ционной теории пассивности — механизм пассивации за-
ключается в том, что кислородные атомы, адсорбируясь
на металле, образуют электрические диполи за счет час-
тичной ионизации кислородного атома электроном ме-
талла. При этом положительный конец образующего
диполя располагается в металле и является отрицатель-
ным в двойном слое, в растворе. Таким образом, имею-
щийся на металле ионный скачок потенциала заменя-
ется сложным адсорбционно-ионным скачком потенциа-
ла. В результате происходит сдвиг общего электродного
потенциала в положительную сторону, и ионизация ме-
талла уменьшается.
Явление перепасснвации металлов и сплавов связано
с увеличением окислительной способности среды, что об-
легчает наступление пассивного состояния многих метал-
лов и сплавов. Это характерно, в частности, для алюми-
ния в растворах HNO3. Однако в ряде случаев при чрез-
мерном повышении окислительно-восстановительного по-
тенциала запассированный материал теряет свою пассив-
ность и переходит в активное состояние.
Это явление, связанное с нарушением пассивности не-
ржавеющих сталей, железа п других металлов в сильно
окислительных средах, получило название псрепассива-
ции. Причиной этого явления считают то, что в средах
с весьма положительным окислительно-восстановитель-
ным потенциалом образуются оксиды металлов высших
валентностей, хорошо растворимые в данной среде. Это
подтверждается тем обстоятельством, что при добавле-
нии окислителей (К2СГ2О7, КМпО4) к азотной кислоте
перепассивация хромистых и хромоникелевых сталей
увеличивается. Перепассивации способствуют повышение
температуры среды, увеличение количества добавляемо-
го окислителя и рост концентрации кислоты. Объясняет-
ся это тем, что вследствие высокого окислительно-восста-
новительного потенциала растворов азотной кислоты с
добавками, например, К2СГ2О7 нержавеющая сталь име-
ет потенциал, близкий к потенциалу реакции образова-
ния шестивалентного хрома:
2Cr3+ + 7Н2О = Cr2Oy— + 14Н+ + бе~
106
Часто легирование металла легко пассивирующимся
металлом приводит к образованию достаточно хорошо
пассивирующихся сплавов. Примером могут служить раз-
личные нержавеющие и кислотостойкие стали типа
Fe—Сг—С, устойчивые в воде, растворах нейтральных
кислот, в атмосфере. Свойство металлов пассивировать-
ся имеет большое практическое значение для различных
отраслей машиностроения — на нем основано создание
многих коррозионно-стойких сплавов.
В современной технике часто используется метод ис-
кусственного пассивирования металлов с целью повыше-
ния коррозионной стойкости некоторых металлов. Прак-
тическое значение пассивации исключительно велико, так
как все конструкционные металлы без их самопроизволь-
ного пассивирования подвергались бы быстрой корро-
зии не только в агрессивных химических средах, но и во
влажной земной атмосфере или пресной воде.
х Глава XII
МЕТОДЫ КОРРОЗИОННЫХ ИСПЫТАНИЙ
1. Способы оценки коррозионных процессов
Коррозионная стойкость металлов определяется ка-
чественно и количественно — скоростью коррозии в дан-
ных условиях, баллом стойкости по принятой шкале.
Коррозионная стойкость может быть оценена:
а) изменением массы металла в результате корро-
зии, отнесенным к единице поверхности н единице вре-
мени;
б) объемом выделившегося водорода (или поглощен-
ного кислорода) в процессе коррозии, отнесенным к еди-
нице поверхности и единице времени;
в) уменьшением толщины металла вследствие корро-
зии, выраженным в линейных единицах и отнесенным к
единице времени;
г) изменением какого-либо показателя механических
свойств за определенное время коррозионного процесса,
выраженным в процентах, или временем до разрушения
образца заданных размеров;
д) изменением отражательной способности поверхно-
сти металла за определенное время коррозионного про-
цесса, выраженным в процентах;
107
е) плотностью тока, отвечающей скорости данного
коррозионного процесса;
ж) временем до появления первого коррозионного
очага * на образце заданных размеров или числом корро-
зионных очагов па образце по истечении заданного вре-
мени.
Скорость коррозии k оценивают по изменению массы
металла (Д<?) с единицы поверхности (S) (1 м2, 1 см2)
к единице времени (т) (час, сутки, год), например, в
г/м2-ч:
При количественной оценке коррозии металлов сле-
дует учитывать фактор неравномерности коррозии
л = —- 100,
где SK— прокорродировавшая поверхность образца;
So — общая поверхность образца.
Для количественной и качественной оценки коррози-
онной стойкости металлов имеется ряд шкал коррозион-
ной стойкости. По ГОСТу СССР установлена десяти-
балльная шкала коррозионной стойкости (табл. 11).
Таблица 11
Десятибалльная шкала для оценки общей коррозионной
стойкости металлов
Группа стойкости Скорость коррозии металла, мм/год Балл
Совершенно стойкие Менее 0,001 1
Весьма стойкие 0,001—0.005 2
0,005—0,01 3
Стойкие 0,01—0,05 4
0,05—0,1 а
Пониженно-стойкие 0,1—0,5 б
0,5—1,0 7
Малостойкие 1,0—5,0 8
5,0—10,0 9.
Нестойкие Свыше 10,0 10
* Коррозионным очагом называют участок поверхности металла,
па котором сосредоточен коррозионный процесс.
108
Глубинный показатель коррозии (П, мм/год), которым
выражается в десятибалльной шкале скорость коррозии
металлов при равномерной коррозии, получают пересче-
том по следующей формуле:
fe-8760
у-1000 ’
где у — плотность металла, г/см3; 8760 — количество ча-
сов в году.
2. Методы коррозионных испытаний
Методы коррозионных испытаний металлических
конструкционных материалов принято подразделять на
лабораторные, внелабораторные и эксплуатационные ис-
пытания. Самый простой и экономичный способ оценки
коррозионной стойкости металлов — лабораторные ис-
пытания. Однако этот способ имеет существенный недо-
статок, так как в лабораторных условиях трудно, а иног-
да невозможно воспроизвести условия, идентичные экс-
плуатационным.
Все принятые методы исследования коррозии метал-
лов по способу оценки подразделяются соответственно на
количественные и качественные. Качественные методы
являются вспомогательными, ио во многих случаях имен-
но они позволяют установить интенсивность и характер
коррозионного процесса.
Основные правила коррозионных испытаний можно
сформулировать так: испытуемый образец должен иметь
точную характеристику (химический состав, структуру,
происхождение); образцы должны иметь предельно про-
стую форму; для механических испытаний форма долж-
на быть стандартной.
При лабораторных испытаниях используются образ-
цы следующих размеров: для листовых материалов
25x50 мм, для цилиндрических образцов диаметр 10—
20, высота 40 мм, для дисков диаметр 30. толщина 5—
10 мм. Для испытаний берется не менее 3—4 одинаковых
образцов, поверхность которых перед испытанием тща-
тельно очищается. Время, требуемое для проведения кор-
розионных испытаний, велико, и с целью сокращения
времени исследований применяют ускоренные методы:
металлы испытывают в условиях более жестких, чем
обычные эксплуатационные.
109
Среди качественных методов основными являются ме-
тоды наблюдения внешнего вида образца (визуальные
или приборные). Проводятся также наблюдения за изме-
нениями, происходящими в растворе.
Среди количественных методов исследований корро-
зии металлов наиболее часто применяется весовой, объ-
емный, электрический, электрохимический. Величину
коррозии по изменению механических свойств оценива-
ют измерением предела прочности и относительным уд-
линением образцов до и после коррозии. Самый распро-
страненный метод количественных испытаний — весовой,
который позволяет определить разность массы образца
до и после коррозии. В зависимости от характера обра-
зующихся продуктов коррозии масса образца может
уменьшаться или увеличиваться.
При образовании на поверхности металла продуктов
коррозии наблюдается привес образцов. Потеря массы
образцов наблюдается в тех случаях, когда продукты
коррозии удаляются с поверхности металла. При опре-
делении потери массы образца продукты коррозии не-
обходимо удалять при помощи мела, промывки водой с
помощью щетки и т. д. Если при этом невозможно очис-
тить металл указанными методами, продукты коррозии
удаляют растворением в соответствующих реагентах.
Скорость коррозии определяют по отношению разницы
между массой образца в исходном состоянии q0 и после
коррозии q1 к исследуемой поверхности S и времени ис-
пытания т:
_ <7о — ?i
"ес ’ Хи ’
Объемный способ применяется в тех случаях, когда
необходимо установить и кинетику коррозионного про-
цесса. Если коррозионный процесс протекает с водород-
ной деполяризацией, можно определить скорость корро-
зии по количеству выделившегося водброда, не опреде-
ляя количество металла, перешедшего в раствор. Метод
основан на том, что количество растворенного металла
эквивалентно количеству выделившегося водорода. Про-
стейший прибор для подобных испытаний — водородный
коррозиметр — показан на рис. 56.
Оценка скорости коррозии в этом случае производит-
ся с помощью объемного показателя коррозии — объема
V, выделившегося водорода в процессе коррозии метал-
ле
ла, отнесенного к единице поверхности металла S и к
единице времени т:
Лоб =--- W(St).
Объемным спрсобом можно определить скорость корро-
зии металлов и в тех случаях, когда процесс протекает
с кислородной деполяризацией по количеству поглощен-
ного кислорода.
При конструировании различного вида аппаратуры
необходимо иметь данные по
изменению свойств матери-
ала после воздействия аг-
рессивной среды. Изменение
механических свойств при
коррозионных испытаниях
носит условный характер:
чем больше площадь на-
чального сечения образца,
тем меньше изменение на-
чального предела прочнос-
ти. Этот вид испытаний при-
меним для определения ме-
ханических свойств листово-
го материала и тонких труб.
Измеряют предел прочности
на разрыв и относительное
удлинение. Расчет ведут по
следующим формулам:
Рис. 56. Схема водородного
коррозиметра:
1 — стакан с раствором кислоты:
2 — бюретка; 3 зажим; 4 — труб-
ка; 5 — крап; 6 — штатив; 7 — испы-
туемым образец; 8~ подставка:
9 — водоструйный иасос
Да —--------— ЮО,
а1
Й1 — Sj
100,
где Oi, 61 — замеры до коррозионных испытаний; о2,
62— после коррозионных испытаний.
В случае, если материал теряет после испытаний свы-
ше 20% своих прочностных свойств, его нельзя использо-
вать в качестве конструкционного материала.
Среди специальных методов коррозионных испытаний
важнейшими являются методы определения склонности
металлических материалов к межкристаллитной корро-
зии. Существует несколько различных способов. По од-
ному из них образцы кипятят в растворе серной кислоты
III
п медного купороса. Склонность к межкристаллитной
коррозии обнаруживается по растрескиванию образцов
(после кипячения), при их загибе на угол, равный 90°.
Глава XIII
КОРРОЗИЯ ВАЖНЕЙШИХ МЕТАЛЛОВ И СПЛАВОВ
1. Коррозия железа и сплавов
на железной основе
Железо и сплавы на его основе не обладают коррози-
онной стойкостью в агрессивных средах. Однако железо
и сплавы на его основе легко пассивируются, их доста-
точно легко и просто защитить от коррозии самыми раз-
личными методами, поэтому они являются важнейшими
конструкционными материалами. Стандартный равновес-
ный электродный потенциал железа для процесса (Fe^s
^Fe2++2e^) равен - -0,44 В, для (Fc^Fe;,+-|-3e )
—0,036 В. Во время пассивации железа иод действием
окислителей его потенциал смещается в 'положительную
сторону. Как правило, пассивная пленка, образующаяся
на железе, непрочна и легко разрушается при удалении
металла из зоны действия пассиватора. В раствор железо
переходит с продуктами коррозии в виде катионов (2 + ),
которые затем окисляются до катионов (3 + ). На поверх-
ности металла идут процессы:
Fe + 1/2О2 + Н2О + 2СО2 Fe (НСОЛ)2
Fe (HCO,t)2 4- 2Н2О Fe (ОН)2 + 2Н2СО3
2Fe (ОН)2 + Н2О + l/2O2 ^2Fe (ОН)3
Оксидная пленка на поверхности металла (ржавчи-
на) состоит из смеси гидроксидов железа -(II) И (III),
имеет переменный состав: nFeO-mFe2O3-pH2O и не от-
вечает требованиям, предъявляемым к защитным оксид-
ным пленкам.
Все железоуглеродистые сплавы неоднородны по хи-
мическому составу и по своим структурным составляю-
щим. К тому же структурно-составляющие сплавов сис-
темы Fe Fe3C отличаются по значению электродных
потенциалов, поэтому коррозионные микроэлементы, об-
разующиеся при контакте этих сплавов с растворами
электролитов, работают очень интенсивно. Возможная
112
разность потенциалов из-за неоднородности структуры
может иметь значение до 0,8—0,9 В, так как электрод-
ный потенциал для железа —0,44 В, а для графита
+0,37 В. Химическая неоднородность сплавов (наличие
различных добавок и примесей) тоже значительно влия-
ет на скорость процесса коррозии, особенно для корро-
зии с водородной деполяризацией. Сплавы железа, со-
держащие минимальное количество примесей (напри-
мер, железо Армко — 0,02% С), довольно устойчивы в
некоторых агрессивных средах.
При обычных температурах коррозия железа в ней-
тральных средах происходит только при наличии раст-
воренного кислорода. Интенсификация процесса корро-
зии наблюдается в тех случаях, когда кислород играет
роль деполяризатора и коррозия лимитируется ско-
ростью диффузии кислорода к поверхности металла. По-
скольку скорость диффузии пропорциональна концент-
рации кислорода, следовательно, коррозия железа также
пропорциональна концентрации кислорода.
При значительной концентрации кислорода в воде
(12—15 мг/л) может проявиться его положительное дей-
ствие вследствие пассивации железа кислородом. Этот
факт подтверждается значениями потенциалов железа в
воде, насыщенной кислородом. Они составляют от 0,1 до
0,4 В.
Скорость коррозии железа в слабокислых, нейтраль-
ных и слабощелочных средах не зависит от pH п опре-
деляется лишь скоростью диффузии кислорода к поверх-
ности металла. Скорость коррозии в области pH от 4 до
10 зависит от природы солей, находящихся в растворе,
их концентрации, наличия окислителей, температуры
раствора и других факторов.
В области при рН<4 пленка оксида железа (II)
быстро растворяется, и металл вступает в непосредст-
венный контакт с окружающей средой. В этом диапазо-
не pH скорость коррозии .возрастает с уменьшением pH.
На скорость процесса коррозии при этом влияют также
природа аниона кислоты, температура, характер приме-
сей, характер образующихся продуктов коррозии.
В кислотах, не обладающих окислительными свойст-
вами по отношению к железу, железо и железоуглероди-
стые сплавы разрушаются, так как образующиеся про-
дукты коррозии растворимы в дайной среде. К числу та-
ких агрессивных сред можно отнести разбавленные раст-
113
воры серной до 76% (рис. 57), азотной до 30% (рис. 58),
фтористоводородной до 50% кислот, растворы соляной
кислоты. Если кислота является окислителем, то с по-
вышением концентрации усиливаются ее пассивирующие
свойства, поэтому в концентрированных кислотах, об-
ладающих окислительными свойствами, устойчивы как
железо, так чугуны и стали
В кислотах, не являющихся окислителями, например
в растворах соляной кислоты, при увеличении концентра-
ции происходит резкое (экспоненциальное) возрастание
Рис. 57 Зависимость скорости
коррозии углеродистой стали
от концентрации серной кисло-
ты при различных температу-
рах
Рис. 58. Зависимость ско-
рости коррозии железа от
концентрации азотной
кислоты при различных
температурах
скорости коррозии. Повышение температуры раствора
также благоприятствует интенсификации ’разрушитель-
ного процесса. Растворы, содержащие менее 30% HNO3,
вызывают значительную коррозию железа н железоугле
родистых сплавов, дальнейшее увеличение концентрации
HNO3 приводит к замедлению скорости коррозии вслед-
ствие их пассивации. При концентрации HNO3 от 94 до
98% железоуглеродистые сплавы подвержены интенсив-
ному разрушению, что связано с перепассивацией.
Повышенная коррозионная стойкость железа и спла-
вов системы Fe—Fe3C в растворах серной кислоты с кон-
центрацией 76,0—90,0% зависит от образования на по
верхности металла защитного слоя из сульфата железа,
который нерастворим в серной кислоте. В олеуме при со-
держании свободного SO3 выше 25% железоуглеродис-
114
тые сплавы не подвергаются коррозии, однако примене-
ние чугуна в этом случае не рекомендуется, так как под
действием олеума может протекать межкристаллитная
коррозия чугуна.
В растворах органических кислот (уксусной, муравь-
иной, щавелевой и др.) железо и железоуглеродистые
сплавы подвержены сильной коррозии, которая усилива-
ется при доступе кислорода и с повышением температу-
ры и скорости движения среды.
В щелочной области значений pH скорость снижает-
ся, так как железо в присутст-
вии щелочей и растворенного
кислорода начинает все более
пассивироваться. Железо,
сталь, чугун устойчивы в раст-
ворах щелочей с концентраци-
ей до 30% (рис. 59), в этом
случае на поверхности металла
образуются нерастворимые
продукты коррозии [гидрокси-
ды железа (II) и (III)], обла-
дающие хорошим сцеплением с
поверхностью и предохраняю-
щие его от дальнейшей корро-
зии. С повышением концентра-
ции щелочи устойчивость спла-
вов уменьшается. Повышение
Рис. 59. Зависимость ско-
рости коррозии листового
железа в растворах
NaOH при кипении
температуры приводит к раз-
рушению защитных пленок.
Особое явление коррозионного растрескивания угле-
родистых сталей — «щелочная хрупкость» наблюдается
в условиях эксплуатации паровых котлов при концентра-
циях щелочи в воде более 15%, температуре раствора
выше 65° С и при наличии значительных механических
напряжений.
В нейтральных, слабощелочных и слабокислых раст-
ворах солей коррозионная стойкость железа и железо-
углеродистых сплавов зависит от концентрации и элек-
тропроводности раствора, степени аэрированности его и
от свойств и характеристик анионов и катионов среды.
Одним из основных факторов, определяющих скорость
коррозии для таких растворов, является растворимость
продуктов коррозии; pH среды, как правило, не влияет
на Скорость коррозии в растворах солей.
115
При увеличении концентрации раствора соли ско-
рость коррозии сплава возрастает. Замедление коррозии
при дальнейшем увеличении концентрации соли в раст-
воре связано с уменьшением растворимости кислорода
по мерс концентрирования растворов.
Соли щелочных и щелочноземельных металлов уве-
личивают электропроводность раствора, которая усили-
вает работу микроэлементов, что приводит к возраста-
нию скорости коррозии.
Растворы нитратов менее агрессивны, чем хлориды,
Рис. 60. Слияние содержа-
ния углерода в сплавах сис-
темы Fe — Fe3C на скорость
их коррозии в разбавленной
серной кислоте при 25' С
а нитриты в определенных пре-
делах концентрации могут дей-
ствовать как ингибиторы («за-
медлители коррозии»).
Влияние природы катионов
и анионов на скорость корро-
зии сказывается в процессе об-
разования пленок из продуктов
коррозии на поверхности ме-
талла. Растворы хлоридов,
сульфатов, нитратов щелочных
металлов при взаимодействии
с железом образуют раствори-
мые продукты. В растворах
карбонатов и фосфатов натрия
и калия на анодных участках
железа образуются нераство-
римые пленки карбоната и фосфата железа, это снижа-
ет скорость коррозионного процесса, но из-за пористости
пленок железоуглеродистые сплавы разрушаются.
Растворы солей, обладающие окислительными свой-
ствами (хроматы, дихроматы, манганаты), не разруша-
ют железа и железоуглеродистые сплавы. В растворах
солей, катион которых элсктроположительнее железа,
разрушение идет по схеме
Fe 4- Cu2+ = Fe2+ -р Си
В органических средах (этиловый, метиловый спир-
ты, бензол, дихлорэтан) железо и железоуглеродистые
сплавы не корродируют. Эти сплавы не корродируют так-
же в четыреххлористом углероде и других хлорзамещен-
ных органических растворителях, даже при повышенных
температурах, но наличие следов влаги ведет к быстрому
разрушению металла.
116
Заметное влияние на скорость коррозии железоугле-
родистых сплавов в кислых средах, не содержащих окис-
лителей, оказывает содержание углерода в сплаве (рис.
60). Причем чугун (3,3% С) в 20%-ной серной кислоте
растворяется в 100 раз быстрее, чем чистое железо. Прн
коррозии в воде содержание углерода в сплаве не ока-
зывает никакого влияния, ио в морской воде повышение
содержания углерода вызывает некоторое увеличение
скорости коррозии.
2. Коррозионная стойкость цветных металлов
Алюминий и его сплавы. Стандартный электродный
потенциал алюминия (А1^А13+4~Зе-) —1,66 В. На осно-
вании этой величины можно предположить, что алюми-
ний весьма активный металл, однако практически он об-
ладает достаточно высокой коррозионной стойкостью во
многих агрессивных средах, так как на поверхности ме-
талла образуется защитная оксидная пленка. Такая
пленка появляется почти мгновенно при соприкосновении
свежего среза металла с воздухом, но рост ее продолжа-
ется медленно. Толщина пленки зависит от многих усло-
вий: для алюминия, хранящегося в помещении, она со-
ставляет 0,01—0,02 мкм, при действии сухого кислоро-
да— от 0,02 до 0,04 мкм, а при термической обработке
металлов доходит до 0,1 мкм. В зависимости от’окружа-
ющих условий поверхностная пленка состоит из аморф-
ного или кристаллического оксида алюминия либо из
гидроксида алюминия. Она обладает хорошим сцеплени-
ем и удовлетворяет условию сплошности. Таким образом,
алюминий устойчив во всех средах, где на его поверх-
ности может существовать защитная плсика, и нестоек
там, где эта пленка разрушается, либо нет условий для
ее образования. Защитная пленка на алюминии может
образовываться даже при отсутствии окислителей; вода,
водные растворы нейтральных солей пассивируют поверх-
ность алюминия.
Коррозионная стойкость алюминия определяется ря-
дом факторов — это природа агрессивной среды, ее кон-
центрация, температура, а также влиянием этих факто-
ров на формирование защитной пленки на поверхности
металла.
В обычной атмосфере алюминий устойчив и может
применяться без особой защиты. В индустриальной ад-
117
мосфере алюминий корродирует и требует специальной
защиты. В сильнокислых и сильнощелочных средах ок-
сидная пленка на поверхности металла разрушается, и
коррозия в этих случаях особенно велика.
В отдельных случаях алюминий проявляет исключи-
тельную стойкость в концентрированных кислотах, на-
пример, в азотной кислоте высоких концентраций стой-
кость алюминия выше, чем у нержавеющих сталей. Поэ-
тому алюминий применяют для аппаратурного оформле-
ния процессов производства крепкой азотной кислоты
методом прямого синтеза.
Наиболее опасными для алюминия являются рас-
творы серной кислоты средних концентраций. В концен-
трированной кислоте и в высокопроцентном олеуме при
200° С алюминий достаточно устойчив. Снижение скоро-
сти коррозии в кислотах более высокой концентрации
связывают с уменьшением концентрации водородных ио-
нов, с затрудненностью диффузии продуктов реакции
с поверхности металла, с возможным пассивированием.
Стойкость алюминия в растворах кислот увеличивается
с повышением его чистоты.
Галогеноводородные кислоты интенсивно действуют
на алюминий, степень их агрессивности снижается со-
гласно следующему ряду: HF—HCI—НВг—HI. В фос-
форной и ускуспой кислотах при комнатных температу-
рах алюминий достаточно устойчив. Муравьиная, щаве-
левая, хлорорганические кислоты разрушают алюминий.
В щелочных растворах оксидная пленка алюминия
легко растворяется по схеме
А12О3 + 2NaOH z+2NaAIO2 + Н2О
Только в слабых растворах щелочей и в водных раство-
рах аммиака алюминий устойчив. К расплавам щелоч-
ных металлов алюминий устойчив при температурах до-
300° С. Ртуть и растворы ее солей образуют с алюмини-
ем амальгамы, разрушая при этом металл. Газовые сре-
ды, содержащие сероводород, пары серы, сухой хлоро-
водород и газообразный аммиак, на алюминий не дей-
ствуют.
Серьезные разрушения алюминия вызывают хлорсо-
держащие органические растворители, даже безводные,
например СС14, разрушают алюминий:
2А1 + 6СС14^ЗС2С16-|-2Л1С13 .
118
Алюминиевые сплавы обладают меныпей коррози-
онной стойкостью, чем чистый алюминий. Особенно не-
высокой стойкостью обладают сплавы алюминия с медью
(дуралюминий). Такие сплавы склонны к межкристал-
литной коррозии. При использовании дуралюминия в ка-
честве конструкционного материала для работы в аг-
рессивных средах необходимо принимать защитные
меры. Обычно дуралюминий плакируют чистым алюми-
нием, при этом осуществляется одновременно и механи-
ческая защита сплава, и электрохимическая (алюминий
всегда является анодом по отношению к сплаву).
Сплавы алюминия с кремнием (силумины) обладают
относительно хорошей коррозионной стойкостью во мно-
гих агрессивных, особенно в окислительных средах. Вы-
сокая стойкость силуминов объясняется образованием
на поверхности защитной пленки, состоящей из А12О3 и
SiO2. Щелочи и плавиковая кислота разрушают эти за-
щитные пленки:
SiO2 + 2NaOH^:Na2OSiO2 + Н2О
• SiO2 + 4HF^:SiF4 + 2H2O
Контакт алюминия и его сплавов с другими металла-
ми может вызвать интенсивную коррозию, особенно в
растворах электролитов или в очень влажной атмосфере,
поскольку большинство металлов является катодами в
отношении к алюминию. Особенно опасен для алюминия
и его сплавов контакт с медью, сплавами меди и нержа-
веющими сталями.
Медь и ее сплавы. Нормальный электродный потенци-
ал медного электрода для процесса (Cu«=^Cu++e")+
+ 0,52 В, a (Cu^±Cu2++2e”) +0,34 В. В отсутствие окис-
лителей медь обладает хорошей стойкостью в водных
растворах и при обычных условиях не вытесняет водород
из кислот. Катион Си+ способен образовывать комплекс-
ные ионы типа [CuCl2]~, [Cu(NH3)4]+, [Си(CN)4]3_. Ка-
тион Си2+ образует с аммиаком, водой, хлоридами ком-
плексные ионы типа [Cu(NH3)4]2+, [Cu(H2O)]2+, [CuC14]2~.
Медь достаточно устойчива в растворах кислот, не
обладающих окислительными свойствами (в разбавлен-
ной серной кислоте, в соляной, уксусной кислоте). Од-
нако в реальных условиях в аэрированных растворах
этих кислот медь подвергается коррозии (рис. 61). На
119
скорость коррозионного процесса кроме температуры су-
щественно влияет скорость движения агрессивной среды.
В концентрированной серной кислоте медь интенсив-
но корродирует:
Си -р 2H2SO4 CuSO4 + 2Н2О + SO2
Из минеральных кислот наиболее агрессивны по отноше-
нию к меди растворы азотной кислоты, разрушающие
медь прл любых температурах. В разбавленных холод-
ных растворях щелочей медь достаточно устойчива, и из
Рис. 61. Скорость коррозии
меди в разбавленных аэри-
рованных растворах кислот
при различном содержании
кислорода (25° С):
/ — соляная; 2— уксусная; 3 —
серная
нее можно изготовлять аппа-
ратуру для хранения щелочных
растворов. Исключение состав-
ляют аммиачные растворы, в
которых из-за образования
комплексных солей металл бы-
стро разрушается.
Коррозия меди в растворах
солей зависит от природы анн-
она соли, pH раствора и при-
сутствия окислителей. В нейт-
ральных пеаэрпрованных раст-
ворах медь устойчива, но на-
личие кислорода в растворе
способствует коррозии. В мор-
ской воде медь устойчива, од-
нако при доступе кислорода
скорость коррозии меди зна-
чительна.
В атмосферных условиях медь относительно устойчи-
ва из-за образования на ее поверхности защитной плен-
ки, состоящей из нерастворимого соединения СиСО3Х
X Си (ОН) 2. Присутствие во влажной атмосфере SO2,
НС1, С12 резко интенсифицирует коррозию меди, так как
образующиеся пленки основной соли типа СнС12Х
ХЗСн(ОН)2 или CuSO4• ЗСи(ОН)2 не обладают защит-
ными свойствами.
В газовых средах, содержащих хлор, бром, иод, пары
серы, оксид углерода (IV), медь разрушается. Техниче-
ские сорта меди интенсивно разрушаются под действием
водорода при высоких температурах. Причиной этого
вида коррозии (рис. 62)—«водородной хрупкости ме-
ди»— является взаимодействие оксида меди (I), всегда
присутствующего в технических сортах меди, с водоро-
120
дом по реакции
Cu2O + Н2 2Си + Н2О
Пары воды нарушают ‘связь между кристаллитами в мег
талле, что приводит к появлению трещин.
Коррозионная стойкость сплавов па основе меди оп-
ределяется их химическим составом. Так, оловянистые
бронзы выше по своей коррозионной стойкости, чем медь,
в таких агрессивных средах, как разбавленные растворы
серной и других минеральных кислот, щелочные раство-
ры (исключая аммиачные), в морской воде. С повыше-
нием содержания олова в
сплаве стойкость бронз уве-
личивается. Однако в азот-
ной кислоте и других окис-
лителях, в растворах циани-
стых соединений эти сплавы
неустойчивы. С повышени-
ем температуры стойкость
оловянистых бронз понижа-
ется.
Алюминиевые бронзы
устойчивы в разбавленных
растворах минеральных кис-
лот, не являющихся окисли-
телями (в соляной, фосфор-
ной) и в ряде органических
Время, мин
Рис. 62. Зависимость глуби-
ны разрушения меди от вре-
мени пребывания в атмосфе-
ре воздуха
:лот. Наилучшими корро-
зионными свойствами отличается бронза, содержащая
9,8% алюминия и 4% железа, а при введении в сплав
4—6% никеля материал приобретает стойкость к газо-
вой коррозии до 500° С.
Кремнистые бронзы устойчивы в 92 %-поп серной кис-
лоте при температурах до 50° С.
Простые латуни обладают меньшей коррозионной
устойчивостью, чем медь. Сложные латуни, содержащие
марганец, хром,, по своей коррозионной стойкости не ус-
тупают меди. Для латуни характерными видами корро-
зионных разрушений являются обесцинкование и корро-
зионное растрескивание. Сущность процесса основана на
том, что при растворении латуни в нейтральных или сла-
бокислых средах в раствор переходят ионы цинка, а на
катодных участках поверхности сплава накапливается
медь. Продукты коррозии цинка могут накапливаться
или задерживаться на поверхности сплава в виде слоя.
Процессу коррозии благоприятствуют высокое содержа-
121
ние цинка в сплавах, аэрация и перемешивание электро-
лита, наличие хлорид-попов в растворе, повышенное со-
держание меди в растворе, контакт сплава с более элек-
троположительными металлами. Основной мерой борьбы
против обесцинкования является дополнительное легиро-
вание сплава, в частности, мышьяком (до 0,03%), сурь-
мой, фосфором или оловом (до 1%)- Содержание мышья-
ка (0,01%) предотвращает обесцинкование латуни
(Л-70) в морской воде при 50° С.
Коррозионное растрескивание — процесс, связанный
с наличием в изделиях после обработки внутренних на-
пряжений. Такие разрушения являются результатом од- «
новременного воздействия на металл межкристаллитной
коррозии и внутренних напряжений. Дополнительное ле-
гирование латуней кремнием (до 1%) снижает коррози-
онное растрескивание. Другой мерой предупреждения
может служить предварительная термическая обработка
изделия.
Свинец. Нормальный электродный потенциал свинца
для процесса (Pb^±Pb2++2e_)— 0,126 В, а для (РЬ^±
чэ=РЬ4++4е~)+0,80 В. Коррозионная стойкость свинца
определяется, в основном, растворимостью продуктов его
коррозии. Свинец устойчив к действию растворов серной,
сернистой, фосфорной кислот и их солей. В растворах
серной кислоты (до 76%) на поверхности свинца образу-
ется беспористая пленка сульфата свинца, сохраняющая
свои свойства до 85° С. В растворах более высоких кон-
центраций свинец быстро разрушается:
Pbso4 + h2so4^: рь (hso4)2
Свинец нестоек в растворах азотной, соляной, уксусной,
муравьиной кислот и в растворах щелочей. Он устойчив
в растворах аммиака и концентрированных растворах ук-
сусной и хлоруксусной кислот, а также в сухих агрессив-
ных газах.
Цинк. Нормальный электродный потенциал цинка
(Zn=p±Zn2++2e") — 0,76 В. В качестве конструкционного
материала цинк не применяется, а используется для за-
щиты от коррозии железоуглеродистых сплавов. При на-
гревании в воде цинк устойчив, исключая интервал тем-
ператур 50—80° С, когда на поверхности металла обра-
зуется рыхлая пленка Zn(OH)2, которая отслаивается от
поверхности. В растворах солей с более электроотрица-
тельным катионом цинк устойчив. Присутствие в раство-
рах более положительного катиона приводит к разруше-
122
нию цинка:
Zn -|- FeSC>4 Fe -'r Z11SO4
В растворах щелочей (pH>12) и кислот цинк неустой-
чив, но он обладает высокой стойкостью в нейтральных
и слабощелочных средах в связи с образованием на по-
верхности Zn(OH)2.
Никель. Нормальный электродный потенциал никеля
(Ni4=tNi2+ + 2e‘_) — 0,25 В. Он обладает высокой коррози-
онной стойкостью во многих средах. В атмосфере, не со-
держащей оксид серы (IV), хлора, аммиака, металл хоро-
шо устойчивдо500°С. В разбавленных минеральных кис-
лотах (НС1, H2SO4 до 70%) и в некоторых органических
кислотах никель устойчив при обычных температурах, а
в азотной кислоте разрушается. В растворах солей, не
обладающих окислительными свойствами по отношению
к никелю, его коррозия незначительна. Однако никель
быстро разрушается в растворах хлоридов железа, меди
и ртути, а также в растворах нитрата серебра, гипохло-
рита натрия и т. п.
Щелочи не действуют на никель ни в водных раство-
рах, ни в расплавленном состоянии. В концентрирован-
ных растворах едких щелочей стойкость никеля обуслов-
лена защитной гидроксидной пленкой. При концентрации
едкого натра до 50% скорость коррозии никеля не выше
0,003 мм/год.
Сухой аммиак не разрушает никель, а в концентриро-
ванных растворах аммиака металл неустойчив. Никель
стоек во многих органических средах даже при повышен-
ных температурах.
Кадмий. Нормальный электродный потенциал кадмия
(Cd4=tCd2++2e_)—0,402 В. Кадмий находит применение
как антикоррозионное покрытие для деталей, погружен-
ных в морскую воду. Поведение кадмия в растворах солей
и кислот аналогично цинку, но он более устойчив в рас-
творах серной кислоты. Устойчивость кадмия в растворах
щелочей объясняется образованием на его поверхности
защитной пленки из продуктов коррозии.
Кобальт. Нормальный электродный потенциал ко-
бальта (Со^±Со2++2е_)—0,28 В. Изделия из кобальта
отличаются высокой прочностью и коррозионной стой-
костью. Однако из-за высокой стоимости изделия из ко-
бальта применяются только в тех случаях, когда аппа-
ратура подвержена одновременному воздействию агрес-
сивных сред и механических нагрузок.
Раздел третий
КОРРОЗИОННО-СТОЙКИЕ МАТЕРИАЛЫ
Глава XIV
МЕТАЛЛИЧЕСКИЕ КОРРОЗИОННО-СТОЙКИЕ МАТЕРИАЛЫ
1. Коррозионно-стойкие сплавы
на железоуглеродистой основе
Легированные чугуны. Кремнистые чугуны — это
сплавы железа с кремнием (Fe — С —Si), содержащие
14—18% кремния. Они имеют высокую коррозионную
стойкость в агрессивных средах. Резкое усиление корро-
зионной стойкости характерно для сплавов с содержа-
нием кремния выше 14,5%.
В СССР распространены две марки железокремни-
стых сплавов: С-15 (0,5—0,8% С; 14,5—15,0% Si) и С-17
(0,3—0,8% С; 16,0—18,0% Si). Этим сплавам свойствен-
ны высокая твердость, хрупкость; их нельзя прокатывать
и обрабатывать резанием. Изготовление аппаратуры или
отдельных узлов и деталей из таких сплавов возможно
только литьем.
Сплавы типа С-15 и С-17 весьма чувствительны к рез-
ким перепадам температур и не выдерживают быстрого
или местного нагрева. Коррозионная стойкость этих спла-
вов весьма высока, особенно в растворах кислот (напри-
мер, скорость коррозии сплава С-17 в 40%-ной H2SO4
менее 0,5 мм/год, а в 60—94%-ных растворах H2SO4—
менее 0,025 мм/год). Эти сплавы устойчивы в концентри-
рованной азотной кислоте при кипении, в растворах фос-
форной кислоты всех концентраций при любых темпера-
турах.
Высокая коррозионная стойкость железокремнистых
сплавов обусловлена образованием на их поверхности за-
щитных пассивных пленок либо SiO2 (при концентрации
Si в сплаве больше 16%), либо состоящей в основном из
оксидов железа. При механическом повреждении пленка
124
под действием окислителей способна к «самозалечива-
нию». В растворах фтористоводородной кислоты и кон-
центрированных растворах щелочей защитная пленка не
образуется и сплавы типа Fe — С—Si в этих средах
разрушаются.
Легирование железокремнистых сплавов молибденом
(2—5%) увеличивает его стойкость в горячей серной и
соляной кислотах. Основные области применения этих
сплавов — изготовление различной запорной арматуры,
центробежных насосов и аппаратуры для работы с аг-
рессивными жидкостями.
Хромистые и никелевые чугуны обладают высокими
механическими свойствами, так для Х-28 предел проч-
ности при изгибе 570—650 МН/м2 (57—65 кгс/мм2),
твердость по Бринеллю 220—270. Эти сплавы обладают
удовлетворительными литейными свойствами. Некоторые
сорта хромистых чугунов после отжига могут подвер-
гаться холодной обработке резанием. Добавки кремния
(1—2%) улучшают механическую обрабатываемость
хромистых чугунов.
Хромистые чугуны устойчивы в растворах азотной
кислоты любой концентрации при нормальных темпера-
турах, в растворах серной (до 62%), фосфорной (до
70%), уксусной кислотах, в растворах солей, но в соля-
ной кислоте они разрушаются. Применяются хромистые
чугуны для изготовления химической аппаратуры, труб,
деталей насосов и т. д.
Характерной особенностью никелевых чугунов явля-
ется их высокая коррозионная стойкость в расплавах со-
лей и концентрированных растворах щелочей.
Легированные стали. В зависимости от основных
свойств легированные стали разделяют па три группы:
нержавеющие (коррозионно-стойкие); жаростойкие (ока-
линостойкне) и жаропрочные стали. Нержавеющей, или
коррозионно-стойкой, сталью называют сталь, обладаю-
щую высокой химической стойкостью в агрессивных сре-
дах. Наиболее распространенные из этой группы — хро-
мистые (13—30% Сг), хромоникелевые (до 10—12% Ni),
хромоникельмолибденовые и другие стали. Механические
свойства хромистых сталей приведены в табл. 12.
Термин «нержавеющие стали» условен и не означает
абсолютную стойкость этих материалов в агрессивных
средах. Так, пассивируемость, а следовательно, и корро-
зионная стойкость хромистых сталей возрастает с увели-
125
Таблица 12
Механические свойства хромистых сталей
Марка стали Предел прочности при рас- тяжении, МН/м2 (кге/дем2) Относительное удлинение, % Твердость по Бринеллю, НВ
20X13 400- 450 (40—45) 25-38 140—160
40X13 850 (85) 15 480
08X17 500 (50) 27 175
15X28 600 (60) 25 180
7F ^7
Концентра ция HNO3,% К онцентрацияУМ^,%
а б
Рис, 63. Скорость коррозии хромистых
сталей в кипящих растворах азотной
кислоты:
а - сталь, содержащая 13% хрома; / — со-
держание углерода 0,1%; 2 — содержание
углерода 0,4%; б — сталь, содержащая 17%
хрома; / — содержание углерода 0,35%;
2 — содержание углерода 0,1%
чением окислительных свойств среды, их электродные по-
тенциалы становятся еще более положительными, однако
при увеличении концентрации азотной кислоты коррозия
хромистых сталей рез-
ко интенсифицируется
вследствие наступле-
ния перепассивации
(рис. 63). При содер-
жании хрома в стали
>25% системы Fe—
С—Сг устойчивы в
«царской водке» и в
такой агрессивной сре-
де, как 30%-ный раст-
вор хлорида железа
(II). В разбавленных
растворах серной кис-
лоты и в соляной кис-
лоте хромистые стали
неустойчивы, посколь-
ку в неокислительных
средах защитная пас-
сивная пленка не обра-
зуется. Сернистая кислота и органические кислоты (му-
равьиная, винная, щавелевая), особенно при нагревании,
разрушают эти сплавы.
В разбавленных щелочных растворах хромистые ста-
ли при обычных температурах устойчивы, но при повы-
шенных температурах в концентрированных растворах и
расплавах щелочей они малоустойчивы.
Хромистые стали подвержены межкристаллитной кор-
розии, что связано с выпадением по границам зереп, бо-
гатых хромом карбидов и обеднения хромом твердого
126
раствора. Межкристаллитную коррозию можно снизить
легированием их титаном, ниобием. Хромистые стали под-
вергаются различным видам механической обработки;
они хорошо отливаются, штампуются и прокатываются.
Нержавеющие стали как конструкционный материал
широко используются в химической, нефтеперерабатыва-
ющей, пищевой промышленности и как декоративный
материал — в архитектуре и автомобилестроении. Кро-
ме того, они применяются для изготовления режущих ин-
струментов, штампов, лопаток паровых турбин.
Железоникелевые сплавы не применяются в качестве
конструкционных материалов, так как они не имеют осо-
бых преимуществ в сравнении с хромистыми сталями, по-
этому часто используют стали на основе системы
Fe — Сг — Ni — С. Введение никеля изменяет структуру
и положительно влияет иа свойства сплава (измельчает
зерно).
Стали сочетают высокую пластичность и вязкость с
достаточной прочностью и жаропрочностью. Прочность
таких сталей можно значительно увеличить путем холод-
ной деформации, например, предел прочности стали по-
вышается с 550 до 1180 МН/м2 (с 55 до 118 кгс/мм2),
предел текучести — с 200 до 1100 МН/м2 (с 20 до
НО кгс/мм2). Наилучшие показатели в отношении меха-
нических свойств имеют хромистоникелсвыс стали с со-
держанием углерода от 0,10 до 0,15%.
Высоколегированные хромоникелевые стали устойчи-
вы в азотной кислоте при концентрациях не выше 80%
и температуре до 70° С, а в соляной кислоте неустойчи-
вы. В фосфорной кислоте они устойчивы при температуре
до 100°С и концентрации не выше 60%. В большинстве
органических соединений (кислоты, спирты и др.), в рас-
творах нитратов, сульфатов и хлоридов, в сухом хлоре
и сернистом газе, в оксидах азота, сероводороде, окецде
углерода (II) хромоникелевые стали достаточно устой-
чивы. При высоких концентрациях растворов азотной
кислоты хромоникелевые сплавы, так же как и хроми-
стые, пз-за перехода хрома в оксиды высшей степени
окисления подвергаются перепассивации, и пассивные
пленки теряют защитные свойства.
Для повышения стойкости хромоникелевой стали
в неокислительных средах в качестве легирующих
присадок вводят молибден, медь, кремний и др.
Так, хромоникельмолибденовые стали (10Х17Н13М2Т;
127
10X17H13M3T), содержащие 2—3% молибдена, сочета-
ют сравнительно высокую прочность с очень высокими
пластическими свойствами и высокой ударной вязкостью.
Эти стали хорошо свариваются, протягиваются и штампу-
ются. Стали, содержащие молибден, склонны к пассива-
ции как в окислительных, так и в восстановительных сре-
дах и в средах, содержащих хлорид-ионы. Хромоникель-
молибденовые стали применяются для изготовления ап-
паратуры, работающей в сильно агрессивных средах, на-
пример, в 10 12%-ных растворах серной кислоты при
40—50° С, в горячих растворах сернистой кислоты, в го-
рячей фосфорной кислоте, в кипящих растворах уксус-
ной, щавелевой и муравьиной кислот.
В СССР разработаны марки . высоколегирован-
ных сталей на основе сложной системы
Fe—Сг—Ni—Мо—Си—С. Коррозионная стойкость хро-
моникельмолибдепомедистых сталей в некоторых агрес-
сивных средах очень велика, например, в растворах сер-
ной кислоты до 80%- Такие стали широко используются в
химической, целлюлозной, пищевой, автомобильной и
других отраслях промышленности.
Под жаростойкостью принято понимать способность
материала противостоять коррозионному разрушению
под действием воздуха или других газов при высоких
температурах. К жаростойким сталям относятся сплавы,
содержащие алюминий, хром, кремний. Такие стали не
образуют окалины при высоких температурах, например,
хромистая сталь, содержащая 30% Сг, .устойчива до
-1200°С. Влияние содержания хрома на жаростойкость
стали с содержанием 0,5% углерода приведено на рис. 64.
Введение небольших добавок алюминия резко повышает
жаростойкость хромистых сталей (рис. 65). Стойкость
таких материалов при высоких температурах объяеня-
ется образованием па их поверхности плотных защитных
пленок, состоящих, главным образом, из оксидов леги-
рующих элементов (хрома, алюминия, кремния).
Основные области применения жаростойких сталей
как конструкционного материала — изготовление раз-
личных деталей нагревательных устройств и энерге-
тических установок.
Под жаропрочностью принято понимать способность
материала выдерживать механические нагрузки без де-
формаций при определенных повышенных температурах.
К числу жаропрочных относятся стали, содержащие
128
хром, кремний, молибден, никель и др. Они сохраняют
свои прочностные свойства при нагреве до 650° С и более.
Из таких сталей изготовляют греющие элементы тепло-
Рпс. 64. Скорость окисления
сталей с 0,5%-ным содержа-
нием углерода в зависимости
от концентрации хрома в
сплаве
Рис. 65. Зависимость ско-
рости окисления жаро-
стойкой стали (С = 0,1,
Сг = 6, Мо —0.5%) при
800° С от содержания
алюминия в сплаве
обменной аппаратуры, детали котлов, впускные и выпуск-
ные клапаны автомобильных, тракторных поршневых
двигателей.
2. Титан и его сплавы
В техническом прогрессе многих отраслей народного
хозяйства все большую роль играет титан. Открытый
около 200 лет назад, он лишь недавно привлек к себе
внимание как конструкционный металл, обладающий
уникальным комплексом ценных свойств. По распростра-
ненности в природе он занимает среди важнейших метал-
лов одно из первых мест.
Обычная технология плавки при получении титана
использоваться не может, так как в расплавленном со-
стоянии титан реагирует с газами и материалом тигля.
Титан получают восстановлением тетрахлорида титана
магнием или натрием. В результате образуется металли-
ческий титан в виде хлопьевидных дендритов, так назы-
ваемая титановая губка. Это тускло-серая пористая мас-
са, которую в дальнейшем очищают в вакуумных элек-
тропечах.
5—3504
129
Сплавы на основе титана (табл. 13) получают плав-
лением измельченной губки с добавлением легирующих
элементов. Введение в состав сплава добавок алюминия,
ванадия, олова, марганца, хрома повышает прочностные
свойства титана, а добавки палладия, молибдена, тан-
тала повышают коррозионную стойкость. Как легирую-
щие элементы при получении титановых сплавов исполь-
зуют цирконий, кремний, ниобий, медь и др.
Таблица 13
Механические свойства титана и его сплавов
Сплав Предел прочности при рас- тяжении, МН/м8 (кгс/мм2) Относительное удлинение, % Относительное сужение, %
ВТ1 450—600 (45—60) 25 50
ОТ4 700—850 (70—85) 15—40 25-55
ВТ9 1140—1300 (114—130) 9—14 25-45
ВТ14 1150—1400 (115—140) 6—10 —
Технически чистый титан ВТ1 хорошо обрабатывается
всеми известными механическими методами. Он свари-
вается, прокатывается, обрабатывается резанием, из него
можно штамповать, прессовать и ковать детали.
По коррозионной стойкости в агрессивных средах ти-
тан превосходит такие широко используемые конструк-
ционные материалы, как нержавеющие стали, алюминий
и его сплавы.
Нормальные стандартные потенциалы титана для
процесса (Ti^*Ti2++2 е~~)— 1,63 В и для (Ti^Ti3++
+3е~)—1,21 В, электроотрицательны, т. е. это химиче-
ски активный элемент. Инертность титана при обычных
температурах объясняется образованием на его поверх-
ности защитной оксидной пленки типа рутила (ТЮг).
В окислительных средах титан устойчив в присутст-
вии хлорид-ионов. По стойкости в растворах азотной и
хромовой кислот титан превосходит все металлы. Так, в
азотной кислоте он устойчив вплоть до температуры ки-
пения. При обычных температурах на титан не действу-
ет «царская водка». В органических кислотах (молочная,
уксусная, стеариновая и др.) отполированная поверх-
ность титана даже не утрачивает своего блеска.
Металл стоек во влажном хлоре (в сухом — неустой-
чив), к газовой сере и ее соединениям. В слабых раство-
130
pax плавиковой, муравьиной, щавелевой и концентриро-
ванных соляной и серной кислот защитный слой не об-
разуется и происходит интенсивная коррозия металла.
В расплавах солей и металлов коррозионная стой-
кость титана неодинакова: так, в расплаве хлорида нат-
рия при наличии контакта с воздухом титан сильно кор-
родирует, а в атмосфере инертных газов коррозия не-
значительна. В расплавленном висмуте, олове, свинце
при 300° С, калии, натрии при 600° С, расплавленной сере
при 240° С титан устойчив, а в расплавах цинка интен-
сивно корродирует. В отдельных случаях, например в
15%-ном растворе серной кислоты, в дымящейся азотной
кислоте, титан склонен к межкристаллитной коррозии.
В атмосферных условиях скорость коррозии титана
не превышает 0,0001 мм/год. В морской воде титан прак-
тически не подвергается коррозии. Рассчитанная ско-
рость коррозии титана в морской воде составляет всего
.2-10-5 мм/год. .
Сплавы-титана с молибденом (3—5%) достаточно
хорошо устойчивы в растворах соляной, серной и фос-
форной кислот. Высокие коррозионные и механические
свойства имеют сплавы с 32—34% Мо. Но они неустой-
чивы в концентрированных растворах серной и азотной
кислотах.
Сплавы титана, содержащие более 40% тантала, об-
ладают коррозионной стойкостью в таких сильно агрес-
сивных средах, как кипящие растворы 20%-ной соляной,
30%-ной серной кислот (табл. 14).
Таблица 14
Коррозионная стойкость сплавов титана
в кипящих растворах кислот, мм/год
Состав сплава, % Кислоты
20%-ная НС] 30%-ная H2S04 60%-ная H2S04 20%-ная Н,Р04 1%-ная С2О4На
40Та, 60Ti 0,99 0,13 0,10 0,007 1,62
50Та, 50Ti 0,025 0,017 — 0,017 0,114
бОТа, 40Ti 0,015 0,000 — 0,000 0,017
Удачное сочетание физико-механических и антикор-
розионных качеств делает титан и его сплавы незамени-
мым конструкционным материалом для авиационной, ав-
томобильной, судостроительной, атомной, химической и
5* 131
других отраслей индустрии. Титан и его сплавы могут
быть применены для работы более чем в 130 агрессив-
ных средах.
Замена титаном стали в сплавах, используемых для
производства рам и осей грузовиков и автоприцепов, поз-
воляет увеличивать их полезную грузоподъемность и
срок службы. Благодаря применению в сплавах титана
снижается масса автомобильных и дизельных двига-
телей.
Большой эффект дает использование титана в произ-
водстве арматуры химических аппаратов, приборов п
т. п., а также в гальванотехнике. Например, титановые
крючки и подвески для изделий, погружаемых в гальва-
нические ванны, выдерживают до 4 000 операций, тогда
как алюминиевые всего лишь 200. Эффективность широ-
кого использования титана и его сплавов в народном
хозяйстве трудно переоценить.
3. Молибден, цирконий, бериллий и их сплавы
Молибден. Мо и его сплавы обладают комплексом
свойств, исключительно ценных для техники. Т. пл. Мо
2610° С. Предел прочности на разрыв для листового мо-
либдена 1200 МН/м2 (120 кгс/мм2), относительное удли-
нение 10—12%. Металлический молибден (в виде порош-
ка) получают восстановлением чистой МоО3 в токе во-
дорода. Образующийся порошок затем прессуют под дав-
лением 200—300 МН/м2 с последующим спеканием в ат-
мосфере водорода. Спеченные заготовки обрабатывают
давлением (прокатка, ковка, протяжка). Образцы мас-
сой 500—2 000 кг получают дуговой плавкой.
Механические свойства молибдена зависят от чисто-
ты металла и предшествующей механической и термиче-
ской его обработки. Молибден устойчив в растворах со-
ляной, плавиковой, фосфорной, муравьиной, уксусной,
щавелевой кислот при обычных температурах. Присут-
ствие окислителей пли аэрация растворов приводит к
резкому усилению коррозионного процесса. В азотной,
серной и соляной кислотах молибден быстро растворя-
ется при 80—100° С. Со щелочами молибден в отсутст-
вие окислителей ие взаимодействует. Он устойчив в рас-
плавленном натрии, свинце, магнии.
Па воздухе и в кислороде при обычной температуре
молибден устойчив, но при 600° С и выше металл быстро
132
окисляется. Пары воды активно реагируют с молибде-
ном при 600—1 000° С, образуя оксиды молибдена п во-
дород. Он разрушается фтором (20°С), хлором (свыше
250°С), бромом (свыше 450°С).
Коррозионная стойкость молибдена повышается ле-
гированием металла небольшими количествами титана,
циркония и ниобия. Сплавы на основе молибдена исполь-
зуются, главным образом, как жаропрочные конструкци-
онные материалы. На основе систем Мо—Ti,
Мо—Ti—Zr—С, Мо—Re и других созданы промышлен-
ные сплавы, обладающие хорошими механическими и тех-
. нологическими свойствами. Среднее значение предела
' прочности на разрыв для сплавов молибдена составляет
при 20° С 700—800 МП/м2 (70—80 кгс/мм2), а при 1200° С
300—450 МН/м2 (30—45 кгс/мм2) при средней величине
относительного удлинения в этих условиях соответствен-
но 7—30 и 10—15%.
Молибден и сплавы на его основе применяют как кон-
струкционный материал в производстве электроосвети-
тельных ламп и электровакуумных приборов (радиолам-
пы, генераторные лампы, рентгеновские трубки). Мо-
либденовая проволока и лента применяются в качестве
нагревателей для высокотемпературных печей. 70—80%
выпускаемого промышленностью молибдена идет на про-
изводство легированных сталей.
Цирконий. Zr обладает низкими прочностными свой-
ствами при высокой пластичности и удельной прочности.
Он обладает высокой способностью поглощать нейтро-
ны, поэтому его применяют в атомной технике, в част-
ности, в конструкциях ядерных реакторов.
Получение чистого металлического циркония — труд-
ная технологическая задача, поскольку цирконий обла-
дает высокой химической активностью. Губчатый цирко-
ний чаще всего получают магнийтермическим способом
(подобно процессу получения титана). После двойного
переплава в дуговых печах получают однородные по со-
ставу и структуре высокопластичные циркониевые
слитки. Механические свойства циркония (табл. 15) оп-
ределяются степенью чистоты металла и методом его об-
работки.
Высокая коррозионная стойкость циркония в средах
электролитов объясняется наличием на его поверхности
защитной пленки ZrO2. Он устойчив в растворах любых
концентраций азотной, соляной (до 100°С), фосфорной
133
Таблица 15
Механические, свойства циркония
1°, с Предел прочности при растяжении, МН/м1 (кгс/мм1) Предел прочности при изгибе, МН/м1 (кгс/мм1) Относительное удлинение, %
20 344 (34,4) 205 (20,5) 34
200 182 (18,2) 107 (10,7) 52
500 79 (7,9) 53 (5,3) 100
(до 60° С) кислот, в растворах серной кислоты с кон-
центрацией до 50% (до 100°С), в органических кисло-
тах. Более крепкие растворы серной кислоты, а также
плавиковой разрушают цирконий. Под действием хлор-
ной и бромной воды при обычных температурах цирко-
ний становится хрупким. По отношению к растворам
щелочей цирконий более стойкий материал, чем титан.
В расплавах щелочных металлов цирконий устойчив до
600° С.
В газовых средах цирконий стоек при комнатной тем-
пературе, но с повышением температуры он взаимодей-
ствует с большинством промышленных газов.
Легирование циркония оловом (до 2,5%), железом,
никелем или хромом (до 1,0%) ревко улучшает антикор-
розионные качества циркония. Для получения сплавов
циркония, применяемых главным образом для конструк-
тивного оформления ядерных реакторов, используют та-
кие легирующие элементы, как алюминий, ниобий, мо-
либден и др.
Цирконий и сплавы на его основе используют в элек-
тронике, в электровакуумных приборах, а также в меди-
цинской промышленности.
Бериллий. Be легкий светло-серый металл с пл.
1,5-103 кг/м3 и т. пл. 1284° С. Он обладает наиболее вы-
сокой из всех металлов теплоемкостью и высоким моду-
лем упругости. Механические свойства бериллия зави-
сят от чистоты металла и характера обработки. Предел
прочности при растяжении бериллия 200—550 МН/м2
(20—55 кгс/мм2), а относительное удлинение 0,2—2%.
Бериллий обладает высокой химической активностью, но
благодаря образованию тонкой прочной защитной пленки
оксида бериллия, он устойчив на воздухе, в концентриро-
ванной азотной кислоте, но легко разрушается под дей-
134
ствием раствора соляной, плавиковой, разбавленной сер-
ной кислот. В водных растворах щелочей бериллий раз-
рушается с образованием бериллатов.
Коррозионная стойкость бериллия в газовых средах
также невысокая. При комнатной температуре бериллий
реагирует с фтором, а при повышенных температурах с
другими галогенами и сероводородом. Бериллий находит
применение в приборостроении, в авйа-ракетно-космиче-
ской технике и для получения сплавов. Из бериллиевой
бронзы изготовляют сотни видов деталей и изделий для
автомобилей, авиационной, часовой, приборостроитель-
ной техники. Использование бериллия и его оксидов в ка-
честве замедлителей и отражателей нейтронов позволя-
ет значительно уменьшить размеры активной зоны атом-
ных реакторов, добиться максимального повышения тем-
пературы в реакторах и высокоэффективно использовать
ядерное топливо.
Глава XV
НЕМЕТАЛЛИЧЕСКИЕ КОНСТРУКЦИОННЫЕ МАТЕРИАЛЫ
Неметаллические коррозионно-стойкие конструкцион-
ные материалы достаточно широко распространены в
различных отраслях индустрии. Применение таких мате-
риалов для изготовления различной аппаратуры позво-
ляет заменить дорогостоящие металлы. Они подразде-
ляются на материалы неорганического и органического
происхождения. К материалам неорганического проис-
хождения относятся, в основном, силикатные материалы,
а к материалам органического происхождения — матери-
алы на основе полимеров.
1. Силикатные материалы
В состав силикатных материалов входят различные
соединения кремния с другими элементами. Как прави-
ло, их получают методом плавления или спекания раз-
личных горных пород. К ним относят и ряд материалов,
не содержащих кремний: магнезитовые, хроммагнезито-
вые и другие высокоогнеупорные материалы.
Каменное литье. Каменное литье — это группа мате-
риалов и изделий, получаемых из расплавов горных по-
род (базальтов, диабазов) и промышленных отходов
(шлаков, золы) с последующей термической обработкой.
135
Варьируя состав сырья и параметры технологического
режима, можно получить материалы с определенными
эксплуатационными свойствами. С целью увеличения
прочности и надежности некоторые изделия из каменного
литья армируют стальной проволокой.
Свойства одного из видов каменного литья, получен-
ного из базальта, характеризуются следующими данны-
ми: предел прочности на сжатие 250 -500 МН/м2 (25—
50 кгс/мм2); предел прочности на изгиб 40—80 МН/м2
(4—8 кгс/мм2). Они устойчивы в серной и соляной кисло-
тах. Сочетание таких свойств позволяет применять из-
делия из каменного литья в различных отраслях народ-
ного хозяйства.
Кварцевое стекло. Кварцевое стекло получают плав-
лением горного хрусталя, кварцевых песков с содержа-
нием 98—99% оксида кремния (IV) при 1700°С с после-
дующей переработкой стекломассы в изделия. В зависи-
мости от исходного сырья получают прозрачное и непро-
зрачное стекло. Прозрачное кварцевое стекло (не со-
держащее видимых пузырьков воздуха) изготовляется
из горного хрусталя и применяется в оптике и приборо-
строении. А непрозрачное получают из чистого кварцевого
песка в электрических печах с угольным или графитовым
электродом. Изделия из кварцевого слитка получают
выдуванием или прессованием. Из него готовят изделия,
выдерживающие длительное нагревание до 1 100° С и
кратковременное — до 1 300—1 400° С.
Кварцевое стекло имеет наивысшую термостойкость
по сравнению с другими стеклами (800°С), низкий ко-
эффициент термического расширения (а=5,8х
X 10-7 град-1), высокую температуру размягчения
(1470°С), прозрачность для всех радиаций, малую элек-
тропроводность и высокие электроизоляционные свой-
ства.
Растворы кислот, кроме плавиковой и ортофосфорной
(выше 300° С), не разрушают изделий из кварцевого стек-
ла. Оксиды кальция, магния, цинка, железа, алюминия
при температурах до 800° С и расплавленные металлы:
олово, свинец — не реагируют с ним. Менее устойчиво
кварцевое стекло к воздействию растворов щелочей и
основных солей, а расплавленные медь, алюминий, се-
ребро его интенсивно разрушают.
Из непрозрачного кварцевого стекла изготовляют
трубы длиной до 1 500 мм при диаметре 300 мм, сосуды
136
• емкостью до 100 л, вакуумные аппараты, работающие
при нагревании под низким давлением.
Силикатное стекло. Химический состав стекла выра-
жают общей формулой xR2O • r/RO • zRO2, где R2O—-окси-
! ды щелочных металлов: Na2O, К2О, Li2O и др.; RO — ок-
сиды щелочноземельных и тяжелых металлов: CaO, MgO,
ВаО, РЬО и др.; RO2 — диоксид кремния, А12О3, Р2О5,
। В2О3. Типичные составы некоторых стекол, выпускаемых
f промышленностью, приведены в табл. 16.
Таблица 16
Типичные составы некоторых промышленных стекол (%)
Марка стекла Оксиды металлов
S1O2 Na «О СаО MgO К.О Al 2O3 В2Од
Оконное 7'2 12 11 2,5 1,5 1
Бутылочное 74 17 5 4 — — —
«Пирекс» 80 4 — —. — 3 13
Кислотные оксиды придают стеклу высокую механи-
ческую прочность, определяют его химическую и терми-
ческую стойкость. Оксиды щелочноземельных металлов
влияют на вязкость стекла, а оксиды щелочных металлов
снижают его твердость, понижают температуру плавле-
ния, а также ухудшают термические и химические свой-
ства стекла.
Ситаллы и шлакоситаллы. Ситаллы — это *продукт
полной или частичной кристаллизации стекол с очень
мелкими, достаточно равномерно распределенными по
объему материала кристаллами, сросшимися друг с дру-
гом или соединенными тонкими прослойками остаточ-
ного стекла.
. Они тверже высокоуглеродистой стали, легче сплавов
алюминия, а. по химической стойкости уступают лишь
благородным металлам. Сырьем для получения стекло-
кристаллических материалов служат горные породы, ме-
таллургические и топливные шлаки, отходы стекольной
промышленности.
Технические ситаллы изготовляют из стекла, полу-
ченного на основе оксидов с добавками специальных
катализаторов, чуобы проходил нужный процесс кристал-
лизации.
Процесс кристаллизации проводят из расплавленного
137
стекла строго определенного химического состава в при-
сутствии катализаторов и получают изделия, которые
при охлаждении имеют стеклообразное состояние. Затем
при повторном нагреве до температуры стеклования
(400—600° С) в стекле происходит возникновение заро-
дышей кристаллизации (кристаллы катализатора), ко-
торые растут до определенных размеров, становясь цен-
трами кристаллизации других фаз, выделяющихся при
дальнейшем нагревании. Обязательно проводят термиче-
скую обработку изделий. Для предотвращения размягче-
ния и деформаций ее ведут в две стадии: при 500—700
и 900—1 100° С. В результате такой термической обра-
ботки изделие имеет кристаллическое, строение (95%
кристаллической фазы) с размерами кристаллов до
2 мкм. В качестве катализаторов используют соединения
благородных металлов, которые выделяются в стекле в
результате облучения изделий проникающей радиацией
(фотоситаллы), а также фториды и фосфаты щелочных
и щелочноземельных металлов, диоксид титана и др.
(термоситаллы).
Ситаллы имеют высокую химическую стойкость, они
устойчивы в растворах кислот (кроме фтористоводород-
ной) и щелочей. Из ситаллов изготовляют трубы для
теплообменников (d = 3—100 мм), подшипники, рабо-
тающие без смазки при температурах до 540° С, поршни
и цилиндры в двигателях внутреннего сгорания, реакци-
онные аппараты и т. п. Ситаллы — незаменимый мате-
риал для изготовления изоляторов.
Большие перспективы имеют шлакоситаллы, разрабо-
танные в СССР, которые уже используются в машино-
строении, приборостроении, в гражданском и промыш-
ленном строительстве.
Кислотоупорные керамические материалы. Природ-
ные материалы, содержащие более 60% диоксида
кремния, обладают высокой химической стойкостью в
большинстве агрессивных сред, особенно в растворах
кислот (кроме HF). Среди природных’кислотоупоров на-
иболее часто в промышленности используют граниты,
бештаунит, андезит. Они используются для изготовления
химической промышленной аппаратуры. Андезит и беш-
таунит применяют и в качестве обкладочных материалов.
Кислотоупорный материал — асбест применяют в набив-
ках, прокладках, фильтрующих тканях в качестве напол-
нителя.
138
Сырьем для получения кислотоупорных керамических
материалов служат тугоплавкие и огнеупорные глины,
спекшийся шамот (или бой каменно-керамических из-
делий) и вещества, снижающие температуру спекания
массы, например полевой шпат. Термическую и химиче-
скую стойкость изделий повышают введением в состав
массы талька, глинозема, диоксида циркония. Керамиче-
ские массы готовят тщательным смешением компонен-
тов с последующим вылеживанием смеси (от 2 до 20
дней) при 20—30° С и относительной влажности около
95%. Избыток воды из массы удаляют в фильтр-прессах.
Подготовленная масса далее поступает на формование
изделий.
Химически стойкие изделия получают пластическим
способом, реже — литьем, а крупные и сложной формы
формуют вручную. После формования их сушат и обжи-
гают при 1150—1250° С.
Кислотоупорные материалы характеризуются плот-
ным спекшимся черепком, непроницаемы для жидкостей
и газов, обладают высокой устойчивостью к воздействию
кислот и щелочей и имеют достаточно высокую проч-
ность.
Из кислотоупорной керамики готовят аппаратуру,
применяемую в химической и других отраслях промыш-
ленности (ванны для электролиза, реторты, царги, ча-
сти насосов, трубы, баллоны для хранения кислот), фу-
теровочные изделия (кирпич, плитки для футеровки стен
котлов, смесителей, сосудов), кольца для наполнения
поглотительных башен и т. д. Кислотостойкость получен-
ных изделий колеблется от 96 до 98,5%, водопоглоще-
ние — от 1,5 до 7%, а предел прочности при сжатии со-
ставляет от 40 до 130 МН/м2 (4—13 кгс/мм2).
Цементы и бетоны. Цементами принято называть
вяжущие вещества, образующие при смешении с водой
пластическую массу, удобную для формования, которая
со временем превращается в прочное камнеподобное те-
ло. В зависимости от свойств цементы разделяют на воз-
душные, гидравлические, кислотоупорные, щелочностой-
кие и другие вяжущие вещества. Воздушные вяжущие
вещества затвердевают и сохраняют свои свойства лишь
на воздухе, гидравлические на воздухе и в воде. Кисло-
тоупорные цементы сохраняют прочностные свойства в
растворах минеральных кислот, что объясняется нали-
чием в их составе кислотных оксидов. Щелочностойкие
139
цементы устойчивы в растворах щелочен, этому качест-
ву способствует наличие в их составе щелочных оксидов
(оксиды магния, кальция).
Наиболее распространены в промышленности вяжу-
щие материалы, называемые портландцементами, кото-
рые получают обжигом глины и известняка или природ-
ных мергелптов при 1300—1 500° С. Клинкер, получае-
мый после обжига, в своем составе содержит в основном
3CaO-SiO2; 2CaO-SiO2; ЗСаО-А12О3; 4СаО-А12О3-
•Fe2O3. После охлаждения клинкер смешивают с добав-
ками (шлаки, трепел и др.), а затем измельчают. Полу-
ченный порошок и называют портландцементом, свойст-
ва которого определяются химическим, минералогичес-
ким составами и тониной помола порошка с удельной
поверхностью 30 000—40 000 м2/кг. При взаимодействии
компонентов портландцемента с водой происходит их
гидролиз и гидратация, что приводит к твердению массы,
например, для трнкальцийсиликата процесс протекает
по схеме
ЗСаО- SiO2 + иН2О 2СаО- SiO2 (и - 1) Н2О + Са (ОН)2
Маркировка портландцементов — 300, 400, 500, 600.
Цифра указывает предел прочности стандартных образ-
цов после 28-дпевного твердения при сжатии в МН/м2Х
ХЮ-1 Для изделий из портландцемента характерна вы-
сокая механическая прочность, водонепроницаемость,
долговечность, однако они заметно разрушаются в агрес-
сивных средах и имеют термостойкость всего до 200° С.
Кислотоупорный цемент получают смешением вод-
ного раствора жидкого стекла (силиката натрия) с кис-
лотоупорным наполнителем (андезит, диабаз, базальт
и т. п.) и ускорителем твердения (кремнийфторид нат-
рия). Предел прочности на сжатие образца из кислото-
упорного цемента через 28 суток составляет 1.6,0—
17,0 МН/м2 (1,6—1,7 кгс/мм2). Цементы применяются в
основном для получения бетона. Бетоном называют
искусственный каменный материал, получаемый из вя-
жущего вещества (цемента), заполнителей и добавок.
Физико-технические свойства бетонов определяются ве-
совым соотношением между цементом и заполнителем
(оно меняется от 2 до 10) и цементно-водным соотноше-
нием. Прочность бетона при сжатии можно определить по
формуле
/?28 = оЯц (U/B-0,
140
где Rzs — прочность бетона при сжатии через 28 суток;
/?ц—прочность цемента; Ц/В— цементно-водное соотно-
шение; а п б — коэффициенты, зависящие от вида цемен-
та и заполнителей (а = 0,4—0,5; 6 = 0,45—0,50).
Прочность бетонов при сжатии колеблется в зависи-
мости от их объемной массы в пределах от 2,5 до
40 МН/м2 (0,25—4 кгс/мм2). Бетоны неустойчивы в сре-
дах минеральных кислот и щелочей, они проницаемы для
нефтепродуктов (бензин, керосин).
Кислотоупорные бетоны готовятся на основе кислото-
упорных цементов, используя в качестве заполнителей
природные или искусственные силикатные материалы —
андезит, диабаз, плавленый базальт. Такие бетоны ус-
тойчивы в растворах минеральных кислот и их солей, не-
проницаемы для агрессивных газов (оксиды азота, окси-
ды серы (IV) и (VI), хлор), но неустойчивы в щелочных
средах.
Огнеупорные бетоны состоят из 15—20% цемента
(портландцемент, кислотоупорный пли глиноземистый
цементы) и 85—80% заполнителя (высокоглппоземпстый
шамот, хромит, хромомагнезит и др.). При получении
термоизоляционных (пористых) бетонов в качестве за-
полнителя используют пористый шамот. Огнеупорные
бетоны быстро твердеют при обычных температурах,
имеют незначительную усадку (при сушке и обжиге),
высокую огнеупорность и температуру деформации под
нагрузкой и высокую термическую стойкость. Области
применения огнеупорных бетонов различны. Так, хроми-
товые бетоны применяются при температурах до 1 300—
1500° С, а бетон на основе глинозема и оксида титана
(IV)—до 1850° С. Огнеупорные бетоны служат обкла-
дочным материалом для дверей коксовых печей, изоля-
ции барабанов котлов ТЭЦ, печей обжига колчедана).
Полимербетоны получают введением различных поли-
мерных материалов в бетонную смесь (асфальтов, биту-
мов, синтетических каучуков, феиолоформальдегидных и
кремнпйорганических смол и т. д.). Свойства полимербе-
тонов зависят от характера и количества полимера, вво-
димого в бетонную смесь. Так, поливинилацетатные бе-
тоны устойчивы к концентрированным и разбавленным
щелочам, к бензолу, дибутилфталату, морской воде, но
не устойчивы в кислотах. Каучукбетоны устойчивы к мор-
ской воде, а полимербетоны, содержащие хлоропрено-
вый, тиоколовый каучук или саран, малоустойчивы.
141
Полимербетоны обладают повышенной износостой-
костью. Так, истираемость полимербетона, содержащего
полпвинилацетат, в несколько раз меньше по сравнению
с обычным бетоном того же состава. Полимербетоны
применяются для изготовления различных химически
стойких покрытии, декоративной отделки железобетон-
ных конструкции, гидроизоляции, для строительства до-
рог, перронов, аэродромов и т. п.
2. Пластические массы
Пластическими массами называют высоко-
полимерные материалы или композиции их с органиче-
скими или неорганическими веществами, способные при
определенных условиях (давлении и температуре) пере-
ходить в пластическое состояние и принимать под дей-
ствием- нагрузок заданную форму. Пластические массы
сочетают ряд ценных свойств. Они имеют низкую плот-
ность, устойчивы к атмосферной коррозии, ко многим
кислотам и щелочам, растворам солей, являются тепло-
изоляционными материалами, хорошими диэлектриками,
могут быть оптически- и радиопрозрачными, упругими
или эластичными. Они легко формуются в изделия, обра-
батываются резанием, а некоторые из них по удельной
прочности превосходят углеродистые стали и сплавы
цветных металлов. Но пластмассы имеют низкую тепло-
стойкость, теплопроводность, твердость, подвержены ста-
рению. Свойства некоторых пластмасс см. табл. 17.
В качестве конструкционных материалов наибольшее
применение находят простые (ненаполненные, гомоген-
ные) и сложные (композиционные, гетерогенные) пласти-
ческие массы. Простые пластмассы получают только из
одного высокомолекулярного соединения — смолы (на- .
пример, из полиэтилена), и поэтому свойства таких
пластмасс определяются свойствами самого полимера.
Сложные пластмассы состоят из смолы-полимера, выпол-
няющего функции связующего, наполнителей, пластифи-
каторов, красителей, стабилизаторов, отвердителей и т. д.
Наполнители придают пластмассам определенные
механические и диэлектрические свойства, снижают го-
рючесть и стоимость изделий, улучшают внешний вид.
В качестве наполнителей применяют порошковые (дре-
весная, кварцевая мука, графит, и др.), волокнистые
(натуральные, асбестовые и синтетические волокна),
листовые (бумага, ткани, древесный шпон) материалы.
142
со
Свойства некоторых пластмасс
Таблица 17
Свойства Полиэтилен высокого давления Полипро- пилен Полистирол блочный Винипласт Фторопласт-4 Текстолит Фаолит
Плотность, кг/м3-103 0,916- 0,9 1,05- 1,38-1,43 2,3 1,3-1,4 1,5—1,65
-0,935 -1,08
Температура размяг- чения, °C 108-120 168 90 80 310 125 150
Термостойкость, °C 100 150 70 70 260
Предел прочности, МН/м2 (кгс/мм2): 120—140
при изгибе 12—17 120 (12) 37,5—55 90 (9) — 30—60
(1,2—1,7) (3,8—5,5) (12—40),’ (3-6)
при сжатии 10—12 65—70 (6,5—7) 10 (1,0) 80—100 12—20 230—250 50—90
(1-1,2) (8-10) (1,2—2,0) (23—25) (5-9)
при растяжении 12—16 35 (3,5) 35 (3,5) 40—60 25 (2,5) 80—100 20—30
(1,2—1,6) 1,5 (4-6) 250 (8-10) (2-3)
Относительное удли- нение, % 150—600 350 10-25 Ю12—10s* — —
Удельное объемное 1015 8-Ю13 1014—101Е 1016 10е ю4
электросопротивление, Ом -и
Электрическая проч- ность, МВ/м 45—60 35 20-25 15-45 20-30 6-8
Пластификаторы — вещества, вводимые в состав
пластмасс для повышения их пластичности и эластично-
сти в условиях переработки и эксплуатации. Некоторые
пластификаторы улучшают такие свойства пластмасс,
как негорючесть, термо- и светостойкость. В качестве
пластификаторов применяют эфиры, ароматических и
алифатических карбоновых кислот, полиэфиры, эфиры
фосфорной и других кислот (дибутилфталат, трикрезил-
фосфат и др.). Красители придают пластическим массам
желаемую окраску. Они должны хорошо смешиваться и
совмещаться с полимером и выдерживать воздействие
температуры, сохраняя цвет как при формовании изде-
лия, так и при его применении.
Отвердители — вещества, способные превращать ли-
нейную структуру полимера в результате сшивания мак-
ромолекул в сетчатую структуру (уротропин, гексаме-
тилентетраамии и др.). В состав сложных пластмасс вво-
дят стабилизаторы вещества, способствующие сохра-
нению пластмассой,первоначальных свойств; смазки, об-
легчающие прессование изделии; порообразователи для
получения псно- и поропластов; фунгициды как средство
защиты от разрушающего действия плесени.
Из пластических масс изготовляют обширный пере-
чень серийных деталей и узлов машин, а также техноло-
гическую оснастку различного назначения. Промышлен-
ность СССР выпускает большое количество синтетиче-
ских смол и пластических масс на их основе.
Простые пластические массы. Полиэтилен получают
полимеризацией этилена. Это термопластичный матери-
ал, обладающий высокой коррозионной стойкостью, хо-
рошими диэлектрическими свойствами, высокой ударной
прочностью. Полиэтилен — твердый материал, прозрач-
ный и бесцветный в тонком слое и белый в толстом. Кор-
розионная стойкость полиэтилена достаточно высока к
воде и водяным парам. При обычных температурах по-
лиэтилен разрушается под действием концентрированных
минеральных кислот (серной, соляной, плавиковой), рас-
творов щелочей, но устойчив к разбавленным кислотам
и щелочам. Из пего готовят аккумуляторные баки, кис-
лотостойкие трубы, различную арматуру, высокочастот-
ный кабель, детали радиоаппаратуры, ленты, пленки.
Полипропилен получают поляризацией пропилена.
Это легкий материал, обладающий высокой теплостой-
костью, жесткостью, прочностью. Без нагрузки его мож-
144
но применять до 150° С. По химической стойкости про-
пилен близок к полиэтилену, при несколько большей
механической прочности. Он устойчив к растворам кис-
лот, щелочей, солей, органическим растворителям. В ав-
томобилестроении пропилен используют для изготовле-
ния вентиляционных трубопроводов, лопастей вентиля-
торов, педалей акселератора, для облицовки дверей.
Полистирол получают из стирола (С6Н5СН = СН2).
Полистирол обладает исключительной водостойкостью,
высокими диэлектрическими свойствами. Высокая хими-
ческая устойчивость полистирола к щелочам и кислотам
определила его применение в качестве антикоррозионно-
го материала для изготовления химической аппаратуры,
лабораторной посуды и аккумуляторных баков. Недо-
статки полистирола: низкая теплостойкость, склонность
к старению и низкий предел прочности па удар.
Поливинилхлорид — это белый аморфный порошок,
растворимый при нагревании в хлорированных углеводо-
родах. Он устойчив в растворах кислот и щелочей раз-
личных концентраций. Многие растворители, в том числе
вода, спирт, бензин, не действуют на полимер.
Из поливпнлхлорпда получают конструкционный ма-
териал, называемый винипласт, который обладает высо-
кой механической прочностью и поддается различным
способам механической обработки, хорошо сваривается
и склеивается. Он стоек к воздействию почти всех ми-
неральных кислот и щелочей, к растворам солей любых
концентраций. Разрушается винипласт в сильно окисли-
тельных средах (азотная кислота высокой концентрации,
олеум), растворим в ароматических п хлорированных уг-
леводородах. Винипласт выпускают в виде пленок, лис-
тов. Из него готовят трубы и различные фасонные изде-
лия. К недостаткам винипласта можно отнести склон-
ность его к ползучести, набухаемость в воде, низкую
ударную вязкость.
Из листового винипласта готовят крупные емкостные
аппараты, сложные фильтры, вентиляционные системы в
помещениях с коррозионно-агрессивной средой. В авто-
мобилестроении винипласт используют для звукоизоля-
ции, защиты днища кузова от коррозии, герметизации
сварных швов внутри кузова. В строительстве поливи-
нилхлорид применяется для получения полихлоридвнни-
лового линоле/ма, пенополихлорвинила и полихлорвп-
ниловой пленки.
145
Фторопласты — полимеры производных этилена, в
которых атомы водорода замещены фтором, хлором.
Весьма высокая прочность связи фтора с углеродом оп-
ределяет высокую термическую и химическую стойкость
полимеров на основе фторпроизводных полиэтилена.
Широкое распространение в практике получили политет-
рафторэтилен (фторопласт-4) и политрифторхлорэтилен
(фторопласт-3).
Фторопласт-4 получают водноэмульсионной полимери-
зацией тетрафторэтилена CF2 = CF2. Это рыхлый поро-
шок, легко прессующийся в плотные таблетки, из кото-
рых получают изделия. При нагревании фторопласт не
плавится, а только размягчается.
По химической стойкости политетрафторэтилен пре-
восходит все известные синтетические полимерные мате-
риалы, специальные сплавы, антикоррозионную керами-
ку и даже благородные металлы (серебро, платину, зо-
лото). На фторопласт-4 не действуют разбавленные п
концентрированные кислоты, в том числе «царская вод-
ка», хлорсульфоновая кислота, горячая азотная кислота,
концентрированные щелочи. Политетрафторэтилен нерас-
творим и не набухает ни в одном из известных раствори-
телей, за исключением фторированного керосина. Фторо-
пласт-4 имеет низкий коэффициент трения. Это свойство
полимера используют при изготовлении втулок подшип-
ников скольжения. Кроме того, из фторопласта-4 изго-
товляют электро- и радиотехнические изделия, пленки,
волокна, уплотнительные детали.
Фторопласт-3 получают из трифторхлорэтилена
(CFs^CFCl). Это тонкий рыхлый порошок с т. пл. 210° С,
а при 300—315° С он разлагается. По химической стой-
кости фторопласт-3 уступает фторопласту-4, но превос.-
ходит другие полимерные материалы. Он стоек к дейст-
вию серной и соляной кислот, «царской водки», щелочей,
но при повышенных температурах поддается воздейст-
вию хлорсульфоновой кислоты и расплавов едких щело-
чей. Фторопласт-3 растворяется либо набухает в ксилоле,
бензоле. Из него изготовляют детали насосов, специаль-
ные приборы, мембраны. Особенно широко фторопласт-3
применяют в антикоррозионной технике.
Сложные пластические массы. Фенопласты относятся к
пластическим массам, получаемым на основе поликон-
денсационпых фенолоформальдегидных смол. Большей
частью эти материалы являются термореактивными. Из-
146
делия, получаемые на их основе, эксплуатируются при
повышенных температурах, мало изменяя первоначаль-
ные свойства, но они имеют низкую ударную вязкость.
Фенопласты, как листовые, так и прессованные, пред-
ставляют собой материалы, полученные на основе феноло-
альдегидпых смол, образующихся при взаимодействии
фенолов (фенол, крезол, ксиленол и др.) и альдегидов
(формальдегид, фурфурол, ацетальдегид и др.) в при-
сутствии кислых или щелочных катализаторов.
По отношению к нагреванию фенолоформальдегид-
ные смолы делятся на термореактивные и термопластич-
ные. Термопластичные (новолачные) смолы образуются
при поликонденсации формальдегида НСНО с избытком
фенола С6Н5ОН в присутствии минеральной кислоты.
При нагревании они плавятся, а при охлаждении затвер-
девают. Эти смолы имеют линейное строение, поэтому
они растворяются в спирте и других растворителях. Тер-
мореактивные (резольные) смолы получают поликонден-
сацией фенола с избытком формальдегида в присутствии
щелочей. Смолы при нагревании переходят из плавкого и
растворимого состояния в неплавкое и нерастворимое.
Такое изменение свойств смолы связано с переходом ли-
нейной структуры полимера в пространственную.
Фенолоформальдегидные смолы используются для
получения литых резитов, прессовочных материалов, как
связующее для слоистых пластиков, лаков, клеев и поро-
пластов. Литые пластмассы (литой резит) представляют
собой ненаполненные фенопласты, состоящие только из
одной смолы. Из-за невысокой прочности, большой
усадки, трудностей при переработке их в изделия, боль-
шого количества отходов при этом эти материалы редко
применяются на практике. Композиционные фенопласты
по структуре наполнителя делятся на неслоистые (пресс-
материалы) и слоистые (слой-материалы).
Из пластмасс на основе фенолоформальдегидных
смол наибольшее применение в машиностроении находят
слоистые материалы. Слоистые материалы получают го-
рячим'прессованием уложенных правильными слоями
листового наполнителя пропитанного резольной смолой.
Текстолит получают из фенолоформальдегидной смо-
лы и текстильной ткани. Он широко применяется в ма-
шиностроении благодаря высокой механической прочно-
сти с типичными для пластмасс достоинствами: водо- и
химической стойкостью, антифрикционными свойствами,
147
легкостью. Машиностроительные и электротехнические
детали из текстолитовых плит получают механической
обработкой. Вкладыши для подшипников получают цель-
нопрессованными или набирают из плит. Благодаря вы-
соким антифрикционным свойствам вкладыши могут ра-
ботать без смазки, но при водяном орошении трущихся
частей (текстолит плохо проводит теплоту). Из текстоли-
та изготовляют бесшумные передаточные шестерни.
Гетинакс (наполнитель бумага) широко применяется
в электро- и радиотехнической промышленности (произ-
водство печатных схем для радио- и телевизоров и т. п.).
Фаолит получают с применением фенолоформальде-
гидных смол и асбеста или смеси асбеста и графита. Он
устойчив к воздействию соляной кислоты любой концен-
трации, к разбавленным H2SO4, Н3РО4, СН3СООН и др.,
хлорированным углеводородам, но разрушается в окис-
лительных средах. Фаолит используют для получения
ванн, адсорберов, труб и различного вида фасонных из-
делий.
Стеклопластики — высокопрочные конструкционные
материалы, получаемые при использовании стекловолок-
нистых наполнителей. Связующими для получения
пластмасс этого класса [стекловолокнитов, стеклотексто-
литов, СВАМ (стекловолокнистый, анизотропный мате-
риал), п др.] служат полимеры с линейным строением,
которые в процессе формования могут образовывать сет-
чатую структуру. Свойства стеклопластиков см. табл. 18.
По ударной прочности стеклопластики в ряде случаев
превосходят ударную прочность стали, дуралюминия, ти-
тана. Они хорошо противостоят действию ударных и ди-
намических нагрузок и способны гасить колебания эле-
ментов конструкции.
Стеклотекстолит получают из стеклянной ткани и свя-
зующего. Он применяется как конструкционный и элек-
троизоляционный материал. По удельной прочности стек-
лотекстолиты не уступают, а в ряде случаев даже пре-
восходят удельную прочность стали, дуралюминия и ти-
тана. Эти материалы хорошо противостоят действию
ударных и динамических нагрузок, т. е. способностью га-
сить колебания элементов конструкции. Так, стеклотек-
столит марки ВФТ-С выдерживает при изгибающем на-
пряжении 60—80 МН/м2 (6—8 кгс/мм2) без разрушения
более 19 000 000 циклов нагружений.
. Стекловолокниты изготовляют из волокон и связую-
148
Свойства стеклопластиков
Таблица 18
Свойства Конструкционные Анизотропные Стекловолокннты
КАСТ-В ВФТ-С СВАМ ЭФ-32-301 марка В марка С
Наполнитель Плотность-103, кг/м3 Ткань 1,75-1,85 Ткань 1,55-1,75 Ориентирован- ное волокно 1,9 Ткань 1,67-1, Волокна рубленные 1,7-1,8 Волокна параллельные 1,7-1,8
Водопоглощение, °/о 0,8-1,5 1,7 0,1-1,3 0,28 0,5 0,5
Предел прочности, МН/м2 (кгс/мм2):
при растяжении 270—320 (27—30) 360—400 (36—401 900—950 (90—95) 225—418 (22,5—41,8) 80 (8) 200 (20)
при сжатии — — 420 (42) 300 (30) 130 (13) 130 (13)
при изгибе Удельная ударная вяз- кость, кДж/м2 150-160 40-55 290 80-100 160—460 (16—46) 245-308 322—415 (32,2—41,5) 120-150 100 (10) 15-25 200 (20) 100
Модуль упругости,' МН/м2 (кгс/мм2) 20 000 2200 35 000—58 000 22 000 — —
Электрическая прочность. МВ/м 10-24 20 (3 500—5 800) 24-32 (2 200) 13 13
щего (фенолоформальдегидные, полиэфирные и другие
смолы) прямым или литьевым прессованием при высо-
ком давлении. Эти материалы используются при изго-
товлении деталей для обшивки вагонов, облицовочных
панелей, строительных конструкций, оконных перепле-
тов, огнестойких перегородок, вкладышей подшипников,
фрикционных деталей, сильно нагруженных корпусов,
термостойких (200° С) изделий и как электроизоляцион-
ный материал.
СВАМ получают из ориентированных стеклянных во-
локон параллельной укладкой их при одновременном на-
несении на них связующего (жидкие бутварофенольные
и другие смолы). В зависимости от способа укладки во-
локон СВАМ может иметь высокую прочность вдоль рас-
положения стекловолокон и более низкую — в попереч-
ном расположении и может обладать подобно фанере
упругой анизотропией, т. е. иметь одинаковые свойства в
поперечном и продольном направлениях и более низ-
кие— под углом. СВАМ используется вместо стали для
арматуры, так как его удельная прочность выше, чем
удельная прочность стали ЗОГСА, что позволяет из
СВАМ изготовлять жесткие конструкции, деформация
которых мало изменяется во времени. Из него также
готовят трубы, стойкие к химическим реагентам, исполь-
зуемые в химической и других отраслях промышленно-
сти. В судостроении он применяется при строительстве
катеров, лодок, баков, труб, деталей и конструкций ко-
раблей и т. п. Из СВАМа изготовляют хранилища для
химических реагентов, кузова автомашин, авто- и жёлез-
нодорожные цистерны и электроизоляционные материа-
лы (электрощиты, электро- и радиотехническая аппара-
тура). В угольной промышленности из СВАМа готовят
кузова шахтных вагонеток и шахтные крепи. Изготов-
ленные подземные сооружения, крепь и другие конструк-
ции значительно легче, влагостойки, не подвержены
коррозии и загниванию.
Эпоксидными смолами принято называть смолы, по-
лученные на основе соединений, содержащих эпоксид-
, О \
ную группу I ) Сырьем для получения эпок-
\ I I '
сидных смол
(СН2 —СН —СН2С1)
являются, например, эпихлоргидрин
и многоатомные фенолы (дифенил-
150
олпропан, гидрохинон). В зависимости от условий про-
цесса синтеза и соотношения компонентов в реакцион-
ной смеси можно получить эпоксидные смолы с различ-
ной молекулярной массой (от 500 до 5 000). Поэтому
смолы могут быть как жидкими, так и твердыми, и свой-
ства их могут изменяться в широких пределах. Линей-
ные эпоксидные смолы термопластичны (растворимы,
мягки), поэтому при получении пластмасс их отверж-
дают, т. е. линейные макромолекулы полимера переводят
в пространственную структуру. В качестве отвердителей
используют амины, кислоты и и.х ангидриды либо добав-
ки мочевинных и фенолоформальдегидных смол.
В зависимости от физико-механических и химических
свойств эпоксидные смолы служат для получения слоис-
тых пластмасс, клеев, лаков и т. д. Очень эффективно
применение эпоксидных смол в качестве связующего при
формовании крупногабаритных изделий с волокнистыми
наполнителями. Эпоксидные смолы отличаются хорошей
адгезией по отношению к металлам. Клеи на их основе
дают прочные соединения.
3. Резина
Резина относится к важнейшим конструкционным ма-
териалам, применяемым в различных отраслях промыш-
ленности, в том числе и в автомобилестроении. Ассорти-
мент резино-технических изделий, от качества которых
во многом зависит надежность работы автомобиля, до-
статочно широк — шины, приводные ремни, втулки, гиб-
кие шланги, электроизоляционные материалы. Для полу-
чения резины используют каучуки.
Каучуки — это высокомолекулярные соединения, от-
личающиеся способностью к большим обратимым на-
грузкам при обычных и пониженных температурах.
Высокая эластичность каучука объясняется сверну-
тым строением молекул полимера, которые при растяже-
нии распрямляются, а при снятии нагрузки вновь свер-
тываются. Натуральные и синтетические каучуки (бута-
диеновые, бутадиенстирольные, изопреновые, бутил-
каучуки, -хлоропреновые и др.) служат основным сырьем
для получения резины, резино-технических изделий, из-
делий специального назначения и т. д.
Резина — материал, способный к большим (до
1000%) обратным высокоэластичным деформациям. Вы-
сокая эластичность резины определяется свойствами ка-
151
учуков, содержание которых в резине колеблется от 10
до 98%. В состав резиновой смеси кроме каучуков вво-
дят различные вещества органического и минерального
происхождения: вулканизирующие вещества, наполните-
ли, пластификаторы (мягчители), красители, противо-
старители и т. д.
Вулканизирующие вещества (сера, оксиды металлов,
органические перекиси) добавляются в состав смеси с
целью трансформации линейной структуры каучука в
пространственную (сетчатую) во время процесса вулка-
низации. Для увеличения скорости процесса вулканиза-
ции вводят специальные вещества — ускорители вулка-
низации (полисульфпды, сульфонимиды, дитиокарбона-
ты и др.).
.Наполнители вводятся в состав резины для придания
или улучшения некоторых свойств материала («белая»
сажа, оксиды титана, сажа, ткани), снижения себестои-
мости резино-технических изделий.
Пластификаторы (мягчители) вводятся в смесь для
равномерного смешения компонентов смеси п облегчения
процесса формования. Это мазут, парафин, нефтяные и
каменноугольные смолы. Устойчивость резины против
старения может быть повышена введением в состав ис-
ходной резиновой смеси противостарителей: фенолов,
воска, фенил-а-нафтиламина, которые реагируют с кис-
лородом воздуха интенсивнее каучука, предохраняя по-
следний от окисления. Для сохранения резино-техниче-
скими изделиями своих размеров под нагрузкой в со-
став резиновых смесей вводятся армирующие материа-
лы— стальная проволока, корд, ткани (синтетические
и хлопчатобумажные).
Процесс получения резиновых изделий включает ряд
операций, но основная и самая сложная операция
при производстве резины — это операция вулканизации,
которой подвергаются все изделия, полученные из рези-
новой смеси, для закрепления приданной им формы.
В зависимости от количества вулканизатора получают
мягкую резину или твердую (эбонит). Она проводится
при 125—180° С в прессах и других аппаратах при не-
высоком давлении в атмосфере горячего воздуха, насы-
щенного пара или перегретой водой, токами высокой ча-
стоты без давления. В процессе вулканизации проис-
ходит сшивание молекулярных цепей эластомера между
лннейными макромолекула ми:
152
----сн2 — CH — CH — CH2 — CH, — CH — CH — CH,---
i :
s s
I I
----CH, — CH — CH — CH2 — CH2 — CH — CI I — CH2-
I I
По назначению и свойствам резины классифицируют-
ся на: а) резины общего назначения, эксплуатируемые
при —50 до +150° С (шины, обувь, ремни, амортизаторы
и т. п.); б) теплостойкие — используемые для длительной
эксплуатации при температурах выше 150° С (детали са-
молетов, машин, электродвигателей и т. п.); в) морозо-
стойкие — устойчивые при работе изделий в условиях
Крайнего Севера, Антарктиды и на больших высотах;
г) маслостонкие — устойчивые в бензине, керосине, неф-
ти; д) химически стойкие — устойчивые к озону, кисло-
там, щелочам, растворам солей и пр.; е) газонаполнен-
ные —используемые как теплоизолирующий и амортиза-
ционный материал; ж) стойкие к действию радиации —
применяемые для изготовления деталей рентгеновских
аппаратов и т. п.; з) диэлектрические — применяемые
для изоляции кабеля.
4. Конструкционные материалы на основе графита
Применение конструкционных материалов на основе
графита связано с присущим для этих материалов
комплексом ценных физико-химических и механиче-
ских свойств, в частности, с жаропрочностью, высокой
электро- и теплопроводностью, химической стойкостью,
малым коэффициентом трения. Особенно широко эти
материалы используются в металлургии, химической,
электротехнической промышленности, ядерной технике.
Наряду с природным графитом широко используются ис-
кусственные разновидности графита, получаемые в элек-
тропечах из нефтяного кокса и каменноугольного пека.
Процесс изготовления графитовых изделий сложен, тре-
бует больших затрат электроэнергии и длителен во вре-
мени. Графитовые материалы имеют низкий модуль уп-
ругости, т. е. повышенную хрупкость, поэтому конструк-
ции из графита обязательно должны быть защищены от
ударных воздействий. Высокая пористость графита де-
153
лает его проницаемым для жидкостей и газов, поэтому
изделия из него требуют пропитки. Среди пропитываю-
щих (связывающих) веществ применяются фенолофор-
мальдегидные, кремнийорганические, эпоксидные смолы,
полиамиды. Искусственные материалы, полученные та-
ким путем, относятся к пластическим массам и называ-
ются графитопластами. В качестве конструкционных хи-
мически стойких теплопроводных материалов распрост-
ранены антегмиты. Физико-механические и химические
свойства антегмитов приведены в табл. 19.
Получают антегмиты на основе искусственного графи-
та и фенолоформальдегидных смол. Для повышения
химической стойкости или теплостойкости изделия из
антегмита подвергают термической обработке. Антегми-
ты химически инертны в большинстве агрессивных сред,
нечувствительны к тепловым ударам, но сохраняют хруп-
кость, присущую для графита. Графитопласты в хими-
ческой промышленности могут применяться как футеро-
вочный и конструкционный материал. Кроме того, из них
изготовляют различные фильтры, поршневые кольца,
уплотнители, электроды в электрофильтрах, литьевые
формы, вкладыши подшипников.
Физико-механические свойства антегмитов Таблица 19
Свойства Антегмиты
АТМ-1 АТМ-10 АТМ-1Г
Кажущаяся плотность, 1,80 1,74 1,74
кг/м3 -103 Предел прочности (20° С), МН/м2 (кгс/мм2): 18—22 9-12 6-8'
при растяжении
(1,8-2,2) (0,9—1,2) (0,6—0,8)
при статическом изгибе 40-50 (4—5) 26(2,6) 20(2)
при сжатии 100—120 (10—12) 55(5,5) 45(4,5)
Теплостойкость, °C, в при- сутствии: 170
воздуха 400 600
в инертном газе 170 2000 2000
Теплопроводность, Вт/м-град 35-40. 95—100 100—140
Удельное электрическое 50—60 16 12
сопротивление, Ом-м-Юс Непрони-
Проницаемость для воз- Непроницаемы
духа наем до 0,5 МН/м2 до 0,3 МН/м2
Термостойкость Воспринимают любые температурные
колебания е пределах теплостойкости
Раздел четвертый
МЕТОДЫ ЗАЩИТЫ ОТ КОРРОЗИИ
В результате коррозионного разрушения машин и ап-
паратов, строительных конструкций, лабораторных и
бытовых приборов, разнообразных металлических изде-
лий около 12% выплавляемого металла безвозвратно те-
ряется в различных отраслях народного хозяйства. Прод-
ление жизни указанного оборудования сэкономит мил-
лионы тонн металла и сократит при этом расходы на его
производство.
В технике борьба с коррозией осуществляется различ-
ными методами. Наиболее рациональный и надежный
путь — это изготовление аппаратов, машин и т. д. из кор-
розионно-стойких как металлических, так и неметалли-
ческих материалов. Однако этот путь борьбы с корро-
зией не всегда может быть использован в силу экономи-
ческих, технических или технологических соображений.
Поэтому в промышленности часто готовят изделия, ап-
параты, трубы из дешевых и доступных материалов, об-
ладающих высокими технологическими и механическими
свойствами с последующей их защитой от коррозии.
В настоящее время для защиты изделий от коррозии
применяют защитные покрытия, электрохимическую за-
щиту и замедлители, или ингибиторы, коррозии, изменя-
ющие состав коррозионной среды.
Глава XVI
ЗАЩИТНЫЕ ПОКРЫТИЯ
Большинство металлов и сплавов, как правило, не-
устойчиво в средах, где они используются. Отдельные
металлы, например алюминий, сами предохраняют себя
от коррозии в некоторых средах в результате образовав-
шихся на их поверхности защитных пленок при взаимо-
155
действии со средой. При помощи защитных покрытий
можно изолировать металл от агрессивной среды искус-
ственным нанесением пленки на поверхность изделия
или, изменяя химический состав поверхности, сделать
металл устойчивым к агрессивной среде. Защитное по-
крытие должно быть сплошным,'непроницаемым для аг-
рессивной среды, иметь высокую прочность сцепления с
металлом (адгезию), равномерно распределяться по всей
поверхности и придавать изделию более высокую твер-
дость, износостойкость и жаростойкость. Коэффициент
теплового расширения пленки должен быть близок к ко-
эффициенту расширения металла. Защитные покрытия
применяют также для предупреждения механического
износа изделий и восстановления размеров деталей ма-
шин, а также для защитно-декоративной отделки.
1. Способы подготовки поверхности изделий
Для получения качественного покрытия необходимо
поверхность изделий тщательно подготовить: удалить
жировые, оксидные и другие загрязнения, ухудшающие
прочность сцепления покрытия с поверхностью защищае-
мого металла. Это осуществляют механической обработ-
кой, обезжириванием и травлением.
При механической обработке поверхности изделий ис-
пользуют гидропескоструйную или дробеструйную очист-
ку, шлифование, полирование и крацевание. Гидропеско-
струйной или дробеструйной очисткой удаляют с поверх-
ности изделий ржавчину, окалину, старую краску, литей-
ную корочку. Осуществляют ее в аппаратах камер-
ного, барабанного и других типов, изготовленных из чу-
гуна или твердых сплавов, с помощью кварцевого песка
или дроби (чугунная или стальная дробь разного раз-
мера). Струю влажного песка или дроби при помощи
сжатого воздуха (0,5—0,8 МН/м2) подают через сопло
на поверхность изделия, в результате чего частицы, уда-
ряясь о поверхность детали, очищают ее от загрязнений.
При гидропескоструйной или дробеструйной очистке
поверхность изделий приобретает равномерную шерохо-
ватость, что обеспечивает хорошее сцепление металла с
покрытием.
Шлифование и полирование применяют для получе-
ния изделий с блестящей поверхностью, удаления неров-
ностей, заусенцев. Эти операции осуществляют на шли-
156
фовально-полнровальных станках или вручную с исполь-
зованием абразивных материалов (наждака, корунда,
карборунда SiC, оксидов хрома и др.). Полирование
также применяют для защитно-декоративных покрытий.
Его осуществляют при помощи паст, состоящих из жи-
ров, воска и частиц абразивов (трепела, оксида алюми-
ния, хрома и др.). Окончательное шлифование и полиро-
вание изделий сложной формы производят щетками-из
конского волоса или из фибера (вид водорослей). Шлам,
разрыхленный слой окалины удаляют с поверхности из-
делий щетками, изготовленными из тонкой латунной или
стальной проволоки. Такой процесс получил название
крацевания.
Обезжиривание поверхности изделий проводят погру-
жением их в ванну с растворителем или в камерах, за-
полненных его парами. В качестве растворителей ис-
пользуют керосин, бензин, трихлорэтилен, растворы ще-
лочей и солей.
Химическое обезжиривание осуществляют погруже-
нием изделий при 70—80° С в растворы щелочей или лег-
ко гидролизующихся солей (ЙагСО3, Na3PO4) в присут-
ствии эмульгаторов (жидкое стекло, мыло, ОП-Ю и др.),
облегчающих растворение жировых веществ, или обра-
боткой изделий на конвейерных установках разбрызги-
ванием раствора на их поверхность при помощи фор-
сунок.
Обезжиривание органическими растворителями про-
изводят погружением деталей в ванну, содержащую рас-
творитель. В последнее время наряду с применением ке-
росина, уайт-спирита, бензина широко используют него-
рючие и невзрывоопасные растворители, например три-
хлорэтилен (т. кип. 87°С). Этот способ обезжиривания
применяют для удаления с поверхности густой смазки,
например солидола, технического вазелина.
Электрохимическое обезжиривание проводят погру-
жением деталей в электролитические ванны, электроли-
том которых служат растворы щелочи или легко гидро-
лизующиеся соли с добавкой эмульгаторов. Изделия мо-
гут быть помещены в ванны на катод или анод. Электро-
химическое обезжиривание ускоряет процесс очистки по-
верхности изделий по сравнению с химическим в 2—3 ра-
за. Объясняется это тем, что в процессе обезжиривания
выделяющиеся пузырьки газов (водород па катоде, а
кислород на аноде) способствуют отрыву жировых ве-
157
ществ от поверхности изделия. Анодное обезжиривание
проводят реже, чем катодное, так как оно менее произ-
водительно.
Термическое обезжиривание деталей проводят в ка-
мерах при 300—400° С, через которые пропускают воздух.
При этом жировые вещества, сгорая, удаляются с поверх-
ности.
Обезжиривание мелких изделий можно осуществлять
при помощи ультразвука с большой скоростью очистки
(до 1 мин). Обусловлено это тем, что обезжиривающая
жидкость оказывает большое давление на поверхность
изделия, которое в нее погружено.
Травление применяют для удаления окалины, про-
дуктов коррозии с поверхности изделий, изготовленных
из чугуна, стали, меди, вольфрама и других металлов и
сплавов. Травление чаще всего проводят в растворах
кислот в присутствии замедлителей коррозии, снижаю-
щих растворение чистого металла, реже — в щелочах.
Химическое травление изделий из углеродистых ста-
лей ведут в 15—20 %-ном растворе серной кислоты при
40—80° С в течение 10—60 мин или в концентрированной
соляной кислоте при температуре около 40°С в течение
5—30 мин, а из чугуна (для удаления литейной короч-
ки) — раствором плавиковой кислоты.
Травление хромоникелевых сталей проводят смесью
соляной и серной или соляной и азотной кислот при 40—
50° С в течение 3—5 мин.
При травлении меди и ее сплавов используют смеси
азотной, серной и соляной кислот или хромовой и серной
кислот, а из алюминия и его сплавов — растворы щеЛочи.
Химическое травление осуществляют в ваннах, травиль-
ных машинах (для листов) или струйной обработкой.
Струйная обработка, применяемая для удаления ржавчи-
ны и окалины с проката, поковок и т. п., является наи-
более эффективным методом, так как поверхность изде-
лия одновременно подвергается химическому и механи-
ческому воздействию.
Электрохимическим способом травят чаще всего из-
делия, изготовленные из углеродистых и легированных
сталей. В качестве электролита используют серную или
соляную кислоту, их смеси, подкисленные растворы солей
железа или растворы солей щелочных металлов. Травле-
ние проводят как на аноде, так и на катоде. Анодное
травление ускоряет растворение металла, так как под
158
действием кислоты облегчается отрыв оксидов от поверх-
ности. Процесс ведут при анодной плотности тока 5—
10 А/дм2, выдерживая изделия в растворе в течение 3—
.5 мин. Катодное травление происходит за счет восста-
новления ионов водорода, который, выделяясь с поверх-
ности металла, механически отрывает окалину с поверх-
ности.
Очистку поверхности мелких изделий (часовые меха-
низмы, детали электровакуумных приборов) проводят
ультразвуком, а изделия ювелирной промышленности
подвергают электрохимическому или химическому поли-
рованию. После травления изделия промывают водой,
сушат и направляют для нанесения покрытий.
2. Металлические покрытия
и методы их нанесения
Защитные покрытия делятся на металлические и не-
металлические и покрытия, получаемые химической и
электрохимической обработкой поверхности металла.
Особое место в технике занимает гуммирование и покры-
тие полимерными материалами.
Металлические покрытия на изделия, изготовленные
из металлических или неметаллических (стекло, кера-
мика, пластмассы и др.) материалов, наносят для защи-
ты от коррозии, повышения твердости, электропроводно-
сти и придания им красивого внешнего вида. Покрытия
наносят электрохимическим осаждением (гальваниче-
ский метод), термомеханическим (плакированием) и
диффузионным (см. гл. V) методами, распылением (ме-
таллизация) и погружением в расплавленный металл
(горячий метод).
По характеру защитного действия против коррозии
металлические покрытия подразделяются на катодные и
анодные. К катодным покрытиям относятся такие покры-
тия, при которых покрывающий металл имеет более по-
ложительный электродный потенциал, чем металл защи-
щаемого изделия, например сталь, покрытая оловом или
медью. При нарушении целостности катодного покрытия
оно перестает защищать изделие от коррозии, более того,
присутствие такого металла на поверхности изделия уси-
ливает его коррозию. Анодными покрытиями являются
такие покрытия, при которых покрывающий металл име-
ет в данной среде более отрицательный электродный по-
159
Рис. 66. Схема элек-
тролизера для нанесе-
ния покрытий:
1 — ванне; 2 — катод; 3 —
анод; 4 — электролит
тенциал, чем защищенный, например, при покрытии ста-
ли цинком.
Анодное покрытие будет защищать основной металл
при нарушении его целостности, лишь само подвергаясь
разрушению. Следовательно, требования герметичности
при нанесении анодного покрытия не очень существенно,
тогда как катодное покрытие должно быть сплошным и
непроницаемым для агрессивной среды.
1. Гальванический метод. Гальванические покрытия
широко применяют в машиностроении, так как нанесение
их на изделия обеспечивает получе-
ние прочных покрытий при неболь-
ших расходах и потерях металла.
Процесс получения гальванического
покрытия состоит в выделении и
осаждении металла или сплава из
водных растворов их солей пропу-
сканием постоянного электрического
тока через электролит. Покрывае-
мое изделие в электролизере слу-
жит катодом, а анодами — пластины
осаждаемого металла (растворимые
аноды), графита или металла нера-
створимого в электролите (нераст-
воримые аноды). В качестве элект-
ролита применяются соли тех металлов, металл которых
наносится па поверхность защищаемого изделия. Прово-
дя электролиз в ваннах с растворимыми анодами, ме-
талл анода растворяется, а из раствора на катоде выде-
ляется такое же количество металла, поэтому концент-
рация раствора соли в электролите практически не изме-
няется в процессе электролиза. При использовании не-
растворимых анодов постоянство концентрации электро-
лита поддерживается периодическим введением требуе-
мого количества соответствующей соли.
Рассмотрим процесс нанесения покрытий никелем
при использовании растворимых анодов (рис. 66). При-
меняя растворимые аноды (никель) и электролит (соль
NiSO4 и НгО), на катоде, и аноде происходят процессы:
Ni2-r + 2е * -> № (на катоде)
N1 — 2е~->Ni2+ (на аноде)
160
Выделяющийся металл Ni покрывает поверхность изде-
лия, образуя металлический осадок различного строе-
ния, начиная от гладкого мелкокристаллического до
крупнокристаллического.
Масса металла, выделившегося при электролизе, за-
висит от количества прошедшего электричества и строго
подчиняется первому закону Фарадея, т. е. количество
вещества, выделяющегося на электроде, прямо пропор-
ционально количеству электричества, проходящего че-
рез электролит. Для выделения 1 г-экв (отношение атом-
ной массы металла к его валентности) любого металла
затрачивается 26,8 А-ч. Количество металла, выделяемое
на катоде при прохождении постоянного тока силой в
один ампер в течение часа, называется электрохимиче-
ским эквивалентом, который различен для металлов, на-
пример; электрохимический эквивалент для серебра ра-
вен 4,025 г/А • ч (107,88/26,8), золота — 7,357 г/А • ч, цин-
ка — 1,210 г/А • ч и т. д.
Толщину слоя металла на изделии определяют по
следующей формуле:
Стг/К
а = —-——•,
d-60-60
где а — толщина покрытия, см; С — электрохимический
эквивалент, г/А-ч; т — продолжительность электролиза,
мин; г] — выход металла по току (отношение практиче-
.ски выделившегося металла к количеству металла, кото-
рое должно было выделиться теоретически), %; /к— ка-
тодная плотность тока, А/см2; d—-плотность металла,
г/см3.
Гальванические покрытия можно наносить на изделие
толщиной от микрон до нескольких миллиметров. По-
крытия обладают высокой чистотой и равномерно рас-
пределены по всей защищаемой поверхности. Гальвани-
ческий способ нанесения покрытий имеет ряд преиму-
ществ перед другими способами и, в частности, отлича-
ется легкостью регулирования толщины покрытия,
малым расходом металла, не требует нагрева электро-
лита, обеспечивает нанесение и металлов, и сплавов, но
получаемое покрытие по этому способу пористо.
Наибольшее применение в настоящее время находят
сернокислотные и цианистые электролиты. Сернокислот-
ные электролиты образуют осадки на металле, которые
имеют крупнокристаллическое строение. Цианистые
6—3504
161
электролиты токсичны, так как при электролизе выде-
ляются парообразные и газообразные цианистые соеди-
нения.
В настоящее время разработаны и находят примене-
ние электролиты, позволяющие повысить скорость осаж-
дения металла по сравнению с сернокислотными и улуч-
шить качество покрытия. К таким электролитам отно-
сятся фторборатные, пирофосфатные, этилендиамино-
вые, аммиакатные, сульфоаминовые и др.
Кроме указанных составов электролитов разработа-
ны неводные электролиты, состоящие из соответствую-
щих солей наносимого металла и органических веществ
(например, А1С13, этиловый эфир, бутиламин). Такие
электролиты могут использоваться при нанесении на из-
делие пленок алюминия, бериллия, циркония.
Цинкование изделий из чугуна и стали широко ис-
пользуется в практике. Объясняется это тем, что цинк
по отношению к стали в водных растворах служит ано-
дом (анодное покрытие), поэтому при электрохимиче-
ской коррозии он растворяется и предохраняет изделие
от разрушения. Цинк устойчив и к атмосферной корро-
зии. Наносят цинк на деталь из сернокислотных, циа-
нистых, щелочных, пирофосфатных, аммиакатных элект-
ролитов. Цинком покрывают резьбовые крепежные де-
тали, тонкие пружины, различные фасонные изделия,
арматуру, трубы, резервуары для защиты от воздействия
воды, продуктов переработки нефти и т. д. Толщина по-
крытий различна и составляет от 3 до 50 мкм.
Кадмий наносят практически только гальваническим
способом. Применяют его для защиты деталей, аппара-
туры из стали от коррозии в морской воде, во влажном
воздухе, в растворах некоторых солей и щелочах. Кад-
мирование осуществляют с использованием сернокислот-
ных, цианистых борфтористоводородных и аммиакат-
ных электролитов. Толщина кадмиевого покрытия зави-
сит от условий эксплуатации и составляет 9—15 мкм для
обычных условий и до 45 мкм для деталей, подвергаю-
щихся воздействию морской и горячей воды.
Олово устойчиво к влажному воздуху и слабым ор-
ганическим кислотам. По отношению к железу олово
является катодным покрытием, поэтому стальные изде-
лия оно защищает от коррозии механически при отсут-
ствии пор. Оловом покрывают жесть, аппараты для хра-
нения и приготовления пищевых продуктов, детали ра-
162
диоаппаратуры, подвергающиеся пайке, кабель, находя-
щийся в слое резины, для защиты от воздействия серы,
при местной защите изделий от азотирования. Лужение
осуществляют из сернокислотных и щелочных электро-
литов. Толщина покрытий колеблется от 1,5 до 20 мкм.
Свинец относится к химически стойким элементам. Он
устойчив к серной кислоте (до 75%), растворам ее солей,
серусодержащим газам, слабой соляной кислоте и т. д.
Свинцом покрывают автоклавы, кристаллизаторы, тру-
бы, вакуум-аппараты и другую аппаратуру, соприкасаю-
щуюся с агрессивными средами. Он также используется
для защиты от воздействия рентгеновских лучей. Нано-
сят свинец на изделия из стали по подслою предвари-
тельно нанесенной меди из борфтористоводородных и
кремнефтористоводородных электролитов. Толщина по-
крытия составляет от 30 до 200 мкм.
Медь неустойчива к атмосферной коррозии, так как
она легко реагирует с парами воды, с оксидом углерода
(IV) воздуха, с серусодержащими газами и другими
средами. Поэтому она для защиты стали от коррозии не
используется, но широко применяется для получения
многослойных защитно-декоративндох покрытий в качест-
ве промежуточной прослойки, например медь — никель —
хром. Кроме того, медь применяют для улучшения пайки,
увеличения электропроводности изделий, защиты сталей
от науглероживания в процессе цементации, уменьшения
шума при трении. Для меднения используют сернокис-
лотные, цианистые, пирофосфатные, борфтористово-
дородные электролиты. Толщина медных покрытий рав-
на 5—30 мкм и более.
Никель главным образом применяется в качестве
защитно-декоративного покрытия, но он способен защи-
щать стальные изделия от коррозии при условии беспо-
ристости образующихся пленок. Беспористые никелевые
покрытия получают попеременным осаждением несколь-
ких слоев металлов, например меди и никеля. Никеле-
вые покрытия обладают высокой твердостью и износо-
стойкостью. Они устойчивы против воздействия раство-
ров щелочей, органических кислот, но разрушаются
минеральными кислотами и растворами, содержащими
аммиак. Никелированию подвергают детали из углероди-
стых и нержавеющих сталей, аммония и его сплавов.
Для никелирования используют сернокислотные, фтор-
боратные, сульфаминные (составленные на основе суль-
6*
163
фаминной кислоты SO3OHNH2), кремнефтористые элек-
тролиты. Толщина покрытий колеблется от 3 до 40 мкм.
Никелем покрывают медицинский и слесарно-монтаж-
ный инструмент, детали и узлы, соприкасающиеся со ще-
лочными металлами, детали часовых и крепежных изде-
лий, мембраны, пружины, поручни автомобилей, ваго-
нов.
Хромированные изделия обладают высокой поверх-
ностной твердостью, износостойкостью, термостойкостью
и химической устойчивостью. Они устойчивы в концент-
рированной азотной кислоте, растворах щелочей, органи-
ческих кислотах, сероводороде, растворах многих солей.
Они плохо смачиваются расплавленными металлами.
Хромистые покрытия применяются для защитно-декора-
тивных целей (детали автомобилей, велосипедов, прибо-
ров ит. и.), в производстве зеркал, отражателей, прожек-
торов, для увеличения износостойкости изделий (мери-
тельные инструменты, фильеры для волочения металлов,
штампы и матрицы, трущиеся- поверхности, напри-
мер, хромирование стенок цилиндров и поршневых колец
двигателей внутреннего сгорания и т. д.), восстановления
у деталей размеров. Хромирование проводят в электро-
литах, состоящих из хромистых кислот (Н2СгО4 и
Н2Сг2О7), серной кислоты, сульфата циркония, кремне-
фторида калия, едкого натра при 18—70°С и плотности
тока от 15 до 100 А/дм2. Толщина покрытий в зависимо-
сти от назначения равна 3—250 мкм и более.
Серебрение в основном используется для придания
деталям высокой электропроводности, для покрытия'из-
делий, применяемых в пищевой и художественной про-
мышленности и во многих отраслях машиностроения.
Серебро наносят на сталь, медь, латунь и другие ма-
териалы.
Золото используется для защиты ценной аппаратуры
и приборов от атмосферной коррозии, в ювелирном и ча-
совом производствах. Наносят его на медь и ее сплавы,
на никель, на сталь — после меднения — и другие ме-
таллы. Гальваническим способом покрывают изделия
платиной, индием, германием, галием и другими метал-
лами.
Для расширения использования электрохимических
покрытий в настоящее время широко применяются спла-
вы из двух и более компонентов, обладающие высокой
электропроводностью, особыми магнитными свойствами.
J64
высокими антифрикционными и коррозионными свойст-
вами, твердостью и износоустойчивостью, каталитиче-
ской активностью и т. д. Предложено более 200 сплавов
для нанесения покрытий и, в частности, такие сплавы,
металлы которых не удавалось путем электролиза вод-
ных растворов выделить в чистом виде, например, воль-
фрам, молибден, ванадий.
Сплавы Сг—Мо, Сг—W, Ni—Со и другие использу-
ются для получения износостойких покрытий. Покрытия
сплавом W—Со обладают высокой твердостью, химиче-
ской стойкостью. Такое покрытие растворяется в серной
кислоте в 3,6 раза медленнее, чем никель, и в 32 раза,
чем кобальт. Сплавы Со—Ni (15—35% Ni) обладают
особыми магнитными свойствами, высокой механической
прочностью, износостойкостью, поэтому их применяют в
радиотехнике, счетно-вычислительных и звукозаписыва-
ющих устройствах. Сплавы РЬ—Sn, РЬ—Sn—Си,
РЬ—Sn—Sb могут использоваться для получения анти-
фрикционных покрытий. Покрытия из сплавов Cd—Ni
(9—23% Ni) обладают высокой стойкостью и механиче-
скими свойствами. Их применяют для защиты от корро-
зии аппаратов, работающих при высокой температуре в
атмосфере с повышенной влажностью и продуктов сго-
рания органических веществ. Сплавы Ag—Cd обладают
высокой твердостью, износостойкостью, которая при ис-
тирании в 6—8 раз больше износостойкости чистого се-
ребра, высоким электросопротивлением (в 4—5 раз боль-
ше, чем у серебра).
2. Горячий метод. Свойство металлов обладать в рас-
плавленном состоянии высокой химической активностью
легло в основу технологии нанесения на изделие метал-
лического осадка. Высокая реакционная способность рас-
плавленного металла в большинстве случаев приводит
к образованию сплава с металлом изделия, который яв-
ляется хорошей основой сцепления для покрываемого
металла.- Некоторые металлы, например цинк и алюми-
ний, с железом образуют твердые и хрупкие сплавы
(Fe2Zn7, Fe2Zn3, AlFe, Al2Fe, Al3Fe). При таком подслое
покрытие при механической обработке легко отделяется
от основного металла. Для устранения образования та-
ких нежелательных слоев к металлу покрытия вводят
другой металл, например, при покрытии стальных изде-
лий цинком в расплав вводят алюминий или олово
165
Для нанесения металлического покрытия горячим ме-
тодом заготовку погружают на несколько секунд в ванну
с расплавленным металлом, который смачивает их'по-
верхность. Для горячего способа нанесения покрытий
применяют металл с более низкой температурой плавле-
ния, чем покрываемый металл. К таким металлам отно-
сятся цинк, свинец, олово, алюминий. Расплав металла
защищают при помощи флюса, например, состоящего из
55,4% NH4C1, 6% глицерина, 38,4% ZnCh- Такой флюс
кроме защиты расплава от окисления растворяет оксид-
ные и другие пленки, находящиеся на поверхности по-
крываемого металла. Удаление пленок с изделия улуч-
шает адгезию металла с металлом покрытия. Толщина
наносимого слоя покрытия зависит от природы исполь-
зуемого металла, температуры и времени выдержки из-
делия в расплавленном металле и колеблется от несколь-
ких микрон до миллиметра. Горячий способ нанесения
покрытий используют для защиты от коррозии полуфаб-
рикатов, фасонных изделий из стали и чугуна.
Свинцом покрывают детали из черных металлов,
которые затем широко используют в химической промыш-
ленности (мешалки, краны, арматуру и т. п.). Свинцо-
вое покрытие беспористо, устойчиво ко многим электро-
литам и, что важно, к воздействию разбавленных раство-
ров серной кислоты и ее солей, сернистых газов. Так как
расплавленный свинец не сплавляется с железом и не
смачивает его поверхность, то его наносят по подслою
из олова, сурьмы или в расплав вводят металлы, способ-
ные растворяться как в железе, так и в свинце. Аппа-
ратура, работающая под вакуумом или обогреваемая че-
рез стенку, покрывается свинцом толщиной 2 мм и бо-
лее.
Цинк применяют для защиты изделий, изготовленных
из стали и чугуна, против атмосферной коррозии, воды
и ряда нейтральных растворов солей. Свыше 80% цинка,
используемого на покрытия, расходуется на горячее цин-
кование. Наносят цинк на детали, погружая их на 6—
20 с в расплавленный цинк или цинк с добавкой алюми-
ния (до 0,2%) или олова (1—3%) при 440—460°С. Цин-
ком покрывают листы, проволоку, банки, ведра, трубы
и т. д.
Олово применяют для защиты медных проводов от
воздействия серы, получения белой жести и при местной
защите поверхности металла при азотировании. Из белой
166
жести готовят молочную посуду, котлы для варки пищи,
тару для хранения и транспортирования пищевых про-
дуктов. Процесс лужения аналогичен с горячим цинко-
ванием.
Алюминий наносят на изделия из железа, стали и чу-
гуна с целью повышения устойчивости к атмосферной и
газовой коррозии. Процесс нанесения покрытия осуще-
ствляют погружением деталей вначале в ванну с флю-
сом, а затем в расплавленный (перегретый до 800° С)
алюминий. Высокие защитные свойства алюминиевого
покрытия связаны с наличием на поверхности равномер-
ной плотной пленки оксида алюминия, образующейся в
результате окисления алюминия под действием кислоро-
да воздуха. Алюминий наносят на выпускные и впускные
клапаны автомобильных двигателей и другие изделия.
Применяя горячий метод нанесения покрытий, не уда-
ется получать равномерные по толщине осадки, предвх-
ранять от коррозии изделия с узкими отверстиями и
резьбой. Расход цветных металлов при испольаовании
горячего способа велик, так как получаемые осадки име-
ют большую толщину. Кроме того, этот метод пееввляет
наносить только металлические осадки на изделия, име-
ющие небольшие размеры.
3. Плакирование. Это — процесс защиты от коррозии
основного металла или сплава другим металлом (спла-
вом), устойчивым к агрессивной среде. Соединить два
металла между собой можно литьевым, прокатным и не-
деформированным плакированием. Наибольшее приме-
нение находит способ совместной прокатки двух метал-
лов, из которых один (химически стойкий) является за-
щитным. Для плакирования применяются металлы или
сплавы, обладающие хорошей свариваемостью. К ним
относятся углеродистые, кислотоупорные стали, дуралю-
миний, сплавы меди. В качестве плакирующего материа-
ла используются нержавеющие стали, алюминий, никель,
титан, тантал и др. Толщина плакирующего слоя состав-
ляет от 3 до 60% толщины основного металла. Получае-
мые двухслойные материалы подвержены всем видам
обработки. Плакируют фасонные изделия, листы, авто-
клавы, проволоку, различного вида сосуды и т. д. Наи-
большее применение находит плакирование дуралюминия
алюминием, углеродистых сталей нержавеющей сталью.
Плакированные изделия широко используются в химиче-
167
ском машиностроении, нефтеперерабатываю’Щей, пище*
вой и других отраслях народного хозяйства.
Метод плакирования металлов лежит в основе полу-
чения материала, получившего название металлопласт.
Получают его прокаткой или склеиванием металлическо-
го листа и одним или двумя листами полимера. Метал-
лопласт готовят из стали, алюминиевых и магниевых
сплавов, а в качестве защитного слоя от коррозии ис-
пользуют термопластичные полимеры: полихлорвинил,
полиизобутилен, полиэтилен, полипропилен и др. По
стоимости металлопласты намного дешевле и долговеч-
нее нержавеющей стали, а по химической стойкости к аг-
рессивным средам превосходят ее. Как конструкционный
материал металлопласт используют для изготовления
различных деталей, применяемых в химической промыш-
ленности, судо-, автомобиле-, аппарато- и приборострое-
нии.
4. Металлизация распылением. Это процесс нанесения
защитных покрытий на поверхность изделий распылени-
ем расплавленного металла или другого тугоплавкого
материала сжатым воздухом или инертным газом. Ме-
таллизацию проводят в аппаратах-металлизаторах. В за-
висимости от применяемой энергии, используемой для
расплавления металла, металлизаторы подразделяются
на газовые и электрические. Газовые металлизаторы
работают на ацетилене, который, сгорая в кислороде, вы-
деляет большое количество теплоты, что приводит >к рас-
плавлению металла. Расплавленный металл под действи-
ем струи сжатого воздуха или инертного газа распыля-
ется на мельчайшие частички (0,02—0,4 мм) и наносится
на поверхность изделия со скоростью частиц 100—
200 м/с. Плавление металла в электрических металли-
заторах происходит за счет теплоты при горении дуги.
Для защиты от коррозии, восстановления сработав-
шихся деталей машин до прежних рабочих размеров ис-
пользуют практически все металлы, металлокерамику,
карбиды, пластмассы, стекло, которые можно наносить
не только на металл, но и на дерево, бетон, стекло, ке-
рамику, бумагу.
При металлизации покрытие образуется за счет вкли-
нивания, прилипания расплавленных частиц металла или
другого материала в поры и неровности поверхности де-
тали. Прочность сцепления его зависит от размера ча-
стиц, скорости их полета и величины их деформации при
168
ударе о поверхность. Покрытие имеет чешуйчатую струк-
туру и высокую пористость, которую уменьшают путем
увеличения толщины покрытия, шлифованием, полирова-
нием и нанесением неметаллических покрытий. Напри-
мер, пористость цинкового покрытия уменьшается в
10 раз при увеличении его толщины от 0,2 до 0,4 мм.
Металлизацию распылением применяют для защиты
от коррозии емкостей и аппаратуры крупных габаритов:
вулканизационных котлов, железнодорожных мостов,
газгольдеров, свай, корабельных и морских труб, метал-
локонструкций шлюзов, плотин, собранных изделий и др.
Для защиты от атмосферной и подземной коррозии при-
меняют цинк и алюминий, наносимые на сталь и чугун
толщиной от 0,05 до 4 мм. Аппаратура сернокислотного
производства покрывается свинцом, а от воздействия во-
дяного пара, сернистого газа, морской атмосферы (при
повышенных температурах)—алюминием толщиной до
0,3 мм. Для защиты от воздействия высоких температур
их покрывают вольфрамом и другими тугоплавкими ме-
таллами. Металлизацию распылением, кроме того, при-
меняют для исправления брака отливок, восстановления
размеров изношенных деталей.
Основные недостатки металлизации, несмотря на ее
простоту, — большой расход металла (угар, распыление),
пористость получаемого покрытия, низкая адгезия по-
крытия к металлу и трудность регулирования толщины
слоя покрытия.
В настоящее время находит широкое применение ме-
тод осаждения металлов на неметаллы в вакууме. Этот
процесс может произойти и в том случае, если поверх-
ность, на которую наносится покрытие, имеет более низ-
кую температуру. Примером осаждения металлов в ваку-
уме может служить процесс серебрения восковых матриц
в производстве грампластинок и получения проводя-
щего слоя на пластмассах. Толщина покрытий, получае-
мых этим способом, очень мала (0,25—2,5 мкм), аппара-
тура, применяемая при этом способе, и ее обслуживание
очень дороги.
3. Неметаллические покрытия
Неметаллические покрытия подразделяются на лако-
красочные, покрытия полимерными материалами, рези-
ной, силикатными эмалями, смазками, пастами. Они
применяются для защиты металлических изделий, аппа-
169
рагуры и конструкций от коррозии, изоляции деталей
электромашин, предохранения изделий от гниения, ув-
лажнения и придания им красивого внешнего вида.
1. Лакокрасочные покрытия. Наибольшее применение
из неметаллических покрытий находят лакокрасочные
покрытия, ассортимент их превышает более 1 000 наиме-
нований. Сырьем для получения лакокрасочных покры-
тий служат пленкообразующие вещества, наполнители,
растворители, пластификаторы, пигменты, катализаторы
(сиккатив). Пленкообразующие вещества являются
основой покрытия. Из них наибольшее применение нахо-
дят синтетические смолы, эфиры, целлюлозы, высыхаю-
щие масла, реже — животные клеи, жидкое стекло, дек-
стрин, казеин, природные смолы. В состав покрытий
пленкообразующие вещества вводятся в жидком состоя-
нии. Для их растворения используются спирты, бензины,
кетоны, ксилол, нитропарафины и другие растворители.
Эластичность пленки покрытия достигается введением в
•го состав пластификаторов-мягчителей (касторовое мас-
ло, дибутилфталат, трикрезилфосфат и др.), количество
которых, достигает 20—75% от массы пленкообразующе-
ге вещества.
Для снижения стоимости покрытия, повышения кор-
розионной стойкости и термостойкости в его состав вво-
дят наполнители: тальк, слюду, каолин, асбестовую пыль,
ииатовые материалы и др. Повышение твердости, термо-
стойкости, механической прочности, водонепроницаемо-
втп, придания определенного цвета достигается введени-
ем в состав покрытия пигментов. Это высокодисперсные
(от 0,5 до 5 мкм), нерастворимые в пленкообразую-
щих веществах, воде и растворителях оксиды, соли или
порошки металлов: литопон, титановые и цинковые бе-
лила, охра, свинцовый, цинковый крон, оксид хрома,
алюминиевая пудра и др. Для ускорения процесса высы-
хания масляных пленок вводят в их состав катализато-
ры-сиккативы (соли жирных органических кислот мар-
ганца, кобальта и др.).
Процесс нанесения покрытия состоит из нескольких
стадий: 1) подготовка поверхности металла к покрытию;
2) нанесение грунта, улучшающего адгезию покрытия
с металлом; 3) нанесение промежуточного слоя с целью
выравнивания поверхности; 4) нанесение одного или не-
скольких слоев покрытия на поверхность изделия; 5) по-
лирование покрытия для получения устойчивого блеска.
170
Рис. 67. Схема строения ла-
кокрасочного покрытия:
/ — металл; 2 — слой грунта;
3— шпаклевка; 4 — слой эмали
Лакокрасочные материалы наносят на поверхность
изделий вальцеванием, распылением, окунанием, обли-
ванием, с помощью кисти, электростатическим и электро-
форетическим методами. Последние два метода широко
используются для окрашивания кузовов автомобилей,
велосипедных рам, швейных машин и т. д.
После нанесения покрытия на поверхность изделия
подвергают холодной или горячей сушке для образова-
ния пленки. Холодная сушка осуществляется на воздухе
при относительной его влажности не более 65% и темпе-
ратуре помещения не ниже
12° С, тогда как температу-
ра горячей сушки зависит от
, свойств и состава покрытия.
Горячую сушку проводят в
сушилах нагретым воздухом
(конвекционная сушка), ин-
фракрасными лучами (ра-
диационная сушка), токами
промышленной или повы-
шенной частоты (индукцион-
ная сушка).
Из лакокрасочных материалов готовят олифы, лаки,
краски, эмали, грунты, шпаклевки. Лаки — растворы
пленкообразующих веществ (синтетических и природ-
ных смол) в легколетучих органических растворителях.
При введении в состав олиф пигментов получают масля-
ные краски. Эмалевые краски, или эмали, готовят введе-
нием в состав лаков пигментов. Для прочного сцепления
покрытия с поверхностью изделия используют грунты.
Грунты придают покрытию антикоррозионные свойства.
Устранение рисок, углублений, изъянов, особенно в швах
после сварки, и т. д. достигается с использованием шпак-
левки— пасты (подмазочная масса), состоящей из пиг-
ментов, наполнителей, пленкообразующих веществ.
Шпаклевки бывают клеевые, масляные, лаковые, пер-
хлорвиниловые и др. Независимо от цели применения-
строение лакокрасочного покрытия однотипно (рис. 67).
По назначению лакокрасочные покрытия подразделя-
ются на устойчивые к агрессивным средам (т. е. устойчи-
вые к атмосферной коррозии, химическим реагентам,
маслам, бензолу), к воздействию нагревания (термо-
стойкие), плесени; токопроводящие, необрастающие, све-
тящиеся; декоративные.
171
Химически стойкие лакокрасочные покрытия. Для
получения химически стойких лакокрасочных покрытий
в качестве пленкообразующего применяют синтетические
смолы, устойчивые к воздействию атмосферы, морской
воды, растворам кислот, щелочей, солей, органическим
соединениям. Наибольшее применение для изготовления
химически стойких покрытий находят эпоксидные, поли-
уретановые, полихлорвиниловые, фуриловые, феноло-
формальдегидные, алкилфенольные и другие смолы. На
основе этих полимеров готовят лаки, эмали, грунты,
шпаклевки.
Эпоксидные смолы обладают высокой адгезией к ме-
таллам и другим материалам. Получаемые на основе
этих смол покрытия устойчивы к воздействию 20-25%--
ного раствора NaOH при нагревании до 125° С, 20—
25%-ной НС1, 70%-ной H2SO4, Н3РО4, HNO3, СН3СООН,
влажного хлора, не растворяются в ксилоле, хлорофор-
ме, бензине и т. д., обладают влаго- и атмосферостой-
костью, высокими электроизоляционными и механически-
ми свойствами, эластичностью. Перед нанесением эпок-
сидных материалов на поверхность детали в их состав
вводят отвердители, способные переводить линейную
структуру полимера в сетчатую и превращать покрытие
в термореактивное состояние. Эпоксидные покрытия на-
носят на стальные бобины машин вискозного производ-
ства, судовые аккумуляторы, приборы, эксплуатирую-
щиеся в тропическом климате, и т. д.
Покрытия на основе полихлорвинила, перхлорвинило-
вых смол и сополимеров хлористого винила применяют
для защиты от коррозии гальванических ванн, аппаратов
химической водоочистки, приборов, сельскохозяйствен-
ных машин, окраски морских и речных судов и т. д. Они
доступны и дешево стоят. Лаки, эмали, полученные на ос-
нове этих смол, устойчивы к азотной, соляной, серной,
уксусной и другим кислотам, щелочам, маслам, бензину,
парам воды и газа (SO2, SO3, N2O3, NH3, HC1). Покры-
тия морозоустойчивы, негорючи, устойчивы против гриб-
ков плесени, но имеют низкую термостойкость (до
100° С) и адгезию к металлам, поэтому их наносят на из-
делия по слою из алкидных, фенолоформальдегидных и
других смол.
Полиуретановые покрытия (лаки, эмали, грунты,
шпаклевки) обладают высокой адгезией к металлам, не-
металлическим материалам. Они устойчивы в кислых
172
средах, органических соединениях, имеют высокие проч-
ностные и электроизоляционные свойства, газонепрони-
цаемы, атмосферостойки, эластичны. Их используют для
окраски емкостей, хранилищ нефти и нефтепродуктов,
защиты магниевых и алюминиевых сплавов, изоляции
проводов, изделий, работающих в условиях тропического
климата, и др.
Покрытия, получаемые на основе фенолоформальде-
гидных смол (растворимых в ацетоне, эфире и спиртах),
устойчивы к воздействию кислот, щелочей, растворов со-
лей, органических соединений.
Для получения лаков, эмалей используют смолы (мо-
дифицированные канифолью или жирными кислотами),
совмещающиеся с растительными маслами и синтетиче-
скими смолами, например алкидными, меламинными.
Фенолоформальдегидные покрытия применяют для
защиты деревянных частей самолетов от увлажнения,
воздействия бактерий, защиты трубопроводов от раство-
ров слабых кислот, щелочей, солей, изделий, устойчивых
в условиях тропического климата, холодильников, сти-
ральных машин, медицинского и торгового оборудования
и т. д.
В последнее время в качестве химически стойких по-
крытий применяются покрытия, получаемые на основе
фуриловых смол, обладающие и повышенной теплостой-
костью.
Термостойкие и электроизоляционные покрытия. Тер-
мостойкие покрытия получают на основе кремнийоргани-
ческих соединений. Они устойчивы к длительному воз-
действию температур до 300° С и кратковременному до
800° С и сохраняют свои свойства при низких темпера-
турах. Покрытия эластичны, водо-, масло-, бензо- и атмо-
сферостойки. Особенно высокой термостойкостью обла-
дают покрытия, содержащие в своем составе пигменты:
оксиды титана, хрома, алюминиевый порошок и наполни-
тели: слюду, асбест, графит. Так, например, эмаль-9, со-
стоящая из полифенилсилоксановой и алкидной смолы
(94%) и алюминиевой пудры (6%), выдерживает нагре-
вание в течение 100 ч до 500° С и более длительное вре-
мя— до 400° С. Поэтому ее применяют для окрашивания
автомобильных радиаторов, деталей сушильных устано-
вок, аппаратуры химических заводов и т. д. Покрытия
на основе полиорганосиликоповой эмали термостойки.
Например, образцы из незащищенной стали при 500° С
173
в течение 380 ч увеличивают массу до 140 г/м2, тогда как
образцы из той же стали, но покрытые эмалью увеличи-
ваются в массе только до 24 г/м2. Это говорит о том, что
сталь при 500° С практически окисляется до разрушения,
тогда как та же сталь, покрытая эмалью, может выдер-
живать такую температуру длительное время.
На основе полиэтил- и полиметилфенилсилоксановых
полимеров, модифицированных другими полимерами, на-
носят покрытия на части катушек и секций электриче-
ских машин, работающих при нагревании, получают теп-
лостойкую изоляцию для электродвигателей, установлен-
ных на судах, самолетах и т. д. Покрытие, полученное
на основе полиметилфенилсилоксаповой смолы, обладает
высокими электроизоляционными свойствами, например,
имеет электрическую прочность при —60, +20, +200° С
соответственно 100—120, 50—70, 90—100 МВ/м, при
удельном объемном электросопротивлении, равным при
+20 и 200°С— (1—5)- 1013 и (1—5)- 109. Для получения
термостойких и электроизоляционных пленок используют
фенолоформальдегидные, эпоксидные, меламиноглифта-
левые и другие смолы. Применение их улучшает исполь-
зование ценных материалов в электрических машинах й
аппаратах, снижает массу и размеры при сохранении
мощности.
Необрастающие и другие покрытия. Необрастающие
краски — краски, наносимые на обшивку морских судов
для защиты их от обрастания раковинами морских орга-
низмов. За один год слой обрастания в южных морях
достигает 0,5 м, т. е. 100—150 кг/м. Это увеличивает со-
противление движению судна, на что затрачивается до
8% мощности двигателей, а следовательно, повышается
расход топлива. Удалить такой слой с поверхности меха-
нически представляет большую трудность и требует вво-
да судна в док. Поэтому подводную часть судна покры-
вают необрастающими красками. Их готовят на основе
перхлорвиниловой смолы, сополимеров винилхлорида с
винилацетатом и других смол, в состав которых вводят
оксид меди (I), оксид ртути, соединения мышьяка. Та-
кие краски не только защищают подводные части кораб-
ля от обрастания, но и предотвращают взаимодействие
металла с морской водой и атмосферой.
Для защиты обшивки самолетов, особенно летающих
со скоростью больше скорости звука, следует учитывать
не только воздействие атмосферной коррозии, но и на-
174
гревание обшивки за счет трения ее поверхности со слоем
воздуха, а также эрозию поверхности при ударах капель
дождя, града, частичек пыли и т. д. Чем выше скорость
самолета, тем выше нагревание его поверхности (рис.
68). Следовательно, для продления срока службы само-
лета необходимо применять лакокрасочные покрытия на
основе термостойких полимеров, которые были бы устой-
чивы к воздействию атмосферной коррозии, к низким и
высоким температурам и обладали износостойкостью.
Для этой цели готовят эмали, содержащие эпоксидные.
поливинилбутираль н ы е,
глифталевые, кремнийор-
ганические (типа К-1.К-2,
№ 9) и другие полимеры.
Для окраски автомо-
билей, велосипедов, мото-
циклов, мотороллеров ис-
пользуются эмали, полу-
чаемые на основе глифта-
левых, мелампноформаль-
дегидных и других смол.
Их наносят в два-три слоя
с последующей сушкой
при 120—130°С в течение
Рис. 68. Изменение температуры
разогревания поверхности обшив-
ки самолета при различных скоро-
стях (v)
60 мин. Получаемое покрытие не требует полировки.
Станки, сельскохозяйственные машины, приборы и дру-
гое оборудование покрывают лаками и красками, полу-
чаемыми с применением быстросохнущих нитроглифта-
левых, алкидностирольных, эпоксидных и других смол.
Такие покрытия устойчивы к атмосферной коррозии,
прочны и могут иметь в зависимости от свойств пигмента
различные цвета: голубой, светло-коричневый, светло-
зеленый, сиреневый, желтый и т. д.
Лакокрасочные материалы используются для окрас-
ки предметов, окружающих нас (мебель, холодильники,
швейные и стиральные машины и т. д ). Кроме перечис-
ленных покрытий применяют термочувствительные (из-
меняют цвета при изменении температуры), фунгицид-
ные и бактерицидные (предотвращают появление плесе-
ни, самодезинфицируют), светящиеся и другие покрытия.
2. Покрытия полимерами. Для защиты от воздействия
внешней среды детали, изделия, конструкции покрыва-
ются смолами — полимерами. Смолу наносят в виде рас-
175
плава или суспензии кистью, окунанием, напылением
(газопламенное и вихревое). После подогрева и охлаж-
дения на поверхности детали образуется пленка полиме-
ра толщиной в несколько миллиметров. Для защиты из-
делий от коррозии применяют термопластичные полиме-
ры: полиэтилен, полипропилен, фторопласты, полисти-
рол, полиизобутилен, эпоксидные смолы и др.
Газопламенное напыление осуществляют аппаратом
пистолетообразного вида, из бачка которого подсасыва-
ется тонкоизмельченный порошок смолы, который пла-
вится под действием теплоты воздушно-ацетиленового
пламени и при выходе из сопла в расплавленном состоя-
нии распыляется сжатым воздухом или инертным газом
на покрываемую поверхность.
Вихревое напыление, или напыление в псевдокипя-
щем слое, проводят в вертикально расположенных ван-
нах, где тонкоизмельченный порошок любого термопла-
стичного полимера под действием сжатого воздуха пре-
вращается в псевдокипящее состояние, напоминающее
кипящую жидкость — «кипящий слой». В такой «кипящий
слой» на несколько секунд вводится покрываемое изде-
лие, предварительно нагретое выше температуры размяг-
чения наносимого полимера. Время пребывания изделия
в «кипящем слое» зависит от толщины получаемого слоя.
По окончании процесса напыления изделие помещают
в печь для окончательного оплавления нанесенного слоя.
Фторопласты наносят в виде суспензий, которые го-
товят из тонкоизмельченного полимера, разбавителя- (во-
да, этиловый спирт и др.) и стабилизатора. Суспензию
наносят кистью, окунанием, распылением, после чего
деталь нагревают до 260—275° С для расплавления поли-
мера и получения на поверхности изделия покрытия, на-
пример, для пленки толщиной 80—120 мкм требуется
нанести до десяти слоев. Фторопластовые покрытия устой-
чивы к воздействию морской воды, неорганическим кис-
лотам, кроме олеума и азотной концентрированной кис-
лоты, в которых набухают, ко многим и другим средам.
Они обладают высокими электроизоляционными и ме-
ханическими свойствами. Кроме того, для футеровки ем-
костей и аппаратов с целью защиты их от коррозии на их
внутреннюю поверхность приклеивают или приваривают
листы из полимерных материалов.
3. Гуммирование. Покрытие резиной и эбонитом хи-
мических аппаратов, трубопроводов, цистерн, емкостей
176
для перевозки и хранения химических продуктов и т. п.
называется гуммированием. В зависимости от условий
технологического процесса, характера среды и т. д. вы-
бирается тип и метод покрытия. Мягкими резинами, со-
держащими от 2,0 до 4,0% серы, гуммируют аппараты,
подвергающиеся сотрясениям, ударам, резким колебани-
ям температур или содержащие суспензии, а для аппа-
ратов, работающих при постоянной температуре, не под-
вергающихся механическим воздействиям, применяют
твердые резины (эбониты), содержащие от 40 до 50%
серы. Для получения плотного защитного слоя очень ча-
сто совмещают резину и эбонит.
Перед нанесением слоя резины или эбонита поверх-
ность изделия тщательно очищают от загрязнений опес-
коструиванием, промывают бензином, обрабатывают
кислотами ( H2SO4, HCI) и затем промывают раствором
соды и воды. Для получения плотного сцепления метал-
лической поверхности с обкладочным материалом приме-
няются резиновые клеи, т. е. растворы каучуков (хлоро-
преновый и др.) в растворителях (бензин и др.).
При гуммировании сырую резину в виде пластин на-
носят на промазанную клеем поверхность, прокатывают
роликами для устранения неплотностей между резиной и
металлом и удаления воздуха, а затем проводят вулка-
низацию. В зависимости от назначения и условий работы
аппарата применяют одно-, двух, трехслойную обкладку.
Для гуммирования могут использоваться резины и эбо-
ниты на основе натурального, бутадиен-стирольного, бу-
тадиен-нитрильного, хлоропренового и фторсодержащих
каучуков, бутилкаучука. Покрытие резиной или эбони-
том обладает хорошими диэлектрическими свойствами,
химической стойкостью к соляной, плавиковой, уксусной,
лимонной кислотам любой концентрации до 65° С, к ще-
лочам, нейтральным растворам солей, к 50 %-ной серной
и 75%-ной фосфорной кислотам. Однако сильные окис-
лители (азотная, концентрированная серная кислоты, пе-
рекиси) разрушают эти покрытия.
Наряду с резиновыми и эбонитовыми обкладками, в
антикоррозионной технике для гуммирования применяют
растворы каучуков с наполнителями и другими добавка
ми на органическом растворителе, образующие на защи-
щаемой поверхности гладкую, плотную пленку. Для этой
цели используются хлоропреновый, натрийбутадиеновый,
полисульфидный и другие каучуки. Применяя хлоропре-
177
новый каучук (наирит), его растворяют в смеси соль-
вента (76%), скипидара (19%) и n-бутилового спирта
(5%). Полученный раствор наносят на защищаемую по-
верхность и изделие вулканизируют.
Из полисульфидных каучуков в технике широко ис-
пользуется жидкий тиокол в смеси с мелкодисперсными
вулканизирующими агентами (перекись марганца), на-
полнителями (сажа) и другими добавками. Из него го-
товят пасты, которые чаще всего наносят на грунт (хло-
ропреновый, эпоксидный и др.) или клей. Вулканизация
тиоколовых резин проводится при комнатной темпера-
туре в течение нескольких часов. Получаемые покрытия
устойчивы к воздействию воды, бензина, маслам и дру-
гим органическим растворителям, атмосферы воздуха и
медленно стареют.
Силиконовые каучуки могут использоваться для за-
щиты аппаратуры от коррозионного разрушения. Эти
каучуки смешиваются с усиливающими наполнителями
(белая сажа и др.) и вулканизирующими агентами
(кремний- и оловоорганические соединения). Покрытия
из диметилсилоксанового каучука на металл наносят на
грунты или клеи. Вулканизацию пленки проводят при
комнатной температуре в течение суток. Такие пленки
не разрушаются при длительном воздействии кислорода
и озона, сохраняют свои свойства от —50 до +250° С,
имеют высокую водостойкость. В табл. 20 приводятся не-
которые свойства резиновых покрытий на основе жидких
материалов.
4. Покрытия силикатными эмалями. Аппаратура, ра-
работающая при повышенных температурах, давлениях
и в сильно агрессивных средах, подвергается эмалирова-
нию. Для эмалирования используют силикатные эмали,
представляющие собой стеклообразное вещество. В за-
висимости от назначения готовятся эмали разнообраз-
ного состава и свойств, но все они содержат стеклообра-
зующие оксиды (SiO2, В2О3 и др.), вспомогательные ве-
щества, например, окислители (NiO), глушители (SnO2,
ZrO2, фториды), красящие вещества (MnO2, Cr2O3, TiO2,
Fe2O3 и др.). Для получения эмалей используют горные
породы (песок, глину) и искусственные химические реа-
генты— плавни (буру, содовые продукты и др.). Для
увеличения адгезии эмали к металлу, придания опреде-
ленной окраски и специальных свойств в состав шихты
вводят оксиды никеля, кобальта, хрома, меди и др.
178
Таблица 20
Некоторые свойства резиновых покрытий
^Свойства Покрытия на основе жидкого
наирита тиокола силоксана
Плотность • 103, кг/м3 1,4—1,5 1,8—2,5 1,9—2,2
Прочность на разрыв, 7—9 2—4 1,5—2,5
МН/м2 (кгс/мм2) (0,7—0,9) (0,2—0,4) (0,15—0,25)
Относительное удлинение, о/ 240—280 250—400 180—220
/0 Адгезия к стали (через 3—5 2,5—3,5 0,6—1,0
грунт) на отрыв, МН/м2 Температура хрупкости, —40 —40 —50
°C Водонабухаемость за 30 3—10 1—1,5 1
суток, % Маслостойкость Удовлетво- Высокая Отсутствует
Химическая стойкость в некоторых средах: а) слабые растворы кис- лот: серная рмтельная С* (до 93%) С (до 50%) Н
соляная с С (до 80%) Н
ортофосфорная С (до 85%) — Н
азотная Н* н н
б) растворы солей и ос- нований:
сульфат алюминия с С (до 31%) —-
Alg (864)3 хлорид натрия NaCl с С (20%) —•
хлорид цинка ZnCl2 с С (10%) ——
едкий натр NaOll с с (10%) с (2%)
едкое кали KOI 1 с С (10%) Н
в) органические раствори- тели: бензин с с н
бензол н н н
этилацетат н УС* н
хлорированные угле- н УС н
водороды * С — стойкий; Н — нестойкий УС — условно стойкий.
Кислотоупорные эмали содержат в своем составе в
основном кремнезем, причем чем его больше, тем выше
кислотостойкость эмали, например, эмаль, содержащая
55—65% SiO2, 2—5% А12О3, 16—41% щелочных и щелоч-
ноземельных металлов, 2—5% CaF2, имеет кислотостой-
кость, равную 99,5%. Такая эмаль разрушается только
179
под действием плавиковой кислоты и фторидов. Наносят
эмали на поверхность изделий сухим (тонкоизмельченный
порошок) или мокрым (сметанообразная масса — шли-
кер) методами.
В зависимости от назначения эмали делят на грунто-
вые (более тугоплавкие) и покровные. Грунтовые эмали
наносят непосредственно на поверхность изделий с целью
улучшения адгезии и уменьшения механических и тер-
мических напряжений. Они предотвращают влияние ме-
талла и его примесей на качество покрытия. Так, при
защите изделий из чугуна грунтовые эмали наносят для
предотвращения окислительно-восстановительных про-
цессов, в результате которых могут образоваться поры и
темные пятна на поверхности покровной эмали.
Для нанесения эмалей применяют несколько спосо-
бов. По одному из них эмалирование проводят следую-
щим образом. Металлическое изделие (из чугуна) под-
вергают полному отжигу и поверхность его готовится к
покрытию. На подготовленную поверхность сначала на-
носится грунтовая эмаль, затем изделие нагревают до
880—920°С для спекания нанесенной на поверхность
пудры. После закрепления грунтовой эмали на нее на-
носится слой тонкоизмельченной покровной эмали и из-
делия снова нагревают при 840—860° С. В тех случаях,
когда требуется нанести несколько слоев эмали, этот
процесс чередуют с нагреванием. Изделия из чугуна по-
крывают тремя слоями (0,6—1,0 мм).
Стальные изделия чаще всего покрывают мокрым
способом (взвесь порошка эмали в воде) с последующим
нагреванием при 850—900° С, затем снова наносится слой
покрытия и производится обжиг и т. д. Эмалирование
осуществляют на станках-автоматах с использованием
индукционного нагрева. Такой способ не требует нагре-
вания всего аппарата до нужной температуры, а прогре-
вается только слой небольшой толщины до полного рас-
плавления эмали. Используя этот способ, эмаль можно
наносить на изделия, имеющие резьбу, резкие переходы
толщин, цилиндрической формы, трубы и т. д.
Эмалированные аппараты широко используются в хи-
мической промышленности, например, при проведении
процессов хлорирования, бромирования, нитрования, при
получении органических, фармацевтических продуктов,
химических реагентов высокой степени чистоты, взрывча-
тых веществ и т. д. Кислотостойкая эмаль устойчива к
180
разбавленным кислотам (до 6% НС1, 15% H2SO4, Н3РО3)
при температуре их кипения. Эмалированная аппаратура
неустойчива к воздействию плавиковой и кремнефтори-
стоводородной (H2SiF6) кислотам, к растворам и рас-
плавам фторидов и гидроксидов.
К недостаткам эмалированной аппаратуры относятся
их невысокая термостойкость (до 300—500°С), низкий
коэффициент теплопередачи, небольшая емкость аппа-
ратов (до 25 м3). Эмалированные аппараты из стали мо-
гут работать при —70° С, а из чугуна — при —30° С.
В последние годы разработаны жаростойкие керамиче-
ские эмали, выдерживающие нагревание до 1 100° С в
газовых средах в течение 150—1 000 ч. Силикатные эма-
ли используются для получения комбинированных по-
крытий.
При использовании эмалированной аппаратуры сле-
дует учитывать, что при ударе эмаль скалывается и рас-
трескивается, не выдерживает резких колебаний темпе-
ратуры, местных перегревов, быстрого нагревания (на-
гревание не более 2 град/мин, а охлаждение — до
1 град/мин) и обогрева аппарата прямым пламенем.
5. Покрытия смазками и пастами. При хранении и пе-
ревозке металлических изделий коррозия их может воз-
никать в результате воздействия остатков хлорида нат-
рия, органических и неорганических веществ, например
хлор- и сульфат-ионов (из воды, применяемой при про-
мывке), действием газообразных продуктов окружающей
среды (О2, СО2, SO2, H2S и т. д.), пыли, паров воды, воз-
духа и т. д.
Для снижения избыточной влажности используют в
основном силикагель, тогда как другие обезвоживающие
средства [СаС12, P2Os, H2SO4 (конц.)] стимулируют корро-
зию. При упаковке авиационных моторов, орудий и ма-
шин силикагель помещается в пыленепроницаемые ме-
шочки, которые вкладываются во внутрь. Поглощая вла-
гу, силикагель поддерживает относительную влажность
воздуха до 20—30%.
Антикоррозионные смазки готовят па основе мине-
ральных масел (машинное, вазелиновое и др.) и воско-
образных веществ (парафина, мыла, жирных кислот
и др.). В смазки для защиты изделий из стали вводят
небольшое количество щелочи (пушечная смазка). Ши-
роко применяется смазка, состоящая из 95% петрола-
тума и 5% парафина.
181
Защитные пасты готовят из суспензий церезина (ми-
неральный воск) или парафина и каучука или полиизо-
бутилена в уайт-спирите (фракция при перегонке неф-
ти). Их наносят на поверхность готового изделия распы-
лением или тампоном. Образующаяся после высыхания
пленка защищает его от воздействия окружающей среды.
С целью предотвращения появления на поверхности де-
тали плесени в состав паст_вводят фунгициды.
Защита металлических аппаратов от коррозии может
осуществляться в парах ингибитора, так как поверхность
металла покрывается адсорбционной защитной пленкой.
Для их защиты необходимо, чтобы в 1 м3 воздуха при
25° С содержалось 2 мг ингибитора. Летучие ингибиторы
применяются в виде пудры, в растворе или нанесенными
на бумагу. Наибольшее применение в качестве замедли-
нс — сн
телей находят вещества следующего строения: нс СН
/R Х
(например, фуран, тиофен, пиррол и Др.), N^-R(H)
XR(H)
(где R — алифатический или ациклический радикал)
и др.
Глава XVII
ЭЛЕКТРОХИМИЧЕСКАЯ ЗАЩИТА
Использование коррозионно-стойких материалов, а
также нанесение защитных покрытий не всегда приме-
нимы для борьбы с коррозией. Окраску металлических
конструкций следует периодически подновлять и возоб-
новлять, что связано с большими затратами. Иногда это
сделать и невозможно, например, на проложенных в зем-
ле трубопроводах и кабелях, конструкциях в морской
воде. Обновление окраски судов связано с перерывом в
их эксплуатации.
Используя электрохимическую защиту, можно преду-
предить разрушение трубопроводов, корпусов судов, ре-
зервуаров и реакционных аппаратов и т. д. При электро-
химической защите к металлическим конструкциям при-
соединяется извне посторонний сильный анод (протек-
тор или источник постоянного тока), который вызывает
на поверхности защищаемого металла катодную поля-
ризацию электродов микрогальванических пар, в резуль-
182
тате чего анодные участки металла конструкции пре-
вращаются в катодные. А это означает, что разрушать-
ся будет не металл конструкции, а присоединенный
анод. Электрохимическую защиту подразделяют на ка-
тодную и анодную.
Рис. 69. Схема катодной защиты
внешним током:
а — принципиальная схема; 1 — труба
с покрытием; 2 — соединительные про-
вода; 3 — источник постоянного тока:
4 — анодиое заземление; б — электри-
ческая схема; К\ — катодные участки
конструкции; Д1 — анодные участки кон-
струкции; Аг — дополнительный анод
1. Катодная защита
Катодную защиту широко используют как дополни-
тельное (к изолирующему покрытию), так и самостоя-
тельное средство для защиты от коррозии металлических
конструкций подземных
сооружений, газопрово-
дов, резервуаров и др.
Применяют ее также для
защиты аппаратуры про-
мышленных предприятий:
конденсаторов, холодиль-
ников, теплообменников и
др. Сущность катодной
защиты состоит в том, что
к защищаемой конструк-
ции присоединяется отри-
цательный полюс источ-
ника постоянного тока
или протектор (катод), а положительный полюс источни-
ка тока присоединяется к пластинке металла или графи-
та (анод). Принципиальная схема катодной защиты при-
ведена на рис. 69. Корродирующий металл можно пред-
ставить как короткозамкнутый многоэлектродный галь-
ванический элемент. Переход ионов металла с анодных
участков в раствор и электронов—с анодных участков
к катодным, восстановление деполяризаторов на катоде
обусловливают появление электрического тока, а следо-
вательно, и коррозию металла. Поэтому, присоединяя
отрицательный полюс источника тока к защищаемому
изделию, превращаем его в катод, т. е. предотвращаем
разрушение. При таком присоединении будет разряжать-
ся источник постоянного тока и разрушаться пластина
металла, являющаяся анодом. Катодную защиту оцени-
вают величиной защищаемого эффекта (Z, %) и коэффи-
циентом защитного действия (А3, г/А):
Йп — k\
z = ——- 100,
Ло
183
где k0 — весовой показатель коррозии металла без элект-
розащиты, г/(м2-ч); ki — весовой показатель коррозии
при использовании электрозащиты, г/(м2-ч).
Для определения К3 необходимо знать катодную
плотность тока 1К (А/м2), весовые потери металла в кор-
розионной среде без электрозащиты Ago (г/м2) и весовые
потери металла при электрозащите Agi (г/м2):
Ago — Agi
Выбор оптимальной плотности тока для защиты оп-
ределяется защитным эффектом, коэффициентом защит-
ного действия, т. е. уменьшением коррозионных потерь
на каждую единицу катодной плотности тока.
Например, в выпарном
аппарате (изготовленном из
чистого никеля) по произ-
водству безводного едкого
натра для предупреждения
коррозии стенок по центру
котла помещается никеле-
вый стержень диаметром
40 мм (анод), а к стенкам
котла подводится ток плот-
ностью 1—10 А/м2. Такая
защита обеспечивает дли-
тельную работу выпарного
аппарата.
Протекторная защита
(рис. 70) осуществляется
присоединением к конструк-
ции пластины металла, по-
тенциал которого более от-
рицательный, чем потенциал металла конструкции. Про-
текторная защита применяется для конструкций, работа-
ющих в растворах солей, морской воде. Применять про-
текторы для защиты аппаратуры, работающей в водо-
проводной или речной воде, невыгодно в связи с их низ-
кой электропроводностью, так как в этом случае приш-
лось бы устанавливать протекторы больших размеров. В
сильно агрессивных средах такую защиту применять не-
целесообразно ввиду быстрого разрушения . протектора.
При защите конструкций из стали, чугуна применяют
протекторы из магния, цинка или сплава, содержащего
Рис. 70. Схема протектор-
ной защиты:
а — принципиальная схема; б —
электрическая схема; Ki — ка-
тодные участки конструкции;
Ai—анодные участки конструк-
ции; А2 — протектор
184
90% алюминия и 10% цинка.
Протекторная защита находит применение для за-
щиты холодильного оборудования (испарители, трубы,
конденсаторы), работающего с солевыми охлаждающи-
ми рассолами, в судостроении, котлостроении и химиче-
ском машиностроении, для защиты хранилищ нефти.
В качестве характеристики работы протектора исполь-
зуется электродный потенциал, защитный эффект, ко-
эффициент защитного действия, выход тока и коэффи-
циент полезного действия. Теоретический выход тока
протектора является обратной величиной электрохими-
ческого эквивалента (СтеОр) металла протектора, т. е.
(1/С
теор), А-ч/г.
Металл . . . • Al Fc Cd Mg Си NI Sn Pb Cr Zn
Стеор, г/А ч . 0,335 1,0416;2,097J 0,454 1,186 1,0948 2.214 3,865 0,324 1,220
Практический выход тока протектора (1/СПракт) опре-
деляется по формуле
Спракт
где Спрайт — практический электрохимический эквива-
лент металла, г/А-ч; \qn — весовые потери протектора,
г/м2; т — время работы протектора, ч.
Коэффициент полезного действия протектора (т), %)
рассчитывается по формуле
Стеор
—------100.
ьиракт
2. Анодная защита
Ряд металлов, например хром, никель, титан, цирко-
ний и железные сплавы, содержащие эти металлы, легко
переходят в пассивное состояние, которое устойчиво со-
храняют в окислительных средах. Это их свойство имеет
огромное практическое значение в защите от коррозии.
Образование пленок на металлах ведет к смещению по-
тенциала активного металла в отрицательную сторону,
что уменьшает скорость коррозии. Следовательно, можно
искусственно создать пассивное состояние поверхности
металла за счет анодной поляризации от внешнего ис-
точника тока электрической энергии, что сократит ско-
185
рость коррозии на несколько порядков при минималь-
ном расходе энергии, так как сила тока очень мала. Этот
вид борьбы с коррозией получил название анодной за-
щиты, которую целесообразно использовать в сильно аг-
рессивных средах. Анодная защита может осуществлять-
ся несколькими способами, но чаще всего простым нало-
жением постоянной э. д. с. от постороннего источника
тока. Причем в отличие от катодной защиты положи-
тельный полюс источника тока присоединяется к защи-
щаемому изделию, а катоды помещаются около поверх-
Рис. 71. Потеря массы
образцом стали
10Х18Н9Т:
1 — без поляризации; 2 — при
анодной поляризации током
2,5-10~« А/см2
ности изделия. Количество ка-
тодов, размеры их и расстоя-
ние от изделия должны обес-
печить равномерную анодную
поляризацию. Анодная защита
используется для предохране-
ния от разрушения изделий, из-
готовленных из легированных
сталей, например, 10Х18Н9Т,
титана, циркония. Эффектив-
ность анодной защиты можно
проследить при рассмотрении
коррозии стали 10Х18Н9Т в
50 %-ной серной кислоте и
50° С (рис. 71).
В настоящее время анодная
защита применяется в
промышленности также для защиты изделий из, углеро-
дистой стали, что увеличивает срок службы аппаратуры.
Применение анодной защиты уменьшает загрязнение аг-
рессивной среды продуктами коррозии. Так, например,
содержание железа в олеуме, находящемся в стальном
аппарате с анодной защитой, составляет всего 0,004%,
тогда как в аппарате без анодной защиты концентрация
железа в олеуме резко возрастает и становится равной
0,12%.
Глава XVIII
ЗАМЕДЛИТЕЛИ КОРРОЗИИ
Снизить скорость коррозионного процесса аппарату-
ры из металлов можно и изменением состава агрес-
сивной среды. Это достигается удалением коррозионно-
активных веществ (веществ, усиливающих коррозию)
186
или введением соединений тормозящих, а иногда и пол-
ностью прекращающих коррозионный процесс. Удалить
из агрессивной среды вещества, усиливающие скорость
коррозии, можно кипячением растворов, пропуская че-
рез них инертные газы, химической обработкой среды
и др.
Большой вред аппаратуре наносит кислород, присут-
ствующий в агрессивной среде, который резко усиливает
скорость коррозии. Поэтому вода или водные растворы
солей, где коррозия металлов и сплавов протекает с кис-
лородной деполяризацией, подвергается обескислорожи-
ванию, или деаэрации. Например, образец стали в сырой
воде начинает разрушаться через несколько минут, тогда
как после кипячения вода не реагирует со сталью дли-
тельное время. Это объясняется тем, что из воды были
удалены газы, в частности кислород. Если такую воду
изолировать от соприкосновения с воздухом, т. е. исклю-
чить растворение в ней кислорода, то сталь не будет
корродировать долгие месяцы и даже годы. Но этот спо-
соб снижения скорости коррозии аппаратуры и обору-
дования является громоздким и трудоемким, поэтому он
находит ограниченное применение. Практически его ис-
пользуют для защиты от коррозии теплосилового обору-
дования, например воду, употребляемую для котельных
установок, котлов, предварительно очищают от кисло-
рода.
Уменьшить или полностью исключить коррозию ме-
таллической аппаратуры возможно введением в агрес-
сивную среду соединений, значительно снижающих кор-
розионный процесс. Такой способ снижения скорости
коррозии называется ингибированием, а вводимые в сре-
ду вещества — ингибиторами, или замедлителями, кор-
розии. Ингибирование применяется только в системах с
постоянным объемом агрессивного раствора, например
при защите резервуаров, цистерн, травильных ванн, па-
росиловых установок, при снятии накипи и т. д. Концен-
трация вводимого в среду ингибитора зависит от состава
и свойств среды, температуры, pH раствора и др.; а эф-
фективность его защиты определяется защитным эффек-
том (Z, %) и защитным действием (К3):
Ка = -£° . Z2 = -^f^-100,
«1 Rq
где Ло — весовой показатель коррозии в среде без замед-
187
лителя, г/м2-ч; k\— весовой показатель коррозии в среде
с замедлителем, г/м2-ч.
Механизм действия замедлителей коррозии в боль-
шинстве случаев носит электрохимический характер, т. е.
одни вещества, вводимые в состав среды, замедляют
анодный, а другие — катодный процесс или одновремен-
но обе стадии процесса.
По характеру защитного действия применяемые ин-
гибиторы подразделяются на катодные, анодные и орга-
нические. К анодным замедлителям относятся вещества,
обладающие окислительными свойствами (хроматы, ди-
хроматы, нитриты и др.). Они образуют на анодной по-
верхности металла или сплава пассивные, чаще всего ок-
сидные пленки толщиной ~0, 01 мкм и уменьшают ско-
рость его растворения. Уменьшение скорости коррозии
достигается непосредственным торможением анодного
перехода металла в раствор или сокращением анодной
поверхности из-за образования защитных пленок.
К катодным замедлителям относятся вещества, спо-
собные тормозить отдельные стадии катодного процесса.
Например, в процессах, идущих с кислородной деполя-
ризацией, скорость коррозии уменьшается при снижении
концентрации кислорода в растворе. Поэтому введение
поглотителей кислорода в раствор (Na2SO3) снижает
скорость коррозии. Можно уменьшить коррозию, приме-
няя катодные замедлители, сокращающие поверхность
катодных участков. К ним относятся ZnSO4, ZnCh и др.
Снижение коррозии при введении этих соединений объ-
ясняется образованием в щелочной среде нерастворимо-
го соединения Zn(OH)2, которое, осаждаясь на стенках
аппарата, изолирует катодные участки поверхности от
соприкосновения с раствором.
Снизить скорость катодного процесса, идущего с во-
дородной деполяризацией, можно введением в агрессив-
ную среду веществ, повышающих перенапряжение водо-
рода на катоде. Такими ингибиторами являются соеди-
нения тяжелых металлов (AS2O3, Bi2(SO4)3 и др.).
Анодные и катодные замедлители (как правило, не-
органические соединения) снижают коррозию в ней-
тральных и щелочных средах, но не оказывают защит-
ного действия в кислых средах.
К органическим замедлителям коррозии относятся
органические коллоиды, поверхностно-активные вещест-
ва и другие соединения.. Органические ингибиторы адсор-
188
бируются на поверхности металла, причем не на всей по-
верхности, а лишь только на катодных, активных ее
участках, тормозя разряд ионов водорода, а следова-
тельно, и разрушение металла. Органические замедли-
тели не адсорбируются окисленной поверхностью или
продуктами коррозии, находящимися на ней, поэтому
они будут разрушаться под действием агрессивной сре-
ды. Этим свойством органических замедлителей пользу-
ются при кислотном травлении металлов, когда ржавчи-
на и окалина растворяются без заметной коррозии ме-
талла.
Защитное действие органических замедлителей зави-
сит от природы этих веществ, температуры и концентра-
ции их в агрессивной среде. С повышением температуры
уменьшается адсорбция их поверхностью и резко снижа-
ется защитное действие. Концентрация ингибитора в рас-
творе должна быть строго определенной.
Рассмотрим процесс очистки котельных установок от
накипи и загрязнений с использованием органических
замедлителей коррозии. Образование накипи вызывает
потерю теплоты, снижает к. п. д. котла, вызывает пере-
грев его стенок, способствует появлению свищей, разры-
ву труб. Механическое удаление накипи при помощи зу-
била, пневматического молотка, скребка часто связано
с повреждением стенок котла и требует больших затрат
труда. В настоящее время накипь удаляется растворе-
нием ее в НС1 в присутствии ингибитора:
СаСО3 -J- 2НС1 = СаС12 4- СО2 4- Н2О
Соляная кислота может реагировать с железом по ре-
акции
Fe 4- 2НС1 = FeCl2 4- Н2
что привело бы к разрушению металла. Но присутствие
ингибитора в кислоте не влияет на скорость растворения
накипи и резко тормозит растворение металла. Исполь-
зование этого способа сокращает применение тяжелого
физического труда, времени простоя оборудования и раз-
борки котельных установок.
Не менее важное применение находят ингибиторы
(табл. 21) при защите металла при травлении железных
труб, холодильных установок, электролизеров, цистерн,
резервуаров и т. д.
189
Таблица 21
Ингибиторы коррозии для различных металлов и сплавов
в различных средах
Металл Агрессивная среда Ингибитор
вещество концент- рация, % вещество концентра- ция, %
Алюминий Азотная кислота 10 Хлорат натрия или калия о,1
Морская вода — Фтор-амил-сте- арат 0,75
Едкий натр 1 Перманганат ка- лия 3-4
Соляная кислота 1 н. Фенилакридин —
Хлорид натрия 3,5 Хромат натрия 1
Фосфорная кис- лота 20—80 Хромат натрия Тиомочевииа 1 0,2
Сталь Аммиак — Формальдегид —
Вода соленая, содержащая суль- фиды Серная кислота 60-70 Мышьяк Додецила мин 0,01— -0,5
Фосфорная кис- лота Конц. Нитрит натрия 0,2
Хлорид натрия 0,05 Сульфат меди (5+.
Сталь Сериая кислота 2,5 ПЯТИВОДНЫЙ +20).
нержавеющая Хлорид натрия 4 Едкий натр • ю-1 0,8
Титан Серная кислота — Окислительная среда —
Никель Серная кислота — Хромовая кисло- та или сульфат ме- ди —
Гипохлорид нат- рия, раствор в бе- лильном щелоке Силикат натрия —_
ОГЛАВЛЕНИЕ
Предисловие . . ....................................... 3
Раздел первый
ОСНОВЫ МЕТАЛЛОВЕДЕНИЯ
Глава I. Строение и кристаллизация металлов............ 5
1. Строение металлов....................- . . 5
2. Построение кривых охлаждения................ 8
3. Кристаллизация металлов..................... 8
4. Аллотропия металлов.........................12
5. Методы изучения строения металлов...........14
Глава II. Основные свойства металлов и их определение . . 15
1. Свойства металлов...........................15
2. Определение свойств металлов................18
Глава III. Основы теории сплавов...................27
1. Основные сведения о сплавах ................27
2. Диаграмма состояния сплавов.................32
3. Связь между свойствами сплавов и типом диа-
граммы состояния...............................36
Глава IV. Железоуглеродистые сплавы................37
1. Диаграмма состояния железо — цементит .... 38
2. Влияние на сталь углерода, постоянных примесей
и легирующих элементов.........................40
3. Чугуны......................................41
Глава V? Термическая и химико-термическая обработка . . 45
1. Термическая обработка стали.................45
2. Химико-термическая обработка стали . . .... . 50
Глава VI. Углеродистые и легированные стали........54
1. Конструкционные стали.......................54
2. Инструментальные стали......................57
Глава VII. Цветные металлы и сплавы................60
1. Алюминий и его сплавы.......................60
2. Магний и его сплавы.........................64
3. Медь и ее сплавы . j........................66
Раздел второй
ОСНОВЫ ТЕОРИИ КОРРОЗИИ МЕТАЛЛОВ
Глава VIII. Классификация и виды коррозионных процессов. 70
1. Введение в теорию коррозии металлов.........70
2. Классификация коррозионных процессов.......71
Глава IX. Химическая коррозия..........................74
1. Коррозия металлов в жидкостях-неэлектролитах 74
2. Газовая коррозия............................75
191
Глава X. Электрохимическая коррозия....................84
1. Механизм электрохимической коррозии.......84
2. Электродные потенциалы.................. .85
3. Поляризация, деполяризация............... 88
4. Коррозия металлов с водородной деполяризацией 90
5 Коррозия металлов с кислородной деполяриза-
цией..........................................91
6. Влияние внутренних и внешних факторов на ско-
рость коррозии.................................92
7. Атмосферная коррозия.......................97
8. Коррозия металлов в почве..................99
9. Коррозия металлов и сплавов в морской воде . .101
10. Коррозия металлов и сплавов под действием
блуждающих токов............................. 102
Глава XI. Пассивность металлов и сплавов...........104
Глава XII. Методы коррозионных испытаний...........107
1. Способы оценки коррозионных процессов......107
2. Методы коррозионных испытаний .............109
Глава XIII. Коррозия важнейших металлов и сплавов . . . 112
1. Коррозия железа и сплавов на железной основе 112
2. Коррозионная стойкость цветных металлов ... .117
Раздел третий
КОРРОЗИОННО-СТОЙКИЕ МАТЕРИАЛЫ
Глава XIV. Металлические коррозиоиио-стойкие материалы 124
1. Коррозионно-стойкие сплавы па железоуглеродис-
той основе..............................*. . . 124
2. Титан и его сплавы........................129
3. Молибден, цирконий, бериллий и их сплавы . . . 132
Глава XV. Неметаллические конструкционные материалы 135
1. Силикатные материалы .....................135
2. Пластические массы........................142
3. Резина....................................151
4. Конструкционные материалы на основе графита 153
Раздел четвертый
МЕТОДЫ ЗАЩИТЫ ОТ КОРРОЗИИ
Глава XVI. Защитные покрытия..........................155
1. Способы подготовки поверхности изделий .... 156
2. Металлические покрытия и методы их нанесения 159
3. Неметаллические покрытия..................169
Глава XVII. Электрохимическая защита...............182
1. Катодная защита . 183
2. Анодная защита . ..........................185
Глава XVIII. Замедлители коррозии..................186
1978Г0Д
ИЗДАТЕЛЬСТВО
ВЫСШАЯ ШКОЛА