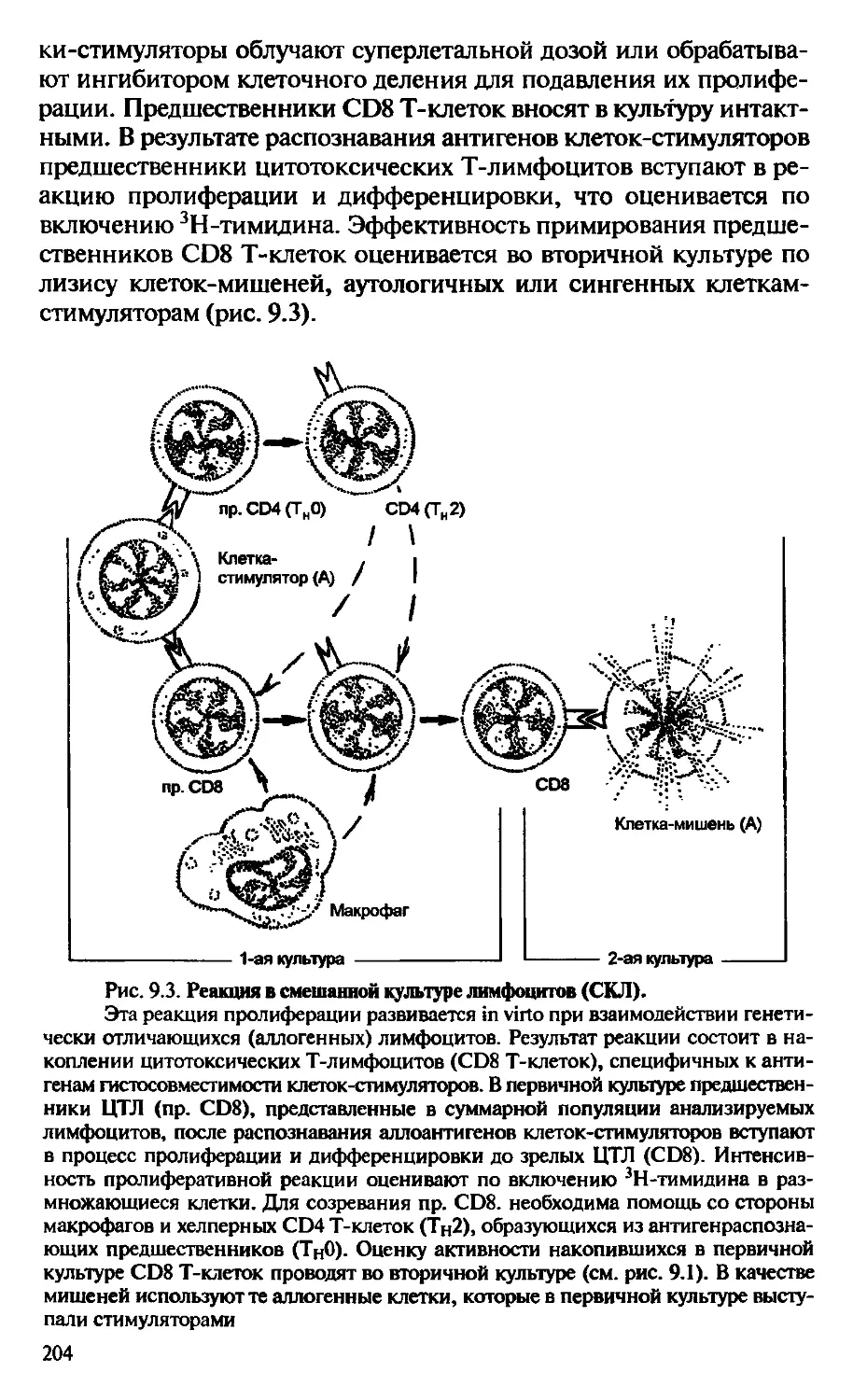
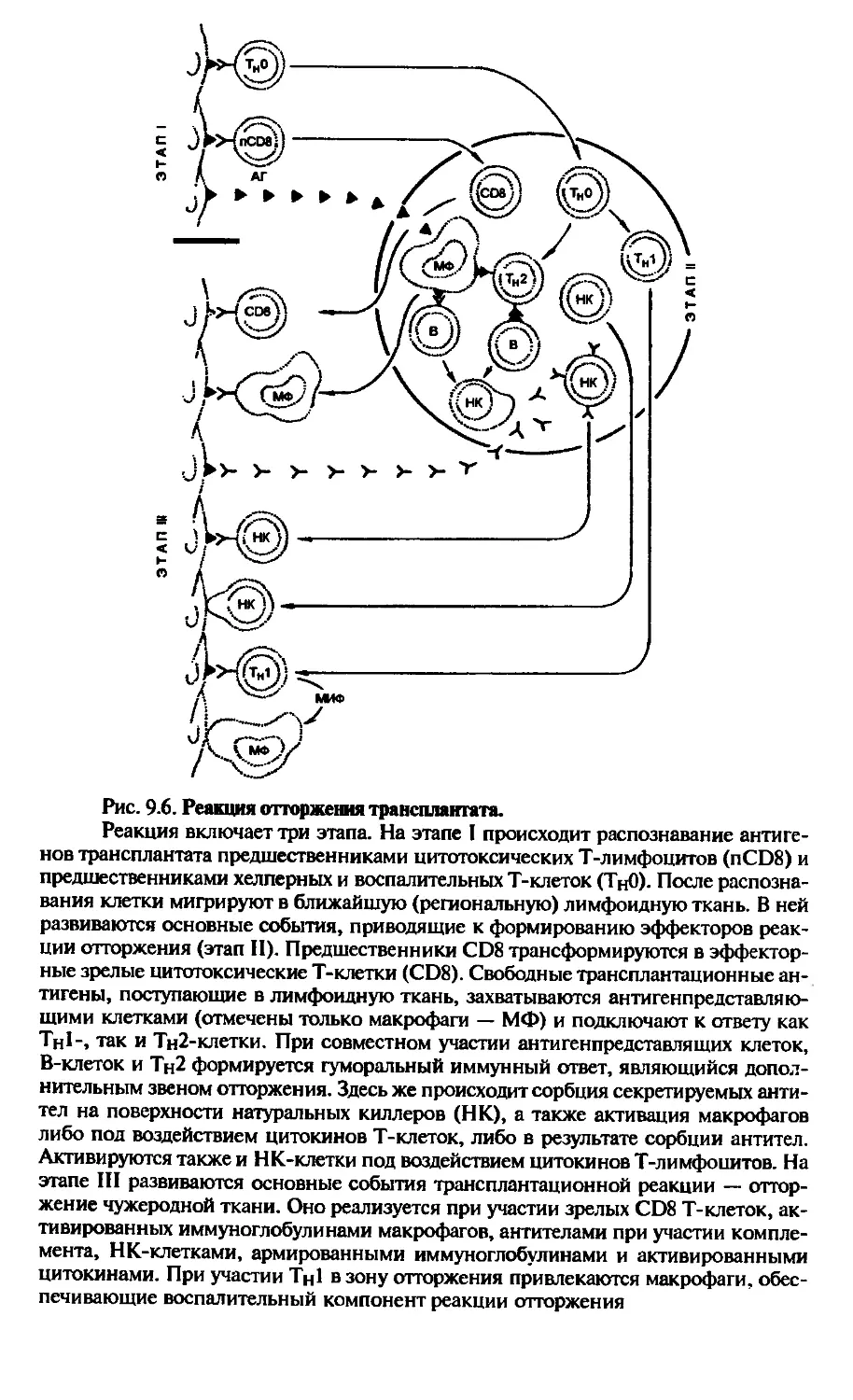
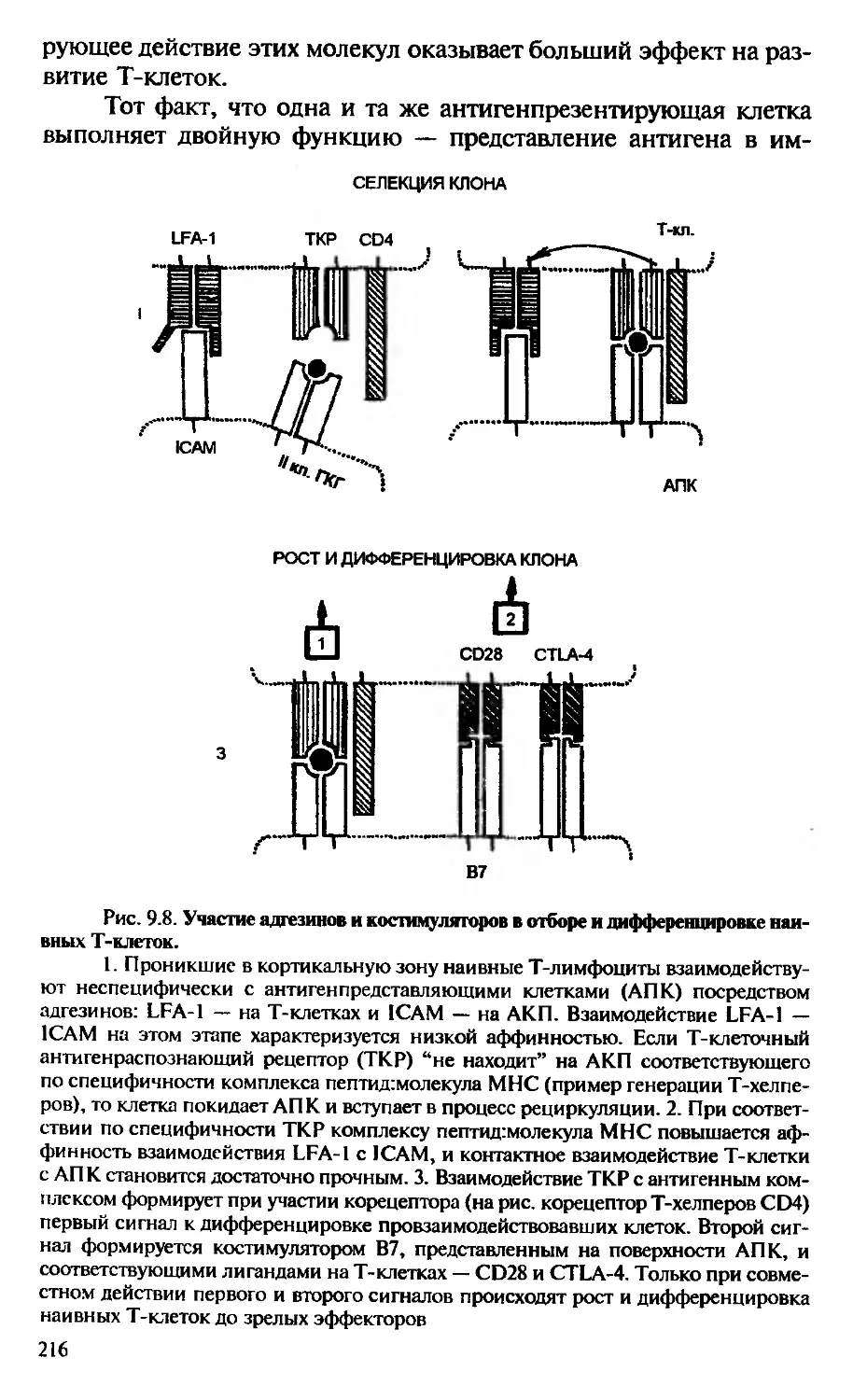
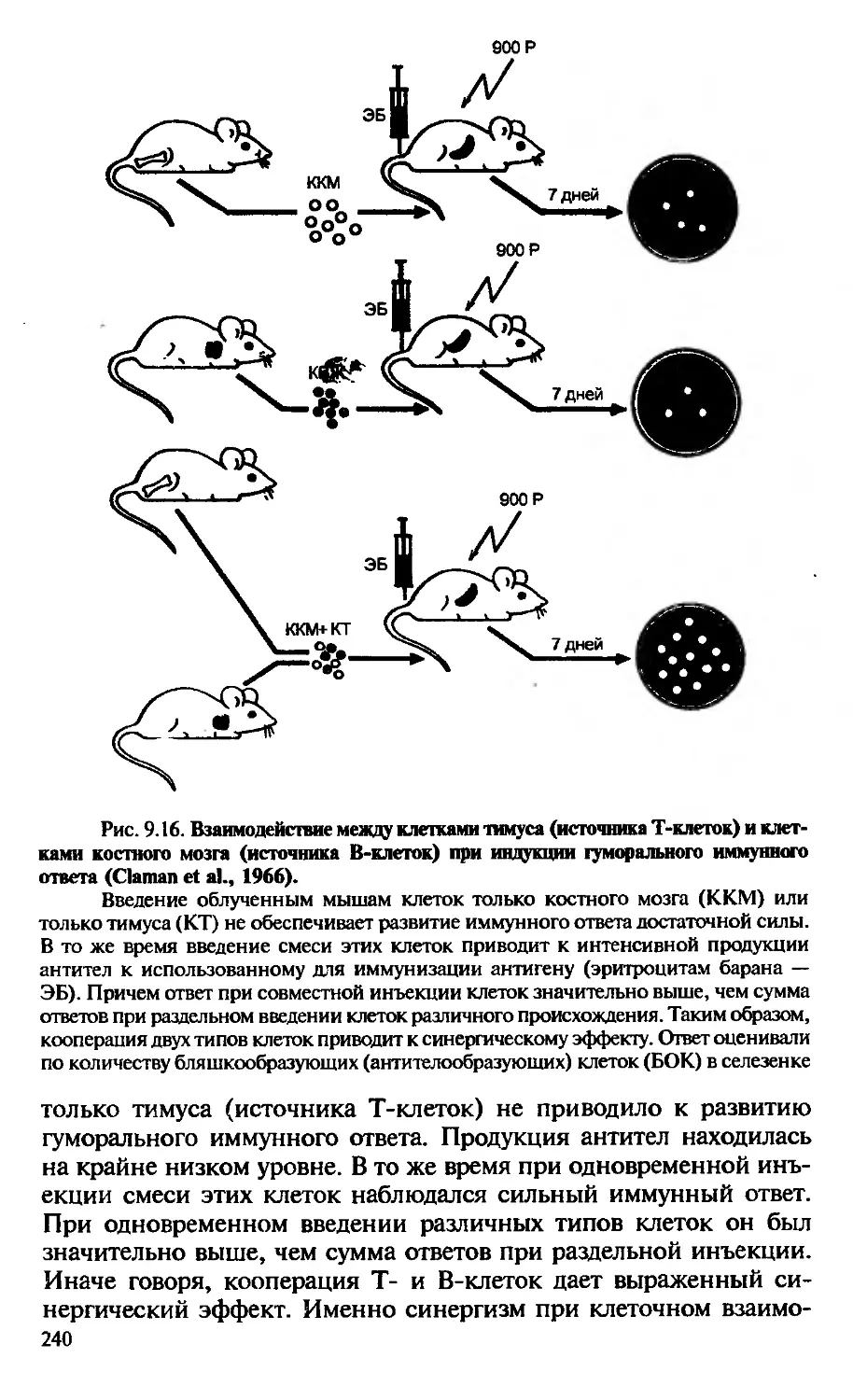
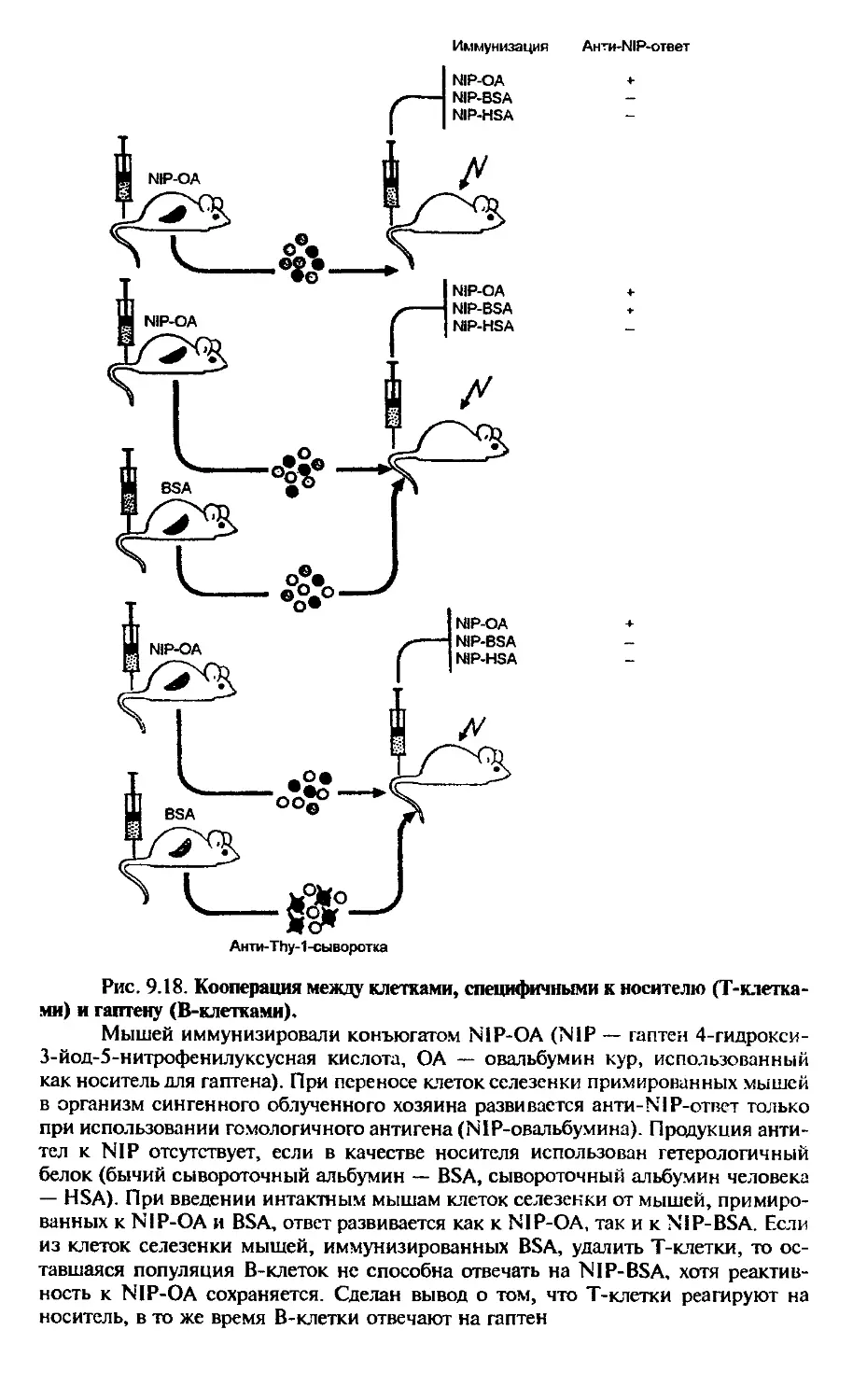
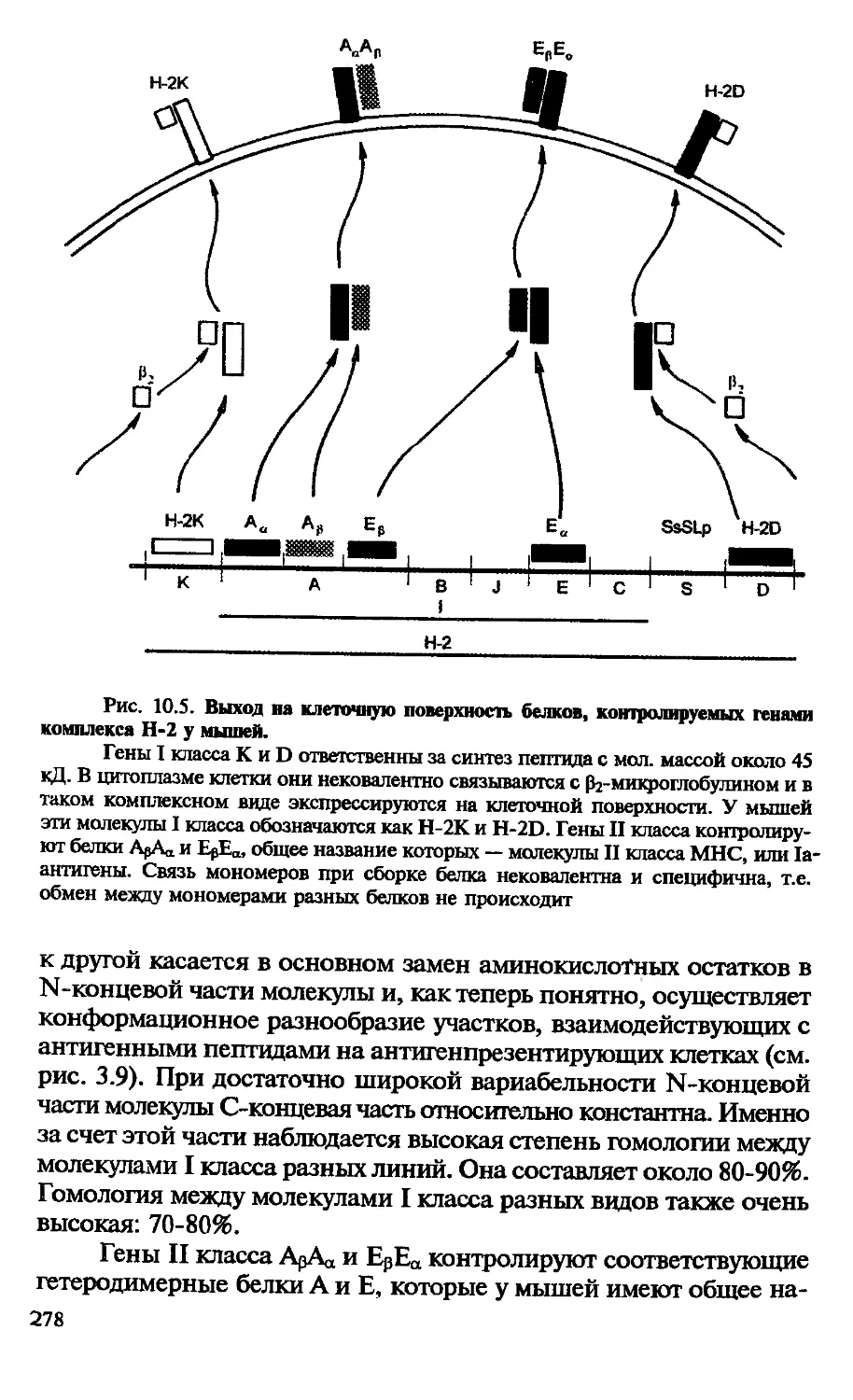
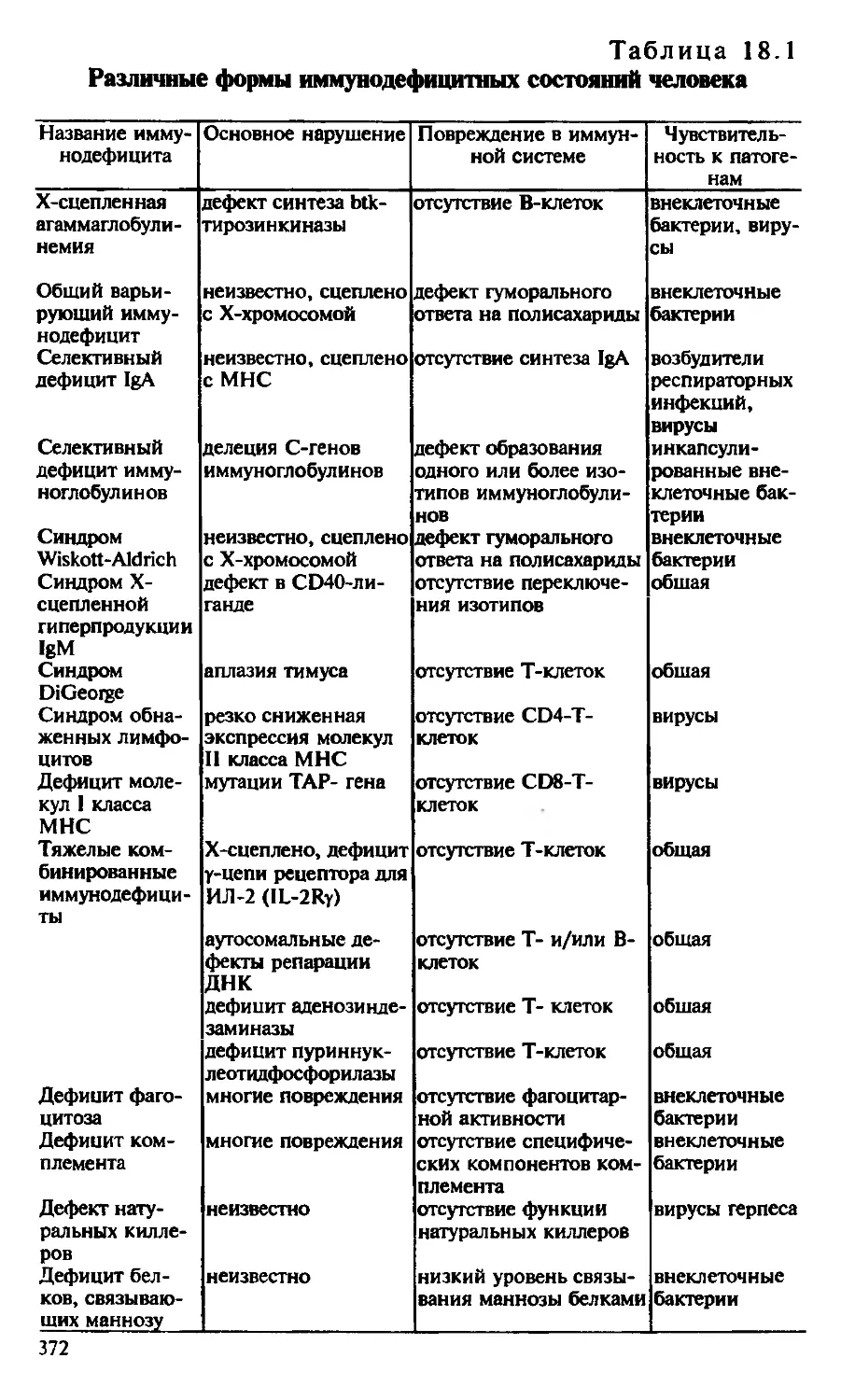
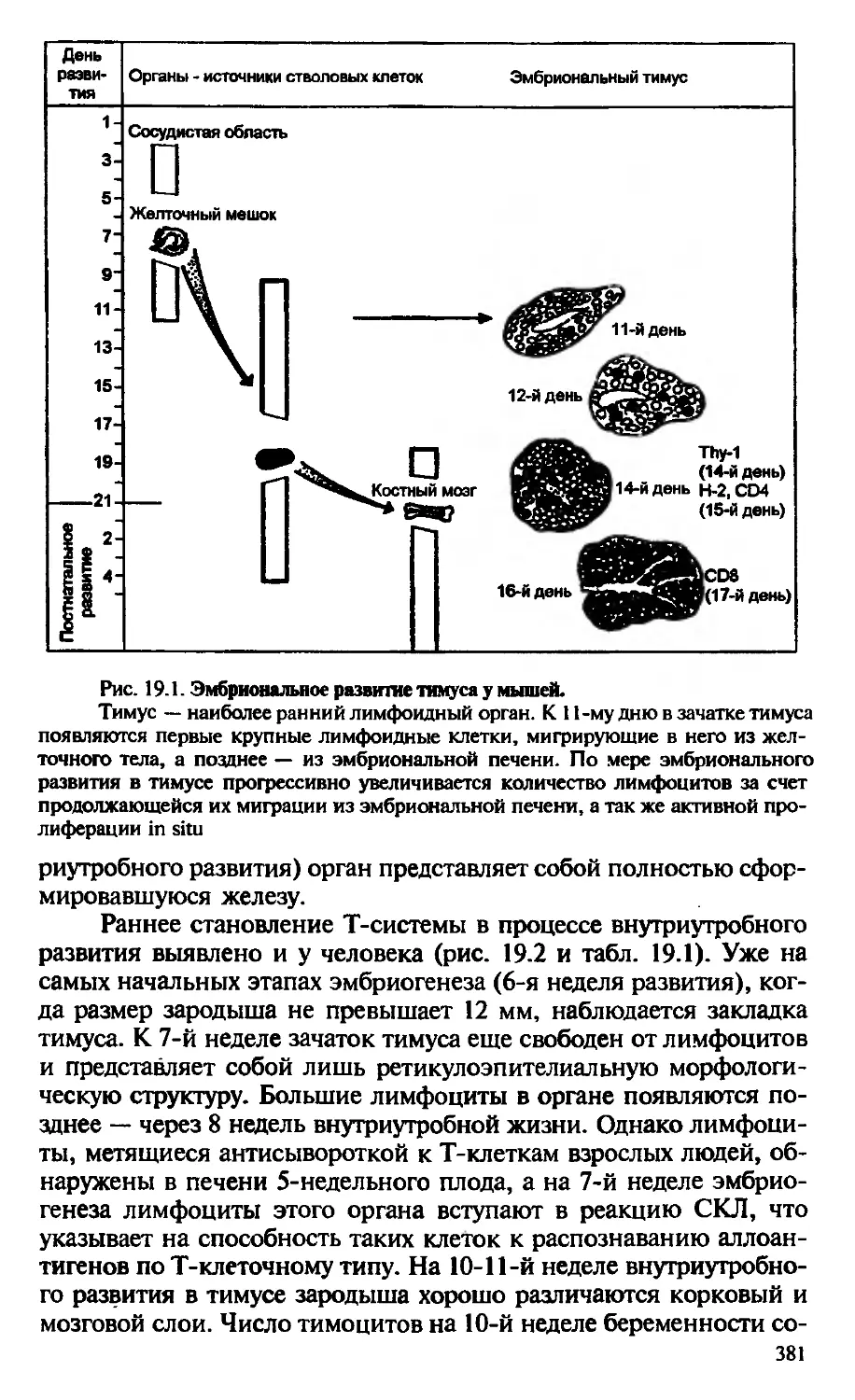
Автор: Галктионов В.Г.
Теги: физиология сравнительная физиология вирусология происхождение и эволюция, генетика биология иммунология
ISBN: 5-211-03717-0
Год: 1998
Текст
В.Г. Галактионов
ИММУНОЛОГИЯ
Рекомендовано Министерством общего и профессионального образования Российской Федерации в качестве учебника для студентов высших учебных заведений, обучающихся по направлению "Биология ”
Издательство Московского университета 1998
УДК 612.017.1
ББК 28.3; 28.07
Г 15
Рецензенты: кафедра вирусологии МГУ (академик РАН Г.Д.Атабеков)\ академик РАН А.А. Ярилин
Издание осуществлено при поддержке Российского фонда фундаментальных исследований по проекту № 97-04-62164
В.Г. Галактионов. Иммунология: Учебник. — М.: Изд-во МГУ. 1998—480с. ISBN 5-211-03717-0
Учебник написан на основе курса лекций, составленных в соответствии с программой биологических, медицинских и ветеринарных высших учебных заведений и читаемых автором в течение последних лет на биологическом факультете МГУ. На базе самых современных научных материалов по молекулярной биологии, генетике, вирусологии, цитологии, эмбриологии рассматриваются проблемы молекулярной и клеточной иммунологии, вопросы частных проявлений иммунитета и его нарушений. Особый интерес представляет раздел по сравнительной иммунологии, где рассмотрено становление иммунной системы в фило- и онтогенезе и излагается собственная позиция автора в отношении роли специфического иммунитета в прогрессивной эволюции животного мира.
Для студентов и аспирантов, изучающих биологию, а также преподавателей и научных сотрудников, занимающихся проблемами иммунологии.
ISBN 5-211-03717-0
© В.Г. Галактионов, 1998 г.
ПРЕДИСЛОВИЕ
Иммунология как самостоятельная научная дисциплина достаточно давно включена в учебные программы биологических, медицинских и ветеринарных высших учебных заведений. При этом, как ни странно, ощущается явный недостаток и даже простое отсутствие соответствующей литературы. Выходившие в свое время учебники и учебные пособия (Петров, 1982; Галактионов, 1986; Ройт, 1991 (англ, издание 1989)), явно устарели. Появившаяся относительно недавно, прекрасно изданная, информативная и хорошо иллюстрированная книга Ch.A.Janeway, Р.Travers “Immunobiology” (1994) недоступна подавляющему большинству студентов и аспирантов. Приступая к работе над данным учебником, я исходил из желания, во-первых, заполнить брешь в соответствующей литературе и тем самым помочь учащейся молодежи в познании предмета и, во-вторых, обобщить собственный опыт преподавания предмета на биологическом факультете МГУ.
В книге пять частей: “Молекулярная иммунология”, “Клеточная иммунология”, “Частные проявления иммунитета”, “Нарушения иммунитета”, “Сравнительная иммунология”. Особого упоминания заслуживает, как мне кажется, заключительная часть. Выходившие до сих пор учебники по иммунологии не рассматривали в обобщенном виде вопросы онто- и филогенеза иммунной реактивности. Именно это обстоятельство определило включение в него части “Сравнительная иммунология” с двумя заключительными главами “Онтогенез иммунной системы” и “Эволюция иммунитета”, где помимо современного фактического материала изложены собственные взгляды автора на роль специфического иммунитета в прогрессивной эволюции мира животных.
К работе над учебником истинный интерес проявили ведущие специалисты в этой области, сотрудники Российской Академии Наук и преподаватели Московского университета Н.Г.Хрущев, Г.И.Абелев, Ю.С.Ченцов, АА.Ярилин, М.АЛанге. Всем им я искренне благодарен также за реальную помощь и чисто человеческую, бескорыстную поддержку.
Как и любая книга, предлагаемый учебник, по-видимому, не лишен недостатков. Поэтому все критические замечания и пожелания читателей будут восприняты мною как стимул к совершенствованию его последующих переизданий.
В.Г.Галактионов
ВВЕДЕНИЕ
Латинское слово “immunitas”, означающее освобождение от каких-либо обязанностей, неприкосновенность кого-либо, дало название реакции нейтрализации и уничтожения антигенно чужеродных веществ, с которыми приходит в контакт тот или иной организм. В медицинскую практику термин “иммунитет” вошел во второй половине XIX века — начальный период активной разработки способов вакцинации для защиты людей от инфекционных заболеваний. Новое, “медицинское” содержание термина закреплено во французском словаре 1869 г. издания и означает “освобождение от болезни”.
По мере развития иммунологии традиционное понимание иммунитета как способа защиты от инфекционных микроорганизмов изменяется. В настоящее время понятно, что иммунные механизмы защиты срабатывают всегда, когда конкретный организм сталкивается с тем или иным чужеродным в антигенном отношении материалом — будь то бактерии, вирусы, мутационно измененные собственные клетки тела, тканевые и органные трансплантаты или простые химические соединения, которым приданы иммуногенные свойства. Иначе, иммунитет есть способ защиты организма от всех антигенно чужеродных веществ как экзогенной, так и эндогенной природы; биологический смысл подобной защиты — обеспечение генетической целостности особей вида в течение их индивидуальной жизни. При подобной трактовке иммунитета становится ясным, что он выступает в качестве фактора стабильности онтогенеза — необходимого условия передачи наследственного материала от поколения к поколению.
Основным предметом исследований в иммунологии является познание механизмов формирования специфического иммунного ответа организма ко всем чужеродным в антигенном отношении соединениям.
Наиболее характерными признаками иммунной системы, отличающими ее от иных систем организма, являются следующие:
1) способность диффернцировать все “свое” от всего “чужого”;
2) создание памяти от первичного контакта с чужеродным антигенным материалом;
3) клональная организация иммунокомпетентных клеток, проявляющаяся в способности отдельного клеточного клона реагировать только на одну из множества антигенных детерминант.
1. КРАТКИЙ ИСТОРИЧЕСКИЙ ОЧЕРК
Иммунология как определенное направление исследований возникла из практической необходимости борьбы с инфекционными заболеваниями.
Имеются свидетельства тому, что первые прививки оспы проводили в Китае за тысячу лет до Рождества Христова. Инокуляция содержимого оспенных пустул здоровым людям с целью их защиты от острой формы заболевания распространилась затем в Индию, Малую Азию, Европу, на Кавказ.
Приемы искусственного заражения в разных странах имели самые неожиданные проявления. Так, например, в России профилактическое самозаражение под название “покупка оспы” носило характер некоторого мистического действия. Здоровых детей вводили в дом к заболевшему и клали им под мышки смазанные оспенным гноем монеты. Считалось, что такая “купленная, задобренная” оспа вызовет лишь слабое заболевание в отличие от “некупленной”.
Интересен и другой факт из нашей российской истории. Во время эпидемии оспы в Австрии, когда заболели императрица Мария Терезия и члены ее двора, Екатерина II, всегда относившаяся к своему здоровью с трепетным вниманием, написала русскому послу в Англии о желании сделать прививку себе и сыну. 12 октября 1768 года один из лучших врачей-инокуляторов Т. Димс-дейл произвел оспопрививание императрице и Павлу. Как мы знаем, ни Екатерина II, ни Павел I никогда не болели оспой.
Однако прием искусственного заражения натуральной (человеческой) оспой не во всех случаях давал положительные результаты. Иногда после инокуляции отмечалась острая форма заболевания и даже смерть.
На смену инокуляции пришел метод вакцинации ( от лат. “vacca” — корова ), разработанный в конце XVIII в. английским врачом Э. Дженнером. Он обратил внимание на тот факт, что молочницы, ухаживавшие за больными животными, иногда заболевали в крайне слабой форме оспой коров, но при этом никогда не болели натуральной оспой. Подобное наблюдение давало в руки исследователя реальную возможность борьбы с болезью людей. В 1796 г., через 30 лет после начала своих изысканий Э. Дженнер решился опробовать метод вакцинации коровьей оспой. Эксперимент прошел успешно и с тех пор способ вакцинации по Э. Дженнеру нашел широкое применение во всем мире.
Несмотря на большой практический вклад Э. Дженнера в борьбу с оспой, его исследования носили частный характер и касались лишь одного конкретного заболевания. Зарождение инфекционной иммунологии связывают с именем выдающегося фран-
цузского ученого Луи Пастера. Первый шаг к целенаправленному поиску вакцинных препаратов, создающих устойчивый иммунитет к инфекции, быЛ сделан после хорошо известного наблюдения Пастера над патогенностью возбудителя куриной холеры. Произошло это в 1879 году. Одна из пробирок с возбудителем была забыта в термостате перед уходом сотрудников института на летний отдых. По возвращению из отпуска Пастер возобновил опыты с куриной холерой. Каково же было его удивление, когда ни одна из птиц, зараженных состарившейся культурой, не заболела. Более того, введение таким птицам свежеприготовленного возбудителя также не вызывало инфекционного процесса. Из этого простого наблюдения Пастер делает вывод: состарившаяся культура, потеряв свою патогенность, остается способной к созданию устойчивости к инфекции. “Счастливый случай для подготовленного ума” определил на многие десятилетия принцип создания вакцинного материала — тем или иным способом (для каждого возбудителя своим) добиваться снижения вирулентности патогена при сохранении его иммуногенных свойств. Знаменательный 1880 год — время публикации статьи по защите кур от холеры — вошел в историю науки как год рождения экспериментальной иммунологии. Уже через пять лет Пастер испробовал первую вакцину на человеке. Сильно покусанный бешеной собакой мальчик Джозеф Мейстер был заражен ослабленным возбудителем. Он выжил и впоследствии (очевидно, в знак признательности и любви к спасителю) прослужил сторожем в институте Пастера до конца своих дней.
Хотя Пастер разработал принципы вакцинации и успешно применял их на практике, он ничего не знал о факторах, включенных в процесс защиты от инфекции. Первыми, кто пролил свет на один из механизмов невосприимчивости к инфекции, были Эмиль фон Беринг и Китазато. Они продемонстрировали, что сыворотка от мышей, предварительно иммунизированных столбнячным токсином, введенная интактным животным, защищает последних от смертельной дозы токсина. Образовавшийся в результате иммунизации сывороточный фактор — антитоксин — представлял собой первое обнаруженное специфическое антитело. Работы этих ученых положили начало изучению механизмов гуморального иммунитета.
У истоков познания вопросов клеточного иммунитета стоял русский биолог-эволюционист Илья Мечников. В 1883 году он сделал первое сообщение по фагоцитарной теории иммунитета на съезде врачей и естествоиспытателей в Одессе. Мечников утверждал тогда, что способность подвижных клеток беспозвоночных животных поглощать пищевые частицы, т.е. участвовать в пищеварении, есть фактически их способность поглощать вообще все “чу-6
жое”, не свойственное организму: различных микробов, инертные частицы, отмирающие части тела. У человека также есть амебоидные подвижные клетки — макрофаги, нейтрофилы. Но “едят” они пищу особого рода — патогенных микробов. Эволюция сохранила поглотительную способность амебоидных клеток от одноклеточных животных до высших позвоночных, включая человека. Однако функция этих клеток у высокоорганизованных многоклеточных стала иной — это борьба с микробной агрессией.
Параллельно с Мечниковым разрабатывал свою теорию иммунной защиты от инфекции немецкий фармаколог Пауль Эрлих. Он знал о том факте, что в сыворотке крови животных, зараженных бактериями, появляются белковые вещества, способные убивать патогенные микроорганизмы. Эти вещества впоследствии были названы им “антителами”. Самое характерное свойство антител — это их ярко выраженная специфичность. Образовавшись как защитное средство против одного микроорганизма, они нейтрализуют и разрушают только его, оставаясь безразличными к другим. Пытаясь понять это явление специфичности, Эрлих выдвинул теорию “боковых цепей”, по которой антитела в виде рецепторов предсуществуют на поверхности клеток. Собственно антиген микроорганизмов выступает в качестве селективного фактора. Вступив в контакт со специфическим рецептором, он обеспечивает усиленную продукцию и выход в циркуляцию только этого конкретного рецептора (антитела). Прозорливость Эрлиха поражает, поскольку с некоторыми изменениями эта в целом умозрительная теория подтвердилась в настоящее время, о чем будет сказано ниже.
Две теории — фагоцитарная (клеточная) и гуморальная — в период своего возникновения стояли на антагонистических позициях. Школы Мечникова и Эрлиха боролись за научную истину, не подозревая, что каждый удар и каждое его парирование сближало противников. В 1908 г. обоим ученым одновременно была присуждена Нобелевская премия.
К концу 40-х — началу 50-х годов нашего столетия завершается первый период развития иммунологии. Был создан целый арсенал вакцин против самого широкого набора инфекционных заболеваний (табл. В.1). Эпидемии чумы, оспы, холеры перестали уничтожать сотни тысяч людей. Отдельные, спорадические вспышки этих заболеваний встречаются до сих пор, но это лишь очень локальные, не имеющие эпидемиологического, а тем более пандемического значения случаи. Так, например, по данным Всемирной Организации Здравоохранения, в Индии, где заболеваемость чумой всегда была чрезвычайно высокой, в 1965 г. было зарегистрировано только 15 случаев этого особо опасного инфекционного заболевания.
Таблица B.l
Вакцины, созданные к первой половине XX в.
Заболевание Источник приготовления вакцины
Оспа Бешенство Брюшной тиф Холера Чума Туберкулез Дифтерия Столбняк Коклюш Желтая лихорадка Грипп Риккетсиоз вирус животного инфицированная ткань животного убитый микроорганизм тоже то же живая разновидность микобактерий токсоид тоже убитый микроорганизм пассаж через мышей живой культуры эмбрион курицы/убитая культура то же
Несмотря на успехи инфекционной иммунологии, экспериментальная и теоретическая иммунология к середине века оставалась в за’шточном состоянии. Две теории иммунитета — клеточная и гуморальная — лишь приоткрыли занавес над неизвестным. Тонкие механизмы иммунной реактивности, биологический диапазон действия иммунитета оставались скрытыми от исследователя.
Новый этап развития иммунологии связан в первую очередь с именем выдающегося австралийского ученого М.Ф. Бернета. Именно он в значительной степени определил лицо современной иммунологии. Рассматривая иммунитет как реакцию, направленную на дифференциацию всего “своего” от всего “чужого”, он поднял вопрос о значении иммунных механизмов в поддержании генетической целостности организма в период индивидуального (онтогенетического) развития. Именно Бернет обратил внимание на лимфоцит как основной участник специфического иммунного реагирования, дав ему название “иммуноцит”. Именно Бернет предсказал, а англичанин Питер Медавар и чех Милан Гашек экспериментально подтвердили состояние, противоположное иммунной реактивности — толерантности. Именно Бернет указал на особую роль тимуса в формировании иммунного ответа. И, наконец, Бернет остался в истории иммунологии как создатель клонально-селекционной теории иммунитета. Формула такой теории проста: один клон лимфоцитов способен реагировать только на одну конкретную, антигенную, специфическую детерминанту.
Особого внимания заслуживают взгляды Бернета на иммунитет как на такую реакцию организма, которая отличает все “свое” от всего “чужого”. После доказательства Медаваром иммунологической природы отторжения чужеродного трансплантата, после накопления фактов по иммунологии злокачественных новообра-8
зований стало очевидным, что иммунная реакция развивается не только на микробные антигены, но и тогда, когда имеются любые, пусть незначительные антигенные различия между организмом и тем биологическим материалом (трансплантатом, злокачественной опухолью), с которым он встречается.
Строго говоря, ученые прошлого, включая Мечникова, понимали, что предназначение иммунитета — не только борьба с инфекционными агентами. Однако интересы иммунологов первой половины нашего столетия концентрировались в основном на разработке проблем инфекционной патологии. Необходимо было время, чтобы естественный ход научного познания позволил выдвинуть концепцию роли иммунитета в индивидуальном развитии. Автором нового обобщения явился Бернет.
Сегодня мы знаем если не все, то многое из механизмов иммунного регирования. Нам известны генетические основы удивительно широкого разнообразия антител и антигенраспознаю-щих рецепторов. Мы знаем, какие типы клеток ответственны за клеточные и гуморальные формы иммунного реагирования; в значительной степени понятны механизмы повышенной реактивности и толерантности; многое известно о процессах распознавания антигена; выявлены молекулярные участники межклеточных отношений (цитокины); в эволюционной иммунологии сформирована концепция роли специфического иммунитета в прогрессивной эволюции животных. Иммунология как самостоятельный раздел науки встала в один ряд с истинно биологическими дисциплинами: молекулярной биологией, генетикой, цитологией, физиологией, эволюционным учением.
2. НЕСПЕЦИФИЧЕСКИЙ (ВРОЖДЕННЫЙ) ИММУНИТЕТ
Под неспецифическим иммунитетом подразумевают систему предсуществующих защитных факторов организма, присущих данному виду как наследственно обусловленное свойство. Так, собаки никогда не болеют чумой человека, а куры — сибирской язвой. Иммунитет, создаваемый анатомическими, физиологическими, клеточными и молекулярными факторами, которые являются естественными составляющими элементами организма, иначе называют конституционным. Такие факторы не возникают вновь при встрече с патогеном, т.е. они не индуцибельны, у них нет строго специфической реакции на антигены микроорганизмов, и они не способны сохранять память от первичного контакта с чужеродностью (гл. 13). ’
Условно факторы неспецифической защиты можно разбить на четыре типа: физические (анатомические); физиологические; клеточные, осуществляющие эндоцитоз или прямой лизис чужеродных клеток; факторы воспаления.
2.1. ФИЗИЧЕСКИЕ БАРЬЕРЫ
Одним из существенных препятствий на пути проникновения возбудителя во внутренную среду организма являются внешние покровы. В этом смысле кожа человека и млекопитающих выполняет в первую очередь механическую, барьерную функцию. Кроме того, кожа подавляет колонизацию и размножение бактерий, поскольку характеризуется сниженным pH за счет присутствия в потовых выделениях молочной и жирных кислот. Другим физическим препятствием являются слизистые покровы дыхательных путей и желудочно-кишечного тракта. Мерцательный эпителий этих морфологических образований удаляет проникшие бактерии. Механическим препятствием к колонизации являются также секреты слизи, слезных и слюнных желез.
У беспозвоночных функцию физического барьера выполняют внешний скелет кораллов и членистоногих, кальцинированные раковины двустворчатых и брюхоногих моллюсков, а также слизь кишечнополостных, кольчатых червей, моллюсков, оболочников.
2.2. ФИЗИОЛОГИЧЕСКИЕ БАРЬЕРЫ
Этот тип защиты включает температуру тела, pH и напряженность кислорода в районе колонизации микроорганизмами, а также различные растворимые факторы. Со времен Пастера известна резистентность кур к возбудителю сибирской язвы. Устойчивость птиц к Baccilla anthracis обусловлена температурой их тела: 41-42°С. При такой температуре окружающей среды возбудитель прекращает размножение. Кислотность желудка — еще один барьер на пути проникновения патогенов в организм. Действительно, лишь очень немногие микроорганизмы способны преодолеть низкое значение pH желудочного сока. Растворимые факторы: лизоцим, интерферон, комплемент — также принимают участие в естественной невосприимчивости. Лизоцим — гидролитический энзим секретов слизи — способен разрушать пептидогликановый слой клеточной стенки бактерий. Интерфероны — группа белков, продуцируемых вирусинфицированными или активированными клетками. Среди прочих иммунорегуляторных функций интерфероны способны прямо подавлять размножение вирусов. Комплемент — группа сывороточных белков, которые циркулируют в неактивной проэнзимной форме. Эти белки могут быть активированы различными специфическими и неспецифическими иммунологическими механизмами, которые конвертируют их в активную форму. Активированные компоненты комплемента принимают участие в
ю
контролируемом энзиматическом каскаде, результатом действия которого является повреждение мембраны бактерий, или их опсонизация.
2.3. ЭНДОЦИТОЗ (ПИНОЦИТОЗ, ФАГОЦИТОЗ)
Эндоцитоз — реакция клеток, направленная на поглощение и переваривание растворимых макромолекулярных соединений , а также чужеродных или структурно измененных собственных клеток. Термин “эндоцитоз” является обобщающим для двух близких, но, тем не менее, самостоятельных процессов — пиноцитоза и фагоцитоза. Первый из них характеризуется поглощением и внутриклеточным разрушением макромолекулярных соединений, таких как белки, нуклеиновые кислоты, полисахариды, липопротеины, белковые комплексы. В то же время фагоцитоз — явление поглощения и переваривания клеткой (макрофагами, нейтрофилами) корпускулярного материала (бактерий, крупных вирусов, отмирающих собственных клеток организма или чужеродных клеток, таких, например, как эритроциты различных видов).
Объектом пиноцитоза как фактора неспецифической иммунной защиты являются, в частности, токсины микроорганизмов.
На рис. В.1 представлены последовательные этапы захвата и внутриклеточного переваривания растворимых, находящихся в экстрацеллюлярном пространстве макромолекул. Адгезия таких молекул на клетке может осуществляться двумя способами: неспецифическим — в результате случайной встречи молекул с клеткой, и специфическим, который зависит от предсуществующих
Рис. В.1. Эндоцитоз макромолекул фагоцитами.
РМ — растворимые макромолекулы; РЦ — рецептор; ПП — пиноцитарный пузырек; ПС — пиносома
рецепторов на поверхности пиноцитирующей клетки. В последнем случае внеклеточные вещества выступают в качестве лигандов, взаимодействующих с соответствующими рецепторами. Адгезия веществ на клеточной поверхности приводит к локальной инвагинации (впячиванию) мембраны, завершающейся образованием пиноцитарного пузырька очень небольшого размера (приблизительно 0,1 ц). Несколько слившихся пузырьков формируют более крупное образование — пиносому. На следующем этапе пиносомы сливаются с лизосомами, содержащими гидролитические ферменты, которые разрушают полимерные молекулы до мономеров. В тех случаях, когда процесс пиноцитоза реализуется через рецепторный аппарат, в пиносомах до слияния с лизосомами наблюдается отсоединение захваченных молекул от рецепторов, которые в составе дочерних пузырьков возвращаются на клеточную поверхность.
Фагоцитоз как фактор неспецифической защиты проявляет себя при проникновении в организм патогенных микробов. Случайный или обусловленный рецепторами контакт микробной клетки с фагоцитом (макрофагом, нейтрофилом) приводит к образованию выростов мембраны — псевдоподий, окружающих чужеродную клетку. Сформировавшаяся вакуоль (фагосома) в 10—20 раз больше пиносомы. Она погружается в клетку, где после слияния с лизосомами образует фаголизосому. Именно в ней за счет активности гидролитических ферментов происходит полное или частичное разрушение патогена. Часть разрушенных компонентов микробной клетки удаляется в экстрацеллюлярную среду, другая остается на поверхности фагоцитирующей клетки (рис. В.2).
Рис. В.2. Фагоцитоз бактерий.
Б — бактерии; П — псевдоподии; ФС — фагосома; ФЛС — фаголизосома 12
2.4. НАТУРАЛЬНЫЕ КИЛЛЕРЫ
Натуральные киллеры (НК) представляют собой популяцию лимфоидных клеток, лишенных признаков Т- или В-лимфоцитов. Их участие в неспецифическом иммунном ответе состоит в способности оказывать прямое цитотоксическое действие на злока-чественнотрансформированные и вирусинфицированные клетки, а также клетки, поглотившие некоторые внутриклеточные бактериальные патогены.
2.5. ВОСПАЛЕНИЕ
Поврежденные кожные покровы являются наиболее доступными воротами для инфекционных агентов. Проникшие патогены индуцируют комплексную реакцию воспаления, которая направлена на локализацию и уничтожение микроорганизмов в месте внедрения (рис. В.З). Наиболее характерные признаки реакции — это усиление кровотока, возрастание проницаемости капилляров, приток фагоцитирующих клеток. Увеличение кровоснабжения приводит к избыточному наполнению кровью капиллярной сети и
Рис. В.З. Начальные этапы воспалительной реакции.
Б — бактерии; КП — кожный покров; Ф — фагоциты; М — медиаторы; Э — эндотелиальные клетки; К — кровеносный сосуд
в результате — к локальному покраснению. Повышенная проницаемость капилляров обеспечивает выход в поврежденную ткань плазмы и клеток крови, среди которых наибольшее количество приходится на фагоцитирующие клеточные формы. Миграция фагоцитов к месту повреждения включает три этапа: (1) адгезию на эпителиальном сосудистом слое; (2) проникновение через эпителий; (3) перемещение в район скопления микроорганизмов. В формировании воспалительного ответа принимает участие также целый набор медиаторов. Среди них медиаторы, выделяемые микроорганизмами, поврежденной тканью, фагоцитирующими клетками, и группа медиаторов плазмы крови, получивших название белков острой фазы. Основным белком этой группы является С-реак-тивный протеин. Данный белок взаимодействует с полисахаридным компонентом клеточной стенки бактерий и грибов и активирует систему комплемента, которая лизирует микроорганизмы или опсонизирует их, способствуя поглощению микроорганизмов фагоцитирующими клетками.
3. СПЕЦИФИЧЕСКИЙ (ПРИОБРЕТЕННЫЙ, АДАПТАЦИОННЫЙ) ИММУНИТЕТ. УРОВНИ ИЗУЧЕНИЯ
Характерная особенность специфического иммунитета отражена уже в самом названии этой формы иммунной защиты. Ф.Бернет определил иммунитет как реакцию организма, направленную на дифференциацию всего “своего” от всего “чужого”. В понятие защиты от “чужого” входят представления о том, что специфический иммунитет проявляется всегда, когда конкретный организм приходит в контакт с тем или иным антигенно чужеродным материалом, будь то микроорганизмы, трансплантаты, мутацион-но измененные собственные клетки или простые химические соединения, которым приданы иммуногенные свойства.
Специфичность ответа реализуется через синтез антител и формирование клонов лимфоцитов, способных взаимодействовать только с одной из множества антигенных детерминант, чужеродных для данного организма. Упрощенная формула иммунологической специфичности: один антиген — одно антитело, один клон пред-существующих лимфоцитов.
Второй характерной особенностью приобретенного иммунитета является его ивдуцибельносгь. В условиях нормы выраженность и функциональная активность клона лимфоцитов незначительны. Специфические антитела либо полностью отсутствуют, либо их количество крайне мало. В то же время контакт организма с антигеном провоцирует как усиленную продукцию соответствующих антител, так и нарастание и функциональное созревание специ-цифического клона клеток.
И, наконец, третий существенный признак иммунной системы связан со способностью сохранять память о первой встрече с антигеном. Именно это свойство специфического иммунитета лежит в основе вакцинации.
Механизмы формирования специфического иммунного ответа и его функциональное проявление изучаются на различных структурно-иерархических уровнях: молекулярном, клеточном, органном, организменном и популяционном. В таблице В.2 суммированы как основные объекты изучения перечисленных уровней организации, так и вопросы, которые решаются на каждом из них.
Таблица В.2 Уровни изучения специфического иммунитета.
Уровень Объект изучения Проблемы
Молекулярный иммуноглобулины; антигенрас- 1) молекулярные основы
познающие рецепторы В-клеток специфичности: выяснение
(поверхностный иммуноглобу- полной аминокислотной
лин — sig ) и Т-клеток (Т-кле- последовательности, общей
точный рецептор — ТКР ). структуры и пространственной организации как всей молекулы, так и антигенсвя-зывающего центра особенно; 2) генетический контроль структуры; 3) биосинтез; 4) функциональное проявление; 5) онто- и филогенез
молекулы главного комплекса 1) структура;
гистосовместимости (МНС) 2) генетический контроль структуры
антигены 1) природа антигенной специфичности и иммуногенности; 2) строение антигенной детерминанты (эпитопа); 3) тимусзависимые и ти-муснезависимые антигены
цитокины 1) функциональная активность в реакциях клеточного и гуморального иммунного ответа;
адгезины 1) структура; 2) участие в становлении иммунной системы и иммунном реагировании
Окончание таблицы В. 2
Уровень Объект изучения Проблемы
Клеточный клетки лимфоидного клеточного комплекса 1) типы клеток, их морфология, молекулярная организация поверхностных мембран; 2) стволовая кроветворная клетка и пути гистогенеза Т-и В-лимфоцитов; субпопуляции Т- и В-лимфоцитов; 3) клональная специфичность Т- и В-лимфоцитов; 4) взаимодействие различных типов клеток, принимающих участие в иммунном ответе; 5) онто- и филогенетические аспекты происхождения и развития иммунологически активных клеток; 6) генетический контроль функциональной активности различных типов клеток
Органный органы лимфо-миелоидного комплекса 1) дифференциальная роль отдельных органов в становлении системы иммунной защиты и иммунореактивности; 2) миграция лимфоцитов 3) онто- и филогенез органов лимфоидной системы;
Организменный организм 1) нейрогормональная регуляция иммуногенеза; 2) влияние факторов внешней среды на иммунный ответ
Популяционный коллективы людей, объединенных в группы различной степени сложности иммунитет как селективный фактор, определяющий генетическую дифференцировку популяций;
природные популяции животных причины сохранения инфекции в природе (природная очаговость инфекционных заболеваний).
3.1. МОЛЕКУЛЯРНЫЙ УРОВЕНЬ
Объектом изучения на этом уровне являются в первую очередь иммуноглобулины (антитела). При анализе структуры и функ-16
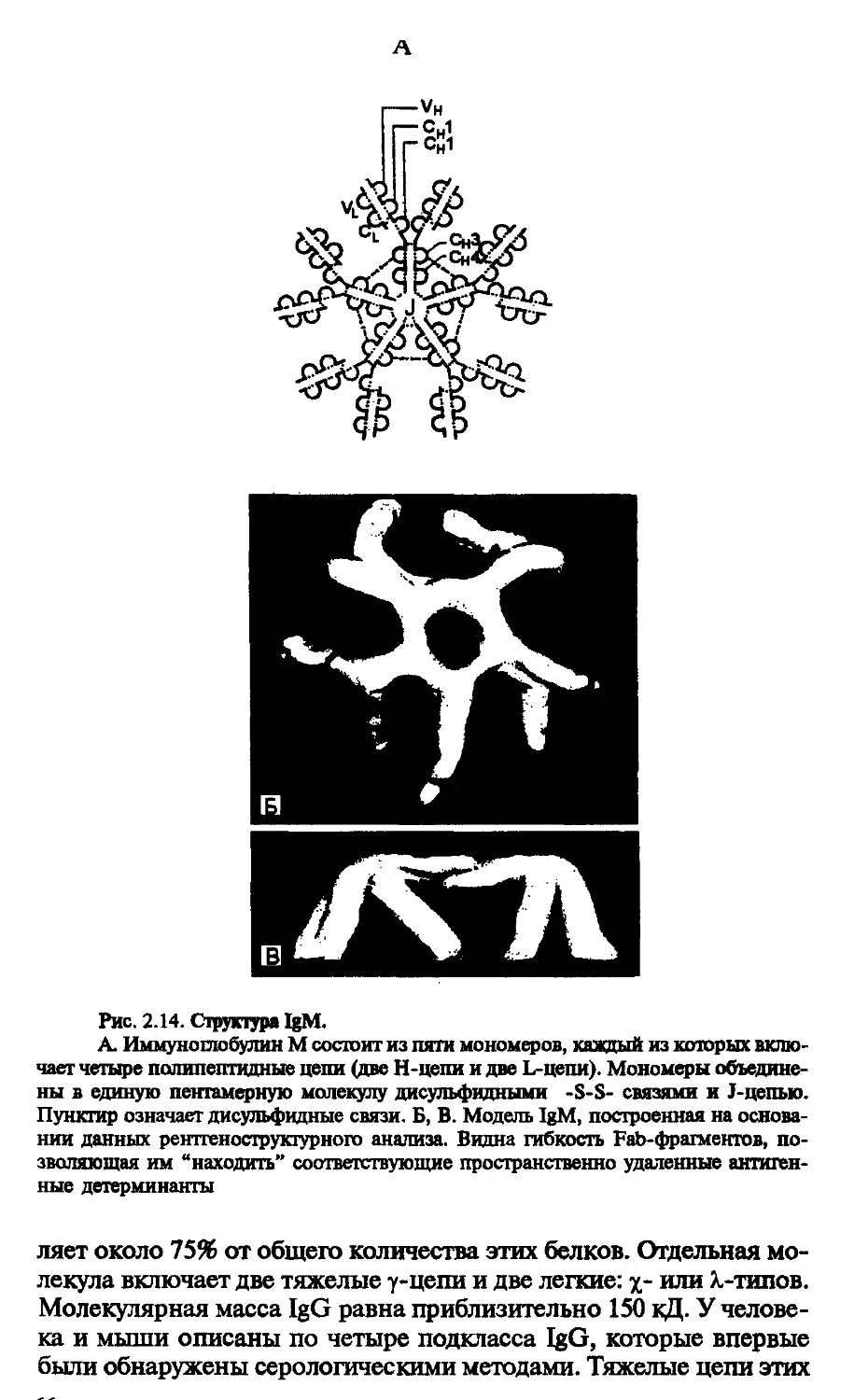
ции антител следует различать два понятия: гетерогенность и вариабельность. Гетерогенность определяет свойства антител, обусловленные константной (С) частью молекулы, т.е. теми структурными особенностями, которые позволяют делить всю группу этих белков на классы, подклассы, аллотипы. Гетерогенность подразумевает также различия в функциональных свойствах разных классов и подклассов иммуноглобулинов за исключением их свойства специфического взаимодействия с антигеном. Вариабельность — это индивидуальная характеристика иммуноглобулинов, относящихся к одному и тому же классу или подклассу. Она проявляется в специфической антигенсвязующей активности и обусловлена последовательностью аминокислотных остатков в N-концевой части молекулы. Два свойства иммуноглобулинов — гетерогенность и вариабельность — отражают функциональный дуализм этих белковых молекул.
Близкими, хотя и не идентичными иммуноглобулинам по структуре, генетическому контролю и основному функциональному предназначению являются Т-клеточные антигенраспознаю-щие рецепторы (ТКР). Основные различия касаются характера распознавания антигена. Если иммуноглобулины способны взаимодействовать со свободными антигенными детерминантами, то ТКР распознают антигенные эпитопы только в комплексе с молекулами I или II классов главного комплекса гистосовместимости (МНС, сокр. от англ, “major histocompatibility complex”).
Вторым объектом изучения на молекулярном уровне являются антигены. Под антигенами подразумевают вещества (в основном белки и полисахариды), чужеродные для данного конкретного организма. Носителями таких чужеродных веществ будут бактерии, вирусы, грибки, трансплантаты, опухолевые клетки. В иммунологии термин “антиген” несет двойную смысловую нагрузку: как индуктор иммунного ответа и как биологический маркер. В качестве индуктора антигены характеризуются антигенной специфичностью и иммуногенностью. Некоторые вещества (например, простые химические группировки — гаптены) не в состоянии запускать иммунный процесс, демонстрируя тем самым отсутствие иммунногенных свойств. В то же время они обладают вполне конкретной специфичностью, т.е. способностью вступать в реакции взаимодействия с предсуществующими к ним антителами. Антигены в качестве биологических маркеров широко используются в сравнительных исследованиях при решении вопросов филогении, систематики, популяционной генетики, морфо- и тканегенеза, клеточной дифференцировки.
Разработка вопросов взаимодействия иммунокомпетентных клеток вскрыла целый пласт исследований, направленных на изу
чение гуморальных регуляторов межклеточных отношений — цитокинов. В настоящее время известно более 30 белков с цитокино-вой активностью. Получены генноинженерные аналоги многих из них. Функция этой группы белков крайне разнообразна. Они принимают участие в дифференцировке и размножении иммунокомпетентных клеток, обеспечивают созревание антителопродуцен-тов и цитотоксических клеток, участвуют в элиминации опухолевых клеток, являются ключевыми факторами в воспалительной реакции и острофазном ответе организма, модифицируют состояние нервной и эндокринной систем.
3.2. КЛЕТОЧНЫЙ УРОВЕНЬ
В развитии специфического иммунного ответа принимают участие три основных клеточных типа: В-лимфоциты, Т-лимфоциты и антигенпрезентирующие клетки (макрофаги, дендритные клетки).
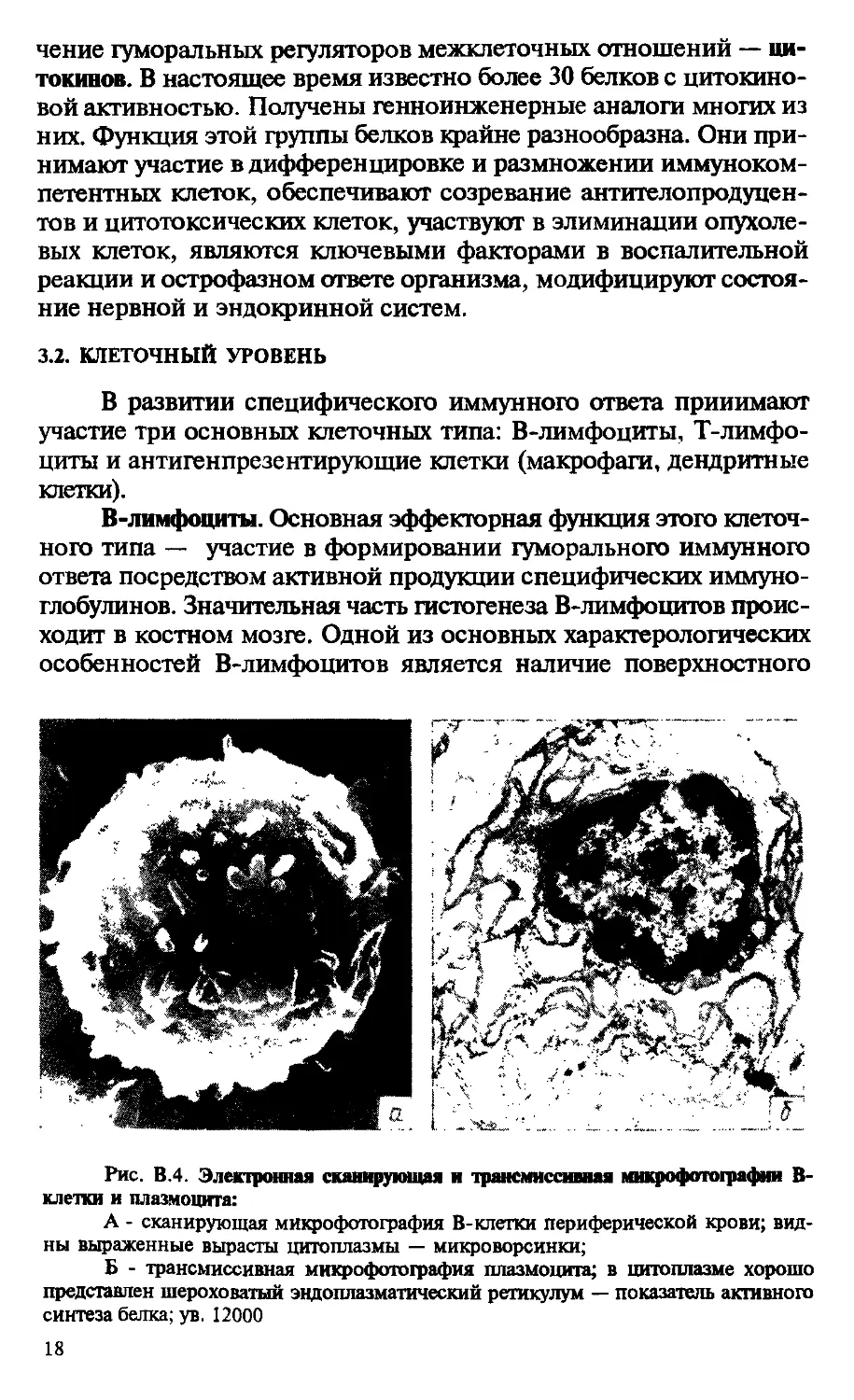
В-лимфоциты. Основная эффекторная функция этого клеточного типа — участие в формировании гуморального иммунного ответа посредством активной продукции специфических иммуноглобулинов. Значительная часть гистогенеза В-лимфоцитов происходит в костном мозге. Одной из основных характерологических особенностей В-лимфоцитов является наличие поверхностного
Рис. В.4. Электронная сканирующая и трансмиссивная микрофотографии В-клетки и плазмоцита:
А - сканирующая микрофотография В-клетки периферической крови; видны выраженные вырасти цитоплазмы — микроворсинки;
Б - трансмиссивная микрофотография плазмоцита; в цитоплазме хорошо представлен шероховатый эндоплазматический ретикулум — показатель активного синтеза белка; ув. 12000
иммуноглобулина (sig), способного к специфическому распознаванию чужеродного антигена. Взаимодействие В-лимфоцита с антигеном приводит к его антигензависимой дифференцировке по двум направлениям — до активно продуцирующего антитела плазмоцита и к формированию пула В-клеток памяти.
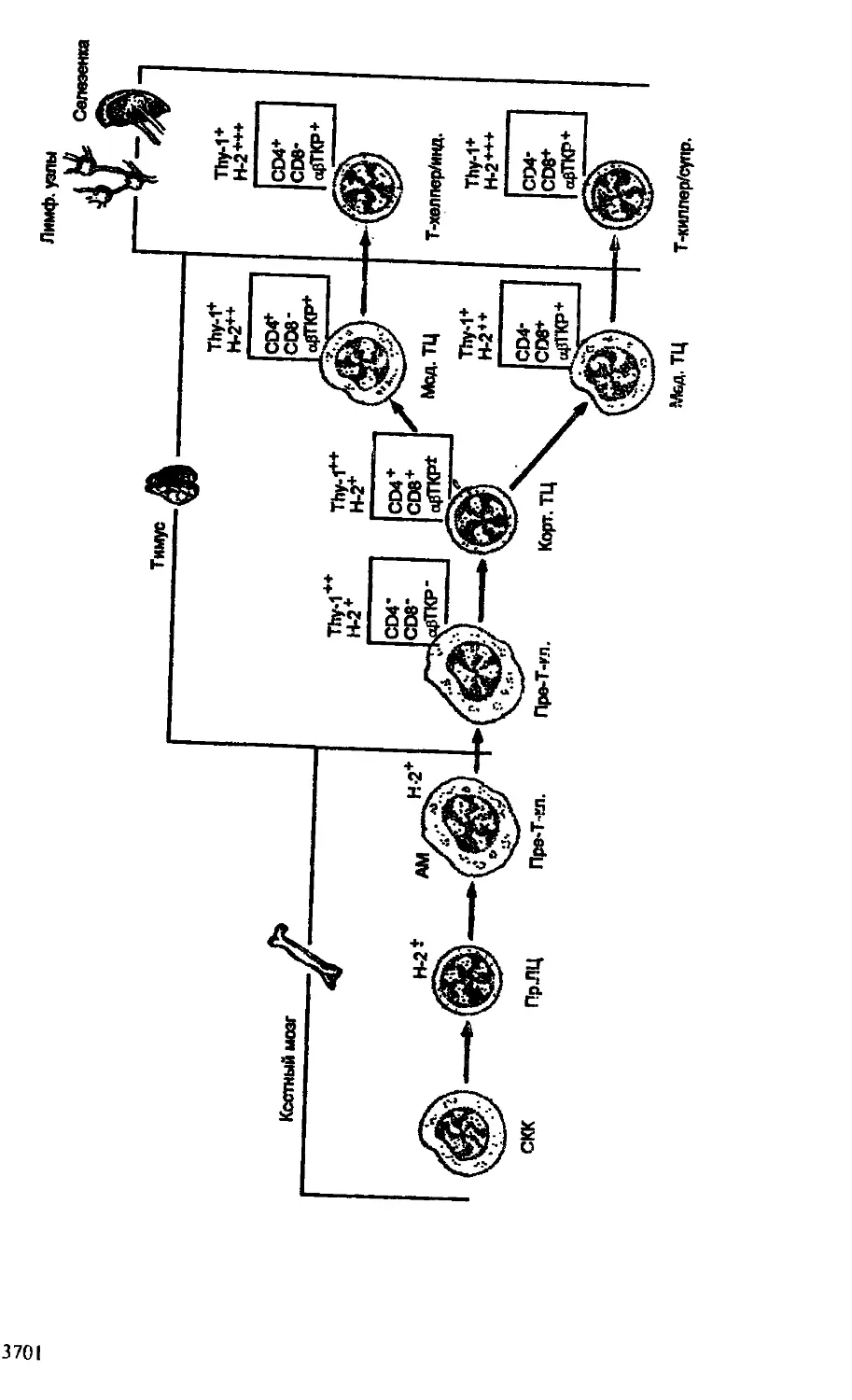
Т—лимфоциты. Данный тип клеток — основной участник так называемой клеточной формы иммунного реагирования. В отличие от В-лимфоцитов, функция которых реализуется через гуморальные продукты — антитела, Т-лимфоциты разрушают чужеродные клетки (трансплантаты, опухолевые клетки, вирустрансформиро-ванные клетки) при непосредственном контакте с данными клеточными формами. Распознавание чужеродных клеток осуществляется антигенраспознающими Т-клеточными рецепторами (ТКР), экспрессирующимися на поверхности Т-лимфоцитов. Помимо основной, цитотоксической функции, рассматриваемый тип клеток осуществляет регуляторное воздействие как на гуморальный, так и на клеточный иммунный ответ, либо усиливая его, когда в реакцию вступают Т-хелперы, либо подавляя, когда проявляется активность Т-супрессоров. Самые начальные этапы дифференцировки Т-лимфоцитов осуществляются в костном мозге, когда из стволовой кроветворной клетки образуется наиболее ранний предшественник, мигрирующий в тимус. Именно в нем происходят
Рис. В.5. Электронная сканирующая и трансмиссивная микрофотографии Т-клетки:
А - сканирующая микрофотография Т-клетки периферии; наблюдается некоторое снижение количества микроворсинок по сравнению с В-клетками;
Б - трансмиссивная микрофотография Т-клетки периферии; видно доминирующее присутствие ядра в клетке и незначительное количество цитоплазмы; ув. 12000
основные дифференцировочные события, приводящие к формированию субпопуляций Т-клеток: цитотоксических Т-лимфоцитов (ЦТЛ), Т-хелперов и Т-супрессоров. ЦТЛ и Т-хелперы легко определяются не только функционально, но и по наличию специфических маркеров дифференцировки, или корецепторов: CD8 — у ЦТЛ и CD4 — у Т-хелперов.
Макрофаги. Участие макрофагов в специфическом иммунном ответе состоит в захвате, внутриклеточном переваривании и выводе неразрушенной до конца части антигена в иммуногенной форме на клеточную поверхность, где он распознается В- и Т-лимфоцитами.
3.3. ОРГАННЫЙ УРОВЕНЬ
Органный уровень указывает на морфологические границы и “место действия” формирующегося иммунного ответа. На этом уровне изучают клеточный состав и гистологические сдвиги в органах, где реализуются механизмы иммунитета; взаимодействие органов между собой в процессе иммуногенеза, потенциальную роль отдельных органов при гуморальном и клеточном иммунном реагировании; факторы, объединяющие иммунореактивные органы в единую систему, их онто- и филогенетическое происхождение.
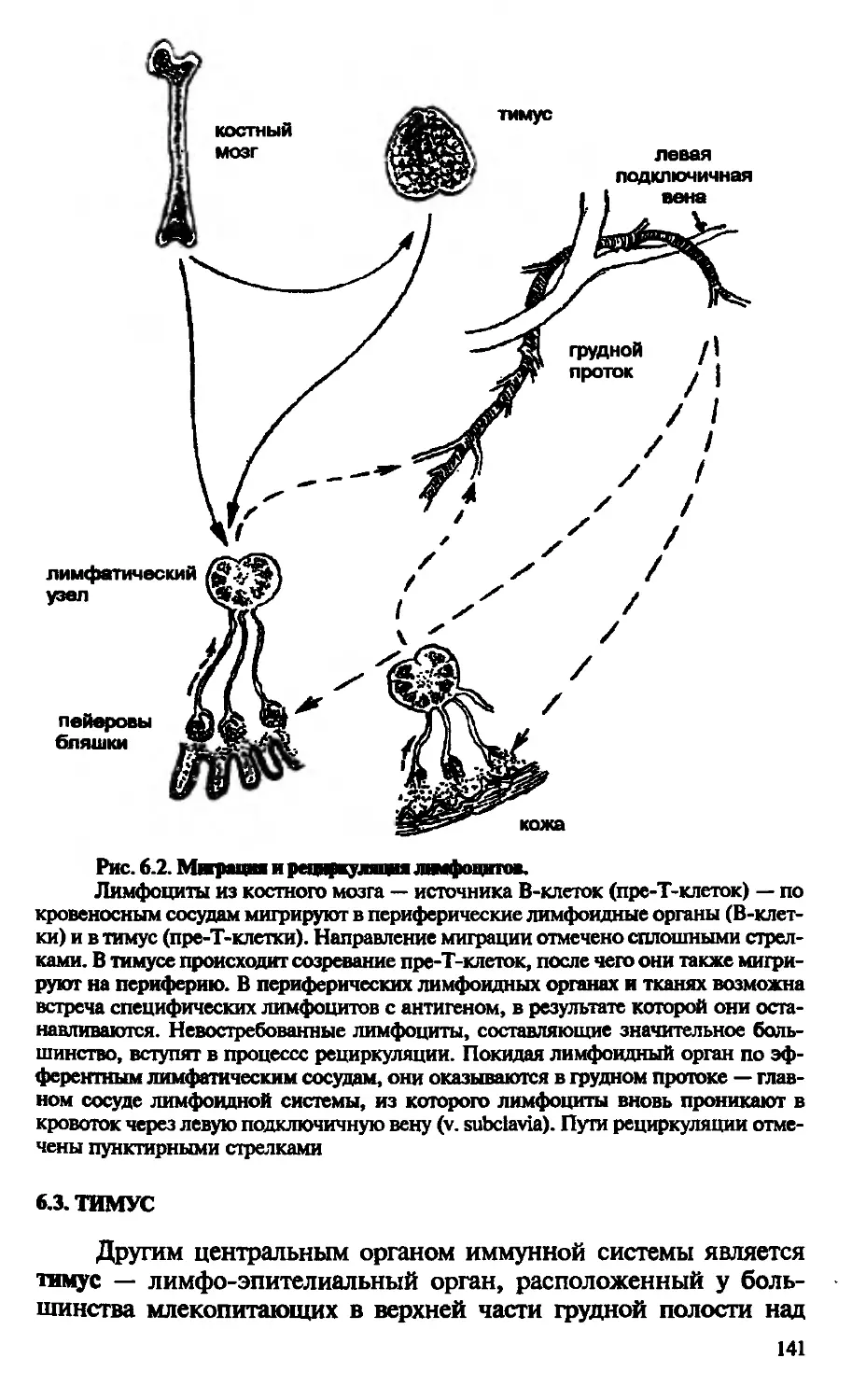
Лимфоидную и кроветворную системы объединяют в единый лимфо-миелоидный комплекс. В него входят: костный мозг, тимус, селезенка, лимфатические узлы, лимфоидные образования пищеварительного тракта, соединительная ткань. Все эти органы и ткани связаны между собой сетью кровеносных и лимфатических сосудов, обеспечивающих межорганный обмен клеточными элементами (рис. В.6).
Костный мозг. Кардинальная особенность костного мозга состоит в том, что он служит основным источником стволовых кроветворных элементов как для миелоидного (кроветворного), так и для лимфоидного ростков дифференцировки. Костный мозг оценивается как первичный орган иммунной системы, поскольку является источником В-клеток для вторичных лимфоидных образований периферии — в основном для селезенки и в меньшей степени для лимфатических узлов.
Тимус. Этот лимфо-эпителиальный орган расположен у млекопитающих в трудной полости непосредственно за трудиной. Он состоит из двух основных долей, которые делятся на мелкие дольки. Каждая долька имеет субкапсулярный, корковый и мозговой слои, или зоны. Формирование паренхимы органа происходит за счет митрации в тимус наиболее ранних, коммитированных в сто-20
Рис. В.6. Схема лимфо-шклондногоктвшекса.
КМ — костный мозг, Т — тимус; С — селезенка; ЛУ — лимфатический узел; К — кишечник; СТ — соединительная ткань; Кр — кровь; ЛС — лимфатические сосуды
рону Т-клеточного пути развития предшественников — пре-Т-кле-ток. Как уже отмечалось, именно в тимусе происходят основные события, связанные с дифференцировкой Т-лимфоцитов на различные субпопуляции. Удивительное свойство органа связано с его способностью к селекции клеток, экспрессирующих Т-кле-точный, антигенный рецептор, который распознает собственные антигены гистосовместимости. В связи с тем, что именно в тимусе определяется будущая судьба Т-лимфоцитов как функционально активной популяции, его вместе с костным мозгом определяют в качестве первичных (центральных) органов иммунитета. Еще одна примечательная особенность тимуса состоит в том, что в его паренхиме представлен только лимфопоэз и полностью отсутствуют миелоидные ростки дифференцировки, и эта особенность позволяет оценивать его как истинно лимфоидное образование. Данное обстоятельство особенно следует помнить при рассмотрении автономности иммунной системы в целом организме.
Лимфатические узлы. Если костный мозг и тимус — центральные органы иммунитета, то лимфатические узлы, селезенка, пейеровы бляшки кишечника представляют собой вторичные структуры. Они не являются местом, определяющим дифференцировку стволовых кроветворных элементов по пути формирования Т- и
В-клеточных популяций. Данные органы служат для развития иммунного ответа после взаимодействия Т- и В-клеток с антигеном и между собой.
Лимфатические узлы, как и тимус, представляют собой истинно лимфоидные образования, расположенные обычно в месте слияния крупных лимфатических сосудов. Размеры узлов у человека колеблются от 3 до 30 мм. Лимфоидная ткань узлов, как и в тимусе, делится на корковый слой и мозговое вещество. В процессе иммунного ответа в корковом слое появляются вторичные фолликулы, или центры размножения, — место формирования эффекторных иммунокомпетентных В-клеток. Большинство лимфоцитов органа представлены Т-клетками (около 65%); на долю В-клеток приходится лишь 28% от общего числа всех лимфоцитов
Селезенка. Характерной чертой строения селезенки является наличие двух гистологически хорошо различающихся участков — красной и белой пульпы. Белая пульпа (мальпигиевы тельца) представляет собой скопление лимфоцитов вокруг эксцентрично расположенного артериального канала. Красная пульпа есть место локализации большого количества эритроцитов, макрофагов, мегакариоцитов, гранулоцитов, лимфоцитов. Для понимания иммунологических процессов наибольший интерес представляют белая пульпа и пограничная область между белой и красной пульпой. Эти регионы заселяются Т- и В-лимфоцитами, мигрирующими из центральных органов иммунной системы. Они распределяются по двум зонам: тимусзависимой, где скапливаются Т-лимфоциты вокруг пронизывающих пульпу артериол, и тимуснезависимой, накапливающей В-лимфоциты. В этой зоне хорошо различимы фолликулы с центрами размножения, которые образуются в ответ на антигенный стимул.
3.4. УРОВЕНЬ ЦЕЛОГО ОРГАНИЗМА
Как и любая другая функция, иммунная реактивность подчиняется высшим отделам регуляции, действующим на уровне целого организма. Этот уровень регуляции обеспечивается активностью нейрогормональной системы. Подобное представление кажется очевидным, поскольку функциональное проявление каждого нижестоящего уровня зависит от более высоких уровней организации. Обращаясь к иммунной системе, необходимо определить главное: на каком этапе формирования иммунного ответа подключаются нейрогормональные факторы регуляции. Известно, что у животных (крысы, кролики, собаки, лошади) величина иммунного ответа зависит от типа нервной деятельности. Разрушение гипоталамических ядер у иммунизированных крыс приводит к снижению иммунного ответа. В то же время адреналэктомия или
введение гормонов анаболического действия (например, соматотропного гормона) определяет увеличение продукции антител. Напротив, гормоны коры надпочечников обуславливают снижение иммунного ответа.
Весь процесс иммуногенеза состоит из двух основных этапов. Первый из них — строго специфический, связанный с распознаванием антигена лимфоцитами. Взаимодействие Т- и В-клеток с антигеном есть автономный, строго специфический процесс, являющийся одной из определяющих особенностей только иммунной системы. Второй этап — неспецифический, начинающийся после распознавания антигена. Он характеризуется функциональным созреванием примированных Т- и В-клеточных клонов и подвержен экзогенным воздействиям, в том числе регулирующему влиянию нейро-гормональной системы.
3.5. ПОПУЛЯЦИОННЫЙ УРОВЕНЬ
На этом уровне изучается роль иммунитета как селективного фактора, обуславливающего генетический полиморфизм и адаптацию популяций к условиям инфекционно опасной зоны жизнедеятельности.
В качестве примера можно привести исследования по инфекционной восприимчивости полуденной песчанки к чуме в низовьях Волги. Пойма реки делит ареал этого грызуна на две самостоятельные популяции: левобережную и правобережную. На правом берегу реки роль основного носителя выполняет малый суслик. На левом берегу носителем инфекции является полуденная песчанка. Возникает вопрос: с чем может быть связано столь различное участие полуденной песчанки в поддержании естественных очагов чумы на территориях, однотипных по ландшафтно-географическим и биотическим условиям? Одно из очевидных предположений сводится к тому, что грызуны двух изолированных популяций обладают неодинаковой резистентностью к возбудителю чумы. Действительно, левобережные песчанки погибают лишь после введения миллиона микробных тел в отличие от правобережных, для которых инъекция в несколько микробных клеток является летальной. При анализе механизмов неодинаковой восприимчивости удалось показать различия в продукции противочумных антител у этих животных. Левобережные песчанки формируют сильный гуморальный ответ. В то же время правобережные грызуны — плохие продуценты антител к возбудителю. Данное свойство специфично, так как зверьки из разных популяций развивают иммунный ответ к столбнячному анатоксину в одинаковой степени. Высокий уровень специфического ответа песчанок левого берега делает их устойчивыми к инфекции. При этом выраженная иммун
ная реактивность не приводит к абсолютному уничтожению возбудителя в организме. Бактериологические исследования выявили небольшое количество микробных тел у левобережных грызунов. Подобное обстоятельство создает реальные условия для циркуляции возбудителя в природе, когда роль носителя инфекции выполняют резистентные животные. Напротив, песчанки правого берега не в состоянии поддерживать очаг чумы из-за высокой восприимчивости к возбудителю. Левобережный очаг чумы значительно старше правобережного. Длительное вовлечение песчанок левого берега в чумные эпизоотии обусловило селективный отбор наиболее устойчивых форм. Конкретное направление отбора шло через сохранение особей с высокой иммунной реактивностью. Для правобережных песчанок процесс отбора не завершен в связи с относительной молодостью очага чумы.
4. ОБЩИЕ И ЧАСТНЫЕ ПРОБЛЕМЫ ИММУНОЛОГИИ
Достаточно условно все исследования в иммунологии (как, впрочем, и в других областях знаний) делятся на две большие группы. Первая из них связана с решением общих иммунологических проблем, изучением клеточных и молекулярных механизмов работы иммунной системы, разработкой основных принципов функционирования данной системы, построением обобщенной концепции иммунитета. Вторая группа включает изучение частных проблем иммунологии. Исследования этой группы ориентированы на практичесую медицину, разработку способов прямого приложения иммунологических знаний к задачам клиники, лечения как самого нарушенного иммунитета, так и тех заболеваний, в развитии которых принимают участие иммунные механизмы. Конечно, подобная градация по группам в определенной степени условна, так как всегда практика стимулирует теорию, а теория ищет практическое приложение. Тем не менее, разделение иммунологических проблем на теоретические и практические удобно, по крайней мере с формальной точки зрения. Примеров единения теории и практики в иммунологии достаточно много. Вот два из них.
Немецкий иммунолог Г. Келер и англичанин Ц. Мильштейн задались целью получить прямые доказательства повышенной му-табельности генов, контролирующих специфичность антител. Для решения этой чисто теоретической задачи им необходимо было иметь клон долгоживущих клеток, продуцирующих антитела одной, узкой специфичности. Такие клоны были получены, и продукт этих клонов — моноклональные антитела, стали доступны в неограниченном количестве для исследования (гл. 2). Сравнительное структурное изучение “ранних” и “поздних” антител, продуцируемых клоном, позволяло получить ответ на основной вопрос:
подвержены ли повышенной мутабельности гены, контролирующие синтез иммуноглобулинов? Понятно, что решение этой проблемы носит сугубо теоретический, фундаментальный характер. В то же время возможность неограниченного получения моноклональных антител оказала неоценимую услугу практической медицине. Во-первых, меченые моноклональные антитела стали использовать с диагностической целью. Например, моноклональные антитела, специфичные к опухолевым антигенам, применяют для определения метастазов у больных со злокачественными новообразованиями. Во-вторых, ведутся практические исследования по использованию моноклональных антител в качестве вектора, доставляющего токсические соединения в злокачественно трансформированные или вирусинфицированные клетки.
Если исследования Г. Келера и Ц. Милыптейна шли от теории к практике, то работы английского иммунолога П. Медавара имели обратное направление — от практической необходимости к теоретическому обобщению. В период второй мировой войны П. Медавар работал в клинике ожоговых поражений и неоднократно наблюдал отторжение кожных лоскутов, пересаживаемых от здорового донора на пораженные участки ожоговых больных. Он задался целью разобраться в причинах такого отторжения. Простое практическое наблюдение стимулировало постановку опытов на лабораторных животных, которые показали в результате иммунологическую природу реакции отторжения (см. гл. 14). Ход дальнейших рассуждений по природе конфликта привел его к открытию индуцируемой иммунологической толерантности — специфической ареактивности иммунной системы (см. гл. 12).
Параллельно исследованиям П. Медавара проблемой толерантности занимался другой выдающийся иммунолог — М. Бернет. Выдвинув концепцию, по которой иммунитет есть реакция организма, дифференцирующая все “свое” от всего “чужого”, он утверждал, что состояние толерантности к “своему” формируется в раннем онтогенезе. Не вдаваясь в подробности всего хода исследований проблемы толерантности, следует лишь подчеркнуть, что, по современным представлениям, естественная толерантность к “своему” и индуцируемая искусственно толерантность к “чужому” — суть явления одного порядка, включащие в работу сходные механизмы. Определяющим звеном в реализации этих механизмов является тимус, способный проводить отрицательную селекцию антигенепецифических лимфоцитов, т.е. исключать из работы клоны, способные взаимодействовать с собственными антигенами или толерогенами (см. гл. 7). Этот последний пример ясно показывает, как чисто практическая необходимость стимулировала целый каскад фундаментальных исследований (, вскрывших одну из принципиальных сторон работы иммунной системы.
Проблема иммунологической специфичности была и остается одной из ведущих проблем иммунологии. Она касается не столько понимания собственно реакции взаимодействия антигена с антителом, сколько расшифровки механизмов онтогенетического становления специфичности антител (иммуноглобулинов) и клонов Т-клеток. Решение проблемы подразумевает ответ на вопрос: почему В- и Т- клоны лимфоцитов реагируют на чужеродные антигенные пептиды и не реагируют на собственные, отличающиеся от чужеродных эпитопов подчас всего одной аминокислотой?
Однако прежде чем ответить на этот главный вопрос, иммунологам необходимо было знать в деталях структурные основы организации иммунной системы, ее молекулярные и морфологические особенности. Структурно-молекулярным основам специфичности посвящены первые три главы учебника. В главе 1 рассказано о многообразии форм антигенов, о природе антигенности и иммуногенности. Одна из наиболее характерных особенностей антигенного материала состоит в том, что запуск иммунного ответа осуществляется целой антигенной молекулой или клеткой (бактерии, грибки, чужеродные соматические клетки), но сам ответ в виде синтеза иммуноглобулинов или активации Т-клеточных клонов направлен только на отдельные части антигена — эпитопы.
Антитела — основные участники зашиты организма от бактериальных инфекций — были обнаружены на заре становления иммунологии. Однако долгое время ничего не было известно об их организации и характере взаимодействия с антигеном. Только к середине 50-х годов создались условия для широкого изучения их молекулярных свойств. В настоящее время известны не только особенности строения различных классов иммуноглобулинов, локализации участков, способных взаимодействовать с антигеном, но выяснены, что крайне важно, генетические основы удивительно широкого многообразия антител (гл. 2).
Если иммуноглобулины распознают антигенную детерминанту’ непосредственно, без участия каких-либо дополнительных структур, то Т-клеточный антигенраспознающий рецептор (ТКР) взаимодействует с комплексом антигенный пептцд:молекулы I или II классов МНС того организма, в котором развивается иммунный ответ. Этот своеобразный механизм распознавания “измененного своего”, т.е. распознавания собственных молекул МНС, ком-плексированных с чужеродным пептидом, был открыт в самом конце 70-х годов и наиболее активно разрабатывался в 80-е годы (гл. 3).
Обнаружение в середине 60-х годов клеточного взаимодействия при развитии иммунного ответа вскрыло большую группу
молекулярных факторов, регулирующих иммуногенез. Эти эндогенные иммунорегуляторы получили обшее название — цитокины. В настоящее время известно более 30 таких цитокинов. Для некоторых из них, имеющих наибольшее значение в клинике, получены генноинженерные аналоги (гл. 4).
Особое место в молекулярной иммунологии занимает большая группа структурно близких белков, которые в той или иной степени участвуют в иммунном реагировании. Это группа гомологичных белков объединена в единое суперсемейство иммуноглобулинов. Сам по себе факт наличия у высших позвоночных животных, включая человека, такого суперсемейства крайне интересен. Во-первых, он указывает на удивительную сложность, многофак-ториальность работы иммунной системы и, во-вторых, говорит о филогенетическом единстве молекулярных участников процесса. Задача иммунологов — попытаться определить возможные филогенетические связи в суперсемействе и установить его эволюционное происхождение.
Иммунная система, как и любая другая система организма, помимо арсенала эффекторных и регуляторных молекул имеет свои собственные клетки, ткани и органы (гл. 6). Центральной фигурой системы является лимфоцит. Неслучайно М. Бернет в свое время дал ему название — иммуноцит. Эволюционно он возник специально для осуществления надзора за генетической целостностью организма (гл. 20), а понятия “лимфоидный” и “иммунный” — суть синонимы, определяющие одну и ту же систему организма.
В начале 60-х годов начались планомерные исследования тимуса как органа, оказывающего особое влияние на становление и проявление иммунной защиты и в первую очередь клеточных форм иммунного реагирования. В результате этих исследований иммунологи пришли к заключению о существовании в пределах иммунной системы двух относительно самостоятельных Т- и В-систем иммунитета (гл. 7,8). Говоря о существовании в организме тех или иных систем, необходимо определить их органные, тканевые, клеточные и молекулярные составляющие. В отношении Т- и В-систем эти критерии полностью выдержаны.
Т-система иммунитета включает тимус (центральный орган иммунитета), различные субпопуляции Т-клеток (Т-киллеры/Т-супрессоры, Т-хелперы/Т-клетки воспаления), антигенраспозна-ющий комплекс как основной специфический компоненет системы и, наконец, ipynny Т-клеточных цитокинов, которые выступают в качестве регуляторов как клеточного, так и гуморального иммунного ответа. Особое место занимает, конечно, тимус как место становления специфических клонов Т-клеток, прошедших положительную и отрицательную селекцию в органе (гл.7).
В-система иммунитета, осуществляющая гуморальный иммунный ответ, представлена костным мозгом (основным местом дифференцировки В-клеток), В-клетками разной степени зрелости и способности к продукции различных изотипов иммуноглобулинов, антителами (иммуноглобулинами) и поверхностными ан-тигенраспознающими рецепторами (sig) (гл.8).
Становление Т- и В-систем иммунитета в доантигенный этап развития создает защитный потенциал к возможной в будущем встрече организма с тем или иным чужеродным антигеном. Проникающие в течение жизни индивидуума в организм антигены (вирусы, бактерии, грибки и др.) провоцируют запуск второго, постантигенного этапа развития систем. Этот этап включает: распознавание антигена клоноспецифическими Т- и В-клетками, усиление миграции лимфоцитов, взаимодействие иммунокомпетентных клеток, созревание наивных Т- и В-клеток до функционально активных клеточных форм, усиление продукции цитокинов, активацию системы комплемента, нейтрализацию и разрушение антигена, формирование Т- и В-клеток памяти (гл. 9).
Уже отмечалось, что деление проблем иммунологии на общие и частные — достаточно условный прием. Он необходим лишь для систематизации фактического материала, упорядочения наших знаний. Иммуногенетика представляет пример такой условности. С одной стороны, этот раздел иммунологии самым тесным образом связан с решением вопросов генетической детерминации силы иммунного ответа, генетики трансплантационных антигенов, изучением механизмов презентации антигена и его распознавания, т.е. с наиболее общими проблемами работы иммунной системы. С другой стороны, именно иммуногенетика призвана решать практические задачи в трансплантологии и вакцинации (гл. 10).
Если все-таки приводить пример наиболее общего, отвлеченного от задач практики направления в иммунологии, то это, конечно, — проблема эволюции иммунитета. Неслучайно именно данное направление в иммунологии самым тесным образом связано с общей биологией. Основные вопросы, решаемые в рамках проблемы эволюции иммунитета, связаны с выяснением причин и филогенетического уровня возникновения способности к специфическому иммунному распознаванию, эволюции лимфоидного клеточного комплекса, этапов исторического становления различных форм иммунной реактивности. При этом наиболее важный вопрос эволюционной иммунологии связан с оценкой роли специфического иммунитета в эволюции многоклеточных животных как одного из факторов, обеспечивших прогресс в мире животных по линии увеличения абсолютного количества соматических клеток особей одного вида (гл. 20).
5. ТЕОРИИ СПЕЦИФИЧЕСКОГО ИММУНИТЕТА
В самой сжатой форме все появившиеся со времен П. Эрлиха гипотетические построения, касающиеся феномена иммунологической специфичности, можно разбить на две группы: инструктивные и селективные.
Инструктивные теории рассматривали антиген в качестве пассивного материала — матрицы, на которой формируется анти-генсвязующий участок антител. По этой теории все антитела имеют одну и ту же последовательность аминокислотных остатков. Различия касаются третичной структуры и возникают в процессе окончательного формирования молекулы антитела вокруг антигена. В настоящее время инструктивные теории полностью оставлены и имеют лишь исторический интерес. Они не выдержали проверки временем и вошли в противоречие с данными как иммунологии, так и молекулярной биологии. С иммунологических позиций они не объясняли, во-первых, почему количество антител в молярном отношении значительно больше количества проникшего в организм антигена, и, во-вторых, не отвечали на вопрос, за счет чего формируется иммунологическая память. С позиций молекулярной биологии они противоречили основной догме биоло-
Рис. В.7. Инструктивная теория.
По этой теории все антитела имеют одну и ту же последовательность аминокислотных остатков. Различия касаются третичной структуры и возникают в процессе окончательного формирования молекулы антитела вокруг антигена; А, В, С — участки полипептидной цепи. Теория противоречит современным фактам иммунологии и молекулярной биологии и представляет только исторический интерес
гии, гласящей, что специфичность белка строго закодирована в последовательности нуклеотидов ДНК в хромосоме, а третичная структура связана с первичной структурой и не может в определенных пределах свободно меняться под влиянием факторов внешней среды без нарушения или полной потери функции.
Более плодотворными оказались селективные теории вариабельности антител. История развития иммунологической мысли в направлении селективных теорий началась с первого построения П.Эрлиха (см. выше). В основе всех селективных теорий лежит
Рис. В.8. Теория “боковых цепей” П.Эрлиха.
Данная теория является первой селективной теорией иммунитета. На поверхности клетки, способной образовывать антитела, имеются комплементарные к введенному антигену структуры — “боковые цепи”. Взаимодействие антигена с “боковой цепью” приводит к ее блокаде и как следствие — к компенсаторному повышенному синтезу и выходу в межклеточное пространство соответствующих “цепей”, выполняющих функцию антител
А Б В
Рис. В.9. Клонально-селекционная теория М.Ф.Бернета.
При дифференцировке лимфоцитов от стволовой кроветворной клетки и при параллельно идущем процессе мутационных изменений в генах, ответственных за синтез антител, возникают клоны клеток (А), которые способны взаимодействовать с антигеном одной конкретной специфичности (Б). В результате подобного взаимодействия формируется отобранный по специфичности клон, который либо секретирует антитела заданной специфичности, либо обеспечивает клеточную реакцию (В)
представление о том, что специфичность антител предопределена, и антиген выступает лишь в качестве фактора отбора соответствующих по специфичности иммуноглобулинов.
В 1955 г. вариант селективной теории выдвинул Н.Ерне (1955). По его представлениям, в организме постоянно присутствуют антитела самой разнообразной специфичности. Антитело после взаимодействия с соответствующим антигеном поглощается фагоцитирующими мононуклеарами, что приводит к активной продукции этими клетками антител исходной специфичности.
Особое место в иммунологии занимает клонально-селекционная теория иммунитета М. Бернета (1059). Он использовал представления П. Эрлиха и Н. Ерне о предсуществовании антител разной специфичности, но указывал на то, что каждое специфическое антитело синтезируется отдельным клоном клеток. По М. Бернету, при дифференцировке лимфоцитов от стволовой кроветворной клетки и при параллельном процессе мутационных изменений в генах, контролирующих синтез специфических антител, возникают клоны клеток, которые способны взаимодействовать только с антигеном соответствующей специфичности. В результате такого взаимодействия формируется отобраный по специфичности клон, который либо секретирует антитела заданной специфичности, либо обеспечивает строго специфическую клеточную реакцию. Клонально-селекционный принцип организации иммунной системы, выдвинутый М. Бернетом, полностью подтвердился в настоящее время. Недостатком теории являются представления о том, что многообразие антител возникает только за счет мутационного процесса.
В то время, когда М. Бернет разрабатывал свою теорию, ничего не было известно о генах иммуноглобулинов и их реком-би-нации в процессе созревания В-клеток. Основной принцип селекции специфических клонов сохранен в теории зародышевой линии Л. Худа и соавт. (1971). Однако первопричину многообразия клонов авторы видят не в повышенной мутабельности иммуноглобулиновых генов, а в исходном зародышевом их предсуществовании. Весь набор V-генов, контролирующих вариабельную область иммуноглобулинов, представлен изначально в геноме и передается от поколения к поколению без изменений. В процессе развития В-клеток происходит рекомбинация иммуноглобулиновых генов,
Рис. В. 10. Теория зародышевой линии Л-Худа и др.
Весь набор V-генов (1. 2, 3, 4 ...), контролирующих вариабельную область иммуноглобулинов, представлен в геноме и передается от поколения к поколению без изменений. В процессе созревания В-клеток при индивидуальном развитии активируется один из V- генов, который в результате взаимодействия с С-геном кодирует иммуноглобулин определенной специфичности. Продукция строго специфических антител (иммуноглобулинов) есть функция определенного В-кле-точного клона
так что отдельно взятая созревающая В-клетка способна синтезировать иммуноглобулин одной специфичности. Такая моноспеци-фическая клетка становится источником клона В-клеток, продуцирующих определенный по специфичности иммуноглобулин.
Таким образом, теоретическая мысль в иммунологии развивалась от представлений П. Эрлиха о предсуществовании специфических антител и выдвижения клонально-селекционного принципа М. Бернетом до представлений о том, что клональность развития В-клеток предопределена в зародышевой линии и формируется в результате рекомбинации иммуноглобулиновых генов. Объединяющим моментом всех этих теоретических построений является убежденность в том, что антиген — лишь фактор селекции, но не участник формирования специфичности.
Часть I. МОЛЕКУЛЯРНАЯ ИММУНОЛОГИЯ
Глава 1. АНТИГЕНЫ
Антигенами называются структурно чужеродные для данного конкретного организма вещества, способные вызывать иммунный ответ. В этом определении скрыты две основные характеристики антигена, две его ипостаси: антигенная специфичность — свойство, отличающее данный антиген от индивидуального, антигенного состава реципиента, и иммуногенность — способность инициировать иммунную систему к формированию эффекторов, нейтрализующих антигенную чужеродность. Гаптены — простые химические соединения — не в состоянии обеспечить развитие иммунного ответа, демонстрируя тем самым отсутствие свойства иммуногенности, но при этом могут взаимодействовать с предсу-ществующими антителами, проявляя свойство специфичности. В то же время высокомолекулярные соединения (белки, полисахариды) обладают как антигенной специфичностью, так и иммуногенностью (рис. 1.1).
1.1. ТЕРМИНОЛОГИЧЕСКОЕ РАЗНООБРАЗИЕ В ОБОЗНАЧЕНИИ АНТИГЕНОВ
Исследователи, занятые в той или иной области иммунологии, для обозначения антигенного материала, с которым работают, используют свои обозначения, призванные, очевидно, подчеркнуть суть изучаемого явления. Терминологическое разнообразие антигенов, если хотите, — научный жаргон: независимо от того, какой чужеродный материал исследуется, две характерологические особенности — специфичность и иммуногенность, остаются основными и в целом достаточными для определения объекта изучения. Тем не менее, специальные названия антигенов укоренились, и для изучающих иммунологию полезно знать набор устоявшихся терминов, что позволит лучше ориентироваться в соответствующей литературе. Они представлены в табл. 1.1.
1.2. ФАКТОРЫ, ОПРЕДЕЛЯЮЩИЕ ИММУНОГЕННОСТЬ
Чтобы спровоцировать иммунный ответ, антиген должен обладать свойством иммуногена, как об этом уже упоминалось. С другой стороны, организму (реципиенту) необходимо обладать способностью воспринимать сигнал и включать иммунные механизмы. Например, при анализе генетического контроля иммунного ответа выявлены линии мышей и морских свинок, одни из которых отвечают на определенный антиген, а другие остаются к
нему ареактивными (см. главу 10). Иными словами, антиген в качестве иммуногена проявляется тогда, когда иммунная система конкретного организма способна к адекватному ответу.
Иммуногенность
Рис. 1.1 .Понятия антигенности и иммуногенности.
А. Гаптены — простые химические группировки — не в состоянии индуцировать специфический иммунный ответ, хотя они и обладают антигенными свойствами, т.е. способностью взаимодействовать с предсуществуюшими антителами.
Б. Большинство высокомолекулярных биологических веществ (белки, полисахариды, нуклеопротеины и др.) являются хорошими индукторами специфического ответа, чем демонстрируют свои иммуногенные свойства.
В. Неиммуногенный гаптен, конъюгированный с иммуногенным носителем, способен индуцировать синтез специфических антител или формирование клона лимфоцитов, проявляя признак антигенной чужеродности
Таблица 1.1
Некоторые устоявшиеся названия антигенов
Название Антигены
Корпускулярные антигены Растворимые антигены Ксеноантигены Аллоантигены Трансплантационные антигены Аутоантигены Аллергены Толерогены Синтетические антигены Гаптены различные клетки и крупные частицы: бактерии, грибки, простейшие, эритроциты белки различной степени сложности, полисахариды, липополисахариды антигены тканей и клеток, отличающиеся от реципиента на видовом уровне антигены тканей и клеток, отличающиеся от реципиента на внутривидовом (индивидуальном) уровне антигены клеточной поверхности, контролируемые главным комплексом гистосовместимости антигены собственных клеток, полимерных молекул антигены пищи, пыли, пыльцы растений, ядов насекомых, вызывающие повышенную реактивность антигены клеток, белков, вызывающие ареак-тивность искусственно синтезированные полимеры аминокислот, углеводов простые химические соединения в основном ароматического ряда
1.2.1. Требования к антигену
Иммуногенность антигена определяется следующими свойствами: чужеродностью для организма, молекулярным весом, химическим строением.
Чужеродность. Чтобы молекула выступила в качестве иммуногена, она должна быть распознана иммунной системой как “не своя”. Это качество антигена кажется очевидным. При этом не все чужеродные молекулы способны вызвать иммунный ответ равной силы. Хорошо известно, что филогенетическая удаленность донора антигена от реципиента и выраженность иммунного ответа находятся в прямой зависимости. Например, синтез антител к бычьему сывороточному альбумину легче вызвать у кролика, чем у козы. Кролики относятся к отряду зайцеобразных, а козы и быки включены в другой отряд — парнокопытных. В зависимости от особенностей антигена его иммуногенные свойства будут проявляться и на внутривидовом (индивидуальном) уровне. Получение антител к антигенам гистосовместимости или аллотипам иммуноглобулинов — обычный прием исследовательской работы. В то же время антитела к альбумину при внутривидовой иммунизации не образуются. В графической форме эти отношения представлены на рисунке 1.2.
Рис. 1.2. Зависимость силы иммунного ответа от особенностей антигена и уровня филогенетических различий между донором антигена и реципиентом.
Бычий сывороточный альбумин (БСА) — слабый иммуноген. На уровне внутривидовых индивидуальных различий иммунный ответ не развивается. Специфический ответ достаточной силы наблюдается только при значительных филогенетических различиях между донором антигена и реципиентом (например, в паре корова:кролик). При меньших филогенетических отличиях (корова:коза) ответ характеризуется умеренным выражением. Антигены главного комплекса гистосовместимости относятся к категории сильных иммуногенов: уже на уровне индивидуальных различий они способны инициировать достаточно выраженный иммунный ответ
Изменение конформации собственных белков (например, при тепловой или химической денатурации) делает такие белки чужеродными для собственного организма, который реагирует на них синтезом антител.
Развитие реакции к собственным, нативным антигенам известно при аутоиммунных заболеваниях. Однако такая патологическая реактивность связана с нарушениями в самой иммунной системе и не связана с какими-либо изменениями в аутоантигенах.
Молекулярная масса. Экспериментаторам хорошо известна зависимость между размерами антигена и силой иммунного ответа. Все корпускулярные антигены (бактерии, гетерологичные эритроциты) — хорошие иммуногены. Для белковых антигенов иммунный ответ будет тем сильнее, чем больше его молекулярная масса. В табл. 1.2. представлены некоторые наиболее часто употребляемые в работе антигены. При всех прочих равных условиях большая молекулярная масса антигена обеспечивает большую имму-
Таблица 1.2
Корреляция между молекулярной массой антигена и его валентностью (количеством эпитопов, с которыми реагируют специфические антитела)
Антиген Молекулярная масса (Да) Малярное отношение: антитело: ангтиен (число эпитопов)*
Рибонуклеаза 13 000 3
Овальбумин кур 42 000 5
Сывороточный альбумин лошади 69 000 6
"/-Глобулин человека 160 000 7
Апоферритин лошади 465 000 26
Тироглобулин 700 000 40
Вирус кустистой карликовости томатов 8 000 000 90
Вирус табачной мозаики 40 000 000 650
‘Поскольку антитела, по крайней мере, двухвалентны, истинное числ мест связывания (эпитопов) у антигена выше, чем то, которое получается при вычислении молярного отношения ангитело:ангиген. Чем больше эпитопов, тем выше иммуногенность антигена.
ногенность. Вирус табачной мазанки — наиболее сильный иммуноген, в отличие от рибонуклеазы — слабого иммуногена.
Химические особенности. Чужеродность и- значительный молекулярный вес не являются достаточным условием для проявления иммуногенности антигена. Синтетический поли-Ь-лизин с высоким молекулярным весом не является иммуногеном. В то же время сополимеры, построенные из двух и более аминокислот, приобретают способность индуцировать иммунный ответ. Иммуногенность значительно усиливается, если в структуру сополимера включены ароматические аминокислоты. Так, например, сополимер аминокислот лизина и глутаминовой кислоты приобретает иммуногенность при минимальной мол. массе 30-40 кД. Добавление в сополимер тирозина снижает минимальную молекулярную массу, достаточную для проявления иммуногенности, до 10-20 кД. При включении еще одной ароматической аминокислоты — фенилаланина — иммуногенность сополимера проявляется при мол. массе всего 4 кД. К этой же категории явлений относится увеличение иммуногенности очень слабого антигена — желатина — добавлением небольшого количества тирозина.
Еще одна особенность, связанная с химическим строением полимерных молекул: антиген распознается Т-хелперами на поверхности антигенпрезентирующей клетки, где он экспрессируется в иммуногенной форме после переработки гидролитическими ферментами. Если антигенные макромолекулы под действием ферментов лизосом не способны подвергаться деструкции, то они остаются неиммуногенными или слабоиммуногенными. Ферменты макрофагов разрушают белки, построенные из L-аминокис-лот, и остаются инертными к D-изомерам, что и является причиной крайне низкой иммуногенности синтетических полимеров, построенных из D-аминокислот.
1.2.2. Требования к организму
Перечисленные выше свойства антигенов: чужеродность, достаточная молекулярная масса, особенности химической структуры, — не всегда являются гарантом развития полноценного иммунного ответа. Конечный результат — формирование иммунного ответа — зависит от иммунизируемого организма, его индивидуальной генетической характеристики — генотипа.
Различные инбредные линии мышей неодинаково отвечают на один и тот же антиген (табл. 1.3 ). Так, мыши, имеющие гаплотип Н-2Ь главного комплекса гистосовместимости (МНС), развивают крайне слабый ответ на синтетический сополимер: полигис-тидин-полиглутаминовая кислота-полиаланин-полилизин [(H,G)-А-L]. При этом мыши с гаплотипом Н-2к характеризуются высоким ответом. К другому сополимеру [(T,G)-A-L], который отличается от предыдущего всего на одну аминокислоту, отмечается ре-
Табл и ца 1.3 Связь гаплотипа главного комплекса гистосовместимости мышей с силой иммунного ответа на синтетические сополимеры (H,G)-A-L
и (T,G)-A-L
Гаплотип Линия мышей Иммунный ответ (продукция антител) на
(H,G)-A-L* (T,G)-A-L
Н-2Ь С57 низкий высокий
Н-2Ь С57В1/6 низкий высокий
Н-2Ь C3H.SW низкий высокий
Н-2Ь 129/J низкий высокий
Н-2к СВА высокий низкий
Н-2к C3H/HeJ высокий низкий
Н-2к C58J высокий низкий
Н-2к B10.BR высокий низкий
H-2S B10.S низкий низкий
‘Синтетические антигены: (T,G)-A-L — политирозин-полиглутаминовая кислота-полиаланин-полилизин; (H-G)-A-L — полигистидин-полиглутаминовая кислота-полиаланин-полилизин
реверсия в силе иммунного ответа: линия с гаплотипом Н-2Ь развивает сильный ответ, линия Н-2к — слабый. В основе столь тонкой дифференцировки антигена лежат различия по генам иммунного ответа (Ir-гснам), локализованным в МНС (об этом подробнее в гл. 10)
1.3. ГАПТЕНЫ
Антиген как первопричина развития иммунного процесса интересовал иммунологов с тех давних пор, когда зародилась иммунология. Однако только благодаря исследованиям К. Ландштейнера в 20-30-х годах сложились условия для изучения тонкой природы специфичности антигена. В качестве объекта исследования ученый взял простые органические соединения — гаптены. Как уже отмечалось, сами по себе эти соединения не способны вызвать иммунологическую реакцию. Наличие чужеродности при низкой молекулярной массе лишает их иммуногенности. При этом комплекс гаптена с белком-носителем иммуногенен (рис. 1.1). Исследования Ландштейнера выявили по крайней мере два существенных момента: (1) очень высокий уровень специфичности (подчас в определении специфичности принимает участие всего один радикал — карбоксильная группа или аминогруппа), (2) специфичность высокомолекулярного антигена представлена отдельными участками (эпитопами) — местами связывания антител или анти-гснраспознающих рецепторов, при этом чем больше молекулярная масса антигена, тем больше мест связывания (табл. 1.4).
Схема постановки опытов, разработанная Ландштейнером, включала иммунизацию кроликов гаптенбелковым комплексом и последующий анализ антисывороток от иммунизированных животных с тем же самым или иным гаптеном, но конъюгированным с другим неродственным белком. Подобный прием позволял работать только с антителами к гаптену и исключал те антитела, которые образовывались к эпитопам белка, взятого для иммунизации (рис. 1.3). В результате удалось показать решающую роль тонкой конфигурации Гаптена в определении специфичности. Другой пример, иллюстрирующий это основное положение, представлен в табл. 1.4.
Изучение гаптенов имеет не только теоретическое значение для понимания явления антигенной специфичности, но и практическое приложение. Многие биологически важные соединения, включая пептидные и стероидные гормоны, циклические АМФ и ГМФ, лекарства и т.д., являются низкомолекулярными, неиммуногенными соединениями. Их конъюгация с иммуногенным белком позволяет получать антигаптеновые антитела. Такие антитела затем используются в тест-системах для определения уровня ана
лизируемых соединений в биологических жидкостях организма. Один из примеров в этом отношении — определение беременности у женщин по выявлению с помощью соответствующих антител хорионического гонадотропина в моче.
Рис. 1.3 Принцип выявления антител, специфичных к гаптену, взятому для иммунизации.
В качестве примера использованы структурно близкие гаптены: динитрофенил (ДНФ), тринитрофенил (ТНФ) и два неродственных белка (условно А и В). Иммунизация кролика конъюгатом ДНФ-белок А приводит к образованию нескольких по специфичности антител. Помимо анти-ДНФ в антисыворотке (АС) представлены антитела к эпитопам белка А. С целью исключить антитела к этому белку при постановке реакции используют конъюгат того же гаптена ДНФ с неродственным белком В. Отрицательный результат реакции антисыворотки с конъюгатом близкого по структуре гаптена ТНФ, комплексированного с белком В, демонстрирует роль тонкой конфигурации гаптена в определении специфичности антител
Таблица 1.4
Значение полярных групп п их положения в специфической реакции взаимодействия с антителами.
Гаптены, использованные в реакции преципитации
Антисыворо тки против: б V соон NH, 1\х^'С00Н NH, ^\х^соон NH,
NHj 0 0 ++++ +++ +
NHj C/'sOjH 0 0 0 0 +++
1.4. ЭПИТОПЫ
Изучение гаптенов указывало на то обстоятельство, что антитела или антигенраспознающие рецепторы В- и Т-лимфоцитов взаимодействуют не с целой антигенной молекулой, а с отдельными ее участками — эпитопами. Причем В- и Т-лимфоциты распознают разные по характерологическим особенностям эпитопы.
1.4.1. В-клеточные эпитопы
Величина эпитопа, с которым взаимодействует антитело или иммуноглобулиновый рецептор В-клеток, как правило, должна соответствовать размеру антигенраспознающего участка. Методами рентгеноструктурного анализа комплексов антиген:антитело (лизоцим куриных яиц и нейраминидаза гриппа) выявлено, что в контактную область включены 15-22 поверхностных аминокислот белкового антигена. Однако не совсем ясно, все ли эти аминокислоты определяют эпитоп, взаимодействующий с антигенсвязыва-ющим участком антител, или часть из них находится в пограничной с эпитопом области. Обычное число аминокислот или сахаров, составляющих эпитоп, равно 6-8 мономерам.
В-клеточные эпитопы (детерминанты) находятся, как правило, на внешней поверхности антигена и относятся к так называемому конформационному типу, т.е. обладают третичной структурой и составляют часть общей пространственной организации антигенной молекулы. Локализация на внешней поверхности определяет их гидрофильность. На рис.1.4 представлена схема строения миоглобина спермы кита, полученная на основании данных рент-
Рис. 1.4 Строение миоглобина спермы кита.
Пространственная организация установлена на основании рентгеноструктурного анализа. Заштрихованные участки — последовательности аминокислотных остатков, выступающие в качестве В-клеточных эпитопов. Цифры указывают на порядковый номер аминокислотных остатков в полипептиде
геноструктурного анализа. Видно, что миоглобин имеет по крайней мере пять эпитопов, расположённых в основном в изгибах полипептидной цепи, т.е. в а-спиральных участках, однако действительное количество эпитопов может быть значительно больше. Так, например, при работе с 64 различными моноклональными антителами к бычьему сывороточному альбумину и панелью альбуминов от 10 разных видов животных было выявлено 25 перекрывающихся эпитопов. Эти факты позволяют предполагать, что вся поверхность белка в целом представляет собой собрание разнообразных эпитопов, а сочетание аминокислот, не встречающееся в иммунизируемом организме, может выступать в качестве эпитопа. Другое дело, что не все эпитопы в составе белка должны обладать равной иммуногенностью. Наиболее сильных, иммуно-доминантных эпитопов, очевидно, немного.
Помимо “внешних” эпитопов имеются “внутренние”, скрытые от распознавания антителами. Так, антитела к синтетическому сополимеру (T,G)-A-L, который имеет тирозин и глутаминовую кислоту на внешней поверхности, не реагируют с сополимером, построенным из тех же аминокислот, но имеющим упомянутые аминокислоты во внутренней части полимерной молекулы (рис. 1.5.).
А Б
Рис. 1.5 Влияние расположения аминокислот в полипептиде па иммуногенность всей молекулы.
А. В тех случаях, когда L-тирозин и L-глутаминовая кислота расположены на внешних участках боковых цепей синтетического полипептида (T,G)-A-L (политирозин-полиглутаминовая кислота-полиаланин-полилизин), вся молекула в целом является сильным иммуногеном. Б. В условиях, когда синтез искусственных полипептидов осуществляется так, что иммуногенные детерминанты L-тирозина и L-глутаминовой кислоты оказываются внутри боковых цепей, а на внешних участках представлен L-аланин, молекула становится неиммуногенной. Эти структурные особенности указывают на значение положения отдельных аминокислот в определении иммуногенности
1.4.2. Т-клеточные эпитопы
В 70-х годах при изучении взаимодействия генетически отличающихся иммунокомпетентных клеток (см. главы 3,9) было высказано предположение о том, что антигенный рецептор Т-клеток (ТКР) распознает не собственно антиген, а его комплекс с продуктами главного комплекса гистосовместимости. Подобное предположение требовало конкретного экспериментального подтверждения. Исследования, проведенные в этом направлении, дали положительные результаты. Так, рентгеноструктурный анализ одного из кристаллизованных антигенов I класса МНС показал наличие в его щели чужеродного олигопептида, являющегося, очевидно, фрагментом процессированного антигена. Пептидные фрагменты куриного альбумина с последовательностью аминокислотных остатков 323-339 взаимодействовали с молекулами II класса 1Аа, но не 1АЬ. При этом в отличие от строго специфического взаимодействия антител с соответствующим В-клеточным эпитопом распознавание молекулами МНС пептидных фрагментов имеет определенные допуски по специфичности. Так, 1Аа молекулы II класса МНС взаимодействуют не только с отмеченным пептидом из куриного альбумина, но и с фрагментами гемагглютинина (остатки 130-142), лямбда-репрессора (остатки 12-26). Участки антигенных молекул, взаимодействующие с молекулами МНС, которые не перекрываются с эпитопами, получили название агретопов. Таким образом, антиген, распознаваемый Т-клетками, должен иметь по крайней мере два участка: один — для распознавания молекулами МНС (агретоп) и другой — для распознавания ТКР (эпитоп) (рис.1.6.).
При работе с клонированными Т-клетками, специфичными к миоглобину спермы кита, было показано, что наименьший участок, способный вызвать клеточную пролиферацию, включает 11 аминокислотных остатков. В таблице 1.6 даны примеры аминокислотных последовательностей иммунодоминантных Т-клеточных эпитопов различных белков. Представленные молекулярные отношения говорят о том, что Т-клеточное распознавание реализуется в результате формирования трехмолекулярного комплекса антигена с двумя типами распознаваемых структур — эпитопов и агретопов, молекул МНС и ТКР.
1.5. ТИМУСЗАВИСИМЫЕ И ТИМУСНЕЗАВИСИМЫЕ АНТИГЕНЫ
Большинство природных антигенов является тимусзависимы-ми. Это означает, что полноценное развитие специфического иммунного ответа на такие антигены начинается только после подключения Т-клеток. Подобные представления сложились на ос
новании опытов как in vivo, так и in vitro. Действительно, неонатально тимэкгомированные мыши либо вообще не отвечают на полноценный антиген продукцией IgG , либо такой ответ крайне слабый. Трансплантация тимуса мышам восстанавливает специ-
Рис. 1.6. Участки шгтигена, распознаваемые молекулами МНС и Т-клеточным атигенраспознающнм рецептором.
Антигенный фрагмент, представляемый для распознавания Т-клеточному рецептору (ТКР), имеет два участка: агретоп и эпитоп. Агретоп - часть антигенного пептида, взаимодействующая с молекулами МНС в процессе экспрессии пептида на поверхность антигенпрезентирующей клетки (АПК). Эпитоп - часть антигенного пептида, непосредственно распознаваемая ТКР
Таблица 1.6
Последовательность аминокислотных остатков, составляющих иммунодоминантные Т-клеточные эпитопы
Антиген Последовательность аминокислот, составляющих эпитоп
Миоглобин спермы кита Цитохром с голубя Гемагглютинин А вируса гриппа Свиной инсулин Лизоцим кур Овальбумин кур Цитохром с быка Основной поверхностный антиген вируса гепатита В 69-78 102-118 132-145 93-104 109-119 130-140 302-313 (В) 5-16 (А) 4-14 46-61 74-86 81-96 109-119 323-339 11-25 66-80 38-52 95-109 140-154
фический ответ. При использовании конъюгата гаптена с различными белками в качестве носителя установлено, что Т-клетки отвечают на носитель (Т-клеточный эпитоп), в то время как В-клет-ки — на гаптен (В-клеточный эпитоп) (рис.1.7.). В опытах in vitro показано, что чистая популяция В-клеток отвечает на антиген только пролиферацией, но при этом неспособна пройти весь путь развития до зрелых, продуцирующих антитела плазмоцитов. Внесение в культуру Т-клеток и макрофагов обеспечивает продукцию специфических антител. Роль макрофагов в комплексной культуре состоит в представлении Т-клеточных эпитопов в иммуногенной форме.
Кроме основной труппы тимусзависимых антигенов имеются антигены, способные инициировать иммунный ответ в отсутствие Т-клеток. Они получили название тимуснезависимых антигенов. Антигены этой труппы в основном относятся к полисахаридам и характеризуются многократным повторением структурно идентичных эпитопов. Подобное однообразие приводит к многоточечному взаимодействию с В-клеткой, что и обеспечивает их полноценное развитие до зрелых, продуцирующих антитела плазмоцитов. Кроме того, в структуре некоторых тимуснезависимых антигенов имеются последовательности с поликлональной, митогенной активностью (например, бактериальные липополисахариды), что также вносит свой вклад в развитие В-клеток в обход помощи со стороны Т-клеток. В табл. 1.7 представлена основная характеристика некоторых тимуснезависимых антигенов.
Заключение
Серьезное изучение антигена как индуктора иммунного ответа началось после работ Ландштейнера в 20-30-х годах. В качестве антигенного материала он взял простые органические соединения — гаптены, которые после конъюгации с белком-носите-
Рис. 1.7. Активация В-клеток тимусзависимыми и тимуснезависимыми антигенами.
1. Действие тимусзависимого антигена на В-клетку без помощи со стороны Т-клеток приводит к пролиферации соответствующего В-клеточного клона, но не обеспечивает его дифференцировки до зрелых lgG-продуцирующих клеток. 2. Для полноценного развития клона В-клеток необходим не только специфический сигнал со стороны гаптеновой части молекулы антигена, но и неспецифический — со стороны медиатора Т-клеток. Секреция последнего начинается после распознавания Т-клетками “несущей” части антигена. 3. Тимуснезависимые антигены, характеризующиеся многократным повторением идентичных антигенных детерминант (эпитопов), способны включать В-клетки и обеспечивать их полноценное развитие до зрелых антителопродуцентов без помощи со стороны Т-хелперов. Для некоторых тимуснезависимых антигенов известно присутствие в структуре молекулы участков с поликлониальной митогенной активностью, что также обеспечивает полноценную активацию В-хелперов
1
Т-амисимый антиген
В-кл.
2
3
Таблица 1.7
Характеристика тимуснезависимых антигенов
Антиген Структура мономера Средняя мол. масса (Да) Среднее число мономерных единиц Число мономеров, достаточное для иммуногенности
Пневмококковый полисахарид (S-111) целлобиуроновая кислота, глюкозо-глюкуроновая кислота 200 тыс. 500 10
Нативный леван (LE) фруктоза 20 млн 111000 55
Липополисахарид (LPS) детерминанта олигосахаридов на боковых цепях основного каркаса 10 млн неизвестно неизвестно
Поливинил-пирро-лидон (FVP) 360 тыс. 3 200 90
Полимеризованный флагеллин (POL) белок 10 млн 300 <1
лем приобретали способность инициировать специфический иммунный ответ в виде синтеза антител. Именно благодаря исследованиям с гаптенами определены достаточно жесткие пределы для проявления антигенной специфичности. В частности, было показано, что незначительные структурные различия между изомерными формами гаптена определяют образование разных по специфичности антител. Кроме того, работы Ландштейнера стали исходными для формирования представлений о таких явлениях, как антигенность и иммуногенность. В основе понятия антигенности лежат структурные, химические особенности веществ, принимающих участие в иммунном процессе. В то же время иммуногенность — функциональная характеристика антигенного материала, которая включает определенные требования как к антигену, так и к иммунизируемому организму. Первое определяющее требование к антигену — это его чужеродность по отношению к реципиенту. Во всех случаях, за исключением аутоиммунных нарушений, антиген должен восприниматься организмом как “не свой”. Однако чужеродность - обязательное, но не единственное условие иммуногенности. Чтобы вызвать иммунный ответ, антигену необходимо обладать достаточной молекулярной массой. Имеется прямая зависимость между этой величиной и силой иммунного ответа. 48
Третьим условием иммуногенности является доступность антигена для ферментативных систем антигенпрезентирующих клеток. Переработка антигена в фаголизосомах до олигопептидов и выход этих фрагментов на клеточную поверхность в комплексе с продуктами МНС в иммуногенной форме создает условия для запуска иммунного процесса.
При наличии всех перечисленных требований к антигену его потенциальная способность к инициации иммунного ответа может остаться нереализованной, если иммунизируемый организм по тем или иным причинам неспособен воспринять чужеродную информацию. Одно из требований к отвечающему организму — это наличие соответствующих генов иммунного ответа (1г-генов). Полиморфизм по Ir-генам определяет неоднозначность ответа различных индивидуумов к одному и тому же антигену. Следует также заметить, что развитие той или иной силы иммунного ответа зависит как от дозы антигена, так и от способа его введения. Низкая доза сильного иммуногена не является гарантом полноценного иммунного ответа даже у тех индивидуумов, которые обладают соответствующим Ir-геном. Способ введения антигена также является ограничивающим фактором для проявления иммуногенности. Так, например, некоторые бактериальные антигены при непосредственном попадании в желудочно-кишечный тракт не способны преодолеть кислотность желудочного сока как естественного барьера. В то же самое время эти же бактерии, введенные непосредственно в кровь, проявляют сильную иммунногенность. Проявление иммуногенных свойств антигена может быть блокировано также врожденным или приобретенным патологическим состоянием самой иммунной системы. Иммунодефицит по тем или иным факторам специфической защиты будет препятствовать проявлению специфических свойств полноценных антигенов.
Общие представления об антигене как иммуногенной молекуле отображены на рис.1.8. В графической форме дан обобщающий, условный образ антигена, не встречающийся в природе. Смысл такой формы — суммировать известные данные об иммунологически значимых детерминантах антигена в едином, удобном для восприятия виде.
Наиболее полно изучены повторяющиеся, разные по специфичности В-клеточные эпитопы (детерминанты). Они локализованы в основном на внешней поверхности молекулы и относятся к так называемому конформационному типу. Помимо “внешних”, доступных для распознавания соответствующими антителами эпитопов, имеются “внутренние”, конформационно недоступные для взаимодействия с антителами. Обычно число аминокислот или сахаров, составляющих В-клеточный эпитоп, равно 6-8 мономерам.
4 Зак. 3701 49
Повторяющиеся» однотипныв ЭПИТОПЫ
je по
|фичности
Мито? учасяп
1И эпитоп
Дгретоп
*
«Часть
Рис. 1.8. Условный образ антигена.
На рисунке представлены детерминанты — участки полипептида, характеризующиеся особенностями включения иммунной системы в работу. Отмечены: (1) разные по специфичности эпитопы (В-клеточные эпитопы), которые инициируют иммунный ответ только при участии Т-хелперов; (2) участки, получившие название “несущей” части, или Т-клеточные эпитопы; (3) в процессе презентации антигена в иммуногенной форме в комплексе с молекулами МНС включены участки ангигена, называемые агретопами; (4) ряд антигенов, имеющих повторяющиеся однотипные эпитопы и митогенные участки, инициируют иммунный ответ без включения в ответ Т-хелперов.
В опытах с комплексным антигеном белок-гаптен, где белок выступал в качестве носителя для гаптена, было показано, что Т-клетки распознают носитель, а В-клетки — гаптен. “Несущая” часть антигена — это другое название Т-клеточного эпитопа. Т-клеточ-ные эпитопы включают большее число аминокислотных остатков по сравнению с В-клеточными эпитопами и относятся к так называемому “линейному” типу, поскольку для его распознавания не требуется сохранения пространственной организации. Помимо детерминант, распознаваемых Т-клеточным рецептором, антигенный фрагмент включает участок, взаимодействующий с продуктами МНС. Этот участок получил название агретоп.
В результате исследований in vivo и in vitro было установлено, что некоторые макромолекулы, в основном полисахариды, способны инициировать иммунный ответ без помощи Т-клеток. Связано это явление с характером строения антигена — наличием в его структуре многократно повторяющихся, однотипных эпитопов. Подобная структурная организация обеспечивает многоточечное взаимодействие с В-клеткой и, как следствие, их активацию без помощи Т-клеток. Кроме того , для многих полисахаридов, в 50
частности для бактериальных липополисахаридов, известна способность к поликлональной активации В-клеток. Подобное свойство позволяет предположить наличие в структуре Т-независимых антигенов митогенных участков.
Представленная схема ясно иллюстрирует функциональную гетерогенность антигенного материала, способность различных эпитопов и участков по-разному включать иммунную систему. Но каким бы способом ни инициировалась иммунореакгивность, главным, определяющим условием остается чужеродность антигена по отношению к иммунизируемому организму. Только в том случае, когда иммунная система распознает антиген как “не свое”, реализуются ее потенциальные возможности.
Глава 2. ИММУНОГЛОБУЛИНЫ: СТРУКТУРА, ФУНКЦИЯ, ГЕНЕТИЧЕСКИЙ КОНТРОЛЬ
Введение
Первое специфическое антитело (или, в современной терминологии, специфический иммуноглобулин) было обнаружено Берингом и Китазато в 1890 г. (см. Введение). При этом о природе обнаруженного столбнячного антитоксина, кроме его специфичности и присутствия в сыворотке иммунного животного, ничего определенного сказать было нельзя. Только с 1937 г. благодаря исследованиям Тизелиуса и Кабата начинается изучение молекулярной природы антител. Авторы, использовав метод электрофореза, продемонстрировали увеличение гамма-глобулиновой фракции сыворотки крови иммунизированных животных. Адсорбция сыворотки антигеном, взятым для иммунизации, снижала количество белка в данной фракции до уровня интактных животных (рис. 2.1).
При анализе структуры и функции иммуноглобулинов следует различать два понятия: гетерогенность и вариабельность. Гетерогенность определяет свойства иммуноглобулинов, обусловленные константной (Q частью молекулы, т.е. теми структурными особенностями, которые позволяют делить всю группу этих белков на классы, подклассы, аллотипы и типы легких цепей. Гетерогенность подразумевает также различия в функциональной активности разных классов иммуноглобулинов за исключением их свойства специфического взаимодействия с антигеном. Вариабельность — это индивидуальная характеристика иммуноглобулинов.
Рис. 2.1. Опыты Тизелиуса Кабэта по обнаружению антител в гамма-глобулиновой фракции сыворотки крови.
При электрофорезе сыворотки крови, полученной от иммунизированных животных, наблюдается значительное увеличение гамма-глобулиновой фракции (сплошная линия). Адсорбция такой сыворотки антигеном, который был использован для иммунизации, снижает содержание белка в этой фракции до уровня, свойственного интактным животным (пунктирная линия)
относящихся к одному и тому же классу или подклассу. Она проявляется в специфической антигенсвязующей активности и обусловлена меняющейся от белка к белку последовательностью аминокислотных остатков в N-конце вой части молекулы. Два свойства иммуноглобулинов — гетерогенность и вариабельность — определяют функциональный дуализм данной группы белковых молекул (рис. 2.2).
Рис. 2.2. Функциональный дуализм иммуноглобулинов.
Каждая иммуноглобулиновая молекула имеет активный (антигенсвязываю-щий) центр (АЦ) и участок, не связанный с основным антигенраспознающим свойством антител, ио выполняющий эффекторные физиологические функции (Э). Две молекулы иммуноглобулина (А( и В]), распознающие тот же самый антиген, могут проявлять разную физиологическую активность. В то же время иммуноглобулины At и Aj, специфичные к разным антигенам, в физиологическом отношении могут быть идентичными
2.1. ОБЩИЙ ПЛАН СТРОЕНИЯ ИММУНОГЛОБУЛИНОВ
У млекопитающих известно пять классов иммуноглобулинов: IgM, IgG, IgA, IgE и IgD, которые имеют общий план строения, но отличаются структурными особенностями тяжелых (Н) цепей.
Первый шаг к пониманию строения иммуноглобулинов был сделан английским исследователем Р.Портером в 1959 г. Он продемонстрировал, что обработка кроличьих антител IgG-класса ферментом папаином расщепляет молекулу на два основных фрагмента с мол. массами 45 кД и 50 кД. Один из этих фрагментом сохранял способность связывать антиген и в силу этого получил название Fab-фрагмента (от англ, “antigen binding”). Второй фрагмент не взаимодействовал с антигеном. Его удалось легко кристаллизовать, что и послужило основанием для его обозначения как Fc-фрагмента (от англ, “ciystallizable”). В количественном отно
шении Fab-фрагментов в два раза больше, чем Fc-фрагментов. Естественно было предположить, что молекула IgG имеет два участка, которые взаимодействуют с антигеном, и один участок — антигенноинертный. Выяснено, что папаин разрушает иммуноглобулин в шарнирной области, выше межцепьевых, дисульфидных связей, что и приводит к образованию двух идентичных и одного отличающегося участков (рис. 2.3.).
Опыты Ниссонова подтвердили это предположение. При работе с пепсином выделен один двухвалентный, антигенсвязываю-щий фрагмент. Часть молекулы IgG, соответствующая Fc-фраг-менту, полностью разрушается. Получение двухвалентного фрагмента иммуноглобулина обеспечено действием пепсина на дистальный конец шарнирной области. В результате N-концевая половина молекулы остается нетронутой. Такой двухвалентный фрагмент обозначают как F(ab)2.
меркаптоэтанол
Рис. 2.3. Определение структуры антител с помощью протеолитических ферментов.
Папаин разрушает молекулу IgG в шарнирной области (незаштрихованная часть рисунка) выше дисульфидных связей. В результате образуется два основных фрагмента с мол. массами 45 и 50 кД. Один из этих фрагментов (Fab) сохраняет способность связывать антиген. Другой С-концевой фрагмент (Fc) не обладает такой способностью. В молярном отношении Fab-фрагментов в два раза больше, чем Fc-фрагментов. При использовании пепсина расщепление молекулы иммуноглобулина происходит в дистальной части шарнирной области, что приводит к получению фрагментов с мол. массой более 90 кД. С-концевая часть молекулы разрушается. Полученный фрагмент способен связывать две молекулы антигена и в силу этого получил обозначение F(ab)2. С помощью меркаптоэтанола, разрушающего дисульфидные (-S-S-) связи, установлено наличие в структуре иммуноглобулинов двух тяжелых (Н) и двух легких (L) цепей. Линии “пунктир” и “пунктир-точка” указывают на места разрыва молекулы
И, наконец, исследования Эдельмана, выполненные с использованием меркаптоэтанола и ряда других соединений, которые разрушают межцепьевые -S-S- связи, показали наличие в молекуле иммуноглобулина двух тяжелых (Н) цепей с мол. массой каждой из них около 50 кД и двух легких (L) с мол. массой 25 кД.
Для получения информации о строении и молекулярных основах специфичности антител необходимо было иметь значительное количество полностью идентичных иммуноглобулинов. Исследования с сывороточными антителами от нормальных доноров не давали такой возможности, так как подобные антитела, являясь производными нескольких клеточных клонов, могли варьировать по тонкой специфичности антигенсвязывающего центра и, кроме того, относиться к различным классам иммуноглобулинов. Необходима была экспериментальная модель, позволяющая работать с иммуноглобулинами, продуцируемыми одним клоном клеток и в силу этого представляющими собой полностью идентичные молекулы. Такой моделью являются злокачественно трансформированные плазматические клетки больных миеломой. Больные данной формой рака имеют около 95% иммуноглобулинов сыворотки крови, относящихся к одному клону — потомству одной исходной клетки. К клональным белкам относятся и белки Бенс-Джонса, названные по имени первооткрывателя. Эти белки представляют собой димеры легких цепей иммуноглобулинов (L-L-цепи). Они обнаруживаются в большом количестве в моче больных миеломой и также являются удобным объектом для секвенирования. У мышей можно индуцировать миелому минеральными маслами. Существует большой набор клонированных плазмоцитом, продуцирующих соответствующие миеломные белки — иммуноглобулины. Эти линии клеток получили название MOPC’s (от англ, “mineral oil induction plasmacytome cells”).
Изучение полной аминокислотной последовательности различных миеломных белков выявило принципиальные особенности в строении иммуноглобулинов. Иммуноглобулины разных классов характеризуются общим планом строения. На рис. 2.4 представлена схема организации IgG. Этот иммуноглобулин содержит две тяжелые (Н) цепи и две легкие (L) цепи, которые объединены в четырехцепочечную молекулу посредством ковалентных, межцепъевых, дисульфидных связей (-S-S-). Каждая цепь включает вариабельную область (соответственно VL и VH для V- и Н-цепей), от которой зависит специфичность иммуноглобулинов как антител, и константную (С), подразделяющуюся на гомологичные :~гастки; Сн1, Сн2, Сн3. L-цепь имеет один константный участок (С^. Между СН1 и Сн2 расположена так называемая шарнирная область, обогащенная пролиновыми остатками. Повышенное
Рис. 2.4. Структура IgG.
Иммуноглобулин G содержит две тяжелые (И) цепи с мол. массой 50 кД и две легкие (L) с мол. массой 25 кД, которые объединены в единую молекулу с помощью ковалентных дисульфидных связей -S-S-. Каждая цепь содержит вариабельную область (VL и VH для L- и Н-цепей соответственно) и константную (С) область, подразделяющуюся у Н-цепей на гомологичные участки (домены): Сн1, Сн2, Сн3. L-цепь имеет один константный участок — CL. От взаимодействия VH- и Уь-областей зависит специфичность иммуноглобулинов как антител. В аминокислотной последовательности V-доменов имеются положения, характеризующиеся частой заменой аминокислот от белка к белку (гипервариабельные участки) и более консервативные положения. Между Сн1- и Сн2-доменами Н-цепи находится шарнирная область, от которой зависит подвижность Fab-фрагмента. Сд2-до-мен является местом присоединения углеводов и связывания комплемента. Сн3-домен взаимодействует с Fc-рецептором на поверхности клеток, принимающих участие в иммунологических реакциях
содержание пролина в данной области обеспечивает конформационную гибкость молекулы, что необходимо для лучшего взаимодействия с антигенными детерминантами, более выраженными на поверхности клеток.
Впервые в 1969 г., еще до получения рентгеноструктурных данных, Дж. Эдельман предположил, что каждый гомологичный участок организован в замкнутую сферу — домев, за счет внутри-цепьевых дисульфидных связей, образующихся полуцистеиновыми остатками. Дисульфидная связь замыкает в петлю около 60 аминокислот. Приблизительно по 20 аминокислот, не входящих в замкнутую часть участка, служат для взаимодействия с соседними доменами (рис. 2.5). Рентгеноструктурный анализ подтвердил общий 56
Рис. 2.5. Принцип доменной организации иммуноглобулинов.
Представлена схема доменной организации IgG. Каждый домен включает приблизительно 100-110 аминокислотных остатков. Около 60 остатков оказываются заключенными в петлю дисульфидной -S-S- связью. По 20 аминокислотных остатков, не входящих в замкнутую часть домена, служат для соединения с соседними доменами. Цифры обозначают последовательность аминокислотных остатков в полипептидах
принцип доменной организации полипептидных цепей иммуноглобулинов и вскрыл ряд тонких деталей строения. На рис. 2.6 представлено схематическое изображение пространственной организации V- и С-доменов легкой цепи. Домен состоит из двух слоев с Р-складчатой структурой, один из которых построен из четырех
96
ct 15 vt
Рис. 2.6. Структурная организация легкой цепи (VL- и CL- доменов).
Организация доменов воспроизведена на основании данных по рентгеноструктурному анализу. Стрелки показывают участки с антипараллельной бета-струк-турной трехсегментного (заштрихован) и четырехсегментного (незаштрихован) слоев. Цифрами обозначены положения аминокислотных остатков. Черные линии — дисульфидные соединения
антипараллельных сегментов, а второй — из трех сегментов. Слои ковалентно связаны дисульфидным мостиком примерно в середине домена. Общая пространственная организация IgG человека представлена на рис. 2.7. Видно, что тяжелые и легкие цепи, взаимодействуя друг с другом, образуют плотно упакованную структуру с тремя частями: два Fab-фрагмента и один Fc-фрагмент.
Рис. 2.7. Трехмерная структура IgG человека.
Светлое и темно-серое изображение обозначают тяжелые цепи; светло-серое — легкие цепи; черное — углеводы
2.2. ВАРИАБЕЛЬНОСТЬ ИММУНОГЛОБУЛИНОВ
Антигенсвязывающий участок, или активный центр антител, формируется при взаимодействии VH- и Уь-доменов. Изменения в последовательности аминокислотных остатков этих доменов от белка к белку определяют собственно меняющуюся специфичность антител.
2.2.1. Классификация V-доменов иммуноглобулинов
Все V-домены делятся на три основные труппы: V -, Vx— для легких цепей х- и Х-типов соответственно, и VH — для тяжелых цепей (рис. 2.8). Каждая труппа включает в свою очередь несколько подтрупп: V*— три, V^—пять и VH — четыре. Белки одной подтруппы имеют около 75% идентичных остатков, тогда как белки разных подгрупп идентичны только в 50% положений. Для при-
Индивидуальные V-домены
Рис. 2.8. Классификация V-доменов иммуноглобулинов.
А — V-домены, относящиеся к одной из трех групп V, Vx или VH. Б — подгруппы, входящие в состав одной из групп; V-домены одной подгруппы достаточно сходны между собой; их различия по аминокислотному составу в идентичных положениях не превышают индивидуальных V-доменов, число которых в той или иной подгруппе неизвестно
мера сравните последовательности паервых двадцати пяти N-koh-цевых аминокислотных остатков V%-доменов, представленных на рис. 2.9. Подгруппа состоит из определенного числа индивидуальных V-доменов. Число индивидуальных вариантов для всех четырех подгрупп VH — более 96 000, для Vx— более 1 200 (расчет см. ниже в этой главе).
2.2.2. Гипервариабельные и каркасные участки
В общей линейной последовательности аминокислотных остатков V-доменов имеются положения консервативные, где замены одних аминокислот на другие незначительны или даже отсутствуют, и положения с частыми заменами. Эти последние получили название гиперварнабельных участков. Так, например, в VH-домене человека гипервариабельные участки составлены аминокислотными остатками в положениях 31-37, 51-68, 84-91 и 101-110 (рис.2.10). By и Кабат в 1970 г. предложили способ расчета уровня вариабельности в отдельных аминокислотных положениях по формуле: V-n/f где V — показатель вариабельности, п — число всех аминокислотных остатков, которые обнаружены в данном положении при анализе всех изученных белков, f — частота наиболее
s
10
15
20
25
A. vKi Asp lie Gin Met Thr Gin Ser Pro Ser Thr Leu Ser Ala Ser Vai Gly Asp Arg Vai Thr lie Thr Cys Arg Ala
Vkh Vai Leu________________________________Leu Ser______Pro Vai Thr Pro______Glu Pro Ala Ser Ser Ser
Vkii Glu Vai Leu Gly Leu Pro Glu Ala Leu Ser
5
20
Б. Ag Asp lie Gin Met Thr Gin Ser Pro Ser Ser Leu Ser Ala Ser Vai Gly Asp Arg Vai Thr He Thr Cys Gin Ala Roy _________________________________________________________________________________________
Au ______________________________________________________________________________________
Bel ____________Leu______________________________________________________________________
Gal _________________________________________________________________________He____Arg___
Kue Thr Gin Pro____________________________________________________________________Arg___
Hau Aro___
Ou ________________________________________________________________________________Arg___
Dau __________________________________________Thr Vai______________________________Aso
Eu Thr Arc
Рис. 2.9. Последовательность N-концевых аминокислотных остатков g-цепей человека.
А — последовательность первых 25 аминокислотных остатков g-цепей, принадлежащих трем основным Vg-подгруппам. Б — аминокислотная последовательность g-цепей, принадлежащих одной Vgl-подгруппе. Линия указывает н идентичность аминокислотных остатков, соответствующую верхней, включающей полную последовательность, цепи. Приведены лишь остатки, отличающиес от последовательности первого, верхнего белка.
Положение в цепи
Рис. 2.10. Гипервариабельные положения V-домена тяжелой цепи человека.
Вариабельность рассчитана по методу By и Кабата (см. текст)
часто встречающего в данном положении аминокислотного остатка. By и Кабат в качестве примера приводят следующий расчет. В положении 7 леткой цепи из 63 изученных иммуноглобулинов в 41 случае представлен серин. Кроме того, в этом же положении обнаруживаются пролин, треонин и аспарагиновая кислота — всего 4
аминокислоты. Частота встречаемости (J) серина будет 41:63=0,65. Из этого следует, что величина вариабельности в положении 7 равна 4:0,65=6,15. Из предложенной формулы для инвариантного положения И=1. В то же время теоретически возможный верхний предел вариабельности для 20 аминокислот с одинаковой частотой встречаемости 1/20 составит 20:1/20=400.
Количество гипервариабельных положений по отношению к количеству относительно инвариантных положений незначительно и составляет всего 15-20% от общего числа аминокислотных остатков V-домена. Молекулярный консерватизм инвариантных положений иллюстрируют сравнительные данные по гомологии иммуноглобулиновых доменов акул и млекопитающих. Гомология между Уь-доменами двух видов акул — тигровой и галапагосской — очень высока и составляет 75% идентичных положений. Степень гомологии VL этих видов акул с VL человека и собаки, учитывая филогенетический разрыв между ними, также значительна: около 55%. В то же время число совпадающих положений между константными участками легких цепей (CrJ) акул, с одной стороны, и человека, мыши и кролика — с другой, всего 20%. Эти факты указывают на то, что V-домены более консервативны в эволюции позвоночных животных, чем С-домены, и эта консервативность связана с инвариантными (каркасными) участками.
2.2.3. Пространственная организация антигенсвязывающего участка
С помощью метода рентгеноструктурного анализа кристаллизованных белков выяснена “морфология” V-доменов. На рис. 2.11. показана пространственная организация V-домена тяжелой цепи IgG человека (миеломного белка New). Упаковка в глобулу полипептида, составляющего V-домен, происходит так, что гипервариабельные участки оказываются в непосредственной близости друг от друга со стороны “внешнего” КН2-конца. Каркасные (инвариантные) участки содержат последовательности , вступающие в контактное взаимодействие с Уь-доменом при образовании анти-генсвязующей области иммуноглобулина. Взаимодействующие VH и VL формируют полость — месторасположение антигена (рис. 2.12). Способность миеломного белка New образовывать комплекс с витамином KjOH позволила рассчитать размеры антигенсвязыва-ющей полости для конкретного гаптенного антигена. Глубина такой полости — 0,5-0,6 нм, длина — 1,6 нм, ширина — 0,7 нм. В большинстве других случаев размеры полости составляют: длина — 2,5-3,6 нм, ширина -1,0-1,7 нм, глубина — 0,6-0,7 нм.
Рис. 2.11. Пространственное объединение гипервариабельных участков V-домена тяжелой цепи IgG человека (миеломного белка New).
Конформационная особенность V-домена состоит в том, что все гипервариабельные участки в результате формирования третичной структуры оказываются в непосредственной близости друг от друга (черные участки рисунка). Каркасные (инвариантные) участки взаимодействуют с соответствующими участками VL-домена при формировании антигенсвязывающего центра (заштрихованные участки рисунка)
Рис. 2.12. Пример взаимодействия аитиген-связывающей области (активного центра) иммуноглобулина с антигеном — витамином KjOH.
Реконструкция на основании д анных рентгеноструктурного анализа. V-домены легкой и тяжелой цепей (VL и VH) образуют полость глубиной 0,5-0,6 нм, длиной — 1,6 нм и шириной — 0,7 нм. С этой полостью специфически комп-лексируется витамин. Как правило, параметры полости других иммуноглобулинов больше отмеченных здесь величин
13. ГЕТЕРОГЕННОСТЬ ИММУНОГЛОБУЛИНОВ
Принадлежность иммуноглобулинов к тому или иному классу и подклассу зависит от характерных особенностей строения константной (С) области Н-цепи (количества и последовательности аминокислотных остатков, молекулярной массы, количества доменов и межцепьевых дисульфидных мостиков, связывания олигосахаридов и др. свойств). Классы и подклассы иммуноглобули-
нов с обозначением тяжелых и легких цепей, а также ряда их биологических свойств, представлены на рис. 2.13. и в табл. 2.1.
Классы и подклассы
Типы цепей Н L
Y1 ХЛ
lgG2
хЛ
1дА1
IgA 2 igD
«1
«2 ст
хЛ хЛ хЛ хЛ хЛ
1дМ
хЛ
хЛ
Рис. 2.13. Классы и подшассы иммуноглобулинов человека.
Принадлежность иммуноглобулина к тому или иному класу и подклассу зависит от характерных особенностей строения тяжелых (Н) цепей (количества и последовательности аминокислотных остатков, молекулярной массы, количества доменов, межцепьевых дисульфидных мостиков, связывания углеводов и др.). Легкие цепи имеют только два типа — % и X.
Тяжелые цепи независимо от принадлежности к тому или иному классу или подклассу образуют комплекс либо Х-, либо с %-типом. У IgA2 легкие цепи не вступают в ковалентную -S-S- связь с тяжелыми цепями, но имеют ее между собой
Таблица 2.1
Основные фвзвко-хпмпческве и биологические свойства иммуноглобулинов человека.
Свойство IgM IgG IgA IgD IgE
Молекулярная форма Обозначения: пентамер мономер мономер, димер и т.д. мономер мономер
Н-цепн Ц Y а 8 S
L-цепи X или X X или X X или X X или X X или X
Молекулярная фор- <Х2Иа)з X2Y2 (хгаг)п X2»2 Х2В2
мула <*-2М2)з *-2Y2 (>-2“2)О Х262 Х2в2
Дополнительные цепи J-цепь J-цепь, секреторный компонент
Подклассы — IgG 1, IgG2, IgG3, IgG 4 IgA 1, IgA2 — —
Подклассы Н-цепей — Yl, Y2, y3, Y4 al, а.2 — —
Аллотипы Н-цепей Мт (2) Gm (ok. 20) Am (2) — —
Количество доменов Н-цепи 5 4 4 4 5
Молекулярная масса 950 000 150 000 160 000 175 000 190 000
Валентность антител 5 илиЮ 2 2 ? ?
Коэффициент седиментации (S) 19S 6,6S 7S, 9S, US, 14S 7S 8S
Содержание углеводов (%) 10 3 7 9 13
Концентрация в сыворотке (мг/100 мл) 125±5О 12501 300 210150 4 0,03
Процент от общего количества 5-10 75-85 7-15 0,3 0,003
Период полураспада (дни) 5,1 23 5,8 2,8 2,5
Скорость синтеза (мг/кг в день) 6,7 33 24 0,4 0,016
Парапротеинемия макроглобу-лннемия миелома миелома миелома миелома
Агглютинирующая активность 100 1 — — —
Фиксация комплемента + + (IgG I, 2,3) — — —
Активация комплемента (альтернативный путь) Цнтофильность к: + (IgG 4) + (feAU) +
макрофагам, — + — — —
лимфоцитам, • — + — — +
К-клеткам, + + — — —.
нейтрофилам — + + — —
моноцитам — + — — —
тучным клеткам — + — — +
Другие биологиче- первичный вторичный характер- основная гомоцн-
ские свойства иммунный ответ; ревматоидный фактор иммунный ответ; перенос через плаценту ные антитела в секретах молекула поверхности лимфоцитов тотроп-ные антитела; анафилаксия; аллергия
2.3.1. Иммуноглобулин М (IgM)
Из всех иммуноглобулинов IgM организован наиболее сложно и имеет наибольшую мол. массу: 950 кД. Он состоит из пяти мономеров, каждый из которых включает две тяжелые цепи (ц-цепи) и две легкие цепи (%- или л-типов). Мономеры объединены в единую пентамерную молекулу дисульфидными связями (-S-S-) и J-цепью. Пять мономерных субъединиц расположены радиально. При этом Fc-фрагменты направлены в центр круга, а Fab-фрагменты — кнаружи (рис. 2.14). В состав ц-цепи входит четыре С-домена (Ср.1, Сц2, Ср.3 и Ср.4), но при этом в структуре тяжелой цепи отсутствует шарнирный участок. В какой-то степени его функцию выполняет Сц2-домен, имеющий остатки пролина. Предполагается, что именно этот домен явился эволюционным предшественником шарнирной области у- и a-цепей IgG и IgA соответственно.
Реконструкция IgM, по данным рентгеноструктурного анализа (рис. 2.14), демонстрирует гибкость Fab-фрагмента за счет остатков пролина Сц2, что позволяет “находить” соответствующие антигенные детерминанты на поверхности антигенпредстав-ляющей клетки.
Предпоследний остаток цистеина в хвостовом С-концевом отрезке, содержащем 18 аминокислотных остатков, очевидно, необходим для полимеризации мономеров в пентамер с помощью J-цепи.
Каждая ц-цепь имеет по пять олигосахаридов; один — в Сц1, три — в СцЗ и один — в хвостовой части.
Помимо пентамерной, свободной формы IgM имеется мономерная форма этого иммуноглобулина, которая представлена на поверхности В-клеток и выполняет функцию антигенраспоз-нающего рецептора. Отличие мономера, ассоциированного с мембраной, от пентамера состоит в количестве аминокислотных остатков в хвостовой части тяжелой цепи. В отличие от пентамерной формы тяжелая цепь мономера включает 41 аминокислотный остаток в хвостовой части. Из них 25 гидрофобных аминокислотных остатков принадлежат трансмембранному отрезку.
В процессе гуморального иммунного ответа наиболее ранние антитела относятся к IgM-классу. Они же первыми появляются в онто- и филогенезе. Наибольшую активность IgM проявляет в антибактериальном иммунитете и при некоторых аутоиммунных заболеваниях.
2.3.2. Иммуноглобулин G (IgG)
Сре ди всех классов иммуноглобулинов в количественном отношении доминирует IgG. В сыворотке млекопитающих он состав-
> 1ак. 3701
65
Рис. 2.14. Структура IgM.
А. Иммуноглобулин М состоит из пяти мономеров, каждый из которых включает четыре полипептидные цепи (две Н-цепи и две L-цепи). Мономеры объединены в единую пентамерную молекулу дисульфидными -S-S- связями и 1-цепью. Пунктир означает дисульфидные связи. Б, В. Модель IgM, построенная на основании данных рентгеноструктурного анализа. Видна гибкость Fab-фрагментов, позволяющая им “находить” соответствующие пространственно удаленные антигенные детерминанты
ляет около 75% от общего количества этих белков. Отдельная молекула включает две тяжелые у-цепи и две легкие: %- или л-типов. Молекулярная масса IgG равна приблизительно 150 кД. У человека и мыши описаны по четыре подкласса IgG, которые впервые были обнаружены серологическими методами. Тяжелые цепи этих
подклассов обозначаются как yl, у2, уЗ и у4. Порядковый номер указывает на количественное содержание каждого подкласса в сыворотке: в наибольшем количестве представлен IgGyl, в наименьшем — IgGy4. Степень гомологии между разными подклассами человека высока и составляет 90-95%. Различия связаны в основном с шарнирной областью, хотя в С-доменах также встречаются отдельные аминокислотные замены.
Шарнирная область характеризуется значительным числом остатков пролина и цистеина, что определяет ее гибкость. Количество дисульфидных связей этой части молекулы варьирует от одного подкласса к другому. Так, в yl- и у4-цепях таких связей две, в у2-цепях — четыре, а в уЗ-цепях — одиннадцать. Именно эти -S-S-связи обеспечивают взаимодействие двух тяжелых цепей. В yl-цепи шарнирная область начинается с 216-го остатка и заканчивается 231-м. В то же время шарнирная область уЗ-цепи на 47 остатков больше по сравнению с yl. Изучение аминокислотной последовательности позволяет предположить, что это увеличение остатков связано с тандемной дупликацией участка 216-231 yl-цепи. Существенной особенностью шарнирной области является возникающая в результате взаимодействия двух тяжелых цепей жесткая, циклическая октапептидная структура:
-Cys-Pro-Pro-Cp--Cys-Pro-Pro-Cys-
Она служит осью вращения всей гибкой шарнирной области, а следовательно и Fab-фрагментов, что необходимо, вероятно, для взаимодействия с антигеном.
Гомология между у-цепями мыши, относящимися, как и у человека, к четырем подклассам, меньше и составляет 60-70%.
Биологическая роль IgG разнообразна. Это — и антибактериальная защита через механизм комплементзависимого лизиса микробной клетки, и проникновение через плаценту с той же защитной для развивающегося зародыша функцией, и “армирование” макрофагов (цитофильность к макрофагам), в результате чего они становятся цитотоксическими для трансплантатов и опухолей, и участие в повышенной реактивности аллергического типа.
2.3.3. Иммуноглобулин A (IgA)
Доминирующим иммуноглобулином секретов желез организма (слюны, пищеварительного сока, выделений слизистой носа и молочной железы) является IgA. В сыворотке крови его содержание незначительно и составляет всего 10-15% от общего количества всех иммуноглобулинов. Мономерная форма IgA построена по классическому типу. Тяжелая цепь включает V-область, три
домена С-области и шарнирный участок. У человека известно два подкласса этого иммуноглобулина: IgAl и IgA2. Соответствующее обозначение тяжелых цепей: al и а2. Без учета шарнирного участка степень гомологии между al и а2 очень высока и составляет около 95%. Кроме того, подкласс IgA2 имеет два аллельных варианта — аллотипы А2ш(1) и А2т(2).
За исключением шарнирного участка различия между подклассами IgAl и IgA2 касаются 14 положений аминокислотных остатков в С-областях тяжелых цепей. При этом различия между аллотипами А2т(1) и А2т(2) в этих положениях отсутствуют, но они представлены в других участках тяжелых цепей, вблизи шарнирного участка. Именно эти положения определяют серологически выявляемые различия между аллотипами.
Шарнирные области al- и а2-цепей значительно отличаются друг от друга. al-Цепь имеет в этом месте на 13 аминокислотных остатков больше, чем а2-цепь. При этом последовательности 224-239 al-цепи возникли в результате тандемной дубликации в той части генома, которая контролирует всего восемь аминокислотных остатков (рис. 2.15). Дубликация столь незначительного отрезка ДНК — явление крайне редкое. Однако особенность этого участка шарнира в другом. В слюне и содержимом толстого кишечника человека представлены протеолитические ферменты, способные расщеплять IgAl именно в дублированной части цепи. Подобной же активностью обладают протеолитические ферменты некоторых бактерий, таких как Streptococcus sanguis, Neisseria gonorrhea, Nmeningitidis. В то же время деления 13 аминокислот у IgA2 в данном месте шарнира обеспечивает устойчивость этого подкласса IgA по отношению к бактериальному протеолизу (рис. 2.15). Вероятно, IgA2 эволюционно возник в результате способности избегать бактериального ферментативного разрушения. Благоприобре-тенность подобного признака кажется очевидной. На рис. 2.16 указаны домены, с которыми связаны изо- и аллотипические характеристики.
Структурными особенностями IgA являются наличие в молекуле J-цепи и секреторного компонента (рис. 2.17). J-Цепь, как и у IgM, служит для полимеризации молекулы. Молекулярная масса цепи незначительна и составляет около 15 кД. Данный полипептид не имеет гомологии с иммуноглобулинами, а кодирующий его ген локализован в хромосоме, не содержащей генов иммуноглобулинов. На заключительном этапе синтеза J-цепь взаимодействует с СООН-концевым участком тяжелой цепи через дисульфидные связи. В результате образуются полимерные формы IgA, представляющие собой в основном димеры, хотя в незначительном количестве имеются и мультимерные молекулы, включающие три и более мономера.
В.Шаршриая
Б.тарифная облапь
Lg А1: -Cya-Pro-VaM1ro-Ser-|Br-Pro-Prc>Ttr-Pro-Sw-Pro-Se<|-[W-Pro-Pf<>-Thr-Pro-Sar-Pro-S«|-Cys-HI»-Prc>-An|-
Lg А2: -Cys-Pro-VaPPro-Pro-Pro-Pro-Pro-.........-...............................Cya-Cys-His-Pro-Arg-
Ч---------------------,--------------------/
Далеция участив цата
Рис. 2.15. Шарнирные области IgAl и IgA2 человека.
А — схема IgA человека с указанием шарнирного участка. Б — последовательность аминокислотных остатков шарнирного участка IgAl. Дуплицированные участки заключены в прямоугольник. Стрелками показаны связи Pro-Thy, которые расщепляются ферментами бактерий Streptococcus sangius (S) и Neisseria gonotritea (G). В — последовательность аминокислотных остатков шарнирной области IgA2. Показана деления части последовательностей аминокислотных остатков, соответствующих участку IgAl, который подвержен протеолитическому расщеплению ферментами бактерий. Отсутствие этой части шарнира у IgA2 объясняет резистентность данного подкласса иммуноглобулина к действию бактериальных ферментов
Для IgA, представленного в секретах, характерно наличие секреторного компонента. Он состоит из нескольких родственных в антигенном отношении полипептидов и экспрессируется на поверхности эпителиальных клеток. При специфическом взаимодействии димера (IgA)2-J с секреторным компонентом на клеточной поверхности образуется комплекс, который после эндоцитоза перемещается в цитоплазме к апикальной части клетки. Здесь комплекс подвергается действию протеолитических ферментов, что позволяет ему высвобождаться в секреты субэпителиального пространства (рис. 2.18).
Функционально IgA выступает в качестве первой линии защиты на слизистых поверхностях, препятствуя проникновению вирусов в организм. Хотя IgA не связывает комплемент и в силу этого не обладает бактерицидной активностью, он играет важную роль в нейтрализации бактериальных токсинов. Кроме того, у млекопитающих, включая человека, секреторный IgA хорошо представлен в молозиве и обеспечивает таким образом специфический иммунитет новорожденных.
2.3.4. Иммуноглобулин Е (IgE)
Содержание IgE в сыворотке крайне мало, хотя удельный вес этих иммуноглобулинов в аллергических реакциях является доминирующим.
1дА1
lgA2m(1)
lgA2m(2)
Рис. 2.16. Общая сравнительная характеристика подклассов иммуноглобулина А.
Наиболее характерное отличие между подклассами IgA связано с шарнирной областью - дедецией части аминокислотных остатков у IgA2. В свою очередь подкласс Ig2A имеет аллотипические варианты, обусловленные заменой аминокислот в Ся1-домене
----дисульфидные связи J - соединяющая цепь СК - секреторный компонент
Рис. 2.17. Строение секреторного иммуноглобулина А.
Общий план строения IgA соответствует другим иммуноглобулинам. Димерная форма образуется посредством ковалентной связи между J-цепью (J) и аминокислотами С-конца тяжелой цепи. В процессе транспорта IgA через эпителиальные клетки к молекуле присоединяется секреторный компонент (СК), защищающий иммуноглобулин от действия протеолитических внутриклеточных ферментов
Рис. 2.18. Транспорт иммуноглобулина А в секреторную жижость.
Из основной циркуляции IgA проникает в эпителиальные клетки, взаимодействуя с секреторным компонентом, который на этом этапе транспорта выполняет функцию рецептора. В самой эпителиальной клетке секреторный компонент защищает IgA от действия протеолитических ферментов. Достигнув апикальной поверхности клетки, комплекс IgArceKperopHbrii компонент выходит в секрет субэпителиального пространства
IgE представляет собой мономер с мол. массой около 190 кД, включающий две тяжелые цепи (е-цепи) и две легкие (х- или X-типов). g-Цепь, как и m-цепь, содержит пять доменов: один Ve- и четыре СЕ-домена.
Функциональная активность IgE проявляется в развитии аллергических реакций. Данный иммуноглобулин способен взаимодействовать с тучными клетками и базофилами посредством Fc-области и соответствующего рецептора на этих клетках. После связи IgE с антигеном (аллергеном) тучные клетки получают сигнал к секреции вазоактивных аминов и других фармакологически значимых соединений, что собственно и приводит к развитию аллергической реакции.
2.3.5. Иммуноглобулин D (IgD)
Иммуноглобулин D был открыт как необычный миеломный белок. Затем его обнаружили в сыворотке крови в очень небольшом количестве. У человека 5-цепь включает три С-домена в отличие от IgD мышей, содержащего только два С-домена: С81 и С83. Приводит ли делеция домена С82 к изменению функции IgD мыши, неизвестно. Данный иммуноглобулин совместно с мономерным IgM экспрессируется на поверхности В-клеток. Вопрос о форме участия IgD в иммунных процессах остается открытым.
«
2.4. ГЕНЫ ИММУНОГЛОБУЛИНОВ
На основании данных о двойственности в строении иммуноглобулинов — наличии вариабельной и константной областей в структуре молекулы — Дрейер и Беннет еще в 1965 г. высказали предположение об участии двух генов (V и С) в построении единой тяжелой или легкой цепей молекулы. “Еретическое” для середины 60-х годов суждение, когда господствовало мнение, выражающееся формулой “один ген — одна полипептидная цепь”, нашло свое подтверждение в несколько усложненном виде в настоящее время.
Для млекопитающих известны три группы сцепления иммуноглобулиновых генов, расположенных на разных хромосомах: группы сцепления для х- и Х-типов легких цепей и группа сцепления для тяжелых цепей (рис. 2.19).
В незрелых В-клетках или в любых других клетках V-гены и С-гены той или иной группы сцепления, находясь на одной и той же хромосоме, удалены друг от друга на значительное расстояние. Подобная нативная локализация генов для иммуноглобулинов определяется как состояние зародышевой линии (англ, “germline”). Однако по мере созревания В-клеток от некоммитированных предшественников к зрелым формам происходит реорганизация гено-72
Гены подгрупп V-областей
Гены С-областей
Рис. 2.19.Группы сцеплешш генов иммуноглобулинов.
Представлены три труппы сцепления для двух легких цепей X- и %-типов и для тяжелых цепей иммуноглобулинов. В каждом конкретном случае один из V-генов той или иной группы вступает во взаимодействие с С-геном той же группы, что реализуется в синтезе иммуноглобулинов определенной специфичности. Выявление групп сцепления составляет фактологическую основу концепции “два гена — одна полипептидная цепь”
ма, так что пространственно удаленные генные сегменты оказываются в непосредственной близости друг от друга, образуя единый информационный участок. Этот процесс перестройки генетического материала получил название соматической рекомбинации. Он связан только с соматическими клетками (в случае с иммуноглобулиновыми генами — только с В-клетками), не наследуется и, следовательно, не затрагивает половые клетки.
2.4.1. Рекомбинация генов, кодирующих легкие и тяжелые цепи иммуноглобулинов
Участок ДНК в некоммитированной клетке, ответственный за синтез легкой цепи х-типа, включает три группы генов (рис. 2.20):
1) 250 Ух-генов, каждый из которых кодирует 94-95 аминокислотных остатков Ух-домена;
2) 5 J-мини-генов (от англ, “joining”), один из которых функционально неактивен и называется в силу этого псевдогеном. Каждый из работающих J-генов кодирует последовательность из 12-14 аминокислотных остатков и тем самым обеспечивает достройку V-гена до того количества нуклеотидных остатков, которое контролирует синтез полноценного Ух-домена;
3) С^-ген кодирует константный регион легкой х-цепи.
Процесс рекомбинации начинается с объединения одного из Ух-генов с одним из J-мини-генов (рис. 2.20). Объединение этих сегментов ДНК происходит за счет делеции (удаления) последовательности пар нуклеотидов, входящих в некодирующую (интронную) последовательность между V и J. Место рекомбинации V-J не является жестко фиксированным. В процессе рекомбинации объединение может происходить как между собственно основаниями V и J, так и между основаниями, соседствующими с этими сегментами. Подобные “ошибки” вносят дополнительную изменчивость в 3-й гипервариабельный участок V-домена.
Прошедшая первичная рекомбинация формирует х-локус, который состоит из трех экзонов (кодирующих участков): L- сегмента, кодирующего лидерный пептид, — участка незрелой х-цепи с 20-25 аминокислотными остатками; рекомбинантного V-J-гена и С-гена константной области.
Такая рекомбинантная ДНК в коммитированных клетках обеспечивает образование первичного транскрипта — пре-мРНК ядра. В результате процессинга (созревания пре-мРНК ядра) некодиру-емые участки между J и С, а также между L и V вырезаются. Таким образом, зрелая, связанная с полирибосомами РНК лишена некодирующих последовательностей. При этом все кодирующие последовательности оказываются слитыми в единый информационный участок. Зрелая мРНК транслирует полипептид с дополнительным лидерным участком (L) аминокислотных остатков. Предполагается, что лидерный участок, включающий в основном гидрофобные аминокислоты, способствует прохождению х-цепи через мембрану эндоплазматического ретикулума. После прохождения он отщепляется, и зрелая х-цепь приобретает, наконец, тот аминокислотный состав, который характерен для секретируемого иммуноглобулина.
Гены, кодирующие легкие цепи Х-типа, организованы несколько иначе (рис.2.21). Для данного типа легких цепей известны два локуса, каждый из которых содержит один V-ген и по два J- и С-гена. Однако Jx4 и С>4 функционально неактивны. Несмотря на различия в хромосомной организации между генами х- и Х-це-пей, сам процесс реорганизации Х-генов внутри локуса идентичен процессу, известному для х-генов.
L VX1 L Vx2 L Vx3
L Vx250
J1 J2J3J4J5
Cx
клетке
L Vx1 L Vx2J4J5 Cx
x-локус
L Vx1 L Vx2 J4 J6 Cx
——ШИШИ—
Сплайсинг-1
LVx2J4 Cx i mm
Трансляция
LVx2J4 Cx
ГИИИИ
Исключение лидера
шиш
пре-м PHK
м-РНК
Первичная х-цаль
X - цель секретируемого 1g
Рис. 2.20. Рекомбинация ram, кодирующих %-цепь иммуноглобулине».
В некоммитированной В-клетке гены, кодирующие %-цепь иммуноглобулинов, отдалены друг от друга в ДНК на значительное расстояние. Процесс рекомбинации начинается с объединения одного из V-генов — (Vx2) с одним из J-мини-генов — (J4). В результате формируется %-локус, контролирующий незрелую пре-мРНК ядра. При созревании такой РНК происходит слияние (сплайсинг) VJ с Сх-геном за счет делеции декодируемой последовательности нуклеотидов. Зрелая мРНК представляет собой единый информационный участок (LV^-MCj), транслирующий первичную %-цепь. При созревании х-иепи лидерная последовательность аминокислотных остатков (L) удаляется, что и приводит, наконец, к формированию полноценной х-непи
Общая схема реорганизации генов для тяжелых цепей иммуноглобулинов та же, что и для легких цепей %-типа, однако имеются и специфические особенности (рис. 2.22). В отличие от генетического контроля V-доменов легких цепей, V-домены тяжелых цепей кодируются тремя генными сегментами: V, D и J. Кроме того, в отличие от генов легких %-цепей, включающих только один С-ген константной области, у человека таких генов десять, у мы-
г
Локус 2
Рис. 2.21. Геномная организация генов, кодирующих Х-цепь иммуноглобулинов.
Варианты 1-цепей кодируются двумя локусами, каждый из которых включает один V^-ген, два J-мини-гена и два Сх-гена. В локусе 1 пара Jx и Сх — некодирующие участки хромосомы (псевдогены). Возможные варианты при рекомбинации: V.2J.2C.2, V,1JX3C,3, V.1J.1C.1 Л Л Л Л Л Л Л А А
шей восемь. Они ответственны за кодирование классов и подклассов иммуноглобулинов.
При образовании участка генома, кодирующего V-домен тяжелых цепей, происходят два рекомбинационных события. Первое — это объединение D- и J-сегментов (мини-генов) и второе — объединение DJ-участка с V-геном. На начальном этапе дифференцировки В-клеток VDJ-ген сливается с геном, контролирующим константную область IgM (Сц). По мере функционального созревания В-клеток наблюдается переключение синтеза IgM на иммуноглобулины других классов и подклассов при сохранении исходной специфичности V-домена, т.е. происходит перекомби-нация того же VDJ-гена с Сн-генами иных классов и подклассов. В целом в процессе развития отдельных В-клеточных клонов возможны две формы реорганизации генома: разные VDJ-гены объединяются с одним и тем же Сн-геном, что обеспечивает формирование разных клонов (ранний этап развития В-клеток), и один и тот же VDJ-ген образует единый информационный участок с разными С-генами (внутриклеточное переключение синтеза с одного класса на другой).
2.4.2. Случайная рекомбинация генных сегментов — основа вариабельности иммуноглобулинов
Изучение хромосомной организации иммуноглобулиновых генов и этапов их реорганизации в процессе развития В-клеток позволило достаточно точно определить первопричину вариабельности антител. Ее основу составляет случайное объединение отдельных генных сегментов в результате рекомбинации: V,D,J — для тяжелых цепей и V, J — для легких цепей иммуноглобулинов. Если число Vjj-генов равно 500 (не исключено, что их больше), D-сегментов — 15 и J-сегментов — 4, число вариантов V-доменов при использовании только этих показателей составит величину 50041544=30 000 (рис. 2.23). Учитывая возможные нарушения при 76
1НЩ11111
Cg Cg Cl3 C J Cy2a C«2b CgC<* лип- T_ .L _ ___
L1 VH1 L2 VH2 15004,500 D1-15 J1-4
-»-»- - --M-----------ИНВВВВВВВШВ BIBB
Рис. 2.22. Рекомбинация генов, кодирующих тяжелые цепи иммуноглобулинов.
Тяжелые цепи иммуноглобулинов кодируются четырьмя типами генов: V, D, J и С. Первое рекомбинационное событие — объединение одного из 15 D-мини-генов с одним из 4 J-мини-генов. Второе рекомбинационное событие — объединение одного из 500 Уи-генов с DJ. Следующий этап в процессе рекомбинации — образование VDJ-CH-локуса. Образующаяся при транскрипции с этого локуса пре-мРНК вступает в процесс созревания — сплайсинга. Особенность реорганизации генома В-клеток состоит в переключении контроля синтеза иммуноглобулинов одного класса на другой при сохранении контроля специфичности за счет реорганизованного VDJ-локуса
рекомбинации, связанные с включением пограничных нуклеотидов справа и слева от D- и J-сегментов, число 30 000 следует умножить на 4. Таким образом, общее число вариантов Ун-доменов составит 120 000. Расчет для с-цепи включает 250 Ух-генов, 4 J-сегмента и множитель 2 — результат ошибок считывания пограничных нуклеотидов. Из этих данных следует, что число вариантов Ух-доменов будет равно 250-4-2=2 000. Так как молекулы иммуноглобулинов строятся из случайного сочетания тяжелых и легких цепей, общее число вариантов антигенсвязывающих центров, а, следовательно, специфических иммуноглобулинов, составит 120 000 -2 000=2,4.108.
По отношению к В-клеточной популяции данная цифра указывает на число клонов В-клеток, способных взаимодействовать с множеством антигенных эпитопов. Ясно, что при подобном порядке величин организм в условиях физиологической нормы полностью защищен от самых разнообразных антигенных вторжений.
Заключение
Известные пять классов иммуноглобулинов — IgM, IgG, IgA, IgE и IgD — построены по общему плану и включают две легкие и две тяжелые полипептидные цепи. Каждая цепь состоит из одного вариабельного и трех или четырех (в зависимости от принадлежности к классу) константных доменов. Специфичность антител зависит от взаимодействия вариабельных доменов легких и тяжелых цепей. Генетический контроль структуры иммуноглобулинов осуществляется большим набором V-генов и незначительным числом дополнительных D- и J-мини-генов. Случайная комбинация одного из У-генов с одним из D- и J-мини-генов при формировании единого информационного участка в процессе реорганизации генома В-клеток лежит в основе вариабельности антител, меняю-
Уц1 Ун2 Ун3 ^2 D3 J1
•-МИМ-----------------Off------------
I_____________________I I_______I I__________I
Отбор 1 иэ 500 Отбор 1 из 15 Отбор 1 из 4
Ун1 QjJ; Ун1 dt УИ d2j4 Ун3
OBES DEES DEE DEES ***
30000 различных комбинаций
Рис. 2.23. Случайная рекомбинация генов иммуноглобулинов — основа их вариабельности.
Представлена схема самых разнообразных сочетаний генных сегментов, дающих в результате 30 000 вариантов тяжелых цепей. Цифра выведена без учета возможных нарушений при рекомбинации, связанных с включением пограничных нуклеотидов справа и слева от D- и J-мини-генов. С учетом этих нарушений число вариантов тяжелых цепей иммуноглобулинов увеличивается до 120 000 78
щейся от белка к белку антигенсвязывающей специфичности. Количество V-генов, D- и J-мини-генов для тяжелых и легких цепей таково, что в условиях случайной рекомбинации возможно потенциальное образование до 2,4x10s отличающихся по специфичности антител. Этот уровень вариабельности достаточен для нейтрализации самого разнообразного набора антигенов.
Глава 3. АНТИГЕНРАСПОЗНАЮЩИЕ РЕЦЕПТОРЫ
Введение
Проблема распознавания антигена клетками иммунной системы возникла давно — в период зарождения иммунологии. Первым, кто пытался разрешить этот вопрос, был немецкий фармаколог Пауль Эрлих, выдвинувший теорию “боковых цепей” в самом начале нынешнего столетия. По представлениям этого ученого, клетка, способная к продукции антител, имеет на своей поверхности широкий набор рецепторов (боковых цепей — антител), каждый из которых взаимодействует только с одним определенным антигеном. Контакт антигена с соответствующим рецептором приводит к отрыву последнего от клетки и к его переходу в экстрацеллюлярную среду. Компенсаторно клетка начинает усиленное производство именно тех рецепторов-антител, которые провзаимодействовали с данным антигеном. В этих отношениях между рецептором и антигеном собственно и заключены специфичность реакции и специфичность образующихся антител (см. рис. В.8).
Теория “боковых цепей” была выдвинута в то далекое время, когда ничего не было известно ни о клетках-продуцентах антител, ни о природе самих антител, кроме того, что они являются белками сыворотки крови, способными к специфическому взаимодействию с антигеном. Тем более удивляет прозорливость П.Эрлиха, поскольку современные данные подтверждают основной вывод о присутствии антигенраспознающих рецепторов на поверхности клетки. Конечно, строение рецепторов и тонкие молекулярно-клеточные механихзмы взаимодействия рецептор-антиген стали понятными лишь в последнее время.
Антигенраспознающие рецепторы В- и Т-клеток представляют собой самостоятельные молекулярные структуры, относящиеся к одному суперсемейству иммуноглобулинов. В данной главе будет рассказано об особенностях организации этих рецепторов и их взаимодействии с антигеном.
3.1. АНТИГЕНРАСПОЗНАЮЩИЕ РЕЦЕПТОРЫ В-КЛЕТОК
3.1.1. Краткая характеристика
Антигенраспознающие рецепторы В-клеток были обнаружены достаточно легко, в основном с помощью антииммуноглобу-линовых антител, меченных либо радиоактивными химическими элементами, либо флюоресцеином. Иммуноглобулины всех изотипов имеют как секреторную, свободно накапливающуюся в жидкостях организма, так и мембранную (рецепторную), экспресси-
рующуюся на поверхности В-клеток форму. При этом доминирующим мембранным иммуноглобулином является мономер IgM.
Мембранный IgM по сравнению с его секреторным гомологом имеет гидрофобный, трансмембранный и хвостовой, находящийся в цитоплазме, домены. В то же время секреторная форма IgM имеет на С-конце углеводные остатки, увеличивающие растворимость данной формы иммуноглобулина, и цистеиновый остаток, необходимый для полимеризации мономеров с помощью J-цепи.
В онтогенезе первые мембранные формы IgM появляются на заключительном этапе дифференцировки В-клеток в костном мозге. Зрелые В-клетки экспрессируют достаточно большое количество этого белка: 2х105 молекул на одну клетку.
Такой рецепторный иммуноглобулин непосредственно взаимодействует либо с белковым или корпускулярным антигеном (рис. 3.1), либо с антигенными детерминантами на поверхности антигенпредставляющих клеток (макрофагов, дендритных клеток и др.).
3.1.2. Генетический контроль структуры мембранного IgM
Контроль синтеза мембранного и секреторного IgM осуществляется одним и тем же участком ДНК. Различия обеспечиваются на уровне транскрипции. В состав иммуноглобулинового локуса входят два специализированных экзона (на рис. 3.2 обозначены как Мк), контролирующие трансмембранный участок и цитоплазматический хвост мембранного IgM. Кроме того, в этом же локусе, непосредственно за геном См4 представлена последователь-
Рис. 3.1. Пример прямого взаимодействия В-клетки с антигеном.
Сканирующая электронная микрофотография В-клетки от примированных мышей, вступившая в контактное взаимодействие с корпускулярным антигеном (эритроцитами барана)
6 Зак. 3701
81
ность нуклеотидов, ответственная за С-концевой участок секреторного иммуноглобулина.
В тех случаях, когда при образовании пре-мРНК считывается вся информация с локуса от лидерного участка до Мк, то формирующаяся в результате сплайсинга зрелая мРНК обеспечивает синтез тяжелой цепи мембранного IgM. Существенным моментом в процессе сплайсинга является деления участка с последовательностью, свойственной секреторному иммуноглобулину (участок Ск на рис. 3.2). Если же считывание информации не затрагивает экзонов Мк, характерных для мембранного иммуноглобулина, то в результате будет образовываться тяжелая цепь секреторного иммуноглобулина.
Уровень продукции секреторного иммуноглобулина выше подобного уровня мембранного белка. Возможно, это связано с тем, что энергетических и химических затрат для синтеза секреторного иммуноглобулина требуется меньше по сравнению с мембранной формой. Кроме того, сплайсинг пре-мРНК для секреторного иммуноглобулина несколько упрощен, так как не требуется удаления последовательности Ск.
Механизм генетичекого контроля образования мембранного иммуноглобулина для всех изотипов идентичен.
3.1.3. АНТИГЕНРАСПОЗНАЮЩИЕ РЕЦЕПТОРЫ В ПРОЦЕССАХ АКТИВАЦИИ В-КЛЕТОК
Мембранный иммуноглобулин, провзаимодействовавший с антигеном, не может сам по себе активировать ответ В-клеток. Связано это с тем, что его цитоплазматический хвост слишком короток. Он содержит всего несколько аминокислотных остатков, не способных вступать в реакционные отношения с внутриклеточными компонентами. Для переноса сигнала с антигенраспознаю-щего рецептора внутрь клетки имеются специальные, низкомолекулярные белки с достаточно длинным хвостовым участком, находящиеся на клеточной поверхности в непосредственной близости от мембранного иммуноглобулина. Всего таких полипептидов два — Iga и Igр. Белок Iga специфичен по отношению к тому или иному изотипу иммуноглобулина. В то же время Ig0 является общим для всех изотипов (рис. 3.3).
Помимо передачи сигнала эти белки выполняют роль “извозчиков”, способствуя выходу мембранного иммуноглобулина на поверхность клетки. В отсутствие этих белков иммуноглобулины остаются во внутриклеточном компартменте.
Активирование В-клеток через взаимодействие антигена с рецептором может происходить как самостоятельно, так и с помощью цитокинов, продуцируемых Т-хелперами и макрофагами. В
Секреторный IgM
Мембранный (рецепторный) IgM
L VDJ
Cg1 Сц2 СцЗ Сц4 Ck рАс Mk pAm
Рекомбинаторная ДНК
Рис. 3.2. Реорганизация локуса, контролирующего образование мембранной (рецепторной) и секреторной форм иммуноглобулина.
При образовании мембранной или секреторной форм иммуноглобулина процесс реорганизации генома характеризуется следующими особеностями. Рекомбинантная ДНК
содержит последовательность нуклеотидов от лидерного участка (L) до терминальной последовательности полиаденина (сокр.: pAm — полиаденин мембранного пути развития) включительно. В реорганизованный локус входят экзон Ск (секреторный компонент) и два экзона Мк (мембранный компонент), один из которых контролирует трансмембранную последовательность, а второй — цитоплазматическую последовательность аминокислотных остатков рецепторного иммуноглобулина. В тех случаях, когда образующийся первичный транскрипт (пре-мРНК) включает экзоны Мк, синтезируется ц-цепь мембранного иммуноглобулина. При этом Ск и рАс (полиаденин секреторного пути реорганизации) подвергаются делении при сплайсинге пре-мРНК. Если первичный транскрипт не включает последовательность Мк и pAm, но сохраняет Ск и рАс, то в результате последующих преобразований синтезируется ц-цепь секреторного иммуноглобулина
Фосфорилирование внутриклеточных белков
Активация Са ^-зависимых ферментов
I
Активация ассоциированных с ДНК белков, которые инициируют генную транскрипцию
Рис. 3.3. Активация В-клеток при взаимодействии с антигеном.
Тимуснезависимый антиген (АГ), взаимодействуя с мембранным (рецепторным) иммуноглобулином, приводит к его агрегации. В результате Iga и Ig0, входящие в антигенраспознающий комплекс, взаимодействуют в цитоплазме с тирозинкиназами (ТК), которые в свою очередь обеспечивают ряд внутриклеточных биохимических процессов, инициирующих транскрипцию иммуноглобулиновых генов
первом случае инициация ответа обеспечивается агрегацией рецепторов при их перекрестном связывании соответствующим лигандом. Перекрестное связывание рецепторов происходит в тех случаях, когда антиген обладает повторяющимися, идентичными эпитопами. Для реализации ответа таким антигенам не нужна помощь со стороны Т-хелперов. Отсюда их название — тимуснезави-симые антигены. К ним относятся, в частности, полисахариды бактерий.
Образование агрегатов мембранных иммуноглобулинов под влиянием антигена (в англ, литературе — “cupfonnation”) приводит к взаимодействию различных тирозинкиназ с Iga и Ig р. Активированные киназы провоцируют каскад реакций, в результате которых в клетке накапливаются Са2+-зависимые ферменты и происходит фосфорилирование внутриклеточных белков. Именно они 84
на заключительном этапе формирования ответа В-клеток активируют связанные с ДНК белки и таким образом инициируют транскрипцию специфических генов.
3.2. АНТИГЕНРАСПОЗНАЮЩИЕ РЕЦЕПТОРЫ Т-КЛЕТОК
Изучение проблемы распознавания антигена В-клетками не вызвало особых экспериментальных осложнений. Легкость обнаружения мембранного иммуноглобулина у данного клеточного типа давала в руки исследователей основу для детального анализа явления. При этом поиск аналогичных структур у Т-клеток столкнулся с определенными трудностями. Использование тех же экспериментальных подходов, которые применялись при изучении антигенных рецепторов у В-клеток, не привело к положительным результатам. Первые шаги к решению проблемы были сделаны, как это ни странно, не в молекулярной иммунологии, а в клеточной — в экспериментах с генетически отличающимися клетками, взаимодействующими in vitro.
Первоначально в гипотетической, на основании клеточной феноменологии, а затем в экспериментально хорошо документированной форме с использованием методов молекулярной биологии было установлено, что Т-клеточный рецептор распознает не собственно чужеродный антиген, а его комплекс с белками, контролируемыми главным комплексом гистосовместимости (МНС от англ, “major histocompatibility complex”).
Особенности распознавания антигена Т-клетками и структурные характеристики собственно Т-клеточных рецепторов (ТКР) заставляют дать описание не только антигенраспознающих молекул, их структуры и генетического контроля, но и представить данные о генетической организации и фенотипических продуктах МНС, а также рассказать об участии молекулярных структур комплекса в представлении чужеродного (экзогенного) антигена в иммуногенной форме для антигенных рецепторов Т-клеток.
3.2.1. Главный комплекс гистосовместимости: генетическая организация и основные белки комплекса
Главный комплекс гистосовместимости был открыт в связи с разработкой вопросов внутривидовой пересадки тканей, отсюда и его название. Комплекс расположен у человека на 6-й, а у мышей — на 17-й хромосоме и занимает значительный участок ДНК, включающий до 4х 106 пар оснований, или около 50 генов. Основными особенностями комплекса являются его значительная поли-генноегь — наличие нескольких неаллельных генов, белковые продукты которых сходны в структурном отношении и выполняют идентичные функции, а также ярковыраженный полиморфизм —
присутствие многих аллельных форм одного и того же гена. Все гены комплекса наследуются по кодоминантному типу (рис. 3.4).
Кодоминантное наследование
Фенотип
А1А2В1 В3
А2В,В2
А1 А2В1
А2 В2 В3
Рис. 3.4. Схема кодоминантного наследования полиморфных и полигенных при* знаков, определяющих антигенную индивидуальность особей вида.
Известны две формы генетической вариабельности признаков (антигенов, ферментов и др.) — полиморфизм и полигения. Полиморфизм определяет наличие многих аллельных вариантов одного и того же гена (Аь А2 и тд.). Под полиге-нией понимают наличие нескольких неаллельных, близкосцепленных генов, контролирующих изогенные признаки (Аь Вь С] или А2, В2, С2). При кодоминантном наследовании сочетание полиморфизма и полигении создает набор фенотипических признаков, которые определяют индивидуальность особей вида (см. нижнюю часть рисунка; для простоты изображения представлено наследование только двух полигонных и двух полиморфных гонов). Схема демонстрирует проявление индвидуальности потомства по гено- и фенотипу
Полигенность и полиморфизм определяют антигенную индивидуальность особей данного вида.
Все гены комплекса делятся на три группы. Каждая группа включает гены, контролирующие синтез полипептидов одного из трех классов (рис. 3.5). У мышей гены Н-2К, D и L, у человека — HLA-A, -В и -С ответственны за образование тяжелой цепи (а-цепи) антигенов (молекул) I класса. Дополнительный однодоменный пептид, ассоциированный с основной цепью, р2-микрогло-булин (Р2-М) контролируется геном, не входящим в комплекс. У человека этот ген расположен на 15-й, а у мышей — на 2-й хро-
Н-2 мышей
HLA человека
Рис. 3.5. Генная организация главного комплекса гистосовместимости у мышей и человека.
Главный комплекс гистосовместимости как у мышей, так и у человека включает три группы генов: (1) гены, контролирующие молекулы II класса (Н-2К, H-2D и H-2L — у мышей и HLA-A, -В, -С — у человека); (2) гены, контролирующие молекулы II класса (а и p-цепи молекул А и Е — у мышей и DP, DQ, DR — у человека); к этой же группе генов относятся LMP и ТАР, контролирующие соответствующие белки, которые участвуют в образовании комплекса антигенного пептида с молекулами МНС; (3) гены III класса ответственны за синтез одного из компонентов системы комплемента, фактора некроза опухолей — аир, ферментов, участвующих в синтезе гормонов
мосоме. Группа генов II класса ответственна за синтез а- и [3-цепей антигенов данного класса. Гены а и р объединены в близко-сцепленные пары для каждого определенного антигена II класса: А и Е — у мышей; DP, DQ и DR — у человека. Кластер DR включает дополнительный p-ген, что обеспечивает образование двух антигенов DR — aPi и ар2. Кроме того, к классу II относятся пары генов LMP и ТАР. Низкомолекулярные белки, контролируемые этими генами, принимают участие в подготовке чужеродного антигена к презентации Т-клеткам (об этом подробнее в данной главе). Кроме хорошо описанных функционально генов класса I имеются гены того же класса (HLA-X, -Е, -J, - Н, -G, -F), предназначение которых пока неизвестно.
Гены класса III контролируют синтез белков, среди которых есть участники иммунных процессов: один из компонентов комплемента, факторы некроза опухолей (ФНО-a и ФНО-р). Здесь же локализованы гены, контролирующие образование ряда ферментов синтеза стероидов.
Наличие в МНС генов, большинство которых кодирует иммунологически значимые полипептиды, заставляет думать, что этот комплекс эволюционно возник и развивался специально для осуществления иммунных форм защиты.
Наиболее важными в иммунологическом смысле гликопротеинами, контролируемыми комплексом, являются антигены I и II классов.
Молекулы I класса экспрессируются на клеточной проверх-ности и представляют собой гетеродимер, включающий тяжелую a-цепь и однодоменный р2-микроглобулин, нековалентно связанный с основным полипептидом. Методами рентгеноструктурного анализа выяснена пространственая организация этого антигена (рис. 3.6). Тяжелая цепь включает три домена: ab a2 и аз. Конформация аз- и р2-микроглобулина напоминают складчатую структуру доменов иммуноглобулинов. Основное свойство антигенов I класса — связывание пептидов и представление их в иммуногенной форме для Т-клеток зависит от двух других доменов — ai и а2. Эти домены имеют значительные a-спиральные участки, которые при взаимодействии между собой образуют щель — место связывания пептидов. Собственно комплекс пептида с ар и а2-доменами определяет иммуногенность экзогенного антигена, его возможность взаимодействовать с антигенраспознающими рецепторами Т-клеток.
Молекулы II класса также являются гетеродимерами, построенными из нековалентно сцепленных а- и p-цепей, каждая из которых включает по два домена (аод и Р1Р2 соответственно). Ан-тигенсвязывающая область подобно антигенам I класса формируется a-спиральными участками взаимодействующих цепей — до-
Рис. 3.6. Структура молекул I и II классов главного комплекса гистосовместимости.
Методами рентгеноструктурного анализа выяснена структура молекул I и И классов главного комплекса гистосовместимости. А. Молекула I класса состоит из тяжелой цепи, включающей три домена: аь а2 и аз, и одной легкой цепи — р2-микроглобулина. Связывание анатигенного пептида молекулой I класса происходит в антигенсвязывающей щели, образованной а-спиральными участками ар и а2-доменов. Б. Молекула II класса представляет собой гетеродимер, состоящий из двух нековалентно связанных цепей: аир, каждая из которых включает два домена: а|, а2 и Pi, pj, соответственно. Антигенсвязывающая область, как и у молекул I класса, образована а-спиральными участками. В построении этой области принимают участие аг и р(-цепи. Между молекулами I и II классов видно структурное сходство: однотипная пространственная организация, общее количество доменов, принцип построения антигенсвязывающей области
менами а, и Рр Общее структурное сходство между двумя классами антигенов очевидно. Это — однотипность пространственной организации всей молекулы, количество доменов, равное четырем, конформационное строение антигенсвязывающего участка,
близкие мол. массы: около 44-49 кД.
Наряду с полигенностью МНС характеризуется крайне выраженным полиморфизмом (рис. 3.7). Ни одна другая генетическая система организма не имеет такого количества аллельных форм определенного гена, как МНС. У человека наибольшее число аллельных вариантов (от 20 до 72) известно для генов I класса и DPp, DQp и DRp генов II класса. Гены, контролирующие а-цепь антигенов II класса, характеризуются меньшей изменчивостью, а у гена DRq она по неизвестным причинам вообще отсутствует. Гомологом такого инвариантного гена у мышей является Еа. Число аллелей различных генов, представленное на рис. 3.7, выявлено для кавказской популяции (белой расы). Индейцы Америки и коренное население Востока имеют дополнительные аллели. Крайне высокий уровень аллельных генов и доминирующее присутствие в популяции гетерозигот при условии кодоминантного наследования обусловливает индивидуальность особей вида по антигенам МНС
Долгое время биологический смысл столь выраженного полиморфизма оставался непонятным, хотя какое-то (?) селективное значение такой аллельной изменчивости было очевидным. В последние несколько лет доказано, что подобный полиморфизм прямо связан с процессом презентации антигенных эпитопов Т-клеткам.
Аллельные формы антигенов МНС могут отличаться друг от друга по 20 аминокислотным остаткам. Большинство из аминокислотных замен локализовано в N-концевой части молекул и
Число аллелей
DPp DPa
I_________
Рис. 3.7. Число аллельных форм молекул I и II классов главного комплекса гистосовместимости у человека.
Видно, что среди молекул II класса наибольшей вариабельностью обладают DPp и DRp; DRa вообще не имеет аллельных форм. Наибольшая вариабельность среди молекул I класса характерна для полипептида В, хотя А и С также обладают значительным числом аллельных вариантов
главным образом в доменах, формирующих антигенсвязывающий участок (рис. 3.8). Именно в этой изменчивости аминокислотной последовательности антигенсвязывающего участка заключена потенциальная возможность взаимодействовать с различными пептидами.
С полиморфизмом антигенов МНС связано такое явление, как генетический контроль иммунного ответа. В тех случаях, когда аминокислотные остатки, образующие щель у антигенов II класса, не в состоянии связать пептидный фрагмент чужеродного антигена, Т-хелперы остаются ареактивными и их помощь В-клет-кам не реализуется. Это обстоятельство и является причиной генетически детерминированного дефекта в иммунном реагировании (подробно см. гл. 3,10).
Основные события, которые привели к формированию разнообразия генов МНС в процессе эволюции, связаны с тандемными дупликациями, точечными мутациями, рекомбинацией и конверсией генетического материала. Тандемные дупликации — процесс повторения исходного гена на той же самой хромосо-
вариабельность мол. I кл. вариабельность мол. II кл.
О 20 40 00 00 100 120 140 too 100 200 220 240 200 200 О 20 40 00 00 100 120 140 100 100 200 остатки остатки
Рис. 3.8. Вариабельные положения в аминокислотной последовательности молекул I и II классов главного комплекса гистосовместимости.
Аллельные варианты молекул I и II классов обусловлены заменами аминокислотных остатков, входящих в состав аг и а2-домеиов молекул I класса и Ргдомен молекул II класса. Именно эти домены формируют антигенсвязывающий участок. Черные столбцы — уровень вариабельности отдельных положений в ар и Pi-доменах соответственно; светлые столбцы — то же для а2- и р2-доменов; вариабельность а2 крайне низкая — на рисунке не обозначена. Черные кружки (нижняя часть рисунка) — наиболее вариабельные положения аминокислотных остатков в антигенсвязывающей области.
ме — хорошо известны для многих генетических систем, контролирующих синтез белков, например иммуноглобулинов. Именно в результате этого процесса возникло несколько полигонных форм антигенов и I, и II классов. Спонтанные замены отдельных нуклеотидов в процессе редупликации ДНК (точечные мутации) также хорошо известны, они приводят к формированию аллельных генов, которые определяют полиморфизм белков. Рекомбинации между отдельными участками гомологичных хромосом в процессе мейоза могут привести к обмену как целых участков этих хромосом, так и отдельных генов и даже частей генов. В последнем случае процесс называется генной конверсией. Мутации, рекомбинации и конверсия генов создают многообразие их аллельных форм и определяют полиморфизм антигенов МНС.
3.2.2. Иммуногенные формы антигена для Т-клеточных рецепторов
Если В-клетки способны распознавать свободные, не связанные с какими-либо другими белками антигены, то Т-клетки отвечают только на комплекс антигенных эпитопов с молекулами I или II классов МНС.
Подготовка антигена к его распознаванию различными классами лимфоцитов начинается в фагоцитирующих клетках.
Большинство бактерий и одноклеточных, эукариотических паразитов в результате фагоцитоза оказываются включенными в фаголизосомы. В то же время основным местом внутриклеточной локализации вирусов является неструктурированная часть клетки — цитозоль.
Вирусные антигены в результате протеолиза в цитоплазме и последующего выхода на поверхность фагоцитирующей клетки в комплексе с молекулами I класса МНС становятся объектом распознавания цитотоксическими Т-лимфоцитами (ЦТЛ, CD8 Т-клетки,Т-киллеры). Следствием такого распознавания является гибель инфицированной клетки.
В случае развития бактериальной инфекции или поражения организма одноклеточными паразитами стратегия иммунитета выглядит иначе. Для внутриклеточных патогенов, таких как микобактерии или возбудители чумы, в процесс уничтожения инфекционного агента вступают Т-клетки воспаления, имеющие маркер CD4 (Тц1)- Эти клетки после распознавания бактериального антигенного эпитопа, комплексированного с молекулами II класса МНС, активируют макрофаги, зараженные бактериями, к внутриклеточному уничтожению (киллингу) возбудителя.
При инфицировании организма возбудителями, размножающимися вне клетки, в иммунный ответ вступают хелперные Т-клетки (Тн2), имеющие тот же маркер CD4, что и воспалительные Т-клетки. Функция клеток этой субпопуляции — активация В-клеток к продукции специфических иммуноглобулинов, кото-92
рые нейтрализуют бактерии или их токсины.
Однако чтобы ЦТЛ и Т-клетки воспаления и антителопро-дукции вступили в ответ на бактериальные или вирусные антигены, необходима предварительная подготовка таких антигенов к распознаванию этими клетками.
3.2.2.1. Этапы внутриклеточной подготовки антигена к образованию комплекса пептида с молекулами I или II класса МНС
Для вирусных белков (антигенов), локализующихся в цитозоле, путь выхода на поверхность клетки в иммуногенной форме включает несколько последовательных этапов (рис. 3.9).
Первый из них — разрушение белковой молекулы до отдельных пептидов. Этот процесс осуществляется с помощью большого каталитического протеазного комплекса, получившего название — протеосома. Комплекс включает 28 субъединиц с мол. массой 28-30 кД. Субъединицы формируют цилиндр, который состоит из четырех колец. Каждое кольцо, в свою очередь, включает 7 субъединиц. Особенностью протеосом, подготавливающих антиген к взаимодействию с молекулами I класса МНС, является наличие в их составе двух субъединиц, которые кодируются генами LMP (от англ, “low molecular weight protein”), локализованными в МНС (см. рис. 3.5).
Образовавшиеся в цитозоле пептидные фрагменты должны проникнуть во внутреннее пространство эндоплазматического ре-тикулумя для встречи с молекулами I класса МНС. Такое проникновение пептидов на втором этапе развития процесса осуществляется с помощью специальных белков: ТАР-1 и ТАР-2 (от англ, “transporters associated with antigen processing-1 and -2”). Каждый белок состит из двух доменов — одного гидрофобного трансмембранного домена и одного АТФ-связывающего домена. Два белка образуют гетеродимер на эндоплазматической мембране. Именно гетеродимер является “воротами” для прохождения пептидов во внутреннее пространство эндоплазматического ретикулума.
Гены, кодирующие ТАР-1 и ТАР-2, как и LMP-гены, локализованы в МНС (см. рис. 3.5). Сам по себе факт знаменателен. Объединение в одном локусе генов для основных и вспомогательных белков, функция которых — переработка и презентация антигена для его распознавания различными типами Т-клеток, указывает на то, что МНС эволюционно возник специально для обеспечения этой функции.
В полости эндоплазматического ретикулума осуществляется встреча транспортируемых пептидов с молекулами I класса МНС. В результате постоянно идущего процесса — синтеза a-цепи и ее соединения с р2-микроглобулином — образуется полноценная молекула I класса. Однако в таком нативном состоянии она неста-
IV.
1
Рис. 3.9. Этапы подготовки
вирусшх белков к взаимодействию с молекулами I класса главного комплекса тстосовместимости.
I этап — разрушение вирусных белков, находящихся в цитозоле, с помощью протеазного комплекса — протеосомы. II этап — транспорт образовавшихся пептидов во внутреннее пространство эндоплазматического ретикулума с помощью ТАР-1 и ТАР-2, образующих гетеродимер на эндоплазматической мембране. III этап — встреча транспортируемых пептидов с молекулами I класса МНС. Молекулы МНС стабилизированы специальным белком — калнексином. Взаимодействие пептида с молекулой I класса приводит к отсоединению калнексина. Образовавшийся ком-
плекс пептид:молекула I класса готов к дальнейшему транспорту к плазматической мембране (ПМ). IV этап — завершающий. Комплекс через аппарат Гольджи транспортируется к клеточной поверхности. Таким образом, вирусный пептид в комплексе с молекулой I класса МНС становится доступным (иммуногенным) для его распознавания Т-клеточными антигенраспознающими рецепторами
бильна и быстро распадается на составляющие элементы. Молекула стабилизируется специальным белком — калнексином (англ, “calnexin”), мол. масса которого 68 кД. Комплекс молекулы I класса с калнексином остается в полости эндоплазматического ретикулума до тех пор, пока не произойдет его встреча с антигенным пептидом. Взаимодействие комплекса с пептидом приводит к отрыву калнексина, что и завершает III этап процесса.
На заключительном IV этапе сформировавшийся новый комплекс пептид:молекула I класса транспортируется через аппарат Гольджи к клеточной поверхности.
Таким образом завершается весь процесс прохождения антигена из цитозоля через эндоплазматический ретикулум и аппарат Гольджи к клеточной поверхности, где он экспрессируется в иммуногенной, доступной для ЦТЛ форме.
Как отмечалось, большинство бактерий и одноклеточных паразитов, а также их токсины генерируют развитие гуморального иммунного ответа с обязательным включением в защитную реакцию CD4 Т-клеток. Эти клетки распознают комплекс чужеродного пептида с молекулами II класса МНС.
Весь процесс подготовки антигена к его распознаванию CD4 Т-клетками включает три этапа (рис. 3.10). На I этапе в результате эндоцитоза бактерии или их токсины оказываются заключенными в фагосомы. После слияния фагосом с лизосомами и образования фаголизосом захваченный материал подвергается гидролитическому расщеплению протеазами, которые действуют при низких значениях pH, характерных для этих органелл.
Параллельно на II этапе процесса во внутреннем пространстве эндоплазматического ретикулума происходит формирование молекул II класса МНС. Они защищены от случайного образования комплекса с пептидами внутри эндоплазматического пространства так называемой инвариантной цепью (у-цепыо). Комплекс молекулы II класса с инвариантной цепью покидает через аппарат Гольджи пространство эндоплазматического ретикулума. На этом этапе процесса комплекс заключен в самостоятельную вакуоль.
На III этапе происходит слияние фаголизосомы, в которой находятся пептидные фрагменты и набор кислых протеаз, с вакуолью, содержащей комплекс молекула II класса:инвариантная цепь. Протеазы, оказавшись в единой вакуоле с комплексом, начинают процесс расщепления инвариантной цепи, что создает условия для снятия “конформационного запрета” на взаимодействие молекулы II класса с пептидом. Дальнейшая активность кислых протеаз полностью разрушает инвариантную цепь, а образовавшийся новый иммуногенный комплекс пептида с молекулой II класса МНС в составе секреторной гранулы перемещается к клеточной
Рис. 3.10. Этапы подготовки шпигепов бактерий и их токсинов к взаимодействию с молекулами II класса главного комплекса гистосовместимости.
I этап — поглощение бактерий или их токсинов фагоцитирующей, способной к презентации антигена клеткой и разрушение захваченного материала до отдельных пептидов в фаголизосомах. II этап — во внутреннем пространстве эндоплазматического ретикулума идет сборка молекул II класса, которые до встречи с пептидом комплексированы со специальным белком, получившим название инвариантной цепи (П). Этот белок защищает молекулу II класса от случайной встречи с бактериальными пептидами в эндоплазматическом ретикулуме. Комплекс молекулы II класса с Ii покидает эндоплазматический ретикулум в составе вакуоли; III этап — вакуоль, содержащая комплекс молекулы II класса с Ii, сливается с фаголизосомой. Кислые протеазы фагализосом разрушают Ii-белок и таким образом снимают запрет на взаимодействие молекул II класса с бактериальными пептидами. Образовавшийся новый комплекс пептидгмолекула II класса в составе секреторной вакуоли перемещается к мембране клетки. Результатом всех этих процессов является экспрессия чужеродного пептида в комплексе с молекулой II класса на клеточной поверхности, что и обеспечивает доступность бактериального пептида для антигенраспознающих рецепторов Т-клеток
поверхности.
В виде заключения в табл. 3.1 представлены особенности подготовки антигенов для молекул двух разных классов МНС. Сравнительные данные указывают, что клеточные и молекулярные механизмы переработки антигеннного материала для его взаимодействия с молекулами I и II классов значительно отличаются друг от друга.
3.2.2.2.Взаимодействие пептидов с молекулами I и II классов ГКГ
При использовании рентгеноструктурного анализа удалось показать, что щель, образуемая а-спиральными последовательностями а;- и «2-доменами молекулы I класса и ар и (3!-доменами молекулы II класса занята плотно упакованным пептидом. Площадь поверхности комплекса, которая контактирует с Т-клеточ-96
Таблица 3.1
Особенности подготовки антигена к взаимодействию с молекулами I и II классов главного комплекса гистосовместимости
Признак Молекулы I класса Молекулы II класса
Основной объект гидролитического разрушения вирусы бактерии, одноклеточные паразиты
Локализация и размножение патогенов цитозоль экстрацеллюлярное пространство, фагосомы
Протеолиз патогенов протеосомы протеаза фаголизосом
Белки-стабилизаторы молекул МНС калнексин инвариантная цепь Су-цепь)
Место образования комплекса пептида с молекулами МНС эндоплазматический ретикулум фаголизосома
Транспорт комплекса пеп- через аппарат Голь- минуя аппарат Гольджи
тид:молекула МНС джи в составе секреторной гранулы в составе секреторной гранулы
ным антигенраспознающим рецептором, составляет около 600 А.
Несмотря на значительный полиморфизм и полигенность молекул МНС, каждая конкретная клетка, в которой происходит переработка антигена, обладает ограниченным количеством вариантов этих молекул. При этом количество пептидов, образующихся в результате протеолиза чужеродных антигенов, велико. В связи с этим возникает естественный вопрос: каким образом строится специфичность комплекса пептид:молекула МНС? Строгая конформационная специфичность, известная для взаимодействия антител или иммуноглобулиновых рецепторов с антигеном, в данном случае не может проявиться в силу ограниченности вариантов молекул I и II класса в клетке конкретного индивидуума. Изучение различных комплексов пептидов с молекулами МНС при их кристаллизации помогло выяснить картину связывания ограниченного числа молекул I и II классов МНС с различными фрагментами антигенов.
Антигенные пептиды (Т-клеточные эпитопы), которые образуют связь с молекулами I класса МНС, обычно включают 8-10 аминокислотных остатков. N- и С-концевые аминокислоты таких пептидов взаимодействуют с инвариантными аминокислотными остатками, входящими в состав антигенсвязывающего желобка молекулы I класса МНС. В зависимости от длины пептида возможен их изгиб в той или иной степени. Аллельные варианты молекул I класса взаимодействуют с разными пептидами. В то же время молекулы одной определенной аллели взаимодействуют со сходными, хотя и неидентичными пептидами. Сходство пептидов определяется в первую очередь наличием так называемых якорных участков — гидрофобных аминокислотных остатков, расположенных у " Зак. 3701 97
.
H’ N R
G Y V G G^ coo-
I I N E coo-
P G N P coo-
H*N*S
H* N*A
H*N*S^I P S A E К ^соо-
Рис. 3.11. Спещфика взаимодейстаия «шип mu > ютгвдов с молекулами I класса главного комплекса гнстосоаместимости.
С каждой аллельной формой молекулы I класса взаимодействует определенное число близких, хотя и неидентичных пептидов (панель 1 или 2; представлены пептиды, взаимодействующие с двумя отличающимися аллельными формами молекул I класса). Взаимодействие таких пептидов происходит через относительно инвариантные гидрофобные аминокислотные остатки, получившие название якорных, которые образуют ковалентную связь с реактивными группами антигенсвя-зывающего участка молекулы I класса. Поскольку расстояние между реактивными группами антигенраспознающего участка может быть короче длины пептида между якорными остатками, то возможна разная форма изгиба у взаимодействующего пептида. Возникающая форма изгиба в линейной последовательности аминокислотных остатков пептида собственно и распознается рецептором Т-клеток
разных пептидов в тех же самых положениях (рис. 3.11).
Пептиды, которые связываются молекулами II класса МНС, имеют большую длину и включают по крайней мере 13 аминокислотных остатков. Они располагаются в виде вытянутого отрезка в щели, образованной а-спиральными последовательностями аг и Pi-цепей. В отличие от молекул I класса инвариантные аминокислотные остатки антигенсвязывающего желобка молекул II класса йе образуют связи с концевыми аминокислотами пептидов. Однако якорные взаимодействия, очевидно, существуют, хотя молекулярная природа таких взаимодействий еще не понята.
3.2.3. Строение и генетический контроль Т-клеточных антигенраспознающих рецепторов
3.2.3.1. Краткая характеристика
Попытки выявить Т-клеточные антигенраспознающие рецепторы (ТКР) с помощью антииммуноглобулиновых антител, как 98
это было сделано при поиске антигенраспознающих структур у В-клеток, оказались безуспешными. Идентифицировать ТКР удалось только с применением моноклональных антител (мАТ) и клонированных линий Т-клеток. Некоторые клоноспецифические мАТ реагировали только с клонами, выделенными от предварительно иммунизированных животных. Внесение в культуру таких клонов соответствующих по специфичности мАТ подавляло способность клонированных Т-клеток распознавать антиген, использованный для иммунизации. Наличие подобных антигенспецифических мАТ обеспечило полноценное изучение антигенраспознающих структур Т-клеток, получивших название Т-клеточных рецепторов (рис. 3.12).
Каждая функционально зрелая Т-клетка имеет около 3-104 ТКР. Они представляют собой гетеродимер, построенный из а- и 0-цепей, ковалентно связанных между собой цистеиновым мостиком. Каждая цепь состоит из вариабельного V- домена и константного С-домена, гомологичных соответствующим доменам иммуноглобулинов (рис. 3.13).В структуре ТКР представлен также шарнирный домен с цистеиновым остатком, который образует дисульфидный мостик, объединяющий а- и 0-цепи в единую молекулу. На клеточной мембране ТКР удерживается гидрофобной трансмембранной последовательностью аминокислотных остатков. Характерной чертой трансмембранного домена является присутствие в нем положительно заряженных аминокислотных остатков. Заканчивается каждая цепь коротким цитоплазматическим хвостом, погруженным в цитоплазму.
Отличие ТКР от иммуноглобулинового рецептора состоит в том, что он одновалентен, в то время как аналогичный рецептор В-клеток двухвалентен. Кроме того, ТКР не секретируется во внеклеточное пространство, что также отличает его от иммуноглобулинового рецептора. Однако все эти различия не могут считаться определяющими, так как основное свойство — построение активного антнгенраспознающего участка за счет взаимодействия двух V-доменов — остается общим.
3.2.3.2. Генетический контроль структуры Т-клеточного антигенраспознающего рецептора
Организация генов, кодирующих а- и 0-цепи ТКР, в основном гомологична той, которая известна для легких и тяжелых цепей иммуноглобулинов. V-домен a-цепи, подобно легкой цепи иммуноглобулинов, контролируется только V- и J-генными сегментами. В то же время образование V-домена 0-цепи, как и тяжелой цепи иммуноглобулинов, обеспечено полным набором V-, D-, J-генных сегментов (рис. 3.14).
В геноме Т-клеток имеется более 100 V-генов для а-цепи
АГ
мАТЗа
► Клоноспецифические, мАТ
мАТЗп
мАТ Клоны
1 2 3 4
мАТЗЬ - - + +
(^1 - - -
мАТЗп + + - -
Компоненты Результат реакции
КлонЗ + мАТЗЬ + АГ Клон 3 + мАТЗс + АГ Клон 3 + мАТЗп + АГ + +
ТКР, что в два с половиной раза меньше того количества, которое известно для легких цепей иммуноглобулинов. Каждый такой ген включает два экзона — один для лидерной (L) последовательности, отсутствующей у зрелой a-цепи, но представленной у этой цепи в момент ее транспорта из эндоплазматического ретикулума к клеточной поверхности, и второй — для кодирования собственно V-домена ТКР. J-Генных сегментов для a-цепи значительно больше, чем для легкой цепи иммуноглобулинов (50 против 4). Константная область a-цепи контролируется С-геном, включающим отдельные экзоны для С-домена, шарнира и один общий экзон — для трансмембранной и хвостовой частей молекулы.
Количество V-генов для p-цепи равно 30. Кроме того, имеется два кластера DJC. Каждый кластер включает один D- и шесть J-генных сегментов. Функциональные различия между кластерами неизвестны. С-ген для константной области ₽-цепи включает четыре экзона для константного, шарнирного, трансмембранного и хвостового участков полипептида.
Процессы рекомбинации, транскрипции, сплайсинга и трансляции генетического материала для а- и p-цепей при образовании ТКР в Т-клетках аналогичны тем, которые обеспечивают синтез иммуноглобулинов в В-клетках.
Так же как в случае с иммуноглобулинами и иммуноглобулиновыми рецепторами, вариабельность ТКР зависит от случайного взаимодействия генных сегментов в процессе рекомбинации генетического материала, кодирующего V-домены: VJ — для а-цепей и VDJ -для p-цепей. Расчет вариабельности V-доменов ТКР, который проводится так же, как и для иммуноглобулинов (см. гл. 2), показывает крайне высокий уровень разнообразия этих анти-
Рис. 3.12. Получение моноклональных антител, специфичных к Т-клегочному антигенраспознающему-рецептору.
На первом этапе работы от мышей, иммунизированных опеределенным антигеном (АГ), получали суммарную, недифференцированную популяцию Т-клеток, содержащую самые различные клоны (на рис. цифры 1 -6). Второй этап состоял в выделении отдельных клонов Т-клеток, среди которых были и специфичные к использованному антигену (на рис. в качестве примера приведено четыре клона, один из которых — клон 3, — специфически реагирует с антигеном). Третий этап работы включал получение моноклональных антител (мАТ) к антигенреактивно-му клону. Задача этого этапа — получение моноклональных антител, способных реагировать только с клоном, использованным для иммунизации. В то же время перекрестная реакция мАТ говорит об общей специфике антигенреактивного клона и непримированных клонов (верхняя таблица). Отсутствие перекрестной реактивности мАТ указывает на наличие у положительно реагирующего примирован-ного клона особой специфичности — предположительно, антигенраспознающего рецептора. Подтверждением подобного предположения является реакция задержки взаимодействия мАТ с соответствующим клоном в присутствии использованного антигена (нижняя таблица). Получение мАТ к антигенраспознающему рецептору Т-клеток создало условия для его полноценного изучения
а-цепь p-цепь
Рис. 3.13. Cipymypa шпигенржяюзшиощего рецептора Т-клеток.
Т-клеточный антигенраспознающий рецептор (ТКР) представляет собой гетеродимер, составленный из а- и p-цепей. Каждая цепь включает два домена: вариабельный (V) и константный (С). Взаимодействующие Va- и Vp-домены формируют антигенраспознающий участок ТКР. Помимо основных V- и С-доменов в структуре ТКР имеется шарнирная область с цистеиновым остатком, образующим ковалентную связь между а- и p-цепями, а также трансмембранный и короткий хвостовой участки
генраспознающих структур (табл. 3.2). При общем сходстве организации и рекомбинации генетического материала для иммуноглобулинов и ТКР следует отметить и некоторые особенности в контроле специфичности этих молекул.
Иммуноглобулины и иммуноглобулиновые рецепторы В-клеток распознают нативные антигенные эпитопы. В связи с этим отдельные участки антигенраспознающего центра имеют равные шансы на изменчивость. Ситуация с ТКР несколько иная, поскольку этот рецептор распознает комплекс антигенного пептцца с молекулами МНС.
Разнообразие ТКР связано в значительной степени с третьей петлей V-домена, формируемой третьим гипервариабельным участком — CDR3 (сокр. от англ, “complementarity determining region”). При образовании антигенсвязывающего центра V-доме-нами а- и [3-цепей CDR3 оказываются во внутренней части этого центра. Первая и вторая петли (CDR1 и CDR2, соответственно) занимают периферию центра. В таком конформационном построе-
L Vi L Уг L V100 Ji 4г Jso C
гены а-цепи
I Ж
Рис. 3.14. Организация генов, контролирующих а- и p-цени Т-клегочного рецептора.
Принцип реорганизации генных сегментов, контролирующих а- и p-цепи ТКР, тот же, что и для иммуноглобулинов. Отличие состоит в том, что локус для p-цепи имеет два идентичных кластера. В чем функциональное знач ение такого дублирования, неизвестно
Таблица 3.2
Вариабельность Т-клеточных рецепторов в сравнении с иммуноглобулиновыми рецепторами и иммуноглобулинами
Генные сегменты Иммуноглобулины Т-клеточный рецептор
Н-цепь х-цепь В-цепь а-цепь
V 500 250 30 100
D 15 — 2 —
J 4 4 12 50
Включение погранич- 4 2 4 2
ных нуклеотидов
Число вариантов 120000 2000 2800 10000
Общая вариабсль- 2,4-108 2,9-107
ность
нии имеется вполне определенный биологический смысл, связанный с адаптацией ТКР к той форме антигена, с которой он взаимодействует. Как уже отмечалось, антигенные пептиды заполняют пространство (щель), образованное а-спиральными структурами молекул МНС и таким образом оказываются в середине антигенного комплекса пепгид:МНС. Подобный комплекс характеризуется огромным множеством антигенных специфичностей, связанных с пептидами, и ограниченным разнообразием, свойственным молекулам МНС. В связи с подобной организацией иммуногенного комплекса следует ожидать повышенную изменчивость CDR3 и меньшую изменчивость CDR1 и CDR2. Изучение генетической организации генов для ТКР подтверждает подобную точку зрения. Так, ТКР имеет значительно меньшее по сравнению с иммуноглобулинами количество V-генов, определяющих специфичность CDR1 и CDR2, но, при этом увеличенное число J-сегментов, принимающих участие в кодировании CDR3 (см. табл. 3.2). На рис. 3.15 представлена упрощенная схема, иллюстрирующая взаимодействие CDR3 с пептидом и CDR1 и CDR2 — с а-спиральной последовательностью молекул МНС.
3.2.4. Антигенраспознающие рецепторы и сопутствующие белки в процессе активации Т-клеток
ТКР, как и мембранный, антигенраспознающий иммуноглобулин В-клеток, имеет очень короткий цитоплазматический хвост. В связи с этим сигнал от взаимодействия ТКР с комплексом пептид: молекулы МНС не может быть передан внутрь клетки. Трансмиссивную функцию выполняют инвариантные, низкомолекулярные, ассоциированные с ТКР белки, которые получили общее название — CD3. Комплекс CD3 включает пять белков: три белка CD3y, CD36 и CD3e, представленных на клеточной поверхности и имеющих определенную гомологию с иммуноглобулинами, и два 104
Антигенраспознающий участок
Комплекс пептида с молекулой I или Н класса
Рис. 3.15. Пришил структурных отношений между гипервариабельными участками Т-клеточного антигенраспознающего рецептора и комплексом пептид:молекулы главного комплекса гистосовместимости.
Гипервариабельные участки ТКР конформаци-онно организованы так, что наиболее вариабельный регион (CDR3) локализован в середине антигенраспознающего участка. При этом распознаваемый тид также находится в середине комплекса между а-спиральными последовательностями молекул МНС. Подобная конформационная особенность обеспечивает наиболее эффективное распознавание пептида в комплексе
цитоплазматических белка — CD3? и CD3n, не имеющих такой гомологии (рис. 3.16).
Белки, гомологичные иммуноглобулинам, экспрессируются на клеточной поверхности в виде гетеродимеров CD3e5 и СПЗ^. Их связь с ТКР осуществляется посредством электростатического притяжения. Отрицательно заряженные трансмембранные участки цепей CD3 взаимодействуют с несущими положительный суммарный заряд трансмембранными участками ТКР. Наличие длинного хвоста позволяет им взаимодействовать с цитоплазматическими белками-трансдукторами после получения антигенного сигнала.
Два других полипептида — CD3^ и CD3n — также входят в состав комплекса в виде димеров или £т]. Около 80% ТКР ассоциировано с гомодимером и только 20% — с гетеродимером. Функциональные различия между ними неизвестны. Основной домен этих белков в отличие от других СОЗ-белков находится в цитоплазме. Именно головная, а не хвостовая часть £ и г] взаимодействует в цитоплазме с белками-трансдукторами.
Помимо сигналпередающей функции, белки CD3 ответственны за транспорт ТКР к клеточной поверхности. У мутантных клеток, в которых отсутствует синтез у-, 5- или е-цепей, экспрессия ТКР полностью подавлена, хотя внутриклеточный синтез этих рецепторов не нарушен. При мутациях гена £-цепи выход ТКР на клеточную поверхность происходит в меньшей степени по сравнению с нормой.
ТКР
Рис. 3.16. Строение Т-клеточного аитигенраспознжицего комплекса.
Комплекс включает Т-клеточный антигенраспознающий рецептор (ТКР) и пять однодоменных инвариантных белков: у, 6, е находятся на поверхности клетки; С и т] погружены в цитоплазму; т] не отмечен на рисунке; у, 8, в, имеющие удлиненный цитоплазматический хвост, служат для передачи сигнала внутрь клетки после взаимодействия ТКР с антигеном
Как трансмиссивная, так и транспортная функции СВЗ-бел-ков гомологична той, которая характерна для Iga- и Igp-белков иммуноглобулинового, антигенраспознающего комплекса.
В активации Т-клеток, распознавших антиген, также принимают участие CD4 и CD8 — маркеры дифференцировки Т-клеток. Как уже отмечалось, первый из них является маркером CD4 Т-клеток, второй — цитотоксических Т-лимфоцитов (CD8 Т-клеток). Долгое время функция этих белков оставалась неизвестной. Оказалось, что они принимают самое непосредственное участие в процессе взаимодействия ТКР с соответствующим лигандом в качестве корецептора.
CD4 представляет собой одноцепочечную молекулу, состоящую из четырех иммуноглобулинподобных доменов (рис. 3.17). Домены D| и D2, а также D3 и D4 образуют между собой парные, плотноупакованные, жесткие структуры. Эти пары соединены гибким шарнирным участком. Хвостовая часть молекулы CD4 имеет достаточную длину для взаимодействия с цитоплазматическими белками-трансдукторами. На клеточной поверхности ТКР и CD4 представлены независимо друг от друга. Их встреча происходит в процессе формирования ответа на антиген. После распознавания 106
АПК
Рис. 3.17. Распознавание CD4 Т-клеткями комплекса пе|ицд:молекулы II класса.
После распознавания ТКР-комплекса пептид:молекула II класса МНС в реакцию взаимодействия вступает корецептор CD4. Взаимодействие происходит между Pj-доменом молекулы II класса и Вгдомена корецептора CD4. Корецептор имеет достаточно длинный цитоплазматический хвост, который передает сигнал о взаимодействии ТКР с антигенным комплексом внутрь клетки
ТКР антигенного комплекса происходит взаимодействие CD4 с молекулой II класса МНС. Реакция взаимодействия осуществляется между 02-Доменом молекулы II класса МНС и первым доменом CD4. Предполагается также слабое включение во взаимодействие и второго домена — Dj .
Аналогичная картина наблюдается при распознавании антигенного комплекса цитотоксическими Т-лимфоцитами. Действующие участники взаимодействия: ТКР цитотоксических Т-лим-фоцитов, комплекс пептида с молекулой I класса МНС и маркер цитотоксических Т-лимфоцитов — CD8 (рис. 3.18). CD8, хотя и выполняет сходную с CD4 функцию корецептора, структурно отличается от маркера Т-хелперов. Он представляет собой гетеродимер, каждая цепь которого включает один иммуноглобулинподоб-ный домен и достаточно длинный, связанный с мембраной участок цепи, который подвержен значительным конформационным изменениям. Также как и CD4, CD8 представлен на клеточной мембране независимо. Его функция корецептора реализуется в процессе антигенного распознавания. После взаимодействия ТКР
АПК
Рис. 3.18. Распознавание цитотоксическими Т-клеткями (CD8 Т-клетками) комплекса пеигид: молекулы 1 класса.
В процесс распознавания вступают ТКР и корецептор CD8. CD8 взаимодействует своими а- и 0-доменами с аз-доменом молекулы I класса МНС. CD8, как и CD4, имеет относительно длинный цитоплазматический хвост, что позволяет ему передавать сигнал о взаимодействии внутрь клетки
с антигенным лигандом происходит контакт а- и р-доменов CD8 с абдоменом молекулы I класса МНС. Образовавшийся молекулярный комплекс является условием передачи через корецептор CD8 сигнала внутрь клетки.
Внутриклеточные события, определяющие активацию Т-клеток, аналогичны тем, которые происходят в В-клетках после антигенной стимуляции. Образовавшийся агрегат из антигенпредстав-ляющих молекул МНС, Т-клеточного рецепторного комплекса, включающего CD3 молекулы, CD4 или CD8 молекул, провоцирует внутриклеточное взаимодействие различных тирозинкиназ с цитоплазматической частью полипептидов. Среди СОЗ-белков наибольшей связывающей активностью обладает CD3?, представленный в цитозоле не хвостовой, а головной частью. Активированные в результате взаимодействия киназы обеспечивают каскад реакций, следствием которых является индукция специфической транс-108
крипции генов. Среди генов, вступивших в процесс транскрипции, особое место занимают те, которые кодируют синтез Т-за-висимых цитокинов, ИЛ-2 в частности. В конечном счете цепь событий от взаимодействия ТКР с антигенным комплексом и образования сложного молекулярного агрегата до внутриклеточных реакционных преобразований приводит к пролиферации и дифференцировке Т-клеток до зрелых, функционально активных цитотоксических Т-лимфоцитов, или Т-хелперов.
Заключение
В- и Т-клетки обладают самостоятельными антигенраспоз-нающими рецепторами, относящимися к одному и тому же суперсемейству иммуноглобулинов. Антигенраспознающие рецепторы В-клеток представляют собой мономерную форму IgM, модифицированную дополнительной последовательностью аминокислотных остатков в С-концевой части молекулы. Эта последовательность составляет трансмембранный и хвостовой участки тяжелой цепи. T-Клеточный антигенраспознающий рецептор (ТКР) состоит из двух полипептвдных цепей, каждая из которых включает два домена: V и С. Механизм генетического контроля V-доменов, как sig, так и ТКР, в целом сходен и включает процесс случайной рекомбинации идентичных генных сегментов (V, D, J). Несмотря на то/ что функциональное предназначение антигенраспознаю-щих рецепторов двух типов клеток одно и то же — распознавание чужеродности, реализация такой функции В- и Т-клетками осуществляется разными способами. В то время как sig В-клеток распознает собственно антигенную детерминанту без каких-либо дополнительных условий, ТКР Т-клеток способен распознать только комплекс антигенной детерминанты с собственными молекулами I или II классов МНС.
Глава 4. ЦИТОКИНЫ
Введение
При изучении дифференцировки иммунокомпетентных клеток и механизмов межклеточного взаимодействия, формирующих клеточный и гуморальный иммунный ответ, была открыта большая труппа медиаторов белковой природы, названных в последующем цитокинами. Известно более 30 цитокинов. Для некоторых из них получены генноинженерные аналоги.
Основная биологическая активность цитокинов — регуляция иммунного ответа на всех этапах его развития: пролиферация и дифференцировка предшественников функционально активных иммунокомпетентных клеток, переработка и презентация антигена в иммуногенной форме на поверхности фагоцитирующих мо-нонуклеаров, пролиферация антигенчувствительных лимфоцитов, дифференцировка В-клеток в продуценты иммуноглобулинов, переключение синтеза иммуноглобулинов с одного изотипа на другой, обеспечение созревания предшественников цитотоксических Т-клеток до зрелых эффекторов, индукция цитотоксичности у макрофагов. Некоторые из цитокинов активно участвуют в воспалительной реакции и острофазном ответе, проявляющих себя в элиминации опухолевых клеток.
По структурным особенностям и биологическому действию все цитокины делятся на несколько самостоятельных групп: гемопоэтины, интерфероны, цитокины суперсемейства иммуноглобулинов, цитокины ФНО-семейства, хемокины. Изученность цитокинов, составляющих различные группы, неодинакова. Наиболее полная информация получена для цитокинов трех групп: гемопоэтинов, интерферонов и цитокинов ФНО-семейства.
4.1. ИНТЕРЛЕЙКИН-1
Экспериментально давно установлено, что одним из основных факторов, обеспечивающих пролиферацию культивируемых лимфоцитов, является интерлейкин-1 (ИЛ-1), который синтезируется макрофагами. Имеется две формы данного цитокина: ИЛ-1а и ИЛ-ip с мол. массой 17 кД, которые контролируются самостоятельными, неаллельными, близкосцепленными генами. В по-липептидной части ИЛ-1а содержится 159 аминокислотных остатков, в ИЛ-1р — 153 таких остатка. Доминирующей формой у человека является ИЛ-ip, в то время как у мышей — ИЛ-1а. Изучение структуры данного цитокина выявило отсутствие у цитоплазматического предшественника лидерных N-пептидов или каких-либо гидрофобных участков в иных местах полипептидной цепи, необходимых для прохождения через мембрану. Возможно, предшественникам ИЛ-1 в цитоплазме оказывается помощь какими-то по
(пока неизвестными) гидрофобными белками, выполняющими, помимо основной функции, роль “извозчика” для этого цитокина. Методами рентгеноструктурного анализа установлено, что ИЛ-1 представляет собой глобулу, N- и С-концевые последовательности которой находятся в пространственной близости. Именно эти концевые участки молекулы формируют центр, взаимодействующий с соответствующим рецептором.
Основным источником продукции ИЛ-1 являются фагоцитирующие мононуклеары различной тканевой локализации: макрофаги и моноциты периферичекой крови и перитонеального экссудата, купферовские клетки печени, клетки Лангерганса в эпидермисе, клетки микроглиии нервной ткани. Активными продуцентами ИЛ-1 являются также эндотелиоциты. Кроме того, способностью секретировать данный цитокин обладают Т- и В-лим-фоциты, фибробласты, НК-клетки, кератиноциты, нейтрофилы.
Покоящиеся макрофаги, как и другие клеточные источники цитокина, не продуцируют ИЛ-1 и не содержат его мРНК. Экспрессия гена ИЛ-1 с образованием биологически активного белка начинается только после активации клеток различными индукторами (табл. 4.1). Среди набора веществ, вызывающих продукцию ИЛ-1, наиболее активны компоненты клеточной стенки бактерий и цитокины, появляющиеся в очаге воспаления в ходе развития защитной реакции.
Таблица 4.1
Стимуляторы продукции интерлейкина-1
Группа Вещества
Компоненты клеточной стенки бактерий липополисахариды, пептидогликаны, мурамил-дипептид, белок А стафилококка
Стимуляторы фагоцитоза частицы кремния, зимозан, латекс
Компоненты иммунной системы аллергены, гетерологичные антигены, иммунные комплексы, агрегированный IgA, IgE, рецептор для IgE (CD23), компоненты комплемента СЗа, С5а
Цитокины ИЛ-1, ИЛ-2, ИЛ-6, ФИО, ИНФ, ГМ-КСФ
Химические соединения форболмиристатацетат, форболмиристатацетат + ионофор, полимиксин В, сапонин, декстрансульфат
Физические факторы УФ-облучение, прилипание к пластику
Другие биологически активные соединения амилоид Р, тромбин, лейкотриен
Примечание. Таблица с некоторыми изменениями приводится по работе СА. Кетлинского с соавт. (1992).
Биологическая активность ИЛ-1 реализуется через взаимодействие с рецепторами, представленными на поверхности клеток-мишеней. Рецепторы к ИЛ-1 имеют мол. массу 80 кД. Внеклеточная, связывающая часть рецептора содержит 319 аминокислотных остатка, организованных в три иммуноглобулинподобные домены, что позволяет отнести этот белок к иммуноглобулиновому суперсемейству. Для данного типа рецепторов сигнал внутрь клетки передается с помощью сериновой протеинкиназы, взаимодействующей с цитоплазматическим хвостом рецептора.
Набор различных типов клеток,несущих рецепторы к ИЛ-1, крайне велик и распространяется фактически по всем системам организма (табл. 4.2.).
Одно из наиболее существенных свойств ИЛ-1 — это стимуляция пролиферации антигенчувствительных Т-лимфоцитов. Сам по себе ИЛ-1 не является фактором роста для Т-лимфоцитов. Механизм его действия заключается в индукции синтеза ИЛ-2 и ИЛ-4 — ростовых факторов, секретируемых Т-хелперами. Кроме того, ИЛ-1 усиливает экспрессию рецепторов к ИЛ-2 и ИЛ-4, что создает условия для аутокринной регуляции пролиферации Т-хелперов. Наибольшая стимулирующая активность ИЛ-1 связана с теми Т-хелперами, которые продуцируют ИЛ-4 (Тн2).
Особое значение для понимания процессов внутритимусной дифференцировки лимфоцитов является способность ИЛ-1 значительно усиливать пролиферацию тимоцитов, стимулированных субоптимальной дозой митогена.
Важным для развития иммунного ответа является ростсти-мулирующее действие ИЛ-1 на В-клетки. Активированные специфическим антигеном или митогеном В-клетки отвечают усиленной пролиферацией под влиянием данного цитокина. Однако как и в случае с Т-хелперами, это стимулирующее действие опосредуется через активацию экспрессии рецептора к другому цитокину — ИЛ-2. Также опосредовано участие ИЛ-1 в дифференцировке В-лимфоцитов. Сам по себе он не обладает дифференцирующей активностью, но обеспечивает трансформацию примирован-ных клеток в антителопродуценты в сочетании с другими цитокинами.
ИЛ-1 помимо участия в специфическом иммунном реагировании выступает в качестве одного из главных медиаторов, ответственных за развитие неспецифических форм защиты — формирования местной воспалительной реакции и острофазного ответа на уровне организма при инфекционном поражении. На это обстоятельство прямо указывают те биологические эффекты, которые отмечены в табл 4.2.
Таблица 4.2
Биологическое действие интерлейкина-1
Мишень Биологические эффекты
Т-хелперы комитогенная активность, усиление экспрессии
В-клетки рецепторов к ИЛ-2, увеличение продукции ИЛ-2, ИЛ-4, ИФН-у, ГМ-КСФ, стимуляция хемотаксиса стимуляция пролиферации преактивированных
Макрофаги антигеном клеток, усиление экспрессии рецептора к ИЛ-2 и антигенов 11 класса МНС стимуляция фагоцитоза, хемотаксиса, цитоток-
НК-клетки сичности; генерация супероксидантов, увеличение экспрессии антигенов II класса МНС, стимуляция продукции ИЛ-1, ИЛ-6, ФНО усиление цитотоксичности, экспрессии рецептора
Нейтрофилы к ИЛ-2, продукции ИЛ-2 и ИФН-у усиление хемотаксиса и дегрануляции, индукция
Фибробласты супероксидантов (прямое действие не доказано) усиление пролиферации, индукция синтеза ИЛ-6,
Базофилы и тучные КСФ, ИФН-Рь пге2 индукция выброса гистамина
клетки
Клетки костного мозга усиление пролиферации полипотентных предше-
Клетки периферической ственников гемопоэза в сочетании с КСФ увеличение числа циркулирующих нейтрофилов
крови
Клетки эндотелия стимуляция пролиферации, изменение экспрес-
Клетки костной и хря- сии поверхностных эндотелиальных антигенов, усиление адгезии различных клеток на эндотелии стимуляция продукции хондроцитами протеаз,
щевой ткани увеличение продукции ПГЕ2, усиление пролифе-
Клетки мышечной ткани рации синовиальных фибробластов и хондроцитов, резорбция хряща и кости протеолиз мышц, стимуляция продукции ПГЕ2
Клетки печени увеличение секреции СЗ-компонента комплемен-
Клетки мозга та и фактора В, снижение синтеза альбумина усиление продукции ПГЕ2 и АКТГ в гипоталаму-
Клетки поджелудочной се, индукция медленноволнового сна, снижение аппетита, усиление пролиферации клеток астроглии разрушение р-клеток островков Лангерганса
железы
Опухолевые клетки разрушение клеток
Примечание. Приводится с некоторыми изменениями по работе С.А. Кетлинского с соавт. (1992).
4.2. ИНТЕРЛЕЙКИН-2
Одним из первых был обнаружен цитокин интерлейкин-2 (ИЛ-2). В середине 60-х годов было показано, что культура стимулированных митогеном или антигеном лимфоцитов накапливает в надосадочной жидкости фактор, который значительно усиливает пролиферацию свежевыделенных лимфоцитов периферической
крови in vitro. Особый интерес вызвал тот факт, что надосадок от культуры стимулированных лимфоцитов способен длительное время поддерживать пролиферацию интактных Т-клеток и обеспечивать функциональную активность клонов таких клеток. Активным соединением в культуральной жидкости стимулированных лимфоцитов оказался цитокин Т-клеточной природы, названный первоначально Т-клеточным ростовым фактором.
ИЛ-2 представляет собой мономерный гликопротеин с мол. массой 14,6 кД, включающий 133 аминокислотных остатка. По данным изоэлектрофокусирования, данный белок представлен несколькими биологически активными формами, отличающимися друг от друга зарядом в связи с разной степенью гликозилирования молекул в посттрансляционный период. ИЛ-2 человека кодируется одним геном, включающим 6684 пары нуклеотидов, и состоит из 4 экзонов и 3 интронов.
Формирующийся в процессе трансляции предшественник ИЛ-2 содержит 153 аминокислотных остатка, 20 из которых образуют сигнальную последовательность, отсутствующую у зрелой молекулы. Полипептид имеет одну внутримолекулярную дисульфидную связь в положениях 58-105, которая играет ключевую роль в создании биологически активной конформации молекулы. Замена цистеина на серин хотя бы в одном положении приводит к полной потере биологической активности ИЛ-2. Место связывания с рецептором к данному цитокину расположено на участке цепи, включающем аминокислотные остатки 1-58. Предполагается наличие второго участка связывания с последовательностью 106-115, однако оценка вклада этого участка во взаимодействие с рецептором требует дополнительной информации.
Основными продуцентами ИЛ-2 являются Т-хелперы. Субпопуляция данного клеточного типа неоднородна по такому показателю как синтез различных цитокинов. Тем не менее, приблизительно 75% ее клеток синтезируют именно ИЛ-2. Около 20% цитотоксических Т-клеток также способны к продукции данного цитокина. На синтез ИЛ-2 в этих клетках влияют не только антигены или митогены, но и ряд других биологически активных соединений. Так, определенные цитокины (ИЛ-1, ИЛ-6, ФНО, ИФН), продуцируемые другими классами клеток, стимулируют продукцию ИЛ-2 у преактивированных антигеном Т-клеток. Гормоны тимуса (тимозин, сывороточный фактор тимуса) обеспечивают дифференцировку незрелых тимоцитов в клетки-продуценты ИЛ-2. Ионофоры, увеличивающие уровень внутриклеточного Са2+, также усиливают продукцию данного цитокина.
Мишенями регуляторного действия ИЛ-2 являются различные субпопуляции Т-клеток, В-клетки, натуральные киллерные 114
клетки, макрофаги (рис. 4.1). Все эти клетки имеют соответствующий рецептор для восприятия сигнала от ИЛ-2. Рецептор построен из трех нековалентно связанных полипептидов: CD25, CD122, ИЛ-2Ру. Первые два из них изучены достаточно полно. Третий открыт недавно и требует дополнительного изучения. Полипептид CD122 с мол. массой 75 кД в отличие от CD25 постоянно представлен на клеточной поверхности Т-клеток и натуральных киллеров. На первом этапе происходит взаимодействие ИЛ-2 именно с CD122. Поскольку этот рецепторный полипептид имеет достаточно большой цитоплазматический хвост, сигнал от взаимодействия легко проходит внутрь клетки. В результате получения сигнала клетка активируется, что проявляется, в частности, в усилении ее пролиферации. Второй рецепторный полипептид (CD25, мол. масса 55 кД) в покоящихся клетках либо отсутствует на клеточной поверхности, либо его крайне мало. Его полноценная экспрессия начинается после стимуляции клетки ИЛ-2. Данный белок имеет слишком короткий, включающий всего 13 аминокислотных остатков, цитоплазматический хвост и в силу этого не способен связыоаю тирозинкиназы и передавать сигнал внутрь клетки. Функция вто-
ИЛ-2
ИЛ-1, ИЛ-6, ФНО.ИФН
антигены, митогены
Рис. 4.1 .Индукторы, клетка-продуцент и клетки-мишени интерлейкина-2.
Основными клетками-продуцентами интерлейкина-2 (ИЛ-2) являются хел-перные Т-клетки (Гц), которые начинают активную продукцию цитокина под влиянием антигенов, митогенов (сплошные стрелки) или других цитокинов (пунктирные стрелки). Мишенями ИЛ-2 являются Т-клетки воспаления (Тн 1), хелпер-ные Т-клетки (Тн2), цитотоксические Т-клетки (ЦТЛ), В-клетки (В-кл.), натуральные киллеры (НК), макрофаги (МФ)
рого полипептида состоит в усилении аффинности всего рецепторного комплекса. Собственная аффинность CD25 низкая и характеризуется константой диссоциации (КД), равной ЮЛ КД при взаимодействии полипептида CD 122 с ИЛ-2 отличается на порядок и составляет 10’. При образовании единого ре ;ептора из двух полипептидов резко повышается эффективность связывания ИЛ-2 с клеткой. КД в этом случае равна 10'11. Наличие на клеточной поверхности всего 1-2 тыс. таких высокоаффинных гетеродимерных рецепторов обеспечивает полноценный ответ клеток на очень низкие физиологические дозы ИЛ-2.
Основным результатом действия ИЛ-2 на покоящиеся или стимулированные антигеном или митогеном клетки является обеспечение их пролиферации. Именно эта биологическая активность ИЛ-2 определяет его как типичный ростовой фактор клеток лимфо-миелоидного комплекса.
4.3. ИНТЕРЛЕЙКИН-3
Интерлейкин-3 (ИЛ-3) — ростовой и дифференцирующий фактор для наиболее ранних предшественников кроветворных кле-ток.Он представляет собой сильно гликозилированный белок с мол. массой 23-28 кД. Эти колебания в весе молекул ИЛ-3 обусловлены разным количеством углеводов (в основном сиаловых кислот), связанных с полипептидом. Молекулярная масса пептидной части, включающей 133 аминокислотных остатка, составляет 14,6 кД.
Сравнительное изучение аминокислотной последовательности ИЛ-3 человека и мыши выявило значительную степень гомологии между ними, равную 29%, и отсутствие такой гомологии с другими цитокинами (ИЛ-2,ГМ-КСФ, ИФН-у).
Основными продуцентами ИЛ-3 являются активированные Т-хелперы, некоторая часть цитотоксических Т-лимфоцитов и эпителиальные клетки тимуса. Для исследовательских целей используют моноцитарную линию клеток WEHI-3B, которая синтезирует ИЛ-3 без стимуляции митогеном и в отличие от Т-лимфоцитов не продуцирует другие цитокины.
В опытах, главным образом in vitro, были продемонстрированы ростстимулирующие и, что особенно важно, дифференцирующие свойства ИЛ-3. Данный цитокин способствует образованию различных фенотипически хорошо определяемых клеток из ранних предшественников всех гемопоэтических ростков дифференцировки: лимфоидного, моноцитарного, гранулоцитарного, ме-гакариоцитарного, эритроидного. Особо следует отметить дифференцирующее влияние ИЛ-3 на ранние предшественники Т-лимфоцитов. В результате подобного влияния незрелые Thy-1“ пре-Т-
клетки трансформируются в Thy-1+ Т-лимфоциты. Данный цитокин принимает участие и в дифференцировке пре-В-клеток до стадии, когда они начинают экспрессию поверхностного иммуноглобулина.
Следует подчеркнуть, что ИЛ-3 не обладает выборочностью по отношению к ранним предшественникам различных линий дифференцировки клеток лимфомиелопоэза. Неслучайно его первоначальное название — мультипотентный колониестимулирующий фактор.
4.4. ИНТЕРЛЕЙКИН-4
Началом изучения интерлейкина-4 (ИЛ-4) был экспериментально установленный факт усиления пролиферации активированных В-клеток под влиянием культуральной среды от Т-клеточной линии EL-4.
Обнаруженный цитокин, как и два предыдущих, относится к группе гемопоэтинов. Он представляет собой мономер, включающий 129 аминокислотных остатков. В силу разной степени гликозилирования молекулярная масса этого цитокина колеблется от 18 до 22 кД.
Особенность ИЛ-4, отличающая его от других цитокинов, состоит в наличии видовой специфичности. ИЛ-4 человека оказывает биологическое действие на клетки человека и обезьян, но не мышей. В свою очередь ИЛ-4 мыши действует только на клетки мышей.
Источником ИЛ-4 являются Т-хелперы, стимулированные митогеном, тучные клетки, неидентифицированные клетки стромы костного мозга (рис. 4.2).
Рецепторы к ИЛ-4 с мол. массой 139 кД представлены на поверхности клеток-мишеней. При этом их количество увеличивается в 5-10 раз при той или иной форме активации клеток. Мишени регуляторного действия ИЛ-4, имеющие соответствующие рецепторы, относятся к самым разнообразным клеточным типам: различные субпопуляции Т-клеток, В-клетки, макрофаги, фибробласты, НК-клетки, тучные клетки, костномозговые предшественники гемопоэза.
По отношению к В-клеткам ИЛ-4 выступает в качестве ко-стимулятора пролиферации. Он не оказывает какого-либо влияния на покоящиеся В-клетки, однако достаточно подействовать на них одним из специфических для данных клеток индуктором активации, чтобы проявилось биологическое действие ИЛ-4: резкое повышении пролиферации данного типа клеток. Известна также способность ИЛ-4 повышать уровень продукции IgE. Предположительно это происходит за счет усиления пролиферации клона кле-
Рис. 4.2. Клетки-продуценты клетки-мишени иигерлейкина-Д.
Основной клеткой-продуцентом интерлейкина-4 (ИЛ-4) является хелпер-ная Т-клетка. Клетки-мишени — это широкий набор как зрелых клеток, так и клеток, находящихся на наиболее ранних стадиях гемопоэза. Сокращения те же, что на рис. 4.1
ток, продуцирующих данный класс иммуноглобулинов. При этом, чтобы такой клон ответил усилением продукции иммуноглобулинов, во всех случаях необходима предварительная специфическая (антигеном) или неспецифическая (митогеном) стимуляция отвечающих клеток.
Первоначально ИЛ-4 был описан как В-клеточный ростовой фактор I (ВКРФ-1). В последующем выяснилось, что он способен усиливать пролиферацию и Т-клеток, относящихся к различным субпопуляциям. Его действие на Т-клетки, как и на В-клетки проявляется только после предварительной их активации антигеном или митогеном.
По своей природе ИЛ-4 выступает в качестве плейотропного регулятора, так как взаимодействует с самыми разнообразными типами клеток. Так, его действие на макрофаги проявляется в усилении экспрессии антигенов II класса МНС и Fc-рецептора для IgG, приобретении противоопухолевой активности по отношению к фибросаркоме, усилении антигенпредставляющей функции.
Участвует ИЛ-4 и в развитии костномозговых клеток-предшественников. Один ИЛ-4 не изменяет интенсивность пролиферации этих клеток, но усиливает митотические процессы в сочетании с другими ростовыми факторами. Тандем ИЛ-4 с гранулоцитарным колониестимулирующим фактором (Г-КСФ) обеспечивает более активное размножение клеток гранулоцитарного и мо-118
ноцитарного ростков дифференцировки, с эритропоэтином — эритроидных предшественников, с ИЛ-1 — клеток-предшественников мегакариоцитарного пути развития.
4.5. ИНТЕРЛЕЙКИН-5
При изучении функции Т-хелперов как регуляторов иммунного ответа было выяснено, что помимо ИЛ-2 и ИЛ-4 клетки данной субпопуляции продуцируют еще один ростовой фактор В-кле-ток. Этот фактор в момент его открытия получил название В-кле-точного ростового фактора II в отличие от описанного в предыдущем разделе В-клеточного ростового фактора I (ИЛ-4). Современное обозначение рассматриваемого цитокина — интерлейкин-5 (ИЛ-5).
ИЛ-5 представляет собой гомодимер с мол. массой 45-50 кД. Как и в случаях с уже упомянутыми цитокинами, его колебания связаны с разной степенью гликозилирования белка, синтезируемого в различных типах клеток. Пептидная часть одной цепи включает 115 аминокислотных остатков. Мономерная и димерная формы ИЛ-5 обладают сходной функциональной активностью. Изучение полной аминокислотной последовательности ИЛ-5 мыши и человека выявило высокую степень гомологии между сравниваемыми белками, равную 70%.
Основными продуцентами данного цитокина являются Т-хелперы, стимулированные митогеном или антигеном, причем продукция ИЛ-5 значительно выше в случае использования специфического для примированных лимфоцитов антигена. Покоящиеся клетки не экспрессируют ген для ИЛ-5, и синтез цитокина отсутствует.
Одной из мишеней действия ИЛ-5 является активированная специфическим антигеном или митогеном В-клетка. Усиление пролиферации В-клеток под влиянием данного цитокина во многом связано с его способностью индуцировать экспрессию рецептора к ИЛ-2 на этих клетках. Кроме стимуляции пролиферации ИЛ-5 значительно усиливает продукцию иммуноглобулинов В-клетками, активированными специфическим антигеном или митогеном. Отличительной особенностью ИЛ-5 является его способность инициировать синтез IgA.
Действие данного цитокина затрагивает и Т-клетки. В присутствии ИЛ-2 он вызывает генерацию цитотоксических Т-лимфоцитов.
Помимо влияния на клетки иммунной системы ИЛ-5 проявляет свою активность и в отношении миелоидных клеток. Мишенью его регуляторного действия являются, в частности, эозинофилы. Этот цитокин избирательно стимулирует пролиферацию и
дифференцировку костномозговых предшественников эозинофилов. Кроме того, под влиянием ИЛ-5 увеличивается продукция супероксидантов и усиливается хемотаксис данных типов клеток.
4.6. ИНТЕРЛЕЙКИН-6
По многообразию клеточных источников продукции и мишеней биологического действия интерлейкин-6 (ИЛ-6) является одним из наиболее активных цитокинов, участвующих в реализации иммунного ответа и воспалительной реакции.
Секретируемый ИЛ-6 состоит из 184 аминокислотных остатков и имеет мол. массу 21 кД. Как и в случае с другими цитокинами, в зависимости от степени гликозилирования наблюдается гетерогенность ИЛ-6 по молекулярной массе.
Биологическое действие ИЛ-6 на клетки реализуется через взаимодействие с рецептором, который представляет собой мономер, включающий 468 аминокислотных остатков. Он имеет участок из 90 аминокислот, последовательность которых гомологична определенным доменам иммуноглобулинов. Это обстоятельство позволяет отнести весь рецептор к суперсемейству иммуноглобулинов. В отличие от рецепторов к другим цитокинам рецептор к ИЛ-6 обладает значительным цитоплазматическим хвостом, включающим 82 аминокислотных остатка. Однако этот цитоплазматический домен не участвует в передаче сигнала внутрь клетки после взаимодействия с соответствующим лигандом, так как в его составе отсутствуют места связывания тирозинкиназ. Вероятно, имеется дополнительный полипептид (или полипептиды), образующий с основным рецепторным белком комплекс, который и приобретает трансмиссивную функцию. Взаимодействие ИЛ-6 со своим рецептором характеризуется высоким сродством; KD равна 31010. Число рецепторов, экспрессирующихся на клеточной поверхности, варьирует в зависимости от типа клеток. В среднем оно составляет около 1,5 тыс. молекул на одну клетку.
Источником рассматриваемого цитокина являются многие типы клеток: Т-хелперы, моноциты-макрофаги, фибробласты, эндотелиальные клетки, кератиноциты (рис. 4.3). Активный синтез ИЛ-6 начинается сразу после воздействия на клетки бактерий, вирусов, митогенов, различных медиаторов. Быстрая и выраженная реакция на всю эту многообразную группу эндогенных и экзогенных веществ указывает на то, что данный цитокин относится к категории ранних медиаторов. Подобное свойство имеет особое значение в быстром формировании реакции организма на внедрение чужеродных патогенов или при повреждении тканей.
Спектр биологического действия ИЛ-6 достаточно широк и реализуется не в увеличении пролиферации клеток-мишеней, а в
Т-хелпер ЦТЛ В-клетка Фибробласт Кпепса-предшвст-Гепатоцит веянии КМ
Рис. 4.3. Индукторы, клетки-продуценты и клетки-мишени иитерлейкина-6.
Интерлейкин-6 (ИЛ-6) является одним из системных эндогенных цитокинов с широким набором как клеток-продуцентов, так и клеток-мишеней обеспечении дифференцировки этих клеток на поздних стадиях развития. Являясь костимулятором, данный цитокин подготавливает пролиферативный ответ Т-клеток на митоген или антиген, обеспечивает усиление продукции ИЛ-2 Т-хелперами, распознавшими антиген. В качестве дифференцирующего фактора ИЛ-6 определяет переход предшественников антигенспецифических ЦТЛ в зрелые эффекторы реакции клеточного лизиса. Показателем дифференцирующего действия ИЛ-6 является увеличение уровня сериновой эстеразы — маркера зрелых ЦТЛ. В условиях вирусного заражения ИЛ-6 усиливает экспрессию антигенов I класса МНС, способствуя тем самым, с одной стороны, более эффективной генерации ЦТЛ, а с другой — подготовке вирусинфицированных клеток к цитолитическому действию зрелых ЦТЛ.
Дифференцирующая активность ИЛ-6 проявляется и по отношению к В-клеткам. Не являясь индуктором пролиферации, он обеспечивает трансформацию подготовленных к синтезу антител клеток в активные их продуценты.
Активность ИЛ-6 по отношению к клеткам печени заключается в дерепрессии генов, контролирующих синтез белков острой
фазы при воспалительных реакциях. Кроме того, ИЛ-6 обладает пирогенными свойствами, а также, действуя на клетки мозга, способствует выбросу АКТГ.
Совокупность свойств ИЛ-6 как фактора дифференцировки ставит его в единый ряд с наиболее важными эндогенными регуляторами иммунных и воспалительных процессов в организме.
4.7. ИНТЕРЛЕЙКИН-7
При изучении развития ранних предшественников В-клеток был обнаружен еще один цитокин, продуцируемый стромальными элементами костного мозга. Он получил название интерлейкин-7 (ИЛ-7). У мышей этот цитокин представляет собой гликопротеин с мол. массой 14,9 кД, содержащий 129 аминокислотных остатков. Положения 69 и 95 являются местами связывания углеводов. В молекуле цитокина имеются 6 цистеиновых остатков, образующих внутримолекулярные дисульфидные связи, которые определяют функционально активную конформацию ИЛ-7. Нарушение этих связей приводит к потере биологической активности цитокина.
Строение ИЛ-7 человека и мыши сходно между собой, но в цитокине человека между положениями 96 и 114 имеется вставка из19 аминокислот, которая не влияет на основную функцию белка. Изучение аминокислотной последовательности ИЛ-7 мыши и человека выявило высокую степень гомологии между сравниваемыми белками, равную 60%.
В пролиферативный ответ на действие ИЛ-7 вступают незрелые предшественники В-клеточного пути развития: npe-Bi и пре-В2. Клетки, более продвинутые в дифференцировке и начавшие экспрессию поверхностного иммуноглобулина, остаются инертными к воздействию цитокина (этапы дифференцировки В-клеток см. в гл. 8). Ростстимулирующая активность ИЛ-7 распространяется и на незрелые пре-Т-клетки костного мозга и тимуса.
Особенностями ИЛ-7, отличающими его от других цитокинов, являются ограниченность как тканевой локализации (клетки стромы костного мозга и, возможно, тимуса), так и направленности действия (незрелые формы В- и Т-клеточного пути развития).
4.8. ИНТЕРЛЕЙКИН-8
В отличие от описанных выше цитокинов интерлейкин-8 (ИЛ-8) относится к группе хемокинов, основное свойство которых — обеспечение хемотаксиса в зону воспаления различных типов клеток: нейтрофилов, моноцитов, эозинофилов, Т-клеток.
ИЛ-8 — небольшой гликопротеин с мол. массой 8,8 кД, вклю-1ающий 72 аминокислотных остатка. Пептидная часть цитокина содержит 4 цистеиновых остатка, образующих в молекуле две дисульфидные связи, которые формируют соответственно две петли. Какое-либо нарушение этих связей приводит к изменению конформации белка и потере его биологических функциий.
Клетками-продуцентами ИЛ-8 являются макрофаги, лимфоциты, эпителиальные клетки, фибробласты, клетки эпидермиса.
Как и другие цитокины, ИЛ-8 — индуцибельный белок. Его продукция начинается после воздействия на клетки митогенов, или эндогенных регуляторов: ИЛ-1,3, ФИО, ГМ-КСФ и др.
Основная функция ИЛ-8 — выступать в качестве хемоаттрактанта для нейтрофилов, макрофагов, лимфоцитов, эозинофилов. Помимо этого биологического действия, ИЛ-8 усиливает адгезивные свойства нейтрофилов, изменяя экспрессию интегринов и других соединений с адгезивными свойствами.Свойства ИЛ-8 вызывать миграцию клеток и способствовать их адгезии определяют его как активного участника острой воспалительой реакции в местах проникновения патогена.
4.9. ФАКТОР НЕКРОЗА ОПУХОЛЕЙ
При изучении различных продуктов, секретируемых активированными макрофагами, был получен фактор, который лизировал большой набор опухолевых клеток in vivo и in vitro. По основному биологическому эффекту он получил название — фактор некроза опухолей. В параллельных исследованиях из культур активированных Т-клеток выделили другой фактор, также обладавший литической активностью по отношению к чужеродным клеткам. По типу клеток, продуцирующих этот фактор, его стали обозначать как лимфотоксин. Детальное изучение этих факторов вскрыло близкое структурное и функциональное сходство между ними. Настоящее их наименование — факторы некроза опухолей аир (ФНО-аиФНО-р).
ФНО-а человека синтезируется в клетке в виде предшественника, включающего 233 аминокислотных остатка. Секреторная, лишенная лидерной последовательности форма состоит из 157 аминокислотных остатков и имеет мол. массу 17 кД.
Молекула ФНО-р, так же как и ФНО-а, синтезируется в клетке в виде предшественника, построенного из 247 аминокислотных остатков. Зрелая форма состоит из 171 аминокислоты и имеет мол. массу 18,66 кД.
ФНО-а человека, мыши и кролика имеют две аминокислотные последовательности: положения 45-69 и 105-133, характеризующиеся крайне высокой степенью гомологии — около 90%. Тако-
ва же степень гомологии по этим участкам между ФНО-а и ФНО-р. Эти факты заставляют предполагать, что отмеченные участки двух сравниваемых факторов являются их активными центрами в процессе лизиса клеток.
Гены ФНО-а и ФНО-р близко сцеплены между собой. Их разделяет фрагмент ДНК, включающий всего 1000 пар оснований. У человека эти гены локализованы на 6-й, а у мыши — на 17-й хромосоме и входят в состав генов МНС.
Покоящиеся клетки — макрофаги или лимфоциты — не продуцируют соответствующие ФНО. Их секреция начинается только после воздействия индуктора. Наиболее активными в этом отношении являются бактерии и компоненты их стенки.
Цитотоксическое действие ФНО на опухолевую клетку связано с деградацией ДНК и нарушением функционирования митохондрий. Литический эффект ФНО усиливается в присутствии интерферона. Один из механизмов синергического действия двух этих цитокинов состоит в усилении экспрессии рецепторов к ФНО на опухолевых клетках под влиянием интерферонов.
4.10. ДРУГИЕ ЦИТОКИНЫ
Помимо отмеченных выше имеется большая группа других цитокинов. Наиболее изученные из них представлены в табл 4.3. К ним относится в первую очередь семейство интерферонов (ИФН), которые не только обладают противовирусной активностью (по этому признаку они были открыты), но и принимают разностороннее участие в регуляции иммунного ответа (см., например, гл. 9). Крайне важным для миелопоэза вообще и формирования клеток иммунной системы, в частности, имеет гранулоцитарно-макрофагальный колониестимулирующий фактор (ГМ-КСФ).
Важен относительно недавно открытый интерлейкин-12, который продуцируется В-клетками и макрофагами. Его способность индуцировать ТНО клетки в Т-клетки воспаления (Тн 1) имеет прямое отношение к формированию иммунной системы.
В реакциях воспаления, трансплантационного отторжения и других активная роль принадлежит макрофагингибирующему фактору (МИФ), выступающему в качестве аттрактанта, который привлекает в зону воспаления и удерживает в ней моноциты-макрофаги.
Заключение
Изучение механизмов клеточного взаимодействия и дифференцировки иммунокомпетентных и гемопоэтических клеток вскрыло большую и разнообразную группу белковых эндогенных регуляторов, получивших название цитокинов. В настоящее время об-124
Таблица 4.3
Основная характеристика некоторых, наиболее изученных цитокинов (дополнительные данные)
Семейство Наименование Форма и число аминокислот Клетки-продуценты Биологическое действие
Интерфероны ИФН-у мономер 143 Т-клетки, натуральные киллеры активация макрофагов, усиление экспрессии молекул МНС
ИФН-а мономер 166 лейкоциты антивирусное действие, усиление экспрессии молекул I класса МНС
ИФН-р мономер 166 фибробласты антивирусное действие, усиление экспрессии молекул I класса МНС
Гемопоэтины ГМ-КСФ мономер макрофаги, стимуляция роста и
(гранулоцитарно-макрофагальный колониестимулирующий фактор) 127 Т-клетки обеспечение дифференцировк и миело-моноци-тарной линии развития
Неклассифи- Интерлейкин-12 гетероди- В-клетки, макро- индукция CD4 Т-
цировано (ИЛ-12) мер, 197,306 фаги клеточной дифференцировки в Тн1 -подобные клетки
Макрофагинги-бирующий фактор (МИФ) мономер 115 Т-клетки, другие подавление миграции макрофагов
наружено и изучено в той или иной степени около 40 цитокинов. Приблизительно 20 из них продуцируется Т-клетками. Все цитокины по особенностям строения делятся на несколько семейств. Функция цитокинов отдельно взятого семейства не является прерогативой только этого семейства и может частично перекрываться с функциями членов других семейств.
В целом вся эта большая группа эндогенных регуляторов обеспечивает самые разнообразные клеточные процессы, такие, например, как пролиферация, дифференцировка, хемотаксис, формирование очага воспаления, переключение синтеза иммуноглобулинов, изменение экспрессии антигенов и различных маркеров и др.
Глава 5. СУПЕРСЕМЕЙСТВО ИММУНОГЛОБУЛИНОВ
Введение
Изучение последовательности аминокислотных остатков тяжелых и легких цепей иммуноглобулинов позволило установить наличие в структуре молекулы гомологичных друг другу участков. Каждый такой участок имеет внутрицепьевую дисульфидную связь, которая стабилизирует его конформацию. Гомологичные друг другу последовательности стали называть доменами (см. главу 2). Доменная гипотеза построения иммуноглобулинов, впервые высказанная Дж. Эдельманом в 1969 г., подразумевала эволюционное происхождение цепей иммуноглобулинов от однодоменной формы. Предковый ген однодоменного предшественника в результате тандемной дубликации образовал локус, кодирующий полноценную иммуноглобулиновую цепь. Подтверждением этой точки зрения явилось обнаружение гомологии между иммуноглобулинами и однодоменными белками — Thy-1-антигеном (маркером тимоцитов и Т-клеток) и Рг-микроглобулином (р2-м), присутствующим в моче пациентов с почечными заболеваниями. Первый из этих однодоменных белков оказался гомологичен V-доменам, второй — С-доменам иммуноглобулинов. Кроме того, среди белков миелина имеется однодоменный белок Ро, который также гомологичен V-доменам иммуноглобулинов.
Широкое изучение особенностей организации белков, принимающих участие в различных иммунологических процессах, позволило установить, что среди них имеется значительное количество таких, которые по основным структурным требованиям (гомологии иммуноглобулинам и доменной организации полипептида) могут быть объединены в единую молекулярную систему (табл. 5.1 и рис.5.1). В систему иммуноглобулинподобных гомологов включены молекулы Т-клеточного антигенраспознающего комплекса, молекулы I и II классов МНС, корецепторы Т-клеток CD4 и CD8, однодоменные белки — Thy-1, р2-м, Ро. Особое место занимают адгезины и рецепторные молекулы, способствующие контактному взаимодействию иммунокомпетентных клеток или адсорбирующие различные классы иммуноглобулинов на клеточной поверхности. Вся эта группа близкородственных белков составляет единое суперсемейство иммуноглобулинов.
5.1. ОСНОВНЫЕ КРИТЕРИИ ВКЛЮЧЕНИЯ МОЛЕКУЛ В СУПЕРСЕМЕЙСТВО ИММУНОГЛОБУЛИНОВ
Основными критериями включения белков в суперсемейство являются доменная организация молекул и статистически достоверная гомология с известными иммуноглобулинами. Как уже
Таблица 5.1
Молекулы суперсемейства иммуноглобулинов
Категория Число аминокислотных остатков Вид
Иммуноглобулины:
Н-цепь (IgM) 572 МЫШЬ
L-цепь /-типа 214 то же
L-цепь Х-типа Т-клеточный рецепторный (ТКР) комплекс: ТКР: 213 - « -
а-цепь 250
Р-цепь 282
у-цепь CD3: 286
у-цепь 160 человек
8-цепь 150 то же
s-цепь Главный комплекс гистосовместимости: класс I: 185
Н-цепь 339 - « -
Рг -микроглобулин класс II: 339 - « -
а-цепь 229
р-цепь Антигены, связанные с Рг-микроглобулином: 237
TL, Н-цепь 335 мышь
Qa, Н-цепь 313 то же
СВ1а, Н-цепь Адгезивные молекулы Т-клеток: 311 человек
CD2 322 крыса
LFA-3 Дифференцнровочные антигены субпопуляций Т-клеток: 207 человек
CD4 435 человек
CD8 210 крыса
CTLA4 Антигены мозга и лимфоидной ткани: 188 мышь
Thy-1 111 крыса
MRC ОХ-2 Иммуноглобулиновые рецепторы: 248 то же
Poly IgR 755 кролик
Fcy2b/ylR Молекулы нервной ткани: 351 мышь
адгезивная молекула нервной ткани (NCAM) 1072 курица
гликопротеин миелина (MAG) 610 крыса
Ро белок миелина Опухолевый антиген: 219 то же
карцино-эмбриональный антиген Рецепторы к ростовым факторам: 668 человек
к фактору тромбоцитов (PDCF) 1067 мышь
к колониестимулирующему фактору-1 (CSF1R) Молекулы, не связанные с клеточной поверхностью: 953 человек
сцВ-гликопротеин 474 то же
белок сцепления (LINK) 339 крыса
CD4
Рис. 5.1. Доменная организация членов суперсемейства иммуноглобулинов.
CD1, CD2, CD4, CD8, CTLA 4, MRC 0X2 — маркеры Т-клеток, LFA3 — адгезивный белок клеток, Fc,2b/ylR — рецептор к Ig2b и IgGl на макрофагах, Poly-IgR — рецептор эпителиальных клеток кишечника и печени, обеспечивающий транспорт IgM и IgA через эпителий, MAG — белок миелина, NCAM — белок нейронов, глии и клеток эмбрионов раннего периода развития, СЕА — маркер эпителиальных клеток и их опухолей, CSF 1R — рецептор к колониестимулирующему фактору, <х1В — гликопротеин сыворотки крови, LINK — белок сцепления, соединяющий протеогликан с гиалуроновой цепыо
отмечалось (глава 2), каждый домен, входящий в состав иммуноглобулина, представляет собой двухслойное молекулярное образование, построенное по принципу нескольких антипараллельных P-структур, стабилизированных -S-S- связями. V-Домен имеет че-
тыре p-структуры в каждом слое и один дополнительный Р-сег-мент, соединяющий два молекулярных слоя; 65-75 аминокислотных остатков домена данного типа составляют участок полипеп-тидной цепи, ограниченной цистеиновым мостиком. У С-домена имеется четыре p-структуры в одном слое и только три — в другом. Число аминокислотных остатков, ограниченных цистеиновой связью, равно 55-60 (см. также гл. 2 и 3).
Таким образом, для включения анализируемого домена в состав суперсемейства необходимо установить сходство его пространственной организации с V- или С-доменами иммуноглобулинов.
Вторым критерием для включения анализируемого белка в состав суперсемейства служит гомологичность его аминокислотной последовательности иммуноглобулинам. Все изученные к настоящему времени домены по степени гомологии различным доменам иммуноглобулинов делятся на три труппы: V, С1 и С2. Группа V включает вариабельные домены изотипов иммуноглобулинов и антигенраспознающих Т-клеточных рецепторов. Кроме того, такие белки суперсемейства, как корецепторы Т-клеток — CD4 и CD8, Poly-IgR, CEA, MRC OX-2, LINK имеют в своей структуре домены V-группы. Для понимания эволюции суперсемейства иммуноглобулинов следует особо подчеркнуть, что однодоменные белки Thy-1 и Ро также входят в V-rpynny.
Cl-группа объединяет домены константной части иммуноглобулинов, С-домены Т-клеточного рецептора и молекул I и II классов МНС. К этой же группе относится однодоменный белок р2-м — один из предковых белков всего суперсемейства
В С2-группу входят домены полипептидов с адгезивными и рецепторными свойствами.
5.2. ФУНКЦИОНАЛЬНЫЕ АСПЕКТЫ
Все белки, входящие в суперсемейство иммуноглобулинов, можно разделить на три функциональные группы:
1) белки, связанные с процессом специфического распознавания антигена;
2) белки, выступающие в качестве вспомогательных молекул или регуляторов различных этапов иммунного реагирования;
3) адгезивные белки, которые принимают участие в межклеточных контактных взаимодействиях как иммунных, так и иных клеток организма (табл. 5.2).
К первой группе относятся: поверхностные иммуноглобулины В-клеток и гуморальные антитела, антигенраспознающие Т-клеточные рецепторы, а также молекулы I и II классов МНС. Основной характеристикой этой группы белков является крайне выра-
9 Зак. 3701
Таблица 5.2
Функциональная активность молекул, родственных иммуноглобулинам
Молекулы и их клеточная экспрессия Функции Распознавание с участием других членов суперсемейства
Иммуноглобулины: антигенраспознающие ре- распознают антиген
В-клетки цепторы В-клеток (sig), антитела самостоятельно, без включения дополнительных молекул
Т-клеточные рецепторы антигенраспознающие ре- гетерофильны: ТКР
(ТКР) : цепторы Т-клеток, раство- связывает комплекс
Т-клетки и тимоииты римые формы неизвестны пептида с молекулами I или II классов МНС, но при этом распознавание не включает 1g-подобные домены МНС
СВЗ-цепи: часть Т-клеточного рецеп- ассоциированы с ТКР;
Т-клетки и тимоциты торного комплекса; передача сигнала внутрь клетки способность взаимодействовать с другими молекулами неизвестна
Молекулы МНС: презентация пептидов для гетерофильны; взаимо-
многие типы клеток распознавания ТКР; известны растворимые формы действие с ТКР
02-микроглобулин: субпопуляции Т-кле- функция неизвестна естественные лиганды неизвестны
ТОК
Адгезивные молекулы Т- CD2 Т-клеток взаимодей- гетерофильны; CD2
клеток: ствуют с LFA-3 на других взаимодействуют с
CD2 — на тимоцитах и Т-клетках (некоторых макрофагах у крыс); LFA-3 — на многих клетках Маркеры субпопулящй клетках в реакциях клеточной адгезии; анти-СВ2 антитела могут инициировать пролиферацию Т-клеток LFA-3 гетерофильны:
Т-клеток:
CD4 и CD8 — на раз- способствуют взаимодейст- могут связывать мате-
личных субпопуляци- вию Т-клеток с молекулами кулы II и I классов
ях Т-клеток и тимо- I или II классов МНС; МНС соответственно;
цитов: CD4 — на макрофагах; CD8 — на НК-клетках;
CTLA 4 — на активиро- функция неизвестна неизвестно
ванных Т-клетках
Антигены лимфоидной ткани и мозга: Thy-1 — на нейронах, фибробластах, тимо- инициируют пролиферацию Т-клеток мышей; природные лиганды неизвестны
цитах и Т-клетках;
MRC ОХ-2 — на нейро- неизвестна
нах, эндотелиальных клетках, различных лимфоидных клетках
Окончание табл. 5.2
Молекулы и их клеточная экспрессия Функции Распознавание с участием других членов суперсемейства
Иммуноглобулиновые рецепторы: Poly-IgR — на эпителиальных клетках кишечника и печени; Fcy2b/ylR — на макрофагах Молекулы нервной ткани: NCAM-на нейронах и глии, клетках раннего эмбрионального развития; MAG-на периферическом и цетральном миелине, некоторых нейронах; Ро-на периферическом миелине СЕД: эпителиальные клетки и их опухали, клетки раннего эмбрионального развития Рецепторы ростовых факторов: PDGFR широко представлен на мезенхимальных клетках; CSF 1R — на клетках моноцитарного ряда Белок сцепления (LINK): сцВ-гликопротеин: представлен в сыворотке транспортирует IgA или IgM через эпителий; связывает агрегированный IgG обуславливает адгезию нервных клеток; функционирует при образовании миелина; составляет 50% белков периферического миелина маркер опухолей, но функция неизвестна взаимодействуют с ростовыми факторами для активации пролиферации клеток действует как молекула сцепления между протеогликаном и гиалуроновой цепью функция неизвестна гетерофильны; первый домен Poly-IgR связывает IgA гемофильное взаимодействие посредством Ig-подобных доменов; неизвестно; возможна гомофиль-ность природные лиганды неизвестны неизвестно взаимодействие с молекулами, отличающимися от ростовых факторов отсутствует природные лиганды неизвестны
женная вариабельность N-концевой части молекул. Вариабельность поверхностных иммуноглобулинов и Т-клеточных рецепторов связана с изменчивостью V-доменов (см. главы 2 и 3). В то же время N-концевая часть молекул МНС не имеет иммуноглобулиновой доменной организации, и ее изменчивость связана с широким полиморфизмом и полигенией, свойственными этой группе белковых молекул (см. главу 3). Если поверхностный иммуноглобулин и антитела распознают антиген самостоятельно, без участия каких-либо других молекул, то распознавание антигена Т-клеточным
рецептором носит более комплексный характер и включает взаимодействие с как молекулой МНС, так и с ассоциированным с ней антигенным пептидом.
Вторая группа представлена белками Т-клеточного рецепторного комплекса — однодоменными СПЗ-молекулами, участвующими в передаче информации внутрь клетки после взаимодействия Т-клеточного рецептора с иммуногеном. К этой же группе относятся корецепторы субпопуляций Т-клеток — CD4 и CD8, которые способствуют стабилизации комплекса Т-клеточного рецептора с молекулами МНС в процессе антигенного распознавания. Стабилизация такого комплекса осуществляется через взаимодействие V-домена CD4 или CD8 с С-доменом молекул II или I класса МНС соответственно. Иммуноглобулиновые рецепторы Poly-IgR, Fc2b/ylR и рецептор к колониестимулирующему фактору (КСФ) CSF 1R выполняют регуляторную функцию. Первые два либо способствуют проникновению IgM и IgA через эпителиальные барьеры (Poly-IgR), либо обеспечивают адгезию IgG на поверхности клеток (макрофаги, НК-клетки), что приводит к их активации в реакциях клеточного иммунитета. CSF 1R принимает участие в дифференцировке клеток моноцитарного ряда.
Третья группа белков суперсемейства представлена молекулами с адгезивными свойствами: LFA3, CD2, NCAM, Ро. Домены этих белков относятся к С2-группе. Их гомология с С-доменами иммуноглобулинов выражена слабее по сравнению с доменами Cl-группы. Функция белков адгезии — обеспечение межклеточных контактных взаимодействий.
Одной из существенных функциональных характеристик молекул суперсемейства иммуноглобулинов является способ взаимодействия их доменов. Различают две формы отношений между доменами этого суперсемейства — гемофильное и гетерофильное. По гемофильному типу взаимодействуют идентичные домены, такие, например, как Сн3 гомологичных Н-цепей в составе единой молекулы иммуноглобулина, Ро, NCAM. Эту форму отношений можно обозначить как взаимодействие “своего” со “своим”. Гомофильный тип взаимодействия, возможно, существует и у молекул I класса МНС в тех случаях, когда в контактные отношения вступают идентичные молекулы, представленные на разных клетках (см. главу 11).
Другая форма междоменного связывания — это гетерофильное взаимодействие. Оно встречается как между доменами разных полипептидных цепей в составе единой молекулы, например, взаимодействие VL с VH или CL с Сн1, так и между доменами молекул, экспрессирующихся на разных клетках или между доменами свободных молекул и доменами молекул клеточной поверхности. По гетерофильному типу взаимодействуют CD2 Т-клеток и LFA-3
антигенпрезентирующих клеток. Яркий пример гетерофилии представляет собой процесс распознавания антигена Т-клетками, когда в реакцию вступают Т-клеточный рецептор и молекулы I или II классов МНС. Гетерофильный тип отношений между свободными молекулами и молекулами клеточной поверхности проявляется в тех случаях, когда рецептор взаимодействует со своим лигандом (Poly-IgR эпителиальных клеток и IgA или IgM, Fc2b/ylR макрофагов и IgG, CSF 1R моноцитов и CSF и т.д.). Наличие двух форм взаимодействия между членами суперсемейства позволяет подойти к пониманию их эволюционного происхождения.
5.3. ФИЛОГЕНЕТИЧЕСКИЕ АСПЕКТЫ
Воспроизведение возможных филогенетических событий, обеспечивших формирование суперсемейства иммуноглобулинов и в первую очередь антигенраспознающих структур, должно включать три определяющих положения:
1) в основе происхождения всех членов суперсемейства лежал предковый однодоменный пептид;
2) локусы, которые контролируют иммуноглобулинподоб-ные молекулы, включающие несколько (от двух до семи) доменов, возникли в результате тандемных дубликаций исходного гена для однодоменного пептида;
3) разные домены суперсемейства обладают одним из двух способов взаимодействия между собой — гемофильной и гетерофильной формой.
Устоялось мнение, что гетерофильной форме взаимодействия предшествовали гемофильные молекулярные отношения. Цепь событий, приведших к формированию антигенраспознающих рецепторов как завершающих молекулярных структур в эволюции суперсемейства, представляется следующим образом (рис. 5.2). Предковые однодоменные белки, связанные с поверхностью клетки, в процессе межклеточного взаимодействия формировали гомодимер (А-А). Подобная форма отношений, очевидно, имела место при возникновении многоклеточных организмов. Гомофильная форма взаимодействия сохранилась до настоящего времени у однодоменного белка Ро и, возможно, Thy-1. В результате тандемной дупликации гена для однодоменного белка и последующих мутационных изменений, затрагивающих контактирующий участок молекулы, стали проявляться гетерофильные клеточные отношения (А-В). Дуплицированные гены экспрессировались в клетках одного и того же или разных типов. Мутационные изменения могли снижать аффинность А-В-взаимодействий, но не отменять их полностью. Возникшие гетерофильные отношения явились источником формирования V-доменов Т-клеточного рецептора (от домена В) и антигенпрезентирующей способности молекул МНС (от домена А).
Рис. 5.2. Схема возможных путей возннкшпениа специфических Т-клеточвых, антнгенраспозшкицих рецепторов (ТКР), поверхностных иммуноглобулиновых рецепторов (sig) и антител.
A-Ai — молекулы МНС и их комплекс с антигенными пептидами, B-Bj — вариабельные домены ТКР (Vtkp), C-Cj — вариабельные домены sig и антител (Vig); А-А — гемофильное взаимодействие, А-В ..А2-В2 — гетерофильные
взаимодействия
Мутационные изменения в домене В носили множественный характер, но среди этих изменений были и такие, которые создавали условия для взаимодействия с комплексом А+чужеродный антигенный пептид. В качестве чужеродных пептидов могли выступать вирусы или измененные собственные антигены. В такой ситуации V-ген Т-клеточного рецептора (V-ткр-ген) попадал под положительное давление отбора. Последующие множественные дупликации Уткр-гена и параллельные и независимые мутационные изме
нения этих вновь возникших генов поставляли материал для дальнейшего действия естественного отбора, что и создавало набор генов для V-доменов Т-клеточных рецепторов, способных взаимодействовать с множеством различных чужеродных пептидов, комплексированных с антигенами МНС. В свою очередь гены для доменов МНС также эволюционировали, создавая полиморфизм и полигению молекул этого комплекса. Однако эволюция как молекул МНС, так и Т-клеточных рецепторов имела свои ограничения. Широкая изменчивость касалась только участков доменов, непосредственно взаимодействующих с антигенным пептидом или распознающих этот пептид. В значительно меньшей степени изменения затрагивали те участки, которые вступают в контактные отношения независимо от антигена (подробнее см. главу 3).
Т-клеточные рецепторы эволюционно предшествовали иммуноглобулинам, и Уткр-гены были исходными для Уи-генов. Об этом, в частности, говорят факты эволюционно более раннего проявления Т-клеточного иммунитета по сравнению с гуморальным иммунитетом (см. главу 20).
Качественное отличие поверхностного иммуноглобулина В-клеток от Т-клеточного рецептора состоит в том, что антигенрас-познающий рецептор В-клеток взаимодействует собственно с экзогенным пептидом без включения продуктов МНС в качестве распознаваемых структур. Кроме того, аффинность В-клеточного рецептора к антигенам значительно выше таковой Т-клеточного рецептора. Константа диссоциации (KD) для Т-клеточного рецептора составляет КУМО 5, в то время как этот показатель для поверхностного иммуноглобулина и антител находится в пределах 10'6-1010. Вероятно, эволюция иммуноглобулинов пошла по линии освобождения зависимости от дополнительных клеточных образований (молекул МНС, корецепторов) и компенсаторного, через усиление аффинности, взаимодействия с экзогенным свободным антигеном.
Эволюция Cl-доменов на самых начальных этапах проходила, очевидно, самостоятельно, с умеренными дупликациями и мутационными изменениями. Факторами отбора в данном случае были не антигены, а иные, физиологические механизмы. У позвоночных животных в результате транслокационных перестроек генов для V- и С-доменов возник единый информационный участок, контролирующий синтез различных изотипов иммуноглобулинов.
Эволюционные изменения С2-доменов, входящих в структуру адгезивных и рецепторных молекул, остаются непонятыми, даже в гипотетическом плане.
Одно из существенных свойств эволюции суперсемейства иммуноглобулинов, как, впрочем, и других систем иммунитета,
состоит в том, что в процессе филогенетического развития этого суперсемейства появляющиеся вновь функционально более совершенные молекулы не исключали предыдущих, от которых они возникли. Так, например, предковые домены Thy-1, р2-м, Ро, стоявшие у истоков формирования суперсемейства, широко представлены у современных видов. Возникновение доменов иммуноглобулиновых рецепторов и антител от доменов Т-клеточных рецепторов не отменило значимую, развившуюся функцию этих последних структур.
Заключение
Функциональное предназначение суперсемейства иммуноглобулинов разнообразно. Однако основное определяющее содержание системы — это обеспечение эффективного распознавания антигена с помощью двух специализированных классов молекул — иммуноглобулинов и Т-клеточных рецепторов.
Эталонной молекулой суперсемейства является, конечно, иммуноглобулин. Собственно именно эта молекула дала название всему суперсемейству. Тот или иной белок может быть включен в состав данного молекулярного объединения при соблюдении двух условий — соответствия пространственной организации своих доменов особенностям конформации доменов иммуноглобулинов и достаточной степени гомологии с последовательностью аминокислот в доменах иммуноглобулинов.
При распознавании ассоциированного с клеткой антигена Т-клеточный рецептор действует не изолированно, а с помощью дополнительных молекул — CD3 у,8,е, CD4 и CD8. С процессом антигенного распознавания связаны также молекулы I и II классов МНС, выполняющие функцию представления антигена в иммуногенной форме для его распознавания Т-клеточными рецепторами.
Адгезивные и рецепторные молекулы суперсемейства: LFA3, CD2, Poly-IgR, Fcy2b/ylR, CSF 1R и др., — не принимают участия в процессе антигенного распознавания, но являются активными участниками регуляции иммунного ответа. Так, CD2 и LFA3 способствуют установлению контакта между Т-клетками и антигенпрезентирующими клетками, Poly-IgR обеспечивает проникновение IgM и IgA через эпителиальные барьеры, CSF IR способствует дифференцировке клеток моноцитарного ряда.
Функция других белков суперсемейства (Ро, Thy-1, LINK, а 1В), в иммунном реагировании неизвестна. Однако в отношении однодоменных белков ясно другое: именно они явились предковыми формами для эволюционного формирования всего суперсемейства.
Эволюция суперсемейства иммуноглобулинов была сопряжена с эволюцией иммунокомпетентных клеток, что приводило ко все большему филогенетическому совершенствованию системы специфической защиты в целом.
Часть II. КЛЕТОЧНАЯ ИММУНОЛОГИЯ
Глава 6. КЛЕТКИ, ТКАНИ И ОРГАНЫ ИММУННОЙ
СИСТЕМЫ
Введение
При изучении иммунной системы как целого необходимо знать ее морфологические границы и установить те факторы, которые определяют свойственные только этой системе функциональные проявления. Собственно функциональная нагрузка в данном случае очевидна и отражена в самом названии системы. Вопрос заключается в другом: является ли система иммунной защиты полностью самостоятельной составляющей организма или же она представляет собой часть кроветворной системы. Для того, чтобы иммунную систему вывести в самостоятельный ранг, необходимо определить признаки, которые свойственны исключительно этой системе и не перекрываются с другими морфофункциональными особенностями организма. Критерии, используемые в подобных случаях, являются общими для определения любой системы организма и должны касаться ее молекулярной, клеточной и органной автономии.
В данной и последующих главах особое внимание обращается на те особенности строения и функции клеток, тканей и органов, которые позволяют утверждать, что понятия “лимфоидный” и “иммунный” — суть синонимы для определения одной и той же системы организма.
6.1. РАСПРЕДЕЛЕНИЕ ЛИМФОИДНОЙ ТКАНИ В ОРГАНИЗМЕ
Иоффе и Куртис (Yoffey, Courtice, 1970) объединили лимфоидную и кроветворную системы в единый лимфо-миелоидный комплекс (см. рис. В.5). Комплекс представляет собой систему органов и тканей, паренхима которых содержит клетки мезенхимального происхождения. В него входят: костный мозг, тимус, селезенка, лимфатические узлы, лимфоидная ткань кишечника и соединительная ткань. Функциональное назначение комплекса — обеспечение кроветворения (миелопоэза) и формирование клеток иммунной системы (лимфопоэза). Среди органов и тканей комплекса имеются истинно лимфоидные образования, в которых происходит только лимфопоэз (тимус, лимфатические узлы, лимфоидная ткань кишечника) и “смешанные” образования, где представлен как лимфо-, так и миелопоэз (костный мозг, селезенка).
Лимфоциты происходят от стволовых клеток костного мозга и дифференцируются в центральных лимфоидных органах: В-лимфоциты — в костном мозге, Т-лимфоциты — в тимусе. Из этих
органов они мигрируют по кровеносному руслу в периферическую лимфоидную ткань — лимфатические узлы, селезенку и лимфоидную ткань, ассоциированную с кишечником (пейеровы бляшки, аппендикс, миндалины). Это движение лимфоцитов от центральных органов иммунной системы на периферию является главным миграционным путем. Кроме того, имеется путь рециркуляции. Лимфатические сосуды, дренирующие тело, собирают внеклеточную жидкость — лимфу — вместе с рассеянными по телу лимфоцитами и переносят ее в лимфатические узлы. Лимфоциты после некоторого времени пребывания в лимфатических узлах собираются в выносящих, эфферентных, лимфатических сосудах. Из них лимфоциты попадают в результате в основной лимфатический сосуд — грудной проток, откуда вновь возвращаются в кровоток через левую подключичную вену (рис. 6.1,6.2).
6.2. КОСТНЫЙ МОЗГ
Костный мозг локализован во внутренней полости трубчатых костей и представляет собой тканевое объединение ретикулярной стромы, плотно упакованных гемопоэтических и лимфоидных клеток, а также разветвленной сети капилляров.
Основное назначение костного мозга — продукция клеток крови и лимфоцитов (рис. 6.3). Развитие клеточных элементов костного мозга начинается от полипотентной стволовой кроветворной клетки (СКК), которая дает начало шести росткам дифференцировки:
1) мегакариоцитариому, заканчивающемуся образованием тромбоцитов;
2) эритроидному, с формированием безъядерных, переносящих кислород эритроцитов крови;
3) гранулоцитарному, с тремя дополнительными направлениями дифференцировки, приводящими к образованию трех самостоятельных клеточных типов: базофилов, эозинофилов, нейтрофилов; эти клетки принимают непосредственное участие в процессах воспаления и фагоцитоза и являются, таким образом, участниками неспецифической формы защиты от патогенов;
4) моноцитарно-макрофагальному; на территории костного мозга дифференцировка в данном направлении завершается образованием моноцитов, мигрирующих в кровь; окончательные зрелые формы в виде тканевых макрофагов локализуются в различных органах и тканях, где они получили специфические названия: гистиоциты соединительной ткани, звездчатые ретикулоциты печени, макрофаги селезенки, макрофаги лимфатических узлов, перитонеальные макрофаги, плевральные макрофаги, клетки микроглии нервной ткани;
аденоиды
миндалины
почка
апецдикс
грудной проток
толстый кишечник
костный мозг
селезенка
пейеровы бляшки
левая подключичная
^Итамус сердце
Рис. 6.1. Лимфоидная ткань человека.
Костный мозг и тимус — центральные органы имунной системы. Из них лимфоциты по кровеносным сосудам митрируют в периферические органы: селезенку, лимфатические узлы, лимфоидную ткань, ассоциированную с желудочно-кишечным трактом (пейеровы бляшки тонкого кишечника, апендикс, миндалины). Кроме того, лимфоциты представлены в нелимфоидных органах (почках, печени, подкожной соединительной ткани). Лимфатические сосуды, пронизывающие все тело, собирают лимфоциты из внеклеточной жидкости в лимфатические узлы. Оказавшиеся в лимфоузлах клетки по эфферентным сосудам поступают в основной лимфатический сосуд — грудной проток, из которого они вновь проникают в кровь через левую подключичную вену
правая подключичная вена
лимфатический
узел
5) Т-клеточному; данный росток дифференцировки на территории костного мозга проходит только самый начальный этап развития — формирование от лимфоидной стволовой клетки предшественника Т-клеток (пре-Т-кл.); основные события процесса созревания различных субпопуляций клоноспецифических Т-клеток разворачиваются в тимусе;
6) В-клеточному; в отличие от Т-клеточного направления развития В-клеточная дифференцировка характеризуется практически полной завершенностью; в связи с этим неслучайно костный мозг относят к центральному органу иммунитета.
Рис. 6.2. Мжрация и ревдиуляиня лимфоцитов.
Лимфоциты из костного мозга — источника В-клеток (пре-Т-клеток) — по кровеносным сосудам мигрируют в периферические лимфоидные органы (В-клетки) и в тимус (пре-Т-клетки). Направление миграции отмечено сплошными стрелками. В тимусе происходит созревание пре-Т-клеток, после чего они также мигрируют на периферию. В периферических лимфоидных органах и тканях возможна встреча специфических лимфоцитов с антигеном, в результате которой они останавливаются. Невостребованные лимфоциты, составляющие значительное большинство, вступят в процессе рециркуляции. Покидая лимфоидный орган по эфферентным лимфатическим сосудам, они оказываются в грудном протоке — главном сосуде лимфоидной системы, из которого лимфоциты вновь проникают в кровоток через левую подключичную вену (v. subclavia). Пути рециркуляции отмечены пунктирными стрелками
6.3. ТИМУС
Другим центральным органом иммунной системы является тимус — лимфо-эпителиальный орган, расположенный у большинства млекопитающих в верхней части грудной полости над
Костный мозг
Кровь
Ткань
га ™“У<:
грудной проток
эозинофил
эозинофил
нейтрофил
эритроцит
Т-клетка
тканевый макрофаг
пре-Т-кп
пре-В-кл.
Рис. 6.3. Дифференцировка клеток лимфо-миелоидного комплекса от стволовой плюрипотентной кроветворной клетки (СКК) костно-го мозга до зрелых клеток периферических тканей.
На первом этапе дифференцировки образуются полипотент-ные предшественники миелопоэ-за (КОЕ) и лимфопоэза — лимфоидная стволовая клетка (ЛСК). КОЕ дает начало формированию мегакариоцитам, эритроцитам и гранулоцитам (базофилам, эозинофилам, нейтрофилам), а также моноцитам. ЛСК обеспечивает развитие В-клеток и самых ранних предшественников Т-клеток (пре-Т-кл.), мигрирующих в тимус для дальнейшего развития. Дифференцированные клетки костного мозга проникают в кровеносную систему, чтобы затем колонизировать
ткани, где и завершают свой жизненный цикл. Исключение составляют эритроциты — переносчики кислорода, и тромбоциты, участвующие в закупорке поврежденных сосудов. Для этих клеточных форм развитие заканчивается в кровеносной системе. Моноциты крови представляют промежуточную форму и завершают дифференцировку на периферии, образуя тканевые макрофаги
\ тромбоциты -мегакариоцит
сердцем. Он состоит из двух основных долей, которые делятся на более мелкие дольки. Орган в целом и отдельные дольки заключены в соединительнотканную капсулу, внутренняя полость которой включает эпителиальную сеть, заполненную лимфоцитами (другое название лимфоцитов тимуса — тимоциты). В каждой дольке ясно выявляются два слоя: кора с плотной упаковкой малых тимоцитов и мозговое вещество (медуллярный слой), где количество тимоцитов снижено (рис. 6.4, Л). Тимоциты медуллярного слоя относятся в основном к бластным формам.
Особенностью организации тимуса является наличие двух элементарных структурно-гистологических единиц: фолликулов Кларка (6.5) и телец Гассаля (рис. 6.4, Б). Корковый слой построен из фолликулов Кларка, как из отдельных “кирпичиков”. Плотно упакованные лимфоциты и расположенные среди них макрофаги окружены эпителиальными клетками, образуя вместе элементарную структурно-гистологическую единицу. В медуллярной зоне наблюдаются свободные от лимфоцитов округлые скопления эпителиальных клеток, получившие название телец Гассаля. Функциональное назначение телец неясно. По мнению одних исследователей, они образуются в результате активной деструкции тимоцитов, что приводит к “обнажению” эпителиальных элементов. Другие авторы склонны видеть в тельцах Гассаля активные эпителиальные структуры, функция которых — продукция регуляторных факторов, поступающих в циркуляцию.
В эмбриогенезе строма органа формируется из двух зародышевых листков — экто- и эндодермы. У мышей зачаток тимуса образуется из эндодермы 3-го глоточого кармана и эктодермы 3-й жаберной щели (рис. 6.6). В результате развития двух слоев эндодермальный росток постепенно окружается эктодермой жаберной щели. Образовавшаяся структура получила название шейного пузырька. При дальнейшем развитии эктодермальный вырост полностью захватывает эндодерму глоточного кармана, происходит отщепление экто- и эндодермальных развивающихся участков от основных слоев, что приводит в результате к формированию тимусного зачатка. Эктодермальный слой дает начало эпителиальным клеткам коры, в то время как эндодерма становится источником эпителиальных клеток медуллы.
Сразу после образования зачатка тимуса начинается его колонизация клетками костного мозга. Помимо предшественников тимоцитов в орган мигрируют макрофаги и дендритные клетки. Все эти клетки имеют мезенхимное происхождение. Таким образом, тимус как самостоятельный орган формируется из трех зародышевых листков: экто-, мезо- и эндодермы (рис. 6.7).
Существенными особенностями клеток тимуса являются их ярко выраженная пролиферативная активность и высокий про-143
Рис. 6.4. Гистологическая картина тимуса.
А — дольки тимуса разделены между собой соединительнотканными перегородками. В каждой дольке видны два слоя: кора с плотной упаковкой малых лимфоцитов (более темная часть дольки) и мозговое вещество (медулла), в котором количество лимфоцитов (в основном лимфобластов) снижено (более светлая часть дольки); Б — мозговое вещество характеризуется присутствием телец Гассаля, представляющих собой округлые скопления эпителиальных клеток
кровеносный сосуд
эндотелий
Рис. 6.5. Схематическое изображение фолликула Кларка в корковом слое тимуса.
Элементарная структурногистологическая единица органа, представляющая собой плотное скопление лимфоцитов, окруженных вытянутыми эпителиальными клетками (Э). Среди лимфоцитов фолликула имеются и макрофаги (Мф)
цент гибели in situ. Сопоставление количества тимоцитов, покидающих тимус (8,6-106 в сутки), с тем количеством, которое образуется вновь в то же самое время (30-107-47 1 07), показывает, что из тимуса выходит лишь 3% вновь образованных клеток. Биологичес-кий смысл столь расточительного процесса связан с селекцией клонов клеток, способных взаимодействовать с собственными антигенами гистосовместимости (подробно см. гл. 7).
6.4. СЕЛЕЗЕНКА
Если костный мозг и тимус — центральные органы иммунитета, то селезенка, лимфатичские узлы, лимфоидные образования кишечника, миндалины, аппендикс относятся к периферическим структурам. Они не являются местом, направляющим дифференцировку стволовых элементов по пути формирования Т- и В-клеточных популяций, оцнако в них в основном развивается иммунный ответ.
Формирование гуморального иммунного ответа в виде продукции специфических иммуноглобулинов связано главным образом с селезенкой — крупным органом, расположенным в верхней левой части брюшины. Снаружи орган окружен соединительнотканной капсулой, от которой внутрь отходят поддерживающие перегородки — трабекулы. Характерной чертой строения селезенки является наличие двух гистологически хорошо различающихся участков — красной и белой пульпы (рис. 6.8). Белая пульпа (мальпигиевы тельца) представляет собой скопление лимфоцитов вокруг эксцентрично расположенного артериального канала. Красная пульпа есть место локализации большого количества эритроцитов, а также макрофагов, мегакариоцитов, гранулоцитов, перемещающихся сюда из белой пульпы лимфоцитов. Четких границ между белой и красной пульпой нет, и между ними происходит частичный клеточный обмен.
Для анализа иммунологических ситуаций наибольший интерес представляют белая пульпа и пограничные области между белой и красной пульпой. Именно здесь локализуются Т- и В-лим-
глоточные ярки
Рис. 6.6. Закладка тимуса в эмбриогенезе у мышей.
Два дискретных слоя эмбриональной ткани: эндодерма участка 3-го глоточного кармана и эктодерма 3-й жаберной щели, развиваясь, приходят в соприкосновение друг с другом (1). Приблизительно с 9-х суток развития эктодерма начинает разрастаться в месте контакта с эндодермой и постепенно захватывает эндодермальный вырост (2). В результате образуется морфологическая структура, получившая название шейного пузырька. Эндо- и эктодермальные участки формирующегося зачатка тимуса еще не отделены от основных слоев (3). На заключительной стадии закладки тимуса (около 11-го дня эмбриогенеза) эндо- и эктодермальные участки отделяются от основных тканевых слоев, образуя эпителиальный зачаток тимуса
о
Кора
Медулла
капсула
тельце Гассаля
дендритные клетки костномозгового происхождения
суб капсулярный эпителий
эндодермальные эпителиальные клетки
макрофаги костномозгового происхождения
эктодермальные эпителиальные клетки
тимоциты костномозгового происхождения
кортикомедуллярная связь
Рис. 6.7. Клеточный состав тимуса.
Схематическое изображение дольки тимуса. Каждая долька представлена двумя дискретными участками: внешним корковым слоем (корой) и центральной медуллой. Кора состоит из плот-
но упакованных незрелых малых тимоцитов, локально окруженных разветвленными эпителиальными клетками эктодермального происхождения. Между тимоцитами коры и эпителиальными клетками наблюдается тесный контакт. Среди скоплений тимоцитов встречаются отдельные макрофаги. Как тимоциты, так и макрофаги имеют костномозговое происхождение. Тимоциты, окружающие их эпителиальные клетки и макрофаги образуют фолликул Кларка (см. рис. 6.5). Медулла состоит из зрелых бластных форм тимоцитов, макрофагов и дендритных клеток. Все эти типы клеток имеют мезенхимальное костномозговое происхождение. В то же время эпителиоциты медуллы относятся к клеткам эндодермального источника. В медуллярном слое наблюдаются обнаженные, практически свободные от тимоцитов участки с округлыми скоплениями эпителиальных клеток — так называемые тельца Гассаля. Их функция неизвестна
Белая пульпа
Красная пульпа (В-лиыфоциты)
Рис. 6.8. Фрагмент селезежи.
Паренхима органа включает белую н красную пульпы. Белая пульпа (мальпигиевы тельца) заселена Т- и В-лимфоцитами, которые мигрируют сюда из центральных органов иммунной системы (костного мозга и тимуса). Лимфоциты белой пульпы распределены по двум зонам: тимусзависимой, где скапливаются вокруг пронизывающих пульпу артериол Т-клетки, и тимуснезависимой — места локализации В-клеток. В этой зоне хорошо видны зародышевые центры (центры размножения), которые образуются в ответ на антигенный стимул. Красная пульпа представлена ретикулокапиллярными петлями, пространство между которыми заполнено свободными клеточными элементами. Большинство клеток красной пульпы представлено эритроцитами, что и определяет ее цвет
фоциты. Т-клетки располагаются вокруг артериол, образуя периартериальные муфты. В-клетки входят в состав зародышевых центров, которые, как правило, расположены в пограничной, маргинальной зоне. В красной пульпе также встречаются лимфоциты и плазмоциты, однако они не образуют в этой зоне морфологически оформленных скоплений. Лимфоцитами красной пульпы являются Т-клетки, покидающие селезенку через венозные синусы. Плазмоциты этой зоны представляют собой те завершившие дифференцировку В-клетки, которые вышли из зародышевых центров.
В пренатальный период селезенка функционирует как смешанный лимфо-эпителиальный орган с хорошо выраженным эритропоэзом. В постнатальный период эритро- и миелопоэтические процессы в селезенке млекопитающих постепенно затухают, хотя у грызунов сохраняются в течение всей жизни. Лимфоидная ткань в данном органе образуется еще до рождения. Однако существенно, что впервые лимфоциты появляются все-таки в тимусе и костном мозге и только вслед за этим — в развивающейся селезенке.
Несмотря на то, что селезенка у многих видов млекопитающих функционирует только как орган лимфопоэза, следует помнить, что это доминирующее свойство приобретается в постнатальный период жизни. В эмбриогенезе селезенка выступает в качестве смешанного лимфо-миелоидного образования.
6.5. ЛИМФАТИЧЕСКИЕ УЗЛЫ
Лимфатические узлы, как и тимус, являются истинно лимфоидными образованиями. Они располагаются в виде зерен по ходу лимфатических сосудов. Размеры узлов у человека в условиях нормы колеблются от 3 до 30 мм. В эмбриогенезе лимфатические узлы возникают в конце 2-го — начале 3-го месяца развития. Они образуются в результате накопления мезенхимных клеток вокруг кровеносных сосудов. Наружный слой мезенхимы дифференцируется в соединительнотканную капсулу, от которой внутрь узла отходят трабекулы-перегородки. Непосредственно под капсулой находится краевой синус, куда поступает лимфа по афферентным (приносящим) лимфатическим сосудам (рис. 6.9). Из краевого синуса лимфа поступает в промежуточные синусы, пронизывающие всю толщу узла, и собирается в эфферентном (выносящем) лимфатическом сосуде, который в конце концов выносит ее в грудной проток. Место выхода сосуда называют воротами узла. Через ворота в узел проходят кровеносные сосуды.
Как и в тимусе, в лимфатическом узле различают корковый слой, расположенный по периферии и организованный в первичные и вторичные фолликулы, и мозговое вещество, находящееся в центре узла. Корковый слой узла есть место концентрации В-клеток. Это — так называемая тимуснезависимая зона, или В-зона. Мозговое вещество представлено относительно слабо упакованными лимфоцитами, плазмоцитами, свободными макрофагами и ретикулярными клетками стромы. Область между корой и мозговым веществом (паракортикальная территория) — место концентрации Т-клеток. В силу этого она получила название тимусзависи-мой зоны, или Т-зоны. Т-лимфоциты этой зоны являются зрелыми тимуспроизводными клетками с ярко выраженной способностью к киллерной функции (рис. 6.9). На долю Т-клеток приходится 65%, а на долю В-клеток — около 28% от общего количества всех лимфоцитов узла.
В центрах размножения помимо В-лимфоцитов различной степени зрелости хорошо представлены дендритные клетки, входящие в состав стромы, и свободные макрофаги с выраженной фагоцитарной активностью. Подобная близость всех трех типов функционально зрелых клеток создает реальные условия для успешного их взаимодействия при развитии иммунного ответа.
афферентный лимфатический сосуд
соединительнотканная капсула
трабекулы-перегородки
краевой синус
корковый слой
паракортикальная область
мозговое вещество
фолликул
зародышевый центр
кровеносные сосуды
эфферентный лимфатический сосуд
Рис. 6.9. Лимфапнеский узел.
Снаружи узел покрыт соединительнотканной капсулой. От капсулы в глубь узла отходят перегородки — трабекулы. Непосредственно под капсулой находится краевой синус, куда поступает лимфа, приносящая лимфоциты с периферии. Из краевого синуса лимфа с клетками проходит в промежуточные синусы, которые пронизывают всю толщу органа, и затем собирается в эфферентном (выносящем) сосуде. Место выхода сосуда называется воротами узла. Через ворота внутрь узла проходят кровеносные сосуды. Лимфоидная ткань узла делится на корковый слой (кору) и мозговое вещество (медуллу). Корковый слой характеризуется плотной упаковкой лимфоидных клеток, которые собраны в округлые скопления — первичные и вторичные фолликулы. Первичные фолликулы представляют собой естественные гистологические структуры органа. Вторичные фолликулы (зародышевые центры, центры размножения) отличаются наличием светлой центральной части, состоящей из активно пролиферирующих бластных клеток. Вторичные фолликулы образуются в ответ на проникновение в орган антигена
Тимуснезависимая эона
Мозговое
Рис. 6.10. Ъпдозависи-мые и тамуеяезависимые зоны в лимфатическом узле.
Корковый слой лимфатического узла получил название тимуснезависимой зоны, или В-зоны, — места концентрации В-клеток, мигрирующих сюда из костного мозга. Территория узла на границе между корой и медул-лой (паракортикальная эона) называется тимусзависимой, или Т-зоной. Эта часть узла колонизирована Т-клетками,
вещество поступающими сюда из тиму-
са. При неонатальной тимэктомии Т-зона становится практически свободной от клеточных элементов. В то же время В-зона и медулла остаются без изменений. Данное экспериментальное наблюдение определило название зон
6.6. ЛИМФОИДНАЯ ТКАНЬ, АССОЦИИРОВАННАЯ СО СЛИЗИСТЫМИ ПОКРОВАМИ
В дополнение к массе периферической лимфоидной ткани, инкапсулированной в селезенке и лимфатических узлах, организм содержит значительное количество “свободной”, не заключенной в соединительнотканную капсулу лимфоидной ткани, которая локализуется в стенках желудочно-кишечного, респираторного и урогенитального трактов. Ее обозначают как лимфоидную ткань, ассоциированную со слизистыми покровами. Ткань представлена либо в виде диффузной инфильтрации, либо в форме узелковых скоплений, лишенных замкнутого соединительнотканного футляра.
В тонком кишечнике такие узелки получили название пейеровых бляшек. Лимфоциты этих образований представлены как В-, так и Т-клетками. Среди В-клеток более 50% имеют поверхностный IgA. Оставшаяся часть представлена клетками с поверхностными IgM и IgG. Продуцирующие антитела плазмоциты и Т-клетки способны проникать в слизистую оболочку кишки, находящуюся в прямом контакте с бляшками (рис. 6.11). Кроме того, в слизистой находятся фагоцитирующие клетки, которые поглощают патогены, оказавшиеся на эпителиальной слизистой поверхности просвета кишечника. Таким образом, пейеровы бляшки являются эффективным инструментом защиты от проникновения патогена через желудочно-кишечный тракт.
Близки по строению и функции миндалины, расположенные вдоль дыхательного тракта. Как и пейеровы бляшки, они не относятся к категории лимфоидных органов, поскольку не полностью инкапсулированы.
A
Б
кишки с Т-клетками
и плазмоцитами
Рис. 6.11. Гистологическая картина пейеровой бляшки.
А. Гистологический срез через пейерову бляшку тонкого кишечника. Б. Схематическое изображение среза пейеровой бляшки. Пейеровы бляшки локализуются в подслизистой тонкого кишечника и не имеют в отличие от лимфатических узлов селезенки или тимуса соединительнотканной капсулы. Лимфоциты этих тканевых структур представлены как В-, так и Т-клетками, которые концентрируются в соответствующих эонах. Кроме того, лимфоциты способны проникать в слизистую оболочку кишки в месте ее контакта с бляшкой. Плазмоциты бляшек продуцируют в основном IgA
6.1. СУМКА ФАБРИЦИУСА ПТИЦ
Особое место в иммунологии занимает сумка Фабрициуса птиц. В середине 60-х годов утвердилось мнение, что она выполняет роль центрального органа иммунитета, являясь поставщиком В-клеток для периферии. Были предприняты даже попытки найти аналогичный орган у млекопитающих, исключая костный мозг. Действительно, сумка Фабрициуса является местом активного образования антителопродуцентов. Однако исключительность этого органа для В-системы иммунитета не подтвердилась.
Сумка Фабрициуса — лимфо-эпителиальный орган, расположенный в задней части клоаки у птиц (рис. 6.12). Просвет сумки выстлан цилиндрическим эпителием, подобным эпителию кишеч-
Рис. 6.12. Локализация сумки Фабрициуса у птиц.
Сумка Фабрициуса — лимфоэпителиальный орган, расположенный в задней части клоаки у птиц. Орган характеризуется значительным накоплением В-клеток и плазмоцитов
ника. Непосредственно за эпителиальным слоем располагаются узелки (дольки), общее строение которых напоминает организацию долек тимуса. Кора представлена в основном плотным скоплением малых лимфоцитов. Более светлое мозговое вещество включает большие лимфоциты, плазматические клетки, макрофаги, гранулоциты, ретикулярные клетки. Эпителиальные клетки органа образуют сеть, переходящую в эпителиальные покровы просвета органа. В отличие от тимуса и других лимфоидных органов в узелках сумки корковый слой отделен от медуллярного основной мембраной (рис. 6.13).
Заключение
Клетки, ткани и органы иммунной системы входят в состав лимфо-миелоидного комплекса. Комплекс включает костный мозг, тимус, селезенку, лимфатические узлы, лимфоидную ткань, ас-
Рис. 6.13. Гистологическая картина сумки Фабрициуса.
А — гистологический срез через сумку Фабрициуса; Б — схематическое изображение среза сумки Фабрициуса. Просвет сумки выстлан цилиндрическим эпителием, подобным эпителию кишечника. Непосредственно за эпителиальным слоем располагаются узелки, общее строение которых напоминает строение соответствующих структур тимуса. Кора пред ставлена в основном плотным скоплением малых лимфоцитов. Более светлое мозговое вещество включает лимфобласты, плазматические клетки, макрофаги, гранулоциты, ретикулярные клетки. Эпителиальные клетки образуют сеть, переходящую в эпителиальные покровы просвета органа. В отличие от тимуса в узелках сумки корковый слой отделен от медуллярного основной мембраной
социированную с кишечником, соединительную ткань. Одна из определяющих функций комплекса состоит в обеспечении кроветворения (миелопоэза) и образования клеток иммунной системы (лимфопоэза). Клетки крови (эритроциты, мегакариоциты, гранулоциты, моноциты) и лимфоциты имеют общего родоначального предшественника — стволовую кроветворную клетку, локализованную в костном мозге. Однако на самом раннем этапе костно
мозговой дифференцировки происходит дивергенция общего стволового элемента на стволовую клетку для миелопоэза и стволовую клетку для лимфопоэза. Последняя определяет две самостоятельные линии развития, приводящие к образованию Т- и В-клеток.
Лимфоциты относятся к той категории клеток, которые широко распространены по организму. В теле человека и позвоночных животных они сгруппированы в три типа объединений (рис. 6.14). Первый тип — диффузная инфильтрация подкожной соединительной ткани и слизистых оболочек. Этот тип не имеет строгой локализации и образуется в ответ на повреждение кожи или местное проникновение патогена. Второй тип представляет собой скопление лимфоцитов в виде отдельных узелков в подслизистой пищеварительного и дыхательного трактов. Подобная форма скопления
Диффузная инфильтрация
Миндалины Инкапсулированная
Тимус
Лимфатический узел
Рис. 6.14. Различные типы морфологической организации лимфоидной тхани.
Наиболее простая форма организации — диффузная инфильтрация клетками соединительной ткани, расположенной ниже слизистых покровов пищеварительной и дыхательной систем, а также в подкожной соединительной ткани (гиподерме). Эти скопления лимфоцитов нельзя классифицировать как тканевые образования в силу непостоянства места локализации, количественного и качественного состава клеток. К истинно лимфоидным тканевым образованиям следует относить скопления лимфоцитов, собранных в узелки (миндалины, пейеровы бляшки). Основным признаком тканевой (но не органной) организации лимфоцитов является отсутствие соединительнотканной капсулы. Скопления лимфоцитов, объединенные в единую морфологическую единицу соединительнотканной капсулой и обладающие территориальной структурированностью по основным клеточным типам (Т-зоны, В-зоны, кора, медулла), можно классифицировать как органы лимфоидной системы
относится ко второму типу клеточного объединения и представляет собой неинкапсулированную лимфоидную ткань. И, наконец, третий тип — это форма организации лимфоидной ткани в органы. При этом типе объединения лимфоидная ткань замкнута в соединительнотканную капсулу, что придает ей вполне конкретную морфологическую автономность.
Различные типы организации лимфоцитов обеспечивают наиболее эффективную реакцию лимфоидной (иммунной) системы при встрече с чужеродным антигеном.
Глава 7. Т-СИСТЕМА ИММУНИТЕТА
Введение
По определению, Т-система иммунитета включает: тимус — место дифференцировки костномозговых предшественников Т-клеток (пре-Т-клетки) до потенциально зрелых форм, различные субпопуляции собственно Т-клеток (Т-хелперы, Т-киллеры); группу цитокинов, продуцируемых этими клетками. Основная функция системы связана с обеспечением клеточной формы иммунного реагирования — цитотоксическим (киллерным) разрушением генетически отличающихся клеток и тканей (чужеродных трансплантатов, раковых и вирустрансформированных клеток), а также с участием в регуляции как клеточного, так и гуморального иммунного ответа посредством включения в иммунный процесс Т-хелперов, Т-супрессоров и Т-клеточных цитокинов.
Т-клетки имеют следующие особенности:
1) клональная организация Т-клеточного пула, позволяющая потомкам одной клетки (клона) реагировать только на один из множества антигенных пептидов: данное свойство Т-клеток является общим с В-клетками;
2) характер распознавания чужеродного антигена; в отличие от поверхностных иммуноглобулинов В-клеток, которые распознают собственно антигенный эпитоп, антигенраспознающий рецептор Т-клеток (ТКР — Т-клеточный рецептор) взаимодействует с комплексом антигенный эпитоп (пептид): молекулы МНС;
3) деление Т-клеток на субпопуляции: Т-киллеры/супрессо-ры и Т-хелперы/Т-клетки воспаления.
В данной главе основное внимание обращено на рассмотрение вопросов формирования клоноспецифических Т-клеток, субпопуляций данных клеток и роли тимуса в этих процессах.
7.1. ТИМУС - ЦЕНТРАЛЬНЫЙ ОРГАН ИММУНИТЕТА
7.1.1. Основная феноменология
Представления о том, что тимус является одним из главных органов, определяющих формирование иммунной системы в целом и Т-системы в частности, стали складываться в начале 60-х годов после опытов Дж. Миллера по неонатальной тимэктомии у мышей. Удаление тимуса у мышей сразу после рождения приводит к резкому истощению популяции лимфоцитов в периферических органах, более длительному выживанию аллогенных кожных трансплантатов, нарушению образования антител. Кроме того, тимэк-томированные животные характеризуются высокой смертностью в первые 4 месяца жизни, повышенной восприимчивостью к ин
фекциям, большей чувствительностью к действию эндотоксинов, склонностью к развитию опухолей.
Иммунологическую реактивность можно восстановить пересадкой тимэктомированным мышам тимуса от молодых животных, а также клеток селезенки, лимфатических узлов или большого числа тимоцитов. Клетки костного мозга даже в очень значительных дозах неэффективны. Этот факт сам по себе примечателен, так как демонстрирует, что лимфоцитам костного мозга для выполнения утраченных при тимэктомии иммунологических функций необходим тимус.
Примером роли тимуса в становлении иммунной компетенции является синдром Ди Джоржи. Синдром характеризуется врожденным недоразвитием тимуса, что приводит к резкому снижению популяции Т-лимфоцитов. Дети с подобным иммунодефицитным заболеванием проявляют повышенную чувствительность к вирусным, грибковым и некоторым бактериальным инфекциям.
Критическая роль стромы тимуса продемонстрирована на двух мутантных линиях мышей: nude и scid, характеризующихся отсутствием зрелых Т-клеток. Если дефицит Т-клеток у nude связан с неспособностью эпителиальных клеток рудиментарного тимуса обеспечивать дифференцировку костномозговых предшественников до зрелых форм, то дефицит Т- клеток у scid связан с дефектом процесса рекомбинации рецепторных генов. Трансплантация тимуса scid мышам nude полностью восстанавливает дифференцировку костномозговых предшественников до зрелых Т-клеток, также как введение клеток костного мозга nude мышам scid приводит к полноценному накоплению Т-клеток. Эта форма трансплантации ясно указывает, во- первых, на потенциальную способность костномозговых предшественников nude дифференцироваться в Т-клетки и, во-вторых, на необходимость эпителиального микроокружения тимуса для реализации такой способности. (рис.7.1).
7.1.2. Этапы внутритимусной дифференцировки лимфоцитов
Два наблюдения: необходимость тимуса для накопления функционально зрелых Т-клеток на периферии и высокая гибель активно пролиферирующих тимоцитов in situ, указывают на тот факт, что в тимусе происходят те основные события, которые определяют полноценность работы всей Т-системы. Подобная феноменология требовала выяснения, по крайней мере, двух вопросов: каков биологический смысл массовой гибели клеток в тимусе и как формируются субпопуляции клоноспецифических Т- клеток (Т-киллеров, Т-хелперов) в органе?
Рис. 7.1. Значение эпителиального микроокружения тимуса для дифференцировки костномозговых предшественников до зрелых Т-клеток.
Мутантные мыши scid имеют полноценный тимус, однако Т-клетки не образуются, так как имеется дефект рекомбинации генов для антигенраспознающих рецепторов (1). Другая мутантная линия мышей — nude — также неспособна к формированию Т-клеток из-за отсутствия тимуса: у этой линии мышей обнаруживается только рудимент органа (2). Трансплантация клеток костного мозга мышей nude мышам scid обеспечивает развитие Т-клеток (3). Опыт демонстрирует наличие у мышей nude полноценных костномозговых предшественников Т-клеток. При трансплантации мышам nude тимуса от мышей scid восстанавливается образование Т-клеток у nude-хозяина. Эта форма трансплантации показывает роль эпителиального микроокружения тимуса для нормального развития костномозговых предшественников до зрелых Т-клеточных форм
Этапы внутритимусной дифференцировки клеток от мигрировавшего в орган костномозгового предшественника (пре-Т-клет-ки) до зрелого Т-лимфоцита, покидающего тимус, связаны с изменением экспрессии фенотипических, Т-клеточных маркеров. Основными из них являются: CD4 — корецептор Т-хелперов, CD8 — корецептор цитотоксических Т-лимфоцитов (ЦТЛ; Т-киллеров) и сфТКР — Т-клеточный антигенраспознающий рецептор. Специфическая комбинация этих поверхностных молекул может быть использована в качестве маркеров дифференцировки клеток в тимусе (табл. 7.1).
Первые мигранты из костного мозга — пре-Т-клетки — представляют собой лимфобласты, имеющие определенный набор 159
Таблица 7.1
Фенотипические маркеры дифференцирующихся тимоцитов
Этап Маркеры Тип дифференцирующихся тимоцитов
корецепторы Т-клеток Т-клеточный рецептор
1 CD4- CD8- арТКР- двойной негатив
2 CD41 CD8* арТКР"
3 CD4+ CD8+ арТКР1 двойной позитив
4 CD4+ CD8+ арТКР+ двойной позитив
5 CD4+ CD8- арТКР* одинарный позитив
CD4- CD8+ аРТКР+ одинарный позитив
поверхностных молекул, но лишенных основных маркеров дифференцировки: CD4 и CD8 (рис. 7.2). Отсюд а и их название — “двойные негативы**. Они заселяют верхнюю часть коры тимуса, расположенные, непосредственно под капсулой органа — субкапсулярную область (рис. 7.3). В полностью развитом тимусе двойные негативные клетки составляют незначительный пул (всего около 5% от общего числа тимоцитов^
Взаимодействие раннего предшественника со стромой субкапсулярной области приводит к экспрессии первого специфического маркера Т-клеток: CD2 — у людей и Thy-1 — у мышей. Обе молекулы обладают адгезивными свойствами и относятся к суперсемейству иммуноглобулинов. Thy-1 является исключительным маркером Т-клеток мышей и сохраняется на всех стадиях дифференцировки данных клеток, хотя уровень его экспрессии у более зрелых тимоцитов и периферических Т-клеток снижен по сравнению с ранними предшественниками.
Тимоцитарные бласты субкапсулярной области, находясь в тесном контакте с эпителиальными клетками-кормилицами, ак-
Рис. 7.2. Этапы атяганкзааисимо* дифференцировки Т-клеток.
На первом этапе из плюрипотентной стволовой кроветворной клетки (СКК) костного мозга, обеспечивающей миело- и лимфопоэз, образуется общий для Т- и В-лимфоцитов предшественник — ПрЛЦ. Ближайший потомок ПрЛЦ — протимоцит, или коммитированный предшественник Т-клеток (пре-Т-кл.). Характерным маркером пре-Т-клеток костного мозга является один из антигенов мозга (AM). Первые мигрирующие в субкапсулярную область тимуса пре-Т-клетки теряют AM, но приобретают типичный маркер тимоцитов и периферических Т-клеток — Thy-1. Тимоциты субкапсулярной зоны являются в основном двойными негативами и не экспрессируют Т-клеточный рецептор (ТКР). Фенотип таких клеток — CD4’CD8’apTKP". Постепенно, по мере перемещения в корковый слой тимоциты начинают экспрессию как CD4-, так и С08-корецепторов, а также арТКР. Медуллярная зона тимуса — место локализации бластных форм с фенотипом, характерным для самостоятельных субпопуляций Т-клеток (CD4+CD8'apTKP+ — Т-хелпе-ры/индукторы; CD4'CD8+apTKP*). Формированием различных субпопуляций завершается внутритимусная дифференцировка тимоцитов. Образовавшиеся субпопуляции мигрируют в периферические лимфоидные органы (лимфатические узлы, селезенку и др.)
Лимф, узлы
?Л6Д. ТЦ
Т-киллер/супр.
Рис. 7.3. Локализация дифференцирующихся тимоцитов в различных областях тамуса.
Пре-Т-клетки, мигрирующие из костного мозга в тимус, заселяют субкапсулярную зону тимуса. Клетки этой стадии развития представляют собой незрелые формы, которые не экспрессируют ТКР и корецепторы (фенотип CD4‘CD8TKP"). В результате их взаимодействия с эпителиальными клетками-кормилицами, представленными в субкапсуле, начинается процесс внутритимусной дифференцировки. В промежуточной зоне между субкапсулой и корой, а также частично в коре, появляются тимоциты с умеренной экспрессией корецепторов и p-цепи ТКР (фенотип CD4±CD8±pTKP±). Под влиянием эпителиальных клеток коры проходит дальнейшее созревание тимоцитов, что регистрируется по усилению экспрессии корецепторов CD4 и CD8 и полноценой экспрессии ТКР (фенотип CD4+CD8'apTKP+). Последующая дифференцировка осуществляется в переходной зоне кортико-медуллярного соединения под влиянием д ендритных клеток и макрофагов. В результате образуются субпопуляции Т-киллеров/супрессоров (фенотип CD4’ CD8+apTKP+) и Т-хелперов/индукторов (фенотип CD4+CD8“apTKP+)
тивно пролиферируют и завершают свой путь развития в данной области умеренной экспрессией CD4 и CD8. Тимоциты с фенотипом CD4±, CDS*, рТКР* перемещаются в корковый слой.
Клетки коры — это в основном малые, плотно упакованные тимоциты. Они находятся в непосредственных контактных отношениях с кортикальными эпителиальными клетками, обладающими разветвленными выростами, которые окружают тимоциты. Выраженная экспрессия на поверхности эпителиальных клеток молекул 1 и II классов МНС является определяющим фактором положительной селекции клеток тимуса (см. ниже). В результате взаимодействия эмигрантов из субкапсулярной области с эпителиальными клетками коры происходит активная, одновременная
экспрессия на поверхности тимоцитов двух корецепторов — CD4 и CD8, что дало названием кортикальным клеткам “двойные позитивы”. При этом двойные позитивные тимоциты становятся обладателями полноценных арТКР. Таким образом основной фенотип кортикальных тимоцитов — CD4+, CD8+, арТКР+.
Факт прохождения положительной селекции в коре определяет дальнейшую дифференцировку на субпопуляции CD4+CD8‘ и CD4'CD8+, которая осуществляется в основном в переходной области — кортико-медуллярном соединении под влиянием взаимодействия с дендритными клетками и макрофагами. Эти клетки получили название “одинарных позитивов”. Здесь же проходит и отрицательная селекция тимоцитов (см.ниже). В результате прошедших дифференцировочных событий в медуллярной области накапливаются клетки с фенотипом CD4+CD8’TK.P+ (Т-хелперы) и CD4'CD8+TKP+ (Т-киллеры), часть которых мигрирует в периферические лимфоидные органы.
7.1.3. Реорганизация генов Т-клеточного рецептора в процессе дифференцировки тимоцитов
Наиболее ранний предшественник Т-клеток, мигрировавший из костного мозга в субкапсулярную область тимуса, обладает нативной организацией генов для ТКР — исходным состоянием генома, которое определяется как генная организация зародышевой линии развития. В результате взаимодействия субкапсулярных тимоцитов с эпителиальными клетками данного региона происходит первое реорганизационное событие. На этом этапе внутри-тимусного развития оно касается только генов для p-цепи ТКР и проявляется в объединении одного из двух D-сегментов с одним из двенадцати J-сегментов.
По мере дальнейшего развития тимоцитов происходит второе реорганизационное событие — объединение одного из 30 V-генов с DJ, что приводит с синтезу полноценной p-цепи. На этом, третьем этапе развития синтезируемая p-цепь еще остается в цитоплазме, и фенотип клеток неотличим от фенотипа предыдущего этапа (CD4', CD8’, ТКР ).
Начало умеренной экспрессии p-цепи в комплексе с CD3-пептидами является сигналом для реорганизации генов a-цепи, а также выхода на клеточную поверхность CD4 и CD8. Эти внутриклеточные события сопряжены с переходом тимоцитов из субкапсулярной области во внутренний корковый слой. Фенотип этих клеток - CD4+, CD8+, рТКР*.
Вскоре тимоциты коры начинают умеренную экспрессию функционально полноценного арТКР. Фенотип таких клеток — CD4+, CD8+, арТКР* . После завершения процесса представле
ния основных функционально активных полипептидов создаются условия селекции тимоцитов по их способности распознавать собственные молекулы МНС (табл. 7.2).
Таблица 7.2
Этапы реорганизации генов сф-цепей Т-клеточного рецептора
Этап Характер реорганизации Фенотип тимоцитов Область тимуса
1 нативный геном CD4CD8apTKP- субкапсула
2 соединение DJ CD4CD8apTKP- субкапсула
3 завершение реоргани- зации генов р-цепи CD4CD8apTKP- (р-цепь в цитоплазме) субкапсула
4 начало реорганизации генов а-цепи CD4+CD8+pTKPT промежуточная зона между субкапсулой и корой; кора
5 завершение реорганизации генов а-цепи CD4+CD8+apTKP± CD4+CD8+aPTKP+ кора; кортико-медуллярное соединение
7.1.4. Положительная и отрицательная селекция клеток в тимусе. Формирование клоноспецифических Т-клеток
7.1.4.1. Эксперименты, демонстрирующие распознавание рецепторами Т-клеток комплекса “своего " с “чужим ”
В главе 3 были представлены молекулярные основы двойного распознавания Т-клетками — распознавания молекул I или II классов МНС и ассоциированных с ними антигенных пептидов. Изучению молекулярных механизмов такого распознавания предшествовали опыты с использованием систем взаимодействия несингенных (аллогенных) клеток in vitro.
Первые опыты в этом направлении были проведены с ин-бредными морскими свинками линий 2 и 13, которые отличаются друг от друга только по генам, контролирующим антигены II класса МНС (рис. 7.4). Т-клетки морских свинок, предварительно сенсибилизированных одним из антигенов (овальбумином, туберкулином и др.), вносили в культуру макрофагов, которые презентируют антиген, использованный для иммунизации. Во всех случаях, когда макрофаги и Т-клетки были генетически идентичными (сингенными), регистрировался сильный пролиферативный ответ Т-клеток, распознавших антиген на поверхности сингенных макрофагов. В то же время Т-клетки, отличающиеся от макрофагов по антигенам II класса, не в состоянии развить пролиферативный ответ в несингенной системе клеточного взаимодействия. Эти первые опыты позволили предположить, что примированные Т-клетки распознают не только антиген, использованный для иммунизи-ции, но и собственные антигены гистосовместимости. Однако уз-
МФ+АГ
Т-клетки
Пролиферативный ответ (включение 3[Н]-тимидина)
Рис. 7.4. Пролиферативный ответ примированных Т-клеток с микрофагами различных генотипов.
Инбредные морские свинки линий 2 и 13 отличаются друг от друга только по генам II класса МНС. Макрофаги (МФ), проинкубированные с антигеном (АГ) (овальбумином, туберкулином и др.), обеспечивают интенсивную пролиферацию in vitro сингенных, идентичных по генам II класса Т-клеток, примированных к соответствующему антигену (А). В то же время Т-клетки морских свинок, отличающиеся от донора макрофагов по генам II класса, не в состоянии развить пролиферативный ответ (Б). Нет ответа и при ксеногенном сочетании: морская свинка — крыса (В)
нать антиген на чужеродной макрофагальной поверхности, имеющей отличающуюся молекулу II класса МНС, этим клеткам не удалось.
Демонстративные опыты были проведены с клонами Т-кле-ток от гибридных морских свинок (2 х 13)Fj, иммунизированных двумя антигенами — овальбумином и туберкулином (рис.7.5). От примированных животных выделили 4 клона антигенреактивных
Рис. 7.5. Способность клонов Т-клеток морских свинок специфически реагировать с антигеном и молекулами II класса главного комплекса гистосовместимости.
Гибридов морских свинок (2xl3)F> иммунизировали двумя антигенами (АГ): туберкулином (PPD) и овальбумином (OVA). От примированных животных выделено 4 клона антигенреактивных Т-клеток, каждый из которых способен реагировать только на один из антигенов, ассоциированных с макрофагами одной из родительских линий (2 или 13). Результат реакции оценивали по интенсивности пролиферации клонированных Т-клеток, взаимодействующих in vitro с макрофагами (МФ), презентирующими тот или иной антиген. Во всех случаях клон отвечал только на тот антиген и молекулу II класса МНС, по которым шла селекция при клонировании
Т-клеток, каждый из которых способен реагировать только на один из антигенов, ассоциированных с макрофагами одной из родительских линий (линии 2 или линии 13). Результаты реакции оценивали по интенсивности пролиферации клонированных Т-клеток, взаимодействующих in vitro с макрофагами определенной линии, презентирующими один из антигенов: макрофаги линии 2 + овальбумин, макрофаги линии 13 + овальбумин, макрофаги пинии 2 + туберкулин и макрофаги линии 13 + туберкулин. Во всех без исключения случаях реакция Т-клеток регистрировалась только на то сочетание макрофага с антигеном, к которому прошло клонирование. Замена либо гаплотипа макрофага, либо антигена отменяла реакцию пролиферации. Поскольку две линии морских свинок отличались друг от друга только по генам, контролирующим молекулы II класса МНС, сделали вывод, что отдельный клон Т-клеток имеет антигенраспознаюшие рецепторы, направленные на комплекс антигена с продуктами этих генов.
Представленные опыты, несмотря на свой феноменологический характер, позволяли сделать принципиальное заключение: рецепторы Т-клеток распознают не собственно чужеродный антиген, а его комплекс с молекулами МНС. Однако они не давали ответа на вопрос, с какой субпопуляцией Т-клеток связано двойное распознавание.
Специальные исследования по выяснению данного вопроса констатировали, что рестрикция по генам МНС существует как для Т-хелперов, так и для Т-киллеров. При этом ограничения в зависимости от характера субпопуляции касаются разных генов МНС: как генов, контролирующих молекулы I класса, так и генов, ответственных за синтез молекул II класса.
В опытах in vitro по генерации Т-хелперов, усиливающих продукцию антител, были получены следующие результаты (рис. 7.6).
В культуру поглотивших антиген макрофагов вносились предшественники Т-хелперов, которые были либо генетически идентичными, либо отличались от макрофагов по генам МНС. После определенного времени совместного культивирования Т-клетки переносили во вторичную культуру, содержащую сингенные клетки селезенки (источник антителопродуцентов) и гомологичный антиген. В тех случаях, когда Т-лимфоциты получали от первичной культуры, в которой взаимодействующие клетки были идентичны по генам, контролирующим молекулы II класса, констатировалось сильное развитие иммунного ответа. В то же время Т-клетки от культуры, содержащей не идентичные по генам II класса клетки, оказались неспособными обеспечить хелперный эффект во вторичной культуре.
Таким образом, созревание Т-хелперов из предшественников в первичной культуре происходит только в условиях идентичности между взаимодействующими клетками по молекулам II класса. Различия, затрагивающие поверхностные молекулы, контролируемые другими генами МНС, не имели значения для генерации Т-хелперов.
Сходные по целевой направленности опыты были проведены при использовании двух систем анализа — in vivo и in vitro (рис. 7.7). Мышей определенного генотипа иммунизировали не нативным антигеном, как это делается в обычной экспериментальной работе, а антигеном, прошедшим переработку в макрофаге и представленным на его поверхности в иммуногенной форме. Схема опыта включала два этапа. Первый этап — иммунизация in vivo. Мышам определенного генотипа вводили несингенные, отличающиеся по генам II класса макрофаги, которые экспрессировали чужеродный антиген. После определенного времени от иммунизированных животных выделяли сенсибилизированные клетки селезенки. Второй этап экспериментов состоял в изучении способнос-
Иммунный ответ
II культура IN VITRO
Рис. 7.6. Участие генов II класса главного комплекса гистосовместимости в индукции Т-хелперов у мышей.
Презентирующие антиген (АГ) макрофаги (МФ), относящиеся к определенному гаплотипу по генам II класса главного комплекса гистосовместимости (например, 1-Аа или 1-Аь), помещали в культуру in vitro вместе с Т-лимфоцитами. После определенного времени совместного культивирования Т-лимфоциты, прошедшие примирование в первичной культуре, переносили во вторичную культуру, куда добавляли интактные клетки селезенки и гомологичный антиген. В тех случаях, когда Т-лимфоциты получали от первичной культуры, в которой взаимодействующие клетки (макрофаги и Т-клетки) были идентичны по генам II класса, констатировали выраженное развитие антителопродукиии во вторичной культуре. В то же время Т-лимфоциты от первичной культуры, содержавшей не идентичные по генам II класса клетки, оказывались неспособными обеспечить хелперный эффект во вторичной культуре. Иначе, созревание Т-хелперов из предшественников происходит только в условиях идентичности по генам II класса между взаимодействующими клетками
ти выделенных клеток развивать вторичный ответ in vitro при взаимодействии с макрофагами различных гаплотипов. Выяснилось, что вторичный ответ развивается только в том случае, если в систему вносят макрофаги, генетически идентичные тем, которые были использованы при первичной иммунизации in vivo. Макрофаги, сингенные клеткам селезенки, не могли индуцировать вторичный ответ.
Объяснение этому эксперименту, как и предыдущему, сводится к следующему. В процессе первичной иммунизации Т-хелперы распознают чужеродный антиген в комплесе с молекулами II класса. В результате накапливается клон Т-хелперов, обладающих антигенраспознающими рецепторами, специфичность которых 168
Рис. 7.7. Участие генов II класса главного комплекса гистосовместимости в при-мировании Т-хелперов и их взаимодействии при вторичном ответе in vintro.
При иммунизации мышей с определенной характеристикой по генам II класса главного комплекса гистосовместимости (например, 1-Аь) макрофагами от донора с иным гаплотипом (например, I-A"), поглотившими антиген (АГ; в конкретных опытах использовали полиглутаминовую кислоту полиаланинполитирозин — GAT), иммунный ответ (анти-GAT), будет развиваться в культуре in vitro только в том случае, если в культуральную систему взаимодействия вносят макрофаги того генотипа, которые использовали при первичной иммунизации. Сингенные макрофаги, ассоциированные с тем же антигеном, не способны обеспечит^ развитие вторичного иммунного ответа. Нет ответа и при использовании свободного антигена. В процессе примирования in vitro были отобраны антигенспецифи-ческие клоны Т-хелперов, способных распознать антиген в комплексе с молекулами II класса того гаплотипа, который был предложен при иммунизации. Представление таким Т-хелперам антигена, ассоциированного с собственными (сингенными) молекулами II класса, не обеспечивает их распознавание и формирование иммунного ответа in vitro (схему, представляющую механизм описанных опытов, см. на рис. 7.8.)
ограничена особенностями строения как чужеродного антигена, так и молекул II класса МНС. Во вторичной культуре такой клон отвечает только на комплекс, использованный при иммунизации (рис. 7.8).
Цитотоксические Т-клетки, как и Т-хелперы, распознают не собственно чужеродный антиген, а его комплекс с молекулами МНС. Однако ограничения в данном случае касаются молекул I класса. Это заключение было сделано по результатам достаточно простых, но демонстративных опытов. Мышей с определенным гаплотипом иммунизировали одним из вирусов (рис. 7.9). От при-мированных животных получали Т-клетки, которые использовали в цитотоксическом тесте с клетками-мишенями. В тех случаях, когда
Распознавание комплекса. Накопление клона
Специфичность вторичной реакции
Рис. 7.8. Фо(мфом1ме антигенспецяфического клона Т-хелперов, распознающих комплекс чужеродного антигена с молекулами II класса главного комплекса
гистосовместимости.
1.Отбор антигенспецифического клона. Антиген (АГ) образует комплекс с молекулами 11 класса главного комплекса гистосовместимости. Среди множества предсуществуюших антигенспецифических клонов Т-хелперов (а, Ь, с и т.д.) в процесс распознавания вступит только тот из них, который имеет антигенраспознающий рецептор (ТКР), конформационно соответствующий антигенному комплексу. Факт взаимодействия рецептора с антигенным комплексом обеспечит накопление соответствующего клона Т-хелперов (завершится процесс примирования клона). 2. При вторичном иммунном ответе на тот же самый антигенный комплекс (на схеме антиген+мо-лекула 11 класса гаплотипа “а”) накопленный клон антигенспецифических Т-хелперов ответит быстрой пролиферативной реакцией. Если этому клону будет предложен тот же самый антиген, но в комплексе с молекулами II класса иного гаплотипа, не использовавшегося при первичной иммунизации (например, гаплотип “Ь”), то клон останется ареактивным к новому антигенному комплексу
ВирусА
Рис. 7.9. Генетические ограничения при взаимодействии Т-киллеров (ЦТЛ) с клетками-мишенями, зараженными вирусом.
Мышей с определенной характеристикой по локусу К или D иммунизировали одним из вирусов (условно вирусом А). От примированных животных получали Т-клетки, которые использовали в цитотоксическом тесте с клетками-мишенями, зараженными вирусом и относящимися по характеру локуса К (или D) либо к донору Т-клеток, либо к его аллельному варианту. Цитотоксическую реакцию оценивали по интенсивности выделения а,Сг из клеток-мишеней. Примиро-ванные Т-киллеры гаплотипа КЕ не дают реакции с генетически идентичными, интактными клетками-мишенями (1). Нет реакции и при заражении клеток-мишеней вирусом, отличающимся от вируса использованного при иммунизации (2). Цитотоксическая реакция положительная, если генетически идентичные Т-киллерам клетки-мишени заражают гомологичным вирусом (3). В то же время при использовании клеток-мишеней, отличающихся по локусу К от Т-киллеров, цитотоксическая реакция не развивается даже при наличии гомологичного вируса у клеток-мишеней (Ка против Кь или Кь против Ка — 4,5). Аналогичные отношения выявлены для локуса D. В то же время генетические ограничения не проявляются по генам, контролирующим молекулы II класса. Из этих опытов следует, что Т-киллеры распознают как собственные молекулы I класса, так и чужеродный вирусный антиген
Т-киллеры и мишени обладали идентичным геном, контролирующим молекулы I класса (Н-2К или H-2D), развивалась сильная цитотоксическая реакция. При генетических различиях по генам I класса реакция не развивалась. Ограничения касались только этих генов и не затрагивали генов, контролирующих антигены II класса.
Аналогичные результаты были получены при использовании гаптена (рис. 7.10).
Объяснение полученных данных строится на том представлении, что в процессе примирования происходит селекция клона Т-
Отвечающие клетки
Рис. 7.10. Генетические ограничения при взаимодействии Т-киллеров с клетками-мишенями, конъюгированными с гаптеном.
Клерки с определенной характеристикой по локусу К конъюгировали с простым химическим соединением — гаптеном. Такие клетки выступали в качестве стимулирующих, антигенпредставляющих клеток в культуре in vitro, куда вносили интактные Т-клетки, идентичные или отличающиеся по локусу К от стимулирующих клеток. После 4-5 суток совместного культивирования Т-клетки собирали и тестировали в цитотоксической реакции с клетками-мишенями, конъюгированными с гомологичным гаптеном. При генетической идентичности по локусу К между стимулирующими и отвечающими клетками, а также клетками-мишенями развивается выраженная цитотоксическая реакция (1). Цитотоксический ответ Т-киллеров отсутствует, если между стимулирующими клетками и клетками-мишенями имеются различия по локусу К (2, 4). В то же время генетическая идентичность по локусу К между этими клетками обеспечивает развитие полноценной цитотоксической реакции, хотя локус Т-киллеров представлен в аллельном варианте по отношению к локусу мишени (К“ против Кь; 3). Аналогичные отношения выявлены для локуса D. Генетические различия по генам 11 класса не имеют значения
киллеров, способных распознавать комплекс антигена с молекулами I класса определенного гаплотипа. В связи с этим популяция Т-клеток, обогащенная специфическими Т-киллерами, будет распознавать только те мишени, зараженные вирусом, которые имеют одинаковый с Т-киллерами генотип по генам I класса.
7.1.4.2. Положительная селекция клеток в тимусе
Прямые доказательства роли стромы тимуса в селекции тимоцитов, распознающих собственные молекулы МНС, получены при работе с облученными мышами, которым компенсаторно вводили костный мозг от генетически идентичных доноров и опустошенную строму тимуса от генетически идентичных или отличающихся доноров (рис. 7.11).
Мышей-гибридов (H-2d / H-2k)Fi облучали летальной дозой, чтобы выбить собственные лимфоидные клетки, и тимэкгомиро-вали. В контрольных опытах обработанным подобным образом животным трансплантировали костный мозг и строму тимуса от гибридных же (сингенных) доноров. Через 3 месяца (время, достаточное для полного восстановления утраченной при облучении лимфоидной ткани) животных заражали вирусом оспы и еще через 6 дней по завершению латентного периода из селезенки иммунизированных животных выделяли лимфоциты. Цитотоксическую активность этих клеток проверяли на клетках-мишенях одного из родителей (гаплотип родителей Н-2к или H-2d). В обоих случаях эффекторные Т-клетки гибридов развивали цитотоксическую реакцию.
Забегая вперед, следует заметить, что эти результаты легко объяснимы с точки зрения внутритимусной селекции к “своему”. Если распознавание “своего” действительно происходит в тимусе, то предшественники гибридного, трансплантированного костного мозга, оказавшись в гибридном же тимусе, встретили как молекулы Н-2к, так и молекулы H-2d, экспрессирующиеся на эпителиальных, стромальных клетках органа. Приобретя специфический рецептор к молекулам того или иного генотипа, клетки прошли селекцию на образование клонов, способных реагировать с комплексом молекула МНС + экзогенный антиген (пептид). В результате такие отобранные лимфоциты разрушают мишени как Н-2к, так и H-2d (рис. 7.12).
Ситуация менялась, если вместо гибридного тимуса трансплантировали тимус родителей H-2d или Н-2к. В тех случаях, когда Т-прекурсоры костного мозга колонизировали родительский тимус, формировались эффекторы цитотоксической реакции, способные разрушать клетки-мишени только того генотипа, к которому относился тимус (рис. 7.11).
A
Рис. 7.11. Роль тимуса в отборе клеток с рецепторами к собственным молекулам главного комплекса гистосовместимости.
А. Мышей-гибридов (H-2d, H-2k)F| облучали летальной дозой и эктомиро-вали тимус. Таким лишенным клеток собственной лимфоидной ткани мышам компенсаторно трансплантировали эпителиальную строму сингенного тимуса и сингенный костный мозг. Через 3 мес (время, достаточное для восстановления лимфоидной ткани облученных реципиентов) животных заражали вирусом оспы. Через 6 дней из селезенки иммунизированных мышей выделяли клетки, цитотоксическую активность которых проверяли на клетках-мишенях одного из родительских гаплотипов (H-2d или Н-2к). В обоих случаях эффекторные клетки гибридов развивали цитотоксическую реакцию.
Б
Цитотоксическая реакция
H-2d
Б. Ситуация менялась, если вместо гибридного тимуса трансплантировали тимус одного из родителей (гаплотипы (H-2d или Н-2к). В тех случаях, когда пре-Т-клетки гибридного костного мозга колонизировали тимус родительского гаплотипа, формировались цитотоксические эффекторы, способные разрушать клетки-мишени только того гаплотипа, к которому относился тимус. Данные свидетельствуют в пользу процесса распознавания тимоцитами собственных антигенов гистосовместимости в тимусе. Подробнее см. текст
Гибридные пре-Т-клетки костного мозга, заселяющие родительский тимус, строма которого экспрессирует только одну аллельную форму молекул МНС (H-2d или Н-2к), после достижения стадии развития с фенотипом CD4+CD8+apTKP± имеют множество клонов с разной специфичностью по а₽ТКР. Однако дальнейший путь развития обеспечен только тем клонам, которые распознали молекулы МНС, характерные для тимуса данного генотипа. Все остальные погибают и не выходят на периферию.
Более прямые доказательства были получены при использовании трансгенных мышей. Когда реорганизованные гены для Т-клеточного рецептора вводятся в геном мышей, перестройка эндогенных генов подавляется, так что большинство развивающихся Т-клеток экспрессируют рецептор, который кодируется трансгенами для а- и p-цепей. При введении трансгенов мышам известного генотипа по МНС можно установить влияние молекул этого комплекса на созревание тимоцитов. Например, введение трансгенов ap-цепей, специфичных к молекулам I класса генотипа Н-2а, мышам с генотипом Н-2Ь приводит к незавершенной дифференцировке тимоцитов Н-2Ь, заканчивающейся на стадии CD4+CD8+. Если таких трансгенных мышей заразить вирусом, их Т-клетки будут разрушать вирусинфицированные мишени, относящиеся к генотипу Н-2а, но не Н-2Ь, как это происходит с Т-клетками нормальных мышей (табл. 7.3).
Ясно, что отсутствие соответствующих рецепторов к собственным молекулам МНС не позволяет тимоцитам пройти полный путь развития и проявить себя в цитолитической реакциии. Через 3-4 дня клетки, неспособные распознать собственные антигены, погибают в тимусе.
События, развивающиеся в тимусе при селекции клеток по
Рис. 7.12. Положительная селекция в тимусе клеток, способных распознавать собственные молекулы главного комплекса гистосовместимости.
Завершившаяся реорганизация генов а- и p-цепей Т-клеточного антиген-распознаюшего рецептора (ТКР) обеспечивает формирование множества клонов с отличающимися по специфичности рецепторами. Среди этих клонов представлены те, рецепторы которых способны распознавать собственные молекулы I класса МНС (1), молекулы II класса МНС (2) и не обладающие такой способностью (3). Последние представлены в подавляющем большинстве. Антигенсвязываюший цен гр ТКР имеет участок, взаимодействующий с молекулами I или II классов (более толстая линия) и участок, взаимодействующий с антигенным пептидом (тонкая линия). Среди обилия формирующихся клонов отбираются только те, которые способны взаимодействовать с молекулами МНС. Все прочие подвергаются апоптозу и погибают в тимусе. Клетки, прошедшие положительную селекцию на специфичность взаимодействия с собственными молекулами МНС, после дополнительной дифференцировки на субпопуляции и отрицательной селекции на аутоантигены (см. рис. 7.13) покидают тимус и мигрируют в периферические лимфоидные органы, где они образуют пул антигенреактивных Т-киллеров и Т-хелперов
Таблица 7.3
Цитолитическая активность Т-клеток нормальных и трансгенных мышей
Экспериментальная ситуация Т-клетки мишени ответ
Норма (трансгены не вводили) Н-2Ь Н-2Ь +
Н-2Ь Н-23 -
Введение трансгенов ар-це-пей, Н-2Ь Н-2Ь -
специфичных к Н-23 Н-2Ь Н-2® +
их способности распознавать собственные молекулы МНС, представлены на рис. 7.12. Завершившаяся на первом этапе реорганизация генов для а- и p-цепей обеспечивает экспрессию Т-кле-точного рецептора на клеточной поверхности. До окончания положительной селекции уровень экспрессии этих рецепторов незначительный, но вполне достаточный для взаимодействия с соответствующими молекулами. Поскольку реорганизация генов, контролирующих вариабельные области Т-клеточного рецептора (VDJ — для p-цепи и VJ — для a-цепи), процесс случайный, то образуются самые разнообразные по специфичности рецепторы. Условно их можно разбить на три категории: те, которые способны взаимодействовать с молекулами I или II классов, и те, которые такой способностью не обладают. Кроме того, антигенсвязы-вающий центр рецепторов независимо от принадлежности к той или иной категории имеет участок, потенциально способный взаимодействовать с экзогенным, чужеродным пептидом.
На стадии умеренной экспресии Т-клеточных рецепторов тимоциты представляют собой сырой материал для отбора. В коре тимуса, обогащенной эпителиальными клетками, которые экспрессируют молекулы как I, так и II классов, происходят основные селекционные процессы. Если тимоциты обладают рецепторами, способными взаимодействовать с молекулами I или II классов, то они подвергаются дальнейшей дифференцировке. Судьба тимоцитов, чьи рецепторы не соответствуют специфичностям молекул МНС, завершается в тимусе. Селекция тимоцитов по специфичности их рецепторов — процесс крайне жесткий. Более 90% клеток гибнет в органе и только незначительная их часть, прошедшая сито отбора (менее 5%), “обречена” на дальнейшую жизнь.
Если клетка не выдержала первичного положительного отбора, она еще некоторое время (3-4 суток) остается жизнеспособной и продолжает реорганизовывать гены a-цепи, представляя новые по специфичности рецепторы. Иначе, отбор не завершается на исходном сочетании ар-цепей. Клетка “стремится придтись ко двору” посредством изменения специфичности рецепторов за счет
a-цепей. Без этого дополнительного механизма гибель тимоцитов, не прошедших первичного отбора, была бы еще выше.
На этапе формировании клонов, способных взаимодействовать с одной из молекул МНС, процесс дифференцировки клеток не заканчивается. Тимоциты, подвергающиеся отбору, экспрессируют как CD4-, так и CDS-корецепторы. Однако как только отбор на специфичность произошел, тимоцит теряет один из корецеп-торов. Во всех случаях отбор на специфичность к молекулам I класса определяет сохранение CD8 и потерю CD4. Напротив, тимоциты, прошедшие селекцию к молекулам II класса, экспрессируют CD4 и подавляют синтез CD8. Наиболее четко корреляция фенотипических маркеров со специфичностью рецепторов показана на трансгенных мышах. Если мышам вводили реорганизованные гены для а₽-цепей со специфичностью к молекулам I класса, то все образовавшиеся зрелые Т-клетки имели фенотип Т-киллеров (CD8). В ситуации, когда специфичность касалась молекул II класса, все зрелые Т -клетки несли корецептор Т-хелперов (CD4). Коррелятивная связь корецепторов со специфичностью Т-рецепторов показана и на других экспериментальных моделях. Мутантные мыши, у которых отсутствуют молекулы II класса, не способны образовывать СО4+-лимфоциты. Введение таким мышам трансгена, кодирующего синтез молекул II класса, полностью восстанавливало формирование СЕ)4+-клеток.
Определяющим моментом экспрессии одного из двух корецепторов в процессе созревания тимоцитов является их способность взаимодействовать с теми молекулами МНС, к которым проходит селекция: CD4 — с молекулами II класса и CD8 — с молекулами I класса (см. рис. 3.19; 3.20). После такого распознавания завершается, наконец, путь внутритимусной дифференцировки тимоцитов с образованием Т-хелперов и Т-киллеров, мигрирующих на периферию.
7.1.4.3. Отрицательная селекция клеток в тимусе
В условиях нормы иммунная система толерантна (терпима) к аутологичным (собственным) антигенам организма. Запрет на иммунную реакцию ко многим аутоантигенам формируется в тимусе.
Принципиальная возможность подобного запрета следует из опытов с трансгенными мышами. Специфический рецептор, синтезируемый трансгенами, будет представлен на всехТ-клетках. Если мышам, имеющим наведенный Т-клеточный рецептор, специфичный к комплексу собственной молекулы МНС с чужеродным пептидом, ввести данный пептид, то реакция клеток в тимусе и на периферии будет прямо противоположной: гибель тимоцитов, не-17* 179
сущих рецептор заданной специфичности, и стимуляция пролиферации периферических Т-клеток, обладающих тем же рецептором.
Другой экспериментальный пример отрицательной селекции в тимусе связан с половым антигеном, который имеется у. мышей-самцов и отсутствует у самок. Трансгенные мыши-самцы, обладающие рецептором, специфичным к комплексу полового антигена с собственными молекулами МНС, характеризуются незавершенным развитием клеток в тимусе. У них дифференцировка тимоцитов, экспрессирующих данный рецептор, завершается на стадии двойных позитивов (CD4+CD8+). В популяции одинарных позитивов (CD4+CD8‘ или СВ4"СВ8+) на периферии также отсутствуют Т-клетки, обладающие рассматриваемым рецептором. В то же время у трансгенных самок тимоциты с рецепторами к антигену самца проходят полный путь дифференцировки и мигрируют на периферию.
7.1.4.4. Возможные механизмы положительной и отрицательной селекции клеток в тимусе
В основе процесса внутритимусной селекции клеток лежит разная степень сродства (аффинности) их рецепторов к молекулам I или II классов МНС.
Экспрессия ар-цепей в начальный период развития тимоцитов определяет накопление самых разнообразных по специфичности клеточных клонов, которые вступают в процесс распознавания молекул МНС на эпителиальных клетках коркового слоя (рис. 7.12; 7.13). Относительно невысокая степень сродства между рецепторами и молекулами МНС является сигналом к началу дифференцировки тимоцитов и миграции созревших клеток на периферию (рис.7.13.1). Значительная степень сродства между взаимодействующими молекулами будет причиной гибели высокоаффинных клонов в результате апоптоза (рис. 7.13,2). Следует заметить, что элиминирующее действие высокой аффинности характерно только для тимуса, но не для периферических лимфоидных образований. Среди клонов клеток тимуса будут и такие, рецепторы которых либо вообще не взаимодействуют с молекулами МНС, либо это взаимодействие осуществляется при крайне низкой степени активности. И в первом, и во втором случаях судьба низкоаффинных клонов предопределена: гибель в области кортико-медуллярного соединения. И, наконец, одно из явлений внутрити-мусного развития клеток связано с элиминацией аутореактивных (запрещенных) клонов. Успешное распознавание молекул МНС в корковом слое еще не гарантирует завершения процесса развития клона и его миграции на периферию. Если рецепторы тимоцитов
I
Периферия
Рис. 7.13. Положительная и отрицательная селекция клеток в тимусе.
1, 2, 3, 4 — Т-клеточные рецепторы (ТКР) разной степени аффинности по отношению к молекулам МНС. Умеренная степень сродства ТКР к молекулам МНС (1) определяет начало дифференцировки соответствующего клона, который по завершению процесса созревания мигрирует на периферию (пример положительной селекции). Очень высокая и очень низкая степень аффинности ТКР или полное отсутствие такой аффинности определяют гибель клеток через процесс апоптоза (2, 3). Клетки с ТКР, имеющим оптимальную аффинность по отношению к молекулам МНС, но при этом способным к распознаванию аутоантигена, комп-лексированного с молекулами I или II классов, также подвергаются апоптозу (пример отрицательной селекции)
способны распознавать собственные антигены (аутоантигены) в комплексе с молекулами МНС, то клетки, обладающие подобными рецепторами, элиминируются и их путь развития заканчи-
вается на ранних стадиях развития (рис. 7.13 4). Фенотип клеток, не прошедших отбор на специфичность, соответствует двойным позитивам (CD4+CD8+) и указывает на незавершенность дифференцировки.
Итак, клетки, погибающие в тимусе, не выдерживают два условия положительного отбора: первое — наличие некоторой средней степени сродства между рецепторами и молекулами МНС (очень высокая и очень низкая аффинность рецепторов приводит к гибели тимоцитов); второе — отсутствие реакции на собственные антигены (аутоантигены). Меньшая часть популяции тимоцитов, прошедших жесткие условия отбора на специфичность, покидает орган после завершения внутритимусного этапа дифференцировки.
7.2. Т-КЛЕТКИ ПЕРИФЕРИИ
7.2.1. Распределение Т-клеток по лимфоидным органам
Клетки, которые покидают тимус по кровеносным сосудам, мигрируют в периферические лимфоидные органы: лимфатические узлы, селезенку, пейеровы бляшки кишечника, оккупируя Т-зоны этих органов.
В зависимости от характера лимфоидных образований количество лимфоцитов определенных субпопуляций в них варьирует. Так, более 70% клеток лимфатических узлов представлено Т-клет-ками, среди которых около 30% составляют Т-киллеры (CD8+) и около 40% — Т-хелперы (CD4+). Напротив, в органах, которые несут основную нагрузку по продукции антител, — селезенке, пейеровых бляшках кишечника — количество Т-клеток снижено и составляет не более 30% от общего числа лимфоцитов (табл. 7.4).
Таблица 7.4
Процентное содержание клеток различных субпопуляций в лимфоидных органах
Орган CD4+ CD8+ CD4+CD8+ НК В-кл.
Тимус 8 4 84 1.5 1
Кровь 42 30 2 11 12
Лимфатические 42 30 2 1.5 19
узлы
Селезенка 17 13 L5 18 50
7.2.2. Адгезины и заселение Т-клетками периферических органов
Процесс миграции тимуспроизводных клеток в периферические лимфоидные органы контролируется целым набором адгезивных молекул (адгезивов), представленных на поверхности как 182
Т-лимфоцитов, так и клеток тех органов, которые заселяются лимфоцитами. Основными адгезивными молекулами являются: селек-тины, интегрины, адгезины суперсемейства иммуноглобулинов, а также муцинподобные молекулы (табл. 7.5). Представленные в таблице
Таблица 7.5
Адгезивные молекулы, участвующие в иммунных процессах
Наименование Экспрессия на клетках и тканях Лиганды Свойства
Селектины: инициация взаимодействия лейкоцитов с эндотелием в результате связывания углеводов
L-селектин неактивированные GlyCAM-l,
(MEL-14, лимфоциты,клетки CD34,
CD62L) памяти, нейтрофилы, моноциты, эозинофилы MAdCAM-1
Р-селектин активированные сивалил Левиса
(PADGEM, CD62P) клетки эндотелия
Е-селектин активированные сивалил Левиса
(ELAM-1, клетки
CD62E) Муцин-подобныс адрессины сосудов: эндотелия инициация взаимодействия лейкоцитов с эндотелиальными клетками в результате связывания L-селектина
CD34 клетки эндотелия L-селектин
GlyCAM-1 высокий эндотелий венул L-селектин
MAdCAM-1 венулы лимфоидной L-селектин,
Интегрины: ткани слизистой VLA-4 связывание с клеточными адгезивными молекулами и экстрацеллюлярным матриксом
aLp2(LFA-l, CDHa/CD18 лимфоциты разные ICAM
о-мРг (Mac-1, макрофаги разные ICAM,
CR3, CDllb/CD18) iC3b
«хРг дендритные клетки, iC3b
(CR4, pl 50,95, CDllc/CD18) макрофаги
<MP1 лимфоциты, моноци- VCAM-1
(VLA-4, LPAM-1, CD49d/CD29) ты
Окончание таблицы 7.5
Наименование Экспрессия на клетках и тканях Лиганды Свойства
“sPi (VLA-5, CD49d/CD29 Т-клетки? фибронектин
<х4р7 (LPAM-2) Члены суперсемейства иммуноглобулинов: В-клетки MAdCAM-1 разнообразная роль в клеточной адгезии; мишень для интегринов
CD2 (LFA-2) Т-клетки LFA-3
ICAM-1 (CD54) активированные сосуды, лимфоциты LFA-1
ICAM-2 (CD102) сосуды в состоянии покоя LFA-1
ICAM-3 (CD50) антигенпрезентирующие клетки LFA-1
LFA-3 (CD58) лимфоциты, антигенпрезентирующие клетки CD-2
VCAM-1 (CD106) активированные клетки эндотелия VLA-4
адгезивы принимают участие не только в расселении клеток по периферии, но и в процессах клеточного взаимодействия при развитии иммунного ответа (см. ниже гл. 9).
Значение адгезинов в заселении клетками определенных лимфоидных структур (хоминге лимфоцитов) иллюстрируется следующими примерами.
Созревшие в тимусе Т-клетки попадают с током крови в лимфатические узлы и пейеровы бляшки, где они, проходя через эндотелий посткапиллярных венул, проникают в паренхиму органа. В этом процессе заселения имеется два самостоятельных этапа. Первый — взаимодействие мигрировавшей Т-клетки с эндотелием посткапиллярных венул и второй — проход через эндотелий в паренхиму. В реализации этих этапов принимают участие разные молекулы адгезинов.
На первом этапе в процесс адгезии вступают L-селектин нативных Т-клеток и муцинподобные адрессины эндотелия сосудов. Все селектины, включая Р- и Е-формы эндотелия,имеют сходную основную структуру, но отличаются строением лектинподобного домена экстрацеллюлярной части молекулы. Лектинподобный домен L-селектина взаимодействует с углеводными компонентами адрессинов эндотелия сосудов. Два адрессина — CD34 и GlyCAM-1 -экспрессируются на поверхности высокого эндотелия венул в лимфатических узлах. Третий — MAdCAM-1 — представлен на эндотелиальных клетках в слизистой и выполняет функцию
Рис. 7.14. Заселение Т-клетками периферических лимфоидных органов с помощью адгезивных молекул.
Процесс заселения лимфоидных органов и тканей Т-клетками состоит из двух этапов. На первом из них происходит адгезия Т-клеток на поверхности эндотелия сосудов, по которым они поступили в орган (1а, 16). На втором — осуществляется проход осевших лимфоцитов через эндотелий в паренхиму органа. Первый этап реализуется с помощью селектинов, представленных на поверхности Т-клеток (на рис. отмечен один из них — L-селектин) и лигандов эндотелия: CD34 и GlyCAM-1 на эндотелии лимфатических узлов и MAdCAM-l — на эндотелии слизистых оболочек. Собственно проход через эндотелий осуществляется посредством интегрина LFA-1 Т-клеток и ICAM эндотелиальных клеток
проводника в лимфоидную ткань, ассоциированную со слизистыми поверхностями, такую как пейеровы бляшки кишечника.
Взаимодействие между L-селектином и сосудистыми адрес-синами лежит в основе специфического хоминга Т-клеток в лимфоидные органы. Однако такое взаимодействие не обеспечивает проход клеток через эндотелий в лимфоидную ткань. Преодоление эндотелиального барьера осуществляется при участии двух других групп адгезинов: интегринов и членов суперсемейства иммуноглобулинов.
Интегрины представляют собой большое семейство молекул, которые принимают участие в различных формах клеточной кооперации. Молекула интегринов построена из двух нековалентно связанных цепей: большей по мол. массе a-цепи и меньшей 0-цепи. Последняя инвариантна и является обшей для всех членов подсемейства; a-цепь варьирует и служит индивидуальной характеристикой определенного члена подсемейства. На лимфоцитах экспрессируются такие важные для преодоления эндотелиального барьера интегрины, как LFA-1, VLA-4 и -5, которые взаимодействуют с членами суперсемейства иммуноглобулинов, представленными на эндотелиальных клетках: ICAM-1 и -2, VCAM-1.
Существует ли какая-либо специфичность по адгезинам, определяющим различную тропность субпопуляций Т-клеток (Т-хелперов и Т-киллеров) к различным лимфоидным образованиям (см. табл. 7.4), пока не ясно.
7.2.3. Наивные Т-клетки периферии
Для дальнейшего изложения удобно применять терминологию, которую использовали, в частности, Janeway и Travers в своей книге “Immunobiology” (1994). Мигрирующие из тимуса клетки, еще не встретившие антиген и не вступившие в иммунный ответ, получили название наивных Т-клеток. Те Т-лимфоциты, которые активируются антигеном и цитокинами, в условиях реального иммунного ответа определяются как армированные Т-клет-ки. Различия между наивными и армированными Т-клетками касаются как усиления экспресии предсуществующих Т-клеточных рецепторов, корецепторов, адгезинов, так и смены их репертуара (подробно см. гл. 9).
Строго охарактеризованы по фенотипическим маркерам только две субпопуляции наивных Т-лимфоцитов: цитотоксические Т-клетки (Т-киллеры; CD8+) и Т-хелперы (CD4+).
СВ4+-клетки в зависмости от локализации антигена (макрофаги, В-клетки и др.) трансформируются в две субпопуляции: ТН1 и Тн2. Если наивная Т-клетка распознает антиген, презентирующийся макрофагом, то она трансформируется в Тн1 -клетки воспаления. Функция таких клеток — усиление активности макрофагов, направленной на уничтожение захваченного антигена, или приведение его в иммуногенную форму. Распознавание антигена на поверхности В-лимфоиитов является сигналом к трансфома-ции в Тн2-хелперы, которые обеспечивают усиление продукции антител.
Традиционно считают, что существуют две самостоятельные СВ8+-субпопуляции: цитотоксические Т-клетки и Т-супрес-соры. Очевидно, это не так. В зависимости от конкретной иммунологической ситуации — дозы антигена, времени введения, характера самого антигена, длительности развития иммунного процесса и других факторов — та же самая СО8+-субпопуляция может выступать в роли то киллера, то супрессора.
7.2.4. Цитокины
Среди различных типов клеток организма Т-лимфоциты являются наиболее активными продуцентами цитокинов. Из более чем 30 цитокинов 20 продуцируется либо только Т-клетками, либо Т-клетками наряду с другими клеточными типами (макрофагами, фибробластами, В-клетками и т.д.). Продукция большинства из 186
этих цитокинов начинается после антигенной или митогенной стимуляции Т-клеток и является, таким образом, одним из показателей функциональной зрелости этих клеток.
Однако некоторые цитокины продуцируются и наивными Т-клетками. В таблице 7.6 перечислены цитокины, продуцируемые как функционально неопределившимися Т-клетками (условно обозначение ТнО), так и клетками, относящимися к функционально зрелым субпопуляциям: Т-клеткам воспаления (Тн 1) и собственно вспомогательным, хелперным Т-клеткам (Тн2).
Таблица 7.6
Цитокины, продуцируемые различными субпопуляциями Т-клеток
Субпопуляция Т-клеток Цитокины Функциональная активность
Тн0 интерлейкин-2 (ИЛ-2) интерлейкин-4 (ИЛ-4) интерферон-у (ИФН-у) стимуляция роста Т-клеток, В-клеток, НК-клеток активация В-клеток, усиление продукции IgGl и IgE, усиление экспрессии молекул II класса МНС, стимуляция роста Т-клеток активация макрофагов, усиление экспрессии молекул МНС
ТН1 интерлейкин-3 (ИЛ-3) гранулоцитмакрофага-льный колониестимулирующий фактор (ГМ-КСФ) интерлейкин-2 ростовой фактор для многих гемопоэтических клеток стимуляция роста и дифференцировки гранулоцитарной и моноцитарной линий развития см. выше
интерферон-у см. выше
фактор некроза опухо-лей-р (ФНО-р; лим-фотоксин) киллинг клеток, активация эндотелиальных клеток, макрофагов
ТН2 интерлейкин-3 см. выше
интерлейкин-5 (ИЛ-5) рост и дифференцировка эозинофилов, дифференцировка IgA В-клеток
интерлейкин-6 (ИЛ-6) рост и дифференцировка В-клеток, индукция КСФ, костимулятор Т-клеток, участие в реакции острой фазы
интерлейкин-10 (ИЛ- 10) усиливает экспрессию молекул 11 класса МНС, подавляет продукцию цитокинов Тн1
Заключение
Т-система иммунитета включает тимус как центральный орган системы, различные субпопуляции Т-клеток (Т-хелперы/индук-торы, Т-киллеры/супрессоры), группу цитокинов, продуцируемых Т-клетками.
Основной вопрос, связанный с данной системой, касается изучения роли тимуса в формировании клоноспецифических Т-лимфоцитов, относящихся к разным субпопуляциям.
Путь дифференцировки тимоцитов от пре-Т-клеток костного мозга начинается в субкапсулярной зоне органа. Клетки, вступающие в процесс развития, не имеют основных маркеров дифференцировки CD4-, CDS-корецепторов, а также Т-клеточного антигенраспознающего рецептора (ТКР). Такие тимоциты получили название двойных негативов. Под влиянием эпителиальных клеток-кормилиц субкапсулярной зоны происходит накопление тимоцитов с умеренной экспрессией CD4 и CD8. Начинается синтез 0-цепи ТКР и последующая экспрессия этого полипептида на клеточной поверхности. Фенотип таких клеток — CD4±CD8±pTKP±. Дальнейшее развитие тимоцитов происходит в коре. Здесь под влиянием эпителиальных клеток усиливается экспрессия корецепто-ров; ТКР представлен полностью сформированной молекулой, хотя его количество на клеточной поверхности умеренно. Основной фенотип клеток коры — CD4+CD8+apTKP±. Тимоциты этой стадии развития получили название двойных позитивов. В корковой зоне происходит одно из основных событий — положительная селекция клеток на способность узнавать собственные молекулы I или II классов МНС. В процессе селекции отбираются клоны, чьи рецепторы конформационно соответствуют молекулам I или II классов. При распознавании молекул 1 класса дифференцировка направляется в сторону формирования Т-киллеров, при распознавании молекул II класса — в сторону Т-хелперов. На клеточной поверхности экспрессируется только один из двух корецепторов: CD4 — на поверхности Т-хелперов и CD8 — на поверхности Т-киллеров. Дифференцировка на субпопуляции сопровождается еще одним, крайне важным событием для функционирования системы — отрицательной селекцией. Из популяции тимоцитов через процесс апоптоза удаляются клетки, способные реагировать с аутоантигенами, комплексированными с собственными молекулами МНС. Незначительное количество прошедших жесткие условия положительного и отрицательного отбора клеток мигрирует на периферию.
Выжившие клетки относят к категории наивных Т-лимфоцитов, т.е. таких клеток, которые еще не вступали в процесс рас-188
познавания чужеродных антигенов. В заселении ими периферических лимфоидных органов и тканей принимают участие адгезивные молекулы клеточной поверхности, экспрессирующиеся как на Т-лимфоцитах, так и на эндотелии кровеносных сосудов, пронизывающих лимфоидные образования. В результате лиганд-рецептор-ных взаимодействий наивные Т-клетки проникают в паренхиму органа.
К Т-системе иммунитета относится также группа цитокинов, продуцируемых клетками этой системы. Их иммунорегуляторное действие начинает проявлятся в основном при антигенной или митогенной стимуляции и носит разнонаправленный характер в зависимости от иммунологической ситуации и типов клеток, принимающих участие в иммунном реагировании.
Весь путь доантигенного развития Т-системы иммунитета создает потенциал для возможной в будущем встречи организма с различным антигенчужеродным материалом.
Глава 8. В-СИСТЕМА ИММУНИТЕТА
Введение
Гуморальный ответ в виде продукции антител (иммуноглобулинов) зависит от функционирования В-системы специфической иммунной защиты. Центральным органом системы является костный мозг — основное место генерации В-клеток. Клеточный состав системы представлен В-лимфоцитами различной степени зрелости вплоть до заключительной клеточной формы в гистогенезе этих клеток — плазмоцита, активно синтезирующего и секретирующего специфические иммуноглобулины.
В процессе развития В-лимфоцитов в костном мозге происходит реорганизация генов для синтеза тяжелой и легкой цепей иммуноглобулинов. В результате такой реорганизации одна клетка синтезирует только одну по специфичности тяжелую и одну легкую цепи из множества возможных (см. главы 2 и 3). Образующийся из такой клетки клон несет иммуноглобулиновый рецептор, способный реагировать только на один антигенный эпитоп. При этом клоны, экспрессирующие иммуноглобулиновые рецепторы к своим собственным антигенам, уничтожаются и не принимают участия в дальнейшем становлении системы. Создание толерантности к собственным антигенам осуществляется на территории костного мозга. В результате на периферии оказываются клетки, рецепторы которых реагируют только на чужеродные антигены.
В данной главе рассматриваются пути гистогенеза В-клеток в костном мозге, формирование гетерогенной популяции В-клеток периферии, создание В-клеточной толерантности к собственным антигенам,
8.1. ЭТАПЫ ДИФФЕРЕНЦИРОВКИ В-ЛИМФОЦИТОВ В КОСТНОМ МОЗГЕ
Весь путь развития В-лимфоцитов от стволовой кроветворной клетки до плазмоцита включает несколько этапов, каждый из которых характеризуется своим клеточным типом. Всего вычленено 7 таких типов:
1) стволовая кроветворная клетка — общий предшественник для всех ростков дифференцировки лимфомиелопоэза;
2) общий лимфоидный предшественник для Т- и В-клеточно-го пути развития — наиболее ранняя лимфоидная клетка, для которой еще не определилось одно из двух направлений развития;
3) ранняя про-В-клетка — ближайший потомок предыдущего клеточного типа и предшественник последующих, продвинутых в дифференцировке клеточных типов (приставка “про” от англ, “progenitor”);
3) поздняя про-В-клетка;
4) пре-В-клетка — клеточный тип, окончательно вышедший на В-клеточный путь развития (приставка “пре” от англ, “precursor”);
5) незрелая В-клетка — завершающая костномозговое развитие клеточная форма, которая активно экспрессирует поверхностный иммуноглобулин и находится в стадии отбора на способность взаимодействовать с собственными антигенами;
6) зрелая В-клетка — клеточный тип периферии, способный взаимодействовать только с чужеродными антигенами;
7) плазматическая клетка — эффекторная, антителопродуцирующая клеточная форма, которая образуется из зрелой В-клетки после ее контакта с антигеном.
8. 1.1. УЧАСТИЕ СТРОМЫ КОСТНОГО МОЗГА В ДИФФЕРЕНЦИРОВКЕ В-КЛЕТОК
Стадии развития от стволовой кроветворной клетки до незрелого В-лимфоцита проходят на территории костного мозга под прямым воздействием стромального микроокружения. Простым доказательством подобного утверждения являются опыты in vitro. Удаление из клеточной культуры стромальных элементов прерывает формирование В-лимфоцитов из стволовых клеток костного мозга. Реконструкция культуры восстанавливает процесс накопления В-клеток.
Участие клеток стромы в дифференцировке В-лимфоцитов проявляется в двух формах. Ранние этапы развития В-лимфоцитов зависят от прямого контактного взаимодействия со стромальными элементами. На более поздних этапах В-лимфоциты испытывают воздействие гуморальных факторов.
Взаимодействие наиболее ранних предшественников В-клеток со стромальными клеточными элементами осуществляется с помощью поверхностных адгезивных молекул (рис. 8.1). Первые контактные отношения возникают на уровне стволовой кроветворной клетки и общего лимфоидного предшественника через взаимодействие между гиалуроновой кислотой клеточной поверхности стромальных клеток и CD44. Это типичный адгезивный белок с относительно небольшой мол. массой 80-95 кД экспрессируется на поверхности различных типов лейкоцитов и эритроцитов. Помимо участия в установлении физического контакта между клетками стромы и ранними предшественниками В-клеток он задействован и в других формах межклеточных взаимоотношений, а также в процессах клеточной миграции и метастазирования. Вероятно,связывание CD44 с лигандом не несет какой-либо прямой сигнальной функции, но стимулирует взаимодействие рецептора c-kit ранних про-В-клеток с другим рецептором стромальных клеток — SCF (сокращение от англ, “stem-cell factor”). Молекула c-kit обладает свойствами тирозинкиназ. В результате связывания этих поверхно-
Стромальные клетки костного мозга
Рис. 8.1. Диференцировка В-клеток в костном мозге.
Весь путь развития В-клеток в костном мозге делят на два основных этапа. Первый из них проходит при доминирующем участии адгезивных молекул: CD44, c-kit и SCF. На этом этапе стволовая кроветворная клетка дифференцируется в лимфоцитарный предшественник, общий для Т- и В-, от которого образуется ранняя про-В-клетка. На втором этапе в процесс костномозговой дифференцировки включаются цитокины, и в первую очередь интерлейкин-7 (ИД-7). В результате путь развития от ранней про-В-клетки идет через образование поздней про-В-клетки, которая в свою очередь дифференцируется в пре-В-клетки. Заключительной клеточной формой дифференцировки в костном мозге является незрелая В-клетка. Отличительными чертами незрелой Вв-клетки являются экспрессия на клеточной поверхности IgM, но отсутствие IgD, который появляется позднее у зрелых В-клеток периферии
стных молекул происходит активация c-kit, что влечет за собой усиление пролиферации и переход В-клеточных предшественников на более продвинутый уровень дифференцировки — стадию поздних про-В-клеток.
Этот этап дифференцировки характеризуется появлением на поверхности поздних В-клеток рецептора к интерлейкину-7 и включением в процесс соответствующего цитокина, секретируемого стромальными клетками. Активность интерлейкина-7 в качестве ростового фактора вполне достаточна для поддержания пролиферации и выживания развивающихся клеток. В результате их зависимость от SCF снижается и на стадии пре-В-клеток полностью прекращается. Контакт пре-В-клеток со стромой осуществляют адге-зины ICAM.
Процесс В-клеточного развития в костном мозге завершается формированием незрелой В-клетки, экспрессирующей поверхностный IgM и подготовленной к миграции на периферию.
Кроме отмеченных, имеется еще целый ряд рецепторов, позволяющих следить за развитием В-клеток (табл. 8.1). Функция этих поверхностных структур не является прерогативой только развивающихся В-клеток. Они включены в процессы клеточного взаимодействия, представления антигена в иммуногенной форме и др. Некоторые их свойства отмечены в подписи к таблице 8.1. 192
Таблица 8.1
Изменение экспрессии молекул клеточной поверхности в процессе дифференцировки В-клеток
Общий предшествен ник Т- н В-линий Ранняя про-В-клетка Поздняя про-В-клетка Пре-В-клетка Незрелая В-клетка Зрелая В-клетка
CD45R CD45R CD45R CD45R CD45R CD45R
CD19 CD19 CD19 CD19 CD19 CD19
CD38 CD38 CD38 CD38
CD40 CD40 CD40 CD40 CD40
CD20 CD20 CD20
CD21 CD21
кл. II ГКГ кл. II ГКГ кл. 11 ГКГ кл. II ГКГ кл. II ГКГ
И IgM IgM IgD
CD45R — одна из изоформ общего лейкоцитарного антигена; экспрессируется на клетках различных Т- и В-субпопуляций, моноцитах, макрофагах; мол. масса 180 кД; трансмембранный белок, цитоплазматический домен которого обладает тирозинспецифической фосфатазной активностью и активирует тирозинки-назы, ассоциированные с антигенными рецепторами и корецеп-торами Т- и В-клеток, таким образом усиливая прохождение сигнала внутрь клетки от антигенрецепторного взаимодействия.
CD19 — экспрессируется на В-клетках; мол. масса — 95 кД; выполняет функцию корецептора у В-клеток.
CD40 — экспрессируется на В-клетках различной степени зрелости, моноцитах, дендритных клетках; мол. масса — 50 кД; выполняет функцию рецептора при костимуляции В-клеток.
CD20 — экспрессируется на В-клетках; мол. масса — 33-37 кД; возможно, участвует в активации В-клеток.
CD21 — экспрессируется на В-клетках, фолликулярных дендритных клетках; мол. масса — 145 кД; выполняет функцию рецептора для C3d - компонента комплемента и вируса Эпштейн-Барр; вместе с CD 19 и CD81 образует корецептор у В-клеток.
8.1 .2. Реорганизация генов тяжелых и легких цепей иммуноглобулинов в процессе дифференцировки В-клеток
Параллельно изменению экспрессии рецепторов в процессе созревания В-клеток в костном мозге происходит реорганизация генов, контролирующих тяжелые и легкие цепи иммуноглобулина М (табл. 8.2).
Первыми в процесс реорганизации вступают гены тяжелых цепей. На этапе ранних про-В-клеток начинается слияние генных сегментов D и J тяжелых цепей иммуноглобулина М. На следую-
13 Зак. 3701
193
Таблица 8.2
Реорганизация иммуноглобулиновых генов в процессе дифференцировки В-клеток
Стволовая клетка Ранняя про-В-клетка Поздняя про-В-клетка Пре-В-клетка Незрелая В-клетка
Гены Н- зародышевая реорганиза- реорганиза- реорганизован- реоргани-
цепи организация ция D-J ция V-DJ ный VDJ зованный VDJ
Гены L- зародышевая зародышевая зародышевая реорганизация реоргани-
цепи организация организация организация V-J зованный VJ
Поверхностный 1g отсутствует отсутствует отсутствует ц-цепь в цитоплазме и на поверхности клетки экспрессия IgM на поверхности клетки
щем этапе развития — этапе поздних про-В-клеток — реорганизованный DJ вступает в процесс объединения с V-генами. Реорганизация генов тяжелых цепей завершается на этапе пре-В-клеток.
Этот же этап характеризуется синтезом ц-цепей и их экспрессией на поверхности клетки. В ситуации, когда имеется мутация гена для p-цепи иммуноглобулина, препятствующая выходу тяжелой цепи на клеточную поверхность, развитие заканчивается на этапе пре-В-клеток. Вероятно, сам факт присутствия p-цепи на клеточной поверхности является сигналом к началу синтеза легких цепей.
Реорганизация генов легких цепей начинается позднее по сравнению с генами тяжелых цепей и происходит только на этапе пре-В-клеток, завершаясь на заключительном этапе развития в костном мозге — этапе незрелых В-клеток. В результате создаются условия для полноценного синтеза иммуноглобулина М и его экспрессии на клеточной поверхности.
Поскольку реорганизация генных сегментов носит случайный характер, сформировавшиеся иммуноглобулиновые молекулы будут иметь широкую вариабельность по специфичности анти-генсвязывающего участка (см. главу 2). Причем в процессе такой реорганизации у отдельно взятой клетки будут синтезироваться моноспецифические иммуноглобулины одной, случайно сформированной специфичности. Интродукция в геном клетки уже реорганизованного гена для тяжелых цепей прерывает процесс собственной рекомбинации генов для этого типа цепей. Все В-клетки таких трансгенных мышей будут синтезировать тяжелую цепь, соответствующую использованному трансгену. При этом гены легких цепей реорганизуются по заданной программе, обеспечивая широкий набор L-цепей. Аналогично у мыши, в геном которой ин-194
тродуцирован реорганизованный ген легких цепей, прерывается процесс реорганизации собственных L-генов. Эти данные лишний раз демонстрируют способность В-клетки производить иммуноглобулины только одной специфичности. Случайность рекомбинационных процессов, обеспечивающих образование реорганизованного гена определенной специфичности, закрывает все прочие потенциально возможные сочетания генных сегментов.
8.1 .3. Селекция В-клеток в костном мозге
Для завершения дифференцировки В-клеток на последнем этапе их развития в костном мозге, т.е. для трансформации незрелых В-клеток с поверхностным IgM в зрелые В-клетки периферии, экспрессирующие два иммуноглобулина — IgM и IgD, требуется несколько дней. За это время происходит одно из главных событий в становлении В-системы иммунитета — отбор клеток, реагирующих только на чужеродные антигены. В-клетки, иммуноглобулиновые рецепторы которых способны взаимодействовать с собственными антигенами, либо погибают в результате апоптоза, либо приходят в состояние ареактивности (анергии). Апоптоз развивается обычно в тех случаях, когда распознавание антигена как “своего” происходит на поверхности клетки. Распознавание свободного (гуморального) антигена приводит к анергии (рис. 8.2).
Наиболее четкая информация о реальности такого отбора пришла из опытов с трансгенными мышами. Интродукция в геном мышей реорганизованных генов для тяжелых и легких цепей иммуноглобулинов приводит к тому, что все зрелые В-клетки имеют проверхностный IgM одной специфичности, соответствующей введенным генам.
В тех случаях, когда трансгены, контролирующие синтез антител, специфичных к антигенам I класса МНС определенного генотипа (например, к Н-2Ка), вводятся мышам иного генотипа (Н-2КЬ), формирование зрелых В-клеток происходит нормально. Напротив, введение трансгенов той же специфичности сингенным мышам (генотип Н-2Ка) приводит к нормальному образованию пре-В-клеток, но полностью блокирует формирование незрелых В-клеток, имеющих проверхностные анти-Н-2Ка IgM. Эти эксперименты ясно показывают, что формирование поверхностного IgM, специфичного к собственным клеточным антигенам, является запрещенным событием. Клоны В-клеток, несущих подобные иммуноглобулины, элиминируются посредством апоптоза.
Ситуация несколько меняется, когда незрелые В-клетки распознают растворимые формы антигена. У мышей, которым одновременно интродуцировали гены, контролирующие синтез лизоцима кур, и реорганизованные гены, ответственные за синтез им-। v 195
Рис. 8.2. Отрицательный отбор В-клеток в костном мозге по способности распознавать собственные антигены.
В процесс селекции вступают незрелые В-клетки, экспрессирующие IgM-рецепторы. Известны две формы отрицательного отбора “self’-реактивных В-клеток: отбор по антигенам, представленным на поверхности клеток, и отбор по растворимым антигенам. В первом случае результат распознавания аутоантигенов приводит к апоптозу В-клеток. Во-втором — к функциональной блокаде В-клеток — анергии
муноглобулинов, специфичных к лизоциму, происходит нормальное образование IgM+ В-клеток. Несмотря на присутствие анти-генраспознающего рецептора на клеточной поверхности, такие В-клетки оказываются ареактивными к антигену, с которым они познакомились в процессе своего развития (табл. 8.3).
8.2. В-КЛЕТКИ ПЕРИФЕРИИ
Оставшаяся после отрицательного отбора на аутореактивность часть популяции незрелых В-клеток подвергается дальнейшему развитию на периферии.
Наивные, еще не встречавшиеся с чужеродным антигеном В-клетки мигрируют по кровеносным сосудам в периферические лимфоидные органы. Здесь они формируют первичные фолликулы лимфатических узлов и селезенки, являющиеся составной частью так называемой В-зоны этих органов. Часть В-клеток мигрирует в
Таблица 8.3
Интродукция мышам трансгенов, контролирующих специфические IgM
Трансгены, контролируй ющие: Мыши -реципиенты (гаплотип) Этапы дифференцировки Результат
пре-В-клетки незрелые В-клетки зрелые В-клетки
IgM анти-Н-2Ка Н-2КЬ +м +lgM +IgM, +IgD миграция на периферию
IgM анти-Н-2Ка Н-2Ка +м - - апоптоз
IgM антилизоцим и лизоцим +р +IgM анергия
лимфоидную ткань, ассоциированную с кишечником, известную как пейеровы бляшки. В этой лимфоидной ткани концентрируются в основном В-клетки, продуцирующие секреторный IgA. Мигрирующие на периферию В-клетки не остаются на месте постоянно и по истечении определенного времени пребывания in situ, если не произошло их стимуляции антигеном, вступают в процесс рециркуляции.
Основной фенотип большинства зрелых В-клеток неотличим от незрелых (см. табл. 8.1) за исключением экспрессии иммуноглобулиновых рецепторов (IgM — у незрелых В-клеток; IgM и IgD — у зрелых В-клеток периферии).
Среди зрелых В-клеток имеется отличающаяся по ряду свойств субпопуляция, клетки которой характеризуются наличием специфического рецептора CD5 (табл. 8.4). CD5+ В-клетки возникают в течение эмбриогенеза и остаются во взрослом состоянии благодаря способности к самообновлению. В постнатальный период формирование данного типа клеток от стволовой кроветворной клетки не происходит, а их присутсвие у взролых особей является сво-
Таблица 8.4
Сравнение свойств CD5+ В-клеток и обычных В-клеток
Свойство CD5+ В-клетки Обычные В-клетки
Появление в эмбриогенезе Способность к обновлению Продукция иммуноглобулинов Специфичность Продукция изотипов Ответ на углеводные антигены Ответ на белковые антигены рано самообновление высокая низкая IgM » IgG есть возможен ПОЗДНО замена мигрантами из костного мозга низкая высокая IgG » IgM возможен есть
еобразной формой “онтогенетического атавизма”. Одно из определяющих свойств данных клеток — это низкая специфичность их антигенраспознающих иммуноглобулиновых рецепторов и способность реагировать в основном с общими полисахаридными антигенами бактерий. Реакция на общие бактериальные антигены имеет значение в раннем периоде формирования иммунитета как один из способов срочной мобилизации антибактериальной защиты.
Заключение
В-система иммунитета включает костный мозг в качестве центрального органа системы, В-клетки, основное назначение которых — обеспечение способности к продукции специфических антител в случае антигенной агрессии, различные классы иммуноглобулинов (антител). Процесс образования клеток системы начинается в костном мозге. Здесь осуществляются пять этапов клеточного развития — от стволовой кроветворной клетки до незрелого В-лимфоцита. Два завершающих этапа с формированием зрелых В-клеток и плазмоцитов — активных продуцентов антител — проходят в периферической лимфоидной ткани. Каждый из этапов характеризуется набором специфических клеточных рецепторов и уровнем реорганизации иммуноглобулиновых генов.
Как и в случае с Т-клетками, в процесс становления В-кле-точного пула включен механизм элиминации клонов, способных продуцировать иммуноглобулины, специфичные к собственным антигенам. Этот крайне важный процесс для нормального, полноценного функционирования В-системы реализуется в костном мозге.
Глава 9. ИММУННЫЙ ОТВЕТ И ВЗАИМОДЕЙСТВИЕ КЛЕТОК
Введение
Развитие Т- и В-систем иммунитета включает два основных этапа. Первый состоит из комплекса событий, которые характеризуют собой доантигенный путь становления систем. Он направлен на создание потенциала клеточных и молекулярных механизмов, необходимых для будущих возможных встреч с антигеном (патогеном). Именно на доантигенном этапе происходят онтогенетическая закладка систем, дифференцировка прекурсоров иммунокомпетентных клеток до функционально подготовленных, способных отвечать на антиген Т- и В-лимфоцитов, формирование специфических клеточных клонов, взаимодействующих только с одной из множества антигенных детерминант, элиминация клонов, реагирующих на собственные антигены, дифференцированное заселение периферических лимфоидных органов и тканей (главы 7 и 8).
Второй этап связан с прямым функционированием Т- и В-систем, с постантигенным путем их развития. Он включает три основных события: (1) распознавание антигена функционально незрелыми (наивными) Т- или В-клетками, (2) их ответную реакцию на антиген в виде пролиферации и дифференцировки до зрелых эффекторных клеток и (3) собственно эффекторную фазу в иммунном ответе — нейтрализацию и уничтожение антигена.
Антиген как фактор индукции специфического ответа определяет запуск целого каскада реакций, среди которых наиболее существенными являются:
- распознавание чужеродного антигена;
- усиление миграции лимфоцитов, распознавших антиген;
- развитие реакции межклеточных взаимодействий;
- пролиферация и дифференцировка клоноспецифических предшественников эффекторных Т- и В-лимфоцитов;
- активизация системы комплемента;
- нейтрализация растворимого антигена специфическими антителами или разрушение чужеродных клеток цитотоксическими Т-лимфоцитами и последующим фагоцитозом антигенного материала;
- формирование Т- и В-клеток памяти после первичного контакта с антигеном.
В самой сжатой форме основное содержание каждого из этапов можно определить несколькими словами: первый этап — это формирование антигенспецифических клонов, второй — работа таких клонов.
Представляемая глава посвящена описанию современных данных о клеточных и молекулярных механизмах работы Т- и В-систем иммунитета в условиях встречи организма с антигеном.
9.1. КЛЕТОЧНЫЙ ИММУННЫЙ ОТВЕТ
В отличие от В-системы иммунитета, которая нейтрализует антиген с помощью гуморальных эффекторных молекул — антител, Т-система уничтожает антигены, представленные на клетках, через прямое взаимодействие специфических, цитотоксический CD8 Т-клеток с изменеными собственными или чужеродными клетками.
Вторая отличительная черта Т-клеток связана с особенностями распознавания антигена. Как уже отмечалось, Т-клетки распознают не собственно антигенный пептид (эпитоп), а его комплекс с молекулами I или 11 классов МНС. Распознавание комплекса, включащего молекулы I класса, осуществляется цитотоксическими Т-лимфоцитами (ЦТЛ); иное обозначение этих клеток — Т-киллеры, CD8 Т-клетки. В тех случаях, когда антигенный пептид образует комплекс с молекулами II класса, в процесс взаимодействия с таким комплексом вступают либо CD4 Т-клетки воспаления (Тн1, прежнее название клеток этой субпопуляции — Т-индукторы, Тгзт), либо хелперные CD4 Т-клетки (Тн2).
Если наивные Т-клетки распознают комплекс на поверхности макрофагов, поглотивших патоген, то такие клетки дифферн-цируются в CD4 Т-клетки воспаления, активируют макрофаги и тем самым способствуют внутриклеточному перевариванию (уничтожению) патогена. Путь проникновения антигена в клетку может осуществляться не только за счет неспецифической адгезии патогена на поверхности макрофагов, но и посредством специфического взаимодействия с предсуществующими антигенраспознаю-щими рецепторами (поверхностными иммуноглобулинами) В-клеток. Экспрессия переработанного антигена в комплексе с молекулами II класса на поверхности В-клеток включает в ответ наивные Т-клетки, дифференцирующиеся в хелперные CD4 Т-клетки. В этом случае хелперные CD4 Т-клетки оказывают помощь В-клеткам в продукции антител, т.е. в формировании гуморального иммунного ответа.
В таблице 9.1 представлены сравнительные характеристики особенностей проявления клеточного и гуморального иммунного ответа.
9.1.1. Основные реакции клеточного иммунитета (феноменология)
Для изучения механизмов клеточного иммунитета, действующего в организме человека и животных, были разработаны модельные, экспериментальные, системы in vitro и in vivo.
Таблица 9.1
Сравнительная характеристика проявлении клеточного и гуморального иммунного ответа
Признак
Клеточный иммунитет
Патоген вирусы (вирус гриппа, вирус оспы, др.). Listeria, Toxoplasma gondi бактерии, простейшие (Mycobacterium tuberculosis, М. leprae, Leishmania donovdni)
Локализация и деградация ЦИТОЗОЛЬ вакуоли макрофагов
Гуморальный ______иммунитет бактерии и их токсины (Clostridium tetani. Staphylococcus aureus, Streptococcus pneumoniae) внеклеточная жидкость; вакуоли В-клеток
Презентация комплекс антиген-
антигена ного пептида с молекулами I кл. МНС на поверхности инфицированной клетки
Эффекторные цитотоксические
Т-клетки CD8 Т-клетки
Эффекторное лизис инфициро-
действие ванных клеток
комплекс антигенного пептида с молекулами II кл. МНС на поверхности инфицированных макрофагов
CD4 Т-клетки воспаления (Тн1)
уничтожение внутриклеточных патогенов активированными макрофагами
комплекс антигенного пептида с молекулами II кл. МНС на поверхности специфических, инфицированных В-клеток хелперные CD4 Т-клетки (Тн2)
синтез специфических антител, нейтрализующих внеклеточные патогены и их токсины
9.1.1.1. Реакция цитотоксических Т-лимфоцитов (ЦТЛ; CD8 Т-клеток)
При вирусной инфекции, опухолевом росте, отторжении трансплантата основными эффекторными клетками являются цитотоксические Т-лимфоциты (CD8 Т-клетки).
Этапы цитолитического действия CD8 Т-клеток включают: распознавание антигена предшественниками, их пролиферацию и дифференцировку до зрелых эффекторов, собственно процесс лизиса измененных своих вирусинфицированных и раковых клеток или чужеродных клеток трансплантированной ткани. Изучение клеточных и молекулярных механизмов, действующих на каждом этапе, было проведено главным образом в опытах in vitro.
Приемы экспериментальной работы достаточно просты. Например, к суспензии клеток-мишеней, зараженных вирусом и 201
меченных хромом-51, добавляют примированные к антигенам вируса лимфоциты, которые выделяют от мышей, предварительно иммунизированных данным вирусом. После определенного времени совместной инкубации (4-24 часа), в течение которого происходят лизис клеток-мишеней и выход в супернатант хрома-51, культуральные пробирки центрифугируют и определяют количество метки в супернатанте, являющееся эквивалентом числу разрушенных клеток-мишеней (рис. 9.1).
4-24 чл
Супернатант Подсчет метки( 51Сг)
Клетки-мишени + вирусЛ+51Сг
Рис. 9-1. Схема одного из вариантов постановки цитотоксической реакции.
От мышей, иммунизированных вирусом (условно, вирусом А), через 4-9 дней после введения антигена получают клетки лимфатического узла или селезенки. Оценку цитотоксической активности таких примированных клеток проводят /л vitro с помощью клеток-мишеней, проинкубированных с вирусом и радиоактивной меткой 51Сг. К клеткам-мишеням добавляют в разном соотношении тестируемые клетки. В результате реакции цитолиза клеток-мишеней в супернатанте накапливается 51 Сг. Количество метки в супернатанте является эквивалентом числу разрушенных клеток
Процесс лизиса чужеродных клеток состоит из нескольких этапов (рис. 9.2). Первый этап — специфическое связывание примированных CD8 Т-клеток с поверхностным чужеродным антигеном (пептидами вирусных, трансплантационных, раковых антигенов). Взаимодействие антигенраспознающих рецепторов цитотоксических Т-клеток с соответствующим антигеном усиливается дополнительными неспецифическими молекулярными структурами клеточной поверхности, которые обеспечивают наиболее эффективную динамическую адгезию между клетками (см. ниже). Второй этап, получивший название “летального удара”, представляет собой основное событие, предопределяющее гибель клетки-мишени. Механическое разобщение эффектора и клетки-мишени на этом этапе не спасает последнюю от гибели. Для этого этапа характерно повышение проницаемости клеточной мембраны, нарушение баланса натрий-калиевого насоса. Механизм, лежащий в основе “летального удара”, не достаточно ясен. Одним из факторов, повреждающих мембрану клетки, выступает лимфотоксин (фактор р некроза опухолей). Третий этап, приводящий к лизису клетки-ми-202
2 Протеазы, ЭДТА, анти- Стимуляторы цАМФ, Низкая температура, пред-q тела к клеткам-мишеням, колхицин, винбластин низолон, хлорохин, трипа-азцд натрия, пуромицин. ЭДТА. гепарин новый синий, фтородаты,
ш динитрофенол декстран
Рис. 9.2. Этапы взаимодействия цитотоксических Т-лимфоцитов (ЦТЛ; Т-киллеров; CD8 Т-клеток) с клеткой-мишенью.
Первый этап — специфическое связывание ЦТЛ с клеткой-мишенью. Механическое разобщение взаимодействующих клеток спасает клетку-мишень от лизиса. Второй этап — ‘‘летальный удар” — основное событие, предопределяющее гибель клетки-мишени. ЦТЛ должен находиться в состоянии активного метаболизма. При этом жизнеспособность клетки-мишени не является обязательным условием. Механическое разобщение между взаимодействующими клетками на этом этапе не спасет клетку-мишень от гибели. Третий этап — заключительный, приводящий к лизису клетки-мишени. ЦТЛ остается неповрежденным и способен к дальнейшему цитолитическому действию
шени, характеризуется увеличением ее объема за счет все большего проникновения НгО через поврежденную мембрану. В результате этих процессов происходит разрыв мембраны клетки-мишени и ее гибель. Эффекторная клетка сохраняется и способна к дальнейшему цитолитическому действию.
9.1.1.2. Реакция в смешанной культуре лимфоцитов (СКЛ)
Для изучения механизмов цитолитического действия CD8 Т-клеток используют два основных приема:
- индукцию цитотоксических Т-лимфоцитов in vivo, когда для получения клеток-эффекторов иммунизируют животных антигенами клеток-мишеней (обычно это — аллогенные, или опухолевые клетки);
- индукцию таких клеток in vitro, когда созревание цитотоксических Т-клеток инициируют в смешанной культуре лимфоцитов (СКЛ).
В последнем случае в качестве стимуляторов для примирова-ния используют клетки лимфоидной ткани, генетически отличающиеся от распознающих предшественников CD8 Т-лимфоцитов, модифицированные вирусом или иным антигеном (например, гаптеном) сингенные клетки, а также сингенные раковые клетки. Клет
ки-стимуляторы облучают суперлетальной дозой или обрабатывают ингибитором клеточного деления для подавления их пролиферации. Предшественники CD8 Т-клеток вносят в культуру интактными. В результате распознавания антигенов клеток-стимуляторов предшественники цитотоксических Т-лимфоцитов вступают в реакцию пролиферации и дифференцировки, что оценивается по включению 3Н-тимидина. Эффективность примирования предшественников CD8 Т-клеток оценивается во вторичной культуре по лизису клеток-мишеней, аутологичных или сингенных клеткам-стимуляторам (рис. 9.3).
1-ая культура
2-ая культура
Рис. 9.3. Реакция в смешанной культуре лимфоцитов (СКЛ).
Эта реакция пролиферации развивается in virto при взаимодействии генетически отличающихся (аллогенных) лимфоцитов. Результат реакции состоит в накоплении цитотоксических Т-лимфоцитов (CD8 Т-клеток), специфичных к антигенам гистосовместимости клеток-стимуляторов. В первичной культуре предшественники ЦТЛ (пр. CD8), представленные в суммарной популяции анализируемых лимфоцитов, после распознавания аллоантигенов клеток-стимуляторов вступают в процесс пролиферации и дифференцировки до зрелых ЦТЛ (CD8). Интенсивность пролиферативной реакции оценивают по включению 3Н-тимидина в размножающиеся клетки. Для созревания пр. CD8. необходима помощь со стороны макрофагов и хелперных CD4 Т-клеток (Тн2), образующихся из антигенраспозна-ющих предшественников (ТнО). Оценку активности накопившихся в первичной культуре CD8 Т-клеток проводят во вторичной культуре (см. рис. 9.1). В качестве мишеней используют те аллогенные клетки, которые в первичной культуре выступали стимуляторами
Установлено, что распознавание антигена предшественниками CD8 Т-клеток недостаточно для генерации функционально активных цитотоксических лимфоцитов: необходима помощь со стороны хелперных CD4 Т-клеток и макрофагов (см. ниже).
9.1.1.3. Реакция гиперчувствительности замедленного типа (ГЗТ)
Одной из форм клеточного иммуного ответа является реакция гиперчувствительности замедленного типа (ГЗТ). Реакция впервые была описана немецким бактериологом Робертом Кохом в 1891 году. Введение интактным морским свинкам вирулентных бацилл туберкулеза (Mycobacterium tuberculosis) приводит к быстрому распространению возбудителя по организму, развитию острого инфекционного процесса, как правило, с летальным исходом. Картина меняется, если бациллы вводятся предварительно иммунизированным животным. В этом случае внутрикожно введенный возбудитель оказывается локализованным в месте инъекции в результате развития воспалительной реакции. Клетки воспалительного узелка представлены в основном макрофагами и лимфоцитами. Картину локальной воспалительной реакции можно наблюдать при введении не только бацилл, но и их продуктов — туберкулина и PPD (англ, “purified protein derivative”). Туберкулин — фильтрат культуральной жидкости М. tuberculosis. PPD состоит из белков, выделенных из культуры.
Реакция локального воспаления развивается не только на бациллы туберкулеза, но и на широкий набор бактерий, вирусов, грибков, для которых макрофаги являются местом выживания и размножения. Кроме того, реакция может быть воспроизведена с модельными антигенами, например с эритроцитами различных видов животных.
При повторном введении антигена реакция ГЗТ проявляется не сразу, а через 24-48 часов, отсюда и ее название — гиперчувствительность замедленного типа. По величине образующегося узелкового уплотнения (гранулемы) в месте введения антигена судят о напряженности иммунной реакции.
Первичное введение антигена в интактный организм приводит к его захвату макрофагами, внутриклеточной деградации части антигена и экспрессии образующихся антигенных фрагментов (пептидов) на клеточной поверхности в комплексе с молекулами II класса МНС (рис. 9.4). Комплекс пептид:молекула II класса распознается наивными CD4 Т-клетками (ТнО), которые дифференцируются в CD4 Т-клетки воспаления (Тн1) и хелперные CD4 Т-клетки (Тн2). При повторном введении того же самого антигена дифференцированные Тн1 и Тц2 быстро вступают в реакцию взаимодействия с макрофагом, поглотившим антиген. Результатом
специфического взаимодействия является секреция Тн1 хемоаттрактантов, привлекающих в зону проникновения антигена макрофаги из кровотока (подробнее см. ниже).
1-е введение АГ
▼
премирование
развитие ГЗТ
Рис. 9.4. Реакция гиперчувствителыюсти замедленного типа (ГЗТ).
Гиперчувствительность замедленного типа — воспалительная реакция повышенной чувствительности, развивающаяся через 24-48 часов на месте повторного проникновения антигена. При первичном введении антигена в интактный организм он поглощается антигенпрезентирующими клетками (в частности, макрофагами), происходит внутриклеточное разрушение и экспрессия образующихся антигенных фрагментов (пептидов) на клеточной поверхности в комплексе с молекулами П класса МНС. Иммуногенный комплекс распознается наивными CD4 Т-клетками (ТнО), которые дифференцируются в CD4 Т-клетки воспаления (Тц1; прежнее обозначение — Тгзт, Т-индукторы). При повторной встрече с тем же антигеном зрелые Тц1 вступают в реакцию распознавания данного антигена. Результатом распознавания является активная продукция Тн 1 хемотаксических факторов, привлекающих в зону проникновения антигена макрофаги и другие клетки воспаления из кровотока
9.1.1.4. Реакция трансплантат против хозяина (РТПХ)
В клинической практике для компенсации врожденной или приобретенной иммунологической недостаточности иногда вынуждены прибегать к пересадке клеток кроветворной и лимфоидной ткани. Поскольку в клеточном трансплантате содержатся иммунокомпетентные клетки, то, как правило, развивается реакция этих клеток на антигены реципиента. Реакция получила название реакции трансплантат против хозяина (РТПХ).
Для экспериментального воспроизведения РТПХ необходимо соблюдение следующих условий:
1) реципиент должен быть толерантным к введенным чужеродным клеткам;
2) трансплантируемые клетки должны обладать иммунологической компетенцией;
3) между клетками донора и реципиента должны существовать антигенные различия.
В эксперименте реакцию оценивают либо по увеличению селезенки или лимфатических узлов, либо по смертности иммунологически инертного реципиента,которому введены лимфоциты, генетически отличающегося донора. Один из вариантов РТПХ — увеличение массы и количества клеток в лимфатическом узле, регионарном к месту введения чужеродных лимфоцитов. Схема постановки реакции представлена на рис. 9.5. Мышам (А х B)F1 вводят лимфоциты одного из родителей (А или В) в подушечку лапы. Реципиент иммунологически толерантен к введенным клеткам, так как антигены родителей полностью представлены в гибриде. Через 7 дней определяют массу или количество клеток в подколенном (регионарном к месту введения клеток) лимфатическом узле. Отношение числа клеток в “опытном” лимфатическом узле к числу клеток в “контрольном” узле дает индекс РТПХ. При отношении опытжонтроль, дающем индекс более 1,3, реакция считается положительной.
Введенные чужеродные лимфоциты распознают неродственные антигены реципиента и формируют антигенспецифическую реакцию. В процесс распознавания включаются две субпопуляции лимфоцитов: предшественники CD8 Т-клеток (цитотоксических Т-клеток) и CD4 Т-клетки. Результатом реакции является накопление зрелых CD8 Т-клеток. Число клеток в селезенке или лимфатическом узле увеличивается не только за счет пролиферации введенных лимфоцитов, но и в результате привлечения в зону реакции собственных клеток реципиента.
9.1.1.5. Реакция отторжения трансплантата
Пересадка тканей или органов от одного индивидуума другому, генетически отличающемуся, или от одной инбредной линии мышей другой, также генетически отличной от линии донора, вызывает реакцию отторжения пересаженного биологического материала. Время отторжения первичного трансплантата — около 14 дней. Вторичный трансплантат отторгается быстрее: приблизительно за 5-7 дней.
Отдельные реакции клеточного иммунитета, представленные выше, имеют свое интегральное проявление при отторжении чужеродной ткани. Собственно реакция отторжения включает два компонента: специфический, связанный в основном с активнос-
ВАРИАНТ ПОСТАНОВКИ РТПХ
РАЗВИТИЕ РТПХ
Распознавание
Пролиферация и дифференцировка
Накопление эффекторов РТПХ
тью цитотоксических Т-клеток, и неспецифический, имеющий характер воспаления.
Развитие реакции трансплантационного иммунитета состоит из трех этапов (рис. 9.6): распознавание чужеродных антигенов трансплантата (I), созревание и накопление эффекторов трансплантационной реакции отторжения в периферической, ближайшей к трансплантату лимфоидной ткани (II), и разрушение трансплантата (III).
Этап I. В процесс распознавания вступают предшественники цитотоксических Т-лимфоцитов (CD8 Т-клеток), предшественники хелперных и воспалительных Т-клеток (ТнО). После распознавания антигена клетки этих типов мигрируют в ближайшую лимфоидную ткань, например в регионарный лимфатический узел.
Этап 2. В периферической лимфоидной ткани развиваются основные события, приводящие к созреванию и накоплению клеток различных типов — эффекторов реакции отторжения. Предшественники цитотоксических Т-лимфоцитов, хелперных Т-клеток и Т-клеток воспаления дифференцируются в зрелые эффекторы.
Процесс распознавания может происходить не только непосредственно в зоне трансплантата, но и в регионарной лимфоидной ткани за счет проникновения в нее антигенов трансплантата. В лимфоидной ткани антиген после усвоения макрофагами и выхода на клеточную поверхность в иммуногенной форме обеспечивает накопление воспалительных Т-клеток (ТнО- Этот же антиген, экспрессируясь на поверхности В-клеток, включает хелперные Т-клетки (Тн2), что обеспечивает накопление специфических антител. Таким образом, помимо эффекторов клеточного иммунитета в лимфоидной ткани идет процесс формирования эффекторов гуморального иммунного ответа.
Рис. 9.5. Реакция трансплантат против хозяина (РТПХ).
Верхняя часть рисунка демонстрирует вариант постановки РТПХ.
Мышам-гибридам (AxB)Fi вводят лимфоциты одного из родителей (А или В) в подушечку лапы. Реципиент иммунологически толерантен к введенным клеткам, так как антигены родителей полностью представлены в гибриде. В подушечку противположной лапы вводятся генетически идентичные клетки гибрида (контроль). Через 7 дней определяют массу или количество клеток в подколенном (региональном к месту введения) лимфатическом узле. Отношение количества клеток в “опытном” лимфатическом узле к количеству клеток в “контрольном” дает индекс РТПХ. При индексе более 1,3 реакция считается положительной. Нижняя часть рисунка указывает на клетки, принимающие участие в развитии реакции. Основными участниками являются предшественники цитотоксических Т-лимфоцитов (nCD8) и предшественники Т-клеток воспаления nCD4. В процесс созревания включаются также макрофаги (МФ). Результатом реакции является накопление зрелых CD8. Увеличение количества клеток в лимфатическом узле или селезенке происходит не только за счет размножения введенных клеток, но и в результате привлечения в зону воспаления собственных клеток реципиента и их пролиферации in situ
Рис. 9.6. Реакция отторжения трансплантата.
Реакция включает три этапа. На этапе I происходит распознавание антигенов трансплантата предшественниками цитотоксических Т-лимфоцитов (nCD8) и предшественниками хелперных и воспалительных Т-клеток (ТцО). После распознавания клетки мигрируют в ближайшую (региональную) лимфоидную ткань. В ней развиваются основные события, приводящие к формированию эффекторов реакции отторжения (этап II). Предшественники CD8 трансформируются в эффекторные зрелые цитотоксические Т-клетки (CD8). Свободные трансплантационные антигены, поступающие в лимфоидную ткань, захватываются антигенпредставляю-шими клетками (отмечены только макрофаги — МФ) и подключают к ответу как Тн1-, так и Тн2-клетки. При совместном участии антигенпредставлящих клеток, В-клеток и Тн2 формируется гуморальный иммунный ответ, являющийся дополнительным звеном отторжения. Здесь же происходит сорбция секретируемых антител на поверхности натуральных киллеров (НК), а также активация макрофагов либо под воздействием цитокинов Т-клеток, либо в результате сорбции антител. Активируются также и НК-клетки под воздействием цитокинов Т-лимфоиитов. На этапе III развиваются основные события трансплантационной реакции — отторжение чужеродной ткани. Оно реализуется при участии зрелых CD8 Т-клеток, активированных иммуноглобулинами макрофагов, антителами при участии комплемента, НК-клетками, армированными иммуноглобулинами и активированными цитокинами. При участии Тц1 в зону отторжения привлекаются макрофаги, обеспечивающие воспалительный компонент реакции отторжения
Секретируемые антитела могут сорбироваться на поверхности так называемых натуральных киллеров (НК-клеток) — особой популяции лимфоцитов, не имеющих маркеров Т- и В-клеток. Цитофильность антител к НК-клеткам обеспечивается взаимодействием Fc-участка иммуноглобулинов с соответствующим рецептором на поверхности НК-клеток. В результате НК-клетки, связавшие иммуноглобулин, приобретают способность к антителозависимому цитолизу клеток трансплантата.
В процессе развития реакции на трансплантат присходит активация макрофагов либо под воздействием цитокинов Т-клеток, либо в результате пассивной сорбции иммуноглобулинов по аналогии с НК-клетками.
Этап III. В разрушении и отторжении трансплантата участвуют перечисленные выше клеточные формы и специфические иммуноглобулины. Цитотоксические Т-лимфоциты (CD8 Т-клетки) и НК-клетки вступают в специфическую реакцию разрушения трансплантата: первые — за счет собственных антигенраспознаю-щих рецепторов, вторые — за счет цитофильных антител. Т-клетки воспаления (Тн1) после взаимодействия с антигенами трансплантата начинают активную секрецию хемотаксического макрофагин-гибирующего фактора, привлекающего в зону отторжения макрофаги, способные к неспецифическому лизису трансплантата (по своей форме это — типичная реакция воспаления). Клетки трансплантата неспецифически лизируются также активированными цитокинами натуральными киллерными клетками.
Таким образом, в реакцию отторжения трансплантата включаются как специфические участники — CD8 Т-клетки (ЦТЛ), CD4 Т-клетки воспления (Тн1), специфические иммуноглобулины, так и неспецифические — активированные макрофаги и натуральные киллеры.
9.1.2. Генерация эффекторных Т-клеток
9.1.2.1. Общая характеристика
При кратком описании реакций клеточного иммунитета, представленном выше, упоминалось, что первичное распознавание чужеродного антигена осуществляется функционально неподготовленными, наивными, Т-клетками, хотя внутритимусная дифференцировка уже определила основные свойства этих клеток, что отражается в их делении на субпопуляции.
Созревание наивных Т-клеток в зрелые, функционально активные (армированные) Т-клетки происходит в лимфоидной ткани. Место проникновения патогена (в более широком смысле — антигена) в организм, как правило, удалено от лимфоидных об
разований. Стоком лимфы антиген попадает в ближайшие лимфатические узлы. Если антиген оказывается в кровотоке, то он оседает в селезенке. Локализация антигена на слизистых приводит к его миграции в лимфоидную ткань, ассоциированную с этими слизистыми покровами, — в пейеровы бляшки, миндалины.
В периферической лимфоидной ткани имеются три типа специализированных клеток, которые способны усваивать антиген и представлять его в иммуногенной форме на своей поверхности для распознавания Т-клетками. Это — макрофаги, дендритные клетки и В-клетки (табл. 9.1, рис. 9.7). Все они получили общее название антигенпрезентирующих клеток (АПК). Макрофаги не имеют гистологически определенного места локализации и широко представлены по всей лимфоидной ткани. Дендритные клетки связаны с Т-зоной лимфатических узлов. В-клетки концентрируются в фолликулах. Функция этих типов клеток — представление антигенных пептидов в комплексе с молекулами 1 или II класса, т.е. придание проникшему антигену иммуногенных свойств.
Оказавшийся в лимфоидной ткани антиген провоцирует усиление рециркуляции лимфоцитов. Наивные Т-клетки попадают в лимфатические узлы в так называемую Т-зону (см. главу 6) через высокий эндотелий венул. Генерация зрелых (армированных) эффекторов Т-клеточного иммунного ответа начинается с распознавания антигенного пептида, комплексированного с молекулами I или II классов МНС, на поверхности макрофагов и дендритных клеток. Сам факт распознавания комплекса является обязательным, но недостаточным условием для инициации развития наивных Т-клеток в зрелые эффекторы. Необходимо предупреждающее включение кофакторов, которые способствуют взаимодействию рецептора Т-клеток с антигенным комплексом. Именно антигенпрезентирующие клетки обеспечивают такое двойное взаимодействие.
Активация наивных Т-клеток при первичной встрече с антигеном получила название примирование. Это определение введено с тем, чтобы отличить первичное взаимодействие с антигеном от взаимодействия зрелых эффекторов с тем же антигеном, когда собственно и проявляется функциональное предназначение различных субпопуляций Т-клеток. В ряде случаев, в частности при формировании специфической, цитотоксической реакции, презентирующая антиген клетка может выступать и как объект распознавания, и как объект цитолитического действия CD8 Т-кле-ток после их созревания (см. представленные выше рисунки). Среди наивных Т-лимфоцитов, проникающих в лимфоидную ткань и временно локализующихся в Т-зонах, только один из 10s оказывается способным к специфическому взаимодействию. Остальные
постепенно перемещаются в медуллярную зону и через эфферентный лимфатический сосуд покидают орган, чтобы вновь оказаться в кровотоке и быть занесенным в другие лимфоидные образования организма.
9.1.2.2. Антигенпрезентирующие клетки в процессе активации наивных Т-клеток
Выше отмечалось (глава 7), что хоминг наивных Т-клеток в лимфатические узлы осуществляется в результате взаимодействия
Рис. 9.7. Рециркуляция Т-клеток после проникновения антигена в лимфоидную ткань.
Антиген с током лимфы от места проникновения в организм заносится в лимфатический узел. Антигенпрезентирующие клетки (макрофаги — МФ, дендритные клетки — ДК, В-клетки — В-кл.) захватывают, перерабатывают и представляют антигенные пептиды в комплексе с молекулами I или II классов МНС на своей поверхности. Эти события активируют процесс рециркуляции клеток. Рециркулирующие наивные Т-клетки, среди которых имеются и специфичные к комплексу лимфоциты (черные кружки) попадают в лимфатический узел либо по афферентным лимфатическим сосудам, либо по кровеносным сосудам. В тех случаях, когда антиген поступает в орган с кровотоком, ему приходится преодолевать высокий эндотелий венул. Оказавшись в паренхиме органа, наивные антигенспеци-фические Т-клетки после распознавания иммуногена на одной из антигенпрезентирующих клеток остаются в органе, с тем чтобы пройти дополнительную дифференцировку до функционально зрелых, армированных CD8- и CD4 Т-клеток. Ан-тигенспецифические клетки, оказавшись невостребованными, покидают орган по эфферентному лимфатическому сосуду и вступают таким образом в новый цикл рециркуляции
L-селектинов Т-клеток с муциноподобными адрессинами сосудов (CD34, GlyCAM-1). При хоминге лимфоцитов в лимфоидную ткань слизистых в процесс включаются L-селектины и MAdCAM-1 эндотелия слизистых покровов. Через эндотелий в паренхиму органа Т-клетки проникают за счет другой группы адгезивных молекул — интегрина LFA-1 и членов суперсемейства иммуноглобулинов ICAM-1, -2, -3 (табл. 9.2).
Таблица 9.2
Адгезивные молекулы, участвующие в заселении лимфоидной ткани наивными Т-клетками и генерации зрелых Т-клеток
Процесс Эндотелий венул Антигенпрезентирующие клетки Т-клетки
Заселение лимфоидной ткани CD34, GlyCAM-1, MAdCAM-1, ICAMs L-селектин LFA-1
Взаимодействие наивных Т-клеток с антигенпрезентирующими клетками ICAMs LFA-3 (CD58) LFA-1 CD2
Проникновение наивных Т-лимфоцитов в кортикальную зону приводит к их столкновению с антигенпрезентирующими клетками. На начальном этапе процесса, как это ни странно, отсутствует специфический компонент взаимодействия, т.е. взаимодействие Т-клеточного рецептора с иммуногеном на поверхности антигенпрезентирующих клеток. В межклеточный контакт вступают LFA-1 и CD2 Т-клеток, а также ICAM-1, -2, -3 и LFA-3 антигенпрезентирующих клеток. Дифференциальная роль каждого из этих адге-зинов не установлена. Возможно, что их одновременная экспрессия на клеточной поверхности обеспечивает определенный “запас прочности”. Известно, что отсутствие синтеза LFA-1 у людей не нарушает функционирования Т-системы. Выпадение звена взаимодействия пары LFA-1:ICAM компенсируется более активным включением пары CD2:LFA-3.
Преходящее взаимодействие наивных Т-клеток с антигенпрезентирующими клетками осуществляется низкоаффинными LFA-1. Отсутствие жесткой формы контактных отношений между клетками имеет конкретный биологический смысл. Низкая аффинность адгезина позволяет Т-клетке приходить в контакт со многими антигенпрезентирующими клетками до тех пор, пока не произойдет специфическое узнавание иммуногена соответствующим антигенраспознающим рецептором. Как только наивная Т-клетка находит “свой” иммуноген, ее перемещение в корковом слое
приостанавливается. От Т-клеточного рецептора идет сигнал на LFA-1, меняющий конформацию адгезина, что приводит к усилению его аффинности по отношению к молекулам ICAM (рис. 9.8). Механизм изменения аффинности LFA-1 не известен. Вероятно, в этом процессе принимают участие ионы Mg+2, но не Са+2. Возникшие изменения стабилизируют контактные отношения между антигенспецифическими наивными Т-клетками и антигенпрезентирующими клетками. В результате такая Т-клетка становится подготовленной к пролиферации и дифференцировке в зрелые ан-тигенспецифические Т-клетки.
Подавляющее большинство наивных Т-клеток не выдерживает отбора на специфичность и покидает лимфатический узел через эфферентный лимфатический сосуд, с тем чтобы вновь вступить в процесс рециркуляции в поисках соответствующих по специфичности антигенов (см. рис. 9.7).
Связывание антигенспецифического рецептора с комплексом пептидгмолекулы I или II класса МНС и включение в комплексообразование корецепторов CD8 или CD4 обеспечивает лишь одно из условий развития наивных Т-клеток — формирование первого сигнала к пролиферации и дифференцировке этих клеток. Чтобы специфически подготовленная клетка начала, наконец, процесс дальнейшего развития, необходим второй сигнал от клеточной поверхности к геному (рис. 9.8). Костимулятором в данном случае выступает молекула В7, экспрессирующаяся на мембране антиген-презентирующей клетки. В7 — это гомодимер, относящийся к суперсемейству иммуноглобулинов. Его костимулирующая активность была продемонстрирована в опытах по переносу гена для этого белка в фибробласты, которые сами по себе не относятся к антигенпрезентирующим клеткам. Внесение в культуру Т-клеток, получивших специфический сигнал об антигене, фибробластов с трансфецированным геном для В7, обеспечивало полноценное развитие специфического ответа. Рецептором для В7 на поверхности наивной Т-клетки является белок CD28, также относящийся к суперсемейству иммуноглобулинов. Взаимодействие CD28:B7 обеспечивает формирование второго сигнала. Антитела к В7, препятствующие его взаимодействию с CD28, отменяют эффект ко-стимуляции.
Помимо CD28 активированные наивные Т-клетки синтезируют и экспрессируют еще один белок с костимулирующей активностью — CTLA-4. Он обладает большей аффинностью по отношению к В7. Между CD28 и CTLA-4 высока гомология по последовательности аминокислотных остатков, а кодирующие их гены близко сцеплены в хромосоме. Ясно, что совместное костимули-
рующее действие этих молекул оказывает больший эффект на развитие Т-клеток.
Тот факт, что одна и та же антигенпрезентирующая клетка выполняет двойную функцию — представление антигена в им-
СЕЛЕКЦИЯ КЛОНА
РОСТ И ДИФФЕРЕНЦИРОВКА КЛОНА
Рис. 9.8. Участие адгезинов и костимуляторов в отборе и дифференцировке наивных Т-клеток.
1. Проникшие в кортикальную зону наивные Т-лимфоциты взаимодействуют неспецифически с антигенпредставляющими клетками (АПК) посредством адгезинов: LFA-1 — на Т-клетках и 1САМ — на АКП. Взаимодействие LFA-1 — 1САМ на этом этапе характеризуется низкой аффинностью. Если Т-клеточный антигенраспознаюший рецептор (ТКР) “не находит” на АКП соответствующего по специфичности комплекса пептид:молекула МНС (пример генерации Т-хелперов), то клетка покидает АПК и вступает в процесс рециркуляции. 2. При соответствии по специфичности ТКР комплексу пептид:молекула МНС повышается аффинность взаимодействия LFA-1 с ICAM, и контактное взаимодействие Т-клетки с АПК становится достаточно прочным. 3. Взаимодействие ТКР с антигенным комплексом формирует при участии корецептора (на рис. корецептор Т-хелперов CD4) первый сигнал к дифференцировке провзаимодействовавших клеток. Второй сигнал формируется костимулятором В7, представленным на поверхности АПК, и соответствующими лигандами на Т-клетках — CD28 и СПАЛ. Только при совместном действии первого и второго сигналов происходят рост и дифференцировка наивных Т-клеток до зрелых эффекторов
муногенной форме и экспрессию лиганда для костимуляции, т.е. определяет формирование специфического и неспецифического сигналов для дифференцировки наивных Т-клеток в активные эффекторы, имеет большой биологический смысл. Отрицательная селекция в тимусе, очевидно, не является абсолютно безошибочным процессом. Определенные “запрещенные” клоны могут выйти в циркуляцию и стать потенциальной причиной аутоиммунного поражения. Однако, как правило, этой аутоагрессии не наблюдается, поскольку сам факт распознавания антигена, в том числе и собственного, не является единственным условием запуска дифференцировки наивных Т-клеток. Необходимо включение кости-мулятора, которое происходит только на антигенпрезентирующих клетках.
9.1.2.3. Дифференциальная роль различных антигенпрезентирующих клеток в инициации иммунного ответа
Макрофаги. Макрофаги помимо участия в неспецифической форме защиты от инфекции проявляют себя как антигенпрезентирующие клетки в реакциях специфического иммунитета.
Как отмечалось выше, клетки, представляющие антиген в иммуногенной форме на мембране, должны обладать, по крайней мере, двумя основными свойствами: способностью образовывать комплекс антигенного пептида с молекулами I или II классов МНС и экспрессировать костимулятор, который обеспечивает прохождение второго сигнала при активации наивных Т-клеток.
Макрофаги в состоянии покоя имеют очень незначительное количество молекул II класса и полностью лишены костимулято-ра В7 на своей поверхности. Их выраженное представительство на мембране начинается после захвата и внутриклеточного переваривания микроорганизмов.
Один из способов поглощения бактерий связан с рецепторами к маннозе, которые способны взаимодействовать с углеводами бактериальной стенки. Захваченные микроорганизмы деградируют в фаголизосомах, образуя отдельные пептиды, которые выносятся на клеточную поверхность в комплексе с молекулами МНС. Именно в процессе внутриклеточного переваривания кор-пускулярого антигена происходит индукция синтеза и экспрессии на клеточной поверхности молекул II класса и костимулятора В7. Факторы индукции неизвестны. Возможно, ими являются рецепторы клеточной поверхности, взаимодействующие с микроорганизмами, поскольку синтез В7 можно индуцировать простой инкубацией макрофагов с отдельными компонентами (углеводами, липополисахаридами) бактериальной стенки.
Индукция костимулирующей активности к общим микробным компонентам позволяет иммунной системе отличать бактериальные антигены от собственных антигенов организма или безвредных, хотя и чужеродных белков. Из практической работы известно, что получение иммунного ответа к некоторым белкам возможно только с использованием адъювантов, включающих убитые микроорганизмы или продукты их бактериальной стенки. Схема возможных отношений в данном случае выглядит следующим образом. Если белковые антигены захватываются и презентируются макрофагами в отсутствие бактериальных компонентов, которые инициируют синтез В7, то Т-клетка специфически распознает антиген, однако остается рефрактерной, так как отсутствует действие второго сигнала для запуска пролиферации и дифференцировки. Внесение в систему бактериальных компонентов — индукторов костимулятора В7 — обеспечивает полноценное включение в ответ Т-клеток. В условиях эксперимента аутоиммунное заболевание легко индуцируется смесью собственных тканевых антигенов с компонентами бактериальной стенки, иллюстрируя тем самым значение костимуляции в процессе разграничения “своего” от “чужого”.
Понимание того факта, что запуск Т-клеточного ответа связан с двухсигнальной системой активации, внесло ясность в работу макрофагов в качестве “мусорщиков”. Купферовские клетки печени и макрофаги селезенки постоянно захватывают и разрушают отжившие клетки этих органов. При этом в отсутствие бактериальных стимуляторов экспрессируемые на поверхности фагоцитирующих клеток собственные антигены как результат деградации захваченных отживших клеток не в состоянии развить аутоиммунный ответ.
В представленных примерах иммуногенность связана не со структурными особенностями антигена, а с реактивностью организма, с потенциальными возможностями его иммунокомпетентных клеток.
Дендритные клетки. Не все патогены индуцируют синтез и экспрессию кости мул яторов на поверхности макрофагов. К этой категории возбудителей инфекционнного заболевания относятся, в частности, вирусы, которые в течение эволюции адаптировались к использованию биосинтетического аппарата клетки для своего воспроизведения. Кажется, что подобная эксплуатация клеток противоречит принципам “всеобщей” защищенности организма от чужеродных антигенов. Подобное несоответствие разрешается включением в противовирусную защиту дендритных клеток.
Этот тип антигенпрезентирующих клеток обильно представлен в лимфоидной ткани и обладает выраженной и, что очень важно, постоянной экспрессией костимулятора В7, молекул I и II классов МНС, а также адгезинов ICAM-1, ICAM-3, LFA-3. Иначе, для дендритных клеток не требуется инициации поверхностных структур, принимающих участие в формировании Т-кле-точного ответа. Подобная заданность иммунологически значимых молекул определяет защитный потенциал дендритных клеток. При этом они не способны к фагоцитозу, но легко усваивают белки и вирусные частицы посредством пиноцитоза. Еще одна особенность дендритных клеток — отсутствие выборочное™ при столкновении с вирусами. Большинство тканей чувствительны только к ограниченному числу различных вирусов. В то же время дендритные клетки поглощают самые разнообразные вирусные частицы.
Постоянная экспрессия молекул I и II классов у этого типа клеток приводит к быстрому формированию иммуногенных комплексов вирусных пептидов с соответствующими молекулами. В результате создаются условия для включения в ответ наивных CD8 Т-клеток и CD-4 Т-клеток, дифференцирующихся в Тн1-клетки воспаления и хелперные Тн2-клетки.
Большинство вирусных белков локализуется в цитозоле клетки, где они разрушаются до отдельных пептидов в протеосомах (см. рис. 3.9). Особенность локализации вирусных белков обеспечивает формирование комплекса с молекулами I класса в эндо-плазматическом ретикулуме и его последующий прямой транспорт к плазматической мембране. Образование комплекса с некоторыми поверхностными вирусными белками имеет иной характер. Такие белки, оказавшись в эндоплазматических вакуолях, которые содержат молекулы II класса, транспортируются к клеточной поверхности в составе этих вакуолей (рис. 3.10). Комплекс вирусный пеп-тид:молекулы II класса будет фактором включения в ответ Т-хелперов. Таким образом, дендритные клетки играют основную роль при формировании как клеточной, так и гуморальной форм антивирусного иммунитета.
Особое место в формировании иммунного ответа принадлежит клеткам Лангерганса. До недавнего времени их относили к тканевым макрофагам кожи. В настоящее время считается, что этот тип клеток функционально и морфологически следует считать предшественниками дендритных клеток. При проникновении патогена через поврежденный участок кожи среди прочих клеточных форм в реакцию изоляции микроорганизма вступают клетки Лангерганса, способные к фагоцитозу, но не экспрессирующие костимуля-тор В7. Мигрируя по лимфатическим сосудам в ближайший лим
фатический узел, клетки оседают и трансформируются в типичные дендритные клетки с поверхностным корецептором В7, что создает условия для включения в иммунный ответ CD8- и CD4 Т-клеток. Таким образом, функция этих клеток состоит в доставке антигена в регионарную лимфоидную ткань, последующей его обработке до иммуногенной формы и инициации клеточного и гуморального иммунного ответа.
В-клетки. Третьим типом клеток, способным представлять антиген в иммуногенной форме для наивных Т-клеток, являются В-лимфоциты. Если макрофаги поглощают в основном бактерии, дендритные клетки — различные вирусы, то активность В-клеток направлена на белковые антигены, включая бактериальные токсины. Два основных свойства В-лимфоцитов определяют их потенциальную способность выступать в качестве антигенпрезентирующих клеток: наличие поверхностных, специфических, иммуноглобулиновых рецепторов (sig) и выраженная экспрессия молекул II класса МНС. При этом у покоящихся В-клеток отсутствует третий обязательный компонент клеточной мембраны — ко-стимулятор В7, однако он начинает экспрессироваться под влиянием компонентов бактериальных стенок, таких, например, как полисахариды.
Активация В-клеток начинается после взаимодействия поверхностных иммуноглобулинов с белковым антигеном (рис. 9.9). В результате эндоцитоза образовавшегося комплекса и его деградации в лизосомальных вакуолях начинается экспрессия пептидных фрагментов белка в ассоциации с молекулами II класса МНС. Активный синтез этих молекул В-клетками обеспечивает выраженное представительство комплекса пептид:молекулы II класса на поверхности клетки. При этом в работу не включаются хелперные Т-клетки, поскольку отсутствует экспрессия костимулятора В7. В условиях реального ответа к инфекционным агентам стимулятором синтеза В7 выступают компоненты клеточной стенки бактерий. Как только начинается экспрессия В7, специфически провза-имодействовавшие наивные Т-клетки вступают в процесс пролиферации и дифференцировки, образуя активные хелперные CD4 Т-клетки (Тн2). Включение в работу зрелых Т-хелперов создает условия для полноценного развития гуморального иммунного ответа.
Как и в случае с макрофагами, необходимость двойного сигнала для активации Т-хелперов является условием, контролирующим ответ В-клеток на собственные антигены. При отсутствии инфекции специфическое взаимодействие наивной Т-клетки с В-лимфоцитом, экспрессирующим аутоантиген, приводит к анергии или гибели соответствующего клона Т-клеток.
Рис. 9.9. В-лимфошгг как антигенпрезентирующая клетка.
1. Выраженная экспрессия поверхностного рецепторного иммуноглобулина (sig) и молекул II класса МНС у В-клеток. 2. Взаимодействие sig с антигеном (АГ). Обычными для В-клеток антигенами являются токсины бактерий. 3. Эндоцитоз В-клеткой комплекса aHTHreH.'sIg и презентация антигенного пептида с молекулами II класса МНС на клеточной поверхности. 4. Экспрессия костимулятора В7 на поверхности В-клстки под влиянием бактериальных полисахаридов. 5. Заключительный этап процесса — формирование двухсигнальной системы активации Т-хелперов (Тн2) при их взаимодействии с В-клетками. Первый сигнал (1) образуется от взаимодействия ТКР Тн с комплексом антигенный пептидгмолекула II класса МНС. Второй сигнал (2) развивается при взаимодействии индуцированного костимулятора В7 с CD28 на Тц2
Итак, Т-клеточный ответ примируется тремя-типами антигенпрезентирующих клеток, каждый из которых адаптирован к обработке определенного класса антигенов (табл. 9.3). Макрофаги захватывают и перерабатывают до иммуногенной формы в основном бактерии и другие корпускулярные антигены, дендритные клетки — вирусы и В-клетки — белки, включая бактериальные токсины. Существенным моментом примирования Т-клеток является необходимость двойного сигнала для созревания Т-клеточ-ных эффекторов. Отсутствие такого сигнала является препятствием для формирования ответа к собственным антигенам. Биологический смысл подобного явления понятен. Помимо внутритимус-ной отрицательной селекции аутореактивных клонов существует дополнительный заслон запрещенным клонам, действующий на периферии. Этот заслон создают макрофаги и В-клетки, у которых в условиях нормы отсутствует один из ключевых костимуляторов В7.
Таблица 9.3
Основные характеристики антигенпрезентирующих клеток
Признак Макрофаги Дендритные клетки В-клетки
Характер взаимодействия с антигеном фагоцитоз +++ фагоцитоз тканевыми дендритными клетками +++ эндоцитоз вирусов ++++ взаимодействие с антигенспецифи-ческим рецептором (sig) ++++
Экспрессия молекул МНС значительно усиливается бакте- риями и цитокинами постоянно представлены ++++ постоянно представлены, возрастает при активации от +++ до ++++
Экспрессия кости мул ирующих молекул П резентируемые антигены Локализация антигенпрезентирующих клеток ОТ ± ДО +++ индуцируется от — до +++ бактерии лимфоидная ткань, соединительная ткань, полость тела постоянно представлены ++++ вирусы лимфоидная ткань, соединительная ткань, эпителий индуцируется от — до +++ токсины, вирусы, бактерии лимфоидная ткань, периферическая кровь
Примечание: знак “+” — относительная сила проявления признака.
9.1.2.4. Участие интерлейкина-2 в процессе созревания Т-клеток
Встреча организма с антигеном требует быстрого формирования гуморального или клеточного иммунного ответа. Одним из основных участников реализации специфического сигнала от ан-222
тигена и костимулирующего сигнала от В7 антигенпрезентирующих клеток является интерлейкин-2 (ИЛ-2). В результате двухсигнальной активации клона наивных Т-клеток начинаются синтез и секреция этого цитокина и одновременная экспрессия на клеточной поверхности его рецептора. ИЛ-2, взаимодействуя с собственным рецептором, обеспечивает быстрое размножение и последующую дифферецировку наивных Т-клеток до зрелых эффекторов.
В процессе инициации синтеза ИЛ-2 ключевая роль принадлежит костимулятору В.7. Распознавание антигена Т-клеточным рецептором индуцирует несколько транскрипционных факторов. Один из них — ядерный фактор активации у Т-клеток (англ. сокр. NF-АТ), который, взаимодействуя с промотором ИЛ-2-гена, обеспечивает транскрипцию соответствующего гена. Однако дерепрессия ИЛ-2-гена не приводит к активной продукции цитокина, так как цитокиновые мРНК нестабильны. При этом взаимодействие CD28 с В7 формирует сигнал, который стабилизирует ИЛ-2 мРНК. В результате такой стабилизаци РНК усиливается синтез ИЛ-2 в 20-30 раз. Т-клетки начинают активно пролиферировать и дифференцироваться в зрелые эффекторные клетки.
Если распознавание антигена Т-клетками происходит в отсутствие костимулирующего сигнала от B7:CD28, то продукция ИЛ-2 крайне низка и Т-клетки не могут адекватно ответить на антиген.
Важное значение ИЛ-2 в инициации специфического иммунного ответа хорошо иллюстрируется применением лекарственных препаратов, подавляющих отторжение трансплантатов. Хорошо известный в клинике циклоспорин А подавляет продукцию ИЛ-2, нарушая прохождение сигнала от провзаимодействовавше-го с антигеном Т-клеточного рецептора.
В результате формирование антигенспецифического клона Т-клеток подавляется, что обеспечивает длительное выживание трансплантированных органов.
9.1.2.5. Изменение экспрессии поверхностных молекул Т-клеток
Взаимодействие наивных Т-клеток с антигенным комплексом и костимулятором В7 на поверхности антигенпрезентирующих клеток инициирует полноценный синтез и секрецию ИЛ-2. Этот цитокин аутокринным способом стимулирует наивные Т-клет-ки к пролиферации и дифференцировке. После пролиферативной фазы, длящейся 4-5 дней, эти клетки дифференцируются в зрелые эффекторные Т-лимфоциты, которые способны синтезировать все белки, требуемые для выполнения специализированных функций. Одно из следствий прошедшей дифференцировки Т-кле-
ток состоит в прямом их действии на чужеродные в антигенном отношении клетки без использования каких-либо костимулирую-щих сигналов.
Обеспечивается подобное прямое эффекторное действие количественным и качественным изменением состава поверхностных молекул у всех, независимо от деления на субпопуляции, зрелых Т-клеток. Во-первых, завершившие дифференцировку Т-клетки характеризуются усилением экспрессии молекул LFA-1 и CD2, которые позволяют им более эффективно взаимодействовать с клетками-мишенями, экспрессирующими чужеродные антигены. Такое усиление особенно существенно для цитотоксических CD8 Т-клеток, так как большинство клеток организма характеризуется незначительным уровнем адгезинов ICAM и LFA-3, которые хорошо представлены только на антигенпрезентирующих клетках. Второе изменение касается антигенраспознающего Т-клеточного рецепторного комплекса. Тирозинспецифическая фосфатаза (CD45), выполняющая важную функцию в передаче сигнала внутрь клетки с Т-клеточного рецепторного комплекса, представлена на поверхности Т-клеток разными изоформами. Одна из функций этих изоформ — связывание Т-клеточного рецептора с корецепторами CD4 или CD8, что обеспечивает эффективное прохождение сигнала от антигена внутрь клетки.
И, наконец, зрелые эффекторные Т-клетки теряют L-селек-тин, который был необходим наивным Т-клеткам при заселении лимфоидной ткани (см. главу 7), но который оказывается не нужным и даже вредным при развитии иммунного ответа, так как мешает миграции в зону проникновения патогена. Экспрессия L-селектина заменяется интегрином VLA-4. Этот адгезии позволяет Т-клеткам связываться с сосудами в зоне воспаления и выполнять тем самым свою антигеннейтрализующую функцию (рис. 9.10).
9.1.2.6. Способы активации наивных CD8 Т-клеток
Инициация дифференцировки наивных CD8 Т-клеток в зрелые цитотоксические Т-лимфоциты осуществляется несколькими способами. Наиболее простой из них связан с дендритными клетками. Этот тип антигенпрезентирующих клеток характеризуется выраженной экспрессией костимулятора В7, что само по себе является достаточным условием активации синтеза ИЛ-2. Этот цитокин обеспечивает активную пролиферацию и дифференцировку наивных Т-клеток, используя аутокринный путь стимуляции (рис. 9.11).
В то же время цитотоксический ответ к некоторым вирусам
Наивные Т-клетки
Рис. 9.10. Изменение экспрессии поверхностных молекул при дифференцировке наивных Т-клеток в зрелые эффекторы.
При созревании наивных Т-клеток изменяется экспрессия поверхностных молекул, обладающих различными функциональными проявлениями в иммунном ответе. ТКР образует комплекс с корецептором CD4 (или CD8) при участии тирозинспецифической фосфатазы клеточной поверхности CD45; усиливается экспрессия адгезинов LFA-1 и CD2 (подобное усилие особенно важно для цитотоксических CD8 Т-клеток); появляется новый адгезии VLA-1, помогающий связыванию Т-клеток с сосудами в зоне проникновения антигена; в то же время подавляется экспрессия L-селектина, который необходим наивным Т-клеткам при заселении лимфоидной ткани, но становится помехой при миграции зрелых Т-клеток в зону проникновения антигена
и чужеродным трансплантатам требует присутствия CD4 Т-клеток. Возможно, это связано с недостаточной иммуногенностью вирусных и трансплантационных антигенов для формирования первого сигнала от Т-клеточного рецептора или слабой экспрессией В7, формирующего второй сигнал. При включении в ответ CD4 Т-клеток, которые способны стимулировать антигенпрезентирующие клетки к синтезу В7, создаются нормальные условия для двойной стимуляции наивных CD8 Т-клеток.
Третий способ стимуляции наивных CD8 Т-клеток к диффе-
15 Зак. 3701
Рис. 9.11. Активация наивных CD8 Т-клеток.
1. Наиболее простой способ активации CD8 Т-клеток наблюдается при распознавании этими клетками иммуногенного комплекса на поверхности дендритных клеток (ДК), обладающих выраженной экспрессией костимулятора В7. Формирование второго сигнала с помощью В7 обеспечивает активную продукцию интерлейкина-2 (IL-2) CD8 Т-клетками. Данный цитокин аутокринным способом активирует наивные CD8 Т-клетки к дифференцировке. 2. В условиях, когда антигенпрезентирующие клетки (АПК) не имеют В7 на своей поверхности, в процесс активации вступают CD4 Т-клетки. Секретируемый CD4 Т-клетками 1L-2 после распознавания иммуногенного комплекса на поверхности АПК стимулирует экспрессию В7 этими клетками. Дальнейшее развитие событий неотличимо от первого случая. 3. В условиях, когда CD8 Т-клстки распознают иммуногенный комплекс на клетках, не способных к экспрессии В7 даже при стимуляции, запуск дифференцировки с помощью IL-2 осуществляется по принципу дистанционного управления
ренцировке связан с прямым действием на них ИЛ-2, секретируемого распознавшими антиген CD4 Т-клетками. Этот способ проявляется при отсутствии индуцируемой экспрессии В7 под влиянием CD4 Т-клеток. Какой из этих способов доминирует в организме при формировании цитотоксического ответа, пока неизвестно.
9.1.2.7. Дифференцировка наивных CD4 Т-клеток в ТН1 и Тн2
CD4 Т-клетки, покинувшие тимус, не могут непосредственно встать на путь созревания до зрелых эффекторов. В отличие от наивных CD8 Т-клеток они должны пройти дополнительный этап развития на периферии, который заканчивается формированием незрелых ТнО-клеток. Именно от этих коммитированных клеток в зависимости от ситуации формируются зрелые эффекторы: Тн1-клетки воспаления и хелперные Тн2-клетки. Они не различаются по фенотипическим маркерам клеточной поверхности, но известны их разные возможности в синтезе цитокинов: Тн0 продуцируют интерлейкин-2, интерлейкин-4; Тн1 (CD4 Т-клетки воспаления) — интерлейкин-2, интерлейкин-3, гранулоцитарно-макрофагальный колониестимулирующий фактор, интерферон-у, фактор некроза опухолей р (лимфотоксин); Тн2 (хелперные CD4 Т-клетки) — интерлейкины-3,4,5,6,10 и гранулоцитарно-макрофагальный колониестимулирующий фактор. Интерлейкин-3 и гранулоцитарно-макрофагальный колониестимулирующий фактор являются общими для ТН1 и Тн2. Эти два цитокина принимают участие в качестве факторов гемопоэтической дифференцировки в костном мозге. Остальные цитокины являются характерными только для определенной субпопуляции. Цитокины, свойственные Тн1, активируют в основном макрофаги, цитокины Тн2 — В-клетки. Активность именно этих цитокинов определяет разную эффекторную функцию двух субпопуляций.
Механизмы, направляющие дифференцировку Т-клеток в зависимости от иммунологической ситуации, пока недостаточно понятны. Однако ряд экспериментальных данных позволяет представить следующую картину. Макрофаги, захватившие бактерии или вирусы, начинают продукцию интерлейкина-12, для которого клеткой-мишенью являются наивные Т-клетки. При этом стимулированные макрофагами нормальные киллеры секретируют интерферон-у. Оба цитокина при совместном действии на наивные Т-клетки определяют их развитие в сторону образования CD4 Т-клеток воспаления. В то же время наивные Т-клетки, стимулированные интерлейкином-4, дифференцируются в хелперные CD4 Т-клетки. Источником интерлейкина-4 могут быть базофилы и туч-1S* 227
ные клетки. При этом интерлейкин-4 является ингибитором развития Т-клеток воспаления.
9.1.3. Эффекторное действие зрелых Т-клеток
Прошедшая постантигенная дифференцировка Т-клеток создает пул функционально активных клеток, действующих на периферии. Основные субпопуляции Т-клеток, призванные эффективно нейтрализовать чужеродный антиген, как уже неоднократно отмечалось выше, представлены цитотоксическими Т-клетками (CD8 Т-клетками), Т-клетками воспаления (Тн1) и хелперны-ми Т-клетками (Тц2). Первые две субпопуляции обеспечивают клеточную форму зашиты, либо непосредственно разрушая инфицированные соматические клетки (CD8 Т-клетки), либо активизируя макрофаги к внутриклеточному разрушению паразитов (Тн1 клетки). Третья субпопуляция (Тн2 клетки), являясь производной Т-системы иммунитета, проявляет свое вспомогательное, эффекторное действие не только в клеточном иммунитете, но и при формировании гуморального иммунного ответа. Функциональная активность этой субпопуляции рассмотрена ниже в этой главе в связи с вопросами защиты организма от патогенов с помощью антител.
9.1.3.1. Активность цитотоксических Т-клеток (CD8 Т-клеток)
Вирусы не имеют собственного биосинтетического аппарата и для своего воспроизведения используют клетки хозяина. Являясь внутриклеточными патогенами, они защищены от прямого действия нейтрализующих антител, и только выход во внешнюю среду в результате разрушения клетки хозяина делает их доступными для специфических иммуноглобулинов. Основным фактором, препятствующим активному размножению вирусов и инфицированию пораженного организма, являются зрелые цитотоксические Т-лимфоциты (CD8 Т-клетки). Очевидным свойством этих клеток является специфичность их действия на клетку-мишень — уничтожение только тех клеток тканей, которые поражены вирусными частицами. В этой выборочное™ действия заключен вполне кон-ретный биологический смысл. Не нарушая ткань в целом, цитотоксические Т-лимфоциты освобождают организм от вирусной инфекции, уничтожая только пораженные вирусом клетки.
Известно две формы гибели клеток: некроз и апоптоз. Первая из них связана с нарушениями в мембране или цитоплазме клеток и не затрагивает существенно клеточного ядра. К некрозу, в частности, приводит атака клетки антителами и комплементом, что
вызывает образование пор в мембране, нарушение осмотического давления в клетке, разрыв мембраны и в результате гибель клетки. Некротическая гибель клеток-мишеней под влиянием зрелых CD8 Т-клеток связана в основном с перфоринами, выделяемыми из гранул цитотоксических Т-клеток после распознавания ими чужеродного антигена на инфицированных вирусом клетках (рис. 9. 2 и 9.12).
Рис. 9.12. Эффекторное действие зрелых цитотоксических Т-лимфоцитов (ЦТЛ; CD8 Т-клеток).
Действие CD8 Т-клеток на клетки-мишени, зараженные, в частности, вирусом, имеет двойное проявление. После распознавания иммуногенного комплекса на клетке-мишени CD8 выделяет целый набор эффекторных молекул, совместное действие которых вызывает либо некроз (лизис), либо апоптоз инфицированных клеток. При некрозе основными эффекторными молекулами являются перфорин и фрагментины. При апоптозе к этим молекулам добавляется ФНО-р (лим-фотоксин). Интерферон-у (ИНФ-у) оказывает прямое ингибируюшее действие на размножение вирусов. Кроме того, этот цитокин активирует макрофаги (МФ), вызывая их миграцию в зону проникновения вирусных частиц. Там активированные клетки выполняют по крайней мере две функции — эффекторов, поглощающих и разрушающих вирусные частицы, и антигенпрезентирующих клеток, способствуя вступлению в реакцию дополнительных CD8 Т-клеток
Другая форма деструкции клетки, известная как запрограммированная клеточная смерть, или апоптоз, является физиологически нормальным процессом. Она встречается при завершении периода жизни клетки, тканеобразовании, метаморфозе у многоклеточных организмов. Примером физиологически нормальной
смерти является апоптоз тимоцитов, не прошедших положительную селекцию на специфичность к собственным молекулам гистосовместимости или оказавшихся реактивными к аутоантигенам при отрицательной селекции (см. главу 7)
Первичные изменения при апоптозе связаны с фрагментацией ДНК, разрушением ядра, изменением морфологии клетки. Активированные эндогенные нуклеазы разрывают связь между нуклеосомами, что приводит к образованию фрагментов ДНК, каждый из которых содержит около 200 пар оснований.
Наиболее раннее проявление цитотоксического действия Т-клеток касается дезинтеграции ДНК клеток-мишеней. Этот процесс инициируется эффекторными молекулами, которые выделяются CD8 Т-лимфоцитами после специфического распознавания клеток-мишеней.
Морфологичекая картина развивающегося апоптоза складывается из первоначальной конденсации хроматина и образования везикул, которые выходят во внеклеточное пространство. На этой ранней стадии процесса клеточная мембрана еще остается целой. Позднее наблюдаются более выраженая конденсация хроматина, потеря цитоплазмы и мембраны, что и характеризует собственно клеточную смерть. Факторы, включенные в апоптоз, и в частности эндонуклеазы, могут принимать участие в деструкции ДНК не только клетки, но и самих вирусных частиц, препятствуя их проникновению в соседние клетки.
Основной механизм, инициирующий апоптоз клеток-мишеней, связан с выделением цитотоксическими Т-лимфоцитами секреторных гранул после специфического распознавания чужеродного антигена. Эти гранулы содержат различные белки, получившие общее название цитотоксинов. Один из них — перфорин, полимеризуясь, образует поры в мембране клетки-мишени. Грензи-мы, или фрагментины, обладают свойствами пищеварительных белков. Секреторные гранулы содержатся во многих клетках организма (например, в панкреатических и тучных клетках). Накопление функционально активных белков способствует быстрейшей реализации их активности при получении сигнала извне. Функция перфорина состоит в образовании пор в клеточной мембране для прохождения фрагментинов. В опытах in vitro было показано, что внесение в культуру клеток только фрагментинов не вызывает развитие апоптоза. В то же время одновременное внесение незначительного количества перфорина приводит к разрушению ядерной ДНК. Участие фрагментинов в разрушении ДНК до олигонуклеотидов носит опосредованный характер, механизм которого пока неизвестен. Очевидным является участие в деструкции клеток-мишеней ФНО-р (лимфотоксина), однако механизм его действия при
апоптозе также предстоит еще изучить. Предполагается, что этот цитокин инициирует собственно процесс апоптоза, взаимодействуя с соответствующим рецептором на клетке-мишени. Другой медиатор, секретируемый CD8 Т-клетками, — интерферон-у (ИНФ-у) — оказывает прямое ингибирующее действие на размножение вирусов, препятствуя тем самым распространению инфекции. Кроме того, ИНФ-у увеличивает экспрессию молекул I класса МНС. Понятно, что подобное увеличение данного класса молекул обеспечивает лучшее распознавание вирусных пептидов CD8 Т-лим-фоцитами на поверхности инфицированных клеток. Кроме того, ИНФ-у способен активировать макрофаги, благодаря чему они мигрируют в зону проникновения вирусной инфекции, где выступают и как эффекторные клетки, разрушая вирусные частицы, и как антигенпрезентирующие клетки, способствующие специфическому распознаванию чужеродного антигена цитотоксическими Т-лимфоцитами.
9.1.4.2. Активность CD4 Т-клеток воспаления
Для некоторых бактерий (возбудителей туберкулеза, лепры, чумы) макрофаги являются “средой обитания”. Оказавшись в результате фагоцитоза в фаголизосомах, они становятся защищенными как от антител, так и от цитотоксических Т-лимфоцитов. Подавляя активность лизосомальных ферментов, эти бактерии активно размножаются внутри клетки и таким образом становятся причиной острого инфекционного процесса. Неслучайно упомянутые в качестве примера заболевания относят к категории особо опасных инфекций.
В этой достаточно сложной ситуации в организме, тем не менее, имеются силы, препятствующие распространению возбудителей, и связаны они в первую очередь с CD4 Т-клетками воспаления. Участие данного типа лимфоцитов в организации иммунного ответа реализуется через активацию макрофагов. Активированные макрофаги не только справляются с внутриклеточными патогенами, но и приобретают в ряде случаев дополнительные свойства, не связанные с антибактериальным действием, например способность разрушать раковые клетки.
Для активации макрофагов требуется два сигнала. Первый из них — интерферон-у (ИНФ-у). Это наиболее характерный цитокин, продуцируемый CD4 Т-клетками воспаления. Хелперные Т-клетки не секретируют данный цитокин и не могут активировать макрофаги обычным путем. Вторым сигналом для активации макрофагов служит поверхностный ФНО-а, который индуцируется к экспрессии после распознавания Т-клетками воспаления иммуногена на мембране макрофагов. Антитела к ФНО-а отменяют дей
ствие второго сигнала.
Цитотоксические Т-клетки становятся активными сразу после распознавания антигена, реализуя потенциальную готовность молекулярного аппарата к уничтожению клеток-мишеней через процесс апоптоза или некроза. Напротив, Т-клетки воспаления после распознавания антигена на поверхности макрофагов тратят часы на синтез de novo медиаторов, активирующих макрофаги. Вновь синтезированные цитокины, собранные в микровезикулы, проникают в макрофаги в месте контакта с Т-клетками. Такой прямой путь, как и в случае с цитотоксическими Т-лимфоцитами, наиболее экономичен и функционально оправдан, поскольку не затрагивает соседние, неинфицированные клетки.
В макрофагах, активированных посредством контакта с Т-клетками воспаления и в результате секреции ИНФ-у, инициируется ряд биохимических изменений, которые обеспечивают данным клетам сильные антибактериальные свойства (рис. 9.13). Так, в условиях взаимодействия с Т-клетками воспаления наблюдается более эффективное слияние фагосом, захвативших бактерии, с лизосомами — хранителями протеолитических ферментов, разрушающих внутриклеточные патогены. Процесс фагоцитоза сопровождается так называемым кислородным взрывом - образовани-
Рис. 9.13. Функциональная активность CD4 Т-клеток воспаления.
Основным объектом действия CD4 Т-клеток воспаления являются инфицированные макрофаги. В результате распознавания иммуногенного комплекса на макрофагах CD4 Т-клетки воспаления экспрессируют на своей поверхности фактор некроза опухолей а (ФНО-а) и усиливают продукцию интерферона-а (ИНФ-а). Совместное действие цитокинов обеспечивает более эффективное образование фаголизосом, накопление кислородных радикалов и окиси азота, которые обладают бактерицидными свойствами, усиление экспрессии молекул II класса МНС, повышение продукции фактора некроза опухолей а. Подобная активизация биохимических процессов в макрофагах не только способствует внутриклеточному уничтожению бактерий, но и определяет дополнительное включение Т-клеток в иммунный ответ
ем кислородных радикалов и окиси азота, обладающих бактерицидной активностью. В условиях костимуляции ФНО-а и ИНФ-у этот процесс идет гораздо активнее. Кроме того, активированные макрофаги усиливают экспрессию молекул II класса МНС и рецептора ФНО-а, что приводит к вовлечению дополнительных наивных Т-клеток. Весь этот комплекс событий обеспечивает достаточно прочный заслон от внутриклеточных патогенов.
Взаимодействующие с макрофагами Т-клетки воспаления не только способствуют усилению внутримакрофагальных биохимических процессов, но при этом сами активируются и выступают в роли организаторов многостороннего иммунного ответа на антиген.
Инфекционный процесс, провоцируемый воспроизводящимися патогенами, отражает борьбу двух сил — собственно возбудителя и иммунной системы хозяина. Например, возбудитель чумы Yersenia pestis обладает способностью к индуцируемому синтезу высокополимеризованного белка I, который начинает экспрессироваться на клеточной стенке при кислом значении pH. Известно, что в месте контакта возбудителя с макрофагом происходит локальное закисление. Это провоцирует синтез и экспрессию белка I. Данный белок, обладая сильными адгезивными свойствами, способствует более эффективному проникновению возбудителя внутрь клетки.Кроме того, он помогает возбудителю избегать действия лизосомальных ферментов. Кислые условия фаголизосом поддерживают синтез этого защитного белка.
Макрофаги, хронически инфицированные внутриклеточными бактериями, могут терять способность активироваться Т-клет-ками. Массовое включение в процесс новых макрофагов происходит при высвобождении патогенов под влиянием синергического действия на инфицированные клетки ФНО-р (лимфотоксина) и ИНФ-у — продуктов активированных CD4 Т-клеток воспаления (рис. 9.14). Это сочетание цитокинов также эффективно для гибели фибробластов — основных компонентов соединительной ткани, что обеспечивает проникновение иммунокомпетентных клеток к месту локализации инфекции. Ясно, что в условиях мобилизации иммунного ответа пул эффекторных Т-клеток должен поддерживаться на высоком уровне. Активированные макрофагами Т-клег-ки воспаления вовлекают дополнительные эффекторы посредством ИЛ-2, способствующего пролиферации и дифференцировке ан-тигенспецифических Т-клеток. Помимо Т-эффекторов рекрутируются и сами макрофаги. Это реализуется двумя способами: во-первых, посредством индукции дифференцировки макрофагов в костном мозге под влиянием ИЛ-3 и гранулоцитарно-макрофагального колониестимулирующего фактора (ГМ-КСФ); во-вторых, вновь образованные макрофаги под влиянием лимфотоксина и
Рис. 9.14. CD4 Т-клетки воспаления как организаторы комплексного иммунного ответа.
CD4 Т-клетки воспаления при взаимодействии с макрофагами не только активируют последние, но и сами активируются. Продуцируя целый набор цитокинов, они тем самым являются организаторами комплексного иммунного процесса. Клетками-мишенями регуляторного действия цитокинов являются макрофаги (1, 2, 5, 6), Т-клетки (3), прекурсоры моноцитарно-макрофагальной линии дифференцировки (4).
ИНФ-у — интерферон-у, ЛТ (ФНО-р) — лимфотоксин (фактор некроза опухолей Р), ИЛ-2 — интерлейкин-2, ИЛ-3 — интерлейкин-3, ГМ-КСФ — гранулоцитарно-макрофагальный колониестимулирующий фактор, МХФ — макрофагальный хемотаксический фактор (фактор хемотаксиса макрофагов), МИФ — макрофагальный ингибирующий фактор (фактор ингибиции макрофагов)
макрофагального хемотаксического фактора начинают миграцию из кровяного русла в очаг локализации инфекции, где они и оседают, испытывая на себе действие макрофагингибирующего фактора, снижающего их подвижность.
Набор цитокинов, продуцируемых активированными CD4 Т-клетками воспаления после специфического распознавания патогена, обеспечивает многопрофильное развитие клеточного иммунного ответа. Таким образом, клетки рассмотренной субпопуляции выступают в качестве организаторов адекватного иммунного ответа.
Заключение
Таким образом, завершение внутритимусного развития лимфоцитов приводит к созданию двух основных субпопуляций: наивных CD8- и CD4 Т-клеток. Созданный при этом потенциал клоноспецифических Т-клеток еще не означает их способность моментально вступать в реакцию нейтрализации и уничтожения чужеродного антигена. До проявления эффекторной активности Т-клеток должно произойти главное событие — они должны созреть. Только после завершения периода постантигенного развития зрелые Т-клетки реализуют свой первоначальный потенциал.
В целом внетимусный период развития клеток включает три этапа: распознавание антигена, созревание наивных Т-клеток до активных эффекторов и собственно “работу” созревших клеток (нейтрализацию и уничтожение антигена). На каждом этапе действуют свои клеточные и молекулярные факторы, при участии которых лимфоциты проходят путь от инертных предшественников до функционально активных эффекторов.
Первая встреча наивных Т-клеток с антигеном происходит в лимфоидной ткани, ближайшей к месту его внедрения. Именно здесь идет отбор Т-клеточных клонов по их способности распознавать чужеродный антиген.
Циркулирующие по кровяному руслу лимфоциты, попадая в лимфатические узлы, проходят через высокий эндотелий венул в паренхиму органа. Здесь наивные Т-клетки встречаются с антигеном. В процесс примирования включены три типа антигенпрезентирующих клеток: макрофаги, дендритные клетки, В-лимфоциты. Распознавание антигена на поверхности этих клеток сопровождается включением в процесс дополнительных факторов межклеточных контактных отношений — адгезинов. Функция адгези-нов — усиление контакта между наивными Т-лимфоцитами и антигенпрезентирующими клетками. Совместное действие специфического компонента распознавания — Т-клеточного антигенраспознающего рецептора и неспецифического вспомогательного фак-
тора — адгезина LFA-1 Т-клеток определяет отбор антигенспеци-фического клона. Среди всех лимфоцитов, проникших в определенный лимфоидный орган, только 1 из 105 оказывается способным к специфическому взаимодействию. Все остальные клетки, не выдержавшие отбора на специфичность, покидают лимфоузел через эфферентный лимфатический сосуд, с тем чтобы вступить в процесс рециркуляции в поисках соответствующего по специфичности антигена.
Связывание Т-клеточным рецептором комплекса антигенный пептид: молекула I или II класса МНС — обязательное, но недостаточное условие для трансформации наивных Т-клеток в зрелые эффекторы. Необходим второй неспецифический сигнал. Кости-муляторами в данном случае выступают экспрессирующиеся на поверхности антигенпрезентирующих клеток молекулы В7, относящиеся к суперсемейству иммуноглобулинов.
Факт происутствия на одной и той же антигенпрезентирующей клетке специфического иммуногена и неспецифического ко-стимулятора имеет вполне конкретный биологический смысл. Отрицательная селекция в тимусе не свободна, очевидно, от ошибок. Какая-то часть запрещенных клонов может выйти в циркуляцию и стать потенциальной причиной аутоиммунной агрессии. Как правило, этого не наблюдается. Наивные Т-лимфоциты, распознавшие аутоантигены, остаются инертными, так как не получают второго сигнала от тканеспецифических клеток. Такие лимфоциты оказываются в состоянии анергии или гибнут через процесс апоптоза.
Двухсигнальная система активации обеспечивает синтез и секрецию ИЛ-2, который включается в процесс пролиферации и дифференцировки Т-клеток. Созревшие Т-клетки характеризуются изменением экспрессии рецепторов клеточной поверхности. Во-первых, они теряют L-селектин, который был нужен наивным Т-клеткам для первоначального заселения лимфоидной ткани, но бесполезен или даже вреден при формировании иммунного ответа, так как мешает миграции Т-клеток в зону проникновения патогена. С помощью тирозинспецифических фосфатаз, характерных для зрелых форм, организуется наиболее эффективная передача сигнала от Т-клеточного антигенраспознающего рецептора внутрь клетки. Появляется новый адгезии VLA-4, который позволяет зрелым Т-клеткам связываться с эпителием сосудов в зоне воспаления, что крайне важно для локального развития иммунного ответа. Наконец, усиливается экспрессия исходных адгезинов LFA-1 и CD2, улучшающая межклеточный контакт.
Постантигенное развитие завершается формированием трех функционально активных субпопуляций: цитотоксических CD8 Т-клеток, CD4 Т-клеток воспаления и хелперных CD4 Т-клеток. 236
Первые две субпопуляции — участники клеточного иммунного реагирования, третья обеспечивает помощь гуморальному иммунитету.
Распознавание антигена зрелыми цитотоксическими CD8 Т-клетками в эффекторную фазу развития иммунного ответа инициирует синтез и секрецию цитотоксических белков, которые вызывают либо некроз, либо апоптоз клеток-мишеней. Наиболее активными медиаторами цитотоксического действия являются перфорин, грензимы (фрагментины), ФНО-р.
Возбудители некоторых инфекций (туберкулеза, лепры, чумы) используют макрофаги как “среду обитания”. Локализуясь в фаголизосомах, они становятся недоступными для антител или цитотоксических Т-лимфоцитов. Единственный способ борьбы с этими внутриклеточными патогенами — усиление лизосомальной активности самих макрофагов. Помощь в стимуляции такой активности исходит от CD4 Т-клеток воспаления (Тн1), которые после взаимодействия с макрофагами начинают усиленную секрецию ИНФ-£( и ФНО-д. В результате взаимодействия активизируется процесс слияния фагосом с лизосомами, инициируется кислородный взрыв, продукты которого токсичны для внутриклеточных патогенов, увеличивается экспрессия молекул II класса МНС. что способствует вовлечению в ответ новых Т-клеток воспаления.
Т-клетки воспаления не только активируют внутримакрофа-гальные биохимические процессы, но и сами оказываются активированными со стороны взаимодействующих с ними фагоцитирующих мононуклеаров. В результате Т-клетки секретируют большой набор цитокинов, выступая в роли организаторов иммунного реагирования.
В целом весь путь развития и функционирования Т-клеток от первичного знакомства с антигеном до его уничтожения представляет собой многоступенчатое явление с включением в процесс широкого набора клеточных и молекулярных структур.
9.2. АМОРАЛЬНЫЙ ИММУННЫЙ ОТВЕТ
Возбудители бактериальных или вирусных заболеваний в процессе своей жизнедеятельности в организме хозяина оказываются в той или иной ситуации во внеклеточной среде. Пребывание в жидкостях организма может быть более длительным — в случае с внеклеточными патогенами, или более коротким — при поражении хозяина внутриклеточными бактериями или вирусами, но оно обязательно представлено. При нормальном функционировании иммунной системы патогены и их токсины, оказавшиеся вне клеток хозяина, подвергаются действию антител — эффекторных молекул, продуцируемых В-лимфоцитами. Особенности строения и генетического контроля структуры иммуноглобулинов (антител) 237
были рассмотрены в главе 2. Здесь же представлены данные, касающиеся функционирования антител, формирования клеточных и молекулярных механизмов эффекторной фазы работы В-системы иммунитета.
Участие антител в иммунном ответе проявляется в трех формах: нейтрализации, опсонизации, активации системы комплемента (рис. 9.15). Вирусы и внутриклеточные бактерии для своего воспроизведения должны первоначально проникнуть из жидкостей организма в клетку — место своей жизнедеятельности. Оказавшись даже на короткое время, во внеклеточном пространстве, патогены подвергаются нейтрализующему действию антител, что проявляется в блокаде рецепторного взаимодействия патогена и инфицируемой клетки. Иначе, антитела препятствуют предетерминиро-ванному взаимодействию клеточных рецепторов с лигандом на поверхности патогена. Процесс нейтрализации проявляется не только в случаях с корпускулярными антигенами, но и с бактериальными токсинами.
Одним из ведущих механизмов элиминации внеклеточных патогенов является активность фагоцитирующих клеток, которые, захватывая антиген, разрушают его в фаголизосомах. Этот неспе
Рис. 915. Феномены, опосредованные антителами.
1. Нейтрализация. Антитела препятствуют проникновению патогена в клетку, блокируя лиганды (антигены), которые взаимодействуют с рецепторами клеток хозяина. 2. Опсонизация. Макрофаги несут на своей поверхности рецепторы к Fc-фрагменту иммуноглобулинов. Предсуществующие антитела, взаимодействуя с антигенами патогена, опсонизируют последний и обеспечивают тем самым более эффективный его захват макрофагами. 3. Активация комплемента. Антитела, вступившие в реакцию с бактериальной клеткой или любыми другими корпускулярными или растворимыми антигенами, активируют белки системы комплемента, действие которых двояко. Во-первых, они лизируют клетку и, во-вторых, выступают в качестве опсонинов, способствуя вместе с антителами более эффективному захвату патогена макрофагами
цифический по основной своей феноменологии процесс усиливается специфическими антителами. Макрофаги — главные участники внутриклеточного разрушения патогенов — имеют на своей поверхности рецептор к Fc-фрагменту иммуноглобулинов. Патоген, связавшийся со специфическим антителом, оказывается значительно более доступным для фагоцитирующих мононуклеаров в результате взаимодействия Fc-фрагмента иммуноглобулина с Fc-рецептором на поверхности фагоцита. Процесс усиления фагоцитоза за счет гуморальных факторов, вообще, и специфических антител, в частности, получил название опсонизации.
Еще одна форма проявления функциональных особенностей антител — активация системы комплемента. Антитела, связавшиеся с поверхностью бактериальной клетки, активируют белки системы комплемента, которые принимают участие в ряде иммунологических явлений. Во-первых, взаимодейстуя с патогеном, некоторые белки системы комплемента выполняют функцию опсонинов. Во-вторых, компоненты комплемента выступают в роли хемотаксических факторов, привлекая в очаг инфекции фагоцитирующие клетки. Третье свойство белков системы комплемента связано с их литической активностью — способностью образовывать поры в клеточной стенке бактерий, что приводит к гибели патогеннов.
При отсутствии антигенной агрессии специфические антитела не образуются. По этому признаку процесс антителогенеза классифицируется как ивдуцибелыюе явление. Фактором индукции служит антиген. Однако, как и в случае с Т-клетками, одного специфического сигнала от антигена недостаточно для начала синтеза антител В-клетками. Необходим второй сигнал для реализации информации от специфического индуктора. Роль второго сигнала исполняют цитокины, продуцируемые хелперными CD4 Т-клетками. Получение второго сигнала для полноценного развития В-клеток в антителопродуцирующие плазмоциты возможно при непосредственном контактном Т-В-взаимодействиии.
В данном разделе рассматриваются условия полноценной продукции антител В-клетками, функциональная активность антител различных изотипов, роль системы комплемента в гуморальном иммунном ответе.
9.2.1. Образование антител В-лимфоцитами
9.2.1.1. Участие хелперных CD4 Т-клеток в продукции антител
Впервые необходимость кооперации Т- и В-лимфоцитов при развитии гуморального иммунного ответа продемонстрировали Клэмен с соавт. в 1966 г. (рис. 9.16). Введение летально облученным мышам клеток только костного мозга (источника В-клеток) или
900 Р
Рис. 9.16. Взаимодействие между клетками тимуса (источника Т-клеток) и клетками костного мозга (источника В-клеток) при индукции гуморального иммунного ответа (daman et а)., 1966).
Введение облученным мышам клеток только костного мозга (ККМ) или только тимуса (КТ) не обеспечивает развитие иммунного ответа достаточной силы. В то же время введение смеси этих клеток приводит к интенсивной продукции антител к использованному для иммунизации антигену (эритроцитам барана — ЭБ). Причем ответ при совместной инъекции клеток значительно выше, чем сумма ответов при раздельном введении клеток различного происхождения. Таким образом, кооперация двух типов клеток приводит к синергическому эффекту. Ответ оценивали по количеству бляшкообразующих (антителообразующих) клеток (БОК) в селезенке
только тимуса (источника Т-клеток) не приводило к развитию гуморального иммунного ответа. Продукция антител находилась на крайне низком уровне. В то же время при одновременной инъекции смеси этих клеток наблюдался сильный иммунный ответ. При одновременном введении различных типов клеток он был значительно выше, чем сумма ответов при раздельной инъекции. Иначе говоря, кооперация Т- и В-клеток дает выраженный синергический эффект. Именно синергизм при клеточном взаимо-240
действии вызвал наибольший интерес исследователей. Эти опыты определили создание целого направления исследований, задача которого — познание механизмов клеточного взаимодействия при развитии иммунного ответа.
Поверхностный иммуноглобулин (sig) играет двойную роль при трансформации В-клеток в антителопродуцирующие плазмоциты. Во-первых, подобно антигенраспознающему рецептору Т-клеток он передает сигнал о встрече с антигеном непосредственно внутрь клетки. Во-вторых, служит молекулярным фактором захвата этого антигена для переноса его в цитоплазму клетки. Там антиген разрушается до отдельных пептидов, которые в комплексе с молекулами II класса МНС выносятся на поверхность клетки. Иммуногенный комплекс является объектом распознавания ан-тигенспецифическими хелперными CD4 Т-клетками (Тн2), которые обеспечивают второй сигнал для активации В-клеток (см. рис. 9.9; 3).
Тимусзависимые и тимуснезависимые антигены.Для большинства антигенов взаимодействие хелперных Т-клеток с В-лимфо-цитами является обязательным условием развития гуморального иммунного ответа. В силу этого подобные антигены (в основном белки, включающие бактериальные токсины) получили название тимусзависимых антигенов (англ, сокр.: “TD antigens”).
Животные или человек с дисфункцией тимуса не способны к полноценной продукции антител. При подобном иммунодефицитном состоянии В-клетки не получают второго сигнала от Т-клеток и переходят в состояние анергии (рис. 9.17).
Хотя для индукции антителогенеза к большинству антигенов требуются зрелые Т-клетки, многие компонентны микробов, такие как бактериальные полисахариды, липополисахарады, высо-кополимерные белки, могут включать В-клетки без дополнительной помощи со стороны хелперных Т-клеток. Эта категория антигенов получила названгие тимуснезависимых антигенов (англ, сокр.: “TI antigens”).
Тимуснезависимые антигены подразделяются на два класса, которые активируют В-клетки разным способом. TI-1-антигены содержат характеристику, которая проявляется в прямой индукции пролиферации В-клеток. При высокой концентрации антигена в процесс пролиферации и дифференцировки вступят все В-клетки, независимо от специфичности их антигенраспознающих рецепторов. Такие антигены получили название поликлональных активаторов, или В-клеточных митогенов. Примером в данном случае может служить липополисахарид бактерий. Снижение концентрации TI-антигена на несколько порядков приводит к стимуляции только антигенспецифического клона В-клеток. Концентрационный эффект связан с наличием у ТЫ антигенов так называемого 16 Зак. 3701 241
Рис. 9.17. Ответ В-клеток на тимусзависимый и тимуснезависимый антигены.
1. В условиях, когда В-клетки (В) провзаимодействовали с антигеном (АГ), но не получили помощи со стороны хелперных CD4 Т-клеток (Т), развивается функциональное подавление клетки — анергия. 2. При адекватном включении в ответ хелперных CD4 Т-клеток и формировании в результате двух сигналов для В-клеток (первый — от поверхностного иммуноглобулина (sig), провзаимодейство-вавшего с антигеном (АГ), второй — от иммуногенного комплекса на В-клетках) создаются условия для полноценного развития В-клеток в антителопродуценты. Антигены, которым необходима помощь со стороны Т-клеток, получили название тимусзависимых антигенов. 3. В-клеточный ответ может развиваться без помощи со стороны Т-клеток в тех случаях, когда он формируется на тимуснезависи-мые антигены (TI). Известно два класса таких антигенов. К первому классу (TI-1) относятся антигены, в чью структуру включат так называемый митогенный участок (МУ), который формирует второй сигнал для В-клеток и тем самым заменяет помощь со стороны Т-клеток. Второй класс — тимуснезависимые антигены (Т1-2) — представлен соединениями, в структуре которых имеются повторяющиеся гомологичные эпитопы. Многоточечное соединение этих эпитопов с поверхностными иммуноглобулинами оказывается достаточным для включения В-клетки в процесс пролиферации и дифференцировки до зрелого антителопродуцента
митогенного участка, который заменяет сигнал от хелперных Т-клеток. При высоких концентрациях антигена, когда нет конкуренции за специфическое взаимодействие между поверхностным иммуноглобулином и эпитопом TI-1 антигена, наблюдается поликлональный ответ. В условиях, когда концентрация антигена незначительна, преимущество остается за клетками, способными к двойному распознаванию — как митогенного участка, так и антигенного эпитопа. В результате наблюдается клональная экспансия антигенспецифических В-клеток. Для TI-1 антигена не требуется многократного повторения идентичных эпитопов, так как нали-
чие митогенного участка компенсирует отсутствие многоточечного взаимодействия, что имеет место при активации В-клеток TI-2-антигенами.
В течение обычного инфекционого процесса концентрация ТЫ -антигенов незначительна. В силу этого будут активироваться только те В-клетки, которые имеют соответствующий антиген-распознающий рецептор, а продуцируемые антитела будут взаимодействовать только с ТЫ-антигеном. Такой ответ развивается к ряду внеклеточных инфекций, причем он формируется быстрее, чем Т-зависимый иммунный ответ, так как не требует времени на созревание антигенспецифических хелперных Т-клеток. Скорость ответа сопряжена с несовершенством самого ответа. Он действительно напоминает “скорую помощь” в самом начале развития инфекции. ТЫ-антигены, действуя самостоятельно, не способны индуцировать переключение синтеза антител с одного изотипа на другой, не оказывают влияния на повышение аффинности антител, не создают клеток памяти. Все эти процессы требуют хелперных Т-клеток.
Второй класс тимуснезависимых антигенов представлен молекулами, имеющими часто повторяющиеся идентичные эпитопы. К этому классу относятся полисахариды бактериальной стенки, сильно полимеризованные высокомолекулярные белки (например, гемоцианин). Механизм активации В-клеток связан с перекрестным сцеплением между повторяющимися антигенными эпитопами и поверхностным иммуноглобулином. Является ли ответ к TI-^-антигенам полностью независимым от хелперных Т-клеток, не ясно. С одной стороны, гуморальный иммунный ответ регистрируется у дефицитных по Т-клеткам мышей nude. С другой — удаление из культуры in vitro всех Т-клеток приводит к подавлению ответа на TI-2-антиген. Введение незначительного количества Т-клеток иммунодефицитным мышам значительно усиливает иммунный ответ к данным антигенам. Вероятно, наиболее ранний ответ в виде синтеза IgM формируется без помощи Т-клеток. Более поздний гуморальный ответ, характеризующийся доминантным синтезом IgG, требует включения хелперных Т-клеток.
Сцепленное распознавание. В условиях конкретной вирусной или бактериальной инфекции В- и Т-клетки должны распознать тот же самый комплексный антиген, но не обязательно те же самые эпитопы этого антигена. Понимание того факта, что В- и Т-клетки могут реагировать с разными эпитопами и что при этом помощь со стороны хелперных Т-клеток проявляется в полной мере, пришло из опытов по индукции гуморального иммуного ответа у животных, иммунизированных комплексом гаптешноси-тель (рис. 9.18). Мышей иммунизировали конъюгатом NIP-OA (N1P — гаптен 4-гидрокси-З-йод- 5-нитрофенилуксусная кислота; ОА 16* 243
Таблица 9.4
Сравнительная характеристика различных классов антигенов, инициирующих гуморальный иммунный ответ
Тимусзависимые (TI) Тимуснезависи- Тимуснезависи-
антигены: токсин дифтерии, вирусный гемагглютинин, мые-1 (ТЫ) антигены: бактериальный лило- мые-2 (TI-2) антигены: полисахарид пневмокок-
Свойства очищенный белковый дериват (PPD) Mycobacterium tuberculosis полисахарид Brucella abortus ков, полимеризованный флагеллин сальмонелла, поли вин ил пирол-лидон, фиколл, конъюгированный с гаптеном
Образование антител у нормальных животных да да да
Образование антител у дефицитных по Т-клеткам животных нет да да
Примирование Т-клеток да нет нет
Поликлональная активация В-кле-ток нет да нет
Требование к повторяющимся эпитопам нет нет да
— овальбумин кур, использованный в качестве носителя для гаптена). При переносе клеток селезенки примированных мышей в организм сингенного облученного хозяина развивается анти-NIP-ответ только после введения того же антигена NIP-OA. Продукция антител к гаптену отсутствовала, если в качестве антигена использовали NIP, конъюгированный с другим носителем, например с бычьим сывороточным альбумином (BSA) или сывороточным альбумином человека (HSA). Отсутствовал ответ и в тех случаях, когда перед введением реципиенту клеток селезенки освобождали от Т-клеток, используя анти-Thy-l-сыворотку. Эта первая часть опытов демонстрировала, во-первых, необходимость примированных Т-клеток для развития гуморального иммунного ответа, и во-вторых, распознавание разных эпитопов NIP-OA конъюгата. Если бы Т-клетки распознавали тот же гаптен, то его введение на ином носителе не отразилось бы на силе гуморального ответа. В последующих вариантах этих опытов проводили адаптивный перенос примированных клеток селезенки от мышей иммунизированных как NIP-OA, так и только посторонним носителем — BSA. В последнем случае иммунный ответ развивался и к NIP-OA, и к NIP-244
Иммунизация Анти-МР~ответ
Рис. 9.18. Кооперация между клетками, специфичными к носителю (Т-клетками) и гаптену (В-клетками).
Мышей иммунизировали конъюгатом N1P-OA (N1P — гаптен 4-гидрокси-З-йод-5-нитрофенилуксусная кислота, ОА — овальбумин кур, использованный как носитель для гаптена). При переносе клеток селезенки примированных мышей в организм сингенного облученного хозяина развивается анти-NIP-ответ только при использовании гомологичного антигена (NIP-овальбумина). Продукция антител к NIP отсутствует, если в качестве носителя использован гетерологичный белок (бычий сывороточный альбумин — BSA, сывороточный альбумин человека — HSA). При введении интактным мышам клеток селезенки от мышей, примированных к NIP-ОА и BSA, ответ развивается как к NIP-ОА, так и к NIP-BSA. Если из клеток селезенки мышей, иммунизированных BSA, удалить Т-клетки, то оставшаяся популяция В-клеток не способна отвечать на NIP-BSA, хотя реактивность к NIP-ОА сохраняется. Сделан вывод о том, что Т-клетки реагируют на носитель, в то же время В-клетки отвечают на гаптен
BSA. Удаление Т-клеток из селезенки мышей, иммунизированных BSA, отменяло и продукцию антител к гаптену. Ясно, что иммуногенность конъюгата связана с возможностью Т-клеток взаимодействовать с носителем. При этом антигенные свойства носителя не имеют значения для специфичности гуморального иммунного ответа.
При реальной бактериальной или вирусной инфекции, как и в эксперименте, Т- и В- клетки распознают разные эпитопы одного и того же комплексного в антигенном отношении патогена. Это явление распознавания В- и Т-клетками разных эпитопов одного и того же антигена получило название сцепленного распознавания. На примере вирусной инфекции цепь событий выглядит следующим образом. Поверхностные белки вирусных частиц, взаимодействуя с предетерминированными антигенраспознающими рецепторами (sig) В-клеток, оказываются поглощенными этими В-клетками. В результате внутриклеточной переработки на клеточной поверхности оказываются пептиды вирусных белков в комплексе с молекулами II класса МНС. Комплекс образуется с пептидами не только внешних вирусных белков, но и внутренних, недоступных для поверхностных иммуноглобулинов В-клеток. Таким образом, В-клетка оказывается подготовленной к встрече со зрелыми хелперными Т-клетками. Т-хелперы проходят свой путь при-мирования, взаимодействуя с тем или иным типом антигенпрезентирующих клеток. Среди Т-клеток будут те, которые способны реагировать с иммуногенными комплексами, включающими пептиды как внешних, так и внутренних белков. Таким образом помощь В-клеткам усиливается способностью Т-клеток распознавать множество пептидных вирусных фрагментов, но при этом специфичность секретируемых В-клеткой антител будет только к поверхностному белку вируса, так как первоначальная встреча В-лимфоцитов была именно с поверхностными эпитопами. Образовавшиеся вирусспецифические антитела обладают как нейтрализующей, так и опсонизирующей активностью, т.е. с одной стороны, препятствуют взаимодействию вируса с клеткой-мишенью, а с другой — усиливают контакт с фагоцитирующими клетками через Fc-фрагмент антител.
Мембранные и секреторные активаторы В-клеток. Зрелые хелперные CD4 Т-клетки, распознавшие комплекс антигенного пептида с молекулами II класса МНС, активируют В-клетки к пролиферации и дифференцировке в зрелые антителопродуценты — плазмоциты. Хелперные Т-клетки после взаимодействия с В-лим-фоцитами начинают экспрессировать мембраносвязанные и секреторные формы молекулярных активаторов (рис. 9.19). Наиболее важными эффекторными молекулами хелперных Т-клеток на ранней стадии активации В-клеток является лигавд CD40, относя-246
Рис. 9.19. Активация В-клеток к пролиферации и дифференцировке в плазмоциты.
В-клетки (В), экспрессирующие комплекс антигенный пептид:молекула II класса МНС, взаимодействуют с антигенспецифическими хелперными Т-клетка-ми (Тн). При этом формируются дополнительные сигналы, необходимые В-клетке для выхода в дифференцировку: первый сигнал — от взаимодействия CD40 В-клеток с лигандом CD40L Т-клеток и второй сигнал — от секретируемого Т-хелперамицитокина интерлейкин-4 (ИЛ-4). Два дополнительных цитокина — ин-терлейкин-5 (ИЛ-5) и интерлейкин-6 (ИЛ-6), секретируемые Т-клетками, вносят свой вклад в процесс дифференцировки В-клеток на заключительных этапах развития
щийся к семейству ФНО-цитокинов. Этот лиганд связывается с поверхностной молекулой В-клеток CD40 — аналогом рецептора к ФНО-а на макрофагах. Вторым стимулирующим В-клетки фактором является интерлейкин-4 (ИЛ-4), секреция которого хелперными Т-клетками начинается после их контакта с В-лимфоцита-ми. Как и в случае с инфицированными макрофагами, требующими для своей активации двух молекулярных сигналов, синтезируемых Т-клетками воспаления (поверхностного ФНО-а и секретируемого цитокина ИНФ-у), В-клетки также активируются двумя стимуляторами — поверхностным СО40-лигандом и секретируемым ИЛ-4. Однако если активация инфицированных макрофагов приводит к быстрому эффекторному действию — разрушению внутриклеточных патогенов, то начальный этап активации наивных В-клеток связан с рядом подготовительных процессов, и в первую очередь с их клональной экспансией — накоплением антигенспе-цифического клона, который после завершения пролиферации переходит к дифференцировке в плазматические клетки, секретирующие антитела заданной специфичности. Два дополнительных цитокина — ИЛ-5 и ИЛ-6, секретируемые хелперными Т-клетками, вносят свой вклад в процесс дифференцировки В-клеток на заключительном этапе процесса В-клеточной активации.
Переключение синтеза изотипов. По мере развития гуморального иммунного ответа синтез антител переключается с одного изотипа на другой при сохранении их исходной специфичности. В самом начале иммунного ответа доминирующим изотипом является IgM. В очень незначительном количестве представлен IgD. Позднее, по мере развития антителогенеза происходит замена синтеза IgM на синтез IgG, IgA и IgE. Эти изменения в преимущественном синтезе того или иного изотипа не наблюдаются у индивидуумов с дефектом экспрессии СВ40-лиганда, принимающего участие в контакном взаимодействии хелперных Т-клеток с В-лимфо-цитами. При подобной форме иммунодефицита наблюдается необычно высокое содержание IgM в сыворотке крови на фоне отсутствия продукции иммуноглобулинов иных изотипов. Активная продукция IgM при недостатке Т-клеточной помощи может быть связана с ответом В-клеток на тимуснезависимые антигены. В то же время эти клинические наблюдения дополнительно демонстрируют, что для сбалансированной продукции различных классов антител необходимо включение в ответ хелперных Т-клеток.
Большинство из того, что известно о регуляции переключения изотипов, пришло из экспериментов, проведенных с мышиными В-клетками, которые стимулировались очищенными цитокинами in vitro. Эти эксперименты показали, что различные цитокины преимущественно индуцируют переключение синтеза “своих” изотипов. Так, ИЛ-4 индуцирует переключение синтеза IgM на IgGl и 1g, в то время как ФНО-0 — на IgG2b и IgA. Другой цитокин — ИЛ-5, секретируемый хелперными CD4 Т-клетками, усиливает продукцию IgA, когда переключение в геноме для синтеза данного изотипа уже произошло. Хотя CD4 Т-клетки воспаления являются плохими регуляторами синтеза антител, они принимают участие в переключении изотипов посредством секретируемого ими ИНФ-у. Этот цитокин оказывает преимущественное влияние на индукцию синтеза IgG3 и IgG2a.
Данные об участии различных цитокинов в продукции антител разных изотипов суммированы в табл. 9.5.
Таким образом, участие хелперных Т-клеток в гуморальном иммунном ответе имеет двойное проявление: во-первых, они инициируют пролиферацию и дифференцировку распознавших антиген В-клеток и, во-вторых, оказывают прямое действие на переключение синтеза антител с одного изотипа на другой.
Повышение аффинности антител в процессе формирования.им-мунного ответа. По мере развития иммунного ответа происходит не только переключение синтеза антител с одного изотипа на другой, но и повышается аффинность (сродство) этих антител к тому антигенному эпитопу, который вызвал их образование. Константа диссоциации “ранних” антител на два-три порядка выше, чем у
Таблица 9.5
Влияние цитокинов на экспрессию различных изотипов иммуноглобулинов
Цито-КИНЫ Изотипы иммуноглобулинов
IgM IgG3 IgGl IgG2b IgG2a IgA IgE
ИЛ-4 ингибирует ингибирует индуцирует ингибирует необходим для индукции
ИЛ-5 усиливает продукцию
ИНФ-у ингибирует индуцирует ингибирует индуцирует ингибирует
ФНО-р ингибирует ингибирует индуцирует индуцирует
“поздних” антител. Кроме того, поданным изоэлектофокусирова-ния известно, что на раннем этапе иммунного ответа гетерогенность антител одной специфичности выше, чем на поздних этапах процесса.
Одна из гипотез, пытающихся объяснить это явление, строится на представлении о гипермутабельности генов, контролирующих вариабельные домены иммуноглобулинов. Известно, что мутационный уровень для всех соматических клеток составляет замену одной пары оснований на 1012 пар при одном клеточном делении. По гипермутационной теории частота замен представляется величиной, равной одной замене на 103 пар оснований. При этом гипермутабельность не затрагивает гены, контролирующие константные регионы. Первое и основное возражение в отношении данной гипотезы заключается в том, что представление о выборочной повышенной мутабельности каких-то участков ДНК (в данном случае V-генов) кажется умозрительным и не укладывается в современные концепции молекулярной генетики. Непонятно, зачем строить искусственные конструкции, когда уровень исходной генетически детерминированной вариабельности 2,4-108 разных по специфичности иммуноглобулинов более чем достаточен для взаимодействия с самыми различными антигенными эпитопами; среди них будут и такие, взаимодействие с которыми осуществляется с наибольшей аффинностью.
Вопрос разрешается достаточно просто на основании представлений о существовании селекции антигенспецифических В-клонов. На рис. 9.20 показан один из возможных механизмов повышения аффинности антител в процессе развития иммунного ответа зрелыми В-клетками. В реакцию распознавания антигенного эпитопа вступают клетки нескольких клонов, имеющих анти-
РАСПОЗНАВАНИЕ
Клетки памяти
Рис. 9.20. Повышение аффинности антител в динамике развития иммунного от-вега.
В реакцию распознавания антигена (АГ) вступают В-клетки нескольких клонов, имеющих близкие, но тем не менее несколько отличающиеся по специфичности антигенраспознающие рецепторы. В силу этого на самых ранних этапах развития иммунного ответа пул специфических антител будет наиболее гетерогенным. Клон, имеющих антигенраспознающие рецепторы с наибольшим сродством к антигену, будет обладать селективным преимуществом в размножении, что обеспечит ускоренное накопление высокоаффинных антител, именно в этом клоне, количественно большим друнгих клонов, вступят в работу с большей эффективностью механизмы переключения синтеза IgM на IgG и формирования клеток памяти. Схема объясняет как большую аффинность IgG по сравнению с таковой IgM, так и преимущественный синтез высокоаффинных IgG антител при вторичном ответе
генраспознающие иммуноглобулиновые рецепторы, которые несколько отличаются друг от друга по строению антигенсвязываю-щего (активного) центра. В силу этого на самых ранних этапах иммунного ответа пул специфических антител к данному антигенному эпитопу будет наиболее гетерогенным. Клон, имеющий антигенраспознающие рецепторы с наибольшим сродством к антигену, будет обладать селективным преимуществом в размножении за счет большей энергии связи, что и обеспечит ускоренное накопление высокоаффинных антител. Именно в этом клоне вступят в работу механизмы переключения синтеза IgM на IgG и формирования клеток памяти. Схема объясняет как большую аффинность IgG, установленную экспериментально, так и преимущественный синтез высокоаффинных IgG при вторичном ответе, что также имеет экспериментальное подтверждение.
Гистологическая картина образования активных антителопро-дуцентов. Одной из характерных черт организации лимфоидной ткани является наличие так называемых центров размножения, которые представляют собой место пролиферации, трансформации и селекции В-клеточных клонов (рис. 9.21). B-Лимфоциты, активированные хелперными Т-клетками в тимусзависимой зоне лимфоидной ткани либо сразу дифференцируются в плазматические клетки, продуцирующие ранние, суммарно низкоаффинные антитела, либо перемещаются в первичные фолликулы и образуют там центры размножения. Здесь они, во-первых, подвергаются селекции на наличие высокоаффинных антигенраспознающих иммуноглобулиновых рецепторов и, во-вторых, завершают дифференцировку в плазмоциты, продуцирующие высокоаффинные антитела. Часть В-клеток с высокоаффинными рецепторами трансформируется в клетки памяти.
Первичный фолликул содержит покоящиеся В-клетки, плотно упакованные вокруг специализированных клеточных типов, называемых фолликулярными дендритными клетками. Эти клетки отличаются от дендритных клеток, активирующих Т-клетки, по крайней мере по двум признакам. Во-первых, они способны длительное время сохранять нативный антиген на своей поверхности. Во-вторых, данные клетки экспрессируют специализированную молекулу CD23, которая является лигандом для CR2 — компонента корецептора В-клеток CD19. Взаимодействующие CD23 и CR2 принимают участие в селекции высокоаффинных В-клеток.
Проникшие в первичный фолликул активированные В-клетки начинают интенсивно делиться, образуя бластные формы. Они легко определяются микроскопически по увеличенному размеру, обильной цитоплазме, диффузному хроматину. Клетки этого типа называются центробластами. Собственно первичный фолликул, накопивший центробласты, гистологически определяется как центр размножения, или вторичный фолликул. Центробласты дифференцируются в центроциты — это те же В-клетки, но прошедшие активацию Т-лимфоцитами и бластную стадию развития.
Присутствующий на фолликулярных дендритных клетках антиген выступает в качестве фактора отбора центроцитов на наличие у них высокоаффинных антигенраспознающих рецепторов. Этот специфический отбор закрепляется вступлением в реакцию взаимодействия лигандов CD24 и CR2. B-Клетки, не прошедшие отбора, погибают, что микроскопически также определяется по наличию апоптических клеток. Клетки, выдержавшие отбор на аффинность, экспрессируют ген bcl-2+, продукт которого защищает клетку от апоптоза.
Активация
Секреция антител
Образование клеток памяти
Рис. 9.21. Гистологическая картина функционального созревания В-клеток.
Фолликулы лимфоидной ткани с центрами размножения представляют собой место локализации В-клеток, находящихся на разных стадиях развития. Более светлая часть фолликула — центр размножения — концентрирует бластные формы — центробласты (В-бласты). Центр окружен созревающими или созревшими центроцитами (В-клетками). В состав фолликула входят также фолликулярные дедрит-ные клетки, которые отличаются от дендритных клеток, активирующих Т-клетки, двумя признаками'.способностью к длительному сохранению нативного антигена на своей поверхности и наличием специализированной молекулы CD23.1. Активация В-клеток (В) хелперными CD4 Т-клетками (Т) в тимусзависимой зоне, прилегающей к фолликулу, приводит in situ к образованию из части активированных клеток ранних плазмоцитов, продуцирующих антитела низкой аффинности. 2. Большая часть активированных В-клеток перемещается в центр фолликула, где начинает активно делиться, образуя бластные формы (центробласты). Микроскопически центр размножения выглядит более светлым. Накопившиеся бласты проходят отбор на повышенную аффинность антигенраспознающих рецепторов. Фактором отбора являются дендритные клетки, несущие на своей поверхности чужеродный антиген и экспрессирующие молекулу CD23. Данная молекула выступает при отборе в качестве лиганда, взаимодействующего с СК2-частью CD 19-рецептора В-клеток. У прошедших положительный отбор В-клеток происходит дерепрессия гена Ъс1-2+, продукт которого защищает В-клетки от апоптоза. Не прошедшие отбор клетки гибнут на месте, что хорошо видно микроскопически по наличию фигур апоптоза. 3. Прошедшие отбор клетки (центроциты) перемешаются на периферию фолликула, где трансформируются в плазмоциты, секретирующие антитела высокой аффинности, или образуют клетки памяти при участии хелперных С D4 Т-клеток
Прошедшие сито отбора центроциты перемещаются на периферию центра размножения, где они дифферецируются либо в активно секретирующие антитела плазмоциты, либо в клетки памяти. Что является определяющим в выборе направления дифференцировки на самом заключительном этапе развития, не ясно. Предполагается, что к трансформации в плазмоциты приводит только взаимодействие СО23-лиганда с CR2. В то же время, если зрелые центроциты вступят в контакт с Т-клетками через взаимодействие CD40 с CD40L, то клеточная трансформация приведет к формированию клеток памяти.
9.2.2. Эффекторная функция различных изотипов антител
Три основных проявления активности антител — нейтрализация, опсонизация и активация системы комплемента, — направлены на выполнение единой задачи — изоляцию и уничтожение патогена. Независимо от принадлежности антител к тому или иному изотипу, все они характеризуются строгой специфичностью по отношению к антигену, вызвавшему их образование. Различия по изотипам касаются константной части молекулы иммуноглобулинов. Именно эта часть молекулы в зависимости от конкретной иммунологической ситуации мобилизует комплекс реакций, направленных на завершение иммунного процесса — окончательное выведение чужеродного антигена из организма.
9.2.2.1. Распределение антител в организме
Наиболее обычными ’’воротами” инфекции являются слизистые покровы дыхательного, уро-генитального, пищеварительного трактов. Раневое повреждение кожи, укусы насекомых, случайные уколы создают угрозу проникновения возбудителя инфекций непосредственно в кровоток. Во всех этих случаях чужеродные антигены инициируют развитие иммунного ответа или взаимодействуют с предсуществующими антителами. В зависимости от места проникновения антиген сталкивается преимущественно с различными изотипами антител. При этом подчас место вхождения патогена и лимфоидная ткань, где образуются антитела, удалены в организме друг от друга. Антитела, чтобы попасть в локальный очаг проникновения антигена, должны преодолеть эпителиальные барьеры.
Первыми при иммунном ответе образуются IgM. По времени возникновения их называют еще ранними антителами. Этот изотип иммуноглобулинов характеризуется относительно низкой аффинностью, поскольку он не подвергался селекции в лимфоидной ткани, для которой требуется определенное время — около 5-6 дней от начала вступления в реакцию активированных В-клеток.
253
Низкая аффинность IgM компенсируется количеством антигенс-вязывающих участков (активных центров) у молекул данного изотипа. Десять антигенсвязывающих участков и высокая подвижность Fab-фрагментов обеспечивают достаточно эффективное многоточечное взаимодействие IgM с корпускулярными, в частности с бактериальными антигенами. Помимо антигеннейтрализующей активности антитела данного изотипа являются сильными активаторами системы комплемента, что также усиливает их роль в изоляции патогена.
Обычное “место действия” IgM — кровоток, однако при повышении проницаемости сосудов под влиянием вазоактивных соединений антитела данного изотипа могут проникать в места локальной концентрации антигена.
Антитела других изотипов (IgG, IgA, IgE), имея меньший молекулярный вес и соответствующие молекулярные механизмы взаимодействия с эпителиальными клетками (см. ниже), значительно легче преодолевают клеточные барьеры и достаточно широко распространяются по организму из мест синтеза. Другой отличительной чертой антител этих изотипов является их большая по сравнению с IgM аффинность. Как отмечалось выше, два процесса — переключение внутриклеточного синтеза иммуноглобулинов с одного изотипа на другой и селекция клонов по признаку наибольшего сродства к антигену — требуют времени, но при этом потеря времени компенсируется у рассматриваемых изотипов повышением аффинности и проницаемости через эпителий, что говорит об их большей функциональной активности.
Основным изотипом в крови и внеклеточной жидкости является IgG. Он активно опсонизирует корпускулярные антигены, способствуя их захвату фагоцитирующими клетками. Кроме того, этот иммуноглобулин является достаточно сильным активатором системы комплемента.
Если IgG распространен в основном во внеклеточном пространстве тканей, где имеется доступ к вспомогательным клеткам и молекулам, то IgA представлен на слизистых поверхностях тела. Здесь необходимые вспомогательные клеточные и молекулярные элементы иммунной реактивности практически отсутствуют, и функция данного изотипа напрямую связана со свойствами самой молекулы — способностью нейтрализовать патогены, оказавшиеся на слизистой поверхности.
И, наконец, IgE представлен в очень небольшом количестве в крови и внеклеточной жидкости. Он характеризуется цитофиль-ностью по отношению к тучным клеткам, которые локализуются под кожей, в слизистых покровах и вдоль сосудов соединительной ткани. Взаимодействие IgE, связавшего антиген, с тучными клетками приводит к выбросу из этих клеток физиологически актив-254
ных медиаторов, которые провоцируют повышенную чувствительность аллергического типа к антигену. Кроме того, действие медиаторов тучных клеток может провоцировать кашель, рвоту и чихание, что дополнительно освобождает организм от патогена.
9.2.2.2. Транспорт через эпителиальные барьеры
Наиболее полно механизм транспорта через эпителий изучен у IgA. Основным местом нейтрализующей активности IgA являются эпителиальные поверхности тела. В то же время плазматические клетки, секретирующие IgA, сконцентрированы главным образом в соединительной ткани, располагающейся под основной мембраной эпителиального слоя (эта соединительная ткань получила название lamina propria). Морфологическая близость не освобождает IgA от необходимости преодолевать эпителиальный барьер, с тем чтобы выйти на его поверхность, контактирующую с внешней средой. Процесс транспорта через эпителий складывается из ряда этапов. Продуцируемый плазматическими клетками lamina propria IgA представляет собой димерную форму. Димер IgA связывается специфически с Poly-Ig-рецептором, экспрессирующимся на базо-латеральной поверхности эпителиальных клеток. После взаимодействия IgA с соответствующим рецептором комплекс IgA:Poly-Ig-penen rop поглощается клеткой и транспортируется через ее цитоплазму в составе транспортной вакуоли к апикальной поверхности. После выхода на клеточную поверхность часть рецептора, связанная с мембраной, отщепляется ферментативным способом. Оставшаяся в комплексе часть, называемая секреторным компонентом, защищает димерный IgA от ферментативного разрушения. Именно в слизистых секретах эпителия и осуществляет свою нейтрализующую функцию комплекс IgAiceKperop-ный компонент.
Особую защитную функцию IgA выполняет у новорожденных. Не имея собственных развитых механизмов гуморального иммунитета, ребенок получает этот иммуноглобулин с молоком матери и тем самым обеспечивает себе специфическую защиту от первых патогенов внешней среды. Другим гуморальным фактором защиты новорожденных является IgG. Еще при внутриутробном развитии IgG транспортируется в организм эмбриона через плаценту непосредственно в кровоток. При рождении ребенок имеет тот же уровень, и тот же набор специфичностей IgG, что и его мать. Если IgA новорожденного, как и взрослого организма, — гуморальный фактор защиты от патогенов, оседающих на внешних слизистых покровах, то IgG защищает новорожденного от возможных проникновений патогенов во внутреннее межклеточное пространство.
9.2.2.3. Нейтрализация антигенов (токсинов, бактерий, вирусов)
В большинстве случаев патогенез инфекционных заболеваний связан с активностью бактериальных токсинов, которые повреждают и дезорганизуют функции соматических клеток. Например, дифтерийный токсин, подавляя синтез белка, приводит к гибели эпителиальных клеток и развитию миокардита. Холерный токсин активирует аденилатциклазу, увеличивает уровень цАМФ, что является причиной изменений в кишечном эпителии и нарушений водно-солевого обмена.
Начало интоксикации связано со способностью токсинов взаимодействовать с соответствующими рецепторами на поверхности клеток-мишеней. Этому процессу противодействуют высокоаффинные, нейтрализующие антитела, относящиеся к IgG- и IgA-изотипам. Первые нейтрализуют токсин во внеклеточном пространстве внутренних тканей организма, вторые — на слизистых поверхностях, имеющих контакт с внешней средой.
Для большинства токсинов способность адсорбироваться на соматических клетках организма и оказывать патологическое действие на них связаны с разными участками полипептида. Это свойство токсинов используют для приготовления вакцин. Обработка нативного токсина тем или иным способом, при котором уничтожается его патологическое действие, но сохраняется способность к рецепторному взаимодействию с соматической клеткой, обеспечивает получение безвредного иммуногенного материала.
Не менее успешно нейтрализующая активность антител может проявляться и по отношению к бактериям. Многие возбудители инфекционных заболеваний, таких, например, как туберкулез, лепра, чума, туляремия, являются внутриклеточными патогенами. Другие, как возбудитель гонорреи, локализуются на поверхности эпителиальных клеток. В обоих случаях нейтрализующие антитела препятствуют продвижению возбудителей к местам своего оптимального существования.
Вирусы, как и некоторые бактерии, являются внутриклеточными патогенами, и механизм их проникновения в клетку аналогичен тому, который используют возбудители бактериальных инфекций. Например, вирус гриппа имеет поверхностный белок гемагглютинин, который, взаимодействуя с сиаловыми кислотами гликопротеинов, экспрессирующихся на поверхности эпителиальных клеток дыхательных путей, проникает в них. Препятствием к вирусному заражению эпителиальных клеток являются секреторные IgA-антитела.
9.2.2.4. Опсонизация и разрушение антигенов
Нейтрализация антигенов представляет собой лишь начальный этап освобождения организма от патогенов. Следующий, наиболее результативный этап связан с опсонизацией корпускулярных, или растворимых антигенов, их захватом фагоцитирующими или иными иммунологически активными клетками, внутриклеточным разрушением патогенов.
Процесс опсонизации, как уже отмечалось, осуществляется соответствующими специфическими антителами, взаимодействующими с антигенными эпитопами бактерий, вирусов, токсинов. Опсонизированный антиген прикрепляется к фагоцитирующей клетке через взаимодействие с поверхностными рецепторами к Fc-фрагменту иммуноглобулинов (Fc-рецептору).
Fc-рецепторы представляют собой семейство молекул, каждый член которого распознает иммуноглобулин одного или нескольких родственных изотипов (табл. 9.6). Рецепторы этого типа входят в состав суперсемейства иммуноглобулинов, что само по себе знаменательно, так как указывает на сопряженность эволюционного происхождения различных изотипов иммуноглобулинов и рецепторов к ним.
Таблица 9.6
Рецепторы к Fc-фрагментам иммуноглобулинов различных изотипов
Fc-рецептор Дополнительная цепь Взаимодействие с изотипом Ig Экспрессия на клетках
FcyRl (CD64) Y IgGl, IgG3, IgG4, IgG2 макрофаги, нейтрофилы, эозинофилы
FcyRII(CD32) Y IgGl, lgG3, IgG4, IgG 2 макрофаги, нейтрофилы, эозинофилы, тромбоциты, В-клетки
FcyRIII(CD16) у ИЛИ 8 IgGl, IgG3 натуральные киллеры, нейтрофилы, эозинофилы, макрофаги
FceRI е или у IgE тучные клетки
Фагоциты. В организма даже при условии очень напряженного гуморального иммунного ответа количество специфических антител к тому или иному антигену всегда значительно меньше общего количества иммуноглобулинов, постоянно циркулирующих в крови и межтканевой жидкости. Является очевидным, что в связи с подобными количественными отношениями должны существовать механизмы, дифференцирующие свободные иммуноглобулины и иммуноглобулины, связавшие антиген. При агреги-257 17 Зак. 3701
ровании антител на корпускулярном антигене имеется несколько Fc-валентностей для взаимодействия с Fc-рецепторами фагоцитирующих клеток. Каждая отдельная связь Fc-фрагмента антител с соответствующим рецептором, характеризующаяся низкоаффинным взаимодействием, неэффективна для провокации фагоцитарного захвата антигена. Поскольку бактериальные антигены агрегируют значительное количество антител, точек взаимодействия Fc-фрагмента иммуноглобулинов с Fc-рецептором на поверхности фагоцитирующей клетки будет много, что повышает авидность взаимодействия и, как следствие, успешное прохождение фагоцитоза.
Другой механизм связан с изменением конформации Fc-фрагмента после взаимодействия антитела с антигеном. Конфор-мационая модификация обеспечивает повышение аффинности взаимодействия и в результате — успех поглощения антигена. Этот последний механизм особенно важен при захвате молекулярных антигенов, таких, например, как токсины бактерий.
Процесс поглощения антигена сопряжен с активацией внутриклеточных молекулярных механизмов, направленных на разрушение чужеродных агентов. Образовавшаяся в результате поглощения опсонизированного антигенного материала фагосома сливается в клетке с одной или несколькими лизосомами, образуя фаголизосому. В фаголизосоме бактериальные и другие антигены оказываются в резко кислой среде (pH 3,5-4,0), которая сама по себе обладает бактериостатическими и бактерицидными свойствами. Кроме того, в результате фагоцитоза происходит усиленное образование кислородпроизводных продуктов, которые крайне токсичны для бактерий. В процесс разрушения и активного переваривания бактерий обязательно включаются антимикробные пептиды (дефенсины и катионные белки), а также основные ферменты лизосом — лизоцим и кислые гидролазы. Совместное действие всех этих механизмов приводит к успешному разрушению чужеродных антигенов до биологически инертных низкомолекулярных соединений.
Несмотря на эффективность фагоцитоза как комплексной реакции на антиген, в организме имеются дополнительные клеточные механизмы, также направленные на элиминацию чужеродных агентов.
Натуральные киллеры. При вирусной инфекции помимо классических цитотоксичеких Т-лимфоцитов в реакцию уничтожения вирусинфицированных клеток может вступать особая субпопуляция лимфоцитов, получившая название натуральных (естественных) киллерных клеток (НК-клеток). Они представляют собой крупные лимфоциты, лишенные каких-либо маркеров Т- и В-клеток. Их содержание в периферической крови и лимфоидной ткани
незначительно. Впервые эти клетки были обнаружены по их способности убивать некоторые опухолевые клетки.
Наличие на поверхности НК-клеток рецептора к Fc-фраг-менту иммуноглобулинов FcyRIII, взаимодействующего с IgGl и IgG3, предопределяет их способность реагировать с клетками, несущими специфический по отношению к соответствующим антителам антиген. В реальных условиях инфекционного процесса объектом активности антителозависимой клеточнообусловленной цитотоксичности являются клетки, инфицированные вирусом. Механизм цитотоксического действия НК-клеток напоминает тот, который известен для цитотоксических CD8 Т-клеток, вплоть до выделения гранул, содержащих перфорин и гранзимы.
Тучные клетки. Когда патогены проходят через эпителиальные барьеры и образуют локальный очаг инфекции, мобилизуются защитные противоинфекционные механизмы, действующие в месте роста патогенов. Одим из факторов локальной реакции защиты являются тучные клетки. Эти клетки представляют собой достаточно крупные клеточные образования, заполненные цитоплазматическими гранулами, которые содержат вазоактивные амины
Тучные клетки концентрируются главным образом в местах наиболее вероятной встречи с патогенами внешней среды: это — подслизистая ткань дыхательных путей и желудочно-кишечного тракта, соединительная ткань вдоль кровеносных сосудов.
Тучные клетки активируются в результате взаимодействия их Fc-рецептора с IgE. В отличие от рецепторов к Fc-фрагментам других изотипов антител реакция взаимодействия FceRI тучных клеток с IgE характеризуется высокой аффинностью. Однако такая аффинность рецепторного взаимодействия не является гарантией активации тучных клеток. Она происходит только в тех случаях, когда антиген способен за счет перекрестного сцепления образовать иммуноглобулиновые агрегаты на клеточной поверхности. Только после этого тучные клетки начинают секрецию содержимого своих гранул, что и является началом воспалительной реакции. Секретируемые из гранул вазоактивные амины гистамин и серотонин являются причиной локального увеличения кровотока и проницаемости сосудов, что немедленно приводит к накоплению жидкости в окружающей ткани и выходу клеток крови, таких как полиморфноядерные лейкоциты. На коже этот ответ реально проявляется в виде покраснения и зуда.
Гистамин и серотонин представляют собой короткоживущие медиаторы, и их количество резко снижается сразу после дегрануляции тучных клеток. Однако они успевают инициировать продукцию других медиаторов, известных как лейкотриены. Эти компоненты тучных клеток также вазоактивны и генерируют более чув
ствительный сосудистый ответ. Наконец, активированные тучные клетки синтезируют и секретируют ряд цитокинов, включая ИЛ-4 и ФНО-а. Последний вносит свой вклад в пролонгирование воспалительной реакции, что также способствует фиксации антигена в местах проникновения.
Первоначально воспалительная реакция с участием IgE и тучных клеток была описана как реакция аллергического типа. В настоящее время понятно ее более широкое значение как фактора сдерживания проникновения патогенов внутрь организма.
9.2.3. Система комплемента в гуморальном иммунитете
Открытие комплемента в конце прошлого столетия связывают с именем Жюля Борде, работавшего в лаборатории И.Мечникова в Париже. Первые данные указывали, что в сыворотке крови животных имеется термолабильное вещество, которое усиливает опсонизацию бактерий и в присутствии антител убивает бактерии. В настоящее время известно, что опсонизирующая и лизирующая активность сыворотки связана с большой группой белков, объе-диненых в единую систему комплемента. Определяющим событием является взаимодействие антител с антигеном, что провоцирует каскад реакций, состоящий из последовательной активации одного белка системы предыдущим белком этой системы. Некоторые из членов системы комплемента связываются ковалентно с бактериями, опсонизируя их для успешного поглощения фагоцитами, обладающими соответствующими рецепторами к комплементу. Другие члены функционируют как хемоаттрактанты, привлекая в зону воспаления, где происходит активация системы комплемента, фагоцитирующие клетки. Заключительные компоненты каскадной реакции выступают в качестве литических факторов, разрушая бактерии.
Имеется два пути реализации эффекторной функции системы комплемента — классический путь активации, по которому цепь реакций инициируется комплексом антиген:антитело, и альтернативный путь, т.е. активация системы только антигеном, без участия антител. Второй путь активации комплемента, зависящий от прямого действия патогена и не включающий специфические факторы гуморального иммунитета, кажется эволюционно более древним. Устоявшееся название для неспецифической активации системы комплемента связано лишь с более поздним открытием этого механизма включения в работу данной системы.
Все белки классического пути активации системы комплемента имеют буквенное обозначение “С” и арабскую цифру, отражающую последовательность открытия белка, но не последовательность его включения в реакцию. Реакционная последователь
ность представляет следующий ряд: С1, С4, С2, СЗ, С5, С6, С7, С8, С9. События, разворачивающиеся после инициации процесса, можно разбить на два этапа: ранний и поздний (табл. 9.7). На раннем этапе классический и альтернативный пути активации комплемента отличаются не только по инициаторам процесса, но и по белковым компонентам, включившимся в реакцию. Поздние этапы по молекулярным механизмам и конечному эффекторному действию являются общими для путей активации системы.
Первым компонентом классического пути является С1, который построен из трех белков: Clq, Clr и Cis (рис. 9.22). Clq состоит из шести идентичных субъединиц, конформационно напоминающих булаву с коллагеноподобной рукоятью. Он находится в прямом контакте с двумя другими белками — Clr и Cis. Головная часть Clq образует связь с Fc-фрагментом IgM. Подробная связь возникает только на клеточной поверхности после того, как произошло взаимодействие IgM с эпитопом патогена или какого-либо иного корпускулярного антигена. В жидкой среде такого взаимодействия не происходит, и связано это с отсутствием конформационных изменений, свойственных иммуноглобулину, адсорбированному на клетке.
Рис. 9.22. Структура первого Cl-белка классического пути активации системы комплемента.
Белок является комплексным и включает отдельные белки: Clq, Clr и Cis. Clq построен из шести субъединиц, каждая из которых имеет головную глобулярную часть и длинный коллагеноподобный хвост. Хвостовые части связывают С1 г- и Cls-белки. Головная часть взаимодействует с Fc-фрагментом иммуноглобулинов. Ниже представлена электронная микрофотография С1-белка (ув. х500000)
При взаимодействии Clq с IgG должно соблюдаться условие плотной “посадки” иммуноглобулина на поверхности корпускулярного антигена, с тем чтобы данный компонент комплемента мог провзаимодействовать с несколькими соседними иммуноглобулиновыми молекулами и образовать таким способом молекулярный агрегат. Контакт только с одной молекулой IgG не обеспечивает активации С1.
Завершившееся взаимодействие иммуноглобулинов с Clq приводит к активации ферментативной активности у данного компонента комплемента, который в свою очередь модифицирует Cis, придавая ему свойства сериновой протеазы. С приобретением ферментативных свойств Cis завершается первый этап классического пути активации системы комплемента.
Следующий этап связан с активностью Cis, который расщепляет сывороточный белок С4 на два фрагмента: больший С4Ь и меньший — С4а. Больший ковалентно связывается с поверхнос-
Таблица 9.7
Основные компоненты комплемента и их функциональная активность
тью патогена и затем взаимодействует с С2, делая его чувствительным к сериновой протеазе Cis. В результате С2 расщепляется на С2Ь и С2а. С2Ь также обладает активностью сериновой протеазы. Комплекс С4Ь с активной сериновой протеазой С2Ь является ферментом СЗ/С5-конвертазой, прикрепленной к поверхности патогена. Наиболее важная функция СЗ/С5-конвертазы состоит в расщеплении большого числа СЗ молекул на СЗЬ, остающиеся прикрепленными к поверхности патогена, и свободные СЗа, играющие значительную роль в инициации локальной воспалительной реакции.
При альтернативном пути активации системы комплемента основные события аналогичны тем, которые известны для классического пути. Инициатором процесса является ковалентно связанный с поверхностью патогена СЗЬ, который образовался как результат работы классического пути активации. Компонент СЗЬ» взаимодействует на поверхности с фактором В. Этот фактор после фиксации на мембране подвергается расщепляющему воздействию фактора D. В результате образуется крупный фрагмент ВЬ, связанный с СЗЬ, и свободный мелкий фрагмент Ва. Фиксированный на мембране патогена комплекс СЗЬ:ВЬ выполняет функцию СЗ/С5: конвертазы и подобно комплексу С4Ь:2Ь классического пути активации обеспечивает накопление на поверхности патогена большого количества молекул СЗЬ.
В суммарном виде белки, принимающие участие в реализации функции системы комплемента, представлены в табл. 9.8.
Таблица 9.8
Функциональная активность белков системы комплемента
Функция Белки
Взаимодействие с комплексом антиген:антитело на поверхности чужеродной клетки Ферментативная активность по отношению к белкам системы комплемента Опсонины и белки, связанные с мембраной чужеродной клетки Медиаторы воспаления Белки, образующие поры в мембране чужеродных клеток Clq Clr, Cis, C2b, Bb, D С4Ь, СЗЬ С5а, СЗа, С4а С56, С6, С7, С8, С9
Заключение
Гуморальный иммунный ответ есть функция В-клеток, трансформирующихся в активные продуценты антител — плазмоциты. Образуемые этими клетками антитела выполняют три основные задачи. Во-первых, они нейтрализуют антиген. Эта способность
антител особенна важна при обезвреживании бактериальных токсинов. Во-вторых, антитела выступают в качестве опсонинов. Взаимодействуя специфически с антигенными эпитопами бактериальной стенки, антитела создают условия для лучшего захвата патогена фагоцитирующими клетками, которые несут на своей поверхности рецепторы к Fc-фрагменту иммуноглобулинов. И, наконец, комплекс антигена с антителом активирует белки системы комплемента, которые в свою очередь выполняют несколько функций: неспецифически опсонизируют антиген, формируют поры в клеточной стенке корпускулярных антигенов, определяя их гибель, выступают в качестве хемоаттрактантов, привлекая в зону проникновения патогена клетки воспаления.
Как и в случае с Т-клетками, В-лимфоциты, закончившие дифференцировку в костном мозге и частично на периферии, создают лишь защитный потенциал будущей встречи с антигеном. Примированная антигеном В-клетка должна пройти путь дополнительной дифференцировки до функционально активного плазмоцита. На этом пути совершаются главные события, обеспечивающие специфический синтез антител.
Поверхностный иммуноглобулин В-клеток несет двойную нагрузку в процессе созревания плазмоцитов. Во-первых, он выполняет роль антигенраспознающей структуры, передавая сигнал о встрече с антигеном внутрь клетки. Во-вторых, служит фактором захвата антигена для его переноса внутрь клетки. После внутриклеточной переработки антигенные пептиды в комплексе с молекулами II класса МНС выносятся на клеточную поверхность. Иммуногенный комплекс распознается антигенспецифическими хелперными Т-клетками, которые и обеспечивают второй сигнал для В-клеточной пролиферации и дифференцировки. В процесс функционального созревания В-клеток включаются также цитокины и мембраносвязанные белки Т-лимфоцитов. Существенным моментом процесса распознавания антигена является феномен сцепленного распознавания. Суть его состоит в следующем. При инициации иммунного ответа на сложный антиген взаимодействующие В- и Т-клетки должны распознать этот антиген, но не обязательно те же самые антигенные эпитопы. Это явление получило название сцепленного распознавания.
По мере развития гуморального иммунного ответа от момента распознавания антигена до наиболее активной продукции антител происходит по крайней мере два важных события: переключение синтеза антител с одного изотипа на другой и повышение аффинности синтезируемых антител. Местом развития этих событий являются вторичные фолликулы, или зародышевые центры лимфоидной ткани. На периферии фолликула происходит распознавание антигена В-клетками и его представительство на поверх-264
ности клетки в иммуногенной форме после внутриклеточной переработки. На этом этапе в процесс формирования гуморального иммунного ответа вступают хелперные Т-клетки. В-Лимфоциты, активированные Т-хелперами, либо сразу дифференцируются в плазмоциты, продуцирующие ранние, суммарно низкоаффинные антитела IgM класса, либо перемещаются в первичный фолликул, образуя центры размножения. В процесс примирования на периферии фолликула вступает несколько клонов В-клеток, имеющих близкие по специфичности антигенраспознаюшие рецепторы. Клетки этих клонов, переместившиеся в центры размножения, подвергаются отбору по признаку высокой аффинности их рецепторов. Фактором отбора выступает антиген, экспрессирующийся на поверхности фолликулярных дендритных клеток. В-Клетки, не прошедшие отбора на высокую аффинность антигенрас-познающих рецепторов, погибают. Клетки, обладавшие высокой рецепторной аффинностью, дифференцируются либо в плазмоциты, либо в клетки памяти. Каков механизм выбора направления дифференцировки на заключительном этапе развития В-клеток, не ясно. Предполагается, что определяющим моментом в данном процессе является повторное взаимодействие прошедших селекцию В-клеток с хелперными Т-лимфоцитами. Именно при их участии создается пул специфических В-клеток памяти.
Параллельно отбору на степень сродства антигенраспознаю-щих рецепторов В-клеток к тому или иному антигену синтеза антител переключается с одного изотипа на другой. Процесс переключения реализуется при участии цитокинов, продуцируемых в основном хелперными Т-клетками. При этом индукция одного из изотипов происходит при одновременном ингибировании других, так что в данный конкретный момент развития иммунного ответа секретируется только один из возможных изотипов.
Т- и В-системы иммунитета, представленные в организме человека и животных, выполняют одну общую функцию — элиминацию чужеродных в антигенном отношении биологических структур, но реагируют главным образом на разные по своей природе антигены. Так, функция Т-системы направлена в основном на уничтожение клеточного антигенного материала (чужеродных трансплантатов, раковых и вирустрансформированных клеток). В то же время В-система реализует свою активность по отношению к бактериальным антигенам. Понятно, что подобная функциональная градация систем в связи с характером антигенного материала не имеет абсолютного значения. Ни одна из систем не работает полностью автономно, подтверждая тем самым известное суждение о том, что в биологии принцип “все или ничего” не имеет места. Так, например, основными эффекторами трансплантаци
онного отторжения являются цитотоксические CD8 Т-клетки. Представлено и гуморальное звено отторжения в виде специфических антител. Другой пример: антибактериальная активность В-системы реализуется в полной мере только при подключении к ответу хелперных CD4 Т-клеток и CD4 Т-клеток воспаления.
В целом возникшая в эволюции и развившаяся иммунная форма защиты организма во всем многообразии клеточных и молекулярных участников явления создает мощный заслон от любого чужеродного в антигенном отношении материала, с которым может столкнуться организм в течение индивидуальной жизни.
Глава 10. ИММУНОГЕНЕТИКА
Введение
Иммуногенетика — раздел иммунологии, занятый изучением четырех основных проблем:
1) генетики гистосовместимости;
2) генетического контроля структуры иммуноглобулинов и других иммунологически значимых молекул (цитокинов, антигенов главного комплекса гистосовместимости и др.).
3) генетического контроля силы иммунного реагирования;
4) генетики антигенов.
В 30-е годы зарождается направление исследований, ставившей задачей познание причин несовместимости тканей при внутривидовых пересадках. Экспериментальные усилия в данном направлении привели к открытию комплекса генов, контролирующих поверхностные клеточные структуры — антигены гистосовместимости, которые и вызывают иммунную реакцию отторжения чужеродной ткани.
Вторая проблема иммуногенетики связана с изучением организации генов иммуноглобулинов. Она возникла после выяснения молекулярной специфики антител и разработки в середине 60-х годов чисто теоретических представлений о генетических основах их структуры.
Изучение генетического контроля силы иммунного ответа как самостоятельного направления исследований началось в 60-х годах и вскоре слилось с проблемой, направленной на выяснение механизмов антигенного распознавания Т-клетками.
В самом начале нашего столетия КЛандштейнером была открыта система АВО групп крови человека. В это же время П. Нат-тол провел сравнительные изучение антигенных свойств белков сыворотки крови человека и обезьян. Эти первые усилия привели к формированию целого направления исследований. Его целью было выявление функции и характера наследования антигенов клеток, тканей, жидкостей организма. Основной прием работы состоял в использовании антител, специфичных к искомому антигену. Антитела получали из сыворотки крови иммунизируемых лабораторных животных. Специфика методики определила название нового направления — серология антигенов. Изучение наследования этих антигенов составило самостоятельную главу в иммуногенетике, причем до недавнего времени она подменяла собой вообще всю иммуногенетику.
В данной главе основное внимание уделено освещению некоторых вопросов генетики гистосовместимости и главным образом тех из них, которые не были рассмотрены ранее в главе 3. В
прямой связи с анализом данного вопроса обсуждается проблема генетического контроля силы иммунного ответа.
10.1. ГЕНЕТИКА ГИСТОСОВМЕСТИМОСТИ. ГЛАВНЫЙ КОМПЛЕКС ГИСТОСОВМЕСТИМОСТИ
Комплекс близкосцепленных генов, основное предназначение которых — контроль различных функциональных проявлений иммунной реактивности, получил название главного комплекса гистосовместимости (англ, “major histocompatibility complex” — МНС). Первоначально было обнаружено, что гены комплекса контролируют реакцию тканевой несовместимости, отсюда и название всего комплекса. В настоящее время известны значительно более широкие функции генов МНС, о чем уже частично говорилось в предыдущих главах.
Первые опыты, которые легли в основу открытия главного комплекса гистосовместимости, были выполнены в самом начале века. Любители-селекционеры, используя близкородственное скрещивание,поддерживали в ряду поколений мутантных мышей с нарушением вестибулярного аппарата.так называемых японских танцующих мышей. Они представляли собой, вероятно, первую инбредную линию животных. Спонтанная опухоль, возникшая у одного из животных этой линии, успешно приживалась у всех особей данной линии, но отторгалась при ее трансплантации белым лабораторным мышам. После установления наследственной основы несовместимости началась целенаправленная работа по выведению инбредных линий животных для целей экспериментальной онкологии.
К 20-30-м гг. было выведено несколько инбредных линий мышей, что создавало условия для генетического анализа причин несовместимости. У истоков открытия новой генетической системы —главного комплекса гистосовместимости — стоял английский исследователь Gorer. Работая с кроличьей антисывороткой к эритроцитам мыши, он обнаружил антиген и условно обозначил его римской цифрой II. Наличие данного антигена на эритроцитах мыши-реципиента и перевиваемой опухоли обеспечивало приживление и развитие опухолевого трансплантата. При различиях по антигену II опухоль отторгалась. Так был обнаружен первый антиген гистосовместимости. Это открытие послужило толчком к изучению генетических механизмов тканевой несовместимости. Для полноценного решения данного вопроса необходимо было иметь значительное количество генетически охарактеризованных линий животных. Наиболее удобными в этом отношении оказались мыши.
10.1.1. Линии мышей
Получение гомозиготных линий животных, в частности мышей, основано на длительном (до 18-20 поколений) близкородственном скрещивании по схеме: брат—сестра. При случайном выборе пары брат—сестра любой из аутосомных локусов будет переходить в гомозиготное состояние с частотой 1/8 на поколение. Двадцать поколений достаточно, чтобы все (или почти все) локусы стали гомозиготными (рис. 10.1). Таким образом, последовательное близкородственное скрещивание приводит в результате к чистой инбредной линии животных. Основная характеристика такой линии состоит в том, что все ее особи гомозиготны и неотличимы в генетическом отношении друг от друга, как однояйцовые близнецы.
Для решения вопросов сцепленности иммунологически значимых признаков с главным комплексом гистосовместимости, в частности признака иммунного отторжения трансплантата, необходимо было иметь линии мышей, которые отличались бы друг от
Рис. 10.1 Кривые возрастания гмозиготности для трех систем инбридинга.
Получение гомозиготных линий животных основано на длительном близкородственном скрещивании по схеме: брат-сестра (линия 2; линии 1 и 3 представлены для сравнения). Оценку генетической идентичности в ряду поколений проводят по результатам трансплантации (например, кожного лоскута, взятого от одной особи инбредируемого поколения и пересаженного на другую особь того же поколения). Полное приживление трансплантата свидетельствует о генетической идентичности (сингенности) между парами донор-реципиент.
1 — самооплодотворяющиеся организмы; 2, 3 — скрещиваемые особи: 2 — братья и сестры; 3 — двоюродные братья и сестры
друга только по этому комплексу В результате был разработан генетический прием получения так называемых конгенных линий.
В основе получения конгенных линий мышей лежит метод возвратного скрещивания — получение потомства в ряду поколений от скрещивания гетерозиготы (детей гомозиготных родителей, генетически отличающихся друг от друга) с одним из исходных гомозиготных родителей. Смысл подобного скрещивания — замена МНС (комплекса Н-2) одной инбредной линии на гаплотип другой. В результате получается конгенная линия, отличающаяся от исходной только по генам МНС. Схема скрещиваний для получения желаемой линии изображена на рис. 10.2. Здесь представлены донорская маркирующая линия А (а/а) и основная линия В (b/b), которой внедряется МНС партнера по скрещиванию. От скрещивания гомозиготных особей этих двух линий получают гибриды первого поколения Fi (a/b; генерация № 1). При дальнейшем скрещивании гибридов Fi с особями основной линии В (b/b) получают потомство, состоящее как из гомозигот (b/b), так и гетерозигот (а/b) по комплексу Н-2. В последующих скрещиваниях отбираются только гетерозиготные особи, имеющие признак “а” (Н-2а), который определяется по приживлению кожного трансплантата от маркирующей линии А и положительной серологической реакции клеток крови с анти-А-сывороткой. По мере продолжения скрещивания a-положительных особей с особями
Рис. 10.2. Получение конгенных линий мышей.
Представлена схема скрещивания мышей, позволяющая внедрить Н-2-ком-плекс одной линии в геном другой инбредной линии. Донорская маркирующая линия обозначена буквой А (генотип а/а), основная линия, воспринимающая Н-2-комплекс донора — буквой В (генотип b/b). От скрещивания гомозиготных особей этих двух линий получают гибрид первого поколения Fi (a/b; генерация №1). При дальнейшем скрещивании гибридов Fi с особями основной линии В получают потомство, состоящее как из гомозигот (b/b), так и гетерозигот (а/Ь). При последующих скрещиваниях отбираются только гетерозиготы, имеющие признак а (Н-2"), который определяется по успешному приживлению кожного трансплантата от маркирующей линии А и положительной серологической реакции клеток крови с анти-а-сывороткой. По мере продолжения скрещивания а-положительных особей с особями основной линии В доля генома линии А постоянно снижается, но при этом для дальнейшего размножения из потомства отбирают только тех особей, которые сохраняют признак а (Н-2а). К двенадцатому поколению (генерация № 12) практически весь геном отбираемых после гибридизации мышей представлен основной линией В за исключением признака а, по которому шел отбор. Дальнейшая задача состоит в переводе признака а в гомозиготное состояние. Для этой цели гетерозигот заключительной генерации (а/b) скрещивают между собой и отбирают для дальнейшего размножения только тех особей потомства, которые отторгают кожный трансплантат линии В и не дают реакции с анти-Ь-сывороткой. Подобный заключительный отбор выявляет особей с отсутствием признака b (Н-2**) и гомозиготность по признаку а (Н-2а). Таким образом, в результате применения представленной схемы скрещивания в геном основной линии В внедряется комплекс Н-2-линии А. С момента перевода комплекса Н-2а в гомозиготное состояние констатируется получение новой конгенной линии
СИСТЕМА СКРЕЩИВАНИЯ
Маркирующий Основной донор
ГЕНЕ- ОТБОР % ГЕНОМА
РАЦИЯ ОСНОВНОЙ
ЛИНИИ
донор
А В
>
№1
50
отбираются особи.
№2 воспринимающие трансплантат от A (а/а) и дающие положительную реакцию с анти-А-сы воротком 75
№3 тоже 87.5
№12
тоже
99,999...
NS12F,
отбираются особи, отторгающие трансплаигатот В (Ь/b) и не дающие положительную реакцию с анти-В-сыеороткой
основной линии В доля генома линии А постоянно снижается, но при этом сохраняется признак а (Н-2а). К двенадцатому поколению (генерация № 12) практически весь геном отбираемых после гибридизации мышей представлен основной линией В,за исключением признака а, по которому шел отбор Для этой цели гетерозигот а/b скрещивают между собой и отбирают для дальнейшего размножения только тех особей потомства, которые отторгают кожный трансплантат, взятый от особей линии В, и не дают реакции с анти-В-сывороткой. Подобный отбор выявляет особей с отсутствием признака b (Н-2Ь) и гомозиготностью по признаку а (Н-2а). Таким образом, в результате применения такой схемы скрещивания в геном основной линии В внедряется комплекс Н-2 маркирующей линии А. С момента перевода комплекса Н-2а в гомозиготное состояние констатируется получение новой линии, кон-генной по отношению к основной линии В. Обе линии будут генетически полностью идентичны за исключением МНС.
Помимо конгенных линий мышей в распоряжении исследователей имеются рекомбинантные по МНС линии. Они отличаются друг от друга только отдельными или даже одним локусом комплекса Н-2. Рекомбинантные линии получают при анализе потомков от скрещивания двух конгенных линий. На рис. 10.3 приведен конкретный пример получения рекомбинантных линий мышей.
К настоящему времени выведено несколько сот линий мышей, объединенных в несколько групп, имеющих общий гаплотип по комплексу Н-2, т.е. идентичный набор генов МНС. В таблице 10.1 даны примеры известных инбредных линий мышей.
10.1.2. Терминология и законы трансплантации
Широкое использование инбредных линий для генетических и иммунологических исследований требовало стандартной терминологии как для удобства в работе, так и для обмена информацией между исследователями. Такая терминология была разработана и признана всеми иммунологами. В таблице 10.2 представлены обозначения различных генетических типов трансплантации тканей.
Выведение достаточного количества инбредных линий мышей позволило Little, Tyzzer и Snell сформулировать результаты трансплантации между ними в виде законов трансплантации. Всего таких законов пять (рис. 10.5).
1. Трансплантация внутри одной инбредной линии (сингенная трансплантация) всегда успешна: между донором и реципиентом отсутствуют генетические, а следовательно, и антигенные, различия.
2. Трансплантация между особями разных инбредных линий (аллогенная трансплантация) терпит неудачу: между донором и реципиентом имеются различия по МНС и по контролируемым 272
им антигенам. В результате у реципиента развивается иммунный ответ на чужеродные антигены донора, что приводит к отторжению трансплантата.
Мыши A.AL (Н-2а|) ----К----------------------------D—
Мыши A.SW (H-2S) ---К----------------------------D—
Мыши A.TL(H-2t1)
Рис. 10.3. Получение рекомбинантных линий мышей по комплексу Н-2.
Приведен конкретный пример получения рекомбинантных линий мышей A.TL (Н-211) и А.ТН (Н-2*2) от исходных линий A.AL (Н-2а1) и A.SW (H-2S), отличающихся друг от друга только по комплексу Н-2. У гибридов, полученных от скрещивания этих линий, произошел обмен участками хромосом в профазе первого мейотического деления, что привело к возникновению половых клеток, имеющих рекомбинантную по комплексу Н-2 хромосому. Дальнейшее скрещивание и серологический анализ потомства обеспечили получение гомозигот по рекомбинантной хромосоме. Две вновь полученные линии идентичны по локусам К и D, но отличаются по участку хромосомы, заключенному между ними. Этот участок является местом локализации генов II класса МНС
---Ki—Н-----------—i------D— I-----------------1
---KS---Н_________—'------D-I_________________I
Мыши А-ТНСН-г*2)
18 Зак. 3701
Таблица 10.1
Инбредные линии мышей с определенным Н-2-гаплотипом
Гаплотип Н-2 Линии
Ъ ABP/Le, A.BY, AKR.B6, BALB, BIO, BAN/Re, BLPBR BTBRTF/New, BXSB, C3H/Bi-H2b, CC57BR, CC57W C3H.B10/Sf, C3H.SW, C57BI/6, C57BI/10Sn, C57L, DI.LP D2.B6, DW/J, HG/Hu, LP/J, SB/Le, St/A,V/Le, B10.12 (6M),129.
d BALB/cBY, BALB/Cj, B6.C-H-2d, B10.D2/n, B10.D2/0 C57BL/Ks, DBA/2J, DI.C, LG/J, NBL/N, NZB, SEA/GnJ SEC/Ign, ST.T6.WN, YBR/Wi
f k A.CA, B10.M, RFM/Un AKR, BALB/AKR, BALB.C3H, BRVR, B6.C3H, B10.BR B10.CBA, BIO.K/Sf, CBA/CaJ, CE, CHI, C3H/An, C3H/DiSn C3H/He, C3H/St, C3H.A, C57BL/6-H-2k, C57BR/a, C57BR/cd, C58, DE/J (?), DI/ST. FL/Ire, FL/2Re, FL/4Re, FL/6Re FSF/Sn, HRS/J, L/St, MA/J. MRL/I, PH/Re, RF/J, RNC, RR SR/Bj, Ю1.
n P q BIO.F/Ao, BIO.F/Eg, BIO.F/Sg, B10.F/Y, F/St BDP/J, B10.CNB, B10.NB, BIO.P, C3H.NB, P/J AU/SsJ, BUB/BnJ, BIO.DI/Ph, B10.G, BIO.Q, С/St, CBA/Rij C3H/HeNRe, C3H.Q, DBA/1, ICR/На, STOLI, SWR/J, T138 T190
Г s z B10.R1H (71NS), LP.R111/J, Rlll/Wy A.SW, B10.ASW, B1O.S, SJL/J, TN NZW
Таблица 10.2
Терминология гистогенетических отношений между донором трансплантата и реципиентом
Генетические отношения Термин, обозначающий характер трансплантации Условия трансплантации
Разные виды ксенотрансплантация трансплантация между особями разных видов
Генетически отличающиеся особи одного вида аллотрансплантация трансплантация между различными, генетически отличающимися особями одного вида или между особями разных инбредных линий
Генетически идентич- сингенная транспланта- трансплантация между однояй-
ные особи одного вида ция новыми близнецами или между различными особями, относящимися к одной инбредной линии
Донор и реципиент — тот же самый индивидуум аутотрансплантация трансплантация с одного участка тела на другой у того же самого индивидуума
3. Трансплантаты родительских линий Pi или Р2 приживаются у гибридов первого поколения (PixPz)Fi. Поскольку антигены гистосовместимости наследуются по кодоминантному типу, гибриды F] имеют полный набор антигенов обоих родителей. Трансплантаты родителей не несут чужеродной информации для гибрида Fj и в результате трансплантат приживается. В то же время трансплантат гибрида Fi отторгается у мышей родительских линий, так как реципиенты (Pi или Р?) реагируют на антигены второго родителя (Рг или Р]), представленные у гибрида Fj.
4. Трансплантаты гибридов второго поколения F2 приживаются у гибридов Fj. У гибридов F2 происходит расщепление признака по антигенам гистосовместимости на гомо- и гетерозиготы, и они не имеют каких-либо антигенов, которые не были бы представлены у Fi. В результате наблюдается приживление трансплантатов.
5. Трансплантаты родительских линий Pi и Pj приживаются у одних особей F2, но отторгаются у других. Поскольку гибриды F2 включают как гомозиготы, так и гетерозиготы, трансплантация ткани одного из гомозиготных родителей на гомозиготную особь F2, имеющую иной генотип, приводит к отторжению трансплантата. Аналогичные отношения существуют и при пересадке родительских трансплантатов на гибрид возвратного скрещивания.
10.1.3. Гены и фенотипические продукты комплекса
В главе 3 представлена упрощенная генетическая карта МНС мышей и человека (см. рис. 3.5). Гены комплекса делятся на три класса. У мышей гены I класса контролируют гомологичные а-полипептиды, которые эволюционно произошли, очевидно, от предкового гена в результате тандемной дубликации с последующей транслокацией по длине хромосомы. В комплексе с низкомолекулярным белком Рг-микроглобулином, который контролируется геном вне МНС, образуются поверхностно экспрессируемые молекулы I класса: Н-2К, H-2D, H-2L (рис. 10.5). В литературе в зависимости от контекста или склонности автора используется либо буквенное обозначение фенотипипического продукта (Н-2К, Н-2D, H-2L), либо выражение “молекулы I класса МНС”.
Тяжелая а-цепь представляет собой гликопротеин с мол. массой около 45 кД, состоящий из трех доменов (а1,а2,аЗ), которые расположены на внешней стороне клеточной мембраны, трансмембранного и хвостового, погруженного в цитоплазму участков. Микроглобулин Рг связан нековалентно с основной цепью и выполняет, очевидно, транспортную роль в процессе выхода молекулы на мембрану. Молекулы класса 1 относятся к наиболее вариабельным белкам. Эта вариабельность от одной аллельной формы
Генотип а/а
Генотип а/а
Рис. 10.4. Законы трансплантации.
Показаны направления трансплантации кожных лоскутов у различных инб-редных гомозиготных линий (а/а или b/b) их гибридов — Fi(axb) и F2, полученных от скрещивания родителей Pi(a/a), P2(b/b) и гибридов.
1 — трансплантация внутри одной инбредной линии всегда успешна; 2 — трансплантация между разными инбредными линиями не имеет успеха; 3 — трансплантаты родительских линий Pt или Р2 приживаются у гибрида первого поколения (PixP2)Fi; 4 — трансплантаты гибридов второго поколения F2 и последующих поколений приживаются у гибридов первого поколения Ft; 5 — трансплантаты родительских линий Pi и Р2 приживаются у одних особей F2, но отторгаются у других (подробнее см. текст)
Генотипы Р,иР2
Генотипы
(FlxFl)F2
Н-2
Рис. 10.5. Выход иа клеточную поверхность белков, контролируемых генами комплекса Н-2 у мышей.
Гены I класса К и D ответственны за синтез пептида с мол. массой около 45 кД. В цитоплазме клетки они нековалентно связываются с 02-микроглобулином и в таком комплексном виде экспрессируются на клеточной поверхности. У мышей эти молекулы I класса обозначаются как Н-2К и H-2D. Гены II класса контролируют белки АрАа и ЕрЕа, общее название которых — молекулы II класса МНС, или 1а-антигены. Связь мономеров при сборке белка нековалентна и специфична, т.е. обмен между мономерами разных белков не происходит
к другой касается в основном замен аминокислотных остатков в N-концевой части молекулы и, как теперь понятно, осуществляет конформационное разнообразие участков, взаимодействующих с антигенными пептидами на антигенпрезентирующих клетках (см. рис. 3.9). При достаточно широкой вариабельности N-концевой части молекулы С-концевая часть относительно константна. Именно за счет этой части наблюдается высокая степень гомологии между молекулами I класса разных линий. Она составляет около 80-90%. Гомология между молекулами I класса разных видов также очень высокая: 70-80%.
Гены II класса АрАх и ЕрЕа контролируют соответствующие гетеродимерные белки А и Е, которые у мышей имеют общее на
звание “1а-антигены”, или “молекулы II класса МНС”. Молекулярная масса a-цепи равна приблизительно 35 кД, что несколько выше молекулярной массы b-цепи, составляющей 28 кД. Полиморфизм a-цепей ограничен. В то же время b-цепи обладают выраженным полиморфизмом и определяют в основном различия между аллельными формами антигенов II класса.
К генам II класса относятся также парные гены LMP1:LMP2 и ТАР1:ТАР2, контролирующие синтез соответствующих низкомолекулярных белков. Их функция состоит в протеолитической подготовке и транспорте антигенных фрагментов к встрече с молекулами I класса в эндоплазматическом ретикулуме (см. рис. 3.9). Знаменательно, что как основные белки (молекулы I и II клас-
Таблица 10.3
Фенотипические продукты, контролируемые различными классами генов (локусов) МНС у мышей
Класс Гены (локусы) Обозначение фенотипических продуктов Функциональная активность
Класс I Н-2К Н-2К презентация чужеродного антигена в
H-2D H-2D иммуногенной форме для распозна-
H-2L H-2L вания цитотоксическими CDS Т-клетками; инициация трансплантационного иммунитета
Класс II АрАа, ЕрЕа Ард, Ера (1а-антигены) презентация чужеродного антигена в иммуногенной форме для распознавания хелперными CD4 Т-клетками и CD4 Т-клетками воспаления; инициация трансплантационного иммунитета
LMP1, LMP2 LMP-1, LMP-2 внутриклеточный транспорт анти-
TAPI, ТАР2 ТАР-1, ТАР-2 генных пептидов во внутреннее пространство эндоплазматического ретикулума
Класс III Ss С4 — компонент системы комплемента участие в классическом пути активации комплемента
Sip исключительный белок самцов функциональная связь с половыми гормонами
TNF-а TNF-a цитокин — регулятор иммунного от-
(ФНО-а) (ФНО-а) вега; участие в локальном воспалении, активации эндотелия; цитотоксичен для некоторых видов опухолей
TNF-P TNF-P цитокин — регулятор иммунного
(ФНО-р) (ФНО-р) ответа; участие в лизисе клеток-мишеней цитотоксическими Т-лимфоцитами, локальном воспалении, активации эндотелия
сов), так и вспомогательные (LMP и ТАР), контролируются генами, которые локализованы в едином комплексе.
Третий класс генов кодирует молекулы Ss и Sip. Они представляют собой высокомолекулярные соединения, состоящие из трех субъединиц с мол. массами 100, 75 и 35 кД. Функционально эти белки являются компонентами комплемента. Этот же класс генов контролирует синтез цитокинов ФНО-а и ФНО-р, принимающих участие в регуляции иммунного ответа.
Представленные здесь пятнадцать генов, контролирующих самостоятельные белковые молекулы, лишь часть из того набора генов, которые входят в состав МНС. Изучение геномной ДНК показало, что комплекс занимает значительный участок хромосомы и влючает до 4х106 пар оснований или около 50 генов. Сам по себе этот факт показывает, что несмотря на значительные успехи в изучении генетической организации комплекса, многое остается еще не познанным.
10.1.4. Иммунобиологические свойства комплекса
Изучение экспрессии молекул I и II классов МНС на различных типах клеток выявило более широкое тканевое распространение молекул I класса в сравнении с молекулами II класса. Если молекулы I класса экспрессируются практически на всех изученных клетках, то молекулы класса II экспрессируются в основном на иммунокомпетентных клетках или клетках, принимающих относительное неспецифическое участие в формировании иммунного ответа, таких как клетки эпителия. В табл. 10.4 представлены данные о характере тканевого распределения молекул МНС у мышей и человека.
Представительство молекул I класса почти на всех типах клеток коррелирует с доминирующей ролью этих молекул в отторжении аллогенного трансплантата. Молекулы II класса менее активны в процессе тканевого отторжения. Как показано в таблице 10.5, некоторые свойства МНС в большей степени связаны с одним из классов, другие являются характерной особенностью обоих классов.
Особое место занимает вопрос о связи антигенов МНС с заболеваниями. При некоторых формах неинфекционных заболеваний частота отдельных антигенов среди больных значительно выше, чем в популяции здоровых людей. Четких механизмов подобной корреляции установить не удается. Однако ясно, что при разных формах заболевания механизмы скорее всего различны. В таблице 10.6 представлена частота некоторых антигенов среди лиц с различными неинфекционными патологиями.
Таблица 10.4
Тканевое распределение молекул I и II классов МНС у мышей и человека
Клетки и органы Н-2-комплекс мышей HLА-комплекс человека
Класс I Класс II Класс I Класс II
В-клетки + + + +
Т-клетки + (+) + (+)
Тимоциты + (+) + (+)
Макрофаги + + + +
Гранулоциты + —
Ретикулоциты + • +
Эритроциты + — — —
Тромбоциты + — + —
Фибробласты + — + —
Эпителиальные клетки + + +
Эпидермальные клетки + + + +
Печень + — + —
Почка + — + —
Сердечная мышца + — + —
Скелетная мышца + — + —
Мозг + — (+)
Плацента + +
Сперматозоиды + + + +
Яйцеклетки (+)
Трофобласт (+)
Бластоциты +
Эмбриональная ткань + +
Таблица 10.5
Сравнительные данные о степени участия молекул I и II классов МНС в некоторых иммунных реакциях
Функциональная активность Класс I Класс II
Интенсивность отторжения аллотрансплантата ++++ ++
Индукция образования антител ++++ ++++
Стимуляция СКЛ + ++++
Инициация РТПХ ++ ++++
Презентация антигена для цитотоксических Т-клеток ++++ —
Презентация антигена для хелперных Т-клеток — ++++
Таблица 10.6
Частота антигенов HLA-комплекса в популяции здоровых людей и у лиц с некоторыми заболеваниями
Заболевание Антиген Больные, % Здоровые, %
Анкилозирующий спондилез В27 81 4
Псориаз В17 22 4
Ювенильный диабет В8 31 11
Гемохроматоз АЗ 81 24
Множественный склероз Dw2 41 12
Заключение
До начала 60-х годов было известно лишь одно свойство антигенов МНС — выступать в качестве фактора, инициирующего реакции отторжения чужеродного трансплантата. Тогда же многие понимали, что это свойство является побочным и не отражает полностью функционального предназначения комплекса.
Обращает на себя внимание тот факт, что большинство из известных генов МНС предназначены для реализации иммунных реакций на разных уровнях развития процесса. Во-первых, они принимают непосредственное участие в инициации иммунного ответа, контролируя молекулы, представляющие антиген в иммуногенной форме для его распознавания цитотоксическими и хелперными Т-клетками. В этот процесс включены гены LMP и ТАР как вспомогательные при образовании иммуногенного комплекса этих молекул с антигеном. Во-вторых, в МНС локализованы гены, контролирующие синтез иммунорегуляторных и эффекторных молекул — цитокинов ФНО-а, ФНО-0, а также некоторых компонентов комплемента. Приведенные факты заставляют думать, что МНС эволюционно возник и развивался специально для осуществления иммунологических функций.
10.2. ГЕНЕТИЧЕСКИЙ КОНТРОЛЬ ИММУННОГО ОТВЕТА
Первые опыты по изучению генетической детерминации силы иммунного ответа были проведены с беспородными кроликами в первой трети нашего столетия. Исследования установили наследуемость иммунного ответа по доминантному типу, однако они не получили развития. Для полноценного изучения явления необходимо соблюдение, по крайней мере, двух условий: наличие генетически хорошо охарактеризованных животных, какими являются, в частности, инбредные линии мышей и морских свинок, и контролируемые по специфичности антигены. К началу 60-х годов в распоряжении экспериментаторов оказалось достаточное количество инбредных, конгенных и рекомбинантных линий мышей и целый набор искуственно синтезированных пептидов с ограниченной специфичностью вплоть до моноспецифичности (см. главу 1).
Решение проблемы генетического контроля силы иммунного ответа требует изучения четырех основных вопросов: (1) каков характер наследования силы иммунного ответа, (2) где в геноме клетки локализованы Ir-гены, (3) что представляет собой фенотипический продукт этих генов, (4) в каком типе клеток экспрессируются продукты, контролируемые 1г-генами.
В данной части главы эти вопросы будут рассмотрены в сжатой форме.
10.2.1. Характер наследования силы иммунного ответа
Инбредные линии мышей, являясь полностью гомозиготными, представляют собой прекрасный объект для изучения характера наследования иммунного ответа. В результате гибридологического анализа, проведенного с большим количеством линий и различными антигенами узкой специфичности, установлено, что во всех случаях гибриды первого поколения Fi от скрещивания высокореактивных линий (Н; high) с низкореактивными линиями (L; light) дают высокий иммунный ответ. Этот факт позволяет заключить, что сила иммунного ответа наследуется по доминантному типу. Анализ гибридов возвратного скрещивания (FlxL)BC дает расщепление на сильных и слабых продуцентов антител как 1:1. Четкое распределение по двум оппозитным равным группам (50% — сильнореагирующие и 50% — слабореагирующие особи) указывает на тот факт, что контроль силы иммунного реагирования осуществляется одним геном. Ген относится к категории аутосомных, так как интенсивность ответа не зависит от пола животных (рис. 10.6).
10.2.2. Локализация генов иммунного ответа (1г-генов)
Выявление генов иммунного ответа определило необходимость локализации этих генов в геноме животных. В опытах с кон-генными, отличающимися только по гаплотипу комплекса Н-2 линиями мышей, обнаружена сцепленность 1г-геновс МНС. Использование значительного количества конгенных линий и большого набора антигенов узкой специфичности показало индивидуальную, зависящую от гаплотипа реакцию на тот или иной антиген (рис. 10.7). Один и тот же антиген вызывал иммунный ответ разной силы у отличающихся по гаплотипу конгенных линий и, наоборот, мыши одной и той же конгенной линии формировали ответ разной силы в зависимости от предложенного антигена. Эти данные можно было трактовать как отражение либо множественности аллельных форм Ir-генов, либо значительного числа близ-косцепленных генов. Нерешенность вопроса не отменяла основного заключения о сцепленности Ir-генов с главным комплексом гистосовместимости.
Факт сцепления Ir-генов с МНС требовал установления конкретного места локализации этих генов. Конгенно-рекомбинант-ные линии мышей предоставляли такую возможность. Принципиальные подходы к выяснению этого вопроса лучше всего проиллюстрировать на конкретном примере (рис. 10.8).
Линия мышей с гаплотипом Н-2а хорошо отвечает на синтетический антиген (H,G)-A-L [(гистидин, глутаминовая кислота)-
Генотип А
А
Рис. 10.6. Принципы определения генетической детерминации силы иммунного ответа н характера наследования генов иммунного ответа (1г-генов).
Эксперименты проводили с инбредными линиями мышей и с различными антигенами. А — мыши генотипа А развивают низкий (L) иммунный ответ на определенный антиген узкой специфичности. Б — мыши генотипа В характеризуются высокой (Н) иммунной реактивностью к тому же антигену. В — гибриды (AxB)Fi — хорошие продуценты антител; из этого следует, что сила иммунного ответа наследуется по доминантному типу. Г — гибриды возвратного скрещивания (AxB)FixA, в котором мыши генотипа А — слабые продуценты антител, дают распределение в потомстве: 50% — слабых продуцентов антител и 50 % — сильных. Четкое распределение по двум равным оппозитным группам указывает на то, что генетический контроль иммунного ответа на антигены узкой специфичности осуществляется одним геном. Характер наследования не зависит от пола животных. Таким образом, генетический контроль иммунного ответа осуществляется одним аутосомным доминантным геном, получившим название 1г-гена
Рис. 10.7. Иммунный ответ мышей с разными Н-2таплотипами на тимуснезависимые антигены трех групп.
Исследования проведены с конгенными, отличающимися только по комплексу Н-2 линиями мышей. Демонстрируется индивидуальная, свойственная только тому или иному гаплотипу мозаичность иммунного ответа на широкий набор антигенов узкой специфичности. Синтетические полипептиды: GLAS — линейный сополимер глутаминовой кислоты, лизина и аланина, составляющего 5% от всех аминокислотных остатков; GLA10 —то же с 10% аланина; GLA30 — то же, с 30% аланина; GA — линейный сополимер глутаминовой кислоты, аланина; САТю — линейный сополимер глутаминовой кислоты, аланина и тирозина, составляющего 10% от всех аминокислотных остатков; GLPros —линейный сополимер глутаминовой кислоты, лизина и пролина, составляющего 5% от всех аминокислотных остатков; (T,G)—A—L — разветвленный, многоцепьевой сополимер тирозина, глутаминовой кислоты, аланина, лизина; (Ф,С)—A—L — то же, но тирозин заменен на фенилаланин; (H,G)—A—L — то же, но тирозин заменен на гистидин. Амоан-тигены мышей: IgA, IgG — иммуноглобулины с аллотипом, отличающимся от аллотипа подопытных мышей; Н—Y — половой антиген самцов; Thy—1.1 — алло-антиген Т-клеток; Еа.1 — антиген эритроцитов диких мышей; Thyroglob. — тирог-лобулин с аллотипом, отличающимся от аллотипа подопытных мышей. Чужеродные белковые антигены: RE — лекгик; Nase — рибонуклеаза; XI — белок сыворотки крови; 1-ОМ — овомукоид; I-BGG — бычий у-глобулин; I-OVA — овальбумин; LDHb — лактагидрогенеза
Н-2-гаплотип
Н-2-области
Ответ на (Н, G)-A-L
К I S D
q
у1
l-A l-B I-C
□□□□□□
BSEiDB
!□□□□□
высокий
низкий
высокий
h4
□□□□□□
III
□□HI
высокий
низкий
высокий
а
а
b
Рис. 10.8. Принцип определения локализации lr-гена в главном комплексе гистосовместимости.
Конгенные и рекомбинантные линии мышей, опозитно реагирующие на синтетический сополимер (H,G)-A-L. Во всех случаях присутствие у рекомбинантных мышей в Н-2-комплексе локуса 1-А, контролирующего молекулы 11 класса, от высокореактивного гаплотипа определяет сильный иммунный ответ. Локус К не оказывает влияния на силу ответа, так как рекомбинанты (Н-2'1), включающие этот локус от ареактивной линии, развивают высокий ответ (подробнее см. текст)
аланин-лизин]. В то же время конгенная линия мышей с гаплотипом Н-2Ч характеризуется низким ответом. Рекомбинант Н-2у1 между двумя этими линиями, который имеет только один общий Н-2К-локус с Н-2Ч, развивает сильный ответ на анализируемый антиген. Из этого следует, что локус Н-2К не принимает участия в контроле силы иммунного ответа. В противном случае рекомбинанты ответили бы по слабому типу. Во второй серии опытов проведены исследования с мышами, имеющими гаплотип Н-2а, — сильными продуцентами, и мышами с Н-2Ь — слабыми продуцентами антител к данному антигену. Рекомбинант Н-2М между Н-2а и Н-2Ь, гаплотип которого включает локусы Н-2К и 1-А (контроль 1а-антигена), а все остальные — от Н-2Ь, характеризуется сильной продукцией антител. Поскольку локус Н-2К не участвует в контроле силы иммунного ответа, следует заключить, что 1г-ген для использованного антигена сцеплен с 1-А локусом. Этот локус ответствен за синтез 1а-антигена (Ара)- и Е₽-цепи ЕРа-антигена. Никаких других продуктов, контролируемых данных локусом, до сих 286
пор не обнаружено. Из этих фактов было сделано предположение, что фенотипическим продуктом 1г-генов являются 1а-антигены (молекулы II класса МНС).
10.2.3. Фенотипический продукт и клеточная экспрессия 1г-генов
Подтверждением этого предположения стали опыты, выполненные с линиями 2 и 13 морских свинок, которые отличаются друг от друга только по антигенам II класса (1а-антигенам). Результаты исследования суммированы в таблице 10.7.
Таблица 10.7
Отношения между Ir-геиами и антигенами II класса у морских свинок линий 2 и 13, а также гибридов (2xl3)Fj и гибридов возвратного скрещивания.
Антигены и специфичность молекул II кл. Линия (2xl3)Fj (2xl3)F,xl3 (2xl3)Fix2
2 13 50% 50% 50% 50%
Антигены: + — + + —
DNP-PLL + — + + —
GL + — + + —
GT •— + + + —
BSA0,l pg + — + + —
DNP-BSA + — + + —
DNFGPA — + + + —
Молекулы II кл.:
линия 2 линия 13 + + + + — —
Линии 2 и 13 реагируют на представленные в таблице антигены противоположно. Характер наследования силы иммунного ответа у гибридов первого поколения F] и гибридов возвратного скрещивания свидетельствует о том, что генетический контроль иммунного ответа осуществляется одним доминантным геном. Сцепленность гена, контролирующего способность к иммунному ответу на определенный антиген, с присутствием в гибриде возвратного скрещивания гена для соответствующей молекулы II класса говорит о том, что либо это те же самые, либо очень близко сцепленные гены.
Подтверждением того, что гены иммунного ответа контрол-труют молекулы II класса МНС, являются опыты, проведенные в культуре in vitro с макрофагами в качестве антигенпрезентирующих клеток и примированными Т-лимфоцитами морских свинок линий 2 и 13, а также их гибридов (рис. 10.9). Особи линии 2 хорошо отвечают на антиген DNP-GL (конъюгат динитрофенила с полиглутаминовой кислотой, полилизином); линия 13 ареактивна к этому антигену. Напротив, особи линии 2 не отвечают на анти-287
Ответ на антигены: DNP-GL
GT
МФ л. 13
3
Рис. 10.9. Генетический контроль иммунного ответа на уровне макрофагов.
Гибридные морские свинки (2x13)F| способны формировать иммунный ответ на два синтетических антигена: DNP-GL (ДНФ-полиглутаминовая кислота, полилизин) и GT (полиглугаминовая кислота, политирозин). В то же время родительские линии 2 и 13 отвечают только на один из них. Примированные Т-клетки гибридов распознают и формируют пролиферативный ответ только на антиген, представленный на поверхности макрофагов (МФ) отвечающей линии, но остаются арективными к тому же антигену, если он ассоциирован с макрофагами неотвечающей линии. Механизм примирования in vivo и распознавания in vitro представлен в нижней части рисунка (подробнее см. текст)
ген GT (полиглутаминовая кислота, политирозин); при этом линия 13 развивает высокий иммунный ответ. Модель, включающая две противоположно реагирующие линии и два по разному при-мирующих антигена, удобна для анализа фенотипического продукта 1г-генов.
Гибриды первого поколения (2xl3)Fi в отличие от родителей отвечают полноценной реакцией на каждый из антигенов, так как способность к иммунному ответу наследуется по доминантному типу. Тип клеток, на котором возможна экспрессия Ir-генов, определяли в системе взаимодействия макрофагов родителей, презентирующих один из антигенов, с Т-клетками гибридов (2xl3)Fi, примированных теми же антигенами. Результаты взаимодействия оценивали по интенсивности пролиферации Т-клеток. Если бы генетический контроль осуществлялся на уровне Т-клеток, то реакция пролиферации этих клеток не зависела бы от линии морских свинок. Однако ответ Т-клеток регистрировали только в случае ассоциации антигена с макрофагами от особей высокореактивных линий (макрофаги линии 2 — антиген DNP-GL или макрофаги линии 13 — антиген GT). В условиях, когда антиген для Т-клеток был представлен макрофагами от особей ареактивных линий, ответа не наблюдалось (макрофаги линии 13 — антиген DNP-GL или макрофаги линии 2 — антиген GT).
Механизм генетического контроля на выбранные антигены включает следующую цепь событий. Молекулы II класса МНС высокореактивных линий представляют антиген в иммуногенной форме на поверхности макрофагов, образуя комплементарную связь с этим антигеном. Т-клетки при примировании распознают только комплекс молекул II класса с антигеном. В тех случаях, когда молекулы II класса в силу своих структурных особенностей не способны образовать комплекс с антигеном на поверхности макрофагов (молекулы II класса линии 13 — антиген DNP-GL), Т-клет-ки не вступают в процесс распознавания антигена, не примиру-ются и, следовательно, не обеспечивают развитие иммунного ответа. Таким образом, представленные данные указывают на тот факт, что фенотипическим продуктом Ir-генов являются молекулы II класса МНС. Возможность образования комплекса антигенного пептида с молекулами I и II классов МНС была рассмотрена в главе 3.
Данные о молекулярных механизмах комплементации генов при иммунном ответе подтверждают экспрессию Ir-генов в макрофагах, а также то, что фенотипическим продуктом этих генов являются молекулы II класса МНС. В качестве примера приведем результаты опытов с двумя конгенными линиями мышей В10 (H-2b), В10А (Н-2к) и их гибридом (B10xB10A)Fi (рис. 10.10). Особи этих двух линий ареактивны к синтетическому полипепти-19 Зак. 3701 289
Линия 1-область Аа Ар Ер J Еа Ответ на GL®
В10 В10А (BIOxBIOAlF, Ь Ь Ь Ь 0 к к к к 7 Ь/к Ь/к b/к Ь/к 0/7 +
В10 В10.А (B10xB10A)F,
Рис. 10.10. Пример комплементами Ьг-генов.
Мыши рекомбинантных линий В10 и В10.А не способны отвечать продукцией антител на синтетический антиген GLO (полиглутаминовая кислота, полилизин, полифенилаланин). Причины арсктивности двух этих линий разные. Ареак-тивность В10 зависит от отсутствия гена для синтеза Еь„-цепи молекулы II класса. В то же время мыши линии В10.А формируют полноценную, экспрессирующуюся на поверхности клетки EkpEka молекулу II класса. Их ареакгивность связана с неспособностью EkpEka образовывать иммуногенный комплекс с взятым для анализа антигеном. Гибридные животные (B10xB10.A)Fl развивают полноценный ответ. В клетках этих животных образуется гибридная молекула. Еьр-цепь — от мышей В10 и Ека-цепь — от мышей В10.А. Такая гибридная молекула комплексируется с антигеном, обеспечивая его иммуногенность и, как следствие,— формирование иммунного ответа
ду ОЬФ (глутаминовая кислота-лизин-фснилаланин). В то же время гибриды развивают сильный иммунный ответ. Генетический контроль в этой системе реализуется на уровне активности макрофагов, т.е. на уровне представления антигена в иммуногенной форме в комплексе с молекулой II класса Ера на поверхности фагоцитирующей клетки. Для Еа-цепи имеется только два аллельных варианта: аллель “+”, определяющий синтез соответствующей цепи, и аллель ”, не способный контролировать синтез этой цепи. Продукт аллеля “+” представлен только одной серологической специфичностью — 1а.7. В то же время Ер-цепь имеет несколько аллельных вариантов. Нулевой аллель для этого пептида отсутствует. Сов
местная “работа” двух генов-Ер и Еа приводит к формированию соответствующей молекулы II класса Е^, которая экспрессируется на клеточной поверхности (см. выше). Расшифровка механизма экспрессии молекул МНС делает понятным молекулярный механизм комплементации генов для обеспечения формирования ответа на антиген СЕФ. В схеме на основании экспериментальных данных возникающие отношения в выбранной паре конгенных линий мышей выглядят следующим образом. Ареактивная линия В10 (Н-2Ь) не экспрессирует Ера, так как имеет нулевой аллель Еа, хотя продукт гена Ер представлен в цитоплазме .У линии В10 А (Н-2к) с положительным аллелем Еа белок Ера экспрессируется на поверхности макрофагов, однако она не способна отвечать на выбранный антиген, поскольку белок Е₽а гаплотипа Н-2к не в состоянии обеспечить иммуногенность антигена СЬФ. При этом макрофаги гибрида (B.10xB.10A)Fi экспрессируют на своей поверхности два Е-белка: один, контролируемый родительской линией В10А и второй, “гибридный”, образованный за счет работы гена Е мышей линий ВЮАи В.10. Таким образом, недостаток продукта нулевого гена Е компенсируется продуктом работающего аллельного гена партнера по скрещиванию.
Заключение
Результат многолетней работы по выяснению механизмов генетического контроля силы иммунного ответа привели к достаточно конкретному заключению: сила иммунного ответа зависит от работы одного, аутосомного, доминантного гена; фенотипическим продуктом такого гена являются молекулы II класса МНС, клеточным типом, экспрессирующим этот ген, — антигенпрезентирующие клетки. В тех случаях, когда конформационные особенности антигенраспознающего участка молекул II класса соответствуют структуре антигена (точнее антигенным эпитопам), образуется иммуногенный комплекс, экспрессирующийся на поверхности антигенпрезентирующих клеток, что и обеспечивает развитие иммунного ответа. Напротив, неспособность молекул II класса особей определенного генотипа взаимодействовать с антигенными пептидами будет причиной иммунной ареактивности.
Глава 11. АЛЛОГЕННАЯ ИНГИБИЦИЯ
Введение
Изучение участия антигенов гистосовместимости в процессах клеточного взаимодействия при формировании иммунного ответа привело в конечном счете к открытию Т-клеточных рецепторов, распознающих комплекс молекул I или II классов с антигенным пептидом (см. главы 3, 7, 9).
Параллельно сформировалось направление исследований, изучающее роль антигенов гистосовместимости в неиммунном взаимодействии клеток лимфо-миелоидного комплекса, т.е. взаимодействие в условиях физиологической нормы. Наибольшее внимание в этой серии работ было уделено анализу явления, получившего название аллогенной ингибиции, или гибридной резистентности.
По определению, аллогенная ингибиция (гибридная резистентность) выражается в подавлении роста и развития клеток и тканей в генетически чужеродном микроокружении при отсутствии активных процессов иммунологической природы.
Рассматриваемое явление было открыто иммунологами и изучалось особенно активно в 60-70-х годах. Однако со временем интерес к феномену аллогенного подавления со стороны иммунологов угас, так как они не смогли найти в нем иммунологической природы механизмов, реализующих эффект подавления. Действительно, феномен аллогенной ингибиции должен был бы больше заинтересовать гистологов, поскольку касается межклеточных отношений в условиях физиологической нормы. К тому же этот феномен может стать прекрасной моделью изучения такого явления как апоптоз.
В данной главе рассматриваются феноменология явления, способы преодоления аллогенной ингибиции, биологическое значение подавления жизнеспособности клеток в генетически чужеродном окружении.
11.1. ФЕНОМЕНОЛОГИЯ
Явление подавления размножения и функционирования клеток и тканей в генетически отличающемся организме впервые наблюдал Снелл в 1958 г. В его опытах лимфома от мышей линии C57BL, трансплантированная в гибрид первого поколения F>, испытывала явное торможение роста в отличие от интенсивного роста в сингенном хозяине C57BL. В последующем эти данные были неоднократно подтверждены.
Для анализа аллогенного подавления наиболее часто использовалась модель, в которой в облученный организм вводились клет-292
ки костного мозга, а затем подсчитывалось число образующихся на строме опустошенной после облучения селезенки колоний, формировавшихся полустволовыми гемопоэтическими предшественниками. Каждая такая колония-клон получила название колониеобразующей единицы (КОЕ) (рис. 11.1, 11.2). Среди общего числа КОЕ, образующихся на селезенке облученных мышей, 42% приходилось на эритроидные колонии, 21% — на гранулоцитарные, 21% — на мегакариоцитарные и 16% — на смешанные. Макроскопические колонии в селезенке мышей образуются через 8 дней после трансплантации костномозговых клеток. При использовании этой модели, как и в случае с лимфомой, было показано резкое снижение числа КОЕ при введении клеток костного мозга родителей в гибрид F].
Ингибиции в Fi-хозяине подвержены не только клетки костного мозга, но также селезенки и эмбриональной печени.
Работа с клетками лимфо-миелоидного комплекса не исключает, что эффекты подавления в генетически отличающемся организме связаны с изменением направления дифференцировки донорских предшественников лимфоидного ряда в силу развития реакции трансплантат против хозяина на антигены второго родителя в гибриде F]. Прямым доказательством того факта, что наблюдаемое угнетение не связано с иммунной передифференци-ровкой, а носит иной характер, являются опыты, где в качестве тест-объекта были использованы нелимфоидные клетки или ткани: саркома, карцинома, индуцированный 5-метилхолантреном рак молочной железы. Во всех случаях рост перечисленных опухолей гомозиготных доноров подавляется в гетерозиготном реципиенте Fi.
Интересные данные получены на инбредных линиях мышей при изучении отторжения кожных лоскутов родителей у гибридного потомства. Средняя продолжительность жизни кожного трансплантата родителей у гибридов Fi составляет около 70 дней. Хроническое отторжение сопровождается истончением лоскутов, их пигментацией, выпадением волос. Напомним, что иммунное отторжение аналогичного кожного трансплантата происходит через 12-14 дней.
Таким образом, феномен аллогенной ингибиции выявлен при переносе клеток или тканей гомозиготных родителей в гибрид первого поколения по схеме: Pi (или Р2) -> (PixP2)Fi. Выбор модели не случаен. При комбинации родитель-гибрид как донор-реципиент отсутствует иммунное подавление роста и развития пересаженных клеток и тканей, так как антигены родителей полностью представлены в гибриде первого поколения. Отсюда следует, что в своей основе феномен обусловлен процессами иного, не иммунного характера.
Рис. 11.1. Метод выявления колониеобразующих единиц (КОЕ).
А. Введение клеток костного мозга облученным реципиентам приводит к формированию отдельных макроскопически выявляемых колоний (КОЕс) — клона одной клетки — на строме опустошенной после облучения селезенки. Среди общего числа КОЕс содержатся эритроидные, гранулоцитарные, мегакариоцитар-ные и смешанные колонии. При ретрансплантации отдельной колонии формируются все типы колоний в том же процентном соотношении. Эти факты явились доказательством в пользу существования единого предшественника для всех трех ростков кроветворения. Б. Макроскопические колонии в селезенке летально облученных мышей через 8 дней после трансплантации клеток костного мозга
11.2. ПОДХОДЫ К АНАЛИЗУ МЕХАНИЗМОВ АЛЛОГЕННОЙ ИНГИБИЦИИ
Стремление понять причины аллогенного подавления привело к формированию четырех направлений исследований:
1) изучение деструкции клеток-мишеней F] интактными лимфоцитами родителей в опытах in vitro',
2) роль антигенов гистосовместимости в реализации феномена;
НЕИММУННОЕ ВЗАИМОДЕЙСТВИЕ
Рис. 11.2. Аллогенная ингибиция колониеобразующей способности клеток костного мозга.
Аллогенная ингибиция — феномен подавления роста и жизнеспособности клеток или тканей родителей в гибриде первого поколения. Комбинация роди-тельтибрид как донор:реципиент обуславливает отсутствие явно выявляемого иммунного компонента в подавлении трансплантированных тканей или клеток, так как антигены родителей полностью представлены у гибрида первого поколения. На рисунке изображена схема опыта по демонстрации аллогенной ингибиции ко-лониеобразования прекурсорными элементами клеток костного мозга (КМ). Клетки КМ одного из родителей (генотип А), введенные в сингенный облученный организм, формируют определенное (в зависимости от дозы) число колониеобразующих единиц (КОЕ). Введение клеток КМ того же генотипа А гибридному реципиенту (AxB)Fi приводит к резкому подавлению колониеобразования. В проявлении аллогенной ингибиции доминирующее значение принадлежит генам, контролирующим молекулы I класса МНС
3) анализ значения клеточного “микроокружения” в проявлении аллогенного подавления;
4) фенотипическая модификация трансплантируемых клеток с помощью мРНК для антигенов гистосовместимости (фенотипическая “сингенизация” пары донор-реципиент).
11.2.1. Деструкция клеток-мишеней интактными лимфоцитами
В начальный период исследований по аллогенной ингибиции предполагалось, что подавление жизнеспособности чужеродного материала связано с цитопатогенной активностью неиммунных лимфоцитов реципиента. Для проверки этой точки зрения изучалась деструкция клеток-мишеней аллогенными, сингенными и полусингенными лимфоцитами.
Внесение в культуру опухолевых или эмбриональных клеток генетически идентичных или отличающихся по антигенам гистосовместимости лимфоцитов не вызывает каких-либо нарушений культивируемых клеток. Однако если в культуру клеток-мишеней добавляют аллогенные или полусингенные лимфоциты одновременно с ФГА, то культивируемые клетки разрушаются. ФГА обеспечивает агрегацию лимфоцитов на культивируемых клетках, что и приводит к цитолизу мишеней. Лизис клеток-мишеней осуществляют только аллогенные или полусингенные лимфоциты. Агрегированные сингенные лимфоциты не оказывают разрушающего действия на клетки монослоя. Облучение эффекторных лимфоцитов дозой 1500-15000 рентген сохраняет их киллерную активность. В то же время алло-антисыворотка к антигенам клеток-мишеней подавляет киллерное действие вносимых в культуру лимфоцитов. Основной вывод из всей этой серии исследований состоит в том, что для осуществления цитопатогенного действия несингенными лимфоцитами необходим прямой контакт между структурно отличающимися (по крайней мере, по антигенам гистосовместимости) клеточными поверхностями. Только после установления контактного взаимодействия проявляется киллерное действие несингенных лимфоцитов.
11.2.2. Роль антигенов гистосовместимости в реализации феномена
Анализ роли антигенов гистосовместимости в проявлении аллогенной ингибиции у мышей показал доминирующее участие генов, контролирующих молекулы I класса МНС. Оличия по минорным системам гистосовместимости также приводят к развитию аллогенного эффекта, хотя и в значительно меньшей степени.
Таблица 11.1
Схема опытов по изучению роли антигенов гистосовместимости в аллогенной ингибиции на модели колониеобразования клетками костного мозга родителей в гибриде F]
№ Гаплотип родителей Гаплотип гибридов Fi (донор) или родителей (реципиент) Результат
1 Pi (Ka-Ia-Da) Р, (Ka-Ia-Da) —
2 Pi (K*-Ia-Da) или Pj (KMS-Da) [(K*-la-Da)x(Kb-Ia-Da)]F1 +++
3 Pi (KM'-D*) или P2 (Ka-Ib-Da) [(Ka-I»-Da)x(Ka-Ib-Da)]F1 +
Примечание: «+» - ингибиция; «—» - отсутствие ингибиции.
На схеме в качестве примера приведены генотипы родителей, клетки костного мозга которых трансплантировали гибридам F]. Эта схема иллюстрирует принцип подбора пар рекомбинантных линий мышей и их гибридов для анализа роли антигенов гистосовместимости в проявлении аллогенной ингибиции.
11.2.3. Отмена аллогенной ингибиции. “Сингенизация микроокружения”
Наиболее интересная информация для понимания механизма рассматриваемого феномена пришла из тех экспериментов, в которых удалось показать отмену аллогенного подавления. В этих опытах проводился анализ главным образом колониеобразующей способности клеток костного мозга родителей в Fi-реципиенте. Основной прием — введение генетически чужеродному реципиенту различных типов клеток, генетически соответствующих донору клеток костного мозга. Иначе, создавались условия “сингенного микроокружения” по отношению к донорским клеткам.
Введение гибридам Fi, лишенным в результате облучения собственной лимфоидной ткани, родительских клеток тимуса, лимфатических узлов, селезенки, эмбриональной печени, перитонеального экссудата приводит к “сингенизации” среды ( в том числе и селезенки). В этих условиях формирующиеся колонии костного мозга родителей не испытывают подавляющего влияния со стороны генетически отличающегося реципиента.
Работа по отмене аллогенной ингибиции проводилась под контролем генетических различий по антигенам МНС. Это обстоятельстве позволяет предполагать особое значение данных антигенов в реализации феномена.
Клеточный тип, образующий сингенную “подслойку” для формирования колоний, неизвестен. Во всех перечисленных случаях работа проводилась с недифференцированными клеточными смесями, хотя и полученными из разных лимфоидных органов (тимуса, лимфатических узлов, эмбриональной печени, перитонеального экссудата). Данные о том, что отмена аллогенной ингибиции воспроизводится при использовании радиорезистентных клеток, позволяют предположить наличие в трансплантируемой клеточной смеси не только лимфоцитов, но и макрофагов. В то же время хорошо известно, что тканевые макрофаги входят в состав стромы и совместно с другими стромальными клетками формируют микроокружение лимфо-миелоидных органов. Один из возможных механизмов отмены аллогенной ингибиции колониеобразо-вания в несингенном организме связан с заселением стромы макрофагами или другими стромальными клетками донорского происхождения. В результате прекурсорные элементы костного мозга
донора сорбируются на генетически измененной стромальной основе реципиента, как на своей собственной, что и определяет восстановление колониеобразования.
Эксперименты с трансплантацией клеток гомозиготных родительских доноров в организм гетерозиготного реципиента были направлены на создание “сингенного микроокружения” в генетически отличающемся хозяине. При этом трансплантируемые клетки костного мозга оставались интактными. Пытаясь преодолеть генетические различия между донором костномозговых клеток и реципиентом, автор учебника и сотрудники пошли по другому пути: проводилось фенотипическое воздействие не на реципиента, где создавалось соответствующее микроокружение, а на донорские клетки костного мозга.
11.2.4. Фенотипическая модификация трансплантируемых клеток с помощью мРНК для антигенов гистосовместимости
Представленные выше экспериментально установленные факты позволяют сделать основное заключение о том, что аллогенное подавление проявляется всегда, когда между донорскими клетками и хозяином имеются генетические различия. Восстановление генетической идентичности, в частности путем создания адекватного клеточного микроокружения, приводит к нормальному развитию трансплантируемых клеток или тканей. Особое значение в явлении аллогенной ингибиции принадлежит антигенам гистосовместимости.
Как уже отмечалось, в работах по отмене аллогенного подавления колониеобразующей способности клеток костного мозга проводилось искусственное воздействие на организм реципиента —создание генетически адекватного трансплантируемым клеткам микроокружения. Нами выбран иной путь — путь специфического воздействия на клетки донора.
Планируя собственные эксперименты, мы исходили из того, что инкубация клеток (первого родителя) с РНК от аллогенного донора (второго родителя) или от гибридного реципиента определит формирование на поверхности культивируемых клеток антигенных структур, свойственных донору РНК. Подобная антигенная модификация аллогенных клеток, по предположению, должна отменить фенотипические различия между донором клеток и реципиентом и довести результат межклеточных взаимодействий при колониеобразовании до уровня, свойственного сингенным системам.
Для решения основной задачи исследования использовали различные классы РНК, выделенные методом фенольно-термического фракционирования с использованием диэтилпирокарбоната — неспецифического ингибитора нуклеаз. Изучены следую-298
щие классы РНК: класс цитоплазматических РНК (температурная фракция 0-4 °C), класс пре-рРНК и рРНК ( фракция 40 °C), класс РНК, содержащий смесь пре-рРНК и пре-мРНК (фракция 55 °C), класс ДНК-подобной пре-мРНК (фракция 63 °C) и класс трудноэкстрагируемых пре-мРНК ядра (фракция 85 °C). Каждая фракция охарактеризована по содержанию остаточного белка, нуклеотидному составу и полимерным свойствам при анализе препаратов по электрофоретической подвижности в полиакриламидном геле и по коэффициенту седиментации в градиенте плотности сахарозы. В работе использовали только те фракции, которые имели высокополимерный молекулярный состав и были лишены спектрофотометрически выявляемого белка.
Во всех случаях независимо от конкретных задач исследования проводили инкубацию анализируемых клеток с одним из классов РНК в течение 30 мин при 37 °C. Проинкубированные клетки вводили сингенным или аллогенным реципиентам.
В таблице 11.2 представлены данные по числу КОЕ в селезенке мышей Fj, которым вводили либо интактные клетки костного мозга, либо обработанные тотальной РНК, выделенной из селезенки родителей или их гибридов. Видно, что число КОЕ снижено, если реципиентам Fi трансплантировали клетки костного мозга от родителей СВА. Колониеобразование не подавлялось, когда использовали клетки костного мозга от мышей DBA/2. Результаты этой части опытов послужили основой для анализа влияния РНК на колониеобразующую способность клеток костного мозга линии мышей, подвергающихся аллогенной ингибиции.
Таблица 11.2
Влияние РНК на число колониеобразующих единиц (КОЕ), формируемое клетками костного мозга родителей
в гибриде первого поколения
Донор клеток костного мозга Реципиент РНК от мышей Число КОЕ
СВА (Н-2*) DBA/2 (Н-21) (CBAxDBA/2) F, СВА СВА СВА СВА C57BL/6J (Н-2Ь) СВА (CBAxC57BL/6J) F, C57BL/6J C457BL/6J C57BL/6J (CBAxDBA/2)F, (CBAxDBA/2) Fi (CBAxDBA/2) F, (CBAxDBA/2) F, (CBAxDBA/2) F! (CBAxDBA/2) F( (CBAxDBA/2) F, (CBAxC57BL/6J) Ft (CBAxC57BL/6J) F, (CBAxC57BL/6J) F, (CBAxC57BL/6J) F! (CBAxC57BL/6J) F, (CBAxC57BL/6J) Fj СВА DBA/2 (CBAxDBA/2) Fi CC57W (H-?) C57BL/6J CBA (CBAxC57BL/6J) F, 9,2 25,0 23,0 12,7 30,6 31,7 12,7 53 17,1 18,2 8,5 15,0 17,2
Предварительная инкубация клеток костного мозга мышей линии СВА с “сингенной” РНК (РНК из селезенки СВА) не приводит к восстановлению колониеобразования. При инкубации клеток костного мозга мышей той же линии с РНК из селезенки второго родителя (DBA/2) или гибрида F] число КОЕ восстанавливается. В то же время РНК, выделенная из селезенки линии мышей, отличающейся по Н-2-комплексу от родительских линий (CC57W — Н-2Ь), оказывается инертной в эффекте отмены аллогенной ингибиции. Представленные факты говорят в пользу линейной специфичности действия РНК. При работе с другим гибридом — (CBAxC57BL/6J)F| — получены аналогичные результаты.
Работа с тотальным препаратом РНК дает представление о принципиальной возможности отмены аллогенной ингибиции с помощью РНК “линейной специфичности”, но затрудняет трактовку полученных данных.
В следующей серии экспериментов была проведена работа с различными классами РНК. Как показывает рис. 11.3, наибольшей активностью в отмене аллогенной ингибиции обладает класс пре-мРНК ядра (фракция 63°С), полученной от реципиента. Дополнительное подтверждение специфичности наблюдаемой отмены ал-
Рис. 11.3. Отмена аллогенной ингибиции колониеобразования с помощью РНК реципиента.
Показано число колониеобразующих единиц (КОЕ) у гибрида (CBAxC57BL/ 6J)Fi, которому вводили клетки родительского костного мозга C57BL/6J, проинкубированные с различными фракциями РНК от (CBAxC57BL/6J)F|. Контроль: верхняя заштрихованная полоса — трансплантация интактных клеток костного мозга от Fi->F|, нижняя — C57BL/6J-»Fi- По горизонтали отмечено количество РНК (мкг), использованное для инкубации с ЗЮ8 клеток. Видно, что наибольшей активностью в отмене аллогенной ингибиции обладает класс пре-м-РНК ядра (63°С фракция)
логенной ингибиции дают сравнительные опыты с пре-мРНК, полученной от линии донора (C57BL) и реципиента (СВАх C57BL)F] (рис. 11.4). Видно, что инкубация клеток костного мозга мышей линии C567BL/6J с различными классами РНК, выделенными из селезенки мышей той же линии, не обеспечивает какого-либо восстановления аллогенного подавления. Ни один из классов РНК донорского типа не способен определить нормализацию колониеобразования в гибридном организме. Восстанавливающий эффект различных классов РНК реципиента (Fi) аналогичен тому, который представлен на предыдущем рисунке.
Планируя последующие эксперименты, мы исходили из тех представлений, что в рассмотренном выше феномене отмены аллогенного барьера имеет место общий механизм, который определен матричной активностью РНК определенного генотипа. Вероятно, “линейная специфичность” действия экзогенной РНК связана с модификацией клеточной поверхности через появление структур (Н-2-антигенов) того генотипа, который послужил источником РНК. В пользу подобного предположения говорят и те эксперименты, которые выявили наибольшую активность класса пре-мРНК ядра в фенотипической модификации клеточных отношений.
Для подтверждения высказанной точки зрения были поставлены опыты in vitro с целью прямого наблюдения за возникнове-
Рис. 11.4. Сравнительные данные по способности клеток костного мозга родительской линии, проинкубированных с РНК донора и гибридного реципиента, формировать колонии в условиях аллогенной ингибиции.
Показано число колониеобразующих единиц (КОЕ) у гибрида (CBAxC57BL/ 6J)Fi, которому вводили родительские клетки костного мозга C57BL/6J, проинкубированные с различными фракциями РНК от C57BL/6J (1) или (CBAxC57BL/ 6J)F| (2). Инкубация клеток костного мозга родительской линии с различными классами РНК, выделенной из селезенки мышей той же родительской линии, не приводит к какому-либо восстановлению колониеобразования у гибридного реципиента. В то же время пре-мРНК гибрида, как и в предыдущем опыте, полностью восстанавливает колониеобразование в условиях аллогенной ингибиции
нием специфических антигенов, соответствующих донору РНК. Работу проводили с клетками перитонеального экссудата мышей линий СВА и C57BL/6J, различными классами РНК мышей этих же линий и антисыворотками: СВА анти-С57ВЬ/6Д и C57BL/6J анти-СВА.
Внесение в монослойную культуру макрофагов пре-мРНК аллогенного донора приводит к появлению через 48 часов культивирования антигенов донора РНК, что оценивается с помощью соответствующей цитотоксической антисыворотки (рис. 11.5). Возникновение аллоантигенов донора РНК связано с высокополи-мерной пре-мРНК, так как использование препарата, выделенного в отсутствие диэтилпирокарбоната и характеризующегося преимущественным содержанием низкомолекулярных фрагментов, не обеспечивает серологической модификации культивируемых клеток. Экспрессия антигенов донора РНК характеризуется определенной динамикой. Пик выхода антигенов наблюдается через 48 часов после внесения РНК в культуру ( рис. 11.6). Наибольшей антигенсинтезирующей активностью обладает класс пре-мРНК, определенная активность наблюдается у суммарной фракции цитоплазматической РНК. Класс рибосомальной РНК не проявлял какой-либо активности (рис. 11.7). Основные антигены, экспрессирующиеся при внесении аллогенной РНК, относятся к антигенам Н-2-комплекса (рис. 11.8). Возникновение Н-2-антигенов на
Разведения СВА анти-С57В1/ 6J сыворотки
Рис. 11.5. Экспрессия антигенов гистосовместимости донора РНК на культивируемых клетках.
Экспрессию антигенов на культивируемых клетках оценивали по цитотоксическому тексту с антисывороткой к антигенам донора РНК. В опытах использована монослойная культура макрофагов СВА, в которую добавляли пре-мРНК мышей линии C57BL/6J, и антисыворотка против антигенов C57BL/6J (СВА анти-C57BL/6J). Добавление в культуру макрофагов пре-мРНК C57BL/6J приводит к появлению на поверхности культивирумых клеток антигенов донора РНК, что оценивали по проценту гибели клеток в цитотоксическом тесте с антисывороткой к антигенам донора РНК (I). РНК, выделенная в отсутствие ДЭП, неактивна (И). Линия III — процент мертвых клеток (МК) в интактной культуре 302
поверхности культивируемых клеток есть результат активного белкового синтеза de novo, о чем говорят опыты с использованием ингибитора белкового синтеза — циклогексимида (рис. 11.9).
Подводя итог представленным экспериментальным данным, следует обратить внимание на три основные группы фактов.
1. Установление “линейной специфичности” действия РНК: в отмене аллогенной ингибиции колониеобразования активна только РНК гибрида или РНК второго родителя в системе переноса родитель — гибрид.
Рис. 11.6. Динамика появления антигенов гистосовместимости донора РНК на культивируемых клетках.
Видно, что максимальная экспрессия антигенов донора пре-мРНК (мышей линии C57BL/6J) на клетках СВА наблюдается через 24-72 ч культивирования
Рис. 11.7. Активность различных классов при экспрессии аллогенных антигенов гистосовместимости на культивируемых клетках.
Различные классы РНК выделяли от мышей линии СВА, которые затем культивировали с макрофагами линии C57BL/6J. Уровень экспрессии антигенов гистосовместимости оценивали по числу мертвых клеток, определяемых в цитотоксическом тесте с антисывороткой C57BL/6J-aHTH-CBA. Культуры: А - без РНК (контроль); I — фракция 40 °C; II — фракция 63 °C; III — фракция 0-4 °C
2. Среди различных классов РНК полноценной активностью в отмене дефекта взаимодействия несингенных клеток обладает класс пре-мРНК ядра.
3. Активность данного класса проявляется в формировании на поверхности культивируемых с РНК клеток Н-2-антигенов, свойственных донору РНК.
Таким образом, следует заключить, что фенотипическая коррекция клеточных взаимодействий в системе колониеобразования связана с антигенной модификацией клеток, вступающих в кооперативные отношения со стромальными элементами хозяина, “сингенизацией” отношений донор-реципиент.
В суммарном виде полученные результаты отражает рис. 11.10.
Рис. 11.8. Доминирующая экспрессия ва поверхности культивирумых клеток антигенов комплекса Н-2, соответствующих донору пре-мРНК.
Использована монослойная культура макрофагов мышей линии C57BL/6J, пре-мРНК мышей линии СВА и антисыворотка C57BL/6J анти-СВА, адсорбированная клетками мышей линии СЗН. Мыши линий СВА и СЗН имеют общий Н-2-гап-лотип. А — культура без РНК (контроль): I — культура с РНК; II — культура с РНК + антисыворотка C57BL/6J анти-СВА, адсорбированная клетками селезенки мышей линии СЗН. Видно, что антисыворотки, из которых удалены антитела к Н-2-антигенам, неспособна обнаружить соответствующие антигены на поверхности культивированных с РНК клеток (II)
Рис. 11.9. Подавление экспрессии антигенов гистосовместимости с помощью ингибитора белкового синтеза циклогексимида.
Внесение в культуру макрофагов C57BL/6J, культивируемых с пре-мРНК мышей линии СВА, увеличивающейся дозы циклогексимида (От 1 до 5 мкг на культуру) подавляет экспрессию антигенов донора РНК (II-IV). Оценку проводили с помощью антисыворотки C57BL/6J анти-СВА, подсчитывая процент мертвых клеток. I — культура без циклогексимида (контроль)
Рис. 11.10. Суммирование результатов опытов по отмене с помощью РНК аллогенной ингибиции колониеобразования.
Верхняя часть рисунка — схема постановки опытов. А, В, и (AxB)F| — родители и гибрид соответственно. Использованы различные классы РНК, выделенные из селезенки мышей определенных генотипов: тот. РНК — суммарная РНК селезенки; цит. РНК — цитоплазматическая РНК; пре-рРНК — предшественник рибосомальной РНК; пре-мРНК — предшественник матричной РНК. 1. Введение клеток костного мозга (КМ) гибридов (AxB)Fi сингенному реципиенту (AxB)Fi приводит к образованию определенного числа колоний (колониеобразующих единиц — КОЕ) на строме, опустошенной после облучения селезенки. 2. Такое же введение клеток КМ одного из родителей (А) приводит к резкому снижению числа КОЕ (констатация аллогенной ингибиции). 3, 4. Предварительная инкубация клеток КМ донора А с тот. РНК от второго родителя В или гибрида (AxB)Fi восстанавливает колониеобразование (эффект отмены аллогенной ингибиции). 5,6. Суммарная (тот.) РНК донора клеток КМ, как и донора неродственного генотипа (С), неспособна восстановить колониеобразование. 7. Цитоплазматическая (цит.) РНК реципиента обладает умеренной активностью по восстановлению колониеобразования. 8. Пре-рРНК реципиента не способна обеспечить восстановление колониеобразования. 9. Пре-мРНК полностью восстанавливает колониеобразование.
КОЕ
Донор клеток КМ Характеристика и генотип донора РНК Реципиент Число КОЕ
Oq (Лхв)Е| 1 (AxB)Fi
Оо А 2 <AxB)Fi
з °О А x/W4 в тот. РНК <A*B)Fi £
Jo А 4 *ЛА/\ (AxB)F тот. РНК ' 1 J
Оо А 5 x/W4 А (AXB)F1
Оо А 6 хЛ/\Л с тот. РНК <axb>fi
< г* ХЛЛ/4 (АхВ)Е цит.РНК (AXB)E|
О А °о А 8 X/W4 /ArB>F пре-рРНК (А B)F’ (AxB)F|
о° А °о 9 X/W4 (AxBJF, пре-мРНК (AxB)Fi J
20 Зак. 3701
Заключение
Уже около 50 лет изучаются процессы ткане- и видоспецифической клеточной адгезии. Исследователи, пытаясь понять действующие силы при этом виде клеточных отношений, предполагают наличие определенных, неидентичных белков мембраны, которые будучи взаимно комплементарными, осуществляют физическую связь между клетками. Иначе, они выдвигают принцип “+/— комплементарности”, или “лиганд-рецепторного взаимодействия”, действующий при ткане- и видоспецифическом клеточном кооперировании. Существует и другая точка зрения, предполагающая взаимодействие по принципу “своего” со “своим”. Эту точку зрения в 1975-1980 гг. высказывал и автор этой книги.
Возможный механизм снижения колониеобразующей способности клеток костного мозга в генетически отличающемся организме и фенотипическая коррекция возникающего подавления представлены на рис 11.11. Прекурсорные кроветворные клетки, введенные в сингенный организм, образуют определенное число колоний. Начало роста колоний зависит от эффективности взаимодействия прекурсора со стромальными элементами селезенки, на которой и формируются КОЕ. Среди компонентов мембранных клеточных структур, обеспечивающих полноценное взаимодей-
рнк от н-г6 (В), (н-2“ н-г6 >рл
Норма Подавление Восстановление
Рис. 11.11. Схема, иллюстрирующая участие антигенов главного комплекса гистосовместимости в межклеточных взаимодействиях на примере восстановления колониеобразования в иесингенном организме.
В условиях нормы костномозговой предшественник миелопоэза (СКК) взаимодействует со стромальными клетками (СК) селезенки посредством антигенов гистосовместимости (на рисунке пример взаимодействия Н-2а и Н-2Ь гибридного костного мозга с гибридной же стромой). Основу такого взаимодействия составляет способность антигенов гистосовместимости к взаимной комплементарности. При нарушении комплементарности по одному из антигенов гистосовместимости (введение клеток костного мозга родителя Pi в гибрид) нормальное взаимодействие нарушается, что и приводит к проявлению аллогенной ингибиции. Восстановление фенотипа вводимых клеток костного мозга с помощью РНК от второго родителя или гибрида определяет нормализацию контактных отношений между антигенами гистосовместимости, что выражается в отмене аллогенной ингибиции
ствие, представлены и антигены гистосовместимости. При нарушении сингенности клеточного взаимодействия (введение родительских клеток костного мозга в гибрид) подавляется процесс нормального клеточного взаимодействия. Это явление получило название аллогенной ингибиции (гибридной резистентности). Инкубация клеток костного мозга одного из родителей с пре-мРНК второго родителя или гибрида F] определяет экспрессию на поверхности культивируемых клеток антигенов донора РНК. Этот процесс собственно и обеспечивает восстановление сингенных отношений между донором и стромальными элементами хозяина — в результате наблюдается восстановление колониеобразования. Одно из возможных объяснений этой феноменологии как раз и состоит в представлении о способности антигенов гистосовместимости контактировать друг с другом по принципу взаимодействия “своего” со “своим”.
Полученные нами факты являются основой для формирования нового направления исследований, задачей которого является экспериментальное и теоретическое решение проблемы фенотипической коррекции клеток как специфически управляемого процесса. Иначе это направление можно было бы назвать клеточной инженерией.
В 1961 г. М.Бернет выдвинул и обосновал положение, согласно которому роль иммунитета сводится не только к обеспечению антиинфекционной защиты, но и к поддержанию генетической целостности соматических клеток, составляющих организм. Явление аллогенной ингибиции представляет другой дополнительный механизм, имеющий то же предназначение, что и иммунитет. Действительно, данные экспериментов демонстрируют, что даже незначительные генетические различия между донором клеток и реципиентом, в частности по минорным антигенам гистосовместимости, приводят к аллогенному подавлению жизнеспособности таких клеток. Следовательно, мутационные изменения клеток тела, определяющие антигеннную, клеточную модификацию, могут привести к подавлению жизнеспособности мутантных клеток в организме, ставшем для них генетически чужеродным.
Иначе, аллогенная ингибиция, как и специфический иммунитет, выступает в качестве фактора стабильности онтогенеза и тем самым обеспечивает передачу наследственного материала от поколения к поколению.
Глава 12. ИММУНОЛОГИЧЕСКАЯ ТОЛЕРАНТНОСТЬ
Введение
Помимо специфического иммунного ответа организм способен развивать специфическую неотвечаемость к антигену. Это явление приобретенной ареактивности стали называть иммунологической толерантностью. Феномен приобретенной толерантности (терпимости), как и феномен иммунологической реактивности, строго специфичен, и индуцируемая неотвечаемость к одному антигену не отменяет полноценного ответа к другому. Набор антигенов, потенциально способных инициировать толерантность, фактически неотличим от того, к которому формируется специфический иммунный ответ. Известно воспроизведение толерантности к аллоантигенам гистосовместимости, экспрессирующимся на поверхности клеток, белкам, синтетическим полипептидам, гаптенам, полисахаридам, живым микроорганизмам.
Экспериментальное воспроизведение толерантности дало в руки исследователей понимание того факта, что явление специфической неотвечаемости представляет собой физиологически нормальный процесс, проявляющий себя в онтогенезе и направленный на создание ареактивности к собственным антигенам. Нарушение этого процесса приводит к аутоиммунным поражениям — иммунологической реакции на собственные антигены организма. Условно, при изучении толерантности удобно дифференцировать два проявления этого феномена: толерантность к своему (“self’ tolerance) и искусственно индуцируемую толерантность к чужеродному антигену (“non-self ’ tolerance). В основе двух форм проявления толерантности лежат одни и те же клеточные механизмы, о чем будет рассказано ниже. Кроме того, следует различать толерантность, индуцируемую в раннем онтогенезе, от толерантности, воспроизводимой у взрослых организмов. В этом случае явление специфической неотвечаемости может включать различные механизмы.
12.1. ОСНОВНОЙ ФЕНОМЕН
Впервые толерантность к клеточным антигенам была обнаружена американским исследователем Р. Оуеном в 1945 г. у дизи-готных телят-близнецов. Такие близнецы не являются генетически идентичными, так как развиваются из разных оплодотворенных яйцеклеток. В процессе эмбриогенеза у телят устанавливается общий плацентарный кровоток, что приводит к обмену клетками крови между ними. В результате каждый теленок представлял собой химеру, обладая как собственными клетками крови, так и клетками близнеца. При взаимной иммунизации телят клетками 308
крови близнецы оставались ареактивными к аллоантигенам партнера по внутриутробной жизни. Английский исследователь П. Ме-давар и его сотрудники показали, что дизиготные близнецы взаимно толерантны к кожному трансплантату, пересаживаемому от одного близнеца другому, несмотря на различия по полу и окраске. В то же время (конец 40-х — начало 50-х годов) было установлено, что толерантность воспроизводится не только к кожным трансплантатам, но и к вирусным антигенам. При иммунизации новорожденных мышей непатогенным вирусом лимфоцитарного хориоменингита иммунитет не вырабатывается, и вирус персистирует в организме хозяина в течение всей его жизни. В то же время введение вируса взрослым животным приводит к быстрой элиминации вирусных частиц.
Наиболее демонстративные опыты, иллюстрирующие специфичность иммунологической неотвечаемости, были проведены в лаборатории П. Медавара с инбредными линиями мышей. Толерантность к антигенам гистосовместимости оценивалась по отторжению кожного трансплантата. Эмбрионам мышей линии СВА (гаплотип Н-2к) вводили клетки селезенки мышей А (Н-2а). После достижения взрослого состояния мышам СВА пересаживали кожный лоскут донора А. Такой аллотрансплантат приживался. Трансплантат от любой другой линии мышей, отличающейся по антигенам гистосовместимости как от донора, так и реципиента, отторгался обычным способом. Чешский исследователь М. Гашек смог индуцировать иммунологическую толерантность у кур слиянием хориоаллантоисных мембран двух эмбрионов, что приводило к установлению общего кровотока.
На первых этапах работы состояние толерантности оценивали по отторжению аллотрансплантата у мышей, которым предварительно вводили клетки донора-трансплантата. Было показано, что для индукции толерантного состояния требуется введение критического числа живых гемопоэтических клеток сразу после рождения животных-реципиентов. Клетки других тканей или мертвые клетки не инициировали толерантность. Состояние иммунологической неотвечаемости можно оценить не только при использовании кожного трансплантата, но и по реакции в смешанной культуре лимфоцитов (СКЛ), когда лимфоциты реципиента помешают в культуру с клетками донора. Отсутствие пролиферативного ответа клеток реципиента на антигены гистосовместимости донора указывает на создание толерантного состояния. Эффективность создания толерантности зависит также от степени антигенных различий между донором аллогенных клеток и реципиентом. Так, при работе с конгенными и рекомбинантными линиями мышей было показано, что толерантность индуцируется легче при различиях
по антигенам II класса, чем при различиях по антигенам I класса МНС. Различия по всему комплексу Н-2 дают наибольший эффект в создании толерантности.
Толерантность удается индуцировать не только к антигенам гистосовместимости, но и к белковым антигенам, хотя и с большими трудностями. К сильным иммуногенам специфическая нео-твечаемость, как правило, не формируется. Напротив, слабо иммуногенные белки индуцируют продолжительную ареактивность, особенно если вводятся животным несколько раз.
Классический путь воспроизведения толерантного состояния — это введение антигена в новорожденный организм, чья иммунная система еще не приобрела полноценного развития. Однако при определенных условиях специфическую неотвечаемость можно воспроизвести и у зрелого организма. Вот некоторые из условий.
1. Во всех случаях эффективность индукции толерантности у взрослых обратно пропорциональна степени иммуногенности антигена: чем более иммуногенен антиген, тем труднее создать толерантное состояние. Например, альбумин является слабым иммуногеном. Он длительное время циркулирует в кровотоке и плохо захватывается антигенпрезентирующими клетками. Эти его особенности создают условия для относительно легкой индукции толерантности. В то же время создание толерантности к сильным иммуногенам, в частности к чужеродным эритроцитам, часто терпит неудачу.
2. Успех индукции толерантности зависит также от дозы используемого антигена. Так, опыты с бычьим сывороточным альбумином показали, что толерантное состояние воспроизводится либо при использовании дозы ниже той, которая является иммуногенной, либо при очень высокой дозе. Эти факты послужили основой для разработки концепции низкодозовой и высокодозо-вой толерантности.
3. Антигены, которые плохо деградируют в организме животных, являются лучшими толерогенами, чем те, которые характеризуются метаболической нестабильностью. Известно, что полимеры D-аминокислот в отличие от L-аминокислот не подвержены гидролитическому разрушению вообще или только в крайне слабой форме. Конъюгация гаптена (например, ДНФ) с синтетическим пептидом, составленным из D-аминокислот, обеспечивает развитие толерантности к гаптену. В то же время конъюгат гаптена с L-аминокислотами не способен индуцировать толерантность.
4. Способность многих белков к агрегации является фактором повышения их иммуногенности. Такое повышение связано с более активным захватом белковых агрегатов макрофагами. Использование дезагрегированных белков, таких как альбумин, иммуноглобулин, обеспечивает более легкое создание толерантного состояния.
5. Взаимодействие иммуноглобулина с Fc-рецептором может быть одним из факторов индукции толерантности. Так, конъюгат аутологичного иммуноглобулина с гаптеном вызывает толерантность к гаптену в отличие от конъюгата этого же гаптена с альбумином или F(ab')2.
6. Использование иммуносупрессорных агентов благоприятствует созданию толерантности. Одновременное введение с антигеном ингибиторов клеточного деления — метатрексата, циклофосфамида, 6-меркаптопурина — обеспечивает относительно легкую индукцию толерантности.
В таблице 12.1 представлены некоторые из условий индукции толерантности к гаптену ДНФ.
Таблица 12.1 Некоторые условия индукции толерантности у взрослых мышей
Антиген Время полураспада антигена Поглощение макрофагами Иммунитет Толерантность
ДНФ-гемопианин минуты ++++ ++++ —
ДНФ-мономер ГГЧ дни ± +++
ДНФ-полимер ГГЧ минуты +++ +++ —
ДНФ-аутолог. IgG дни — +++
ДНФ-аутолог. альбумин дни ± — +
ДНФ-Ь-ГЛ минуты 4-4- — ±
ДНФ-О-ГЛ минуты 4-4- — +++
Примечание: ГГЧ — гамма-глобулин человека, ДНФ-Ь-ГЛ — динит-рофенил-Ь-полиглутаминовая кислота и полилизин
12.2. КЛЕТОЧНЫЕ ОСНОВЫ ТОЛЕРАНТНОСТИ
Становление толерантности есть активный процесс, связанный с участием различных типов клеток.
В системе переноса иммунокомпетентных клеток от толерантных мышей в организм интактных, облученных животных было установлено, что состояние толерантности зависит как от Т-, так и В-клеток (рис. 12.1).Введение облученным мышам тимусзависи-мых клеток от толерантных животных вместе с интактными В-лимфоцитами, также как и введение в обратном сочетании, т.е. В-клетки — от толерантных мышей, а Т-клетки — от интактных, приводит к толерантному состоянию у реципиентов. Причем, Т-зависимая толерантность — более стойкая по сравнению с В-за-висимой ареактивностью. Более того, для индукции толерантности, связанной с В-клетками, требуется большая доза толерогена.
Существенным моментом является участие макрофагов в индукции толерантности. В тех случаях, когда антиген активно захватывается макрофагами, индуцировать толерантность не удается (табл 12.1). Напротив, слабое участие макрофагов в поглощении антигена обеспечивает, как правило, развитие толерантности.
311
Связано это явление с тем, что талероген, минуя антигенпрезентирующую клетку, действует непосредственно на специфические клоны лимфоцитов, что приводит к нарушению нормальной клеточной кооперации при формировании иммунного ответа.
Относительная легкость индукции толерантности у неонатальных мышей связывают, в частности, с малочисленностью субпопуляции макрофагов, экспрессирующих молекулы II класса МНС (1а-антигены). В ситуации недостатка 1а+-макрофагов Т-хелперы не отвечают на тимусзависимые антигены, что и способствует развитию толерантности.
Рис. 12.1. Участие тимоцитов и клеток костного мозга в создании толерантного состояния.
Перенос клеток тимуса и костного мозга от толерантных мышей в облученных животных вызывает прочную, более 100 дней, неотвечаемость реципиента на использованный антиген. Тимоциты в отличие от клеток костного мозга обеспечивают более д лительное состояние толерантности. ГГЧ — гамма-глобулин человека; ТТ и ТКМ — тимоциты и клетки костного мозга от толерантных мышей; ИТ и ИКМ — тимоциты и клетки костного мозга от интактных мышей, соответственно
В создании толерантности, возможно, участвуют специфические Т-супрессоры. Активность этих клеток реализуется через хелперные Т-клетки. Известно, что Т-супрессоры подавляют функцию Т-хелперов, препятствуя тем самым их успешной кооперации с В-лимфоцитами. Примером участия Т-супрессоров в создании толерантности могут служить опыты на крысах с использованием модели отторжения кожного трансплантата. Показано, что предварительная инъекция новорожденным крысятам аллогенных клеток костного мозга обеспечивает приживление соответствующего трансплантата. Индуцируемая таким способом толерантность высокоспецифична и может быть перенесена нормальным взрослым реципиентам с помощью лимфоцитов первичного реципиента. Этот факт демонстрирует, что индуцируемая толерантность во втором хозяине есть активный процесс, связанный с лимфоцитами, подавляющими иммунную реакцию этого хозяина на аллогенный трансплантат. Введение вторичному реципиенту большого количества нормальных сингенных лимфоцитов не отменяет индуцируемой супрессорными клетками толерантности. Имеются и другие аналогичные примеры. К сожалению, механизм действия Т-супрессоров в создании антигенспецифической толерантности до сих пор неясен.
Существенным моментом сохранения толерантного состояния является длительное пребывание антигена в организме (табл. 12.1). Присутствие такого антигена в свободной форме обеспечивает вступление в реакцию блокады все новых Т- и В-клеток, специфически взаимодействующих с данным антигеном. Исключение составляет конъюгат ДНФ с D-формами полиглутаминовой кислоты — полилизина. Механизм создания толерантности в данном случае, очевидно, отличается от общих правил, так как особая форма аминокислот, составляющих антиген, включает и особый путь его метаболизма.
12.3. ТОЛЕРАНТНОСТЬ К “СВОЕМУ” И ТОЛЕРАНТНОСТЬ К “ЧУЖОМУ”-ДВЕ СТОРОНЫ ОДНОГО ЯВЛЕНИЯ
При нормальных физиологических процессах клональное истощение в тимусе, костном мозге и возникающее состояние анергии на периферии исключают из работы Т- и В-клетки, способные распознавать собственные антигены (главы 7,9). Ареактивность Т-клеток к собственным антигенам формируется в тимусе в результате процесса отрицательной селекции аутоантигенспецифи-ческих клонов, а также на периферии при отсутствии костимуля-ции со стороны антигенпрезентирующих клеток. В-клеточная толерантность к “своему” осуществляется в костном мозге и на периферии, когда помощь со стороны Т-клеток или костимулирующего сигнала отсутствует.
Активный процесс клонального истощения проявляется лишь при условии достаточной плотности на клеточной поверхности комплекса пептида (“своего” или “чужого”) с молекулами МНС. Большинство тканевых антигенов, несмотря на способность образовывать комплекс с молекулами МНС, представлено в столь незначительном количестве, что не в состоянии преодолеть порог распознавания. В такой ситуации Т-клетки, потенциально способные взаимодействовать с аутокомплексом, остаются невостребованными, и только те или иные патогенетические сдвиги, приводящие к активации “запрещенных” клонов, становятся причиной аутоиммунного поражения.
Таким образом, толерантность к “своему” формируется двумя способами: отрицательной селекцией аутоантигенспецифичес-ких клонов в тимусе и инактивацией соответствующих клонов на периферии. В свою очередь ареактивность клонов на периферии возникает либо из-за отсутствия костимулирующего воздействия на Т-клоны, исходящего, в частности, от антигенпрезентирующих клеток (см. главу 9), либо из-за слишком низкого уровня экспрессии комплекса собственных пептидов с молекулами I или II классов МНС.
Каких-либо принципиальных различий в формировании толерантного состояния к “своему” и индуцируемой толерантности к “чужому” нет. В этом отношении исследования П. Медавара и его сотрудников по индукции толерантности к антигенам гистосовместимости у новорожденных мышей интерпретируются с позиций клонального истощения в тимусе, как это происходит в нормальных условиях (см. главу 7). Введение неонатальным мышам аллогенного костного мозга приводит к тому, что часть костномозговых клеток, включая антигенпрезентирующие клетки, заселяет тимус (рис. 12.2). Формирование ареактивности к антигенам МНС донора происходит на уровне отрицательной внутритимусной селекции. Отбору подвергаются четыре интересующие нас формы иммуногенного комплекса, которые экспрессируются на поверхности антигенпрезентирующих клеток:
1) комплекс молекул I или II классов МНС собственных антигенпрезентирующих клеток реципиента (обозначение — А) с пептидами собственных же антигенов гистосовместимости (а);
2) комплекс тех же молекул МНС реципиента с пептидами антигенов гистосовместимости донора (Ь);
3) комплекс молекул МНС донора (В) с пептидами антигенов гистосовместимости реципиента (а);
4) комплекс молекул МНС донора с пептидами антигенов гистосовместимости того же донора (Ь).
В результате отрицательной селекции в тимусе подвергаются клетки, чьи рецепторы распознают комплексы Аа, АЬ, Ва и ВЬ. 314
Клоны, потенциально способные распознавать антигены гистосовместимости иных гаплотипов, избегают отрицательного отбора и покидают тимус, мигрируя в периферические лимфоидные органы.
Прошедшая элиминация клонов, способных реагировать как с собственными антигенами, так и с антигенами гистосовместимости конкретного по гаплотипу донора, обеспечивает эффективное приживление кожного трансплантата донора на генетически чужеродном реципиенте. Успех трансплантации связан с отсутствием в лимфоидной ткани периферии клонов Т-клеток, реагирующих с антигенами гистосовместимости донора. Индуцируемая неонатальная толерантность строго специфична и не проявляется по отношению к трансплантату линий мышей, не участвующих в переносе клеток костного мозга (С). Для под держания состояния неотвечаемости у реципиента на чужеродные антигены необходимы
Трансплантация
Тимус
Периферия
Антигенпрезентирующие клетки
Отсутствие распознавания
Рис. 12.2. Один № возможных механизмов формирования толерантности к антигенам гистосовместимости.
А, В, С — обозначение генотипа мышей и их молекул МНС; а, Ь, с — антигенные пептиды соответствующих генотипов. Введение клеток костного мозга (КМ) генотипа В, включающих как пре-Т-клетки, так и антигенпрезентирующие клетки, новорожденным мышам иного генотипа (А) обеспечивает создание толерантности к антигенам гистосовместимости, что оценивается по приживлению кожного лоскута донора клеток. Приживление обеспечено отрицательнойФелекци-ей в тимусе антигенреактивных клонов, специфичных к комбинациям собственных или введенных антигенов гистосовместимости с собственными же или трансплантированными молекулами МНС, экспрессирующимся на антигенпрезентирующих клетках. Отрицательный отбор посредством апоптоза не затрагивает какие-либо другие антигенные специфичности (например, антигены гистосовместимости генотипа С)
повторные трансплантации донорских клеток. Связано это с тем, что у реципиента в условиях нормы ранние предшественники Т-клеток постоянно мигрируют из костного мозга в тимус, а они тоже требуют селекции на введенные антигены донора.
Заключение
Открытие в 1953 г. П. Медаваром и его сотрудниками иммунологической толерантности (явления, обратного по своей природе иммунологической реактивности) позволило М. Бернету определить иммунитет как способ дифференцировки всего “своего” от всего “чужого”, а изучение механизмов индуцируемой толерантности (non-self tolerance) и механизмов неотвечаемости к собственным антигенам (self tolerance) слилось в единое направление исследований, задача которого — понять главный, определяющий принцип работы иммунной системы.
На этом пути стало понятным участие тимуса в отборе и уничтожении антигенспецифических клеточных клонов, способных реагировать с собственными антигенами. Кроме того, стало понятным и другое: в тех случаях, когда тканевые антигены не могут проникнуть в тимус и инициировать отбор “запрещенных” клонов, происходит дополнительный отрицательный отбор клонов на периферии. В этой последней ситуации потенциально аутореактивные клоны переходят в состояние анергии (см. главу 9). Подобные же процессы происходят и при индуцируемой толерантности, когда иммунная система начинает воспринимать чужеродный антиген как свой собственный.
Следует, однако, помнить, что индуцируемая толерантность зависит во многом от искусства экспериментатора, и организму предлагается подчас ситуация, которая не встречается в условиях физиологической нормы, например введение искусственно синтезированных антигенов.
В развитии индуцируемой толерантности участвуют как Т-, так и В-лимфоциты, а также антигенпрезентирующие клетки, в том числе макрофаги. Роль макрофагов в создании толерантности особенно наглядна. Неспособность этих клеток поглощать антиген и перерабатывать его в иммуногенную форму является одним из наиболее существенных событий в создании индуцируемой толерантности. Бесспорно участие в процессе формирования толерантности Т-супрессоров. Правда, пока имеется лишь хорошая феноменология их участия при отсутствии четкого понимания механизмов.
В целом толерантность как антипод иммунной реактивности является одним из способов сохранения индивидуальной, клеточной целостности организма. При нарушении механизмов толерантности развивается аутоиммунное поражение.
316
Часть III. ЧАСТНЫЕ ПРОЯВЛЕНИЯ ИММУНИТЕТА
Глава 13. АНТИИНФЕКЦИОННЫЙ ИММУНИТЕТ
Введение
Организм человека и животных постоянно подвергается атаке самых различных инфекционных агентов. Однако выраженное инфекционное заболевание в условиях физиологической нормы проявляется относительно редко. Развитию инфекции препятствуют две формы иммунного реагирования: неспецифический (врожденный) иммунитет и специфический (адаптационный, приобретенный) иммунитет. В большинстве случаев бывает достаточно защитного потенциала, которым обладают антигеннеспецифичес-кие формы зашиты. Только когда патоген преодолевает барьер врожденного иммунитета, генерируется специфическая реакция защиты, характеризующаяся клональной экспансией антигенспецифических лимфоцитов и активной продукцией соответствующих антител.
Таким образом, весь инфекционный процесс по признаку доминирующего участия различных форм иммунной защиты легко разбить на два этапа: первый, ранний этап — немедленная реакция факторов неспецифической защиты, и второй, более поздний этап — включение в реакцию защиты от патогена участников специфической иммунной защиты с последующим формированием памяти о первой встрече с возбудителем инфекции.
В данной главе последовательно представлены клеточные и молекулярные механизмы, реализующие две формы иммунной защиты от инфекционных агентов различной природы.
13.1. ОБЩАЯ ХАРАКТЕРИСТИКА ИНФЕКЦИОННОГО ПРОЦЕССА
Вирусы, бактерии, грибки, простейшие, паразитические черви — вот тот набор патогенов, с которыми потенциально возможна встреча человека и животных в течение жизни.
Простейшие и паразитические черви (гельминты, нематоды) являются объектом изучения самостоятельного раздела медико-биологических исследований — паразитологии. Вирусы, бактерии и грибки изучаются клинической микробиологией. В таблице 13.1 суммированы некоторые, наиболее часто встречающиеся патогены, которые вызывают различные формы инфекционных заболеваний.
Инициация инфекционного заболевания во многом зависит от ряда особенностей, связанных с самим возбудителем, теми свойствами, которые определяют его инфекциозность. К ним относят-
Таблица 13.1
Некоторые возбудители наиболее часто встречающихся заболеваний человека
Основной таксон Классификационная категория
Вирусы ДНК-вирусы аденовирусы аденовирусы человека (типы 3,4
Бактерии РНК-вирусы грам-положи- вирусы герпеса вирусы оспы парвовирусы паповавирусы вирусы гепатита ортомиксовирусы парамиксовирусы пикорнавирусы реовирусы флавивирусы аренавирусы ретровирусы стафилококки и 7) вирус простого герпеса, вирус Эпштейн-Барра, цитомегаловирус вирус оспы человека парвовирус человека вирус папилломы вирус гепатита В вирус гриппа вирус свинки, кори, респираторного тракта вирус полиомиелита, коксаки, гепатита А ротавирус, реовирус вирус желтой лихорадки вирус лимфатического хориоме-нингита, лихородки Ласса вирус Т-клеточной лейкемии человека (ВИЧ) Staphylococcus aureus
Грибки Простейшие Черви (гельминты и нематоды) тельные кокки грам-отрицательные кокки грам-положительные бацил- лы грам-отрицательные ба- циллы анаэробные бактерии спирохеты микобактерии рикеттсии хламидии микоплазмы кишечник ткани кровь, печень стрептококки нейссерии клостридии Streptococcus pneumoniae, St. pyogenes Neisseria gonorrheae, N. meningitidis Corynebacteria, Bacillus anthracis,Listeria monocytogenes Salmonella, Shigella, Campylobacter, Vibrio, Yersinia, Pasteurella, Pseudomonas, Brucella, Hemophilus, Legionella Clostridium tetani, C. botulinus, C. perfringens Treponema pallidum, Borrelia burgdorferi, Leptospira interrogans Mycobacterium tuberculosis, M. leprae Rickettsia prowazeki Chlamydia trachomatis Mycoplasma pneumoniae Candida albicans, Aspergillus, Histo-plasma capsulatum, Coccidiusoide immits Entamoeba histolytica, Leishmania, Plasmodium, Trypanosoma, Toxoplasma gondii Trichteris trichiura, Ascaris lumbri-coides, Enterobius vermicularis filaria, Onchocerca volvulus Schistosoma, Clonorchis sinensis
ся: доза возбудителя, способ его проникновения и распространения в организме хозяина, устойчивость микроорганизма к факторам внешней среды. Так, например, возбудитель сибирской язвы во внешней среде образует споры, что позволяет ему быть высокорезистентным к повышенной температуре и высыханию. В то же время вирус иммунодефицита человека не способен сохраняться во внешней среде, вне организма хозяина или продуктов его жизнедеятельности .
Первым и существенным барьером на пути проникновения большинства инфекционных агентов в организм человека или животных являются кожа и эпителиальные, слизистые покровы тела. Проникновению возбудителя через эти тканевые образования препятствуют локальные химические факторы, фагоцитирующие клетки, особенно хорошо представленные в слизистых легких. Только когда микроорганизмы преодолевают по тем или иным причинам эпителиальные барьеры, можно говорить о начале инфекционного процесса. Обычно возбудитель проникает при механическом повреждении эпителиальных покровов. Неспецифическая защита в зоне поврежденного эпителия проявляется в тромбировании раны, включении в защитную реакцию антибактериальных белковых факторов, фагоцитозе. Микроорганизмы, неспособные к расселению, остаются в месте проникновения, и весь защитный процесс формируется в основном в виде локального воспаления. Если внеклеточный патоген обладает способностью к расселению, то на первом этапе он заселяет субэпителиальные ткани. В качестве факторов неспецифической защиты на этом этапе выступают фагоцитирующие клетки, комплемент, активированный по альтернативному пути, цитокины макрофагального происхождения, натуральные киллерные клетки. Внеклеточные патогены, способные преодолевать эту линию защиты, проникают в лимфатические сосуды и с током лимфы попадают в ближайшие лимфатические узлы. При активном размножении патогена существует возможность его проникновения в кровоток и широкого расселения по организму. С момента попадания патогена в лимфатическую систему создаются условия для формирования специфического иммунного ответа, хотя неспецифическая линия борьбы в виде фагоцитоза, активности альтернативного пути системы комплемента, цитолитического действия натуральных киллеров остается.
Внутриклеточные патогены распространяются по организму от зараженной клетки к интактным клеткам либо в результате прямого межклеточного контакта, либо через выход во внеклеточную среду с последующим реинфицированием интактных клеток.
Совместная работа неспецифического и специфического иммунитета подавляет размножение патогена в организме и в след-319
ствие этого ведет к выздоровлению. Как правило, завершение инфекционного процесса проходит без каких-либо побочных явлений, хотя в ряде случаев прошедшая инфекция оставляет после себя тканевые повреждения и остаточные патологические нарушения.
В зависимости от специфических особенностей патогена повреждение тканей может быть прямым, связанным с продуктами жизнедеятельности микроорганизма, или опосредованным, когда повреждение вызвано развитием защитных иммунных механизмов. В таблице 13.2 приведены примеры двух форм патогенетического действия микроорганизмов на клетки хозяина. Экзотоксины — продукты жизнедеятельности внеклеточных паразитов, оказывают свое патогенное действие на клетки хозяина, приводя их к гибели или извращению реактивности. Эндотоксины, продуцируемые внутриклеточными патогенами, активируют макрофаги, в которых они локализуются, к выделению цитокинов. Избыточная продукция таких цитокинов инициирует локальные или системные нарушения в организме хозяина. Иммунный ответ как таковой может стать причиной повреждения тканей хозяина. Среди факторов иммунопатогенного действия известны такие как иммунные комплексы, оседающие на стенках сосудов или в тканях почек, перекрестно реагирующие антитела, вызывающие аутоиммунные повреждения, активность цитотоксических Т-лимфоци-тов в тех случаях, когда антигены микроорганизмов экспрессируются на клетках хозяина.
Таблица 13.2
Возбудители, оказывающие прямое и опосредованное патологическое действие на ткани инфицированного организма
Прямое действие патогена на ткани Опосредованное действие на ткани факторами специфического иммунитета
ЭКЗОТОКСИН ЭНДОТОКСИН ЦИТОЛИЗ клеток иммун. комплексы аутоантитела активность - ЦТЛ
Strept. pyogenes, Staphyl. aureus, Corynebac. diptheriae, Clostridium tetani, Vibrio cholerae Escherichia coli Hemophilus influenzae, Salmonella typhi, Shigella Pseudomonas aeruginosa Yersinia pestis вирус гепатита В, вирус оспы, вирус кори, вирус гриппа вирус гепатита В, плазмодий малярии, Strept. pyogenes, Treponema pallidum, Strept. pyogenes ?, Mycoplasma pneumoniae Mycobac. tuberculosis, Mycobac. leprae, вирус лимф, хориоменин-гита, вирус иммун. дефицита человека, Schistosoma mansoni
13.2. НЕСПЕЦИФИЧЕСКИЙ (ВРОЖДЕННЫЙ) ИММУНИТЕТ ПРИ ИНФЕКЦИИ
13.2.1. Барьерная функция эпителия
Наше тело защищено от внешней среды кожей и эпителиальными покровами: эпителиальными клетками, выстилающими желудочно-кишечный тракт, дыхательные пути, уро-генитальный тракт. Инфекция возникает лишь тогда, когда патоген способен колонизировать эпителий или когда нарушается целостность эпителиальных покровов в результате механических повреждений (раны, ожоги) или укусов насекомых — переносчиков инфекционных заболеваний (блох, вшей, комаров, москитов, клещей). Кстати, трансмиссивный путь передачи возбудителя с помощью насекомых является основным механизмом поддержания инфекции в природных очагах (чумы, клещевого энцефалита, малярии и других).
Эпителиальные покровы — это не только механическая преграда инфекционной агрессии. Клетки эпителия продуцируют определенный набор химических соединений^либо, убивающих микробов, либо подавляющих их рост. Так, например, кислый желудочный сок и пищеварительные ферменты верхних отделов желудочно-кишечного тракта являются реальной защитой от инфекции. Кроме того, эпителиальные клетки кишечника секретируют набор антибактериальных пептидов широкого спектра действия. Эпителиальные покровы имеют свою собственную микрофлору непатогенных бактерий, которые препятствуют колонизации эпителия патогенными микроорганизмами. Один из механизмов отторжения патогенов связан с продукцией бактериями нормальной микрофлоры антибактериальных веществ, таких, например, как колицины — белки, продуцируемые Escherichia coli. Если нормальная микрофлора кишечника уничтожается в результате тех или иных воздействий (одно из них — антибиотикотерапия), то опустошенные места занимаются патогенными микроорганизмами, что приводит к серьезным кишечным заболеваниям. В таблице 13.3 представлены основные факторы эпителиальной формы защиты.
13.2.2. Альтернативный путь активации комплемента
Основное функциональное отличие альтернативного пути активации комплемента от классического пути развития реакции состоит в быстроте ответной реакции на патоген. Если классическому пути активации комплемента требуется время для накопления специфических антител, то альтернативный путь развивается сразу после проникновения патогена.
Компонент комплемента СЗ, обильно представленный в плазме, постоянно расщепляется на СЗа и СЗЬ. Хотя большая часть 321
21 Зак. 3701
Таблица 13.3 Механизмы антибактериальной защиты, осуществляемые эпителиальными покровами
Фактор зашиты Эффекторы
Механический плотное соединение эпителиальных клеток; смыв микроорганизмов движением жидкости и воздуха вдоль эпителиальных покровов
Химический жирные кислоты (кожа); ферменты: лизоцим (слюна, слезы, пот), пепсин (кишечник); низкое pH (желудок); антибактериальные пептиды дефенсины (кишечник)
Миробиологи- конкуренция нормальной микрофлоры с патогеном за источ-
ческий ник питания и способность к преимущественной колонизации эпителия; продукция антибактериальных соединений.
СЗЬ в сыворотке инактивируется в результате гидролиза, некоторое его количество ковалентно связывается с клетками хозяина или проникшими патогенами. Связь СЗЬ с патогеном особенно существенна, так как определяет комплекс реакций, которые приводят к дальнейшему накоплению СЗЬ, выступающему в качестве фактора опсонизации бактериальных клеток. В таком клеточно-связанном состоянии СЗЬ способен нековалентно взаимодействовать с фактором В, после чего под воздействием сывороточной протеазы (фактора D) он расщепляется на ВЬ и Ba. С этого момента каскад реакций на клетках хозяина и на бактериальных клетках осуществляется разными способами. На поверхности соматических клеток представлено два белка: DAF (англ.: “decay accelerating fgactor”) — фактор, усиливающий расщепление, и МСР (англ.: “membrane cofactor proteolysis ”) — мембранный кофактор протеолиза, а в сыворотке фактор — Н. DAF и фактор Н связываются с СЗЬ и таким способом вытесняют ВЬ из комплекса с СЗЬ. В результате последующие реакции прерываются.
У микробных клеток отсутствуют протективные белки DAF и МСР, а фактор Н хозяина преимущественно взаимодействует с клетками хозяина же. На поверхности патогена происходят иные события. Комплекс СЗЬ:ВЬ стабилизируется регуляторным компонентом, известным как пропердин, или фактор Р. Стабилизированный комплекс СЗЬ:ВЬ действует так же, как конвертаза СЗ/С5 классического пути. Именно комплекс СЗЬ:ВЬ обеспечивает накопление СЗа и СЗЬ, расщепляя компонент СЗ, выступающий в качестве опсонина для микробных клеток. Кроме того, СЗЬ взаимодействует с компонентом С5 и разрушает его до С5Ь. Последний совместно с СЗа выступает в качестве воспалительного фактора, привлекая в зону проникновения патогена фагоцитирующие клетки.
Таким образом, результатом всей цепочки реакций альтернативного пути активации комплемента является накопление двух существенных факторов неспецифической защиты — опсонина (СЗЬ) и факторов воспаления (СЗа и С5Ь).
^СЗа СЗ ^СЗЬ Спонтанное расщепление СЗ на СЗЬ и СЗа
СЗЬ СЗЬ Ковалентная связь СЗЬ с соматической клеткой и патогеном
/^-\Гсзь / P(AB ^|£СЗЬ Нековалентное взаимодействие СЗЬ с фактором В. Взаимодействие фактора В с фактором D
ЙГ о Ba СЗЬ Расщепление фактора ВнаВаиВЬ
МСР езь Н сзы сзы Неактивная форма Фат р вь езь СЗЬ:ВЬ 1 СЗ СЗа СЗЬ crop воспаления Опсонин Взаимодействие МСР, DAF (на клетке) и Н (в сыворотке) с комплексом СЗЬ: Bb. DAF не указан. DAF и Н вытесняют ВЬ из комплекса. Фактор 1 инактивирует СЗЬ. На бактериальной клетке фактор Р (пропердин) стабилизирует комплекс СЗЬ:ВЬ, который расщепляет свободный СЗ л СЗа и СЗЬ
Рис. 13.1. Взаимодействие компонентов альтернативного пути активации комплемента с соматическими и бактериальными клетками
13.2.3. Активация макрофагов
Субэпителиальная соединительная ткань содержит большое количество макрофагов, которые выступают здесь в качестве одного из ведущих факторов неспецифической защиты от патогена.
Цепь событий с участием макрофагов представляется следующим образом. Патоген, преодолевший эпителиальный барьер, сталкивается с фагоцитирующими мононуклеарами, которые экспрессируют на своей поверхности рецепторы к наиболее общим компонентам клеточной стенки микроорганизмов. Среди них — рецепторы к липополисахариду и маннозе. Взаимодействие патогена с макрофагами приводит к поглощению микробной клетки посредством фагоцитоза и ее последующему разрушению в фаго-лизосомах.
Следствием взаимодействия тканевых макрофагов с патогеном является также секреция различных цитокинов фагоцитирующими клетками. Возможно, что в индукции секреции цитокинов участвуют те же самые рецепторы, что и при взаимодействии с патогеном. Продукция цитокинов сама по себе является важнейшим фактором, направленным на мобилизацию в зону проникновения патогена дополнительных клеток и гуморальных веществ, совместное действие которых создает для него мощный заслон.
И, наконец, еще одно свойство макрофагов в зоне проникновения патогена — это подготовка антигенов микроорганизмов к индукции специфического иммунного ответа.
Активация альтернативного пути развития системы комплемента и поглощение макрофагами преодолевших эпителиальный барьер микроорганизмов представляют собой наиболее раннюю реакцию врожденного, неспецифического иммунитета, которая встречается в первые часы после заражения. Если же микроорганизм все-таки ускользает от постоянно присутствующих факторов ранней, немедленной защиты, то мобилизуются клеточные и гуморальные механизмы, которые характеризуют собой ранний индукционный ответ. Импульсом к развитию такого ответа является факт распознавания антигенов микроорганизмов, которые по своей природе являются наиболее общими для них, например упоминавшийся выше липополисахарид. Понятно, что тонкая антиген-распознающая специфичность, свойственная адаптивному иммунитету, в данном случае отсутствует. Более того, природа факторов, включенных в ранний индукционный ответ, такова, что не создает памяти от первичного контакта с антигеном, столь свойственной специфическому иммунитету. Следует помнить, что именно на неспецифическом этапе развития противоинфекционного иммунитета закладываются основы для формирования специфического ответа. Этот преадаптационный процесс связан в первую очередь с переработкой антигенов микроорганизмов в их индуци-324
бельную (иммуногенную) форму для клеточных элементов специфической защиты.
Как отмечалось, одно из проявлений активности макрофагов в ранний индукционный период состоит в интенсивной продукции семейства цитокинов (монокинов). Основные из них: интерлейкины-1,6,8,12 (ИЛ-1,6,8,12) и фактор некроза опухолей а (ФНО-а). Эти цитокины обладают местным и системным эффектами (табл. 13.4). Главным из них является ФНО-а, основное предназначение которого состоит в формировании очага воспаления.
Таблица 13.4
Функциональная активность цитокинов (монокинов), секретируемых активированными макрофагами
Цитокин Локальные эффекты Системные эффекты
Интерлейкин-1 активация сосудистого эндотелия; активация лимфоцитов; усиление прохождения эффекторных клеток через эндотелий; локальное разрушение тканей лихорадка, пирогенный эффект, инициация продукции ИЛ-6
Интерлейкин-6 Интерлейкин-8 активация лимфоцитов хемотаксический фактор для лейкоцитов; усиление прохождения эффекторных клеток через эндотелий повышение температуры тела
Интерлейкин-12 увеличение продукции антител индукция белков острой фазы
ФНО-а активация сосудистого эндотелия и повышение проницаемости сосудов, что обеспечивает увеличение поступления IgG, комплемента и клеток в зону проникновения патогена; усиливает ток лимфы через лимфатические узлы повышение температуры тела; мобилизация метаболитов; инициация шока
Воспалительный ответ в месте проникновения патогена характеризуется локальным образованием вздутия, покраснением, болью, повышением температуры. Все эти патологические нарушения есть результат двух основных событий, связанных с ФНО-а. Прежде всего, под влиянием ФНО-а увеличивается диаметр сосудов в очаге инфекции, что приводит к локальному усилению кровотока и, как следствие, к местному покраснению и повышению температуры. Кроме того, усиливается проницаемость сосудов, влекущая за собой локальное накопление жидкости, которая определяет формирование припухлости и возникновение болевых ощущений. Увеличение проницаемости сосудов и локальное накопление жидкости обеспечивает концентрацию в очаге проникновения инфекции иммуноглобулинов, комплемента и других функционально значимых белков.
Второе событие состоит в экспрессии под влиянием ФНО-а адгезивных молекул на эндотелиальных клетках, в результате усиливается приток фагоцитов в очаг воспаления, что крайне важно для локализации инфекции.
Процесс миграции лейкоцитов в очаг воспаления делится на четыре этапа. На первом этапе под влиянием ФНО-а происходит экспрессия Р- и Е-селектинов на эпителиальных клетках сосудов. Селектины распознают углеводные радикалы на гликопротеиновых рецепторах циркулирующих в кровеносном русле лейкоцитов. Однако такое распознавание проходит при низкой аффинности. Лейкоциты, проходя мимо эпителиальных клеток с Р- и Е-селек-тинами, лишь замедляют движение, но не образуют прочных кон-стактных связей.
Под влиянием ФНО-а индуцируются не только селектины, но и адгезивные молекулы суперсемейства иммуноглобулинов ICAM-1, которые также экспрессируются на эпителиальных клетках. Взаимодействие ICAM-1 со своим лигандом LFA-1, представленным на фагоцитирующих клетках, как и в предыдущем случае, низкоаффинно. На этом фоне в процесс клеточного взаимодействия вступают молекулы ИЛ-8, продукция которых обеспечена активированными макрофагами инфекционного очага. Взаимодействие ИЛ-8 со своим рецептором на поверхности фагоцитов приводит к такому конформационному изменению LFA-1, которое значительно повышает эффективность связи с ICAM-1. В результате всех этих клеточно-молекулярных событий наступает важный момент в миграционном процессе — остановка движения фагоцитов по кровеносному руслу, что и характеризует второй этап.
Рис. 13.2. Этапы проникновения фагоцитирующих лейкоцитов из кровяного русла в очаг воспаления.
I этап. Низкоаффинное взаимодействие адгезинов эндотелиальных клеток с лигандами лейкоцитов. Под влиянием ФНО-а, продуцируемого поглотившими антиген макрофагами в очаге воспаления, экспрессируется адгезивный белок Е-селектин на эндотелиальных клетках. Он взаимодействует при низком уровне аффинности с углеводными радикалами (УВ) поверхности лейкоцитов. Индуцируемый ФНО-а адгезии ICAM-1 вступает во взаимодействие с LFA-1 лейкоцитов. Данная форма взаимодействия также низкоаффинна. При подобных формах взаимодействия лейкоциты замедляют свое движение вдоль эндотелия, но не прекращают его полностью.
II этап. Остановка движения лейкоцитов. ИЛ-8, продуцируемый активированными макрофагами, взаимодействует со своим рецептором на поверхности лейкоцитов, усиливая тем самым аффинность взаимодействия ICAM-1:LFA-1, что и является причиной остановки движения.
III этап. Диапедез. Остановившийся лейкоцит проходит между эндотелиальными клетками с помощью рецепторов CD31 и ICAM-1:LFA-1.
IV этап. Миграция в очаг воспаления. Лейкоцит, оказавшийся в субэндотелиальной области, перемещается против градиента плотности ИЛ-8 в зону воспаления
Очаг воспаления
• ИЛ-8
После установления достаточно прочной связи между фагоцитами и эндотелиальными клетками разворачивается третий этап — проход клеток через эндотелиальную стенку сосудов. Проникновение реализуется через взаимодействие тех же молекул LFA-1 и дополнительных иммуноглобулиноподобных молекул CD31, экспрессирующихся как на лейкоцитах, так и на эпителиальных клетках в местах плотного соединения клеток. Именно эти молекулы обеспечивают диапетез фагоцитов — проход через эпителиальную стенку в район развития воспалительной реакции.
На четвертом, заключительном, этапе проникшие через эндотелиальную стенку фагоциты мигрируют непосредственно в очаг воспаления, перемещаясь по градиенту плотности , создаваемому ИЛ-8.
Помимо ФНО-а, значительная роль в формировании защитных механизмов при местной инфекции принадлежит хемокинам — низкомолекулярным белкам, секретируемым различными типами клеток в очаге проникновеения патогена. Все хемокины делятся на две группы: аир. Хемокины а являются хемоаттрактантами для нейтрофилов. К этой группе хемокинов относится, в частности, ИЛ-8. Хемокины р способствуют миграции моноцитов, которые, достигнув очага инфекции, дифференцируются в тканевые макрофаги. Одним из активных р-хемокинов является MCAF (сокр. от “англ, macrophage chemoattractant and activating factor”). Другие хемокины привлекают в зону инфекции иные клеточные типы. Свойства хемокинов двух групп суммированы в табл. 13.5.
Таблица 13.5
Основные свойства различных хемокинов
Хемокин Субкласс Клетки-продуценты Влияние на
Т-клетки Моноциты Нейтрофилы
ИЛ-8 РВР/p-TG/ а а моноциты, макрофаги, фибробласты, кератиноциты тромбоциты активация миграции активация миграции и дегрануляции
MIP-1B р моноциты, макрофаги, нейтрофилы, эндотелиоциты активация миграции CD8 Т-кл. активация миграции
MCAF р моноциты, макрофаги, фиброласты, кератиноциты активация миграции Т-кл. памяти активация миграции
RANTES р Т-клетки активация миграции CD4 Т-кл. памяти активация миграции
Существенную роль в формировании антибактериальной защиты играют цитокины ИЛ-1 и ИЛ-6. Их особое значение, помимо всего прочего, состоит в том, что они, с одной стороны, являясь эндогенными пирогенами, инициируют повышение температуры тела, а с другой, стимулируют продукцию белков острой фазы (С-реактивный белок, или белок, связывающий маннозу). Спектр биологической активности ИЛ-1 и ИЛ-6 представлен в табл. 13.6.
Таблица 13.6
Биологическая активность цитокинов интерлейкина-1 и интепрлейкина-6
Мишень Функциональное действие Конечный результат
Печень Эндотелий костного мозга индукция синтеза белков острой фазы (С-реактивного белка, сывороточного амилоидного белка, фибриногена, белка, связывающего маннозу) мобилизация нейтрофилов активация комплемента, опсонизация усиление фагоцитарного ответа
Гипоталамус повышение температуры тела подавление размножения бактерий и вирусов; усиление презентации антигена в иммуногенной форме; усиление специфического иммунного ответа
Жировая ткань, мышцы мобилизация белков и энергии, приводящие к повышению температуры тела то же
Т- и В-лимфо-циты увеличение активности то же
При развитии инфекции повышение температуры тела имеет вполне положительное значение, так как препятствует размножению микроорганизмов и спосбствует формированию специфического иммунного ответа.
Благодаря усиленной продукции ИЛ-6 активированными макрофагами инициируется синтез белков острой фазы. Один из них — С-реактивный белок, взаимодействуя с фосфорилхолином бактериальной стенки, выступает и как опсонин, и как индуктор классического пути активации системы комплемента. Другой белок острофазного ответа связывает маннозу. Его структура напоминает С1-компонент комплемента. В противоинфекционном ответе он выполняет две функции: выступает в качестве опсонина, взаимодействуя с маннозой бактериальных стенок, и активирует протеолитический белковыр комплекс, который расщепляет С4 и 329
С2-компоненты комплемента с тем, чтобы инициировать развитие классическогго пути активации системы комплеменнта.
Таким образом, макрофаги, столкнувшись с патогеном, инициируют целую цепь событий, направленных на подавление развития инфекции. Активность фагоцитирующих мононуклеаров проявляется не только во внутриклеточном переваривании и уничтожении микроорганизма, но и в инициации секреции набора цитокинов с различной функциональной активностью. Все разнообразие биологического действия цитокинов (монокинов), секретируемых макрофагами, направлено на нейтрализацию и уничтожение патогена от инициации белков острой фазы, активации системы комплемента до привлечения в зону проникновения патогена дополнительных фагоцитирующих клеток.
13.2.4. Роль интерферонов
При инфицировании клеток вирусом индуцируется продукция особой группы белков, известных как интерфероны. Два из них — интерферон-а (ИНФ-а) и интерферон-p (ИНФ-р), действуют на ранних этапах развития антивирусного ответа. Третий — интерферон-у (ИНФ-у), продуцируется эффекторными Т-клетка-ми после индукции адаптивного иммунного ответа. ИНФ-а синтезируется вирусинфицированными лейкоцитами, ИНФ-р — продукт фибробластов и многих других клеточных типов.
Индуктором синтеза интерферонов является вирусная, двунитчатая РНК.
Противовирусная активность интерферонов-а и -р состоит в подавлении белкового синтеза и репликации ДНК в вирусинфи-цированных клетках, в активации натуральных киллеров (НК), лизирующих пораженные клетки, в усилении экспрессии молекул I класса МНС. Эта последняя активность интерферонов имеет прямое отношение к индукции специфического иммунного ответа, так как обеспечивает повышенную генерацию антивирусных цитотоксических Т-клеток (CD8 Т-клеток).
13.2.5. Натуральные киллеры
Натуральные киллеры (НК) первоначально были обнаружены по их способности убивать лимфоидные опухолевые клетки in vitro без какого-либо предварительного примирования. В дальнейшем стало известно, что эти клетки принимают участие в неспецифической защите против некоторых вирусных и бактериальных внутриклеточных патогенов.
Активность НК-клеток усиливается в 20-100 раз под влиянием интерферонов-а и -₽, а также цитокина ИЛ-12, продуцируемого макрофагами в ранний период развития инфекции. Этот цито-ззо
кин совместно с ФНО-а, также образуемым макрофагами, обеспечивает активную секрецию ИНФ-у НК-клетками. Секреция ИНФ-у создает условия ранней защиты от некоторых инфекций до тех пор, пока в реакцию не вступят Т-клетки, продуцирующие тот же цитокин. Мыши, дефицитные по Т- или В-клеткам, вполне резистентны к внутриклеточному бактериальному патогену Listeria monocytogenes. Однако в условиях дефицита зараженных мышей по НК-клеткам, ФНО-а или ИНФ-у развивается инфекция, которая губит животных еще до включения в ответ примированных Т-клеток.
Каким образом НК-клетки отличают собственные интактные соматические клетки от таких же клеток, но инфицированных вирусом? Возможно, дифференцирующий механизм связан с двумя рецепторами, экспрессирующимися на мембране НК-клеток. Один из них — NKR-P1 — является основным в реализации киллерной функции данных клеток.,В результате взаимодействия этого рецептора с соответствующим лигандом на любой из возможных клеток создаются условия для реализации киллерного действия. Однако действие НК-клеток против собственных нативных клеток блокируется вторым рецептором — Ly49, способным контактировать с молекулами I класса МНС. Именно эта связь предотвращает лизис нативных собственных клеток.
Инфицированные вирусом клетки становятся чувствительными к НК-клеткам одним из двух способов. Во-первых, некоторые вирусы подавляют белковый синтез в клетках хозяина. Таким образом, усиленный синтез молекул I класса МНС , индуцированный интерфероном, может селективно блокироваться в вирус-инфицированных клетках. Это в свою очередь приведет к тому, что Ьу49-рецептор будет не в состоянии предотвращать киллерную активность НК-клеток. Вторая возможность состоит в том, что некоторые вирусы препятствуют экспрессии молекул I класса МНС, что также делает вирусинфицированные клетки объектом киллерного действия НК-клеток.
13.2.6. CD5 В-клетки
На ранних этапах антиинфекционного процесса проявляет активность особая, ’’полуспецифическая” субпопуляция В-клеток, имеющих маркер CD5, который отличает их от основной популяции В-клеток. CDS-клетки рано возникают в онтогенезе, используют о<раниченный набор V-генов при формировании антиген-распознающего рецептора (sig), способны к самовозобновлению на периферии и подчас являются основными лимфоцитами в некоторых частях организма, в частности в перитонеальной полости.
CD5 В-клетки образуют антитела в основном к полисахаридам, т.е. к тимуснезависимым антигенам 2-го типа (TI-2). Преимущественные антитела, синтезируемые этими клетками, относятся к классу IgM. Ответная реакция CD5 В-клеток на патоген начинается рано: всего через 48 часов после проникновения антигена в организм. И, наконец, данный тип В-клеток не способен дифференцироваться в клетки памяти. Вторичный ответ ни по срокам, ни по напряженности не отличается от первичного ответа.
Все эти признаки: быстрота ответа, ограниченность специфичности и ответ только на наиболее общие бактериальные антигены, отсутствие памяти, — характеризуют CD5 В-клетки как участников скорее неспецифического, чем специфического иммунного ответа.
Возможно, CD5 В-клетки в эволюционном смысле являются предшественниками функционально более совершенных, клонально несравнимо более разнообразных истинных В-клеток.
13.3. СПЕЦИФИЧЕСКИЙ ИММУНИТЕТ ПРИ ИНФЕКЦИИ
Антагонистические отношения между патогенами самой различной природы и инфицируемым хозяином приводят к разнонаправленным адаптационным процессам, в основе которых лежит все та же необходимость выжить в конкретных условиях среды. С одной стороны, патоген “стремится” преодолеть защитные механизмы хозяина, модифицируя посредством отбора свою антигенную и биосинтетическую характеристику. С другой стороны, та же потребность — выжить под натиском патогенов — определяла совершенствование механизмов иммунной защиты. Думается, что одним из движущих факторов (хотя и не единственным) эволюционного становления и совершенствования специфического иммунитета явилась способность микроорганизмов посредством мутационных изменений ускользать от защитных сил хозяина. Примером способности патогенов препятствовать защитным иммунным механизмам может служить возбудитель чумы Yersinia pestis. Возбудитель чумы обладает белком, который получил название — белок I, или белок рНб. При физиологически нормальных значениях pH окружающей среды (7,2-7,4) данный белок не экспрессируется. Его появление на поверхности клеточной стенки регистрируется при кислых значениях pH. Как известно, такие значения pH характерны для фаголизосом фагоцитирующих клеток — наиболее активных участников врожденного, неспецифического иммунитета. Экспрессия белка I на клеточной стенке возбудителя чумы защищает патоген от протеолитического действия лизосомальных ферментов. Неслучайно чума относится к группе особо опасных инфекционных заболеваний человека.
Ясно, что способность определенных возбудителей преодолевать барьер врожденного иммунитета привела в эволюции к развитию дополнительных адаптационных механизмов защиты. Однако сразу следует оговориться. Патоген был существенным, но не единственным фактором эволюционного становления и развития специфического иммунитета (см. главу 20).
Развитие острой инфекции с включением специфических иммунных форм защиты можно разбить на ряд этапов. 1. Начало инфекционного процесса — этот этап характеризуется моментальным включением неспецифических форм иммунного реагирования. 2. Индукция специфического ответа — этап, обусловленный неспособностью врожденного иммунитета нейтрализовать патоген; в результате начинается формирование пула антигенспеци-фических Т- и В-клеток; на фоне раннего развития специфического ответа происходит размножение и накопление патогена. 3. Через 4-5 дней от момента заражения сформированные клоны Т- и В-клеток начинают атаку на патоген, завершающуюся его уничтожением. 4. Заключительный этап характеризуется накоплением специфических к патогену клеток памяти. В результате завершения инфекционного процесса с участием факторов специфической иммунной защиты формируется состояние протективного иммунитета к конкретной инфекции.
13.3.1. Т-клетки в антиинфекционном иммунитете
Первый этап в развитии специфического иммунного ответа на инфекцию связан с активацией Т-клеток в ближайшем к месту проникновения патогена лимфатическом узле. Именно в лимфоидном органе возможна специфическая сенсибилизация таких лимфоцитов. Как было рассмотрено выше (гл.9), антиген (патоген) из тканей проникает в ближайшие лимфатические узлы по лимфатическим сосудам. Если он попадает непосредственно в кровеносное русло, то основным местом формирования иммунного ответа становится селезенка. Антиген в лимфоидной ткани захватывается специализированными антигенпрезентирующими клетками, с тем чтобы представить фрагменты антигена в иммуногенной форме на поверхности этих, клеток. Среди постоянно циркулирующих через лимфоидную ткань Т-клеток задерживаются только те, которые имеют соответствующие по специфичности антиген-распознающие рецепторы. Понятно, что таких преадаптированных клеток очень немного. Основная же масса Т-клеток выходит из конкретного лимфоидного органа и вступает в новый цикл рециркуляции. Молекулярные механизмы проникновения Т-клеток в органы и выход из них рассматривались в главе 9.
Распознавшие антиген наивные CD4 Т-клетки дифференцируются в эффекторы одного из двух классов — либо в хелперные CD4 Т-клетки (Тн2), либо в CD4 Т-клетки воспаления (Тн1). Этот этап развития адаптивного иммунитета имеет критическое значение, так как определяет характер самого ответа — будет ли в нем доминировать гуморальное звено в виде продукции специфических антител (участие Тн2) или же процесс пойдет по линии активации макрофагов (участие Тн1).
Понимание возможного механизма, контролирующего этот этап дифференцировки CD4 Т-клеток, пришло из опытов in vitro. Было показано, что CD4 Т-клетки, стимулированные in vitro в присутствии ИЛ-12 и интерферона-у, развиваются в CD4 Т-клетки воспаления (Тн1) При этом интерферон-у подавляет пролиферацию хелперных CD4 Т-клеток (Тн2). Для внутриклеточных патогенов (вирусов, некоторых бактерий) подключение к ответу ТН1 Т-клеток обеспечивает активацию макрофагов и, как следствие, — разрушение внутриклеточного патогена. Источником ИЛ-12 и интерферона-у являются макрофаги и натуральные киллеры (НК) — участники неспецифической формы защиты. Таким образом, данные типы клеток как бы передают эстафету от неспецифической защиты к специфической и определяют преемственность между ними.
В условиях, когда наивные CD4 Т-клетки получают костиму-лирующий сигнал от ИЛ-4, развитие направляется в сторону хелперных CD4 Т-клеток (Тн2). Созревающие и зрелые Тн2-клетки продуцируют ИЛ-4 и ИЛ-5. Первый из этих двух цитокинов подавляет дифференцировку Т-клеток воспаления (Тн1). В результате доминирует формирование гуморального иммунного ответа.
Процесс коммитирования в ту или иную сторону развития наивных CD4 Т-клеток зависит также от плотности антигена на антигенпрезентирующих клетках. При внутриклеточной локализации патогена экспрессия антигенных фрагментов этого патогена в комплексе с молекулами II класса выражена сильнее, чем в ситуации, когда основным местом пребывания патогена является экстрацеллюлярная среда. Эти различия определяют доминантное включение в ответ либо Тн1, либо Тн2. При высокой плотности антигена на антигенпрезентирующих клетках дифференцировка наивных CD4 Т-клеток смещается в сторону образования CD4 Т-клеток воспаления.(Тн1). Напротив, при низкой плотности антигена формируются в основном хелперные CD4 Т-клетки (Тн2).
Созревание Т-клеток сопровождается изменением в экспрессии адгезивных молекул клеточной поверхности, которые способствуют миграции армированных, прошедших дифференцировку Т-клеток из лимфоидной ткани в очаг локализации патогена. Все армированные, эффекторные Т-клетки теряют L-селектин, кото-334
рый был необходим им при хоминге наивных Т-клеток в лимфоидную ткань в начале развития инфекции. В то же время они приобретают новые адгезивные молекулы. Наиболее выраженной экспрессией характеризуется интегрин VLA-4, который взаимодействует с VCAM-1 (сосудистая клеточная адгезивная молекула-1). Экспрессия этого адгезина на эндотелиальных клетках сосудов в месте проникновения патогена индуцируется цитокинами (монокинами) макрофагов в самом начале развития инфекции.
Процесс созревания и миграции цитотоксических CD8 Т-клеток в зону проникновения вируса аналогичен тому, который известен для CD4 Т-клеток.
В заключение этого раздела следует заметить, что в условиях конкретного ответа на тот или иной антиген дифференцировка наивных CD4 Т-клеток в сторону либо CD4 Т-клеток воспаления (Тн 1), либо хелперных CD4 Т-клеток (Тн2) не имеет абсолютного значения. Так, преимущественное накопление ТН1 при внутриклеточном размножении патогена не означает полного отсутствия ан-тигенспецифических Тн2 и синтеза антител, также как при внеклеточном размножении микроорганизмов доминантное участие в ответе Тн2 не исключает реактивности Тн1.
13.3.2. В-клетки в антиинфекционном иммунитете
Клоны В-клеток, специфичные к белковым антигенам, не могут вступить в ответную реакцию созревания и продукции антител на данный антиген, до тех пор пока не произойдет их взаимодействие с соответствующими по специфичности, зрелыми хелперными CD4 Т-клетками. Понятно, что функциональному созреванию В-клеток предшествует дифференцировка наивных Т-клеток.
Цепь событий, приводящих к накоплению клоноспецифических, функционально активных В-клеток и последующей продукции антител, выглядит следующим образом. Известно, что антиген (патоген), проникший в организм, усиливает миграционные процессы. В условиях антигенной стимуляции мигрирующие В-клетки проникают в лимфоидный орган (селезенку, лимфатические узлы и др.) через высокий эндотелий венул посредством тех же адгезивных молекул, которые обеспечивают миграцию Т-клеток. Встреча наивных В-клеток с хелперными CD4 Т-клетками происходит на пути В-клеток в первичный фолликул, т.е. в Т-зоне или в пограничных между Т-зоной и фолликулами районах. Именно здесь В-клетки распознают антиген и, получив стимул от хелперных Т-клеток, осуществляют накопление антигенспецифичес-кого клона. Некоторые В-клетки после дозревания до плазмоцитов начинают синтез антител здесь же, в месте встречи с Т-клетками.
Другие перемещаются в первичный фолликул, где пролиферируют, образуя центры размножения, и подвергаются отбору на аффинность. После дифференцировки до плазмоцитов начинается активный синтез высокоаффинных антител заданной специфичности.
Благодаря совместной работе Т- и В-клеток при первичной инфекции формируется специфический иммунный ответ, который не только блокирует первичное заражение, но и является залогом протективного иммунитета в будущем, при реинфицировании.
13.4. ИММУНОЛОГИЧЕСКАЯ ПАМЯТЬ
/
По определению, иммунологическая память есть способность иммунной системы отвечать более быстро и эффективно на антиген (патоген), с которым был предварительный контакт организма. Такая память обеспечивается предсуществующими антиген-специфическими клонами как В-, так и Т-клеток, которые функционально более активны в результате прошедшей первичной адаптации к определенному антигену.
Пока неясно, устанавливается ли память в результате формирования долгоживущих специализированных клеток памяти или же память отражает собой процесс рестимуляции лимфоцитов постоянно присутствующим антигеном, попавшим в организм при первичной иммунизации.
13.4.1. В-клеточная память
Общая характеристика В-клеток при вторичном ответе, которая собственно и определяет В-клеточную память, включает следующие показатели.
1. На порядок увеличивается количество специфических В-клеток, вступающих во вторичный ответ, по сравнению с количеством этих клеток при первичном ответе; так, отношение анти-генспецифических В-клеток к общему содержанию В-клеток в селезенке при первичном иммунном ответе к патогенам составляет приблизительно 1:104; в то же время при вторичном ответе это отношение равно 1:103.
2. Сокращается латентный период и раньше достигается максимум продукции антител. Для разных антигенов эти показатели варьируют, однако в среднем время латентного периода и достижения пика антител при вторичном ответе уменьшается на 2-4 дня.
3. При первичном ответе доминирует продукция IgM. Вторичный ответ характеризуется преимущественной продукцией IgG.
4. Повышается аффинность антител.
Все эти характерологические признаки В-клеточной памяти закладываются при развитии первичного иммунного ответа (см. гл. 9), когда происходит накопление антигенспецифического клона В-клеток, идет процесс его дифференцировки, осуществляется отбор клонов на наибольшую аффинность с помощью фолликулярных дендритных клеток.
При вторичном ответе принципиальные события, очевидно, те же, что и при первичном ответе. Однако в реакцию на антиген вступают уже подготовленные клетки с высокоаффинными анти-генраспознающими рецепторами. Возможно, при вторичном ответе идет дополнительное повышение аффинности рецепторов, что определяет еще большее сродство антител к антигену. Это предположение строится на экспериментальных данных по последовательному повышению аффинности антител после первичной, вторичной и третичной иммунизации.
13.4.2. Т-клеточная память
Быстрота и напряженность вторичного ответа связаны не только с активностью В-клеток памяти, но и с функциональной подготовленностью Т-клеток — наличием Т-клеток памяти.
Т-клетки памяти отличаются от наивных Т-клеток изменением экспрессии функционально значимых рецепторов клеточной поверхности (табл. 13.7).
Особое значение имеют различия по L-селектину, CD44 и CD45RO. Первые два белка участвуют в хоминге Т-клеток в лимфоидные органы и очаги проникновения патогена. В то же время CD45RO выступает в качестве передатчика сигнала внутрь клетки при формировании антигенраспознающего комплекса.
Изменение экспрессии рецепторов у Т-клеток памяти существенно отличает их от наивных Т-клеток. При этом следует помнить, что констатация подобных изменений не отвечает на вопрос: образуются ли Т-клетки памяти в результате дивергенции наивных Т-клеток в процессе дифференцировки на армированные эффекторные Т-клетки и Т-клетки памяти или же Т-клетки памяти — долгоживущая субпопуляция армированных Т-клеток. Иначе, являются ли Т-клетки памяти результатом дивергентного или монофилетического развития?
13.4.3. Роль антигена в поддержании иммунологической памяти
Успешно развившийся специфический иммунитет как заключительный этап антиинфекционной защиты разрешает, наконец, конфликт между патогеном и организмом в пользу последнего. Выздоровевший организм характеризуется отсутствием легко выявляемых эффекторных антигенспецифических клеток и ан-337
22 Зак. 3701
Таблица 13.7
Изменение экспрессии молекул клеточной поверхности на Т-клетках памяти
Молекулы клеточной поверхности Относительная экспрессия на Функция
наивных Т-клетках Т-клетках памяти
LFA-3 1 >8 лиганд для CD2, обеспечивающий адгезию клеток и передачу сигнала
CD2 1 3 обеспечивает адгезию Т-клеток и их активацию
LFA-1 1 3 обеспечивает адгезию лейкоцитов и передачу сигнала
VLA4 1 4 хоминг Т-клеток в ткани
CD44 1 2 хоминг лимфоцитов в ткани
CD45RO 1 30 изоформа CD4S с низким мол. массой; экспрессируется на Т-клетках памяти; включена в Т-клеточный рецепторный комплекс в качестве костимулятора
CD45RA 10 1 основная форма CD4S с высокой мол. массой; экспрессируется на наивных Т-клетках
L-селектин высокий уровень низкий уровень рецептор, участвующий в хоминге наивных Т-клеток в лимфоидную ткань
CD3 1 1 входит в состав Т-клеточного анти-генраспознающего комплекса
тител и наличием клеток памяти. Однако все эти факты еще не говорят о полном освобождении от антигенов, которыми обладал возбудитель. При работе с мечеными высокомолекулярными антигенами метка была обнаружена на поверхности фолликулярных дендритных клеток через несколько месяцев после иммунизации. Возможно, некоторые антигены того или иного возбудителя могут сохраняться в виде иммунных комплексов на дендритных клетках. Не исключена вероятность длительной персистенции незначительных количеств вирусов или бактериальных клеток, которым удалось “скрыться” от иммунной элиминации. Примером может служить вирус простого герпеса, длительно пребывающий в нервной ткани. Если возбудители действительно ведут себя именно так, то клонам наивных Т-клеток, покидающих тимус, постоянно предоставляется материал для распознавания и дифференцировки в армированные клоноспецифические Т-клетки, что и создает пул постоянно присутствующих подготовленных эффекторов для ответной реакции на повторное проникновение патогена.
13.S. СОВРЕМЕННЫЙ ПОДХОД К ПОЛУЧЕНИЮ ВАКЦИН
Смысл вакцинации, как об этом уже говорилось, состоит в защите людей, домашних и сельскохозяйственных животных от инфекционных заболеваний, многие из которых приводят к летальному исходу. Понятно, что в основе успешной вакцинации лежит способность иммунной системы формировать память от первичного контакта организма с чужеродными антигенами (патогенами).
Основные принципы получения эффективных вакцин хорошо известны.
1. Вакцины должны быть безвредны для организма человека и животных, т.е. у микроорганизмов, из которых готовят вакцинный препарат, должна отсутствовать генетически детерминированная патогенность (вирулентность).
2. Вакцинные микроорганизмы при потере патогенности обязательно должны сохранять иммуногенность — способность вызывать сильный иммунный ответ и формировать длительную, по крайней мере в течение нескольких лет, иммунологическую память, тем самым проявляя свои протективные свойства.
3. Для ряда инфекций, возбудители которых атакуют невос-производящиеся клетки (например, вирус полиомиелита, оккупирующий нейроны), вакцины должны индуцировать высокий титр нейтрализующих антител для предотвращения проникновения возбудителя в клетку.
4. Другие требования к производству вакцин включают ее биологическую стабильность (неизменность протекгивных свойств при длительном хранении в обычных условиях), легкость процедуры массовой вакцинации, низкую стоимость наработки вакцинного препарата.
К первой половине XX века были получены вакцины к большому набору инфекционных заболеваний. Некоторые, наиболее важные из них представлены в табл. В.1. Заметим, все они были получены эмпирическим путем, т.е. методом “проб и ошибок”. Ясно, что подобный подход значительно удлиняет достижение желаемого результата. Более того, использование нативных неразрушенных микробных клеток для получения вакцинных препаратов чревато в ряде случаев опасностями. Дело в том, что неразрушенные микроорганизмы, из которых в основном и готовят вакцинные препараты, представляют собой комплексные антигены, обладающие множеством отдельных как В-, так и Т-клеточных эпитопов. На каждый из таких эпитопов формируется свой самостоятельный ответ. Понятно, что подобный многосторонний ответ создает чрезмерное напряжение как для иммунной системы, так и для организма в целом и может сопровождаться рядом сис
темных нарушений. Так, например, необходимость ежегодной противочумной вакцинации сотрудников, работающих в природных очагах этой особо опасной инфекции, приводит достаточно часто к ряду расстройств, связанных с нарушением функционирования почек, печени, суставов.
Снижение или полную отмену побочных эффектов при вакцинации связывают с получением вакцин нового поколения. Наметилось несколько технологических подходов к разработке таких вакцин. Один из них состоит в выделении из массы отдельных антигенов инфекционных микроорганизмов тех, которые обладают наибольшим протективным эффектом, т.е. инициируют наибольшее количество соответствующих по специфичности антител или обеспечивают преимущественный рост клона специфических Т-лимфоцитов. Однако подобная процедура приводит к снижению иммуногенности выделенных антигенов. Задача состоит в получении такого вакцинного материала, который, с одной стороны, сохранял бы узкую, наиболее характерную антигенную специфичность патогена, а с другой — был бы достаточно иммуногенен для инициации сильного протективного иммунитета. В качестве носителей с адъювантным эффектом для белковых антигенов или пептидов используют иммунологически инертные полимерные молекулы L-аминокислот (например, L-лизин), химических соединений, а также липиды, организованные в гранулы (липосомы), внутри которых содержится антиген.
Другой подход к созданию вакцин нового поколения строится на применении технологии рекомбинантной ДНК. Традиционно для защиты от вирусной инфекции используют либо аттенуированные (ослабленные), либо убитые вирусы. Аттенуация вирусных частиц достигается пассажем дикого (исходного) вируса человека через культуру клеток животных (например, обезьян). Снижение патогенности вируса происходит за счет множественных мутаций той части вирусного генома, которая ответственна за его вирулентность. Существует еще один прием, состоящий в прямом удалении рекомбинантной технологией части вирусной ДНК, ответственной за вирулентность, при сохранении всех прочих участков генома и в первую очередь тех, которые обеспечивают иммуногенность вируса. Вирусы с такой рекомбинированной ДНК могут использоваться в качестве вакцины.
Точное знание участков вирусных или бактериальных ДНК, ответственных за синтез протективных антигенов, позволяет получать белковые вакцины. Отрезок ДНК для протективных белковых антигенов вводится в геном экспрессирующей клеточной культуры с тем, чтобы иметь большое количество интересующего белка. Первая белковая вакцина, при разработке которой использовалась генноинженерная технология, была получена для гепатита В.
Еще один перспективный подход к производству вакцинных препаратов получил название “иммунизация генами”. Опыты проведены на мышах. Часть ДНК, ответственная за синтез гемагглютинина вируса гриппа — достаточно сильного иммуногена, вводится в плазмиду, которая в свою очередь инъецируется в мышечную ткань. Подобная процедура обеспечивает синтез соответствующего вирусного белка — протективного антигена, сенсибилизирующего организм. Введение провоцирующей дозы вируса гриппа экспериментальным животным полностью предотвращает размножение нативного вируса. Важность подобных исследований кажется очевидной.
Помимо разработки новых вакцин, основанной на технологии рекомбинантной ДНК, ведутся исследования с использованием приемов белковой инженерии. Сведения о первичной структуре белковых антигенов, локализации В- или Т-клеточных эпитопов в структуре молекулы позволяют получать такие эпитопы синтетическим путем. Однако синтезированные пептиды теряют иммуногенность, свойственную целой молекуле. Это препятствие преодолевается использованием адъювантов. Один из них — липосомы, позволяющие доставлять антигенные пептиды непосредственно в антигенпрезентирующие клетки и тем самым обеспечивать запуск специфической реакции.
Заключение
Иммунологическая сторона инфекционного процесса представлена двумя формами защиты — неспецифическим (врожденным, наследуемым) и специфическим (приобретенным, адаптационным) иммунитетом.
Иммунный процесс развивается сразу после контакта организма с патогеном. Его можно разбить на три фазы: немедленную, длящуюся не более 4 часов (фаза I), раннюю, индукционную, проходящую от 4 часов до 4 суток (фаза II) и позднюю, специфическую, проявляющую себя после 4 суток (фаза III).
Каждая фаза характеризуется включением определенного набора неспецифических и специфических механизмов защиты. Первая фаза представляет собой чисто неспецифическую форму защиты. В ней задействованы барьерная функция кожи и эпителия, фагоцитарная реакция, альтернативный путь активации комплемента, макрофаги, натуральные киллеры. При этом отсутствуют специфические проявления Т- и В-клеток.
Во второй фазе доминируют факторы неспецифической защиты, однако идет процесс и специфической индукции иммунного ответа. Эта фаза ответа характеризуется в первую очередь развитием локальной воспалительной реакции, которая обеспечена
активностью макрофагов, компонентов альтернативного пути активации комплемента, цитокинов (ФНО-а и ИЛ-1,6,8,12), продуцируемых активированными макрофагами. При вирусной инфекции значительная роль на этом этапе принадлежит интерферонам и активированным ими натуральным киллерам. Цитокины макрофагов организуют местную воспалительную реакцию и оказывают системное воздействие, проявляющееся в повышении температуры тела, синтезе белков острой фазы. Несмотря на то, что в течение этой фазы происходит специфическая индукция адаптивного иммунитета, Т- и В-клеточные клоны еще не вступают в реакцию и находятся на стадии созревания.
Их полноценная функциональная активность проявляется лишь на третьей, заключительной стадии. Именно третий период развития защитных процессов характеризуется всеми теми специфическими событиями, которые были описаны здесь и более подробно — в главе 9.
Глава 14. ТРАНСПЛАНТАЦИОННЫЙ ИММУНИТЕТ
Введение
В самом названии феномена — трансплантационный иммунитет, скрыты как иммунологическая природа явления, так и объект действия иммунных механизмов — трансплантируемый материал. Включение таких механизмов в реализацию феномена a priori определяет наличие антигенных различий между трансплантатом и хозяином, воспринявшим данный трансплантат.
Участие иммунной системы в отторжении чужеродной ткани впервые продемонстрировал английский иммунолог П. Медавар в 1945 г. При пересадке кожного лоскута от одного кролика к другому им были обнаружены антитела у реципиента, специфичные к антигенам донора. Эти первые наблюдения явились отправной точкой для формирования одного из разделов иммунологических исследований — трансплантационной иммунологии.
Условно этот раздел можно разбить на две соподчиненные части — экспериментальную и клиническую. В первом случае задачи исследований сводятся к изучению интимных механизмов тканевой несовместимости, во втором — к практическому приложению данных эксперимента в клинике по трансплантации органов и тканей. При этом следует заметить, что трансплантационная иммунология не смогла бы оформиться в самостоятельное направление исследований, если бы перед ней не стояли практические задачи преодоления несовместимости при органной трансплантации у людей.
14.1. ОБЩАЯ ХАРАКТЕРИСТИКА ОТТОРЖЕНИЯ
Основные закономерности отторжения чужеродной ткани были выявлены при трансплантации кожных лоскутов между инб-редными линиями мышей (см. гл. 3,10). При первичной пересадке аллотрансплантата в первые два дня устанавливается общее кровообращение между трансплантатом и реципиентом, края пересаженной кожи срастаются с кожей хозяина. Внешне в течение 4-5 дней трансплантат кажется прижившимся. Однако именно в этот внешне благополучный период формируются эффекторные механизмы отторжения. К 6-7-му дню наблюдается отечность трансплантата, прекращается его кровоснабжение, развиваются геморрагии. В зоне локализации трансплантата скапливаются клетки воспалительной реакции, среди которых доминируют лимфоциты. Начинается процесс деструкции трансплантата. К. 10-11-му дню трансплантат погибает, а его пересадка на исходного донора не приводит к восстановлению жизнеспособности. Такова в самых общих чертах картина отторжения первичного трансплантата (в англ, литературе: first set rejection).
При повторной пересадке трансплантата от того же донора реакция отторжения развивается приблизительно в два раза быстрее — за 6-8 дней. Первоначальная незначительная васкуляризация трансплантата быстро сменяется тромбозом сосудов и клеточным некрозом. Иногда наблюдается особо острая форма вторичного отторжения (second set rejection) по типу “белого трансплантата”. При этой форме не происходит васкуляризации трансплантата. Процесс отмирания ткани начинается сразу после пересадки. Трансплантат остается тонким и депигментированным. Реакция вторичного отторжения специфична и не наблюдается при пересадке трансплантата от постороннего донора на исходного реципиента. В этом случае аллотрансплантат отторгается по варианту первичной пересадки.
Основными провоцирующими отторжение факторами являются молекулы (антигены) МНС. Однако при условии полной идентичности по МНС между донором трансплантата и реципиентом, но различиях по другим антигенам (так называемым минорным антигенам гистосовместимости) реакция все-таки развивается, хотя и носит хронический характер.
Изучение гистологии отторжения почечного трансплантата у людей выявило картину, в основном аналогичную той, которая описана для мышей при отторжении первичного кожного трансплантата.
14.2. ИММУННЫЕ МЕХАНИЗМЫ ОТТОРЖЕНИЯ
Основными, хотя и не единственными, эффекторами трансплантационного отторжения являются Т-клетки (см. рис. 9.6). Мыши линии nude, лишенные функционирующего тимуса и зрелых Т-клеток, воспринимают аллогенный трансплантат, но начинают его отторгать после адоптивного переноса им Т-клеток. Другой пример — перенос интактным мышам Т-клеток от сингенных мышей, отторгнувших аллогенный трансплантат. В этом случае новый хозяин развивает реакцию отторжения того же аллогенного трансплантата по вторичному типу (second set rejection).
Субпопуляционный анализ Т-клеток, участвующих в отторжении, показал, что основными эффекторами являются цитотоксические CD8 Т-клетки и CD4 Т-клетки воспаления. Последние привлекают в зону отторжения трансплантата клетки воспаления и в первую очередь макрофаги. Распознавание трансплантационных антигенов происходит либо непосредственно на клетках трансплантата, либо в ближайшей (региональной) лимфоидной ткани, куда поступает отрывающийся от клеточной поверхности антиген (рис. 9.6). Распознавание чужеродных антигенов МНС происходит одним из трех способов: 1) непосредственное распознавание молекул МНС донора Т-клетками; иначе, это та форма распознава-344
ния, при которой не образуется комплекс чужеродного пептида с молекулами I или II классов МНС; около 10% Т-клеток из обшей популяции тимуспроизводных лимфоцитов способно к такому распознаванию; 2) распознавание Т-клеточными рецепторами донорского пептида, комплексированного с молекулами МНС того же донора; 3) классическая форма распознавания донорского пептида, комплексированного с молекулами МНС реципиента.
Особое место в отторжении трансплантата играют антитела, которые по тем или иным причинам предсуществуют в организме реципиента. Такие антитела, взаимодействуя с антигенами эндотелия сосудов, пронизывающих трансплантат, инициируют систему комплемента и каскад реакций, приводящих к закупорке сосудов. Случаи “белого трансплантата” как раз и являются следствием активности предсуществующих антител.
Следует упомянуть об особой форме успешной “трансплантации”, осуществляемой самой природой. Имеется в виду плод, развивающийся в организме беременной женщины. Действительно, зародыш представляет собой гетерозиготный организм, включающий антигены как матери, так и отца, и по этой причине иммунная система матери реагирует на мужские антигены. Однако никакого иммунологического конфликта не происходит, и в условиях нормы беременность длится отведенное ей время. Одно из объяснений кажущегося парадокса состоит в представлении о барьерной функции плаценты. Трофобластические клетки, образующие внешний слой плаценты и контактирующие с тканями матери, лишены антигенов гистосовместимости и в силу этого не могут служить мишенями для цитотоксических Т-лимфоцитов или антител. Вторым фактором, который может защищать эмбрион от иммунологической атаки со стороны матери, является а-фето-протеин. Хорошо известна ярко выраженная иммуносупрессивная активность этой фетальной формы альбумина. В ситуации возможного проникновения лимфоцитов матери в кровоток зародыша а-фетопротеин блокирует иммунологическую активность сенсибилизированных лимфоцитов.
14.3. КЛИНИЧЕСКИЕ ПРОБЛЕМЫ ТРАНСПЛАНТАЦИИ
Замена поврежденных органов, особенно почек, на здоровые донорские органы стала, если не обыденным, то во всяком случае достаточно часто используемым приемом в хирургической практике. Успех трансплантации зависит от многих факторов и в первую очередь от уровня идентичности по антигенам гистосовместимости между донором трансплантата и больным реципиентом. Подбор пар для пересадки труден, так как слишком высока антигенная индивидуальность среди людей. Даже максимально возможное сходство по МНС между донором и реципиентом не ис-345
ключает значительных различий по минорным антигенам гистосовместимости. Вторым осложняющим моментом при трансплантации является возможное присутствие у пациента антител к антигенам донора трансплантата. Это обстоятельство определяет необходимость предварительного тестирования реципиента на наличие у него антител к антигенам трансплантируемого органа.
Несмотря на эти ограничения, пересадка органов с достаточно высоким процентом успешных операций стала обычной, хотя и трудной лечебной процедурой. В табл. 14.1. представлены сводные данные американских авторов по проценту трансплантатов различных органов, выживших более 5 лет (Janeway, Travers, 1994).
Таблица 14.1
Процент успешных трансплантаций различных органов, в США
Трансплантат Выживание в течение 5 лет, %
Почка Печень Сердце Легкие Кожа Роговица Костный мозг 80-90 40-50 70 выживаемость низкая результат переменный >90 80
Проведение успешной работы по трансплантации органов требует соблюдения ряда условий: 1) наличие разветвленной сети центров по трансплантологии, задача которых — сбор информации о потенциальных донорах и состоянии здоровья пациентов, ожидающих хирургического вмешательства; проведение HLA-ти-пирования как донора, так и пациента; организация максимально быстрой доставки органа в клинику: 2) организация специализированных клиник по трансплантации со штатом квалифицированных хирургов; 3) постопреационный контроль состояния хирургического больного; среди прочих терапевтических мер, применяемых к таким больным, обязательное использование иммуносупрессивной терапии: наиболее эффективными в данном случае являются циклоспорин А и FR-506, подавляющие Т-клеточную активность.
Заключение
Трансплантационная иммунология как самостоятельный раздел иммунологических знаний сразу возникла в виде экспериментально-практического направления исследований. Первые опыты П. Медавара были проведены в связи с. проблемой трансплантации кожи в ожоговой клинике. Сегодня приемы трансплантации различных органов и тканей достаточно разработаны и широко 346
применяются в профильных клиниках. Практический успех трансплантации зависит от правильного подбора пар донор:реципиент по антигенам гистосовместимости, эффективного применения иммуносупрессорных препаратов, успешной профессиональной работы хирурга. Будущее клинической трансплантологии зависит от глубокого и максимально полного понимания клеточных и гуморальных механизмов иммунного отторжения, расшифровка которых невозможна без экспериментальных усилий в исследовательских научных лабораториях.
Глава 15. ИММУНИТЕТ К ОПУХОЛЯМ
Введение
Спонтанное или индуцированное усиление клеточной пролиферации приводит к возникновению опухолей, которые в большинстве случаев являются злокачественными для организма.
Клинические и экспериментальные наблюдения указывают на участие иммунных механизмов контроля за неопластическим ростом: 1) вероятность возникновения опухолей у иммунодефи -цитых детей в 10 000 раз выше, чем у здоровых, 2) тимэктомия или врожденное отсутствие тимуса, как, например, у мышей линии nude, приводят к увеличению частототы спонтанных опухолей или к большей легкости канцерогенной индукции новообразований, 3) применение иммунодепрессивной терапии способствует возникновению неопластического роста, 4) наличие у опухолевых клеток специфических антигенов определяет развитие иммунного ответа главным образом Т-клеточного типа.
В ряде случаев опухолевые клетки приобретают способность подавлять иммунный ответ и тем самым “ускользать” из под контроля со стороны иммунной системы.
Понимание отношений опухолыхозяин определяет подход к разработке способов иммунотерапии злокачественных новообразований.
15.1. АНТИГЕННАЯ ХАРАКТЕРИСТИКА ОПУХОЛЕВЫХ КЛЕТОК
Показано, что опухоли, индуцируемые канцерогенными химическимми соединениями (например, метилхолантреном), отличаются от нормальных тканей появлением новой антигенной специфичности. Причем у разных животных индуцируемые опухоли, как правило, отличаются друг от друга по антигенным характеристикам. Более того, даже в пределах одной опухоли могут присутствовать клетки с разными антигенными специфичностями. Следствием появления новых индуцируемых антигенов является формирование специфического иммунного ответа. На рис. 15.1. представлена схема опыта, иллюстрирующего роль специфических отношений в сингенной системе переноса. При трансплантации индуцированных метилхолантреном опухолей от двух разных особей в организм интактного сингенного реципиента и одновременное введение Т-клеток от одного из доноров приводит к регрессии опухоли того донора, от которого получены Т-клетки. Опухоль второго донора успешно развивается. Опыты демонстрируют как разную антигенную характеристику опухолей, так и роль специфического иммунитета в регрессии опухоли.
Опухоли, индуцированные вирусами, также несут новые для клетки антигены. В отличие от опухолей, развивающихся при кан-348
Рис. 15.1. Опыт, демонстрирующий участие Т-клеток в элиминации сингенной опухоли
церогенной трансформации, вирусиндуцированные опухоли независимо от индивидуума, в котором они возникли, характеризуются общими антигенными свойствами. Более того, опухолевые клетки разной тканевой принадлежности будут обладать идентичными антигенами.
Антигенные изменения опухолевых клеток помимо отмеченных выше случаев могут быть связаны с точковыми мутациями в генах, контролирующих клеточные белки. Так, например, в составе молекул I класса МНС были обнаружены пептиды, отличающиеся от аналогичных пептидов нормальных клеток заменой всего одной аминокислоты.
Кроме того, описаны изменения в антигенной структуре трансформированных клеток, связанные с упрощением антигенного спектра клеточной поверхности. Достаточно давно было обнаружено, что некоторые типы опухолей теряют определенные антигены групп крови. Относительно недавно была продемонстрирована делеция генов I класса МНС у спонтанно возникшей опухоли. Ясно, что при упрощении антигенной структуры опухолевых клеток иммунная система не в состоянии элиминировать трансформированные клетки. Возможно, при такой ситуации развиваются механизмы, действующие по принципу аллогенной ингибиции (см. гл. 11).
Помимо опухолевых антигенов, отличающихся структурными особенностями от антигенов пораженного организма, имеются так называемые ‘“эмбриональные”, или “онкофетальные” антигены. Эти стадиоспецифические антигены экспрессируются только на зародышевых клетках, но начинают продуцироваться у взрос-349
лых онкологических больных при некоторых типах опухолевого поражения. К данной категории антигенов относится, в частности, а-фетопротеин, впервые обнаруженный Г.И. Абелевым в начале 60-х годов в клетках гепатокарциномы. Появление в сыворотке больных а-фетопротеина является диагностическим признаком онкологического поражения печени.
Таким образом, антигенная модификация злокачественно трансформированных клеток происходит в результате: 1) действия канцерогенных соединений, 2) инфицирования клеток онкогенными вирусами, 3) точковых мутаций генов, контролирующих поверхностные клеточные белки, 4) делеции генов, ответственных за синтез определенных антигенов, 5) дерепрессии генов, контролирующих эмбриональные белки. Три первых формы антигенных изменений подразумевают включение иммунной системы защиты от неопластиических поражений. Две последние формы в силу характера антигенных изменений не в состоянии вызвать специфический ответ. Возможно, что в этих случаях контроль за нео-пластичеим ростом осуществляется посредством механизмов аллогенной ингибиции.
15.2. ИММУНОЛОГИЧЕСКИЙ НАДЗОР И МЕХАНИЗМЫ ПРОТИВООПУХОЛЕВОГО ИММУНИТЕТА
В начале 60-х годов известный австралийский ученый М. Бернет выдвинул концепцию иммунологического надзора, по которой иммунная система конкретного индивидуума срабатывает всегда, когда сталкивается с признаками генетически чужеродной информации. Иначе, иммунитет призван не только осуществлять антиинфекционную защиту, но главным образом обеспечивать генетическую целостность соматических клеток организма в течение его индивидуальной жизни. Среди прочих факторов, с которыми имеет дело иммунологический надзор, особое место занимают злокачественно перерожденные клетки. По представлениям М. Бернета, онкологические заболевания проявлялись бы в значительно большем числе случаев и в гораздо более раннем возрасте, если бы отсутствовал иммунологический контроль за потоком мутационно измененных клеток.
Т-клетки. Среди иммунологических факторов, принимающих участие в защите организма от неоплазм, юминирующая роль принадлежит клеточной форме защиты. Наиболее активными клетками в разрушении опухоли являются CD8 Т-клетки и Т-хелперы. Если CD8 Т-клетки выполняют прямую киллерную функцию,то Т-хелперы способствуют ее успешной реализации. Помощь со стороны Т-хелперов осуществляется через секретируемые цитокины. Среди них наибольшую роль играет интерферон-у, который стимулирует макрофаги и увеличивает активность НК клеток. Ин-350
формация о противоопухолевом действии CD8 Т-клеток пришла в основном из опытов по лизису вирустрансформированных клеток in vitro и in vivo. Цитолитическое действие примированных CD8 Т-клеток наблюдали как в клеточной культуре, так и системе адоптивного переноса in vivo. Активность CD8 Т-клеток проявляется в результате распознавания комплекса — пептид опухолевого анти-генагмолекула I класса МНС. Представленные выше опыты по генетической рестрикции взаимодействия CD8 Т-клеток с клетками-мишенями, модифицированными вирусом (гл. 3 и 9), прямо указывают на роль молекул I класса в процессе распознавания вирусного антигена. К тому же, антитела против молекул I класса МНС блокируют лизис вирусиндуцированных опухолевых клеток.
В-клетки. Участие клеток В-системы в противоопухолевом иммунитете может проявляться несколькими способами: 1) разрушением опухолевых клеток антителами, фиксирующими комплемент, 2) накоплением НК-клеток, имеющих на своей поверхности цитофильные антитела. Данные формы активности антител продемонстрированы in vitro. Однако не ясно, имеют ли они место in vivo. Более того, показано, что в ряде случаев с солидными опухолями специфические антитела блокируют эффект цитотоксических клеток.
Натуральные киллеры (НК). Другим типом клеток, осуществляющих иммунологический надзор и участвующих в уничтожении трансформированных клеток, являются НК. Они относятся к лимфоидным клеткам, но при этом лишены маркеров Т- и В-лимфоцитов. Набор клеток, подвергающихся литическому действию НК, достаточно широк. Это — ряд вирусинфицированных и опухолевых клеток, клеток, на поверхности которых представлены цитофильные антитела, эмбриональные клетки. Несмотря на то что НК морфологически напоминают лимфоциты или лимфобласты, их гистогенетическая связь с Т- или В-лимфоцитами не установлена. Вероятно, НК относятся к самостоятельной линии дифференцировки, хотя на самых ранних этапах развития у них имеется общий с лимфоцитами предшественник. В отличие от лимфоцитов, НК не имеют антигенраспознающих рецепторов, не увеличиваются количественно после взаимодействия с чужеродным (например, вирусным) антигеном и не спрособны к формированию иммунологической памяти. При этом их активность повышается под влиянием цитокинов Т-клеток и в первую очередь интер-лейкина-у.
Особая роль НК в противоопухолевом иммунитете подтверждается не только прямыми наблюдениями in vitro, но и сравнительными данными по активности этих клеток у мышей инбредных линий. Различные линии этих животных характеризуются индивидуальным уровнем НК, и этот уровень коррелирует со спо-351
собностью развивать антиопухолевую защиту. У мышей с высоким уровнем НК спонтанные или индуцируемые опухоли встречаются редко. У мышей с низким исходным уровнем НК частота спонтанных опухолей, напротив, высокая. Трансплантация клеток от линий мышей с высоким уровнем НК линиям с низким содержанием этих клеток обеспечивает защиту последних от некоторых форм опухолей. Клинические данные также демонстрируют связь между уровнем НК в периферичекой крови больных и интенсивностью роста опухоли.
Одной из характеристик НК является наличие Fc-рецептора. Казалось бы, способность НК связывать антитела должна обеспечивать лизис опухолевых клеток в процессе развития реакции защиты, однако четких доказательств такой возможности пока нет.
Макрофаги. В опытах in vitro установлено, что макрофаги, активированные цитокинами Т-клеток, оказывают определенное противоопухолевое действие. Оно может быть связано как с явлением прямого фагоцитоза опухолевых клеток, так и с процессом, опосредованным ФНО-а, секретируемым фагоцитирующими мо-нонуклеарами. Какого-либо бесспорного доказательства противоопухолевой активности макрофагов in vivo пока не получено.
Таким образом, наиболее активными участниками противоопухолевого иммунитета являются два типа клеток: Т-лимфоциты и НК. Понимание роли макрофагов и антител в этом процессе требует дополнительного изучения.
15.3. ПРЕОДОЛЕНИЕ ИММУНОЛОГИЧЕСКОГО НАДЗОРА ОПУХОЛЕВЫМИ КЛЕТКАМИ
В основе преодоления опухолевыми клетками иммунологического надзора лежат явления, связанные, с одной стороны, с нарушением в работе иммунной системы (врожденные и приобретенные иммунодефициты, возрастное снижение иммунной реактивности), а с другой — с наличием у злокачественно перерожденных клеток механизмов, блокирующих успешное проявление иммунной реактивности.
В тех случаях, когда у опухолевых клеток происходит делеция генов I и II классов МНС, специфические для опухоли антигены не могут экспрессироваться в иммуногенной форме для их распознавания и последующего цитолиза CD8 Т-клетками.
Другое ограничение для успешной реализации иммунологического контроля — отсутствие у большинства опухолей костиму-лирующих (В7) и адгезивных (ICAM) молекул. Подобное обстоятельство также препятствует проявлению активности Т-клеток (см. гл. 3 и 9).
Известны примеры, когда опухолевые клетки избегают им-мунолгической атаки посредством интернализации антигена. Об-352
разовавшийся комплекс опухолевого антигена со специфическим антителом поглощается клеткой. В результате происходит отбор клеток, лишенных исходного антигена, но сохранивших способность к усиленной пролиферации.
Помимо молекулярно-структурных способов преодоления противоопухолевого иммунитета, некоторые типы злокачественных новообразований способны “защищать” себя в активной форме, секретируя так называемый трансформирующий ростовой фактор р (ТРФ-р). ТРФ-Р либо подавляет активность CD4 Т-клеток воспаления, либо активирует Т-супрессоры, препятствуя тем самым полноценному развитию клеточного иммунитета.
Итак, организм с онкологическими нарушениями представляет собой как бы арену борьбы двух начал — иммунной системы и активно пролиферирующих злокачественных опухолевых клеток. Задача онколога-клинициста определить такие способы терапии, которые создавали бы условия для более успешной работы иммунной системы, причем в связи с разнообразием форм злокачественных поражений и общего состояния больного каждый раз подход к лечению должен носить индивидуальный характер.
15.4. НЕКОТОРЫЕ ПОДХОДЫ К РАЗРАБОТКЕ СПОСОБОВ ИММУНОТЕРАПИИ ЗЛОКАЧЕСТВЕННЫХ ОПУХОЛЕЙ
Один из очевидных способов иммунотерапии злокачественного роста основан на принципе специфической стимуляции иммунной системы. В эксперименте иммунизация животных убитыми опухолевыми клетками создает специфическую защиту от живых трансплантируемых клеток.
Другой прием создания противоопухолевой защиты основан на неспецифической стимуляции иммуннолго ответа широким набором агентов. Точкой приложения стимуляторов в данном случае выступают, как правило, макрофаги. Одним из наиболее изученных препаратов этой группы является туберкулезная вакцина БЦЖ. Введение вакцины внутрь опухоли приводит к заметному подавлению опухолевого роста или даже к полной регрессии новообразования. Определенные успехи использования БЦЖ в клинике получены при лечении меланом. Способ применения вакцины, как и в условаиях эксперимента, основан на прямом ее введении в опухоль.
Понимание молекулярных механизмов распознавания антигена привело в последние годы к разработке приемов иммунотерапии, основанных на повышении иммуногенности опухолевых антигенов. Как описывалось выше (гл. 3 и 9), созревание CD8 Т-клеток до зрелых цитотоксических эффекторов включает не только распознавание комплекса пептид:молекула I класса МНС, но 353
23 Зак. 3701
и костимулирующее действие рецептора В7 антигенпрезентирующих клеток. В эксперименте введение гена В7 в геном опухолевых клеток обеспечивает успешное специфическое созревание CD8 Т-клеток, что проявляется в эффективном лизисе этих клеток. Более того, при повторном введении примированным животным тех же опухолевых клеток, но лишенных трансфецированного гена В7 наблюдается тот же результат — эффективный лизис трансплантированных клеток.
Другой способ повышения цитотоксического действия CD8 Т-клеток включает введение в геном опухолевых клеток участка ДНК, кодирующего тот или иной цитокин (ИЛ-2, ИЛ-4). В процессе распознавания опухолевых антигенов наивными CD8 Т-клетками цитокины опухолевых клеток способствуют успешному созреванию цитотоксических эффекторов.
Экспериментально разработанные приемы повышения эффективности созревания CD8 Т-клеток легко адаптировать к условиям онкологической клиники.
Кроме отмеченных подходов к иммунотерапии онкологических больных разрабатываются и другие, в частности, использующие моноклональные антитела, конъюгированные с фармакологическими препаратами. Предполагается, что адресное действие препаратов обеспечит уничтожение опухолевых клеток, не затрагивая здоровые клетки того же тканевого происхождения.
Заключение
Одной из характеристик злокачественно трансформированных клеток является появление у них новых, неизвестных для нормальных клеток антигенных особеностей. Антигенная модификация происходит за счет индуцируемых или спонтанных мутаций в геноме клеток. Опухолевые антигены инициируют развитием противоопухолевого иммунитета, однако сила иммунного ответа к опухолям часто незначительна либо из-за недостаточной иммуногенности опухолевых антигенов, либо в силу продукции злокачественно измененными клетками супрессорных факторов.
Задача онкологов сводится к разработке приемов повышения иммунной реактивности пораженного организма. Один из наиболее эффективных подходов к иммунотерапии опухолей состоит в использовании молекулярно-генетических приемов управления противоопухолевым иммунитетом.
Часть IV. НАРУШЕНИЯ ИММУНИТЕТА
Глава 16. РЕАКЦИИ ГИПЕРЧУВСТВИТЕЛЬНОСТИ
Введение
Определенные формы антигена при повторном контакте с организмом могут вызвать реакцию, специфическую в своей основе, но включающую неспецифические клеточные и молекулярные факторы острого воспалительного ответа. Известны две формы повышенной реактивности: гиперчувствительность немедленного типа и гиперчувствительность замедленного типа. Первый тип реакции проявляется при участии антител IgE, которые цитофильны по отношению к тучным клеткам и базофилам — продуцентам медиаторов воспаления, а также IgG. Второй тип реализуется с помощью Т-клеток воспаления (Тн 1; другое обозначение этих клеток — Тгзт) как основных эффекторов реакции, обеспечивающих накопление в зоне воспаления макрофагов.
Впервые гиперчувствительность замедленного типа наблюдал немецкий бактериолог Р.Кох в конце прошлого века. Введение туберкулезных бацилл в кожу зараженного туберкулезом животного вызывает через 1-2 суток сильное местное воспаление с образованием гранулем. У интактных животных такая инъекция приводит лишь к очень слабой кратковременной реакции.
В 1902 г. Рише и Портье, изучая антитоксический иммунитет к яду морской анемоны, описали феномен анафилактического шока. Повторное внутривенное введение предварительно иммунизированным собакам яда в количестве, значительно меньшем летальной дозы, приводило к развитию острой системной реакции, проявляющейся в спазме сосудов, коллапсе и гибели животных. Введение яда в кожу иммунизированным животным провоцировало только местную реакцию воспаления.
В то же время Артюс описал одну из форм местной аллергической реакции. Исследователь работал с нетоксическими формами антигена. Первая инъекция такого антигена в кожу либо не вызывала реакции, либо она была очень слаба. Повторное введение того же антигена в ряде случаев приводило к интенсивной инфильтрации места инъекции полиморфноядерными лейкоцитами, геморрагической реакции, некрозу сосудов.
Еще один феномен, связанный с аллергической реакцией, был обнаружен при широком применении лошадиных антидифтерийных и антистолбнячных сывороток для лечения соответствующих заболеваний. Введение значительного количества этих сывороток на поздних этапах лечения иногда приводит к системной реакции, сопровождающейся повышением температуры, высыпанием, крапивницей, а в ряде случаев — поражением суставов и
почек. Феномен получил название сывороточной болезни, так как связан с образованием антител к белкам вводимой сыворотки.
Способность развивать все эти аллергические реакции в интактном организме можно инициировать с помощью переноса сыворотки от больных доноров. Причем сенсибилизированный подобным способом реципиент при введении разрешающей дозы аллергена разовьет столь же быстрый ответ повышенной чувствительности, что и донор сыворотки.
Если гиперчувствительность немедленного типа можно передать с помощью сыворотки, то инициировать гиперчувствительность замедленного типа в интактном организме возможно только при адоптивном переносе жизнеспособных лимфоидных клеток от сенсибилизированного донора. Как и у донора, время развития реакции замедленного типа у пассивно сенсибилизированного рецепиента достигает 1-2 суток. Эти первые результаты ясно указывали на то, что в основе двух типов повышенной чувствительности лежат разные механизмы.
16.1. ГИПЕРЧУВСТВИТЕЛЬНОСТЬ НЕМЕДЛЕННОГО ТИПА
Аллергия есть реакция повышенной чувствительности немедленного типа в ответ на ряд веществ внешней среды с антигенными свойствами. В связи с характером индуцируемой этими антигенами реакции их называют аллергенами. Аллергические реакции имеют широкое проявление — от воспаления слизистой носа и чихания до анафилактического шока, приводящего подчас к летальному исходу (табл. 16.1). Несмотря на разнообразную симпто-
Таблица 16.1
Аллергические реакции, обусловленные антителами класса IgE
Синдром Аллергены Способ проникновения аллергена в организм Характер ответа
Системная анафилаксия лекарства, гетерологичная сыворотка, яды животных внутривенный увеличение проницаемости сосудов, эдема, нарушение дыхания, коллапс, смерть
Аллергичес- пыльца (амброзии, через дыха- покраснение, раздражение
кий ринит (сенная лихорадка) тимофеевки, березы, др. растений) тельные пути слизистой носа
Бронхиальная пыльца, фекалии через дыха- спазм бронхов, увеличе-
астма клешей пыли тельные пути ние отделяемого слизистой, воспаление дыхательных путей
Поражение кожи укусы насекомых, кожные пробы на аллергию внутрикожный локальное увеличение проницаемости сосудов, локальное покраснение
Пишевая аллергия крабы, молоко, яйца, рыба, др. через рот рвота, понос, крапивница
матику, в основе аллергических проявлений лежит общий механизм
16.1.1. Аллергический ринит (сенная лихородка)
В качестве примера можно взять реакцию на пыльцу растений (сенную лихорадку). Первая встреча с аллергеном не приводит к проявлению каких-либо признаков повышенной чувствительности. Однако проникшая через дыхательные пути пыльца сенсибилизирует организм через активацию как В-, так и Т-клеток. Продукция антител класса IgE начинается после распознавания аллергена В-клетками и их взаимодействия с хелперными Т-клетками (Тн2), секретирующими интерлейкин-4. Как уже отмечалось ранее, этот цитокин обеспечивает переключение внутриклеточного синтеза иммуноглобулинов В-клетками на продукцию IgE. Образовавшийся IgE взаимодействует с соответствующим рецептором (Fc R) на поверхности тучных клеток. На этой стадии завершается сенсибилизация организма после первичной встречи с аллергеном. Когда пыльца растения того же вида вновь попадает в дыхательные пути, белки такой пыльцы проникают через эпителий в подслойку, где они взаимодействуют с предсуществующим на поверхности тучных клеток IgE. Факт образования комплекса антиген-антитело на мембране тучных клеток является сигналом к активному выбросу медиаторов этими клетками, что вызывает быстрое развитие симптома, получившего название аллергический ринит, или сенная лихорадка.
С целью предотвращения аллергических проявлений используется прием десенсибилизации пациентов. Основу этого приема составляет контролируемое по дозе и времени введение специфического аллергена в организм больного. Механизм десенсибилизации до конца неизвестен. Предполагается, что дополнительная экспозиция к аллергену обеспечивает продукцию антител IgG и IgA, блокирующих аллерген и тем самым препятствующих его взаимодействию с IgE.
Две основные особенности IgE-зависимой аллергии требуют специального пояснения. Во-первых, не все вещества, обладающие антигенными свойствами, способны выступить в качестве аллергенов. Из этого следует, что для веществ, способных обеспечить повышенную реакцию, существуют какие-то особые условия, отличающие их от обычных антигенов. Во-вторых, не все индивидуумы, находящиеся в идентичных условиях среды, отвечают реакцией на аллерген. Ясно, что в этом случае подверженность аллергии генетически детерминирована. Большинство аллергенов являются относительно низкомолекулярными, растворимыми белковыми молекулами, которые вдыхаются в составе сухих частиц,
таких как зерна пыльцы или фекалии клещей. При попадании во влажную среду дыхательных путей аллерген быстро растворяется и проникает в слизистую. Доза аллергена, вызывающая реакцию, крайне мала. По специально проведенным подсчетам подверженный сенной лихорадке индивидуум получает в год не более 1 мкг аллергена из пыльцы амброзии. Низкая доза аллергена благоприятствует активации хелперных Т-клеток (Тн2), продуцирующих интерлейкин-4.
Б целом аллергены, проникающие в организм через дыхательные пути, характеризуются следующими особенностями: (1) все они являются белками, относящимися к категории Т-зависи-мых антигенов; (2) их высокая растворимость в условиях влажной среды дыхательных путей способствует быстрой диффузии из вдыхаемых частиц; (3) низкий молекулярный вес обеспечивает им относительно свободное проникновение в слизистую, (4) низкая провоцирующая доза благоприятствует включению в ответ хелперных CD4 Т-клеток; продукция этими клетками интерлейки-на-4 обеспечивает переключение синтеза иммуноглобулинов в В-клетках на IgE.
Предрасположенность к аллергии генетически детерминиро-
Таблица 16.2
Корреляция между DR-аллелями HLA-комплекса человека и способностью к продукции антител IgE в ответ на отдельные белки
аллергенов
Аллерген Белок Молекулярная масса, Да Связь ответа IgE с аллелями DR
Пыльца амброзии Amb а V 5 000 DR2
Amb а VI 11 500 DR5
Amb t V 4 400 DR2
Пыльца различных трав Lol р I 27 000 DR3
Lol p II 11 000 DR3
Lol p III 11 000 DR3
вана. В табл. 16.2 показана корреляция между генотипом по генам II класса МНС и способностью отвечать продукцией IgE в ответ на аллергены из пыльцы амброзии и различных трав.
Установление такой коррелятивной связи, возможно, говорит о том, что пептиды представленных белков образуют эффективный иммуногенный комплекс с молекулами выявленных DR-аллелей.
16.1.2. Анафилактический шок
Острота проявления аллергической реакции зависит от дозы и способа проникновения аллергена в организм. Если аллерген по тем или иным причинам поступает в организм систематически, то 358
происходит массированная активация тучных клеток цитофиль-ным IgE и в том числе клеток, которые локализованы в соединительной ткани в непосредственной связи с кровеносными сосудами. Рано или поздно наступает момент, когда уровень сенсибилизации организма достигает определенного предела. В этих условиях внутривенное проникновение аллергена вызовет острую системную реакцию, получившую название анафилактический шок. Эта реакция сопровождается увеличением проницаемости сосудов, приводящим к катастрофическому падению кровяного давления, бронхоспазмом, первоначальным возбуждением и последующим угнетением центральной нервной системы.Смерть может наступить в результате паралича дыхательного центра.
Наиболее часто острая аллергическая реакция в виде анафилактического шока проявляется к пенициллину. Он действует как гаптен. Введенный в организм пенициллин образует ковалентную связь с аминотруппой собственных белков пациента. Такой сформировавшийся конъюгат активирует ответ Т-клеток к белковому носителю и В-клетки — к антибиотику. Результатом будет анафилактический шок.
Таблица 16.3
Значение способа проникновения аллергена и его дозы в развитии различных форм аллергических реакций, обусловленных антителами IgE
Локализация тучных клеток Способ проникновения аллергена; доза Характер реакции
Соединительная внутривенный; анафилактический шок; генерализо-
ткань высокая подкожный или внутрикожный; низкая ванное выделение гистамина, расширение сосудов, падение кровяного давления; в крайних случаях — коллапс, смерть кожная аллергическая реакция; локальное выделение гистамина, вздутие, покраснение
Слизистая через дыхательные пути; низкая через рот аллергический ринит при поражении верхних дыхательных путей; бронхиальная астма при поражении нижних дыхательных путей; спазм гладкой мускулатуры бронхов, локальное расширение сосудов пищевая аллергия: сыпь, крапивница, спазм гладкой мускулатуры кишечника, рвота, понос
Значение способа проникновения аллергена в организм и его дозы для развития различных форм аллергической реакции, обусловленной антителами класса IgE, представлены в табл. 16.3.
16.1.3. Гиперчувствительность, обусловленная антителами IgG
Помимо аллергических реакций, зависящих от IgE (1 тип реакций гиперчувствительности), имеются реакционные состояния, причиной которых являются антитела класса IgG. Среди них — реакция IgG с молекулами, фиксированными на клеточной поверхности или внеклеточном матриксе (II тип реакций). Иногда этот тип гиперчувствительности развивается при длительном применении лекарственных препаратов. Так, например, квинидин — препарат, используемый при аритмии сердца, способен сорбироваться на эритроцитах. При наличии предсуществуюших или индуцированных специфических антител класса IgG происходит взаимодействие этих антител с препаратом на поверхности эритроцитов. В результате включения в реакцию комплемента наблюдается массированная гибель эритроидных клеток. Данный тип реакции встречается редко.
III тип гиперчувствительности реализуется в условиях, когда IgG взаимодействует с растворимым антигеном. Патологическое состояние развивается при локализации агрегатов антигена с антителом (иммунных комплексов) в определенных тканевых участках. Иммунные комплексы образуются при любом гуморальном ответе. Однако не во всех случаях они являются патогенетическим фактором, и связано это в первую очередь с их размерами. Достаточно крупные комплексы после взаимодействия с комплементом усваиваются фагоцитами и затем выводятся из организма. Б то же время малые комплексы, образующиеся в условиях избытка антигена, могут сорбироваться на стенках сосудов и таким образом выступать в качестве первопричины сосудистого повреждения. В условиях, когда организм имеет предсуществующие IgG-антитела, а специфический антиген проникает в кожу, развивается локальный воспалительный процесс, получивший название реакции Артюса. Образующийся в тканевых слоях комплекс активирует систему комплемента, в результате чего накапливаются компоненты С5а,СЗа — медиаторы воспаления. Они в свою очередь обеспечивают начало локального воспалительного ответа, усиливая проницаемость сосудов. Как следствие в очаге воспаления накапливаются нейтрофилы, тромбоциты, увеличивается объем жидкости. Как и любой другой воспалительный ответ, реакция Артюса носит защитный характер, препятствуя проникновению антигена во внутренние области организма.
Введение в интактный организм большого количества чужеродного белка часто приводит к развитию особой формы повышенной чувствительности — сывороточной болезни. Б настоящее время специфическую антисыворотку лошадей используют в основном для лечения лиц, пострадавших от укуса ядовитых змей. В
зависимости от видовой принадлежности змей такие антисыворотки называются анти-кобрин, анти-порзин и т. д. Кроме того, до эры антибиотиков антисыворотка применялась для борьбы с инфекционными заболеваниями. Лечебный эффект таких антисывороток бесспорен. Однако параллельно с защитой от патогенов или ядов возникали осложнения, связанные с процессом иммунизации пациентов чужеродными белками введенной антисыворотки. В результате инъекции антисыворотки начинается образование антител класса IgG к чужеродным белкам ( в представленных примерах — к белкам сыворотки лошади). Образовавшиеся антитела взаимодействуют с оставшимися после инъекции белковыми антигенами, образуя комплексы антиген:антитело. Патогенетическое действие комплекса проявляется в повышении температуры тела, лихорадке, крапивнице, кожном зуде, протеинурии. Состояние повышенной чувствительности проходит без каких-либо рецидивов, как только антиген полностью элиминируется из организма.
Как и для гиперчувствительности, обусловленной IgE, для развития различных форм заболеваний, связанных с IgG, критическое значение имеют дозы и способ проникновения антигена в организм. В табл. 16.4. представлен ряд патологических состояний, которые наблюдаются при IgG-зависимой гиперчувствительности немедленного типа.
Таблица 16.4
Значение дозы и способа проникновения антигена в организм для развития различных форм патологий иммунных комплексов
Способ проникновения антигена Патология Место локализации иммунных комплексов .
Внутривенный (высокая доза) Подкожный (низкая доза) Респираторный васкулит нефрит артрит реакция Артюса легочное заболевание фермера (Farmer’s lung) стенки кровеносных сосудов почечные клубочки сочленение суставов периваскулярная область пространство вокруг кап-пиляров альвеол
16.1.4. Медиаторы аллергических реакций
Имеется два основных класса химических медиаторов, ответственных за реакции гиперчувствительности немедленного типа. Предсуществующие, или первичные, медиаторы являются молекулами, которые уже накоплены в гранулах тучных клеток и базофилах и начинают секретироваться в эстрацеллюлярную среду сразу после контакта клетки с антигеном. Эти медиаторы представлены
четырьмя основными видами молекул: 1) вазоактивными аминами — гистамином, серотонином, 2) хемотаксическими факторами для гранулоцитов, 3) энзимами, 4) протеогликанами — гепарином (в тучных клетках) и хондроитинсульфатом (в базофилах). Вторичные медиаторы являются молекулами, синтезируемыми de novo после контакта тучных клеток, базофилов или других клеток воспаления с антигеном. В основном вторичные медиаторы представлены производными липидов и включают лейкотриены и фактор, активирующий тромбоциты.
Мишенями одного из главных медиаторов аллергических поражений — гистамина — являются гладкая мускулатура, кровеносные сосуды, некоторые экзокринные железы, лейкоциты. События, приводящие к развитию различных форм аллергических реакций, развиваются в несколько этапов (рис. 16.1). Подверженный аллергии организм уже имеет сенсибилизированные специфическими IgE-антителами тучные клетки. Предварительная сенсибилизация прошла при первичном контакте с аллергеном и не имела последствий в виде развития реакционного состояния. Тот же самый аллерген при повторном проникновении в организм взаимодействует с предсуществующими IgE. Перекрестное сцеп-
Гладкая мускулатура
Рис. 16.1. Участие гистамина в аллергических реакциях.
В результате взаимодействия аллергена со специфическими IgE- антителами, предсуществующими на тучных клетках, начинается активный выброс гистамина из гранул. Гистамин, взаимодействуя с рецепторами на клетках гладкой мускулатуры и/или на клетках сосудистого эндотелия, реализует свое патогенетическое действие
ление аллергена с IgE обеспечивает поступление Са2+ внутрь клетки, в результате чего клетка активируется и из внутриклеточных гранул высвобождается гистамин. Медиатор взаимодействует с соответствующими рецепторами Н1 и Н2, представленными на клетках-мишенях. Основным проявлением патогенетического действия гистамина является резкое сокращение гладкой мускулатуры. Подобное сокращение ответственно, в частности, за бронхоспазм при астме или анафилактическом шоке. Влияние гистамина на сосудистую систему проявляется главным образом в поражении эпителиальных клеток. Они сужаются под действием гистамина, обнажая сосудистую стенку, что способствует повышенной проницаемости крупных молекул во внесосудистую область.
Патогенетическое действие на организм, сходное с гистамином, оказывает другой медиатор — серотонин. У человека активность этого соединения наблюдается только в отношении тромбоцитов и клеток тонкого кишечника.
Хемотаксические факторы, выделяемые из гранул тучных клеток, обеспечивают приток гранулоцитов и нейтрофилов в очаг развития реакции.
16.2. ГИПЕРЧУВСТВИТЕЛЬНОСТЬ ЗАМЕДЛЕННОГО ТИПА
Если первые три типа повышенной реактивности опосредуются антителами классов IgE и IgG, то IV тип — гиперчувствительность замедленного типа (ГЗТ) — есть результат работы антигенспецифических CD4 Т-клеток воспаления.
Прототипом данной формы реагирования является туберкулиновая проба, до сих пор используемая в клинике инфекционных заболеваний (см. выше).
Последовательность событий, приводящих к проявлению реакции, складывается из следующих этапов (рис. 16.2).
1. Первичное внедрение антигена в организм приводит к накоплению специфических CD4 Т-клеток воспаления (Тн1).
2. При повторном подкожном проникновении антигена происходит его захват регионально локализованными тканевыми макрофагами. Эти антигенпрезентирующие клетки выводят фрагменты антигена в комплексе с молекулами II класса МНС на свою поверхность.
3. Предсуществуюшие антигенспецифические ТН1 -клетки взаимодействуют с иммуногенным комплексом на поверхности макрофага — ключевое событие для последующего развития всей реакции ГЗТ. После прошедшего взаимодействия Т-клетки воспаления начинают секрецию целого набора цитокинов: фактора, подавляющего миграцию макрофагов (макрофагингибирующего фактора — МИФ), макрофагального хемотаксического фактора
(МХФ), интерферона-у и интерферона-0 (ИФН-у и ИНФ-0), ФНО-0, интерлейкина-3 (ИЛ-3) и гранулоцитарно-макрофагального колониестимулирующего фактора (ГМ-КСФ).
4. Секретируемые цитокины обеспечивают собственно реакцию воспаления и, как следствие, ее визуальное проявление. МИФ и МХФ привлекают в зону проникновения антигена дополнительные фагоцитирующие клетки. ИФН-у активирует макрофаги, которые усиливают продукцию медиаторов воспаления. ФНО-0 оп-
Рис. 16.2. CD4 Т-клетки воспаления (Тн1) — основные участки реакции гиперчувствительности замедленного типа.
В результате первичной иммунизации накапливаются зрелые CD4 Т-клетки воспаления. При повторном введении антигена происходит его презентация в иммуногенной* форме на поверхности макрофага. Зрелые CD4 Т-клетки, распознав антиген, начинают продукцию набора цитокинов, которые организуют очаг воспаления в зоне проникновения антигена. ИЛ-3 — интерлейкин-3; ГМ-КСФ — гранулоцитарно-макрофагальный колониестимулирующий фактор; ФНО-р — фак-торнекроза опухолей р ; ИФН-у — интерферон-у; МИФ — макрофагингибирую-щий фактор; МХФ — макрофагальный хемотаксический фактор; СКК — стволовая кроветворная клетка
ределяет локальное тканевое повреждение и усиливает экспрессию адгезивных молекул на кровеносных сосудах зоны воспаления, способствуя тем самым более легкому поступлению дополнительных клеток воспаления. И, наконец, ИЛ-3 и ГМ-КСФ как факторы гемопоэтической дифференцировки обеспечивают созревание моноцитов из прекурсоров костного мозга. Вновь образующиеся моноциты-макрофаги, мигрируя в зону воспаления, компенсируют убыль тех макрофагов, которые, выполнив свою функцию, разрушаются.
Все эти процессы, направленные на изоляцию патогена (или какого-либо иного антигена), завершаются за 24-48 часов формированием воспалительного очага.
Глава 17. АУТОИММУНИТЕТ
Введение
Аутоиммунные заболевания развиваются в тех случаях, когда в организме появляются антитела или клоны Т-клеток, способные взаимодействовать с собственными антигенами и тем самым разрушать клетки и ткани, обладающие этими антигенами. Возникший аутоиммунный процесс — явление в значительной степени хроническое, приводящее в долговременному повреждению тканей. Связано это в первую очередь с тем, что аутоиммунная реакция постоянно поддерживается тканевыми антигенами.
Механизм аутоиммунного разрушения клеток и тканей неотличим от того, который действует в условиях нормы при адаптивном иммунитете, и включает как специфические антитела различных классов, так и субпопуляции Т-клеток, способных реагировать на собственные антигены.
Какие факторы обеспечивают запуск запрещенных клонов в реакционный ответ, не известно. Однако существует определенная коррелятивная связь между HLA-генотипом и относительным риском аутоиммунного поражения. Кроме того, провоцирующими сигналами для инициации иммунного ответа к собственным антигенам могут служить факторы внешней среды.
17.1. АУТОИММУННЫЕ ЗАБОЛЕВАНИЯ, ИНИЦИИРОВАННЫЕ АНТИТЕЛАМИ ИЛИ Т-КЛЕТКАМИ
Одним из наиболее показательных аутоиммунных заболеваний, обусловленных антителами, является аутоиммунная гемолитическая анемия. Аутоантитела к антигенам эритроцитов либо непосредственно лизируют клетки в присутствии комплемента, либо комплекс эритроцит:антитело захватывается и разрушается фагоцитами. Разрушение ядросодержащих клеток антителами не является всеобщим явлением, может быть, потому, что эти клетки более устойчивы к действию комплемента. Однако они могут быть разрушены через механизм антителозависимого клеточного цитолиза, обусловленного естественными киллерными клетками. Гуморальный аутоиммунный ответ на внеклеточные молекулы матрикса — явление достаточно редкое, но, если оно встречается, то имеет крайне тяжелые последствия. Например, при синдроме Гуд-пастера антитела, образующиеся к IV типу коллагена и поражающие основные мембраны почечных клубочков и сосудов, будут причиной быстро развивающегося заболевания с летальным исходом.
Определенную группу аутоиммунных заболеваний составляют те, при которых аутоантитела продуцируются к клеточным ре-366
цепторам, причем такие антитела либо усиливают активность клетки-мишени, либо препятствуют ее нормальному функционированию. Так, при аутоиммунном тиреоидите (болезни Грейвса) образуются антитела к рецептору для тиреоидстимулируюшего гормона на клетках щитовидной железы. В условиях нормы между щитовидной железой и гипофизом, продуцирующим тиреоидстимулирую-щий гормон, существуют отношения, действующие по принципу “feetback”- регуляции: высокий уровнь тиреоидного гормона подавляет секрецию тиреоидстимулирующего гормона. Аутоантитела, взаимодействующие с рецептором к тиреоидстимулирующему гормону, нарушают это состояние равновесия. Несмотря на то что механизм отрицательной обратной связи сохраняется, продукция тиреоидного гормона остается повышенной за счет стимулирующего действия аутоантител.
При миастении гравис продуцируются аутоантитела к а-цепи ацетилхолинового рецептора, локализованного в месте контакта нервной и мышечной клетки. В результате взаимодействия антител с соответствующим рецептором нарушается прохождение импульса от нейрона к мышце, что и приводит к нарушению мышечного сокращения.
Особая форма аутоиммунных поражений связана с образованием иммунных комплексов. Примером наиболее острой патологии в данном случае может служить системная красная волчанка. Образующийся комплекс аутоантител с нуклеиновыми кислотами и гистонами оседает повсеместно на стенках малых сосудов и почечных клубочков, что приводит в присутствии комплемента к развитию воспалительных процессов, особенно опасных в тех случаях, когда комплекс локализуется в почках или мозге.
Одна из форм аутоиммунного поражения связана с адоптивным переносом антител. Антитела IgG-класса беременной женщины с аутоиммунной патологией могут проходить через плаценту в организм развивающегося эмбриона, вызывая у него те же патологические нарушения, что и у матери. Однако подобные нарушения, к счастью, преходящи, так как материнские аутоантитела у новорожденного ребенка вскоре разрушаются.
Не все аутоиммунные заболевания связаны с активностью антител. Многие из них вызываются специфическими аутореактивными Т-клетками как прямыми эффекторами разрушения клеток хозяина. Кроме того, Т-клетки необходимы и для поддержания продукции аутоантител. Примером цитотоксического действия Т-клеток могут служить процессы при инсулинзависимом диабете. При этой форме аутоиммунного заболевания 0-клетки панкреатических островков, продуцирующие инсулин, селективно разрушаются специфическими CD8 Т-клетками. Трансплантация больным диабетом фрагмента панкреатической железы от идентично-
го двойника не дает терапевтического эффекта. Трансплантат инфильтруется CD8 Т-лимфоцитами хозяина, которые и разрушают перенесенные клетки.
Примеры некоторых аутоиммунных заболеваний представлены в таблице 17.1.
Таблица 17.1
Примеры некоторых аутоиммунных заболеваний, классифицированных по основному механизму иммунопатогенного действия
Основной провоцирующий механизм Синдром Аутоантигены Характер нарушений
Антитела к антигенам клеточной поверхности или матрикса аутоиммунная гемолитическая анемия аутоиммунная тромбоцитопения антигены группы крови Rh на эритроцитах интегрин gpIIb:IIIa на тромбоцитах разрушение эритроцитов комплементом, фагоцитоз, анемия гемофилия
Иммунные комплексы синдром Гудпасте-ра острая ревматическая лихорадка (стрептококковый эндокардит) постстрептококковый гломерулонефрит узловатый полиартериит IV тип коллагена антигены стрептококка, антитела к стрептококку, перекрестно реагирующие с сердечной мышцей стрептококковый антиген антиген вируса гепатита В васкулит, почечная недостаточность миокардит, артрит, патологические нарушения сердечных клапанов преходящее поражение почек системный васкулит
Активность Т-клеток системная красная волчанка инсулинзависимый диабет ДНК, гистоны, рибосомы антиген р-клеток гломерулонефрит, васкулит, артрит разрушение р-клеток
ревматоидный артрит неизвестный синовиальный антиген воспаление, разрушение тканей
экспериментальный аутоиммунный энцефаломиелит основной белок миелина, протеолипидный белок инвазия Т-клеток в мозг, параличи
17.2. МЕХАНИЗМЫ АУТОИММУННЫХ ПОРАЖЕНИЙ
Решение ряда вопросов аутоиммунной патологии проводилось на инбредных линиях мышей, так как подобная “мышиная” модель исключала ограничения по МНС. Во-первых, у инбредных животных можно искуственно инициировать аутоиммунитет, вво-368
дя им ткани, клетки или очищенные белки от мышей той же линии (сингенный перенос), т.е. имитируя аутоантигенную иммунизацию. Во-вторых, от таких сингенно иммунизированных мышей можно выделить примированные Т-клетки, провести их клонирование и тем самым получить характеристики пептидов (эпитопов), способных выступать в качестве аутоантигенного материала. Одно из таких “мышиных” заболеваний — экспериментальный аллергический энцефаломиелит, напоминающий множественный склероз человека, воспроизводится при многократной инъекции ткани мозга подопытным животным. На сингенных животных была показана, в частности, возможность инициации энцефаломиелита с помощью клонированных Т-клеток, которые получали к отдельным пептидам основного белка миелина, входящего в состав муфты аксона. Развивающаяся аутоиммунная реакция включает составным компонентом воспалительную реакцию. В системе адоптивного переноса было показано, что наиболее активными в экспериментальном аллергическом энцефаломиелите являются клонированные CD4 Т-клетки воспаления (Тн1), но не хелперные CD4 Т-клетки (Тн2).
При ревматоидном артрите CD4 Т-клетки воспаления также принимают активное участие. Сенсибилизируясь к антигенам суставов, такие клетки с помощью секретируемых цитокинов привлекают в зону реакции нейтрофилы и макрофаги, которые и повреждают хрящевую ткань, что ведет к деструкции места сочленения суставов. Ревматоидный артрит — комплексное заболевание, которое включает и аутоантитела, а среди них — анти-IgG-aHTH-тела, относящиеся к IgM-классу. Эти антитела получили название ревматоидного фактора.
Изучение причин аутоиммунных заболеваниий выявило значительное участие генетических факторов в развитии патологии. Известна, например, наследственная предрасположенность ко многим формам аутоиммунных нарушений у человека. Кроме того, имеются линии мышей, одна из основных характеристик которых — спонтанное развитие аутоиммунитета.
Известна коррелятивная связь между аллелями МНС и предрасположенностью к заболеванию (табл. 17.2). Возможно, что предрасположенность носителей определенных аллелей к тем или иным аутоиммунным заболеваниям связана с процессом презентации пептидов, входящих в состав аутоантигенов. Поскольку все аутоиммунные ответы включают Т-клетки, то их аутореактивность будет зависеть от комплекса пептида собственного антигена с полиморфными молекулами I или II классов МНС. Подобный процесс вполне вероятен, хотя и не имеет прямых доказательств.
Таблица 17.2
Связь HLA-генотипа с чувствительностью к аутоиммунным заболеваниям
Заболевание Н LA-аллель Относительный риск
Спондилоартрит анкилозирующий В27 87,4
Синдром Гудпастера DR2 15,9
Множественный склероз DR2 4,8
Болезнь Грейвса DR3 3,7
Миастения гравис DR3 2,5
Системная красная волчанка DR3 5,8
Инсулинзависимый диабет DR3 или DR4 3,2
Ревматоидный артрит DR4 12
Заключение
В основе аутоиммунных заболеваний лежит активность аутоантител или аутореактивных Т-клеткок. Собственно повреждение тканей есть результат либо прямой атаки антител и Т-лимфоцитов на клетки, несущие соответствующие аутоантигены, либо патогенного действия иммунных комплексов, а также клеточных и гуморальных участников воспалительного процесса.
Известные аутоиммунные патологические расстройства можно классифицировать по основному механизму иммунологических процессов, включенных в их развитие:
1) группа заболеваний, обусловленная антителами к антигенам собственных клеток или межклеточного матрикса;
2) заболевания, вызванные патогенным действием иммунных комплексов — аутоантител, с антигенами организма;
3) заболевания, причиной которых являются аутоантиген-специфические Т-клетки.
Все аутоиммунные расстройства включают воспалительный процесс как один из ведущих патогенетических факторов. Клеточные и молекулярные участники воспалительного процесса аналогичны тем, которые сопровождают и другие формы иммунной реактивности.
Причины возникновения аутоиммунной патологии, нарушения основного принципа работы иммунной системы — дифференцировки “своего” от “чужого”, остаются непонятыми. Что определяет возникновение запрещенных клеточных клонов к собственным антигенам и почему таким клонам' удается преодолеть механизмы отрицательной селекции в тимусе и на периферии? Все эти вопросы требуют ответа, так как от их положительного решения зависит успех борьбы с аутоиммунитетом.
Глава 18. ИММУНОДЕФИЦИТНЫЕ СОСТОЯНИЯ
Повреждение того или иного звена в иммунной системе приводит к нарушению иммунного ответа, к той форме иммунопатологии, которая получила название иммунодефицитных заболеваний.
Все иммунодефицитные состояния делятся на две большие группы: врожденный (наследственно обусловленный) иммунодефицит и приобретенный иммунодефицит.
В основе наследственно обусловленного иммунодефицитного состояния лежат дефекты генов, контролирующих работу определенных звеньев иммунной системы. В то же время приобретенный иммунодефицит есть результат воздействия факторов внешней среды на клетки иммунной системы. Среди таких, наиболее полно изученных факторов следует отметить облучение и фармакологические средства. Другой пример нарушения в работе иммунной системы под влиянием внешних воздействий представлен синдромом приобретенного иммунодефицита человека, вызванного соответствующим вирусом.
Нарушения в работе иммунной системы могут быть связаны либо с одной из клеточных популяций (Т-клетками, В-клетками, макрофагами), либо с комплексным нарушением, затрагивающим многие звенья иммунитета.
18.1. ВРОЖДЕННЫЕ ИММУНОДЕФИЦИТЫ
В таблице 18.1 перечислены наследственно обусловленные иммунодефицитные состояния человека с указанием основного поврежденного звена в работе иммунной системы.
18.1.1. В-клеточные дефициты
Первое иммунодефицитное заболевание, получившее название Х-сцепленной агаммаглобулинемии (ХСА) было описано в 1952 г. О. Братоном. Заболевание обусловлено рецессивным геном, локализованным на Х-хромосоме, и выявляется только у мальчиков, обладающих набором половых хромосом XY. Девочки не болеют, так как даже если они гетерозиготны, то рецессивный ген одной Х-хромосомы компенсируется нормальным геном гомологичной Х-хромосомы. При данной форме иммунодефицита отсутствуют В-клетки и плазмоциты, в лимфоидной ткани нет центров размножения, в сыворотке не удается обнаружить IgM, IgD, IgA или IgE.ypoeeHb IgG крайне низкий и составляет всего 10% от нормы. В то же время больные имеют нормально развитый тимус. Т-клетки в количественном и функциональном отношении не отличаются от клеток здоровых детей. При этом заболевании наблю-
24*
371
Таблица 18.1
Различные формы иммунодефицитных состояний человека
Название иммунодефицита Основное нарушение Повреждение в иммунной системе Чувствительность к патогенам
Х-сцепленная агаммаглобулинемия дефект синтеза btk-тирозинкиназы отсутствие В-клеток внеклеточные бактерии, вирусы
Общий варьи- неизвестно, сцеплено дефект гуморального внеклеточные
руюший иммунодефицит с Х-хромосомой ответа на полисахариды бактерии
Селективный дефицит IgA неизвестно, сцеплено с МНС отсутствие синтеза IgA возбудители респираторных инфекций, вирусы
Селективный деления С-генов дефект образования инкапсули-
дефицит иммуноглобулинов иммуноглобулинов одного или более изотипов иммуноглобулинов рованные внеклеточные бак- терии
Синдром неизвестно, сцеплено дефект гуморального внеклеточные
Wiskott-Aldrich с Х-хромосомой ответа на полисахариды бактерии
Синдром X-сцепленной гиперпродукции IgM дефект в СВ40-ли-ганде отсутствие переключения изотипов общая
Синдром DiGeoige аплазия тимуса отсутствие Т-клеток общая
Синдром обнаженных лимфоцитов резко сниженная экспрессия молекул II класса МНС отсутствие CD4-T-клеток вирусы
Дефицит молекул 1 класса МНС мутации ТАР- гена отсутствие CDS-Т-клеток вирусы
Тяжелые комбинированные иммунодефициты Х-сцеплено, дефицит у-цепи рецептора для ИЛ-2 (IL-2Ry) аутосомальные дефекты репарации ДНК дефицит аденозинде-заминазы дефицит пуриннук-леотидфосфорилазы отсутствие Т-клеток отсутствие Т- и/или fi-клеток отсутствие Т- клеток отсутствие Т-клеток общая общая общая общая
Дефицит фагоцитоза многие повреждения отсутствие фагоцитарной активности внеклеточные бактерии
Дефицит комплемента многие повреждения отсутствие специфических компонентов комплемента внеклеточные бактерии
Дефект натуральных киллеров неизвестно отсутствие функции натуральных киллеров вирусы герпеса
Дефицит белков, связывающих маннозу неизвестно низкий уровень связывания маннозы белками внеклеточные бактерии
дается обычное развитие гиперчувствительности замедленного типа и отторжение аллотрансплантата. До 9-12-месячного возраста болезнь не проявляется, так как новорожденные получают защитные антитела с молоком матери. Однако после этого периода ребенок подвергается постоянному инфицированию такими возбудителями, как Hemophilis influenza, Diplococcus pneumoniae, Staphylococcus aureus, Streptococcus pneumoniae.
Установлено, что ген, ответственный за развитие ХСА, кодирует белок тирозинкиназу, обозначенную как btk (сокр. от англ, “bruton s tyrosine kinase”). Этот белок экспрессируется в В-клетках и полиморфноядерных нейтрофилах. Мутантная форма гена btk проявляет себя только в В-клетках. Отсутствие нормального гена btk приводит к приостановке развития В-клеток на стадии пре-В-клеток, когда уже произошла реорганизация генов для тяжелых цепей, но еще не начата реорганизация генов для легких цепей. В результате нарушается процесс формирования антигенраспозна-ющего рецепторного комплекса В-клеток.
Другим примером иммунных нарушений, затрагивающих В-систему, является общий варьирующий иммунодефицит. При этом заболевании наблюдается в основном дефицит продукции IgG и IgA, хотя в некоторых случаях проявляется и неполноценность Т-клеточной функции. Гены, контролирующие эту форму иммунопатологии, локализованы в том же регионе, что и гены III класса МНС, однако природа собственно генов и их продуктов неизвестна.
Одной из наиболее часто встречающихся форм иммунодефицитных нарушений является селективный IgA-дефицит, который проявляется с частотой 1 случай на 800 здоровых лиц. Люди с нарушением продукции IgA чаще других подвержены хроническим легочным инфекциям, вызываемым широким набором специфических возбудителей. Генетический механизм этого дефекта также неизвестен, но, как и в предыдущем случае, гены, ответственные за его проявление, сцеплены с генами III класса МНС.
В редких случаях встречаются семьи с нарушением способности к переключению изотипов иммуноглобулинов. Причиной подобных нарушений является делеция генов, контролирующих С-области иммуноглобулинов разных классов. Лица с подобными мутациями, как правило, обладают нормальной чувствительностью к инфекциям, и само явление имеет скорее познавательное, чем патолгическое значение.
18.1.2. Т-клеточные дефициты
Помимо иммунодефицитных состояний, обусловленных нарушениями в работе В-клеток, имеются заболевания, связанные с дефектами Т-клеточной функции.
Одно из них — синдром Х-сцепленной гиперпродукции IgM. Пациенты с подобным дефектом характеризуются нормальным развитием В- и Т-клеточных популяций и высоким общим уровнем IgM, но при этом не способны к активной продукции специфических IgM к тимусзависимым антигенам. Кроме того, полностью отсутствует синтез всех изотипов иммуноглобулинов, кроме IgM и IgD. Подобные нарушения делают иммунодефицитных больных чувствительными к инфекциям, вызываемым внеклеточными бактериями. Нарушение гуморального иммунного ответа связано в данном случае с дефектом в структуре СО40-лиганда активированных Т-клеток, который в такой мутационно измененной форме не способен взаимодействовать с СВ40-рецептором В-клеток. Дефекты в функционировании Т-клеток могут быть причиной развития группы заболеваний, получивших общее название тяжелых комбинированных иммунодефицитов (SCID, сокр. от англ, “severe combined immune deficiency”). Многогранное участие Т-клеток в специфическом реагировании делает их ведущим компонентом всей иммунной системы. Именно поэтому поражение Т-клеток приводит к особо тяжелым формам иммунодефицита.
Среди SCID лучше других изучен Х-сцепленный тяжелый комбинированный иммунодефицит. Причиной данной формы иммунопатологии является мутация в гене, контролирующем у-цепь ИЛ-2-рецептора. Ген локализован в Х-хромосоме. У пациентов с подобной мутацией подавлено функционирование Т-клеток, хотя В-клетки неотличимы от клеток здоровых людей. Следствием мутационного нарушения соответствующего гена является нарушение аутокринного способа активации Т-клеток через взаимодействие ИЛ-2 со своим ИЛ-2-рецептором. Кроме того, у-цепь ИЛ-2 рецептора входит также в состав рецепторов к другим цитокинам, в частности она является частью ИЛ-7-рецептора. Нарушение взаимодействия рецептор:лиганд в этой системе будет причиной подавления раннего развития Т-клеток. Далее, эта же у-цепь входит в состав ИЛ-4-рецептора. Ясно, что дефект данного рецептора на В-клетках лишает их помощи со стороны хелперных CD4 Т-клеток. Таким образом, Х-сцепленный SC1D является примером того, как мутация всего в одном гене определяет цепь событий, приводящих к комплексному многостороннему нарушению работы иммунной системы.
Два других SCID связаны с активностью ферментов нуклеинового обмена аденозиндезаминазы и пуриннуклеотидфосфори-лазы. При нарушении функции этих ферментов происходит накопление промежуточных продуктов обмена, токсичных для Т-клеток и частично для В-клеток.
Интересен как научный факт, но, конечно, не как патологическое состояние иммунодефицит, получивший название синд-374
ром обнаженных лимфоцитов. При данной форме заболевания происходит резкое снижение экспрессии молекул II класса МНС. В результате у иммунодефицитных больных отсутствует положительная селекция клеток в тимусе, что приводит к приостановке нормального процесса дифференцировки CD4 Т-клеток, антигенпрезентирующие клетки не в состоянии представить антигены в иммуногенной форме на своей поверхности, незначительное количество имеющихся CD4 Т-клеток не стимулируется антигеном, и помощь со стороны этих клеток В-клеткам отсутствует. Как следствие всех этих нарушений иммунная система неспособна сформировать адекватную специфическую защиту от многих инфекционных агентов. Синдром голых лимфоцитов не связан с мутациями в гене, контролирующем структуру молекул II класса, и обусловлен повреждениями в регуляторных генах.
Примером острого Т-клеточного дефицита, имеющего комплексные последствия для иммунного ответа, является сивдром DiGeorge. Заболевание характеризуется аплазией тимуса. Так же, как и у мышей nude, тимусный эпителий не может обеспечить нормальное развитие Т-клеток. В результате у пациентов с данной формой иммунодефицита страдает как клеточный, так и гуморальный иммунный ответ.
18.2. ПРИОБРЕТЕННЫЕ ИММУНОДЕФИЦИТЫ
Приобретенные иммунодефициты представляют собой группу заболеваний, в основе которых лежат нарушения либо отдельных звеньев иммунитета, либо комплексное повреждение этой системы под влиянием факторов внешней среды или патологических процессов, в своей этиологии не связанных с иммунной системой, но оказывающих на нее подавляющее действие.
Иммунодефицитное состояние может быть вызвано облучением, глюкокортикоидной терапией, применением фармакологических препаратов. Кроме того, иммунодефицит возникает в качестве сопутствующего явления при таких патологиях, как заболевания желудочно-кишечного тракта, нефротические нарушения, множественные миеломы и др.
Наиболее ярким и драматичным примером индуцируемого поражения иммунной системы является синдром приобретенного иммунодефицита (СПИД) человека.
18.2.1. Развитие ВИЧ-инфекции
В 1981 г. в ряде крупных городов США была зарегистрирована вспышка инфекционного заболевания, вызываемого Pneumocystis carinii — грибком, который при нормальном состоянии иммунитета не вызывает инфекции. Эпидемиологический анализ показал, 375
что заболевание распространяется среди лиц, имеющих интимные контакты с инфицированным индивидуумом. В основе заболевания лежит резкое ослабление иммунитета, что и приводит к развитию инфекции. Неизвестную ранее форму подавления работы иммунной системы стали обозначать как синдром приобретенного иммунодефицита (СПИД). Несколько позднее, в 1983 году, выделили вирус, который и определяет развитие данной формы иммунодефицитного состояния. Новый, не известный ранее вирус получил название вирус иммунодефицита человека (ВИЧ).
ВИЧ относится к семейству лентивирусов, входящему в группу ретровирусов. Большинство ретровирусов вызывает неконтролируемый рост клеток хозяина. В то же время патогенетическое действие лентивирусов проявляется в разрушении клеток, которые они инфицируют.
Развитие ВИЧ-инфекции начинается сразу после проникновения вируса в организм человека. Заражение происходит через семя, вагинальную жидкость, кровь больного в результате его контакта со здоровыми лицами. ВИЧ инфицирует преимущественно CD4 Т-клетки и макрофаги.
В первый период развития инфекции, обозначаемый как этап гриппоподобного состояния, происходит вспышка размножения вируса, что регистрируется по числу вирионов в крови. Увеличение вирусных частиц является симптоматическим признаком заболевания. В этот же период наблюдается значительное снижение CD4 Т-клеток в периферической крови: приблизительно с 1000 кл/мл до 600 кл/мл.
Через две недели от момента заражения начинается развитие второго периода — асимптоматической фазы ВИЧ-инфекции. В этот период мобилизуются иммунные механизмы защиты: накапливаются антитела к вирусным белкам и увеличивается количество специфических к вирусу CD8 Т-клеток. Вирус в асимптоматичес-кий период практически полностью исчезает из крови, а количество CD4 Т-клеток в начале периода возвращается к норме. Однако отсутствующий в крови вирус концентрируется на поверхности фолликулярных дендритных клеток в виде комплекса с антителами. Отсюда он проникает в интактные CD4 Т-клетки, окружающие первичные и вторичные фолликулы.
Именно фолликулы лимфоидной ткани являются основным местом поддержания инфекции, а сформировавшийся иммунный ответ не в состоянии препятствовать эффективному накоплению вирионов. В симптоматический период происходит выраженное снижение количества CD4 Т-клеток и экспоненциальное накопление вируса в крови.
Вырвавшийся из-под контроля иммунной системы процесс вирусного размножения приводит к полному истощению лимфо-376
идной ткани, возникновению сопутствующих инфекций и в результате — к летальному концу.
Если на начальных этапах инфекции страдают только CD4 Т-клетки, то по истечении времени патологиеские нарушения захватывают многие звенья иммунной системы: резко снижается пролиферация лимфоцитов, нарушается процесс образования CD4 Т-клеток памяти, погибают антигенпрезентирующие фолликулярные дендритные клетки и макрофаги, активируются специфические CD8 Т-клетки, которые разрушают вирусинфицированные клетки. В результате патогенетических сдвигов во всей иммунной системе создаются условия для возникновения оппортунистических инфекций, т.е. таких, к которым здоровый человек резистентен. В табл. 18.2 перечислены патогены и злокачественные опухоли, которые приводят к гибели больных СПИД.
Таблица 18.2
Патогены и опухоли, приводящие к летальному исходу больных СПИД
Бактерии Mycobacterium tuberculosis, Mycobacterium avium intracellulare, Salmonella spp.
Вирусы вирус простого герпеса, цитомегаловирус, вирус varicella zoster
Простейшие Toxoplasma spp., Crytosporidium spp., Leishmania spp., Microsporidium spp.
Грибы Pneumocystis carini, Cryptococcus neoformans, Candida spp., Histoplasma capsulation, Coccidioides immits
Опухоли саркома Калоши, лимфома Беркитта, первичная лимфома мозга
18.2.2. Размножение ВИЧ в клетке
Зрелая вирусная частица имеет поверхностный белок gpl20, который вступает в высокоаффинное взаимодействие с CD4-KO-рецептором, специфичным для СВ4-Т-клеток. В результате такого взаимодействия оболочка вируса сливается с клеточной поверхностью , что позволяет вирусному геному проникнуть внутрь клетки. Вирусный фермент обратная траскриптаза обеспечивает образование на вирусной РНК двухнитчатой копии ДНК, которая интегрируется в геном клетки. Интегрированная ДНК от вирусной матрицы называется провирусом. В активированной СБ4-Т-клетке
Инфицирование I
Смерть I
Рис. 18.1. Развитие ВИЧ инфекции.
Весь инфекционный процесс делится на четыре периода. Первый период — состояние, напоминающее грипп; характеризуется значительным накоплением вируса в крови и снижением числа СО4чТ-клеток к концу периода. Во втором, асимптоматическом, периоде регистрируется почти полное исчезновение вируса из крови, нормализуется количество СD4-Т-клеток в первой половине периода, наблюдается выраженное накопление специфических антител и CDS-Т-клеток. Третий, симптоматический период включает нарастание вируса в крови, значительно снижается общее число СЕ)4-Т-клеток, сохраняется уровень антител и специфических СВ8-Т-клеток. В четвертом, заключительном периоде резко увеличивается концентрация вируса в крови. Почти полностью исчезают СЕ)4-Т-клетки, незначительно снижается уровень антител и СВ8-Т-клеток
на провирусе образуются копии исходной РНК, которая в свою очередь обеспечивает синтез вирусных белков, включая gpl60, расщепляющийся на gpl20 и gp41. Процесс заканчивается формированием новых вирусных частиц, которые покидают клетку с тем, чтобы инфицировать новые интактные СЭ4-Т-клетки.
Одна из наиболее пагубных для организма хозяина особенностей ВИЧ состоит в его ярко выраженной способности мутировать. Механизм мутаций связан с вирусной обратной транскриптазой. Фермент, обеспечивающий синтез ДНК на вирусной РНК как матрице, допускает неточности копирования, что приводит к ошибкам в последовательности нуклеотидов в ДНК. Мутации являются множественными, и от одного и того же больного можно выделить несколько мутантных линий ВИЧ. Особенно опасны мутации, затрагивающие участок генома, контролирующего синтез белка gp!20. Как уже говорилось, именно этот белок вступает во взаимодействие с СО4-корецептором Т-клеток. При этом основные нейтрализующие антитела также образуются к этому белку, 378
точнее к той его части, которая представлена аминокислотной последовательностью, формирующей петлю V3. Аминокислотная последовательность, взаимодействующая с CD4, располагается рядом и не входит в состав петли. В тех случаях, когда мутации затрагивают V3, вирус ускользает от нейтрализующего действия антител, но сохраняет способность к взаимодействию с CD4 и проникновению в клетку хозяина.
Повышенная мутабельность вируса делает невозможным получение вакцинного препарата. Один из разрабатываемых подходов в .борьбе с ВИЧ направлен на поиск способов блокады специфических вирусных белков (обратная транскриптаза, tat-белок и др.), которые включены в процесс репликации вирионов.
Заключение
Все иммунодефицитные состояния делятся на две большие группы: наследственно обусловленные (врожденные) иммунодефициты и приобретенные иммунодефициты. Понятно, что причины двух этих форм иммунодефицитных расстройств различны, хотя общий результат один — снижение сопротивляемости организма к инфекциям и/или повышение чувствительности к онкогенным заболеваниям.
Изучение как врожденных, так и приобретенных иммунодефицитов, и в первую очередь СПИД, дает в руки исследователей окончательные доказательства роли отдельных эффекторных, сигнальных, регуляторных молекул и различных типов клеток в иммунном реагировании. Именно комплекс лабораторных исследований и клинических наблюдений раскрывает интимные механизмы работы иммунной системы. Клиницисты без знания фундаментальной иммунологии не смогли бы точно определить первопричины возникновения той или иной формы иммунодефицита, так же как экспериментаторы без “причуд” природы не имели бы окончательных доказательств удельного значения отдельных факторов иммунитета в защите организма от чужеродного материала.
Часть V. СРАВНИТЕЛЬНАЯ ИММУНОЛОГИЯ
Глава 19. ОНТОГЕНЕЗ ИММУННОЙ СИСТЕМЫ
Введение
Долгое время считалось, что эмбрион иммунологически полностью некомпетентен. Разработка современных методов исследования и расширение числа видов экспериментальных животных изменило эту точку зрения. Конечно, уровень иммунной реактивности развивающихся зародышей значительно уступает половозрелым особям и, тем не менее, начальные этапы становления Т-и В-систем иммунитета проявляются очень рано.
Если на ранних стадиях онтогенеза эффективность работы иммунной системы возрастает по мере развития организма, то при старении наблюдается обратный процесс — постепенное снижение иммунных функций, что приводит к развитию ряда заболеваний пожилого возраста.
В данной главе будут рассмотрены в сжатой форме вопросы становления Т- и В-систем иммунитета в процессе эмбрионального развития и снижения иммунной реактивности в позднем онтогенезе.
19.1. СТАНОВЛЕНИЕ ИММУННОЙ СИСТЕМЫ В ЭМБРИОГЕНЕЗЕ
19.1.1. Эмбриогенез Т-системы иммунитета
Тимус — наиболее ранний лимфоидный орган, возникающий в процессе зародышевого развития у позвоночных животных. У мышей он формируется из эндодермы 3-го и 4-го глоточных карманов и эктодермы 3-й и 4-й жаберных щелей и до 10-го дня внутриутробного развития представляет собой незначительную плотную массу эпителиальных клеток (см. рис. 6.6 и 19.1). К 11-му дню в зачатке органа обнаруживаются первые крупные лимфоциты с выраженной базофилией цитоплазмы. Они мигрируют сюда из желточного мешка, а позднее — из эмбриональной печени. Источником предшественников тимоцитов в постнатальном периоде являются клетки костного мозга. По мере эмбрионального развития в тимусе прогрессивно увеличивается количество тимоцитов как за счет продолжающейся их миграции из эмбриональной печени и развивающегося костного мозга, так и благодаря активной пролифераций клеток in situ. На 14-15-й дни эмбриогенеза тимоциты приобретают маркер Т-клеток — Thy-1, антигены МНС. В этот же период в тимусе наблюдаются клетки с маркером хелперных Т-клеток — CD4. На 17-й день развивающийся тимус обогащается клетками, экспрессирующими маркер цитотоксических Т-лимфоцитов — CD8. К моменту рождения (21-й день внут-380
Рис. 19.1. Эмбриональное развитие тимуса у мышей.
Тимус — наиболее ранний лимфоидный орган. К 11 -му дню в зачатке тимуса появляются первые крупные лимфоидные клетки, мигрирующие в него из желточного тела, а позднее — из эмбриональной печени. По мере эмбрионального развития в тимусе прогрессивно увеличивается количество лимфоцитов за счет продолжающейся их миграции из эмбриональной печени, а так же активной пролиферации in situ
риутробного развития) орган представляет собой полностью сформировавшуюся железу.
Раннее становление Т-системы в процессе внутриутробного развития выявлено и у человека (рис. 19.2 и табл. 19.1). Уже на самых начальных этапах эмбриогенеза (6-я неделя развития), когда размер зародыша не превышает 12 мм, наблюдается закладка тимуса. К. 7-й неделе зачаток тимуса еще свободен от лимфоцитов и представляет собой лишь ретикулоэпителиальную морфологическую структуру. Большие лимфоциты в органе появляются позднее — через 8 недель внутриутробной жизни. Однако лимфоциты, метящиеся антисывороткой к Т-клеткам взрослых людей, обнаружены в печени 5-недельного плода, а на 7-й неделе эмбриогенеза лимфоциты этого органа вступают в реакцию СКЛ, что указывает на способность таких клеток к распознаванию аллоан-тигенов по Т-клеточному типу. На 10-11-й неделе внутриутробного развития в тимусе зародыша хорошо различаются корковый и мозговой слои. Число тимоцитов на 10-й неделе беременности со
ставляет всего 15 000, но уже к 13-й неделе это число увеличивается в 6 раз, а к 16-й — в 100 раз. В дальнейшем идет постепенное функциональное совершенствование Т-системы иммунитета эмбрионов.
Рис. 19.2. Этапы становления Т- и В-сястем иммунитета у зародыша человека.
На самых ранних этапах развития (6 нед), когда размер плода не превышает 12 мм, происходит закладка тимуса. Большие лимфоциты в органе появляются через 8 нед внутриутробного развития. У 7-недельного эмбриона имеются лимфоциты в печени, способные к распознаванию аллоантигенов (реакция в СКЛ). В это же время в цитоплазме лимфобластов обнаруживается IgM. В дальнейшем идет постепенное совершенствование Т- и В-систем иммунитета
На 14-й неделе внутриутробного развития в корковом слое тимуса появляются лимфоциты с характерными маркерами зрелых Т-клеток — CD4 и CD8. Это созревание сопровождается отчетливой экспрессией молекул I и II классов HLA-комплекса.
Развивающийся тимус зародыша характеризуется интенсивной клеточной пролиферацией и увеличением массы органа. Относительная масса тимуса к массе тела достигает максимума в последней трети беременности, хотя абсолютное увеличение веса органа продолжается до половозрелого состояния, после чего начинается его прогрессивная инволюция (рис. 19.3).
Раннее эмбриональное развитие Т-системы иммунитета является общей характерной чертой всех позвоночных животных. Так, у овец первые лимфоциты в тимусе появляются на 41-43-й день внутриутробного развития (при общей продолжительности беременности 150 дней), в лимфатических узлах — на 45-й день, в селезенке — после 58-го дня и в лимфоидной ткани кишечника —
Таблица 19.1
Показатели Т- и В-систем иммунитета у плода человека
Время внутриутробного развития, недели Признаки
3 5 гемопоэз в желточном мешке появление лимфоцитов в печени, реагирующих с антисыворот-
6 7 кой к Т-клеткам; начало формирования селезенки закладка тимуса; начало экспрессии HLA-антигенов появление лимфоцитов в крови; ответ клеток фетальной печени на аллоантигены в реакции СКЛ; IgM в цитоплазме больших лимфоцитов печени
8 заселение тимуса лимфоцитами; начало синтеза компонентов комплемента: СЗ, С4, С5 и интерферона
9 появление в печени лимфоцитов; экспрессирующие поверхностные IgM и IgG; начало синтеза лизоцима
10 начало синтеза и секреции IgM; реакция тимоцитов на ФГА и клеток селезенки — на аллоантигены
11 образование Е-розеток тимоцитами; начало лимфопоэза в селезенке
12 начало синтеза IgG; появление лимфатических узлов; реакция тимоцитов на аллоантигены; способность лимфоцитов индуцировать РТПХ
13 14 реакция лимфоцитов крови и селезенки на ФГА проявление цитотоксической активности лимфоцитами селезенки и крови; синтез компонента комплемента Clq
15 16 20 образование Е-розеток лимфоцитами крови и селезенки проявление цитотоксической активности тимоцитов максимальная лейкопоэтическая активность клеток селезенки; появление скоплений лимфоцитов и первичных фолликулов в слизистой аппендикса
30 максимальная гемопоэтическая активность клеток костного мозга; начало синтеза IgA
ЗОлет
Рис. 19.3. Возрастные изменения абсолютной массы и клеточного состава тимуса.
У новорожденных отношение коркового слоя к медуллярному смешено в сторону коры. В этот период тимус находится в наиболее активной фазе как источник периферических Т-клеток. К 15-20 годам относительные размеры коры снижаются, а медуллярной зоны увеличиваются. Количество лимфоцитов снижается как в коре, так и в медуллярной зоне. Паренхима замещается жировой тканью. После 30 лет количество лимфоцитов в органе резко снижается
после 75-го дня развития. Показательно, что уже у 75-дневных эмбрионов наблюдается способность к формированию комплексной клеточной реакции на аллогенный трансплантат (рис. 19.4).
В онтогенезе кур первые лимфоциты в зачатке тимуса появляются на 11-й день эмбрионального развития. Это крупные клетки с диаметром около 11 мкм. Между 11-м и 13-м днями преимущественный размер тимоцитов составляет 8 мкм, к 16-му дню — 5,5 мкм. Смена гистологической картины связана с процессом внутритимусной дифференцировки и поэтапным переходом клеток от незрелых предшественников к более зрелым формам.
Тщательное изучение онтогенеза иммунной реактивности было проведено у шпорцевой лягушки Xenopus laevis (рис. 19.5). Первые мигрирующие в зачаток тимуса стволовые элементы регистрируются через 3 дня после оплодотворения (стадия 44); через 13 дней (стадия 49) наблюдается умеренная способность к алло-
Отторжение трансплантата
БФ Ф ГЦ
Дни 41 56 75 80
120
Тимус вмнивмввин 41-43
Лимфатические узлы ИННВИЗВ^ВЙМ 45
Селезенка МВЯЕсЯН
>58
Кишечник Ц|
>75
Дифтерийный токсин
БЦЖ
Рис. 19.4. Развитие лимфоидной системы и формирование гуморального иммунного ответа в эмбриогенезе овец.
Первые лимфоциты в тимусе появляются на 41-43-й день развития при общей продолжительности беременности в ISO дней. В это же время регистрируется способность плода формировать гуморальный ответ на сильный иммуноген — бактериофаг 0Х-174. У 75-дневного эмбриона развивается комплексная клеточная реакция при отторжении аллогенного трансплантата.
БФ — бактериофаг 0Х-174; Ф — ферритин; ГЦ — гемоцианин; ОА — овальбумин; БЦЖ — вакцина БЦЖ
трансплантационному отторжению; через 25 дней лимфоциты способны развивать реакцию в СКЛ. Кроме того, наблюдается райнее появление антигенов гистосовместимости. Молекулы II класса МНС начинают экспрессироваться на эпителиальных клетках тимуса на 4-е сутки личиночной стадии развития. На поверхности тимоцитов и Т-клеток они обнаруживаются позднее — на 47-й день, в период прохождения метаморфоза. По мере развития лягушек от самых начальных этапов личиночного развития до взрослых молодых особей количество лимфоцитов прогрессивно увеличивается от 1-Ю3 до 1-Ю7. Однако период позднего метаморфоза характеризуется некоторой инволюцией тимуса, когда число тимоцитов снижается до 1-Ю5. Кстати, в этот же период проявляется временная супрессия иммунного ответа.
В другом классе позвоночных животных — у рыб — признаки Т-системы также появляются очень рано. Так, у лососевых лимфо-25 Зак. 3701 385
О 10 20 30 40 50 60 75
' 49 бЬ 5^ ^354 ' бк ^6 ' £?7 ^б|бЬ dl| Й All б1э '
3645 59 62 65
90 105
I I
Стадии
Q Начало циркуляции
[~| Выклевывание
I Пре-В-клетки в печениТ
1 I 1+2
В-клетки в печени (1) и селезенке (2) IgM в сыворотке IgY в сыворотке
Набор признаков взрослой особи Полная Т-кпеточная помощь I
11-10* 3*104 3^10* 9*10» 1,5^108 9*10» 1*0» 2*10» 110*1
Число лимфоцитов в тимусе
Рис. 19.5.0пшовленнеТ-и В-систем иммунитета в онтогенезе шиорцевой лягушки Хаюргв laevis.
Констатируется крайне ранее становление как Т-, так и В-систем иммунитета. Сразу после выклевывания наблюдается миграция стволовых элементов в зачаток тимуса. В это же время обнаруживаются пре-В-клетки в печени.
Тэ\Тол — тимэктомия^ толерантность
циты в зачатке тимуса обнаружены за 22 дня до выклевывания. У карпа с интенсивным зародышевым развитием (всего в несколько дней) уже через 3 дня после оплодотворения в зачатке тимуса появляются лимфоциты.
Все представленные здесь факты ясно указывают на очень раннее становление Т-системы иммунитета, по крайней мере по морфологическим признакам. Функционально активность системы выражена недостаточно полно, хотя такое свойство этой системы, как аллоспецифическое распознавание, обнаружено на самых начальных этапах эмбриогенеза.
19.1.2. Эмбриогенез В-системы иммунитета
У развивающегося эмбриона стволовые кроветворные клетки впервые обнаруживаются в желточном мешке. Позднее основным депо стволовых элементов становится эмбриональная печень. У плода человека на 7-8-й неделе внутриутробного развития начинается закладка костного мозга. При этом как кроветворный орган он начинает функционировать только с 4-го месяца беременности.
Первые В-клетки появляются на 5-7-й неделе эмбриогенеза в паренхиме печени. Эти клетки характеризуются наличием цитоплазматического IgM, но при этом отсутствует как поверхностный, так и секреторный иммуноглобулин. Полноценный синтез IgM В-клетками начинается на 10-11-й неделе развития; чуть позднее — на 12-й неделе появляются В-клетки, синтезирующие IgG. На этой стадии эмбриогенеза большинство В-лимфоцитов относится к пре-В-клеткам.
В условиях нормального развития плод не образует плазматических клеток, однако они возникают при инфекционных заболеваниях матери.
Изучение гуморального иммунного ответа у эмбрионов овец (рис. 19.4) показало достаточно раннее проявление данной формы реактивности. Уже на 41-й день внутриутробного развития плод отвечает синтезом специфических антител на сильный иммуноген бактериофаг ФХ-174. В дальнейшем способность к продукции антител усиливается и ответы формируются уже на антигены все меньшей иммуногенности. Плод в возрасте 56 дней реагирует на ферритин, 80-дневный — на гемоцианин, а через 120 дней, за месяц до окончания внутриутробного развития, образует антитела к овальбумину.
Ранним формированием В-системы иммунитета характеризуются и земноводные (Xenopus laevis). Первые пре-В-клетки в печени появляются уже на 4-й день после оплодотворения. На 12-й день личиночной стадии развития более зрелые В-клетки пред
ставлены в печени и селезенке. В это же время в сыворотке крови обнаруживается IgM.
Столь же рано В-система иммунитета появляется у рыб. Например, у стальноголового лосося В-лимфоциты с поверхностным IgM появляются в пронефросе на 4-5-й день после выклевывания.
Итак, является очевидным, что как Т-, так и В-системы иммунитета формируются в процессе эмбриогенеза очень рано. При этом функциональная активность этих систем выражена недостаточно, и это связано, скорее всего, не с собственными элементами систем, а с незрелостью вспомогательных, регуляторных компонентов организма. Важной, однако, является способность Т-клеток развивать аллоспецифический ответ на самых начальных этапах эмбрионального развития. На этот факт будет обращено специальное внимание в следующей главе.
19.2. ИММУНИТЕТ НОВОРОЖДЕННЫХ
Содержание в крови новорожденных детей Т-клеток такое же, как у взрослых людей. Пролиферативный ответ Т-клеток новорожденных на митогены имеет тот же уровень, что и аналогичный ответ взрослых. В то же время реакция на бактериальные антигены у новорожденных снижена и достигает нормы только к 6-12-му месяцу постнатального развития. Некоторое функциональное несовершенство Т-клеток связано, в частности, со сниженной продукцией интерлейкина-2 и интерферона, а также подавленной киллерной активностью. Кроме того, полноценной реакции лимфоцитов на антигены у новорожденных мешает избыточный уровень супрессорных CD8 Т-клеток. Супрессорные свойства лимфоцитов плода проявляются достаточно рано. Их активность в эмбриогенезе обеспечивает подавление аллогенных клеток матери, проникающих в плод через плаценту. Сохраняющийся некоторое время у новорожденного повышенный уровень супрессорных Т-клеток является своего рода отногенетическим “атавизмом” и к 11-му месяцу постнатального развития приходит в норму.
Количество В-клеток у новорожденных, также как и Т-кле-ток, соответствует их содержанию у взрослых. При этом число антителопродуцентов значительно снижено. Так, в пуповинной крови новорожденных пул плазматических клеток, синтезирующих IgM, составляет всего 16% от числа аналогичных клеток взрослых людей. Число IgA-синтезирующих клеток незначительно, а IgG-клетки отсутствовали. Однако к концу 1-го месяца постнатальной жизни количество IgM-положительных клеток достигает уровня, характерного для взрослых, хотя количество IgA- и IgG-синтези-рующих клеток все еще остается сниженным. Недостаток собственных иммуноглобулинов у новорожденных компенсируется антителами матери, поступающими в организм младенца с молоком. 388
19.3. ИММУНИТЕТ ПРИ СТАРЕНИИ
Подавление иммунитета с возрастом не связано со снижением абсолютного количества Т- и В-клеток, но зависит от изменения их функциональной активности.
Как у человека, так и у животных недостаточность Т-клеточ-ного ответа проявляется в:
1) увеличении времени отторжения аллотрансплантата;
2) снижении способности отвечать на аллоантигены в смешанной культуре лимфоцитов;
3) ослаблении силы реакции трансплантат против хозяина;
4) подавлении пролиферации в ответ на Т-клеточные митогены.
Аналогичная картина депрессии иммунной реактивности наблюдается при развитии гуморального (В-клеточного) ответа. На фоне стабильности общего числа В-лимфоцитов продукция антител к гетерологичным антигенам значительно снижается, причем в основном страдает ответ на тимусзависимые антигены.
Одним из основных факторов подавления клеточного и гуморального иммунного ответа в пожилом возрасте является нарушение функциональной активности хелперных Т-клеток, в результате необходимая помощь этих клеток при формировании как Т-, так и В-клеточного ответа оказывается недостаточной. Вторым существенным фактором возрастного нарушения иммунной реактивности является подавление активности Т-супрессоров. Сниженная активность этих двух субпопуляций Т-клеток вносит свой вклад в развитие так называемых болезней возраста — злокачественных опухолей и аутоиммунных повреждений. В таблице 19.2 суммированы некоторые показатели активности Т- и В-систем иммунитета у людей пожилолго возраста.
Таблица 19.2
Иммунологические изменения у человека при старении
Показатель иммунитета Возрастная группа, лет
20-39 80-99
Т-система иммунитета Реакция на фитогемагглютинин нормальная снижена
Реакция на конканавалин А нормальная снижена
Реакция на аллоантигены в СКЛ нормальная снижена
Супрессорное действие лимфоцитов, нормальное снижено
стимулированных конканавалином А Доля периферических Т-клеток нормальная нормальная
В-снстема имиунитета Образование антител к гетерологичным нормальное снижено
антигенам Образование аутоантител нормальное повышено
Содержание IgG и IgA в сыворотке нормальное повышено
Доля периферических В-клеток нормальная нормальная
Заключение
Становление Т- и В- систем иммунитета в процессе зародышевого развития происходит очень рано. Уже через 6 недель у эмбриона человека закладывается тимус. Через 7 недель лимфоциты печени реагируют на аллоантигены в смешанной культуре лимфоцитов. На восьмой неделе эпителиальный тимус заселяется лимфоцитами, появляются тельца Гассаля, паренхима органа дифференцируется на корковую и мозговую зоны. В последующие сроки функции Т-системы все больше усложняются. Столь же раннее становление этой системы известно для мышей, овец, птиц, земноводных, рыб.
Так же рано, хотя, возможно, и с некоторым отставанием, начинает формироваться В-система иммунитета. В цитоплазме больших лимфоцитов печени IgM появляется на 8-й неделе, хотя активный синтез иммуноглобулинов регистрируется только на 11-12-й недели беременности.
К моменту рождения ребенка Т- и В- системы являются сформированными по основным признакам, однако для достижения полной функциональной зрелости требуется еще некоторое время постнатального развития.
При сохранении нормального количества Т- и В-клеток иммунитет людей пожилого возраста характеризуется подавленной реактивностью. Связано это в первую очередь с изменениями в популяционной структуре и функционировании Т-лимфоцитов. Функции как хелперных, так и супрессорных Т-клеток подавлены, что приводит к типичным болезням пожилого возраста — неопластическим поражениям и аутоиммунным расстройствам.
Глава 20. ЭВОЛЮЦИЯ ИММУНИТЕТА
Введение
При изучении любой биологической проблемы исследователь невольно обращается (или, по крайней мере, должен обращаться) к ее сравнительно-историческим аспектам. Связано это в первую очередь с тем, что изучение механизмов какого-либо явления только у млекопитающих, как правило, сталкивается с определенными трудностями в силу эволюционно сложившейся мно-гофакториальности процессов, лежащих в основе любого биологического феномена. Путь, который помогает изучить отдельные элементы процесса, установить их взаимосвязь и тем самым придти к пониманию явления в целом, — это обращение к филогенетически менее организованным формам жизни с постепенным переходом от групп, в которых данное явление только зарождалось, к группам, в которых оно усложнилось.
Главные вопросы эволюционной иммунологии — это решение проблемы возникновения способности к специфическому антигенному распознаванию, т.е. появления антигенраспознающих рецепторов как молекулярных факторов такого распознавания, и выяснение путей эволюционного происхождения лимфоцитов — основных участников иммунологических событий.
Кроме того, имеется более общий и фундаментальный вопрос, связанный с оценкой роли специфического иммунитета в эволюции многоклеточных животных. Как отмечали Н.В.Тимофе-ев-Ресовский и соавторы (1969), эволюционное изучение какого-либо биологического явления может внести определенный вклад в понимание, а возможно, и в изменение теоретических взглядов на течение эволюционного процесса.
Подобные представления как нельзя лучше согласуются с оценкой роли иммунитета в прогрессивном эволюционном развитии жизни. В свое время нами был выдвинут тезис о том, что на эволюцию специфического иммунитета не следует смотреть только как на самостоятельное явление исторического развития; скорее, ее следует оценивать как такой процесс, который обеспечил прогресс в мире животных по линии увеличения абсолютного количества соматических клеток.
Основной прием эволюционной иммунологии — сравнительный, использующий сопоставление конкретной формы иммунной реактивности у представителей одной определенной систематической группы с таковой у других групп, эволюционно удаленных в той или иной степени от исходной. В связи с этим филогенетическое древо — схематизированный образ возможных эволюционных преобразований в мире животных — для сравнительного
иммунолога выступает в качестве матрицы, в ячейки которой закладывается информация о состоянии иммунитета определенной таксономической группы.
На рис. 20.1 изображено устоявшееся представление о филогенетических связях в мире животных. Черными кружками отмечены те труппы животных, у представителей которых анализировались определенные формы иммунной реактивности.
Рис. 20.1. Филогенетическое древо взаимных отношений между основными типами животных.
Черными кружками отмечены типы, у представителей которых изучались те или иные формы иммунитета.
До середины 60-х годов иммунологи проводили резкую грань между способом иммунной защиты у беспозвоночных и позвоночных животных. Считалось, что все беспозвоночные, включая хордовых, обладают только неспецифической формой реагирования, в то время как позвоночные животные, начиная с круглоротых, являются носителями приобретенного иммунитета, характеризующегося специфичностью в распознавании антигена, инду-цибельностъю и формированием иммунологической памяти. Подобные различия в иммунной реактивности между двумя группами животных связывали с наличием у позвоночных тимуса, отсутствующего у беспозвоночных. Предполагалось, что для беспозвоночных с короткой продолжительностью жизни и значительным потенциалом к самовоспроизведению достаточной является неспецифическая форма реагирования. Действительно, неспецифическая клеточная и гуморальная защита у беспозвоночных выражены достаточно хорошо. При этом представления о том, что беспозвоночные лишены каких-либо проявлений специфического иммунного реагирования, оказались ошибочными.
В середине 60-х годов была показана способность представителей семейства дождевых червей Eisenia foetida и Lumbricus terrestris к специфическому отторжению аллогенной ткани и формированию кратковременной иммунологической памяти. Несколько позднее, в 70-х годах установлено специфическое аллоиммунное отторжение даже у таких низкоорганизованных многоклеточных, каковыми являются губки и кишечнополостные. Полученные факты ясно указывали на то обстоятельство, что специфический иммунитет не является прерогативой только позвоночных животных. Первые преадаптационные проявления специфического иммунного реагирования возникли очень давно, вероятно, с момента появления первых многоклеточных, около 2 млрд, лет тому назад. Кроме того, и на это следует обратить особое внимание, выявленные факты позволяют предполагать время возникновения предшественников антигенраспознающих рецепторов Т- и В-клеток.
Особое место в разработке проблем эволюции иммунитета занимает вопрос о происхождении лимфоцита — основного участника иммунологических событий. Вполне вероятно, что лимфоцит как самостоятельный клеточный тип исторически возник специально для осуществления клеточной формы иммунного реагирования, а понятия “лимфоидный” и “иммунный” — синонимы для обозначения одной и той же системы организма. Подобная оценка строится на факте одновременного появления в эволюции нового клеточного типа — лимфоцита — у немертин и кольчатых червей и способности этих животных к специфическому отторжению трансплантата.
Морфологический аспект эволюции лимфоидной системы представляет самостоятельную проблему, в равной мере относящуюся как к гематологии, так и иммунолгии. По представлениям В.Н.Беклемишева (1964), родоначальным клеточным типом, давшим начало внутренней (мезенхимальной) среде организма, был блуждающий амебоцит кишечнополостных. Факт появления амебоцита-макрофага автор оценивал как важное эрогенное событие, следствием которого явилось формирование целой системы органов, объединенных в лимфо-миелоидный комплекс. Элементы комплекса в виде различного рода лимфоидных скоплений и узелков уже представлены у беспозвоночных с полостью тела: кольчатых червей, моллюсков, членистоногих, иглокожих, оболочников. Однако своего совершенства комплекс достигает у высших позвоночных животных.
Обращаясь собственно к лимфоидной системе, следует выделить, по крайней мере, два основных исторических события, два эволюционных новшества:
1) возникновение лимфоцита как морфологически обособленного клеточного типа, основная функция которого — иммунологическая;
2) вычленение из лимфо-миелоидного комплекса лимфоидной ткани в качестве автономной структуры со своими специфическими (иммунологическими) функциями; особое место здесь занимает тимус.
20.1. КЛЕТКИ, ТКАНИ И ОРГАНЫ ЛИМФО-МИЕЛОИДНОГО КОМПЛЕКСА У ПРЕДСТАВИТЕЛЕЙ РАЗЛИЧНЫХ ТИПОВ ЖИВОТНЫХ
Возникновение многоклеточных животных в докембрии (более 2 млрд, лет назад) было сопряжено с функциональной и морфологической дифференцировкой клеток на различные типы. Уже у наиболее примитивных многоклеточных — губок (Porifera) —насчитывается около восьми самостоятельных, хотя и способных к взаимной трансформации клеточных форм. Достаточно разнообразен клеточный состав и в другом филуме низших многоклеточных — кишечнополостных (Coelenterata). Экго- и эндодерма этих животных включают по крайней мере шесть клеточных типов. По мере филогенетического совершенствования животных шло как прогрессивное функциональное усложнение уже имеющихся клеток, так и возникновение новых клеточных форм. Так, у наиболее высокоорганизованных животных — млекопитающих — имеется, вероятно, более ста различных самостоятельных типов клеток.
Содержание данного раздела ограничено сравнительно-эволюционным рассмотрением только тех клеток, функция которых направлена на реализацию иммунологических потенций организма. 394
Специальное место в эволюционной иммунологии занимает вопрос о формировании кроветворных органов и тканей, т.е. тех морфологичеких структур, где осуществляются процессы развития иммунокомпетентных клеток. Среди них особое внимание уделено тимусу как центральному органу иммунитета.
20.1.1. Клетки
Губки (Porifera). Наиболее просто организованные первичные многоклеточные — губки, клетки которых еще не объединены в ткани, уже имеют несколько морфологически и функционально самостоятельных клеточных типов. Среди них: пинакоциты — клетки, покрывающие внешнюю поверхность тела и стенки внутренних водоносных каналов, хоаноциты — сферические или кубои-дальные, снабженные ресничками клетки, которые выстилают поверхность камер и обеспечивают движение воды в теле губок. Имеется также группа клеток, локализованных в мезоглее: колленциты и лофоциты, продуцирующие коллаген; спонгоциты, образующие спонгин; склероциты, ответственные за формирование игольчатых структур (спикул); миоциты — сократительные клетки; “серые клетки” — накопители гликогена. Особое место среди клеток мезоглеи занимают крупные, подвижные клетки —археоциты, ин; че — блуждающие амебоциты. Археоциты содержат в цитоплазме большое количество фагосом и лизосомальных структур, имеют большое пузырчатое ядро с хорошо различимыми ядрышками. Данные клетки очень лабильны и не имеют постоянной, строго очерченной формы. Предполагается, что этот клеточный тип тотипотентен и является предшественником всех других классов клеток у губок.
Хоаноциты, обеспечивая движение воды, одновременно фиксируют на своей поверхности органические остатки и микроорганизмы. Такой фиксированный материал захватывается затем блуждающими амебоцитами. Поглощенные микроорганизмы перевариваются , а продукты катаболизма транспортируются по всему организму.
У губок видов Terpios zeteki и Ephydatia fluviatilis описаны два типа фагоцитирующих клеток: археоциты и колленциты. Они поглощают в условиях эксперимента широкий набор веществ: китайскую тушь, зерна кармина, эритроциты и пр.
Кишечнополостные (Coelenterata). Кишечнополостные (медузы, кораллы, морские анемоны) — двухслойные многоклеточные, обладающие истинно тканевыми образованиями в виде экто- и эндодермы. Между этими слоями находится неструктурированная, желеобразная мезоглея. Среди клеток, входящих в тканевые слои, описаны такие формы как стрекательные клетки, реснитчатые клетки, гликоциты, интерстициальные клетки. В мезоглее пред
ставлены в небольшом количестве блуждающие амебоциты, которые локализуются также в эндодерме, окружающей пищеварительный тракт. Помимо пищеварительной функции, блуждающие амебоциты принимают участие в трансплантационном отторжении. Другими клетками, претендующими на роль защитных клеточных элементов, являются подвижные интерстициальные клетки эктодермы.
Кольчатые черви (Annelides). Кольчатые черви — животные, значительно продвинутые в филогенетическом ряду. Они обладают вторичной полостью тела (целомом) и замкнутой кровеносной системой. Целомоциты червей делят на пять основных классов: базофилы и нейтрофилы (гиалиновые амебоциты), гранулоциты и ацидофилы (гранулярные амебоциты) и хлорагогенные клетки (элеоциты). Данные электронной микроскопии позволяют отнести базофилы к лимфоцитоподобным клеткам двух типов: с большим или меньшим количеством псевдоподий (рис.20.2). Эти клетки демонстрируют структурное сходство с незрелыми лимфоцитами позвоночных и обладают маркером Т-клеток млекопитающих. Нейтрофилы напоминают макрофаги позвоночных животных (рис. 20.3). В их вакуолях заметны различного рода включения, в том числе и бактериальные клетки. У кольчатых червей процесс фагоцитоза, инкапсуляции, распознавания чужеродности, трансплантационного отторжения и адоптивного переноса обеспечивается в
Рис. 20.2. Клетки из целомической жидкости дождевого червя Lumbricus terrestris.
а — лимфоцитоподобный целомоцит типа I; б — он же, тип II. Видны: ядро (Я), плотное ядрышко (Яд), участки диффузного хроматина (Хр), шероховатый эндоплазматический ретикулум (ЭР), небольшое количество митохондрий (М), хорошо представленный аппарат Гольджи (Г), вакуоли (В), псевдоподии (ПС) (по: Cheng, 1981)
основном гиалиновыми амебоцитами: лимфоцитоподобными амебоцитами первого и второго типов (базофилами), а также нейтрофилами, характеризующимися способностью к активному фагоцитозу. При отторжении алло- и ксенотрансплантатов в реакцию вступают в основном лимфоцитоподобные амебоциты и нейтрофилы-макрофаги.
Членистоногие (Arthro-poda). Членистоногие — наиболее развитый в эволюционном
Рис. 20.3. Живой нейтрофил (макрофагоподобная клетка) Lumbricus temstris, содержащий фагоцитированные бактерии (Б), гранулы (Гр), ядро (Я), ядрышко (Яд)
отношении тип первичноротых, ведущий свое начало от кольчатых червей. У хорошо изученного класса насекомых (Insecta) идентифицировано шесть типов лейкоцитов с той или иной формой иммунологической активности.
Прогемоциты напоминают малые лимфоциты позвоночных животных. Эти клетки диаметром 8-9 мкм имеют круглую или овальную форму, содержат большое ядро. Цитоплазма располагается достаточно узкой полосой вокруг ядра и лишена значительных клеточных включений и органелл. Данные клетки составляют около 1% от общего количества лейкоцитов.
Плазматоциты, составляющие 45% циркулирующих лейкоцитов, являются высокоплейоморфными клетками. Называются они разными авторами по разному: фагоциты, гранулоциты, мак-ронуклеоциты, ламеллоциты. Их ядра занимают половину объема клетки. Цитоплазма содержит гранулы различной величины, митохондрии, лизосомы, микротрубочки. Плазматоциты являются наиболее активными фагоцитирующими клетками и проявляют свойства, характерные для макрофагов позвоночных: адгезируют на стекле, активируются в присутствии чужеродных эритроцитов, выпуская псевдоподии и образуя розетки с этими эритроцитами. Кроме того, они способны реагировать на антигенные агрегаты и образуют вокруг чужеродного материала меланизированные капсулы.
Моллюски (Mollusca). Моллюски представляют собой большой, четко очерченный тип первичноротых животных. Лейкоциты моллюсков, имевшие по терминологии различных авторов до 76 названий, делятся в настоящее время на два класса: гиалиновые клетки и гранулоциты. Округлые лимфоцитоподобные клетки (рис. 20.4), циркулирующие в гемолимфе, способны образовывать ро-397
Рис. 20.4. Электронная макрофотография лимфоцита обыкновенной мидии Mytilus edulis.
Видны: четко обозначенное ядро (Я), имеющее классическую для лимфоцита выемку, митохондрии (М) Уз. 16000 (по: Cheng, 1981)
зетки с эритроцитами барана, так же как Т-клетки человека. Другая группа циркулирующих гиалиновых гемоцитов адгезирует на стекле, обладает способностью к распластыванию, активно фагоцитирует инертные частицы, отвечает кислородным взрывом на стимуляцию. По этим признакам отмеченная группа клеток напоминает макрофаги позвоночных животных. Данный тип клеток наиболее активен в фагоцитозе бактерий и инкапсуляции паразитов. Подобной активностью обладают и гранулоциты, хотя и в менее выраженной форме.
Иглокожие (Echinodermata). Иглокожие — высокоорганизованные беспозвоночные, хотя в ветви вторичноротых занимают низшее положение. В их крови и целомической жидкости представлены те же формы лейкоцитов, что и у насекомых, однако имеется
и дополнительный клеточный тип — вибрирующие клетки, воору
женные жгутиками и содержащие мукополисахаридные гранулы. Эти клетки коагулируют и разрушаются в процессе изоляции чужеродного корпускулярного материала, выполняя тем самым барьерную, защитную функцию.
У иглокожих трансплантат инфильтруется лимфоцитами, гранулоцитами и фагоцитирующими мононуклеарами, что указывает на их иммунологическую активность.
Оболочники (Tunicata). Оболочники являются уникальной группой животных в силу своебразия своего роазвития. В личиночной стадии они обладают хордой, однако во взрослом состоянии в результате метаморфоза хорда полностью резорбируется. Наличие личиночной хорды ставит оболочников в единый филогенетический ряд с позвоночными животными. В связи с подобной общностью данный тип животных интересен и для понимания эволюции иммунитета как обладатель предсуществующей системы специфической защиты позвоночных.
Лимфоциты оболочников рассматриваются в качестве гомологов лимфоцитов позвоночных животных. Этот тип клеток, как и у позвоночных, чувствителен к облучению, отвечает на митогены Т-клеток, образует розетки с эритроцитами барана и обеспечивает отторжение трансплантата, инфильтруя пересаженную ткань.
Типичными клетками гемолимфы (около 70% от общего количества) являются вакуолизированные, содержащие ванадий клеточные формы. Их функция связана с переносом кислорода. Неспецифическая иммунологическая активность данных клеток проявляется в инкапсуляции инородных частиц, включая гетерологичные эритроциты. Способностью к фагоцитозу обладают многие клеточные формы: амебоциты, гиалиновые клетки, гранулоциты, макрофаги.
Позвоночные (Vertebrata). Позвоночные животные в целом характеризуются завершенностью формирования макрофагальнолимфоцитарного клеточного комплекса. В сравнении с беспозвоночными усложнение клеточного состава комплекса у позвоночных касается в основном лимфоидных клеток, но оно не связано с появлением новых морфологических типов и обогащено лишь формированием функционально различных субпопуляций в лимфоидном ряду развития.
В классе круглоротых (Cyclostomata) произошло важное эволюционное событие, которое обеспечило прогресс в становлении всего специфического иммунитета. Это — возникновение морфологических структур, явившихся прообразом тимуса более высокоорганизованных позвоночных животных. Наличие тимуса позволяет говорить о новом типе лимфоцитов — тимусзависимых клетках (Т-клетках). Кроме того, именно в этом классе впервые в филогенезе появляются морфологически оформленная костномозговая ткань протопозвоночной дуги и антителопродуцируюшие плазмоциты, что указывает на возникновение на уровне круглоротых В-системы иммунитета и В-лимфоцита как самостоятельного клеточного типа.
Более чем столетний период изучения клеток лимфо-миелоидного комплекса у рыб (Piesces) показал, что его клеточный состав представлен наиболее полно и характерен для всех вышестоящих классов позвоночных животных, включая млекопитающих. Лейкоциты крови рыб подразделяются на две основные группы: гранулоциты, включающие нейтрофилы, эозинофилы,базофилы, и агранулоциты, представленные моноцитами-макрофагами, большими, средними и малыми лимфоцитами, а также тромбоцитами.
Содержание фагоцитирующих мононуклеаров в крови рыб незначительно и колеблется от 4 до 7%. Так же, как и у других животных, макрофаги совместно с нейтрофилами обеспечивают неспецифическую иммунную защиту, а также принимают участие в воспалительных реакциях. В зоне воспаления макрофаги могут сливаться, образуя гигантские многоядерные клетки. Кроме того, фагоцитирующие мононуклеары рыб, как и млекопитающих, способны к презентации антигена, демонстрируя тем самым свое уча-
стие в процессах клеточного взаимодействия при формировании специфического иммунного ответа.
Более 70% лейкоцитов периферической крови рыб представлены лимфоцитами. Популяция этих лимфоцитов функционально неоднородна и представлена как В-, так и Т-клетками. Более того, Т-клетки делятся на субпопуляции с цитотоксической, хелпер-ной и супрессорной активностью. Таким образом, лимфоидный клеточный комплекс рыб достаточно гетерогенен и фактически неотличим от такового наиболее высокоорганизованных позвоночных животных.
20.1.2. Ткани и органы лимфо-миелоидного комплекса
Имеется общее представление о том, что процесс роста, дифференцировки и функционального созревания клеток происходит более эффективно в условиях микроокружения соответствующих органов и тканей, чем при свободном пребывании в гуморальной среде. Подобные представления сформировались в результате многочисленных исследований, показавших, что именно на территории органов создаются наиболее благоприятные условия для множественных межклеточных взаимодействий прекурсорных, дифференцирующихся клеток со стромальным клеточным окружением и для наиболее прямого, короткодистантного воздействия гуморальных факторов дифференцировки.
Эти самые общие замечания определяют необходимость сравнительного рассмотрения вопроса о филогенетическом развитии не только иммунокомпетентных клеток, но также тканей и органов лимфо-миелоидного комплекса, с тем чтобы представить эволюционные изменения иммунной системы в виде единого процесса.
Беспозвоночные. Очаги гемо-лимфопоэза как самостоятельные морфологические образования являются приобретением наиболее развитых беспозвоночных. Так, прогресс иммунной системы на уровне кольчатых червей проявляется в том, что у представителей данного таксона впервые в филогенетической ветви первичноротых появляются лейкопоэтические “органы”, которые служат местом клеточной дифференцировки. “Органы” представляют собой парные узелки, расположенные в целоме вдоль кишки в каждом из сегментов, и связаны с дорсальным кровеносным сосудом. В узелках представлено большинство типов целомоцитов, включая лимфоцитоподобные клетки. У тех видов, которые обладают узелками, лейкопоэз происходит в этих морфологических образованиях. У видов, не имеющих узелков, клеточная дифференцировка осуществляется в целомической жидкости.
Кроме лейкопоэтических узелков, локализованных в целоме, у представителей рода Lumbriculus описан специализированно
ный гемопоэтический “орган” в алиментарном кровяном синусе. Подобные же лимфо-миелоидные образования, названные кровяными железами, имеются у некоторых видов родов Pheretima, Maoridrilus, Pontodrilus и др.
Хотя отмеченные морфологические структуры обнаружены лишь у определенного числа видов Annelides и не являются эволюционным достижением всего филума, тем не менее, следует подчеркнуть, что на уровне кольчатых червей развивающаяся иммунная система обогащается важным эволюционным приобретением в виде сконцентрированной лимфогемопоэтической ткани, где локально происходят процессы клеточного созревания.
Гемопоэтическая ткань обнаружена также в типе членистоногих. У чешуйчатокрылых (Lepidoptera) представлен двойной характер развития гемоцитов. Гранулоциты и сферические клетки вступают в митотическое деление в гемолимфе. В то же время прогемоциты (лимфоциты), плазматоциты (макрофаги) и оеноциты размножаются и созревают на территории гемопоэтических образований. После процесса дифференцировки зрелые клетки поступают в гемолимфу.
Таблица 20.1
Лимфоцитоподобные, макрофагоподобные клетки и очаги гемопоэза у беспозвоночных животных
Тип Макрофагоподобные клетки Лимфоцитоподобные клетки Очаги гемопоэза
Губки блуждающие амебоциты (археоциты) — —
Кишечнополостные блуждающие амебоциты — —
Немертины гиалиновые амебоциты ли мфоцитоподобные амебоциты —
Кольчатые гиалиновые аме- л и мфоцитоподобные парные узелки в цело-
черви боциты (нейтрофилы) клетки двух типов (базофилы) ме, гемопоэтическая ткань в алиментарном кровяном синусе
Моллюски гиалиновые амебоциты лимфоцитоподобные клетки гемопоэтическая ткань целома, белое тело головоногих моллюсков
Членистоногие плазматоциты прогемоциты гемопоэтические участки в различных частях тела
Иглокожие фагоцитирующие амебоциты лимфоциты аксиальный орган
Оболочники макрофаги лимфоциты лимфатические узелки в глоточной стенке вокруг пищеварительного тракта
26 Зак. 3701
Рис. 20.5. Диссекция осьминога Eldone cerrosa через два дня после внутривенной инъекции большой дозы угля.
Слюнные железы, жабры и “белое тело” сильно пигментиоованы. 1 —
У моллюсков (Molluska), как у кольчатых червей и членистоногих, обнаружены гемопоэтические структуры. Наличие гемопоэтической ткани продемонстрировано у брюхоногих (Gastropoda) и двустворчатых (Bivalvia) моллюсков. Так, например, у брюхоногого моллюска Lymnaea glabrata и L. truncatula амебоцитпродуцируюший “орган” локализован во вторичной полости тела между пери-кардиумом и почкой. Инвазия паразитов усиливает продукцию амебоцитов этими образованиями. Представители наиболее совершенного класса моллюсков — головоногих (Cephalopoda) — обладают достаточно структурированной парной железой, получившей название “белое тело”,
глаз, 2 — “белое тело”, з — задняя слюн- Эта лимфо-эпителиальная желе-ная железа, 4 — печень, 5 — жабры, 6 — за локализована В орбитальных мантия „ ,
впадинах головных хрящей (рис.
20.5) . Медуллярная область железы имеет клеточные жгуты, предположительно содержащие стволовые элементы. Каждый жгут отделен от соседнего синусоидами, через которые клетки после созревания покидают орган и выходят в циркуляцию. Первичные лей-кобласты имеют ячеистое ядро и богатую РНК цитоплазму. После ряда делений образуются зрелые формы лейкоцитов, морфологически напоминающие моноциты позвоночных животных. По общей морфологии “белые тела” головоногих напоминают лимфатические узлы позвоночных.
У иглокожих (Echinodermata) местом образования лейкоцитов является осевой (аксиальный) орган, расположенный в центральном диске. Из этого органа фагоциты, лимфоциты, гранулоциты, сферические, вибрирующие и кристаллические клетки проникают в сосудистую, кровеносную систему.
Таким образом, высшие беспозвоночные являются обладателями не только макрофаге- и лимфоцитоподобных клеток, но и морфологических структур, где эти клетки проходят путь дифференцировки до зрелых форм.
Позвоночные. Взрывоподобный характер носит становление тканей и органов кроветворения и лимфопоэза у позвоночных животных (табл. 20.2).
402
Таблица 20.2
Лимфо-миелоидные органы и ткани у позвоночных животных
Таксономическая группа Органы, ткани
Круглоротые:
МИКСИНЫ слизистая, подслизистая кишечника, пронефрос
миноги зачаток тимуса, примитивный костный мозг, селезенка
Хрящевые рыбы:
акулы тимус, селезенка, лимфоидная ткань кишечника, почек, гонад
скаты тимус, селезенка, лимфоидная ткань кишечника, почек, гонад
химеровые тимус, селезенка, др. образования
Костные рыбы:
костно-хрящевые рыбы тимус, селезенка, околосердечная лимфо-миелоидная ткань, лимфоидная ткань кишечника
костистые рыбы тимус, селезенка, пронефрос, др. образования (?)
двоякодышащие рыбы тимус (?), селезенка, лимфоидная ткань кишечника, др. образования
Амфибии:
безногие тимус, селезенка, лимфоидная ткань печени, почек
хвостатые тимус, костный мозг, селезенка, лимфоидная ткань кишечника, печени, почек
бесхвостые тимус, костный мозг, югулярные, прокора-коидные, проперикардиальные, эпителиальные тела, селезенка, миндалины, почки
Рептилии:
чешуйчатые тимус, селезенка, миндалины, лимфоидная ткань кишечника
черепахи тимус, костный мозг, селезенка, миндалины, бурса, лимфоидная ткань кишечника
крокодилы тимус, селезенка, бурса, глоточные узлы, лимфоидная ткань кишечника, др. образования
Птицы:
настоящие птицы тимус, костный мозг, сумка Фабрициуса, подкожные и кишечные узелки, железа Гардера, селезенка
Млекопитающие:
настоящие звери тимус, костный мозг, селезенка, лимфатические узлы, миндалины, лимфоидная ткань
кишечника
Наиболее примитивный класс позвоночных животных — круглоротых— обладает относительно слабо развитыми лимфо-миелоидными образованиями по сравнению с более совершенными представителями типа. У миксин (Mixini) еще отсутствует тимус. Лимфоидные скопления наблюдаются в окологлоточной области, фолликулах вдоль кишки, притмитивной селезенке, первичном
пронефросе. Представители другого подкласса — миног (Petromy-zones) — характеризуются приобретением нового лимфоидного образования — зачаточного тимуса, представляющего собой скопление лимфоидных клеток околожаберных щелей. В состав такого тимуса входят: малые лимфоциты, лимфобласты, макрофаги, стромальные элементы, межклеточные волокнистые структуры. Помимо этой лимфоидной ткани, лимфо-миелоидные образования представлены примитивным костным мозгом протопозвоночной дуги (жировым телом), зачаточной селезенкой, пронефросом, лимфоидными скоплениями слизистой и подслизистой кишечника.
Дальнейшего совершенства лимфо-миелоидный комплекс достигает у хрящевых (Chondrichthyes) и костных (Osteichthyes) рыб. У рыб с хрящевым скелетом тимус — это компактный, заключенный в соединительнотканный футляр орган, имеющий кору и медуллу. Более того, в тимусе некоторых видов имеются эпителиальные скопления, напоминающие тельца Гассаля, столь характерные для млекопитающих. Селезенка заключена в соединительнотканную капсулу и гистологически подразделяется на белую и красную пульпу. Кроме этих образований лимфоидная ткань хрящевых рыб представлена в кишечнике (орган Лейдига), в паренхиме почек, в гонадах, вокруг главного кровеносного сосуда.
У рыб с костным скелетом строение тимуса и селезенки напоминает строение органов млекопитающих. Тимус разделен на дольки, имеет корковый и медуллярный слои, а также тельца Гассаля. В селезенке хорошо выявляются зоны белой и красной пульпы. Кроме того, лимфоидная ткань представлена вокруг илиоце-кального клапана, около предсердия и желудочка, в про- и мезонефросе, в слизистой и подслизистой кишечника.
Главным органом гемо-лимфопоэза у рыб является почка. Строма органа сформирована двумя основными типами клеток: ретикулоцитами, имеющими разнообразную, неправильную форму с многочисленными цитоплазматическими выростами, и фиксированными тканевыми макрофагами. Два этих клеточных типа образуют каркас для кроветворных и лимфоидных элементов. В почках рыб описаны все ростки лимфомиелопоэза: эритроидный, макрофагальный, тромбоцитарный, лимфоидный. Строго территориального распределения клеток различных рядов дифференцировки не наблюдается, хотя лимфоциты и макрофаги образуют локальные скопления , которые классифицируются как белая пульпа почек. Селезенка рыб не является органом активного лимфопоэза. Имеющиеся лимфоциты не организованы в фолликулы, а их количество непостоянно.
Переход от водного образа жизни к наземному сопровождался многими адаптационными событиями. Среди прочих — развитие конечностей с трубчатыми костями. Подобное эволюцион-404
ное приобретение имело существенное значение для совершенствования иммунитета, так как именно костному мозгу суждено было стать основным источником стволовых элементов лимфоми-елопоэза наземных позвоночных животных. Кроме того, освоение воздушной среды приводило к неизбежным контактам вышедших на сушу животных с новыми, не известными ранее микроорганизмами, что само по себе должно было стимулировать дальнейшее развитие иммунной системы.
У амфибий (Amphibia) иммунная система усиливается включением в работу костного мозга, печени, вторичных лимфоидных узелков.
Дальнейший морфологический прогресс в эволюции иммунной системы связан с классом рептилий (Reptilia). В целом лимфомиелоидный комплекс рептилий включает хорошо организованный тимус, селезенку, малые лимфатические узлы, лимфоидную ткань кишечника, лимфоидные агрегаты в клоаке. У представителей двух отрядов ( крокодилов— Crocodylia и черепах — Testudines) описаны глоточные миндалины. Своеобразное лимфоидное образование представлено у геккона (Gehyra variegata) — осевая лимфоидная ткань, связанная с грудиной и пронизанная лимфатическими и кровеносными сосудами. Одно из новшеств лимфо-миелоидного комплекса у рептилий — это расхождение клеточных потоков по самостоятельным лимфатическим и кровеносным путям. Обмен лимфоцитами между кровью и лимфой происходит посредством диапетеза в осевых синусах, окружающих вены. В тимусе, селезенке, крови присутствует определенное количество Т- и В-клеток, которое колеблется в зависимости от сезона.
У птиц имеется многодольчатый, хорошо структурированный тимус, расположенный вдоль яремных вен. В селезенке, в белой пульпе представлены центры размножения, где осуществляется дифференцировка лимфоцитов от прекурсорных клеток. Сам факт присутствия четко определяемых гистологических центров размножения свидетельствует о напряженной функциональной активности лимфоидной ткани в целом. В весенне-летнее время у птиц легко выявляются подкожные лимфатические узлы. Они, как и узелковые образования кишечника, имеют афферентные и эфферентные сосуды, медуллярную зону с плотной упаковкой клеток и центры размножения. Типичными для птиц являются два морфологических образования: железа Гарднера и сумка Фабрициуса. Первый орган расположен дорсально по отношению к глазному яблоку, второй локализован в клоаке. Железа Гарднера — активный в иммунологическом отношении орган, который содержит ретикулоциты, эпителиальные клетки, дендритные клетки, макрофаги, Т- и В-лимфоциты, плазматические клетки, синтезирующие иммуноглобулин. Железа имеет центры размножения,
увеличивается с возрастом и характеризуется истощением пиро-нинофильных клеток при химической бурсэктомии. Сумка Фабрициуса является местом генерации В-клеток, и удаление этого органа приводит к резкому или полному подавлению антителопродукции. Клеточный состав органа не отличим от такового железы Гарднера.
Млекопитающие (Mammailia) представляют собой класс, в котором воплощен весь исторический опыт формирования системы иммунной защиты.
20.2. ТРАНСПЛАНТАЦИОННЫЙ ИММУНИТЕТ
Познание проблем эволюции иммунитета невозможно без сравнительного изучения явлений, объединеных общим понятием — трансплантационный иммунитет. Констатация факта реакции на трансплантационные антигены и создания памяти от первичного контакта с чужеродным фактором у представителей того или иного таксона позволяет говорть о наличии у них специфической иммунной формы защиты.
В рамках проблемы эволюции трансплантационного иммунитета решаются следующие вопросы.
1. С какого филогенетического уровня возникла способность к специфическому, истинно иммунному распознаванию чужеродности антигенного материала?
2. Каковы конкретные клеточные механизмы, действующие в реакции отторжения чужеродного материала?
3. Являются ли клетки, участвующие в отторжении трансплантата у разных филогенетических групп (имеются в виду в первую очередь беспозвоночные и позвоночные животные), гомологами или аналогами по отношению друг к другу?
4. Каковы причины возникновения и эволюционного развития специфических реакций отторжения?
20 .2.1. Сравнительная феноменология трансплантационного иммунитета
Губки и кишечнополостные. Губки, как и колониальные кишечнополостные, являются удобным объектом для проведения трансплантационных исследований. Отростки некоторых видов губок легко пересаживать с одной особи на другую, так же как боковые выросты колониальных кораллов.
Способности губок к самораспознаванию на межвидовом и внутривидовом уровнях были продолжены в 70-80-х годах с использованием приемов трансплантации отдельных отростков. Во всех случаях при аутотрансплантации (пересадке отростка с одного места особи на другое) наблюдается полное срастание транс-406
Рис. 20.6. Образование разделительного коллагеноподобного слоя (РКС) между отростками двух линий пресноводной губки Ephydatia fluviatilis
плантата с организмом. В то же время при аллотрансплантации (пересадке между особями одного вида) развивается реакция отторжения. Причем такая реакция имеет две формы проявления в зависимости от вида губок. Так, у пресноводной губки Ephydatia fluviatilis в зоне контакта формируется “цементный” (коллагеноподобный) слой (рис. 20.6). У Axinella polypoides — реакция несовместимости носит иной, физиологически более активный характер и проявляется в развитии зоны клеточного некроза в месте контакта. Отторжение
трансплантата включает три этапа: 1) слияние трансплантата с основным организмом, 2) локальная клеточная аккумуляция в зоне контакта, 3) отделение (некроз или образование “цементного” слоя) трансплантата от хозяина.
Среди губок имеются виды, такие, например, как Ephydatia fluviatilis, Eph. mulleri, Axinella polypoides, Ax. mexicana, Cyamon argus и др., которые не способны к формированию иммунологической памяти после первичного контакта с алло- или ксенотрансплантатом и демонстрируют тем самым неиммунологическую природу отторжения. В то же время, другие виды — Callispongia diffusa, Xestospongia exigus, Hymeniacidon perleve — характеризуются формированием кратковременной иммунологической памяти от первичного контакта с аллотрансплантатом (табл. 20.3).
При аллогенном переносе у кишечнополостных реакция несовместимости и проявляется либо в лизисе контактирующих клеток трансплантата (рис. 20.7), либо в образовании гипербластичес-кого столона при отсутствии слияния трансплантационных партнеров. Реакция несовместимости при межвидовых переносах носит более выраженный характер по сравнению с аллогенной трансплантацией. Формирования иммунологической памяти у таких видов как Hydractinia echinata, Anthopleura elegantissima, An. krebsi, Leptogorgia yirgulata, Lophogorgia sarmentosa и др. не происходит. Однако американский исследователь Hildemann, работая в акватории Гавайских островов, обнаружил один вид кораллов —Montipora verrucosa, который демонстрировал иммунологическую природу отторжения. У аллогенных парабионтов в месте контакта неродственных тканей развивалась зона некроза, достигавшая максимума к 22-му дню. Вторичный трансплантат от той же самой доноре-
Таблица 20.6
Временные параметры и особенности отторжения алло(ксено)трансплантатов (1 — первичного, 2 — вторичного) у животных различных таксономических групп
Тип, класс Вид Алло-, ксено-транс-плантат Время выживания, дни Форма отторжения
1 2
Губки Ephydatia fluviatilis Axinella polypoides, Hymeniacidon sinapium Ephydatia fluviatilis, Eph. mulleri, Spongilla lacustris, Eunapius fragilis алло- алло- алло- ксено- образование коллагеноподобного слоя образование зоны некроза то же
Callispongia diffusa алло- 11,3 7,0
Xestospongia exiges Hymeniacidon perleve аллоалло- 8,2 3,2
Кишечнополостные Hydractinia echinata Anthopleura elegantisima, An. krebsi, Leptogorgja vitgulata, Eunicella stricta, Lophogorgia sarmentosa алло- ксено- 10,4 (7-14) 7,0 (4-14) гиперпластический рост гиперпластический рост или образование зоны некроза
Montipora verrucosa алло- 22,0 (16-40) 11,6 (9-23) образование зоны некроза
Немертины Lineus sanguineus -t L. ruber ксено- 15,4 8,6 образование зоны некроза, депигментация ткани
L. ruber -> L.sanguineus ксено- 16,4 8,6 то же
Кольчатые черви Eisenia foetida алло- 15-225 =70
E. foetida -> Lumbricus terrestris ксено- 40 25 _и_
Членистоногие Blaberus giganteus -> Periplaneta americana ксено- >3 инкапсуляция
Иглокожие Cucumaria tricolor алло- 129-185 = 50 образование зоны некроза, депигментация ткани
Dermasterias imbricata алло- 213 (170-266) 42,2 (18-110) то же
Strongylocentrotus droebachiensis алло- 30 12
408
Окончание таблицы 20.3
Тип, класс Вид Алло-, ксено-транс-плантат Время выживания, дни Форма отторжения
1 2
Оболочни- Styella plicata алло- 38±6 28±3
ки
Позвоноч-
ные:
кругло- Eptatreus stoutii алло- 72 28
ротые (41-140) (18-119)
Petromyson marinus алло- 38 (21- 18
291) (7-252)
хряще- Dasyatus americana алло- 31 12
вые рыбы Heterodontis алло- 41,1 16,7 и
francisci (27-48) (15-22)
костные Polyodon spathula алло- 42,7 12 к
рыбы (21-76)
Lepisosteus platyrhincus алло- 18 —
Osteoglossum алло- 17,9 5,1
bicirhosum (13-25) (3-7)
Carassius auratus алло- 7,2 4,7
(6-11) (4-6)
Cyprinus carpio алло- 7,5 4,1 а
Asquidens latifrons алло- 7,2 4,5 - -
(6-11) (3-6)
Cymatogaster sp. алло- 5,8 4,0 и
Fundulus sp. алло- 3,5 2,0
амфибии Diemictylus viridescens алло- 40 —
Typhlonectes compressicauda алло- 21-161 42-78
Bombina ombina алло- 50-63 17-30 _и_
Bufo bufo алло- 52 —
Xenopus laevis алло- 51 —
пресмы- Chlidra serpentina алло- 47,3 25,4 и
кающиеся (41-70) (20-32)
Chrysemys picta -> ксено- 26,3 17,4
Chelidra serpentina (22-28) (16-21)
Emys blandingii -> ксено- 24,8 15,6 _w_
Ch. serpentina (22-29) (12-19)
Anolis carolinensis ксено- 60-90 —
Chemidophorus sexlineatus алло- 26 — _и_
Ctenosaura pectinata алло- 48-87 30-86
Calotes versicolor алло- 60-80 —
Xanthusia vigilis алло- 21-245 —
Thramnophis sirtalis алло- 41 25
(31-53) (21-29)
Caiman sclerops алло- 65 (25-110) —
Chaicides ocellatus алло- 28 —
кой колонии, подсаженный через две недели после отторжения первичного трансплантата, отторгался в два раза быстрее — в сред-409
нем за 11,6 дня. При пересадке вторичного трансплантата через 4 недели после первичной трансплантации наблюдалось снижение эффективности вторичной реакции — до 15,3 дня. Ускоренного отторжения вообще не было, если повторная пересадка осуществлялась через 8-16 недель. Эти данные прямо демонстрируют формирование кратковременной памяти. Относительно незначительное время сохранения памяти связано, вероятно, с ограниченной продолжительностью жизни клеток, осуществляющих иммунологический надзор у
Рис. 20.7. Образование зоны некроза (ЗН) между ветвями разных колоний горгониевого коралла Lophogprpa sarmen-tosa
Montipora verrucosa.
Немертины. Немертины образуют самостоятельный тип животных, включенных в надтип низших червей. Основной характеристикой этих животных является отсутствие вторичной полости тела, хотя они в отличие от кишечнополостных развиваются из трех зародышевых листков, и мезодерма определяет формирование тканей внутренней среды, столь существенной в становлении иммунной системы.
У немертин рода Lineus аутологичные и аллогенные трансплантаты приживаются, ксенотрансплантаты отторгаются. В качестве трансплантируемого материала берут переднюю, головную часть тела, которую подсаживают на соответствующий участок тела реципиента. Реакция тканевого отторжения проявляется в депигментации клеток, набухании трансплантата, формировании зоны некроза в месте контакта с чужеродной тканью. Время отторжения ксенотрансплантата варьирует в зависимости от видовой принадлежности пары донор — реципиент.
Кольчатые черви. Тип кольчатых червей объединяет сегментированных, первичноротых беспозвоночных, имеющих вторичную, разделенную перегородками полость тела. Как в крови, так и в целоме представлен идентичный набор клеток, принимающих участие в иммунологических реакциях зашиты.
В середине 60-х годов, когда господствовало мнение об отсутствии какой-либо формы специфического иммунитета у всех без исключения беспозвоночных, три исследователя: Валембо (1963), Дюпре (1964) и Купер (1965) — показали, что представители семейства Lumbricidae способны к специфическому распознаванию чужеродного трансплантата и созданию иммунологической памяти. Эксперименты проводили с кусочками покровных 410
тканей. Аутологичная ткань полностью срасталась с тканью хозяина. В то же время при алло- и ксенотрансплантации регистрировались депигментация клеток пересаженной ткани, ее набухание и в итоге — отмирание трансплантата. УEisenia foetida первичный аллотрансплантат отторгается в хронической форме с временными колебаниями в пределах 15-225 дней. Максимальная продолжительность жизни вторичного трансплантата — 70 дней.
Межвидовая трансплантационная реакция в сем. Lumbricidae имеет более острый характер. Трансплантат от Е. foetida отторгается хозяином L. terrestris приблизительно за 40 дней. Вторичный ксенотрансплантат отмирает за более короткий срок.
Иглокожие и оболочники. Иглокожие и оболочники представляют собой два самостоятельных типа высших беспозвоночных, относящихся в филогенетическом древе к мощной ветви вторичноротых. Прямая филогенетическапя связь этих типов с позвоночными животными определяет важность изучения их специфического иммунитета как предвестника наиболее совершенных форм иммунной защиты, свойственной млекопитающим.
Наличие специфического аллотрансплантационного иммунитета с формированием кратковременной иммунологической памяти в типе иглокожих известно для морского огурца Cucumaria tricolor — обитателя тропической зоны Тихого океана. Как и для многих других беспозвоночных, визуальным критерием отторжения является депигментация пересаженной ткани. Первичный аллотрансплантат у данного вида отторгается в хронической форме за 129-185 дней. Вторичное отторжение проходит эффективнее — приблизительно за 60 дней, демонстрируя тем самым способность к формированию иммунологической памяти.
В типе оболочников специфическое отторжение аллотрансплантата обнаруживается как у одиночных, так и у колониальных форм. У Botryllus schlosseri в ситуации, когда генетически отличающиеся колонии вступают в прямой контакт, наблюдается либо отторжение неродственных особей с некрозом контактирующих поверхностей, либо их слияние, однако в результате такого объединения физиологически стойкого химеризма не возникает, и один из партнеров в химере подвергается резорбции. В то же время генетически идентичные особи при прямом физическом контакте сливаются , образуя единую форму. Слияние особей в природе при их плотном поселении описано, например, для одиночного оболочника Styela plicata. Частота слившихся пар небольшая и, как правило, не достигает 0,1%.
Позвоночные. На уровне позвоночных животных иммунитет характеризуется определенным прорывом в сторону совершенствования механизмов специфической защиты. Частным случаем прогрессивного развития иммунитета является усиление способности к отторжению аллотрансплантата.
У представителей класса круглоротых первичное отторжение проявляется еще в виде хронического воспаления с явлениями гемморагий и разрушения пигментных клеток (рис. 20.8). У тихоокеанской миксины Eptatretus stoutii первичный трансплантат кожи живет около 72 дней. В результате контакта с аллогенной тканью формируется иммунологическая память, обеспечивающая ускоренное отторжение вторичного трансплантата приблизительно за 28 дней.
У хрящевых рыб, как и у круглоротых, отторжение первичного аллотрансплантата осуществляется по хроническому типу за 30-40 дней. Вторичное отторжение сопровождается более острой воспалительной реакцией.
Костные рыбы (Osteichthyes) представляют собой таксономически сложную и разнородную по морфофункциональным ха-
Рис. 20.8. Отторжение аллотрансплантата у тихоокеанской миксины Eptatretus stoutii.
а — общий вид животного с трансплантатами на боковой стороне в нескольких сантиметрах от головы; б — полностью жизнеспособный аутотрансплантат (слева) и обесцвеченный аллотрансплантат (справа), время выживания которого близится к завершению
рактеристикам группу. По мере эволюционного совершенствования внутри данного класса наблюдается постепенное нарастание силы трансплантационного реагирования. Для анализа явлений трансплантационного отторжения у рыб разработан простой прием пересадки. На место удаленной чешуи реципиента в образующееся ложе вставляют чешую донора. При этом нет необходимости в каких-либо фиксирующих средстах, так как основание чешуи донора точно соответствует подготовленному ложу. В первые сутки после трансплантации (около 72 ч) мягкие ткани донорской чешуи срастаются с тканью хозяина, устанавливается общий кровоток. Однако по истечении латентного периода развивается воспалительная реакция, характеризующаяся гиперплазией, помутнением эпителия, формированием зон некроза, разрушением пигментных клеток. Полная потеря клеточного пигмента — признак завершения деструкции трансплантата.
Настоящие костистые рыбы отторгают первичный и вторичный трансплантаты в острой форме (см. табл.20.3).
В целом у круглоротых, хрящевых и костных рыб прослеживается постепенное нарастание силы трансплантационного реагирования от менее продвинутых в эволюционном отношении таксонов к более прогрессивным группам. Второе существенное обстоятельство состоит в том, что в отличие от беспозвоночных рыбы способны к более длительному сохранению памяти от первичного контакта с чужеродным материалом. Например, несмотря на то что хрящевые рыбы отторгают первичный трансплантат по хроническому типу, через два месяца после пересадки все еще сохраняется память о первичной сенсибилизации.
Класс амфибий включает три отряда: хвостатые (Urodela), безногие (Apoda) и бесхвостые (Anura). Все эти отряды произошли от разных групп палеозойских земноводных, получивших общее название стегоцефалы. Наибольшим эволюционным прогрессом характеризуются бесхвостые амфибии. В этом отряде регистрируются субострая и острая формы отторжения первичного трансплантата. У более примитивных видов: краснобрюхой и желтобрюхой жерлянок (ВотЫпа ЬотЫпа и В. variegata), серой жабы (Bufo bufo) — трансплантат отторгается в субострой форме. В то же время у лягушек наблюдается острая форма отторжения.
В целом в классе амфибий наблюдается та же тенденция, что и у рыб: сокращение времени отторжения аллогенной ткани от менее организованных к более совершенным в морфофункциональном отношении таксонам. Иначе, трансплантационный иммунитет как частный случай специфического иммунного реагирования проходит этапы совершенствования внутри класса амфибий.
Современные пресмыкающиеся включают три основных отряда: черепахи (Testudines), чешуйчатые (Squamata) с двумя наибо
лее многочисленными в видовом отношении подотрядами — ящерицы (Sauna) и змеи (Ophidia) и отряд крокодилов (Crocodylia). Все эти отряды произошли от различных групп котилозавров, возникших от амфибий в каменноугольном периоде — около 325 млн. лет тому назад. Для иммунологов познание специфических форм защиты от чужеродных антигенов у представителей данного класса животных крайне интересно, так как позволяет проследить преемственную связь с птицами и млекопитающими, иммунитет которых изучен достаточно полно.
Следовало бы ожидать, что отторжение аллотрансплантата у рептилий будет более эффективным, чем у амфибий , эволюционно менее совершенного класса. Однако это оказалось не так. Отторжение первичного аллотрансплантата у представителей всех трех классов проходит по хроническому типу. В качестве примера можно привести реакцию отторжения аллотрансплантата у ящерицы-кровососа (Calotes versicolor). Трансплантируемым материалом служили покровные чашуйки. Каждая чешуйка содержит центральное тело — дермин, помещенный в эпидермальный карман, который в свою очередь окружен тонким кератиновым слоем. В субэпидермальном слое находятся темные, звездчатые клетки — меланофо-ры, совместно с красными и желтыми ксантофорами. Во всех случаях через одну неделю после пересадки ауто- и аллотрансплантаты выглядят вполне жизнеспособными. Они хорошо срастаются с тканями хозяина и васкуолизируются. Эпителий хозяина разрастается, заполняя пустоты в трансплантационном ложе. Первые заметные различия между ауто- и аллотрансплантатом наблюдаются через 9 дней после пересадки. Наиболее характерный признак в этот период — набухание кровеносных сосудов, пронизывающих аллотрансплантат. В аутотрансплантате никаких видимых изменений не регистрируется. Через 15 дней «окончательно разрушается некоторое число меланофор и накапливаются свободные темные зерна. К 24-му дню зерен становится больше, почти все мела-нофоры оказываются разрушенными. К 45-му посттрансплантационному дню отсутствуют все пигментные клетки, что является критерием завершения процесса отмирания аллотрансплантата. Время окончательного удаления разрушенного трансплантата в виде струпьев достигает 60-80 дней (рис. 20.9). Описанная картина является наиболее общей для всех рептилий.
В самом общем виде напряженность реакции аллотрансплан-тационного отторжения от наиболее примитивных форм к более совершенным имеет тенденцию к усилению, что выражается во временных параметрах. Однако в этой стратегической линии эволюционного совершенствования реакции несовместимости имеется достаточно много исключений. Так, эффективность отторжения первичного трансплантата у губок и кишечнополостных сравнима с таковой у млекопитающих. Возможно, специфический ком-414
Рис. 20.9. Аллотрансплантация у ящерицы-кровососа Calotes versicolor.
а — кожа хозяина с участками посадки ауто- (справа) и аллотрансплантации (слева); на месте аллотрансплантата после полного отторжения виден рубец; аутотрансплантат выглядит вполне прижившимся; два типа трансплантатов разделены спинным гребнем; б — часть нормальной чешуйки со звездчатыми мелано-форами и кровеносными сосудами; в — часть чешуйки аллотрансплантата через 24 часа после пересадки; видно определенное число разрушенных меланофоров (темные неструктурированные частицы) и некоторое число сохранившихся звездчатых меланофоров; г — часть чешуйки аллотрансплантата через 45 дней после пересадки; видно полное разрушение меланофоров и нормальной структуры ткани
понент иммунного реагирования у представителей данных типов низкоорганизованных животных усилен неспецифической цитотоксической реакцией на чужеродность.
В типе позвоночных сохраняется общая тенденция усиления трансплантационного реагирования от круглоротых к млекопитающим (рис. 20.10). При этом внутри отдельных классов выраженность реакции отторжения у представителей различных таксономических групп неоднозначна. Например, в классе костных рыб представители ганоидных рыб реагируют на аллогенную стимуляцию в хронической форме. Аравановые развивают реакцию отторжения средней силы. В то же время представители настоящих кос-
Настоящие птицы
Бескилевые
| ПТИЦЫ |
Крокодилы
гаттерия
Чешуйчатые ящерицы змеи
Клювоголовые
ара вана
Низшие звери
Настоящие звери
Сумчатые опосум и др.
Высшие Яйцекладущие звери Первозвери
| МЛЕКОПИТАЮЩИЕ |
Черепахи
Настоящие костные рыбы
саламандры
Аравановые
[амфибии
Безногие червяги
| РЕПТИЛИИ
Бесхвостые лягушки жабы
Костные ганоиды щуки, ильные рыбы
Кистеперые Г\ латимерия
Ганоидные осетр веслонос
Двоякодышащие Акулы Скаты Химеры рыбы
Лучеперные рыбы
Лопастолерые рыбы
I КОСТНЫЕ РЫБЫ |
I ХРЯЩЕВЫЕ РЫБЫ I _ ..~' Т--------
Цельноголовые
Пластиножаберные
Круглоротые
Рис. 20.10. Интенсивность отторжения первичного аллотрансплантата у представителей различных классов позвоночных животных.
Черные кружки — острая форма отторжения (около 14 дней); кружки с редкой штриховкой — хроническая форма отторжения (более 30 дней); кружки с частой штриховкой — подострая форма отторжения (около 20 дней); белые кружки — анализ не проводился
тистых рыб отторгают аллотрансплантат в острой форме. Аналогичная картина разных возможностей наблюдается у представителей групп внутри класса амфибий.
20 .2.2. Клеточные эффекторы реакции тканевой несовместимости
Демонстрация способности представителей самых разнообразных типов животных отторгать чужеродный трансплантат ставила вопрос о клетках-эффекторах реакции тканевой несовместимости. Если более высокоорганизованные беспозвоночные и позвоночные животные имеют лимфоциты как самостоятельный тип клеток, то у представителей простейших многоклеточных данная клеточная форма отсутствует. Это обстоятельство тем более возбуждало интерес к выявлению клеток, обеспечивающих отторжение.
Губки и кишечнополостные. Морская губка Hymeniacidon perleve способна как отторгать первичный аллотрансплантат, так и формировать иммунологическую память на аллоантигены. При первичной аллотрансплантации после этапа срастания чужеродных тканей наблюдается интенсивная инфильтрация трансплантированного материала археоцитами (подвижными амебоцитами) хозяина. В зоне контакта происходит некроз тканей либо донора, либо донора и реципиента. Клеточному лизису подвергаются клетки покровного эпителия — пинакоциты и хоаноциты.
Аналогичная картина разрушения аллотрансплантата с участием археоцитов описана у кишечнополостных.
Остается открытым вопрос о клетках, обеспечивающих иммунологическую память. По аналогии с млекопитающими следует предполагать, что за это явление ответственны все те же археоциты, принимающие участие в первичном отторжении.
Кольчатые черви. Большая выраженность процесса отторжения при ксенотрансплантации по сравнению с аллотрансплантацией у кольчатых червей послужила основным аргументом для использования межвидовых химер при анализе клеточных эффектов реакции несовместимости. При этом подразумевалось, что принципиальных различий в механизме клеточного ответа хозяина на алло- и ксенотрансплантат не существует, а сила реакции зависит исключительно от степени антигенных различий между партнерами по пересадке.
При работе с двумя видами кольчатых червей — Е. foetida и L. terrestris — выяснена следующая картина ксенотрансплантацион-ных отношений. В первые 24 ч после трансплантации происходят концентрация целомоцитов вблизи пересаженной ткани и инфильтрация трансплантата клетками. В случае с аутотрансплантатом такая инфильтрация прекращается сразу после удаления механически поврежденных в результате оперативного вмешательства участков ткани. После прекращения воспалительной реакции аутологичная ткань полностью приживается. При ксенотрансплантации возрастающая инфильтрация пересаженной ткани целомоцитами 27 Зак. 3701 417
хозяина сохраняется до полного ее разрушения. Ускоренное разрушение вторичного ксенотрансплантата связано с большим (в 20-40 раз) количеством клеток, мигрирующих в зону отторжения, по сравнению с тем количеством, которое мигрирует при первичном отторжении.
Электронномикроскопические исследования выявили несколько последовательных этапов включения клеток в реакцию несовместимости. В первые три дня наблюдается инфильтрация пересаженной ткани нейтрофилами (макрофагоподобными клетками). По истечении этого времени начинается процесс деструкции внутренних, прилегающих к тканям хозяина мышечных слоев донорского трансплантата. В нейтрофилах видны фрагменты мышечной ткани и крупные фагосомы. Через 11-13 дней нейтрофилы мигрируют во внешние мышечные слои трансплантата. На этой стадии в инфильтрате появляются базофилы (малые лимфоциты), ускоряющие процесс деструкции ткани. При этом, что крайне существенно, ни у ложнооперированных животных, ни при аутотрансплантации в месте нарушения целостности стенки тела реципиента никогда не встречаются лимфоцитоподобные клетки.
Таким образом, при ксенотрансплантации у кольчатых червей в реакцию отторжения вступают не только макрофагоподобные клетки, но и лимфоцитоподобные клеточные элементы, хотя их активность и не имеет той степени проявления, которая присуща высшим позвоночным животным.
Иглокожие и оболочники. У рогатой морской звезды Protoreaster nodosus (тип иглокожие) аутотрансплантат в виде кусочка наружного покрова сохраняет нормальную, свойственную даному виду морфологию. На гистологическом срезе видны три хорошо различимых слоя: эпидермис, толстый слой собственно кожи с рыхлой соединительной тканью и, наконец, подлежащий мышечный слой, в котором видны крипты, выполняющие, очевидно, сенсорносекреторную функцию. В толще ткани встречается незначительное количество лимфоцитов и макрофагов. Аллотрансплантат покровной ткани на последнем этапе выживания представляет собой картину глубокой деградации. К 160-му дню после пересадки пигментные клетки почти полностью разрушены, эпидермис и собственно кожа вакуолизированы, крипты утрачены. В отмирающем трансплантате накапливается большое количество лимфоцитов и эозинофилов; представительство макрофагов ограничено.
Как и у иглокожих, инфильтрация аллотрансплантата у пред-тавителей типа оболочников осуществляется в основном лимфоцитами и макрофагами. При аутотрансплантации у асцидии Styela plicata в первое время после операции наблюдается приток клеток в ложе пересаженной ткани. Однако вскоре их число снижается до
исходного физиологически нормального уровня. Аутогенная ткань полностью приживляется. В случае с аллотрансплантацией на 40-й день после пересадки регистрируется выраженный подъем клеток в инфильтрате, причем лимфоцитов в нем всегда больше, чем макрофагов. При вторичной и третичной аллотрансплантации максимум лимфоцитов в инфильтрате наблюдается к 20-му дню, т.е. раньше, чем при первичном переносе.
Позвоночные. В настоящее время нет каких-либо сомнений в том, что основными эффекторами трансплантационного отторжения у позвоночных животных являются лимфоциты. Простое гистологическое наблюдение указывает на присутствие в воспалительном очаге — зоне отторжения аллотрансплантата — лимфоцитов, гранулоцитов, макрофагов. Более того, среди лимфоцитов доминирующее участие принимают Т-клетки.
Помимо гистологических свидетельств имеются функциональные доказательства. Так, например, у карасей Carassius auratus способность к ускоренному отторжению аллотрансплантата достигается переносом лимфоцитов пронефроса сенсибилизированных доноров в организм интактных рыб. Зашита области тимуса при летальном облучении обеспечивает отторжение аллогенной чешуи в сроки, характерные для необлученных реципиентов.
У амфибий, как и у рыб, отторжение аллотрансплантата сопровождается помимо сосудистых нарушений повышением миграции малых лимфоцитов в зону контакта с чужеродной тканью, причем наибольшее их количество наблюдается в последний период перед отторжением.
Гистологическая картина отторжения аллотрансплантата у рептилий, птиц и млекопитающих достаточно сходна. Помимо прямых эффекторов трансплантационного отторжения — лимфоцитов, в зоне реакции представлены клетки воспаления — неспецифические участники реакции.
20 .2.3. Система гистосовместимости в трансплантационном иммунитете
Эффективность отторжения трансплантата зависит, по крайней мере, от двух причин: уровня развития иммунной системы хозяина и степени индивидуальных различий по антигенам гистосовместимости между донором трансплантата и реципиентом. Подтверждением второго положения являются, в частности, исследования на дождевых червях из разных по удаленности популяций. Во всех случаях межпопуляционные отторжения были более эффективными, чем внутрипопуляционные. Очевидно, в основе ярко выраженных различий по временным параметрам отторжения у иглокожих, круглоротых, хрящевых и костных рыб, хвостатых ам
фибий также лежат индивидуальные, антигенные различия между донором трансплантата и реципиентом.
В настоящее время устоялось мнение, что система гистосовместимости — одна из наиболее общих и древних систем в мире животных. Она представлена уже у наиболее примитивных многоклеточных — губок и кишечнополостных. Подтверждением тому факту, что данные антигены провоцируют развитие реакции специфического отторжения, являются, в частности, опыты по трансплантации у морской анемоны Anthopieura elegantissima (тип кишечнополостные). Мышиные антитела к одному из клонов данного вида подавляют развитие трансплантационного отторжения только того клона, который был взят для получения антител. С помощью моноклональных, клоноспецифических антител был выделен антиген, ответственный за развитие отторжения. Им оказался низкомолекулярный, чувствительный к протеазам полипептид с мол. массой 10 кД.
Система гистосовместимости описана также и у наиболее успешных беспозвоночных — оболочников. УВоПуИих sp. аллорас-познавание контролируется одним высокополиморфным главным и несколькими минорными локусами.
Получены прямые доказательства гомологии между антигенами I класса главного комплекса гистосовместимости млекопитающих и наиболее древних позвоночных животных — хрящевых рыб. При использовании клонированной кДНК в геноме акулы Triakis stylla обнаружен ген, нуклеотидная последовательность которого гомологична последовательности, контролирующей третий домен тяжелой цепи антигена I-класса. У другого вида — акулы-няньки (Ginglymostoma cirratum) выявлен участок ДНК, кодирующий полипептид, аминокислотная последовательность которого гомологична p-цепи антигена II класса главного комплекса гистосовместимости млекопитающих.
Дивергенция антигенов гистосовместимости на два класса у хрящевых рыб закрепилась в эволюции. Этими антигенами обладают костные рыбы, амфибии, рептилии, птицы.
Таким образом, сравнительные данные по выявлению антигенов, провоцирующих реакции отторжения трансплантатов, указывают на очень раннее зарождение системы гистосовместимости. Уже на уровне губок и кишечнополостных данная система имеет свое проявление. Правда, пока непонятно, имеется ли филогенетическая связь этой системы низших многоклеточных с классической системой гистосовместимости, описанной первоначально для млекопитающих (мыши, человека), а затем и для низших позвоночных животных (хрящевых и костных рыб, амфибий, рептилий).
Заключение
Методический прием, основанный на внутривидовой пересадке тканей, оказался достаточно информативным для решения проблем эволюционной иммунологии. В первую очередь он внес вклад в определение уровня, начиная с которого находит свое проявление специфическая иммунная реакция защиты от чужеродности.
По современным данным, наиболее просто организованные многоклеточные (губки, кишечнополостные) уже обладают простейшим механизмом специфического реагирования. Основу такой реакции составляет способность к распознаванию чужеродности с формированием иммунологической памяти. Конечно, иммунная реактивность у этих животных слаба и не является приобретением всех представителей соответствующих таксонов. Однако важен сам факт, демонстрирующий первые признаки специфического ответа на чужеродность.
Возникновение новой функциональной системы, получившей название иммунной системы, имело явно прогрессивное значение для многоклеточных, о чем свидетельствуют данные по формированию все более совершенных способов отторжения чужеродной ткани и созданию все более длительной иммунологической памяти по мере подъема по филогенетической лестнице.
Вопрос о клеточных эффекторах трансплантационного отторжения в определенных пределах кажется решенным. Во всех случаях в зоне отторжения трансплантата помимо клеток воспаления — макрофагов, гранулоцитов, нейтрофилов и др. — обязательно присутствуют лимфоциты. Их количество и динамика включения в процесс варьируют в зависимости от филогенетического уровня реципиента. При этом прямое участие данного клеточного типа в реакции отторжения не вызывает сомнения. До некоторого времени оставался неясным вопрос о типе клеток, реализующих реакцию несовместимости у губок и кишечнополостных. В настоящее время установлено накопление в очаге отторжения этих животных как блуждающих амебоцитов (фагоцитирующих археоцитов), так и трансформирующихся в фагоцитирующие элементы клеток паренхимы, оказавшихся в зоне контакта с чужеродной тканью.
Участие блуждающих амебоцитов губок и кишечнополостных в аллотрансплантационном отторжении заслуживает особого внимания. Функциональная идентичность археоцитов и лимфоцитов более высокоорганизованных многоклеточных в реакции гистонесовместимости реализуется, вероятно, через один и тот же молекулярный механизм — распознавание чужеродного антигена предковым, возможно, однодоменным предшественником Т-клеточного рецептора (ТКР) у археоцитов и полноценным ТКР
— у высших позвоночных животных. Эти представления позволяют говорить об эволюционной преемственности между данными клеточными типами (подробнее см. ниже в этой главе).
Ясно, что реакция трансплантационного отторжения есть ответ на чужеродные антигены. У позвоночных животных индукторами реакции являются в основном антигены гистосовместимости. Наличие антигенной системы гистосовместимости обнаружено и у беспозвоночных животных, однако остается пока неясным, являются ли эти системы аналогами или гомологами по отношению друг к другу. Решение проблемы лежит в сфере молекулярногенетических исследований.
20.3. ЭВОЛЮЦИЯ Т-СИСТЕМЫ ИММУНИТЕТА
Как отмечалось выше (гл. 7), Т-система иммунитета включает тимус, различные субпопуляции Т-лимфоцитов, группу цитокинов, продуцируемых Т-клетками, и эффекторные молекулы — антигенраспознающие Т-клеточные рецепторы (ТКР). Ясно, что полноценному проявлению этой системы у млекопитающих предшествовал длительный путь эволюционного развития.
20.3.1. Возникновение и развитие тимуса
Тимус как центральный орган иммунной системы представляет собой эволюционное приобретение позвоночных животных. У всех беспозвоночных он отсутствует, даже в зачаточной форме. Возникновение данного органа у примитивных позвоночных животных было бесспорно ключевым событием в эволюции иммунитета, и по значимости его следует отнести к эволюционному процессу, подходящему под определение ароморфоза. Действительно, появление специальной органной структуры, основное назначение которой — генерализация в онтогенезе Т-клеточного пути развития, значительно повысило эффективность работы всей системы специфической иммунной защиты. Как говорилось выше, именно в тимусе формируются основные функционально активные субпопуляции Т-клеток, именно в тимусе медиаторы иммунитета находят свое наиболее эффективное выражение в регуляции созревания Т-клеточного пула, именно в тимусе созданы условия для клоноспецифической экспансии Т-клеток и, наконец, именно от тимуса зависит заселение периферии эффекторными и регуляторными клетками, принимающими непосредственное участие в иммунном реагировании (гл. 7).
Круглоротые. В классе круглоротых произошло важное эволюционное событие, определившее формирование Т-системы иммунитета в качестве самостоятельного морфофункционального
образования, входящего в общую систему специфической иммунной защиты. Это событие связано с возникновением в данном классе зачаточного тимуса.
У миксин каких-либо морфологических структур, хотя бы отдаленно напоминающих тимус, еще нет. Однако у более совершенного подкласса миног в области жаберных щелей обнаруживается лимфоидная ткань, которую и считают прообразом лимфо-эпителиального тимуса более высокоорганизованных животных. Это единственное достаточно локальное скопление лимфоцитов с относительно высоким уровнем митотической активности, превышающей пролиферативный потенциал данных клеток в периферической крови.
Хрящевые рыбы. Хрящевые рыбы в целом как класс характеризуются наличием тимуса, расположенным в головной части вблизи глазных впадин. Показательно, что у таких примитивных хрящевых рыб, как цельноголовые (Holocephali), тимус уже дифференцирован на корковую и медуллярную зоны. У представителей подкласса пластинчатожаберных (Elasmobranchii; акул, скатов) также имеется тимус, причем он, как и у других более высокоорганизованных позвоночных животных, подвержен возрастной инволюции.
Костные рыбы. В классе костных рыб лимфо-эпителиальный тимус представлен не только у настоящих костистых рыб (Teleostei), но и у ганоидных, к которым относятся веслонос (Pofyodon spatula) и ильная рыба (Amia calva).
В онтогенезе рыб тимус развивается из эпителия одного или нескольких глоточных карманов. У взрослых рыб он расположен под жабрами в месте крепления верхнего конца жаберной дуги. Как и у млекопитающих, тимус рыб является поставщиком зрелых клеток для периферических лимфо-миелоидных органов и тканей: селезенки, почки, лимфоидной ткани печени. Выселяющиеся из тимуса клетки создают потенциал долгоживущих Т-лимфоцитов периферии, продолжительность жизни которых более 5 месяцев.
Функциональная роль тимуса в иммунных процессах проявляется, в частности, при формировании ответа к аллоантигенам. Так, летальное облучение рыб продлевает жизнь трансплантата, а в ряде случаев чешуя вообще не отторгается. В то же время защита области тимуса свинцовым экраном при облучении сохраняет силу иммунного отторжения аллотрансплантата. В ранние сроки развития иммунного ответа лимфоциты медуллярной зоны тимуса мигрируют на периферию, чтобы принять участие в реакции на антиген. По мере затухания иммунного ответа количество клеток в медуллярной зоне восстанавливается.
Амфибии. В онтогенезе тимус у лягушек возникает очень рано — через три дня после оплодотворения, в результате инвагинации дорсального эпителия второго глоточного кармана. У личинок на 6-8-й день развития (стадия 48) уже сформированы корковая и медуллярная зоны. В отличие от млекопитающих кора и медулла отделены друг от друга особым клеточным барьером, который богат кровеносными сосудами и IgM-продуцирующими клетками. Кора содержит в основном пролиферирующие лимфоциты, окруженные эпителиальными клетками. Кроме того, здесь представлены макрофаги и дендритные клетки. В медуллярной зоне помимо лимфоцитов и клеток стромы изредка встречаются миелоидные клетки, клетки слизистых покровов и пузырчатые, дегенерирующие клетки.
Одно из существенных свойств тимуса амфибий состоит в его способности осуществлять положительную селекцию клонов тимоцитов, распознающих чужеродный антиген в комплексе с собственными антигенами главного комплекса гистосовместимости. Эта ситуация гомологична той, которая известна для млекопитающих.
Функциональная роль тимуса в иммуногенезе наиболее полно проявляется в опытах с тимэктомией. Удаление тимуса приводит к резкому ослаблению аллотрансплантационной реакции, подавлению ответа в смешанной культуре лимфоцитов, угнетению пролиферации лимфоцитов к Т-клеточным митогенам и снижению гуморального иммунного ответа к Т-зависимым антигенам. При этом реакции, которые развиваются без прямого участия Т-клеток, такие как ответ лимфоцитов к В-клеточным митогенам, антителопродукция к Т-независимым антигенам, не страдают у бестимусных животных.
Рептилии. Тимус рептилий начинает развиваться на самых ранних этапах онтогенеза. В результате инвагинации дорсального эпителия глоточных карманов происходит закладка органа. Тимус ящериц, змей, черепах развивается от разных пар глоточных карманов. Так, у ящериц данный орган берет свое начало от второго и третьего, у змей — от четвертого и пятого, у черепах — от третьего и четвертого глоточных карманов. Транзиторные и рудиментарные тимусные почки могут возникнуть также от эпителиальных закладок других глоточных карманов.
У взрослых животных в зависимости от принадлежности к одному из четырех отрядов рептилий наблюдаются анатомические вариации органа как по локализации, так и по числу сформированных долей. Например, у гаттерии и большинства ящериц имеются две нерасчлененные доли с каждой стороны шеи. Отдельно взятая доля состоит из коры и медуллы и не подразделяется на дольки. Тимус крокодила представлен вытянутыми четкообразны-424
ми структурами, которые начинаются у основания черепа, проходят по всей длине шеи и заканчиваются в области сердца. Подобная анатомия тимуса крокодила напоминает морфологию тимуса птиц. Наиболее структурирован тимус у черепах. Он представлен одной долей с каждой стороны шеи в районе раздвоения сонной артерии. Отдельно взятая доля в свою очередь подразделяется на более мелкие дольки с собственной корой и медуллой.
Кора тимуса представлена плотно упакованными малыми лимфоцитами, которые окружены тонкой сетью звездчатообразных эпителиальных клеток. В медуллярной зоне преобладают сла-боокрашиваемые эпителиоциты. Количество лимфоцитов в Медулле относительно невелико. Дополнительными клетками этой зоны выступают макрофаги, эозинофилы и моноциты.
Как и у всех других позвоночных животных, тимус рептилий подвержен возрастной инволюции, выражающейся в нивелировке различий между корой и медуллой и замещении лимфоидной массы органа соединительной тканью.
Тимэктомия и антилимфоцитарная сыворотка значительно снижают ответ к тимусзависимым антигенам. Это подавление коррелирует с истощением Т-зон в селезенке.
Птицы. Тимус птиц представляет собой набор семи пар желез, расположенных на правой и левой сторонах шеи от нижней челюсти до грудной клетки. Нижние доли могут быть погружены в ткань щитовидной железы. В отдельно взятой доле различают кортикальную и медуллярную зоны.
В онтогенезе тимус птиц начинает развиваться из третьего и четвертого глоточных каналов. Первые лимфоциты в зачатке тимуса появляются на 11-й день эмбриогенеза. Это крупные клетки с диаметром около 11 мкм. В последующие дни большие лимфоциты замещаются клетками меньших размеров. Так, между 11-ми 13-м днями эмбрионального развития преимущественный размер тимоцитов составляет 8 мкм, к 16-му дню основная масса клеток имеет размер около 5,5 мкм. Смена гистологической картины связана с процессами внутритимусной дифференцировки и поэтапного перехода клеток от незрелых предшественников к более зрелым формам.
Как и у млекопитающих, тимус птиц является поставщиком функционально отличающихся субпопуляций Т-клеток.
20.3.2. Эволюция Т-клеточного комплекса
Приблизительно до конца 60-х годов существовало мнение, что беспозвоночные как первично-, так и вторичноротые не способны формировать специфический иммунный ответ к чужеродным антигенам. Подобную “несостоятельность” некоторые исследо
ватели связывали с отсутствием у беспозвоночных тимуса. Однако данные по алло(ксено)трансплантационному отторжению у дождевых червей, а также губок и кишечнополостных отвергли устоявшееся мнение. Главный результат исследований на этих животных заключается в констатации того факта, что беспозвоночные, как и позвоночные животные, способны отличать “свое” от “чужого”, развивая специфический ответ с созданием иммунологической памяти. Сам по себе этот вывод имеет принципиальное значение, так как указывает на филогенетический уровень зарождения всей системы специфической иммунной защиты.
В очаге отторжения аллогенной ткани у всех подвергавшихся анализу на тканевую совместимость беспозвоночных за исключением губок и кишечнополостных обнаружены клетки, напоминающие лимфоциты позвоночных животных. Естественно предположить, что именно эти клетки обладают свойством распознавания чужеродности и инициации трансплантационного отторжения. Однако тут же возникает вопрос: являются ли лимфоцитоподобные, эффекторные клетки беспозвоночных гомологами или же они всего лишь аналоги лимфоцитов позвоночных животных? Имея определенный набор сравнительных экспериметальных характеристик можно подойти к решению выдвинутого вопроса.
Основные критерии в данном случае следующие:
1) степень морфологического сходства между клетками беспозвоночных и позвоночных животных (обязательная, но недостаточная характеристика);
2) наличие или отсутствие общих клеточных маркеров и рецепторов у эффекторных клеток сравниваемых групп;
3) спектр функциональной активности клеток-эффекторов беспозвоночных и позвоночных животных.
Морфологическая характеристика. Лимфоцитоподобные клетки обнаружены у простейших червей и всех целомических беспозвоночных животных. Наиболее полно данный тип клеток изучен у кольчатых червей сем. Lumbricidae.
В очаге отторжения ксенотрансплантата у дождевых червей Lumbricus terrestris и Eisenia foetida скапливаются малые (тип I) и большие (тип II) лимфоциты. Именно с этими клетками связан процесс деструкции и отторжения чужеродной ткани. Лимфоцитоподобные клетки имеют размер 5-30 мкм и составляют более 60% от всех клеток целомической жидкости. Малые лимфоциты представляют собой овальные или сферические клетки с незначительным количеством цитоплазмы. Среди органелл представлены митохондрии, аппарат Гольджи и шероховатый эндоплазматический ретикулум. Кроме того, встречаются дополнительные включения в виде прозрачных гранул и темных вакуолей.
Несколько более крупные лимфоцитоподобные целомоциты типа II представляют сходную с клетками типа I морфологическую картину. Однако у них больший объем цитоплазмы, которая формирует тонкие псевдоподии, а также увеличено количество внутриклеточных включений (см. рис. 20.2).
В целом лимфоцитоподобные целомоциты L. terrestris обладают структурным сходством с незрелыми лимфоцитами позвоночных животных.
Маркеры и рецепторы. Среди маркеров и рецепторов Т-клеток млекопитающих наиболее характерными являются: Thy-1 — маркер всех тимусзависимых лимфоцитов, рецептор к эритроцитам барана, рецепторы к клеточным митогенам ФГА и Кон А; антигенраспознающий рецептор Т-клеток (Е-клеточный рецептор — ТКР) и, конечно, антигены дифференцировки CD4 и СВ8.
Структуры, серологически родственные белку Thy-1 грызунов, представлены на целомоцитах кольчатых червей, моллюсков, оболочников, рыб, амфибий, рептилий, птиц. Более того, при использовании метода иммуноблотинга их удалось обнаружить даже у бактерий и дрожжей.
Из нервной ткани кальмара (тип моллюски) был выделен гомолог Thy-1 млекопитающих, который содержал 84 аминокислотных остатка и включал блок из пяти аминокислот, уникальный для маркера Thy-1.
Первоначально данный маркер не был связан только с одним типом клеток. Лишь последующие эволюционные преобразования определили его принадлежность Т-клеткам. В данном случае важна не эволюционная динамика, а тот факт, что Thy-1 представлен как на тимусзависимых клетках млекопитающих, так и на целомоцитах первично- и вторичноротых беспозвоночных.
Помимо маркера Thy-1 у дождевых червей обнаружен рецептор к эритроцитам барана, свойственный для Т-клеток млекопитающих.
Целомоциты как первичноротых, так и вторичноротых способны отвечать пролиферативным ответом на митогены Т-клеток — ФГА и Кон А.
И, наконец, крайне существенно, что у вторичноротых беспозвоночных (морских звезд, оболочников) обнаружены гомологи антигенраспознающих рецепторов Т-клеток млекопитающих.
Сравнительная характеристика функциональной активности Т-клеток. Является очевидным, что о зрелости клеток организма следует судить по тому, насколько эффективно тот или иной класс клеток реализует генетически детерминированную функцию, насколько быстро клетки отвечают на сигналы к осуществлению предначертанной активности. По отношению к Т-клеткам как единой клеточной популяции Т-системы иммунитета показателями полноценности функционального проявления являются: эффек
тивность распознавания антигенно чужеродногоматериала, скорость мобилизации (через пролиферацию и дифференцировку) клона или клонов Т-клеток в ответ на внешние антигенные сигналы, выраженность регуляторной (хелперной и супрессорной) активности, способность к сохранению специфической отвечаемос-ти в виде формирования клеток памяти или сохранения реактивности в системе адоптивного переноса, участие в реакциях клеточного взаимодействия, продукция молекулярных регуляторов (цитокинов) клеточного и гуморального иммунного реагирования. Ясно, что этот перечень функциональных отправлений Т-кле-ток формировался в эволюции постепенно.
Лимфоциты наиболее примитивных позвоночных, каковыми являются круглоротые, хрящевые и костные рыбы, способны отвечать пролиферативной реакцией на Т-клеточные митогены — ФГА и Кон А, хотя требуют при этом значительно большей дозы, чем лимфоциты более высокоорганизованных позвоночных животных. При этом сам ответ никогда не достигает тех значений, которые известны для Т-лимфоцитов млекопитающих. В то же время пролиферативный ответ лимфоцитов амфибий и рептилий на Т-клеточные митогены не отличим от ответа Т-клеток птиц и млекопитающих (табл. 20.4).
Таблица 20.4
Показатели Т-системы иммунитета у различных групп животных
Таксон Тимус Антиген Thy-1 Ответ на Т-кл. митоген Реакция в СКЛ
Кольчатые черви — + + ?
Иглокожие — + + +
Позвоночные
Круглоротые:
МИКСИНЫ — ? + +
миноги + 9 ? 9
Хрящевые рыбы + 9 + +
Костные рыбы + + + +
Амфибии + + + +
Рептилии + + + +
Таксон Ответ на гаптен-носитель Т-хелперы Т-супрессоры ИЛ-2-подобный фактор
Кольчатые черви 9 ? ? ?
Иглокожие ? ? ? +
Круглоротые:
миксины — ? ? ?
миноги ? ? ? ?
Хрящевые рыбы — ? ? ?
Костные рыбы + + + +
Амфибии + + + ?
Рептилии + + + +
Примечание. «—» — отрицательный показатель; «+» — положительный показатель; «?» — не анализировалось.
Реакция в смешанной культуре лимфоцитов (СКЛ) развивается при различиях по антигенам гистосовместимости между взаимодействующими клетками (см. гл. 9). Изучение этой реакции в филогенетическом аспекте крайне важно, так как обнаружение в той или иной группе животных способности их-лимфоцитов реагировать в СКЛ будет указывать на присутствие в лимфоидной популяции Т-клеток, обладающих поверхностными структурами с антигенраспознающей функцией.
Лимфоциты морских звезд (тип Иглокожие) не способны развивать аллогенный ответ в СКЛ. В то же время при различиях между взаимодействующими клетками на видовом уровне регистрируется полноценный ответ. Отсутствие аллогенной СКЛ вовсе не означает, что лимфоциты иглокожих ареакгивны по отношению к аллоантигенам. Как уже отмечалось, животные данного типа отличают “свое” от “чужого” в реакции трансплантационного отторжения. Обнаружение у морских звезд поверхностного белка, гомологичного p-цепи ТКР млекопитающих, также говорит о принципиальной возможнрости к аллораспознаванию. Ареактивность в алло-СКЛ может быть связана с отсутствием определенного рода костимуляторов, которые важны в проявлении реакции in virtro и не столь очевидны in vivo.
Круглоротые и хрящевые рыбы развивают лишь слабую реакцию в СКЛ. В объяснении сниженной реактивности лимфоцитов данных таксономических групп может быть использован тот же аргумент, что и для иглокожих.
Более высокоорганизованные позвоночные животные — костные рыбы и амфибии развивают вполне выраженную реакцию в СКЛ.
Иммунная система рептилий в морфологическом и функциональном отношениях представлена достаточно полно и сопоставима с данной системой птиц и млекопитающих. Отражением подобной морфофункциональной зрелости является способность лимфоцитов представителей этого класса развивать полноценный ответ в СКЛ. Однако если у гомойотермных птиц и млекопитающих подверженность иммунной реактивности сезонным колебаниям выражена слабо или отсутствует (за исключением нескольких видов, впадающих в спячку), то у рептилий напряженность иммунного ответа в значительной степени связана со временем года.
При изучении гетерогенности лимфоцитов у животных различных таксономических групп с выделением клеток, выполняющих Т-клеточную функцию, был использован целый ряд экспериментальных моделей. Одна из них связана с изучением типов клеток, реагирующих на комплекс гаптен—носитель. Выше отме-
чалось (гл. 9), что у мышей В-клетки отвечают на гаптен, в то время как Т-клетки с хелперной активностью — на носиттель.
Изучение реакции на гаптен—носитель у круглоротых и хрящевых рыб дало отрицательные результаты. При этом лимфоциты костных рыб отличают гаптен от носителя, демонстрируя тем самым гетерогенность по признаку Т-, В-клеток.
У амфибий, как и у рыб, воспроизводится феномен гаптен-носитель, в котором именно Т-клетки с хелперной активностью распознают носитель. Анализ взаимодействия Т- и В-клеток у амфибий обогащен данными о роли антигенов гистосовместимости в клеточной кооперации. Феномен гаптен—носитель был проанализирован, в частности, у лягушки Xenopus laevis в опытах с разделенными на нейлоновой вате Т-клетками, примированными к носителю, и В-клетками, примированными к гаптену. Антитела изотипа IgY, которые являются высокотимусзависимыми, и высокоаффинные IgM-антитела обнаруживались в Т-В-клеточной культуре только в условиях идентичности гаплотипов взаимодействующих клеток.
Способностью дифференцировать носитель и гаптен обладают также лимфоциты рептилий, что продемонстрировано в опытах in vitro.
Явления клеточного взаимодействия при формировании иммунного ответа подразумевают наличие клеточных гуморальных факторов, реализующих это взаимодействие. У млекопитающих имеется целый набор Т-клеточных цитокинов, которые обеспечивают регуляцию иммунного ответа (гл. 4, 9, 13). Сравнительная иммунология пока не может похвастаться теми успехами, которые достигнуты при изучении данной группы белков у млекопитающих, хотя определенные усилия в этом направлении предприняты и касаются главным образом рыб и амфибий. Именно в этих классах позвоночных животных обнаружены цитокины с ИЛ-1-, ИЛ-2- и МИФ-подобной активностью. Кроме того, фактор с митогенной активностью выделен из Т-подобных клеток аксиального органа морских звезд.
Заключение
Все беспозвоночные лишены тимуса — места развития Т-кле-ток. Впервые зачаток тимуса в виде небольшого скопления лимфоидных клеток в районе жаберных щелей появляются у круглоротых. Возникновение в филогенезе данного морфологического образования бесспорно явилось важным арогенным событием, так как поставило всю систему специфической иммунной защиты на более высокий уровень. Адаптационное значение данного события легко понять, наблюдая путь, по которому шло эволюционное 430
совершенствование органа от менее структурированной формы низших позвоночных животных к более высокой морфологической и гистологической организации у представителей высокоорганизованных таксонов. Эта тенденция выражается, в частности, в делении органа на доли, дольки, фолликулы Кларка — элементарные гистологические структурные единицы, в наличии телец Гассаля и четком делении паренхимы на корковый и медуллярный слой.
Эволюционное развитие Т-системы связано с возникновением Т-лимфоцита. Знаменательно, что еще до появления специализированного органа, где собственно и происходит “оформление” недифференцированного предшественника в Т-лимфоцит (тимуса), животные (кольчатые черви, иглокожие, оболочники и др.) уже имеют целомоциты с Т-клеточными свойствами. О преадаптации целомоцитов беспозвоночных к Т-клеточному пути развития говорит целый ряд фактов.
1. В очагах отторжения алло(ксено)трансплантатов у беспозвоночных представлены клетки, морфологически неотличимые от лимфоцитов позвоночных животных.
2. На целомоцитах представителей многих филумов беспозвоночных обнаружены структуры, родственные наиболее характерному маркеру Т-клеток млекопитающих — антигену Thy-1.
3. Лимфоциты беспозвоночных, как и клетки позвоночных животных, способны отвечать на Т-клеточные митогены — ФГА, Кон А. Несмотря на то, что этот ответ ниже, чем у высших позвоночных животных, важен сам факт такой возможности. Он говорит о наличии на поверхности лимфоцитов беспозвоночных структур, взаимодействующих с митогенами Т-клеток.
4. Очень существенна информация об экспрессии на поверхности лимфоцитов иглокожих и оболочников отдельных полипептидов или полноценных антигенраспознающих рецепторов, гомологичных соответствующим молекулярным структурам Т-клеток млекопитающих. Эти факты прямо указывают на механизм распознавания чужеродности у беспозвоночных.
5. Лимфоциты иглокожих вступают в реакцию СКЛ на ксено-антигены гистосовместимости, демонстрируя тем самым способность как к распознаванию трансплантационных антигенов, так и формированию ответной реакции — явлениям, свойственным Т-клеткам позвоночных животных.
20.4. ЭВОЛЮЦИЯ В-СИСТЕМЫ ИММУНИТЕТА
Эволюционное становление В-системы иммунитета требует рассмотрения трех основных проблем:
1) возникновение и развитие лимфо-миелоидных образований, ответственных за развитие В-клеток;
2) филогенетический уровень, на котором возникают лимфоциты с В-клеточной функцией;
3) возникновение и развитие основных эффекторных молекул В-системы — иммуноглобулинов.
20 .4.1. В-клетки и антителопродуцирующие органы
У млекопитающих гуморальный иммунный ответ на большинство антигенов (тимусзависимых антигенов) включает несколько этапов. Это — презентация антигена в иммуногенной форме на поверхности фагоцитирующих клеток, распознавание антигена Т-и В-лимфоцитами, антигензависимая дифференцировка В-клеток до продуцирующих антитела плазмоцитов, переключение синтеза одного изотипа антител на другой, формирование клеток памяти (гл.9). Не все из исследованных групп животных, принадлежащих к различным таксонам, способны к реализации этих антигензави-симых процессов в равной степени (табл. 20.5).
Возможно, что первые признаки В-клеток появились у иглокожих. Клетки аксиального органа морской звезды Asterias rubens, прилипающие к нейлоновой вате при фракционировании, способны отвечать на В-клеточные митогены (ЛПС, экстракт из Nocardia ораса). Культура этих клеток в условиях повторной стимуляции гаптеном ТНФ продуцирует антителоподобный фактор, специфичный к соответствующему гаптену. Насколько эти клетки отвечают требованиям В-лимфоцитов, пока не ясно.
Круглоротые. Лимфоидная ткань первичных позвоночных животных — круглоротых — представлена слабо, миксины не имеют дискретных, морфологически хорошо обособленных и самостоятельных истинно лимфоидных образований. Мононуклеарные клетки лимфоидного типа встречаются в мышечной ткани глоточной и заднежаберной областей, в фолликулах кишечника, паренхиме пронефроса, крови. С помощью моноклональных антител в периферической крови тихоокеанской миксины выявлено около 65% лимфоцитов с поверхностным иммуноглобулином (sig) — явным характерологическим признаком В-клеток. Однако у этих животных отсутствует способность формировать активно продуцирующие антитела плазмоциты — завершающую клеточную форму в гистогенезе В-клеток.
В то же время более высокоорганизованные представители класса — миноги — демонстрируют некоторый успех в развитии лимфоидной ткани в целом и В-системы, в частности. Основным органом лимфомиелопоэза взрослых миног является жировое тело — морфологически оформленное структурное образование, расположенное над хордой (рис. 20.11). У личинок функцию лимфомиелопоэза выполняют тифлозоль (спиральный клапан) — прообраз
Таблица 20.8
Характерные признаки В-системы иммунитета в различных таксономических группах
Таксон Интенсивность продукции антител Память В-клетки Плазмоциты
Иглокожие ±
Круглоротые:
миксины ± •— + —
миноги ± — + +
Хрящевые рыбы ± — + +
Костные рыбы + ± + +
Амфибии:
хвостатые + ±* + +
бесхвостые ++ + + +
Рептилии ++ + + +
Птицы +++ + + +
Млекопитающие 4-4-4-+ + + +
Таксон Основной антите-лопродуцирущий орган Число изотипов иммуноглобулинов Выраженн ость спек-тротипов Повышение аффинности антител
Иглокожие Круглоротые: аксиальный орган
миксины 1
МИНОГИ жировое тело (взрослые), тифлозоль (личинки) 1
Хрящевые рыбы пронефрос 1 ± —
Костные рыбы Амфибии: пронефрос ± —
хвостатые ± —
бесхвостые югулярные тела, костный мозг 3 +
Рептилии селезенка, костный мозг 3 ± +
Птицы сумка Фабрициуса 3 ± +
Млекопитающие селезенка 5 ++ ++
Примечания: «*» — память регистрируется не для всех видов таксона; «»*» — двоякодышащие рыбы имеют два или три изотипа; «»»»» — аксолотль имеет два изотипа иммуноглобулинов.
селезенки, и почка, которые в процессе метаморфоза резорбируются, и их функция переходит к жировому телу (зачатку костного мозга протопозвоночной дуги). В тифлозоле личинок и жировом теле взрослых особей обнаружены плазматические клетки — продуценты иммуноглобулинов.
Хрящевые рыбы. У хрящевых рыб (акул, скатов) лимфоциты с поверхностным иммуноглобулином и плазматические клетки представлены в пронефросе, селезенке, лимфо-миелоидном органе Лейдига, связанном с пищеводом, эпигональном органе, распо-
Рис. 20.11. Жировое тело ручьевой миноги Lamperta planeri.
в — жировое тело (препарат Ланге и др., 1990)
ложенном вблизи гонад. В эмбриогенезе первым иммуноглобу-линпродуцирующим органом является печень.
Костные рыбы. У костных рыб около половины лимфоцитов периферической крови обладают поверхностным иммуноглобулином, т.е. являются В-клетками. Этот класс позвоночных животных не имеет функционально активного костного мозга, сумки Фабрициуса, лимфатических узлов. Функцию источника стволовых элементов для лимфоидных и миелоидных клеток и первичного органа для В-клеточного пути развития выполняет пронефрос.
Амфибии. Амфибии представляют собой класс, который определенный прорыв в
совершенствовании специфического иммунитета. Связано это
а — хорда; б — нервная трубка; делает
в первую очередь с их переходом от водного образа жизни к наземному и с необходимостью иметь дополнительные возможности защиты от новой группы инфекционных агентов воздушной и почвенной среды. Прогресс в развитии иммунной системы касается бесхвостых амфибий, которые в эволюционном развитии становятся обладателями функционирующего костного мозга и лимфатических узлов. Процентное распределение В-клеток в различ
ных органах лягушек выглядит следующим образом: югулярные тела — 50%, костный мозг — 14%, кровь — 14%, селезенка — 10% тимус — 1%. Основным источником В-клеток у лягушек, как и у млекопитающих, является костный мозг. Именно переход к наземному образу жизни, потребовавшему развития конечностей,
определил костномозговую ткань как существенное или доминирующее место в преимущественном развитии В-клеточного ростка дифференцировки.
Рептилии. Лимфоидные органы и ткани у рептилий достаточно развиты. Помимо специализированных органов — морфологически хорошо обособленных тимуса, селезенки, костного мозга, лимфоидные скопления встречаются в слизистой кишечника, клоаке, осевом регионе. Наиболее активным органом в продукции антител, как и у млекопитающих, является селезенка. В ней пред-
ставлено около 50% В-клеток, в периферической крови — 25%, в костном мозге — 20% и в тимусе — менее 1%. У зародышей большое количество В-лимфоцитов выявлено в печени, которая, очевидно, является главным органом, где происходит дифференцировка В-клеток в раннем онтогенезе.
Птицы. Сумка Фабрициуса в клоаке, селезенка, железы слепой кишки и железа Гардеотана — органы, где у птиц реализуется антителопродукция. Среди них сумка Фабрициуса занимает доминирующее место. Однако представление о том, что данный орган является первичным в формировании В-клеток, пересматривается.
20 .4.2. Изотипы иммуноглобулинов
По устоявшемуся мнению, способность к синтезу антител есть привилегия позвоночных животных. Тем более интересны данные, полученные французским исследователем Леклером при работе с морскими звездами. Ему и его соавторам удалось выявить антигенспецифический, индуцибельный фактор, который продуцируется клетками аксиального органа. Антителоподобный продукт представляет собой тетрамер с мол. массой субъединицы 30 кД и всей молекулы — 120 кД. Если эти исследования подтвердятся, они будут иметь особый интерес, поскольку иглокожие находятся в одном подразделе с позвоночными животными и эволюционно предшествовали им.
Круглоротые. В классе круглоротых, происшедших от бесчелюстных щитковых, первые находки которых относятся к верхнему ордовику (около 450 млн. лет назад), впервые регистрируются иммуноглобулины. Они обнаружены как в подклассе миксин, так и в подклассе миног. У миксин иммуноглобулин имеет высокомолекулярную форму — около 1 млн. дальтон — и представлен комплексом нековалентно связанных субъединиц с мол. массой каждой от 17 до 33 кД, причем доминирует компонент с мол. массой 22 кД. По этому показателю он подобен легким цепям иммуноглобулинов высших позвоночных животных. Представители более высокоорганизованного подкласса круглоротых — миног — обладают иммуноглобулином с мол. массой около 180 кД. Помимо мономерной формы в незначительном количестве представлена более комплексная форма этого иммуноглобулина (рис. 20.12).
Хрящевые рыбы. У акул обнаружены иммуноглобулины двух молекулярных форм, относящихся к одному и тому же изотипу — с высокой (900 кД) и низкой (189 кД) мол. массой. Как и у млекопитающих, пентамерная форма иммуноглобулина акул объединена в единую молекулу J-цепью. Помимо чисто “внешнего” сходства между иммуноглобулинами двух далеко отстоящих классов 28* 435
позвоночных животных имеется гомология и по аминокислотной последовательности.
Костные рыбы. В классе костных рыб наблюдается определенная гетерогенность молекулярных форм иммуноглобулинов. Однако доминирующей по видам формой являются тетрамер и мономер, относящиеся к одному и тому же IgM-изотипу. В этом же классе впервые в филогенезе возникает дифференцировка иммуноглобулинов по изотипам двоякодышащих рыб.
IgM •а* IgN
Птицы ! !
Рептилии ✓V ! !
Амфибии ✓V 1 !
Двоякодышащие рыбы ч^> М.м. 175 кД М.м. 120 кД
Костистые рыбы 1 М.м. 660 кД
Хрящевые рыбы М.м. 900 кД
_ Миноги ф 1 М.м. 180 кД
1 Миксины «)п
Рис. 20.12. Изотипы иммуноглобулинов у позвоночных животных. Дополнительные сведения в тексте
Амфибии, рептилии, птицы — все характеризуются гетерогенностью по иммуноглобулинам. При этом эволюционная преемственность с млекопитающими установлена только для IgM. Филогенетическая связь других изотипов иммуноглобулинов млекопитающих с изотипами нижестоящих филумов не установлена.
20.5. ИММУНИТЕТ - КОНТРОЛИРУЮЩИЙ ФАКТОР ПРОГРЕССИВНОЙ ЭВОЛЮЦИИ
Современный уровень иммунологических знаний таков, что позволяет в значительной степени понять не только сам предмет иммунологии в целом, но и подойти к оценке роли специфического иммунитета в эволюционном развитии живых существ. Одна из наиболее важных задач иммунологии состоит в разработке второго положения — познания иммунитета как явления, включенного в процесс эволюции.
20.5.1. Мутационный риск — плата за многоклеточность
По определению, мутационные изменения соматических клеток имеют тот же характер, что и подобные изменения половых клеток. М. Бернет, предполагая, что частота мутаций для половых и соматических клеток имеет один уровень, использует следующий расчет. Ежедневно у человека в митоз вступает 10" — 1012 клеток. Какое-либо мутационное изменение должно встречаться с частотой 10-6 на репликацию. Из этого следует, что в одной генетической смене клеточного пролиферирующего пула, происходящей ежедневно, должно накапливаться 105 мутаций. Если принять, что в одной клетке происходит только одно мутационное событие, то легко установить, что к зрелому возрасту (приблизительно к 27 годам; 10 000 дней) в организме человека должно накопиться около 109 мутантных клеток. Цифра значительно занижена, так как выведена без учета более интенсивных пролиферативных процессов в эмбриональный и ранний постнатальный периоды развития. Подобный уровень мутационных нарушений слишком велик, чтобы не приносить ущерба сбалансированной системе целого организма. Особенно следует помнить, что некоторые мутации могут привести к интенсивной клеточной пролиферации, значительно превышающей скорость нормальных пролиферативных процессов.
При рассмотрении вопросов о механизмах защиты индивидуального генотипа следует обратить внимание еще на один факт. Основное заболевание, причину возникновения которого, помимо прочего, связывают с мутационными нарушениями в соматических клетках, — злокачественное новообразование имеет статистически достоверное возрастное распределение. Наибольшая встречаемость различных форм неоплазм у человека отмечается после
40 лет. Естественно предположить, что подобное явление не зависит от увеличения с возрастом частоты мутаций. Напротив, так как по мере старения скорость пролиферативных процессов снижается, вероятность ошибок падает. Остается допустить подавление с возрастом эффективности механизмов, элиминирующих измененные клетки.
Ясно, что уровень мутационного риска тем выше, чем больше соматических клеток в организме.
Эволюционное возникновение многоклеточных от одноклеточных объясняют тем, что возможности многоклеточного организма по сравнению с одноклеточным предшественником значительно шире в его борьбе за существование. Процесс развития собственно многоклеточных шел как по пути увеличения абсолютного количества соматических клеток, так и по пути усиления специализации и дифференцированности отдельных групп клеток. Своего совершенства этот прогрессивный процесс достиг у позвоночных животных.
Однако увеличение числа соматических клеток у эволюционирующих форм жизни шло параллельно с усилением мутационной опасности для клеток тела и, следовательно, всего организма в целом. Мутационный риск есть следствие возникновения и развития многоклеточности — это как бы дань за те преимущества, которые получают многоклеточные формы в их борьбе за существование.
Для иллюстрации высказанного положения обратимся к рис. 20.13. Представим себе гипотетический ряд животных, у которых число возобновляющихся за единицу времени клеток от одного представителя к другому увеличивается на порядок. В начале ряда стоит одноклеточное животное (предположим, это обыкновенная амеба), в конце — человек, имеющий 10'4 соматических клеток, из которых 10п-1012 ежедневно возобновляются.
Мутационный риск (МР) для животных, организм которых содержит то или иное количество делящихся клеток, будет выражаться произведением частоты мутаций 10‘6на число возобновляющихся клеток тела Z:
MP=10-6xZ, где Z — число делящихся клеток; 10~6 — частота мутации.
Подчеркнем, что эта величина выводится только для одной смены клеточной генерации. На рисунке видно, что риск мутационного поражения возрастает по мере увеличения количества делящихся клеток. Так, для животных, имеющих незначительное число возобновляющихся клеток (от 1 до 105), мутационный риск будет величиной отрицательной. Потребуется несколько полных смен клеточных поколений (20-4), чтобы возникла одна мутаци-онно измененная клетка. У животных с большим числом возобновляющихся клеток (106-10") мутационный риск представляет 438
Число клеточных делений, необходимое для возникновения одной мутантной клетки
Рис. 20.13. Зависимость величины мутационного риска (МР) от количества возобновляющихся клеток тела.
Z - число возобновляющихся клеток тела за одну генерацию; 10'6 — частота спонтанных мутаций соматических клеток
собой положительную величину. Уже при смене только части делящихся клеток возникнут мутантные клеточные формы.
Появление многоклеточных явилось важным арогенным преобразованием в природе. Быть многоклеточным с обилием хорошо дифференцированных клеток — полезно для вида. Разнообразие функций, выполняемых отдельными специализированными клеточными популяциями, взаимная связь между клетками, определяющая организм как единую систему, есть результат прогрессивной эволюции. Собственно два показателя: увеличение абсолютного числа клеток и их возрастающая специализация —являются наиболее демонстративными признаками морфо-функционального прогресса в мире животных. Однако быть эволюционно развитым организмом с астрономическим числом высокодиффе-
ренцированных клеток и крайне опасно. Эта опасность кроется в самом факте многоклеточности, в неизбежности сопутствующего мутационного риска. Ясно, что природа должна была выработать механизм, препятствующий накоплению мутантных клеток.
20.5.2. Роль иммунитета в эволюции
Исходя из тех представлений, что величина мутационного риска прямо пропорциональна количеству делящихся клеток, следует допустить, что параллельно процессу развития многоклеточности шло формирование механизмов, сдерживающих мутационный поток. В данном случае необходимо обратить внимание не на внешние биоценотические факторы, а на внутренние, свойственные самому многоклеточному организму. Без успешного формирования этих механизмов эволюция “застряла” бы на том уровне, при котором количество соматических клеток у какого-либо животного ничтожно мало, а период воспроизведения короток. В этом смысле критическая точка — 106 клеток — гипнотизирует. Она выглядит некоторым пределом в эволюции многоклеточных по линии увеличения количества активно делящихся клеточных форм.
Суммируя представленный в данной главе материал, можно попытаться привести в соответствие факты по эволюционному возникновению различных способов иммунного реагирования с уровнем организации в мире животных (рис. 20.14). Всего включено пять проявлений иммунитета: фагоцитоз, аллогенная ингибиция, специфическая клеточная форма защиты, реактивность антигенраспознающих рецепторов и продукция иммуноглобулинов.
Способность одноклеточных организмов к фагоцитозу является тем свойством, которое обеспечивает их питание. Фагоцитоз как реакция амебоцитов-макрофагов на чужеродный материал сохранился у всех многоклеточных животных.
Данные по неиммунному распознаванию чужеродности у большинства изученных представителей наиболее просто организованных многоклеточных — губок и кишечнополостных (табл. 20.6), а также демонстрация явления аллогенного подавления у млекопитающих (гл. 11) позволяют думать, что подобная форма реактивности есть общее свойство всех многоклеточных.
Факты зарождения клеточных форм специфического реагирования у простейших многоклеточных и усиление специфического клеточного иммунитета , обусловленного активностью лимфоцитов, у первично- и вторичноротых животных определяют рамки, в которых данная форма иммунитета имеет место. Если верхний предел специфического клеточного реагирования ясен (это уровень млекопитающих), то нижний (губки, кишечнополостные) выглядит достаточно расплывчатым. Лишь некоторые представи-
ло
Рис. 20.14. Соотношение между различными факторами иммунитета и уровнями организации в мире животных
тели этих таксонов способны к специфическому реагированию с формированием кратковременной иммунологической памяти. Подобные отношения следует отнести к явлению преадаптации элементов клеточной формы реагирования. На рисунке квазииммун-ная форма реагирования отмечена пунктирной линией.
Специфичность клеточной иммунной реакции подразумевает наличие на поверхности эффекторных клеток молекулярных структур, способных к распознаванию чужеродного антигенного материала. Несмотря на то что наличие антигенраспознающих рецепторов у беспозвоночных выявлено только у иглокожих и оболочников, следует предполагать присутствие этих рецепторов также у более низкоорганизованных беспозвоночных, способных к специфическому клеточному реагированию. Широкое распространение однодоменных белков суперсемейства иммуноглобулинов (Thy-1, р2-микроглобулина, Ро — гл. 5) от одноклеточных до высших позвоночных животных вселяет уверенность в том, что какие-то иммуноглобулинподобные, антигенраспознающие структуры будут найдены у низкоорганизованных многоклеточных, способных к специфическому реагированию.
И, наконец, показано, что синтез иммуноглобулинов — компонентов специфического гуморального реагирования — есть привилегия позвоночных животных.
Анализ схемы, представленной на рис. 20.13, ясно указывает на необходимость совершенствования иммунных механизмов кон-441
троля за процессом эволюционного развития многоклеточных животных.
Конечно, тезис о том, что прогресс по линии увеличения количества соматических клеток обеспечивался системой иммунологического контроля за мутационным потоком, был бы более убедительным, если бы удалось провести строгую коррелятивную связь между эволюционно возникающими формами иммунитета и все увеличивающимися размерами носителей этого иммунитета, как это сделано для развивающегося зародыша человека (гл. 19). Отсутствие сведений об истинном количестве воспроизводящихся клеток у представителей разных таксонов, недостаток знаний о состоянии иммунной реактивности у наиболее просто организованных животных не позволяют установить абсолютной связи. И тем не менее, можно попытаться провести подобную оценку в гипотетической форме, опираясь на возможные в прошлом пути развития многоклеточное™. На рис. 20.15 в условном графическом виде представлены варианты эволюционных изменений количества возобновляющихся клеток у представителей тех или иных таксономических групп животных. Относительная клеточная величина отображена размером круга (чем больше предполагаемое количество воспроизводящихся клеток, тем больше диаметр круга и наоборот). Условно нарастание многоклеточное™ обозначено последовательными цифрами 1 — 9. Следует еще раз подчеркнуть, что данная схема полностью умозрительна и указывает лишь на возможные тенденции в эволюционном развитии многоклеточное™.
В глубоком геологическом прошлом (очевидно, в архее) эволюция по линии увеличения количества соматических клеток, вероятно, завершилась бы на стадии С4 и не имела бы успеха в дальнейшем увеличении клеточности по причине отсутствия специфического контроля за мутационным потоком. Вместе с тем, при том же уровне многоклеточное™ форма D4, обладающая определенным видом специфического иммунологического контроля, “обречена”на эволюционный успех. Дальнейшее историческое развитие могло привести как к увеличению абсолютного количества пролиферирующих клеток (линия D-Н), так и к различного рода колебаниям по многоклеточное™ (D-Dn, Е-Еп и т.д.). Это может быть связано с различными условиями существования вида и действием факторов отбора, отличных от иммунных. В результате на уровне современных форм (Dn-Hn) диапазон колебаний многоклеточное™ велик, а представители с незначительным количеством клеток, но прошедшие предковый путь становления иммунитета, соседствуют с формами, имеющими большее количество соматаческих клеток, но не обладающими специфическим иммунитетом. Так, наиболее мелкие виды высокоорганизованных клаЬ-442
I— Фагоцитоз
h Аллогенная ингибиция ——.........——————
Специфический кпет. и гумор. иммунитет
Рис. 20.22. Схема включения иммунных механизмов контроля за эволюцией много клеточности.
Точка — одноклеточные; кружки 1 —9 — условное обозначение количества воспроизводящихся соматических клеток у эволюционирующих многоклеточных животных; B-Bn, C-Cn, D-Dn — направления условного филогенетического развития; Си — тупиковый путь развития; D4 — многоклеточный организм, с которого начинается филогенетическое развитие специфического иммунитета
сов птиц и млекопитающих, имеющих полностью сформированные механизмы иммунной защиты, уступают по размерам некоторым видам кишечнополостных, либо не обладающим специфической защитой, либо с очень слабой защитой. Иными словами, выдвигая тезис о контролирующей роли исторически развивающихся механизмов специфического иммунитета, следует относить эту роль к начальным этапам становления многоклеточное™, к тому исходному периоду, когда определялся сам путь эволюционного развития многоклеточное™.
Каково количество соматаческих клеток, начиная с которого оно не могло бы увеличиваться без параллельного становления специфических форм иммунологической защиты? Исходя из принципов биогенетического закона Геккеля, следует думать, что такое количество незначительно. Уже на самых ранних этапах зародышевого развития позвоночных животных регистрируются признаки Т- и В-систем иммунитета (гл. 19). Возможно, эта величина составляла 1x10е воспроизводящихся клеток — тот предел, с которого мутационный риск становится положительной величиной (рис. 20.13).
На основании всего сказанного выше следует заключить, что на эволюцию иммунитета не следует смотреть только как на самостоятельную линию исторического развития, связанную с анти-инфекционной защитой, но скорее как на такой эволюционный процесс, который самым тесным образом связан с эволюцией многоклеточных вообще. В связи с подобными представлениями кажется разумным утверждение, согласно которому исторически развивающийся иммунитет явился одним из важных факторов прогрессивной эволюции в мире животных.
Выяснение механизмов, препятствующих мутационному потоку в процессе индивидуального развития, и разработка вопроса о значении таких механизмов в прогрессивной эволюции — это в действительное™ познание еще одного фактора стабильности в биологии. Жизнь на нашей планете представлена хорошо обособленными, дискретными формами, которые образуют собой видовую мозаику биосферы. Стабильность генома в ряду поколений обеспечивается механизмами наследственности. Имеющиеся мутационные нарушения генетического аппарата половых клеток незначительны, хотя и необходимы для эволюционного преобразования.
Стабильность индивидуального развития — залог осуществления наследственной преемственности. Иными словами, стабильность в процессе онтогенеза требуется для доставки наследственного материала от особей одного поколения особям другого. Од-
ним из механизмов генетической стабильности соматических клеток в процессе онтогенеза является специфический иммунитет. Это утверждение справедливо для большинства многоклеточных форм жизни. Без формирования в онтогенезе и эволюционного развития в филогенезе механизмов иммунологического контроля за соматическим мутагенезом жизнь достаточно организованных многоклеточных была бы невозможна.
Заключение
Оценивая в целом историческое становление специфического иммунитета, следует подчеркнуть следующее.
1. Определяющая форма защиты от инфекционных агентов у беспозвоночных — неспецифическая, обеспеченная в основном активностью амебоцитов-макрофагов и набором гуморальных факторов. Однако даже у низших многоклеточных, каковыми являются губки и кишечнополостные, наблюдается определенная форма преадаптации к специфическому иммунному реагированию на чужеродный материал. Аллотрансплантационное отторжение с формированием кратковременной иммунологической памяти у этих животных является показателем такой преадаптации. Главная эффекторная клетка в реакции иммунного отторжения, как и в ан-тиинфекционном иммунитете, — блуждающий амебоцит. Очевидно, именно этот клеточный тип впервые в эволюции становится обладателем предкового V-гена.
2. К стратегическим успехам эволюционного развития иммунной системы следует отнести возникновение как в линии первичноротых, так и в линии вторичноротых беспозвоночных специализированной, антигенраспознающей клетки — лимфоцита. Именно с лимфоцитом беспозвоночных связывается окончательная судьба антигенраспознающих рецепторов. Данный клеточный тип становится основным эффектором специфического иммунитета. Возникновение лимфоцита как основного клеточного инструмента иммунного реагирования следует отнести к категории аро-морфного преобразования по Северцеву, так как это событие определило дальнейшее развитие целой системы организма, без функционирования которой эволюционное формирование многоклеточных было бы невозможно.
Обращает на себя внимание факт гомологии развития лимфоцитов в сравниваемых линиях первично- и вторичноротых. Между антигенраспознающими клетками двух этих филогенетически очень далеко отстоящих линий имеется не только функциональная связь (распознавание антигена в реакциях трансплантационного иммунитета и цитолиз чужеродной ткани, способность к адоптивному переносу, ответ на Т-клеточные митогены), но и морфологичес-445
кая, что само по себе иллюстрирует теорию Заварзина о параллелизме развития функционально идентичных клеток и тканей.
3. Вторым важным эволюционным новшеством в развитии иммунитета является возникновение тимуса у круглоротых. Именно с появлением этого органа лимфоидная (иммунная) система приобретает самостоятельную роль в жизнедеятельности организма. По важности это событие следует отнести к еще одному аро-морфозу в развитии системы.
4. Важным является вопрос о возникновении и развитии вариабельности V-генов как для Т-клеточного рецептора, так и для иммуноглобулинового рецептора. Думается, что процесс множественных тандемных дупликаций и мутационной дивергенции генов для двух типов рецепторов шел параллельно.
5. Одно из существенных свойств эволюции иммунной системы состоит в том, что в процессе ее исторического развития появляющийся вновь признак не исключал предыдущего, от которого он произошел. Так, например, амебоциты (макрофаги) низших беспозвоночных, дав начало лимфоцитам, сохранились для иммунной системы, взяв на себя функцию подготовки антигена к иммуногенной форме и продукции иммунорегуляторных цитокинов. Возникновение доменов иммуноглобулиновых рецепторов В-клеток и антител от доменов Т-клеточных рецепторов не отменило значимую, развивающуюся активность этих последних структур. Примеры подобного рода можно было бы продолжить. Таким образом, специфическая иммунологическая реактивность млекопитающих впитала в себя весь исторический опыт развития иммунных форм защиты — от одноклеточных и низших многоклеточных до высших позвоночных животных.
6. Сопоставление уровней организации в мире животных от одноклеточных до высших многоклеточных, включая позвоночных, с проявлением различных форм иммунного реагирования позволяет предполагать, что иммунитет явился одним из важных факторов прогресса в мире животных по линии увеличения абсолютного количества соматических клеток.
ОСНОВНЫЕ ВЫВОДЫ
1. Иммунитет есть способ защиты организма от всех антигенно чужеродных веществ как эндогенной, так и экзогенной природы; биологический смысл подобной защиты — обеспечение генетической целостности особей вида в течение их индивидуальной жизни.
2. Основным предметом исследований в иммунологии является познание механизмов формирования иммунного ответа ко всем чужеродным в антигенном отношении соединениям.
3. Наиболее характерными признаками иммунной системы, отличающими ее от иных систем организма, являются:
- способность дифференцировать все “свое” от всего ’’чужого”,
- формирование памяти от первичного контакта организма с чужеродным антигенным материалом,
- клональная организация иммунокомпетентных клеток, проявляющаяся в способности отдельного клеточного клона реагировать только на одну из множества возможных антигенных детерминант.
4. Антигенами являются структурно чужеродные для данного организма вещества, способные вызывать иммунный ответ.
Антигены обладают двумя основными характеристиками — антигенной специфичностью и иммуногенностью. Антигенная специфичность есть свойство, отличающее данный антиген от индивидуального антигенного состава иммунизируемого организма (реципиента). Наличие антигенной специфичности проверяется по реакции антигенного вещества с предсуществующими антителами. Иммуногенность представляет собой способность антигенно чужеродного материала инициировать иммунный ответ.
Комплексные антигены (белки, полисахариды) имеют участки, состоящие из немногих аминокислот или углеводов, получившие название “эпитопы”, или “антигенные детерминанты”, на которые собственно и формируется специфический иммунный ответ.
Все антигены делят на тимусзависимые и тимуснезависимые. Первые из них не могут активировать В-лимфоциты без участия Т-клеток, вторые способны к независимой от Т-клеток активации этих лимфоцитов.
5. Иммуноглобулины (антитела) — белки, продуцируемые плазмоцитами и осуществляющие специфическую реакцию нейтрализации антигена, вызвавшего их образование.
Всего известно пять классов (изотипов) иммуноглобулинов: IgM, IgD, IgG, IgA и IgE, характеризующихся общим планом строения. Мономерная форма иммуноглобулина состоит из двух тяже-
лых (Н) и двух легких (L) цепей, объединенных в единую молекулу дисульфидными связями. IgG, IgD и IgE являются мономерами. IgM — пентамер, IgA — димер или тример. Различия между иммуноглобулинами связаны с характерными особенностями строения тяжелых цепей. Как тяжелые, так и легкие цепи состоят из доменов — гомологичных участков полипептидной цепи, замкнутых на себя дисульфидными связями. Тяжелые и легкие цепи имеют N-концевую вариабельную (V) область, включающую один V-домен, и константную (С) область, состоящую у тяжелых цепей из трех или четырех С-доменов в зависимости от класса иммуноглобулинов.
Специфичность иммуноглобулинов формируется при взаимодействии V-доменов тяжелых и легких цепей. Меняющаяся от белка к белку аминокислотная последовательность V-доменов, определяющая собственно специфичность иммуноглобулинов, зависит от рекомбинации набора генов для V-области в процессе созревания В-клеток. Всего число вариантов V-доменов тяжелых цепей равна приблизительно 120 000, вариантов V-доменов легких цепей — 2 000. Случайное сочетание тяжелых и легких цепей в процессе развития клонов В-клеток обеспечивает 2,4-Ю8 специфических иммуноглобулинов. Поскольку каждый клон синтезирует иммуноглобулины одной специфичности, эта цифра указывает на количество В-клеточных клонов.
б. Основным антигенраспознающим рецептором В-клеток является поверхностный иммуноглобулин, относящийся к IgM классу (slgM). Т-Клеточный антигенраспознающий рецептор (ТКР) по своим структурным характеристикам относится к суперсемейству иммуноглобулинов. ТКР построен из двух цепей — аир, которые так же, как и иммуноглобулины, имеют варибельный (V) и константный (С) домены. Специфичность ТКР определяется взаимодействием V-доменов а- и p-цепей. Вариабельность V-доменов, как и у иммуноглобулинов, зависит от рекомбинации генов, контролирующих V-домены ТКР. При этом особенности распознавания антигена у двух типов рецепторов отличаются. Если sig и растворимые формы иммуноглобулина способны к непосредственному распознаванию В-клеточных эпитопов, то ТКР распознает свои Т-клеточные эпитопы только в комплексе с молекулами I или II классов главного комплекса гистосовместимости (МНС). Комплекс экспрессируется на поверхности антигенпрезентирующих клеток (макрофагов, дендритных клеток, В-лимфоцитов).
7. Среди различных белков, принимающих участие в иммунологических процессах, имеется значительное количество таких, которые по основным структурным характеристикам (гомологии аминокислотной последовательности и доменной организации полипептидов) могут быть объединены в единую молекулярную си-448
стему, получившую название “суперсемейство иммуноглобулинов”. В систему иммуноглобулинподобных гомологов включены молекулы Т-клеточного антигенраспознающего комплекса, молекулы I и II классов МНС, корецепторы Т-клеток CD4 и CD8, адгези-ны, рецепторы к иммуноглобулинам. Особое место занимают однодоменные белки — Thy-1, р2-микроглобулин, Рокак эволюционные предшественники всего суперсемейства.
8. Самостоятельную главу в молекулярной иммунологии представляют цитокины как эндогенные регуляторы иммунных процессов. К настоящему времени известно более 30 цитокинов.
В силу структурных особенностей и биологического действия все цитокины делятся на несколько групп: гемопоэтины, интерфероны, цитокины суперсемейства иммуноглобулинов, цитокины ФНО-семейства, хемокины.
Биологическая активность цитокинов проявляется в регуляции таких процессов, как пролиферация и дифференцировка ранних предшественников иммунокомпетентных клеток, созревание наивных Т- и В-клеток в зрелые эффекторы клеточного и гуморального иммунного ответа, переключение синтеза иммуноглобулинов с одного изотипа на другой, индукция цитотоксичности у макрофагов, активация натуральных киллеров, формирование наряду с другими факторами воспалительной реакции и острофазного ответа.
9. Основная функция лимфоидной ткани, которая широко представлена в организме, состоит в реализации иммунных процессов, а понятия “лимфоидный” и ’’иммунный” — суть синонимы для определения одной и той же системы организма.
10. Известны две формы иммунного реагирования — клеточный тип иммунного ответа, осуществляемый Т-системой иммунитета, и гуморальный тип иммунного ответа, который обеспечивается В-системой иммунитета.
11. Т-система иммунитета включает тимус как центральный орган, различные субпопуляции Т-клеток (хелперные CD4 Т-клет-ки — Тн2, CD4 Т-клетки воспаления — Тн1, цитотоксические и супрессорные CD8 Т-клетки), а также группу цитокинов, продуцируемых различными субпопуляциями Т-клеток.
Определяющая функция системы связана с обеспечением клеточной формы иммунного реагирования — цитотоксическим (киллерным) разрушением антигенчужеродных клеток и тканей (трансплантатов, опухолевых и вирусинфицированных клеток), а также с участием в регуляции как клеточного, так и гуморального иммунного ответа посредством включения в иммунный процесс CD4 Т-клеток и супрессорных CD8 Т-клеток.
Основная нагрузка в формировании системы принадлежит тимусу. В органе осуществляются главные события, связанные с 29 Зак. 3701 449
дифференцировкой Т-клеток — их положительной и отрицательной селекцией. При распознавании дифференцирующимися тимоцитами молекул I класса МНС, обильно представленных на эпителиальных клетках органа, развитие завершается формированием CD8 Т-клеток. В то же время, распознавание молекул II класса МНС определяет развитие тимоцитов в CD4 Т-клетки. Помимо этого магистрального пути отбора идет не менее важный процесс отрицательной селекции Из популяции тимоцитов, прошедших положительную селекцию, удаляются клетки, способные реагировать с аутоантигенами, комплексированными с собственными молекулами МНС.
12. В-система иммунитета включает костный мозг в качестве центрального органа иммунитета, В-клетки, обеспечивающие продукцию антител, различные классы (изотипы) антител.
Основное функциональное предназначение системы — формирование антибактериальной защиты.
Процесс образования клеток системы начинается на территории костного мозга. Здесь осуществляется пять этапов клеточного развития от стволовой кроветворной клетки до незрелого В-лимфонита. Два завершающих этапа, включающие формирование зрелых В-клеток и плазмоцитов — активных продуцентов антител, проходят в периферической лимфоидной ткани. Каждый из этапов характеризуется набором специфических клеточных рецепторов и степенью реорганизации иммуноглобулиновых генов.
Как и в случае с Т-клетками, в процесс становления В-клеточного пула включен механизм элиминации клонов, способных продуцировать иммуноглобулины к собственным антигенам. Этот крайне важный процесс для нормального функционирования В-системы реализуется в костном мозге.
13. Клеточный тип иммунного реагирования обеспечивается Т-клетками как основными эффекторами специфического ответа.
Завершение внутритимусного развития лимфоцитов приводит к формированию двух основных субпопуляций — наивных клоноспецифических CD8 и CD4 Т-клеток. Для того, чтобы эти клетки вступили в эффекторную фазу уничтожения антигена, необходимо их дополнительное созревание.
Внетимусный период развития Т-клеток включает три этапа: распознавание антигена, созревание наивных Т-клеток до активных эффекторов и собственно эффекторное действие созревших клеток. При распознавании антигена на поверхности антигенпрезентирующих клеток (макрофагов, дендритных клеток, В-клеток) формируются два сигнала, активирующие Т-клетки к дальнейшему развитию: первый сигнал — в результате взаимодействия Т-клеточного рецептора (ТКР) с иммуногеном и второй сигнал —
от взаимодействия костимулятора В7 с соответствующим лигандом Т-клеток CD28.
Распознавание антигена обеспечивает формирование трех функционально активных субпопуляций: цитотоксических CD8 Т-клеток, СЕМ Т-клеток воспаления (Тн1) и хелперных CD4 Т-клеток (Тн2).
В результате распознавания антигена зрелыми цитотоксическими CD8 Т-клетками в эффекторную фазу иммунного ответа происходят синтез и секреция цитотоксических белков, которые определяют либо некроз, либо апоптоз клеток-мишеней. Созревшие CD4 Т-клетки воспаления после распознавания антигена на поверхности макрофагов начинают усиленную секрецию цитокинов ИФН-у и ФНО-а, которые усиливают процесс разрушения внутримакрофагальных патогенов. Зрелые хелперные CD4 Т-клетки — участники гуморального иммунного ответа.
14. Гуморальный иммунный ответ есть функция В-клеток, трансформирующихся в активные продуценты антител — плазмоциты. Образуемые антитела выполняют три основные задачи: нейтрализацию антигена, его специфическую опсонизацию и активацию белков системы комплемента. Белки системы комплемента, в свою очередь, выполняют ряд функций: неспецифически опсонизируют антиген, формируют поры на поверхности корпускулярных антигенов, определяя их гибель, выступают в качестве аттрактантов, привлекая в зону проникновения патогена клетки воспаления.
В-лимфоциты, закончившие дифференцировку в костном мозге и частично на периферии, остаются функционально неактивными и создают лишь потенциал к будущей встрече с антигеном. Примированная антигеном В-клетка должна пройти путь дополнительной дифференцировки до функционально активного плазмоцита.
По мере развития гуморального иммунного ответа от момента распознавания антигена до наиболее активной продукции антител происходят по крайней мере два важных события: переключение синтеза антител с одного изотипа на другой и повышение аффинности синтезируемых антител. Местом развития этих событий являются вторичные фолликулы, или зародышевые центры. Именно здесь в процесс функционального созревания В-лимфо-цитов вступают два типа клеток — дендритные клетки фолликулов и хелперные CD4 Т-клетки. Первые из них обеспечивают отбор В-клеток на повышенную аффинность, вторые — переключение синтеза антител. В результате вступления данных клеточных типов в иммунный ответ окончательно завершается процесс дифференцировки В-клеток — формируются плазмоциты, активно продуцирующие антитела высокой аффинности, и образуются клетки памяти.
15. Иммуногенетика — раздел иммунологии, занятый изучением четырех основных проблем:
- генетики гистосовместимости,
- генетического контроля структуры иммуноглобулинов и других иммунологически значимых молекул (цитокинов, антигенов главного комплекса гистосовместимости и др.),
- генетического контроля силы иммунного реагирования, - генетики антигенов.
Главные из них — генетика гистосовместимости и генетический контроль силы иммунного реагирования.
16. Главный комплекс гистосовместимости представляет собой группу близкосцепленных генов, основное предназначение которых — контроль различных функциональных проявлений иммунной системы.
Комплекс расположен у человека на 6-й, а у мышей — на 17-й хромосоме и занимает значительный участок ДНК, включающий до 4-108 пар оснований, или около 50 генов. Основными особенностями комплекса являются как его значительная поли-генность — наличие нескольких неаллельных генов, белковые продукты которых гомологичны в структурном отношении и выполняют идентичные функции, так и ярковыраженный полиморфизм — присутствие многих аллельных форм одного и того же гена. Все гены комплекса наследуются по кодоминантному типу. Полиген-ность и полиморфизм определяют антигенную индивидуальность особей вида.
Комплекс включает три группы генов. Каждая группа представлена генами, контролирующими синтез полипептидов одного из трех классов. Наиболее важными в иммунологическом смысле являются молекулы I и II классов. Основная функция этих молекул — представление антигена в иммуногенной форме на поверхности антигенпрезентирующих клеток для цитотоксических CD8 Т-клеток и CD4 хелперных/воспалительных Т-клеток соответственно.
17. Генетический контроль силы иммунного ответа осуществляется одним аутосомным, доминантным геном (Ir-геном), локализованным в главном комплексе гистосовместимости. Фенотипическим продуктом Ir-гена является молекула II класса главного комплекса гистосовместимости. Механизм контроля реализуется через возможность молекул II класса представлять антиген в иммуногенной форме на поверхности антигенпрезентирующих клеток.
18. Аллогенная ингибиция (гибридная резистентность) представляет собой явление подавления роста и развития клеток и тканей в генетически чужеродном микроокружении при отсутствии 452
активных процессов иммунологической природы. Доминирующее значение в феномене аллогенной ингибиции принадлежит молекулам I класса главного комплекса гистосовместимости. Различия по этим молекулам между донором трансплантируемых клеток и реципиентом будет основной причиной явления.
Один из возможных механизмов отмены аллогенной ингибиции связан с созданием микроокружения у реципиента, генетически идентичного трансплантируемым клеткам донорского происхождения.
Другой способ состоит в фенотипической коррекции трансплантируемых клеток. Предварительная инкубация трансплантируемых клеток с мРНК для антигенов гистосовместимости, выделенной от реципиента, отменяет эффект аллогенного подавления.
Явление может быть использовано для анализа механизмов апоптоза и адгезивных свойств молекул главного комплекса гистосовместимости.
19. Помимо специфического иммунного ответа организм способен развивать специфическую неотвечаемость к антигену. Это явление приобретенной ареактивности стали называть иммунологической толерантностью (терпимостью). Феномен приобретенной толерантности, как и феномен иммунологической реактивности, строго специфичен, и индуцируемая толерантность к одному антигену не отменяет ответа на другой. Экспериментальное воспроизведение толерантности дало понимание того факта, что явление специфической неотвечаемости представляет собой физиологически нормальный процесс, проявляющий себя в онтогенезе и направленный на создание ареактивности к собственным антигенам.
20. Организм человека и животных в течение всей жизни постоянно подвергается атаке самых разнообразных инфекционных агентов. Развитию инфекции препятствуют два типа иммунного реагирования: неспецифический (врожденный) иммунитет и специфический (адаптационный, приобретенный) иммунитет.
Весь инфекционный процесс по признаку доминирующего участия одной из форм иммунной защиты делится на два этапа: первый, ранний этап характеризуется немедленной реакцией факторов неспецифический защиты; на втором, более позднем этапе в реакцию защиты от патогена включаются участники специфического иммунного ответа с последующим формированием памяти о первой встрече с возбудителем инфекции.
К факторам врожденного иммунитета относятся: эпителиальные покровы, альтернативный путь активации комплемента, макрофаги и секретируемые ими цитокины (монокины), интерфероны, натуральные киллеры, CD5 В-клетки. Совместная работа
этих факторов приводит к развитию локального по отношению к месту внедрения патогена воспалительного процесса.
Специфическая форма защиты осуществляется Т- и В-сис-темами иммунитета, обеспечивающими нейтрализацию патогена, его последующее разрушение в фагоцитирующих клетках или прямой цитолиз корпускулярных (клеточных) патогенов. Противовирусный иммунитет обусловлен в основном активностью Т-систе-мы иммунитета, в то же время антибактериальный иммунитет формируется в результате работы В-системы иммунитета с подключением клеток Т-системы в качестве регуляторов. Характерной особенностью специфического антиинфекциолнного иммунитета является формирование памяти от первичного контакта с патогеном.
21. Трансплантационный иммунитет представляет собой специфическую реакцию организма на генетически чужеродный биологический материал, проявляющуюся в отторжении неродственного трансплантата и создании иммунологической памяти от первичного контакта с чужеродностью. Иммунная реакция отторжения трансплантата носит комплексный характер и включает как специфические, так и неспецифические компоненты Основными участниками отторжения являются цитотоксические CD8 Т-клетки. Кроме того, в реакции принимают участие специфические иммуноглобулины, а также CD4 Т-клетки воспаления, макрофаги, натуральные киллеры. Макрофаги и другие фагоцитирующие клетки являются участниками воспалительной реакции, развивающейся в зоне отторжения трансплантата.
Успех трансплантации в клинике зависит от индивидуального подбора пар донор-реципиент по признаку максимально возможной идентичности (по трансплантационным антигенам), а также от правильного применения иммунодепрессантов.
22. Одной из характеристик злокачественно трансформированных опухолевых клеток является появление новых, неизвестных для нормальных клеток антигенных особенностей. Появление новых антигенных свойств у опухолевых клеток вызывает развитие противоопухолевого иммунитета. Однако эффективность иммунного ответа к опухолям часто блокируется либо недостаточной иммуногенностью опухолевых антигенов, либо продукцией супрессорных факторов злокачественно измененными клетками.
23. Известны две основные формы повышенной иммунной реактивности: гиперчувствительность немедленного типа и гиперчувствительность замедленного типа. Первый тип реакции проявляется при участии антител IgE, которые цитофильны по отношению к тучным клеткам и базофилам — продуцентам медиаторов воспаления, а также IgG. Второй тип реализуется с помощью
CD4 Т-клеток воспаления (прежнее их обозначение — ТГЗт) как основных эффекторов, обеспечивающих накопление в зоне воспаления макрофагов.
24. В тех случаях, когда в организме появляются антитела или клоны Т-клеток, реагирующие с собственными антигенами, развиваются аутоиммунные расстройства. Известные аутоиммунные заболевания классифицируют по основному механизму иммунологических процессов, включенных в их развитие:
- группа заболеваний, обусловленная антителами к антигенам собственных клеток или клеточного матрикса,
- заболевания, вызванные патогенным действием иммунных комплексов — аутоантител с антигенами организма,
- заболевания, причиной которых являются аутоантигенспе-цифические Т-клетки.
25. Все иммунодефицитные состояния делятся на две большие группы: врожденный (наследственно обусловленный) иммунодефицит и приобретенный иммунодефицит.
В основе наследственно обусловленного иммунодефицитного состояния лежат дефекты генов, контролирующих работу определенных звеньев иммунной системы. В то же время приобретенный иммунодефицит есть результат воздействия факторов внешней среды на клетки иммунной системы. Среди таких наиболее изученных факторов следует отметить облучение и фармакологические средства. К категории иммунодефицитных состояний, вызванных факторами внешней среды, относится и синдром приобретенного иммунодефицита человека, провоцируемый соответствующим вирусом.
26. Становление Т- и В-систем иммунитета у развивающегося зародыша происходит очень рано. Уже через 6 недель у эмбриона человека закладывается эпителиальный тимус. Через 7 недель лимфоциты печени реагируют на аллоантигены в смешанной культуре лимфоцитов. На 8-й неделе зачаток тимуса заселяется лимфоцитами, появляются тельца Гассаля, паренхима органа дифференцируется на корковую и мозговую зоны. Столь же раннее становление Т-системы известно для мышей, овец, птиц, земноводных, рыб.
IgM в цитоплазме больших лимфоцитов появляется на 8-й неделе, хотя определяемый синтез иммуноглобулинов регистрируется только на 11-12-й неделе беременности.
К моменту рождения Т- и В-системы сформированы по основным признакам, однако для достижения полной функциональной зрелости требуется еще некоторое время постнатального развития.
В пожилом возрасте функции как хелперных, так и супрессорных Т-клеток подавлены, что приводит к развитию неопластических поражений и аутоиммунных расстройств.
27. Основные вопросы эволюционной иммунологии связаны с решением проблем возникновения способности к специфическому антигенному распознаванию, т.е. появлению антигенрас-познающих рецепторов как молекулярных факторов такого распознавания, определению путей эволюционного происхождения лимфоцитов — основных участников иммунологических событий, оценке роли специфического иммунитета в эволюционном развитии многоклеточности.
Широкое распространение однодоменных белков — гомологов доменов Т-клеточных рецепторов и иммуноглобулинов от одноклеточных до высших многоклеточных животных, включая человека, возникновение специфического аллоантигенного распознавания у губок и кишечнополостных, появление лимфоцита как самостоятельного клеточного типа у первично- и вторичноротых, а также факты прямой зависимости клеточного мутационного риска от количества воспроизводящихся клеток, позволяют судить о том, что иммунитет явился важным фактором прогрессивного развития в мире животных по линии увеличения абсолютного количества соматических клеток.
СЛОВАРЬ ТЕРМИНОВ
Авидность — суммарная сила множественных (“многоточечных”) взаимодействий между клетками или молекулами, что отличает этот показатель взаимодействия от аффинности как силы взаимодействия отдельного участка в системе рецепторши-ганд.
Агаммаглобулинонемия Х-сцепленная — иммунодефицитное состояние, связанное с дефектом гена, контролирующего синтез тирозинкиназы, btk; при этой форме иммунодефицита развитие В-клеток завершается формированием пре-В-клеток; зрелые В-клетки и антитела не образуются.
Агглютинация — реакция агрегации клеток или корпускулярных частиц (например, липосом); в иммунологии используется для описания взаимодействия клеток со специфическими антителами, где антитела выступают в качестве связующего звена между клетками; реакция взаимодействия эритроцитов с соответствующими антителами получила название гемагглютинации.
Адаптивный (приобретенный) иммунный ответ — специфический по отношению к антигену ответ, осуществляемый клонами Т- и В-кпеток, имеющих соответствующие антигенраспознающие рецепторы.
Адгезивные молекулы — белки, экспрессирующиеся в основном на клеточной поверхности и обеспечивающие взаимодействия между клетками или между клетками и внеклеточным матриксом; неспецифические по отношению к иммунному ответу, они помогают его формированию, организуя миграцию клеток или усиливая межклеточные контакты в процессе распознавания антигена.
Адоптивный иммунитет (от англ, adoptiv — восприимчивый) — иммунитет, вызываемый у интактного реципиента переносом лимфоидных клеток от активно иммунизированного донора.
Адъювант — вещество, усиливающее иммунный ответ при одновременном его введении с антигеном в виде общей смеси или комплекса.
Аллели — варианты одного и того же гена, расположенные на гомологичных хромосомах; определяют полиморфизм особей вида по тому или иному признаку.
Аллелыюе исключение — продукция гетерозиготной клеткой одного из двух возможных аллельных фенотипических вариантов, наблюдается при синтезе аллельных форм иммуноглобулинов, когда одна из форм не образуется.
Аллерген — антиген внешней среды, инициирующий аллергическую реакцию гиперчувствительности немедленного типа.
Аллергическая астма — бронхоспазм, провоцируемый вдыхаемым аллергеном.
Аллергическая реакция — ответ предсуществующих антител на контакт организма с аллергеном; наиболее типичным проявлением реакции является взаимодействие аллергена с предсуществуюшими IgE-антителами, связанными с тучными клетками или базофилами, которые после прошедшего взаимодействия секретируют медиаторы воспаления.
Аллергический ринит — аллергическая реакция в слизистой полости носа.
Аллореактивностъ — термин, используемый в основном для описания реакции Т-клеток на аллоантигены МНС.
Аллотипы иммуноглобулинов — полиморфные формы иммуноглобулинов, связанные с изменением аминокислотной последовательности в тяжелых цепях одного и того же класса этих молекул.
Аллоантигены — антигены клеток и тканей, отличающиеся от иммунизируемого реципиента на внутривидовом (индивидуальном) уровне.
Аллогенная ингибиция (гибридная резистентность) — явление подавления роста и развития клеток и тканей в генетически чужеродном микроокружении при отсутствии процессов отторжения иммунологической природы.
Аллотрансплантация — пересадка органов или тканей между генетически отличающимися особями одного и того же вида или между особями разных инбредных линий определенного вида.
Альтернативный путь активации комплемента — инициируется взаимодействием компонента комплемента СЗЬ с поверхностью бактериальной клетки; активация происходит без участия антител; данный путь активации комплемента относится к факторам врожденного иммунитета.
Анафилактический шок — острая форма аллергической реакции на систематически поступающий в организм антиген, что приводит к отеку дыхательных путей, удушью, коллапсу; в основе реакции лежит массированное взаимодействие антигена с IgE антителами на тучных клетках соединительной ткани.
Анергия — состояние неотвечаемости к антигену Т- или В-клеток.
Антиген — структурно чужеродное для данного конкретного организма вещество, способное вызвать иммунный ответ.
Антигенная детерминанта — см. эпитоп.
Антигенная специфичность — структурные особенности, отличающие определенный антиген от индивидуального, антигенного состава иммунизируемого организма; антигенная специфичность не подразумевает способность носителей этой специфичности вызывать иммунный ответ; гаптены обладают антигенной специфичностью, реагируя с предсуществующими антителами, но сами не могут вызвать их образование.
Антигенпрезентирующие клетки — высокоспециализированные клетки, способные к поглощению и переработке антигена, а также представлению пептидных антигенных фрагментов на клеточной поверхности в комплексе с молекулами I или II классов МНС; основные антигенпрезентирующие клетки: макрофаги, дендритные клетки, В-лимфоциты.
Аигнгенраспозняющий В-клеточный рецептор (поверхностный иммуноглобулин — sig) — поверхностная мономерная ферма иммуноглобулина, относящегося к классу IgM; способен взаимодействовать со свободным антигеном, не связанным с какими-либо дополнительными молекулами.
Аитигенраспознающий Т-клеточный рецептор (ТКР) — сф-гетеродимер, экспрессирующийся на поверхности Т-клеток в комплексе с однодоменными СЗ-белками; основная функция — распознавание иммуногена (антигенный пептид:молекулы I или II классов МНС) на поверхности антигенпрезентирующей или вирусинфици-рованной клетки.
Анпиенсвязываюший участок (аигигенкомбииирующий участок, активный центр антител) — N-концевой участок антител и антигенраспознающих рецепторов, взаимодействующий с антигеном посредством прямого физического контакта; образуется тремя гипервариабельными петлями V-доменов тяжелой и легкой цепей.
Антигены групп крови — поверхностные молекулы эритроцитов, которые обнаруживаются антителами от индивидуума, не имеющего данного антигена; антигены одной группы контролируются аллельными генами; главные антигены представлены группой крови АВО и Rh-системой.
Антисыворотка — жидкая часть крови, которая содержит антитела против антигенов, использованных для иммунизации.
Антитела (иммуноглобулины) — белки сыворотки крови, продуцируемые плазмоцитами в ответ на введение антигена; характерная особенность антител — строгая специфичность по отношению к введенному в организм антигену.
Аигигелозависимая, обусловленная клетками цитотоксичность — разрушение клеток-мишеней, покрытых антителами, эффекторными клетками, имеющими Fc-рецептор; в основном клетками-эффекторами являются натуральные киллеры, обладающие рецептором к Fc-фрагменту иммуноглобулинов.
Апоптоз — программированная клеточная смерть как нормальный физиологический процесс, сопровождающийся деградацией ядерной ДНК, дегенерацией ядра и последующим фагоцитозом погибшей клетки.
Армированные Т-клетки — лимфоциты, прошедшие постантигенный путь активации и способные к непосредственному выполнению своей функции.
Атопическая аллергия (атопия) — явление, обусловленное немедленной гиперчувствительностью к аллергену, взаимодействующему с антителами IgE.
Аттенуированный патоген — патоген, сохранивший свою иммуногенность, но потерявший способность вызывать острое инфекционное заболевание; аттенуация патогена лежит в основе одного из способов получения вакцинного материала.
Аутоантигены — антигены собственных клеток, полимерных молекул конкретного индивидуума.
Аутоантитела — антитела, специфичные к собственным антигенам индивидуума.
Аутоиммунитет — явление разрушения собственных клеток и тканей организма аутоантителами или Т-клетками, примированными к собственным антигенам.
Аутоиммунная гемолитическая анемия — патологическое состояние, характеризующееся крайне низким содержанием эритроцитов в результате их разрушения соответствующими по специфичности аутоантителами.
Аутотрансплантация — пересадка ткани с одного участка тела на другой у того же самого индивидуума.
Аффинность — сила связывания (степень сродства) между отдельными участками взаимодействующих молекул (пример: взаимодействие молекулы антигена с молекулой антитела).
Белки острой фазы — белки, обнаруживаемые в крови вскоре после проникновения инфекционного агента; принимают участие в ранней фазе защиты организма от инфекции; примеры: С-реактивный белок, белок, связывающий маннозу.
Вариабельная область (V-область) — N-концевая часть иммуноглобулина или Т-клеточного рецептора, ответственная за антигенсвязывающую специфичность, которая формируется в результате взаимодействия V-доменов тяжелой и легкой цепей.
Вариабельность иммуноглобулинов — индивидуальная характеристика иммуноглобулинов, относящихся к одному и тому же классу или подклассу; обусловлена меняющейся от белка к белку последовательностью аминокислотных остатков в N-концевой части молекулы; отражает антигенсвязующую специфичночсть иммуноглобулинов как антител.
Вирус иммунодефицита человека (ВИЧ) — инфекционный агент, вызывающий развитие синдрома приобретенного иммунодефицита человека (СПИД); ВИЧ яв
ляется ретровирусом семейства лентивирусов, селективно инфицирующим CD4 Т-клетки, что приводит к их постепенному истощению.
Вирус Epstein-Barr — вирус герпеса, который селективно инфицирует В-клетки человека, взаимодействуя с рецептором к комплементу (CD21); вызывает длительную латентную инфекцию В-клеток, которая контролируется Т-клетками.
Воспаление — реакция организма на тканевое повреждение, инфекцию; характеризуется повышением проницаемости сосудов, накоплением жидкости и клеток в месте инфекции или физического повреждения.
Воспалительные CD4 Т-клетки (Тн1) — субпопуляция Т-клеток, способствующая внутриклеточному разрушению патогена макрофагами; основные цитокины, продуцируемые этими клетками — интерферон-у и фактор некроза опухолей.
Вспомогательные клетки — клетки, которые оказывают помощь при развитии иммунного ответа, но сами не способны к распознаванию антигена; к ним относятся фагоциты, в первую очередь макрофаги, натуральные киллерные клетки, тучные клетки.
Гаплотип — набор сцепленных генов одной гаплоидной хромосомы; гаплотипы гомологичных хромосом идентичны; гаплотипы гетерологичных хромосом могут отличаться (например, у инбредных линий мышей, являющихся гомозиготными, гаплотипы по Н-2-комплексу на гомологичных хромосомах идентичны; гибриды двух инбредных линий имеют Н-2-гаплотипы от каждого из родителей).
Гаптены — простые химические соединения в основном ароматического ряда, не обладающие иммуногенностью, но характеризующиеся антигенной специфичностью, что определяется по их способности взаимодействовать с предсушествую-щими антителами.
Гемолитическая болезнь новорожденных — острое гемолитическое заболевание, вызванное Rh-несовместимостью между матерью и плодом; Rh-отрицательная мать в процессе беременности образует анти-КЪ-антитела, атакующие Rh-положитель-ные эритроциты плода, в результате в периферической крови развивающегося эмбриона накапливаются в значительном количестве незрелые эритробласты на фоне практически полного отсутствия зрелых форм.
Гены иммунного ответа (Ir-гены) — гены, контролирующие силу иммунного ответа; локализованы в 1-области главного комплекса гистосовместимости; фенотипическим продуктом Ir-генов являются молекулы II класса главного комплекса гистосовместимости.
Гетерогенность иммуноглобулинов — свойство, обусловленное костантной частью молекулы, т.е. теми структурными особенностями, которые позволяют делить все иммуноглобулины на классы (изотипы), подклассы, аллотипы и типы легких цепей.
Гибридома — гибридная клеточная линия, полученная в результате слияния антителопродуцирующей клетки с миеломной, активно пролиферирующей клеткой, у которой отсутствует собственный синтез иммуноглобулинов; гибридома образует высокоаффинные антитела узкой специфичности.
Гипервариабельные участки — положения в аминокислотной последовательности V-доменов, в которых наиболее часто встречаются замены аминокислот; эти замены от белка к белку собственно и определяют специфичность иммуноглобулинов и антигенраспознающих рецепторов.
Гипериммунизация — неоднократно повторяющаяся иммунизация организма с целью получить максимально возможный иммунный ответ.
Гиперчувствительность замедленного типа (ГЗТ) — одна из реакций клеточного иммунитета, инициирумая антигеном при внутрикожном введении; реакция обусловлена CD4 Т-клетками воспаления (Тн1); время развития реакции — от нескольких часов до 1-2 суток после введения антигена.
Гиперчувствительностъ немедленного типа — реакция повышенной чувствительности, развивающаяся сразу же после проникновения в предварительно сенсибилизированный организм антигена (аллергена); реакция зависит от специфических к аллергену IgE и IgG, связанных с поверхностью тучных клеток и базофилов.
Гиперчувствительностъ, тип I — реакция повышенной чувствительности, развивающаяся при участии IgE.
Гиперчувствительностъ, тип II — реакция повышенной чувствительности, развивающаяся при участии IgG.
Гиперчувствительностъ, тип III — реакция повышенной чуствительности, обусловленная комплексом антиген :антитело.
Гиперчувствительностъ, тип IV — реакция повышенной чувствительности, обусловленная Т-клетками.
Главный комплекс гистосовместимости (МНС; сокр. от англ, major histocompatibility complex) — группа близкосцепленных генов, кодирующих в основном иммунологически значимые молекулы трех классов; наиболее значимыми являются молекулы I класса, принимающие участие в генерации CD8 Т-клеток, и молекулы II класса, обеспечивающие развитие CD4 Т-клеток.
Грудной проток — основной лимфатический сосуд, в который собирается лимфа из периферических тканей; отсюда она поступает в кровь в месте соединения протока с левой подключичной веной.
Гуморальный иммунный ответ — специфический иммунный ответ, обусловленный антителами.
Деления — удаление последовательности пар нуклеотидов, входящих в некодирующую (интронную) часть ДНК, расположенную между кодирующими последовательностями.
Дендритные клетки —класс клеток, локализованных в Т-клеточной зоне лимфоидной ткани; наиболее характерная морфологическая особенность — разветвленная форма; способны представлять антиген в иммуногенной форме на своей поверхности; наиболее сильные антигенспецифические стимуляторы Т-клеток.
Диапедез — перемещение клеток крови (в основном лейкоцитов) из кровяного русла через эпителий сосудистой стенки в ткани.
Донор — в трансплантологии или экспериментальной клеточной иммунологии организм, от которого получают материал для его введения в другой организм (реципиент).
Зародышевая линия организации генов иммуноглобулинов — исходная локализация иммуноглобулиновых генов в геноме, свойственная зародышевым клеткам или соматическим, неиммунокомпетентным клеткам, а также в геноме В-клеток до начала процесса рекомбинации.
Зачаток тимуса — эпителиальная ткань экто-эндодермального происхождения, из которой развивается строма тимуса в течение эмбриогенеза.
Идиотип — антигенная характеристика вариабельной, антигенсвязуюшей области иммуноглобулинов.
Изотипы иммуноглобулинов (антител) — все иммуноглобулины по структурным особенностям константной области тяжелых цепей делятся на пять изотипов (классов): IgM, IgG, IgA, IgE и IgD.
Иммунитет — способ защиты организма от всех антигенно чужеродных веществ как экзогенной, так и эндогенной природы; фактор стабильности онтогенеза.
Иммунитет неспецифический (врожденный) — представляет систему предсуществу-ющих защитных реакций организма, присущих данному виду как наследственно обусловленное свойство.
Иммунные комплексы — агрегаты антигена со специфическими антителами.
Иммуногенетика — раздел иммунологии, занятый изучением четырех основных проблем: 1) генетики гистосовместимости, 2) генетического контроля структуры иммуноглобулинов и других иммунологически значимых молекул (цитокинов, молекул МНС и др.), 3) генетического контроля силы иммунного ответа, 4) генетики антигенов.
Иммуногенность — способность антигенов индуцировать иммунный ответ.
Иммуноглобулины — см.: антитела.
Иммунологическая память — долговременное сохранение способности иммунной системы отвечать более сильной реакцией на повторную встречу с антигеном, вызвавшим первичный ответ.
Иммунология — медики-биологическая дисциплина, изучающая способы защиты организма от всех антигенно чужеродных веществ (патогенов, трансплантатов, опухолевых клеток).
Инбредная линия — линия животных (в иммунологии главным образом мыши), все особи которой гомозиготны и генетически неотличимы друг от друга, как однояйцовые близнецы.
Шггегрины (LFA-1) — адгезивные гетеродимерные белки клеточной поверхности; принимают участие в межклеточных взаимодействиях и взаимодействии клеток с матриксом; выполняют важную роль в контактной связи лимфоцитов с антигенпрезентирующими клетками и при миграции лимфоцитов и лейкоцитов в ткани.
Интерлейкины (ИЛ) — цитокины, продуцируемые лимфоцитами, макрофагами, натуральными киллерами, другими клетками; основная функция — регуляция иммунитета.
Интерфероны (ИФН) — цитокины, подавляющие внутриклеточное размножение вирусов; интерферон-а и интерферон-^ продуцируются лейкоцитами, фибробластами, другими клетками; интерферон-у — продукт CD4 Т-клеток воспаления, CD8 Т-клеток, натуральных киллеров; активируют макрофаги.
Интрон — некодирующий участок гена, расположенный между экзонами.
Каркасные участки — положения в аминокислотной последовательности V-доме-нов, в которых замены аминокислот от белка к белку встречаются редко в отличие от гипервариабельных участков; такие каркасные участки определяют конформационный консерватизм V-доменов.
Киллерные Т-клетки — общее название для Т-лимфоцитов, способных к разрушению чужеродных клеток; основные киллерные клетки — цитотоксические CD8 Т-лимфоциты.
Классический путь активации комплемента — инициируется взаимодействием Clq с антителами, связанными с поверхностными антигенами бактериальной клетки; в результате последующего развития каскада реакций образуются белки с цитолитической (киллерной) активностью, опсонины, хемоаттрактанты.
462
Кластеры дифференцировки (сокр. англ. CD) — характерологические молекулы клеточной поверхности, выявленные с помощью набора моноклональных антител к различным эпитопам одной молекулы.
Клетки Лангерганса — фагоцитирующие клетки эпидермиса; мигрируют из эпидермиса в региональные лимфатические узлы, где дифференцируются в дендритные клетки.
Клеточная иммунология — раздел иммунологии, занятый изучением клеточных основ иммунитета.
Клон — потомство клеток, возникшее от одного общего предшественника.
Клональная экспансия — активная пролиферация антигенспецифических лимфоцитов в ответ на стимуляцию соответствующим антигеном и их последующая дифференцировка в зрелые эффекторы; накопление антигенспецифического клона — необходимое условие полноценной реализации адаптивного иммунитета.
Клональное истощение — элиминация незрелых лимфоцитов, взаимодействующих с собственными антигенами; процесс, обеспечивающий толерантность к собственным антигенам (self-толерантность).
Кодоминантность — проявление у гетерозиготы признаков обоих аллелей; пример — гетерозиготы по генам I и/или II классов МНС одновременно экспрессируют молекулы, контролирумые каждым из аллелей.
Комплемент (система комплемента) — группа белков, действующая совместно для удаления внеклеточных форм патогена; система активируется либо спонтанно определенными патогенами, либо комплексом антиген:антитело; активированные белки либо непосредственно разрушают патоген (киллерное действие), либо обеспечивают лучшее их поглощение фагоцитами (опсонизирующее действие); либо выполняют функцию хемотаксических факторов, привлекая в зону проникновения патогена клетки воспаления (см. также альтернативный путь активации комплемента, классический путь активации комплемента).
Конгенные линии — линии животных (в иммунологии — мыши), являющиеся генетически идентичными между собой за исключением одного какого-либо локуса; у конгенных линий мышей — различия по главному комплексу гистосовместимости.
Константная область (С-областъ) — инвариантная часть тяжелой и легкой цепей иммуноглобулинов, ответственная за их гетерогенность; состоит из одного С-др-мена у легких цепей и 3 или 4 С-доменов у тяжелых цепей в зависимости от изотипа иммуноглобулинов.
Кора тимуса (кортикальная зона, корковое вещество) — гистологически внешняя зона каждой, отдельно взятой дольки тимуса; место, где предшественники Т-клеточного пути развития пролиферируют, реорганизуют гены Т-клеточных рецепторов, подвергаются положительной селекции при взаимодействии с молекулами I или II классов МНС на кортикальных эпителиальных клетках.
Корецептор — белок клеточной поверхности, усиливающий взаимодействие антигенного рецептора с антигеном и принимающий участие в передаче сигнала внутрь клетки; CD4 и CD8 — корецепторы CD4 и CD8 Т-клеток соответственно; CD19 — корецептор В-клеток.
Костимулятор — белок клеточной поверхности антигенпрезентирующих клеток, выполняющий роль второго сигнала для антигенреактивных клеток; для Т-клеток костимулятором является В7, для В-клеток — лиганд CD40.
Костный мозг — гемопоэтическая ткань трубчатых костей, где развиваются клетки крови: эритроциты, моноциты, полиморфноядерные лейкоциты, тромбоциты; цен-
тральный “орган” иммунитета в качестве основного места развития В-клеток у млекопитающих, а также источник родоначальных Т-клеточных элементов, мигрирующих в тимус.
Ксеаоантигены — антигены клеток и тканей, отличающиеся от иммунизируемого реципиента на видовом уровне, как правило, в рамках одного класса животных.
Ксенотрансплантация — пересадка органов или тканей между особями, относящимися к разным видам.
Купферовские клетки — фагоциты, локализованные в синусоидах печени (тканевые макрофаги печени); удаляют дебриз и мертвые клетки из кровотока; их участие в инициации иммунного ответа не установлено.
Лейкемия — неограниченная пролиферация злокачественных белых клеток крови; может быть лимфоцитарной, миелоцитарной, моноцитарной.
Лейкоцитоз — увеличение количества лейкоцитов в крови; обычно наблюдается при инфекционном процессе.
Лейкоциты — общее обозначение белых клеток крови, включающих лимфоциты, полиморфноядерные клетки, моноциты.
Лизоцим — гидролитический фермент секретов слизи; способен разрушать пептидогликановый слой клеточной стенки бактерий; фактор неспецифической иммунной защиты.
Лимфатические сосуды — тонкостенные, содержащие лимфу сосуды, разветвленные по всему организму; внеклеточная жидкость и лимфациты, которые накапливаются в тканях, собираются в лимфатических сосудах и, проходя через лимфатические узлы, поступают в основной лимфатический сосуд — трудной проток.
Лимфатические узлы — вторичные лимфоидные органы, широко распространенные по телу в местах соединения нескольких лимфатических сосудов; место индукции и развития адаптивного иммунитета, где встречаются антиген и антигенраспознающие лимфоциты.
Лимфобласт — лимфоцит с увеличенным количеством цитоплазмы, высоким уровнем РНК и активным белковым синтезом; образуются на определенных этапах дифференцировки лимфоцитов при их активации антигеном или митогеном.
Лимфокины — цитокины, продуцируемые лимфоцитами.
Лимфома — злокачественное перерождение лимфоцитов, размножающихся в лимфоидной ткани и не проникающих в кровь.
Лимфо-миелоидный комплекс — система органов и тканей, основная функция которых — обеспечение гемо(миело)- и лимфопоэза; в состав комплекса входят: костный мозг, тимус, селезенка, лимфоидные образования пищеварительного тракта, соединительная ткань; органы и ткани комплекса объединены сетью кровеносных и лимфатических сосудов, обеспечивающих межорганный обмен клеточными элементами.
Лимфоциты В (В-клетки) — один из двух классов лимфоцитов, компоненты В-системы иммунитета, осуществляющей гуморальную форму иммунного ответа; основной признак В-клеток — наличие поверхностного антигенраспознающего иммуноглобулинового рецептора (sig); при антигенной активации В-клетки дифференцируются в плазмоциты, продуцирующие антитела той специфичности, которой обладал антигенраспознающий рецептор.
Лимфоциты Т (Т-клетки) — один из классов лимфоцитов, в становлении которого ведущая роль принадлежит тимусу; главные участники Т-системы иммунитета, 464
осуществляющей клеточную форму иммунной защиты; основной признак Т-кле-ток — наличие Т-клеточного антигенраспознающего гетеродимерного рецептора (ТКР), ассоциированного с однодоменными СЗ белками, а также маркера (антигена) Thy-1 (у мышей).
Макрофаги — большие мононуклеарные клетки, широко представлены в тканях организма; производные костномозговых предшественников; играют критическую роль в развитии иммунитета; в неспецифическом врожденном иммунитете выполняют роль фагоцитирующих клеток с киллерной активностью, а также основных участников воспалительной реакции; активированные макрофаги способны уничтожать некоторые формы опухолевых клеток; в специфическом адаптивном иммунитете выполняют роль антигенпрезентирующих клеток и продуцируют группу цитокинов (монокинов) — эндогенных регуляторов иммунного ответа.
Медулла (медуллярная зона или мозговое вещество) — центральная часть лимфоидных образований; место концентрации прошедших дифференцировку лимфоцита
Межклеточные адгезивные молекулы (ICAMs) — адгезивные молекулы клеточной поверхности, выполняющие роль лигандов для интегринов; играют критическую роль во взаимодействии лимфоцитов с антигенпрезентирующими и эндотелиальными клетками; включены в состав суперсемейства иммуноглобулинов.
Миастения гравис — аутоиммунное заболевание, вызванное аутоантителами к ацетилхолиновому рецептору на клетках скелетной мускулатуры; в результате аутоиммунной атаки развивается нарушение мышечного сокращения.
Миеломные белки — иммуноглобулины, продуцируемые злокачественными (миеломными) плазматическими клетками; поскольку миеломные клетки конкретного индивидуума представляют собой клон, продуцируемые ими иммуноглобулины относятся к категории моноклональных иммуноглобулинов.
Молекулярная иммунология — раздел иммунологии, занятый изучением молекулярных механизмов иммунной защиты; основными объектами изучения молекулярной иммунологии являются: антитела (иммуноглобулины), антигенраспозна-ющие рецепторы, молекулы МНС, цитокины, адгезины.
Монокины — цитокины, секретируемые макрофагами.
Моноклональные антитела — антитела, продуцируемые одним клоном В-клеток.
Моноциты — клетки крови с характерным бобовидным ядром; предшественники тканевых макрофагов.
Наивные лимфоциты — лимфоциты, прошедшие доантигенный путь развития, но не контактировавшие с антигеном; встреча с антигеном обеспечивает их дальнейшее постантигенное развитие с формированием функционально активных эффекторных клеток.
Натуральные киллеры (НК) — лимфоцитоподобные клетки, лишенные признаков Т- или В-клеток; способны к уничтожению некоторых опухолевых и вирусинфи-цированных клеток; являются важным фактором неспецифического (врожденного) иммунитета.
Нейтрализация — в иммунологии процесс инактивации специфическими антителами токсинов, вирусов.
Некроз — гибель клеток или тканей в результате химического или физического повреждения, что отличает эту форму гибели клеток от апаптоза как биологически запрограммированной клеточной смерти; накапливающийся при некрозе клеточный дебриз поглощается фагоцитами.
30 Зак. 3701
Носители — в иммунологии достаточно высокомолекулярные белки, с которыми ковалентно связывают неиммуногенные антигены (гаптены) с целью получить специфический ответ на последние; спонтанное ковалентное взаимодействие может происходит и in vivo при приеме некоторых лекарств, которые образуют ковалентное взаимодействие с собственными белками пациента, что может быть причиной лекарственной аллергии.
Опсонизация — процесс изменения клеточной поверхности патогена или других частиц в результате их взимодлействия с внеклеточными молекулами, что приводит к захвату опсонизированных клеток фагоцитами; специфические антитела и комплемент — активные факторы опсонизации патогенов.
Опухолевые антигены — чужеродные для данного организма антигены, возникающие на злокачественно трансформированных клетках в результате действия канцерогенных соединений, ифицирования клеток онкогенными вирусами, точковых мутаций генов, контролирующих поверхностные клеточные белки.
Отрицательная селекция — удаление из популяции прошедших положительный отбор тимоцитов тех клеток, которые распознают собственные (не-МНС) антигены; аналогичный процесс селекции В-клеток происходит в костном мозге.
Отторжение трансплантата — разрушение тканевого или органного трансплантата иммунокомпетентными клетками генетически отличающегося реципиента; основными клеточными эффекторами являются цитотоксические CD8 Т-клетки и CD4 Т-клетки воспаления
Пейеровы бляшки — локальное тканевое скопление лимфоцитов вдоль тонкого кишечника.
Первичный фолликул — гистологически выявляемые структуры лимфоидной ткани, составленные из дендритных клеток и покоящихся В-лимфоцитов; первичные фолликулы являются местом формирования центров размножения (вторичных фолликулов) при антигенной стимуляции.
Перфорин — белок, продуцируемый цитотоксическими Т-клетками и натуральными киллерами; сохраняется в их гранулах до контакта с клетками-мишенями; на клетках-мишенях полимеризуется, образуя поры, которые разрушают мишени.
Пиноцитоз — поглощение и внутриклеточное разрушение макромолекулярных соединений (белков, полинуклеотидов, полисахаридов, вирусных частиц и др.) клетками, способными к эндоцитозу.
Плазмоцит — клетка, продуцирующая антитела; заключительная клеточная форма в В-клеточной линии дифференцировки.
Поверхностный иммуноглобулин — см.: антигенраспознающий В-клеточный рецептор.
Полигения — наличие нескольких неаллельных, обычно близкосцепленных генов, белковые продукты которых выполняют сходные функции.
Поликлональная активация — активация лимфоцитов митогенами.
Полиморфизм — наличие у вида нескольких аллельных форм одного и того же гена.
Положительная селекция — сохранение только тех дифференцирующихся в тимусе клеток, которые способны распознать собственные антигены гистосовместимости (молекулы I или II классов МНС), что обеспечивает их дальнейшее развитие; тимоциты, неспособные к подобному распознаванию погибают in situ.
Презентация антигена — процесс приведения антигена на поверхность фагоцитирующей клетки в иммуногенной форме; связан с внутриклеточным разрушением
антигена до пептидов и образованием комплекса таких пептидов с молекулами I или II классов МНС, который экспрессируется на клеточной поверхности.
Прнмировавде — активация наивных Т-клеток при первичной встрече с антигеном; понятие введено с тем, чтобы отличить первичное взаимодействие с антигеном от взаимодействия зрелых эффекторов с тем же антигеном.
Пропердин (фактор Р) — положительный регуляторный компонент альтернативного пути активации комплемента; выступает в качестве стабилизатора СЗ/С5-конвертазы на поверхности бактериальной клетки.
Процессинг антигена — внутриклеточное разрушение белков до отдельных пептидов, которые связываются с молекулами МНС, чтобы предстать в иммуногенной форме для Т-клеток.
Реакция Артюса — кожная реакция, при которой антиген, введенный внутрикожно, реагирует со специфическими антителами IgG во внеклеточном пространстве; в результате взаимодействия антигена с антителом активируется комплемент и усиливается миграция фагоцитирующих клеток в место введения антигена, что приводит к развитию локальной воспалительной реакции.
Реакция в смешанной культуре лимфоцитов (СКЛ) — пролиферативный ответ Т-клеток на аллоантигены МНС в культуре, содержащей клетки двух генетически отличающихся индивидуумов или клетки мышей двух разных линий
Реакция трансплантат против хозяина (РТПХ) — реакция Т-клеток донора на ал-лоантигеиы генетически чужеродного и иммунологически инертного реципиента; в клинике наблюдается при трансплантации больным клеток костного мозга от МНС-несовместимого донора.
Ревматоидный артрит — общее воспалительное заболевание, которое, возможно, связано с аутоиммунным ответом; заболевание сопровождается образованием ревматоидного фактора (анти-IgG антител, относящихся классу IgM).
Рекомбинантные линии — генетически идентичные линии, отличающиеся между собой только по некоторой части аллельного локуса, вплоть до одного гена; в иммунологии — рекомбинантные линии мышей, отличающиеся друг от друга по некоторым генам или даже по одному гену главного комплекса гистосовместимости.
Репертуар антител — общее количество вариантов антител, которые потенциально может продуцировать индивидуум; для млекопитающих количество вариантов антител составляет величину 2,8-1 О’.
Реципяеяг — в трансплантологии и экспериментальной клеточной иммунологии организм, воспринимающий ткани или клетки от другого организма (донора).
Селезенка — орган лимфо-миелоидного комплекса, представлен красной пульпой — местом удаления отмирающих клеток крови (в основном стареющих эритроцитов) и белой пульпой, включающей лимфоциты, которые отвечают на антиген, поступающий сюда с током крови.
Селестины — семейство адгезивных молекул клеточной поверхности лейкоцитов и эндотелиальных клеток, принимающих участие в хоминге наивных лимфоцитов в лимфоидные органы.
Сингенная трансплантация — пересадка органов или тканей между генетически идентичными особями одного вида (однояйцовые близнецы, особи одной и той же инбредной линии).
Сншфом ГУдпастера — аутоиммунное заболевание, вызванное аутоантителами к IV типу коллагена; в результате аутоиммунной атаки развивается острый васкулит, приводящий к летальному исходу.
Синдром обнаженных лимфоцитов — иммунодефицитное состояние, при котором молекулы II класса МНС не экспрессируются на клетках; пациенты с данной формой иммунодефицита имеют незначительное количество CD4 Т-клеток.
Синдром приобретенного иммунодефицита (СПИД) — инфекционное заболевание, вызываемое вирусом иммунодефицита человека и сопровождающееся резким снижением содержания CD4 Т-клеток.
Синдром DiGeorge — иммунодефицитное состояние, контролируемое рецессивным геном; характеризуется аплазией тимуса, отсутствием Т-клеток.
Синдром Wiskott-Aldrich — иммунодефицитное состояние, характеризующееся дефектом в продукции антител к полисахаридам; пациеты с данной формой иммунодефицита чувствительны к инфекциям, вызываемым пиогенными бактериями.
Синтетические антигены — искусственно синтезированные полимеры аминокислот, углеводов.
Системная красная волчанка — классический пример системного аутоиммунного заболевания, при котором продуцируются антитела к ДНК, РНК, гистонам; образующиеся иммунные комплексы повреждают малые кровеносные сосуды.
Соматическая рекомбинация — изменение расположения генов в геноме клетки в процессе митоза; по отношению к генам иммуноглобулинов (главным образом генных сегментов, контролирующих V-домены) — перегруппировка и слияние генов в одном локусе; образовавшийся локус не наследуется и является свойством только данного клона лимфоидных клеток.
Стволовая кроветворная клетка (СКК) — общий предшественник для всех ростков дифференцировки лимфо-миелопоэза, локализованный у взрослых в костном мозге.
Строма тимуса — эпителиальные и соединительнотканные клетки органа, формирующие микросреду, необходимую для дифференцировки Т-клеток; гистологически строма напоминает сеть, в ячейках которой расположены тимоциты.
Сумка Фабрициуса — лимфо-эпителиальный орган, расположенный у птиц в клоаке; место активной генерации В-клеток; возможный аналог костного мозга млекопитающих как основного источника созревающих В-клеток периферии.
Суперсемейство иммуноглобулинов — группа близкородственных белков, эволюционно возникших от общих предшественников — однодоменных беков: Thy-1, р2-микроглобулин, Ро; критериями для включения белков в суперсемейства служат гомология их аминокислотной последовательности с иммуноглобулинами и характер доменной организации; в состав суперсемейства входят: иммуноглобулины, антигенраспознающие рецепторы В- и Т-клеток, молекулы I и II классов МНС, корецепторы CD8 и CD4, рецепторы к иммуноглобулинам, ряд адгезивных молекул, однодоменные белки, отмеченные выше.
Сцепленное распознавание — распознавание Т- и В-лимфоцитами своих эпитопов, которые физически сцеплены на одной и той же клетке или молекуле.
Тельца Гассаля — свободные от тимоцитов, округлые скопления эпителиальных клеток в медуллярной зоне тимуса.
Тимоциты — популяция дифференцирующихся лимфоцитов тимуса.
Тимоциты “двойные негативные* — субпопуляция незрелых, находящихся на ранней стадии внутритимусной дифференцировки клеток, у которых отсутствуют ко-рецептороы CD4 и CD8.
Тимоциты “двойные позитивные“ — субпопуляция тимоцитов, находящихся на промежуточной стадии внутритимусной дифференцировки клеток, у которых одновременно экспрессируются два корецептора — CD4 и CD8.
Тимоциты “одинарные позитивные^ — субпопуляция тимоцитов, находящихся на завершающей стадии внутритимусной дифференцировки, прошедших положительный отбор на способность реагировать с собственными антигенами гистосовместимости; фенотип клеток — либо CD4+CD8~, либо CD4~CD8+.
Тимус — лимфо-эпителиальный орган, расположенный у млекопитающих за тру-диной по средней линии трудной клетки; место развития Т-клеток от костномозгового предшественника.
Тимусзависимые антигены — антигены, которые обеспечивают развитие иммунного ответа только при участии Т-клеток.
Тимуснезависимые антигены — антигены, которые способны инициировать развитие иммунного ответа без помощи со стороны Т-клеток: известно два типа тимус-независимых антигенов; антигены типа I имеют в структуре участок с митогенной активностью, который заменяет собой второй сигнал, исходящий от Т-клеток при инициации ответа; антигены типа II характеризуются наличием повторяющихся гомологичных эпитопов, которые активируют В-клетки в результате перекрестного сцепления антигенраспознающих рецепторов этих клеток.
Тимэктомия — хирургическое удаление тимуса.
Толерантность иммунологическая — явление специфической иммунологической неотвечаемости; индуцируемая неотвечаемость к одному антигену не отменяет полноценного ответа к другим антигенам.
Толерогены — антигены клеток, белков, полисахаридов, вызывающие при определенных условиях введения в организм специфическую неотвечаемость.
Трансгены — чужеродные гены, встроенные в геном того или иного организма, что позволяет с максимальной точностью изучать функцию таких генов и их фенотипических продуктов.
Трансплантационные антигены — антигены клеточной поверхности, контролируемые главным комплексом гистосовместимости.
Трансплантационный иммунитет — явление иммунного отторжения трансплантируемой чужеродной ткани или органа; в реакции отторжения принимает участие главным образом Т-система иммунитета.
Трансфекция — включение участка чужеродной ДНК в геном клетки.
Трансцитозис — транспорт молекул через эпителиальные клетки; примером может служить транспорт IgA из крови в носовую полость, просвет кишечника и др.
Тучные клетки — крупные, с большим количеством гранул клетки, локализованные в соединительной ткани; особенно обильно представлены в подслизистой соединительной ткани; играют ключевую роль в развитии аллергических реакций, благодаря наличию высокоаффинного рецептора к IgE; аллерген, который взаимодействует с IgE, представленным на поверхности клеток, инициирует выброс большого количества гистамина — ведущего фактора развития реакции немедленного типа.
Тяжелый комбинированный иммунодефицит, сцепленный с Х-хромосомой — заболевание, при котором нарушены самые ранние стадии внутритимусного развития Т-клеток; отсутствие Т-клеточного иммунитета, а также продукции антител к ти-мусзавивимым антигенам; заболевание обусловлено дефектом в гене, контролирующем одну из полипептидных цепей рецепторов к некоторым цитокинам.
Фагоцитоз — захват и внутриклеточное переваривание корпускулярного материала (бактерий, чужеродных и собственных отмирающих клеток, инертных частиц, та
ких как липосомы, китайская тушь и др.); основными клетками, способными к активному фагоцитозу, являются макрофаги, нейтрофилы.
Фолликул Кларка — элементарная гистологическая единица коркового слоя тимуса; представляет собой плотное скопление тимоцитов, окруженное вытянутыми эпителиальными клетками.
Фолликулярные дендритные клетки — клетки лимфоидных фолликулов, образующих плотную сеть, заполненную В-клетками; длинные, ветвистые отростки позволяет им вступать с тесные интимные контакты с В-клетками; наличие Fc-pe-цептора обеспечивает длительное сохранение на поверхности клеток комплекса антигенгантитело; играют ключевую роль в антигензависимой дифференцировке В-клеток и отборе этих клеток на повышенную аффинность антигенраспознающих рецепторов.
Хелперные CD4 Т-клетки (Тн2) — субпопуляция Т-клеток, оказывающая помощь В-клеткам в продукции антител.
Хемокины — низкомолекулярные цитокины, принимающие участие в миграции и активации фагоцитирующих клеток и лимфоцитов; играют центральную роль в воспалительном ответе.
Центральные органы иммунитета — места основного развития В- и Т-клеток; определяющим местом для дифференцировки В-клеток является костный мозг, для Т-клеток — тимус.
Центробласты — крупные, быстро делящиеся клетки, находящиеся в центрах размножения и относящиеся к В-клеточной линии развития; предшественники плазмоцитов и В-клеток памяти.
Центроциты — малые, непролиферирующие В-клетки центров размножения, прямые потомки центробластов; созревают до активно продуцирующих иммуноглобулины плазмоцитов и В-клеток памяти или подвергаются апоптозу в зависимости от характера рецепторного взаимодействия с антигеном на поверхности фолликулярных дендритных клеток.
Цитокины — эндогенные белковые регуляторы, принимающие участиие в наиболее эффективном проявлении иммунного ответа; цитокины, продуцируемые ли-моцитами, часто называют лимфокинами; адресное действие цитокинов обеспечивается наличием соответствующих цитокиновых рецепторов на клетках-мишенях.
Цитотоксины — белки, продуцируемые цитотоксическими Т-клетками, которые разрушают клетки-мишени; основными цитотоксическими белками являются перфорины и гранзимы (фрагментины).
Цитотоксические Т-лимфоциты (ЦТЛ; CD8 Т-клетки) — клетки, способные убивать другие клетки, к антигенам которых они примированы; при специфическом клеточном иммунитете киллерным действием обладает главным образом субпопуляция зрелых CD8 Т-клеток; цитотоксическое действие этих клеток на клетки-мишени, эксперссирующие чужеродный антиген, рестриктировано по генам I класса МНС.
Эволюционная иммунология — раздел иммунологии, занятый изучением трех основных вопросов: 1) возникновение и филогенетическое развитие способности к специфическому иммунному распознаванию чужеродности, 2) возникновение и филогенетическое развитие лимфоцитов, основная функция которых иммунная; эволюционное становление Т- и В-систем иммунитета, 3) роль исторически развивающегося иммунитета в прогрессивной эволюции животных.
Экзон — кодирующая последовательность нуклеотидов в гене; каждый экзон отделен от соседнего некодирующим участком (интроном).
Экспериментальный аллергический энцефаломиелит — воспалительное заболевание центральной нервной системы, развивающееся после активной иммунизации мышей антигенами нервной ткани.
Эндогенные пирогены — цитокины, повышающие температуру тела в условиях развития инфекции или острой воспалительной реакции; примером могут служить интерлейкин-1, интерлейкин-6.
Эндотоксины — бактериальные токсины, которые выделяются только при повреждении клетки в отличие от экзотоксинов, продуцируемых бактериальной клеткой во внешнюю среду.в условиях нормы.
Эцдоцитоз — реакция клеток, направленная на поглощение и переваривание растворимых макромолекулярных соединений, а также чужеродных или структурно измененных собственных клеток; термин является обобщающим для двух близких, но, тем не менее, самостоятельных процессов — пиноцитоза и фагоцитоза.
Эпитоп (антигенная детерминанта) — участок антигена, распознаваемый антителами; эпитоп, ассоциированный с молекулами I или II классов распознается Т-клеточным рецептором.
Эпитоп В-клеточный — часть молекулы антигена, соответствующая той пространственной организации, которая свойственна ей в нативном белке; антигенраспоз-нающие рецепторы В-клеток и иммуноглобулины распознают нативную конформацию эпитопа, но не линейную последовательность аминокислотных остатков.
Эпитоп Т-клеточный — линейная последовательность аминокислотных остатков, составляющих часть антигена; не требует сохранения нативной конформации.
Якорные остатки — аминокислотные остатки линейного пептидного фрагмента антигена, которые образуют связь с аминокислотами в щели молекулы I класса МНС; таким образом формируется иммуноген линейный пептид антигена с молекулой I класса, экспрессирующийся на поверхности клетки и доступный для распознавания цитотоксическими CD8 Т-лимфоцитами.
В-система иммунитета — система органов, клеток и эффекторных молекул, осуществляющих гуморальную форму иммунного реагирования; центральным (первичным) “органом” системы является костный мозг — основное место генерации В-лимфоцитов; клеточный состав системы включает В-клетки различной степени зрелости, вплоть до заключительной клеточной формы в гистогенезе этих клеток — плазмоцита, активно синтезирующего и секретирующего специфические антитела; эффекторные молекулы системы представлены пятью классами иммуноглобулинов: IgM, IgG, IgA, IgE и IgD.
С-домен — составная часть константной области иммуноглобулинов и антигенрас-познаюших рецепторов; каждый домен включает более 100 аминокислотных остатков, замкнутых на себя дисульфидной (-S-S-) связью; С-домены не принимают участия в распознавании антигена, однако выполняют иные физиологические функции: связывание комплемента, взаимодействие с Fc-рецептором, прохождение через эндотелиальные барьеры.
CDR’s (complementarity determining regions) — регионы иммуноглобулиновых рецепторов и Т-клеточных рецепторов, комплементарно взаимодействующие с антигеном и формирующие антигенсвязывающий участок этих рецепторов; каждый регион конформационно представляет собой петлю, составленную из аминокислотных остатков гипервариабельного участка V-домена; у иммуноглобулинов антигенсвязывающий участок строится из трех CDR V-домена легкой цепи и трех CDR V-домена тяжелой цепи; аналогично построен антигенраспознающий участок Т-клеточного рецептора включающий по три CDR от а- и р-цепей.
Е-розетки — микроскопически выявляемые конгломераты (грозди), образуемые взаимодействием Т-клеток человека с эритроцитами барана; используются для анализа количества Т-клеток, а также для выделения этих клеток с помощью градиентного центрифугирования.
Fab-фрагмент — фрагмент, образующийся в результате обработки IgG папаином; состоит из легкой цепи и N-концевой половины тяжелой цепи; включает V-доме-ны, взаь юдействующие с антигеном; (Fab — сокр. от англ.: Fragment antigen binding).
Fc-фрагмент — фрагмент, образующийся в результате обработки IgG папаином; состоит из С-концевых половин тяжелых цепей иммуноглобулинов, соединенных между собой дисульфидными связями; ( Fc — сокр. от англ. Fragment crystallizable).
Т-система иммунитета — система органов, клеток, эффекторных и регуляторных молекул, обеспечивающих клеточную форму иммунного реагирования; система включает тимус — место дифференцировки костномозговых предшественников Т-клеток (пре-Т-клеток), различные функционирующие субпопуляции собственно Т-клеток (хелперные CD4 Т-клетки, CD4 Т-клетки воспаления, цитотоксические и супрессорные CD8 Т-клетки), эффекторные, антигенраспознающие рецепторы, группу цитокинов, продуцируемых Т-клетками; основная функция связана с цитотоксическим разрушением генетически отличающихся клеток и тканей (чужеродных трансплантатов, опухолевых и вирустрансформированных клеток), а также с участием в регуляции клеточного и гуморального иммунного ответа.
ТАР-1,2 (транспортеры, участвующие в процессинге антигена) — белки, связанные с мембраной эндоплазматического ретикулума; основная их функция — перенос антигенного пептида из цитозоля во внутреннее пространство эндоплазматического ретикулума, где пептид соединяется с молекулами I класса МНС.
V-домен — представляет собой вариабельную область тяжелых и легких цепей иммуноглобулинов и Т-клеточных рецепторов; включает около 100 аминокислотных остатков, замкнутых на себя дисульфидной (-S-S-) связью; при взаимодействии V-доменов тяжелой и легкой цепей иммуноглобулинов формируется антигенраспознающий участок.
РЕКОМЕНДУЕМАЯ ЛИТЕРАТУРА
Абелев Г.И. Основы иммунитета//Сорос. образ, журн. 1996. Т. 5. С. 4-10.
Абелев Г.И. Воспаление//Сорос. образ, журн. 1996. Т. 10. С. 28-32.
Альберте Б., Брей Д., Льюиз Дж. и др. Молекулярная биология клетки. М., 1994.
Галактионов В.Г. Графические модели в иммунологии. М., 1986.
Галактионов В.Г. Очерки эволюционной иммунологии. М., 1986.
Галактионов В.Г. Генетический контроль взаимодействия иммунокомпетентных клеток//Сорос, образ, журн. 1998, Т. 1.
Галактионов В.Г. Как работает иммунная система//Сорос. образ, журн. 1998, Т.1.
Кетлинский С.А., Симбирцев А.С., Воробьев А.А. Эндогенные иммуномодуляторы. Спб., 1992.
Пол У. (ред.) Иммунология. М., Т. 1-3.1988.
Ройт Р. Основы иммунологии. М., 1991.
Ульянкина Т.П. Зарождение иммунологии. М., 1994.
Фрейдлин И. С. Цитокины и межклеточные контакты в противоинфекцион-ной защите организма//Сорос. образ, журн. 1996. Т. 7. С. 19-25.
Ярилин А.А., Пинчюк В.Г., Гриневич Ю.А. Структура тимуса и диференциров-ка Т-лимфоцитов. Киев, 1991.
Janeway СЛ.А., Travers Р. Immunobiology. L., 1994.
ОГЛАВЛЕНИЕ
Предисловие....................................................... 3
Введение ............................................................. 4
1. Краткий исторический очерк................................... 5
2. Неспецифиченский (врожденный) иммунитет...................... 9
2.1. Физические барьеры.......................................... 10
2.2. Физиологические барьеры..................................... 10
2.3. Эндоцитоз (пиноцитоз, фагоцитоз)......................... 11
2.4. Натуральные киллеры......................................... 13
2.5. Воспаление.................................................. 13
3. Специфический (приобретенный, адаптационный) иммунитет.
Уровни изучения............................................. 14
3.1. Молекулярный уровень........................................ 16
3.2. Клеточный уровень........................................... 18
3.3. Органный уровень............................................ 20
3.4. Уровень целого организма.................................... 22
3.5. Популяционнгый уровень...................................... 23
4. Общие и частные проблемы иммунологии........................ 24
5. Теории специфического иммунитета............................ 29
Часть 1, Moieitv.MOTiM иммуио.югпи................................... 34
Глава 1. Антигены.................................................... 34
1.1 Терминологическое разнообразие антигенов.................... 34
1.2. Факторы, определяющие иммуногенность........................ 34
1.2.1. Требования к антигену....................................... 36
1.2.2. Требования к организму...................................... 39
1.3. Гаптены..................................................... 40
1.4. Эпитопы..................................................... 42
1.4.1. В-клеточные эпитопы......................................... 42
1.4.2. Т-клеточные эпитопы......................................... 44
1.5 Тимусзависмые и тмимуснезависимые антигены.................. 44
Заключение........................................................... 46
Глава 2. Иммуноглобулины: структура, функция, генетический контроль . 52
Введение............................................................. 52
2.1. Общий план строения иммуноглобулинов........................ 53
2.2. Вариабельносить иммуноглобулинов............................ 58
2.2.1. Классификация V-доменов иммуноглобулинов. 58
2.2.2. Гипервариабельные и каркасные участки....................... 59
2.2.3. Пространственная организация антигенсвязывающего участка. 61
2.3. Гетерогенность иммуноглобулинов............................. 62
2.3.1. Иммуноглобулин М (IgM)..................................... 65
2.3.2. Иммуноглобулин G (IgG)..................................... 65
2.3.3. Иммуноглобулин A (IgA)..................................... 67
2.3.4. Иммуноглобулин Е (IgE)..................................... 69
2.3.5. Иммуноглобулин D (IgD)..................................... 72
2.4. Гены иммуноглобулинов....................................... 72
2.4.1. Рекомбинация генов, кодирующих легкие и тяжелые цепи
иммуноглобулинов............................................ 73
2.4.2. Случайная рекомбинация генных сегментов — основа вариабельности иммуноглобулинов....................................... 76
Заключение........................................................... 78
Глава 3. Антигенраспознающие рецепторы............................... 80
Введение............................................................. 80
3.1. Антигенраспознающие рецепторы В-клеток...................... 80
3.1.1. Краткая характеристика...................................... 80
3.1.2. Генетический контроль структуры мембранного IgM............. 81
3.1.3. Антигенраспознающие рецепторы в процессах
активации В-клеток.......................................... 82
3.2. Антигенраспознающие рецепторы Т-клеток...................... 85
3.2.1. Главный комплекс гистосовместимости: генетическая организация и основные белки комплекса...................................... 85
3.2.2. Иммуногенные формы антигена для Т-клеточных рецепторов..... 92
3.2.2.1. Этапы внутриклеточной подготовки антигена к образованию
комплекса пептида с молекулами I или II класса МНС.......... 93
3.2.2.2 Взаимодействие пептидов с молекулами I или II класса МНС... 96
3.2.3. Строение и генетический контроль Т-клеточных антиген-
распознающих рецепторов..................................... 98
3.2.3.1. Краткая характеристика...................................... 98
3.2.3.2. Генетический контроль структуры Т-клеточного антиген-
распознающего рецептора..................................... 99
3.2.4. Антигенраспознающие рецепторы и сопутствующие белки в
процессе активации Т-клеток................................ 104
Заключение.......................................................... 109
Глава 4. Цитокины................................................... 110
Введение ............................................................ ПО
4.1. Интерлейкин-1............................................... ПО
4.2. Интерлейкин-2.............................................. 113
4.3. Интерлейкин-3.............................................. 116
4.4. Интерлейкин-4.............................................. 117
4.5. Интерлейкин-5.............................................. 119
4.6. Интерлейкин-6.............................................. 120
4.7. Интерлейкин-7.............................................. 122
4.8. Интерлейкин-8.............................................. 122
4.9. Фактор некроза опухолей.................................... 123
4.10. Другие цитокины............................................ 124
Заключение.......................................................... 124
Глава 5. Суперсемейство иммуноглобулинов............................ 126
Введение ........................................................... 126
5.1. Основные критерии включения молекул в суперсемейство
иммуноглобулинов........................................... 126
5.2. Функциональные аспекты..................................... 129
5.3. Филогенетические аспекты................................... 133
Заключение.......................................................... 136
Часть П, Клеточная иммунология...................................... 138
Глава 6. Клетки, ткани и органы иммунной системы.................... 138
Введение ........................................................... 138
6.1. Распределение лимфоидной ткани в организме................. 138
6.2. Костный мозг............................................... 139
6.3. Тимус...................................................... 141
6.4. Селезенка.................................................. 145
6.5. Лимфатические узлы......................................... 149
6.6. Лимфоидная ткань, ассоциированная со слизистыми покровами.. 151
6.7. Сумка Фабрициуса птиц...................................... 153
Заключение.......................................................... 153
Глава 7. Т-система иммунитета ...................................... 157
Введение ........................................................... 157
7.1. Тимус — центральный орган иммунитета....................... 157
7.1.1. Основная феноменология..................................... 157
7.1.2. Этапы внутритимусной дифференцировки лимфоцитов.......... 158
7.1.3. Реорганизация генов Т-клеточного рецептора в процессе
дифференцировки тимоцитов................................. 163
7.1.4. Положительная и отрицательная селекция клеток в тимусе.
Формирование клоноспецифических Т-клеток.................. 164
7.1.4.1. Эксперименты, демонстрирующие распознавание рецепторами Т-клеток комплекса “своего с чужим”................................... 164
7.1.4.2. Положительная селекция клеток в тимусе..................... 173
7.1.4.З. Отрицательная селекция клеток в тимусе..................... 179
7.1.4.4. Возможные механизмы положительной и отрицательной селекции
клеток в тимусе........................................... 180
7.2. Т-клетки периферии......................................... 182
7.2.1. Распределение Т-клеток по лимфоидным органам............... 182
7.2.2. Адгезины и заселение Т-клетками периферических органов..... 182
7.2.3. Наивные Т-клетки периферии ................................ 186
7.2.4. Цитокины................................................... 186
Заключение.......................................................... 188
Глава 8. В-система иммунитета....................................... 190
Введение ........................................................... 190
8.1. Этапы дифференциролвки В-клеток в костном мозге ’........ 190
8.1.1. Участие стромы костного мозга в дифференцировке............ 191
8.1.2. Реорганизация генов тяжелых и легких цепей иммуноглобулинов в процессе дифференцировки В-клеток................................. 193
8.1.3. Селекция В-клеток в костном мозге.......................... 195
8.2. В-клетки периферии......................................... 196
Заключение.......................................................... 198
Глава 9. Иммунный ответ и взаимодействие клеток..................... 199
Введение ........................................................... 199
9.1. Клеточный иммунный ответ................................... 200
9.1.1. Основные реакции клеточного иммунитета (феноменология)..... 200
9.1.1.1. Реакция цитотоксических Т-лимфоцитов (ЦТЛ; CD8 Т-клеток)... 201
9.1.1.2. Реакция в смешанной культуре лимфоцитов (СКЛ).............. 203
9.1.1.3. Реакция гиперчувствительности замедленного типа (ГЗТ)...... 205
9.1.1.4. Реакция трансплантат против хозяина (РТПХ)................. 206
9.1.1.5. Реакция отторжения трансплантата........................... 207
9.1.2. Генерация эффекторных Т-клеток............................. 211
9.1.2.1. Общая характеристика....................................... 211
9.1.2.2. Антигенпрезентирующие клетки в процессе активации наивных
Т-клеток.................................................. 213
9.1.2.3. Дифференциальная роль различных антигенпрезентирующих
клеток в инициации иммунного ответа....................... 217
9.1.2.4. Участие интерлейкина-2 в процессе созревания Т-клеток...... 222
9.1.2.5. Изменение экспрессии поверхностных молекул Т-клеток......... 223
9.1.2.6. Способы активации наивных CD8 Т-клеток...................... 224
9.1.2.7. Дифференцировка наивных CD4 Т-клеток в Тц1 и Тн2............ 227
9.1.3. Эффекторное действие зрелых Т-клеток........................ 228
9.1.3.1. Активность цитотоксических Т-клеток (CD8 Т-клеток).......... 228
9.1.3.2. Активность CD4 Т-клеток воспаления.......................... 231
9.2. Гуморальный иммунный ответ.................................. 237
9.2.1. Образование антител В-лимфоцитами........................... 239
9.2.1.1. Участие хелперных CD4 Т-клеток в продукции антител.......... 239
9.2.2. Эффекторная функция различных изотипов антител.............. 253
9.2.2.1. Распределение антител в организме........................... 253
9.2.2.2. Транспорт через эпителиальные барьеры....................... 255
9.2.2.3. Нейтрализация антигенов (токсинов, бактерий, вирусов)....... 256
9.2.2.4. Опсонизация и разрушение антигенов.......................... 257
9.2.3. Система комплемента в гуморальном иммунитете................ 260
Заключение........................................................... 263
Глава 10. Иммуногенетика............................................. 267
Введение ............................................................ 267
10.1. Генетика гистосовместимости. Главный комплекс гистосовместимости.................................................. 268
10.1.1. Линии мышей................................................. 269
10.1.2. Терминология и законы трансплантации........................ 272
10.1.3. Гены и фенотипические продукты комплекса.................... 275
10.1.4. Иммунобиологические свойства комплекса...................... 280
10.2. Генетический контроль иммунного ответа...................... 282
10.2.1. Характер наследования силы иммунного ответа................. 283
10.2.2. Локализация генов иммунного ответа (1г-генов)............... 283
10.2.3. Фенотипический продукт и клеточная экспрессия 1г-генов..... 287
Заключение........................................................... 291
Глава 11. Аллогенная ингибиция....................................... 292
Введение ............................................................ 292
11.1. Феноменология............................................... 292
11.2. Подходы к анализу механизмов аллогенной ингибиции........... 294
11.2.1. Деструкция клеток-мишеней интактными лимфоцитами............ 295
11.2.2. Участие антигенов гистосовместимости в реализации феномена. 296
11.2.3. Отмена аллогенной ингибиции. “Сингенизация
микроокружения”............................................ 297
11.2.4. Фенотипическая модификация трансплантируемых клеток с
помощью мРНК для антигенов гистосовместимости.............. 298
Заключение........................................................... 306
Глава 12. Иммунологическая толерантность............................. 308
Введение ............................................................ 308
12.1. Основной феномен............................................ 308
12.2. Клеточные основы толерантности.............................. 311
12.3. Толерантность к “своему” и толерантность к “чужому” — две стороны одного явления.............................................. 313
Заключение........................................................... 316
Часть III. Частные проявления иммунитета............................. 317
Глава 13. Антиинфекционный иммунитет................................. 317
Введение ............................................................ 317
477
13.1. Общая характеристика инфекционного процесса................ 317
13.2. Неспецифический (врожденный) иммунитет при инфекции........ 321
13.2.1. Барьерная функция эпителия................................. 321
13.2.2. Альтернативный путь активации комплемента.................. 321
13.2.3. Активация макрофагов....................................... 324
13.2.4. Роль интерферонов.......................................... 330
13.2.5. Натуральные киллеры........................................ 330
13.2.6. CD5 В-клетки............................................... 331
13.3. Специфический иммунитет при инфекции....................... 332
13.3.1. Т-клетки в антиинфекционном иммунитете..................... 333
13.3.2. В-клетки в антиинфекционном иммунитете..................... 335
13.4. Иммунологическая память.................................... 336
13.4.1. В-клеточная память......................................... 336
13.4.2. Т-клеточная память......................................... 337
13.4.3. Роль антигена в поддержании иммунологической памяти........ 337
Заключение.......................................................... 341
Глава 14. Трансплантационный иммунитет.............................. 343
Введение ........................................................... 343
14.1. Общая характеристика отторжения............................ 343
14.2. Иммунные механизмы отторжения.............................. 344
14.3. Клинические проблемы трансплантации........................ 345
Заключение.......................................................... 346
Глава 15. Иммунитет к опухолям...................................... 348
Введение ........................................................... 348
15.1. Антигенная характеристика опухолевых клеток................ 348
15.2. Иммунологический надзор и механизмы противоопухолевого
иммунитета................................................. 350
15.3. Преодоление иммунологического надзора опухолевыми клетками.... 352
15.4. Некоторые подходы к разработке способов иммунотерапии
злокачественных опухолей................................... 353
Заключение.......................................................... 354
Часть ГУ. Нарушения иммушпега....................................... 355
Глава 16. Реакции гиперчувстггельносш............................... 355
Введение ........................................................... 355
16.1. Гиперчувствительность немедленного типа.................... 356
16.1.1. Аллергический ринит (сенная лихорадка)..................... 357
16.1.2. Анафилактический шок....................................... 358
16.1.3. Гиперчувствительность, обусловленная антителами IgG........ 360
16.1.4. Медиаторы аллергических реакций............................ 361
16.2. Гиперчувствительность замедленнонго типа................... 363
Глава 17. Аутоиммунитет............................................. 366
Введение ........................................................... 366
17.1. Аутоиммунные заболевания, инициированные антителами или Т-
клетками................................................... 366
17.2. Механизмы аутоиммунных поражений........................... 368
Заключение.......................................................... 370
Глава 18. Иммунодефицитные состояния................................ 371
18.1. Врожденные иммунодефициты.................................. 371
18.1.1. В-клеточные дефициты....................................... 371
18.1.2. Т-клеточные дефициты....................................... 373
18.2. Приобретенные иммунодефициты............................... 375
18.2.1. Развитие ВИЧ-инфекции...................................... 375
18.2.2. Размножение ВИЧ в клетке................................... 377
Заключение.......................................................... 379
Часть V, Сммлпежмм иматпожииа....................................... 380
Глава 19. Онтогенез иммунной системы................................ 380
Введение ........................................................... 380
19.1. Становление иммунной системы в эмбриогенезе................ 380
19.1.1. Эмбриогенез Т-системы иммунитета........................... 380
19.1.2. Эмбриогегез В-системы иммунитета........................... 387
19.2. Иммунитет новорожденных.................................... 388
19.3. Иммунитет при старении..................................... 389
Заключение.......................................................... 390
Глава 20. Эволюция иммунитета....................................... 391
Введение ........................................................... 391
20.1. Клетки, ткани и органы лимфо-миелоидного комплекса у представителей различных типов животных............................. 394
20.1.1. Клетки..................................................... 395
20.1.2. Ткани и органы лимфо-миелоидного комплекса................. 400
20.2. Трансплантационный иммунитет............................... 406
20.2.1. Сравнительная феноменология трансплантационного иммунитета.... 406
20.2.2. Клеточные эффекторы реакции тканевой несовместимости....... 417
20.2.3. Система гистосовместимости в трансплантационном иммунитете. 419
20.3. Эволюция Т-системы иммунитета.............................. 422
20.3.1. Возникновение и развитие тимуса............................ 422
20.3.2. Эволюция Т-клеточного комплекса............................ 425
20.4. Эволюция В-системы иммунитета.............................. 431
20.4.1. В-клетки и антителопродуцирующие органы.................... 432
20.4.2. Изотипы иммуноглобулинов................................... 435
20.5. Иммунитет — контролирующий фактор прогрессивной эволюции... 437
20.5.1. Мутационный риск — плата за многоклеточность............... 437
20.5.2. Роль иммунитета в эволюции ................................ 440
Заключение.......................................................... 445
Основные выводы.................................................... 447
Словарь терминов.................................................... 457
Рекомендуемая литература............................................ 473
Учебное издание Галактионов Вадим Гелиевич ИММУНОЛОГИЯ
Зав. редакцией И.И.Щехура Редактор Г.Г.Есакова Переплет художника А.А.Кущенко
Изд. лиц. № 040414 от 18.04.97.
Подписано в печать 20.07.98.
Формат 60x90/16. Бумага офс. № 1.
Гарнитура Таймс. Офсетная печать. Уел. печ. л. 30,0.
Уч.-изд. л. 33,56. ТиражЮОО экз. Заказ 3701—98
Ордена “Знак Почета”
Издательство Московского университета. 130009, Москва, ул. Б. Никитская, 5/7.
Спечатано с оригинал-макета заказчика в 12 ЦТ МО.
ИММУНОЛОГИЯ