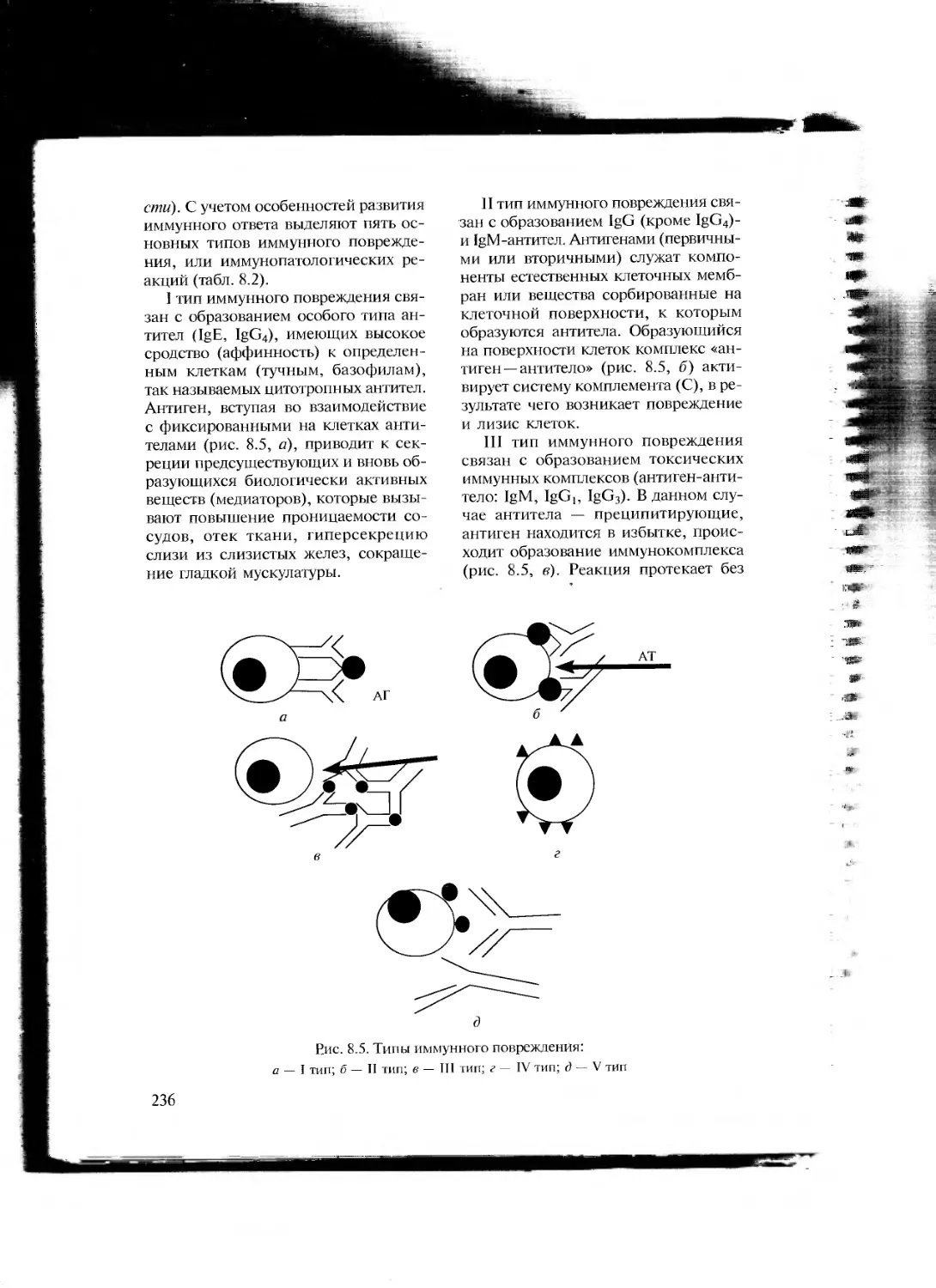
Автор: Порядин Г.В. Воложин А.И.
Теги: патологическая физиология формы развития заболеваний патогенез учение о происхождении заболеваний общая патология медицина физиология патофизиология
ISBN: 5-7695-2727-7
Год: 2006
ф
S
X
re
и
о
rt
re
Q_
vo
о
ф
о
X
с
ге
х
о
S
и
и
Ф
е
о
о,
с
ф
ф
3
и
3
со
ПАТОФИЗИОЛОГИЯ
В трех томах
Под редакцией
А. И. Воложина, Г. В. Порядина
Том 1
Учебник
ВЫСШЕЕ ПРОФЕССИОНАЛЬНОЕ ОБРАЗОВАНИЕ
ПАТОФИЗИОЛОГИЯ
В ТРЕХ ТОМАХ
Под редакцией
А.И.ВОЛОЖИНА,
Г. В. ПОРЯДИНА
ТОМ 1
Рекомендовано
Учебно-методическим объединением по медицинскому и фармацевтическому образованию
вузов России в качестве учебника для студентов, обучающихся по специальностям:
060101 (040100) «Лечебное дело», 060103 (040200) «Педиатрия»,
060104 (040300) «Медико-профилактическое дело», 060105 (040400) «Стоматология»,
060109 (040600) «Сестринское дело», 060112 (040800) «Медицинская биохимия»,
060113 (040900) «Медицинская биофизика», 060114 (041000) «Медицинская кибернетика»
ACADEMA
Москва
Издательский центр «Академия»
2006
УДК 616-092.18(075.8)
ББК 52.5я73
П20
Авторский коллектив:
А. И. Воложин, I. В. Порядин, В. А. Войнов, Н. Л. Богуш, Ю. В. Грачев, А. Б. Денисов,
Р. А. Дружинина, Д. А. Еникеев, Г. Н. Крыжановский. П.Ф.Литвицкий, А. В.Лихтенштейн,
Н. К. Логинова, \Н. И. Лосев,\ Л. Н. Осколок, Н. Н. Петрищев, В. А. Румянцев, А. Г. Русанова,
Т. И. Сашкина, |/О. С, Свердлов^ М. Л. Степанян, Г. И. Шелкунова, А. П. Ястребов
Рецензенты:
зав. кафедрой патофизиологии Сибирского государственного
медицинского университета, академик РАМН, профессор В.В.Новицкий',
зав. кафедрой патофизиологии Российского университета дружбы народов,
профессор В.А.Фролов
Патофизиология. В 3 т.: учеб, для студ. высш. учеб, заведений / [А. И. Воло-
П20 жин и др.] ; под ред. А. И. Воложина, Г. В. Порядина. — Т. 1. — М. : Изда-
тельский центр «Академия», 2006. — 272 с.
ISBN 5-7695-2727-7
В учебнике на современном уровне излагаются основные разделы дисциплины: общее
учение о болезни, типовые патологические процессы и патофизиология органов и систем.
В 1-м гоме учебника рассмотрены этиология, патогенез, патофизиология клетки, роль
внутренних и внешних факторов в патологии. Большое внимание уделено описанию таких
типовых патологических процессов, как воспаление, лихорадка, инфекции, а также пдто-
логин иммунной системы.
Для студентов медицинских вузов.
УДК 616-092.18(075.8)
ББК 52.5я73
Учебное издание
Воложин Александр Ильич, Порядин Геннадий Васильевич,
Войнов Владимир Антонович и др.
Патофизиология
Том 1
Учебник
Редактор Н. В. Шувалова. Технический редактор Н. И. Горбачева
Компьютерная верстка: Г. Ю. Никитина. Корректоры Л. В. Гаврилина, В. М. Малек,
А. П. Сизова
Изд. № 101109289. Подписано в печать 17.05.2006. Формат 70* 100/16. Гарнитура «Таймс».
Бумага офсетная № 1. Печать офсетная. Усл. печ. л. 22,1. Тираж 3 000 экз. Заказ №719.
Издательский центр «Академия», www.academia-moscow.ru
Санитарно-эпидемиологическое заключение № 77.99.02.953.Д.004796.07.04 от 20.07.2004.
117342. Москва, ул. Бутлерова. 17-Б. к. 360. Тел./факс: (495)330-1092, 334-8337.
Отпечатано в ОАО «Тверской полиграфический комбинат».
170024, г. Тверь, пр-т Ленина. 5. Телефон: (4822) 44-42-15.
Ноте page-www.iverpk.ru Электронная почта (E-mail)-salesWtverpk.ru Ж
Оригинал-макет данного издания является собственностью Издательского центра «Академия»,
и его воспроизведение любым способом без согласия правообладателя запрещается
Q Коллектив авторов, 2006
ISBN 5-7695-2727-7 (т. 1) © Образовательно-издательский центр «Академия». 2006
ISBN 5-7695-2724-2 © Оформление. Издательский центр «Академия», 2006
Посвящается 100-летию
со дня рождения выдающегося
российского патофизиолога
академика АМН СССР Николая
Александровича Федорова
ПРЕДИСЛОВИЕ
Создание в 2000 г. Государственных
образовательных стандартов высшего
профессионального образования и
квалификационных характеристик по
соответствующим специальностям
медицинских вузов послужило осно-
ванием для разработки новых учебных
программ и учебной литературы по
патофизиологии, соответствующих
современным требованиям медицин-
ской науки и практики, а также пе-
дагогики и психологии высшей шко-
лы. При этом новые прогрессивные
технологии в медицине непременно
должны быть интегрированы с клас-
сическими представлениями о причи-
нах болезней, механизме их развития,
принципах лечения и профилактики.
Модернизация медицинского образо-
вания может быть основана только на
преемственности между достижения-
ми предшествующих научных школ и
новыми непрерывно развивающими-
ся теориями и концепциями в биоло-
гии и медицине.
Важная роль в формировании вра-
чебного мышления принадлежит па-
тофизиологии — фундаментальной
медицинской дисциплине, изучающей
в основном функциональные аспек-
ты причин, патогенеза, исходов па-
тологических процессов и болезней
человека и принципы их коррекции.
В основе педагогического процесса в
высшей медицинской школе лежит
учебник.
Многие поколения врачей в на-
шей стране воспитаны на учебной
литературе по патофизиологии, под-
готовленной выдающимися учеными.
Особенно следует отметить учебники,
а также учебные руководства патоло-
гов и патофизиологов В. В. Пашути-
на, В. В. Подвысоцкого, А. А. Бого-
мольца, Л.А.Тарасевича, Н.Н.Анич-
кова, В. В. Воронина, Д. Е. Альперна,
А.Д.Адо, И. Р. Петрова, Н. А.Федоро-
ва, Н. Н. Зайко и др. Каждый из этих
учебников не только отличался сти-
лем изложения, но и отражал состоя-
ние науки в определенный период ее
развития. Соответственно приоритет-
ными в учебниках были разделы, от-
ражающие направления научных и
педагогических школ, руководимых
ведущими учеными-патофизиологами
нашей страны.
Значительным событием в совер-
шенствовании преподавания патофи-
зиологии было издание, подготовлен-
ное коллективом авторов — предста-
вителей ведущих патофизиологиче-
ских школ под редакцией А.Д.Адо и
И. Р. Петрова в 1957 г. Этот учебник
можно назвать лучшим до середины
XX в., так как он вполне отражал со-
временные для того времени тенден-
ции в развитии теоретической меди-
цинской науки. Принцип построения
учебника был сохранен в новом из-
дании, созданном коллективом авто-
ров — ведущих патофизиологов Рос-
сии и стран СНГ под редакцией
А.Д.Адо и В. В. Новицкого в 1994 г.
Особенностью его было не только со-
временное толкование вопросов этио-
3
логии и патогенеза основных патоло-
гических процессов, но и включение
новых разделов, необходимых для
высшего медицинского образования
на современном этапе его развития.
Существенным вкладом в совершен-
ствование преподавания патофизио-
логии было издание в 2001 г. учебни-
ка, составленного коллективом авто-
ров под редакцией Г. В. Порядина в
2002 г. — двухтомного учебника для
медицинских вузов П.Ф.Литвицкого
«Патофизиология».
Существование нескольких учеб-
ных изданий по патофизиологии для
медицинских вузов, авторами которых
являются ведущие специалисты, не
носит конкурентного характера, а на-
против, позволяет изучающему этот
предмет студенту или врачу, ознако-
миться с разными точками зрения и
особенностями изложения того или
иного вопроса. Обучающийся вправе
самостоятельно решить, какой учеб-
ник для него наиболее приемлем, и в
этом заключается один из принципов
высшего образования.
Развитие медицинской науки идет,
как известно, не только по пути углу-
бления наших знаний и раскрытия
механизмов развития типовых пато-
логических процессов и болезней че-
ловека. Важное значение для после-
дующей медицинской практики вра-
ча имеет приобретение специальных
знаний, которыми он овладевает на
соответствующих факультетах медицин-
ских вузов: лечебном, педиатрическом,
стоматологическом, фармацевтиче-
ском, медсестринском. Специализация
по каждому из этих профилей требует
не только получения основополага-
ющих, фундаментальных знаний, нс
и углубленного изучения тех разделов,
с которыми связана основная деятель-
ность медицинского работника. На ос-
нове принципов безусловного сохра-
нения базовых представлений по все-
му курсу патофизиологии впервые
был издан учебник по патофизиоло
гии для стоматологических факульте-
тов медицинских вузов. Потребность
в его издании была продиктована спе-
цификой подготовки студентов-сто-
матологов и необходимостью освое-
ния ими таких разделов патофизио-
логии, как этиология и патогенез ка-
риеса, пульпита, патология пародон-
та и периодонта, слизистой оболочки
полости рта и т.д. В учебниках по па-
тофизиологии почти не рассматрива-
ются механизмы проявления в поло-
сти рта наследственных и врожден-
ных заболеваний, патологии нейро-
эндокринной, сердечно-сосудистой,
дыхательной систем, желудочно-ки-
шечного тракта, слюнных желез и т.д.
Мы со всей ответственностью по-
нимаем, что ни одно учебное издание
не может успеть за темпами развития
науки, поэтому в процессе обучения
учащимся на различных уровнях пе-
дагогического процесса предложены и
другие источники информации, на-
пример, учебные пособия, рекомен-
дации, фильмы и т.д. Авторский кол-
лектив выражает надежду, что исполь-
зование данного учебника повысит
качество знаний студентов лечебных
и стоматологических факультетов.
А. И. ВОЛОЖИН, Г. В. ПОРЯДИН
ВВЕДЕНИЕ
Основные определения. Патофизио-
логия — это наука о жизнедеятельно,-
сти больного организма человека, ко-
торая изучает причины, общие меха-
низмы развития, исходы и принципы
коррекции болезни, механизмы вы-
здоровления.
В основе патофизиологии как учеб-
ного предмета лежит раскрытие в ос-
новном функциональных аспектов
болезни человека, т.е. «физиология»
больного организма в динамике его
взаимодействия с окружающей средой.
Патофизиология служит неотъем-
лемой частью общего медицинского
предмета — «патология человека», ко-
торый включает в себя как функцио-
нальные. так и тесно связанные с
ними структурные нарушения (пато-
логическая анатомия) в организме в
процессе развития болезни. Оба пред-
мета объединены одной целью, но для
ее достижения используют различные
методические подходы: функциональ-
ный и морфологический, хотя четкой
границы провести между ними нельзя.
Приступая к изучению патологии
и специальных медицинских дисцип-
лин, студент-медик на первых курсах
уже ознакомился с общебиологически-
ми представлениями о деятельности
здорового организма человека, функ-
циях его органов из курсов нормаль-
ной анатомии, физики, физиологии,
гистологии, биохимии и др. Таким об-
разом, он в определенной степени уже
владеет биологической терминологией,
относящейся к организму человека.
С древних времен врачеватели пы-
тались обобщить полученные резуль-
таты практической деятельности,
симптомы, наблюдавшиеся у посте-
ли больного, чтобы выяснить причи-
ны возникновения, пути развития и
методы лечения болезней. И хотя, с
современной точки зрения, они рас-
полагали сравнительно малым коли-
чеством знаний, им удавалось успеш-
но лечить некоторые болезни и до-
стигать обобщений, не потерявших
своего значения до настоящего вре-
мени.
Объединенные общим термином
«патология» (от греч. pathos — страда-
ние. logos — учение) медицинские
дисциплины изучают изменения в
организме человека, которые возни-
кают в результате болезни, в частно-
сти, отдельные стороны течения па-
тологического процесса и его взаимо-
действия с организмом.
Академик И. В. Давыдовский (1969)
считал, что «патология — обширная
область биологии, изучающая прояв-
ления измененной или нарушенной
деятельности». По определению про-
фессора Я. Л. Рапопорта (1958), общая
патология занимается изучением об-
щих черт разнообразных патологиче-
ских процессов и установлением об-
щих для всех патологических процес-
сов закономерностей их развития (т. е.
возникновения, течения и исхода). Та-
ким образом, задача патологии как на-
уки — объединение в единое целое
разрозненных фактов и знаний, по-
5
лученных в ходе клинических наблю-
дений и проверенных в эксперимен-
тах на животных.
Следует отметить тесную связь меж-
ду дисциплинами, изучающими па-
тологические процессы, а также орга-
низм в норме — анатомией и физио-
логией. Академик Российской академии
медицинских наук (РАМН) Г. Н. Кры-
жановский отмечает, что различия
между физиологическими и патоло-
гическими реакциями определяются
мерой их осуществления. Если эта мера
соответствует потребности организма,
реакция имеет адаптивный, физио-
логический характер, если не соот-
ветствует. то реакция приобретает
дизадаптивный, т.е. патологический
характер.
К дисциплинам, изучающим па-
тологические процессы в организме
и развитие болезни, относятся, как
было сказано, патофизиология и па-
тологическая анатомия. Объектом па-
тологической анатомии служат в ос-
новном изменения морфологической
структуры клеточных и тканевых эле-
ментов при патологическом процес-
се, без знания которых невозможно
создать его общую модель, посколь-
ку функциональные изменения про-
исходят на морфологическом уровне.
Организм представляет единство мор-
фологических структур и физиологи-
ческих функций, и только их совмест-
ное рассмотрение дает возможность
представить картину изменений, про-
исходящих в организме в результате
патологического процесса. Иными сло-
вами, патологическая анатомия изу-
чает изменения в строении органов,
тканей, клеток, а патофизиология рас-
сматривает функциональные измене-
ния в организме, происходящие в ре-
зультате их повреждения. Патофизио-
логия кроме сведений, полученных
при клинических исследованиях, ши-
роко применяет экспериментальные
методы, изучая отдельные стадии и
стороны патологического процесса на
животных.
Патофизиология как фундамен-
тальная наука в системе медицинского
образования занимает особое место.
Являясь интегративной медико-биоло-
гической наукой, связывающей фун-
даментальные основополагающие
предметы (физиологию, биохимию,
биофизику, морфологию и др.) с кли-
ническими дисциплинами, она спо-
собствует развитию врачебного мыш-
ления. По выражению Г.Н. Крыжанов-
ского (1990) патофизиология — мост
между базисными теоретическими об-
разовательными дисциплинами и кли-
никой.
В задачу патофизиологии входит не
только анализ функциональных аспек-
тов болезни, но и создание единой
системы представлений о закономер-
ностях и механизмах дизрегуляции
функций, лежащих в основе развития
как типовых патологических процес-
сов, так и нозологических форм бо-
лезней. Эта система представлений со-
ставляет логическую модель, которую
в дальнейшем использую! клиници-
сты в своей лечебной деятельности.
Патофизиологический анализ болез-
ни охватывает совокупность многооб-
разных процессов, происходящих в
различных органах и тканях, на раз-
ных структурно-функциональных уров-
нях. При этом оценивают биологиче-
ское значение болезнетворных факто-
ров, их взаимосвязи, причинно-след-
ственные отношения между внутрен-
ними и внешними факторами, стадии
протекания обнаруженных явлений,
их качественные и количественные ха-
рактеристики и т.д.
Поскольку некоторые элементы па-
тологических процессов повторяются в
той или иной степени в разных ком-
бинациях при различных заболевани-
ях, патофизиология изучает типовые
патологические процессы: отек, вос-
паление, нарушение микроциркуля-
ции, гипоксию, энергетический дефи-
цит, дегенерацию, нарушение функ-
ции мембран, рецепторных процес-
сов, дистрофические нарушения, из-
менение деятельности генома клеток
и некоторые другие.
Традиционно патофизиологию как
учебную медицинскую дисциплину
подразделяют на три взаимосвязанных
раздела: 1) общую нозологию (общее
учение о болезни); 2) типовые пато-
логические процессы; 3) патофизио-
логию органов и систем. Третий раз-
дел предмета в наши дни по своей сути
все больше приобретает черты клини-
ческой патофизиологии, изучающей об-
щие вопросы этиологии, патогенеза и
исходов болезней человека. Необходи-
мость в выделении этого раздела обу-
словлена тем, что для большинства
болезней человека отсутствуют аде-
кватные экспериментальные модели,
а развитие неинвазивных и малоинва-
зивных методов исследования часто
позволяет в полной мере оценить со-
стояние внутренних органов и регуля-
торных систем. Принципы гуманного
отношения к животным не позволяют
широко использовать их в лаборатор-
ных опытах для решения проблем па-
тофизиологии. Это возможно только в
том случае, если провести исследова-
ния в клинических условиях нельзя по
этическим соображениям.
Клиническая патофизиология —
наиболее интенсивно развивающий-
ся раздел дисциплины, что связано с
успехами других медико-биологиче-
ских и технических наук; ее цель за-
ключается в изучении наиболее об-
щих вопросов этиологии и патогене-
за болезней человека с помощью раз-
нообразных клинических и физио-
логических методов исследования.
В соответствии с этой целью в зада-
чи клинической патофизиологии вхо-
дят: изучение, анализ характера и тя-
жести нарушений функций жизненно
важных органов и систем больного на
каждом этапе развития заболевания.
Результаты функционального исследо-
вания органов и систем больного че-
ловека используют для обоснования
адекватного лечения и профилактики
заболеваний. В задачу клинической па-
тофизиологии входит также выясне-
ние компенсаторных возможностей
организма, которые обеспечивают его
функционирование в условиях болез-
ни и патологического процесса, оцен-
ка характера и степени дизрегуляции
нервного, эндокринного, иммунного,
температурного, физико-химического
и других сторон гомеостаза.
Особый раздел клинической пато-
физиологии — натурный эксперимент.
Цель его заключается в изучении со-
стояния организма человека при воз-
действии на него внешних потенци-
ально болезнетворных факторов, ког-
да в эксперименте на животных эта
цель не может быть достигнута. Напри-
мер, воздействие перегрузок, гиподи-
намии, высокого и низкого давления,
измененного газового состава возду-
ха, испытание техники (космической,
авиационной, морской и т.д.), влия-
ние психологических воздействий и
многих других факторов в конечном
счете может быть изучено только с уча-
стием человека, биологические свой-
ства и социальные функции которого
имеют значительные особенности.
Методы патофизиологии. Каждая
наука имеет свои приоритетные мето-
ды исследования. Основными метода-
ми патофизиологии являются: экспе-
риментальное моделирование; натур-
ный эксперимент с участием человека;
математическое и электронно-кибер-
нетическое моделирование; создание
искусственных систем или органов.
Экспериментальное моделирование.
Данный метод позволяет воспроизво-
7
дить, как правило, в более упрощен-
ной форме патологические процессы
и наиболее важные синдромы болез-
ней на животных, изучать их этиоло-
гию и патогенез, разрабатывать науч-
но обоснованные методы профилак-
тики и терапии, а также оценивать их
эффективность. Важную роль играет
выбор вида и возраста животного для
воспроизведения патологических про-
цессов и болезней человека. Напри-
мер, кариес зубов лучше моделиру-
ется на молодых крысах и хомяках,
пульпит и патология периодонта — на
собаках, атеросклероз — на кроликах,
различные виды опухолей воспроиз-
водятся на мышах, крысах, кроликах
и т.д. Нередко используют метод срав-
нительной патологии, так как живот-
ные разного вида и возраста по-раз-
ному реагируют на один и тот же бо-
лезнетворный фактор.
В дикой природе у разных животных
нередко встречаются врожденные за-
болевания, например, тромбоцитопе-
ния у свиней, нарушения костно-су-
ставного аппарата и воспаление око-
лозубных тканей у собак и др.
Эти заболевания по происхожде-
нию близки к заболеваниям у челове-
ка и могут быть отнесены к естествен-
ным, природным моделям, которые
используют для решения задач пато-
физиологии. Природные модели болез-
ней применены для выведения линий
животных, страдающих наследствен-
ными формами патологии (или пред-
расположенными к ним): сахарным
диабетом, артериальной гипертонией,
тучностью с жировой дистрофией,
остеопорозом, лейкозом и др. Меха-
низмы развития этих заболеваний у
животных сходны с аналогичными за-
болеваниями человека и в связи с этим
их широко используют для изучения
и разработки методов лечения.
Экспериментальное моделирование
состоит из нескольких этапов:
1) изучение параметров жизнеде-
ятельности в пределах нормы;
2) моделирование болезни (патоло-
гического процесса);
3) изучение болезни (патологиче-
ского процесса) в динамике;
4) разработка методов патогенети-
ческой терапии (или профилактики)
с последующим переносом получен-
ных данных в клинические условия
(клиническая апробация).
Моделирование патологических про-
цессов и синдромов на животных пре-
следует цель воспроизведения наибо-
лее важных и характерных признаков
заболеваний человека. Полностью вос-
произвести с помошью эксперимен-
тальной модели болезнь человека не
представляется возможным, так как
организм человека как система зна-
чительно сложнее, чем у животных.
Кроме того, на жизнедеятельность че-
ловека влияют не только природные,
но и особенно социальные факторы,
в том числе действующие через пси-
хическую сферу.
Экспериментальное моделирование
осуществляют на разных уровнях ин-
теграции организма животного. Соот-
ветственно этому выделяют следу-
ющие типы экспериментального мо-
делирования: на уровне целостного
организма, на органном, тканевом,
клеточном, субклеточном, геномном
и молекулярном уровнях.
На уровне целостного орга-
низма моделируют состояния, наи-
более близкие к заболеваниям челове-
ка, например невроз у собак и обезь-
ян, сахарный диабет, почечная арте-
риальная гипертензия, иммунодефи-
цитное состояние и др. Этот тип
моделирования наиболее приближен
к реальным, клиническим условиям,
и он позволяет получить большую ин-
формацию об изменении в целостном
организме при том или ином воздей-
ствии. Однако данный метод не поз-
8
воляет оценить характер взаимодей-
ствия болезнетворного фактора с от-
дельными органами-мишенями, что
необходимо для выяснения патогенеза
данного заболевания. Например, дли-
тельное содержание молодых крыс на
сахарозно-казеиновой диете вызывает
изменения во всех органах и системах,
но важнейшим органом-мишенью яв-
ляются зубы, которые подвергаются
кариозному процессу с последующим
развитием пульпита, периодонтита и
распространению воспалительного
процесса на окружающие ткани. Или
другой пример. Снижение кровотока
в почках путем уменьшения просвета
почечной артерии приводит к разви-
тию стойкой артериальной гипертен-
зии с последующим нарушением
функции органов на системном уров-
не. Однако первичным звеном этих на-
рушений является изменение функ-
ции почек, в частности повышение
выработки прессорных и снижение
секреции депрессорных факторов. Та-
ких примеров можно привести мно-
жество.
Практически важно знать, какой из
органов является основной мишенью
для болезнетворного фактора. Для вы-
яснения этого вопроса используют
метод моделирования на органном
уровне. В его основе лежит установ-
ление функциональных, биохимиче-
ских и структурных нарушений в изо-
лированных органах, содержащихся
(переживающих) в специальной сре-
де для поддержания жизнедеятельно-
сти. Для оценки патогенеза широко
используют влияние различных фак-
торов на изолированное сердце, пе-
чень, почки, головной мозг и другие
органы.
Необходимо помнить, что полное
выключение нейрогуморальных связей
изолированного органа с целостным
организмом вносит существенные кор-
рективы в интерпретацию полученных
данных. Реакция органа на то или иное
воздействие в условиях целостного
организма может существенно отли-
чаться благодаря компенсаторному
влиянию других органов, изменению
кровотока, нейрогуморальной регуля-
ции метаболических процессов. Поэто-
му при необходимости прибегают к
методу частично изолированных орга-
нов, связь которых с организмом осу-
ществляется благодаря сохранению
нервной регуляции или сосудистой
системы.
Для изучения патогенеза измене-
ний в отдельных органах при систем-
ном воздействии болезнетворного фак-
тора широко используют метод «вы-
ключения». В этих целях в острых и
хронических опытах на животных пе-
ререзают, разрушают или удаляют от-
дельные структуры. Например, удале-
ние части зубов у собак приводит к
перегрузке опорного аппарата сохра-
нившихся зубов с последующим раз-
витием воспалительного процесса в
околозубных тканях челюсти. Односто-
роннее удаление слюнных желез у
крыс вызывает компенсаторную ги-
пертрофию симметричных желез. Пе-
ресечение нижнего альвеолярного не-
рва у собак приводит к нарушению ре-
паративной регенерации кости после
травмы челюсти. Удаление околощи-
товидных желез у крыс приводит к
резкому нарушению минерализации
постоянно растущих зубов (гипопла-
зия эмали).
Выяснение вопроса о том, какой
орган является основной мишенью для
патогенного агента, является важным,
но недостаточным этапом углубленно-
го анализа патогенеза развития пато-
логического процесса. Даже в изоли-
рованном органе сохраняются струк-
турно-функциональные связи между
различными тканями, например меж-
ду соединительнотканными и парен-
химатозными элементами в почках
и печени. При перфузии изолирован-
ного органа (сердца) питательной жид-
костью частично сохраняется местная
сосудистая регуляция метаболизма.
Для выделения «чисто тканевого
компонента» патологии органа и ис-
ключения местных регуляторных вли-
яний используют метод культуры тка-
ней (тканевый уровень модели-
рования патологического процесса).
Для его выполнения обычно берут срез
ткани (или взвесь, например, кост-
ного мозга) органа животного, под-
вергнутого воздействию патогенного
агента, либо этим агентом влияют на
изолированную ткань интактного жи-
вотного. Ткань содержат в культураль-
ной среде, которая обеспечивает ос-
новные процессы жизнедеятельности,
и ее подвергают всестороннему иссле-
дованию разными методами. Таким об-
разом, удается более точно на ткане-
вом уровне определить точку прило-
жения патогенного фактора в органе.
Следующим после тканевого явля-
ются клеточный и внутрикле-
точный уровни исследования ме-
ханизмов развития патологических
процессов. Для этого с помощью спе-
циальных методов изолируют, выде-
ляют и культивируют в искусственной
среде отдельные клеточные популяции
и изучают многочисленные показате-
ли, включающие мембранный потен-
циал, возбудимость, эндо- и экзоци-
тоз, внутриклеточные процессы, свя-
занные с деятельностью мембран и
органелл клеток. С помощью этого
уровня моделирования раскрыты ме-
ханизмы действия многих болезне-
творных факторов: четыреххлористо-
го углерода на гепатоциты, токсина
ботулизма на нервные клетки, солей
тяжелых металлов на мышцу сердца и
клетки головного мозга, перегревание
зуба при препарировании — на клет-
ки соединительной ткани пульпы —
одонтобласты и т.д.
Влияние болезнетворных факторов
на клетки, как правило, опосредова-
но изменением активности молекуляр-
ных структур. Молекулярный
уровень моделирования заключает-
ся в выделении и изучении измене-
ния активности и свойств ферментов,
белков и других соединений, а также
рецепторного аппарата клеток под
влиянием патогенных факторов. Мо-
лекулярная биология, разрабатыва-
ющая эти проблемы, — интенсивно
развивающаяся самостоятельная на-
ука — достигла больших успехов в изу-
чении молекулярных механизмов па-
тологических процессов.
Моделирование на уровне ге-
нома клетки преследует цель — изу-
чение механизмов влияния болезне-
творных факторов на мутацию клеток,
что широко применяют для изучения
этиологии и патогенеза наследствен-
ных и врожденных заболеваний, опу-
холевого роста, «болезней накопле-
ния» и др. Этот метод моделирования
широко используют специалисты в
области фундаментальной и медицин-
ской генетики — одного из передовых
направлений в науке.
Молекулярный и генный уровни
моделирования патологических про-
цессов тесно связаны меду собой. Бла-
годаря этим методам раскрыты неко-
торые механизмы влияния ионизиру-
ющей радиации, канцерогенных и
других веществ на наследственный
аппарат клетки, выведены линии жи-
вотных с наследственной патологией,
близкой к нозологическим формам
болезней человека или с наследствен-
ной предрасположенностью к этим
болезням.
Следует помнить, что наиболее
полное понимание механизмов разви-
тия патологических процессов и болез-
ней человека возможно лишь при ис-
пользовании методологических прин-
ципов научного познания: от общего
10
к частному с последующим обобще-
нием полученных данных на уровне
целостного организма. Следовательно,
для достижения поставленных в па-
тофизиологии задач должны быть ис-
пользованы разные уровни моделиро-
вания типовых патологических процес-
сов: от целостного организма до мо-
лекулярных структур. Каждый метод
моделирования имеет свои ограниче-
ния преимущества и недостатки. Но в
целом следует помнить, что задачей
экспериментального моделирования
патологических процессов на разных
уровнях интеграции организма явля-
ется достижение главной цели пато-
физиологии — изучение этиологии,
патогенеза и исходов болезней чело-
века, а также разработка методов кор-
рекции.
Натурный эксперимент с участием
человека. Это — вынужденный тип мо-
делирования, так как испытание воз-
действий, в первую очередь экстре-
мальных, может быть осуществлено
только на людях. Чувствительность и
устойчивость организма человека к
некоторым факторам существенно от-
личается от реакции животных. К та-
ким воздействиям относятся: невесо-
мость и гиподинамия, гравитационные
перегрузки, гипоксия, действие ды-
хательных газовых сред измененного
состава, высокой и низкой темпера-
туры, физических нагрузок, влияние
эмоциональных факторов, длительной
изоляции и т.д.
Как правило, натурный экспери-
мент ставят после проведения пред-
варительных исследований на живот-
ных и прогнозирования в целях мак-
симального обеспечения безопасности
возможных реакций у человека на изу-
чаемое воздействие. Наиболее распро-
странено применение натурного экс-
перимента в космической, авиацион-
ной и морской медицине. Благодаря
натурному эксперименту человечество
добилось значительных успехов в ос-
воении космического пространства,
мирового океана, в создании совре-
менных летательных аппаратов, транс-
портных средств, другой современной
техники и средств защиты от небла-
гоприятных факторов окружающей
среды.
В исследованиях на моделях ис-
пользуют все известные науке мето-
дики: физические, химические, фи-
зиологические, электрофизиологиче-
ские, гематологические, биофизиче-
ские, биохимические, морфологиче-
ские, электронно-микроскопические,
изотопные, иммунологические и др.
Методы математического и элект-
ронно-кибернетического моделирования,
создания искусственных систем или ор-
ганов. Эти методы особенно широко
развиваются в последнее время. Раз-
работка и применение этих методов
возможны только при наличии дан-
ных, полученных в результате экспе-
риментального моделирования на раз-
ных уровнях интеграции организма.
Например, вопросы, связанные с био-
механикой жевательного аппарата,
моделируют с помощью специальной
программы, которая основана на кон-
кретных данных по прочности кост-
ной ткани, форме, размеру, плотно-
сти кости, возрасту и состоянию здо-
ровья пациента.
Таким образом, с помощью ком-
пьютера удается с известной степенью
вероятности прогнозировать измене-
ния в зубочелюстной системе при ис-
пользовании дентальных имплантатов,
вида протезов и найти оптимальное
решение для проведения лечебных и
реабилитационных мероприятий у па-
циента. Созданы математические и
электронно-кибернетические модели
работы сердца и сосудов, почек, пе-
чени и других органов и систем.
Данное направление в моделирова-
нии в настоящее время интенсивно
развивается и определяет состояние
медицинской науки в целом и пато-
физиологии в частности. Прогресс в
создании искусственных органов и си-
стем (сердца, сосудов, суставов, сен-
сорных устройств и др.) во многом
обязан разработке адекватных матема-
тических моделей, в основу которых
положены функции органов в норме
и патологии с учетом условий их дей-
ствия.
Требования, предъявляемые к моде-
лям болезней. Основными требовани-
ями, предъявляемыми к моделям бо-
лезней (патологических процессов),
при моделировании с использовани-
ем животных являются: идентичность
болезнетворных факторов, условий
возникновения и периодов развития
патологии и болезни; сходство функ-
циональных и морфологических изме-
нений на различных уровнях интегра-
ции организма (системном, органном,
клеточном, субклеточном и молекуляр-
ном), эффективность действия одних
и тех же лекарственных препаратов для
лечения в клинических условиях и в
экспериментах. Особое значение име-
ет выбор животных, они должны реа-
гировать на данный болезнетворный
фактор так же, как и человек. Это за-
висит от особенностей иммунной ре-
активности животного, скорости ме-
таболизма, основного обмена, прони-
цаемости внешних и внутренних ба-
рьеров, возраста и продолжительно-
сти жизни.
Допустимыми отличиями экспери-
ментальной модели от оригинала, т. е.
нозологической формы болезни чело-
века, является разная длительность пе-
риодов болезни, интенсивность и рас-
пространенность патологических про-
цессов у подопытных животных.
Следует признать, что основным
методом моделирования в патофизио-
логии является организменный, так
как он позволяет выявить основные
закономерности происхождения, те-
чения и исхода заболевания челове-
ка, в то время как все другие уровни
моделирования в большей мере рас-
сматриваю! организм как биологи-
ческий объект.
При моделировании необходимы
четкое определение реальной цели и
постановка конкретных задач исследо-
вания с обоснованием информативных
методик, адекватных его цели и зада-
чам, объективный анализ и синтез по-
лученных данных. Любой метод экс-
периментального моделирования име-
ет свои определенные границы и
разрешающие возможности, так как
полностью воспроизвести болезнь че-
ловека на животных невозможно. При
постановке опытов следует соблюдать
правила гуманного отношения к жи-
вотным, вытекающие из приказа ми-
нистра здравоохранения СССР «Пра-
вила проведения работ с использова-
нием экспериментальных животных»
от 12.08.1977 г. № 755.
Краткие сведения об истории пато-
физиологии в России. Свое начало па-
тофизиология как наука берет с 1758 г.,
когда вышло в свет первое в истории
медицины руководство И.Д.Гаубия по
медицинской обшей патологии, в ко-
тором при рассмотрении сущности,
различия, причины и последствия на-
рушения нормального состояния твер-
дых и жидких частей организма был
применен термин «общая патология».
В Западной Европе и России на
протяжении XVIII в. и в начале XIX в.
патологию преподавали как неотъем-
лемую часть курса теоретической ме-
дицины. Особенно большой вклад в
развитие обшей патологии в первой
половине XIX в. внесли врач-философ
И. Е. Дядьковский и его ученик К. В. Ле-
бедев, читавшие курс обшей патоло-
гии и терапии в Императорском Мос-
ковском университете. Их общепато-
логические воззрения — «философия
12
Г. у'*ЯЙИИвЙЬЙ1
патологии» — легли в основу первого
оригинального руководства на русском
языке «Общая патология», изданного
К. В. Лебедевым в 1835 г.
Уставом Российских университетов
в 1835 г. введено преподавание общей
патологии совместно с физиологией.
Профессор кафедры физиологии и об-
шей патологии Императорского Мос-
ковского университета А. М.Филома-
фитский в 1835—1847 гг. впервые в
России провел ряд экспериментов по
удалению почек у животных, перевяз-
ке мочеточников; в 1847—1848 гг. он
возглавил экспериментально-клини-
ческие исследования действия на орга-
низм эфира, хлороформа и других нар-
котических веществ. В 1868— 1869 гг.
А.И. Полунин организовал в Москов-
ском университете самостоятельную
кафедру общей патологии.
В последней трети XIX в. отчетли-
во проявилась тенденция формирова-
ния в недрах общей патологии пато-
логической физиологии, о настоятель-
ной необходимости которой говорил
Р. Вирхов. Его ученик Ю. Конгейм обо-
гатил науку выдающимися экспери-
ментальными исследованиями, посвя-
щенными эмболии, инфаркту, описал
причины и механизм развития воспа-
ления. В 1877—1880 гг. он издал клас-
сическое двухтомное руководство по
общей патологии, которое было пе-
реведено на русский язык в 1878 —
1881 гг. Основное внимание Ю. Кон-
гейм уделил патологической физио-
логии, которая, по его словам, учит,
каким образом совершаются функции
органов в болезненном их состоянии
после того, как произошло наруше-
ние нормального жизненного процесса.
В 1878 —1879 гг. в переводе с немецкого
вышло также «Руководство к общей па-
тологии в смысле патологической фи-
зиологии» С. Самуэля.
Термин «патологическая физиоло-
гия» впервые применил профессор
Эрфуртского университета А. Геккер
(A. Hecker, 1763 — 1811) в учебнике
«Основы патологической физиоло-
гии», вышедшем в Галле (Германия)
в 1791 г. Позднее Л.Кейлиот (L.Cail-
liot, 1819) применил термин «пато-
логическая физиология» в учебнике
под названием «Pathologic generale et
physiologic phatologique»*.
В России основоположником пато-
логической физиологии как самостоя-
тельной науки и предмета преподава-
ния был физиолог-экспериментатор,
ученик И. М. Сеченова В. В. Пашутин,
возглавлявший с 1874 г. кафедру об-
щей патологии медицинского факуль-
тета Казанского университета, а с
1878 г. — аналогичную кафедру Санкт-
Петербургской Медико-хирургической
академии. В. В. Пашутин опубликовал
в 1878 и 1881 гг. «Лекции по общей па-
тологии (патологической физиологии)»
и фундаментальный двухтомный «Курс
общей и экспериментальной патоло-
гии», вышедший в 1885 и 1902 гг.
В. В. Пашутин создал первый в мире
калориметр, продолжил оригиналь-
ные методы исследования газообмена
и теплообмена у человека и животных.
Используя эти методы в эксперимен-
те на животных и человеке, В. В. Па-
шутин и его ученики выполнили ка-
питальные исследования в области
изучения различных видов голодания,
обмена веществ и теплообмена при
патологических состояниях организма.
Почти заново они создали учение о
кислородном голодании.
В. В. Пашутин основал первую оте -
чественную школу общих патологов
(патофизиологов). Его преемником по
кафедре был П.М.Альбипкий, пло-
дотворно разрабатывавший пробле-
мы голодания, обмена веществ, газо-
обмена. Особенно ценными являют -
* «Общая патология и патологическая фи-
зиология».
13
ся его работы по кислородному голо-
данию и открытие П. М.Альбицким
феномена «обратного действия по-
следствия углекислоты» (1911). Заклю-
чение П. М. Альбицкого о том, что по-
стоянно высокое напряжение СО2
в крови имеет огромное биологиче-
ское значение, возбуждая дыхатель-
ный центр и регулируя окислительные
процессы в теле, было основополага-
ющим для дальнейшего формирования
специальной физиологии человека в
экстремальных условиях и разработки
проблемы ауторегуляции обменных
процессов продуктами обмена.
Большой вклад в разработку про-
блем газового и теплового обмена в
организме при полном голодании внес
ученик В. В. Пашутина П. П. Авроров,
работавший в 1904—1922 гг. профес-
сором кафедры общей патологии Том-
ского университета, а с 1922 г. до кон-
ца жизни — заведующим кафедрой
фармакологии Кубанского медицин-
ского института.
Ученик В. В. Пашутина Н. В. Весел-
кин с сотрудниками предприняли
исследования по вопросам патологии
углеводно-фосфорного обмена, па-
тогенезу панкреатического диабета,
а также исследования обмена веществ
при хроническом, неполном голода-
нии.
Направление исследований, нача-
тое И. М. Сеченовым, В. В. Пашути-
ным, П.М.Альбицким, успешно раз-
вивалось впоследствии на кафедре па-
тологической физиологии Военно-ме-
дицинской академии под руководством
заведующего кафедрой И. Р. Петрова:
проблемы кислородной недостаточно-
сти на моделях, которые вызывались
у животных; влияние пониженного ба-
рометрического давления на живот-
ных с острой кровопотерей, череп-
но-мозговыми и другими ранениями.
И. Р. Петров и его преемник по ка-
федре патологической физиологии
В. К. Кулагин с сотрудниками выпол-
нили фундаментальные исследования
по проблемам шока и терминальных
состояний, кровопотери, посттранс-
фузионных осложнений, разработали
методы и принципы ранней профи-
лактики и лечения шока и кровопоте-
ри с использованием крови, кровеза-
менителей, адренокортикотропного
гормона, кортикостероидов и некото-
рых ферментов. Они опубликовали ра-
боты по методологии патологии, про-
блемам общего учения о болезни.
Видным представителем школы
В. В. Пашутина, сочетавшим экспери-
ментально-физиологическое и физи-
ко-химическое направление развития
общей патологии, был Н. Г. Ушинский.
Будучи патофизиологом-эксперимен-
татором, Н. Г. Ушинский ограничил
преподавание рамками патологиче-
ской физиологии, которую рассмат-
ривал как одну из наиболее важных
глав общей патологии. Под патологи-
ческой физиологией он подразумевал
не всю общую патологию, а науку о
ходе жизненных процессов и отправ-
лений в больном организме, о тех не-
нормальностях, которые производит
в жизни организма болезнь.
Ученик В. В. Пашутина А. В. Репрев
вошел в историю медицины как один
из родоначальников отечественной
эндокринологии. Его «Учебник обшей
патологии» (1897) и фундаментальное
руководство «Основы общей и экспе-
риментальной патологии» способство-
вали развитию экспериментального
направления в патологии.
Общее направление работ А. В. Реп-
рева по изучению патологии эндо-
кринной системы и обмена веществ
получило дальнейшее развитие в ис-
следованиях представителей созданной
им Харьковской школы патофизио-
логов: Д.Е. Альперна, С. М.Лейтеса,
М. М. Павлова, С.Г. Генеса. Д. П. Гри-
нева и их сотрудников.
Дальнейшим укреплением экспе-
риментального направления в пато-
логии послужили работы В.В.Под-
высопкого и созданной им школы
(И.Г.Савченко (гг. Казань, Красно-
дар), Д.К. Заболотный (Санкт-Петер-
бург, Киев), Л.А.Тарасевич (Москва),
А. А. Богомолец (Саратов, Москва,
Киев)). В. В. Подвысоцкий с сотрудни-
ками установили, что печень, слюн-
ные и мейбомиевы железы обладают
выраженной способностью к регене-
рации после разнообразных травмати-
ческих повреждений и отравлений. Ре-
генерация идет за счет не только сек-
реторных клеток, но и эпителия вы-
водящих протоков. В 1891 г. вышло
первое издание учебника В. В. Подвы-
соцкого «Основы общей патологии. Ру-
ководство к физиологии больного
организма», а в 1894 г. — второе, зна-
чительно дополненное издание, кото-
рое было переведено на французский,
немецкий и японский языки.
В Санкт-Петербургской Военно-
медицинской академии А. А. Максимов
в 1902—1905 гг. провел анализ генети-
ческих взаимоотношений крови и со-
единительной ткани при воспалении;
сформулировал унитарную теорию
кроветворения, согласно которой лим-
фоцит является родоначальной ство-
ловой кроветворной клеткой, из ко-
торой могут дифференцироваться все
клеточные элементы крови. Его уче-
ник Н. Н. Аничков развил это направ-
ление, делая акцент на разработке мор-
фодинамики изучаемых процессов и
болезней; выдвинул «инфильтрацион-
ную теорию морфогенеза и атероскле-
роза» (1913— 1914), создал «комбина-
ционную теорию патогенеза атеро-
склероза» (1924), внес крупный вклад
в развитие представлений о ретикуло-
эндотелиальной системе (1930), поло-
жил начало систематической разработ-
ке проблемы внутриинфекционных
процессов (1937).
Воспитанник Санкт-Петербург-
ской Военно-медицинской академии
С. М. Лукьянов, возглавлявший кафед-
ру общей патологии в Варшаве, а за-
тем Институт экспериментальной ме-
дицины в Санкт-Петербурге, выпол-
нил фундаментальные работы, посвя-
щенные теоретическим основам об-
щей патологии, изучению изменений
строения клеток и их составных час-
тей при экспериментально вызванном
патологическом процессе. С. М. Лукь-
янов в отличие от Р.Вирхова исходил
из принципа, что за морфологической
структурой скрывается «структура фи-
зико-химическая». Акцентируя внима-
ние на физиологических и физико-
химических аспектах клеточной пато-
логии, он стремился к постижению
связи и взаимодействия «системы жиз-
ненных очагов» многоклеточного орга-
низма и к созданию молекулярной
патологии, основанной на знании за-
конов молекулярной механики и мик-
рохимического анализа. Важное на-
правление исследований он видел в
изучении влияния гуморальных фак-
торов, и прежде всего ферментов, на
функционирование клеток и обеспе-
чение их связей и взаимодействий.
В своих трудах он осуществил синтез
разных направлений патологии в еди-
ном общебиологическом направле-
нии, цель которого — изучение био-
логических законов происхождения и
сущности патологических процессов.
Выдающаяся роль в формировании
экспериментального направления
в патологии принадлежит биологу
И. И. Мечникову и созданной им на-
учной школе. Изучение физиологии
клетки последовательно привело его
к созданию сравнительной и эволю-
ционной патологии. Исследования
И. И. Мечникова показали, как с ус-
ложнением организации животных
форм в процессе эволюции фагоци-
тозно-пищеварительная функция ме-
15
няет свое назначение, переходит от
функции преимущественно внутри-
клеточного пищеварения к приспособ-
лению защитного характера. Таким
образом, исследования внутриклеточ-
ного пищеварения стали источником
построения учения о фагоцитозе и
фагоцитарной теории иммунитета,
а также представлений о естествен-
ном иммунитете как общебиологиче-
ском явлении, выходящем далеко за
границы инфекционной патологии.
Наряду с выдвинутой П. Эрлихом гу-
моральной «теорией боковых цепей»
учение И. И. Мечникова послужило
основой для формирования иммуно-
логического направления в медици-
не. Сформулированная им теория
воспаления послужила основой для
развития учения о реактивности орга-
низма.
В 1898—1908 гг. в лаборатории
И. И. Мечникова были проведены ис-
следования в целях получения токси-
ческих (иммунных) сывороток и ан-
тител к разнообразным чужеродным
клеткам и органным экстрактам. Боль-
шие дозы вызывали подавление функ-
ции соответствующих клеточных эле-
ментов, тогда как малые действовали
активизирующе. В 1900 г. В. К.Линде-
ман открыл нефролитическую сыво-
ротку, при помощи которой вызывал
у подопытных животных геморрагиче-
ский нефрит. Так была получена одна
из первых экспериментальных моделей
аутоиммунного заболевания. В своем
двухтомном «Учебнике общей патоло-
гии» (Киев, 1910—1911) В.К.Линде-
ман акцентировал внимание на том,
что основной задачей общей патоло-
гии является изучение законов, управ-
ляющих патологическими явлениями.
Он считал, что патология представ-
ляет крайние степени проявления при-
способляемости — основного свойства
организма, без которого немыслима
никакая эволюция.
Учение И. И. Мечникова о роли
макрофагов получило дальнейшее раз-
витие в исследованиях Л. А. Тарасеви-
ча о гемолизинах, в котором показа-
на прямая связь между гуморальными
факторами и клеточными элементами,
перекинут мост между физиологиче-
скими функциями организма и им-
мунитетом. Ученик Л. А. Тарасевича
А. А. Богомолец показал, что соедини-
тельная ткань принимает участие в об-
менных процессах и защитных реакциях
организма. Его учение о соединитель-
ной ткани явилось предпосылкой для
последующего учения о коллагенозах
и попытке различать типы конститу-
ции людей. Исследования А. А. Бого-
мольца способствовали выяснению
роли активной соединительной ткани
и эндокринно-вегетативной регуляции
в определении реактивности организ-
ма. А. А. Богомолец сформулировал по-
ложения о механизме действия пере-
ливания крови, цитотоксической сти-
муляции функций соединительной тка-
ни, роли печени в регуляции обмена
веществ. В 1925 г. он создал антиретику-
лярную цитотоксическую сыворотку
(АЦС), которая в малых дозах стиму-
лировала функцию ретикулоэндотели-
альной системы, усиливая продукцию
защитных веществ. В годы Великой Оте-
чественной войны АЦС широко при-
меняли для заживления ран и трофи-
ческих язв. А. А. Богомолец выдвинул
концепцию, объясняющую процесс
старения организма изменением физи-
ко-химических свойств тканей и меж-
клеточного вещества, ослаблением
трофической функции соединитель-
ной ткани. Он создал научную школу
патофизиологов, представителями ко-
торой являются Н. Н. Сиротинин (Са-
ратов, Казань, Киев), Н.А. Федоров
(Москва), Н.Н. Зайко (Киев) и дру-
гие ученые.
Основные труды Н. Н. Сиротинина
посвящены вопросам сравнительной
16
патологии реактивности и резистент-
ности организма к действию экстре-
мальных факторов — гипоксии, ана-
филаксии, аллергии. Применив мето-
ды сравнительной патологии, он до-
казал, что филогенетически наиболее
древняя форма развития инфекции —
простое размножение микробов в
организме при сравнительно слабых
реакциях как клеточного, так и гумо-
рального типа. Филогенетически наи-
более новой формой инфекционного
процесса является совершенствование
лимфогистиоцитарного аппарата в
направлении выработки антител и
спецификации фагоцитарного процес-
са. Еще более новым в историческом
развитии инфекционного процесса в
животном мире является включение в
картину инфекционного процесса ал-
лергических реакций.
Выполненные Н. Н. Сиротининым
работы по изучению патогенеза гор-
ной болезни показали, что ведущими
изменениями при этом являются ги-
поксия, газовый алкалоз и утомление
организма. Изучая в эволюционном
плане различные виды кислородного
голодания и процессы адаптации к
гипоксии в условиях высокогорья,
Н.Н. Сиротинин разработал принцип
ступенчатой акклиматизации в горах
и показал, что адаптацию к высоко-
горному климату можно использовать
для лечения болезней, сопровожда-
ющихся гипоксией, а также для суще-
ственного повышения устойчивости
организма к экстремальным воздей-
ствиям в высотных и космических по-
летах. Под его руководством в 1958 г.
были развернуты исследования по изу-
чению влияния гипокинезии на орга-
низм здорового человека, имеющие
большое значение для авиационной и
космической физиологии и медицины.
Важную роль в интеграции важней-
ших направлений формирования тео-
ретических основ медицины сыграл
ученик Н. Н. Сиротинина профессор и
заведующий кафедрой патологической
физиологии Казанского университета
и 2-го Московского медицинского
института А. Д. Адо. Своими трудами он
внес существенный вклад в разработ-
ку проблем воспаления, реактивно-
сти, аллергии и патогенеза инфекци-
онных болезней. Обшебиологический
подход к решению этих проблем,
идеи эволюции и диалектическую ме-
тодологию, сочетаемую с тщательно
проведенными экспериментальными
исследованиями, он использовал в
борьбе со спекулятивными, односто-
ронними позициями многочисленных
претендентов на создание так называ-
емой единой теории медицины.
Считая общую патологию «фило-
софией медицины» и широко ис-
пользуя принципы диалектического
материализма, А.Д.Адо вместе с тем
критически относился к попыткам
рассматривать различные теории ме-
дицины или принципиальные обобще-
ния по тому или иному ее разделу как
философскую категорию, закон или
даже систему.
Основным недостатком таких обоб-
щений является, по мнению АД.Адо,
упрошенное распространение отдель-
ных фактов и наблюдений на всю па-
тологию, медицину, возведение в ранг
«теории медицины» частных законо-
мерностей, освещающих механизм
развития отдельных нозологических
форм заболеваний.
Основные труды А.Д.Адо посвяще-
ны патофизиологии аллергии, воспа-
ления, иммунитета, участию нервной
системы в механизме аллергических
реакций. Он изучил механизм действия
микробных агентов, токсинов и виру-
сов на нервную систему, установил
особенности их действия и показал,
что они являются макромолекулярны-
ми раздражителями нервных клеток
и волокон. А-Д.Адо — автор четырех
изданий учебника по патофизиологии
(1953, 1973, 1980, 1994).
Большой вклад в развитие экспе-
риментального направления в пато-
логии внесли исследования руково-
дителя отдела общей патологии Ин-
ститута экспериментальной медици-
ны в Санкт-Петербурге Е. С.Лондона.
В 1904 г. он разработал новый ориги-
нальный метод авторадиографии, по-
зволивший учитывать, какие ткани в
большей степени поглощают эмана-
цию радия. Он установил, что под вли-
янием лучей радия наиболее ранние и
выраженные патогистологические из-
менения происходят в кроветворных,
половых и лимфоидных органах.
Е. С. Лондон совместно с Н. П. Коч-
невой разработали метод вазостомии
(ангиостомии) — наложения посто-
янных фистул на крупные венозные
сосуды, позволяющий изучать обмен
веществ отдельных органов на осно-
вании сравнительного анализа прите-
кающей к ним и оттекающей от них
крови в естественных условиях и при
различных патологических состояни-
ях без нарушения взаимоотношений
органов и нервно-гуморальной регу-
ляции.
Большим толчком в развитии обшей
патологии и создании теоретического
фундамента клинической медицины
послужила Московская школа патоло-
гов-патофизиологов, основанная про-
фессором А. Б.Фохгом. В 1890 г. он орга-
низовал Институт общей и экспери-
ментальной патологии при Импера-
торском Московском университете,
в 1912 г. — подобный институт Мос-
ковских высших женских курсов при
2-й Градской больнице (ныне кафедра
патофизиологии Российского государ-
ственного медицинского университета).
А. Б. Фохт был одновременно кли-
ницистом и патологом-эксперимента-
тором, что позволило ему эффектив-
но развивать клинико-эксперимен-
тальное направление в патологии. Его
основные труды посвящены изучению
приспособительных, компенсаторных
реакций организма на влияние болез-
нетворных факторов, изучению роли
нервных и гуморальных механизмов
регуляции функций при патологии
сердечно-сосудистой, эндокринной,
лимфоотделительной и мочевыдели-
тельной систем. А. Б. Фохт разработал
(1899—1903) оригинальные методики
получения экспериментальных моде-
лей заболеваний сердца (эксперимен-
тальные пороки клапанов сердца, эм-
болия коронарных сосудов, гидропе-
рикардиты, тампонада сердца и др.),
которые и послужили основой для
формирования в России эксперимен-
тальной кардиологии и позволили
совершить выдающиеся открытия.
А. Б. Фохт первым оценил роль ин-
тероцептивных импульсов в проис-
хождении общих патологических на-
рушений кровообращения. В 1902 г.
А. Б. Фохт и В. К.Линдеман показали
компенсаторное значение усиления
работы правого желудочка и расши-
рения легочных сосудов при эмболии
легочной артерии в поддержании нор-
мального кровообращения. Авторы
правильно оценили важную роль аф-
ферентных нервов легочных сосудов в
динамике изучаемого патологическо-
го процесса. Они высказали предпо-
ложение, что расстройство гемодина-
мики большого круга кровообращения
при эмболии мелких ветвей легочной
артерии «зависит от рефлекса на центр
блуждающего нерва с его чувствитель-
ных окончаний в легочной ткани». Это
выдающееся открытие получило даль-
нейшее развитие в наше время в тру-
дах В. В. Парина и В. Н. Черниговско-
го, подтвердивших наличие рефлектор-
ных влияний с сосудов малого круга
кровообращения на сосудистую систе-
му большого круга. Труды А. Б. Фохта
«Исследования о воспалении около-
18
-tffHf< ffffГ f Ш f И H f f I
сердечной сумки» (1899), «О функцио-
нальных и анатомических нарушени-
ях сердца при закрытии венечной ар-
терии» (1901), «О нарушениях крово-
обращения и деятельности сердца при
эмболии легочной артерии» (совмест-
но с В. К.Линдеманом, 1903), «Пато-
логия сердиа» (1910) явились осново-
полагающими для отечественной экс-
периментальной патологии.
А. Б. Фохт создал научную школу,
наиболее видными представителями
которой были такие ученые, как
А. И.Тальяннев, В. К. Линдеман,
Д.Д. Плетнев, Ф. А.Андреев, Ф.Ф. Ве-
нулет, Г. П. Сахаров.
Характерной особенностью науч-
ной школы А. Б.Фохта было клини-
ко-экспериментальное направление,
ориентирующее на комплексное изу-
чение болезни с помощью морфоло-
гических, экспериментально-физиоло-
гических и клинических методов иссле-
дования. Представители этого направ-
ления являлись не только лаборатор-
ными учеными, но и авторитетными
врачами - практикам и.
Многие представители научной
школы А. Б. Фохта стали крупными
учеными и возглавили кафедры и ла-
боратории в Москве, Ленинграде,
Киеве, Варшаве, Лондоне и других го-
родах. А. И.Тальянцев стал преемни-
ком А. Б. Фохта на кафедре обшей па-
тологии Московского университета.
Написанное им руководство по об-
щей патологии выдержало пять из-
даний. Начиная с 1903 г. постоянную
творческую связь с Институтом обшей
патологии поддерживал Д.Д. Плетнев,
который занимался под руководством
А. Б.Фохта экспериментальной разра-
боткой патологии сердца. В 1906 г. при
кафедре начал работать в должности
сверхштатного лаборанта Ф. А. Андре-
ев, ставший впоследствии одним из ве-
дущих специалистов в области сердеч-
но-сосудистой патологии. В 1913 г. он
предложил оригинальный способ
оживления животных, а в дальнейшем
одним из первых разработал положе-
ние о роли корково-подкорковых со-
отношений головного мозга в патоге-
незе гипертензии и других соматиче-
ских заболеваний. Ф. А. Андреев и дру-
гие сторонники клинико-эксперимен-
тального направления патологии
включили в круг представлений о бо-
лезнях человека факторы социальной
среды и качественные особенности че-
ловека как социального существа.
Г.П.Сахаров — ученик А.Б.Фох-
та — исследовал в лаборатории П. Эр-
лиха феномен сывороточной анафи-
лаксии (1905). В 1910— 1914 гг. он был
профессором кафедры общей патоло-
гии в Варшаве, с 1914 по 1949 гг. —
в Москве. Он удачно сочетал философ-
ское, экспериментально-физиологи-
ческое, общебиологическое и клини-
ко-экспериментальное направления
исследований, что позволило ему сде-
лать ряд открытий и подняться до тео-
ретических обобщений по проблемам
реактивности, иммунологии, бакте-
риологии и наследственности. Г. П. Са-
харов и его сотрудники (С.М. Павлен-
ко и др.) способствовали развитию
учения о цитотоксинах и эксперимен-
тальной эндокринологии. В его книге
«Методология патологии», вышедшей
в двух изданиях в 1933 и 1935 гг., об-
щая патология охарактеризована как
наиболее интегративная медицинская
дисциплина, подходящая к изучению
болезни со стороны ее сущности.
В Томском университете А.Д.Тимо-
феевский совместно со своим учите-
лем П. Г!. Авроровым впервые в Рос-
сии начал заниматься выращиванием
и изучением клеток и тканей вне орга-
низма. Используя метод культуры тка-
ней, они впервые (1912) вырастили
клетки крови и костного мозга боль-
ных лейкемией, а в 1914 г. экспланти-
ровали несколько сарком человека.
19
В 1925— 1927 гг. А. Д.Тимофеевский и
С. В. Беневоленская доказали генети-
ческое родство между лимфоидным и
миелоидным кроветворением и экс-
периментально подтвердили унитар-
ную теорию кроветворения А. А. Мак-
симова.
Успешно продолжил развитие си-
бирской гематологической школы уче-
ник А.Д.Тимофеевского Д. И. Гольд-
берг. В годы Великой Отечественной
войны (1944) Д. И. Гольдберг с сотруд-
никами провели широкое изучение
действия эмбриональных экстрактов
на заживление ран, успешно приме-
ненное на практике, осуществили при-
оритетные исследования патогенеза,
терапии и профилактики агастриче-
ских В|2-дефицитных анемий.
Основываясь на идеях нервизма, воз-
никшего в середине XVIII в. и получив-
шего развитие в трудах А.Галлера,
У. Куллена, Е. О. Мухина, И. Е. Дядь-
ковского, К. В. Лебедева и других,
школа И. П. Павлова способствовала
созданию патофизиологии высшей не-
рвной деятельности и кортико-висце-
ральной патологии.
С попыткой установления общих
закономерностей, характерных для
разнообразных болезней, с позиций
нервизма выступил в начале 1930-х гг.
ученик И. П. Павлова А. Д. Сперанский.
На основе серии исследований, нача-
тых в 1927 г., он доказал, что в пато-
генезе патологических, в том числе и
инфекционно-токсических процессов,
принимают участие рефлекторные ме-
ханизмы, которые носят неспецифи-
ческий характер и вызывают стерео-
типные поражения соответствующих
органов. Эти одинаковые изменения
А.Д. Сперанский назвал стандартны-
ми формами нервных дистрофий.
А. Д. Сперанский акцентировал вни-
мание на изучении не раздражителей,
а раздражений с учетом того, что ре-
акции организма — результат его био-
логической целостности, возникшей
в процессе эволюции в связи с разви-
тием коррелятивных систем, и особен- Я$л
но нервной. Он считал, что специфика
заболевания связана со своеобразным ЯЧ1
качеством раздражения патогенным Яр*
агентом соответствующих нервных ЯЬ^
। [риборов. Ост ювываясь на эксперимен- Я1>
тальном и клиническом материале, он
пришел к выводу, что для понимания Ян
механизмов патологических процессов <Я$
следует учитывать и оценивать: место ЯР
первичного раздражения (рецепцию); ЯЙ
интенсивность раздражения и его ка- ЯВ
чество; время раздражения, интервал,
ритм; исходный фон и следовую ре- W
акцию. ЯЁ
Представитель научной школы .чж'
А. Д. Сперанского Г. Н. Крыжановский Я£
разработал теорию генераторных, де-
терминантных и системных механиз- 'ЯР
мов нервных расстройств. Итоги ис- Уг
следований Г. Н. Крыжановский обоб-
щпл в книге «Детерминантные струк-
туры в патологи нервной системы»
(1980). Автор доказал, что основным
механизмом патологической системы Я
является патологическая детерминан-
та — структура ЦНС, гиперактиви-
руемая локализованным в ней гене- *
ратором патологически усиленного Ж
возбуждения, который представляет *
собой агрегат гиперактивных нейро- *--
нов. Г. Н. Крыжановский показал, что *•
дезинтеграция системных отношений
и растормаживание функциональных
структур являются универсальными
биологическими закономерностями.
Повреждение системы, означающее ту
или иную ступень ее дезинтеграции,
неизбежно влечет за собой нарушение
внутрисистемного контроля, растор-
маживание отдельных частей системы
и известную автономизацию. Особое
значение в этих процессах имеет по-
вреждение ведущего звена, которое
организует систему и детерминирует
ее поведение.
20
На современном этапе развития
медицинской науки проблема болез-
ни решается как проблема разносто-
роннего нарушения регуляции функ-
ций, захватывающего различные уров-
ни нервной, эндокринной и других
физиологических систем вплоть до
молекулярных соотношений.
Таким образом, эксперимент, вне-
сенный в общую патологию, создал
возможность раскрытия физиологи-
ческого механизма наиболее общих
патологических процессов, своего рода
философского объяснения внутренних
связей между ними и поставил все
изучение болезни на строго научную
почву. Благодаря этому общая патоло-
гия в нашей стране стала наукой экс-
периментальной, изучающей «физио-
логию патологических процессов», т.е.
по существу патологической физиоло-
гией. Именно это обстоятельство по-
будило В. В. Пашутина и В. В. Подвы-
соцкого ввести в употребление термин
«патологическая физиология» в каче-
стве дополнения к термину «обшая
патология».
Ученик В. В. Подвысоцкого А. А. Бо-
гомолец пошел дальше своего учите-
ля и стал наиболее ревностным по-
борником переименования общей па-
тологии в патологическую физиологию.
Учебники, изданные им во время за-
ведования кафедрой общей патологии
Саратовского университета, называ-
лись «Краткий курс патологической
физиологии/Ч. 1. Общая патология»
(1921) и «Патологическая физиоло-
гия» (1924).
На заседании методической комис-
сии Главпрофобра в июне 1924 г., об-
суждавшем обращение А. И. Абрикосо-
ва и Н. Н. Аничкова о слиянии кафедр
патологической анатомии и общей па-
тологии в связи с реформой высшего
медицинского образования, А. А. Бо-
гомолец высказался против слияния,
и предложил переименовать общую
патологию в патологическую физио-
логию. Это предложение было приня-
то и оформлено приказом Народного
комиссариата просвещения. Сторонни-
ком переименования кафедры был
С. С. Халатов, который определял па-
тологическую физиологию как науку,
изучающую общие проявления болез-
ненных процессов вообще и их осо-
бенности, связанные с заболеванием
тех или иных органов или физиологи-
ческих систем. С этого момента в
СССР, а затем в России кафедры об-
щей патологии стали называть кафед-
рами патологической физиологии.
Большой вклад в развитие пато-
физиологии внес ученик выдающего-
ся отечественного патофизиолога
А.А. Богомольца — академик Акаде-
мии медицинских наук (АМН) СССР
Н. А. Федоров. Работы Н. А. Федорова,
его сотрудников и учеников (М. Л. Гар-
функеля, М.Г. Катехелидзе, В.Б.Ко-
зинера, А. М.Немятышевой, Н. А. Гор-
буновой, В. С.Ярочкина, И. К. Коря-
киной, Б. Е. Мовшева и др.) посвяще-
ны проблемам патогенеза экстремаль-
ных состояний (кровопотеря, шок,
ожоговая болезнь). Они впервые пред-
ложили теорию регуляции кроветво-
рения, основанную на взаимодействии
стимулирующих и угнетающих эрит-
ропоэз факторов. Много внимания
было уделено механизмам восстанов-
ления гомеостаза после кровопотери
и ожога, впервые описан в экспери-
менте синдром диссеминированного
внутрисосудистого свертывания кро-
ви при острой массивной кровопоте-
ре и создана трансфузиологическая
модель ДВС-синдрома. Н. А. Федоров
стоял у истоков совместных советско-
американских исследований по про-
блеме трансфузионной терапии в сер-
дечно-сосудистой хирургии.
Н.А. Федоров одновременно с ру-
ководством лабораторией патофизио-
логии в Институте гематологии и пе-
21
реливания крови в течение многих лет
заведовал кафедрой патологической
физиологии в Московском медицин-
ском стоматологическом институте
(ММСИ) им. Н. А. Семашко. Под ру-
ководством Н. А. Федорова было созда-
но новое и прогрессивное научное на-
правление: изучение роли нарушения
фосфорно-кальциевого и белкового
обмена в минерализованных тканях в
патогенезе основных стоматологиче-
ских заболеваний. Объектом исследо-
вания были минерализованные ткани,
в первую очередь, зубы, челюсти, а
также другие кости. Такой методоло-
гический подход, заключающийся в
комплексной оценке состояния мета-
болизма в тканях опорно-двигатель-
ного аппарата скелета и зубочелюст-
ной системы, был принципиально
важным для развития стоматологии.
В те годы в стоматологии преобладал
«локальный» подход к пониманию
причин и механизмов развития кари-
еса, пародонтита, пародонтоза, забо-
леваний слизистой оболочки полос-
ти рта и других патологических про-
цессов без обоснованного понимания
тесной взаимосвязи между стомато-
логическими заболеваниями и состо-
янием органов и систем всего орга-
низма.
К наиболее важным в теоретиче-
ском плане исследованиям, выпол-
ненным на кафедре патофизиологии
ММСИ, были работы, посвященные
механизму развития эксперименталь-
ного алиментарного кариеса, роли
микробного фактора, состояния внут-
ренних органов и систем (А. А. Про-
хончуков, Н.А.Жижина, М.С.Голин-
ская, А. Г. Колесник и др.). Важное ме-
сто в научной работе коллектива зани-
мала тематика, посвященная проница-
емости твердых тканей зуба (Е. В. Бо-
ровский, Е. И. Померанцева). Эти
исследования нашли продолжение в
разработке средств, повышающих ре-
зистентность твердых тканей зубов к
кариесу. Проведен анализ роли эндо-
кринных желез (надпочечников, ви-
лочковой железы, околощитовидных
желез, половых желез, гипофиза),
инкреторной функции слюнных же-
лез в регуляции и дизрегуляции об-
менных процессов в минерализован-
ных тканях (М.С.Бубякина, 3. В. За-
харова, А. И. Воложин, В. И. Аверчен-
ко, В. П. Матвиенко, Р. А.Дружинина,
О. И. Ефанов и др.). Под руководством
Н. А. Федорова были созданы програм-
мы и методические пособия для изу-
чения предмета на стоматологическом
факультете, подготовлены педагоги и
научные работники, обладающие глу-
бокими знаниями в области теорети-
ческой и экспериментальной стомато-
логии, а также патологической физио-
логии. Развитие тематики, которая
была начата на кафедре под руковод-
ством Н. А. Федорова, оказало мощ-
ное позитивное влияние на развитие
всех разделов стоматологии.
Таким образом, за более чем 245-
летний период патофизиология про-
шла сложный путь становления как са-
мостоятельная фундаментальная меди-
цинская наука и учебная дисциплина.
Менялись названия (общая патоло-
гия, патология, экспериментальная
патология, клиническая физиология)
и место патофизиологии в системе
подготовки будущих врачей. Однако
потребность в патофизиологии всегда
сохранялась и в наши дни сохраняет-
ся в интегрирующей и аналитической
научной специальности, изучающей
общие закономерности возникнове-
ния. развития и завершения патоло-
гических процессов и болезней, фор-
мулирующей принципы их диагно-
стики, профилактики и лечения.
ЧАСТЬ I
ОБЩЕЕ УЧЕНИЕ О БОЛЕЗНИ
ГЛАВА 1
ЭТИОЛОГИЯ И ПАТОГЕНЕЗ
1.1. Нозология
Основные понятия и определения.
Эмпирические научные обобщения,
раскрывая содержание исследуемого
предмета, не могут дать понимания
сущности явлений, составляющих
фундаментальную основу предмета,
которая определяет его возникнове-
ние, существование и развитие. Сущ-
ность явлений может быть понята лишь
на теоретическом уровне, использу-
ющем накопленный наукой эмпири-
ческий материал. Таким теоретическим
уровнем медицины является нозоло-
гия (от греч. nosos — болезнь) — тео-
рия болезни как состояния человека.
Принципиальное различие между
нозологией и патологией заключает-
ся в том, что патология изучает из-
менения в человеческом организме в
результате патологического процесса
как биологическом объекте, т.е. из-
менения в строении и жизнедеятель-
ности организма. Но человек в отли-
чие от животных является существом
социальным, т.е. выполняет соци-
альные функции, на которые пато-
логия оказывает влияние, но непо-
средственно не определяет возмож-
ность этих функций.
Нозология изучает болезнь как со-
стояние человека, при котором пато-
логический процесс нарушает выпол-
нение им социальных функций. Поэто-
му нозология совместно с медико-био-
логическими аспектами состояния
организма человека рассматривает ряд
социально обусловленных проблем,
влияющих на здоровье человека.
Следовательно, имея единый объект
изучения — организм человека, пато-
логия и нозология различаются пред-
метом изучения. Предмет изучения па-
тологии — изменения биологических
функций организма в результате па-
тологического процесса, нарушивше-
го его структуру. Предмет нозологии —
человек в его целостности, соци-
альные функции которого нарушены
патологией организма.
Проблемы нозологии решаются на
теоретическом уровне с использова-
нием материалов медико-биологиче-
ских, медико-социальных (медицин-
ская социология, экология, статисти-
ка) и других наук о человеке (биология
человека, антропология, экология че-
ловека). Таким образом, нозология
связывает медико-биологические на-
уки с комплексом наук о человеке.
Нозология рассматривает патоло-
гию как составную часть состояния
болезни человека. Патология как био-
логическое явление, которое заклю-
чается в нарушении строения и жиз-
недеятельности организма, свойствен-
на всему живому, включая растения.
23
Различие между патологией животных
и человека заключается в том, что
организм животного выполняет пре-
имущественно одну функцию — обес-
печение его жизнедеятельности. Для
здорового человека жизнедеятельность
является биологической основой вы-
полнения им главной функции — со-
циальной, определяющей его сущ-
ность.
Животное в составе сообщества
(популяции) самостоятельно осуще-
ствляет свою жизнедеятельность, ис-
пользуя природные факторы. Челове-
ческое общество в этом смысле отли-
чается тем, что существует за счет де-
ятельности каждого его члена, по-
скольку использование природных
ресурсов осуществляется с помощью
производительного труда. При этом
каждый человек создает определенную
часть общего продукта, необходимого
для его существования.
В результате распределения видов
деятельности, в том числе материаль-
ной и духовной, каждый человек вы-
полняет определенную социальную
роль. Это и является его социальной
функцией, т.е. деятельность на пользу
всего общества. В свою очередь обще-
ство обеспечивает каждого члена ус-
ловиями, необходимыми для его дея-
тельности, в том числе и для сохране-
ния здоровья.
Сущность основной категории но-
зологии — болезни человека — может
быть определена путем сопоставления
двух основных категорий, качествен-
но отличающихся друг от друга: «здо-
ровье» и «болезнь».
Определение «здоровье» зафикси-
ровано в преамбуле Устава Всемирной
организации здравоохранения (ВОЗ):
«Здоровье — это состояние полно-
го физического, душевного и социаль-
ного благополучия организма, допу-
скающее наиболее полноценное его
участие в различных видах обществен-
ной трудовой деятельности, а не толь-
ко отсутствие физических дефектов».
Таким образом, можно сказать, что
болезнь всегда включает в себя пато-
логию как физическое неблагополу-
чие, но, как мы увидим в дальней-
шем, не всякая патология развивает-
ся в болезнь. Болезнь как результат
развития патологии приводит к невоз-
можности для человека выполнять со-
циальную функцию, что и подтверж-
дается врачом, освобождающим его от
трудовой деятельности.
С нашей точки зрения наиболее пра-
вильным является определение болез-
ни, данное И. Р. Петровым и А.Д.Адо:
«Болезнь — это нарушение нор-
мальной жизнедеятельности организ-
ма, возникающее под влиянием вред-
ных для него факторов внешней сре-
ды и характеризующееся ограничени-
ем приспособляемости и снижением
трудоспособности человека при одно-
временной активации защитно-ком-
пенсаторных механизмов.»
Нозология как общее теоретическое
учение о болезни не рассматривает
конкретные патологические процес-
сы, их формы и течение. Предметом
ее изучения служат: сущность болез-
ни как особое состояние человека,
причины и условия ее возникновения,
стадии развития болезни, классифи-
кация болезни и ее элементов.
Поэтому нозология включает сле-
дующие разделы: общая нозология,
общая этиология, общий патогенез,
терминологическая система нозологи-
ческих единиц.
Общая нозология изучает специфи-
ческое состояние человека — болезнь,
с целью выявления ее сущности, роли
в жизнедеятельности человека и за-
кономерностей проявления. Общая
нозология не рассматривает конкрет-
ные патологические процессы. Ее за-
дача заключается в том, чтобы выяс-
нить следующие вопросы: что такое
24
болезнь как состояние человека и чем
она отличается от здоровья и патоло-
гии? Какова роль болезни в жизни от-
дельного человека, человечества в це-
лом, ее биологический и социальный
смысл? Какие закономерности опре-
деляют возникновение, развитие и
исход болезни?
Чем отличаются понятия «болезнь»
и «патология»? Термин «патология»
обозначает развивающееся нарушение
функций организма при повреждении
его структур патогенным фактором
любого происхождения как реакцию
организма на взаимодействие с этим
фактором. В наиболее общем виде та-
кими факторами могут быть:
травма — нарушение целостности
тканей и органов при воздействии на
них внешних, обычно механических и
физико-химических факторов;
внутренние (эндогенные) факто-
ры, связанные с нарушением струк-
тур и функций элементов организма
при отсутствии прямого воздействия
внешних факторов;
инфекционные агенты.
Патология, генерализуясь может
привести к дисфункции организма —
болезни. Таким образом, под терми-
ном «болезнь» следует понимать со-
стояние человека, при котором он
в результате патологического процес-
са, изменившего физиологические
функции организма, не способен вы-
полнять свои социальные функции и
нуждается в специальных мерах для
их восстановления, т.е. выздоровле-
ния.
Нарушение функций отдельных
биологических структур организма во
многих случаях не препятствует соци-
альной деятельности человека. Это за-
висит от вида его деятельности и ме-
дицинских мероприятий, которые
компенсируют возникшие в результа-
те патологии дефекты. Примером та-
кой компенсации является протезиро-
вание при отсутствии зубов, исполь-
зование эндопротезов для опорно-дви-
гательного аппарата, сердца, сосудов,
введение иммуноглобулинов при им-
мунодефицитном состоянии, приме-
нение слухового аппарата, колясок для
передвижения и т.п. Такая компенса-
ция нарушенных функций у человека
может быть охарактеризована как со-
циальная. Она позволяет при наличии
некоторых форм патологии, несмотря
на наличие дефектов структур организ-
ма, в большей или меньшей степени
восстановить социальную деятельность
человека.
Чем более развито общество, тем
на более раннем, глубинном уровне
возникновения патологического про-
цесса осуществляются компенсацион-
ные социальные и медицинские ме-
роприятия, которые ограничивают
действие биологических механизмов
приспособления, снижающих выра-
женность патологического процесса и
превращение его в болезнь.
Социальная компенсация, в том
числе медицинская помощь, включа-
ет два взаимосвязанных и взаимообу-
словленных этапа:
1) обеспечение или сохранение
жизнедеятельности организма, его
биологического функционирования;
2) социальную реабилитацию, т.е.
восстановление трудовых функций че-
ловека.
В отечественной медицинской на-
учной литературе обсуждались две ос-
новные концепции биологической
сущности патологии, которая отожде-
ствлялась с болезнью, поскольку в
современной медицинской термино-
логии понятия «патология» и «бо-
лезнь», как правило, не различают-
ся, что создает некоторые сложности
при теоретическом обсуждении ряда
вопросов.
Согласно концепции, выдвинутой
академиком И. В.Давыдовским, бо-
лезнь — это «приспособительный про-
цесс, при котором организм перестра-
ивает свои биологические структуры
и функции для противодействия па-
тогенному-' фактору в физиологических
пределах». Таким образом, он отрица-
ет различия между здоровьем и болез-
нью, поскольку в обоих случаях на-
блюдаются схожие физиологические
реакции и механизмы их осуществ-
ления. Отсюда следует, что понятия
нормы (физиологии) и патологии яв-
ляются субъективными, т. е. принци-
пиальное различие между ними в дей-
ствительности отсутствует, а существу-
ет только теоретически.
Концепция И.В.Давыдовского
определяет болезнь как разновид-
ность физиологических компенсатор-
но-приспособительных процессов в
организме.
Противники этой концепции утвер-
ждают, что процесс, в результате ко-
торого человек испытывает страда-
ние и даже может умереть, не может
считаться приспособительным. Еще
Аристотель считал болезнь и здоро-
вье качественно различными катего-
риями.
Согласно концепции, сторонником
которой является академик РАМН
А. И. Струков, сущностью болезни яв-
ляется реактивность организма, т.е. его
способность отвечать патологической
реакцией на некоторые внешние воз-
действия («реактивная» концепция).
При взаимодействии с патогенным
фактором нарушается структура орга-
низма, и он реагирует на это патоло-
гией. Если организм реагирует, напри-
мер, на изменение температуры в не-
больших пределах, физиологически,
т.е. кровеносные сосуды расширяются
или сужаются, увеличивается или
уменьшается потоотделение, то реак-
ция носит приспособительный харак-
тер и болезнь не развивается. В то же
время при воздействии на кожный по-
кров очень высокой или низкой тем-
пературы ткань разрушается и орга-
низм реагирует на это воспалением,
т.е. патологически, в результате раз-
вивается болезнь. Таким образом, бо-
лезнь является эволюционно закреп-
ленной реакцией организма на по-
вреждение. Однако причины болезни
неизвестны.
Как мы в дальнейшем увидим, на
современном этапе развития науки
противопоставлять приспособитель-
ную и реактивную концепцию сущно-
сти болезни нельзя, хотя они и опи-
раются на наблюдаемые факты. В про-
цессе эволюции человека, в основе
которой лежит естественный отбор,
сформировались разнообразные при-
способительно-компенсаторные меха-
низмы организма, которые позволя-
ют выполнять человеку биологические
и социальные функции в постоянно
изменяющихся условиях внешней сре-
ды. К таким механизмам относятся по-
веденческие реакции, изменение со-
судистого тонуса при температурных,
химических и эмоциональных воздей-
ствиях, изменения секреции гормонов
и синтеза многочисленных медиато-
ров, скорости метаболических процес-
сов и др. Но эти приспособительные
реакции не могли возникнуть самопро-
извольно и наследственно закрепить-
ся. Они развились в процессе есте-
ственного отбора, т. е. в ответ на воз-
действие повреждающего фактора воз-
никла патология и выжили (и дали по-
томство) те организмы, которые
обладали приспособительными меха-
низмами. Такие механизмы формиро-
вались постепенно и закреплялись в
процессе эволюции, что обусловле-
но действием основного закона био-
логии — изменчивостью.
Приспособительные механизмы до-
стигли очень высокого уровня разви-
тия у людей, которые живут в различ-
ных климатических условиях и испы-
26
ж
V
<
*
в
1-
ж
&
>
й-
*
:fr
•t
I"
Ф-
Ф.
II.
Ф
Г
тывают действие многочисленных при-
родных факторов. В результате есте-
ственного отбора возникли популяции
людей, приспособленных к конкрет-
ным природным условиям. Так сфор-
мировались разные расы, отличающи-
еся конституцией, особенностями об-
мена веществ, поведенческими реак-
циями. В формировании этих популя-
ций также сыграла роль патология,
которая могла развиться в болезнь,
если отсутствовали соответствующие
приспособительные механизмы.
Таким образом, приспособительная
концепция рассматривает роль патоло-
гии в филогенезе человеческой попу-
ляции. Следовательно, если принять
только приспособительную концеп-
цию, то болезнь может быть охарак-
теризована как результат прогрессив-
ной эволюции человека, что совпа-
дает также с мнением таких филосо-
фов, как В. П. Павленко и А. Д. Степа-
нов. Одним из первых И. И. Мечников
(1901) сформулировал значение эво-
люционного процесса в оценке сущ-
ности болезни. Эта идея была в даль-
нейшем развита Н. Н.Сиротининым
(1957) и другими учеными. Если при-
способительная концепция болезни
основана на эволюционном подходе,
то, следовательно, она рассматривает
эту проблему на уровне популяции,
а не отдельного организма.
Концепция же реактивности орга-
низма рассматривает отдельный орга-
низм в онтогенезе, когда действие сло-
жившихся в процессе приспособления
механизмов (эволюционно обуслов-
ленных в популяции) проявляется как
патология и показывает, насколько
приспособлен к условиям существо-
вания этот конкретный организм. Сле-
довательно, эти концепции (приспо-
собительная и реактивная) дополня-
ют друг друга. Они в конечном счете
отражают различие сторон одного и
того же прогрессивного процесса раз-
вития жизни как результата взаимо-
действия отдельного организма и сре-
ды, включающей объекты живой и
неживой природы, а также общество
как необходимое условие человече-
ского существования.
Норма и патология в онтогенезе.
Развитие организма человека в основ-
ном определяется свойством генома:
суммой наследственно обусловленных
признаков, присущих только данно-
му организму, закрепленных в его ге-
нетическом коде. Геном включает: при-
знаки обусловливающие видовую при-
надлежность организма, а также ана-
томические и физиологические струк-
туры, общие для всего вида «Ното
sapiens»; признаки конкретной попу-
ляции; признаки, отличающие детей
от родителей; индивидуальные при-
знаки. Из бесконечного многообразия
признаков, закрепленных в генотипе
вида, геном содержит признаки, обес-
печивающие нормальное развитие
организма в условиях, к которым при-
способлен вид.
В качестве нормы принимают опре-
деленные параметры анатомических и
физиологических структур и функций
организма, например, рост, массу
тела, частоту сердечных сокращений,
частоту дыхания, содержание гемо-
глобина в крови и т.д. Если признаки
количественно не выходят за рамки
нормы, то считают, что организм здо-
ров. Обратите внимание: организм,
а не человек. Мы в данном случае го-
ворим о биологической норме, т. е. о здо-
ровье организма, а не человека. Сле-
довательно, под нормой следует
понимать такую форму жизнедеятель-
ности, которая обеспечивает организ-
му адекватные физиологические реак-
ции при взаимодействии с окружа-
ющей средой.
Отличить норму от патологии слож-
но. так как норма не имеет абсолют-
ного выражения. Каждый человеческий
27
организм индивидуален, что обуслов-
лено свойством генома. Следователь-
но, если все разнообразие признаков
у отдельных людей уложить в четкие
количественные рамки, то окажется,
что признак, выходящий за эти рам-
ки, автоматически может быть при-
нят за «ненормальный», патологиче-
ский. Такой подход давно признан не-
правильным, так как он не опирается
на биологический закон об изменчи-
вости.
Выход был найден медициной в
формировании среднестатистических
норм, которыми и пользуются врачи.
На основании многовековых наблю-
дений за состоянием миллионов орга-
низмов были эмпирически установ-
лены границы признаков, в пределах
которых организм нормально функ-
ционирует, т.е. адекватно реагирует на
внешние воздействия и находится в
относительном равновесии со сре-
дой. В среднестатистические нормы
входят показатели видовых признаков
общих для всех людей и частично для
определенных популяций.
Среднестатистическая норма учи-
тывает расовые, возрастные и поло-
вые особенности, но она не может
учитывать все возможности генотипа.
Известно, что существуют люди, у ко-
торых некоторые признаки отличают-
ся от «средней» нормы, но организм
функционирует нормально. И наобо-
рот, «нормальные» среднестатистиче-
ские признаки у отдельных людей яв-
ляются для них признаками патоло-
гии или болезни. В таком случае целе-
сообразно применять динамическую
норму, отражающую особенности
конкретного организма на протяжении
его жизни.
В отличие от вида в целом особен-
ностью отдельной особи является то,
что она существует в форме феноти-
па, т.е. признаки, полученные благо-
даря геному, дополняются признака-
ми, приобретенными организмом в
процессе его жизнедеятельности, т.е.
в результате влияния внешних воздей-
ствий. Если геном определяет возмож-
ности организма, то фенотип — реа-
лизация этих возможностей в конкрет-
ных условиях существования данного
организма.
Конституциональные признаки орга-
низма, определяемые геномом, могут
быть частично изменены под влияни-
ем условий жизни и деятельности че-
ловека. Здоровый образ жизни, равно-
мерно усиливающиеся физические
нагрузки, уравновешенная психика,
исключение вредных привычек при-
водят к тому, что организм функцио-
нирует в пределах нормы. Наследствен-
ные приспособительные системы при
этом развиваются в благоприятных
условиях, обеспечивая нормальное
функционирование всех систем и ор-
ганов при взаимодействии с внешни-
ми факторами, нормальными для су-
ществования вида. Знаменитый рос-
сийский полководец А. В. Суворов,
например, родившийся слабым, бо-
лезненным ребенком, путем закали-
вания и строгого режима достиг кор-
рекции приспособительных признаков
своего организма и отличался впослед-
ствии большой выносливостью.
Особенностью приобретенных в
результате взаимодействия с окружа-
ющей средой свойств организма яв-
ляется то, что они не передаются по
наследству. В то же время эти свойства
индивида, развивающиеся в процессе
жизни, усиливают приспособляемость
всей популяции, поскольку здоровый
организм имеет большие возможности
в воспроизводстве здорового потом-
ства.
Нормальное функционирование
организма, т е. здоровье, имеет боль-
шое число градаций: от показателей,
находящихся в границах нормы (ми-
нимальных или максимальных) до по-
28
казателей, устойчиво соответствующих
средней норме. Соответственно отли-
чаются и приспособительные возмож-
ности организма, т.е. способность нор-
мально (физиологически) реагировать
на внешние воздействия любого про-
исхождения.
Как можно видеть, традиционное
деление реакций на физиологические
и патологические достаточно условно,
на что обращал внимание И. В. Давы-
довский, так как те и другие обуслов-
лены физиологическими процессами
в организме. Различие проявляется в
форме этих реакций, их направленно-
сти, т.е. в том, какую роль они вы-
полняют: адаптивную или компенса-
торную. Рассмотрим сущность реак-
ций, составляющих основу приспособ-
ления.
Компенсаторная перестройка реак-
ций является началом патологическо-
го процесса. Так, если в результате
возникновения патологии какого-либо
органа, с него «снимается» нагрузка,
превышающая присущую ему физио-
логическую норму, то она перерас-
пределяется на непораженные органы,
которые восполняют недостаточную
функцию пораженного органа. Очаг
поражения освобождается от нежиз-
неспособных элементов и восстанав-
ливается структура и функция органа.
Это происходит, например, при та-
ком патологическом процессе, как
воспаление.
Если повреждение незначительное
(небольшая часть клеток), достаточно
компенсации со стороны тождествен-
ной ткани или органа для восстанов-
ления функции пораженной ткани.
В этом случае мы будем иметь дело с
локальным патологическим процессом
(«мини-патологией», по выражению
академика В. X. Василенко), которая
может практически не повлиять на
здоровье организма, временно огра-
ничив функции его органа.
Если повреждается большое число
клеток и компенсаторные возможно-
сти ткани и органа недостаточны для
замещения утраченных клеток и вос-
становления его функции, приспосаб-
ливаться к повреждению начнет си-
стема, включающая как сам поражен-
ный орган, так и внешние по отно-
шению к нему ткани и органы. Таким
образом, происходит компенсация
функции пораженного органа.
Компенсаторные реакции могут
происходить в пределах клетки и тка-
ни. Повышенная нагрузка на клетку
вызывает компенсаторное усиление
образования внутриклеточных струк-
тур, например в мышечных и нервных
клетках. На тканевом уровне: в резуль-
тате кровопотери включаются нейро-
гуморальные механизмы, приводящие
к компенсаторному усилению деле-
ния клеток-предшественников кост-
ного мозга. Повреждение кожи или
слизистой оболочки полости рта со-
провождается развитием репаративных
процессов, важнейшим компонентом
которого является компенсаторное
усиление деления и созревания недиф-
ференцированных клеток ткани. По-
вреждение твердых тканей зуба в ре-
зультате препарирования вызывает
гибель части клеток пульпы, в пер-
вую очередь одонтобластов. Ткань
пульпы отвечает на это повреждение
компенсаторной реакцией, выража-
ющейся в пролиферации других одон-
тобластов с восстановлением их чис-
ленности.
Компенсация может происходить и
в пределах системы. Например, пора-
жение одной слюнной железы вызы-
вает компенсаторное усиление функ-
ции оставшихся желез. Потеря части
зубов сопровождается перераспределе-
нием нагрузки на оставшиеся зубы.
Поражение парного органа, например
почки, приводит к усилению функции
здоровой почки.
29
Таким образом, в ответ на пато-
логию включаются механизмы, заме-
щающие утраченную (постоянно или
временно) функцию органа или тка-
ни. Генерализации патологии и раз-
вития болезни не происходит до тех
пор, пока компенсаторные системы
справляются с повышенной нагруз-
кой.
Развитие болезни происходит в слу-
чае генерализации патологии. Так,
если уколоть иглой палец, будут по-
вреждены клетки, почувствуется боль
и внешне этим все ограничится. Ткань
восстановит поврежденные клетки,
устранив «мини-патологию». Если в
ранку попадет инфекция и произой-
дет массовая гибель клеток, то орган
ответит универсальным патологиче-
ским процессом — ограниченным вос-
палением. Это патология, но еше не
болезнь. От состояния зашитно-при-
способительных механизмов организ-
ма зависит, будет ли ограничена реак-
ция на повреждение локальной пато-
логией или она генерализуется, перей-
дя, например, в сепсис, т.е. болезнь,
когда в борьбу с патологией включа-
ются системы сохранения жизни.
В период болезни биологические
возможности организма направлены
на восстановление своих функций.
Если этих возможностей достаточно —
человек выздоравливает, если недоста-
точно — наступает смерть, или, в луч-
шем случае, болезнь приобретает хро-
нический характер, наступает инва-
лидность.
В основе любой патологии лежит
патологический процесс, в котором со-
четаются как реакции собственно по-
вреждения структур при взаимодей-
ствии с внешними факторами, так и
защитно-приспособительные реакции
поврежденных тканей, органов или
организма.
Кратковременная, необычная реак-
ция организма на какое-либо воздей-
30
ствие носит название «патологическая
реакция».
Определение «патологический про-
цесс» еще не раскрывает сущности па-
тологии.
Во-первых, в патологическом про-
цессе участвуют две стороны приспо-
собления, т.е. адаптивные физиологи-
ческие реакции, изменяющие функ-
ции органов и систем, и компенса-
торные патологические реакции, на-
правленные в конечном счете на со-
хранение биологических функций
организма и социальных функций че-
ловека.
Во-вторых, физиологические и на-
званные ранее адаптивные и компен-
саторные патологические реакции в
патологическом процессе обусловле-
ны генотипом, т.е. сложились в про-
цессе эволюции человеческого организ-
ма, сопровождавшейся одновременно
и социальным развитием человека. Об
этом свидетельствует наличие у чело-
века форм патологий, присущих толь-
ко ему и связанных с особенностями
его организма, в частности с приспо-
соблением организма к прямохожде-
нию. В онтогенезе отдельного челове-
ка эти генотипические реакции лишь
реализуются, проявляясь индивиду-
ально в зависимости от фенотипа.
В-третьих: исход патологии зависит
от возможностей приспособительной
(адаптационной) нормы индивида.
Выздоравливают и выживают те люди,
организм которых наиболее приспо-
соблен к условиям существования.
Можно сделать вывод о том, что
патология индивида служит проявле-
нием естественного отбора и, следо-
вательно, приспособительна по своей
сути.
Все сказанное справедливо при
рассмотрении биологической основы
человеческого организма. Однако че-
ловек является социальным суще-
ством и на его биологическую основу
накладывается определяющая роль
общества, выраженная в том, что оно
осуществляет социальные меропри-
ятия по сохранению здоровья своих
членов.
На выполнение этих мероприятий
направлена деятельность органов здра-
воохранения и социального развития,
обеспечивающих условия, препятству-
ющие воздействию патогенных факто-
ров на людей. Для обеспечения без-
опасных условий труда, санитарно-ги-
гиенических мер, контроля качества
потребительских продуктов, пропаган-
ды здорового образа жизни созданы
различные государственные и обще-
ственные структуры.
Цель медицинского обслуживания
населения заключается в том, чтобы
с помощью лечебных мероприятий не
допустить перехода патологии в бо-
лезнь, а при болезни — предупредить
инвалидность или летальный исход,
сохранив жизнь человека. К таким ме-
роприятиям относится, например,
обеспечение больных сахарным диа-
бетом инсулином, других больных —
зубными протезами, слуховыми аппа-
ратами.
Социальная компенсация биологи-
ческих приспособительно-компенса-
торных механизмов организма приоб-
ретает все большее значение. Создает-
ся впечатление, что генотип человека
сложился, и естественный отбор на
него не влияет. Но «генотип» понятие
не только обобщенное, абстрактное,
включающее признаки, свойственные
виду, но и отражающее все многооб-
разие признаков, присущих индивидам.
Приспособительно-компенсатор-
ные механизмы на любом уровне —
от клетки до популяции — представ-
ляют сложный взаимообусловленный
комплекс морфофизиологических
структур, нарушение целостности ко-
торого может привести к непредвиден-
ным последствиям.
Для клинициста определяющей
стороной деятельности в борьбе с па-
тологией является характер реактив-
ности конкретного организма, кото-
рому он должен помочь. Но прене-
брежение к защитно-приспособитель-
ной стороне патологии не может быть
оправданно, так как патологический
процесс является результатом прояв-
ления адаптивно-компенсаторных ме-
ханизмов, обеспечивающих защиту
организма от повреждений и борьбу с
ними. Деятельность этих механизмов
реализуется в форме реакций организ-
ма и его систем на внешние воздей-
ствия и является, в конечном счете,
причиной болезни.
Вопрос о причине возникновения
патологического процесса у конкрет-
ного человека не менее важен для ме-
дицины, чем понимание сущности
болезни.
1.2. Общая этиология
Основные понятия. Слово «этиоло-
гия» (от греч. aitia — причина, logos —
учение) означает учение о причинах
и условиях, порождающих патологию.
В этиологии рассматривается взаимо-
действие организма и внешней среды
как источника патогенных факторов.
Отличие общей этиологии от частной
клинической состоит в том, что пер-
вая исследует причину и условия воз-
никновения патологии как наруше-
ния нормальной деятельности чело-
веческого организма в любой форме,
а вторая рассматривает причины и
условия конкретных форм патологий.
Основной категорией, определя-
ющей причинно-следственные связи,
является причина, т. е. внутреннее, при-
сущее рассматриваемому объекту свой-
ство — способность характеристик
объекта изменяться при взаимодей-
ствии с внешним фактором, порож-
31
дая следствие, т.е. соответствующее
изменение.
Внешний для объекта фактор ни-
когда не может быть причиной пато-
логии, которая является генетически
детерминированной, эволюционно вы-
работанной реакцией организма. Вне-
шний фактор можно назвать причи-
ной лишь в том смысле, что он вызы-
вает повреждение, а патология разви-
вается в ответ на это повреждение. Для
развития конкретной патологии вне-
шний, болезнетворный фактор игра-
ет роль условия, позволяющего при-
чине (внутреннему свойству организ-
ма) проявляться с необходимостью,
т.е. типовой реакцией па повреждение.
В то же время условие связано со слу-
чайностью и без соответствующего
условия причина не действует. Поэто-
му причину нельзя рассматривать вне
условий, вызвавших ее действие.
Смена причин и следствий образу-
ет причинно-следственную цепочку,
в конечном звене которой скрывается
первая причина, связанная с сущно-
стью объекта и вызвавшая последнее
следствие, поэтому иногда трудно
установить эту причину. Условие, выз-
вавшее последнее следствие, непо-
средственно наблюдаемое, называет-
ся поводом.
Проблема причины болезней инте-
ресует представителей медицины на
протяжении многих веков. Она реша-
лась в каждую эпоху истории в соот-
ветствии с господствующими в обще-
стве мировоззренческими представле-
ниями. При этом длительное время
этиология не выделялась из патоге-
неза, и причина болезни рассматри-
валась на фоне течения патологии.
И. В.Давыдовский писал о том, что,
начиная с Дж. Фракасторо (1458 —
1553), выделяются внутренние (бли-
жайшие) и внешние (отдаленные)
причины. Как было сказано ранее,
причина патологии — всегда внутрен-
32
ний фактор, определяемый свойства-
ми предмета, а так называемая вне-
шняя причина — повреждающий фак-
тор. — это условие. Как бы не был;
специфична по своему содержание
этиология, нельзя не считаться с этин
положением. Вопрос о причине услож-
няется тем, что следствие превраща-
ется в новую причину, создавая при-
чинно-следственную связь.
Рана, возникшая как следствие
повреждения, становится причиной
регенерации ткани. Можно воздейство-
вать на эту рану с помощью лечебных
мероприятий, и тогда раневой про-
цесс будет протекать в более благопри-
ятных условиях. Ню рана заживает не
потому, что мы создали для этого
условия, а вследствие того, что ткань
имеет способность к регенерации. Как
видно, причина заживления — также
внутренняя. И так в любом случае:
условие может ускорить или замедлить
действие причины, но не заменить ее.
Это видно на примере борьбы с ин-
фекционными болезнями: вакцинация
воздействует на организм, активизи-
руя присущее ему свойство формиро-
вания устойчивости (резистентности)
к инфекции за счет иммунных меха-
низмов. Следовательно, причина ре-
зистентности заключается в свойстве
организма формировать иммунный
ответ, а не в факторе, который ини-
циировал развитие патологии.
При иммунодефицитном состоя-
нии резистентность не формируется
или формируется слабо. При борьбе
с оспой воздействуют не на вирус
оспы — внешнюю причину, а на орга-
низм, делая его не способным к пато-
логической реакции при взаимодей-
ствии с возбудителем оспы, которая
явилась причиной болезни и даже
смерти из-за отсутствия достаточных
компенсаторно-приспособительных
механизмов защиты. Примеры можно
приводить бесконечно и всегда ока-
жется, что причиной патологии явля-
ется свойство организма, а не того
фактора, который в конкретном слу-
чае выступает как «возбудитель» па-
тологии. Это не освобождает нас от не-
обходимости изучать и учитывать роль
болезнетворного фактора в патогене-
зе, так как мы убедились, что от па-
тогена зависит форма протекания па-
тологии и ее специфические проявле-
ния. Характеристика болезнетворных
факторов, их неспецифическое и спе-
цифическое действие на организм бу-
дут изложены в дальнейшем.
Рассмотрим некоторые представле-
ния о причинах патологии, историче-
ски развивавшиеся в медицине.
Механический каузализм, монокау-
зализм. Глубокое изучение причин па-
тологии в медицине потребовало
аналитического подразделения этих
причин на составные элементы и их
описания. Развитие аналитической
тенденции в обшей этиологии харак-
теризует механистический детерми-
низм (его разрабатывали Ф. Бэкон.
Р.Декарт, Г. Галилей и др.).
В эпоху господства метафизическо-
го взгляда на мир все наблюдаемые в
мире изменения сводились и отожде-
ствлялись с законами механики. Со-
гласно этому взгляду природа, весь
мир — это огромный часовой меха-
низм, в котором все происходит по
законам механики, физики, матема-
тики, т.е. организм сравнивается с
машиной. Механистический взгляд
стал господствующим в мире. Причи-
ну возникновения заболевания нача-
ли сводить к чисто внешнему воздей-
ствию на организм какого-либо фак-
тора, т.е. причина — активна, орга-
низм — пассивен, а развитие болезни
определяется только действием вне-
шних причин. Наибольшего развития
такой взгляд получил в XIX в., озна-
меновавшемся открытием микробов —
возбудителей ряда болезней. Открытие
микробов как первичных факторов
инфекционных заболеваний имело
такое же большое значение, как и от-
крытие Р. Вирховом значения клетки
в развитии неинфекционных форм
патологии.
Утверждение о том, что причиной
инфекционных болезней являются
микробы, было крупным завоеванием
как теоретической, так и практичес-
кой медицины. Оно нанесло удар по
учению об «археях», этиологии «скры-
тых качеств», «духовных начал» и на-
учно утвердило материалистический
принцип причинности в патологии.
Вместе с открытием возбудителей
инфекционных болезней, разработкой
методик обнаружения и доказательства
тождественности бактерии возбудите-
лю болезни были сделаны попытки
свести инфекционное заболевание ис-
ключительно к инфицированию и воз-
действию микробов на микроорганизм.
Согласно этому представлению одно-
го внешнего фактора достаточно, что-
бы развилась болезнь.
Такое направление в этиологии
именуется монокаузализмом, которое
является вершиной механистического
детерминизма. Монокаузализм направ-
лял деятельность врачей на поиски
микробов — возбудителей заболевания
и средств защиты от инфекционных
болезней. Однако это направление,
прогрессивное для того периода раз-
вития медицины, впоследствии стало
тормозом прогресса, так как было
явно механистическим.
Сторонники монокаузализма пони-
мали причину болезни упрощенно: она
сводилась к одному из этиологических
факторов (обычно внешнему) и отож-
дествлялась чаще с микробом, роль
которого в возникновении и развитии
болезни преувеличивалась. Ограничен-
ность монокаузализма заключалась в
том, что при анализе причины болез-
ни организм выступал лишь пассив-
33
ным объектом, а его воздействию,
свойствам и характеру взаимодействия
с внешней средой не уделялось долж-
ного внимания.
Следовательно, согласно монокау-
зализму изучать надо не организм (пас-
сивную субстанцию), а то, что на него
действует.
Многообразие причин сводилось,
главным образом, к форме механиче-
ского, физического, химического, ин-
фекционного воздействия. Патолог
В. В. Подвысоцкий (1894) писал по
поводу монокаузализма: «Увлечение
доходило до того, что считалось до-
статочным констатировать какую-ни-
будь бактерию в больном организме,
чтобы уже считать ее возбудителем,
причиной болезни». С позиций моно-
каузализма рассматривалось возникно-
вение не только инфекционных, но и
других заболеваний. Однако Л. Пастер
придерживался другого взгляда: основ-
ная роль в развитии заболевания при-
надлежит организму.
Представления монокаузалистов
противоречили многим наблюдениям.
Приведем некоторые из них. Извест-
но, что даже во время самых жесто-
ких эпидемий не все люди заболева-
ли, а среди заболевших наблюдалась
неодинаковая тяжесть заболевания и
не все они умирали.
Опыты Л.Пастера доказали, что
курица, не способная в обычных
условиях заразиться сибирской язвой,
заболевает, если ее предварительно
охладить путем погружения лап в хо-
лодную воду. Доярки, перенесшие ко-
ровью оспу, не заболевали во время
эпидемии натуральной оспы. В 1884 г.
Ф. Леффлер открыл факт бациллоно-
сительства (дифтерия). В связи с эти-
ми и многими другими фактами стало
очевидно, что теория монокаузализ-
ма несостоятельна, и вновь появилась
необходимость пересмотра взглядов на
общую этиологию болезней.
Кризис монокаузализма совпаг
XX в. с более благоприятными ус.
виями для развития учения о при
нах и условиях болезней. Возникло -
вое направление — кондиционализм
лат. condicio — условие). В отличие
монокаузалистов сторонники дан?
го направления основное внимав
уделяли роли условий в развитии •'
лезней. Это течение в обшей этио."
гии, игнорирующее ведущую рс
причины в возникновении болезн
заменяющее его суммой нередко с.-
чайных и вполне равноценных по зь
чению условий. Но данные пред ст.
ления в отличие от монокаузали:
впали в другую крайность. По мнен
кондиционалистов, болезнь вызывав
ся не одним каким-либо факторе
а бесчисленным множеством услов!
обычно равноценных. В результе
врач, исходя из своих субъективн:
наблюдений, выделяет то или иг
условие в качестве главного и назые
ет его причиной болезни.
Кондиционалисты отрицали объе
тивность причинной связи в пато.'
гическом процессе, считая ее прог
водным от субъекта. Они придержиЕ
лись в исследовании патологии той •
линии субъективного идеализма, к
торую в философии утверждал Э. М.
считавший, что нет причины, на?,
дящейся вне нашего сознания. Коп?
ционалисты видели причину болез-
в наборе условий, причем любое
них является равноценным (т.е. ст
пифической причины болезней, по
взглядам, нет).
Одни ученые (Форвори, Д. Ган:
ман) считали эти условия субъектг
но, а другие (Г. В. Шор, 1925; В. А. О
пель. 1908, 1927) — объективно с
шествующими. В соответствии с эт:
развивались два философских взгл
да на этиологию (субъективный ид
ализм и метафизический матери
лизм).
34
Разновидностью кондиционально-
го метода анализа этиологии является
так называемая «констелляционная
патология». В данной теории понятия
причины и условий заменены факто-
рами, которые для каждого случая за-
болевания составляют констелляцию,
т. е. сумму равноценных факторов, не-
обходимых для наступления болезни.
Кондиционализм любого направления
отрицает детерминизм, субъективно
или объективно оценивает значение
главным образом факторов внешней
среды и игнорирует роль самого орга-
низма в развитии заболевания.
Следующим направлением в раз-
витии учения об общей этиологии яв-
ляется конституционализм. Оно осно-
вывалось на положениях формальной
генетики и наследственной предрас-
положенности к заболеваниям, воз-
никновение которых связывается с по-
рочной конституцией. Под конститу-
цией сторонники этого направления
правильно понимали совокупность
устойчивых морфофункциональных
свойств организма, сформированных
в процессе онтогенеза на наследствен-
ной основе.
Согласно концепции конституцио-
налистов решающее значение для воз-
никновения болезни имеют не мик-
робы и другие факторы внешней сре-
ды, а сам организм, в частности его
конституция. Однако последняя рас-
сматривалась ими только на основе
концепции Вейсмана — Моргана о не-
изменности наследственного вещества.
По представлениям этих ученых, ге-
нотип неизменен, поэтому свойство
организма, в том числе и болезнь, пе-
редается по наследству без изменений.
Современная наука доказала, что мно-
гие заболевания и особенно предрас-
положенность к ним действительно
наследуются. Однако абсолютизиро-
вать роль наследственности нельзя,
так как ген не является абсолютно
консервативным и его изменение нео-
бязательно проявляется в виде патоло-
гии. Отрицание изменчивости наслед-
ственного аппарата способствовало
формированию мнения конституцио-
налистов о том, что в возникновении
и развитии заболевания отсутствует
влияние внешней среды. Таким обра-
зом, заболевание всегда предуготов-
лено, фатально, если набор генов по-
рочен.
На основании этого учения были
сделаны выводы, в том числе и поли-
тические, самым реакционным из ко-
торых является фашизм, обосновыва-
ющий уничтожение генетически не-
полноценной расы и людей с наслед-
ственными болезнями.
Монокаузализм, кондиционализм
и конституционализм основывались на
реальных эмпирических фактах, но
ошибочность представлений этих на-
правлений заключается в некоррект-
ном осмыслении наблюдаемых фактов.
Монокаузалисты абсолютизировали
возбудителя, например бактерию, как
единственную причину патологии.
Кондиционалисты, правильно отра-
зив влияние условий на возникнове-
ние патологии, абсолютизировали это
положение, отказавшись признать на-
личие причинно-следственной зави-
симости в патогенезе. Конституцио-
налисты отрицали роль внешних,
болезнетворных, факторов и условия
возникновения болезни, преувеличи-
вая роль наследственного аппарата.
Подлинное понимание причины
патологии неразрывно связано с уче-
том роли организма в возникновении
патологии. Основоположником совре-
менного научного представления об
этиологии можно считать Галена, ко-
торый сформулировал правило исход-
ного состояния организма, не поте-
рявшее своего значения и в настоя-
щее время. Согласно этому правилу ни
одна причина не может вызвать забо-
35
левание, если нет особой восприим-
чивости организма. Положение о внут-
ренней причине заболевания было
основано на учениях древних филосо-
фов Демокрита, Гераклита и, в осо-
бенности, Гиппократа, который кате-
горично утверждал, что каждая бо-
лезнь имеет свою естественную при-
чину, и ничто не совершается без ес-
тественной причины. Однако особое
значение для учения Галена о причи-
нах патологии имело введение Арис-
тотелем в науку понятия о причинных
(кондициональных) факторах. Идею о
взаимосвязи причин и условий в воз-
никновении заболеваний мы находим
и в «Каноне врачебной науки» Абу Али
Ибн-Сины (Авиценны), который счи-
тал, что не всякая причина, достига-
ющая тела, оказывает на него действие.
Авиценна видел причину болезни во
взаимодействии трех элементов: внеш-
него фактора, реактивного состояния
организма и условия их взаимодей-
ствия. Один и тот же фактор может
быть патогенным для одного организ-
ма и не вызывать патологии в другом.
Следовательно, причина болезни
связана с особенностями организма
человека, является внутренней для
него. При этом нужно помнить, что
причина действует, т.е. порождает
следствие, только при наличии соот-
ветствующих условий, в результате ко-
торых нарушаются существенные мор-
фофизиологические связи организма,
независимо от происхождения факто-
ров, составляющих это условие. Вне-
шний фактор является патологическим
постольку, поскольку он может вы-
звать патологическую реакцию у дан-
ного организма. Поэтому, с одной сто-
роны, многие воздействия нельзя на-
звать абсолютно патогенными, а с
другой, — каждый внешний фактор
может проявить патогенность в конк-
ретной ситуации. Простуда, например,
для одного организма ограничивается
ринитом, а для другого — острой ПН:
монией с летальным исходом. К аб.
лютно патогенным внешним фактор
относятся: высокая или низкая те
пература, вызывающая ожог или с
морожение, длительное раздавливай
ткани, лучевое воздействие и мног
другие, всегда реализующие внутре-
нюю причину и вызывающие пато:
гию и болезнь.
В то же время нельзя преуменьши
значение этиологии для формироь
ния врачебного диагноза. Во-первь
знание этиологии является основ
для разработки профилактических м
роприятий, поскольку позволяет пр
дупредить возможность возникновен.
условий взаимодействия организма
факторами, которые могут оказать,
для него патогенными. Во-вторы
этиология тесно связана с патоген,
зом и знание этиологии заболевай
обязательно для грамотного лечен!
больного.
Относительно небольшое колич.
ство типичных патологических реа-
ций и процессов в сочетании с прак-
тически бесконечным количестве
внешних воздействий порождает бол;
шое число нозологических форм п.
тологии.
Организм и причины патологии. Вы
смотрим этиологические факторь
Патология, возникшая как следств!
действия причины, определяется вз.
имодействием двух характерней
организма, лежащих в основе его коь
ституции: реактивности и резистен-
ности.
Конституция — это совокупное-
морфологических, функциональны'
психических свойств организма, еле
жившихся на основе генотипа под вл1
янием факторов окружающей средь
определяющая его реактивность.
Конституция, обусловленная гене
типом, характеризует фенотипически
особенности конкретного организм.
поэтому она динамична, т. е. может с
течением времени меняться, сохраняя
основные показатели. Конституция
индивидуальна и конституциональные
различия определяют все многообра-
зие реакций людей на болезнетворные
факторы.
Поскольку конституция организма
обязательно включает характеристики,
определяемые генотипом, рассмот-
рим, каким образом сложилось это
многообразие конструкций в филоге-
незе.
Человеческая популяция в резуль-
тате естественного отбора приспосо-
билась к определенным условиям
внешней среды, которые стали нор-
мой ее существования. Но результаты
влияния условий среды на организм
индивидуальны и колебания характе-
ристик среды, нормальные для всей
популяции, могут оказаться экстре-
мальными для отдельного организма,
что может вызвать патологию. Казалось
бы, естественный отбор в конечном
счете должен уничтожить все особи,
характеристики которых не укладыва-
ются в норму колебаний условий су-
ществования, допустимую для попу-
ляции, но этого не происходит. На-
оборот, в популяции появляются
группы, различным образом реагиру-
ющие на патоген. Рассмотрим меха-
низм этого явления на примере взаи-
модействия патогенных микроорганиз-
мов и организма человека.
При возникновении эпидемии мы
сталкиваемся с четырьмя различным
образом реагирующими на патоген
группами организмов:
I) организмы, у которых патоло-
гия не возникает, поскольку попав-
ший в организм патоген уничтожает-
ся физиологическими реакциями не-
специфической или специфической
(иммунной) системы до того, как он,
размножившись, сможет повредить
организм. Это — устойчивые к данно-
му патогену организмы, обладающие
конституциональной, т.е. врожденной
или приобретенной, устойчивостью;
2) организмы, у которых патоло-
гия или даже болезнь возникает, но
защитные механизмы организма до-
статочны для уничтожения патогена,
вызвавшего повреждение организма;
нарушенные структуры и функции
восстанавливаются, а в результате па-
тологии возникает иммунитет к дан-
ному патогену. В этом случае патоло-
гический процесс имеет приспособи-
тельное значение для конкретного
организма, не являясь, на первый
взгляд, таковым для популяции в це-
лом, так как приобретенные механиз-
мы защиты не передаются по наслед-
ству. Однако в этом случае в популя-
ции повышается количество защищен-
ных от патогена организмов за счет их
преимущественного выживания;
3) организм реагирует на патоген
патологией, но его компенсаторные
возможности недостаточны для унич-
тожения патогена. Эти организмы ха-
рактеризуются тем, что их защитные
механизмы ослаблены в силу внутрен-
них причин или внешних условий. Па-
тология включает по очереди ком-
пенсаторные механизмы все более
высокого уровня, вплоть до организ-
менных. Истощение компенсаторных
возможностей организма приводит к
летальному исходу. В случае если со-
противление организма уравновеши-
вает воздействие патогена, но не мо-
жет преодолеть его, возникает хрони-
ческая форма патологии, при которой
происходит приспособительная пере-
стройка функций организма («сосуще-
ствование с патогеном»);
4) организм не реагирует патоло-
гически на воздействие патогена из-за
дефекта механизмов защиты, который
беспрепятственно разрушает организм,
вплоть до летального исхода. Патоло-
гия возникает как реакция на повреж-
дение структур организма, но она не
направлена на борьбу с патогеном.
Любая популяция включает по типу
реагирования все четыре группы орга-
низмов, поэтому при длительном воз-
действии на нее патогенных факторов,
например микроорганизмов, должен,
очевидно, наступить момент, когда в
популяции погибнут все особи с ос-
лабленным или дефектным приспосо-
бительно-компенсаторным механиз-
мом. Однако в этом случае популяция
патогенных микроорганизмов также
исчезнет, поскольку потеряет среду
существования, а сохранившаяся часть
микроорганизмов уже не будет пато-
генной. Таким образом, гибель особей
с несовершенным механизмом защи-
ты является элементом приспособле-
ния вила к взаимодействию с патоге-
нами: за счет части гибнущих организ-
мов спасается и приспосабливается
целое — популяция. Физиологическая
защитная реакция (иммунитет) на
данный микроорганизм закрепляется
генетически, как конституциональный
(видовой) иммунитет.
Процесс приспособления является
двусторонним, поэтому популяция
микроорганизмов также приспосабли-
вается к изменяющимся условиям су-
ществования. В результате мутаций
микроорганизмов возникают новые
штаммы, против которых ранее устой-
чивый к этому виду организм челове-
ка не имеет защитных механизмов или
они не полностью обеспечивают унич-
тожение патогена. В таком случае орга-
низм, генетически относящийся к
первой группе, взаимодействует с но-
вым штаммом как организм второй
или даже третьей группы.
Происходит борьба между система-
ми приспособления микроорганизмов
и человека, в процессе которой из-
меняется и организм человека, и мик-
роорганизмы. Сложность высокоорга-
низованных организмов, с одной сто-
роны, позволяет им формиро: 1
Структуры И функциональные М; 1
низмы защиты в процессе приспо. 1
ления к взаимодействию с микрс (
ганизмами. С другой стороны, в 1
организмах, отличающихся разнг 1
разием индивидуальных свойств, ч. .1
могут возникнуть нарушения, де^
в каком-либо звене, которые и
пользуются популяцией микроог
низмов. В то же время при относите
ной структурной простоте способнс
микроорганизмов к размножени
короткие сроки (например, бакте
альная клетка, делящаяся каж;
полчаса, через 15 ч дает потомс:
численностью 1 млрд особей приб
зительно 30 поколений) определ
возможность возникновения в эт
потомстве мутаций, против котог.
ранее выработанная организмом зад
та не эффективна. Или в понудят
людей появятся особи с таким дефе
том защиты, при котором патоген г
зовет у них патологическую реакцг:
патологический процесс и болезнь
Таким образом, возникновение г
тол огни связано с реактивностью ор:
низма.
Реактивность (от лат. reactia — пр
тиводействие) — это всеобщее сво
ство живых организмов отвечать изл
нением своих морфофизиологическ
характеристик на воздействие окруж
юшей среды, приспосабливаясь (ада:
тируясь) к ней.
От рективности в большой степ
ни зависит поддержание гомеостаз;
Чем выше организация животы
го, тем сложнее формы реактива
сти: от тропизмов и настий у раст.
ний до целенаправленных реакций
человека.
Реактивность человеческого орг
низма — это его способность при вз.
имодействии с внешними воздейств;
ями изменять характеристики соотве
ствующих органов и систем, которь
38
взаимодействуют с внешним фактором.
В результате такой способности сохра-
няется равновесие между организмом
и средой.
Реактивность каждого организма
индивидуальна и определяется следу-
ющими элементами:
возбудимость, которая позволяет
определить уровень раздражимости
тканей. Минимальная сила воздей-
ствия раздражителя, способная поко-
ящуюся клетку или ткань привести в
действие, называется порогом возбу-
димости;
функциональная подвижность (ла-
бильность), которая определяет уве-
личение или снижение реактивности
нервной системы;
чувствительность, которая обуслов-
ливает способность органов чувств
приходить в возбужденное состояние
при минимальной силе воздействия
соответствующего раздражителя. Нару-
шение чувствительности может суще-
ственно повлиять на реактивность
организма.
Особенностью реактивности чело-
веческого организма является то, что
кроме воздействия факторов внешней
среды раздражителем для человека
служит вторая сигнальная система, по
определению И. П. Павлова, т. е. рече-
вое воздействие. Слово является таким
же раздражителем, вызывающим опре-
деленную реакцию, как и воздействие
на организм внешней среды.
При воздействии на организм усло-
вий среды, к которым он приспособ-
лен, равновесие со средой достигает-
ся за счет физиологических реакций.
Если же воздействия со стороны пре-
вышают способность организма к фи-
зиологическому ответу, реакция орга-
низма принимает форму патологиче-
ской, т. е, включаются компенсаторные
механизмы, направленные на сохра-
нение организма и его органов, защиту
^т разрушающей нагрузки.
Специфической формой реактив-
ности является иммунологическая реак-
тивность — способность организма
отвечать на действие антигена (пато-
логические факторы биологической
природы) выработкой гуморальных
антител и комплексом клеточных ре-
акций, специфичных по отношению
к данному антигену, направленных на
противодействие его повреждающему
действию.
Конституция организма включает
также свойство резистентности (от
лат. resistentia — сопротивление). Если
реактивность организма определяет
непосредственно возможность пато-
логической реакции, то свойство ре-
зистентности определяет форму ре-
акции и ее результат. Под резистент-
ностью понимается способность
организма, его адаптивно-компенса-
торных механизмов сопротивляться
патогенным (болезнетворным) воз-
действиям.
Необходимо отметить, что поня-
тие резистентности по отношению к
организму достаточно условно, если
рассматривать его относительно всей
совокупности болезнетворных факто-
ров. Это связано с тем, что организм
по-разному реагирует на различные
патологические факторы, особенно
на воздействие патогенных микроор-
ганизмов. Человек, устойчивый к воз-
будителям чумы, может погибнуть от
гриппа, поэтому логично говорить о
резистентности к конкретному пато-
генному фактору для определенного
организма. Иммунный к одному фак-
тору организм может быть сенсибили-
зирован к другому.
Вернемся к рассмотренным ранее
четырем группам организмов. Иммун-
ный к определенному болезнетвор-
ному фактору организм, независимо
от того, является ли иммунитет кон-
ституциональным (врожденным) или
приобретенным, адаптирован к воз-
39
действию конкретного патогена. Им-
мунная система такого организма на-
чинает противостоять с момента ин-
вазии патогенного агента в организм,
не допуская увеличения его числен-
ности до количества, за которым сле-
дует патологическая реакция. Таким
образом, иммунная система дает пол-
ный ответ на инвазию патогена, не до-
пуская его разрушительного действия
на организм. Это наиболее совершен-
ное, высокое проявление резистент-
ности. В данном случае организм реа-
гирует на нагрузку со стороны пато-
гена физиологически, адаптивно. Во
включении компенсаторных механиз-
мов нет необходимости, поскольку нет
повреждения.
Организм второй группы не имеет
готовых механизмов иммунитета к
данному патогенному агенту', а дея-
тельность неспецифической защитной
системы (фагоцитоза и гуморальных
бактерицидных факторов) в скрытом
(латентном) периоде болезни недо-
статочна. Но в этой группе мобили-
зуется специфическая система защи-
ты — иммунитет, которая осуществ-
ляет полноценный иммунный ответ.
В результате иммунного ответа
формируются клоны лимфоцитов и
иммуноглобулинов, способных унич-
тожить популяцию болезнетворных
организмов до того, как она нанесет
необратимые повреждения организ-
му. При этом включаются компенса-
торные механизмы, например воспа-
лительного процесса, еще больше
усиливающие действие иммунной си-
стемы. Организм уничтожает патоген-
ный агент и наступает выздоровле-
ние.
Сформировавшийся в результате
внедрения антигена клон специфиче-
ских для данного патологического
агента лимфоцитов и иммуноглобули-
нов при последующем воздействии на
организм этого же патогенного агента
осуществляет полный иммунный
вет с момента инвазии микрооргаь
мов. Организм становится иммунь.
(более или менее продолжительнс
этому возбудителю.
Организм третьей группы отли
ется тем, что в силу ослаблень
условиями жизни резистентно!,
организма, дефекта иммунной сис
мы, перенесенного заболевания отв
чает патологической реакцией нем;
ленно после инвазии патогена. Лате?
ный период очень короток, поскол?
неспецифическая система защиты
может сдерживать размножения и р.
рушающего действия патогена. Спег
фическая система не имеет достатс
ного времени для развертывания
следовательно, не подготовлена к пс
ному ответу. В результате компенсатс
ные механизмы организма не мог
помешать действию патогена, вкл
чая все более высокие уровни компе
сации, вплоть до организменных. С
лабленный организм не обеспечив,
энергетически сопротивление, и г
тощение его сил может привести
летальному исходу.
В случае, когда сопротивление ор:
низма воздействию патогенного аге
та все же уравновешивается, патол
гия принимает хроническую фор?
периоды ремиссии чередуются с г
риодами обострения болезни, что ск
зывается на физиологических функи
ях организма, вынужденного прись
собиться к существованию в услови
взаимодействия с возбудителем. Opi
низм, не оказывая сопротивления г.
тогенному фактору, может быстро г..
гибнуть.
Организмы четвертой группы, .
дающие иммунного ответа на инвазг
патогена, не обладают свойством г
зистентности к нему или оно прог
ляется на очень низком уровне.
Не следует забывать, что резистеь
ность организма не абсолютна, а
40
li ЭТ-
»-из-
1-ым
* к
k-a-
эй
кти
кте-
k-e-
нд-
г-гг-
Йь.ку
не
ГДЗ-
1йЛ-
Р-З-
fc И,
ко-
к~т
ДйЭ-
fcT
ч к
VI-
е--
ЛС—
«Г.;
fie-
&-
'k-
'?£.-
:-Чй-
tv f
многом зависит от специфики пато-
гена и видовой адаптированности к
нему популяции.
Все изложенное еще раз подтвер-
ждает, что причиной любой патоло-
гии является состояние соответству-
ющих систем организма, а не болез-
нетворный фактор, который вызы-
вает только первичное повреждение
и выявляет те стороны морфофизио-
логических систем конкретного орга-
низма, которые не приспособлены к
физиологическому взаимодействию с
определенными факторами внешней
среды. Способность человеческого
организма приспосабливаться к ме-
няющимся условиям окружающей
среды, сложившаяся в процессе фи-
логенеза, позволяет лаже в онтоге-
незе при формировании фенотипа
корректировать недостатки приспо-
собительно-компенсаторных меха-
низмов.
Даже к ядовитым веществам орга-
низм можно приспособить, повышая
порог их патологического действия пу-
тем постепенного повышения дозы,
начиная с абсолютно безвредной и
кончая превышающей летальную дозу.
Это явление называется «митрида-
тизм».
Следовательно, для того чтобы до-
биться сохранения здоровья, необхо-
димо главное внимание обратить на
укрепление адаптивно-компенсатор-
ных механизмов в осуществлении фи-
зиологического, а не патологическо-
го ответа на воздействия внешней сре-
ды. Для этого необходимы меры
социальной компенсации, которая
предусматривает комплекс меропри-
ятий по обеспечению нормальных
жизненных условий, начиная с обес-
печения питанием, одеждой, жильем
и кончая пропагандой здорового об-
раза жизни, борьбой с вредными при-
вычками, созданием благоприятных
условий труда и т.д.
1.3. Этиологические
(болезнетворные)
факторы внешней среды
Организм не может существовать
вне среды. И. М.Сеченов писал, что
организм без внешней среды, поддер-
живающей его существование, невоз-
можен, поэтому в научное определе-
ние организма должна входить и сре-
да, влияющая на него. Для человека
среда — это природное и социальное
окружение, с которым он непосред-
ственно взаимодействует, испытывая
влияние среды и в свою очередь воз-
действуя на нее. Гармоничное, дина-
мическое равновесие организма со
средой — главное условие здоровья. Но
изменяющиеся характеристики от-
дельных факторов среды приводят к
нарушению этого равновесия, вынуж-
дая организм перестраиваться в целях
достижения нового равновесия.
Нагрузки от изменений в среде, со-
ответствующие норме адаптации орга-
низма, преодолеваются с помощью
физиологических реакций, сформиро-
вавшихся в процессе филогенеза вида
и онтогенеза организма. Меняющиеся
воздействия среды вследствие измене-
ния ее характеристик, действующих на
структуры организма, могут достиг-
нуть уровня, при котором они разру-
шаются. На это разрушение структур
организм реагирует патологически, т. е.
перестраивает свои физиологические
функции, усиливая те из них, кото-
рые направлены на противодействие
болезнетворным факторам.
Этиология выделяет и изучает фак-
торы внешней среды, которые в опре-
деленной ситуации являются патоген-
ными для любого человеческого орга-
низма.
Патогенные факторы можно под-
разделить на природные и социальные
по их принадлежности к среде. В дей-
41
ствительности обе эти группы факто-
ров обычно действуют совместно, но
каждая группа имеет свои специфи-
ческие отличия.
Следует заметить, что болезнетвор-
ные факторы различаются по силе
(слабые, умеренные, сильные, сверх-
сильные), времени (мгновенные, бы-
стрые, действующие длительно, по-
стоянно, ритмично или хаотично)
действия.
Учитываются такие свойства этио-
логического фактора, как локализация
и время его действия, площадь сопри-
косновения с тканью и ее свойства.
Болезнетворным для человека часто
является отсутствие факторов, необ-
ходимых для осуществления жизнен-
ных функций, например, кислорода
и питательных веществ, атмосферно-
го давления и гравитации, инсоляции,
снижение двигательной активности и
физической нагрузки (гипокинезия и
гиподинамия).
Природные болезнетворные факто-
ры. Природные болезнетворные фак-
торы подразделяют на глобальные и
локальные.
К глобальным факторам относят
космическо-планетарные явления,
охватывающие одновременно своим
влиянием территории, соразмерные с
поверхностью Земли, воздействуя на
состояние здоровья людей. Особенно
усилилось внимание ученых к влиянию
космических факторов на здоровье
людей благодаря работам А. Л. Чижев-
ского. К таким факторам относится
влияние излучаемых Солнцем заря-
женных частиц, которое проявляется
в форме магнитных бурь. Под влияни-
ем этого излучения наблюдается гло-
бальное возбуждение колебаний маг-
нитного поля Земли, отрицательно
влияющее на состояние людей с ос-
лабленным здоровьем и больных. Кро-
ме того, магнитные бури вызывают
изменения атмосферных условий, усу-
губляющих состояние больных сера-,
но-сосудистыми и другими заболе.
ниями, которые обозначаются 1
метеопатии. К этой же группе мож
отнести влияние стихийных бедств.
Локальные факторы действуют
ограниченное количество людей:
популяции до отдельного организм,
по своей природе могут быть раз1-
образными.
Физические факторы. Большую гр;
пу болезнетворных факторов сост.
ляют физические воздействия.
Механическое повреждение, или.'
ханическая травма (от греч. trauma -
рана). Возникает в результате меха:
ческих нагрузок: удары, растяжеы
сдавливание, изгибы тканей с силе
превышающей их способность к сопр
тивлению. В результате ткани повре
даются: возникают порезы, раздроб.
ние, растяжение и разрывы мягких тг
ней, переломы костей. В некотор;
случаях небольшие по силе воздейстг
могут вызвать повреждение тка.
вследствие их длительности, наприм
у лежачих больных появляются пр
лежни мягких тканей.
Температурные (термические) /:
вреждения. Патологическое возде
ствие может оказать как тепло, так
холод. Если термическому воздейств1.
подвергается весь организм, то г
будет перегревание или переохлажу
ние. если отдельные участки — ож
или отморожение.
Ожоги возникают при соприкосн
вении тканей с пламенем, горячи'
твердыми телами. Ожог паром или г
рячими жидкостями — это обварю
ние. При повышении температуры тк
ни выше 45 — 50 °C гибнут клетки в >
сте нагревания, развивается воспа.
ние, некроз поврежденных тканс
При обширных ожогах нарушает,
общее состояние всего организма -
развивается ожоговая болезнь. Пег
гревание (гипертермия) в резулы;
42
''О^миштма
гзеч- внешнего теплового воздействия, со-
h еза- провождающееся новы шением тем пе-
t ..ак ратуры организма до 42 °C и более вы-
k - но зывает нарушение механизма терморе-
Р";лй. гулянии, приводит к тепловому удару,
к на который в тяжелых случаях заканчива-
р. от ется летально. Ожог может быть вызван
к _ и и длительным воздействием сравни-
Р -о- тельно невысоких температур.
Не менее опасно влияние на орга-
» ' п- низм низких температур. При общем
‘.в- переохлаждении (гипотермии) темпе-
ратура организма может снизиться
* г- ниже уровня, необходимого для осу-
' — ществления жизненных функций. В та-
т- ком случае человек погибает от пере-
я, охлаждения. Результат действия холо-
:т, да зависит во многом от состояния
организма. Здоровый, крепкий орга-
к- низм менее подвержен действию хо-
е- лода, чем истощенный, переутомлен-
1- ный, ослабленный.
:;х Отморожение является результатом
.я нарушения белковых структур тканей,
л рефлекторных процессов, резкого из-
:р менения микроциркуляции и обмена
веществ под действием холода. Разви-
тие стойких изменений в сосудах с
закупоркой их просвета и прекраще-
нием кровоснабжения может закон-
т читься некрозом тканей.
-? Повреждающее действие звуков и
з шума. Человеческое ухо воспринимает
звуки с частотой колебаний от 16 до
2 000 Гц. Звуки интенсивностью выше
1 мкВт/см2 могут вызвать повреждаю-
щее действие. Шумы — это сочетание
звуков различных тонов, частоты,
интенсивности и продолжительности,
меняющихся во времени. В зависимо-
сти от частоты колебаний, имеющих
максимальную интенсивность, разли-
чают шумы низко-, средне- и высо-
кочастотные. Нормальный уровень
шума лежит в пределах 40—50 дБ. При
шумах 100 дБ и более возникают на-
рушения функции центральной не-
рвной системы (ЦНС). Постоянно
действующий шум даже небольшой
силы приводит к быстрой утомляемо-
сти, снижению внимания и работо-
способности, ухудшению памяти, по-
вышенной раздражительности. Систе-
матически действующий в течение
продолжительного времени шум мо-
жет привести к глухоте.
Повреждающее действие ионизиру-
ющего излучения. Ионизирующее излу-
чение — результат распада радиоактив-
ных веществ и действия рентгенов-
ской аппаратуры. При этом различа-
ют: альфа-, бета- и гамма-излучение,
потоки протонов и нейтронов, рент-
геновские лучи. Повреждающее дей-
ствие ионизирующего излучения за-
висит от их проникающей способно-
сти, продолжительности действия,
реактивности организма и других фак-
торов.
Повреждающее действие электри-
ческой энергии. Человеческий организм
может подвергаться действию элект-
рического тока при пользовании тех-
ническими средствами и в результате
влияния природных факторов (грозо-
вых разрядов, электрических органов
некоторых животных). При ударе мол-
нии очень высокое электрическое на-
пряжение приводит к параличу дыха-
ния, остановке сердца, механическим
повреждениям и ожогам.
Действие электрического тока опре-
деляется его физическими параметра-
ми, направленностью и продолжи-
тельностью воздействия на организм,
особенно состоянием центральной
нервной системы.
Повреждающее действие изменения
барометрического давления. Поврежда-
ющее действие оказывает как повы-
шенное, так и пониженное баромет-
рическое давление. Повышенное баро-
метрическое давление (гипербария)
используется при водолазных и кес-
сонных работах, в подводном флоте и
в специальных барокамерах. Повреж-
43
V'
дающее действие гипербарии прояв-
ляется при компрессии — переходе от
нормального к повышенному давле-
нию и при декомпрессии — переходе
от высокого давления к нормальному.
При компрессии наиболее важным
фактором является повышение раство-
римости газов в крови и тканях. Это в
первую очередь относится к азоту,
который растворяясь в нервной тка-
ни, вызывает сначала наркотический,
а затем токсический эффект: головные
боли, головокружение, галлюцина-
ции, нарушение координации движе-
ний.
При быстрой декомпрессии раство-
римость газов в крови уменьшается,
в тканях и капиллярах образуются пу-
зырьки газа, что может привести к
газовой эмболии. Эмболия азотом при-
водит к характерным симптомам —
мышечным и суставным болям, судо-
рогам, нарушению функции нервной
системы.
Пониженное барометрическое дав-
ление (гипобарию) человек испыты-
вает при горных восхождениях, поле-
тах в негерметичных летательных ап-
паратах, барокамерах. Повреждающее
действие вызывается расширением га-
зов в тканях и сосудах на большой
высоте. Так, на высоте 10 км объем
газов увеличивается в 3,85 раз. Это мо-
жет привести к газовой эмболии, осо-
бенно азотной, так как с понижени-
ем давления уменьшается раствори-
мость газов в тканях и крови.
Химические факторы. Химические
болезнетворные факторы подразделя-
ются на экзогенные и эндогенные.
Экзогенная интоксикация — это
наиболее часто встречающееся воздей-
ствие на организм химических ве-
ществ, которые могут вызвать как на-
ружные повреждения тканей в форме
ожогов от действия кислот, щелочей,
некоторых солей, так и отравление
при попадании внутрь организма. От-
равление в отличие от физически 1
внешних повреждений химически i
веществами может вызвать повреж
ние организма не сразу после взаи-
действия с ними, а спустя некого >.
время, что осложняет меры по пр:
отвращению их действия.
Болезнетворным может быть и -
достаток химического вещества. Э
например, удушье при низком нап:
жении кислорода в воздухе. В некое
рых местностях отсутствие или лее;
цит йода в воде и пище приводгг
болезни щитовидной железы — эн.,
мическому зобу.
При уменьшении в почве кальц;
заменяемого стронцием, возник;
уровская болезнь, когда в костях в>
сто кальция организм использх
стронций и т.п.
Эндогенная интоксикация (aymot
токсикация) — это отравление вен.
ствами внутреннего происхождения -
промежуточными продуктами метаС
лизма, токсичными для организма
Аутоинтоксикация возникает, т
пример, в результате нарушения фут:
ции систем, обезвреживающих и эг
кретирующих токсины (печень, пс
ки и др.). Аналогичное действие мог
вызвать при обширных повреждени
тканей образующиеся биологичес
активные вещества, способные оказа
токсическое воздействие на органи:
Аутоинтоксикация вызывает нсдом
гание, разбитость, головную бог
головокружение, она может осложни
течение основного заболевания.
Следовательно, химические вс
действия имеют разнообразные мех.
низмы. Это — непосредственное р<
рушение (ожог) тканей при возде
ствии кислот, щелочей и других едк
веществ, отравление при попадай:
химических веществ в организм с п:
щей, питьем или при дыхании, нар
шение обменных процессов в органг
ме при избытке или недостатке в ср
44
I X и
г-де-
» чо-
r?oe
.~ед-
-:e-
-o,
<’?Я-
- то-
к
се-
-ТЯ,
• ~ет
ет
г
\
г
л
«.-
tSi-.r.
?а>л
:йб'<-1
ИГ -
де необходимых химических веществ
и т.п.
Биологические факторы. К биоло-
гическим болезнетворным факторам
можно отнести все виды взаимодей-
ствия человека с живыми существа-
ми, которые в результате воздействия
на организм могут нанести поврежде-
ние. Некоторые авторы условно под-
разделяют биопатогены на три груп-
пы: «макрохищники», «микрохищни-
ки» и растения.
«Макрохищники» — это животные,
которые при нападении на человека
могут механически повредить ткани
укусами или когтями, либо ввести в
организм человека яд, оказывающий
химическое повреждающее действие.
К макрохищникам относятся практи-
чески все дикие и домашние живот-
ные, рептилии и насекомые, способ-
ные нанести травму человеку.
«Микрохищники» — это мельчайшие
паразиты человека, начиная от виру-
сов, различимых только с помощью
электронного микроскопа, и заканчи-
вая различными гельминтами, видимы-
ми невооруженным глазом, которые
живут и размножаются в организме.
По мнению академика О. В. Барояна,
из огромного количества микроорга-
низмов патогенными являются более
2000 видов, из них бактерии и рик-
кетсии вызывают 1 000 видов заболе-
ваний, вирусы — 500, грибы — 500,
гельминты — 200 видов. Один и тот
же паразит может вызывать различные
заболевания в зависимости от локали-
зации.
Вирусы — это мельчайшие био-
логические объекты, способные к са-
мовоспроизведению в клетке хозяина
и находящиеся на грани между живым
и неживым по простоте своего устрой-
ства. Простейшая форма вируса — это
нуклеиновая кислота РНК или ДНК,
окруженная белковой оболочкой. Вне-
дрив в клетку свою ДНК или РНК,
вирус перестраивает обменные про-
цессы в клетке и размножается, а клет-
ка может погибнуть. Размножившийся
вирус заражает другие клетки. Уста-
новлено, что вирусы, содержащие
РНК, вызывают такие заболевания как
СПИД, полиомиелит, грипп, паро-
тит, бешенство, желтую лихорадку.
Вирусы, содержащие ДНК, вызыва-
ют натуральную и ветряную оспу, гер-
пес, бородавки и др. Доказано участие
вирусов в развитии некоторых опухо-
лей у человека и животных.
Бактерии — одноклеточные орга-
низмы диаметром от 1 мкм, которые
окружены тонкой мембраной и срав-
нительно толстой клеточной оболоч-
кой, содержат ДНК и РНК одновре-
менно. Некоторые бактерии имеют
жгутики и способны к самостоятель-
ному передвижению. Размножаются
бактерии обычно делением на две оди-
наковые части, хотя существуют на-
учные данные о простейшем половом
процессе у некоторых одноклеточных,
при котором происходит обмен гене-
тическим материалом. Часть бактерий
образует споры (покоящиеся формы),
устойчивые к неблагоприятным усло-
виям. Большинство бактерий способ-
но жить вне организма животных или
растений, обычно во влажных, теп-
лых местах. Некоторые бактерии мо-
гут жить только в организме животно-
го или человека, в межклеточном про-
странстве тканей или внутри клеток.
Многие бактерии являются в раз-
ной степени патогенными для чело-
века. Патология возникает в случае
прямого разрушения клеток ткани,
которые бактерии используют как
питательную среду, или при отравле-
нии организма выделяемыми ядови-
тыми продуктами жизнедеятельности
бактерий — экзотоксинами, или ве-
ществами, содержащимися в бактери-
альной клетке и попадающими в ткань
организма при их гибели — эндоток-
45
синами. Различные виды бактерий вы-
зывают скарлатину, менингит, чуму,
холеру, тиф и другие болезни.
Риккетсии и микоплазмы
являются по размерам и свойствам
промежуточными формами между бак-
териями и вирусами. Риккетсии слу-
жат возбудителями большой группы
заболеваний — риккетсиозов. Особую
группу составляют микобактерии, по-
крытые толстой восковой капсулой,
затрудняющей борьбу с ними. В част-
ности, микобактерии вызывают тубер-
кулез и проказу.
Простейшие, как и бактерии, яв-
ляются одноклеточными организмами.
Они более сложно устроены и имеют
некоторое сходство с клетками мно-
гоклеточных организмов. Питаются
они мелкими частицами органических
веществ, хорошо передвигаются, раз-
множаются простым делением. Это,
например, амебы, среди которых есть
и болезнетворные виды, вызывающие
амебную дизентерию; малярийный
плазмодий, который интересен тем,
что половое размножение его проис-
ходит в организме комара — перенос-
чика малярии. В результате образуется
большое количество промежуточных
клеток — спорозоитов. Проникая в
организм человека при укусе комара,
спорозоиты попадают в печень чело-
века и в ней размножаются делением
на формы, паразитирующие в эрит-
роцитах крови. При серповидной ане-
мии цикл развития паразита не мо-
жет быть завершен из-за дефекта ге-
моглобина эритроцитов. Для того
чтобы произошло дальнейшее поло-
вое размножение плазмодия, споро-
зоит должен опять попасть в организм
комара с кровью при укусе больного
малярией человека.
К простейшим относятся также
трипаносомы — вытянутые клетки
длиной 25 мкм, имеющие орган дви-
жения — жгутик. Так же, как плазмо-
дий малярии, трипаносомы име:-
двух хозяев: муху цепе и человека. П
падая в кровь человека при укусе мух
они внедряются в центральную ь
рвную систему, вызывая сонную с
лезнь.
Глисты — это черви от едва
метных особей до солитеров длин,
несколько метров и толщиной до 1 с
Паразитируя в кишечнике человек;,
тканях организма, глисты, наприм.
аскариды, захватывают пищу, осла
ляя организм, вызывают усиленна
перистальтику кишечника, в некот
рых случаях приводят к кровопотег
Печеночные двуустки, паразитируя
желчном пузыре, вызывают пирр
печени. Личинки овечьих глистов, п.
падая в печень, легкие или другие тк
ни, образуют кисты эхинококков, ра
рушающие ткани. Глисты могут вызь
вать также аллергическую реакци
организма.
Грибы — несколько более слог
ные организмы, чем бактерии. Пар.
зитические грибы, или как их час
называют «грибки», растут в виде мш
гоклеточных нитей, образующих се:
трубчатых клеток — мицелий. К гр:
бам относятся и отдельные клетк
овальные или круглые, размножают:
еся путем почкования, как, наприме.
дрожжи. Грибы могут существовать
как сочетание отдельных клеток, и
виде мицелия. Большинство грибов ь
нуждается в тканях животных для с ж
его развития. Однако некоторые вш
могут паразитировать на животны
размножаясь в кожном эпителии, ка-
например, грибок стригущего лиша
паразитирующий на коже, или гри
Candida, вызывающий молочницу
полости рта и на других слизисть:
оболочках. Как и бактерии, грибы мс-
гут внедряться в глубоко лежащие тк;
ни организма.
Социальные факторы. На человек
в силу его социальной природы во:
46
действуют факторы, связанные с со-
циальной формой существования. Без-
условно, необходимая для существо-
вания человека социальная среда яв-
ляется в то же время источником бо-
лезнетворных факторов, количество
которых с развитием человеческой
Цивилизации увеличивается в резуль-
тате антропогенного воздействия на
природу, противоречий в социальных
взаимоотношениях, неравномерно-
сти развития отдельных популяций.
К условиям, отрицательно влияющим
на здоровье человека, можно отнести
следующие:
неблагоприятную социальную об-
становку, ведущую к нарушению сло-
жившихся в обществе связей, повы-
шению роли отрицательных эмоций в
общественном сознании, а в экстре-
мальных случаях — к войне, самому
антигуманному способу разрешения
социальных проблем;
неблагоприятную экологическую
обстановку как следствие антропоген-
ных воздействий (загрязнения воздуш-
ной и водной среды вредными для
здоровья компонентами, антисанитар-
ных условий жизни, влияния произ-
водственных и бытовых факторов —
шума, электромагнитных и ионизиру-
ющего излучения и т.п.);
психическую напряженность, вы-
званную недостаточностью социально-
бытового обеспечения;
неблагоприятные бытовые условия
и соответственно недостаточность и
низкое качество отдыха;
гиподинамию и гипокинезию;
неправильный режим и недостаточ-
ность рациона питания;
вредные привычки: табакокурение,
алкоголизм, наркоманию, токсикома-
нию;
хронические психотравмируюшие
(стрессовые) воздействия.
Особенность социальных факторов,
влияющих на здоровье, заключается в
том, что они действуют совокупно,
взаимосвязаны и их усиление или ос-
лабление определяются деятельностью
человека. Обостренная социальная об-
становка влечет за собой нарушение
сложившихся условий жизни и, как
следствие, повышенное эмоциональ-
ное напряжение населения. Возника-
ют частые психоэмоциональные на-
пряжения, которые могут привести к
массовым стихийным беспорядкам,
разрешаемым с применением силы,
вплоть до военных действий. Война,
кроме того, еше больше снижает жиз-
ненный уровень населения и приво-
дит к человеческим жертвам. Помимо
непосредственного поражения людей
во время боевых действий, возникают
условия для развития эпидемий. Воз-
можность применения оружия массо-
вого уничтожения грозит уничтожени-
ем миллионов людей.
Экологические кризисы (глобаль-
ные и локальные) нередко происхо-
дят в результате неграмотного исполь-
зования природных ресурсов. В целях
решения каких-либо задач, внешне
направленных на улучшение условий
жизни (развитие промышленности,
обеспечение дополнительных ресурсов
для жизнеобеспечения населения), не
учитывается ограниченная способ-
ность природы к восстановлению. В ре-
зультате воздух, вода, почва оказыва-
ются отравленными промышленными
и бытовыми отходами, что непосред-
ственно действует на здоровье. Попу-
ляция. попавшая в условия антропо-
генно измененной среды, вынуждена
приспосабливаться к ней, вследствие
чего обостряются патологические про-
цессы.
Урбанизация, приводящая к скоп-
лению в городах огромных масс лю-
дей, сопровождающаяся развитием го-
родской промышленности, усугубля-
ет положение тем, что возникают
дополнительные источники патоло-
1.4. Общий патогенез
гни: промышленный и транспортный
шу.м, загазованность, электромагнит-
ное, а в некоторых случаях — ионизи-
рующее излучение.
Неравномерность в обеспечении
социально-бытовых потребностей соз-
дает условия для психической напря-
женности у наименее обеспеченной
части населения.
Стрессы способствуют снижению
сопротивляемости организма болез-
нетворным факторам различного про-
исхождения.
В качестве патогенных факторов
выступает также неправильная орга-
низация труда, неравномерность тру-
дового ритма, нарушения правил тех-
ники безопасности, которые ведут к
травматизму и профессиональным за-
болеваниям.
Развитие производства привело к
повышению доли нагрузок на психи-
ческую сферу человека, поскольку
физический труд вытесняется трудом
операторов сложных технических
устройств, что требует постоянного
нервного напряжения. Недостатки в
организации труда ведут к нарушению
режима отдыха, неритмичной работе
и т. п.
Качество отдыха также находится
на недостаточном уровне, поскольку
не всегда могут быть созданы условия
для каждого человека отдыхать в со-
ответствии с его объективными по-
требностями.
Повышенная психологическая на-
ствии сбалансированного рапио-
питания, с одной стороны, увлечен
различными модными системами с
роедения, голодания, раздельнь.
питанием — с другой, приводит к н
рушению нормального обеспечен,
организма необходимыми для е;
функционирования компонентами
Все указанные факторы в целом
многие из них в отдельности вызыб.
ют хроническое психотравмируюш?
воздействие на нервную систему, я
ляются стрессовыми ситуациями, ч-
помимо психического нарушения (ш
врозы, психозы) приводит и к сом
тическим заболеваниям.
Общий патогенез (от греч. pathos -
страдание, genesis — происхождение) -
это последовательность возникнов;
ния, развития и исхода патология:
ского процесса и его отдельных ст.
дий. независимо от их этиологии.
Как уже было сказано, физиолс
гические и патологические реакции
организме осуществляются по одни
и тем же механизмам. Различные г
форме и уровню проявления они ед!
ны по своей сущности и являются ре
зультатом функционирования морфе
физиологических систем. Деятельност
больного организма подчинена тем х
основным принципам, которые де1
ствуют и в здоровом организме. В т
грузка в условиях города часто соче-
тается с недостатком физических на-
грузок, поскольку все большее число
людей занимается умственным трудом
при малоподвижном образе жизни. Это
ведет к ослаблению физического то-
нуса организма, способствует накоп-
лению жировых отложений и разви-
’ тию различных заболеваний.
LB условиях дефицита пищевых про-
дуктов и их низком качестве, отсут-
48
' Т —
же время следует отметить, что пс
вреждение или разрушение биолог!
ческих структур и функциональнь:
систем — только одна сторона патолс
гического процесса. Наряду с деструь
тивными, патологическими процесс;
ми в организме действуют восстанов!
тельные механизмы. Они направлен,
на предотвращение возникновения
развития патологии, ее ликвидацию
восстановление нарушенных функш
и обозначаются понятием «саногенез»
(от лат. sanitas — здоровье, genesis —
развитие). Патогенез и саногенез раз-
виваются одновременно. В результате
их совместного действия образуется па-
тодинамическая организация функцио-
нирования организма — патологиче-
ская система. Она характеризуется
формированием новых отношений
между поврежденными и неповреж-
денными органами и тканями, в ре-
зультате которых возникают вторич-
ные, эндогенные механизмы развития
патологии (Г. Н. Крыжановский).
Непосредственно патология может
разрушать структуры организма, но не
создавать новые. Напротив, механиз-
мы приспособления обеспечивают
адаптивные реакции здорового и боль-
ного организма. Для того чтобы убе-
диться в этом, рассмотрим основные
принципы деятельности организма,
позволяющие одним и тем же систе-
мам осуществлять и адаптивные, и
компенсаторные реакции. Это позво-
лит при рассмотрении патогенеза уви-
деть, как нормальные реакции превра-
щаются в патологические и как раз-
вивается патология, превращаясь в
болезнь.
Принцип минимизации. Для того что-
бы осуществлять жизнедеятельность,
организм обменивается со средой ве-
ществом, энергией и информацией.
Усваивая различные вещества из окру-
жающей среды (пищу, воду, кисло-
род), организм использует содержащи-
еся в пище химические элементы для
построения своих белковых, углевод-
ных и других составляющих. Одновре-
менно в результате физико-химиче-
ских обменных процессов, происходя-
щих на молекулярном уровне, извле-
кается содержащаяся в пище энергия.
Она расходуется на синтез белков и
других элементов, составляющих клет-
ки, ткани и органы; осуществление
связей между системами и элемента-
ми, определяющими жизненные фун-
кции различных уровней организма
как целостности; накопление резервов
энергии, необходимой для осуществ-
ления взаимодействия со средой. При
этом в процессе приспособления жи-
вого к изменяющемуся воздействию
среды сформировался принцип мини-
мизации затрат энергии. Он выражает-
ся в том, что при нормальной жизне-
деятельности оптимальная эффектив-
ность всех процессов, внутренних и
внешних, осуществляется при мини-
мальных затратах энергии. Этот прин-
цип подчиняет себе все остальные
принципы и механизмы жизнедеятель-
ности организма, на которые в норме
расходуется энергия в количествах, со-
ответствующих потребности функци-
онирующего в данной момент органа
или системы.
Формирование принципа миними-
зации — результат того, что прогресс
в эволюции определенных форм жи-
вого вещества достигался за счет осу-
ществления двух взаимосвязанных и
противоположных механизмов, кото-
рые регулировались естественным от-
бором. С одной стороны, это повыше-
ние эффективности усвоения энергии
из окружающей среды, а с другой —
формирование принципов и процес-
сов, позволяющих регулировать рас-
ход энергии таким образом, чтобы при
минимальной ее затрате на функцио-
нирование элементов обеспечить мак-
симальный результат для организма в
целом.
Таким образом, другой стороной
принципа минимизации является ме-
ханизм минимизации структур, кото-
рый! обеспечивает деятельность эле-
ментов организма в условиях его пе-
рехода к новой норме адаптации.
Механизм минимизации структур
заключается в том, что при ограни-
ченном поступлении энергии извне,
для обеспечения энергией деятель-
d ности элементов функционирующих
H (в пределах нормы адаптации) с по-
, вышенной нагрузкой организм пере-
распределяет собственную энергию
• в рамках существующего баланса энер-
р' гии. Это перераспределение заключа-
ется в том, что в ненагруженных струк-
турах усиливаются катаболические ре-
. акции и эти структуры «сжигаются»,
а поток высвободившейся энергии и
; вещества направляется на усиление
структур, функционирующих с повы-
шенной нагрузкой. В них соответствен-
но усиливаются анаболические реак-
ции. В первую очередь разрушаются
жировые ткани, составляющие энер-
гетические резервы организма.
Следует отметить также, что расхо-
дование энергии, накопленной орга-
5 низмом при недостаточном ее возме-
г щении, зависит от важности структур
для жизнедеятельности организма. Чем
важнее роль функционального элемен-
= та для жизни организма, тем позже
начинается его катаболическое разру-
: шение. В первую очередь «сжигается»
жировая, затем соединительная и мы-
S щечная ткани. Развиваются атрофиче-
ские и дистрофические процессы, ко-
1торые могут затронуть в конечном ито-
ге и жизненно важные органы.
Патологический процесс любой
формы вызывает перераспределение
энергетического баланса организма.
При локальных патологических про-
цессах (например, при воспалении с
d последующей регенерацией повреж-
i денных тканей) требуется повышен-
' ный приток энергии на осуществление
' этих процессов, и организм осуществ-
; ляет это перераспределение. В первую
П очередь ограничиваются двигательные
4 функции пораженного органа как наи-
L1 более энергоемкие. Этому способству-
,) ет чувство боли при движении. При
J распространении патологического
процесса снижаются двигательные
Я функции всего организма с развити-
J 50
ем катаболических процессов в а . ;
щечных тканях. Часто ограничиваем J
функция пищеварения, что в св ч
очередь усугубляет дисбаланс энер! 1
в организме.
Минимизация функций структ 1
способствует усилению снабжен: I
энергией систем, обеспечивают
борьбу с болезнетворным факторе
В результате может возникнуть поре
ный круг: перераспределение вещест:
и энергии для борьбы с патологи-,
приводит к снижению способное
организма усваивать вещества и эне
гию из среды. Минимизация задейств
ванных в патологии функций и стр\
тур приводит к дальнейшему истош
нию ресурсов за счет патологическ;
процессов на клеточном и тканевс
уровнях организма.
Таким образом, принцип миним;
зации, в норме направленный на обес-
печение функционирующих структу:
непосредственно включенных в акты:
ные действия, может в определенны
условиях, как, например, при пате-
логии, выполнять отрицательную рол.
для организма.
При рассмотрении принципа ми-
нимизации мы отметили, что не вс
структуры органа или организма уча-
ствуют во взаимодействии со средой
Одни нагружены больше, другие мень-
ше. Такое неравномерное функциони-
рование присуще и структурным эле-
ментам, выполняющим одинаковы;
функции.
Такое явление было обозначено ака-
демиком РАМН Г. Н. Крыжановскш
как принцип перемежающейся актив-
ности функциональных структур. Суг_
его заключается в том, что при нор-
мальной нагрузке функциональны;
элементы любой системы «задейство
ваны» неполностью. Из общего числ:
элементов структуры, выполняющей
какую-либо функцию, активно дей-
ствует только та часть, которая обес-
«ч
печивает фактическую нагрузку. На
протяжении всего времени деятельно-
сти ткани и органа происходит заме-
на активных элементов ранее пассив-
ными, т.е. в каждый момент есть дей-
ствующие и отдыхающие элементы
функционирующей системы. При по-
вышении нагрузки на систему коли-
чество активных элементов увеличи-
вается за счет включения пассивных,
а при снижении нагрузки количество
активных элементов уменьшается. Ука-
занный принцип действует на всех
уровнях организма: от молекулярного
до организменного. В каждый момент
в норме действует количество функ-
циональных элементов, соответству-
ющее величине и виду нагрузки.
В случае нагрузки на функциональ-
ную систему, достигающей максималь-
ного для нее уровня, могут включить-
ся все ее элементы, но на короткое
время, ограниченное энергетическими
возможностями ткани или органа, со-
ставляющих функциональную систему.
Стадии патологического процесса
и болезни. При большом разнообра-
зии проявлений патологии, обуслов-
ленном как индивидуальными свой-
ствами организма, так и различием
реакций на конкретные болезнетвор-
ные факторы, патологический про-
цесс имеет общие черты, которые рас-
сматриваются в рамках общего пато-
генеза. Соответственно можно выде-
лить следующие стадии патологиче-
ского процесса и болезни:
предпатология;
латентный период патологии;
патологический процесс (предбо-
лезнь);
болезнь;
исход болезни.
Патофизиология, изучая патогенез,
не выделяет стадию предпатологии,
хотя использует такое понятие, как
«группы риска», под которым подра-
зумевается предрасположенность орга-
низма к патологическим реакциям,
когда организм еще здоров. В резуль-
тате дискутируется проблема «предбо-
лезни», под которой одни авторы по-
нимают состояние до патологии, ког-
да организм только предрасположен к
ней из-за влияния на него соответству-
ющих факторов, другие понимают
предболезнь как первичную патоло-
гию, которая ведет к болезни. По-
скольку при этом не определяются
различия в понимании таких поня-
тий, как «болезнь», «патология», то
каждая из сторон, в соответствии со
своим пониманием этих терминов до-
казывает правильность своей точки
зрения.
Предпатология — состояние орга-
низма, у которого в силу сложивших-
ся опасных внешних условий, ослаб-
ления адаптивно-компенсаторных ме-
ханизмов значительно понижен порог
резистентности к воздействию пато-
генных факторов и любое воздействие
приведет к развитию патологического
процесса.
К предпатологии относятся такие
состояния как наследственная пред-
расположенность к таким заболевани-
ям, как сахарный диабет, гипертони-
ческая болезнь, атопическая аллергия,
пародонтит и многие другие. Умерен-
но выраженное иммунодефицитное
состояние, содержание гемоглобина и
эритроцитов на уровне нижней гра-
ницы нормы относятся к категории
предпатологии, которая может раз-
виться в патологию при неблагопри-
ятных воздействиях внешней среды.
Низкое содержание минералов в кос-
тях создает риск переломов и прогрес-
сирующего разрушения тканей паро-
донта. Беременные составляют группу
риска по развитию кариеса и гинги-
вита.
Состояние предпатологии во мно-
гих случаях достоверно определяется
и в каждом отдельном случае требует
принятия мер по его устранению ме-
тодами социальной компенсации,
включая и медицинское вмешатель-
ство в необходимых случаях. В одних
случаях рекомендуются мероприятия
по усилению иммунитета, например
закаливание, в других — назначаются
диеты и пищевые добавки, содержа-
щие необходимые микроэлементы
(йод, селен, железо), кальций, фос-
фор, витамины, антиоксиданты и др.
Если группа риска объединяет боль-
шое число людей, например в очаге
эпидемии, такой мерой будет вакци-
нация населения.
Недостаточное внимание к стадии
предпатологии приводит к тому, что
врач сталкивается с уже развившейся
патологией, вместо того чтобы пред-
отвратить ее.
Начало патологического процесса
определяется природой патогенного
фактора. Травматическое повреждение
вызывает немедленную патологиче-
скую реакцию, поскольку при этом
разрушаются ткани организма, что
требует немедленной компенсации на-
рушенных травмой структур.
Латентным называется период,
в течение которого происходит скры-
тый переход от нормы к патологии.
Латентный период свойствен пато-
логии, вызываемой микропатогенами,
в этом случае он, как правило, назы-
вается инкубационным периодом. Дли-
тельность латентного периода зависит
как от вида микропатогена, так и от
индивидуальных особенностей орга-
низма и может продолжаться от не-
скольких часов при острых респира-
торных заболеваниях до нескольких
лет, например при лепре. Латентный
период начинается с момента инва-
зии микроорганизмов в организм, что
вызывает физиологическую реакцию
неспецифической системы зашиты.
Реакция человеком не ощущается до
того момента, пока популяция мик-
роорганизмов не достигнет численн
сти, при которой неспецифическ.
система защиты уже не может прот
востоять повреждающему действг
микропопуляции и включается спец,
фическая (иммунная) система.
При конституциональном иммун;
тете латентная стадия не переходит
патологическую, поскольку полнь
иммунный ответ организма происхс
дит на физиологическом уровне и б.
лезнь не развивается. Таким образе'
истинная латентная стадия осущсст
ляется у организмов, способных к ю
мунному ответу. У организмов, не пр>.
тиводействующих патогенному агент
латентная стадия не переходит в п.
тологический процесс как в защи
но-приспособительную реакцию г
болезнетворный фактор, действие кс
торого может генерализоваться и вы
вать гибель организма. Патологически
процесс возникает в этом случае
результате повреждения тканей боле:
нетворным фактором.
В случае если воздействие на орг;
низм, вызванное патологией, являе.
ся чрезмерным, происходит поврем
дение структур, ответственных за адаг
тационные реакции. Тогда адаптивнь
механизмы могут сами подвергать
дисфункции, усугубляя действие па-
тологии на организм. В этом случг
включаются компенсаторные меха-
низмы, направленные на сохранен!,
функции структуры, повреждаемой нг
грузкой. Компенсация осушествляетс
органами и системами более высоко
го уровня, чем нагруженный функцис
нальный элемент.
Понятие функционального элемен-
та сформулировал академик А. М. 4ef
нух: «Под функциональным элементо
понимается анатомо-физиологическг
основа любого органа, «пространстве:- -
но-ориентированный структурно-фун:
циональный комплекс», т.е. клеточнь
и волокнистые образования орган.
включающие все его ткани, имеющие
единое кровоснабжение, метаболизм
и иннервацию».
В любом случае основу функцио-
нального элемента составляет опреде-
ленным образом организованная си-
стема специфических клеток, выпол-
няющих основную функцию опреде-
ленного органа. Например, сердце и
скелетные мышцы включают мышеч-
ные клетки, печень — гепатоциты,
мозг — нервные клетки и т. и. При воз-
действии определенных характеристик
внешней среды на организм возраста-
ет активность соответствующих функ-
циональных систем и их элементов,
ответственных за взаимодействие с
ними. Ф. 3. Меерсон предложил назы-
вать их «доминирующими».
Таким образом, латентная стадия
заканчивается тогда, когда начинает-
ся патологический процесс, т.е. вклю-
чается компенсаторный механизм.
Поскольку этот переход происходит не
одномоментно, а по мере нарастания
воздействия патологического агента,
границу перехода физиологической
реакции в патологическую определить
невозможно и человек ощущает пато-
логический процесс, когда он уже до-
статочно развился. Например, универ-
сальный типовой патологический про-
цесс — воспаление. Но это еще не
болезнь, поскольку компенсаторные
механизмы могут остановить развитие
патологии до того, как будут наруше-
ны основные функции человека, не
допустить перехода патологии в бо-
лезнь. локализовав ее на уровне тка-
ни. Поэтому мы определяем эту ста-
дию как «предболезнь».
Дальнейшее развитие патологиче-
ского процесса приводит к перестрой-
ке энергетических обменных процес-
сов. Для функционирования компен-
саторных механизмов необходимы
дополнительные энергетические за-
траты. В связи с этим снижается энер-
гетическое обеспечение функций орга-
низма, не связанных непосредствен-
но с борьбой против патологического
агента. Снижается двигательная актив-
ность органа, движения часто сопро-
вождаются болью, снижается функция
пищеварения и т.д. Человек не может
полноценно выполнять свои соци-
альные функции. Наступает собствен-
но болезнь, когда организм все свои
ресурсы сосредоточивает на обеспече-
нии деятельности систем, ведущих
борьбу с патогенным агентом и по-
следствиями его повреждающей де-
ятельности.
Традиционно в учебниках по пато-
логии и патофизиологии выделены
четыре стадии болезни:
1) латентная (инкубационная, или
скрытая, для инфекционных болез-
ней);
2) продромальная (от первых при-
знаков до полного проявления);
3) стадия выраженных проявлений;
4) завершающая (исход болезни),
которая включает полное, неполное
выздоровление (т. е. переход в хрони-
ческую форму), смерть (клиническая
и биологическая, т.е. истинная).
Как видно, эта классификация не
учитывает стадии готовности организ-
ма к развитию патологии при воздей-
ствии внешних условий, опасных для
здоровья (т.е. стадии предпатологии);
латентный период является здесь ста-
дией инфекционного заболевания.
Предложенная нами классификация
стадий болезни основана на том же
принципе, но является более универ-
сальной, т. е. применима для различ-
ных нозологических форм, а не толь-
ко инфекционных.
Здесь следует отметить, что пере-
ход патологического процесса (пред-
болезни) в болезнь зависит от рези-
стентности организма. Организмы
в зависимости от степени резистент-
ности могут различным образом реа-
гировать на патологию. Наиболее ре-
зистентные организмы уже на стадии
предболезни способны перейти к вос-
становлению физиологических реак-
ций на патоген. При слабой резистент-
ности организма наблюдается полная
картина развития болезни, вплоть до
кризисных явлений, т.е. до момента,
когда все системы полностью вклю-
чены в борьбу с болезнью.
В резистентном организме компен-
саторные механизмы переключаются
на восстановление физиологических
реакций, ликвидацию повреждений,
нанесенных болезнью, восстановление
энергетических ресурсов организма.
Это достаточно опасный момент бо-
лезни. Организм истощен перенесен-
ной болезнью, в то же время человек
чувствует себя выздоровевшим и со-
ответственно себя ведет, теряя осто-
рожность. В результате возможно ос-
ложнение болезни, например инфи-
цирование организма другим агентом,
поскольку иммунная система еще на-
целена на борьбу с предшествовавшим
патогенным фактором. В случае выздо-
ровления восстанавливается физиоло-
гическая норма реакции приспособи-
тельных систем, а затем и возможность
возвращения к трудовой деятельно-
сти — реабилитация.
Сенсибилизированный организм
переносит болезнь наиболее остро.
Компенсаторные механизмы нуждают-
ся во все большем притоке энергии,
и организм истощается до такой сте-
пени, что не может поддерживать жиз-
ненные функции и погибает. Возмо-
жен исход, когда компенсаторные ме-
ханизмы останавливают поврежда-
ющее действие патогена, но не в силах
уничтожить его. Болезнь принимает за-
тяжной хронический характер, со сме-
нами ремиссий и обострений.
Хотя понятия физиологической и
патологической реакции противопо-
ставляются по форме их проявления,
суть их едина. И та, и другая реак-
ции осуществляются теми же самы-
ми физиологическими системами. Раз-
личие состоит в степени участия раз-
личных физиологических и морфоло-
гических систем в осуществлении
ответа на количественные и каче-
ственные различия в воздействии
факторов внешней среды на органы
и системы организма.
Исходы болезни. Исходы болезни
могут быть различными.
Выздоровление — восстановление
нарушенных функций больного орга-
низма, его приспособление к суще-
ствованию в окружающей среде и (для
человека) возвращение к трудовой
деятельности.
При полном выздоровлении в орга-
низме не остается следов тех рас-
стройств, которые были во время бо-
лезни. Адаптивные процессы и реакции
полностью восстанавливают гомеостаз
организма.
При неполном выздоровлении со-
храняются разной степени выражен-
ности нарушения функций отдельных
органов и их регуляции. Одним из по-
казателей неполного выздоровления
является рецидив (возврат) болезни.
Переход в хроническую форму — за-
тяжное. хроническое (несколько ме-
сяцев и лет) течение при неблаго-
приятном развитии болезни.
Смерть этническая — отсутствие
внешних признаков жизни (сердечной
деятельности и дыхания). Однако в
тканях сохраняются на сниженном
уровне обменные процессы. Клиниче-
ская смерть является обратимым со-
стоянием, продолжительность ее. как
правило, у человека 5 — 6 мин, после
чего развиваются необратимые явле-
ния в ЦНС и клиническая смерть сме-
няется биологической смертью.
Частым исходом болезни или пато-
логического процесса является пато-
логическое состояние, которое характе-
54
ризуется стойким изменением струк-
туры и функции органов и систем.
Патологическое состояние — это
медленно (вяло) текущий патологи-
ческий процесс (например, рубцовое
сужение пищевода после ожоговой
травмы, послеоперационный рубец,
состояние после удаления зуба и т. п.).
Патологическое состояние, как из-
вестно, характеризуется снижением
резистентности организма, что может
способствовать возникновению болез-
ни. Патологическое состояние бывает
приобретенным и врожденным. При-
мерами приобретенного патологиче-
ского состояния являются: послед-
ствие удаления зубов, когда человек
не в состоянии нормально пережевы-
вать пищу; рубцовые изменения в тка-
нях и органах после ожогов; ампута-
ция конечностей и т.д.
Патологическое состояние служит
фоном для развития нового патологи-
ческого процесса. Отсутствие зубов
повышает риск развития патологии
желудка и других отделов желудочно-
кишечного тракта. Отсутствие нижней
конечности перераспределяет нагруз-
ку на опорно-двигательный аппарат и
вызывает деформацию костей скеле-
та, в том числе позвоночника. Бакте-
рионосительство после перенесенно-
го инфекционного заболевания также
относится к патологическому состоя-
нию, так как при ослаблении имму-
нитета инфекционный процесс может
возобновиться. Остеопороз длительное
время не является болезнью, а пато-
логическим состоянием. Но при его
прогрессировании легко возникают
переломы костей.
К врожденным патологическим со-
стояниям относятся многочисленные
пороки развития: первичное отсут-
ствие зубов при дефектах развития
соединительной ткани, расщелины
губы и нёба, недоразвитие нижней
челюсти, синдром Крузона и многие
другие. Первичное иммунодефицит-
ное состояние может длительное вре-
мя не проявляться в виде болезни.
В результате стрессорных воздействий,
нарушения питания, воздействия ин-
фекции и других факторов латентно
протекающее патологическое (имму-
нодефицитное) состояние способ-
ствует возникновению болезни. Еще
раз следует подчеркнуть, что такие
состояния не являются болезнью, но
люди, имеющие эти дефекты, нахо-
дятся в группе риска и у них легче
развивается болезнь. Например, при
расщелинах нёба нарушено дыхание,
снижен иммунитет и часто развива-
ются инфекционные заболевания; не-
доразвитие нижней челюсти у детей
приводит к тяжелым нарушениям со
стороны органов дыхания. Таких при-
меров можно приводить множество.
Разработка и совершенствование
методов профилактики болезней и
пропаганда здорового образа жизни
снижает также число людей с пато-
логическими состояниями, что в свою
очередь уменьшает риск новых болез-
нен.
Контрольные вопросы
1. Что такое нозология, в чем заключа-
ется ее содержание?
2. Что такое патологический процесс?
3. Что такое патологическая реакция?
4. Что такое реактивность и резистент-
ность организма? Какова их роль в разви-
тии патологии?
5. Что такое этиология и патогенез за-
болевания?
6. Назовите и охарактеризуйте основ-
ные этиологические факторы.
7. Что такое монокаузализм. кондицио-
нализм, конституционализм?
8. Что такое патологический процесс?
9. Какие стадии болезни вам известны?
.да» - i
ГЛАВА 2
ПАТОФИЗИОЛОГИЯ КЛЕТКИ
2.1. Понятие
о физиологической,
репаративной
и патологической
регенерации клеток
Характеристика клеток. В человече-
ском организме находится около 70 —
80 триллионов клеток, осуществля-
ющих специфические функции в за-
висимости от их генетических разли-
чий. Из клеток в организме формиру-
ются все ткани: эпителиальная, мы-
шечная, нервная и соединительная.
Все клетки растущего организма
человека или животного берут начало
от одной клетки (зиготы), которая об-
разуется в результате слияния мужской
и женской гамет. Зигота содержит ге-
нетическую информацию обо всем
организме и схеме его развития. В про-
цессе эмбриогенеза зигота делится и
дает начало восьмиклеточному (5 —
7-дневному) эмбриону, клетки кото-
рого имеют единственную функцию:
передачу генетического материала. Эти
эмбриональные стволовые клетки
(ЭСК) носят название тотипотентных
клеток и еще не имеют специализации,
из них потенциально могут развиться
любые клетки и целый организм. В про-
цессе развития эмбриона формирует-
ся бластоцит, в нем эмбриональные
стволовые клетки преобразуются в
плюрипотентные стволовые клетки,
каждая из которых может создать толь-
ко определенный вид ткани. Плюри-
потентные стволовые клетки сохраня-
ются у плода, а затем и у взрослог
организма.
Стволовая клетка — это незрела-
клетка, способная к самообновленш
и развитию в специализированны;
клетки организма.
Во взрослом организме стволовы.
клетки находятся в основном в кост-
ном мозге и в меньших количества'
во всех органах и тканях: коже, семен-
никах и яичниках, мышцах, жирово;
ткани, кишечнике, нервной ткани :
даже в сетчатке глаза. Стволовые клет-
ки обеспечивают физиологическое i
посттравматическое восстановлени;
участков органов и тканей. Стволовые
клетки, получив от регулирующгг
нейрогуморальных систем сигналы ос
уменьшении клеточной популяции, п<
кровяному руслу устремляются к по-
раженному органу. В результате проис-
ходит восстановление практическь
любого повреждения, так как эти клет-
ки размножаются и дифференцируют-
ся на месте в необходимые организм;,
клетки (костные, гладкомышечные
клетки печени, сердечной мышцы,
а возможно, и в нервные).
Таким образом, стволовые клетки
являются внутренним резервом орга-
низма, который необходим для реге-
нерации органа или ткани в течение
всей жизни. Высокодиффсренцирован-
ные клетки (кардиомиоциты, нейро
ны) не делятся, в то время как менее
дифференцированные клетки — фиб-
робласты, гепатоциты частично сохра-
1-.д
няют способность к размножению и
при определенных условиях (напри-
мер, при травме или длительном уси-
лении функции) делятся и числен-
ность их увеличивается. Обшей зако-
номерностью является то, что если
клетка полностью дифференцирована,
то количество делений, которое она
может пройти, ограничено.
Особенности реакций соматических
клеток на повреждающий фактор за-
висят как от его характеристики, так
и от типа клетки, который может быть
определен по ее способности к деле-
нию. Принято считать, что по этому
признаку в организме существуют три
типа клеток (табл. 2.1).
Клетки первого типа (не обновля-
ющиеся) к моменту рождения или в
первые годы жизни достигают высоко-
специализированного состояния, но
«расплачиваются» за это полной по-
терей способности к размножению.
В организме отсутствуют источники во-
зобновления популяции этих клеток
в случае их разрушения. К таким клет-
кам относятся, например, клетки мио-
карда, особенно желудочкового отде-
ла и нейроны, фагоциты крови и тка-
ни. У ребенка есть все необходимые
нервные клетки, а в дальнейшем их
число непрерывно уменьшается в ре-
зультате «изнашивания» и гибели.
В клетках первого типа основным
способом обновления их состава яв-
ляется физиологическая внутрикле-
точная регенерация, которая развер-
тывается на уровне мельчайших струк-
тур: от молекул до органелл. Если на-
грузка на такие клетки находится в
физиологических пределах, то они
увеличиваются в размерах за счет уве-
личения массы органелл, т. е. развива-
ется гипертрофия клеток. Если функ-
циональная нагрузка на клетки чрез-
мерная, то они подвергаются повреж-
дению и погибают. В последние годы в
научной литературе активно обсужда-
ется возможность образования этих
клеток из соматических стволовых кле-
ток, мигрирующих в место дефекта из
депо (главным образом из костного
мозга) или введения извне в кровь
либо в зону повреждения, например,
Таблица 2.1
Характеристика соматических клеток
Тип Название Способность к делению Способность к внутриклеточной регенерации
Первый Мышечные, нервные, жировые, гранулоциты, макрофаги тканей Деление отсутствует. После гибели не воспроизводятся Высокая, за исклю- чением фагоцитов
Второй Паренхиматозные клет- ки: гепатоцит, гормо- нально-активная клет- ка, клетки экзокринных желез Деление редкое, но резко усиливается после травмы органа Умеренная
Третий Клетки костного мозга, кожи, слизистых оболо- чек, рыхлой соедини- тельной ткани Деление отсутствует. Непрерывно воспроиз- водится за счет низко- дифференцированных клеток Слабая или очень низкая
при инфаркте миокарда, ишемии моз-
га и т.д.
Клетки второго типа (медленно об-
новляющиеся) отличаются большой
продолжительностью жизни, их деле-
ние после полного завершения диф-
ференцировки происходит редко. При-
мером таких клеток служат гепатоци-
ты, клетки почек, хряща, рыхлой
соединительной ткани, гормонально-
активная клетка, ацинарная клетка
экзокринных желез. В покое эти клет-
ки не синтезируют ДНК, в физиоло-
гических условиях делятся редко, а при
стимуляции, возникающей, напри-
мер, после травмы, в них начинает
синтезироваться ДНК, они интенсив-
но делятся, несмотря на высокую спе-
циализацию. К факторам, которые
непосредственно инициируют митоз
клеток второго типа, относятся цито-
кины, обладающие митогенным свой-
ством. Восстановление популяций этих
клеток происходит не только в резуль-
тате их деления, но и за счет недиф-
ференцированных стволовых клеток,
которые мигрируют в поврежденный
орган и попадают в микроокружение,
способствующее делению и созрева-
нию в необходимом направлении.
Особую разновидность представля-
ет популяция лимфоцитов, которые
быстро обновляются и делятся под
влиянием интерлейкинов с митоген-
ными свойствами.
Клетки третьего типа (обновля-
ющиеся. но не делящиеся) — это мно-
гие высокоспециализированные клет-
ки: зрелые клетки костного мозга и
периферической крови (эритроциты,
гранулоциты, тромбоциты, макрофа-
ги крови и тканей), клетки кожи, сли-
зистых оболочек, которые выполня-
ют определенные функции и затем
либо изнашиваются и разрушаются,
либо слущиваются с различных по-
верхностей, причем иногда очень бы-
стро. Эти зрелые клетки подобно клет-
58
кам первого типа не способны размно-
жаться, однако в организме существ} -
ет механизм их непрерывного воспро-
изведения за счет стволовых клеток
частично дифференцированных клето.-
тканей. Частично дифференцированные
клетки находятся в зонах роста косте
и зубов, в базальном слое эпидерми-
са, в половых железах, в криптах ки-
шечника, в миелоидном и эритроид-
ном ростке костного мозга, в лимфо-
идной ткани.
Процессы физиологической внут-
риклеточной регенерации в клетка
третьего типа слабые или очень сла-
бые, но клеточное обновление про-
исходит интенсивно. Функцию заме-
щения клеток этой категории выпол-
няют не только стволовые, но и не
утратившие способности к размноже-
нию более дифференцированные клет-
ки-предшественники той же линш
(клона), которые еще не стали пол-
ностью специализированными. Ош
служат постоянным источником но-
вых клеток, которые дифференциру-
ются в зрелые и замещают соответству-
ющие специализированные клетки
утраченные организмом.
Как было сказано, реакция клетю
на действие патогенного фактора
значительной степени зависит от ее
типа. Клетки первого типа обладаю-
выраженной способностью к внутри-
клеточной регенерации, в результате
восстанавливаются утраченные части
клетки, но при условии сохранения
ядерного аппарата и трофического
обеспечения. Клетки второго типа пр,
повреждении гибнут, в них умереннс
выражена внутриклеточная регенера-
ция, но активно стимулируются ме-
ханизмы возобновления клеток за сче-
деления недифференцированных кле-
ток. Репродукция клеток третьего тип.
происходит за счет клеток-предше-
ственников довольно быстро, но он.
существенно замедляется при недоста-
точности питания, обеспечения кис-
лородом и нарушении регуляции, что
в условиях патологии встречается до-
вольно часто, например, при гипок-
сии различного происхождения, эн-
докринопатиях, интоксикации и дру-
гих нарушениях.
Следует заметить, что с возрастом,
особенно к старости, число стволовых
клеток и более дифференцированных
клеток-предшественников снижается,
что приводит к замедлению как фи-
зиологической, так и репаративной
регенерации тканей.
Регенерация. Таким образом, непре-
рывное обновление структур — реге-
нерация, является свойством в равной
степени присущим всем органам без
исключения, но в одних органах оно
проявляется в форме клеточного и
внутриклеточного обновления, в дру-
гих — исключительно в форме внут-
риклеточного (табл. 2.2).
Физиологическая регенерация явля-
ется основой любых проявлений нор-
мальной жизнедеятельности организ-
ма, а при действии экстремальных
факторов — базой для развертывания
его компенсаторно-приспособитель-
ных реакций.
Что касается клеточного обновле-
ния, то значение этого процесса осо-
бенно велико в органах, которые под-
вержены непрерывному и легкому
повреждению, например кожа, слизи-
стые оболочки, кроветворные ткани.
Репаративная регенерация, наступа-
ющая после прекращения действия па-
тогенного фактора, когда возникает
дефект ткани или клетки. Это так на-
зываемая репаративная (посттравмати-
ческая) регенерация. Примером репа-
ративной регенерации является лик-
видация повреждения тканей путем
клеточного деления, происходящая
при гибели клеток в очаге некроза
либо после механической или терми-
ческой травмы.
При воздействии на ткань патоген-
ных факторов: механических, терми-
ческих. микроорганизмов, токсинов,
когда клетки подвергаются дистрофи-
ческим и некротическим повреждени-
ям, включаются приспособительные
механизмы, называемые патологиче-
ской регенерацией.
Таблица 2.2
Регенерация клеток и тканей
Вид Характеристика Результат
Физиологическая Обновление внутриклеточных структур в течение всей жизни Обеспечение нормальной деятельности клеток и тканей
Репаративная Заживление после прекращения действия патогенного фактора Заполнение дефекта анало- гичной (полная регенерация) или соединительной (непол- ная регенерация) тканью
Патологическая Обновление внутриклеточных структур на фоне действия па- тогенных факторов (микробных, токсических, лучевых и др.). Заживление ткани в условиях патологии Возможна как полная регене- рация внутриклеточных струк- тур и клеток, так и неполная регенерация
59
Патологическая регенерация — вос-
становление тканей в условиях про-
должающегося действия патогенного
фактора — происходит в тех же фор-
мах, в которых осуществляется и фи-
зиологическая регенерация, т.е. путем
внутриклеточного обновления струк-
тур и деления клеток. Благодаря об-
новлению внутриклеточных структур
патологически измененных клеток
может произойти восстановление их
структуры и функции, наблюдается
обратимость патологических измене-
ний.
Процесс внутриклеточной регене-
рации является в природе универсаль-
ным, так как при любой болезни в
клетках возникают патологические
изменения.
Патологическая регенерация раз-
вивается в результате нарушения пи-
тания, нервной регуляции, при эндо-
кринных и иммунных нарушениях.
Она может проявляться как при фи-
зиологической, так и при репаратив-
ной регенерации и характеризовать-
ся количественными и качественны-
ми изменениями при заживлении
раны, образованием трофических язв,
ложных суставов, келлоидных рубцов.
Патологической может быть также
внутриклеточная регенерация, т.е. на-
рушение обновления внутриклеточных
структур. В качестве примера можно
привести патологическую регенера-
цию в клетках после действия иони-
зирующей радиации.
Клетки первого типа, обладающие
только внутриклеточной регенераци-
ей, относительно устойчивы к радиа-
ции, для их повреждения нужна боль-
шая продолжительность облучения и
более высокие дозы радиации.
В результате лучевого повреждения
этих клеток нарушается внутриклеточ-
ное возобновление органелл и проис-
ходит гибель клеток. В дальнейшем на
месте погибших клеток развивается
60
фиброз в результате размножения фи
робластов.
В клетках второго типа, способы
как к воспроизводству путем делени
так и к внутриклеточной регенераци
нарушаются оба процесса. В этих клс
ках в первую очередь теряется спосое
ность к воспроизводству, они предо.'
жают жить, но функционально нес:
стоятельны: фибробласт прекращав
синтез коллагена, экзокринные кле-
ки прекращают накапливать и вы;г
лять секрет. Таким же образом прож
ходит повреждение клеток кости -
остеоиитарная смерть. Дозы облучен!
для поражения клеток второго типа -
меньшие, чем для клеток перво:
типа.
Клетки третьего типа довольь
устойчивы к облучению, но резко гг
рушается процесс их непрерывно:
воспроизводства. Это связано с те'
что клетки-предшественники, обес-
печивающие в норме обновление пс
кровных тканей и систему кроветвс
рения, наиболее чувствительны к ос
лучению. Их радиационное поражен7
ведет к патологическому митозу, в ре
зультате которого клетка либо поги-
бает в период митоза, либо соверша-
ет ряд делений после облучения
погибает («репродуктивная» смерт
клетки).
Тот факт, что чем быстрее делите
клетка, тем она более чувствительн
к радиации, положен в основу npi
менения лучевой терапии, направлеь
ной на повреждение опухолевых клс
ток и сохранение нормальных.
В тканях, в которых физиологиче-
ская регенерация происходит путе
непрерывного обновления клеточне-
го состава (третий тип клеток), таки
же образом обеспечивается ликвида-
ция повреждения и восстановление ис-
ходной массы тканей (например, нор
мализиция численности клеток кров
после кровопотери, восстановлен):.
непрерывности эпителия кожи и сли-
зистых оболочек).
В клетках второго типа, в которых
регенерация происходит как с помо-
щью внутриклеточного механизма об-
новления, так и клеточного, регене-
рация после повреждения осуществля-
ется также двумя путями: увеличением
численности клеток за счет деления
зрелых клеток и клеток-предшествен-
ников {гиперплазия) и возрастанием
массы органелл и других внутрикле-
точных структур в сохранившихся
клетках {гипертрофия).
В клетках первого типа, в которых
физиологическое обновление происхо-
дит только благодаря внутриклеточно-
му механизму (миокард, нервные клет-
ки), нормализация нарушенных функ-
ций ткани осуществляется за счет ги-
пертрофии внутриклеточных структур.
В результате внутриклеточных про-
цессов регенерации происходит либо
восстановление структуры и числа
органелл поврежденной клетки (соб-
ственно внутриклеточная регенера-
ция), либо увеличение числа органелл
в сохранившейся клетке после гибели
другой клетки (компенсаторная гипер-
плазия органелл, сопровождавшаяся
гипертрофией клетки). В итоге в обоих
случаях происходит нормализация
функции органа (Д. С. Саркисов, 1991).
Регенерация может быть полной и
неполной.
Полной называется регенерация,
в результате которой дефект ткани за-
полняется аналогичной тканью, и ме-
сто повреждения полностью исчезает.
Эта форма регенерации характерна для
клеточного типа замещения утрачен-
ной ткани (костный мозг, эпителий
кожи и слизистой оболочки). Если в
патологически измененных клетках
произойдет замена ультраструктур на
новые, «здоровые», то такая внутри-
клеточная регенерация также называ-
ется полной.
Неполная регенерация происходит
главным образом в тканях, для кото-
рых свойственна как гиперплазия, так
и гипертрофия клеток, окружающих
дефект, а он сам, образующийся, на-
пример, в результате некроза замеща-
ется соединительной тканью. Неполная
регенерация характерна для тканей с
внутриклеточной регенерацией (сер-
дце, центральная нервная система).
Своеобразной формой неполной
регенерации является «регенерация на
отдалении». При поражении почек,
например, происходит качественное
изменение клеток кожи, которая при-
обретает способность выводить конеч-
ные продукты метаболизма из организ-
ма. После обширной резекции тонкой
кишки наблюдается компенсаторная
гиперплазия главных клеток желудка
с усилением ферментативной актив-
ности желудочного сока. В основе этих
процессов лежит гиперплазия на уль-
траструктурном (увеличение числа
органелл) и клеточном (увеличение
числа клеток) уровнях за пределами
области повреждения.
2.2. Механизмы
приспособления клеток
к изменяющимся
условиям
функционирования
тканей. Действие
возросшей нагрузки
на клетку
Функциональная нагрузка на клет-
ку, вызванная действием факторов
среды, вызывает приспособительные
изменения в этой клетке, влияя в пер-
вую очередь на ее генетический аппа-
рат. В дальнейшем эти приобретенные
в ходе жизни изменения (т.е. феноти-
пическое приспособление) не насле-
дуются, а определяют вместе с наслед-
61
ственными признаками фенотип —
индивидуальную характеристику орга-
низма.
По мнению Ф.З. Меерсона, выде-
ляются общие черты возрастания по-
вышенной нагрузки на клетку, кото-
рые заключаются в формировании
срочного и долговременного периода
адаптации (термины «приспособле-
ние» и «адаптация» используются здесь
как синонимы). Он считает, что сроч-
ный этап адаптационной реакции воз-
никает непосредственно после начала
действия раздражителя и, следователь-
но, может реализоваться лишь на ос-
нове готовых, ранее сформированных
физиологических механизмов; долго-
временный этап адаптации возникает
постепенно, в результате длительно-
го или многоразового действия на
организм факторов среды. На приме-
ре сердечной мышцы выделены четы-
ре стадии реакции клетки на повы-
шенную нагрузку (табл. 2.3).
Первая, аварийная, стадия характе-
ризуется тем, что возросшая нагрузка
на орган приводит к мобилизации
функционального резерва. Следова-
тельно. дифференцированная клеть,
выполняет тот же минимум функциг
но более интенсивно, используя име-
ющиеся в ее составе сократительны,
белки, органеллы, ферментные си-
стемы.
При этом в результате усилени
функции клетки расход АТФ в эту ста-
дию превосходит ее ресинтез, т. е. воз-
никает дефицит макроэргов и разви-
вается функциональная недостаточ-
ность органа. При уменьшении нагруз-
ки до прежней величины происходи-
восстановление функции клетки. Од-
нако при значительном дефиците АТС
вследствие комплекса метаболически:
нарушений возможно повышение про-
ницаемости лизосомальных мембран
повреждение других клеточных струк-
тур, что усиливает функциональную:
недостаточность клеток.
Вторая, переходная, стадия адапта-
ции характеризуется тем, что актива-
ция генетического аппарата приводш
в конечном счете к увеличению массь
клеточных структур. Таким образом
уменьшается нагрузка на каждую функ-
ционирующую единицу гипертрофи-
Таблица 2.;
Реакция клетки на повышенную нагрузку (по Ф. 3. Меерсону)
Стадия Внутриклеточные изменения и их механизмы
1 — аварийная Мобилизация функционального резерва клетки, преобла- дание расхода АТФ над синтезом
II — переходная Активация генетического аппарата с последующим увели- чением массы клеточных структур. Восстановление содер- жания АТФ, увеличение функциональной активности клет- ки
III — устойчивая Стабилизация синтеза РНК, белков и АТФ на новом уров- не адаптации, соответствующем повышенной нагрузке на клетку
IV — патологическая Развивается при чрезвычайных и постоянных нагрузках. Ис- тощение резервных возможностей генетического аппарата, недостаточность генерации РНК, белка и АТФ, наруше- ние внутриклеточной регенерации, гибель клеток
62
рованной клетки и восстанавливается
концентрация АТ Ф. Скорость синтеза
РНК, белка клетки и ее функция нор-
мализуются. Активация синтеза нукле-
иновых кислот и белков, формиру-
ющих основные структуры клеток
функциональной системы, специфи-
чески ответственна за приспособле-
ние, что определяется термином «си-
стемный структурный след» (Ф.З. Ме-
ерсон), благодаря которому увеличи-
вается функциональная мощность си-
стем адаптации, и становится возмож-
ным превращение срочной адаптации
в долговременную.
Третья стадия, устойчивой адапта-
ции, характеризуется тем, что масса
клетки сохраняется увеличенной, син-
тез РНК, белка и АТФ стабилизиру-
ется на нормальном, но более высо-
ком уровне, необходимом для обнов-
ления увеличенной массы клеточных
структур.
Четвертая стадия развивается при
очень интенсивных и длительных на-
грузках, их многократных повторени-
ях. В этой стадии происходит превра-
щение адаптационной реакции в па-
тологическую, обозначенную Ф. 3. Ме-
ерсоном как «локальное изнашивание
доминирующих в адаптации систем».
В этой стадии генетический аппарат
исчерпал возможности и уже не мо-
жет обеспечивать повторные приспо-
собления к таким нагрузкам путем ге-
нерации новых порций РНК и белка.
В итоге происходит вначале гибель
внутриклеточных структур из-за невоз-
можности их обновления, затем гибель
специализированных клеток и замеще-
ние их соединительной тканью. Такой
механизм повреждения клеток вслед-
ствие их длительной гиперфункции
с последующей функциональной не-
достаточностью характерен для раз-
личных специализированных клеток
(сердца, почек, нервных центров,
эндокринных и экзокринных желез).
Следует заметить, что ускорение
изнашивания и локального старения
клеток при их гиперфункции проис-
ходит на фоне генетически ослаблен-
ных систем, ответственных за компен-
саторное увеличение синтеза РНК и
белка, необходимых для структурного
обеспечения функции клетки в усло-
виях ее гиперфункции.
2.3. Пути поступления
веществ в клетку
Проникновение болезнетворных
факторов в клетку происходит тем же
путем, что и поступление естествен-
ных метаболитов. Все механизмы по-
ступления веществ в клетку можно
разделить на две категории: пассив-
ный, или энергонезависимый (диффу-
зия), и активный, или энергозависи-
мый транспорт.
Пассивный транспорт. Пассивная
(свободная) диффузия в свою очередь
подразделяется на простую и облег-
ченную.
При простой пассивной диффузии
происходит поступление веществ из
зоны с более высокой концентрацией
в зону с меньшей концентрацией без
участия переносчиков. Таким образом
в клетку поступают кислород и угле-
кислый газ, а также жирорастворимые
вещества, легко растворяющиеся в ли-
пидной цитоплазматической мембра-
не клетки.
Диффузия прекращается, когда
исчезает градиент концентрации, т.е.
вещество равномерно распределяется
по обе стороны границы между зона-
ми. Аналогичным образом в клетку бы-
стро проникают жирорастворимые бо-
лезнетворные вещества, например че-
тыреххлористый углерод, метилмет-
акрилат, дихлорэтан и многие другие,
применяемые в медицине, промыш-
ленности и др.
63
При облегченной пассивной диффу-
зии свободно поступают вода и водо-
растворимые вещества (в том числе
патогенные факторы) через каналы
цитоплазматической мембраны по
электрохимическому градиенту без
затраты энергии.
Осмос также является пассивным
способом транспорта воды. С помощью
осмоса вода диффундирует через ци-
топлазматическую мембрану, которая
является границей раздела двух вод-
ных сред, отличающихся разными
концентрациями растворенных ве-
ществ. Вода диффундирует в сторону
более высокой концентрации осмоти-
чески активных веществ, главным об-
разом электролитов. При этом обяза-
тельным условием является непрони-
цаемость клеточной мембраны для
растворенных в воде веществ.
Активный транспорт. В отличие от
пассивного активный транспорт — это
перенос веществ через мембрану про-
тив химического, электрического и ос-
мотического градиентов, т.е. в направ-
лении более высокой концентрации
вещества. Активно транспортируются
моносахара, аминокислоты, жирные
кислоты. Это происходит с помощью
систем переносчиков, т.е. транспорт-
ных систем, расходующих энергию
макроэргов, но без расходования
мембраны клетки. Эти энергозависи-
мые системы называют также насо-
сами. Типичным примером активно-
го транспорта является деятельность
NaVlC-насоса, который при участии
АТФ перекачивает ионы Na+ из клет-
ки, препятствуя их накоплению и,
следовательно, увеличению в клетке
осмотического давления и ее набуха-
нию. Ионы К' из клетки пассивно диф-
фундируют во внеклеточное простран-
ство, вследствие того, что их концен-
трация в клетке больше, чем вне ее.
Благодаря деятельности Na7f<?-насо-
са ионы К" возвращаются внутрь клет-
ки. Активный транспорт многих пр
стых водорастворимых веществ ocyiL-
ствляется также путем энергозавис
мого образования комплексов с Бег-
ствами белковой структуры чер.
цитоплазматические каналы для иое
К+, Na+, Са2+ и Mg2+. В этом процес
участвуют ферменты — пермеазы.
Прекращение деятельности это
насоса происходит при снижении и.
прекращении синтеза АТФ, тогда кле
ка набухает, а мембранный потенцп-
уменьшается и исчезает. Такую клет
следует считать погибшей.
Таким образом, в основе механг
ма активного транспорта лежит фун
ционирование в мембране сложно-
комплекса веществ, осуществляют
специфический и ориентированнг
перенос субстрата. Путем активно:
транспорта переносятся также йог
сульфата, железа, некоторые азотист:
основания, желчные кислоты, витам
ны. Аналогичным образом может ос.
ществляться активный транспорт
клетку7 патогенных факторов, имеют-
химически сходную структуру с уг,Щ
водами, жирами, белками и др.
Рассмотренные механизмы посту
ления веществ в клетку не связаны
затратой субстрата цитоплазматич.
ской мембраны клетки в отличие :
двух других процессов — эндоцито:
и экзоцитоза.
Эндоцитоз является способом п.
ступления в клетку различных В:
ществ, в том числе и патогенных. Эг
доцитоз связан с затратой АТФ
включает два процесса: фагоцитоз
пиноцитоз.
Под фагоцитозом понимак
процесс захвата клеткой извне и вт
гивание в себя какой-либо частит
или макромолекулярного агрегата.
Явление фагоцитоза (чаще все
таким образом в клетку попадают б;
терии) тесно связано с наличием
клетках лизосом, которые являют.
64
-ро-
'ле-
<и-
s=_ue-
грез
нов
;ссс
эго
.ши
1ЭЛ
<13-
чк-
к - эго
• лих
г - ый
Е - ЭГО
НН
- гые
- 1И-
-'V-
в
-ИХ
<е-
п-
< с
от
за
э-
--Ч-
и
и
-эт
~Ч-
_ы
мембранными органеллами клеток
практически всех типов. Лизосома,
которая отпочковывается от зрелой
поверхности стопки комплекса Голь-
джи, называется первичной лизосомой.
Она может взаимодействовать с час-
тицами. внесенными в клетку извне,
или с разрушенными органеллами и
ненужными веществами, образующи-
мися в самой клетке. При этом фор-
мируется пузырек, в котором находит-
ся как подлежащий перевариванию
материал, так и лизосомальные фер-
менты.
При соприкосновении с частицей
клеточная мембрана окружает ее со
всех сторон, образуя маленький мемб-
ранный мешочек, который называет-
ся фагоцитозным пузырьком. Внутрен-
ний слой клеточной мембраны стано-
вится наружным слоем мембраны
пузырька. Затем пузырек с содержа-
щейся частицей отделяется от клеточ-
ной мембраны и погружается вглубь —
в цитоплазматический матрикс, где он
становится фагосомой. Когда послед-
няя встречается с лизосомой, наруж-
ные слои мембраны обоих пузырьков
соприкасаются так, что в месте кон-
такта они сливаются, и лизосома че-
рез отверстие выделяет свое содержи-
мое в фагосому.
Таким образом, два пузырька пре-
вращаются в один, который уже на-
зывается вторичной лизосомой или
фаголизосомой. С ней могут сливаться
и другие первичные лизосомы. Кроме
того, несколько вторичных лизосом
могут сливаться вместе. В результате
создаются условия для ферментативно-
го переваривания материалов, содер-
жащихся в фаголизосоме. После этого
во вторичной лизосоме остаются веще-
ства — продукты переваривания, ко-
торые в конечном счете выталкивают-
ся из клетки путем экзоцитоза.
Наиболее эффективно уничтожают-
ся микроорганизмы с помощью фаго-
цитов — макро- и микрофагов, на ци-
толемме которых есть рецепторы для
иммуноглобулинов, специфически свя-
занных с мембранами микробов. Чуже-
родная частица втягивается вместе с
рецептором и частью цитоплазмы
внутрь фагоцита, соединяется с лизо-
сомами и быстро переваривается.
Вторым способом попадания пато-
генного фактора в клетку является
пиноцитоз (микровезикулярный
транспорт), при котором жидкость
втягивается в виде пузырьков. Этот
процесс принципиально сходен с фа-
гоцитозом. Механизм пиноцитоза за-
ключается в следующем. Белок при-
крепляется к внешней мембране клет-
ки, что приводит к образованию на
ней углубления, которое превращает-
ся в пузырек, двигающийся в цито-
плазму вместе с участками цитоплаз-
матической мембраны. К поверхности
пузырька прикрепляются лизосомы,
из которых выделяются гидролитиче-
ские ферменты, расщепляющие
сложные вещества на более простые,
которые могут быть использованы
клеткой. Непереваренные вещества
остаются в пузырьке или удаляются
через цитоплазматическую мембрану
в окружающую среду.
Экзоцитоз является также стандарт-
ной функцией клетки, выражающей-
ся в освобождении во внеклеточную
жидкость растворимых продуктов. Сек-
реторная гранула, образованная с по-
мощью комплекса Гольджи, прикреп-
ляется к внутренней поверхности кле-
точкой мембраны, которая раскрыва-
ется, высвобождая содержимое во вне-
клеточное пространство. Процессы
экзоцитоза лежат в основе секретор-
ного процесса, необходимого дня пи-
щеварения, деятельности экзокрин-
ных желез, передачи нейросекрета
и т.д. Экзоцитоз требует энергии
АТФ, поэтому недостаточность в
энергообеспечении клетки вызывает
65
нарушение ее секреции. Другим веду-
щим механизмом нарушения экзоци-
тоза является недостаточная фермен-
тативная активность клетки, как пра-
вило, вследствие нехватки лизосо-
мальных ферментов, а также патоло-
гии цитоплазматической и внутренних
мембран клетки.
В процессе жизнедеятельности клет-
ки происходит обновление внутрикле-
точных структур. Митохондрии, фраг-
менты гранулярного эндоплазматиче-
ского ретикулума и другие органеллы
в результате изнашивания и повреж-
дения перестают функционировать и
тогда они с помощью мембраны обо-
собляются от остальной цитоплазмы
подобно фагосомам (в этом случае они
называются аутофагосомами), слива-
ются с лизосомами и подвергаются пе-
ревариванию.
Еще одним активным механизмом
поступления патогенного фактора в
клетки является эндоневральный и
ретроградный аксонный транспорт.
Эндоневральный транспорт — это
поступление нейротропных токсинов
и вирусов, возбудителей лепры и дру-
гих болезней с тканевой жидкостью в
эндоневральные пространства нервных
стволов, а затем с током эндоневраль-
ной жидкости в ЦНС. Скорость дви-
жения эндоневральной жидкости со-
ставляет около 2—3 мм/ч.
Ретроградный аксонный транспорт
отличается тем, что он происходит в
результате адсорбционного эндоцитоза
патогенных агентов в области терми-
налей аксона. Сущность адсорбцион-
ного эндоцитоза заключается в том,
что патогенные факторы, к которым
относятся токсические белки расти-
тельного или животного происхожде-
ния, дифтерийный токсин, холерный
вибрион, яд рицин соединяются с ре-
цепторами цитоплазматической мемб-
раны. Затем вместе с этими рецепто-
рами и участком мембраны токсиче-
ские вещества поступают к эндоп.:
матической сети, а затем к компле
Гольджи и лизосомам. Особенное:. -
этих пузырьков является то, что с
окружены белком кластрином (поэ-
му их называют кластерами), котор.
защищает пузырьки от лизосомалы-:
ферментов, в связи с чем патогенн
фактор остается непереваренным
способен нарушать действие ферме
тов преимущественно белкового ci
теза.
Если процесс адсорбционного
доцитоза происходит в области терз
налей аксона, то перемещение г
зырьков-кластеров в сому нейрона
ретроградным током аксоплазмы н
рушает деятельность нервной клеть.
Это происходит при действии токе
нов столбняка и ботулизма.
Следует заметить, что механп
адсорбционного эндоцитоза дейстс
ет и в норме для обеспечения норма,-
ного метаболизма. Так, регуляторн
пептиды, такие как факторы рос-
нервов и эпителия, цитокины, нек
торые гормоны и медиаторы, связ.
ваются со специфическими рецепт
рами клеток, втягиваются в цитопль
му вместе с мембраной и рецепторе
и также окружаются белком кластр:
ном. Однако при подходе к лизосо:
эти пузырьки подвергаются действе
лизосомальных ферментов, а венд
ства, содержащиеся в них, освобо:
даются и проявляют свою активнос-
как регуляторные факторы.
Таким образом, действующий
нормальных условиях механизм аз
сорбционного эндоцитоза, направле-
нье на регуляцию функции клеток
помощью биологически активных Б;
ществ, вызывает при поступлеш:
нейротропных факторов тяжелые н
рушения функций клеток, в перв>
очередь центральной нервной сист
мы, часто приводящие к смертс.пы
му исходу.
66
:зз-
.-.су
7ЬЮ
ни
.-го-
няй
-ых
-ый
' и
' ен-
• !Н-
эн-
" ш-
“ лу-
-а с
на-
• жи.
:и-
Гистогематический барьер. В меха-
низме проникновения различных ве-
ществ, в том числе патогенных фак-
торов, в клетку большая роль принад-
лежит межклеточным контактам,
которые представляют собой особые
структуры и бывают разных типов:
плотные, щелевидные и адгезивные.
В зависимости от характера соеди-
нения клеток между ними и кровью
формируется гистогематический ба-
рьер. Он регулирует поступление из
крови в органы и ткани необходимых
энергетических и пластических ве-
ществ и выведение продуктов мета-
болизма, что обеспечивает постоян-
ство состава тканевой жидкости, пре -
пятствуя поступлению из крови в
органы и ткани чужеродных и ядови-
соединительнотканные структуры и
тканевая жидкость, состав которой
зависит от состояния микроциркуля-
торного русла и особенностей капил- 5
лярной стенки, поступления веществ
из крови, уровня метаболизма орга-
на, транспорта продуктов метаболиз-
ма и клеток в тканевую жидкость и i
далее в кровь. В основе этих процессов
лежит пассивный и активный транс-
порт веществ. Активность механизмов |
транспорта меняется в соответствии с !
условиями функционирования органа
и ткани. Третьим компонентом гисто- f
тематического барьера являются барь-
ерные компоненты клетки: гликока-
ликс, цитоплазматическая мембрана,
внутриклеточные мембраны органелл,
система канальцев.
:зм
зу-
’>_7Ь-
" -ые
:та
:<0-
-Ы-
- *0-
'•-ЦЗ-
тых веществ.
К гистогематическому барьеру от-
носятся все барьерные образования
между кровью и клетками, в том чис-
ле специализированные барьеры — ге-
матоэнцефалический. гематоофгалъ-
мический, гематосаливарный и др.
Специализированные барьеры облада-
ют высокой селективной (избиратель-
ной) проницаемостью.
:эм
Структура гистогематического ба-
В механизме защиты клетки особая
роль принадлежит гликокаликсу —
довольно толстому слою, состояще-
му из гликопротеидов, гликолипидов,
протеогликанов и других соединений.
Отрицательный заряд цитоплазмати-
ческой мембраны в значительной сте-
пени зависит от наличия в гликока-
ликсе сиаловых кислот. Благодаря гли-
кокаликсу клетки распознают себе
подобные клетки, предотвращают
КДИ-
< че
!Ю
рьера определяется в значительной
степени строением органа, его мор-
фологическими и физиологическими
аутолиз, обеспечивают адгезивные
свойства и регулируют поступление ве-
ществ из межклеточного пространства
_е- особенностями. Первым структурным
.к- компонентом этого барьера является
.ть капилляр. Эндотелий капилляров в
разных органах имеет характерные
в морфологические особенности (не-
л- прерывный, перфорированный, фе-
Г'-Щ- нестрироваиный). Непосредственно
•_ с под эндотелием располагается базаль-
ная мембрана. Перикапиллярный слой
- :и представлен основным веществом,
-а- которое является высокореактивным
ю и лабильным звеном этой части гис-
тогематического барьера, и волокни
стыми структурами, в основном кол-
лагеном. Второй компонент барьера
в клетку.
Значение гистогематического барь-
ера заключается в задержке перехода
того или иного вещества из крови в
ткани (защитная функция) и в созда-
нии оптимальных условий для жизне-
деятельности клеток (регуляторная
функция), что способствует сохране-
нию клеточного и органного гомео-
стаза.
При действии различных патоген-
ных факторов возможно повреждение
как внешних, так и внутренних барь-
еров или их одновременное наруше-
ние. Повреждение внешних барьеров
67
вызывает недостаточность их функций
с развитием соответствующей патоло-
гии. Например, при патологии верх-
них дыхательных путей развивается не-
достаточность их барьерной функции,
и патогенные факторы, проникая во
внутреннюю среду, взаимодействуют
с внутренними барьерами. При этом
включаются дополнительные барьер-
ные механизмы, недостаточность ко-
торых будет способствовать развитию
патологического процесса, например
воспаления.
Причины нарушения гистогемати-
ческого барьера разнообразны: изме-
нения проницаемости сосудов, уров-
ня pH, действие ядов, токсинов, ле-
карственных веществ, облучение, на-
рушение нервной регуляции и др. Эти
факторы могут действовать преиму-
щественно на различные звенья ба-
рьера: капиллярную стенку, мембран-
ную систему клеток, соединительно-
тканные структуры и тканевую жид-
кость.
Гистогематические барьеры облада-
ют большой пластичностью и зависят
от возраста, состояния вегетативной
нервной и эндокринной систем, вне-
шних и внутренних воздействий. При
патологии барьерные функции неред-
ко изменяются, проницаемость барь-
ера повышается или снижается, что
может усугублять или ослаблять раз-
витие патологических изменений в
тканях.
Таким образом, барьерные функ-
ции в организме играют важнейшую
роль в защите клеток органов от пато-
генного воздействия и развития раз-
личных форм патологии в организме.
Нарушение или недостаточность барь-
ерных свойств слизистой оболочки
полости рта и пародонтального барь-
ера играет ведущую роль в развитии
стоматита, гингивита, пародонтита,
пародонтоза, других стоматологиче-
ских заболеваний.
2.4. Причины
повреждения клеток
и характеристика
патогенных факторов
Результат повреждения зависит
от свойств самого патогенного (]
тора, так и состояния клетки. Па
генные факторы традиционно де.:
ся на физические, химические и би
гические.
Болезнетворные агенты чаще вс:
действуют не изолированно, а в сс
тании. причем последовательность
действия может меняться, напри.v
в зависимости от цикла развития м
роорганизма, вируса, плазмодия и'
Реакция клетки на разнообразь
патогенные факторы имеет как нес
цифические черты, которые не за:
сят от характера воздействия и п
клетки, так и специфические особ;
ности. Далее будут рассмотрены тип
ные нарушения органелл клетки.
Патология клеточных мембр:
Определены четыре ведущие при1
ны, приводящие к нарушению ба;
ерной функции мембран: 1) перек
ное окисление липидов; 2) дейст:
эндогенных липаз; 3) осмотичес:
(механическое) растяжение мембр.
4) адсорбция на липидном слое чу>
родных белков или полиэлектроли:
(Ю. А. Владимиров).
Указанные причины приводя:
увеличенной проницаемости клетс
ных, в том числе цитоплазматическ
мембран.
При первичном повреждении ме:
раны клетки может измениться чис
каналов, их функция, нарушение ме
бранного ионного транспорта, L
приведет в конечном счете к пато:
гии клетки.
В процессе повреждения клеточн.
структур важнейшая роль принадлед
свободным радикалам: гидроксилы
68
‘t. :e-
-ЗИ-
’.ла
Сн-
1.ЛМ-
1.
’Ч,н.
»-Ji-
’s. ?ь-
гл ле
ft. -.эе
5! ,J_
: эв
й
му радикалу ОН' и одному из липид-
ных радикалов — L’, LO' или LO2,
либо всем трем радикалам (Ю. А. Вла-
димиров). Гидроксилрадикал ОН' —
трехэлектронная форма восстановлен-
ного кислорода. В клетках он в основ-
ном образуется при взаимодействии
Н2О2 и супероксиданионрадикала О2:
Н2О2 + О2 -» он- + ОН’ + О2
Реакция активируется ионом Fe2+.
Роль кислорода заключается в восста-
новлении ₽е3+до Fe2+, а ОН’ образу-
ется при разложении Н2О2 ионом Fe2'.
Другие восстановители также спо-
собны взаимодействовать с О‘2, обра-
зуя ОН'. Гидроксилрадикал как трех-
электронная форма восстановленно-
го кислорода образуется и другим
путем:
Н2О2 + ё —> Н2О + ОН'
Двухэлектронная форма восстанов-
ленного кислорода Н2О2 образуется в
результате реакции дисмутации ради-
калов супероксида, которая развива-
ется либо спонтанно (медленно), либо
в результате каталитического дей-
ствия фермента супероксиддисмута-
зы (СОД):
О2 + е + 2Н+ —> Н2О2
к
о
о
О2 + О'2---> Н2О2 + О2
В свою очередь одноэлектронная
форма восстановленного кислорода О2
образуется преимущественно клетка-
ми-фагоцитами при их активации в
результате окисления НАДФ Н моле-
кулярным кислородом, а также в ми-
тохондриях и мембранах эндоплазма-
тического ретикулума. Эти процессы
активизируются при частичном по-
вреждении митохондрий и при микро-
сомальном окислении токсичных ве-
ществ. Одним из ферментов, осуще-
ствляющих одноэлектронное восста-
новление кислорода до супероксидно-
го радикала, является ксантиноксида-
за, окисляющая ксантин до мочевой
кислоты:
Гипоксантин + Н2О + 2О2 ->
-» Ксантин + О2 + 2Н+
Ксантин + Н2О + 2О2 ->
—> Мочевая кислота + 2О2 + 2Н+
В условиях патологии, например
при ишемии, происходит усиление
активности этого фермента.
Сам по себе О‘2 малоактивен по
отношению к клетке, как и перекись
водорода. Нов присутствии ионов же-
леза эти два вещества вступают в ре-
акции с образованием гидроксильных
радикалов:
Fe3+ + О2 Fe2+ + О2
Fe2+ + Н2О2 -» Fe3+ + ОН- + ОН’
О2 + Н2О2 -» О2 + ОН + ОН'
Концентрацию супероксидных ра-
дикалов снижает фермент супероксид-
дисмутаза (СОД). Фермент каталаза
метаболизирует пероксид водорода,
снижая таким образом его содержание.
Скорость этой реакции уменьшается
при снижении в среде тиоловых со-
единений, в первую очередь восста-
новленного глютатиона. Уменьшение
содержания тиолов вызывает актива-
цию образования кислородных ради-
калов О2 и ОН ’. Концентрация в плаз-
ме крови свободного двухвалентного
железа имеет минимальную величи-
ну за счет окисления Fe2+ до Fe3+ бла-
годаря наличию церулоплазмина без
образования свободных радикалов.
Внутри клеток окисление Fe2+ до Fe3+
происходит благодаря ферритину.
В дальнейшем ион Fe3+ связывается
транспортным белком — трансферри-
ном и депонирующими белковыми
комплексами — ферритином и лакто-
феррином. Все процессы, связанные с
повреждением клеток свободными ра-
69
дикалами кислорода, обусловлены ак-
тивацией систем, генерирующих су-
пероксидный радикал, либо угнетени-
ем активности защитных систем, либо
сочетанием этих причин.
Основными мишенями гидроксиль-
ных радикалов являются нуклеиновые
кислоты и липиды мембран клеток.
Например, разрыв нитей ДНК лежит
в основе медленно развивающихся
процессов мутагенеза, в том числе
канцерогенеза, старения, действия
радиации, аутоиммунных поражений
и др.
Что касается быстрых цитотокси-
ческих эффектов гидроксильных ради-
калов, то они связаны с их действием
на липиды мембран благодаря иници-
ации реакций перекисного окисления
липидов. Образование пероксидов ли-
пидов (L‘, LO" или LO'j) из цепей
ненасыщенных жирных кислот фосфо-
липидов при отсутствии образования
свободных радикалов угасает благода-
ря взаимодействию радикалов между
собой или с антиоксидантами, к ко-
торым относится а-токоферол, жен-
ские половые гормоны, тироксин и
другие фенольные соединения.
В условиях усиления образования
свободных радикалов кислорода, на-
пример при избытке Fe2’1, снижении
уровня тиоловых соединений, недоста-
точности «липидных» антиоксидантов,
происходит усиление перекисного
окисления липидов, что обусловливает
быстрые токсические воздействия на
мембрану. Такой механизм установлен
при гипоксии, ишемии, имеет важ-
ную роль в инициации воспаления
и г.д.
Благоприятное действие а-токо-
ферола или других антиоксидантов
(ионола и т.д.) является доказатель-
ством участия пероксидации липидов
в патогенезе повреждения клеток и
заболеваний. Вместе с тем антиокси-
данты оказывают и неблагоприятное
действие, подавляя липоксидаз!:
путь образования лейкотриенов и уг-
тая тем самым некоторые звенья :
мунного ответа и деления клеток.
Водорастворимые продукты ш
оксидного окисления липидов вы:
вают избирательное увеличение п:
ницаемости для радикалов Н' и 0-
а возможно, те для ионов Са2+ и д:
гих катионов. Одновременно с эт
под влиянием перекисного окислен
липидов происходит разрушение S -
групп, что увеличивает проницаемо,
мембран митохондрий, способств;
их набуханию с нарушением биоэн;
гетических функций. Перекисное ок
ление вызывает также коллоидно-с
мотический гемолиз эритроцитов.
Таким образом, следствием э_
процессов является утрата барьер!:
свойств мембраной клетки, что мол
привести к ее разрушению и смерд
Действие эндогенных липаз идк
значение в основном в механизме г
вреждения мембран митохондрий г.
тканевой гипоксии, в результате :
торой происходит активапия лиг
внутриклеточным кальцием. Механ
ческое растяжение мембран так
имеет значение в патологии митохог.
рий при их набухании, что привод
к потере барьерных свойств мембр.
и разобщению окислительного фс
форилирования с дыханием. Бог
подробно эти вопросы рассмотрев
при описании патологии митохог
рий.
Еще одной причиной поврежден
мембран является формирование к
налов вследствие адсорбции полиэле
тролитов на липидном слое. Напри ml
антибиотик полимиксин Б или пол
катионный белок протамин встраиг
ются в липидный слой, создавая в н:
гидрофильные каналы (поры), чер
которые проходят ионы. Следует ук
зать, что процесс фиксации полиэле
тролитов на липидном слое иницп
70
руется и облегчается при активации
перекисного окисления липидов и
действии фосфолипаз.
Состояние клеточных мембран за-
висит также от их химического соста-
ва. Липиды, входящие в мембрану,
имеют две неполярные молекулярные
цепочки, расположенные в виде '«хво-
ста». Липиды, состоящие из одной це-
почки и разрушающие мембраны,
обычно не синтезируются клеткой в
большом количестве. Яд некоторых
змей содержит фермент фосфолипа-
зу С. В его присутствии происходит раз-
рушение клеточных мембран, напри-
мер эритроцита, что служит одной из
причин смерти при укусе змеи.
Холестерин является исключитель-
но важным регулятором физико-хи-
мического состояния клеточных мемб-
ран. Кроме того, он может выполнять
роль своеобразного мембранного амор-
тизатора: одна молекула холестерина,
вклиниваясь между двумя липидными
молекулами мембраны, блокирует пе-
редачу движения от одной липидной
цепи к другой. При атеросклерозе в
крови резко возрастает содержание
холестерина и интенсивность его про-
никновения в клетки сосудистой стен-
ки. Встраиваясь в мембраны клетки,
холестерин, если он присутствует в
избыточном количестве, может нару-
шать нормальную функцию клеточных
мембран.
Жирорастворимые витамины А и
Е, воздействуя на лизосомные мемб-
раны, резко повышают их проницае-
мость, так как эти витамины также
встраиваются в оболочки лизосом. Ана-
логичным действием обладают и сво-
бодные жирные кислоты. При избы-
точном накоплении этих продуктов в
клетках может произойти выраженное
повышение проницаемости лизосом-
ных мембран, выход ферментов в ци-
топлазму с последующим аутолизом и
гибелью клеток.
Воздействие на мембранные белки
также может привести к повреждению
и гибели клетки. Как известно, белко-
вые молекулы биомембран не занима-
ют постоянного положения в липид-
ном слое, хотя часть из них в этом слое
фиксирована. Белковые молекулы в
зависимости от функции клетки мо-
гут менять свое местоположение, со-
единяться вместе или, наоборот, бо-
лее равномерно распределяться по
поверхности. Этот механизм, в част-
ности, играет важную роль для лей-
коцита в процессе фагоцитоза, когда
под влиянием хемотаксинов на одном
из полюсов клетки образуются белко-
вые «шапочки», состоящие из соеди-
нившихся друг с другом молекул бел-
ка и во многом определяющие даль-
нейшую динамику фагоцитарного
процесса. Некоторые микробы выде-
ляют вещества, которые соединяются
с белковыми молекулами биомембра-
ны лейкоцита и тормозят процесс
фагоцитоза.
Патология биомембран приводит к
нарушению транспортных и метаболи-
ческих процессов в клетке, что ухуд-
шает условия функционирования всех
ее систем.
Все указанные причины и условия
повреждения мембран приводят к еди-
ному результату: увеличению прони-
цаемости мембран для ионов К+, Н+,
Са2+, снижению «электрической проч-
ности» (потенциала «пробоя») мемб-
раны. Когда электрическая прочность
мембран снижается до уровня транс-
мембранного потенциала (70 мВ на ци-
топлазматических и 175 мВ на мембра-
нах митохондрий) происходит «само-
пробой» мембран, что является веду-
щим механизмом, приводящим к на-
рушению барьерных свойств мембран
и гибели клеток.
Роль клеточных рецепторов в па-
тологии. В клетках рецепторы находят-
ся в мембранных системах и обеспе-
чивают восприятие разнообразных раз-
дражителей из окружающей клетку
среды.
Сами рецепторы являются глико-
протеидами, углеводная часть которых
расположена над наружной поверхно-
стью клетки, а пептидная часть нахо-
дится в толще мембраны. Рецепторы
способны перемещаться в плоскости
клеточной мембраны благодаря ее
жидкому состоянию. Некоторые рецеп-
торы неподвижны, так как связаны с
цитоскелетом.
На клетках имеются рецепторы для
всех физиологически активных ве-
ществ, таких как гормоны, антигены,
антитела, токсины некоторых микро-
организмов, мембранные белки мик-
робов.
Из многочисленных факторов, воз-
действующих на рецепторный аппа-
рат, особенно большое внимание сле-
дует уделить токсинам. Например, ток-
син холерных вибрионов (холераген)
является мощным активатором аде-
нилатциклазы эпителиальных клеток
тонкой кишки, что приводит к уси-
лению выработки циклического аде-
нозинмонофосфата (цАМФ). В резуль-
тате всасывающая функция эпители-
альных клеток превращается в секре-
тирующую функцию, что в конечном
счете вызывает диарею.
Общее и первое свойство всех ре-
цепторов, расположенных на поверх-
ности или внутри клеток, заключает-
ся в том, что первоначально рецептор
распознает соответствующее вещество.
Обязательным условием распознава-
ния является специфичность взаимо-
действия рецептора и этого вещества.
В результате такого взаимодействия
реализируется вторая функция рецеп-
торов — трансформация полученного
сигнала в биохимическую реакцию,
выражающуюся в изменении актив-
ности ферментов, проницаемости
ионных каналов и др. В конечном итоге
это проявляется в физиологичес 1
реакции живых систем, по отношег
к которым рецепторы выполняв"
условиях постоянно изменяющ]
параметров среды приспособитель?
функцию.
Все рецепторы физиологически
тивных веществ по принципу выг
няемых ими функций подразделяют
две группы: основные рецепторы и
цепторы-модуляторы.
Интегральный ответ клетки за:
сит также от регуляторного влияв,
всех рецепторов — и основных, и :
дуляторов. Следовательно, можно '
верить о сложном межрецепторн
взаимоотношении в клетке, пару:
ние которого приводит к различи:
формам патологии.
Реакция клетки на комплекс «т
цептор — биологически активное :
шество (регулятор)» опосредуется -
рез аденилатциклазу, которая воспр
нимает, трансформирует и передает
клетку информацию с поверхног
плазматических мембран и таким с
разом стимулирует и контролирт
течение различных биохимическ
процессов. Чувствительность ферме
та к разнообразным гормонам, ионе
нуклеотидам делает возможным е
участие в многосторонней тонкой f
гуляции этих процессов. Аденилатцг
лаза состоит из трех функциональ-
различных участков:
1) рецепторного, осуществляют
го избирательное связывание опрет
ленного гормона, медиатора или др
того биологически активного вещест
на внешней поверхности плазматич
ской мембраны;
2) каталитического, обеспечив
ющего образование циклического ал
нозинмонофосфата (3',5' цАМФ)
АТФ:
3) коммуникаторного, осушествл
ющего связь между двумя другими у1
стками.
Регуляция, а следовательно, и диз-
регуляция аденилатциклазной актив-
ности могут происходить на любом из
этих трех уровней в зависимости от
воздействующего фактора. Аденилат-
циклаза различных тканей активиру-
ется специфическими для этих тканей
гормонами. Для обеспечения связыва-
ния гормона рецептором необходимы
интактные SH-группы, а для переда-
чи гормонального сигнала каталити-
ческой единице необходимым услови-
ем является целостность мембран. Аде-
нилатииклаза теряет чувствительность
к гормонам в результате действия на
клетку детергентов, фосфолипазы и
других патогенных факторов. Большое
значение в регуляции активности аде-
нилатциклазы играют различные ка-
тионы, особенно магния и кальция.
Магний необходим для активации
фермента и образования комплекса с
субстратом. Еше более мошными ак-
тиваторами аденилатпиклазы являют-
ся ионы марганца и фтора, в то время
как ионы ртути, свинца, меди, ко-
бальта и цинка тормозят активность
этого фермента. В высоких концентра-
циях ионы кальция выступают как
ингибиторы аденилатциклазы, а в фи-
зиологических — как активаторы.
Активация аденилатциклазной си-
стемы, мобилизующей защитные ме-
ханизмы, которые играют важную роль
при повреждении клетки, является
первым механизмом включения фи-
зиологических процессов в клетке.
Вторым, не связанным с аденилат-
циклазной системой путем активации
физиологических процессов, развива-
ющихся в ответ на взаимодействие
стимула (например, физиологически
активного вещества или патогенного
фактора) с рецептором плазматиче-
ской мембраны, является фосфоино-
зитидный. Воздействие стимула на ре-
цепторы приводит к активации в клет-
ке фермента — фосфолипазы С,
катализирующей распад полифосфо-
инозитидов с образованием двух про-
дуктов: инозитолтрифосфата и диа-
цилглицерина, участвующих в генера-
ции клеточного ядра. Передача сигнала
от рецептора внутрь клетки к фосфо-
липазе С происходит с участием N-
белков.
Таким образом, рецепторы клеток
для физиологически активных ве-
ществ — материальные субстраты чув-
ствительности и реактивности кле-
ток — представляют собой генетиче-
ски детерминированные, лабильные,
белковые структуры, осуществляющие
распознавание действующего фактора
с последующей трансформацией это-
го сигнала в адекватный ответ клетки.
В патогенезе большинства заболе-
ваний, в том числе сердечно-сосуди-
стых и онкологических, важное зна-
чение имеет нарушение отношений
между биологически активными веще-
ствами, рецепторным аппаратом и ре-
акциями клетки на их взаимодействие.
Патология митохондрий. Энергия,
вырабатываемая в митохондриях, не-
обходима для большинства процессов,
происходящих в клетке. Следователь-
но, повышение ее функциональной
активности должно приводить к уси-
лению выработки энергии вначале в
результате увеличения числа действу-
ющих митохондрий, а затем — их ги-
перфункции. Типичной реакцией ми-
тохондрий при усилении функции
клетки является их набухание. Оно свя-
зано с уменьшением количества в этих
органеллах АТФ, которая усиленно
расходуется при гиперфункции мито-
хондрий с соответствующим увеличе-
нием количества АДФ. Сущность этого
явления заключается в следующем.
В митохондриях имеются кристы, пред-
ставляющие собой складки внутренней
митохондриальной мембраны. На по-
верхности крист располагаются эле-
менты дыхательной цепи, по которой
73
при наличии кислорода передаются
электроны и протоны, т.е. происхо-
дит дыхание (окисление). Параллельно
с дыханием идет другой процесс —
фосфорилирование — перенос неор-
ганического фосфата на молекулу АДФ
с образованием АТФ.
Поскольку окисление и фосфори-
лирование сопряжены друг с другом,
весь процесс в целом носит название
«окислительное фосфорилирование»,
при котором электроны и протоны не
только транспортируются вдоль (по
поверхности) митохондриальной мемб-
раны, но происходит их переход с од-
ной поверхности мембраны на дру-
гую. Таким образом, процесс окис-
лительного фосфорилирования зави-
сит как от площади мембранной по-
верхности митохондрий, так и от ее
целостности.
При набухании митохондрий крис-
ты развертываются, в результате энер-
гообразующая поверхность органеллы
увеличивается, и выработка энергии
возрастает. Набухание митохондрий
является одним из важных проявлений
приспособительной реакции клетки в
условиях усиления ее функциональной
активности.
Разнообразные вещества (тиреоид-
ные гормоны и др.) разобщают связь
между процессами дыхания и фосфо-
рилирования, поэтому выработка
энергии в митохондриях уменьшается
и в них накапливается большое коли-
чество АДФ, что в результате увели-
чения проницаемости приводит к уси-
лению поступления воды в митохонд-
рии, т.е. к их набуханию. Это может
происходить в очень короткие проме-
жутки времени и носит приспособи-
тельный характер.
Если набухание митохондрий ста-
новится чрезмерным, выработка энер-
гии в них уменьшается и развивается
патология. Это происходит вследствие
того, что при очень сильном набуха-
нии кристы перерастягиваются,
ведет к увеличению расстояния м.
ду соседними молекулярными ко1
лексами, которые передают друг л
гу электроны и протоны. Кроме т<.
набухание митохондрий, как ирг
ло, сопровождается деструкцией
крист тем сильнее, чем резче вы
жено набухание, в связи с чем наб.
дается прогрессирующее сниже:
выработки энергии.
Аналогичные явления происхс.
со стороны наружной митохондрии
ной мембраны, которая, как и кр
ты, принимает участие в вырабо
энергии. При умеренном набухаь
митохондрий ее поверхность те*
увеличивается, а при чрезмерном
повреждается.
Первым признаком повреждения.
тохондрий является длительное нс,
хание. Умеренное набухание спос
ствует усилению энергообразован
что может рассматриваться как пр
способительный процесс, а чрезьк
ное набухание приводит к снижен
выработки энергии в митохондриа;
ном комплексе и может оказаться и
циальным механизмом в развитии г
тологии клетки.
Вторым признаком повреждения.
тохондрий являются уменьшение г
полное исчезновение матрикса, т.е. пр
странства между кристами, заполни
него водой и коллоидами. В матри
митохондрий сосредоточены ферм:
ты цикла Кребса и энзимы, участ
ющие в расщеплении жирных кис.:
что является предварительным этап
выработки энергии, которая заверь
ется на митохондриальных криста
процессе окислительного фосфора,
рования.
При патологическом воздейстг
различной этиологии в матриксе
тохондрий могут происходить разл:
ные изменения: вначале, как пра:
ло, уменьшается его количество, .
74
- что
еж-
1: мп-
-РУ-
~:то.
Г-ЗИ-
- их
глра-
г :ю-
счие
:<дят
ШЬ-
сдс-
ь:ке
L-'ИИ
'.же
„Мь,
Ш ".и
Й -_оу-
•<.зб-
Ш-ля,
Ш тон-
₽..ер-
pt-лю
фыть-
» -и-
Шг ла-
4
yw '-т-
'HfcF -ДИ
•t ро-
фйнен-
Йг <се
ач»
W--H-
Щгзх-
Шщт,
|Н11Ьч_.
Г_- хм
тем матрикс подвергается вакуолиза-
ции, т.е. в митохондриях образуются
полости. В конечном счете, происхо-
дит полное вымывание матрикса из
митохондрий. С уменьшением количе-
ства матрикса ослабляется интенсив-
ность процесса энергообразования.
Третий признак повреждения мито-
хондрий — уменьшение их числа. Это
обусловлено тем, что вследствие чрез-
вычайно высокой нагрузки основная
доля вырабатывающейся энергии идет
на преодоление этой нагрузки и вы-
полнение функции. Следовательно, на
пластические процессы, в том числе
и на обеспечение ресинтеза самих ми-
тохондрий. энергии не хватает. Мито-
хондрии гибнут и не восстанавлива-
ются, а энергообеспечение клетки
начинает уменьшаться, что снижает
ее приспособительные возможности
и устойчивость к патогенным воздей-
ствиям.
Важной причиной повреждения ми-
тохондрий является тканевая гипоксия.
Длительный дефицит кислорода вы-
зывает нарушение биоэнергетической
функции митохондрий (Ю. А. Влади-
миров). Это обусловлено тем обстоя-
тельством, что в условиях гипоксии
внутренняя мембрана митохондрий
становится более проницаемой для
ионов ЬГ и К?. В свою очередь увели-
чение содержания ионов Н1 в мито-
хондриях приводит к снижению ды-
хательного контроля, разобщению
окислительного фосфорилирования и
дыхания, а увеличение содержания
ионов К+ вызывает набухание мито-
хондрий. В конечном счете эти изме-
нения приводят к падению уровня
АТФ и АДФ в митохондриях, проник-
новению и накоплению ионов Са2+ в
ктетке. Ионы Са2+ в анаэробных усло-
виях оказывают повреждающее дей-
ствие на митохондрии, так как акти-
вируют собственную митохондриаль-
ную фосфолипазу и, следовательно,
усиливают гидролиз части фосфоли-
пидов этих органелл и увеличивают
проницаемость их мембран для катио-
нов. Повреждающее действие послед-
них еще больше нарушает функцию
митохондрий.
Уменьшение осмотического давления
в клетке приводит к ее набуханию и
повреждению митохондрий. Объем ми-
тохондрий увеличивается пропорцио-
нально уменьшению концентрации
ионов и молекул в окружающем эти
органеллы растворе (Ю.А. Владими-
ров). В результате внутриклеточной ги-
поксии, развивающейся при систем-
ных нарушениях водно-солевого обме-
на, в первую очередь страдает наруж-
ная митохондриальная мембрана и
уменьшается содержание цитохрома С,
что приводит к уменьшению скоро-
сти дыхания в митохондриях. Более
устойчивой является внутренняя мемб-
рана, проницаемость которой увели-
чивается лишь при прогрессирующем
уменьшении осмотического давления
в клетке. По существу, происходит ме-
ханическое растяжение мембраны ми-
тохондрий, что приводит к увеличе-
нию ее проницаемости для катионов
и разобщению окислительного фосфо-
рилирования. Этот процесс является
обратимым, если к нему не присо-
единяется разрушение мембраны фос-
фолипазой, например, при гипоксии
или под действием продуктов перекис-
ного окисления липидов. Ресинтезу
фосфолипидов и восстановлению ли-
пидного слоя митохондрий способ-
ствует добавление АТФ.
Набухание митохондрий представ-
ляет собой, как правило, неспецифи-
ческую типичную реакцию клетки на
повреждение. Однако эта реакция мо-
жет быть и специфической при воздей-
ствии факторов, способных разобщать
дыхание и фосфорилирование. Напри-
мер, при гиперфункции шитовидной
железы, приводящей к накоплению
75
в организме избытка йодсодержащих
тиреоидных гормонов, происходит
разобщение дыхания и фосфорилиро-
вания и, как следствие, набухание ми-
тохондрий, достигающее очень высо-
кой степени.
Таким образом, независимо от вида
и характера действия патогенного фак-
тора, митохондрии отвечают стандарт-
ной реакцией, выражающейся в их
набухании, повышении проницаемо-
сти для ионов и водорастворимых мо-
лекул. В результате нарушения свойств
липидного слоя мембраны, недоста-
точности синтеза макроэргов и ослаб-
ления дыхательного контроля, а так-
же при активации собственной мито-
хондриальной фосфолипазы процесс
переходит в необратимую стадию, что
приводит к разрушению этих орга-
нелл, патологии и гибели клетки.
Патология лизосом. Лизосомы яв-
ляются сферическими органеллами,
окруженными мембраной и содержа-
щими гидролитические ферменты,
число которых достигает 70. Наиболь-
шая роль принадлежит лизосомальным
протеиназам (эндо- и экзопептида-
зам), которые осуществляют полный
или ограниченный протеолиз белков.
Ферменты синтезируются в комплек-
се Гольджи и эндоплазматической сети
и участвуют в процессах внутриклеточ-
ного пищеварения.
Гидролитические ферменты лизо-
сом разрушают белки, нуклеотиды,
углеводы и жиры. Происходит это сле-
дующим образом. В результате эндо-
цитоза клетка поглощает частицу ве-
щества, мембраны эндоцитозного пу-
зырька и лизосомы сливаются, обра-
зуя общую, окруженную мембраной,
везикулу, в которой начинается пе-
реваривание. Кроме того, лизосомы
переваривают изношенные или по-
врежденные части клетки, участвуя
тем самым во внутриклеточной реге-
нерации.
76
Гибель клеток сопровождается р;
рушением мембран лизосом, в резу.
тате клетка подвергается са моразруи.
нию, т.е. аутолизу. Сохранение цел
стности мембран является главна
причиной того, что живая клетка :
подвергается аутолизу.
Лизосомы играют важнейшую рсл
в процессах переваривания патогеннь
факторов, в том числе микробов, п.
павших в лейкоциты путем фагоцит
за, а также чужеродных белков. Окол
90 % поступивших в клетку фагоцит,
рованных белоксодержащих субстрат
быстро перевариваются в лизосома
Остальные 10% депонируются в «м.
лых» лизосомах, что имеет значен;
для иммуногенеза: антигены, депон:
рованные в лизосомах макрофаге:
выходят в цитоплазму и вместе с гла;
ным комплексом гистосовместимс
сти передают информацию на ли:
фоциты.
Важную роль лизосомы играют
динамике патологических процессе:
При воспалении ферменты лизосс
инициируют ряд реакций, лежащих
основе развития альтерации, экссуд.
ции и пролиферации.
Повреждение лизосом — важне
звено в процессе развития шока. Та,-
например. при шоке резко повыш.
ется проницаемость мембран лизосс
лейкоцитов крови, происходит выхе
их ферментов в цитоплазму и цирк;
лирующую кровь, нарушение фунт
ции гладкомышечных элементов сос;
диетой стенки. Этот механизм являе^
ся одним из тех, который при распре
страненном процессе аутолиза клетс
крови вызывает резкое падение арте
риального давления и смерть, ка
следствие так называемой необрап:
мой стадии шока.
Установлена важная роль лизосс
в процессе канцерогенеза. Доказана
что лизосомы могут накапливать каг
церогенные вещества, а затем высвс
бождать их в клетку, создавая в ней
высокую концентрацию канцерогенов
и «запуская» тем самым процесс ма-
лигнизании.
Одной из форм повреждения лизо-
сом является недостаточность фермен-
тов в клетке, которая может быть пер-
вичной и вторичной.
Первичная недостаточность фермен-
тов лизосом возникает в результате
нарушения синтеза ферментов, обу-
словленного наследственным дефек-
том аппарата синтеза белка, вслед-
ствие изменения нуклеотидной по-
следовательности в пределах одного
гена или группы генов. В результате
возникают соответственно моноген-
ные болезни (фенилкетонурия, галак-
тозурия, фруктозурия и др.), обуслов-
ленные недостаточностью одного фер-
мента, или полигенные болезни
(врожденный сахарный диабет, ран-
ний атеросклероз и др.), связанные с
дефицитом нескольких ферментов.
В данном случае врожденная недоста-
точность ферментов является основ-
ной причиной развития болезни. Пер-
вичная недостаточность ферментов
приводит к развитию заболеваний, но-
сящих название «лизосомные болезни»
или «болезни накопления». Суть их
сводится к тому, что вследствие врож-
денного дефекта ферментного набо-
ра лизосом они теряют способность
расщеплять тот или иной субстрат. Он
накапливается в лизосомах и постепен-
но заполняет их полностью. Такие ли-
зосомы, потерявшие способность к
выполнению своих специфических
функций, начинают заполнять клет-
ку, и в конечном итоге она превра-
щается в огромную каплю того веще-
ства, которое не смогли расщепить де-
фектные лизосомы. Появление все
большего и большего количества та-
ких клеток приводит к резкому нару-
шению функции соответствующего
органа. Чаще всего при этих болезнях,
связанных с избыточным накоплени-
ем в клетках веществ, поражаются пе-
чень, мышцы и особенно — централь-
ная нервная система, что ведет к воз-
никновению тяжелых заболеваний,
часто заканчивающихся смертью.
Разнообразные совместные нару-
шения в деятельности ферментных
систем возникают также при хромо-
сомных болезнях, когда наследуются
количественные или качественные
нарушения в хромосомном аппарате
клетки (болезнь Дауна, трисомия X
и др.).
Первичная недостаточность синте-
за лизосомальных ферментов может
быть не только наследственной, но и
приобретенной, что обусловлено воз-
действием на ядерный аппарат свобод-
ных радикалов при активации свобод-
но-радикального окисления в клетке.
Чаще всего это связано с дефицитом
ферментов антиоксидантной системы
или с облучением.
В отличие от наследственного при-
обретенное нарушение деятельности
ядерного аппарата клетки вызывает
развитие недостаточности не одного
или нескольких, а большого числа
различных ферментов, в связи с чем
нарушаются основные функции клет-
ки. Возникающие изменения могут
оказаться несовместимыми с жизнью
клетки, она погибает, либо резко сни-
жается ее устойчивость к действию
патогенных факторов.
Недостаточность лизосомальных
протеиназ приводит к снижению ка-
таболизма липопротеидов очень низ-
кой плотности (ЛПОНП) в эндотелии
сосудов, что позволяет рассматривать
лизосомальный аппарат клетки как
структурно-метаболическое звено в
патогенезе атеросклероза.
Вторичная недостаточность фер-
ментных систем лизосом является при-
обретенной и связана с воздействием
патогенных факторов непосредствен-
но на ферменты. К таким воздействи-
ям относятся: инактивация активных
центров ферментов токсинами, соля-
ми тяжелых металлов; резкие изме-
нения температуры, осмолярности
клетки, кислотности; недостаточность
энергетического обеспечения деятель-
ности ферментов; нарушение связи не-
которых ферментов с мембранами,
например в митохондриях и др.
Вторичное снижение ферментатив-
ной активности также может быть
обусловлено недостаточной стимуляци-
ей образования вторичных посредни-
ков (циклический аденозинмонофос-
фат — цАМФ и циклический гуанозин-
монофосфат — цГМФ) в результате
нарушения деятельности аденилатцик-
лазной системы цитоплазматической
мембраны клетки. Следует упомянуть
еще об одной причине вторичной не-
достаточности ферментных систем —
нарушение гормональной регуляции
клеточных функций, так как актив-
ность ряда ферментных систем зави-
сит от содержания гормонов. Напри-
мер, при недостаточности инсулина
уменьшается активность гексокиназы,
особенно в почках, и усиливается де-
ятельность ферментов глюконеогене-
за и т. д. В этих случаях характер нару-
шения в клетках зависит от вида и сте-
пени гормонального дисбаланса. Стра-
дают вначале клетки-мишени, фер-
ментные системы которых находятся
под регулирующим действием соответ-
ствующих гормонов.
К причинам, приводящим к недо-
статочности функции лизосом, отно-
сятся также: угнетение их продукции
комплексом Гольджи, стабилизация
мембран лизосом при избытке глюко-
кортикоидов, уменьшение содержания
в лизосомах гидролитических фермен-
тов и др. В этих случаях страдает аппа-
рат питания и защиты клетки, т.е.
функций, которые осуществляются с
участием лизосом.
Освободившиеся из лизосом
менты в конечном итоге вызьп
аутолиз всей клетки. При умерег
степени лабилизации лизосомаль
мембран освобождающиеся в и'
плазму ферменты вызывают воз’
дение деятельности органелл и с
ронизацию их активности, что г
лом усиливает механизмы заш
Вместе с тем это приводит к увел,
нию проницаемости цитоплазмат
ских мембран, что облегчает пос
ление в клетку болезнетворных <
торов и проявление их патоген:-
действия.
Если большое количество лизс.
или ферментов поступает из разрук
ных клеток в окружающую сред;
это может инициировать воспалит,
ную реакцию. Такая ситуация ра
вается при иммунных реакциях, i.
водящих к накоплению в органах,
пример в костно-суставном аппар
большого количества активирован
микро- и макрофагов, которые я-
ются источниками лизосомаль-
ферментов.
Нарушение питания вызывает
достаточность образования энерг
ведет к снижению пластических и
гих функций клетки, а подавление
ханизма образования фагосом, в к,
рых перевариваются патогенные об
ты, создает условия для поврежде-
внутриклеточных структур. Можнс
ворить о снижении резистентнс.
клетки к действию патогенных о
горов.
Лизосомы могут подвергаться
рушению некоторыми бактериаль
ми токсинами и лекарственными г
парагами, при введении больших
витамина А, а также в результате
муноконфликтных ситуаций и
Если разрушение лизосом достиг
высокой степени и в кровь высвоб
дается много гидролаз, то это вь:
вает резкое нарушение обменных г
78
• ;>ер-
-злют
» ной
- -НЫХ
2 'ТО-
1-ЛЖ-
- :нх-
i це-
- ты.
_-че-
г:че-
так-
it -ого
г сом
*_гн-
ег то
ге.ть-
Л-. ЗИ~
эи-
I на-
г-ттте,
l- -:ых
Ш -З.ТЯ-
й,. - ых
Hfc hi,
д?у-
Ш. ле-
W* 70-
’Ж. - ЛЯ
flfe- "о-
.711
ж -
ед»___х-
• *-
ИВЬ,-
• :е-
»: :эз
w - д.
«К _;Т
Ж
ЭДИй. _
цессов во всем организме, вплоть до
состояния, несовместимого с жизнью.
Таким образом, патология лизосом
играет чрезвычайно важную роль в
развитии ряда заболеваний и патоло-
гических процессов.
2.5. Виды повреждения
клетки
Различают острые и хронические
повреждения клеток. В зависимости от
степени нарушений внутриклеточно-
го гомеостаза повреждения клеток
могут быть обратимыми и необрати-
мыми. В тех случаях, когда нарушения
внутриклеточного гомеостаза, вызван-
ные повреждающими агентами, устра-
няются при мобилизации внеклеточ-
ных и внутриклеточных защитных ме-
ханизмов. повреждение клеток носит
обратимый характер (стадия паранек-
роза). Например, обратимыми могут
быть повреждения миокардиоцитов
при рефлекторной ишемии миокарда,
эритроцитов при кратковременных
изменениях осмотического давления
крови, клеток кожи при эритеме, выз-
ванной ультрафиолетовыми лучами,
эпителия слизистой оболочки носа
при воздействии пыльцы злаковых
трав у больных поллинозом.
Если повреждающие агенты вызы-
вают стойкие изменения внутрикле-
точного гомеостаза, неустранимые при
вовлечении внеклеточных и внутри-
клеточных защитно-компенсаторных
механизмов, развиваются необрати-
мые повреждения клеток (стадия не-
кробиоза), приводящие, как правило,
к их гибели или значительному сокра-
щению сроков жизни. В качестве при-
меров можно привести повреждения
миокардиоцитов при длительной ише-
мии миокарда, клеток кожи при дей-
ствии больших доз ультрафиолетовых
лучей, эритроцитов при действии ак-
тивированного комплемента или гемо-
литических ядов, эпителия слизистой
носа при действии вирусов гриппа.
Следует заметить, что необратимые
повреждения всегда вызывают быст-
рую гибель клеток. Например, в клет-
ках стареющего организма происходит
отложение липофусцина, образующе-
гося в результате взаимодействия пе-
рекисных радикалов жирных кислот с
токоферолом при недостаточности ли-
зосомальных ферментов. При этом жи-
ровые клетки приобретают желтый
цвет. Отложение в клетках продуктов
конденсации гликогена при гликоге-
нозах, мукополисахаридов при муко-
висцидозе, холестерина при атеро-
склерозе также не приводят к немед-
ленной гибели клеток, но значительно
снижают их функциональную актив-
ность и продолжительность жизни.
Проявления повреждения могут
быть как специфическими, т.е. харак-
терными только для какого-то конк-
ретного болезнетворного агента, так
и неспецифическими.
Примерами специфических проявле-
ний повреждения могут’ служить иммун-
ный гемолиз эритроцитов при нали-
чии в организме специфических ан-
тиэрнтроцитарных антител, образова-
ние радиотоксинов при радиационном
повреждении, избирательное тормо-
жение отдельных клеточных фермен-
тов при химическом повреждении,
например, подавление активности
цитохромоксидазы при отравлении
цианидами, угнетение холинэстеразы
фосфорорганическими соединениями.
В то же время в поврежденных клет-
ках наблюдаются стереотипные неспе-
цифические изменения их жизнедея-
тельности. общие для действия раз-
нообразных повреждающих агентов.
Примерами неспецифических прояв-
лений повреждений клетки являются
угнетение ферментов внешних и внут-
ренних мембран, клеточных «насо-
79
сов», нарушение энергетического об-
мена, обмена воды, электролитов,
развитие ацидоза, изменение структу-
ры и функции внутриклеточных орга-
нелл: митохондрий, лизосом и др.
Острое повреждение клетки. Реак-
ция клетки на повреждающий фактор
зависит от исходного состояния самой
клетки, а также от характеристики
болезнетворного агента. Состояние
клетки определяется в свою очередь ее
типом, особенностями строения ци-
топлазматической мембраны, характе-
ром и свойством межклеточных кон-
тактов, строением и составом глико-
каликса и многими другими фактора-
ми, о которых упоминалось ранее.
Различают три формы острого по-
вреждения клетки: 1) преддепресси-
онная гиперактивность; 2) парциаль-
ный некроз: 3) тотальное необрати-
мое повреждение (табл. 2.4).
Таблица 2,-
Характеристика острого повреждения клетки
Форма Причины и условия Функциональные проявления
1. Преддепрессионная гиперактивность (обрати- мое повреждение клетки) Слабое повреждающее дей- ствие на клетку, хорошо выраженная регенерация Увеличение потребления кислорода и активизация деятельности органелл, по- вышение продукции АТФ и активизация энергозави- симых процессов. Разруше- ние и удаление из клетки патогенных агентов, внутри- клеточная регенерация, выздоровление клетки, нормализация функции
2. Парциальный некроз Слабое повреждающее дей- ствие на клетку, хорошо выраженная регенерация Образование демаркацион- ной мембраны, фагоцитоз погибшей части клетки. Восстановление клетки путем гиперплазии клеточ- ных структур, выздоровле- ние клетки, нормализация функций
3.Тотальное необратимое повреждение клетки Периоды: 1-й — преддепрессионная ги п ерактивность 2-й — агония Сильное повреждение клет- ки, низкая способность к образованию демаркацион- ной мембраны и слабая клеточная регенерация Кратковременная гипер- активность не обеспечивает выздоровления клетки. Прогрессирующее наруше- ние энергозависимых про- цессов, недостаточность функции всех органелл, гипоп оляризация мембран, ги перосм и я. оте к клетки, активация гидролитических ферментов. Нарушение функции ядра, уменьшение и прекращение синтеза белка.
80
Окончание табл. 2.4
Форма Причины и условия Функциональные проявления
3-й — смерть клетки 4-й — некролиз 5-й — элиминация Выравнивание концентра- ции ионов Na+ и К+ вне и внутри клетки, исчезнове- ние мембранного потенциа- ла. прекращение всех функ- ций клетки, резкое увели- чение проницаемости мемб- ран, денатурация белков Разрушение всех структур клетки лизосомальными । ид рол азами (аутолизис), ферме! нами фагоцитов или микробов (гетеролизис) Фагоцитоз и полное уничтожение клеток
Преддепрессионная гиперактивност ь.
При данной форме повреждения в ре-
зультате снижения деятельности ион-
ных насосов происходит деполяриза-
ция мембраны и снижается мембран-
ный потенциал. Как следствие депо-
ляризации появляется спонтанная
деятельность клетки. Преддепрессион-
ная гиперактивность является кратко-
временной и обратимой формой по-
вреждения клетки после воздействия
на нее повреждающих факторов на
фоне хорошей способности клетки к
внутриклеточной регенерации. В ре-
зультате такого повреждения в мемб-
ране клетки происходит неспецифи-
ческое возбуждение рецепторного
аппарата и включаются механизмы
защиты. Активируется образование
вторичных посредников (циклических
нуклеотидов) и усиливается деятель-
ность органелл, в первую очередь ли-
зосом и митохондрий. Увеличение чис-
ла функционирующих митохондрий
приводит к повышению окисления
субстратов и активации синтеза АТФ.
Усиление функции рибосом может
привести к увеличению образования
ферментов, способствующих расщеп-
лению болезнетворного фактора. Од-
новременно с этим мобилизуются все
энергозависимые процессы, направ-
ленные на повышение устойчивости
клетки к паталогическому фактору,
ускорение его расщепления и удале-
ния из клетки.
В результате может произойти «выз-
доровление» клетки с последующим
восстановлением утраченных структур
и функций, т.е. преддепрессионная ги-
перактивность является обратимой
формой повреждения клетки.
Парциальный некроз. В его основе
лежит образование «демаркационной»
мембраны, ограничивающей повреж-
денную часть клетки от жизнеспособ-
ной. Причиной развития парциально-
го некроза является поступление па-
тогенного фактора путем фагоцитоза
или пиноцитоза в ограниченную часть
цитоплазмы. Обязательным условием
сохранения жизнеспособности клетки
является наличие интактного ядерно-
го аппарата.
Поврежденные участки клетки вы-
деляют вещества — хемоаттрактанты,
привлекающие фагоциты, которые
уничтожают эти участки, после чего
структура и функция клетки восста-
навливаются, т.е. клетка реадаптиру-
81
ется к первоначальному состоянию.
В данном случае проявляется действие
внутриклеточного репаративного ме-
ханизма. При этом количество вновь
образованных структур соответствует
уровню нового функционального со-
стояния клетки. Если функциональное
состояние клетки усиливается, то уве-
личивается число внутриклеточных
структур. Причем этот процесс после-
довательно охватывает все структур-
ные уровни: молекулярный (амплифи-
кация или умножение числа генов,
ускоренный синтез новых молекул),
субклеточный (увеличение числа орга-
нелл) и клеточный — увеличение чис-
ла клеток.
При парциальном некрозе увели-
чение объема субклеточных единиц
следует рассматривать как проявление
компенсаторной реакции клетки на их
функциональную недостаточность.
Возникшее после повреждения новое
устойчивое состояние клетки морфо-
логически сопровождается гипертро-
фией ядра и ядрышка, увеличением
отложения липидов, углеводов и дру-
гих веществ.
Тотальное необратимое повреждение
клетки. В процессе медленного умира-
ния клетки можно выделить ряд пе-
риодов, которые принципиально сход-
ны для различных клеток.
1-й период — преддепресси-
онная гиперактивность — ме-
нее продолжителен, чем при обрати-
мом повреждении клетки и не завер-
шается «выздоровлением». Однако для
этого периода характерно то, что при-
способительные механизмы в клетке
протекают до тех пор, пока не насту-
пает ее смерть.
2-й период — агония — отли-
чается прогрессирующим нарушени-
ем всех энергозависимых процессов,
в первую очередь снижением транс-
порта через клеточные мембраны,
в том числе снижением деятельности
калий-натриевого насоса. В результат;
в цитоплазме повышается концентрг-
ция ионов Na+, возникает гиперос-
мия, приводящая к отеку. При гипо-
поляризации мембран отек внутри-
клеточных структур приводит к сни-
жению функциональной активности
клеток. В результате нарушения окис-
лительного фосфорилирования в ми-
тохондриях клетки анаэробные про-
цессы начинают преобладать на.
аэробными, резко усиливается глико-
лиз. в клетке накапливаются кислоть
(молочная, пировиноградная и др.),
что приводит к внутриклеточному аци-
дозу. В свою очередь ацидоз также спо-
собствует отеку клетки, так как уве-
личивает гидрофильность коллоидоь
и повышает проницаемость мембран
Кроме того, при снижении pH акти-
визируются ферменты, способствую-
щие разрушению внутриклеточных
структур.
Отек ядра клетки приводит к раз-
рыву его мембраны и переходу жид-
кости нуклеоплазмы в перинуклеар-
ное пространство. При этом оставший-
ся хроматин собирается в компактнук
массу. Такие изменения носят назва-
ние «пикноз ядра» и характеризуют
агонию клетки как необратимую фазу
его повреждения. Ядрышки при этом
также подвергаются неспецифическим
изменениям в виде сморщивания или.
наоборот, увеличения размеров, а так-
же дезинтеграции гранулярных агре-
гатов РНК, фибрилл и внутриядрыш-
кового хроматина, что в конечном
счете приводит к нарушению вплоть
до полного прекращения его функции.
Некоторые патогенные факторы
могут вызвать и специфические изме-
нения в ядрышке. В первую очередь это
те вещества, которые действуют как
ингибиторы РНК-полимеразы, т.е.
препятствующие образованию матрич-
ного РНК (мРНК). К ним относятся
афлатоксины, актиномицин Д, ток-
82
г»: те
г "л-
>*.-. и
Вь
В —>
В ~лд
В •
Вйг . Ы
в -
в*' -’
• °~
В :>в
ВГюн.
В-'~1-
А_
W7/ -о-
Ш» - -[х
Ж '.:3-
е* -д-
tfc Л-
фг- Ю
ЗДЬиЬй. ; J-
• «ЛИ,
ф—е-
ЧВш,л-
Фг- м
син бледной поганки, некоторые ви-
русы и микоплазмы.
При отеке клетки в период ее аго-
нии в митохондриях происходят из-
менения, характеризующие наруше-
ние кислородного обмена, что бывает
при воздействии любых, специфиче-
ских и неспецифических патогенных
факторов. Эти органеллы набухают и
вакуолизируются, происходит дезин-
теграция их мембран с нарушением
энергетических процессов. Атрофия и
гипоплазия клетки сопровождается
сморщиванием митохондрий (с их
фрагментацией) и лизосом. Следует
подчеркнуть, что агония и гибель клет-
ки происходят в том случае, если по-
вреждается большинство митохонд-
рий, а не отдельные органеллы, как
это бывает при обратимых формах по-
вреждения клетки.
В цитоплазматической сети в стадии
агонии происходит вначале дезинтег-
рация, а затем исчезновение рибосом
и фрагментация мембран, что свиде-
тельствует о резких нарушениях про-
цессов синтеза, в первую очередь фер-
ментов и других белков. Нарушение
ферментативных механизмов приводит
также к недостаточному катаболизму
веществ в клетке, в результате они на-
капливаются в цитоплазме, в том чис-
ле и аномальные белки, и продукты
распада, усиливающие повреждение
клетки. Нарушение ферментативных
процессов особенно сильно прогресси-
рует при нарушении гормональной ре-
гуляции — дефиците анаболических
стероидов, инсулина, гормона роста —
под влиянием нейротропных вирусов
(вирус полиомиелита нарушает функ-
цию рибосом в нейронах, происходит
их тигролиз). Резко снижается дето-
ксикационная функция, которую в
клетке выполняет агранулярная цито-
плазматическая сеть и микросомы.
В комплексе Гольджи в период аго-
нии происходит распад на мелкие ве-
зикулы, которые быстро исчезают.
Особенно часто это наблюдается при
токсическом повреждении клетки ве-
ществами химического и бактериаль-
ного происхождения.
Лизосомальный аппарат, как изве-
стно, участвует в процессах зашиты и
переваривания путем образования пи-
щеварительных вакуолей (фаголизо-
сом) из первичных лизосом и фаго-
сом. При агонии клетки вследствие рез-
кого нарушения аэробных процессов
активизируются анаэробные реакции,
образуются кислоты, снижается pH,
что способствует быстрому разруше-
нию мембран лизосом. Освобождаю-
щиеся гидролитические ферменты вы-
зывают прогрессирующее поврежде-
ние и смерть клетки.
В период острого повреждения клет-
ки быстрый и резкий недостаток син-
теза АТФ вызывает снижение всех
энергозависимых процессов, в том
числе фагоцитоза и пиноцитоза.
3-й и е р и од — с м е ртьзавер-
шает период агонии. Морфологиче-
ским выражением смерти клетки яв-
ляется ее некроз. Иногда смерть и то-
тальный некроз рассматривают как
отдельные стадии, в связи с тем что
некротические процессы развиваются
как посмертные изменения. Смерть
клетки — необратимое нарушение ее
функций, которое характеризуется
выравниванием концентрации калия
и натрия ио обе стороны мембран
клетки. Это приводит к исчезновению
мембранного потенциала и прекраще-
нию деятельности селективных (изби-
рательных) механизмов транспорта
различных веществ между клеткой и
ее средой.
Одним из ранних и важных прояв-
лений таких изменений является на-
рушение деятельности натрий-каль-
циевого насоса, повышение проница-
емости цитоплазматической и внутри-
клеточных (особенно митохондриаль-
83
ных) мембран по отношению к ионам
Са2+, увеличение его внутриклеточной
концентрации. Повышение проница-
емости мембран клетки и изменения
клеточных коллоидов вследствие де-
натурации белков приводит к усиле-
нию сорбционных свойств клеток. Дан-
ный феномен используют для выяв-
ления поврежденных и погибших кле-
ток по степени сорбции красителей,
которыми обрабатывают эти клетки.
Причиной окрашивания ядра клетки
после гибели являются резкие изме-
нения свойств ядерной оболочки и пе-
ринуклеарного пространства, которые
в норме являются мощным барьером
для проникновения чужеродных ве-
ществ из цитоплазмы.
4-й период — некролиз —
наблюдается после смерти клетки.
В этот период происходит растворе-
ние погибшей клетки. Существует три
вида некролиза: аутолитический, ге-
теролитический и вид, сочетающий
оба процесса.
Аутолиз является процессом, на-
правленным на разрушение структур
клетки собственными ферментами,
в основном лизосомального проис-
хождения. Аутолитические процессы
в норме обеспечивают обновление
внутриклеточных структур, т.е. служат
важным этапом физиологической ре-
генерации клетки, но в отличие от па-
тологии этот процесс является регу-
лируемым местными и системными
механизмами в организме. Эти меха-
низмы в норме обеспечивают избира-
тельное повреждение внутриклеточных
структур, в то время как посмертный
аутолиз принципиально отличается от
физиологического массированным по-
вреждением лизосом и разрушением
их ферментами всех внутриклеточных
структур.
Как известно, в результате физио-
логической регенерации аминокисло-
ты, сахара и другие простые вещества
используются клеткой в качестве пг.
стического материала для построен
внутриклеточных структур, необхо.
мых для гипертрофии (при усилен
функции), деления клетки и т.д, П
смертный аутолиз клетки также пр
водит к образованию простых вещее'
в результате ферментативных проие.
сов, но они могут быть использован
только другими жизнеспособны:
клетками.
Некролитические процессы быв.
ют также гетеролитическими, т. е. я:
ляются результатом действия ферме
тов, чужеродных для погибшей кле'
ки. Источником этих ферментов с.',
жат, как правило, фагоциты и ми
роорганизмы.
В целостном организме ауто-, гем
ролитические некролитические пр
цессы протекают одновременно, нс
разных соотношениях в зависимое'
от типа клетки, среды, в которой о.
функционирует, и характеристики п.
тогенного фактора. В результате некр
лиза продукты распада клетки акт.
визируют механизмы образования v
мотаксических веществ (главны
образом путем активации систем
комплемента), благодаря которь:
происходит возбуждение подвижна
фагоцитирующих клеток (микро-
макрофагов), которые уничтожат
погибшую и разрушенную клетку, т.:
подвергают ее удалению.
5-й завершающий период-
элиминация клетки. Клетка п.
гибла, и ткань реагирует на это ко
пенсапией путем замещения вновь с :
разованными аналогичными клетк.
ми или гиперплазией оставших.
клеток, что зависит от типа поп:
шей клетки.
Необходимо учитывать тот фа:-
что при повреждении тканей боле
нетворным агентом в различных кле'
ках развиваются разные формы нар
шения. В одних клетках происход.
84
обратимая преддепрессионная гипер-
активность с усилением обмена ве-
ществ и потребления кислорода, в дру-
гих наблюдаются дальнейшие фазы
повреждения клетки с освобождени-
ем гидролитических ферментов, акти-
вацией анаэробных процессов, обра-
зованием недоокисленных продуктов
обмена, ацидозом, отеком и смертью
клетки, в третьих — парциальный не-
кроз и т.д.
Таким образом, в зависимости от
степени повреждения, особенностей
тканей и патогенного агента характер
нарушения обмена веществ может
быть различным, что следует учиты-
вать при оценке функционального со-
стояния тканей после их поврежде-
ния. Если число поврежденных кле-
ток достигает критической величины,
то происходят: нарушение деятельно-
сти функциональной единицы ткани,
органа; взаимосвязанные и взаимо-
обусловленные изменения межклеточ-
ного вещества, нервного аппарата,
сосудистой системы и, в конечном
счете, организма в целом.
2.6. Апоптоз
Повреждения клетки и ее гибель
не обязательно являются следствием
действия патогенного фактора. Смерть
как прекращение функции отдельной
клетки и целого организма является
постепенно наступающим и необрати-
мым процессом, результатом есте-
ственного старения. Вследствие обыч-
ного функционирования происходит
естественное изнашивание внутрикле-
точных структур, истощение механиз-
мов их регенерации, прекращение ин-
тегративной деятельности структурных
компонентов, биохимических, элек-
трических и других процессов, обра-
зования энергии и т.д. Этот процесс
клеточной смерти в норме генетиче-
ски детерминирован и происходит в
течение всей жизни в тканях организ-
ма, начиная с эмбрионального состо-
яния.
Различные по строению и функции
клетки имеют разную продолжитель-
ность жизни. Например, эпителиаль-
ные клетки кишечника обновляются
спустя сутки, клетки волосяных луко-
виц — через 12 ч, а клетки печени —
через 1 год. В то же время большин-
ство нейронов и мышечных клеток
живут столько же, сколько и целый
организм.
Таким образом, нормальная клет-
ка «имеет программу» пролиферации,
обусловливающую ее размножение
и «программу клеточной гибели» —
апоптоз. Судьба клетки, а значит, орга-
на и организма в целом зависит от вза-
имодействия этих «программ». Уста-
новлено, что усиление апоптотиче-
ского процесса имеет важное значение
при СПИДе, нейродегенеративных за-
болеваниях, миелодиспластических
синдромах, ишемических поражени-
ях и др.
Исследования последних лет пока-
зали. что патогенез многих заболева-
ний человека связан с неспособно-
стью клеток подвергаться апоптозу,
например, при раке, лейкозе, ауто-
иммунных болезнях и вирусных ин-
фекциях. В процессе апоптоза клетки
непосредственной причиной смерти
является увеличение свободных ради-
калов. концентрации свободного каль-
ция и активация протеолитических
ферментов.
В клетках могут одновременно су-
ществовать два типа клеточной смер-
ти: апоптоз и некроз, что предполага-
ет наличие некоторого сходства меж-
ду ними, а возможно, переходных ва-
риантов. Апоптоз протекает как в
структурно неповрежденных нормаль-
ных тканях, так и при наличии в них
патологического процесса.
85
нтЦ*ГЧГ«!>»<>* даНКВГ
Смерть клетки играет биологиче-
ски важную защитную роль в элими-
нации тех клеток, выживание которых
вредно для организма в целом, напри-
мер клеток-мутантов или клеток, по-
раженных вирусом. Уничтожение та-
ких клеток с помощью механизма
апоптоза обеспечивает минимальное
повреждение ткани по сравнению с
другими вариантами уничтожения
клеток.
В процессе апоптоза в клетке уве-
личивается концентрация кальция,
активируется фермент эндонуклеаза,
которая фрагментирует ДНК. Такая
клетка, называемая апоптозной час-
тицей, фагоцитируется и окончатель-
но разрушается, что предупреждает
перенос и размножение генетическо-
го материала. Аналогичный процесс
происходит при одновременном при-
сутствии в клетке бактерий и вирусов.
Бактерии вырабатывают в большом
количестве дезоксирибонуклеазу, ко-
торая разрушает ДНК вирусов, фраг-
ментируя ее, вызывая апоптоз клеток,
зараженных вирусом.
Увеличение содержания эндонукле-
азы, фрагментирующей ДНК, являет-
ся обязательным маркером апоптоза.
Для предупреждения апоптоза в
клетке существует защитный механизм
(ядерный фрагмент ДНК-полимеразы
в комплексе с ДНК-лидазой), кото-
рый препятствует расщеплению кон-
цов «разорванных» нитей ДНК и спо-
собствует «склеиванию» разрывов. Од-
нако при множественных повреждени-
ях ДНК, т. е. при усилении апоптоза,
этот защитный механизм, требующий
большого количества энергии и нали-
чия макроэргических соединений, не
действует и происходит смерть клет-
ки, а имеющиеся в клетках запасы
макроэргов быстро утилизируются и
деградация пуриновых оснований про-
исходит до конечного продукта — мо-
чевой кислоты.
Пероксид водорода в малых коли-
чествах индуцирует апоптоз, а в боль-
ших — вызывает некроз. Индукци
апоптоза может быть внутриклеточно
и внеклеточной. К внеклеточным фак-
торам относится фактор некроза от -
холей, вызывающий в клетке быст-
рое увеличение содержания активны
форм кислорода.
К внутриклеточным факторам апс
птоза относятся системы митохондрь
ального окисления, микросомальнг
система цитохрома Р450. При активг-
ровании апоптоза происходит изби-
рательный протеолиз некоторы
структурных белков. В свою очеред.
уменьшение содержания некоторы
белков, вызванное применением ин-
гибиторов в синтезе белка и РНК
вызывает апоптоз. Аналогичная реак-
ция происходит при снижении содер-
жания в тканях фактора роста перво:
гормонов, ростовых факторов гемс-
поэза.
Апоптоз может быть не только уси-
лен, но и ослаблен. Например, бел-
ки некоторых вирусов (аденовирус?
и т.п.) непосредственно блокирую
апоптоз. Подавление этого процесс
способствует объединению вируса
геномом хозяина, переходу патоло-
гического процесса в хронически?
стадию с риском перерождения в оп; -
холь. Механизм этого явления заклк
чается в том, что многие вирусы свя-
зывают р53 — ген подавления опухс-
левого роста. Этот ген является мощ-
ным индуктором апоптоза и, следо-
вательно, тормозит перерождены
нормальной клетки в опухолевую.
Смерть клетки может наступи^
мгновенно при температурном, гр;
бом механическом или токсическс
воздействии, под влиянием электри-
ческого тока, химических вещестз
биологических факторов.
Менее интенсивное и продолжч -
тельное воздействие вызывает посте
86
V-
V' :ь-
_Т1Я
-эй
22К-
~У~
К *Т~
V - ых
-~°"
--И-
B>1 -
Як! -;,_
’’;[-
V : \
дк'..!Б
F<3IX
Я*» Ч-
W-K,
Чкягэ-
ЯКъ: в,
J-
> 1И-
♦ ’<1-
•г .ы
•г -зт
Шг.га
(Г- с
-W j-
•с- О
пенное умирание клеток. Следует под-
черкнуть относительность такого по-
нятия, как интенсивность воздей-
ствия, так как она зависит не только
от характеристики патогенного фак-
тора, но и от свойств клетки: ее типа,
возраста и генетических особенностей.
2.7. Нарушения
биоритмов клетки
Биоритмы как неотъемлемая часть
ритмов во всей окружающей нас Все-
ленной проявляются на всех уровнях
организации биосферы: видовом, по-
пуляционном, организменном, си-
стемном. тканевом и клеточном.
Деление клеток также является про-
цессом ритмическим, нарушение ко-
торого приводит к патологии всех ви-
дов регенерации: внутриклеточной,
клеточной и репаративной. Не исклю-
чено, что беспредельное размножение
опухолевых клеток также связано с
нарушением внутриклеточных автоко-
лебательных процессов.
Биоритмами обладают как одна
клетка, так и их совокупность, а так-
же орган в целом. Изучение особен-
ностей деятельности различных орга-
нов и систем позволило открыть прин-
цип перемежающейся активности их
отдельных клеточных структур: одна
часть клеток работает в усиленном ре-
жиме, другая — в нормальном, а тре-
тья часть «отдыхает», функционируя
явно ниже не только максимального,
но и среднего уровня. Такое чередо-
вание максимальной, нормальной и
минимальной активности клеточных
систем (а в этих системах периоди-
чески происходит смена режимов
функционирования отдельных кле-
ток, и те клетки, которые ранее ра-
ботали максимально, затем переходят
на более экономные режимы функ-
ционирования. и наоборот) позволя-
ет системе в целом функционировать
с максимальным коэффициентом по-
лезного действия (В.А.Фролов). По-
добные закономерности наблюдаются
и внутри клетки: одновременно актив-
но функционирует одна часть мито-
хондрий, другая — не работает, а че-
рез некоторое время начинают функ-
ционировать не работавшие ранее, и
наоборот.
В эволюции формирование вре-
менной организации биосистем свя-
зано с проблемой обратимости и нео-
братимости биологического развития.
Именно благодаря образованию про-
странственно-временной структуры
возможно возникновение биологиче-
ской упорядоченности и самооргани-
зации биологических систем, что в ко-
нечном счете приводит к достижению
необратимости развития биосистемы.
Решающую роль в этом играют коле-
бания метаболических процессов, поз-
воляющие биосистеме перейти в но-
вое необратимое состояние (И.При-
гожин, лауреат Нобелевской премии).
Именно колебания (флюктуации), по
теории И. Пригожина, вынуждают си-
стему выбрать путь, по которому бу-
дет происходить ее дальнейшая эво-
люция и в конечном счете определит
ход этой эволюции, т.е. «в настоящем
биосистемы не содержится ее будущее,
а содержится одна из возможностей
этого будущего».
Нарушение временной организа-
ции биосистем изучается в разделе
хронобиологии — хронопатологии.
Целью хронопатологии является рас-
крытие локализации, распространен-
ности, нарушений биоритмов и вы-
яснение первичности и вторичности
патологических изменений. В результа-
те таких нарушений может произойти
разрушение биосистемы или наруше-
ние ее функционирования в соответ-
ствии с вновь возникающей патоло-
гической временной организацией.
87
Пространственно-временная орга-
низация характеризует единство всех
биосистем и их принадлежность к ос-
новным формам существования мате-
рии.
2.8. Атрофия
и дистрофия клеток
Жизнедеятельность клетки обеспе-
чивают трофические процессы, в ко-
торых в тесной взаимосвязи участву-
ют нервная, гуморальная и иммунная
системы организма. Дизрегуляция этих
систем, количественные и качествен-
ные их изменения приводят в первую
очередь к типичным патологическим
процессам в клетке: атрофии и дист-
рофии.
Атрофические изменения клеток обу-
словлены недостатком питательных
веществ и включают два понятия: фи-
зиологическая и патологическая ат-
рофия (Д. С. Саркисов). Физиологи-
ческая атрофия является нормальным
процессом увядания функциональных
структур, например, в старости или
инволюционные процессы в вилоч-
ковой железе в молодом возрасте,
что генетически запрограммировано.
Патологическая атрофия в отличие
от физиологической характеризует
раннюю, преждевременную инволю-
цию. вызванную бездействием, де-
нервацией, кастрацией и другими
причинами.
Суть патологической атрофии мо-
жет быть раскрыта на примере дли-
тельного голодания. В этих условиях
вначале атрофируются жировые, за-
тем мышечные, лимфоидные и кост-
ные клетки. При атрофии клетки про-
исходит уменьшение размеров всех ее
ультраструктур и снижение функций,
вплоть до полного их прекращения. Не-
достаток в пище витаминов, микро-
элементов и других компонентов вы-
зывает в клетке характерные измене-
ния со стороны ядра, митохондрий г
аппарата синтеза белка.
Иммобилизация конечностей ил;
тенотомия (гиподинамия) вызывас
атрофию от бездействия, что прояв-
ляется прежде всего в уменьшени;
диаметра миофибрилл в миоцитах
В костной ткани уменьшаются разме-
ры, число и функциональная актив-
ность остеобластов.
Многочисленные энзимопатии
вызывающие дистрофические изме-
нения в клетках, могут быть сведень
к следующим видам (А. П.Авиын
В.А. Шахламов): 1) ингибированп.
ферментов химическим веществох
(например, цианиды инактивируют
питохромоксидазу, актиномицин Д
ингибирует РНК-полимеразу и т.д.)
2) генетические нарушения, включа-
ющие нарушения синтеза, или ано-
мальная структура фермента («болез-
ни накопления» и др.); 3) недостато:-
субстрата для деятельности ферменте:
(алиментарный дефицит жиров, бел-
ков, углеводов и другие биохимиче-
ские нарушения); 4) дефицит кофер-
мента (недостаток витаминов, микро-
элементов и т.д.); 5) нарушение со-
отношения между активатором i
ингибитором ферментов (протеазо;
и антипротеазой и др.). Эта класси-
фикация энзимопатий может быт:-
расширена. Например, изменения ак-
тивности ферментных систем могу?
быть первичными и вторичными, ком-
пенсированными и декомпенсирован-
ными.
В зависимости от сочетания много-
численных факторов, вызывающи'
нарушения питания клетки, виды ди-
строфии подразделяют на защитные
вакуольные и гидропические, гиали-
новые, жировые, амилоидные, глико-
геновые и др. Эти виды дистрофии пол
робно рассматриваются в курсе пато-
логической анатомии.
88
•».. ене-
ЧВШг :i и
" LTI1
г. вдет
< яв-
1---.ИИ
~ _ах.
'-.. :е-
j." *в_
щ,
•е-
дены
I .ЛН,
'. - не
га ом
С 'ЮТ
I-.- д
’-.);
»ча-
I --IO-
» ез-
.ток
t ~ов
. 41-
че-
ЧЙк :о-
: и
•ЬЛ.ЭЙ
4(fc_:ii-
Ф ' ТВ
фь- ак-
ф * 7VT
Ф :м-
«№ !.ан-
фит 70-
W_;ix
фь :л-
фп-ie.
*
2.9. Нарушение нервной
регуляции функции
клеток
В механизме развития атрофии и
дистрофии важная роль принадлежит
нарушению нервной и гуморальной
регуляции клеточных функций.
Французский физиолог Ф. Мажан-
ди в 1824 г. впервые установил нали-
чие прямого воздействия нервной си-
стемы на клетки. Он перерезал у кро-
лика первую ветвь тройничного нерва
и через несколько дней обнаружил
развитие язвенного кератита на сто-
роне перерезки нерва. Так было дока-
зано, что в организме наряду с двига-
тельными, чувствительными и секре-
торными существуют еще и трофиче-
ские, регулирующие питание тканей
и клеток, нервы.
Прямое трофическое влияние не-
рвной системы на ткани было обна-
ружено известным физиологом акаде-
миком Л.А. Орбели (1882— 1958) и его
соавторами.
Большой вклад в развитие теории
о нервной трофике внес А. Д. Сперан-
ский (1887/1888— 1961). Он писал, что
неврогенные дистрофии «входят в со-
став всех без исключения патологиче-
ских процессов, и каждый нерв неза-
висимо от выполняемой им функции
является трофическим».
Нейродистрофический процесс,
возникающий после перерезки нерва,
приводит к тому, что микробные, ме-
ханические и другие факторы стано-
вятся патогенными в денервированных
тканях. Следовательно, денервация
вызывает эндогенные изменения в
тканях, усиливающие воздействие бо-
лезнетворных факторов.
С современных позиций нейродис-
трофический процесс представляет
собой стандартную форму патологии
клетки и относится, таким образом,
к числу типичных патологических про-
цессов. Нейродистрофический процесс
обусловлен прекращением или изме-
нением влияния нервной системы.
Прекращение действия нервной си-
стемы заключается в том, что нару-
шается выделение или действие ней-
ромедиаторов, комедиаторов (нейро-
модуляторов, которые осуществляют
вместе с нейромедиаторами регуляцию
рецепторных и функциональных эф-
фектов) и трофогенов в иннервируе-
мые структуры.
Трофогены в отличие от нейроме-
диаторов не выполняют функцию си-
наптической передачи информацион-
ного сигнала. Они представляют собой
высокомолекулярные вещества (бел-
ки, полипептиды, нуклеиновые кис-
лоты), осуществляющие трофическое
влияние непосредственно на нервные
клетки и иннервируемые ими клет-
ки-репипиенты. Механизмы действия
трофогенов в норме заключаются в
специфическом воздействии на ре-
цепторный комплекс с последующим
эндоцитозом и воздействием на обмен
веществ либо генетический аппарат,
что в конечном счете вызывает устой-
чивые изменения в клетке. Трофоге-
ны могут иметь различную природу и
источники: нейроны, клетки-мише-
ни, глиальные и швановские клетки,
сывороточные и иммунные белки,
гормоны. Если источником трофоге-
нов являются растущие отростки ней-
ронов (при регенерации или в онто-
генезе), то после установления кон-
такта с клеткой-мишенью в ней также
начинают образовываться трофиче-
ские вещества, способствующие ори-
ентации отростков и установлению
синаптических контактов, без чего
нейрон может погибнуть (Г. Н. Крыжа-
новский).
Одним из важных трофогенов яв-
ляется фактор роста нервов, который
способствует росту, дифференциров-
89
ке и выживанию нейронов. Он обра-
зуется в большом количестве в разви-
вающейся нервной системе, особен-
но в эмбриогенезе, а также при реге-
нерации нервной ткани, вследствие
того что эти трофогены растормажи-
вают соответствующие гены.
В трофике нейронов участвуют так-
же ганглиозиды (сиалогликолипиды),
локализующиеся в основном в плаз-
матических мембранах. Они усилива-
ют рост и жизнеспособность нейронов
при повреждении, а также активизи-
руют гипертрофию оставшихся нейро-
нов, поэтому их используют в меди-
цине. Трофогенной функцией облада-
ют также пептиды: лей- и мет-энке-
фалины, субстанция Р, В-эндорфин
и др. Эти пептиды могут действовать
как трофогены, а также способство-
вать образованию других трофогенных
веществ.
Трофогены поступают в клетку-ре-
ципиент через несинаптические кон-
такты путем эндоцитоза и включают-
ся в обменные процессы либо воздей-
ствуют на генетический аппарат.
Развитие нейродистрофического
процесса может быть обусловлено раз-
личными причинами: нарушением
синтеза трофогенов, недостаточным
поступлением в клетку-реципиент
либо изменением степени их действия
на уровне самой клетки. Трофогены,
вызывающие полезный эффект, назы-
ваются нормотрофогенами.
Нарушение нервной трофики мо-
жет также произойти в результате
образования в нейронах патотрофоге-
нов — веществ, индуцирующих устой-
чивые патологические изменения кле-
ток-реципиентов (Г. Н. Крыжанов-
ский). Например, патотрофогены син-
тезируются в эпилептнзированных
нейронах, откуда они поступают с
аксоплазмой в другие нейроны и ин-
дуцируют в них эпилептические свой-
ства. Другие патотрофогены вызыва-
ют дегенерацию, гиперактивацш
нейронов, дегенерацию мышц и т.д
К патотрофическим относятся веще-
ства, образующиеся не только в не-
рвной, но и других тканях, Hanpi •
мер, в мышце — белок дистрофи
при наследственной мышечной деге-
нерации и др.
Трофогены и патотрофогены, ка;
токсины, вирусы, иммуноглобулинь
могут распространяться между самы-
ми отдаленными нейронами, стано-
вясь механизмом генерализации пато-
логического, в том числе дистрофи-
ческого. процесса.
Классическим объектом для изу-
чения нейродистрофического про-
цесса является мышца, которая по-
лучает трофогены, синтезирующие-
ся непосредственно в двигательно
нейроне и его аксоне. С аксоплазма-
тическим током эти трофогены по-
ступают в мышечные волокна. Поэте
му после перерезки двигательног
нерва в мышцах развивается денер-
вационный синдром, в основе кото-
рого лежит нейродистрофическп
процесс в мышечной клетке. Врем
наступления денервационного синд-
рома зависит от уровня перерезк
двигательного нерва. Чем перерезк
ближе к нейрону, тем больше оста-
ется трофогенов в периферичсскс
отрезке нерва, тем позднее наступ, -
ет денервационный синдром.
Денервация в других тканях так/ .-.
вызывает нейродистрофический про
цесс, например в коже. Перерезка acj
ферентных нервов кожи вызывает
ней дистрофические изменения, в ра
витии которых среди прочих факте •
ров важная роль принадлежит субстак
ции Р. Эта субстанция представляв
собой биологически активное веш;
ство, усиленно выделяющееся в ко;
при электрической стимуляции пер
ферического отрезка тонких нервнь
волокон. Под влиянием избыточно'
90
ЙГ;-ДИЮ
н Т.д.
з г:ете-
не-
_.:ри-
~' 5ии
• зеге-
ь как
:НЫ,
-Л1Ы-
-1Н0-
• “1ТО-
т Ьи-
t !3у-
~.ро-
S-- по-
't _ие-
f-HOM
r<\ia-
Г: ПО-
?ТО-
- зго
je-ep-
'фв «: то-
Ф*-КИЙ
Ф кемя
Ф' - нд-
Фс-ДКП
фегезка
’Ф : та-
ло
количества субстанции Р возникает
нейрогенное воспаление кожи, харак-
теризующееся отеком и гиперемией.
Существуют различные причины,
приводящие к количественным и ка-
чественным нарушениям аксотока,
вызывающим нейротрофические про-
цессы в клетках. К ним относятся па-
тологические изменения нервных про-
водников и синапсов, уменьшение
запасов медиаторных веществ, нару-
шение или извращение их синтеза и
распада в нервной клетке, а также в
клетке-эффекторе, которая осуществ-
ляет обратную связь с нервной клет-
кой. Наконец, типовая форма нейро-
дистрофии развивается после прекра-
щения тока нейросекреторного веще-
ства по аксонам при денервации. Таким
образом, в основе развития нейроди-
строфии тканей лежит изменение ме-
таболизма клеток: нуклеинового, бел-
кового, энергетического.
Микроциркуляторные и другие из-
менения в денервированных тканях
также связаны с нарушением выработ-
ки факторов роста сосудов и регуля-
ции кровотока.
Независимо от причины, вызвав-
шей нейродистрофию, в клетках воз-
никают сходные патологические про-
цессы, связанные с избыточным на-
коплением в цитозоле свободного
Са2+, что приводит к активации про-
теинкиназ и фосфолипаз, разрушению
внутриклеточных структур, гибели
клетки или хроническому дистрофи-
ческому процессу.
Важнейшей особенностью клеток
денервированной ткани является при-
обретение ими свойств малодиффе-
ренцированных клеток, как бы возврат
к ранним этапам их филогенетиче-
ского развития. Ультраструктурные из-
менения при нейродистрофических
процессах касаются прежде всего ми-
тохондрий, что проявляется в умень-
шении их числа, набухании и разру-
шении крист, просветлении матрик-
са. Нарушение спектра белков клеток,
появление новых антигенов вследствие
изменений в генетическом аппарате
способствуют развитию аутоиммунно-
го процесса в денервированных тка-
нях, что может привести к развитию
иммунного конфликта.
Повреждение нерва вызывает так-
же нарушение репаративной регене-
рации. При этом не только прекраща-
ется или нарушается транспорт меди-
аторов для осуществления пластиче-
ских процессов в регенерирующей
ткани, но и перестают поступать в не-
рвную систему биологически активные
вещества этой ткани, возникающие
при гибели, размножении и взаимо-
действии клеток, т.е. прекращается
двусторонняя связь «нерв—ткань».
Особенности репаративной регене-
рации после денервации можно опи-
сать на примере костной ткани. Деаф-
ферентация путем перерезки нижне-
альвеолярного нерва у кроликов од-
новременно с нанесением травмы
нижней челюсти вызывают ускорение
образования первичной фиброзной
мозоли, но вместе с тем значительно
замедляется ее замещение зрелой пла-
стинчатой костной тканью, что объяс-
няется торможением синтеза костно-
го коллагена.
В условиях аналогичной чувствитель-
ной денервации (деафферентации)
изменяется также течение острого
воспалительного процесса в периапи-
кальной ткани зуба. Это выражается
в развитии хронического течения вви-
ду недостаточного формирования кле-
точных барьеров в очаге воспаления,
в первую очередь микрофагального,
что также способствует его распро-
странению.
Кроме местно-трофических наруше-
ний также может возникнуть дистро-
фический процесс в результате повреж-
дения высших вегетативных центров,
91
например гипоталамуса при опухолях,
травмах и т. п. Эти процессы проявля-
ются в виде разнообразных поражений
в тканях полости рта, легких, желудоч-
но-кишечного тракта и других органов.
Таким образом, развитие патоло-
гии клеток при первичных нарушени-
ях различных отделов нервной систе-
мы является важным патогенетиче-
ским звеном в формировании патоло-
гических процессов на уровне ткани,
органа и целого организма. В основе
этой связи лежит существование еди-
ной трофической системы организма,
в том числе гуморальной регуляции
клеточных функций.
2.10. Ишемическое
повреждение клетки
Тяжесть ишемического повреждения
клеток зависит от степени нарушения
кровообращения, сохранения процес-
са выведения метаболитов из органа,
продолжительности ишемии и темпе-
ратуры среды. Важным фактором явля-
ется вид органа, подвергающегося
ишемии, так как чувствительность раз-
личных органов к ишемии различна и
при оценке на легко стандартизируе-
мой модели тотальной ишемии снижа-
ется в ряду «головной мозг—печень —
почки и сердце —скелетные мышцы —
эндокринные органы — кожа».
При ишемическом повреждении
энергообеспечение клеток нарушает-
ся на трех основных этапах: 1) синте-
за АТФ; 2) транспорта энергии АТФ
от места продукции к эффекторным
структурам клеток; 3) утилизации
энергии АТФ.
Нарушение синтеза АТФ при ише-
мическом повреждении клеток про-
исходит в основном в результате по-
давления окислительных процессов,
обусловленного дефицитом кислоро-
да и субстратов метаболизма, и раз-
вивающегося вторично поврежден!
структуры и ферментов митохондри
Клетка реагирует при этом мобил;
зацией энергии из внутриклеточнг
запасов и уменьшением потреблен!
энергии.
Мобилизация внутриклеточных з.
пасов энергии происходит путем ис-
пользования богатых энергией ве-
ществ, например креатинфосфата
мышечных и нервных клетках, гликг •
гена, глюкозы, триглицеридов, а та?
же за счет активации гликолиза. Этс
процесс можно рассматривать к,,
один из механизмов компенсации. И:-
вестно, что при полном окислен!;
одной молекулы глюкозы образуете
38 молекул АТФ, а при гликолитичс-
сом расщеплении — всего лишь 2 ме
лекулы (при гидролизе 1 моля АТФ вь
деляется 40 кДж энергии). Следов.-
тельно, этот механизм несовершене-
и не способен устранить дефицит ма? -
роэргических соединений в тканях, гз
основным источником энергии явля-
ются жирные кислоты и глюкоза, вс -
влекаемые в цикл трикарбоновых кис-
лот. Ограничение потребления энерп
осуществляется за счет уменьшен!
функциональной активности клетк
ограничения транспорта ионов и х;
мических процессов синтеза.
Падение внутриклеточного пари:
ального давления кислорода них:
«критического уровня» (примерно 1 -
2 мм рт.ст.) является лимитируюш!
фактором для основных этапов аэро "
ных энергопродуцирующих процессе с
1) окислительного образования аг.
тил-КоА из жирных кислот, пирувг'
и аминокислот;
2) метаболизма ацетильных груг’
в цикле трикарбоновых кислот;
3) транспорта электронов к кисл
роду, сопряженного с фосфорилир
ванием.
Таким образом, при ишемическс
повреждении клеток происходит суш-.
92
яия
Ч1Й.
_1И-
ных
НИЯ
_ за-
ис-
ве-
а в
:ко-
гак-
:?ТОТ
как
Из-
-:ии
лея
-че-
чо-
зы-
: ва-
жен
ак-
. где
3.7Я-
30-
д ге-
ли
-ИЯ
~<и,
л-
л-
f же
. ам
Г>?б-
г>в:
згта
лп
30-
70-
JM
ственное нарушение процессов энер-
гетического обеспечения не только на
уровне продукции АТФ, но также
транспорта и утилизации энергии.
2.11. Реперфузионное
повреждение клеток
Восстановление кровообращения в
ткани после кратковременной ишемии
может привести к полному восстанов-
лению структуры и функций повреж-
денных клеток. Однако восстановление
кровообращения после длительной
ишемии может привести к развитию
так называемого реперфузионного по-
вреждения.
В механизме развития реперфузи-
онного повреждения клеток основное
значение имеют:
фазные изменения, локальной гемоди-
намики, заключающиеся в развитии
реактивной гиперемии с последующим
падением кровотока ниже исходного
(феномен отсроченного неполного
восстановления кровотока — феномен
«по-reflow») либо неполного восста-
новления кровотока, возникающего
сразу после реперфузии органа (пер-
вичный феномен «по-reflow») на фоне
длительной ишемии. Считают, что ос-
новными причинами возникновения
феномена «по-reflow» являются вазо-
спастические изменения тонуса стенок
мелких резистивных сосудов и меха-
нические препятствия для кровотока,
связанные с отеком эндотелия, внут-
рисосудистой агрегацией клеточных
элементов, перикапиллярным отеком
и сдавлением капилляров, а в мышеч-
ных органах (сердце, скелетных мыш-
цах) — с нарастающей ишемической
контрактурой;
повышение интенсивности перекис-
ного окисления липидов мембран клеток
и внутриклеточных структур вслед-
ствие развившейся в процессе ишемии
недостаточности ферментов антиокси-
дантной защиты и гипероксией. При-
ток кислорода в ранее ишемизирован-
ную зону приводит к массированному
взаимодействию его с субстратами
перекисного окисления, являющими-
ся донорами электронов, что сопро-
вождается не только четырехэлектрон-
ным (оксидазным, полным) восста-
новлением молекулы кислорода, но и
одно-, двух- или трехэлектронной (ок-
сигеназной, неполной) редукцией. Это
обусловливает образование активных
форм кислорода, взаимодействующих
с органическими, прежде всего липид-
ными, субстратами с образованием
токсических перекисей.
Важнейшим источником активных
форм кислорода при реперфузии яв-
ляются фагоцитирующие клетки. Дли-
тельная ишемия тканей приводит к
массивному образованию хемоаттрак-
тантов в поврежденных тканях. При
реперфузии фагоциты устремляются в
поврежденные ткани, активируются,
и начинают продуцировать в больших
количествах активные формы кисло-
рода.
Контрольные вопросы
1. Какие пути поступления патогенных
агентов в клетку вам известны?
2. Назовите виды острого повреждения
клетки.
3. Каковы причины и условия разви-
тия предепрессионной гиперактивности?
4. Расскажите о стадиях и механизмах
тотального необратимого повреждения
клетки.
5. Каковы причины, условия и меха-
низмы развития парциального некроза?
6. Перечислите причины и механизмы
повреждения лизосом.
7. Каковы причины и механизмы по-
вреждения митохондрий?
8. Какие причины и механизмы повреж-
дения клеточных мембран вам известны?
- - ГЛАВА 3
НЕШНИХ И ВНУТРЕННИХ ФАКТОРОВ
в патологии
—
\
i. Роль термических
факторов
Перегревание (гипертермия). Это
состояние организма характеризуется
нарушением теплового баланса и теп-
лосодержания. Перегревание является
следствием пролонгированного воздей-
ствия высокой температуры окружа-
ющей среды, особенно в комбинации
с факторами, затрудняющими тепло-
отдачу. Такое состояние организма раз-
вивается на фоне отсутствия первич-
ных нарушений механизмов терморе-
гуляции.
Тепловые поражения человека име-
ют довольно широкую распространен-
ность. Нередко перегревание организ-
ма наблюдается в условиях производств
с высокой температурой окружающей
среды и повышенной влажностью воз-
духа. Поражению организма теплом
способствует интенсивная мышечная
работа. Острая форма перегревания —
тепловой удар — нередко встречается
у спортсменов: велосипедистов, фут-
болистов, бегунов-марафонцев. Так
называемые атмосферные «тепловые
волны» являются причиной смерти
значительного числа жителей: прохож:-
дение «тепловой волны» в июле 1980 г.
в г. Канзас-Сити (США) привело к ги-
бели примерно 10 % лиц, подвергшихся
воздействию температурного фактора.
Различные виды тепла по-разному
действуют на организм.
Так, экзогенное тепло постепенно
прогревает поверхностные ткани, по-
94
вышает температуру крови в кожных
капиллярах. Нагретая кровь в после-
дующем переносит тепло внутрь.
Прямое действие тепла на биоло-
гические системы проявляется в из-
менениях структуры и функции бел-
ков, нуклеиновых кислот, в измене-
ниях физико-химического состояния,
функций липидов, а также в измене-
ниях скоростей протекания биохими-
ческих реакций. Отмеченные сдвиги
приводят к нарушениям параметров
обмена вешеств, функционального
состояния различных органов и си-
стем, в частности систем физической
и химической терморегуляции.
Подчеркнем, что рефлекторная ак-
тивация системы физической терморе-
гуляции при перегревании формирует
три группы срочных защитно-приспо-
собительных реакций: характерные
поведенческие реакции; усиление ме-
ханизмов теплоотдачи; включение ме-
ханизмов неспецифической защиты в
рамках развивающегося общего адап-
тированного синдрома.
Патофизиологические изменения в
организме под действием тепла при-
нято делить на стадии компенсации и
декомпенсации.
Стадия компенсации представляет
собой начальный период перегрева-
ния, когда температура тела продол-
жает оставаться нормальной. Реакции
систем физической и химической тер-
морегуляции на этой стадии происхо-
дят как следствие теплового раздра-
жения терморецепторов кожи и сосу-
ГЛАВА 3
РОЛЬ ВНЕШНИХ И ВНУТРЕННИХ ФАКТОРОВ
В ПАТОЛОГИИ
3.1. Роль термических
факторов
Перегревание (гипертермия). Это
состояние организма характеризуется
нарушением теплового баланса и теп-
лосодержания. Перегревание является
следствием пролонгированного воздей-
ствия высокой температуры окружа-
ющей среды, особенно в комбинации
с факторами, затрудняющими тепло-
отдачу. Такое состояние организма раз-
вивается на фоне отсутствия первич-
ных нарушений механизмов герморе-
гуляции.
Тепловые поражения человека име-
ют довольно широкую распространен-
ность. Нередко перегревание организ-
ма наблюдается в условиях производств
с высокой температурой окружающей
среды и повышенной влажностью воз-
духа. Поражению организма теплом
способствует интенсивная мышечная
работа. Острая форма перегревания —
тепловой удар — нередко встречается
у спортсменов: велосипедистов, фут-
болистов, бегунов-марафонцев. Так
называемые атмосферные «тепловые
волны» являются причиной смерти
значительного числа жителей: прохож-
дение «тепловой волны» в июле 1980 г.
в г. Канзас-Сити (США) привело к ги-
бели примерно 10 % лиц, подвергшихся
воздействию температурного фактора.
Различные виды тепла по-разному
действуют на организм.
Так, экзогенное тепло постепенно
прогревает поверхностные ткани, по-
вышает температуру крови в кожнк
капиллярах. Нагретая кровь в после-
дующем переносит тепло внутрь.
Прямое действие тепла на биолс-
гические системы проявляется в из-
менениях структуры и функции бел-
ков, нуклеиновых кислот, в измене-
ниях физико-химического состояния
функций липидов, а также в измене-
ниях скоростей протекания биохими-
ческих реакций. Отмеченные сдвиг
приводят к нарушениям параметре;
обмена веществ, функционально!
состояния различных органов и си-
стем, в частности систем физическо
и химической терморегуляции.
Подчеркнем, что рефлекторная ак-
тивация системы физической терморе-
гуляции при перегревании формируе-
три группы срочных защитно-приспо-
собительных реакций: характерны?
поведенческие реакции; усиление ме-
ханизмов теплоотдачи; включение ме-
ханизмов неспецифической зашиты -
рамках развивающегося общего адап-
тированного синдрома.
Патофизиологические изменения :
организме под действием тепла при-
нято делить на стадии компенсации
деком пе нсации.
Стадия компенсации представляе'
собой начальный период перегрева-
ния, когда температура тела продол-
жает оставаться нормальной. Реакцш
систем физической и химической тер-
морегуляции на этой стадии происхс-
дят как следствие теплового раздра-
жения терморецепторов кожи и сос; -
94
дов. При более интенсивном тепловом
воздействии изменение физиологиче-
ских функций связывают с прямым
действием нагретой крови на ЦНС,
в частности на нейронный комплекс
гипоталамического терморегуляторно-
го центра.
Первичные реакции теплоотдачи,
выраженные в расширении кожных со-
судов, увеличении их кровенаполне-
ния, повышении температуры кожи,
включаются в том случае, если тем-
пература окружающей среды становит-
ся выше комфортной (более 18 — 20 °C).
При повышении температуры кожи до
33 —35 °C появляется ощущение дис-
комфорта и к теплоотдаче присоеди-
няется секреция пота.
При дальнейшем нарастании тем-
пературы окружающей среды тепло-
отдача путем конвекции и излучения
быстро снижается, а отдача тепла ис-
парением влаги с поверхности тела
возрастает. Так, при повышении тем-
пературы воздуха от 18 до 33 °C доля
теплоотдачи путем теплопроведения,
теплоизлучения, конвекции снижает-
ся с 70 до 1 %, а теплоотдача за счет
испарения влаги возрастает с 30 до
95 %. Практически это означает, что
при температуре окружающей среды
33 —35 °C потоотделение становится
единственным механизмом теплоот-
дачи.
Эквивалентная теплообразованию
теплоотдача на стадии компенсации не
увеличивает содержание тепла в орга-
низме, и температура тела не повы-
шается. Вместе с тем на этой стадии
наблюдаются изменения многих веге-
тативных функций организма. Артери-
альное давление несколько снижает-
ся, уменьшается легочная вентиляция,
потребление кислорода, выведение
углекислого газа, могут незначитель-
но возрасти минутный объем сердца
и частота сердечных сокращений. Об-
щее состояние человека остается удов-
летворительным, отмечаются вялость,
сонливость.
Стадия декомпенсации наступает
при продолжающемся дальнейшем по-
вышении температуры окружающего
воздуха, когда происходит перенапря-
жение механизмов терморегуляции, их
срыв, и общая тепловая нагрузка не
компенсируется испарением влаги.
В ходе этой стадии температура внут-
ренней среды организма может по-
выситься до 42 — 43 °C.
Скорость нарастания явлений де-
компенсации зависит от трех факто-
ров:
1) адаптированности организма к
тепловым воздействиям (ее формиро-
вание предполагает повышение теп-
лопроводности периферических тка-
ней тела, увеличение потоотделения,
уменьшение потребления кислорода,
формирование термостабильности
белков, повышение устойчивости кле-
точных мембран);
2) температуры окружающей сре-
ды;
3) продолжительности теплового
воздействия (подъем температуры тела
до 42 °C при температуре окружающей
среды 60 °C происходит в течение 5 —
6 ч, тогда как при температуре 80 °C
всего за 40 мин).
На стадии декомпенсации самочув-
ствие человека значительно ухудшает-
ся: появляется чувство жара, сердце-
биение, пульсация и ощущение дав-
ления в висках, тяжесть в голове,
головная боль. Отмечается двигатель-
ное беспокойство, профузное обиль-
ное потоотделение, приводящее к по-
терям водорастворимых витаминов,
к грубому нарушению водно-электро-
литного обмена из-за уменьшения в
организме воды, содержания ионов
Na+, К+, хлоридов (потери хлоридов
иногда составляют 10 — 30 г при об-
щем содержании их в организме в ко-
личестве 165 г). Уменьшение содержа-
95
ния воды в организме приводит к уве-
личению вязкости крови.
В дальнейшем отмечается усугубле-
ние нарушений сердечно-сосудистой
системы: нарастает тахикардия, уве-
личивается разница между систоличе-
ским и диастолическим давлением,
систолический объем сердца падает,
минутный объем поддерживается на
нижней границе нормы за счет тахи-
кардии.
Нарушение функций дыхательной
системы проявляется в увеличении
легочной вентиляции и приводит к
вымыванию диоксида углерода из
организма. Снижению содержания ди-
оксида углерода способствуют наруше-
ния его связывания кровью. Гипокап-
нии сопутствует гипоксемия как ре-
зультат циркуляторных нарушений в
сердечно-сосудистой системе, а так-
же понижение степени диссоциации
оксигемоглобина в результате разви-
вающегося алкалоза.
Используемая для окисления глю-
коза в условиях недостаточного по-
ступления кислорода расщепляется
гликолитически, что быстро форми-
рует энергодефицитное состояние.
Существенные сдвиги наблюдают-
ся в гипоталамо-гипофизарно-надпо-
чечниковой системе. Стрессорное дей-
ствие тепла в работе этой системы
проявляет себя двояко. С одной сторо-
ны, усиление выброса глюкокортико-
идов способствует росту клеточно-тка-
невой резистентности в начальном
периоде перегревания, с другой —
увеличение выброса катехоламинов
мобилизует обменные процессы и ве-
дет к дальнейшему росту температуры
тела. Впоследствии эти механизмы ис-
тощаются. За счет нарушения работы
гипоталамо-гипофизарно-тиреоидной
системы снижается функциональная
активность щитовидной железы.
Действие высокой температуры,
гипокапния, гипоксемия, циркуляр-
96
ные изменения ведут к нарушении
деятельности центральной нервно;
системы в результате расстройств си-
наптической передачи. Как известно
существенные изменения проводимо-
сти синапсов корковых нейронов на-
блюдается при температуре примерно
38 °C.
Крайним вариантом декомпенса-
ции механизмов терморегуляции npi
тепловых поражениях является тепло-
вой удар — патологическое состояние
связанное с максимальным накопле-
нием тепла в организме. Его разно-
видностью является солнечный удар
обусловленный прямым воздействи-
ем на организм инфракрасной части
спектра солнечного излучения. Меха-
низмы патогенеза при обоих видах ги-
пертермии практически не отличают-
ся. Тепловой удар у человека развива-
ется при ректальной температуре 42 —
43 °C.
Клинические проявления теплово-
го удара обнаруживаются в двух вари-
антах: иногда через продромальны;
период, иногда внезапно. Если тепло-
вой удар протекает с продромальны'
периодом, в его течении отмечаете-,
внезапная слабость, чувство жара, го-
ловокружение и головная боль, шу?
в ушах, потемнение в глазах, увели-
чение частоты сердечных сокрашенш
и дыхания, носовые кровотечения
тошнота, рвота, боль в надчревной об-
ласти, спине и конечностях. Если теп-
ловой удар развивается внезапно, об-
ращают на себя внимание отсутствие
потоотделения, сухость, повышенш
температуры и гиперемия кожи. Воз-
никает обморочное СОСТОЯНИе ВПЛОТ;
до развития коматозных явлений, су-
дорожных сокращений мышц. Пуль,
становится частым, нитевидным, дь -
хание прерывистым, сухожильны;
рефлексы обычно отсутствуют, появ-
ляются патологические рефлексг
В тяжелых случаях больные погибаю"
ной
си-
тно,
лю-
на-
рно
-:са-
при
'.’.70-
ние,
дте-
1НО-
дар,
7ВИ-
дсти
:ха-
•. ги-
150T-
;*ва-
дэ___
:во-
йри-
:-ЫЙ
“ЛО-
-ым
.лея
.. го-
лум
лли-
ений
-ля.
•! эб-
-?П-
эб-
гзие
Е.чие
дэз-
ГЛ эть
f гу-
8 льс
I ды-
ь-ые
’ чв-
t- ;ы.
« -от,
не приходя в сознание. Смерть насту-
пает спустя несколько часов после
поражения при явлениях падения сер-
дечной деятельности и остановки ды-
хания.
В чем заключается патогенетическая
основа тяжелого поражения организма
при перегревании? Высокая температу-
ра резко изменяет деятельность сердеч-
но-сосудистой системы. В настоящее
время установлено, что ее функцио-
нальные возможности — это один из
важнейших лимитирующих факторов,
определяющих переносимость орга-
низма тепловой нагрузки. В экспери-
ментах на изолированных полосках
миокарда доказано снижение его со-
кратительной способности при воз-
действии высокой температуры. Это
объясняется структурно-функциональ-
ными изменениями сократительного
аппарата кардиомиоцитов при гипер-
термии. Происходит также нарастание
энергодефицита сердечной мышцы из-
за нарушений гликолитического рас-
щепления глюкозы, изменения харак-
теристик утилизации жирных кислот,
снижение содержания белка, разобще-
ние процессов окисления и фосфори-
лирования, нарушение ресинтеза
АТФ.
На электрокардиограмме (ЭКГ) от-
мечается экстрасистолия, нарушение
проводимости, слияние элементов же-
лудочкового комплекса, отрицатель-
ный зубец Г, смещение интервала ST,
т.е. все признаки выраженного диф-
фузного повреждения миокарда.
При температуре, превышающей
42 °C, артериальное давление у чело-
века снижается, а венозное — увели-
чивается, уменьшается линейный и
объемный кровоток, снижается ми-
нутный объем сердца. Тахикардия пре-
вышает 140 уд./мин. Страдает микро-
циркуляция крови.
Особо выраженные нарушения при
тепловом ударе обнаруживаются в фор-
менных элементах крови. На фоне на-
рушения количественных показате-
лей эритроцитов, высокой вязкости
крови ее реологические свойства из-
меняются вплоть до развития ДВС-
синдрома.
Резко изменяется дыхание, оно ста-
новится очень частым, поверхност-
ным, аритмичным, в случае нараста-
ния острой сосудистой недостаточно-
сти — по типу Чейна — Стокса.
Грозным осложнением теплового
удара является почечная недостаточ-
ность. Возникновение ее обусловлено
рядом причин. Падение артериально-
го давления и гипокалиемия приво-
дят к снижению скорости клубочко-
вой фильтрации и повреждению по-
чечных канальцев. Канальцевые рас-
стройства связаны с миоглобинурией,
гипоксией, в особенности в сочетании
с ДВС-синдромом.
Наблюдается прогрессирующее сни-
жение функции щитовидной железы.
Структурно-функциональное состоя-
ние надпочечников характеризуется
грубыми изменениями, вплоть до раз-
вития явлений острой надпочечнико-
вой недостаточности. С недостаточ-
ностью надпочечников при тепловом
ударе связаны адинамия, сердечно-
сосудистая недостаточность, падение
артериального давления.
Функциональное состояние цент-
ральной нервной системы соответству-
ет терминальным фазам ее активно-
сти. Принято считать, что поражения
важнейших нервных центров при теп-
ловом ударе представляют собой ко-
нечные звенья его патогенеза.
Значительная роль в патогенезе теп-
лового удара отводится формирующей-
ся в организме аутоинтоксикации. Это
подтверждается тем, что чаще всего
организм погибает спустя несколько
часов после теплового поражения,
когда температура тела близка к норме.
Накопление токсических продуктов
97
нарастает пропорционально степени
роста температуры тела и достигает
максимума при тепловом ударе. Среди
аутотоксинов главная роль отводится
аммиаку. Для проявления его токси-
ческих свойств в ситуации теплового
удара формируется ряд условий. К наи-
более очевидным относятся следу-
ющие условия: клеточный ацидоз и
распад белков в силу разрыва слабых
химических связей; снижение выдели-
тельной функции почек; отчетливое
увеличение токсичности аммиака в
условиях гипертермии.
Помимо аммиачной аутоинтокси-
кации наблюдается активация пере-
кисного окисления липидов с обра-
зованием липидных перекисей и про-
дуктов их вторичного превращения —
альдегидов, кетонов, эпоксидов, вы-
сокотоксичных для организма.
Дополнительным показателем уров-
ня эндогенной интоксикации являет-
ся накопление в крови молекул сред-
ней массы (МСМ). МСМ — это груп-
па веществ с молекулярной массой
500—5000 Да, являющихся по хими-
ческой структуре пептидами, глико-
протеидами, полиаминами, олигоса-
харами. Содержание этих веществ зна-
чительно возрастает при тепловом
ударе и является своеобразным мар-
кером интоксикации организма.
Таким образом, патогенетически-
ми факторами острого перегревания
являются: непосредственное действие
тепла на ткани, гипоксия тканей, ги-
покапния, изменение pH. нарушение
водно-электролитного гомеостаза, об-
разование и накопление токсических
продуктов с последующей аутоинток-
сикацией, поражение надпочечников
(рис. 3.1). Все это приводит к тяжелому
страданию человека и требует свое-
временного проведения комплекса ле-
чебно-профилактических мероприя-
тий, препятствующих развитию теп-
лового удара.
Искусственная гипертермия прим
няется в двух вариантах: 1) как пир
терапия; 2) как локальная гиперте
мия, связанная с тепловым везде
ствием на ткани организма. Второй е
риант используют в основном в цел
терапии опухолей. Непосредствен
опухолевые клетки по термоустойч
вости не отличаются от нормальн.
клеток, но в самой опухоли или с
дельных ее зонах создаются некотор
условия, обеспечивающие повышен
термочувствительности клеток. Де
ствие температурного фактора огран
чивает кровоток, что усугубляет нн=
кое парциальное давление кислорс:
и водорода в клетках опухоли. Помп
этого страдают белки и липиды ме>
ран опухолевых клеток, нарушается .
проницаемость, в клетку устремляй
ся ионы Са2+, а из клетки выводят,
ионы К+. Определенное значение пр
тепловом воздействии на опухолей.,
клетки имеет накопление в них гл
татиона, влияющего на ядерный с
парат клеток.
Установлено, что опухолевые кле
ки наиболее термочувствительна
S-фазе митоза. Увеличение темпера?
ры опухоли на 1 °C свыше 43 °C пр
мерно в 2 раза снижает выживаемо,
опухолевых клеток.
Локальная гипертермия опухо..
чаще всего сочетается с радио-, химг
терапией и потенцирует их лечебн-
эффект, делая опухолевые клетки с
лее уязвимыми для этих воздейств:
Охлаждение организма. Охлажл
ние организма (гипотермия) —
расстройство функций организм;
результате действия низкой темпер
туры. Оно является следствием нар
шения терморегуляции, связанно,
усилением теплоотдачи, снижен! ;
теплообразования, сочетанием э~
причин.
Термин «переохлаждение орган,
ма», применяемый иногда для опр
98
Рис. 3.1. Схема патогенеза перегревания организма (по Н. Б. Козлову)
' „ М№иП|М№ОД ГI 'Я!!| № Wfep
деления данного состояния, является
менее удачным, так как предполагает
такое снижение температуры тела,
которое несовместимо с жизнью. Рек-
тальная температура 25 °C является по-
граничной между жизнью и смертью.
Этот интервал положительных темпе-
ратур ни в коей мере не является по-
рогом устойчивости для клеток орга-
низма.
Если при перегревании подъем тем-
пературы лимитируется денатурацией
белковых молекул, которая возника-
ет уже при увеличении температуры
тела на 6 — 8 °C, то снижение темпе-
ратуры вовсе не ведет к денатурации
белка. Изолированные органы и тка-
ни человека способны выдерживать
весьма низкую температуру. В услови-
ях обычной рабочей деятельности кле-
ток, тканей органов, систем организ-
ма диапазон допустимого снижения
температуры в целом невелик, как и
при перегревании.
Действие холода на организм яв-
ляется довольно распространенным.
Многие районы нашей страны нахо-
дятся в зоне холодного климата. Раз-
витие мореплавания в северных ши-
ротах, освоение полярных районов
земного шара, полеты в космос — это
далеко не полный перечень ситуаций,
связанных с воздействием холода на
организм человека.
В этиологии гипотермии необхо-
димо отметить и роль условий. Среди
условий действия холода на организм
выделяют: 1) внешние — высокая
влажность воздуха, его движение со
значительной скоростью, неутеплен-
ная и промокшая одежда; 2) внутрен-
ние — пожилой и ранний детский воз-
раст; алкогольное опьянение, приво-
дящее к расширению поверхностных
кровеносных сосудов и угнетению
центров терморегуляции; истощение
и утомление человека; гипофункция
щитовидной железы. Среди внутрен-
них условий особо следует отметит:
роль адаптированности организма
действию холода. Высокая адаптаци
к холоду у аборигенов Севера обуслот-
ливает широкий диапазон приспосо-
бительных реакций, повышает рези-
стентность организма к действию это):
фактора.
В основе акклиматизации к холод,
лежат следующие физиологические ме -
ханизмъг. повышение интенсивност;
метаболического термогенеза; увели-
чение ежедневного потребления вы-
сококалорийной пищи; преходяще^
уменьшение массы тела; гипертрофи-
шитовидной железы и надпочечников
бурой жировой ткани, а также отно-
сительное по сравнению со скелетно
мускулатурой увеличение массы сер-
дца, почек, печени и других внутрен-
них органов; увеличение потреблен!)
тканями кислорода; значительное воз-
растание калоригенного потенциал,
катехоламинов; снижение теплоотда-
чи из-за ограничения кровотока в по-
верхностных тканях организма — «обо-
лочке» тела.
В патогенезе расстройств организ-
ма при охлаждении ведущая роль при-
надлежит функциональным и метабо-
лическим изменениям. По степени из-
менения ректальной температуры
охлаждении организма выделяют де.
стадии: стадию компенсации, когд.
температура в прямой кишке не опус-
кается ниже 35 °C и стадия декомпег. -
сации, которая характеризуется даль-
нейшим снижением ректальной тем-
пературы.
Принято считать, что на стали,
компенсации теплообразование прак-
тически соответствует теплоотдаче. Эз
достигается прежде всего снижение
теплоотдачи путем прекращения по-
тоотделения, формирования спазм
сосудов поверхности тела, уменью-,
ния теплопроведения из «ядра» тела
его поверхности.
100
НТИТЬ
<a к
~-ПИЯ
'-TOB-
. со-
:ези-
<ого
’оду
-л ме-
г :сти
те.ти-
- зы-
L’Jiee
фия
S-xOB,
~но-
Г~НОЙ
‘ :ер-
~~ен-
ееяия
t 303-
слла
и :да-
. з ю-
<бо-
Г--ИЗ-
Ь ~эи-
е _5о-
лз-
в
Шг две
<• : ’Да
Ш---Tyc-
Ш. ен-
• 1ЫЬ-
<Й ’ем-
АЕгспи
Шзгак-
Ifc Это
Е- :ем
W о-
fc_:Ma
Значительно ослабляет теплопоте-
ри поза «калачиком». При этом, с од-
ной стороны, в 3 раза уменьшается
отношение поверхности тела к его
массе (S/m), с другой, — активизи-
руются механизмы сократительного и
несократительного термогенеза. Обыч-
но через 5 — 20 мин (в зависимости от
толщины жирового слоя) после воз-
действия холода на рецепторы кожи
возникает выраженная мышечная
дрожь, в результате которой энерге-
тический обмен у человека возрастает
на 300 — 400%. Включение сократи-
тельного термогенеза повышает рек-
тальную температуру на 0,6 — 0,8 °C.
В стадии компенсации в крови уве-
личивается содержание жирных кис-
лот, глюкозы, а содержание гликоге-
на в гепатоцитах снижается, возрас-
тает потребление кислорода, что сви-
детельствует об активизации реакций
обмена веществ.
В результате стрессорного воздей-
ствия холода происходит нейрогумо-
ральная стимуляция деятельности ги-
поталамуса, приводящая к освобож-
дению гормонов аденогипофиза, осо-
бенно тиреотропного гормона и адре-
нокортикотропного гормона (АКТГ).
В ответ на это в крови увеличивается
содержание тиреоидных гормонов,
глюкокортикоидов, катехоламинов,
глюкозы и жирных кислот. На этом
фоне развивается тахикардия, повы-
шается артериальное давление, при-
чем наблюдается опережающий рост
диастолического давления, увеличива-
ется вязкость крови, возрастает коли-
чество эритроцитов и лейкоцитов. Па-
раллельно нарастает минутный объем
сердца и частота дыхания. В целом
описанные механизмы обеспечивают
должную компенсацию гомеостаза, в
том числе и температурного.
Состояние организма на стадии
компенсации оценивается как удовле-
творительное. Оно характеризуется не-
которым возбуждением (объективно
определяется усиление электрической
активности коры головного мозга),
жалобами на озноб, цианотичностью
губ, холодностью и бледностью кож-
ных покровов, мышечной дрожью,
одышкой.
Стадия компенсации при воздей-
ствии холода не требует специальных
лечебных мероприятий. Необходимо
лишь предотвратить дальнейшее дей-
ствие этого фактора.
При продолжающемся действии
холода начинают появляться и нара-
стать явления декомпенсации. Тепло-
отдача преобладает над образованием
тепла в организме, что приводит к
прогрессирующей гипотермии. Струк-
турно-функциональной основой пато-
генеза стадии декомпенсации стано-
вятся значительные нарушения ткане-
вого метаболизма. Прослеживается
отчетливая тенденция к угнетению ин-
тенсивности всех видов обмена ве-
ществ. В клетках печени, мышечной
ткани резко снижается содержание
гликогена, уменьшается потребление
кислорода в тканях, в крови исчезает
гипергликемия.
Снижение температуры в тканях
смешает кривую диссоциации оксиге-
моглобина влево, что затрудняет от-
дачу кислорода клетками, развивает-
ся тканевая гипоксия и сопутству-
ющий ей метаболический ацидоз.
В результате снижается энергетическое
обеспечение тканей. На фоне метабо-
лических расстройств формируются
многочисленные функциональные
нарушения. Среди них следует отме-
тить снижение функциональной ак-
тивности коры больших полушарий
мозга, а затем подкорковых центров,
в том числе и центров терморегуля-
ции. Эти изменения приводят к изме-
нению рефлекторной деятельности.
Возникает адинамия, апатия, сонли-
вость, утрачивается мотивация целе-
101
направленной борьбы с холодом. Спа-
дает тоническое напряжение мышц,
прекращается мышечная дрожь.
Со стороны сердечно-сосудистой
системы отмечается брадикардия, сни-
жение артериального давления, сни-
мается спазм кожных сосудов, что
приводит к возникновению ложного
чувства жара, отмечаются выраженные
глухие тоны сердца. Существенные на-
рушения наблюдаются в микроцирку-
ляторном русле: увеличение вязкости
крови, повреждение эндотелия сосу-
дов активируют пусковой фактор
свертывания (фактор Хагемана), что
ведет к образованию микротромбов,
за счет активации кининовой систе-
мы увеличивается проницаемость ка-
пилляров; нередко формируется ис-
тинный капиллярный стаз с образо-
ванием сладжа (от англ, sludge — грязь,
тина) — однородной красной массы
эритроцитов.
Охлаждение бульбарных центров и
судороги дыхательных мышц делают
дыхание редким, поверхностным, на
терминальной стадии возникает дыха-
ние типа Чейна —Стокса.
Изменения в деятельности желез
внутренней секреции на стадии глу-
бокой гипотермии соответствуют фазе
истощения общего адаптационного
синдрома.
Морфологические изменения в
органах и тканях в терминальной фазе
охлаждения организма характеризу-
ются венозной гиперемией во внут-
ренних органах, головном и спинном
мозге, множественными кровоизли-
яниями в мозг, слизистую оболочку
желудка, межальвеолярные пере-
городки, развивается отек легких.
Смерть наступает чаще всего в резуль-
тате остановки дыхания, фибрилля-
ции желудочков сердца, асистолии,
коллапса.
Искусственная гипотермия — искус-
ственное охлаждение тела в целях
снижения интенсивности обменных
процессов в организме и повышения
устойчивости к гипоксии и травме
Данный метод применяют в основное
в хирургической практике. Историчес-
ки необходимость в искусственной ги-
потермии возникла в связи с выпол-
нением кратковременных операций н;.
сердце, чаще всего связанных с поро-
ками, без применения аппаратов ис-
кусственного кровообращения. В насто-
ящее время искусственное охлаждение
тела сочетается с миорелаксацией
наркозом, использованием аппарате:
искусственного кровообращения.
В ходе искусственной гипотерм и;
температура тела может снижаться дс
31 —20 °C. Наиболее распространен,
искусственная гипотермия с темпера-
турой тела 30 — 28 °C. Патофизиологи-
ческие изменения в организме при ис-
кусственной гипотермии связаны с:
снижением клеточного метаболизма
уменьшением потребления кислород,
и выделения углекислоты. При это'
устойчивость тканей к гипоксии воз-
растает настолько, что представляете
возможным выключение сердца из м: -
гистрального кровотока на 8 — 12 миг
В сердце при гипотермии снижаете:
возбудимость, скорость проведенг
возбуждения по миокарду, формиру-
ется синусовая брадикардия, наблк
дается урежение пульса, снижен!.,
артериального давления, минутное
объема сердца. При правильно прове
денной искусственной гипотермг:
гипергликемия и ацидоз не возник,
ют. Снижение температуры тела _
30 °C не изменяет электрическую а
тивность коры головного мозга, :-
электроэнцефалограмме (ЭЭГ) per;
стрируются а- и [3-ритмы; рефлектс;
ная деятельность нервной системы
нарушается.
При необходимости проведен
длительных операций (до 60 — 80 mi:
используют глубокую искусственн;
102
ЧЫХ
„чия
ьзме.
'ном
- -:ес-
_ ги-
«пол-
Е! на
। :ро-
5 ИС-
нсто-
жчие
. ей,
сетов
г гии
— до
г-ена
г-ра-
ги-
ги лс-
&. СО
•яма,
стэда
.-том
Ш £03-
Ш лея
Л- ма-
"С .ин.
•л .лея
W- ИЯ
Ф* ЭУ-
Щьчо-
•fc-ИЯ
Ф! - ДН)
fc—:ую
гипотермию с применением аппара-
тов искусственного кровообращения.
Иногда в особых случаях применя-
ют локальную искусственную гипо-
термию, например, желудка, почек,
предстательной железы, краниоце-
ребральную гипотермию плода для ре-
гионального изменения метаболизма,
кровотока, функциональной активно-
сти организма, что облегчает прове-
дение тех или иных лечебных меро-
приятий.
3.2. Радиационное
повреждение
Изучение биологического действия
ионизирующих излучений началось
тотчас после открытия рентгеновских
лучей. Еще в 1896 г. наш соотечествен-
ник И. Ф. Тарханов в опытах на лягуш-
ках и насекомых обнаружил реакции
на облучение во многих системах орга-
низма и высказал предположение о
возможности лечебного применения
рентгеновских лучей. В том же году
появились сообщения о поражении
кожи (эритемах, дерматитах, выпаде-
нии волос) у лиц. подвергавшихся
действию рентгеновских лучей при
проведении экспериментов.
На начальных этапах внедрения
и становления рентгенорадиологии
профессиональным заболеванием счи-
тался рак кожи рук рентгенологов.
К 1959 г. было уже известно о 359 спе-
циалистах-радиологах, погибших от
лучевого рака кожи или лейкемии.
Жертвами радиации стали и известные
лауреаты пяти Нобелевских премий —
Мария, Ирен и Фредерик Жолио
Кюри, посвятившие свою жизнь ис-
следованию радиоактивности.
После того как немецкие ученые
Г. Вальхов и Г.Гизель впервые сооб-
щили о действии радия на кожу,
П. Кюри тотчас проверил это на соб-
ственном предплечье и получил ожог.
А. Беккерель в 1901 г. в течение 6 ч
носил в кармане жилета ампулу с ра-
дием и тоже получил эритему, пре-
вратившуюся затем в длительно не-
заживающую язву. Эти наблюдения,
а также эксперименты на животных
позволили П. Кюри вместе с учены-
ми-медиками К. Бушаром и В. Бальта-
заром прийти к выводу о лечебном
действии радия на волчанку и неко-
торые формы рака.
Долгое время объектом наблюде-
ния оставалась в основном кожа, так
как никто не предполагал, что рент-
геновские лучи могут влиять на глу-
боко расположенные ткани. В 1903 г.
после экспериментов русского учено-
го Е. С. Лондона, обнаружившего ле-
тальное действие лучей радия на мы-
шей, Г.Хейнеке, вызвав гибель жи-
вотных рентгеновским облучением,
впервые описал лучевую анемию и
лейкопению и обратил внимание на
поражение органов кроветворения,
в том числе на атрофию селезенки. Он
же детально описал типичные гисто-
логические изменения клеток костно-
го мозга и лимфатических узлов. В мно-
гочисленных экспериментах Е. С. Лон-
дон продемонстрировал действие из-
лучения радия на многие системы
организма и в 1911 г. написал книгу
«Радий в биологии и медицине».
В начале XX в. было выявлено дей-
ствие ионизирующей радиации на
эмбриогенез, а в 1925 г. русские уче-
ные Г. А. Надсон и Г. Ф. Филиппов в
опытах на дрожжах впервые наблюда-
ли действие радиации на генетиче-
ский аппарат клетки, и позже многие
ученые-генетики широко использова-
ли в экспериментах мутагенное дей-
ствие ионизирующего излучения.
Этиология и патогенез радиацион-
ного повреждения. Ионизирующая ра-
диация (ИР) — это такие виды лучей
высокой энергии, которые, проникая
103
в облучаемую среду, вызывают иони-
зацию, т.е. приводят молекулы и ато-
мы вещества в возбужденное состоя-
ние и превращают их в электрически
заряженные ионы. К ионизирующему
излучению относят: рентгеновские и
у-лучи, о- и р-частицы, протоны, ней-
троны, л-мезоны, дейтроны и косми-
ческие лучи.
Последствия патогенного действия
на организм ионизирующей радиации
зависят от многих факторов и усло-
вий:
1) от вида излучения и его физи-
ческих характеристик — ионизиру-
ющей и проникающей способности,
плотности ионизации и биологиче-
ской эффективности (например, у
о-частиц больше ионизирующая спо-
собность, а у у-лучей — проникаю-
щая) и т.п.;
2) величины поглощенной дозы,
измеряемой в греях (Гр), и мощности
дозы (Гр/сут, Гр/ч, Мгр/с и т.п.);
3) кратности и длительности об-
лучения (повреждающее действие ИР
будет сильнее, если организм облучать
в дозе 10 Гр в течение 14 мин по срав-
нению с организмом, облученным в
дозе 10 Гр в течение 140 мин);
4) распространенности облуче-
ния — общее облучение значительно
опаснее, чем местное (при лучевой те-
рапии местно используют такие дозы
радиации, которые при общем облу-
чении были бы абсолютно смертель-
ны); при попадании радионуклидов в
организм происходит поражение тех
органов, в которых они накапливают-
ся, например, йод-131 — в щитовид-
ной железе, стронций-90 — в костях;
5) вида живого организма — наи-
более чувствительны к ИР собаки,
морские свинки и человек, а наиме-
нее — одноклеточные организмы и
черви;
6) состояния организма в момент
облучения — пола и возраста, интен-
сивности окислительных процессов,
температуры и содержания в организ-
ме кислорода. Наиболее чувствитель-
ны к ИР дети, старики и мужчины;
повреждающее действие радиации
усиливается при увеличении интен-
сивности окислительных процессов,
повышении температуры и особенно
при увеличении в организме содержа-
ния кислорода — так называемый
«кислородный эффект».
Патогенез радиационного повреж-
дения складывается из прямого и кос-
венного действия ИР на организм.
Прямое действие обусловлено влия-
нием ионизирующей радиации на уров-
не молекул и атомов, вызывающим
разрыв связей, возбуждение и иониза-
цию. Принято считать, что даже при
действии на организм смертельной
дозы радиации число первично по-
врежденных молекул не столь уж и
велико.
Вся катастрофа обусловлена тем,
что. во-первых, эти молекулы — ДНК
и Н2О уникальны, а во-вторых, тем,
что возникает косвенное действие ра-
диации, еще более разрушительное,
чем прямое.
Под влиянием ионизирующего из-
лучения происходит радиолиз воды с
образованием ОН’, Н' и в дальнейшем
таких активных форм кислорода, как
супероксидный радикал, гидроперок-
сидный радикал, атомарный кислород
и пероксид водорода. Усиливается про-
цесс перекисного окисления липидов
и появляются свободные радикалы
жирных кислот. Очень быстро образу-
ются так называемые «первичные ра-
диотоксины»: гидропероксиды и пе-
роксиды, хиноны и семихиноны, ли-
пидные радиотоксины. Хиноны и
семихиноны подобно самой радиации
повреждают ДНК клеток. Позже по-
являются «вторичные радиотоксины»:
фенолы и полифенолы, альдегиды,
аномальные белки и полипептиды.
104
i-.COB,
Ц.НИЗ-
гтель-
R-шы;
*ЗЦИИ
г-тен-
с.гов,
ёенно
ержа-
С’-!ЫЙ
егеж-
1 кос-
" •>/
i-ТИЯ-
эов-
_1ИМ
-иза-
лри
з ной
' по-
К И
ем,
ZHK
-ем,
е ра-
sHoe,
г ,13-
СЫ С
геем
как
сок-
крод
Цеков
(fc. 3V-
W эа-
й те-
ik ,:и-
и
Цвьыш
Ш 70-
,Жа_ >
ЦЕДЫ,
Ш-ды,
биогенные амины и др. Под влиянием
радиотоксинов повреждаются цито-
плазматические и внутриклеточные
мембраны, повышается их проницае-
мость, изменяется третичная и четвер-
тичная структуры белков, нарушается
работа ферментов, в клетках нараста-
ет дефицит энергии, приводящий к
гипергидратации, ацидозу и аутолизу
клеток.
Известно несколько доказательств
появления и поражающего действия
радиотоксинов:
ядро клетки, внедренное в предва-
рительно облученную клетку, повреж-
дается так же, как и от прямого дей-
ствия радиации (так называемый «ди-
станционный эффект»);
предварительно облученные пита-
тельные среды оказывают выраженное
мутагенное воздействие на помещен-
ные в них микроорганизмы;
кровь облученных кроликов оказы-
вает токсическое действие при введе-
нии ее интактным животным.
Так как главными инициаторами
появления радиотоксинов являются
активные формы кислорода, стано-
вится понятным «кислородный эф-
фект» — чем больше кислорода, тем
больше свободных радикалов и радио-
токсинов. и наоборот. Для усиления
эффекта лучевой терапии злокаче-
ственных опухолей используют окси-
радиотерапию (облучение в атмосфе-
ре избытка кислорода). Для ослабле-
ния поражающего действия радиации
используют гипоксические газовые ды-
хательные смеси (10% кислорода +
+ 90 % азота).
В 1936 г. А. Маршак провел опыт,
в процессе которого облучал ИР ядер-
ные и безъядерные клетки и доказал,
что большую часть энергии поглоща-
ет ядро. В результате он установил, что
ядро в 100 раз чувствительнее к дей-
ствию радиации, чем цитоплазма,
а главной мишенью является ДНК.
Известно четыре вида поврежде-
ний ДНК: I) повреждение пурино-
вых и пиримидиновых оснований;
2) однонитевые разрывы молекулы
ДНК; 3) двухнитиевые разрывы ДНК;
4) поперечные сшивки обломков ДНК.
Первые два вида повреждений воз-
никают при облучении даже неболь-
шими дозами (0,2 Гр), а вторые два
вида — при действии доз более 0,2 Гр,
они считаются потенциально леталь-
ными. Существуют научные данные
о том, что при общем облучении в
дозе 1 Гр в каждой клетке организма
повреждается до 5 000 оснований,
возникает до 1 000 однонитевых раз-
рывов и от 10 до 100 двухнитевых раз-
рывов.
Клетка наделена выработанными в
процессе эволюции механизмами репа-
рации повреждении ДНК: сверхбы-
строй, когда исправление повреж-
денного основания в ДНК происхо-
дит в течение 1 — 2 мин с помощью
ферментов инсертаза и ДНК-лигаза,
и быстрой, при которой с участи-
ем ДНК-полимеразы повреждение ис-
правляется за 10 мин. Различают так-
же медленную эксцизионную ре-
парацию, которая продолжается от 40
до 60 мин и требует участия несколь-
ких ферментов (экзо- и эндонуклеа-
зы, ДНК-полимеразы. лигазы и др.),
которые работают по принципу «вы-
резай и латай». Становится понятным,
почему дробное облучение менее опас-
но, чем однократное в одной и той
же дозе: к моменту нового поврежде-
ния большинство дефектов ДНК уже
исправлено.
Репарация ДНК может быть без-
ошибочной, ошибочной и неполной.
В последних двух случаях возникают
негативные для организма послед-
ствия радиационного повреждения
ДНК:
гибель клетки в момент деления
(митотическая гибель):
105
задержка митоза и прекращение
деления (репродуктивная гибель), т.е.
клетка не дает «потомства»;
подавление синтеза РНК и ДНК:
синтез аномальных и антигенно
чужеродных белков;
мутации в половых или соматиче-
ских клетках (генные, хромосомные
или геномные).
В 1906 г. французские исследовате-
ли Ж. Бергонье и Л.Трибондо устано-
вили, что радиационное повреждение
клетки зависит от фазы клеточного
цикла и наиболее чувствительными к
ионизирующему излучению являют-
ся клетки, находящиеся в состоянии
митоза или мейоза (правило Берго-
нье—Трибондо). Чем менее диффе-
ренцированы клетки, чем больше у
них способность к размножению, тем
больше их радиочувствительность. Ис-
ключением являются только диффе-
ренцированные зрелые лимфоциты,
для которых характерна интерфазная
(вне митоза) гибель при облучении. Их
цитоплазматическая мембрана стано-
вится «дырявой» даже после облуче-
ния малой дозой — 0,01 Гр. Возмож-
но, как полагают некоторые иссле-
дователи. радиация подталкивает зре-
лые лимфоциты к преждевременно-
му апоптозу.
Пользуясь правилом Бергонье —
Трибондо, все клетки, ткани и орга-
ны можно разделить на два вида —
радиочувствительные и радиорезис-
те нтные.
Радиочувствительными являются
центральные и периферические орга-
ны иммунной системы (тимус, селе-
зенка, лимфатические узлы и др.),
красный костный мозг, яичники и се-
менники, базальные клетки эпителия
кожи и слизистых оболочек, клетки эн-
дотелия и эмбриональные клетки. Наи-
большие повреждения после облучения
обнаруживаются в тимусе. Японские
исследователи Ямада и Охияма даже
высказали любопытную гипотезу с
«бешеной фосфофрукто киназе», ак-
тивность которой в тимусе после дей-
ствия ионизирующего излучения чрез-
вычайно возрастает, что сопровожда-
ется чрезмерным расходованием АТФ
и выраженным энергодефицитом, по-
явлением большого количества альде-
гида и повреждением клеток тимуса.
Радиорезистентными считаются ко-
сти, хрящи, связки, мышцы, печень,
почки и высокодифференцированные
клетки центральной нервной системы,
которые повреждаются или очень вы-
сокими дозами радиации или вторич-
но после повреждения эндотелиоци-
тов и нарушения кровообращения.
Поскольку радиочувствительным
является прежде всего непосредствен-
но процесс деления клеток, то впол-
не понятно, что радиорезистентныг
орган можно сделать радиочувстви-
тельным, стимулируя в нем процесс
деления клеток. Например, в экспе-
рименте на животном печень стано-
вится радиочувствительной после ре-
зекции ее части на фоне активизиро-
ванной регенерации.
Для практической медицины наи-
больший интерес представляет вопрос
«Как повысить радиорезистентносг-
чувствительных к ИР органов и тка-
ней?». Оказывается, самыми эффек-
тивными радиопротекторами являют-
ся вещества, которые на время тор-
мозят деление клеток (тормозят синте.
предшественников ДНК, уменьшают
скорость репликации ДНК). Напри-
мер, введенный до облучения мерк-
амин или более сильный проге кто:
пропамин значительно увеличивае~
выживаемость экспериментальных жи-
вотных. При этом уменьшается по-
вреждение ДНК и выработка дефект-
ных молекул, облегчается работа ре-
паративных ферментов.
Механизм действия других радио-
протекторов — физико-химически!
106
он сводится к уменьшению количества
ионизированных и возбужденных мо-
лекул и свободных радикалов, экра-
нированию молекул, перехвату и ней-
трализации свободных радикалов. Из
естественных защитников клетки сле-
дует вспомнить супероксиддисмутазу
(СОД), глютатионпероксидазу и вос-
становленный глютатион, «-токофе-
рол (витамин Е), белки теплового
шока и др. «Ловушкой» свободных ра-
дикалов является препарат диметил-
сульфоксид (димексид). Используют
также препараты селена и алкоголь.
Радиационное повреждение может
быть местным — от эритемы до тяже-
лых лучевых ожогов, упорных и дли-
тельно не заживающих. Возможно по-
ражение тех органов, где накаплива-
ются радиоактивные вещества или
через которые они выводятся из орга-
низма.
При общем {тотальном) облучении
организма развивается острая или хро-
ническая лучевая болезнь.
Острая лучевая болезнь. При внеш -
нем равномерном облучении организ-
ма в зависимости от дозы радиации
возникают поражения от едва улови-
мых реакций со стороны отдельных си-
стем до острых форм лучевой болезни
(ОЛБ).
Костно-мозговая форма ОЛБ. Это
типичная форма острой лучевой бо-
лезни — развивается при общем об-
лучении в дозе 0,8—10 Гр (легкая
форма — при облучении до 2 Гр, сред-
ней тяжести — 2—4 Гр, тяжелая — 4 —
6 Гр, крайне тяжелая — 6 — 10 Гр). При
облучении в дозе более 10 Гр леталь-
ность составляет 100 %.
Желудочно-кишечная форма ОЛБ
возникает при общем облучении в
дозах 10 — 20 Гр и продолжительность
жизни больных составляет 1 — 2 нед.
Ведущими патогенетическими факто-
рами являются: полное оголение вор-
синок кишечника из-за гибели клеток
слизистой оболочки, тяжелая аутоин-
токсикация, нарушения водно-элект-
ролитного баланса и кислотно-основ-
ного состояния.
Токсемическая форма ОЛБ. Развива-
ется после облучения в дозе 20 — 80 Гр,
больные погибают в течение 4 — 7 сут.
Церебральная форма ОЛБ характер-
на для облучения в дозе более 80 Гр,
больным суждено прожить от не-
скольких часов до трех суток. Именно
такие большие дозы ионизирующего
излучения вызывают непосредствен-
ное повреждение и интерфазную ги-
бель клеток центральной нервной си-
стемы. При общем облучении в дозе
более 250 Гр наблюдается «смерть под
лучом».
Костно-мозговая форма ОЛБ. В раз-
витии заболевания выделяют четыре
периода: 1) период первичных реак-
ций; 2) период кажущегося благопо-
лучия, или латентный; 3) разгар за-
болевания; 4) период восстановления.
Период первичных реак-
ций продолжается от нескольких ча-
сов при легкой и до 3 — 4 сут — при
тяжелой форме ОЛБ. Для него харак-
терны диспепсические расстройства:
тошнота, рвота, диарея, сухость и го-
речь во рту. Любопытно, что однократ-
ная рвота типична для легкой формы
болезни, а многократная и мучитель-
ная — для тяжелых форм.
Общеклинические проявления ха-
рактеризуются слабостью, сонливо-
стью, головной болью, лабильностью
пульса, а при тяжелых формах ОЛБ
могут наблюдаться адинамия, сниже-
ние артериального давления, повыше-
ние температуры тела, нарушения со-
знания.
Гематологические изменения за-
ключаются в быстром уменьшении
числа лимфоцитов в крови (лимфо-
цитопения) и увеличении числа ней-
трофилов (перераспределительный
нейтрофильный лейкоцитоз). При об-
лучении в дозе более 3 Гр возможно
увеличение содержания в крови саха-
ра, билирубина, аминокислот и умень-
шение содержания альбуминов. В кост-
ном мозге резко уменьшается число
митотически активных кроветворных
клеток.
Из местных проявлений следует
отметить эритему, позволяющую оце-
нить направление действия ионизиру-
ющей радиации.
Латентный период продол-
жается от нескольких часов при тяже-
лой форме ОЛБ до одного месяца —
при легкой и характеризуется или пол-
ным отсутствием каких-либо субъек-
тивных ощущений, или очень слабы-
ми проявлениями. Специальными ме-
тодами можно выявить незначительные
нарушения со стороны нервной и сер-
дечно-сосудистой систем. Однако не зря
данный период называется периодом
мнимого, или кажущегося, благополу-
чия. В крови у больных значительно
уменьшается число всех видов лейко-
цитов (лейкопения), начинает умень-
шаться число тромбоцитов (тромбоци-
топения) и при облучении в дозе бо-
лее 4 Гр уже в этом периоде начинает
развиваться анемия — снижение чис-
ла эритроцитов и количества гемо-
глобина. Такая последовательность из-
менений в крови прежде всего зави-
сит от исходного количества клеток и
продолжительности их жизни: снача-
ла уменьшается число короткоживу-
щих лейкоцитов, затем — тромбоци-
тов и позднее всего — эритроцитов. Не
погибшие от прямого действия ради-
ации зрелые клетки постепенно от-
живают свой положенный срок, од-
нако их восстановление в пораженном
костном мозге не происходит. Клини-
ческие признаки, обусловленные де-
фицитом клеток крови, появятся при
достижении ими критического уровня.
Период разгара наступает
внезапно: нарастает слабость, повы-
шается температура тела, появляются
признаки дистрофии миокарда с та-
хикардией и изменениями на ЭКГ,
снижается артериальное давление, от-
сутствует аппетит. В ротовой полости
выявляются отеки, эрозии, язвенно-
некротический стоматит, ангина. При
тяжелых формах ОЛБ в желудочно-
кишечном тракте развиваются язвен-
но-некротические процессы, сопро-
вождающиеся аутоинтоксикацией,
кровотечениями, кишечной непрохо-
димостью, перфорацией, перитони-
том. Наибольшую угрозу для жизни
представляет инфекция (пневмония,
сепсис), а также тяжелые кровоте-
чения.
В крови обнаруживается глубокая
панцитопения — дефицит всех клеток
крови. До критических цифр снижено
число всех лейкоцитов, из-за чего у
больных практически не работают ме-
ханизмы как клеточного, так и гумо-
рального иммунитета. Количество тром-
боцитов — менее 40- 109/л, что явля-
ется причиной тяжелого геморрагиче-
ского синдрома. Дефицит эритроцитов
(анемия) становится причиной тяже-
лой гипоксии.
В костном мозге наблюдается опус-
тошение (панмиелофтиз), т.е. красный
костный мозг замешается жировой
тканью и кроветворных клеток почти
не остается.
Принципы лечения ОЛБ. Они сводят-
ся к выведению радиотоксинов (в пер-
вом периоде), профилактике инфек-
ций и кровотечений, уменьшению ин-
токсикации, нормализации водно-
электролитного баланса, к борьбе с
гипоксией, в том числе путем пере-
ливания крови. Если кроветворение в
костном мозге не восстановится из со-
хранившихся стволовых клеток само-
стоятельно, то используют современ-
ные стимуляторы кроветворения (им-
муностимуляторы, цитокины, эритро-
поэтины и колониестимулирующие
108
г<тся
. та-
?КГ,
к от-
. :гти
Г-НО-
11 При
-:но-
> нен-
тро-
цдей,
гсхо-
г: ни-
4--.ЗНИ
- -ия,
=: те-
се кая
.теток
о ено
*70 у
г ме-
~ лю-
~ом-
*гля-
Г:Че-
к. :тов
~тже-
• Д’С-
1й.-:ый
к ЗОЙ
ic чти
:дят-
тер-
тек-
г ин-
дяо-
еёе с
тере-
еие в
г. ;о-
ДЧО-
ен-
!М-
г~ро-
u _ие
факторы) или проводят транспланта-
цию костного мозга.
К отдаленным последствиям ОЛБ
можно отнести развитие катаракты,
бесплодие, астеновегетативные и эн-
докринные нарушения, злокачествен-
ные опухоли и аутоиммунные заболе-
вания, в том числе энцефалопатию
(например, «чернобыльское слабо-
умие»).
Хроническая лучевая болезнь. Хро-
ническая лучевая болезнь (ХЛБ) раз-
вивается у лиц, подверженных облу-
чению малыми дозами радиации в те-
чение длительного времени, напри-
мер, у жителей населенных пунктов с
повышенным радиационным фоном
(территории, где проводились испы-
тания ядерного оружия, произошло
радиационное загрязнение среды пос-
ле аварий на АЭС и т. п.) или у лиц,
профессионально связанных с иони-
зирующим излучением.
В отличие от острой лучевой болез-
ни при ХЛБ первыми страдают слабо
регенерирующие и медленно обновля-
ющиеся системы — нервная, сердеч-
но-сосудистая, эндокринная.
Различают четыре степени ХЛБ. Для
1-й степени характерны нерезкие на-
рушения регуляции сердечно-сосуди-
стой, нервной и эндокринной систем,
проявляющиеся повышенной утомля-
емостью, головной болью, неустойчи-
востью артериального давления и
пульса. В крови происходит умеренное
нестойкое уменьшение лейкоцитов и
тромбоцитов.
При 2-й степени ХЛБ выявляются
существенные нарушения тех же си-
стем с выраженным астеновегетатив-
ным синдромом. Присоединяются на-
рушения функции пищеварительной
системы и изменения обмена веществ.
В крови происходит стойкое уменьше-
ние числа лейкоцитов и тромбоцитов.
В красном костном мозге появляются
признаки угнетения кроветворения.
Для 3-й степени ХЛБ характерна
выраженная депрессия кроветворения
и панцитопения — дефицит в крови
лейкоцитов, тромбоцитов и эритроци-
тов. Больные подвержены инфекцион-
ным заболеваниям из-за резкого сни-
жения иммунитета, страдают от ги-
поксии из-за анемии и нарушений
кровообращения, склонны к кровоте-
чениям из-за дефицита тромбоцитов.
Выявляются органические дегенера-
тивные изменения в центральной не-
рвной системе.
При 4-й степени болезни к выше-
описанным проявлениям присоединя-
ются: кахексия, необратимые измене-
ния обмена веществ, желудочно-ки-
шечные кровотечения, диарея, нару-
шения водно-электролитного обмена,
аутоинтоксикация и др.
К отдаленным последствиям дей-
ствия на организм ионизирующей ра-
диации относят: возникновение опу-
холей, наследственные дефекты, ра-
диационное сокращение продолжи-
тельности жизни, радиационную ка-
таракту.
Возникновение опухолей и наслед-
ственных дефектов объясняется спо-
собностью ионизирующего излучения
вызывать мутации в соматических и
половых клетках. Опасность при этом
представляют не большие дозы ради-
ации, которые приводят к гибели кле-
ток, а малые. Доза, удваивающая час-
тоту мутаций в половых клетках, рав-
на 0,01 Гр. В репродуктивном возрасте
противопоказано облучение области
яичников и семенников. Дети, рожден-
ные от матерей, подвергавшихся в
период беременности рентгеновскому
облучению, имеют повышенный риск
развития злокачественных заболеваний.
«Лучевой рак» в пробирке был полу-
чен путем облучения клеток хомяка в
дозах, не вызывающих лучевую бо-
лезнь. В настоящее время установлено,
что развитие опухолей обусловлено
109
мутагенным действием ионизирующе-
го излучения на протоонкогены ДНК
клеток.
Установлена линейная зависимость
радиационного канцерогенеза от дозы.
Латентный период для развития лей-
коза после облучения составляет 2 —
3 года, а для рака кожи, легких и дру-
гих локализаций — до 20 лет.
Сокращение продолжительности
жизни (ускоренное радиационное ста-
рение) облученных организмов объяс-
няют эффектом стабильного наслед-
ственного повышения частоты гибе-
ли клеток. Суть данного эффекта
заключается в том, что не смертельно
облученная клетка дает потомство,
среди которого увеличена частота ги-
бели клеток, в следующем потомстве
клеток гибнет еще больше и т.д. Дан-
ный эффект выявлен даже у облучен-
ных амеб. Подсчитали, что у человека
на каждые 0,01 Гр однократного об-
лучения продолжительность жизни со-
кращается на 1—15 сут, а при хрони-
ческом воздействии — на 0,08 сут.
Развитие жизни на Земле всегда
происходило в присутствии радиа-
ционного фона окружающей среды
(0,9 мГр в год). Ученые спорят о том,
шло ли развитие жизни наперекор
скрытому вредному воздействию ра-
диации. или способность радиации
вызывать мутации служила основой не-
прерывной эволюции биологических
видов. Ответа в этом споре пока нет.
Достижения научно-технического
прогресса — это дополнительная ра-
диационная нагрузка, которой люди
подвергаются при рентгеновском об-
следовании, полете в реактивном са-
молете, космонавты — в космических
кораблях, при выпадении радиоактив-
ных осадков после испытаний ядер-
ного оружия, в результате работы АЭС
и т. п.
Реакция тканей челюстно-лицевой
области при лучевой терапии. Ионизи-
110
рующее излучение в качестве самосто-
ятельного метода лечения или в ком-
бинации с хирургическим вмешатель-
ством применяется у 89 % больных со
злокачественными опухолями челю-
стно-лицевой области и у 82 % боль-
ных раком гортани и щитовидной
железы (Ю. И. Воробьев и др.. 1991).
В зону облучения попадает большой
объем здоровых костных и мягких тка-
ней, в которых возникают различные
лучевые реакции и повреждения. Ме-
стные реакции выражаются гипереми-
ей, отеком, очаговым или сливным
эпителиитом, болями, изменением
вкусовых ощущений. Затрудняются
прием пищи, речь, ухудшается сон,
снижается работоспособность. Приме-
нение средств ухода за полостью рта
становится затруднительным или не-
возможным. В результате дистанцион-
ной лучевой терапии опухолей челю-
стно-лучевой области возникают выра-
женные изменения в эмали, дентине,
цементе, пульпе зубов (Г.М.Барер.
1991).
Одним из постоянных осложнений
при проведении лучевой терапии у
больных со злокачественным новооб-
разованием челюстно-лицевой области
является гипосаливация. Она отмеча-
ется уже после первых доз облучения
(7— 10 Гр). По мере увеличения сум-
марной очаговой дозы (СОД) гипо-
саливация нарастает: при дозе 50 Гр
она наблюдается более чем у полови-
ны пациентов, а при дозе 60 Гр нару-
шения в слюнных железах, находя-
щихся под прямым действием лучей,
приобретают необратимый характер.
В механизме постлучевых изменений
основная роль принадлежит повреж-
дению ацинарных клеток, сосудистых
структур и развитию фиброза слюн-
ных желез. Уменьшается скорость слю-
ноотделения, выработка иммуногло-
булинов, слюна становится вязкой,
снижается ее ферментативная актив-
ж сто-
«:ом-
f ель-
Й=А СО
। гелю-
I :<ль-
1»-2НОЙ
41).
Гн_юЙ
it тка-
ьт--1ыс
к. Ме-
Вге'.ги-
е-ым
Ис-?:ем
te < тся
Ь 2 ОН,
fci:\ie-
Ьс рта
к? не-
it эн-
ГЭе.ра-
к :не,
fcrep,
Вений
к и у
Ь-Об-
г л п
г* :ча-
|Н -:ия
к -.-м-
~то-
I Гр
т:зи-
к
кыля-
*- чей,
Ьесер.
Ь» ИЙ
ИхЛЫХ
к .он -
к ”.О-
Ь-ХЭЙ,
»~.<в-
ность, буферная емкость сдвигается в
сторону закисления. Снижение объе-
ма слюны, бактерицидных свойств,
увеличение ее вязкости замедляют са-
моочищение полости рта, способству-
ют образованию бактериального нале-
та на зубах, нередко присоединяется
грибковая инфекция и развивается
кандидомикоз.
В патогенезе повреждения твердых
тканей зубов (лучевой кариес) при лу-
чевом воздействии играет роль прямое
влияние на ткани ионизирующего из-
лучения благодаря повреждению кри-
сталлических и органических структур
свободными радикалами, дегенерации
одонтобластов, а также действию мик-
рофлоры, активность которой резко
возрастает. Резко повышается хрупкость
твердых тканей зубов. Большое значе-
ние имеет также образование трещин,
пронизывающих всю толщу эмали и
дезинтеграция эмали и дентина. Эти
изменения происходят на фоне нару-
шения процессов реминерализации
вследствие снижения содержания в
ротовой жидкости ионизированного
кальция, уменьшения объема слюны
и увеличения ее вязкости.
Поражение пародонта с преобла-
данием язвенно-некротического про-
цесса в результате лучевого воздей-
ствия также обусловлено изменением
саливации и состава слюны, прямым
повреждающим действием на ткани и
резкой активацией пародонтопатоген-
ной микрофлоры.
Серьезными осложнениями луче-
вой терапии являются остеонекроз
(лучевой остеомиелит) и лучевые язвы
на слизистой оболочке полости рта.
Остеонекроз нередко развивается в
отдаленные сроки после облучения —
через несколько месяцев или даже лет.
Это, по-видимому, объясняется луче-
вым повреждением в первую очередь
клеток-предшественников костной
ткани — от стволовых клеток до пре-
остеобластов. Менее радиочувствитель-
ные зрелые костные клетки, остеобла-
сты и остеоциты в результате лучевого
поражения сохраняют функциональ-
ную активность. После завершения
жизненного цикла зрелых костных кле-
ток в зоне облучения возобновление их
популяции за счет более молодых кле-
ток затрудняется или становится невоз-
можным, в результате развивается не-
кроз из-за прекращения физиологиче-
ской регенерации костной ткани.
Различные отделы слизистой обо-
лочки полости рта обладают неоди-
наковой радиочувствительностью.
Наиболее чувствительна слизистая
оболочка задней стенки глотки, нёб-
ных дужек и мягкого нёба, состоящая
из нёороговеваюшего эпителия. Это
обусловлено тем, что, чем выше ми-
тотическая активность молодых низ-
кодифференцированных клеток эпи-
телиального типа и скорость клеточ-
ного обновления, тем ткань более чув-
ствительна к лучевому поражению.
Распространенность и степень тя-
жести лучевых поражений зависит от
многих факторов: варианта фракцио-
нирования, величины разовой и сум-
марной очаговой дозы облучения,
интервала между сеансами, размера и
расположения полей облучения. Важ-
ную роль играют: возраст больного,
исходное гигиеническое состояние
полости рта, функциональное состо-
яние слюнных желез, а также вредные
привычки. Курение и злоупотребление
спиртными напитками, например,
повышает чувствительность тканей
полости рта к лучевому повреждению.
3.3. Роль наркотических
средств
Наркотики (от греч. narkotikos —
приводящий в оцепенение) — общее
название наркотических веществ и
111
наркотических лекарственных средств,
способных вызвать наркоманию.
Наркомания —- общее название бо-
лезней, проявляющееся влечением к
постоянному приему в возрастающих
количествах наркотических веществ и
наркотических лекарственных препа-
ратов. Вследствие стойкой психической
и физической зависимости развивает-
ся абстиненция при прекращении их
приема. Наркомания приводит к глу-
боким изменениям личности и другим
расстройствам психики, а также к на-
рушениям функций внутренних орга-
нов.
Наркотическое вещество не явля-
ется лекарственным препаратом (в том
числе и полупродукт, из которого про-
изводится наркотический лекарствен-
ный препарат), способным вызвать
наркоманию.
Определения понятий достаточно
однозначны. Однако в последнее вре-
мя возникла некоторая путаница в том,
какие вещества и средства должны быть
отнесены к наркотическим. Как пи-
шет известный российский нарколог
С. Б. Белагуров, принадлежность суб-
станции к наркотическим веществам
определяется национальными право-
выми документами и ничем иным. Да-
лее он обращает внимание на то. что
потребление указанного вещества не
должно быть традиционным в данном
культурном обществе (иначе в пер-
вую очередь необходимо было бы от-
нести к наркотикам табак и алкоголь).
С этими высказываниями нельзя со-
гласиться. В решении данного вопро-
са необходимо разграничивать меди-
цинский и юридический аспекты. Да,
данное вещество (например, алко-
голь) разрешено использовать, оно
не подлежит уничтожению, распро-
странение его уголовно не наказуемо
и к наркотикам оно не относится. Но
это юридический аспект. С медицин-
ской точки зрения алкоголь обладает
всеми признаками наркотического ве-
щества. В настоящее время обсуждает-
ся вопрос легализации препаратов ко-
нопли. Законодательным актом можно
разрешить использование этого легко-
го наркотика, но тогда постепенно пре-
параты конопли могут стать широко и
традиционно используемыми, к тому
же вред, который они наносят здоро-
вью человека, не уменьшится, а уве-
личится, т. е. медицинский аспект со-
хранится.
Кроме того, в список наркотиче-
ских веществ не включены бензин,
клеи, аэрозоли и растворители, кото-
рые вдыхаются для получения состоя-
ния эйфории (приподнятого настрое-
ния), что является, с медицинской
точки зрения, разновидностью нарко-
мании — токсикоманией.
Поэтому далее медицинские нар-
котические средства, легальные нар-
котики (алкоголь, табак) и психоак-
тивные вещества будут именоваться
только как «наркотики».
Таким образом, к наркотикам от-
носятся как вещества, не используе-
мые в медицине, так и некоторые ле-
карственные препараты (средства). Но
в руководстве по лекарственным сред-
ствам нет рубрики «Наркотики». Пре-
параты многих фармакологических
групп относятся к наркотическим
(в первую очередь наркотические
анальгетики, психостимуляторы, ад-
реномиметики и др.). Следовательно,
термин «наркотики» — собиратель-
ный. Важно уточнить, по каким кри-
териям то или иное вещество, или
средство, относят к наркотикам.
К наркотикам те или иные веще-
ства относят обычно по следующим
критериям:
способность влиять на психику (уси-
ливать, подавлять, изменять сознание):
способность вызывать эйфорию или
по крайней мере приятные субъектив-
ные переживания;
112
ве-
цзет-
i ко-
> -ЛЮ
е~ко-
тре-
\О и
"Эму
д:ро-
. уве-
1“ со-
" qe-
!• Ill,
•,:то-
•-7ОЯ-
гтое-
*--\ОЙ
йГКО-
- -зр-
г -ар-
яш :ак-
Ш. зся
01-
flfe :Sye-
'W-»- ле-
ЧЖ Но
Ш -ред-
Лре-
-КИХ
ЧВг.сим
ф*г.:<ие
ЧЦ|ь« ад-
WtTsHO,
Ш«ге.ть-
Шк ._эи-
'•в дли
Ш :-ле-
Ш;-ИМ
Ш ги-
*c.-.ie);
пи
лв-
способность вызывать зависимость
(психическую и/или физическую);
способность наносить существен-
ный вред психическому и/или физи-
ческому здоровью при бесконтроль-
ном их употреблении.
Указанные эффекты у различных
групп наркотических препаратов вы-
ражены в разной степени. Так, пре-
парат ЛСД (галлюциноген) значи-
тельно изменяет сознание, но прак-
тически не вызывает эйфорию и не
формирует зависимость.
Побудительные причины начала по-
требления наркотиков. Эти причины
подробно исследованы врачами, пси-
хологами и социологами.
1. В связи с тем, что большинство
больных начинают злоупотреблять
наркотиками в молодом возрасте,
предпосылки наркомании связывают
с психологическими особенностями
этого возрастного периода. Наркома-
нию связывают с наличием комплек-
са неполноценности, недостатком
любви и душевного тепла, желанием
самоутвердиться, стремлением побо-
роть депрессию. Среди побудительных
причин также можно назвать любо-
пытство, желание провести экспери-
мент над сознанием. Не последнюю
роль играют влияние ровесников, про-
блемы социализации: желание расши-
рить круг общения и повысить свою
популярность, быть смелым, модным,
современным, стильным, а значит,
уважаемым среди своих друзей.
Развитию наркомании способству-
ют психопатии, олигофрения и дру-
гие состояния, снижающие способ-
ность пациента к самоконтролю.
2. Купирование болевого синдрома
наркотиками с нарушением дозы, ча-
стоты и продолжительности приема
также может привести к наркотиче-
ской зависимости. Особенно опасно са-
молечение или продолжение назначе-
ния наркотика «для профилактики».
3. Наследственное предрасположе-
ние к наркомании связано с тем, что
потомство наркоманов оказывается
психически неустойчивым. Кроме
того, ученые ведут исследования по
выявлению генетической предраспо-
ложенности. В настоящее время выяв-
лен ген алкоголизма. В 50 % случаев
алкоголизма обнаружена его связь с
положительным семейным анамнезом.
4. Прозелитизм — склонность нар-
команов учить других принимать нар-
котики — является одним из факто-
ров, способствующих первичному по-
треблению наркотика. Это объясняется
своеобразным «альтруизмом» (желани-
ем «поделиться удовольствием») и
корыстными побуждениями (расшире-
ние круга наркоманов облегчает по-
иск наркотика и средств для его при-
обретения).
Независимо от первоначального
мотива приема наркотика причиной
последующих приемов служит жела-
ние повторно испытать состояние эй-
фории.
Все перечисленные факторы игра-
ли роль в развитии наркомании и ра-
нее. Значительный рост наркомании
среди населения в настоящее время
связан с доступностью наркотиков.
Механизм действия наркотических
веществ. В настоящее время известно,
что большинство наркотиков изменя-
ют кинетику или объем выработки та-
ких нейромедиаторов, как дофамин
(отвечает за удовольствие), серотонин
(улучшает настроение), норадреналин.
После приема наркотика количество
этих веществ значительно уменьшает-
ся, а аксоны мозга «устают» от силь-
ного воздействия этими нейротранс-
миттерами. При приеме высоких доз
наркотических препаратов аксоны де-
градируют. Такое явление называется
нейротоксичностью.
Классификация наркотиков. По про-
исхождению наркотики подразделяют
113
на органические (природные) и син-
тетические; по интенсивности воздей-
ствия на организм — на легкие и тя-
желые. Наибольший интерес представ-
ляют классификации, в которых нар-
котики сгруппированы в зависимости
от вызываемых ими эффектов. Однако
деление по такому принципу до не-
которой степени условно.
На людей различных рас наркоти-
ческие вещества действуют по-разно-
му. Так, у представителей черной расы
опийные препараты вызывают не се-
дативный, как у европейцев и азиа-
тов, а возбуждающий эффект. У лю-
дей даже одной расы наблюдаются
индивидуальные отличия в реакции
на наркотик. Различны реакции на
наркотик в животном мире. В основе
подразделения наркотиков на груп-
пы лежат преобладающие эффекты,
которые наблюдаются у людей, впер-
вые употребляющих их. Однако и эти
эффекты у одного и того же нарко-
тика могут быть очень многообраз-
ны. В существующих многочисленных
классификациях наркотические веще-
ства не только подразделяют по их
воздействию, но и выделяют самосто-
ятельные группы веществ (облада-
ющих многообразными эффектами в
зависимости от доз), например пре-
параты конопли и опиатные нарко-
тики. Представляем одну из таких
классификаций.
1. Производные конопли:
а) высушенная или свежая зеленая
травянистая часть конопли, которую
также называют «марихуана»;
б) прессованная смесь смолы, пыль-
цы и мелко измельченных верхушек
конопли («анаша», «гашиш», «план»
или «хеш»).
Действующим веществом конопли
является группа алкалоидов под об-
щим названием «тетрагидроканнаби-
нолы» (англ, аббревиатура — ТНС).
Производные конопли обладают сти-
мулирующим, седативным и галлюци-
ногенным (в высоких дозах) эффек-
тами.
2. Опиатные наркотики (наркотики,
изготовленные из мака или действу-
ющие сходным с ними образом):
а) органические (из опийного ма-
ка — опий, маковая соломка, мор-
фий, кодеин);
б) полусинтетические (героин);
в) синтетические (фентанил, ме-
тадон. промедол).
Опиаты характеризуются следу-
ющими основными эффектами:
болеутоляющей активностью, силь-
ным уменьшением болей любого про-
исхождения;
эйфоризируюшей активностью,
способностью вызывать особое психи-
ческое состояние благополучия и бла-
годушия;
подавление кашлевого и дыхатель-
ного центров мозга;
активизацией парасимпатической
системы, сужением зрачка, повыше-
нием тонуса кишечника, запорами,
спазмом гладких мышц;
снижением активности при дли-
тельном применении (привыкание);
неприятными эффектами при вне-
запной отмене препарата (абстинен-
ция);
способностью вызывать психологи-
ческую и физическую зависимость
(пристрастие).
3. Депрессанты: алкоголь, седатив-
ные (бромиды, настойка валерианы),
снотворные (барбитураты) препараты,
средства для ингаляционного нарко-
за, транквилизаторы (реланиум, эле-
ниум).
Депрессанты вызывают состояние,
характеризующееся угнетенным или
тоскливым настроением и снижени-
ем психической активности, сочета-
ющимися с двигательными расстрой-
ствами и разнообразными соматиче-
скими нарушениями.
114
ии-
соек-
ы~:КИ,
!>--7Ву-
•- ма-
• ор-
к-1 :
। ме-
-еду-
U. ДЬ-
s ~?о-
U"zK),
ч' ~а-
ET'iTb-
fe- - ЭЙ
Щь_е-
fc и,
»
• ~ и-
Шик :
Л
<tabc.i-
Ш.з,
ь
|кг. 3.
ШИМж' *
зяриг,-1_ I.
Wr-
iter-. ?-
Ш -е-
Wt е.
• ел
-
Bte-
Щв
ЧШ’1:-
4. Диссоциативы: кетамин, холино-
литики (атропин, дурман, мандраго-
ра, белена, тарен).
Эти препараты способны вызывать
отделение (диссоциацию) сознания от
физического тела и/или временно на-
рушать целостность психики, «распы-
ляя» сознание.
5. Стимуляторы ЦНС. кокаин, ам-
фетамин и эфедрин — наиболее близ-
кие синтетические аналоги кокаина,
кофеин, фенамин, первитин, теобро-
мин, антидепрессанты, ноотропы —
ноотропил, аминалон. адаптогены —
корень женьшеня, никотин.
Вещества этой группы действуют в
основном на стволовую часть мозга,
временно повышают умственную и
физическую работоспособность, уве-
личивают выносливость, повышают
скорость реакции, устраняют чувство
усталости и сонливости, увеличивают
объем внимания, способность к за-
поминанию и скорость обработки ин-
формации. В психологическом отноше-
нии стимуляторы вызывают ощуще-
ние бодрости, улучшение настроения,
вплоть до выраженной эйфории, по-
вышают общий уровень мотивации.
6. Гиперстимуляторы (психоделики,
галлюциногены):
а) псилоцин и псилоцибин — вы-
деляется из грибов рода Psilocibunr,
б) диэтиламид лизергиновой кис-
лоты (ЛСД) — синтетический пре-
парат;
в) мескалин — содержится в как-
тусе пейот.
Вещества данной группы стимули-
руют преимущественно кору головного
мозга, вызывают у здоровых людей на-
рушения психики в форме зрительных
и слуховых галлюцинаций и других на-
рушений восприятия.
7. Остальные вещества', аманита (му-
хомор). аминазин, клофелин.
Клиническая картина наркомании.
Независимо от вида употребляемого
наркотика для клинической картины
наркомании характерны толерант-
ность, абстиненция, зависимость,
пристрастие.
Толерантность {синдром измененной
реактивности). Под толерантностью
понимают снижение биологической
или поведенческой реакции на повтор-
ное введение одного и того же коли-
чества наркотического вещества, или
толерантность — это необходимость
увеличения дозы наркотика для до-
стижения одинакового желаемого эф-
фекта.
С началом заболевания чувствитель-
ность к наркотику постепенно снижа-
ется, поэтому переносимость отдель-
ных препаратов повышается (напри-
мер, препаратов опия — в 200 раз).
Наркоман легко переносит летальную
для здорового человека дозу наркоти-
ка. Скорость развития толерантности
зависит как от регулярности приема,
так и от свойств вещества. Опийные
алкалоиды, например, способны очень
быстро вызывать высокую толерант-
ность (через 1—2 мес).
Максимальный уровень переноси-
мости индивидуален, он достигается
постепенно и сохраняется в течение
нескольких лет. Затем наступает по-
степенное снижение переносимости,
и прежние дозы вызывают острый ток-
сический эффект.
Толерантность при наркомании —
неспецифический симптом, отража-
ющий общую физиологическую зако-
номерность — способность адаптиро-
ваться к высокому уровню вредности,
т. е. речь идет о формировании нового
(патологического) уровня гомеостаза.
Механизм толерантности не совсем
понятен, но очевидно, что он отра-
жает гомеостатическую адаптацию,
в результате которой организм проти-
водействует влиянию наркотика.
Наиболее изучено формирование
толерантности при потреблении алко-
115
голя. У лиц, не потребляющих алко-
голь, наблюдается низкий уровень
(фоновый) активности алкогольде гид-
рогеназы печени. При регулярном
употреблении алкоголя (субстратная
адаптация) активность этого фермен-
та увеличивается. По-видимому, суще-
ствует не только фенотипическая адап-
тация, но и генотипическая. Предки
европейцев не были знакомы с опи-
ем, опийная настойка, капли, загу-
стевший сок для курения попали в Ев-
ропу в XVII — XVIII вв. в начале коло-
низации англичанами Азии. Менее
чувствительные к алкоголю европей-
цы быстро погибают от опийных ал-
калоидов — морфина, героина. Они не
в состоянии долгие годы употреблять
опиаты на бытовом уровне — в уме-
ренных количествах, быстро наращи-
вают дозы, у них развиваются грубые
психические и физические изменения.
Представители желтой расы по срав-
нению с европейцами устойчивее к
действию опия, но патологически ре-
агируют на алкоголь и спиваются зна-
чительно быстрее. Исследования пока-
зали, что у японцев по сравнению с
представителями белой расы иное со-
отношение изоферментов алкогольде-
гидрогеназы. Это объясняется опытом
предков.
Зависимость. Зависимость — это
потребность в постоянном приеме нар-
котического вещества для предотвра-
щения или ослабления физических
или психологических нарушений. Она
имеет физическую и психологическую
составляющие.
Синдром психической за-
висимости включает два основных
симптома — неодолимое влечение к
приему наркотика и достижение пси-
хического комфорта при интоксика-
ции наркотиком. Влечение к наркоти-
ку, потребность в опьянении для до-
стижения психического благополучия
и удовлетворительного отправления
психических функций показывает, что
психическое существование наркома-
на зависит от присутствия наркотика
в его организме.
Синдром физической за-
висимости включает симптомы
физического влечения к наркотику,
возможность достижения физическо-
го комфорта в состоянии интоксика-
ции, а также абстинентный синдром.
Формирование физической зависимо-
сти наблюдается обычно при длитель-
ном применении наркотика. Однако и
после довольно непродолжительного
использования препарата возможно
развитие физической зависимости.
Скорость развития физической за-
висимости определяется предрасполо-
женностью человека, частотой введе-
ния препарата и его дозой.
При отсутствии наркотика пациент
чувствует себя больным, испытывает
неприятные ощущения. Объективно
при этом обнаруживаются функцио-
нальная слабость, явления дисрегуля-
ции ряда систем. Больной бледен,
зрачки расширены, отмечается тахи-
кардия, мышечная гипертония, сосу-
дистая гипертензия, сухость слизистых
оболочек. После приема наркотика
функциональные показатели нормали-
зуются и проявляется стимулирующий
эффект наркотика (изменение формы
опьянения) — прилив бодрости, же-
лание и способность выполнять даже
тяжелую физическую работу. По мере
развития наркомании наступает физи-
ческое истощение и в связи с этим
стимулирующий эффект наркотика ос-
лабевает; обычно потребляемая доза
лишь умеренно тонизирует наркома-
на, позволяя отчасти и ненадолго со-
браться с силами.
Пристрастие. Пристрастие к упо-
треблению наркотического вещества
(наркомания) — это непреодолимая
тяга к наркотику и ослабленный кон-
троль за приемом наркотика, несмот-
116
с.. что
> эма-
>: тика
<- за-
'"эмы
тику,
: тгко-
*-Лка-
<эом.
К-.-ТМО-
:<тель-
г—КО И
Г-НОГО
*: :кно
С i*
• : за-
лто-
з^еде-
и-гент
^зает
'“зно
j^-ло-
ЧИТАТЯ-
t-зен,
’ АИ-
Ш . Су-
^ИГ[- —
•к-.: ых
Як ~/ка
Шк‘Д1И-
—ИЙ
Ф» 7 МЫ
Як ле-
«' ере
w;’. 2И-
ЗЖс. дм
JC-
Чк . ш
са-
Шг _о-
s.-t. тза
’*е • ая
л . ;н-
ря на опасные последствия. К нарко-
тическим веществам, вызывающим
наиболее сильное пристрастие, отно-
сятся опиаты, кокаин, амфетамины,
алкоголь и никотин.
Абстинентный синдром. Абстинен-
ция (синдром отмены) — это синд-
ром физических и/или психологиче-
ских нарушений, которые развивают-
ся после резкого прекращения упо-
требления наркотического вещества
или фармакологического блокирова-
ния его действия. Абстиненция разви-
вается у лиц достаточно длительно
потребляющих наркотические препара-
ты с сформировавшейся психической
и физической зависимостью. Синдром
отмены развивается обычно не после
эпизодических приемов наркотиче-
ских веществ, а в результате посто-
янного приема наркотика в течение
нескольких суток. Обычно заметные
симптомы абстиненции проявляются
после отмены препарата, принимав-
шегося в течение одной недели. При-
чем, чем продолжительней был пос-
ледний прием, тем интенсивнее раз-
витие симптомов абстиненции.
Начало развития синдрома отмены
проявляется через 8—16 ч после по-
следнего введения препарата и интен-
сивно нарастает в течение 48 — 72 ч,
после чего медленно исчезает. Наибо-
лее продолжительным симптомом яв-
ляется бессонница, которая может
продолжаться 4 нед и более.
Развитие абстиненции наблюдает-
ся на фоне неудержимого влечения.
В первые сутки для абстинентного син-
дрома характерны зевота, слюно- и
слезотечение, насморк, чиханье, гу-
синая кожа; на вторые сутки появля-
ются озноб, приступы жара, потли-
вость, напряженность в мышцах; к кон-
цу вторых суток — боли в мышцах,
суставах, двигательное беспокойство;
на третьи сутки — диспепсические рас-
стройства, судороги (ломка).
При некоторых формах наркома-
нии, начиная с третьих суток абсти-
нентного синдрома, в течение 3 —
5 дней вероятны не только большие
судорожные припадки, но и острый
психоз (делириозный синдром с су-
меречным помутнением сознания, на-
плывом галлюцинаций, бредом; «бе-
лая горячка» у алкоголиков). Наруша-
ются функции всех систем организма,
повышается кровяное давление, рез-
ко учащается сердцебиение. Больные
не могут найти удобного положения,
характерно двигательное беспокой-
ство, которое чередуется с резкой сла-
бостью и обездвиженностью. Наруша-
ется работа пищеварительного аппа-
рата; возникают рвота, понос, боли в
желудке и по ходу кишечника, отсут-
ствует аппетит, нарушается сон.
Все симптомы выражены по-разно-
му при различных формах наркома-
нии, поэтому диагноз заболевания с
указанием вида наркотика, который
принимает наркоман, врач может по-
ставить, даже если больной это скры-
вает.
Если абстинентный синдром не ле-
чить, то его симптомы достигают наи-
высшей выраженности на 5 — 7-е сут-
ки, после чего начинается литическое
угасание симптомов в порядке, про-
тивоположном последовательности их
появления. Длительность такого абсти-
нентного синдрома — около 1 — 2 мес
при условии лечения — 5 — 7 дней.
Остаточными симптомами абстинен-
ции являются неправильный ритм и
поверхностность сна, подавленное на-
строение, чувство опустошенности,
усталость, психическое влечение к
наркотику.
Стадии наркомании. Синдромы из-
мененной реактивности, психической
и физической зависимости проходят
определенные этапы развития в тече-
нии наркомании, которые можно рас-
сматривать как стадии болезни.
117
Первая стадия характеризуется ста-
новлением синдрома измененной ре-
активности (растущая толерантность,
постепенное ослабление защитных
реакций, способность к регулярному
потреблению наркотика; как показа-
тель возросшей толерантности угасает
эйфорический эффект, хотя форма
опьянения не изменена) и синдрома
психической зависимости (неосознан-
ное психическое влечение, психиче-
ский комфорт в состоянии опьянения).
Последствия хронической интоксика-
ции клинически не проявляются; ос-
ложнения, как правило, не возни-
кают.
Вторая стадия может быть условно
обозначена как манифестная. На этой
стадии происходит полное формиро-
вание всех стержневых синдромов хи-
мической зависимости: измененной
реактивности, патологического и аб-
стинентного влечения. Синдром изме-
ненной реактивности характеризует-
ся новыми симптомами: стабилизиро-
ванной максимальной толерантно-
стью, отсутствием защитных реакций
по отношению к наркотику и регуляр-
ности его потребления, стимулиру-
ющим характером опьянения, прак-
тически полным отсутствием эйфори-
ческих переживаний).
К синдрому психической зависимо-
сти, выраженному в осознанном вле-
чении, высоком уровне психических
функций в состоянии опьянения, при-
соединяется синдром физической за-
висимости, который характеризуется
высоким уровнем физических функ-
ций в состоянии опьянения, компуль-
сивным (непреодолимым) влечением.
Увеличивается продолжительность и
тяжесть абстинентного синдрома. Во
второй стадии наркомании появляют-
ся последствия хронической интокси-
кации: исхудание, бледность, потеря
блеска, ломкость волос и ногтей, яв-
ления психической и физической сла-
118
бости, падение работоспособности,
а также различные осложнения в за-
висимости от форм наркомании. Обо-
стряются сопутствующие болезни,
учащаются соматические заболевания.
На этой стадии проявляется практи-
чески весь спектр отрицательных со-
циальных последствий наркомании:
нарушение семейных отношений, пре-
кращение учебы, потеря профессио-
нальной квалификации, уголовно на-
казуемые действия.
Третья стадия характеризуется
трансформацией стержневых синдро-
мов наркомании. После того как они
достигают своего пика, начинается их
постепенный регресс. Ослабляется
клиническое проявление синдрома
измененной реактивности (постепен-
но снижается толерантность). Прием
наркотика становится прерывистым,
с прогрессивно снижающимися доза-
ми. Изменяется синдром психической
и физической зависимости: снижает-
ся тонизирующее действие наркоти-
ка, отсутствует эйфория. Наблюдается
вялый абстинентный синдром с обез-
движенностью, угрозой коллапса.
В клинической картине наркомании
преобладают последствия хронической
интоксикации (психическое сниже-
ние, нравственная и социальная де-
градация). а также осложнения, зави-
сящие от вида принимаемого нарко-
тика. Третья стадия характеризуется
ин валид изацией.
Длительность каждой стадии варь-
ирует в зависимости от формы нарко-
мании. Опиомании, например, свой-
ственно наиболее быстрое становле-
ние (длительность первой стадии —
8—10 нед регулярного приема), но и
наиболее длительное течение (вторая
стадия продолжается 5—10 лет в за-
висимости от интенсивности нарко-
тизации, третья — 2 — 5 лет).
Все наркотики независимо от пути
введения в организм в большей или
меньшей степени обязательно повреж-
дают нервную (в том числе головной
мозг) и иммунную системы, печень.
сердце, легкие.
Общими всех форм признаками
наркомании являются: физическое
истощение, слабость и низкая функ-
циональная активность всех физиоло-
гических систем.
Наиболее частыми причинами смер-
ти больных наркоманией являются пе-
редозировки. насильственная смерть,
суициды, осложнения.
Наиболее распространенные ос-
ложнения наркомании — это сердеч-
ная, легочная недостаточность, пече-
ночная недостаточность как следствие
перенесенных токсических гепатитов.
Хроническая интоксикация наркоти-
ками приводит к общесистемному
функциональному истощению — про-
грессирующему снижению активно-
сти, влечений, потребностей, эмоций,
нравственных чувств, интеллектуаль-
ной слабости. Ослабление организма
способствует развитию инфекционных
заболеваний с септическими ослож-
нениями, даже нетяжелая болезнь
может привести к смерти.
Выздороветь от наркомании прак-
тически невозможно. Пока возможно
лишь обеспечить ремиссию — воздер-
жание. Средняя продолжительность
терапевтических ремиссий у подавля-
ющего большинства больных, дли-
тельно лечившихся с использованием
дезинтоксикационной, симптомати-
ческой терапии и психофармакотера-
пии в наркологических стационарах, —
не более 6 мес, и только у 5 % боль-
ных превышает год. В крайне редких
случаях ремиссия может быть даже по-
жизненной. Описаны случаи отказа от
приема наркотиков без проводимого
лечения. Так, некоторые преступники,
отсидевшие по 5 — 7 лет в тюрьме,
особенно в случае роста их авторитета
в криминальной среде, прекращают
прием наркотиков, что, вероятно, свя-
зано с появлением новой личностной
доминанты. Кроме того, отдельные
больные — наркоманы с латентно раз-
вивающейся шизофренией — при по-
явлении галлюцинаций и паронои от-
казываются от приема наркотиков.
Типы течения наркомании. Динами-
ка развития патологических изменений
в организме зависит не только от вида
используемого наркотика, но и, ве-
роятно, от индивидуальных особенно-
стей наркомана. В зависимости от час-
тоты и дозы используемого наркоти-
ка, а следовательно, скорости и тя-
жести развития заболевания, можно
выделить насколько типов течения
наркомании.
Непрерывный тип может развивать-
ся по двум вариантам:
1) злокачественный тип течения,
характеризующийся постоянно возра-
стающими дозами приема наркотика,
высокой толерантностью, постоянным
усилением патологического влечения,
значительной тяжестью абстинентно-
го синдрома, катастрофически нара-
стающей тяжестью соматических и не-
врологических нарушений, полной
социальной дезадаптации;
2) монотонный (стационарный)
тип течения отличается более благо-
приятным течением, при котором
доза наркотика не увеличивается, то-
лерантность снижена, патологическое
влечение выражено слабо, тяжесть аб-
стинентного синдрома незначительна,
тяжесть соматических и неврологиче-
ских нарушений не нарастает, соци-
альная адаптация сохранена.
Периодический тип также развива-
ется по двум вариантам:
1) приступообразно-злокачествен -
ный тип течения, сопровождающий-
ся ухудшениями от обострения к обо-
стрению. Наблюдается употребление
наркотика в виде эксцессов различной
продолжительности в высоких дозах.
Незначительно снижается толерант-
ность, усиливается патологическое
влечение. Значительная тяжесть абсти-
нентного синдрома нарастает от обо-
стрения к обострению, присоединя-
ются тяжелые соматические и психо-
неврологические нарушения. Прогрес-
сивно снижается социальная адапта-
ция;
2) интермиттирующий тип тече-
ния — менее злокачественный. При
этом наблюдается прерывистый, с уве-
личивающимися интервалами, прием
наркотика со снижением доз. Наблю-
даются значительное снижение толе-
рантности, слабо выраженное пато-
логическое влечение, незначительная
тяжесть абстинентного синдрома, со-
матических и неврологических нару-
шений. Социальная адаптация сохра-
няется.
Транзиторный (безрецидивный) тип —
наиболее редкий тип течения нарко-
мании, характеризующийся несколь-
кими единичными случаями приема
наркотиков. При этом отсутствуют со-
матоневрологические осложнения,
сохранена психика.
Влияние наркомании на состояние
пародонта. В стоматологической прак-
тике также можно выявить некоторые
признаки наркотической зависимости.
Они отражают общие изменения в
организме при наркомании и имеют
некоторые характерные для каждого
вида наркомании черты. Так, при нар-
котической зависимости от опиатов
отмечается развитие ксеростомии,
увеличивается поражение зубов кари-
есом. При обследовании на зубах об-
наружены меловидные пятна и кари-
озные полости различной глубины.
Число кариозных зубов у наркоманов
по сравнению .с контролем возраста-
ет в несколько раз, число удаленных
или подлежащих удалению зубов воз-
растает в 4 раза. Общий индекс КПУ
возрастает в 3 раза.
Характерно, что хронический пуль-
пит и периодонтит у больных опио-
манией не сопровождается болью. Ден-
тин кариозных полостей рыхлый, тем-
ного цвета. Цвет эмали и дентина
варьирует от желтоватого до интенсив-
но-желтого. Поражение эмали и ден-
тина по внешнему виду очень напо-
минает соответствующие дефекты при
тетрациклиновой гипоплазии твердых
тканей зуба, однако в отличие от по-
следней у больных опиоманией сохра-
няется блеск эмали.
У данных больных увеличивается
частота и возрастает тяжесть перело-
мов челюстей, причем при этих трав-
мах значительно увеличивается число
осложнений (остеомиелит, остит).
У 79 % опийных наркоманов в возра-
сте 18 — 25 лет развиваются воспали-
тельные заболевания пародонта, что
в 2,2 раза чаще, чем у лиц, не упо-
требляющих наркотики. У большинства
наркоманов наблюдается хроническое
течение генерализованной формы ка-
тарального гингивита и пародонтита.
Язык больных опиоманией отечный
с отпечатками зубов на боковых по-
верхностях, явлениями десквамации
нитевидных и увеличением грибовид-
ных сосочков. На третьей стадии опио-
мании возможно развитие гипертро-
фической формы ромбовидного глос-
сита. Нередко развивается хроническое
кандидозное поражение языка. Деск-
вамативный глоссит при опиомании
отличается от аналогичного, обуслов-
ленного другой этиологией, отсутстви-
ем болезненности при выраженных
воспалительных явлениях. Отмечается
выраженная иктеричность мягкого
нёба. Изменения в полости рта связы-
вают с отсутствием достаточной лич-
ной и профессиональной гигиены по-
лости рта, неправильным характером
питания, нарушением процессов са-
моочищения ротовой полости, пато-
генным влиянием наркотиков и асо-
120
ль-
ГИО-
- 2ен-
г- Тем-
кина
г-:ив-
• ген-
- 2ПО-
L :ри
СТ ДЫХ
г по-
- ра-
«сстся
еело-
' ~73В-
гло
и- :т).
w :эа-
чЖП.^7и-
МВ. -;то
« -.0-
Ш ;~ва
*е..<ое
Ж. <а-
зг" ла.
-ый
«в 70-
•е^ии
Ж i тд-
* :0-
®1Г 70-
яь.,.эе
•ь- 'И
ЗСГЛИ-
«П- -;х
•ж-.я
г- 70
7.4
Sit j-
ЖТ-’ М
< . -
циальным образом жизни в целом.
Кроме того, в слюне значительно сни-
жена концентрация IgA.
Не вызывает сомнения тератоген-
ное действие опийных наркотиков.
У родившихся от наркоманов детей
возникают аномалии развития языка,
нёба и других органов полости рта.
Токсическое влияние наркотиков
на центральную и периферическую
нервную систему приводит к сниже-
нию болевой, тактильной чувстви-
тельности слизистой оболочки десны,
а также к снижению вкусовой чувстви-
тельности языка.
В экспериментальных исследовани-
ях установлено, что у крыс, получав-
ших в течение 20 дней морфий, обна-
ружены изменения, выражающиеся
в разрыхлении и отечности десны,
утолщении эпителия и разрастании
эпителиальных сосочков. У крыс с па-
родонтитом, моделированным путем
наложения лигатуры на десну в обла-
сти шейки резцов, и получавших мор-
фий, через 20 дней после удаления
лигатуры сохранялась воспалительная
реакция в пародонте. На 40-й день опы-
та у животных не происходило восста-
новление ткани пародонта и даже на-
блюдалось прогрессирование деструк-
тивных процессов, что проявлялось
разрушением эпителиального прикре-
пления, иногда с обнажением подле-
жащих тканей вплоть до гребня альве-
ол. Сохранялся отек и инфильтрация
тканей лейкоцитами, что свидетель-
ствовало о продолжении развития вос-
палительного процесса. Кроме того,
появлялись участки некроза в костной
перегородке альвеол.
Кокаин (наиболее часто вдыхается
через нос) также способствует обра-
зованию кариеса, вызывает рецессию
десны, но наиболее характерна при его
длительном потреблении атрофия сли-
зистой оболочки полости рта и носа,
вплоть до перфорации носовой пере-
городки. В научной литературе описа-
ны также случаи лейкоплакии слизи-
стой оболочки верхней челюсти при
длительном употреблении кокаина.
Употребление марихуаны вызыва-
ет изменение окраски языка и отек
язычка нёба.
В Аргентине исследования слюно-
отделения и частоты кариеса зубов у
наркоманов, принимавших различные
виды наркотиков (амфетамин, мари-
хуану и др.), показали, что у них мо-
жет быть снижено слюноотделение от
4,1 до 26,2%. Концентрация кальция
в слюне у лиц, принимающих только
амфетамины, заметно возрастает, в
то время как содержание белка, фос-
фата и pH слюны значительно сни-
жается.
При употреблении амфетамина по-
является металлический привкус во
рту, кофеина — сухость во рту.
Врачам всех специальностей важно
помнить, что при многих видах нар-
команий (особенно при опийной нар-
комании) снижается чувствительность
к обезболивающим препаратам и нар-
козу.
3.4. Роль
наследственности
в патологии
Наследственность — это свойство
живых организмов повторять в ряду
поколений сходные типы обмена ве-
ществ и индивидуального развития в
целом. Вместе с тем наследственная
(генетическая) информация, реализу-
ющаяся в каждом индивиде, обеспе-
чивает формирование всех признаков
и свойств во взаимодействии с усло-
виями внешней среды. Таким образом,
нормальные и патологические призна-
ки организма — это результат взаимо-
действия наследственных (внутрен-
них) и средовых (внешних) факторов.
121
Следовательно, общее понимание па-
тологических процессов возможно
только с учетом взаимодействия на-
следственности и среды. В генетиче-
ской конституции организма заложе-
на способность сохранять постоянство
внутренней среды при колеблющихся
внешних условиях.
Основу надежности генотипа со-
ставляет, прежде всего, дублирован-
ность его структурных элементов. Су-
ществование всех генетических локу-
сов в удвоенном количестве повышает
надежность генотипа. Диплоидность
препятствует проявлению действия не-
благоприятных генов(например, при
рецессивных признаках). Доминирова
ние нормальных аллелей над аллеля-
ми, измененными в неблагоприятную
сторону, — важный механизм надеж-
ности функционирования частично
«поврежденного» генотипа.
Однако дублированностыо генети
ческих элементов не исчерпывается ста-
бильность генотипа. Эволюция снабди-
ла генетический аппарат, и прежде
всего ДНК, разносторонней системой
механизмов репарации, т.е. исправле-
ния повреждений генов. К настояще-
му времени открыто несколько меха-
низмов, с помощью которых ДНК
способна устранять то или иное по-
вреждение (эксцизионная репарация
пиримидиновых димеров, одноните -
вых разрывов ДНК, рекомбинация
между сестринскими молекулами ДНК
и ряд других).
Стабильность генетического аппа-
рата — лишь одна сторона наслед-
ственности. Другой ее стороной, столь
же неотъемлемой, является наслед-
ственная изменчивость, или мутаци-
онный процесс. В ходе его новые мута-
ции возникают, фенотипически про-
являются и, подвергаясь отбору, либо
закрепляются в популяции, либо уда-
ляются. Именно благодаря этому ста-
ла возможной эволюция жизни на
Земле. Наследственная изменчивость
организма обеспечивает необходимую
приспособленность к условиям суще-
ствования как в пределах жизни од-
ного индивида, так и в рамках суще-
ствования биологического вида, кото-
рый организм представляет.
Если принять здоровье как состоя-
ние равновесия клеточных (физиоло-
гических) функций, обусловленных
генетически и воздействиями внешней
среды, то болезнь можно представить
как смещение этого равновесия.
У наследственно отягощенного ин-
дивида в результате ослабления ген-
ного контроля внутренней среды при
обычных воздействиях факторов
внешней среды может происходить
нарушение гомеостаза, что в конеч-
ном итоге приведет к развитию бо-
лезни.
Причины наследственной патологии.
Е1аследственными болезнями называ-
ют такие болезни, этиологическим
фактором которых является мутация
или изменения наследственных струк-
тур. Многовековой опыт медицины
убедительно свидетельствует об инди-
видуальном характере патологии у
каждого больного. Это проявляется в
сроках развития болезни, интенсивно-
сти, выраженности патологического
процесса, специфике его проявления,
различных исходах заболевания и т.д.
Основным источником этого много-
образия служит изменчивость наслед-
ственных признаков, реализуемая в
конкретных условиях внешней среды.
В зависимости от причин различают
наследственную и ненаследственную
(модификационную) изменчивость. При-
чины ненаследственной изменчиво-
сти заключаются в действии факторов
среды, включая питание, образ жиз-
ни и другие, хотя и в этом случае ре-
акция на действие факторов внешней
среды, как правило, в известной мере
обусловлена генетически.
122
Наследственную изменчивость под-
разделяют на два основных вида —
комбинативную (рекомбинационную)
и мутационную. Под комби натив-
ной изменчивостью понимают воз-
никновение новых сочетаний неиз-
менных генов (ни качественно, ни ко-
личественно) за счет перегруппиров-
ки в процессе мейоза и случайности
встречи гамет при оплодотворении.
Поскольку проявление генов зависит
от их взаимодействий в составе гено-
типа, рекомбинативная изменчивость
имеет очень большое значение в об-
щей наследственной изменчивости.
В частности, генетической рекомбина-
цией обусловленно в подавляющем
большинстве случаев развитие рецес-
сивно наследуемых болезней. Мута-
ционная изменчивость обусловле-
на возникновением мутаций, т.е. ко-
личественных или качественных изме-
нений организма, передаваемых в про-
цессе репликации генома от клетки к
клетке и от поколения к поколению.
По характеру изменения генотипа в
соответствии с тремя уровнями орга-
низации генетического материала
(гены — хромосомы — геном) разли-
чают мутации генные, хромосомные
и геномные.
Генные мутации связаны с
изменением структуры отдельных ге-
нов и обусловливают превращение
одних аллелей в другие. На молекуляр-
ном уровне механизмы генных мута-
ций могут быть различными. Это мо-
жет быть модификация отдельного пу-
ринового или пиримидинового осно-
вания в цепи ДНК с образованием
ошибочных пар оснований и их даль-
нейшей фиксацией (при действии
ионизирующего излучения, ряда хи-
мических мутагенов). Образование не-
правильных пар оснований в ДНК
происходит за счет таутомеризации
(изменения заряда) пуриновых и пи-
римидиновых оснований (при дей-
ствии высоких температур). Образова-
ние пиримидиновых димеров (чаще
димеров тимина) может стимулиро-
вать ультрафиолетовое облучение
(УФО).
По фенотипическому проявлению
и значению генные мутации могут
сильно различаться. Если мутация за-
трагивает отрезки ДНК, кодирующие
второстепенные участки полипептида
(например, не входящие в активный
центр фермента), то мутация с тру-
дом может быть обнаружена и не бу-
дет серьезно влиять на соответству-
ющую функцию или жизнеспособ-
ность организма. Наоборот, мутации,
искажающие структуру принципиаль-
но важных участков полипептидов,
вызывают серьезные расстройства
функций, нарушения развития и даже
приводят к гибели организма. Это так
называемые «летальные мутации». Ча-
сто такие мутации проявляются еще
во внутриутробном развитии и могут
быть причиной спонтанных абортов,
мертворождений.
Следующий уровень мутационных
изменений — хромосомные му-
тации, т.е. структурные перестрой-
ки хромосом: делении, дупликации,
инверсии, транслокации.
Изменения числа хромосом в на-
боре, не сопровождаемые изменени-
ем их структуры, называются геном-
ными мутациями (полиплоидии,
анеуплоидии). Анеуплоидии — наибо-
лее распространенный класс геномных
мутаций, обусловливающих основные
формы хромосомных болезней.
Мутации в зародышевых (половых)
клетках (мутации гамет) ведут к раз-
витию полностью мутантного организ-
ма и передаются из поколения в по-
коление. Соматические мутации за-
хватывают определенный участок тела
в зависимости от стадии онтогенеза,
на которой возникли эти мутации. Их
можно видеть, например, в виде лей-
123
кодермических пятен. Соматические
мутации не передаются следующему
поколению через половые клетки.
Мутации бывают спонтанными и
индуцированными. Спонтанные
мутации возникают в результате
еще недостаточно изученных причин,
вероятно, эндогенного характера (хи-
мические вещества, образующиеся в
ходе метаболизма, ошибки реплика-
ции и т.п.). Индуцированные
мутации возникают под воздействи-
ем различных факторов экзогенного
। [роисхождения (ионизирующей ради-
ации, действием космических лучей,
ряда химических веществ). Факторы,
вызывающие возникновение мутаций,
получили название «мутагены».
Общие закономерности патогенеза
наследственных болезней. Согласно
современным представлениям для воз-
никновения любого наследственно-
го заболевания первоначально долж-
но произойти изменение (мутация)
в гене, которое может передаваться
из поколения в поколение. Функция
гена состоит в управлении синтезом
определенного фермента или белка.
Мутационное изменение в гене ведет
к качественному или количественно-
му нарушению в синтезируемом бел-
ковом продукте и затем, как след-
ствие, к изменению или нарушению
развития отдельных признаков орга-
низма, приводящему в конечном счете
к проявлению клинической картины
заболевания.
Таким образом, развитие наслед-
ственных признаков можно выразить
обшей схемой «ген —> фермент —> био-
химическая реакция —> признак». С этих
позиций в настоящее время объясня-
ют патогенез многих наследственных
обменных заболеваний, в расшифров-
ке которых достигнуты наибольшие
успехи.
Сказанное можно продемонстри-
ровать на примере рецессивного на-
следственно обусловленного заболе-
вания — алкаптонурии (рис. 3.2).
со2 + н2о
Рис. 3.2. Генетические дефекты аминокислотного обмена
124
При алкаптонурии отсутствует ок-
сидаза гомогентизиновой кислоты. Это
ведет к тому, что вместо нормального
метаболизма гомогентизиновой кисло-
ты она накапливается в организме,
связывается с коллагеном, нарушает
его эластичность. В результате разви-
вается характерная клиническая кар-
тина с артритами, поражениями кла-
панов сердца, отложением пигмента
цвета охры во всех органах. Большое
количество кислоты выводится с мо-
чой, придавая ей темный цвет при
стоянии на воздухе.
Классификация форм наследствен-
ной патологии. Наследственность и сре-
да оказываются этиологическими фак-
торами или играют роль в патогенезе
любого заболевания человека, но доля
их участия в каждой болезни своя,
причем чем больше доля одного фак-
тора, тем меньше — другого. По соот-
ношению этих факторов в патогенезе
заболевания можно выделить три груп-
пы наследственной патологии, между
которыми нет резких границ (это пер-
вый принцип классификации).
Первую группу составляют соб-
ственно наследственные болезни, в ко-
торых этиологическую роль играет на-
следственность, а роль среды заклю-
чается лишь в модификации проявле-
ний заболевания. В эту группу входят
моногенно обусловленные болезни
(фенилкетонурия, гемофилия, ахон-
дроплазия), а также хромосомные бо-
лезни.
Вторая группа (экогенетическая) —
это также наследственные болезни,
обусловленные патологической мута-
цией, однако для их проявления уже
необходимо специфическое воздей-
ствие среды. Таковы проявления не-
достаточности гемоглобина S (серпо-
видноклеточная анемия) у его гете-
розиготных носителей при понижен-
ном парциальном давлении кислорода.
Возникновение острой гемолитиче-
ской анемии у лиц с мутациями в ло-
кусе глюкозо-6-фосфатдегидрогеназы
может происходить под влиянием
сульфаниламидов.
Третью группу составляет подавля-
ющее большинство распространенных
болезней, особенно болезней зрелого
и преклонного возраста (гипертони-
ческая болезнь, ишемическая болезнь
сердца, язвенная болезнь желудка и
двенадцатиперстной кишки и др.).
Основным этиологическим фактором
в их развитии служит неблагоприят-
ное воздействие среды, однако реа-
лизация действия фактора зависит от
индивидуальной генетически детер-
минируемой предрасположенности
организма, поэтому данные болезни
называют мулыпифакторными или бо-
лезнями с наследственным предраспо-
ложением. Последние неодинаковы по
относительной роли наследственности
и среды. Среди них можно выделить
болезни со слабой, умеренной и вы-
сокой степенью наследственного пред-
расположения.
Второй принцип классификации —
с генетической точки зрения. Наслед-
ственные болезни подразделяют на
две большие группы: генные и хро-
мосомные.
Генные болезни — это болезни, вы-
зываемые мутациями в генах. По ко-
личеству затронутых мутацией генов
выделяют моногенные и полигенные
болезни. Выделение моногенных болез-
ней в настоящее время основано на
их сегрегации в поколениях по зако-
нам Менделя. К категории полигонных
болезней относятся прежде всего бо-
лезни с наследственным предрасполо-
жением, поскольку предрасположен-
ность является многофакторной.
Кроме генных болезней существу-
ет большая группа патологических со-
стояний, основные проявления кото-
рых составляют множественные поро-
ки развития, обусловленные отклоне-
ниями в содержании хромосомного
материала — хромосомные болезни.
Деление наследственных болезней
на эти две группы не формально. Ген-
ные мутации передаются из поколения
в поколение без изменений, в то вре-
мя как большинство хромосомных бо-
лезней вообще не передаются, а струк-
турные перестройки (инверсии, транс-
локации) передаются с дополнитель-
ными перекомб и нациями.
Третий принцип — преимуществен-
но поражаемая система органов. По
этому принципу наследственная пато-
логия может быть классифицирована
в соответствии с медицинскими спе-
циальностями (наследственные болез-
ни в офтальмологии, оториноларин-
гологии, неврологии и психиатрии,
дерматологии, ортопедии, педиатрии,
гастроэнтерологии и т.д.). Существует
большая условность в системно-орган-
ной классификации, поскольку в ос-
новном наследственные болезни явля-
ются многосистемными.
Четвертый принцип классифика-
ции — патогенетический, т.е. по пер-
вичному биохимическому дефекту, об-
наруживаемому при наследственных
болезнях. Такая классификация явля-
ется более правильной, она как бы
объединяет оба начала — генетиче-
ское и физиологическое (клиниче-
ское), однако пока она возможна
лишь для небольшой части наслед-
ственных болезней, при которых пер-
вичное биохимическое изменение,
вызванное мутацией, установлено.
Методы изучения наследственной
патологии. До середины 50-х гг. XX в.
изучение наследственных болезней в
основном осуществлялось клинико-ге-
неалогическим методом. Суть метода
сводится к выяснению родственных
связей и прослеживанию болезни (или
признака) в семье с указанием типа
родственных связей между членами
родословной. Генеалогический метод
относится к наиболее универсальным
методам генетики человека. Он скла-
дывается из двух этапов: составления
родословной и генеалогического ана-
лиза. Первый этап начинается от про-
банда, которым называется лицо, пер-
вым попавшее в поле зрения врача.
Обычно родословную собирают по
одному или нескольким признакам.
Целью генеалогического анализа
является установление наследственно-
го характера признака и типа насле-
дования.
Близнецовый метод — исследование
генетических закономерностей на близ-
нецах. Данный метод позволяет судить
о соотносительной роли наследствен-
ности и среды в изменчивости разных
признаков организма и основан на
сравнении встречаемости признаков в
разных группах близнецов. При этом
сопоставляют монозиготных близне-
цов с дизиготными, партнеров моно-
зиготных пар между собой, результа-
ты анализа близнецовой выборки и
обшей популяции.
М о н о з и г о т н ы м и (однояйцо-
выми, идентичными) близнецами на-
зываются индивиды, выросшие из од-
ной зиготы, разделившейся на ранних
стадиях дробления на две части. Д и-
зиготные (двуяйцевые, неиден-
тичные) близнецы возникают за счет
оплодотворения двух одновременно
развившихся яйцеклеток. Какой-либо
качественный признак может встре-
чаться либо у обоих близнецов дан-
ной пары, либо у одного из них. В пер-
вом случае пара называется ко и ко р-
дантной, во втором — дискор-
д а н т н о й. Степень конкордантности
по наследственно обусловленным при-
знакам будет выше у идентичных близ-
нецов. Сравнение степени конкордант-
ности у двух групп близнецов позво-
ляет судить об относительном вкладе
наследственности и среды в конкрет-
ные формы патологии.
126
Г-ЗЪНЫМ
скла-
---'.ения
ана-
~ про-
с:. пер-
! грача,
ьст по
н-:ам.
--дтиза
"енно-
-зсле-
£- эание
t 5лиз-
' лить
1-7зен-
Т-ЗНЫХ
ын на
Ь-\ОВ в
* этом
зне-
' эно-
-* эьта-
г<и и
'• ‘llO-
fc- на-
(-. од-
7а.-:них
Д и-
ЧЙ^лен-
~эи-
W ' лз-
•е э т-
•г ,зо-
Шгм. аде
"Ш&.: ет-
Популяционно-статистический ме-
тод заключается в исследовании при-
знаков в больших группах, различа-
ющихся по наследственным характе-
ристикам (расы, нации, этнические
группы, изоляты) или условиям жиз-
ни. Популяционно-статистический
метод позволяет изучать значение на-
следственных факторов в антропоге-
незе, частоту наследственных болез-
ней, роль наследственности и среды в
развитии болезней с наследственным
предрасположением, причины разных
частот наследственных болезней в гео-
графических зонах или в разных по-
пуляциях.
Цитогенетические методы, осно-
ванные на микроскопическом изуче-
нии хромосом, занимают существен-
ное место в изучении наследственной
патологии. К таким методам относят-
ся анализы кариотипа и полового хро-
матина.
Анализ кариотипа проводят
в следующих случаях: при обнаруже-
нии у пробанда в ходе клинического
обследования признаков каких-либо
хромосомных болезней; у детей с мно-
жественными врожденными пороками
неясной этиологии; у супругов при
многократных спонтанных абортах,
мертворождениях, при определении
прогноза здоровья потомства, если в
родословной имеются лица с хромо-
сомными болезнями.
Анализ полового хромати-
на (тельца Барра) проводят при об-
наружении у пробанда признаков ка-
ких-либо хромосомных болезней в
ходе клинического обследования и у
женщин с нарушением репродуктив-
ной (детородной) функции неясного
генеза.
Наряду с перечисленными чисто
генетическими методами, в зависимо-
сти от поставленной задачи при изу-
чении наследственной патологии все
большее распространение получают
различные параклинические методы
исследования, позволяющие проник-
нуть в суть патогенеза болезни.
Биохимические методы применяют
в основном в тех случаях, когда есть
подозрение на наследственные болез-
ни обмена веществ, на те формы на-
следственных болезней, при которых
установлен дефект первичного генно-
го продукта или патогенетическое зве-
но развития заболевания.
Иммунологические методы исполь-
зуют для обследования пациентов и их
родственников при подозрении на им-
мунодефицитные заболевания (агам-
маглобулинемия, дисгаммаглобулине-
мия, атаксия-телеангиэктазия и др.),
антигенную несовместимость матери и
плода или для определения наслед-
ственного предрасположения к болез-
ням.
Довольно широко применяется ме-
тод изучения рельефных узлов на
коже, образуемых папиллярными ли-
ниями и гребешками или дерматогли-
фика (от греч. derma — кожа, glypho —
гравировать). Метод основан на инди-
видуальном характере папиллярного
рисунка, который находится под ге-
нетическим контролем.
Экспериментальное моделирование
наследственных болезней основано на
искусственном размножении мутант-
ных линий животных, имеющих те или
иные наследственные дефекты, ана-
логичные таковым у человека (ахонд-
роплазия у кроликов, гидроцефалия
и дефекты губы у мышей, гемофилия
у собак).
Характеристика наследственных бо-
лезней. Индивидуальное течение на-
следственной болезни у каждого боль-
ного, даже при самой строгой оценке
на идентичность мутаций как этиоло-
гического фактора, не вызывает со-
мнений. Не бывает двух одинаковых
больных, страдающих одним и тем же
заболеванием. Широкое разнообразие
127
клинических проявлений любого за-
болевания определяется понятием
«клинический полиморфизм».
Полиморфизм наследственных забо-
леваний выражается в разном времени
проявления симптомов или начала за-
болевания, степени выраженности бо-
лезненных проявлений, неодинаковых
сроках летальных исходов. Вариации в
проявлении наследственных болезней
не ограничены только клиническими
характеристиками. Они выражаются
также в колебаниях значений биохи-
мических и других показателей, кото-
рые входят в общее понятие «фено-
тип». Так, заболевание несовершенный
остеогенез характеризуется патологи-
ческой ломкостью костей, прогресси-
рующей потерей слуха и голубыми
склерами, но все эти три главных при-
знака встречаются только у 44 % но-
сителей гена, ломкость костей — у
63 %, а глухота — у 60 %. Таким обра-
зом, у разных больных основные па-
тологические симптомы комбиниру-
ются по-разному. Одним из компонен-
тов несовершенного остеогенеза
является опалесцирующий дентин (ян-
тарные зубы) с выраженной демине-
рализацией.
Может значительно колебаться вре-
мя проявления заболевания. Так, при
хорее Гентингтона (неврологическом
заболевании, характеризующемся ги-
перкинезами конечностей, туловища
и лица) средний возраст начала забо-
левания — 35 — 40 лет. но у некото-
рых больных оно проявляется уже в
первые годы жизни, а иногда после
60 лет.
Различную тяжесть поражения мож-
но проиллюстрировать на примере
фенилкетонурии (см. рис. 3.2), прояв-
ление которой варьирует от легкой
степени умственной отсталости (боль-
ные справляются со школьной про-
граммой) до глубокой имбицильно-
сти.
Причины клинического полимор-
физма в общей форме обусловлены
комплексом генетических и внешних
факторов. Поскольку генотип каждого
человека и факторы среды в его онто-
генезе абсолютно индивидуальны, они
и обеспечивают корректировку прояв-
ления генной мутации.
Не меньшую роль, чем генотип, в
происхождении клинического поли-
морфизма могут играть и факторы сре-
ды. Они могут действовать во внутри-
утробном или постнатальном периоде.
Так, например, богатая фенилалани-
ном диета беременной гетерозиготной
женщины усугубляет тяжесть фенил-
кетонурии у будущего гомозиготного
ребенка. Частые падения больного ге-
мофилией ребенка в раннем детстве
усиливают степень проявления дефек-
та. Еще большим клиническим поли-
морфизмом характеризуются болезни
с наследственным предрасположени-
ем, поскольку в этом случае к вариа-
циям генетических факторов присо-
единяются еще и вариации факторов
внешней среды.
Генные болезни. Как видно из са-
мого определения, этиологическим
фактором генных болезней являются
генные мутации, т.е. молекулярные
изменения на уровне ДНК. У челове-
ка примерно 100 тыс. генов, и каждый
ген может мутировать и обусловливать
другое строение белка. Следовательно,
количество наследственных болезней
генной природы может быть очень
большим.
Каждая генная мутация обусловли-
вает изменение структуры или полное
отсутствие белка. Так, например, при
галактоземии (рис. 3.3) резко снижена
активность фермента галактозо-1 -фос-
фат-уридилтрансферазы, в результате
в клетках накапливается галактозо-1-
фосфат. Это соединение подавляет
ферментативные реакции углеводно-
го обмена с участием фосфорилиро-
128
‘*-Ч?"Жяо4|
м ор-
;_:ены
зДШИХ
-“ЛОГО
: нто-
ы. они
~~эяв-
ь~<п, в
: "1.1И-
Г".! гре-
•н три-
t~ -оде.
ШНИ-
" ГНОЙ
‘Иенил-
ю~ного
»r-j ге-
irJIBC
tk-фек-
fc*:ли-
ш.- .зни
ЖЙК* гНИ-
•fcSucna-
Wrzco-
-фьл: эов
са-
<Йь.<:им
4йкуся
ЧВс-ые
: зе-
ШЫЫЙ
Шдать
ЧЕЛЛО,
•глей
s-'-ень
Рис. 3.3. Патогенез галактоземии
ж^ги-
«. -ое
Ж “ЭИ
-ш г на
жь ~ те
t, -]-
* -ет
Ж1 - J-
Ж»~ Э-
ванных промежуточных продуктов. За
этим следует поражение печени, моз-
га, общее нарушение развития. Ката-
ракты, характерные для этого заболе-
вания, образуются за счет высокой
концентрации галактозе-1-фосфата в
жидкостях организма и образования
галактитола.
Для многих генных болезней уже
идентифицирован первичный ано-
мальный продукт гена или ключевое
патогенетическое звено на биохими-
ческом уровне (см. рис. 3.2). Исходя из
этого их классифицируют по биохи-
мическому принципу в зависимости от
того, какие белки поражены — струк-
турные, транспортные или фермент-
ные.
Примером заболевания, при кото-
ром изменения касаются структурных
белков, может служить синдром Элер-
са-Данлоса, при котором нарушена
структура коллагена. Синдром харак-
теризуется повышенной эластично-
стью кожи, увеличенной подвижно-
стью суставов, повышенной растяжи-
мостью хорд сердечных клапанов,
отслойкой сетчатки, подвывихом хру-
сталика, выраженными изменениями
пародонта временных и постоянных
зубов, аномалией корней и увеличе-
нием полости зуба. Больные обычно
жалуются на кровоточивость десен и
подвижность зубов.
Поражение транспортных белков
отмечается, например, при лизинури-
ческой непереносимости белка, при ко-
торой нарушается транспорт диамино-
кислот (лизина, аргинина, орнитина)
в почечных канальцах.
Наиболее обширная и изученная
группа моногенных заболеваний —
энзимопатии. Принятие на вооружение
гипотезы «один ген — один фермент»
привело к расшифровке многих из них.
Энзимопатии, при которых расшиф-
рован первичный дефект фермента,
подразделяются на болезни накопления
липидов, гликогена, гликопротеидов,
болезни нарушений аминокислотно-
го, углеводного, пуринового и пири-
мидинового обменов, гормоногенеза
и др.
Однако подавляющее большинство
моногенных наследственных болезней
составляют болезни с неизвестным
первичным биохимическим дефектом.
Примером такого заболевания может
служить ахондроплазия — наследствен-
ная болезнь костной системы. Клини-
ческая картина ее характеризуется ано-
мальным ростом и развитием хряще-
вой ткани в основном в эпифизах
трубчатых костей и основании черепа.
129
Для больных характерны: низкий рост
(до 120 см) при сохранении нормаль-
ной длины туловища; бугристая моз-
говая часть черепа; резкое укорочение
верхних и нижних конечностей, осо-
бенно за счет бедренной и плечевой
костей, с их деформацией и утолще-
нием.
Болезни с наследственным предрас-
положением. Болезни с наследствен-
ным предрасположением занимают
особое место среди патологических
состояний наследственной природы и
отличаются от генных болезней тем,
что для своего проявления нуждаются
в сочетанном действии факторов
внешней среды и генетических фак-
торов. Они представляют собой наи-
более обширную группу наследствен-
ной патологии, весьма многообразную
по своим проявлениям. Эти болезни
могут быть как моногенными, т.е. вы-
зываться мутацией единственного
гена, так и полигенными, при разви-
тии которых страдают многие гены.
Как правило, эти формы по типу
наследования являются рецессивными
(аутосомными или сцепленными с
Х-хромосомой). Моногенные формы
наследстве н но го пред рас пол оже н и я
проявляются при действии разных
факторов среды: загрязнения воздуха,
пищевых веществ, лекарств. Известно,
например, что ряд пищевых веществ
может вызывать патологическое со-
стояние у лиц с наследственным
предрасположением. Так, у некоторых
людей после приема молока или мо-
лочной пищи наблюдается газообра-
зование в кишечнике. В популяциях ев-
ропейской расы такие индивиды со-
ставляют 10 —20 %, а у восточных на-
родов, негров и индейцев Америки —
до 70 — 100 %. Это связано с аутосом-
ным рецессивным признаком непере-
носимости лактозы. В кишечнике
взрослых гомозигот отсутствует (З-га-
лактозидаза, поэтому молочный сахар
не усваивается, а под действием мик-
рофлоры кишечника подвергается бро-
жению.
Известно значительное варьирова-
ние эффективности и побочных дей-
ствий лекарств среди различных групп
населения и у разных лиц. Так, зака-
пывание в глаза раствора глюкокор-
тикоидов у некоторых людей вызыва-
ет сильное повышение внутриглазно-
го давления, у других — меньшее, а у
третьих внутриглазное давление совсем
не повышается. С помощью близнецо-
вого и клинико-генеалогического ме-
тодов обнаружено, что такое варьи-
рование в значительной степени де-
терминировано генетически.
Существует и другой тип генети-
чески обусловленных нарушений —
задержка в выведении лекарств, обу-
словленная неправильным их метабо-
лизмом. Так, например, после введе-
ния противотуберкулезного препара-
та — изониазида в стандартной дозе
у некоторых лиц концентрация его в
сыворотке спустя 6 ч значительно по-
вышается. Это связано с тем, что он
не ацетилируется и медленно выводит-
ся с мочой. У таких лиц наблюдаются
побочные реакции на изониазид, свя-
занные с поражением периферических
нервов. Патологический аллель прояв-
ляет свое действие по аутосомно-ре-
цессивному типу.
На примере моногенных форм на-
следственного предрасположения мож-
но видеть, что изучение генетических
вариаций чувствительности к факто-
рам окружающей среды становится все
более актульным в связи с тем, чтс
среда обитания человека наполняется
все новыми и новыми факторами (ле-
карства, пестициды, пищевые добав-
ки и т.д.), с которыми человек не
сталкивался в процессе своей эволю-
ции.
Несмотря на то что полигенные
болезни с наследственным предраспо-
130
мик-
бро-
эова-
дей-
групп
зака-
жор-
;ыва-
ЗЗНО-
е.ау
всем
-ецо-
э ме-
ВрЬИ-
л де-
-:ети-
iil —
обу-
вабо-
зеде-
тара-
дозе
его в
: по-
он
•: дит-
-ОТСЯ
гвя-
езких
гояв-
:-ре-
- на-
* .ож-
ег ких
: _:<то-
с - все
• что
• лтся
ле-
. :ав-
не
:ю-
- - ые
.. по-
ложением являются наиболее распро-
страненной группой (гипертоническая
болезнь, ишемическая болезнь серд-
ца, атеросклероз, язвенная болезнь
желудка и двенадцатиперстной киш-
ки, шизофрения, сахарный диабет,
бронхиальная астма, псориаз и др.),
механизм их возникновения наименее
изучен.
Для мультифакторных болезней,
несмотря на их разнообразие, харак-
терны все признаки полигонного на-
следования, отличающие их от груп-
пы моногенных болезней: 1) относи-
тельно высокая частота болезней в
общей популяции и в то же время зна-
чительная семейная подверженность
заболеваниям; 2) наличие патогене-
тических и ассоциированных маркеров
предрасположения; 3) относительно
невысокая конкордантность (совпаде-
ние) болезни у монозиготных близ-
нецов (60 %); 4) однотипность прояв-
ления болезни у больного ребенка и
ближайших родственников; 5) чем
реже встречается болезнь в популяции,
тем выше риск для родственников про-
банда и тем большая разница в вели-
чине риска между родственниками 1
и II степени родства и между родствен-
никами II и III степени; 6) чем силь-
нее выражена болезнь у пробанда, тем
выше риск для его родственников;
7) риск для родственников пробанда
будет выше, если имеется другой боль-
ной кровный родственник; 8) в слу-
чае разницы в частоте болезни по полу
риск для родственников будет выше,
если пробанд относится к менее по-
ражаемому полу.
Значимость наследственных факто-
ров в патологии человека. Наследствен-
ные болезни представлены практиче-
ски во всех медицинских специально-
стях. Это многочисленные болезни
внутренних органов, обмена веществ,
крови, эндокринной системы, печени,
глаз, мочеполовой системы, нервные
и психические заболевания и т.д. На-
пример, в дерматологии известно око-
ло 250 наследственных заболеваний,
в офтальмологии — свыше 200, в кли-
нике нервных болезней — около 200.
Весьма существенной является и
распространенность наследственных
болезней в популяциях человека, ко-
торая составляет только для генных бо-
лезней 1,5 —2,0 %. Еще более вырази-
тельной становится картина при ана-
лизе контингента больных клиник,
особенно педиатрических. Установле-
но, что 25 — 30 % коек в детских боль-
ницах приходится на больных с на-
следственной патологией.
По современным данным, с хро-
мосомными болезнями рождаются
0,7 % всех живорожденных младенцев.
Основная часть эмбрионов с хромо-
сомными аномалиями погибает еще до
своего рождения, обусловливая более
40 % спонтанных абортов и около 6 %
мертворождений. Наконец, существу-
ет ряд широко распространенных бо-
лезней с наследственным предраспо-
ложением (атеросклероз, гипертони-
ческая болезнь, шизофрения и др.).
Так, по данным Международной фе-
дерации по диабету, в мире насчиты-
ваются десятки миллионов больных
сахарным диабетом.
Приведенные цифры определяют
вклад наследственной патологии в та-
кие показатели, как заболеваемость,
инвалидность и смертность.
Хромосомные болезни. В отличие от
генных хромосомные болезни обяза-
ны своим возникновением более гру-
бым изменениям генетического мате-
риала, связанным с нарушением чис-
ла или структуры хромосом. В связи с
этим все хромосомные болезни мож-
но подразделить на две большие груп-
пы: вызванные геномными мутациями,
т.е. изменением числа хромосом (по-
липлоидии, анеуплоидии) при сохра-
нении структуры последних и обу-
131
словленные хромосомными мутациями,
т. е. изменением структуры хромосомы
(транслокации, инверсии, делеции).
Хромосомная болезнь может возник-
нуть в результате мутаций в гаметах
родителей или в результате мутаций в
клетках эмбриона на ранних стадиях
его развития (особенно на стадии
дробления зиготы).
У человека обнаружены все формы
хромосомных и геномных мутаций.
Полные формы тетра- и полиплоидий
обнаружены только при спонтанных
абортах, что свидетельствует об их
летальном эффекте на ранних стадиях
развития. Общее количество описан-
ных типов хромосомных аномалий у
человека только гаметического проис-
хождения составляет около 750, из ко-
торых около 50 — количественные и
свыше 700 — структурные изменения
хромосом.
В настоящее время выделяются сле-
дующие группы и виды хорошо рас-
познаваемых хромосомных синдро-
мов.
Синдромы моносомий. Х-моносо-
мия, или синдром Шерешевского —
Тернера (45 Х0), характеризуется ти-
пичными признаками: низким рос-
том, крыловидными кожными склад-
ками на шее, первичной аменореей,
бесплодием, врожденными пороками
сердца, уменьшенными размерами зу-
бов. У 82 % больных встречается кари-
ес, у 62 % — парадонтит.
Синдромы трисомий. Синдром Патау
(наличие лишней 8-й хромосомы) —
трисомия по хромосоме группы D —
характеризуется у младенцев: микро-
цефалией, аномикрофтальмом, де-
формацией ушных раковин, расщели-
ной верхней губы и нёба, полидакти-
лией, недоразвитием обеих челюстей,
врожденными пороками сердца. Син-
дром Эдвардса — это наличие доба-
вочной 9-й хромосомы в группе Е. Для
синдрома характерны: деформация
ушных раковин, узкие глазные щели,
гипоплазия нижней челюсти, расще-
лина нёба, микроцефалия, пороки
сердца, пороки органов пищеварения,
сращение почек. Синдром Дауна — это
наличие добавочной 21-й хромосомы.
Среди полисомий по половым хро-
мосомам можно выделить Х-трисомию
(XXX) и синдром Клайнфелтера (47
XXY), или тестикулярная дисгенезия.
Последняя является наиболее распро-
страненной формой мужского гипого-
надизма. Характерные признаки син-
дрома — высокий рост, евнухоидное
телосложение, нарушение спермато-
генеза, гинекомастия, нарушения пси-
хики. При данном синдроме довольно
часты аномалии формы и размеров зу-
бов — микродентия. В ядрах клеток бук-
кального эпителия обнаруживается по-
ловой хроматин — тельце Барра.
К синдромам, обусловленным де-
лениями, относятся синдром «коша-
чьего крика» 5р-, кольцевая хромосо-
ма 13-13q, кольцевая хромосома 21-
21 q, кольцевая хромосома 22-22q.
Эти синдромы имеют четкую кли-
ническую картину. Так, характерная
округлая форма головы и плоское лицо
больных, монголоидный разрез глаз,
увеличенный язык, клинодактилия,
мышечная гипотония в сочетании с
разболтанностью суставов имеются в
комплексе у всех больных синдромом
Дауна, хотя каждый признак в отдель-
ности может отсутствовать в 20 — 30 %
случаев. Характерна также глубокая ум-
ственная отсталость, обычно в степе-
ни имбицильности. Около половины
больных имеют пороки сердца и круп-
ных сосудов, у 93 % больных задержи-
вается прорезывание временных зубов,
а у 64 % — постоянных зубов, неред-
ко встречается гипоплазия моляров.
Одним из частых признаков является
тяжелая форма пародонтита. При бо-
лезни Дауна изменено состояние гу-
морального и клеточного иммуните-
132
дели,
дсще-
: роки
гения,
— это
сомы.
:ч хро-
-?МИЮ
7i (47
-:езия.
длро-
-ТОГО-
. син-
•дное
чато-
s. пеп-
ельно
X 3 зу-
'-бук-
дпо-
де-
•оша-
S40CO-
21-
кли-
теэная
* лицо
~ глаз,
гелия,
ЩИИ С
г лея в
д ном
Егдель-
t-30%
ум-
। ~епе-
КЕЛНЫ
» ‘.руп-
ьетжи-
t ? бов,
теред-
к?лров.
едется
h бо-
Ь17 гу-
f -атле-
та, с чем связана повышенная воспри-
имчивость больных к инфекциям.
У 94 % больных обнаруживается карио-
тип 47 XX/XY, 21+, т.е. простая фор-
ма трисомии аутосомы 21. Около 4 —
5 % больных имеют транслокационную
форму трисомии, почти исключитель-
но с вовлечением других акроцентри-
ческих хромосом.
Общими для всех форм хромосом-
ных болезней являются тяжелые на-
рушения физического и полового раз-
вития. К ним могут быть отнесены ум-
ственное и физическое недоразвитие,
микроцефалия, деформация черепа,
косолапость, пороки сердца, наруше-
ние функций нервной и эндокринной
систем.
Для хромосомных болезней харак-
терно следующее распределение ос-
новных типов хромосомных аномалий
среди новорожденных: все виды ане-
уплоидий по половым хромосомам
составляют 38 %, трисомии по ауто-
сомам — 22%, структурные пере-
стройки — 40 %. Половина всех струк-
турных перестроек относится к семей-
ным случаям, все трисомии — спора-
дические случаи.
Анализ частоты хромосомных ано-
малий среди эмбрионов, полученных
при медицинских абортах, показыва-
ет, что почти 3 % эмбрионов на ста-
дии 8—12 нед развития имеют хро-
мосомные аномалии. Часть из них
впоследствии элиминируется (спон-
танные аборты, мертворождения),
другая часть (примерно 0,6 —0,7%)
сохраняется до рождения.
Основным видом нарушения явля-
ются анеуплоидии (90 % всех хромо-
сомных аномалий). Полиплоидии (три-
и тетраплоидии) встречаются среди
плодов с хромосомными аномалиями
в 10% случаев. О роли хромосомных
аномалий во внутриутробной гибели
плода можно судить по результатам
хромомсомного обследования спон-
танных абортов и мертворожденных.
Частота хромосомных аномалий при
спонтанных абортах составляет 30 —
60 %. Наиболее частыми мутациями,
приводящими к спонтанным абортам,
являются трисомии и полисомии. Так,
трисомии составляют около 50 % от
общего числа хромосомных аномалий,
а полисомии — 22,6 %, из которых
17,3 % приходится на триплоидию
и 5,3 % — на тетраплоидию. Суще-
ственна роль хромосомных и геном-
ных мутаций в перинатальной смерт-
ности. Не менее 6 % случаев перина-
тальной смертности обусловлено хро-
мосомной патологией.
Принципы лечения и профилакти-
ки наследственных заболеваний и бо-
лезней с наследственным предраспо-
ложением. Признание роли факторов
внешней среды в проявлении наслед-
ственной патологии позволяет разра-
батывать различные подходы к лече-
нию больных с наследственными за-
болеваниями. Как и при лечении
любого заболевания, можно выделить
три основных метода лечения наслед-
ственных болезней и заболеваний с на-
следственным предрасположением.
Симптоматический метод предпо-
лагает применение лекарственной те-
рапии, хирургического лечения (уда-
ление или замена пораженных очагов,
например, поллипоза толстой кишки,
коррекция, при незаращении верхней
губы, врожденных пороках сердца).
Патогенетический метод заключает-
ся в коррекции обмена веществ (на-
значение диеты с низким содержани-
ем фенилаланина при фенилкетонурии
предотвращает развитие слабоумия);
освобождении от продуктов обмена,
являющихся субстратом патологиче-
ской реакции (выведение железа при
талассемии, гемосорбция при семей-
ной гиперхолестеринемии); хирур-
гическом шунтировании (наложение
анастомоза между воротной и нижней
полой веной при гликогенозах); воз-
мещении недостающего продукта (вве-
дение тироксина при гипотиреозе,
антигемофильного глобулина при ге-
мофилии, инсулина при сахарном ди-
абете) и т.д.
Этиологический метод с учетом
успехов молекулярной биологии и ген-
ной инженерии можно считать перс-
пективным. Он предполагает включе-
ние искусственно полученных генов в
геном человека, возможность исполь-
зования направленного химического
мутагенеза, позволяющего индуциро-
вать специфические мутации в строго
определенном локусе (получение об-
ратных мутаций — от патологическо-
го аллеля к нормальному).
Профилактика наследственной па-
тологии, несомненно, является важ-
нейшим разделом современной меди-
цины и организации здравоохранения.
В целом профилактика должна быть на-
правлена на три типа наследственной
патологии: вновь возникающие на-
следственные болезни, как результат
спонтанной мутации в зародышевых
клетках родителей; болезни, унасле-
дованные от предыдущих поколений;
заболевания, развивающиеся в резуль-
тате наследственного предрасположе-
ния и действия проявляющих факто-
ров внешнейЧгреды.
Чрезвычайно серьезную проблему
представляет профилактика наслед-
ственных болезней за счет воздействия
химических, физических и биологи-
ческих факторов среды, количество
которых постоянно увеличивается в
связи с научно-техническим прогрес-
сом. Поскольку индуцированный му-
тагенез ведет к повышению частоты
наследственных болезней, он, с точ-
ки зрения профилактической медици-
ны, должен быть полностью исключен.
В настоящее время разработаны мето-
ды проверки факторов внешней сре-
ды на мутагенность, обоснована си-
стема генетических и гигиенических
мероприятий по исключению мутаген-
ных факторов.
Наиболее распространенным и эф-
фективным подходом к профилакти-
ке наследственных болезней является
медико-генетическое консультирование.
Суть его заключается в определении
прогноза рождения ребенка с наслед-
ственной болезнью, объяснении веро-
ятности этого события консультиру-
ющимся, помощи семье в принятии
решения.
3.5. Значение
конституции в патологии
Тесно с проблемой наследственно-
сти смыкается учение о конституциях
человека. Под конституцией человека
(от лат. constitutio — состояние, свой-
ство) принято понимать совокупность
гено- и фенотипических свойств и осо-
бенностей (морфологических, биохи-
мических, функциональных) организ-
ма, складывающихся в определенных
природных и социальных условиях и
определяющих возможности его за-
щитно-приспособительных реакций,
направленных на сохранение гомео-
стаза при изменениях условий внеш-
ней среды.
В современной медицинской науке
конституция рассматривается в каче-
стве основной биологической харак-
теристики целого организма, посколь-
ку за разными вариантами нормы
скрываются различные способы адап-
тации организма к условиям среды,
особенно в связи с резистентностью
к определенным заболеваниям.
Под конституциональными призна-
ками подразумеваются такие показа-
тели структуры, функции и поведе-
ния, которые изо дня в день или даже
на протяжении нескольких лет не из-
меняются существенно. Для человека.
134
-еских
< ~аген-
>- л эф-
Л-ЦКТИ-
Е-лется
р вание.
^“ении
<след-
зеро-
^-иру-
• яти и
гии
'енно-
ЛИЯХ
1 зека
: -Зой-
ic -ость
Ь - осо-
эхи-
1Г-НИЗ-
Sc-Hbix
kt лх и
за-
£.-> _ИЙ,
чео-
I :-еш-
• -ауке
« 'зче-
' _?ак-
В.. ль-
s 7 мы
ь -лап-
“тДЫ,
* ДЬЮ
ЧВГ' :на-
• лза-
> л.е-
дже
Ш-- лз-
как и для других представителей жи-
вотного мира, характерна индивиду-
альность формы и размеров телосло-
жения, некоторых черт характера и
темперамента, определяющая стойкие
различия между людьми. Каждый ин-
дивид, взрослый или ребенок, имеет
свою неповторимую индивидуальную
конституцию или сумму морфологи-
ческих и функциональных свойств
организма. Это и послужило основой
для создания учения о конституции,
уходящего своими корнями в глубо-
кую древность.
Основоположник древнегреческой
медицины Гиппократ (ок. 460 —ок.
370 гг. до н. э.) различал следующие
виды конституции человека: хорошую
и плохую, сильную и слабую, сухую
и влажную, вялую и упругую, считая
что сущность болезней заключается в
неправильном смешении четырех ос-
новных соков организма (крови, сли-
зи, желтой и черной желчи). Преобла-
дание того или иного сока определяет
индивидуальные конституциональные
особенности.
По характеру темперамента Гип-
пократ эмпирически разделял людей
на холериков, сангвиников, флегма-
тиков и меланхоликов. Он делал так-
же и практические выводы, рекомен-
дуя учитывать конституциональные
особенности при лечении переломов
и вывихов.
Классификация Гиппократа удер-
живалась вплоть до начала XX в.
В результате накопления фактов о
значении индивидуальных особенно-
стей организма человека в возникно-
вении и течении болезней появились
попытки установления типов консти-
туции по морфологическим или функ-
циональным особенностям организма,
типичным для большой группы лю-
дей. Это так называемый антропомор-
фологический принцип. Одной из клас-
сификаций конституциональных ти-
пов, основанных на этом принципе,
и получивших в медицине широкое
распространение, является классифи-
кация конституциональных типов по
Сиго, согласно которой выделяется
четыре типа телосложения.
1. Дыхательный (респиратор-
ный) тип характеризуется сильным
развитием грудной клетки в длину, с
острым эпигастральным углом, длин-
ной шеей, относительно небольшой
головой. Люди этого конституциональ-
ного типа особенно склонны к забо-
леваниям дыхательной системы (эм-
физема, бронхиальная астма и др.)
2. Пищеварительный (диге-
стивный) тип отличается хорошо
развитой короткой и широкой груд-
ной клеткой с тупым эпигастральным
углом, короткой шеей, объемистым
животом. Люди этого типа склонны к
болезням обмена веществ и заболева-
ниям органов пищеварения (ожирение,
болезни печени, подагра и др.).
3. М ышечн ый тип характери-
зуется развитой мускулатурой, широ-
кой грудью, пропорциональным те-
лосложением, небольшим объемом
брюшной полости. По мнению Сиго,
люди этого типа более склонны к за-
болеваниям сердечно-сосудистой, мы-
шечной и костной систем.
4. Церебральный (мозговой)
тип характеризуется большим чере-
пом, слабо развитыми грудной клет-
кой и мышечной системой, коротки-
ми конечностями. Люди этого типа
более склонны к различным заболе-
ваниям нервной системы.
Много работ по изучению пробле-
мы конституции человека выполнено
отечественными учеными (С. Г. Зыбе-
лин, В. П. Крылов, А. А. Богомолец,
М. В. Черноруцкий и др.). Так, на мор-
фологических признаках основана клас-
сификация конституций, предложен-
ная М. В. Черноруцким, но она учи-
тывает уже и функциональные, и био-
химические особенности. М. В. Черно-
руцкий выделял три основных типа
конституции: астенический, гиперсте-
нический и нормастенический.
Для астенического типа ха-
рактерен высокий рост, стройность и
легкость в строении тела, слабость об-
щего развития, низкое артериальное
давление, слабая моторика желудка.
Язвенная болезнь желудка и двенад-
цатиперстной кишки, хронический
колит встречается преимущественно у
астеников.
Для гиперстенического типа
свойственны преимущественно рост
в ширину, массивность, относитель-
но длинное туловище и короткие ко-
нечности, относительно высокий уро-
вень артериального давления, боль-
шое сердце, расположенное попереч-
но, высокое стояние диафрагмы. Люди
этого типа чаше страдают сердечно-со-
судистыми заболеваниями (атероскле-
розом, гипертонической болезнью, ин-
фарктом миокарда). У них чаще встре-
чаются заболевания, связанные с на-
рушением обменных процессов, жел-
чнокаменная болезнь.
Нормостеники занимают про-
межуточное положение между астени-
ками и гиперстениками.
Другим подходом к определению
конституции явились попытки клас-
сификации типов конституции по
функциональному состоянию отдель-
ных систем организма (эндокринной,
нервной и др.).
Так, Г.Эппингер и В. Гесс по осо-
бенностям функций отдела вегетатив-
ной нервной системы выделяли консти-
туции людей с преобладанием тонуса
симпатической (симпатикотоники),
парасимпатической (ваготоники) не-
рвной системы и с уравновешенной
вегетативной нервной системой.
Учение о конституции А.А. Бого-
мольца (1926) основано на представ-
лении о главной роли системы соеди-
нительной ткани, состояние которой
определяет конституциональный тип
организма. По состоянию соединитель-
ной ткани А. А. Богомолец предложил
выделить четыре типа конституции:
астенический (тонкая, нежная
соединительная ткань);
фиброзный (преобладаниеплот-
ной, волокнистой соединительной
ткани);
пастозный (с преобладанием
рыхлой соединительной ткани);
липоматозный (обильное раз-
витие жировой ткани).
При этом важную роль в формиро-
вании конституции организма А. А. Бо-
гомолец уделял эндокринной и веге-
тативной нервной системам.
Большим вкладом в определение
конституциональных свойств организ-
ма явилось учение И. П. Павлова о ти-
пах высшей нервной деятельности,
учитывающее особенности нервной си-
стемы. Основываясь на функциональ-
ной особенности нервной системы
(сила основных нервных процессов —
возбуждения и торможения, их рав-
новесие и подвижность) И. П. Павлов
выделял четыре основных типа:
сильный неуравновешен-
ный— возбудимый или безудержный
(с относительным преобладанием ре-
акций возбуждения и недостаточным
торможением);
сильный уравновешен-
ный — подвижный или быстрый
(с одинаково сильным развитием про-
цессов возбуждения и торможения);
слабый уравновешенный —
спокойный или медленный (с инерт-
ностью основных нервных процессов);
слабый, или тормозной, тип (ха-
рактеризуется слабостью раздражи-
тельного и тормозного процессов с от-
носительным преобладанием послед-
него).
В научной литературе имеются дан-
ные, что у людей с сильным неурав-
136
<торой
‘iGi ТИП
и-титель-
Е_ТОЖИЛ
~ тши:
нежная
?:е плот-
"Т-ТЬНОЙ
гением
"Г
раз-
гсииро-
Ч \.Бо-
- веге-
□еление
сганиз-
ет о ти-
ь-эсти,
CU-
V. наль-
~<_темы
«г.. , о в —
гх рав-
лвлов
с нен-
ужный
кем ре-
тным
t _ е н-
1>*:трый
f- про-
е-дя);
st л й —
; L-ерт-
•ессов);
тс (ха-
нт ажи-
ве с от-
ттслед-
К-« дан-
не.-рав-
новешенным и слабым типом нервной
системы легче возникают некоторые
психические заболевания, чаще воз-
никают язвенная, гипертоническая
болезни, бронхиальная астма, ревма-
тизм, быстрый рост раковых опухолей,
развитие метастазов.
В настоящее время в нашей стране
широко применяется схема конститу-
циональных типов, предложенная еще
в 1929 г. В.Г. Штефко и А. Д. Остров-
ским. Ее преимущество заключается в
том, что она пригодна для классифи-
кации как детей, так и взрослых.
Согласно этой классификации вы-
деляются следующие типы:
астеноидный — характеризует-
ся тонким скелетом и преимуществен-
ным развитием нижних конечностей,
узкой грудной клеткой, острым эпи-
гастральным углом, слабо выражен-
ным животом;
торакальный — характеризует-
ся сильным развитием грудной клет-
ки в длину, большой жизненной ем-
костью легких, небольшим животом;
мышечный — отличается тем,
что туловише развито равномерно,
эпигастральный угол средний, плечи
широкие и высокие, грудная клетка
средней длины, резко выражены кон-
туры мышц;
д и г е с т и в н ы й — характеризует-
ся короткой шеей, короткими ниж-
ними конечностями, широкой и ко-
роткой грудной клеткой, сильным
развитием живота с выраженными
жировыми складками, эпигастраль-
ный угол тупой.
Таким образом, смысл учения о
типах конституции заключается в том,
что каждому из типов присущи ха-
рактерные особенности деятельности
нервной и эндокринной систем, ме-
таболизма (биохимических показате-
лей), структуры и функции внутрен-
них органов. Конкретные типы кон-
ституции характеризуются различны-
ми показателями иммунитета, пред-
расположенности к инфекционным и
неинфекционным заболеваниям.
Конституциональные особенности
организма имеют большое значение в
развитии патологических процессов.
Причем следует подчеркнуть, что ано-
малия конституции — это не заболе-
вание, а лишь тот фактор, который
может способствовать развитию раз-
нообразных заболеваний.
3.6. Значение возраста
в патологии
Многие болезни могут возникнуть
в любом возрасте. Однако хорошо из-
вестно, что каждому возрасту свой-
ственны свои болезни. В связи с этим
принято различать болезни новорож-
денных, детские болезни, болезни пе-
риода полового созревания, болезни
зрелого возраста и, наконец, болезни
старческого возраста.
У новорожденного легкие в 30 раз
менее растяжимы, чем у взрослого,
кишечник в 6 раз больше длины
тела, тогда как у взрослого — только
в 4,5 раза. Слизистая оболочка кишеч-
ника у него тонкая, мускулатура сла-
бо развита, нервная регуляция дея-
тельности указанных систем еще не
совершенная. Анатомо-физиологиче-
ские особенности этого периода жиз-
ни ребенка обусловливают более ча-
стые, чем у взрослых, болезни орга-
нов дыхания и пищеварительной
системы. У новорожденных слабее,
чем у взрослых, выражена приспособ-
ляемость к колебаниям температуры
окружающей среды (из-за недоразви-
тия системы терморегуляции) и, как
следствие, легко возникает перегре-
вание или переохлаждение организ-
ма. Вместе с тем новорожденные по-
чти не подвержены таким болезням,
возникновение которых возможно
137
лишь на определенном уровне разви-
тия организма.
Некоторые болезни (корь, скар-
латина, коклюш, дифтерия) свой-
ственны преимущественно детям 6 —
12-месячного возраста. Это объясня-
ется недоразвитием у них барьерных
систем организма, прекращением к
этому периоду циркуляции в крови
ребенка антител, полученных от ма-
тери (через плаценту и при кормле-
нии грудью), при одновременной не-
способности еще к полноценной вы-
работке антител в собственном орга-
низме.
В пожилом возрасте увеличивается
частота развития злокачественных опу-
холей, характерно развитие атеро-
склеротических процессов. Связано
это, по-видимому, с возрастными осо-
бенностями деятельности регуляторных
систем, их перестройкой в процессе
индивидуального развития. Вследствие
понижения функций нервной систе-
мы, ослабления функции барьерных
систем, способности к формированию
иммунного ответа в старческом воз-
расте вновь повышается восприимчи-
вость к инфекциям, особенно вызван-
ным кокковыми бактериями. Вместе с
тем для старческого возраста характер-
но вялое течение воспаления, лихо-
радки, процессов регенерации.
Причины старения организма. Под
старением понимают постоянно разви-
вающиеся и в основном необратимые
морфологические, биохимические и
функциональные изменения, возника-
ющие на протяжении жизни индивида.
Признаки старения обнаруживаются на
всех уровнях организации живого орга-
низма: молекулярном, клеточном и
тканевом, органном, системном и на
уровне целого организма.
Старческий возраст характеризует-
ся уменьшением размеров, массы
тела, роста, атрофией внутренних ор-
ганов. Атрофические изменения со-
138
провождаются понижением интенсив-
ности обмена веществ. Стареющие тка-
ни теряют воду, в них увеличивается
содержание натрия, хлора и кальция,
уменьшается содержание калия, маг-
ния, фосфора. С возрастом уменьша-
ются минутный и систолический
объемы сердца (понижается его по-
лезная работа), уменьшается жизнен-
ная емкость легких. Заметно склеро-
зируются почки, в них разрастается
соединительная ткань, они выделя-
ют меньше мочи.
Атрофия слизистой оболочки же-
лудка и кишечника, угнетение функ-
ции поджелудочной железы ведут к
снижению выделения соляной кисло-
ты, пищеварительных ферментов, что
сопровождается нарушением перева-
ривания белков и других продуктов
питания.
Для объяснения причин старения
предложено множество теорий. Груп-
па теорий объясняет процессы старе-
ния коллоидно-химическими изменени-
ями в тканях. Согласно этим теориям,
по мере старения организма клеточ-
ные коллоиды утрачивают способность
связывать воду и переходят из гидро-
фильного состояния в гидрофобное.
Эти изменения белковых веществ ве-
дут к прогрессирующему замедлению
всех биохимических реакций.
Некоторые теории ведущее место в
развитии старения приписывают раз-
личным интоксикациям. Так, И. И. Меч-
ников объяснял процессы старения
результатом хронического отравления
организма образующимися в кишеч-
нике продуктами гнилостного распа-
да в результате деятельности патоген-
ной микрофлоры кишечника. По мне;
нию А. А. Богомольца, старение на-
чинается с нарушения трофической
функции соединительной ткани в ре-
зультате необратимых изменений тка-
невых коллоидов и изменения лабиль-
ности белковых молекул.
~енсив-
_ле тка-
1 зается
_1ЬЦИЯ,
* з. маг-
»гныиа-
-еский
-~о по-
*лзнен-
-•леро-
S-лается
-- -..деля-
-л же-
ст JVHK-
клут к
' -1СЛО-
г:з. что
терева-
«д.ктов
’л гния
РУп-
ларе-
*-:-.ени-
тлям,
лгточ-
ость
лро-
► <ное.
’Чвь- ве-
Шндгнию
Шустов
эаз-
Чеч-
«вк-гния
ЧВггния
“Ж,- леч-
^®л..;па-
~гн~
;не-
•* . на-
efc. кой
ш -<а-
-ЛЬ”*
К. Броун-Секар, Э. Штейнах,
Д. Л. Воронов и другие связывали воз-
никновение старческих изменений с
эндокринной недостаточностью орга-
низма, в частности с недостаточностью
функции половых желез.
В настоящее время доказано, что
первичные механизмы старения свя-
заны с возрастными изменениями в ге-
нетическом аппарате клеток. В ядре
клетки находится сложный молеку-
лярный комплекс — хроматин, в ко-
тором заключена молекула ДНК. не-
сущая генетическую информацию.
С возрастом изменяется структура и
функция хроматина (увеличивается
доля неактивного хроматина), что за-
трудняет считывание генетической ин-
формации и способствует постоянно-
му накоплению повреждений ДНК.
При старении уменьшается коли-
чество негистоновых белков (активи-
рующих гены), что изменяет работу
регуляторных генов. Все это изменяет
соотношение синтеза как отдельных
белков, так и их блоков, кодируемых
различными генами. Возникающие в
процессе старения нарушения регули-
рования генома приводят к активации
«молчащих» генов, что ведет к появ-
лению белка, ранее не синтезировав-
шегося клеткой. В зависимости от его
типа могут возникать различные сдви-
ги в деятельности клетки, вплоть до
ее гибели.
Механизмы старения. Как было от-
мечено, в старении организма боль-
шую роль играют нарушения на уров-
не клетки, приводящие к развитию не-
обратимых изменений в синтезе белка
и активации ранее не работавших ге-
нов. Эти изменения и составляют ос-
нову нарушения жизнедеятельности
клеток, приводящего к их старению.
В процессе старения снижаются
энергетические затраты организма. Это
связано с тем, что при старении про-
исходит снижение количества мито-
хондрий в клетке, появляются разру-
шенные митохондрии, снижается ин-
тенсивность окислительного фосфо-
рилирования, меняется мембранный
потенциал митохондрий.
При старении происходит увеличе-
ние содержания соединительной тка-
ни. В мозге уменьшается число нервных
клеток и увеличивается количество
глиальных элементов. Увеличение чис-
ла соединительнотканных волокон при
старении отмечено в сердце, сосудах,
скелетных мышцах, почках и т.д. Уве-
личение числа соединительнотканных
элементов становится важной причи-
ной нарушения кровоснабжения, не-
рвной деятельности, развития гипок-
сии, нарушения иммунитета, наблю-
даемых при старении.
Ослабление функции отдельных ор-
ганов (сердце, ЦНС, эндокринных
желез) при старении организма связа-
но с непосредственным изменением
функции отдельных клеток. Важней-
ший механизм старения — ослабление
нервного контроля над деятельностью
внутренних органов. Ослабление не-
рвного контроля связано с тем, что
при старении снижается синтез медиа-
торов, гибнет часть нервных оконча-
ний. Это изменяет реакции внутрен-
них органов и вызывает нарушение в
них обменных процессов.
Большую роль в механизме старе-
ния играет угасание функции эндо-
кринных желез (половых, щитовид-
ной).
Представления о механизмах старе-
ния составляют основу целенаправлен-
ных попыток увеличения продолжитель-
ности жизни, предупреждения прежде-
временного старения.
Высокая двигательная активность
повышает устойчивость организма и
способствует увеличению продолжи-
тельности жизни, предупреждает уско-
ренное старение. Физические нагруз-
ки совершенствуют адаптационно-ре-
ih'S «ДО
139
гуляторные механизмы (улучшают
кровоснабжение тканей, активизиру-
ют синтез многих белков, уменьшают
расход кислорода и т.д.)
Широкое применение в клиниче-
ской практике нашли гериатрические
средства (геропротекторы), повыша-
ющие устойчивость организма в ста-
рости, увеличивающие продолжитель-
ность жизни (антиоксиданты, ингиби-
торы биосинтеза белка, гемосорбция,
энтеросорбция).
Калорийно-ограниченная диета яв-
ляется одним из наиболее эффектив-
ных способов влияния на темп про-
цесса старения.
В старости характерно сосущество-
вание нескольких заболеваний (мно-
жественность патологии), что требует
лечения в первую очередь основной,
обострившейся болезни.
Необходимо помнить о снижении
толерантности к лекарственным ве-
ществам в старости. Следует избегать
назначения препаратов, вызывающих
сухость слизистых оболочек, атонию
кишечника, мочевого пузыря, сфинк-
теров, нарушение координации дви-
жений (холинолитики, ганглиоблока-
торы, транквилизаторы, снотворные
и т.п.).
Контрольные вопросы
1. Какие группы наследственной пато-
логии вам известны?
2. Какие методы изучения наследствен-
ной патологии вам известны?
3. Что такое перегревание? Каковы при-
чины и механизмы компенсации перегре-
вания?
4. Что такое охлаждение? Каковы при-
чины и механизмы компенсации охлаж-
дения?
5. Какие формы острой лучевой болез-
ни в зависимости от дозы вы знаете?
6. Какие различают степени хрониче-
ской лучевой болезни? Каковы их прояв-
ления?
7. Какие осложнения могут возникнуть
при проведении лучевой терапий у боль-
ных со злокачественными новообразова-
ниями в челюстно-лицевой области?
8. Что такое наркомания?
9. Какие синдромы наркомании вам из-
вестны? Охарактеризуйте их проявления.
ТИПОВЫЕ ПАТОЛОГИЧЕСКИЕ ПРОЦЕССЫ
ГЛАВА 4
ВОСПАЛЕНИЕ
4.1. Определение
понятия. Этиология
острого воспаления
Воспаление представляет собой
наиболее частую форму типового па-
тологического процесса, который воз-
никает при воздействии на организм
болезнетворного фактора. Воспали-
тельный процесс является ведущим
патогенетическим звеном многих бо-
лезней, а его локализация в том или
ином органе нередко определяет спе-
цифику болезни и ее нозологическую
форму.
Врачу при диагностике и лечении
большинства заболеваний приходит-
ся встречаться с симптомокомплексом
явлений, обусловленных воспалитель-
ным процессом, который либо лежит
в основе данного заболевания, либо
присоединяется к нему. Противовос-
палительные мероприятия часто явля-
ются ведущим методом лечения очень
многих заболеваний. Поэтому на про-
тяжении всей истории медицины по-
нятен глубокий интерес к вопросу о
воспалительном процессе, механиз-
мам его возникновения, развития и
выздоровления.
У древних римлян 2 тыс. лет до н. э.
воспаление фигурирует под названи-
ем «inflammatio», а у греков — «рЫо-
gosis». Внешние проявления воспале-
ния на коже и слизистых оболочках у
человека были впервые описаны еще
в древности, и прежде всего — в трак-
татах Гиппократа, Цельса и Галена.
Одному из выдающихся врачей
древности Цельсу принадлежит выра-
жение, объединяющее внешние симп-
томы воспаления: «Tumor et rubor cum
calore et dolore», что в переводе с ла-
тинского означает: «Припухание и
краснота, сопровождающиеся жаром
и болью». К этим четырем ведущим
симптомам воспаления Гален присо-
единил пятый (functio laesa) — нару-
шение функции. Не все эти признаки
могут быть четко выражены, напри-
мер при воспалении печени краснота
не видна, а боль не сопровождает вос-
паление некоторых внутренних орга-
нов. Потребовались сотни лет для по-
лучения более ясного представления
о сущности воспаления и его значе-
нии в патологии, для понимания вос-
паления как диалектического един-
ства местной и общей типовой реак-
ции организма на патогенный раздра-
житель.
Описания воспаления в трудах вра-
чей древности носили умозрительный
характер, и с позиций нашего вре-
мени их следует расценивать как ге-
ниальные пророчества, основанные
на исключительной наблюдательно-
сти и философском складе ума их соз-
дателей. Начало материалистическо-
му объяснению воспаления положе-
но в трудах У. Гарвея и Хантера в
XVII—XVIII вв. Большой вклад в уче-
ние о воспалении внесли труды ос-
новоположника патологической ана-
томии Р. Вирхова, который активно
пропагандировал концепцию дистро-
фических изменений в соединитель-
ной ткани как первооснову воспале-
ния.
Воспаление — это возникший в
ходе эволюции типовой патологиче-
ский процесс, заключающийся в пре-
имущественно защитной реакции
организма на различные болезнетвор-
ные воздействия, выражением кото-
рой является повреждение тканей
(альтерация), нарушение микроцир-
куляции с повышением сосудистой
проницаемости, экссудацией и эми-
грацией лейкоцитов, а также образо-
вание новых тканевых элементов (про-
лиферация), приводящее к заживле-
нию дефекта.
Причины воспаления чрезвычай-
но многообразны. Возбудителями вос-
паления являются патогенные мик-
роорганизмы, животные-паразиты,
физические факторы (лучевая, элек-
трическая энергия, тепло, холод, ме-
ханическая травма), химические ве-
щества: кислоты, щелочи и др.
Воспаление также может быть выз-
вано эндогенными факторами. Напри-
мер, при уремии токсические веще-
ства, образующиеся в организме, вы-
деляются из крови слизистыми обо-
лочками, кожей, экзокринными же-
лезами и вызывают в этих тканях вос-
палительную реакцию. Воспаление
вызывают эндогенные вещества, об-
разующиеся при некрозе тканей,
ожогах, массивном разрушении ли-
зосом и т.д.
Указанные причины действуют в
конкретных условиях, от которых тес-
но зависят. Иными словами, условия
создают ту или иную обстановку для
действия причинного фактора, в свя-
зи с чем одна и та же причина вызы-
вает различное следствие. Условия не
вызывают патологического процесса,
а способствуют или препятствуют его
возникновению.
Условия могут быть неблагоприят-
ными или благоприятными для орга-
низма. Одни условия снижают сопро-
тивляемость (резистентность) к па-
тогенному фактору, а другие, наобо-
рот, — повышают ее. Например, на-
рушение барьерной функции слизи-
стых оболочек и кожи, иммунодефи-
цитные состояния, гиповитаминозы,
сахарный диабет и другие эндокри-
нопатии, заболевания почек, патоло-
гия сердечно-сосудистой системы яв-
ляются условиями, облегчающими
развитие воспалительного процесса в
тканях. Благоприятные условия, на-
оборот, ослабляют болезнетворное
действие причины (и) или усилива-
ют защитные силы организма. Такая
ситуация возникает при создании
п роти воинфе кцион н ого и ммун итета,
рациональном закаливании, полно-
ценном сбалансированном питании
и т.д.
Конституциональные особенности
организма на разных уровнях его ин-
теграции: от системного до субклеточ-
ного, опосредованные генетическими
факторами, также являются условия-
ми, которые повышают или снижают
устойчивость организма к патогенным
факторам. Для примера можно приве-
сти высокую устойчивость жителей
северных широт к холоду, а южных —
к теплу, что обусловлено длительной
адаптацией людей к условиям суще-
ствования.
Развитие воспалительной реакции
зависит от возраста. Во внутриутроб-
ной жизни человека все признаки вос-
паления начинают формироваться
142
- ~овия
-<• для
- s свя-
L. 2ЫЗЫ-
[я не
с- _есса,
F - i его
’ трият-
-•; эрга-
r-?про-
ь .< па-
--обо-
iна-
I -7ИЗИ-
- ;ефи-
* - -юзы,
к:кри-
--7ЭЛО-
s - ы яв-
* —ИМИ
Одессав
м. - . на-
т-: эпос
- Дива-
H. 'лкая
- 1-НИИ
и- теза,
’:лно-
~1НИИ
ЧИИг - - ЗСТИ
’ЭДИ - цц_
“04-
. ИМИ
зия-
' - ают
-ным
« ”две-
‘ злей
2 ной
це-
' ЛИ!
"* - эб-
<•-* ZOC-
" юся
только на IV—V месяце. В постнаталь-
ном периоде, особенно в первые ме-
сяцы жизни, устойчивость организма
к патогенным факторам еще снижена
и уменьшена способность к созданию
полноценных барьеров. В дальнейшем
при нормальном развитии организма
его устойчивость к неблагоприятным
воздействиям возрастает, остается на
высоком уровне в течение длительно-
го времени и только в старости вновь
уменьшается.
Следует помнить, что условия дей-
ствия патогенного фактора на челове-
ка зависят не только от его биологи-
ческой природы. Человек — это суще-
ство социальное и поэтому в отличие
от животных на него действуют соци-
альные факторы, такие, например,
как условия труда, быта, которые
опосредуют свое влияние на ткани
через нейрогуморальную систему. На-
пример, слово как возникшая в про-
цессе филогенеза новая форма сигна-
лизации, связанная с речью, может
вызвать настолько сильный эмоцио-
нальный стресс, что он сам по себе
станет не условием, а причиной воз-
никновения патологического процес-
са или болезни.
Обозначать воспаление в том или
другом органе или ткани принято пу-
тем добавления окончания «itis» к ла-
тинскому названию этих структур. На-
пример, воспаление нерва называют
nevritis (неврит), воспаление мышцы —
myositis (миозит), воспаление почки —
nephritis (нефрит), воспаление пече-
ни — hepatitis (гепатит), воспаление
пульпы зуба — пульпитом, пародон-
та — пародонтитом и т.д.
Воспаления некоторых органов
имеют специальные названия: напри-
мер. воспаление легких называют
пневмонией (от греч. рпеитоп — лег-
кое), воспаление подкожной клетчат-
ки — флегмоной (от греч. phlegma —
жар, воспаление).
4.2. Патогенез острого
воспаления
Компоненты воспаления, механизмы
альтерации тканей. Единый комплекс
трех компонентов: альтерация, сосу-
дистая реакция с экссудацией и эмиг-
рацией лейкоцитов, а также пролифе-
рация составляют сущность воспале-
ния, как качественно своеобразный
процесс. Без любого из этих компонен-
тов нет воспаления, но каждый из них
может существовать самостоятельно
вне воспалительной реакции. Рассмот-
рим отдельно каждый из этих трех ком-
понентов воспаления.
В качестве пускового механизма
острого воспаления выступает повреж-
дение тканей — альтерация.
Альтерация (от лат. alters — изме-
нение) подразделяется на первичную
и вторичную.
Под первичной альтерацией пони-
мают изменения в ткани под влияни-
ем самого патогенного фактора. Они
зависят от силы, длительности и объе-
ма повреждения тканей болезнетвор-
ным агентом, иннервации, сосудистой
системы, а также от устойчивости тка-
ни к воздействию и состоянию всего
организма.
Вторичная альтерация — это струк-
турные и функциональные изменения
в тканях, являющиеся выражением
сдвигов тканевого обмена в процессе
развития воспаления. Вторичная аль-
терация охватывает клетки, межкле-
точное вещество и морфологически
проявляется в форме различных дист-
рофий.
Ткани могут повреждаться разны-
ми способами: механическим путем
при разрезах, разрывах, переломах,
внедрении инородного тела; химиче-
скими веществами — сильными кис-
лотами и щелочами, скипидаром,
кротоновым маслом, нитратом сереб-
ра; при ожогах и обморожениях, раз-
143
личными видами облучения; при по-
вреждении клеток химическими или
микробными ядами (токсинами воз-
будителей, например, дифтерии, хо-
леры).
Первичное повреждение ведет к
освобождению из гибнущих клеток
лизосомальных протео-, глико- и ли-
политических ферментов, которые
инициируют каскад реакций. Фермен-
ты разрушают мембраны других кле-
ток в зоне повреждения, а также мат-
рикс соединительной ткани (колла-
ген, протеогликаны, гликозамино-
гликаны), способствуют инициации
образования и освобождения медиа-
торов.
Наиболее чувствительны к лизосо-
мальным ферментам тучные клетки,
дегрануляция которых приводит к
быстрому освобождению в ткани ги-
стамина и других биологически актив-
ных веществ, играющих важнейшую
роль в патогенезе воспалительной ре-
акции. Гибель клеток сопровождается
нарушением окислительно-восстано-
вительных процессов. Вследствие это-
го в участке повреждения накаплива-
ются продукты окисления, которые в
норме полностью окисляются в ходе
реакций цикла Кребса: пировиноград-
ная. о:-кетоглютаровая, янтарная и
другие органические кислоты. При ли-
полизе также образуется много жир-
ных кислот. Развивающийся тканевый
ацидоз частично компенсируется ка-
тионами Na+. К+ и др. Это в свою оче-
редь ведет к гиперосмии — росту ос-
мотического давления в поврежденном
участке.
Повреждение тканей при воспале-
нии, или альтерация, приводит к боль-
шему или меньшему нарушению функ-
ций воспаленного органа. Например,
при воспалении суставов и мышц дви-
жения ограничиваются по амплитуде
и становятся болезненными, а потом
могут быть выключены. Степень по-
вреждения собственных тканей при
воспалении зависит от реактивности
организма. В качестве примера можно
привести феномен Артюса и другие
воспалительные реакции, развива-
ющиеся в сенсибилизированном орга-
низме. Они протекают с обширными
некрозами тканей.
Характер течения воспаления во
многом зависит от возраста: у детей
такие процессы в очаге воспаления,
как альтерация, экссудация и эмигра-
ция, а также пролиферация клеток,
протекают намного активнее, чем у
стариков. Ход воспаления резко моди-
фицируется при авитаминозах, облу-
чении, физических перегрузках и пси-
хоэмоциональном напряжении, при
гипотермии и в состоянии анабиоза у
животных (зимней спячки).
Сосудистая реакция при воспалении.
Главные события в периоде подготов-
ки к острому воспалению происходят
в области так называемой микроцир-
куляторной единицы (А. М. Чернух).
Она включает в себя конечные отде-
лы артерий — терминальные артерио-
лы диаметром 20 — 30 мкм, прекапил-
лярные сфинктеры, обменные микро-
сосуды — истинные капилляры и си-
нусоиды, и, наконец, посткапилляр-
ные собирательные венулы.
В развитии воспаления можно вы-
делить четыре стадии изменений кро-
вотока в микроциркуляторных сосудах:
кратковременный спазм принося-
щих артериол;
расширение микроциркуляторных
сосудов и ускорение кровотока (арте-
риальная гиперемия);
дальнейшее расширение сосудов и
замедление кровотока (венозная гипе-
ремия);
остановка кровотока (стаз).
Сразу же в ответ на повреждение
возникает кратковременное сужение
(спазм) приносящих артериол (пер-
вая фаза), которое продолжается от
144
: При
г ЭСТИ
•:жно
д угие
глва-
.эга-
г-ыми
.1 .’ во
детей
гения,
»: т-ра-
ееток,
-м у
- ди-
блу-
( тси-
при
•*; за у
4Шьеяии.
70В-
’•*- :дят
*ЯВЕ 7Ир-
Wi тде-
!ЖГ7 7И0-
шксил-
ЭО-
Ш СИ-
•ро-
зах:
:я-
-ых
7?е-
S И
-• - ;ie
-не
ОТ
10—20 с до нескольких минут. В меха-
низме спазма, или вазоконстрикции,
главную роль играют местно освобож-
дающиеся катехоламины. Спазму спо-
собствует также болевая реакция. По-
скольку катехоламины быстро разру-
шаются ферментом моноаминоксида-
зой, спазм длится недолго. Спазм не
является обязательной фазой сосуди-
стой реакции при повреждении тка-
ни, особенно если оно не сопровож-
дается болевой реакцией и быстрым
освобождением катехоламинов из
окончаний симпатических нервов.
Вслед за сокращением происходит
расширение артериол, развивается
покраснение ткани, или артериальная
гиперемия (вторая фаза). Ранним про-
явлением этой фазы сосудистой реак-
ции при повреждении ткани является
усиление кровотока вследствие расши-
рения артериол, причем вначале кровь
проходит быстрее по артериовеноз-
ным анастомозам. В механизме расши-
рения артериол основная роль при-
надлежит аксон-рефлексу. В результа-
те повреждения ткани происходит
раздражение окончаний чувствитель-
ных нервов. Возбуждение распростра-
няется по афферентному аксону до
тела нервной клетки, а затем анти-
дромным путем по эфферентному ак-
сону той же клетки достигает артери-
ол. В окончании эфферентного аксона
выделяется ацетилхолин.
Следовательно, артериальная гипе-
ремия в этой фазе сосудистой реакции
имеет нейрогенный механизм, в ре-
зультате которого сосуды расширяют-
ся не только в зоне повреждения, но и
в окружающих тканях. Благодаря рас-
ширению артериол развивается стой-
кое покраснение тканей — коллате-
ральная гиперемия по периферии оча-
га воспаления, которая сохраняется и
после того, как в самой зоне повреж-
дения артериальная гиперемия сменя-
ется венозной гиперемией и стазом.
Гиперемированная наружная зона,
окружающая патологический очаг,
имеет защитную функцию, так как
повышает устойчивость неповрежден-
ных тканей к действию болезнетвор-
ного агента. Сосуды этой зоны имеют
нормальную ультраструктуру и не спо-
собствуют явлениям экссудации и
эмиграции лейкоцитов. В возникнове-
нии гиперемированной зоны, поми-
мо нейрогенного механизма, также
играют роль биологически активные
вещества, которые проникают по меж-
клеточным пространствам за пределы
непосредственного действия патоген-
ного фактора.
Таким образом, первая фаза арте-
риальной гиперемии имеет нейроген-
ный механизм. Вторая фаза носит на-
звание «артериальная воспалительная
гиперемия», которая имеет миопара-
литическую природу и сопровожда-
ется расширением сосудов сопротив-
ления и капилляров. Сущность мио-
паралитической воспалительной ар-
териальной гиперемии заключается в
том, что сосуды микроциркуляторно-
го русла, прежде всего прекапилля-
ры, достигнув максимального расши-
рения. перестают реагировать на со-
судосуживающие раздражения. Эта
фаза продолжается от 30 мин до од-
них суток, в течение которых наблю-
дается дальнейшее покраснение и по-
тепление тканей, ускорение кровото-
ка, увеличение артериального давле-
ния в этих сосудах.
В этот период происходит значи-
тельное увеличение объема и протя-
женности кровотока по сети капилляр-
ных сосудов вследствие расширения
артериол. При этом изменения в са-
мой капиллярной стенке еще незна-
чительны и поэтому экстраваскуляр-
ная потеря плазмы здесь небольшая.
Постепенное повреждение сосудистой
стенки, как правило, идет параллель-
но со снижением тонуса и исчезнове-
145
нием спонтанной многенной активно-
сти, что говорит об обшем механизме
этих явлений. В тот же период сосуды
и в первую очередь прекапиллярный
сфинктер становятся менее чувстви-
тельными к сосуд©суживающим меди-
аторам (в норме пороговая концент-
рация адреналина, вызывающего со-
кращение прекапилляра, составляет
1:250000), а затем вовсе перестает на
них реагировать.
. Таким образом, повреждение тка-
ни сопровождается расширением ар-
териальной части терминального со-
судистого русла. Лишь после тяжелого
повреждения или введения болезне-
творного агента вблизи расположения
артерий и артериол они вначале су-
жаются, а затем вскоре наступает ги-
перемия.
При артериальной гиперемии воз-
растает объемная скорость тока кро-
ви (0, т.е. увеличивается ее количе-
ство, протекающее через участок
кровоснабжения по капиллярам в
единицу времени. При этом линейная
скорость кровотока, которая опреде-
ляется по формуле V = Q/S, может
оставаться прежней или даже сни-
жаться за счет увеличения суммарно-
го поперечного сечения (5) раскры-
тых и расширенных капилляров. В этой
фазе приток крови в капилляры и
венулы увеличивается и давление в
них возрастает.
Расчеты показывают, что при ар-
териальной гиперемии в артериолах
давление увеличивается в среднем на
25 см вод. ст., в капиллярах — на 7 см,
а в венулах — на 9 см вод. ст. Текучесть
крови в эту фазу тоже возрастает.
Вслед за артериальной воспалитель-
ной гиперемией развивается третья
фаза сосудистой реакции — венозная
гиперемия, которая сопровождается
замедлением тока крови, расширени-
ем сосудов, что внешне проявляется
в виде синюшности, отека, снижения
температуры. Венозная гиперемия за-
вершается престазом и стазом. В эту
фазу в артериальной части микроцир-
куляторного русла преобладают вазо-
дилятаторные реакции и отсутствуют
или резко снижаются вазоконстриктор-
ные, что доказывается резким угнете-
нием реакции сосудов на катехолами-
ны или на раздражение сосудосужи-
вающих нервов. Существует несколько
внутри- и внесосудистых причин пе-
рехода артериальной гиперемии в ве-
нозную.
1. Уже в период артериальной вос-
палительной гиперемии проявляются
признаки замедления оттока крови по
венулам вследствие увеличения их чув-
ствительности к катехоламинам, а так-
же местного увеличения концентрации
серотонина.
2. Паралич вазоконстрикторов,
обусловленный гистамином, брадики-
нином и другими биологически актив-
ными веществами, приводит к тому,
что стенки резистивных сосудов пере-
стают сокращаться в ответ на их на-
полнение в такт деятельности сердца,
т.е. исчезает миогенный сосудистый
тонус.
3. Экссудат увеличивает внутритка-
невое давление, что вызывает сдавли-
вание вен и лимфатических сосудов,
в связи с чем нарушается отток крови
и лимфы.
4. При венозном застое в результа-
те резкого замедления кровотока в
сосудах скапливаются агрегаты эри-
троцитов в виде монетных столбиков.
Это сменяется развитием «сладжа»,
когда полностью стираются границы
между отдельными эритроцитами и в
просвете микрососудов собирается
однородная красная масса. Замедление
кровотока ведет к перераспределению
тромбоцитов и лейкоцитов в присте-
ночный слой. Это создает дополнитель-
ное препятствие для кровотока и еще
больше его замедляет.
146
"_л за-
3 эту
С'. дир-
зазо-
-"зуют
г-ктор-
- хчете-
С МП
•-?ЖИ-
:лько
f • пе-
s з ве-
I зос-
-.-:?этся
». ей по
*.чув-
- -так-
"Т-ЦИИ
:ров,
сдики-
• .ив-
- эму,
*-ере-
на-
-•--Дца,
а .тый
т ска-
-ЛЗ.ТИ-
зов,
зови
>;а
т <а в
Д -ри-
* :<ов.
:-2.ка»,
к-лцы
- и в
:-зтся
_ к-ше
: ЧИЮ
~ .те-
.. ;Ь-
. ле
5. Сгущение крови и тромбоз в мел-
ких сосудах при воспалении возника-
ет в результате действия нескольких
факторов: уменьшения выделения
стенкой сосуда ингибиторов агрегации
тромбоцитов и антикоагулянтов, сни-
жения заряда клеток эндотелия, уве-
личения концентрации тканевых фак-
торов свертывания. В целом начинают
преобладать прокоагулянты, возникает
тромбообразование.
6. Эндотелиальные клетки набуха-
ют в результате ацидоза и действия
биологически активных веществ, об-
разующихся при воспалении, что вы-
зывает активацию сократительного
аппарата клетки, вследствие чего она
из веретенообразной становится окру-
глой.
7. Ацидоз и гиперосмия ткани при-
водят к увеличению гидрофильности
тканевых коллоидов, в том числе кол-
лагеновых и эластиновых волокон,
вплетающихся в стенки мелких вен,
удерживающих их в здоровой ткани в
постоянном положении (В. В. Воро-
нин). В результате ослабления этого
«сосудистого каркаса» происходит
уменьшение просвета мелких сосудов,
что нарушает их проходимость и спо-
собствуют развитию венозной гипе-
ремии.
8. Замедление кровотока обусловле-
но также значительным возрастанием
площади поперечного сечения крове-
носного русла по сравнению с нара-
станием объема протекающей крови
вследствие увеличения числа функ-
ционирующих микрососудистых еди-
ниц, ранее находившихся в недеятель-
ном состоянии.
Процесс замедления движения кро-
ви со временем прогрессирует, и в
некоторых разветвлениях сосудов вна-
чале возникает престаз, а затем пол-
ная остановка кровотока — стаз. Та-
кие нарушения кровотока еше боль-
ше увеличивают проницаемость стенки
сосудов, что способствует тромбозам,
распаду тканей, образованию и скоп-
лению токсических продуктов. Таким
образом, венозный застой и связан-
ные с ним тканевые нарушения уси-
ливают воспалительные явления.
Постепенно замедление кровотока
при венозном застое сменяется нару-
шением поступательного движения
крови, а затем и полной остановкой
кровотока, или стазом. Перед стазом
обычно возникают синхронные с рит-
мом сердечных сокращений маятни-
кообразные движения крови. При этом
в момент систолы кровь движется в
капиллярах в обычном направлении —
от артериолы к венуле, успевает про-
скочить через капилляр и создает вол-
ну, известную под названием «капил-
лярный пульс». В момент диастолы
кровь встречает препятствие к оттоку
по венулам и оттекает обратно из-за
падения кровяного давления в арте-
риолах и капиллярах.
Стаз возникает в результате закры-
тия просвета посткапиллярной вену-
лы агрегатами клеток или тромбами
изнутри, либо из-за пережатия сосуда
снаружи экссудатом. При повреждени-
ях эндотелия микрососудов нарушения
микроциркуляции могут сразу сво-
диться к стазу, минуя все предшеству-
ющие фазы расстройств кровотока. Это
можно наблюдать, например, при тя-
желых ожогах, термических или хими-
ческих, механических разрывах сосу-
дов, при повреждении эндотелия им-
мунными комплексами.
Возникая в результате закупорки
сосудов, стаз в то же время создает
условия для локального повышения
активности факторов свертывания
крови. Стаз дает возможность сконцен-
трироваться плазменным и клеточным
медиаторам воспаления в одном мес-
те, на коротком отрезке сосудистого
русла, препятствуя их распространению
по кровотоку'. Наконец, благодаря ста-
147
зу лейкоциты получают возможность
окончательно расположиться в присте-
ночном слое и вступить в тесный кон-
такт с эндотелием микрососудов.
Плазменные медиаторы воспаления.
Замедление кровотока, а затем и его
полная остановка готовят почву для
следующих этапов воспалёния. Про-
исходят изменения свойств поверхно-
сти клеток эндотелия, что служит сиг-
налом к активации фактора контакта
(син.: фактор Хагемана, фактор XII
свертывания крови) и включению
механизма внутрисосудистого сверты-
вания крови. Помимо свертывания
крови фактор Хагемана активирует
фермент калликреин. Под действием
калликреина от (/.-глобулинов плазмы
отщепляется полипептид, состоящий
из 10 аминокислот, — брадикинин. На-
ряду с ним образуются и другие бра-
дикинины, состоящие из 11 и 13 ами-
нокислот. Они также активны, но в
меньшей степени, чем лизил-бради-
кинин. В норме брадикинины быстро
инактивируются специфическими пеп-
тидазами-кининазами (их особенно
много в легочной ткани). Однако при
стазе создаются условия для накоп-
ления брадикининов, а их инактива-
ция тормозится. Затормозить образо-
вание брадикининов можно искусст-
венным путем — ингибиторами кал-
ликреина — тразилолом. диизопро-
пилфторфосфатом, антагонистом
трипсина из соевых бобов. Своевремен-
ное введение этих и других препара-
тов тормозит развитие воспаления.
Брадикинин расширяет капилляры
и посткапиллярные венулы, повыша-
ет проницаемость эндотелия, что свя-
зано с сокращением эндотелиоцитов,
расхождением их отростков и откры-
тием межэндотелиальных щелей.
Наряду со свертыванием крови под
действием фактора Хагемана запуска-
ется фибринолиз, т. е. процесс раство-
рения фибриновых сгустков.
Под действием фактора Хагемана
в ходе свертывания крови активиру-
ется также система комплемента, фрак-
ции которого являются источниками
для образования медиаторов воспале-
ния. Происходит это следующим об-
разом. Фактор Хагемана прямо пере-
водит фермент СЗ-конвертазу в ак-
тивную форму. Под влиянием актив-
ной СЗ-конвертазы из СЗ-компонен-
та комплемента образуются две актив-
ные фракции — СЗа и СЗв. Молекула
СЗа имеет меньшие размеры и поэто-
му переходит в жидкую фазу (в плаз-
му крови), а более крупный СЗв-фраг-
мент сохраняет связь с клеточными
мембранами (эритроцитами, тромбо-
цитами, лейкоцитами крови). К СЗв-
фрагменту на клеточной мембране
присоединяется другой компонент —
С5. Он в свою очередь расщепляется
на две молекулы: С5а и С5в. С5а пере-
ходит в жидкую фазу, а С5в остается
на мембранах клеток. Если к молекуле
С5в на мембране присоединяются
компоненты С6, С7, С8 и С9, то в
конце концов клетка может подверг-
нуться лизису. Перешедшие в плазму
или другую биологическую жидкость
фракции СЗа и С5а начинают высту-
пать в качестве молекулярных медиа-
торов воспаления. Под их влиянием по-
вышается проницаемость эндотелия.
Это связано с тем, что С5а-фракция
взаимодействует с тучными клетками,
из которых выделяется гистамин и дру-
гие факторы — медиаторы воспале-
ния, расширяющие микрососуды и
повышающие их проницаемость.
В крови имеются не только актива-
торы, но и ингибиторы системы ком-
племента. В противном случае любая,
даже ничтожная по величине, травма
сосуда и окружающих тканей может
привести к бесконтрольному распро-
странению воспалительного процесса,
который потерял бы свои защитные
свойства. Наибольшее значение име-
148
- л.гана
"•5ИРУ-
с ррак-
- ками
к .тале-
Ь-Ч об-
» -.ере-
s’ -- ак-
' -<ТИВ-
гг.нен-
: счтив-
Ь’^кула
I ~.ээто-
s -таз-
58-эраг-
-:ыми
ТСМбо-
1. *. СЗв-
»<ране
C-tzHT —
р-тчется
лере-
'х~лется
«-‘екуле
«’ЮТСЯ
• * то в
* тзерг-
тлазму
пл.-: ость
г зысту-
-едиа-
se'-i по-
14~елия.
йт-кпия
е—ками,
» дру-
r< тале-
<1 ты и
^тива-
ь :<ом-
’юбая,
—авма
t чожет
ТЛ'-ЛрО-
> леса.
L. оные
»- дме-
ют ингибиторы первого и третьего
компонентов комплемента — С1 и СЗ,
действие которых через систему ком
племента тормозит распространение
патологического процесса на окружа-
ющие ткани.
Клеточные медиаторы воспаления.
В результате резкого замедления, а за-
тем и полной остановки кровотока в
тканях концентрируются не только
плазменные, но и клеточные медиа-
торы воспаления. Так, лейкоциты кро-
ви содержат вещества, которые повы-
шают проницаемость капилляров и
даже могут повреждать эндотелий.
Прежде всего следует остановиться на
функциях нейтрофилов крови, кото-
рые относятся к полиморфно-ядерным
лейкоцитам. В них имеются особые гра-
нулы, насыщенные биологически ак-
тивными веществами. У человека, кро-
лика, крысы и других видов эти гра-
нулы неоднородны. Различают азуро-
фильные и специфические гранулы.
Под электронным микроскопом азу-
рофильные гранулы выглядят как
плотные округлые тельца диаметром
0,3 —0,5 мкм. Специфические гранулы
меньше по размерам и больше варьи-
руют по форме. В зрелом нейтрофиле
!/з гранул относится к азурофил ьным
(они избирательно прокрашиваются
азуром), а 2/з — к специфическим гра-
нулам. Однако главное заключается не
в окраске и структуре гранул, а в их
содержимом (табл. 4.1). Основная часть
факторов, повышающих проницае-
мость микрососудов («факторов про-
ницаемости») сосредоточена в азуро-
фильных гранулах. В частности, в них
имеется особый протеолитический
фермент, активный в кислой среде.
Под его действием от (/.-глобулинов
крови отщепляется полипептид, со-
стоящий из 25 аминокислот. Так же как
брадикинины, он резко повышает
проницаемость сосудов. Наряду с ним
нейтрофилы выделяют калликреин,
обладающий ферментативной активно-
стью и запускающий образование бра-
дикинина. Ферменты нейтрофилов —
коллагеназа и эластаза — расщепляют
базальные мембраны, что также ведет
к росту проницаемости микрососудов.
Выделение медиаторов воспаления
резко усиливается после стимуляции
нейтрофилов эндотоксином, иммун-
ными комплексами, СЗа- и С5а-фрак-
циями комплемента, калликреином.
В этих случаях клетки начинают выде-
лять большое количество перекиси
водорода, активных форм восстанов-
Таблица 4.1
Содержимое азурофильных и специфических полиморфно-ядерных лейкоцитов гранул
человека
Класс веществ Гранулы
Азурофильные Специфические
Кислые гидролазы Р-глицерофосфатаза, N-ацетил-а-глюкозаминидаза, Р-глюкуронидаза, с/.-маннозидаза, катепсин D —
Нейтральные протеазы Эластаза, катепсин G, прочие сериновые протеиназы Коллагеназа
Бактерицидные ферменты Миелопероксидаза, лизоцим Лизоцим, лактоферрин
149
ленного кислорода — супероксидани-
онрадикал О2 и синглетный кислород
О). Эти факторы могут «обстреливать»
разные клеточные мишени, в том чис-
ле эндотелий капилляров. В результате
такого воздействия в мембранах кле-
ток запускается перекисное окисление
липидов.
Стимулированные полиморфно-
ядерные лейкоциты выделяют продук-
ты перекисного окисления арахидоно-
вой кислоты, которая входит в состав
фосфолипидов их мембран. При окис-
лении арахидоновой кислоты с помо-
щью фермента циклооксигеназы об-
разуются простагландины и тромбо-
ксаны. Под влиянием простагландинов
группы Е проницаемость эндотелия
резко возрастает, а микрососуды рас-
ширяются. Напротив, простагландины
группы F вызывают не расширение,
а спазм микрососудов и уменьшение
их проницаемости. Тромбоксан А2 вы-
зывает агрегацию тромбоцитов и со-
кращение кровеносных сосудов.
При другом пути окисления ара-
хидоновой кислоты под действием
фермента липоксигеназы образуются
полициклические продукты, полу-
чившие название лейкотриены. Из со-
единений этого класса наиболее ста-
бильной биологической активностью
обладают лейкотриены В4, С4, D4 и
Е4. Цифра «4» обозначает число двой-
ных связей в молекуле. Лейкотриен
В4 — мощный хемоаттрактант для лей-
коцитов. Комбинация из трех лейко-
триенов (С4, D4 и Е4) — так называе-
мая медленно реагирующая субстан-
ция анафилаксии (МРС-А) — явля-
ется сильным спазмогеном, вызывает
сокращение гладкой мускулатуры со-
судов и бронхов. Лейкотриены повы-
шают проницаемость капилляров и
усиливают агрегацию тромбоцитов.
Окисление арахидоновой кислоты
под влиянием фермента липоксигена-
зы наряду с лейкотриенами приводит
к образованию 15-гидроксиэйкозан-
тетраеновой кислоты (15-НЕТЕ), ко-
торая может превращаться в липокси-
ны (LX), обладающие сильным про-
тивовоспалительным эффектом. Ли-
поксины снижают увеличенную со-
судистую проницаемость, вызванную
лейкотриенами, тормозят хемотаксис
нейтрофилов, уменьшают цитоток-
сичность натуральных киллеров.
Фосфолипиды клеточных мембран
служат источником еще одного важ-
ного медиатора воспаления — факто-
ра активации тромбоцитов (ФАТ). Он
увеличивает проницаемость микроцир-
куляторных сосудов, сокращает глад-
кую мускулатуру бронхов, является
сильным хемоаттрактантом для нейт-
рофилов, эозинофилов, макрофагов,
вызывает дегрануляцию полиморфно-
ядерных лейкоцитов, способствует
развитию воспалительного отека.
В свою очередь в агрегатах тромбо-
цитов освобождаются собственные
медиаторы воспаления — серотонин,
тромбоксан А2, АДФ, простагланди-
ны Е.
Клеточные и плазменные медиа-
торы в кровотоке действуют сообща.
Например, СЗа- и С5а-фракнии ком-
племента стимулируют нейтрофилы,
которые секретируют протеазы, а они
в свою очередь активируют компле-
мент. Образующиеся в результате ак-
тивации комплемента СЗа и С5а,
а также ряд других фракций вновь сти-
мулируют полиморфно-ядерные лей-
коциты.
Аналогичный механизм формиру-
ется и при другом пути активации ком-
племента — через иммунные комплек-
сы. Образующиеся в этом случае СЗа-
и С5а-фракции комплемента, так же
как и сами иммунные комплексы, че-
рез соответствующие рецепторы сти-
мулируют нейтрофилы в зоне контак-
та с эндотелием. Полиморфно-ядерные
лейкоциты выделяют медиаторы, на-
150
- -эзан-
Е1. ко-
7 >кси-
про-
Ли-
- :-э со-
З-Нную
' ‘1КСИС
; JTOK-
-- -'.бран
: - важ-
:акто-
I-ы. Он
&-'?цир-
*- глад-
f 'ется
л- ейт-
? с агов,
з'Агвует
мбо-
аечные
’?нин,
7’ :: uii
елиа-
• ''бща.
ком-
сллы,
- 7 ОНИ
щле-
ак-
С5а,
: - СТИ-
лей-
: шру-
?’ <ом-
хлек-
~t СЗа-
к же
к^,. че-
Га сти-
-так-
кххные
г-i. на-
рушающие проницаемость эндотелия
в месте контакта, и открывают доро-
гу воспалению. Становится понятно,
почему при резком дефиците поли-
морфно-ядерных лейкоцитов(напри-
мер, после введения горчичного яда
или облучения) удается затормозить
даже такие остротекущие формы им-
мунокомплексного воспаления, как
феномен Артюса, острый гломеруло-
нефрит и другие формы воспаления,
вызванные органоспецифическими
антителами.
В повышении проницаемости мик-
рососудов принимают деятельное уча-
стие не только клетки крови, но и
клетки тканей, окружающих сосуды.
Из них очень важную роль играют туч-
ные клетки. В их характерных метахро-
матически окрашенных гранулах со-
держится гистамин, серотонин, гепа-
рин и другие медиаторы воспаления.
Тучные клетки начинают «разгружать-
ся» от медиаторов под действием С5а-
фракции комплемента, протеолити-
ческих ферментов, освобождающихся
из гибнущих клеток или при воздей-
ствии специфического аллергена. В па-
тогенезе острого воспаления наиболь-
шую роль играет гистамин — первый
медиатор, который был обнаружен в
очаге воспаления еше в 1910 г. Дейлом.
Особенно много гистамина выделяет-
ся тучными клетками в очаге аллер-
гического воспаления, протекающего
с явлениями повышенной чувстви-
тельности немедленного типа. Гиста-
мин вызывает быстрое и резкое сокра-
щение эндотелиоцитов. В связи с этим
обнажаются межэндотелиальные щели
и усиливается выход жидкой части
крови и ее форменных элементов в
ткань.
Активация клеток, находящихся в
зоне воспаления, приводит к синтезу
и секреции большого числа белков —
цитокинов, воздействующих на клет-
ки ближайшего окружения и отдален-
но расположенных органов. Среди ци-
токинов есть такие, которые способ-
ствуют или, напротив, препятствуют
развитию воспаления — провоспали-
тельные и противовоспалительные.
К числу провоспалительных цитоки-
нов относятся интерлейкин-1 (ИЛ-1)
и фактор некроза опухолей ос (ФНО-сс),
главными продуцентами которых яв-
ляются активированные моноциты и
макрофаги.
Механизмы развития воспалитель-
ного отека (экссудация). В результате
усиленного выхода жидкой части кро-
ви из сосуда в ткань, т. е. экссудации,
развивается воспалительный отек. Его
развитие зависит от ряда причин:
от повышения проницаемости мик-
рососудов;
увеличения кровяного (фильтраци-
онного) давления в посткапиллярных
венулах;
повышения коллоидоосмотическо-
го давления в околососулистых тканях.
Главной причиной воспалительного
отека является повышение проницаемо-
сти стенки микрососудов для белка.
В связи с этим в отечной жидкости при
воспалении скапливается намного
больше белка и других макромолекул.
Проницаемость сосудов для жидкой
части крови и ее клеточных элемен-
тов прежде всего зависит от свойств
эндотелия капилляров. Большинство
капилляров имеет непрерывный тип
строения. Такой тип характерен для
капилляров скелетных мышц, сердца,
легких. Эндотелий капилляров других
органов имеет фенестры (оконца), за-
тянутые тонкой диафрагмой. Фенест-
ры обнаружены в микрососудах эндо-
кринных желез, ворсинок тонкого ки-
шечника, языка и т.п. Наконец, су-
ществуют капилляры в виде синусои-
дов в печени, селезенке. Они имеют
широкие межэндотелиальные щели и
множество фенестр, размеры которых
могут быстро меняться в зависимости
151
от давления в сосуде. При росте дав-
ления отверстия сливаются друг с дру-
гом и жидкость начинает быстрее
фильтроваться из сосуда в ткань.
Вещества плазмы могут проникать
через стенку микрососудов разными
путями. Вода, электролиты, глюкоза
и другие простые соединения с малой
массой проникают путем диффузии.
Белки и другие макромолекулы про-
ходят более сложным путем. Он по-
лучил название микровезикулярного
транспорта и заключается в том, что
от наружной мембраны вначале от-
почковывается пузырек диаметром
45 — 70 нм. В таких везикулах, или пу-
зырьках, или микропиноцитозных ва-
куолях содержатся плазменные белки.
Пузырек погружается в цитоплазму
эндотелиоцита и проходит от одного
полюса клетки к другому, разгружа-
ясь у базальной мембраны. Таким об-
разом, эндотелиальные клетки могут
активно захватывать в акте пиноцито-
за нужные им макромолекулы из плаз-
мы крови и переносить их в околосо-
судистые ткани. Это явление называ-
ется цитопемсисом (от греч. pemsis —
проведение).
Наконец, вещества плазмы могут
проникать в ткань через щели между
эндотелиоцитами, или фенестры. Раз-
меры щелей зависят от того, в каком
состоянии находятся клетки эндоте-
лия. Если они сокращаются, то щели
обнажаются, и наоборот, расслабле-
ние эндотелиоцитов ведет к перекры-
тию щелей. Этот процесс был четко
продемонстрирован в опытах, в кото-
рых эндотелий культивировали in vitro'.
под действием лейкотриенов С4 и D4,
О2, брадикинина, гистамина, добав-
ленных в инкубационную среду, эн-
дотелий капилляров и посткапилляр-
ных венул быстро округлялся и между
клетками открывались щели.
Фильтрация и транспорт компо-
нентов плазмы через эндотелий капил-
ляров протекает в нашем теле посто-
янно. Благодаря этим процессам обес-
печивается нормальный обмен ве-
ществ между кровью и тканями. В то
же время в ходе воспаления жидкая
часть крови начинает намного быст-
рее и в большем объеме покидать со-
суды и устремляться в зону повреж-
дения. Воспалительный отек имеет
определенное защитное значение:
белки отечной жидкости связывают
токсины, задерживают их всасывание
в кровь и распространение по всему
организму.
Рассасывание отечной жидкости
зависит от дренирующей функции
лимфатической системы. При воспа-
лении она, как правило, страдает в
большей или меньшей степени из-за
закупорки лимфатических капилляров
фибриновыми сгустками или их сдав-
ливания снаружи отечной жидкостью
(экссудатом).
Прилипание лейкоцитов к эндоте-
лию. Для развития воспаления необ-
ходимо, чтобы лейкоциты не просто
скапливались в просвете сосуда, но и
вступали в тесный контакт с эндоте-
лием и, таким образом, были готовы
к эмиграции за пределы сосуда в ткань,
где сложилась аварийная ситуация.
В норме нейтрофилы крови сосре-
доточены в двух отсеках сосудистого
русла. Половина их свободно цирку-
лирует в осевом слое кровотока,
а половина практически не участвует
в циркуляции, образуя пристеночный
слой, т.е. примыкает к эндотелию ка-
пилляров. Для моноцитов эти показа-
тели еще больше смещены в пользу
пристеночного слоя.
При воспалении число лейкоцитов
в пристеночном слое может возрастать
в десятки раз. Это связано с резким
замедлением кровотока в расширен-
ных капиллярах и венулах и с ростом
адгезионной (прилипающей) способ-
ности лейкоцитов. Адгезивность наруж-
152
t 7ЭСТО-
c.- обес-
*»ен ве-
» В то
юпкая
< 5ыст-
Х7Ь СО-
г вреж-
лмеет
-хние:
вхзают
хзание
1 всему
гхости
-кции
:-ЭС па-
изет в
и из-за
гляров
Я сдав-
Ь стью
* "оте-
> -еоб-
т? эсто
*. но и
ыоте-
" 770 ВЫ
i лань,
ИлЯ.
-^ре-
йх ТОГО
П?Ку-
’~эка,
е~вует
-ный
о: ка-
‘Г'.иаза-
тг.дьзу
P3-T0B
сыпать
ьяг.ким
Ы рен-
кигом
кхоб-
ккгуж-
ной мембраны нейтрофила находится
в прямой зависимости от его актив-
ности.
После стимуляции нейтрофилы
начинают прочно фиксироваться на
эндотелии. Только после этого они
получают возможность двигаться даль-
ше, в ткань, откуда поступает сигнал.
Повышение адгезионной способно-
сти мембран нейтрофилов после их
стимуляции происходит в связи с уси-
лением синтеза гликопротеинов на
наружной мембране клетки, а также
с образованием в мембране продук-
тов окисления арахидоновой кислоты
типа тромбоксана А2.
Адгезивность мембраны эндотелио-
питов в зоне повреждения возраста-
ет, что делает контакт эндотелия с лей-
коцитами особенно прочным. Установ-
лено, что адгезивность эндотелия
сильно меняется под влиянием про-
дуктов, выделяемых нейтрофилом,
который готовится вступить с ним в
контакт. Среди продуктов — катион-
ные белки, лейкотриены, простаглан-
дин Е, биоокислители (Н2О2, О2 и др.).
Факторы, освобождающиеся в агрега-
тах тромбоцитов (тромбоксан А2,
АДФ, серотонин), также придают эн-
дотелию повышенные адгезионные
свойства. Адгезивность эндотелия за-
висит и от его свойств: при раздраже-
нии эндотелиоциты начинают синте-
зировать гликопротеин — фибронек-
тин. За счет него сцепление между
лейкоцитами и эндотелием становит-
ся особенно прочным.
В месте тесного контакта лейкоци-
тов (фагоцитов) с эндотелием возни-
кают благоприятные условия для ло-
кального повышения концентрации
медиаторов воспаления. В связи с этим
проницаемость микрососудов возрас-
тает именно в тех местах, где нахо-
дятся клетки — эффекторы воспале-
ния, готовые покинуть сосуд и перей-
ти в ткань.
Миграция лейкоцитов в очаг повреж-
дения. После прилипания лейкоцитов
к эндотелию капилляров вскоре начи-
нается их миграция за пределы сосуда.
Этап прохождения лейкоцита через
эндотелий и базальную мембрану мик-
рососуда называют диапедезом (от
греч. diapedesis— проскакивание). Ми-
грация зависит от вида лейкоцитов.
Полиморфноядерные лейкоциты про-
ходят через межэндотелиальные щели.
Вначале лейкоцит пропускает к месту
соединения узкий отросток-псевдопо-
дию, при этом смежные клетки — эн-
дотелиоциты — раздвигаются. Затем
содержимое клетки переливается в
псевдоподию, внедрившуюся в щель
между эндотелиоцитами. Гистамин и
другие факторы проницаемости со-
кращают эндотелиоциты и тем самым
облегчают выход полиморфно-ядер-
ного лейкоцита из сосуда в ткань. Этот
«традиционный» способ эмиграции не
является единственным: полиморф-
но-ядерные лейкоциты могут прони-
кать за пределы сосуда непосредствен-
но через тело эндотелиальной клетки.
В месте контакта эндотелиоцита с
нейтрофилом мембрана эндотелия
размягчается. В этом процессе прини-
мают участие биоокислители (Н2О2,
О2 и др.), фосфолипазы, выделяемые
нейтрофилом в зону тесного смыка-
ния обоих типов клеток. В итоге это
ведет к тому, что нейтрофил прони-
кает в цитоплазму эндотелиоцита,
который при этом сохраняет свою
функцию.
Через базальную мембрану микро-
сосуда лейкоцит проходит легко, бла-
годаря тому что в месте контакта с ним
мембрана переходит из состояния геля
в состояние коллоидного раствора.
После прохождения клетки через ка-
пилляр структура мембраны восста-
навливается. Моноциты крови поки-
дают сосуды тем же путем, что и ней-
трофилы, а лимфоцит проходит через
153
тело эндотелиоцита, будучи погружен
в большую вакуоль. Все эти процессы
протекают в основном в капиллярах и
посткапиллярных венулах.
В норме значительная часть нейтро-
филов и моноцитов постоянно поки-
дает кровоток и переходит в ткани.
Нейтрофилы живут в тканях 5 —7 дней,
а моноциты превращаются в .макро-
фаги и живут неделями и даже меся-
цами без замены новыми клетками.
Вместо клеток, мигрировавших из ко-
стного мозга, поступает такое же ко-
личество свежих лейкоцитов. Попав в
ткани, лейкоциты контролируют го-
меостаз. Кроме фагоцитоза и выпол-
нения бактерицидных функций, они
также переносят метаболиты из кро-
ви в ткани, активно участвуют в мно-
гочисленных цитокиновых механизмах
регуляции обмена вешеств.
Хемотаксис. При воспалительном
процессе скорость поступления лейко-
цитов в поврежденную ткань во много
раз выше, чем в нормальном состоя-
нии. Костный мозг начинает выбрасы-
вать в кровь свои резервы, резко воз-
растает созревание новых лейкоцитов,
что в итоге ведет к лейкоцитозу. При
остром гнойном воспалении общее
число лейкоцитов в крови обычно уве
личивается за счет зрелых нейтрофи-
лов и их менее зрелых форм (палочко-
ядерных, юных, миелоцитов). В самом
очаге воспаления срок жизни лейко-
цитов, пришедших из крови, тоже со-
кращается. Если в норме вышедшие в
ткань лейкоциты движутся в разных на-
правлениях, то при воспалении они ак-
тивно перемешаются в строго опреде-
ленном направлении — в сторону мак-
симальной концентрации притягива-
ющих их веществ — хемоаттрактантов
(от лат. attractio— притяжение). Направ-
ленная миграция фагоцитов получила
название «хемотаксис» (от греч. taxis —
порядок). Без хемотаксиса не было бы
воспаления, так как лейкоциты — эф-
фекторы — не собирались бы в одном
месте, а рассредоточивались по ткани.
Благодаря тому, что миграция клеток
в очаг повреждения сфокусирована в
строго определенном направлении,
возникает клеточный инфильтрат и
серия последующих событий, связан-
ных с его формированием.
Активное перемещение фагоцитов
в направлении градиента хемоаттрак-
тантов происходит с помощью особых
ультраструктур клеток — микронитей.
Они состоят из актиноподобного со-
кратительного белка, молекулы кото-
рого располагаются по периферии ци-
топлазмы фагоцита. При возбуждении
клетки они собираются в агрегаты
(пучки). В то же время другие функции
фагоцитоза после воздействия хемо-
аттрактантов (способность распозна-
вать объекты фагоцитоза и генериро-
вать бактерицидные факторы, секре-
ция) не страдают.
Для возбуждения направленной
миграции лейкоцитов достаточно,
чтобы концентрация хемоаттрактантов
у фронтального полюса клетки, обра-
щенного в сторону вектора перемеще-
ния, была хотя бы на 1 % выше, чем у
противоположного полюса.
Каким образом формируется гра-
диент хемоаттрактантов, притягива-
ющий лейкоциты и ведущий к раз-
витию воспалительного инфильтрата?
Во-первых, многие компоненты
плазмы, фильтрующиеся в ткань, об-
ладают хемотаксическими свойствами.
К ним относятся вещества, которые
образуются в процессе свертывания
крови — калликреин, активатор плаз-
миногена, фибринпептид В, СЗа- и
С5а-фракции комплемента. От имму-
ноглобулинов класса G отщепляются
пептиды-лейкоагрессины с выражен-
ными хемотактическими свойствами.
Далее приведена классификация хемо-
аттрактантов в зависимости от источ-
ника происхождения.
154
:лном
лани,
сеток
ь-яа в
-НИИ,
~ат и
зхзан-
C-ITOB
~рак-
< 7'ОЫХ
спей.
- СО-
ото-
ЦИ-
дении
'егаты
нхции
е mo-
г.: зна-
-Ро-
-екре-
: ной
-:но,
~ нтов
>5ра-
'••'3’ле-
ем у
s :ра-
' rfBcL“
-- раз-
~зта?
ТО4ТЫ
l об-
хами,
сэые
ЕД НИЯ
тлаз-
'7з- и
i MV-
ву.тся
*-• ен-
Н.2МИ.
е МО-
s. 734-
I. Эндогенные хемоаттрактанты:
плазменные факторы — калликре-
ин, активатор плазминогена, фибрин-
пептид В, фракции комплемента СЗа,
С5а, лейкоагрессины;
продукты окисления липидов кле-
точных мембран — простагландины,
лейкотриены;
продукты распада соединительной
ткани — частично денатурированный
коллаген и эластин;
продукты секреции других клеток —
нейтрофилов, моноцитов, лимфоци-
тов.
2. Экзогенные хемоаттрактанты:
микробы;
микробные продукты — N-формил-
метионил-пептиды, пептидогликаны,
эндотоксины (липополисахариды).
Во-вторых, хемоаттрактанты обра-
зуются при разрушении клеточных
мембран. При окислении арахидоно-
вой кислоты образуются лейкотриены
С4 и D4, и другие производные, резко
усиливающие хемотаксис лейкоцитов
в очаг.
В третьих, появившись в очаге по-
вреждения, сами лейкоциты выделя-
ют вещества, которые поддерживают
высокий градиент хемоаттрактантов.
Так, лизосомальные протеазы нейтро-
филов прямым путем активируют ком-
племент, и в ходе этой активации об-
разуются хемоаттрактанты — СЗа, С5а
и др. Такие нейтральные протеазы, как
коллагеназа и эластаза, разрушают
волокнистые структуры соединитель-
ной ткани — коллагеновые и эласти-
новые нити. Продукты частичной де-
струкции коллагена и эластина служат
хемоаттрактантами не только для по-
лиморфно-ядерных лейкоцитов, но и
для моноцитов.
Движение (аттракцию) нейтрофи-
лов вызывают и продукты других кле-
ток из очага воспаления. Так, моно-
циты секретируют низкомолекуляр-
ный фактор массой 400—600 Да. По
своим свойствам он отличается от С5а.
Лимфоциты после их стимуляции спе-
цифическим антигеном или неспеци-
фическими митогенами (лектинами —
фитогемагглютинином (ФГА), конка-
лавалином (Кон-А) и др.) секрети-
руют белки, также привлекающие по-
лиморфно-ядерные лейкоциты в очаг
воспаления.
Важно подчеркнуть, что хемоат-
трактанты не просто привлекают лей-
коциты в зону повреждения, но и ак-
тивируют их. так как на мембранах
нейтрофилов имеются специальные
рецепторы к хемоаттрактантам.
В очаге воспаления фагоциты в от-
вет на стимуляцию начинают секре-
тировать в окружающую среду лизо-
сомальные гранулы, из которых ос-
вобождаются преимущественно гид-
ролитические ферменты, имеющие
большое значение в очищении зоны
повреждения от разрушенных тканей
и патогенного фактора, а также в ре-
гуляции восстановления тканей по-
сле завершения воспалительного про-
цесса.
Оказавшись в патологическом оча-
ге, нейтрофилы функционируют не в
одиночку, а в тесной кооперации с
другими типами клеток. Важную роль
играет взаимодействие нейтрофилов с
лимфоцитами, макрофагами и тучны-
ми клетками. Лимфоциты в очаге вос-
паления выделяют факторы-лимфоки-
ны, которые усиливают микробицид-
ные функции нейтрофилов, повыша-
ют их боеспособность в борьбе с мик-
робами. Наряду с этим В-лимфоциты
и плазматические клетки выделяют ан-
титела. Образующиеся комплексы «ан-
тиген-антитело» усиливают эффектор-
ные функции нейтрофилов в очаге
воспаления. Это часто наблюдается при
аллергическом воспалении, когда в
патологический очаг мигрирует мно-
го эозинофилов. При контакте со спе-
цифическим аллергеном клеток-ми-
155
шеней, сенсибилизированных IgE-ан-
тителами, выделяется эозинофильно-
хемотаксический фактор. Участие
эозинофилов в патогенезе воспаления
заключается в том, что они нейтрали-
зуют гистамин и другие медиаторы
воспаления, выделяемые различными
типами клеток-эффекторов.
Фагоцитоз. Фагоцитоз включает в
себя следующие этапы:
распознавание (узнавание) фагоци-
том объекта, подлежащего поглоще-
нию;
прикрепление объекта фагоцитоза
к наружной мембране клетки и по-
гружение его в составе отпочковав-
шейся вакуоли (фагосомы) внутрь ци-
топлазмы;
умерщвление микроба в фагосоме
и его последующее переваривание;
выделение остатков от переварен-
ного микроба во внеклеточную среду.
Для связывания микробов на мемб-
ране фагоцитов имеются специальные
рецепторы к Fc-фрагменту иммуно-
глобулина и к СЗЬ-компоненту комп-
лемента. Дело в том, что в ответ на
попадание микробов в организм об-
разуются противомикробные антите-
ла IgM- и IgG-класса, которые сор-
бируются на поверхности микроба.
В случае сорбции IgM-антител к ним
дополнительно присоединяется СЗЬ-
фракция комплемента. Другими сло-
вами, фагоцит связывает не микроб в
чистом виде, а комплекс «микроб—
IgG-антитело» или «микроб—IgM-ан-
титело—СЗЬ-фракция комплемента»
через рецепторы на мембране фагоци-
та. Таким образом, антитела выступа-
ют в роли опсонинов — факторов, об-
легчающих фагоцитоз.
После того как объект зафиксиру-
ется на мембране фагоцита, начина-
ется образование фагоцитарной ваку-
оли, или фагосомы. В образовании фа-
госомы участвуют сократительные
белки фагоцита, по свойствам напо-
минающие актин и миозин мышечных
клеток.
В фагосоме, содержащей микроб,
происходит серия процессов, которые
ведут к уничтожению возбудителя и его
последующей деструкции. Бактерицид-
ные эффекты в таких случаях связаны
с деятельностью НАДФ-НАДФН-ок-
сидазы и других ферментативных си-
стем, которые участвуют в образова-
нии Н2О2, супероксиданиона О2, син-
глетного кислорода О2 и других био-
окислителей. Эти ферментативные си-
стемы включены в мембрану фагосо-
мы. При их слабом функционировании
микроб получает возможность беспре-
пятственно жить внутри фагоцита, а
острое воспаление переходит в затяж-
ную форму.
Внутри фагоцита вакуоль с убитым
микробом должна слиться (конъюги-
ровать) с лизосомой. Только в таком
случае начнется переваривание объек-
та фагоцитоза. В самой фагосоме гид-
ролитические ферменты не содержат-
ся. После соединения фагосомы с ли-
зосомой образуется сложная вакуоль —
фаголизосома, в которой убитые мик-
робы подвергаются атаке со стороны
лизосомальных гидролаз. В фаголизо-
сомах еще полнее развертывается бак-
терицидный потенциал клетки. В не-
которых случаях микробы сохраняют
способность жить в фагосомах, но бы-
стро погибают после слияния фагосо-
мы с лизосомой. Вирулентные штам-
мы микробов персистируют внутри
фагосом с лизосомами. В то же время
авирулентные штаммы такой способ-
ностью не обладают и в результате бы-
стро погибают после слияния и об-
разования фаголизосомы. Вещества,
тормозящие слияние фагосом с ли-
зосомами, одновременно способству-
ют затяжному течению воспаления.
К ним относятся так называемые ли-
зосомотропные препараты — сурамин,
поли-у-глютаминовая кислота из клас-
156
-ЧНЫХ
-.лкроб,
торые
-1? II его
е?;щид-
- = 23аны
1С Н-ок-
е_-1Х си-
«тгзова-
- > син-
ч... био-
к-_’.е си-
С270СО-
>' вании
‘еепре-
'-лта, а
: хтяж-
5 лтым
1-ЪЮГИ-
1 таком
:бъек-
1ч е гид-
□ержат-
ь с ли-
» эль —
ас ЧИК-
~ : роны
г:.:изо-
”1 бак-
L В He-
ir -.4 Я ЮТ
- э бы-
сггосо-
: _там-
i ГА ТРИ
с тремя
х эсоб-
ите бы-
? об-
щества,
* : ли-
сству-
i-ХНИЯ.
•_ае ли-
~2МИН,
• - клас-
са полианионов. Напротив, пол и катио-
ны — липофильные вторичные или
третичные амины —• хлорохин или
трибутиламин — усиливают конъюга-
цию фагосом с лизосомами и ускоря-
ют завершение острого воспаления.
Тем же свойством обладают и некото-
рые антибиотики. Например, антибио-
тик рифампицин, применяемый при
лечении туберкулеза, резко стимули-
рует конъюгацию мембран фагосом и
лизосом, создавая тем самым благо-
приятные условия для реализации ан-
тимикробного потенциала фагоцита.
Виды экссудатов. Часть полиморф-
но-ядерных лейкоцитов в очаге вос-
паления гибнет в ходе фагоцитоза.
Причиной гибели клеток служит чрез-
мерная активация лизосомальных
ферментов и нарушение проницаемо-
сти мембран лизосом. В результате
ферменты из гранул попадают в ци-
топлазму и клетка подвергается само-
перевариванию (аутолизу). Проница-
емость мембран лизосом в фагоцити-
рующих нейтрофилах возрастает под
действием биоокислителей — О2,
Н2О2, ОН; обладающих мощным бак-
терицидным эффектом. Особенно вы-
сокий процент нейтрофилов гибнет
при остром гнойном воспалении, ко-
торое вызывается гноеродными кок-
ками (стрепто-, стафило-, пневмо-
кокками, гонококками и пр.). В ре-
зультате активной гибели лейкоцитов
и других типов клеток формируется
гнойный экссудат или гной.
Воспаленная ткань становится мягкой,
колышется при нажиме (флюктуиру-
ет). Если нет дренирования, то гной-
ный экссудат может распространять-
ся на новые участки. В качестве при-
мера можно привести ситуацию, ког-
да очаги воспаления волосяного
мешочка кожи (фурункул) сливают-
ся друг с другом и дают начало бо-
лее крупному очагу гнойного воспа-
ления — карбункулу. Если его свое-
временно не дренировать, то разовь-
ется разлитое гнойное воспаление под-
кожной клетчатки — флегмона.
В отличие от гнойного экссудата
серозный экссудат содержит
значительно меньше лейкоцитов и
продуктов их распада. Примером се-
розного экссудата является содержи-
мое пузыря на коже при ожоге II сте-
пени. По составу и физико-химиче-
ским свойствам серозный экссудат
мало отличается от транссудата —
жидкости, которая скапливается в тка-
нях при застойных отеках, но содер-
жит больше белка (табл. 4.2).
Если экссудат содержит большое
количество мукополисахаридов, сек-
реторных антител (иммуноглобулинов
класса А) и лизоцима, то он называ-
ется катаральным (слизи-
стым) экссудатом. Такой экссу-
дат образуется при воспалении слизи-
стых оболочек носоглотки, воздухо-
носных путей легких, желудочно-ки-
шечного тракта.
Если к серозному' экссудату' при-
мешивается фибрин, то образуется
фиброзный экссудат. В качестве
примера можно привести фибриноз-
ные налеты в зеве или гортани при
дифтерии. При разрешении воспале-
ния фибриновые пленки растворяют-
ся плазмином (фибринолизином).
В этом процессе важную роль играют
активаторы плазминогена — лизосо-
мальные ферменты лейкоцитов экссу-
дата.
Когда к серозному экссудату при-
мешиваются эритроциты и продукты
их распада, то в таком случае возни-
кает геморрагический экссу-
дат. Геморрагический экссудат харак-
терен для острой гриппозной пневмо-
нии.
Пролиферация при воспалении. Про-
лиферация (proliferatio, от лат. proles —
потомство, ferre — создавать) при вос-
палении представляет собой местное
157
Таблица 4.2
Сравнительная характеристика состава транссудата и серозного экссудата
Свойства Транссудат Серозный экссудат
Удельный вес От 1,006 до 1,013 От 1,018 и выше
Содержание белка, % Менее 3 Более 3
Отношение содержания альбуминов к содержанию глобулинов 2 — 4 и более 0,5—1,0 и более
Свертываемость Обычно не свертывается Иногда свертывается при со- держании белка более 3 %
Общее количество клеток в 1 мм3 Менее 100 3000 и более
Показатель pH 7,4-7,6 6 — 7 и ниже
Осмотическое давление, д°с 0,56 — 0.6 и выше 0,6— 1,0 и выше
размножение клеток, в котором при-
нимают участие различные тканевые
компоненты.
Пролиферативные процессы в ране
начинаются вскоре после начала вос-
паления, но особенно активно они
протекают после отторжения некроти-
ческих масс и уничтожения болезне-
творных агентов. В условиях воспаления
поврежденные ткани и особенно клет-
ки крови являются источниками гумо-
ральных факторов, стимулирующих
восстановление тканей.
Практически важным является то
обстоятельство, что чем более эффек-
тивно осуществляется очищение раны
от поврежденных тканей, лейкоцитов
и микроорганизмов, тем эффективней
происходит пролиферация элементов
тканей с восстановлением их структу-
ры и функциональной целостности.
Очищение раны происходит благода-
ря фагоцитозу в основном за счет по-
лиморфно-ядерных лейкоцитов и тка-
невых макрофагов, а также лизису и
аутолизу поврежденных тканей. При
этом важная роль принадлежит фер-
ментам микроорганизмов и собствен-
ным ферментам ткани, активность
которых повышается за счет разруше-
ния их ингибиторов.
Среди ферментов, осуществляющих
деградацию тканей, основную роль
играют протеиназы (коллагеназа, эла-
стаза и др.), активность которых ин-
дуцируется цитокинами и простаглан-
динами. Основным источником цито-
кинов являются фагоциты, однако их
деятельность, направленная на унич-
тожение разрушенных тканей и мик-
роорганизмов, приводит к устране-
нию источников хемотаксинов. Таким
образом, исчезает стимул для ми-
грации лейкоцитов в зону воспале-
ния, что характеризует завершающий
этап развития воспаления, когда на-
чинают преобладать пролифератив-
ные процессы.
В сущности, пролиферация при ос-
тром воспалении на завершающих эта-
пах его развития сходна с заживлени-
ем раны после повреждения ткани.
В механизме восстановления строения
и функции ткани в процессе важней-
158
~зен-
- зсть
лце-
эс-
та-
и-
и.
1Я
тих
'ОЛЬ
эла-
ин-
~ан-
!ТО-
> их
ич-
лк-
:не-
<им
чи-
пе-
:ий
на-
!В-
шая роль принадлежит пролиферации
фибробластов — основных клеток со-
единительной ткани.
Фибробласты секретируют три ос-
новных продукта: проколлаген, гли-
козаминогликаны и проэластин. а так-
же микрофибриллярный белок, кото-
рый включается в эластиновые волок-
на. В условиях воспаления, когда об-
разуется большое количество стиму-
ляторов роста, происходит формиро-
вание фибробластов и капилляров,
вероятно, из перицитов. Этот процесс
наиболее активно происходит в глу-
бине раны, где образуется наибольшее
количество соединительнотканных
структур, которые по мере роста вы-
полняют дно щели, выстланной эпи-
телием, поднимая его до уровня по-
верхности. Эпидермис в течение дли-
тельного времени остается тонким.
Источником пролиферации являет-
ся мезенхимальные клетки стромы и
паренхимы органов. Среди многочис-
ленных гуморальных факторов, регу-
лирующих образование и секреторную
функцию фибробластов, основная
роль принадлежит также макрофагам.
Эти клетки при активации выделяют
факторы — цитокины, стимулиру-
ющие пролиферацию фибробластов и
синтез коллагена, а также фактор,
способствующий поступлению этих
клеток в очаг воспаления. Макрофаги
способствуют пролиферации эндотели-
альных, гладкомышечных клеток, что
приводит к образованию сосудов —
основного компонента грануляцион-
ной ткани. Угнетение или усиление
функции макрофагов за счет много-
численных нейрогуморальных меха-
низмов меняет течение острого гной-
ного воспаления.
Взаимодействие макрофагов с лим-
фоцитами запускает другой, более от-
даленный по времени механизм спе-
цифической защиты — иммунологи-
ческий. Макрофаги могут выделять не
только активаторы, но и ингибиторы
пролиферации и функциональной ак-
тивности клеток. Помимо макрофагов
факторы роста выделяются тромбоци-
тами (тромбоцитарный фактор роста
с молекулярной массой 30000). Раз-
личные гормоны — инсулин, сома-
тотропин, глюкогон и другие — по-
видимому, влияют на фибробласты
посредством макрофагальных и тром-
боцитарных факторов роста.
Пролиферация клеток при воспа-
лении является важнейшей составной
частью регенерации тканей — процес-
са, особенности течения которого за-
висят от вида тканей, объема повреж-
дения, реактивности организма, гене-
тических и других иммунобиологиче-
ских характеристик организма.
Обмен веществ в зоне воспаления.
В зоне острого воспаления происходят
резкие изменения тканевого обмена,
что обусловлено, во-первых, повреж-
дением ткани, во-вторых, нарушени-
ем регионарного кровотока. В начале
развития воспаления, особенно в фазу
артериальной гиперемии, происходит
усиление обмена веществ главным
образом за счет углеводов.
В крови, оттекающей из очага вос-
паления, уменьшается содержание
глюкозы, глютатиона, аскорбиновой
кислоты, что говорит об их ускорен-
ном использовании в условиях пато-
логии.
В динамике развития воспалитель-
ного процесса вследствие нарушения
регионарного кровотока, возникнове-
ния венозного застоя с экссудацией,
миграцией лейкоцитов в очаг воспа-
ления и отеком развивается местная
гипоксия, которая вызывает наруше-
ние аэробного обмена в более обшир-
ном участке ткани, чем зона повреж-
дения. Реакция клеток на гипоксию
зависит от степени ее выраженности,
от типа клеток и их резистентности к
действию патогенного фактора.
I
!
г
г
5
I
F
159
В очаге воспаления происходит угне-
тение потребления кислорода и акти-
вация анаэробных процессов, в резуль-
тате чего снижается дыхательный ко-
эффициент до 0,65 — 0,7. Прежде всего
активизируется гликолиз, и в тканях
накапливается избыточное количе-
ство молочной кислоты, в несколько
раз превышающее норму. Интенсив-
ный гликолиз свойствен не только
тканям, находящимся в условиях по-
вреждения и гипоксии, но и быстро
растущим и размножающимся, так как
обеспечивает их не столько энергией,
сколько необходимыми продуктами
обмена, используемыми в ходе плас-
тических процессов.
Вследствие нарушения жирового
обмена в ткани накапливаются жир-
ные кислоты, глицерин, кетоновые
тела. Нарушается белковый обмен,
поэтому в очаге воспаления накапли-
вается большое количество полипеп-
тидов, аминокислот, альбумозы, пеп-
тона, т.е. идет усиленный протеолиз.
Увеличивается и дисперсность белков.
С нарушением белкового обмена свя-
зано и образование биогенных аминов
и кининов, в том числе брадикинина.
В тканях наблюдаются также рез-
кие сдвиги со стороны водно-солевого
баланса. При этом из разрушенных и
поврежденных клеток в ткань выхо-
дит калий, который является внутри-
клеточным ионом.
При серозном воспалении, когда
количество погибших клеток относи-
тельно невелико, концентрация калия
в экссудате составляет 15 — 20 ммоль/л,
т.е. соответствует его содержанию в
плазме. При гнойно-серозном воспа-
лении концентрация калия увеличи-
вается до 40—50 ммоль/л, а при гной-
ном воспалении до 100 ммоль/л и бо-
лее.
Концентрация кальция существен-
но не изменяется, поэтому отношение
калия к кальцию увеличивается в за-
висимости от вида воспалительной ре-
акции.
Вследствие накопления недоокис-
ленных продуктов обмена возникает
местный ацидоз. В норме кислотность
среды ткани pH 7,2. При воспалении
за счет действия буферных систем,
особенно фосфатной и белковой, ве-
личина pH вначале не меняется, а за-
тем после истощения буферной емко-
сти снижается. При серозном воспа-
лении происходит небольшой сдвиг
pH, при гнойном он значительный и
pH составляет 6,3 —6,4. Редко pH экс-
судата достигает более низких цифр.
В результате гнилостных процессов в
тканях образуется «ихорозный» гной,
величина pH которого находится в
диапазоне щелочных значений и до-
стигает 7,6 —8,0.
Резко изменяются и физико-хими-
ческие свойства воспаленной ткани. Об
этом свидетельствует повышение ос-
мотического давления экссудата. В нор-
ме депрессия межклеточной жидко-
сти составляет 0,62, а осмотическое
давление находится в пределах 7,5 —
8,0 атм. При тяжелом гнойном воспа-
лении осмотическое давление дости-
гает 19 атм, а депрессия при этом рав-
на 0,8. Увеличение осмотического
давления экссудата обусловлено воз-
растанием молярной концентрации
веществ, главным образом гиперкали-
емией, гипер-Н-ионией, увеличени-
ем концентрации недоокисленных
продуктов обмена. Кроме того, при
ацидозе увеличивается диссоциация
солей, что приводит к повышению
концентрации ионов и, следователь-
но, осмотического давления. Коллоид-
но-осмотическое давление увеличива-
ется за счет высокой концентрации
белка в экссудате и перехода белков
из крупно- в мелкодисперсные.
В результате развивающегося аци-
доза в очаге воспаления происходит
несколько взаимосвязанных явлений:
||<Й:
ik. яг-
-.я*1
4.Ч.-
160
ейре-
-СКИС-
- -кает
^-:ость
дении
-л :тем,
t ве-
s з за-
| тЧКО-
з»: :па-
.:виг
ь-ый и
3-' экс-
дфр-
с.:эв в
» ной,
иТЭЯ в
» до-
Г ЛМИ-
Об
ь»е ос-
Ш-= нор-
«- ЭКО-
экое
Швь -.5—
ib кспа-
: сти-
'Шезч эав-
4k*f-xoro
303-
•ГТДЦИИ
’•ЕХДЛИ-
•ьи-ени-
ipSE-HblX
ЧЬ при
-ЛцДДЦИЯ
«ЛьтНИЮ
Лй1»:.1ь-
’Wb- 311Д-
Vе'' '!ва-
«рГ-ДИИ
зков
яЬс- ши-
Мп.. ЭДИТ
фк-ий:
активируются протеолитические фер-
менты, в связи с чем ускоряется рас-
щепление белков, в том числе ток-
сических, являющихся продуктами
жизнедеятельности микроорганизмов
и распада тканей. Развивается медлен-
ная дилатация сосудов и повышается
проницаемость их стенок; возникает
коллоидное набухание белков за счет
увеличения их гидрофильности. Воз-
растание коллоидно-осмотического
давления является одним из важных
факторов развития отека.
Таким образом, ацидоз и обуслов-
ленные им реакции усугубляют нару-
шение микроциркуляции и обмена
веществ в ткани при острой воспали-
тельной реакции.
Взаимоотношения между очагом
воспаления и целостным организмом.
Острая воспалительная реакция ока-
зывает выраженное влияние на весь
организм. В обмене веществ наблюда-
ется усиление анаэробных процессов,
поэтому в крови возрастает концент-
рация недоокисленных продуктов об-
мена, особенно молочной кислоты.
Более значительная гиперлактациде-
мия бывает редко, так как образую-
щаяся в зоне воспаления молочная
кислота быстро окисляется, особен-
но в печени при ее нормальном функ-
ционировании. Увеличение содержа-
ния недоокисленных продуктов обме-
на возникает по двум причинам: во-
первых, они поступают из очага вос-
паления в кровь, а, во-вторых, в
результате интоксикации в организ-
ме наблюдается нарушение обмена ве-
ществ. что приводит к ацидотиче-
скому сдвигу, выявляемому по пока-
зателям кислотно-основного состоя-
ния в виде компенсированного мета-
болического ацидоза. Уровень в крови
пировиноградной кислоты при нор-
мальной функции печени, как пра-
вило, не изменяется. Возрастает кон-
центрация азотистых веществ в ре-
зультате усиленного катаболизма бел-
ка и угнетения белкового синтеза.
Для острого воспаления характер-
но развитие нейтрофильного лейкоци-
тоза с регенераторным сдвигом, что
выявляется по величине «лейкоцитар-
ного индекса интоксикации» (ЛИИ),
нередко используемого на практике
и определяемого по формуле:
(4Ми + ЗЮ +2П + С)(Пл + 1)
-----------------—------- = ЛИИ,
(Л + Мон)(Э + 1)
где Ми — миелоциты; Ю — юные (ме-
тамиелоциты); П — палочкоядерные;
Пл — плазматические клетки; С —
сегментоядерные; Л — лимфоциты;
Э — эозинофилы: Мон — моноциты.
В норме он составляет 0,5 —1,5.
Сдвиг регенерации происходит в
основном за счет увеличения числа па-
лочкоядерных нейтрофилов, появле-
ния юных форм и значительно реже —
миелоцитов. В большинстве случаев
число лейкоцитов при остром воспа-
лении возрастает до 9-12- 109/л, но
может достигать и 20 - 30- 109/л.
Величина ЛИИ находится в пря-
мой зависимости от интенсивности
воспалительного процесса; в норме
она составляет в среднем 0,5—1,5,
при легком воспалении увеличивает-
ся до 2 — 3, а при тяжелом воспале-
нии превышает 5. Однако при измене-
нии реактивности организма этот ин-
декс может неадекватно отражать сте-
пень выраженности патологического
процесса. Например, низкая величи-
на ЛИИ бывает при обширном воспа-
лении у больных с лейкопенией и им-
мунодефицитном состоянии.
Причиной лейкоцитоза и сдвига
регенерации является активация сим-
патоадреналовой системы, а также
воздействие продуктов распада и ток-
синов на костный мозг. Однако веду-
щее значение в развитии лейкоцито-
за, по-видимому, имеют лейкопоэти-
161
ны, воздействующие на кроветворные
органы.
В результате активации симпатоад-
реналовой системы повышается сосу-
дистый тонус, ускоряется кровоток,
поэтому уменьшается число лейкоци-
тов, фиксированных на стенке сосу-
дов и поступающих в ткань. Кроме
того, медиаторы симпатической не-
рвной системы стимулируют деятель-
ность сократительного аппарата лей-
коцитов и тем самым ускоряют их пе-
реход из костного мозга, чему способ-
ствует также ускорение кровотока.
Прямое воздействие на костный мозг
веществ, поступивших из очага вос-
паления в кровь, заключается в по-
вышении проницаемости межэндоте-
лиальных пространств, что облегчает
выход лейкоцитов в периферическую
кровь.
П ри воспалении происходит также
стимуляция лейкопоэза, которая обу-
словлена воздействием специфическо-
го фактора — лейкопоэтина, который,
как полагают, образуется в очаге вос-
паления при участии лейкоцитов и
стимулирует пролиферацию крове-
творных клеток-предшественников
гранулоцитарной группы в костном
мозге. Это видно из того, что при вос-
палительном процессе кровь обогаща-
ется веществами, способными вызвать
у интактных животных стимуляцию
гранулоцитопоэза в костном мозге.
При тяжелом воспалительном процес-
се, сопровождающемся явлениями
интоксикации, может наблюдаться
небольшой лейкоцитоз и резкое уве-
личение ЛИИ, почти полное исчез-
новение из крови эозинофилов и сни-
жение числа лимфоцитов.
Изменения в системе лейкоцитов
и иммунитета существенно меняют
резистентность организма к микроб-
ному заражению. Так, если развивает-
ся воспаление, вызванное листерия-
ми, то одновременно возрастает
устойчивость к заражению не только
теми же микробами, но и к вирусам
гриппа, микобактериям туберкулеза,
сальмонеллам, гноеродным коккам,
грибкам и др. Повышение резистент-
ности организма к заражению в про-
цессе воспаления связано с активаци-
ей макрофагов-резидентов, входящих
в ретикулоэндотелиальную систему.
Эти макрофаги прочно встроены в
стенки кровеносных капилляров и со-
единительнотканный каркас органов,
где из них формируется барьер для
факторов, нарушающих гомеостаз,
в том числе микробов. К макрофагам-
резидентам относятся клетки Купфе-
ра печени, макрофаги синусов селе-
зенки, альвеолярных перегородок лег-
кого, микроглии нервной системы.
Установлено, что макрофаги-резиден-
ты так же, как и блуждающие макро-
фаги из очага воспаления, образуют-
ся из моноцитов крови.
Очаг воспаления способствует по-
вышению не только обшей резистент-
ности к инфекции. В нем идет посто-
янная «переработка антигенной ин-
формации», в результате формируются
и усиливаются реакции иммунитета.
В отсутствие воспаления развивается,
как правило, менее стойкий иммуни-
тет к инфекции, и наоборот.
Система красной крови значитель-
но более устойчива при воспалении,
чем система белой крови. Лишь при
тяжелых воспалительных процессах у
ослабленных больных довольно часто
наблюдается гипохромная анемия. Ве-
личина СОЭ увеличивается при ост-
ром воспалении в несколько раз, при-
чем имеется определенное соответ-
ствие между этим показателем и ве-
личиной ЛИИ в зависимости от тя-
жести патологического процесса.
Содержание общего белка в крови
при воспалении, как правило, не ме-
няется, но при тяжелых процессах,
сопровождающихся сепсисом и об-
май
fIff fl
ГС -ЭЛЬКО
t- - русам
вг-7.леза,
* :ккам,
. гент-
»« 7 про-
ж заци
< »„ 7ЯЩИХ
> .. :гему.
В“- ены в
Ир г- и со-
t с анов,
ЙГ-с? ДЛЯ
ЙМ.:: : стаз,
и» тагам-
fc '..ифе-
селе-
” .< лег-
-7СМЫ.
‘ден-
зкро-
дуют-
77 ПО-
77ент-
* эсто-
ин-
7 7ОТСЯ
пета.
делся,
‘.уни-
7ель-
.нии,
--Ж_; при
W- _;ах у
-асто
е.» Ве-
~ ост-
тк. при-
7вет-
: ве-
' - тя-
эови
-- ме-
ссах,
об-
ширной интоксикацией этот показатель
имеет тенденцию к уменьшению. Вме-
сте с тем закономерно изменяется со-
отношение белковых фракций: умень-
шается содержание альбуминов, уве-
личивается содержание al-, а2-глобу-
линов, в результате чего снижается
альбумин-глобулиновый коэффициент.
При остром воспалении содержание
Р-глобулиновой фракции плазмы кро-
ви существенно не меняется, а у-гло-
булиновая фракция, в составе кото-
рой находятся иммуноглобулины, не-
редко возрастает.
Лихорадка при воспалении возни-
кает в результате воздействия на тер-
морегулирующие центры пирогенов,
образующихся в патологическом оча-
ге. Пирогены продуцируются в основ-
ном фагоцитами и лимфоцитами.
В большинстве случаев интенсивность
лихорадочной реакции зависит от вы-
раженности воспаления, но при на-
рушении реактивности организма эта
закономерность не проявляется. Неко-
торые инфекционные заболевания со-
провождаются воспалением, но про-
текают без лихорадочной реакции.
При остром воспалении усилива-
ется опсонизирующая способность
сыворотки крови, повышается фаго-
цитарная и переваривающая актив-
ность лейкоцитов.
В результате активации лейкопоэза
и миграции лейкоцитов в очаг воспа-
ления, где они быстро разрушаются,
в крови увеличивается содержание та-
ких важнейших неспецифических фак-
торов резистентности организма, как
лизоцим, лактоферрин, катионные
белки, комплемент, р-лизины и др.
Увеличение антителообразования про-
исходит в основном в лимфатических
узлах, регионарных по отношению к
очагу воспаления.
Реакция организма на острое вос-
паление характеризуется также изме-
нениями со стороны системы гемокоа-
гуляции. У большинства больных с тя-
желыми воспалительными заболева-
ниями увеличивается толерантность
плазмы к гепарину и время рекальци-
фикации плазмы, возрастает концен-
трация фибриногена и ускоряется
свертывание крови. В то же время фиб-
ринолитическая активность крови, как
правило, снижается. Таким образом,
при остром воспалении преобладает
прокоагулянтная система и наблюда-
ется тенденция к гиперкоагуляции.
Охарактеризованная реакция цело-
стного организма на острое воспале-
ние отражает возникновение адаптив-
ных процессов, направленных на по-
вышение активности механизмов,
ускоряющих ликвидацию воспалитель-
ного процесса и восстанавливающих
структуру и функцию поврежденной
ткани.
Хол воспаления можно ускорить
или затормозить нейромедиаторами
или гормонами, изменением функ-
ционального состояния центральной
нервной системы. У животных, нахо-
дящихся под наркозом или в состоя-
нии анабиоза (зимней спячки), раз-
витие воспаления, как правило, тор-
мозится. Местная анестезия, перерезка
нервов, денервация ткани, вызываю-
щая нарушение нервной трофики,
также меняет ход воспаления. Это свя-
зано с изменениями кровотока, про-
ницаемости эндотелия и базальных
мембран капилляров (А. М. Чернух).
При нарушениях иннервации могут
тормозиться регенераторные процес-
сы в очаге воспаления и развиваться
долгонезаживающие трофические язвы.
Течение воспаления зависит от со-
стояния вегетативной нервной систе-
мы. Это обусловлено тем, что нейро-
медиаторы меняют реактивность ней-
трофилов и моноцитов-макрофагов,
т. е. клеток — эффекторов воспаления.
Ацетилхолин и его аналоги индуци-
руют синтез цГМФ в фагоцитах. Это
163
в свою очередь служит сигналом для
секреции лизосом из клетки в среду
(секреторная дегрануляция) и приво-
дит к обострению воспаления. Напро-
тив, под действием катехоламинов (ад-
реналина, норадреналина) в фагоци-
тах начинает синтезироваться другой
нуклеотид — цАМФ. Под его влияни-
ем усиливаются поглотительные, но
затормаживаются секреторные функ-
ции фагоцитов. В результате воспале-
ние может протекать менее остро.
Развитие воспаления находится под
контролем гормонов. Особенно актив-
ны в этом плане гормоны коры над-
почечников. Так, минералокортикои-
ды обостряют воспаление, тогда как
глюкокортикоиды обладают ярким
противоспалительным действием, по-
этому они широко применяются при
лечении воспалительных заболеваний.
Гидрокор! изон и его синтетические
аналоги (преднизолон, триамсино-
лон) резко тормозят эффекторные
функции фагоцитов воспаления, в том
числе такие, как способность секре-
тировать лизосомальные ферменты,
биогенные амины, кинины, биоокис-
лители, лейкотриены. Под влиянием
глюкокортикоидных гормонов снижа-
ется чувствительность макрофагов к
лимфокинам, что тоже приводит к ан-
тивоспалительному эффекту. Наконец,
глюкокортикоиды уменьшают приток
свежих лейкоцитов в очаг воспаления,
так как гормоны стабилизируют ба-
зальные мембраны сосудов и снижа-
ют проницаемость капилляров. Это
способствует рассасыванию воспали-
тельных инфильтратов, поскольку от-
ток клеток из очага начинает превы-
шать их поступление в зону воспале-
ния.
Среди других гормонов, контроли-
рующих воспаление, следует упомя-
нуть тироксин, женские половые гор-
моны и инсулин. Тироксин и эстроге-
ны усиливают микробицидный потен-
164
циал фагоцитов. Под влиянием тирок-
сина йод включается в главную цепь
«миелопероксидаза + йод + Н2О2», от
которой зависят антимикробные функ-
ции фагоцитов. Под действием эстро-
генов, кроме того, ускоряется созре-
вание грануле- и моноцитов в кост-
ном мозге и их поступление в кровь.
Скорость транспорта глюкозы в
фагоциты прямо зависит от концент-
рации инсулина в крови. В то же время
глюкоза необходима для энергетиче-
ского обеспечения фагоцитоза. Окис-
ление глюкозы в пентозном цикле дает
толчок к образованию микробицидных
факторов в фагоцитах. При недоста-
точности функций р-клеток инсуляр-
ного аппарата поджелудочной железы
воспаление принимает торпидное, за-
тяжное течение. Это хорошо известно
врачам, которые лечат больных сахар-
ным диабетом.
Острый воспалительный процесс
также вызывает в организме одновре-
менно с гормональными и другие сдви-
ги — так называемые реакции острой
фазы (см. гл. 6). Эти реакции являются
универсальными в ответ на поврежде-
ние тканей. Они заключаются в усиле-
нии образования и освобождения мак-
рофагами одного из важнейших цито-
кинов — пептида интерлейкина-1,
который инициирует усиление синте-
за в печени белков острой фазы и их
выделение в кровь. К острофазным
относятся следующие белки:
С-реактивный белок, способный
связываться с многими веществами,
которые являются продуктами по-
вреждения тканей и микробов, акти-
вировать комплемент и усиливать фа-
гоцитоз;
гаптоглобин, относящийся к гли-
копротеинам, который, взаимодей-
ствуя с гемоглобином, образует ком-
плекс, обладающий пероксидазной
активностью. Он фагоцитируется мак-
рофагами, разрушается, в результате
!>!
ирок-
< цепь
от
с эунк-
* гстро-
f :озре-
J кост-
1 <?овь.
КчЗЗЫ в
сндент-
И Бремя
г~:тиче-
L ?КИС-
*=ле дает
единых
-=доста-
гкуляр-
!•.лозы
за-
ЯШкдестно
-дхар-
освобождается железо, которое в транс-
портной форме поступает в костный
мозг;
церулоплазмин является металло-
иротеидом крови, транспортирующим
медь. Он также относится к факторам,
блокирующим свободно-радикальное
окисление.
Таким образом, неспецифические
защитные реакции организма при вос-
палении опосредуются также через
белки острой фазы.
4.3. Патогенез
экссудативно-
деструктивного гнойного
и хронического
(мононуклеарного)
воспаления
• дхцесс
врс-
-ДВИ-
•fc- - трои
потея
•ч-гежде-
Ш5 :иле-
ч»мак-
• _ПТО-
‘Ж* -Л-1,
ЭД® - нте-
д их
W дным
Ведущая роль в развитии воспале-
ния, как любого типового патологи-
ческого процесса, принадлежит на-
следственно закрепленной програм-
ме, сформированной в процессе эво-
люции. Эта программа реализуется как
при нормальной, так и нарушенной
регуляции (дизрегуляции) систем,
участвующих в течении воспаления.
Важное значение имеет характер воз-
действия болезнетворного агента: его
количество, степень патогенности,
’Ж. 'ный
К'”; .ми,
д по-
• ж . :<ти-
фа-
- ‘.ТИ-
й ней-
-.ОМ-
Д.- той
- . нк-
лате
пути проникновения, продолжитель-
ность и частота воздействия. Если вос-
паление возникло, то его тип (неспе-
цифический, специфический, острый
и хронический), форма течения (нор-
ме-, гипо-, гиперергическая), а так-
же устойчивость к лечебным меро-
приятиям зависят от состояния регу-
ляторных систем, обеспечивающих
программу осуществления этого па-
тологического процесса.
Общая стратегия течения воспали-
тельного процесса при нормальной
регуляции и дизрегуляции имеет сход-
ные черты, но есть и существенные
различия. Принимая во внимание раз-
личные механизмы развития экссуда-
тивно-деструктивного гнойного, за-
тяжного гнойного и хронического (мо-
нонуклеарного) воспаления (Д.Н. Ма-
янский, И.Г.Урсов), их причину, те-
чение и исход следует рассмотреть от-
дельно.
Фаза подготовки. В «фазу подготов-
ки» к экссудативно-деструктивному
гнойному воспалению основные события
разворачиваются в области «микроцир-
куляторной единицы» (А. М. Чернух).
При этом важнейшим элементом яв-
ляется повреждение эндотелия венул,
более чувствительных, чем эндотелий
артериол. Возникающая при этом ак-
тивация фактора XII свертывания
крови инициирует каскад реакций:
свертывание крови и накопление
плазменных медиаторов воспаления,
стимулирующих образование кини-
нов, которые в свою очередь активи-
руют систему комплемента. В эту же
фазу происходит освобождение меди-
аторов из внесосудистых источников
медиаторов воспаления, в первую оче-
редь — из тучных клеток, выделяющих
гистамин, а также из клеток задних
корешков спинного мозга, синтезиру-
ющих субстанцию Р, которая по чув-
ствительным нервам перемещается на
периферию и является мощным вазо-
I
£
дилататором и активатором выделения
того же гистамина. Важно подчерк-
нуть, что образование плазменных и
клеточных медиаторов является ауто-
каталитическим процессом, который
запускается патогенным фактором,
а затем образование медиаторов мо-
жет продолжаться и без его участия.
В фазу подготовки гнойного воспа-
ления происходит, в качестве обяза-
тельного процесса, активация лейко-
цитов, в первую очередь нейтрофи-
лов. Активация нейтрофилов иници-
ируется разнообразными факторами:
165
микробами, плазменными медиатора-
ми воспаления, цитокинами, продук-
тами разрушения ткани, особенно ос-
вобождающимися при этом лизосо-
мальными ферментами. Активный
нейтрофил приобретает новые свой-
ства: резко увеличивается его адгезив-
ная способность благодаря адгезив-
ным белкам (лейкоцитарным интег-
ринам — Мас-1, LFA-1, VFA-4 и др.),
с помощью которых они образуют
между собой лейкоцитарные агрегаты
и соединяются с эндотелием сосудов.
Лейкоцитарные интегрины облада-
ют и другими функциями: они явля-
ются рецепторами для хемоаттрактан-
тов, опсонинов и цитокинов. Следо-
вательно, они обеспечивают, помимо
образования агрегатов и фиксации на
эндотелии лейкоцитов, их направлен-
ное движение в сторону повреждения,
фагоцитоз, переваривание и благода-
ря цитокинам включение других кле-
точных ассоциаций в процесс воспа-
ления.
Активированные нейтрофилы вы-
деляют гранулы как до (секреторная
де грануляция), так и после гибели
клетки. Выделившиеся ферменты,
в основном эластаза и коллагеназа,
разрушают в первую очередь необра-
тимо поврежденные ткани, переводя
их в жидкое состояние — гной, кото-
рый легче может быть удален из орга-
низма. Эти же ферменты активируют
комплемент, компоненты которого
образуют цитотоксические комплек-
сы, также разрушающие ткань. К фак-
торам зашиты, выделяющимся из ней-
трофилов, относятся также лизоцим,
катионные белки и другие компонен-
ты, обладающие бактерицидным дей-
ствием. В последние годы большое зна-
чение придается мембранным медиа-
торам нейтрофилов. Так, фактор ак-
тивации тромбоцитов, увеличивает,
кроме того, проницаемость сосудов и
хемотаксис тех же лейкоцитов, повы-
шает чувствительность гладкой муску-
латуры сосудов и бронхов к медиато-
рам воспаления. Таким образом, ней-
трофилы также включаются в аутока-
талитический процесс в периоде под-
готовки к развитию воспаления.
К важнейшим мембранным меди-
аторам нейтрофилов относятся про-
дукты окисления арахидоновой кис-
лоты — эйкозаноиды, к которым от-
носятся простагландины (сильное со-
судорасширяющее действие, болевая
чувствительность) и лейкотриены
(мощные хемоаттрактанты, повыша-
ют тонус сосудов и бронхов).
Нейтрофилы являются источником
цитокинов — регуляторных пептидов,
основными из которых являются ИЛ-1
(а и Р) и ФНО-а. Интерлейкин-1 яв-
ляется многофункциональным цито-
кином: он усиливает миграцию лей-
коцитов в очаг воспаления, активи-
рует лейкопоэз, вызывает лихорадку
при воспалении, способствует синте-
зу в печени белков острой фазы. Важ-
ной функцией ИЛ-1 является вклю-
чение в процесс защиты иммунной
системы благодаря активации образо-
вания лимфокинов и синтезу антител,
осуществляющих защиту организма от
патогенных факторов антигенной при-
роды. По отношению к воспалению
ИЛ-1 и ФНО-а выполняют сходные
функции.
В фазу подготовки к экссудативно-
деструктивному гнойному воспалению
происходит активация эндотелия бла-
годаря экспрессии собственных адге-
зивных белков (ELAM-1 для нейтро-
филов, ICAM-1 и VCAM-1 для моно-
нуклеаров). Активный эндотелий, кро-
ме того, приобретает способность к
сокращению, благодаря чему образу-
ются пространства, обеспечивающие
проникновение лейкоцитов в ткань и
развитие собственно воспалительного
процесса. Под влиянием ИЛ-4 повы-
шается активность эндотелиальных
.«ЯИР
я»
л»
йШ---
-ssaei-
"аИЖ
166
л гуску-
«с—иато-
tней-
; ..лока-
под-
чеди-
-- про-
кис-
=0.1 от-
it.- ~ е со-
’ левая
"гиены
лыша-
Н--ДКОМ
r^TiUOB,
г_ ИЛ-1
-I яв-
_ито-
леи-
» -~~ИВИ-
в»«адку
Ч||р _ • :нте-
ЧВь Важ-
нее л:<лю-
иной
ЧИв '"эазо-
•4--~дтел,
Шдча от
чВв при-
Ш-ЛНИЮ
W„:. лные
вно-
Чвх~ дию
явер; ола-
ччиишь лдге-
-» ~с тро-
як ЭНО-
’ кро-
-ТЬ к
в 'тазу-
Швь: щИе
411 > .:!> И
ЧИГ _ - ого
-;вы-
Ж-ОНЫХ
клеток для эозинофилов, базофилов
и моноцитов, характерных для аллер-
гического воспаления, но не для ней-
трофилов.
Таким образом, в фазу подготов-
ки к воспалению ведущая роль при-
надлежит медиаторам плазменного и
клеточного происхождения. Эти ме-
диаторы характеризуются каскадно-
стью активации, многофункциональ-
ным действием, взаимозаменяемостью
и аутокаталитическими свойствами.
Следует подчеркнуть, что процес-
сы, происходящие в эту фазу, только
инициируются болезнетворным фак-
тором, после чего он может не играть
существенной роли в развитии воспа-
ления. Однако аутокаталитический
процесс может привести к распро-
странению повреждения эндогенными
факторами, например протеазами и
неадекватной реакцией организма на
воспаление. Поэтому процессы акти-
вации всегда сопровождаются обра-
зованием ингибирующих факторов.
К ним относятся ингибиторы сверты-
вания крови, антагонисты протеаз,
противовоспалительные цитокины,
факторы стресслимитируюшей и ан-
тиноцицептивной системы и др. Таким
образом, в фазу подготовки благода-
ря деятельности системы ограничения
развивающийся в дальнейшем процесс
воспаления протекает в пределах нор-
мы адаптации, т.е. не превышает
меры, необходимой для успешного
течения и завершения патологического
процесса.
Фаза инфильтрации ткани лейкоци-
тами. Вслед за завершением подготов-
ки к экссудативно-деструктивному
гнойному воспалению начинается фаза
инфильтрации ткани лейкоцитами.
В этот период лейкоцит, фиксирован-
ный с помошью адгезивных белков на
стенке микрососуда, проникает меж-
ду эндотелиальными клетками и бла-
годаря особому сократительному ап-
парату перемещается в сторону болез-
нетворного фактора или поврежден-
ной ткани. Хемотаксины, непосред-
ственно включающие механизмы на-
правленного движения лейкоцитов,
имеют разное происхождение (клеточ-
ное и плазменное): они образуются в
результате активации комплемента,
выделяются из разных лейкоцитов и
других клеток, образуются в результа-
те частичной деструкции белков, дея-
тельности и распада микроорганизмов.
Наличие многочисленных источников
хемотаксинов определяет их важней-
шую роль в процессе воспаления.
Гуморальные факторы — медиаторы
воспаления — обладают многофунк-
циональным действием. Например,
лейкотриен В4, фактор активации
тромбоцитов, цитокин ИЛ-8 (вклю-
чает семейство хемокинов) помимо
специфического действия являются
мощными хемоаттрактантами.
В свою очередь хемоаттрактанты
усиливают активность адгезивных бел-
ков. ИЛ-1, ИЛ-6 и другие цитокины
выполняют множество функций не
только местного, но и системного дей-
ствия (включение иммунных механиз-
мов, усиление выработки энергии,
адаптивные изменения в нервной си-
стеме). В процессе синтеза гепатоци-
том острофазных белков типа С-ре-
активного белка, фибриногена, гап-
тоглобина и амилоида ингибитором
является ИЛ-6, вырабатываемый в ос-
новном макрофагами, а также ИЛ-1.
Белки острой фазы в свою очередь не
только являются индикаторами остро-
ты воспаления, но и выполняют роль
опсонинов, подготавливая микроор-
ганизмы и гибнущие клетки к фаго-
цитозу.
Многофункциональность, синер-
гизм и антагонизм медиаторных меха-
низмов обеспечивают в целом надеж-
ность системы формирования барьера
между зоной повреждения и организ-
167
мом с минимальными энергетически-
ми затратами.
Эффекты разных медиаторов не
просто суммируются, они могут уси-
ливаться или, наоборот, ослабляться
благодаря местным аутокаталитиче-
ским механизмам регуляции. При этом
основная цель происходящих в по-
врежденных тканях процессов в фазу
подготовки к гнойному воспалению в
условиях нормальной регуляции за-
ключается в том, что создаются усло-
вия для миграции в ткани достаточ-
ного количества нейтрофилов, выпол-
няющих основную при экссудативно-
деструктивном гнойном воспалении
функцию: санацию очага повреждения
и инициации репаративных процессов.
Вслед за фазой подготовки следует
фаза инфильтрации (по классифика-
ции Д. Н. Маянского). В эту фазу фик-
сированные к эндотелию сосудов и
активированные нейтрофилы приоб-
ретают двигательную активность. Важ-
нейшая роль в этом процессе принад-
лежит белку кальмодулину, который
под действием Са2+ активирует кина-
зу миозина.
Основными инициаторами движе-
ния лейкоцитов являются хемоаттрак-
танты. К их источникам, о которых
сказано выше, в фазу инфильтрации
добавляются хемоаттрактанты, обра-
зующиеся в поврежденной ткани (про-
дукты распада коллагена и эластина,
фибрина), а также микробы, если вос-
паление имеет инфекционную приро-
ду. Важным источником хемотаксинов
являются сами лейкоциты: они выде-
ляют лейкотриены, фактор активации
тромбоцитов и др. Хемоаттрактанты
воздействуют на рецепторы нейтрофи-
лов, в результате чего осуществляют-
ся его основные функции.
В условиях нормальной регуляции
активация лейкоцитов обеспечивает
формирование инфильтрата, в кото-
ром осуществляются все защитные
механизмы, которые выполняют те же
клетки. В основе этих механизмов ле-
жит фагоцитоз, который включает в
себя несколько этапов: распознавание
микроба, его погружение в состав фа-
госомы, ее слияние с лизосомой, умер-
щвление и переваривание патагента и
выделение продуктов распада в окру-
жающую среду. Каждый из этих эта-
пов имеет собственные механизмы ре-
гуляции. Среди них: опсонизация мик-
робов перед фагоцитозом, количество
и состояние рецепторного аппарата
нейтрофила, набор ферментов в фа-
голизосоме, содержание бактерицид-
ных веществ, в основном лизоцима,
лактоферрина, активных радикалов
кислорода (супероксида, пероксида
водорода).
Если повреждение ткани сравни-
тельно невелико, а регуляция фаго-
цитарной активности осуществляется
на физиологическом уровне, то фаза
инфильтрации может завершиться без
формирования полости, заполненной
гнойным экссудатом с последующим
быстрым восстановлением ткани (ин-
фильтративное воспаление (А. И. Во-
ложин, В. В. Рогинский). При необхо-
димости более эффективной санации
очага повреждения и удаления разру-
шенных тканей, микробов и других чу-
жеродных факторов они переводятся
в растворимое состояние и удаляются
из организма с гнойным экссудатом.
Фаза репаративных процессов. Уже
в фазу санации очага воспаления про-
исходит подготовка к фазе репаратив-
ных процессов. Этот процесс иниции-
руют моноциты, трансформирующи-
еся в тканевые макрофаги. Механизмы
миграции моноцитов в ткань такие же,
как и нейтрофилов, и функции их так-
же схожи. Но макрофаги обладают
большим числом функций. Помимо
фагоцитарной и бактерицидной функ-
ции, благодаря цитокинам они ини-
циируют активность лимфоцитов и та-
168
те же
< в ле-
зет в
звание
.в фа-
.-мер-
:-:та и
: - КРУ-
с< эта-
мы pe-
rt мик-
:т- ество
гврата
в фа-
-‘ГТИД-
г зима,
i ХЭЛОВ
г <еида
гзвни-
:аго-
вт-ется
г фаза
без
«енной
! С ЛИМ
i (ИН-
. Л. Bo-
rfe: бхо-
Л-_1ЦИИ
Т<лру-
чу-
1..:ятся
Г-ИЭТСЯ
атом.
«. Уже
!.!’ ЛрО-
Iзтив-
кшии-
ЩИ-
гТЗМЫ
►. е же,
о. так-
г ахают
ЙСИИМО
t тунк-
й лни-
г-а и та-
ким образом включают специфиче-
скую защиту — иммунную, ведущую
долговременную и эффективную
борьбу с конкретными болезнетвор-
ными факторами антигенной приро-
ды, включая и собственные изменен-
ные белки.
Еще одним важным свойством мак-
рофагов является синтез и выделение
факторов роста, которые стимулиру-
ют репаративные процессы, способ-
ствуют образованию и функциониро-
ванию фибробластов, эпителиальных
клеток, росту нервов и сосудов. Важ-
но подчеркнуть, что эти функции мак-
рофаги выполняют вместе с системой
лимфоцитов. Причем оба вида моно-
нуклеаров благодаря межклеточным
взаимодействиям регулируют и допол-
няют свои функции, создавая единую
мононуклеарную систему защиты. Эта
система не только активирует, но и
ограничивает пролиферацию и прояв-
ление функциональной активности
клеток также с помощью биологиче-
ски активных веществ — простаглан-
динов, лейкотриенов, цитокинов. Ко-
нечным результатом этой фазы явля-
ется формирование рубца, объем,
строение и перестройка которого так-
же находятся под контролем цитоки-
нов, продуцируемых клетками воспа-
лительного очага.
Дизрегуляция острого воспаления
существенно изменяет эволюционно
закрепленный ход этого патологиче-
ского процесса. Характер нарушения
зависит от того, какое звено регуля-
ции воспаления нарушено, а также от
возможностей компенсаторных меха-
низмов, препятствующих проявлению
нарушенной регуляции физиологиче-
ских механизмов защиты и восстанов-
ления.
В результате нарушения регулятор-
ных механизмов (дизрегуляции), уча-
ствующих в развитии экссудативно-
деструктивного воспаления, оно мо-
жет протекать чрезвычайно остро с
неадекватно большим объемом по-
вреждения ткани или, наоборот, пе-
реходить в хроническую форму. Каж-
дый из этих вариантов следует рас-
смотреть раздельно.
4.4. Механизмы
затяжного течения
острого воспаления
Острое, или экссудативно-деструк-
тивное, воспаление развивается, как
было сказано, в основном с участием
полиморфно-ядерных лейкоцитов,
которые являются основными эффек-
торами этого патологического процес-
са. Воспаление может протекать более
или менее остро, а также принимать
затяжное течение со склонностью к
распространению. Такое воспаление
характерно для авитаминозов, эндо-
кринных расстройств, иммунодефи-
цитных состояний, многократных
стрессов, старения и др. В этих ситуа-
циях в первую очередь нарушаются
различные функции клеток, в основ-
ном полиморфно-ядерных лейкоци-
тов, что проявляется в снижении их
адгезивных свойств, замедлении миг-
рации в очаг воспаления вследствие
рефрактерное™ к хемотаксинам, не-
достаточности микробицидных функ-
ций. Снижается также способность по-
лиморфно-ядерных лейкоцитов выра-
батывать факторы резистентности, так
называемые дефензины.
Затяжному течению острого воспа-
ления способствует также недостаточ-
ность макрофагов, которые мигриру-
ют в очаг воспаления вслед за лейко-
цитами. В результате из моноцитов
выделяется малое количество цитоки-
нов, включающих процессы регенера-
ции. Нарушения деятельное™ иммун-
ной системы также способствуют пе-
реходу воспаления в хроническую
169
форму вследствие снижения образо-
вания иммуноглобулинов, оказыва-
ющих опсонизирующее действие на
микроорганизмы. Недостаточность в
системе иммунитета может сопровож-
даться снижением выделения лимфо-
цитами лимфокинов, способствующих
миграции и проявлению фагоцитар-
ной активности полиморфно-ядерных
лейкоцитов.
Типичным случаем хронизации ост-
рого воспаления является длительное
или часто возникающее стрессорное
состояние, при котором происходит
гиперпродукция катехоламинов, вы-
зывающих блокаду образования реак-
тивных метаболитов кислорода через
eel - и «2-рецепторы полиморфно-ядер-
ных лейкоцитов и макрофаги. Как из-
вестно, метаболиты кислорода, такие
как супероксиданион, синглетный
кислород и пероксид водорода, ответ-
ственны за бактерицидный эффект в
фагоците.
Восстановление функции фагоци-
тов после окончания стрессорного воз-
действия происходит под влиянием
соматотропного гормона и пролакти-
на. Кроме воздействия на фагоциты
стресс способствует также снижению
функции естественных киллерных
клеток, что потенцирует опухолевую
трансформацию клеток в очаге воспа-
ления, т.е. увеличивает риск опухоле-
вого роста.
Очень тяжелый стресс или введе-
ние больших доз глюкокортикоидных
гормонов тормозит миграцию поли-
морфно-ядерных лейкоцитов в дыха-
тельные пути, но способствует их за-
держке в легких, что делает эти клет-
ки особенно уязвимыми для патоген-
ных факторов и способствует развитию
воспалительного процесса в легочной
ткани. Таким образом, увеличение со-
держания лейкоцитов повышает их
чувствительность к патогенным фак-
торам.
В результате длительного и интен-
сивного стресса мобилизуются не
только адаптивные гормоны, но и ве-
щества стресслимитирующей системы,
к которым относятся опиоидные пеп-
тиды. На лейкоцитах и макрофагах
имеются рецепторы к этим пептидам,
воздействия на которые приводят к
изменениям функций лейкоцитов .и
к их участию в развитии воспаления.
На Т-лимфоцитах (CD4 и CD8) так-
же есть рецепторы для опиоидов.
Таким образом, патогенетическую
основу вяло и монотонно протека-
ющего воспаления составляют гипер-
гия клеток-эффекторов, в основном
полиморфно-ядерных лейкоцитов. Ча-
сто обостряющееся воспаление, на-
оборот, возникает при гиперергии
этих клеток. Поэтому в первом случае
требуется стимуляция фагоцитов, что
обостряет воспалительную реакцию и
усиливает разрушение поврежденных
соединительнотканных структур, вы-
деление хемотаксинов, способствую-
щих миграции в очаг воспаления мо-
нонуклеаров и фибробластов, обеспе-
чивающих репарацию тканей.
Во втором случае принцип лечения
затяжного воспаления, протекающе-
го с частыми обострениями, должен
быть иным и направлен в первую оче-
редь на блокирование воспалитель-
ного процесса путем нейтрализации
реактивных метаболитов кислорода,
протеаз и эйкозаноидов. Стимуляция
воспаления в этих тканях еще больше
обострит течение процесса, но может
оказаться и целесообразной, если ис-
тощит клетки воспаления и вызовет
ремиссию процесса.
Хроническое (мононуклеарное, пер-
вично хроническое) воспаление. В очаге
воспаления с самого начала его воз-
никновения могут скапливаться не
нейтрофилы (полиморфно-ядерные
лейкоциты), а моноциты, тканевые
макрофаги, лимфоциты и их произ-
170
•_нтен-
тся не
: и ве-
:темы,
•.е пеп-
Т'фагах
тндам,
дят к
•лов ,и
-тения.
*> так-
та.
-ескую
: :тека-
типер-
- Т’ВНОМ
:в. Ча-
те. на-
терши
-дучае
:з. что
сию и
денных
•р. вы-
хтвую-
гдя мо-
те еспе-
те-тения
люще-
т.лжен
-? оче-
тлтель-
тттации
г:рода,
г тяция
’•тльше
» чожет
Х.ТЛ ис-
ici зовет
е. пер-
.3 эчаге
воз-
r-ся не
серные
t-тевые
I произ-
водные. Скопление мононуклеарных
клеток в воспалительной ткани полу-
чило название мононуклеарного ин-
фильтрата, или гранулемы. Образова-
ние гранулемы служит предпосылкой
к первично-хроническому течению
воспаления.
В отличие от острого хроническое
воспаление начинается не с наруше-
ний микроциркуляции и каскада по-
следующих событий в сосудистом рус-
ле, а с накопления активированных,
или раздраженных, макрофагов в ка-
ком-либо участке тела. Чаще это слу-
чается во внутренних органах, где и в
норме присутствует много макрофа-
гов. К таким органам относится пе-
чень, легкие, головной мозг, селезен-
ка, кишечник. Некоторые микробы
поглощаются макрофагами, но оказав-
шись в фагосоме, не погибают, а, бо-
лее того, могут даже размножаться
внутри клетки. В таком случае макро-
фаги активируются и непрерывно сек-
ретируют медиаторы воспаления, ко-
торые можно подразделить на пять
групп.
1. Гидролитические ферменты: ли-
зосомальные гидролазы, нейтральные
протеазы.
2. Медиаторы, образуемые из ли-
пидов: простагландины, лейкотриены,
фактор, активирующий тромбоциты.
3. Факторы, влияющие на сверты-
ваемость крови: тромбопластин (про-
коагулянт), активатор плазминогена
(антикоагулянт).
4. Микробицидные факторы: супер-
оксидрадикал, пероксид водорода.
5. Компоненты комплемента альтер-
нативного каскада: С4, С2, СЗ, С5.
К возбудителям, паразитирующим
в макрофагах, относятся микобактерии
туберкулеза, проказы, возбудители
листериоза, токсоплазмоза, лейшма-
ниоза, бруцеллеза и других хрониче-
ски протекающих инфекционно-воспа-
лительных заболеваний. Макрофаги мо-
гут переходить в активное состояние
не только под действием микробов,
которые в них паразитируют, но и под
влиянием лимфокинов — продуктов
сенсибилизированных лимфоцитов из
очага воспаления (от греч. kineo — при-
водить в движение)
Как только в ткани накапливается
необходимое число активированных
макрофагов, возникают условия для
дальнейшего увеличения участка мо-
нонуклеарной инфильтрации. Это свя-
зано с тем, что активированные мак-
рофаги выделяют хемоаттрактанты,
привлекающие в очаг новые клетки.
Это лейкотриены С4 и D4, проста-
гландины группы Е. В то же время ак-
тивированный макрофаг выделяет ве-
щества, из которых в последующем
образуются хемоаттрактанты. К ним
относятся С2-, С4-, С5-, Сб-фракции
комплемента, которые затем активи-
руются в молекулы СЗа, СЗв, С5а,
с высокой биологической активностью.
В этом превращении важную роль иг-
рают протеолитические ферменты, сек-
ретируемые теми же макрофагами.
Макрофаги не только формируют
градиент концентрации хемоаттрак-
тантов, но и повышают проницаемость
микрососудов. В этом плане особенно
активны такие секреты макрофагов,
как лейкотриены, фактор агрегации
тромбоцитов, супероксидрадикал, кол-
лагеназа, активатор плазминогена и
другие протеазы. Они либо разрыхля-
ют (повышают проницаемость) мемб-
раны микрососудов, либо вызывают
сокращение эндотелиоиитов и обнаже-
ние межэндотелиальных щелей, или
оказывают то и другое действие.
В результате ускоряется выход лей-
коцитов (прежде всего моноцитов и
лимфоцитов) из крови в ткань, где
они присоединяются к другим клет-
кам мононуклеарного инфильтрата.
Лимфоциты поступают в инфильтрат
не только с кровью, но и с лимфой.
171
Моноциты в инфильтратах выделя-
ют фибронектин. Благодаря этому бел-
ку они прочно связываются с соеди-
нительной тканью (заякориваются) и
дифференцируются в зрелые макрофа-
ги. С момента заякоривания моноци-
ты и макрофаги приступают к актив-
ному фагоцитозу.
В реальных условиях макрофаги ра-
ботают не в изоляции, а в комплексе
с другими типами клеток, также вхо-
дящих в состав гранулемы. Хорошо
изучена функциональная взаимосвязь
между макрофагами и лимфоцитами,
необходимая для иммунного ответа.
Макрофаги поглощают и перерабаты-
вают антигены в своих фаголизосомах.
В модифицированном виде эти анти-
генные детерминанты вновь всплыва-
ют на цитоплазматическую мембрану
макрофага. Здесь они вступают в ком-
плексную связь с la-молекулами. По-
следние представляют собой белки,
синтез которых находится под конт-
ролем генов, детерминирующих силу
иммунного ответа. Только в таком со-
четании с la-молекулой антиген рас-
познается лимфоцитом, в мембране
которого для этих целей имеются спе-
циальные участки, или сайты (от англ.
site — место). Взаимодействия между
макрофагом и лимфоцитом, лежащие
в основе иммунного ответа, можно
назвать антигензависимыми. Они разыг-
рываются не только в лимфоидных
органах, но и в самой гранулеме. Луч-
ше всего эти взаимодействия просле-
живаются при инфекционном воспа-
лении, которое протекает с явления-
ми аллергии замедленного типа.
Взаимодействие макрофагов с лим-
фоцитами может осуществляться не-
зависимо от иммунного ответа. Этот
канал связи можно обозначить как ан-
тигеннезависимый. При этом активиро-
ванные макрофаги выделяют цитоки-
ны (о- и [3-интерлейкин-1), усилива-
ющие рост лимфоцитов и повыша-
ющие их активность, а лимфоциты вы-
деляют лимфокины, активирующие
макрофаги. К ним относятся лимфо-
кины: тормозящие миграцию макро-
фагов; усиливающие слияние макро-
фагов друг с другом и образование ги-
гантских многоядерных клеток; повы-
шающие микробицидный потенциал
макрофагов.
Хроническое мононуклеарное вос-
паление в отличие от острого воспа-
ления не может закончиться быстро
по нескольким причинам.
Во-первых, макрофаги в очаге вос-
паления имеют продолжительный жиз-
ненный цикл, они персистируют в
гранулеме в течение нескольких недель
и даже месяцев. Особенно медленно
возобновляются макрофаги в застаре-
лых гранулемах.
Во-вторых, гранулема — это не за-
стывшее образование. В нее постоян-
ным потоком с кровью следуют все
новые и новые моноциты, и размеры
гранулемы увеличиваются. Активиро-
ванные макрофаги в гранулеме выра-
батывают гемопоэтины, которые сти-
мулируют образование моноцитов в
костном мозге. До тех пор, пока под-
держивается секреция гемопоэтинов,
приток клеток в инфильтрат будет
нарастать.
В третьих, в очагах хронического
воспаления сохраняется источник ан-
тигенной стимуляции, поскольку мик-
робы персистируют в макрофагах. От-
сюда макрофаги постоянно стимули-
руются продуктами сенсибилизиро-
ванных лимфоцитов и секретируют
медиаторы воспаления.
В-четвертых, активированные мак-
рофаги выделяют большое количество
Н2О2, О2 и повреждают другие клет-
ки в зоне воспаления.
В макрофагах, кроме того, имеется
антиоксидантная система аварийной
нейтрализации биоокислителей, кото-
рые необходимы для санации очага
: ~Ы ВЫ-
: тощие
~имфо-
чакро-
чакро-
u-ие ги-
i товы-
►нциал
т-е вос-
зоспа-
:ыстро
ате вос-
ЬЙ жиз-
»гуют в
-:едель
казенно
гдттаре-
г не за-
СС7ОЯН-
•хт все
гг.меры
~:зиро-
с зыра-
ё СТИ-
l сов в
кд под-
ГДНОВ,
эудет
некого
е:к ан-
г мик-
хл. От-
я.чули-
зг.лро-
дуют
к мак-
'г-ество
: <лет-
меется
НИНОЙ
. кэто-
: чага
воспаления. В эту систему входят фер-
менты каталаза, глютатионпероксида-
за и глютатионредуктаза. Хроническое
воспаление поддерживает нарушения
в системе антиоксидантной зашиты в
макрофагах.
Хроническое воспаление периоди-
чески обостряется, когда в очаг по-
ступают нейтрофилы и свежие мак-
рофаги с высоким флогогенным дей-
ствием. В гранулеме может идти де-
струкция соединительной ткани. В от-
вет на это происходит разрастание
новых волокнистых структур, что мо-
жет завершиться склерозом с частич-
ным или полным выключением спе-
циализированных функций органа.
Именно это приходится наблюдать при
циррозах печени после вирусного ге-
патита, при хронических пневмони-
ях, гломерулонефритах и воспалитель-
ных процессах другой локализации.
Барьерная функция воспаления.
В условиях воспалительной реакции в
организме формируются различные
барьеры, предназначенные для лока-
лизации болезнетворного агента, его
иммобилизации и уничтожения. За-
щитные механизмы тканей развивают-
ся вскоре после действия патогенного
фактора. Одним из важнейших явля-
ется сосудистый барьер, назначение
которого заключается в возникнове-
нии венозного и лимфатического за-
стоя и стаза, а также тромбоза, что
препятствует распространению пато-
генного фактора за пределы повреж-
денной ткани. В экспериментах на жи-
вотных установлено, что введение
смертельных доз яда (цианистого ка-
лия, стрихнина) в очаг воспаления не
приводит к их гибели.
В результате резкого увеличения
проницаемости и повышения гидро-
статического давления в сосудах мик-
роциркуляторного русла, а также уве-
личения коллоидно-осмотического
давления в тканях развивается экссу-
дация, в результате которой в зону
действия патогенного фактора посту-
пают защитные белки крови и клеточ-
ные элементы. К защитным белкам
относятся различные бактерицидные
факторы, а также фибриноген, кото-
рый переходит в фибрин в результате
активации прокоагулянтной системы
тканевыми и гуморальными фактора-
ми. Нити фибрина, пронизывая очаг
воспаления, также выполняют барь-
ерную функцию, так как на них фик-
сируются болезнетворные факторы и
они легче подвергаются фагоцитозу.
Формированию защитных механиз-
мов при воспалении важная роль при-
надлежит клеточным барьерам. Уже
через 30 мин — 1 ч в очаг воспаления
через межэндотелиальные щели миг-
рируют нейтрофильные лейкоциты,
создающие «нейтрофильный» барьер.
Основной функцией полиморфно-
ядерных лейкоцитов является фагоци-
тоз болезнетворных факторов, т.е. осу-
ществление неспецифической клеточ-
ной защиты. Кроме того, нейтрофиль-
ные лимфоциты при разрушении
выделяют бактерицидные субстанции
(лизоцим, лактоферрин, катионные
белки, |3-лизины, миелопероксидазу),
а также лизосомальные ферменты, ко-
торые выполняют защитные функции.
Нейтрофилы в очаге воспаления жи-
вут довольно короткое время, так как
они быстро разрушаются в кислой сре-
де и в условиях гиперосмолярности.
Количество этих клеток в жизнеспо-
собном состоянии быстро уменьшает-
ся, и примерно через 12 ч после нача-
ла острого воспаления в ткани начи-
нают преобладать макрофаги. Они бо-
лее устойчивы к кислой среде в очаге
воспаления и поэтому их функция в
ткани осуществляется более длитель-
ное время по сравнению с нейтрофи-
лами.
Основной функцией следующего
клеточного барьера — макрофагалыю-
173
го — также является фагоцитоз и пе-
реваривание патогенных агентов, при-
чем более крупных, чем объекты, фа-
гоцитируемые нейтрофилами. Однако
макрофаги в отличие от нейтрофилов
в большинстве тканей осуществляет
расщепление болезнетворного агента
не до конечных продуктов, а до мак-
ромолекулярных структур, которые
образуют информационные иммуно-
генные, включаюшие Т- и В-системы
лимфоцитов и иммунные механизмы
зашиты.
Макрофаги фагоцитируют и рас-
творенные вещества путем их пино-
цитоза. Они также выделяют факторы
неспецифической гуморальной защи-
ты: лизосомальные ферменты, очища-
ющие очаг воспаления от некротизи-
рованных тканей путем их лизиса. Бла-
годаря бактерицидным веществам
(лизоцим, интерферон и др.), а так-
же факторам роста, стимулирующим
образование и активность фиброблас-
тов и капилляров, в очаге воспаления
стимулируются репаративные процес-
сы, ограничивающие поврежденные
ткани от здоровых.
Важная барьерная функция при-
надлежит также и лимфатической си-
стеме. Болезнетворный фактор попа-
дает в лимфатические сосуды и во-
влекает их в воспалительный процесс.
Эндотелиальные клетки набухают, вы-
деляют прокоагулянты, поэтому в
лимфатических сосудах образуется
тромб, состоящий в основном из фиб-
рина и затрудняющий распростране-
ние патогенного агента, особенно кор-
пускулярного, за пределы очага вос-
паления. Кроме того, в лимфатических
сосудах резко усиливается функция
макрофагов.
Вовлечение лимфатических сосудов
в воспалительный процесс клиниче-
ски проявляется в виде лимфангиита.
Барьерной функцией в тканях обла-
дают и небольшие скопления лимфо-
идной ткани, называемые неинкапсу-
лированными фолликулами, которые
беспорядочно рассеяны по рыхлой со-
единительной ткани, находящейся под
эпителием, однако их можно видеть и
в других тканях. Функция лимфатиче-
ских фолликулов заключается в обра-
зовании лимфоцитов, которые явля-
ются источником плазматических кле-
ток — продуцентов антител.
Если воспалительный процесс до-
стигает лимфатического узла, то он
становится мощным барьером на пути
распространения патогенного факто-
ра. Лимфа и содержащиеся в ней па-
тогенные факторы фильтруются через
синусы, содержащие фагоциты. В си-
нусах лимфатического узла при вос-
палении усиливается фагоцитоз, а так-
же возникает отек, вследствие чего
увеличивается давление внутри узла,
что сдавливает как приносящие, так
и отводящие лимфатические сосуды.
Это не только препятствует распро-
странению болезнетворного агента в
общую лимфоциркуляцию и далее в
кровеносную систему, но и создает оп-
тимальные условия для уничтожения
патогенного фактора во всем регионе
от очага воспаления до лимфатиче-
ского узла.
Однако частично патоген может
преодолеть и лимфатический барьер,
и тогда он поступает в общую лимфа-
тическую, а оттуда — в кровеносную
систему.
В системе гемоциркуляции болез-
нетворный агент частично инактиви-
руется благодаря наличию в крови
системы клеточной (фагоцитарной) и
гуморальной защиты. Наиболее актив-
ным в сосудах является фагоцитоз,
осуществляемый клетками — микро-
и макрофагами, фиксированными на
стенках сосудов микроциркуляторно-
го русла — капилляров и венул.
При попадании патогенного фак-
тора из сосудов в ткань он также под-
174
ИИ?-
-_mcy-
торые
: й со-
-?под
деть и
-?иче-
: ебра-
: ЧВЛЯ-
кле-
--- до-
"□ он
-- пути
:_кто-
ш па-
-:ерез
। В си-
вос-
_так-
чего
•< .-зла,
так
- ‘-УДЫ.
' .:лро-
- -- та в
—нее в
ее оп-
* ения
ионе
.~иче-
эжет
-рьер,
'фа-
.<;ную
:<лез-
•тиви-
лови
- :й) и
_<тив-
-?Л03,
:<ро-
-.л на
.эно-
эак-
-- под-
вергается разрушению системой фаго-
цитов, воздействию факторов неспе-
цифической гуморальной защиты и
механизмов иммунологической рези-
стентности. Очень активен фагоцитоз
в легочной ткани, где имеются хоро-
шие условия для деятельности макро-
фагов.
Кроме того, токсические вещества
с кровью попадают в печень, где со-
единяются с кислотами с образовани-
ем малоактивных соединений, а так-
же подвергаются окислению или уда-
лению с желчью. Низкомолекулярные
вещества фильтруются в почечных
клубочках и выделяются с мочой.
Слюнные и другие железы внешней
секреции также выделяют патогенные
факторы, которые в этих секретах со-
единяются с гликопротеидами и ста-
новятся значительно менее активны-
ми. Как видно, патогенный фактор по-
падает в ткани, в которых капилляры
имеют высокую проницаемость.
Таким образом, в воспалительный
процесс вовлекается не только ткань,
поврежденная болезнетворным аген-
том, но и весь организм, участвующий
в борьбе за сохранение постоянства
внутренней среды.
Барьерные функции организма
иногда оказываются недостаточными
для защиты. Чаще всего возникает де-
фект клеточных барьеров. Нарушения
этого барьера происходят в результате
лейкопении различного происхожде-
ния, например, при угнетении дея-
тельности костного мозга вследствие
интоксикации, облучения, генетиче-
ских дефектов и др. Качественная не-
полноценность лейкоцитов связана с
недостаточностью их фагоцитарной и
переваривающей активности, напри-
мер, при снижении активности фер-
ментов, особенно фосфатазы, сниже-
нии продукции активных метаболитов
кислорода. Лейкопении, вызываемые
введением цитостатических препара-
тов, облучением или другими факто-
рами, ослабляют развитие воспали-
тельного отека, уменьшают интенсив-
ность местных тканевых реакций и
общей реакции организма на воспа-
ление. В этих условиях происходит за-
тяжное течение острого воспаления,
механизмы которого рассмотрены ра-
нее.
4.5. Сущность
и биологическое
значение воспаления
На протяжении веков было много
различных точек зрения на воспале-
ние как на патологический процесс.
Однако только в прошлом веке Р. Вир-
хов впервые сформулировал теорию
воспаления. Сущность этой теории сво-
дилась к тому, что под влиянием бо-
лезнетворного фактора происходит
пролиферация клеток соединительной
ткани, накопление в них питательно-
го материала, увеличение клеток в
объеме, деление и образование боль-
шого числа молодых не дифферен-
цированных клеток. Поэтому теория
Р. Вирхова названа нутритивной («пи-
тательной»), Клетки, по теории Р. Вир-
хова, «гибнут от переедания». По мне-
нию Р. Вирхова, все клетки при вос-
палении имеют местное происхожде-
ние, он не признавал клеток-пришель-
цев и считал, что сосудистая реакция
имеет второстепенное значение, так
как этот патологический процесс мо-
жет протекать и в бессосудистой сре-
де. а сосудистая система только до-
ставляет питательный материал. Р. Вир-
хов не признавал защитно-приспосо-
бительной роли воспалительного про-
цесса. В 1867 г. Ю. Конгейм, ученик
Р. Вирхова, опубликовал свои опыты,
проведенные на брыжейке лягушки.
Этот известный опыт Ю.Конгейма
благодаря точности методики и до-
175
ступности привлек большое внимание.
В изучении патогенеза воспаления
главным моментом стала сосудистая
реакция, без которой, по теории
Ю. Конгейма, нет воспаления. Одна-
ко, данная теория хорошо объясняла
явления со стороны сосудов, но весь
воспалительный комплекс оставляла
без достаточного внимания и поэтому
вызвала много возражений.
И. И. Мечников в лекциях по срав-
нительной патологии привел данные
о сущности воспаления с точки зре-
ния сравнительной патологии. Он ис-
следовал воспаление на различных
классах животного мира, начиная с
простейших. Так, если амебу заразить
микросферой, то она либо погибает,
либо переварит ее или отторгнет с ча-
стью цитоплазмы. Иначе говоря, в од-
ноклеточном организме питание совме-
щено с защитой. У многоклеточных,
например двухслойных, животных
(гидры), состоящих из производных
экто- и эндодермы, в ответ на раздра-
жение действуют клетки эндодермаль-
ного слоя. При этом так же, как у од-
ноклеточных, функции питания и за-
щиты в этих клетках совмещены.
У трехслойных организмов (губки)
наибольшее значение в воспалитель-
ной реакции имеет средний — мезо-
дермальный — слой, который содер-
жит амебовидные клетки, сходные с
лейкоцитами, способными к фагоци-
тозу и обладающими хемотаксисом.
При введении в толщу колокола ме-
дузы инородного тела на другой день
возникает белое пятно около места по-
вреждения, состоящее из амебовидных
клеток мезодермального происхожде-
ния. Эти клетки мигрируют к месту
повреждения через всю толщу массы
животного, несмотря на то что у ме-
дузы нет кровеносных сосудов.
У низших червей имеется незамк-
нутая кровеносная система, и она не
реагирует на воспаление, а подвиж-
ные клетки — фагоциты — так же, как
у медузы, мезодермального происхож-
дения, скапливаются в фокусе воспа-
ления. У высших червей существует
замкнутая кровеносная система, но и
она не реагирует на воспаление, ко-
торое протекает по такому же типу,
как и у низших червей.
Следующая ступень эволюционно-
го развития животного мира — рыбы.
Они имеют хорошо развитую замкну-
тую кровеносную систему, которая
реагирует на воспаление так же, как у
всех позвоночных, включая амфибий.
Сосудистая реакция при воспале-
нии в онтогенезе повторяет сосуди-
стую реакцию в филогенезе. Напри-
мер, у 10 — 15-дневнсго зародыша ас-
колотля в плавнике отсутствуют со-
суды и на воспаление реагируют звез-
дчатые клетки мезодермального слоя,
которые являются фагоцитами. Затем,
когда в плавнике прорастают крове-
носные сосуды, они вначале не реа-
гируют на раздражитель, как у чер-
вей, и лишь незадолго до рождения
аксолотля формируется сосудистая
реакция.
Сущность воспалительного процес-
са состоит в фагоцитарной реакции
живого организма, которая проявля-
ется вне зависимости и наличия у него
кровеносной системы. Все остальные
реакции, в том числе реакция сосу-
дистой системы, направлены на уве-
личение и облегчение притока фаго-
цитов к поврежденной зоне. В отли-
чие от И. И. Мечникова Р. Вирхов и
Ю. Конгейм видели сущность воспа-
лительной реакции в отдельных явле-
ниях. Через 20 лет после И. И. Мечни-
кова, в 1923 г., Г.Шаде предложил
физико-химическую трактовку воспа-
ления. Он показал, что в начале раз-
вития воспаления под действием па-
тогенного агента происходит значи-
тельное повышение тканевого обмена
(«пожар обмена»), увеличение концен-
176
ц. как
» -2Х0Ж-
: юзпа-
д.гвует
к_ но и
вне. ко-
fc типу,
kJ :нно-
- ?ыбы.
*. нкну-
•торая
каку
шсн.бий.
ы гпале-
- -уди-
~-при-
ь_:а ас-
* - : Co-
S'- звез-
г слоя,
-етем,
‘ гове-
ее реа-
чер-
1 -гения
"•глетая
-тгоцес-
ЯСтКЦИИ
гк звля-
и-". него
пт ьные
к сосу-
-1 уве-
к. эаго-
i 1Т.ТИ-
»Г - ов и
ь >.спа-
кз. твле-
« ечни-
—' ЭЖИЛ
>:спа-
се раз-
веч па-
лачи-
смена
.. цен-
трации ионов водорода и повышение
осмотического давления. В этой теории
также делается акцент на отдельных
сторонах данного процесса.
Согласно современному учению
воспаление является патологическим
процессом, в котором имеются эле-
менты как повреждений, так и защи-
ты. Развиваясь филогенетически как
приспособительно-защитная реакция,
она сохраняет эти свойства в целост-
ном организме. Защитной реакцией
при воспалении является фагоцитоз,
а также активация ретикулоэндотели-
альной системы, в частности плазма-
тических клеток, которые являются
продуцентами антител. Блокирование
кровеносных и лимфатических путей
также имеет защитное значение, так
как из очага воспаления ограничива-
ется всасывание токсинов и продук-
тов распада тканей. Большое значение
имеет возникновение демаркации вос-
паления на границе с омертвевшими
тканями. Это приводит либо к изоля-
ции омертвевшего очага с помощью
грануляционной ткани, либо к оттор-
жению его от живой части органа. За-
щитное значение имеют некоторые
биохимические сдвиги как в самом
воспалительном очаге, так и в целост-
ном организме.
Однако воспаление, являясь фило-
генетически зашитно-приспособитель-
ной реакцией, включает и элементы
повреждения, наносящие ущерб орга-
низму. Причем то, что должно иметь
защитный характер, может приобре-
сти и противоположное, вредное зна-
чение. Например, экссудация, с од-
ной стороны, приводит к ускорению
завершения воспалительного процес-
са, так как с экссудатом к очагу по-
вреждения подходят лейкоциты, фер-
менты, но, с другой стороны, этот эк-
ссудат может распространиться и на
другие ткани и вызвать там развитие
воспалительного процесса. При гипер-
ергии, т.е. чрезмерной реакции тканей
на болезнетворный фактор, может
развиться некроз значительной части
органа, что приведет к состоянию,
несовместимому с его деятельностью,
а также системы и организма в целом.
4.6. Воспаление
в челюстно-лицевой
области
Этиология, роль микрофлоры. Вос-
палительные заболевания челюстно-
лицевой области, как правило, име-
ют инфекционную природу. Даже тог-
да, когда повреждение тканей вызва-
но механическими, физическими или
химическими факторами, всегда зона
повреждения оказывается в большей
или меньшей степени обсеменена
микроорганизмами, которые поступа-
ют в зону альтерации со слизистых
оболочек, с кожи или привносятся из
внешней среды.
В зависимости от локализации
«входных ворот» для микроорганизмов
различают одонтогенные, стоматоген-
ные, тонзиллогенные, риногенные,
отогенные, дерматогенные острые и
хронические воспалительные процес-
сы челюстно-лицевой области и шеи.
В подавляющем большинстве слу-
чаев воспалительные процессы явля-
ются одонтогенными, т.е. микроорга-
низмы попадают в ткань через частич-
но или полностью некротизированную
пульпу зуба, либо через пародонталь-
ные карманы.
Характерной чертой резидентных
бактерий, которые могут определять
развитие воспаления в челюстно-ли-
цевой области, является колонизация,
инвазивность и токсикогенность.
При гнойных воспалительных про-
цессах выявляется смешанная аэроб-
ная и анаэробная микрофлора. Пре-
имущественно обнаруживаются грам-
177
отрицательные формы — бактероиды
и фузобактерии, грамположительные
кокки и в небольшом количестве грам-
положительные бактерии — лактоба-
циллы, актиномицеты, клостридии
и т.д.
Анаэробная флора присутствует в
85 % случаев при развитии абсцесса в
челюстно-лицевой области. При этом
более чем в половине случаев отмече-
но наличие смешанной анаэробно-
аэробной флоры. При воспалительных
заболеваниях челюстно-лицевой обла-
сти выделяют преимущественно фа-
культативные и анаэробные бактерии
с превалированием последних. Мик-
роорганизмы, встречающиеся при вос-
палительных заболеваниях в челюст-
но-лицевой области, продуцируют
экзотоксины и ферменты, такие как
коллагеназа, эластаза, фибринолизин,
гиалуронидаза и др.
Анаэробные микроорганизмы вы-
деляют факторы патогенности (фер-
менты — нейраминидазы, гиалурони-
дазы, декарбоксилазы аминокислот и
других соединений; эндотоксины —
липополисахариды клеточной стенки
грамотрицательных бактерий; адгези-
ны — липотейхоевые кислоты; анти-
фагоцитарные факторы и т.д.).
Патогенный потенциал бактерий
определяется как прямым поврежда-
ющим действием вырабатываемых ими
продуктов, так и запуском иммунно-
го ответа на антигены микробов.
Продукты жизнедеятельности мик-
роорганизмов — токсины и фермен-
ты — оказывают не только прямое по-
вреждающее действие на ткани, но и
опосредованно инициируют эндоген-
ные механизмы в развитии воспале-
ния. К веществам, синтезируемым
микроорганизмами и патологически
измененными тканями полости рта.
относятся жирные кислоты, альдеги-
ды, кетоны и другие, прямо или опо-
средованно инициирующие воспале-
ние. Эти вещества находятся в рото-
вой жидкости и воздушной среде по-
лости рта. Развитие современных на-
учных технологий позволяет с высо-
кой точностью определить концент-
рацию этих веществ в средах полости
рта.
Являясь нормальными метаболита-
ми для факультативной и облигатной
анаэробной микрофлоры, летучие ко-
роткоцепочечные жирные кислоты
выполняют функцию энергообеспече-
ния ее некоторых видов.
Низкомолекулярные метаболиты
сахаролитической микрофлоры, в пер-
вую очередь летучие жирные кисло-
ты, лактат и другие, обладают замет-
ным бактериостатическим эффектом.
Они способны ингибировать рост саль-
монелл, дизентерийных шигелл, мно-
гих грибов, энтеропатогенной кишеч-
ной палочки. Короткоцепочечные жир-
ные кислоты препятствуют адгезии
патогенной микрофлоры к эпителию
и способствуют проникновению в сли-
зистую оболочку молекул воды, ионов
К+, Na". Поступившие в эпителиоци-
ты такие молекулы утилизируются да-
лее в митохондриях и используются в
реакциях цикла Кребса: через ацетил-
КоА — уксусная и масляная кислоты
(Р-окисление), через сукцинил-КоА —
также масляная и пропионовая кис-
лоты при карбоксилировании.
Изоформы короткоцепочечных
жирных кислот возникают как резуль-
тат протеазной, а не сахаролитиче-
ской активности микрофлоры. Повы-
шенное содержание изокислот свиде-
тельствует о чрезмерной, аномальной
протеолитической активности микро-
флоры. Источником изоформ кислот
могут быть пептострептококки, пеп-
тококки, бактероиды, клостридии,
а изокапроновой кислоты — в допол-
нение еще грибы рода кандида.
Продукты жизнедеятельности ана-
эробной микрофлоры (в том числе
и .
V
Т.
не "
б.'
я---
л-
-Т
и
ус
Ф '
м.
м.
тс.
те
ер
д;
Р'-’
ле
Mi
дс.
гс-
пе
г,-
лг
Н'. "
п;
к:
ф.
Р
КС
9е
К:
31 -
се
И.
VC
0.
ш
р-
м:
II.'
не
178
I» 5 7OTO-
Хгде ло-
на-
f :oICO-
к. -_ент-
► ~ :ости
ii'.< тита-
И Д7НОЙ
е ко-
Klt - 7 оты
•»*. 7ече-
<* литы
ь : пер-
► < :гло-
г ^мет-
►эс 'ДОМ.
fcr ;пь-
fc.. >'НО-
►шеч-
В»с кир-
езии
ЯВГгЛИЮ
Чр» : :ли-
Чрк. : нов
?ци-
ЦН" - -- да-
' гя в
нД'ИЛ-
клэты
- X -
Д1С-
f НЫХ
и короткоцепочечных жирных кислот)
участвуют в патогенезе воспаления.
Так, бутират модулирует хемотаксис
нейтрофилов. Ацетат, пропионат, изо-
бутират, бутират, изовалериановая и
янтарная кислоты подавляют деграну-
ляцию нейтрофилов и выделение ими
лизоцима. Они снижают пролифера-
цию гингивальных кератиноцитов,
усиливают их апоптоз и некроз.
Жирные кислоты, особенно их изо-
формы, из-за большей молекулярной
массы вызывают деполяризацию плаз-
матических мембран и увеличивают,
таким образом, проницаемость эпи-
телиальных и гематотканевых барь-
еров.
Являясь главными побочными про-
дуктами метаболизма анаэробов, ко-
роткоцепочечные жирные кислоты
легко проникают через биологические
мембраны, подавляют пролиферацию
десневых фибробластов, а также фа-
гоцитоз, хемотаксис и дегрануляцию
полиморфно-ядерных лейкоцитов. Они
также угнетают Т- и В-клеточную про-
лиферацию. Выявлена градация актив-
ности жирных кислот:
масляная > изовалериановая > про-
пионовая.
Особая роль отводится масляной
кислоте, которая является общим
фактором вирулентности Р. gingivalis,
Р. loescheii, F. nucleatum и даже в низ-
кой концентрации подавляет на 92 —
96 % Т- и В-клеточную пролиферацию.
Кроме того, масляная кислота тормо-
зит продукцию иммуноглобулинов и
стимулирует продукцию моноцитами
ИЛ-ip, обладающего способностью
усиливать резорбцию костной ткани.
Ослабление Т-клеточной пролифера-
ции происходит посредством ингиби-
рования летучими жирными кислота-
ми секреции ИЛ-2, ИЛ-4, ИЛ-5, ИЛ-6,
ИЛ-10.
Таким образом, короткоцепочеч-
ные жирные кислоты — это бактери-
альные токсины, способные к инги-
бированию иммунного ответа организ-
ма, что показывает их важную роль в
патогенезе воспаления.
Значение реактивности. В зависимо-
сти от реактивности организма и ви-
рулентности микрофлоры воспаление
может протекать по нормергическому,
гипергическому и гиперергическому
типам.
При нормергическом типе воспали-
тельной реакции время, прошедшее от
момента появления первых клиниче-
ских симптомов до развития выражен-
ного гнойного воспалительного про-
цесса и обращения больного к врачу,
составляет в среднем 1,5 — 3,0 сут. Бо-
левой синдром выражен умеренно,
боль усиливается при функциональных
нагрузках. Температурная реакция в
пределах 37,5 —38,5 °C. Как правило,
воспалительный процесс поражает
одну анатомическую область. Степень
нарушения функций (глотания, жева-
ния, речи и т.д.) соответствует объе-
му и локализации поражения. Симпто-
мы интоксикации (озноб, нарушение
вегетативных функций, деятельности
кишечника, состояния сознания) вы-
ражены умеренно, т.е. нормергия ха-
рактеризуется нормальным ответом
организма на воспалительный про-
цесс.
Со стороны иммунологических и
неспецифических показателей рези-
стентности для нормергического вос-
паления характерно увеличение фаго-
цитарной активности лейкоцитов. Так-
же происходит увеличение концент-
рации IgG в 2 раза, отмечается тен-
денция к увеличению IgM. Со сторо-
ны показателей клеточной защиты
существенных изменений не происхо-
дит. Это свидетельствует о том, что при
нормергическом воспалении происхо-
дит усиление гуморальной защиты на
фоне нормального уровня клеточного
иммунитета.
179
При гипергическом (вялотекущем)
типе воспалительной реакции время,
прошедшее с момента появления пер-
вых клинических симптомов до раз-
вития выраженной картины воспале-
ния, составляет более трех суток. За-
болевание начинается незаметно, при
удовлетворительном самочувствии
больного, что увеличивает интервал
времени до обращения за медицин-
ской помошью. Часто больные само-
стоятельно применяют согревающие
компрессы, грелки, тем самым спо-
собствуя распространению воспале-
ния.
Клинически болевой синдром вы-
ражен слабо либо не выражен. Часто
боль беспокоит только при касании и
функциональных нагрузках. Темпера-
тура тела либо в пределах субфебриль-
ных цифр, либо не повышается. Чаще
воспалительным процессом поража-
ется две и более анатомические об-
ласти. Степень ограничения функций
выражена значительно. Симптомы
интоксикации не выражены. При
вскрытии гнойного очага на фоне об-
ширной инфильтрации тканей полу-
чают незначительное количество
гноя.
При гипергическом воспалении фа-
гоцитарная активность лейкоцитов со-
ответствует значениям, полученным у
здоровых доноров, или отклоняется
незначительно, чаще в сторону сни-
жения. Наблюдается тенденция к сни-
жению клеточной иммунологической
защиты на фоне повышения уровня
гуморальной (увеличение содержания
IgG), что носит компенсаторный ха-
рактер.
При гиперергическом типе воспали-
тельной реакции заболевание развива-
ется быстро, порой молниеносно,
в течение 0,5 — 1,0 сут, реже —1,5 сут.
Температура тела выше 38,5 °C. Боле-
вой синдром, степень ограничения
функций, симптомы интоксикации
резко выражены. Воспаление распро-
страняется на две и более анатомиче-
ские области. При вскрытии гнойного
очага получают стабильное количество
гноя.
Такие клинические показатели, как
сроки гноетечения, экссудации и по-
явление видимых грануляций, увели-
чены при гиперергии и в еще боль-
шей степени при гипергии по сравне-
нию с нормергией.
Для гиперергического воспаления
характерно усиление фагоцитоза в 3 —
4 раза и более по сравнению с обще-
принятой нормой, нормальный уро-
вень показателей клеточной зашиты и
нормальный или несколько повышен-
ный уровень гуморального иммуните-
та (особенно повышение концентра-
ции IgM). Это может свидетельствовать
о том, что гиперергия обеспечивает-
ся, прежде всего, значительным уси-
лением фагоцитоза.
Контрольные вопросы
1. Что такое острое неспецифическое
воспаление?
2. Назовите этиологические факторы
острого неспецифического воспаления.
3. Какие компоненты воспаления вам
известны?
4. Назовите клинические признаки ос-
трого неспецифического воспаления.
5. Перечислите стадии и механизмы раз-
вития сосудистых реакций при воспалении.
6. Какие плазменные и клеточные ме-
диаторы принимают участие в развитии
острого воспаления? Объясните их про-
исхождение и эффекты.
7. Каковы механизмы развития воспа-
лительного отека (экссудации)?
8. Назовите и охарактеризуйте эндоген-
ные и экзогенные хемоаттрактанты.
9. Какие виды экссудатов вам извест-
ны?
- ИЯ
-ЛИИ
~?0-
• >:че-
- эго
ГЛАВА 5
ЛИХОРАДКА
как
• ~o-
гели-
"<ль-
Lsne-
гния
гле-
эо-
Ь»~Ы И
ЛШи_ен-
Ши- :те-
•К’ ~ра-
ШВВ дать
"•вннает-
* гИ.
Hi »
.кое
ры
зам
эс-
?аз-
-ии.
че-
ТИИ
~эо-
ЙШВ -;н-
•газет-
5.1. Механизмы
регуляции температуры
тела
Температура оказывает существен-
ное влияние на скорость протекания
химических реакций. В этой связи тем-
пературная константа организма вы-
ступает как важный фактор, предоп-
ределяющий динамические характери-
стики клеточного метаболизма.
Температура тканей устанавливает-
ся в ходе соотношения метаболиче-
ской продукции тепла и рассеивания
образующейся теплоты в окружающую
среду. В процессе эволюционного раз-
вития у млекопитающих и птиц выра-
ботались сложные физиологические
механизмы, поддерживающие темпе-
ратуру тела на постоянном уровне,
независимо от колебаний внешней
температуры.
Таких животных называют гомойо-
термными в отличие от пойкилотерм-
ных, не способных поддерживать тем-
пературу своего тела на постоянном
уровне. Гомойотермные организмы об-
ладают гораздо большими возможно-
стями адаптироваться к среде обита-
ния по сравнению с пойкилотермны-
ми благодаря стабильности функцио-
нирования физиологических систем,
в частности ЦНС, обеспечивающей це-
лостные приспособительные реакции
на экзо- и эндогенные раздражители.
Гомойотермия человека формиру-
ется в онтогенезе. Терморегуляция но-
ворожденных весьма несовершенна,
однако по мере роста и развития че-
ловеческого организма она довольно
быстро формируется.
Следует подчеркнуть, что механиз-
мы терморегуляции человека обеспе-
чивают постоянство температуры толь-
ко лишь так называемого «ядра» тела.
Это прежде всего мозг и совокупность
внутренних органов. Так, температура
крови, омывающей «ядро» тела, прак-
тически не отклоняется от постоян-
ного значения. В правом желудочке
сердца она равна 37 °C. Температура
поверхности тела — «оболочки» — на-
против, варьирует в довольно широ-
ких пределах — от 24,4 до 34 °C. Наи-
более низкая температура отмечается
в пальцах нижних конечностей, самая
высокая — в подмышечной впадине,
где она всего лишь на 0,5 °C оказыва-
ется ниже температуры «ядра» тела.
Температура различных участков по-
верхности тела зависит от уровня об-
мена веществ, кровообращения дан-
ного участка, температурных влияний
внешней среды на соответствующий
участок тела и многих других факто-
ров. Индивидуальное распределение
температуры на поверхности кожи
составляет температурную схему тела,
обладающую относительным постоян-
ством у различных индивидуумов.
Поддержание постоянства темпера-
туры тела у гомойотермных животных
обеспечивается совокупными систем-
ными механизмами химической и фи-
зической терморегуляции (М. Рубнер).
181
Химическая терморегуляция. Под хи-
мической терморегуляцией понимают
активацию обмена веществ в организ-
ме и, как следствие, усиление тепло-
продукции в ответ на холодовое воз-
действие. В результате процессов хими-
ческой терморегуляции производство
тепла в организме может увеличивать-
ся в 3 — 5 раз.
Усиление теплопродукции обеспе-
чивается за счет двух комплексных
механизмов термогенеза — сократи-
тельного и несократительного.
Сократительный термогенез вклю-
чает в себя: термозависимое измене-
ние тонуса скелетной мускулатуры,
обеспечивающего соответствующую
позу животного и человека, направ-
ленную на уменьшение поверхности
теплоотдачи; мышечную дрожь.
Последняя у взрослого человека
является особо мощным механизмом
производства тепла. Установлено, что
термодинамический эффект мышеч-
ной дрожи превышает термодинами-
ческие эффекты фазных и тонических
мышечных сокращений. Это связано с
тем, что при дрожи внешняя работа
не выполняется и вся образующаяся
энергия трансформируется в тепловую
энергию.
Несократительный термогенез не
связан с сократительной активностью
скелетной мускулатуры, основным его
источником являются экзотермиче-
ские метаболические реакции, проте-
кающие в тканях, в частности в ске-
летных мышцах, сердце, печени, поч-
ках, желудочно-кишечном тракте.
В качестве дополнительного источ-
ника «химического» тепла в организ-
ме выступают окислительные процес-
сы в бурой жировой ткани. Бурый жир
откладывается преимущественно в
области шеи, подмышечной области,
между лопатками. От белой бурая жи-
ровая ткань отличается наличием в ее
клетках многочисленных мелких капе-
лек жира, окруженных митохондрия-
ми.
Ферментные системы митохондрий
бурого жира, контролирующие ско-
рость окислительных процессов, со-
держат цитохромы — железосодержа-
щие пигменты, придающие бурый
оттенок ткани. Скорость окисления
жирных кислот в бурой жировой тка-
ни почти в 20 раз превышает анало-
гичный процесс в белой жировой тка-
ни. Этот процесс обеспечивает извле-
чение из клеток бурой жировой ткани
значительного количества тепла.
Физическая терморегуляция. Под
физической терморегуляцией понима-
ют совокупность механизмов, обеспе-
чивающих теплоотдачу. Сброс избыт-
ков тепла во внешнюю среду реализу-
ется путем теплопроведения, тепло-
излучения, конвекции, испарения
жидкости с поверхности кожи, дыха-
тельных путей.
Теплопроведение, теплоизлучение
реализуются только в том случае, если
поверхность тела имеет большую тем-
пературу, чем температура среды.
В противном случае организм будет по-
лучать дополнительное тепло из сре-
ды обитания, что может привести к
перегреванию.
На эффективность теплопроведе-
ния существенно влияет теплопровод-
ность среды, поэтому при одинаковой
температуре среды количество теряе-
мой организмом теплоты, например
во влажном воздухе, обычно превы-
шает потери тепла в сухом воздухе.
Определенное значение в процес-
се отдачи избытков тепла организ-
мом имеет конвекция, возникающая
при изменении температуры возду-
ха, окружающего тело. Этот слой воз-
духа толщиной 4—8 мм имеет почти
ту же температуру, что и поверхность
кожи. Нагретый воздух поднимается
вверх, его место занимает холодный
воздух, который постепенно согрева-
182
дрия-
-дрий
: СКО-
Е co-
re ?жа-
' рый
дения
тка-
^-по-
: 7Ка-
дзле-
~:<ани
Под
?ма-
геспе-
t :быт-
Д7ЛЗУ-
"ЕДЛО-
сения
гыха-
: '-е ние
к если
гм-
-с еды.
‘лее no-
te гре-
*-:ти к
лгееде-
гй: зод-
к.звой
I *еряе-
• “ мер
птевы-
~ :ес-
гениз-
.спая
зду-
II I* воз-
’ зачти
tx -эсть
i-еется
I-’ еный
г- дева-
ется. Таким образом, вблизи тела че-
ловека устанавливается кругооборот
воздуха, изменяющийся в зависимо-
сти от естественных (ветер) или ис-
кусственных (принудительная венти-
ляция) перемещений.
При температуре воздуха, прибли-
жающейся к температуре тела, един-
ственным способом сброса излишков
тепла является выделение пота пото-
выми железами и испарение его с кож-
ной поверхности, а также испарение
жидкости с поверхности слизистой
оболочки, выстилающей дыхательные
пути. Как известно, испарение 1 мл
пота сопровождается выделением энер-
гии 0,58 ккал. В условиях комфортной
температуры примерно 20 °C в сутки
с поверхности тела испаряется около
500 мл пота, а с поверхности дыха-
тельных путей — 300—400 мл жидко-
сти. При этом выделяется примерно
500 ккал энергии. С повышением тем-
пературы среды процессы потоотделе-
ния и испарения интенсифицируют-
ся. В горячих цехах при тяжелой физи-
ческой работе объем испаряющейся
жидкости может составить 9 —12 л в
сутки, что обеспечивает сброс тепла
в пределах от 5 до 7 тыс. ккал. Следует
помнить о том, что эффективность
сброса тепла за счет испарения пота и
жидкости ослабляется при повышении
влажности воздуха. При абсолютном
насыщении воздуха водяными парами
испарение с поверхности тела не про-
исходит (в парилке пот выделяется,
но не испаряется), поэтому человек
плохо переносит высокую температу-
ру воздуха в условиях повышенной
влажности.
Роль нервной системы в терморе-
гуляции. Основные нервные центры,
определяющие режим работы перифе-
рических эффекторов, непосредствен-
но поддерживающих температурную
константу организма, расположены в
гипоталамической области (К. Бернар).
Разрушение гипоталамуса в экспери-
менте, перерезка ствола мозга на уров-
не четверохолмия приводит к тому,
что животные в этих случаях утрачи-
вают способность к гомойотермии,
фактически становятся пойкилотерм-
ными.
Разные области гипоталамуса кон-
тролируют различные механизмы тер-
морегуляции.
В области ядер заднего гипоталаму-
са располагается центр химической тер-
морегуляции, или центр теплопродукции.
Разрушение этого центра (область ги-
поталамуса, прилежащая к мамилляр-
ным телам) приводит к тому, что жи-
вотные теряют способность поддержи-
вать нормальную температуру тела в
условиях пониженной температуры
среды обитания из-за невозможности
включения в работу систем химиче-
ской регуляции, обеспечивающих по-
вышенное производство тепла в орга-
низме.
Командные, эфферентные влияния
центра химической терморегуляции,
запускающие исполнительные эффек-
торы в составе периферических меха-
низмов теплопродукции, передаются
посредством ретикулярной формации
ствола мозга. Именно повышение то-
нуса структур стволовой ретикулярной
формации при возбуждении гипотала-
мического центра химической термо-
регуляции активизируют механизмы
сократительного термогенеза в резуль-
тате усиления активности у- и «-мо-
тонейронов спинного мозга, иннер-
вирующих соответственно интра- и эк-
страфузальные волокна скелетных
мышц. Повышение активности адре-
нергического субстрата ретикулярной
формации проявляется в увеличении
активности спинальных центров сим-
патической нервной системы, что
приводит к сужению сосудов кожи и
уменьшению сброса тепла, а также
значительному усилению активности
183
надпочечников. В кровь выбрасывают-
ся катехоламины — адреналин и нор-
адреналин. Гормоны мозгового веще-
ства надпочечников, взаимодействуя
с 0-адренорецепторами, активируют
в составе клеточных мембран адени-
латциклазу. Последняя, катализируя
в свою очередь образование из АТФ
циклического 3',5'-аденозинмонофос-
фата, значительно активизирует энер-
гетический обмен клеток скелетной
мускулатуры, сердца, печени, почек
и других органов с выделением боль-
шого количества энергии.
Помимо мозгового вещества надпо-
чечников, активизация гипоталамиче-
ского центра теплопродукции сопро-
вождается повышением гормональной
активности щитовидной железы в ре-
зультате образования тиреотропин-ри-
лизинг-гормона и высвобождения в
аденогипофизе тиреотропного гормо-
на. Последний, действуя на мембраны
клеток щитовидной железы, вызыва-
ет усиление синтеза и секрецию ее
гормонов. Поступая в кровь, гормо-
ны щитовидной железы оказывают
избирательное действие на клетки-
мишени, активируя ферментные ком-
плексы в составе митохондрий, что
приводит к ускоренному окислению
жиров и углеводов с высвобождени-
ем тепловой энергии. Повышенный
уровень активности щитовидной же-
лезы обеспечивается не только гумо-
ральным, но и нервным путем в ре-
зультате повышения тонуса симпати-
ческой нервной системы при возбуж-
дении гипоталамического центра теп-
лоотдачи.
В области ядер переднего гипота-
ламуса расположен центр физической
терморегуляции, или центр теплоотда-
чи. Изолированное разрушение ядер
гипоталамуса, прилежащих к передней
комиссуре, зрительному перекресту и
относящихся к центру теплоотдачи,
приводит к тому, что животные утра-
чивают способность поддерживать
нормальную температуру тела в усло-
виях повышенной температуры среды
обитания и перегреваются из-за невоз-
можности запуска периферических
механизмов сброса тепла.
Регулирование процессов тепло-
отдачи основано преимущественно
на изменении кровообращения в кож-
ной поверхности, предопределяюще-
го температуру кожи, от которой соб-
ственно и зависит величина теплоот-
дачи. При усилении активности цент-
ра теплоотдачи имеет место реципрок-
ное угнетение гипоталамического цен-
тра теплопродукции. Это ведет к
ослаблению симпатической нервной
системы, угнетению активности над-
почечников.
Совокупность рассмотренных реак-
ций ведет к пассивному расширению
кожных сосудов, усилению кровото-
ка, повышению температуры и уси-
лению сброса тепла в окружающую
среду путем теплопроведения, тепло-
излучения, конвекции.
Как отмечалось ранее, одним из
механизмов выделения тепла являет-
ся испарение лота. Повышение актив-
ности потовых желез также связано
с активизацией гипоталамического
центра, регулирующего теплоотдачу.
Усиление секреции потовых желез
возникает в результате опосредован-
ного возбуждения особых стволовых
и апикальных структур, управляющих
потоотделением через холинергиче-
ские симпатические нервные волокна.
Интересно, что усиление потоот-
деления приводит к вторичному рас-
ширению кожных сосудов за счет вы-
броса клетками потовых желез протео-
литического фермента калликреина.
Последний поступает в кровь, расщеп-
ляет молекулу «2-глобулина с обра-
зованием декапептида калидина и в
последующем нонапептида брадики-
нина, оказывающего сильнейшее со-
с - 4W
Е -W*
с i9flk
л. -flF
т:.„_
в-
н. ай
IL Ж
ие- ЯМ*
не- -w-
бе W
и *
с; ~ т*
К _ - г»
( -Ж
не ля
ее w
в; - v
в; w
те- «
н .ж
В:
Р> - *
те ТХ
се- ж
ме .ха
ЛС-
МС
II; ...
те:
ре_
184
> щ.-. :-r в;««ЩМПЯ>ЯЧ
' зать
гло-
-зеды
-тзоз-
е:ких
:~.Л0-
:=ННО
i <ОЖ-
г'< ще-
•' ;об-
v ?от-
1_ент-
юзок-
‘ ден-
СгТ К
г 2 ЛОЙ
п -ад-
’теак-
к -ию
»₽'?ТО-
’ .си-
i -Дую
Т: ~то-
₽-< из
•-дет-
я дано
с «.эго
Гачу.
*:лез
t ван-
s’': зых
С лих
тде-
<: *.на.
т:ог-
зас-
- зы-
глео-
с<на.
д_еп-
юра-
i и в
п«и-
- го-
судорасширяющее действие. Сосудо-
расширяющий эффект брадикинина,
с одной стороны, поддерживает ги-
персекрецию пота, испаряющегося с
поверхности тела, с другой — повы-
шает кожную температуру. И первый,
и второй эффекты способствуют ин-
тенсивному выделению тепла в окру-
жающую среду.
Пусковым фактором, вызывающим
реорганизацию работы гипоталами-
ческого центра терморегуляции, на-
правленной в конечном итоге на ста-
билизацию температурной константы
организма, является изменение темпе-
ратуры крови.
Как показывают физиологические
эксперименты, самые незначительные
сдвиги температуры крови немедлен-
но воспринимаются терморецептора-
ми в кровеносных сосудах (синокаро-
тидная область и др.), в различных
внутренних органах (желудок, кишеч-
ник и др.). Вместе с тем наибольший
интерес вызывают терморецепторы
непосредственно терморегуляторного
центра. Они представляют собой осо-
бые термочувствительные нейроны,
импульсная активность которых зави-
сит от температуры крови, поступа-
ющей в гипоталамическую область.
Описаны термочувствительные нейро-
ны, преимущественно возбуждающи-
еся при повышении температуры кро-
ви, — тепловые термосенсоры, акти-
визирующие центральные механизмы
теплоотдачи и оказывающие тормоз-
ное влияние на центр теплопродукции.
Выявлены термочувствительные ней-
роны, возбуждающиеся при снижении
температуры крови (холодовые термо-
сенсоры), активизирующие механиз-
мы защиты от холода (механизмы теп-
лопродукции) и оказывающие тор-
мозное влияние на центр теплоотдачи.
Центральные тепловые и холодовые
термосенсоры являются основными
рецепторами, которые фиксируют от-
клонения регулируемой центральной
нервной системой температуры крови.
Величина отклонения кодируется в
форме импульсного потока определен-
ной частоты, поступающего к эффек-
торным нейронам гипоталамического
терморегуляторного центра.
Следует отметить, что нейроны тер-
морегуляторного центра воспринима-
ют импульсацию не только от цент-
ральных терморецепторов. Они вос-
принимают также импульсацию от
терморецепторов сосудов, внутренних
органов и терморецепторов кожи, реа-
гирующих на колебания температуры
окружающей среды и формирующих
специфические температурные ощуще-
ния. В коже, как и в ЦНС, различают
холодовые и тепловые рецепторы, рас-
положенные в самой коже, в под-
кожной клетчатке. Морфологически
терморецепторы «оболочки» тела пред-
ставляют собой свободные окончания
тонких сенсорных волокон типа As—
С, не связанных с какими-либо спе-
циализированными морфофункцио-
нальными образованиями, что затруд-
няет объективное электрофизио-
логическое изучение деятельности
терморецепторов в ответ на темпера-
турные раздражители в условиях пря-
мой регистрации микроэлектродами.
Конкретное представление о динами-
ке работы холодовых и тепловых ре-
цепторов кожи было получено в ходе
отведения электрической активности
афферентных волокон, проводящих
импульсацию от этих рецепторов
в ЦНС. В таких исследованиях было
установлено, что различие между теп-
ловыми и холодовыми рецепторами
заключается в вызванных реакциях
импульсаций на изменение темпера-
турного раздражителя. Холодовые ре-
цепторы реагируют кратковременным
усилением активности на охлаждение
и кратковременным угнетением ак-
тивности — на нагревание, тепловые
185
рецепторы реагируют противополож-
ным образом: они отвечают кратко-
временным угнетением разрядной
активности на охлаждение и кратко-
временным усилением активности —
на нагревание.
Экспериментально доказано, что
в коже существует преобладание хо-
лодовых рецепторов по сравнению с
тепловыми. Неравномерность распре-
деления по кожной поверхности хо-
лодовых и тепловых терморецепторов
обусловливает неодинаковую чувстви-
тельность различных участков тела по
отношению к тепловым и холодовым
воздействиям. Известно, что наиболь-
шей чувствительностью к таким воз-
действиям обладает кожная поверх-
ность лица человека, наименьшей —
поверхность конечностей, особенно
нижних.
Сигнализация от периферических
кожных терморецепторов, переключа-
ясь в структурах задних рогов спинно-
го мозга, направлена к спинальным
нервным центрам и по восходящим
трактам поступает в головной мозг.
Главным проводником импульсов яв-
ляется спиноталамический тракт, по
которому возбуждение передается в
специфические проекционные и ассо-
циативные зоны коры головного моз-
га, а также в ретикулярную формацию
и гипоталамический терморегулятор-
ный центр. С точки зрения современ-
ных представлений, в гипоталамиче-
ском терморегуляторном центре про-
исходит сравнение периферической
информации о параметрах темпера-
туры среды с уровнем активности
центральных терморецепторов, отра-
жающих температуру крови, межкле-
точной жидкости головного мозга.
Взаимодействие афферентных сигна-
лов периферического и центрального
происхождения на вставочных нейро-
нах гипоталамуса обеспечивает форми-
рование импульсаций, задающих ре-
жим работы конечных — командных
нейронов центров физической и хи-
мической терморегуляции.
На рис. 5.1 приведена блок-схема
функциональной системы, обеспечива-
ющей поддержание температурной
константы на оптимальном уровне.
Объектом управления в системе
выступает температура внутренней
среды организма — температура кро-
ви. Для некоторого «устойчивого со-
стояния» функциональной системы
Рис. 5.1. Схема функциональной системы, обеспечивающей поддержание температурной
константы на оптимальном уровне (описание в тексте)
186
•г-ы- ааЯ|№«>^«<>яМГ
t ЛССО-
E" MO3-
<4 -ЦИЮ
г -_тгор-
ыгечен-
ffi.i чиче-
Г7< Про-
веской
г < тера-
К5-ЭСТИ
№ ?тра-
яс »:кле-
* <:'зга.
к -<гна-
г ЛОГО
* ’ТЙрО-
эми-
iiCi-A ре-
ь -.ных
1м < хи-
Ькхема
t -• .wa-
in- 7 ной
к^стеме
^fc-ней
fex кро-
Йв”: со-
Ьо.^емы
С'Й
иной
регулируемая температура — это сум-
марная температура «ядра» тела, при
которой не включаются ни механиз-
мы выделения излишков тепла, ни
механизмы, обеспечивающие защиту
организма от холода (К. Брюк).
При тенденциях снижения темпе-
ратуры «ядра» тела (температуры цир-
кулирующей крови) первично проис-
ходит активизация холодовых гипота-
ламических терморецепторов (ГПТ
РЦ). Помимо гипоталамических термо-
чувствительных нейронов (холодовых
термосенсоров) происходит активиза-
ция холодовых сосудистых и органных
терморецепторов. Их импульсация вы-
зывает дополнительное возбуждение
нейронного аппарата гипоталамиче-
ского центра химической терморегу-
ляции. В результате активизации этого
центра усиливается работа перифери-
ческих аппаратов химической термо-
регуляции — аппаратов производства
тепла в организме. Нейрофизиологи-
ческая активность центра физической
терморегуляции, а также перифери-
ческих систем теплоотдачи в этой си-
туации снижается. Тем самым, обо-
значившаяся тенденция уменьшения
температуры внутренней среды орга-
низма будет компенсаторно заблоки-
рована.
При повышении температуры внут-
ренней среды организма происходят
процессы противоположного характе-
ра — возбуждаются гипоталамические
тепловые терморецепторы, тепловые
рецепторы сосудов, внутренних орга-
нов. При этом активизируются цент-
ральные и периферические механиз-
мы физической терморегуляции.
Процесс выделения тепла усилива-
ется. Выработка энергии в организме
тормозится реципрокным центром хи-
мической терморегуляции.
В целом аналогичные механизмы
терморегуляции запускаются при тем-
пературных воздействиях на кожные
терморецепторы, реагирующие на из-
менение температуры внешней среды
организма. При действии на терморе-
цепторы кожи пониженной темпера-
туры за счет афферентной нервной
импульсации происходит возбуждение
центра, контролирующего выработку
энергии — центра химической термо-
регуляции. Это приводит к активиза-
ции периферических механизмов вы-
работки энергии в организме, в то же
время механизмы выделения энергии
тормозятся. При повышении темпера-
туры окружающей среды происходит
возбуждение тепловых рецепторов, ра-
бота системы выделения энергии уси-
ливается, а выработка энергии тормо-
зится.
Наличие кожных терморецепторов
позволяет функциональной системе
более тонко организовать процесс ста-
билизации регулируемой константы на
оптимальном уровне, так как пере-
стройка центральных аппаратов функ-
циональной системы в случае вовле-
чения кожных рецепторов протекает
с опережением по отношению к ре-
альным изменениям температуры кро-
ви внутренней среды. Это происходит
в результате поступления информации
от кожных терморецепторов, как
предупредительного сигнала о веро-
ятном изменении температуры внут-
ренней среды организма. Опережающие
реакции гипоталамических аппаратов
функциональной системы терморегу-
ляции делают колебания регулируемой
температурной константы в условиях
физиологической нормы практически
равными нулю.
Применительно к природной ак-
тивности организма следует отметить,
что большой вклад в обеспечение де-
ятельности функциональной системы
терморегуляции в целом отводится по-
веденческому звену регуляций. Как по-
казывает индивидуальный опыт, по-
веденческие реакции в условиях по-
нижения или повышения температу-
ры внешней среды всегда строго спе-
цифичны и эффективны.
5.2. Механизм развития
лихорадки
Повышение температуры тела явля-
ется одним из наиболее распростра-
ненных признаков болезней. При этом
гипертермия — нередко первый и
единственный признак заболевания,
поэтому механизмы ее развития дол-
жны быть в каждом конкретном слу-
чае хорошо понятны врачу.
Диагностическая доступность ги-
пертермии издавна позволяла лекарю
и врачу по характеру жара в организ-
ме неплохо распознавать многие бо-
лезни. В методике постановки диагно-
за заболеваний в современных усло-
виях гипертермии также отводится
существенная роль.
Гипертермия всегда является след-
ствием изменения механизмов термо-
регуляции. Эти терморегуляторные
сдвиги могут быть результатом нару-
шения механизмов химической термо-
регуляции, т.е. повышенного калори-
генного состояния метаболизма, или
механизмов физической терморегуля-
ции, т.е. сниженной теплоотдачи. При
разных видах гипертермии роль уси-
ления теплообразования и снижения
теплоотдачи неодинакова.
Среди гипертермии наиболее час-
то встречается и является наиболее
важной для практической врачебной
деятельности лихорадка.
Лихорадка (лат. — febris', греч. —
pyrezaa) — это типовой патологиче-
ский процесс, характеризующийся
повышением температуры тела вслед-
ствие изменения механизмов термо-
регуляции, вызванного действием пи-
рогенных веществ. Данное определение
включает основные элементы этиопа-
тогенетической характеристики лихо-
радки.
Лихорадка как защитный механизм
сформировалась на позднем этапе эво-
люции. Если способностью к гомойо-
термии обладают лишь высшие живот-
ные, то отчетливую лихорадочную
реакцию дают лишь высшие гомойо-
термные животные и человек. Причем
выраженность лихорадки у живых су-
ществ постепенно нарастает в ряду
«мышь—крыса—кроли к—приматы—
человек». Такое становление лихорад-
ки в филогенезе связано с уровнем
развития центральной нервной систе-
мы и формированием механизмов тер-
морегуляции.
Как известно из курса физиологии,
центральным органом терморегуляции
является гипоталамус. В отношении
поддержания изотермии внутренней
среды организма гипоталамус неодно-
роден: в переднем гипоталамусе сосре-
доточены центры физической термо-
регуляции (теплоотдачи), в заднем —
химической терморегуляции (теплооб-
разования).
Функциональное несовершенство
механизмов теплорегуляции, и в ос-
новном теплоотдачи, связанное с не-
состоятельностью регуляции сосуди-
стого тонуса, лежит в основе отсут-
ствия или слабой выраженности ли-
хорадки в первые месяцы жизни у не-
зрелорождающихся животных и чело-
века. Педиатрам хорошо известно, что
многие инфекционные и воспалитель-
ные процессы у детей первых месяцев
жизни протекают на фоне нормаль-
ной температуры.
Лихорадка как типовой патологи-
ческий процесс вовлекает в свое раз-
витие не только терморегуляторные
гипоталамические центры, но и сер-
дечно-сосудистую, дыхательную, эн-
докринную, иммунную, кроветвор-
ную системы, а также другие систе-
мы организма. Деятельность их при
нес.
ИНС :
ниг
тел г -
пос
дан:.
ВЫ31-
НЫ'
ЭН. -
росс
тур-
ран-
вхол
пол; .
роге
пог:
тив:-
Так.
нал.
жиз;
...
ток.
СЫ
ВЫ J
челе:
Б.
ИХ 3.
харе-
сты-
188
.1ИХО-
с £НИЗМ
спе эво_
. '•'ОЙО-
t КИВОТ-
с:чную
длюйо-
7ричем
sez.x су-
з РЯДУ
И дты—
льдорад-
товнем
й .исте-
акз тер-
*..::лии,
ег дяции
ж _;ении
*тенней
гЮДНО-
к госре-
* тгрмо-
«и.-ем —
гедлооб-
IL'iHCTBO
t з ос-
ке с не-
. :суди-
t зтсут-
М1~1 ли-
ат а у He-
's чело-
ГЧО. ЧТО
стдтель-
• есяцев
ксмаль-
вГ'.ЛОГИ-
sce раз-
: рные
>’ ?. сер-
г -о. эн-
HcTBOp-
’ :исте-
> -х при
лихорадке имеет приспособительный
характер.
Таким образом, в ходе эволюцион-
ного развития лихорадка сформирова-
лась как неспецифическая защитная
реакция организма на появление в его
внутренней среде чужеродного мате-
риала.
Этиология лихорадки. К числу фак-
торов, вызывающих этот процесс, от-
носятся инфекционные и неинфекци-
онные агенты. Наиболее изучены к
настоящему времени механизмы раз-
вития инфекционной лихорадки. В ис-
тории изучения инфекционной пато-
логии давно было отмечено, что боль-
шинство этих заболеваний протекает
с выраженным подъемом температу-
ры. Этот факт направил исследовате-
лей по пути поиска пирогенных (жар-
несущих) факторов в возбудителях
инфекционных болезней при попада-
нии их в организм. Оказалось, действи-
тельно, что продукты жизнедеятель-
ности бактерий — токсины при попа-
дании во внутреннюю среду организма
вызывают лихорадку. Наиболее изучен-
ными на сегодняшний день являются
эндотоксины грамотрицательных мик-
роорганизмов. По химической струк-
туре это липополисахаридные мемб-
ранные комплексы, в состав которых
входит липидная часть (липоид А),
полисахаридная и белковая части. Пи-
рогенной активностью обладает ли-
поид А, причем его пирогенная ак-
тивность проявляется в микродозах.
Так, отечественный препарат пироге-
нал, созданный на основе продуктов
жизнедеятельности бактерии Pseydo-
monas aerogynosa, в дозе 1 мкг/кг мас-
сы через 60—90 мин после введения
вызывает выраженную лихорадку у
человека, продолжающуюся 6 —8 ч.
Бактериальные пирогены помимо
их высокой пирогенной активности
характеризуются низкой токсично-
стью, отсутствием видовой специфич-
ности, развитием к ним толерантно-
сти при многократном применении,
они термостабильны. Следует также
отметить, что между патогенностью
и токсичностью микроорганизмов,
с одной стороны, и его пирогенными
свойствами — с другой, никакой свя-
зи нет. Так, бактерии, обладающие вы-
сокой патогенностью (микобактерии
туберкулеза, возбудители столбняка,
бутулизма, холеры), не вызывают вы-
сокой лихорадки при попадании в
организм. В то же время такие возбу-
дители инфекций, как кокковая мик-
рофлора, вирусы, не обладая высокой
патогенностью, могут давать выражен-
ную лихорадку.
Вместе с тем давно известно, что
существует и так называемая неинфек-
ционная лихорадка, вызываемая па-
рентеральным введением в организм
веществ белковой и другой природы:
при переливании крови, введении
белков для парентерального питания,
внутривенном введении жировых
эмульсий. Ясность в вопросе о путях
развития инфекционной и неинфек-
ционной лихорадки была внесена в
50-е гг. XX в. благодаря работам Ат-
кинса и Вуда. Оказалось, что через 30—
60 мин после введения в организм жи-
вотного как инфекционных, так и не-
инфекционных пирогенов, в крови
накапливаются особые вещества пеп-
тидного строения, обладающие пиро-
генной активностью в нанодозах. Эти
пептиды получили название эндопи-
рогенов, в то время как внешние пи-
рогенные факторы стали называться
экзопирогенами.
Кривые, отражающие характер из-
менения температуры тела при введе-
нии в организм экзо- и эндопироге-
нов, существенно отличаются. При
введении эндопирогенов кривая пока-
зывает монофазный дозозависимый
характер их действия. Подъем темпе-
ратуры при введении экзопирогенов
189
Рис. 5.2. График изменения ректальной
температуры кролика при внутривенном
введении:
1 — эндопирогена (ИЛ-1) в дозе 100 нг на
1 кг массы тела; 2 — экзопирогена (очи-
щенного липополисахаридного комплекса)
в дозе 1 мкг на 1 кг массы тела
имеет более длительный латентный
период, не имеет строгой монофазно-
сти и прямой зависимости от количе-
ства экзопирогена (рис. 5.2).
Эндопирогены, образующиеся в
организме, являются истинными ме-
диаторами лихорадочной реакции. Их
образование в организме связано с
фагоцитозом бактерий или пиноцито-
зом их токсинов клетками белой кро-
ви. Способностью вырабатывать эндо-
пирогены обладают нейтрофильные
лейкоциты; моноциты; макрофаги,
фиксированные в легких, печени, се-
лезенке, лимфатических узлах.
В настоящее время считается, что
как таковой эндопироген не содер-
жится в фагоцитах, а образуется лишь
в результате их стимуляции. Этот этап
требует определенного времени, не-
обходимого для синтеза новой ин-
формационной РНК. Секреция эндо-
генного пирогена не ведет к лизису
или гибели фагоцитов. Эндопироге-
ны получены и in vitro из лейкоци-
тов перитонеального экссудата —
отсюда их название «лейкоцитарные
пирогены».
В последние годы представления об
эндопирогенах существенно расширены.
К числу эндопирогенов относят не-
сколько цитокинов, которые наряду
со специализированными функциями
обладают и пирогенной активностью:
интерлейкины-1 и 6 (ИЛ-1, ИЛ-6),
фактор некроза опухолей ФНО-а, ин-
терферон. В научной литературе обсуж-
дается вопрос о пирогенной активно-
сти некоторых других цитокинов, в
том числе и лимфокинов, хотя ранее
считали, что лимфоциты не могут вы-
рабатывать эндопирогены, так как не
являются фагоцитами. Экспериментапь-
но доказано, что вовлечение лимфо-
цитов в различные формы иммунного
ответа сопровождается выделением
ими ФНО-а, интерферона. В настоящее
время точно установлено, что моно-
цитарными эндопирогенами являются
ИЛ-1 и ИЛ-6. Эндопирогены — это по-
липептиды с молекулярной массой
15 000 — 30 000. Несмотря на белковую
природу, эндопирогены видонеспеци-
фичны. Они не обладают токсично-
стью, термолабильны, к ним не раз-
вивается толерантность.
Несколько сложнее механизм об-
разования эндопирогенов в том слу-
чае, когда лихорадка вызывается по-
паданием в организм грамположитель-
ных бактерий, вырабатывающих экзо-
токсины, вирусов, риккетсий, гриб-
ков, гельминтов, простейших, комп-
лексов «антиген —антитело». Однако
центральным звеном образования
организменных пирогенов и здесь
остается фагоцитоз. При аллергиче-
ском воспалении образование эндо-
пирогенов связано с вовлечением в
иммунный ответ различных форм лей-
коцитов.
Процесс образования эндопироге-
нов может быть индуцирован и внут-
ренними факторами: распадающими-
ся тканями при инфаркте или опухо-
левом росте; при накоплении в орга-
190
льной
энном
нг на
- Ючи-
лекса)
Рис. 5.3. График изменения температуры
у здорового человека после введения ти-
фозной вакцины при температуре воз-
духа 43 °C (7) и 29 °C (2)
•ЭВ, в
ранее
т вы-
дк не
-таль-
:мфо-
нного
гнием
эящее
юно-
-ются
то по-
весой
*:овую
теци-
-ЧНО-
т раз-
об-
-- слу-
по-
: дель-
экзо-
триб-
*:эмп-
тнако
ЭЗНИЯ
:десь
•_иче-
-НДО-
-ем в
лей-
троге-
знут-
-ИМИ-
тухо-
! эрга-
низме продуктов метаболизма стеро-
идных гормонов, например, во время
менструаций у женщин. Во всех этих
случаях также повышается лейкоци-
тарная активность и, как следствие,
пирогенная активность крови.
Определенное значение в этиологии
лихорадки имеют и условия, в кото-
рых действует фактор причины. Среди
условий главную роль играет состоя-
ние реактивности организма: фагоци-
тарная активность крови, состояние
нейроэндокринной регуляции органов
и систем, своевременность и адекват-
ность проводимой антибактериальной
терапии основного заболевания и др.
Температурный режим окружающей
среды существенного влияния на раз-
витие лихорадки не оказывает (рис. 5.3)
(П. Н. Веселкин).
Таким образом, на примере этио-
логии лихорадки наглядно демонстри-
руется высокое эволюционное совер-
шенство этого патологического про-
цесса: в ходе повреждения организма
первичными этиологическими факто-
рами (экзопирогенами) образуются
вторичные (эндопирогены), которые
запускают патогенез лихорадки, при-
дают ей защитно-приспособительный
характер.
Патогенез лихорадки. Непосред-
ственное развитие процесса начина-
ется с накопления в крови эндопи-
рогенов. Циркулируя с током крови,
эти пептиды достигают гипоталами-
ческих центров терморегуляции и в
результате специфического воздей-
ствия на структуры гематоэнцефали-
ческого барьера в этой зоне и повы-
шения его проницаемости напрямую
воздействуют на термочувствительные
нейроны преоптической области пе-
реднего гипоталамуса (рис. 5.4). Воз-
действие на нейроны сопровождает-
ся активацией фермента фосфолипа-
зы А2. приводящей к высвобождению
арахидоновой кислоты из фосфоли-
пидов мембран нейронов. Далее эн-
допирогены активируют фермент
циклооксигеназу (одна из простаглан-
динсинтетаз), направляя метаболизм
арахидоновой кислоты по пути обра-
зования простагландинов Е2. Патоге-
нетическая роль простагландинов Е2
убедительно доказана в эксперимен-
тах с блокадой циклооксигеназного
пути метаболизма арахидоновой кис-
лоты. Применение блокатора ибупро-
фена препятствует развитию экспери-
ментальной лихорадки, вызываемой
как экзо-, так и эндопирогенами.
Простагландины Е2 активируют аде-
нилатциклазу, что приводит к повы-
шению концентрации в цитоплазме
этих нейронов циклического 3',5'-аде-
нозинмонофосфата. Через активацию
АМФ-зависимых протеинкиназ и фос-
форилирование белков-ферментов из-
меняется метаболизм этих нейронов,
выполняющих роль центральных тер-
морецепторов. В результате перестрой-
191
Преоптическая область Заднйй гипоталамус
z Мышечная дрожь
Рис. 5.4. Схема, иллюстрирующая механизмы повышения температуры тела на I стадии
лихорадки
ки метаболизма возбудимость холо-
дочувствительных нейронов повыша-
ется, а теплочувствительных снижа-
ется.
Такое изменение возбудимости цент-
ральных гипоталамических терморе-
цепторов представляет собой основное
звено патогенеза лихорадки. Дальней-
шие патогенетические механизмы но-
сят исполнительный, эфферентный
характер, выступая в роли ведущих
патогенетических факторов.
Снижение порога деполяризации
холодочувствительных нейронов повы-
шает их чувствительность к действию
холодовых факторов. Это приводит к
тому, что кровь обычной нормальной
температуры (37 °C) начинает возбуж-
дать эти центральные терморецепто-
ры. Электрическая активность холо-
дочувствительных нейронов интегри-
руется в заднем гипоталамусе, в ко-
тором формируются эфферентные
команды на периферию. Эти коман-
ды представляют собой не что иное,
как симпатические адренергические
влияния.
Значение симпатоадреналовой ак-
тивации при лихорадке доказывается
многочисленными экспериментами с
применением адрено- и симпатоми-
метиков, адреноблокаторов. Адрено-
миметики фенамин, эфедрин потен-
цируют развитие лихорадки, вызван-
ной пирогеналом. Напротив, введение
адреноблокаторов аминазина, обзида-
на препятствует становлению процес-
са. Более того, блокирование норад-
реналина в аксонных терминалях сим-
патических нервов рауседилом также
приводит к торможению развития ги-
пертермии.
Главными среди симпатических
влияний на этой стадии развития ли-
хорадки следует считать механизмы,
приводящие к сужению просвета пе-
риферических, в первую очередь кож-
ных сосудов. Это связано с активаци-
ей прессорного отдела сердечно-со-
судистого центра. Его активация со-
провождается усилением сердечной
деятельности и перераспределением
сосудистого тонуса: сосуды кожи су-
живаются, а во внутренних органах
192
gw**»» JI ~IRJWг»
' кожи
:талии
:-?Й ак-
:.зается
•~лми с
--70МИ-
•дрено-
“.отен-
:<3ван-
гсление
>5зида-
тоцес-
-:орад-
ял сим-
, также
~1Я ги-
• еских
~’Я ли-
--ИЗМЫ,
<та пе-
д- кож-
- заци-
1-:о-со-
ц.?я со-
ДгЧНОЙ
деяием
.. ки су-
~ танах
расширяются. Сужение кожных сосу-
дов снижает объемный кровоток, кожа
становится холодной и бледной (не-
редко цианотичной вследствие накоп-
ления восстановленного гемоглобина),
возникает пилоэрекция.
Снижение кожной изотермы на
несколько градусов ведет к возбужде-
нию кожных холодовых рецепторов.
Афферентная им пульсация от них до-
стигает заднего гипоталамуса и адре-
суется ретикулярной формации сред-
него мозга. Ее возбуждение связано с
посылкой к мотонейронам спинного
мозга, а далее к скелетным мышцам
возбуждающих влияний. В результате
формируется асинхронное сокращение
отдельных мышечных волокон, что
воспринимается как тоническое на-
пряжение мышц — возникает так на-
зываемый терморегуляционный мы-
шечный тонус.
Дальнейшее возбуждение мышц
синхронизирует сократительную дея-
тельность от дельных двигательных еди-
ниц — возникает мышечная дрожь: не-
произвольные залповые сокращения
мышц. В дрожание вовлекаются раз-
личные группы скелетной мускулату-
ры, вплоть до жевательных, сокраще-
ние которых приводит к стучанию
зубов. В результате активизации мы-
шечной деятельности (терморегуля-
ционный мышечный тонус и мышеч-
ная дрожь) резко усиливается био-
энергетика мышц, что ведет к обра-
зованию большого количества тепла.
Это усиление теплообразования за счет
мышечной деятельности получило
название сократительного термогене-
за. Он также характеризуется возник-
новением неприятного субъективно-
го ощущения озноба.
Помимо усиления мышечной дея-
тельности, симпатическая активация
включает и другие механизмы обра-
зования тепла в организме — механиз-
мы несократительного термогенеза.
Повышение активности симпатиче-
ской нервной системы всегда ведет к
усилению выработки в надпочечниках
катехоламинов, усиливающих био-
энергетику в мышцах, печени, голов-
ном мозге. Подобным образом вегета-
тивная симпатическая нервная систе-
ма усиливает деятельность щитовид-
ной железы, способствуя повышенной
инкреции тиреоидных гормонов. Эта
же железа испытывает активизиру-
ющее влияние при лихорадке и через
гипоталамо-гипофизарно-тиреоидную
систему регуляции. Термогенный же
эффект гормонов щитовидной желе-
зы хорошо известен.
Существенную роль в несократи-
тельном термогенезе играет бурая жи-
ровая ткань, расположенная у чело-
века в межлопаточной области и во-
круг шеи. В адипоцитах бурой жировой
ткани в отличие от белой жировой зна-
чительно больше митохондрий, цито-
хромов, что в 20 раз превышает ско-
рость окисления жирных кислот, при
этом идет свободное их окисление (без
накопления АТФ) с единственной
целью — получения энергии. Одно-
значно утверждать термогенную роль
бурой жировой ткани при лихорадке
нельзя, хотя известно, что симпато-
адреналовая активация пептида термо-
генина, локализованного на внутрен-
ней поверхности митохондрий жиро-
вых клеток, усиливает распад жирных
кислот и теплообразование. Механиз-
мы несократительного термогенеза
являются отсроченными реакциями
организма и их максимальный вклад
в развитие лихорадки проявляется в
большей степени на последующих эта-
пах становления процесса.
На фоне сужения кожных сосудов
резко снижается теплоотдача (тепло-
излучение, конвекция, теплопроведе-
ние и испарение). Образование энер-
гии в организме существенно увеличи-
вается. Это преобладание теплообразо-
193
вания над теплоотдачей ведет к разо-
греванию организма: температура тела
повышается. Ведущая роль в подъеме
температуры принадлежит механиз-
мам физической теплорегуляции, т.е.
снижению теплоотдачи.
Этим заканчивается I стадия ли-
хорадки — стадия подъема темпера-
туры (st.incrementi). Она сменяется
II стадией — стадией стояния высо-
кой температуры (st. fastigii), которая
характеризуется тепловым балансом,
но на новом, более высоком, чем в
норме, уровне: в этой стадии в орга-
низме образуется много тепла, но это-
му соответствует эквивалентная теп-
лоотдача. Патогенетические механиз-
мы усиления теплоотдачи на данной
стадии лихорадки связаны с усилени-
ем электрической активности теплочув-
ствительных центральных терморецеп-
торов преоптической области передне-
го гипоталамуса за счет возбуждения
их кровью высокой температуры.
Определенную роль в усилении теп-
лоотдачи играет возбуждение перифе-
рических тепловых рецепторов, распо-
ложенных в основном во внутренних
органах. Их возбуждение при высокой
температуре приводит к реципрокно-
му торможению механизмов теплооб-
разования и стимуляции теплоотдачи.
Повышенная электрическая актив-
ность теплочувствительных нейронов
преоптической области переднего ги-
поталамуса также интегрируется в зад-
нем гипоталамусе, который активизи-
рует нисходящие парасимпатические
и симпатические холинергические
влияния. Высокий симпатический то-
нус теперь уравновешивается с высо-
ким парасимпатическим тонусом, что
приводит к расширению перифериче-
ских сосудов, кожа становится горя-
чей, отмечается ее гиперемия, возни-
кает чувство жара, усиливается функ-
ция потовых желез. Все это увеличивает
теплоотдачу.
Для врача принципиально важно
понимать две характеристики этой ста-
дии лихорадки: ее длительность и уро-
вень подъема температуры. Длитель-
ность лихорадки связана в основном
со свойствами возбудителей болезни:
насколько долго он может иницииро-
вать образование эндопирогенов в
организме. Отсутствие к ним толерант-
ности делает процесс полностью за-
висимым от этого.
С динамикой образования эндопи-
рогенов в организме связаны типы тем-
пературных кривых при различной па-
тологии. Эти кривые строят с учетом
физиологических колебаний суточной
температуры: минимальный подъем
ее наблюдается в 4—5 ч, максималь-
ный — в 18—19 ч. Суточные колеба-
ния температуры в норме в среднем
составляют 1 °C. Обычно выделяют сле-
дующие типы температурных кривых:
постоянная — суточные колебания
температуры не превышают 1 °C (кру-
позная пневмония, брюшной тиф,
сыпной тиф);
ремитирующая — температура ко-
леблется в пределах более 1 °C, но не
возвращается к норме (большинство
вирусных инфекций);
интермиттирующая, или послабля-
ющая, — температура нормализуется
несколько раз в день (гнойная инфек-
ция, абсцессы, туберкулез);
гектическая, или истощающая, —
очень большие подъемы температуры
с быстрым спадом, повторяющиеся
2 — 3 раза в сутки (сепсис);
возвратная — лихорадочные при-
ступы, возникающие через несколько
дней (малярия, лимфогранулематоз).
Следует отметить, что типичность
температурных кривых в условиях со-
временной антибактериальной тера-
пии все более стирается.
Уровень подъема температуры при
лихорадке зависит от следующих при-
чин:
E
ПГ.
H._
тсс
II.
ш.
Р-
Р-
вс
ш
ВС
Р--
вс:
с;:
пес
F-~
194
• зажно
--jrt ста-
гз а уро-
1 лтель-
t-эвном
Тлезни:
и _ииро-
генов в
глерант-
<-~ью за-
—1Д0ПИ-
[»г_ы тем-
p.-ой па-
. учетом
- точной
тодъем
ь_?тмаль-
t«юлеба-
-реднем
-м сле-
i <?ивых:
./гоания
- (кру-
1. : тиф,
к~.ра ко-
I но не
ай •нство
г.слабля-
L* -дуется
к шфек-
ь_ая, —
Гстатуры
шиеся
far прн-
сЖОЛЬКО
>тт -.атоз).
Г: -:ность
К 5. 1ЯХ со-
тера-
ты при
Н_:Х при-
количества образующихся в орга-
низме эндопирогенов и состояния ре-
активности организма, зависящей от
возбудимости термочувствительных
(плотности рецепторов нейрональных
мембран к эндопирогенам) и других
центральных нейронов;
особенностей симпатоадреналовой
регуляции сосудистого тонуса;
сократительного и несократитель-
ного термогенеза;
иммунного статуса организма и т.д.
На практике уровень подъема тем-
пературы во многом определяется
токсическими свойствами возбудите-
ля, способностью к разобщению про-
цессов окисления и фосфорилирова-
ния.
В настоящее время расплывчатость
понятия «реактивность организма» при
лихорадке дополнена сведениями о
конкретном механизме регуляции
уровня подъема температуры. Речь идет
о так называемой системе эндоген-
ного антипиреза, представленной ги-
поталамическим аргининвазопресси-
новым механизмом предотвращения
типерпирексии. С большой долей уве-
ренности можно полагать, что в ос-
нове снижения температуры при дей-
ствии пептида аргининвазопрессина
лежит нейромодуляторный механизм
воздействия на центры терморегуля-
ции, т.е. его способность к снижению
возбуди мости ход одочувствите л ьн ых
нейронов преоптической области пе-
реднего гипоталамуса (ПОПГ), при-
водящему к устранению эффектов
симпатоадреналовой активизации на
периферии.
Модулирующее и главным образом
тормозное влияние на состояние ги-
поталамических центров терморегуля-
ции оказывает кора больших полуша-
рий мозга. Это доказывается в экспе-
риментах по моделированию лихорад-
ки у декортицированных собак, а так-
же у собак со снижением функцио-
нальной активности коры больших по-
лушарий мозга путем выключения сен-
сорных, слуховых, зрительных и обо-
нятельных возбуждающих влияний. Ре-
акция на пирогены у этих животных
возрастает почти вдвое в сравнении с
таковой у животных с бодрствующим
состоянием коры мозга.
Множество других, непирогенных,
свойств возбудителей болезней может
неспецифически влиять на продолжи-
тельность и выраженность лихорадки.
В качестве примера можно привести
длительную и высокую лихорадку при
риккетсиозах (сыпной тиф, марсель-
ская лихорадка), которая во многом
объясняется выраженным при этих ин-
фекциях васкулитом, что облегчает
миграцию лейкоцитов в очаг, фаго-
цитоз и попадание эндопирогенов в
кровоток.
По уровню подъема температуры
различают следующие формы лихо-
радки: субфебрильная — до 38 °C; уме-
ренная — 38 —39 °C; высокая — 39 —
41 °C; гиперпиретическая — более 41 °C.
Заключительная III стадия лихорад-
ки — стадия снижения температуры (st.
decrementi) приходит на смену II ста-
дии тогда, когда в организме прекра-
щается выработка эндопирогенов. Их
отсутствие возвращает возбудимость
холодочувствительных нейронов пре-
оптической области переднего гипо-
таламуса к исходному уровню, что
нормализует тонус симпатического
отдела вегетативной нервной систе-
мы и теплообразование в организме.
Теплочувствительные нейроны пре-
оптической области возбуждаются
кровью, температура которой остает-
ся повышенной, в результате в тече-
ние некоторого времени сохраняется
высокий парасимпатический тонус.
Формируется его преобладание над
симпатическим и, как следствие, —
преобладание теплоотдачи над обра-
зованием тепла.
195
Температура тела начинает сни-
жаться. Чаще температура снижается
постепенно (литическое снижение
температуры тела), но иногда это про-
исходит очень быстро (критическое
снижение). Поскольку высокий пара-
симпатический тонус формирует от-
рицательные ино-, батмо-, хроно- и
дромототропные эффекты на сердце,
то это приводит к падению сердечной
деятельности, снижению артериально-
го давления. В случае критического сни-
жения температуры это может проис-
ходить резко и приводить к возникно-
вению постлихорадочных коллапсов,
особенно у детей.
Преобладание парасимпатического
тонуса резко активизирует деятельность
потовых желез, их гиперфункция ве-
дет к местному накоплению брадики-
нина, что в свою очередь вызывает вто-
ричное стойкое расширение кожных
сосудов. Температура тела продолжает
снижаться и приходит к норме. Счита-
ется, что существует прямая зависи-
мость между продолжительностью I и
III стадий лихорадки. В русской терми-
нологии стадии лихорадки в соответ-
ствии с основными клиническими про-
явлениями получили образные харак-
теристики: «озноб, жар, пот».
Изменения в органах и системах при
лихорадке. При рассмотрении этого
вопроса следует помнить, что орган-
ные изменения при заболеваниях,
протекающих с лихорадкой, весьма
многообразны и могут наносить суще-
ственный вред больному. Это связано
с токсическими, деструктивными,
метаболическими, аллергическими и
другими повреждающими механизма-
ми. Здесь же рассматриваются лишь те
изменения в деятельности систем орга-
низма, которые непосредственно па-
тогенетически «задействованы» лихо-
радкой.
Сердечно-сосудистая система харак-
теризуется наиболее отчетливыми из-
менениями, связанными с фазными
изменениями тонуса отделов вегета-
тивной нервной системы. Преоблада-
ние симпатического тонуса на I ста-
дии лихорадки усиливает сердечную
деятельность, повышает артериальное
давление, централизует кровообраще-
ние. Согревание синоатриального во-
дителя ритма и симпатические воз-
буждающие влияния ведут к тахикар-
дии и росту минутного объема крови.
Выраженная лихорадка у больных с
сердечно-сосудистой патологией не-
редко приводит к синусовой аритмии,
изменениям электрической активно-
сти сердца: сокрашению интервала
Р— Q, снижению амплитуды комплек-
са QRS, изменению зубца Т на ЭКГ,
иногда возникают экстрасистолы. Во
II стадии лихорадки артериальное дав-
ление несколько снижается. В III ста-
дии сердечно-сосудистая система пре-
терпевает изменения, противополож-
ные 1 стадии.
Система дыхания также испытыва-
ет фазные изменения: замедление ды-
хания в I стадии, учащенное поверх-
ностное — во II стадии и частое —
в III стадии лихорадки. Связанное с
активацией метаболизма увеличение
парциального давления СО2 повыша-
ет альвеолярную вентиляцию, обеспе-
чивая адекватное метаболической си-
туации в организме поступление кис-
лорода. Этому также способствует
развивающееся в результате централи-
зации кровообращения повышение
давления в бассейне легочной артерии.
Легочная гипертензия при умеренных
воспалительных процессах в легких
имеет приспособительное значение,
так как усиливает альвеолярный газо-
обмен и оксигенацию крови.
Пищеварительная система реагирует
снижением аппетита, сухостью в ро-
товой полости вследствие уменьшения
слюноотделения; понижением секре-
торной и моторно-эвакуаторной ак-
не
л
Е:
К_.
дс
л:
т.
к:'
Ч; -
гк-
ду
Р--
де,-
Б;
Л
ГД.
с:-.
Р>-
э-
р. *
Н1
П-
Н -
те
к
с:
Р-"
н;
196
адыми
® Д'гега-
блада-
I ста-
чечную
Е* льное
*,,'эаще-
*’< го bo-
ss е воз-
г-1 икар-
*-*рови.
h-'-НЫХ С
ел не-
te' тмии,
•as- ивно-
*~еэвала
•*' '.тлек-
Г ♦- ЭКГ,
ы. Во
дав-
Й J ста-
fc'enpe-
~ ?.1ОЖ-
I
^Гс-тыва-
•fe- еды-
* ' зерх-
Н^_~эе —
t-чое с
-ение
г~- :ыша-
► беспе-
-й си-
hiH е кис-
h*’. гвует
Р^~рали-
ь ~ение
^-ерии.
к-енных
Н -гких
й*--ение,
газо-
друет
И* 3 ро-
ения
еекре-
ак-
тивности желудочно-кишечного трак-
та; возможны запоры, метеоризм; сни-
жается кислотность желудочного сока,
активность некоторых пищеваритель-
ных ферментов.
Эндокринная система также под-
вергается функциональным измене-
ниям. Она ответственна за симпатиче-
скую активацию мозгового вещества
надпочечников, что почти всегда при-
водит к росту концентрации адрена-
лина в крови, увеличению образова-
ния тиреоидных гормонов щитовид-
ной железой. Помимо этого, важную
роль в патогенезе лихорадки, безу-
словно, играет активация системы
«гипоталамус — гипофиз — надпочеч-
ники», в ходе которой инкреция АКТГ
значительно усиливается, что и опре-
деляется в крови на всем протяжении
лихорадки. В настоящее время получе-
ны убедительные данные, объясня-
ющие гиперсекрецию кортикостерои-
дов по механизму прямого влияния эн-
допирогенов (ИЛ-1, ИЛ-6) на гипо-
таламические центры продукции
кортиколиберинов. Более тонкое изу-
чение содержания гормонов выявляет
перестройку в функционировании и
других эндокринных желез при лихо-
радке. В последние годы появились све-
дения об активации некоторых ткане-
вых адаптогенных факторов на фоне
лихорадки.
Центральная нервная система все-
гда является адресатом гипертермиче-
ских состояний организма. При лихо-
радке деятельность ЦНС изменяется.
Это проявляется головной болью,
разбитостью, сонливостью и наруше-
нием сна, спутанностью сознания и
галлюцинациями; нарушением услов-
но-рефлекторной деятельности; у де-
тей возможно развитие судорог. С точ-
ки зрения объективных проявлений
следует упомянуть синхронизацию
ритмов ЭЭГ (увеличение амплитуды
на фоне снижения частоты), причем
медленноволновой сон на ЭЭГ под-
твержден в экспериментах с внутри-
венным введением ИЛ-1. Некоторые
другие нарушения нервной деятель-
ности при лихорадках связаны с про-
явлением токсического начала забо-
левания.
Обмен веществ при лихорадке ха-
рактеризуется разнообразными изме-
нениями. Увеличивается основной об-
мен, что, с одной стороны, связано
с симпатоадреналовой и тироксино-
вой стимуляцией, а с другой — с ро-
стом скорости химических реакций со-
гласно правилу Вант-Гоффа. В резуль-
тате увеличения обменных процессов
организм получает тепло (повышение
температуры на 1 °C увеличивает ос-
новной обмен на 10—12 %). На I ста-
дии лихорадки вклад его в разогрева-
ние организма невелик и составляет
10—15%. Основная энергия в орга-
низме накапливается за счет вазокон-
стрикции и сократительного термо-
генеза. Наибольший вклад в тепловой
баланс организма активизация обмен-
ных процессов вносит на 11 стадии ли-
хорадки.
Определенные изменения наблюда-
ются и в обмене углеводов, жиров и
белков. В начальном периоде лихорад-
ки идет преимущественный распад
углеводов, что подтверждается высо-
ким дыхательным коэффициентом.
Отсутствие запаса углеводов стимули-
рует распад жиров — дыхательный ко-
эффициент снижается до 0,7. В резуль-
тате снижения аппетита распаду под-
вергаются организменные жиры. Их
распад при отсутствии должного ко-
личества углеводов идет не до конеч-
ных продуктов, что приводит к накоп-
лению в крови кетоновых тел. Преиму-
щественно углеводная диета препят-
ствует развитию кетоза.
Изменения в белковом обмене при
различных видах лихорадки носят неод-
нозначный характер. Точные данные
о нарушении синтеза белка при лихо-
радке отсутствуют, но все же распад
белков преобладает над синтезом и в
моче обнаруживается повышенное
количество продуктов белкового рас-
пада как проявление отрицательного
азотистого баланса. Полагают, что уме-
ренная лихорадка в течение несколь-
ких дней существенно не сказывается
на белковом метаболизме.
Изменяется водно-электролитный
обмен. В начальном периоде в силу ар-
териальной гипертензии диурез нара-
стает, а затем повышенная секреция
альдостерона, вазопрессина способ-
ствует задержке жидкости в организме.
На заключительной стадии лихорадки
теряется значительное количество жид-
кости, натрия, хлоридов. В связи с
обильным потоотделением необходи-
мо постоянное возмещение запаса
жидкости, особенно у детей.
Отличие лихорадки от других ви-
дов гипертермии. Нередко термины
«лихорадка» и «гипертермия» упо-
требляются как синонимы. Вместе с
тем имеются существенные различия
в механизмах развития обоих процес-
сов. Критерием отличия лихорадки от
других видов гипертермии является
пирогенная обусловленность лихорад-
ки, чего не наблюдается в других слу-
чаях. Следует дифференцировать ли-
хорадку с другими вилами гипертер-
мий:
гипертермическим синдромом, ко-
торый по механизму развития наибо-
лее близок к лихорадке, поскольку
подъем температуры обусловлен воз-
действиями на термочувствительные
зоны гипоталамуса. Возбуждение цент-
ральных терморецепторов гипоталаму-
са может быть связано с влиянием
механических факторов — травмы,
опухоли, гематомы; химических —
стрихнина, кофеина; с рекруитирова-
нием этих нейронов в повышенную
электрическую активность при эпилеп-
сии. Последующие патогенетические
механизмы повышения температуры
близки к таковым при лихорадке;
«злокачественной гипертермией».
Этот синдром в своей основе имеет
наследственную природу — по ауто-
сомно-доминантному типу передает-
ся неполноценность мембран мышеч-
ных клеток. Эта неполноценность вы-
является на фоне сочетания наркоза
и миорелаксантов: вместо расслабле-
ния скелетных мышц формируется их
ригидность и в течение короткого вре-
мени температура тела достигает 43 —
45 °C, что чаще всего ведет к гибели
больного. В механизме этой гипертер-
мии имеют значение повышение кре-
атинфосфокиназной активности в
мышечных клетках; накопление ионов
кальция в миоплазме; усиленный рас-
пад гликогена с образованием молоч-
ной кислоты, двуокиси углерода и
энергии; разобщение митохондриаль-
ного окислительного фосфорилирова-
ния; угнетение синтеза АТФ;
перегреванием организма, связан-
ным с воздействием на организм вы-
сокой внешней температуры. Меха-
низмы теплоотдачи, несмотря на их
максимальное напряжение, оказыва-
ются недостаточными для сохранения
нормальной температуры тела. Начи-
нается ее патологическое повышение.
Субъективные ощущения в этом слу-
чае оказываются более тяжелыми, чем
при лихорадке. При перегревании все
эффекторные процессы напряжены до
предела, чего не происходит при ли-
хорадке. При перегревании сначала
повышается температура тела и только
после этого в крови нарастает концен-
трация глюкокортикоидов, повыша-
ющих неспецифическую резистент-
ность организма; при лихорадке — на-
оборот. Длительное перегревание при-
водит к гибели организма (температура
тела достигает 42 —43 °C), а лихорад-
ка причиной смерти не является;
С.
Т-
к
Б.
С?
легкие
t'-уры
«г-лей»,
к смеет
к зуто-
гт^дает-
* 111СЧ-
D£“b ВЫ-
+.?коза
с_’дбле-
;я их
®г: вре-
е±~43-
i. ~:бели
«тертер-
w t кре-
кн~ :ти в
fc ЮНОВ
hr: рас-
• - J.TO4-
1г'::да и
ню галь-
кт рова-
i л чзан-
> i: вы-
k '-lexa-
г- -:а их
*^;ыва-
Bs. нения
в. Начи-
ш_ение.
IF. СЛу-
:. чем
и :л все
Мины до
г хи ли-
| -начала
|> _:лько
Г-л нцен-
»пыша-
ЕУ : тент-
Ви — на-
йм- : при-
Иетатура
ь.и" ?рац-
гипертермией, связанной с попа-
данием в организм ядов, разобща-
ющих процессы окисления и фосфо-
рилирования в митохондриях клеток:
2,4-динитрофенола, цианидов, амита-
ла, олигомицина. Менее жесткое раз-
общение этих процессов вызывает по-
вышение в организме концентрации
тиреоидных гормонов и прогестерона.
Разобщение процессов окисления и
фосфорилирования нарушает аккуму-
лирование энергии окисления в про-
цессе образования макроэргов и спо-
собствует выделению энергии в виде
значительного количества тепла;
повышением температуры тела в
ситуациях эмоционального стресса —
у актеров перед выходом на сцену,
спортсменов на старте, студентов во
время экзаменов. Незначительный
подъем температуры в этих случаях
объясняется симпатоадреналовой ак-
тивацией метаболизма.
Значение лихорадки. Как типиче-
ский патологический процесс, сопро-
вождающий многие заболевания, ли-
хорадка привносит в организм меха-
низмы зашиты и элементы поврежде-
ния. В оценке значимости лихорадки
недопустим утилитарный подход: по-
лезна лихорадка или нет. Правильным
является другой критерий: помогает ли
лихорадка формированию резистент-
ности организма при действии на него
повреждающих факторов и в первую
очередь инфекционных агентов. С этих
позиций и следует рассматривать ее
положительную и отрицательную роли.
Лихорадка имеет следующие положи-
тельные стороны:
препятствует размножению микро-
организмов. Это во многом связано с
тем, что при лихорадке снижается
количество сывороточного ионизиро-
ванного железа (в основном за счет
связывания его ферритином), иони-
зированного цинка, концентрация
меди нарастает. Изменение концент-
раций перечисленных двухвалентных
ионов рассматривается в настоящее
время как один из механизмов биоло-
гического действия эндогенных имму-
номодуляторов (ИЛ-1, ИЛ-6). Хорошо
известно, что при температуре 40 °C
практически не размножаются мико-
бактерии туберкулеза, гонококки, тре-
понемы, некоторые пневмококки. Ли-
хорадка снижает устойчивость возбу-
дителей заболеваний к антимикроб-
ным препаратам;
усиливает иммунный ответ. Это ка-
сается активации как специфическо-
го иммунитета (увеличивается выра-
ботка антител), так и неспецифиче-
ского механизма защиты (стимулиру-
ется фагоцитоз), особенно хемотаксис
нейтрофилов и моноцитов, активиру-
емый лимфокинами и монокинами,
количество которых при температуре
более 38 °C значительно возрастает;
в процессе развивающегося при
лихорадке общего адаптационного
синдрома включаются механизмы га-
поталамо-гипофизарно-надпочечни-
ковой защиты, формирующей глубо-
кие приспособительные изменения
метаболизма;
способствует выработке многих за-
щитных факторов: интерферона, ли-
зоцима. Интерферон является един-
ственным организменным фактором,
эффективно влияющим на вирус грип-
па. При более высокой температуре
вдет активация внутриклеточных фер-
ментов, препятствующих репродукции
вирусов;
искусственно созданная лихорадка
(путем введения пирогенов) форми-
рует условия для более эффективного
специфического лечения вялотекущих
заболеваний (костно-суставного тубер-
кулеза, сифилиса, гонореи и др.). Это
связано с ростом проницаемости гис-
тогематических барьеров, расширени-
ем сосудов и увеличением местного
объемного кровотока. Следует лишь
199
отметить, что увлечение пиротерапи-
ей при лечении многих болезней,
наблюдавшееся в 60 —70-е гг. XX в.,
в настоящее время сменилось более на-
учным и аргументированным подхо-
дом к назначению пирогенных средств.
Это связано с пониманием непироген-
ного воздействия пирогенала и его
аналогов на различные системы орга-
низма и прежде всего на иммунную
систему. Будушее пиротерапии связа-
но с внедрением в клиническую прак-
тику препаратов, созданных на базе
эндопирогенов, не обладающих ток-
сичностью;
очень часто лихорадка — первый и
единственный признак заболевания и
наблюдение за ее характером являет-
ся важным элементом диагностиче-
ской тактики врача, а для больного —
это сигнал о необходимости обраще-
ния к врачу;
в большинстве случаев лихорадка
обеспечивает физиологически оправ-
данный постельный режим больного.
Таким образом, отмеченные мно-
гочисленные положительные свойства
лихорадки подчеркивают ее защитно-
приспособительное значение при фор-
мировании разнообразной патологии.
Сравнительно-эволюционный подход
к оценке значения этого типового па-
тологического процесса подтверждает
это утверждение:
само становление сложных меха-
низмов гипертермии при лихорадке,
их активный характер, совершенство-
вание их в фило- и онтогенезе. Глу-
бокая эволюционная связь лихорад-
ки с наиболее древней и стабильной
защитно-приспособительной клеточ-
ной реакцией организма — фагоци-
тозом;
известные опыты Клюгера, Бемгей-
ма, Метью (Kluger, Bernheim, Metthew)
по введению ящерицам культуры
Aeromonas hydrophila, являющейся па-
тогенной для рептилий в поведенче-
ской ситуации выбора температурно-
го режима, сопровождались перемеще-
нием ящериц в зону более высокой
температуры, что способствует их вы-
живанию. Летальность у ящериц, ко-
торые не имели выбора и пребывали
на фоне бактериального повреждения
в зоне низкой температуры была на-
много выше;
наличие в организме, наряду с ме-
ханизмами повышения температуры,
системы, регулирующей уровень ее
подъема. При этом центральные зве-
нья обеих систем эволюционно сфор-
мированы на уровне гипоталамуса.
Лихорадка имеет отрицательные,
опасные стороны:
увеличивает нагрузку на сердечно-
сосудистую систему, особенно у лиц
с ее органическими поражениями.
Следует также помнить о нежелатель-
ных проявлениях III стадии в случае
критического падения температуры;
снижает аппетит, нарушает секре-
цию и моторику желудочно-кишечно-
го тракта; при длительной лихорадке
происходит исхудание организма;
тяжелая лихорадка неблагоприятно
влияет на центральную нервную си-
стему, угнетая ее — возникает голов-
ная боль, нарушается условнорефлек-
торная деятельность и координация
внимания, сон; у детей нередко фор-
мируются судороги;
вызывает у больного явления дис-
комфорта: озноб, жар, пот, сонли-
вость, чувство разбитости и др.;
выраженная 5 —7-дневная лихо-
радка выключает сперматогенез на
3 — 4 нед.
Весьма непростым является вопрос
о патогенетическом подходе к жаро-
понижающей терапии. В основном
приспособительное значение лихорад-
ки обусловливает сужение показаний
для назначения жаропонижающих
средств. Назначение антипиретиков во
всех случаях лихорадки явно неоправ-
б '.тЛВ
.£. -
V: -ЙВ*
ч-; - :
200
эно-
"c ,еще-
^-ОКОЙ
" \ вы-
г < _. ко-
глвали
е. *дения
\ на-
t- v ме-
^.дуры,
‘зснъ ее
зве-
- ; фор-
h. .а.
<.‘;ные,
г дечно-
г . лиц
и -_:ЯМИ.
»-’-:ель-
- _~учае
ры;
.екре-
I. _ечно-
* : радке
W7331THO
► •? си-
Г VIOB-
'5трлек-
i_. ацня
1--. фор-
! -. ДИС-
-:нли-
ИХО-
»--.ез на
t зспрос
- каро-
: зном
эрад-
.... аний
:* - ощих
г- ов во
---: трав-
данно, так как при этом ингибируется
множество эволюционно закрепленных
механизмов компенсации повреждений
организма, таких как фагоцитоз, син-
тез простагландинов, интерлейкинов,
интерферона, угнетаются окислитель-
ные процессы, кровоток, тонус и ак-
тивность скелетных мышц.
Показаниями для назначения жа-
ропонижающих препаратов, безуслов-
но, можно считать:
гиперпиретическую лихорадку;
лихорадку у лиц с поражениями
сердечно-сосудистой системы;
лихорадку у детей младшего возра-
ста, склонных к развитию судорожно-
го синдрома;
отдельные клинические случаи за-
болеваний. требующие специализиро-
ванной оценки, например, при бере-
менности в акушерской практике, ле-
чении бактериального шока и т.д.
Таким образом, коррекция темпе-
ратурного режима требует не шаблон-
ного подхода, а гибкой врачебной так-
тики.
Контрольные вопросы
1. Что такое химическая и физическая
терморегуляция?
2. Что такое лихорадка?
3. Назовите этиологические факторы,
вызывающие лихорадку.
4. Как изменяется тепловой обмен на
первой стадии лихорадки?
5. Охарактеризуйте изменение тепло-
вого обмена на второй стадии лихорад-
ки.
6. Как изменяется тепловой обмен на
третьей стадии лихорадки?
7. Какое значение для организма имеет
лихорадка?
8. Какие виды лихорадки вы знаете?
9. Какие типы температурных кривых
вам известны?
ГЛАВА 6
ОТВЕТ ОСТРОЙ ФАЗЫ
6.1. Механизм ответа
острой фазы
Любое повреждение, сопровожда-
ющееся заметными нарушениями ге-
мостаза, вызывает наряду с местной
воспалительной реакцией ряд сложных
системных реакций, которые обуслов-
лены активацией защитных и регуля-
торных систем организма. Эти реакции
обозначены как «ответ острой фазы».
Для ответа острой фазы характерны
нарушения, обусловленные вовлече-
нием в реакцию нервной, эндокрин-
ной, иммунной и кроветворной си-
стем, к которым относятся:
лихорадка;
сонливость;
потеря аппетита (анорексия);
безразличие к окружающему;
боли в мышцах (миалгия) и суста-
вах (артралгия);
нейтрофильный лейкоцитоз со сдви-
гом влево;
ускорение СОЭ;
активизация фагоцитоза (усиление
кислородного метаболизма, поглоти-
тельной и бактерицидной активности
нейтрофилов, моноцитов, макрофагов);
изменение концентрации и соотно-
шения сывороточных белков — повы-
шение уровня белков острой фазы,
снижение содержания альбумина и
трансферрина;
активация системы комплемента;
активизация системы свертывания
крови; повышение содержания в сы-
воротке крови ряда гормонов (адре-
нокортикотропного гормона (АКТГ),
вазопрессина);
отрицательный азотистый баланс;
изменение содержания микроэле-
ментов в сыворотке крови (снижение
уровня железа и цинка, повышение
уровня меди).
Ответ острой фазы обусловлен воз-
действием бактериальных, грибковых
и вирусных инфекций, острых и хро-
нических заболеваний неинфекцион-
ной природы, а также ожогов, травм,
ишемических повреждений тканей,
неопластического роста и др.
Системные реакции, составляющие
суть ответа острой фазы, связаны с
синтезом в организме специальных
медиаторов, функцию которых выпол-
няют провоспалительные цитокины.
Они секретируются клетками, участву-
ющими в воспалительном ответе, раз-
вивающемся в месте первичного по-
вреждения: моноцитами, макрофага-
ми, нейтрофилами, лимфоцитами,
клетками эндотелия микроциркуля-
торных сосудов, фибробластами и др.
Эти медиаторы попадают в кровоток
и условием для их воздействия на клет-
ки-мишени является присутствие на
поверхности последних соответствую-
щих рецепторов. К числу важнейших
медиаторов ответа острой фазы отно-
сятся ИЛ-1, ИЛ-6, фактор некроза
опухолей (ФНО-сс).
Спектр клеток-мишеней так же ши-
рок. как и спектр клеток продуцен-
тов. К ним относятся кроветворные
клетки, практически все клетки им-
202
:тг),
дне;
: эле-
:ение
:ение
: зоз-
:вых
•:ро-
-ЛОН-
гзвм,
-лей,
<шие
--: ы с
-НЫХ
сол-
ны.
^тву-
раз-
ло-
<зга-
"-МИ,
V ля-
др.
а*: ток
I 'Лет-
не на
~ую-
!>ОИХ
- 310-
t-лоза
_ДИ-
г -ен-
*т-1ые
t- ам-
Рис. 6.1. Ответ острой фазы (схема):
ИЛ-1 — интерлейкин-1; ИЛ-6 — интерлейкин-6; ФНО-а — фактор некроза опухолей альфа
мунной системы, включая моноииты,
макрофаги и лимфоциты, клетки со-
судистого эндотелия, гепатоциты, в
случае ИЛ-1 — клетки гипоталамуса
и гипофиза и т.д.
При условии проникновения про-
воспалительных цитокинов в кровоток
реализуется их системное действие, в
том числе стимуляция проявлений
ответа острой фазы (рис. 6.1).
Действие всех рассматриваемых
цитокинов носит преимущественно за-
щитный характер, однако в тех случа-
ях, когда стимул к их выработке и
активации клеток-мишеней бывает
слишком интенсивным, эффект ци-
токинов может стать деструктивным.
Это проявляется в развитии местного
повреждения тканей вследствие раз-
вития чрезмерно интенсивного воспа-
ления, а также индукции программи-
рованной гибели клеток.
6.2. Белки острой фазы
Ответ острой фазы характеризует-
ся существенным увеличением содер-
жания в сыворотке определенных бел-
ков, которые получили название бел-
ков острой фазы (табл. 6.1). У человека
к ним причисляют С-реактивный бе-
лок, сывороточный амилоид А, фиб-
риноген, гаптоглобин, а-1-антитрип-
син, а-1 -антихимотрипсин и другие —
всего около 30 белков.
Таблица 6.1
Белки острой фазы в сыворотке крови
Степень увеличения содержания Наименование белков
Значительная (в 1000 раз и более) С-реактивный белок, сывороточный амилоид А
Умеренная (в 210 раз) а-1 -антитрипсин, а-1 -антихимотрипсин, фибриноген, гаптоглобин
Слабая (в 2 раза) Церулоплазмин, СЗ-компонент комплемента, инактиватор С1-компонента комплемента
Белки острой фазы участвуют в
процессах, способствующих сохране-
нию гомеостаза: в развитии воспале-
ния, фагоцитоза чужеродных частиц,
нейтрализации свободных радикалов,
инактивации потенциально опасных
для тканей хозяина ферментов и т.д.
При остро развивающемся повреж-
дении концентрации С-реактивного
белка и сывороточного амилоида А
в крови существенно возрастают уже
через 6 — 10 ч после начала повреж-
дения.
Концентрация других белков ост-
рой фазы, в том числе фибриногена и
антиферментов, растет более медлен-
но, в течение 24—48 ч.
Существуют белки, содержание
которых в сыворотке во время ответа
острой фазы снижается. Такие белки
иногда называют негативными белка-
ми острой фазы. К ним относятся, в
частности, альбумин и трансферрин.
Уровень белков острой фазы в кро-
ви определяется прежде всего синте-
зом и секрецией их гепатоцитами. Важ-
нейшая роль в регуляции этих процес-
сов принадлежит ИЛ-6 и родственным
ему цитокинам, в меньшей степени
ИЛ-1, ФНО-а, а также глюкокорти-
коидам.
Возможно, продукция различных
белков острой фазы контролируется
разными цитокинами.
С-реактивный белок (СРБ) был
одним из первых идентифицированных
белков острой фазы. Он получил на-
звание в связи со способностью взаи-
модействовать в присутствии Са2+ с
С-полисахаридом пневмококков. СРБ
взаимодействует с полисахаридными
и липидными компонентами поверх-
ности микробов, прежде всего с фос-
форилхолином. В то же время, он не
способен взаимодействовать с фосфо-
рилхолином соматических клеток хо-
зяина.
С-реактивный белок действует как
опсонин, поскольку его связь с мик-
роорганизмами облегчает поглощение
их фагоцитами хозяина; активирует
комплемент, способствуя лизису бак-
терий и развитию воспаления; уси-
ливает цитотоксическое действие
макрофагов на клетки опухолей; сти-
мулирует высвобождение цитокинов
макрофагами.
Содержание СРБ в сыворотке кро-
ви быстро нарастает в самом начале
инфекционных и неинфекционных
болезней (от 1 мкг/мл до более чем
1 мг/мл) и быстро снижается при вы-
здоровлении. Поэтому СРБ служит до-
статочно ярким, хотя и неспепифи-
ческим маркером повреждений.
Сывороточный амилоид А (САА) —
другой главный белок острой фазы у
человека. Он находится в сыворотке
204
оыл
-:ных
как
ик-
:тие
Езаи-
с
СРВ
ид- ыми
ьерх-
’ - рос-
.- не
ахсфо-
: ХО-
ги-
Ще ;ти-
ЩВЕ‘ нов
крови в комплексе с липопротеинами
высокой плотности и вызывает адге-
зию и хемотаксис фагоцитов и лим-
фоцитов, способствуя развитию вос-
паления в пораженных атеросклерозом
сосудах.
Продолжительное увеличение со-
держания САА в крови при хрониче-
ских воспалительных и неопластиче-
ских процессах предрасполагает к ами-
лоидозу.
Фибриноген —- белок системы свер-
тывания крови; создает матрикс для
заживления ран, обладает противовос-
палительной активностью, препят-
ствуя развитию отека.
Церуплазмин (поливалентная окси-
даза) — белок, содержащий медь про-
тектор клеточных мембран, нейтрали-
зующий активность супероксидного и
других радикалов, образующихся при
воспалении.
Гаптоглобин — связывает гемогло-
бин, а образующийся при этом комп-
лекс действует как пероксидаза —
фермент, способствующий окислению
различных органических веществ пе-
рекисями. Конкурентно тормозит ка-
тепсин С и катепсины В и L. Ограни-
чивает утилизацию кислорода патоген-
ными бактериями.
Ингибиторы активности фермен-
тов — так называемые антифермен-
ты — сывороточные белки, которые
ингибируют протеолитические фер-
менты, проникающие в кровь из мест
Щк. ..ро-
W -_-:але
- ных
itofc -:ем
эЫ-
до-
ек,... эи-
W
Шес.д у
Щкндке
воспаления, где они появляются в ре-
зультате дегрануляции лейкоцитов и
гибели клеток поврежденных тканей.
К ним относится а-1-антитрипсин,
который подавляет действие трипси-
на, эластазы, коллагеназы, урокина-
зы, химотрипсина, плазмина, тром-
бина, ренина, лейкоцитарных проте-
аз. Недостаточность а-1-антитрипсина
приводит к разрушению тканей фер-
ментами лейкоцитов в очаге воспа-
ления.
Другой известный антифермент
а-1-антихимотрипсин — оказывает
действие, сходное с таковым а-1-ан-
титрипсина.
Трансферрин — белок, обеспечива-
ющий транспорт железа в крови. При
ответе острой фазы его содержание в
плазме снижается, что приводит к ги-
посидермии. Другой причиной гипо-
сидермии при тяжелых воспалитель-
ных процессах может быть усиленное
поглощение железа макрофагами и
повышение связывания железа лакто-
феррином, который синтезируется
нейтрофилами и содержание которо-
го в крови увеличивается параллель-
но с увеличением содержания ней-
трофилов. Одновременно со снижени-
ем содержания трансферрина усили-
вается синтез ферритина, что способ-
ствует переходу лабильного железа в
ферритиновые запасы и затрудняет
использование железа. Снижение сы-
вороточного железа препятствует раз-
множению бактерий, но в то же вре-
мя может способствовать развитию же-
лезодефицитной анемии.
6.3. Главные медиаторы
ответа острой фазы
Интерлейкин-1 (ИЛ-1) — это мно-
гофункциональный (плейотропный)
цитокин, обнаруженный впервые как
продукт лейкоцитов, вызывающий
лихорадку при введении животным. Он
относится к семейству, состоящему из
трех структурно родственных пепти-
дов: интерлейкина-1а (ИЛ-1а); интер-
лейкина- 1р (ИЛ-1р) и антагониста
рецептора для ИЛ-1.
Две известные формы ИЛ-1 (а и
Р) — продукты разных генов. Они раз-
личаются своей аминокислотной
последовательностью, но имеют сход-
ную трехмерную структуру. Интерлей-
кины взаимодействуют с одним и тем
205
же рецептором, обнаруживая сходную
биологическую активность. Главной
секреторной формой является ИЛ-1р.
Интерлейкин-1 секретируют мно-
гие клетки: моноциты, макрофаги, эн-
дотелиальные клетки, нейтрофилы,
В-клетки, натуральные киллерные
клетки, фибробласты, дендритные
клетки кожи, мезангиальные клетки
почек, клетки глии, нейроны. Способ-
ностью секретировать ИЛ-1 обладают
также некоторые опухолевые клетки.
Продукция ИЛ-1 может быть вы-
звана разными агентами, включая
микроорганизмы и продукты их жиз-
недеятельности: антигены немикроб-
ного происхождения, органические и
неорганические соединения неанти-
генного происхождения (например,
соли кремния, желчных кислот, мо-
чевой кислоты), цитокины (ФНО-а,
ИЛ-6), активные компоненты комп-
лемента (С5а), нейрогормоны (веще-
ство Р), гликопротеины табака, ульт-
рафиолетовое излучение, гамма-излу-
чение, гипоксия или гипероксия,
перегревание и др.
Интерлейкин-1 опосредует различ-
ные защитные процессы в организме,
активируемые при повреждении раз-
ных тканей. Как отмечалось, он явля-
ется одним из важнейших медиаторов
воспаления, развивающегося в месте
повреждения. Когда связанная с вос-
палением продукция ИЛ-1 возраста-
ет, он вызывает системные реакции,
что делает его важнейшим медиатором
ответа острой фазы.
Интерлейкин-1 стимулирует им-
мунную систему: активирует Т-клет-
ки и усиливает продукцию ими ин-
терлейкина-2, индуцирует экспрессию
рецепторов для ИЛ-2 на активирован-
ных антигеном Т-клетках. Это приво-
дит к быстрому разрастанию соответ-
ствующего клона Т-клеток. Совмест-
но с другими цитокинами активирует
В-клетки, способствуя их пролифера-
ции и дифференцировке в плазмати-
ческие клетки, продуцирующие анти-
тела.
Этот цитокин воздействует на цент-
ральную нервную систему. Появление
в мозге ИЛ-1 вызывает лихорадку,
сонливость, снижение аппетита, ади-
намию, снижение интереса к окружа-
ющему, депрессию, меняет функцию
эндокринной системы. Он активизи-
рует ось «гипоталамус — гипофиз —
надпочечники», вызывает высвобож-
дение гипоталамусом аргинин-вазо-
прессина. В то же время он ингибирует
секрецию пролактина, снижает сек-
рецию гонадотропина и половых сте-
роидных гормонов. Одним из важных
последствий изменения функций эн-
докринной системы под влиянием
ИЛ-1 является предупреждение избы-
точной активации иммунной системы.
Интерлейкин-1 действует как гемо-
поэтин на стволовые клетки костного
мозга в присутствии ИЛ-3 и других
факторов гемопоэза, что приводит к
нейтрофильному лейкоцитозу со сдви-
гом влево и к увеличению содержа-
ния тромбоцитов в крови. ИЛ-1 сти-
мулирует секрецию других цитокинов,
участвующих в ответы острой фазы,
прежде всего ИЛ-6 и ФНО-а.
Существует два типа поверхностных
рецепторов для ИЛ-1 (ИЛ-1Р): ИЛ-1Р
типа I и ИЛ-1Р типа II, внеклеточ-
ные домены которых сходны, а внут-
риклеточные различны. Связь ИЛ-1 с
рецептором типа I обеспечивает пе-
редачу сигнала внутрь клетки, а связь
ИЛ-1 с рецептором типа II не приво-
дит к передаче сигнала. В результате
ИЛ-1Р типа 11 действует как «ловуш-
ка» для ИЛ-1, предупреждая его взаи-
модействие с очень большим числом
рецепторов типа I и соответственно
чрезмерную активацию клеток-ми-
шеней.
Значительная часть эффектов ИЛ-1
реализуется с участием циклооксиге-
206
чати-
: ЗНТИ-
г. дент-
зление
~шку,
: ади-
•щужа-
-.<цию
'-2ИЗИ-
ггиз—
З'.ООЖ-
t-зазо-
с'рует
сек-
fc сте-
й-кных
з< < эн-
<-:ием
: !30Ы-
•~емы.
i емо-
<~ного
~угих
Л IT к
и -ДВИ-
сержа-
*- гти-
sc нов,
’ :азы,
₽>.~ных
J-1P
L 7ТОЧ-
знут-
Цвк" ПС
езязь
lit 'Z :во-
ОЙ ззаи-
♦ ;<слом
•l. 1-е ННО
•F -МИ-
Ш"г <Л-]
W .иге-
назы, которая катализирует метабо-
лизм арахидоновой кислоты, ведущий
к образованию простагландинов. При-
менение блокаторов циклооксигеназы
(ацетилсалициловой кислоты, индо-
метацина) подавляет лихорадку, сни-
жение аппетита, усиленную секрецию
АКТГ и другие эффекты ИЛ-1.
В организме человека существует
сложная система регуляции потенци-
ально повреждающего действия ИЛ-1.
В крови здоровых и больных людей
циркулируют растворимые рецепторы
ИЛ-1, которые являются внеклеточ-
ными фрагментами цитоплазматиче-
ских рецепторов ИЛ-1 типов 1 и II. Оба
растворимых рецептора связывают сво-
бодный ИЛ-1, предупреждая тем са-
мым его взаимодействие с мембран-
ными рецепторами.
Другим важным элементом систе-
мы регуляции действия ИЛ-1 являет-
ся естественный антагонист рецепто-
ра ИЛ-1. Естественный антагонист ре-
цептора ИЛ-1 (ИЛ-1РА) — третий
член семейства ИЛ-1. Размеры и струк-
тура его молекулы сходны с таковы-
ми ИЛ-1. Антагонист рецептора ИЛ-1
продуцирует многие клетки, в том
числе и те, которые секретируют
ИЛ-1, хотя главными продуцентами
естественного ИЛ-1РА являются ско-
рее всего гепатоциты, что позволяет
считать его одним из белков острой
фазы. Антагонист рецептора ИЛ-1 свя-
зывается с клеточными рецепторами
для ИЛ-1, блокируя тем самым дей-
ствие ИЛ-1 на его клетки-мишени. При
этом взаимодействие самого ИЛ-1РА
с рецептором не является сигналом
для начала каких-либо внутриклеточ-
ных процессов, в связи с чем его на-
зывают чистым рецепторным антаго-
нистом. Введение антагониста рецеп-
тора ИЛ- 1 эффективно подавляет
многие вызываемые ИЛ-1 патологи-
ческие процессы: лихорадку, сонли-
вость, гипотензию, синтез белков ос-
трой фазы в печени, симптомы сеп-
тического шока in vivo.
Несмотря на существование указан-
ных механизмов сдерживания провес-
палительной активности ИЛ-1, при
некоторых обстоятельствах он секре-
тируется в чрезмерных количествах,
что вызывает разрушение тканей, сте-
пень которого может превышать пер-
воначальное повреждение. В таких слу-
чаях продукция ИЛ-1 становится фак-
тором, определяющим все дальнейшее
течение болезни. Значительное увели-
чение сывороточного ИЛ-ip обнару-
живается при септическом шоке —
клиническом синдроме, возникающем
при тяжелых бактериальных инфекци-
ях. Синдром характеризуется глубокой
гипотензией, лихорадкой, увеличени-
ем содержания лейкоцитов в перифе-
рической крови. Многие симптомы
септического шока можно воспроиз-
вести у животных введением ИЛ-1.
Введение блокаторов действия ИЛ-1
оказывает положительный эффект при
экспериментальном септическом шоке
у животных, а также у людей с септи-
ческим шоком.
При ревматоидном артрите — хро-
ническом небактериальном воспале-
нии суставов — синовиальная оболоч-
ка инфильтрирована макрофагами,
лимфоцитами и другими клетками
хронического воспаления. В синовиаль-
ной жидкости суставов обнаруживает-
ся ИЛ-1 и многие симптомы ревмато-
идного артрита — лейкоцитарная ин-
фильтрация синовиальной оболочки,
распад хряща и ремоделирование ко-
стей вокруг суставов — могут быть вос-
произведены в эксперименте на живот-
ных введением им в сустав ИЛ-1.
Интерлейкин-1 является одним из
главных медиаторов острого повреж-
дения легких, возникающего при ост-
ром респираторном дистресс-синдро-
ме взрослых, который проявляется
резким отеком легких и массивной ин-
207
фильтрацией легочной ткани нейтро-
филами. В бронхиальном лаваже обна-
руживают увеличенную концентрацию
ИЛ-1.
Имеются веские доказательства уча-
стия ИЛ-1 и повреждении тканей при
воспалительных болезнях кишечника,
почек, в гибели р-клеток поджелудоч-
ной железы при инсулинзависимом
сахарном диабете, в развитии атеро-
склероза и в патогенезе многих других
болезней. Представлены данные о том.
что ИЛ-1 способствует прогрессии
миелолейкоза.
Интерлейкин-6 (ИЛ-6) — много-
функциональный (плейотропный)
цитокин, идентифицированный впер-
вые как секретируемый Т-клетками
фактор, вызывающий конечную диф-
ференцировку' В-клеток в плазмати-
ческие клетки, продуцирующие ан-
титела. По химической структуре это
белок молекулярной массой около
26000.
К числу клеток-продуцентов ИЛ-6
относятся макрофаги, фибробласты,
клетки сосудистого эндотелия, эпите-
лиальные клетки, моноциты, Т-клет-
ки, кератиноциты кожи, клетки эндо-
кринных желез, глиальные клетки и
нейроны дискретных областей мозга.
Стимуляторами синтеза ИЛ-6 яв-
ляются вирусы, бактерии, эндотокси-
ны, липополисахариды, грибы, про-
воспалительные цитокины ИЛ-1 и
ФНО-а. Интерлейкин-6 секретируют
также многие формы опухолевых кле-
ток (клетки остеосаркомы, карцино-
мы мочевого пузыря, шейки матки,
миксомы, глиобластомы). В отличие от
нормальных клеток опухолевые клет-
ки продуцируют ИЛ-6 постоянно без
внешней стимуляции.
Интерлейкин-6 является главным
стимулятором синтеза и секреции ге-
патоцитами печени белков острой
фазы. Кроме того, он активирует ось
«гипоталамус — гипофиз—надпочеч-
ники», вызывая секрецию кортико-
тропинвысвобождаюшего фактора
нейронами гипоталамуса и непосред-
ственно воздействуя на клетки перед-
ней доли гипофиза. Подобно ИЛ-1,
ИЛ-6 опосредует лихорадочный ответ
на эндотоксин, стимулирует пролифе-
рацию лейкоцитов в костном мозге.
Интерлейкин-6 необходим для ко-
нечной дифференцировки активиро-
ванных В-клеток в плазматические
клетки, продуцирующие антитела,
он усиливает продукцию некоторых
классов иммуноглобулинов зрелыми
плазматическими клетками, стимули-
рует пролиферацию и дифференци-
ровку Т-клеток, увеличивает продук-
цию интерлейкина-2 зрелыми Т-клет-
ками.
Интерлейкин-6 относится к семей-
ству гемопоэтических цитокинов. Он
обладает свойствами фактора роста и
дифференцировки для мультипотент-
ных стволовых клеток, стимулирует
рост гранулоцитов и макрофагов.
Хотя первичная роль ИЛ-6 состоит
в активации процессов восстановле-
ния нарушенного гомеостаза, его из-
быточная продукция способствует по-
вреждению тканей. Так, существует
прямая корреляция между степенью
увеличения ИЛ-6 и прогрессией ауто-
иммунного ответа. Интерлейкин-6 спо-
собствует воспалительному поврежде-
нию суставов при ревматоидном арт-
рите. Длительное повышение уровня
ИЛ-6 в крови может быть причиной
активации остеокластов, разрушаю-
щих костную ткань.
Третий ключевой медиатор ответа
острой фазы — фактор некроза опухо-
лей (ФНО-о) — впервые был обнару-
жен как агент, способный уничтожать
опухолевые клетки in vitro и вызывать
геморрагический некроз транспланти-
рованных опухолей у мышей in vivo.
Этот же агент оказался ответственным
за кахексию, развивающуюся при тя-
208
•.орти ко-
фактора
-епосред-
" _.f перед-
iT-'э ИЛ-1,
С -Ъ1Й ответ
г “.оолифе-
» г мозге.
S* тля ко-
‘ х_' гивиро-
.'ческие
.-гтитела,
- чоторых
:эелыми
~лмули-
серенци-
" чродук-
? Т-клет-
?• семей-
с -:ов. Он
г. роста и
г дотент-
• -пирует
!СЭВ.
гостоит
-~шовле-
- его из-
~ует по-
-ествует
-"е ленью
леи ауто-
6 спо-
1 ережде-
1-: м арт-
г .ровня
Д' 'ЧИНОЙ
. ~.-шаю-
г этвета
-- тухо-
'нару-
•-ложать
-г :ывать
1".-ДНТИ-
vivo.
денным
“ли тя-
желых хронических болезнях, что дало
ему второе название «кахектин».
Клетками-продуцентами ФНО-а
являются прежде всего макрофаги,
а кроме того, Т-, В-клетки, Т-килле-
ры, нейтрофилы, эозинофилы, астро-
циты, тучные клетки.
Продукция ФНО-а может быть вы-
звана бактериальными токсинами (ли-
пополисахаридами, энтеротоксином),
вирусами, микобактериями, грибами,
паразитами, активированными ком-
понентами комплемента, комплекса-
ми «антиген — антитело», цитокинами
(ИЛ-I, ИЛ-6, ГМ-КСФ).
Фактор некроза опухолей а облада-
ет мощным провоспалительным дей-
ствием, которое обнаруживается преж-
де всего в местах его высвобождения.
Он активирует лейкоциты, вызывает
экспрессию молекул адгезии на мемб-
ране эндотелиальных клеток микро-
циркуляторных сосудов, способствуя
тем самым миграции лейкоцитов из
крови во внеклеточный матрикс; сти-
мулирует секрецию лейкоцитами ак-
тивных метаболитов кислорода; сти-
мулирует участвующие в воспалении
клетки к секреции провоспалительных
цитокинов, в том числе ИЛ-I, ИЛ-8,
ИЛ-6, '/-интерферона. Во время зажив-
ления раны ФНО-а содействует про-
лиферации фибробластов, стимулиру-
ет ангиогенез.
Фактор некроза опухолей усилива-
ет пролиферацию Т-клеток, пролифе-
рацию и дифференцировку В-клеток,
стимулирует рост натуральных килле-
ров, усиливает их цитотоксичность.
ФНО-а — один из важных факторов
защиты от внутриклеточных патоге-
нов, он обладает противовирусной
активностью, замедляет рост или вы-
зывает геморрагический некроз опу-
холей in vivo, цитотоксичен для мно-
гих линий опухолевых клеток in vitro.
В то время как все перечисленные
действия ФНО-а направлены на вос-
становление нарушенного гомеостаза,
избыточная продукция его взывает
системные токсические эффекты, ха-
рактер которых зависит от степени и
длительности подъема ФНО-а в кро-
ви. В числе токсических эффектов, выз-
ванных быстрым и значительным уве-
личением ФНО-а, следует в первую
очередь назвать нарушения гемодина-
мики, характеризующиеся снижени-
ем сократимости миокарда, падением
минутного объема сердца, уменьше-
нием венозного возврата. ФНО-а в вы-
сокой концентрации вызывает диф-
фузное увеличение проницаемости
капилляров. Расстройства гемодинами-
ки вызывают шок и недостаточность
функций многих органов. Избыток
ФНО-а нарушает антикоагулянтные
свойства эндотелия сосудов, что спо-
собствует возникновению синдрома
диссеминированного внутрисосуди-
стого свертывания. Гиперпродукция
ФНО-а может вызвать и другие угро-
жающие жизни расстройства, вклю-
чая острый респираторный дистресс-
синдром взрослых, множественные
некрозы в желудочно-кишечном трак-
те, некроз эпителия почечных каналь-
цев, кровоизлияния в надпочечники.
Увеличение концентрации ФНО-а
в меньшей степени, но на более дли-
тельный период вызывает анорексию,
лихорадку, кахексию, обусловленную
усиленным катаболизмом белка и ис-
чезновением жировых запасов, обез-
воживание, синтез белков острой фазы
в печени, резистентность к инсулину.
Как острый, так и хронический
эффекты ФНО-а являются следстви-
ем его непосредственного действия
на клетки-мишени и действия дру-
гих веществ, высвобождение которых
ФНО-а стимулирует. Так, острое ток-
сическое действие высокой концент-
рации ФНО-а связано с его прямым
цитотоксическим действием на мно-
гие клетки, включая клетки сократи-
209
тельного миокарда, гладкие мышцы
сосудов и клетки сосудистого эндоте-
лия, и с высвобождением таких био-
логически активных веществ, как ка-
техоламины, глюкагон, АКТГ, корти-
зол, ИЛ-1, ИЛ-6, у-интерферона,
фактора активации тромбоцитов, эй-
козаноидов. Возникновение лихорад-
ки и анорексии связано с прямым дей-
ствием ФИО-а на нейроны гипотала-
муса. Прямое действие ФНО-а на
клетки жировой ткани вызывает угне-
тение липогенных ферментов, в част-
ности липопротеинлипазы, приводя к
постепенному исчезновению жировой
ткани. Действие ФНО-а на мышцы вы-
зывает инсулиновую резистентность
мышц, распад мышечного белка, сни-
жение потенциала мембраны мышеч-
ных волокон, что способствует пере-
ходу натрия и воды внутрь миоцитов
и уменьшению воды во внеклеточном
пространстве, дегидратации тканей.
Существует два типа рецепторов
для ФНО-а, которые присутствуют на
всех типах клеток за исключением
эритроцитов. Рецепторы I типа имеют
молекулярную массу 55000, молеку-
лярная масса рецепторов II типа —
75000. Многие, и прежде всего цито-
токсические, эффекты ФНО-а на раз-
личные клетки опосредуются рецеп-
торами 1 типа (Рц55). Участие рецеп-
торов II типа (Рц75) в цитотоксично-
сти, возможно, сводится к тому, что
они связывают ФНО-а и «передают»
его затем Рц55, которые и обеспечи-
вают передачу сигнала. Оба типа ре-
цепторов разными способами участву-
ют в реализации вызываемого ФНО-а
клеточного апоптоза.
Цитотоксическое действие ФНО-а
усиливается в присутствии ингибито-
ров белкового синтеза. Полагают, что
многие клетки продуцируют белки,
нейтрализующие ФНО-а или «сопро-
тивляющиеся» его цитотоксическому
действию. Высокая цитотоксичность
ФНО-а для опухолевых клеток может
быть связана с тем. что опухолевые
клетки не продуцируют таких белков.
В сыворотке и в моче больных опу-
холями, СПИДом, сепсисом обнару-
жены фрагменты внеклеточных доме-
нов обоих типов рецепторов, извест-
ные как ФНО-связывающие белки.
Концентрация этих белков в крови
существенно возрастает в условиях
избыточной продукции ФНО-а. Бел-
ки связываются с ФНО-а во внекле-
точной жидкости, препятствуя тем са-
мым взаимодействию ФНО-а с цито-
плазматическими рецепторами и пред-
упреждая цитотоксическое действие
ФНО-а на клетки. Несмотря на то, что
молярная концентрация ФНО-связы-
вающих белков, как правило, на не-
сколько порядков превышает моляр-
ную концентрацию ФНО-а, этого не-
достаточно для того, чтобы предот-
вратить токсический эффект ФНО-а
при септическом шоке и менингите.
Контрольные вопросы
I. Что такое «ответ острой фазы»?
2. Охарактеризуйте реакции «ответа ос-
трой фазы».
3. Чем вызывается ответ острой фазы?
4. Какие белки острой фазы вам изве-
стны?
5. Какими свойствами характеризуют-
ся белки острой фазы?
6. Какие медиаторы острой фазы вам
известны?
7. Какими свойствами характеризуют-
ся медиаторы острой фазы?
ЬГхЮТ, ЧТО
белки,
“i" -сопро-
> вескому
ь-ичность
может
' толевые
белков.
•-ь:.х опу-
। бнару-
ьг<_ доме-
извест-
с белки.
5 КРОВИ
-ТОВИЯХ
t-x Бел-
* внекле-
> ' тем са-
i : цито-
" и пред-
действие
t- то, что
-гвязы-
• на не-
' чоляр-
ттго не-
~эедот-
йНО-а
*нтите.
ГЛАВА 7
ПАТОФИЗИОЛОГИЯ ИНФЕКЦИОННОГО ПРОЦЕССА
«И 5W,
I
е:-. •1
гтета ос-
разы?
it-» изве-
ег :уют-
‘□ьц; вам
гг- л.ют-
7.1. Инфекционные
агенты
Инфекции (от лат. infectio — зара-
жение) — это болезни, обусловлен-
ные повреждением клеток и тканей,
вызванным проникшими внутрь орга-
низма человека чужеродными организ-
мами. Вероятность такого проникно-
вения или инфицирования существу-
ет постоянно, поскольку микроорга-
низмы населяют все окружающее нас
пространство и даже живут на поверх-
ности нашего тела — на коже, в по-
лости рта. кишечника и в других со-
общающихся с внешней средой поло-
стях. В обычных условиях большая часть
таких микроорганизмов сосуществует
с человеком, не причиняя ему вреда,
формируя его нормальную микрофло-
ру. Однако эти безобидные микроор-
ганизмы могут становиться патогена-
ми и вызывать так называемые оппор-
тунистические инфекции, если осла-
бевают защитные механизмы хозяина
или если эти микроорганизмы зано-
сятся в несвойственные им места. При-
мером может служить занос кишечной
палочки в мочеполовой тракт.
Время от времени человек встре-
чается с микробами, которые не вхо-
дят в состав его нормальной микро-
флоры. Некоторые из них сравнитель-
но легко преодолевают защитные
барьеры и, проникая внутрь организ-
ма человека, вызывают болезнь. Хотя
число таких болезнетворных, или па-
тогенных, организмов относительно
невелико, инфекции остаются одной
из главных причин заболеваемости и
смертности человека.
Вирусы — небольшие (диаметром
менее 200 нм) частички, состоящие
из белка и нуклеиновой кислоты —
РНК или ДНК, в которой содержит-
ся полная информация, необходимая
для воспроизведения вируса. Однако
вирусы лишены аппарата, способно-
го реализовать эту информацию, и
репликация (размножение) вируса
становится возможной только после
того, как он проникает внутрь клеток
хозяина и использует биосинтетиче-
ский аппарат для собственного вос-
произведения.
Бактерии — это одноклеточные
микроорганизмы (прокариоты) диа-
метром около 1 мкм, способные к ав-
тономному существованию. Подобно
вирусам бактерии не имеют ядра, но
в отличие от вирусов содержат как
ДНК, так и РНК, и имеют геном, со-
стоящий из ДНК. У бактерий есть кле-
точная мембрана. Лишь некоторые из
множества окружающих нас бактерий
способны вызывать болезни.
Эукариоты — наиболее сложные
инфекционные агенты. Внутри клеток
эукариот имеются различные органел-
лы, в том числе ядро и митохондрии,
выполняющие специальные функции.
К патогенным организмам этой груп-
пы относятся простейшие, грибы, и
многоклеточные паразитарные черви.
Прионы — самые простые инфек-
ционные агенты, представляющие со-
211
бой одиночные чрезвычайно устойчи-
вые белковые молекулы, не содержа-
щие генетической информации. Уве-
личение числа («размножение») этих
молекул происходит благодаря тому,
что они преобразуют внутриклеточный
белок хозяина в белок приона.
Насекомые и паукообразные также
способны паразитировать на человеке
и вызывать болезни, например, чесо-
точный клещ вызывает чесотку.
7.2. Источники инфекций
и пути их проникновения
в организм
Источник инфекции может быть
эндогенным (собственная микробная
флора в случае оппортунистических
инфекций) или экзогенным — окру-
жающая среда (вода, пиша, почва или
воздух). Источником инфекционных
агентов могут быть больные люди, ди-
кие или домашние животные и птицы.
Болезни, которыми человек заража-
ется от животных, получили название
«зоонозы». К зоонозам относится си-
бирская язва, бешенство, кошачья ца-
рапка, пситтакоз (орнитоз) и другие
болезни, вызываемые бактериями, ви-
русами, риккетсиями, а также прото-
зойные (вызываемые простейшими)
болезни, передаваемые человеку при
укусах членистоногих-переносчиков,
такие как малярия, энцефалит, мно-
гие тропические болезни, вызываемая
трипаносомами сонная болезнь.
Существуют различные пути про-
никновения (входные ворота) возбу-
дителей инфекционных болезней в
организм.
Пенетрация. Проникновение (инва-
зия) микроорганизмов внутрь челове-
ческого тела облегчается при любом
нарушении целостности поверхност-
ных барьеров — кожи, слизистых обо-
лочек, которое может быть следстви-
ем ранений, разнообразных медицин-
ских процедур, предшествующих ин-
фекционных или неинфекционных
воспалительных процессов. Инфекци-
онные агенты могут быть занесены
непосредственно в кровоток (инъек-
ции, укусы животных или насекомых).
Такая инвазия особенно опасна, по-
скольку сразу большое количество воз-
будителей проникает в организм хозяи-
на, обходя связанную с кожей и сли-
зистыми оболочками систему защиты.
Прямой контакт. Заражение неко-
торыми патогенами может происхо-
дить при прямом контакте инфици-
рованных тканей или секретов с не-
поврежденными обнаженными слизи-
стыми. Это особенно характерно для
инфекций, передаваемых половым
путем, — СПИДа, сифилиса, гоно-
реи, хламидиоза, генитального герпе-
са. Возбудители этих болезней могут
вызывать и «вертикальное» заражение
плода через плаценту или во время
родов при контакте плода с заражен-
ной слизистой влагалища.
Алиментарное заражение. Проник-
новение микроорганизмов и их ток-
синов через рот и желудочно-кишеч-
ный тракт (ЖКТ) — один из наибо-
лее частых путей заражения человека.
Именно таким способом человек за-
ражается многими бактериальными,
вирусными и протозойными инфек-
циями, включая холеру, брюшной
тиф, бактериальную и амебную дизен-
терию, гепатит А. Возбудители болез-
ней попадают в организм вместе с за-
грязненной водой, пищей, при несоб-
людении личной гигиены. Заражение
происходит в том случае, если доста-
точное число микроорганизмов (ин-
фицирующая доза) выживает в кис-
лой среде желудка, выдерживает дей-
ствие пищеварительных ферментов и
неблагоприятное воздействие кишеч-
ной перистальтики. Попавшие в ЖКТ
микроорганизмы должны, кроме того,
212
гтицин
<—их ин-
— ионных
'* фскшн
•_ несены
— инъек-
t-хОМЫХ).
-- ;а, по-
^'-’ВО воз-
хозяи-
е и сли-
1 защиты.
< е неко-
-роисхо-
нфици-
= с не-
елизи-
“-РНО для
т: новым
•Li ГОНО-
► “ герпе-
; могут
гжение
э. время
-'тжен-
2ОНИК-
* X ток-
*-<-ялеч-
-аибо-
звека.
ь- в-ек за-
-ыми,
Яр* нфек-
• г • -Зной
гизен-
йэлез-
с за
Яры -есоб-
ЧввТ-хение
- эста-
' ин-
:<ис-
« - дей-
'В И
-зеч-
жкт
•В** того,
успешно конкурировать за питательные
вещества с нормальной микрофлорой
кишечника. Лица с пониженной желу-
дочной секрецией и другими болезня-
ми ЖКТ менее устойчивы к алимен-
тарному заражению, чем здоровые.
Ингаляция. Дыхательный тракт здо-
рового человека снабжен многоступен-
чатой системой защиты, предупреж-
дающей проникновение в легкие по-
тенциальных патогенов. Поверхность
дыхательного тракта покрыта слизью,
которая постоянно выводится в по-
лость рта движениями ресничек ци-
лиарного эпителия. Удалению посто-
ронних частиц из дыхательных путей
также способствует кашель. Секреты
дыхательных путей содержат антитела
и ферменты, способные инактивиро-
вать микроорганизмы.
Чужеродные частицы и микроор-
ганизмы, которые все-таки проника-
ют внутрь легких, поглощаются фаго-
цитами. Несмотря на это некоторые
патогены преодолевают эти барьеры и
проникают через дыхательный тракт
в легкие, вызывая пневмонии разно-
го генеза, туберкулез. Ингаляционный
путь заражения характерен также для
вирусных инфекций, таких как грипп,
острые респираторные заболевания,
корь, ветряная оспа, инфекционный
паротит и др. Нарушения функций
легких или слизистых оболочек рес-
пираторного тракта, вызванные неин-
фекционными процессами (эмфизе-
ма) или возникающие в связи с куре-
нием, увеличивают риск инфекций,
приобретаемых ингаляционным путем.
7.3. Специфичность
поражения
инфекционными агентами
Во многих случаях независимо от
входных ворот проникшие внутрь хо-
зяина микроорганизмы заселяют (ко-
лонизируют) определенные органы,
обнаруживая таким образом выра-
женную органотропность. Так, виру-
сы гепатита А, В, С, Е поражают ге-
патоциты, вирусы полиомиелита —
мотонейроны передних рогов спин-
ного мозга и ядер черепномозговых
нервов, вирусы иммунодефицита
человека (ВИЧ) — клетки иммунной
системы.
В одних случаях органотропность
обусловлена наличием соответствую-
щих друг другу — комплементарных —
структур на поверхностях патогена и
клеток-мишеней; в других случаях
тем, в какой степени условия суще-
ствования внутри того или иного
органа соответствуют биологическим
свойствам инфицирующего агента.
Поэтому анаэробные микроорганиз-
мы колонизируют толстый кишечник,
в то время как аэробные — верхние
дыхательные пути.
Отдельные микроорганизмы инфи-
цируют, как правило, только опреде-
ленные органы: возбудители гонореи
(A. gonorrhoeae) — органы мочеполо-
вого тракта; шигеллы — желудочно-
кишечный тракт. Биология бактерии,
вызывающей язву желудка (Helicobac-
ter pylori), такова, что она не способ-
на инфицировать какой-либо другой
орган.
Фактором, определяющим локали-
зацию инфекции, могут стать также
входные ворота инфекции. Так, золо-
тистый стафилококк, который явля-
ется частью нормальной микрофлоры
поверхности кожи и носоглотки, ста-
новится возбудителем инфекционно-
го воспаления кожи (и подлежащих
мягких тканей) в месте, где он про-
никает внутрь дермы в результате по-
вреждения эпидермиса при различного
рода ранениях, укусах насекомых или
поверхностных грибковых инфекциях.
Избирательность поражения (органо-
тропность) определяется, кроме того,
213
особенностями иммунной системы
инфицируемого субъекта и другими
факторами.
7.4. Возможные
механизмы повреждения
тканей инфекционными
агентами
Инфекционные болезни возника-
ют тогда, когда жизнедеятельность
микроорганизмов приводит к повреж-
дению тканей хозяина. Механизмы
повреждения могут быть различными.
Болезнетворное действие бактерий
определяется, как правило, их токси-
нами, которые подразделяют на эк-
зотоксины и эндотоксины.
Экзотоксины — это белки, высво-
бождаемые бактериям в процессе их
жизнедеятельности, способные изби-
рательно нарушать определенные
функции клеток организма хозяина,
что может привести к их гибели.
К числу экзотоксинов относятся:
дифтерийный токсин, нарушающий
внутриклеточный синтез белка; столб-
нячный токсин, блокирующий вы-
свобождение медиатора из окончаний
тормозных нейронов в спинном моз-
ге; ботулинический токсин, блокиру-
ющий высвобождение ацетилхолина
из окончаний холинэргических нервов.
Токсин холерного вибриона наруша-
ет секрецию воды и электролитов
клетками эпителия тонкого кишечни-
ка; токсин одного из штаммов р-ге-
молитического стрептококка вызыва-
ет синдром токсического шока.
Эндотоксины — липополисахариды,
входящие в состав клеточной стенки
грамотрицательных бактерий. Токси-
ческие свойства сложных молекул ли-
пополисахаридов связаны с их липид-
ной частью. Эндотоксины ответствен-
ны за многие симптомы септического
шока — гипотензию, внутрисосудис-
тое свертывание крови, лихорадку.
Многие эффекты эндотоксинов опо-
средуются фактором некроза опухолей
(ФНО-ос) и другими цитокинами,
высвобождаемыми клетками, участву-
ющими в воспалительном ответе.
Повреждение клеток вирусами обу-
словлено самой природой этих аген-
тов, которые являются облигатными
внутриклеточными патогенами. Раз-
множение вирусов возможно только
после их проникновения внутрь кле-
ток. При этом выбор клеток для раз-
множения обусловлен в значительной
степени структурой белковой оболоч-
ки вируса, которая определяет его спо-
собность прикрепляться и проникать
внутрь клеток-мишеней. Когда вирус
начинает размножаться и новообразо-
ванные вирусные частицы покидают
клетку, мембрана клетки повреждает-
ся, а клетка погибает.
Проникновение вируса внутрь клет-
ки-мишени не означает немедленное
начало его репликации и немедлен-
ную смерть клетки. Некоторые вирусы
встраивают свой геном в хромосомную
ДНК клеток хозяина, где он может
оставаться в латентном состоянии (не
обнаруживать себя) многие годы пос-
ле инфицирования. Так ведут себя,
в частности, ДНК-вирусы группы гер-
песа и аденовирус. Например, вирус
герпеса [herpes simplex virus-l(HSV-l)],
входными воротами которого чаще
всего оказывается слизистая оболоч-
ка рта, может оставаться в латентном
состоянии внутри тел нервных кле-
ток ядра тройничного нерва, другой
вирус герпеса — генитальный вирус
(HSV-2) — внутри клеток сакральных
ганглиев и т.д. Известны вирусы, на-
пример цитомегаловирус, которые мо-
гут не проявлять себя на протяжении
всей жизни человека-носителя и вы-
зывать болезнь только после наруше-
ния механизмов иммунитета, как это
ф
л
с
Г
гл
г
Г.
v -
н
Е.
С
214
'--‘СУДИС-
’ -радку.
ИСЗ опо-
холей
хлнами,
частву-
вете.
обу-
ъл аген-
ГхТНЫМИ
<*л. Раз-
F' ТОЛЬКО
'~ь кле-
-'-Т раз-
дельной
болоч-
г-'?спо-
*|В№: чикать
Wfc- знрус
Hljtefc, сразо-
^Р*г<1дают
’Ш» «дает-
*
клет-
дниое
1рЬ’ед1ен-
ЧВь- : русы
Швиь: ’.щую
*6;'и <ожет
’Шй»г । л (не
Шъ дос-
Жйг- себя
гер-
•• хЛруе
fc-i)],
-:аще
Wt'r /оч-
^ЙвЬ’ЛНОМ
*Ик<1‘ хле-
-С . той
=лрус
WSLxHblX
W-x на-
=S|fctac XfO-
i ЗЫ-
Wr-де-
это
бывает у больных СП ИДом, у лиц, по-
лучающих иммуносупрессоры в связи
с пересадкой органов и т.п. Таким об-
разом, болезни, вызываемые цитоме-
галовирусом, являются примером оп-
портунистических инфекций.
РНК-вирус иммунодефицита чело-
века (ВИЧ) остается латентным в те-
чение нескольких лет после проник-
новения в клетки-мишени — чаще
всего в Т4-лимфоциты. Толчком к ак-
тивации и размножению вируса могут
служить вторичные инфекции, стиму-
лирующие иммунную систему.
Риккетсии — это грамотрицатель-
ные микроорганизмы, которые подоб-
но вирусам являются облигатными
внутриклеточными паразитами, но в
отличие от вирусов имеют клеточную
стенку и содержат РНК и ДНК.
Заражение человека происходит
при участии членистоногих перенос-
чиков — блох, клешей и вшей. Рик-
кетсии населяют пищеварительный
тракт этих членистоногих и вместе с
их испражнениями попадают в орга-
низм через повреждения кожи, воз-
никающие при расчесах. Риккетсии
размножаются внутри цитоплазмы
клеток человека, поглошая поступа-
ющие в них питательные вещества и
витамины, что приводит к гибели кле-
ток. У человека риккетсии вызывают
ряд болезней, в частности, смертель-
но опасный сыпной тиф, при кото-
ром поражается центральная нервная
система, легкие, сердце, иммунная
система, почки.
Хламидии имеют сходную с риккет-
сиями структуру, но диаметр их мень-
ше. В отличие от риккетсий заражение
хламидиями происходит путем прямо-
го контакта без участия переносчиков.
Инфицирующая форма хламидий,
называемая элементарной частицей,
прикрепляется к клетке хозяина и про-
никает внутрь нее, где превращается
в более крупное ретикулярное тельце.
Последнее дает начало множеству эле-
ментарных частиц, которые высвобож-
даются во внеклеточное пространство,
чтобы начать новый цикл инфекции.
У человека хламидии чаще всего
вызывают передаваемые половым пу-
тем генитальные инфекции. При опре-
деленных условиях возможны пораже-
ния глаз (трахома), пневмония ново-
рожденных.
К числу болезней, вызываемых хла-
мидиями, относится также пситтакоз,
источником которого являются разные
виды больных птиц (попугаи, голуби,
индюшки, утюг, цыплята). Заражение
происходит в основном путем вдыха-
ния аэрозолей, содержащих частицы
экскрементов зараженных птиц. Забо-
левание характеризуется чаще всего
развитием пневмонии, в тяжелых слу-
чаях могут поражаться печень, почки,
нервная система.
Грибы — это свободно живущие
эукариоты, отдельные виды которых
могут быть частью нормальной мик-
рофлоры человека. Грибы подразделя-
ют на дрожжи и плесени в соответ-
ствии с различиями их морфологии.
Дрожжи — одноклеточные микроор-
ганизмы, которые размножаются поч-
кованием; плесени растут, образуя
длинные ветвящиеся нити.
Заражение грибами происходит
либо посредством прямого контакта,
либо в результате вдыхания их спор.
У человека' грибы вызывают болезни
кожи, подкожных тканей, а в случае
ослабления механизмов иммунитета —
тяжелые, угрожающие жизни систем-
ные инфекции (кандидоз, аспергил-
лез, кокцидиоз, гистоплазмоз и др.).
Системные болезни трудно вылечить,
имеющиеся в настоящее время про-
тивогрибковые лекарственные веще-
ства высоко токсичны. Нередки слу-
чаи развития грибкового сепсиса.
Прионы — белковые молекулы, пре-
образующие внутриклеточный белок
215
хозяина в белок приона. Белки приона
накапливаются в центральной нервной
системе, вызывая так называемый губ-
чатый энцефалит — неизлечимую смер-
тельную болезнь, первоначальными
симптомами которой являются психи-
ческие расстройства и нарушения ко-
ординации движений. Один из воз-
можных путей заражения прионами —
ятрогенный путь, связанный с пере-
садкой взятого от человека трупного
материала (роговицы) или с введени-
ем полученного из гипофиза умерших
людей гормона роста. В последнее вре-
мя стали предполагать, что прионами
можно заразиться, употребляя в пищу
мясо больных губчатой энцефалопати-
ей коров. Патоморфология этой болез-
ни, называемой «коровье бешенство»,
весьма сходна с вызываемыми приона-
ми болезнями человека.
7.5. Инфекции
как результат
взаимодействия
инфекционных агентов
с организмом хозяина
Возникновение, распространение и
течение инфекций зависят, с одной
стороны, от вирулентности патоген-
ных агентов, с другой — от способно-
сти организма-хозяина защитить себя
от проникновения и возможности
уничтожать проникших внутрь микро-
бов. Вирулентные организмы могут об-
ходить или преодолевать имеющиеся
в распоряжении человека нормальные
механизмы защиты. Встреча с такими
патогенами, как правило, приводит к
развитию болезни. Микроорганизмы со
слабой вирулентностью вызывают бо-
лезнь только в случае нарушения ме-
ханизмов иммунитета.
Вирулентность микроорганизмов —
их способность вызывать болезни —
определяется многими факторами,
включая факторы адгезии, инвазии,
а также возможностью противостоять
защитным механизмам хозяина. Невос-
приимчивость (устойчивость) хозяи-
на к инфекциям определяется меха-
низмами врожденного и приобретен-
ного иммунитета.
Факторы адгезии. Микробная ин-
фекция невозможна, если микроорга-
низмы не способны к адгезии — при-
креплению или прилипанию к тканям
хозяина. Адгезия может быть резуль-
татом неспецифического взаимодей-
ствия, например, прилипания микро-
бов к увлажненным поверхностям
тела, или действия электростатических
сил притяжения. Она возможна также
в результате специфического взаимо-
действия микробов с определенными
структурами клеток хозяина.
Специфические структуры, к кото-
рым прикрепляются микроорганизмы,
называют рецепторами, вещества,
которые взаимодействуют с рецепто-
рами, — лигандами или адгезинами.
Рецепторы могут быть белками, угле-
водами, липидами или комплексами,
состоящими из разных типов веществ.
Лиганды могут быть простыми или
сложными молекулами.
Многие вирусы, включая вирусы
гриппа, кори, свинки, аденовирус,
имеют специальные выросты или ши-
пики, на поверхности которых распо-
лагаются адгезины, распознающие уг-
леводные рецепторы на поверхности
эпителиальных клеток верхних дыха-
тельных путей хозяина. Геликобактер
пилори прикрепляется к слизистой
оболочке желудка с помощью не-
скольких адгезинов, взаимодейству-
ющих со специфическими рецептора-
ми на мембране эпителиальных кле-
ток слизистой пилорической части
желудка.
Факторы инвазии. Продукты возбу-
дителей инфекций, которые облегча-
216
-.эрами,
ваши,
-'СОСТОЯТЬ
Невос-
И^-"- хозяи-
меха-
1“ .бретен-
И|кп<-;ая ин-
<!< роорга-
— при-
тканям
ИМ^- эезуль-
людей-
•v микро-
ностям
►г- тческих
т также
Езаимо-
Ц^-~- энными
’ЯЙ*11 < кото-
:^^Г_НИЗМЫ,
*. эст на,
ЦЕ тедепто-
ТУ1” щами,
угле-
^р«-:ексами,
в. шесть.
-t или
шрусы
“fcr вирус,
ярь СИ ши-
’ЯВь' асно-
Щвшь. _ие уг-
ЧЦикс шости
4jBfc < дыха-
?5 актер
ЧР*- : истой
ЯВкщ.-о не-
^ИЮ-ИСТВу-
ЯВки-глтора-
^ВЬгщ= кле-
ЧВвь части
-,озбу-
4Pt •'легча-
ют их проникновение внутрь организ-
ма хозяина, называют факторами ин-
вазии. Большая часть этих факторов —
ферменты, способные разрушать кле-
точные мембраны (фосфолипазы), со-
единительную ткань (эластазы, колла-
геназы), межклеточный матрикс (гиа-
луронидаза) и структурные белковые
комплексы (протеазы).
Факторы уклонения (избегания).
Многие микробы вырабатывают фак-
торы, помогающие им уклоняться (из-
бегать) или противостоять различным
механизмам иммунной зашиты хозяи-
на. Так, некоторые виды стрептокок-
ков (например, Sreptococcus pneumoniae)
продуцируют полисахариды, которые
образуют внеклеточную капсулу, пре-
пятствующую поглощению микробов
фагоцитами. Отдельные виды бакте-
рий, грибов и паразитов избегают фа-
гоцитоза, продуцируя лейкоцидины —
вещества, которые разрушают цито-
плазматическую мембрану лейкоцитов
и убивают нейтрофилы и моноциты
хозяина. Штаммы золотистого стафи-
лококка продуцируют поверхностный
белок (протеин А), который взаимо-
действует с иммуноглобулинами клас-
са IgG и предупреждает контакт рас-
познающих антигены Fab-фрагментов
этих антител с поверхностью микроб-
ной клетки. Кроме того, эти стафило-
кокки секретируют особый фермент —
коагулазу, который превращает рас-
творимые факторы свертывания в
плотный сгусток, окружающий и за-
щищающий микроорганизмы от анти-
тел и фагоцитов хозяина.
Вирусы гриппа (Н. influenzae) и воз-
будители гонореи (N. gonorrhoeae) сек-
ретируют фермент, который расщеп-
ляет и инактивирует секреторные им-
муноглобулины класса IgA, разрушая
таким образом, первичную иммунную
защиту слизистой дыхательного и мо-
чеполового трактов в месте входных
ворот инфекции.
Патогенные микробы, ответствен-
ные за инфекции, возникающие пос-
ле операций имплантации искусствен-
ных суставов, клапанов сердца, про-
тезов сосудов образуют сложные
сообщества, формирующие биоплен-
ку, которая защищает эти образующи-
еся на поверхности синтетических
материалов сообщества от иммунных
механизмов хозяина и от действия бак-
терицидных лекарств.
Поселяющийся в желудке гелико-
бактер пилори избегает бактерицидного
действия соляной кислоты, активно
перемещаясь с помощью жгутиков в
глубь слоя слизи на поверхности же-
лудочного эпителия и секретируя уреа-
зу, которая вызывает гидролиз моче-
вины с образованием углекислоты и
аммиака, связывающего ионы водо-
рода.
7.6. Механизмы,
защищающие
от инфекции
Механизмы иммунной защиты де-
лят на врожденные и приобретенные.
К врожденным относят анатомические
барьеры (кожу, слизистые), физиоло-
гические барьеры (например, бакте-
рицидные вещества, входящие в со-
став секретов, омывающих слизистые),
а также способность развивать стан-
дартный воспалительный ответ в слу-
чае проникновения микробов во внут-
реннюю среду организма.
К механизмам приобретенного
(адаптивного) иммунитета относят
способность организма отвечать на
проникновение внутрь чужеродных
антигенов выработкой специфических
антител и/или пролиферацией специ-
фических Т-лимфоцитов.
Повреждение механизмов защиты
способствует возникновению различ-
ных инфекций. Так, повреждения ана-
217
томических барьеров (кожи и слизи-
стых оболочек) способствуют возник-
новению генерализованных инфек-
ций, вызываемых живущими на коже
и слизистой оболочке носоглотки грам-
положительными кокками — золоти-
стым стафилококком и пиогенным
стрептококком. Кожные раны, загряз-
ненные почвой могут быть колони-
зированы столбнячными клостриди-
ями, которые вырабатывают нейро-
токсин, вызывающий тяжелые судо-
рожные расстройства. Повреждения
слизистой оболочки кишечника, на-
пример, в результате ухудшения мик-
роциркуляции при шоке, нарушают
барьер, удерживающий кишечную
флору в полости кишечника. Это при-
водит к транслокации (перемещению)
населяющих кишечник грамотрица-
тельных бактерий, прежде всего ки-
шечной палочки, в кровоток и к раз-
витию септицемии.
Если по тем или иным причинам
микроорганизмы обходят поверхно-
стные барьеры и проникают во внут-
реннюю среду организма хозяина, они
могут быть уничтожены различными
способами. Многие грамположитель-
ные бактерии (стафилококки, стреп-
тококки), грамотрипательные бакте-
рии (кишечная палочка) живут и раз-
множаются вне клеток. Главная защита
против них — фагоцитоз, осуществ-
ляемый нейтрофилами с помощью
комплемента. Внутриклеточные пато-
гены (вирусы, грибы, простейшие)
и факультативные внутриклеточные
патогены (микобактерии) не доступ-
ны действию нейтрофилов, антител
и комплемента. Иммунная система
уничтожает эти патогены другими спо-
собами.
Первый способ связан с тем, что
инфицированные вирусами клетки
синтезируют вирусный белок, кото-
рый соединяется с молекулами глав-
ного комплекса гистосовместимости
1 класса и экспрессируется на поверх-
ности клетки. Антиген-специфические
цитотоксические СВ8+-лимфоциты
распознают эти комплексы и лизиру-
ют пораженные клетки. Уничтожение
микроорганизмов, живущих внутри
макрофагов, происходит с помощью
специфических Т-хелперных (Th) кле-
ток, которые секретируют у-интерфе-
рон. Интерферон активирует внутри-
клеточные бактерицидные механизмы
макрофагов, что приводит к гибели
инфицирующих их микробов.
Существование специализирован-
ных механизмов иммунитета объясня-
ет, почему недостаточность нейтрофи-
лов, комплемента или антител при-
водит к повторным бактериальным
инфекциям, тогда как больные с де-
фектом Т-лимфоцитов страдают в пер-
вую очередь от вирусных, грибковых
и протозойных болезней.
7.7. Бактериемия
и септицемия
Кратковременное появление бак-
терий в крови (бактериемия), не вы-
зывающее каких-либо болезненных
симптомов, может быть обнаружено
после незначительных повреждений
кожи или слизистых. У здоровых лю-
дей такая бактериемия является пре-
ходящей, поскольку кровь быстро очи-
щается от бактерий с помощью раз-
личных механизмов иммунитета. Если
по тем или иным причинам иммун-
ная система не справляется с проник-
шими в кровь микробами, возникает
болезнь, которую называют сепсисом
или септицемией. Клиническими при-
знаками септицемии являются высокая
лихорадка, озноб, гипотензия, миал-
гия, головная боль. Септицемия при-
водит к возникновению в органах ме-
тастатических очагов инфекции, а в
некоторых случаях — к септическому
218
— поверх-
ьш рические
> фоциты
1» лизиру-
’tj' -ложен ие
-•*. внутри
“эмошью
ь Th) кле-
- -нтерфе-
знутри-
> - < анизмы
»г * гибели
ь-.лрован-
. 5ъясня-
I --йтрофи-
Гт~5-Т при-
— -ЯВНЫМ
-<ес де-
4-Г'Т в пер-
~ ТОКОВЫХ
-де бак-
не вы-
: денных
гружено
ге “.ДОНИЙ
кеых лю-
«г~-я пре-
~оо очи-
-ю раз-
Если
ммун-
роник-
* икает
-рейсом
и при-
* ьдсокая
» миал-
при
K--ix ме-
*ь-д. а в
►л-:кому
шоку. Септицемию вызывают бакте-
рии, проникающие через кожу (зо-
лотистый стафилококк и другие грам-
положительные кокки), мочеполовой
тракт (кишечная палочка и другие
трам отрицательные бактерии), дыха-
тельные пути (стрептококк пневмо
нии), желудочно-кишечный тракт
(грамотрицательные бактерии), тазо-
вые органы (нейссерия гонореи, ана-
эробные клостридии). Тяжелый сепсис
может быть следствием менингокок-
ковой инфекции, возбудитель которой
(Neisseria meningitidis) проникает в кро-
воток через слизистую оболочку носа.
Единственным источником инфекции
являются люди, большая часть кото-
рых может быть бессимптомными но-
сителями менингококка, населяюще-
го их носоглотку. В последнее время в
связи с учащением грибковых инва-
зий, вызываемых кандидами, аспер-
гиллами и другими, нередки случаи
грибкового сепсиса.
7.8. Общее течение
инфекционных болезней
Весь ход болезни, сопровождающей
инвазию микроорганизмов, может
быть разделен на несколько стадий или
периодов в соответствии с характером
и интенсивностью болезненных симп-
томов: инкубационный (вслед за ин-
вазией); продромальный; разгара болез-
ни (острый); восстановительный; пе-
риод полного разрешения болезни.
Продолжительность каждой стадии и
особенности ее симптомов могут быть
характерными для определенной ин-
фекции, что должно учитываться при
диагностике.
Инкубационный период — период, во
время которого возбудитель (патоген)
начинает активно размножаться, не
вызывая, однако, отчетливой симпто-
матики болезни у хозяина. Инкубаци-
онный период может быть коротким,
как при сальмонеллезе (6 — 24 ч), или
продолжительным, как при гепатите В
(50—150 дней) или СПИДе (месяцы
или годы). На продолжительность ин-
кубационного периода оказывают вли-
яние состояние здоровья хозяина,
входные ворота инфекции, инфици-
рующая доза патогена.
Продромальный период начинается с
появлением первых симптомов болез-
ни, которые могут ограничиваться
всего лишь неясным ощущением об-
щего недомогания, головной боли,
болей в мышцах и суставах. У больно-
го может быть слабая лихорадка, по-
вышенная утомляемость. Симптомы
продромальной стадии не являются
специфическими, они одинаковы
при многих болезнях. Продолжитель-
ность продромальной стадии у раз-
ных субъектов, заразившихся одной и
той же болезнью, может варьировать.
Острый период, или стадия разгара
болезни, соответствует быстрой проли-
ферации и диссеминации возбудите-
ля. Концентрация токсических продук-
тов метаболизма микробов становит-
ся максимальной. Е1апряженность
процессов взаимодействия инфекци-
онных агентов и противодействующих
им иммунных механизмов хозяина
растет. Сопутствующее этим процес-
сам повреждение тканей достигает
максимума. Симптомы болезни стано-
вятся более выраженными и специ-
фическими (патогномоничными) для
определенного заболевания.
Восстановительный период характе-
ризуется прекращением распростране-
ния инфекции внутри организма хозя-
ина, растущим удалением (элиминаци-
ей) патогенного агента, восстановле-
нием поврежденных тканей, ослабле-
нием и исчезновением соответствую-
щих симптомов. Продолжительность
восстановительного периода может
быть различной в зависимости от типа
219
патогенного микроорганизма, эффек-
тивности иммунного ответа хозяина и
от проводимого лечения.
Период полного разрешения болезни
наступает тогда, когда патогенный
агент полностью удаляется из орга-
низма и исчезают связанные с болез-
нью симптомы. Существуют разного
рода исключения из описанного клас-
сического течения инфекционного
процесса.
Хронические инфекции характери-
зуются растянутым и иногда нетипич-
ным течением заболевания. Отдельные
симптомы инфекции могут проявлять-
ся постоянно или спорадически в те-
чение месяцев и даже лет без наступ-
ления фазы восстановления.
Выделяют также субклиническую,
или подострую, форму болезни, ког-
да от момента инфицирования до ста-
дии разрешения болезнь протекает без
выраженной симптоматики. Если про-
дромальный период растянут во вре-
мени, говорят о постепенном начале
болезни; если продромальный период
чрезвычайно короток или отсутству-
ет, а симптомы болезни обнаружива-
ются внезапно, говорят о молниенос-
ном начале болезни.
Вариантом типового развития бо-
лезни можно считать также инфек-
ции, которые заканчиваются не вы-
здоровлением, а приводят к смерти
больного.
Системные реакции организма на
инфекции аналогичны таковым при
лихорадке и ответе острой фазы и
были подробно рассмотрены в преды-
дущих главах.
Контрольные вопросы
1. Какие инфекционные агенты вы зна-
ете?
2. Какие источники инфекции вам из-
вестны?
3. Какие существуют пути поступления
возбудителей инфекционных болезней в
организм?
4. Каковы механизмы повреждения тка-
ней инфекционными агентами?
5. Что такое факторы адгезии, инвазии,
уклонения?
6. Какие механизмы, защищающие от
инфекции, вам известны?
7. Что такое бактериемия и септицемия?
8. Какие выделяют периоды в течении
инфекционных болезней?
9. Какие возникают системные реакции
организма на инфекцию?
т
- :Яфек-
не вы-
.черти
н -ма на
feXf при
газы и
з ~реды-
ГЛАВА 8
ПАТОЛОГИЯ ИММУННОЙ СИСТЕМЫ
1ы зна-
нгм из-
~ тления
та’.ней в
t- и тка-
’ -зазии,
« _ие от
"•_емия?
' - - ении
ткции
8.1. Основные положения
Способность организма сопротив-
ляться воздействиям окружающей его
среды, сохраняя при этом постоянство
гомеостаза, тесно связана с функцио-
нированием как механизмов неспеци-
фической защиты, так и механизмов
специфической защиты — способно-
стью развивать высокоспециализиро-
ванную форму реакции (иммунный
ответ).
Более того, иммунные (специфи-
ческие) механизмы являются цент-
ральным биологическим механизмом
реактивности и резистентности, ос-
новной биологический смысл которо-
го заключается в поддержании анти-
генного гомеостаза.
В связи с этим проблема иммуно-
логической реактивности (резистент-
ности) как важнейшей составляющей
реактивности организма в целом при-
обретает важное значение для прак-
тической медицины.
Что же такое иммунологическая ре-
активность?
Иммунологическая реактивность —
это способность организма отвечать на
действие антигена выработкой гумо-
ральных антител и/или комплексом
клеточных реакций, специфичных по
отношению к данному антигену.
Как и любые системы организма,
иммунная система подвержена пато-
логическим процессам. Область теоре-
тической и практической медицины,
изучающая закономерности наруше-
ний (повреждений) иммунной систе-
мы, лежащие в основе различных па-
тологических процессов и заболеваний,
получила название иммунопатология.
Термин происходит от слов иммуни-
тет (от лат. immunitas — свободный, ос-
вобожденный) и патология (от греч.
pathos — страдание, logos — учение).
Иммунопатология проявляется раз-
личными по форме, характеру и ин-
тенсивности нарушениями реактивно-
сти (способности организма отвечать,
реагировать) и резистентности (спо-
собности организма быть устойчи-
вым), как правило, к внешним, а так-
же внутренним патогенным факторам,
в основном к различным веществам
антигенного или гаптенного проис-
хождения.
Основу иммунопатологии составля-
ет неспособность иммунной системы
обеспечивать антигенный гомеостаз
организма (распознавать «свое» и «чу-
жеродное»), т.е. выполнять присущие
ей в норме защитные функции («свое
не трогать, чужое — уничтожать»).
Патология может касаться различ-
ных уровней и звеньев иммунной си-
стемы:
центральных (вилочковая железа,
костный мозг, слизистые оболочки
ЖКТ и других, неизвестных пока, ана-
логов сумки Фабрициуса);
периферических (селезенка, лимфа-
тические узлы, лимфоидная ткань мин-
далины, пищеварительный тракт, лим-
фоциты, моноциты, гранулоциты кро-
ви, лимфы, тканей) нарушений не
-де<П«---------------
221
только деления, но и созревания, фун-
кционирования иммунокомпетентных
клеток.
Выделяют четыре основных типа
иммунопатологии:
I) иммунная недостаточность или
иммунодефицитные состояния вслед-
ствие дефектов развития иммунной
системы или действия на нее повреж-
дающих факторов;
2) измененная реактивность им-
мунной системы на антигены экзоген-
ного происхождения или гиперчув-
ствительность (аллергия);
3) иммунологическая недостаточ-
ность, обусловленная срывом имму-
нологической резистентности (толе-
рантности) в отношении собственных
антигенных структур (аутоиммунная
патология);
4) иммунологическая недостаточ-
ность, связанная с нарушением про-
лиферации иммунокомпетентных кле-
ток (лимфопролиферативные процес-
сы).
8.2. Иммунодефицитные
состояния
Иммунодефицитными состояния-
ми (ИДС) называют стойкие или вре-
менные изменения иммунного стату-
са, обусловленные дефектом одного
или нескольких механизмов иммунно-
го ответа на антигенное воздействие.
Различают первичные (наслед-
ственные) и вторичные (приобретен-
ные) иммунодефицитные состояния.
Вторичные ИДС в свою очередь под-
разделяются на физиологические и
патологические иммунодефициты
(табл. 8.1).
Первичные иммунодефициты. В со-
ответствии с номенклатурой ВОЗ под
и ммунологичес кой недостаточностью
первичного происхождения принято
понимать генетически обусловленную
неспособность организма реализовать
то или иное звено иммунного ответа.
Согласно классификации, предло-
женной ВОЗ, в зависимости от преиму-
щественного поражения В- и Т-звена
иммунной системы, выделяют следу-
ющие первичные специфические им-
мунодефицитные состояния:
комбинированные, с одновремен-
ным в одинаковой или разной степе-
ни выраженности повреждением кле-
точного (Т) и гуморального (В) зве-
ньев иммунной системы;
с преимущественным повреждени-
ем клеточного (Т) звена иммунной
системы;
с преимущественным повреждени-
ем гуморального (В) звена иммунной
системы (патология продукции анти-
тел).
Первичные иммунодефицитные со-
стояния встречаются, как правило,
редко. По международной классифи-
кации болезней выделяют несколько
разновидностей.
Тяжелый комбинированный Т- и
В-иммунодефицит отличается разви-
тием дефекта иммунокомпетентных
структур на самых ранних этапах раз-
вития организма. Клинически проте-
кает наиболее тяжело. Гибель организ-
ма может наступить внутриутробно, в
первые дни после рождения из-за от-
сутствия или резкого угнетения ство-
ловых и коммитированных гемопоэти-
ческих клеток, а также из-за отсут-
ствия или резкого угнетения тимуса и
других органов иммунной системы, с
одновременным и выраженным сни-
жением числа как Т-, так и В-лимфо-
цитов и плазматических клеток. Кли-
нически проявляется резким сниже-
нием реактивности и резистентности
организма к действию различных па-
тогенных факторов, в том числе ви-
русов, бактерий, грибов.
Варианты комбинированных имму-
нодефицитных состояний обусловле-
г
..7-- Й
с: лШ
р_ ян»
- -
т.' - jas*.:
с• ,ж
Т- ШИ
В- ш»
зр
с-
222
:затъ
~зета.
ЧИН.. елло-
ЧВиг -ежму-
♦ ~-:вена
«В» --дду-
i ИМ-
~ - !ен-
.тепе-
- - <те-
: зве-
17. ни-
Ши г • иной
*лени-
’ -:ной
-НТИ-
--Де со-
Шьт. :лько
>
lb**- Т- и
4jfc! --зви-
’WBtT: -ТНЫХ
раз-
~?оте-
ЧР* нпз-
CHO, В
ЧР* - - -Д от-
Шя ;тво-
зэти-
; тсут-
чЫ 1' уса и
фйГ:'/Ы, С
фн.., СНИ-
фВ- мфо-
фг* Кли-
<» --шже-
; - аИВ1Е ОС 1 и
6ЩрИ' -Л па-
ви-
i Л1му-
-эвле-
Таблица 8.1
Иммунодефицитные состояния
Первичные (наследственные) Вторичные (приобретенные)
Физиологические Патологические
Комбинированные, с одно- временным повреждением клеточного и гуморального звеньев иммунной системы Новорожденных детей Инфекция, интоксикация
С преимущественным по- вреждением клеточного звена иммунной системы Беременных Потеря белка
С преимущественным по- вреждением гуморального звена иммунной системы (патология продукции анти- тел) Старческого возраста Лимфотропные вирусы. Опухолевый рост. Иммунологическая недо- статоч ность ятроген ной природы
ны генетическими дефектами, затра-
гивающими различные линии диффе-
ренцировки лимфоцитов, а также
ранние этапы их развития, общие для
Т- и В-популяций (рис. 8.1).
Существует несколько клинических
форм комбинированного иммуноде-
фицитного состояния.
Швейцарский тип агам-
маглобулинемии развивается по
аутосомно-рецессивному типу. В основе
механизма иммунодефицита лежит ге-
нетический дефект на уровне фермен-
тов аденозиндезаминазы и пуриннук-
леотидфосфорилазы, что ведет к на-
рушению метаболизма аденозина.
В результате блокируется выработка ги-
поксантина и идет избыточное накоп-
ление АТФ в тканях, что блокирует
созревание Т-клеток. Данный тип ха-
рактеризуется гипоплазией тимуса и
лимфоидной ткани, особенно лимфа-
тических узлов. Патогенез заболевания
обусловлен дефицитом в основном
Т-лимфоцитов и в меньшей степени
В-лимфоцитов при нарушении их со-
зревания и функциональной активно-
сти (способности трансформировать-
ся в плазматические клетки). Больные
очень чувствительны и малоустойчи-
вы к различным (вирусным, бактери-
альным, паразитарным) инфекциям
и грибковым поражениям, в резуль-
тате чего дети погибают в первые годы
жизни.
Синдром Луи —Бар (атаксия-
телеангиэктазия) характеризуется сни-
жением количества и особенно со-
зревания Т- и В-лимфоцитов. Среди
Т-лимфоцитов в основном страдает
субпопуляция Т-хелперов. Недостаточ-
ность В-лимфоцитов проявляется су-
щественным снижением иммуногло-
булинов, особенно изотипов IgA, IgE,
IgG. Клинически данный тип прояв-
ляется развитием и прогрессировани-
ем инфекций и злокачественных опу-
холей, которые и приводят к леталь-
ному исходу.
Синдром Вискотта — Олд-
рич а характеризуется развитием вы-
раженного дефицита Т-лимфоцитов с
нарушением их структуры и физико-
химических свойств мембран, а также
возникновением гипогаммаглобулине-
мии. Этот тип клинически проявляет-
ся развитием не только вирусных и
бактериальных инфекций, но и аллер-
223
Рис. 8.1. Варианты комбинированных иммунодефицитных состояний (АДА — аденозин-
дезаминаза; ПНФ — пуриннуклеотидфосфорилаза)
гических, в частности экзематозных,
форм патологии.
Иммунодефициты с преимуществен-
ным нарушением Т-системы лимфоци-
тов сопровождаются в основном сни-
жением клеточного иммунитета за счет
резко выраженного уменьшения коли-
чества и функциональной активности
Т-лимфоцитов-эффекторов (киллеров).
Выявляется гипоплазия тимуса. Кли-
нически проявляется развитием син-
дрома Ди-Джорджи (рис. 8.2).
Синдром Ди-Джорджи ха-
рактеризуется выраженным угнетени-
ем реакций клеточного иммунитета,
сниженными, но сохраненными ре-
акциями гуморального иммунитета.
У больных не наблюдаются реакции
гиперчувствительности замедленного
типа (ГЗТ), не отторгаются трансплан-
таты, не отмечаются реакции на фи-
тогемагглютинины. Дети высоко пред-
расположены к развитию кожных ин-
фекций и грибковых заболеваний. Бо-
лезнь протекает тяжело, характеризу-
ется частыми рецидивами.
Иммунодефициты с преимуществен-
ным дефектом В-лимфоцитов характе-
ризуются нормальным уровнем, но
сниженной функциональной активно-
стью В-лимфоцитов, уменьшенным
количеством плазматических клеток
и различных антител. На фоне резко
угнетенного гуморального иммуните-
та у больных определяется нормаль-
ный клеточный иммунитет.
У больных отмечается частое разви-
тие гнойных (стрептококковой, пнев-
мококковой) инфекций с преимуще-
ственным дефицитом В-системы лим-
фоцитов, аутоиммунных процессов,
диареи, уменьшенного всасывания
жиров и витамина В]2, а также выра-
женное снижение устойчивости орга-
224
Рис. 8.2. Синдром Ди-Джорджи
:ин-
ин-
Бо-
:<зу-
<!?«-
_<ге-
но
гно-
яым
еток
езко
ите-
Lilb-
13ВИ-
:нев-
уше-
~им-
:сов,
зния
ыра-
?рга-
низма к патогенному действию ки-
шечной палочки и незначительное
понижение устойчивости к вирусам
и грибам.
Клиническими формами преиму-
щественно дефицита В-системы лим-
фоцитов являются агаммаглобулине-
мия Брутона, синдром Йова, селек-
тивный дефицит изотопов IgG либо
IgA, либо IgM (рис. 8.3).
Агаммаглобулинемия Бру-
тона является наследственным забо-
леванием, сцепленным с Х-хромосо-
мой. Болеют мальчики. Характеризу-
ется преимущественным нарушением
продукции антител, обусловленного
резким снижением (вплоть до отсут-
ствия) числа плазматических клеток.
Основой заболевания является мута-
ция гена, детерминирующего фер-
мент тирозинкиназу (btk), которая
связана с антигенраспознающим ре-
цептором В-лимфоцитов. Клеточный
иммунитет обычно сохранен. Симп-
томы заболевания начинают прояв-
ляться с 5—12 мес жизни ребенка,
когда заканчивается запас материн-
ских антител (иммуноглобулинов). Бо-
лезнь отличается часто рецидивиру-
ющими гнойными инфекциями (оти-
тами, пневмониями, абсцессами) и
сохранением резистентности организ-
ма к вирусам, грибам, туберкулезным
бациллам.
Синдром Йова, или селектив-
ный иммунодефицит IgA, при высо-
ком уровне IgE характеризуется эози-
нофилией, снижением хемотаксиса
лейкоцитов, гиперчувствительностью
кожи к стафилококку, развитием ста-
филококковых инфекций кожи (ста-
филококковых дерматитов), а также
кандидозов кожи и слизистых.
Встречаются также клинические
формы, характеризующиеся дефици-
том антител при норме- и даже ги-
пергаммагл обулинемии.
Принципы профилактики первичных
иммунодефицитов. Среди населения,
особенно среди беременных женщин
целесообразно проводить профессио-
нальное медико-генетическое кон-
сультирование. При выявлении внут-
риутробной и постнатальной недоста-
точности иммунной системы, отмечае-
мой при разнообразных токсикозах
беременных, необходимо выполнять
следующие условия:
проводить роды при помощи кеса-
рева сечения;
помещать новорожденного в сте-
рильные условия;
225
Рис. 8.3. Клинические формы дефицита системы В-лимфоцитов
№
а*
*
St
ж
ч’Ё
ПК
ж
.«г
«
ж
ж
•в
в
л»
иж
*
обеспечивать гнотобиотическое со-
держание детей:
резко ограничивать широкое ис-
пользование антибиотиков, цитоста-
тиков и других лекарственных средств,
не контактировать с бытовыми и про-
мышленными ядами, так как они спо-
собны вызвать развитие тератогенных
нарушений и мутации.
Принципы терапии первичных им-
мунодефицитов. Прежде чем начать
конкретное лечение, необходимо вы-
яснить тип иммунодефицита и сте-
пень, а также уровень повреждения
иммунной системы и механизмы раз-
вития иммунной недостаточности.
Для лечения иммунодефицитов ис-
пользуют как этиотропное, так и па-
тогенетическое лечение.
Этиотропная терапия на-
правлена на устранение или ослабле-
ние действия патогенных факторов,
в том числе лекарственных, бытовых
и производственных, способных выз-
вать повреждения различных звеньев
иммунной системы, а также на повы-
шение устойчивости (резистентности
организма) к действию этих факторов.
Патогенетическая тера-
пия, т. е. восстановительное патогене-
тическое лечение при комбинирован-
ном иммунодефиците сводится к про-
ведению эффективной транспланта-
ции эмбриональных тканей костного
мозга, тимуса, печени, в том числе
стволовых клеток, либо части совме-
стимого костного мозга, либо отдель-
ных его фракций.
226
* = на-
'>-~абле-
^.тэров,
яытовых
ВЫЗ-
зеньев
ь ~овы-
«~-:ости
к ~?РОВ.
*ера-
К' гене-
Кюван-
» ' лро-
С-'знта-
ИК~НОГО
* деле
»-: зме-
• )~ель-
При преимущественно гуморальном
иммунодефиците и некоторых комби-
нированных формах целесообразно
проводить заместительную патогенети-
ческую терапию путем внутривенного
введения совместимой свежей плазмы
крови, содержащей либо многие им-
муноглобулины, либо конкретные не-
достающие иммуноглобулины, в том
числе у-глобул ины, а также рекомен-
дуется назначение антитоксических,
антигриппозных и других сывороток.
Можно проводить активную имму-
низацию с помощью соответству-
ющих вакцин. Целесообразно прово-
дить фармакологическую коррекцию
эффекторного звена иммунной си-
стемы иммуномодуляторами, медиа-
торами иммунной системы, гормона-
ми, адаптогенами, а также проводить
соответствующую противомикробную
и противогрибковую терапию.
Необходимо выводить из организ-
ма разные ингибирующие факторы,
связывающие антитела (АТ) и блоки-
рующие эффекты иммунокоррекции,
путем проведения гемосорбции, гемо-
диализа, плазмо- и лимфофереза.
При избирательной недостаточно-
сти IgA не рекомендуется введение
плазмы и комплекса иммуноглобули-
нов.
При избирательном (или преиму-
щественном) клеточном иммунодефи-
ците противопоказано переливание
свежей крови и препаратов крови.
При одновременном наличии тром-
боцитопении и иммунодефицита не-
обходимо избегать проведения хирур-
гических и стоматологических вмеша-
тельств, а также внутривенных и внут-
римышечных инъекций.
Вторичные (приобретенные) имму-
нодефициты. Вторичные, или приоб-
ретенные, иммунодефициты — это на-
рушение иммунной защиты организ-
ма, встречающееся в постнатальном
периоде в результате действия внеш-
них или внутренних факторов, не свя-
занное с первичным поражением ге-
нетического аппарата.
Вторичные иммунодефициты встре-
чаются довольно часто.
Физиологические иммунодефициты
связаны с определенными причинами.
Недостаточность иммунной систе-
мы новорожденных детей ха-
рактеризуется неполноценностью кле-
точного и гуморального звеньев, а так-
же факторов неспецифической резис-
тентности.
Большое количество лимфоцитов в
периферической крови новорожден-
ных сочетается со снижением функ-
циональной активности Т- и В-лим-
фоцитов. Синтез антител на антиген
идет преимущественно за счет IgM,
содержание IgG и IgA снижено и до-
стигает уровней взрослых людей толь-
ко к 11 — 14-летнему возрасту. Отме-
чается низкая фагоцитарная актив-
ность и опсонизирующая способность
крови. Уровень комплемента снижен
и нормализуется к 3 —6-му месяцу
жизни.
Иммунный статус беременных
женщин отличается снижением чис-
ла и функций Т и В-лимфоцитов, что
можно объяснить увеличением содер-
жания и активности Т-супрессоров. Это
необходимо для подавления иммунно-
го ответа на аллоантигены плода.
Недостаточность иммунной систе-
мы п р и старен и и проявляется в
снижении активности как гумораль-
ного, так и клеточного звеньев. Сни-
жаются уровни нормальных антител в
крови, уменьшается способность к
синтезу антител на антигенную сти-
муляцию. Это, в основном, низкоавид-
ные антитела IgM; выработка антител
IgG и IgA значительно уменьшена.
Угнетается синтез антител IgE, по-
этому острота аллергических реакций
смягчается. Существенно страдает кле-
точное звено иммунной системы. Сни-
жается общее число лимфоцитов пе-
риферической крови, а также отно-
сительное и абсолютное число Т- и
В-лимфоцитов и их функциональная
активность.
Уменьшается фагоцитарная актив-
ность макрофагов, нейтрофильных
гранулоцитов, активность комплемен-
та, лизоцима и бактерицидная актив-
ность сыворотки крови. Аутоиммунные
реакции учащаются и с возрастом ста-
новятся более интенсивными.
Патологические иммунодефициты,
так же как и первичные (наследствен-
ные), характеризуются увеличением
частоты (в десятки и даже сотни раз)
злокачественных опухолей (ретикуло-
сарком, лимфосарком и др.), особен-
но лейкозов, лимфом. При вторичных
иммунодефицитах, как и при первич-
ных, также может больше страдать
либо гуморальный, либо клеточный
иммунитет. Так, к развитию гумораль-
ного вторичного иммунодефицита ча-
сто приводят заболевания, сопровож-
дающиеся потерей белков: ожоги, не-
фротический синдром, хронические
нефриты и др.
К развитию клеточного вторично-
го иммунодефицита приводят тяжело
протекающие вирусные инфекции
(корь, грипп), грибковые заболевания
(кандидозы наружные и внутренние).
Развитие иммунодефицита может
происходить и по вине врачей, дли-
тельно использующих при трансплан-
тации органов и лечении различных
тяжелых заболеваний, особенно опу-
холевых, аутоиммунных (ревматоид-
ного артрита), воспалительных имму-
нодепрессанты:
кортикостероидные гормональные
препараты;
ингибиторы белкового синтеза;
антибиотики;
противоопухолевые цитостатики;
антиметаболиты пуринового и пи-
римидинового ряда;
рентгеновское облучение и др.
Среди вторичных иммунодефици-
тов в последнее десятилетие приоб-
ретает все большее значение син-
дром приобретенного имму-
нодефицита (СПИД). Последний
был впервые описан в научной лите-
ратуре в 1981 г. американскими уче-
ными.
По данным ВОЗ, в последние годы
число лиц с зарегистрированными
случаями СПИДа удваивается за каж-
дые пол года.
Если раньше число ВИЧ-инфици-
рованных было в 50— 100 раз больше,
чем заболевших, то уже в 2001 г. чис-
ло инфицированных достигло 130 млн
человек, в том числе у 35 млн человек
отмечались клинические проявления
СПИДа.
Особенно широко СПИД распро-
странен среди гомо- и бисексуальных
мужчин и наркоманов, пользующихся
коллективными шприцами для внутри-
венного введения наркотиков. СПИД
встречается и среди реципиентов ге-
мотрансфузий, а также у детей, роди-
тели которых больны СПИДом.
Этиология СПИДа. Возбудитель
СПИДа относится к ретровирусам
подсемейства лентивирусов (ВИЧ-1 —
HIV-1 — от англ. Human immunodefi-
ciency virus).
В организм вирус поступает с кро-
вью и ее компонентами (плазмой,
эритроцитарной, лейкоцитарной,
тромбоцитарной массой), клетками
при пересадке органов и тканей, а так-
же при переливании крови от больных
СПИДом, со спермой и слюной через
поврежденные слизистые оболочки или
кожу.
Далее вирус внедряется, инфици-
рует клетки человека, особенно Т-лим-
фоциты-хелперы, богатые рецептора-
ми CD4 (к которым гликопротеиды
вирусной оболочки имеют высокий
аффинитет), а также в моноциты, ги-
р; .
м. -
Р. -
Г; '
228
ГИЦИ-
тиоб-
: и н- у-
• -ГНИЙ
- v гите-
уче-
г годы
-ыми
-JSSET' - каж-
• г дни-
гзше,
Ж: й| чис-
Г .млн
:товек
.гения
Вё - дпро-
-ГЗНЫХ
Wfc' дихся
SBW - -•три-
ЧИВВкг ~пид
тИИТ". ' в ге-
- годи-
глтель
дсам
4-1 -
•г- : >defi-
стиофаги, клетки нейроглии и даже
нейроны.
Вирус можно обнаружить в цирку-
лирующей крови, слюнных железах,
простате, яичках.
Возможна передача ВИЧ через пла-
центу от матери к плоду и развитие
у последнего СПИДа. Уже через 1,5 —
2 и более месяцев жизни новорож-
денного обнаруживаются антитела
к вирусу иммунодефицита человека
(ВИЧ-1).
Патогенез СПИДа. Как и дру-
гие ретровирусы, ВИЧ нуждается в на-
личии рецептора для прикрепления к
клеточной поверхности. Особенностью
вирусов ВИЧ является то, что они
фиксируются только к одной опреде-
ленной структуре клеток — антигену
CD4. Данный антиген содержится в
большом количестве на поверхности
Т-хелперов, макрофагов, микроглии
и В-лимфоцитов. Однако лишь Т-хел-
перные лимфоциты гибнут в резуль-
тате вирусной инфекции.
Попавший в организм вирус при-
крепляется к клеточной мембране, не-
сущей антиген CD4, и сливается с ней
путем объединения капсиды с мемб-
раной или попадает в клетку путем пи-
ноцитоза.
Затем происходит «раздевание», ос-
вобождение от вирусной оболочки,
и вирусная РНК выходит из сердце-
винной структуры. Под влиянием ви-
русного фермента обратной транс-
криптазы вирусная РНК становится
матрицей для синтеза двунитевой
ДНК, которая попадает в ядро.
Далее происходит интеграция ви-
рус-специфической ДНК с хромосо-
мами клетки хозяина и переход ви-
руса СПИД в следующие клеточные
генерации при каждом клеточном де-
лении.
Массовая гибель Т-хелперов про-
исходит в связи с взаимодействием ви-
русного белка на поверхности зара-
женных клеток с CD4 на поверхности
незараженных клеток. Таким путем
одна зараженная клетка может при-
соединить к себе до 500 незараженных.
Образуется гигантская многоярусная
нежизнеспособная структура, что уси-
ливает эффект гибели клеток у боль-
ных СПИДом.
Инфицированные клетки, особен-
но Т-хелперы, впоследствии погиба-
ют в результате лизиса. Одновременно
уменьшается количество естественных
Т-киллеров. В итоге развивается про-
грессирующая лимфопения со сниже-
нием функциональной активности в
основном Т-киллеров и Т-хелперов.
Наконец, клетки гибнут вследствие
деятельности самой иммунной систе-
мы: начиная со 2 —4-й недели после
заражения, развивается иммунный от-
вет хозяина на инфицировавший его
вирус.
Одним из видов иммунного ответа
хозяина, который существенно влия-
ет на распространение вируса, явля-
ется выработка нейтрализующих анти-
тел к белкам ВИЧ.
Другим направлением иммунного
ответа является выработка аутоанти-
тел к лимфоцитам (избирательно к
Т-хелперам). При инфицировании
вирусом Т-хелперы экспрессируют
антиген, являющийся мишенью для
аутоантител. Иммунный ответ против
данного белка усугубляет деструкцию
Т-клетки и сопровождается прогрес-
сированием заболевания.
Поражение одного из видов клеток
иммунной системы, осуществляюще-
го регуляцию иммунного ответа, вы-
водит из строя иммунную защиту в
целом и лишает организм способно-
сти противостоять каким-либо инфек-
циям (рис. 8.4).
В результате этих иммунных пере-
строек развиваются и рецидивируют
разнообразные вторичные, как прави-
ло, тяжелые инфекции; формируют-
229
«к.
Рис. 8.4. Патогенез СПИДа
*
ЛК
ЯКг
- ж
- *
_ в
зв
.Ж
. тик
Л»
sal*
2 ЯП.
«Ж*'
ЗВ
- лев
ев
О
ся и прогрессируют лимфоретикуляр-
ные и другие опухоли (саркома Ка-
поши, тимома и др.); ослабляются
(вплоть до исчезновения) реакции
гиперчувствительности замедленно-
го типа; возникают и прогрессируют
аутоиммунные заболевания; нараста-
ет частота развития сывороточной
болезни при лечении у-глобулином
и т.д.
Принципы лечения ВИЧ-
инфекции (СПИДа) основаны на
политерапии, т.е. на применении ком-
плекса последовательно назначаемых,
различных по строению, механизмам
и эффектам действия фармакологиче-
ских средств:
нейтрализующих вирус СПИДа;
предотвращающих проникновение
вируса в клетки организма;
ингибирующих ранние этапы ин-
теграции вирусной ДНК в геном клет-
ки организма-хозяина;
действующих в постинтегральной
фазе жизни вирусных частиц;
влияющих на отпочковывание (про-
дукцию) вирусных частиц;
действующих на зараженные виру-
сом клетки организма;
активирующих или модулирующих
различные звенья иммунной системы;
обладающих способностью подав-
лять возбудителей вторичной инфек-
ции (других вирусов и различных па-
тогенных бактерий, грибов, простей-
ших и паразитов);
ослабляющих расстройства различ-
ных физиологических систем;
активизирующих механизмы за-
щиты. компенсации и приспособ-
ления.
8.3. Аллергия
Аллергия (от греч. alios — иной,
ergon — действую) — это форма им-
мунного ответа организма на экзоген-
ные вещества антигенной или гаптен-
ной природы, сопровождающаяся по-
С ИР"
230
J
й-
-1
6
•гшро-
фчй?у-
за-
Ш> _эб-
К-ОЙ,
ЧЦик. лм-
^•с'з ен
вреждением структуры и функции соб-
ственных клеток, тканей, органов.
Понятие «аллергия» было предло-
жено в 1906 г. австрийским патологом
и педиатром К. Пирке для определе-
ния состояния измененной реактив-
ности, которое он наблюдал у детей
при сывороточной болезни и инфек-
ционных заболеваниях. Говоря об ал-
лергическом состоянии организма,
часто употребляют термины гиперчув-
ствительность, или повышенная чув-
ствительность, подразумевая способ-
ность организма болезненно реагиро-
вать на безвредные для большинства
индивидов вещества (пыльцу трав и
деревьев, цитрусовые и др.).
Все аллергические болезни объеди-
няют общие особенности:
этиологическая роль различных ал-
лергенов;
иммунный механизм развития;-
повреждающее действие комплек-
са «антиген—антитело» (АГ—АТ) или
антиген (АГ) — сенсибилизированные
лимфоциты на клетки и ткани орга-
низма.
Важно подчеркнуть, что сама сен-
сибилизация (иммунизанизация) за-
болевания не вызывает, лишь повтор-
ный контакт с тем же антигеном мо-
жет привести к нежелательному эф-
фекту.
Как уже было сказано, иммунные
реакции являются центральным меха-
низмом реактивности организма, под-
держивающим его гомеостаз, прежде
всего антигенный.
Контакт человека (животного) с
разнообразными инфекционными и
токсическими агентами ведет к обра-
зованию антител, которые «защища-
ют» его организм посредством лизи-
са, нейтрализации или элиминации
(с помощью фагоцитов) чужеродных
веществ, сохраняя при этом постоян-
ство внутренней среды. Однако резуль-
татом иммунных реакций может быть
не только «защита» организма от чу-
жеродных антигенов, но и поврежде-
ние.
В этом случае развивается тот или
иной вид иммунопатологии — пато-
логический процесс или заболевание,
в основе которого лежит нарушение
иммунного ответа (иммунологической
реактивности).
Среди болезней, характеризующих
картину современной патологии, важ-
ное место занимают аллергические
заболевания.
Проявления аллергических реакций
и заболеваний. Аллергия у человека
имеет чрезвычайно многообразные
проявления. Условно можно выделить
системные и местные реакции сенси-
билизированного организма.
К системным (общим) реакциям от-
носятся: анафилактический шок, сы-
вороточная болезнь, бронхиальная
астма, крапивница, поллинозы (сен-
ная лихорадка).
К местным реакциям относятся: ал-
лергический ринит, конъюнктивит,
бронхоспазм, периартериит, отек Квин-
ке, феномен Артюса, феномен Овери,
аллергические дерматиты, реакция от-
торжения трансплантата, реакции ту-
беркулинового типа (Пирке, Манту).
Наряду с самостоятельными аллер-
гическими заболеваниями существуют
заболевания (в основном инфекцион-
ные), где аллергические реакции и
процессы участвуют как сопутству-
ющие или вторичные механизмы: ту-
беркулез, бруцеллез, лепра, скарлати-
на и ряд других.
В среднем аллергическими заболе-
ваниями страдают 10 — 22 % населения
земного шара с колебаниями от 1 до
50 % в различных регионах. Так, на-
пример, в экономически высоко раз-
витой стране — США аллергически-
ми заболеваниями (главным образом,
бронхиальной астмой и поллинозом)
страдают более 30 млн человек. Другая
231
высоко развитая страна Германия за-
нимает ведущее место по смертности
от бронхиальной астмы. В СССР про-
цент аллергических заболеваний коле-
бался от 2 до 23 % в разных регионах.
Как в России, так и за рубежом в про-
мышленных районах заболеваемость
аллергией выше, чем в сельских. По
данным ВОЗ, в большинстве стран
мира отмечается неуклонный рост
числа аллергических заболеваний, зна-
чительно превышающий иногда забо-
леваемость злокачественными опухо-
лями, сердечно-сосудистыми заболе-
ваниями. Аллергия в настоящее время
становится, по существу, нацио-
нальным бедствием для многих стран
мира.
Высокий уровень заболеваемости
аллергией — обратная сторона про-
гресса, своего рода расплата за циви-
лизацию. Загрязнение биосферы ток-
сичными, раздражающими и сенсиби-
лизирующими веществами, эмоцио-
нальные стрессы, активная химизация
условий труда и быта, злоупотребле-
ние фармакологическими средствами
способствуют постоянному напряже-
нию гомеостатических механизмов с
вовлечением резервных механизмов
жизнедеятельности. Все это создает
почву для срыва механизмов адапта-
ции, развитию различных заболева-
ний, в том числе и аллергических.
Аллергизации населения способ-
ствуют следующие факторы внешней
среды (в том числе социальные фак-
торы):
массовая обязательная вакцинация
населения против многих инфекцион-
ных заболеваний (дифтерия, коклюш,
оспа и др.). Известно, что коклюшная
вакцина повышает чувствительность
тканей к гистамину, вызывает блока-
ду p-адренергических рецепторов
в бронхиальной ткани, играет роль
адъюванта для синтеза аллергических
антител;
применение сывороток в лечебных
целях, которые сами могут являться
аллергенами:
появление значительного количе-
ства простых и сложных химических
веществ — потенциальных аллергенов,
окружающих человека. К ним относят-
ся лекарства, препараты бытовой хи-
мии, пестициды, применяемые в сель-
ском хозяйстве, воздух и вода, загряз-
ненные промышленными отходами.
Известно, что в среднем аллергиче-
ские заболевания охватывают около
10 % населения земного шара.
Этиология аллергических реакций
и заболеваний. Вещества, вызывающие
аллергическую реакцию, получили
название «аллергены». Они могут быть
антигенами с многочисленными ан-
тигенными Детерминантами и био-
логически активными веществами,
представляющими смесь антигенов
(пыльца трав, частицы эпидермиса).
Аллергены обладают чужеродностью
и часто — макромолекулярностью,
хотя гаптены тоже могут иметь аллер-
генные свойства, становясь антигена-
ми только после соединения с бел-
ками тканей организма (метаболиты
лекарств, простые химические веще-
ства — йод, бром, хром, никель). При
этом образуются так называемые ком-
плексные антигены, специфичность ко-
торых определяется специфичностью
гаптена. По химической структуре ал-
лергены являются белками, белково-
полисахаридными комплексами (сы-
вороточные, тканевые, бактериальные
аллергены) или могут быть полисаха-
ридами или соединениями полисаха-
ридов с липоидами (аллерген домаш-
ней пыли, бактериальные аллергены).
К развитию аллергии может при-
водить ряд этиологических факторов.
Инфекционные агенты (грибковые,
вирусные, паразитарные) играют важ-
ную роль в развитии аллергических
реакций. Наиболее активны среди ин-
232
учебных
сняться
‘ <оличе-
-<ческих
-* Эргенов,
носят-
~ гой хи-
з сель-
- загряз-
злами.
-Лтргиче-
» - около
«акций
t лающие
з учили
* ” 7 ОЫТЬ
Шчи ан-
* • био-
1г-’вами,
'генов
tr-Tiica).
Г7- зстью
Г-: етью,
дыер-
*_агена-
* : бел-
!г> ‘ЛИТЫ
с. веще-
ъ При
ье ком-
9СТЬ ко-
> :-гтью
’те ал-
L’XOBO-
и I сы-
t-’ьные
л :аха-
/. .лха-
л чаш-
Г:ЧЫ).
г :ри-
Г”ТОВ.
* :зые,
г" гаж-
“егких
[Ц- ин-
фекционных аллергенов грибковые ал-
лергены. За ними следуют бактериаль-
ные, вирусные, паразитарные. Необ-
ходимо подчеркнуть, что структурные
элементы бактерий очень часто могут
действовать как адъюванты (при вак-
цинации), вызывая сенсибилизацию
организма.
Однако инфекция, вызывая воспа-
ление, приводит к повышению прони-
цаемости слизистой оболочки, кожи,
что в свою очередь способствует про-
никновению в организм других аллер-
генов и развитию полисенсибилиза-
ции.
Сенсибилизация — это процесс
приобретения организмом повышен-
ной чувствительности к тому или ино-
му аллергену.
Различают сенсибилизацию актив-
ную и пассивную.
Активная сенсибилизация раз-
вивается в результате реакции иммун-
ной системы на введение аллергена в
малых дозах (миллионных и тысячных
долях грамма), основу которой состав-
ляет выработка большого количества
АТ в течение 7—14 сут с сохранением
повышенной чувствительности орга-
низма к аллергену в течение длитель-
ного времени (месяцы и даже годы).
Пассивная сенсибилизация
развивается в неиммунизированном
организме путем введения значитель-
ного количества АТ, или иммуноци-
тов, взятых от иммунизированного
соответствующим аллергеном организ-
ма. Последний становится способным
отвечать аллергической реакцией очень
быстро — уже через несколько часов.
Поллинозы — аллергические забо-
левания, вызываемые пыльцой расте-
ний, занимают значительное место в
общей аллергической заболеваемости.
В разных регионах России поллиноза-
ми страдают от 1 до 5 % населения. На
сенсибилизацию населения к пыльце
в значительной мере влияют особен-
ности региона: распространенность тех
или иных растений, степень агрессив-
ности (аллергенности) пыльцы этих
растений. Так, наибольшей аллерго-
опасностью в средней полосе России
обладают тимофеевка, мятлик, ежа
сборная, овсяница луговая. В Красно-
дарском и Ставропольском краях ос-
новным растительным аллергеном яв-
ляется сорная трава — амброзия.
Сенсибилизация к домашней пыли
является также наиболее частой при-
чиной неинфекционной аллергии. Ат-
лергией к домашней пыли страдает от
4 до 15 % населения. Состав домашней
пыли весьма сложен: остатки органи-
ческих веществ (шерсть, шелк, чешуй-
ки перхоти, перья, пыльца растений)
и отходы пластмасс, синтетических
тканей, различные виды грибов, бак-
терий и др. Однако главным аллерги-
зируюшим фактором домашней пыли
являются микроскопические клещи
семейства Pyroglyphidae, которые и
определяют ее аллергенную актив-
ность. На распространение клешей
значительно влияют температура и
влажность воздуха. Поэтому более
высокая сенсибилизация к клещам
наблюдается в регионах с влажным и
теплым (среднегодовым) климатом.
Кровососущие насекомые (гнус, мос-
киты, мошки, комары) являются сен-
сибилизирующим фактором в таких
регионах России, как Сибирь и Даль-
ний Восток, характеризующихся
сложной экологической обстановкой.
Их размножению в огромных количе-
ствах способствуют суровая, длитель-
ная зима, вечная мерзлота, перепады
температур (суточные и сезонные). Ал-
лергия к кровососущим насекомым
вызывает тяжелые аллергические ре-
акции в виде генерализованной экс-
судативной крапивницы, отека Квин-
ке, лихорадки.
Химические вещества, обладающие
сенсибилизирующими свойствами,
233
способствуют росту профессиональной
аллергии, вызванной их воздействи-
ем. Вероятность контакта с ними уве-
личивается благодаря неуклонному ро-
сту химического производства, внед-
рению химии в быт. Наиболее частые
химические аллергены — скипидар,
эпоксидные смолы, красители, лаки
и др.
Воздействи ю металлов-аллергенов
подвергаются значительные контин-
генты рабочих строительной, горно-
рудной, металлургической промыш-
ленности, жители крупных промыш-
ленных регионов. Воздействие таких
металлов, как хром, никель, кобальт,
марганец (электросварка, литейное,
горнорудное производство), приводит
к развитию аллергических дерматозов,
аллергическим заболеваниям органов
дыхания. Одним из эффектов биоло-
гического действия бериллия, плати-
ны, палладия является сенсибилиза-
ция организма.
Проблема лекарственной аллергии
приобретает особое значение в по-
следние годы. Это связано с увеличе-
нием производства и внедрением в
медицинскую практику высокоактив-
ных, длительнодействуюших (адъю-
вантных) лекарственных препаратов.
Большинство лекарственных препара-
тов, сывороток и вакцин обладают
способностью сенсибилизировать
организм, вызывая при повторном
введении аллергические реакции раз-
личной степени тяжести.
Возможность возникновения аллер-
гического заболевания у данного ин-
дивидуума определяется характером,
свойствами и количеством антигена,
путем его поступления в организм,
а также особенностями реактивности
организма. Например, аскаридозный
антиген стимулирует образование ан-
тител IgE-класса, т.е. аллергических
антител. Антигены, являющиеся сла-
быми иммуногенами и находящиеся
в окружающей среде в небольших ко-
личествах (пыльца растений, домаш-
няя пыль), попадая в организм, так-
же могут вызвать развитие аллергиче-
ского заболевания.
У многих людей, получавших ле-
чение пенициллином, обнаруживают-
ся антитела различных классов имму-
ноглобулинов к пенициллину, одна-
ко аллергические реакции на пеницил-
лин развиваются только у некоторых
из них. Указанные факторы связыва-
ют с особенностями реактивности
организма.
Классификация аллергических реак-
ций. С первых шагов изучения аллер-
гии у человека (начиная с 1906 г.)
были сделаны попытки классифици-
ровать ее многообразные проявления.
Долгое время существовала клас-
сификация, предложенная в 1930 г.
Cooke, согласно которой аллергиче-
ские реакции были разделены на две
большие группы: аллергические реак-
ции (гиперчувствительность) немед-
ленного и замедленного типов.
В основу данной классификации по-
ложено время появления реакции после
повторного контакта с аллергеном. Ре-
акции немедленного типа развивают-
ся через 15 — 20 мин, замедленного
типа — через 24—48 ч и более.
Эта классификация не охватывала
всего разнообразия проявлений алер-
гии, в связи с чем возникла необхо-
димость классифицировать аллергиче-
ские реакции с учетом особенностей
их патогенеза.
А.Д.Адо (1963) предпринял пер-
вую попытку разделить аллергические
реакции с учетом особенностей их па-
тогенеза на две группы: истинные и
ложные (псевдоаллергические) аллер-
гические реакции.
При истинных аллергических реак-
циях развивается повышенная чувстви-
тельность (сенсибилизация) к аллер-
гену, впервые попавшему в организм.
234
:_ИХ КО-
z-эмаш-
<'•!. так-
i- еэгиче-
®._их ле-
*'*;,:вают-
!",в- имму-
одна-
•-ЛЦИЛ-
-ТОРЫХ
1’Зыва-
’’з:-ости
п реак-
f плер-
-*.6 г.)
+;ици-
г’ения.
д <тас-
-30 г.
етгиче-
- i две
е реак-
“гиед-
£<! ПО-
г 'осле
? - Ре-
»'З.ЗЮТ-
- ного
~>зала
’ vep-
ГОХО-
гпзче-
«:стей
' рер-
г=-:кие
с па-
=ь < и
-лер-
1 :езк-
«И.-ЗИ-
дм.
При повторном воздействии на уже
сенсибилизированный организм ал-
лерген соединяется с образовавшими-
ся антителами или лимфоцитами.
Ложные аллергические реакции воз-
никают при первом контакте с аллер-
геном без предшествующей сенсиби-
лизации. По внешним проявлениям
они лишь напоминают аллергические,
но не имеют основного, ведущего (им-
мунного) механизма, характерного
для истинных аллергических болезней.
В настоящее время согласно клас-
сификации, предложенной в 1969 г.
Желлом и К. Кумбсом и позднее до-
полненной А. Ройтом, аллергические
реакции подразделяют с учетом реак-
ций повреждения {гиперчувствительно-
Таблица 8.2
Классификация аллергических реакций
Тип иммунного повреждения Характеристика аллергии Аутоиммунные заболевания
I тип (IgE-зависимый, анафилактический) Атопическая бронхиальная астма, поллиноз, аллергиче- ские риниты, конъюнктиви- ты, анафилактический шок, аллергическая крапивница, отек Квинке и др.)
II тип (цитотоксический или цитолитический) Лекарственная тромбоцито- пеническая пурпура, аллерги- ческий лекарственный агра- нулоцитоз, гемотрансфузион- ные реакции, возникающие вследствие несовместимости групп крови Нефротоксический нефрит, постинфарктный миокар- дит, миастения гравис
III тип (образование токсических иммунных комплексов «антиген — антитело») Экзогенный аллергический альвеолит, сывороточная болезнь, аллергическая крапивница Ревматоидный артрит, гломе- рулонефрит, иридоциклит, сывороточный гепатит, си- стемная красная волчанка, васкулит, рассеянный скле- роз, тиреоидит Хашимото, реакция «трансплантат про- тив хозяина» (РТПХ)
Феномен Артюса
IV тип (клеточно-опо- средованный) Аллергия, формирующаяся при некоторых инфекционных заболеваниях (туберкулез, проказа, лепра, бруцеллез, сифилис), аллергический контактный дерматит
Реакция отторжения трансплантата
V тип (антирецептор- ный) Бронхиальная астма, атопи- ческий дерматит и др. Иммунный тип сахарного диабета, иммунные заболе- вания щитовидной железы, гипофиза и др.
235
emu). С учетом особенностей развития
иммунного ответа выделяют пять ос-
новных типов иммунного поврежде-
ния, или иммунопатологических ре-
акций (табл. 8.2).
I тип иммунного повреждения свя-
зан с образованием особого типа ан-
тител (IgE, IgG4), имеющих высокое
сродство (аффинность) к определен-
ным клеткам (тучным, базофилам),
так называемых цитотропных антител.
Антиген, вступая во взаимодействие
с фиксированными на клетках анти-
телами (рис. 8.5, а), приводит к сек-
реции предсуществующих и вновь об-
разующихся биологически активных
веществ (медиаторов), которые вызы-
вают повышение проницаемости со-
судов, отек ткани, гиперсекрецию
слизи из слизистых желез, сокраще-
ние гладкой мускулатуры.
II тип иммунного повреждения свя-
зан с образованием IgG (кроме IgG4)-
и IgM-антител. Антигенами (первичны-
ми или вторичными) служат компо-
ненты естественных клеточных мемб-
ран или вещества сорбированные на
клеточной поверхности, к которым
образуются антитела. Образующийся
на поверхности клеток комплекс «ан-
тиген-антитело» (рис. 8.5, б) акти-
вирует систему комплемента (С), в ре-
зультате чего возникает повреждение
и лизис клеток.
III тип иммунного повреждения
связан с образованием токсических
иммунных комплексов (антиген-анти-
тело: IgM, IgGb IgG3). В данном слу-
чае антитела — преципитирующие,
антиген находится в избытке, проис-
ходит образование иммунокомплекса
(рис. 8.5, в). Реакция протекает без
Рис. 8.5. Типы иммунного повреждения:
а — I тип; б — II тип; в — III тип; г — IV тип; д — V тип
236
Вк-ля свя-
► igG4)-
рИГ'ЩЧНЫ-
Вг <j\ino-
Н* чемб-
Н^-.-ые на
В *. торым
В*^ _ийся
ВЕ-’.: «ан-
к акти-
В“ •- • вре-
Вго-.«^ение
имения
к- веских
РВ.--1НТИ-
-ЧВВк? я слу-
ЭДВгт <шие,
4Bt роис-
’•к.* лекса
•e'-zt без
предварительного связывания аллер-
гена или антител на клетке.
IV тип иммунного повреждения —
клеточно-опосредованный. Сенсиби-
лизированные лимфоциты окружают
клетку (рис. 8.5, г), реакция не связа-
на с действием антител.
V тип иммунного повреждения (ан-
тирецепторный) — связан с наличи-
ем в крови антител (главным образом
IgG) к физиологически важным де-
терминантам клеточной мембраны —
рецепторам (P-адренорецепторам, аце-
тилхолиновым рецепторам, инсулино-
вым рецепторам, рецепторам для ти-
реотропного гормона — ТТГ). Анти-
ген (рецепторы клеточных мембран)
фиксирован на поверхности клетки
(рис. 8.5, д). Для развития реакции не
требуется участие комплемента. V тип
иммунного повреждения играет осо-
бую роль при аутоиммунизации. Реак-
ция АГ (рецептор) + АТ может вести
к стимуляции или блокаде эффекта.
В развитии бронхиальной астмы, ато-
пического дерматита и некоторых дру-
гих заболеваний антирецепторный тип
повреждения может быть одним из
важных механизмов, осложняющих те-
чение заболевания.
При многих аллергических заболе-
ваниях можно одновременно обнару-
жить патогенетические механизмы раз-
личных типов повреждения. Например,
при атопической бронхиальной астме
и анафилактическом шоке участвуют
механизмы I и III типов, при аутоим-
мунных заболеваниях — реакции II и
IV типов и т.д. Однако для патогене-
тически обоснованной терапии всегда
важно установить ведущий механизм.
Общий патогенез аллергических ре-
акций. Независимо от того, к какому
типу повреждения относится аллерги-
ческая реакция, в ее развитии можно
выделить три стадии.
I. Стадия иммунных реакций (имму-
нологическая). Начинается с первого
контакта организма с аллергеном и
заключается в образовании в организ-
ме аллергических антител (или сен-
сибилизированных лимфоцитов) и их
накоплении. В результате организм
становится сенсибилизированным
или повышенно чувствительным к
специфическому аллергену. При по-
вторном попадании в организм спе-
цифического аллергена происходит
образование комплексов АГ—АТ (или
АГ-сенсибилизированный лимфо-
цит), которые и обусловливают сле-
дующую стадию аллергической реак-
ции.
II. Стадия биохимических реакций
(патохимическая). Суть ее состоит в
выделении готовых и образовании но-
вых биологически активных веществ
(медиаторов аллергии) в результате
сложных биохимических процессов,
запускаемых комплексами АГ —АТ
или АГ-сенсибилизированным лимфо-
цитом.
III. Стадия клинических проявлений
(патофизиологическая). Представляет
ответную реакцию клеток, органов и
тканей организма на образовавшиеся
в предыдущей стадии медиаторы.
Механизм развития аллергических
реакций по I типу иммунного повреж-
дения. В патогенезе аллергических ре-
акций 1 типа выделяют следующие
стадии:
1. Стадия иммунных реакций (про-
дукция IgE). Продукция реагинов —
IgE-антител (основных в аллергических
реакциях, развивающихся по I типу
иммунного повреждения) подвержена
тем же закономерностям, что и синтез
иммуноглобулинов других классов.
Однако синтез реагинов-IgE-антител
индуцируется взаимодействием аллер-
генпредставляющих клеток с Т-хелпе-
рами 2 (Th-2), приводящими к преиму-
щественной стимуляции образования
ИЛ-4 и одновременно к подавлению
секреции ИФН-у, что переключает
237
активированные IgM-IgG-несущие
В-клетки на синтез IgE.
После внедрения в организм аллер-
ген связывается поверхностными им-
муноглобулиновыми молекулами ал-
лерген-спенифических В-клеток, ко-
торые в 10000 раз более эффективны
в представлении очень малых коли-
честв растворимых антигенов Т-клет-
кам, чем макрофаги.
Алл е pre н - имм у н о гл обул и н о вы й
комплекс интернализируется в клет-
ку, где (как и в макрофагах) проис-
ходит фрагментация (процессинг) ис-
ходной молекулы аллергена на пептид-
ные фрагменты.
Пептидные компоненты аллерге-
на представляются затем на поверх-
ности В-клеток в ассоциации с мо-
лекулами II класса главного комплек-
са гистосовместимости (МНС-П).
В такой форме комплекс «аллергенный
пептид — МНС» связывается Т-кле-
точным рецептором ('I CR). Таким об-
разом устанавливается контакт В-клет-
ки с Т-клеткой.
Распознавание комплекса «аллер-
генный пептид — МНС» Т-клеточным
рецептором активирует Т-клетку (Тй2)
и приводит к возникновению двух
очень важных событий. Во-первых,
избирательная стимуляция аллерген-
специфических Т-клеток (Th2) стиму-
лирует секрецию ИЛЛ. а также дру-
гих цитокинов (ИЛ-5, ИЛ-6). Сигнал,
осуществляемый ИЛ-4, ответствен за
выбор изотипа IgE, на который про-
исходит переключение синтеза. Во-вто-
рых, на Т-клетке экспрессируется ли-
ганд для молекулы CD40 (CD40L). На
покоящейся Т-клетке CD40L отсут-
ствует.
Экспрессия этой молекулы CD40L,
сопровождающая активацию клетки,
делает Т-клетку полностью компетен-
тной в индукции образования IgE.
Связывание молекулы CD40 на
В-лимфоците своим лигандом CD40L,
экспрессированным на Т-клетках,
обеспечивает другой сигнал, который
запускает переключающую рекомби-
нацию на синтез IgE.
Однако непосредственно действия
ИЛ-4 на В-клетки и связывание мо-
лекулы CD40 на В-лимфоците лиган-
дом CD40L на Т-клетках еще недо-
статочно для запуска секреции IgE.
К сигналам, необходимым для спе-
цифического IgE-синтеза, относятся
также IgE-связывающие факторы с
разной физиологической направлен-
ностью (IgE-усиливающий фактор —
IgE-УФ — усиливает образование IgE,
IgE-тормозящий фактор — IgE-ТФ —
угнетает продукцию IgE), которые под-
держивают образование IgE. Точкой
приложения действия этих факторов
является несущая поверхностный IgE
В-клетка памяти. IgE-УФ способству-
ет дифференцировке этих клеток в
IgE-секретирующие плазматические
клетки, IgE-ТФ тормозит продукцию
IgE плазматическими клетками.
ИФН-у оказывает тормозящее дей-
ствие как на этапе переключения на
синтез IgE, так и на более поздних
этапах за счет торможения функции
IgE-образующих клеток.
Набор цитокинов, секретируемых
Т-хелперными клетками (ИЛ-3, ИЛ-5,
ИЛ-6) наряду с синтезом IgE, спо-
собствует пролиферации, созреванию
и активации тучных клеток, базофиль-
ных и эозинофильных гранулоцитов с
вовлечением их в IgE-опосредованный
иммунный ответ.
Ситуация еше более усложняется
тем, что тучные клетки и базофилы
после антигениндуцированного пере-
крестного взаимодействия рецепторов
для IgE на их клеточной мембране
секретируют не только медиаторы ал-
лергии (гистамин, лейкотриены, про-
стагландины), но и цитокины, соот-
ветствующие цитокинам Т-хелперных
клеток. Таким образом происходит
238
тках,
эрый
мби-
:твия
мо-
ан-
:ятся
аы с
--лен-
~ под-
едо-
IgE.
спе-
, 'Р —
Вил. е IgE,
ЬмЁ-ТФ —
: чкои
• оров
L<1 [gE
"•teri <ству-
. СТОК В
Шг- ' еские
г хцию
<
ЧШш..:: дей-
- ;-Я на
:дних
в* ' -кции
»
<Wr - емых
«- ИЛ-5,
W - 5 спо-
Т сНИЮ
ОШТЬ-
Чвг - _ то в с
'*& -Т4НЫЙ
• истся
ми : [;и.1ы
’Ив дере-
ШГГ. : “ТОрОВ
- эране
**•' гы ал-
WH1L. 2.:, про-
ЧВВ> соот-
.оных
.ходит
пролонгирование и усиление [gE-
опосредованного иммунного ответа,
замыкается порочный круг. Возникший
синтез IgE поддерживается на опре-
деленном уровне и благодаря этому
осуществляется механизм IgE-зависи-
мого высвобождения медиаторов ал-
лергического воспаления.
IgE-антитела значительно отлича-
ются по своим свойствам от других
антител. Прежде всего они обладают
цитотропностью (цитофильностью).
Считают, что присущее им свойство
прикрепляться к клеткам и фиксиро-
ваться в тканях, связано с приобретен-
ным! в филогенезе дополнительными
110 аминокислотами на Ес-фрагменте
молекулы. Концентрация IgE-антител
в сыворотке крови потому и низка,
что синтезируемые в региональных
лимфатических узлах молекулы IgE в
меньшей степени попадают в крово-
ток, так как в основном фиксируются
в окружающих тканях. Разрушение или
инактивация этого участка нагревани-
ем (до 56 °C) приводит к потере ци-
тотропных свойств этих антител, т.е.
они термолабильны.
Фиксация антител клетками про-
исходит при помощи рецептора,
встроенного в мембрану клеток. Самой
высокой способностью связывать IgE-
антитела обладают рецепторы для IgE,
обнаруженные на тучных клетках и ба-
зофилах крови, поэтому эти клетки
получили название «клетки-мишени
I порядка». На одном базофиле может
фиксироваться от 3 000 до 300 000 мо-
лекул IgE. Рецептор для IgE обнару-
жен также на макрофагах, моноцитах,
эозинофилах, тромбоцитах и лимфо-
цитах, однако их связывающая спо-
собность ниже. Эти клетки получили
название «клетки-мишени II порядка».
Связывание IgE на клетках — за-
висимый от времени процесс. Опти-
мальная сенсибилизация может насту-
пить через 24—48 ч. Фиксированные
антитела могут долго находиться на
клетках, поэтому аллергическая реак-
ция может быть вызвана спустя неде-
лю и более. Особенностью IgE-анти-
тел является также трудность их обна-
ружения, так как они не участвуют в
серологических реакциях.
Итак, первичное попадание аллер-
гена в организм запускает через взаи-
модействие макрофагов, Т- и В-лим-
фоцитов сложные механизмы синтеза
IgE-антител, фиксирующихся на клет-
ках-мишенях. Повторная встреча орга-
низма с этим аллергеном приводит к
образованию комплекса АГ—АТ, при-
чем через фиксированные молекулы
IgE сам комплекс тоже окажется фик-
сированным на клетках. Если про-
изошло связывание аллергена хотя бы
с двумя соседними молекулами IgE,
то этого достаточно для нарушения
структуры мембран и активации кле-
ток-мишеней. Начинается II стадия
аллергической реакции.
2. Стадия биохимических реакций.
В этой стадии основная роль принад-
лежит тучным клеткам и базофилам,
т.е. клеткам-мишеням I порядка. Туч-
ные клетки — это клетки соедини-
тельной ткани. Они обнаруживаются
преимущественно в коже, дыхатель-
ных путях, железистой ткани, оболоч-
ке сосудов, по ходу кровеносных со-
судов и нервных волокон. Тучные
клетки имеют большие размеры (диа-
метр 10—30 мкм) и содержат грану-
лы диаметром 0,2 —0,5 мкм, окружен-
ные перигранулярной мембраной. Ба-
зофилы выявляются в крови, оттуда
они поступают в ткани. Гранулы туч-
ных клеток и базофилов содержат ме-
диаторы: гистамин, гепарин, фактор
хемотаксиса эозинофилов аллергии
(ФХЭ-А), фактор хемотаксиса нейт-
рофилов аллергии (ФХН-А), IgE
(табл. 8.3).
Образование комплекса АГ—АТ на
поверхности тучной клетки (или ба-
239
Таблица 8.3
Медиаторы аллергических реакций I типа
Медиаторы Биологическая активность
Первичные. Предсуществующие
Г истамин Повышение проницаемости сосудов, расшире- ние артериол и прекапилляров, сокращение гладкой мускулатуры, увеличение секреции слизи
Фактор хемотаксиса эозинофилов (ФХЭ-А) (ИЛ-5) Хемотаксис эозинофилов
Фактор хемотаксиса нейтрофилов (ФХН-А) (ИЛ-8) Хемотаксис нейтрофилов
Базофильный калликреин Образование брадикинина из кининогена
Гепарин Антикоагулянт, анти комплементарная активность
Первичные. Вновь синтезируемые
МРС-А (лейкотриены С4, D4) Сокращение гладкой мускулатуры, повышение проницаемости сосудов
Лейкотриен В4 Хемотаксис нейтрофилов и эозинофилов
Простагландин D2 Сокращение гладкой мускулатуры, снижение АД
Фактор активации тромбоцитов Агрегация тромбоцитов, высвобождение медиа- торов из тромбоцитов, сокращение гладкой му- скулатуры
Тромбоксан А2 Сокращение гладкой мускулатуры, агрегация тромбоцитов
Вторичные
Простагландин F2a(PGF2a) Сокращение гладкой мускулатуры, повышение проницаемости сосудов, стимуляция высвобож- дения медиаторов из тучных клеток
Простагландин Е2 (PGE2) Расслабление гладкой мускулатуры бронхов, торможение высвобождения медиаторов из туч- ных клеток
Брадикинин и лейкокинин Повышение проницаемости сосудов, расшире- ние артериол и прекапилляров, сокращение гладкой мускулатуры, стимуляция хемотаксиса нейтрофилов, моноцитов, эозинофилов
Серотонин Сокращение гладкой мускулатуры, повышение проницаемости сосудов, спазм сосудов почек, сердца, мозга, легких, расширение сосудов скелетных мышц
Лизосомальные ферменты грануло- цитов и оксиданты Повреждение клеток
240
t _a 8.3
зофила) приводит к стягиванию бел-
ков-рецепторов для IgE, клетка акти-
вируется и секретирует медиаторы.
Максимальная активация клетки до-
стигается связыванием нескольких со-
тен и даже тысяч рецепторов.
В результате присоединения аллер-
гена рецепторы приобретают энзима-
тическую активность, и запускается
каскад биохимических реакций. Уве-
личивается проницаемость клеточной
мембраны для ионов кальция. Послед-
ние стимулируют эндомембранную
проэстеразу, которая переходит в эс-
теразу и переводит в активную фор-
му фосфолипазу D, гидролизующую
мембранные фосфолипиды.
Гидролиз фосфолипидов способ-
ствует разрыхлению и истончению
мембраны и тем самым облегчает слия-
ние цитоплазматической мембраны с
перигранулярной, а также способству-
ет разрыву цитоплазматической мемб-
раны с выходом содержимого гранул
(и медиаторов) наружу, происходит
экзоцитоз гранул.
При этом важную роль играют про-
цессы, связанные с энергетическим
обменом, особенно гликолиз. Энерге-
тический запас имеет значение как для
синтеза медиаторов, так и для выхода
медиаторов через внутриклеточную
транспортную систему. По мере раз-
вития процесса гранулы перемещают-
ся на клеточную поверхность. Для
проявления внутриклеточной под-
вижности определенное значение
имеют микроканальцы и микрофила-
менты.
Энергия и ионы Са2+ необходимы
для перехода микроканальиев в функ-
ционирующую форму, в то время как
повышение уровня цАМФ или сниже-
ние цГМФ дает обратный эффект.
Энергия требуется также для освобож-
дения гистамина из рыхлой связи с
гепарином под влиянием обмена на
ионы Na+, К+, Са2' внеклеточной жид-
кости. По окончании реакции АГ—АТ
клетка остается жизнеспособной.
Кроме выхода медиаторов, уже
имеющихся в гранулах тучных клеток
и базофилов, в этих клетках происхо-
дит быстрый синтез новых медиато-
ров (см. табл. 8.3). Источником их яв-
ляются продукты распада липидов:
фактор активации тромбоцитов, про-
стагландины, тромбоксаны и лейко-
триены (последние объединяются под
названием «медленно реагирующая
субстанция анафилаксии» — МРС-А).
Следует отметить, что дегрануля-
ция тучных клеток и базофилов мо-
жет происходить и под влиянием не-
иммунных активаторов, т.е. активиру-
ющих клетки не через IgE-рецепторы.
К ним относятся: АКТЕ, вещество Р,
соматостатин, нейротензин, химо-
трипсин, АТФ, компоненты системы
комплемента СЗа и С5а. Таким свой-
ством обладают продукты активации
клеток, вторично вовлекаемых в ал-
лергическую реакцию: катионный бе-
лок нейтрофилов, пероксидаза, сво-
бодные радикалы и др. Некоторые ме-
дикаменты также могут активировать
тучные клетки и базофилы, например
морфин, кодеин, рентгеноконтраст-
ные вещества.
В результате выделения из тучных
клеток и базофилов факторов хемотак-
сиса нейтрофилов и эозинофилов по-
следние скапливаются вокруг клеток-
мишеней 1 порядка и происходит их
взаимодействие. Нейтрофилы и эози-
нофилы активируются и тоже высво-
бождаю! биологически активные ве-
щества и ферменты. Часть из них яв-
ляется также медиаторами повреж-
дения (например, фактор активации
тромбоцитов, лейкотриены и др.),
а часть (гистаминаза, арилсульфатаза,
фосфолипаза D и др.) — фермента-
ми, разрушающими определенные ме-
диаторы повреждения. Так, арилсуль-
фатаза из эозинофилов вызывает раз-
241
рушение МРС-А, гистаминаза — раз-
рушение гистамина. Образующиеся
простагландины группы Е снижают
высвобождение медиаторов из тучных
клеток и базофилов.
3. Стадия клинических проявлений.
В результате действия медиаторов раз-
вивается повышение проницаемости
микроциркуляторного русла, что со-
провождается выходом жидкости из
сосудов с развитием отека и серозно-
го воспаления. При локализации про-
цессов на слизистых оболочках возни-
кает гиперсекреция. В органах дыхания
развивается бронхоспазм, который
наряду с отеком стенки бронхиол и
гиперсекрецией мокроты обусловли-
вает резкое затруднение дыхания. Все
эти эффекты клинически проявляют-
ся в виде приступов бронхиальной аст-
мы, ринита, конъюнктивита, крапив-
ницы (волдырь и гиперемия), кожно-
го зуда, местного отека, диареи и др.
В связи с тем, что одним из медиато-
ров является ФХЭ-А, очень часто I тип
аллергии сопровождается увеличени-
ем количества эозинофилов в крови,
мокроте, серозном экссудате.
В развитии аллергических реакций
I типа выделяют раннюю и позднюю
стадии.
Ранняя стадия появляется в
течение первых 10 — 20 мин характер-
ными вздутиями (пузырями), зудом,
эритемой. В ней преобладает влияние
первичных медиаторов.
Поздняя стадия аллергиче-
ской реакции наблюдается через 2—
6 ч после контакта с аллергеном и в
основном связана с действием вторич-
ных медиаторов. Она развивается к мо-
менту исчезновения эритемы и вол-
дыря, характеризуется отеком, крас-
нотой, уплотнением кожи, которое
рассасывается в течение 24 — 48 ч с
последующим образованием петехий.
Морфологически поздняя стадия ха-
рактеризуется наличием дегранулиро-
ванных тучных клеток, периваскуляр-
ной инфильтрации эозинофилами,
нейтрофилами, лимфоцитами. Окон-
чанию стадии клинических проявле-
ний способствуют следующие условия:
в ходе 3-й стадии удаляется повреж-
дающее начало — аллерген. Антитела
и комплемент обеспечивают его инак-
тивацию и удаление. Активизируется
цитотоксическое действие макрофа-
гов, стимулируется выделение энзи-
мов, супероксидного радикала и дру-
гих медиаторов, что очень важно для
зашиты против гельминтов;
благодаря, в первую очередь, фер-
ментам эозинофилов, устраняются
повреждающие медиаторы аллергиче-
ской реакции.
Псевдоаллергические реакции. В ал-
лергологической практике врачу все
чаще приходится иметь дело с боль-
шой группой реакций, часто клини-
чески неотличимых от аллергических.
Эти реакции имеют аналогичные с
аллергическими патохимическую и
патофизиологическую стадии, они
получили название «псевдоаллерги-
ческие (неиммунологические)». Выя-
вить участие иммунных механизмов не
удается.
В развитии псевдоаллергических
реакций особую роль играют такие
медиаторы, как гистамин, лейкотрие-
ны, продукты активации комплемен-
та, калликреин-кининовой системы.
Выделяют три группы псевдоаллер-
гических реакций:
реакции, связанные с избыточным
освобождением медиаторов (гистами-
на) из тучных клеток или с нарушени-
ем их инактивации. Их причинами яв-
ляются: высокая температура, УФО,
ионизирующая радиация, антибиоти-
ки, полисахариды;
реакции в связи с дефицитом пер-
вого компонента комплемента (С1-
1NA) и не иммунологической актива-
цией комплемента по альтернативно-
242
<уляр-
«с :ами,
Экон-
> гтсявле-
» „товия:
- ’:зреж-
i -тоитела
► лнак-
«*.. туется
»- > тофа-
ЭНЗИ-
дру-
®то-о для
кд- фер-
Е- - ются
-ггиче-
н. В ал-
:.®тоу все
IV - боль-
ГТ? -ТПНИ-
“ ч -егких.
иг - -:ые с
Kt.кую и
t? . они
ta-лерги-
Kt Выя-
И?. чов не
г* -еских
|Б~ такие
о.- :трие-
&-,емен-
снтемы.
кддтлер-
.‘ЧНЫМ
'т* .тами-
еь." мени-
fctx- 'И ЯВ-
Ць УФО,
иг-* лоти-
вг пер-
(Cl-
ub .дтива-
J»-TOiBHO-
му (пропердиновому) пути. Их при-
чинами являются: яд кобры, бактери-
альные липополисахариды, ферменты
(трипсин, плазмин, калликреин), ак-
тивирующиеся при повреждении;
реакции, связанные с нарушени-
ем метаболизма полиненасыщенных
жирных кислот (в первую очередь ара-
хидоновой). Они развиваются в резуль-
тате приема аналгетиков, ацетилсали-
циловой кислоты, производных пира-
золона, нестероидных противовоспа-
лительных препаратов.
Основные проявления псевдоаллер-
гических реакций — эритема крапив-
ница, отек Квинке, бронхоспазм, ана-
филактический шок.
Аллергические реакции II типа (ци-
тотоксический тип аллергии). Цитоток-
сическим этот тип называют потому,
что образовавшиеся к антигенам кле-
ток антитела соединяются с клетками
и вызывают их повреждение и даже ли-
зис (цитолитическое действие). В фор-
мирование учения о цитотоксинах зна-
чительный вклад внесли выдающиеся
русские ученые И. И. Мечников,
Е. С.Лондон, А.А. Богомолец, Г.П.
Сахаров. Свою первую работу о так
называемых клеточных ядах (цитоток-
синах) И. И. Мечников опубликовал
еще в 1901 г.
Причиной цитотоксических реак-
ций является образование в организ-
ме клеток с измененными компонен-
тами клеточной мембраны. Важную
роль в процессе приобретения клет-
ками аутоиммунных свойств играет
действие на них различных химических
веществ, чаще лекарств, попадающих
в организм. Они могут изменять анти-
генную структуру клеточных мембран
за счет конформационных изменений
присущих клетке антигенов, повреж-
дения мембраны и появления новых
антигенов: образования комплексных
аллергенов с мембраной, в которых
химическое вещество играет роль гап-
тена (например, 2-метилдофагипотен-
зивный препарат). По одному из ука-
занных механизмов может развиться
аутоиммунная гемолитическая анемия.
Повреждающее действие на клетку
могут оказывать лизосомальные фер-
менты фагоцитирующих клеток, бак-
териальные энзимы, вирусы. Поэтому
многие паразитарные, бактериальные
и вирусные инфекционные заболева-
ния сопровождаются образованием
аутоантител к различным клеткам тка-
ней и развитием гемолитической ане-
мии, тромбопитапении и др. Как было
сказано ранее, по типу цитотоксиче-
ского повреждения могут развиваться
аллергические реакции на некоторые
лекарственные вещества и аутоиммун-
ные заболевания.
Патогенез цитотоксических аллер-
гических реакций включает следующие
стадии:
I. Иммунную стадию. В ответ на по-
явление аутоаллергенов начинается
выработка аутоантител IgG- и IgM-
классов. Они обладают способностью
фиксировать комплемент и вызывать
его активацию. Часть антител обладает
опсонизирующими свойствами (уси-
ливающими фагоцитоз) и обычно не
фиксирует комплемент. В ряде случаев
после соединения с клеткой происхо-
дят конформационные изменения в
области Бс-фрагмента антитела, к ко-
торому затем могут присоединяться
К-клетки (киллеры).
Общее свойство киллерных клеток —
наличие у них мембранного рецепто-
ра для Ес-фрагмента IgG—АТ и спо-
собность к цитотоксическому дей-
ствию (так называемая антителозави-
симая клеточная цитотоксичность),
т.е. они способны к уничтожению
только тех измененных клеток, кото-
рые покрыты антителами. К таким эф-
фекторным клеткам относят: грануло-
циты, макрофаги, тромбоциты, клет-
ки из лимфоидной ткани без харак-
243
Рис. 8.6. К-клеточный лизис Fab- и Fc-
фрагментами IgG
терных маркеров Т- и В-клеток и на-
зываемые К-клетками. Механизм ли-
зиса у всех этих клеток одинаков.
Антитела (IgG) участвуют в К-кле-
точном лизисе Fab- и Гс-фрагментами
(рис. 8.6). Считается, что антитела слу-
жат «мостиком» между эффекторной
клеткой и клеткой-мишенью.
В результате всех этих реакций во
2-ю патохимическую стадию появля-
ются иные медиаторы, чем в реакци-
ях реагинового типа (табл. 8.4).
Основным медиатором компле-
мент-опосредованной цитотоксич-
ности являются активированные по
классическому пути (через комплекс
АГ—АТ) компоненты комплемента:
С4в2аЗв; C3a,C5a; С567; С5678;
С56789, образующие в мембране клет-
ки гидрофильный канал, через кото-
рый начинают проходить вода и соли.
Во время поглощения опсонизиро-
ванных клеток фагоциты выделяют ряд
лизосомальных ферментов, которые
могут играть роль медиаторов повреж-
дения. В ходе реализации антителоза-
висимой клеточной цитотоксичности
также принимает участие секретируе-
мый гранулоцитами крови суперок-
сидный анион-радикал.
Таблица 8.4
Медиаторы аллергических реакций II типа
Медиаторы Биологическая активность
1. Активированные компоненты комплемента: С4в2аЗв СЗ а -. С5 -анафи л атокс ины С567 С5678 С56789 Иммунное прилипание к фагоцитам (иммуноадге- ренция), усиление фагоцитоза, экзоцитоз гранул нейтрофилов Хемотаксис нейтрофилов, эозинофилов и моноци- тов, освобождение лизосомальных ферментов из нейтрофилов, стимуляция высвобождения гиста- мина из тучных клеток, повышение проницаемости сосудов, непосредственное действие на гладкую мускулатуру и микроциркуляцию Селективный хемотаксис нейтрофилов Медленное повреждение клеточных мембран, вы- свобождение лизосомальных ферментов Быстрое повреждение клеточных мембран, высво- бождение лизосомальных ферментов
2. Оксиданты: О2 — супероксид- ный анион-радикал; ОН — гид- роксильный радикал Инициирование перекисного окисления липидов, повреждение клеточных мембран
3. Лизосомальные ферменты Повреждение опсонизированных клеток
*
ж
ж
Л
244
чгЗКЦИЙ ВО
К лоявля-
i реакци-
<омпле-
" гтоксич-
ш-:ные по
- лмплекс
глемента:
' С5678;
с _не клет-
=тез кото-
LL2 II СОЛИ.
а- : низиро-
ГйЛЛЮТ ряд
- которые
к ловреж-
г~лелоза-
кс лчности
!М?етируе-
। лперок-
п • : па 8.4
R-A.-iire-
i “ПНУЛ
~ из
~ :ла-
—ечости
зуо
к.-, зы-
ЛНС ЗО-
СТ лов,
3. Патофизиологическая стадия. Ко-
нечным звеном комплемент- и анти-
телозависимой цитотоксичности явля-
ются повреждение и гибель клеток с
последующим удалением их путем
фагоцитоза.
О метаболических процессах, не-
обходимых для лизиса, известно очень
мало, но установлено, что эффектор-
ные клетки должны быть живыми.
Клетка-мишень является совершенно
пассивным партнером в процессе ли-
зиса, и ее роль заключается лишь в
экспозиции антигена. После контакта
с эффекторной клеткой клетка-ми-
шень гибнет, эффекторная клетка вы-
живает и может взаимодействовать с
другими мишенями. Гибель клетки-ми-
шени обусловлена тем, что в поверх-
ности мембран клетки образуются ци-
линдрические поры диаметром от 5 до
16 нм. С появлением таких трансмемб-
ранных каналов возникает осмотиче-
ский ток (вход в клетку воды) и клет-
ка гибнет.
Цитотоксический тип играет важ-
ную роль в иммунной системе, когда
в качестве антигена выступают чуже-
родные для данного организма клет-
ки, например, микробы, простейшие,
опухолевые или отработавшие свой
срок клетки организма. Однако в усло-
виях, когда нормальные клетки орга-
низма под влиянием воздействия при-
обретают аутоантигенность, этот
защитный механизм становится пато-
генным и реакция из иммунной пере-
ходит в аллергическую, приводя к
повреждению и разрушению клеток
тканей.
Цитотоксический тип реакции мо-
жет быть одним из проявлений лекар-
ственной аллергии в виде лейкопении,
тромбоцитопении, гемолитической
анемии и др. Этот же механизм вклю-
чается и при попадании в организм
гомологичных антигенов, например,
при переливании крови в виде аллер-
гических гемотрансфузионных реак-
ций (на многократное переливание
крови), при гемолитической болезни
новорожденных.
Действие цитотоксических антител
не всегда заканчивается повреждени-
ем клеток. При этом важное значение
имеет их количество. В случае малого
количества антител вместо поврежде-
ния можно получить феномен стиму-
ляции. Например, с длительным сти-
мулирующим действием естественно
образовавшихся аутоантител к щито-
видной железе связывают некоторые
формы тиреотоксикоза.
Аллергические реакции III типа (ре-
акции «болезнь» иммунных комплексов).
Повреждение при данном типе аллер-
гической реакции вызывают иммун-
ные комплексы АГ—АТ. Вследствие
постоянного контакта человека с ка-
кими-либо антигенами происходят
иммунные реакции с образованием
комплексов АГ—АТ (они происходят
постоянно). Эти реакции являются
выражением защитной функции им-
мунитета и не сопровождаются по-
вреждением. Однако при определен-
ных условиях комплекс АГ—АТ мо-
жет вызывать повреждение и развитие
заболевания. Концепция о том, что им-
мунные комплексы могут играть роль
в патологии, была высказана еще в
1905 г. К. Пирке и Б. Шиком. С тех пор
группа заболеваний, в развитии кото-
рых основная роль принадлежит им-
мунным комплексам, получила назва-
ние «болезни иммунных комплексов».
Причиной иммунокомплексных за-
болеваний являются экзо- и эндоан-
тигены и аллергены. Среди них: лекар-
ственные препараты (пенициллин,
сульфаниламиды и др.), антитоксиче-
ские сыворотки, гомологичные у-гло-
булины, пищевые продукты (молоко,
яичные белки и др.), ингаляционные
аллергены (домашняя пыль, грибы
и др.), бактериальные и вирусные ан-
245
тигены, ДНК, антигены клеточных
мембран и др. Важно, что антиген
имеет растворимую форму.
В патогенезе реакций иммунных
комплексов различают следующие ста-
дии:
I. Иммунная стадия. В ответ на по-
явление аллергена или антигена на-
чинается синтез антител, преимуще-
ственно IgG- и IgM-классов. Эти ан-
титела называют также преципитиру-
ющими за их способность образовы-
вать преципитаты при соединении с
соответствующими антигенами.
При соединении АТ с АГ образу-
ются иммунные комплексы. Это мо-
жет быть местно, в тканях либо в кро-
вотоке, что в значительной мере опре-
деляется путями поступления или
местом образования антигенов (ал-
лергенов). Патогенное значение ПК
определяется их функциональными
свойствами и локализацией вызывае-
мых ими реакций.
От количества и соотношения мо-
лекул АГ и АТ зависят величина ком-
плекса и структура решетки. Так, круп-
норешетчатые комплексы быстро уда-
ляются из кровотока ретикулоэндоте-
лиальной системой. Препипитирован-
ные, нерастворимые иммунные комп-
лексы, образованные в эквивалентном
соотношении, обычно легко удаляют-
ся при помощи фагоцитоза и не вызы-
вают повреждения за исключением слу-
чаев их высокой концентрации или
образования в мембранах с фильтру-
ющей функцией (в гломерулах, сосу-
дистой оболочке глазного яблока).
Небольшие комплексы, образован-
ные при избытке антигена, циркули-
руют длительное время, но обладают
слабой повреждающей активностью.
Повреждающее действие обычно ока-
зывают комплексы растворимые, об-
разованные в небольшом избытке
антигена, с молекулярной массой
900000 —1 000000 Да. Они плохо фа-
гоцитируются и долго находятся в
организме.
Значение вида антител определя-
ется тем, что разные классы и под-
классы обладают различной способно-
стью активировать комплемент и фик-
сироваться через Е3С3-рецепторы на
фагоцитирующих клетках. Так, IgM-,
IgG-антитела связывают комплемент,
a IgE и IgG4 — не связывают.
При образовании патогенных им-
мунных комплексов развивается вос-
паление различной локализации. Ин-
галяционные антигены способствуют
прежде всего реакциям в альвеоляр-
ных капиллярах (аллергический аль-
веолит). При ревматоидном артрите
локализацию определяют выработка
ревматоидного фактора и присутствие
его в синовиальной жидкости.
Решающую роль для циркулирую-
щих в крови иммунных комплексов
играют проницаемость сосудов и на-
личие определенных рецепторов в тка-
нях, например к СЗ на гломеруляр-
ной базальной мембране.
2. Патохимическая стадия. Под влия-
нием иммунных комплексов и в про-
цессе их удаления образуется ряд ме-
диаторов, основная роль которых за-
ключается в обеспечении условий,
способствующих фагоцитозу и пере-
вариванию комплекса. Однако при не-
адекватности сложившихся условий
(см. 3-ю стадию) процесс образования
медиаторов может стать чрезмерным,
и тогда они начинают оказывать и по-
вреждающее действие.
Основными медиаторами являют-
ся:
комплемент, в условиях акти-
вации которого различные компонен-
ты и субкомпоненты оказывают ци-
тотоксическое действие. Ведущую роль
играет образование СЗ, С4, С5, кото-
рые усиливают определенные звенья
воспаления (СЗв усиливает иммунную
адгезию иммунокомплексов к фагоци-
'зЛ--
Ж
Ж-
дЖ
ж
246
лод-
бно-
ZIIK-
2.; на
Л1-,
ент,
лм-
зос-
Ин-
угот
:яр-
лгь-
ите
тка
вне
'.сов
на-
тка-
л.яр-
-.ют-
З.Д1Я-
1 ТРО-
щ ме-
с за-
ий,
ере-
• не-
:вий
ьния
-:ым,
i ПО-
кти-
-:ен-
ци-
?оль
гто-
нья
ю
:ии-
там, СЗа играет роль анафилатокси-
на, как и С4а, и т.д.);
лизосомальные ферменты,
освобождение которых во время фа-
гоцитоза усиливает повреждение ба-
зальных мембран, соединительной
ткани;
кинины, в частности брадики-
нин. При повреждающем действии им-
мунокомплексов происходит актива-
ция фактора Хагемана, в результате
из ц-глобулинов крови под влиянием
калликреина образуется брадикинин;
гистамин, се ротон ин, игра-
ющие важную роль в аллергических
реакциях III типа. Источником их яв-
ляются тучные клетки, тромбоциты
и базофилы крови, которые активи-
руются СЗа- и С5а-компонентами
комплемента;
супероксидный ан и о н-р а-
дикал также принимает участие в
развитии реакции этого типа.
Действие всех перечисленных ос-
новных медиаторов характеризуется
усилением протеолиза.
3. Патофизиологическая стадия.
В результате появления медиаторов
развивается воспаление с альтераци-
ей, экссудацией и пролиферацией.
Развиваются васкулиты, приводящие
к появлению узловатой эритемы, узел-
кового периартериита, гломерулонеф-
рита. Могут возникать цитопении (на-
пример, гранулоцитопении). Вслед-
ствие активации фактора Хагемана
или/и тромбоцитов иногда происходит
внутрисосудистое свертывание крови.
Ill тип аллергических реакций яв-
ляется ведущим в развитии сывороточ-
ной болезни, экзогенных аллергиче-
ских альвеолитов, некоторых случаев
лекарственной и пищевой аллергии,
в ряде случаев аутоиммунных заболе-
ваний (ревматоидный артрит и др.).
При значительной активации компле-
мента развивается системная анафи-
лаксия в виде шока.
Аллергические реакции IV типа (ги-
перчувствительность замедленного
типа, опосредованная Т-клетками). Эта
форма реактивности сформировалась
на поздних этапах эволюции на осно-
ве иммунных реакций и воспаления.
Она направлена на распознавание
и ограничение действия аллергена.
IV тип иммунного повреждения лежит
в основе многих аллергических и ин-
фекционных заболеваний, аутоиммун-
ных болезней, отторжения трансплан-
тата (трансплантационный иммуни-
тет), контактного дерматита (контакт-
ная аллергия), противоопухолевого
иммунитета. Наиболее ярким ее про-
явлением служит туберкулиновая ре-
акция, которую в клинической прак-
тике используют в виде реакции Ман-
ту. Относительно позднее проявление
этой реакции (не ранее, чем через 6 —
8 ч в месте введения возникает покрас-
нение, в дальнейшем эритема увели-
чивается и достигает расцвета через
24—48 ч после введения антигена)
позволило также назвать ее гиперчув-
ствительностью замедленного типа.
Этиология и особенности антиген-
ной стимуляции при ГЗТ. Антигены,
индуцирующие ГЗТ, могут быть раз-
личного происхождения: микробы (на-
пример, возбудители туберкулеза, бру-
целлеза, сальмонеллеза, дифтерии,
стрептококки, стафилококки), виру-
сы коровьей оспы, герпеса, кори, гри-
бы, тканевые белки (например, кол-
лаген), антигенные полимеры амино-
кислот, низкомолекулярные органи-
ческие соединения. По химической
природе антигены, которые способ-
ны вызвать ГЗТ, относятся чаще к бел-
ковым соединениям.
Белки, вызывающие ГЗТ, отлича-
ются низкой молекулярной массой и
«слабыми» иммуногенными свойства-
ми. Поэтому они не способны в доста-
точной мере стимулировать антитело-
образование. При этом иммунологи-
247
ческая реакция при ГЗТ обладает ря-
дом отличительных особенностей. Им-
мунный ответ направлен не только по
отношению к гаптену, как это имеет
место при реакциях немедленного
типа, но и к белку-носителю, причем
специфичность в отношении антиге-
на при ГЗТ выражена гораздо силь-
нее, чем при реакциях немедленного
типа. Разрешающий антиген при ГЗТ
должен быть обязательно представлен
комплексом антигена и белка-носи-
теля, а при реакциях немедленного
типа в этой роли может выступать
один гаптен.
На формирование ГЗТ может ока-
зать влияние не только качество, но и
количество поступающего в организм
антигена. Как правило, для воспроиз-
ведения ГЗТ требуется небольшое ко-
личество антигена (микрограммы).
В патогенезе аллергической реакции
IV типа условно, как и в аллергиче-
ских реакциях I, II, III типов, можно
выделить три стадии.
1. Иммунологическая стадия. Посту-
пающий в организм антиген чаще все-
го встречается с макрофагом, обраба-
тывается им, а затем в переработан-
ном виде передается Т-лимфоцитам-
индукторам, имеющим на своей
поверхности рецепторы для антигена.
Клетки-индукторы распознают анти-
ген, а затем с помощью интерлейки-
нов (веществ-посредников, выделяе-
мых макрофагами и лимфоцитами) за-
пускают пролиферацию антигенрас-
познающих клеток — Т-эффекторов с
фенотипом CD4+, а также клеток па-
мяти. Последнее немаловажно, так как
клетки памяти позволяют сформиро-
вать быстрый иммунный ответ при по-
вторном попадании антигена в орга-
низм.
Осуществляющие ГЗТ иммунные
лимфоциты захватывают антиген, по-
видимому, в непосредственной бли-
зости от места его введения. Необхо-
димым условием активации лимфо-
цитов является одновременное связы-
вание Т-клетки как с антигеном, так
и с молекулами главного комплекса
гистосовместимости (ГКГ). В резуль-
тате одновременного «двойного рас-
познавания» антигена и продуктов
ГКГ начинается пролиферация кле-
ток (трансформация лимфоцитов) и
превращение их из зрелых клеток** в
бласты.
2. Патохимическая стадия. Антиген-
ная стимуляция лимфоцитов сопро-
вождается их трансформацией, обра-
зованием и дальнейшим выделением
медиаторов ГЗТ — лимфокинов. Для
каждого медиатора на клетках-мише-
нях обнаружены рецепторы. Действие
медиаторов неспецифично (для их
действия не нужен антиген). Биологи-
ческий эффект лимфокинов разнооб-
разен (табл. 8.5). Они изменяют клеточ-
ную подвижность, активируют клетки,
участвующие в воспалении, способ-
ствуют пролиферации и созреванию
клеток, регулируют взаимодействие
иммунокомпетентных клеток. Клетка-
ми-мишенями для них служат: макро-
фаги и нейтрофилы, лимфоциты,
фибробласты, стволовые клетки кос-
тного мозга, опухолевые клетки, ос-
теокласты и др.
В зависимости от оказываемого эф-
фекта, лимфокины делятся на две
большие группы:
1) факторы, подавляющие функ-
циональную активность клеток (фак-
тор, угнетающий миграцию макрофа-
гов или лимфоцитов; фактор, агглю-
тинирующий макрофаги; хемотакси-
ческие факторы; лимфотоксины);
2) факторы, усиливающие функ-
циональную активность клеток (фак-
тор переноса; факторы, активирующие
макрофаги или лимфоциты; митоген-
ный фактор и др.).
3. Патофизиологическая стадия. За-
висит от природы этиологического
248
»• ~:-'мфо-
Jsic ;вязы-
Ет: ч. так
« текса
-i гезуль-
ih-тоз рас-
тим туктов
ИЛЯ клс-
илтов) и
сетоФв
Сятиген-
э гопро-
t-. обра-
щением
н:з. Для
i-wfflie-
истине
для их
злэлоги-
лезнооб-
«леточ-
т «летки,
елособ-
гезанию
действие
. Клетка-
г лакро-
сс литы,
гхи кос-
ГХД, 0С-
!ч:го эф-
if на две
fc функ-
f.». |фак-
#>хкрофа-
в згглю-
>:такси-
е-.ы);
к функ-
'’Л.. (фак-
кующие
•_:тоген-
iccjx. За-
ялеского
Таблица 8.5
Медиаторы аллергических реакций, опосредованных Т-клетками
Медиаторы Биологическая активность
Медиаторы, действующее на лимфоциты
Фактор переноса (ФП) Ответствен за перенос ГЗТ, усиление цитотоксиче- ского действия, увеличение бласттрансформации
Факторы трансформации лимфо- цитов (ФТЛ): митогенный (МФ): бластогенный Определяют бласто- и митогенную активность, неспецифическое вовлечение лимфоцитов в аллер- гическую реакцию
Интерлейкин-1 (ИЛ-1) (проду- цируется макрофагами) Усиливает ответ тимоцитов и Т-лимфоцитов на антиген, активирует В-лимфоциты
Интерлейкин-2 (ИЛ-2) (проду- цируется Т-лимфоцитами) Стимулирует пролиферацию Т-лимфоцитов под влиянием митогенов и антигенов, способствует дифференцировке предшественников Т-лимфоци- тов в цитотоксические Т-лимфоциты, проявляет хелперную активность в отношении В-лимфоцитов
Медиаторы, действующие на фагоцитоз
Фактор, угнетающий миграцию макрофагов (ФУМ) Способствует накоплению макрофагов в области аллергической альтерации
Фактор, активирующий макро- фаги (ФАМ) Превращает макрофаги (моноциты) в активную форму
Факторы хемотаксиса (ФХ) Способствует хемотаксису макрофагов и грануло- цитов
Медиаторы, действующие на клетки-мишени
Лимфотоксин (ЛТ) Оказывает цитотоксический эффект
Интерферон-а Оказывает противовирусное действие, усиливает цитотоксичность лимфоцитов, активирует макро- фаги и естественные киллеры
Интерферон-у Оказывает противовирусный эффект, стимулирует иммунные реакции (усиление выработки антител, цитотоксичности лимфоцитов, фагоцитоза макро- фагами)
Фактор, ингибирующий проли- ферацию Вызывает торможение деления клеток
Фактор, ингибирующий клони- рование (ФИК) Подавляет клональный рост клеточных культур
фактора и той ткани, где «разыгрыва-
ется» патологический процесс. Это
могут быть процессы, протекающие в
коже, суставах, внутренних органах.
В воспалительном инфильтрате преоб-
ладают мононуклеарные клетки (лим-
фоциты, моноциты и макрофаги). На-
рушение микроциркуляции в очаге по-
вреждения объясняется повышением
проницаемости сосудов под влияни-
ем медиаторов белковой природы (ки-
нины, гидролитические ферменты,
249
фактор проницаемости), а также ак-
тивацией свертывающей системы кро-
ви и усилением образования фибрина.
Отсутствие значительного отека, так
характерного для иммунных поражений
при аллергических реакциях немедлен-
ного типа, связано с весьма ограни-
ченной ролью гистамина в ГЗТ.
При ГЗТ повреждение может раз-
виваться в результате:
прямого цитотоксического действия
CD4+ Т-лимфоцитов на клетки-мише-
ни, которые приобрели аутоаллерген-
ные свойства (растворимый лимфоток-
син и комплемент не принимают уча-
стие в этом процессе);
цитотоксического действия лим-
фотоксинов (так как действие лим-
фотоксина неспецифично, то повреж-
даться могут не только те клетки, ко-
торые вызвали его образование, но и
интактные клетки в зоне его образо-
вания);
выделения в процессе фагоцитоза
лизосомальных ферментов, поврежда-
ющих тканевые структуры (эти фер-
менты выделяют в первую очередь
макрофаги).
Составной частью ГЗТ является
воспаление, которое подключается к
иммунной реакции действием медиа-
торов патохимической стадии. Как и
при иммунокомплексном типе аллер-
гических реакций, оно подключается
в качестве защитного механизма, так
как способствует фиксации, разруше-
нию и элиминации аллергена. Однако
воспаление является одновременно
фактором повреждения и нарушения
функции тех органов, где оно разви-
вается, и ему принадлежит важней-
шая патогенетическая роль в разви-
тии инфекционно-аллергических,
аутоиммунных и некоторых других за-
болеваний.
Профилактика аллергических реак-
ций и заболеваний. Заключается в пред-
отвращении и резком ослаблении по-
ступления в организм разнообразных
аллергенов, так и контактов организ-
ма с теми или иными аллергенами.
Для этого используют как индивиду-
альные, так и производственные ме-
роприятия, способы и средства (не-
допущение попадания из внешней
среды в организм разных видов анти-
генов и гаптенов, оздоровление орга-
низма).
Общие принципы терапии аллерги-
ческих реакций и заболеваний. Среди
них выделяют этиотропный, патоге-
нетический, саногенетический и сим-
птоматический принципы терапии.
Патогенетическая терапия направ-
лена на разрыв основного и ведущих
звеньев патогенеза аллергии путем
использования различных видов спе-
цифической и неспецифичёской
гипо- или десенсибилазации, направ-
ленных: на индукцию иммунологиче-
ской толерантности к аллергенам,
снижение количества аллергических
антител и медиаторов аллергии (путем
уменьшения их образования и уско-
рения их разрушения в организме и
выведения их из организма), на по-
вышение устойчивости клеточно-тка-
невых структур исполнительных и ре-
гуляторных систем, являющихся ми-
шенями для медиаторов аллергии.
Саногенетическая терапия призва-
на активизировать различные защит-
ные, компенсаторные, адаптивные,
в том числе регенераторно-репаратив-
ные, процессы и механизмы на раз-
личных уровнях организации организ-
ма. Для этого используют различные
медикаментозные (фитоадаптогены,
витамины, микроэлементы, энзимы,
нейротропные и другие) средства и
немедикаментозные воздействия (ле-
чебное питание или голодание, за-
каливание организма, психотерапию
и др.).
Симптоматическая терапия на-
правлена на предотвращение или су-
250
шественное ослабление разнообразных
психоэмоциональных неприятных
ощущений (подавленности, волне-
ний, тревоги, головной боли и болей
другой локализации). Для этого ис-
пользуют обезболивающие, седатив-
ные (успокаивающие), адаптогенные,
психотропные средства, проводят се-
ансы внушения, отвлекающую тера-
пию.
8.4. Непереносимость
материалов,
используемых
в стоматологии
Непереносимость зубных протезов
из акриловых пластмасс. Этиология и
патогенез. Термином «непереноси-
мость» обозначают неприятные ощу-
щения в полости рта, заставляющие
больного отказываться от пользования
пластмассовым протезом или пользо-
ваться им кратковременно. Жалобы
больных сводятся на явления паре-
стезии, жжение, сухость и боли в
слизистой оболочке протезного ложа.
Гиперестезии наблюдаются как при
клинически неизмененной слизистой
оболочке протезного ложа, так и при
очаговом и диффузном ее воспалении.
Наиболее частыми и важными при-
чинами «непереносимости» протезов
из акрилатов являются следующие:
механическая травма протезами
слизистой оболочки полости рта;
аллергическое и химико-токсиче-
ское воздействие веществ, входящих
в состав протезов;
воздействие налета на протезах;
нефизиологические условия под
съемными протезами;
заболевания внутренних органов
(анемия, патология желудочно-ки-
шечного тракта, слюнных желез, ате-
росклероз и др.);
гормональные расстройства (диа-
бет, климакс и др.);
психологические факторы;
действие токсинов микроорганиз-
мов, колонизирующих базис протезов.
Механическая травма — одна из
основных причин непереносимости
съемных пластмассовых протезов, так
как при их использовании базисы про-
тезов постоянно совершают микро-
экскурсии. В результате развивается
давление по вертикали и трение при
скольжении жестких базисов по по-
верхности слизистой оболочки поло-
сти рта. Давление протеза может вы-
зывать ишемию слизистой оболочки,
которая в большинстве случаев явля-
ется кратковременной вследствие раз-
вития коллатерального кровообраще-
ния.
Механическая травма слизистой
оболочки зависит не только от каче-
ства изготовления протезов, но и от
индивидуальной устойчивости слизи-
стой оболочки к воздействию.
Аллергическое и химико-токсическое
воздействие веществ, входящих в состав
протезов. Акриловые пластмассы спо-
собны вызывать аллергические и ток-
сические стоматиты. Аллергические
реакции могут быть вызваны вещества-
ми не только белковой природы, но и
гаптенами — простыми химическими
веществами, а также более сложными
продуктами небелковой природы. При
попадании в организм они становят-
ся аллергенами только после соеди-
нения с антигенами организма. При
повторном попадании в сенсибилизи-
рованный организм эти аллергены
могут соединяться с антителами и
(или) Т-лимфоцитами ГЗТ. Роль гап-
тена может выполнять определенная
часть молекулы. Одинаковые части
молекулы (группировки) могут нахо-
диться в составе различных химиче-
ских веществ. Поэтому при сенсиби-
лизации к одному химическому веще-
251
ству возможны аллергические реакции
и на другие вешества, имеюшие ана-
логичные активные группировки, что
называется перекрестной реакцией.
Реакции на аллергены, содержащие-
ся в акрилатах, протекающие по ато-
пическому (реаги новому) типу, встре-
чаются редко. Чаше реакция идет, по
замедленному типу и проявляется в
виде контактной аллергии. Основная
роль в механизме реакции замедлен-
ного типа принадлежит образованию
сенсибилизированных Т-лимфоцитов
на внедрение в организм аллергена.
Основным мономером для акрило-
вых пластмасс является метилмета-
крилат. В качестве сомономеров в не-
больших количествах применяют так-
же эфиры метакриловой и акриловой
кислот. Мономер и эти вещества мо-
гут оказывать аллергическое и токси-
ческое воздействие.
Полной полимеризации мономера
добиться нельзя, поэтому выход ос-
таточного мономера из базиса проте-
за в дистиллированную воду у боль-
ных продолжается в течение многих
лет. Нарушение режима полимериза-
ции приводит к увеличению количе-
ства остаточного мономера и пори-
стости пластмассы.
Существуют доказательства аллер-
генных свойств компонентов акрило-
вых пластмасс. Например, если мор-
ских свинок сенсибилизировать путем
многократного смазывания слизистой
щеки жидкостью мономера в течение
28 дней и через 15 дней еще внутри-
кожно ввести 0,1 мл этого же моно-
мера, то у животных через 24 ч разви-
вается местная аллергическая реакция
в виде гиперемии и плотного инфильт-
рата, что свидетельствует о реакции
гиперчувствительности по IV (замед-
ленному) типу.
Заболевания органов желудочно-
кишечного тракта способствуют повы-
шению проницаемости слизистых обо-
лочек, ослабляется барьерная функция
печени для всех аллергенов. В резуль-
тате повышается риск сенсибилизации
к компонентам акриловой пластмассы.
Сенсибилизирующее и токсиче-
ское воздействие протезов из акри-
ловых пластмасс усиливается еще и
тем, что в порошковые рецептуры ба-
зисных пластмасс включены многие
другие химически активные компо-
ненты: пластификаторы, замутнители,
красители и катализаторы. Располага-
ясь между молекулами, они наруша-
ют монолитность протеза, вымывают-
ся слюной или попадают в полость рта
в результате стирания пластмассы при
приеме пищи и способствуют разви-
тию явлений непереносимости.
Воздействие валета на протезах.
Акриловые протезы во время пользо-
вания поглощают воду, что способ-
ствует поглощению пластмассы, воз-
никновению внутренних напряжений
и образованию пор. Шероховатость и
пористость, а также плохой уход за
протезами благоприятствуют проник-
новению микроорганизмов полости
рта в базис и образованию на его по-
верхности налета, в котором содержат-
ся микроорганизмы, углеводы, белки,
клетки слущенного эпителия, лейко-
циты и др. В результате создаются бла-
гоприятные условия для жизнедея-
тельности грибов, особенно рода Can-
dida albicans. Продукты их метаболизма
могут вызывать боли в области про-
тезного ложа, жжение, токсические и
аллергические реакции. Этому способ-
ствует иммунодефицитное состояние,
при котором возрастает микробная
колонизация базиса протеза и сенси-
билизация организма продуктами жиз-
недеятельности микробов.
Нефизиологические условия под съем-
ными протезами. Такие условия под
съемными протезами могут быть свя-
заны с тем, что пластмасса является
плохим проводником тепла, и это
г1
252
й5 нкция
:езуль-
снзапии
ГЧЗССЫ.
1:иче-
г _кри-
' еле и
г ты ба-
’t ногие
- мпо-
т-. гели,
ь~:лага-
кцеуша-
Килдот-
»«:~ь рта
«-ты при
тззви-
*>тез«х.
тсльзо-
эеоб-
Л» ВОЗ-
т»ений
г:сть и
"• эд за
’г»: НИК-
НИ ОСТИ
-7 3 ПО-
тержат-
5елки,
"тЛКО-
тл бла-
-едея-
Дх Сап-
нлизма
про-
е.кие и
ЭСОб-
г:-чние,
с?: оная
» :енси-
жиз-
:ъем-
под
"х евя-
зт-ется
I это
приводит к локальному повышению
температуры, что способствует разви-
тию микрофлоры. При хорошей фик-
сации пластиночные протезы закры-
вают протоки малых слюнных желез,
вызывая стаз слюны, увеличивая ее
вязкость, содержание защитных бак-
терицидных и трофических веществ.
Заболевания внутренних органов.
Многие заболевания внутренних ор-
ганов могут способствовать развитию
явлений непереносимости акриловых
протезов. К ним относятся эндокрин-
ные заболевания, другие болезни об-
мена веществ, патология кроветвор-
ной системы и системы кровообраще-
ния, заболевания вегетативной нерв-
ной системы и др.
Чувство «жжения в полости рта»
может возникать при сахарном диабе-
те, анемиях, особенно апластической
и пернициозной, в климактерическом
периоде, атеросклерозе язычной арте-
рии, интоксикациях, например, соля-
ми тяжелых металлов, заболеваниях
желудочно-кишечного тракта и др.
Слизистая оболочка тесно связана с
различными органами и системами
организма. Так, при заболеваниях сер-
дечно-сосудистой системы в тканях
полости рта нарушается микроцирку-
ляция, снижаются окислительно-вос-
становительные реакции, развивается
гипоксия, накапливаются продукты
метаболизма. Характерна отечность
слизистой оболочки протезного ложа,
жжение языка, сочетающееся с атро-
фией нитевидных сосочков и истон-
чением эпителия языка.
У больных язвенной болезнью же-
лудка и двенадцатиперсной кишки при
хроническом течении заболевания не-
редко отмечается гипосаливация, что
способствует непереносимости зубных
протезов. При синдроме Крона (хро-
нический стенозирующий язвенный
илеит) на слизистой оболочке поло-
сти рта обнаруживаются афты, кото-
рые могут глубоко рубцеваться, иног-
да развивается фибриноидное набуха-
ние сосудистых стенок, вплоть до их
некроза. При железодефицитной ане-
мии развиваются трофические нару-
шения слизистой оболочки полости
рта, больные жалуются на извраще-
ние вкусовой чувствительности, паре-
стезию и сухость слизистой оболочки
полости рта.
У больных сахарным диабетом в
результате уменьшения стойкости ка-
пилляров полости рта и повышения
сосудистой проницаемости происхо-
дят нарушения в слизистой полости
рта. Больные жалуются на сухость во
рту, снижение вкусовой чувствитель-
ности, при травмировании протеза-
ми быстро развиваются декуб италь-
ные язвы. Повышение концентрации
глюкозы в слюне может способство-
вать размножению микрофлоры, осо-
бенно Candida albicans, повышенно-
му образованию налета мягкой кон-
систенции на зубах и протезах, это
может привести к воспалению про-
тезного ложа.
При тиреотоксикозе нередко выяв-
ляют такие симптомы, как жжение
слизистой оболочки, снижение вкусо-
вой чувствительности, глоссит.
У 60— 80 % женщин в постменопау-
зальном периоде наблюдается наруше-
ние вкусовых ощущений, глоссалгия,
рецидивирующий афтозный стоматит,
зачастую пациентки не могут пользо-
ваться съемными протезами независи-
мо от качества их изготовления.
Сухость слизистой оболочки про-
тезного ложа — один из симптомов
непереносимости акрилатов — может
отмечаться при микседеме, недоста-
точности половых желез, инфекцион-
ных заболеваниях, применении меди-
каментов. угнетающих функцию па-
расимпатической нервной системы,
при угнетении центральной нервной
системы, патологии слюнных желез,
253
сопровождающейся синдромом ксеро-
стомии.
Психологические факторы. Психоло-
гическое состояние больного играет
большую роль в развитии явлений не-
переносимости съемных акриловых
протезов.
Явления непереносимости акрила-
тов могут отмечаться у больных с пси-
хозами, причем у женщин более час-
то, чем у мужчин. Особенно подверже-
ны ипохондрическому состоянию лица
с тревожно-мнительным характером,
неврозами, шизофренией, органиче-
скими заболеваниями центральной
нервной системы, депрессиями.
Явления непереносимости аллергиче-
ского происхождения. Контактные ал-
лергические реакции IV типа на ак-
рилаты, проявляются такими призна-
ками, как воспаление слизистой
оболочки десны и нёба, соответству-
ющие протезному ложу, мелкие точеч-
ные кровоизлияния, глоссит, голово-
кружение, тошнота, чувство жжения
на участке контакта, сухость во рту,
изменение вкусовых ощущений, де-
прессивное состояние, канцерофобия.
Вслед за зудом и жжением в области
контактов появляется эритема, затем
пузырьки, после разрыва которых эро-
зия может распространиться и повлечь
за собой развитие вторичной инфек-
ции.
Субъективные ощущения могут
превалировать над объективной кар-
тиной заболевания, или наоборот.
Гиперчувствительность к акрилатам
может развиться вскоре после нало-
жения протеза или появиться через
несколько недель и даже месяцев.
Непереносимость металлических
включений в полость рта. В результате
воздействия металлических зубных
протезов и пломб у некоторых паци-
ентов развивается патологический
симптомокомплекс, который нередко
обозначается термином «непереноси-
мость металлических включений в по-
лости рта».
Для терапевтического и ортопеди-
ческого лечения в стоматологии при-
меняется большое количество сплавов
металлов. Лишь в редких случаях уда-
ется изготавливать пломбы, вкладки,
коронки, мостовидные, бюгельные и
пластиночные протезы из сплавов од-
нородных металлов. Из-за своей не-
однородности сплавы металлов в по-
лости рта подвергаются электрохими-
ческой коррозии. Всегда, когда металл
и электролит находится вместе, воз-
никает электрический феномен, ко-
торый заключается в стремлении ме-
талла отдать положительно заряжен-
ные ионы в раствор, сохранив при-
надлежащие ему электроны. Вслед-
ствие этого на металле, находящемся
в электролите (слюне), возникает от-
рицательный заряд, затрудняющий
дальнейшее накопление ионов метал-
ла и способствующий наступлению
равновесия, при котором реакции ра-
створения и присоединения одинако-
вы: Me = Ме2+ + 2ё. Уравнение реак-
ции показывает образование двойно-
го слоя, что дает толчок реакции и,
следовательно, отделению ионов ме-
талла (редокс-система). Благодаря про-
исходящим процессам между металлом
и электролитом, всегда имеется раз-
ность потенциалов, которая зависит от
природы металла и электролита, их
концентрации, а также от температу-
ры. Каждый металл, погруженный в
раствор стандартной концентрации
(при данной температуре), приобре-
тает определенный, свойственный
только ему потенциал. Этот потенци-
ал измеряют по отношению к нор-
мальному водородному электроду,
потенциал которого принят равным
нулю.
Если в полости рта находятся два
металла с различными потенциалами,
то образуется гальванический элемент,
254
- л в по-
~~ эпеди-
“ при-
. плавов
*---Х уда-
ьладки,
-^ные и
эв од-
-ей не-
- в по-
~: хпми-
- металл
-~t. BO3-
КО-
ли ме-
•лчжен-
при-
Зслед-
немея
гхдет от-
-?П1ИЙ
-.етал-
ению
I—?и ра-
— нако-
эеак-
xs: ино-
iu_-ni и,
- -= ме-
SC-: про-
t~£LTOM
раз-
t- -ИТ от
Kt’i. их
►Г;рату-
С+-ЫЙ в
и-~ зции
пэбре-
Ьс-ГНЫЙ
Ь'Щцц-
’ яор-
Ь;.~?ОДУ,
Г-ЗНЫМ
два
Н-ДМИ,
Uc :ент,
напряжение которого можно прямо
измерить. Так как потенциалы отдель-
ных электродов могут изменяться,
напряжение элемента (разность потен-
циалов) не будет постоянным. При
одном полуэлементе реакция раство-
рения и присоединения одинаковой
величины. Однако это равновесие мо-
жет нарушиться, если будет идти до-
полнительная катодная реакция. Так,
в кислых электролитах при потребле-
нии электронов ионами Н+ может об-
разовываться водородный газ:
анодная реакция
Me -> Ме2+ + 2ё,
катодная
2Н+ + 2ё -э Н2
О2 + 2Н2О + 4е -> 4(0 Н)
Благодаря изъятию электронов,
анодное растворение усиливается, т. е.
металл коррозирует. В нейтральной
среде растворенный в электролитах
кислород может восстанавливаться в
ионы гидроксила (см. ранее), после
чего вновь возможно растворение
электрода (металла). В связи с тем, что
кислород и влага есть везде, кисло-
родная коррозия является главной
причиной технических коррозионных
повреждений.
Клинические проявления непереноси-
мости металлических включений в по-
лость рта. Патологический симптомо-
комплекс, характерный для неперено-
симости электрогальванического про-
исхождения описан достаточно полно.
Обычно он выражен: металлическим
привкусом; вкусом соли, горечи, кис-
лоты (особенно после приема кислой
пищи); парестезией слизистой обо-
лочки полости рта, глоссодинией,
глоссалгией, гипо- или гиперсалива-
цией; чувством «прохождения тока»
при введении металлических предме-
тов в рот; развитием воспаления сли-
зистой рта, а также гиперкератозом ее
в виде красного плоского лишая и лей-
коплакий.
Г.Д.Овруцкий и А.Д. Ульянов вы-
деляли три синдрома клинических
проявлений гиперчувствительности к
нержавеющей стали.
1. Объективные признаки пораже-
ния слизистой оболочки не обнаружи-
ваются, характеризуются болью в язы-
ке, деснах, слизистой оболочке поло-
сти рта, сухостью во рту, чувством
вязкости на губах, привкусом метал-
ла, извращением вкуса, в некоторых
случаях — жжением, пощипыванием,
зудом и саднением в языке, деснах и
других участках слизистой полости рта.
Больные раздражительны, часто стра-
дают бессоницей, нередко депрессив-
ны, жалуются на недомогание, общую
слабость, склонны к канцерофобии.
2. Сочетание болевых и неприятных
ощущений во рту с объективно выяв-
ленными морфологическими элемен-
тами поражения слизистой полости
рта. На участках слизистых оболочек
полости рта, главным образом контак-
тирующих с зубными протезами, по-
является гиперемия, отек, папулез-
ные, афтозные, буллезно-эрозивные
элементы, реже — явления десквама-
ции, кератоза.
3. Наряду с объективными ощуще-
ниями и морфологическими поражени-
ями слизистой оболочки рта, характер-
но поражение кожи, на которой обна-
руживаются эритематозные, папулез-
ные и буллезно-эрозивные элементы.
Аллергический стоматит может со-
провождаться функциональными на-
рушениями со стороны нервной си-
стемы: раздражительностью, бессони-
цей, эмоциональной лабильностью,
канцерофобией, прозопалгией, а так-
же обострением хронических холеци-
ститов, гастритов, колитов.
Пользование зубными протезами
из никельхромовых сплавов с высо-
ким содержанием никеля также мо-
255
жет сопровождаться аллергическими
реакциями в местах их расположения
в виде воспаления и гиперплазии сли-
зистой оболочки, очагового пародон-
тита, гиперемии, отека, эрозирования
и изъязвления слизистой, а также кра-
пивницей без поражения слизистой
оболочки полости рта.
Описаны случаи непереносимости,
проявляющиеся в виде жжения, ги-
перемии, отека слизистой рта на ор-
тодонтическую проволоку из нержа-
веющей стали, никелево-титанового
сплава.
Аллергия к палладию может про-
текать в виде контактного дерматита,
красного плоского лишая на слизистой
полости рта. Гиперчувствительность
может развиваться и на золото. Она
проявляется гиперемией и отеком тка-
ней, находящихся в контакте с зуб-
ными протезами, эрозиями и язвами,
а также жжением во рту, которое бы-
вает первым признаком патологиче-
ской реакции.
Непереносимость амальгамы. Амаль-
гамы — это сплавы, в состав которых
в качестве одного из элементов вхо-
дит ртуть.
Входящая в состав пломб ртуть мо-
жет испаряться и вдыхаться вместе с
воздухом. Распределение ртути внутри
органов происходит неравномерно.
Сначала ртуть накапливается в альвео-
лах, откуда поступает в кровь. Почки
являются главным хранилищем ртути
после поступления в организм ее па-
ров или неорганических солей. Кроме
того, она аккумулируется в щитовид-
ной железе, поджелудочной железе,
яичках, яичниках и предстательной
железе. До 50 —90 % общего содержа-
ния ртути в организме приходится на
почки.
Ртуть связывается с белками через
сульфгидрильные группы, т.е. в пер-
вую очередь присоединяют ртуть бел-
ки с высоким содержанием SH-rpynn,
при этом может изменяться структура
белковой молекулы. Прочные соеди-
нения ионов ртути с тканевыми бел-
ками вызывают блокаду функциональ-
ных групп клеточных протеинов, сни-
жение активности ферментных систем
и гормонов. Модификация белка мо-
жет быть настолько существенной, что
он приобретает свойства антигена и
может служить пусковым механизмом
аллергической реакции 1, 11, III ти-
пов.
Проблема опасности применения
амальгамы из-за токсического дей-
ствия ртути рассматривается в двух
аспектах: гигиеническом и клиниче-
ском. Первый отражает вредность рту-
ти для медицинского персонала, вто-
рой — токсическое действие ртути на
организм пациента.
Таким образом, наиболее характер-
ная клиническая картина аллергии на
компоненты стоматологических «ре-
ставраций» из металла выражается сле-
дующими признаками: изменение вку-
са (привкус металла, кислоты, соли,
горечи), парестезии различных участ-
ков слизистой оболочки полости рта
и языка, глоссалгия, стомалгия, ко-
торые всегда сочетаются с объектив-
ными изменениями слизистой рта, губ
и языка: гиперемия, отек, папулы,
эрозии, афты, язвы, точечные крово-
излияния, очаговый парадонтит.
Наряду с местными могут разви-
ваться и реакции, удаленные от сли-
зистой оболочки рта (ринит, крапив-
ница, дерматит, экзема), которые либо
сопутствуют указанным выше субъек-
тивным и объективным симптомам,
либо, что значительно реже, являются
единственным проявлением аллергии.
Принципы диагностики непереноси-
мости металлических включений. Диа-
гностика непереносимости стоматоло-
гических «реставраций» из металла
затруднена в связи с отсутствием па-
тогномоничных клинических симпто-
256
т.-хтура
соеди-
'е- ?: бел-
’ ?наль-
'; д.сни-
ы .истом
;с\<а мо-
:и. что
г- гена и
•--измом
а. 'II ти-
»’ч t нения
ь дей-
н двух
:ичс-
Н-.-Ь рту-
1Ы.Д. вто-
- ' и на
“Дсгктер-
гкгди на
^.-д «ре-
мг д сле-
s-.te вку-
’Ь соли,
w .част-
К'.ти рта
гнч. ко-
1ЩсКТИВ-
( era. губ
гапулы,
t нрово-
" ггзви-
: " сли-
салив-
1Ь»е либо
- бъек-
“: мам,
а.потея
-ергии.
ГЪ-.OCU-
•u Диа-
». по-
галла
»-< па-
ЧПТО-
мов. Многие исследователи пытались
регистрировать электрический ток,
который образуется в полости рта при
наличии металлических включений,
с помощью различных приборов: стан-
дартных микроамперметров, гальвано-
метров, приборов собственной конст-
рукции. При этом величина тока ва-
рьировала от 0,5 до 100 мкА, но па-
тологический симптомокомплекс
наблюдался как при высоких, так и
низких значениях силы тока.
В качестве диагностического крите-
рия предложено использование разно-
сти потенциалов (РП), регистрируе-
мой между металлическими конструк-
циями, а также между ними и слизи-
стой оболочкой языка. Однако степень
выраженности патологических измене-
ний не всегда пропорциональна вели-
чине РП; индивидуальная реакция
организма является решающей.
Прямые методы измерения силы
тока и РП приборами с низким вход-
ным сопротивлением имеют малую
точность. Более точным методом изме-
рения электродвижущей силы (ЭДС)
гальванических элементов является
компенсационный метод, но он весь-
ма громоздкий и трудно выполнимый.
По величинам потенциалов метал-
лических включений невозможно су-
дить о реальном коррозионном про-
цессе. Поэтому такие электрические
величины, как сила тока, разность
потенциалов между металлическими
конструкциями в полости рта или
между ними и слизистой оболочкой;
электродный потенциал металличе-
ской конструкции, измеренный отно-
сительно электрода сравнения; pH
смешанной слюны, мало информатив-
ны. Измерение любого из названных
параметров не облегчает выявление
причинно-следственных связей при
данной патологии.
Диагностика непереносимости аллер-
гического происхождения. Наиболее рас-
пространенным способом диагностики
аллергической гиперчувствительности
организма к металлическим зубным
протезам являются накожные (эпику-
танные) пробы: капельные, скарифи-
кационные, компрессные.
В качестве стандартных используют
следующие аллергены: 0,5 % раствор
бихромата калия, 0,25 —1,0 % раствор
хромата калия, 5 % сульфат никеля в
вазелине, 2 % раствор хлорида кобаль-
та, 1 % хлорид палладия в вазелине
и т.д. Однако накожные пробы не име-
ют абсолютного диагностического зна-
чения и могул давать как ложно-по-
ложительные. так и ложно-отрица-
тельные результаты. По этой причине
целесообразно постановку эпикутан-
ных проб и их оценку проводить в со-
трудничестве с опытным аллергологом
или дерматологом.
Отрицательный результат эпику-
танного аллергологического теста не
исключает аллергию на металл, так как
возможна изолированная сенсибили-
зация только слизистой полости рта.
Распространенность сенсибилиза-
ции к никелю (по данным кожных
проб) среди населения высока и со-
ставляет 4,5 — 28,5 % обследованных,
у женщин она наблюдается значитель-
но чаще, чем у мужчин. Гиперчувстви-
тельность кожи к хрому отмечена у
1,5 % мужчин и 4,1 % женщин. Одна-
ко несмотря на столь высокую часто-
ту аллергии кожи к металлам, аллер-
гические реакции на металлические
зубные протезы встречаются редко. По-
этому положительный результат эпи-
кутанных проб еще не означает, что
жалобы больных обусловлены аллер-
гической реакцией.
Эпикутанные аллергологические
пробы перед изготовлением зубных
протезов целесообразно проводить
лишь при полиаллергии и в случаях,
когда в анамнезе пациентов имеются
указания на патологические реакции,
которые могли быть связаны с гипер-
чувствительностью к металлам.
Сенсибилизация организма медицин-
ского персонала. Многие врачебные
специальности отличаются присущи-
ми только им профессиональными
особенностями и сопряжены с воздей-
ствием на организм медперсонала не-
благоприятных факторов, зависящих
как от окружающей обстановки, так
и от характера самого труда.
Стоматологи испытывают воздей-
ствие ряда неблагоприятных производ-
ственных факторов, в числе которых
зрительное и эмоциональное напря-
жение, вынужденная рабочая поза,
нерациональное освещение, опасность
передачи инфекции, контакт с аллер-
генами и токсическими веществами,
шум, вибрация, рентгеновское и ла-
зерное излучение и некоторые другие
факторы.
Работа медицинского персонала
стоматологических кабинетов отлича-
ется от работы других медицинских
работников некоторыми специфиче-
скими особенностями. Они заключа-
ются в контакте кожи рук с лекар-
ственными, пломбировочными, зубо-
техническими и другими материалами
(число которых свыше 600), в том чис-
ле антибиотики, анестетики, гипс,
ротовая жидкость пациентов.
Тесный контакт с аллергенами в
процессе работы имеют зубные тех-
ники.
Среди химических загрязнителей
воздуха стоматологических кабинетов
встречаются аллергены, в первую оче-
редь компоненты латексных перчаток,
акриловых пластмасс.
Микробный фон в атмосфере сто-
матологических кабинетов также по-
вышен, что связано с препарирова-
нием твердых тканей зуба и другими
манипуляциями в полости рта.
Из воздуха стоматологических каби-
нетов выделено более 100 химических
258
соединений, причем около !/3 их име-
ют значительную концентрацию.
Улучшение воздушной среды отме-
чается в случае, если работа с акри-
ловыми пластмассами проводится пер-
соналом в вытяжных шкафах с вклю-
ченной тягой.
В воздухе стоматологических каби-
нетов различного профиля уровень
общей бактериальной обсемененно-
сти составляет в ортопедических и те-
рапевтических кабинетах 2 000—3 000
микробных тел в 1 м3, в хирургиче-
ских — около 1 000, т. е. приближается
к допустимому (не более 1 500 мик-
робных тел в 1 м3), а в ортопедиче-
ских превышен примерно в 1,5 раза.
Контакт с аллергенами происхо-
дит, как правило, на фоне неблаго-
приятных условий труда: температура
воздуха, повышенная влажность, хи-
мический состав воздуха, что увели-
чивает риск сенсибилизации работа-
ющих.
Все перечисленные условия при-
водят к повышенной аллергической
заболеваемости врачей-стоматологов.
Установлено, что женщины подвер-
жены этим заболеваниям в большей
степени, чем мужчины. Наибольшее
число больных отмечается в возраст-
ной группе 50—59 лет. С увеличени-
ем стажа по специальности растет
число лиц, страдающих аллергиче-
скими заболеваниями, и достигает в
группе врачей почти 50%. Степеньал-
лергизации выше всего в группе ор-
топедов.
В стоматологии применяется более
600 различных лекарственных средств,
пломбировочных и зуботехнических
материалов: анестетики, акрилаты,
дезинфектанты, антибиотики, гипс,
латекс и др. Чаше всего из перечис-
ленных групп веществ отмечается сен-
сибилизация к акрилатам, далее сле-
дуют дезинфектанты, анестетики, гипс,
антибиотики.
< име-
- :тме-
_:<ри-
-; лер-
г >-1ю-
г «дои-
те зень
£ -г-:но-
: 1 ,:те-
► - 3 000
г 7 гдче-
| «лется
• :ик-
И’-ллче-
- щза.
Г” ‘.схо-
^"ЛЗГО-
ктлдра
" . хи-
зели-
ш!Ата-
-;хой
1 лов.
1 дзер-
... ,:Л1ей
। _mee
’ 73СТ-
* гНИ-
з-;тет
лг/че-
• зет в
t?-z XI-
~= Ор-
хлее
IC2CTB,
л;ких
- -ТЫ,
хлс,
Х-ИС-
.ен-
г :ле-
~--Чс,
Проявления сенсибилизации к ме-
дикаментам и материалам -имеют раз-
личный характер: сыпь, зуд, покрас-
нения, отеки, сухость кожи, слизи-
стых, головная боль. Причем встреча-
ются врачи как с одним, двумя вида-
ми, так и с многочисленными прояв-
лениями. Чаше других отмечаются
такие симптомы, как головная боль,
затем — покраснение, сухость кожи и
слизистых оболочек, сыпь, зуд.
Существует сезонность проявлений
аллергии, особенно у женщин-стома-
тологов всех специальностей.
В возрастной группе до 20 лет при
наличии аллергии, не связанной с
избранной профессией, положитель-
ные кожные пробы на медикаменты и
материалы, применяемые в стомато-
логии, используются в два раза чаще.
Это, безусловно, следует учитывать
при выборе профессии.
В работе стоматологов всех специ-
альностей производственный контакт
с лекарственными аллергенами пред-
ставляет реальную опасность возник-
новения аллергических реакций. Так,
у хирургов чаще других отмечается
сенсибилизация к новокаину, у те-
рапевтов — к акрилатам и антибио-
тикам, у ортопедов — к акрилатам и
гипсу.
Поскольку сенсибилизация врачей-
стоматологов происходит в основном
через слизистые оболочки, то содер-
жание S-lgA имеет большое значение
для сохранения здоровья. Доказано,
что с увеличением стажа работы от-
мечается снижение содержания S-IgA.
Самая низкая концентрация S-IgA от-
мечается у ортопедов, у них чаще
встречаются аллергические реакции.
Снижение уровня IgA, связанное с
увеличением стажа работы, свидетель-
ствует об истощении этой системы
защиты и снижении иммунологиче-
ской резистентности, что способствует
развитию аллергических заболеваний.
не связанных с воздействием профес-
сиональных аллергенов.
8.5. Аутоиммунные
заболевания
Аутоиммунные болезни — это фор-
ма иммунного ответа организма на
собственные (эндогенные) антигены,
сопровождающаяся повреждением
структуры и функции клеток, тканей,
органов.
К аутоиммунным заболеваниям от-
носятся: ревматизм, ревмоэндокардит,
ревмомиокардит, ревмоперикардит,
ревматоидный артрит (основу которых
составляют ревматические поврежде-
ния различных структур сердца, пе-
риферических суставов и др.); миас-
тения гравис (основу которой состав-
ляют повреждения холинорецепторов,
в силу чего ацетилхолин оказывается
неспособным стимулировать Н-холи-
норецепгоры и активизировать скелет-
ные мышцы); гломерулонефрит (вос-
паление клубочков и других структур
почек); системная красная волчанка
(СКВ) (основу которой составляют
повреждения ядерной и цитоплазма-
тической ДНК многих тканей и орга-
нов, особенно кровеносных сосудов,
кожи, почек и других); склеродермия
(основу которой составляет прогрес-
сирующий склероз структур кожи, по-
чек, легких и других органов) и др.
Следует отметить, что у здорового
человека образование аутоантител и
активация аутологичных лимфоцитов
не происходит в силу развития в про-
цессе эмбриогенеза толерантности
иммунной системы к антигенам соб-
ственных тканей организма. Последнее
происходит благодаря, во-первых,
элиминации генерации клеток, обла-
дающих способностью к аутоагрессии,
во-вторых, полной супрессией им-
мунореактивных клеток, в-третьих,
259
блокадой детерминант лимфоцитов с
помощью АТ или иммунных комплек-
сов.
Классификация аутоиммунных забо-
леваний. В зависимости от преимуще-
ственной локализации патологическо-
го процесса или заболевания разли-
чают моноорганные, или органоспе-
цифические (например, тиреоидит
Хашимото), и полиорганные, или ор-
ганонеспецифические — системные
(ревматоидный артрит, склеродермия,
системная красная волчанка) аутоим-
мунные процессы.
По тяжести течения различают за-
болевания легкой, средней и тяжелой
степени тяжести.
По клиническому течению, скоро-
сти развития и длительности течения
различают острые и хронические за-
болевания.
Поскольку в основе аутоиммунных
заболеваний лежит потеря толерант-
ности (резистентности), в настоящее
время существует несколько теорий,
объясняющих потерю толерантности
при аутоиммунных заболеваниях.
1-я теория объясняет развитие им-
мунной реакции на собственные ан-
тигены появлением так называемых
изолированных антигенов — в норме
не присутствующих в крови, напри-
мер, формирование антител против
сперматозоидов, ткани хрусталика,
миелина.
2-я теория объясняет развитие ауто-
иммунных реакций как результат по-
вреждения Т-клеточной системы (им-
мунорегуляторных клеток — Т- хелпер-
ных клеток ТЫ). В пользу этой теории
свидетельствует наличие лимфоцито-
тропных антител при СКВ, первич-
ном биллиарном циррозе, аутоиммун-
ном тиреоидите, рассеянном склеро-
зе, миастении гравис, ревматоидном
артрите, склеродерме, лекарственно-
индуцированной гемолитической ане-
мии, ревматической болезни.
3-я теория связывает развитие ауто-
иммунных заболеваний с перекрест-
но-реагирующими антигенами, на-
пример, выработка антител к стреп-
тококковым бактериям и белкам сер-
дечной мышцы при ревматическом
повреждении сердца. Чаще перекрест-
ные реакции развиваются на полиса-
харидные антигены, но могут возник-
нуть и на белковые молекулы.
Возникают перекрестные реакции
при модификации собственных анти-
генов чужеродными химическими аген-
тами (например, лекарственные ауто-
иммунные процессы). Образующиеся
при этом антитела или агрессивные
Т-клетки могут перекрестно взаимо-
действовать с нормальными аутоанти-
генами неповрежденных тканей.
4-я теория объясняет развитие ауто-
иммунных заболеваний потерей толе-
рантности в результате поликлональ-
ной активации В-клеток (активация
В-лимфоцитов комплексной субстан-
цией, содержащей множественные
антигены; бактерии и вирусы). В ре-
зультате стимулы, идущие от Т-кле-
ток, не реализуются В-системой. При-
мером может служить образование ан-
тител к ДНК после бактериальных,
вирусных, паразитарных инфекций,
при ревматоидном артрите, системной
красной волчанке.
Согласно 5-й теории механизмы
аутоиммунизации связываются с ме-
ханизмами апоптоза (ослаблением
апоптоза).
Большинство, а может быть, и все
клетки животных при серьезных по-
вреждениях или отсутствии биологи-
ческой целесообразности дальнейше-
го существования обладают способ-
ностью самоуничтожаться за счет ак-
тивации внутренней суицидной про-
граммы.
Апоптоз в клетках взрослого орга-
низма является повсеместным и по-
стоянно происходящим процессом. Все
1 В * И 1 * » ’Ю I
260
Г.ТО-
ва- %гест-
м. * на-
'< -“ren-
te' :ep-
*- - ком
tt -i re ст-
* ' .'>ca-
r * - ДК-
tat L-mi-
•»”' -’ен-
tar Д.ТО-
teu-еся
tet з -:ыс
►*bu. MO-
te^-ти-
tat . .-ro-
te :.ie-
ter-^b-
*жД1Я
ЗЧ-ТЗН-
«э -ые
e -?n-
iwe 2H-
Ku--£X,
всгии,
®>ной
«t: чы
тем
• » все
к :o-
ю: ти-
к<~е-
*< so-
ln - ro-
ll тга-
। * -0_
или большинство клеток организма
способны претерпевать апоптоз — про-
граммированную клеточную гибель.
Нарушение процессов клеточной
гибели может приводить к возникно-
вению патологических состояний и
заболеваний, которым сопутствуют
как дегенеративные, так и пролифе-
ративные изменения.
Повышенная активация апоптоза
(через патологическую элиминацию
Т-хелперов) является звеном патоге-
неза СПИД (ВИЧ-инфекции), ише-
мических повреждений разных орга-
нов, болезни Альцгеймера, паркинсо-
низма, апластической анемии, ише-
мической болезни сердца (ИБС).
Ингибирование клеточной гибели
(апоптоза) определяет опухолевые
поражения различной природы и ауто-
иммунные заболевания.
В физиологических условиях регу-
лирование клеточной гибели необхо-
димо для устранения аутореактивных
лимфоцитов в процессе развития и
удаления избытка клеток после завер-
шения иммунного ответа. Активация
апоптоза является способом элимина-
ции потенциально аутореактивных
клеток (тимоцитов), которые подвер-
гаются апоптозу (негативная селекция).
Неспособность к устранению ауторе-
активных клеток может приводить к
развитию аутоиммунных заболеваний.
На основании имеющихся данных
роль апоптоза в патогенезе аутоиммун-
ных заболеваний может быть представ-
лена следующим образом.
Активирование клеточной гибели
ответственно за изменение негативно-
го отбора самореактивных Т-лимфо-
цитов в тимусе. Одной из критических
молекул в регулировании клеточной
гибели лимфоцитов является поверх-
ностный клеточный рецептор Fas —
член семейства рецепторов ФНО.
Стимулирование Fas-рецептора у
активированного лимфоцита приводит
к индукции апоптоза. Нарушение Fas-
опосредованного Т-клеточного апо-
птоза в тимусе не только облегчает
персистирование (устойчивость) ауто-
реактивных клонов, но и блокирует
образование полного состава апоптоз-
ных аутоантигенов, к которым долж-
на развиться толерантность. При этом
действие вызывающего апоптоз фак-
тора приводит к тому, что даже низ-
кий уровень антигенов на фоне сен-
сибилизированной иммунной системы
вызывает манифестирование клини-
ческих проявлений аутоиммунного за-
болевания.
В настоящее время имеются данные
о роли апоптоза в развитии таких ауто-
иммунных заболеваний, как систем-
ная красная волчанка, ревматоидный
артрит, псориаз, аутоиммунный диа-
бет и при других заболеваниях.
Важнейшими дополнительными
условиями включения и поддержания
аутоиммунного процесса являются:
хронические вирусные инфекции;
проникновение возбудителей с пе-
рекрестно реагирующими антигена-
ми;
наследственные или приобретен-
ные молекулярные аномалии строения
важнейших структурных и регулятор-
ных молекул иммунной системы;
индивидуальные особенности кон-
ституции и обмена веществ, предрас-
полагающие к вялотекущему характе-
ру воспаления;
пожилой возраст.
Механизм повреждения тканей при
аутоиммунных заболеваниях. Условно
патогенез аутоиммунных расстройств
можно разделить на два этапа — ин-
дуктивный и эффекторный.
Индуктивный этап связан со
срывом иммунологической толерант-
ности.
Эффекторный этап пред-
ставляет реализацию аутоиммунного
процесса. Основу повреждения тканей
261
и клеток при большинстве аутоиммун-
ных болезней на этом этапе составля-
ют II, III, IV, V типы иммунных ре-
акций (по Желлу и К. Кумбсу).
Примером аутоиммунных болез-
ней, в основе которых лежит II или
V тип реакции, могут служить аутоим-
мунные гемолитические анемии, пер-
нициозная анемия, нейтропении, лим-
фопении, тромбоцитопении (II тип);
образование антирецепторных анти-
тел при миастении гравис, образова-
ние антирецепторных антител к ин-
сулину, при атаксии телеангиэктазии
(V тип).
В подавляющем большинстве ауто-
иммунные заболевания, развивающие-
ся по II и V типам иммунного по-
вреждения, являются органоспецифи-
ческими.
Ряд аутоиммунных болезней сопро-
вождается повреждением тканей в ре-
зультате развития III типа иммунного
повреждения.
В качестве примеров можно назвать
СКВ, тиреоидит Хашимото, ревма-
тоидный артрит, склеродерму, дер-
матомиозит, при которых образова-
ние иммунных комплексов (ДНК-
анти ДНК) приводит к различным
повреждениям: васкулитам, гломеру-
лонефриту, артритам, вызывающим
поражение многих органов и систем
(при СКВ):
Это так называемые системные
аутоиммунные заболевания.
Патогенетические классы аутоим-
мунных болезней. Патогенетически
можно выделить пять классов аутоим-
мунных болезней.
Класс А. Первичные аутоиммунные
болезни с наследственной предраспо-
ложенностью:
органоспецифические (аутоиммун-
ный тиреоидит);
промежуточные (аутоиммунная па-
тология печени и желудочно-кишеч-
ного тракта);
органонеспецифические (коллаге-
нозы).
Класс В. Вторичные аутоиммунные
болезни (алкогольный цирроз пече-
ни, хроническая лучевая болезнь),
возникающие при длительном воз-
действии внешних неблагоприятных
факторов, что приводит к модифи-
кации аутоантигенов и последующе-
му включению аутоиммунного отве-
та на них.
Kwcc С. Аутоиммунные болезни на
основе генетических дефектов комп-
лемента (некоторые формы наслед-
ственных гемолитических анемий).
Класс D. Аутоиммунные болезни,
связанные с медленными вирусными
инфекциями (болезнь Альцгеймера).
Класс Е. Комбинированные формы
аутоиммунных болезней.
Принципы терапии аутоиммунных
заболеваний. Следует отметить, что
лечение аутоиммунных заболеваний
является крайне сложным и далеко не
всегда эффективным. Несмотря на это
его необходимо начинать своевремен-
но и проводить обоснованно. При этом
крайне важно учитывать многие мо-
менты:
причину (причинные факторы, не-
благоприятные внешние и особенно
внутренние условия);
преимущественную локализацию
аутоагрессивных повреждений как тка-
ней организма, так и звеньев иммун-
ной системы;
вид аутоантигенов;
тип, характер, тяжесть и особен-
ности клинического течения аутоим-
мунного заболевания;
конкретные механизмы его разви-
тия, в частности, наличие или отсут-
ствие первичного нарушения иммун-
ной системы, как зависимое, так и не-
зависимое от образования собственных
аутоантигенов.
Этиотропное лечение направлено
на устранение или ограничение дей-
262
ствия на организм причинных фак-
торов и неблагоприятных внешних,
и внутренних условий. В частности, из
организма можно удалить иммуноген
и адьювант (особенно если он пред-
ставлен микроорганизмами). Это до-
стигается уничтожением патогенных
для организма микробов, т.е. санаци-
ей очагов микробного размножения,
путем использования различных бак-
терицидных и бактериостатических
средств (антибиотиков, сульфанил-
амидов и др.).
Патогенетическое лечение включа-
ет в основном заместительную и ин-
гибирующую терапию, а также стиму-
лирующую и корригирующую тера-
пию.
Заместительная терапия успешно
может быть осуществлена путем назна-
чения недостающих биологически ак-
тивных веществ (гормонов, витами-
нов, микроэлементов и др.). Напри-
мер, для лечения аутоиммунного зоба
вводят препараты тироксина, а ауто-
иммунной пернициозной анемии —
витамин В12 и т.д.
Ингибирующая терапия предназна-
чена для успешного подавления про-
цесса образования аутоиммунных ан-
тител или сенсибилизированных
\ Т-лимфоцитов, проявляющих агрес-
сивное действие против собственных
нормальных клеточно-тканевых струк-
| тур организма.
Ингибирующая терапия включает
использование различных иммуноде-
( прессантов, блокаторов медиаторов и
! рецепторов иммунологических реак-
ций, а также различных противовос-
[ палительных средств и т.д.
| Симптоматическое лечение направ-
е лено на устранение или ослабление
*. неприятных субъективных ощущений,
, возникающих вследствие нарушений
I различных метаболических и физио-
I логических процессов в разных тканях,
i органах и системах организма.
8.6. Болезни, связанные
с нарушением
пролиферации
иммунокомпетентных
клеток
(иммунопролиферативные
заболевания)
И ммунопрол иферати вные заболе -
вания — это пролиферативные про-
цессы, которые происходят в клетках
иммунной системы. Выделяют две
группы болезней.
1. Болезни, обусловленные нару-
шением пролиферации лимфоидной
ткани:
лимфогранулематоз;
неходжкинские лимфомы;
инфекционный мононуклеоз;
саркоидоз.
2. Болезни, обусловленные проли-
ферацией плазматических клеток.
Болезни, обусловленные нарушени-
ем пролиферации лимфоидной ткани.
Лимфогранулематоз (болезнь Ходж-
кина) характеризуется нарушением
Т-клеточного звена иммунной систе-
мы, в основе которого лежит сниже-
ние пролиферативной активности
лимфоидных клеток. Этиология связа-
на с инфекциями (вирусным пораже-
нием Т-лимфоцитов), опухолями. Па-
тогенез не установлен.
Неходжкинские лимфомы — это ло-
кальные процессы, которые не сопро-
вождаются выходом пролиферирую-
щих клеток в периферическую кровь.
Общепринятая классификация учи-
тывает клеточный состав лимфомы и
степень дифференцировки клеток.
В соответствии с этими признаками
выделяют четыре группы.
1. В-клеточные лимфомы
(плазмоцитоидная лимфома, иммуно-
цитома, фолликулярная лимфома,
иммунобластная лимфома, лимфома
Беркитта — злокачественная лимфо-
263
ма: лимфопролиферативное заболева-
ние, обусловленное вирусом Эпштей-
на-Барра (EBV). В основе лежит
транслокация частички 8-й хромосо-
мы в полосе q24, где локализуется он-
коген С-тус, на 14-ю хромосому. При
транслокациях детерминируется фено-
тип клеток лимфомы Беркитта (C8q,
C14q+). Если в норме этот онкоген
обеспечивает контроль за клеточным
ростом и пролиферацией, то при его
новой локализации механизм регуля-
ции нарушается.
2. Т-клеточные лимфомы
(полиморфная Т-клеточная лимфома,
инфекционный мононуклеоз — доб-
рокачественное лимфопролифератив-
ное заболевание, обусловленное ви-
русом Эпштейна —Барра (EBV)). За-
болевание характеризуется выражен-
ной клеточной пролиферацией в лим-
фатических узлах и в паренхиматоз-
ных органах (печени, сердце, почках,
легких). В основе лежит усиленная
пролиферация им муноре гуляторных
Т-клеток.
3. Гистиоц и тарные лимфо-
м ы. К этой группе относится ретику-
лосаркома.
4. Неклассифицированные
л и м ф о м ы включают такие заболе-
вания, как лимфоэпителиальная
лимфома, болезнь а-пепей, гистио-
цитоз X, ангиофолликулярная лим-
фома. Большинство лимфом вызыва-
ются онкогенными (РНК-содержащи-
ми) вирусами. Наряду с этим отме-
чена роль радиации, РТПХ, иммуно-
супрессантов. Общий патогенез осно-
ван на теории онкогенов. Вирус,
попадая в организм, вызывает транс-
локацию генов, которым принадле-
жит значительная роль в контроле за
клеточным ростом и нормальной про-
лиферацией. Транслокация этих генов
в другие области хромосом наруша-
ют механизм регуляции клеточного
роста и пролиферации, что приводит
к развитию злокачественной проли-
ферации.
Саркоидоз (болезнь Бека) — эпи-
телиоидные гранулемы, локализую-
щиеся преимущественно в перифери-
ческих органах иммунной системы —
селезенке и лимфатических узлах,
а также в легких, средостении, гла-
зах, в коже.
Этиология заболевания неясна. Па-
тогенез связан с иммунным дефектом
обусловленным пролиферацией и ак-
тивацией эффекторных клеток, в ос-
новном Т-клеток (преимущественно
Т-хелперов) и макрофагов.
Болезни, обусловленные нарушени-
ем пролиферации плазматических кле-
ток. Доброкачественные моноклональ-
ные гаммапатии возникают в резуль-
тате хронических инфекций (туберку-
леза, сифилиса, малярии), опухолевых
процессов (лимфосаркомы, лимфо-
гранулематоза) .
Плазмоцитома (множественная
миелома — миеломная болезнь) —
синтез части молекулы иммуноглобу-
лина IgG-, IgM-, IgA-, IgD-, IgE, a-,
y-, р-цепей. Этиология неясна.
Макроглобулинемия (поликлональ-
ная, моноклональная) связана с про-
дукцией IgM-парапротеина. Этиология
неясна.
Поликлональная гипергаммаглобули-
немия (болезнь Вальденстрема) —
усиленный синтез поликлональных
иммуноглобулинов (преимуществен-
но IgG) при отсутствии эффекта су-
прессии.
Этиология связана с СКВ, хрони-
ческими болезнями печени.
Общим для всех форм является
продукция единственного типа глобу-
лина с абсолютно идентичной первич-
ной, вторичной и третичной структу-
рой белка — М-протеина (монокло-
нального белка — белка Бенс-Джонса:
низкомолекулярного белка или пара-
протеина).
264
' голи-
— эпи-
—* зую-
гг-сери-
ге--гы —
злах,
“1» гла-
>2 Па-
;се:<том
я ак-
в ос-
-венно
»*ни-
п кле-
X-аль-
х:уль-
герку-
<’Л?ВЫХ
М фо-
se-ная
#—.эбу-
«£ а-,
ЙНДЛЬ-
- :ро-
*-’СГИЯ
т'ули-
к —
Г-НЫХ
хгзен-
S~i су-
тт :ти-
счется
~ :«бу-
ЕТВИЧ-
г кту-
«ло-
ьзнса:
~вра-
8.7. Роль иммунных
механизмов в развитии
стоматологических
заболеваний
Развитие кариеса. Развитие имму-
нологии и микробиологии привело к
уточнению ряда положений в концеп-
ции происхождения и развития карие-
са зуба.
Кариес (эмали, дентина, корня)
может возникнуть только при участии
микроорганизмов. Доказательством
этого являются следующие факты:
у стерильных животных не возникает
кариес; бактерии полости рта способ-
ны участвовать в деминерализации
эмали зуба; в эмали и дентине при
кариозном поражении обнаружены
бактерии.
Наиболее часто встречающимися
микроорганизмами при поражениях
зуба являются грамположительные
факультативные кокки, особенно
Str. mutans, S. salivarius, а также лакто-
бациллы, присутствие которых харак-
терно для кариеса фиссур. Возбудитель
Str. mutans является инициальным мик-
рорганизмом при этом поражении, он
эффективно ферментирует сахар в мо-
лочную кислоту, которая способству-
ет растворению эмали, а также явля-
ется основным продуцентом нераство-
римых внеклеточных декстранов,
которые облегчают разрушение бакте-
риями поверхности зуба. Кроме того,
этот микроорганизм проявляет высо-
кую избирательность к пелликуле обо-
лочке, окружающей эмаль.
Основные минералы эмали отно-
сятся к гидроксиапатитам. При pH 6.8
растворимость гидроксиапатита очень
мала, если pH снижается, то раство-
римость эмали возрастает. Под крити-
ческим понимают такое значение pH,
при котором гидроксиапатиты деста-
билизируются в результате реакции
кислоты с гидроксильными группа-
ми в центре кристалла, вследствие
чего образуется вода. В кристаллах на-
чинают превалировать диссоцииро-
ванные формы фосфата кальция и
они растворяются. Как и все реакции
с кислотами, растворение гидрокси-
апатитов является равновесным про-
цессом и, если местная концентра-
ция кальция увеличивается и/или ве-
личина pH возрастает, то происходит
восстановление кристаллов гидрокси-
апатита.
При прогрессировании кариозно-
го процесса поражение быстро распро-
страняется вдоль дентино-эмалевой
границы и на дентин, что обусловле-
но рядом факторов. Во-первых, ден-
тин менее минерализован, чем эмаль
и, таким образом, кислоты способны
уничтожать большее количество мат-
рицы дентина, чем эмали. Во-вторых,
строение дентина способствует более
легкому проникновению бактерий в
глубокие слои этой ткани.
В динамике формирования бактери-
альной бляшки на поверхности зуба
происходят характерные изменения
соотношения микроорганизмов. На
ранних стадиях превалируют аэробные
микроорганизмы, особенно грамполо-
жительные кокки, вследствие того,
что некоторые компоненты стенки
этих микроорганизмов имеют молеку-
лярное сродство к компонентам слю-
ны. На этой стадии среда, окружаю-
щая микроорганизмы, богата кисло-
родом. Примерно к седьмому дню
формирования бляшки относительное
содержание кокков падает и устанав-
ливается примерно равное соотноше-
ние между кокками, нитевидными и
палочковидными бактериями. Быстрый
рост стрептококков в свою очередь
приводит к снижению pH среды, со-
держания питательных веществ и окис-
лительно-восстановительного потен-
циала в глубоких слоях органической
265
матрицы бляшки, что способствует
росту других микроорганизмов.
Развитие бактериальной бляшки
по Ньюбрам (Newbrum) проходит
три фазы: 1) начальная колонизация;
2) быстрый рост бактерий; 3) ремо-
делирование. Продукция кислот в
бляшке является ведущим процессом,
приводящим к адгезии и колонизации
бактерий на поверхности зуба.
В результате первичного контакта
бактерий и пелликулы возникают ко-
лонии и тогда основная роль в разви-
тии кариеса принадлежит последую-
щим процессам. В ходе этих процес-
сов происходит продукция экстрацел-
люлярных бактериальных веществ,
которые служат для защиты бактерий
и снабжения их питательными веще-
ствами.
Формирование эмалевой пеллику-
лы происходит в течение нескольких
минут после взаимодействия со слю-
ной. Затем в течение нескольких часов
протекает первая фаза образования
бляшки, начинающаяся бактериаль-
ным прикреплением. Стрептококки,
которые в основном формируют ко-
лонии, удваиваются каждые 2 ч. Спу-
стя 12 — 24 ч после начального при-
крепления развивается вторая фаза:
бактериальные колонии образуют тон-
кий налет на поверхности эмали. В те-
чение этого времени бактерии проду-
цируют большое количество экстра-
целлюлярных глюконов, которые при-
крепляются к матрице налета. При
благоприятных для бактериального
роста условиях этот налет покрывает
все поверхности зуба. Рост бактерий в
некоторых зонах несколько ограничен
вследствие жевания.
Употребление волокнистой пищи
может оказывать влияние на распре-
деление налета в пришеечной и дру-
гих зонах, которые чаще всего пора-
жаются кариесом. Если через 2 — 3 дня
налет не разрушается, то его внутрен-
няя среда становится более анаэроб-
ной и поэтому в налете появляются
другие бактериальные формы. Количе-
ство налета значительно увеличивает-
ся, и он выглядит как желеобразная
масса на эмали. Если налет сохраняет-
ся на поверхности зуба, в нем могут
откладываться фосфорно-кальциевые
соединения, приводящие к преобра-
зованию налета в камень.
Резистентность организма и кариес.
Одним из важнейших факторов, не-
обходимых для возникновения кари-
озного процесса, является нарушение
механизмов зашиты. Это подтвержда-
ет тот факт, что кариес развивается в
течение 1 — 2 лет, так как существу-
ют механизмы, ингибирующие раз-
витие кариозного процесса и завися-
щие от некоторых факторов, усили-
вающих или тормозящих развитие
заболевания.
Одним из неблагоприятных факто-
ров, способствующих развитию карие-
са, является форма зуба и зубного
ряда, что приводит к бактериально-
му росту в результате ретенции бак-
терий. Кроме того, моляры часто име-
ют глубокие ямки и фиссуры, спо-
собствующие развитию бляшки. Ос-
новным фактором защиты человека
от кариеса является слюна, которая
содержит большое количество ве-
ществ, обеспечивающих защиту от
кариозного процесса. Теоретически
эти защитные вещества можно раз-
делить на две группы: активные и
пассивные. Активные, сходные с ан-
тибиотиками вещества, оказывают
бактериостатический эффект, пассив-
ные — предотвращают или прекраща-
ют развитие бляшки путем измене-
ния микробной среды.
В настоящее время наиболее эф-
фективным методом профилактики
является фторирование воды. Вместе
с тем, широко рассматривается так-
же вопрос и о создании противока-
266
ие-
эго
-'о-
ме-
70-
Эс-
от
<11
3-
и
ная
кие
-да-
:я в
тзу-
:аз-
III-
роб-
ются
дче-
•I эгут
•лзые
ячэгтбра-
«аэнес.
не-
риозной вакцины. Есть основания счи-
тать, что такая вакцина может быть
создана. К этому имеются определен-
ные теоретические предпосылки.
Как упоминалось ранее, слюна со-
держит от 1 до 3 % иммуноглобули-
нов, среди которых основным явля-
ется S-IgA. Кроме этого, слюна содер-
жит IgG. Имеются и клеточные ком-
поненты зашиты: нейтрофилы, мак-
рофаги, лимфоциты.
Роль иммуноглобулиновой зашиты
организма при кариозном процессе
состоит в том, что рост кариесоген-
ных бактерий находится под их конт-
ролем и они играют важную роль в
поддержании физиологического состо-
яния полости рта.
Развитие хронического верхушечно-
го периодонтита. Хронический перио-
донтит (ХП) является осложнением
пульпита и его лечения, развивается
в результате внедрения в периапикаль-
ную область микрофлоры, токсинов,
продуктов распада тканей, лекарствен-
ных препаратов и т.д. В периапикаль-
ную область инфекция, в основном
смешанная, попадает через дентинные
канальцы, периодонтальную связку и
гематогенным путем.
Роль иммунных механизмов в фор-
мировании хронического воспаления
заключается в следующем. Уже при
пульпите в периапикальной зоне ак-
тивируются реакции ГЗТ, которые
рекруитируют макрофаги, в результа-
те возникают реактивные процессы,
заключающиеся в развитии гипере-
мии, усилении лимфокоагуляции и
миграции макро- и микрофагов в пе-
риапикальную область. Эти изменения
носят обратимый характер и должны
рассматриваться как компенсаторные,
направленные на усиление противо-
микробной защиты. В дальнейшем,
если происходит некроз пульпы, и в
том числе ее корневой части, боль-
шое количество микробов, токсинов
и продуктов распада тканей поступа-
ет в периапикальную область, что
вызывает острую воспалительную ре-
акцию. Эта реакция имеет некоторые
отличия от воспаления в других тка-
нях ввиду особенностей анатомиче-
ского строения периодонта: наличие
плотной кортикальной пластинки за-
трудняет удаление токсинов, отечной
жидкости и способствует их накопле-
нию. В результате развивается типич-
ная острая воспалительная реакция,
сопровождающаяся болями и отеком
окружающих тканей.
Эндотоксин, продуцируемый грам-
отрицательными бактериями, оказы-
вает сильное антигенное воздействие
на иммунную систему в области пе-
риодонта, токсически действует на
фибробласты. Микроорганизмы акти-
вируют систему комплемента, что
приводит к образованию медиаторов
воспаления.
Переход острого воспаления в хро-
ническое в периодонте; характеризу-
ется образованием в периапикальной
области гранулем, как результат им-
мунологической реакции типа ГЗТ в
ответ на непрерывное раздражение
антигенами, в основном эндотокси-
нами грамотрицательных микроорга-
низмов, поступающими из корневой
системы зуба.
Реакции ГЗТ продолжаются до тех
пор, пока не будут удалены антиге-
ны, например, при тщательной са-
нации и обработке каналов корня
зуба, что является основным услови-
ем прекращения патологического про-
цесса.
При иммунодефицитных состояни-
ях (ИДС) формирование защитных
барьеров нарушается, что проявляет-
ся более ранним образованием очагов
деструкции в периапикальной облас-
ти зубов с нечеткими границами. Раз-
витие хронического деструктивного
процесса при ИДС характеризуется
267
активным течением и диффузным
распространением в кости челюсти.
Такое течение периодонтита может
сопровождать ИДС, вызванное облу-
чением, применением иммуносупрес-
сорных препаратов, травмами, вирус-
ными инфекциями и другими причи-
нами.
Лечение верхушечного периодонти-
та на фоне ИДС только путем плом-
бирования корневых каналов часто
малоэффективно, так как очаги дест-
рукции в периапикальной области
достигают больших размеров за счет
недостаточного образования противо-
воспалительных барьеров и снижения
регенерации кости челюсти.
8.8. Принципы и методы
иммунокоррекции
Принципы воздействия на иммунную
систему. Принципы воздействия на им-
мунную систему, определяемые как
иммунотерапия и иммунокоррекция,
включают иммунозаместительное воз-
действие, иммуностимуляцию, имму-
носупрессию и выведение ингибиру-
ющих иммунологическую реактив-
ность факторов.
К числу иммунотерапевтических
воздействий относится также выведе-
ние иммунных комплексов и ингиби-
рующих факторов, которые связыва-
ют антитела, введенные с заместитель-
ной целью или блокируют эффект
иммунокорригирующих препаратов.
Для этого проводят гемодиализ, гемо-
сорбцию, иммуносорбцию, плазма- и
лимфаферез.
Иммунокоррекция — это активное
вмешательство в работу иммунной
системы, исправление ее дефектного
функционирования путем стимуляции
или супрессии всей системы или ее
отдельных клеточных субпопуляций
(Т-хелперов, Т-супрессоров, Т-килле-
ров), стимуляция или блокада гене-
раций конкретной специфичности.
Иммунокоррекцию проводят фар-
макологическими, физико-химиче-
скими методами и с помощью ген-
ной инженерии (фенотипическая кор-
рекция.
Фармакологические препараты,
корригирующие работу иммунной си-
стемы, подразделяются на иммуно-
стимуляторы, иммунодепрессанты и
иммуномодуляторы. Иммуностимуля-
торы в свою очередь подразделяют на
синтетические, применяемые при ле-
чении различных заболеваний (дека-
рис — противоглистный препарат, ди-
уцефон — при лечении лепры, поли-
оксидоний, неовил, ликопид, имму-
нофан и т.д.), и естественные (такти-
вин, лейкинферон, сывороточные и
плацентарные иммуноглобулины, вак-
цины и эндотоксины).
Иммунодепрессивные препараты
подразделяют на четыре класса: сте-
роиды; анти метаболиты пуринового,
пиримидинового и белкового синтеза
(имуран, 5-фторурацил и т.д.), алки-
лирующие агенты (циклофосфамид,
милеран и др.); антибиотики типа ак-
тиномицинов С и Д, хлорамфенико-
ла, циклоспорина и т.д.; антилимфо-
цитарная сыворотка (АЛС). Новые
принципы иммуносупрессии заключа-
ются в воздействии на взаимосвязан-
ные процессы в иммунной системе,
включая клеточную миграцию. Этот
нарушающий взаимосвязи эффект им-
мунодепрессантов связан с торможе-
нием миграции стволовых клеток из
костного мозга.
Принципиально новым направле-
нием в иммунокоррекции явилось от-
крытие и применение гормонов и ме-
диаторов, вырабатываемых самой им-
мунной системой для регуляции и
созревания функции иммунокомпе-
тентных клеток. К ним относятся ти-
мические факторы (тактивин, тима-
268
лин, тимоптин, тимоген и т.д.), кост-
номозговые факторы (миелопид, сти-
мулятор антителопродуцентов САП —
и т.д.), интерлейкины (лимфокины и
монокины).
Интерлейкины представляют собой
коммуникационные молекулы, за счет
которых происходит «общение» кле-
ток иммунной системы. Они включа-
ют в себя монокины и лимфокины и
различаются по источнику клеток-
продуцентов: лимфокины продуциру-
ются лимфоцитами, а монокины клет-
ками моноцитарно-макрофагальной
системы.
Клетки моноцитарно-макрофагаль-
ного ряда секретируют ИЛ-I, стиму-
лирующий клеточные и гуморальные
иммунные реакции.
ИЛ-1 активирует Т-хелперные лим-
фоциты, в результате чего они при-
обретают способность синтезировать
ИЛ-2, необходимый для прогрессии
клеточного цикла Т-лимфоцитов.
Кроме Т-клеток, ИЛ-1 способству-
ет пролиферации и дифференциров-
ке В-лимфоцитов, усиливает продук-
цию антител, влияет на пролифера-
цию эпителиальных клеток тимуса,
индуцируя секрецию тимических гор-
монов. Известны стимулирующие эф-
фекты ИЛ-1 на функцию макрофагов.
ИЛ-1 вызывает нейтрофилию со сдви-
гом влево, что объясняется его спо-
собностью стимулировать выход юных
форм нейтрофилов в циркуляцию из
костного мозга. ИЛ-I обладает нейро-
эндокринным действием, оно направ-
лено на регуляцию функции гипота-
ламуса и гипофиза. ИЛ-1 воздействует
на центр терморегуляции, вызывает
гипертермическую реакцию, аналге-
зию, увеличивает продолжительность
сна, регулирует уровень АКТГ, кор-
тикостерона, эндорфинов, метабо-
лизм норадреналина в ЦИС, индуци-
рует продукцию печеночного остро-
фазного гликопротеина.
К монокинам относится и ИЛ-6,
вырабатываемый преимущественно
моноцитами и макрофагами. ИЛ-6 ак-
тивирует В-клетки, действуя на конеч-
ную стадию их превращения в плаз-
матические иммуноглобулинпродуци-
рующие клетки.
К лимфокинам относятся ИЛ-2,
ИЛ-3, ИЛ-4, ИЛ-5.
ИЛ-2 продуцируется главным об-
разом Т-хелперными лимфоцитами.
Этот лимфокин способствует гене-
рации и накоплению эффекторных
Т-клеток (с цитотоксическими, хел-
перными и супрессорными функци-
ями), пролиферации и дифференци-
ровке В-лимфоцитов, участию во
взаимодействиях «моноцит — Т-лим-
фоцит».
ИЛ-3 продуцируется Т-лимфоцита-
ми и является гемопоэтическим фак-
тором роста, стимулирует пролифера-
цию и функцию клеточных элементов
всех ростков кроветворения. ИЛ-4 про-
дуцируется Т-клетками, стимулирует
продукцию IgG и IgE В-клетками,
оказывает эффекты практически на все
клетки гемопоэтического происхожде-
ния (макрофаги, гранулоциты, мега-
кариоциты и др.). ИЛ-5 продуцирует-
ся Т-клетками и для него характерна
индукция синтеза IgE и IgA. Он игра-
ет главную роль в возникновении эози-
нофилии, является фактором диффе-
ренцировки эозинофилов. ИЛ-7 уси-
ливает пролиферацию В-клеток,
индуцирует цитотоксичность Т-клеток.
ИЛ-8, или хемокин, стимулирует миг-
рацию нейтрофилов через монослои
эндотелия, что свидетельствует о ве-
дущей роли этого интерлейкина в на-
коплении нейтрофилов в очагах вос-
паления.
Важная роль в регуляции иммун-
ных функций принадлежит интерфе-
ронам (ИФ). ИФ-у продуцируется пре-
имущественно Т-хелперными лимфо-
цитами (допускается, что ИФ-у могут
269
секретировать естественные киллер-
ные клетки — ЕКК).
ИФ-у обладает антивирусной ак-
тивностью, подавляет пролиферацию
стволовых клеток — предшественни-
ков гранулоцитов, макрофагов, инду-
цирует цитотоксическую и секретор-
ную активность макрофагов. Макрофа-
ги приобретают способность секрети-
ровать ИЛ-1, простагландины и другие
биологически активные вещества.
Иммуномодулирующим действием
обладают и нейропептиды (эндорфи-
ны и энкефалины), синтезируемые
клетками нервной системы.
К лимфокинам костномозгового
происхождения относятся миелопеп-
тиды, обладающие широким спектром
биологического действия. Они стиму-
лируют продукцию антител на пике
иммунного ответа, регулируют реак-
ции Т-клеточного иммунитета, про-
являют аналтезирующее (опиатопо-
добное) действие. Введение миело-
пептидов снижает порог тактильной
чувствительности, порог переноси-
мой боли. В составе миелопептидов вы-
явлены вещества, идентичные а-, р-
и у-эндорфинам.
На основе миелопептидов разрабо-
тан новый иммунокорригирующий
препарат — миелопид, стимулиру-
ющий иммунитет и обладающий сла-
бообезболивающим действием. Миело-
пид особенно эффективен при лече-
нии пневмонии, сепсиса, ожогов и
других состояний, сопровождающих-
ся иммунодефицитом. Известно, что
хирургические вмешательства, травмы
сопровождаются вторичным иммуно-
дефицитом. что приводит к снижению
сопротивляемости организма к инфек-
циям. В связи с этим применение мие-
лопида для предупреждения и лече-
ния послеоперационных осложнений
тем более целесообразно, что миело-
пид восстанавливает иммунореактив-
ность и обладает аналгезирующим дей-
ствием.
К иммунокорригирующим воздей-
ствиям относится и генная инженерия.
Человек может быть низко- или вы-
соко реагирующим по отношению к
различным возбудителям заболевания.
При низкореагирующем генотипе воз-
будитель не может стимулировать
сильный иммунный ответ. Превраще-
ние генетически низкореагирующих в
иммунологическом отношении особей
в высокореагируюшие (фенотипиче-
ская коррекция) становится возмож-
но, если антигены различных инфек-
ционных агентов со слабым проявле-
нием иммунитета присоединить к мак-
ромолекулам искусственных электро-
литов. Такой комплекс может быть
положен в основу «вакцинирующих
молекул» для создания искусственных
вакцин будущего.
Контрольные вопросы
1. Что такое аллерген?
2. Как классифицируют аллергические
реакции?
3. Какие вы знаете стадии в развитии
аллергических реакций?
4. Какие антитела играют ведущую роль
в развитии гиперчувствительности 1-го
типа? Охарактеризуйте их свойства.
5. Назовите клинические варианты ана-
филактического шока у человека.
6. Какие антитела играют ведущую роль
в развитии гиперчувствительности 2-го
типа? Опишите их свойства.
7. При каких условиях образуются цир-
кулирующие иммунные комплексы (ЦИМ)
и какого типа гиперчувствительность при
этом развивается?
8. Назовите известные вам лимфокины.
9. Что такое псевдоаллергические ре-
акции?
ОГЛАВЛЕНИЕ
Предисловие ко 2-му изданию.......3
Введение..........................5
ЧАСТЬ I
ОБЩЕЕ УЧЕНИЕ О БОЛЕЗНИ
Глава 1. Этиология и патогенез
(А. И. Воложин)..................23
1.1. Нозология...................23
1.2. Общая этиология.............31
1.3. Этиологические
(болезнетворные) факторы
внешней среды................41
1.4. Общий патогенез.............48
Глава 2. Патофизиология клетки
(А. И. Воложин)..................56
2.1. Понятие о физиологической,
репаративной и патологической
регенерации клеток..............56
2.2. Механизмы приспособления
клеток к изменяющимся условиям
функционирования тканей.
Действие возросшей нагрузки
на клетку........................61
2.3. Пути поступления веществ
в клетку.........................63
2.4. Причины повреждения клеток
и характеристика патогенных
факторов........................68
2.5. Виды повреждения клетки.....79
2.6. Апоптоз.....................85
2.7. Нарушения биоритмов
клетки..........................87
2.8. Атрофия и дистрофия клеток..88
2.9. Нарушение нервной регуляции
функции клеток..................89
2.10. Ишемическое повреждение
клетки............................92
2.11. Реперфузионное повреждение
клеток............................93
Глава 3. Роль внешних и внутренних
факторов в патологии (Г. В. Порядин,
А. И. Воложин, Г. П. Щелкунова,
А. Г. Русанова)...................94
3.1. Роль термических факторов....94
3.2. Радиационное повреждение.... 103
3.3. Роль наркотических средств.. 111
3.4. Роль наследственности
в патологии..................... 121
3.5. Значение конституции
в патологии..................... 134
3.6. Значение возраста
в патологии..................... 137
ЧАСТЬ II
ТИПОВЫЕ ПАТОЛОГИЧЕСКИЕ
ПРОЦЕССЫ
Глава 4. Воспаление
(А. И. Воложин)................. 141
4.1. Определение понятия. Этиология
острого воспаления.............. 141
4.2. Патогенез острого
воспаления...................... 143
4.3. Патогенез экссудативно-
деструктивного гнойного
и хронического (мононуклеарного)
воспаления................. 165
4.4. Механизмы затяжного течения
острого воспаления............. 169
4.5. Сущность и биологическое
значение воспаления............ 175
4.6. Воспаление в челюстно-лицевой
области........................ 177
Глава 5. Лихорадка
(А. И. Воложин)................ 181
5.1. Механизмы регуляции темпера-
туры тела................... 181
5.2. Механизм развития
лихорадки .................. 188
271
Глава 6. Ответ острой фазы
(Ю. С. Свердлов) ................202
6.1. Механизм ответа острой фазы.202
6.2. Белки острой фазы...........203
6.3. Главные медиаторы ответа
острой фазы......................205
Глава 7. Патофизиология
инфекционного процесса
(Ю. С. Свердлов)..............211
7.1. Инфекционные агенты ......211
7.2. Источники инфекций и пути их
проникновения в организм.......212
7.3. Специфичность поражения
инфекционными агентами.........213
7.4. Возможные механизмы
повреждения тканей
инфекционными агентами ........214
7.5. Инфекции как результат
взаимодействия инфекционных
агентов с организмом
хозяина.....................216
7.6. Механизмы, защищающие от
инфекции.......................217
7.7. Бактериемия и септицемия...218
7.8. Общее течение инфекционных
болезней........................219
Глава 8. Патология иммунной
системы {Г. В. Порядин,
А. И. Воложин, Т. И. Сашкина) .221
8.1. Основные положения........221
8.2. Иммунодефицитные
состояния......................222
8.3. Аллергия..................230
8.4. Непереносимость материалов,
используемых
в стоматологии..............251
8.5. Аутоиммунные заболевания...259
8.6. Болезни, связанные
с нарушением пролиферации
иммунокомпетентных клеток
(иммунопролиферативные
заболевания)................263
8.7. Роль иммунных механизмов
в развитии стоматологических
заболеваний.................265
8.8. Принципы и методы иммуно-
коррекции .....................268