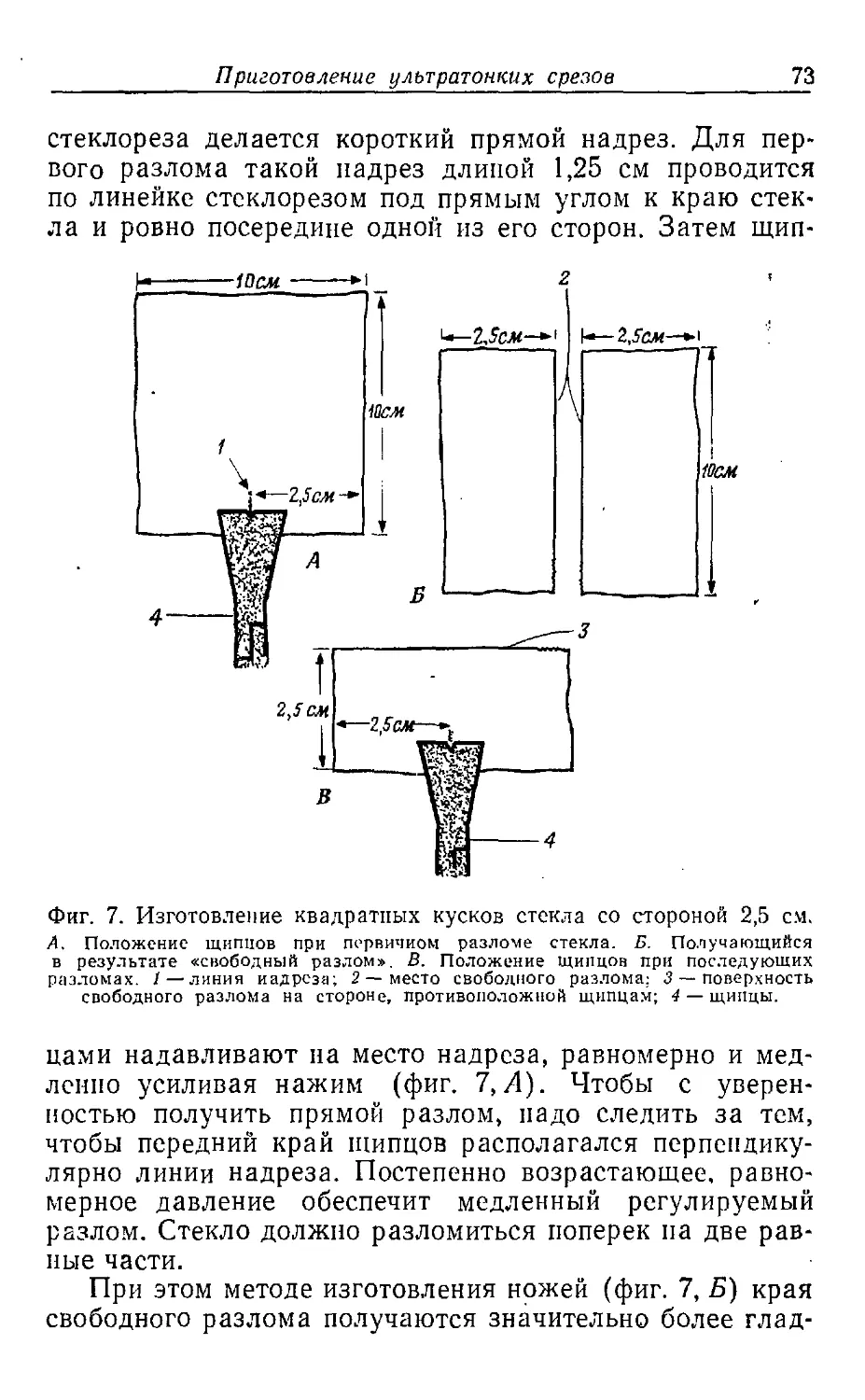
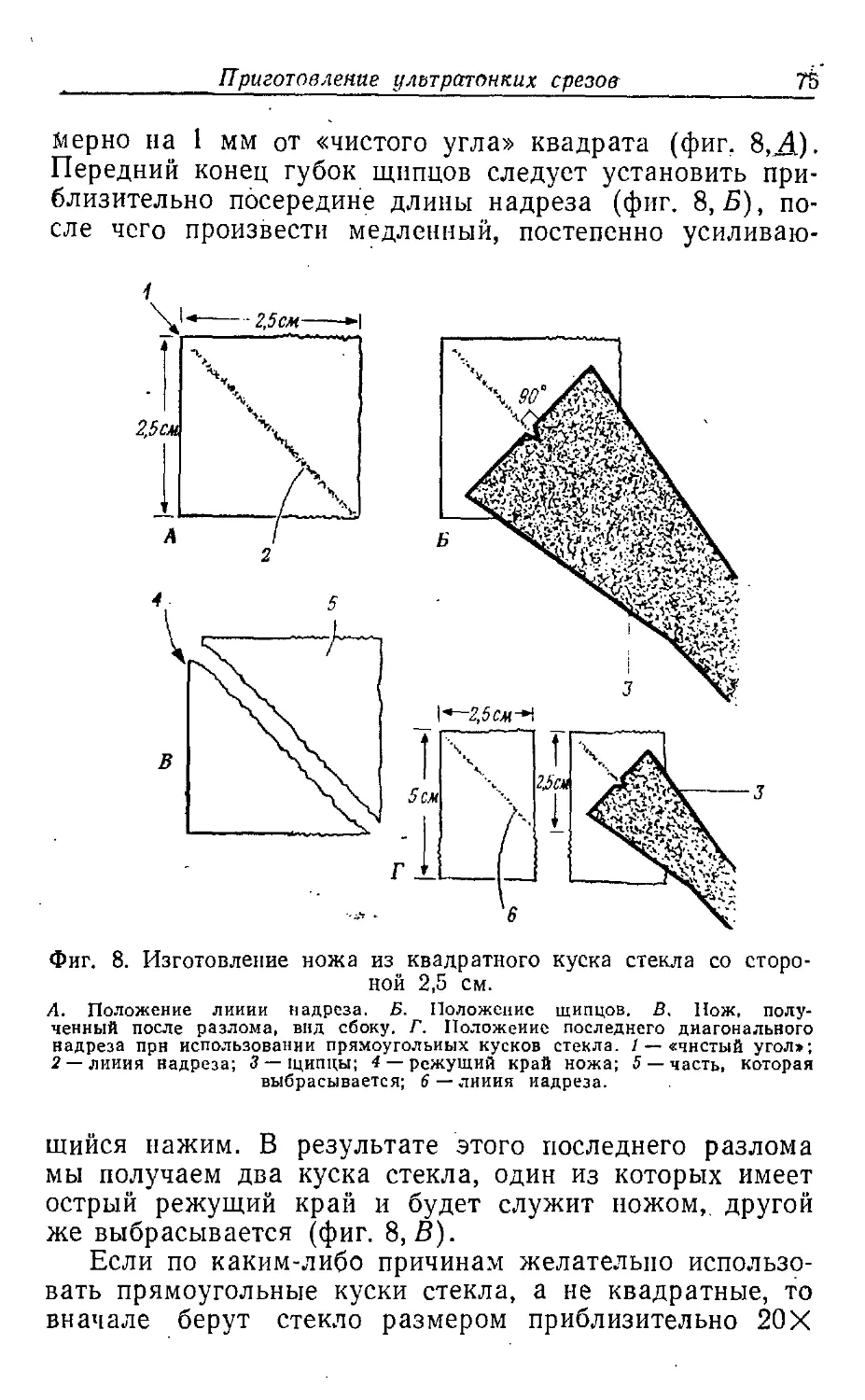
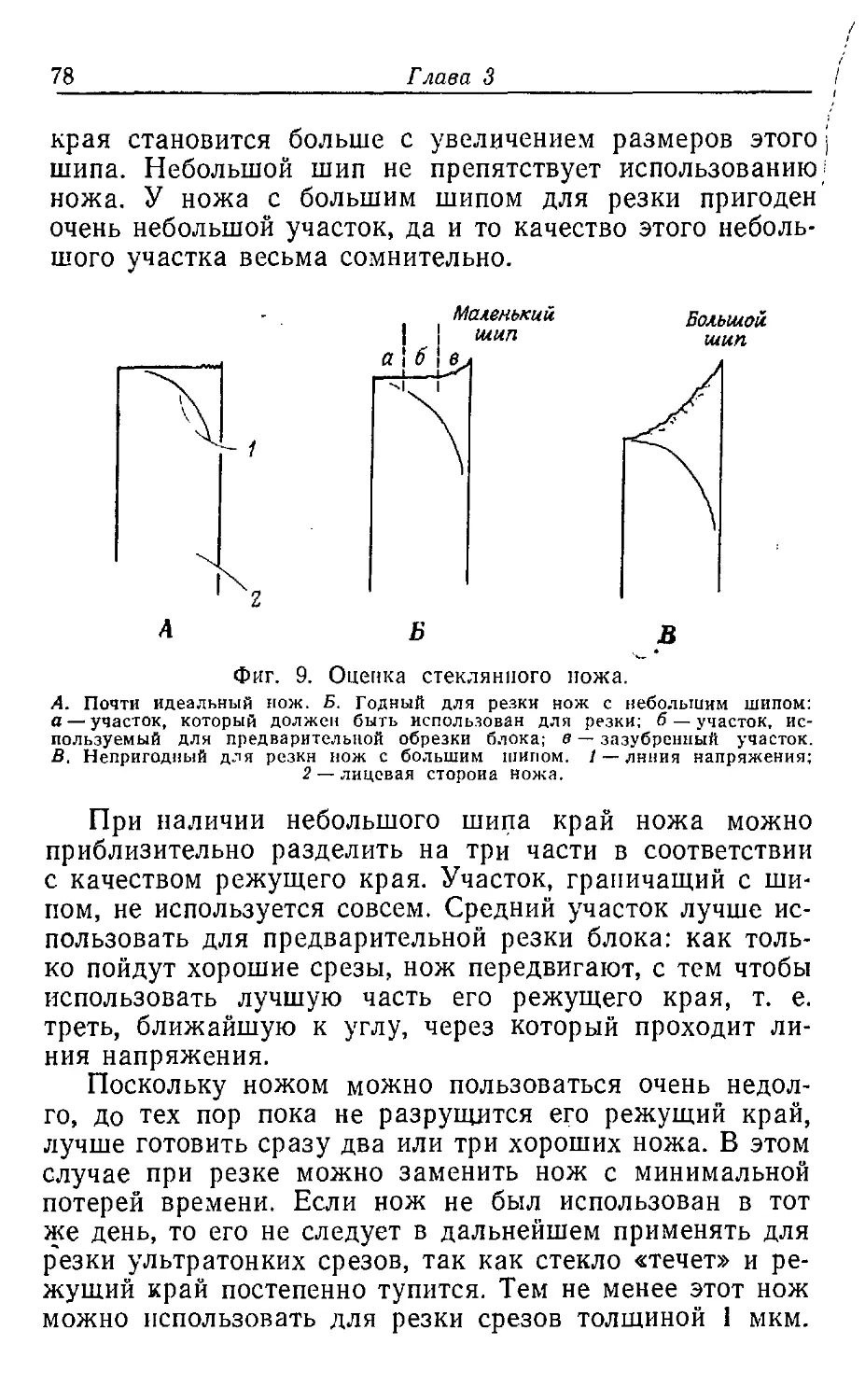
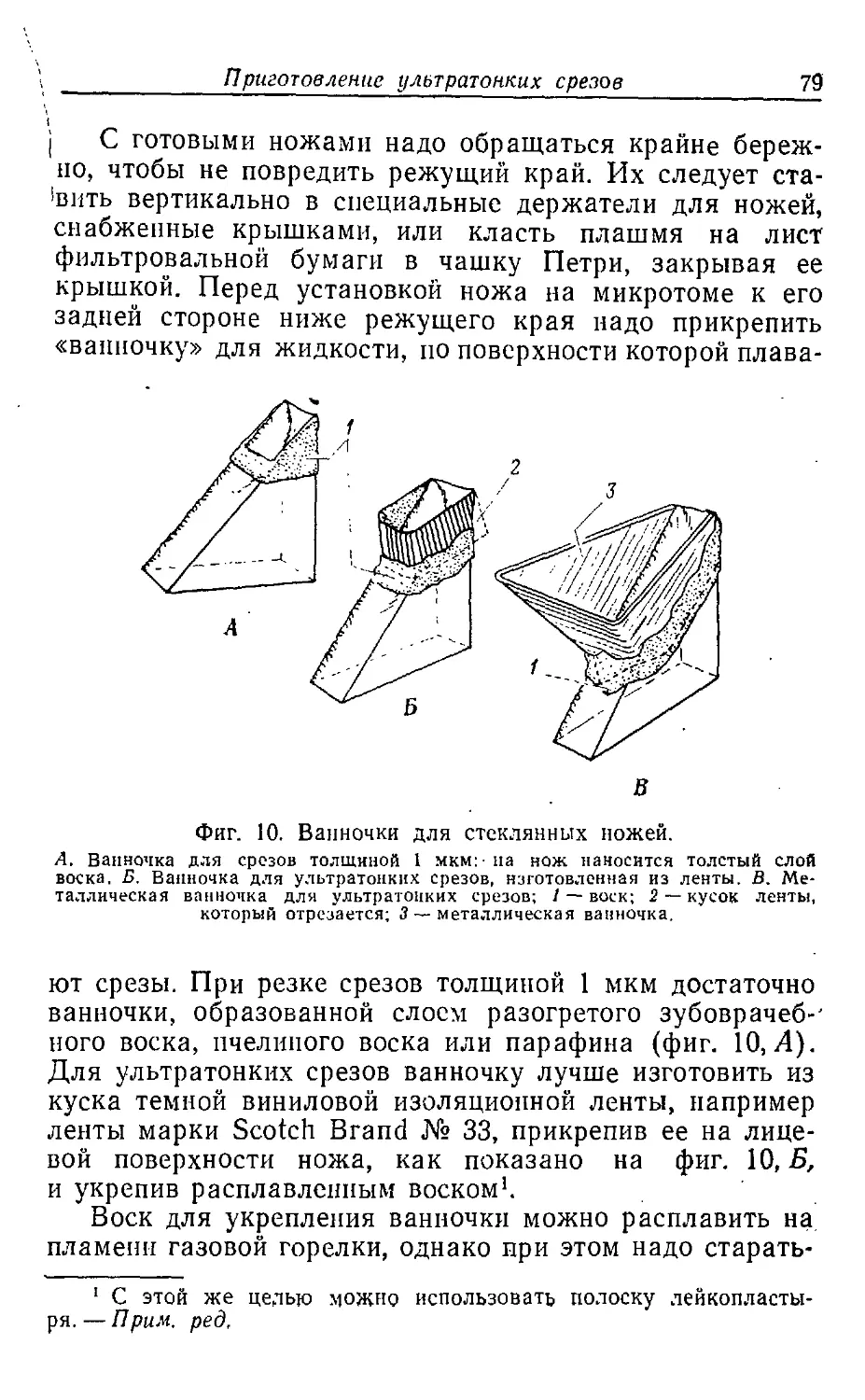
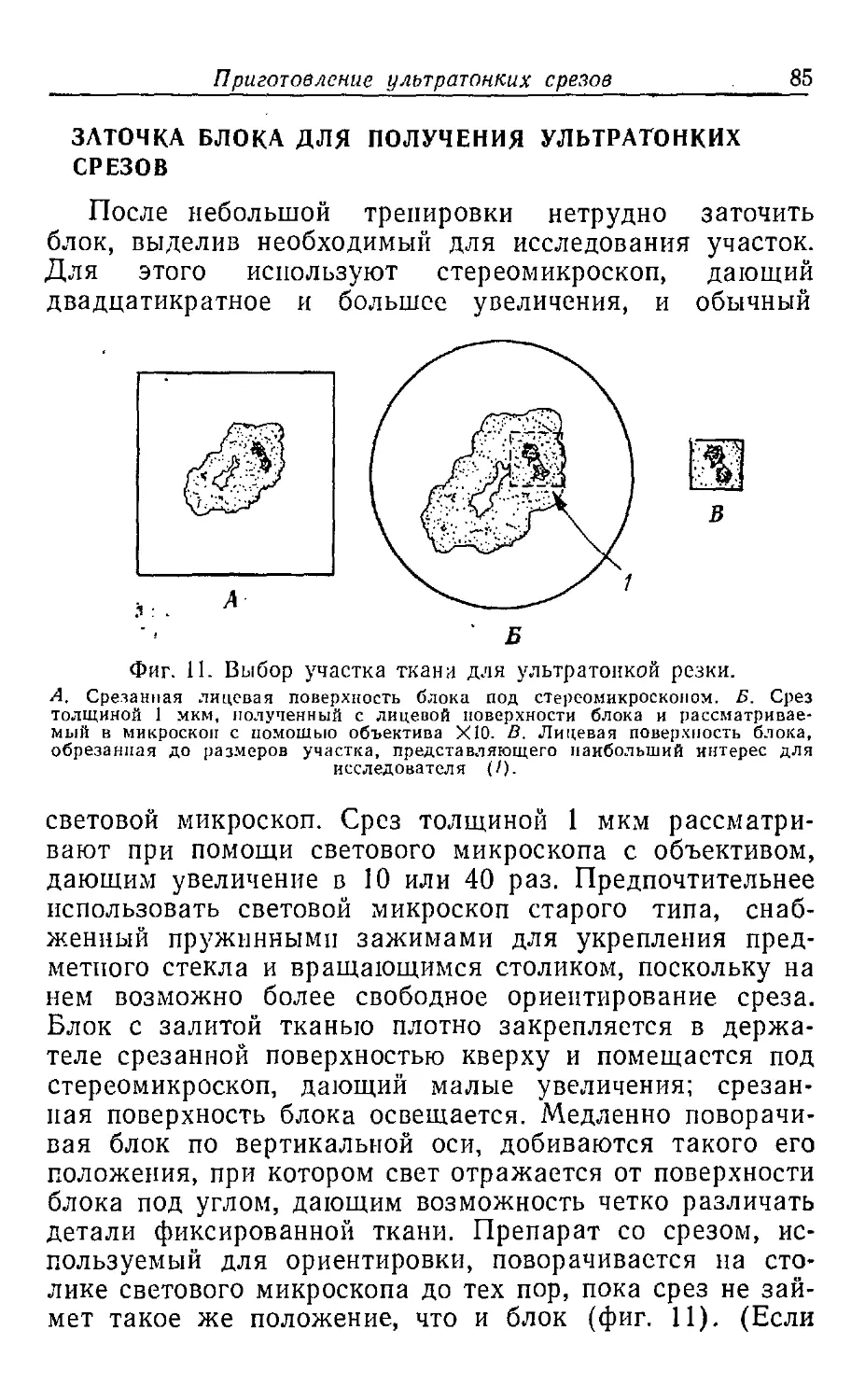
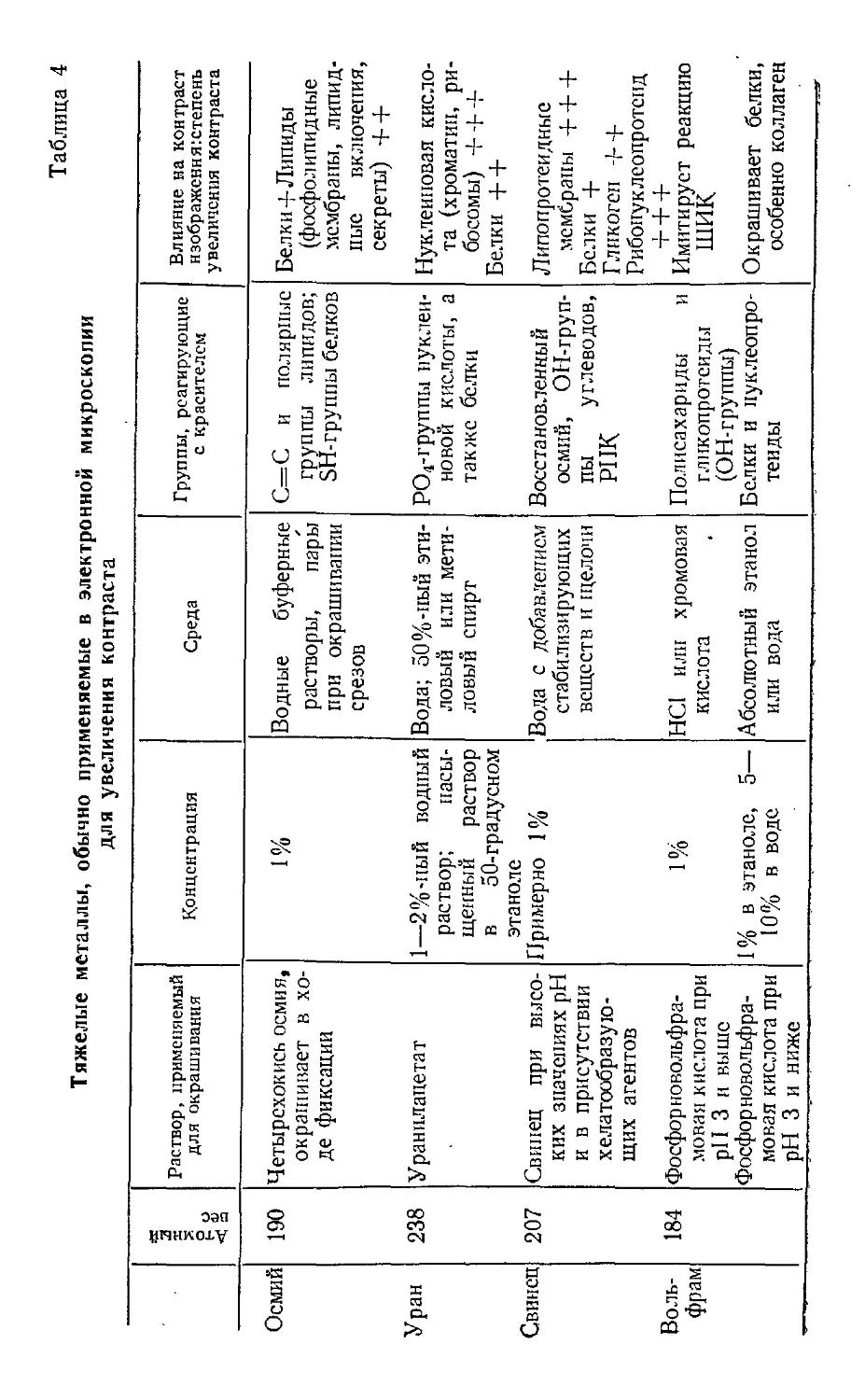
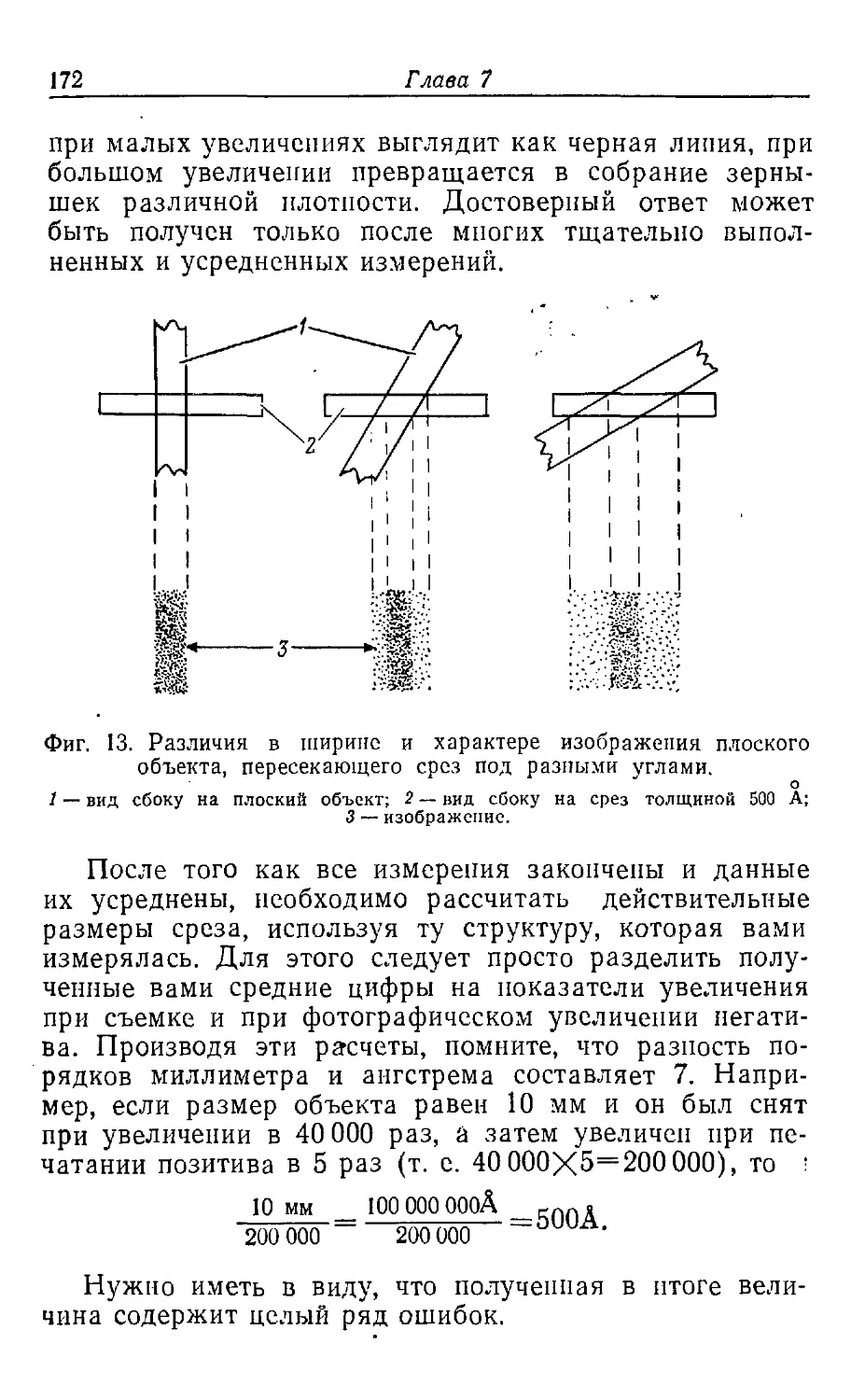
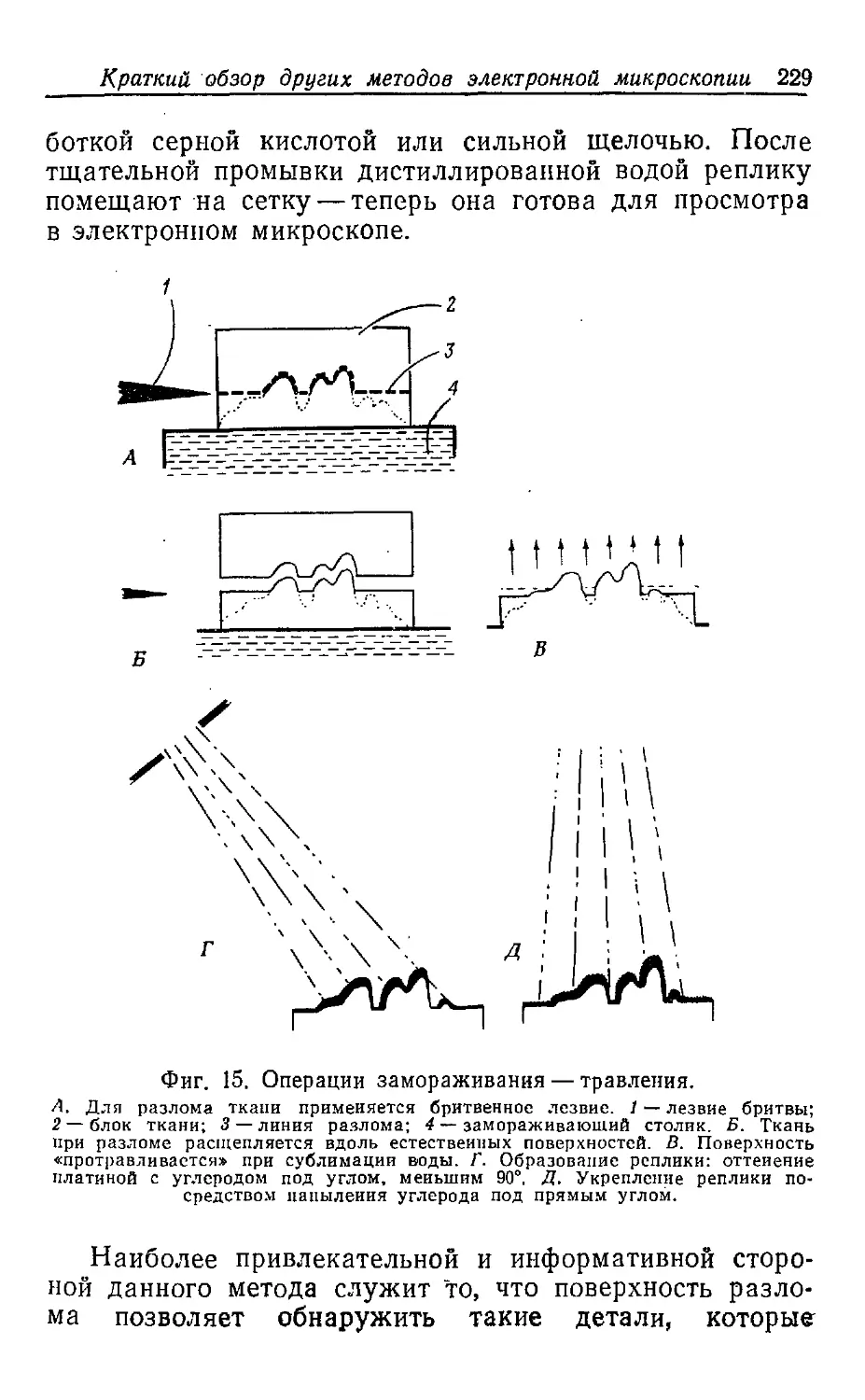
Текст
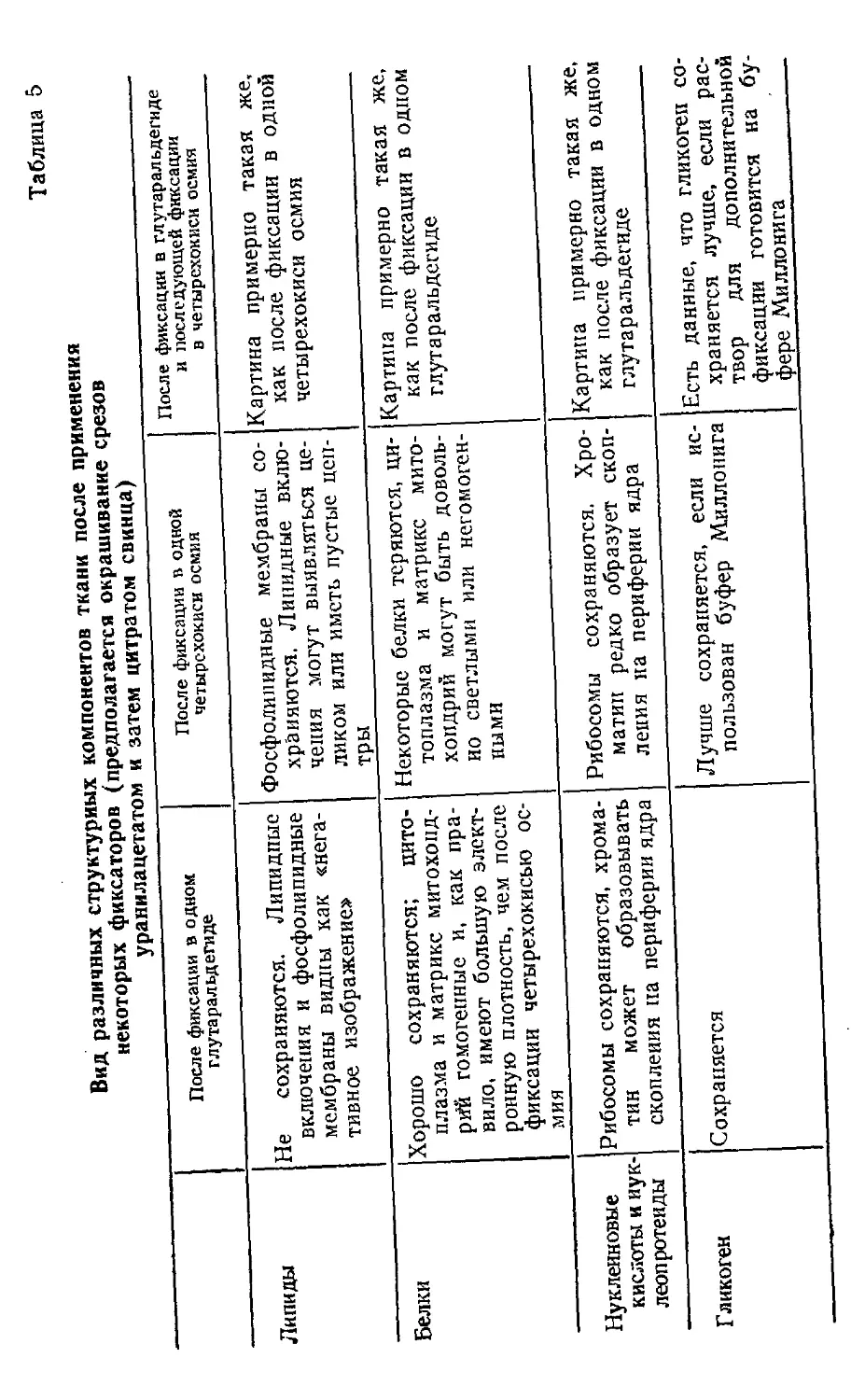
Б.Уикли
ЭЛЕКТРОННАЯ
i
МИКРОСКОПИЯ
ДЛЯ НАЧИНАЮЩИХ
чъ
\Г
"1
^W^-w
V <f
4»
\*
X-.
»Y*
a*f
^n>
A Beginner's Handbook
in Biological Electron
Microscopy
Brenda S. Weakley
Л. В., Л. М., Ph. D.
Lecturer in Anatomy,
The University, Dundee
Churchill Livingstone
Edinburg and London 1972
Б. Уикли
ЭЛЕКТРОННАЯ
МИКРОСКОПИЯ
ДЛЯ НАЧИНАЮЩИХ
Перевод с английского
канд. мед. наук И. В. Викторова
Под редакцией и с предисловием
канд. биол. наук В. Ю. Полякова
Издательство «Мир»
Москва 1975
УДК 591.8.611
Просто и ясно написанное руководство для биологов и
медиков, использующих в своих исследованиях электронный
микроскоп; особенно большую ценность книга представляет для
начинающих исследователей. Рассмотрены теоретические
основы электронной микроскопии; методы фиксации,
обезвоживания, заливки; ультрамикротомия; контрастирование;
интерпретация полученных картин; электронно-микроскопическая
цитохимия и радиоавтография; ряд дополнительных методик.
Предназначена для биологов и медиков различных
специальностей, для студентов и преподавателей биологических
факультетов университетов, медицинских и сельскохозяйственных
институтов.
Редакция биологической литературы
21003-120
У 041(01)-76 120~75 © Перевод на русский язык, «Мир», 1975
Предисловие к русскому изданию
Читатель, которому адресована книга Б. Уикли,
определен самим автором — начинающий микроскопист,
пожелавший спуститься (или подняться?) до уровня
макромолекул. Лет 10—15 назад таких людей во всем мире
можно было пересчитать по пальцам. И только за
последние годы электронный микроскоп превратился из
уникального, «экзотического» прибора в обычный,
доступный большинству биологов инструмент исследования.
Спектр использования микроскопов различных типов
в биологии чрезвычайно широк — от систематики
растений и энтомологии до молекулярной биологии и генетики.
Чрезвычайно многочисленны и разнообразны -и те
методические подходы, которые используются для
приготовления препаратов. Если еще учесть, что от момента
фиксации препарата до получения фотографий его
ультраструктуры проходит 1—2 недели, то станет понятным,
насколько трудоемки современные методики электронно-
микроскопических исследований. Своеобразие работы
в этой области состоит также и в том, что, несмотря на
более чем 20-летнюю историю развития, в электронной
микроскопии до сих пор нет устоявшихся,
общепринятых методических приемов. Каждый опытный
исследователь вносит собственные модификации в методы, в
каждой лаборатории существуют свои «секреты», которые
остаются секретами не потому, что их тщательно
оберегают, а потому, что в публикуемые статьи часто
невозможно включить все те методические тонкости и уловки,
6
Предисловие к русскому изданию
которые используются в повседневной работе. Поэтому
для начинающих особенно важно поработать несколько
месяцев в хорошо оснащенной лаборатории, где в
качестве основного метода исследований используется
электронная микроскопия. К сожалению, такой путь по
ряду причин не всегда доступен; зачастую начинающим
приходится «вариться в собственном соку». В этом
случае хорошим советчиком и помощником могут служить
такие руководства но технике электронной микроскопии,
как книга Б. Уикли.
Эта книга — не простой перечень тех методических
приемов, которые используются в электронной
микроскопии. Автор делится такими, казалось бы,
незначительными подробностями работы, от которых во многом
зависит успех исследований. Руководство охватывает
практически все разделы электронной микроскопии, включая
такие новейшие методы, как сканирующую и
высоковольтную микроскопию. Однако наиболее детально
Б. Уикли описывает методические приемы, связанные
с подготовкой биологических объектов для
просвечивающей электронной микроскопии. Главы, посвященные при- ^
готовлению сеток, пленок-подложек, фиксации,
заключению образца, могут служить хорошим пособием в
повседневной работе не только для начинающего, но и
для опытного микроскописта. Однако, так как
руководство адресовано именно начинающим, необходимо
сделать некоторые замечания относительно ряда
методик. Так, Уикли подробно описывает способ фиксации
ткани но Паладу и метод заключения ткани в эфиры ме-
такриловой кислоты (метакрилаты). В настоящее время
метакрилаты вышли из употребления, так как эти
заливочные среды обладают рядом крупных недостатков:
высокой экстрагирующей способностью, сильной усадкой
при полимеризации и т. д. Также практически не ис-
Предисловие к русскому изданию
1
пользуется фиксация но Паладу (1%-ный Os04,
приготовленный на веронал-ацетатном буфере), так как этот
фиксатор экстрагирует из ткани слишком большое
количество белков. С некоторой осторожностью
необходимо относиться и к таким новейшим приемам цитохимии,
как, например, реакция на выявление РНК.
Действительно, последовательное использование для окраски
срезов, уранилацетата, ЭДТЛ и свинца позволяет
выявить в ядре и цитоплазме клеток РНК-содержащие
структуры, однако нет строгих доказательств, что такой
способ обработки вызывает повышение контраста только
РНК-содержащих структур. Вообще, начинающий
исследователь должен отдавать себе отчет в том, что во
многих разделах электронной микроскопии до сих нор
преобладает эмпирический подход. Так, не разработано
строго научных рекомендаций относительно способа
фиксации материала, нет работ по химии контрастирования
ультратопких срезов, в «зачаточном состоянии»
находятся цитохимические методики электронной микроскопии.
Именно поэтому некоторые приемы, используемые в
электронной микроскопии, можно вслед за Уикли
назвать «искусством».
Нельзя согласиться также с некоторыми
рекомендациями Уикли, касающимися обслуживания электронного
микроскопа. Как показывает практика работы многих
лабораторий нашей страны, наиболее целесообразно
иметь в штате лаборатории квалифицированного
инженера, который вел бы постоянное наблюдение за
эксплуатацией электронного микроскопа, осуществлял бы
профилактический осмотр прибора, его юстировку и т. д.
Это не только продлило бы срок службы такого
дорогого прибора, как электронный микроскоп, но и
позволило бы наиболее полно использовать его возможности.
В заключение, адресуясь опять-таки к начинающим,
8
Предисловие к русскому изданию
можно сказать, что мало овладеть всеми тонкостями
электронно-микроскопических методик. Применение
такого чрезвычайно трудоемкого метода, как электронная
микроскопия, будет оправдано только в том случае,
если поставленную конкретную научную задачу
невозможно решить никаким другим методом.
В. Ю. Поляков
Предисловие автора
В процессе обучения теории и практике электронной
микроскопии выяснилось, что не существует простого,
краткого и доступного пособия по электронной
микроскопии, которое содержало бы ответы на вопросы,
встающие перед начинающими, и позволило преодолеть
«ничейную землю», лежащую между теорией и «рабочей
кухней». Все необходимые сведения, разумеется, уже
имеются в письменной форме, но для того чтобы извлечь
их, нужны недели чтения разнообразной литературы, в
частности изучение обзорных статей и оригинальных
работ, ссылки на которые трудно найти начинающим.
Я полагаю, что многие начинающие, так же как
и мои ученики, да и я сама когда-то, слегка пугаются
при виде множества толстых томов. Тот, кто намерен
избрать электронную микроскопию своей
специальностью, несомненно, должен прочесть эти книги, но не
сразу. Они будут более понятны после того, как новичок
сам поработает в лаборатории электронной
микроскопии — проведет обработку тканей, по неосторожности
немного подышит парами осмия и расстанется со
страхом перед электронным микроскопом.
Пока я не начал! писать эту книгу, я и не
подозревала, насколько поверхностными были мои собственные
знания в электронной микроскопии. При тщательной
проверке известных мне «фактов» оказалось, что
некоторые из них относятся к области мифов. Обращаясь
за советом к литературе, я обнаружила, что
специалисты пугающе часто расходятся во мнениях. Конечным
результатом явилась эта книга, которая, я надеюсь, даст
некоторые полезные практические советы начинающим,
не заводя их слишком глубоко в чащу противоречивых
и часто неверных сведений. Любые ошибки, которые
обнаружатся в книге, лежат целиком на моей ответствен-
10
Предисловие автора
ностн, и я была бы очень признательна тем, кто мне на
них укажет.
Эта книга предназначена для аспирантов и
студентов — медиков и биологов, изучающих методы
электронной микроскопии, а также для тех научных работников
в области биологии, кто хотел бы использовать
электронный микроскоп в своих исследованиях, но не
намерен стать профессиональным электронным микроскопи-
стом. В книгу включена глава об уходе за электронным
микроскопом, которая может быть полезной техникам,
впервые приступающим к работе с ним, а также тем, кто
готовится к сдаче экзаменов по электронной
микроскопии.
Мы ограничились здесь преимущественно изложением
методов подготовки тканей для
электронно-микроскопического исследования — их заливке и резке. Лишь бегло
упоминаются методы изучения вирусов, бактерий и
других частиц. В гл. 10 дан краткий обзор методов
замораживания, высоковольтной электронной микроскопии и
методов изучения поверхностей (например, сканирующей
микроскопии).
Списки литературы для дополнительного чтения,
помещенные в конце каждой главы, концентрируют
внимание на книгах и статьях, подробно рассматривающих
частные вопросы, обсуждавшиеся в данной главе.
Ссылки даются как па ранние, основополагающие работы, так
и на самые последние методические и обзорные статьи.
В приложении дано подробное описание некоторых
наиболее полезных методик; особое внимание уделено
способам хранения отдельных реактивов,
Надеемся, что в этих весьма узких рамках книга
окажет некоторую помощь тем, кто в пей нуждается.
Бренда С. Уикли
ГЛАВА 1
Элементарные основы теории
электронной микроскопии
РАЗРЕШАЮЩАЯ СПОСОБНОСТЬ
(РАЗРЕШЕНИЕ)
Представьте две точки на препарате, который вы
рассматриваете в микроскоп. Если сближать эти точки,
то по достижении какого-то критического расстояния
они сольются и будут восприниматься как одна.
Разрешающая способность (разрешение) — это то наименьшее
расстояние, на котором две близлежащие точки объекта
еще воспринимаются раздельно.
Изображение любой точки объекта (образца)
представляет собой вследствие дифракции кружок,
окаймленный тонкими кольцами (см. раздел «Дифракция»,
стр. 20). Если центры кружков, образованных двумя
соседними точками, расположены на некотором
расстоянии друг от друга, то говорят о разрешении этих двух
точек. Теоретически разрешающая способность
микроскопа составляет примерно половину длины волны луча,
применяемого для освещения объекта.
Длины волн видимой области спектра находятся
в пределах от 0,4 до 0,7 мкм (4000 и 7000 А).
Следовательно, наилучшее разрешение, которого можно
достигнуть с помощью светового микроскопа, равно
приблизительно 0,2 мкм (2000А). »•
ВОЛНОВАЯ ПРИРОДА ЭЛЕКТРОННОГО ЛУЧА
Уже в 1924 г. было известно, что волновые свойства
присущи также н электронам и что длина волны
электрона обратно пропорциональна его скорости [3]. Вскоре
после этого было установлено, что электронный луч
можно фокусировать, пропуская через магнитное
поле [4]. Эти два свойства электронного луча послужили
12
Глава 1
основой для создания электронного микроскопа, в
котором при особых условиях может быть достигнуто
минимальное разрешение 2 А (0,0002 мкм).
основы конструкции электронного
МИКРОСКОПА
Принцип устройства электронного микроскопа
несложен. Основная часть представляет собой металлический
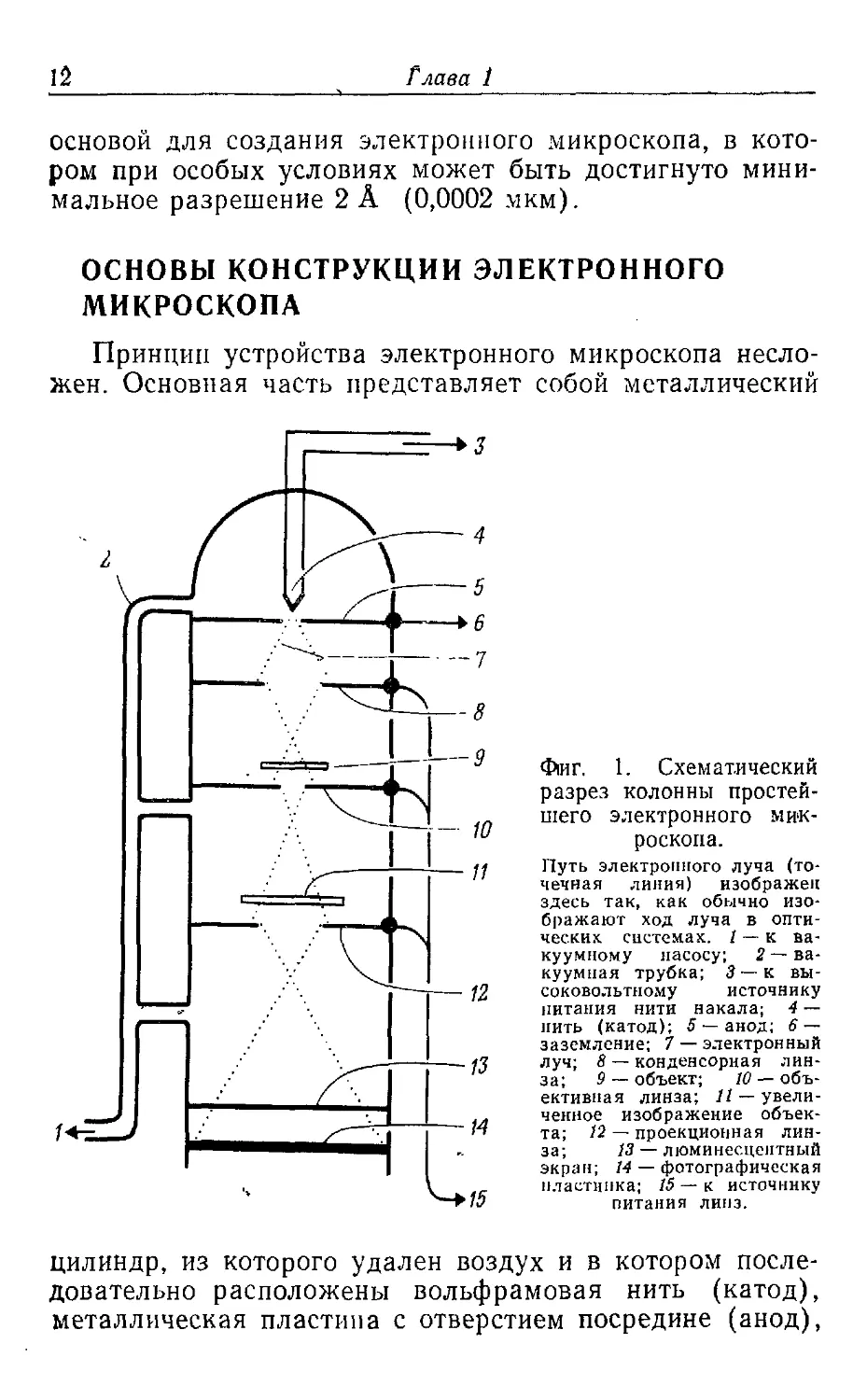
Фиг. 1. Схематический
разрез колонны
простейшего электронного
микроскопа.
Путь электронного луча
(точечная линия) изображен
здесь так, как обычно
изображают ход луча в
оптических системах. / — к
вакуумному насосу,
г—вакуумная трубка; 3 —к
высоковольтному источнику
питания нити накала; 4 —
нить (катод); 5 —анод; 6 —
заземление; 7 — электронный
луч; 8 — конденсорная
линза; 9 — объект; 10 —
объективная линза; //—
увеличенное изображение
объекта; /2 — проекционная
линза; 13 — люминесцентный
экран; 14 — фотографическая
пластинка; 15 — к источнику
питания линз.
цилиндр, из которого удален воздух и в котором
последовательно расположены вольфрамовая нить (катод),
металлическая пластина с отверстием посредине (анод),
Элементарные основы теории Электронной микроскопии 13
ряд магнитных линз, люминесцирующий экран и
фотографическая пластинка (фиг. 1). Ток, проходящий через
вольфрамовую нить, нагревает ее и вызывает эмиссию
электронов. Высокое отрицательное напряжение,
приложенное к нити, обусловливает большую разницу
потенциалов, возникающую между нитью и заземленной
пластиной анода. Разница потенциалов ускоряет
движение электронов по направлению к аноду. Часть
электронов проходит через отверстие в центре анода
(центральную апертуру) и образует электронный луч,
направляющийся вниз по колонне микроскопа.
Электронный луч, сфокусированный первой магнитной линзой
(конденсорной), освещает объект. Большая часть
электронов проходит через объект без отклонения,
однако часть электронов рассеивается тяжелыми атомами
объекта и выбивается из общего электронного луча.
В результате формируется такая структура выходящего
луча, которая при повторной фокусировке преобразуется
в изображение объекта. Электроны, прошедшие через
объект, фокусируются второй магнитной линзой
(объективной), которая формирует увеличенное изображение
объекта. Это изображение в дальнейшем снова
увеличивается третьей магнитной линзой (проекционной)
и проецируется на люминесцентный экран. Изображение
можно сфотографировать, если поднять люминесцентный
экран, с тем чтобы луч попал на фотографическую
пластинку. В большинстве случаев фотографирование
производится при увеличении примерно до 100000 раз1.
В дальнейшем при печати фотографии можно увеличить
еще в 10 раз.
Напряжение, которое используется для ускорения
потока электронов в большинстве просвечивающих
электронных микроскопов, достигает 50 000—100 000 В (50—
100 кВ). Длина волны электрона при этих напряжени-
V
1 При фотографировании ультратонких Срезов, как правило,
используется увеличение в 5—50 тыс. раз. При исследовании
макромолекул в некоторых случаях используют увеличение около 100 000.—
Прим. ред.
14
Глава 1
ях составляет от 0,055 до 0,039 А соответственно1.
Однако теоретическое максимальное разрешение, равное
половине длины волны (приблизительно 0,02 А),
практически не может быть достигнуто по целому ряду причин.
К ним относятся трудности изготовления деталей
микроскопа с необходимой точностью, нестабильность
высокого напряжения и тока в обмотках линз, дифракция,
а также аберрации линз, которые позволяют
использовать линзы только с очень небольшими апертурами.
Разрешение в 2 А было достигнуто для кристаллических
(периодических) материалов, разрешение в 3—4 А — для
некоторых материалов с непериодической структурой.
Однако для большинства биологических материалов
разрешение в 10—20 А обычно считается приблизительным
пределом; это обусловлено спецификой методов
подготовки объекта и самой природой биологических
объектов. (Биологические объекты обычно представляют
собой срезы растительной или животной ткани,
помещенные на поддерживающую металлическую ячеистую
сетку, или частицы, нанесенные на тонкую пленку,
поддерживаемую сеткой.)
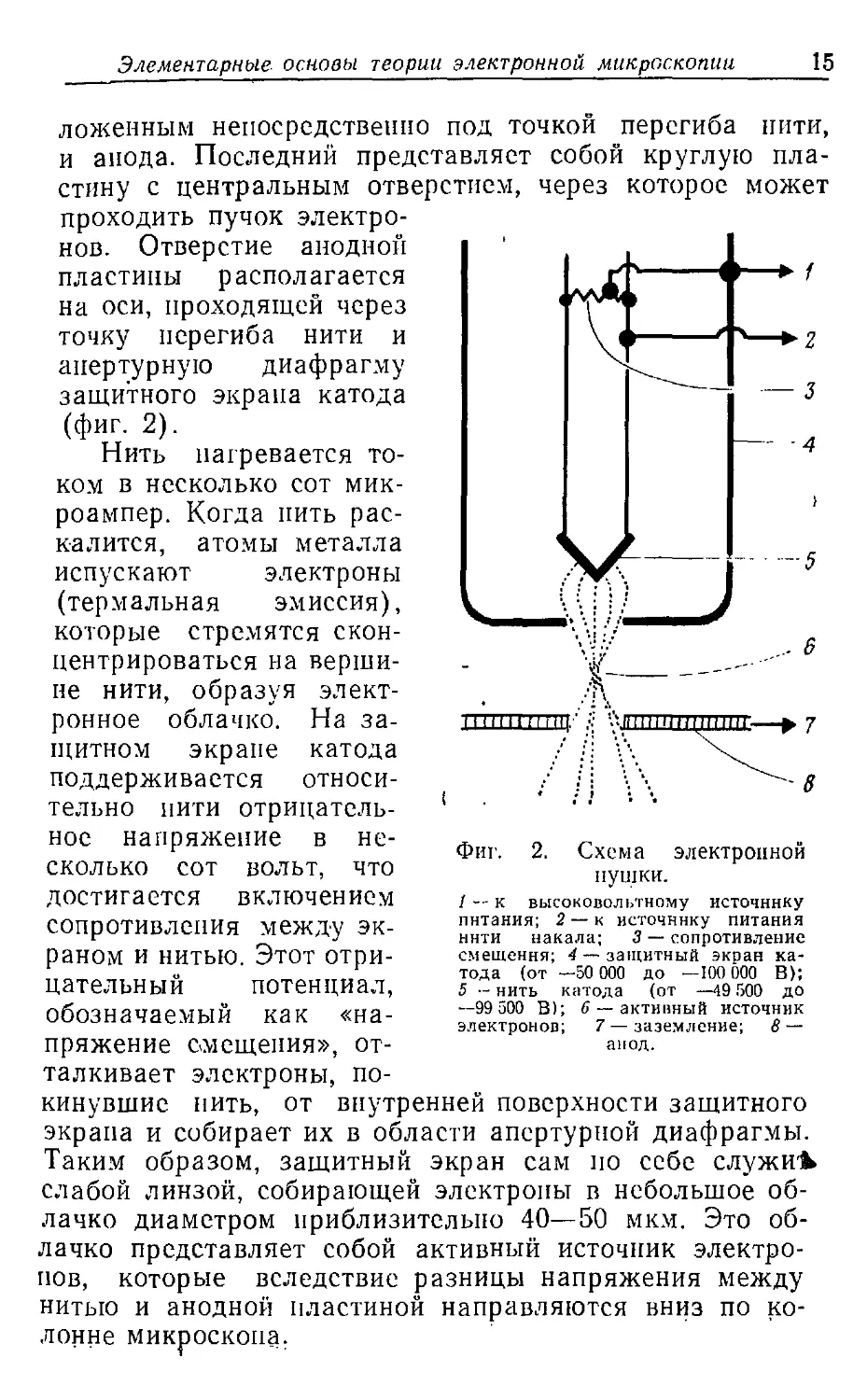
ЭЛЕКТРОННАЯ ПУШКА
Электронная пушка состоит из трех частей: катода
(вольфрамовой проволоки — нити катода, — изогнутой
в форме буквы V), который окружен металлической
оболочкой (защитный экран катода) с отверстием, распо-
1 Вычисляется по формуле де Бройля [3]:
Я,— h/mv,
где Я — длина волны; h — постоянная Планка; /га — масса
электрона; v — скорость электрона.
При математическом преобразовании этой формулы и ее
применении к электрону, который ускорен благодаря разнице
потенциалов, она приобретает вид
где У— ускоряющее напряжение.
Элементарные основы теории электронной микроскопии 15
ложенным непосредственно под точкой перегиба нити,
и анода. Последний представляет собой круглую
пластину с центральным отверстием, через которое может
проходить пучок
электронов. Отверстие анодной
пластины располагается
на оси, проходящей через
точку перегиба нити и
анертурную диафрагму
защитного экрана катода
(фиг. 2).
Нить нагревается
током в несколько сот
микроампер. Когда нить
раскалится, атомы металла
испускают электроны
(термальная эмиссия),
которые стремятся
сконцентрироваться на
вершине нити, образуя
электронное облачко. На
защитном экране катода
поддерживается
относительно нити
отрицательное напряжение в
несколько сот вольт, что
достигается включением
сопротивления между
экраном и нитью. Этот
отрицательный потенциал,
обозначаемый как
«напряжение смещения»,
отталкивает электроны,
покинувшие нить, от внутренней поверхности защитного
экрана и собирает их в области апертурной диафрагмы.
Таким образом, защитный экран сам по себе служив
слабой линзой, собирающей электроны в небольшое
облачко диаметром приблизительно 40—50 мкм. Это
облачко представляет собой активный источник
электронов, которые вследствие разницы напряжения между
нитью и анодной пластиной направляются вниз по
колонне микроскопа.
Фиг.
Схема электронной
пушки.
/ -- к высоковольтному источнику
питания; 2 — к источнику питания
нити накала; 3 — сопротивление
смещения; 4 — защитный экран
катода (от —50 000 до —100 000 В);
5 — нить катода (от —19 500 до
—99 500 В); 6 — активный источник
электронов; 7 —заземление; 8 —
анод.
16
Глава 1
МАГНИТНЫЕ ЛИНЗЫ
Основа магнитной линзы — несколько тысяч витков
проволоки, через которую пропускают ток силой 1 А или
меньше. Проходящий через катушку ток создает
магнитное поле, которое отклоняет попадающие в него
электроны. Для того чтобы избежать необходимости
использовать токи большой силы и создать концентрированное
магнитное поле,
наружные и
внутренние витки катушки
упаковываются в
железный панцирь,
на внутренней
стороне которого имеется
небольшая
кольцевая щель (фиг. 3).
Таким образом, все
магнитное поле
концентрируется внутри
этой щели; для того
чтобы добиться еще
большей
концентрации поля, в канал
объективной линзы
помещают железные
полюсные
наконечники, что позволяет сузить как сам канал, так и
кольцевую щель, в которой, собственно, и происходит
концентрация магнитного поля.
Электрон, попадающий в магнитное поле, движется
по спирали вследствие сложения двух сил: 1) разности
потенциалов между катодом и анодом, которая толкает
электрон вниз по прямой линии, и 2) магнитного поля,
которое заставляет электрон двигаться по окружности
под прямым углом к электронно-оптической оси. В
результате электрон движется по спирали.
Чтобы сфокусировать электронный луч в заданной
плоскости, необходимо с очень высокой точностью
поддерживать нужную силу тока в катушке магнитной
линзы. При возрастании силы тока фокус луча переме-
Фиг. 3. Разрез через магнитную линзу,
снабженную полюсными наконечниками.
/ — верхний полюсный наконечник; 2 — щель
магнита; 3 — нижний полюсный наконечник;
4 —катушка лннзы: 5— кожух из мягкого
железа.
Элементарные основы теории электронной микроскопии 17
щается к линзе, а при уменьшении отдаляется от нее.
Колебания тока в линзе или напряжения, ускоряющего
электроны, всего лишь в несколько миллионных долей
приводят к расфокусировке изображения, создаваемого
объективной линзой, и ограничивают разрешающую
способность микроскопа.
При изменении фокальной плоскости магнитных линз
электронного микроскопа изображение, возникающее на
экране, -меняется по-разному в зависимости от того,
какой из линз манипулируют. Назначение конденсорной
. ИГР .I'll.,
п b В
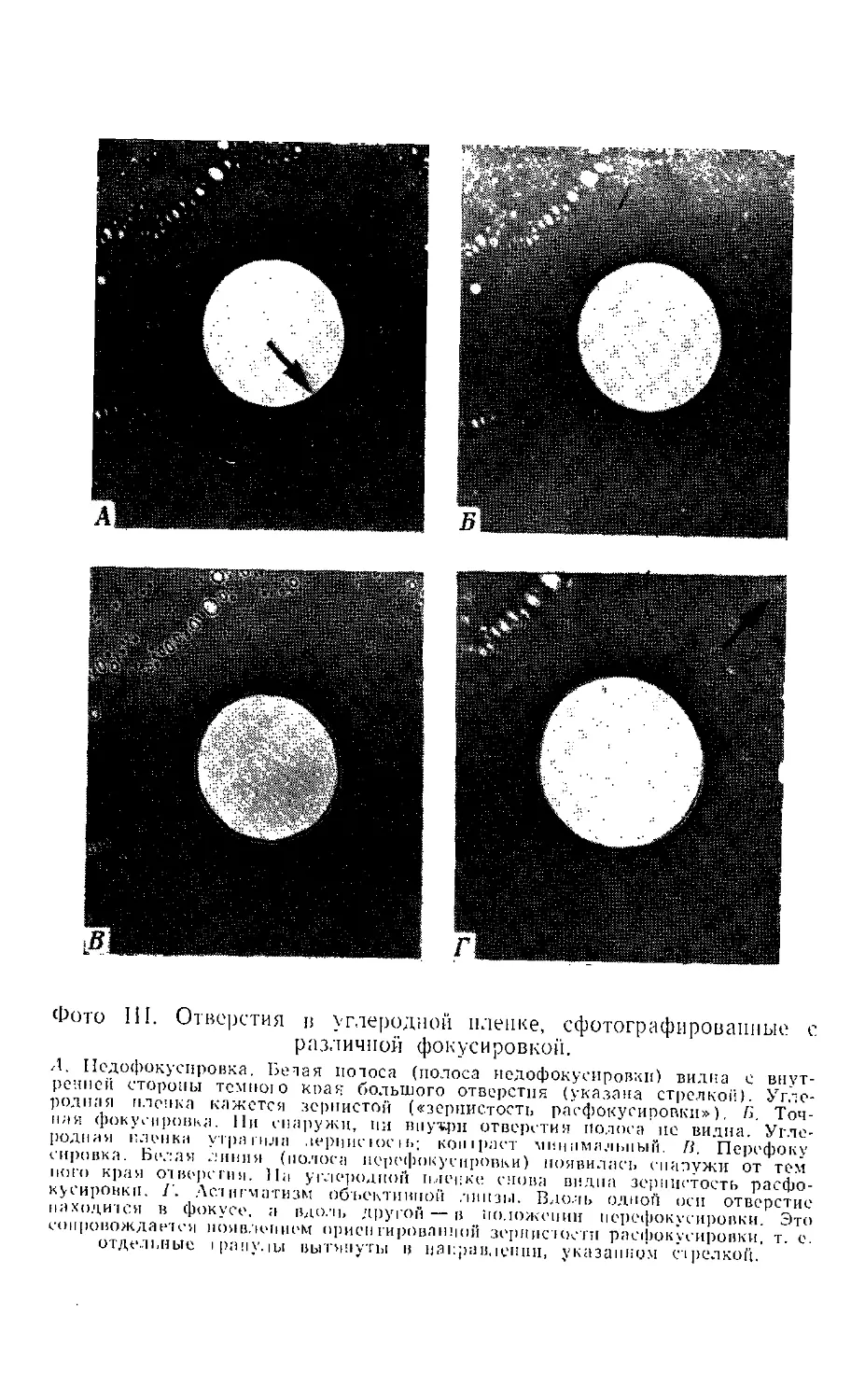
Фиг. 4. Фокусировка, перефокусировка и педофокусиронка
конденсорной линзы.
Л. При фокусировке электооппого луча на объекте формируется небольшой
участок интенсивного освещения. Б. При фокусировке луча выше объекта
(«нерефокусировка») освещается большая площадь поверхности объекта.
#. При фокусировке луча ниже объекта («педофокусиронка») также
освещается большая площадь поверхности объекта.
1 — копдеисорная линза; 2— объект.
линзы — освещать объект. Это относительно слабая
линза, фокусное расстояние которой значительно больше
фокусного расстояния объективной и проекционной линз.
Конденсорная линза может фокусировать электронный
луч непосредственно на объекте, т. е. потоки электронов,
образующих электронный луч, перекрещиваются в
плоскости объекта, образуя участок интенсивного
освещения с минимальным диаметром на небольшой площади
объекта (фиг. 4, Л). В этом случае говорят, что
конденсор сфокусирован. В других случаях луч может быть
сфокусирован либо выше, либо ниже плоскости объекта,
в результате чего луч распределяется по большей
площади объекта, которая освещается менее интенсивно
(фиг. 4, Б, В). Чтобы сфокусировать луч выше плоекд-
8—97-7
18
Глава I
сти объекта, надо усилить ток в линзе, поэтому в данном
случае говорят о «перефокусировке». Когда же
вследствие уменьшения тока в линзе фокус смещается ниже
плоскости объекта, говорят о «педофокусировке».
Объективная линза — это сильная линза с высокой
степенью концентрации магнитного поля и коротким
фокусным расстоянием (приблизительно 2—3 мм при
максимальном возбуждении линзы). Она служит для
повторной фокусировки электронного луча, прошедшего
через объект, в точке, которая располагается всего лишь
на несколько миллиметров ниже объекта. На небольшом
расстоянии от точки фокуса возникает увеличенное
изображение объекта, которое можно наблюдать в
микроскопах, имеющих «промежуточный» люминесцентный
экран, вмонтированный в плоскости этого изображения,
например в микроскопах типа «Сименс». Качество
изображения, формируемого объективной линзой, и
определяет качество изображения, которое окончательно
регистрируется на фотопластинке. Следовательно, именно
объективная линза определяет разрешение микроскопа
и именно здесь существенное значение приобретают
электронно-оптические аберрации (см. ниже).
Глубина резкости объективной линзы электронного
микроскопа (т. е. то расстояние по оптической оси, на
протяжении которого данная структура объекта
находится в фокусе) равна приблизительно 0,2 мкм (2000 А),
что в два раза превышает глубину резкости светового
микроскопа. Поскольку толщина среза, пригодного для
электронно-микроскопического исследования, равна
примерно 600 А, все его детали будут находиться в фокусе
объективной линзы, что делает возможным
стереоскопическое изучение объекта, как это описано в главе,
посвященной специальным методам электронной
микроскопии.
Размер промежуточного изображения (т. е.
увеличение объективной линзы) остается постоянным и
определяется длиной фокусного расстояния данной
объективной линзы. Усиление или ослабление тока в катушке
объективной линзы служит лишь для четкого
фокусирования изображения, которое в дальнейшем
увеличивается проекционной линзой.
Элементарные основы теории электронной микроскопии 19
Увеличение проекционной линзы зависит от силы
тока, проходящего через обмотку этой линзы. При
большей силе тока в проекционной линзе фокус электронного
луча сдвигается вверх по оптической оси. Это означает,
что электронный луч, доходя до люминесцентного
экрана, распределяется на большей площади. Чем больше
площадь, по которой распределяется луч, тем больше
увеличивается изображение в любой заданной точке,
расположенной на оптической оси ниже линзы.
Проекционная линза имеет очень большую глубину резкости
(несколько метров), и, таким образом, расстояние от
линзы до люминесцентного экрана или фотографической
пластинки не имеет существенного значения. Другими
словами, экран или фотографическая пластинка,
помещенные в любой удобной точке на оптической оси ниже
фокальной точки проекционной линзы, зафиксируют
резкое изображение, если промежуточное изображение,
сформированное объективной линзой, сфокусировано
резко.
Для простоты в приведенном выше описании
принципов действия микроскопа мы исходим из основной
трехлинзовой модели этого прибора. Однако
практически в большинстве совремеппых просвечивающих
электронных микроскопов используются две конденсор-
ные линзы (обозначаемые К1 и К2), с тем чтобы
получить очень' небольшую область интенсивного освещения
объекта для работы/ при больших увеличениях. Функция
К1 в двухлинзовых кондепсорпых системах
заключается в том, чтобы уменьшить диаметр изображения
эффективного источника электронов с 40—50 до 1 мкм
или менее («демагнификация»). Такое уменьшенное,
«демагнифицироваиное» изображение проецируется
затем на объект с помощью второй конденсорной линзы
К2. Это дает возможность по желанию освещать очень
небольшие участки объекта и избежать тем самым
повреждения лучом других его частей. Размеры
проецируемого изображения источника электронов можно
произвольно изменять, увеличивая или уменьшая силу
тока в катушке конденсорной линзы К2.
Обычно имеются также две проекционные линзы
(П1, которая иногда называется промежуточной линзой,
2*
20
Глава 1
и П2), что позволяет получить большое увеличение
конечного изображения при относительно небольшой
длине колонны микроскопа.
ФИЗИЧЕСКИЕ ЯВЛЕНИЯ И ДЕФЕКТЫ ЛИНЗ,
ОГРАНИЧИВАЮЩИЕ ВОЗМОЖНОСТИ
ЭЛЕКТРОННОГО МИКРОСКОПА
1. Дифракция. Дифракция обусловлена волновой
природой световых и электронных лучей. Устранить
дифракцию нельзя, однако можно свести к минимуму ее
влияние на изображение. Любые препятствия и помехи,
встречающиеся на пути распространения волн,
порождают новые волны, которые распространяются во всех
направлениях. Это явление, приводящее к потере
абсолютной резкости теней, называется дифракцией.
Отраженные волны могут вступать в сложные
взаимодействия друг с другом и с исходной волной, что
вызывает колебания интенсивности, которые часто выявляются
как дифракционные полосы. Формирование
изображения в световом и электронном микроскопах
сопровождается двойной дифракцией, вначале на краях
неровностей объекта, а затем на краях диафрагмы
объективной линзы. Такая двойная дифракция в диафрагме
объективной линзы главным образом и ограничивает
разрешение микроскопа.
Именно дифракция обусловливает тот факт, что
изображение отдельной точки объекта мы никогда не
видим как точку, а воспринимаем как кружок (диск
Эри), окаймленный множеством нерезко выраженных
колец (дифракционных полос). Радиус (d)
центрального кружка, в котором концентрируется около 80%
общей энергии, определяется формулой
,_ 0.61Я
-п sin a '
где X — длина волны, п — показатель преломления
среды между линзой и объектом и а — угол половины
апертуры объективной линзы, т. е. половины угла 0,
образованного линиями, соединяющими края линзы, или
ограничивающей ее апертуры с точкой объекта (фиг. 5).
Элементарные основы теории электронной микроскопии 21
В общем виде разрешение микроскопа можно
определить следующим образом: две точки объекта будут
разрешены, если центры образуемых этими точками
дисков Эри отстоят друг от друга па расстоянии,
равном d. Таким образом, приведенная формула
определяет то наименьшее расстояние между двумя точками
объекта, на котором они еще воспринимаются
раздельно.
±0-
Фиг. 5. Угол половины апертуры (а).
А. а ограничивается диаметром линзы. В. а ограничивается апертурой.
/ — точка на объекте; 2 —линза.
И световые и электронные микроскопы
характеризуются так называемой «численной апертурой» (NA —
numerical aperture), которая эквивалентна члену п sin a
в приведенном выше уравнении. Поскольку d — это
разрешающая способность (RP — resolving power),
приведенное выше уравнение записывают иногда в
следующем виде:
При ускоряющем напряжении 60 кВ длина волны
электронного луча будет равна 0,05А. Если бы
электронные линзы были такими же совершенными, как и
оптические, то радиус диска Эри и минимальное
разрешение составляли бы примерно половину этой величины.
Практически же различные конструктивные недостатки
и аберрации ограничивают апертурный угол линз
электронного микроскопа примерно до одной сотой того
значения, которое может быть достигнуто с помощью опти-
22
Глава I
ческих линз, так что разрешение составляет величину
порядка нескольких ангстрем [12].
2. Сферическая аберрация. Этот дефект свойствен
и оптическим и электронным линзам. В обоих случаях
лучи, проходящие через линзу далеко от оптической оси
линзы, фокусируются в иной плоскости, чем лучи,
идущие вблизи нее; это ведет к смазанности изображения
и соответствующему снижению разрешения. В
электронной микроскопии сферическая аберрация объективной
линзы доставляет особенно много хлопот, поскольку
именно эта линза формирует и фокусирует первичное
изображение объекта. Влияние сферической аберрации
можно свести к минимуму, если использовать только
центральную часть линзы. С этой целью в капал
объективной линзы помещают металлический диск с
небольшим отверстием. При этом в формировании
изображения примут участие только те электроны, которые
проходят достаточно близко от оптической оси линзы.
Однако края отверстия вызовут дифракцию, которая
ограничит разрешение. Таким образом, в конструкции
объективной линзы приходится искать компромиссное
решение, направленное на уменьшение сферической
аберрации и снижение влияния дифракции. Согласно
данным Эгера [1], такой компромисс достигается в том
случае, когда величина угла половины апертуры а
равна приблизительно 10 2 рад, что составляет всего лишь
примерно 36'. Практически в повседневной работе
обычно применяется апертура диаметром 50 мкм, а для
более точных исследований — 25 мкм. Угол половины
апертуры и размер апертуры связаны между собой
следующим отношением:
Диаметр апертуры
а-—- щ ,
где f — длина фокусного расстояния объективной
линзы.
Например,
3. Хроматическая аберрация. Хроматическая
аберрация может возникнуть по нескольким причинам. Во-пер-
Элементарные оснопы теории электронной микроскопии 23
вых, из-за нестабильности ускоряющего напряжения
микроскопа, что составляет проблему конструирования
этого прибора и не может контролироваться
работающим на нем оператором; во-вторых, вследствие
загрязнения колонны микроскопа и, в-третьих, может быть
обусловлена характером самого- изучаемого объекта.
Два последних источника хроматической аберрации
находятся в известной мере под контролем оператора.
В световой микроскопии хроматической аберрацией
называют такое явление, когда лучи разного цвета (т. е.
с разной длиной волны) фокусируются в разных
плоскостях, в связи с чем изображение размывается. В
электронной микроскопии мы сталкиваемся со сходным
дефектом фокусировки, который также носит название
хроматической аберрации, хотя электронный луч не
имеет цвета.
Длина волны электронного луча определяется
ускоряющим напряжением. Следовательно, любое
колебание этого напряжения с неизбежностью приводит к
изменению длины волны электронов и, таким образом,
меняет плоскость фокусировки. Для уменьшения
хроматической аберрации до уровня, который не ограничивает
разрешение, необходимо стабилизировать ускоряющее
напряжение так, чтобы колебания этого напряжения не
превышали величины порядка нескольких миллионных
долей единицы; это успешно осуществляется в
современных электронных микроскопах.
Хроматическая аберрация возникает также
вследствие того, что электроны покидают пить катода с
различной начальной скоростью. Однако хроматическая
аберрация, обусловленная различиями в скорости
электронов, не так уж велика и ее влияние на разрешение
меньше, чем совместное влияние сферической аберрации и
дифракции.
Хроматическая аберрация возникает также при
загрязнении внутренних поверхностей колонны
микроскопа, деталей линз или диафрагм. Загрязнения могут
приобретать довольно большой электрический заряд,
достаточный для того, чтобы снизить скорость электронов
в луче и увеличить длину их волны. Следовательно,
чистота колонны микроскопа имеет существенное значе-
24
Глава 1
иие в электронной микроскопии с высоким
разрешением.
Вероятно, наиболее важный источник хроматической
аберрации, находящийся под контролем оператора
электронного микроскопа, представляет собой
исследуемый объект. Чем толще объект, тем большее число
электронов он рассеет. Те электроны, которые
рассеиваются и не попадают в диафрагму объективной линзы,
уже не входят в состав электронного луча. Этим
обусловлена та структура выходящего луча, благодаря
которой при его фокусировке возникает изображение.
Однако некоторые электроны, рассеянные объектом
недостаточно сильно, не выпадают из луча. Эти
электроны теряют скорость и, таким образом, служат
причиной хроматической аберрации, что приводит к
увеличению диаметра диска вокруг точек на изображении.
Такое явление назвали «электронным шумом». Именно
электронный шум и является одним из факторов,
существенно ограничивающих разрешение при исследовании
ультратонких срезов биологического материала.
4. Астигматизм. Астигматизм в электронной
микроскопии обусловлен одной причиной — асимметрией
магнитного ноля объективных линз. В результате
происходит перефокусировка данной точки исследуемого
объекта в одном направлении и недофокусировка ее в
другом. Другими словами, эта точка не может быть
сфокусирована точно, и происходит увеличение кружка вокруг
точек изображения. Распределение дифракционных
полос Френеля вокруг такой точки создает впечатление,
что эта точка вытянута в одном направлении.
Несомненно, что астигматизм объективной линзы сильно влияет
на разрешение.
Асимметрия магнитного поля объективной линзы
объясняется следующими прич-инамн:
1) негомогенностыо металла, использованного для
изготовления полюсного наконечника объектива;
2) невозможностью изготовления полюсного
наконечника с каналом абсолютно круглого сечения;
3) загрязнениями, которые заряжаются и
оказывают влияние на иоле линзы. Эти загрязнения могут
находиться на диафрагме объектива, держателе образца,
Элементарные основы теории электронной микроскопии U5
самом образце, в канале полюсного наконечника или на
других поверхностях, расположенных неподалеку от
образца и доступных электронному лучу.
Две первые причины асимметрии магнитного поля
устранить невозможно, однако они могут быть
компенсированы применением корректоров астигматизма
(называемых иногда стигматорами). Корректор
астигматизма— это приспособление, которое вводит
дополнительную асимметрию ноля линзы в направлении,
перпендикулярном ее естественной асимметрии.
Посредством этого сводится на нет влияние асимметрии поля
линзы.
Подробное описание коррекции астигматизма
объективной линзы приведено в гл. 5. Если необходимо
достичь разрешения выше чем 100 А, то такая
коррекция обязательна.
Третью причину асимметрии магнитного поля можно
устранить, соблюдая идеальную чистоту области
объективной линзы и исследуемого объекта. Астигматизм,
обусловленный загрязнениями, несущими электрический
заряд, компенсируется корректором астигматизма в том
случае, если этот астигматизм не слишком велик.
Однако, если загрязнение слишком велико, его влияние не
может быть компенсировано.
Крнденсорные линзы также могут быть астигматич-
ны, но'в этом случае астигматизм в большей степени
влияет на освещение объекта, а не на разрешение: если
конденсорная линза астигматична, то светлое пятно
в фокусе будет не круглым, а продолговатым. При
таком луче, распределенном на большой площади
(расфокусированном луче), объект освещается неравномерно.
Для исправления этого астигматизма
предусматривается корректор астигматизма конденсора (см. гл. 5).
Астигматизм, присущий конденсориой линзе, обычно не
имеет такого значения, как состояние диафрагмы
конденсора: если она не имеет круглой формы или
загрязнена, то изображение сфокусированного луча также не
будет круглым.
Астигматизм проекционной линзы существенно не
влияет на качество изображения и не требует
компенсации. ...... __j
26
Глава 1
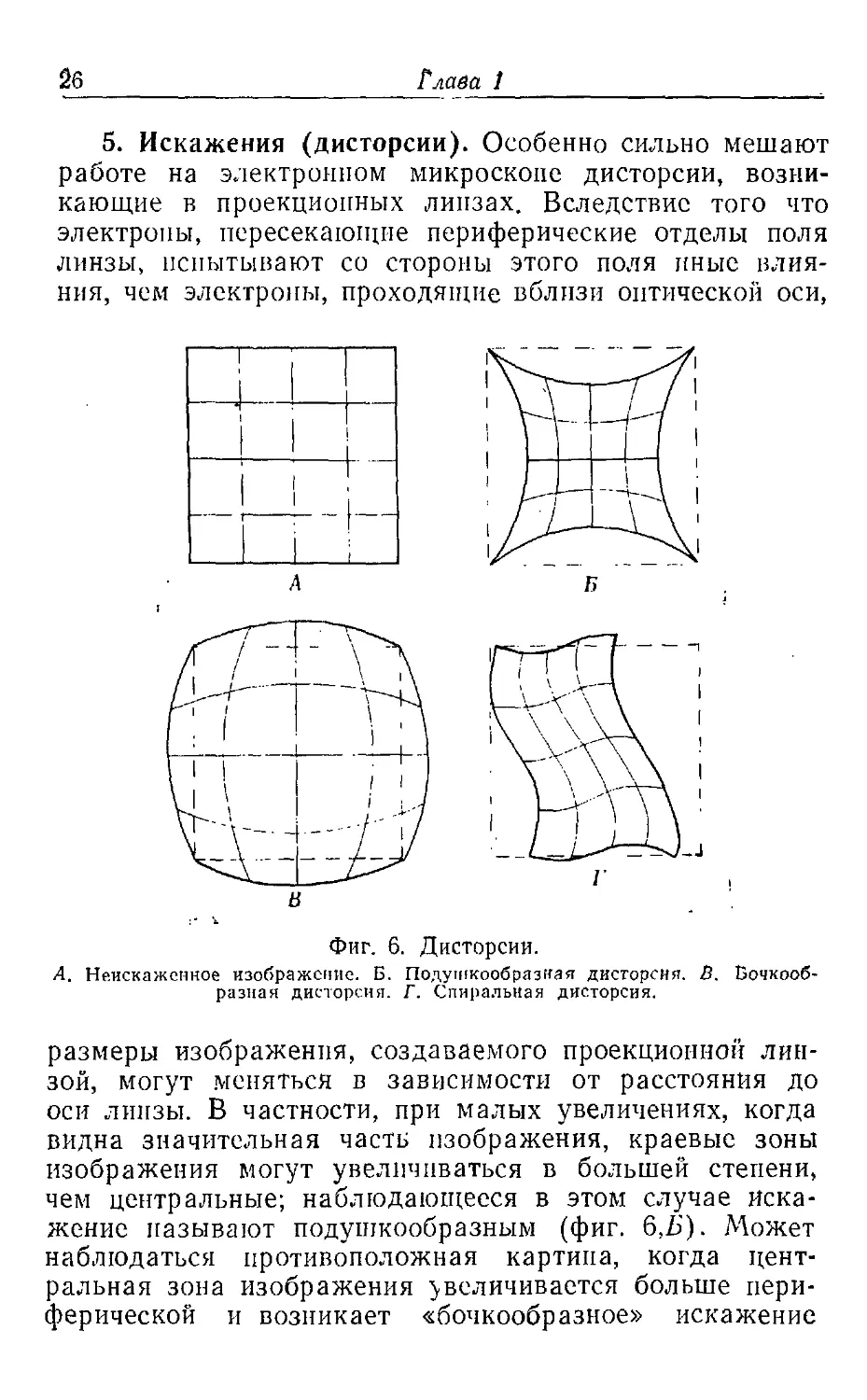
5. Искажения (дисторсии). Особенно сильно мешают
работе на электронном микроскопе дисторсии,
возникающие в проекционных линзах. Вследствие того что
электроны, пересекающие периферические отделы поля
линзы, испытывают со стороны этого поля иные
влияния, чем электроны, проходящие вблизи оптической оси,
Фиг. 6. Дисторсии.
А. Неискаженное изображение. Б. Подушкообразная дисторенп. В.
Бочкообразная дисторсии. Г. Спиральная дисторсия.
размеры изображения, создаваемого проекционной
линзой, могут меняться в зависимости от расстояния до
оси линзы. В частности, при малых увеличениях, когда
видна значительная часть изображения, краевые зоны
изображения могут увеличиваться в большей степени,
чем центральные; наблюдающееся в этом случае
искажение называют подушкообразным (фиг. 6,Ь"). Может
наблюдаться противоположная картина, когда
центральная зона изображения увеличивается больше
периферической и возникает «бочкообразное» искажение
Элементарные основы теории электронной микроскопии 27
(фиг. 6, В). Эти искажения можно частично исправить,
регулируя напряжение и направление поля двух
проекционных линз.
Спиральное искажение (фиг. 6, Г) обусловлено тем,
что угол поворота изображения в магнитном поле
зависит от расстояния до оптической оси. Такое искажение
можно устранить, предусмотрев намотку катушек
объективной и проекционной линз в противоположных
направлениях, так чтобы спиральное искажение,
создаваемое одной линзой, компенсировалось аналогичным
искажением, создаваемым другой линзой.
Искажения редко позволяют использовать
увеличение менее чем в 1000 раз для детального исследования
объекта, хотя малые увеличения очень полезны при
выборе участка, подлежащего изучению.
ЛЮМИНЕСЦЕНТНЫЙ ЭКРАН
Люминесценция — это способность к
электромагнитному излучению под влиянием бомбардировки
электромагнитными или электронными лучами. Некоторые
вещества при этом излучают видимый свет.
Явление люминесценции используют в электронной
микроскопии для того, чтобы сделать видимым
электронное изображение. С этой целью на пути электронного
луча ниже проекционной лппзы помещают экран,
покрытый люминесцентным веществом, например сернистым
цинком. Под воздействием электронов экран излучает
видимый свет. Естественно, что электроны, вышедшие
из состава луча, не достигают экрана, и те места экрана,
которые не подвергаются бомбардировке, остаются
темными.
Разрешение люминесцентного экрана ограничивается
размерами частиц люминеецнрующего вещества
приблизительно до 70—100 мкм, а также рассеиванием света
в слое этого вещества. Поэтому при фотографировании
объектов следует использовать фотопластинки с
мелкозернистой эмульсией, которые обеспечивают фиксацию
всех деталей электронного изображения. Анализ
микрофотографий можно проводить позднее. •
28
Глава 1
ВАКУУМНАЯ СИСТЕМА
В воздухе электроны могут проходить лишь
несколько микрометров, а затем они либо останавливаются,
либо скорость их снижается в результате столкновения
с молекулами газов, содержащихся в воздухе.
Поскольку расстояние между электронной пушкой и
фотографической пластинкой составляет приблизительно 1 м,
внутри микроскопа необходимо создать вакуум.
Рабочий вакуум обычно равен 1~4 мм рт. ст.1 В этих
условиях электрон может пройти в среднем 2,5 м, прежде
чем он столкнется с молекулой газа.
Существуют и другие причины, по которым
необходимо соблюдение вакуума в колонне электронного
микроскопа. Если между нитью катода и анодом
содержатся молекулы газа, то эти молекулы под влиянием
бомбардировки электронами легко превращаются в
положительно заряженные ионы. Такие заряженные ионы
настолько сильно увеличивают проводимость между
катодом и анодом, что создаются условия для
возникновения непрерывных электрических разрядов вместо
постоянного потока электронов.
При работе на микроскопе с «плохим» вакуумом в
результате бомбардировки положительно заряженными
ионами, а также окисления сокращается срок службы
нити катода. Кроме того, окисление снижает
эффективность эмиссии электронов питью катода.
Для поддержания требуемого вакуума необходимы
вакуумные насосы двух типов. С помощью ротационного
механического форвакуумного насоса осуществляют
первую, предварительную откачку. Этот насос
располагается отдельно от микроскопа и соединен с ним
вакуумным шлангом, что позволяет избежать влияния
вибрации. Форвакуумпый насос создает вакуум порядка
10~2 мм рт. ст. Когда достигнут такой вакуум, включа-
1 1 мм рт. ст. — 1 миллиметр ртутного столба — это давление,
создаваемое столбиком ртути высотой 1 мм при температуре О "С.
Эта единица часто обозначается как 1 торр (по имени Торричелли).
Эквивалентом 1 мм рт, ст. в международной системе единиц (СИ,
см. стр. 30) является 1,33 миллибар (мбар). Давление выше
10-3 торр относят к низкому вакууму; давление ниже этого
значения относят к высокому вакууму.
Элементарные основы теории электронной микроскопии 29
ют насос второго типа (диффузионный), который увели-,
чивает вакуум до 10~4 мм рт. ст. Диффузионный насос,
встроенный в микроскоп, может работать эффективно
лишь после того, как начальное давление газа снижено
форвакуумным насосом.
Диффузионные насосы бывают ртутными или
масляными, однако чаще применяют масляные насосы. Пары
масла, образуемые в результате -действия нагревателя,
вмонтированного в диффузионный насос, увлекают за
собой молекулы газов. Эти пары выводятся из
подогреваемой камеры и конденсируются в охладительной
системе насоса. Молекулы газов, высвобождающиеся при
конденсации пароа. масла, откачиваются форвакуумным
насосом, который в данном случае обычно называют
поддерживающим насосом, так как он поддерживает
работу диффузионного насоса. Масло после конденсации
вновь поступает в нагреватель и включается в
повторный цикл.
Вакуум, который создает масляный диффузионный
насос, определяется давлением пара, образуемого
маслом. Применение масла с высоким давлением пара
вызывает загрязнение колонны микроскопа молекулами
масла, поэтому необходимо применять специальное
высоковакуумное масло с низким давлением пара.
Для того чтобы в колонне микроскопа не
восстанавливалось атмосферное давление при каждой смене
объектов или фотографических пластинок, в
соответствующих местах колонны встраиваются специальные шлюзы.
При необходимости шлюзы перекрываются, что дает
возможность заполнить воздухом только камеру
образцов или фотокамеру. В этих небольших камерах можно
быстро создать вакуум до 10~2 мм рт. ст., если открыть
клапаны, непосредственно соединяющие их с
форвакуумным насосом. Затем шлюзы между камерами и колонной
могут быть открыты снова, причем в колонне
происходит лишь небольшое снижение вакуума.
СИСТЕМА ОХЛАЖДЕНИЯ
При работе микроскопа диффузионный насос и
магнитные линзы охлаждаются водой, циркулирующей в
специальной охлаждающей рубашке. При употреблении
30
Глава 1
для этой цели нефильтрованной водопроводной воды
может произойти быстрое засорение системы охлаждения
микроскопа. Чтобы избежать частой смены и чистки
фильтров, многие микроскопы снабжены встроенной
системой повторной циркуляции деионнзованной или
дистиллированной воды.
ЕДИНИЦЫ ДЛИНЫ И ДАВЛЕНИЯ,
ПРИМЕНЯЕМЫЕ
В ЭЛЕКТРОННОЙ МИКРОСКОПИИ
Международная система единиц (СИ) была принята
в 1960 году. В этой системе за основные единицы длины,
массы п времени приняты соответственно метр (м),
килограмм (кг) и секунда (с), с помощью которых
обозначают все производные количественные единицы.
Например, давление измеряется силой, приложенной к едини-
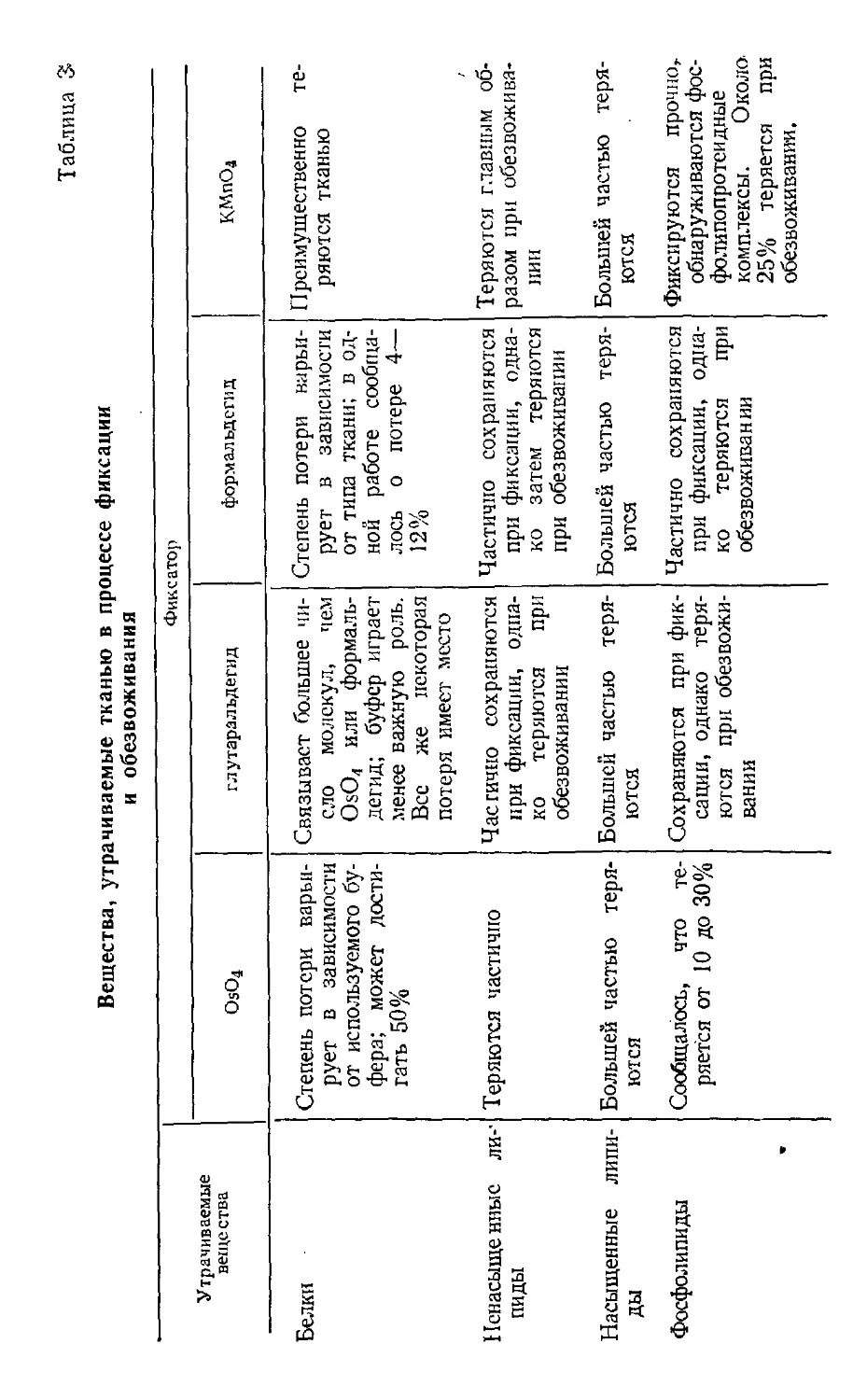
Таблица 1
Единицы длины
Старая система
1 миллиметр (мм) — Ю-3 метра
1 микрон (мк)=10~* метра
1 миллимикрон (ммк)-= 10"* метра
1 ангстрем (А)=10-10 метра
Эквивалент
п системе СИ
1 миллиметр (мм)
I микрометр (мкм)
I нанометр (им)
0,1 нанометра
Таблица 2
Единицы давления
Старая система
1 атмосфера--760 мм рт. ст.
—760 торр
= 1,013 бар
I бар=0,987 атмосферы
1 мм рт. ст.= 1 торр
— 1,33 миллибар (мбар)
Эквивалент в системе СИ
1,013-105 кг-ы-ч-сг*--- 1,013 6vp
1 бар=Ы0в кг-м-1-с-2
133 кг-м-1-с-2=1,33 мбар
Элементарные основы теории электронной микроскопии 31
це площади, т. е. массой/(длина X время2), и
выражается в СИ как 1 КГ'М ''Г2. В приводимых выше таблицах
даны прежние единицы длины и давления (включены
наиболее часто употребляемые в электронной
микроскопии) и их эквиваленты в системе СИ.
Ко времени написания этой книги некоторые
журналы, публикующие данные электронно-микроскопических
исследований, Journal of Ultrastructure Research (USA),
Journal of Cell Biology (USA), Journal de Microscopie
(France)" и Zeitschrift fur Zellforschung und Mikrosko-
pisce Anatomy (Germany), еще не перешли на систему
СИ, поэтому читателю рекомендуется ознакомиться
с обеими системами1.
Представленные выше основы теории электронной
микроскопии даны в наипростейшей форме в расчете на
читателей, имеющих минимальные познания в физике
и математике. Для дополнительного чтения на более
высоком уровне рекомендуется приводимая ниже
литература, в особенности работы Шёстранда [14J и Мика
[11]. История развития электронного микроскопа очень
хорошо представлена в работах Бредбери [2] и Мертона
[10].
Список литературы
1. Agar A. W., In Techniques for Electron Microscopy, Chap. 1
(Edited by D. II. Kay), Oxford, Blackwell Scientific Publications, 1965.
2. Bradbury S., The Evolution of the Microscope, Chap. 8, Oxford and
New York, Pergamon Press, 1967.
3. De Broglie L., A tentative theory of light quanta, Philosophical
Magazine, 47, 446—458 (1924).
4. Busch H., Calculation of trajectory of cathode rays in axially
symmetric electromagnetic fields, Annalen der Physik, 81 (Ser. 4),
974--993 (1926).
5. Cossletl V. E., Practical Electron Microscopy, London, Butterworth,
1951.
6. Grivet P., Electron Optics, Oxford, Pergamon Press, 1965.
7. Maine M. E., In Advances in Electronics and Electron Physics,
Vol. 6, New York, Academic Press, 1954.
8. Maine M. E., Cosslelt V. E., The Electron Microscope: The Present
State of the Art, London, E. and F. N. Spon, 1961.
1 По-видимому, такая единица, как ангстрем, будет без
ограничений использоваться в электронной микроскопии.
32
Глава 1
9. Hall С. Е., Introduction to Electron Microscopy, 2nd edn, New York,
McGraw-Hill, 1966.
10. Marton L., Early History of the Electron Microscope, San
Francisco, San Francisco Press, 1968.
11. Meek G. A., Practical Electron Microscopy for Biologists, Chap. 1,
3 and 5, London, and New York, Wiley-lnterscience, 1970.
12. Ruska E., In Advances in Optical and Electron Microscopy, London
and New York, Academic Press, 1966.
13. Siegel В. М., Modern Developments on Electron Microscopy,
Chap. 1, London, Academic Press, 1964.
14. Sjostrand F. S., Electron Microscopy of Cells and Tissues, Vol. 1,
Chap. 2, 3 and 4, New York and London, Academic Press, 1967.
15. Zworykin V. K-, Morton G. A., Romberg E. G., Hillier J., Vance A.,
Electron Optics and the Electron Microscope, New York, John
Wiley, 1945.
ГЛА6А i
Обработка тканей
ПРЕДОСТЕРЕЖЕНИЕ
Некоторые вещества, используемые в электронной
микроскопии для обработки тканей, ядовиты, и
обращаться с ними надо осторожно.
Четырехокись осмия. Работать с четырехокисью
осмия необходимо только в вытяжном шкафу, так как это
вещество токсично и очень летуче. Пары четырехокиси
осмия раздражают дыхательные пути и могут вызвать
тяжелые поражения глаз. Раствор этого вещества едкий
и вызывает ожоги. Если раствор четырехокиси осмия
попал на кожу, необходимо немедленно смыть его
проточной водой.
Глит ар альдегид. Глутаральдегид не столь токсичен
и летуч, как четырехокись осмия, однако вдыхать пары
этого вещества не рекомендуется. При попадании на
кожу глутаральдегид может вызвать дерматит.
, Эпоксипропан (окись пропилена). Эпоксипропан
также токсичен, очень летуч, и работать с ним следует
только в вытяжном шкафу. Кроме того, это вещество
легко воспламеняется и может
взорваться при работе в помещении с
открытым огнем. Хранить эпоксипропан необходимо в хо-.
лодильнике.
Ацетон и ксилол. Ацетон и ксилол легко
воспламеняются, и с ними нельзя работать возле открытого
пламени. При длительном вдыхании эти вещества могут
вызвать поражение печени.
Эпоксидные смолы, применяемые для заливки (арал-
дит, эпон, их катализаторы и уплотнители). Все эти
вещества токсичны и у лиц, чувствительных к ним, могут
вызвать дерматит. В экспериментах на животных
показано, что эти вещества обладают канцерогенными свой-
3—977
34 Глава U
ствами. При работе с заливочными средами
рекомендуется надевать резиновые перчатки.
Метакрилаты. Пары метакрилатов опасны, и с этими
веществами лучше работать в вытяжном шкафу.
Метакрилаты, нерастворимые в воде, легко воспламеняются,
и нужно соблюдать осторожность при проведении
операций, предшествующих их полимеризации.
Перекись бензоила (перекись дибензоила, люцидол).
Это вещество применяется как катализатор при
полимеризации метакрилатов. Оно бурно разлагается при
температуре 106°С, по относительно безопасно при
нормальной температуре. Перекись бензоила часто
поступает в продажу в виде пасты. Рекомендуется хранить
это вещество в холодильнике.
Люперко CDB. Это вещество иногда применяется как
катализатор для гликольметакрилата и представляет
собой 50%-ный раствор перекиси 2,4-дихлорбензоила в ди-
бутилфталате. Люперко CDB — вещество, еще менее
стабильное, чем перекись бензоила, и, следовательно,
более опасно. По-видимому, оно не имеет особенных
преимуществ по сравнению с перекисью бензоила, и
поэтому применять его не рекомендуется.
Амилацетат. Это вещество используют в качестве
растворителя коллодия (нитроцеллюлозы) при
изготовлении сеток, покрытых опорной пленкой. Амилацетат
обладает наркотическими свойствами, и работать с ним
следует только в хорошо проветриваемом помещении.
При длительном вдыхании паров амилацетата возможны
поражения печени.
Свинец. Свинец, содержащийся в «электронных
красителях», способен проникать через неповрежденную
кожу. Свинец вместе с пылью попадает в дыхательные
пути, если растворы свинцовых красителей разливаются
и высыхают. В связи с этим необходимо всегда
вытирать стол и мыть руки до'и после работы с
красителями. Длительное воздействие свинца может привести
к бесплодию. Описаны случаи смерти от хронического
свинцового отравления.
Фотографические проявители. У лиц, обладающих
повышенной чувствительностью, проявители могут вызвать
дерматит.
Обработка тканей
35
ВЫБОР ЭКСПЕРИМЕНТАЛЬНЫХ ЖИВОТНЫХ
И ВЗЯТИЕ ТКАНЕЙ
При прочих равных условиях в
электронно-микроскопических исследованиях выгоднее использовать ткани
мелких животных. Например, из яичника золотистого
хомячка, также как и из яичника коровы, можно
получить достаточное число срезов, затратив при этом
гораздо меньше времени.
Вероятность того, что мы исследуем ультраструктуру
совершенно нормальной ткани какого-то животного,
определяется статистически. Эта вероятность возрастает
при использовании молодых и обязательно здоровых
животных.
Выбирая метод забоя животного, следует иметь в
виду, что посмертные изменения начинаются сразу же
после гибели животного, причем скорость деструкции
разных тканей различна. Было обнаружено, что
практически очень трудно отдифференцировать посмертные
изменения ткани, которые произошли до фиксации, от
изменений, являющихся результатом последующей
обработки. Трамп и Эриксон [55] указывают, что явному
посмертному (аутолитическому) разрушению клеточных
органелл предшествует, вероятно, состояние их
повышенной хрупкости, которая предрасполагает к
усиленному их разрушению в процессе обработки ткани. Для
выяснения этого вопроса необходимы дополнительные
исследования; к тому же авторы, опубликовавшие
данные но этому вопросу, расходятся во мнении
относительно того, насколько важно сразу же после смерти
животного быстро брать ткань. Однако пока что эти
противоречия остаются нерешенными; по-видимому, имеет смысл
брать ткань и фиксировать ее до того, как животное
погибнет. Можно ввести животному наркотическую дозу
нембутала и взять ткань сразу же после наступления
наркоза. Если возможно, фиксацию начинают еще до
взятия кусочков, вводя фиксатор в орган in situ. Затем
ткань иссекается как можно быстрее и переносится
в каплю свежего фиксатора, помещенную па твердую
поверхность. После этого ткань режут на кусочки
размером не более чем 0,5—1 мм3, которые помещают в ие-
3*
36
Глава 2
большой пузырек (снабдить четкой надписью!),
содержащий несколько миллилитров фиксатора. Переносить
кусочки ткани очень удобно при помощи широкой
пастеровской пипетки. Очень важно, чтобы размер кусочков
не превышал 1 мм3; в противном случае их внутренние
части будут фиксированы не полностью или совсем не
фиксированы.
После взятия ткани животное забивают массивной
дозой нембутала.
Описанный метод даст возможность брать ткань у
животного прижизненно, однако еще не установлено,
в какой степени нембуталовый наркоз изменяет
ультраструктуру различных тканей. Существующий в
Великобритании закон о вивисекции запрещает прижизненно
брать ткань у нснаркотизированных животных. В связи
с этим легально провести сравнительное исследование
ультраструктур в тканях, взятых у нснаркотизированных
и наркотизированных или мертвых животных, не
представляется возможным. Можно лишь сравнить ткани,
взятые прижизненно у животных, которые находятся под
действием различных препаратов для наркоза (таких,
как эфир, хлороформ, нембутал), и у животных, забитых
введением одного из этих веществ или ударом по голове.
Если такие исследования на ультраструктурном уровне
и были выполнены, то они прошли мимо моего
внимания. Однако на микроскопическом уровне с помощью
качественных и количественных методик Аль-Азави и
Стоуорд [1] показали, что наличие и распределение ли-
зосом в мышцах зависит от того, каким способом
забивали животных.
ФИКСАЦИЯ
Цель фиксации состоит в том, чтобы 1) остановить
посмертные изменения и 2) сохранить ткань в состоянии,
по возможности наиболее близком к прижизненному.
Одна из наиболее распространенных причин
неудовлетворительной фиксации, с которой сталкивается
начинающий, заключается в величине кусочка ткани, которую
он пытается зафиксировать. Понятия «один кубиче-
Обработка тканей
37
ский миллиметр» или «половина кубического
миллиметра» имеют мало смысла до тех пор, пока не увидишь
своими глазами кусочки таких размеров. У нас в
лаборатории имеются два небольших стеклянных пузырька,
в которые помещены в качестве образца цветные
пластмассовые кубики упомянутых выше размеров.
При разрезании ткани на кусочки даже с помощью
очень острого лезвия безопасной бритвы наблюдается
повреждение наружных клеточных пластов; время,
ушедшее на проникновение фиксатора, возможно, имеет
меньшее значение, чем соответствующая сохранность
внутренних отделов кусочка. При фиксации осмием узкая
зона хорошо фиксированной ткани обычно находится
непосредственно под поверхностью кусочков [39].
Ранее считали, что альдегиды, являющиеся
низкомолекулярными веществами, проникают в ткань быстрее,
чем четырехокись осмия, и что вследствие этого можно
успешно фиксировать более крупные • кусочки ткани.
Между тем опыты Эриксона и Биберфилда [21]
свидетельствуют о том, что на самом деле глутаральдегид
проникает в ткань медленнее, чем четырехокись осмия.
Авторы пришли к заключению, что оптимальная
сохранность ткани во всех отделах кусочка достигается при
использовании глутаральдегидного фиксатора только
в том случае, если размер кусочка не превышает 1 мм3.
Противоречивые мнения высказываются относительно
оптимальной температуры фиксации. В течение
длительного времени фиксацию проводили при 0°С, с тем
чтобы свести к минимуму посмертные изменения ткани и
экстрагирование тканевых компонентов. Однако при
снижении температуры фиксатора уменьшается скорость его
проникновения в ткань. Точно не установлено,
насколько тесно взаимодействие этих двух факторов па
практике и как оно меняется в зависимости от фиксатора.
Более подробно этот вопрос рассмотрен в работе Хайата
[27].
Еще одним переменным фактором является время
фиксации. В повседневной практике ткань фиксируют
2—4 ч в альдегиде, а затем 1 ч в четырехокнеп осмия.
Продолжительность фиксации в четырехокнеп осмия
(1 ч) кусочков объемом 1 мм3 или меньше была устапов-
38
Глава 2
лена эмпирически. В значительной степени это решение
представляет собой компромисс, обусловленный тем, что,
с одной стороны, фиксатор должен полностью
проникнуть в кусочек и с другой — тем, что белки и
некоторые другие вещества постепенно экстрагируются из
ткани в процессе фиксации [10]. Баркл и Шихль [15]
определили, что скорость проникновения растворов четырех-
окиси осмия в ткань составляет 0,75 мм/ч. Это хорошо
согласуется с данными, полученными Хадстрёмом и
Бэром [25] для 1%-ного раствора Os04 на
дистиллированной воде. Эти авторы, однако, обнаружили, что при
добавлении к фиксатору буферного раствора или сахарозы
скорость его проникновения в ткань снижается.
Сабатипи и др. [47], предложившие использовать
в качестве фиксатора глутаральдегид, фиксировали
в нем от одного часа до нескольких дней. Эти авторы
считают, что оптимальная продолжительность фиксации
находится в пределах от 30 мин до 2 ч. Однако опыты
Эриксона и Биберфилда [21], а также Хопвуда [28]
дают основания полагать, что 4 ч составляют оптимальное
время для фиксации кусочка объемом 1 мм3. Для
некоторых специальных цитологических методик
применялась короткая 15-минутная фиксация в альдегиде,
однако сохранность ультраструктур при этом была крайне
неудовлетворительной. При соприкосновении ткани е
глутаральдегидом фиксация происходит сразу же.
Формальдегид, напротив, быстро проникает в ткань, но
реакции, протекающие во время фиксации, завершаются в
течение нескольких часов.
Оптимальное время, необходимое для фиксации,
варьирует в зависимости от типа ткани, времени,
прошедшего с момента взятия ткани и до момента
попадания ее в фиксатор, размера кусочка, концентрации
фиксатора и применяемого -буферного раствора. Ткань
фиксируется и обезвоживается легче, если на все время
фиксации сосуды с кусочками этой ткани поместить на
медленно вращающийся диск. При этом, однако,
возможно, что скорость процессов экстрагирования также
увеличивается.
Как правило, рН в течение фиксации поддерживают
на физиологическом уровне (7,3—7,4). Шульц и Карлсон
Обработка тканей
39
[49] приводят данные, свидетельствующие о том, что
ткани, фиксированные при величинах рН от 6 до 8,
почти ие различаются по виду. Другие авторы, например
Хайат [27], подчеркивают важность соблюдения
физиологических значений рП фиксатора, особенно при
работе с высоким разрешением.
Как уже упоминалось ранее, фиксацию можно начать
еще до взятая ткани у животного. Если ткань, которая
должна быть фиксирована, входит в состав органа,
имеющего капсулу, то эту капсулу надо рассечь, чтобы
обеспечить проникновение фиксатора; тканевую
жидкость или кровь необходимо смыть свежими порциями
фиксатора.
В качестве наиболее эффективного средства доставки
фиксатора в глубокие отделы ткани рекомендуется его
введение (перфузия) в кровеносную систему животного.
Канюля обычно вводится в главную артерию,
снабжающую данный орган, и закрепляется. Затем перерезается
главная вена, отводящая кровь от этой ткани. Кровь из
органа вымывают фиксатором, после чего пережимают
вену и несколько увеличивают давление фиксатора, для
того чтобы сосуды расширились и фиксатор прошел но
ним в ткань. Конечно, давление не должно быть
слишком высоким, иначе может произойти разрыв тканей.
Примерно через 5 мин ткань можно разрезать на
кусочки величиной 1 мм3 и фиксировать далее в свежей
порции фиксатора.
Четырехокись осмия не рекомендуется применять для
перфузии, так как это вещество вызывает спазм
кровеносных сосудов и фиксатор почти не проходит по ним
и не проникает в ткань. Перфузия альдегидами дает
значительно лучшие результаты. Метод перфузии
особенно ценен при работе с такими тканями, как мозг и
почки, фиксировать которые весьма трудно. Однако
считают, что перфузия отнимает слишком много времени
и применять ее в обычной практике для фиксации более
доступных тканей нецелесообразно. Более подробно
метод перфузии описай в работах Пиза [42], Карлсона
и Шульца [30], Маупсбаха [35—37] и Шульца и Кенза
[50]. ......
40
Глава 2
МЕХАНИЗМЫ ФИКСАЦИИ
Фиксирующие вещества, используемые в
электронной микроскопии (четырехокись осмия, альдегиды,
марганцовокислый калий), применяются обычно в водных
растворах. Величина рН этих растворов поддерживается
на уровне физиологических значений с помощью буфера,
а физиологическое осмотическое давление создается
добавлением некоторых осмотически активных веществ.
Для того чтобы понять, что происходит с тканью в
процессе ее фиксации, необходимо рассмотреть действие
всех веществ, входящих в состав фиксатора.
Некоторые реакции, происходящие между
фиксаторами и составными частями клетки, сейчас уже известны,
однако значительно большее число их остается неясным.
Более того, непонятно, каким образом добавленные
к фиксаторам различные буферные и осмотически
активные вещества могут менять механизмы фиксации.
В целом картина еще весьма фрагментарна, и в этом
направлении требуется выполнить значительный объем
исследований. Ниже кратко изложены некоторые данные
о наиболее изученных механизмах фиксации.
Действие четырехокиси осмия и альдегидов сводится
к образованию поперечных связей между молекулами
клеточных веществ, что приводит к возникновению во
всей клетке прочной сети. Это, во-первых, препятствует
потере веществ, включенных в саму сеть, и, во-вторых,
задерживает или замедляет выход веществ, захваченных
такими молекулярными сетями.
Несомненно, что под действием фиксаторов могут
происходить и происходят реакции других типов, при
этом разные фиксаторы действуют на различные
группы молекул. Обусловленные фиксатором связи могут
формироваться либо между „молекулами самого
фиксатора и компонентами ткани, либо только между
компонентами ткани, реакционные группы которых
демаскируются под влиянием фиксатора [41, 77].
Четырехокись осмия. Как известно, четырехокись
осмия взаимодействует с липидами по месту двойных
связей [9]. Полагают [32, 52], что поперечные связи между
соседними молекулами формируются следующим обра-
Обработка тканей
41
зом:
I О О |
СН •% ^ СН
II + Os + |!
СН ^ V СН
I О О |
Существует предположение, что четырсхокись осмия,
прореагировав по месту двойных связей липидов,
реагирует затем с их полярными группами [45].
Что касается взаимодействия Os04 с белками, то
в этом вопросе ясности еще нет. По-видимому, Os04
способствует образованию поперечных связей между
молекулами белков [26]. Высказывается предположение
о взаимодействии между SH- и SS-группами [9, 10],
а также о взаимодействии между аминогруппами
боковых цепей [47], однако правомочность таких
предположений остается пока под сомнением [27, 41].
Нуклеиновые кислоты и углеводы, вероятно, не
взаимодействуют с четырехокисыо осмия. Однако если
нуклеиновые кислоты связаны с белками, как, например,
в рибосомах или в хромосомах, то они удерживаются
при фиксации белковой части комплекса.
Малорастворимые частицы агрегированного гликогена обычно
удерживаются в ткани молекулярной сетью фиксированных
белков. Небольшие растворимые молекулы, как
правило, не сохраняются.
Альдегиды. Ненасыщенные липиды и фосфолипиды
не стабилизируются при фиксации альдегидами. Если
не проводить дополнительной фиксации
(«постфиксации») в четырехокиси осмия, то эти вещества
растворяются при обезвоживании и не сохраняются в ткани.
Однако альдегиды связывают белки эффективнее, чем
четырсхокись осмия.
Как указывает Пирс [41], между формальдегидом
и белками происходят многочисленные и сложные
реакции. Однако для тех, кто занимается электронной
микроскопией, ( особый интерес представляет протекающая
в два этапа реакция образования поперечной связи в
результате взаимодействия формальдегида и аминогрупп
боковой цепи.
Н—С—Оч о—С—Н
> I >Os< I +11,0.
Н—С—0 х || \о—С—Н
■ I О I
42
Глава 2
Этап 1
Н
I
| —Nil, - IICIIO > | —N—СН2(ОН).
Продукт этой реакции может теперь вступить в реакцию
со второй белковой молекулой посредством образования
«метилеиового мостика».
Этап 2
II Н II Н
I III
| —N—CH2(OH) + Н—К—| > |—N—СИ2—N—| + И20.
Реакции диальдегидов (например, глутаральдегида)
с молекулами белков также сложны и многочисленны.
Сейчас уже нет оснований считать, что в этом случае
одна мономерная молекула глутаральдегида просто
связывает две белковые цепи. Ричарде и Нолис [44]
обнаружили, что в водных растворах глутаральдегнд
существует в форме мономеров, диамеров и даже более
сложных полимеров. При этом в растворе содержится также
значительное количество ненасыщенных альдегидов,
образующихся в результате альдольной конденсации.
В процессе фиксации может участвовать любой вид
этих молекул, что, возможно, и объясняет высокую
связывающую активность глутаральдегидного фиксатора.
Ричарде и Нолис [44] предположили, что образующаяся
прочная и необратимая межмолекулярная связь,
вероятнее всего, возникает в результате реакции с
ненасыщенными альдегидами.
При фиксации в глутаральдегиде цитоплазма
сохраняется значительно лучше, чем при фиксации только
в четырехокиси осмия. Такие органеллы, как
микротрубочки, нити митотичсского веретена и цитомембраны
в яйцеклетках некоторых грызунов, обычно можно
видеть только после глутаральдегидной фиксации. По
своей способности сохранять тонкие клеточные структуры
глутаральдегнд превосходит все другие альдегиды и
является, таким образом, наиболее употребительным
фиксатором.
Формальдегид менее эффективен при фиксации
белков, чем глутаральдегнд, однако его часто применяют
Обработка тканей
43
в тех случаях, когда особенно важно сохранить
активность ферментов в тканях. Карновский [31], Фрэнд
и Фаркер [24] рекомендовали использовать смесь глу-
таральдегида и формальдегида; при этом они исходили
из того, что быстро проникающий в ткань формальдегид
остановит посмертные изменения, а проникший позднее
глутаральдегид завершит формирование
межмолекулярных связей. Шульц и Кейз [50], однако, поставили под
сомнение целесообразность применения формальдегида
(даже в комбинации с глутаральдегидом) в том случае,
когда должна быть достигнута оптимальная
морфологическая сохранность ткани.
Применение формальдегида и других альдегидов
в гистохимических исследованиях ферментов будет
рассмотрено в гл. 8.
Качество фиксации в значительной степени зависит
от чистоты прнменяемых альдегидов. Формальдегидные
фиксаторы необходимо готовить свежими из
порошкообразного параформальдегида; глутаральдегидпые
фиксаторы готовят из специально стабилизированных
растворов, предназначенных для электронной микроскопии
(«Е. М. grade»). Подробнее см. приложение, стр 278—
281.
Двойная фиксация. В настоящее время наиболее
распространенным методом сохранения ткани является
«двойная фиксация», т. е. первичная фиксация в глу-
таральдегиде *с последующей дополнительной
фиксацией в четырехокиси осмия. Этот метод сочетает в себе
преимущества обоих фиксаторов: сохраняется больше
белков, чем при фиксации только в четырехокиси осмия,
а четырехокись осмия в свою очередь стабилизирует
некоторые нейтральные липиды и большую часть фосфо-
липидов.
Марганцовокислый калий (перманганат калия). Пер-
мапганатные фиксаторы (обычно используется
марганцовокислый калий) широко применялись для фиксации
растительных тканей и в меньшей степени для фиксации
животных тканей. В настоящее время эти фиксаторы в
значительной мере вытеснены глутаральдегидом.
Химические процессы, лежащие в основе фиксации
перманганатом, пока еще не совсем ясны. Перманганат,
44
Глава $
как чстырехокись осмия, — окислитель, однако его
воздействие на ткань существенно отличается от
воздействия OsO,j. Бредбери и Мик [13] обнаружили, что при
фиксации псрмапганатом из тканей удаляются РНК
и пистоны. Эти авторы высказали предположение, что
марганцовокислый калий вообще не оказывает никакого
фиксирующего действия, а фиксация на самом деле
проходит в спиртах в процессе последующего
обезвоживания. Результаты экспериментов in vitro, выполненных
Хейком [26], показывают, что если чстырехокись осмия
связывает молекулы белков и стабилизирует их, то пер-
мапганат калия растворяет одни белки и резко
изменяет другие. В ходе дальнейшей обработки ткани теряется
значительная часть клеточных белков и липидов,
наблюдается набухание митохондрий. Некоторое количество
ДНК сохраняется, но скопления хроматина в ядре
неразличимы. Не видны также и рибосомы. Однако фос-
фолипидные мембраны сохраняются очень хорошо;
поэтому исследования, выполненные на тканях,
фиксированных псрмапганатом, внесли существенный вклад
в изучение мембранных структур [51].
Обзоры литературы по перманганатным и другим
металл-содержащим фиксаторам, можно найти в
работах Трампа и Эриксона [55], Хопвуда [29] и Хайата
[27].
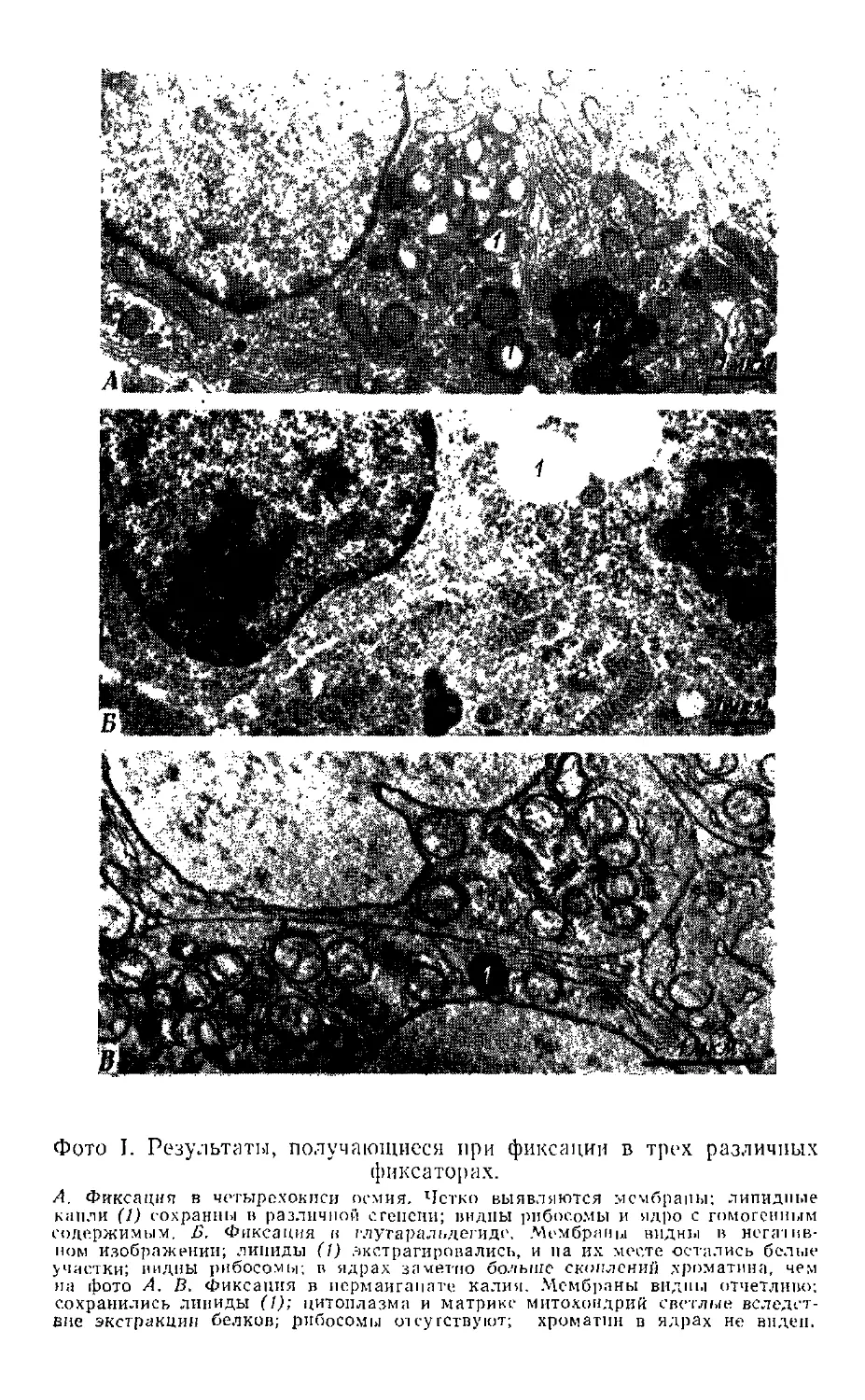
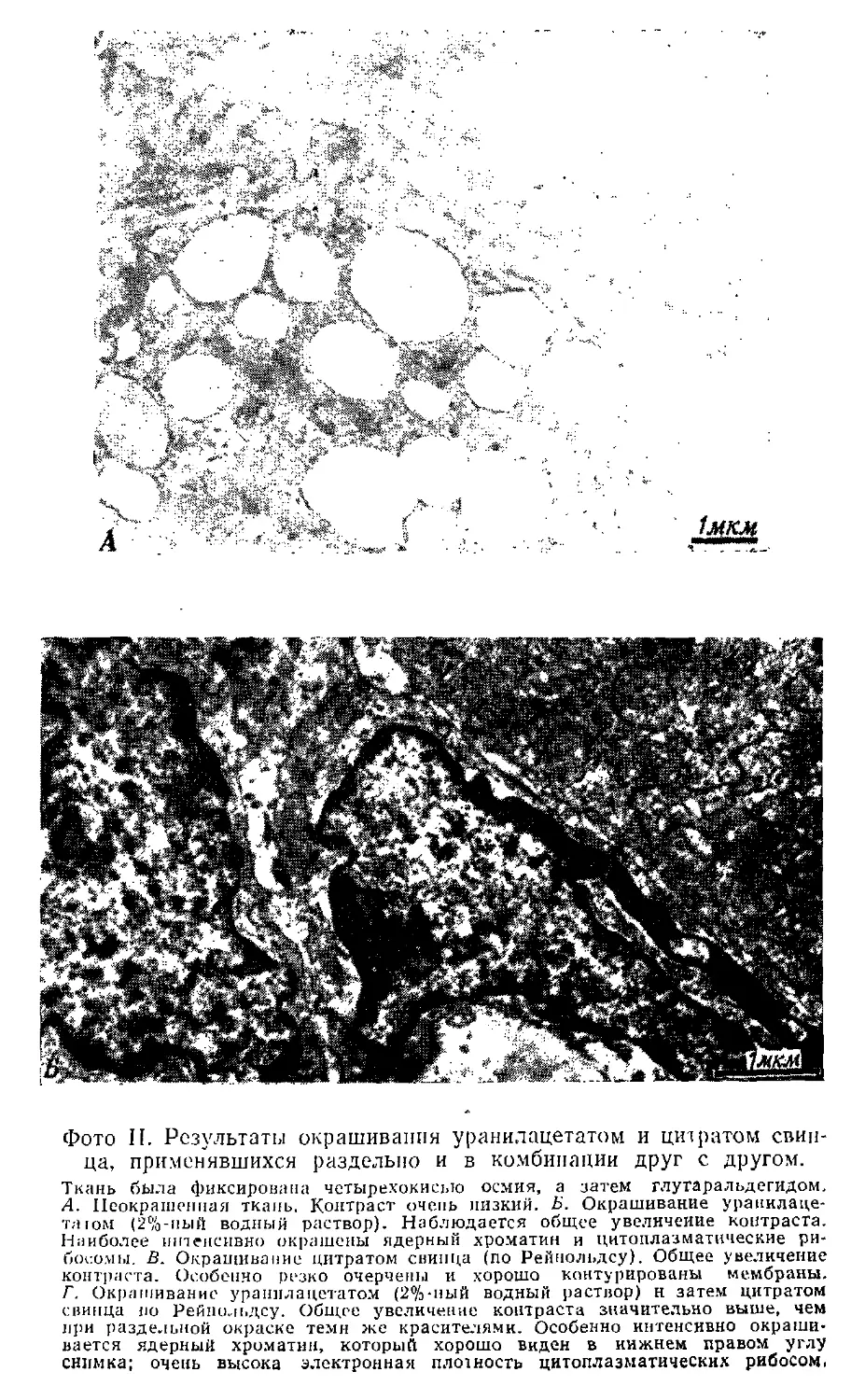
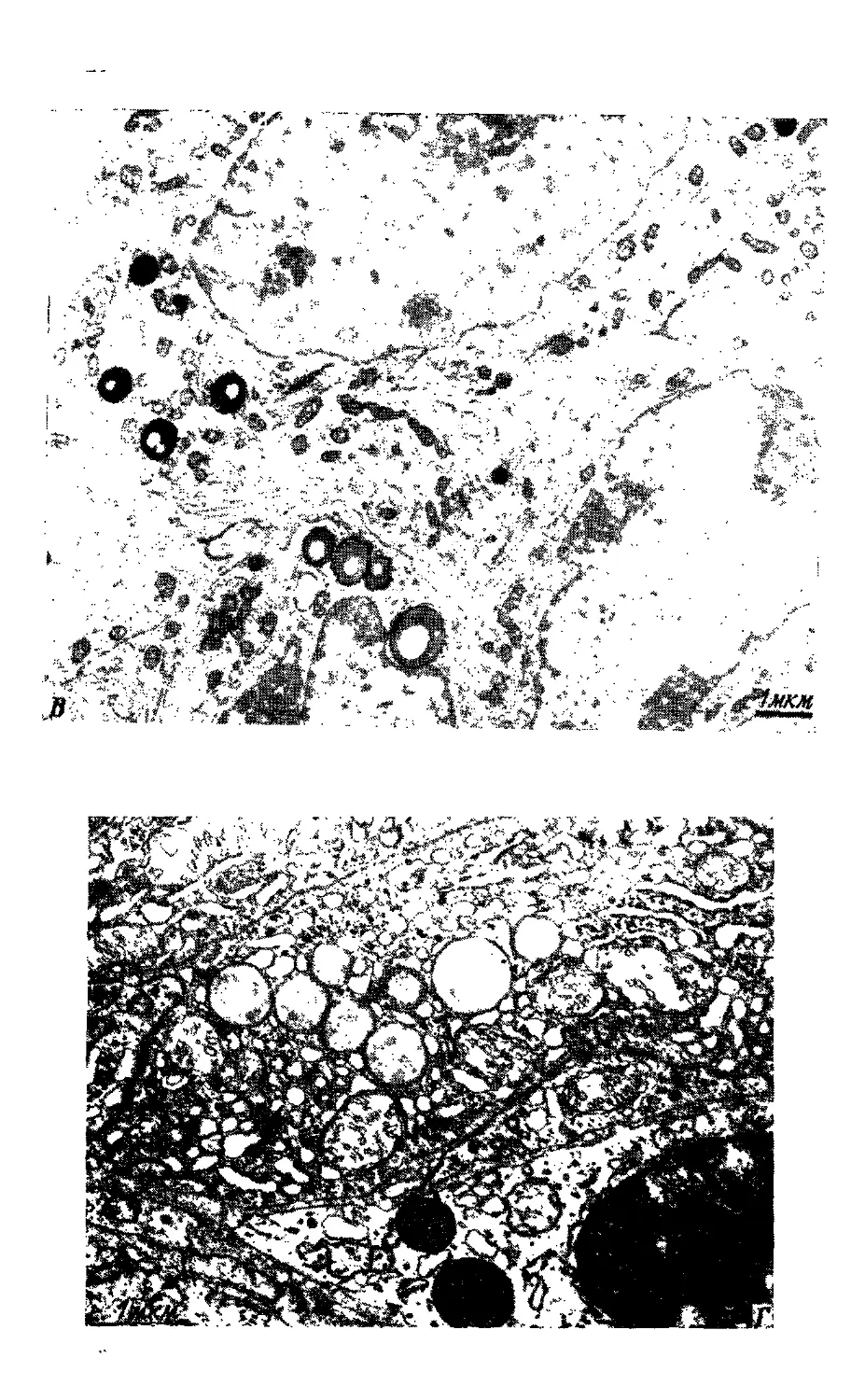
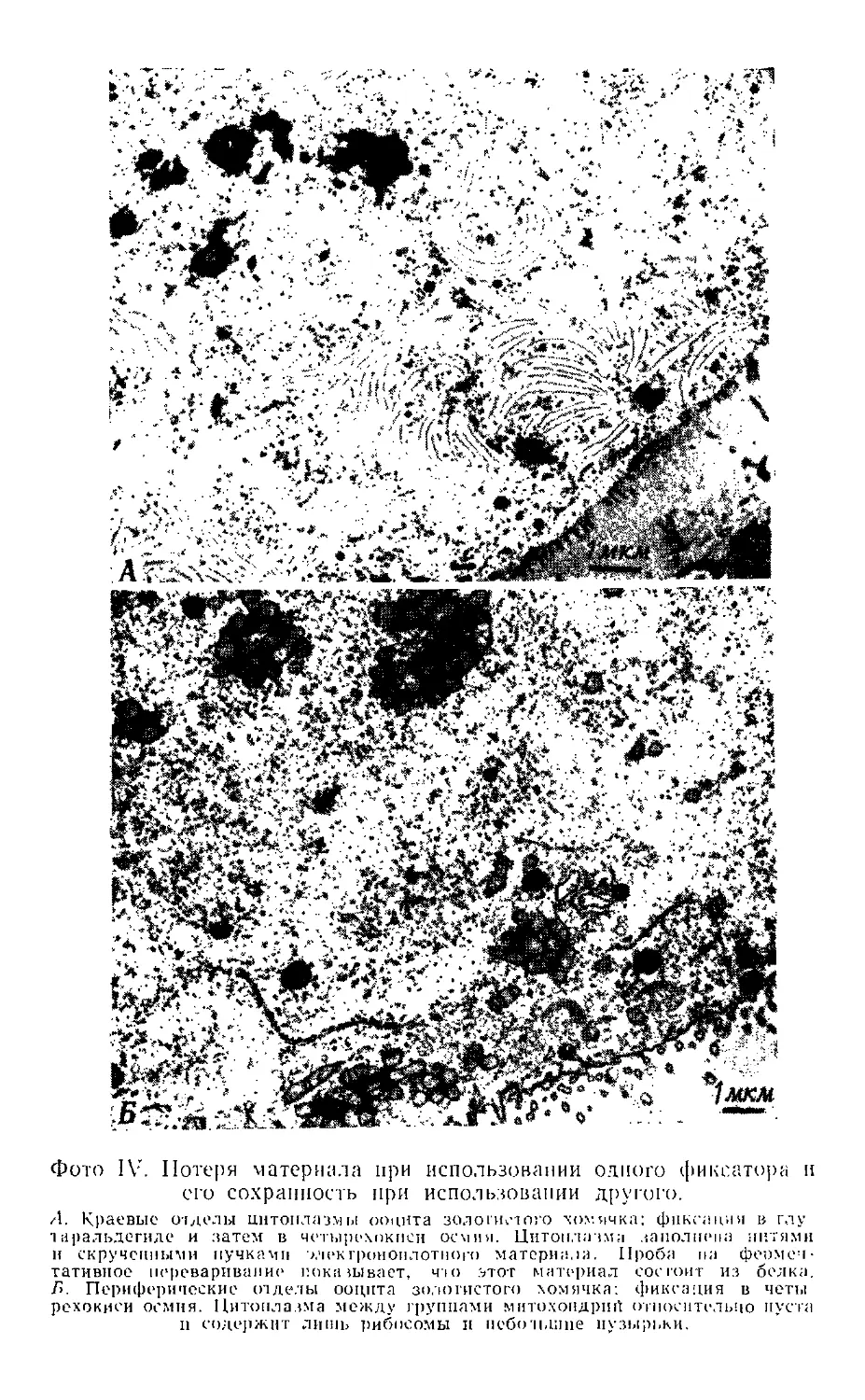
На фото I показаны типичные картины тканей,
фиксированных в трех различных фиксаторах. >
Прописи наиболее часто применяемых фиксаторов
приведены в приложении.
БУФЕРНЫЕ РАСТВОРЫ, ОБЫЧНО ИСПОЛЬЗУЕМЫЕ
ДЛЯ ПРИГОТОВЛЕНИЯ ФИКСАТОРОВ
Веронал-ацетатный буфер. Этот буфер получил
широкое распространение, поскольку он был единственным
буфером, рекомендованным Паладом [39] для
приготовления его оригинального осмиевого фиксатора. Однако
этот буфер непригоден для альдегидных фиксаторов, так
как реакция, происходящая между фиксатором и
буфером, лишает последний буферных свойств.
Обработка тканей
45
Фосфатные буферы. Эти буферы пользуются все
возрастающей популярностью и применяются как с
осмиевыми, так и с альдегидными фиксаторами. Они
представляют собой так называемые «физиологические
буферы», поскольку содержатся в живых системах, не
токсичны, имеют рН 7,4 и характеризуются очень
высокой буферной емкостью. Для приготовления осмиевых
фиксаторов особенно удобно использовать фосфатный
буфер Миллонига, так как он предотвращает вымывание
белков и других веществ в процессе фиксации [38].
Какодилатный буфер. Буфер, содержащий какодилат
натрия, был использован в глутаральдегидном
фиксаторе Сабатини и др. [47]; применяется этот буфер
довольно широко и сейчас. Его успешно используют для
приготовления как. осмиевых, так и альдегидных фиксаторов.
5-Коллидин. s-Коллидин был предложен в качестве
буфера для фиксаторов Беннетом и Люфтом [12],
которые нашли, что применение этого буфера облегчает
резку ткани. Его преимущество состоит также в том, что он
остается стабильным и не подвергается разрушению под
действием бактерий в течение длительного времени. Этот
буфер медленно входил в практику вследствие того, что
в коммерческих препаратах трудно добиться
необходимой степени чистоты, а методы очистки его в
лабораторных условиях крайне трудоемки. Однако в настоящее
время s-коллидин специальной очистки (Е. М. grade)
можно получить в большинстве фирм, поставляющих
материалы для электронной микроскопии.
Прописи нескольких буферных растворов,
содержащих s-коллидии, приведены в приложении.
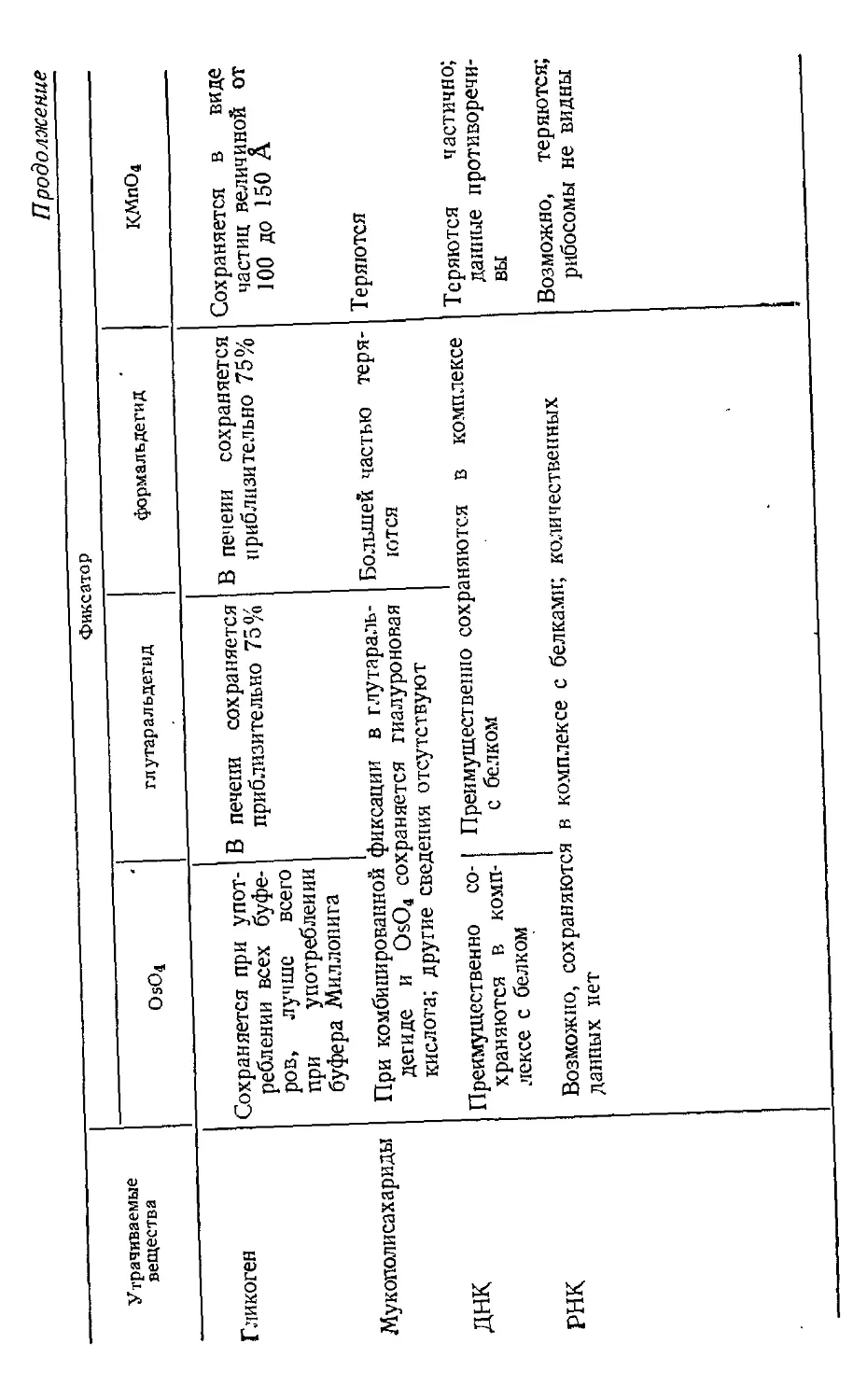
УТРАТА КОМПОНЕНТОВ ТКАНИ
ПРИ ЕЕ ОБРАБОТКЕ
Предпринималось много попыток установить, какие
вещества теряются или сохраняются в процессе
фиксации и обезвоживания ткани. Было использовано
несколько методов на различных тканях и отмечены
существенные колебания в величине потерь. Величина
потерь зависит от многих факторов, в том числе от типа
ткани, фиксатора, времени фиксации, буфера, применяе-
Таблица 3-
Вещества, утрачиваемые тканью в процессе фиксации
и обезвоживания
Утрачиваемые
веще ства
Белки
11снасыще нныс ли-'
пиды
Насыщенные липи-
ды
Фосфолипиды
Фиксатор
Os04
Степень потери
варьирует в зависимости
от используемого
буфера; может
достигать 50%
Теряются частично
Большей частью
теряются
Сообщалось, что
теряется от 10 до 30%
глутаралъдегид
Связывает большее
число молекул, чем
Os04 или
формальдегид; буфер играет
менее важную роль.
Все же некоторая
потеря имеет место
Час гичцо сохраняются
при фиксации,
однако теряются при
обезвоживании
Большей частью
теряются
Сохраняются при
фиксации, однако
теряются при
обезвоживании
формальдегид
Степень потери
варьирует в зависимости
от типа ткани; в
одной работе
сообщалось о потере 4—
12%
Частично сохраняются
при фиксации,
однако затем теряются
при обезвоживании
Большей частью
теряются
Частично сохраняются
при фиксации,
однако теряются при
обезвоживании
КМпОд
Преимущественно
теряются тканью
Теряются главным
образом при
обезвоживании
Большей частью
теряются
Фиксируются прочно,
обнаруживаются фос-
фолипопротеидные
комплексы. Около
25% теряется при
обезвоживании.
Продолжение
Утрачиваемые
вещества
Гликоген
Мукополисахариды
ДНК
РНК
Фиксатор
Os04
глутаральдегид
формальдегид
Сохраняется при упот- В печени сохраняется В печени сохраняется
реблении всех буфе- приблизительно 75% приблизительно 75%
ров, лучше всего
при употреблении
буфера Миллонига
При комбинированной фиксации в глутараль- Большей частью теря-
дегиде и Os04 сохраняется гиалуроновая ются
кислота; другие сведения отсутствуют
Преимущественно со- Преимущестпенпо сохраняются в комплексе
храняются в комп- с белком
лексе с белком
Возможно, сохраняются в комплексе с белками; количественных
данных нет
КМп04
Сохраняется в виде
частиц величиной от
100 до 150 А
Теряются
Теряются частично;
данные
противоречивы
Возможно, теряются;
рибосомы не видны
48
Глава 2
мого при фиксации и промывке ткани. Обзоры
литературы по этим вопросам приведены в работах Хопвуда
[29] и Уильямса [58].
К сожалению, вполне может оказаться, что
вымываются наиболее важные с физиологической точки зрения
компоненты клетки, многие из которых растворимы. Так,
могут быть полиостью утрачены легко диффундирующие
ионы натрия. Почти полностью неизвестно влияние
фиксаторов на электростатически связанные ионы. Таким
образом, то статичное изображение клетки, которое мы
видим на микрофотографии, дает нам в лучшем случае
лишь слабое представление о клеточной динамике.
Потеря веществ может происходить также при
пропитывании и заливке ткани, хотя пока еще этому
вопросу посвящено очень мало работ.
В табл. 3 сделана попытка в самой общей форме
суммировать некоторые из имеющихся в нашем
распоряжении сведений.
ОСМОТИЧЕСКОЕ ДАВЛЕНИЕ
Поскольку термин «осмотическое давление»
постоянно появляется в электронно-микроскопической
литературе, будет полезно кратко его обсудить. Приведем
несколько относящихся к этому вопросу определений.
Один моль — количество граммов вещества,
численно равное его
молекулярному весу. Например,
молекулярный вес гидрата окиси натрия
(NaOH) составляет 40 единиц
массы атома (углеродных
единиц); следовательно, 1 моль
этого вещества эквивалентен 40 г.
Молярный раствор — раствор, содержащий 1 моль
растворимого вещества в 1 л
раствора. Например, 40 г NaOH
растворяют в воде, а затем объем
раствора доводят до 1 л.
Моляльный раствор — 1 кг раствора, содержащего
1 моль растворенного вещества.
Цели раствор очень сильно раз-
Обработка тканей
49
бавлен, объем растворенного
вещества не принимается во
внимание. Следовательно, поскольку
1 кг воды занимает объем,
равный 1 л, моляльная
концентрация считается равной молярной
концентрации, если используют
разбавленные водные растворы.
Молярность вещества в растворе=молярной
концентрации (М)=числу граммов вещества в 1 л
раствора, деленному на его молекулярный вес.
Общая молярность раствора равна сумме отдельных
молярных концентраций растворенных веществ.
Если два раствора разной молярности разделены
полупроницаемой мембраной, через которую проходит
вода, но не проходят частицы растворенного в ней
вещества, то вода будет переходить через мембрану в более
концентрированный раствор до тех пор, пока не будет
достигнуто равновесие, т. е. пока молярности растворов,
находящихся по обеим сторонам мембраны, не станут
равны. Это явление называют осмосом. Давление,
которое должно быть приложено к раствору с более высокой
концентрацией для того, чтобы предотвратить
проникновение в него воды, равно разнице между осмотическими
давлениями данных растворов. В качестве единиц
осмотического давления обычно используют осмоль или мил-
лиосмоль.
Если исходные молярности двух растворов,
разделенных полупроницаемой мембраной, равны, то вода не
переходит из одного раствора в другой; иными словами,
эти растворы находятся в состоянии равновесия.
Биологи часто называют такие растворы изоосмотическими.
Эта относительно простая картина значительно
усложняется в том случае, если молекулы растворенного
вещества диссоциируют, образуя в растворе заряженные
частицы, или если вещество имеет ионную природу
(соли). Сильные кислоты и основания, а также все
водорастворимые соли диссоциируют полностью, так что
число частиц в растворе увеличивается, пропорционально
числу частиц, образовавшихся в результате диссоциации.
Так, 1 моль хлористого натрия (NaCl) дает в растворе
50
Глава 2
1 моль ионов натрия (Na+) и 1 моль ионов хлора (С1~),
что в целом составляет 2 моля частиц. Однако
осмотическое давление раствора электролита, как правило,
меньше, чем можно было бы ожидать исходя из
концентрации частиц, что обусловлено электрическими
взаимодействиями между ионами и другими явлениями. Так,
например, осмотическое давление 0,1 М раствора КаС1
на 7°/о ниже ожидаемого.
Концентрация частиц в растворе равна молярной
концентрации растворенного вещества, умноженной на
число частиц, образующихся при диссоциации каждой
молекулы. Общую концентрацию частиц в растворе
часто называют «осмотичностыо» или «осмотической
концентрацией», полагая при этом, что концентрация частиц
пропорциональна осмотическому давлению. Однако, как
указывал Дик [18], такое предположение ошибочно,
потому что в растворе молекулы и ионы
взаимодействуют друг с другом, как это упоминалось выше.
Как бы то ни было, степень снижения точки
замерзания раствора растворенным веществом
непосредственно зависит от осмотического давления этого раствора,
так что осмотическое давление раствора довольно точно
можно определить по понижению точки замерзания
раствора. Один моль неэлектролита, растворенный в 1 кг
воды, снижает точку ее замерзания на 1,86°С. Для
определения осмотического давления (осмотичности)
любого водного раствора, исходя из точки его замерзания,
используют простое уравнение. Например, осмотическое
давление раствора, у которого снижение точки
замерзания составляет 0,279СС, равно (0,279/1,86) =0,15 осмоля.
Более подробно этот вопрос рассмотрен в работе Дика
[18]-
Однако точно предсказать, какое влияние на клетки
той или иной ткани будет оказывать осмотическое
давление раствора, невозможно, даже если это давление
тщательно вычислено с помощью криоскопического
метода. Биологические мембраны нельзя назвать
полупроницаемыми в полном смысле этого слова.
Плазматическая мембрана, окружающая клетку, не пассивна: до
известной степени она может выбирать, какие ионы
и соответственно какое количество воды впустить в клет-
Обработка тканей
Si
ку или выпустить из нее. Вещества, поглощенные
клеткой, могут быть изолированы от других клеточных
компонентов с помощью внутриклеточных мембран,
структура которых различна у разных органелл.
Жидкость, входящая в состав цитоплазмы или
заключенная в различных внутриклеточных отсеках и органел-
лах, содержит помимо солей также и белки.
Осмотические свойства раствора, содержащего соли и белки, сильно
отличаются от осмотических свойств раствора,
содержащего одни лишь электролиты. К тому же состав
внутриклеточной жидкости в клетках разных типов может
быть очень различен и может изменяться в каждой
отдельной клетке в зависимости от ее функционального
состояния.
Короче говоря, биолог сталкивается с
исключительно сложной ситуацией. Практически он рассматривает
ее, используя эмпирические термины. Такие слова, как
«изотонический», «гипертонический» и «гипотонический»,
он употребляет для того, чтобы описывать действие этих
растворов на клетки и ткани.
Изотонический раствор — раствор, в котором клетки
сохраняют объем, свойственный им в живой ткани.
Гипертонический раствор — раствор, в котором
происходит сморщивание клеток.
Гипотонический раствор — раствор, в котором
происходит набухание клеток.
Осмотическое давление плазмы крови составляет
приблизительно 0,3 осмоля; это давление является
изотоническим для большинства клеток млекопитающих.
Таким же действием обладает 0,16 М раствор
хлористого натрия (т. е. физиологический 0,9%-н.ый солевой
раствор). В связи с этим на основании определения точки
замерзания было получено множество растворов,
близких по своим осмотическим свойствам к плазме крови,
которые применяются для промывки живой ткани.
Однако другие изотонические растворы были просто
составлены так, чтобы общая концентрация частиц в них
составляла 0,3 М.
Результаты опытов по измерению осмотичпости
внутри клеток (обзор их сделан Диком [18]) показали, что
осмотическое давление плазмы крови служит надеж-
4*
52
Глава 2
ным стандартом внутриклеточного осмотического
давления.
Положение значительно осложняется, когда тот или
иной раствор употребляется для фиксации ткани.
Идеальный фиксатор не должен вызывать при фиксации ни
сморщивания, ни набухания клеток. По вопросу о том,
что важнее — общая концентрация всего фиксирующего
раствора или концентрация среды, в которой
растворено фиксирующее вещество, — существуют разные
мнения (ср., например, [37] и [57]). Вообще же слишком
часто остается без внимания наиболее важный и
малоизученный вопрос, а именно что происходит с клеточной
мембраной, когда на нее воздействуют молекулы
фиксатора. В обычном состоянии клеточная мембрана
обладает свойством избирательной проницаемости для
определенных ионов. Точно не известно, как долго сохраняется
эта избирательность после взаимодействия с
различными фиксирующими веществами и средами, в которых они
растворены. Данные опытов Элберса [19]
свидетельствуют о том, что под воздействием ряда осмиевых
фиксаторов клеточные мембраны некоторых яйцеклеток в
течение нескольких секунд становятся полностью
проницаемыми для ионов. При использовании глутаральде-
гида проницаемость изменяется медленнее.
Палад [39] показал, что при фиксации осмиевыми
фиксаторами в ткань сначала проникает среда, в
которой растворено фиксирующее вещество, а затем — более
тяжелые молекулы четырехокиси осмия. Поскольку
именно четырехокись осмия является веществом,
стабилизирующим (т. е. фиксирующим) составные части клетки,
возможно, что повреждение клеток вызывает среда, если
она поступает в ткань раньше молекул фиксатора.
И в самом деле, эмпирически было показано, что при
употреблении осмиевых фиксаторов качество фиксации
в значительной степени зависит от используемого
буфера [20, 55, 59]. Обычно при работе с наиболее
распространенными осмиевыми фиксаторами
концентрацию частиц в среде повышают приблизительно до 0,3 М
за счет добавления сахарозы [16] или глюкозы [38].
Что касается таких фиксаторов, как формальдегид
и глутаральдегид, то они представляют собой низкомо-
Обработка тканей
83
лекулярные вещества, и нет основания полагать, что
среда, в которой они растворены, первой проникает
в ткань. Не исключено при этом, что употребляемый в
этих фиксаторах буфер обусловливает меньшую
разницу в качестве фиксации, чем буфер, применяемый в
осмиевых фиксаторах. 4°/о-ные растворы этих/альдегидов,
наиболее часто используемые для фиксации, являются
гипертоническими. 4%-ный раствор глутаральдегида
соответствует 0,4 М раствору, и 4%-ный раствор
формальдегида"— 1,3 М; к этим величинам, конечно, следует
добавить величину концентрации среды, в которой
растворены используемые вещества. Как бы то ни было,
применение таких концентраций позволяет получить
хорошие результаты при фиксации. Для лучшей
сохранности ультраструктур Сабатини н др. [47] рекомендовали
добавлять сахарозу к фиксаторам, содержащим
формальдегид.
К неожиданным результатам часто приводит
употребление гипертонических растворов. Например, Бёргос
и др. [14], изучая влияние концентрации альдегидных
фиксаторов на ультраструктуры, обнаружили, что при
использовании высоких концентраций набухание
митохондрий наблюдается чаще, чем их сморщивание.
Несмотря на то что осмотическое давление 0,5 М раствора
мочевины выше, чем осмотическое давление плазмы
крови, воздействие этого раствора вызывает набухание
клеток [18].
Если применяют метод двойной фиксации, например
фиксируют сначала глутаральдегидом и затем осмием,
то, как показывает практика, наиболее
целесообразно использовать один и тот же буфер для обоих
фиксаторов. Однако это делается далеко не всегда, и
поэтому трудно оценить все «за» и «против». Спорным
является также вопрос о том, необходимо ли отмывать
первый фиксатор перед последующей фиксацией в
осмии. Если ткань промывают, то неизвестно, каким
должно быть осмотическое давление буферного раствора,
используемого для промывки: должно ли оно
соответствовать осмотическому давлению первого фиксатора
(который часто бывает гипертоническим), или
осмотическому давлению второго, осмиевого фиксатора, или же
54
Глава 2
надо выбирать какое-то произвольное промежуточное
его значение. Конечно, в любом случае следует
соблюдать основное условие — как можно меньше повреждать
ткань в процессе ее обработки, но, каким образом это
лучше сделать, ученые, по-видимому, к единому мнению
еще не пришли. Фаимп и Дрохмапс [22] считают, что
наилучшие результаты получаются при использовании
для промывки ткани умеренно гипертонических
растворов.
Как довести концентрацию буфера приблизительно
до 0,3 М, указывается в приложении на стр. 283.
Подводя итог, можно сказать, что еще очень мало
известно о том, какое влияние оказывают различные
системы фиксатор — буфер на молекулярный состав
и ионную концентрацию внутри клетки. Пока что
каждый, кто занимается электронной микроскопией, стоит
перед необходимостью решать, какой способ фиксации
исследуемой им ткани даст лучшие результаты, и в
любом случае выбор окажется в значительной степени
случайным.
Более подробно эти вопросы освещены в работах Мо-
унсбаха [35—37], Карлсона и Шульца [3, 30], Шульца
и Карлсона [49], Тахмизяпа [53], Бёргоса и др. [14],
Элберса [19]: и особенно в обзорах Трампа и Эриксона
[55], Хопвуда [29] и Хайата [27]!.
ОБЕЗВОЖИВАНИЕ И ЗАЛИВКА
Для того чтобы приготовить из фиксированной ткани
достаточно топкие для электронной микроскопии срезы,
необходимо пропитать эту ткань материалом для
заливки, который будет ее поддерживать и сведет к
минимуму повреждения при резке. Среды для заливки,
наиболее часто применяемые в электронной микроскопии, не
смешиваются с водой. Следовательно, для того чтобы
ткани полностью пропитались заливочной средой, вода
в ткани должна быть замещена каким-либо веществом,
способным смешиваться с заливочной средой. Для этой
цели использовали различные обезвоживающие
вещества, в том числе ацетон и метанол, однако сейчас пришли
Обработка тканей
55
к единому мнению, что этиловый спирт (этанол)
удаляет воду из ткани, наименее повреждая ее. Однако,
поскольку спирт растворяет липиды, обезвоживание нужно
проводить очень быстро, чтобы избежать вымывания лич
ппдеодержащих компонентов клетки.
Если из фиксатора ткань сразу же перенести в
100%-ный этанол, то могут возникать механические
повреждения вследствие изменения поверхностного
натяжения и токов, образующихся при смешивании этих
жидкостей. Для уменьшения повреждений ткань
«проводится» по ряду спиртов возрастающей концентрации,
скажем 70, 90 и 100%. Это легко сделать, отсасывая
пипеткой или сливая одну жидкость и заменяя ее другой.
Обычно оказывается достаточным десятиминутное
пребывание ткани в каждом из спиртов указанной выше
концентрации с последующей пятнадцатиминутной
обработкой в двух сменах 100%-ного («абсолютного»)
этанола. Обезвоживание проходит лучше, если во время
этой процедуры сосуды с тканью и спиртами поместить
па медленно вращающийся диск.
Если среда, используемая для заливки, смешивается
с этанолом, то сразу же после обезвоживания ткань
можно перенести в эту заливочную среду. В противном
случае ткань нужно обработать какой-либо жидкостью,
которая смешивается как с этанолом, так и с
заливочной средой. Когда для заливки применяют эпоксидные
смолы, то в качестве такой промежуточной среды
используют эпоксипронап (проннленоксид), в двух-сменах
которого ткань достаточно обработать в течение 5 мин.
Затем ткань переносят в небольшой пластиковый сосуд,
содержащий неполимеризованную заливочную среду.
Для того чтобы не повредить ткань, пинцет, которым ее
переносят, следует сначала окунуть в среду для заливки,
при этом на конце пинцета останется небольшая
капелька. Ткань подхватывают этой капелькой и переносят,
фактически даже не дотрагиваясь до нее пинцетом.
В неполимеризованной заливочной среде ткань
должна находиться до-тех пор, пока среда полностью не
пропитает ее. При комнатной температуре для этого обычно
достаточно нескольких часов пли ночи. Когда
пропитывание закончится, ткань переносят в свежую заливочную
56
Глава 2
среду, налитую в какой-либо сосуд, где должна
происходить окончательная полимеризация. Как правило, для
этой цели используют желатиновые и полиэтиленовые
капсулы или специальные формочки для заливки.
Размеры и форма пластмассового блока, получаемого при
заливке в капсулах, соответствуют объектодержателю
микротома. Капсулы или формочки помещают в
термостат (обычно при температуре 60 °С), где в присутствии
соответствующего катализатора происходит
полимеризация (затвердение) заливочной среды. Полимеризацию
некоторых заливочных сред (метакрилатов) лучше
проводить в холодной комнате, используя ультрафиолетовое
излучение в качестве агента, вызывающего
полимеризацию.
ТИПЫ ЗАЛИВОЧНЫХ СРЕД
Для того чтобы электронный луч прошел сквозь срез
ткани, толщина этого среза не должна превышать
1000 А (0,1 мкм). Используя обычные гистологические
среды, например парафин, получить такие тонкие срезы
невозможно. Именно поэтому в самые первые годы
развития электронной микроскопии особое внимание было
уделено поискам подходящего для заливки материала.
Метакрилаты. Первым заливочным материалом,
нашедшим широкое применение в практике электронной
микроскопии, был бутилметакрилат [70]. Это вещество
представляет собой акриловый пластик, близкий по
своему химическому составу к перспексу1. Позднее
обнаружили, что при смешивании бутил- и метилметакрилатов
в различных соотношениях можно получить заливочные
.среды соответствующей степени твердости или мягкости-,
которые позволяют резать различные ткани на срезы
толщиной 500 А и менее--
Большая часть ранних поисковых исследований
в электронной микроскопии была выполнена на тканях,
залитых в метакрилаты. Сморщивание ткани при поли-
1 Принятое в Англии торговое название акрилового пластика,
сходного с органическим стеклом (плексигласом}. — Прим. перев.
Обработка Тканей
St
меризации метакрилатов часто достигает 20%, а сам
процесс полимеризации может проходить неравномерно,
что сопровождается повреждением ткани. Если не
принять специальных мер предосторожности, то вокруг
ткани могут собраться пузырьки воздуха. Срезы
заключенной в метакрилат ткани могут перемещаться под
воздействием электронного луча (так называемое термальное
смещение). Электронный луч способствует также
испарению (возгонке) метакрилата; это увеличивает
контрастность объекта, но вызывает также и загрязнение
микроскопа. Кроме того, метакрилатные срезы довольно
хрупки и не выдерживают давления электронного луча,
если металлическая сетка, на которой монтируются
срезы, не покрыта тонкой пленкой коллодия или формвара.
Это, конечно, увеличивает толщину материала, через
который проходит электронный луч, и снижает
разрешающую способность.
Эпоксидные смолы. В середине 50-х годов Глауэрт
и др. [63, 64] предложили в качестве заливочной среды
для электронной микроскопии использовать аралдит,
а Кушида [68] и Финк [61]—эпон. Применение этих
эпоксидных смол позволило решить ряд проблем,
которые возникали при заливке в метакрилаты. В
значительной степени уменьшилось сморщивание и
повреждение ткани при полимеризации, перестало быть
проблемой образование воздушных пузырьков внутри блока.
Скорость испарения эпоксидных смол под воздействием
электронного луча очень незначительна. Срезы тканей,
заключенных в эпоксидную смолу, достаточно прочны,
и их можно монтировать на сетках без опорной пленки.
В настоящее время аралдит или эпон служат
обычными заливочными средами в большинстве
лабораторий. Становятся особенно популярными различные
смеси этих двух эпоксидных смол [69].
Полиэфирные смолы. Эти заливочные среды
обладают преимуществами эпоксидных смол в том смысле, что
полимеризация их протекает однородно, сморщивание
ткани при этом незначительно. Широко применяется
лишь одна из них — вестопал W [71]. Блоки из вестопа-
ла W режутся довольно трудно, тем не менее Шёстранд
[80] рекомендует использовать эту смолу в тех случа-
58
Рлава 2
ях, когда необходимо получить высокое разрешение,
поскольку скорость ее испарения при действии
электронного луча очень невелика, вследствие чего деформация
компонентов ткани, возникающая в результате возгонки
заливочного материала, сводится к минимуму.
Более подробные данные о водонерастворимых
заливочных средах приводятся в статье Вахтеля и др. [73].
Водорастворимые заливочные среды. В том случае,
когда заливочная среда растворима в воде, нет
необходимости удалять всю воду из тканей. Обычно достаточно
того обезвоживания, которое происходит при
проведении ткани по заливочным средам возрастающей
концентрации. Заключенная и порезанная ткань может
окрашиваться или подвергаться цитохимическим реакциям,
которые невозможно применять при заливке в водонерас-
творимые среды- Из всех изученных водорастворимых
сред—аквона [62], дуркупана [72], гликольметакрила-
та [65] и оксипропилметакрилата [66] — по-видимому,
наиболее пригоден гликольметакрилат.
Более подробное указание по применению гликоль-
метакрилата приводится в гл. 8, а пропись его
приготовления и употребления — на стр. 290—291
приложения.
ВЛИЯНИЕ ЗАЛИВОЧНОЙ СРЕДЫ НА ТКАНЬ
Ни одна из заливочных сред не является химически
инертной, в связи с чем необходимо учитывать их
возможное влияние на ткань. О воздействии па ткань
различных фиксаторов написано очень много, тогда как
о влиянии на ткань разных заливочных сред известно
мало. Эта ситуация отражает недостаток твердо
установленных фактов о таких влияниях и явно
свидетельствует о необходимости проведения значительно большего
числа исследований в этой" области. Метакрилаты
обладают способностью быстро испаряться под действием
электронного луча; при этом из ткапи улетучиваются
некоторые вещества, и особенно белки. Использование
эпоксидных и полиэфирных смол позволило частично
устранить этот недостаток. Было показано, что
мономеры эпона, аралдита и метакрилатов растворяют жиры.
Обработка тканей
59
При обезвоживании ткани, фиксированной альдегидом,
в водорастворимых заливочных средах возрастающей
концентрации (как это часто и делается) происходит
экстракция гликогена [66], а липидные компоненты
ткани теряются, если процедуру обезвоживания не
проводить при температуре, равной примерно —20°С [60].
ВАЖНОСТЬ СТРОГОГО СОБЛЮДЕНИЯ
ПРИНЯТОЙ МЕТОДИКИ ОБРАБОТКИ ТКАНИ
Мы рассмотрели методы обработки ткани,
применяемые в электронной микроскопии. Из всего сказанного
ясно, что мнения различных авторов относительно
времени и температуры фиксации, величины рЫ и
осмотического давления фиксатора, наилучших способов
обезвоживания и заливки ткани в значительной степени
расходятся. Ясно также, что с момента выбора
экспериментального животного и до просмотра ультратоиких срезов
в микроскопе перед исследователем встает пугающее
множество различных вариантов фиксации,
обезвоживания и заливки. В идеальном случае ткань, выбранную
для исследования, следовало бы вначале изучить в серии
строго контролируемых экспериментов, с тем чтобы
точно установить, как тот или иной вариант влияет на ее
ультраструктуру. На практике это делается редко;
исключение составляют лаборатории, специально
занимающиеся именно этими проблемами. Обычно же
какой-то определенный метод обработки ткани
принимается просто потому, что он хорошо зарекомендовал
себя в работе другого специалиста, проводившего
сходные исследования.
Отсутствие единого мнения относительно
«наилучшего» метода обработки ткани вовсе не означает, что мы
можем пренебрегать какими-либо деталями' методики
или не соблюдать продолжительности отдельных ее
операций. Лучшим способом добиться того, чтобы
возможные варианты методов не свели на нет ценность ваших
наблюдений, является стандартизация принятой
методики. Уж если для обработки данной ткани было решено
использовать какой-то метод, то его следует строго
придерживаться. В этом случае достигается стандартизация
60
Глава 2
различных вариантов метода, что дает возможность
сравнивать ткани, обработанные в разное время в
процессе данного исследования. Любые изменения уже
принятой методики оправданы только тогда, когда их
вносят с целью получить дополнительные данные об
исследуемой ткани, а не потому, что приближается обеденный
перерыв. Если в методику вносят изменения, то их
необходимо тщательно записать, и о них надо помнить,
анализируя полученные микрофотографии.
СХЕМА ОБРАБОТКИ ТКАНИ, РЕКОМЕДУЕМАЯ
ДЛЯ ТЕКУЩЕЙ РАБОТЫ
Приводимая ниже схема обработки ткани успешно
применяется в нашей лаборатории в течение многих лет.
Подробные прописи используемых фиксаторов,
буферных растворов, заливочных сред и окрасок можно найти
в приложении.
/. Подготовка к обработке ткани.
а) Проверьте все прописи методик, которые вы
будете использовать при обработке ткани, и подберите
необходимые вещества и посуду. Приготовление
фиксаторов, буферов, растворов для обезвоживания и
заливочных сред должно быть закончено задолго до взятия
ткани у животного. Составьте приблизительное
расписание, чтобы руководствоваться им во время работы. Если
фиксацию надо проводить при 0СС, отведите время,
необходимое для охлаждения растворов на ледяной бане
до нужной температуры.
б) Приготовьте необходимые растворы и среды.
в) Соберите материалы, необходимые для обработки
ткани: инструменты для препаровки, бритвенные лезвия
для измельчения ткани, пластинку с ровной и чистой
поверхностью (например, пластинку зубоврачебного воска)
для измельчения ткани, широкие пастеровские пипетки
для переноса ткани или отсасывания фиксатора,
небольшие пузырьки (снабженные соответствующими
этикетками), в которых ведется фиксация н обезвоживание, и
формочки для заливки пли капсулы. Пузырьки должны
быть очень тщательно вымыты, особенно если
применяются осмиевые фиксаторы, так как остатки органических
Обработка тканей 61
веществ будут восстанавливать осмий и снижать
эффективность фиксатора.
г) Включите термостат и установите требуемую
температуру (обычно 60СС).
2. Взятие ткани. У животного под нембуталовым
наркозом (0,1 мл 5%-ного раствора на .100 г веса
животного; вводится внутрибрюшинно) ткань берут, как было
описано выше.
3. Фиксация. 2—4%-ный забуференный раствор глу-
таральдегида, 4 ч.
4. Промывка. Удалите фиксатор с помощью
пастеровской пипетки и замените его буферным раствором.
Можно также аккуратно слить фиксатор (в бюкс, а не прямо
в раковину, куда вместе с жидкостью можно вылить
кусочки ткани!). Для промывки используйте тот же самый
буферный раствор, что и в фиксаторе, повысив его
молярную концентрацию приблизительно до 0,3 М с
помощью сахарозы или глюкозы. Промывайте по меньшей
мере 30 мин в трех сменах буферного раствора1.
5. Дополнительная фиксация. 1%-ный раствор четы-
рехокиси осмия [38], 1 ч.
6. Промывка. Сполосните в двух сменах фосфатного
буфера Миллоннга или дистиллированной воды.
7. Обезвоживание. Этиловый спирт (этанол) по
следующей схеме:
70%-ный— 10 мин
90°/0-ный — 10 мин
100°/о-нын— 10 мин
100%-ный — две смены по 15 мин
(100%-ный, безводный, спирт должен храниться перед
употреблением на обезвоженном силикагеле).
Эпоксипропап (окись пропилена)—две смены в
течение 5 мин (общее время обезвоживания — 65 мин)2.
1 Сабатини и др. [47] сообщали, что ткань можно хранить в
буферном растворе при 4 РС в течение нескольких месяцев. Однако
теперь это не рекомендуется, поскольку точно не установлено, какие
вещества могут утрачиваться в течение такого длительного хранения.
2 Столь короткое время обезвоживания, по-видимому,
непригодно при фиксации и заливке растительных объектов, — Прим. ред.
62
Глава 2
8. Пропитывание. Поместите ткань в заливочную
смесь аралдпта и оставьте на ночь при комнатной
температуре.
9. Заливка. Перенесите ткань в свежую заливочную
смесь аралдпта, разлитую в капсулы или формочки для
заливки, и поместите в термостат на 24 ч при
температуре 60 СС. Если пользуются капсулами, то в каждую
капсулу помещают один кусочек ткани, затем капсулы
размещают в специальных подставках в вертикальном
положении, с тем чтобы кусочки осели на дно капсул.
10. Заточка. Заточите полимеризованный блок, как
указано в гл. 3.
11. Резка и окраска.
а) Срезы толщиной 1 мкм для ориентировки и
исследования помещают на предметное стекло и быстро
окрашивают метиленовым синим с бурой1.
б) Ультратонкие срезы для электронной
микроскопии помещают на сетки и окрашивают водным
раствором уранилацетата и затем цитратом свинца по Рен-
нольдсу.
После этого материал готов для просмотра в
электронном микроскопе.
Список литературы
Посмертные изменения тканей
1. А1 АггаЫ Н. Т., Steward P. J., The effect of various forms of
euthanasia on the histochemically demonstrable activities of
lysosomal enzymes, Proceedings of the Microscopical Society, 5, 13—14
(1970).
2. Ho S., In The Interpretation of Ultrastructure, Vol. 1, pp. 129—148
(Edited by R. J. С Harris), New York, Academic Press, 1962.
3. Karlsson U., Schultz R. L., Fixation of the central nervous system
for electron microscopy by aldehyde perfusion. III. Structural
changes after exsanguination and delayed perfusion, Journal of Ultra-
structure Research, 14, 47—63 (1966).
4. Malhotra S. K., In Cell Structure and its Interpretation, pp. 381—
391 (Edited by S. M. McGee-Russell and K. F. A. Ross), London,
Edward Arnold, 1968.
1 Во многих лабораториях для изучения таких толстых срезов
используется фазово-коптрастный микроскоп. — Прим. ред.
Обработка тканей
63
5. Sjostrand F. S., Hanzon V., Membrane structure of cytoplasm and
mitochondria in exocrine cells of mouse pancreas as revealed by
high resolution electron microscopy, Experimental Cell Research, 7,
393—414 (1954).
6. Trump B. F., Goldblatt P. L, Stowell R. E., An electron
microscopic study of early cytoplasmic alterations in hepatic parenchymal
cells of the mouse liver during necrosis in vitro (autolysis),
Laboratory Investigation, 11, 986—1015 (1962).
7. Trump B. F., Goldblatt P. J., Stowell R. E., Studies on necrosis of .
mouse liver in vitro, Laboratory Investigation, 14, 343—371 (1965).
Фиксаторы и методы фиксации; осмотическое давление растворов
8. Afzelius В. A., In The Interpretation of Ultrastructure, pp. 1—19
(Edited by R. J. С Harris), New York, Academic Press, 1962.
9. Bahr G. F., Osmium tetroxide and ruthenium tetroxide and their
reactions with biologically important substances. Electron stains III,
Experimental Cell Research, 7, 457—479 (1954).
10. Bahr G. F., Continued studies about the fixation with osmium
tetroxide. Electron Stains IV, Experimental Cell Research, 9, 277—285
(1955).
11. Bahr G. F., Bloom G., Friberg W., Volume changes of tissues in
physiological fluids during fixation in osmium tetroxide or
formaldehyde and during subsequent treatment, Experimental Cell
Research, 12, 342—355 (1957).
12. Bennet H. S., Luft #., s-collidine as a basis for buffering fixatives,
Journal of Biophysical and Biochemical Cytology, 6, 113—114
(1959).
13. Bradbury S., Meek G. A., A study of potassium permanganate
"fixation" for electron microscopy, Quarterly Journal of Microscopical
Science, 101, 241—250 (1960).
14. Burgos M. H., Vitale-Caple R., Tellezale-Inon M. Т., Studies on
paraformaldehyde fixation for electron microscopy. 1. Effect of
concentration on ultrastructure, Journal de Microscopie, 6, 457—468
(1967).
15. Burkl W., Schiechl H., A study of osmium tetroxide fixation, Journal
of Histochemistry and Cytochemistry, 16, 157—161 (1968).
16. Caulfield J. В., Effects of varying the vehicle for osmium tetroxide
in tissue fixation, Journal of Biophysical and Biochemical Cytology,
3, 827—820 (1957).
17. Dalton A. J., A chrome-osmium fixative for electron microscopy,
Anatomical Record, 121, 281 (abs.) (1955).
18. Dick D. А. Т., Cell Water, Chap. 3, pp. 15—43, London, Butter-
worth, 1966.
19. Fibers P. F., Ion permeability of the egg of Limnaea stagnalis L. on
fixation for electron microscopy, Biochemica et biophysica Acta, 112,
318—329 (1966).
20. Ericsson J. L. E., Saladino A. J., Trump B. F., Electron microscopic
observation of the influence of different fixatives on the appearance
of cellular ultrastructure, Zeitschrift fur Zellforschung und Mikro-
skopische Anatomie, 66, 161—181 (1965).
64
Глава i
21. Ericsson J. L. E., Biberfeld P., Studies on aldehyde fixation.
Fixation rates and their relation to fine structure and some histochemi-
cal reactions in liver, Laboratory Investigation, 17, 281—298 (1967).
22. Fahimi H. D., Drochmanns P., Essais de standardisation de la
fixation au glularaldehyde. II. Influence des concentrations en aldehyde
et de l'osmolarite, Journal de Microscopie, 4, 737—748 (1965).
23. Fawcett D. W., In Modern Developments in Electron Microscopy,
Chap. 6, p. 309 (Edited by В. М. Siegel), New York and London,
Academic Press, 1964.
24. Friend D. S., Farquhar M. G., Function of coated vesicles during
protein absorption in the rat vas deferens, Journal of Cell Biology,
35, 357—376 (1967).
25. Hagstrom L., Bahr G. F., Penetration rates of osmium tetroxide
with different fixation vehicles, Histochemie, 2, 1—4 (1960).
26. Hake Т., Studies on the reactions of osmium tetroxide and
potassium permanganate with amino acids, peptides and proteins.
Laboratory Investigation, 14, 1208—1212.
27. Hayat M. A., Principles and Techniques of Electron Microscopy:
Biological Applications, Vol. 1, New York and Londori, Van
Nostrand-Reinhold, 1970.
28. Hopwood D., Some aspects of fixation with glutaraldehyde, Journal
of Anatomy, 101, 83—92 (1967).
29. Hopwood D., Fixatives and fixation: a review, Journal of
Histochemistry and Cytochemistry, 1, 323—360 (1969).
30. Karlsson U., Schultz R. L., Fixation of the central nervous system
for electron microscopy by aldehyde perfusion. I. Preservation with
aldehyde perfusates versus direct perfusion with osmium tetroxide,
with special reference to membranes and the extra-cellular space,
Journal of infrastructure Research, 12, 160—186 (1905).
31. Kornovsky M. J., A formaldehyde-glutaraldehyde fixative of high
osmolarity for use in electron-microscopy, Journal of Cell Biology,
27, 137A—138A (1965).
32. Korn E. D., A chromatographic and spectrophometric study of the
products of the reaction of osmium tetroxide with unsaturated lipids,
Journal of Cell Biology, 34, 627—638 (1967).
33. Luft J. H., Permanganate—a new fixative for electron microscopy,
Journal of Biophysical and Biochemical Cytology, 2, 799—801
(1956).
34. Luft J. H., Wood R. L., The extraction of tissue protein during and
after fixation with osmium tetroxide in various buffer systems,
Journal of Cell Biology, 19, 46A (1963).
35. Maunsbach А. В., Comparison of renal tubule ultrastructure after
perfusion fixation with different fixatives, Journal of Cell Biology,
23, 108A—109A (1964).
36. Maunsbach А. В., The influence of different fixatives and fixation
methods on the ultrastructure of rat kidney proximal tubule cells.
I. Comparison of glutaraldehyde, formaldehyde and osmium
tetroxide fixatives, Journal of Ultrastructure Research, 15, 242—282
(1966).
37. Maunsbach А. В., The influence of different fixatives and fixation
methods on the ultrastructure of rat kidney proximal tubule cells.
Обработка тканей
65
11. The effects of varying osmolarity, ionic strength, buffer systems
and fixative concentrations of glutaraldehyde solutions, Journal of
Ultrastructure Research, 15, 283—309 (1966).
38. Miltonig G., In Fifth International Congress in Electron
Microscopy, Vol. 2, p. 8 (Edited by S. S. Breese), New York, Academic Press,
1962.
3d. Palade G. E., A study of fixation for electron microscopy, Journal
of Experimental Medicine, 95, 285—298 (1952).
40. Palay S. L., McGee-Russell S. M., Gordon S. J., Grillo M. A.,
Fixation of neural tissues for electron microscopy by perfusion with
solutions of osmium tetroxide, Journal of Cell Biology, 12, 385—410
(1962).
41. Pearse A. G. E., In Histochemistry, Theoretical, and Applied, 3rd
edn, Chap. 5, London, J. and A. Churchill, 1968.
42. Pease D. C, Buffered formaldehyde as a killing agent and primary
fixative for electron microscopy, Anatomical Record, 142, 342 (abs.)
(1962).
43. Porter K. R-, Kailman Т., The properties and effects of osmium
tetroxide as a tissue fixative with special reference to its use for
electron microscopy, Experimental Cell Research, 4, 127 (1953).
44. Richards F. M., Knowles J. R., Glutaraldehyde as a protein cross-
linking reagent, Journal of Molecular Biology, 37, 231—233 (1968).
45. Riemersma J. C., Osmium tetroxide fixation of lipids for electron
microscopy: a possible reaction mechanism, Biochimica et biophysi-
ca Acta, 152, 718—727 (1968).
46. Roth L. E. et al., Glutaraldehyde — osmium tetroxide fixation for
electron microscopy of the mitotic apparatus in plant and insect
cells, Journal of Cell Biology, 19, 91A (1963).
47. Sabatini D. D., Bensch K-, Barnett R. J., Cytochemistry and electron
microscopy — the preservation of cellular ultrastructure and
enzymatic activity by aldehyde fixation, Journal of Cell Biology, 17,
19—58 (1963).
48. Sabatini D. D., Miller F., Barnett R. J., Aldehyde fixation for
morphological preservation and enzyme histochemical studies with the
electron microscope, Journal of Histochemistry and Cytochemistry,
12, 57—71 (1964).
49. Schultz R. L„ Karlsson U., Fixation of the central nervous system
for electron microscopy by aldehyde perfusion. II. Effect of
osmolarity, pll of perfusate and fixative concentration, Journal of ultra-
structure Research, 12, 187—206 (1965).
50. Schultz R. L., Case N. M., A modified aldehyde perfusion technique
for preventing certain artefacts in electron microscopy of the central
nervous system, Journal of Microscopy, 92, 69—84 (1970).
51. Sjostrand F. S., In The Interpretation of Ultrastructure, pp. 47—68
(Edited by R. J. С Harris), New York and London, Academic Press,
1962.
52. Stoeckenius W., Mahr S. C, Studies on the reaction of osmium
tetroxide with lipids and related compounds, Laboratory
Investigation, 14, 1196—1207 (1965).
5—977
66 Глава. 2
53. Tahmisian Т. N., Use of the freezing point method to adjust the
tonicity of freezing point solutions, Journal of Ultrastructure
Research, 10, 182—188 (1964).
54. Tandler С J., Libanati C. M., Sanchis С A., The intracellular
localisation of inorganic cations with potassium pyroantimonate,
Journal of Cell Biology, 45, 355—366 (1970).
55. Trump B. F., Ericsson J. L. E., The effect of the fixative solution on
the ultrastructure of cells and tissues, Laboratory Investigation, 14,
1245—1323 (1965).
56. Trump B. F., Bulger R. E., New ultrastructural characteristics of
cells fixed in a glutaraldehyde — osmium tetroxide mixture,
Laboratory Investigation, 15, 368—379 (1966).
57. Weibel E. R., Stereological principles for morphology in electron
microscopic cytology, International Review of Cytology, 26, 235—
302 (1969).
58. Williams M. A., In Advances in Optical and Electron Microscopy,
Vol. 3, pp. 219—228 (Edited by R. Barer and V. E. Cosslett),
London and New York, Academic Press, 1969.
59. Wood R. L., Luft J. H., The influence of buffer systems on fixation
with osmium tetroxide, Journal of Ultrastructure Research, 12,
22—45 (1965).
Заливочные среды
60. Cope G. H., Williams M. A., Quantitative studies on neutral lipid
preservation in electron microscopy, Journal of the Roayl
Microscopical Society, 88, 259—277 (1968).
61. Finck H., Epoxy resins in electron microscopy, Journal of
Biophysical and Biochemical Cytology, 7, 27—30 (1960).
62. Gibbons I. R., An embedding resin miscible with water for electron
microscopy, Nature, London, 184, 375—376 (1959).
63. Glauert A. M., Rogers G. E., Glauert R. H., A new embedding
medium for electron microscopy, Nature, London, 178, 803 (1956).
64. Glauert A. M., Glauert R. H., Araldite as an embedding medium for
electron microscopy, Journal of Biophysical and Biochemical
Cytology, 4, 191—194 (1958).
65. Leduc E. H., Bernhard W., In The Interpretation of Ultrastructure,
pp. 21—45 (Edited by R. J. С Harris), New York and London,
Academic Press, 1962.
66. Leduc E. H., Holt S. J., Hydroxypropyl methacrylate, a new water
miscible embedding medium for electron microscopy, Journal of Cell
Biology, 26, 137—155 (1965).
67. Luft J. H., Improvements in epoxy resin embedding methods,
Journal of Biophysical and Biochemical Cytology, 9, 409—414 (1961).
68. Kushida H., On an epoxy resin e"mbedding method for ultrathin
sectioning, Electron Microscopy, 8, 72—74 (1959).
69. Motlenhauer H. H., Plastic embedding mixtures for use in electron
microscopy, Stain Technology, 39, 111—114 (1964).
70. Newman S. В., Borysko E., Swerdlow M., Ultramicrotomy by a new
method, Journal of Applied Physiology, 12, 67 (abs.) (1950).
71. Ryter A., Kellenberger E., L'inclusion au polyester pour l'ultra-
microtomic, Journal of Ultrastructure Research, 2, 200—214 (1958).
Обработка тканей
67
72. Staubli W., Nouvelle matiere d'inclusion hydrosoluble pour la
cytologic electronique. Comptes rendu hebdomadaire des seances de
l'Academie des sciences, 250, 1137—1139 (1960).
73. Wachtel A. W., Gettner M. E., Ornstein L., In Physical Techniques
in Biological Research, 2nd edn, Vol. 3, Part A Cells and Tissues,
Chap. 4 (Edited by A. W. Pollister), New York and London,
Academic Press, 1969. Ссылки на другие работы — см. библиографию
в конце гл. 8.
74. Bahr G. F., Zeitler E. H. (Eds.), Proceedings of a Symposium on
Quantitative Electron Microscopy. Seven papers on the topic
"Effects of the preparation procedure on the appearance of the object in
electron micrographs", Laboratory Investigation, 14, 1169—1245
(1965).
75. Glauert A. M., In Techniques for Electron Microscopy, Chap. 7,
pp. 166—212 (Edited by D. H. Kay), Oxford, Blackwell Scientific
Publications, 1965.
76. McGee-Russell S. M., De Bruijn W. C, In Cell Structure and its
Interpretation (Edited by S. M. McGee-Russel and K- F. A. .Ross),
London, Edward Arnold, 1968.
77. Millonig G., Marinozzl V., In Advances in Optical and Electron
Microscopy, Vol. 2, pp. 251—341 (Edited ba R. Barer and V. E. Cos-
slett), London and New York, Academic Press, 1968.
78. Pease D. C, In Histological Techniques for Electron Microscopy,
2nd edn, Chap. 2, 3 and 4, New York and London, Academic Press,
1964.
79. Sjostrand F. S., In Electron Microscopy of Cells and Tissues, Vol. 1,
Chap. 6 and 7, pp. 138—176, New York and London, Academic
Press, 1967.
80. Sjostrand F. S., In Physical Techniques in Biological Research,
Vol. 3, Part C, Cells and Tissues, pp. 169—189 (Edited by A. W. Pol-
lister), New York and London, Academic Press, 1969.
81. Wischnitzer S., Current techniques in biomedical electron microscopy,
International Review of Cytology, 22, 1—61 (1967). См. также
библиографию в конце гл. 8.
5*
ГЛАВА 3
Приготовление ультратонких срезов
для электронной микроскопии
Резка ткани по многим причинам является наиболее
трудоемким процессом, доставляющим немало
огорчений начинающим заниматься электронной
микроскопией. Трудно сказать, помогает ли в этом имеющийся опыт
резки материала для световой микроскопии. Большая
часть операций по получению ультратонких срезов
осуществляется при помощи стереомикроскоиа, так что
необходимо приобрести навык работы с этим весьма
важным прибором. Одной из существеннейших предпосылок
успеха является терпение. Если терпение на исходе,
лучше всего на некоторое время оставить микротом,
заняться чем-нибудь еще, а потом с новыми силами
вернуться к работе.
Время, необходимое для того, чтобы приобрести
достаточный навык в изготовлении ультратонких срезов,
для каждого различно. Некоторые известные
электронные микроскописты, так и не овладевшие этим
искусством, перепоручали резку материала хорошо обученным
лаборантам. Овладение навыками получения хороших
срезов не заменяет, конечно, умения разбираться в
особенностях ультраструктуры. Тем не менее, если
электронный микроскопист хорошо владеет техникой резки на
ультратоме, ему будет легче подготовить
высококвалифицированных лаборантов, а в случае необходимости
приготовить срезы особо ценного экспериментального
материала. Некоторые весьма авторитетные в области
электронной микроскопии специалисты настоятельно
рекомендуют, чтобы каждый исследователь сам готовил
для себя срезы.
Обычно начинающим удается получить
удовлетворительные срезы примерно через две недели, и толькр
Приготовление ультратонких срезов
69
очень немногие добиваются успеха с первой попытки.
Лишь изредка нашим лаборантам приходилось резать
материал для аспирантов, с тем чтобы дать им
возможность завершить научную работу.
НЕОБХОДИМОСТЬ ОРИЕНТИРОВКИ СРЕЗОВ
Для того чтобы быть уверенным в том, что взят
именно тот участок ткани, который содержит
необходимый для исследования материал, вам следует
предварительно приготовить «толстые» срезы и просмотреть их
с помощью светового микроскопа. К счастью, свойства
акриловых пластмасс и эпоксидных смол, применяемых
для заливки ткани, позволяют получать с помощью
стеклянного ножа срезы толщиной 1 мкм. После
соответствующей окраски на таких срезах детали структуры
выявляются значительно лучше, чем на парафиновых
срезах той же ткани. Ориентируясь па срезы толщиной
1 мкм, можно заточить блок таким образом, что
ультратонкие срезы будут содержать только необходимый для
исследования материал. Срезы в 1 мкм можно получить
либо на обычном микротоме, приспособленном для резки
стеклянным ножом, либо на ультратоме. Основываясь
на повседневной практике нашей лаборатории, мы
считаем, что наиболее удобно проводить резку «толстых»
и ультратонких срезов на отдельных микротомах, спи-1
зив, таким образом, рабочую нагрузку на ультратомы..
Если необходимы срезы тоньше 1 мкм, то готовить их
надо на ультратоме, поскольку обычные модели микро-
'томов редко приспособлены для того, чтобы получать
срезы тоньше 1 мкм. Во всяком случае, срезы, толщина
которых меньше 1 мкм, содержат такое незначительное
количество ткани, что окраска их для световой
микроскопии значительно ухудшается по мере того, как срез
становится тоньше.
СТЕКЛЯННЫЕ НОЖИ
Стеклянные ножи были предложены Латтой и Харт-
маном [4]. Они несравнимо лучше для резки ультратои-
ких срезов ткани, залитой в акриловые пластмассы или
го
Глава 3
эпоксидные смолы, чем металлические ножи.
Стеклянными ножами можно пользоваться в течение короткого
времени до тех пор, пока не разрушится режущий край,
однако стоимость их столь незначительна, что их можно
выбрасывать после употребления. Желательно
использовать стеклянные ножи вскоре после их изготовления,
поскольку стекло представляет собой переохлажденную
жидкость, которая постепенно течет, в результате чего
режущий край становится тупым. ,
СПОСОБЫ ИЗГОТОВЛЕНИЯ СТЕКЛЯННЫХ НОЖЕЙ
Ножи для резки срезов толщиной 1 мкм, а также
ультратонких срезов для электронной микроскопии
(толщиной от 100 до 1200 А) изготавливаются одним и тем
же способом из зеркального или литого стекла
толщиной примерно 6 и 4 мм соответственно. Чтобы очистить
стекло от жира и пыли, которые могут загрязнять срезы
во время резки, его тщательно моют в детергенте,
споласкивают горячей водой и сушат на воздухе. Стекло
нельзя протирать, так как в результате этого
образуется электрический заряд и на стекле скапливается пыль.
Стекло нарезают на прямоугольные или квадратные
куски соответствующих размеров, из которых затем
изготавливают ножи.
ПРИБОРЫ ДЛЯ ИЗГОТОВЛЕНИЯ СТЕКЛЯННЫХ НОЖЕЙ
Ножи можно делать вручную или с помощью
специального прибора для изготовления ножей наподобие
того, который выпускает фирма LKB. Прибор этот прост
неупотреблении и позволяет получить очень высокий
процент превосходных ножей при условии, что строго
соблюдаются указания, содержащиеся в приложенной к
нему инструкции. Фирма поставляет также полоски
специально обработанного высококачественного стекла для
изготовления ножей. Прибор для изготовления ножей
и стекло для него дороги, однако в конечном счете их
использование сберегает время и позволяет избежать
неудач в тех лабораториях, где изготовлением ножей
приходится -заниматься многим сотрудникам.
Приготовление ультратонких срезов 71
Изготовление ножей вручную. Если нет прибора для
изготовления ножей, то их' приходится делать вручную.
Это требует навыка и вначале сопровождается большим
числом неудач.
Могут возникать трудности в приобретении стекла
необходимого качества. Независимо от метода
изготовления стекла качество его будет различным в разных
партиях. Если вы обнаружили образцы стекла, которое
позволяет получить хорошие срезы, старайтесь
приобрести стекло той же партии. Ножи могут казаться
идеальными по всем обычным показателям (см. стр. 77) и все
же не будут давать хороших срезов, если качество
данной партии стекла плохое. К сожалению, единственным
и вполне надежным критерием хорошего ножа служит
его способность давать хорошие срезы.
Ножи для резки срезов толщиной 1 мкм и для резки
ультратонких срезов готовятся одинаково.
Окончательные размеры стеклянной пластинки, из которой
готовится нож, зависят от типа имеющегося микротома. Для
большинства современных ультратомов нужны
пластинки размером 2,5X2,5 см; в некоторых, более старых
моделях ручного ультратома Кембридж-Хаксли применя:
ются прямоугольные пластинки размером 2,5 X 3,5 см.
Для разламывания стекла необходим роликовый
стеклорез и специальные щипцы. Колесико стеклореза
должно быть в очень хорошем состоянии. Шипцы для
разламывания стекла, специально предназначенные для
изготовления стеклянных ножей, выпускают фирмы Sorvall
и Cambridge Instruments.
Для изготовления стеклянных ножей можно также
приспособить обычные плоскогубцы, используя тесьму,
как это описано Портером [5]. Однако тесьму
приходится периодически менять, тогда как специальные щип-
пы не нуждаются в дополнительных приспособлениях.
Тем не менее использование тесьмы позволяет
индивидуально приспособить плоскогубцы к силе сжатия кисти и
дает возможность добиться медленного, регулируемого
разлома стекла путем изменения количества и
распределения тесьмы.
Для того чтобы получить прямую выщербленную
линию с помощью стеклореза, необходимо иметь линейку
72
Глава 3
с ровным краем. Для этого вполне подойдет
металлическая линейка или линейка любого желаемого размера,
изготовленная из плексигласа. Если метод изготовления
стеклянных ножей предусматривает использование
полосок стекла шириной 5 см, то такие полоски можно
изготовить при помощи линейки с прямыми углами
шириной 4,5 см и длиной примерно 20 см, накладывая ее
на лист стекла таким образом, чтобы длинная сторона
линейки совпадала _с краем стекла. Стеклорезом
делается надрез вдоль края линейки и затем стекло
разламывается с помощью щипцов. Эта операция
повторяется до тех пор, пока весь лист стекла не будет разрезан
иа полоски шириной примерно 5 см. (Стеклорез обычно
имеет допуск, или зазор, составляющий около 4 мм;
таким образом, ширина линейки для резки стекла должна
быть на 4 мм меньше ширины полоски стекла, которую
надо получить. Например, если нужна полоска шириной
4 см, то ширина линейки должна быть равна примерно
3,6 см, а для полоски в 2,5 см или для кусков стекла
площадью 6,5 см2 необходима линейка шириной 2 см.)
Небольшая линейка размером 2X13 см удобна для
резки небольших кусков стекла. С ее помощью можно
получить квадратные куски стекла размером 2,5x2,5 см,
прямоугольные 3,5X2,5 см или 2,5x5 см, если
последовательно нарезать полоски стекла шириной 2,5; 3,5
и 5 см.
Существует множество способов разламывания
стекла на куски определённой формы. В этой главе будут
кратко описаны два из них.
/. Метод «свободного разлома». Данный метод,
введенный Камероном [1], в опытных руках дает ножи
превосходного качества. Существует несколько вариантов
этого метода. Метод, описанный ниже, исходит в
основном из способа, который предложен Портером [5].
Квадратный лист стекла, сторона которого равна
примерно 10 см, разламывают пополам; половинки
снова разламывают пополам, и так до тех пор, пока не
получат 16 квадратных кусочков, стороны которых
равны 2,5 см. Из каждого такого кусочка, разломив его по
диагонали, получают один стеклянный нож. Для того
чтобы легко разломить стекло, от его края с помощью
Приготовление ультратонких срезов 73
стеклореза делается короткий прямой надрез. Для
первого разлома такой надрез длиной 1,25 см проводится
по линейке стеклорезом под прямым углом к краю
стекла и ровно посередине одной из его сторон. Затем щип-
-юсм
г,5см~-
-2,5см-*>
Шсм
WCM
-1,5см—►,
Фиг. 7. Изготовление квадратных кусков стекла со стороной 2,5 см.
А. Положение щипцов при первичном разломе стекла. Б. Получающийся
в результате «свободный разлом». В. Положение щипцов при последующих
разломах. / — линия надреза; 2 — место свободного разлома: 3 — поверхность
свободного разлома на стороне, противоположной щипцам; 4 — щипцы.
цами надавливают на место надреза, равномерно и
медленно усиливая нажим (фиг. 7,А). Чтобы с
уверенностью получить прямой разлом, надо следить за тем,
чтобы передний край типцов располагался
перпендикулярно линии надреза. Постепенно возрастающее,
равномерное давление обеспечит медленный регулируемый
разлом. Стекло должно разломиться поперек па две
равные части.
При этом методе изготовления ножей (фиг. 7, Б) края
свободного разлома получаются значительно более глад-
74
Глава 3
кими, чем края разлома, идущего по надрезу. Если бы
надрез был сделан через все стекло от одного края до
другого, то разлом прошел бы по линии надреза и по
краям разлома располагались бы мельчайшие
зазубрины («оперение») от стеклореза.
Последующие разломы стекла делаются таким же
образом до получения квадратных кусочков со стороной
2,5 см. Производя каждый разлом, необходимо
убедиться в том, что сторона стекла со «свободным разломом»
расположена напротив щипцов (фиг. 7,В). В итоге все
квадратики стекла, полученные методом «свободного
разлома», будут иметь по меньшей мере две гладкие
стороны, сходящиеся под прямым углом, причем ни на
одной из сторон этого угла не будет «оперения» от
надреза. Нож, получающийся в результате разлома по
диагонали через такой «чистый угол», будет иметь
режущий край, который значительно лучше режущего края,
образовавшегося при разломе через «угол с оперением».
Это происходит оттого, что напряжения, возникающие
в стекле при надрезе, могут вызывать образование
неровностей вдоль режущего края ножа1.
Изготовление квадратных стекол со стороной, равной
2,5 см, относительно просто. Значительно труднее
получить хороший нож, разламывая такой квадрат по
диагонали. Даже незначительное отклонение надреза от
диагонали квадрата ведет к нарушению формы края ножа.
То же самое происходит, если щипцы располагаются не
точно по диагонали и не в центре надреза.
Диагональный разлом делают с помощью щипцов по
надрезу, который проводится по линейке, отступя при-
1 Полоски стекла, которые поставляются вместе с большей
частью приборов для изготовления ножей, имеют края с
«оперением», тем не менее, если ножи изготовляются в соответствии с
инструкцией и сам прибор хорошо отрегулирован, ножи получаются
вполне удовлетворительными. По-видимому, важное значение при
этом имеет глубина надреза, которая может быть различной.
Большое давление на стеклорез дает глубокий надрез и создает в стекле
значительное напряжение. Легкое и равномерное давление
вызывает меньшее напряжение [9]. Конечно, фирмы принимают это во
внимание при производстве стеклянных полосок и при
проектирований самих приборов. Необходимое давление на режущий инструмент
значительно легче создать с помощью должным образом
отрегулированного прибора, чем вручную. — Прим. автора.
Приготовление ультратонких срезов 7Ь
мерно на 1 мм от «чистого угла» квадрата (фиг. 8,Д).
Передний конец губок щипцов следует установить
приблизительно посередине длины надреза (фиг. 8,5),
после чего произвести медленный, постепенно усиливаю-
Фиг. 8. Изготовление ножа из квадратного куска стекла со
стороной 2,5 см.
Л. Положение линии надреза. Б. Положение щипцов. В. Нож,
полученный после разлома, вид сбоку. Г. Положение последнего диагонального
надреза прн использовании прямоугольных кусков стекла, / — «чистый угол»;
2 —линия надреза; 8 —щипцы; * — режущий край ножа; 5 — часть, которая
выбрасывается; 6 — линия надреза.
шийся нажим. В результате этого последнего разлома
мы получаем два куска стекла, один из которых имеет
острый режущий край и будет служит ножом, другой
же выбрасывается (фиг. 8,6).
Если по каким-либо причинам желательно
использовать прямоугольные куски стекла, а не квадратные, то
вначале берут стекло размером приблизительно 20X
76 Глава 3
Х25 см и разрезают его на четыре полосы шириной
около 3,5 см. Из каждой такой полосы можно получить
четыре прямоугольника размером 3,5 X 2,5 см, сделав
вдоль нее надрезы через 2,5 см. Диагональный надрез
делается на прямоугольнике так, как это показано на
фиг. 8, Г.
Если предполагается использовать приведенный
выше вариант метода свободного разлома, то мы
рекомендуем ознакомиться с ним более подробно по работе
Портера [5]. Другой вариант этого метода детально описан
Шёстрандом [9].
2. Метод «свободного разлома» в модификации Пай-
пера. Изготовление первоклассных ножей путем
разламывания по диагонали квадратных кусков стекла после
надреза, сделанного стеклорезом по линейке, —
трудоемкая операция, требующая навыка и терпения.
Значительно проще получить хороший нож, используя для
фиксации стекла при последнем надрезе шаблон,
который гарантирует правильное диагональное положение
этого надреза. Такой шаблон применен Пайпером [6]
в его модификации метода «свободного разлома».
Лист стекла надрезается по линейке и разламывается
щипцами на полоски шириной около 5 см. Затем эти
полоски разламываются на квадраты со стороной, равной
5 см, также по надрезам, проведенным по линейке.
Последующее разламывание каждого квадрата позволяет
получить четыре квадратных куска со стороной
примерно 2,5 см, каждый из которых имеет по меньшей мере
один «чистый угол». При изготовлении ножа из
квадрата со стороной 2,5 см применяется специальный
шаблон, который определяет положение последнего надреза
по отношению к «чистому углу».
Этот метод прост и позволяет быстро получить
большое число хороших ножей. Пайлер подробно описал
изготовление шаблона и щипцов, так что их легко сделать
в мастерской. Помимо этого, набор для изготовления
ножей, предложенный Пайпером, можно купить у фирмы
Cambridge Scientific Instruments, которая продает их в
качестве «нестандартного добавления» к ультрамикрото-
му «Кембридж Хаксли Mkll». Модификация метода
«свободного разлома», предложенная Пайпером, может
Приготовление ультратонких срезов
77
^оказаться весьма полезной в тех лабораториях, которые
■не имеют специального прибора для изготовления ножей.
ОЦЕНКА КАЧЕСТВА СТЕКЛЯННОГО НОЖА
Сделать хороший срез ножом, режущий край
которого не самого высокого качества, невозможно. Не
тратьте времени зря, пытаясь резать ткань ножом
сомнительного качества.
Край ножа следует всегда проверять под стереомик-
роскопом, для чего, как правило, вполне достаточно
20-кратного увеличения. Большие увеличения (вплоть
до 400 раз) необходимы в тех случаях, когда
желательно получить наиболее тонкие срезы для микроскопиро-
вания с высоким разрешением [11]. Сфокусировав
микроскоп на режущем крае ножа, начинают медленно
вращать нож вперед и назад до тех пор, пока свет не
отразится от его режущего края (нож может быть
неподвижен, и в этом случае производят необходимую
подгонку освещения). Как только свет отразится от края
ножа, становятся отчетливо видны его дефекты.
Край «идеального» ножа должен быть очень
тонким и прямым, не должен иметь зазубрин или
неровностей. Ни на передней, ни на задней стороне ножа не
должно быть линий надреза, идущих вверх по
направлению к режущему краю. На задней стороне ножа (т. е.
на поверхности, образованной последним диагональным
разломом) находится линия напряжения, проходящая
но кривой к одному из углов режущего края (фиг. 9).
От этого угла идет та часть режущего края ножа,
которая позволяет получить наилучшие срезы, причем
протяженность этой части может быть различной. Край
ножа возле угла, противоположного тому, который
пересекает линия напряжения, бывает зазубрен и непригоден
для резки. На этом углу может находиться короткий
стеклянный шип, образующийся в результате
незначительного отклонения последнего надреза квадратного
(2,5 X 2,5 см) или прямоугольного (2,5 X 3,5 см) стекла
от их диагоналей. Идеально, если этого шипа нет совсем,
поскольку протяженность зазубренной части режущего
78 Глава 3
края становится больше с увеличением размеров этого j
шипа. Небольшой шип не препятствует использованию
ножа. У ножа с большим шипом для резки пригоден
очень небольшой участок, да и то качество этого
небольшого участка весьма сомнительно.
Маленький
| | шип
, „_, а I б ! в.
А В Д
Фиг. 9. Оценка стеклянного ножа.
A. Почти идеальный нож. Б. Годный для резки нож с небольшим шипом:
а — участок, который должен быть использован для резки: б — участок,
используемый для предварительной обрезки блока; в — зазубренный участок.
B. Непригодный для резкн нож с большим шипом. / — линия напряжения;
2 — лицевая сторона ножа.
При наличии небольшого шипа край ножа можно
приблизительно разделить на три части в соответствии
с качеством режущего края. Участок, граничащий с
шипом, не используется совсем. Средний участок лучше
использовать для предварительной резки блока: как
только пойдут хорошие срезы, нож передвигают, с тем чтобы
использовать лучшую часть его режущего края, т. е.
треть, ближайшую к углу, через который проходит
линия напряжения.
Поскольку ножом можно пользоваться очень
недолго, до тех пор пока не разрущится его режущий край,
лучше готовить сразу два или три хороших ножа. В этом
случае при резке можно заменить нож с минимальной
потерей времени. Если нож не был использован в тот
же день, то его не следует в дальнейшем применять для
резки ультратонких срезов, так как стекло «течет» и
режущий край постепенно тупится. Тем не менее этот нож
можно использовать для резки срезов толщиной 1 мкм.
Большой
шип
Приготовление ультратонких срезов 79
С готовыми ножами надо обращаться крайне
бережно, чтобы не повредить режущий край. Их следует
ставить вертикально в специальные держатели для ножей,
снабженные крышками, или класть плашмя на лист
фильтровальной бумаги в чашку Петри, закрывая ее
крышкой. Перед установкой ножа на микротоме к его
задней стороне ниже режущего края надо прикрепить
«ванночку» для жидкости, по поверхности которой плава-
Фиг. 10. Ванночки для стеклянных ножей.
А. Ванночка для срезов толщиной 1 мкм:на нож наносится толстый слой
воска. Б. Ванночка для ультратонких срезов, изготовленная из ленты. В.
Металлическая ванночка для ультратонких срезов; / — воск; 2 — кусок ленты,
который отрезается; 3 — металлическая ванночка.
ют срезы. При резке срезов толщиной 1 мкм достаточно
ванночки, образованной слоем разогретого зубоврачеб-'
ного воска, пчелиного воска или парафина (фиг. 10, А).
Для ультратонких срезов ванночку лучше изготовить из
куска темной виниловой изоляционной ленты, например
ленты марки Scotch Brand № 33, прикрепив ее на
лицевой поверхности ножа, как показано на фиг. 10, Б,
и укрепив расплавленным воском1.
Воск для укрепления ванночки можно расплавить на
пламени газовой горелки, однако при этом надо старать-
1 С этой же целью можно использовать полоску
лейкопластыря. — Прим. ред.
80 Глава 3
ся не перегревать его. Этого следует избегать не только
из-за опасности пожара. Дело в том, что перегревание,
изменяет свойства некоторых сортов воска, вследствие
чего жировые вещества, входящие в его состав,
становятся растворимыми, попадают в жидкость, которой
заполняется ванночка, и загрязняют срезы. Чтобы
избежать перегревания воска, снимайте его с газовой
горелки до того, как он расплавится целиком. Для нанесения
веска на стеклянный нож удобно использовать какой-
либо разогретый в пламени металлический инструмент,
например ножик с ручкой, не проводящей тепло. При
этом, конечно, надо стараться не измазать воском
режущий край стеклянного ножа.
Некоторые фирмы снабжают микротомы
металлическими ванночками (фиг. 10,5), которые также могут
укрепляться на ноже с помощью расплавленного воска.
Перед повторным использованием такую металлическую
ванночку необходимо тщательно вымыть. Большую часть
воска аккуратно соскребают, а остатки смывают
ксилолом. Затем ксилол удаляется спиртом. Ножи до
употребления можно сохранять в чистом спирте.
АЛМАЗНЫЕ НОЖИ
Первым применил алмазные ножи Ферпандес-Мо-
ран [2]. Несомненно, срок службы алмазного ножа
значительно больше, чем стеклянного, и эти ножи
намного удобнее для резки твердых тканей. Затупившиеся
алмазные ножи можно вновь наточить, так что они могут
служить в течение нескольких лет. Однако качество
алмазных ножей, имеющихся в продаже, весьма
неравноценно. Кроме того, высокая стоимость алмазных ножей
препятствует их широкому применению.
РЕЗКА
На всех этапах приготовления ультратонких срезов
особое внимание необходимо уделять чистоте.
Ультратонкие срезы — конечный результат всего этого
процесса—исследуются при таких увеличениях, когда
становится видимым объект, размеры которого не
превышают 100 А. Любой чужеродный материал, попавший на
Приготовление ультратонких срезов 81
срезы, может свести на нет результаты кропотливого
многочасового труда. Очень полезно перед началом
работы протереть рабочий стол влажной губкой, чтобы
удалить пыль. Убедитесь, что инструменты и пипетки
чистые, а копчики пинцетов в хорошем состоянии.
Свежие растворы ацетона надо готовить ежедневно и
хранить их закрытыми, чтобы избежать загрязнения.
Надежнее употреблять химически чистый ацетон, поскольку
ацетон других марок может содержать различные
примеси.
Если загрязнены сетки (некоторые партии поступают
от фирм в состоянии далеко не идеальном), то их
следует очистить, руководствуясь описанной далее
методикой (см. приложение, стр. 309).
МАТЕРИАЛЫ, НЕОБХОДИМЫЕ ПРИ РЕЗКЕ
A. Материалы для резки полутонких (1 мкм) и
ультратонких срезов. 1. Свежий 10%-ный раствор ацетона
на дистиллированной воде, полученной в стеклянном
дистилляторе. (Некоторые авторы рекомендуют 20%-ный
раствор ацетона или 10—20%-ный раствор этанола,
другие предпочитают использовать дистиллированную воду.
Добавление ацетона или этанола уменьшает
поверхностное натяжение воды и упрощает манипулирование
срезами.)
2. Пастеровская пипетка или шприц с длинной
иглой для наливания раствора ацетона в ванночку.
3. Вторая пипетка или шприц для удаления
раствора ацетона из ванночки.
4. Стаканчик для сливания раствора ацетона, уда-
лепного из ванночки.
Б. Материалы, используемые только для резки
полутонких (1мкм) срезов. 1. Чистые предметные стекла.
2. Держатель (щипцы или пинцет) для захватывания
предметного стекла при его нагревании в пламени
газовой горелки.
3. Реактивы для окрашивания полутонких срезов.
B. Материалы, используемые только для резки
ультратонких срезов. 1. Небольшой пузырек с хлороформом,
в пробку которого вставлена стеклянная палочка; этой
5-977
82
Глава 3
палочкой, смоченной в хлороформе, проводят над
ванночкой со срезами, что вызывает расправление срезов
после резки (вместо стеклянной можно использовать
деревянную палочку с намотанным на конце маленьким
ватным тампоном). "
2. Ресница, укрепленная на конце деревянной
палочки воском. С помощью такой палочки очень удобно
манипулировать срезами на поверхности раствора ацетона,
налитого в ванночку.
3. Два тонких остро заточенных пинцета для
захватывания сеток.
4. Чистая, протертая от пыли чашка Петри с
уложенной на дно фильтровальной бумагой для
размещения опорных сеток.
5. Опорные сетки без подложки или же покрытые
пленкой коллодия или формвара в зависимости от типа
сетки и характера заливочной среды. При обычной
работе с материалом, залитым в эпоксидную смолу (арал-
дит, эпон), употребление подложки не обязательно, если
используются достаточно мелкоячеистые сетки. Однако
срезы ткани, залитой в метакрилат, деформируются под
действием электронного луча, если не создать для них
дополнительной опоры в виде пленки-подложки- Такие
специальные методы, как радиоавтография (см. гл. 9),
также нуждаются в применении сеток с нанесенными на
них подложками. Само собой разумеется, что пленки
должны быть как можно более тонкими, чтобы
электронный луч мог пройти и через эту пленку и через объект.
Методы нанесения подложек на сетки приведены в
приложении на стр. 301—307.
6. Вторая чашка Петри, выстланная фильтровальной
бумагой для размещения сеток с нанесенными на них
срезами.
7. Один или несколько контейнеров для хранения
сеток после окончания резки (желатиновые капсулы Или
специальные коробочки для сеток с прорезью для
каждой сетки). Сообщалось, что при длительном хранений
сеток в желатиновых капсулах на поверхности образца
образуется пленка, однако этого, по-видимому, не
следует опасаться, если время хранения не превышает шести
месяцев.
Приготовление ультратонких срезов
83
РЕЗКА СРЕЗОВ ТОЛЩИНОЙ 1 мкм
Процесс резки в сущности одинаков независимо от
того, ведется ли она на микротоме обычного типа или
на ультратоме, хотя управление приборами разных типов
будет различным. На микротоме необходимо установить
подачу образца на 1 мкм. Если объект заливался в
капсуле, то в результате образуется плотный
цилиндрический блок из заливочного материала, на одном из
концов которого помещается кусочек ткани. Капсулу
следует удалить, причем полиэтиленовые капсулы
снимают, делая продольный разрез с одной стороны, а
желатиновые капсулы растворяют в теплой воде. Блок
помещается в специальный держатель (который прочно
закрепляется на микротоме) таким образом, чтобы ткань
была обращена кнаружи. Затем на микротоме
устанавливается нож, при этом передняя сторона ножа
обращена к образцу, а задняя сторона, к которой прикреплена
ванночка, — к оператору. Передняя сторона ножа
наклонена по отношению к образцу под углом, не
превышающим 6—7°. Положение ткани по отношению к ножу
проверяется с помощью стереомикроскопа, расположенного
перед микротомом. Лицевая сторона блока, содержащая
ткань, должна быть параллельна режущему краю ножа.
Нож подводят как можно ближе к блоку, но так,
чтобы он не касался блока, и закрепляют в этом
положении. После этого при каждом подъеме и опускании
блока производится его подача на 1 мкм по направлению
к краю ножа до того момента, когда с лицевой стороны
блока не будет получен срез.
Теперь в восковую ванночку, укрепленную на
лицевой стороне ножа, помещают каплю 10%-ного ацетона,
с тем чтобы образовался мениск, на который всплывают
срезы. Очень важна форма мениска. Если мениск
чрезмерно выпуклый, то раствор ацетона при опускании
блока будет стекать по передней стороне ножа, увлекая за
собой срезы. Если мениск слишком вогнут, то раствор
ацетона не достигает края ножа и срезы будут
приставать к его лицевой стороне.
После того как будут получены четыре-пять срезов,
их можно снять с мениска с помощью тонкой кисточки
6*
84
Глава 3
и перенести в каплю раствора ацетона, помещенную на
чистое предметное стекло. Затем стекло быстро
проводят над пламенем газовой горелки до испарения
раствора ацетона, находящегося под срезами. Обычно
достаточно провести стекло над пламенем десять-пятпадцать
раз. Старайтесь не перегревать стекло, так как при этом
ацетон закипит и под срезами образуются пузырьки.
Высушенные таким образом срезы расправляются и
плотно приклеиваются к стеклу; теперь их можно
обрабатывать различными растворами, не опасаясь, что они
отстанут.
Существует и другой способ наклеивания срезов:
предметное стекло покрывают тонким слоем яичного
белка, затем помещают срезы в каплю воды,
нанесенную на это стекло, и высушивают их на подогреваемом
столике. Этот способ требует больше времени, однако
в некоторых случаях получаются срезы менее
сморщенные, чем срезы, которые приклеивают над пламенем
газовой горелки.
ОКРАСКА СРЕЗОВ ТОЛЩИНОЙ 1 мкм
После высушивания срезы можно окрасить для
исследования в световом микроскопе. Ниже приведен
простой и удобный метод окрашивания.
Нанесите на стекло со срезами одинаковое число
капель 1%-ного раствора метиленового синего и 1%-ного
раствора буры. Быстро проведите стекло раз десять над
пламенем газовой горелки. Следите, чтобы краска не
закипела^. Промойте стекло под тонкой медленно текущей
струей горячей водопроводной воды и протрите его
обратную сторону чистой тряпочкой или бумажной
салфеткой.
Такой препарат можно сразу просмотреть под
световым микроскопом и выбрать нужный участок среза.
Затем лицевую сторону блока необходимо обрезать таким
образом, чтобы сохранить только этот участок. При этом
можно быть уверенным, что последующие ультратонкие
срезы будут содержать выбранный участок ткани.
Другие методы окраски срезов толщиной 1 мкм
приведены в приложении.
Приготовление ультратонких срезов
85
ЗЛТОЧКА БЛОКА ДЛЯ ПОЛУЧЕНИЯ УЛЬТРАТОНКИХ
СРЕЗОВ
После небольшой тренировки нетрудно заточить
блок, выделив необходимый для исследования участок.
Для этого используют стереомикроскоп, дающий
двадцатикратное и большее увеличения, и обычный
Фиг. 11. Выбор участка ткани для ультратонкой резки.
Л. Срезанная лицевая поверхность блока под стереомикросконом. Б. Срез
толщиной 1 мкм, полученный с лицевой поверхности блока и
рассматриваемый в микроскоп с помощью объектива ХШ. В. Лицевая поверхность блока,
обрезанная до размеров участка, представляющего наибольший интерес для
исследователя (/).
световой микроскоп. Срез толщиной 1 мкм
рассматривают при помощи светового микроскопа с объективом,
дающим увеличение в 10 или 40 раз. Предпочтительнее
использовать световой микроскоп старого типа,
снабженный пружинными зажимами для укрепления
предметного стекла и вращающимся столиком, поскольку на
нем возможно более свободное ориентирование среза.
Блок с залитой тканью плотно закрепляется в
держателе срезанной поверхностью кверху и помещается под
стереомикроскоп, дающий малые увеличения;
срезанная поверхность блока освещается. Медленно
поворачивая блок по вертикальной оси, добиваются такого его
положения, при котором свет отражается от поверхности
блока под углом, дающим возможность четко различать
детали фиксированной ткани. Препарат со срезом,
используемый для ориентировки, поворачивается на
столике светового микроскопа до тех пор, пока срез не
займет такое же положение, что и блок (фиг. И). (Если
86
Глава 3
при переносе среза на предметное стекло он был нере-
вернут, то ясно, что получится зеркальная проекция
того изображения, которое видно на лицевой стороне блока.)
С помощью бритвенного лезвия легко обрезать блок
так, чтобы лицевая сторона почти полностью содержала
только участок, предназначенный для исследования.
(Чтобы не порезать руку,
лучше разломать лезвие
бритвы вдоль пополам и при
обрезке блока захватывать
пальцами обломанный
край.) Блок необходимо
заточить в форме
четырехгранной пирамиды с плоской
вершиной (фиг. 12), которая
и будет служить
поверхностью для резки. Сама
пирамида представляет собой
широкую опору для
срезаемой поверхности и поэтому
предохраняет блок от
вибрации, которая возникает при
прохождении режущего
края ножа.
Некоторые современные ультрамикротомы снабжены
специальным зажимом для заточки блока, который
может укрепляться прямо на ультрамикротоме. На
микротомах фирмы LK.B имеется весьма полезное
приспособление, с помощью которого пирамида и ее лицевая
поверхность могут быть заточены стеклянным ножом.
Некоторые фирмы поставляют специальный прибор для
заточки блока; этот прибор используется отдельно от
ультрамикротома. В основе своей он представляет собой
стереомикроскоп, снабженный блокодержателем,
который может поворачиваться во всех направлениях.
Прибор оборудован фрезой для заточки пирамиды и обрезки
е.е лицевой поверхности.
Фиг. 12. Блок, заточенный для
ультратопкой резки.
А. Вид сверху. Б. Вид сбоку.
ультрамикротомия
Заточенный блок готов для резки на
ультрамикротоме. Детали инструкций, которым надо следовать при
Приготовление ультратонких срезов 87
ультратонкой резке, различны у микротомов различных
типов. Некоторые микротомы работают в полностью
автоматизированном режиме после того, как блок
закреплен в держателе и ручки управления установлены в
соответствующем положении. Блок подается по
направлению к режущему краю ножа за счет теплового
расширения нагреваемого металлического стержня, а
опускание блока ниже края ножа и его возвращение в
исходное положение контролируются электронной схемой.
Может показаться, что все обязанности состоят в том,
чтобы стоять рядом и снимать ленту серийных срезов по
мере того, как она сходит с ножа. На деле же, однако,
овладение мастерством резки на автоматических
ультратомах требует значительной усидчивости.
Некоторые фирмы, выпускающие автоматические
ультрамикротомы, организуют регулярные курсы по
обучению ультратонкой резке. По-видимому, обучение на
таких курсах имеет большой смысл для тех, кто
собирается постоянно работать на автоматических ультратомах.
LKB Ultramicrotomy Laboratory (Стокгольм, Швеция)
организует двухнедельные курсы, которые проводятся в
Англии, Франции и Германии1.
Ручная ультратонкая резка на хорошо
зарекомендовавших себя приборах, таких, например, как старая
модель ультрамикротома Cambridge Huxley, дает
превосходные единичные ультратонкие срезы, однако получить
ленты серийных срезов на них значительно труднее,
чем на автоматических приборах. Обучение резке на
ультрамикротомах с ручным управлением имеет
определенные преимущества. Одно из них заключается
в том, что оператор осуществляет самый
непосредственный н постоянный контроль за процессом резания и
может легко следить за последовательностью
многочисленных вариантов этого процесса. Однако несомненно, что
при резке ряда «трудных» тканей или тканей, залитых
в водорастворимые метакрилаты, автоматические
ультрамикротомы получили заслуженное признание. Новая
модель ультрамикротома Cambridge Huxley (Cambridge
1 Подобные же курсы организуются фирмой LKB в Советском
Союзе, — Прим. перед.
88
Глава 3
Mkll) имеет электрический привод и ручное управление,
сочетая, таким образом, преимущества автоматической
и ручной резки.
Подробная инструкция работы на ультрамикротоме
предоставляется фирмой-ичготовителем, а
представители фирмы демонстрируют приемы работы на этом
приборе при его установке. Однако существует несколько
основных правил, которые следует выполнять при
работе на всех микротомах. Прежде всего необходимо
устранить все возможные источники вибрации. Надо
убедиться в том, что блок с заключенной в него тканью
надежно закреплен в держателе и что сам держатель
прочно укреплен на микротоме. Убедитесь также в том,
что нож поставлен под нужным углом и надежно
закреплен. Угол наклона ножа (угол, образованный
передней стороной ножа с вертикальной плоскостью,
обозначается также как угол клиренса) должен быть
равным 1—7°. Проверьте параллельность края ножа и
лицевой поверхности блока, которые должны быть так
расположены относительно друг друга, чтобы в первый
момент не был срезан большой кусок ткани. Один
толстый срез может затупить режущий край ножа,
а слишком толстый — повредить также и лицевую
сторону блока.
Если лицевая сторона блока обрезана в форме
прямоугольника, то его короткая сторона должна
располагаться параллельно краю ножа [5]. Это позволяет
большее число раз передвигать блок вдоль того участка
режущего края ножа, который дает наилучшие срезы.
Однако Шёстранд [9] рекомендует располагать параллельно
краю ножа длинную сторону такого прямоугольника.
Положение лицевой стороны блока и весь процесс
резки можно наблюдать при больших увеличениях сте-
реомикроскопа (вплоть до 100 раз), установленного
перед микротомом или на самом микротоме. Стереомикро-
скоп должен иметь регулируемый осветитель,
позволяющий поддерживать оптимальный режим освещения.
. В ванночку, укрепленную на задней стороне ножа,
наливают 10°/о-ный раствор ацетона и устанавливают
правильный уровень мениска. Так же как и при резке
срезов толщиной 1 мкм, слишком высокий мениск (вы-
11 pain:деление ультратонких срезов
89
пуклый) В'.дет к тому, что ацетон будет стекать по
иср-сднен стороне ножа. Если это произойдет, то
остановить стекапне ацетона очень трудно, поскольку
нарушается поверхностное натяжение на крае ножа, и,
возможно, этот нож придется выбросить. Вместе с тем при
слишком низком (вогнутом) мениске получаемые срезы
не будут попадать на поверхность жидкости.
Лучше всего начинать резать средней третью ножа
и затем,, когда пойдут хорошие срезы, передвинуть нож
таким образом, чтобы продолжать резку самой лучшей
частью его режущего края. После того как нож
передвинут, начинать резку следует с большой
осторожностью, так как, передвигая нож, мы могли слишком
приблизить его к блоку; в связи с этим нож
необходимо немного отодвинуть, чтобы не орезать толстого
куска ткани.
Скорость, с которой движется объект у края ножа,
имеет большое значение. Эту скорость можно
регулировать и изменять в зависимости от типа ткани, которую
необходимо порезать. Обычно, если не требуется
получить особенно тонкие (200—300 А) срезы, используют
медленный равномерный темп нисходящего движения
блока; для того чтобы получить ультратонкие срезы,
движение блока должно быть более быстрым.
Все современные микротомы снабжены
приспособлением, которое гарантирует, что блок при обратном
(восходящем) движении не будет приходить в
соприкосновение с краем ножа. При резке на лицевой стороне блока
образуется электрический заряд. Этот заряд и силы
капиллярного натяжения, возникающие в очень узкой
щели перед блоком, достаточны для того, чтобы увлечь
жидкость, а вместе с ней и только что полученный срез,
из ванночки на лицевую поверхность блока. При
следующем нисходящем движении блока жидкость,
находящаяся на его лицевой стороне, смочит переднюю
сторону ножа, и, по всей вероятности, туда же будет
увлечен и срез. В некоторых ультрамикротомах удается
избежать этого благодаря тому, что стержень, в
котором закреплен блок, сдвигается в сторону перед
началом движения вверх, вследствие чего блок не проходит
вблизи края ножа при своем возвратном движении.
90
Глава 3
В ультрамикротомах фирмы LKB перед движением
блока вверх нож сдвигается назад на 20—30 мкм, что
создает достаточный зазор между ножом и блоком.
При резке происходит сжатие срезов, которое
значительно больше, если нож тупой или неправильно
ориентирован. Такое сжатие приводит к деформации ткани,
однако его можно частично устранить, если над
срезами подержать стеклянную палочку, смоченную
хлороформом. При этом видно, как срезы расправляются под
воздействием паров хлороформа.
ОПРЕДЕЛЕНИЕ ТОЛЩИНЫ СРЕЗОВ
После того как срезы расправятся, можно
приблизительно определить их толщину, отмечая цвет срезов
в отраженном свете. Серебристо-серые срезы имеют
толщину около 500—600 А—именно такие срезы и надо
стараться получить. Серебристые срезы имеют толщину
около 600—900 А, золотистые —900—1200 А. Эти
последние срезы также можно использовать, но они
непригодны при работе с высоким разрешением. Темно-
золотистые, пурпурные, синие или зеленые срезы,
слишком толсты. Все срезы тоньше 500 А серого цвета, и
начинающим получить их удается крайне редко.
. Толщину срезов можно изменять, регулируя
соответствующую ручку настройки микротома. Эта ручка
может иметь шкалу, указывающую толщину среза,
однако даже в лучшем случае ее показания
приблизительны. Более правильным показателем толщины среза
служит отраженный от него свет. Этот, а также другие
методы определения толщины среза описаны в статье
Вильямса [12].
НЕКОТОРЫЕ ПРОБЛЕМЫ, ВОЗНИКАЮЩИЕ
В ПРОЦЕССЕ РЕЗАНИЯ 1
Число срезов, которые можно получить, используя
один нож, зависит от множества факторов, в том числе
от размеров лицевой стороны блока, от толщины срезов,
твердости ткани, от качества и протяженности того уча-,
стка режущего края ножа, который дает наилучшие
Приготовление ультратонких срезов 91
< ■
срезы. В том случае, когда на срезах появляются
царапины или другие дефекты, надо несколько передвинуть
нож, с тем чтобы резать новым участком ножа. Если
после этого царапина вновь появляется точно на том же
месте среза, то причиной ее может быть что-то твердое
в самой ткани. Возможно, что ткань была неправильно
зафиксирована или залита.
Горизонтальная исчерченность (следы вибрации) на
срезах может быть вызвана слишком большим углом
наклона ножа или тем, что блок не был заточен в
форме правильной пирамиды. Однако чаще горизонтальная
исчерченность обусловливается тем, что блок не был
прочно закреплен в зажиме, а зажим — в микротоме,
или тем, что нож не был хорошо закреплен в
держателе. Если все было закреплено правильно, то причиной
повреждения среза может быть вибрация внутри или вне
здания. Если же все эти факторы исключаются, то
возможно, что микротом требует наладки или технического
осмотра1.
Для выявления источника неполадок при ультрамик-
ротомии очень полезным может оказаться блок полиме-
ризованного заливочного материала, не содержащий
ткани. Если блок с залитой в него тканью режется
плохо, замените его на блок без ткани. Если этот блок
режется хорошо, то, следовательно, причиной неудачи
является сама ткань. Если же заливочный материал без
ткани также режется плохо, то это значит, что либо нож
имеет плохой режущий край или установлен
неправильно, либо сам микротом нуждается в техническом
осмотре.
ВЫЛАВЛИВАНИЕ СРЕЗОВ
После того как на поверхности мениска образуется
лента срезов (или шесть и более отдельных срезов), их
вылавливают на сетку. Чтобы сделать это, сетку
захватывают-за край тонким пинцетом и опускают ее прямо
на срезы. Отдельные срезы перед вылавливанием на сет"
1 В некоторых случаях вибрация возникает по причине
несоответствия твердости блока и скорости резания. Чем тверже блок,
тем ниже должна быть скорость резания.—Прим. ред.
92
Глава 3
ку можно расположить определенным образом на
поверхности жидкости с помощью ресницы, укрепленной
на конце деревянной палочки.
Медные сетки, применяемые для обычной
электронной микроскопии, имеют одну полированную и другую
матовую стороны. На какую из сторон помещают
срезы — безразлично, однако нужно твердо помнить, какая
из сторон была для этого использована. Когда объект
помещается в колонне микроскопа, то срезы всегда
должны лежать под переплетом сетки. В противном
случае истинное увеличение не будет соответствовать
показаниям шкалы увеличений. Таким образом, если срезы
всегда помещаются на одну сторону сетки, например на
матовую, то можно с первого взгляда определить, как
следует ориентировать сетку в держателе объекта. Прак-
тьчески очень важно всем работающим на данном
микроскопе договориться относительно того, какой из сторон
сетки они будут пользоваться для размещения срезов.
Это позволит избежать недоразумений.
После того как сетка коснулась срезов, ее снимают
с мениска. Теперь срезы будут плавать на капле
10%-ного ацетона, которая пристала к сетке1.
Поверните сетку таким образом, чтобы капля оказалась сверху,
и промокните ее нижнюю сторону чистой
фильтровальной бумагой. Ацетон впитается в фильтровальную
бумагу, а срезы распластаются, тесно прилегая к
переплетам сетки.
Некоторые считают, что проще погрузить сетку ниже
поверхности мениска и затем подвести ее под срезы. Оба
метода дают хорошие результаты, и выбор одного из
них в значительной мере дело вкуса.
Иногда возникают трудности при вылавливании
срезов на сетку — срезы быстро отплывают от сетки, как
бы активно отталкиваясь от нее. Возможно, что это
обусловлено наличием электрического заряда. В таком
случае может помочь заземление держателя микротома,
в котором зажимается блок, или смачивание ацетоном
1 Если сетка имеет пленку-подложку, то срезы прилипают к
подложке сразу же после прикосновения. В этом случае отсосать
избыток жидкости можно, прикоснувшись ребром сетки к
фильтровальной бумаге. — Прим. ред.
Приготовление ультратонких срезов
93
пинцета перед захватыванием им сетки. Трудно
выловить срезы и при загрязнении сеток. Если в помещении,
где проводилась резка, работал вакуумный насос, то
отработанный воздух, выбрасываемый насосом, может
загрязнять открытые сетки. Метод очистки сеток
приводится в приложении на стр 309.
Для обычных целей не имеет смысла готовить сразу
более чем четыре сетки. Блок следует сохранить так,
чтобы позже, если потребуется, можно было
приготовить большее число срезов этой ткани на том же или
более глубоком уровне.
КАЧЕСТВО СРЕЗОВ
До тех пор пока срезы не будут просмотрены в
электронном микроскопе, об их качестве нельзя сказать
ничего определенного. Только при просмотре может
выясниться, что срез, казавшийся отличным на поверхности
мениска, содержит непригодную для просмотра ткань.
Вместе с тем можно получить удовлетворительный
снимок со среза, который при резке казался далеким от
совершенства. Только опыт может подсказать, когда срез
в действительности настолько плох, что его не стоит
брать для исследования. Если ткань особенно трудна
для резки, имеет смысл просматривать отдельные
заведомо плохие срезы в надежде получить какие-либо
данные об этой ткани. Если причина затруднения при
резке неясна, просмотр срезов в электронном микроскопе
может указать на источник этих затруднений. Это
особенно справедливо в отношении тканей, подвергавшихся
необычным экспериментальным воздействиям.
Срезы перед просмотром лучше окрашивать;
исключением из этого правила могут быть лишь специальные
случаи. Во-первых, оценка качества неокрашенной ткани
может быть довольно трудной, особенно для
начинающих. Во-вторых, взаимодействие электронного луча со
срезом может сделать его невосприимчивым к
красителю. В-третьих, было показано [7], что окрашивание
дает более высокий контраст, если оно производится до
полного высушивания срезов.
91-
Глава 3
РЕЗКА ТКАНИ ДЛЯ ИССЛЕДОВАНИИ
С ВЫСОКИМ РАЗРЕШЕНИЕМ
В этой книге высокое разрешение произвольно
определяется как разрешение 25 А и менее. Разрешение
менее 15 А редко достигается при исследовании срезов
залитой ткани, хотя Шёстранд [8] сообщал о разрешении
v 10, а Хейдон [3]—в 5 А. Достигаемое разрешение
частично зависит от толщины среза и обычно считается
равным примерно одной десятой этого показателя
(другие факторы, определяющие разрешение, обсуждаются
г. статье Вахтеля и др. [11]). Шёстранд [9]
использовал срезы толщиной 100 А и менее; в его лаборатории
обычны серийные срезы средней толщины — 200—300 А.
Большинство электронных микроскопистов работают
со срезами толщиной от 500 до 1000 А. Чтобы получить
более тонкие срезы, необходимо строго придерживаться
некоторых технических правил, указанных Шёстрандом
[8, 9]. Вот некоторые из них:
1. Режущий край ножа должен иметь самое высокое
качество, которое проверяется с помощью стереомикро-
скопа при большом увеличении и хорошем освещении.
2. Угол наклона ножа должен быть небольшим: 1—3°.
3. Лицевая поверхность блока должна быть очень
небольшой— 0,1 мм2 или менее. Блок необходимо заточить
в виде пирамиды, что позволяет избежать вибрации.
4. Скорость резания должна быть высокой.
5. Для обеспечения максимальной гомогенности
блока ткани очень важно хорошее пропитывание и
полимеризация заливочного материала. Более тонкие срезы
легче получаются с твердых блоков, чем с мягких.
6. Микротом должен быть налажен исключительно
хорошо, а все возможные источники вибраций должны
быть устранены.
Поскольку эта книга предназначена для начинающих,
в ней'даны те сведения о тонком искусстве резания для
электронно-микроскопического исследования с высоким
разрешением," которые позволяют в полной мере
представить степень технического совершенства и личной
организованности, необходимые для получения таких
срезов. Если мастерство при обычной резке достигает та-
Приготовление ультраТонКих срезов
55
кого уровня, когда постоянно получаются серебристые
или серебристо-серые срезы, то это значит, что пришло
время для внимательного чтения раздела в книге
«Электронная микроскопия клеток и тканей»,
озаглавленного «Приготовление тонких срезов для электронной
микроскопии» [9]. В этом разделе приведены также
очень ценные советы по искусству серийного резания.
УЛЬТРАТОНКИЕ ЗАМОРОЖЕННЫЕ СРЕЗЫ
Методы получения ультратонких замороженных
срезов фиксированных и нефиксированных тканей,
разрабатываемые в настоящее время в нескольких
лабораториях, описаны в гл. 8.
Список литературы
1. Cameron D. A., A note on breaking glass knives, Journal of
Biochemical Cytology, 2, Suppl., 57—59 (1956).
2. Fernandez-Moran H., A diamond knife for ultrathin sectioning,'
Experimental Cell Research, 5, 255—256 (1953).
3. Haydon G. В., An electron optical lens effect as a posiible source
of contrast in biological preparations, Journal of Microscopy, 90,
1—13 (1969).
4. Latta H., Hartmann J. F., Use of a glass edge in thin sectioning
for electron microscopy, Proceedings of the Society for
Experimental Biology and Medicine, 74, 438—439 (1950).
5. Porter K. R-, In Modern Developments in Electron Microscopy,
pp. 119—145 (Edited by В. М. Siegel), New York and London,
Academic Press, 1964.
6. Pyper A. S., A glass plier kit for making glass knives for electron
microscopy, Laboratory Practice, 19, 491—492 (1970).
7. Shalla T. A., Carrol T. W., De Zoeten G. A., Penetration of stain in
ultrathin sections of tobacco mosaic virus, Stain Technology, 39,
257—265 (1964).
8. Sjostrand F. S., A new ultrastructural element of the membranes
in mitochondria and of some cytoplasmic memebranes, Journal of
Ultrastructure Research, 9, 340—361 (1963).
9. Sjostrand F. S., In Electron Microscopy of Cells and Tissues, Vol. 1,
Chap. 9, pp. 222—310, New York and London, Academic Press,
1967.
10. Sjostrand F. S., In Physical Techniques in Biological Research,
Vol. 3, Part C, Cells and Tissues, 2nd edn. pp. 139—200 (Edited by
A. W. Pollister), New York and London, Academic Press, 1969.
11. Wachtel A. W. et al., In Physical Techniques in Biological Research,
Vol. Ill, Part A, Cells and Tissues 2nd edn, Chap. 4 (Edited by
A. W. Pollister), New York and London, Academic Press, 1966.
12. Williams M. A., In Advances in Optical and Electron Microscopy,
Vol. 3, pp. 228—238 (Edited by R. Barer and V. E. Cosslett),
London and New York, Academic Press, 1969.
ГЛАВА 4
Контрастирование (окрашивание)
биологических материалов
для электронной микроскопии
ВОЗНИКНОВЕНИЕ КОНТРАСТА ИЗОБРАЖЕНИЯ
В электронной микроскопии изображение объекта
формируется с помощью электронного луча,
сфокусированного магнитными линзами. При прохождении
электронного луча через объект плотные компоненты объекта
вызывают отклонение (рассеивание) части электронов.
В том случае, когда такое отклонение электронов
компонентами ткани достаточно велико, электроны
попадают за пределы апертурнои диафрагмы и полностью
исключаются из луча. Таким образом, на
люминесцентном экране или фотографической пластинке,
помещенных ниже объекта по ходу электронного луча,
формируется изображение.
Темные области люминесцентного экрана
соответствуют плотным компонентам объекта, которые
выбивают электроны из луча. Светлые (люминесцирующие)
области экрана показывают те места, где электроны
смогли пройти сквозь объект и вызвать свечение вещества,
покрывающего люминесцентный экран. Количество
электронов, рассеиваемых каждой точкой объекта,
зависит от толщины среза и атомного веса составляющих
его атомов. Объект нельзя увидеть, если он рассеивает
менее 5% луча [27J.
При низком ускоряющем напряжении электроны
в луче обладают меньшей энергией и рассеиваются
легче. В пределах напряжений, применяемых в электронной
микроскопии, контрастность изображения и ускоряющее
напряжение связаны между собой обратной
зависимостью. При уменьшении размеров апертурнои
диафрагмы увеличивается число электронов, не попадающих
в ее отверстие, возрастает контрастность изображения.
Таким образом, контрастность изображения в электрон-
Контрастирование биологических материалов 97
ном микроскопе зависит от следующих факторов: 1)
толщины среза; 2) наличия в объекте тяжелых атомов;
3) ускоряюще) ) напряжения; 4) размера аиертурной
диафрагмы.
УСИЛЕНИЕ КОНТРАСТА
Если в световой микроскопии дифференцировка
компонентов ткани достигается с помощью окрашивания
теми или иными красителя, то в электронной
микроскопии «красители» — это вещества или ионы,
содержащие элементы с большим атомным весом, интенсивно
рассеивающие электроны. Чем больше протонов
содержится в атомном ядре, тем больше электронов,
окружающих это ядро. Как ядро атома, так и
расположенное вокруг него электронное облако отклоняют
электроны в луче, проходящем через объект. Однако именно
рассеивание электронов луча электронным облаком
(неупругое рассеивание) в наибольшей степени
способствует созданию контрастности изображения. Большинство
химических элементов, входящих в состав животных
и растительных тканей, характеризуется небольшим
атомным весом:
Водород 1
Углерод 12
Азот 14
Кислород 16
Фосфор 31
Сера 32
Эти легкие элементы обладают очень небольшой
способностью рассеивать электроны.
Для того чтобы создать в тканевых компонентах
диапазон плотностей, достаточный для получения их
отчетливого изображения, в качестве «электронных
красителей» были использованы различные тяжелые металлы
(т. е. атомы с большими ядрами, окруженными облаком
с большим числом электронов). Естественно, что чисто
случайное распределение атомов тяжелых металлов по
ткани не придало бы изображению в электронном
микроскопе необходимую контрастность. Для этого нужно
7—977
98
Глава 4
увеличить массу определенных участков объекта. Было
показано, что целый ряд солей тяжелых металлов
можно использовать в качестве «электронных красителей»,
усиливающих контрастность изображения, и
приблизительно полдюжины их нашло широкое применение.
Реакции между «электронными красителями» и
компонентами ткани, как и реакции взаимодействия
фиксатора и ткани, еще не до конца выяснены. Большинство
катионов тяжелых металлов образуют комплексы с
отрицательно заряженными группами тканевых
компонентов; обычно в состав этих групп входит азот, кислород,
сера или фосфор. Ионы свинца, урана, ипдия, висмута
и железа могут образовывать связи с кислородом и,
следовательно, присоединяться к фосфатным группам
нуклеиновых кислот [27]. Свинец может также связываться
с комплексами, образованными при фиксации осмиевыми
фиксаторами и компонентами ткани. Некоторые соли
урана (особенно уранилацетат) имеют сильно
выраженное сродство к нуклеиновым кислотам, но при этом
действуют и как универсальные красители на белки.
ОКРАШИВАНИЕ ПРИ ФИКСАЦИИ
И ОБЕЗВОЖИВАНИИ
Четырехокись осмия окрашивает ткань в процессе
ее фиксации, поскольку содержит атом тяжелого
металла. Четырехокись осмия реагирует как с лнпидами,
так и с белками, в результате чего усиливается
контрастность лииопротеидпых клеточных мембран и
жировых включений. Контрастность нуклеопротеидов
увеличивается в меньшей степени, так как осмий реагирует
только с их белковым компонентом.
Перманганат калия также является «красителем»
и при фиксации усиливает контрастность фосфолипид-
ных мембран. Можно окрашивать также, добавляя
соединения других тяжелых металлов либо к фиксатору,
либо к обезвоживающим средам. Именно так
использовали уранилацетат и фосфорновольфрамовую кислоту
с самых первых дней развития электронной
микроскопической техники. Позднее было обнаружено, что
рутений красный усиливает контрастность некоторых вне-
Контрастирование биологических материалов 99
клеточных веществ, в состав которых входят углеводы
[1]. Предполагают [2], что увеличение контрастности
ядер при обработке ткани перед обезвоживанием
раствором аммиачного серебра происходит вследствие
окрашивания гистонов. Это предположение, однако, еще
требует подтверждения.
Основной недостаток окрашивания в процессе
фиксации или обезвоживания состоит в том, что краситель
плохо пропик.ает в кусочек ткани. Даже в том случае,
когда краситель проникает в межклеточные
пространства, диффузия крупных молекул этого красителя внутрь
отдельных клеток часто задерживается барьерами,
создаваемыми плазматическими мембранами.
ОКРАШИВАНИЕ УЛЬТРАТОНКИХ СРЕЗОВ
Показано, что значительно более удобным и
эффективным способом усиления контраста является
окрашивание ультратопких срезов залитого материала. Эти
срезы, толщина которых незначительна в сравнении с
диаметром любой клетки, могут быть подвергнуты
воздействию красящих веществ с одной или с обеих сторон.
В этом случае перед красителем нет барьеров,
создаваемых плазматическими мембранами, и он может
непосредственно воздействовать на открытые внутренние
отделы клетки. Единственным препятствием на пути
красителя является сам заливочный материал. К счастью,
определенные взаимодействия контрастирующих
веществ с компонентами тканей, залитых в эпоксидные
смолы и метакрилаты, могут происходить и происходят,
так что окраска ультратонких срезов относительно
несложна. Для этого сетки с ультратонкими срезами
просто помещают на поверхность капли раствора красителя
или погружают в нее на определенный промежуток
времени. При этом заливочная среда не окрашивается,
а окрашиваются только срезанные поверхности ткани',
если ее реактивные группы не были блокированы в ходе
предшествующей обработки.
1 Показано, что водный раствор уранилацетата может
проникать в блок ткани, заключенный в эпоп на несколько десятков
микрометров. — Прим. ред.
7*
100
Глава 4
ИЗБИРАТЕЛЬНОСТЬ И СПЕЦИФИЧНОСТЬ
К сожалению, в большинстве случаев использование
одних и тех же электронно-микроскопических методик
в различных лабораториях приводит к неодинаковым
результатам. В этом отношении процедуры окрашивания
не представляют собой исключения. Незначительные
отклонения от методики обработки ткани на любом ее
этапе могут повлиять на сродство ультратонких срезов
к красителю. Результаты окрашивания зависят не
только от типа и времени фиксации, но также и от буфера,
применяемого для приготовления фиксатора. Различные
заливочные среды по-разному воздействуют на ткань.
Так, например, ткань, залитая в эпои, окрашивается
быстрее, чем ткань, залитая в аралдит; ткани, залитые
в водорастворимые и водонерастворимые метакрилаты,
будут окрашиваться различно, и, наконец, та и другая
залитая ткань будет отличаться от ткани, залитой
в эпоксидные смолы. Очень важны также температура
и рН, при которых ведется окрашивание. Но тем не
менее некоторые методы окрашивания, такие, например,
как окрашивание уранилацетатом и цитратом свинца
по Рсйнольдсу, применяемые при стандартизованных
условиях, дают довольно постоянные результаты.
Необходимо помнить, что в реакции, которая
происходит при контакте красителя и среза, компоненты
клетки могут не принимать никакого участия. Краситель
может вступить в реакцию с молекулами фиксатора,
связанными с тканью, как это происходит при
окрашивании свинцом, который, по-видимому, связывается
с осмиевыми соединениями, образующимися между
осмием и некоторыми компонентами клетки в процессе
фиксации [10]. Таким образом, после осмиевой
фиксации свинец действует как универсальный краситель.
Окрашивание свинцом, получаемое после фиксации
одними альдегидами, обусловливается преимущественно
материалом, содержащим РНК [10], а также гидро-
ксильными группами углеводов [5].
Отдельные «электронные красители» проявляют
некоторую избирательность в отношении различных
клеточных компонентов, однако ни один из них нельзя назвать
Контрастирование биологических материалов 101
строго специфическим красителем. Если
предварительно блокировать свободные валентности белков или
углеводов, то треххлористый индий будет окрашивать
только ДНК и РНК, однако отличить эти кислоты друг от
друга не удастся [25]. Уранилацетат сильно
увеличивает контраст ДНК и РНК, но окрашивает также, хотя
и в меньшей степени, белки, вследствие чего его
считают селективным, но не специфическим красителем для
нуклеиновых кислот. Сообщалось, что в некоторых очень
строго определенных условиях уранилацетат
дифференцированно окрашивает РНК и ДНК [4, 9, 11].
Растворы солей свинца при высоких значениях рН,
впервые предложенные Уотсоном в 1958 г., великолепно
контрастируют клеточные мембраны. Некоторые
исследователи, в том числе Мариноцци [10], Демс и Персьин
[5], установили, что уранилацетат и свинец в строго
определенных условиях могут дифференцированно
окрашивать -РНК и ДНК. Сложный катион, содержащий
два атома свинца [РЬ(ОН)гРЬ]2+, служит,
по-видимому, активной группой ионов во всех широко
используемых свинцовых красителях с высоким значением рН
[18].
Фосфорновольфрамовая кислота при рН ниже 2
имеет большое сродство к полисахаридам [14, 17], однако
специфичность этой реакции все еще служит предметом
жарких споров (см. [7] и [15]). При рН 3,0—3,5
фосфорновольфрамовая кислота проявляет сродство к
белкам и нуклеопротеидам.
Короче говоря, специфичность (в строгом
цитохимическом смысле) «электронных красителей»,
используемых в настоящее время, в лучшем случае спорна. Более
подробно об этом сказано в гл. 8.
НАИБОЛЕЕ ЧАСТО УПОТРЕБЛЯЕМЫЕ МЕТОДЫ
ОКРАШИВАНИЯ
В приложении IV приведены прописи наиболее часто
употребляемых методов контрастирования.
Начинающему необходимо тщательно ознакомиться с результатами,
получающимися при использовании' этих методов,
прежде чем пытаться их усовершенствовать. Подробное об-
Таблица 4
Тяжелые металлы, обычно применяемые в электронной микроскопии
для увеличения контраста
Осмий
Уран
Свинец
Вольфрам
Атомный
вес
190
238
207
184
Раствор, применяемый
для окрашивания
Четырсхокись осмия,
окрашивает в
ходе фиксации
Уранилацетат
Свинец при
высоких значениях рН
и в присутствии
хелатообразую-
щих агентов
Фосфор новольфра-
мовая кислота при
рП 3 и выше
Фосфор новольфра-
мовая кислота при
рН 3 и ниже
Концентрация
1%
1—2%-пый водный
раствор;
насыщенный раствор
в 50-градусном
этаноле
Примерно 1 %
1%
1% в этаноле, 5—
10% в воде
Среда
Водные буферные
растворы, пары
при окрашивании
срезов
Вода; 50%-ный
этиловый или
метиловый спирт
Вода с добавлением
стабилизирующих
веществ и щелочи
НС1 или хромовая
кислота
Абсолютный этанол
или вода
Группы, реагирующие
с красителем
С=С и полярные
группы липидов;
SH-группы белков
Р04-группы
нуклеиновой кислоты, а
также белки
Восстановленны и
осмий, ОН-груп-
пы углеводов,
РНК
Полисахариды и
глнкопрогеиды
(ОН-группы)
Белки и иуклеопро-
теиды
Влияние на контраст
нзображення:степень
увеличения контраста
Белки+Липиды
(фосфолипидные
мембраны, липид-
н ые включения,
секреты) + +
Нуклеиновая
кислота (хроматин,
рибосомы) -f + +
Белки + +
Липопротеидные
мембраны + + +
Белки +
Гликоген -f- +
Рибонуклеопротеид
+ + +
Имитирует реакцию
шик
Окрашивает белки,
особенно коллаген
Контрастирование биологических материалов 103
суждение этих методов и их вариантов можно найти
в работах Пиза [13], Глауэрта [6], а также других,
приведенных в библиографии к данной главе и к гл. 8.
В табл. 4 перечислены наиболее часто применяемые
«электронные красители» и суммировано то немногое,
что известно о механизмах их действия. Следует
заметить, что обычно пользуются однопроцентными
красителями независимо от атомного веса входящего в их
состав тяжелого металла. Было обнаружено, что
концентрация красителя, необходимая для увеличения
контрастности объекта дайной толщины, не зависит от
его природы. При употреблении красителя с одинаковым
весовым содержанием (т. е. с одинаковым процентным
содержанием) на каждый миллилитр его раствора
будет приходиться примерно одинаковое число электронов.
Однако если используют равномолярные растворы
красителя, то создаваемый красителем контраст зависит от
его молекулярного веса [12].
ДВОЙНОЕ ОКРАШИВАНИЕ
Одним из наиболее употребительных методов
является последовательное окрашивание урапилацетатом и
цитратом свинца по Рейнольдсу [18]. При совместном
использовании урапилацетата и свинца контрастность
препарата увеличивается в значительно большей
степени, чем при раздельном применении этих веществ [9]
<ср. фото U, Б, В и Г).
В том случае, когда ткань была фиксирована четы-
рехокисью осмия, окрашивание уранилацетатом —
цитратом свинца было бы правильнее назвать «тройным
окрашиванием», поскольку и осмий, и уран, и свинец
принимают участие в увеличении контраста. Пропись
данного метода приводится в приложении па стр. 296. -
ПРОСМОТР СРЕЗА ПЕРЕД ОКРАШИВАНИЕМ
При некоторых обстоятельствах может возникнуть
необходимость просмотреть и сфотографировать сетку как
до окрашивания, так и после него. Это возможно, если
протекающая в ткани цитохимическая реакция сопро-
104 Глава 4
вождается отложением свинца в тех местах, где она
протекает. Очевидно, может возникнуть желание
зарегистрировать наличие продуктов этой цитохимической
реакции до того, как окрашивание свинцом или другими-
красителями затемнит места протекания реакции.
Однако без окрашивания контраст объекта может быть
настолько мал, что различить, в какой части клетки
происходит реакция или даже какой тип клеток принимает
участие в цитохимической реакции, оказывается
трудным, а порой и невозможным делом. Поэтому после
того, как будут сфотографированы места, где протекает
эта реакция, было бы полезно окрасить срезы и
сфотографировать повторно те же самые участки.
Делая это, необходимо помнить, что электронный
луч существенно изменяет объект. Ионизация
компонентов объекта под действием электронного луча может
изменить как его структуру, так и химический состав. Это
в свою очередь может изменить и его сродство к
красителю. Кроме того, при длительном воздействии
электронного луча поверхность образца загрязняется,
вследствие чего он прочно изолируется от молекул красителя.
Однако если просмотр и фотографирование среза
ограничиваются очень небольшим промежутком времени, то
неблагоприятные влияния на последующее окрашивание
сводятся до минимума.
ЗНАЧЕНИЕ РАЗМЕРОВ ЧАСТИЦ КРАСИТЕЛЯ
Пригодность красителя, повышающего контраст, для
электронно-микроскопических работ с высоким
разрешением отчасти ограничивается размером частиц этого
красителя, которые присоединяются к компонентам
ткани. Ясно, что крупные частицы красителя, содержащего
металл, сделают неразличимыми детали, размер
которых меньше размера этих частиц. Серебро из-за
крупного размера частиц (40—50 А), отлагающихся в тканях
при обычных условиях окрашивания, применяется
только в особых случаях.
Шёстранд [20] сообщает, что ему удалось получить
разрешение в 10 А на ультратонких срезах, окрашенных
уранилацетатом. В другой работе [22] он утверждает»
Контрастирование биологических материалов 105
что при окрашивании свинцом краситель может
откладываться в виде скоплений диаметром до 50 А, не
уточнив, однако, при каких условиях отлагаются такие
крупные частицы. Хейдон [8], используя популярный метод
Рейнольдса с цитратом свинца, получил скопления
свинца, диаметр которых лишь немного превышал 10 А.
На размер образующихся частиц красителя
оказывают влияние многие факторы, в том числе природа и
концентрация атомов тяжелого металла, применяемого для
окрашивания, наличие в красящем растворе других
ионов, температура и рН красителя, продолжительность
окрашивания. Фиксатор, которым фиксировали ткань,
и пространственные взаимоотношения тканевых
компонентов, на которых отлагается краситель, также могут
влиять на размеры скоплений частиц красителя.
Взаимодействия этих различных факторов не совсем ясны.
Вопрос о размере частиц красителя, образующихся в
специфических условиях каждого отдельного метода
окрашивания, по-видимому, никогда систематически не
исследовался. Таким образом, искусство окрашивания
для электронно-микроскопических исследований при
высоком разрешении все еще требует множества
эмпирических трюков.
ПОВЕРХНОСТНОЕ ОКРАШИВАНИЕ
Одним из факторов, ограничивающих разрешение
электронного микроскопа, является толщина среза. Как
указывалось в гл. 1, рассеивание электронов толстым
срезом может вызывать значительную хроматическую
аберрацию, которая ограничивает разрешение.
Отрицательно сказывается на разрешении также наложение
проекций структур друг па друга в таких срезах.
Если на разных уровнях среза лежат близко
расположенные тельца диаметром 50 А, то при толщине
среза более чем 50 А их проекции будут накладываться
друг на друга [22]. Поскольку глубина фокуса
электронного микроскопа во много раз больше толщины
среза, все такие тельца окажутся в фокусе одновременно,
что даст в результате не поддающуюся расшифровке
106
Глава 4
путаницу тонких структур. Кослетт несколько лет назад
вычислил, что разрешение, получаемое на срезах,
составляет примерно одну десятую толщины среза.
Практически редко удается изготовить"срезы тоньше
100—200 А, и срезы, получаемые в большей части
лабораторий, бывают, как правило, от серебристо-серых
до бледно-золотистых, что соответствует толщине 500—
900 А. Таким образом, для исследований с высоким
разрешением обычно рекомендуется использовать
«поверхностное окрашивание».
Теоретически считается, что если сетку с
ультратонкими срезами не погружать в каплю красителя, а
положить ее иа каплю срезами вниз, то окрашиваться
будет только одна сторона среза. Полагают, что
краситель не проходит в глубь среза, поскольку окрашивание
только одной стороны дает в результате меньший
контраст, чем окрашивание среза путем погружения.
Конечно, когда в качестве фиксатора применяется осмий,
материал но всей толщине среза будет иметь определенную
степень контрастности. Тем не менее если поверхность
среза после окрашивания будет достаточно контрастна,
то материал, лежащий в более глубоких отделах,
окажется по сравнению с ней настолько светлым, что его
доля в общей плотности изображения будет ничтожна
[22]. Сообщалось, что после заливки в эпон, используя
метод поверхностного окрашивания цитратом свинца
по Рейнольдсу, на срезах толщиной 500 А было
получено разрешение 10 А [8]. Однако оказалось, что успех
поверхностного окрашивания зависит от многих
непостоянных факторов. Шалла и др. [19] показали, что если
срезы ткани, залитой в аралдит или мараглас
(эпоксидная смола), не высушить после резки, то в тех местах,
где компоненты ткани пересекают поверхность среза,
происходит проникновение перманганата стронция.
Однако они сообщали, что этот краситель не проникал
через чистую эпоксидную смолу и не достигал полностью
замкнутых в ней структур. Позднее Питере и др. [16]
представили убедительные доказательства того, что
уранилацетат и цитрат свинца проходят полностью
через срез ткани, залитой в аралдит 502, толщиной до
2000 А и окрашивают маленькие частицы, такие, на-
Контрастирование биологических материалов 107
пример, как рибосомы, которые целиком заключены
внутри среза.
Несомненно, что очень ценным вкладом в эту
область исследования была бы постановка серий
тщательно контролируемых опытов, цель которых — определить
при разных условиях глубину проникновения в ткань,
залитую в разные среды, наиболее часто применяемых
электронных красителей. Между тем из работы Шалла
и др. ['19] можно сделать заключение, что если для
исследований с большим разрешением желательно чисто
поверхностное окрашивание, то это скорее всего можно
осуществить, используя срезы, полностью высушенные
перед окрашиванием. Если же желателен
максимальный контраст за счет высокого разрешения, то,
по-видимому, следует предпочесть окрашивание влажного
среза, погружая его в краситель; этот метод можно сочетать
с методами, которые, по общему мнению, усиливают
проникновение красителя в ткань [13].
НЕГАТИВНОЕ КОНТРАСТИРОВАНИЕ
Эта методика применяется для исследования такого
биологического материала, как бактерии, вирусы и
различные субклеточные частицы, и не годится для
ультратонких срезов.
Присоединение атомов тяжелых металлов к
структурным компонентам объекта называется позитивным
окрашиванием, так как при этом красится сам объект.
Однако если биологический объект погружен в электро-
ноплотное вещество, которое не окрашивает его, а
создает вокруг него темный фон, то говорят о негативном
окрашивании, или негативном контрастировании.
Плотное вещество может также проникать в промежутки
между структурными компонентами объекта или
ложиться на его наружную поверхность, способствуя,
таким образом, контрастному выявлению деталей его
поверхности. Этот метод, разработанный Бреннером
и Хорне [29], позволил получить очень интересные
данные, касающиеся структуры бактерий, вирусов,
изолированных клеточных органелл, волокон, нитей и
макромолекул.
108
Глава 4
Для негативного контрастирования использовали
целый ряд солей тяжелых металлов, но особенно широкое
распространение получил фосфорновольфрамовый
натрий. Суспензия исследуемого материала готовится
обычно в 1%-ном водном растворе фосфорновольфрамового
натрия, затем суспензия из пульверизатора, либо с
помощью микропипетки наносится на поверхность сетки,
покрытой коллодием или формваром. Сетки высыхают
почти мгновенно и образуется тонкая пленка красителя,
заключающая в себе объект.
Методические приемы, используемые при
негативном окрашивании, могут приводить к возникновению
ряда артефактов. Например, изолированные компоненты
клетки, подвергнутые ряду последовательных процедур
отделения их от обычного для них окружения,
помещают (как правило, без предварительной фиксации) в
раствор для негативного окрашивания. Вопрос о том, каким
образом взаимодействует негативный краситель и
изолированные компоненты клетки, остается невыясненным.
Можно предполагать, что высушивание и последующее
воздействие электронного луча также влияют на
ультраструктуру.
Разрешение при негативном окрашивании выше, чем
разрешение, получаемое на ультратонких срезах. При
использовании фосфорновольфрамового натрия предел
разрешения составляет приблизительно 12 А и
определяется размером частиц высушенного красителя [34].
Несколько лучшее разрешение достигается с помощью
мелкозернистых негативных красителей, например
урановой соли муравьиной кислоты [33].
Более подробно методы негативного окрашивания
описаны в работе Хорне [31, 32]; факторы, влияющие
на вид биологических объектов при негативном
окрашивании, обсуждаются в статье Глауэрта [30].
Список литературы
Окрашивание в ходе обработки ткани
I. Luft J. #., Fine structure of capillary and endocapillary layer as
revealed by ruthenium red. Federation Proceedings, Federation of
American Societies for Experimental Biology, 25, 1773—1783 (1966).
Контрастирование биологических материалов 109
2. MacRae Е. К-, Meetz G. D., Electron microscopy of the ammoniacal
silver reaction for histones in the erythropoietic cells of the chick,
Journal of Cell Biology, 45, .235—245 (1970).
Окрашивание ультратонких срезов
3. Beer M., Selective staining for electron microscopy, Laboratory
Investigation, 14, 1020-1025 (1965).
4. Bernhard W., Л new staining procedure for electron
microscopical cytology, Journal of Infrastructure Reseadch, 27, 250—265-
(1969):
5. Daems W. Th., Persijn J.-P., Selective staining with heavy metals
of osmium-fixed and formol-fixed mouse liver, Journal of The Royal
Microscopical Society, 81, 199—201 (1963).
6. Glauert A. M., In Techniques for Electron Microscopy, Chap. 9
(Edited by D. H. Kay), Oxford, Blackwell Scientific Publications, 1965.
7. Glick D., Scott J. E., Phosphotungstic acid not a stain for
polysaccharide, Journal of Histochemistry and Cytochemistry, 18, 455
(1970).
8. Haydon G. В., Electron phase and amplitude images of stained
biological thin sections, Journal of Microscopy, 89, 73—82 (1969).
9. Huxley H. E., Zubay G., Preferential staining of nucleic acid con-
tainning structures for electron microscopy, Journal of Biophysical
and Biochemical Cytology, 11, 273—296 (1961).
10. Marinozzi V., The role of fixation in electron staining, Journal of
the Royal Microscopical Society, 81, 141—154 (1963).
11. Monneron A., Bernhard W., Fine structural organization of the
interphase nucleus in some mammalian cells, Journal of Ultrastructure
Research, 27, 266—288 (1969).
12. Pearse A. G. E., In Histochemistry Theoretical and Applied, 2nd
edn, pp. 767—768, London, J. and Л. Churchill, 1961.
13. Pease D. C, Histological Techniques for Electron Microscopy, 2nd
edn, Chap. 7, New York and London, Academic Press, 1964.
14. Pease D. C, Polysaccharides associated with the exterior surface of
epithelial cells: kidney, intestine, brain, Journal of Ultrastructure
Research, 15, 555—588 (1966).
15. Pease D. C, Phosphotungstic acid as a specific electron stain- for
complex carbohydrates, Journal of Histochemistry and
Cytochemistry, 18, 455—458 (1970).
16. Peters A., Hinds P. L., Vaughn J. E., Extent of stain penetration
in sections prepared for electron microscopy, Journal of
Ultrastructure Research, 36, 37—45 (1971).
17. Rambourg A., Hernandez W., Leblond C. P., Detection of complex
carbohydrates in the Qolgi apparatus of rat cells, Journal of Cell
Biology, 40, 395—414 (1969).
18. Reynolds E. S., The use of lead citrate at high pH as an electrono-
paque stain in electron microscopy, Journal of Cell Biology, 17,
208—212 (1963).
19. Shalla T. A., Carroll T. W., de Zoeten G. A., Penetration of stain
in ultrathin sections of tobacco mosaic virus, Stain Technology, 39,
257—265 (1964).
по
Глава 4
20. Sjostrand F. S., A new ultrastructural element of the membranes
in mitochondria and some cytoplasmic membranes, Journal of Ultra-
structure Research, 9, 340—361 (1963).
21. Sjostrand F. S., In Electron Microscopy of Cells and Tissues, Vol. 1,
p. 391, New York and London, Academic Press, 1967.
22. Sjostrand F. S., In Physical Techniques in Biological Research,
Vol. 3, Part C, pp. 169—200 (Edited by A. W. Pollister), New York
and London, Academic Press, 1969.
23. Wachtel A. W., Gettner M. £., Ornstein L., In Physical Techniques
in Biological Research, Vol. 3, Part A, pp. 239—246 (Edited by
Л. W. Pollister), New York and London, Academic Press, 1966.
24. Watson M. L., Staining of tissue sections for electron
microscopy. II. Application of solutions containing lead and barium, Journal
of Biophysical and Biochemical Cytology, 4, 727—730 (1958).
25. Watson M. L., Aldridge W. G., Methods for the use of indium as an
electron stain for nucleic acids, Journal of Biophysical and
Biochemical Cytology, 11, 257—272 (1961).
26. Zobel C. R., Beer M., Electron Stains. I. Studies on the interaction
of DNA with uranyl salts, Journal of Biophysical and Biochemical
Cytology, 10, 335—346 (1961).
27. 7.obel R. E., Beer M., The use of heavy metal salts as electron
stains, International Review of Cytology, 18, 363—400 (1965).
Негативное окрашивание
28. Anderson Т. F., In The Interpretation of Ultrastructure, pp. 251—262
(Edited by R. J. С Harris), New York, Academic Press, 1962.
29. Brenner S., Home R. W., A negative staining method for high
resolution electron microscopy of viruses, Biochimica et biophysica
Acta, 34, 103—110 (1959).
30. Glauert A. M., Factors influencing the appearance of biologic
specimens in negatively stained preparations, Laboratory Investigation,
14, 1069—1079 (1965).
31. Home R. W., The application of negative staining methods to
quantitative electron microscopy, Laboratory Investigation, 14, 1054—
1068 (1965).
32. Home R. W., In Techniques for Electron Microscopy, Chap. 11
(Edited by D. H. Kay), Oxford, Blackwcll Scientific Publications, 1965.
33. Leberman R., Use of uranyl formate as a negative stain, Journal of
Molecular Biology, 13, 607—610 (1965).
34. Parsons D. F., Effects of the preparation procedures on the
appearance of the object in electron micrographs, Laboratory
Investigation, 14, 1169—1177 (1965).
35. Valentine R. C, The shape of protein molecules suggested by
electron microscopy, Nature, London, 184, 1838—1841 (1959).
36. Valentine R. E., Home R. W., In~ Interpretation of Ultrastructure,
pp. 263—278 (Edited by R. J. С Harris), New York, Academic Press,
1962.
ГЛАВА 5
Режим управления электронным
микроскопом
В этой главе мы обсудим некоторые общие аспекты
управления, единые для большинства современных
электронных микроскопов. Детали конструкции и
управления значительно различаются у разных моделей
микроскопов; в новейших приборах многие операции
полностью автоматизированы. Осваивать приемы работы на
данном микроскопе лучше всего под наблюдением
опытного оператора. Лишь после этого можно начинать
работать на микроскопе самостоятельно, руководствуясь,
однако, инструкциями, предоставляемыми
фирмой-изготовителем. В некоторых инструкциях схемы отдельных
операций приводятся на листах, которые можно вынуть
и сброшюровать в том порядке, в котором ими наиболее
удобно пользоваться.
Вначале будет трудно манипулировать
миниатюрными предметами, которые используются при работе на
электронном микроскопе: опорными сетками, объекто-
держателямп, диафрагмами и держателями диафрагм.
Когда это возможно (т. е. когда нет необходимости
пользоваться лампами с защитными фильтрами), работайте
с хорошим освещением, а в случае необходимости
пользуйтесь стереомикросконом. Для работы с сетками
необходимы тонкие часовые пинцеты, которые должны
быть чистыми и в хорошем состоянии.
Управление электронным микроскопом
осуществляется в полутьме, поэтому многие операции приходится
делать па ощупь. У оператора вскоре развивается
правильное кинестетическое чувство, так что его руки
автоматически ложатся на нужные ручки управления, когда
возникает необходимость ими пользоваться. Выработать
это чувство можно быстрее, если немного
попрактиковаться при включенном освещении. Мысленно представь-
112
Глава 5
те расположение панелей управления и различных
приспособлений, расположенных па колонне микроскопа,
которые вам нужно будет находить в темноте. Научитесь
находить их не глядя и, кроме того, ознакомьтесь с теми
ручками, которые располагаются поблизости и которые
вы можете спутать с ними. Например, если ручка
наклона электронной пушки находится рядом с ручкой
центрировки луча, то, спутав их в темноте, можно
нарушить центрирование освещения или даже совсем
«потерять» электронный луч. Полезно пометить обычное
положение различных ручек управления на случай, если
они будут по ошибке смещены.
В начале обучения удобно нанести белые точки на
те ручки управления микроскопом, которыми
пользуются постоянно: на ручку тонкой фокусировки второй кон-
денсорной линзы (в дальнейшем она обозначается как
«конденсор 2» или К2) и ручку центрировки луча. Эти
точки будут видны в полутемной комнате и помогут
избежать недоразумений. Для этой цели удобно
использовать липкие белые кружочки, применяемые для
ориентации слайдов.
Для того чтобы отчетливо видеть объект на
люминесцентном экране и точно фокусировать его изображение,
необходимо адаптироваться к темноте и сохранить эту
адаптацию в течение всего времени работы на
микроскопе. Для достижения оптимальных результатов надо
выключить лабораторный фонарь и свести до минимума
или совсем выключить освещение панели управления.
При таких условиях люминесцентный экран будет
казаться более ярким и контраст изображения будет
выше. Это важно, поскольку фокусировка и
экспонирование при съемке должны производиться также при
относительно низкой интенсивности электронного луча,
падающего на люминесцентный экран, с тем чтобы
получить оптимальную экспозицию без смещения объекта.
ТИПИЧНЫЕ ОПЕРАЦИИ ПРИ ПОВСЕДНЕВНОЙ
РАБОТЕ НА ЭЛЕКТРОННОМ МИКРОСКОПЕ
Приведенное ниже описание операций предполагает,
что прибор включен и установлен согласно приложенной
Режим управления электронным микроскопом 113
инструкции и что астигматизм кондснсорных и
объективной линз компенсирован с помощью
перфорированной угольной пленки (как это описано на стр 132—135),
ускоряющее напряжение (иногда называемое высоким
вольтажем, высоким напряжением или ВН) включено,
а ток накала нити выключон так, что микроскоп
находится в режиме холостого хода в соответствии с
инструкцией по эксплуатации.
КАК ВВЕСТИ ОБРАЗЕЦ В МИКРОСКОП
Вне микроскопа объектодержатель нужно хранить
в чистой закрытой банке с веществами, поглощающими
влагу. Это предотвращает попадание паров воды с объ-
сктодержателя в колонну микроскопа.
Держатель никогда не следует трогать пальцами, так
как жир и влага с пальцев будут способствовать
загрязнению колонны микроскопа (см. стр 129). Берите сетку
чистым пинцетом, а объектодержатель с помощью белой
нейлоновой перчатки или неворсистой ткани, если для
этого нет специального захвата.
Сетка с образцом вкладывается в объектодержатель
таким образом, чтобы срезы в колонне были обращены
вниз (важно всегда помещать образцы на одну и ту же
сторону сетки, как это указывалось в гл. 3; таким
образом вы будете точно знать, па какой стороне сетки
находятся срезы). Срезы должны быть обращены вниз, дл«л
того чтобы обеспечить правильное положение объекта
относительно поля объективной линзы. Увеличение,
создаваемое объективной линзой, изменяется в зависимости
от положения объекта на оси микроскопа.
Теперь объектодержатель можно ввести в камеру
объекта микроскопа. Для того чтобы это сделать, надо
сначала отключить камеру объекта (иногда называемую
шлюзом объекта) от остальной колонны микроскопа,
перекрыв соответствующий клапан. Затем в камеру
объекта впускается воздух. Когда давление воздуха в камере
достигнет атмосферного, можно открыть заслонку
камеры. После того как объектодержатель установлен в
камере, заслонку закрывают и из камеры откачивают
воздух. Обычно это занимает приблизительно 30 с. За от-
Я Q77
114
Глава 5
качиванием воздуха из камеры следят по трубке Гейс-
слера (иногда ее называют ионизационным манометром)
или по индикатору давления. Трубка Гейсслера — это
люминесцентная лампа, установленная на панели
управления микроскопа. Лампа дает розовый свет, когда
в камере объекта находится воздух, голубой — при
уменьшении давления воздуха в камере и в конце
концов гаснет при достижении требуемого вакуума. После
откачивания воздуха камеру объекта можно соединять
с колонной микроскопа.
КАК ПОЛУЧИТЬ ХОРОШЕЕ ОСВЕЩЕНИЕ
После того как объект введен в микроскоп, из
камеры объекта откачан воздух и камера соединена с
колонной, можно включать ток накала нити. Если
микроскоп хорошо отцентрирован и отрегулирован,
электронный луч можно увидеть на люминесцентном экране по
мере того, как повышается ток накала нити.
Сначала па экране будет видно несколько
светящихся «пятен», что соответствует нескольким зонам
электронной эмиссии на поверхности нити, которые
образуются при низком уровне тока. По мере увеличения тока
эмиссия электронов концентрируется в области точки
перегиба нити. Напряжение смещения катодного экрана
(отрицательное по отношению к нити накала)
конденсирует электронное облако ниже точки перегиба нити
до высокой плотности. Это плотное электронное облако
служит эффективным источником электронов. Теперь на
люминесцентном экране видно одиночное светящееся
нятно. Ток накала нити следует увеличивать только до
того момента, когда будет достигнута максимальная
яркость сфокусированного пятна. Дальнейшее
увеличение тока накала не увеличит яркости, а лишь сократит
срок службы нити.
Когда достигнут максимум освещенности, центрируют
луч на экране с помощью ручек центрировки луча,
которые корректируют ось осветителя но отношению к оси
объективной линзы. Затем с помощью ручки тонкого
Режим управления электронным микроскопом 115
контроля конденсора 2 луч может быть расфокусирован
для того, чтобы получить равномерное освещение
необходимого участка. Если аиертурная диафрагма кон-
денсорной линзы правильно центрирована и астигматизм
конденсора компенсирован, то освещенность должна
изменяться равномерно и концентрически.
Что делать, если не удается вывести луч. Если при
включении тока накала нити луч на экране не
появляется, то:
1. Убедитесь, что включено высокое напряжение.
2. Проверьте показания прибора, измеряющего ток
накала. Если стрелка не движется при вращении ручки
тока, то это обычно означает, что нить разомкнута
(перегорела) и в цепи нет тока. В этом случае надо
сменить катод (см. гл. 11, стр. 259).
3. Если показания прибора свидетельствуют о
прохождении тока через нить, то убедитесь в том, что
камера образца соединена с колонной и что объектодер-
жатель установлен правильно.
4. Поверните ручку перемещения объекта, чтобы
убедиться, что переплет сетки не перекрывает свет.
5. Поверните ручку апертурной диафрагмы
объективной линзы в положение «Апертура выключена», чтобы
эта диафрагма не располагалась более па пути луча.
Если после этого луч появится, то, следовательно, его
перекрывала апертурная диафрагма объективной
линзы, которую нужно заново центрировать.
6. Проверьте, все ли ручки установки находятся
в положениях, указанных в технической инструкции.
7. Откройте камеру объекта, как описано выше,
и выньте объектодержатель. Убедитель, что в объек-
тодержателе помимо вашей сетки пет какой-либо
другой.
8. Выньте сетку и введите в камеру объекта пустой
объектодержатель. Откачайте воздух из камеры и
попытайтесь снова вывести луч.
9. Если все оказалось в порядке, а луча все же нет,
необходимо провести обычные операции цептрировки
прибора, описанные в инструкции по эксплуатации
микроскопа.
о*
116
Глава 5
КАК НАЙТИ УЧАСТОК ОБРАЗЦА ДЛЯ ИССЛЕДОВАНИЯ
Некоторые микроскопы имеют специальное
устройство для отыскания срезов образца при малом увеличении.
Это позволяет избежать трудоемкого просмотра каждого
отверстия сетки при увеличении в 1000 раз и более. При
отсутствии такого «поискового устройства» можно
рекомендовать систематический просмотр сетки от одной
ее стороны до другой. Это проще делать на щелевых
сетках, т. е. сетках с длинными прямоугольными
отверстиями, особенно если при установке на минимальное
увеличение удается просматривать одновременно два
таких отверстия. Если у вас выработалась привычка
всегда просматривать сетку в определенной
последовательности, то вы не пропустите какого-либо важного
объекта и вам будет легче вспомнить, на каком участке
сетки вы остановили просмотр, если вас прервали.
Если позволяет время, то имеет смысл, просматривая
сетку, фотографировать все, что покажется важным.
Бывает довольно трудно снова отыскать нужную область
среза, если вы извлекли сетку из микроскопа. Кроме
того, существует риск потерять или повредить сетку при
ее извлечении.
После того как на сетке найден срез, переходите на
большее увеличение, пока не станут различимы крупные
компоненты объекта (например, отдельные клетки или
клеточные ядра). При изменении увеличения может
возникнуть необходимость повторной центрировки луча
с помощью соответствующей ручки. Оптимальное
увеличение для отыскания нужной области зависит от
характера объекта и контраста, полученного при
окрашивании. При очень низкой контрастности объекта
и малом увеличении бывает, невозможно определить,
есть или нет ткань в срезе. Переход на большее
увеличение и использование бинокулярной лупы,
смонтированной на микроскопе, дадут вам возможность найти
нужный материал. Убедитесь в том, что расстояние
между тубусами бинокулярной лупы установлено точно по
вашим глазам и что приставка сфокусирована на
плоскость люминесцентного экрана.
Режим управления электронным микроскопом 117
ЧТО ФОТОГРАФИРОВАТЬ
Люминесцентный экран не может служить местом
для изучения электронного изображения1. Разрешение
большей части веществ, используем.ых для покрытия
экрана, ограничивается 50—100 мкм. Более того, если
микроскоп не имеет приспособления, предупреждающего
загрязнение среза, объект под действием электронного
луча загрязняется так быстро, что вскоре детали его
становятся неразличимыми. Для того чтобы сохранить
важные детали, их необходимо фотографировать.
Что следует считать важными деталями? Ответ на-
этот вопрос зависит от типа ткани и от того, какая
задача стоит перед исследователем. Если данная ткань
мало изучена с помощью электронного микроскопа и вы
хотите полнее описать ее ультраструктуру, то у вас нет
другого выбора, как делать многочисленные снимки со-
срезов, взятых из областей, которые были тщательно-
отобраны при изучении препаратов, используемых для
ориентировки. Только сделав такой довольно
тщательный фотографический обзор нужной области, вы
сможете накопить достаточное количество подробной
информации, которая будет представлять собой определенную-
ценность. Если же ультраструктура данной ткани
известна достаточно хорошо и вы хотите изучить только'
какую-то отдельную структуру или клетку какого-та
одного типа, то вопрос, что фотографировать, решается:
значительно проще. Вам надо лишь просматривать сетки
до тех пор, пока не будет найдена интересующая вас
структура или тип клетки.
Когда вы нашли то место на срезе, которое хотите-
сфотографировать, делайте снимки как можно скорее,,
тщательно фокусируя изображение. Чем больше
времени вы потратите на подготовку к снимку, тем больше*
загрязнится срез и тем меньше будет выявлено
деталей. Помимо этого, электронный луч может вызвать-
повреждение объекта (см. стр. 129). Обычно бывает
1 С этим утверждением нельзя полностью согласиться. Именно
просмотр срезов (или макромолекул) непосредственно на экране
микроскопа позволяет составить полное впечатление об особенностях
образца и выбрать для фотосъемки наиболее характерные зоны. —
Прим. ред.
118
Глава 5
очень полезно сделать один-два снимка данного участка
при малом увеличении, которые необходимы для
ориентировки при последующем исследовании этого участка.
Если не применяется приспособление, предупреждающее
загрязнение срезов, лучше сначала сделать снимки при
большом увеличении, с тем чтобы выявить необходимые
тонкие детали структуры до того, как объект
загрязнится. После этого переходят на меньшее увеличение,
чтобы сфотографировать большие участки среза.
Прежде чем начать фотографировать, убедитесь
в том, что изображение электронного луча на экране
сохраняет круглую форму, распространяясь по
люминесцентному экрану при повороте ручки тонкой
фокусировки конденсора 2. Иначе при большом увеличении не
будет получено равномерной освещенности поля. Если
поперечное сечение луча не имеет круглой формы,
компенсируйте астигматизм конденсора, как это
описывается на стр. 132.
При установке данного увеличения нужно сначала
усилить ток в проекционной линзе до уровня,
превышающего тот, при котором будет производиться съемка,
а затем снизить этот ток, чтобы получить желаемое
увеличение. Причина этого объясняется так называемым
явлением магнитного гистерезиса. Напряженность поля
.линзы, в которой ток усилен до уровня заданного
увеличения, не соответствует напряженности поля той же
самой линзы при том же уровне увеличения, но после
того, как было произведено снижение тока с более
высокого уровня. Другими словами, размер
фотографируемого изображения после повышения увеличения с 16 000
до 20 000 раз не будет равен размеру фотографируемого
изображения после того, как увеличение было снижено
-с 40 000 до 20 000. Разница в размере может достигать
±10%- Было обнаружено, что любое заданное
увеличение легче воспроизводить сразу после того, как
магнитное поле линзы было уменьшено.
Некоторые микроскопы снабжены специальным
устройством, и эффект магнитного гистерезиса можно
снять нажатием кнопки; вследствие этого
предварительное увеличение и снижение тока в проекционной линзе
становятся ненужными.
Режим управления электронным микроскопом 119
КАК ФОКУСИРОВАТЬ
Точная фокусировка требует практики. Часто,
особенно при больших увеличениях, сталкиваются с
необходимостью решить, какая степень нерезкости
изображения представляет собой истинный фокус. Все, что"
можно сказать полезного при обсуждении вопроса о
фокусировке, заключено в нескольких общих советах.
В остальном дело сводится главным образом к
просмотру, фотографированию и критической оценке полученных
результатов.
1. Используйте при фокусировке бинокулярные
лупы для наблюдения люминесцентного экрана. ' Лупу
устанавливают таким образом, чтобы в случае
необходимости ее можно было отодвинуть в сторону или вновь
поставить в положение для наблюдения. Убедитесь, что-
она хорошо подогнана по вашим глазам и точно
сфокусирована на зернистость люминесцентного экрана.
2. Всегда начинайте фокусировку, установив ручки
фокусировки приблизительно в среднее положение.
3. Добивайтесь возможно более точной фокусировки,
переводя ручку грубой фокусировки в обе стороны от
положения, дающего фокус, т. е. из позиции с явной не-
дофокусировкой (поворот против часовой стрелки, ток
линзы снижается) к позиции, означающей явную
перефокусировку (поворот по часовой стрелке, ток линзы:
повышается).
4. Повторите ту же процедуру со всеми ручками
фокусировки, от грубой до тонкой. Вы не сможете получить,
фокусировки изображения, регулируя ручку тонкой
фокусировки, если предварительно не получен фокус
ручками грубой фокусировки.
5. При малых увеличениях (от 1000 до 4000) вы
обнаружите, что ручку тонкой фокусировки можно
передвигать на значительное расстояние без явного
изменения резкости изображения. Иными словами,
изображение будет казаться сфокусированным в широких
пределах вращения ручки. В действительности же оно недо-
фокусировано во всем диапазоне вращения ручки, за
исключением одной точки, за пределами которой
наблюдается очевидная перефокусировка изображения. Сле-
120
Глава 5
довательно, надо поворачивать ручку фокусировки по
часовой стрелке до тех пор, пока изображение впервые
не окажется перефокусированным, а затем повернуть
ручку в обратном направлении ровно настолько, чтобы
изображение оказалось в фокусе. Фотография,
сделанная тогда, когда ручка находится в этой точке, будет в
фокусе или очень близко к нему. Вследствие эффектов
фазового контраста несколько педофокусированное
изображение будет казаться более резким, чем правильно
сфокусированное, так что нужно развивать острую
наблюдательность, особенно при работе с малыми
увеличениями. При самых малых увеличениях полный
поворот ручки тонкой фокусировки может не изменить
резкости изображения. В этом случае надо использовать
следующую ручку более грубой фокусировки точно так
же, как было описано выше.
При увеличениях приблизительно от 6000 до 20 000
раз поверните ручку тонкой фокусировки таким образом,
чтобы изображение прошло стадию фокусировки, и
найдите точку, лежащую посредине между положениями ие-
дофокусировки и перефокусировки. Немного
попрактиковавшись, вы, возможно, заметите, что это положение,
соответствующее четкой фокусировке, соответствует
также и положению, при котором изображение имеет
наименьший контраст. (Это справедливо как в отношении
малого, так и в отношении большого увеличения,
однако при малом увеличении это становится очевидным
только в том случае, когда удалена апертурная
диафрагма объективной линзы. В некоторых микроскопах
очень просто удалить апертурную диафрагму при
фокусировке и вновь быстро вернуть ее в прежнее
положение; в других микроскопах трудности, связанные с
удалением диафрагмы, лишают эту 'операцию
практического смысла.)
При больших увеличениях (от 40 000 до 250 000),
когда примерно достигается максимальная разрешающая
способность микроскопа, в определении фокуса, вновь
возникают трудности, связанные с явлениями
дифракции и фазового контраста [3, 8]. Если изображение
слегка недофокусировано, то вокруг структур объекта
появляются дифракционные полосы Френеля, которые увели-
Режим управления электронным микроскопом 121
чивают контрастность изображения и могут создавать
ложную видимость тонких деталей (зернистость
расфокусировки). Вследствие появления дифракционных
полос структуры кажутся крупнее, чем они есть на самом
деле. Если в поле зрения видно небольшое отверстие,
можно фокусировать изображение по его краю: когда
дифракционные полосы на краю отверстия исчезают,,
изображение находится в фокусе. Если же такого
«удобного» отверстия нет, то нужно сделать серию
фотографий при различной фокусировке, чтобы получить одну
фотографию с хорошим фокусом.
КАК ФОКУСИРОВАТЬ, НЕ ДОПУСКАЯ ЗАГРЯЗНЕНИЯ
СРЕЗА
Если вы работаете на микроскопе без специального
устройства, предупреждающего загрязнение среза,
и нашли интересующую вас структуру, то
фотографировать ее следует как можно быстрее, чтобы избежать
появления на срезе загрязнений. Это особенно важно при
больших увеличениях. На практике полезно несколько
сместить изображение в сторону от того места, которое
вы хотите сфотографировать, и наводить па фокус по
другой структуре, а затем снова вывести в центр
нужный участок. Перед съемкой следует лишь несколько
поправить ручку тонкой фокусировки.
Ручку тонкой фокусировки необходимо поправлять
перед каждым снимком, поскольку лежащие рядом
области среза могут быть расположены на несколько
разных уровнях вследствие прогиба среза на переплетах
сетки.
КАК ФОТОГРАФИРОВАТЬ
Если микроскоп не имеет экспонометра, то
приходится определять необходимую для
микрофотографирования освещенность на глаз. Это довольно трудно и
требует опыта. Количество удачных снимков, получаемых
разными операторами, весьма различно. В идеальном
случае фотографирование нужно проводить при той же
122
Глава 5
самой освещенности, при которой проводилась
фокусировка.
Уменьшение яркости луча после фокусировки может
вызвать тепловое смещение (боковой сдвиг) объекта,
снижающее разрешение. Фокусировка должна
проводиться с той наименьшей освещенностью, при которой еще
возможно фокусировать. Если ваши глаза
адаптировались к темноте и освещение шкал приборов микроскопа
выключено, то можно провести точную фокусировку при
пониженной освещенности, позволяющей выбрать
оптимальную и приемлемую по времени экспозицию при
сгемке.
Было показано, что пластинки Ilford ПМ6,
экспонированные в течение 4 с при сниженной освещенности,
дают снимки с хорошим воспроизведением изображения;
оптимальный контраст достигается при 4—5-минутном
проявлении в проявителе PQ Universal. Небольшой опыт
дает возможнооть находить освещенность, необходимую
для получения таких результатов. Экспонировать дольше
4 с не рекомендуется, поскольку нестабильность
микроскопа или объекта съемки может привести к нерезкости
получаемого снимка.
Способы фотографирования различны в зависимости
от конструкции микроскопа, но, как правило, состоят
в том, что под люминесцентный экран помещается либо
фотопластинка, либо форматная или катушечная
фотопленка. В некоторых микроскопах экспонирование
производится простым подъемом люминесцентного экрана
на определенное время, после чего экран опускается.
Однако, если при этом не соблюдать необходимой
осторожности, подъем и опускание экрана могут вызвать
.вибрацию.
Значительно удобнее, когда микроскоп снабжен
автоматическим затвором, который позволяет
получить точное время экспозиции и который не
срабатывает, пока не прекратится вибрация, возникшая при
подъеме экрана.
Чтобы избежать вибрации, оператор не должен
прислоняться к микроскопу во время фотографирования или
ставить на него локти. Это же относится и к тем, кто
наблюдает за фотографированием.
Режим управления электронным микроскопом 12&
После того как сделан снимок, экспонированная
пластинка возвращается в кассету, а роликовая пленка
перематывается. Данные, относящиеся к снимку, а именно-
помер пластинки, обозначение снятой структуры и
увеличение, должны быть занесены в отведенный
специально для этого журнал.
КАК ИЗВЛЕЧЬ ФОТОМАТЕРИАЛ ИЗ МИКРОСКОПА
И ПЕРЕЗАРЯДИТЬ КАМЕРУ
Когда все пластинки а камере экспонированы, дефо-
кусируют К2, снижают ток луча, выключают ток накала
нити и устанавливают минимальное увеличение.
Перекрывая соответствующий клапан, отсоединяют
фотокамеру от колонны микроскопа и заполняют
фотокамеру воздухом, открыв соответствующий клапан. Теперь
камеру можно открыть и вынуть пластинки пли пленку.
Кассеты в некоторых фотокамерах светонепроницаемы,,
так что ее можно открыть при включенном освещении.
В противном случае нужно включить лабораторный
фотофонарь и перенести пластинки или пленку в
светонепроницаемый контейнер.
Перезаряжают фотокамеру новыми пластинками или
пленкой (они должны храниться в вакуумной сушилке)
и затем откачивают из нее воздух. Пока из фотокамеры
откачивается воздух, экспонированные пластинки или
пленку можно перенести в фотолабораторию и проявить.
Следите за тем, чтобы ваши руки и стол, на котором вы
работаете, были чистыми и сухими, потому что любые
загрязнения, которые попадают па кассеты для
пластинок пли на пленки, заносятся в колонну микроскопа.
Если пользуются пластинками, то па крае каждой
пластинки (на стороне эмульсии) обычным графитным
карандашом можно написать дату съемки и номер
пластинки. Следите за тем, чтобы нумерация пластинок
совпадала с их нумерацией в журнале. Катушечную
пленку тоже лучше пронумеровать. После маркировки
пластинки вынимают из кассет и кладут в кювету для
проявления. Процесс проявления проводится так, как
описано в главе о фотоработах.
124
Глава 5
После того как фотоматериалы будут проявлены,
фиксированы и поставлены па промывку, проверьте
показания индикатора давления или трубки Гейсслера на
микроскопе. Если приборы показывают, что достигнут
необходимый вакуум (приблизительно Ю-1—10~2 мм
рт. ст.), камеру можно соединить с колонной
микроскопа. Дождитесь, когда приборы зарегистрируют вакуум
по меньшей мере в 10~4 мм рт. ст. Теперь микроскоп
готов к работе, и можно снова включить ток накала
нити.
Пока в микроскопе создается необходимый для
работы вакуум, в фотолаборатории можно вложить в
кассеты новые пластинки или зарядить кассету катушечной
пленкой. Кассеты сначала надо тщательно очистить от
пыли щеткой и обдуть струей воздуха, чтобы удалить
с них пыль и мелкие осколки стекла. Ни в коем случае
нельзя прикасаться к кассетам или пластинкам
влажными руками.
При помещении неэкспонированных пластинок в
кассеты их надо располагать так, чтобы в колонне они
были обращены эмульсией вверх. Цвет эмульсионной и ие-
эмульсионной сторон пластинки может быть
одинаковым, но неэмульсиоиная сторона пластинки глянцевая,
тогда как сторона, покрытая эмульсией, матовая.
После того как неэкспонированные пластинки или
катушечная пленка будут вставлены в запасную кассету,
их нужно поместить в вакуумную сушилку, чтобы
удалить влагу с фотоматериалов и кассеты. Сушить
пластинки нужно по меньшей мере 2 ч перед помещением
в микроскоп. Фотографические эмульсии, состоящие из
желатины и галогенидов серебра, содержат
значительное количество влаги, которую необходимо по
возможности полнее удалить, чтобы испаряющиеся молекулы
воды не проникали из камеры в колонну микроскопа.
О ВАЖНОСТИ ПОВТОРНОЙ ПРОВЕРКИ КОРРЕКЦИИ
АСТИГМАТИЗМА
При выполнении точных работ при больших
увеличениях очень важно, чтобы астигматизм объективной
линзы оставался скорректированным. Если микроскоп
Режим управления электронным микроскопом 125
вычищен и апертуриая диафрагма объективной линзы
хорошо центрирована, то основным источником нара-.
стающего астигматизма этой линзы служат
загрязнения, образующиеся по краю диафрагмы. Для того
чтобы свести к минимуму сферическую аберрацию, эта
диафрагма должна иметь как можно меньшие размеры
(25—50 мкм в диаметре). Частично компенсировать
астигматизм, возникающий вследствие загрязнений,
можно с помощью корректора астигматизма объективной
линзы. .Все же возможно, что через некоторое время
диафрагму придется заменить вследствие увеличения
загрязнений, эффект которых уже нельзя компенсировать.
Если с помощью корректора астигматизма объективной
линзы (см. стр. 132) исправить астигматизм не удается,
извлеките загрязненную аиертурную диафрагму
объективной линзы и замените ее новой, руководствуясь
приложенной инструкцией.
ОСНОВНЫЕ НЕПОЛАДКИ, ВОЗНИКАЮЩИЕ
ПРИ РАБОТЕ НА МИКРОСКОПЕ
1. Движение объекта. Движение объекта может
возникнуть в результате теплового расширения при
нагревании объекта под действием электронного луча. Это
особенно вероятно, если срез рваный или неплотно
прилегает к опорной сетке. Иногда такое движение
прекращается, если луч прошел по линии контакта между
срезом и переплетом сетки, спаяв их между собой. Если
же движение объекта происходит не из-за теплового
расширения, то следует обратить внимание на
объектный столик, в котором могут быть неполадки.
2. Недостаточная освещенность. Если при переходе
к большему увеличению происходит резкое падение
освещенности, то требует регулировки система освещения.
В некоторых микроскопах это достигается простым
перемещением ручки центрирования анода до тех пор,
пока освещенность экрана не достигнет максимума. Если
осветительная система хорошо центрирована, но при
большом увеличении освещенность все еще остается
недостаточной, то, возможно, необходимо уменьшить
ускоряющее напряжение. Однако, когда это напряжение
126
Глава 5
снижено, необходимо снова проверить точку насыщения
нити, с тем чтобы ток накала нити не превышал
необходимого уровня. Если при работе с низким ускоряющим
напряжением недостаточность освещенности
обусловлена толщиной объекта, то надо увеличить ускоряющее
напряжение, после чего заново центрировать освещение,
проверить точку насыщения нити и коррекцию
астигматизма объективной линзы.
3. Эллиптическая форма поперечного сечения луча.
Это явление обусловлено астигматизмом конденсора,
который нужно компенсировать (см. стр. 132).
4. Центрировка конденсора. Если луч перемещается
поперек ноля вместо того, чтобы равномерно
распространяться от центра экрана, то необходимо заново
центрировать диафрагму коиденсорной линзы. Это делается
поочередным вращением ручки центрирования
диафрагмы конденсора и ручки центрирования луча до тех пор,
пока луч не распространится по экрану равномерно.
5. Отсутствие фокусировки изображения. Если не
удается получить четкого фокуса с помощью ручки тонкой
фокусировки, Надо проверить, правильно ли было
фокусировано изображение с помощью ручки грубой
фокусировки. Затем проверьте, не нарушена ли коррекция
астигматизма объективной линзы, после чего перекройте
клапан шлюзовой камеры объекта, откройте камеру и
убедитесь в том, что сетка не прогнулась, лежит
срезами вниз и правильно вставлена в объектодержатель,
а сам объектодержатель установлен верно. Если
устранение этих неполадок не приводит к хорошей
фокусировке изображения, то возможно, что причина
отсутствия фокуса находится в электрической схеме.
6. Исчезновение луча. Прежде всего проверьте, не
отключилось ли высокое напряжение из-за
неправильного управления микроскопом или его неисправности.
Если это так, произведите аварийное выключение прибора
и найдите неисправность (например, слишком низкое
давление воды в системе охлаждения линз, протечка
воздуха в колонну и т. д.). В том случае, когда высокое
напряжение не отключилось, следует проверить
показания прибора, измеряющего ток накала нити: если
стрелка его стоит на нулевом делении, возможно, что сгорела
Режим управления электронным микроскопом 127
пить. При нормальных показаниях прибора поверните
ручку смещения объекта, чтобы убедиться, что переплет
сетки не перекрывает хода луча. После этого поставьте
ручку в среднее положение, чтобы быть уверенным, что
вы попросту не сдвинули весь объект. Если луча по-
прежнему нет, верните все ручки управления
микроскопом в их исходное «холостое» положение и убедитесь,
что на пути луча нет ничего постороннего. Удалите
ансртурную диафрагму объективной линзы. Если луч
появился, введите диафрагму обратно и хорошо ее
отцентрируйте. Если после всех этих операций луча по-
прежнему нет, то, возможно, необходимо снова провести
обычную процедуру наладки прибора.
Все описанные выше причины неполадок, а также
ряд других приведены в табл. 6, в главе о повседневном
уходе за микроскопом (стр. 268—271).
АВАРИЙНОЕ ВЫКЛЮЧЕНИЕ
Если во время работы на микроскопе возникла
какая-то неисправность и вы не знаете, как вести себя
в создавшейся обстановке, сразу выключите микроскоп,
следуя правилам «аварийного выключения»,
изложенным в технической инструкции. Копия этих правил
должна быть вывешена на видном месте, с тем чтобы в
случае крайней необходимости не надо было
разыскивать их.
Многие микроскопы снабжены надежными
устройствами, которые автоматически выключают высокое
напряжение в случае возникновения тех или иных
неполадок. Среди обстоятельств, при которых происходит
выключение высокого напряжения, можно назвать
повышение давления в вакуумной системе, уменьшение или
увеличение давления воды в системе охлаждения линз
и диффузионного насоса, нестабильность высокого
напряжения, вызванная сильными загрязнениями
электронной пушки. Итак, самые первые меры при
неполадках — выключение высокого напряжения (обычно
автоматическое) и отключение диффузионного насоса от
колонны микроскопа.
128
Глава 5
Отключение диффузионного насоса от колонны
особенно важно по следующим причинам:
1. Если прекращается циркуляция воды,
охлаждающей рубашку диффузионного насоса, то пары масла
перестают конденсироваться, проникают в колонну и
загрязняют ее. Масло достигает такой высокой
температуры, что происходит его крекинг (при этом крупные
молекулы масла расщепляются и оно становится более
летучим).
2. Если прерывается основная электрическая цепь,
то диффузионный насос будет продолжать работать
благодаря тепловой инерции. Однако ротационный (фор-
вакуумный) насос, поддерживающий работу
диффузионного, остановится. Если в вакуумной системе нет
устройства, изолирующего при повреждении электрической
цепи диффузионный пасос от всей вакуумной системы,
то масло и масляные пары из ротационного насоса
будут засасываться в высоковакуумную систему до тех
пор, пока не произойдет выравнивания давлений. Масло
из ротационного насоса, попадая в диффузионный насос,
может разлагаться под воздействием температуры, и его
пары будут проникать в колонну микроскопа.
ЧТО НАДО ДЕЛАТЬ, ЗАКОНЧИВ РАБОТУ
НА МИКРОСКОПЕ
Если на сегодня работа па микроскопе полностью
закончена, то нужно расфокусировать луч с помощью
ручки тонкой регулировки фокуса конденсора 2, уменьшить
и выключить ток накала нити и ручку увеличений
установить в крайнее положение, соответствующее
минимальному увеличению. Сетка извлекается из камеры
объекта и, если это необходимо, убирается для
хранения. Если сетку оставить в микроскопе, ее наверняка
выбросит тот, кто будет работать следом за вами.
Удобным контейнером для сеток служат желатиновые
капсулы; сетки можно также положить на лист чистой
фильтровальной бумаги, помещенный в чашку Петри. Если
с материала данной сетки были сделаны ценные
фотографии, то такую сетку лучше сохранить до окончания
Режим управления электронным микроскопом
анализа микрофотографий, с тем чтобы при желании
вернуться к ее просмотру.
Если в тот же день на микроскопе будет работать
кто-то еще, то попросту оставьте его, установив ручки
управления в холостых позициях, указанных в
инструкции по эксплуатации прибора. Если микроскоп не
предполагается использовать до следующего дня, его можно
выключить и оставить под вакуумом, опять-таки в
соответствии с инструкцией по эксплуатации.
Электронные микроскопы вне эксплуатации
правильнее оставлять под вакуумом. Это препятствует
адсорбции молекул газа на стенках колонны и позволяет более
быстро получить нормальный рабочий вакуум при
подготовке прибора к работе.
ЗАГРЯЗНЕНИЕ ОБРАЗЦА
В предыдущем описании типичных операций при
повседневной работе на электронном микроскопе
несколько раз упоминалось о загрязнениях и возникающих
в связи с этим проблемах. Даже при таком высоком
вакууме, как Ю-4 или Ю-5 мм рт. ст., внутри колонны
электронного микроскопа находится некоторое
количество молекул газа, которые в основном представлены
двумя группами — молекулами углеводородов и
молекулами воды. Молекулы углеводородов образуются при
испарении масла из диффузионного и ротационного насосов,
из вакуумной смазки, резиновых вакуумных сальников,
с деталей, которых касались пальцами перед тем, как
поместить в микроскоп, и загрязненных сеток. Вода
испаряется с эмульсии фотопластинок или пленок,
помещенных в камеру, даже в том случае, если они были
высушены в вакууме перед введением в колонну
микроскопа. Влага заносится также с объектодержателем и
стержнями диафрагм, которые хранились не в
высушенном состоянии.
Когда нет электронного луча, молекулы
углеводородов время от времени ударяются об объект, после чего
начинают двигаться в противоположном направлении.
В конце концов устанавливается равновесие между
молекулами, движущимися к поверхности объекта и от
9—977
130
Глава 5
нее. Однако, когда по объекту скользит электронный
луч, электроны вступают во взаимодействие с
молекулами, расположенными на освещенном участке
поверхности образца. При этом, во-первых, происходит
полимеризация соседствующих молекул углеводородов, что
препятствует их удалению с поверхности объекта, и, во-
вторых, дальнейшая бомбардировка возникших
полимеров сопровождается высвобождением водорода и
образованием на объекте сплошного слоя углерода. Это не
только маскирует детали объекта, но также
может-вызвать деформацию среза, поскольку слой углерода
и объект имеют различные коэффициенты расширения.
Скорость образования слоя загрязнения зависит от ряда
причин, включая состояние вакуума, температуру
образца и чистоту колонны микроскопа. Ясно, что в
тщательно вычищенной колонне микроскопа, в которой
применено минимальное количество вакуумной смазки,
обеспечивающей вакуумную изоляцию, образуется меньше
загрязняющих углеводородных молекул.
ОПРЕДЕЛЕНИЕ СТЕПЕНИ ЗАГРЯЗНЕННОСТИ
Можно непосредственно наблюдать образование
загрязнений на объекте. Одним из лучших объектов для
наблюдения за этим явлением служит углеродная
пленка с очень маленькими отверстиями. Направьте
электронный луч довольно высокой интенсивности на одно
из отверстий при увеличении, скажем, в 60 000—
80 000 раз. По мере того как образуется загрязнение,
края отверстия будут покрываться углеродом, а диаметр
этого отверстия будет уменьшаться. В конце концов
отверстие закроется совсем. Фотографируя это отверстие
дважды на одну и ту же пластинку с интервалом
в 2 мин и измеряя его радиус, можно определить
скорость загрязнения для любых условий. Если происходит
медленное смещение объекта, то это также будет
заметно на пластинке, так как второе изображение отверстия
сместится в сторону. Скорость загрязнения не должна
превышать 1 А/с, и, если возможно, нужно стараться,
чтобы она была ниже.
Режим управления электронным микроскопом 131
УДАЛЕНИЕ МАТЕРИАЛА ИЗ ОБРАЗЦА («ВОЗГОНКА»)
Молекулы паров воды, находящиеся в колонне
микроскопа, могут вызывать выход материала из объекта.
Молекулы воды, находящиеся на поверхности объекта,
будут ионизироваться под действием электронного луча.
Высвобождающийся при этом кислород как высокореак-
ционноспособный радикал может окислять углеродсодер-
жащие компоненты объекта с образованием СО, СОг,
Нг и НгО, которые затем переходят в колонну и
удаляются. Таким же образом с поверхности объекта
удаляется часть загрязняющих его молекул углерода, однако
не в такой степени, чтобы предотвратить образование
углеродного слоя. В некотором отношении
загрязняющий поверхность объекта углеродный слой фактически
защищает расположенные под ним части объекта от
действия ионов воды, однако при этом, конечно,
ухудшается разрешение электронного микроскопа. Влияние
электронной бомбардировки на состав объекта обсуждается
в работе Стенна и Бара [9].
устройство для защиты от загрязнении
Если микроскоп, на котором вы работаете, не имеет
устройства для защиты от загрязнений, то единственным
способом избежать снижения разрешения из-за
загрязнений является быстрый выбор необходимого участка
среза и возможно быстрые фокусировка и фотосъемка.
Фактически же такие устройства обязательны, чтобы
достичь того предельного разрешения, которое
способны дать современные электронные микроскопы.
Устройство для защиты от загрязнений — это по
существу охлаждающаяся камера, окружающая объект,
с отверстием, через которое проходит электронный луч.
Обычно эта камера охлаждается жидким азотом, и на
ней конденсируются загрязняющие колонну молекулы
газа, прежде чем они смогут достичь образца. При
температуре —80 °С приостанавливается загрязнение
молекулами углеводородов, но при этом поверхность объекта
остается незащищенной от воздействия ионизованных
молекул водяного пара и может происходить возгонка
9*
132
Глава 5
веществ объекта. Однако при температуре —190 °С
происходит такая инактивация молекул воды, что объект
можно наблюдать в течение часа и более, если
необходимо, без каких-либо видимых его изменений. Чтобы
определить, хорошо ли работает устройство для борьбы с
загрязнениями, можно сделать пробу на скорость
возгонки: если возгонка происходит, то в течение примерно
5 мин отверстие в углеродной пленке будет
увеличиваться и по краям будет казаться «зазубренным».
Более полно вопросы загрязнения и его
предупреждения обсуждаются в работе Руски [5], там же
приводятся библиографические ссылки на оригинальные
исследования в этой области.
КОРРЕКЦИЯ АСТИГМАТИЗМА
О природе астигматизма говорилось в гл. 1. Если
объективная линза астигматична, то становится
невозможным четкое фокусирование изображения и мельчайшие
детали будут вытянуты в одном направлении. При
астигматизме поля конденсорнои линзы поперечное сечение
электронного луча, расфокусированного при малых
увеличениях, будет иметь форму эллипса, а не круга и при
больших увеличениях становится невозможным получить
равномерное освещение объекта.
Для коррекции астигматизма конденсора вводится
добавочное поле (корректор астигматизма конденсора),
которое вызывает деформацию пятна сфокусированного
луча в направлении, перпендикулярном искажению,
вызванному асимметрией поля самой линзы. Регулируя
напряженность и направление добавочного поля, можно
добиться того, что произойдет взаимное наложение
эффектов двух полей и поперечное сечение
расфокусированного луча приобретет круглую форму. Коррекция
должна производиться при увеличении, не
превышающем 1500 раз. Операции по коррекции несколько
различаются в зависимости от марки микроскопа, но их легко
выполнить, руководствуясь инструкцией по эксплуатации
'прибора.
Коррекция астигматизма объективной линзы более
трудоемка и требует значительного навыка. При этом
Режим управления электронным микроскопом 133
также вводится компенсирующее магнитное поле, с тем
чтобы погасить влияние асимметрии поля линзы.
Ориентировка поля и регулирование его напряженности с
помощью корректора астигматизма объективной линзы
требуют пристального наблюдения за дифракционными
полосами Френеля вокруг некоторых структур объекта.
Для наблюдения за дифракцией удобно пользоваться
угольной пленкой с небольшими отверстиями, на краях
которых можно хорошо видеть полосы Френеля. Обычно
видна только самая первая широкая полоса, которую
далее мы будем называть просто дифракционной
полосой, полосой перефокусировки или полосой недофокуси-
ровки.
При использовании высококачественных линз,
полностью свободных от астигматизма, точно
сфокусированный край отверстия в коллодиевой пленке не
должен был бы иметь дифракционной полосы Френеля
(фото III,Б). Конечно, на самом деле дифракционная
полоса существует в силу волновой природы
электронного луча, но, когда изображение сфокусировано, эта
полоса столь узка, что она не выявляется при микроскопи-
ровании.
Когда изображение переводится в состояние
перефокусировки усилением тока в катушке объективной
линзы, ширина дифракционной полосы увеличивается и она
становится видимой как яркая симметричная линия,
расположенная снаружи от темного края отверстия
(фото III,В). Если изображение недофокусировано
снижением тока в катушке объективной линзы, то полоса
также расширяется, но видна уже как яркая линия,
лежащая внутри темного края отверстия (фото III,Л). Без
большого навыка эту полосу недофокусировки очень
трудно заметить.
Наблюдение дифракционных полос по краю
отверстий в углеродной пленке может само по себе дать
много сведений о состоянии микроскопа.. Достигнутую
степень разрешения определяют посредством
фотографирования дифракционной полосы при минимальной
перефокусировке и измерения ее ширины на проявленном
негативе. Такое измерение нужно производить на
дифракционной полосе, появляющейся в тот момент, когда
134
Глава 5
изображение перефокусировано- ровно настолько, чтобы
различить эту полосу при увеличении, например, в 80 000
или более раз. Для того чтобы определить разрешение,
измеряется расстояние от середины светлой полосы до
середины темной полосы, которая представляет собой
край отверстия (фото III,В). Это так называемая
«минимальная дифракционная полоса» составляет один из
важнейших тест-объектов в электронной микроскопии.
При астигматизме объективной линзы нельзя точно
сфокусировать отверстия в углеродной пленке. Они
будут перефокусированы в одном направлении и
сфокусированы или недофокусированы в направлениях,
расположенных под прямыми углами к предыдущему. То, что
при этом видно на люминесцентном экране, изображено
на фото III,Г. Полосы пере- и недофокусировки будут
иметь наименьшую ширину в тот момент, когда объект
ближе всего к правильной фокусировке. Любая точка,
наблюдаемая в условиях астигматизма, будет
вытянутой, как это видно на фото III,Л
Для того чтобы скорректировать астигматизм
изображения, представленного на фото III, .Г, проделайте
следующие операции:
1. Установите увеличение выше того, при котором вы
собираетесь фотографировать.
2. Выключив корректор астигматизма, определите
направление полосы перефокусировки на отверстии
таких размеров, которые позволяют видеть его целиком.
3. Включите корректор астигматизма на полную
мощность.
4. Отрегулируйте направленность поля корректора
астигматизма таким образом, чтобы образуемые им
дифракционные полосы нерефокусировки были
расположены под прямым утлом к полосам перефокусировки,
которые наблюдаются при выключенном корректоре
астигматизма.
5. Уменьшайте напряженность поля корректора
астигматизма до тех пор, пока дифракционные полосы
двух полей не погасят друг друга. При этом вокруг
отверстия будет видна одна симметричная полоса, которая
исчезнет при точной фокусировке, после чего отверстие
будет выглядеть так, как на фото III, Б.
Режим управления электронным микроскопом 135
Теперь астигматизм ноля линзы компенсирован.
Однако необходимо постоянно проверять полученную
компенсацию, поскольку она будет снижаться по мере
увеличения загрязненности апертуриой диафрагмы
объективной линзы.
ОПАСНОСТЬ РЕНТГЕНОВСКОГО ОБЛУЧЕНИЯ
См. гл. 11, стр. 253—254.
ЭЛЕКТРОННАЯ МИКРОСКОПИЯ С ВЫСОКИМ
РАЗРЕШЕНИЕМ
В предыдущих разделах книги описывались
операции, выполняемые на электронном микроскопе при
обычных исследованиях со средним разрешением.
Электронная микроскопия с высоким разрешением
(разрешение для биологических объектов менее 25 А) — это
своего рода искусство, и мы не будем в кратком
руководстве для начинающих останавливаться на этом вопросе.
Требования, предъявляемые при работе с высоким
разрешением, отличаются особой строгостью. Для
успеха таких исследований необходимы специальная
юстировка микроскопа и очень тонкие срезы высокого
качества. Для интерпретации и оценки получаемых
результатов должны применяться особые критерии. Всем, кто
собирается заниматься электронной микроскопией с
высоким разрешением, мы рекомендуем пройти курс
обучения в первоклассной электронно-микроскопической
лаборатории, где такие исследования проводятся
повседневно. Методика этих исследований исключительно
трудна, и овладеть ею по описаниям вряд ли возможно.
Однако некоторое представление о необходимых
методических приемах можно получить, обратившись к
работам, приведенным в списке литературы.
Список литературы
1. Agar A. W., In Techniques for Electron Microscopy, Chap. 1
(Edited by D. H. Kay), Oxford, Blackwell Scientific Publications, 1965.
2. Bahr G. E., Zeltler E. H. (Eds.), Quantitative Electron Microscopy,
Laboratory Investigation, 14, 1082—1158 (1965).
136
Глава 5
3. Haydon G. В., On the interpretation of high resolution electron
micrographs of macromolecules, Journal of Ultrastructure Research,
25, 349—361 (1968).
4. Meek G. A, Practical Electron Microscopy for Biologists, Chap. 10
and 11 and pp. 400—402, London and New York, Wiley Interscience,
1970.
5. Ruska E., In Advances in Optical and Electron Microscopy, Vol. 1,
pp. 154—171, London and New York, Academic Press, 1966.
6. Siegel В. М. (Ed.), Modern Developments in Electron Microscopy,
pp. 51—78, New York and London, Academic Press, 1964.
7. Sjostrand F. S., Electron Microscopy of Cells and Tissues, Vol. 1,
pp. 106—110 and Chap. 10 and 11, New York and London, Academic
Press, 1967.
8 Sjostrand F. S., In Physical Techniques in Biological Research,
Vol. 3C, 2nd edn, pp. 172—173, 1969.
9. Stenn K. S., Bahr G. F., A study of mass loss and product formation
after irradiation of some dry amino acids, peptides, polypeptides and
proteins with an electron beam of low current density, Journal of
Histochemistry and Cytochemistry, 18, 574—580 (1970).
ГЛАВА 6
Фотолабораторные работы
Если вы впервые знакомитесь с техникой
фотографии, то убедитесь, что этот раздел будет для вас
наиболее полезным. Основные сведения, изложенные здесь,
одинаково удовлетворяют требованиям и
микрофотографии с помощью светового микроскопа, и обычной
фотографии, которая, возможно, станет в дальнейшем вашим
увлечением. Сведения, которые мы приводим ниже,
рассчитаны на людей, не имеющих опыта в области
фотографии.
ФОТОГРАФИЧЕСКИЙ ПРОЦЕСС
В обычной фотографии свет, отраженный объектом,
проходит через отверстия светонепроницаемой камеры
и падает на светочувствительную эмульсию, нанесенную
либо на целлулоидную или пластмассовую подложку,
либо на стеклянную пластинку. Эмульсия представляет
собой суспензию частиц (кристаллов)1, или «зерен»,
галоидного серебра в желатине. Эти кристаллы
галоидного серебра, поглощая энергию падающего на них
света, превращаются сначала в частицы скрытого
изображения. Если эти частицы достаточно велики, то они
делают кристаллы галоидного серебра способными к
проявлению:
А^ЧЗг- (твердое вещество) > Ag (твердое вещество) + Вг.
1 В отечественной Литературе принят термин «кристаллы галоид-
лого серебра», который мы и будем применять в дальнейшем.
Термин «зерна» применяется главным образом по отношению к уже
проявленным кристаллам галоидного серебра. — Прим. перев.
138
Глава 6
Когда экспонированную пленку или пластинку
погружают в проявитель (делать это необходимо в
темноте), кристаллы галоидного серебра, содержащие
достаточно крупные частицы скрытого изображения,
активируются проявителем, который в сущности
представляет собой восстановитель и восстанавливает соли серебра
до металлического серебра. Таким образом, на пленке
или пластинке появляется негативное изображение
сфотографированного объекта.
Затем пленку или пластинку отмывают от
проявителя и погружают в закрепитель, который просветляет
изображение и превращает все непроявленное галоидное
серебро в водорастворимые вещества, удаляемые при
промывке. Теперь эмульсия теряет свою активность, и
высушенный негатив можно хранить до тех пор, пока не
потребуется печатать позитивы.
Позитивная печать производится следующим
образом: через негатив па бумагу, покрытую
фотографической эмульсией, проецируется свет. Свет проходит через
негатив в количествах, обратно пропорциональных
различным плотностям негативного изображения. Под
непрозрачными областями негатива па бумаге, покрытой
эмульсией, содержащей кристаллы бромистого серебра,
скрытое изображение не формируется. Там, где свет
проник через светлые области негатива и достиг
фотобумаги, он активирует кристаллы бромистого серебра,
которые чернеют при проявлении. После экспонирования
фотобумагу проявляют, закрепляют, промывают и
высушивают так же, как и негативные фотопленки или
фотопластинки.
С помощью таких же методов получают электронные
микрофотографии. Единственное отличие состоит в том,
что в качестве источника активации вместо световога
луча используется электронный луч. К счастью,
взаимодействие электронов с кристаллами галоидного серебра
в значительной мере сходно с тем, которое наблюдается
при действии на них света, что позволяет использовать
для электронной фотографии те же эмульсин, что и для
световой. О различиях во взаимодействии электронов,
и фотонов с кристаллами галогенидов серебра будет
коротко сказано на стр. 149.
Фотолабораторные работы 139
ПРОЯВИТЕЛИ
По существу проявители — это растворы
восстанавливающих веществ, обычно либо метола и гидрохинона,
либо фенидона и гидрохинона. В нашей лаборатории при
проявлении стеклянных пластинок, широко применяемых
в электронной микроскопии, хорошие результаты дает
использование проявителя Ilford PQ Universal. Этот
проявитель можно также использовать при печатании
микрофотографий с проявленных пластинок. В
продажу проявитель поступает в виде запасного раствора,
который следует разводить перед употреблением
соответствующим образом.
Под действием воздуха происходит окисление
проявителя и вследствие этого снижение его эффективности.
Проявитель, изменивший свой цвет, использовать нельзя.
При особо ответственных работах для получения
наилучших результатов каждый день надо готовить свежий
проявитель. Проявитель не должен попадать на руки,
так как он может вызвать дерматит у лиц с повышенной
чувствительностью кожи. Перед работой в
фотолаборатории полезно смазывать руки защитным кремом.
ЗАКРЕПИТЕЛИ
Основной составной частью закрепителя обычно
является тиосульфат натрия (гипосульфит, Na2S203'5H20),
который участвует в следующей реакции:
AgBr (твердое вещество) + 2S20§~ (водорастворимое вещество) >
>■ Вг_ (водорастворимое вещество) +
+ Ag(S203)|s- (водорастворимое вещество).
Закрепители, имеющиеся в продаже, значительно
различаются по скорости действия. Очень удобен для
работы закрепитель марки Нурага Rapid Fixative,
который фиксирует изображение на фотопластинках и
фотобумаге за 30 с. Выпускают его в виде запасного
раствора и перед употреблением разбавляют четырьмя
частями воды. К этому закрепителю часто добавляют
уплотнитель желатинового слоя (Hypam Hardener), ко-
140
Глава 6
торый увеличивает прочность эмульсии фотопластинок
и таким образом уменьшает опасность повреждения
негативов во время их обработки.
ПЛАСТИНКИ
Обычно для электронной микроскопии применяются
стеклянные диапозитивные пластинки (например, Ilford
ЕМ6)'. Это тонкослойные пластинки,
сенсибилизированные к синему цвету, достаточно мелкозернистые для
работы с большим разрешением. Они быстро высыхают,
поскольку стекло не впитывает воду. Однако эти
пластинки легко ломаются и требуют много места для
хранения.
КАТУШЕЧНАЯ ПЛЕНКА
Использование катушечной пленки имеет следующие
преимущества: большое количество негативов требует
значительно меньше места для хранения, чем такое же
количество стеклянных негативов; стоимость одного-
снимка значительно ниже; пленочные негативы не
ломаются. Однако недостатки катушечной пленки
препятствуют ее широкому применению. Так, пленки легко
поцарапать, и обращаться с ними в темном помещении
значительно труднее, чем с фотопластинками. Высушивание
катушечной пленки требует большего времени. Ее
неудобно использовать в микроскопах, не имеющих
экспонометра, поскольку нельзя взять для обработки и
просмотра отдельный экспонированный негатив. При
печати требуется большее (по сравнению с пластинками)
увеличение, в связи с чем зернистость позитива может
стать проблемой.
ФОРМАТНАЯ(ПЛОСКАЯ)ПЛЕНКА
Форматную пленку нарезают по размерам
стеклянных фотопластинок и помещают в кассетные камеры то-
1 В Советском Союзе для работы на электронном микроскопе
используются фотопластинки типа «MP» и «ДиапозитиЕНые для
научных исследований». — Прим. ред.
Фотолабораторные работы
141
го же типа, что и пластинки. Она имеет те же самые:
преимущества и недостатки, что и катушечная пленка,,
когда речь идет о хранении, стоимости, повреждаемости
и обработке. Необходимо к тому же строго следить за
тем, чтобы пленка в кассете лежала абсолютно плоско,
так как при любом изгибе увеличение в разных участках
пленки будет различным. По сравнению с катушечной
пленкой форматная пленка имеет одно преимущество:
каждый отснятый негатив можно вынуть из микроскопа
и проявить его, не дожидаясь, как при работе с
катушечной пленкой, когда будет отснята вся кассета.
В приложении X перечислены фотографические
материалы, пригодные для электронной микроскопии.
ПРОЯВЛЕНИЕМ ПОЛУЧЕНИЕ ОТПЕЧАТКОВ
Все перечисленные ниже операции проводятся в
фотолаборатории при свете фонаря, снабженного
соответствующим защитным фильтром (например, Kodak
Wratten OB или Ilford S902)1.
Дверь фотокомнаты, в которой вы работаете, должна
быть заперта. Если вам необходимо выйти из
фотокомнаты до того, как закончена работа, то, прежде чем
открыть дверь, убедитесь в том, что вся фотобумага и
фотопластинки убраны в светонепроницаемые коробки. Для
повседневной работы отдельно можно хранить
небольшие количества фотобумаги, так что если она случайно
и засветится, то потеря фотоматериалов будет
незначительна.
Продолжительность различных этапов обработки
фотоматериалов зависит от свойств используемого
проявителя и закрепителя, температуры проявителя, а также от
типа фотопластинок и номера фотобумаги. Если нет
никого, кто мог бы указать вам оптимальное время
проявления и закрепления в данном конкретном случае, то
определить это придется методом проб и ошибок.
Вначале следуйте инструкциям, прилагаемым к различным
фотоматериалам. Подобрав время и температуру прояв-
1 Работу с фотопластинками можно проводить при красном
свете. — Прим. ред.
142
Глава 6
ления согласно такой инструкции, найдите для
пластинки или пленки нужную комбинацию продолжительности
экспозиции и времени проявления.
Ниже приведен способ обработки пластинок Ilford
ЕМ6 при использовании универсального проявителя PQ,
быстро работающего закрепителя Hyp am и фотобумаг*
Kodabromide или Ilford № 1—4. Температура в
фотолаборатории должна быть примерно 20 °С.
ПРОЯВЛЕНИЕ ПЛАСТИНОК
Оптимальная продолжительность проявления
правильно экспонированных пластинок Ilford EM6 в
проявителе PQ составляет 4 мин1. (Термин «проявление»
означает постепенное выявление изображения в процессе
обработки материала.) Если ваш микроскоп имеет
экспонометр, то определение выдержки не составляет труда
и время проявления может быть постоянным. Однако
при этом необходимо также поддерживать постоянную
температуру проявителя. Все значительно осложняется,
если в микроскопе нет экспонометра, поскольку
оценивать освещенность люминесцентного экрана на глаз
довольно трудно. Переэкспонированпые пластинки
проявляются слишком быстро, и поэтому трудно определить,
когда будет достигнуто оптимальное проявление; фон
таких пластинок бывает плотным. Слишком малая
экспозиция дает «слабые» (слишком прозрачные)
негативы, на которых не прорабатываются детали фона.
Необходимо перемешивать проявитель во время
проявления. Так, фирма Ilford советует постоянно
перемешивать проявитель во время проявления фотопластинок
типа ЕМ6. Фирма Associated Electrical Industries
(изготавливает электронные микроскопы серии AEI)
рекомендует в своей брошюре для начинающих
электронных микроскопистов 10-секундпое перемешивание
проявителя на каждую минуту проявления. Валентайн [5]
подчеркивает, что для равномерного проявления
изображения по всей пластинке особенно важно перемешива-
1 Примерно то же время необходимо для проявления
фотопластинок «MP» и «диапозитивные». — Прим. ред.
Фотолабораторные работы
143'
ние проявителя в течение первого периода проявления.
Некоторые специалисты пропускают через бачок с
проявителем газообразный азот, в результате чего
проявитель перемешивается и одновременно вытесняется
кислород, который окисляет проявитель и сокращает срок
его службы.
После проявления пластинки необходимо промыть
в течение приблизительно 30 с, чтобы нейтрализовать
проявитель перед фиксацией и таким образом увеличить
срок службы закрепителя. Для этой цели в
промывочную воду обычно добавляют несколько капель ледяной
уксусной кислоты. Такая промывка обычно называется
«стоп-ванна», поскольку уксусная кислота
останавливает дальнейшее действие проявителя. Перед тем как
перенести фотопластинки в закрепитель, их можно
поочередно вынуть из «стон-ванны» и просмотреть при свете
фотофонаря с защитным светофильтром, чтобы
определить, достаточно ли они проявлены. Если окажется,
что одна-две пластинки недопроявлены, то их можно
снова поместить в проявитель, быстро сполоснув
предварительно в водопроводной воде для удаления
уксусной кислоты. Если проявление велось по всем правилам,
пластинки не должны быть перепроявлеиы. Однако если
это все же произошло, то их можно иногда исправить,
осторожно обрабатывая фармеровским ослабителем (см.
приложение X). Ослабление можно провести в любое
время, так что передержанные пластинки обычно
закрепляют вместе с нормальными пластинками, а ослабляют
их в свободное время. Сильно перепроявленные
пластинки исправить нельзя.
Если вы решили, что пластинки проявлены нормально,
то следует перенести их из промывочной ванны в
закрепитель (например, Hypam Rapid Fixative). Пластинки
остаются в закрепителе в течение времени, которое
должно приблизительно в 2 раза превышать время,
необходимое для их «просветления». («Просветление»
означает, что пластинки становятся прозрачными и на них
отчетливо видно изображение.) Процесс закрепления
проходит в две стадии.
Первая стадия. Исчезновение молочно-белой вуали.
Образующийся тиосульфат серебра представляет собой
144
Глава 6
нерастворимое вещество, и если его не растворить, то
оно вызовет окрашивание пластинок.
Вторая стадия. Нерастворимый тиосульфат серебра
превращается в растворимую комплексную соль.
Просветление (первая стадия) должно произойти
в течение первых двух минут. Если этого не происходит,
то, следовательно, раствор закрепителя истощился и
второй стадии фиксации не произойдет. В этом случае
старый раствор закрепителя следует заменить свежим.
С пластинками ничего не случится, если их оставить
в закрепителе на более продолжительный срок, хотя при
длительном воздействии закрепителя может
наблюдаться отбеливание негативов.
После закрепления пластинки промывают не менее
30 мин в проточной водопроводной воде для удаления из
эмульсии закрепителя и побочных продуктов и затем
высушивают на воздухе в защищенном от пыли месте.
После завершения первой стадии закрепления
пластинки можно обрабатывать на свету.
ПОЛУЧЕНИЕ ПОЗИТИВОВ С ФОТОПЛАСТИНОК
Бумаги Kodabromide и Ilford имеют номера от 0 до
б1, соответствующие степени контрастности, которую
можно получить на этих бумагах. Чем выше номер, тем
выше контрастность фотобумаги. Однако следует иметь
в виду, что чем выше контрастность фотобумаги, тем
меньше деталей выявляется на отпечатке.
Правильно экспонированная и проявленная
пластинка имеет достаточный контраст и хорошую проработку
деталей и может быть с успехом отпечатана на
бумаге № 2. Номера 0 и 1 применяются редко, т. е.
получаемый на них контраст ниже того, который необходим для
электронно-микроскопических снимков. Номер 3
применяется в том случае,- когда контраст, получаемый на
бумаге № 2, недостаточен; бумага № 3 дает вполне
достаточную проработку деталей. Бумага № 4 применяется
1 Соответствует в общем № 1—7 отечественных фотобумаг. —
Прим. перев.
Фотолабораторные работы 145
только для печатания с еильно недодержанных или
недопроявленных пластинок. Пластинки, которые требуют
при печати бумаги № 5 и 6, лучше выбросить, "так как
детали таких снимков будут проработаны очень плохо.
Обычно чем прозрачнее негатив и бледнее изображение,
тем более высокий номер бумаги надо использовать для
печати.
При печатании с фотопластинок их помещают в
рамку увеличителя. Свет проецируется через фотопластинку
на фотобумагу, которая удерживается рамкой,
помещенной под увеличителем. В увеличителе есть диафрагма,
уменьшая которую, мы тем самым уменьшаем
количество света, проходящего через объектив. «Прозрачный»
(т. е. недодержанный) негатив пропускает через
объектив больше света, чем нормальный негатив, и это можно
частично компенсировать, уменьшая диафрагму. Вообще
более длительная выдержка при сниженном освещении
позволяет получить фотографию с большим количеством
деталей и с лучшим контрастом, чем короткая выдержка
при ярком освещении. Короткие выдержки (менее 5 с)
не позволяют полностью выявить тонкие детали, при
этом также недостаточно времени для маскирования при
печати (см. следующий параграф о печатании с
неравномерно экспонированных негативов).
Длительность выдержки при печатании позитивов
обратно пропорциональна количеству света, проходящего
через объектив увеличителя. Хорошо проявленная
пластинка при печатании на бумаге № 2 требует, как
правило, выдержки 6 с при сниженной освещенности.
Экспонированную фотобумагу кладут в проявитель. Если дать
излишне большую выдержку, то изображение проявится
слишком быстро, отпечаток будет темным, неотчетливым
и лишенным деталей. Контрастность такого отпечатка
будет плохой. Если изображение появляется в первые
30 с проявления, то отпечаток, вероятнее всего, будет
низкого качества. Отпечатки, изображение на которых
появляется примерно через 45 с, обычно можно
оставить в проявителе на 2—3 мин, не опасаясь
перепроявления их. Правильная выдержка и правильное
проявление позволят лучше выявить детали изображения и его
контраст. Слишком длительное проявление вызовет об-
I П Q77
146
Глава 6
разование вуали и потемнение отпечатка. При печатании
лучше всего строго придерживаться определенного
времени и температуры проявления, а изменять лишь
выдержку. После того как достигнута желательная степень
проявления, отпечаток промывают в водопроводной
воде, к которой добавлено несколько капель ледяной
уксусной кислоты, и закрепляют в течение 30 с в быстро
работающем закрепителе, не содержащем веществ,
уплотняющих желатиновый слой. Извлекать отпечаток
из закрепителя точно па тридцатой секунде, конечно, нет
необходимости. Однако, поскольку основным свойством
такого закрепителя является его быстрое действие,
свойством этим не следует пренебрегать. Фиксированный
отпечаток промывают затем в проточной водопроводной
воде по меньшей мере 30 мин. При недостаточной
промывке отпечаток может очень скоро потемнеть или
обесцветиться. Нет необходимости в слишком
длительной промывке, которая может в конце концов вызвать
размягчение желатинового слоя отпечатка.
После промывки отпечатки высушивают на глянце-
вателе. Если нужен матовый отпечаток, то его
помещают в глянцеватель лицевой стороной к полотну. Если
необходимо получить глянцевый отпечаток (например,
для публикации), то его прижимают лицевой стороной
к полированной поверхности барабана или пластины
глянцевателя.
РАБОЧИЕ ОТПЕЧАТКИ
Конечно, не все электронные микрофотографии
потенциально годны для публикации, н некоторые
негативы, может быть, даже не стоит печатать. Негативы
с плохо сфокусированным изображением не содержат
полезной информации, и их надо выбросить. Однако
резкий негатив или негатив с незначительными
отклонениями от точной фокусировки должен быть отпечатан,
даже если его беглый просмотр вызывает разочарование.
Множество деталей можно выявить только после
тщательного изучения отпечатанной микрофотографии, и
подчас снимок, не доставляющий эстетического
удовольствия, дает нам богатую информацию. Можно не
публиковать микрофотографию, испорченную осадками
Фотолабораторные работы
147
красителя или царапинами от ножа, однако с ее
помощью можно получить весьма цепные дополнительные
данные и использовать их при описании полученных
результатов.
Обычно «рабочие отпечатки» делают таких же
размеров, как и сами негативы или при небольшом
увеличении. Это позволяет использовать фотобумагу малого
формата н хранить отпечатки, разместив их по порядку
в скоросшивателе. Как правило, не имеет смысла зря
расходовать фотобумагу, стараясь «выжать» хорошие
результаты при изготовлении рабочих отпечатков. Их
можно использовать при условии, что интересующие вас
детали структуры видны достаточно хорошо. А уж если
какие-то микрофотографии отобраны для публикации
или для демонстрации, то тогда можно тратить и время,
и бумагу, пытаясь получить возможно лучшие
результаты.
УВЕЛИЧЕНИЕ МИКРОФОТОГРАФИИ
Если изображение па негативе сфокусировано
хорошо, то шести- или семикратное увеличение позволит
увидеть невооруженным глазом все детали, характерные
для этого негатива. Происходит это оттого, что наш глаз
может видеть раздельно две точки, если они лежат на
расстоянии 100—200 мкм друг от друга, иными словами,
предел разрешения нашего глаза составляет 100—
200 мкм. Шести- или семикратное увеличение негатива
приведет к тому, что глаз уже начнет различать
«зерно» фотографической эмульсии. Дальнейшее увеличение
будет способствовать лучшей видимости этой тонкой
структуры, но не приведет к разрешению большего
числа существенных деталей1. Для работы при относитель-
1 Необходимо заметить, что «зерно» в данном случае не
относится к размеру самих кристаллов галоидного серебра. В
фотоэмульсиях, используемых для электронной микроскопии, диаметр таких
кристаллов район приблизительно 0,5—1 мкм и, следовательно, для
того чтобы они были заметны невооруженным глазом, их надо было
бы увеличить в 100—200 раз. «Зерно», видимое в данном случае па
фотопластинке при увеличении в 5—6 раз, образуется благодаря
«электронному шуму», т. е. взаимодействию двух случайных
процессов, происходящих при экспозиции. Подробнее этот вопрос
обсуждался в работе Валентайна [5].
10*
148
Глава 6
но низком разрешении более чем шестикратное
увеличение практически применяется редко.
По мере возрастания увеличения контраст
снижается, так что для компенсации этого явления необходимо
применять более контрастную фотобумагу.
Иногда негатив, дающий на пробном отпечатке
четкое изображение, при увеличении дает расплывчатое
изображение. Конечно, не имеет смысла печатать такой
негатив с большим увеличением. При небольшом навыке
вы сможете различать такие несфокусированные
негативы еще до печати, поместив их в увеличитель, и это
позволит экономить фотобумагу.
Фотобумага стоит очень дорого, и для начинающих
редко бывает необходимо печатать увеличенные снимки
размером более обычных рабочих отпечатков.
Увеличивать нужно лишь в том случае, когда необходимо
произвести какие-либо измерения или когда детали
сфотографированной вами важной структуры нельзя
отчетливо видеть при увеличении рабочего отпечатка.
ЧТО ДЕЛАТЬ С НЕРАВНОМЕРНО ЭКСПОНИРОВАННЫМИ
НЕГАТИВАМИ
Если при микросъемке фотопластинка освещалась
неравномерно, то при проявлении отпечатка,
полученного с такого негатива, его отдельные участки проявляются
с разной скоростью. Если неравномерность плотности
негатива не слишком велика, то ее в отдельных
случаях можно компенсировать методом «маскирования» при
печатании. Делается это следующим образом. При
экспонировании быстро проводят рукой взад и вперед над
фотобумагой таким образом, чтобы движущаяся тень
руки уменьшала количество света, падающего на
определенные участки отпечатка. При этом надо стараться
держать руку не слишком близко от бумаги. Например,
если левый край негатива темнее правого, то подбирают
продолжительность выдержки, которая необходима для
печатания более темного края. При экспонировании
тень от руки должна двигаться над фотобумагой таким
образом, чтобы перекрывался свет, идущий от правого
(более светлого) края негатива. Следите за тем, что-
Фотолабораторные работы
149
бы рука все время была в движении, иначе на снимке
получится просто изображение вашей руки!
Возможно также, что из-за неравномерного
распределения луча при съемке углы негатива будут слишком
темные, тогда как середина его — нормальной. Если на
периферии негатива нет каких-либо важных деталей, то
самое простое, что можно сделать, это увеличивать
негатив до тех пор, пока на снимке не окажется только
его средняя, равномерно освещенная часть.
О ЧИСТОТЕ В ФОТОЛАБОРАТОРИИ
Во время работы в полутемном помещении при свете
одного лишь фотофонаря может расплескаться
проявитель, вода для промывки, закрепитель. Все, что
пролито, похоже на воду. Однако закрепитель, подсохнув,,
превращается в белый порошок, а проявитель дает
окрашенный осадок. Высохнув, эти вещества превращаются'
в пыль, которая разлетается и, оседая, загрязняет все
вокруг. Следовательно, окончив работу в
фотолаборатории, надо протереть стол чистой губкой, сполоснуть
ее и протереть стол еще раз. Если проявитель и
закрепитель еще годны для работы, то каждый из этих
растворов необходимо сливать в специально
предназначенную для него бутыль. Если же пользоваться этими
растворами больше не будут, то их следует вылить.
Тщательно вымойте фотографические ванночки, высушите
их и уберите на место.
О РАЗЛИЧИЯХ В ДЕЙСТВИИ ЭЛЕКТРОНОВ И СВЕТА
НА ФОТОГРАФИЧЕСКИЕ ЭМУЛЬСИИ
Для формирования скрытого изображения в
кристалле галоидного серебра при действии света необходимо
некоторое число фотонов.
Однако при действии на фотографическую эмульсию
электронов с учетом ускоряющего напряжения,
применяемого в электронном микроскопе, для формирования
скрытого изображения в кристалле галоидного серебра
достаточно энергии одного электрона. Таким образом,
150
Глава 6
взаимодействие электронов с галоидными кристаллами
представляет собой «одноударный процесс». Это имеет
практическое значение, поскольку касается
взаимоотношения контрастности изображения и времени
экспозиции.
Плотность (D) негатива (фотопластинки или
фотопленки) выражается в показателях шкалы от 0 до 3.
Негатив плотностью, равной 0, должен быть прозрачен
после проявления, поскольку он не подвергался
воздействию света или электронов, на нем не было скрытого
изображения и, таким образом, процесс проявления
отсутствовал. Теоретически такой негатив должен
пропускать 100% падающего на него света. Пластинка,
плотность которой после проявления равна 1, пропускает
10% света и имеет светло-серую окраску. При
плотности, равной 2, только 1 % света проходит через почти
черный негатив. Негатив плотностью 3 пропускает лишь
0,1% света и практически непрозрачен. Электронные
микроскописты стараются обычно получить негативы,
у которых D=l—1,5.
Плотность негатива и число проявленных зерен
серебра находятся в линейной зависимости. Однако
плотность негатива не зависит линейно от времени
экспозиции фотопластинки. Это объясняется многоударной
природой взаимодействия фотона и кристаллов галоидного
серебра. Чем крупнее кристалл в эмульсии, тем больше
фотонов ударяется об этот кристалл и тем быстрее в
нем будет сформировано скрытое изображение. Как
следствие этого контраст, достигаемый при данном
времени экспозиции, зависит от свойств используемой
эмульсии, а также от времени экспозиции и условий
проявления.
Когда же на фотопластинку воздействуют
электронами, то между плотностью негатива и временем
экспозиции в пределах экспозиций, используемых в электронной
микроскопии (1—4 с), наблюдается линейная
зависимость, поскольку удар одного электрона вызывает
формирование скрытого изображения в одном кристалле
галоидного серебра, будь то большой или маленький
кристалл. Вследствие этого контраст негатива не зависит от
хвойств используемой эмульсии и прямо пропорционален
Фотолабораторные работы
151
времени экспозиции. Контраст определяется только
временем экспозиции и условиями проявления.
Основными факторами, определяющими выбор
эмульсии для электронной микроскопии, являются размер-
гранул AgBr, чувствительность, толщина и
относительная светочувствительность.
Эмульсия, используемая в электронной микроскопии,
должна быть мелкозернистой (размер кристаллов
галоидного серебра от 0,1 до 1 мкм), чтобы проявленные
зерна серебра «прорисовывали» тонкие детали
изображения. Предпочтительнее эмульсия, обладающая низкой
чувствительностью, для того чтобы фотопластинка
получала большое число электронов. Однако
низкочувствительные пластинки требуют длительных выдержек, а
нестабильность микроскопа затрудняет использование
выдержек длительнее 4 с. Компромиссным решением в этом
случае является выбор эмульсии средней
чувствительности. Проникновение электронов в эмульсию
увеличивается с увеличением ускоряющего напряжения; в
тоже время толщина эмульсии должна быть достаточной
для того, чтобы полностью поглощать все электроны
падающего на нее луча. При ускоряющем напряжении
от 20 до 100 кВ этому условию удовлетворяет эмульсия
толщиной 25 мкм.
Удобнее работать с эмульсиями,
сенсибилизированными к синему свету. Эти эмульсии менее
чувствительны к свету и обрабатывать их можно при свете
лабораторного фонаря, снабженного соответствующим (в
данном случае оранжевым) светофильтром.
Более полно все эти вопросы, а также математическое
определение отношений между временем экспозиции,,
плотностью и контрастом негатива рассмотрены в
работе Валентайна [5].
УВЕЛИЧИТЕЛИ
Используются в основном увеличители трех типов:
1. Увеличитель с лампами «холодного» света.
Свет излучается несколькими люминесцентными
трубками; для равномерного освещения негатива
используется светорассеивающий (диффузионный) экран. Диф-
152
Глава 6
фузия света снижает контраст и уменьшает число
тонких деталей, воспроизводимых на снимке. Этот тип
увеличителя не рекомендуется использовать для
электронно-микроскопических работ.
2. Конденсорами увеличитель с матовой лампой.
Частично рассеянный свет излучается спиральной
нитью накаливания. Такие увеличители дешевле, чем
увеличители с точечным источником света, и пригодны
для работ со средним разрешением.
3. Конденсорный увеличитель с точечным источником
света.
Свет излучается вершиной V-образной нити
накаливания. Это позволяет получить высококонтрастные
отпечатки с хорошей проработкой всех деталей. Однако при
этом выявляются также все дефекты негатива и
фокусировка изображения имеет очень существенное значение.
Увеличители с точечным источником света очень важны
для работ с высоким разрешением.
МАШИНЫ ДЛЯ ОБРАБОТКИ ОТПЕЧАТКОВ
Эти машины сокращают время, необходимое для
печатания. Пластиночный или пленочный негатив
помещают в увеличитель и делают отпечаток на специальной
фотобумаге, которая содержит проявляющие вещества
в неактивной форме. Экспонированную бумагу
закладывают в машину для обработки отпечатков, где
происходит химическая активация проявителя, а затем другие
вещества фиксируют изображение; процесс завершается
промывкой и частичной сушкой отпечатка. Весь процесс
занимает примерно 10 с.
Главным достоинством машин для обработки
отпечатков является огромная экономия времени. Однако
у них есть и ряд недостатков. Если негатив, с которого
производится печать, не был' правильно экспонирован,
то получить хороший отпечаток нельзя. Следовательно,
с каждого негатива необходимо делать пробные
отпечатки для определения выдержки, а специальная
фотобумага, применяемая для этого, стоит дорого. Если
отпечатки дополнительно не фиксировать и не промывать,
то они спустя несколько месяцев поблекнут и обесцве-
Фотолабораторные работы
153
тятся. Тем не менее дополнительную обработку
отпечатков можно провести в любое время в течение шести
месяцев после их получения, причем за один раз можно
обработать большое число снимков. Если отпечатки
должны быть высушены и наклеены, то их обязательно
следует фиксировать и промывать дополнительно, иначе
они потемнеют при нагревании. Кроме того, отпечатки
имеют свойство скручиваться и ломаться даже в том
случае, если их хранят в расправленном состоянии.
В целом, по-видимому, можно считать, что
преимущества описанной обработки отпечатков превосходят ее
недостатки, и это особенно существенно для лабораторий,
в которых ежедневно печатается большое количество
снимков.
Машины для обработки отпечатков выпускаются
фирмами Kodak и Ilford.
Список литературы
1. Engel С. Е. (Ed.), Photography for the Scientist, London, Academic
Press, 1968.
2. Farnell G. C, Saunders A. E., Flint R. В., The response of
photographic materials to exposure in the electron microscope, British
Journal of Photography, 117, 139—141 (1970).
3. Meek G. A., Practical Electron Microscopy, Chap. 13, pp. 343—360,
London and New York, Wiley-lnterscience, 1970.
4. Sjostrand F. S., Electron Microscopy of Cells and Tissues, Vol. 1,
Chap. 5, London and New York, Academic Press, 1967.
5. Valentine R. C, In Advances in Optical and Electron Microscopy,
Vol 1, pp. 180—203 (Edited by R. Barer and V. E. Cosslett), London
and New York, Academic Press, 1966.
ГЛАВА 7
Некоторые общие советы, связанные
с изучением ультраструктуры
Термин «ультраструктура» в этой книге мы
используем для обозначения структур, лежащих за пределами
разрешающей способности светового микроскопа. Одним
из основных инструментов для их изучения служит
электронная микроскопия, а другим — биохимия.
С самого начала в развитии электронной
микроскопии наметились два отчетливых направления: это, во-
первых, исследования с использованием низкого и
среднего разрешения и, во-вторых, исследования с
использованием высокого разрешения. Линейные величины, на
которых кончается среднее разрешение и начинается
высокое, со временем возросли вследствие
усовершенствования электронных микроскопов и методов
подготовки объектов для исследования. Однако разрешение
все еще зависит от характера изучаемого материала.
Так, при исследовании кристаллических объектов было
достигнуто разрешение в 2 А. Сообщения о достижении
разрешения в 10 А или менее при исследовании
ультратонких срезов биологических материалов очень редки
(например, [6, 20, 25]), и 15 А обычно считается
практической границей разрешения.
В этой книге исследованиями с высоким разрешением
мы произвольно называем только такие, в которых при
изучении структуры биологических материалов
достигается разрешение ниже 25 А. .
Электронная микроскопия с низким и средним
разрешением дает возможность описывать строение
клеточных органелл, а использование методов цитохимии
позволяет получить некоторые общие данные об их
химической природе. Она дополняет световую микроскопию
и, поскольку она может быть использована для изуче-
Некоторые советы, связанные с изучением ультраструктуры 155
ния морфологии изолированных клеточных фракций,,
смыкается с биохимией и дополняет также ее.
Электронная микроскопия с высоким разрешением
позволяет изучать структуру цитоплазмы на
молекулярном и макромолекулярном уровнях и, таким образом,,
представляет собой раздел молекулярной биологии. Для
проведения электронно-микроскопических исследований
с высоким разрешением пользуются значительно более
тонкими методами, чем для исследований с малым и
средним разрешением. Трактуя результаты, полученные
при высоких разрешениях, исследователь сталкивается
с трудностями, которые не стоят перед электронными
микроскопистами, работающими с более низким
разрешением. Среди этих проблем — объяснение фазово-конт-
растных и дифракционных явлений на получаемом
изображении. Небольшая расфокусировка сопровождается,
увеличением контрастности изображения за счет
появления вокруг структур объекта минимальной
дифракционной полосы. Дальнейшая расфокусировка будет
сопровождаться появлением так называемой «зернистости
дефокусировки», которая заметна по всему полю даже
.в случае отсутствия объекта. Эта зернистость может
быть ошибочно принята за молекулярную структуру
[19, 25]. Кроме того, до сих пор точно не известно
влияние фиксаторов, красителей и других веществ,
применяемых при обработке ткани, на молекулярную
конфигурацию структур, видимых при используемом разрешении.
Исследования Ленарда и Зингера [22], Шёстранда
и Барайас [26] указывают на то, что фиксаторы, обычно
применяемые в электронной микроскопии, коренным
образом меняют структуру белка. Необходимо также
принимать во внимание воздействие электронного луча на
молекулярную конфигурацию объекта исследования.
В этой книге, которая служит руководством для
начинающих, не обсуждаются подробно методы и
проблемы электронной микроскопии с высоким разрешением.
Читатель должен лишь уяснить, что между
исследованиями с низким и средним разрешением и
исследованиями с высоким разрешением действительно пролегает
четкая граница. Литература, приведенная в конце этой
главы, должна послужить справочным материалом при
156
Глава 7
проведении исследований с высоким разрешением. Для
тех, кто собирается заняться такими исследованиями,
было бы очень полезно пройти 6-месячный курс обучения
в лаборатории, где имеются опытные специалисты в этой
области электронной микроскопии.
Настоящая глава посвящена анализу электронных
микрофотографий, полученных при использовании
методов, которые позволяют достичь разрешения не выше
25—50 А. Эти приблизительные границы разрешения
определяются целым рядом непостоянных факторов.
Некоторые Из них не поддаются контролю со стороны
оператора. Это — фокусное расстояние и численная
апертура объективных линз, а также характеристики
источников питания. Другие непостоянные факторы связаны
с методами подготовки материала, и среди них
важнейший — это толщина среза. В некоторых микроскопах,
для того чтобы получать разрешение 20 А, необходимо
использовать срезы, толщина которых не должна
превышать 150 А. Другие же микроскопы позволяют достичь
такого же разрешения на срезах в десять раз толще при
условии, что некоторые детали метода подготовки
объекта тщательно контролируются [9].
ИЗУЧЕНИЕ УЛЬТРАСТРУКТУРЫ.
ПРЕДВАРИТЕЛЬНОЕ ОБСУЖДЕНИЕ
АНАЛИЗ ОПУБЛИКОВАННЫХ МИКРОФОТОГРАФИЙ
Предполагается, что тот, кто хочет использовать
электронный микроскоп для изучения биологического
материала, овладел основами гистологии и общей
цитологии. Они составляют тот фундамент, на котором
строится весь анализ информации, содержащейся в
электронных микрофотографиях. Тот, кто слушал курс
цитологии несколько лет назад, должен прочесть одно
из руководств по цитологии, перечисленных в
библиографии, помещенной в конце этой главы.
Если вам не приходилось ранее анализировать
электронные микрофотографии, то советуем серьезно
заняться этим и в течение нескольких недель выделять
ежедневно немного времени для просмотра таких снимков.
Некоторые советы, связанные с изучением ультраструктуры 157
В результате этого, пока вы обучаетесь обращению
с электронным микроскопом и овладеваете методами
подготовки ткани для исследования, вы сможете также
уяснить для себя, что можно видеть с помощью
электронного микроскопа. Умение «чувствовать»
ультраструктуру нельзя приобрести за один день. Не
ограничивайтесь только тем типом ткани, который вас
заинтересовал. Некоторые структуры свойственны клеткам всех
типов, хотя они и могут иметь в разных тканях либо
незначительные, либо очень существенные различия.
Несколько прекрасных атласов ультраструктур,
которые могут быть использованы для этой цели,
перечислены в конце этой главы '. Начните с атласа Тонера и
Kappa [16], в котором даны самые общие сведения, затем
прочтите атлас Портера и Бонвилля [15], в котором
описывается ультраструктура различных тканей, и,
наконец, перейдите к атласу Фосетта [14], где более
глубоко рассматриваются ультраструктура различных
клеточных органелл и их тонкие структурные вариации.
Тщательно изучите каждую микрофотографию, используя
сопровождающий ее текст. Это даст вам возможность
познакомиться со структурами, которые видны на
электронных микрофотографиях, и понять, как они меняются
в зависимости от направления плоскости среза. Чем с
большим числом разных структур вы будете знакомы,
тем легче вы будете распознавать их на ваших
собственных микрофотографиях и тем меньше возможность
того, что вы проглядите на них что-либо важное или
предложите для публикации снимок варианта какого-
нибудь хорошо известного компонента клетки под
заголовком «Открыта новая цитоплазматическая
структура». Очень полезно также просмотреть учебники
гистологии Хэма и Лизона [32] или Блума и Фосетта [31]
(последние издания, конечно) и сравнить приведенные
в них электронные и световые микрофотографии
различных тканей. Всегда рассматривайте ультраструктуру
в связи с ее функцией.
1 В Советском Союзе также изданы атласы, которые могут быть
использованы для обучения начинающих. — Прим ред.
158
Глава 7
ПОДГОТОВИТЕЛЬНАЯ РАБОТА СО СВЕТОВЫМ
МИКРОСКОПОМ
Прежде чем начинать исследование данной ткани на
ультраструктурном уровне, следует подробно
ознакомиться с ее архитектоникой на уровне световой
микроскопии. Некоторые нужные сведения можно почерпнуть
из учебников гистологии. Однако в учебниках чаще
всего описываются ткани человека, так что, если
исследование проводится на животном, нужно принимать во
внимание видовые различия структур. Огромное значение
имеет изучение серии срезов исследуемого органа. Если
это невозможно, то необходимо изучить достаточное
количество срезов, чтобы позднее, используя срезы
толщиной 1 мкм, полученные из ткани перед ультрамикрото-
мией, можно было приблизительно определить, что
вошло в состав кусочка размером 1 мм. Это поможет
также решить (после того как из данного органа взято
несколько таких кусочков), все ли типы клеток,
интересующих исследователя, обнаруживаются в этом кусочке.
На срезах толщиной 1 мкм, полученных из ткани,
которая подготовлена для электронно-микроскопического
исследования, можно провести более подробное и
целенаправленное светомикроскопическое исследование, чем
на обычных парафиновых срезах толщиной 5 мкм.
Частично это обусловлено высоким качеством глутараль-
дегидной фиксации с последующим осмированием или
без него, а частично — толщиной срезов. На срезах
толщиной 1 мкм значительно лучше, чем на обычных
гистологических препаратах, видны детали клеточных струк-
тур. Четко выделяются границы клеток, смещение или
повреждение цитоплазматических органелл
незначительно или отсутствует совсем, минимальны потеря и
нарушения ядерного и цитоплазматического материала по
сравнению с потерей и нарушениями при использовании
обычных гистологических методик. Существует ряд
методик, с помощью которых можно окрашивать срезы
толщиной 1 мкм тканей, залитых в' эпоксидные смолы,
причем имеются данные, свидетельствующие о том, что
некоторые из этих методик обладают определенной
степенью специфичности. Прописи ряда таких методик
приводятся в приложении.
Некоторые советы, связанные с изучением ультраструктуры 159
ВАЖНОСТЬ ОРИЕНТИРОВКИ МАТЕРИАЛА ПЕРЕД
ИЗГОТОВЛЕНИЕМ СРЕЗОВ
Было подсчитано, что если из блока ткани объемом
1 мм3 резать серийные ультратонкие срезы для
электронной микроскопии и фотографировать всю площадь
каждого среза, то получится приблизительно 4ХЮ8
фотографических снимков.
Если с поверхности такого блока сделать срез
в 1 мм2, то образуется площадь 1 млн. мкм2, на которой
может разместиться свыше 4000 профилей плотно
прилегающих друг к другу клеток со средним диаметром
15 мкм. Площадь ткани, закрытой металлическими
переплетами опорной сетки, варьирует в зависимости от
размеров и формы отверстий и может достигать 65%
при использовании сеток с маленькими круглыми
отверстиями. Тем не менее детальный просмотр в
электронном микроскопе видимых участков ткани такого
среза занял бы много часов. Даже поиск специфических
деталей структуры при беглом просмотре среза
потребовал бы массы времени, если бы перерывы,
создаваемые опорной сеткой, не делали такой поиск
невозможным.
Просмотр среза в электронном микроскопе,
требующий много времени, значительно упрощается, если та
специфическая область, которую желательно
исследовать, отыскивается предварительно с помощью светового
микроскопа, как это было описано в главе, посвященной
изготовлению ультратонких срезов. Срезы толщиной
1 мкм, приготовленные для ориентировки, могут также
оказать существенную помощь при анализе
электронной микрофотографии, полученной с ультратонкого
среза. Из таких срезов можно изготовить постоянные
препараты, если их высушить на предметном стекле с
помощью гистологической плитки или в термостате, а
затем накрыть покровным стеклом, заключив в какую-
либо подходящую среду, например депекс. Некоторые
красители, такие, как метиленовый синий, выцветают
под действием света, однако если препараты хранить
в темноте, то их можно использовать в течение многих
месяцев и даже лет. Сообщалось, что использование
160
Глава 7
эпоксидных смол в качестве среды для заключения
препаратов замедляет их выцветание [4].
Конечно, срез толщиной 1 мкм будет содержать
больше ткани, чем ультратонкий срез с заточенного
блока. Поэтому после заточки блока полезно сделать
приблизительную схематическую зарисовку всего
одномикронного среза, просмотрев его с помощью светового
микроскопа, и отметить на этой схеме ту область,
которая соответствует лицевой поверхности заточенного
блока. Такая зарисовка может храниться вместе с
препаратом, используемым для ориентировки. Затем перед
просмотром ультратонкого среза, полученного с этого
блока, можно вернуться к изучению схематической
зарисовки и постоянного препарата, что облегчит
распознавание структур, которые будут видны в электронном
микроскопе.
Если сетки с серийными срезами хранятся в
отдельных контейнерах и соответствующим образом
пронумерованы, а вслед за последним ультратонким срезом
изготовлен второй ориентировочный срез, то можно
составить довольно точное представление о том, что
должно быть видно на таких сетках.
Следует иметь в виду, что если блок был правильно
установлен на ультрамикротоме, так что потеря ткани
перед первым хорошим ультратонким срезом
незначительна или отсутствовала совсем, и если резка
проходила без осложнений, то рисунок второго ориентировочного
препарата может почти не отличаться от рисунка
первого препарата. Если получено пять сеток, на каждой из
которых находится лента из пяти срезов, и если каждый
срез имеет толщину в среднем 500 А, тогда
5x5x500=125001, или 1,2 мкм.
Такая величина составляет лишь 8% толщины клетки
диаметром 15 мкм.
Нужно заметить, что пять срезов на одной сетке
составляют серию и суммарная толщина их равна только
2500 А, или 0,25 мкм. Следовательно, если какая-то
структура внутри клетки пять раз встречается на одной
сетке, то микроскопист должен с особой осторожностью
Некоторые советы, связанные с изучением ультраструктуры 161
решить вопрос о том, встречаются ли эти пять объектов
в пяти различных клетках или это просто серия срезов
одной структуры в одной клетке.
ПОЛНОЦЕННЫЙ ОБРАЗЕЦ ТКАНИ
Прежде всего следует обсудить вопрос о том, что
с точки зрения электронной микроскопии можно считать
полноценным образцом ткани. Понятно, что нельзя
сделать какие-либо выводы, основываясь на
микрофотографиях ткани одного животного независимо от того,
сколько было получено срезов. Здесь необходимо
придерживаться тех же критериев, которых придерживаются
и в световой микроскопии: чтобы избежать ошибки и не
принять за норму какие-либо отклонения от нее,
должны быть изучены образцы ткани от достаточного числа
животных. Конечно, абсолютное число животных может
быть различным и зависит от характера исследований,
однако, по-видимому, в большинстве случаев
минимальным является 4—б животных. Возраст животных
каждой группы должен быть приблизительно одинаковым,
поскольку ультраструктура большинства органов с
возрастом меняется. Как велики эти изменения, до конца
еще фактически не выяснено. В некоторых
исследованиях важными факторами могут стать упитанность, вес,
пол и если это самка, то число пометов.
Особенно трудно брать нужные образцы ткани в том
случае, когда исследуемая ткань имеет сложное
строение. Нельзя, например, просто разрезать надпочечник
на кусочки объемом 1 мм3, перемешать их, провести всю
необходимую обработку, выбрать для исследования
наугад несколько таких кусочков и при этом рассчитывать
на то, что удастся изучить структуру надпочечника на
уровне световой или электронной микроскопии. Кора
надпочечника состоит из трех зон, каждая из которых
существенно отличается по структуре от двух других.
Один кубический миллиметр ткани из клубочковой зоны
не может дать никаких сведений о строении сетчатой
зоны. Мозговое вещество надпочечника представляет
собой ткань совершенно другого типа, отличающуюся от
ткани коры. В онтогенезе ткань мозгового вещества раз-
11—977
1.62
Глава 7
вивается из другой закладки и обладает функциями,
абсолютно не сходными с функциями коры. При
исследовании таких органов, как надпочечник, надо
предпринимать все возможные меры, чтобы гарантировать
взятие ткани из той зоны, которая вас интересует; кроме
того, необходимо брать образцы ткани из нескольких
отделов этой зоны. Удобнее фиксировать и заливать не
кубические кусочки ткани, а тонкие пластинки, толщина
которых не должна превышать 1 мм. Таким образом
можно получить более обширные области для
ориентировочного просмотра в световом микроскопе.
Даже взятие образцов таких довольно гомогенных
тканей, как ткань печени, требует тщательности и
внимания. Считается, что эпителиальные клетки печени (ге-
патоциты) представляют собой единый тип клеток, а
между тем они выполняют великое множество функций.
Ультраструктура клетки может меняться в зависимости
от функции; функция может меняться в зависимости от
положения клетки в печеночной дольке.
ИЗУЧЕНИЕ УЛЬТРАСТРУКТУРЫ: АНАЛИЗ
ПОЛУЧЕННЫХ МИКРОФОТОГРАФИЙ
Прежде чем приступить к исследованию какой-то
ткани с помощью электронного микроскопа, необходимо
ознакомиться с особенностями ее строения на уровне
световой микроскопии. На этом этапе не столь важно
знать во всех подробностях то, что уже известно об этой
ткани другим электронным микроскопистам. Иначе на
деле это может оказаться помехой, поскольку слишком
пристальное внимание к тому, что известно другим,
может создать такое положение, при котором
исследователь будет видеть только то, что ожидает увидеть. По-
видимому, для новичка наиболее действенным способом
приобретения опыта в электронной микроскопии будет
просмотр ткани — большого количества ткани —
неискушенным глазом и письменное изложение всего
увиденного. Это моя сугубо личная точка зрения, и у
начинающего исследователя со временем и по мере накопления
опыта может сформироваться совершенно иной подход.
Тем не менее такой метод, вероятно, хорош для начала.
Некоторые советы, связанные с изучением ультраструктуры 163
Полезно при изучении подборки микрофотографий,
сделанных с сеток, полученных за один сеанс резки,
вернуться к препаратам, изготовленным для
ориентировки па светомикроскопичсском уровне, и детально описать
включенный в них участок ткани. Поразительно, как
словесное описание увиденного позволяет увидеть еще
больше.
Сделайте то же самое и с электронными
микрофотографиями. Опишите как можно полнее общую
архитектонику ткани, видимую на микрофотографии. Опишите
клетки. Все ли они одного типа? Как вы это
определяете? Каковы взаимоотношения клеток друг с другом?
Имеются ли между ними промежутки или они плотно
связаны между собой («плотный контакт» — tight
junction)? Если такие промежутки есть, не являются ли они
артефактом? Есть ли десмосомы или другие какие-либо
формы межклеточных контактов? Есть ли какие-либо
неровности клеточной мембраны? Видны ли пиноцитоз-
иые или иные пузырьки под этой мембраной? Если они
есть, опишите их содержимое. Не повреждены ли
клеточные мембраны? Нет ли признаков набухания или
повреждений, связанных с фиксацией (артефакты
фиксации) или с грубой обработкой ткани?
Гомогенна или неоднородна цитоплазма клеток?
Прозрачна она или обладает довольно высокой электронной
плотностью? Есть ли в цитоплазме какие-либо тонкие
нити? Являются ли они действительно нитями или это
края поперечно срезанных пластин? Как они выглядели
бы, если бы срез был сделан под другим углом?
Представляет ли собой их поперечный срез окружность?
Как выглядят митохондрии? Расположены ли они
в одной части клетки или распределены по всей клетке?
Какие они — круглые, нитевидные, разветвленные;
расположены ли они в одиночку или собраны в пучки? Нет
ли набухания этих структур? Равномерна ли плотность
матрикса митохондрий? Видны ли какие-либо частицы
в этом матриксе? Какова форма крист? -"-/
Какого вида эндоплазматическая сеть присутствует
в клетке — гладкая она или шероховатая? Расположена
ли она в каком-либо определенном участке цитоплазмы?
Образует ли она «стопки» или представлена одиночными
II*
164
Глава 7
цистернами? Все ли рибосомы связаны с эндоплазматн»
ческоч сетью или некоторые из них рассеяны по
цитоплазме? По отдельности или группами лежат свободные
рибосомы?
Имеются ли в клетке какие-либо цптоплазматические
тельца, которые вы не можете идентифицировать? Есть
ли особые, лишенные органелл области, из которых
были экстрагированы какие-то вещества?
Выражен ли аппарат Гольджи? Есть ли в нем как
цистерны, так и пузырьки? Какова величина той его
части, которая образована пузырьками? Содержится ли
какой-либо элсктроноплотныи материал в цистернах
и пузырьках? Одна или несколько центриолей находятся
■вблизи аппарата Гольджи?
Правильна ли форма ядер? Если ядра имеют
неправильную форму, то обусловлено ли это их
сморщиванием или отражает определенное физиологическое
состояние клетки? Имеются ли впячивання цитоплазмы в
ядро? Нет ли указаний на возможность перехода веществ
из ядра в цитоплазму или обратно? Есть ли ядрышко?
Какова его форма? Различимы ли в нем какие-либо
отдельные компоненты? Лежит ли ядрышко в
центральной части ядра или прилегает к его мембране?
После того как описаны многие срезы различных
образцов изучаемой ткани, приобретается особое
«чувство» ткани — знакомство, которого не так-то легко
достичь каким-либо другим способом. Теперь настало
время обратиться к литературе и начать ее интенсивное
чтение. Если данную ткань усиленно изучали другие
исследователи, то может оказаться, что о многих
описанных вами фактах уже упоминалось в литературе.
Предположим, что вы пришли к каким-то предварительным
заключениям относительно определенной органсллы, но
эта же самая структура описана кем-то еще и его
заключения полностью расходятся с вашими. Возможно,
.что правы вы — подумайте об этом и продолжайте
читать.
.. Не забывайте о видовых различиях. Помните, . что
ткани крысы во многих отношениях отличаются от тка.-
*ней человека. Если вы решили работать на игуанах, то,
возможно, вы обрели пол® деятельности для себя.лично.
Некоторые советы, связанные с изучением ультраструктуры 165
АРТЕФАКТЫ
Один из моих учеников, сдавая экзамен, сказал, что
электронная микрофотография — это фотография тени
артефакта. (Он утверждал, что это его собственное
определение.) Если представить себе то количество
веществ, которое удаляется из клетки в процессе
обработки ткани, то можно признать, что такое утверждение не
так уж далеко от истины. Примерно 60% большинства
клеток составляет вода, которая удаляется при
обезвоживании в спиртах и сначала замещается
обезвоживающими веществами, а затем — заливочной средой. Из
оставшихся 40% при фиксации, а позднее при
обезвоживании и заливке удаляются различные количества
белков, липидов, углеводов и нуклеиновых кислот. Все,
что остается после фиксации в глутаральдегиде с
последующей фиксацией в четырехокиси осмия,— это
остов, образованный теми веществами (главным образом,
структурированными белками и связанными с ними
молекулами), которые «стабилизируются» фиксатором.
Если учесть, что в клетке сохраняется, вероятно, всего
лишь 20—30% исходных веществ, то покажется
довольно удивительным, что изображение, видимое в
электронном микроскопе, может иметь какое-либо отношение к
действительности.
Тем не менее при сопоставлении результатов,
полученных при употреблении различных фиксаторов и
разных обезвоживающих веществ, а также результатов,
полученных методами лиофилизации, замещения в
замороженном состоянии или методом изучения реплик с
лиофилизированной ткани (см. гл. 10), оказывается, что
картины ультраструктуры клетки удивительно схожи
независимо от использованного метода.
Однако существуют определенные артефакты,
которые обычно видны на микрофотографиях, и
начинающий электронный микроскопист должен научиться
распознавать их. Те артефакты, которые обсуждаются
ниже, можно видеть при средних разрешениях
микроскопа. При таких разрешениях мы имеем дело с тем, что
можно было бы назвать «анатомией» клетки, т. е. мы
видим общий вид ее ядра, митохондрий, лизосом и
мембран так, как они выявляются при разрешениях от 25
166
Глава 7
до 50 А. При высоких разрешениях (менее 25А)
достигается уже макромолекулярный уровень, при котором
на первый план выступают артефакты другого порядка.
Причины, вызывающие появление артефактов, можно
условно разделить на три основные группы: 1)
механическое повреждение вследствие грубой обработки
ткани; 2) химические, физические и осмотические
нарушения и экстракция веществ, происходящие при фиксации,
обезвоживании и заливке (артефакты обработки), и
3) артефакты, появляющиеся после заливки ткани, т. е.
повреждения при резке, загрязнения при работе со
срезами, осадки красителей, повреждения, вызванные
электронным лучом. Артефакты первой и третьей групп
обычно легко различимы при просмотре объекта.
Артефакты второй группы могут быть как хорошо заметны,
так и трудно различимы, но независимо от этого в
любом случае связать их возникновение с какой-то
определенной стадией обработки ткани исключительно
трудно. Ниже приводятся признаки, характерные для этих
трех групп артефактов.
1. Механические повреждения. Такие повреждения
могут проявляться в нарушении целостности мембран,
разрыве клеток и клеточных оргаиелл или появлении
эритроцитов в межклеточных пространствах.
Повреждения меньших размеров уже трудно отличить от
повреждений, возникающих при обработке ткани.
2. Артефакты обработки. Сильные повреждения
такого рода становятся очевидными уже тогда, когда с
блока получают срез толщиной 1 мкм. Внутренняя часть
ткани может крошиться, способность такой ткани к
окрашиванию может меняться от периферии к внутренним
отделам. Если одномикронный срез кажется вполне
сохранным, то артефакты обработки могут проявляться на
ультраструктурном уровне любым из признаков, опи-
-санным ниже (а—г):
а) Набухание. Набухание клеток и органелл возни-
-кает в тех случаях, когда ткань подвергается
воздействию гипотонических растворов или когда в ней
развиваются посмертные изменения до завершения фиксации.
В тех тканях, для которых характерна быстрая смена
клеточных популяций, набухать могут гибнущие клетки.
Некоторые советы, связанные с изучением ультраструктуры 167
расположенные среди нормальных клеток. Набухание
может также свидетельствовать о некоторых
патологических процессах, однако если ткань берется у
здоровых животных, то более вероятно, что причиной этого
артефакта служит методика обработки ткани. Особенно
склонны к набуханию митохондрии; при этом
увеличивается средний размер этих оргапелл по сравнению с
размером, характерным для данной ткани, митохондри-
альный матрикс становится более светлым и в
некоторых случаях неоднородным. Может наблюдаться
увеличение (пузырьковидное вздутие) крист или их
деструкция. Иногда наблюдается также набухание эндоплазма-
тической сети, особеио в гибнущих клетках. Цитоплазма
при набухании может быть негомогенной и содержать
вакуоли.
Однако необходимо иметь в виду, что размер
митохондрий может варьировать в зависимости от их
функционального состояния, а набухание эндоплазматиче-
скои сети в секреторных клетках может просто
означать накопление клеточных секреторных продуктов. Не
всякое увеличение размеров органеллы следует не за'-
думываясь относить к артефактам.
б) Сморщивание. Этот процесс развивается в том
случае, когда ткань подвергается воздействию
гипертонического раствора. Одним из признаков сморщивания
может быть зубчатый контур ядра клетки. Митохондрии
могут уменьшаться в размерах по сравнению со
средними размерами этих органелл, характерными для
данной ткани, их контуры становятся неровными, а
матрикс очень плотным. Однако как увеличение органелл,
так и уменьшение их или различия в плотности не
всегда являются артефактом.
в) Повреждения клеточных мембран. В том случае,
когда цитоплазма клеток очень светлая и
неоднородная, обратите особое внимание на клеточные мембраны:
в них могут быть разрывы, через которые цитоплазма
вытекает в межклеточные пространства. При этом .fl
межклеточных пространствах нередко видно
содержимое клеток— фрагменты цитоплазмы (не путать с цито-
плазматическими отростками фибробластов), пучки
скрученных мембран, «выпавшие» из клеток митохонд-
168
Глава 7
рии. Клеточные мембраны могут разорваться вследствие
резкого изменения осмотического давления или
механического повреждения ткани при ее обработке. При
использовании в качестве среды для заливки метакри-
латов такие разрывы могут возникать также как
результат полимеризационного повреждения ткани. Разрывы
мембран происходят также и при гибели клеток.
г) Миелиновые фигуры. Иногда внутри клеток или
в межклеточных пространствах можно видеть
скрученные пучки мембран, напоминающие миелиновые
оболочки, столь характерные для нервных клеток.
Согласно данным Трампа и Эриксона [8], а также Кёрджи
[2J, появление таких образований обусловливается
частичным разрушением клеточных липопротеидных
мембран при фиксации в альдегидах. Образующиеся липи-
ды выявляются с помощью четырехокиси осмия там,
где они окажутся к моменту дополнительной фиксации.
Возможно, что такое объяснение справедливо в
большинстве случаев. Однако в некоторых развивающихся
тканях миелиновые фигуры можно видеть на
определенных стадиях формирования различных клеточных типов,
тогда как на других стадиях они отсутствуют [1, 10,
11]. Такая закономерность сохраняется независимо от
того, была ли ткань фиксирована в альдегиде, а затем
в четырехокиси осмия или только в четырехокиси
осмия. Эти данные позволяют предположить, что
образование миелиновых фигур в некоторых случаях
отражает какие-то процессы развития ткани, а не артефакты,
возникшие при ее фиксации.
д) Различия тканей, зависящие от применяемого
фиксатора. Никогда нельзя сказать заранее, что
структурные компоненты ткани будут выглядеть точно так
же, если использовать другой фиксатор. Одним из
примеров этого служат упоминавшиеся выше миелиновые
фигуры, другим — морфология клеточных ядер. Ядра
клеток, фиксированных четырехокисью осмия, обычно
имеют довольно гомогенное содержимое; исключение
составляет только ядрышко. Однако фиксация
альдегидами вызывает, как правило, появление скоплений
хроматина (нуклеопротеидов, содержащих ДНК), особенно
р краевых зонах ядра. Обычно считается, что диспер-
Некоторые советы, связанные с изучением ультраа руктуры 169
гированпое состояние хроматина, наблюдаемое при
осмиевой фиксации, в большей степени соответствует его
распределению в живой клетке1. Это предположение
подтверждается данными о том, что при фиксации
ткани осторожной перфузией альдегида не происходит
образования скоплений хроматина и внешний вид ядер
сходен с тем, который получается при фиксации четы-
рехокисыо осмия.
е) Изменения, сходные с патологическими. Следует
заметить, что артефакты, упомянутые в пунктах а — д,
вызываются не только обработкой ткани, но и
обусловливаются как нормальными физиологическими, так и
патофизиологическими процессами. Особенно важно
помнить об этом при изучении патологических
изменений тканей. Если кусочек ткани фиксирован
неравномерно, то в нем можно обнаружить весь спектр
клеточных изменений, которые сходны с изменениями,
возникающими в условиях патологии. До сих пор еще не
установлены вполне надежные критерии, позволяющие
оценивать те многочисленные и тонкие изменения,
которые можно при этом обнаружить.
3. Артефакты, возникающие после заливки ткани.
а) Сжатие. Даже в том случае, когда ультратонкие
срезы были расправлены парами хлороформа, ткань все-
таки остается в некоторой степени сжатой вследствие
давления ножа при резке. При этом круглые объекты
будут выглядеть несколько вытянутыми, что
необходимо учитывать, выполняя точные измерения.
б) Грязь. Грязь довольно легко отличить от
структурных компонентов ткани, несмотря даже на то, что
морфология последних, конечно, очень разнообразна.
Загрязнения препарата — это прямое следствие работы
на грязном месте или небрежности, допущенной в
процессе выполнения каких-либо процедур при фиксации,
обезвоживании и т. д. Грязь не только губит хорошие
1 Показано, что при фиксации в OsCU толщина нитей ДНП
уменьшается с 200 до 100 А, что, по-видимому, связано с
экстракцией части белка. Глутаровый альдегид в отличие от Os04
сохраняет структуру ДНП без изменений. Следовательно, утверждение
автора о преимуществе осмиевой фиксации нельзя считать
обоснованным. — Прим. ред.
170
Глава 7
срезы, но и увеличивает загрязнение колонны
микроскопа.
в) Осадки красителей. Осадки красителей также
легко отличить от структур ткани. Осадок каждого
красителя имеет свою характерную форму. Уранилацетат
обычно выпадает в виде игольчатых кристаллов
умеренной электронной плотности; цитрат свинца дает
прямоугольные кристаллы очень высокой электронной
плотности (форма кристаллов может, конечно, меняться в
зависимости от условий окрашивания). Если у вас
возникают неприятности вследствие выпадения осадков
красителей, рекомендуем еще раз прочесть описания
методов окрашивания, приведенные в приложении.
г) Повреждения, вызываемые электронным лучом.
Этот вопрос уже обсуждался в гл. 5.
ИЗМЕРЕНИЕ СТРУКТУР НА ЭЛЕКТРОННЫХ
МИКРОФОТОГРАФИЯХ
Поскольку ангстрем и микрометр — это те две
единицы линейного измерения, которые чаще всего
применяются в электронной микроскопии, полезно помнить, что
разность порядков этих величин равна 4: 2500 А==
= 0,25 мкм.
Измерения структур на негативе или позитивном
отпечатке. Предположим, что вы сфотографировали
необычную структуру в цитоплазме клетки и хотите знать
ее размеры. Прежде чем приступить к измерениям,
вспомните, что профиль, который вы видите на срезе,
представляет собой лишь очень тонкую пластинку,
размеры которой могут значительно измениться, если срез
через объект пройдет на другом уровне. Пока вы не
измерите много таких структур, ваши данные не смогут
дать вам представление об истинном строении этого
объекта.
Измерения делают либо на негативе, либо на
отпечатанном с него позитиве. Если структура очень мала,
то более точно измерить ее можно на увеличенном
отпечатке. Кроме того, на позитиве можно начертить
линии разметки, а негатив сохранить для изготовления
дополнительных отпечатков, если они потребуются. Если
Некоторые советы, связанные с изучением ультраструктуры 171
вы делаете измерения на отпечатке, то помните, что
ошибки в определении фотографического увеличения
позитива при печатании будут сказываться на точности
конечных результатов ваших измерений. Помимо этого,
отпечаток в процессе его обработки может слегка
уменьшаться в размерах (сжиматься).
Для измерения крупных объектов пользуются точно
калиброванной линейкой с делениями 0,5 мм. Для
измерения мелких деталей следует пользоваться
специальным измерителем с увеличительным стеклом и
сеткой.
Принять окончательное решение о том, где измерять
данную структуру, не всегда бывает легко. Если она
имеет «округлую» форму, то ее диаметр, возможно,
будет значительно варьировать при измерении через
произвольно выбранную «центральную» точку. Чтобы
определить в этом случае средний диаметр структуры,
необходимо выполнить целый ряд измерений. Если такое
«округлое» тело несколько вытянуто, то необходимо
принять во внимание возможность его деформации при
резке. Естественно, что при измерении тел
неправильной формы перед нами встает еще более трудная
задача.
Примерную ширину удлиненных объектов можно
установить посредством усреднения нескольких замеров,
выполненных вдоль длинной оси. Установить длину
объекта невозможно, если она больше толщины среза и сам
объект выходит за его пределы. Ширину объекта,
например «листка» материала, идущего через срез,
можно измерить только в том случае, если он пересекает
срез точно под прямым углом. Если он проходит
наклонно, то видимая ширина его будет возрастать по мере
увеличения наклона; при этом края изображения будут
менее плотными, чем его центр (фиг. 13).
По-настоящему понять трудность определения того, под каким
углом— прямым или острым — объект проходит через
срез, вы сможете только тогда, когда попытаетесь
сделать это сами.
При больших увеличениях возникает еще одна
проблема— необходимость производить измерения между
нечеткими зернистыми изображениями, так как то, что
172 Глава 7
при малых увеличениях выглядит как черная линия, при
большом увеличении превращается в собрание
зернышек различной плотности. Достоверный ответ может
быть получен только после многих тщательно
выполненных и усредненных измерений.
Фиг. 13. Различия в ширине и характере изображения плоского
объекта, пересекающего срез под разными углами.
о
/ — вид сбоку на плоский объект; 2 — вид сбоку на срез толщиной 500 А;
3 — изображение.
После того как все измерения закончены и данные
их усреднены, необходимо рассчитать действительные
размеры среза, используя ту структуру, которая вами
измерялась. Для этого следует просто разделить
полученные вами средние цифры на показатели увеличения
при съемке и при фотографическом увеличении
негатива. Производя эти pa-счеты, помните, что разность
порядков миллиметра и ангстрема составляет 7.
Например, если размер объекта равен 10 мм и он был снят
при увеличении в 40 000 раз, а затем увеличен при
печатании позитива в 5 раз (т. е. 40 000X5=200 000), то ■
Юмм _ юр ооо оооА __ с00 ■
200 000 — 200 000 ~
Нужно иметь в виду, что полученная в итоге
величина содержит целый ряд ошибок.
Некоторые советы, связанные с изучением ультраструктуры 173
1. Показания увеличения на электронном
микроскопе даются только с точностью до ±5%. Следовательно,
если необходимо выполнить особо точные измерения, то
увеличения электронного микроскопа должны быть от-
калиброваны для каждого положения ручки установки
увеличения, обычно с помощью реплики дифракционной
решетки в качестве стандарта [5, 7]. Необходимо
удостовериться в том, что перед фотографированием вь*
учли магнитный гистерезис линзы, как это было
описано на стр. 118.
2. Увеличение объекта меняется в зависимости от его
положения на оптической оси микроскопа. Убедитесь
в том, что сетка имеет плоскую форму и помещена в
колонну микроскопа срезом вниз. Иначе положение среза
в микроскопе будет изменяться на величину, равную
толщине сетки.
3. При малых увеличениях, если объект не помещен
при съемке в центр поля, его размеры могут меняться
иод влиянием эффектов линейного искажения
изображения.
4. Возможно, что не было точно определено
увеличение при фотопечати.
5. В процессе обработки позитивного отпечатка
может происходить его небольшое сжатие.
Короче говоря, выводы, полученные на основании
измерения объектов, сфотографированных в
электронном микроскопе, нужно принимать с известной долей
осторожности. Это в одинаковой степени относится и к
вашим собственным, и к литературным данным.
Шкала увеличения на микрофотографиях. Масштаб
микрофотографии может быть указан с помощью линии,
помещенной в одном из углов отпечатка. Например,
если увеличение равно 50 000, то можно начертить линии*
длиной 50 000 мкм (5 см) и обозначить над ней «1 мкм»
или линию длиной 5 мм с обозначением «1000 А».
Морфометрия и стереологическая цитология. Даже
когда учтены все перечисленные выше причины ошибок
измерений, нужно, помимо всего прочего, помнить, что
измеряемая структура представляет собой всего лишь
тонкий слой более крупной структуры, слой столь
тонкий, что он практически имеет всего два измерения. Ее-
174
Глава 7
тественно, что невозможно определить трехмерную
структуру органеллы на основании единичного ее
среза толщиной 500 А.. Как видно на фиг. 14, круглый
профиль можно получить на срезе любой из приведенных
фигур.
Проблема трехмерности структуры должна
решаться с позиции статистического подхода. Если органелле
свойственны определенные признаки, которые
позволяют распознавать ее профиль, то возможно, используя
очень большое число таких профилей, составить опре-
Фиг. 14. Фигуры, поперечное сечение которых представляет собой
окружность.
деленное представление о трехмерных характеристиках
такой органеллы. Чтобы результаты были
статистически достоверны, исследуемые образцы должны быть
получены методом случайной выборки, иметь крупные
размеры и брать их надо из материала, который дает
достаточно полное представление об изучаемой ткани.
Искусство измерения оргапелл на
электронно-микроскопическом уровне с целью изучения их трехмерной
структуры и расположения в клетке стремительно
развивается в последние годы.
Вейбель, Стобли, Лауд и другие показали, что
изменения функции органелл как в норме, так и в условиях:
патологии часто сопровождаются увеличением или
уменьшением их количества, а не какими-то
определенными морфологическими изменениями. Есть надежда,
что морфометрические и стереологические методы от-
Некоторые советы, связанные с изучением ультраструктуры 175
кроют возможность корреляции биохимических и
физиологических данных с дянными морфологии.
Вейбель и Элиас [13], а также Вейбель [12]
следующим образом определяют понятия морфометрии и сте-
реологии: «Морфометрия— это использование
количественных данных при описании структурных признаков.
Морфометрические данные могут быть получены с
помощью целого ряда измерений на объекте любого типа,
однако они могут быть также получены и при стереоло-
гическбм анализе срезов ткани. Стереология — это
геометрический анализ структур и тканей; она включает
методы, которые позволяют непосредственно получить
данные о метрических свойствах' структур, исходя из
двумерных срезов и основываясь на статистико-геомет-
рических доказательствах».
Полный обзор и подробное обсуждение методов и
технических приемов, используемых в морфометпии и
стереологии, можно найти в работе Вейбеля [12],
ПЛАНИРОВАНИЕ ИССЛЕДОВАТЕЛЬСКОЙ РАБОТЫ
Д™ начинающего в любой области исследований
всегда очень легко с огромным энтузиазмом буквально
окунуться с головой в научную работу, усердно
трудиться в течение нескольких недель, однако вскоре он
убеждается в том, что добрая половина его методов либо
очень несовершенна, либо неверно использована, что
контроль эксперимента недоказателен и что он не
может представить вразумительного отчета о проделанной
работе.
Если научный руководитель начинающего
исследователя загружен работой так же, как и бо"ьшинство
руководителей, то новичку остается рассчитывать только
на свои силы и искать наилучший для себя выход из
положения. Возможно, что лучшим средством, которое
предохранит от всяческой путаницы, будет разработка
детального плана научного исследования. В нем
должны быть четко сформулированы обоснование работы,
подробное изложение особенностей методов, которые
будут использованы, приведены ссылки на литературу
и список необходимых веществ, приборов и т. д. Надо
178
Глава 7
составить также и примерный календарный план
работы. Используйте его только как ориентир, не делайте
из него догмы (исследование, как правило, требует
примерно в пять раз больше времени, чем предполагается).
Прежде чем начать реализацию такого плана, дайте
просмотреть его вашему руководителю, чтобы он
оценил его выполнимость.
Четко составленный план в дальнейшем может быть
полезным при работе над докладом, статьей для
публикации или диссертацией.
ВЕДЕНИЕ ПРОТОКОЛОВ
Необходимость ведения записей при любой научной
работе совершенно очевидна. Каждый, кто серьезно
занят исследовательской деятельностью, должен
запомнить слишком много самых разных вещей, чтобы все их
можно было держать в памяти, и для него совершенно
незачем доказывать научную компетентность,
демонстрируя емкость памяти.
Каждый эксперимент должен быть тщательно
описан. Если вы изменяете состав данного фиксатора или
продолжительность какой-либо процедуры, напишите,
как и почему вы это делаете.
Особое внимание надо также уделять маркировке
тканей. Нет ничего более загадочного, чем черный
кусочек ткани, залитой в аралдит, за исключением, быть
может, серии ультратонких срезов на сетках,
рассыпанных на полу вместе с десятком других сеток. Самое
тщательное из когда-либо сделанных в мире описаний
будет бессмысленным, если его по ошибке отнесут не
к тому объекту.
НЕОБХОДИМОСТЬ СЛЕДИТЬ ЗА ЛИТЕРАТУРОЙ
Электронная микроскопия — это быстро,
развивающаяся область знаний. Постоянно совершенствуются ее
методы и оборудование. Электронно-микроскопическая
литература поистине огромна и увеличивается с
каждым днем. Если делать что-нибудь помимо чтения, то
уследить за всей литературой невозможно. Надо
стараться проводить часа два в неделю в библиотеке, про-
Некоторые советы, связанные с изучением ультраструктуры 177
сматрлвая последние номера журналов и следя за
библиографией работ, имеющих отношение к вашим
собственным исследованиям. Список журналов,
посвященных в основном исследованиям
ультраструктуры,'приведен в конце этой главы. Большую помощь в поиске
последних публикаций по интересующей вас теме может
оказать Current Contents — еженедельный
информационный бюллетень, публикующий оглавления статей,
напечатанных в научных журналах. Этот бюллетень
можно найти" в большинстве научных библиотек.
Список литературы
Общие работы
1. Coupland R. Е., Weakley В. S., Developing chromaffin tissue in the
rabbit: an electron microscopic study, Journal of Anatomy, 102,
425—455 (1968).
2. Curgy J. J., Influence du mode de fixation sur la possibilite d'obser-
ver des structures myeliniques dans les hepatocytes d'embryons de
poulet, Journal de Microscopie, 7, 63—80 (1968).
3. Fawcett D. W., In Modern Developments in Electron Microscopy,
Chap. 6 (Edited by В. М. Siegel), New York and London, Academic
Press, 1964.
4. Harrison G. A., (1971). Личное сообщение.
5. Meek G. A., Practical Electron Microscopy for Biologists, Chap. 11
and Chap. 12, pp. 335—338, London and New York, Wiley-Interscien-
ce, 1970.
6. Sjostrand F. S., A new ultrastructural element of the membranes
in mitochondria and some cytoplasmic membranes, Journal of Ultra-
structure Research, 9, 340—361 '(1963).
7. Sjostrand F. S., Electron Microscopy of Cells and Tissues, Vol. 1,
Chap. 10, II and 12, New York and London, Academic Press, 1967.
8. Trump B. F., Ericsson J. L. E., The effect of the fixative solution
on the ultrastructure of cells and tissues. A comparative analysis
with particular attention to the proximal convoluted tubule of the
rat kidney, Laboratory Investigation, 14, 1245—1323 (1965).
9. Wachtet A. W., Gettner M. E., Ornstein L., In Physical Techniques
in Biological Research, 2nd edn, Vol. 3, Part A, Chap. 4, New York
and London, Academic Press, 1966.
10. Weakley B. S., Ultrastructure of the fetal thymus in the golden
hamster, Journal of Morphology, 115, 319—354 (1964).
11. Weakley B. S., Electron microscopy of the oocyte and granulosa
cells in the developing ovarian follicles of the golden hamster
(Mesocricetus auratus), Journal of Anatomy, 100, 503—534 (1966).
12. Weibel E. R., Techniques for quantitative evaluation of structure
"Morphometry", International Review of Cytology, 26, 235—302
(1969).
12-977
178
Глава 7
13. Weibel E. R., Elias И., Quantitative Methods in Morphology,
Berlin, Springer, 1967.
Атласы ультраструктуры
14. Fawcett D. W., An atlas of Fine Structure —The Cell, Philadelphia
and London, W. B. Saunders, 1967.
15. Porter K. R., Bonneville M. A., Fine Structure of Cells and Tissues,
3rd edn., London, Henry Kimpton, 1968.
16. Toner P. G., Carr К. Е., Cell Structure, Edinburgh and London,
E. and S. Livingstone, 1968.
Интерпретация ультраструктуры
17. Bohr G. F., Zeitter E. H. (Eds.), Proceedings of a Symposium on
Quantitative Electron Microscopy, Laboratory Investigation, 14,
739—1340 (1965).
18. Harris R. J. C. (Ed.), The Interpretation of Ultrastructure, New
York and London, Academic Press, 1962.
19. Haydon G. В., On the interpretation of high resolution electron
micrographs of macromolecules, Journal of Ultrastructure Research,
25, 349—361 (1968).
20. Haydon G. В., Electron phase and amplitude images of stained
biological thin sections, Journal of Microscopy, 89, 73—82 (1969).
21. Haydon G. В., An electron-optical lens effects as a possible source
of contrast in biological preparations, Journal of Microscopy, 90,
1—13 (1969).
22. Lenard J., Singer S. J., Alterations of the conformation of proteins
in red blood cell membranes and in solution by fixatives used in
electron microscopy, Journal of Cell Biology, 37, 117—121 (1968).
23. McGee-Russell S. M., Ross K. F. A. (Eds.), Cell Structure and its
Interpretation, London, Edward Arnold, 1968.
24. Parsons D. F. (Ed.), Some Biological Techniques in Electron
Microscopy, New York and London, Academic Press, 1970.
25. Sjostrand F. S., In Physical Techniques in Biological Research,- 2nd
edn., Vol. 3C, pp. 169—200 (Edited by A. W. Pollister), New York
and London, Academic Press, 1969.
26. Sjostrand F. S., Barajas L., Effect of modification in conformation
of protein molecules on structure of mitochondrial membranes,
Journal of Ultrastructure Research, 25, 121—155 (1968).
Руководства по цитологии и молекулярной биологии
27. Haggis G. H., Michie D., Muir A. R., Roberts К. В.. Walker P. В. М.,
Introduction to Molecular Biology, London, Longmans, 1965.
28. Haggis G. H., The Electron Microscope in Molecular Biology,
London, Longmans, Green and Co., 1966.
29. Loewy A. G., Siekevitz P., Cell Structure and Function, 2nd end.,
New York, Holt, 1969.
30. De Robert Is E. D., Nowinski W. W., Saez F. A., Cell Biology, 5th
edn., Philadelphia and London, W. B. Saunders, 1970. (Э. de Po-
бертис, З. Новинский, Ф, Саэс, Биология клетки, изд-во «Мир»,
М., 1973.)
Некоторые советы, связанные с изучением ультраструктуры 179
Руководства по гистологии
31. Bloom W., Fawcett D W., A Textbook of Histology, 9th edn.,
Philadelphia and London, W. B. Saunders, lt>68.
32. Ham A. W., Leeson T. S., Histology, 5th edn., London, Pitman
Medical Publishing, Philadelphia, J. B. Lippincott, 1965.
Журналы, специализирующиеся на публикации
электронно-микроскопических и цитологических работ
Journal of Ultrastructure Research, New York, Academic Press.
Journal of Cell Biology, New York, Rockefeller Press.
Journal de'Microscopie, Paris, CNRS.
Zeitschrift fur Zellforschung und microskopische Anatomie, Berlin und
New York, Springer-Verlag.
Tissue and Cell, Edinburgh, Oliver and Boyd.
Journal of Microscopy, Oxford, Blackwells.
Experimental Cell Research, New York and London, Academic Press.
Journal of Cell Science, Cambridge, University Press.
Информация о текущих публикациях
Garfield E. (Ed.), Current Contents: Life Sciences, Philadelphia,
Institute for Scientific information, Inc. (издается еженедельно).
12*
ГЛАВА 8
Ультраструктурная цитохимия
Электронная цитохимия — быстро растущая область
исследований, однако еще недалеко ушедшая от своей
начальной стадии. Ее развитие в ближайшее
десятилетие пойдет по многим направлениям и будет
исключительно увлекательным для тех, кто посвятит себя этим!
исследованиям. Уже сейчас есть ряд относительно
простых методик, которые могут быть использованы
начинающими электронными микроскопистами; однако они
должны отдавать себе отчет в том, что
интерпретировать данные, полученные с помощью методов, которые
все еще слишком новы, чтобы быть оцененными до
конца, следует с крайней осторожностью.
ИНФОРМАЦИЯ, ПОЛУЧАЕМАЯ
ПРИ ИСПОЛЬЗОВАНИИ ДВУХ
ИЛИ БОЛЕЕ ФИКСАТОРОВ
Как стало очевидным из данных световой
микроскопии, различные фиксаторы по-разному воздействуют на
структурные компоненты клеток. То, как реагируют те
или иные компоненты клетки на различные фиксаторы,
уже дает возможность получить некоторые
предварительные данные о природе этих компонентов.
Источником информации могут быть также данные о том, как
различные фиксаторы воздействуют на последующую!
окраску клеточных структур. Однако следует отметить
сугубо предварительный характер подобного рода
данных, которые могут быть использованы только как
предпосылка для дальнейших исследований.
Ультраструктурная цитохимия
181
Перманганат калия редко используется теперь в
электронной микроскопии как фиксатор, поскольку он
экстрагирует из клеток большую часть белков и нуклео-
протеидов, оставляя лишь каркас, состоящий главным
образом из мембран, углеводов и небольшого остатка
белков,— картина, не дающая слишком много
информации. Четырехокись осмия лучше фиксирует белки, хотя
во время фиксации и последующего обезвоживания
ткани все еще экстрагируется большое количество
белков.
Самым лучшим фиксатором для белков является
глутаральдегид благодаря своей сильно выраженной
способности образовывать межмолекулярпые связи.
Альдегиды стабилизируют белки, нуклеопротеиды и
некоторые углеводы, однако часть линидов при этом
теряется при последующем обезвоживании в спиртах.
Таким образом, если для фиксации используются одни
альдегиды, то липидные включения в клетках будут
иметь вид белых участков («негативные изображения»).
Системы клеточных мембран после альдегидной
фиксации и последующего окрашивания уранилацетатом и
цитратом свинца также выявятся как «негативное
изображение». Однако на месте мембран сохраняется часть
материала, который может быть выявлен с помощью
окрашивания псрмангаиатом калия [1]. Точно еще не
установлено, в какой степени удаляются различные ли-
попротеидные комплексы («скрытые липиды»);
наглядным примером подобных комплексов служат мембраны,
окружающие клетки и их органеллы.
Заметного разрушения ткани вследствие экстракции
липидов не происходит, поскольку фиксируются белки,
локализованные вокруг или внутри участков, занятых
материалом, содержащим липиды, что и обеспечивает
сохранение структурной целостности цитоплазмы.
Когда ткань, фиксированная глутаральдегидом,
промывается буферным раствором и затем дополнительно
фиксируется в четырехокиси осмия, последняя
реагирует с ненасыщенными липидами, вследствие чего при
обезвоживании происходит значительно меньшая
экстракция этих веществ. В результате такой ' обработки
ткани создается картина, сходная с той, что получается
Вид различных структурных компонентов ткани после применения
некоторых фиксаторов (предполагается окрашивание срезов
уранилацетатом и затем цитратом свинца)
Таблица 5
Лкпнды
Белки
Нуклеиновые
кислоты и иук-
леопротеиды
Гликоген
После фиксации в одном
глутаральдегиде
Не сохраняются. Липидпые
включения и фосфолипидные
мембраны видны как
«негативное изображение»
Хорошо сохраняются;
цитоплазма и матрикс
митохондрий гомогенные и, как
правило, имеют большую
электронную плотность, чем после
фиксации четырехокисью
осмия
Рибосомы сохраняются,
хроматин может образовывать
скопления на периферии ядра
Сохраняется
После фиксации в одной
четырехокиси осмия
Фосфолипидные мембраны
сохраняются. Линидные
включения могут выявляться
целиком или иметь пустые
центры
Некоторые белки теряются,
цитоплазма и матрикс
митохондрий могут быть
довольно светлыми или
негомогенными
Рибосомы сохраняются.
Хроматин редко образует
скопления на периферии ядра
Лучше сохраняется, если
использован буфер Млллонига
После фиксации в глутаральдегиде
и последующей фиксации
в четырехокиси осмия
Картина примерно такая же,
как после фиксации в одной
четырехокиси осмия
Картина примерно такая же,
как после фиксации в одном
глутаральдегиде
Картина примерно такая же,
как после фиксации в одном
глута р альдегиде
Есть данные, что гликоген
сохраняется лучше, если
раствор для дополнительной
фиксации готовится на
буфере Миллонига
Ультраструктурная цитохимия
183
при фиксации только в четырехокиси осмия, однако
значительно лучше при этом сохраняются некоторые
белковые компоненты.
Таким образом, простое использование двух
фиксаторов (по отдельности или в комбинациях) может дать
некоторую предварительную информацию о
цитохимической природе клеточных структур. Если эти структуры
после альдегидной фиксации выявляются как
«негативное изображение», но становятся электроноплотными
после Дополнительной фиксации в четырехокиси осмия
или после фиксации только четырехокисью осмия, то,
возможно, они содержат липиды.
Если структуры видны в ткани, фиксированной
одним глутаральдегидом, а также после совместной
фиксации в глутаральдегиде и четырехокиси осмия, но не
выявляются в тканях после фиксации только в одном
осмии, то, вероятно, это либо белки, либо углеводы (см.
фото IV, А и Б). Ответ на вопрос, какое это вещество,
можно иногда получить, используя методы
ферментативного переваривания, речь о которых пойдет ниже.
Нуклеопротеиды сохраняются и при альдегидной и
при осмиевой фиксации, так что о них можно получить
лишь очень небольшую информацию, используя
сочетание этих двух фиксаторов. Уже говорилось о том, что
состояние агрегации ядерного хроматина будет различные
при фиксации альдегидами (хроматин образует
скопления, становится более плотным) и при осмиевой
фиксации (хроматин более светлый, гомогенный),
однако исключения из этого правила многочисленны. В табл.
5 суммирована основная информация, которая
получена при использовании этих двух наиболее
распространенных фиксаторов. Фото I иллюстрирует некоторые из
этих положений.
ОГРАНИЧЕНИЯ ПОЗИТИВНОГО ОКРАШИВАНИЯ
Как указывалось в гл. 4, понятие специфичность
окрашивания в строгом цитохимическом смысле можно
лишь с очень большой осторожностью относить к тем
методам, которые применяются в электронной
микроскопии- Использование некоторых красителей при строго оп-
184
Глава 8
ределеиных условиях и в комбинации с
соответствующим контролем позволяет получить иногда довольно
четкие данные. Например, если известно, что
краситель реагирует с несколькими компонентами ткани, то
могут быть использованы блокирующие вещества в
расчете на то, что блокированы будут все места
возможных реакций, за исключением одного, которое
интересует исследователя. Другим подходом является удаление
определенных компонентов ткани, которые иначе
вступили бы в реакцию с красителем. Для этого можно
воспользоваться обычными биохимическими методами
экстрагирования или методом ферментативного
переваривания, который описан в одном из следующих
разделов. Ферментативное переваривание (если оно
возможно) предпочтительнее для этой цели, поскольку
процедуры экстрагирования обычно ухудшают
сохранность ультраструктуры ткани.
ОПРЕДЕЛЕНИЕ МЕСТОНАХОЖДЕНИЯ
(ЛОКАЛИЗАЦИИ) СПЕЦИФИЧЕСКИХ
БЕЛКОВ В ТКАНЯХ
ЛОКАЛИЗАЦИЯ ФЕРМЕНТОВ
Если фермент присутствует в ткани в активной
форме, то он может воздействовать па специфичный для
него субстрат. Такое действие фермента будет выражаться
в образовании одного или нескольких продуктов
реакции. Если один из них можно сделать электроноплот-
ным, то его можно будет видеть в электронном
микроскопе.
Для выявления ферментов в тканях на электронно-
микроскопическом уровне были взяты общеизвестные
методы световой гистохимии.'Обычно они включают
получение срезов толщиной 25—50 мкм из фиксированной,
замороженной, но не залитой ткани, поскольку
заливочные среды резко снижают активность ферментов в
тканях. Затем срезы инкубируют в растворе, содержащем
субстрат, на который действует данный фермент, а
также какие-либо вещества (часто ионы тяжелых метал-
Ультраструктурная цитохимия
185
лов), которые способны вступать в реакцию с одним или
несколькими продуктами ферментативной активности,
чтобы образовать нерастворимый электроноплотныи
осадок в месте протекания реакции.
После инкубации срезы можно при необходимости
дополнительно фиксировать в четырехокиси осмия и
затем обезводить и залить обычными методами.
Как описывается в гл. 10, в разделе, посвященном
методам замораживания, была проделана большая
работа по созданию методов быстрого замораживания
нефиксированной ткани с целью сохранить
неизмененными компоненты ткани и в то же самое время избежать
ее повреждения кристаллами льда. Такой методический
подход позволил получить значительное количество
морфологических данных, однако применение этих методов
в ультраструктурной цитохимии не дало той богатой
информации, на которую надеялись поначалу. Даже
если процедура начального замораживания давала
высокое качество сохранности ультраструктуры, то
оказалось очень трудным решить техническую задачу
проведения цитохимических реакций в таких условиях,
которые обеспечили бы поддержание того же уровня
сохранности ультраструктуры. Следовательно, хотя
фиксация всегда пагубно сказывается на ферментативной
активности, ткань все же в большинстве случаев
фиксируется перед замораживанием.
Фиксация обычно снижает активность ферментов
прямо пропорционально способности фиксатора к
образованию поперечных связей. К сожалению, качество
морфологической сохранности ткани возрастает с
увеличением способности фиксатора к образованию этих связей.
Следовательно, невозможно совместить высокий уровень
ферментативной активности и хорошую
морфологическую сохранность ткани. Значительная ферментативная
активность может сохраняться после фиксации
формальдегидом, который обладает ограниченной
способностью к формированию поперечных связей. Однако
морфологическая сохранность при этом может быть
относительно плохой, а потеря белков высокой, особенно
вследствие того, что ткань после фиксации более
чувствительна к повреждениям, возникающим при ее замо-
186
Глава 8
раживании и резке. Глутаральдегид как вещество с
сильно выраженной способностью к формированию
поперечных связей обеспечивает лучшую
морфологическую сохранность ткани, но при этом активность
ферментов 'может быть низкой или отсутствовать совсем.
Приемлемый компромисс найден при использовании
ткани, фиксированной в формалине,
свежеприготовленном из порошкообразного параформальдегида, как это
рекомендовано Пизом [3] (см. приложение, стр. 280).
Четырехокиаь осмия, хотя она и не является
фиксатором с сильно выраженной способностью к
формированию поперечных связей, оказалась в общем
малопригодной для исследования ферментов. Четырехокись
осмия не только блокирует многие реактивные группы в
ткани, но и способствует денатурации ферментов.
Совсем недавно были созданы приспособления для
резки фиксированной незамороженной ткани, о которых
подробнее будет сказано ниже. Применение их
позволяет избежать артефактов, связанных с
замораживанием, причём повреждения, возникающие при резке,
находятся в допустимых пределах.
Классическим примером выявления локализации
ферментов в ткани служит метод Гомори для фосфатаз.
Многие исследователи применяли его для электронно-
микроскопических исследований (см. ссылки в конце
этой главы). Фосфатазы—это ферменты, отщепляющие
фосфатные группы. Ткань инкубируют в среде, в состав
которой входят субстрат, содержащий фосфаты
(например, р-глицерофосфат), и ацетат свинца. Ферменты
ткани воздействуют на субстрат, отщепляя его фосфатные
группы. Свободный фосфатный ион вступает в реакцию
с ионом свинца (РЬ2+), образуя нерастворимый фосфат
свинца, который обладает высокой электронной
плотностью и виден в электронном микроскопе, возможно,
в том месте, где произошла ферментативная реакция.
Метод Гомори позволил собрать большое количество
данных, касающихся локализации на
ультраструктурном уровне таких ферментов, как кислая и щелочная
фосфатазы, нуклеотидфосфатазы и дифосфатазы. К
сожалению, подобные методы связаны с целым рядом
трудностей и результаты их зачастую спорны [5, 6, 9].
Ультраструктурная цитохимия
187
Поскольку фиксация неизменно снижает активность
ферментов и может полностью подавить ее,
отрицательный результат еще ни о' чем не говорит. Основная
трудность может заключаться в проникновении
инкубационной среды в ткань. В самом деле, ферменты,
находящиеся в клетке, не могут реагировать с субстратом, если
субстрат не достигнет фермента. Если же фермент и
субстрат встретились и вступили в реакцию, то
продукты этой реакции часто обладают способностью к
диффузии. Таким образом, они могут либо целиком
теряться тканью, либо так перемещаться, что определение
места исходной реакции становится невозможным.
Путаницу увеличивает и то, что свинец имеет особую
склонность адсорбироваться на свободных поверхностях и
может дать совершенно искаженную картину
распределения ферментативной активности in vivo. Поэтому
необходим тщательный контроль результатов реакции.
Однако обычно считается, что некоторые положительные
реакции, такие, например, как реакция на кислую фос-
фатазу в лизосомах, АТФазу в митохондриях и нуклео-
тиддифосфатазу в аппарате Гольджи, вполне
убедительны, поскольку биохимические методы подтверждают
наличие этих ферментов в соответствующих клеточных
фракциях.
Предпринималось множество попыток разработать
методики для выявления локализации ферментов, с тем
чтобы эти методики позволили избежать недостатков
реакции типа Гомори. Огава и Барпет [14]
использовали соли тетразолия для демонстрации системы де-
гидрогеназных ферментов на кристах митохондрий. Эти
соли действуют как акцепторы электронов в окислитель-
пых реакциях, для которых ферменты служат
катализаторами, и образуют электроноплотные частицы фор-
мазаиа. Данный метод не оправдал себя на практике,
однако он интересен тем, что продукты реакции видны
в электронном микроскопе, хотя применяемые реактивы
не содержат атомов тяжелых металлов. Зелигман и др.
[15] улучшили этот метод, применив разновидности
солей тетразолия с высокой осмиофильностью.
Другим методом использования органических ве^
ществ является метод диазосочетания. примененный для
188
Глава 8
электронной микроскопии Лерером и Орнстайном [17],
которые использовали а-нафтилацетат в качестве
субстрата для холинэстеразы и парарозанилингексазонии
для связывания продукта. Несколько более надежный
метод для выявления холинэстеразы был использован
в электронно-микроскопических исследованиях Карнов-
ским [16]. В этом методе холииэстераза расщепляет
ацетилхолин с образованием тиохолина, который в свою!
очередь восстанавливает содержащийся в среде фер-
рицианин до феррицианида; последний реагирует с
ионами меди и образует электроноплотпый ферриииа-
ннд меди.
Метод, который был разработан Карновским [22],
Грехемом и Карновским [21], а в дальнейшем развит
Новиковым и Голдфишером [24, 25], Фахими [20], Зе-
лигманом, Вассеркругом и Плапингером [26], щироко
использовался при изучении некоторых окислительных
ферментов, в том числе каталаз (пероксидаз) и цито-
хромов. Данный метод основан на реакции окисления
ферментами диаминобензидина (ДАБ) или
родственных ему соединений. Продукты этой реакции
характеризуются высокой осмиофильностью.
До сих пор электронно-микроскопическая цитохимия
ограничивается исследованием лишь тех ферментов,
которые способствуют гидролитическому расщеплению
или окислению. Изучение обширной группы ферментов,
участвующих в процессах синтеза, а не в реакциях
разложения органических соединений, только начинается.
Для подробного знакомства с методами выявления
ферментов, разработанных к 1965 и 1968 годам,
читателю следует обратиться соответственно к работам Скар-
пелли и Кончака [4], а также Брсдбери [2].
ЭЛЕКТРОННАЯ МИКРОСКОПИЯ ИММУННЫХ РЕАКЦИЙ
(ИММУНОЭЛЕКТРОННАЯ МИКРОСКОПИЯ)
Реакция антиген—антитело высокоспецифична.
Каждое антитело вступает в реакцию с одним и только с
одним определенным антигеном. Образование
специфических антител можно вызвать повторным введением
животному определенного антигена. Спустя некоторое
Ультраструктурная цитохимия
189
время у животного образуются антитела,
предназначенные для специфической реакции с введенным антигеном.
Затем у животного берут кровь, содержащую антитела,
и из нее выделяют интересующее исследователя
антитело. После этого, соединяя антитело с веществом,
которое может быть использовано в качестве «маркера»,
прослеживают судьбу данного антитела в последующих
экспериментах.
Для целей световой микроскопии готовят конъюгаты
таких антител с флуоресцентным красителем, а затем
комплекс антитело — краситель вводят в живую или
фиксированную ткань, где он реагирует со
специфическим антигеном. После этого ткань отмывают от
антител, не вступивших в реакцию, и исследуют с помощью
флуоресцентного микроскопа. В тех местах, где
произошла реакция антиген — антитело, будет наблюдаться
флуоресценция.
На электронно-микроскопическом уровне антитела
можно метить электроноплотными маркерами,
благодаря которым в электронном микроскопе будут видны
места реакции между антигеном и антителом. Первые
работы в этой области были выполнены Зингером [29],
Зингером и Шиком [30] и в дальнейшем проводились
целым рядом исследователей (обзор этих работ см. в
[31]). В методе, предложенном Зингером и Шиком,
была использована реакция присоединения ферритина
(железосодержащий электроноплотный белок) к
специфическому антителу.
Основная трудность данного метода заключается в
том, что комплекс ферритип—антитело редко
проникает в клетки, поскольку размеры его очень велики. Таким
образом, эти реакции в основном ограничиваются пока
только поверхностью клеток. Другая трудность состоит
в том, что не всегда можно обеспечить строгую
специфичность получаемого препарата. Однако данный метод
позволяет выяснить ранние стадии синтеза антител,
определить устойчивость антигенов и локализацию
специфических белков в клеточных органеллах [30].
Более современный подход к решению данной
проблемы состоит в использовании комплекса антитела с
ферментом. Такие методы были независимо друг от
190
Глава 8
друга предложены Накане и Пирсом [28] и Аврамеасом
и Уриелем (ссылку на эту работу см. в [27]). После
того как комплекс антитело — фермент вступит в
ткани в реакцию с антигеном, можно использовать
стандартные методы электронной цитохимии для выявления
фермента. Для электронно-микроскопических
исследований наиболее часто используются фосфатазы и перо-
ксидазы, поскольку именно для определения этих
ферментов были разработаны довольно надежные методы.
Считается, что меньшие по размерам соединения типа
антитело—фермент несколько лучше проникают внутрь
тела клетки, чем ферритин. Однако и в связи с этим
возникали трудности, поскольку молекулярный вес
самих 78-антител составляет в среднем 150 000 [27].
Несмотря на очевидные преимущества, этот метод снискал
репутацию особенно трудного для успешного
выполнения.
ВЫЯВЛЕНИЕ ЛОКАЛИЗАЦИИ ПОЛИСАХАРИДОВ
И МУЦИНОВ
Полисахариды в животных тканях служат
энергетическим резервом, а также входят в состав основного
вещества соединительной ткани. Часть их, соединяясь со
специфическими белками, образует мукополисахариды
(к которым относятся гликопротеиды).
Мукополисахариды являются частью слизистых секретов и входят
в состав клеточной оболочки (гликокаликс), которая
располагается снаружи от плазматической мембраны
большинства клеток. Они содержатся также и в базаль-
ных мембранах. Внутри клеток мукополисахариды были
обнаружены в аппарате Гольджи, лизосомах, плотных
тельцах, мультивезикулярных тельцах, в секреторных
« запасающих гранулах.
На электронно-микроскопическом уровне
полисахариды и мукополисахариды можно выявить с помощью
специальных методов. Однако необходимо соблюдать
ряд предосторожностей, чтобы быть уверенным, что в
процессе обработки ткани не произошло потери этих
веществ.
Ультраструктурная цитохимия
t91
Методы, разработанные для выявления
полисахаридов и мукополисахаридов, могут быть объединены в три
группы:
1. Методы, берущие начало от классической для
световой микроскопии реакции Шифф — йодная кислота.
Метод Шифф — йодная кислота выявляет
полисахариды и мукополисахариды, окисляя их 1>2-гликольные
группы до альдегидов, которые затем вступают в
реакцию с реактивом Шиффа.
Для электронно-микроскопического исследования
реактив Шиффа заменяется веществами, которые
образуют отложения электроноплотных веществ на месте
реакции. Ниже приводятся три таких метода с
необходимыми ссылками на последние работы. Просматривая
обширную библиографию, приведенную в этих работах,
заинтересованный читатель может найти более ранние
публикации, относящиеся к этим методам.
A. Метод йодная кислота — метанамин серебра [44,
47].
Б. Метод йодная кислота — тиокарбогидразид — че-
тырехокись осмия [53, 54].
B. Метод йодная кислота — тиокарбогидразид (или
тиосемикарбазид)—протеинат серебра [34, 54].
Г. Пентафторфенилгидразиновый метод [33].
Эти методы, вероятно, позволяют выявить тот же
самый спектр углеводов, что и классическая ШИК-реак-
ция. В контроле исключается либо йодная кислота,
либо «окрашивающее» вещество. Методы, использующие
тиокарбогидразид и пентафторфенилгидразин,
по-видимому, наиболее перспективны. В них вещества,
-содержащие сульфгидрильную (SH) группу, присоединяются
к молекуле углевода, а затем SH-группа может
вступить в реакцию с серебром или осмием.
2. Методы, основанные на сродстве фосфорноволь-
фрамовой кислоты при низких значениях рН к
полисахаридам. Механизм окраски и специфичность реакций
фосфорновопьфрамовой кислоты с полисахаридами до
сих пор вызывают много споров. Это подтверждается
сопоставлением двух статей, одновременно
опубликованных в одном из недавних выпусков Journal of
Histochemistry and Cytochemistry [36, 43]. См. также [52].
192
Глава 8
3. Методы, специфичные для кислых групп. Эти
методы основаны на широко известных методах
выявления полиапионов, богатых сульфатными или гидрок-
сильными группами. В электронной микроскопии они
применяются для выявления кислых мукополисахари-
дов.
A. Метод Ревеля [49] с коллоидной двуокисью тория.
Вероятно, двуокись тория образует связь с уроновыми,
карбоксильными или сульфатными группами кислых му-
кополисахаридов. Реакция проводится на ультратонких
срезах, полученных из материала, залитого в метакри-
лат. В модификации этого метода, предложенной Рам-
бургом и Леблоном [46], реакция ведется на
небольших кусочках фиксированной ткани.
Б. Методы, основанные на методе Хале с
коллоидным железом [35, 56]. Реакция проводится на срезах
замороженной ткани толщиной 25—50 мкм;
проникновение реактива в ткань обычно плохое. Положительно
заряженные частицы коллоидного железа, возможно,
присоединяются к уроновым, карбоксильным или
сульфатным группам кислых мукополисахаридов.
B. Окрашивание рутениевым красным. Этот метод
был предложен Люфтом [40, 41]. Люфт ввел краситель
в фиксатор, но обнаружил, что проникновение
красителя при этом настолько плохое, что окрашивались лишь
мукополисахариды на поверхности клеток или в
межклеточных пространствах. Для того чтобы облегчить
проникновение красителя, Густафсон и Пиль [37]
применили этот метод на ультратопких срезах ткани,
залитой в гликольметакрилаты. В результате интенсивно
окрашивались гранулы в тучных клетках и при
определенных условиях в некоторой степени окрашивались ядра.
Пригодность данного красителя для ультратонких
срезов изучена еще недостаточно.
Г. Альциановый синий. Бенке и Зеландер [32]
сообщали, что добавление к глутаральдегидному фиксатору
1%-ного альцианового синего делает кислые муцины и
гликопротеины нерастворимыми. Образующийся в
результате комплекс краситель — муцин характеризуется
осмиофильностыо, и, таким образом, его можно видеть
в электронном микроскопе после дополнительной фик-
Ультрйструктурнйя цитохимия
193
сации ткаии в четырехокиси осмия. Поскольку
краситель вводится в состав фиксатора, а не применяется на
ультратонких срезах, то затруднения, связанные с
проникновением красителя, ограничивают применение
этого метода; его используют преимущественно для
окрашивания наружных частей клеток и межклеточных
веществ.
Об окрашивании ультратонких срезов алышановым
синим сообщали Тисе и Барнет [55], а в последнее
время Ротман [51], однако в этих условиях специфичность
реакции для муцинов не утверждалась.
Д. Лантан. Действие лантана очень сходно с
действием рутениевого красного и альциаиового синего в том'
отношении, что оно ограничивается поверхностью
клетки и межклеточными веществами. Лантан применялся
для определения проницаемости и выявления структуры
«плотных контактов» эпителиальных клеток [50]; было
показано также, что лантан осаждает белки и
полисахариды, экстрагированные из хряща [38].
По-видимому, способность лантана соединяться со специфическими
внеклеточными компонентами ткани зависит от условий,
при которых он применяется. Если лантан используется
в процессе фиксации перманганатом калия, то он
прочно связывается с поверхностным слоем шириной 50 А,
который продолжается в плазматическую мембрану и
исчезает при действии фосфолиназы [39]. Обзор
методов окрашивания лантаном дан в работе Мартинец-Па-
ломо [42].
МЕТОДЫ ФЕРМЕНТАТИВНОГО
ПЕРЕВАРИВАНИЯ
Эти методы используются главным образом как
дополнительные в сочетании с электронным
«окрашиванием» или иными цитохимическими методами.
Если фермент, который вызывает специфическое
расщепление какого-то вещества, вводят в ткань,
содержащую это вещество, то оно подвергается расщеплению
(«переваривается»), а затем вследствие диффузии
продуктов расщепления исчезает. Сравнивая срезы ткани,
подвергшейся воздействию фермента, со срезами ткани,
13—977
194
Глава 8
не подвергавшейся такому воздействию, иногда можно
установить морфологическую локализацию тех веществ,
которые исчезли иод действием фермента. Если эти
участки постоянно соответствуют местам расположения
определенных органелл, то можно с достаточной
уверенностью предположить, что данные органеллы в
обычном состоянии содержат такие вещества.
Непременным условием успеха является самое
тщательное соблюдение необходимых приемов обращения с
ферментами. Ферменты должны обладать активностью,
которую необходимо проверить с помощью
соответствующих проб, выполненных in vitro; кроме того, они
должны быть в высшей степени очищены, что
обеспечит их специфичность, т. е. должно быть известно, что
они не содержат примесей других ферментов. Хранить
ферменты нужно в состоянии глубокого замораживания
или в морозильной камере холодильника в присутствии
веществ, поглощающих влагу. Стеклянная посуда для
работы с ферментами должна очищаться специальными
методами (см. приложение, стр. 307). Вода для
приготовления инкубационных сред должна быть дважды
перегнана в стеклянном дистилляторе (т. е.
дистилляторе, не имеющем металлических частей), с тем чтобы
избежать возможной инактивации фермента ионами
металлов. При взвешивании ферментов нужно употреблять
стеклянные, а не металлические принадлежности. '
Существует два основных метода обработки ткани
ферментами для последующего
электронно-микроскопического исследования, причем в обоих случаях очень
важным является выбор фиксатора. Все фиксаторы в
определенной степени снижают активность ферментов.
Некоторые ферменты воздействуют только на ткани,
фиксированные формальдегидом, другие — на ткани,
фиксированные любым из альдегидов, и лишь очень
немногие могут действовать на ткани, фиксированные че-
тырехокисью осмия. Активность фермента, как правило,
■выше после фиксации ткани формальдегидом, однако
сохранность ткани лучше после глутаральдегидной
фиксации. Следовательно, если фермент активен после
того и другого фиксатора, то следует использовать глу-
таральдегид. Заливочная среда также может влиять на
Ультраструктурная цитохимия 195
активность фермента в том случае, когда ферментом
обрабатываются срезы, полученные из залитого
материала.
1. Применение метода ферментативного
переваривания для небольших кусочков или толстых срезов неза-
литой ткани. Этот метод включает-инкубацию
небольших кусочков (со стороной 0,5—1 мм) и срезов
фиксированной ткани (обычно толщиной 25—50 мкм) в
среде, содержащей переваривающий фермент. После
инкубации кусочек или срез ткани промывают,
обезвоживают и заливают. Если применялась альдегидная
фиксация, то после того, как будет закончена
обработка ферментом, ткань можно дополнительно фиксировать
в четырехокиси осмия.
Небольшие кусочки ткани легче готовить и
обрабатывать, но фермент проникает в такой кусочек обычно
плохо и его воздействие ограничивается лишь первым-
вторым поверхностными слоями клеток. Лучшее
проникновение фермента обычно наблюдается при
использовании срезов толщиной 25—50 мкм, полученных из
небольших кусочков фиксированной ткани, порезанной в
криостате или на замораживающем углекислотном
микротоме. Срезы собирают в охлажденный буферный
раствор того же состава, что и в фиксаторе, или в раствор
сахарозы. Затем срезы инкубируют в среде, содержащей
фермент.
Однако при использовании описанного выше метода
могут возникнуть значительные повреждения ткани
вследствие ее замораживания, резки на микротоме и
оттаивания. Очень важно, чтобы нож был наточен заново
и находился в отличном состоянии.
Метод получения срезов толщиной 25—50 мкм без
замораживания ткани был предложен Смитом и Фарке-
ром [81]. Приспособление для резки ткани,
сконструированное этими авторами, позволяет получать срезы
фиксированного материала одинаковой толщины в
пределах от 20 до 100 мкм, при этом сохранность
структуры и локализации ферментов на этих срезах
значительно лучше, чем на срезах замороженной ткани.
Совсем недавно был выпущен микротом другого типа,
который позволяет получать срезы толщиной от 5 до
13"
190
Глава 8
20 мкм с незамороженной ткани. Сравнение и оценка
»тих двух типов микротомов даны в работе Смита [82].
Независимо от того, используются ли небольшие
кусочки или срезы ткани, процедуры последующей
инкубации, дополнительной фиксации, обезвоживания и
заливки сходны. Конечно, срезы надо заливать в
расправленном виде в плоских ванночках для заливки, а не в
капсулах.
Если для заливки были использованы срезы
толщиной 20—50 мкм, то получить ультратонкие срезы порой
бывает довольно трудно. Зачастую трудно резать ткань
после-ее инкубации в растворе фермента, и нередко,
порезав всю пластинку ткани толщиной 20 мкм, не
удается получить ни одного хорошего ультратонкого среза.
Следовательно, разумно инкубировать и заливать
довольно большое число срезов.
Время инкубаиии зависит от используемого
фермента, фиксатора, температуры и типа ткани. Существует
такое множество вариантов, что, как правило,
необходимо использовать метод проб и ошибок, хотя
кое-какие сведения на этот счет можно получить и из
соответствующей литературы. Можно попробовать извлекать
ткань из инкубационной среды через 5, 15, 30 мин, 1 и'
2 ч; извлеченную ткань следует тщательно промыть
несколько раз в буферном растворе для полного удаления
фермента. Процедура обработки контрольных срезов
такая же, за тем лишь исключением, что среда для
инкубации либо совсем не содержит фермента, либо в нее
вводятся вещества, подавляющие активность фермента.
Постановка тщательных контролен особенно
необходима при использовании методов переваривания
ферментами, поскольку существует вероятность потери
изучаемого вещества в процессе длительной инкубации даже
в том случае, если среда не содержит фермента.
Должны быть предприняты особые предосторожности, чтпЛы
избежать загрязнения ферментом контрольных
растворов. Это может произойти по недосмотру, если,
например, используется та же самая кисточка для переноса
экспериментальных и контрольных срезов из одного
раствора в другой. Даже самые незначительные следы
фермента могут сделать контроль недостоверным.
Ультраструктцрная цитохимия
197
Если по условиям метода необходима инкубация при'
37°С, то имеет смысл инкубировать также часть ткани
при комнатной температуре, поскольку при более
низкой температуре сохранность ультраструктуры ткани
будет лучше, а активность фермента при этих условиях
может быть вполне достаточной для достижения
желаемых результатов.
Одномикронные срезы, полученные из залитых
срезов толщиной 25—50 мкм, могут также дать сведения
о степени ферментативного переваривания ткани, и их
необхотимо тщательно изучить.
2. Применение метода ферментативного
переваривания для ультратонких срезов ткани. Даже в том случае,
когда используются срезы толщиной 25—50 мкм,
проникновение фермента в ткань может быть все же
затруднено, и отрицательные результаты, по пученные на
таком материале, не всегда достоверны. Поэтому в
течение ряда лет предпринимались попытки
ферментативного переваривания ультратонких срезов залитой ткани.
К сожалению, несмотря на исключительно малую
толщину срезов, присутствие заливочной среды затрудняет
проникновение фермента в ткань.
Обработка ткани, залитой в эпоксидные смолы,
проводится обычным способом. При использовании
водорастворимых заливочных сред обезвоживание ткани,
как правило, проводят в растворах с увеличивающейся
концентрацией самой заливочной среды, а не в спиртах.
Обезвоживание может осуществляться также при
«инертной дегидратации» ткани, сохраняемой и
обезвоживаемой в гликоле, как это описано у Пиза [78, 791.
Показано, что при заливке в водорастворимые или водонерас-
творимые метакрилатпые заливочные среды
полимеризация протекает с меньшими повреждениями ткани,
если она проводится в холодном помещении под
ультрафиолетовой лампой [68]. В этом случае нельзя
использовать в качестве фиксатора четырехокись. осмия,
поскольку она делает ткань непрозрачной для
ультрафиолетовых лучей и полимеризация внутри ткани- не
протекает до конца.
Ультратонкие срезы инкубируют в среде,
содержащей необходимый фермент. Надо избегать инкубации
198 Глава 8
срезов, монтированных на медных сетках, так как ионы
металла могут инактивировать фермент.
Проводка цементированных ультратонких срезов по
нескольким растворам и необходимость в конце этой
процедуры поместить их целыми и невредимыми на
сетку— жестокое испытание. Практическая сторона этого
вопроса освещена в работе Мариноцци [72] и Мак-Ги-
Рассела [71]. Другая возможность состоит в
использовании золотых сеток, поскольку золото значительно
менее активно, чем медь, и в большинстве случаев его
можно применять, не опасаясь взаимодействия с
ферментом. Золотые сетки очень дороги; они очень мягкие
и с ними трудно работать, поэтому в большинстве
лабораторий стремятся обучить персонал искусству
обращения с немонтированными срезами.
Сетки, используемые для размещения срезов ткани,
залитой в метакрилаты (как водорастворимые, так и
водонерастворимые), должны быть покрыты тонкой
пленкой коллодия или формвара, укрепленной тонким
слоем углерода (см. приложение, стр. 305), поскольку
такие срезы без подложки имеют свойство разрушаться
под действием электронного луча.
Результаты ферментативного переваривания
ультратонких срезов исключительно изменчивы, и данные,
полученные в одной лаборатории, часто не могут быть
воспроизведены в другой. Более успешные результаты
чаще получаются при использовании водорастворимых
заливочных сред, хотя морфологическая сохранность
ткани при этом обычно не такая хорошая, как при
заливке в эпоксидные смолы. Помимо этого, при
использовании водорастворимых заливочных сред зачастую
трудно получить хорошие срезы.
Водорастворимые заливочные среды были
предложены в начале 60-х годов: гликольметакрилат (ГМА) —
Розенбергом, Бартлем и Лешко [80]; дуркуиан —
Стебли [83]; оксипропилметакрилат (ОПМА)—Ледюком и
Хольтом [69]. ГМА и ОПМА оказались наиболее
приемлемыми для работы с ферментами, а модификация
метода заливки в ГМА, предложенная Ледюком и Берн-
хардом [68], является наилучшей. Применение указан-
Ультраструктурная цитохимия 199
ных сред почти целиком ограничивается методами
ферментативного переваривания, тогда как попытки
выявить локализацию ферментов оказались в целом
безуспешными [62].
Как протеазы, так и нуклеазы активны при их
использовании на ткани, фиксированной формалином и
залитой в гликольметакрилат [67, 70, 73]. Такие
протеазы, как пепсин и проназа, также активны и при
обработке ими материала, фиксированного в глутаральде-
гиде. Активность нуклеаз менее постоянна, и некоторые
исследователи сообщают, что нуклеопротеиды можно
удалить только после предварительной обработки
ткани протеазой. Рибонуклеаза активна после фиксации
ткани и в формальдегиде, и в глутаральдегиде.
Применение дезоксирибонуклеазы, как правило,
безрезультатно после фиксации глутаральдегидом и в любом случае
дает непостоянные и спорные результаты независимо от
применяемого фиксатора. Этот фермент совершенно
неактивен после заливки ткани в оксипропилметакрилат.
До работ Мониерона и Бернхарда [75] считалось,
что материал, залитый в эпоксидные смолы, не
подвержен действию ферментов. Между тем эти авторы
показали, что из срезов ткани, залитой в зпон, возможно
частично удалить белки и полисахариды. При этом
снижается электронная плотность рибосом, хотя эти орга-
неллы и не исчезают; ядрышковая РНК выглядит
неизмененной. Попытки удалить ДНК оказались
безуспешными. Однако Дуглас [64] сообщил об извлечении ДНК
из ультратонких срезов ткани, залитой в смесь эпона
и аралдита, с помощью хлорной кислоты, так что
данный метод в настоящее время является, по-видимому,
лучшим. Смесь эпона и аралдита была использована
также при обработке тканей некоторыми протеиназами
[59, 60, 65].
Считается, что трудности, с которыми приходится
сталкиваться при удалении нуклеопротеидов на
электронно-микроскопическом уровне, обусловлены связью
нуклеаз с нуклеопротеидами [57, 58, 76]. В результате
эти нуклеопротеиды теряют способность специфически
окрашиваться обычными красителями для световой
микроскопии вследствие того, что нуклеаза блокирует ме-
200
Глава 8
ста реакции с красителем. Таким образом, создается
впечатление, что пуклеопротеиды «удалены», так как
они более не окрашиваются. Однако на электронно-
микроскопическом уровне связывание нуклеазы
нуклеиновой кислотой может фактически привести к
увеличению электронной плотности, если предварительно не
расщепить рибопуклеопротеид с помощью протеазы.
Основные работы по ферментативной экстракции
приведены в конце главы. Дополнительные ссылки
можно найти в библиографии этих статей.
ПАРАЛЛЕЛЬНЫЕ ЦИТОХИМИЧЕСКИЕ
ИССЛЕДОВАНИЯ НА СРЕЗАХ ТОЛЩИНОЙ 1 мкм,
ПРОВОДИМЫЕ С ПОМОЩЬЮ СВЕТОВОГО
МИКРОСКОПА
Окрашивание полутонких (толщиной 1 и 2 мкм)
срезов ткани, залитой в метакрилат, для исследований с
помощью светового микроскопа широко практиковалось
тогда, когда только еще начинали развиваться методы
изготовления ультратонких срезов. Не сразу было
установлено, что такую ткань можно окрашивать без
предварительного удаления заливочного материала. Ме-
такрилаты могут быть удалены из срезов с помощью
ксилола, однако это пагубно сказывается на тканях.
Когда для заливки были впервые предложены
эпоксидные смолы, сложилось общее мнение, что
окрашивание таких срезив обычными красителями,
применяемыми в световой микроскопии, неосуществимо,
поскольку эпоксидную заливочную среду нельзя удалить, не
прибегая к очень грубым методам. Лейн и Юропа [86]
обнаружили, что синтетические заливочные среды
можно удалить насыщенным раствором едкого натра в
абсолютном спирте, но результаты гистохимических
реакций после такой обработки срезов оказались довольно
неутешительными, что, впрочем, не удивительно.
Однако уже вскоре стало очевидным, что при
соблюдении некоторых условий срезы можно окрасить без
удаления эпоксидной смолы. В целом ряде лабораторий
были разработаны практически методы окрашивания,
Ультраструктурная цитохимия
201
часть которых приведена в работе Глауэрта [85].
Стивене [87] приводит обширный список публикаций,
посвященных окрашиванию срезов ткани, заключенной в
метакрилаты, вестопал W, аралдит и эпоп, но,
по-видимому, с тех пор не было опубликовано достаточно
полного обзора развития этих методов.
В приложении VII даются прописи нескольких
наиболее употребительных методов окрашивания. Однако
надо помнить, что та специфичность или
избирательность, которая свойственна этим методам окрашивания,
если их применяют для ткани, фиксированной
обычными гистологическими фиксаторами и заключенной в
парафин, может совершенно исчезать или меняться самым:
неожиданным образом, когда окрашивают материал,
залитый в эпоксидные смолы. Сейчас срезы толщиной I —
2 мкм используют не только для ориентировки при
изготовлении ультратонких срезов. Сравнивая следующие
друг за другом ультратонкие и «толстые» (толщиной
1 мкм) срезы, можно получить ценную дополнительную
информацию об изучаемой ткани. Многие
цитохимические реакции, которые наблюдаются в электронном
микроскопе, также выявляются и на срезах толщиной
1 мкм, а детали клеточных структур на последних
видны значительно лучше, чем па срезах толщиной 5 мкм,
изготовленных из обычного гистологического материала,
НОВЫЕ НАПРАВЛЕНИЯ В РАЗВИТИИ
УЛЬТРАСТРУКТУРНОЙ ЦИТОХИМИИ
Методами, которые приведены в данном разделе,
конечно, не будут пользоваться начинающие электронные
микроскописты. Эти методы включены только для того,
чтобы показать, в каких направлениях прокладываются
новые пути.
криоультрамикротомия
В течение последних нескольких лет делались
попытки усовершенствовать методы получения
ультратонких срезов нефиксированной замороженной ткани.
Толчком к этому послужили главным образом попытки
203
Глава 8
гисто- и цитохимиков определить внутриклеточную
локализацию некоторых ферментов. Как уже было
показано в настоящей главе, некоторые проблемы, связанные
с применяемыми сейчас методами электронной
микроскопии, сдерживают развитие цитохимических
исследований. К ним относятся:
1. Потеря веществ клетками и тканями при их
обработке.
2. Изменение места первичной локализации
материала в ткани.
3. Химическое изменение макромолекулярной
структуры при фиксации и последующей обработке ткани
с возникающей в результате потерей биологической
активности.
4. Трудности проникновения цитохимических
реактивов в толстые срезы незалитого материала или в
ультратонкие срезы залитого материала.
Если бы удалось мгновенно заморозить
нефиксированную ткань для того, чтобы приостановить все
обменные процессы и предотвратить возможное перемещение
или потерю веществ, а затем изготовить ультратонкие
срезы для постановки цитохимических реакций, то все
эти проблемы были бы решены. Практически такой
идеальный метод еще не создан, хотя в некоторых
лабораториях были проведены интенсивные работы,
приближающие нас к его созданию.
Предварительные попытки резки ультратонких
замороженных срезов [92] были безуспешными, и их
прекратили, так как предпочтение было отдано более
перспективным методам приготовления срезов из
материала, залитого в метакрилаты. Группа Бернхарда во
Франции возродила интерес к подобным исследованиям,
и были разработаны методы [89, 94], которые
позволили провести некоторые цитохимические реакции на
ультратонких срезах фиксированных замороженных
тканей1.
1 В лаборатории Бернхарда предложен чрезвычайно простой и
доступный для начинающих микроскопистов метод выявления РНК
на ультратонких срезах материала, залитого в эпон (Bernchard W., J.
Ultr. Res., 27, 250, 1969). — Прим. ред.
&льтраструктурная цитохимия 203
В ряде лабораторий были получены
обнадеживающие результаты при использовании срезов
нефиксированной незалитой замороженной ткани [88, 90, 91]. Ход-
сон и Маршал [93] сконструировали «ультракриотом»,
позволяющий получать ультратонкие замороженные
срезы нефиксированных незалитых образцов,
находящихся при температуре жидкого азота. Ткань
замораживается в дихлордифторметане, охлажденном до
точки его .замерзания жидким азотом. Срезы режутся
стеклянным ножом в циклогексан и собираются на медные
сетки, покрытые слоем углерода. Трудности сбора
срезов на сетки были преодолены очень остроумно:
электрически заряженная сетка частично погружается в
ванночку с циклогексаном, где плавают срезы; избыточный
заряд «стекает» с сетки и электризует плавающие
срезы; затем потенциал сетки снижается относительно
заряда замороженных срезов, срезы притягиваются к
сетке и распластываются на ее поверхности.
После этого сетки переносят в камеру для сушки в
замороженном состоянии, размещенную на ультратоме,
где лед удаляется со срезов вследствие сублимации.
Затем температура камеры повышается до комнатной,
после чего срезы готовы для просмотра.
Данный метод обладает потенциальными
возможностями решения всех четырех перечисленных выше
цитохимических проблем. Единственным химическим
веществом, с которым соприкасается ткань (помимо
вещества, в котором она охлаждается), является циклогексан;
по-видимому, при используемых температурах
циклогексан не извлекает из ткани липидов или каких-либо
других веществ. .
АНАЛИТИЧЕСКАЯ ЭЛЕКТРОННАЯ МИКРОСКОПИЯ
Одно из наиболее увлекательных направлений
последнего времени — совместное использование
электронного микроанализатора и просвечивающего
электронного микроскопа высокого разрешения.
Электронный микроанализатор с зондом
«просматривает» объект тонким сходящимся пучком электронов
(собственно зонд). Взаимодействие такого зонда с объ-
ш
Глава 8
ектом вызывает рентгеновское излучение, которое
можно проанализировать спектрометрически, с тем чтобы
определить химические элементы, находящиеся в
объекте.
Фирма AEI недавно выпустила в продажу
аналитический электронный микроскоп tMMA-4, в котором
совмещены чувствительный электронный микроапализатор
и электронный микроскоп, позволяющий получить
разрешение в 10 А. Ультратонкий срез может, как обычно,
исследоваться при высоком разрешении. Когда найден
участок среза, требующий химического анализа, такой
анализ можно выполнить сразу, не сдвигая объекта и не
теряя данного участка из поля зрения. Для этого надо
просто включить линзу зонда и сфокусировать
электронный зонд. Можно анализировать участки размером
от немногим менее тысячи ангстрем и до нескольких
тысяч ангстрем в диаметре. Определить количество
присутствующего вещества можно исходя из числа
квантов рентгеновских лучей в секунду, подсчитанных в
момент зондирования этого вещества.
Если не известно, какие химические элементы входят
в состав исследуемого образца, то прибор может быть
установлен па режим автоматического поиска
элементов периодической системы и регистрации их спектра
на графике. Вместе с тем можно точно определить
наличие данного элемента в образце, настроив
спектрометр на этот элемент и проведя последовательный
анализ различных участков образца. Электронный зонд
можно в любой момент расфокусировать и исследовать
интересующий вас участок среза при обычном высоком
разрешении.
Ясно, что такой прибор имеет огромные возможности
в целом ряде областей науки, среди которых особое
место занимают гистохимия и цитохимия. Здесь развитие
аналитической электронной микроскопии сможет
вскоре заменить используемые сегодня несовершенные
методы применения «электронных» красителей,
обладающих сомнительной специфичностью, или
невоспроизводимые методы обработки ферментами. Теперь можно
будет использовать методы специфического
окрашивания, которые прежде использовались только на уровне
Ультраструктурная цитохимия
205
световой микроскопии. Появилась возможность
проследить перенос продуктов обмена внутри клетки или
между клетками после соответствующего мечепия веществ,
необходимого для выявления электронным зондом.
Поисковые исследования уже были выполнены с помощью/
аналитического микроскопа ЕММА-4 на ультратопких
срезах замороженной нефиксированной ткани, методы
получения которых описаны в предыдущем разделе.
Безграничны возможности применения
аналитического электронного микроскопа в медицине. С помощью
этого прибора можно определить нормальный
минеральный состав тканей, выявить наличие инородных веществ
и проследить их перемещение [98]. Установление
нормальных электронно-микроскопических параметров для
различных тканей и клеток позволит выяснить не
известные до сих пор причины многих патологических
изменений в тканях и даст возможность диагностировать
болезни еще до появления клинических симптомов.
Список литературы
Фиксация
1. Lewis P. R., Knight D. (1971). Личное сообщение.
Методы локализации ферментов
2. Bradbury S., In Cell Structure and its Interpretation, pp. 135—147
(Edited by S. M. McGee-Russell and K- F. A. Ross), London,
Edward Arnold, 1968.
3. Pease D. C, Histological Techniques for Electron Microscopy, 2nd
edn., p. 53, New York and London, Academic Press, 1964.
4. Scarpelli D. G., Kanczak N. M., Ultrastructural cytochemistry:
principles, limitations and applications, International Review ol
Experimental Pathology, 4, 55—126 (1965).
Реакции типа реакции Гомори
5. Etherton J. E., Botham С. М., Factors affecting lead capture
methods for the fine localization of rat lung acid phosphatase, Histo-
chemical Journal, 2, 50/—519 (1970).
6. Ganote C. E., Rosenthal A. S., Moses H. L., Tice L. №.. Lead and
phosphate as sources of artifact in nucleoside phosphatase
histochemistry, Journal of Histochemistry and Cytochemistry, 17, 641—650
(1969).
7. Goldfischer S., Essner E., Novikoff А. В., The localization of
phosphatase activities at the level of ultrastructure, Journal of
Histochemistry and Cytochemistry, 12, 72—95 (1964).
206 Глава 8
8. Holt S. Л, Hicks R. M., In Interpretation of Ultra structure, pp. 193—
211 (Edited by R. J. C. Harris), New York and London, Academic
Press, 1962.
9. Moses H. L., Rosenthal A. S., Pitfalls in the use of lead ion for
histochemical localization of nucleoside phosphatase, Journal of
Histochemistry and Cytochemistry, 16, 530—539 (1968).
10. Novikoff А. В., Essner £., Goldlischer S., Hens M., In The
Interpretation of Ultrastructure, pp. 149—192 (Edited by R. J. С
Harris), New York and London, Academic Press, 1962.
11. Sabatini D. D., Bensch K., Barrnett R. J., Cytochemistry and electron
microscopy. The preservation of cellular ultrastructure and
enzymatic activity by aldehyde fixation, Journal of Cell Biology, 17, 19—58
(1963).
12. Sabatini D. D., Miller F., Barrnett R. /., Aldehyde fixation for
morphological and enzyme histochemical studies with the electron
microscope, Journal of Histochemistry and Cytochemistry, 12, 57—71
(1964).
13. Wachstein M., Meiset E., Histochemistry of hepatic phosphatases at
a physiologic pH with special reference to the demonstration of bile
canaliculi, American Journal of Clinical Pathology, 27, 13—23
(1957).
Методы выявления дегидрогеназ
14. Ogawa K-, Barrnett R. /., Electron cytochemical studies of
succinic dehydrogenase and dihydronicotinamide—adenine dinucleotide
diaphorase studies, Journal ol Ultrastructure Research, 12, 488—508
(1965).
15. Seligman A. M-, Ueno H„ Morizono Y., Wasserkrug H. L., Kat-
zo[f L., Hanker I. S-, Electron microscopic demonstration of
dehydrogenase activity with a new osmiophilic ditetrazolium salt
(TC-NBT), Journal of Histochemistry and Cytochemistry, 15, 1—13
(1967).
Реакции диазосочетания и выявление колинэстеразы
16. Karnovsky M. J., The localization of cholinesterase activity in rat
cardiac muscle by electron microscopy, Journal of Ceil Biology, 23,
217—232 (1964).
17. Lehrer G. M., Ornstein L., A diazo coupling method for the electron
microscopic localization of cholinesterase, Journal of Biophysical
and Biochemical Cytology, 6, 399—404 (1959).
18. Tennyson V. M., Brzin M., The appearance of acetylcholinesterase in
the dorsal root neuroblast of the rabbit embryo, Journal of Cell
Biology, 46, 64—80 (1970).
Реакции на пероксидазу (включая катализу) и цитохромы
19. Bainton D. E., Farquhar M. G., Segregation and packaging of
granule enzymes in eosinophilic leukocytes, Journal of Cell Biology,
45, 48—54 (1970).
Ультраструктурная цитохимия 207
20. Fahimi H. D., Cytochemical localization of peroxidase activity of
catalase in rat hepatic microbodies (peroxisomes), Journal of Cell
Biology, 43, 275—288 (1969).
21. Graham R. C, Karnovsky M. J., The early stages of absorption of
injected horseradish peroxidase in the proximal tubule of the mouse
kidney. Ultrastructural cytochemistry by a new technique, Journal
of Histochemistry and Cytochemistry, 14, 291—302 (1966).
22. Karnovsky M. J., Vesicular transport of exogenous peroxidase across
capillary endothelium into the T system of muscle, Journal of Cell
Biology, 27, 49A —50A (1965).
23. Legg G., Wood R. L., New observations on microbodies. A
cytochemical study on CPIB-treated rat liver, Journal of Cell Biology,
45, 119—129 (1970).
24. Novikoff А. В., Goldfischer S., Visualization of microbodies for
light and electron microscopy, Journal of Histochemistry and
Cytochemistry, 16, 507 (1968).
25. Novikoff А. В., Goldfischer S., Visualization of peroxisomes (micro-
bodies) and mitochondria with diaminobenzidine, Journal of
Histochemistry and Cytochemistry, 17, 675—680 (1969).
26. Setigman A. M., Wasserkrug H. L., Plapinger R. E., Comparison of
ultrastructural demonstration of cytochrome oxidase activity with
three bis (phenylene-diamines), Histochemie, 23, 63—70 (1970).
Электронная микроскопия иммунных реакций
27. Avrameas S., Immunoenzyme techniques: Enzymes as markers for
the localization of antigens and antibodies, International Review of
Cytology, 27, 349—385 (1970).
28. Nakane P. K-, Pierce G. В., Enzyme-labeled antibodies: preparation
and application for the localization of antigens, Journal of
Histochemistry and Cytochemistry, 14, 929—931 (1966).
29. Singer S. J., Preparation of an electron-dense antibody conjugate,
Nature, London, 183, 1523—1524 (1959).
30. Singer S. J., Schick A. F., The properties of specific stains for
electron microscopy prepared by the conjugation of antibody
molecules with ferritin, Journal of Biophysical and Biochemical
Cytology, 9, 519—537 (1961).
31. Sternberger L. A., Electron microscopic immunocytochemistry; a
review, Journal of Histochemistry and Cytochemistry, 15, 139—159
(1967).
Методы выявления полисахаридов и мукополисахаридов
32. Behnke О., Zelander Т., Preservation of intercellular substance by
the cationic dye alcian blue in preparative procedures for electron
microscopy, Journal of Uitrastructure Research, 31, 424—438
(1970).
33. Bradbury S., Stoward P. J., The specific cytochemical
demonstration in the electron microscope of periodate-reactive mucosubstan-
208
Глава 8
ces and polysaccharides containing vic-glycol groups, Histochemie,
11, 71—80 (1967).
34. Flection J.-E., Nature glycoproteique des granules corticaux de l'oeuf
de lapine. AAise en evidence par ('utilisation comparee de techniques
ultrastructurales. Journal de Microscopie, 9, 221—242 (1970).
35. Gasic G. J., Berwick L., Sorrentio M., Positive and negative collo-
dial iron as cell surface electron stains, Laboratory Investigation,
18, 63-71 (1968).
36. Click D., Scott J. E., Phosphotungstic acid not a stain for
polysaccharide, Journal of Histochemistry and Cytochemistry, 18, 455
(1970).
37. Gustafson G. Т., Pihl E., Staining of mast cell acid glycosamino-
glycans in ultrathin sections by ruthenium red, Nature, London,
216, 697—698 (1967).
38. Khan T. A., Overton J., Lanthanum staining of developing chick
cartilage and reaggregating cartilage cells, Journal of Cell Biology,
44, 433—438 (1970).
39. Lesseps R. J., The removal by phospholipase С of a layer of
lanthanum-staining material external to the cell membrane in
embryonic chick cells. Journal of Cell Biology, 34, 173—183 (1967).
40. Luft J. H., Fine structure of capillary and enriocapillary layer as
revealed by ruthenium red. Federation Proceedings. Federation of
American Societies for Experimental Biology, 25, 1773—1783 (1966).
41. Luft J. H., Selective staining of acid mucopolysaccharides by
ruthenium red. Proceedings of the 26th Annual Meeting of the
Electron Microscopic Society of America, pp. 38—39 (Edited by
С J. Arceneaux), Baton Rouge, Clailor's Publishing Division,
1968.
42. Martinez-Palomo A., The surface coats of animal cells, International
Review of Cytology, 29, 29—75 (1970).
43. Pease D. C, Phosphotungstic acid as a specific electron stain for
complex carbohydrates, Journal of Histochemistry and Cytochemistry,
18, 455—458 (1970).
44. Rambourg A., An improved silver methenamine technique for the
detection of periodic acid-reactive complex carbohydrates with the
electron microscope, Journal of Histochemistry and Cytochemistry,
15, 409—412 (1967).
45. Rambourg A., Detection des glycoprotcines en microscopie electro-
nique: coloration de la surface cellulaire et de l'appareil de Qolgi
par un melange acide chromique — phosphotungstique, Compte
rendu hebdomadaire des Seances de l'Academie des Sciences, Paris D.,
265, 1426—1428 (1967). '
46. Rambourg A., Leblond C. P., Electron microscope observations on
the carbohydrate-rich cell coat present at the surface of cells in the
rat. Journal of Cell Biology, 32, 27—53 (1967).
47. Rambourg A., Localisation ultrastructurale et nature de materiel
colore au niveau de la surface cellulaire par le melange chromique-
phosphotungstique, Journal de Microscope, 8, 325—342 (1969).
48. Rambourg A., Hernandez W., Leblond C. P., Detection of complex
carbohydrates in the Golgi apparatus of rat cells, Journal of Cell
Piology, 40, 395—414 (1969).
Ультраструктурная цитохимия
209
49. Revel J. P., A stain for the ultrastructural localization of acid
mucopolysaccharides, Journal de Microscopic 3, 535—544 (1964).
50. Revel J. P., Karnovsky M. J., Hexagonal array sunhunits in
intercellular junctions of the mouse heart and liver, Journal of Cell
Biology, 33, C7 — C12 (1967).
51. Rothman A. H., Alcian blue as an electron stain, Experimental Cell
Research, 58, 117—179 (1969).
52. Scott J. E., Glick £>., The invalidity of "Phosphotungstic acid as a
specific electron stain for complex carbohydrates", Journal of
Histochemistry and Cytochemistry, 19, 63—64 (1971).
53. Seligman A. M., Hanker J. S., Wasserkrug H., Dmochowski H., Kat-
zoff L.% Histochemical demonstration of some oxidized macromole-
cules with thiocarbohydrazide (TCH) or thiosemicarbazide (TSC)
and osmium tetroxide, Journal of Histochemistry and Cytochemistry,
13, 629—639 (1965).
54. Thiery J. P., Mise en evidence des polysaccharides sur coupes fines
en microscopie electronique, Journal de Microscopie, 6, 987—1018
(1967).
55. Tice L. W., Barrnett R. J., Alcian blue staining for electron
microscopy, Journal of Histochemistry and Cytochemistry, 10, 688—689
(1962).
56. Wetzel M. G., Wetzel B. K., Spicer S. S., Ultrastructural
localization of acid mucosubstanccs in the mouse colon with iron containing
stains, Journal of Cell Biology, 30, 299—315 (1966).
Методы ферментативного переваривания
57. Atdridge W. G., Studies on histochemical ribonuclease digestions,
Journal of Histochemistry and Cytochemistry, 10, 682 (19G2).
58. Alfert M., Das N. K., Eastwood J. M., Effects of RNAse on living
cells and on cells fixed by different methods, Journal of
Histochemistry and Cytochemistry, 10, 681—682 (1962).
59. Anderson W. A., Andre L, The extraction of some cell components
with pronase and pepsin from thin sections of tissue embedded in
an Epon — Araldite mixture, Journal de Microscopie, 7, 343—354
(1968).
60. Anderson W. A., Ellis R. A., Ultractructure of Trypanosoma lewl-
sii: flagellum, microtubules, and the kinetoplast, Journal of Photo-
zoology, 12, 483—499 (1965).
61. Beaulaion J., Sur Taction d'enzymes au niveau des pores niicleaires
■ et d'autres structures de cellules sccretrices prothoraciques incluses.
en Epon, Zeitschrift fur Zellforschung und microscopische Anatomie,
89. 443—461 (1968).
62. Bernhard W., Progress and limitations of ultrastructural
cytochemistry carried out on ultrathin sections, Journal of Histochemistry
and Cytochemistry. 14, 746—747 (1966).
63. Chopra H. C, 'Shibley G. P., Walling M. J-, Electron microscopic
cytochemistry of herpes simplex virus using enzyme extraction and
autoradiography^ Journal de Microscopie, 9, 167—176 (1970),
14—977
210
Глава 8
64. Douglas W. И. Л, Perchloric acid extraction of deoxyribonucleic
acid from thin sections of Epon — Araldite-embedded material,
Journal of Histochemistry and Cytochemistry, 18, 510—514 (1970).
65. Douglas W. H. J., Ripley R. C, Ellis A., Enzymatic digestion of
desmosomes and hemiaesmosome plaques performed on ultrathin
sections, Journal of Cell Biology, 44, 211—215 (1970).
66. Granboulan N.. Granboulan P., Cytochemie ultrastructurale du
nucleole. 11. Etudes des sites de synthese du RNA dans le nucleole
et le noyau, Experimental Cell Research, 38, 604—619 (1965).
67. Leduc E. H., Bernhard W., In The Interpretation of infrastructure,
pp. 21—45 (Edited by R. J. С Harris), New York and London,
Academic Press, 1962.
68. Leduc E. H., Bernhard W., Recent modifications of the glycol
methacrylate embedding procedure, Journal of Ultracstructure
Research, 19, 196—199 (1967).
69. Leduc E. H., Holt S. J., Hydroxypropyl methacrylate, a new water-
miscible embedding medium for electron microscopy, Journal of Cell
Biology, 26, 137—155 (1965).
70. Leduc E. #., Marinozzl V.. Bernhard W., The use of water-soluble
glycol methacrylate in ultrastructural cytochemistry, Journal of the
Royal Microscopical Society, 81, 119—130 (1963).
71. McGee-Russell S. M., A ring and cup technique for handling thin
sections for electron microscopy, Journal of the Royal Microscopical
Society, 85, 91—96 (1965).
72. Marinozzl V., Cytochemie ultrastructurale du nuclueole — RNA et
proteines intranucleolaires, Journal of Ultractructure Research, 10,
433—456 (1964).
73. Marinozzl V., Bernhard W., Presence dans le nucleole de deux types
de ribonucleoproteines morphologiquement distinctes, Experimental
Cell Research, 32, 595—598 (1965).
74. Monneron A„ Utilisation de la pronase en cytochemie
ultrastructurale, Journal de Microscopie, 5, 583—596 (1966).
75. Monneron A., Bernhard W., Action de certaines enzymes sur des
tissus inclus en Epon, Journal de Microscopie, 5, 697—714 (1966).
76. Moreno G., Vinzens F., Comparison en microscopie optique et ele-
ctronique de Taction de la DNAse sur des cellules en couche mono-
cellulaire, Journal de Microscopie, 9, 321—332 (1970).
77. Nass S., Nass M. M. K-, Intramitochondrial fibers with DNA
characteristics. II. Enzymatic and other hydrolytic treatments, Journal
of Cell Biology, 17, 613—629 (1963).
78. Pease D. C, The preservation of unfixed crytological detail by
dehydration with "inert agents", Journal of Ultrastructure Research,
1*4, 356—378 (1966).
79. Pease D. C, Anhydrous ultrathin sectioning and staining for
electron microscopy, Journal of Ultrastructure Research, 14, 379—
390 (1966).
80. Rosenberg M., Bartl P., Lesko J., Water soluble methacrylate as an
embedding medium for the preparation of ultrathin sections, Journal
of Ultrastructure Research, 4, 298—303 (1960). .
Ультраструктурная цитохимия
211
81. Smith R. E., Farquhar M. G., Preparation of non-frozen sections
for electron microscope cytochemistry, Scientific Instrument News,
10, 13—19 (1965).
82. Smith R. E., Comparative evoluation of two instruments and
procedures to cut nonfrozen sections, Journal of Histochemistry and
Cytochemistry, 18, 590—591 (1970).
83. Staubli W., A new embedding technique for electron microscopy,
combining a water-soluble epoxy resin (Durcupan) with water
insoluble Araldite, Journal of Cell Biology, 16, 197—201 (1963).
84. Weakley B. S., Initial steps in the formation of cytoplasmic
lamellae in the hamster oocyte and the identification of associated
electron-dense particles, Zeitschrift fur Zellforschung und microscopi-
sche Anatomie, 97, 438—448 (1969).
Окрашивание одномикронных срезов
85. Glauert A. M., In Techniques for Electron Microscopy, 2nd edn.,
pp. 303—305 (Edited by D. H. Kay), Oxford, Blackwell Scientific
Publications, 1965.
86. Lane B. P., Europa D. L., Differential staining of ultrathin sections
of Ероп-embedded tissues for light microscopy, Journal of
Histochemistry and Cytochemistry, 13, 579—582 (1965).
87. Stevens A. R., In Methods in Cell Physiology, Vol. 2, pp. 274—285
(Edited by D. M. Prescott), New York and London, Academic Press,
1966.
Криоультрамикротомия
88. Appleton Т. С, Ultrathin frozen sections for electron microscopy,
Report published by LKB Instruments, Inc., 1968.
89. Bernhard W., Leduc E. H., Ultrathin frozen sections. I. Methods and
ultrastructural preservation, Journal of Cell Biology, 34, 757—771
(1967).
90. Christensen A. K-, A simple way to cut frozen thin sections of
tissue at liquid nitrogen temperatures, Anatomical Record, 157, 227
(1967).
91. Christensen A. K-, Fresh-frozen thin sections cut, flattened and
freezedried at a temperature of —75°C, Journal of Cell Biology, 29,
25A (1968).
92. Fernandez-Moran H., Applications of the ultrathin freezing
sectioning technique to the study of cell structures with the electron
microscope, Arkiv for Fysik, 4, 471 (1952).
93. Hodscn S., Marshall J., Ultracryotomy: a technique for cutting
ultrathin sections of unfixed frozen biological tissues for electron
microscopy, Journal of Microscopy, 91, 105—117 (1969).
94. Leduc E. H., Bernhard W., Holt S. J., Tranzer J. P., Ultrathin frozen
sections. II. Demonstration of enzymic activity, Journal of Cell
Biology, 34, 773—786 (1967).
Аналитическая электронная микроскопия
95. Chandler J. A., Chou С. К., The distribution of preservatives in
wood and uptake by fungal hyphae, examined in the analytical
14*
212
Глава 8
electron microscope, Proceedings of the International Congress of
Electron Microscopy, Vol. 3, pp. 493—494 (Edited by P. Favard),
Paris, Societe Francais de Microscopie Electronique, 1970.
96. Clarke J. A., Salsbury A. J., Willoughby D. A., Application of
electron probe microanalysis and electron microscopy to the transfer
of antigenic material, Nature, Lond., 227, 69—71 (1970).
97. Cosslett V. £., Possibilities and limitations of the differentiation of
elements in the electron microscope, Laboratory Investigation, 14,
1009—1019 (1965).
98. Robertson A. J., The electron probe microanalyzer and its
applications in medicine, Physics in Medicine and Biology, 13, 505—522
(1968).
99. Schafer P. W., Chandler J. A., Electron probe X-ray microanalysis
of a normal centriole, Science, 170, 1204—1205 (1970).
ГЛАВА i
Радиоавтография в электронной
микроскопии
Самый большой недостаток электронного
микроскопа в настоящее время состоит в том, что с его помощью
нельзя исследовать живую ткань. Однако в последние
годы было показано, что методы радиоавтографии
имеют неоценимое значение в изучении тканевой и
клеточной динамики на уровне как световой, так и
электронной микроскопии.
Следует подчеркнуть, что с помощью
радиоавтографии можно узнать, где синтезируется то или иное
вещество, и, если исследования строго рассчитаны во
времени, определить, куда перемещаются эти вещества.
Этот метод не позволяет выявлять вещества,
синтезированные до того, как введены их меченые
предшественники. Следовательно, мы имеем дело не с чрезвычайно
тонкой цитохимической пробой на наличие или
отсутствие какого-либо вещества, а с инструментом для
изучения синтеза, обмена и миграции веществ. На
электронно-микроскопическом уровне радиоавтография
помогает выяснить роль различных органелл в синтезе и
распределении клеточных и внеклеточных веществ.
Литература, посвященная вкладу
электронно-микроскопической радиоавтографии в исследование
динамики клеточного обмена, слишком обширна, и
полностью цитировать ее в этой книге не представляется
возможным. Поэтому в конце главы будут даны ссылки
только на основные статьи и книги, имеющие отношение
к приведенным здесь методам. Ссылки на работы по
специальным вопросам цитодинамики можно найти в
книге Базерги и Маламуда [2].
214
Глава 9
ТЕОРЕТИЧЕСКИЕ ОСНОВЫ МЕТОДА
Распад радиоактивного изотопа сопровождается
высвобождением энергии и образованием другого изотопа.
Время, необходимое для распада половины имеющегося
количества изотопа, называют периодом полураспада,
строго определенным для каждого изотопа. Если период
полураспада велик в сравнении с продолжительностью!
радиоавтографического эксперимента, то можно
считать, что скорость распада в течение этого
эксперимента постоянна. В процессе распада радиоактивные
вещества испускают а, |3- или у-излучение. Эти виды
излучения, воздействуя на слой светочувствительной эмульсии,
формируют в кристаллах галоидного серебра,
входящего в состав эмульсии, скрытое изображение. Таким
образом, на фотоэмульсии можно регистрировать
характер радиоактивного излучения изотопа.
Радиоавтография — это метод исследования,
основанный на указанных выше явлениях. Если хотят
определить место синтеза какого-то вещества в ткани или
в клетке, то можно подобрать некое соединение,
необходимое для синтеза этого вещества и ввести в него
радиоактивную метку. Меченые соединения вводят
затем животному на определенное время с таким
расчетом, чтобы они достигли интересующей нас ткани и
включились в синтез тех веществ, которые предстоит
выявить. Затем кусочек ткани извлекают из тела
животного, фиксируют, заливают и режут. На срезы
наносят фотографическую эмульсию и препараты помещают
в темное место на время, достаточное для того, чтобы
на фотографической эмульсии сформировалось скрытое
изображение радиоактивной метки. Затем
фотографическую эмульсию проявляют, закрепляют, получают
отпечатки и изучают сопоставляя их с исследуемой
тканью.
РАДИОАВТОГРАФИЯ В СВЕТОВОЙ МИКРОСКОПИИ
Было установлено, что для световой микроскопии
удобно наносить слой жидкой эмульсии на поверхность
срезов ткани, наклеенных на предметное стекло; это
Радиоавтография в электронной микроскопии 216
обеспечивает необходимую степень контакта эмульсии
и среза. Длительность экспозиции зависит от
нескольких факторов, в том числе от периода полураспада
радиоактивной метки и от количества меченого вещества
в срезе. Последнее будет, естественно, меняться в
соответствии с интенсивностью метаболических
процессов в исследуемой ткани и толщиной среза. Если в
качестве метки используется тритий, то экспозиция
длится, как правило, от 1 до 4 недель. Срез и эмульсия
остаются в контакте во время проявления и закрепления.
Полученный препарат может быть окрашен и
исследован с помощью светового микроскопа. Проявленные
зерна серебра при этом будут располагаться над теми
участками ткани, где имело место радиоактивное
излучение.
Методы радиоавтографии для световой микроскопии
довольно просты и, как правило, дают возможность
получить удовлетворительные результаты после
небольшой практики уже через несколько недель.
РАДИОАВТОГРАФИЯ
НА ЭЛЕКТРОННО-МИКРОСКОПИЧЕСКОМ УРОВНЕ
Методы радиоавтографии, применяемые в
электронной микроскопии, более сложны и требуют значительно
больше времени, чем методы радиоавтографии для
световой микроскопии. Единственным маркером, который
широко используется в электронной микроскопии,
служит тритий, который испускает р-частицы с
коротким пробегом, хотя в некоторых случаях использовали
изотоп серы 35S. Период полураспада трития составляет
двенадцать с половиной лет. Время, необходимое для
того, чтобы то незначительное количество вещества,
которое содержится в срезе толщиной 600 А, облучило
фотографическую эмульсию, лежит в пределах от 2 до
3 месяцев. Начинающему приходится овладевать столь
большим количеством методов, варианты которых очень
многочисленны, а число возможных неудач настолько
велико, что можно потратить месяцы кропотливой работы
и тем не менее в конце концов не получить желаемых
результатов. Это обходится дорого и в отношении затра-
216
Глава 9
ченного времени, и в отношении затраченных
материалов.
Нельзя начинать радиоавтографические
исследования на ультраструктурном уровне, не ознакомившись
тщательно с возможными вариантами и неудачами.
В задачу этой книги не входит подробное описание
электронно-микроскопической радиоавтографии, и
читатель, намеревающийся серьезно заняться такой
работой, должен обратиться к тем книгам и статьям по
теории и методам электронной радиоавтографии, которые
перечислены в конце главы.
Если это возможно, то следует пройти курс
обучения методам электронной радиоавтографии в тех
лабораториях, где активно ведутся исследования этим
методом.
Хотя тритий как вещество, излучающее частицы с
коротким пробегом, не представляет собой
радиационной опасности, пока работающие с ним пользуются
резиновыми перчатками, все же опасность загрязнения
им очень велика. Это в первую очередь относится к
таким веществам, как меченый тимидин, который при
попадании в пищеварительный тракт может включиться
в ДНК клеточных ядер всего тела и вызвать тем самым»
тяжелые поражения тканей.
Для тех, кто хотел бы в общих чертах ознакомиться
с радиоавтографией в электронной микроскопии, ниже
приведено описание метода, с помощью которого в
лаборатории автора были получены неплохие результаты.
В основе этого метода лежат методы Салпетера и Бах-
мана [11, 12], а также Бахмапа и Салпетера
[1], модифицированные Роджерсом [9].
СХЕМА МЕТОДА
1. Животным вводится внутрибрюгаинно
специфичный и высокоактивный радиоактивный индикатор, так
чтобы доза его составляла 10 мкКи на 1 г массы тела.
Вся доза должна вводиться по возможности в виде
концентрированного раствора, чтобы избежать повышения
давления в брюшной полости вследствие введения
большого объема жидкости. Контрольным животным вводят
Радиоавтография в электронной микроскопии 217
такой же объем стерильного физиологического
раствора. Меченые вещества поступают обычно в пузырьках
объемом 10 мл, закрытых резиновым колпачком; в
каждом таком пузырьке содержится 1 мл
концентрированного раствора радиоактивного индикатора. После того
как вычислена необходимая доза индикатора, его
можно развести до необходимой концентрации стерильным
физиологическим раствором, который вводится
шприцем через резиновый колпачок. Чтобы давление
внутри пузырька при этом не увеличивалось, надо
одновременно пропустить через резиновый колпачок вторую'
стерильную инъекционную иглу (без шприца), через
которую и будет удаляться вытесняемый воздух. В
противном случае возникает опасность выхода
радиоактивного индикатора с пузырьками воздуха в месте прокола
пробки иглой.
2. Животное забивают через определенный
промежуток времени, продолжительность которого зависит от
особенностей материала, подлежащего исследованию.
Для выяснения продолжительности этого промежутка
следует использовать данные литературы. Нужно
помнить, что могут существовать выраженные видовые
различия в скоростях метаболизма и что вследствие этого
порой возникает необходимость проведения пробных
экспериментов, прежде чем будет найдено подходящее
время.
3. Ткань фиксируют в глутаральдегиде,
формальдегиде или четырехокиси осмия. У каждого фиксатора
есть свои недостатки. Четырехокись осмия может
ускорить исчезновение скрытого изображения.
Формальдегид и глутаральдегид могут снизить чувствительность
фотоэмульсии. Многие исследователи рекомендуют
фиксацию формальдегидом, полагая, что это меньшее из
зол. Монерои [8] предпочитает глутаральдегид,
промывая ткань по крайней мере в течение двух дней в
десяти сменах буферного раствора, чтобы предотвратить
неспецифическое связывание радиоактивной метки
с компонентами ткани. Выбор глутаральдегида в
качестве фиксатора представляется оправданным,
поскольку сохранность ультраструктуры в этом случае лучше,
чем при использовании формальдегида. Конечно, еле-
ш
Глава 9
дует помнить об особенностях и недостатках выбранного
фиксатора и учитывать их.
4. Ткань обезвоживают и заливают. После заливки
время хранения материала уже не имеет
существенного значения, поскольку период полураспада трития
достаточно велик.
5. Готовят срезы, причем делают не только
ультратонкие срезы для электронной микроскопии, но также
и срезы толщиной 1 мкм для световой микроскопии. Эти*
последние помещают на каплю воды, налитую на
стекло, предварительно покрытое слоем желатины (см. [9]
стр. 211), и высушивают. Ультратонкие срезы
помещают на золотую сетку, покрытую пленкой коллодия
или формвара. (Золотые сетки рекомендуются потому,
что золото менее активно, чем медь, и, следовательно,
менее вероятно затемнение фотоэмульсии вследствие
химических процессов. Однако некоторые
исследователи, в том числе и автор, получали хорошие результаты
при использовании медных сеток.)
6. Срезы окрашиват уранилацетатом и цитратом
свинца, а затем покрывают слоем углерода толщиной
200 А; это предохраняет фотографическую эмульсию от
завуалирования в результате воздействия на нее
красителей. Было установлено, что окрашивание срезов
до экспонирования дает лучшие результаты, чем
окрашивание после экспонирования. Краситель плохо
проникает через слои фотоэмульсии, и, кроме того,
существует опасность смещения радиоактивной метки под
действием сильно щелочного раствора свинца.
7. Сетки прикрепляют на чистое предметное стекло
размером 25X75 мм по модифицированному методу Хея
и Ревеля [7J. Для прикрепления используют
двустороннюю липкую ленту Sellotape (шириной 25 мм) или
Scotch masking Tape № 400.,Эти лепты имеют клеящую
поверхность с обеих сторон, причем одна сторона
защищена бумагой. Берут полоску ленты длиной 75 мм и на
расстоянии 25 мм от одного из ее концов делают
отверстие, размеры которого несколько меньше диаметра
сетки. Затем ленту наклеивают на предметное стекло и
обрезают бритвенным лезвием по размерам этого стекла.
Защитную бумагу снимают с поверхности ленты, и сет-
Радиоавтография в электронной микроскопии 219
ки укладывают точно над центром отверстия. Если
сетка помещается на расстоянии примерно 25 мм от
нижнего края стекла, то легче получить однородный тонкий
слой эмульсии на сетке, после того как стекло будет
погружено в эмульсию и вынуто из нее.
8. Стекла переносят в фотолабораторную комнату,
которая освещается фонарем с защитным фильтром
Ilford 902S и лампой мощностью 15 Вт. Эмульсия марки
Ilford L4.расплавляется на водяной бане при
температуре 43°С. Одна часть эмульсии разводится обычно
восемью частями дистиллированной воды, к которой
добавлен 1 % глицерина. Глицерин предохраняет
эмульсию от растрескивания при хранении. Пробные стекла
окунают в эмульсию и затем выносят из
фотолаборатории для просмотра. После высушивания слой эмульсии
над сеткой должен иметь фиолетовый
интерференционный цвет, что свидетельствует об образовании монослоя
эмульсии.
9. Каждое стекло с монтированными па нем сетками
быстро погружают в эмульсию, в течение 30 с
обсушивают в вертикальном положении на фильтровальной
бумаге и затем помещают для сушки в вертикальный
штатив. Когда последнее стекло будет покрыто эмульсией,
лабораторный фонарь выключают и сушат стекла в
полной темноте в течение 30 мин. После этого стекла
укладывают в светонепроницаемую коробку, куда
помещают влагопоглотитель (силикагель в пластиковых
мешочках с отверстиями). Ящик со стеклами ставят в
холодильник па все время экспонирования эмульсии.
Срезы толщиной 1 мкм для световой микроскопии
обрабатывают сходным образом, за тем лишь
исключением, что эмульсия Ilford L4 разводится в отношении
1 :3, а после первичного обсушивания на
фильтровальной бумаге в течение 30 с стекла кладут плашмя на
металлический поднос, который предварительно был
охлажден мешочками, заполненными льдом. Стекла
высушивают в полной темноте в течение 45 мин, а затем
укладывают в светонепроницаемую коробку.
10. Время экспонирования препаратов для
электронной микроскопии определяют исходя из времени,
необходимого для получения удовлетворительных результа-
220
Глава 9
тов па препаратах для световой микроскопии. Эти
препараты просматривают каждые 7 дней экспонирования,
чтобы определить, когда появятся проявленные зерна
серебра. Препараты можно проявлять в любом обычном
проявителе, например PQ Universal 3—5 мин, а затем
окрасить смесью равных объемов 1%-ного раствора ме-
тиленового синего и 1%-пой буры при комнатной
температуре в течение 15 мин — 1 ч, используя
стаканчики для окрашивания (время окрашивания зависит от
качества данной партии метилсиового синего). Время
экспозиции, которое потребовалось для выявления
метки на препарате для световой микроскопии, умножают
на 10, чтобы приблизительно определить срок
готовности препаратов для электронной микроскопии. Следует
подчеркнуть, что это лишь весьма приближенные
данные. Целесообразно начать проверять
электронно-микроскопические препараты приблизительно через 6
недель после начала экспозиции.
Срок годности эмульсии Ilford L4 составляет
примерно 6 мес, однако при экспозиции
продолжительностью более двух месяцев возникает опасность усиления
фона вследствие старения эмульсии.
11. Препараты для электронной микроскопии
проявляют в проявителе Microdol X в течение 3—4 мин. Это
мелкозернистый проявитель, который позволяет
получить проявленные зерна размером 0,12—0,16 мкм.
Следовательно, может быть получено разрешение
приблизительно того же порядка. (Этот проявитель нельзя,
конечно, использовать при обработке препаратов для
световой микроскопии, поскольку размер проявленных
зерен лежит за пределами разрешающей способности
светового микроскопа.)
После проявления сетки промывают в двух сменах
дистиллированной воды, закрепляют не более 1 мин в
закрепителе Hypam Rapid Fixative, после чего
окончательно промывают в течение 15 мин в трех сменах
дистиллированной воды. Затем сетки снимают с клейкой
ленты, высушивают и до просмотра хранят в
желатиновых капсулах или каких-либо других контейнерах.
Снимать сетки с ленты нужно с большой осторожностью
под бинокулярным микроскопом, чтобы избежать де-
Радиоавтография в электронной микроскопии 221
формации или повреждения сеток. Несколько легче
снимать сетки с ленты до того, как она полностью
высохнет после промывки.
Теперь сетки готовы для просмотра. К этому
моменту на основании изучения препаратов для световой
микроскопии у исследователя уже должно сложиться
некоторое представление о том, что можно будет увидеть
на этих сетках. Большинство авторитетных
специалистов советуют провести предварительное
радиоавтографическое исследование на уровне световой микроскопии
и только после этого приступить к каким-либо работам
на электронно-микроскопическом уровне. Однако,
поскольку лучшее разрешение па световом уровне
получают при использовании срезов толщиной 1 мкм,
приготовленных из материала, залитого в аралдит, и
поскольку как для световых, так и для
электронно-микроскопических препаратов используют одну и. ту же
эмульсию L4, представляется более выгодным в смысле
экономии времени и средств одновременно готовить с
того же самого блока образцы для электронной
микроскопии.
В худшем случае это послужит «тренировкой» для
достижения необходимых навыков в методах
электронной радиоавтографии, а в лучшем — даст хорошие
препараты для исследования.
Роджерс [9] рекомендует метод Бахмапа и Салпе-
тера для монтирования ультратонких срезов на
предметное стекло, покрытое пленкой коллодия. Затем после
экспонирования и проявления коллодиевую пленку
снимают па поверхность воды, а сетки накладывают на
участки, содержащие срезы. Этот метод с успехом
применяют во многих лабораториях. Следовательно, выбор
метода является в основном делом личного вкуса
экспериментатора. Оба метода имеют свои трудности; оба
могут дать в опытных руках хорошие результаты.
Вещества, меченные радиоактивными изотопами,
можно получить (тем сотрудникам лаборатории,
которые имеют разрешение на работу с ними) из
Radiochemical Centre, Amersham, England. По запросу этот
центр высылает каталоги, брошюры и информационные
материалы.
222 Глава 9
Список литературы
1. Bachman L., Salpeter M. М., Autoradiography with the electron
microscope. A quantitative evaluation, Laboratory Investigation, 14,
Ю41—1053 (1965).
2. Baserga R., Malamud D., Autoradiography. Techniques and
Applications, New York, Hoeber, 1969.
3. Cleaver J. E„ Thymidine Metabolism and Cell Kinetics, Amsterdam,
North Holland Publishing, 1967.
4. Evans E. A., Tritium and its Compounds, London, Butterworths,
1966.
5. Feinendegen L. E., Tritium-Labeled Molecules in Biology and
Medicine, New York and London, Academic Press, 1967.
6. Gude W. D., Autoradiographic Techniques — Localization of
Radioisotopes in Biological Material, Englewood Cliffs, N. J., Prentice-
Hall, 1968.
7. Hay E. D., Revel J. P., The fine structure of the DNP component
of the nucleus. An electron microscopic study utilizing
autoradiography to localize DNA synthesis, Journal of Cell Biology, 16,
29—30 (1963).
8. Monneron A., Motile Y., Critical evaluation of specificity in
microscopical radioautography in animal tissues, Experimental Cell
Research, 56, 179—193 (1969).
9. Rogers A. W., Techniques of Autoradiography, Amsterdam, London
and New York, Elsevier, 1967.
10. Salpeter M. M., In Methods of Cell Physiology, Vol. 2, pp. 229—253
(Edited by D. M. Prescott), New York and London, Academic Press,
1966.
11. Salpeter M. M., Bachmann L., Autoradiography with the electron
microscope, Journal of Cell Biology, 22, 469—477 (1964).
12. Salpeter M. M., Bachmann L., In The Use of Autoradiography in
the Investigation of Protein Synthesis (Edited by R. J. С Harris),
New York, Academic Press, 1965.
13. Sjostrand F. S., Electron Microscopy of Cells and Tissues, Vol. !,
Chap. 17, New York and London, Academic Press, 1967.
14. Stevens A. R., In Methods in Cell Physiology, Vol. 2, pp. 255—310,
New York and London, Academic Press, 1966.
15. Williams M. A., In Advances in Optical and Electron Microscopy,
Vol. 3, pp. 219—279 (Edited by R. Barer and V. E. Cosslett),
London and New York, Academic Press, 1969.
ГЛАВА 10
Краткий обзор других методов
электронной микроскопии
МЕТОДЫ ЗАМОРАЖИВАНИЯ
В главе, посвященной обработке ткани, говорилось
о том, что ткань, взятая у животного, существенным
образом измс-ияется в процессе ее подготовки к
электронно-микроскопическому исследованию. В частности,
реакции, протекающие при химической фиксации ткани,
играют первостепенную роль в предопределении того,
как в конце концов будет выглядеть ткань при
просмотре в электронном микроскопе.
Различные фиксаторы в разной степени
способствуют экстракции веществ из клеток; при этом из них
целиком удаляются вещества, имеющие наиболее
важное значение в клеточном обмене. Под действием
фиксатора может полностью изменяться молекулярная
конфигурация остающихся в клетке структур.
Насколько полно структура фиксированной клетки
соответствует той структуре, которой клетка обладает
при жизни? Очевидно, для выяснения этого должны
быть использованы какие-то специальные методы, в
которых ткань исследуют без предварительной химической
фиксации.
ЗАМОРАЖИВАНИЕ - ВЫСУШИВАНИЕ
Один из таких методов, замораживание —
высушивание, заключается в быстром замораживании ткани
с последующим ее обезвоживанием. Метод
замораживания— высушивания, который уже ранее использовался
в других областях науки, был применен в электронной
микроскопии Шёстрандом и Бейкером [20] и
модифицирован Хензоном и Хермодсоном [9], Сено и Яшизава
[18] и др.
224
Глава 10
Если небольшой кусочек ткани погрузить в пропан,
изопентаи или фреон, охлажденные до температуры
жидкого азота (—196°С), то он замерзает почти
мгновенно. Ткань стабилизируется, и все обменные процессы
прекращаются в значительно более короткое время, чем
это происходит при обычной фиксации. Если ткань
замораживается достаточно быстро, то кристаллов льда
в ней не образуется. Это обусловлено тем, что при
сильном охлаждении молекулы становятся слишком
инертными, связи между ними не возникают и не успевает
образоваться правильная трехмерная кристаллическая
решетка. В результате вода переходит в стекловидное
(некристаллическое) состояние, при котором
молекулярная структура беспорядочна. Клеточные структуры при
этом не разрушаются, поскольку не формируются
кристаллы льда. Затем ткань помешают в условия
высокого вакуума (10~6—Ю-7 мм рт. ст.), где происходит
возгонка (сублимация) воды, находящейся в стекловидном
состоянии. После такого высушивания ткань
пропитывается заливочной средой. Обычно для этой цели
используют метакрилаты, хотя применялись также и аралдит,
и вестопал W. Метакрилат погружают в жидкий воздух
Для затвердения и на такой затвердевший заливочный
Материал помещают кусочек ткани. По мере повышения
температуры метакрилат разжижается и проникает в
ткань. Полимеризуют метакрилат при —10°С под
действием ультрафиолетовых лучей. После того как
температуру залитой ткани доведут до комнатной, ткань
можно резать и окрашивать, используя обычные
методики. Таким образом, исключаются как химическая
фиксация ткани, так и воздействие на нее
обезвоживающих веществ.
При использовании метода замораживания —
высушивания приходится сталкиваться с некоторыми
трудностями. Одна из них состоит в том, что практически
чрезвычайно сложно достаточно быстро заморозить
ткань так, чтобы избежать образования кристаллов
льда. Чистая вода экстрагируется из протоплазмы
клеток, образуя кристаллы льда, и при этом увеличивается
концентрация других веществ цитоплазмы, что
приводит к повреждению оргапелл вследствие осмотического
Краткий обзор других методов электронной микроскопии 225
воздействия, а также вследствие изменения рН [5].
Кристаллы льда могут вызвать смещение и даже
разрыв органелл. «Тени» таких кристаллов видны на
микрофотографиях как большие «прозрачные» участки.
Чтобы получить достоверные данные, приходится
затрачивать много времени в поисках участков ткани,
лишенных артефактов, вызванных формированием
кристаллов льда.
Трудностей, связанных с образованием кристаллов
льда, можно в какой-то степени избежать, если ткань
перед замораживанием погрузить в 20—30%-ный
раствор глицерина. Глицерин и вода полностью
смешиваются в любых соотношениях, при этом молекулы
глицерина прочно связываются с молекулами воды
посредством водородных связей. Таким образом, молекулы
воды оказываются отделенными друг от друга, что
предотвращает образование кристаллов льда. Считается,
что глицерин обладает значительной инертностью и
обеспечивает защиту от повреждений, обусловленных
образованием кристаллов льда, не вступая в химические
реакции с какими-либо другими веществами,
входящими в состав клеток.
Другая трудность состоит в том, что ткань после
удаления воды в результате сублимации легко
подвергается деформации, особенно при пропитывании
заливочной средой. «Усадка» заливочной среды в результате
полимеризации может повредить ткань. Кроме того,
поскольку заливочная среда сама по себе не является
химически инертной, она может реагировать с
веществами, входящими в состав ткани, изменяя их структуру.
По-видимому, липиды экстрагируются из ткани как
самими метакрилатами, так и раствором ацетона,
используемым при резке; таким образом, мембраны
выявляются как «негативное изображение». Белки теряются
лишь в очень незначительной степени, поэтому
плотность матрикса цитоплазмы и органелл остается
высокой. Вследствие этого конечный контраст электронных
микрофотографий довольно низкий.
Несмотря на все эти трудности, метод заморажива-
вания — высушивания позволил получить весьма
обнадеживающее и довольно неожиданное подтверждение
1S—OT7
226
Глава JO
того, что ультраструктура клетки после фиксации
химическими веществами, по-видимому, близка ее истинной
структуре, по крайней мере при использовании средних
разрешений электронного микроскопа. Органеллы в
ткани, подвергнутой замораживанию и высушиванию,
имеют в общем те же размеры, распределение и
ультраструктуру, что и после химической фиксации, хотя они
несколько отличаются по электронной плотности и
способности окрашиваться.
Однако на макромолекулярном уровне, достигаемом
при высоких разрешениях, метод замораживания —
высушивания имеет ограниченную ценность. Как
указывает Бюльван [5]: «Структура белков, нуклеиновых
кислот и липидов зависит от их взаимодействия с
окружающими слоями воды; конфигурация крупных молекул
этих веществ изменяется, когда перед приготовлением
тонких срезов вода замещается неполяризованной
заливочной средой».
ЗАМОРАЖИВАНИЕ - ЗАМЕЩЕНИЕ
Метод замораживания — замещения является
вариантом метода замораживания — высушивания, и его
легче выполнить. Данный метод был предложен Фер-
нандес-Мораном [7, 8] и" Бюльваном [4]. Начальное
замораживание ткани производят так же, как и в методе
замораживания — высушивания, однако воду,
перешедшую в стекловидную форму, удаляют, погружая
замороженную ткань перед заливкой в ацетон, спирт или
какие-либо другие обезвоживающие вещества. При
используемых низких температурах ацетон и спирт мало
влияют на структуру ткани. Однако, если желательно,
ткань можно фиксировать после замораживания,
воздействуя на нее либо парами фиксатора, либо
растворив фиксатор в обезвоживающем веществе.
Несомненно, фиксация отчасти сводит на нет основную цель
метода замораживания — высушивания, а именно—>
избежать артефактов, обусловленных применением
химических веществ. Однако метод замораживания —»
замещения имеет своп преимущества: уменьшаются
повреждения ткани, вызываемые пропитыванием ткани
Краткий обзор других методов электронной микроскопии 227
заливочной средой; водорастворимые вещества не
экстрагируются в процессе проводки, поскольку в
замороженной ткани нет свободной воды; наконец, если в
качестве фиксатора используется четырехокись осмия, то
сохраняются мембраны, содержащие липиды, и
структуры этих мембран можно сравнивать со структурой
мембран, выявляемых с помощью других методов.
В целом ультраструктура клетки и ее органелл,
которая выявляется при использовании метода
замораживания— замещения, сопоставима с ультраструктурой
после обычных процедур фиксации, заливки и резки.
Электронная плотность многих компонентов ткани
выше, так как сохраняется большее количество веществ
и, так же как при замораживании — высушивании,
изображения отличаются невысоким контрастом.
Мембраны крист в митохондриях кажутся слившимися [10], и
несколько изменяется характер периодичности миелино-
вой оболочки; в остальном при исследовании со
средним разрешением не наблюдается значительных
изменений мембранных структур.
Прекрасный обзор методов замораживания —
высушивания и замораживания — замещения принадлежит
Бюльвану [5].
РЕЗКА ЗАМОРОЖЕННЫХ ОБРАЗЦОВ
(КРИОУЛЬТРАМИКРОТОМИЯ)
Этот метод описан в гл. 8; в конце той же главы
приведены ссылки на необходимую литературу.
ЗАМОРАЖИВАНИЕ —ТРАВЛЕНИЕ
Этот изящный метод был впервые предложен
Старом [21] и получил свое развитие в работах
нескольких исследователей, в том числе в работах Мура, Мю-
леталера, Вальднера и Фрей-Висслинга [14], Бюльвана
и Аме [6]. Самые последние модификации'этого метода
описаны Бишопом [1], Муром [13], Бюльваном
[5]. Медленное внедрение метода замораживания +-
травления объясняется исключительной трудностью
изготовления образцов, однако теперь он находит все
более широкое применение, поскольку были усов.ершенст-
15*
228
Глава 10
вованы оборудование и технические приемы,
используемые в этом методе.
Замораживание — травление — это чисто физический
метод, и в нем полностью исключены как химические,
так и структурные изменения в ткани, которые
обусловлены химической фиксацией, обезвоживанием, заливкой
и резкой. Поскольку из ткани не удаляются никакие
вещества, не может происходить ее сморщивания.
О том, в какой степени фотографии образцов,
полученных методом замораживания — травления,
соответствуют истинной структуре живой ткани, можно судить
на основании того факта, что живые клетки дрожжей,
поверхность которых изучалась этим методом,
оказались способными восстановить нормальные функции и
размножаться [12].
Ткань пропитывается глицерином и замораживается
в жидком фреоне, охлажденном до —150°С жидким
азотом. Затем ткань погружают в жидкий азот
(—196°С). После извлечения из жидкого азота ткань
помещают па охлажденный столик и разламывают с
помощью бритвенного лезвия таким образом, что клетки
расщепляются поперек (фиг. 15). Поверхность разлома
подвергается действию высокого вакуума (10~6—
10~7 мм рт. ст.). По мере того как вода, перешедшая в
стекловидную форму, возгоняется, поверхность
разлома как бы «протравливается», так что на ней
рельефно выделяются оргапеллы. Па «протравленную»
поверхность напыляется покрытие из платины и углерода с
помощью системы одномоментно совмещенных платиново-
углеродных электродов.
Таким образом формируется реплика исследуемой
поверхности (подробнее об изготовлении реплики см.
на стр. 232—234). Платину и углерод напыляют под
углом, так что происходит «оттенение» структур,
выступающих над «протравленной» поверхностью, и
увеличивается контрастность получаемой реплики.
Реплика укрепляется за счет перпендикулярного напыления
на ее поверхность слоя углерода. Затем ткань
согревают в дистиллированной воде, и реплика всплывает.
Следы органических веществ, остающиеся на реплике,
удаляются с помощью трипсина с последующей обра-
Краткий обзор других методов электронной микроскопии 229
боткой серной кислотой или сильной щелочью. После
тщательной промывки дистиллированной водой реплику
помещают на сетку — теперь она готова для просмотра
в электронном микроскопе.
1
,У(Л-
\\V\
|1\
\
1 \
Фиг. 15. Операции замораживания — травления.
Л. Для разлома ткани применяется бритвенное лезвие. / — лезвие бритвы;
2 — блок ткани; 3 — линия разлома; 4 — замораживающий столик. Б. Ткань
при разломе расщепляется вдоль естественных поверхностей. В. Поверхность
«протравливается» при сублимации воды. Г. Образование реплики: оттеиение
платиной с углеродом под углом, меньшим 90°. Д. Укрепление реплики
посредством напыления углерода под прямым углом.
Наиболее привлекательной и информативной
стороной данного метода служит то, что поверхность
разлома позволяет обнаружить такие детали, которые
230
Глава 10
не выявляются при использовании других методов.
Разлом, следуя по линии наименьшего сопротивления,
имеет тенденцию проходить по естественным поверхностям
внутри клеток. Этими естественными поверхностями
являются мембраны таких органелл, как ядро,
митохондрии, аппарат Гольджи и пузырьки. Следовательно,
открываются поверхности этих оргаиелл, которые можно
детально изучать. Например, можно наблюдать
распределение ядерных пор на всей поверхности половины
ядра.
Таким образом было установлено, что
распределение ядерных пор значительно варьирует у клеток
разных типов, т. е. у клеток одного типа поры могут
образовывать гексагональные фигуры, у клеток других
типов — располагаться в виде кружков или
параллельных линий [15].
В зависимости от метода и условий разлома может
происходить также и поперечный разлом самих
органелл; при этом получается поразительное трехмерное
изображение внутренних отделов органеллы.
В общем метод замораживания — травления
позволил показать, что картина ультраструктуры клеток,
полученная после химической фиксации и приготовления
тонких срезов, в основном соответствует
действительности. Однако интерпретировать картины поверхностей,
полученных этим методом, довольно трудно. Когда
разлом проходит по мембране органеллы, следует ли он по
наружной или внутренней ее поверхности или
отщепляет листок этой мембраны? Могут ли все три возможных
варианта выявляться в зависимости от типа органеллы
или условия разлома? Мур [12, 13] исследовал
дополняющие друг друга реплики, снятые с обеих
поверхностей, образующихся при одном разломе, и пришел к
выводу, что разлом проходит по поверхности мембраны.
Брентон [2, 3], да Сильва и Брентон [19], исследуя
аналогичный материал, пришли к заключению, что
мембрана при разломе расщепляется посредине и,
следовательно, открывающиеся поверхности состоят,
по-видимому, из неполярных (гидрофобных) концов фосфоли-
пидных молекул. Авторы предположили, что
гидрофобные связи ослабевают при замораживании.
Краткий обзор других методов электронной микроскопии 2$i
На многих мембранных поверхностях,
открывающихся при разломе, видны небольшие частицы, обычно
диаметром около 100 А, или небольшие вдавления,
соответствующие таким частицам. Число и распределение
частиц различно у разных органелл, причем эти
различия постоянны. В связи с этим полагают, что такие
частицы соответствуют каким-то реально
существующим элементам мембран. Да Сильва и Брентон [19]
высказали предположение, что частицы размером
100 А (их диаметр, возможно, ближе к 40—50 А, если
принять во внимание увеличение, обусловленное «отте-
нением») представляют собой либо частицы белка,
заключенного в сдвоенный слой фосфолипидов, либо ми-
целлярные скопления самих фосфолипидов. Если такое
толкование Верно, то мы имеем картину внутренней
мембранной структуры, которую не удается видеть при
использовании какого-либо другого метода. Этот метод
открывает удивительные возможности для изучения
мембранных структур.
.Разрешение, получаемое методом замораживания—(
травления, зависит от вида тяжелого металла,
используемого для получения реплики. При напылении пла-
тино-углеродной реплики разрешение ограничено 20—'
30 А. Однако использование тантала и некоторых
других металлов показывает, что с помощью этого метода
можно достичь разрешения 10 А [13]. Такое
разрешение, несомненно, значительно лучше разрешения,
обычно получаемого при использовании ультратонких
срезов.
Последние обзоры, посвященные методу
замораживания— травления, опубликованы Муром [13] и Брен-
тоном [3].
В заключение можно сказать, что методы
замораживания дали ценные сведения, подтверждающие
результаты, полученные с помощью общепринятых
методов электронной микроскопии. Трудности, связанные
с применением методов замораживания — высушивания
и замораживания — замещения, ограничивают их
широкое применение. Между тем технический прогресс,
достигнутый в области использования метода
замораживания— травления, привел к увеличению числа исследо-
232
Глава 10
вателей, применяющих этот метод. Следует ожидать,
что при сочетании гистохимических и цитохимических
методов с методом замораживания — травления будут
получены в высшей степени информативные данные.
ИССЛЕДОВАНИЕ ПОВЕРХНОСТЕЙ
в электронной микроскопии
ТОНКИЕ ПЛЕНОЧНЫЕ РЕПЛИКИ И ОТТЕНЕНИЕ
Для того чтобы электронный луч прошел через
образец и сформировал неискаженное изображение,
толщина объекта, как правило, должна быть менее 1200 А
В начале 50-х годов, пока еще не были разработаны
методы получения ультратонких срезов, тонкие образцы
получали, приготавливая тонкопленочные реплики с
поверхности изучаемого материала. Как уже было
сказано в предыдущем разделе, реплики служат также
неотъемлемой частью метода замораживания —
травления.
Для изучения биологического материала
использовался целый ряд методов изготовления реплик. Два из
них применяются наиболее часто: 1) изготовление
реплики на поверхности образца из тонкого слоя формва-
ра или коллодия и 2) образование реплики путем
нанесения тонкого слоя вещества (обычно это металл или
углерод) на образец напылением в вакууме.
Для получения реплики напылением образец и
вещество, пары которого нужно получить, помещают в
вакуумную камеру, давление в которой снижают до
10~5 мм рт. ст.; это позволяет избежать влияния
молекул газа на процесс испарения. Выбранное для
испарения вещество нагревается при пропускании тока
через V-образиую вольфрамовую проволоку; при этом
перегиб проволоки, т. е. ее самая горячая часть,
соприкасается с этим веществом. Для изготовления тонких
пленочных реплик применяются кремний, углерод и
некоторые металлы. Особенно пригоден для этой цели
углерод, поскольку он легко испаряется и настолько
инертен, что ткань можно удалить, растворив ее, и не
повредить при этом реплики.
Краткий обзор других методов электронной микроскопии 233
Если пленка, образующая реплику, имеет
равномерную толщину и одинаковый состав, то она,
естественно, будет лишена контраста при просмотре в
электронном микроскопе. Такой контраст реплики можно
создать, напыляя под острым углом электроноплотпое
вещество, например тяжелый металл. Атомы этого
металла скопятся на той стороне поверхностных контуров,
которая ближе к источнику напыления, а их количество
на стороне, удаленной от этого источника, будет
меньшим (фиг. 15, Г). Здесь можно провести аналогию с
предметом, который находится под яркими лучами
солнца: такой предмет освещен со стороны,
обращенной к солнцу, а его противоположная сторона
отбрасывает тень. Поэтому такой процесс напыления известен
как «оттенение». •
На позитивном отпечатке, сделанном с негатива, на
котором сфотографирована оттененная поверхность,
будут видны темные массы на стороне контуров,
обращенных к источнику напыления, и светлые «тени» с
противоположной стороны. Поэтому обычно изготовляют
негативные отпечатки, с тем чтобы оттененный материал
выглядел более привычно.
Если известны угол напыления 9 и длина тени /,
которую определяют, измеряя ее на негативном отпечатке
и затем деля полученную величину на показатель
общего увеличения, то высоту объекта (h) можно вычислить
по формуле
Нанесение реплики и оттенение можно производить
за один прием, если на поверхность объекта напылять
одновременно платину и углерод с помощью смешанных
платиново-углеродных электродов.
Разрешение тонких деталей, достигаемое с помощью
этого метода, зависит от вещества, применяемого для
изготовления реплики. Коллодий и формвар можно
использовать для этого только в том случае, если не
требуется проводить исследование при высоком
разрешении. Некоторые металлы, например золото, имеют
свойство осаждаться при напылении в виде грубых зерен.
234
Глава 10
Легкие металлы не дают достаточного контраста, если
их использовать в виде тонких пленок.
Было найдено, что одновременное напыление
платины и углерода предотвращает формирование крупных
зерен платины [23]. Комбинация этих веществ дает
очень четкие тени и позволяет получить разрешение
приблизительно в 20—30 А.
При изучении некоторых биологических материалов
возникает необходимость отделить образец от реплики.
Небольшие частицы, как, например, органеллы и
волокна, выделенные из фрагмеитированной ткани, вирусы,
бактерии и макромолекулы, такие, как глобулярные
белки и нуклеиновые кислоты, могут быть высушены на
опорной пленке, оттенены и изучены без какой-либо
дополнительней обработки. Это фактически можно
считать разновидностью негативного окрашивания —
«красителем» в данном случае является напыляемое
вещество.
Более подробные сведения об изготовлении реплик
и оттенении можно найти в работах Пиза [25] и Бред-
ли [24].
СКАНИРУЮЩИЙ ЭЛЕКТРОННЫЙ МИКРОСКОП
Сканирующая электронная микроскопия
представляет собой значительный шаг вперед в исследовании
поверхностей по сравнению с методом получения реплик.
Первый сканирующий электронный микроскоп был
построен в Германии в 1938 г.— задолго до того, как
усовершенствование конструкции этого прибора дало
возможность выпустить его в продажу. Первый микроскоп
такого типа выпущен для продажи в 1965 г. фирмой
Cambridge Instrument Company, которая
использовала конструкцию, разработанную профессором
Кембриджского университета Отли и его сотрудниками
[28, 29].
При сканирующей электронной микроскопии
поверхность образца сканируется тонким электронным лучом
(зондом) по квадратному растру и полученная
информация передается на электронно-лучевую трубку (ЭЛТ),
Краткий обзор других методов электронной микроскопии 235
покрытую люминофором с длительным послесвечением.
Вторая ЭЛТ с малым послесвечением и высокой
разрешающей способностью используется для получения
фотографий образца.
Характер информации, которая может быть
получена при взаимодействии электронов с образцом,
изменяется с изменением режима управления прибором.
Любое явление, которое возникает в результате
взаимодействия электронного луча и образца, может быть
преобразовано электронным путем в видимое
изображение. Первичные электроны, рассеянные поверхностью
образца, вторичные электроны, «выбитые» из атомов
этого образца, первичные адсорбированные электроны—i
все они несут информацию об исследуемом образце.
Распределение элементов в образце может быть
обнаружено при улавливании электронов, подвергшихся
обратному рассеянию поверхностными слоями образца,
поскольку элементы с большим атомным числом
рассеивают больше электронов, чем элементы с меньшим
атомным числом. Можно обнаружить также и
люминесценцию компонентов образца, возникающую под
действием электронного луча, однако это явление пока еще
не нашло сколько-нибудь существенного применения в
биологической электронной микроскопии.
В сканирующем электронном микроскопе
используется более низкое рабочее напряжение, чем в обычных
просвечивающих электронных микроскопах. Как
правило, такое напряжение равно 1—30 кВ. Пределы
полезного увеличения составляют 10—50 тыс. раз, что
обеспечивает переход от световой микроскопии к
просвечивающей электронной микроскопии.
Сканирующий микроскоп, снабженный
соответствующими приспособлениями, может быть использован
также и для просвечивающей электронной микроскопии.
Помимо этого, существуют так же специальные
сканирующие приставки, которые можно применять с
просвечивающими микроскопами обычного типа. Переход
от сканирования к просвечивающей микроскопии и
наоборот занимает всего несколько минут, так что в
течение небольшого времени один и тот же образец
может быть исследован с помощью обоих методов.
236
Глава 10
Для исследования биологических образцов чаще
всего используют излучающий способ сканирования. При
этом образец испускает вторичные электроны с низкой
энергией, излучаемые поверхностью образца. Используя
такой способ сканирования, удается при оптимальных
условиях добиться выявления деталей поверхности с
разрешением 100 А. Благодаря огромной глубине
фокуса сканирующего микроскопа, которая в сотни раз
больше, чем у светового микроскопа, получается почти
трехмерное изображение исследуемой поверхности (фото
V). При этом видны детали в щелях и отверстиях, а
также за выступающими участками поверхности,
поскольку сканирующий электронный луч вызывает
эмиссию регистрируемых вторичных электронов со стенок
этих структур [27].
Однако иногда бывает трудно определить, выступает
ли данная структура над поверхностью или она
вдавлена в поверхность. Решается эта проблема с помощью
метода стереофотографии.
При стереофотографировании изготовляются два
снимка под углом, не меньшим чем 5—6°, а затем эти
снимки проецируются специальным стереопроектором
на экран. Если угол при фотографировании был
выбран правильно, то, рассматривая изображение через
специальные очки, мы видим великолепную трехмерную'
картину поверхности образца.
В биологии сканирующий электронный микроскоп
наиболее широко используется для исследования
растительных тканей, которые почти совсем не требуют
специальной обработки. В ботанике большое значение для
систематики, морфологии и диагностики имеет
изучение структуры поверхности семян, плодов, пыльцы, спор
грибов и т. д. [27].
В целлюлозной и бумажной промышленности
проведены обширные исследования' микроструктуры
древесины; при этом были получены очень ценные сведения как
по нормальной морфологии древесных волокон, так и по
влиянию химических и физических процессов на эти
волокна. Исключительно интересные исследования были
выполнены также в области палеоботаники и при
изучении микроископаемых.
Краткий обзор других Методов электронной микроскопии 237
При изучении мягких животных тканей с помощь»
сканирующего микроскопа перед исследователем
встает ряд трудностей, поскольку необходимо применять
специальные методы обработки таких тканей, прежде
чем они будут подготовлены для исследования.
Во-первых, необходимо удалить из них воду такими
средствами, которые не вызывают сморщивания оставшихся
структур. Это можно сделать либо методом
замораживания — высушивания, либо с помощью фиксации и
последующего обезвоживания в спиртах1. После
удаления воды ткань закрепляется в объектодержателе и
покрывается тонким слоем сплава золота и платины.
Тонкий слой металла делает поверхность образца
электропроводной, что позволяет избежать накопления
электрического заряда, который иначе может отрицательно
сказаться на разрешении. После всех этих процедур
объект готов для просмотра.
Довольно легко подготовить для исследования
поверхности, покрытые эпителием, мезотелием или
эндотелием, а также изолированные клетки, культуры
тканей и мазки. В некоторых случаях может оказаться
полезным частичное переваривание ткани, например
удаление коллагена из межуточного вещества. Однако
при необходимости просмотра внутренней структуры
ткани она может быть отпрепаровапа, развернута или
разломана, для того чтобы открыть ее внутренние
поверхности. Срезы залитого материала не годятся для
изучения в сканирующем микроскопе; их гладкие, ровно
срезанные поверхности не содержат в себе никакой
полезной информации [26].
Разработка методов исследования с помощью
сканирующего микроскопа все еще находится в зачаточном!
состоянии. Нет никаких сомнений, что по мере их
совершенствования откроются новые области, в которых
этот многообещающий исследовательский подход
сможет быть плодотворно использован.
1 Для изучения биологических тканей после обезвоживания в
спиртах полезно использовать амилацетат, а уже затем высушивать
ткань на воздухе. Еще лучше сушить ткань в жидкой двуокиси
углерода. — Прим. ред.
238
Глава iO
высоковольтная электронная
микроскопия
Были созданы электронные микроскопы, в которых
используется ускоряющее напряжение 1—3 млн. В.
Пока такие микроскопы эксплуатируются в нескольких
странах, особенно во Франции, Японии,
Великобритании и США.
Стоимость изготовления таких микроскопов
(примерно 200 000 фунтов стерлингов) в значительной мере
сдерживает рост их числа. Несмотря на это, сейчас
имеется уже более двадцати высоковольтных микроскопов
и еще большее их число уже строится. В обычной
практике на одном высоковольтном микроскопе могут
проводить исследования большое число научных
работников. Так, в Англии микроскоп AEI EM7 мощностью
1 млн. В, установленный в Центре исследований по
атомной энергии (Харвелл, Беркшир), доступен для
использования за умеренную плату опытными
электронными микроскопистами, работающими на 100-кВ
микроскопах.
ПРИНЦИПЫ КОНСТРУКЦИИ ВЫСОКОВОЛЬТНОГО
ЭЛЕКТРОННОГО МИКРОСКОПА
По мере увеличения ускоряющего напряжения
возрастает энергия электронов, составляющих
электронный луч, и становится труднее остановить или
отклонить отдельные электроны. Следовательно, при
использовании высокого напряжения электронный луч может
проходить через более толстые объекты. ,
При увеличении ускоряющего напряжения
снижается длина волны электронного луча. Конечный эффект
такого снижения длины волны не имеет существенного
значения с точки зрения разрешающей способности:
теоретическая разрешающая способность обычного
микроскопа мощностью 100 кВ составляет 2,7 А; это
обусловлено различными причинами, о которых шла речь
в гл. 1. Разрешающая способность микроскопа
мощностью 1 млн. В равна 1,1 А [31]. Однако, поскольку при
увеличении скорости электронов они в меньшей степени
Краткий обзор других методов электронной микроскопии 239
рассеиваются образцом данной толщины, снижается и
хроматическая аберрация, вызываемая этим
рассеянием. Можно ожидать, следовательно, значительного
улучшения разрешения при исследовании
биологического материала.
До того как были разработаны методы
изготовления ультратонких срезов, наблюдался повышенный
интерес к созданию электронного микроскопа,
использующего сверхвысокое напряжение; полагали, что с его
помощью можно будет просматривать толстые объекты.
В конце 40-х годов было сконструировано несколько
прототипов таких приборов. Однако, поскольку
непосредственная задача — исследование внутренней
структуры— была решена методом получения тонких срезов,
коммерческие интересы устремились преимущественно
на усовершенствование уже применявшихся
микроскопов мощностью 50—100 кВ.
При исследовании ультратонких срезов с помощью
просвечивающего микроскопа обычного типа
мощностью 50—100 кВ была получена такая богатая
информация, что биологи в течение последних двадцати лет
занимались в основном ее регистрацией и
расшифровкой. В результате этого потребность в высоковольтных
микроскопах исходила преимущественно от
промышленности, производящей различные материалы, и,
возможно, промышленные запросы обусловили главным
образом развитие этой отрасли электронной микроскопии.
Некоторые естествоиспытатели утверждают, что
высоковольтная электронная микроскопия не даст сколько-
нибудь полезной биологической информации. Другие же
выражают уверенность в том, что высоковольтная
электронная микроскопия имеет огромные возможности в
биологии и медицине [30].
ПРИМЕНЕНИЕ ВЫСОКОВОЛЬТНОЙ ЭЛЕКТРОННОЙ
МИКРОСКОПИИ В БИОЛОГИИ
В настоящее время исследования биологических
материалов с помощью высоковольтных электронных
микроскопов развиваются очень медленно. Развитие это
240
Глава 10
идет преимущественно в двух направлениях, которые
мы кратко опишем ниже.
1. Микроскопия живых объектов. Дюпуи и его
сотрудники во Франции разработали специальную
камеру, в которой во влажной атмосфере могут находиться
бактерии и другие живые объекты. Эта камера имеет
два окошка из тонкой пластмассы, через которые может
проходить электронный луч. В такой камере
исследовали и фотографировали бактерии, а затем извлекали их
и переносили в питательную среду для
культивирования. Авторы сообщили, что бактерии достаточно
хорошо выдерживают облучение потоком электронов,
остаются живыми, сохраняют способность к размножению
[31, 32]. Фотографии живых объектов, полученные к
настоящему времени, не несут пока какой-то специальной
информации, однако реализация возможностей этого
метода еще впереди. На фото VI представлен снимок
бактерии, полученный с помощью электронного
микроскопа мощностью 1 млн. В.
2. Трехмерная стереоскопическая электронная
микроскопия. Используя ультратонкие срезы, очень трудно
получить данные о трехмерной организации тканей,
клеток и органелл. Как уже указывалось в гл. 7, серийная
резка и фотографирование кусочка ткани объемом
1 мм3 потребовали бы 4-Ю8 снимков, а время, которое
пошло бы на создание трехмерной модели по этим
фотографиям, вообще трудно себе представить.
Более реальный подход — это стереофотография
толстых срезов, которые можно изучать с помощью
высоковольтных электронных микроскопов [30, 33, 34, 35,
37, 38]. Стереометоды необходимы для того, чтобы
разобраться в путанице перекрывающих друг друга
структур, которые видны при просмотре толстых срезов.
Исключительно высокая способность
высоковольтного электронного луча проходить через толстые объекты!
в сочетании с возможностью наклона объекта при
съемке и стереометодами (см. ниже) может дать все
возрастающее количество ценной информации. Эти методы
сопряжены с трудностями, но они не кажутся
непреодолимыми.
Краткий обзор других методов электронной микроскопии 241
НАКЛОННЫЙ ОБЪЕКТНЫЙ СТОЛИК
Если структурные компоненты объекта, например
мембраны, располагаются точно по оси электронного
луча, т. е. они идут строго перпендикулярно плоскости
среза, то контраст и разрешение их улучшаются
благодаря тому, что подлежащие структуры усиливают эти
характеристики на поверхности среза, а не уменьшают
их. Следовательно, эффекты наложения (суперпозиций)
могут быть сведены до минимума соответствующей
ориентацией нужных структур. Таким образом, используя
ускоряющее напряжение всего лишь 100 кВ, можно
получить разрешение выше 30 А на окрашенных срезах
толщиной 3000 А [40].
Очевидно, что огромные преимущества дает
возможность такого наклона объекта, при котором его
структурные компоненты могут быть расположены
параллельно электронному лучу. Новейшие модели
просвечивающих электронных микроскопов, в том числе и
высоковольтные микроскопы, могут быть оборудованы
специальными объектными столиками, которые дают
возможность наклонять объект под углом до 45° в двух
взаимно перпендикулярных направлениях, а в
некоторых случаях также обеспечивают поворот объекта на
360°. Наклоняя срез, можно точно установить в
электронном луче те структуры, которые проходят косо
через срез, например мембраны или нитевидные
структуры. Мембраны, лежащие под некоторым углом к
электронному лучу, дают размытое изображение. Если же
мембрана располагается вдоль оси луча, то в ней четко
выявляются поперечные структуры (фиг. 13).
Наклон объекта позволяет также фотографировать
структуры, находящиеся в тонком срезе (или в толстом,
если используется высоковольтный электронный
микроскоп), с нескольких позиций. Такие небольшие
образования, как рибосомы и зерна гликогена, могут целиком
располагаться внутри тонкого среза; наклоняя такой
срез в разных плоскостях, можно получить ценные
данные об их трехмерной структуре. Фотографируя одну
и ту же структуру под двумя разными углами, можно
получить фотографическую «стереопару»; при рассмат-
1^—977
242
Глава 10
ривании таких снимков в стереоскопе воспроизводится
трехмерная картина объекта. По данным Грея и Уил-
лиса [39], стереопару могут составить снимки,
сделанные под углом не более 20°; если этот угол превышает
20°, то полученные картины будут слишком отличаться
друг от друга и не дадут единого стереоскопического
изображения.
ФОТОГРАФИЧЕСКИЕ МЕТОДЫ УСИЛЕНИЯ
ДЕТАЛЕЙ ОБЪЕКТА
Ротационный метод Маркхема. Маркхем, Фрей и
Хиллз [43] предложили ротационный фотографический
метод для улучшения разрешения электронных
микрофотографий некоторых материалов. Если объект
обладает естественной радиальной симметрией, то его
симметричные детали можно усилить; для этого
фотографируют объект, затем поворачивают его на
определенное число градусов и повторно фотографируют на ту же
самую пластинку. В результате усиливаются
симметричные детали, тогда как те детали, которые не
являются симметричными, становятся " менее четкими.
Этот метод оказался очень полезным для выяснения
структуры некоторых вирусов. Однако, применяя его,
очень легко получить недостоверные результаты. Было
написано множество работ, основой которых послужили
исследования, выполненные на материале, который по
существу не способен в силу отсутствия необходимой
естественной симметрии дать достоверные результаты при
использовании ротационного метода (обзор и
обсуждение этого вопроса можно найти в работе Фридмена
[41]). Тем не менее ротационный метод Маркхема при
eFo правильном применении может оказаться очень
полезным.
Оптический дифрактометр для электронных
микрофотографий. При достижении предела разрешения
электронного микроскопа возникает проблема диффе-
ренцировки случайных шумов, а также фазово-контраст-
ных эффектов от истинных структур образца. Было
найдено, что отделить структуры от шума на электронных
Краткий обзор других методов электронной микроскопии 24$
микрофотографиях, сделанных при высоком
разрешении, можно с помощью метода оптической дифракции.
В результате был создан оптический дифрактометр для
электронных микрофотографий, основанный на
разработках профессора Р. Маркхема и доктора Р. Хорие.
Так же как в ротационном методе Маркхема, в данном
случае объект должен обладать некоторой
регулярностью структуры, например периодичностью или
симметрией. Этот метод позволяет также выявить эффекты
астигматизма, смещения объекта или фокусировки.
Подробно этот метод описан в работе Маркхема [42], в
которой имеются и соответствующие
библиографические ссылки.
Список литературы
Методы замораживания
1. Bishop W. R., Methodology of rapid freeze cleavage replication of
mammalian tissues and cells, Balzers High Vacuum Report No. 24,
1—19 (1969).
2. Branton £>., Fracture faces of frozen membranes, Proceedings of
the National Academy of Sciences of the U.S.A., 55, 1048—1056
(1966).
3. Branton D., Membrane Structure, Annual Review of Plant
Physiology, 20, 209—238 (1969).
4. Bullivant S,, The staining of thin sections of mouse pancreas
prepared by the Fernandez-Moran helium II freeze-substitution method,
Journal of Biophysical and Biochemical Cytology, 8, 639—647
(1960).
5. Bullivant S., In Some Techniques in Electron Microscopy, pp. 101—
146 (Edited by D. F. Parsons), New York and London, Academic
Press, 1970.
6. Bullivant S., Ames A., A simple freeze-fracture replication method
for electron microscopy, Journal of the Cell Biology, 29, 435—447
(1966).
7. Fernandez-Moran H., Electron microscopy of retinal rods in relation
to localization of rhodopsin, Science, New York, 129, 1284—1285
(1959).
8. Fernandez-Moran H., Low temperature preparation techniques for
electron microscopy of biological specimens based on rapid freezing
with liquid helium 11, Annals of the New York Academy of
Sciences, 85, 689—713 (1960).
9. Hanzon V., Hermodsson L. H., Freeze-drying of tissues for light
and electron microscopy. Journal of Ultrastructure Research, 4,
332—348 (1960).
16»
244
Глава 10
10. Malhotra S. К., In Cell Structure and its Interpretation, pp. 11—21
(Edited by S. M. McGee-Russell and K- F. A. Ross), London,
Edward Arnold, 1968.
11. Moor H., Freeze-etching. Balzers High Vacuum Report 2, 1—23,
Balzers, Principality of Liechtenstein, Balzers A. G., 1965.
12. Moor H., The performance of freeze-etching and the interpretation
of results concerning the surface structure of membranes and the
fine structure of microtubules and spindle fibres, Balzers High
Vacuum Report, 9, 1—11 (1966).
13. Moot H., Freeze-etching. International Review of Cytology, 25,
391—412 (1969).
14. Moor H., Muhlethaler K., Waldner H., Frey-Wyssling A., A new
freezing ultramicrotome, Journal of Biophysical and Biochemical
Cytology, 10, 1—13 (1961).
15. Northcote D. H., Lewis D. R., Freeze-etched surface of membranes
and organelles in the cells of pea root tips, Journal of Cell Science,
3, 199—206 (1968).
16. Pease D. C, Eutectic ethylene glycol and pure propylene glycol as
substituting media for the dehydration of frozen tissue, Journal of
Ultrastructure Research, 21, 75—97 (1967).
17. Rebhun L. I., Freeze-substitution: fine structure as a function of
water concentration in cells, Federation Proceedings, Federation of
American Societies for Experimental Biology, 24, Suppl., 15, S-217
to S-232 (1965).
18. Seno S., Yashizawa K., Electron microscopic observations on frozen-
dried cells, Journal of Biophysical and Biochemical Cytology, 8,
617—638 (1960).
19. Silva P. P. da, Branton D., Membrane splitting in freeze-etching,
Journal of Cell Biology, 45, 598—605 (1970).
20. Sjostrand F. S., Baker R. F., Fixation by freeze drying for electron
microscopy of tissue cells, Journal of Ultrastructure Research, 1,
239—246 (1958).
21. Steere R. L., Electron microscopy of structural detail in frozen
biological specimens, Journal of Biophysical and Biochemical
Cytology, 3, 45—60 (1957).
22. Stowell R. E. (Ed.), Cryobiology, Federation Proceedings
Supplement 15, Washington, Federation of American Societies for
Experimental Biology, 1965.
Получение реплик и оттенение
23. Bradley D. E., High resolution „shadow-casting technique for the
electron microscope using the simultaneous evaporation of platinum
and carbon, British Journal of Applied Physics, 10, 198—203 (1959).
24. Bradley D. E., In Techniques for Electron Microscopy, 2nd edn.,
Chap. 5 (Edited by D. H. Kay), Oxford, Blackwell Scientific
Publications, 1965.
25. Pease D. C, Histological Techniques for Electron Microscopy, 2nd
edn., Chap. 10, New York and London, Academic Press, 1964.
(Имеется перевод 1-го изд., Д. Пиз, Гистологическая техника в
электронной микроскопии, ИЛ, М., 1963.)
Краткий обзор других методов электронной микроскопии 245
Сканирующий электронный микроскоп
26. Boyde A., Wood С, Preparation of animal tissues for surface-
scanning electron microscopy, Journal of Microscopy, 90, 221—249
(1969).
27. Ileywood V. 11., Scanning electron microscopy in the study of plan)
materials, Micron, 1, 1—14 (1969).
28. Oatley С W., The scanning electron microscope, Scientific Progress
London, 54, 483—495 (1960).
29. Oatley С W., Nixon W. C, Pease R. F. W., Scanning electron
microscopy, Advances in Electronics and Electron Physics, 21, 181—
247 (1965).
Высоковольтная электронная микроскопия
30. Cosslett V. E., High voltage electron microscopy, Quarterly Review
of Biophysics, 2, 95—133 (1969).
31. Dupouy G., In Advances in Optical and Electron Microscopy,
Vol. 2, pp. 167—250 (Edited by R. Barer and V. E. Cosslett), New
York and London, Academic Press, 1968.
32. Dupouy G., Perrier F., Durrieu L., L'observation de la matiere vivan-
te au moyen d'un microscope electronique sous trd haute tension,
Compte rendu hebdomadaire des Seances de l'Acadcmie des
Sciences, Paris, 251, 2836—2841 (1960).
33.* Hama K-, A stereoscope observation of tracheal epithelium of mouse
by means of the high voltage electron microscope, Journal of Cell
Biology, 45, 654—649 (1970).
34.* Наша К-, Porter K. R-, An application of high voltage electron
microscopy to the study of biological materials, Journal de Microsco-
pie, 8, 149—158 (1969).
35.* Nagata F., Hama K-, Porter K- R-, Three-dimensional observation
of biological specimens with high voltage electron microscope,
Journal of Electron Microscopy, 18, 106—109 (1969).
36. Parsons D. F., In Some Biological Techniques in Electron
Microscopy, pp. 19—28 (Edited by D. F. Parsons), New York and
London, Academic Press, 1970.
37.* Porter K- R-, Hama K-, High voltage electron microscope study of
tissue sections, Journal of Cell Biology, 39, 157 (Abs.) (1968).
38.* Ris H., Use of the high voltage electron microscope for the study
of thick biological specimens, Journal de Microscopie, 8, 761—766
(1969).
Стереофотография и наклонный объектный столик
39. Gray E. G., Willis R. A., Problems of electron stereoscopy of
biological tissue, Journal of Cell Science, 3, 309—326 (1968).
40. Wachtel A. W., Gettner M. E., Ornstein L., In Physical Techniques
in Biological Research, Vol. Ill, Part A, p. 239 (Edited by
246
Глава 10
A. W. Pollister), New York and London, Academic Press, 1966.
См. также ссылки, помеченные звездочкой в разделе
«Высоковольтная электронная микроскопия».
Фотографические методы усиления деталей объекта
41. Friedman M. Н., A re-evaluation of the Markham rotation technique
using model systems, Journal of Ultrastructure Research, 32, 226—
236 (1970).
42. Markham R., In Methods in Virology, Vol. 4, pp. 503—529 (Edited
by Maramorosch and H. Koprowski), New York, Academic Press,
1968.
43. Markham R., Frey S., Hills G. H., Methods for the enhancement of
image and detail and accentuation of structure in electron miscro-
scopy, Virology, 20, 88—102 (1963).
ГЛАВА II
Повседневный уход за электронным
микроскопом
Число электронных микроскопов растет поистине
с астрономической скоростью. Эти приборы находят
применение не только в биологии, но и в металлургии,
геологии, технике, прикладных науках,, текстильной
промышленности, при производстве пластмасс и во многих
других отраслях хозяйства. Они применяются и в
фундаментальных физических, химических и биохимических
исследованиях. Электронные микроскопы использовали
также для исследования образцов лунных пород,
которые доставили космические корабли «Аполлон».
В биологии электронные микроскопы стали обычным
оборудованием медицинских и биологических
институтов, а также кафедр биологии. Земледелие и
садоводство, морская биология и естествознание — во всех этих
областях науки электронно-микроскопические
исследования приносят неоценимую пользу.
Объединенный британский комитет по электронной
микроскопии подсчитал, что в Великобритании к
началу 1970 г. использовались 766 просвечивающих
электронных микроскопов. Среди них наибольшее число
приборов английского производства (Associated Electrical
Industries — сокращенно AEI, Harlow, Essex), а также
электронные микроскопы других фирм: Philips
(Голландия), Siemens и Zeiss (Западная Германия^, Jeolco
и Hitachi (Япония).
Перспективы использования электронного
микроскопа беспредельны, поскольку во многих областях науки
эра электронно-микроскопических исследований
только-только начинается; хороший пример тому—пато-
морфология. Пока лишь немногие клиники используют
электронные микроскопы в целях диагностики. Другие
248
Глава 11
ожидают, когда будет разработано большее число
методов электронно-микроскопической диагностики и
когда станут доступными небольшие и недорогие
электронные микроскопы, дающие среднее разрешение.
С быстрым увеличением числа приборов
стремительно растет потребность в специалистах для их
обслуживания. В программы университетов, медицинских
институтов и техникумов включаются курсы обучения
методам электронной микроскопии. Потребность в опытных
специалистах, знакомых с повседневным
обслуживанием микроскопа, постоянно превышает их наличие, и
разрыв этот продолжает увеличиваться. Поэтому часто
приходится брать на работу совершенно необученных
сотрудников и обучать их в процессе работы.
Часто бывает так, что микроскоп приобретают
тогда, когда один или несколько сотрудников института
доводят свои исследования до такого уровня, на
котором использование электронного микроскопа
становится логическим продолжением этих исследований.
Возможно, что такие сотрудники никогда не работали на
электронном микроскопе и должны будут осваивать
методы работы на нем с азов. Незадолго до приобретения
микроскопа или во время его установки на работу
могут быть приняты техники и лаборанты для
обслуживания прибора и подготовки материала для исследования.
Сотрудников, которые будут обслуживать новый
микроскоп, часто посылают на краткосрочные курсы
(продолжительностью от 2 до 5 дней), которые
организуются фирмой, производящей эти приборы. Такие
курсы дают необходимые сведения по основам электронной
микроскопии и повседневному уходу за микроскопом.
Польза от таких курсов во многом определяется
качеством преподавания и их продолжительностью, а также
предыдущим опытом обучающихся. Тот, кто имеет
хорошую подготовку в области физики и электроники, а
вдобавок еще и некоторые практические навыки
обращения с точными приборами, естественно, извлечет
больше пользы, чем тот, кто не обладает ни такой
подготовкой, ни такого рода практическим опытом.
Последнему будет значительно труднее усвоить за время
обучения все необходимые подробности и навыки, особен»
Повседневный уход за электронным микроскопом 249
но если там, где он работает, нет никого, кто мог бы
в дальнейшем помочь ему советом.
Именно для такого человека предназначена
настоящая глава. При написании этой главы мы исходили из
того, что помимо курсов по общей биологии и химии
исследователь не имеет какого-либо специального
образования, а также что при установке электронного
микроскопа был заключен договор на обслуживание
прибора и что в обязанности техника входит только
повседневный уход за ним. В конце этой главы даны
ссылки на книги, в которых подробно излагаются вопросы,
касающиеся обслуживания электронного микроскопа,
и вопросы, связанные с выявлением его неисправностей.
ДОГОВОРЫ НА ОБСЛУЖИВАНИЕ
Обычно фирмы, производящие электронные
микроскопы, для удобства своих клиентов предлагают
заключать договоры на обслуживание. Такие договоры
особенно полезны в том случае, когда из работающих на
микроскопе нет никого, кто имел бы подготовку в
области электроники и техники. Электронный
микроскоп— это сложное, тонкое и очень дорогое
произведение инженерного искусства; в неопытных руках он
очень легко может выйти из строя.
Ясно, что решение вопроса о том, заключать ли
договор на обслуживание и что включать в такой договор,
зависит от того, сколько раз в год могут возникнуть
неполадки в микроскопе, которые не могут быть
устранены техником, обслуживающим его. К концу
гарантийного срока, составляющего обычно 1 г., становится
достаточно просто решить, стоит или нет заключать
договор на обслуживание. Обслуживание электронного
микроскопа— это дело специалиста, что особенно
справедливо в отношении самых современных приборов. Как
правило, чем проще управление микроскопом, тем
сложнее его обслуживание. Большинство из тех, кто
приобрел новый микроскоп, особенно если это биологи,
остаются довольны, подписав договор на обслуживание
по истечении гарантийного срока, и достаточно
разумны, чтобы не прервать его.
230
t.taea И
ЦЕНТРИРОВКА
Сразу же следует отметить, что самые полные
данные по центрировке и повседневному уходу за
электронным микроскопом содержатся в инструкции по его
эксплуатации, предоставляемой фирмой, выпускающей этот
микроскоп. В частности, в приборах, сконструированных
исключительно для биологических исследований, таких,
например, как электронный микроскоп AEI 801,
определенные операции центрировки производятся на заводе
или при установке микроскопа и не требуют внимания
со стороны работающего на нем оператора. Отдельные
узлы микроскопов разных типов отличаются друг от
друга, и могут также значительно различаться
последовательные этапы центрировки этих узлов. Большую
часть таких этапов можно осуществлять
несколькими путями. Метод, рекомендуемый фирмой,
представляет собой тот особый определенный порядок операций,
постоянная эффективность которого подтверждена
многолетней практикой. Любое отклонение от этого
порядка должно вводиться только с одобрения
представителя фирмы, занятого обслуживанием микроскопа.
К сожалению, не все инструкции по эксплуатации
микроскопов отличаются ясностью изложения. В
особенности это относится к инструкциям, переведенным
с другого языка. Кроме того, порой приводится лишь
порядок операций, которые должны быть выполнены,
без какой-либо попытки дать представление о том, для
какой цели необходима каждая отдельная операция.
Именно поэтому в данный раздел включено обсуждение
вопросов, связанных с центрировкой микроскопа, с тем.
чтобы дать читателю представление об этом довольно
сложном процессе. Его описание намеренно упрощено
в расчете на то, что более -сложные детали легче
усвоить позднее, после того как сложится обобщенная
картина, частью которой они являются. Когда это будет
сделано, следует ознакомиться с блестящими работами
по теории центрировки электронного микроскопа Зи-
геля [2], Шёстранда [6] и Мика [4].
Цель центрировки — добиться определенного
взаиморасположения узлов внутри колонны электронного
Повседневный уход за электронным микроскопом 251
микроскопа, позволяющего получить конечное
разрешение, которое способен дать данный прибор. Нарушение
центрировки служит причиной движения изображения,
что приводит к нерезкости и снижению разрешения.
В идеальном случае основной электронный луч1 должен
идти вдоль колонны микроскопа по прямой линии вниз,
причем ось его распространения должна совпадать с
механической и оптической осями микроскопа.
Существуют три вертикальные оси, которые следует
учитывать при центрировке электронного микроскопа.
1. Механическая ось, проходящая через вершину
нити катода, центр апертурной диафрагмы анода, центры
апертурных диафрагм конденсорной, объективной и
проекционной линз и центр люминесцентного экрана.
2. Магнитной осью (центром тока) называют ось,
проходящую через ту точку изображения, видимого па
люминесцентном экране, которая сохраняет
устойчивость, когда при постоянном напряжении меняется сила
тока в любой из линз, формирующих изображение (т. е.
объективной или проекционной линзах). Точки,
лежащие вне этого центра, будут вращаться вокруг него при
изменении тока. Этот центр представляет собой такую1
точку на изображении, в которой колебания тока в
линзах вызывают наименьшее смещение изображения.
Магнитные оси линз, формирующих изображение, должны
соответствовать друг другу и совместно определять
единую оптическую ось прибора.
3. Вольтажная ось (центр напряжения). Эта ось
относится к той точке изображения, которая остается
неподвижной при изменении напряжения электрического
тока в электронной пушке. При увеличении или
снижении напряжения точки, лежащие по периферии от
этого центра, будут двигаться в радиальном направлении.
Центр напряжения представляет собой такую точку, в
которой колебания высокого напряжения создают
минимальное смещение изображения. Это вторая
оптическая ось прибора.
1 Основной луч — центральный луч* который определяет
направление распространения излучения [2].
252
Глава 11
В идеальном случае для того, чтобы достичь
предельного разрешения, свойственного данному
электронному микроскопу, нужно совместить все три его оси.
Однако практически центры тока и напряжения редко
совпадают полностью из-за неточности изготовления
отдельных узлов микроскопа. Следить за тем, чтобы
несовпадение осей практически не сказывалось на
разрешении микроскопа, указанном в паспорте к данному
прибору,— дело фирмы, производящей микроскопы.
Поскольку эти две оптические оси точно не совпадают,
необходимо решить, какая из них должна быть совмещена
с механической осью микроскопа. Порядок
центрировки, рекомендуемый большинством фирм, связан с
совмещением центра тока (магнитной оптической оси) с
механической осью. (Однако для работы с высоким
разрешением некоторые операторы предпочитают
центрировать свои микроскопы по центру напряжения.)
Центрировка большинства приборов ведется, как
правило, сверху вниз по колонне микроскопа. При
регулировке в качестве контрольной точки используется
фиксированный центр люминесцентного экрана.
Сначала центрируется электронная пушка (катод и анод) по
отношению к двум конденсорным линзам (эти линзы
обычно объединены в одну конструктивную единицу).
Затем система пушка — конденсор (т. е. «осветитель-
пая» система) центрируется по отношению к
объективной линзе. И наконец, проекционные линзы (которые
иногда называют «промежуточной» и проекционной,
или П1 и П2) центрируются по отношению к
объективной линзе. На протяжении всех этих операций
необходимо следить за движением изображения на
люминесцентном экране при изменениях параметров тока,
проходящего через линзы. Если изображение уходит за
пределы экрана, то его нужно вернуть, изменив с
помощью соответствующих ручек управления наклон
пушки.
Наиболее ответственной частью операции
центрирования является совмещение осей пушки и копденсорных
линз с магнитной осью объективной линзы.. Если этого
не сделать достаточно точно, то возникнут чрезмерные
сферическая и хроматическая аберрации. Центрировка
Повседневный уход за электронным микроскопом 253
объективной и проекционной линз в некоторой степени
менее ответственная операция, однако при хорошем
совмещении их осей можно быть уверенным, что
изображение останется центрированным при смене
увеличений.
Из инструкции по эксплуатации, предоставляемой
фирмой, или у представителя фирмы, обслуживающего
микроскоп, необходимо выяснить:
1. Какие отдельные узлы микроскопа были
центрированы на производстве или при установке микроскопа
и не должны меняться впоследствии (центрированными
могут быть две или более линзы; в дальнейшем они
называются «фиксированные линзы»).
2. Какие отдельные операции по центрировке
должны выполняться только инженером, обслуживающим
микроскоп, при регулярных осмотрах или при разборке
колонны для чистки или ремонта.
3. Какие операции центрировки необходимо
проводить при повседневной работе с микроскопом. :
Именно выполнение этой последней группы
операций будет входить в задачу техника, занятого
ежедневным уходом за микроскопом. В современных
биологических микроскопах повседневные операции включают
зачастую только центрировку осветительной системы
(т. е. центрировку электронной пушки по отношению к
конденсорным линзам) и центрировку апертурных
диафрагм. Конечно, в деталях эти операции будут
различны в зависимости от типа микроскопа.
ОПАСНОСТЬ РЕНТГЕНОВСКОГО ОБЛУЧЕНИЯ
Рентгеновские лучи возникают при работе
электронного микроскопа, когда ускоренные электроны
бомбардируют любое препятствие, встречающееся на их пути.
Анодная диафрагма, диафрагма второй конденсорной
линзы, держатель образца, диафрагма объективной
линзы, люминесцентный экран — все это зоны
взаимодействия с электронами. Для защиты оператора
электронного микроскопа от рентгеновского облучения
производится тщательное экранирование колонны, а в
смотровые люки вставляются свинцовые стекла. Следо-
254 Глава 11
вателыю, при хорошем экранировании и центрировании
прибора, когда электронный микроскоп работает
нормально, опасности рентгеновского облучения
практически не существует. Однако при выполнении некоторых
этапов центрировки возникает опасность облучения
избыточным количеством рентгеновских лучей, если не
придерживаться определенных условий работы с
электронным потоком и ускоряющим напряжением. Эти
условия должны быть перечислены в инструкции по
эксплуатации микроскопа, и их необходимо строго
соблюдать.
Следует постоянно помнить, что рентгеновское
излучение может достичь опасного уровня в том случае,
когда прибор работает без диафрагмы конденсорной линзы
или с выключенной первой конденсорной линзой.
Для того чтобы не сомневаться в надежном
экранировании микроскопа, всегда полезно проверить вновь
установленный микроскоп с помощью счетчика Гейгера
и добиться того, чтобы в течение первых ста часов
работы обслуживающий его персонал носил индикаторы
излучения [4].
ИСПЫТАНИЕ РАБОТЫ МИКРОСКОПА ПОСЛЕ
ОКОНЧАНИЯ ЕГО ЦЕНТРИРОВКИ
После центрировки колонны микроскопа необходимо
убедиться в том, что 1) любые ошибки в центрировке,
которые могли быть допущены, не столь существенны,
чтобы нарушать необходимое разрешение, и 2) нет
значительного загрязнения прибора. Такую проверку
работы микроскопа следует делать после каждой
центрировки. Испытания проводятся с помощью тонкой
углеродной перфорированной пленки. Ширина минимальной
дифракционной полосы, измеренной на негативе,
полученном при самом большом увеличении, укажет на
степень разрешения, которую может дать прибор при
существующих условиях его работы.
Если ширина такой полосы укажет на
недостаточность разрешения для предполагаемого исследования,
микроскоп следует центрировать заново.
Перефокусировка дифракционной полосы в одном направлении и
Повседневный уход за электронным микроскопом 255
недофокусировка — в другом, лежащем под прямым
углом к первому, обусловливает астигматизм объективной
линзы, который следует компенсировать. При условии,
что загрязнение образца и его окружения невелико,
этот астигматизм может быть компенсирован с
помощью корректора астигматизма (гл. 5). Если
астигматизм не поддается коррекции, то необходимо заменить
диафрагму объективной линзы. Если и после этого не
удается-добиться коррекции астигматизма, то нужно
выявить источник загрязнения в районе образца
(например, на держателе образца, стержне диафрагмы
объективной линзы или экранирующем кожухе) и
удалить его.
Медленное движение образца (дрейф) может быть
причиной нерезкости изображения, но это движение не
всегда заметно на глаз. Дрейф можно выявить при
двукратном фотографировании отверстия на одну и ту
же пластинку с интервалом в две минуты: если
образец движется, то будет видно, что отверстие сместилось
вбок. Эта проба позволяет также определить скорость,
с которой загрязняется образец. Скорость загрязнения,
выраженная в /с, будет равна частному от деления
разности диаметров отверстий, выраженной в
ангстремах, после двухмииутного воздействия электронного
луча па время, выраженное в секундах. Скорость
загрязнения образца в микроскопе, не имеющем устройства,
предупреждающего загрязнение, не должна превышать
1 А/с. Противозагрязнителыюе устройство должно
снижать скорость загрязнения до 0,1—0,01 А/с и менее
[4].
КАЛИБРОВКА УВЕЛИЧЕНИЯ
Действительное увеличение микроскопа может
значительно отличаться от показаний на шкале ручки
увеличения и в лучшем случае соответствует этим
показаниям с точностью ±5%. Это обусловлено целым рядом
причин, в том числе колебаниями тока в линзах и
нестабильностью высокого напряжения, а также
различиями в положении образца на оси микроскопа. От
правильной калибровки увеличения зависят и точное опре-
266 Глава It
деление разрешения микроскопа, и точность измерения
структур на микрофотографиях.
Необходимо периодически заново определять
увеличение микроскопа для каждого положения ручки
увеличения, особенно когда предполагается работа при
высоком разрешении или необходимо выполнить точные
измерения.
Калибровку удобно производить, фотографируя
реплику дифракционной решетки, расстояния между
линиями которой точно известны. Реплика
фотографируется при каждом положении ручки увеличения, и для
каждого из этих положений производится целый ряд
измерений, которые усредняются. Реплики
дифракционных решеток могут быть изготовлены в лаборатории,
однако это трудно сделать с достаточной точностью.
Проще приобрести одну реплику у фирмы,
поставляющей материалы для электронной микроскопии. Если с
репликой бережно обращаться, то она прослужит
несколько лет.
Калибровка с помощью реплики дифракционной
решетки становится затруднительной при больших
увеличениях; в этом случае рекомендуется использовать
другие типы калибровочных образцов. Различные методы
калибровки увеличений подробно обсуждаются в
работах Мика [4] и Шёстранда [6].
НЕКОТОРЫЕ ОБЩИЕ СВЕДЕНИЯ
О ПОВСЕДНЕВНОМ УХОДЕ ЗА МИКРОСКОПОМ
КОГДА МИКРОСКОП СЛЕДУЕТ ОСТАВИТЬ В ПОКОЕ
Если микроскоп работает исправно (т. е. дает
разрешение, требуемое для выполняемого исследования), то
лучше всего оставить его в покое до того момента, пока
не возникнет достаточно веская причина, заставляющая
что-то делать с ним. Каждый раз, когда открывают
колонну, возникает возможность ее загрязнения. После
того как колонну открывали, требуется несколько дней
для полного удаления из нее воздуха и для того, чтобы
получить необходимый вакуум. При разборке колонны
появляется возможность сильно нарушить центрировку
Повседневный уход за электронным микроскопом 257
или повредить тонкие детали при ее сборке. Частота,
с которой следует производить чистку микроскопа,
зависит от используемого для повседневной работы
вакуума, чистоты воздуха и воды в лаборатории, а также
от числа отснятых пластинок или пленок. Однако, если
микроскоп не используется круглосуточно,
по-видимому, нет необходимости разбирать и чистить всю
колонну чаще чем 1 раз в год. В промежутках между
полными разборками колонны (их делает инженер,
обслуживающий микроскоп) возможна обычная чистка,
ограниченная теми узлами колонны, которые
располагаются выше объективной линзы (камера электронной
пушки, защитный экран катода, анод), и теми частями,
которые могут быть извлечены из колонны без ее
разборки, например конденсорных и объективной диафрагм,
держателя образца. Другими словами, нет
необходимости извлекать конденсорные линзы из колонны
микроскопа в промежутках между его капитальными
осмотрами.
Любая деталь, которая вводится в колонну,
должна быть идеально чистой и совершенно сухой; ее
никогда нельзя трогать пальцами. Чистые объектодержателн
и стержни апертурных диафрагм хранятся до введения
их в микроскоп в присутствии влагопоглотителей. Дело
в том, что жир с пальцев и другая грязь будут
испаряться в вакууме и увеличат загрязненность внутренних
поверхностей колонны микроскопа. Соединения,
которые образуются при бомбардировке электронами
веществ, загрязняющих колонну, могут приобретать
электрический заряд, достаточный для того, чтобы исказить
изображение и снизить разрешение. В этом отношении
особенно много неприятностей приносят загрязнения
деталей объектодержателя, который вводится в поле
объективной линзы. Если фотографические пластинки или
катушечная пленка не были достаточно хорошо
высушены, то с ними в колонну заносятся водяные пары.
Фотографические пластинки должны быть высушены
в вакууме или в присутствии такого влагопоглотителя,
как пятиокись фосфора, по крайней мере в течение 2 ц
перед введением их в ко тонну микроскопа; катушечнаа
пленка должна сушиться более продолжительное время.
17—977
258 ... Глава 11
■■ После извлечения из сушилки пластинки необходимо
сразу помещать в колонну микроскопа, поскольку
пятиминутное их пребывание при нормальном
атмосферном давлении целиком сводит на нет весь эффект
сушки.. В некоторых лабораториях при исследованиях с
высоким разрешением для ликвидации вакуума в камеру
для сушки пластинок вводят не воздух, а сухой азот.
При этом азот образует вокруг пластинок защитный
бЛой, который предотвращает поглощение влаги
фотоэмульсией при переносе этих пластинок из сушилки в
микроскоп. С той же целью можно вводить в колонну
микроскопа сухой азот, чтобы довести давление в ней
до уровня атмосферного.
" Брать детали, вводимые в колонну микроскопа, нуж-
но> используя либо чистые белые нейлоновые или
хлопчатобумажные перчатки, либо неворсистую бумагу.
Детали, которые на время вынимают из колонны
микроскопа, следует класть на неворсистую бумагу в
защищенном от пыли месте. Если колонна открывается
сверху,: то ее необходимо прикрыть, лучше всего чистой
металлической пластинкой, с тем чтобы предотвратить
попадание в- колонну пылевых частиц.
В идеальном случае электронно-микроскопическая
лаборатория должна быть спланирована так, чтобы
количество пыли и других загрязнений было
минимальным. Чтобы пыль не скапливалась, поверхность стен
должна быть гладкой; нужна вентиляционная система,
подающая фильтрованный воздух.
Расписание и протоколы обслуживания
Необходимо составлять расписание обслуживания
микроскопа, соответствующее потребности данной
лаборатории. Некоторые процедуры нужно делать
ежедневно, Другие — раз в неделю или раз в месяц. Если
микроскоп работает постоянно, то диафрагмы объективных
^йнз, вероятно, надо менять ежедневно. Если скорость
загрязнения образца велика или выполняются работы
щри высоком разрешении, то за один день приходится'
иногда несколько раз сменить отдельные диафрагмы.
Под-рукой всегда должны-быть чистые стержни, снаб-
Повседневный уход за электронным микроскопом 259
женные чистыми диафрагмами. Их следует держать су-'
хими и очищенными от пыли в. чистой закрытой про-1
бирке.
Влагопоглотители для ротационного насоса и каме-'
ры, в которой сушатся фотографические пластинки, нуж-;
но менять по меньшей мере раз в неделю. Другие работы,
такие, как чистка камеры электронной пушки и анода,
можно выполнять тогда, когда при перегорании нити
макала возникает необходимость открывать колонну.
Однако если оператору необходимо спешно продолжить*
работу на микроскопе, то такая чистка может быть вы-;
полнена в другое время, с интервалом приблизительно
в один месяц.
Контрольные измерения силы тока и напряжения
также необходимо делать ежемесячно и сохранять
протоколы, измерений, с тем чтобы сравнить их с
показателями, которые будут получены при очередной провер--
ке микроскопа обслуживающим его инженером.
Ежемесячно нужно также измерять скорость загрязнения
образца, чтобы убедиться, что эта скорость не увеличив
вается. Необходимо записывать даты смены нити нака~
ла; по этим датам возможно будет приблизительно'
предсказать, когда произойдет перегорание нити. Если
нить перегорает очень часто, то это может свидетельств
вовать об ухудшении вакуума, создаваемого
диффузионным насосом. Нужно подробно записывать обо всех
возникающих неполадках в микроскопе и хранить ия-
для сведения.
СМЕНА НИТИ НАКАЛА
Срок службы нити накала различен и зависит от
условий ее эксплуатации. Считается, что нормальный срой
службы нити накала составляет примерно 25 ч. Испаре-'
ние металла с поверхности нити, так же как и
окисление, которое происходит вследствие наличия в колонне'
микроскопа остаточных молекул газа и водяных паров,
снижает срок службы нити.
Для того чтобы сберечь время, надо держать
готовый запасной катод, который сразу можно поставить %■
колонну, как только сгорит нить, иакала. Он должёй
17*
260
Глава И
быть чистым, с точно установленной и
отцентрированной нитью в соответствии с указаниями инструкции по
эксплуатации. Весьма важным является положение
верхушки нити пакала по отношению к апертуре
защитного экрана катода, которое различно у разных
микроскопов.
Когда сгорает нить, электронный луч исчезает,
стрелка прибора, измеряющего ток накала нити, падает
до нуля. Незадолго перед этим может наблюдаться
мерцание луча, но нить может сгореть и внезапно. Ручку
прибора, измеряющего ток накала нити, следует
установить в исходном положении и поставить
переключатель тока накала в положение «выключено».
Необходимо выключить высокое напряжение, отключить
диффузионный насос от колонны и впустить воздух в колонну, как
это указано в инструкции по эксплуатации микроскопа.
Когда давление в колонне сравняется с атмосферным,
камера электронной пушки может быть открыта.
Предупреждение: на электронной пушке
может сохраняться остаточный заряд.
Чтобы избежать тяжелой электротравмы, снимите заряд,
прикоснувшись к внутренней поверхности колонны и
защитному экрану катода отверткой с изолированной
ручкой.
Предупреждение: катодный узел может
быть очень горячим. Вынимать его следует
осторожно, пользуясь чистой тканью или бумажной
салфеткой, и отложить в сторону. Теперь в камеру
электронной пушки вставляют запасной катодный узел.
Проверьте, чтобы камера электронной пушки и фарфоровые
изоляторы были чистыми и свободными от ныли и
чтобы анодная диафрагма была отцентрирована. Если
анодная и кондепсорная диафрагмы загрязнены, то их
необходимо вычистить и сразу поставить на место в
соответствующем порядке. Затем закрывают камеру
электронной пушки и откачивают воздух из колонны. Когда
будет достигнут необходимый вакуум, можно включить
ток накала нити. Если нить была правильно
центрирована и не сдвинулась при нагреве, то должен
появиться электронный луч. Если он не появляется, то нужно
снова открыть колонну и проверить положение нити на-
Повседневный уход за электронным микроскопом 261
кала. Обычно на заводе нити «прокаливаются», чтобы
сиять напряжение в них, поэтому при нагревании нити
током маловероятно, что она будет двигаться. Если же
пить смещается настолько сильно, что приходит в
соприкосновение с защитным экраном катода, то она
снова мгновенно сгорает.
Если луч появляется и при этом электронная
пушка правильно центрирована, то освещение должно
достигнуть максимальной яркости и сохранять эту интен-
ЛЛЛ
А 5 В
Фиг. 16. Нить катода после перегорания в результате: 1) обычного
испарения металла (А); 2) избыточного количества газа в колонне
микроскопа (Б); 3) перенакала, нити (В).
сивность по мере увеличения тока. Необходимо
проверить центрировку диафрагмы конденсорной линзы и
исправить астигматизм конденсорной и объективной линз.
После этого может быть возобновлена нормальная
работа на микроскопе.
Узел нити накала, содержащий сгоревшую пить,
надо вычистить, поставить в него новую нить и
отцентрировать ее, подготовив к использованию. Внутренняя
поверхность катодного экрана будет покрыта
вольфрамом, испарившимся из нити, а также обычными
загрязнениями, содержащими углеводороды. Если загрязнение
не слишком велико, то его можно удалить с помощью
ультразвука, как описано в разделе, посвященном
методам очистки.
Осмотр сгоревшей нити покажет, чем вызвано
перегорание нити: нормальным испарением металла,
слишком высоким давлением газа в колонне или перекалом
(фиг. 16). Обычно нить перегорает с одной стороны
независимо от того, что послужило причиной этого. Края
разрыва нити будут ровными, если причиной ее перего-
1*-877
262
Глава 11
рания было нормальное испарение, зазубренными —
если перегорание было вызвано повышением давления
газа, и оплавленными в форме горошин — если причиной
послужил перенакал.
ЦЕНТРИРОВКА ДИАФРАГМ КОНДЕНСОРНОЙ
И ОБЪЕКТИВНОЙ ЛИНЗ
Если диафрагма коидепсорной линзы неправильно
отцентрирована, то при вращении рукоятки тонкой
фокусировки конденсора луч будет перемещаться поперек
поля, вместо того чтобы равномерно и концентрически
распространяться и сжиматься вокруг центра
люминесцентного экрана. Центрируйте диафрагму с помощью
соответствующих ручек. Если луч после центрировки
диафрагмы будет иметь не круглую, а эллиптическую
форму, то следует исправить астигматизм конденсора,
перемещая соответствующие ручки.
Если апертура объективной линзы смещается от
центра более чем на одну треть своего диаметра, то это
может нарушить коррекцию астигматизма объективной
линзы и даже перекрыть луч. Положение диафрагмы
объективной линзы надо время от времени проверять.
МЕТОДЫ ЧИСТКИ ЭЛЕКТРОННОГО МИКРОСКОПА
Существует целый ряд методов чистки различных
частей электронного микроскопа, в связи с чем
отдельные детали этого процесса могут быть различными в
разных лабораториях. Прежде чем приступить в первый
раз к чистке какой-либо части микроскопа, необходимо
обратиться за советом к представителю фирмы,
обслуживающему микроскоп.
Самое главное — это знать, чего нельзя делать. В
частности, не имея опыта, нельзя трогать какие-либо
части линз. Представитель фирмы, само собой
разумеется, продемонстрирует те методы, которые должны быть
использованы.
Общепринятые методы чистки, дающие хорошие
результаты, включают обработку ультразвуком тех дета-
Повседневный уход за электронным микроскопом 263
лей, размеры которых позволяют поместить их в
контейнер ультразвукового генератора, и тщательную
полировку слишком крупных или слишком сильно
загрязненных деталей.
Полировка. Полировка сильно загрязненных деталей
или тех деталей, которые слишком велики и не могут
быть очищены ультразвуковой обработкой, может быть
выполнена с помощью высококачественной не
содержащей абразивных веществ полировочной пасты
(например, марки Silvo), нанесенной па мягкую ткань. Ни в'
коем случае нельзя использовать такие абразивы, как
наждак или карборунд. Участки, которые трудно
очистить с помощью ткани, можно очищать ватным
тампоном, навернутым на деревянную палочку. После
полировки детали нужно хорошо вымыть в растворе детер-
гената и тщательно сполоснуть дистиллированной водой.
Детали насухо протирают мягкой тканью или сушат в
сушильном шкафу; при этом температура не должна
превышать 40 °С.
Очистка с помощью ультразвука. Основа
ультразвукового генератора — это небольшой бак, который
вибрирует с высокой частотой (от 10 до 100 кГц1) вследствие
преобразования электрического тока. Вибрация,
возникающая в стенках бака, передается жидкости
(обычно это водопроводная вода), налитой в бак до уровня
примерно 2,5 см. Детали, подлежащие очистке,
помещают в контейнер и заливают моющим раствором.
Контейнер опускается в бак, так что дно контейнера
погружается в заполняющую его водопроводную воду.
Контейнер подвешивается таким образом, что он не
касается стенок бака. Вибрация, возникающая в воде,
передается через стеклянные стенки контейнера жидкости,
окружающей детали, которые должны быть очищены.
Вибрация мягко, по эффективно удаляет загрязнения
с деталей.
Предупреждение: ультразвуковые вибрации
могут повреждать ткани человеческого организма, так
что не прикасайтесь к работающему генератору.
1 1 кГц = 1000 циклов в 1 с.
1 п*
234
Глава И
Очень важно использовать моющие растворители,
которые могут быть полностью удалены при
последующей промывке, иначе остающиеся молекулы
растворителя будут испаряться в колонне микроскопа и
увеличивать ее загрязненность.
Предупреждение: ни в коем случае нельзя
употреблять в генераторе такие растворители, как
ацетон или эфир. Вибрация увеличит испарение этих
веществ, и возникнет опасность пожара, взрыва или
отравления их парами.
Фирма, выпускающая микроскопы серии AEI,
рекомендует использовать два хороших и безопасных
моющих раствора, которые дают успешные результаты:
1) растворитель жиров 1,1,1-трихлорэтан (Inhibisol) и
2) аммонийный детергент, действующий как слабое
протравливающее вещество (Quadralene instrument
cleaner).
Было найдено, что хорошие результаты получаются
при использовании следующего метода:
1. В течение 1 мин обрабатывают ультразвуком в
Inhibisol.
2. Высушивают, обдувая воздухом комнатной
температуры, который поступает из компрессорной
установки, подающей фильтрованный воздух.
3. В течение 2 мин обрабатывают ультразвуком в
10%-ном растворе Quadralene, приготовленном на
холодной воде.
4. Тщательно промывают в дистиллированной воде.
5. Высушивают, обдувая воздухом.
6. В течение 1 мин промывают в свежей порции
Inhibisol.
При очистке нельзя использовать деионизованную
воду; дистиллированную воду нужно получать в
стеклянном, а не в металлическом дистилляторе.
Чистка апертурных диафрагм линз. После
предварительной очистки ультразвуком, как было описано выше,
молибденовые диафрагмы, используемые в конденсор-
ной и объективной линзах, должны очищаться путем
нагревания в вакууме. Это удобно делать в вакуумной
камере для напыления, помещая диафрагмы вогнутой
стороной вниз в молибденовую вганночку, которая под-
Повседневный уход за электронным микроскопом 265
вешивается между электродами (ванночка
предварительно, до помещения в нее диафрагм, должна быть
очищена нагреванием, как это описано ниже).
Деревянные заостренные палочки или зубочистки удобно
использовать для того, чтобы вынимать апертурные
диафрагмы из ванночки, если их нельзя просто вытрясти из
нее.
При пропускании через ванночку тока силой около
65 А в течение примерно 5 с диафрагмы нагреваются
до желтого каления (приблизительно 1200°С). Затем
диафрагмы охлаждают до комнатной температуры,
вынимают из вакуумной камеры и просматривают под
микроскопом с объективом ХЮ> для того чтобы
убедиться, что они чистые. Если загрязнения остаются, то
всю процедуру прокаливания можно повторить. Если
после трехкратного прокаливания загрязнение все еще
остается, то диафрагмы следует в'ыброснть.
УХОД ЗА НАСОСАМИ
В диффузионном насосе нужно время от времени
менять масло, что обычно делает инженер,
обслуживающий микроскоп, при периодических осмотрах. Если
происходят нарушения охлаждающей системы
диффузионного насоса, то перегревание может привести к
крекингу масла, которое после этого необходимо сменить
(в результате крекинга длинные молекулы
углеводородов с высокой точкой кипения распадаются па более
короткие молекулы с низкой точкой кипения).
Необходимо следить, чтобы уровень масла в
ротационном насосе находился па отметке смотрового
стекла; если масло мутнеет вследствие попадания в него
воды, его необходимо сменить.
ВЛАГОПОГЛОТИТЕЛИ
Влагопоглотители, используемые в камерах для
сушки фотографических пластинок и в ротационных
насосах, надо периодически обновлять. Сам вид влагопо-
глотителя может часто подсказать, когда необходима
его замена. Так, например, снликагедь меняет голубой
266 Глава 11
цвет на желтый, а влажная пятиокись фосфора
затвердевает.
Предупреждение: используя безводную
пятиокись фосфора, надо особенно следить за тем, чтобы в
него не попала вода, так как может произойти взрыв.
Когда это вещество поглотило значительные
количества паров воды и затвердело, его можно смыть из
чашки водопроводной водой, однако даже это надо делать
очень осторожно.
ВОДНЫЕ ФИЛЬТРЫ
Если микроскоп оборудован устройством для
фильтрации воды, поступающей в охладительную систему, то
это устройство следует периодически чистить, чтобы
обеспечить необходимый ток воды. Прекращение
подачи воды к линзе быстро вызывает ее перегревание и
повреждение обмотки катушек линзы.
ВОЗДУШНЫЕ ФИЛЬТРЫ
Если силовой блок имеет вентилятор, снабженный
фильтром, то этот фильтр также надо регулярно чистить
и заменять. Это очень важно, поскольку необходима
непрерывная подача холодного воздуха.
ОБНОВЛЕНИЕ ЛЮМИНЕСЦЕНТНОГО ЭКРАНА
Примерно через каждую тысячу часов работы
необходимо обновление люминесцентного вещества,
покрывающего экран электронного микроскопа. Возможно,
что фирма, выпускающая микроскоп, рекомендует
подходящий люмипесцирующии состав и даст инструкцию
по его использованию. В - случае отсутствия такого
состава рекомендуем обратиться к работе Мика [4].
Особо мелкозернистые экраны применяются все шире.
Изготовить такой экран своими силами трудно, и лучше
приобрести его у фирмы, выпускающей микроскопы.
Предупреждение: поскольку сульфид цинка и
сульфид кадмия, обычно входящие в состав
люминесцентных смесей, ядовиты, нужно очень осторожно обра-
Повседневный уход за электронным микроскопом 267
щаться с экраном и составом для его покрытия, чтобы'
избежать распыления люминесцирующих веществ в
воздухе. После окончания работы с этими веществами
надо тщательно вымыть руки.
БЛОК ВЫСОКОГО НАПРЯЖЕНИЯ
Периодически нужно измерять напряжение и силу
тока в блоке высокого напряжения с помощью
соответствующих приборов; данные таких замеров
записываются, что помогает выяснить причины возможных
неполадок. Методику измерений нужно освоить под
наблюдением представителя фирмы, обслуживающего
микроскоп. Блок высокого напряжения, Дающий ток в
100 000 В, может быть СМЕРТЕЛЬНО ОПАСЕН ДЛЯ
НЕОПЫТНОГО РАБОТНИКА, который должен
допускаться только к снятию показаний приборов.
СПРАВОЧНИКИ
Каждый работающий в
электронно-микроскопической лаборатории должен иметь под рукой некоторые
справочные книги, в которых подробно излагаются
вопросы повседневного ухода за микроскопом и методики
подготовки образца для исследования. Список таких
книг приведен в конце этой главы.
НЕКОТОРЫЕ НАИБОЛЕЕ ЧАСТО ВСТРЕЧАЮЩИЕСЯ
НЕИСПРАВНОСТИ И ИХ УСТРАНЕНИЕ
В табл. 6 приведены некоторые наиболее часто
встречающиеся неполадки, доставляющие много хлопот
электронным микроскопистам. Этот список далеко не
полный, и в нем указаны лишь наиболее вероятные
причины неисправностей.
Таблица 6-
Электронный
Некоторые наиболее часто встречающиеся неполадки
Признаки
луч отсутствует при
включенном напряжении
накала
Электронный
работы
i
луч исчез во
ннти
время
Возможные причины
1. Выключено высокое напряжение
2.: Перегорела ннть накала
3. Поднят люминесцентный экран
4. Закрыта камера объекта
5. Луч чем-то перекрыт
6. Расфокусирован кондесор 2
7. Не установлено минимальное
увеличение
8. Стержень, подающий объект, не
доходит до конца
9. Нецентрирована колонна
1. Выключилось высокое напряжение
вследствие низкого давления
воды или нарушения вакуума
2. Сгорела нить накала
&_ Стержень, подающий объект, не
и их устранение
Способы устранения
Включите высокое напряжение
Проверьте показания прибора,
измеряющего ток в цепн нити накала;
если тока нет, смените нить накала
Опустите экран
Откройте камеру объекта
Подвиньте образец, чтобы убедиться,
что переплет сетки не перекрывает
луч. Не вложены ли в объектодер-
жатель две сетки одновременно?
Проверьте положение анертурных.
диафрагм конденсорной и
объективной линз
Сфокусируйте конденсор 2
Установите минимальное увеличение
Отцентрируйте заново стержень
Проверьте центрировку колонны
Найдите причину н устраните ее
Смените нить накала
Отцентрируйте заново стержень-
Поперечное сечение луча имеет
овальную форму или
деформировано
Луч мерцает
4. Случайно сдвинута одна из ручек
. центрировки
5. Смещена диафрагма объективной
линзы
1. Требует коррекции астигматизм
конденсора
2. Слишком велико загрязнение
конденсора и астигматизм не
поддается коррекции
1. Перегорает нить накала
2. Загрязнена электронная пушка
илн камеры электронной пушки
3. Напряжение нестабильно
Снижение освещенности
При измеиенни тока конденсора
луч перемещается поперек
экрана
При изменении фокусировки
объективной линзы изображение
движется поперек экрана
При изменении увеличения
изображение движется поперек
экрана
Изображение пе фокусируется
1. Нарушена центрировка
электронной пушкн
2. Нить накала слишком удалена от
апертурнон диафрагмы защитного
экрана катода
Нецентрирована диафрагма
конденсора
Конденсорная линза пе точно
центрирована по отношению к
объективной линзе
Проекционная линза не точно цент-
риронаиа по отношению ко всей
колонне микроскопа
1. Нарушено положение ручки грубой
фокусировки
Проверьте положение ручек
Центрируйте заново диафрагму
объективной линзы
Исправьте астигматизм конденсора
Проверьте, не загрязнены лн
диафрагма конденсора, анертурный
стержень и экранирующая трубка
Подождите немного
Вычистите узел электронной пушки
Вызовите инженера, обслуживающего
микроскоп
Отрегулируйте наклон анода или
пушки
Отрегулируйте высоту нитн
Заново центрируйте диафрагму
конденсора
Исправьте центрировку
Исправьте центрировку
Исправьте фокусировку, переходя
постепенно от ручкн грубой
фокусировки к ручке тонкой фокусировки
Продолжение
Признаки
Размытость дифракционной
полосы, расположенной вокруг
отверстия в углеродной пленке,
в одном направлении
Размытость дифракционной
полосы вокруг всего отверстия в
углеродной пленке
Изображение «плывет»
Короткий срок службы нити
накала
Возможные причины
2. Астигматизм объективной линзы
3. Неверно установлен объектодер-
жатель
4. Неполадки в электрических сетях
Механическая вибрация вблизи
микроскопа или нестабильность
магнитного поля в одном
направлении
Нестабильность тока в линзах или
нестабильность высокого
напряжения
1. Тепловое расширение образца или
сетки под воздействием
электронного луча
2. Нарушена целостность образца
3. Загрязнение образца
4. Загрязнение объектодержателя
5. Неисправность столика объекта
1. Слишком высокое напряжение
тока, питающего нить накала
Способы устранения
Устраните астигматизм или вставьте
чистые диафрагмы и затем
устраните астигматизм
Проверьте положение
объектодержателя
Вызовите инженера,
обслуживающего микроскоп
Выявите источник вибрации или
причину нестабильности магнитного
ноля и устраните их
Вызовите инженера,
обслуживающего микроскоп
11росмотр.ите участок, уменьшив
интенсивность луча. Смещение
изображения может прекратиться
Попробуйте найти другой участок
сетки или другой срез
Смените образец
Очистите объектодержатель
Вызовите инженера,
обслуживающего микроскоп
Не повышать напряжения после
достижения насыщения
Разряды в электронной пушке
Высокая скорость загрязнения
объекта
Слой загрязнения, заметный на
люминесцентном экране и
смотровом люке
2. Недостаточный вакуум
3. Неправильное положение нити
накала относительно апертуры
защитного экрана катода
1. Недостаточный вакуум
2. Загрязнение камеры электронной
пушки
Загрязнение объектодержателя
2. Недостаточный вакуум
3. Крекинг масла п диффузионном
насосе
Попадание масла в колонну вследст-
иие неисправностей клапана,
отделяющего диффузионный насос от
колонны; повреждение
электрической линии; неисправность
охладительной системы
диффузионного насоса
Контролируйте снижение вакуума,
манипулируя различными
ручками и наблюдая за индикатором
вакуума
Причиной может служить также
загрязнение насоса. Для ликвидации-
неполадок, возможно, потребуется
помощь инженера
Отрегулируйте положение нити
накала
Контролируйте снижение
как описано выше
Удалите загрязнение
вакуума,
Очистите объектодержатель
Контролируйте снижение вакуума,
как описано выше
Прочистите насос, залейте свежее
масло (обратитесь за помощью к
инженеру, обслуживающему
микроскоп)
Вызовите инженера,
обслуживающего микроскоп: необходима
разборка и чистка колонны и
диффузионного насоса
272
Глава U
Список литературы
Общая литература
1. Agar A. W., In Techniques for Electron Microscopy (Edited by
D. H. Kay), Oxford, Blackwell Scientific Publications, 1965.
2. Siegel В. М., In Modern Developments in Electron Microscopy,
pp. 66—70 (Edited by В. М. Siegel), New York and London,
Academic Press, 1964.
Справочная литература, рекомендуемая для использования
в электронно-микроскопической лаборатории
3. Kay D. H. (Ed.), Techniques for Electron Microscopy, Oxford, Black-
wells Scientific Publications, 1965.
4. Meek G. A., Practical Electron Microscopy for Biologists. See
particularly, pp. 242—243; 268—280; 335—372, London and New York,
Wiley-Interscience, 1970.
5. Pease D. C, Histological Techniques for Electron Microscopy, 2nd
edn., New York and London, Academic Press, 1964. (Имеется
перевод 1-го изд., Д. Пнз, Гистологическая техника в электронной
микроскопии, ИЛ, М., 1963.)
6. Sjostrand F. S., Electron Microscopy of Cells and Tissues, Vol. I,
pp. 311—325; 362—366, New York and London, Academic Press,
1967.
ПРИЛОЖЕНИЕ
I. КАК ПОЛЬЗОВАТЬСЯ ВЕЩЕСТВАМИ,
ГИДРАТИРОВАННЫМИ В РАЗЛИЧНОЙ
СТЕПЕНИ
Количество вещества, приводимое-в рецепте, иногда
должно быть изменено в соответствии с
содержанием гидратной воды в тех реактивах, которые имеются
в лаборатории. Например, если в рецепте указано,
что надо взять 2 г безводного ацетата натрия
(КаСгНзОг, молекулярный вес 82,04), а в лаборатории
этот реактив имеется в кристаллической форме
(ЫаСгНзОг-ЗНгО, молекулярный вес 136,09), то
очевидно, что надо брать 136/82-2 г кристаллической соли, т. е.
3,2 г.
К сожалению, авторы не всегда указывают
содержание гидратной воды в реактивах. Если содержание
воды не указывается, то приходится полагать, что это
вещество в безводной форме (если такая форма имеется
в продаже) или что оно содержит наименьшее
возможное количество гидратной воды.
Молекулярные веса, количество гидратной воды и
другие физические константы реактивов приводятся в
«Руководстве по химии и физике», опубликованном
Chemical Rubber Publishing Company, Cleveland, Ohio.
Эту книгу в шутку называют «Резиновая Библия», и
она является настольной книгой в каждой лаборатории1.
1 Советский читатель может пользоваться «Справочником
химика», изд-во «Химия», Ленинградское отделение, т. I—V, 1962—
1968. — Прим. ред.
274 Приложение
II. МОЛЯРНОСТИ КИСЛОТ И ЩЕЛОЧЕЙ,
ОБЫЧНО ПРИМЕНЯЕМЫХ ДЛЯ ПОЛУЧЕНИЯ
ЗАДАННЫХ ВЕЛИЧИН рН ФИКСАТОРОВ
И БУФЕРНЫХ РАСТВОРОВ
Мы не приводим точных расчетов молярности
растворов, которые могут быть установлены только
методом титрования. Вместе с тем указанные величины
достаточно точны для выполнения большинства
электронно-микроскопических работ.
Гидрат окиси натрия (едкий, натр)
Мол. вес 40, следовательно, 4%-ный
раствор (масса/объем) = 1 М
1 мл 1 М раствора, разведенного
дистиллированной водой до объема 10'мл, —0,1 М
1 мл 0,1 М раствора, разведенного до 10 мл, —0,01 М
Полученные растворы необходимо хранить в
пластиковых пузырьках, так как щелочь разъедает стекло
и из него в раствор переходят кремниевые соединения.
Концентрированная соляная кислота продается в
любой из двух указанных ниже молярных концентраций,
однако более распространена копцептрация 11,65 М.
Разведение кислоты надо производить всегда над
раковиной и осторожно вливать кислоту в воду, а не
наоборот.
Соляная кислота
Удельный вес 1,18 = 36% (по массе) =11,65М
0,86 мл, разведенные дистиллированной
водой до объема 10 мл, ■ =1 М
1 мл 1 М раствора, разведенного до 10 мл, =0,1 М
1 мл 0,1 М раствора, разведенного до 10мл, =0,01 М
Соляная кислота
Удельный вес 1,16 = 32% (по массе) =10,2 М
0,98 мл, разведенные дистиллированной
водой до объема 10 мл, =1 М
1 мл 1 М раствора, разведенного до 10 мл, =0,1 М
1 мл 0,1 М раствора, разведенного до 10 мл, =0,01 М
Приложение
275
III. ФИКСАТОРЫ
Все запасные растворы нужно хранить в
холодильнике (4°С), если не указаны другие условия их
хранения. Некоторые растворы, особенно фосфатные буферы,
сахароза или глюкоза, очень подвержены заражению
бактериями или грибами. Такое заражение можно
выявить, вращая бутылку, при этом у ее дна видны
завихрения выпавших в осадок бактерий или грибов.
Фиксаторы, упомянутые в данном разделе, обычно
забуферепы так, что величина рН составляет 7,2—7,4.
Как уже указывалось, рН 8,0—8,5 обеспечивает
лучшую сохранность материала, содержащего большие
количества воды, например эмбриональной ткани,
простейших или беспозвоночных.
ОСМИЕВЫЕ ФИКСАТОРЫ
Обычная продолжительность фиксации в осмиевых
фиксаторах составляет приблизительно 1 ч.
Готовить осмиевые фиксаторы следует за день до
употребления, поскольку четырехокись осмия
растворяется очень медленно. Свежеприготовленный фиксатор
можно оставить в темном месте при комнатной
температуре на ночь, а затем на следующее утро поместить в
холодильник.
Работать с четырехокисыо осмия нужно только в
вытяжном шкафу. Добавление Os04 не меняет рН
раствора, поэтому доводить величину рН до определенного
значения можно вне вытяжного шкафа перед
добавлением OsCv Растворы четырехокиси осмия
чувствительны к свету, их нужно хранить в бутылках темного
стекла.
Четырехокись осмия легко восстанавливается, и
поэтому при работе с ее растворами обязательно следует
использовать химически чистую посуду. Даже в том
случае, когда фиксатор хранится в холодильнике,
возможно спонтанное восстановление осмия в течение
нескольких дней вследствие реакции между четырех-
окисью осмия и другими компонентами фиксатора
(четырехокись осмия, растворенная в дистиллированной
276
Приложение
воде, сохраняется значительно дольше). Если фиксатор
приобретает коричневую или красноватую окраску, его
надо вылить. Некоторые осмиевые фиксаторы можно
довольно долго хранить в замороженном состоянии.
В других фиксаторах при замораживании образуется
осадок и их качество после этого становится
сомнительным.
1. Фиксатор Миллонига [16]
Раствор А: 2,26%-ный Стабилен в течение неде-
NaHaP04-H20 ли и более
Раствор Б: 2,52%-ный Хранить в полиэтилено-
NaOH вой бутылке при
комнатной температуре.
Стабилен долгое время
Раствор В: 5,4%-ная Быстро зарастает гриба-
глюкоза ми даже при 4 °С
Раствор Г: 41,5 мл раствора А
8,5 мл раствора Б
Фиксатор: 45 мл раствора Г
5 мл раствора В
0,5 г Os04
Этот очень распространенный фиксатор широко
используется во многих лабораториях. Считается, что он
лучше сохраняет белки и гликоген, чем другие
осмиевые фиксаторы, и обеспечивает более равномерную
фиксацию кусочка ткани. В замороженном состоянии
фиксатор можно хранить в „течение нескольких недель.
Замораживая фиксатор, не заполняйте им бутылку
целиком— жидкость расширится при замерзании и
может разорвать бутылку. При оттаивании согревайте
фиксатор постепенно, сначала под струей прохладной
водопроводной воды, а затем постепенно увеличивая ее
температуру. Фиксатор готов к употреблению сразу
после оттаивания,
Приложение
277
2. Фиксатор Палада [20]
Запасной буферный рас- 14,7 г веронала натрия1
твор (стабилен в течение 9,7 г ацетата натрия
нескольких месяцев): Вода дистиллированная до
500 мл
Запасной раствор четы- 2%-ный раствор четырех-
рехокиси осмия: окиси осмия в
дистиллированной воде (в отличие от
фиксатора этот водный
раствор можно хранить в
течение нескольких недель в
охлажденном состоянии)
Фиксатор: 5 мл запасного буферного
раствора
5 мл 0,1 М НС1
2,5 мл дистиллированной
воды
12,5 мл 2%-ного раствора
четырехокиси осмия
Этот оригинальный осмиевый фиксатор был разработан
для электронной микроскопии Паладом. Он все еще
широко применяется во многих лабораториях.
3. Фиксатор Колфилда [5]
Это тот же фиксатор Палада, к которому добавлено
4,5% сахарозы для повышения осмотического давления.
4. Осмиевый фиксатор на s-коллидиновом буфере [3].
Запасной буферный рас- 2,67 мл s-коллидина
твор: 50 мл дистиллированной
воды
9,0 мл 1,0 М НС1
Развести дистиллированной
водой до 100 мл
1 5,5-диэтилбарбитурат натрия, барбитал натрия. — Прим. nepeq.
\9-r-977
278
Приложение
В результате получается стойкий 0,2 М буферный
раствор с рН 7,4—7,5. Этот раствор можно хранить
довольно долго и использовать для приготовления
осмиевых, перманганатиых и альдегидных фиксаторов. Однако
он имеет свойство сравнительно быстро
восстанавливать осмий, поэтому такой фиксатор нужно
использовать в течение 3—4 дней после приготовления.
Фиксатор: 1 часть буфера
2 части 2%-ного водного раствора четырех-
окиси осмия.
В результате получается 1,33%-нын раствор четырех-
окиси осмия в 0,067 М буферном растворе. Вначале этот
фиксатор не получил широкого распространения,
поскольку s-коллидии, имевшийся в продаже, содержал
примеси, удаление которых требовало довольно
трудоемких методов. Теперь большинство фирм,
изготавливающих материалы для электронной микроскопии,
предлагает s-коллидин высокой очистки, специально
предназначенный для фиксаторов.
АЛЬДЕГИДНЫЕ ФИКСАТОРЫ
Рекомендуемое время фиксации — 2—4 ч. В глута-
ральдегиде лучше фиксировать в течение 4 ч. С
альдегидными фиксаторами нельзя использовать веронал-
ацетатные буферы, так как между альдегидами и
буфером происходит реакция (типа реакции Каиницаро),
которая изменяет буферные свойства раствора.
Глутаральдегидные фиксаторы. Очень важны
чистота и рН запасных растворов глутаральдегида. В
концентрациях 25% и выше глутаральдегид может
окисляться кислородом воздуха я. полимеризоваться. Если
раствор глутаральдегида не был стабилизирован, то
продукты этих реакций накапливаются быстро, что пагубно
сказывается на качестве фиксатора. В результате
накопления глутаровой кислоты снижается рН раствора
глутаральдегида. Сабатини и др. [28] обнаружили, что
качество фиксации ухудшается, если рЫ запасного
раствора глутаральдегида падает ниже 3,5.
Приложение
279
1. Глутаральдегид на какодилатном буфере
Запасной буферный раствор 0,2 М какодилата натрия:
10,7 г какодилата натрия развести дистиллированной
водой, довести конечный объем раствора до 250 мл.
Хранить при 4°С.
Запасной раствор глутаральдегид а:
25%-ный (или 50%-пый) раствор специально
стабилизированного глутаральдегида для электронной
микроскопии (поставляется как 25%-ный или 50%-ный
раствор). Хранить при 4°С.
Фиксатор: 8 мл 25%-ного (или 4 мл 50%-пого)
глутаральдегида
25 мл 0,2 М какодилата натрия
Довести рП до 7,3—7,4, добавляя 1 М IIC1.
Добавить дистиллированной воды до 50 мл.
В результате получается 4%-ный раствор
глутаральдегида в 0,1 М (гипертоническом) буфере. Этот
фиксатор был рекомендован Сабатипи и др. [28], которые
предложили глутаральдегид в качестве фиксатора для
электронной микроскопии. Теперь многие исследователи
отдают предпочтение более низким концентрациям
глутаральдегида, обычно около 2%. Для этого вместо 8 мл
берут 4 мл 25%-ного глутаральдегида.
2. Глутаральдегидный фиксатор на фосфатном
буфере Миллонига
Запасные растворы:
A. 2,26%-ный раствор КаН2Р04-Н20
Б. 2,52%-пый раствор NaOH
B. 25%-ный раствор глутаральдегида
Фиксатор: 8 мл 25%-ного (4 мл 50%-пого)
глутаральдегида
32 мл раствора А.
Довести рН до 7,3—7,4, добавляя раствор Б.
Добавить дистиллированной воды до 50 мл (к этому
фиксатору не надо добавлять глюкозу, поскольку он уже
является гипертоническим).
19*
*•
080
Приложение
3. Глутаральдегид на£-коллидиновом буфере [31]
Для того чтобы снизить осмотическое давление
фиксатора, приблизив его к осмотическому давлению
плазмы крови, Вейбель [31] рекомендует использовать
1,5%-ный глутаральдегид на s-коллидиновом буфере.
Этот раствор готовится следующим образом:
27 мл 0,2 М раствора s-коллидина
3 мл 25%-пого глутаральдегида
Проверьте величину рН; если" это необходимо,
доведите ее до 7,2—7,4; конечный объем раствора должен
составлять 50 мл.
Параформальдегидные фиксаторы. Приготовляя фор-
мальдегидные фиксаторы для электронной
микроскопии, необходимо использовать только химически чистый
порошкообразный параформальдегид. 37%-ный раствор
формальдегида, который имеется в продаже, содержит
в качестве консерванта метанол, что отрицательно
сказывается на качестве фиксации. Формальдегидный
фиксатор должен каждый раз готовиться заново, поскольку
он быстро окисляется и образуется муравьиная
кислота.
1. Параформальдегид в буфере Миллонига
(Модификация прописи, предложенной Пизом в 1964 г.)
Запасные растворы:
А. 2,26%-ный NaH204-H20
Б. 2,52%-ный NaOH
Фиксатор: 41,5 мл раствора А
8,5 мл раствора Б
Нагреть до 60—80 °С (в закрытом сосуде, чтобы
избежать испарения). Добавить 2,0 г химически чистого
порошкообразного параформальдегида. Довести рН до
7,2—7,4. Встряхивать до полного растворения
параформальдегида. Профильтровать. Охладить.
В результате получается 4%-ный формальдегидный
фиксатор. Если желательно получить менее
гипертонический раствор, то следует соответственно уменьшить
количество параформальдегида.
»*
.______^__ Приложение 281
2. Пара,формальдегид-глутаральдегидный
фиксатор [12]
1. Растворяют 2 г порошкообразного параформаль-
дегида в 25 мл дистиллированной воды при 60—70 °<3
и постоянном помешивании.
2. Добавляют 1—3 капли 1 М раствора едкого
натра; перемешивают до просветления раствора
(допускается незначительная опалесценция).
3. Охлаждают раствор.
4. Добавляют 5 мл 50%-ного глутаральдегида.
5. Доводят объем до 50 мл, добавляя 0,2 М какоди-
латный или фосфатный буфер, рН 7,4—7,6. Конечная
величина рН должна быть равна 7,2. Если используют
какодилат, то следует добавить 25 мг СаС1г
(безводного). Фиксируют в течение 2,5—5 ч; промывают от 3 до
12 ч в 0,1 М буфере, дополнительно фиксируют в че-
тырехокиси осмия. Несмотря на то, что этот фиксатор в
значительной степени гипсртоничеп, предложивший его
автор не обнаружил сморщивания ткани.
ПЕРМАНГАНАТНЫЕ ФИКСАТОРЫ
Поскольку перманганатные фиксаторы в
значительной степени утратили свое значение для электронной
микроскопии, мы приведем здесь лишь оригинальную
пропись этого фиксатора, предложенную Люфтом.
Раствор А: 1,,2%-ный раствор перманганата калия.
Хранят в наполненной доверху закупоренной бутыли
темного стекла при 4СС (предпочтительнее готовить по
мере надобности свежие растворы)
Раствор Б. Буфер Палада:
14,7 г веронала натрия
9,7 г ацетата натрия
Дистиллированная вода до 500 мл
Фиксатор: 12,5 мл 1,2%-ного раствора КМп04
5.0 мл буфера Палада
2,5 мл дистиллированной воды
5,0 мл 0,1 н. НС1
Довести рН раствора до 7,3—7,4, добавляя НС1
282
Приложение
Конечная концентрация перманганата калия
составляет 0,6%. Более высокие концентрации могут привести
к повреждению ткани. Время фиксации не должно
превышать 1 ч.
IV. БУФЕРЫ ДЛЯ ПРОМЫВКИ
И ХРАНЕНИЯ ТКАНИ
Эти буферы служат для трех целей:
1. Для удаления из ткани избытка фиксатора перед
началом обезвоживания. По-видимому, ткань можно
также быстро промывать в дистиллированной воде.
Вообще мнения о необходимости такой промывки
противоречивы.
2. Для удаления избытка первого фиксатора перед
дополнительной фиксацией в четырехокиси осмия.
Необходимость этого этапа оспаривается, н многие
исследователи опускают его (см. обсуждение этого вопроса
в гл. 2, стр. 61).
3. Для составления среды, в которой ткань
хранится после альдегидной фиксации до того момента, когда
удобно провести ее обезвоживание или дополнительную
фиксацию осмиевой кислотой. Это допустимо при
определенных исследованиях, однако из ткани постепенно
экстрагируются некоторые вещества. Отдельные
исследователи предпочитают хранить ткань в первичном
фиксаторе, однако вопрос этот остается спорным. ;
Буферы для промывки и хранения ткани готовят из
запасных буферных растворов, которые употребляются
для приготовления фиксаторов. Величина рН этих
растворов должна быть равной 7,2—7,4; величину
осмотического давления выбирают по желанию исследователя,
исходя из сложившихся к настоящему времени
представлений (см. раздел об осмотическом давлении
растворов в гл. 2). Для достижения определенного
осмотического давления можно использовать сахарозу или
глюкозу. Если желательно точно придерживаться
определенного осмотического давления, то необходимо
использовать хороший осмометр. Вместе с тем для
приблизительного определения осмотического давления рас-
Приложение
283
твора можно использовать показатели молярной
концентрации составляющих его веществ.
Приведем пример получения 100 мл раствора како-
дилатного буфера с осмотическим давлением, равным
приблизительно 0,3 осмоля. С помощью 0,1 М НС1
доводим рЫ 50 мл 0,2 М раствора какодилата до 7,2—7,4;
записываем точный объем использованной для этого
0,1 М НС1. Подсчитываем суммарную молярную
концентрацию какодилата натрия и соляной кислоты, исходя
из того, что конечный объем раствора составит 100 мл.
Она будет несколько меньше 0,3 М, поэтому перед
окончательным разведением раствора необходимо
увеличить молярную концентрацию, добавив соответствующее
количество 2 М раствора сахарозы.
Приблизительные количества необходимых
компонентов приведены в табл. 7.
Таблица 7
Характеристика различных компонентов, входящих в состав буферов
для промывки и хранения тканей
Компоненты
Какодилат натрия
НС1
Сахароза
Вода
Моляр-
ность
0,2
0,1
2,0
Количество
частиц
в молекуле
2
2
1
Необходимое
количество,
мл
50
8
4,2
37,8
100
Молярная
концентрация
после
разведения
до 100 мл
0,2
0,016
0,084
0,3
Осмотическое давление такой смеси, определенное по
понижению точки замерзания, находится в пределах
0,29 осмоля.
V. ЗАЛИВОЧНЫЕ СРЕДЫ
Ниже приводятся только наиболее
распространенные прописи заливочных сред. Данные о других средах
и дополнительные сведения можно найти в гл, 4 моно-
284 Приложение
графии Д. Пиза [21], в работе Глауэрта [6], а также
в работах, указанных в библиографии, приведенной в
конце гл. 2 и 8. Одни и те же заливочные среды могут
иметь различные названия, поэтому во избежание
путаницы в табл. 8 приведены эти названия.
Таблица 8
Названия химических веществ, применяемых при заливке,
и их эквиваленты
Название
Araldite CY212
Dodecenyl succinic
anhydride
Tridimethylaminomethyl
phenol1
Benzyl dimelhylamine1
2,4-dichlorobenzoyl
peroxide с добавкой дибу-
тилфталата
Methyl nadic anhydride
1,2-epoxypropane
Эквивалент
Araldite 502 (эквивалент,
применяемый в США)
HY964 (прежде 964В)
(Англия); DDSA (США)
DY064 (прежде 964С)
(Англия); DMP30 (США)
DYQ62 (Англия); BDMA
(США)
Luperco CDB (США)
MNA; NMA; melhyl-endo
methylene phathalic
anhydride
Propylene oxide (США)
Назначение
Заливочная
смола
Уплотнитель
Катализатор
»
»
Уплотнитель
Облегчает
проникновение
заливочной
среды
1 Взаимозаменяемые вещества.
ЗАЛИВКА В АРАЛДИТ
После обезвоживания в спирте ткань проводят
через эпоксипропан и помещают в смесь для заливки на
срок от 2 до 20—24 ч при комнатной температуре.
Возможно, для большей уверенности в том, что ткань
полностью пропиталась, лучше оставлять ее в заливочной
смеси на ночь. Удобные сосуды для пропитки можно
изготовить из пластиковой формочки для приготовления
Л{>да. После пропитки ткань помещают в свежую зали-
_, Приложение 286
вочную среду, которая полимеризуется в течение
приблизительно 24 ч при 60°С. Если заливку проводят в
желатиновых капсулах, то их необходимо перед
употреблением просушить в течение примерно 1 ч при
температуре 60 °С. Полиэтиленовые капсулы, формочки или
ванночки для заливки не нуждаются в
предварительной просушке.
МЕТОД I
Запасной раствор: смесь равных объемов аралдита
CY212 и уплотнителя HY964. Чтобы заливка была
хорошей, эту смесь нужно тщательно перемешать,
однако в ней не должно быть пузырьков воздуха,
поскольку она может затвердеть. Для перемешивания
лучше всего пользоваться магнитной мешалкой.
Перемешивание облегчается, если составные части
смесей нагреть до 60 °С. Данный запасной раствор
устойчив, и его можно хранить при комнатной
температуре в течение многих недель (в том случае, когда
предстоит резать очень твердую ткань, Vio часть
HY964 можно заменить на MNA).
Заливочная среда: 20 мл запасного раствора
0,4 мл DY064 (катализатор или ускоритель)
0,6 мл дибутилфталата (пластификатор)
Данная заливочная среда позволяет получить блок
средней твердости. Консистенция блока регулируется
добавлением большего или меньшего количества
пластификатора.
Сосуд с заливочной средой прикрепляют к
вращающемуся диску или помещают во вращающийся
барабан; перемешивание среды осуществляют при
умеренной скорости вращения в течение 2 ч перед заливкой.
Если после заливки ткани еще остается какое-то.
количество заливочной среды, то ее можно хранить
несколько недель в закрытом пробкой сосуде, который
помещается в морозильную камеру холодильника или
в условии глубокого замораживания. Хранить
заливочную среду при низкой температуре можно до тех пор,
пока есть уверенность, что в сосуд со средой не про-
286 Приложение
никла влага. Непосредственно перед употреблением
среду согревают в термостате при 60 °С для уменьшения
вязкости и для того, чтобы удалить следы влаги перед
открыванием сосуда.
МЕТОД 2
Все процедуры такие же, как и в методе 1.
Различаются лишь компоненты запасного раствора и
заливочной среды.
Запасной раствор: 10 частей аралдита 502
7 частей IIY964 (DDSA)
Заливочная среда: смешать запасной раствор с 1,5—
2% раствора DY064 (DMP-30).
Если DY064 свежий, достаточно 1,5% раствора, если
он старый, возможно, следует добавить 2% раствора.
Тщательно перемешать.
Эта пропись позволяет получить блок средней
твердости. Если желательно иметь более твердый или более
мягкий блок, надо изменить количество уплотнителя
(HY964) в запасном растворе.
ЗАЛИВКА В ЭПОН
Довольно большая гигроскопичность эпона
затрудняет резку изготовленных из него блоков, в особенности
при сырой погоде. Чтобы избежать попадания влаги из
воздуха в запасные растворы эпона, их нужно хранить
в плотно закупоренных флаконах. По той же причине
нужно закрывать сосуды при пропитывании и заливке
ткани.
Наиболее часто применяется метод заливки в
модификации, предложенной Люфтом [14]. Для заливки
необходимы два запасных раствор'а, которые могут
храниться примерно 4 мес при температуре 4°С.
Запасной раствор 1: энон 812 — 62 мл
DDSA (HY964) —100 мл
Запасной раствор 2: эпоп 812 —100 мл
MNA — 89 мл
Приложение
287
Первый раствор дает очень мягкие блоки, второй —
очень твердые; таким образом, для получения желаемой
степени твердости блока эти растворы смешивают.
Блок средней твердости получается при смешивании 7
частей раствора 1 и 3 частей раствора 2.
После обезвоживания ткань помещают на 1 ч в
смесь равных объемов этилового спирта и заливочной
среды, содержащей 1,5—2% DY064 (DMP-30) в
качестве катализатора. Затем ткань переносят в
предварительно просушенные желатиновые капсулы (или иные
сосуды для заливки), заполненные свежей заливочной
средой, содержащей катализатор. Полимеризация
проводится при 60 °С в течение 20—24 ч.
Оставшуюся заливочную среду можно хранить в
морозильной камере холодильника или при глубоком
замораживании, как это было указано для аралдита.
СМЕСИ ЭПОН - АРАЛДИТ
Смеси энона и аралдита находят все более и более
широкое применение. Эпоп значительно быстрее
проникает в ткань, чем аралдит; аралдит надежнее
сохраняет ультраструктуру ткани и лучше режется. Многие
исследователи считают, что «убить двух зайцев» можно,
смешивая обе эти заливочные среды. После
обезвоживания и проводки через эноксипропан ткань
пропитывается при комнатной температуре.
Пропись 1 [17]
100 г эпона 812
55 г аралдита 502
180 г DDSA (IIY964).
10 г BDMA (DY064 из расчета 5 г на 335 г
смеси синтетических смол)
После пропитывания ткань заливают в свежую
заливочную среду при 60 °С. Качество аралдита и эпона,
поставляемых разными фирмами, может быть различным,
и это обстоятельство вызывает затруднения при
резке. Именно поэтому аралдит 502 и эпоп 812,
поставляемые фирмой Polysciences, рекомендованы (той
же фирмой!) для приведенной выше прописи.
288
Приложение
Пропись 2 [1]
20 мл аралдита 502 (или CY212)
25 мл эпона 812
60 мл DDSA (HY964)
1,5—2,5% DMB-30 (DY064)
После пропитывания ткань заливают в свежую смесь
при 60 °С.
ЗАЛИВКА В ВЕСТОПАЛ W
Эта полиэфирная заливочная среда была
предложена Райтером и Келлеибергером [27] и рекомендуется
Шёстрандом [29] для исследований с высоким
разрешением, хотя другие электронные микроскописты,
работающие с высоким разрешением, не согласны с тем,
что вестопал W более пригоден для этих целей, чем
эпоксидные смолы (см., например, [23]). Вестопал W
особенно удобен при заливке твердых тканей.
СМЕСИ ДЛЯ ЗАЛИВКИ
К вестопалу W добавляют 1% третичного бутилпер-
бензоата (инициатор) и 0,5% нафтената кобальта
(активатор). Инициатор и активатор нельзя смешивать
непосредственно друг с другом, так как смесь их
взрывается.
Все три компонента надо предохранять от действия
света и хранить в холодильнике. Вестопал W можно
хранить в течение нескольких месяцев, тогда как
активатор и инициатор, по некоторым данным, разрушаются
после двух месяцев хранения.
Поскольку полиэфирные смолы нерастворимы в
спирте, для обезвоживания ткани применяют ацетон.
Обезвоживание: 30, 50 и 75%-ный ацетон по 15 мин
90%-ный ацетон в течение 30 мин
100%-ный ацетон (обезвоженный
медным купоросом), 80 мин
Приложение
289
Пропитывание: безводный ацетон — вестопал W, 3:1,
30 мин
безводный ацетон —вестопал W, 1:1, 30 мин
безводный ацетон — вестопал W, 1 :3, 30 мин
Заливка: 12—24 ч в заливочной смеси при 60 °С.
ЗАЛИВКА В МЕТАКРИЛАТЫ
Пары метакрилатов могут вызвать отравление при
вдыхании; поэтому работать с метакрилатами
необходимо в вытяжном шкафу.
Чистый бутилметакрилат дает слишком мягкие для
резки блоки, тогда как метилметакрилатные блоки
слишком тверды. Эти два вещества можно смешивать
в различных пропорциях и получать блоки различной
степени твердости соответственно консистенции
заливаемой ткани.
Для ткани средней твердости обычно с успехом
применяется следующая пропись:
9 частей бутилметакрилата
1 часть метилметакрилата
от 0,5 до 2% перекиси бензоила (катализатор).
Перекись бензоила при 106° разлагается со взрывом,
однако она относительно безопасна при комнатной
температуре. Тем не менее в Англии это вещество часто
перевозится в форме увлажненной пасты, и, возможно,
целесообразно хранить его в холодильнике. Небольшие
количества перекиси бензоила, употребляемые в
качестве катализатора, можно высушивать на
фильтровальной бумаге при 50—60°С непосредственно перед
употреблением.
После обезвоживания в спиртах (проводка через
эпоксипропан не обязательна) ткаиь пропитывают по
следующей схеме:
Смесь спирта и метакрилата
без катализатора, 1:1 30 мин
Смесь метакрилата без ката- 60 мин с одноразовой
лизатора сменой этой смеси
Смесь метакрилата с
катализатором 30 мин
Преполимериэованнын мета-
кри-лат на ночь
290
П риложение
(Преполимеризация производится путем нагревания
заливочной смеси с добавленным катализатором в
конической колбе при 90 °С на водяной бане; смесь
постоянно перемешивают до того момента, пока она не
станет вязкой.)
После пропитывания ткань помещают в
желатиновые капсулы, высушенные в течение 24 ч при 40—60 °С
непосредственно перед употреблением, и заливают
свежим преполимеризоваиным метакрилатом.
Полимеризация проводится при освещении ультрафиолетовой
лампой в течение 1—3 сут в прохладном помещении. Для
полимеризации используют ртутпо-кварцевые лампы,
дающие свет с длиной волны, равной 3650 А.
ВОДОРАСТВОРИМАЯ ЗАЛИВОЧНАЯ СРЕДА
Ниже описана лишь заливка в гликольметакрилат
(ГМК), модифицированная Ледюком и Бернхардом
[13]. Сведения о других водорастворимых заливочных
средах можно найти в работах, приведенных в конце
гл. 8.
N.B. Нельзя использовать осмиевые фиксаторы
перед заливкой в гликольметакрилат, поскольку осмиро-
ванпая ткань становится непрозрачной для
ультрафиолетовых лучей, применяемых для полимеризации.
Необходимо использовать свежие партии гликольме-
такрилата, так как при длительном хранении может
произойти спонтанная полимеризация. Если
гликольметакрилат данной партии не полностью смешивается с
водой, его следует выбросить (или использовать для
обучения искусству иреполимеризации, которое очень
сложно).
Заливочная смесь: 7 частей 97%-ного раствора гликоль-
метакрилата в дистиллированной воде.
3 части бутилметакрилата, содержащего
2% люперко1 в качестве катализатора.
1 Люперко нельзя достать в Англии, и Бсрпхард (личное
сообщение) считает, что это вещество не имеет особых преимуществ по
сравнению с перекисью бензоила, которую он теперь обычно и
применяет. Кроме того, люперко более опасен, чем перекись бензоила.
Приложение
291
Обезвоживание и заливку ведут в прохладной
комнате. В процессе обезвоживания постепенно повышают
концентрацию гликольметакрилата, а не спирта:
80%-ный раствор мономера гликольметакрилата в
дистиллированной воде 20 мин
97%-ный раствор мономера гликольметакрилата в
дистиллированной воде 20 мин
Непреполимеризованная заливочная смесь 20 мин
ПрепоЛимеризованная заливочная смесь на ночь.
Ткань помещают в свежую преполимеризованную
заливочную смесь в предварительно высушенные
желатиновые капсулы (не применяйте полиэтиленовых капсул,
так как они непрозрачны для ультрафиолетовых
лучей!). Оставляют капсулы открытыми на 30 мин, чтобы?
удалить пузырьки воздуха. Плотно закрывают
капсулы колпачками, чтобы заливаемый материал по
возможности меньше соприкасался с воздухом. Полимери-
зуют с помощью ртутно-кварцевой лампы, дающей свет
с длиной волны 3650 А, и течение 1—3 сут в холодном
помещении. Расстояние между тканью и
ультрафиолетовой лампой должно быть приблизительно 2,5 см.
Ледюк и Берпхард [13] рекомендуют проводить
нреполимеризацию следующим образом. В коническую
колбу наливают тонкий слой (приблизительно 1 см)
заливочной смеси и нагревают ее на газовой горелке;
содержимое колбы перемешивают, быстро вращая колбу,
до появления сильных конвекционных токов или до
кипения. Немедленно погружают колбу в ледяную баню
и перемешивают до тех пор, пока температура смеси не
достигнет температуры этой бани. Показано, что пре-
нолимер хранится при глубоком замораживании очень
долгое время. У нас он сохранялся не дольше
нескольких недель.
Предостережение: Реакция нреполимеризации
может легко выйти из-под контроля. Держите колбу
отверстием от себя. В результате нескольких первых
попыток вы можете получить ни на что не годную
пенистую массу полимера. Несомненно, что коническая
колба должна быть изготовлена из стекла марки пирекс
или другого сорта термостойкого стекла.
ы
Приложение
VI. ОКРАШИВАНИЕ УЛЬТРАТОНКИХ СРЕЗОВ
ДЛЯ УСИЛЕНИЯ ИХ КОНТРАСТА
Ниже описано лишь несколько наиболее часто
используемых методик окрашивания. Варианты этих
методик, а также другие методики окрашивания можно
найти в работах, приведенных в гл. 4 и 8.
ОКРАШИВАНИЕ, ПРИВОДЯЩЕЕ К ОБЩЕМУ
НЕСПЕЦИФИЧЕСКОМУ УСИЛЕНИЮ КОНТРАСТА
Более подробно эти методики окрашивания и их
варианты описаны в работе Пиза, гл. 4 [21] и Глауэрта
[6]
Оптимальное время окрашивания варьирует в
зависимости от используемой заливочной среды.
Продолжительность окрашивания, если нет каких-либо оговорок,
приведена для материала, залитого в аралдит.
Удобный сосуд для окрашивания можно изготовить,
сделав три-четыре ровных углубления на полоске
плексигласа размером с предметное стекло. В каждое
углубление помещают каплю краски, и сетки можно либо
помещать на поверхность жидкости, либо погружать в нее.
Если необходимо предохранить краску от
соприкосновения с воздухом или предотвратить ее высыхание при
длительном окрашивании, надо осторожно закрыть
углубления, в которых капля образует вогнутый мениск,
предметным стеклом, опуская его под углом. При этом
создается хорошая герметизация (конечно, если капли
закрываются таким способом, окрашивание сеток на их
поверхности невозможно).
Другой метод состоит в том, что отдельные капли
наносят на поверхность пластинки зубоврачебного
воска, которую кладут на дно чашки Петри, и сетки
помещают на поверхности капель„или погружают в них.
Если нужно создать влажную атмосферу, то под воск
подкладывают влажную фильтровальную бумагу, после
чего чашку Петри держат закрытой в течение
требуемого для окрашивания времени. Для окрашивания
можно применять также стеклянные пластинки с
углублением.
Приложение
293
1. Уранилацетат
А. 1—2%-ный водный раствор уранилацетата устойчив
при комнатной температуре в течение многих недель.
Если предполагается последующее докрашивание
цитратом свинца, то окрашивание уранилацетатом
ведут в течение 15 мин с подогреванием на
гистологической плитке. Если же докраски свинцом не
требуется, то окрашивают в течение 30—60 мин с
подогреванием, закрыв ванночку, в которой
производится окрашивание, чтобы предупредить высыхание
краски и появление осадка на срезе. Чтобы удалить
возможный осадок, сетки тщательно промывают
тонкой струей дистиллированной воды. Воду удаляют,
прикоснувшись сеткой (той стороной, где нет срезов)
к фильтровальной бумаге. Можно применять также
и насыщенный водный раствор уранилацетата,
однако его необходимо перед употреблением
профильтровать или отцептрифугировать. Ясно, что
насыщенный раствор при испарении будет давать осадок.
Б. Насыщенный раствор уранилацетата в 50%-ном
этаноле. Перед употреблением раствор краски
необходимо профильтровать. Окрашивают в течение 30 мин,
подогревая в закрытой ванночке для
предупреждения испарения и выпадения осадков. Спиртовые
растворы уранилацетата плохо сохраняются, и их нужно
готовить свежими. Считается, что спиртовые
растворы уранилацетата окрашивают быстрее, чем водные.
Некоторые авторы рекомендуют применять 1—2%-
ные спиртовые растворы уранилацетата.
2. Свинцовые красители
Эти красители имеют свойство поглощать
углекислый газ из воздуха и давать на срезах осадки
углекислого свинца. Краситель, хранящийся в пузырьке,
следует осторожно набирать пастеровской пипеткой из
средних слоев, не перемешивая всего раствора.
Пипетку после употребления выбрасывают. Если окрашивание
ведется на поверхности капли, то для поглощения
углекислого газа из воздуха на дно чашки Петри кладут
294
Приложение
фильтровальную бумагу, смоченную раствором едкого
натра. Можно также погрузить сетки в краску, налитую
в углубления плексигласовой пластинки, и герметично
закрыть их чистым предметным стеклом (см. выше).
Свинцовые красители с высокими значениями рН (11 —
12), содержащие хелатообразуюшие агенты, более
устойчивы и менее склонны образовывать осадок.
А. Окрашивание цитратом свинца по Рейнольдсу [25].
По-видимому, это наиболее распространенный в
настоящее время метод окрашивания свинцом. Он дает чистые,
тонко выявляемые клеточные структуры и, если
предпринимаются необходимые предосторожности, не
образует осадков. Цитрат-ионы, присутствующие в
красящем растворе, действуя как хелатообразующие агенты,
предотвращают выпадение осадков. Предполагается,
что реакция между цитратом свинца и едким натром
ведет к образованию сложного катиона, содержащего два
атома свинца (РЬ(ОН)2РЪ)2+. Этот катион, атомный
вес которого равен 448,4, по-видимому, связывается
восстановленным осмием, гидроксильными группами
углеводов, а также РНК.
Краситель: 1,33 г нитрата свинца
1,76 г цитрата натрия Ыаз(СвН502) *2Н20
30 мл дистиллированной воды
Смесь взбалтывают в 50-миллилитровой мерной колбе
и оставляют на 30 мин, периодически встряхивая, чтобы
быть уверенным в полном переходе всего нитрата
свинца в цитрат. Затем добавляют 8 мл 1 М раствора
NaOH и доводят объем раствора до 50 мл
дистиллированной водой. Раствор перемешивают, переворачивая
колбу.
Величина рН красителя должна быть равна обычно
12,0±1. Краситель устойчив при хранении до 6 мес;
считается, что при этом происходит его «созревание».
Время окрашивания — 5—30 мин. Сетки промывают
перед окрашиванием и после него в 0,02 М растворе
NaOH. После окончательной промывки раствором
едкого натра сетки дважды промывают тонкой струей
дистиллированной воды. . . .
Приложение
295
Б. Модификация метода окрашивания свинцом по Рей-
нольдсу [30]. К 10 мл дистиллированной воды, налитой
в центрифужную пробирку с завинчивающейся
крышкой, добавляют 0,01—0,04 г цитрата свинца, затем
наливают 0,1 мл 10 М раствора NaOH, закрывают
пробирку и энергично встряхивают до полного растворения
цитрата свинца.
N.B. Очень важно использовать для приготовления
краски только концентрированный раствор или гранулы
едкого натра. Время окрашивания варьирует от 10 с до
5 мин. При двойном окрашивании водным раствором
уранилацетата необходимо в каждом растворе
окрашивать в течение нескольких секунд. Окрашенные срезы
промывают, быстро окунув их 20 раз в два или три
сосуда с дистиллированной водой. Сушат сетки на
воздухе, положив на фильтровальную бумагу.
«Перекрашивание», слишком высокая концентрация
цитрата свинца, загрязнение раствора едкого натра
углекислым газом из воздуха, недостаточно чистая вода —
все это вызывает образование больших скоплений
красителя и соответствующее ухудшение разрешения.
В. Окрашивание свинцом по Карновскому, метод В
[11]. К Ю—15 мл 10%-ного раствора какодилата
натрия в воде добавляют избыточное количество
моноокиси свинца (РЬО) и смесь осторожно кипятят в течение
15 мин. После охлаждения смесь фильтруют.
Два мл фильтрата наливают в 10-миллилитровый
мерный цилиндр и при постоянном помешивании добавля
ют 10%-ный раствор какодилата натрия до 10 мл.
Затем по каплям доливают 1 М раствор NaOH,
энергично перемешивая смесь (в течение по меньшей мере
15 с после каждой капли). При этом образуется легкая
муть, которая, однако, исчезает при помешивании и
добавлении последней капли. Обычно для этого бывает
достаточно 6 капель раствора едкого натра; не
следует добавлять избытка щелочи. После того как раствор
станет прозрачным, его сливают в 12-миллилитровую
центрифужную пробирку и закрывают пробкой; этот
раствор можно хранить в течение нескольких месяцев.
Время окрашивания варьирует от 1 до 30 мин.
Окрашенные срезы промывают дистиллированной водой.
296
Приложение
Г. Метод эффективного двойного окрашивания при
обычных лабораторных исследованиях.
1. Помещают сетки в 2%-ный водный раствор ура-
нилацетата, подогреваемый на гистологической
плитке, на 15 мин.
2. Осторожно промывают сетки дистиллированной
водой.
3. Осторожно промывают сетки 0,02 М NaOH.
4. Окрашивают цитратом свинца по методу Рей-
нольдса в течение 30 мин при комнатной
температуре.
5. Осторожно промывают 0,02 М NaOH.
6. Осторожно промывают дистиллированной водой.
7. Обсушивают сетки на фильтровальной бумаге;
протирают пинцет, чтобы удалить загрязнения
осадками красителя.
8. Повторяют промывку в дистиллированной воде.
9. Обсушивают на фильтровальной бумаге.
10. Высушивают в защищенном от пыли месте
(например, в чашке Петри) и хранят в желатиновых
капсулах или в специальных контейнерах для
сеток.
МЕТОДЫ ОКРАШИВАНИЯ УЛЬТРАТОНКИХ СРЕЗОВ,
ОБЛАДАЮЩИЕ НЕКОТОРОЙ СТЕПЕНЬЮ СПЕЦИФИЧНОСТИ
1. Окрашивание ультратонких срезов для выявления
РНК-содержащих структур [18]
Ткань фиксируют в течение 1 ч в альдегиде на
фосфатном буфере и заключают в эпон или гликольмета-
крилат.
Окрашивание срезов ткани, заключенной в эпон:
1. 5%-ный водный раствор уранилацетата 1 мин.
2. Промывка дистиллированной водой.
3. 0,2 М раствор этилендиаминтетрауксусной
кислоты 30 мин.
4. Промывка в дистиллированной воде.
5. Окрашивание цитратом свинца по методу Рей-
нольдса 1 мин.
Фото I. Результаты, получающиеся при фиксации в Tpijx различных
фиксаторах.
А. Фиксации в четырехокнси осмия. Четко выявляются мембраны; липидпые
капли (1) сохранны в различной степени; видны рибосомы и ядро с гомогенным
содержимым. 13. Фиксация и глугаральдегиде, .Мембраны видны в нстгп ив-
ном изображении; лиииды (1) .-экстрагировались, и па их мосте остались белые
участки; видны рибосомы; в ядрах заметно больше скоплений хроматина, чем
на фото А. В. Фиксация в пермаигаиате калия. Мембраны видны отчетливо;
сохранились линиды (]); цитоплазма и матрикс митохондрий светлые
вследствие экстракции белков; рибосомы отсутствуют; хроматин в ядрах не виден.
Фото П. Результаты окрашивания уранилацетатом и цитратом
свинца, применявшихся раздельно и в комбинации друг с другом.
Ткань была фиксирована четырехокисыо осмия, а затем глутаральдегидом,
А. Неокрашенная ткань. Контраст очень низкий. В. Окрашивание уранилаце-
тяюм (2%-ный водный раствор). Наблюдается общее увеличение контраста.
Наиболее интенсивно окрашены ядерный хроматин и цитоплазматические
рибосомы. В. Окрашивание цитратом сиипца (по Рейнольдсу). Общее увеличение
контраста. Особенно резко очерчены и хорошо контурированы мембраны.
Г. Окрашивание уранилацетатом (2%-ный водный раствор) н затем цитратом
свинца но Рейнольдсу. Общее увеличение контраста значительно выше, чем
при раздельной окраске теми же красителями. Особенно интенсивно
окрашивается ядерный хроматин, который хорошо виден в нижнем правом углу
снимка; очень высока электронная пло1ность цитоплазматических рибосом,
.<&w#
в
.*-©
t
Фото III. Отверстия г, углеродной пленке, сфотографированные
различной фокусировкой.
Л. Недофокусировка. Белая полоса (полоса недофокусировкн) витна с
резней стороны темною кпак большого отверстия ({-казана стрепкои)
родная пленка кажется зернистой («зернистость расфокусипопкн») Г,
пая фокусировка. Ни снаружи, пи ппуцш отверстия полоса Не видна
родням пленка утратила лернис юс, ь; ко аст минимальный П
сировка. Ье.тли линия (полоса перефокусиропки) поивилпе
пого края отверстии. На углеродной пленке снова
кусиронкн. Г. Астигматизм обьектинпоП линзы Вдот!
1ЯХОДИ1СН в фокусе, а вдоль .'фугой -
B!IVT-
Угле-
Точ-
Угле-
Перефоку
пужи от тем
дна зернистость расфо-
одпой оси отверстие
оложепин перефокусировки. Это
сопровождается появлением прием гирова я зернистости расфокусировки
отдельные i ранулы вышнуты в направлении, указанном стрелкой.
* -■* / -j --. - *f" -'£ v1* ^K* -: > .-■ -1 ;- : ^"^Si-*U:
*2&
,--\>;'-•-■;£V .''('W
/ *?*Л\-: .*V*Y> ■'...'• ': -a* •-':,
■ Б"^&
;.-«!.£
Фото IV. Потеря материала при использовании одного фиксатора и
его сохранность при использовании другого.
Л. Краевые очделы цитоплазмы ооцита золопк-юго "чоммчка: фиксации в глу
таральдегиде и затем в четыречокмеи осмия. Цитоплашн заполнен» нитями
и скрученными пучками лчекгроноилотного матери»,! а. Проб» n;i феомеч•
татнвное переваривание показывает, чю vtot материал состоит из белка.
Б. Периферические отделы ооцита золотистого хомячка; фиксация в четы
рехокцси осмия. Цитоплазма между группами митохондрии относительно пуста
и содержит лишь рибосомы и небом,шпе цузыр|.ки.
Фото V. Электронная микрофотография яйца Rhysolritia duplicate
(панцирный клещ), полученная на сканирующем микроскопе; ХЮОО.
Фото VI. Bacillus proteus.
Фотография сделана с помощью электронною микроскопа при напряжении
I млн. волы (Laboratoire d'Optique Eleclronique du C.N.R.S., Tuuluse, France).
Приложение
297
Окрашивание срезов ткани, заключенной в гликольме-
такрилат:
Перед размещением срезов сетка должна быть
покрыта формваром или коллодиевой пленкой.
1. 0,5%-иый водный раствор уранилацстата 1 мин.
' 2. Промывка в дистиллированной воде.
3. 0,2 М раствор этилендиаминтетрауксусной
кислоты в дистиллированной воде, рН 7,0 1—2 мин.
4. Промывка в дистиллированной воде.
5. Окрашивание цитратом свинца по методу Рей-
нольдса в течение 1 мин.
Это так называемое «регрессивное окрашивание»,
при котором хроматин «отбеливается» под действием
этилендиаминтетрауксусной кислоты, тогда как
структуры, содержащие РНК, остаются окрашенными.
Результаты окрашивания можно контролировать методом
ферментативного переваривания так, как описывают
авторы приведенной методики.
2. Окрашивание фосфорновольфрамовой кислотой
при низких величинах рН для выявления
полисахаридов и гликопротеидов (метод Пиза [21]
в модификации Рамбурга [24])
Рекомендуется фиксация альдегидами с
последующей заливкой в гликольметакрилат.
1. Срезы (не монтированные на сетках)
обрабатывают 1%-ным раствором фосфорновольфрамовой
кислоты, приготовленным па 10% -ном растворе
хромовой кислоты (рН 0,3), в течение 2 мин.
2. Срезы быстро промывают в дистиллированной
воде.
3. Срезы монтируют на сетках, покрытых
формваром или коллодиевой пленкой.
Контроль. Реакция окрашивания блокируется после
ацетилирования уксусным ангидридом и пиридином в
течение 12 ч при 37 °С [15]. Окрашенный материал
выглядит так же, как и при типичной ШИК-реакции,
за исключением того, что при этом экстрагируются ли-
пиды и гликоген. Окрашиваются примембраниые слои
20—977
298
II риложениё
клеточной оболочки (глпкокаликс), аппарат Гольджи,
лизосомы, базальпая мембрана, некоторые секреторные
гранулы и др.
VII. ОКРАШИВАНИЕ ПОЛУТОНКИХ (1-2 мкм)
СРЕЗОВ ПОСЛЕ ЗАЛИВКИ МАТЕРИАЛА
В ЭПОКСИДНЫЕ СМОЛЫ
ИЛИ АКРИЛОВЫЕ ПЛАСТМАССЫ
Необходимо помнить, что реакции окрашивания
материала, залитого в эпоксидные или акриловые
пластмассы, могут значительно отличаться от реакций,
протекающих в тканях, из которых удален заливочный
материал (парафин). Специфичность этих реакций нельзя
считать доказанной.
Время окрашивания и получаемые результаты
различны в зависимости от фиксации и вида заливочного
материала. Например, материал, залитый в аралдит,
требует более продолжительного окрашивания, чем
материал, залитый в другие пластмассы. Указанное ниже
время окрашивания, если оно не оговорено особо, дает
хорошие результаты на материале, залитом в аралдит.
Эффективность красителей, поставляемых разными
фирмами, может быть различной, могут различаться
также и отдельные партии красителя одной и той же
фирмы. Чтобы облегчить проникновение некоторых
красителей в ткань, Мапгер [19] предложил перед
окрашиванием обрабатывать срезы ксилолом в течение 1 ч,
а затем проводить их по спиртам нисходящей
концентрации до воды.
Многие красители обесцвечиваются при длительном
воздействии света и при сушке срезов с подогреванием.
В том случае, когда желательно получить постоянные
препараты, их лучше высушивать иа воздухе при
комнатной температуре, заключать в депекс или пермаунт1,
которые необходимо высушить при комнатной
температуре в темпом месте. Заключение препаратов в эпок-
1 Синтетические нейтральные смолы для заключения препаратов
(см. Р. Лилли, «Патогистологичеекая техника и практическая
гистохимия», изд-во «Мир», М., 1969). — Прим. перев.
П риложение
299
сидный клей также может препятствовать выцветанию
красителей [9].
1. Быстрое окрашивание метиленовым синим [22]
1. Переносят срезы в каплю воды или 10%-пого
ацетона, помещенную на предметное стекло.
2. Приклеивают срез к стеклу, быстро проведя
стекло через пламя газовой горелки. Срез должен
хорошо расправиться и прочно укрепиться на стекле,
если жидкость, в которую он помещен, не
испаряется слишком быстро.
3. Наносят па срез 2 капли 1%-ного водного
раствора метилепового синего и 2 капли 1%-ного
водного раствора буры (тетраборнокислого натрия).
Бура повышает величину рН красителя примерно
до 9.
4. Проводят стекло 10—12 раз над пламенем
газовой горелки. Не допускайте закипания раствора
красителя!
5. Осторожно промывают под струей горячей
водопроводной воды (если промывать в холодной
воде, стекло лопнет).
Результаты окрашивания этим методом довольно
вариабельны; он рекомендуется главным образом из-
за быстроты и может быть очень полезен при поиске
нужного участка в блоке ткани, а также для общей
ориентации на срезе. Воспроизводимые результаты можно
получить при окрашивании препаратов в течение
приблизительно 5 мин с подогреванием па гистологической
плитке или погрузив стекла на срок от 30 мин до 2 ч
в раствор, составленный из смеси равных объемов
1%-ных растворов метилепового синего и буры.
Качество окрашивания зависит от партии применяемого
красителя и заливочного материала.
2. Другие красители, применяемые при высоких
величинах рН
Метнлеповый синий в приведенной выше прописи
может быть заменен другими основными красителями:
20»
300
Приложение
толуидиновым синим, азуром II — метиленовым синим,
кристаллическим фиолетовым, сафранином 0 или тиони-
ном [26].
В нашей лаборатории мы обнаружили, что хорошее
окрашивание получается также при использовании
насыщенной красящей смеси Гимза или 1%-ного
раствора пиронина Y, смешанных на стекле с 1%-ным
раствором буры и подогретых на пламени газовой горелки.
Очень изящная двухцветная окраска получается, если
после пиронина Y срезы докрашивать 1%-ным
толуидиновым синим или 1%-ным метиленовым синим,
смешанными на стекле с 1%-ным раствором буры и
подогретыми над пламенем газовой горелки. Главную роль
при этом играет продолжительность вторичного
окрашивания, которая зависит от партии применяемого
красителя.
3. Окрашивание метиленовым синим — основным
фуксином [2]
1. Срезы окрашивают 1%-ным раствором метилено-
вого синего в 1%-иом растворе буры в течение
15—30 с на гистолической плитке при 70 °С.
2. Промывают в горячей водопроводной воде и
высушивают.
3. Окрашивают 2%-ным раствором основного
фуксина, приготовленным на дистиллированной воде,
в течение 1—2 мин при комнатной температуре.
4. Промывают в холодной воде.
5. Высушивают, заключают в депекс.
(Нами было обнаружено, что строгое соблюдение
этой прописи не дает хороших результатов на срезах
материала, залитого в аралдит. Однако если срезы
предварительно обработать ксилолом в течение 1 ч или
более, затем провести по спиртам нисходящей
концентрации до воды и окрашивать, подогревая стекла на
пламени газовой горелки, то получаются превосходные
результаты.)
Приложение
301
4. ШИК-метод
Сообщалось об удачном применении многих
вариантов реакции ШИК для окрашивания срезов ткани,
залитых в аралдит и эпон. Ниже приводится вариант
метода, который мы считаем наиболее удачным:
1. Наклеивают срезы иа стекло, высушивая их над
пламенем.
2. Обрабатывают ксилолом по меньшей мере в
течение 1 ч, чтобы облегчить проникновение
красителя.
3. Проводят срезы по спиртам нисходящей
концентрации до воды.
4. Окисляют 15 мин в 1%-ной йодной кислоте.
5. Промывают в дистиллированной воде.
6. Окрашивают в течение 45 мин в реактиве Шиффа.
7. Промывают в двух сменах (по 2 мин в каждой)
свежеприготовленного раствора метабисульфита
калия (5 мл 10%-ного раствора K2S2O0, 5 мл 1 М
НС1 долить водой до 100 мл).
8. Промывают в двух сменах дистиллированной
воды.
9. Слегка докрашивают в смеси равных объемов
1%-ного метиленового синего и 1%-ной буры,
подогревая стекло на газовой горелке, для чего
обычно достаточно 4—5 раз быстро провести
стекло через пламя. Промывают в горячей воде.
10. Сушат на воздухе при комнатной температуре в
темном месте.
11. Заключают в депекс.
VIII. ПРИГОТОВЛЕНИЕ ПЛЕНОК-ПОДЛОЖЕК
Наиболее часто, применяемые пленки-подложки
готовят из коллодия (нитроцеллюлоза), формвара (полй-
винилформаль) или напыленного углерода. Углерод,
испаряемый в вакууме, образует прочную пленку
толщиной всего 20 А, которая используется главным обра-<
зом при исследованиях с высоким разрешением.
302
Приложение
1. КОЛЛОДИЕВЫЕ ПЛЕНКИ
Если в коллодиевой пленке, приготовленной по
описанному ниже методу, образуются дырки, то это
означает, что раствор коллодия, по-видимому, поглотил
воду и его следует заменить.
А. Приготовление пленки на поверхности воды по
Дрюмону [7]. На дно мелкой чашки диаметром около
20 см кладут кружок тонкой проволочной сетки (40
отверстий на 1 см). Чашку наполняют дистиллированной
водой. На сетчатый кружок помещают большое
количество сеток для электронной микроскопии вверх той
стороной, которая должна нести на себе опорную
пленку. На воду в центре чашки наливают из пипетки две
капли 2%-ного раствора коллодия в амилацетате.
Растворитель испаряется и оставляет на поверхности
воды пленку коллодия. Первую пленку, предназначенную1
для очистки поверхности воды от частиц пыли,
удаляют с помощью препаровальной иглы и выбрасывают.
Этот этап очень важен, и его никогда нельзя опускать,
поскольку загрязненная опорная пленка делает
негодным исследуемый образец.
Вторую пленку готовят точно таким же способом.
Затем сетчатый кружок вынимают из чашки, и он
захватывает пленку, которая, таким образом, накрывает
помещенные на него сетки. Тот же результат
получается, если отсосать воду из чашки с помощью сифона.
У некоторых фирм можно приобрести специально для
этих целей изготовленные большие чашки Петри со
сливной трубкой и краном.
Сетки высушивают на сетчатом кружке в
защищенном от пыли месте. Когда они высохнут, их можно
снять пинцетом, при этом пленка обрывается по краям
сетки и остается неповрежденной на ее поверхности.
Если при снятии сеток возникают затруднения, нужно
обрезать пленку вокруг сетки иглой или тонко
заточенным пинцетом.
Данный метод удобен в том случае, когда надо
изготовить большое число сеток за один прием. Однако
если сетки с пленкой-подложкой не используются веко-
_ Приложение 303
ре после их изготовления, то пленка становится ломкой
и трескается.
Б. Отслаивание пленки со стекла на воду. Данный
метод позволяет получить более прочные пленки, чем
описанные выше, и служит основным методом во
многих лабораториях. Он удобен, когда одномоментно
покрывают пленкой небольшое число сеток.
Готовят 0,5%-ный раствор коллодия в амилацетате.
Предупреждение: амилацетат — летучее
вещество и может вызвать поражение печени при
длительном вдыхании его паров. Закрывайте сосуд с
раствором коллодия, чтобы избежать испарения
растворителя и увеличения концентрации коллодия.
Можно готовить запасной раствор более высокой
концентрации (например, 5%-ный) и, разводя его амилацетатом,
получать 0,5%-ный рабочий раствор коллодия.
Запасной раствор хорошо сохраняется в течение нескольких
месяцев.
Небольшую каплю типола или сходного с ним
детергента помещают на одну сторону предметного стекла и
растирают пальцем по всей поверхности стекла, чтобы
образовался тонкий слой этого вещества. Излишки
детергента удаляют чистой тряпочкой (стекло не должно
быть слишком чистым, иначе пленку не удастся снять).
Стекло погружают в раствор коллодия, вынимают,
дают стечь раствору на фильтровальную бумагу и суша'т
в течение 10 мин в вертикальном положении в
защищенном от пыли месте. Лезвием безопасной бритвы или
острым пинцетом делают надрез, параллельный краю
стекла, на той его стороне, где под коллодиевой
пленкой находится слой детергента (фиг. 17). Поверхность
дистиллированной воды, налитой в чашку, очищается
с помощью коллодиевой пленки, как это описано в
методе А. Подышите на стекло и, наклонив его
(примерно на 30° по отношению к горизонтальной плоскости),
медленно погружайте в чашку с дистиллированной
водой. Пленка коллодия должна отслоиться на воду.
О толщине пленки можно судить по отраженному
от нее свету. Самая тонкая пленка видна только в
отраженном свете и кажется серой или серебристо-серой.
Золотистая пленка слишком толста. Чтобы получить
504
Приложение
требуемую толщину пленки, можно менять процент
содержания коллодия в растворе.
На плавающую пленку опускают сетки. Легкое
нажатие на каждую сетку пинцетом или иглой обеспечит
Фиг. 17. Приготовление пленки на стеклянной пластинке.
А. Погружение стекла в раствор коллодия или формвара. Б. Сушка в
вертикальном положении. В. Нанесение р.презов, параллельных краям стекла.
Г. Снятие пленки на поверхность воды. Д. Размещение сеток на плавающей
пленке. 1 — предметное стекло; 2—коллодиевая кленка; 3 — фильтровальная
бумага; 1 — сетки.
хороший контакт между сеткой и пленкой. Кусок
неворсистой бумаги «велии» (пергамента) опускают на
пленку и, поднимая его, извлекают пленку вместе с сетками.
Бумагу кладут сетками кверху в чашку Петри, в
которой она высыхает и может храниться до того
момента, пока не понадобятся сетки. Сетки можно снять
пинцетом, как описано в методе А.
Приложение
305
2. ФОРМВАРОВЫЕ ПЛЕНКИ
Пленки из формвара более прочны, чем коллодие-
вые, однако приготовить их бывает труднее и запасной
раствор формвара необходимо чаще обновлять. Очень
важно также, чтобы формвар, из которого готовится
запасной раствор, был достаточно свежим. Если
пленка не снимается со стекла, нужно убедиться, не
слишком ли чисто вымыты стекла. Если же причина
неудачи не в этом, следует испробовать свежую партию
формвара.
Хорошую формваровую пленку нельзя приготовить,
наливая раствор формвара на поверхность воды. Такие
пленки всегда получают методом отслаивания со стекла
на воду.
Готовят 0,3—1%-ный раствор формвара в
дихлорэтане или хлороформе. Держите сосуд с раствором
закрытым, иначе растворитель будет испаряться. Пленка
готовится так же, как коллодиевая (метод 1, Б см.
выше). Меняйте концентрацию формвара в растворе до
тех нор, пока не будет получена пленка нужной
толщины.
Если в качестве растворителя применяется
хлороформ, то для погружения стекол лучше пользоваться
высоким сосудом. При этом стекло, погруженное в
раствор формвара, может быть просушено перед тем, как
оно будет окончательно вынуто из сосуда. Именно
такое просушивание в атмосфере, насыщенной парами
хлороформа, позволяет избежать образования не
одинаковой по толщине пленки и неравномерного испарения
растворителя ([21], стр. 198).
3. УГЛЕРОДНЫЕ ПЛЕНКИ
Углеродные пленки прочнее и более устойчивы при
действии электронного луча, чем пленки из коллодия
или формвара. Они также более пригодны для
исследований с высоким разрешением, поскольку можно
получить углеродную пленку толщиной всего 20 A s
А. Пленки из формвара, а также коллодиевые
пленки можно при необходимости укрепить, нанеся на них
Тонкий слой углерода при его испарении в вакууме (по-
306
Приложение
дробно о технике испарения углерода в вакууме см.
[23, 24] is библиографии к гл. 10).
Б. Тонкую пленку чистого углерода для
исследований с высоким разрешением можно получить, нанеся
слой углерода на сетку, покрытую коллодием или форм-
варом, и затем удалив их с помощью соответствующих
растворителей (амилацетат для коллодия; хлороформ
для формвара). Сетки помещают в растворитель на
30 мин, а затем переносят еще на 10 мин в свежую
порцию растворителя.
ПРИГОТОВЛЕНИЕ ПЕРФОРИРОВАННОЙ УГЛЕРОДНОЙ
ПЛЕНКИ, ИСПОЛЬЗУЕМОЙ ДЛЯ ЭКСПЛУАТАЦИОННЫХ
ИСПЫТАНИИ МИКРОСКОПА (МЕТОД ХАРРИСА [8],
ПРИНЯТЫЙ КОНСУЛЬТАТИВНОЙ ЛАБОРАТОРИЕЙ AEI)
При добавлении небольшого количества воды к рас-
твору формвара (в данном случае — 50%-ного
глицерина) образуется пленка с отверстиями.
1. Добавляют 0,25 мл 50%-ного глицерина к 30 мл
0,5%-ного раствора формвара в хлороформе.
2. Раствор встряхивают, чтобы смешать глицерин и
формвар. Непосредственно перед применением
раствор перемешивают, подвергая воздействию
ультразвука.
3. Готовят сетки, покрытые пленкой, как это
описано для коллодиевых пленок (метод Б).
4. Сетки высушивают на бумаге «велин» в течение
30 мин в защищенном от пыли месте.
5. Для удаления глицерина и воды сетки на 15 мин
кладут на «фитиль» из фильтровальной бумаги,
погруженный в метиловый спирт. (Такой
«фитиль»— это просто стопка фильтровальной
бумаги, уложенная в закрытый бюкс; основание
стопки погружено в метиловый спирт.)
6. Сетки высушивают.
7. Покрывают слоем углерода путем испарения
этого вещества в вакууме (бумага «велин» быстро
дегазуется, так что сетки можно покрывать
углеродом, не снимая их с этой бумаги).
Приложение
307
8. Формвар удаляют, погружая сетки па 30 мин в
хлороформ и затем в свежую порцию
хлороформа еще на 10 мин (это очень важный этап,
поскольку толстая пленка из формвара и углерода
может послужить причиной хроматических
аберраций).
IX. МЫТЬЕ ПОСУДЫ И ОТМЫВКА СЕТОК
Методы очистки, применяемые при повседневном
уходе за микроскопом, описаны в гл. 10.
МЫТЬЕ СТЕКЛЯННОЙ ПОСУДЫ
Очень распространенным и эффективным
детергентом для повседневного мытья стеклянной посуды
является типол. Его надо тщательно отмывать (три
промывки в деионизованной воде и три — в
дистиллированной воде). Однако с помощью типола не удается до
конца отмыть некоторые более стойкие загрязнения,
вызванные органическими или радиоактивными
веществами и жирами.
Кислотные растворы для мытья посуды. Сильно
загрязненную посуду, применявшуюся для фиксации
ткани, а также посуду, соприкасавшуюся с ферментами при
гистохимических исследованиях или употреблявшуюся
для радиоавтографии, хорошо вымыть кислотой. Ясно,
что с кислотой надо обращаться очень осторожно,
избегая ее попадания на кожу или в глаза. Применяемая
обычно смесь состоит из:
Бихромата калия —100 г
Концентрированной
серной кислоты —250 мл
Воды —750 мл
Всегда необходимо медленно и при помешивании
добавлять кислоту к водному раствору бихромата, а не
наоборот. В противном случае смесь может закипеть
и начнет разбрызгиваться. Готовится раствор кислоты
в термостойкой посуде, помещенной в водопроводную
раковину.
308
Приложение
Продолжительность обработки посуды в кислотной
ванне зависит от характера ее загрязнений и
концентрации кислоты. Может понадобиться длительная
обработка, но даже при этом некоторые загрязняющие
вещества остаются устойчивыми к действию кислоты.
Однако сама стеклянная посуда может портиться от
действия кислоты. Особенно вредно это сказывается на
калиброванной посуде.
Посуду, обработанную смесью серной кислоты и би-
хромата, надо очень тщательно промыть, чтобы удалить
все следы кислоты. Некоторые сорта стекла особенно
прочно удерживают кислоту. После предварительной
промывки в деионизовашюй воде посуду лучше
оставить на некоторое время в свежей дистиллированной
воде, чтобы удалить еще оставшуюся на стекле
кислоту. Затем посуду снова моют в свежей
дистиллированной воде, полученной в стеклянном дистилляторе.
Особенно эффективным концентрированным
раствором для очистки стеклянной посуды является декон-75.
Показано, что он более эффективно, чем хромовая
кислота, удаляет некоторые органические вещества, жиры,
радиоактивные загрязнения и даже стойкие
загрязнения такими веществ.амн, как силиконы, поливиниловый
спирт, поливинилацетат и полиметилметакрилат [4].
Декон-75 не повреждает стеклянной посуды и
полностью удаляется при четырехкратной промывке в де-
ионизованпой воде. При использовании посуды для
электронно-микроскопических исследований
необходима дополнительная промывка ее в дистиллированной
воде, полученной в стеклянном дистилляторе.
Декон-75 не токсичен и не опасен при храпении и
работе с ним, однако, чтобы избежать излишней
сухости кожи рук, надо надевать резиновые перчатки. В
отличие от многих детергентов декон-75 разрушается
биологическими средствами, и, таким образом, не
возникает проблемы его ликвидации после использования.
Он стоит дорого, но применяется в виде сильно
разбавленных растворов: 2—7%-ный раствор для обычных
целей, 20%-ный раствор — для радиоактивных
загрязнений. При удалении грубых загрязнений декон-75
применяется при температуре несколько выше комнатной.
Приложение ЗС§
Очевидно, вследствие своей эффективности декон-75
исключительно ценен для обработки посуды,
применяемой в особо важных экспериментах.
ОТМЫВКА ОПОРНЫХ СЕТОК
Грязные сетки могут поступать от
фирм-изготовителей, могут загрязняться они и в лаборатории. Такие
сетки будут загрязнять помещаемые на них срезы.
Некоторые' виды загрязнения делают почти невозможным
вылавливание среза на сетку.
Пиз ([21], стр. 215) рекомендует отмывать сетки,
встряхивая их в растворе детергента, налитого в 200-
миллилитровую коническую колбу, после чего сетки
тщательно споласкивают в нескольких сменах
дистиллированной воды и химически чистом ацетоне. Ацетон
сливают, а сетки вытряхивают па большой лист бумаги
и сушат в защищенном от пыли месте.
Если необходимо повторно использовать дорогие
сетки, изготовленные из молибдена, золота или других
драгоценных металлов, то методы их очистки будут
различаться в зависимости от того, что было помещено на
сетке. Пленки из коллодия или формвара можно
удалить с помощью соответствующих растворителей,
например амилацетата или хлороформа. Для этого сетки
погружают на 30 мин в растворитель, а затем еще на
10 мин в новую порцию этого растворителя, после чего
сетки тщательно промывают спиртом. Если в
результате этого не удается удалить пленку целиком, то может
потребоваться обработка ультразвуком в течение 2 мин
в растворителе и затем в течение 2 мин в этиловом
спирте. Очищенные сетки раскладывают на большом
листе фильтровальной бумаги или бумаги «велин» и
сушат в защищенном от пыли месте. Каждую сетку
просматривают при большом увеличении светового
микроскопа, чтобы убедиться в ее чистоте и пригодности для
повторного использования.
310
Приложение
X. ФОТОГРАФИРОВАНИЕ
Для электронно-микроскопических работ
рекомендуются следующие фотографические материалы1:
Пластинки: Ilford
Kodak
Agfa-Gevaert
Форматная пленка:
Ilford
Kodak
Agfa-Gevaert
Катушечная пленка:
Ilford
Agfa-Gevaert
Проявители: Ilford
Kodak
May and Baker
EM4 (высокой
чувствительности), EM5 (средней
чувствительности), ЕМ6 (низкой
чувствительности)
Electron Image Plates
(.приобретаются в США,
довольно дороги)
Scientia 23D50
N7E50 6,5 X 9,0 см
Electron Microscope Film
(приобретаются в США,
упаковка 200 коробок по
100 листов)
Scientia 23D56
N4E50
Scientia 22D50 или 19D50
PQ Universal (разводится
1 :20)
DX80 (разводится 1 : 10)
Teknol (разводится 1 : 20)
Все перечисленные проявители продаются в жидком
виде, что делает их удобным для употребления.
Закрепители: Ilford
Kodak
May and Baker
Защитные светофильтры:
Hypam
Rapid Fixer с дубителем
Amfix and Super Amfix
Ilford 902S или 904F
Kodak OB
1 В Советском Союзе производятся следующие виды
фотопластинок, пригодных для электронно-микроскопических исследований: тип
«MP для ядерных исследований», диапозитивные сверхконтрастпые
для контактной печати. Списки реактивов для фоторабот н
рецепты проявляющих и закрепляющих растворов можно найти в любом
справочнике. Желательно использовать контрастно работающие
проявители. — Прим. ред.
Список литературы
311
ОСЛАБИТЕЛЬ ПО ФАРМЕРУ И СПОСОБ
ЕГО ПРИМЕНЕНИЯ
Если пластинка или пленка не были слишком
сильно передержаны, то их плотность может быть снижена
до необходимого уровня с помощью ослабителя
Фармера.
Раствор 1. Тиосульфат натрия (гипосульфит)' 240 г
Вода до ' 1000 мл
Раствор 2. Железосинеродистый калий 19 г
Вода до 250 мл
Растворы храпят раздельно и смешивают
непосредственно перед употреблением в следующей пропорции:
1 часть раствора 2
4 части раствора 1
32 части воды
Негатив погружают в раствор ослабителя и затем
просматривают каждые 15 с для наблюдения за ходом
процесса ослабления. Когда достигается нужная степень
ослабления, негатив промывают в воде, дополнительно
закрепляют, снова промывают и сушат.
Список литературы
1. Anderson W. A., Andre J., The extraction of some cell components
with pronase and pepsin from thin sections of tissue embedded in
an Epon-Aralditc mixture, Journal de Microscopic, 7, 343—354
(1968).
2. Aparicio S. R., Marsden P., A rapid methylene blue-basic fuchsin
stain for semi-thin sections of peripheral nerve and other tussues,
Journal of Microscopy, 89, 139—141 (1968).
3. Bennett H. S., Luff J. H., s-Collidine as a base for buffering
fixatives, Journal of Biophysical and Biochemical Cytology, 6, 113—114
(1959).
4. Bradshaw J. R., Comparison of surface-active agents, Process
Biochemistry, 5, 19—20 (1970).
5. Caulfietd J. В., Effects of varying the vehicle for osmium tetroxide
in tissue fixation, Journal of Biophysical and Biochemical Cytology,
3, 827 (1957).
6. Glauert A. M., In Techniques for Electron Microscopy (Edited by
D. H. Kay), Oxford, Blackwell Scientific Publications, 1965.
7. Drummond D. G., The practice of electron microscopy: basic
techniques, Journal of the Royal Microscopical Society, 70, 17—19
(1950).
312
Список литературы
8. Harris W. I., Holey films for electron microscopy, Nature, London,
196, 499—500 (1962).
9. Harrison G. A. (1971), личное сообщение.
10. Hodgman С. D., Weast R. C, Selby S. M. (Eds.), Handbook of
Chemistry and Physics, 5th edn., Cleveland, Chemical Rubber
Publishing Co, 1970.
11. Karnovsky M. I., Simple methods for "staining with lead" at high
pH in electron microscopy, Journal of Biophysical and Biochemical
Cytology, 11, 729—732 (1961).
12. Karnovsky J. J., A formaldehyde-glutaraldehyde fixative of high
osmolarity for use in electron microscopy, Journal of Cell Biology,
27, 137—138 (1965).
13. Leduc E. H., Bernhard W., Recent modifications of the glycol
methacrylate embedding procedure, Journal of Ultrastrncture Re-
14. Luft J. H., Improvements in epoxy resin embedding methods,
Journal of Biophysical and Biochemical Cytology, 9, 40Э—414 (1961).
15. Marinozzi V., In Fourth European Regional Conference on Electron
Microscopy, Vol. 2, pp. 55—56 (Edited by D. S. Bocciarelli), Rome,
Tipographia Poliglotta Vaticana, 1968.
16. Millonig G., In Fifth International Congress on Electron Microsco-
■ py, Vol. 2, p. 8 (Edited by S. S. Breesc), New York, Academic Press,
1962. ,
search, 19, 196—199 (1967).
17. Moltenhauer H. H., Plastic embedding mixtures for use in electron
microscopy, Stain Technology, 39, 111—114 (1964).
18. Monneron A., Bernhard W., Fine structural organization of the
interphase nucleus in some mammalian cells, Journal of Ultrastructu-
re Research, 27, 266—288 (1969).
19. Munger B. L., Staining methods applicable to sections of osmium-
fixed tissue for light microscopy, Journal of Biophysical and
Biochemical Cytology, 11, 502—506 (1961).
20. Palade G. E., A study of fixation for electron microscopy, Journal
of Experimental Medicine, 95, 285—298 (1962).
21. Pease D. C, In Histological Techniques for Electron Microscopy,
2nd edn., pp. 52, 198, 215, New York and London, Academic Press,
1964.
22. Philpott D. E., A rapid method for staining plastic-embedded tissue
for light microscopy, Scientific Instruments, 11, 11 — 12 (1966).
23. Porter K- R-, In Modern Developments in Electron Microscopy,
p. 139 (Edited by В. М. Siegel), New York and London, Academic
Press, 1964.
24. Rambourg A., Hernandez W., Leblond C. P., Detection of complex
carbohydrates in the Golgi apparatus of rat cells, Journal of Cell
Biology, 40,395—414 (1969).
25,. Reynolds E. S., The use of lead citrate at high pH as an electrono-
paque stain in electron microscopy, Journal of Cell Biology, 17,
208—212 (1963).
26. Richardson K- C., larrett L., Finke E. H., Embedding in epoxy resins
for ultrathin sectioning in electron microscopy, Stain Technology,
$5, 313—323 (1960).
Список литературы
313
27. Ryter A., Kellenberger Е., L'inclusion au polysster pour I'ultramfcro-
tomie, Journal of Ultrastructure Research, 2, 200—214 (1958).
28. Sabatini D. D., Bensch K-, Barrnett R. /., Cytochemistry and electron
microscopy — the preservation of cellular ultrastructure and
enzymatic activity by aldehyde fixation, Journal of Cell Biology, 17,
19—58 (1963).
29. Sjostrand F. S., In Physical Techniques in Biological Research, 2nd
edn., Vol. 3, Part C, p. 181 (Edited by A. W. Pollister), New York
and London, Academic Press, 1969.
30. Venable J. H., CoggeshaU R., A simplified lead citrate stain for use
in electron microscopy, Journal of Cell Biology, 25, 407—408
(1965). •
31. Weibel E. R., Stereological principles for morphometry in electron
microscopic cytology, International Review of Cytology, 26, 262
(1969).
?I—977
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
Аварийное выключение
микроскопа 127, 128
Акриловые смолы, см.
Заливочные среды, Метакрилаты
Альдегиды, см. Фиксаторы
Амилацетат 34, см. также Кол-
лодиевые пленки
Аналитическая электронная
микроскопия 203—205
Анод 12, 13, 15, 125, 251, 252,
см. также Электронная
пушка
Анодная пластина, см. Анод
Апертура численная 21
Анертурные диафрагмы 20—23,
251, 258, 259, 262, 264, 265
центрировка 262
чистка 264, 265
Апертурный угол 20, 21
Аралдит, см. Заливочные
среды, Эпоксидные смолы
Артефакты 165—170
Астигматизм 24, 25, 124—126,
132—135
— копденсорпой линзы 25, 118,
132, 262
-- корректоры (стигматоры) 25,
125
— коррекция 124, 132—135
^-объективной линзы 24, 124,
125, 132—135, 255, 262
Белки 40—47, 165, 180—183, см.
также Ферменты и Иммупо-
элсктронная микроскопия
рензо.ила перекись, см.
Катализаторы
Буферные растворы для
приготовления фиксаторов 276—
282
для промывки и храпения
ткани 282, 283
• осмотичность 48—54
Вакуумная система 28, 29, 265
Вестопал W, см. Заливочные
среды
Вибрация, см. Ультрамикрото-
мия, проблемы
Водные фильтры 266, см.
также Электронный микроскоп,
Блок высокого напряжения
Вольтажный центр 251, см.
также Центрировка
Высокое напряжение, см.
Ускоряющее напряжение
Высоковольтная электронная
микроскопия 238—240, фото 6
Гейсслера трубка 114
Гидратированные реактивы 273
Гистерезис магнитный, см.
Линзы, гистерезис
Гликольметакрилат, см.
Заливочные среды
водорастворимые
Глутаральдегид, см. Фиксаторы
Давление единицы 30
Движение (дрейф, смещение)
объекта 122, 125, 255, 270
Предметный
указатель
ы&
Дифракция 20—22, 120, 121,
133, 134, 254
Дифракционные полосы 20—22,
120, 121, 133, 134, 254, фото 3
Дифракционной решетки
реплика 255, 256
Диффузионный насос 29, 265,
271
Животные 35, 36
— выбор объекта
исследования 35
— способы забоя 35, 36
Загрязнения 24, 25, 121, 125,
129—132, 254—258, 260, 261
— колонны 24, 25, 125, 129—
130, 256—258, 260, 261
— образца 25, 129—131
Заливка 54—56, 283—291
Заливочные среды 33, 34, 54—
58, 99, 197, 198, 283—291
аралдат 33, 57, 62, 199,
284—287
вестешал W 57, 288
водорастворимые 28, 290,
291
метакрилаты (акриловые
смолы) 34, 56, 57, 197, 289—
291
полимеризация 285—291
сублимация (возгонка) 57,
131
эпоксидные смолы 33, 55,
57, 62, 283—288
эион 33, 57, 197, 284, 286,
287
Измерение структур 170—175,
см. также Морфометрия
Иммуноэлектрониая
микроскопия 188—190
Ионизационный манометр, см.
Гсйсслера трубка
Искажения (дисторсии) 26, 27
— бочкообразные 26
— подушкообразные 26
— спиральные 27
Испытание работы микроскопа,
см. Электронный микроскоп,
обслуживание
Катализаторы 34, 284
Катод, см. Катода нить
Катода нить 12, 15, 114, 115,
126, 127, 259—262, 268-271
смена 259—262
срок службы 28, 259
Катода экран защитный 14,
260, 261, 269
Коллодиевая пленка, см.
Пленки-подложки
Конденсорные линзы,
назначение 19
Контраст 96—'110
— усиление на ультратонких
срезах 97, 98, 292—298
— формирование-96
Контрастирование, см.
Окрашивание
Криоультра.микротомия 201—
203
Линзы магнитные 12, 16, 26,
29, 30, 118, 124—126, 132—
135, 250—253, 266, 268—271
аберрации 20—27
-гистерезис 118, 173
— конденсорные 12, 13, 17—19,
29, 30, 118, 126, 252, 268—271
— объективные 12, 13, 18, 124—
126, 132—135, 250—253
— охлаждение 29, 30
— промежуточные
(проекционные) 12, 13, 18—20, 118,
250 253
Липиды 40—44, 46, 47, 180—183
Луча исчезновение, см.
Электронный луч
Люминесцентный экран 13, 27,
122, 253, 266, 267
Люминесценция 27
Люперко CDB, см.
Катализаторы
Люцидол, см. Бензоила
перекись
21*
316
Предметный указатель
Магнитная ось микроскопа 251,
см. также Центрировка
Маркхема метод ротационный,
см. Фотографические методы
усиления деталей объекта
Метакрилаты, см. Заливочные
среды
Методы замораживания 201—
203, 223—232
замораживание-высушивание 223—226
замораживание-замещение 226, 227
замораживание-травление
227—232
Механический центр 251, см.
также Центрировка
Миелиновые фигуры 168
Морфометрия 170—175
Мукополисахариды 47, 190—
193
Напряжение смещения 15
Напряжения источник 12, 13,
267
Насосы, см. Вакуумная система
Негативное контрастирование
107, 108
Ножи, см. Ультрамикротомия
Нуклеиновые кислоты 41, 44,
47, 168, 169, 182, 199, 202
Обезвоживание 54—56, 61, 224,
237, 288, 289
— перед заключением в весто-
пал W 288
— перед заключением в
водорастворимые смолы 291
— физические способы 224, см.
также Замораживания
методы
Объектодержатель 113, 115,
255, 268—271
Объекта камера 113, 114, 268,
269
Окрашивание
(контрастирование) 69, 84, 98—108, 158, 159,
170, 292—301
Окрашивание двойное (по Рей-
польдсу) 103, 294—296
— для сканирующего
микроскопа 237
— избирательность и
специфичность 100, 101
— лимитирующие факторы
(ограничения позитивного
окрашивания) 183, 184
— негативное 107, 108
—осадки красителей 170
—поверхностное 105—107
— пропяси 292—301
— полутонких (1 мкм) срезов
84, 159, 160, 298—301
— ультратонких срезов 99—107,
292—298
Оксипропилметакрилат, см.
Заливочные среды,
водорастворимые
Оптическая дифрактометрия,
см. Фотографические методы
усиления деталей объекта
Ориентированные срезы 69, 85,
86, 159-161
Осветительная система 126,
252, 253, 268—271, см.
также Электронная пушка,
Линзы
— центрировка 126, 252, 253,
268—271
«Оси» электронного
микроскопа 251—253, см. также
Механическая ось, Магнитная
ось, Вольтажная ось
Осмия четырехокись, см.
Фиксаторы
Осмотичность 48—54
Охлаждения система 29, 30,
266
Параформальдегид, см. Фикса-
* торы
Патологические изменения в
ткани 169, см. также
Артефакты
Перманганат калия, см.
Фиксаторы
Пленки-подложки 82, 130, 218,
221, 301—307
Йредметный указатель
317
Пленки-подложки коллодие-
вые 82, 221, 302—304
— углеродные 130, 305—307
— формваровые 82, 221, 305—
307
Полисахариды 46, 47, 190—193
Полиэфирные смолы, см.
Заливочные среды
Полюсный наконечник 16
Посмертные изменения в ткани
35, 36, 166, см. также
Артефакты
Постфиксация 43
Пропиленоксид, см. Эпоксипро-
пан
Противозагрязпителыюе
устройство 131
Радиоавтография 213—222
— в световой микроскопии 214,
215
— в электронной микроскопии
215—222
— теория 214
Разрешающая способность
(разрешение) 10, 20—22, 108,
120, 121, 135, 154, 155
Резка, см. Ультрамикротомия
Рентгеновское облучение 253,
254
Реплики, изготовлеиие 232—234
Сетки 91, 92, 173, 218, 302—
306, 309
СИ (система единиц) 30, 31
Сканирующий электронный
микроскоп 234—237, фото 5
Спектрометрический анализ, см.
Аналитическая электронная
микроскопия
Срезы полутонкие 83, 84, 200,
201
Стабилизирующие агенты, см.
Фиксаторы, Альдегиды
Стереологическая цитология,
. см. Морфометрия
Стереофотография 236, 240, 241
Стигматор, см. Астигматизм,
корректоры
Сублимация (возгонка), см.
Заливочные среды,
сублимация
Сферическая аберрация 22
Термальная эмиссия 15
Тоничность растворов, см.
Осмотичиость
Точка замерзания растворов 50,
см. также Осмотичиость
Увеличения калибровка, см.
Электронный микроскоп,
обслуживание
Угол половины апертуры 21
Углеродная пленка, см.
Пленки-подложки
Ультразвуковая очистка
деталей 263, 264
Ультрамикротомия 67—95
— материалы 81, 82
— ножи алмазные 80
— ножи стеклянные 69—80
оценка качества 77—80
— методы изготовления
70—77
— проблемы 90, 91
— с предварительной
ориентировкой 69, 83, 84, см. также
Ориентированные срезы
— сжатие образца при резке
90, 169
Ультрамикротомы 86—88
Ускоряющее напряжение
высоковольтного
электронного микроскопа 238
просвечивающего
электронного микроскопа 13
сканирующего
электронного микроскопа 235
Фазового . контраста эффект,
см. Фокусировка
Ферменты 184—188, 193—200,
201, см. также Белки и Им-
муноэлектронная
микроскопия
318
Йредметный ' указатель
Ферменты локализация 184—
188
— переваривание 193—200
Фиксаторы 33, 40—44, 46, 47,
61, 98, 165—169, 275—282
— альдегиды 33, 41—43, 46, 47,
61, 98, 165—169, 278—281
— глутаральдегид 33, 37, 41, 43,
278—280, фото 1, Б
— осмия четырехокись 33, 36—
41, 46, 47, 275—278, фото \,А
и \,Б
— параформальдегид 43, 280,
281
— перманганат калия 43, 46, 47,
281, фото \,В
— — — приготовление 275—282
— формалин 38, 41—43, 46, 47,
61, 98, 165—169, 278—281
Фиксация 36—54, 61, 180—183,
275—282, фото 1, 2 .и 4, Л
— время 37
— двойная 43, 183
— механизмы 40—44
—■ перфузионная 39
— рН фиксаторов 39
— прописи 60—62, 275—282
— температурные условия 37
— экстракция тканевых
компонентов 45—48, 180—183,
фото 4
Фокусировка 16—18, 119—121,
254, 255
— глубина фокуса 18, 19, Mb
— зернистость дефокусировки
120, 121
— педофокусировка 17, 18,
119-121
— перефокусировка 17, 18,
119-121
— способы точной
фокусировки 120, 121, фото 3, А — Г
— фазового контраста эффект
120
Формальдегид, см. Фиксаторы
Формваровая пленка, см.
Пленки-подложки
Фотографирование 27, 117, 118,
121—124, 137—153, 170—173,
240—243, 310, 311
Фотографирование
высушивание пластинок и пленок 124,
140, 257, 258
— машины для обработки
фотоматериалов 152
— перезарядка фотокамеры
123, 124
— проявление и печать 123,
124, 141—144
— реактивы и материалы 34,
142—145, 310, 311
— теория 137, 138, 149—151 .
— увеличители 151
к- увеличение
микрофотографий 147, 148, 172
Фотографические методы
усиления деталей объекта 242,
243
Хранение фиксированного
материала 282, 283
Хроматическая аберрация 22—
24, см. также Линзы
Центрировка (юстировка) 250—
253
Цитохимия 180—205
—■ ультраструктурная 180—200
— полутонких срезов 200, 201
Чистка электронного
микроскопа и принадлежностей 256—
258, 262—264, 306—309
Электронов рассеяние 13, 24,
96—98, 235, 239
Электронная пушка 14, 252,
253, 269—271
-Электронный луч 11, 13, 114,
115, 125—127, 129, 130, 260,
262, 268, 269
загрязнения под
воздействием луча, см. Загрязнений
— — исчезновение 126, 268
мерцание 260, 269
— — основной 251
отсутствие 115, 268, 269
Предметный указатель
319
Электронный луч свойства
образца после облучения 57,
104, 10&>
формирование 12, 13, 15
центрировка конденсора
(осветителя) 126, 262
эллиптическая форма
сечения 25, 126, 132, 269
Электронный микроанализатор,
см. Аналитическая
электронная микроскопия
Электронный микроскоп,
обслужив а иле 247—272
^блок высокого
напряжения 267
водные фильтры 266
воздушные фильтры 266
— — возможные
неисправности, устранение 268—271
график и протоколы
обслуживания 258, 259
калибровка увеличения
255, 256
Электронный микроскоп
контракты на обслуживание 249
■ насосы 265, 266
■ рабочие тесты 254, 255
чистка 262—267
повседневная работа
оператора 111 — 135, 268—271
• аварийное выключение
127, 128
возможные неисправности
125—127, 268—271
Электронный «шум» 24, 238,
239, 257 ">
Эпои, см. Заливочные среды
Эпоксидные смолы, см.
Заливочные среды
Эпоксипропан 33, 55, 61
Эри диск 20
Эффективный источник
электронов 15, 114
Яды, вредные вещества 33, 34
ОГЛАВЛЕНИЕ
Предисловие к русскому изданию 5
Предисловие автора 9
Глава 1. Элементарные основы теории электронной
микроскопии П
Разрешающая способность (разрешение) И
Волновая природа электронного луча 11
Основы конструкции электронного микроскопа . . . . 12
Электронная пушка . 14
Магнитные линзы 16
Физические явления и дефекты линз, ограничивающие
возможности электронного микроскопа 20
Люминесцентный экран 27
Вакуумная система 28
Система охлаждения ■ 29
Единицы длины и давления, применяемые в электронной
микроскопии 30
Список литературы 31
Глава 2. Обработка тканей 33
Предостережение 33
Выбор экспериментальных животных и взятие тканей . . 35
Фиксация 36
Механизмы фиксации 40
Буферные растворы, обычно используемые для
приготовления фиксаторов 44
Утрата компонентов ткани при "ее обработке .... 45
Осмотическое давление 48
Обезвоживание и заливка 54
Типы заливочных сред 56
Влияние заливочной среды на ткань 58
Важность строгого соблюдения принятой методики
обработки ткани 59
Схема обработки ткани, рекомендуемая для текущей работы 60
Список литературы .......... Щ
Оглавление
321
Глава 3. Приготовление ультратонких срезов для электронной
микроскопии ■ . 68
Необходимость ориентировки срезов 69
Стеклянные ножи 69'
Способы изготовления стеклянных ножей 70
Приборы для изготовления стеклянных ножен ... 70
Оценка качества стеклянного ножа 77
Алмазные ножи 80
Резка 80
Материалы, необходимые при резке 81
Резка срезов толщиной 1 мкм . , 83
Окраска срезов толщиной 1 мкм 84
Заточка блока для получения ультратонких срезов . . 85
Ультрамикротомия - 86
Определение толщины срезов 90
Некоторые проблемы, возникающие в процессе резани8 90
Вылавливание срезов 91
Качество срезов 93
Резка ткани для исследований с высоким разрешением 94
Ультратонкие замороженные срезы 95
Список литературы 95
Глава 4. Контрастирование (окрашивание) биологических
материалов для электронной микроскопии .... 96
Возникновение контраста изображения ...... 96
Усиление контраста ... 97
Окрашивание при фиксации и обезвоживании .... 98
Окрашивание ультратонких срезов " 99
Избирательность и специфичность 100
Наиболее часто употребляемые методы окрашивания 101
Двойное окрашивание 103
Просмотр среза перед окрашиванием 103
Значение размеров частиц красителя 104
Поверхностное окрашивание 105
Негативное контрастирование 107
Список литературы 108
Глава 5. Режим управления электронным микроскопом . . 111
Типичные операции при повседневной работе па
электронном микроскопе 112
Как ввести образец в микроскоп 113
Как получить хорошее освещение 114
Как найти участок образца для исследования . . . , 116
Что фотографировать 117
Как фокусировать 119
Как фокусировать, не допуская загрязнения среза .' . 121
Как фотографировать . 121
Как извлечь фотоматериал из микроскопа и перезарядить
камеру 123
О важности повторной проверки коррекции астигматизма 124
322
Оглавление
Основные неполадки, возникающие при работе на
микроскопе 126
Аварийное выключение 127
Что надо делать, закончив работу па микроскопе . . . 128
Загрязнение образца , 129
Определение степени загрязненности 130
Удаление материала из образца («возгонка») .... 131
Устройство для защиты от загрязнений 131
Коррекция астигматизма 132
Опасность рентгеновского облучения 135
Электронная микроскопия с высоким разрешением . . 135
Список литературы . 135
Глава 6. Фотолабораторные работы 137
Фотографический процесс 137
Проявители . 139
Закрепители ...... 139
Пластинки 140
Катушечная пленка 140
Форматная (плоская) пленка . 140
Проявление и получение отпечатков 141
Проявление пластинок 142
Получение позитивов с фотопластинок 144
Рабочие отпечатки 146
Увеличение микрофотографий 147
Что делать с неравномерно экспонированными негативами 148
О чистоте и фотолаборатории 149
О различиях в действии электронов и света на
фотографические эмульсии 149
Увеличители 151
Машины для обработки отпечатков 152
Список литературы 153
Глава 7. Некоторые общие советы, связанные с изучением
.ультраструктуры 154
Изучение ультраструктуры. Предварительное обсуждение 156
Анализ опубликованных микрофотографий 156
Подготовительная работа со световым микроскопом . . 158
Важность ориентировки материала перед изготовлением
срезов 159
Полноценный образец ткани . . - 161
Изучение ультраструктуры: анализ полученных
микрофотографий 162
Артефакты 165
Измерение структур на электронных микрофотографиях 170
Планирование исследовательской работы 175
Ведение протоколов 176
Необходимость следить за литературой 176
Список литературы 177
Оглавление
323
Глава 8. Ул'ьтраструктурная цитохимия 180
Информация, получаемая при использовании двух или более
фиксаторов 180
Ограничения позитивного окрашивания 183
Определение местонахождения (локализации)
специфических белков в тканях 184
Локализация ферментов 184
Электронная микроскопия иммунных реакций (иммуно-
электропная микроскопия) 188
Выявление локализации полисахаридов ,и муцинов . . . 190
Методы ферментативного переваривания 193
Параллельные цитохимические исследования на срезах
толщиной 1 мкм, проводимые с помощью светового микроскопа 200
Новые направления в развитии ультраструктурной
цитохимии 201
Криоультрамикротомия 201
Аналитическая электронная микроскопия ..... 203
Список литературы 205
Глава 9. Радиоавтография в электронной микроскопии . 213
Теоретические основы метода 214
Радиоавтография в световой микроскопии 214
Радиоавтография на электронно-микроскопическом уровне 215
Схема метода 216
Список литературы 222
Глава 10. Краткий обзор других методов электронной
микроскопии 223
Методы замораживания 223
Замораживание — высушивание 223
Замораживание — замещение 226
Резка замороженных образцов (криоультрамикротомия) 227
Замораживание — травление 227
Исследование поверхностен в электронной микроскопии 232
Тонкие пленочные реплики и оттенепие 232
Сканирующий электронный микроскоп 234
Высоковольтная электронная микроскопия 238
Принцип конструкции высоковольтного электронного
микроскопа 238
Применение высоковольтной электронной микроскопии
в биологии 239
Наклонный объектный столик 241
Фотографические методы усиления деталей объекта . 242
Список литературы •. 243
Глава 11. Повседневный уход за электронным микроскопом ■ 247
Договоры па обслуживание 249
Центрировка 250
Опасность рентгеновского облучения 253
Испытание работы микроскопа после окончания его
центрировки 254
324 Оглавление
Калибровка увеличения 255
Некоторые общие сведения о повседневном уходе за
микроскопом 256
Когда микроскоп следует оставить в покое .... 256
Расписание и протоколы обслуживания 258
Смена нити накала 259
Центрировка диафрагм кондепсорпой и объективной линз 262
Методы чистки электронного микроскопа 262
Уход за насосами 265
Влагопоглотители
265
Водные фильтры 266
Воздушные фильтры 266
Обновление люминесцентного экрана 266
Блок высокого напряжения 267
Справочники 267
Некоторые наиболее часто встречающиеся неисправности
и их устранение 267
Список литературы 272
Приложение 273
I. Как пользоваться веществами, гидратированиыми в
различной степени 27Ь
II. Модярпости кислот и щелочей, обычно применяемых для
получения заданных величин рН фиксаторов и буферных
растворов 274
III. Фиксаторы 275
Осмиевые факторы 275
Альдегидные фиксаторы 278
Перманганатиые фиксаторы 281
IV. Буферы для промывки и хранения ткани .... 232
V. Залипочиые среды 283
Заливка в аралдит 284
Заливка в эпон 286
Смеси эпон — аралдит 287
Заливка в вестопал W 288
Заливка в метакрилаты 289
Водорастворимая заливочная среда 290
VI. Окрашивание ультратонких срезов для усиления их
контраста 292
Окрашивание, приводящее к общему иеспецифнческому
усилению контраста 292
VII. Окрашивание толстых (I—2 мкм) срезов после заливки
материала в эпоксидные смолы или акриловые пластмассы 298
VIII. Приготовление пленок-подложек 301
IX. Мытье посуды и отмывка сеток 307
Мытье стеклянной посуды 307
Отмывка опорных сеток 309
X. Фотографирование 310
Ослабитель по Фармеру и способ его применения . 311
Список литературы 311
Предметный указатель 314
Б. Уикли
ЭЛЕКТРОННАЯ МИКРОСКОПИЯ
ДЛЯ НАЧИНАЮЩИХ
Редактор М. Николаева
Художник М. Мержеепский
Художественный редактор Ю. Максимов
Технический редактор Н. Толстякова
Корректор Л. Панова
Сдано в набор 27/VIII 1974 г.
Подписано к печати 18/XII 1974 г.
Бумага № 2 84Х108'/и = 5.25 бум. л.
17,64 усл. печ. л. в т/ч. 1 вкл. 0,42 и. л. иллюстр.
Уч.-изд. л. 17,30. Изд. № 4/7422
Цена I р. 21 к. Зак. 977.
ИЗДАТЕЛЬСТВО «МИР»
Москва, 1-й Рижский пер., 2
Московская типография К° 11 Союзполиграфпрома
при Государственном комитете Совета Министров
СССР по делам издательств, полиграфии и
книжной торговли. Москва, 113105. Нагатинская ул., д. I.
УВАЖАЕМЫЙ ЧИТАТЕЛЬ!
Ваши замечания о содержании книги, ее
оформлении, качестве перевода и другие просим присылать по
адресу:
129820, Москва, И-ПО, ГСП
1-й Рижский пер., д. 2,
издательство «Мир»
ИЗДАТЕЛЬСТВО «МИР»
v Выйдут в свет в 1975 году
Поликар Л. Поверхность клетки и ее микросреда,
перевод с французского, 6 листов.
Имя автора — крупного французского гистолога А. Поликара —
хорошо изпестпо советским читателям по другим его книгам,
изданным на русском языке (А. Поликар, М. Бесси, «Элементы
патологии клетки»; Л. Поликар, «Молекулярная цитология
мембранных систем животной клетки»). Настоящая книга посвящена
актуальнейшим вопросам молекулярной нитофизиологии: электронно-
микроскопическому строению клеточной оболочки, ее функциям,
взаимоотношениям клетки с ее микросредой и с другими клетками,
проникновению различных веществ в клетку м т. д.
Предназначена для научных работников — медиков и биологов
различных специальностей: гистологов, цитологов, физиологов,
биохимиков, микробиологов, биофизиков, для студентов и аспирантов
соответствующих кафедр.
Хиллман X. Определенность и неопределенность в
биохимических методах, перевод с английского, 8 листов.
Эта оригинальная книга посвящена причинам возникновения
ошибок и артефактов при разного рода биохимических
исследованиях. Критически рассмотрены шесть важных биохимических
методов исследования: 1) фракционирование - субклеточных частиц;
2) гистохимические методики; 3) электронная микроскопия; 4)
изотопные методы; 5) электрофорез; 6) хроматография. Автор
анализирует последовательные этапы каждого метода, оценивая
значимость получаемых данных и факторы, могущие привести к
неверным выводам.
Предназначена для биологов, медиков и химиков различных
специальностей,применяющих в своей работе перечисленные методы.
Особенно полезна для студентов и начинающих исследователей.
Поправка
i
Вместо указанной, цены книги 1 р. 21 к.
следует считать цеиу 1 р. 33 к.
зак. 977